Химерные рецепторы антигена против мезотелина человека и их применение - RU2714902C2
Код документа: RU2714902C2
Чертежи













































Описание
По настоящей заявке испрашивается приоритет международной заявки № PCT/CN2013/089979, поданной 19 декабря 2013 года, международной заявки № PCT/CN2014/082610, поданной 21 июля 2014 года и международной заявки № PCT/CN2014/090509, поданной 6 ноября 2014 года, полное содержание каждой из этих заявок включено в настоящее описание в качестве ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[001] Настоящее изобретение относится, главным образом, к применению T-клеток, модифицированных способами инженерии для экспрессии химерного рецептора антигена (CAR), для лечения заболевания, ассоциированного с экспрессией мезотелина.
УРОВЕНЬ ТЕХНИКИ, К КОТОРОМУ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[002] Мезотелин первоначально был идентифицирован Pastan и коллегами в качестве опухолеассоциированного с антигена вследствие его ограниченной экспрессии нормальными тканями и сверхэкспрессии в опухолях. Chang K, et al., Cancer Res. 1992;52(1):181-186 и Chang K, et al. ProcNatlAcadSciUSA. 1996;93(1):136-140. Ген мезотелина кодирует белок-предшественник массой 71 кДа, который процессируется с образованием белка мезотелина массой 40 кДа который заякоривается на клеточной мембране гликозилфосфатидилинозитольной (GPI) связью и N-концевым слущивающимся фрагментом массой 31 кДа, называемым мегакариоцит-стимулирующим фактором (MPF). Оба фрагмента содержат участки N-гликозилирования. Растворимый вариант по сплайсингу C-концевого фрагмента массой 40 кДа, называемый "растворимым мезотелином/родственный MPF" был обнаружен в сыворотке пациентов с протоковой аденокарциномой поджелудочной железы (PDA). Johnston, F, et al. Clinical Cancer Research. 2009;15(21):6511. Мезотелин в настоящее время исследуют как в качестве терапевтической мишени, так и в качестве биомаркера активности заболевания и терапевтического ответа. Argani P, et al. Clin Cancer Res. 2001; 7(12):3862-3868.
[003] Мезотелин является антигеном дифференцировки, который также присутствует на нормальных тканях. С использованием антитела мыши против мезотелина человека K1, которое было разработано группой Pastan, была продемонстрирована выраженная реактивность K1 в мезотелиальных клетках, которые выстилают брюшную, плевральную и перикардиальную полости, хотя и на более низких уровнях, чем обычно наблюдают в злокачественных тканях. Chang K, et al., Cancer Res. 1992; 52(1):181-186. Слабая реактивность K1 была обнаружена в клетках фаллопиевых труб, базальном эпителии трахей и эпителии миндалевидных желез. Мезотелин также был обнаружен в всех слоях роговицы. Jirsova K, et al. Experimental eye research. 2010;91(5):623-629. Однако реактивность K1 не была обнаружена в большинстве нормальных тканей, включая печень, почки, селезенку, костный мозг, лимфатические узлы, тимус, сердечную мышцу, язык, скелетную мышцу, кожу, кору головного мозга, мозжечок, спинной мозг, периферический нерв, гипофиз, надпочечник, слюнную железу, молочную железу, щитовидную железу, паращитовидную железу, яичко, предстательную железу, придаток яичка, эпителий шейки матки, паренхиму легких, пищевод, эпителий тонкого кишечника, эпителий толстого кишечника, эпителий мочевого пузыря, эпителий желчного пузыря. Chang K, et al., Cancer Res. 1992; 52(1):181-186.
[004] Мезотелин сверхэкспрессируется в большинстве первичных аденокарцином поджелудочной железы, при этом редкая и слабая экспрессия наблюдается в доброкачественной ткани поджелудочной железы. Argani P, et al. Clin Cancer Res. 2001;7(12):3862-3868. Эпителиальная злокачественная мезотелиома плевры (MPM) широко экспрессирует мезотелин, в то время как саркомоподобная MPM не экспрессирует мезотелин. Большинство серозных карцином яичника и родственных первичных карцином брюшины экспрессируют мезотелин.
[005] Мезотелин является мишенью природного иммунного ответа при раке яичника, и он был предложен в качестве мишени для иммунотерапии злокачественной опухоли. Bracci L, et al. Clin Cancer Res. 2007;13(2 Pt 1):644-653; Moschella F, et al. Cancer Res. 2011;71(10):3528-3539; Gross G, et al. FASEB J. 1992;6(15):3370-3378; Sadelain M, et al. NatRevCancer. 2003;3(1):35-45; Muul LM, et al. Blood. 2003; 101(7):2563-2569; Yee C, et al. Proc Natl Acad Sci U S A. 2002;99(25):16168-16173. Присутствие мезотелин-специфических CTL у пациентов с раком поджелудочной железы коррелирует с общей выживаемостью. Thomas AM, et al. J Exp Med. 2004; 200:297-306. Кроме того, Pastan и коллеги использовали растворимые фрагменты антитела против мезотелина, конъюгированные с иммунотоксинами, для лечения пациентов со злокачественными положительными по мезотелину опухолями. Этот подход продемонстрировал приемлемую безопасность и некоторую клиническую активность при раке поджелудочной железы. Hassan R, et al. Cancer Immun. 2007; 7:20 и Hassan R, et al. Clin Cancer Res. 2007;13(17):5144-5149. При раке яичника эта терапевтическая стратегия обеспечила один незначительный ответ согласно критериям RECIST и стабильное заболевание у второго пациента, у которого также произошло полное разрешение асцитов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[006] Изобретение относится, например, к способам обеспечения иммунного ответа у пациентов путем введения иммунной эффекторной клетки, которая модифицирована способами инженерии для экспрессии химерного рецептора антигена (CAR), который содержит антитело (например, scFv), которое специфически нацелено на мезотелин. В частности, изобретение относится к применению иммунной эффекторной клетки, например, такой как T-клетка или NK-клетка, модифицированной способами инженерии для экспрессии CAR, который содержит антитело, такое как его антигенсвязывающий фрагмент, для лечения злокачественной опухоли, ассоциированной с экспрессией мезотелина (или MSLN). В частности, изобретение относится к адоптивному клеточному переносу, который может быть особенно пригодным для пациентов с экспрессирующими мезотелин злокачественными опухолями, например, такими как мезотелиома (например, злокачественная плевральная мезотелиома, рак легкого (например, немелкоклеточный рак легкого, мелкоклеточный рак легкого, плоскоклеточный рак легкого или крупноклеточный рак легкого), рак поджелудочной железы (например, протоковая аденокарцинома поджелудочной железы, метастазирующий рак поджелудочной железы), рак яичника, рак ободочной и прямой кишки и рак мочевого пузыря, или любая их комбинация.
[007] Таким образом, в одном аспекте изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей химерный рецептор антигена (CAR), где CAR содержит мезотелин-связывающий домен (например, мезотелин-связывающий домен человека), трансмембранный домен и внутриклеточный сигнальный домен, содержащий стимулирующий домен. В одном варианте осуществления кодируемый мезотелин-связывающий домен содержит одну или более (например, все три) из определяющей комплементарность области 1 легкой цепи (CDR1 LC), определяющей комплементарность области 2 легкой цепи(CDR2 LC) и определяющей комплементарность области 3 легкой цепи (CDR3 LC) мезотелин-связывающего домена человека, описанного в настоящем описании, и одну или более (например, все три) из определяющей комплементарность области 1 тяжелой цепи (CDR1 HC), определяющей комплементарность области 2 тяжелой цепи (CDR2 HC) и определяющей комплементарность области 3 тяжелой цепи (CDR3 HC) мезотелин-связывающего домена человека, описанного в настоящем описании. В одном варианте осуществления кодируемый мезотелин-связывающий домен человека содержит или состоит из вариабельной области легкой цепи, описанной в настоящем описании (например, в таблице 2, 4 или 5), и/или вариабельной области тяжелой цепи, описанной в настоящем описании (например, в таблице 2, 4 или 5). В одном варианте осуществления кодируемый мезотелин-связывающий домен представляет собой scFv, содержащий или состоящий из легкой цепи и тяжелой цепи с аминокислотной последовательностью, представленной в таблице 2. В одном варианте осуществления мезотелин-связывающий домен (например, scFV) содержит или состоит из: вариабельной области легкой цепи, содержащей аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены), но не более 30, 20 или 10 модификаций (например, замен) аминокислотной последовательности вариабельной области легкой цепи, описанной в таблице 2, или последовательность с 95-99% идентичностью с аминокислотной последовательностью, представленной в таблице 2; и/или вариабельной области тяжелой цепи, содержащей или состоящей из аминокислотной последовательности, имеющей по меньшей мере одну, две или три модификации (например, замены) но не более 30, 20 или 10 модификаций (например, замен) аминокислотной последовательности вариабельной области тяжелой цепи, описанной в таблице 2, или последовательности с 95-99% идентичностью с аминокислотной последовательностью, представленной в таблице 2. В одном варианте осуществления мезотелин-связывающий домен человека содержит или состоит из последовательности, выбранной из группы, состоящей из SEQ ID NO: 39; SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61 и SEQ ID NO: 62, или последовательности с 95-99% идентичностью с ними. В одном варианте осуществления последовательность нуклеиновой кислоты, кодирующая мезотелин-связывающий домен человека, содержит или состоит из последовательности, выбранной из группы, состоящей из SEQ ID NO: 87; SEQ ID NO: 88, SEQ ID NO: 89, SEQ ID NO: 90, SEQ ID NO: 91, SEQ ID NO: 92, SEQ ID NO: 93, SEQ ID NO: 94, SEQ ID NO: 95, SEQ ID NO: 96, SEQ ID NO: 97, SEQ ID NO: 98, SEQ ID NO: 99, SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 102, SEQ ID NO: 103, SEQ ID NO: 104, SEQ ID NO: 105, SEQ ID NO: 106, SEQ ID NO: 107, SEQ ID NO: 108, SEQ ID NO: 109 и SEQ ID NO: 110, или последовательности с 95-99% идентичностью с ними.
[008] В одном варианте осуществления выделенная нуклеиновая кислота дополнительно содержит последовательность, кодирующую трансмембранный домен, например, трансмембранный домен, описанный в настоящем описании. В одном варианте осуществления кодируемый трансмембранный домен содержит или состоит из трансмембранного домена белка, выбранного из альфа-, бета- или зета-цепи T-клеточного рецептора, CD28, CD3-эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137 и CD154. В одном варианте осуществления кодируемый трансмембранный домен содержит или состоит из последовательности SEQ ID NO: 12. В одном варианте осуществления трансмембранный домен содержит или состоит из аминокислотной последовательности, имеющей по меньшей мере одну, две или три модификации (например, замены), но не более 20, 10 или 5 модификаций (например, замен) аминокислотной последовательности SEQ ID NO: 12, или последовательности с 95-99% идентичностью с аминокислотной последовательностью SEQ ID NO: 12.
[009] В одном варианте осуществления кодируемый CAR включает мезотелин-связывающий домен, например, мезотелин-связывающий домен, описанный в настоящем описании, связанный с трансмембранным доменом шарнирной областью, например, шарнирной областью, описанной в настоящем описании. В одном варианте осуществления шарнирная область содержит или состоит из SEQ ID NO: 6 или SEQ ID NO: 8.
[0010] В одном варианте осуществления выделенная молекула нуклеиновой кислоты дополнительно содержит последовательность, кодирующую костимулирующий домен, например, костимулирующий домен, описанный в настоящем описании. В одном варианте осуществления костимулирующий домен представляет собой функциональный сигнальный домен, полученный из белка, выбранного из группы, состоящей из OX40, CD27, CD28, CDS, ICAM-1, LFA-1 (CD11a/CD18), ICOS (CD278) и 4-1BB (CD137). В одном варианте осуществления кодируемый костимулирующий домен содержит или состоит из последовательности SEQ ID NO: 14. В одном варианте осуществления костимулирующий домен содержит или состоит из аминокислотной последовательности, имеющей по меньшей мере одну, две или три модификации (например, замены), но не более 20, 10 или 5 модификаций (например, замен) аминокислотной последовательности SEQ ID NO: 14, или последовательности с 95-99% идентичностью с аминокислотной последовательностью SEQ ID NO: 14.
[0011] В одном варианте осуществления выделенная нуклеиновая кислота содержит последовательность, кодирующую внутриклеточный сигнальный домен, например, внутриклеточный сигнальный домен, описанный в настоящем описании. В одном варианте осуществления выделенная нуклеиновая кислота кодирует функциональный сигнальный домен 4-1BB и/или функциональный сигнальный домен CD3-зета. В одном варианте осуществления кодируемый внутриклеточный сигнальный домен содержит последовательность SEQ ID NO: 7 и/или последовательность SEQ ID NO: 9 или SEQ ID NO: 10. В одном варианте осуществления внутриклеточный сигнальный домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены), но не более 20, 10 или 5 модификаций (например, замен) аминокислотной последовательности SEQ ID NO: 7 и/или аминокислотной последовательности SEQ ID NO: 9 или SEQ ID NO: 10, или последовательности с 95-99% идентичностью с аминокислотной последовательностью SEQ ID NO: 7 и/или аминокислотной последовательностью SEQ ID NO: 9 или SEQ ID NO: 10. В одном варианте осуществления кодируемый внутриклеточный сигнальный домен содержит или состоит из последовательности SEQ ID NO: 7 и последовательности SEQ ID NO: 9 или SEQ ID NO: 10, где последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в одной рамке считывания и в качестве одной полипептидной цепи.
[0012] В другом аспекте изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей конструкцию CAR, содержащую лидерную последовательность, например, SEQ ID NO: 1; мезотелин-связывающий домен, описанный в настоящем описании, например, имеющий аминокислотную последовательность, представленную в таблице 2, или последовательность с 95-99% идентичностью с ней; шарнирную область, например, SEQ ID NO: 2; трансмембранный домен, например, имеющий последовательность SEQ ID NO: 6; костимулирующий домен, например, костимулирующий домен 4-1BB, имеющий последовательность SEQ ID NO: 7; и первичный сигнальный домен, например, стимулирующий домен CD3-зета, имеющий последовательность SEQ ID NO: 9 или 10. В одном варианте осуществления выделенная молекула нуклеиновой кислоты содержит (например, состоит из) последовательности нуклеиновой кислоты, кодирующие полипептид, имеющий аминокислотную последовательность, представленную в таблице 2. В одном варианте осуществления выделенная молекула нуклеиновой кислоты содержит (состоит из) нуклеиновой кислоты, кодирующей полипептид, имеющий аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены), но не более 30, 20 или 10 модификаций (например, замен) аминокислотной последовательности, представленной в таблице 2, или последовательности с 95-99% идентичностью с аминокислотной последовательностью, представленной в таблице 2.
[0013] В другом аспекте изобретение относится к выделенной полипептидной молекуле, кодируемой последовательностью нуклеиновой кислоты, например, нуклеиновой кислотой, описанной в настоящем описании.
[0014] В другом аспекте изобретение относится к выделенной полипептидной молекуле, содержащей или состоящей из последовательности, выбранной из группы, состоящей из последовательностей, представленных в таблице 2, аминокислотной последовательности, имеющей по меньшей мере одну, две или три модификации (например, замены), но не более 30, 20 или 10 модификаций (например, замен) аминокислотной последовательности вариабельной области тяжелой цепи, представленной в таблице 2, или последовательности с 95-99% идентичностью с аминокислотной последовательностью, представленной в таблице 2. В одном варианте осуществления выделенный полипептид содержит одну или более (например, все три) из определяющей комплементарность области 1 легкой цепи (CDR1 LC), определяющей комплементарность области 2 легкой цепи (CDR2 LC) и определяющей комплементарность области 3 легкой цепи (CDR3 LC) мезотелин-связывающего домена человека, описанного в настоящем описании, и одну или более (например, все три) из определяющей комплементарность области 1 тяжелой цепи (CDR1 HC), определяющей комплементарность области 2 тяжелой цепи (CDR2 HC) и определяющей комплементарность области 3 тяжелой цепи (CDR3 HC) мезотелин-связывающего домена человека, описанного в настоящем описании.
[0015] В другом аспекте изобретение относится к выделенной молекуле химерного рецептора антигена (CAR), содержащей мезотелин-связывающий домен, описанный в настоящем описании, например, мезотелин-связывающий домен человека, описанный в настоящем описании, трансмембранный домен и внутриклеточный сигнальный домен, содержащий стимулирующий домен.
[0016] В одном варианте осуществления мезотелин-связывающий домен не конкурирует за связывание мезотелина человека с антигенсвязывающим доменом, содержащим последовательность, содержащую SEQ ID NO: 279.
[0017] В одном варианте осуществления мезотелин-связывающий домен конкурирует за связывание мезотелина человека с антигенсвязывающим доменом, содержащим CDR1 LC, CDR2 LC и CDR3 LC аминокислотной последовательности легкой цепи антитела против мезотелина, выбранной из SEQ ID NO: 43 или SEQ ID NO: 49, и CDR1 HC, CDR2 HC и CDR3 HC аминокислотной последовательности тяжелой цепи антитела против мезотелина, выбранной из SEQ ID NO: 43 или SEQ ID NO: 49. В одном варианте осуществления мезотелин-связывающий домен конкурирует за связывание мезотелина человека с антигенсвязывающим доменом, содержащим SEQ ID NO: 43 или SEQ ID NO: 49.
[0018] В одном варианте осуществления мезотелин-связывающий домен связывается с эпитопом мезотелина человека, отличающимся от эпитопа мезотелина человека, на который нацелен антигенсвязывающий домен, содержащий последовательность SEQ ID NO: 279. В одном варианте осуществления эпитоп содержит последовательность аминокислот, выбранную из аминокислот 314-315, 317-318, 346-349 и 369-375 SEQ ID NO: 278 или любой их комбинации. В одном варианте осуществления эпитоп содержит одну или более аминокислот, выбранных из аминокислот 314-315, 317-318, 346-349 и 369-375 SEQ ID NO: 278 или любой их комбинации.
[0019] В одном варианте осуществления мезотелин-связывающий домен, описанный в настоящем описании, не связывается с N-концом мезотелина, как показано в SEQ ID NO: 278. В одном варианте осуществления мезотелин-связывающий домен связывается с C-концом мезотелина человека. В одном варианте осуществления мезотелин-связывающий домен связывается с эпитопом в пределах аминокислот 450-588 SEQ ID NO: 278. В одном варианте осуществления эпитоп, связываемый мезотелин-связывающим доменом, содержит последовательность, выбранную из аминокислот 485-490, 498-507, 532-537 и 545-572 SEQ ID NO: 278 или их комбинации. В одном варианте осуществления эпитоп, связываемый мезотелин-связывающим доменом, содержит одну или более аминокислот, выбранных из аминокислот 485-490, 498-507, 532-537 и 545-572 SEQ ID NO: 278 или любой их комбинации. В этих вариантах осуществления SEQ ID NO: 278 обозначает аминокислоты 296-588 мезотелина человека, например, первая аминокислота SEQ ID NO: 278 представляет собой аминокислоту 296 и последняя аминокислота SEQ ID NO: 278 представляет собой аминокислоту 588.
[0020] В одном варианте осуществления мезотелин-связывающий домен содержит одну или более (например, все три) из определяющей комплементарность области 1 легкой цепи (CDR1 LC), определяющей комплементарность области 2 легкой цепи (CDR2 LC) и определяющей комплементарность области 3 легкой цепи (CDR3 LC) мезотелин-связывающего домена человека, описанного в настоящем описании, и одну или более (например, все три) из определяющей комплементарность области 1 тяжелой цепи (CDR1 HC), определяющей комплементарность области 2 тяжелой цепи (CDR2 HC) и определяющей комплементарность области 3 тяжелой цепи (CDR3 HC) мезотелин-связывающего домена человека, описанного в настоящем описании. В одном варианте осуществления мезотелин-связывающий домен человека содержит или состоит из вариабельной области легкой цепи, описанной в настоящем описании (например, в таблице 2), и/или вариабельной области тяжелой цепи, описанной в настоящем описании (например, в таблице 2). В одном варианте осуществления мезотелин-связывающий домен представляет собой scFv, содержащий или состоящий из вариабельной области легкой цепи и вариабельной области тяжелой цепи аминокислотной последовательности, представленной в таблице 2. В одном варианте осуществления мезотелин-связывающий домен (например, scFV) содержит или состоит из: вариабельной области легкой цепи, содержащей аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены), но не более 30, 20 или 10 модификаций (например, замен) аминокислотной последовательности вариабельной области легкой цепи, представленной в таблице 2, или последовательности с 95-99% идентичностью с аминокислотной последовательностью, представленной в таблице 2; и/или вариабельной области тяжелой цепи, содержащей аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены) но не более 30, 20 или 10 модификаций (например, замен) аминокислотной последовательности вариабельной области тяжелой цепи, представленной в таблице 2, или последовательности с 95-99% идентичностью с аминокислотной последовательностью, представленной в таблице 2. В одном варианте осуществления мезотелин-связывающий домен человека содержит или состоит из последовательности, выбранной из группы, состоящей из SEQ ID NO: 39; SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61 и SEQ ID NO: 62, или последовательности с 95-99% идентичностью с ними.
[0021] В одном варианте осуществления трансмембранный домен представляет собой трансмембранный домен белка, выбранного из группы, состоящей из альфа-, бета- или зета-цепи T-клеточного рецептора, CD28, CD3-эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137 и CD154. В одном варианте осуществления трансмембранный домен включает трансмембранный домен, описанный в настоящем описании, например, имеющий последовательность SEQ ID NO: 6, аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены), но не более 20, 10 или 5 модификаций (например, замен) аминокислотной последовательности SEQ ID NO: 6, или последовательность с 95-99% идентичностью с аминокислотной последовательностью SEQ ID NO: 6.
[0022] В одном варианте осуществления мезотелин-связывающий домен связан с трансмембранным доменом шарнирной областью. В одном варианте осуществления шарнирная область содержит шарнирную область, описанную в настоящем описании, например, шарнирную область SEQ ID NO: 2.
[0023] В одном варианте осуществления выделенная молекула CAR дополнительно содержит костимулирующий домен, например, костимулирующий домен, описанный в настоящем описании. В одном варианте осуществления костимулирующий домен представляет собой функциональный сигнальный домен, полученный из белка, выбранного из группы, состоящей из OX40, CD27, CD28, CDS, ICAM-1, LFA-1 (CD11a/CD18), ICOS (CD278) и 4-1BB (CD137) или его функционального варианта. В одном варианте осуществления костимулирующий домен содержит или состоит из последовательности SEQ ID NO: 7. В одном варианте осуществления костимулирующий домен содержит или состоит из аминокислотной последовательности, имеющей по меньшей мере одну, две или три модификации (например, замены), но не более 20, 10 или 5 модификаций (например, замен) аминокислотной последовательности SEQ ID NO: 7, или последовательности с 95-99% идентичностью с аминокислотной последовательностью SEQ ID NO: 7.
[0024] В одном варианте осуществления выделенная молекула CAR содержит внутриклеточный сигнальный домен, например, внутриклеточный сигнальный домен, описанный в настоящем описании. В одном варианте осуществления внутриклеточный сигнальный домен содержит функциональный сигнальный домен 4-1BB и/или функциональный сигнальный домен CD3-зета. В одном варианте осуществления внутриклеточный сигнальный домен содержит или состоит из последовательности SEQ ID NO: 7 и/или последовательности SEQ ID NO: 9 или SEQ ID NO: 10. В одном варианте осуществления внутриклеточный сигнальный домен содержит или состоит из аминокислотной последовательности, имеющей по меньшей мере одну, две или три модификации (например, замены), но не более 20, 10 или 5 модификаций (например, замен) аминокислотной последовательности SEQ ID NO: 7 и/или аминокислотной последовательности SEQ ID NO: 9 или SEQ ID NO: 10, или последовательности с 95-99% идентичностью с аминокислотной последовательностью SEQ ID NO: 7 и/или аминокислотной последовательностью SEQ ID NO: 9 или SEQ ID NO: 10. В одном варианте осуществления внутриклеточный сигнальный домен содержит или состоит из последовательности SEQ ID NO: 9 и последовательности SEQ ID NO: 9 или SEQ ID NO: 10, где последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в одной рамке считывания и в качестве единой полипептидной цепи.
[0025] В другом аспекте изобретение относится к выделенной молекуле CAR, содержащей лидерную последовательность, например, SEQ ID NO: 1; мезотелин-связывающий домен, описанный в настоящем описании, например, имеющий аминокислотную последовательность, представленную в таблице 2, или последовательность с 95-99% идентичностью с ней; шарнирную область, например, SEQ ID NO: 2; трансмембранный домен, например, имеющий последовательность SEQ ID NO: 6; костимулирующий домен, например, костимулирующий домен 4-1BB, имеющий последовательность SEQ ID NO: 7; и первичный сигнальный домен, например, стимулирующий домен CD3-зета, имеющий последовательность SEQ ID NO: 9 или SEQ ID NO: 10. В одном варианте осуществления выделенная молекула CAR содержит (например, состоит из) полипептид, имеющий аминокислотную последовательность, представленную в таблице 2. В одном варианте осуществления выделенная молекула CAR содержит (состоит из) полипептид, имеющий аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены), но не более 30, 20 или 10 модификаций (например, замен) аминокислотной последовательности, представленной в таблице 2, или последовательности с 95-99% идентичностью с аминокислотной последовательностью, представленной в таблице 2. В одном варианте осуществления выделенная молекула CAR содержит или состоит из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 63; SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 69, SEQ ID NO: 70, SEQ ID NO: 71, SEQ ID NO: 72, SEQ ID NO: 73, SEQ ID NO: 74, SEQ ID NO: 75, SEQ ID NO: 76, SEQ ID NO: 77, SEQ ID NO: 78, SEQ ID NO: 79, SEQ ID NO: 80, SEQ ID NO: 81, SEQ ID NO: 82, SEQ ID NO: 83, SEQ ID NO: 84, SEQ ID NO: 85 и SEQ ID NO: 86.
[0026] В другом аспекте изобретение относится к вектору, содержащему последовательность нуклеиновой кислоты, описанную в настоящем описании. В одном варианте осуществления последовательность нуклеиновой кислоты кодирует молекулу CAR, например, молекулу CAR, описанную в настоящем описании. В одном варианте осуществления вектор выбран из группы, состоящей из ДНК, РНК, плазмиды, лентивирусного вектора, аденовирусного вектора или ретровирусного вектора.
[0027] В одном варианте осуществления вектор представляет собой лентивирусный вектор, например, лентивирусный вектор, описанный в настоящем описании. В одном варианте осуществления вектор дополнительно содержит промотор. В одном варианте осуществления промотор представляет собой промотор EF-1α. В одном варианте осуществления промотор EF-1α содержит последовательность SEQ ID NO: 11.
[0028] В одном варианте осуществления вектор представляет собой вектор, транскрибируемый in vitro, например, вектор, который транскрибирует РНК молекулы нуклеиновой кислоты, описанной в настоящем описании. В одном варианте осуществления РНК транскрибируется с вектора, транскрибируемого in vitro, где вектор представляет собой pD-A.anti-meso BD OF.2bg.150A, где anti-meso BD представляет собой мезотелин-связывающий домен, описанный в настоящем описании. В одном варианте осуществления последовательность нуклеиновой кислоты в векторе дополнительно содержит поли(A)-хвостовую часть, например, поли-A-хвостовую часть, описанную в настоящем описании, например, содержащую приблизительно 150 аденозиновых оснований (SEQ ID NO: 271). В одном варианте осуществления последовательность нуклеиновой кислоты в векторе дополнительно содержит 3’UTR, например, 3’UTR, описанную в настоящем описании, например, содержащую по меньшей мере один повтор 3’UTR, происходящий из бета-глобулина человека.
[0029] В другом аспекте изобретение относится к клетке, содержащей вектор. Клетка может представлять собой, например, клетку, описанную в настоящем описании. В одном варианте осуществления клетка представляет собой T-клетку человека, например, T-клетку, описанную в настоящем описании, или NK-клетку человека, например, NK-клетку человека, описанную в настоящем описании. В одном варианте осуществления T-клетка человека представляет собой CD8+ T-клетку. В одном варианте осуществления клетка представляет собой аутологичную T-клетку. В одном варианте осуществления клетка представляет собой аллогенную T-клетку. В одном варианте осуществления клетка представляет собой T-клетку, и T-клетка имеет дефицит диаглицеринкиназы (DGK). В одном варианте осуществления клетка представляет собой T-клетку, и T-клетка имеет дефицит Ikaros. В одном варианте осуществления клетка представляет собой T-клетку, и T-клетка имеет дефицит как DGK, так и Ikaros.
[0030] В одном аспекте экспрессирующая CAR клетка, описанная в настоящем описании, может дополнительно содержать второй CAR, например, второй CAR, который включает другой антигенсвязывающий домен, например, для той же мишени (мезотелин) или другой мишени (например, мишень, отличная от мезотелина, на стромальных клетках, например FAP; мишень, отличная от мезотелина, на клетках рака предстательной железы, например рецептор андрогена, OR51E2, PSMA, PSCA, PDGRF-β, TARP, GloboH, MAD-CT-1 или MAD-CT-2; мишень, отличная от мезотелина, на клетках рака яичника, например Tn, PRSS21, CD171, Lewis Y, рецептор фолатов α, клаудин 6, GloboH или белок спермы 17; например, мишень, отличная от мезотелина, на клетках рака легкого, например VEGF, HER3, IGF-1R, EGFR, DLL4 или Trop-2). В одном варианте осуществления экспрессирующая CAR клетка содержит первый CAR, который нацелен на первый антиген и включает внутриклеточный сигнальный домен, имеющий костимулирующий сигнальный домен, но не первичный сигнальный домен, и второй CAR, который нацелен на второй отличающийся антиген и включает внутриклеточный сигнальный домен, имеющий первичный сигнальный домен, но не костимулирующий сигнальный домен. В одном варианте осуществления экспрессирующая CAR клетка содержит первый CAR против мезотелина, который включает мезотелин-связывающий домен, трансмембранный домен и костимулирующий домен, и второй CAR, который нацелен на антиген, отличный от мезотелина (например, антиген, экспрессируемый на стромальных клетках, клетках рака легкого, клетках рака предстательной железы или клетках рака яичника), и включает антигенсвязывающий домен, трансмембранный домен и первичный сигнальный домен. В другом варианте осуществления экспрессирующая CAR клетка содержит первый CAR против мезотелина, который включает мезотелин-связывающий домен, трансмембранный домен и первичный сигнальный домен, и второй CAR, который нацелен на антиген, отличный от мезотелина (например, антиген, экспрессируемый на стромальных клетках, клетках рака легкого, клетках рака предстательной железы или клетках рака яичника), и включает антигенсвязывающий домен для антигена, трансмембранный домен и костимулирующий сигнальный домен.
[0031] В одном варианте осуществления экспрессирующая CAR клетка содержит CAR против мезотелина, описанный в настоящем описании, и ингибиторный CAR. В одном варианте осуществления ингибиторный CAR содержит антигенсвязывающий домен, который связывает антиген, встречающийся на нормальных клетках, но не на злокачественных клетках, например, на нормальных клетках, которые также экспрессируют мезотелин. В одном варианте осуществления ингибиторный CAR содержит антигенсвязывающий домен, трансмембранный домен и внутриклеточный ингибиторный домен. Например, внутриклеточный домен ингибиторного CAR может представлять собой внутриклеточный домен PD1, PD-L1, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4 и TGFR-бета.
[0032] В другом варианте осуществления экспрессирущая CAR клетка, описанная в настоящем описании, может дополнительно экспрессировать другое средство, например, средство, которое повышает активность или выносливость CAR-экспрессирующей клетки, например, средство, описанное в настоящем описании. Например, в одном варианте осуществления средство может представлять собой средство, которое ингибирует молекулу, которая модулирует или регулирует, например ингибирует, T-клеточную функцию. В некоторых вариантах осуществления молекула, которая модулирует или регулирует T-клеточную функцию, представляет собой ингибиторную молекулу. Примеры ингибиторных молекул включают PD1, PD-L1, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4 и TGFR-бета. В вариантах осуществления средство, например, ингибиторную нуклеиновую кислоту, например, дцРНК, например, миРНК или кшРНК; или, например, ингибиторный белок или систему, например, короткие палиндромные повторы, регулярно расположенные кластерами (CRISPR), нуклеазу, подобную активатору транскрипции, (TALEN) или эндонуклеазу с цинковыми пальцами (ZFN), например, как описано в настоящем описании, можно использовать для ингибирования экспрессии молекулы, которая модулирует или регулирует, например ингибирует, T-клеточную функцию в CAR-экспрессирующей клетке. В одном варианте осуществления средство представляет собой кшРНК, например, кшРНК, описанную в настоящем описании. В одном варианте осуществления средство, которое модулирует или регулирует, например ингибирует, T-клеточную функцию, ингибируется в CAR-экспрессирующей клетке. Например, молекула дцРНК, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например ингибирует, T-клеточную функцию, связана с нуклеиновой кислотой, которая кодирует компонент, например, все компоненты CAR.
[0033] В одном варианте осуществления средство, которое ингибирует ингибирующую молекулу, содержит первый полипептид, например ингибиторную молекулу, связанный со вторым полипептидом, который дает положительный сигнал клетке, например, внутриклеточным сигнальным доменом, описанным в настоящем описании. В одном варианте осуществления средство содержит первый полипептид, например, из ингибиторной молекулы, такой как PD1, PD-L1, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, CTLA4, VISTA, CD160, BTLA, LAIR1, TIM3, 2B4, TGFR-бета и TIGIT, или фрагмент любой из них (например, меньшей мере часть внеклеточного домена любой из них), и второй полипептид, который представляет собой внутриклеточный сигнальный домен, описанный в настоящем описании (например, содержащий костимулирующий домен (например, 41BB, CD27 или CD28, например, как описано в настоящем описании) и/или первичный сигнальный домен (например, сигнальный домен CD3-зета, описанный в настоящем описании)). В одном варианте осуществления средство содержит первый полипептид из PD1 или его фрагмента (например, по меньшей мере часть внеклеточного домена PD1), и второй полипептид внутриклеточного сигнального домена, описанный в настоящем описании (например, сигнальный домен CD28, описанный в настоящем описании, и/или сигнальный домен CD3-зета, описанный в настоящем описании).
[0034] В другом аспекте изобретение относится к способу получения клетки, включающему трансдукцию клетки, описанной в настоящем описании, например, T-клетки или NK-клетки, вектором, содержащим нуклеиновую кислоту, кодирующую молекулу CAR, например, молекулу CAR, описанную в настоящем описании.
[0035] Настоящее изобретение также относится к способу получения популяции клеток со сконструированной РНК, например, клеток, описанных в настоящем описании, например, T-клеток или NK-клеток, временно экспрессирующих экзогенную РНК. Способ включает введение транскрибированной in vitro РНК или синтетической РНК в клетку, где РНК содержит нуклеиновую кислоту, кодирующую молекулу CAR, описанную в настоящем описании.
[0036] В другом аспекте изобретение относится к способу обеспечения опухолевого иммунитета у индивидуума, включающему введение индивидууму эффективного количества клеток, содержащих молекулу CAR, например клеток, экспрессирующих молекулу CAR, описанную в настоящем описании, клеток, описанных в настоящем описании. В одном варианте осуществления клетка представляет собой аутологичную T-клетку или NK-клетку. В одном варианте осуществления клетка представляет собой аллогенную T-клетку или NK-клетку. В одном варианте осуществления индивидуумом является человек.
[0037] В другом аспекте изобретение относится к способу лечения индивидуума, имеющего заболевание, ассоциированное с экспрессией мезотелина (например, пролиферативное заболевание, предзлокачественное состояние и не связанное со злокачественной опухолью показание, ассоциированное с экспрессией мезотелина), включающему введение индивидууму эффективного количества клеток, содержащих молекулу CAR, например, как описано в настоящем описании.
[0038] В одном варианте осуществления заболевание, ассоциированное с мезотелином, представляет собой злокачественную опухоль, например, злокачественную опухоль, описанную в настоящем описании. В одном варианте осуществления заболевание, ассоциированное с мезотелином, выбрано из группы, состоящей из:мезотелиомы (например, злокачественная плевральная мезотелиома), рака легкого (например, немелкоклеточный рак легкого, мелкоклеточный рак легкого, плоскоклеточный рак легкого или крупноклеточный рак легкого), рака поджелудочной железы (например, протоковая аденокарцинома поджелудочной железы), рака яичника, рака ободочной и прямой кишки и рака мочевого пузыря или любой их комбинации. В одном варианте осуществления заболевание представляет собой рак поджелудочной железы, например, метастазирующую протоковую аденокарциному поджелудочной железы (PDA), например, у индивидуума, у которого произошло прогрессирование при по меньшей мере одной предшествующей стандартной терапии. В одном варианте осуществления заболевание представляет собой мезотелиому (например, злокачественная плевральная мезотелиома), например, у индивидуума, у которого произошло прогрессирование при по меньшей мере одной предшествующей стандартной терапии. В одном варианте осуществления заболевание представляет собой рак яичника, например, серозный эпителиальный рак яичника, например, у индивидуума, у которого произошло прогрессирование после по меньшей мере одного предшествующего стандартного режима терапии.
[0039] В одном варианте осуществления клетку, экспрессирующую CAR против мезотелина, например, T-клетку или NK-клетку, вводят индивидууму, которому вводили предшествующую дозу мелфалана.
[0040] В одном варианте осуществления клетки, экспрессирующие молекулу CAR, например молекулу CAR, описанную в настоящем описании, вводят в комбинации со средством, которое повышает активность или выносливость клеток, экспрессирующих молекулу CAR, например, средством, описанным в настоящем описании.
[0041] В одном варианте осуществления клетки, экспрессирующие молекулу CAR, например, молекулу CAR, описанную в настоящем описании, вводят в комбинации с низкой усиливающей иммунитет дозой ингибитора mTOR. Без связи с теорией, полагают, что лечение низкой усиливающей иммунитет дозой (например, доза, которая является недостаточной для полного подавления иммунной системы, но является достаточной для улучшения иммунной функции) сопровождается снижением уровня положительных по PD-1 T-клеток или повышением уровня отрицательных по PD-1 T-клеток. Положительные по PD-1 T-клетки, но не отрицательные по PD-1 T-клетки, можно устранять посредством контакта с клетками, которые экспрессируют лиганд PD-1, например, PD-L1 или PD-L2.
[0042] В одном варианте осуществления этот подход можно использовать для оптимизации эффективности клеток CAR, описанных в настоящем описании, у индивидуума. Без связи с теорией полагают, что в одном варианте осуществления эффективность эндогенных немодифицированных иммунных эффекторных клеток, например, T-клеток, повышается. Без связи с теорией полагают, что в одном варианте осуществления эффективность клеток, экспрессирующих CAR против мезотелина, повышается. В других вариантах осуществления клетки, например, T-клетки или NK-клетки, которые модифицированы или будут модифицированы для экспрессии CAR, можно обрабатывать ex vivo путем контакта с количеством ингибитора mTOR, которое повышает количество отрицательных по PD1 иммунных эффекторных клеток, например T-клеток, или увеличивает соотношение отрицательные по PD1 иммунные эффекторные клетки, например T-клетки/положительные по PD1 иммунные эффекторные клетки, например T-клетки.
[0043] В одном варианте осуществления введение низкой повышающей иммунитет дозы ингибитора mTOR, например аллостерического ингибитора, например RAD001, или каталитического ингибитора, начинают до введения экспрессирующих CAR клеток, описанных в настоящем описании, например T-клеток или NK-клеток. В одном варианте осуществления клетки с CAR вводят после достаточного периода времени или достаточного дозирования ингибитора mTOR, чтобы уровень отрицательных по PD1 иммунных эффекторных клеток, например T-клеток, или соотношение отрицательные по PD1 иммунные эффекторные клетки, например T-клетки/положительные по PD1 иммунные эффекторные клетки, например T-клетки, по меньшей мере временно увеличивались.
[0044] В одном варианте осуществления клетку, например, T-клетку или NK-клетку, подлежащую модификации способами инженерии для экспрессии CAR, собирают после достаточного периода времени или после достаточного дозирования низкой усиливающей иммунитет дозы ингибитора mTOR, чтобы уровень отрицательных по PD1 иммунных эффекторных клеток, например, T-клеток, или соотношение отрицательные по PD1 иммунные эффекторные клетки, например T-клетки/положительные по PD1 иммунные эффекторные клетки, например T-клетки, у индивидуума или взятые от индивидуума, по меньшей мере временно увеличивались.
[0045] В одном варианте осуществления клетки, экспрессирующие молекулу CAR, например, молекулу CAR, описанную в настоящем описании, вводят в комбинации со средством, которое смягчает один или более побочных эффектов, ассоциированных с введением клеток, экспрессирующих молекулу CAR, например средством, описанным в настоящем описании.
[0046] В одном варианте осуществления клетки, экспрессирующие молекулу CAR, например молекулу CAR, описанную в настоящем описании, вводят в комбинации со средством, которое осуществляет лечение заболевания, ассоциированного с экспрессией мезотелина, например средством, описанным в настоящем описании.
[0047] В одном варианте осуществления клетки, экспрессирующие молекулу CAR, например, молекулу CAR, описанную в настоящем описании, вводят в дозе и/или по схеме дозирования, которые описаны в настоящем описании.
[0048] В одном варианте осуществления клетки, экспрессирующие молекулу CAR, например молекулу CAR, описанную в настоящем описании, вводят в качестве терапии первой линии от заболевания, например злокачественной опухоли, например злокачественной опухоли, описанной в настоящем описании. В другом варианте осуществления клетки, экспрессирующие молекулу CAR, например молекулу CAR, описанную в настоящем описании, вводят в качестве второй, третьей, четвертой линии терапии заболевания, например злокачественной опухоли, например злокачественной опухоли, описанной в настоящем описании.
[0049] В одном варианте осуществления вводят популяцию клеток, описанных в настоящем описании.
[0050] В одном варианте осуществления молекулу CAR вводят в T-клетки или NK-клетки, например, с использованием транскрипции in vitro, и индивидууму (например, человеку) проводят первоначальное введение клеток, содержащих молекулу CAR, и одно или более последующих введений клеток, содержащих молекулу CAR, где одно или более последующих введений проводят менее чем через 15 суток, например, через 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3 или 2 суток, после предшествующего введения. В одном варианте осуществления более одного введения клеток, содержащих молекулу CAR, проводят у индивидуума (например, человека) в неделю, например проводят 2, 3 или 4 введения клеток, содержащих молекулу CAR, в неделю. В одном варианте осуществления индивидууму (например, человеку) проводят более одного введения клеток, содержащих молекулу CAR, в неделю (например, 2, 3 или 4 введения в неделю) (также называемые в настоящем описании курсом), а затем следует одна неделя без введения клеток, содержащих молекулу CAR, а затем проводят одно или более дополнительных введений индивидууму клеток, содержащих молекулу CAR (например, более одного введения клеток, содержащих молекулу CAR, в неделю). В другом варианте осуществления у индивидуума (например, человеку) проводят более одного курса введения клеток, содержащих молекулу CAR, и время между курсами составляет менее 10, 9, 8, 7, 6, 5, 4 или 3 суток. В одном варианте осуществления клетки, содержащие молекулу CAR, вводят раз в двое суток с 3 введениями в неделю. В одном варианте осуществления клетки, содержащие молекулу CAR, вводят в течение по меньшей мере двух, трех, четырех, пяти, шести, семи, восьми или более недель.
[0051] В одном аспекте изобретение включает популяцию аутологичных или аллогенных клеток, которые трансфицированы или трансдуцированы вектором, содержащим молекулу нуклеиновой кислоты, кодирующую молекулу CAR против мезотелина, например, как описано в настоящем описании. В одном варианте осуществления вектор представляет собой ретровирусный вектор. В одном варианте осуществления вектор представляет собой самоинактивирующийся лентивирусный вектор, как описано в настоящем описании. В одном варианте осуществления вектор доставляют (например, путем трансфекции или электропорации) в клетку, например T-клетку или NK-клетку, где вектор содержит молекулу нуклеиновой кислоты, кодирующую молекулу CAR против мезотелина, как описано в настоящем описании, которая транскрибируется в молекулу мРНК, и с молекулы РНК транслируется молекула CAR против мезотелина и экспрессируется на поверхности клетки.
[0052] В другом аспекте настоящее изобретение относится к популяции экспрессирующих CAR клеток, например CART-клеток. В некоторых вариантах осуществления популяция экспрессирующих CAR клеток содержит смесь клеток, экспрессирующих различные CAR. Например, в одном варианте осуществления популяция CART-клеток может включать первую клетку, экспресссирующую CAR, имеющий мезотелин-связывающий домен, описанный в настоящем описании, и вторую клетку, экспрессирующую CAR, имеющий другой связывающий мезотелин домен, например, мезотелин-связывающий домен, описанный в настоящем описании, который отличается от мезотелин-связывающего домена в CAR, экспрессируемом первой клеткой. В качестве другого примера, популяция экспрессирующих CAR клеток может включать первую клетку, экспрессирующую CAR, который включает мезотелин-связывающий домен, например, как описано в настоящем описании, и вторую клетку, экспрессирующую CAR, который включает антигенсвязывающий домен для мишени, отличной от мезотелина (например, мишень, отличная от мезотелина, на стромальных клетках, например FAP; мишень, отличная от мезотелина, на клетках рака предстательной железы, например рецептор андрогена, OR51E2, PSMA, PSCA, PDGRF-β, TARP, GloboH, MAD-CT-1 или MAD-CT-2; мишень, отличная от мезотелина, на клетках рака яичника, например Tn, PRSS21, CD171, Lewis Y, рецептор фолатов α, клаудин 6, GloboH или белок спермы 17; например, мишень, отличная от мезотелина, на клетках рака легкого, например VEGF, HER3, IGF-1R, EGFR, DLL4 или Trop-2). В одном варианте осуществления популяция экспрессирующих CAR клеток включает, например, первую клетку, экспрессирующую CAR, который включает первичный внутриклеточный сигнальный домен, и вторую клетку, экспрессирующую CAR, который включает вторичный сигнальный домен.
[0053] В другом аспекте настоящее изобретение относится популяции клеток, где по меньшей мере одна клетка в популяции экспрессирует CAR, имеющий мезотелин-связывающий домен, описанный в настоящем описании, и вторая клетка экспрессирует другое средство, например, средство, которое повышает активность или функцию CAR-экспрессирующей клетки. Например, в одном варианте осуществления средство может представлять собой средство, которое ингибирует молекулу, которая модулирует или регулирует, например ингибирует, функцию T-клеток. В некоторых вариантах осуществления молекула, которая модулирует или регулирует T-клеточную функцию, представляет собой ингибиторную молекулу, например, средство, описанное в настоящем описании. Примеры ингибиторных молекул включают PD1, PD-L1, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4 и TGFR-бета. В одном варианте осуществления средство, например, ингибиторную нуклеиновую кислоту, например дцРНК, например миРНК или кшРНК; или, например, ингибиторный белок или систему, например короткие палиндромные повторы, регулярно расположенные кластерами (CRISPR), нуклеазу, подобную активатору транскрипции (TALEN), или эндонуклеазу с цинковыми пальцами (ZFN), например, как описано в настоящем описании, можно использовать для ингибирования экспрессии молекулы, которая модулирует или регулирует, например ингибирует, T-клеточную фунукцию в CAR-экспрессирующей клетке. В одном варианте осуществления средство представляет собой кшРНК, например, кшРНК, описанную в настоящем описании. В одном варианте осуществления средство, которое модулирует или регулирует, например ингибирует, T-клеточную функцию, ингибируется в CAR-экспрессирующей клетке. Например, молекула дцРНК, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например ингибирует, T-клеточную функцию, связана с нуклеиновой кислотой, которая кодирует компонент, например, все компоненты CAR.
[0054] В одном варианте осуществления средство, которое ингибирует ингибирующую молекулу, содержит первый полипептид, например, ингибиторную молекулу, связанный со вторым полипептидом, который дает положительный сигнал клетке, например, внутриклеточным сигнальным доменом, описанным в настоящем описании. В одном варианте осуществления средство содержит первый полипептид, например, из ингибиторной молекулы, такой как PD1, PD-L1, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, CTLA4, VISTA, CD160, BTLA, LAIR1, TIM3, 2B4, TGFR-бета и TIGIT, или фрагмент любой из них (например, меньшей мере часть внеклеточного домена любой из них), и второй полипептид, который представляет собой внутриклеточный сигнальный домен, описанный в настоящем описании (например, содержащий костимулирующий домен (например, 41BB, CD27 или CD28, например, как описано в настоящем описании) и/или первичный сигнальный домен (например, сигнальный домен CD3-зета, описанный в настоящем описании)). В одном варианте осуществления средство содержит первый полипептид из PD1 или его фрагмента (например, по меньшей мере часть внеклеточного домена PD1), и второй полипептид внутриклеточного сигнального домена, описанный в настоящем описании (например, сигнальный домен CD28, описанный в настоящем описании, и/или сигнальный домен CD3-зета, описанный в настоящем описании).
[0055] В одном варианте осуществления молекула нуклеиновой кислоты, кодирующая молекулу CAR против мезотелина, например, как описано в настоящем описании, экспрессируется в качестве молекулы мРНК. В одном варианте осуществления генетически модифицированные экспрессирующие CAR против мезотелина клетки, например, T-клетки или NK-клетки, можно получать путем трансфекции или электропорации молекулы РНК, кодирующей желаемые CAR (например, без векторной последовательности), в клетку. В одном варианте осуществления молекула CAR против мезотелина транслируется с молекулы РНК после введения и экспрессии ее на поверхности рекомбинантной клетки.
[0056] В другом аспекте изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей молекулу CAR, например молекулу CAR, описанную в настоящем описании, к молекуле CAR, описанной в настоящем описании, к вектору, содержащему молекулу CAR, описанную в настоящем описании, и/или к клетке, содержащей молекулу CAR, описанную в настоящем описании, для применения в качестве лекарственного средства.
[0057] В другом аспекте изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей молекулу CAR, описанную в настоящем описании, к молекуле CAR, описанной в настоящем описании, к вектору, содержащему молекулу CAR, описанную в настоящем описании, и/или к клетке, содержащей молекулу CAR, описанную в настоящем описании, для применения для лечения заболевания, при котором экспрессируется мезотелин, например, как описано в настоящем описании.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0058] На фиг.1 представлена схема плазмиды pD-A.anti-meso BD.OF.BBZ.2bg.150A. На фиг. SEQ ID NO: 271 представлена в качестве "150A".
[0059] На фиг.2 представлено получение клеток и схемы лечения, которые можно использовать. (A) Аутологичные клетки получают посредством афереза лейкоцитов и T-клетки увеличивают в количестве путем экспансии с использованием покрытых mAb против CD3/CD28 магнитных гранул. Клетки увеличивают в количестве в течение от 8 до 12 суток. На последние сутки культивирования гранулы извлекают с помощью магнитного поля и клетки промывают, подвергают электропорации с использованием конструкции мРНК meso-CAR человека, и замораживают в инфузируемой среде. (B) Представлены схемы инфузионного введения. В первой 1 схеме пациентам вводят 1×108 meso-содержащих CART-клеток человека посредством внутривенной (в/в) инфузии на 0 сутки, а затем 1×109 meso-содержащих CART-клеток человека через одну неделю. Мониторинг безопасности можно проводить в течение минимум одного месяца до того, как пациентам можно будет проводить схему 2. В схеме 2 пациентам вводят 1×108 meso-содержащих CART-клеток человека посредством в/в инфузии три раза в неделю в течение одной недели, за которой следует одна неделя покоя, а затем 1×109 meso-содержащих CART-клеток человека вводят три раза в неделю в течение одной недели. В схеме 3 пациентам вводят 3×108/м2 meso-содержащих CART-клеток человека посредством в/в инфузии три раза в неделю в течение трех недель, а затем проводят внутриопухолевую инъекцию в первичный очаг повреждения 2×108 meso-содержащих CART-клеток человека на сутки +35 и +57.
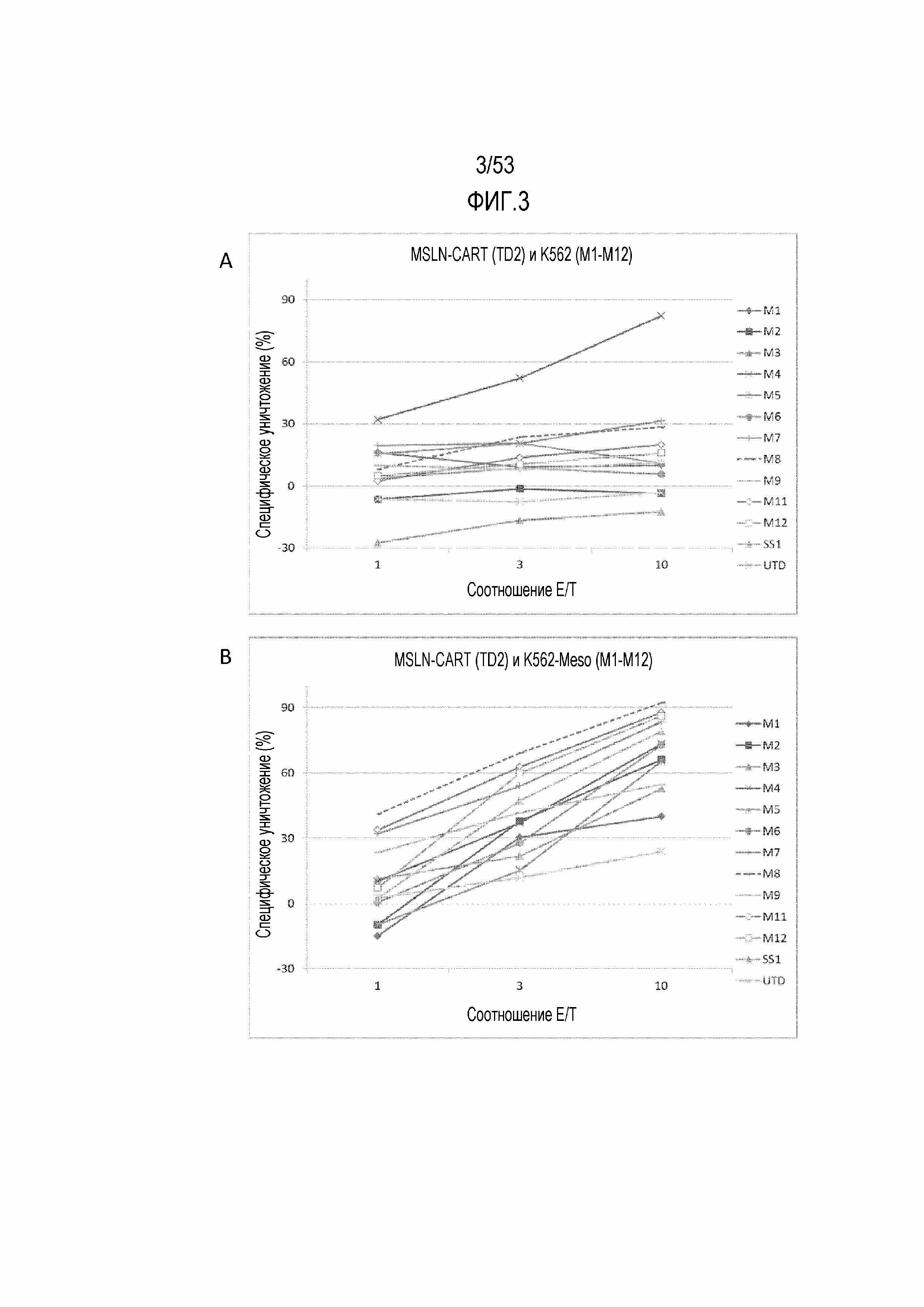
[0060] На фиг.3A и 3B показано графическое представление цитотоксичности для проанализированных T-клеток донора 2 (здоровый донор), трансдуцированных CAR SS1 мыши или CAR против MSLN с M1 по M12 по изобретению и культивированных либо с контрольными клетками K562, которые не экспрессируют MSLN, как показано на фиг.3A, либо с клетками K562, трансдуцированными для экспрессии MSLN (K562-Meso), как показано на фиг.3B.
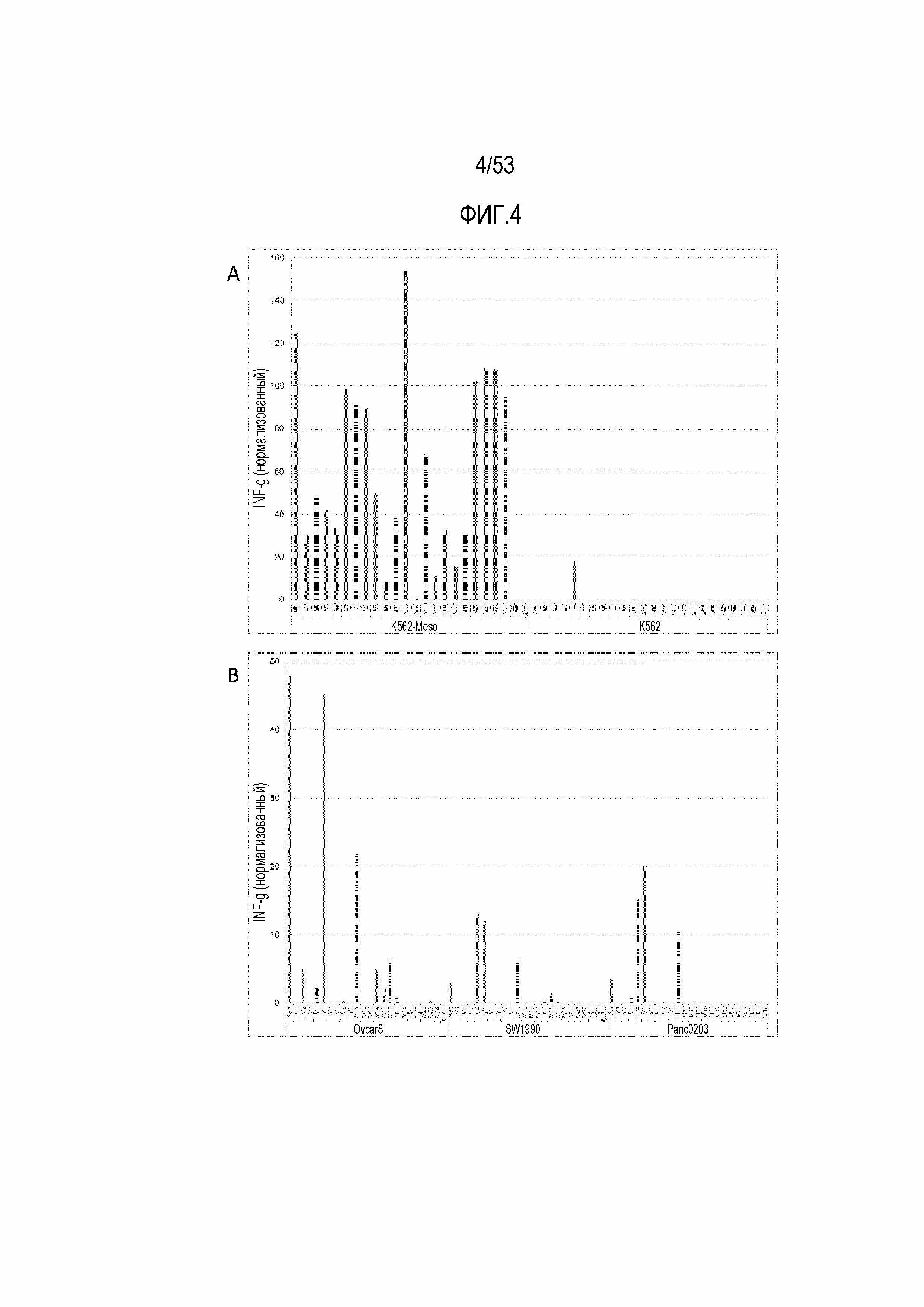
[0061] На фиг.4A и 4B представлены графики, демонстрирующие секрецию IFNγ из CART SS1 мыши, и CART против CD19 мыши, и CART против MSLN при стимуляции MSLN+ клетками. На фиг.4A представлена реактивность в отношении трансдуцированной клеточной линии K562-Meso и ее отрицательной по MSLN родительской клеточной лини K562. На фиг.4B представлена реактивность в отношении злокачественных клеток, естественным образом экспрессирующих MSLN; линии рака яичника Ovcar8 и линий рака поджелудочной железы SW1990 и Panc0203.
[0062] На фиг.5 представлена схема клинических испытаний для CART против мезотелина, полученных путем трансдукции конструкции CAR с использованием лентивирусного вектора.
[0063] На фиг.6A, 6B, 6C и 6D представлена противоопхуолевая активность CART-meso-клеток.
[0064] На фиг.7A, 7B и 7C представлена выносливость in vivo CARTmeso-клеток и перенос в области первичных и метастатических опухолей.
[0065] На фиг.8 представлены цитокины и хемокины в сыворотке после инфузии CARTmeso-клеток.
[0066] На фиг.9A и 9B представлена индукция CARTmeso-клетками протипоопухолевых антител. Сыворотки получали от пациента с MPM (фиг.9A) и пациента с раком поджелудочной железы (фиг.9B).
[0067] На фиг.10 представлен рост опухоли у мышей NSG, которым инъецировали клетки опухоли EMMESO. После роста опухолей до размера ~200 мм3, mesoCAR T-клетки инъецировали через хвостовую вену и проводили измерение в течение 39 суток после инъекции.
[0068] На фиг.11A и 11B представлена экспрессия mesoCAR посредством анализа с использованием проточной цитометрии в момент инъекции (фиг.11A) или через 40 суток в момент сбора из ксенотрансплантатов опухолей.
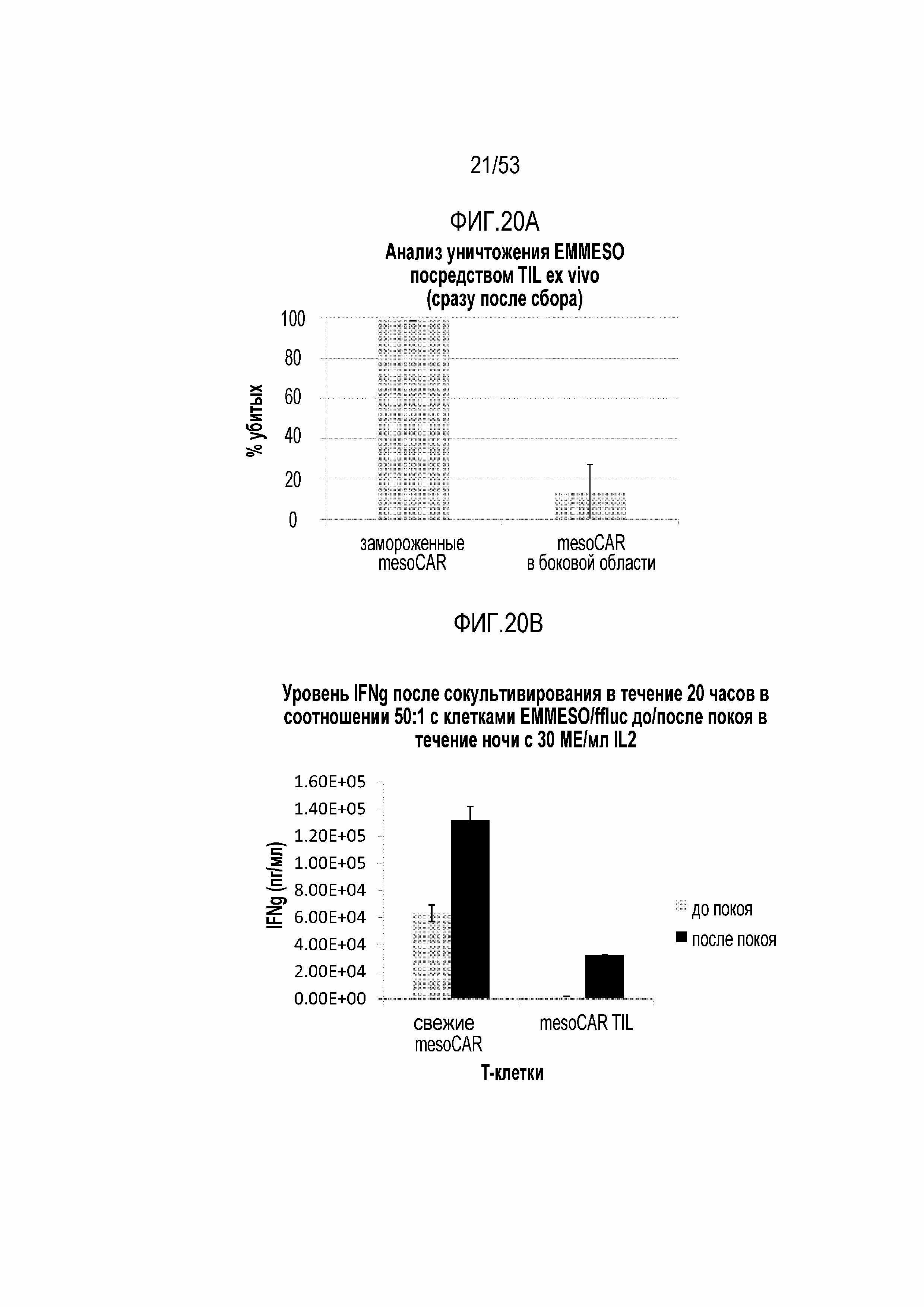
[0069] На фиг.12 представлена функциональная способность mesoCAR T-клеток в отношении уничтожения in vitro при выделении из боковых областей мышей NSG через 39 суток или при криоконсервации после трансдукции.
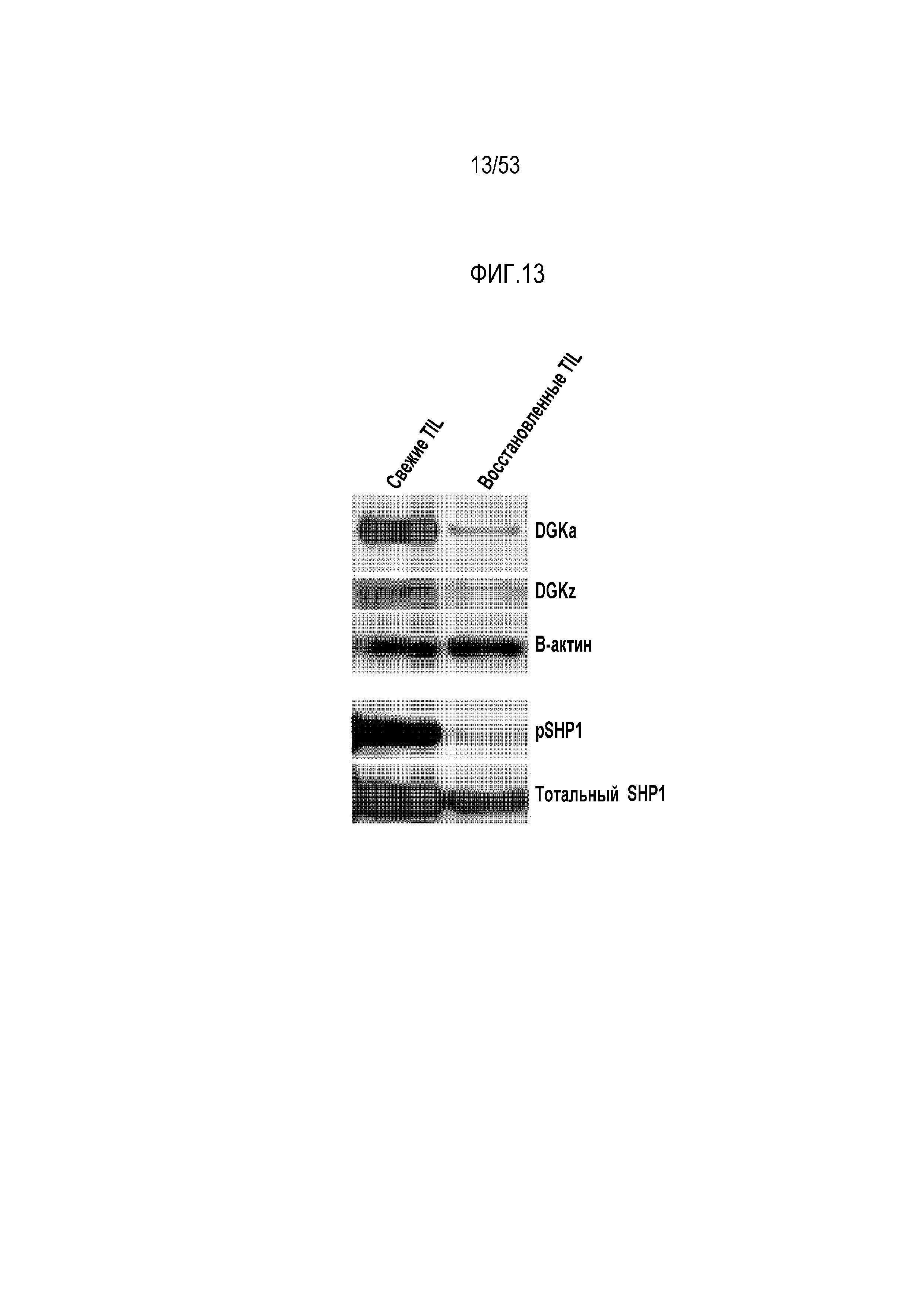
[0070] На фиг.13 представлена экспрессия ингибиторных ферментов DGK и SHP1 в TIL, выделенных из боковых опухолей EMESO по сравнению с покоившимися в течение ночи TIL.
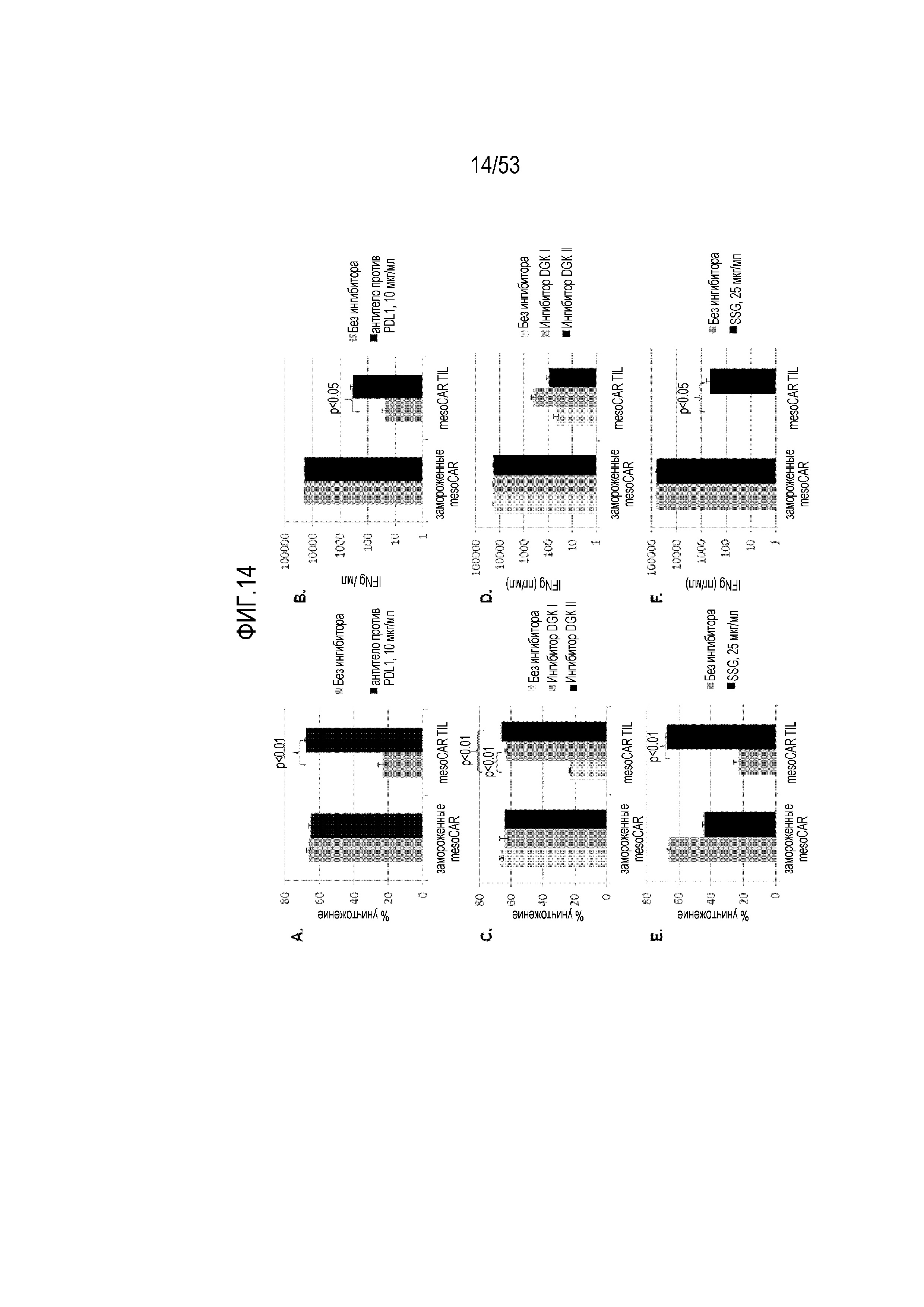
[0071] На фиг.14A, 14B, 14C, 14D, 14E и 14F представлен эффект введения ингибиторов (антитело против PDL1, ингибитор DGK и SSG) ингибиторных механизмов, которые подавляют функцию mesoCART, на уничтожение опухолевых клеток (фиг.14A, 14C и 14E) и секреция цитокина IFN-гамма (фиг.14B, 14C и 14F).
[0072] На фиг.15A, 15B, 15C и 15D представлена секреция цитокинов из небольшой панели CART-MSLN человека после стимуляции различными опухолевыми клеточными линиями. На фиг.15A представлена секреция IFN-гамма. На фиг.15B представлена секреция TNF. На фиг.15C представлена секреция IL-2. На фиг.15D представлена секреция IL-4.
[0073] На фиг.16A и 16B представлены результаты анализа уничтожения CART-MSLN-5, CART-MSLN-11, CART-MSLN17 и CART-MSLN-SS1 мыши в отношении опухолевых клеток Ovcar3 (фиг.16A) и U87mg (фиг.16B).
[0074] На фиг.17A и 17B представлены результаты анализа уничтожения для панели CART-MSLN против опухолевых клеток Ovcar3.
[0075] На фиг.18 представлена противоопухолевая активность первого набора CART-MSLN (включая M5, M11, M17 и M21) в модели ксенотрансплантата Ovcar8.
[0076] На фиг.19 представлена противоопухолевая активность второго набора CART-MSLN (включая M12, M14, M16 и M23) в модели ксенотрансплантата Ovcar8.
[0077] На фиг.20A, 20B и 20C представлена утрата функциональности mesoCAR T-клеток в микроокружении опухоли (TIL) с течением времени по сравнению со свежими или размороженными mesoCAR T-клетками. A) Анализ цитотоксичности; B) анализ высвобождения IFNγ; и C) анализ передачи сигнала ERK с использованием вестерн-блоттинга (через фосфорилирование).
[0078] На фиг.21 представлен эффект делеции DGK на цитотоксичность mesoCAR T-клеток. Процентное уничтожение клеток-мишеней оценивают в различных соотношениях эффектор:мишень.
[0079] На фиг.22 представлен эффект делеции DGK на продукцию IFNγ и высвобождение из mesoCAR T-клеток. Концентрацию IFNγ оценивают при различных соотношениях эффектор:мишень.
[0080] На фиг.23 представлен эффект делеции DGK на передачу сигнала ERK или активацию T-клеток в mesoCAR T-клетках. B: альбумин, M: мезотелин, 3/28: клетки, стимулированные CD3/CD28.
[0081] На фиг.24 представлен эффект делеции DGK на чувствительность к TGFβ mesoCAR T-клеток в отношении цитотоксической активности.
[0082] На фиг.25A и 25B представлен эффект делеции DGK на терапевтическую эффективность mesoCAR T-клеток в модели опухоли мыши. A) Эффект на противоопухолевую активность показан посредством объема опухоли с течением времени. B) Выносливость и пролиферация опухолевых инфильтрирующих клеток.
[0083] На фиг.26A, 26B, 26C, 26D, 26E и 26F представлена продукция цитокинов и высвобождение цитотоксических медиаторов в экспрессирующих CAR T-клетках со сниженными уровнями Ikaros. На фиг.26A представлена экспрессия Ikaros в CAR T-клетках дикого типа и Ikzf1+/- при измерении с использованием проточной цитометрии (левая панель) и вестерн-блоттинга (правая панель). После стимуляции покрытыми мезотелином гранулами, PMA/иономицином (PMA/I) или покрытыми BSA гранулами (контроль), определяли процент клеток, продуцирующих IFN-γ (фиг.26B), TNF-α (фиг.26C) и IL-2 (фиг.26D), экспрессию цитотоксического медиатора гранзима B (фиг.26E) и CD107a (фиг. 26F).
[0084] На фиг.27A, 27B и 27C представлена продукция цитокинов и высвобождение цитотоксических медиаторов в экспрессирующих CAR T-клетках с доминантно-негативным аллелем Ikaros (IkDN). После стимуляции покрытыми мезотелином гранулами, PMA/иономицином (PMA/I) или покрытыми BSA гранулами (контроль), определяли процент клеток, продуцирующих IFN-γ (фиг.27A), IL-2 (фиг.27B) и экспрессию CD107a (фиг.27C).
[0085] На фиг.28A, 28B, 28C, 28D и 28E показано, что устранение Ikaros не усиливало активацию и передачу сигнала в CAR T-клетках после стимуляции антигеном. Уровни CD69 (фиг.28A), CD25 (фиг.28B) и 4-1BB (фиг.28C) определяли проточной цитометрией в указанные моменты времени в Ikzf1+/- CAR T-клетках. На фиг.28D, исследовали пути передачи сигнала RAS/ERK в клетках дикого типа (WT) и доминантно-негативных по Ikaros клетках (IkDN) после стимуляции TCR антителами против CD3/CD28. Уровни фосфорилированных сигнальных белков TCR, таких как фосфорилированная PLCγ, фосфорилированная Lck, фосфорилированная JNK, фосфорилированная Akt, фосфорилированная ERK, фосфорилированный IKKα и IκBα, оценивали с использованием вестерн-блоттинга. На фиг.28E клетки WT и IkDN, трансдуцированные mesoCAR, стимулировали BSA или покрытыми мезотелином гранулами и нижеследующие пути передачи сигнала исследовали с использованием вестерн-блоттинга путем оценки уровней фосфорилированной ERK и фосфорилированной PLCγ.
[0086] На фиг.29A, 29B, 29C, 29D и 29E показано, что снижение уровня Ikaros в CAR T-клетках усиливает ответ против клеток-мишеней AE17 или мезотелин-экспрессирующих AE17 (AE17 meso) in vitro. На фиг.29A представлена продукция IFNγ в meso CART-клетках WT и Ikzf1+/- при указанных соотношениях эффектор:мишень. Цитолиз экспрессирующих meso CAR WT и Ikzf1+/- (фиг.29B) и IkDN (фиг.29C) измеряли при указанных соотношениях эффектор:мишень. Продукцию IFNγ (фиг.29D) и цитолиз (фиг.29E) WT и Ikzf1+/-, трансдуцированных FAP-CAR, измеряли при указанных соотношениях эффектор:клетка-мишень, где клетки-мишени представляли собой экспрессирующие FAP клетки 3T3.
[0087] На фиг.30A, 30B и 30C представлена эффективность CAR T-клеток с истощением Ikaros против развернутых опухолей in vivo. CAR T-клетки вводили мышам, содержащим развернутые экспрессирующие мезотелин опухоли AE17. Объем опухоли измеряли после введения mesoCAR-экспрессирующих WT и Ikzf1+/- (фиг.30A) или IkDN (FIG. 30B). Объем опухоли измеряли после введения FAP-CAR-экспрессирующих WT и Ikzf1+/- (фиг.30C).
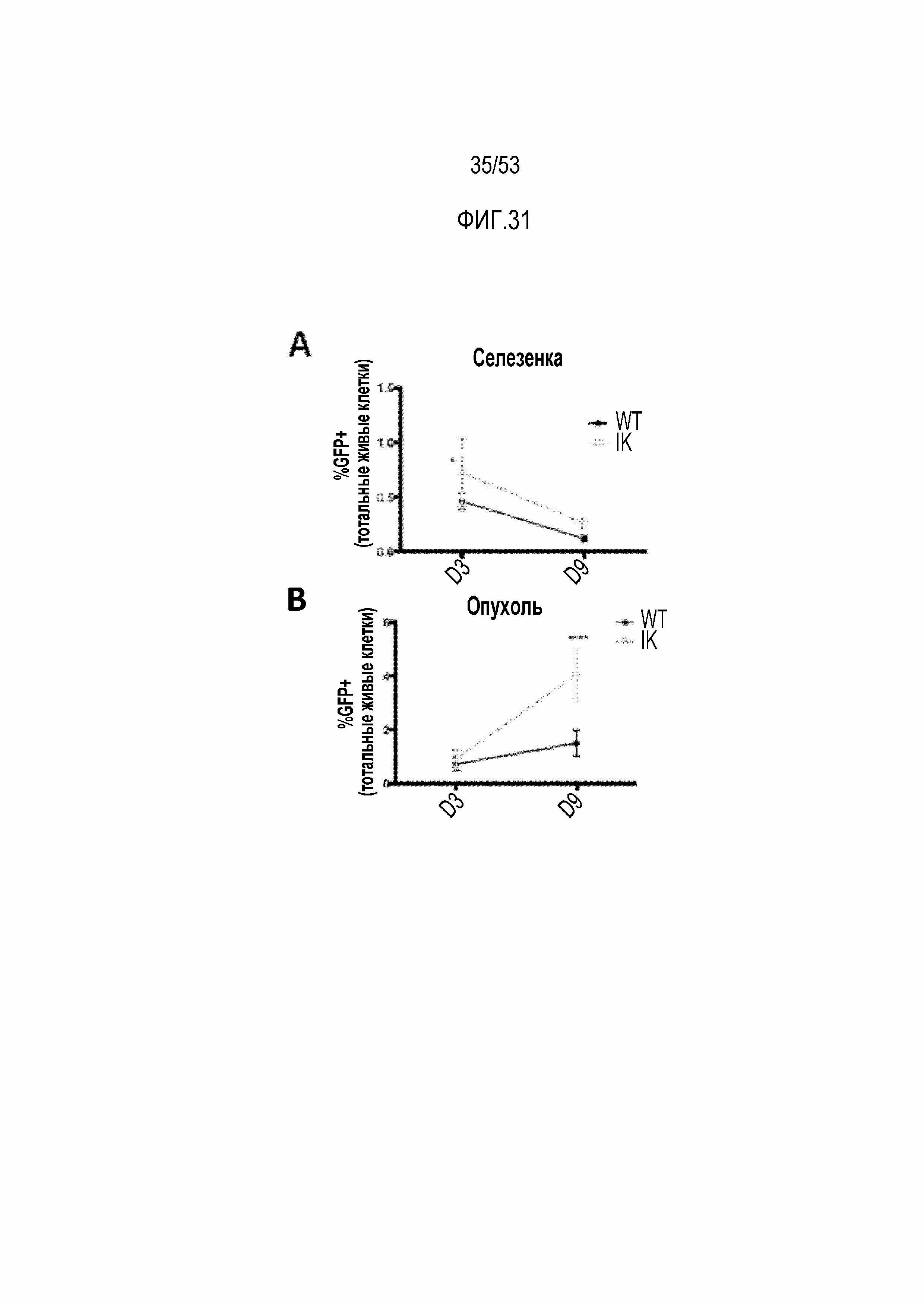
[0088] На фиг.31A, 31B, 31C, 31D, 31E и 31F представлена увеличенная устойчивость Ikzf1+/- CAR T-клеток в иммунодепрессивном микроокружении опухоли по сравнению с CAR T-клетками WT. Процент экспресирующих CAR клеток WT или Ikzf1+/- (GFP-положительные) выявляли проточной цитометрией клеток, полученных из селезенки (фиг.31A) и опухолей (фиг.31B). Функциональную способность CAR T-клеток, собранных через 3 суток после инфузии, из селезенки или опухолей оценивали путем измерения продукции IFNγ после стимуляции антителами против CD3/CD28 (фиг.31C) или PMA/иономицином (PMA/I) (фиг.31D). Регуляторные T-клетки (экспрессия CD4+FoxP3+) и макрофаги (экспрессия CD206) оценивали путем измерения экспрессии маркеров Treg или макрофагов на CAR T-клетках, собранных через 9 суток после инфузии, из селезенок или опухолей.
[0089] На фиг.32A и 32B показано, что T-клетки со сниженными уровнями Ikaros являются менее чувствительными к растворимым ингибиторным факторам TGFβ и аденозину. Экспрессирующие MesoCAR клетки WT, Ikzf1+/- и IkDN исследовали в отношении их способности продуцировать IFNγ (фиг.32A) и цитотоксичности (фиг.32B) в ответ на TGF-β или аденозин.
[0090] На фиг.33A и 33B представлены графики, демонстрирующие увеличение титров вакцинных штаммов гриппа по сравнению с плацебо. На фиг.33A увеличение выше исходного уровня среднего геометрического значения титров вируса гриппа в отношении каждого из 3 вакцинных штаммов гриппа (H1N1 A/California/ 07/2009, H3N2 A/Victoria/210/2009, B/Brisbane/60/ 2008) относительно увеличения в группе плацебо через 4 недели после вакцинации показано для каждой из групп дозирования RAD001 в выборке пациентов с намерением лечиться. Жирной черной линией указано увеличение титров в 1,2 раза относительно плацебо, для которого требовалось, чтобы для 2 из 3 вакцинных штаммов гриппа удовлетворялся первичный результат исследования. Звездочкой "*" указано, что увеличение титра GMT относительно плацебо превышает 1 с апостериорной вероятностью по меньшей мере 80%. На фиг.33B представлен график для тех же данных, что и на фиг.33A для подгруппы индивидуумов с исходными титрами вируса гриппа <=1:40.
[0091] На фиг.34 показан график рассеяния для концентрации RAD001 против кратности увеличения геометрического среднего значения титра для каждого вакцинного штамма гриппа через 4 недели после вакцинации. Концентрации RAD001 (через 1 час после введения дозы) измеряли после дозирования индивидуумам в течение 4 недель. Все индивидуумы, для которых были проведены фармакокинетические измерения, были включены в анализируемую группу. Кратность увеличения геометрического среднего значения титров через 4 недели после вакцинации относительно исходного уровня показан на оси y.
[0092] На фиг.35 показано графическое представление, демонстрирующее увеличение титров в отношении гетерологичных штаммов вируса гриппа по сравнению с плацебо. Увеличение геометрического среднего значения титров вируса гриппа для 2 гетерологичных штаммов вируса (A/H1N1 штамм A/New Jersey/8/76 и A/H3N2 штамм A/Victoria/361/11), не содержавшихся в вакцине против вируса гриппа относительно увеличения в группе плацебо через 4 недели после вакцинации показано для каждой из групп дозирования RAD001 в выборке пациентов с намерением лечиться. * указывает на увеличение титра относительно плацебо, превышающее 1, с апостериорной вероятностью по меньшей мере 80%.
[0093] На фиг.36A и 36B показаны графические представления уровней IgG и IgM до и после вакцинации против гриппа. Уровни IgG и IgM против гриппа A/H1N1/California/07/2009 измеряли в сыворотке, полученной от индивидуумов до и через 4 недели после вакцинации против гриппа. Не было обнаружено значительных отличий в изменении от исходного уровня до 4 недель после вакцинации уровней IgG и IgM против гриппа H1N1 между группами RAD001 и плацебо (все значения p>0,05 согласно критерию суммы рангов Крускала-Уоллиса).
[0094] На фиг.37A, 37B и 37C показаны графические представления снижения процента положительных по PD-1 CD4 и CD8 и увеличения отрицательных по PD-1 CD4 T-клеток после лечения RAD001. Процент положительных по PD-1 CD4, CD8 и отрицательных по PD-1 CD4 T-клеток определяли с использованием FACS-анализа образцов PBMC на исходном уровне, после введения лекарственного средства в течение 6 недель (6 недель) и через 6 после прекращения введения исследуемого лекарственного средства и через 4 недели после вакцинации против гриппа (12 неделя). На фиг.37A показано, что происходило значительное снижение (-37,1 − -28,5%) уровня положительных по PD-1 CD4 T-клеток на 12 неделе в группах, в которых вводили RAD001 при уровнях дозы 0,5 мг/сутки (n=25), 5 мг/неделя (n=29) и 20 мг/неделя (n=30) по сравнению с группой плацебо (n=25) с p=0,002 (0,02), p=0,003 (q=0,03) и p=0,01 (q=0,05) соответственно. На фиг.37B показано, что происходило значительное снижение (-43,3 − -38,5%) уровня положительных по PD-1 CD8 T-клеток на 12 неделе в группах, в которых вводили RAD001 (n=109), при уровнях доз 0,5 мг/сутки (n=25), 5 мг/неделя (n=29) и 20 мг/неделя (n=30) по сравнению с группой плацебо (n=25) с p=0,01 (0,05), p=0,007 (q=0,04) и p= 0,01 (q=0,05), соответственно. На фиг.37C показано значительное увеличение (3,0 − 4,9%) уровня отрицательных по PD-1 CD4 T-клеток на 12 неделе в группах, в которых вводили RAD001 (n=109), при уровнях доз 0,5 мг/сутки (n=25), 5 мг/неделя (n=29) и 20 мг/неделя (n=30) по сравнению с группой плацебо (n=25) с p=0,0007 (0,02), p=0,03 (q=0,07), и p=0,03 (q=0,08), соответственно.
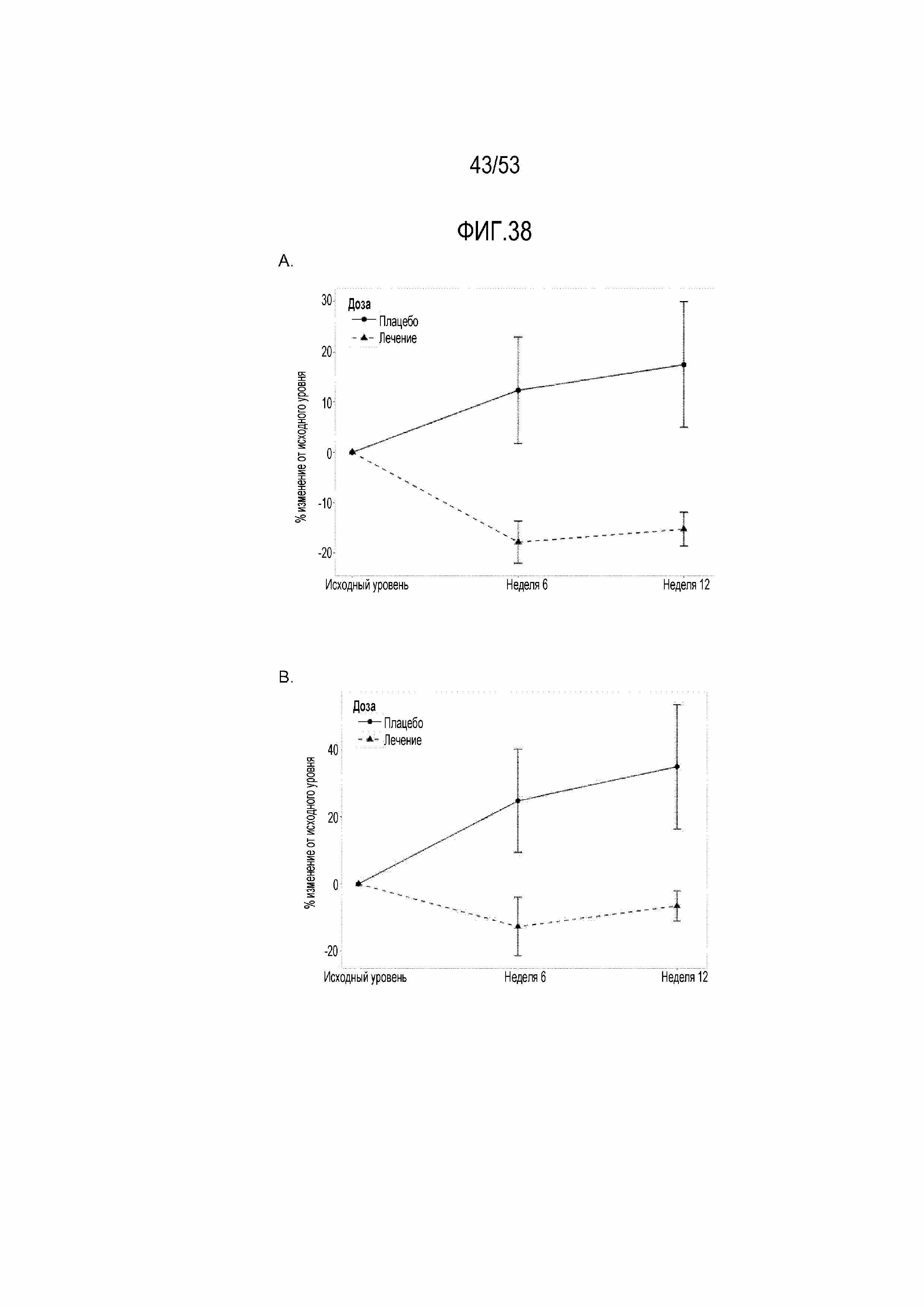
[0095] На фиг.38A и 38B показаны графические представления снижения процента положительных по PD-1 CD4 и CD8 T-клеток и увеличения отрицательных по PD-1 CD4 T-клеток после введения RAD001 с поправкой на различия в исходной экспрессии PD-1. Процент положительных по PD-1 CD4, CD8 и отрицательных по PD-1 CD4 T-клеток определяли с использованием FACS-анализа образцов PBMC на исходном уровне, после 6 недель введения исследуемого лекарственного средства (6 неделя), и через 6 недель после прекращения введения исследуемого лекарственного средства, и через 4 недели после вакцинации против гриппа (12 неделя). На фиг.38A показано значительное снижение, составляющее 30,2%, PD-1+ CD4 T-клеток на 6 неделе в объединенной группе RAD (n=84) по сравнению с группой плацебо (n=25) с p=0,03 (q=0,13). Снижение положительных по PD-1 CD4 T-клеток на 12 неделе в объединенной группе RAD по сравнению с группой плацебо составляет 32,7% с p=0,05 (q=0,19). На фиг.38B показано значительное снижение уровня положительных по PD-1 CD8 T-клеток, составляющее 37,4%, на 6 неделе в объединенной группе RAD001 (n=84) по сравнению с группой плацебо (n=25) с p=0,008 (q=0,07). Снижение положительных по PD-1 CD8 T-клеток на 12 неделе в объединенной группе RAD001 по сравнению с группой плацебо составляет 41,4% с p=0,066 (q=0,21). На фиг.38A и 38B представлены данные с фиг. 37A, 37B и 37C, но для других групп дозирования RAD001, чем на фиг.37A, 37B и 37C, объединенных в одну группу введения RAD001 на фиг.38A и 38B.
[0096] На фиг.39 представлено увеличение физической нагрузки и энергии у пожилых индивидуумов в ответ на RAD001.
[0097] На фиг.40A и 40B представлен спрогнозированный эффект RAD001 на активность P70 S6K в клетках. На фиг.40A представлено ингибирование киназы P70 S6 более высокими дозами RAD001, водимого раз в неделю и раз в сутки; на фиг.40B представлено ингибирование киназы P70 S6 более низкими дозами RAD001, вводимого раз в неделю.
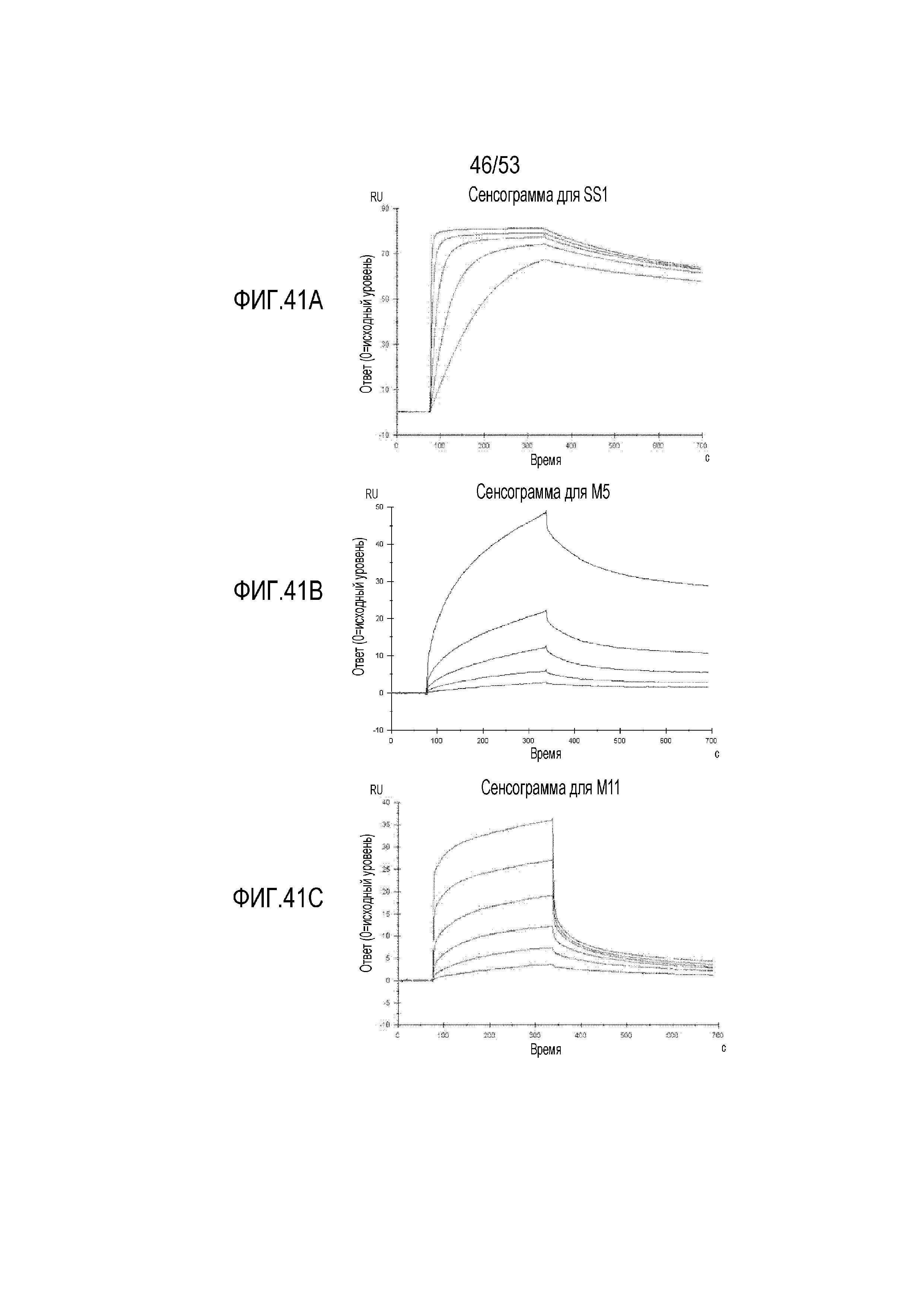
[0098] На фиг.41A, 41B и 41C представлены сенсограммы Biacore T200 SPR для scFv SS1 (фиг.41A), M5 (фиг.41B) и M11 (фиг.41C).
[0099] На фиг.42A, 42B и 42C представлены сенсограммы SPR для сортировки эпитопов для scFv против мезотелина человека по сравнению с scFv SS1 мыши. Конкурентное связывание наблюдали для scFv M12, M14, M16, M17, M21 и M23 (фиг.42A). ScFv M5 (фиг.42B) и M11 (фиг.42C) связываются с эпитопом, отличным от эпитопа SS1.
[00100] На фиг.43 представлен график, на котором показан рост опухоли после различных введений мезотелина CAR T в модели опухоли OVCAR8. Представлен средний объем опухоли +/- SEM до 62 суток после имплантации опухоли. T-клетки вводили на 14 и 19 сутки. Мелкие круги: мыши, которым вводили 100 мкл PBS через боковую хвостовую вену; черные квадраты: мыши, которым вводили изотипические контрольные T-клетки; серые треугольники: мыши, которым вводили одну дозу SS1 CAR T-клеток; перевернутые треугольники: мыши, которым вводили двойную дозу SS1 CAR T-клеток; ромбы: мыши, которым вводили одну дозу M5 CAR T-клеток; большие круги: мыши, которым вводили двойную дозу M5 CAR T-клеток; серые квадраты: мыши, которым вводили одну дозу M11 CAR T-клеток; и черные треугольники: мыши, которым вводили двойную дозу M11 CAR T-клеток.
[00101] На фиг.44 показано схематичное представление охвата пептидов мезотелина человека в анализе с использованием масс-спектрометрии водород-дейтериевого обмена. Каждая черная планка соответствует пептиду.
[00102] На фиг.45A и 45B показано графическое представление, демонстрирующее захват дейтерия мезотелином человека, когда он находился в комплексе с SS1 (черные столбики) и M5 (серые столбики). Различие захвата дейтерия при связывании антитела (показанного на оси y) представлено для каждого обнаруженного пептидного фрагмента (представленного на оси x), пептидами в аминокислотах 297-464 на фиг.45A и пептидами в аминокислотах 458-586 на фиг.45B. Все отличия приведены относительно захвата дейтерия несвязанным мезотелином (контроль). * обозначает области статистической значимости при использовании критерия Тьюки для отличий, составляющих менее 0,75 Да.
[00103] На фиг.46 показано схематическое представление, демонстрирующее первичную последовательность антигена мезотелина человека (аминокислоты 296-588) и области, защищенные посредством SS1 и M5. Черные планки обозначают аминокислоты, являющиеся защищенными, когда он находится в комплексе с SS1 (аминокислоты 314-315, 317-318, 346-349 и 369-375). Серые планки обозначают аминокислоты, защищенные, когда он находится в комплексе с M5 (аминокислоты 485-490, 498-507, 532-537 и 545-572). На фиг.47 показана общая карта, демонстрирующая различные конфигурации конструкций, кодирующих CAR, с кшРНК для совместной экспрессии CAR и кшРНК. На фиг.47A-47D показаны различные конфигурации на одном векторе, например, где регулируемая U6 кшРНК находится выше или ниже регулируемых EF1-альфа элементов, кодирующих CAR. В иллюстративных конструкциях, представленных на фиг.47A и 47B, транскрипция происходит через промоторы U6 и EF1-альфа в одном направлении. В иллюстративных конструкциях, представленных на фиг.47C и 47D, транскрипция происходит через промоторы U6 и EF1-альфа в различных направления. На фиг.47E, кшРНК (и соответствующий промотор U6) находится на первом векторе, а CAR (и соответствующий промотор EF1-альфа) находится на втором векторе (фиг.16E).
[00104] На фиг.48 представлены структуры двух иллюстративных конфигураций RCAR. Представители, связывающие антиген, содержат антигенсвязывающий домен, трансмембранный домен и домен переключения. Внутриклеточные связывающие представители содержат домен переключения, костимулирующий сигнальный домен и первичный сигнальный домен. Эти две конфигурации демонстрируют, что первый и второй домены переключения, описанные в настоящем описании, могут находиться в различных ориентациях в отношении антигенсвязывающего представителя и внутриклеточного связывающего представителя. Другие конфигурации RCAR дополнительно описаны в настоящем описании.
ПОДРОБНОЕ ОПИСАНИЕ
Определения
[00105] Если не определено иначе, все технические и научные термины, используемые в настоящем описании, обладают тем же значением, которое обычно подразумевает специалист в области, к которой относится изобретение.
[00106] Форма единственного числа относится к одному или более чем к одному (т.е. по меньшей мере к одному) грамматическому объекту в форме единственного числа. В качестве примера "элемент" означает один элемент или более одного элемента.
[00107] Термин "приблизительно", когда он относится к поддающейся измерению величине, такой как количество, период времени и т.п., охватывает отклонения ±20%, или в некоторых случаях ±10%, или в некоторых случаях ±5%, или в некоторых случаях ±1%, или в некоторых случаях ±0,1% от указанной величины, поскольку такие отклонения являются пригодными для выполнения описанных способов.
[00108] Термин "химерный рецептор антигена" или альтернативно "CAR" относится к набору полипептидов, как правило, двум в наиболее простых вариантах осуществления, который, когда находится в иммунной эффекторной клетке, обеспечивает специфичность клетки к клетке-мишени, как правило, злокачественной клетке, и индукцию внутриклеточного сигнала. В некоторых вариантах осуществления CAR содержит по меньшей мере внутриклеточный антигенсвязывающий домен, трансмембранный домен и цитоплазматический сигнальный домен (также обозначаемый в настоящем описании как "внутриклеточный сигнальный домен"), содержащий функциональный сигнальный домен, происходящий из стимулирующей молекулы и/или костимулирующей молекулы, как определено ниже. В некоторых аспектах полипептиды в наборе являются соседними друг с другом. В некоторых вариантах осуществления набор полипептидов включает переключатель димеризации, который в присутствии молекулы димеризации может связывать полипептиды друг с другом, например, может связывать антигенсвязывающий домен с внутриклеточным сигнальным доменом. В одном аспекте стимулирующая молекула представляет собой зета-цепь, связанную с T-клеточный рецепторным комплексом. В одном аспекте цитоплазматический сигнальный домен дополнительно содержит один или более функциональных сигнальных доменов, происходящих из по меньшей мере одной костимулирующей молекулы, как определено ниже. В одном аспекте костимулирующая молекула выбрана из костимулирующих молекул, описанных в настоящем описании, например, 4-1BB (т.е. CD137), CD27 и/или CD28. В одном аспекте CAR содержит химерный слитый белок, содержащий внеклеточный антигенсвязывающий домен, трансмембранный домен и внутриклеточный сигнальный домен, содержащий функциональный сигнальный домен, происходящий из стимулирующей молекулы. В одном аспекте CAR содержит химерный слитый белок, содержащий внеклеточный антигенсвязывающий домен, трансмембранный домен и внутриклеточный сигнальный домен, содержащий функциональный сигнальный домен, происходящий из костимулирующей молекулы, и функциональный сигнальный домен, происходящий из стимулирующей молекулы. В одном аспекте CAR содержит химерный слитый белок, содержащий внеклеточный антигенсвязывающий домен, трансмембранный домен и внутриклеточный сигнальный домен, содержащий два функциональных сигнальных домена, происходящих из одной или более костсимулирующей молекулы(молекул), и функциональный сигнальный домен, происходящий из стимулирующей молекулы. В одном аспекте CAR содержит химерный слитый белок, содержащий внеклеточный антигенсвязывающий домен, трансмембранный домен и внутриклеточный сигнальный домен, содержащий по меньшей мере два функциональных сигнальных домена, происходящих из одной или более костимулирующей молекулы(молекул), и функциональный сигнальный домен, происходящий из стимулирующей молекулы. В одном аспекте CAR содержит необязательную лидерную последовательность на N-конце (N-ter) слитого белка CAR. В одном аспекте CAR дополнительно содержит лидерную последовательность на N-конце внеклеточного антигенсвязывающего домена, где лидерная последовательность необязательно отщепляется от антигенсвязывающего домена (например, scFv) в ходе клеточного процессинга и локализации CAR на клеточной мембране.
[00109] Термин "сигнальный домен" относится к функциональной части белка, которая действует, передавая информацию в клетке для регуляции клеточной активности через определенные пути передачи сигнала путем образования вторичных посредников или функционирования в качестве эффекторов посредством ответа на таких посредников.
[00110] Как используют в рамках изобретения, термин "мезотелин" относится к белку мезотелину массой 40 кДа, который заякоривается на клеточной мембране посредством гликозилфосфатидилинозитольной (GPI) связи и N-концевого слущивающегося фрагмента массой 31 кДа, называемого мегакариоцит-стимулирующим фактором (MPF). Оба фрагмента содержат участки N-гликозилирования. Также термин относится к растворимому варианту по сплайсингу C-концевого фрагмента массой 40 кДа, называемому "растворимым мезотелином/родственный MPF". Предпочтительно, термин относится к мезотелину человека под номером доступа GenBank AAH03512.1, и его частям, образованным в результате естественного расщепления, например, экспрессируемым на клеточной мембране, например, на мембране злокачественных клеток.
[00111] Термин "антитело", как используют в рамках изобретения, относится к белку, или полипептидной последовательности, происходящим из молекулы иммуноглобулина, которая специфически связывается с антигеном. Антитела могут быть поликлональными или моноклональными, имеющими множество цепей или одноцепочечными, или интактными иммуноглобулинами, и они могут происходить из природных источников или из рекомбинантных источников. Антитела могут представлять собой тетрамеры молекул иммуноглобулинов.
[00112] Термин "фрагмент антитела" относится по меньшей мере к одной части антитела, которая сохраняет способность специфически взаимодействовать (например, путем связывания, пространственного препятствования, стабилизации/дестабилизации, пространственного распределения) с эпитопом антигена. Примеры фрагментов антител включают, но не ограничиваются ими, Fab, Fab', F(ab')2, Fv-фрагменты, фрагменты антител scFv, связанные дисульфидной связью Fv (sdFv), Fd-фрагмент, состоящий из доменов VH и CH1, линейные антитела, однодоменные антитела, такие как sdAb (либо VL, либо VH), домены VHH животных семейства верблюжьих, мультиспецифические антитела, образованные фрагментами антител, такими как двухвалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области, и выделенные CDR или другие связывающие эпитоп фрагменты антитела. Антигенсвязывающий фрагмент также может быть включен в однодоменные антитела, максиантитела, миниантитела, наноантитела, интраантитела, диантитела, триантитела, тетраантитела, v-NAR и бис-scFv (см., например, Hollinger and Hudson, Nature Biotechnology 23:1126-1136, 2005). Антигенсвязывающие фрагменты также могут быть пересажены в каркасы на основе полипептидов, таких как фибронектин типа III (Fn3)(см. патент США №: 6703199, в котором описаны миниантитела на основе полипептида фибронектина).
[00113] Термин "scFv" относится к слитому белку, содержащему по меньшей мере один фрагмент антитела, содержащий вариабельную область легкой цепи, и по меньшей мере один фрагмент антитела, содержащий вариабельную область тяжелой цепи, где вариабельные области легкой и тяжелой цепей связаны друг с другом, например, через синтетический линкер, например, короткий гибкий полипептидный линкер, и способному экспрессироваться в качестве одноцепочечного полипептида, и где scFv сохраняет специфичность интактного антитела, из которого он происходит. Если не указано, как используют в рамках изобретения, scFv может иметь вариабельные области VL и VH в любом порядке, например, относительно N-конца и C-конца полипептида scFv может содержать VL-линкер-VH или может содержать VH-линкер-VL.
[00114] Часть CAR по изобретению, содержащая антитело или фрагмент антитела, может существовать в различных формах, где антигенсвязывающий домен экспрессируется в качестве части непрерывной полипептидной цепи, включая, например, однодоменный фрагмент антитела (sdAb), одноцепочечное антитело (scFv), гуманизированное антитело или биспецифическое антитело (Harlow et al., 1999: Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, NY; Harlow et al., 1989: Antibodies: A Laboratory Manual, Cold Spring Harbor, New York; Houston et al., 1988, Proc. Natl. Acad. Sci. USA 85:5879-5883; Bird et al., 1988, Science 242:423-426). В одном аспекте антигенсвязывающий домен композиции CAR по изобретению содержит фрагмент антитела. В следующем аспекте CAR содержит фрагмент антитела, который содержит scFv.
[00115] Термин "тяжелая цепь антитела" относится к более крупной из двух типов полипептидных цепей, присутствующих в молекулах антитела в их встречающихся в природе конформациях, и обычно определяющему класс, к которому относится антитело.
[00116] Термин "легкая цепь антитела" относится к меньшей из двух типов полипептидных цепей, присутствующих в молекулах антител в их встречающихся в природе конформациях. Легкие цепи каппа (κ) и лямбда (λ)относятся к двум основным изотипам легких цепей антител.
[00117] Термин "рекомбинантное антитело" относится к антителу, которое получают с использованием технологии рекомбинантных ДНК, например, такому как антитело, экспрессируемое бактериофагом или дрожжевой экспрессирующей системой. Термин также следует истолковывать как антитело, полученное посредством синтеза молекулы ДНК, кодирующей антитело, причем эта молекула ДНК экспрессирует белок антитела или аминокислотную последовательность, характеризующую антитело, где ДНК или аминокислотная последовательность получены с использованием технологии рекомбинантных ДНК или аминокислотных последовательностей, которая доступна и хорошо известна в данной области.
[00118] Термин "антиген" или "Ag" относится к молекуле, которая индуцирует иммунный ответ. Иммунный ответ может вовлекать либо продукцию антител, либо активацию специфических иммунокомпетентных клеток, или оба из этих вариантов. Квалифицированному специалисту будет понятно, что любая макромолекула, включая практические все белки или пептиды, может выступать в качестве антигена. Более того, антигены могут происходить из рекомбинантной или геномной ДНК. Квалифицированному специалисту будет понятно, что любая ДНК, которая содержит нуклеотидные последовательности или частичную нуклеотидную последовательность, кодирующую белок, который индуцирует иммунный ответ, таким образом, кодирует "антиген", как этот термин используют в настоящем описании. Более того, квалифицированному специалисту будет понятно, что антиген не должен кодироваться исключительно полноразмерной нуклеотидной последовательностью гена. Хорошо понятно, что настоящее изобретение включает, но не ограничивается ими, применение частичных нуклеотидных последовательностей из более чем одного гена, и что эти нуклеотидные последовательности располагаются в различных комбинациях для кодирования полипептидов, которые индуцируют желаемый иммунный ответ. Более того, квалифицированному специалисту будет понятно, что антиген вовсе не должен кодироваться "геном". Хорошо понятно, что антиген можно получать путем синтеза, или он может происходить из биологического образца, или может представлять собой макромолекулу помимо полипептида. Такой биологический образец может включать, но не ограничиваться ими, образец ткани, образец опухоли, клетку или жидкость с другими биологическими компонентами.
[00119] Термин "конкурировать" относится к способности антигенсвязывающего домена, например, антитела или его фрагмента, препятствовать связыванию прямо или непрямо другого антигенсвязывающего домена, например, антигенсвязывающего домена, описанного в настоящем описании, например, антитела или его фрагмента, описанных в настоящем описании, с мишенью, например, мезотелином. Степень, с которой антигенсвязывающий домен, например, антитело или его фрагмент, способны препятствовать связыванию другого антигенсвязывающего домена, например, антитела или его фрагмента, с мишенью, и, таким образом, возможность определения этого как конкуренция, можно определять с использованием конкурентного анализа связывания. В некоторых вариантах осуществления конкурентный анализ связывания представляет собой количественный конкурентный анализ. Например, в одном особенно пригодном количественном конкурентном анализе используется подход на основе поверхностного плазмонного резонанса (SPR) для измерения связывания, например, конкуренции, между одним антителом или его фрагментом и другим антителом или его фрагментом, в отношении связывания с иммобилизованной мишенью. Иллюстративный конкурентный анализ на основе SPR описан в примере 2 настоящего описания. В другом подходящем количественном конкурентно анализе используется подход на основе FACS для измерения конкуренции между меченным (например, His-меченным, биотинилированным или радиоактивно меченным, среди прочих) антителом или его фрагментом и другим антителом или его фрагментом, в отношении связывания с мишенью.
[00120] Термин "противораковый эффект" относится к биологическому эффекту, который может проявляться различными путями, включая, но не ограничиваясь ими, например, снижение объема опухоли, уменьшение количества злокачественных клеток, уменьшение количества метастазов, увеличение продолжительности жизни, снижение пролиферации злокачественных клеток, снижение выживаемости злокачественных клеток или смягчение различных физиологических симптомов, ассоциированных со злокачественным состоянием. "Противораковый эффект" также может проявляться способностью пептидов, полинуклеотидов, клеток и антител к предупреждению возникновения злокачественной опухоли изначально. Термин "противоопухолевый эффект" относится к биологическому эффекту, который может проявляться различными путями, включая, но не ограничиваясь ими, например, снижение объема опухоли, уменьшение количества опухолевых клеток, снижение пролиферации опухолевых клеток или снижение выживаемости опухолевых клеток.
[00121] Термин "аутологичный" относится к любому материалу, происходящему из того же индивидуума, которому его впоследствии обратно вводят.
[00122] Термин "аллогенный" относится к любому материалу, происходящему из другого животного того же вида относительно индивидуума, которому материал вводят. Два или более индивидуумов называют аллогенными друг другу, когда гены в одном или более локусов не являются идентичными. В некоторых аспектах аллогенный материал от индивидуумов того же вида может быть достаточно генетически отличающимся, чтобы происходило антигенное взаимодействие.
[00123] Термин "ксеногенный" относится к трансплантату, происходящему из животного другого вида.
[00124] Термин "злокачественная опухоль" относится к заболеванию, характеризующемуся неконтролируемым ростом аберрантных клеток. Злокачественные клетки могут распространяться локально или через кровоток и лимфатическую систему в другие части организма. Примеры различных злокачественных опухолей описаны в настоящем описании и включают, но не ограничиваются ими, мезотелиому, рак молочной железы, рак предстательной железы, рак яичника, рак шейки матки, рак кожи, рак поджелудочной железы, рак ободочной и прямой кишки, рак почки, рак печени, злокачественную опухоль головного мозга, лимфому, лейкоз, рак легкого и т.п.
[00125] Выражение "заболевание, ассоциированное с экспрессией мезотелина," включает, но не ограничивается ими, заболевание, ассоциированное с экспрессией мезотелина, или состояние, ассоциированное с клетками, которые экспрессируют мезотелин, включая, например, пролиферативные заболевания, такие как рак или злокачественная опухоль, или предзлокачественное состояние, такое как мезотелиальная гиперплазия; или не связанное со злокачественной опухолью показание, ассоциированное с клетками, которые экспрессируют мезотелин. Примеры различных злокачественных опухолей, которые экспрессируют мезотелин, включают, но не ограничиваются ими, мезотелиому, рак легкого, рак яичника, рак поджелудочной железы и т.п.
[00126] Термин "консервативные модификации последовательности" относится к модификациям аминокислот, которые не влияют или не изменяют в значительной степени характеристики связывания антитела или фрагмента антитела, содержащих аминокислотную последовательность. Такие консервативные модификации включают аминокислотные замены, вставки или делеции. Модификации можно вносить в антитело или фрагмент антитела по изобретению стандартными способами, известными в данной области, такими как сайт-направленный мутагенез и ПЦР-опосредуемый мутагенез. Консервативные аминокислотные замены представляют собой замены, в которых аминокислотный остаток заменен аминокислотным остатком, имеющим сходную боковую цепь. Семейства аминокислотных остатков, имеющих сходные боковые цепи, определены в данной области. Эти семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислотными боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Таким образом, один или более аминокислотных остатков в CAR по изобретению могут быть заменены другими аминокислотными остатками из того же семейства боковых цепей, и измененный CAR можно исследовать, например, в отношении способности связывать мезотелин, с использованием функциональных анализов, описанных в настоящем описании.
[00127] Термин "стимуляция" относится к первичному ответу, индуцированному посредством связывания стимулирующей молекулы (например, комплекс TCR/CD3 или CAR) с ее собственным лигандом (или опухолевым антигеном в случае CAR), что, тем самым, опосредует событие передачи сигнала, такое как, но не ограничиваясь ими, передача сигнала через комплекс TCR/CD3 или передача сигнала через соответствующий рецептор NK или сигнальные домены CAR. Стимуляция может опосредовать измененную экспрессию определенных молекул.
[00128] Термин "стимулирующая молекула" относится к молекуле, экспрессируемой иммунной клеткой (например, T-клеткой, NK-клеткой, B-клеткой), которая предоставляет сигнальную последовательность(и), которая регулирует активацию иммунной клетки стимулирующим образом для по меньшей мере некоторого аспекта каскада передачи сигнала иммунными клетками. В одном аспекте сигнал представляет собой первичный сигнал, который инициируется, например, связыванием комплекса TCR/CD3 с молекулой MHC, нагруженной пептидом, и который приводит к опосредованию T-клеточного ответа, включая, но не ограничиваясь ими, пролиферацию, активацию, дифференцировку и т.п. Первичная цитоплазматическая сигнальная последовательность (также обозначаемая как "первичный сигнальный домен"), которая действует стимулирующим образом, может содержать сигнальный мотив, который известен как иммунорецепторный тирозиновый активирующий мотив или ITAM. Примеры содержащей ITAM цитоплазматической сигнальной последовательности, которая является особенно пригодной в рамках изобретения, включают, но не ограничиваются ими, последовательности, происходящие из CD3-зета, общего FcR-гамма (FCER1G), Fc-гамма RIIa, FcR-бета (Fc-эпсилон R1b), CD3-гамма, CD3-дельта, CD3-эпсилон, CD79a, CD79b, DAP10 и DAP12. В конкретном CAR по изобретению внутриклеточный сигнальный домен в любом одном или более CAR по изобретению содержит внутриклеточную сигнальную последовательность, например, первичную сигнальную последовательность CD3-зета. В конкретном CAR по изобретению первичная сигнальная последовательность CD3-зета представляет собой последовательность, представленную в SEQ ID NO: 9, или эквивалентные остатки из не являющегося человеком вида, например, мыши, грызуна, мартышки, человекообразной обезьяны и т.п. В конкретном CAR по изобретению первичная сигнальная последовательность CD3-зета представляет собой последовательность, представленную в SEQ ID NO: 10, или эквивалентные остатки из не являющегося человеком вида, например, мыши, грызуна, мартышки, человекообразной обезьяны и т.п.
[00129] Термин "антигенпредставляющая клетка" или "APC" относится к клетке иммунной системы, такой как вспомогательная клетка (например, B-клетка, дендритная клетка и т.п.), которая экспонирует чужеродный антиген в комплексе с основным комплексом гистосовместимости (MHC) на ее поверхности. T-клетки могут распознавать эти комплексы с использованием их T-клеточных рецепторов (TCR). APC процессируют антигены и презентируют их T-клеткам.
[00130] "Внутриклеточный сигнальный домен", как используют в настоящем описании, относится к внутриклеточной части молекулы. Внутриклеточный сигнальный домен генерирует сигнал, который стимулирует иммунную эффекторную функцию содержащей CAR клетки, например, CART-клетки. Примеры иммунной эффекторной функции, например, в CART-клетке, включают цитолитическую активность и хелперную активность, включая секрецию цитокинов.
[00131] В одном варианте осуществления внутриклеточный сигнальный домен может содержать первичный внутриклеточный сигнальный домен. Иллюстративные первичные внутриклеточные сигнальные домены включают домены, происходящие из молекул, ответственных за первичную стимуляцию или антигензависимую стимуляцию. В одном варианте осуществления внутриклеточный сигнальный домен может содержать костисмулирующий внутриклеточный домен. Иллюстративные костимулирующие внутриклеточные сигнальные домены включают домены, происходящие из молекул, ответственных за костисмулирующие сигналы или антиген-независимую стимуляцию. Например, в случае CART первичный внутриклеточный сигнальный домен может содержать цитоплазматическую последовательность T-клеточного рецептора, и костимулирующий внутриклеточный сигнальный домен может содержать цитоплазматическую последовательность из корецептора или костимулирующей молекулы.
[00132] Первичный внутриклеточный сигнальный домен может содержать сигнальный мотив, который известен как иммунорецепторный тирозиновый активирующий мотив или ITAM. Примеры содержащих ITAM первичных цитоплазматических сигнальных последовательностей включают, но не ограничиваются ими, последовательности, происходящие из CD3-зета, общего FcR-гамма (FCER1G), Fc-гамма RIIa, FcR-бета (Fc-эпсилон R1b), CD3-гамма, CD3-дельта, CD3-эпсилон, CD79a, CD79b, DAP10 и DAP12.
[00133] Термин "зета" или альтернативно "зета-цепь", "CD3-зета" или "TCR-зета" определяют как белок, представленный под номером доступа GenBan № BAG36664.1, или эквивалентные остатки из не являющегося человеком вида, например, мыши, грызуна, обезьяны, и т.п., и "зета-стимулирующий домен" или альтернативно "стимулирующий домен CD3-зета" или "стимулирующий домен TCR-зета" определяют как аминокислотные остатки из цитоплазматического домена зета-цепи или их функциональные производные, которые являются достаточными для функциональной передачи первоначального сигнала, необходимого для активации T-клеток. В одном аспекте цитоплазматический домен зета-цепи содержит остатки с 52 по 164 последовательности с номером доступа GenBank № BAG36664.1 или эквивалентные остатки из не являющегося человеком вида, например, мыши, грызуна, мартышки, человекообразной обезьяны и т.п., которые являются их функциональными ортологами. В одном аспекте "зета-стимулирующий домен" или "стимулирующий домен CD3-зета" представляет собой последовательность, предоставленную в качестве SEQ ID NO: 9. В одном аспекте "зета-стимулирующий домен" или "стимулирующий домен CD3-зета" представляет собой последовательность, предоставленную в качестве SEQ ID NO: 10.
[00134] Термин "костимулирующая молекула" относится к распознающему связывающему партнеру на T-клетке, который специфически связывается с костимулирующим лигандом, тем самым, опосредуя костсимулирующий ответ T-клеткой, такой как, но не ограничиваясь ими, пролиферация. Костимулирующие молекулы представляют собой молекулы клеточной поверхности, отличные от рецепторов антигенов или их лигандов, которые вносят вклад в эффективный иммунный ответ. Костимулирующие молекулы включают, но не ограничиваются ими, молекулу MHC класса I, BTLA и рецептор Toll-лиганда, а также OX40, CD27, CD28, CDS, ICAM-1, LFA-1 (CD11a/CD18), ICOS (CD278) и 4-1BB (CD137). Следующие примеры таких костимулирующих молекул включают CDS, ICAM-1, GITR, BAFFR, HVEM (LIGHTR), SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD160, CD19, CD4, CD8альфа, CD8beta, IL2R beta, IL2R gamma, IL7R альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76, PAG/Cbp и лиганд, который специфически связывается с CD83.
[00135] Костимулирующий внутриклеточный сигнальный домен может представлять собой внутриклеточную часть костимулирующей молекулы. Костимулирующая молекула может принадлежать одному из следующих семейств белков: белки-рецепторы TNF, иммуноглобулин-подобные белки, рецепторы цитокинов, интегрины, сигнальные молекулы активации лимфоцитов (белки SLAM) и активирующие рецепторы NK-клеток. Примеры таких молекул включают CD27, CD28, 4-1BB (CD137), OX40, GITR, CD30, CD40, ICOS, BAFFR, HVEM, ICAM-1, ассоциированный с функцией лимфоцитов антиген 1 (LFA-1), CD2, CDS, CD7, CD287, LIGHT, NKG2C, SLAMF7, NKp80, CD160, B7-H3 и лиганд, который специфически связывается с CD83, и т.п.
[00136] Внутриклеточный сигнальный домен может содержать всю внутриклеточную часть или весь нативный внутриклеточный сигнальный домен молекулы, из которой он происходит, или его функциональный фрагмент или производное.
[00137] Термин "4-1BB" относится к представителю суперсемейства TNFR с аминокислотной последовательностью, представленной в качестве последовательности с номером доступа GenBank № AAA62478.2, или эквивалентными остатками из не являющегося человеком вида, например, мыши, грызуна, мартышки, человекообразной обезьяны и т.п. В одном аспекте "костимулирующий домен 4-1BB" определяют как аминокислотные остатки 214-255 последовательности с номером доступа GenBank № AAA62478.2, или эквивалентные остатки из не являющегося человеком вида, например, мыши, грызуна, мартышки, человекообразной обезьяны и т.п. В одном аспекте "костимулирующий домен 4-1BB" представляет собой последовательность, представленную в качестве SEQ ID NO: 7, или эквивалентные остатки из не являющегося человеком вида, например, мыши, грызуна, мартышки, человекообразной обезьяны и т.п.
[00138] "Антигенпредставляющая клетка", как используют в рамках изобретения, означает клетку иммунной системы, такую как вспомогательная клетка (например, B-клетка, дендритная клетка и т.п.), которая экспонирует чужеродный антиген в комплексе с основным комплексом гистосовместимости (MHC) на ее поверхности. T-клетки могут распознавать эти комплексы с использованием их T-клеточных рецепторов (TCR). APC процессируют антигены и презентируют их T-клеткам.
[00139] Термин "кодирующий" относится к свойству, присущему конкретным последовательностям нуклеотидов в полинуклеотиде, таком как ген, кДНК или мРНК, выступать в качестве матрицы для синтеза других полимеров и макромолекул в биологических процессах, имеющих либо определенную последовательность нуклеотидов (т.е. рРНК, тРНК и мРНК), либо определенную последовательность аминокислот, и к биологическим свойствам, являющимся следствием этого свойства. Таким образом, ген, кДНК или РНК, кодирует белок, если транскрипция и трансляция мРНК, соответствующей этому гену, продуцирует белок в клетке или другой биологической системе. Как кодирующая цепь, нуклеотидная последовательность которой идентична последовательности мРНК и обычно предоставляется в списках последовательностей, так и некодирующая цепь, используемая в качестве матрицы для транскрипции гена или кДНК, могут упоминаться как кодирующие белок или другой продукт этого гена или кДНК.
[00140] Если нет иных указаний, "нуклеотидная последовательность, кодирующая аминокислотную последовательность," включает все нуклеотидные последовательности, которые являются вырожденными версиями друг друга и которые кодируют одну и ту же аминокислотную последовательность. Выражение нуклеотидная последовательность, которая кодирует белок или РНК, также может включать интроны, поскольку нуклеотидная последовательность, кодирующая белок, может в некоторой версии содержать интрон(ы).
[00141] Термины "эффективное количество" или "терапевтически эффективное количество" используют в настоящем описании взаимозаменяемо, и они относятся к количеству соединения, состава, материала или композиции, как описано в настоящем описании, эффективному для достижения конкретного биологического результата. Термин "эндогенный" относится к любому материалу из или продуцируемому внутри организма, клетки, ткани или системы.
[00142] Термин "экзогенный" относится к любому материалу, внесенному извне или продуцированному вне организма, клетки, ткани или системы.
[00143] Термин "экспрессия" относится к транскрипции и/или трансляции конкретной нуклеотидной последовательности, запускаемой ее промотором.
[00144] Термин "вектор для переноса"относится к композиции, которая содержит выделенную нуклеиновую кислоту и которую можно использовать для доставки выделенной нуклеиновой кислоты внутрь клетки. В данной области известны многочисленные векторы, включая, но не ограничиваясь ими, линейные полинуклеотиды, полинуклеотиды, ассоциированные с ионными или амфифильными соединениями, плазмиды и вирусы. Таким образом, термин "вектор для переноса" включает автономно реплицирующуюся плазмиду или вирус. Термин также следует истолковывать как дополнительно включающий неплазмидные и невирусные соединения, которые облегчают перенос нуклеиновой кислоты в клетки, такие как, например, соединение полилизина, липосома и т.п. Примеры вирусных векторов для переноса включают, но не ограничиваются ими, аденовирусные векторы, векторы на основе аденоассоциированного вируса, ретровирусные векторы, лентивирусные векторы и т.п.
[00145] Термин "экспрессирующий вектор" относится к вектору, содержащему рекомбинантный полинуклеотид, содержащий последовательности контроля экспрессии, функционально связанные с нуклеотидной последовательностью, подлежащей экспрессии. Экспрессирующий вектор содержит достаточное количество цис-регуляторных элементов для экспрессии; другие элементы для экспрессии могут быть предоставлены клеткой-хозяином или экспрессирующей системой in vitro. Экспрессирующие векторы включают векторы, известные в данной области, включая космиды, плазмиды (например, голые или содержащиеся в липосомах) и вирусы (например, лентивирусы, ретровирусы, аденовирусы и аденоассоциированные вирусы), которые включают рекомбинантный полинуклеотид.
[00146] Термин "лентивирус" относится к роду семейства Retroviridae. Лентивирусы являются уникальными среди ретровирусов, поскольку они способны инфицировать неделящиеся клетки; они могут доставлять значительное количество генетической информации в ДНК клетки-хозяина, так что они являются одним из наиболее эффективных способов доставки вектора с геном. Примерами лентивирусов являются ВИЧ, SIV и FIV. Термин "лентивирусный вектор" относится к вектору, происходящему по меньшей мере из части генома лентивируса, включая, а частности, самоинактивирующийся лентивирусный вектор, представленный в Milone et al., Mol. Ther. 17(8): 1453–1464 (2009). Другие примеры лентивирусных векторов, которые можно использовать в клинике, включают, но не ограничиваются ими, например, технологию доставки генов LENTIVECTOR® от Oxford BioMedica, векторную систему LENTIMAXTM от Lentigen и т.п. Также доступны неклинические типы лентивирусных векторов, и они известны специалисту в данной области.
[00147] Термин "гомологичный" или "идентичность" относится к идентичности последовательности субъединиц между двумя полимерными молекулами, например, между двумя молекулами нуклеиновых кислот, таких как две молекулы ДНК или две молекулы РНК, или между двумя полипептидными молекулами. Если положение субъединицы в обеих из двух молекул занимает одна та же мономерная субъединица, например, если положение в каждой из двух молекул ДНК занимает аденин, тогда они являются гомологичными или идентичными в этом положении. Гомология между двумя последовательностями является прямой функцией количества совпадающих или гомологичных положений; например, если половина (например, пять положений в полимере длиной десять субъединиц) из положений в двух последовательностях являются гомологичными, тогда две последовательности являются на 50% гомологичными; если 90% положений (например, 9 из 10) совпадают или гомологичны, тогда две последовательности являются на 90% гомологичными.
[00148] Термин "гуманизированный" относится к формам не являющихся человеческими антител (например, мыши), которые представляют собой химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие связывающие антиген подпоследовательности антител), которые содержат минимальную последовательность, происходящую из не являющегося человеческим иммуноглобулина. В основном гуманизированные антитела и их фрагменты представляют собой иммуноглобулины человека (реципиентное антитело или фрагмент антитела), в которых остатки из определяющей комплементарность области (CDR) реципиента заменены остатками из CDR не являющегося человеком вида (донорное антитело), такого как мышь, крыса или кролик, имеющими желаемую специфичность, аффинность и емкость. В некоторых случаях остатки каркасной области Fv (FR) иммуноглобулина человека заменены соответствующими не являющимися человеческими остатками. Более того, гуманизированное антитело/фрагмент антитела может содержать остатки, которые не встречаются ни в реципиентном антителе, ни в импортированных последовательностях CDR или каркасной области. Эти модификации могут далее усовершенствовать и оптимизировать эффективность антитела или фрагмента антитела. Как правило, гуманизированное антитело или его фрагмент содержат значительную часть по меньшей мере одного, и, как правило, двух, вариабельных доменов, в которых все или по существу все из областей CDR соответствуют областям CDR не являющегося человеческим иммуноглобулина и все или по существу все из областей FR представляют собой области FR из последовательности иммуноглобулина человека. Гуманизированное антитело или фрагмент антитела также могут содержать по меньшей мере часть константной области (Fc) иммуноглобулина, как правило, иммуноглобулина человека. Для более подробного описания, см. Jones et al., Nature, 321: 522-525, 1986; Reichmann et al., Nature, 332: 323-329, 1988; Presta, Curr. Op. Struct. Biol., 2: 593-596, 1992.
[00149] Термин "полностью человеческий" относится к иммуноглобулину, такому как антитело или фрагмент антитела, где вся молекула происходит из человека и состоит из аминокислотной последовательности, идентичной человеческой форме антитела или иммуноглобулина.
[00150] Термин "выделенный" означает измененный или извлеченный относительно природного состояния. Например, нуклеиновая кислота или пептид, естественным образом присутствующие в живом животном, не являются "выделенными", но те же нуклеиновая кислота или пептид, частично или полностью отделенные от сосуществующих с ними материалов природного состояния, являются "выделенными". Выделенная нуклеиновая кислота или белок могут существовать в по существу очищенной форме или могут существовать в ненативной среде, например, такой как клетка-хозяин.
[00151] В контексте настоящего изобретения используют следующие сокращения для обычно встречающихся оснований нуклеиновой кислоты. "A" относится к аденозину, "C" относится к цитозину, "G" относится к гуанозину, "T" относится к тимидину и "U" относится к уридину.
[00152] Термин "функционально связанный" или "контроль транскрипции" относится к функциональной связи между регуляторной последовательностью и гетерологичной последовательностью нуклеиновой кислоты, приводящей к экспрессии последней. Например, первая последовательность нуклеиновой кислоты функционально связана со второй последовательностью нуклеиновой кислоты, когда первая последовательность нуклеиновой кислоты находится в функциональной взаимосвязи со второй последовательностью нуклеиновой кислоты. Например, промотор функционально связан с кодирующей последовательностью, если промотор влияет на транскрипцию или экспрессию кодирующей последовательности. Функционально связанные последовательности ДНК могут быть смежными друг с другом и, когда необходимо связать две кодирующих белок области, находится в одной рамке считывания.
[00153] Термин "парентеральное" введение иммуногенной композиции включает, например, подкожную (п/к), внутривенную (в/в), внутримышечную (в/м) или проводимую внутрь очага повреждения инъекцию, внутриопухолевое введение или способы инфузии.
[00154] Термины "нуклеиновая кислота" или "полинуклеотид" относятся к дезоксирибонуклеиновым кислотам (ДНК) или рибонуклеиновым кислотам (РНК) и их полимерам либо в одноцепочечной, либо в двухцепочечной форме. Если конкретно не ограничено, термин охватывает нуклеиновые кислоты, содержащие известные аналоги природных нуклеотидов, которые имеют сходные свойства связывания с эталонной нуклеиновой кислотой и метаболизируются аналогично встречающимся в природе нуклеотидам. Если нет иных указаний, конкретная последовательность нуклеиновой кислоты также косвенно охватывает ее консервативно модифицированные варианты (например, вырожденные замены кодонов), аллели, ортологи, SNP и комплементарные последовательности, а также последовательность, прямо указанную. В частности, вырожденные замены кодонов можно осуществлять путем получения последовательностей, в которых третье положение одного или более выбранных (или всех) кодонов замещено смешанными остатками и/или остатками дезоксиинозина (Batzer et al., Нуклеиновая кислота Res. 19:5081 (1991); Ohtsuka et al., J. Biol. Chem. 260:2605-2608 (1985); и Rossolini et al., Mol. Cell. Probes 8:91-98 (1994)).
[00155] Термины "пептид", "полипептид" и "белок" используют взаимозаменяемо, и они относятся к соединению, состоящему из аминокислотных остатков, ковалентно связанных пептидными связями. Белок или пептид должны содержать по меньшей мере две аминокислоты, и отсутствует ограничение на максимальное количество аминокислот, которые могут содержаться в последовательности белка или пептида. Полипептиды включают любой пептид или белок, содержащие две или более аминокислот, связанных друг с другом пептидными связями. Как используют в рамках изобретения, термин относится к как коротким цепям, которые также обычно называют в данной области, например, пептидами, олигопептидами и олигомерами, так и к более длинным цепям, которые обычно называют в данной области белками, для которых существует множество типов. "Полипептиды" включают, например, биологически активные фрагменты, по существу гомологичные полипептиды, олигопептиды, гомодимеры, гетеродимеры, варианты полипептидов, модифицированные полипептиды, производные, аналоги, слитые белки, среди прочих. Полипептид включает природный пептид, рекомбинантный пептид, рекомбинантный пептид или их комбинацию.
[00156] Термин "промотор" относится к последовательности ДНК, распознаваемой синтетическим аппаратом клетки или введенным синтетическим аппаратом, которая требуется для инициации транскрипции полинуклеотидной последовательности.
[00157] Термин "промоторная/регуляторная последовательность" относится к последовательности нуклеиновой кислоты, которая требуется для экспрессии продукта гена, функционально связанного с промоторной/регуляторной последовательностью. В некоторых случаях эта последовательность может представлять собой основную промоторную последовательность и в других случаях эта последовательность также может включать энхансерную последовательность и другие регуляторные элементы, которые требуются для экспрессии продукта гена. Промоторная/регуляторная последовательность, например, может представлять собой последовательность, которая экспрессирует продукт гена тканеспецифическим образом.
[00158] Термин "конститутивный" промотор относится к нуклеотидной последовательности, которая, когда она функционально связана с полинуклеотидом, который кодирует или определяет продукт гена, вызывает продукцию продукта гена в клетке при большинстве или всех физиологических условиях в клетке.
[00159] Термин "индуцибельный" промотор относится к нуклеотидной последовательности, которая, когда она функционально связана с полинуклеотидом, который кодирует или определяет продукт гена, обеспечивает продукцию продукта гена в клетке, по существу только когда индуктор, который соответствует промотору, присутствует в клетке.
[00160] Термин "тканеспецифический" промотор относится к нуклеотидной последовательности, которая, когда она функционально связана с полинуклеотидом, который кодирует или определяет продукт гена, обеспечивает продукцию продукта гена в клетке, по существу только если клетка представляет собой клетку типа ткани, соответствующего промотору.
[00161] Термин "гибкий полипептидный линкер", как используют в контексте scFv, относится к пептидному линкеру, который состоит из аминокислот, таких как остатки глицина и/или серина, используемых отдельно или в комбинации, для связывания вариабельной области тяжелой цепи и вариабельной области легкой цепи вместе. В одном варианте осуществления гибкий полипептидный линкер представляет собой линкер Gly/Ser, и он содержит аминокислотную последовательность (Gly-Gly-Gly-Ser)n(SEQ ID NO: 38), где n представляет собой положительное целое число, равное или превышающее 1. Например, n=1, n=2, n=3, n=4, n=5 и n=6, n=7, n=8, n=9 и n=10. В одном варианте осуществления гибкие полипептидные линкеры включают, но не ограничиваются ими, (Gly4 Ser)4 (SEQ ID NO: 27) или (Gly4 Ser)3 (SEQ ID NO: 28). В другом варианте осуществления линкеры включают множество повторов (Gly2Ser), (GlySer) или (Gly3Ser) (SEQ ID NO: 29). Также в объем изобретения входят линкеры, описанные в WO2012/138475, включенной в настоящее описание в качестве ссылки).
[00162] Как используют в рамках изобретения, 5'-кэп (также называемый РНК-кэпом, 7-метилгуанозиновым кэпом РНК или m7G-кэпом РНК) представляет собой модифицированный гуаниновый нуклеотид, который добавляется "спереди" или на 5'-конце эукариотической матричной РНК вскоре после начала транскрипции. 5'-кэп состоит из концевой группы, которая связана с первым транскрибируемым нуклеотидом. Его присутствие является важным для распознавания рибосомой и защиты от РНКаз. Присоединение кэпа сопряжено с транскрипцией и происходит котранскрипционно, так что каждое из этих событий влияет на другое из них. Вскоре после начала транскрипции 5'-конец синтезируемой мРНК связывается синтезирующим кэп комплексом, ассоциированным с РНК-полимеразой. Этот ферментативный комплекс катализирует химические реакции, которые требуются для кэпирования мРНК. Синтез протекает в качестве многостадийной биохимической реакции. Кэпирующую часть можно модифицировать для модулирования функциональности мРНК, такой как ее стабильность или эффективность трансляции.
[00163] Как используют в рамках изобретения, "транскрибированная in vitro РНК" относится к РНК, предпочтительно мРНК, синтезированной in vitro. Как правило, транскрибированную in vitro РНК получают с помощью вектора для транскрипции in vitro. Вектор для транскрипции in vitro содержит матрицу, которую используют для получения транскрибированной РНК in vitro.
[00164] Как используют в рамках изобретения, "поли(A)" представляет собой последовательность остатков аденозина, присоединенную путем полиаденилирования мРНК. В предпочтительном варианте осуществления конструкции для временной экспрессии поли-A имеют от 50 до 5000 (SEQ ID NO: 30), предпочтительно более 64, более предпочтительно более 100, наиболее предпочтительно более 300 или 400 оснований. Последовательности поли(A) можно модифицировать химически или ферментативно для модулирования функциональности мРНК, такой как локализация, стабильность или эффективность трансляции.
[00165] Как используют в рамках изобретения, "полиаденилирование" относится к ковалентному присоединению полиаденилильной части или ее модифицированного варианта к молекуле матричной РНК. В эукариотических организмах большинство молекул матричной РНК (мРНК) являются полиаденилированными на 3'-конце. 3'-поли(A)-хвостовая часть представляет собой длинную последовательность адениновых нуклеотидов (часто более сотен), присоединяемую к пре-мРНК под действием фермента полиаденилатполимеразы. У высших эукариот поли(A)-хвостовая часть присоединяется к транскриптам, которые содержат конкретную последовательность – сигнал полиаденилирования. Поли(A)-хвостовая часть и белок, связывающийся с ней, способствуют защите мРНК от деградации экзонуклеазами. Полиаденилирование также является важным для терминации транскрипции, экспорта мРНК из ядра и трансляции. Полиаденилирование происходит в ядре непосредственно после транскрипции ДНК в РНК, но, кроме того, также оно происходит позднее в цитоплазме. После завершения транскриции цепь мРНК отщепляется под действием эндонуклеазного комплекса, ассоциированного с РНК-полимеразой. Участок расщепления обычно характеризуется последовательностью оснований AAUAAA вблизи участка расщепления. После отщепления мРНК остатки аденозина являются связанными со свободным 3'-концом участка расщепления.
[00166] Как используют в рамках изобретения, "временный" относится к экспрессии невстроенного трансгена в течение периода, составляющего более часов, суток или недель, где период экспрессии является меньшим, чем период экспрессии гена, если он встроен в геном или содержится в стабильном плазмидном репликоне в клетке-хозяине.
[00167] Как используют в рамках изобретения, термины "лечить", "лечение" и "проведение лечения" относятся к снижению или смягчению прогрессирования, тяжести и/или длительности пролиферативного нарушения, или к смягчению одного или более симптомов (предпочтительно, одного или более различимых симптомов) пролиферативного нарушения вследствие проведения одной или более терапий (например, введения одного или более лекарственных средств, таких как CAR по изобретению). В конкретных вариантах осуществления термины "лечить", "лечение" и "проведение лечения" относятся к смягчению по меньшей мере одного поддающегося измерению физического параметра пролиферативного нарушения, такого как рост опухоли, не обязательно заметного для пациента. В других вариантах осуществления термины "лечить", "лечение" и "проведение лечения" относятся к ингибированию прогрессирования пролиферативного нарушения, либо физически, например, путем стабилизации различимого симптома, либо физиологически, например, путем стабилизации физического параметра, или обоими путями. В других вариантах осуществления термины "лечить", "лечение" и "проведение лечения" относятся к снижению или стабилизации размера опухоли или количества злокачественных клеток.
[00168] Термин "каскад передачи сигнала" относится к биохимической взаимосвязи между различными молекулами передачи сигнала, которые играют роль в передачи сигнала из одной части клетки в другую часть клетки. Выражение "рецептор клеточной поверхности" включает молекулы и комплексы молекул, способные получать сигнал и передавать сигнал через мембрану клетки.
[00169] Термин "индивидуум" включает живые организмы, у которых может быть индуцирован иммунный ответ (например, млекопитающие, человек).
[00170] Термин "по существу очищенная" клетка относится к клетке, которая по существу свободна от других типов клеток. По существу очищенная клетка также относится к клетке, которая отделена от других типов клеток, с которыми она обычно ассоциирована в ее природном состоянии. В некоторых случаях популяция по существу очищенных клеток относится к гомогенной популяции клеток. В других случаях этот термин относится просто к клетке, которая отделена от клеток, с которыми она ассоциирована в ее природном состоянии. В некоторых аспектах клетки культивируют in vitro. В других аспектах клетки не культивируют in vitro.
[00171] Термин "терапевтический", как используют в рамках изобретения, означает лечение. Терапевтический эффект достигают путем снижения, подавления, обеспечения ремиссии или устранения болезненного состояния.
[00172] Термин "профилактика", как используют в рамках изобретения, означает предупреждение или защитное лечение от заболевания или болезненного состояния.
[00173] Термины "ассоциированный со злокачественной опухолью антиген" или "опухолевый антиген" взаимозаменяемо относится к молекуле (как правило, белок, углевод или липид), которая экспрессируется на поверхности злокачественной клетки, либо полностью, либо в качестве фрагмента (например, MHC/пептид), и которая является пригодной для предпочтительного нацеливания фармакологического средства на злокачественную клетку. В некоторых вариантах осуществления опухолевый антиген представляет собой маркер, экспрессируемый как нормальными клетками, так и злокачественными клетками, например, маркер линии дифференцировки, например, CD19 на B-клетках. В некоторых вариантах осуществления опухолевый антиген представляет собой молекулу клеточной поверхности, которая сверхэкспрессируется в злокачественной клетке по сравнению с нормальной клеткой, например, сверхэкспрессируется в 1 раз, сверхэкспрессируется в 2 раза, сверхэкспрессируется в 3 раза или более по сравнению с нормальной клеткой. В некоторых вариантах осуществления опухолевый антиген представляет собой молекулу клеточной поверхности, которая ненадлежащим образом синтезируется в злокачественной клетке, например, молекулу, которая содержит делеции, вставки или мутации по сравнению с молекулой, экспрессируемой на нормальной клетке. В некоторых вариантах осуществления опухолевый антиген экспрессируется исключительно на клеточной поверхности злокачественной клетки, полностью или в качестве фрагмента (например, MHC/пептида), и не синтезируется или не экспресируется на поверхности нормальной клетки. В некоторых вариантах осуществления CAR по настоящему изобретению включают CAR, содержащие антигенсвязывающий домен (например, антитело или фрагмент антитела), который связывается с пептидом, презентируемым MHC. Обычно, пептиды, происходящие из эндогенных белков, занимают карманы молекул основного комплекса гистосовместимости (MHC) класса I и распознаются T-клеточными рецепторами (TCR) CD8+ T-лимфоцитах. Комплексы MHC класса I констситутивно экпрессируются всеми ядросодержащими клетками. При злокачественной опухоли вирусоспецифические и/или опухолеспецифические комплексы пептид/MHC представляют собой уникальный класс мишеней клеточной поверхности для иммунотерапии. Описаны пептиды, нацеливающие TCR-подобные антитела, происходящие из вирусных или опухолевых антигенов, в контексте лейкоцитарного антигена человека (HLA)-A1 или HLA-A2 (см., например, Sastry et al., J Virol. 2011 85(5):1935-1942; Sergeeva et al., Blood, 2011 117(16):4262-4272; Verma et al., J Immunol 2010 184(4):2156-2165; Willemsen et al., Gene Ther 2001 8(21): 1601-1608; Dao et al., Sci Transl Med 2013 5(176): 176ra33; Tassev et al., Cancer Gene Ther 2012 19(2):84-100). Например, TCR-подобное антитело может быть идентифицировано при скрининге библиотеки, такой как библиотека фагового дисплея scFv человека.
[00174] Термины "трансфицированный", или "трансформированный", или "трансдуцированный" относятся к процессу, посредством которого экзогенная нуклеиновая кислота переносится или вводится в клетку-хозяина. "Трансфицированная", или "трансформированная", или "трансдуцированная" клетка представляет собой клетку, которая трансфицирована, трансформирована или трансдуцирована экзогенной нуклеиновой кислотой. Клетка включает первичную клетку индивидуума и ее потомство.
[00175] Термин "специфически связывается" относится к антителу или лиганду, которые распознают и связываются с белком-партнером по связыванию (например, опухолевым антигеном), присутствующем в образце, но при этом эти антитело или лиганд по существу не распознают или не связывают другие молекулы в образце.
[00176] "Регулируемый химерный рецептор антигена (RCAR)" как этот термин используют в настоящем описании, относится к набору полипептидов, как правило, двум в наиболее простых вариантах осуществления, которые, когда он находится в клетке RCARX, обеспечивает специфичность клетке RCARX в отношении клетки-мишени, как правило, злокачественной клетке, и регулируемое генерирование внутриклеточного сигнала или пролиферацию, которые могут оптимизировать иммунное эффекторное свойство клетки RCARX. Клетка RCARX основана по меньшей мере частично, на антигенсвязывающем домене для обеспечения специфичности в отношении клетки-мишени, которая содержит антиген, связываемый антигенсвязывающим доменом. В одном варианте осуществления RCAR включает переключатель димеризации, который в присутствии молекулы димеризации может связывать внутриклеточный сигнальный домен с антигенсвязывающим доменом.
[00177] "Мембранный якорь" или "связывающий с мембраной домен", как этот термин используют в настоящем описании, относится к полипептиду или части, например, миристоильной группе, достаточным для заякоривания внеклеточного или внутриклеточного домена на плазматической мембране.
[00178] "Домен переключения", как этот термин используют в настоящем описании, например, при указании на RCAR, относится к структуре, как правило, структуре на основе полипептида, которая в присутствии молекулы димеризации ассоциирует с другим доменом переключения. Эта ассоциация приводит к функциональному связыванию первой структуры, связанной, например слитой, с первым доменом переключения, и второй структуры, связанной, например слитой, со вторым доменом переключения. Первый и второй домены переключения в совокупности называют в настоящем описании переключателями димеризации. В вариантах осуществления первый и второй домены переключения являются одинаковыми, например, они представляют собой полипептиды, имеющие одинаковую первичную аминокислотную последовательность, и их в совокупности называют переключателями гомодимеризации. В вариантах осуществления первый и второй домены переключения отличаются друг от друга, например, они представляют собой полипептиды, имеющие отличающиеся первичные аминокислотные последовательности, и их в совокупности называют переключателями гетеродимеризации. В вариантах осуществления переключение является внутриклеточным. В вариантах осуществления переключение является внеклеточным. В вариантах осуществления домен переключения представляет собой структуру на основе полипептида, например, на основе FKBP или FRB, и молекула димеризации представляет собой низкомолекулярное соединение, например, рапалог. В вариантах осуществления домен переключения представляет собой структуру на основе полипептида, например scFv, который связывает пептид myc, и молекула димеризации представляет собой полипептид, его фрагмент или мультимер полипептида, например, myc-лиганд или мультимеры myc-лиганда, которые связываются с одним или более scFv к myc. В вариантах осуществления домен переключения представляет собой структуру на основе полипептида, например рецептор myc, и молекула димеризации представляет собой антитело или его фрагменты, например, антитело против myc.
[00179] "Молекула димеризации", как этот термин используют в настоящем описании, например, при указании на RCAR, относится к молекуле, которая обеспечивает ассоциацию первого домена переключения со вторым доменом переключения. В вариантах осуществления молекула димеризации не является встречающейся в природе у индивидуума или не встречается в концентрациях, которые привели бы к значительной димеризации. В вариантах осуществления молекула димеризации представляет собой низкомолекулярное соединение, например, рапамицин или рапалог, например RAD001.
[00180] Термин "биоэквивалент" относится к количеству средства, отличного от эталонного соединения (например, RAD001), требуемому для обеспечения эффекта, эквивалентного эффекту, обеспечиваемому эталонной дозой или эталонным количеством эталонного соединения (например, RAD001). В одном варианте осуществления эффект представляет собой уровень ингибирования mTOR, например, при измерении по ингибированию киназы P70 S6, например, при оценке в анализе in vivo или in vitro, например, при измерении с использованием анализа, описанного в настоящем описании, например, анализа Boulay или измерения уровней фосфорилированной S6 с использованием вестер-блоттинга. В одном варианте осуществления эффект представляет собой изменение соотношения положительные по PD-1/отрицательные по PD-1 T-клетки при измерении посредством сортировки клеток. В одном варианте осуществления биоэквивалентное количество или доза ингибитора mTOR представляют собой количество или дозу, которые достигают того же уровня ингибирования киназы P70 S6, что и эталонная доза или эталонное количество эталонного соединения. В одном варианте осуществления биоэквивалентное количество или доза ингибитора mTOR представляют собой количество или дозу, которые достигают того же уровня изменения соотношения положительные по PD-1/отрицательные по PD-1 T-клетки, как и эталонная доза или эталонное количество эталонного соединения.
[00181] Термин "низкая усиливающая иммунитет доза", когда его используют применительно к ингибитору mTOR, например, аллостерическому ингибитору mTOR, например RAD001 или рапамицину, или каталитическому ингибитору mTOR, относится к дозе ингибитора mTOR, которая частично, но не полностью ингибирует активность mTOR, например, при измерении по ингибированию активности киназы P70 S6. Способы оценки активности mTOR, например, по ингибированию киназы P70 S6, описаны в настоящем описании. Доза является недостаточной для обеспечения полного подавления иммунного ответа, но является достаточной для усиления иммунного ответа. В одном варианте осуществления низкая усиливающая иммунитет доза ингибитора mTOR приводит к уменьшению количества положительных по PD-1 T-клеток и/или увеличению количества отрицательных по PD-1 T-клеток, или к увеличению соотношения отрицательные по PD-1 T-клетки/положительные по PD-1 T-клетки. В одном варианте осуществления низкая усиливающая иммунитет доза ингибитора mTOR приводит к увеличению количества наивных T-клеток. В одном варианте осуществления низкая усиливающая иммунитет доза ингибитора mTOR приводит к одному или более из следующих:
увеличение экспрессии одного или более из следующих маркеров: CD62Lhigh, CD127high, CD27+ и BCL2, например, на T-клетках памяти, например, предшественниках T-клеток памяти;
снижение экспрессии KLRG1, например, на T-клетках памяти, например, предшественниках T-клеток памяти; и
увеличение количества предшественников T-клеток памяти, например, клеток с любой или комбинацией из следующих характеристик: увеличенный уровень CD62Lhigh, увеличенный уровень CD127high, увеличенный уровень CD27+, сниженный уровень KLRG1 и увеличенный уровень BCL2;
где любое из описанных выше изменений происходит, например, по меньшей мере временно, например, по сравнению с индивидуумом без лечения.
[00182] Диапазоны: на протяжении настоящего описания различные аспекты изобретения могут быть представлены в формате диапазонов. Следует понимать, что описание в формате диапазонов предоставлено только для удобства и краткости, и его не следует истолковывать как строгое ограничение объема изобретения. Таким образом, описание диапазона следует считать имеющим конкретно описанные все возможные числовые поддиапазоны, а также индивидуальные числовые величины в этом диапазоне. Например, описание диапазона, такого как от 1 до 6, следует истолковывать как диапазон, имеющий конкретно описанные поддиапазоны, такие как от 1 до 3, от 1 до 4, от 1 до 5, от 2 до 4, от 2 до 6, от 3 до 6 и т.д., а также индивидуальные числа в этом диапазоне, например, 1, 2, 2,7, 3, 4, 5, 5,3 и 6. В качестве другого примера диапазон, такой как идентичность 95-99%, включает что-либо с 95%, 96%, 97%, 98% или 99% идентичностью и включает поддиапазоны, такие как идентичность 96-99%, 96-98%, 96-97%, 97-99%, 97-98% и 98-99%. Это применимо независимо от ширины диапазона.
Описание
[00183] В рамках настоящего изобретения предусматриваются композиции и способы применения для лечения заболевания, такого как злокачественная опухоль, с использованием химерных рецепторов антигенов (CAR) против мезотелина, например, CAR против мезотелина человека.
[00184] В одном аспекте изобретение относится к ряду химерных рецепторов антигенов, содержащих антитело или фрагмент антитела, сконструированные для специфического связывания с белком мезотелином. В одном аспекте изобретение относится к клетке (например, T-клетке или NK-клетке), модифицированной способами инженерии для экспрессии CAR, например, где CAR T-клетка ("CART") проявляет противораковое свойство. В одном аспекте клетка трансформирована CAR и CAR экспрессируется на поверхности клетки. В некоторых вариантах осуществления клетка (например, T-клетка или NK-клетка) трансдуцирована вирусным вектором, кодирующим CAR. В некоторых вариантах осуществления вирусный вектор представляет собой ретровирусный вектор. В некоторых вариантах осуществления вирусный вектор представляет собой лентивирусный вектор. В некоторых таких вариантах осуществления клетка может стабильно экспрессировать CAR. В другом варианте осуществления клетка (например, T-клетка или NK-клетка) трансфицирована нуклеиновой кислотой, например, мРНК, кДНК, ДНК, кодирующей CAR. В некоторых таких вариантах осуществления клетка может временно экспрессировать CAR.
[00185] В одном аспекте связывающая белок мезотелин часть CAR представляет собой scFv-фрагмент антитела. В одном аспекте такие фрагменты антител являются функциональными, поскольку они сохраняют эквивалентную аффинность связывания, т.е. они связывают тот же антиген с аффинностью, сравнимой с IgG-антителом, из которого они происходят. В одном аспекте такие фрагменты антител являются функциональными, поскольку они обеспечивают биологический ответ, который может включать, но не ограничивается ими, активацию иммунного ответа, ингибирование индукции передачи сигнала от их антигена-мишени, ингибирование киназной активности и т.п., как будет понятно специалисту в данной области. В одном аспекте домен CAR, связывающий антиген мезотелина, представляет собой scFv-фрагмент антитела, который является человеческим или гуманизированным по сравнению с последовательностью мыши для scFv, из которого он происходит. В одном варианте осуществления scFv-фрагмент антитела против мезотелина человека содержит вариабельную область легкой цепи и/или вариабельную область тяжелой цепи, представленную в таблице 2, или последовательность с существенной идентичностью с ней, например, с 95-99% идентичностью.
[00186] В некоторых аспектах антитела по изобретению включены в химерный рецептор антигена (CAR). В одном аспекте CAR содержит полипептидную последовательность, представленную в настоящем описании как SEQ ID NO: 39; SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61 и SEQ ID NO: 62, или последовательность с 95-99% идентичностью с ними.
[00187] В одном аспекте часть CAR в виде scFv человека кодируется трансгеном, последовательность которого подвергнута оптимизации кодонов для экспрессии в клетке млекопитающего. В одном аспекте вся конструкция CAR по изобретению кодируется трансгеном, полная последовательность которого подвергнута оптимизации кодонов для экспрессии в клетке млекопитающего. Оптимизация кодонов относится к открытию, что частота встречаемости синонимичных кодонов (т.е. кодонов, которые кодируют одну и ту же аминокислоту) в кодирующей ДНК является смещенной в различных видах. Такая вырожденность кодонов позволяет кодирование идентичных полипептидов различными нуклеотидными последовательностями. Различные способы оптимизации кодонов известны в данной области и включают, например, способы, описанные по меньшей мере в патентах США под номерами 5786464 и 6114148.
[00188] В одном аспекте CAR против мезотелина человека содержит scFv-часть, представленную в SEQ ID NO: 39. В одном аспекте CAR против мезотелина человека содержит scFv-часть, представленную в SEQ ID NO: 40. В одном аспекте CAR против мезотелина человека содержит scFv-часть, представленную в SEQ ID NO: 41. В одном аспекте CAR против мезотелина человека содержит scFv-часть, представленную в SEQ ID NO: 42. В одном аспекте CAR против мезотелина человека содержит scFv-часть, представленную в SEQ ID NO: 43. В одном аспекте CAR против мезотелина человека содержит scFv-часть, представленную в SEQ ID NO: 44. В одном аспекте CAR против мезотелина человека содержит scFv-часть, представленную в SEQ ID NO: 45. В одном аспекте CAR против мезотелина человека содержит scFv-часть, представленную в SEQ ID NO: 46. В одном аспекте CAR против мезотелина человека содержит scFv-часть, представленную в SEQ ID NO: 47. В одном аспекте CAR против мезотелина человека содержит scFv-часть, представленную в SEQ ID NO: 48. В одном аспекте CAR против мезотелина человека содержит scFv-часть, представленную в SEQ ID NO: 49. В одном аспекте CAR против мезотелина человека содержит scFv-часть, представленную в SEQ ID NO: 50. В одном аспекте CAR против мезотелина человека содержит scFv-часть, представленную в SEQ ID NO: 51. В одном аспекте CAR против мезотелина человека содержит scFv-часть, представленную в SEQ ID NO: 52. В одном аспекте CAR против мезотелина человека содержит scFv-часть, представленную в SEQ ID NO: 53. В одном аспекте CAR против мезотелина человека содержит scFv-часть, представленную в SEQ ID NO: 54. В одном аспекте CAR против мезотелина человека содержит scFv-часть, представленную в SEQ ID NO: 55. В одном аспекте CAR против мезотелина человека содержит scFv-часть, представленную в SEQ ID NO: 56. В одном аспекте CAR против мезотелина человека содержит scFv-часть, представленную в SEQ ID NO: 57. В одном аспекте CAR против мезотелина человека содержит scFv-часть, представленную в SEQ ID NO: 58. В одном аспекте CAR против мезотелина человека содержит scFv-часть, представленную в SEQ ID NO: 59. В одном аспекте CAR против мезотелина человека содержит scFv-часть, представленную в SEQ ID NO: 60. В одном аспекте CAR против мезотелина человека содержит scFv-часть, представленную в SEQ ID NO: 61. В одном аспекте CAR против мезотелина человека содержит scFv-часть, представленную в SEQ ID NO: 62.
[00189] В одном аспекте CAR, описанный в настоящем описании, сочетает в себе антигенсвязывающий домен специфического антитела с внутриклеточной сигнальной молекулой. Например, в некоторых аспектах внутриклеточная сигнальная молекула включает, но не ограничивается ими, зета-цепь CD3, сигнальные модули 4-1BB и CD28 и их комбинации. В одном аспекте антигенсвязывавющий домен связывается с мезотелином. В одном аспекте CAR против мезотелина содержит последовательность, представленную в таблице 2.
[00190] В одном аспекте CAR против мезотелина включает CAR, выбранный из последовательности, представленной в одной или более из SEQ ID NO: 63-86. В одном аспекте CAR против мезотелина содержит последовательность, представленную в SEQ ID NO: 63. В одном аспекте CAR против мезотелина содержит последовательность, представленную в SEQ ID NO: 64. В одном аспекте CAR против мезотелина содержит последовательность, представленную в SEQ ID NO: 65. В одном аспекте CAR против мезотелина содержит последовательность, представленную в SEQ ID NO: 66. В одном аспекте CAR против мезотелина содержит последовательность, представленную в SEQ ID NO: 67. В одном аспекте CAR против мезотелина содержит последовательность, представленную в SEQ ID NO: 68. В одном аспекте CAR против мезотелина содержит последовательность, представленную в SEQ ID NO: 69. В одном аспекте CAR против мезотелина содержит последовательность, представленную в SEQ ID NO: 70. В одном аспекте CAR против мезотелина содержит последовательность, представленную в SEQ ID NO: 71. В одном аспекте CAR против мезотелина содержит последовательность, представленную в SEQ ID NO: 72. В одном аспекте CAR против мезотелина содержит последовательность, представленную в SEQ ID NO: 73. В одном аспекте CAR против мезотелина содержит последовательность, представленную в SEQ ID NO: 74. В одном аспекте CAR против мезотелина содержит последовательность, представленную в SEQ ID NO: 75. В одном аспекте CAR против мезотелина содержит последовательность, представленную в SEQ ID NO: 76. В одном аспекте CAR против мезотелина содержит последовательность, представленную в SEQ ID NO: 77. В одном аспекте CAR против мезотелина содержит последовательность, представленную в SEQ ID NO: 78. В одном аспекте CAR против мезотелина содержит последовательность, представленную в SEQ ID NO: 79. В одном аспекте CAR против мезотелина содержит последовательность, представленную в SEQ ID NO: 80. В одном аспекте CAR против мезотелина содержит последовательность, представленную в SEQ ID NO: 81. В одном аспекте CAR против мезотелина содержит последовательность, представленную в SEQ ID NO: 82. В одном аспекте CAR против мезотелина содержит последовательность, представленную в SEQ ID NO: 83. В одном аспекте CAR против мезотелина содержит последовательность, представленную в SEQ ID NO: 84. В одном аспекте CAR против мезотелина содержит последовательность, представленную в SEQ ID NO: 85. В одном аспекте CAR против мезотелина содержит последовательность, представленную в SEQ ID NO: 86.
[00191] Более того, настоящее изобретение относится к композициям CAR против мезотелина и к их применению в лекарственных средствах и способах лечения, среди прочих заболеваний, рака или любой злокачественной опухоли, или аутоиммунных заболеваний, вовлекающих клетки, которые экспрессируют мезотелин.
[00192] В одном аспекте изобретение относится к клетке (например, T-клетка или NK-клетка), модифицированной способами инженерии для экспрессии химерного рецептора антигена (CAR), где CAR T-клетка ("CART") проявляет противоопухолевое свойство. Предпочтительным антигеном является мезотелин. В одном аспекте антигенсвязывающий домен CAR содержит фрагмент антитела человека против мезотелина. В одном аспекте антигенсвязывающий домен CAR содержит фрагмент антитела человека против мезотелина, содержащий scFv. Таким образом, изобретение относится к CAR против мезотелина, который содержит мезотелин-связывающий домен человека и введен способами инженерии в T-клетку или NK-клетку, и к способам их применения для адоптивной терапии.
[00193] В одном аспекте CAR против мезотелина содержит по меньшей мере один внутриклеточный сигнальный домен, выбранный из группы, состоящей из сигнального домена CD137 (4-1BB), сигнального домена CD28, сигнального домена CD3-зета и любой их комбинации. В одном аспекте CAR против мезотелина содержит по меньшей мере один внутриклеточный сигнальный домен одной или более костимулирующей молекулы(молекул), отличной от сигнального домена CD137 (4-1BB) или CD28, CD3-зета, или любой их комбинации.
[00194] Более того, настоящее изобретение относится к композициям CAR против мезотелина и к их применению в лекарственных средствах и способах лечения, среди прочих заболеваний, рака или любой злокачественной опухоли, или аутоиммунных заболеваний, вовлекающих клетки или ткани, которые экспрессируют мезотелин.
Химерный рецептор антигена (CAR)
[00195] Настоящее изобретение охватывает рекомбинантную конструкцию нуклеиновой кислоты, содержащую последовательности, кодирующие CAR, где CAR содержит антитело, которое специфически связывается с мезотелином, например, фрагмент антитела человека, который специфически связывается с мезотелином. В одном аспекте мезотелин представляет собой мезотелин человека, и последовательность фрагмента антитела является соседней и находится в одной рамке считывания с последовательностью нуклеиновой кислоты, кодирующей внутриклеточный сигнальный домен. Внутриклеточный сигнальный домен может содержать костимулирующий сигнальный домен и/или первичный сигнальный домен, например, зета-цепь. Костимулирующий сигнальный домен относится к части CAR, содержащей по меньшей мере часть внутриклеточного домена костимулирующей молекулы.
[00196] В конкретных аспектах конструкция CAR по изобретению содержит scFv-домен, выбранный из группы, состоящей из SEQ ID NO: 39-62, где scFv может предшествовать необязательная лидерная последовательность, такая как последовательность, представленная в SEQ ID NO: 1, и после него может следовать необязательная последовательность шарнирной области, такая как последовательность, представленная в SEQ ID NO: 2, или SEQ ID NO: 3, или SEQ ID NO: 4, или SEQ ID NO: 5, трансмембранная область, такая как последовательность, представленная в SEQ ID NO: 6, внутриклеточный сигнальный домен, который включает SEQ ID NO: 7 или SEQ ID NO: 8, и последовательность CD3-зета, которая включает SEQ ID NO: 9 или SEQ ID NO: 10, где домены являются соседними и находятся в одной рамке считывания для формирования слитого белка. Также изобретение включает нуклеотидную последовательность, которая кодирует полипептид, выбранный из группы, состоящей из SEQ ID NO: 87; SEQ ID NO: 88, SEQ ID NO: 89, SEQ ID NO: 90, SEQ ID NO: 91, SEQ ID NO: 92, SEQ ID NO: 93, SEQ ID NO: 94, SEQ ID NO: 95, SEQ ID NO: 96, SEQ ID NO: 97, SEQ ID NO: 98, SEQ ID NO: 99, SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 102, SEQ ID NO: 103, SEQ ID NO: 104, SEQ ID NO: 105, SEQ ID NO: 106, SEQ ID NO: 107, SEQ ID NO: 108, SEQ ID NO: 109 и SEQ ID NO: 110, или последовательность с 95-99% идентичностью с ними. Также изобретение включает нуклеотидную последовательность, которая кодирует полипептид каждого из scFv-фрагментов, выбранных из группы, состоящей из SEQ ID NO: 39; SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61 и SEQ ID NO: 62, или последовательность с 95-99% идентичностью с ними, и каждый из доменов SEQ ID NO: 1, 2 и 6-9, плюс кодируемый слитый белок CAR против мезотелина по изобретению. В одном аспекте иллюстративные конструкции CAR против мезотелина содержат необязательную лидерную последовательность, внеклеточный мезотелин-связывающий домен, шарнирную область, трансмембранный домен и внутриклеточный стимулирующий домен. В одном аспекте конструкция CAR против мезотелина содержит необязательную лидерную последовательность, мезотелин-связывающий домен, шарнирную область, трансмембранный домен, внутриклеточный костимулирующий домен и внутриклеточный стимулирующий домен. Конкретные конструкции CAR против мезотелина, содержащие scFv-домены человека, представлены в качестве SEQ ID NO: 87-110.
[00197] Полноразмерные последовательности CAR также представлены в настоящем описании в качестве SEQ ID NO: 63; SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 69, SEQ ID NO: 70, SEQ ID NO: 71, SEQ ID NO: 72, SEQ ID NO: 73, SEQ ID NO: 74, SEQ ID NO: 75, SEQ ID NO: 76, SEQ ID NO: 77, SEQ ID NO: 78, SEQ ID NO: 79, SEQ ID NO: 80, SEQ ID NO: 81, SEQ ID NO: 82, SEQ ID NO: 83, SEQ ID NO: 84, SEQ ID NO: 85 или SEQ ID NO: 86. Иллюстративная лидерная последовательность представлена в качестве SEQ ID NO: 1. Иллюстративная шарнирная/спейсерная последовательность представлена в качестве SEQ ID NO: 2 или SEQ ID NO: 3 или SEQ ID NO: 4 или SEQ ID NO: 5. Иллюстративная последовательность трансмембранного домена последовательность представлена в качестве SEQ ID NO: 6. Иллюстративная последовательность внутриклеточного сигнального домена белка 4-1BB представлена в качестве SEQ ID NO: 7. Иллюстративная последовательность внутриклеточного сигнального домена CD27 представлена в качестве SEQ ID NO: 8. Иллюстративная последовательность домена CD3-зета представлена в качестве SEQ ID NO: 9 или SEQ ID NO: 10.
[00198] В одном аспекте настоящее изобретение охватывает рекомбинантную конструкцию нуклеиновой кислоты, содержащую молекулу нуклеиновой кислоты, кодирующую CAR, где молекула нуклеиновой кислоты содержит последовательность нуклеиновой кислоты, кодирующую мезотелин-связывающий домен, например, описанный в настоящем описании, который является соседним и находится в одной рамке считывания с последовательностью нуклеиновой кислоты, кодирующей внутриклеточный сигнальный домен. В одном аспекте мезотелин-связывающий домен выбран из одной или более из SEQ ID NO: 87-110. В одном аспекте мезотелин-связывающий домен содержит SEQ ID NO: 87. В одном аспекте мезотелин-связывающий домен содержит SEQ ID NO: 88. В одном аспекте мезотелин-связывающий домен содержит SEQ ID NO: 89. В одном аспекте мезотелин-связывающий домен содержит SEQ ID NO: 90. В одном аспекте мезотелин-связывающий домен содержит SEQ ID NO: 91. В одном аспекте мезотелин-связывающий домен содержит SEQ ID NO: 92. В одном аспекте мезотелин-связывающий домен содержит SEQ ID NO: 93. В одном аспекте мезотелин-связывающий домен содержит SEQ ID NO: 94. В одном аспекте мезотелин-связывающий домен содержит SEQ ID NO: 95. В одном аспекте мезотелин-связывающий домен содержит SEQ ID NO: 96. В одном аспекте мезотелин-связывающий домен содержит SEQ ID NO: 97. В одном аспекте мезотелин-связывающий домен содержит SEQ ID NO: 98. В одном аспекте мезотелин-связывающий домен содержит SEQ ID NO: 99. В одном аспекте мезотелин-связывающий домен содержит SEQ ID NO: 100. В одном аспекте мезотелин-связывающий домен содержит SEQ ID NO: 101. В одном аспекте мезотелин-связывающий домен содержит SEQ ID NO: 102. В одном аспекте мезотелин-связывающий домен содержит SEQ ID NO: 103. В одном аспекте мезотелин-связывающий домен содержит SEQ ID NO: 104. В одном аспекте мезотелин-связывающий домен содержит SEQ ID NO: 105. В одном аспекте мезотелин-связывающий домен содержит SEQ ID NO: 106. В одном аспекте мезотелин-связывающий домен содержит SEQ ID NO: 107. В одном аспекте мезотелин-связывающий домен содержит SEQ ID NO: 108. В одном аспекте мезотелин-связывающий домен содержит SEQ ID NO: 109. В одном аспекте мезотелин-связывающий домен содержит SEQ ID NO: 110. В одном аспекте настоящее изобретение охватывает рекомбинантную конструкцию ДНК, содержащую трансген, кодирующий CAR, где трансген содержит последовательность нуклеиновой кислоты, кодирующую мезотелин-связывающий домен, описанный в настоящем описании, например, мезотелин-связывающий домен человека, выбранный из одной или более из SEQ ID NO: 87-110, где последовательность является соседней и находится в рамке считывания с последовательностью нуклеиновой кислоты, кодирующей внутриклеточный сигнальный домен. Иллюстративный внутриклеточный сигнальный домен, который можно использовать в CAR, включает, но не ограничивается ими, один или более внутриклеточных сигнальных доменов из, например, CD3-зета, CD28, 4-1BB и т.п. В некоторых случаях CAR может содержать любую комбинацию CD3-зета, CD28, 4-1BB и т.п. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR по изобретению выбрана из одной или более из SEQ ID NO: 111-134. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 111. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 112. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 113. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 114. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 115. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 116. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 117. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 118. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 119. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 120. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 121. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 122. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 123. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 124. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 125. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 126. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 127. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 128. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 129. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 130. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 131. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 132. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 133. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 134.
[00199] Последовательности нуклеиновых кислот, кодирующие желаемые молекулы, можно получать с использованием рекомбинантных способов, известных в данной области, например, таких как скрининг библиотек клеток, экспрессирующих ген, получение гена из вектора, о котором известно, что он включает его, или выделение непосредственно из клеток и тканей, содержащих его, с использованием стандартных способов. Альтернативно представляющую интерес нуклеиновую кислоту можно получать синтетически, а не клонировать.
[00200] Настоящее изобретение включает конструкции ретровирусных и лентивирусных векторов, экспресирующие CAR, которые можно прямо трансдуцировать в клетку. Настоящее изобретение также включает конструкцию РНК, которая может быть прямо трансфицирована в клетку. Способ получения мРНК для применения в трансфекции вовлекает транскрипцию in vitro (IVT) матрицы с использованием специально сконструированных праймеров, с последующим присоединением поли-A, с получением конструкции, содержащей 3’- и 5’-нетранслируемую последовательность ("UTR"), 5’-кэп и/или участок внутренней посадки рибосомы (IRES), нуклеиновую кислоту, подлежащую экспрессии, и поли-A хвостовую часть, как правило, длиной 50-2000 оснований (SEQ ID NO: 35). РНК, полученную таким образом, можно эффективно трансфицировать в различные типы клеток. В одном варианте осуществления матрица включает последовательности CAR. В одном варианте осуществления РНК-вектор CAR трансдуцируют в T-клетку способом электропорации.
Антигенсвязывающий домен
[00201] В одном аспекте CAR по изобретению содержит специфичный к мишени связывающий элемент, также называемый антигенсвязывающим доменом. Выбор антигенсвязывающего домена зависит от типа и количества антигенов, которые определяют поверхность клетки-мишени. Например, антигенсвязывающий домен может быть выбран так, чтобы он распознавал антиген, который выступает в качестве маркера клеточной поверхности на клетках-мишенях, ассоциированных с конкретным болезненным состоянием.
[00202] В одном аспекте опосредуемый CAR ответ иммунных эффекторных клеток может быть направлен на клетки, которые экспрессируют представляющий интерес антиген, где CAR содержит антигенсвязывающий домен, который специфически связывается с представляющим интерес антигеном. В одном аспекте часть CAR, содержащая антигенсвязывающий домен, содержит антигенсвязывающий домен, который нацелен на мезотелин. В одном аспекте антигенсвязывающий домен нацелен на мезотелин человека.
[00203] Антигенсвязывающий домен может представлять собой любой домен, который связывается с антигеном, включая, но не ограничиваясь ими, моноклональное антитело, поликлональное антитело, рекомбинантное антитело, антитело человека, гуманизированное антитело и его функциональный фрагмент, включая, но не ограничиваясь ими, однодоменное антитело, такое как вариабельный домен тяжелой цепи (VH), вариабельный домен легкой цепи (VL) и вариабельный домен (VHH) наноантитела, происходящего из животного семейства верблюжьих, и альтернативный каркас, о котором в данной области известно, что он функционирует в качестве антигенсвязывающего домена, такой как рекомбинантный домен фибронектина и т.п. В некоторых случаях является предпочтительным, чтобы антигенсвязывающий домен происходил из того же вида, в котором в итоге будет использоваться CAR. Например, для применения у человека может быть предпочтительным, чтобы антигенсвязывающий домен CAR содержал остатки человека или гуманизированные остатки для антигенсвязывающего домена антитела или фрагмента антитела. Таким образом, в одном аспекте антигенсвязывающий домен содержит антитело или фрагмент антитела человека.
[00204] В одном варианте осуществления мезотелин-связывающий домен не конкурирует или плохо конкурирует за связывание мезотелина человека с антигенсвязывающим доменом, содержащим аминокислотную последовательность, содержащую SEQ ID NO: 279, например, scFv SS1 мыши, например, в конкурентном анализе, описанном в настоящем описании.
[00205] Аминокислотная последовательность scFv SS1 мыши представлена ниже (SEQ ID NO: 279):
QVQLQQSGPELEKPGASVKISCKASGYSFTGYTMNWVKQSHGKSLEWIGLITPYNGASSYNQKFRGKATLTVDKSSSTAYMDLLSLTSEDSAVYFCARGGYDGRGFDYWGQGTTVTVSSGGGGSGGGGSGGGGSDIELTQSPAIMSASPGEKVTMTCSASSSVSYMHWYQQKSGTSPKRWIYDTSKLASGVPGRFSGSGSGNSYSLTISSVEAEDDATYYCQQWSGYPLTFGAGTKLEI
[00206] В одном варианте осуществления мезотелин-связывающий домен конкурирует за связывание мезотелина человека с антигенсвязывающим доменом, содержащим CDR1 LC, CDR2 LC и CDR3 LC аминокислотной последовательности легкой цепи антитела против мезотелина, выбранной из SEQ ID NO: 43 или SEQ ID NO: 49, и CDR1 HC, CDR2 HC и CDR3 HC аминокислотной последовательности тяжелой цепи антитела против мезотелина, выбранной из SEQ ID NO: 43 или SEQ ID NO: 49, например, в конкурентном анализе, описанном в настоящем описании. В одном варианте осуществления мезотелин-связывающий домен конкурирует за связывание мезотелина человека с антигенсвязывающим доменом, содержащим CDR1 LC, выбранную из SEQ ID NO: 203 или SEQ ID NO: 209, CDR2 LC, выбранную из SEQ ID NO: 227 или SEQ ID NO: 233, и CDR3 LC, выбранную из SEQ ID NO: 251 или SEQ ID NO: 257; и CDR1 HC, выбранную из SEQ ID NO: 138 или SEQ ID NO: 144, CDR2 HC, выбранную из SEQ ID NO: 156 или SEQ ID NO: 162, и CDR3 HC, выбранную из SEQ ID NO: 179 или SEQ ID NO: 185, например, в конкурентном анализе, описанном в настоящем описании.
[00207] В одном варианте осуществления мезотелин-связывающий домен конкурирует за связывание мезотелина человека с антигенсвязывающим доменом, содержащим последовательность, выбранную из SEQ ID NO: 43 или SEQ ID NO: 49, например, в конкурентном анализе, описанном в настоящем описании.
[00208] В вариантах осуществления конкурентный анализ представляет собой анализе на основе SPR. В кратком изложении антиген, например, мезотелин человека, иммобилизован на поверхности. С использованием микроструйной системы эталонное антитело инжектируют над слоем антигена. При связывании эталонного антитела с антигеном выявляется увеличение сигнала, например эталонного сигнала, как правило, выражаемое в единицах ответа (RU). После требуемого периода времени исследуемое антитело инжектируют над поверхностью слоя антигена. Если исследуемое антитело связывается с другой областью или эпитопом антигена, тогда обнаруживается дополнительное увеличение сигнала, например RU, например, на 5% или более, 10% или более, 15% или более, 20% или более, 25% или более, 30% или более, 35% или более, 40% или более, 45% или более, 50% или более, 55% или более, 60% или более, 65% или более, 70% или более, 75% или более, 80% или более, 85% или более, 90% или более, или 95% или более, по сравнению с наиболее высоким сигналом, обнаруженным при связывании эталонного антитела, например, эталонным сигналом. Если исследуемое антитело связывается с той же областью или эпитопом антигена, тогда обнаруживается небольшое или отсутствие увеличения сигнала, например RU, например, составляющее менее 20%, менее 15%, менее 10%, менее 5%, менее 4%, менее 3%, менее 2% или менее 1%, по сравнению с наиболее высоким сигналом, обнаруженным при связывании эталонного антитела, например, эталонным сигналом. При использовании этого конкурентного анализа на основе SPR антитело считают конкурирующим с эталонным антителом, когда обнаруживают увеличение сигнала, например RU, составляющее менее 20%, менее 15%, менее 10%, менее 5%, менее 4%, менее 3%, менее 2% или менее 1% по сравнению с эталонным сигналом, обнаруженным при связывании эталонного антитела с антигеном. Антитело считают не конкурирующим или слабо конкурирующим с эталонным антителом, когда обнаруживают увеличение сигнала, например RU, составляющее 5% или более, 10% или более, 15% или более, 20% или более, 25% или более, 30% или более, 35% или более, 40% или более, 45% или более, 50% или более, 55% или более, 60% или более, 65% или более, 70% или более, 75% или более, 80% или более, 85% или более, 90% или более, или 95% или более по сравнению с эталонным сигналом, обнаруженным при связывании эталонного антитела с антигеном.
[00209] Идентификацию эпитопа, связываемого антигенсвязывающими доменами, описанными в настоящем описании, можно проводить различными способами, известными в данной области. Например, можно получать кристаллические структуры, содержащие антигенсвязывающий домен, связанный или находящийся в комплексе с антигеном. В другом примере можно проводить анализы, например анализ защиты, для идентификации областей антигена, которые вносят вклад в эпитоп, или для идентификации эпитопа. Иллюстративный анализ защиты, масс-спектрометрический анализ с водород/дейтериевым обменом (HDX), описан далее в примере 18. Масс-спектрометрию HDX проводили для идентификации предполагаемых эпитопов на MSLN человека, например hMSLN296-588, например SEQ ID NO: 278, для SS1 мыши, например SEQ ID NO: 279, и scFv M5, описанного в настоящем описании, например SEQ ID NO: 43. hMSLN296-588, например SEQ ID NO: 278, представляет собой аминокислоты 296-588 мезотелина человека, например, первая аминокислота SEQ ID NO: 278 представляет собой аминокислоту 296 и последняя аминокислота SEQ ID NO: 278 представляет собой аминокислоту 588. Аминокислотная последовательность мезотелина человека, аминокислоты 296-588, представлена ниже: (SEQ ID NO: 278)
EVEKTACPSGKKAREIDESLIFYKKWELEACVDAALLATQMDRVNAIPFTYEQLDVLKHKLDELYPQGYPESVIQHLGYLFLKMSPEDIRKWNVTSLETLKALLEVNKGHEMSPQAPRRPLPQVATLIDRFVKGRGQLDKDTLDTLTAFYPGYLCSLSPEELSSVPPSSIWAVRPQDLDTCDPRQLDVLYPKARLAFQNMNGSEYFVKIQSFLGGAPTEDLKALSQQNVSMDLATFMKLRTDAVLPLTVAEVQKLLGPHVEGLKAEERHRPVRDWILRQRQDDLDTLGLGLQG
[00210] Результаты масс-спектрометрического анализа HDX показали, что одна или более аминокислот из 314-315, 317-318, 346-349 и 369-375 hMSLN296-588, например, SEQ ID NO: 278, вносят вклад в эпитоп, распознаваемый SS1. Результаты масс-спектрометрического анализа HDX показали, что одна или более аминокислот из 485-490, 498-507, 532-537 или 545-572 hMSLN296-588, например, SEQ ID NO: 278, вносят вклад в эпитоп, распознаваемый антигенсвязывающим доменом против мезотелина, описанным в настоящем описании, например scFv M5, например SEQ ID NO: 43.
[00211] В одном варианте осуществления мезотелин-связывающий домен, описанный в настоящем описании, связывается с отличающимся эпитопом мезотелина человека, например SEQ ID NO: 278, чем эпитоп мезотелина человека, на который нацелен антигенсвязывающий домен, содержащий последовательность, содержащую SEQ ID NO: 279, например, SS1 мыши.
[00212] В одном варианте осуществления эпитоп, распознаваемый SS1, содержит последовательность, выбранную из аминокислот 314-315, 317-318, 346-349 или 369-375 hMSLN296-588, например SEQ ID NO: 278, или любой их комбинации. В одном варианте осуществления эпитоп, распознаваемый SS1, содержит одну или более аминокислот, выбранных из аминокислот 314-315, 317-318, 346-349 или 369-375 hMSLN296-588, например SEQ ID NO: 278.
[00213] В одном варианте осуществления мезотелин-связывающий домен, описанный в настоящем описании, связывается с C-концом мезотелина человека. В одном варианте осуществления мезотелин-связывающий домен, описанный в настоящем описании, связывает эпитоп в пределах аминокислот 450-588 SEQ ID NO: 278, например, где эпитоп, частично или целиком, может находиться в пределах аминокислот 450-588, в пределах аминокислот 480-580, или в пределах аминокислот 485-572 SEQ ID NO: 278. В одном варианте осуществления эпитоп, распознаваемый мезотелин-связывающим доменом, описанным в настоящем описании, содержит последовательность, выбранную из аминокислот 485-490, 498-507, 532-537 или 545-572 hMSLN296-588, например SEQ ID NO: 278, или любой их комбинации. В одном варианте осуществления эпитоп, распознаваемый мезотелин-связывающим доменом, описанным в настоящем описании, содержит одну или более аминокислот, выбранных из 485-490, 498-507, 532-537 или 545-572 hMSLN296-588, например SEQ ID NO: 278, или любой их комбинации.
[00214] В одном варианте осуществления мезотелин-связывающий домен содержит одну или более (например, все три) из определяющей комплементарность области 1 легкой цепи (CDR1 LC), определяющей комплементарность области 2 легкой цепи (CDR2 LC) и определяющей комплементарность области 3 легкой цепи (CDR3 LC) мезотелин-связывающего домена человека, выбранного из SEQ ID NO: 39-62, и одну или более (например, все три) из определяющей комплементарность области 1 тяжелой цепи (CDR1 HC), определяющей комплементарность области 2 тяжелой цепи (CDR2 HC) и определяющей комплементарность области 3 тяжелой цепи (CDR3 HC) мезотелин-связывающего домена человека, выбранного из SEQ ID NO: 39-62. В одном варианте осуществления мезотелин-связывающий домен человека содержит вариабельную область легкой цепи, описанную в настоящем описании (например, в таблице 2), и/или вариабельную область тяжелой цепи, описанную в настоящем описании (например, в таблице 2). В одном варианте осуществления мезотелин-связывающий домен представляет собой scFv, содержащий вариабельную область легкой цепи и вариабельную область тяжелой цепи с аминокислотной последовательностью, представленной в таблице 2. В одном варианте осуществления мезотелин-связывающий домен (например, scFV) содержит: вариабельную область легкой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены), но не более 30, 20 или 10 модификаций (например, замен) аминокислотной последовательности вариабельной области легкой цепи, представленной в таблице 2, или последовательности с 95-99% идентичностью с аминокислотной последовательностью, представленной в таблице 2; и/или вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены) но не более 30, 20 или 10 модификаций (например, замен) аминокислотной последовательности вариабельной области тяжелой цепи, представленной в таблице 2, или последовательности с 95-99% идентичностью с аминокислотной последовательности, представленной в таблице 2.
[00215] В одном варианте осуществления мезотелин-связывающий домен человека содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 39-62, или последовательность с 95-99% идентичностью с ней. В одном варианте осуществления последовательность нуклеиновой кислоты, кодирующая мезотелин-связывающий домен человека, содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 87-110, или последовательность с 95-99% идентичностью с ней. В одном варианте осуществления мезотелин-связывающий домен человека представляет собой scFv, и вариабельная область легкой цепи, содержащая аминокислотную последовательность, описанную в настоящем описании, например, в таблице 2 или 3, связана с вариабельной областью тяжелой цепи, содержащей аминокислотную последовательность, описанную в настоящем описании, например, в таблице 2 или 3, через линкер, например, линкер, описанный в настоящем описании. В одном варианте осуществления гуманизированный мезотелин-связывающий домен включает линкер (Gly4-Ser)n (SEQ ID NO: 26), где n представляет собой 1, 2, 3, 4, 5 или 6, предпочтительно 3 или 4. Вариабельная область легкой цепи и вариабельная область тяжелой цепи scFv могут находиться, например, в любой из следующих ориентаций: вариабельная область легкой цепи-линкер-вариабельная область тяжелой цепи или вариабельная область тяжелой цепи-линкер-вариабельная область легкой цепи.
[00216] В одном аспекте часть в виде антигенсвязывающего домена содержит одну или более последовательностей, выбранных из SEQ ID NO: 39-62. В одном аспекте CAR выбран из одной или более последовательностей, выбранных из SEQ ID NO: 63-86.
[00217] В одном аспекте антитела по изобретению могут существовать в множестве других форм, включая, например, Fab, Fab', F(ab')2, Fv-фрагменты, scFv-фрагменты антител, связанные дисульфидной связью Fv (sdFv), Fd-фрагмент, состоящий из доменов VH и CH1, линейные антитела, однодоменные антитела, такие как sdAb (либо VL, либо VH), домены VHH животных семейства верблюжьих, мультиспецифические антитела, образованные из фрагментов антител, таких как двухвалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области, и выделенную CDR или другие связывающие эпитоп фрагменты антитела. В одном аспекте фрагмент антитела, описанный в настоящем описании, представляет собой scFv. В некоторых случаях scFv человека также может происходить из библиотеки дрожжевого дисплея.
[00218] Библиотека дисплея представляет собой коллекцию структур; каждая структура включает доступный полипептидный компонент и поддающийся выделению компонент, который кодирует или идентифицирует полипептидный компонент. Полипептидный компонент варьируется так, чтобы были представлены различные аминокислотные последовательности. Полипептидный компонент может иметь любую длину, например, от трех аминокислот до более чем 300 аминокислот. Структура библиотеки дисплея может включать более одного полипептидного компонента, например, две полипептидных цепи Fab. В одном иллюстративном варианте осуществления библиотеку дисплея можно использовать для идентификации мезотелин-связывающего домена. При селекции полипептидный компонент каждого представителя библиотеки исследуют с использованием мезотелина или его фрагмента, и, если полипептидный компонент связывается с мезотелином, представителя библиотеки дисплея идентифицируют, как правило, по удержанию на подложке.
[00219] Удерживаемые представители библиотеки дисплея выделяют с подложки и анализируют. Анализ может включать амплификацию и последующую селекцию в сходных или несходных условиях. Например, можно чередовать положительную и отрицательную селекции. Анализ также может включать определение аминокислотной последовательности полипептидного компонента, т.е. мезотелин-связывающего домена, и очистку полипептидного компонента для детальной охарактеризации.
[00220] Можно использовать множество форматов библиотек дисплея. Примеры включают фаговый дисплей. В фаговом дисплее белковой компонент обычно связан с белком оболочки бактериофага. Связывание является результатом трансляции нуклеиновой кислоты, кодирующей белковый компонент, слитый с белком оболочки. Связь может включать гибкий пептидный линкер, участок для протеазы или аминокислоту, включенную в результате подавления стоп-кодона. Фаговый дисплей описан, например, в патенте США 5223409; Smith (1985) Science 228:1315-1317; WO 92/18619; WO 91/17271; WO 92/20791; WO 92/15679; WO 93/01288; WO 92/01047; WO 92/09690; WO 90/02809; de Haard et al. (1999) J. Biol. Chem 274:18218-30; Hoogenboom et al. (1998) Immunotechnology 4:1-20; Hoogenboom et al. (2000) Immunol Today 2:371-8 и Hoet et al. (2005) Nat Biotechnol. 23(3)344-8. Бактериофаг, экспонирующий белковый компонент, можно выращивать и собирать с использованием стандартных способов получения фагов, например, преципитации с PEG из среды для роста. После отбора индивидуальных фагов дисплея нуклеиновую кислоту, кодирующую выбранные белковые компоненты, можно выделять из клеток, инфицированных выбранными фагами, или из самих фагов, после амплификации. Индивидуальные колонии или бляшки можно отбирать, из них можно выделять нуклеиновую кислоту и ее можно секвенировать.
[00221] Другие форматы дисплея включают клеточный дисплей (см., например, WO 03/029456), слитые конструкции белок-нуклеиновая кислота (см., например, US 6207446), рибосомальный дисплей (см., например, Mattheakis et al. (1994) Proc. Natl. Acad. Sci. USA 91:9022 и Hanes et al. (2000) Nat Biotechnol. 18:1287-92; Hanes et al. (2000) Methods Enzymol. 328:404-30; и Schaffitzel et al. (1999) J Immunol Methods. 231(1-2):119-35), и периплазматический дисплей E. coli (J Immunol Methods. 2005 Nov 22; PMID: 16337958).
[00222] В дополнение к применению библиотек дисплея для получения мезотелин-связывающего домена можно использовать другие способы. Например, мезотелин или его фрагмент можно использовать в качестве антигена у не являющегося человеком животного, например, грызуна.
[00223] В одном варианте осуществления не являющееся человеком животное включает по меньшей мере часть гена иммуноглобулина человека. Например, является возможным конструирование линий мышей с дефицитом продукции антител мыши, имеющих большие фрагменты локусов Ig человека. С использованием технологии гибридом можно продуцировать и отбирать антигенспецифические моноклональные антитела (Mab), происходящие из генов с желаемой специфичностью. См., например, XenoMouseTM, Green et al., 1994, Nat. Gen. 7:13-21; U.S. 2003-0070185, WO 96/34096, опубликованную 31 октября 1996 года, и заявку PCT № PCT/US96/05928, поданную 29 апреля 1996 года.
[00224] В некоторых случаях scFv можно получать в соответствии со способом, известным в данной области (см., например, Bird et al., (1988) Science 242:423-426 и Huston et al., (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883). Молекулы ScFv можно получать путем связывания областей VH и VL вместе, например, с использованием гибких полипептидных линкеров.Молекулы scFv могут содержать линкер (например, линкер Ser-Gly) с оптимизированной длиной и/или аминокислотным составом.Длина линкера может в значительной степени влиять на то, как вариабельные области scFv будут сворачиваться и взаимодействовать. В действительности, если используют короткий полипептидный линкер (например, 5-10 аминокислот), это препятствует внутрицепочечному фолдингу. Внутрицепочечный фолдинг также требуется для сближения двух вариабельных областей для формирования функционального участка связывания эпитопа. Для примера ориентации и размера линкера см., например, Hollinger et al. 1993 Proc Natl Acad. Sci. U.S.A. 90:6444-6448, публикации патентных заявок США № 2005/0100543, 2005/0175606, 2007/0014794, и публикации PCT № WO2006/020258 и WO2007/024715, которые включены в настоящее описание в качестве ссылок.
[00225] scFv может содержать линкер по меньшей мере из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50 или более аминокислотных остатков между его областями VL и VH. Линкерная последовательность может содержать любую встречающуюся в природе аминокислоту. В некоторых вариантах осуществления линкерная последовательность содержит аминокислоты глицин и серин. В другом варианте осуществления линкерная последовательность содержит наборы глициновых и сериновых повторов, такие как (Gly4Ser)n, где n представляет собой положительное целое число, равное или превышающее 1. (SEQ ID NO: 135) В одном варианте осуществления линкер может представлять собой (Gly4Ser)4 (SEQ ID NO: 27) или (Gly4Ser)3(SEQ ID NO: 28). Варьирование длины линкера может сохранять или повышать активность, обеспечивая улучшенную эффективность в исследованиях активности.
Стабильность и мутации
[00226] Стабильность мезотелин-связывающего домена, например молекул scFv (например, растворимого scFv), можно оценивать относительно биофизических свойств (например, термическая стабильность) стандартной контрольной молекулы scFv или полноразмерного антитела. В одном варианте осуществления scFv человека имеет термическую стабильность, превышающую приблизительно 0,1, приблизительно 0,25, приблизительно 0,5, приблизительно 0,75, приблизительно 1, приблизительно 1,25, приблизительно 1,5, приблизительно 1,75, приблизительно 2, приблизительно 2,5, приблизительно 3, приблизительно 3,5, приблизительно 4, приблизительно 4,5, приблизительно 5, приблизительно 5,5, приблизительно 6, приблизительно 6,5, приблизительно 7, приблизительно 7,5, приблизительно 8, приблизительно 8,5, приблизительно 9, приблизительно 9,5, приблизительно 10 градусов, приблизительно 11 градусов, приблизительно 12 градусов, приблизительно 13 градусов, приблизительно 14 градусов или приблизительно 15 градусов Цельсия относительно контрольной связывающей молекулы (например, стандартной молекулы scFv) в описанных анализах.
[00227] Затем увеличенную термическую стабильность мезотелин-связывающего домена, например scFv, сообщают всей конструкции CAR против мезотелина, что приводит к улучшению терапевтических свойств конструкции CAR против мезотелина. Термическую стабильность мезотелин-связывающего домена, например scFv, можно повышать по меньшей мере приблизительно на 2°C или 3°C по сравнению со стандартным антителом. В одном варианте осуществления мезотелин-связывающий домен, например scFv, имеет термическую стабильность, увеличенную на 1°C, по сравнению со стандартным антителом. В другом варианте осуществления мезотелин-связывающий домен, например scFv, имеет термическую стабильность, увеличенную на 2°C, по сравнению со стандартным антителом. В другом варианте осуществления мезотелин-связывающий домен, например scFv, имеет термическую стабильность, увеличенную на 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15°C по сравнению со стандартным антителом. Сравнение можно проводить, например, между молекулами scFv, описанными в настоящем описании, и молекулами scFv или Fab-фрагментами антитела, из которых происходят VH и VL scFv. Термическую стабильность можно измерять с использованием способов, известных в данной области. Например, в одном варианте осуществления можно измерять Tm. Способы измерения Tm и другие способы определения стабильности белка более подробно описаны ниже.
[00228] Мутации в scFv (возникающие посредством прямого мутагенеза растворимого scFv) изменяют стабильность scFv и повышают общую стабильность scFv и конструкции CART. Стабильность гуманизированного scFv сравнивают против scFv мыши с использованием показателей, таких как Tm, температура денатурации и температура агрегации.
[00229] В одном варианте осуществления мезотелин-связывающий домен, например scFv, содержит по меньшей мере одну мутацию, так что мутантный мезотелин-связывающий домен, например scFv, сообщает увеличенную стабильность конструкции против мезотелина. В другом варианте осуществления мезотелин-связывающий домен, например scFv, содержит по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 мутаций, так что мутантный мезотелин-связывающий домен, например scFv, сообщает увеличенную стабильность конструкции против мезотелина. Связывающую способность мутантных scFv можно определять с использованием анализов, описанных в разделе "Примеры".
Аффинность связывания
[00230] В данной области известно широкое множество способов определения аффинности связывания. В иллюстративном способе определения аффинности связывания используется поверхностный плазмонный резонанс. Поверхностный плазмонный резонанс представляет собой оптическое явление, которое позволяет анализ биоспецифических взаимодействий в реальном времени путем детекции изменений концентраций белков в биосенсорной матрице, например, с использованием системы BIAcore (Pharmacia Biosensor AB, Uppsala, Швеция, и Piscataway, N.J.). Для более подробного описания см. Jonsson, U., et al. (1993) Ann. Biol. Clin. 51:19-26; Jonsson, U., i (1991) Biotechniques 11:620-627; Johnsson, B., et al. (1995) J. Mol. Recognit. 8:125-131; и Johnnson, B., et al. (1991) Anal. Biochem. 198:268-277.
[00231] В одном аспекте часть композиции CAR по изобретению, содержащая антитело или его фрагмент, содержит аминокислотные последовательности, которые гомологичны аминокислотным последовательностям, описанным в настоящем описании и где антитело или его фрагмент сохраняют желаемые функциональные свойства фрагментов антитела против мезотелина по изобретению. В одном конкретном аспекте композиция CAR по изобретению содержит фрагмент антитела. В следующем аспекте этот фрагмент антитела содержит scFv.
[00232] В различных аспектах часть, содержащая антитело или фрагмент антитела, в композиции CAR по изобретению, модифицирована способами инженерии путем модификации одной или более аминокислот в одной или обеих вариабельных областях (т.е. VH и/или VL), например, в одной или более областях CDR и/или в одной или более каркасных областях. В одном конкретном аспекте композиция CAR по изобретению содержит фрагмент антитела. В следующем аспекте этот фрагмент антитела содержит scFv.
[00233] Специалисту в данной области будет понятно, что антитело или фрагмент антитела по изобретению можно далее модифицировать так, чтобы варьировалась их аминокислотная последовательность (например, относительно дикого типа), но не желаемая активность. Например, в белке можно проводить дополнительные нуклеотидные замены, приводящие к аминокислотным заменам в "несущественных" аминокислотных остатках. Например, несущественный аминокислотный остаток в молекуле можно заменять другим аминокислотным остатком из того же семейства боковых цепей. В другом варианте осуществления цепь аминокислот можно заменять структурно сходной цепью, которая отличается порядком и/или композицией представителей семейства боковых цепей, т.е. можно проводить консервативную замену, в которой аминокислотный остаток заменяют аминокислотным остатком со сходной боковой цепью.
[00234] Семейства аминокислотных остатков, имеющих сходные боковые цепи, определены в данной области, включая основные боковые цепи (например, лизин, аргинин, гистидин), кислотные боковые цепи (например, аспарагиновая кислота, глутаминовая кислота), незаряженные полярные боковые цепи (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин), неполярные боковые цепи (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета-разветвленные боковые цепи (например, треонин, валин, изолейцин) и ароматические боковые цепи (например, тирозин, фенилаланин, триптофан, гистидин).
[00235] Процентная идентичность в контексте двух или более последовательностей нуклеиновых кислот или полипептидных последовательностей относится к двум или более последовательностям, которые являются одинаковыми. Две последовательности являются "по существу идентичными", если две последовательности имеют конкретный процент аминокислотных остатков или нуклеотидов, которые являются одинаковыми (т.е. 60% идентичность, необязательно 70%, 71%. 72%. 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%,81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% идентичность на протяжении указанной области или, когда не уточняется, на протяжении всей последовательности), при сравнении и выравнивании на максимальное соответствие на протяжении окна сравнения или указанной области, как измеряют с использованием одного из следующих алгоритмов сравнения последовательностей или путем выравнивания вручную или визуального исследования. Необязательно, идентичность существует на протяжении области, которая имеет длину по меньшей мере приблизительно 50 нуклеотидов (или 10 аминокислот), или более предпочтительно на протяжении области, которая имеет длину от 100 до 500 или 1000 или более нуклеотидов (или 20, 50, 200 или более аминокислот).
[00236] Для сравнения последовательностей, как правило, одна последовательность выступает в качестве эталонной последовательности, с которой сравнивают исследуемые последовательности. При использовании алгоритма сравнения последовательностей, исследуемую и эталонную последовательности вводят в компьютер, координаты подпоследовательностей указывают, если необходимо, и назначают параметры программы с алгоритмом сравнения последовательностей. Можно использовать параметры программы по умолчанию или альтернативно параметры можно назначать. Затем алгоритм сравнения последовательностей вычисляет процентную идентичность последовательностей для исследуемых последовательностей относительно эталонной последовательности, исходя из параметров программы. Способы выравнивания последовательностей для сравнения хорошо известны в данной области. Оптимальное выравнивание последовательностей для сравнения можно проводить, например, с использованием алгоритма локальной гомологии Smith and Waterman, (1970) Adv. Appl. Math. 2:482c, с использованием алгоритма выравнивания по гомологии Needleman and Wunsch, (1970) J. Mol. Biol. 48:443, с использованием способа поиска сходства Pearson and Lipman, (1988) Proc. Nat’l. Acad. Sci. USA 85:2444, с использованием компьютерных воплощений этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA в Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., Madison, WI), или путем выравнивания вручную и визуального исследования (см., например, Brent et al., (2003) Current Protocols in Molecular Biology).
[00237] Двумя примерами алгоритмов, которые пригодны для определения процентной идентичности последовательностей и сходства последовательностей, являются алгоритмы BLAST и BLAST 2.0, которые описаны в Altschul et al., (1977) Nuc. Acids Res. 25:3389-3402; и Altschul et al., (1990) J. Mol. Biol. 215:403-410, соответственно. Программное обеспечение для осуществления анализов BLAST является общедоступным через National Center for Biotechnology Information.
[00238] Процентную идентичность между двумя аминокислотными последовательностями также можно определять с использованием алгоритма E. Meyers и W. Miller (Comput. Appl. Biosci., 4:11-17, 1988), который включен в программу ALIGN (версии 2.0), с использованием таблицы веса остатков PAM120, штрафа за продолжение пропуска 12 и штрафа за пропуск 4. Кроме того, процентную идентичность между двумя аминокислотными последовательностями можно определять с использованием алгоритма Needleman и Wunsch (J. Mol, Biol. 48:444-453, 1970), который включен с программу GAP в пакете программ GCG (доступном на http://www.gcg.com), с использованием либо матрицы Blossum 62, либо матрицы PAM250, и штрафа за пропуск 16, 14, 12, 10, 8, 6 или 4 и штрафа за продолжение пропуска 1, 2, 3, 4, 5 или 6.
[00239] В одном аспекте настоящее изобретение предусматривает модификации исходной аминокислотной последовательности антитела или фрагмента (например, scFv), которые приводят к функционально эквивалентным молекулам. Например, VH или VL мезотелин-связывающего домена, например, scFv, содержащегося в CAR, можно модифицировать для сохранения по меньшей мере приблизительно 70%, 71%, 72%. 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% идентичности с исходной каркасной области VH или VL мезотелин-связывающего домена, например scFv. Настоящее изобретение предусматривает модификации всей конструкции CAR, например, модификации одной или более аминокислотных последовательностей различных доменов конструкции CAR для получения функционально эквивалентных молекул. Конструкцию CAR можно модифицировать, чтобы она сохраняла по меньшей мере приблизительно 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% идентичность с исходной конструкцией CAR.
Трансмембранный домен
[00240] Что касается трансмембранного домена, в различных вариантах осуществления CAR можно конструировать так, чтобы он содержал трансмембранный домен, который связан с внеклеточным доменом CAR. Трансмембранный домен может включать одну или более дополнительных аминокислот, соседних с трансмембранной областью, например, одну или более аминокислот, ассоциированных с внеклеточной областью белка, из которого происходит трансмембранный домен (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 вплоть до 15 аминокислот внеклеточной области) и/или одну или более дополнительных аминокислот, ассоциированных с внутриклеточной областью белка, из которой происходит трансмембранный белок (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 вплоть до 15 аминокислот внутриклеточной области). В одном аспекте трансмембранный домен представляет собой домен, который ассоциирован с одним из других доменов, используемых в CAR, например, в одном варианте осуществления трансмембранный домен может происходить из того же белка, что и сигнальный домен, костимулирующий домен или шарнирный домен. В другом аспекте трансмембранный домен не происходит из того же белка, что и любой другой домен CAR. В некоторых случаях трансмембранный домен можно выбирать или модифицировать посредством аминокислотной замены, чтобы избежать связывания таких доменов с трансмембранными доменами тех же или отличающихся поверхностных мембранных белков, например, для минимизации взаимодействий с другими представителями рецепторного комплекса. В одном аспекте трансмембранный домен способен к гомодимеризации с другим CAR на клеточной поверхности CAR-экспрессирующей клетки. В другом аспекте аминокислотная последовательность трансмембранного домена может быть модифицирована или замещена, чтобы минимизировать взаимодействия со связывающими доменами нативного связывающего партнера, присутствующего в той же CAR-экспрессирующей клетке.
[00241] Трансмембранный домен может происходить либо из природного, либо из рекомбинантного источника. Когда источник является природным, домен может происходить из любого мембраносвязанного или трансмембранного белка. В одном аспекте трансмембранный домен способен передавать сигнал на внутриклеточный домен(ы), когда CAR связывается с мишенью. Особенно пригодный в рамках настоящего изобретения трансмембранный домен может включать по меньшей мере трансмембранный домен(ы), например, альфа-, бета- или зета-цепи T-клеточного рецептора, CD28, CD3-эпсилон, CD45, CD4, CD5, CD8 (например, CD8-альфа, CD8-бета), CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137, CD154. В некоторых вариантах осуществления трансмембранный домен может включать по меньшей мере трансмембранную область(и), например, из KIRDS2, OX40, CD2, CD27, LFA-1 (CD11a, CD18), ICOS (CD278), 4-1BB (CD137), GITR, CD40, BAFFR, HVEM (LIGHTR), SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD160, CD19, IL2R-бета, IL2R-гамма, IL7Rα, ITGA1, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, TNFR2, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, PAG/Cbp, NKG2D и NKG2C.
[00242] В некоторых случаях трансмембранный домен может быть связан с внеклеточной областью CAR, например, антигенсвязывающим доменом CAR, через шарнирную область, например, шарнирную область из белка человека. Например, в одном варианте осуществления шарнирная область может представлять собой шарнирную область Ig (иммуноглобулина) человека (например, шарнирная область IgG4, шарнирная область IgD), линкер GS (например, линкер GS, описанный в настоящем описании), шарнирную область KIR2DS2 или шарнирную область CD8a. В одном варианте осуществления шарнирная область или спейсер содержат (например, состоят из) аминокислотную последовательности SEQ ID NO: 2. В одном аспекте трансмембранный домен содержит (например, состоит из) трансмембранный домен SEQ ID NO: 6.
[00243] В одном аспекте шарнирная область или спейсер содержат шарнирную область IgG4. Например, в одном варианте осуществления шарнирная область или спейсер содержат шарнирную область со следующей аминокислотной последовательностью: ESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGKM (SEQ ID NO: 3).
[00244] В некоторых вариантах осуществления шарнирная область или спейсер содержат шарнирную область, кодируемую следующей нуклеотидной последовательностью: GAGAGCAAGTACGGCCCTCCCTGCCCCCCTTGCCCTGCCCCCGAGTTCCTGGGCGGACCCAGCGTGTTCCTGTTCCCCCCCAAGCCCAAGGACACCCTGATGATCAGCCGGACCCCCGAGGTGACCTGTGTGGTGGTGGACGTGTCCCAGGAGGACCCCGAGGTCCAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCACAACGCCAAGACCAAGCCCCGGGAGGAGCAGTTCAATAGCACCTACCGGGTGGTGTCCGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAGGAATACAAGTGTAAGGTGTCCAACAAGGGCCTGCCCAGCAGCATCGAGAAAACCATCAGCAAGGCCAAGGGCCAGCCTCGGGAGCCCCAGGTGTACACCCTGCCCCCTAGCCAAGAGGAGATGACCAAGAACCAGGTGTCCCTGACCTGCCTGGTGAAGGGCTTCTACCCCAGCGACATCGCCGTGGAGTGGGAGAGCAACGGCCAGCCCGAGAACAACTACAAGACCACCCCCCCTGTGCTGGACAGCGACGGCAGCTTCTTCCTGTACAGCCGGCTGACCGTGGACAAGAGCCGGTGGCAGGAGGGCAACGTCTTTAGCTGCTCCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGAGCCTGAGCCTGTCCCTGGGCAAGATG (SEQ ID NO: 14).
[00245] В одном аспекте шарнирная область или спейсер содержат шарнирную область IgD. Например, в одном варианте осуществления шарнирная область или спейсер содержат шарнирную область с аминокислотной последовательностью RWPESPKAQASSVPTAQPQAEGSLAKATTAPATTRNTGRGGEEKKKEKEKEEQEERETKTPECPSHTQPLGVYLLTPAVQDLWLRDKATFTCFVVGSDLKDAHLTWEVAGKVPTGGVEEGLLERHSNGSQSQHSRLTLPRSLWNAGTSVTCTLNHPSLPPQRLMALREPAAQAPVKLSLNLLASSDPPEAASWLLCEVSGFSPPNILLMWLEDQREVNTSGFAPARPPPQPGSTTFWAWSVLRVPAPPSPQPATYTCVVSHEDSRTLLNASRSLEVSYVTDH (SEQ ID NO: 4).
[00246] В некоторых вариантах осуществления шарнирная область или спейсер содержат шарнирную область, кодируемую нуклеотидной последовательностью AGGTGGCCCGAAAGTCCCAAGGCCCAGGCATCTAGTGTTCCTACTGCACAGCCCCAGGCAGAAGGCAGCCTAGCCAAAGCTACTACTGCACCTGCCACTACGCGCAATACTGGCCGTGGCGGGGAGGAGAAGAAAAAGGAGAAAGAGAAAGAAGAACAGGAAGAGAGGGAGACCAAGACCCCTGAATGTCCATCCCATACCCAGCCGCTGGGCGTCTATCTCTTGACTCCCGCAGTACAGGACTTGTGGCTTAGAGATAAGGCCACCTTTACATGTTTCGTCGTGGGCTCTGACCTGAAGGATGCCCATTTGACTTGGGAGGTTGCCGGAAAGGTACCCACAGGGGGGGTTGAGGAAGGGTTGCTGGAGCGCCATTCCAATGGCTCTCAGAGCCAGCACTCAAGACTCACCCTTCCGAGATCCCTGTGGAACGCCGGGACCTCTGTCACATGTACTCTAAATCATCCTAGCCTGCCCCCACAGCGTCTGATGGCCCTTAGAGAGCCAGCCGCCCAGGCACCAGTTAAGCTTAGCCTGAATCTGCTCGCCAGTAGTGATCCCCCAGAGGCCGCCAGCTGGCTCTTATGCGAAGTGTCCGGCTTTAGCCCGCCCAACATCTTGCTCATGTGGCTGGAGGACCAGCGAGAAGTGAACACCAGCGGCTTCGCTCCAGCCCGGCCCCCACCCCAGCCGGGTTCTACCACATTCTGGGCCTGGAGTGTCTTAAGGGTCCCAGCACCACCTAGCCCCCAGCCAGCCACATACACCTGTGTTGTGTCCCATGAAGATAGCAGGACCCTGCTAAATGCTTCTAGGAGTCTGGAGGTTTCCTACGTGACTGACCATT (SEQ ID NO: 15).
[00247] В одном аспекте трансмембранный домен может быть рекомбинантным, и в этом случае он содержит в основном гидрофобные остатки, такие как лейцин и валин. В одном аспекте на каждом конце рекомбинантного трансмембранного домена может находиться триплет из фенилаланина, триптофана и валина.
[00248] Необязательно, короткий олиго- или полипептидный линкер длиной от 2 до 10 аминокислот может образовывать связь между трансмембранным доменом и цитоплазматической сигнальной областью CAR. Глицин-сериновый дублет обеспечивает особенно подходящий линкер. Например, в одном аспекте линкер содержит аминокислотную последовательность GGGGSGGGGS (SEQ ID NO: 5). В некоторых вариантах осуществления линкер кодируется нуклеотидной последовательностью GGTGGCGGAGGTTCTGGAGGTGGAGGTTCC (SEQ ID NO: 16).
[00249] В одном аспекте шарнирная область или спейсер содержат шарнирную область KIR2DS2 и ее часть.
Цитоплазматический домен
[00250] Цитоплазматический домен или область CAR включает внутриклеточный сигнальный домен. Внутриклеточный сигнальный домен обычно ответственен за активацию по меньшей мере одной из нормальных эффекторных функций иммунной клетки, в которую введен CAR. Термин "эффекторная функция" относится к специализированной функции клетки. Эффекторная функция T-клетки, например, может представлять собой цитолитическую активность или хелперную активность, включая секрецию цитокинов. Таким образом, термин "внутриклеточный сигнальный домен" относится к части белка, которая передает сигнал эффекторной функции и направляет клетку на выполнение специализированной функции. Хотя обычно можно использовать весь внутриклеточный сигнальный домен, во многих случаях не является обязательным использование всей цепи. Когда используют укороченную часть внутриклеточного сигнального домена, такую укороченную часть можно использовать вместо интактной цепи при условии, что она передает сигнал эффекторной функции. Таким образом, подразумевают, что термин "внутриклеточный сигнальный домен" включает любую укороченную часть внутриклеточного сигнального домена, достаточную для передачи сигнала эффекторной функции.
[00251] Примеры внутриклеточных сигнальных доменов для применения в CAR по изобретению включают цитоплазматические последовательности T-клеточного рецептора (TCR) и корецепторов, которые действуют совместно для инициации передачи сигнала после связывания рецептором антигена, а также любое производное или вариант этих последовательностей и любую рекомбинантную последовательность, которая имеет ту же функциональную способность.
[00252] Известно, что сигналы, индуцируемые TCR отдельно, являются недостаточными для полной активации T-клеток, и что также требуется вторичный и/или костимулирующий сигнал. Таким образом, можно считать, что активация T-клеток опосредуется двумя различными классами цитоплазматических сигнальных последовательностей: последовательности, которые инициируют антигензависимую первичную активацию через TCR (первичные внутриклеточные сигнальные домены), и последовательности, которые действуют независимым от антигена образом, обеспечивая вторичный или костимулирующий (вторичный цитоплазматический домен, например, костимулирующий домен).
[00253] Первичный цитоплазматический сигнальный домен регулирует первичную активацию комплекса TCR либо стимулирующим путем, либо ингибиторным путем. Первичные внутриклеточные сигнальные домены, которые действуют стимулирующим образом, могут содержать сигнальные мотивы, которые известны как иммунорецепторные тирозиновые активирующие мотивы, или ITAM.
[00254] Примеры содержащих ITAM первичных внутриклеточных сигнальных доменов, которые особенно применимы в рамках изобретения, включают сигнальные домены CD3-зета, общего FcR-гамма (FCER1G), Fc-гамма RIIa, FcR-бета (Fc-эпсилон R1b), CD3-гамма, CD3-дельта, CD3-эпсилон, CD79a, CD79b, DAP10 и DAP12. В одном варианте осуществления CAR по изобретению содержит внутриклеточный сигнальный домен, например, первичный сигнальный домен CD3-зета.
[00255] В одном варианте осуществления первичный сигнальный домен содержит модифицированный домен ITAM, например, мутантный домен ITAM, который имеет измененную (например, увеличенную или сниженную) активность по сравнению с нативным доменом ITAM. В одном варианте осуществления первичный сигнальный домен содержит модифицированный ITAM-содержащий первичный внутриклеточный сигнальный домен, например, оптимизированный и/или укороченный ITAM-содержащий первичный внутриклеточный сигнальный домен. В одном варианте осуществления первичный сигнальный домен содержит один, два, три, четыре или более мотивов ITAM.
[00256] Следующие примеры молекул, содержащих первичный внутриклеточный сигнальный домен, которые являются особенно применимыми в рамках изобретения, включают DAP10, DAP12, и CD32.
[00257] Внутриклеточный домен CAR может содержать сигнальный домен CD3-зета сам по себе или в комбинации с любым другим желаемым внутриклеточным сигнальным доменом(ами), пригодным в контексте CAR по изобретению. Например, внутриклеточный сигнальный домен CAR может содержать часть в виде цепи CD3-зета и костимулирующий сигнальный домен. Костсимулирующий сигнальный домен относится к части CAR, содержащей внутриклеточный домен костимулирующей молекулы. Костимулирующая молекула представляет собой молекулу клеточной поверхности, отличную от рецептора антигена или его лигандов, которая требуется для эффективного ответа лимфоцитов на антиген. Примеры таких молекул включают CD27, CD28, 4-1BB (CD137), OX40, CD30, CD40, PD-1 (также известный PD1), ICOS, ассоциированный с функцией лимфоцитов антиген 1 (LFA-1), CD2, CD7, LIGHT, NKG2C, B7-H3, и лиганд, который специфически связывается с CD83, и т.п. Например, было продемонстрировано, что костимуляция CD27 повышает экспансию, эффекторную функцию и выживаемость клеток CART человека in vitro и усиливает живучесть и противоопухолевую активность T-клеток человека in vivo (Song et al. Blood. 2012; 119(3):696-706). Следующие примеры таких костимулирующих молекул включают CDS, ICAM-1, GITR, BAFFR, HVEM (LIGHTR), SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD160, CD19, CD4, CD8-альфа, CD8-бета, IL2R-бета, IL2R-гамма, IL7R-альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), NKG2D, CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76 и PAG/Cbp.
[00258] Внутриклеточные сигнальные домены в цитоплазматической части CAR по изобретению могут быть связаны друг с другом в случайном или определенном порядке. Необязательно короткий олиго- или полипептидный линкер, например, длиной от 2 до 10 аминокислот (например, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот), может образовывать связь между внутриклеточными сигнальными доменами. В одном варианте осуществления в качестве подходящего линкера можно использовать глицин-сериновый дублет. В одном варианте осуществления в качестве подходящего линкера можно использовать одну аминокислоту, например, аланин, глицин.
[00259] В одном аспекте внутриклеточный сигнальный домен сконструирован, чтобы он содержал два или более, например, 2, 3, 4, 5 или более, костимулирующих сигнальных доменов. В одном варианте осуществления два или более, например, 2, 3, 4, 5 или более, костимулирующих сигнальных доменов, разделены линкерной молекулой, например линкерной молекулой, описанной в настоящем описании. В одном варианте осуществления внутриклеточный сигнальный домен содержит два костимулирующих сигнальных домена. В некоторых вариантах осуществления линкерная молекула представляет собой остаток глицина. В некоторых вариантах осуществления линкер представляет собой остаток аланина.
[00260] В одном аспекте внутриклеточный сигнальный домен сконструирован так, чтобы он содержал сигнальный домен CD3-зета и сигнальный домен CD28. В одном аспекте внутриклеточный сигнальный домен сконструирован, чтобы он содержал сигнальный домен CD3-зета и сигнальный домен 4-1BB. В одном аспекте сигнальный домен 4-1BB представляет собой сигнальный домен SEQ ID NO: 16. В одном аспекте сигнальный домен CD3-зета представляет собой сигнальный домен SEQ ID NO: 17.
[00261] В одном аспекте внутриклеточный сигнальный домен сконструирован так, чтобы он содержал сигнальный домен CD3-зета и сигнальный домен CD27. В одном аспекте сигнальный домен CD27 содержит аминокислотную последовательность QRRKYRSNKGESPVEPAEPCRYSCPREEEGSTIPIQEDYRKPEPACSP (SEQ ID NO: 8). В одном аспекте сигнальный домен CD27 кодируется последовательностью нуклеиновой кислоты AGGAGTAAGAGGAGCAGGCTCCTGCACAGTGACTACATGAACATGACTCCCCGCCGCCCCGGGCCCACCCGCAAGCATTACCAGCCCTATGCCCCACCACGCGACTTCGCAGCCTATCGCTCC (SEQ ID NO: 19).
[00262] В одном аспекте экспрессирующая CAR клетка, описанная в настоящем описании, может дополнительно содержать второй CAR, например, второй CAR, который включает другой антигенсвязывающий домен, например, для той же мишени (мезотелин) или другой мишени (например, мишень, отличная от мезотелина, на стромальных клетках, например FAP; мишень, отличная от мезотелина, на клетках рака предстательной железы, например рецептор андрогена, OR51E2, PSMA, PSCA, PDGRF-β, TARP, GloboH, MAD-CT-1 или MAD-CT-2; мишень, отличная от мезотелина, на клетках рака яичника, например, Tn, PRSS21, CD171, Lewis Y, рецептор фолатов α, клаудин 6, GloboH или белок спермы 17, например, мишень, отличная от мезотелина, на клетках рака легкого, например, VEGF, HER3, IGF-1R, EGFR, DLL4 или Trop-2). В одном варианте осуществления экспрессирующая CAR клетка содержит первый CAR, который нацелен на первый антиген и включает внутриклеточный сигнальный домен, имеющий костимулирующий сигнальный домен, но не первичный сигнальный домен, и второй CAR, который нацелен на второй отличающийся антиген и включает внутриклеточный сигнальный домен, имеющий первичный сигнальный домен, но не костисмулирующий сигнальный домен. Включение костимулирующего сигнального домена, например, 4-1BB, CD28, CD27 или OX-40, в первый CAR, и первичного сигнального домена, например, CD3-зета, во второй CAR может ограничить активность CAR до клеток, где экспрессируются обе мишени. В одном варианте осуществления экспрессирующая CAR клетка содержит первый CAR мезотелина, который включает мезотелин-связывающий домен, трансмембранный домен и костимулирующий домен, и второй CAR, который нацелен на антиген, отличный от мезотелина (например, мишень, отличная от мезотелина, на стромальных клетках, например FAP; мишень, отличная от мезотелина, на клетках рака предстательной железы, например рецептор андрогена, OR51E2, PSMA, PSCA, PDGRF-β, TARP, GloboH, MAD-CT-1 или MAD-CT-2; мишень, отличная от мезотелина, на клетках рака яичника, например, Tn, PRSS21, CD171, Lewis Y, рецептор фолатов α, клаудин 6, GloboH или белок спермы 17, например, мишень, отличная от мезотелина, на клетках рака легкого, например, VEGF, HER3, IGF-1R, EGFR, DLL4 или Trop-2), и включает антигенсвязывающий домен, трансмембранный домен и первичный сигнальный домен. В другом варианте осуществления экспрессирующая CAR клетка содержит первый CAR против мезотелина, который включает мезотелин-связывающий домен, трансмембранный домен и первичный сигнальный домен, и второй CAR, который нацелен на антиген, отличный от мезотелина (например, мишень, отличная от мезотелина, на стромальных клетках, например FAP; мишень, отличная от мезотелина, на клетках рака предстательной железы, например рецептор андрогена, OR51E2, PSMA, PSCA, PDGRF-β, TARP, GloboH, MAD-CT-1 или MAD-CT-2; мишень, отличная от мезотелина, на клетках рака яичника, например, Tn, PRSS21, CD171, Lewis Y, рецептор фолатов α, клаудин 6, GloboH или белок спермы 17, например, мишень, отличная от мезотелина, на клетках рака легкого, например, VEGF, HER3, IGF-1R, EGFR, DLL4 или Trop-2), и включает антигенсвязывающий домен для антигена, трансмембранный домен и костимулирующий сигнальный домен.
[00263] В одном варианте осуществления экспрессирующая CAR клетка содержит CAR против мезотелина, описанный в настоящем описании, и ингибиторный CAR. В одном варианте осуществления ингибиторный CAR содержит антигенсвязывающий домен, который связывает антиген, встречающийся на нормальных клетках, но не на злокачественных клетках, например, на нормальных клетках, которые также экспрессируют мезотелин. В одном варианте осуществления ингибиторный CAR содержит антигенсвязывающий домен, трансмембранный домен и внутриклеточный домен ингибиторной молекулы. Например, внутриклеточный домен ингибиторного CAR может представлять собой внутриклеточный домен PD1, PD-L1, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4 и TGFR-бета.
[00264] В одном варианте осуществления, когда экспрессирующая CAR клетка содержит два или более различных CAR, антигенсвязывающие домены различных CAR могут быть такими, что антигенсвязывающие домены не взаимодействуют друг с другом. Например, клетка, экспрессирующая первый и второй CAR, может иметь антигенсвязывающий домен первого CAR, например, в качестве фрагмента, например scFv, который не образует связи с антигенсвязывающим доменом второго CAR, например, антигенсвязывающий домен второго CAR представляет собой VHH.
[00265] В некоторых вариантах осуществления антигенсвязывающий домен содержит однодоменные антигенсвязывающие (SDAB) молекулы, которые включают молекулы, в которых определяющие комплементарность области являются частью однодоменного полипептида. Примеры включают, но не ограничиваются ими, вариабельные домены тяжелой цепи, связывающие молекулы, естественным образом лишенные легких цепей, единичные домены, происходящие из общепринятых антител с 4 цепями, сконструированные домены и однодоменные каркасы, отличные от каркасов, происходящих из антител. Молекулы SDAB могут представлять собой любые молекулы SDAB в данной области или любые будущие однодоменные молекулы. Молекулы SDAB могут происходить из любого вида, включая, но не ограничиваясь ими, мышь, человека, верблюда, ламу, миногу, рыбу, акулу, козу, кролика и животное семейства бычьих. Этот термин также включает встречающиеся в природе однодоменные молекулы антител из видов, отличных от животных семейства верблюжьих и акул.
[00266] В одном аспекте молекула SDAB может происходить из вариабельной области иммуноглобулина, встречающегося у рыб, как например, SDAB, которая происходит из изотипа иммуноглобулина, известного как новый рецептор антигенов (NAR), встречающийся в сыворотке акул. Способы получения однодоменных молекул, происходящих из вариабельной области NAR ("IgNAR") описаны в WO 03/014161 и Streltsov (2005) Protein Sci. 14:2901-2909.
[00267] Согласно другому аспекту молекула SDAB представляет собой встречающуюся в природе однодоменную антигенсвязывающую молекулу, известную как тяжелая цепь, лишенная легких цепей. Такие однодоменные молекулы описаны, например, в WO 9404678 и Hamers-Casterman, C. et al. (1993) Nature 363:446-448. Для ясности этот вариабельный домен, происходящий из молекулы тяжелой цепи, естественным образом лишенной легкой цепи, описан в настоящем описании как VHH или наноантитело, чтобы отличить его от общепринятой VH иммуноглобулинов с четырьмя цепями. Такая молекула VHH может происходить из вида животных семейства верблюжьих, например, верблюда, ламы, дромедара, альпаки и гуанако. Другие виды помимо животных семейства верблюжьих могут продуцировать молекулы тяжелых цепей, естественным образом лишенные легкой цепи; такие VHH входят в объем изобретения.
[00268] Молекулы SDAB могут быть рекомбинантными, имеющими пересаженные CDR, гуманизированными, камелизированными, деиммунизированными и/или полученными in vitro (например, отобранными с использованием фагового дисплея).
[00269] Также было открыто, что в клетках, имеющих множество химерных погруженных в мембрану рецепторов, содержащих антигенсвязывающий домен, взаимодействия между антигенсвязывающими доменами рецепторов могут быть нежелательными, например, поскольку они ингибируют способность одного или более из антигенсвязывающих доменов связывать их собственный антиген. Таким образом, в настоящем описании описаны клетки, имеющие первый и второй не встречающиеся в природе химерные погруженные в мембрану рецепторы, содержащие антигенсвязывающие домены, которые минимизируют такие взаимодействия. Также в настоящем описании описаны нуклеиновые кислоты, кодирующие первый и второй не встречающиеся в природе химерные погруженные в мембрану рецепторы, содержащие антигенсвязывающие домены, которые минимизируют такие взаимодействия, а также способы получения и применения таких клеток и нуклеиновых кислот. В одном варианте осуществления антигенсвязывающий домен одного из первого и второго не встречающихся в природе химерных погруженных в мембрану рецепторов содержит scFv, а другой содержит единичный домен VH, например, домен VH животного семейства верблюжьих, акулы или миноги, или единичный домен VH, происходящий из последовательности человека или мыши.
[00270] В некоторых вариантах осуществления заявленное изобретение содержит первый и второй CAR, где антигенсвязывающий домен одного из первого и второго CAR не содержит вариабельный домен легкой цепи и вариабельный домен тяжелой цепи. В некоторых вариантах осуществления антигенсвязывающий домен одного из первого и второго CAR представляет собой scFv, а другой не является scFv. В некоторых вариантах осуществления антигенсвязывающий домен одного из первого и второго CAR содержит единичный домен VH, например, единичный домен VH животного семейства верблюжьих, акулы или миноги, или единичный домен VH, происходящий из последовательности человека или мыши. В некоторых вариантах осуществления антигенсвязывающий домен одного из первого и второго CAR содержит наноантитело. В некоторых вариантах осуществления антигенсвязывающий домен одного из первого и второго CAR содержит домен VHH животного семейства верблюжьих.
[00271] В некоторых вариантах осуществления антигенсвязывающий домен одного из первого и второго CAR содержит scFv, а другой содержит единичный домен VH, например, единичный домен VH животного семейства верблюжьих, акулы или миноги, или единичный домен VH, происходящий из последовательности человека или мыши. В некоторых вариантах осуществления антигенсвязывающий домен одного из первого и второго CAR содержит scFv, а другой содержит наноантитело. В некоторых вариантах осуществления антигенсвязывающий домен одного из первого и второго CAR содержит scFv, а другой содержит домен VHH животного семейства верблюжьих.
[00272] В некоторых вариантах осуществления связывание антигенсвязывающего домена первого CAR, когда он присутствует на поверхности клетки, с распознаваемым им антигеном по существу не снижается в присутствии второго CAR. В некоторых вариантах осуществления связывание антигенсвязывающего домена первого CAR с его собственным антигеном в присутствии второго CAR составляет 85%, 90%, 95%, 96%, 97%, 98% или 99% от связывания антигенсвязывающего домена первого CAR с его собственным антигеном в отсутствие второго CAR.
[00273] В некоторых вариантах осуществления антигенсвязывающие домены первого и второго CAR, когда они присутствуют на поверхности клетки, ассоциируют друг с другом в меньшей степени, чем если бы они оба представляли собой антигенсвязывающие домены scFv. В некоторых вариантах осуществления антигенсвязывающие домены первого и второго CAR ассоциируют друг с другом на 85%, 90%, 95%, 96%, 97%, 98% или 99% меньше, чем если бы они оба представляли собой антигенсвязывающие домены scFv.
[00274] В другом аспекте экспрессирующая CAR клетка, описанная в настоящем описании, может дополнительно экспрессировать другое средство, например, средство, которое повышает активность или выносливость экспрессирующей CAR клетки. Например, в одном варианте осуществления средство может представлять собой средство, которое ингибирует молекулу, которая модулирует или регулирует, например ингибирует, T-клеточную функцию. В некоторых вариантах осуществления молекула, которая модулирует или регулирует T-клеточную функцию, представляет собой ингибиторную молекулу. Ингибиторные молекулы, например PD1, в некоторых вариантах осуществления могут снижать способность экспрессирующей CAR клетки индуцировать иммунный эффекторный ответ. Примеры ингибиторных молекул включают PD1, PD-L1, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4 и TGFR-бета. В вариантах осуществления средство, например, ингибиторную нуклеиновую кислоту, например дцРНК, например миРНК или кшРНК; или например, ингибиторный белок или систему, например, короткие палиндромные повторы, регулярно расположенные кластерами (CRISPR), нуклеазу, подобную активатору транскрипции, (TALEN) или эндонуклеазу с цинковыми пальцами (ZFN), например, как описано в настоящем описании, можно использовать для ингибирования экспрессии молекулы, которая модулирует или регулирует, например ингибирует, T-клеточную функцию в экспрессирующей CAR клетке. В одном варианте осуществления средство представляет собой кшРНК, например, кшРНК, описанную в настоящем описании. В одном варианте осуществления средство, которое модулирует или регулирует, например ингибирует, T-клеточную функцию, ингибируется в экспрессирующей CAR клетке. Например, молекула дцРНК, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например ингибирует, T-клеточную функцию, связана с нуклеиновой кислотой, которая кодирует компонент, например, все компоненты CAR.
[00275] В одном варианте осуществления средство, которое ингибирует ингибирующую молекулу, содержит первый полипептид, например ингибиторную молекулу, связанный со вторым полипептидом, который дает положительный сигнал клетке, например, внутриклеточным сигнальным доменом, описанным в настоящем описании. В одном варианте осуществления средство содержит первый полипептид, например, из ингибиторной молекулы, такой как PD1, PD-L1, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, CTLA4, VISTA, CD160, BTLA, LAIR1, TIM3, 2B4, TGFR-бета и TIGIT, или фрагмент любой из них (например, меньшей мере часть внеклеточного домена любой из них), и второй полипептид, который представляет собой внутриклеточный сигнальный домен, описанный в настоящем описании (например, содержащий костимулирующий домен (например, 41BB, CD27 или CD28, например, как описано в настоящем описании) и/или первичный сигнальный домен (например, сигнальный домен CD3-зета, описанный в настоящем описании)). В одном варианте осуществления средство содержит первый полипептид из PD1 или его фрагмента (например, по меньшей мере часть внеклеточного домена PD1), и второй полипептид внутриклеточного сигнального домена, описанный в настоящем описании (например, сигнальный домен CD28, описанный в настоящем описании, и/или сигнальный домен CD3-зета, описанный в настоящем описании). PD1 представляет собой ингибиторный представитель семейства рецепторов CD28, которое также включает CD28, CTLA-4, ICOS и BTLA. PD-1 экспрессируется на активированных B-клетках, T-клетках и миелоидных клетках (Agata et al. 1996 Int. Immunol 8:765-75). Было показано, что два лиганда для PD1, PD-L1 и PD-L2, подавляют активацию T-клеток при связывании с PD1 (Freeman et a. 2000 J Exp Med 192:1027-34; Latchman et al. 2001 Nat Immunol 2:261-8; Carter et al. 2002 Eur J Immunol 32:634-43). PD-L1 распространен в злокачественных опухолях человека (Dong et al. 2003 J Mol Med 81:281-7; Blank et al. 2005 Cancer Immunol. Immunother 54:307-314; Konishi et al. 2004 Clin Cancer Res 10:5094). Иммунную супрессию можно обращать вспять путем ингибирования локального взаимодействия PD1 с PD-L1.
[00276] В одном варианте осуществления средство содержит внеклеточный домен (ECD) ингибиторной молекулы, например, Programmed Death 1 (PD1), который может быть слит с трансмембранным доменом и внутриклеточными сигнальными доменами, такими как 41BB и CD3-зета (также обозначаемый в настоящем описании как PD1 CAR). В одном варианте осуществления PD1 CAR, когда его используют в комбинациях с CAR против мезотелина, описанным в настоящем описании, повышает живучесть T-клетки. В одном варианте осуществления CAR представляет собой PD1 CAR, содержащий внеклеточный домен PD1, указанный подчеркиванием в SEQ ID NO: 24, и сигнальную последовательность в аминокислотах 1-21 SEQ ID NO: 24. В одном варианте осуществления PD1 CAR содержит аминокислотную последовательность SEQ ID NO: 24.
[00277] Malpvtalllplalllhaarppgwfldspdrpwnpptfspallvvtegdnatftcsfsntsesfvlnwyrmspsnqtdklaafpedrsqpgqdcrfrvtqlpngrdfhmsvvrarrndsgtylcgaislapkaqikeslraelrvterraevptahpspsprpagqfqtlvtttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlyckrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelrvkfsrsadapaykqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr (SEQ ID NO: 24).
[00278] В одном варианте осуществления PD1 CAR без N-концевой сигнальной последовательности содержит аминокислотную последовательность, представленную ниже (SEQ ID NO: 22).
pgwfldspdrpwnpptfspallvvtegdnatftcsfsntsesfvlnwyrmspsnqtdklaafpedrsqpgqdcrfrvtqlpngrdfhmsvvrarrndsgtylcgaislapkaqikeslraelrvterraevptahpspsprpagqfqtlvtttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlyckrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelrvkfsrsadapaykqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr (SEQ ID NO: 22).
[00280] В одном варианте осуществления средство содержит последовательность нуклеиновой кислоты, кодирующую PD1 CAR, с N-концевой сигнальной последовательностью, например, PD1 CAR, описанный в настоящем описании. В одном варианте осуществления последовательность нуклеиновой кислоты для PD1 CAR представлена ниже с PD1 ECD, подчеркнутым в SEQ ID NO: 23
[00281] atggccctccctgtcactgccctgcttctccccctcgcactcctgctccacgccgctagaccacccggatggtttctggactctccggatcgcccgtggaatcccccaaccttctcaccggcactcttggttgtgactgagggcgataatgcgaccttcacgtgctcgttctccaacacctccgaatcattcgtgctgaactggtaccgcatgagcccgtcaaaccagaccgacaagctcgccgcgtttccggaagatcggtcgcaaccgggacaggattgtcggttccgcgtgactcaactgccgaatggcagagacttccacatgagcgtggtccgcgctaggcgaaacgactccgggacctacctgtgcggagccatctcgctggcgcctaaggcccaaatcaaagagagcttgagggccgaactgagagtgaccgagcgcagagctgaggtgccaactgcacatccatccccatcgcctcggcctgcggggcagtttcagaccctggtcacgaccactccggcgccgcgcccaccgactccggccccaactatcgcgagccagcccctgtcgctgaggccggaagcatgccgccctgccgccggaggtgctgtgcatacccggggattggacttcgcatgcgacatctacatttgggctcctctcgccggaacttgtggcgtgctccttctgtccctggtcatcaccctgtactgcaagcggggtcggaaaaagcttctgtacattttcaagcagcccttcatgaggcccgtgcaaaccacccaggaggaggacggttgctcctgccggttccccgaagaggaagaaggaggttgcgagctgcgcgtgaagttctcccggagcgccgacgcccccgcctataagcagggccagaaccagctgtacaacgaactgaacctgggacggcgggaagagtacgatgtgctggacaagcggcgcggccgggaccccgaaatgggcgggaagcctagaagaaagaaccctcaggaaggcctgtataacgagctgcagaaggacaagatggccgaggcctactccgaaattgggatgaagggagagcggcggaggggaaaggggcacgacggcctgtaccaaggactgtccaccgccaccaaggacacatacgatgccctgcacatgcaggcccttccccctcgc (SEQ ID NO: 23).
[00282] В другом аспекте настоящее изобретение относится к популяции экспрессирующих CAR клеток, например, клеток CART. В некоторых вариантах осуществления популяция экспрессирующих CAR клеток содержит смесь клеток, экспрессирующих различные CAR. Например, в одном варианте осуществления популяция клеток CART может включать первую клетку, экспрессирующую CAR, имеющую связывающий домен против CD19, описанный в настоящем описании, и вторую клетку, экспрессирующую CAR, имеющую другой связывающий CD19 домен, например, мезотелин-связывающий домен, описанный в настоящем описании, который отличается от мезотелин-связывающего домена в CAR, экспрессируемом первой клеткой. В качестве другого примера популяция экспрессирующих CAR клеток может включать первую клетку, экспрессирующую CAR, которая включает мезотелин-связывающий домен, например, как описано в настоящем описании, и вторую клетку, экспрессирующую CAR, которая включает антигенсвязывающий домен, для мишени, отличной от мезотелина (например, мишень, отличная от мезотелина, на стромальных клетках, например FAP; мишень, отличная от мезотелина, на клетках рака предстательной железы, например рецептор андрогена, OR51E2, PSMA, PSCA, PDGRF-β, TARP, GloboH, MAD-CT-1 или MAD-CT-2; мишень, отличная от мезотелина, на клетках рака яичника, например, Tn, PRSS21, CD171, Lewis Y, рецептор фолатов α, клаудин 6, GloboH или белок спермы 17; например, мишень, отличная от мезотелина, на клетках рака легкого, например,VEGF, HER3, IGF-1R, EGFR, DLL4 или Trop-2). В одном варианте осуществления популяция CAR-экспрессирующих клеток включает, например, первую клетку, экспрессирующую CAR, которая включает первичный внутриклеточный сигнальный домен, и вторую клетку, экспрессирующую CAR, которая включает вторичный сигнальный домен.
[00283] В другом аспекте настоящее изобретение относится популяции клеток, где по меньшей мере одна клетка в популяции экспрессирует CAR, имеющий мезотелин-связывающий домен, описанный в настоящем описании, а вторая клетка экспрессирует другое средство, например, средство, которое повышает активность или функцию экспрессирующей CAR клетки. Например, в одном варианте осуществления средство может представлять собой средство, которое модулирует или регулирует, например ингибирует, T-клеточную функцию. В некоторых вариантах осуществления молекула, которая модулирует или регулирует T-клеточную функцию, представляет собой ингибиторную молекулу, например средство, описанное в настоящем описание. В некоторых вариантах осуществления ингибиторные молекулы, например, могут снижать способность экспрессирующей CAR клетки индуцировать иммунный эффекторный ответ. Примеры ингибиторных молекул включают PD1, PD-L1, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4 и TGFR-бета. В одном варианте осуществления средство, которое ингибирует ингибиторную молекулу, содержит первый полипептид, например ингибиторную молекулу, ассоциированную со вторым полипептидом, которая дает сигнал клетке, например, внутриклеточный сигнальный домен, описанный в настоящем описании. В одном варианте осуществления средство содержит первый полипептид, например, из ингибиторной молекулы, такой как PD1, PD-L1, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4 и TGFR-бета, или фрагмент любого из них (например, по меньшей мере часть внеклеточного домена любого из них), и второй полипептид, который представляет собой внутриклеточный сигнальный домен, описанный в настоящем описании (например, содержащий костимулирующий домен (например, 41BB, CD27 или CD28, например, как описано в настоящем описании) и/или первичный сигнальный домен (например, сигнальный домен CD3-зета, описанный в настоящем описании). В одном варианте осуществления средство содержит первый полипептид PD1 или его фрагмент (например, по меньшей мере часть внеклеточного домена PD1), и второй полипептид внутриклеточного сигнального домена, описанного в настоящем описании (например, сигнальный домен CD28, описанный в настоящем описании, и/или сигнальный домен CD3-зета, описанный в настоящем описании).
[00284] В одном аспекте настоящее изобретение относится к способам, включающим введение популяции экспрессирующих CAR клеток, например CART-клеток, например, смеси клеток, экспрессирующих различные CAR, в комбинации с другим средством, например, ингибитором киназы, таким как ингибитор киназы, описанный в настоящем описании. В другом аспекте настоящее изобретение относится к способам, включающим введение популяции клеток, где по меньшей мере одна клетка в популяции экспрессирует CAR, имеющий мезотелин-связывающий домен, как описано в настоящем описании, и вторая клетка эксперессирует другое средство, например средство, которое повышает активность или выносливость экспрессирующей CAR клетки, в комбинации с другим средством, например, ингибитором киназы, таким как ингибитор киназы, описанный в настоящем описании.
Регулируемые химерные рецепторы антигенов
[00285] В некоторых вариантах осуществления является желательным регулируемый CAR (RCAR), где активность CAR можно контролировать, для оптимизации безопасности и эффективности терапии CAR. Существует много путей регуляции активности CAR. Например, индуцибельный апоптоз с использованием, например, каспазы, слитой с доменом димеризации (см., например, Di et al., N Egnl. J. Med. 2011 Nov. 3; 365(18):1673-1683), можно использовать в качестве переключателя безопасности при терапии CAR по настоящему изобретению. В одном аспекте RCAR содержит набор полипептидов, как правило, два в наиболее простых вариантах осуществления, в которых компоненты стандартного CAR, описанного в настоящем описании, например, антигенсвязывающий домен и внутриклеточный сигнальный домен, разделены на отдельные полипептиды или представители. В некоторых вариантах осуществления набор полипептидов включает переключатель димеризации, который в присутствии молекулы димеризации может связывать полипептиды друг с другом, например, может связывать антигенсвязывающий домен с внутриклеточным сигнальным доменом.
[00286] В одном аспекте RCAR содержит два полипептида или представителя: 1) внутриклеточный сигнальный представитель, содержащий внутриклеточный сигнальный домен, например, первичный внутриклеточный сигнальный домен, описанный в настоящем описании, и первый домен переключения; 2) антигенсвязывавющий представитель, содержащий антигенсвязывающий домен, например, который нацелен на мезотелин, как описано в настоящем описании, и второй домен переключения. Необязательно, RCAR содержит трансмембранный домен, описанный в настоящем описании. В одном варианте осуществления трансмембранный домен может быть расположен на внутриклеточном сигнальном представителе, на антигенсвязывающем представителе, или на обоих из них. (Если нет иных указаний, когда представители или элементы RCAR описаны в настоящем описании, порядок может быть таким, как представлено, однако также включены другие порядки. Иными словами, в одном варианте осуществления порядок является таким, как указано в тексте, а в других вариантах осуществления порядок может отличаться. Например, порядок элементов на одной стороне трансмембранной области может отличаться от приведенного в качестве примера, например, расположение домена переключения относительно внутриклеточного сигнального домена может отличаться (например, может быть обратным).
[00287] В одном варианте осуществления первый и второй домены переключения могут образовывать внутриклеточный или внеклеточный переключатель димеризации. В одном варианте осуществления переключатель димеризации может представлять собой переключатель гомодимеризации, например, где первый и второй домены переключения являются одинаковыми, или переключатель гетеродимеризации, например, где первый и второй домены переключения отличаются друг от друга.
[00288] В вариантах осуществления RCAR может содержать "множественный переключатель". Множественный переключатель может содержать домены-переключатели гетеродимеризации или домены-переключатели гомодимеризации. Множественный переключатель содержит множество, например 2, 3, 4, 5, 6, 7, 8, 9 или 10, доменов переключения, независимо, на первом представителе, например, на антигенсвязывающем представителе, и на втором представителе, например, на внутриклеточном сигнальном представителе. В одном варианте осуществления первый представитель может содержать множество первых доменов переключения, например, доменов переключения на основе FKBP, и второй представитель может содержать множество вторых доменов переключения, например, доменов переключения на основе FRB. В одном варианте осуществления первый представитель может содержать первый и второй домены переключения, например, домен переключения на основе FKBP и домен переключения на основе FRB, и второй представитель может содержать первый и второй домены переключения, например, домен переключения на основе FKBP и домен переключения на основе FRB.
[00289] В одном варианте осуществления внутриклеточный сигнальный представитель содержит один или более внутриклеточных сигнальных доменов, например, первичный внутриклеточный сигнальный домен и один или более костимулирующих сигнальных доменов.
[00290] В одном варианте осуществления антигенсвязывающий представитель может содержать один или более внутриклеточных сигнальных доменов, например, один или более костимулирующих сигнальных доменов. В одном варианте осуществления антигенсвязывающий представитель содержит множество, например 2 или 3, костимулирующих сигнальных доменов, описанных в настоящем описании, например, выбранных из 41BB, CD28, CD27, ICOS и OX40, и в вариантах осуществления не содержит первичного внутриклеточного сигнального домена. В одном варианте осуществления антигенсвязывающий представитель содержит следующие костимулирующие сигнальные домены от внеклеточного к внутриклеточному: 41BB-CD27; 41BB-CD27; CD27-41BB; 41BB-CD28; CD28-41BB; OX40-CD28; CD28-OX40; CD28-41BB или 41BB-CD28. В таких вариантах осуществления внутриклеточный связывающий представитель содержит домен CD3-зета. В одном таком варианте осуществления RCAR содержит (1) антигенсвязывающий представитель, содержащий антигенсвязывающий домен, например описанный в настоящем описании, трансмембранный домен, и два костимулирующих домена и первый домен переключения; и (2) внутриклеточный сигнальный домен, содержащий трансмембранный домен или связывающий с мембраной домен, и по меньшей мере один первичный внутриклеточный сигнальный домен, и второй домен переключения.
[00291] Вариант осуществления относится к RCAR, где антигенсвязывающий представитель не связан с поверхностью клетки CAR. Это позволяет клетке, имеющей внутриклеточный сигнальный представитель, удобным образом образовывать пару с одним или более антигенсвязывающими доменами без трансформации клетки последовательностью, которая кодирует антигенсвязывающий представитель. В таких вариантах осуществления RCAR содержит: 1) внутриклеточный сигнальный представитель, содержащий: первый домен переключения, трансмембранный домен, внутриклеточный сигнальный домен, например, первичный внутриклеточный сигнальный домен, и первый домен переключения; и 2) антигенсвязывающий представитель, содержащий: антигенсвязывающий домен, например, описанный в настоящем описании, и второй домен переключения, где антигенсвязывающий представитель не содержит трансмембранный домен или связывающий с мембраной домен, и необязательно не содержит внутриклеточный сигнальный домен. В некоторых вариантах осуществления RCAR может дополнительно содержать 3) второй антигенсвязывающий представитель, содержащий: второй антигенсвязывающий домен, например, второй антигенсвязывающий домен, который связывает отличающийся антиген, чем у антигенсвязывающего домена; и второй домен переключения.
[00292] Также в рамках настоящего изобретения предусматриваются RCAR, где антигенсвязывающий представитель обладает способностью биспецифической активации и нацеливания. В этом варианте осуществления антигенсвязывающий представитель может содержать множество, например, 2, 3, 4 или 5 антигенсвязывающих доменов, например, scFv, где каждый антигенсвязывающий домен связывается с антигеном-мишенью, например, различными антигенами или одним антигеном, например, одним и тем же или различными эпитопами на одном антигене. В одном варианте осуществления множество антигенсвязывающих доменов располагаются тандемно, и необязательно между антигенсвязывающими доменами находится линкер или шарнирная область. Пригодные линкеры и шарнирные области описаны в настоящем описании.
[00293] Вариант осуществления относится к RCAR, имеющим конфигурацию, которая позволяет переключение пролиферации. В этом варианте осуществления RCAR содержит: 1) внутриклеточный сигнальный представитель, содержащий: необязательно трансмембранный домен или связывающий с мембраной домен; один или более костимулирующих сигнальных доменов, например, выбранных из 41BB, CD28, CD27, ICOS и OX40, и домен переключения; и 2) антигенсвязывающий представитель, содержащий: антигенсвязывающий домен, например, описанный в настоящем описании, трансмембранный домен, и первичный внутриклеточный сигнальный домен, например, домен CD3-зета, где антигенсвязывающий представитель не содержит домен переключения или не содержит домен переключения, который димеризуется с доменом переключения на внутриклеточном сигнальном представителе. В одном варианте осуществления антигенсвязывающий представитель не содержит костимулирующий сигнальный домен. В одном варианте осуществления внутриклеточный сигнальный представитель содержит домен переключения из переключателя гомодимеризации. В одном варианте осуществления внутриклеточный сигнальный представитель содержит первый домен переключения переключателя гетеродимеризации и RCAR содержит второй внутриклеточный сигнальный представитель, который содержит второй домен переключения переключателя гетеродимеризации. В таких вариантах осуществления второй внутриклеточный сигнальный представитель содержит те же внутриклеточные сигнальные домены, что и внутриклеточный сигнальный представитель. В одном варианте осуществления переключатель димеризации является внутриклеточным. В одном варианте осуществления переключатель димеризации является внеклеточным.
[00294] В любой из конфигураций RCAR, описанных в настоящем описании, первый и второй домены переключения содержат переключатель на основе FKBP/FRB, как описано в настоящем описании.
[00295] Также в настоящем описании описаны клетки, содержащие RCAR, описанный в настоящем описании. Любую клетку, которая модифицирована способами инженерии для экспрессии RCAR, можно использовать в качестве клетки RCARX. В одном варианте осуществления клетка RCARX представляет собой T-клетку и ее обозначают как RCART-клетка. В одном варианте осуществления RCARX-клетка представляет собой NK-клетку и ее обозначают как RCARN-клетка.
[00296] Также в рамках настоящего изобретения предусматриваются нуклеиновые кислоты и векторы, содержащие кодирующие RCAR последовательности. Последовательность, кодирующая различные элементы RCAR, может располагаться на одной молекуле нуклеиновой кислоты, например, на одной плазмиде или векторе, например, вирусном векторе, например, лентивирусном векторе. В одном варианте осуществления (i) последовательность, кодирующая антигенсвязывающий представитель, и (ii) последовательность, кодирующая внутриклеточный сигнальный представитель, может присутствовать на одной нуклеиновой кислоте, например векторе. Продукции соответствующих белков можно достигать, например, с использованием отдельных промоторов или с использованием бицистронного продукта транскрипции (который может обеспечить продукцию двух белков посредством расщепления единого продукта трансляции или посредством трансляции двух отдельных белковых продуктов). В одном варианте осуществления между (i) и (ii) расположена последовательность, кодирующая расщепляемый пептид, например, последовательность P2A или F2A. В одном варианте осуществления между (i) и (ii) расположена последовательность, кодирующая IRES, например, IRES EMCV или EV71. В этих вариантах осуществления (i) и (ii) транскрибируются в качестве единой РНК. В одном варианте осуществления с (i) функционально связан первый промотор и с (ii) функционально связан второй промотор, так что (i) и (ii) транскрибируются в качестве отдельных мРНК.
[00297] Альтернативно последовательность, кодирующая различные элементы RCAR, может быть расположена на различных молекулах нуклеиновых кислот, например, различных плазмидах или векторах, например, вирусных векторах, например лентивирусных векторах. Например, последовательность (i), кодирующая антигенсвязывающий представитель, может присутствовать на первой нуклеиновой кислоте, например, первом векторе, и последовательность (ii), кодирующая внутриклеточный сигнальный представитель, может присутствовать на второй нуклеиновой кислоте, например, втором векторе.
Переключатели димеризации
[00298] Переключатели димеризациии могут быть нековалентными или ковалентными. В нековалентном переключателе димеризации молекула димеризации обеспечивает нековалентное взаимодействие между доменами переключения. В ковалентном переключателе димеризации молекула димеризации обеспечивает ковалентное взаимодействие между доменами переключения.
[00299] В одном варианте осуществления RCAR содержит переключатель димеризации наоснове FKBP/FRAP или FKBP/FRB. FKBP12 (FKBP, или связывающий FK506 белок) представляет собой распространенный цитоплазматический белок, который служит в качестве первоначальной внутриклеточной мишени для природного иммунодепрессивного лекарственного средства рапамицина. Рапамицин связывается с FKBP и с большим гомологом PI3K FRAP (RAFT, mTOR). FRB представляет собой часть FRAP из 93 аминокислот, которая является достаточной для связывания комплекса FKBP-рапамицин (Chen, J., Zheng, X. F., Brown, E. J. & Schreiber, S. L. (1995) Identification of an 11-kDa FKBP12-rapamycin-binding domain within the 289-kDa FKBP12-rapamycin-associated protein and characterization of a critical serine residue. Proc Natl Acad Sci U S A 92: 4947-51.)
[00300] В вариантах осуществления в переключателе на основе FKBP/FRAP, например, FKBP/FRB может использоваться молекула димеризации, например, рапамицин или аналог рапамицина.
[00301] Аминокислотная последовательность FKBP является следующей:
D V P D Y A S L G G P S S P K K K R K V S R G V Q V E T I S P G D G R T F P K R G Q T C V V H Y T G M L E D G K K F D S S R D R N K P F K F M L G K Q E V I R G W E E G V A Q M S V G Q R A K L T I S P D Y A Y G A T G H P G I I P P H A T L V F D V E L L K L E T S Y (SEQ ID NO: 382)
[00302] В вариантах осуществления домен переключения FKBP может содержать связывающий FRB фрагмент FKBP, например, подчеркнутую часть SEQ ID NO: 382, которая представляет собой:
V Q V E T I S P G D G R T F P K R G Q T C V V H Y T G M L E D G K K F D S S R D R N K P F K F M L G K Q E V I R G W E E G V A Q M S V G Q R A K L T I S P D Y A Y G A T G H P G I I P P H A T L V F D V E L L K L E T S (SEQ ID NO: 383)
[00303] Аминокислотная последовательность FRB является следующей:
ILWHEMWHEG LEEASRLYFG ERNVKGMFEV LEPLHAMMER GPQTLKETSF NQAYGRDLME AQEWCRKYMK SGNVKDLTQA WDLYYHVFRR ISK (SEQ ID NO: 384)
[00304] "Переключатель на основе FKBP/FRAP, например FKPP/FRB", как этот термин используют в настоящем описании, относится к переключателю димеризации, содержащему: первый домен переключения, который содержит FRB-связывающий фрагмент или аналог FKBP, например RAD001, и обладает по меньшей мере 70, 75, 80, 85, 90, 95, 96, 97, 98 или 99% идентичностью или отличается не более чем на 30, 25, 20, 15, 10, 5, 4, 3, 2 или 1 аминокислотный остаток от последовательности FKBP SEQ ID NO: 382 или 383; и второй домен переключения, который содержит FKBP-связывающий фрагмент или аналог FRB и обладает по меньшей мере 70, 75, 80, 85, 90, 95, 96, 97, 98 или 99% идентичностью или отличается не более чем на 30, 25, 20, 15, 10, 5, 4, 3, 2 или 1 аминокислотный остаток от последовательности FRB SEQ ID NO: 384. В одном варианте осуществления RCAR, описанный в настоящем описании, содержит один домен переключения, который содержит аминокислотные остатки, представленные в SEQ ID NO: 382 (или SEQ ID NO: 383), и один домен переключения, который содержит аминокислотные остатки, представленные в SEQ ID NO: 384.
[00305] В вариантах осуществления переключатель димеризации FKBP/FRB содержит модифицированный домен переключения FRB, который проявляет измененную, например увеличенную, аффинность в отношении молекулы димеризации, например, рапамицина или рапалога, например RAD001. В одном варианте осуществления модифицированный домен переключения FRB содержит одну или более мутаций, например 2, 3, 4, 5, 6, 7, 8, 9, 10 или более, выбранных из мутаций в положении(ях) аминокислот L2031, E2032, S2035, R2036, F2039, G2040, T2098, W2101, D2102, Y2105 и F2108, где аминокислота дикого типа заменена любой другой встречающейся в природе аминокислотой. В одном варианте осуществления мутантный FRB содержит мутацию в положении E2032, где E2032 заменен на фенилаланин (E2032F), метионин (E2032M), аргинин (E2032R), валин (E2032V), тирозин (E2032Y), изолейцин (E2032I), например SEQ ID NO: 385, или лейцин (E2032L), например SEQ ID NO: 386. В одном варианте осуществления мутантный FRB содержит мутацию T2098, где T2098 заменен на фенилаланин (T2098F) или лейцин (T2098L), например, SEQ ID NO: 387. В одном варианте осуществления мутантный FRB содержит мутацию в E2032 и в T2098, где E2032 заменен на любую аминокислоту и где T2098 заменен на любую аминокислоту, например, SEQ ID NO: 388. В одном варианте осуществления мутантный FRB содержит мутацию E2032I и T2098L, например, SEQ ID NO: 389. В одном варианте осуществления мутантный FRB содержит мутацию E2032L и T2098L, например, SEQ ID NO: 340.
[00306] Таблица 15. Иллюстративный мутантный FRB, обладающий увеличенной аффинностью в отношении молекулы димеризации.
[00307] Другие пригодные переключатели димеризации включают переключатель димеризации на основе GyrB-GyrB, переключатель димеризации на основе гибберелина, переключатель димеризации метка/связывающий элемент, переключатель димеризации halo-метка/snap-метка. Согласно руководству, представленному в настоящем описании, такие переключатели и соответствующие молекулы димеризации будут очевидны специалисту в данной области.
Молекула димеризации
[00308] Ассоциацию между доменами переключения обеспечивает молекула димеризации. В присутствии молекулы димеризации взаимодействие или ассоциация между такими доменами обеспечивает передачу сигнала между полипептидом, связанным, например слитым, с первым доменом переключения, и полипептидом, связанным, например слитым, со вторым доменом переключения. В присутствии неограничивающих уровней молекулы димеризации передача сигнала возрастает в 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2, 5, 10, 50, 100 раз, например, при измерении в системе, описанной в настоящем описании.
[00309] Рапамицин и аналоги рапамицина (иногда называемые рапалогами), например RAD001, можно использовать в качестве молекул димеризации в переключателе димеризации на основе FKBP/FRB, описанном в настоящем описании. В одном варианте осуществления молекула димеризации может быть выбрана из рапамицина (сиролимус), RAD001 (эверолимус), зотапролимуса, темсиролимуса, AP-23573 (ридафоролимус), биолимуса и AP21967. Дополнительные аналоги рапамицина, пригодные для применения с переключателями димеризации на основе FKBP/FRB, описаны ниже в разделе "Комбинированная терапия", или в подразделе под названием "Иллюстративные ингибиторы mTOR".
Трансфекция РНК
[00310] В настоящем описании описаны способы получения транскрибируемой in vitro РНК CAR. Настоящее изобретение также включает кодирующую CAR конструкцию РНК, которая может быть прямо трансфицирована в клетку. Способ получения мРНК для применения в трансфекции может вовлекать транскрипцию in vitro (IVT) матрицы с использованием специально сконструированных праймеров с последующим присоединением поли-A, с получением конструкции, содержащей 3'- и 5'-нетранслируемую последовательность ("UTR"), 5'-кэп и/или участок внутренней посадки рибосомы (IRES), нуклеиновую кислоту, подлежащую экспрессии, и поли-A хвостовую часть, как правило, длиной 50-2000 оснований (SEQ ID NO: 35). РНК, полученной таким образом, можно эффективно трансфицировать различные типы клеток. В одном аспекте матрица включает последовательности для CAR.
[00311] В одном аспекте CAR против мезотелина кодируется матричной РНК (мРНК). В одном аспекте мРНК, кодирующую CAR против мезотелина, вводят в T-клетку для получения CART-клетки.
[00312] В одном варианте осуществления транскрибируемую in vitro РНК CAR можно вводить в клетку посредством временной трансфекции. РНК продуцируют путем транскрипции in vitro с использованием матрицы, полученной посредством полимеразной цепной реакции (ПЦР). Представляющую интерес ДНК из любого источника можно прямо конвертировать способом ПЦР в матрицу для синтеза мРНК in vitro с использованием подходящих праймеров и РНК-полимеразы. Источником ДНК может быть, например, геномная ДНК, плазмидная ДНК, фаговая ДНК, кДНК, синтетическая последовательность ДНК или любой другой подходящий источник ДНК. Желаемой матрицей для транскрипции in vitro является CAR по настоящему изобретению. Например, матрица для РНК CAR содержит внеклеточную область, содержащую одноцепочечный вариабельный домен противоопухолевого антитела; шарнирную область, трансмембранный домен (например, трансмембранный домен CD8a); и цитоплазматическую область, которая включает внутриклеточный сигнальный домен, например, содержащий сигнальный домен CD3-зета и сигнальный домен 4-1BB.
[00313] В одном варианте осуществления ДНК для применения в ПЦР содержит открытую рамку считывания. ДНК может происходить из встречающейся в природе последовательности ДНК генома организма. В одном варианте осуществления нуклеиновая кислота может включать некоторые или все из 5'- и/или 3'-нетранслируемых областей (UTR). Нуклеиновая кислота может включать экзоны и интроны. В одном варианте осуществления ДНК для применения в ПЦР представляет собой последовательность нуклеиновой кислоты человека. В другом варианте осуществления ДНК для применения в ПЦР представляет собой последовательность нуклеиновой кислоты человека, включающую 5'- и 3'-UTR. Альтернативно ДНК может представлять собой искусственную последовательность ДНК, которая в норме не экспрессируется во встречающемся в природе организме. Иллюстративная искусственная последовательность ДНК представляет собой последовательность ДНК, которая содержит части генов, которые лигированы с образованием открытой рамки считывания, которая кодирует слитый белок. Части ДНК, которые лигированы вместе, могут быть из одного организма или из более чем одного организма.
[00314] ПЦР используют для получения матрицы для транскрипции in vitro мРНК, которую используют для трансфекции. Способы проведения ПЦР хорошо известны в данной области. Праймеры для применения в ПЦР конструируют так, чтобы они имели области, которые по существу комплементарны областям ДНК, используемым в качестве матрицы для ПЦР. Термин "по существу комплементарный" относится к последовательностям нуклеотидов, где большинство или все из оснований в последовательности праймеров являются комплементарными, или одно или более оснований являются некомплементарными или несоответствующими друг другу. По существу комплементарные последовательности способны к отжигу или гибридизации с предполагаемой ДНК-мишенью в условиях отжига, используемых для ПЦР. Праймеры можно конструировать, чтобы они были по существу комплементарными любой части ДНК-матрицы. Например, праймеры можно конструировать, чтобы они амплифицировали часть нуклеиновой кислоты, которая обычно транскрибируется в клетках (открытая рамка считывания), включая 5'- и 3'-UTR. Праймеры также можно конструировать для амплификации части нуклеиновой кислоты, которая кодирует конкретный представляющий интерес домен. В одном варианте осуществления праймеры конструируют для амплификации кодирующей области кДНК человека, включая все или части 5'- и 3'-UTR. Праймеры, пригодные для ПЦР, можно получать способами синтеза, которые хорошо известны в данной области. "Прямые праймеры" представляют собой праймеры, которые содержат область нуклеотидов, которая по существу комплементарна нуклеотидам на ДНК-матрице, располагающимся выше последовательности ДНК, подлежащей амплификации. Термин "выше" относится к положению с 5’-стороны от последовательности ДНК, подлежащей амплификации, относительно кодирующей цепи. "Обратные праймеры" представляют собой праймеры, которые содержат область нуклеотидов, по существу комплементарную двухцепочечной ДНК-матрице выше последовательности ДНК, подлежащей амплификации. Термин "ниже" относится к положению с 3'-стороны от последовательности ДНК, подлежащей амплификации, относительно кодирующей цепи.
[00315] В способах, описанных в настоящем описании, можно использовать любую ДНК-полимеразу, пригодную для ПЦР. Реагенты и полимераза являются коммерчески доступными из ряда источников.
[00316] Также можно использовать химические структуры, обладающие способностью повышать стабильность и/или эффективность трансляции. Предпочтительно РНК имеет 5'- и 3'-UTR. В одном варианте осуществления 5'-UTR имеет длину от одного до 3000 нуклеотидов. Длину последовательностей 5'- и 3'-UTR для присоединения к кодирующей области можно изменять различными способами, включая, но не ограничиваясь ими, конструирование праймеров для ПЦР которые гибридизуются с различными областями UTR. С использованием этого подхода специалист в данной области может модифицировать длину 5'- и 3'-UTR, требуемую для достижения оптимальной эффективности трансляции после трансфекции транскрибированной РНК.
[00317] 5' и 3'-UTR могут быть представлять собой встречающиеся в природе эндогенные 5'- и 3'-UTR для представляющей интерес нуклеиновой кислоты. Альтернативно последовательности UTR, которые являются эндогенными для представляющей интерес нуклеиновой кислоты, можно добавлять путем включения последовательностей UTR в прямые и обратные праймеры или посредством любых других модификаций матрицы. Использование последовательностей UTR, которые не являются эндогенными для представляющей интерес нуклеиновой кислоты, может быть полезным для модификации стабильности и/или эффективности трансляции РНК. Например, известно, что AU-богатые элементы в последовательностях 3'-UTR могут снижать стабильность мРНК. Таким образом, 3'-UTR можно выбирать или конструировать для повышения стабильности транскрибируемой РНК, исходя из свойств UTR, которые хорошо известны в данной области.
[00318] В одном варианте осуществления 5'-UTR может содержать последовательность Козака из эндогенной нуклеиновой кислоты. Альтернативно, когда 5'-UTR, которая не является эндогенной для представляющей интерес нуклеиновой кислоты, добавляют способом ПЦР, как описано выше, консенсусную последовательность Козака можно переконструировать путем добавления последовательности 5'-UTR. Последовательности Козака могут повышать эффективность трансляции некоторых РНК-транскриптов, но, по-видимому, не требуются для обеспечения эффективной трансляции всех РНК. Требование наличия последовательностей Козака для многих мРНК известно в данной области. В других вариантах осуществления 5'-UTR может представлять собой 5’-UTR РНК-вируса, РНК-геном которого стабилен в клетках. В других вариантах осуществления в 3'- или 5'-UTR можно использовать различные нуклеотидные аналоги для препятствования деградации мРНК экзонуклеазами.
[00319] Для обеспечения синтеза РНК с ДНК-матрицы без необходимости в клонировании генов промотор транскрипции должен быть связан с ДНК-матрицей выше последовательности, подлежащей транскрипции. Когда последовательность, которая функционирует в качестве промотора РНК-полимеразы, добавляют к 5'-концу прямого праймера, промотор РНК-полимеразы включается в продукт ПЦР выше открытой рамки считывания, подлежащей транскрипции. В одном предпочтительном варианте осуществления промотор представляет собой промотор полимеразы T7, как описано в настоящем описании. Другие пригодные промоторы включают, но не ограничиваются ими, промоторы РНК-полимеразы T3 и SP6. Консенсусные нуклеотидные последовательности для промоторов T7, T3 и SP6, известны в данной области.
[00320] В предпочтительном варианте осуществления мРНК имеет как кэп на 5'-конце, так и 3'-поли(A)-хвостовую часть, которая определяет связывание рибосом, инициацию трансляции и стабильность мРНК в клетке. На кольцевой ДНК-матрице, например, плазмидной ДНК, РНК-полимераза продуцирует длинный конкатемерный продукт, который не пригоден для экспрессии в эукариотических клетках. Транскрипция плазмидной ДНК, линеаризованной на конце 3'-UTR, приводит к мРНК нормального размера, которая не является эффективной при эукариотической трансфекции, даже если она полиаденилируется после транскрипции.
[00321] На линейной ДНК-матрице РНК-полимераза фага T7 может удлинять 3'-конец транскрипта за пределы последнего основания матрицы (Schenborn and Mierendorf, Nuc Acids Res., 13:6223-36 (1985); Nacheva and Berzal-Herranz, Eur. J. Biochem., 270:1485-65 (2003).
[00322] Общепринятым способом встраивания участков поли-A/T в ДНК-матрицу является молекулярное клонирование. Однако последовательность поли-A/T, встроенная в плазмидную ДНК, может приводить к нестабильности плазмиды, поэтому плазмидные ДНК-матрицы, полученные из бактериальных клеток, часто в высокой степени контаминированы делециями и другими аберрациями. Это делает процедуру клонирования не только трудоемкой и времязатратной, но часто и ненадежной. Поэтому является в высокой степени желаемым способ, который позволит конструирование ДНК-матриц с 3'-участками поли-A/T без клонирования.
[00323] Сегмент поли-A/T в транскрипционной ДНК-матрице можно продуцировать в процессе ПЦР с использованием обратного праймера, содержащего поли-T-хвостовую часть, такую как 100T-хвостовая часть (SEQ ID NO: 31) (размер может составлять 50-5000 T (SEQ ID NO: 32)), или после ПЦР любым другим способом, включая, но не ограничиваясь ими, лигирование ДНК или рекомбинацию in vitro. Поли-(A)-хвостовые части также обеспечивают стабильность РНК и снижают их деградацию. Как правило, длина поли-(A)-хвостовой части положительно коррелирует со стабильностью транскрибированной РНК. В одном варианте осуществления поли(A)-хвостовая часть имеет от 100 до 5000 остатков аденозина (SEQ ID NO: 33).
[00324] Поли(A)-хвостовые части РНК, кроме того, можно удлинять после транскрипции in vitro с использованием поли(A)-полимеразы, такой как поли-A-полимераза E. coli (E-PAP). В одном варианте осуществления увеличение длины поли(A)-хвостовой части от 100 нуклеотидов до 300-400 нуклеотидов (SEQ ID NO: 34) приводит приблизительно к двукратному повышению эффективности трансляции РНК. Кроме того, присоединение различных химических групп к 3'-концу может повышать стабильность мРНК. Такое присоединение может включать модифицированные/искусственные нуклеотиды, аптамеры и другие соединения. Например, ATP аналоги можно встраивать в поли(A)-хвостовую часть с использованием поли(A)-полимеразы. Кроме того, стабильность РНК могут повышать аналоги ATP.
[00325] 5'-кэпы также обеспечивают стабильность молекул РНК. В предпочтительном варианте осуществления РНК, продуцируемые способами, описанными в настоящем описании, включают 5'-кэп. 5'-кэп предоставляют с использованием способов, известных в данной области и описанных в настоящем описании (Cougot, et al., Trends in Biochem. Sci., 29:436-444 (2001); Stepinski, et al., RNA, 7:1468-95 (2001); Elango, et al., Biochim. Biophys. Res. Commun., 330:958-966 (2005)).
[00326] РНК, продуцируемые способами, описанными в настоящем описании, также могут содержать последовательность участка внутренней посадки рибосомы (IRES). Последовательность IRES может представлять собой любую вирусную, хромосомную или искусственно сконструированную последовательность, которая инициирует кэп-независимое связывание рибосомы с мРНК и способствует инициации трансляции. Могут быть включены любые растворенные вещества, пригодные для электропорации клеток, которые могут содержать факторы, способствующие клеточной проницаемости и жизнеспособности, такие как сахара, пептиды, липиды, белки, антиоксиданты и поверхностно-активные вещества.
[00327] РНК можно включать в клетки-мишени с использованием любого из ряда различных способов, например коммерчески доступными способами, которые включают, но не ограничиваются ими, электропорацию (Amaxa Nucleofector-II (Amaxa Biosystems, Cologne, Германия)), (ECM 830 (BTX) (Harvard Instruments, Boston, Mass.) или Gene Pulser II (BioRad, Denver, Colo.), Multiporator (Eppendort, Hamburg, Германия), катионную опосредуемую липосомами трансфекцию с использованием липофекции, инкапсулирование в полимер, опосредуемую пептидом трансфекцию, или системы биолистической доставки частиц, такие как "генные пушки" (см., например, Nishikawa, et al. Hum Gene Ther., 12(8):861-70 (2001).
Конструкции нуклеиновых кислот, кодирующие CAR
[00328] Настоящее изобретение относится трансгенам CAR, содержащим последовательности нуклеиновых кислот, кодирующие одну или более конструкций CAR по изобретению. В одном аспекте трансген CAR предоставляют в качестве транскрипта матричной РНК. В одном аспекте трансген CAR предоставляют в качестве конструкции ДНК.
[00329] Таким образом, в одном аспекте изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей химерный рецептор антигена (CAR), где CAR содержит мезотелин-связывающий домен (например, мезотелин-связывающий домен человека), трансмембранный домен и внутриклеточный сигнальный домен, содержащий стимулирующий домен. В одном варианте осуществления мезотелин-связывающий домен представляет собой мезотелин-связывающий домен, описанный в настоящем описании, например, мезотелин-связывающий домен, который содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 87-111, или последовательность с 95-99% идентичностью с ней. В одном варианте осуществления выделенная молекула нуклеиновой кислоты, кроме того, содержит последовательность, кодирующую костимулирующий домен. В одном варианте осуществления трансмембранный домен представляет собой трансмембранный домен белка, выбранный из группы, состоящей из альфа-, бета- или зета-цепи T-клеточного рецептора, CD28, CD3-эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137 и CD154. В одном варианте осуществления трансмембранный домен содержит последовательность SEQ ID NO: 6, или последовательность с 95-99% идентичностью с ней. В одном варианте осуществления мезотелин-связывающий домен связан с трансмембранным доменом шарнирной областью, например, шарнирной областью, описанной в настоящем описании. В одном варианте осуществления шарнирная область содержит SEQ ID NO: 2, или SEQ ID NO: 3, или SEQ ID NO: 4, или SEQ ID NO: 5, или последовательность с 95-99% идентичностью с ними. В одном варианте осуществления выделенная молекула нуклеиновой кислоты, кроме того, содержит последовательность, кодирующую костимулирующий домен. В одном варианте осуществления костимулирующий домен представляет собой функциональный сигнальный домен белка, выбранного из группы, состоящей из OX40, CD27, CD28, CDS, ICAM-1, LFA-1 (CD11a/CD18), ICOS (CD278) и 4-1BB (CD137). Следующие примеры таких костимулирующих молекул включают CDS, ICAM-1, GITR, BAFFR, HVEM (LIGHTR), SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD160, CD19, CD4, CD8-альфа, CD8-бета, IL2R-бета, IL2R-гамма, IL7R-альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76 и PAG/Cbp. В одном варианте осуществления костимулирующий домен содержит последовательность SEQ ID NO: 7, или последовательность с 95-99% идентичностью с ней. В одном варианте осуществления внутриклеточный сигнальный домен содержит функциональный сигнальный домен 4-1BB и функциональный сигнальный домен CD3-зета. В одном варианте осуществления внутриклеточный сигнальный домен содержит последовательность SEQ ID NO: 7 или SEQ ID NO: 8, или последовательность с 95-99% с ней, и последовательность SEQ ID NO: 9 или SEQ ID NO: 10, или последовательность с 95-99% идентичностью с ней, где последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в одной рамке считывания и в качестве единой полипептидной цепи. В другом аспекте изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей конструкцию CAR, содержащую лидерную последовательность SEQ ID NO: 1, домен scFv, имеющий последовательность, выбранную из группы, состоящей из SEQ ID NO: 39; SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61 и SEQ ID NO: 62 (или последовательность с 95-99% идентичностью с ними), шарнирную область SEQ ID NO: 2, или SEQ ID NO: 3, или SEQ ID NO: 4, или SEQ ID NO: 5 (или последовательность с 95-99% идентичностью с ними), трансмембранный домен, имеющий последовательность SEQ ID NO: 6 (или последовательность с 95-99% идентичностью с ней), костимулирующий домен 4-1BB, имеющий последовательность SEQ ID NO: 7 (или последовательность с 95-99% идентичностью с ней) или костимулирующий домен CD27, имеющий последовательность SEQ ID NO: 8 (или последовательность с 95-99% идентичностью с ней), и стимулирующий домен CD3-зета, имеющий последовательность SEQ ID NO: 9 или SEQ ID NO: 10 (или последовательность с 95-99% идентичностью с ней).
[00330] В другом аспекте изобретение относится к выделенной полипептидной молекуле, кодируемой молекулой нуклеиновой кислоты. В одном варианте осуществления выделенная полипептидная молекула содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 63; SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 69, SEQ ID NO: 70, SEQ ID NO: 71, SEQ ID NO: 72, SEQ ID NO: 73, SEQ ID NO: 74, SEQ ID NO: 75, SEQ ID NO: 76, SEQ ID NO: 77, SEQ ID NO: 78, SEQ ID NO: 79, SEQ ID NO: 80, SEQ ID NO: 81, SEQ ID NO: 82, SEQ ID NO: 83, SEQ ID NO: 84, SEQ ID NO: 85 и SEQ ID NO: 86, или последовательность с 95-99% идентичностью с ними.
[00331] В другом аспекте изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей молекулу химерного рецептора антигена (CAR), которая содержит мезотелин-связывающий домен, трансмембранный домен и внутриклеточный сигнальный домен, содержащий стимулирующий домен, и где нуклеиновая кислота, кодирующая мезотелин-связывающий домен, содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 111; SEQ ID NO: 112, SEQ ID NO: 113, SEQ ID NO: 114, SEQ ID NO: 115, SEQ ID NO: 116, SEQ ID NO: 117, SEQ ID NO: 118, SEQ ID NO: 119, SEQ ID NO: 120, SEQ ID NO: 121, SEQ ID NO: 122, SEQ ID NO: 123, SEQ ID NO: 124, SEQ ID NO: 125, SEQ ID NO: 126, SEQ ID NO: 127, SEQ ID NO: 128, SEQ ID NO: 129, SEQ ID NO: 130, SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, или последовательность с 95-99% идентичностью с ними.
[00332] В одном варианте осуществления кодируемая молекула CAR, кроме того, содержит последовательность, кодирующую костимулирующий домен. В одном варианте осуществления костимулирующий домен представляет собой функциональный сигнальный домен белка, выбранного из группы, состоящей из OX40, CD27, CD28, CDS, ICAM-1, LFA-1 (CD11a/CD18) и 4-1BB (CD137). В одном варианте осуществления костимулирующий домен содержит последовательность SEQ ID NO: 7. В одном варианте осуществления трансмембранный домен представляет собой трансмембранный домен белка, выбранного из группы, состоящей из альфа-, бета- или зета-цепи T-клеточного рецептора, CD28, CD3-эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137 и CD154. В одном варианте осуществления трансмембранный домен содержит последовательность SEQ ID NO: 6. В одном варианте осуществления внутриклеточный сигнальный домен содержит функциональный сигнальный домен 4-1BB и функциональный сигнальный домен зета. В одном варианте осуществления внутриклеточный сигнальный домен содержит последовательность SEQ ID NO: 7 и последовательность SEQ ID NO: 9, где последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в одной рамке считывания и в качестве единой полипептидной цепи. В одном варианте осуществления мезотелин-связывающий домен связан с трансмембранным доменом шарнирной областью. В одном варианте осуществления шарнирная область содержит SEQ ID NO: 2. В одном варианте осуществления шарнирная область содержит SEQ ID NO: 3, SEQ ID NO: 4 или SEQ ID NO: 5.
[00333] В другом аспекте изобретение относится к выделенной молекуле CAR, содержащей лидерную последовательность SEQ ID NO: 1, домен scFv, имеющий последовательность, выбранную из группы, состоящей из SEQ ID NO: 39-62, или последовательность с 95-99% идентичностью с ними, шарнирную область SEQ ID NO: 2, или SEQ ID NO: 3, или SEQ ID NO: 4, или SEQ ID NO: 5, трансмембранный домен, имеющий последовательность SEQ ID NO: 6, костимулирующий домен 4-1BB, имеющий последовательность SEQ ID NO: 7, или костимулирующий домен CD27, имеющий последовательность SEQ ID NO: 8, и стимулирующий домен CD3-зета, имеющий последовательность SEQ ID NO: 9 или SEQ ID NO: 10. В одном варианте осуществления кодируемая молекула CAR содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 63-86, или последовательность с 95-99% идентичностью с ней.
[00334] Кроме того, настоящее изобретение относится к векторам, содержащим трансгены CAR. В одном аспекте векторы CAR можно прямо трансдуцировать в клетку, например, T-клетку или NK-клетку. В одном аспекте вектор представляет собой клонирующий или экспрессирующий вектор, например, вектор, включающий, но не ограничивающийся ими, одну или более плазмид (например, экспрессирующие плазмиды, клонирующие векторы, миникольца, минивекторы, двойные микрохромосомы), ретровирусных и лентивирусных векторных конструкций. В одном аспекте вектор способен экспрессировать конструкцию CAR в T-клетках или NK-клетках млекопитающих. В одном аспекте T-клетка млекопитающих представляет собой T-клетку человека или NK-клетку человека.
[00335] Настоящее изобретение также относится к кодирующей CAR конструкции РНК, которая может быть прямо трансфицирована в клетку, например, T-клетку или NK-клетку. Способ получения мРНК для применения в трансфекции вовлекает транскрипцию in vitro (IVT) матрицы с помощью специально сконструированных праймеров с последующим присоединением поли-A с получением конструкции, содержащей 3'- и 5'-нетранслируемую последовательность ("UTR"), 5'-кэп и/или участок внутренней посадки рибосомы (IRES), ген, подлежащий экспрессии, и полиA-хвостовую часть, как правило, длиной 50-2000 оснований. РНК, полученной таким образом, можно эффективно трансфицировать различные типы клеток. В одном аспекте матрица включает последовательности для CAR.
[00336] В одном аспекте трансген CAR против мезотелина кодируется матричной РНК (мРНК). В одном аспекте мРНК, кодирующую трансген CAR против мезотелина, вводят в T-клетку для получения CART-клетки или NK-клетки.
Векторы
[00337] Настоящее изобретение также относится к векторам, в которые встроена ДНК по настоящему изобретению. Векторы, происходящие из ретровирусов, таких как лентивирус, являются подходящими инструментами для достижения долговременного переноса генов, поскольку они обеспечивают долговременное стабильное встраивание трансгена и его увеличение в количестве в дочерних клетках. Лентивирусные векторы имеют дополнительное преимущество над векторами, происходящими из онкоретровирусов, таких как вирусы лейкоза мыши, поскольку они могут трансдуцировать непролиферирующие клетки, такие как гепатоциты. Также они имеют дополнительное преимущество, состоящее в низкой иммуногенности.
[00338] В одном варианте осуществления вектор, содержащий нуклеиновую кислоту, кодирующую желаемый CAR по изобретению, представляет собой ДНК, РНК, плазмиду, аденовирусный вектор, лентивирусный вектор или ретровирусный вектор.
[00339] В другом варианте осуществления вектор, содержащий нуклеиновую кислоту, кодирующую желаемый CAR по изобретению, представляет собой аденовирусный вектор (A5/35). В другом варианте осуществления экспрессию нуклеиновых кислот, кодирующих CAR, можно проводить с использованием транспозонов, таких как sleeping beauty, CRISPR, CAS9 и нуклеазы с цинковыми пальцами цинк. См., например, June et al. 2009 Nature Reviews Immunology 9,10: 704-716, включенную в настоящее описание в качестве ссылки в полном объеме.
[00340] В кратком изложении, экспрессии природных или синтетических нуклеиновых кислот, кодирующих CAR, обычно достигают путем функционального связывания нуклеиновой кислоты, кодирующей полипептид CAR или его части, с промотором, и встраивания конструкции в экспрессирующий вектор. Векторы могут быть пригодными для репликации и встраивания у эукариот. Типичные клонирующие векторы содержат терминаторы транскрипции и трансляции, последовательности инициации и промотор, пригодные для регуляции экспрессии желаемой последовательности нуклеиновой кислоты.
[00341] Экспрессирующие конструкции по настоящему изобретению также можно использовать для иммунизации нуклеиновыми кислотами и генной терапии с использованием стандартных протоколов доставки генов. Способы доставки генов известны в данной области. См., например, патенты США № 5399346, 5580859, 5589466, включенные в настоящее описание в качестве ссылок в полном объеме. В другом варианте осуществления изобретение относится к вектору для генной терапии.
[00342] Нуклеиновую кислоту можно клонировать в множество типов векторов. Например, нуклеиновую кислоту можно клонировать в вектор, включающий, но не ограничивающийся ими, плазмиду, фагмиду, производное фага, вирус животных и космиду. Векторы, представляющие особый интерес, включают экспрессирующие векторы, реплицирующиеся векторы, векторы для получения зондов и векторы для секвенирования.
[00343] Кроме того, экспрессирующий вектор может быть предоставлен клетке в форме вирусного вектора. Технология вирусных векторов хорошо известна в данной области и описана, например, в Sambrook et al., 2012, MOLECULAR CLONING: A LABORATORY MANUAL, volumes 1-4, Cold Spring Harbor Press, NY), и в других справочниках по вирусологии и молекулярной биологии. Вирусы, которые пригодны в качестве векторов, включают, но не ограничиваются ими, ретровирусы, аденовирусы, аденоассоциированные вирусы, вирусы герпеса и лентивирусы. Как правило, подходящий вектор содержит ориджин репликации, функциональный по меньшей мере в одном организме, промоторную последовательность, удобные участки для эндонуклеаз рестрикции, и один или более селективных маркеров (например, WO 01/96584; WO 01/29058 и патент США № 6326193).
[00344] Был разработан ряд систем на основе вирусов для переноса генов в клетки млекопитающих. Например, ретровирусы обеспечивают удобную платформу для систем доставки генов. Выбранный ген можно встраивать в вектор и упаковывать ретровирусные частицы с использованием способов, известных в данной области. Затем рекомбинантный вирус можно выделять и доставлять в клетки индивидуума либо in vivo, либо ex vivo. В данной области известен ряд ретровирусных систем. В некоторых вариантах осуществления используют аденовирусные векторы. В данной области известен ряд аденовирусных векторов. В одном варианте осуществления используют лентивирусные векторы.
[00345] Дополнительные промоторные элементы, например энхансеры, регулируют частоту инициаций транскрипции. Как правило, они расположены в области на 30-110 п.о. выше участка инициации, хотя было показано, что ряд промоторов также содержат функциональные элементы ниже участка инициации. Спейсер между промоторными элементами часто является гибким, так что промоторная функция сохраняется, когда элементы инвертируются или смещаются друг относительно друга. В промоторе тимидинкиназы (tk) спейсер между промоторными элементами может быть увеличен до 50 п.о. до того, когда активность начнет снижаться. Оказалось, что в зависимости от промотора индивидуальные элементы могут функционировать либо совместно, либо независимо, активируя транскрипцию. Иллюстративные промоторы включают промоторы гена IE CMV, EF-1α, убиквитина C или фосфоглицерокиназы (PGK).
[00346] Примером промотора, который способен экпрессировать трансген CAR в T-клетке млекопитающего, является промотор EF1-альфа (EF1a или EFlα). Нативный промотор EF1a контролирует экспрессию альфа-субъединицы комплекса фактора элонгации 1, который ответственен за ферментативную доставку аминоацил-тРНК в рибосому. Промотор EF1a широко используют в экспрессирующих плазмидах млекопитающих, и было показано, что он является эффективным для запуска экспрессии CAR с трансгенов, клонированных в лентивирусный вектор. См., например, Milone et al., Mol. Ther. 17(8): 1453–1464 (2009). В одном аспекте промотор EF1a содержит последовательность, представленную в качестве SEQ ID NO: 11.
[00347] Другим примером промотора является последовательность предраннего промотора цитомегаловируса (CMV). Эта промоторная последовательность представляет собой последовательность мощного конститутивного промотора, способного обеспечивать высокие уровни экспрессии любой полинуклеотидной последовательности, функционально связанной с ним. Однако также можно использовать другие конститутивные промоторные последовательности, включая, но не ограничиваясь ими, ранний промотор вируса 40 обезьян (SV40), промотор вируса опухоли молочной железы мыши (MMTV), промотор длинного концевого повтора (LTR) вируса иммунодефицита человека (ВИЧ), промотор MoMuLV, промотор вируса лейкоза птиц, предранний промотор вируса Эпштейна-Барр, промотор вируса саркомы Рауса, а также промоторы генов человека, такие как, но не ограничиваясь ими, промотор актина, промотор миозина, промотор фактора элонгации 1α, промотор гемоглобина и промотор креатинкиназы. Кроме того, изобретение не ограничивается применением конститутивных промоторов. Также в качестве части изобретения предусматриваются индуцибельные промоторы. Применение индуцибельных промоторов обеспечивает молекулярный переключатель, способный запускать экспрессию полинуклеотидной последовательности, с которой он функционально связан, когда такая экспрессия желательна, или выключать экспрессию, когда экспрессия является нежелательной. Примеры индуцибельных промоторов включают, но не ограничиваются ими металлотиониновый промотор, гликокортикоидный промотор, прогестероновый промотор и тетрациклиновый промотор.
[00348] Для оценки экспрессии полипептида CAR или его частей экспрессирующий вектор, подлежащий введению в клетку, также может содержать либо ген селективного маркера, либо репортерный ген, или оба из них, для облегчения идентификации и селекции экспрессирующих клеток из популяции клеток, которые намереваются трансфицировать или инфицировать вирусными векторами. В других аспектах селективный маркер может содержаться на отдельном фрагменте ДНК и использоваться в методике котрансфекции. Как селективные маркеры, так и репортерные гены, могут фланкироваться соответствующими регуляторными последовательностями для обеспечения экспрессии в клетках-хозяевах. Пригодные селективные маркеры включают, например, гены устойчивости к антибиотикам, такие как neo и т.п.
[00349] Репортерные гены используют для идентификации потенциально трансфицированных клеток и для оценки функциональности регуляторных последовательностей. Как правило, репортерный ген представляет собой ген, который не присутствует или не экспрессируется в организме или ткани реципиента и который кодирует полипептид, экспрессия которого проявляется некоторым легко поддающимся обнаружению свойством, например, ферментативной активностью. Экспрессию репортерного гена анализируют в подходящий период времени после встраивания ДНК в реципиентные клетки. Подходящие репортерные гены могут включать гены, кодирующие люциферазу, бета-галактозидазу, хлорамфениколацетилтрансферазу, секретируемую щелочную фосфатазу, или ген зеленого флуоресцентного белка (например, Ui-Tei et al., 2000 FEBS Letters 479: 79-82). Подходящие экспрессирующие системы хорошо известны, и их можно получать с использованием известных способов или приобретать от коммерческих поставщиков. Как правило, в качестве промотора идентифицируют конструкцию с минимальной 5'-фланкирующей областью, демонстрирующей наиболее высокий уровень экспрессии репортерного гена. Такие промоторные области можно связать с репортерным геном и использовать для оценки средств в отношении способности модулировать запускаемую промотором транскрипцию.
[00350] В одном варианте осуществления вектор, кроме того, может содержать нуклеиновую кислоту, кодирующую второй CAR. В одном варианте осуществления второй CAR включает антигенсвязывающий домен, например, для мишени, отличной от мезотелина, на стромальных клетках, например FAP; мишени, отличной от мезотелина, на клетках рака предстательной железы, например рецептора андрогенов, OR51E2, PSMA, PSCA, PDGRF-β, TARP, GloboH, MAD-CT-1 или MAD-CT-2; мишени, отличной от мезотелина, на клетках рака яичника, например Tn, PRSS21, CD171, Lewis Y, рецептора фолатов α, клаудина 6, GloboH или белка спермы 17; например, мишени, отличной от мезотелина, на клетках рака легкого, например VEGF, HER3, IGF-1R, EGFR, DLL4 или Trop-2. В одном варианте осуществления вектор содержит последовательность нуклеиновой кислоты, кодирующую первый CAR, который нацелен на первый антиген и включает внутриклеточный сигнальный домен, имеющий костимулирующий сигнальный домен, но не первичный сигнальный домен, и последовательность нуклеиновой кислоты, кодирующую второй CAR, который нацелен на второй, отличающийся, антиген и включает внутриклеточный сигнальный домен, имеющий первичный сигнальный домен, но не костимулирующий сигнальный домен. В одном варианте осуществления вектор содержит нуклеиновую кислоту, кодирующую первый CAR против мезотелина, который включает мезотелин-связывающий домен, трансмембранный домен и костимулирующий домен, и нуклеиновую кислоту, кодирующую второй CAR, который нацелен на антиген, отличный от мезотелина (например, мишень, отличная от мезотелина, на стомальных клетках, например FAP; мишень, отличная от мезотелина, на клетках рака предстательной железы, например, рецептор андрогенов, OR51E2, PSMA, PSCA, PDGRF-β, TARP, GloboH, MAD-CT-1 или MAD-CT-2; мишень, отличная от мезотелина, на клетках рака яичника, например Tn, PRSS21, CD171, Lewis Y, рецептор фолатов α, клаудин 6, GloboH или белок спермы 17; например, мишень, отличная от мезотелина, на клетках рака легкого, например VEGF, HER3, IGF-1R, EGFR, DLL4 или Trop-2) и включает антигенсвязывающий домен, трансмембранный домен и первичный сигнальный домен. В другом варианте осуществления вектор содержит нуклеиновую кислоту, кодирующую первый CAR против мезотелина, который включает мезотелин-связывающий домен, трансмембранный домен и первичный сигнальный домен, и нуклеиновую кислоту, кодирующую второй CAR, который нацелен на антиген, отличный от мезотелина (например, мишень, отличная от мезотелина, на стомальных клетках, например FAP; мишень, отличная от мезотелина, на клетках рака предстательной железы, например, рецептор андрогенов, OR51E2, PSMA, PSCA, PDGRF-β, TARP, GloboH, MAD-CT-1 или MAD-CT-2; мишень, отличная от мезотелина, на клетках рака яичника, например Tn, PRSS21, CD171, Lewis Y, рецептор фолатов α, клаудин 6, GloboH или белок спермы 17; например, мишень, отличная от мезотелина, на клетках рака легкого, например VEGF, HER3, IGF-1R, EGFR, DLL4 или Trop-2) и включает антигенсвязывающий домен для антигена, трансмембранный домен и костимулирующий сигнальный домен.
[00351] В одном варианте осуществления вектор содержит нуклеиновую кислоту, кодирующую CAR против мезотелина, описанный в настоящем описании, и нуклеиновую кислоту, кодирующую ингибиторный CAR. В одном варианте осуществления ингибиторный CAR содержит антигенсвязывающий домен, который связывает антиген, встречающийся на нормальных клетках, но не на злокачественных клетках, например, на нормальных клетках, которые также экспрессируют CLL. В одном варианте осуществления ингибиторный CAR содержит антигенсвязывающий домен, трансмембранный домен и внутриклеточный домен ингибиторной молекула. Например, внутриклеточный домен ингибиторного CAR может представлять собой внутриклеточный домен PD1, PD-L1, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4 и TGFR-бета.
[00352] В одном варианте осуществления вектор содержит нуклеиновую кислоту, кодирующую CAR против мезотелина, описанный в настоящем описании, и ингибиторную нуклеиновую кислоту, например дцРНК, например миРНК или кшРНК, например, как описано в настоящем описании.
[00353] Способы введения и экспрессии генов в клетках известны в данной области. В контексте экспрессирующего вектора вектор может быть легко введен в клетку-хозяина, например, клетку млекопитающих, бактерий, дрожжей или насекомых, любым способом, известным в данной области. Например, экспрессирующий вектор можно переносить в клетку-хозяина физическим, химическим или биологическим способами.
[00354] Физические способы введения полинуклеотида в клетку-хозяина включают преципитацию с фосфатом кальция, липофекцию, бомбардировку частицами, микроинъекцию, электропорацию и т.п. Способы получения клеток, содержащих векторы и/или экзогенные нуклеиновые кислоты, хорошо известны в данной области. См., например, Sambrook et al., 2012, MOLECULAR CLONING: A LABORATORY MANUAL, volumes 1-4, Cold Spring Harbor Press, NY). Предпочтительным способом введения полинуклеотида в клетку-хозяина является липофекция, например, с использованием липофектамина (Life Technologies).
[00355] Биологические способы введения представляющего интерес полинуклеотида в клетку-хозяина включают применение ДНК- и РНК-векторов. Вирусные векторы, и, особенно ретровирусные векторы, стали наиболее широко используемым способом введения генов в клетки млекопитающих, например человека. Другие вирусные векторы могут происходить из лентивирусов, поксвирусов, вируса простого герпеса I, аденовирусов и аденоассоциированных вирусов и т.п. См., например, патенты США № 5350674 и 5585362.
[00356] Химические средства для введения полинуклеотида в клетку-хозяина включают коллоидные дисперсные системы, такие как макромолекулярные комплексы, нанокапсулы, микросферы, гранулы и системы на основе липидов, включая эмульсии типа "масло в воде", мицеллы, смешанные мицеллы и липосомы. Иллюстративной колллоидной системой для применения в качестве носителя для доставки in vitro и in vivo является липосома (например, искусственная мембранная везикула). Доступны другие способы уровня техники для направленной доставки нуклеиновых кислот, такие как доставка полинуклеотидов с использованием нацеленных наночастиц или другой подходящей субмикронной системы доставки.
[00357] В случае, когда используют невирусную систему доставки, иллюстративным носителем для доставки является липосома. Для введения нуклеиновых кислот в клетку (in vitro, ex vivo или in vivo) предусматривается применение липидных составов. В другом аспекте нуклеиновую кислоту можно связывать с липидом. Нуклеиновая кислота, связанная с липидом, может быть инкапсулирована в водное содержимое липосомы, распределена в липидном бислое липосомы, связана с липосомой через линкерную молекулу, которая связана как с липосомой, так и с олигонуклеотидом, заключена в липосому, быть в комплексе с липосомой, диспергирована в растворе, содержащем липид, смешана с липидом, объединена с липидом, содержаться в качестве суспензии в липиде, содержаться или быть в комплексе с мицеллой, или может быть иным образом ассоциирована с липидом. Композиции, ассоциированные с липидами, липидами/ДНК или липидами/экспрессирующими векторами не ограничиваются какой-либо конкретной структурой в растворе. Например, они могут находиться в бислойной структуре в качестве мицелл или могут быть со "спавшейся" структурой. Они также могут быть просто распределены в растворе, возможно формируя агрегаты, которые не являются однородными по размеру или форме. Липиды представляют собой жирные вещества, которые могут представлять собой встречающиеся в природе или синтетические липиды. Например, липиды включают жировые капли, которые встречаются в природе в цитоплазме, а также класс соединений, который содержит алифатические углеводороды длинной цепи и их производные, такие как жирные кислоты, спирты, амины, аминоспирты и альдегиды.
[00358] Липиды, пригодные для применения, можно получать из коммерческих источников. Например, димиристилфосфатидилхолин ("DMPC") можно получать от Sigma, St. Louis, MO; дицетилфосфат ("DCP") можно получать от K & K Laboratories (Plainview, NY); холестерин ("Choi") можно получать от Calbiochem-Behring; димиристилфосфатидилглицерин ("DMPG") и другие липиды можно получать от Avanti Polar Lipids, Inc. (Birmingham, AL.). Исходные растворы липидов в хлороформе или смеси хлороформ/метанол можно хранить при приблизительно -20°C. Хлороформ используют в качестве единственного растворителя, поскольку он легче испаряется, чем метанол. "Липосома" является общим термином, охватывающим множество однослойных и многослойных липидных везикул, образованных путем формирования заключенных друг в друга липидных бислоев или агрегатов. Липосомы могут быть охарактеризованы как имеющие везикулярные структуры с фосфолипидной бислойной мембраной и внутренней водной средой. Многослойные липосомы имеют множество липидных слоев, разделенных водной средой. Они образуются самопроизвольно, когда фосфолипиды суспендируют в избытке водного раствора. Липидные компоненты претерпевают самоперестройку перед формированием замкнутых структур и заключением воды и растворенных веществ между липидными слоями (Ghosh et al., 1991 Glycobiology 5: 505-10). Однако также предусматриваются композиции, которые имеют в растворе структуры, отличающиеся от нормальной везикулярной структуры. Например, липиды могут принимать мицеллярную структуру или существовать только в качестве неоднородных агрегатов липидных молекул. Также предусматриваются комплексы липофектамин-нуклеиновая кислота.
[00359] Независимо от способа, использованного для введения экзогенных нуклеиновых кислот в клетку-хозяина или иного воздействия на клетку ингибитора по настоящему изобретению, для подтверждения присутствия последовательности рекомбинантной ДНК в клетке-хозяине можно проводить различные анализы. Такие анализы включают, например, "молекулярно-биологические" анализы, хорошо известные специалистам в данной области, такие как саузерн- и нозерн-блоттинг, ОТ-ПЦР и ПЦР; "биохимические" анализы, такие как обнаружение присутствия или отсутствия конкретного пептида, например, иммунологическими способами (ELISA и вестерн-блоттинг) или анализами, описанными в настоящем описании, для идентификации средств, входящих в объем изобретения.
[00360] Кроме того, настоящее изобретение относится к вектору, содержащему молекулу нуклеиновой кислоты, кодирующую CAR. В одном аспекте вектор CAR можно прямо трансдуцировать в клетку, напримерT-клетку или NK-клетку. В одном аспекте вектор представляет собой клонирующий или экспрессирующий вектор, например, вектор, включающий, но не ограничивающийся ими, одну или более плазмид (например, экспрессирующие плазмиды, клонирующие векторы, миникольца, минивекторы, двойные микрохромосомы), ретровирусные и лентивирусные векторные конструкции. В одном аспекте вектор способен экспрессировать конструкцию CAR в T-клетках млекопитающих. В одном аспекте T-клетка млекопитающего представляет собой T-клетку человека. В одном аспекте клетка млекопитающего представляет собой NK-клетку человека.
Источники клеток
[00361] Перед увеличением в количестве и генетической модификации источник клеток (например, T-клеток или NK-клеток) получают от индивидуума. Подразумевают, что термин "индивидуум" включает живые организмы, в которых можно индуцировать иммунный ответ (например, млекопитающие). Примеры индивидуумов включают человека, собак, кошек, мышей, крыс и их трансгенные виды. T-клетки можно получать из ряда источников, включая мононуклеарные клетки периферической крови, костный мозг, ткань лимфатических узлов, пуповинную кровь, ткань тимуса, ткань из области инфекции, асцитную жидкость, плевральный выпот, ткань селезенки и опухоли. В некоторых аспектах по настоящему изобретению можно использовать любую из множества линий T-клеток, доступных в данной области. В некоторых аспектах настоящего изобретения T-клетки можно получать из единицы крови, взятой от индивидуума, с использованием любого из множества способов, известных квалифицированному специалисту, таких как разделение в FicollTM. В одном предпочтительном аспекте клетки из циркулирующей крови индивидуума получают аферезом. Продукт афереза, как правило, содержит лимфоциты, в том числе T-клетки, моноциты, гранулоциты, B-клетки, другие ядросодержащие лейкоциты, эритроциты и тромбоциты. В одном аспекте клетки, полученные аферезом, можно промывать для удаления фракции плазмы и для помещения клеток в соответствующий буфер или среды для последующих стадий обработки. В одном аспекте изобретения клетки промывают фосфатно-солевым буфером (PBS). В альтернативном аспекте промывочный раствор лишен кальция и может быть лишен магния или может быть лишен многих, или даже всех, двухвалентных катионов. Первоначальные стадии активации в отсутствие кальция могут приводить к усиленной активации. Как будет хорошо понятно специалистам в данной области, стадию промывания можно проводить способами, известными в данной области, как например, с использованием полуавтоматической "проточной" центрифуги (например, устройство для обработки клеток Cobe 2991, Baxter CytoMate, или Haemonetics Cell Saver 5) в соответствии с инструкциями изготовителя. После промывания клетки можно ресуспендировать в различных биосовместимых буферах, например, таких как не содержащий Ca, не содержащий Mg PBS, PlasmaLyte A, или другой солевой раствор с буфером или без него. Альтернативно нежелательные компоненты образца для афереза можно удалять и клетки прямо ресуспендировать в культуральной среде.
[00362] В одном аспекте T-клетки выделяют из лимфоцитов периферической крови человека посредством лизиса эритроцитов и устранения моноцитов, например, посредством центрифугирования в градиенте PERCOLLTM или посредством центрифужной элютриации в противотоке. Конкретную субпопуляцию T-клеток, такую как CD3+, CD28+, CD4+, CD8+, CD45RA+ и CD45RO+ T-клетки, можно далее выделять способами положительной или отрицательной селекции. Например, в одном аспекте T-клетки выделяют посредством инкубации с гранулами, конъюгированными с антителом против CD3/против CD28 (например, 3x28), такими как DYNABEAD® M-450 CD3/CD28 T, в течение периода времени, достаточного для положительной селекции желаемых T-клеток. В одном аспекте период времени составляет приблизительно 30 минут. В следующем аспекте период времени находится в диапазоне от 30 минут до 36 часов или более, включая все целые числа между ними. В следующем аспекте, период времени составляет по меньшей мере 1, 2, 3, 4, 5 или 6 часов. В другом предпочтительном аспекте период времени составляет от 10 до 24 часов. В одном аспекте период времени инкубации составляет 24 часа. Для выделения T-клеток от пациентов с лейкозом применение более длительного времени инкубации, такого как 24 часа, может увеличивать выход. Более длительное время инкубации можно использовать для выделения T-клеток в любой ситуации, где T-клеток мало по сравнению с другими типами клеток, как например, в случае выделения инфильтрирующих опухоль лимфоцитов (TIL) из ткани опухоли или из индивидуумов с иммунодефицитом. Кроме того, использование более длительного времени инкубации может повышать эффективность улавливания CD8+ T-клеток. Таким образом, посредством простого укорочения или удлинения времени T-клеткам позволяют связываться с гранулами CD3/CD28 и/или путем увеличения или снижения соотношения гранул и T-клеток (как дополнительно описано в настоящем описании), можно предпочтительно проводить отбирать в отношении или против субпопуляции T-клеток при инициации культуры или в другие моменты времени процесса. Кроме того, путем увеличения или снижения соотношения антител против CD3 и/или антител против CD28 на гранулах или другой поверхности, можно предпочтительно проводить отбор в отношении или против субпопуляции T-клеток при инициации культуры или в другие желаемые моменты времени. Квалифицированному специалисту будет понятно, что также в контексте изобретения можно использовать множество раундов селекции. В некоторых аспектах может быть желательным проведение процедуры селекции и применение "неотобранных" клеток в процессе активации и экспансии. "Неотобранные" клетки также можно подвергать дополнительным раундам селекции.
[00363] Увеличение в количестве популяции T-клеток посредством отрицательной селекции можно проводить с использованием комбинации антител, направленных на поверхностные маркеры, уникальные для отобранных посредством негативной селекции клеток. Одним из способов является сортировка клеток и/или селекция посредством негативной магнитной иммуноадгезии или проточной цитометрии, в которой используется смесь моноклональных антител, направленных на маркеры клеточной поверхности, присутствующей на клетках, подвергаемых отрицательной селекции. Например, для увеличения в количестве CD4+ клеток посредством отрицательной селекции смесь моноклональных антител обычно включает антитела к CD14, CD20, CD11b, CD16, HLA-DR и CD8. В некоторых аспектах, может быть желательным увеличение в количестве или положительная селекция регуляторных T-клеток, которые обычно экспрессируют CD4+, CD25+, CD62Lhi, GITR+ и FoxP3+. Альтернативно в некоторых аспектах T-регуляторные клетки устраняют с использованием конъюгированных с антителом против C25 гранул или другого сходного способа селекции.
[00364] В одном варианте осуществления можно отбирать популяцию T-клеток, которые экспрессируют один или более из IFN-γ, TNFα, IL-17A, IL-2, IL-3, IL-4, GM-CSF, IL-10, IL-13, гранзима B и перфорина, или другие подходящие молекулы, например, другие цитокины. Способы скрининга экспрессии клеток можно определять, например, способами, описанными в публикации PCT № WO 2013/126712.
[00365] В одном варианте осуществления популяция T-клеток имеет дефицит диаглицеринкиназы (DGK). Клетки с дефицитом DGK включают клетки, которые не экспрессируют РНК или белок DGK, или имеют сниженную или ингибированную активность DGK. Клетки с дефицитом DGK можно получать с использованием генетических подходов, например, путем введения средств РНК-интерференции, например, миРНК, кшРНК, миРНК, для снижения или предупреждения экспрессии DGK. Альтернативно клетки с дефицитом DGK можно получать посредством обработки ингибиторами DGK, описанными в настоящем описании.
[00366] В одном варианте осуществления популяция T-клеток имеет дефицит Ikaros. Клетки с дефицитом Ikaros включают клетки, которые не экспрессируют РНК или белок Ikaros, или имеют сниженную или ингибированную активность Ikaros, клетки с дефицитом Ikaros можно получать с использованием генетических подходов, например, введения средств РНК-интерференции, например, миРНК, кшРНК, микроРНК, для снижения или предупреждения экспрессии Ikaros. Альтернативно клетки с дефицитом Ikaros можно получать посредством обработки ингибиторами Ikaros, например леналидомидом.
[00367] В вариантах осуществления популяция T-клеток имеет дефицит DGK и дефицит Ikaros, например, не экспрессирует DGK и Ikaros, или имеет сниженную или ингибированную активность DGK и Ikaros. Такие клетки с дефицитом DGK и Ikaros можно получать любыми способами, описанными в настоящем описании.
[00368] Для выделения желаемой популяции клеток посредством положительной или отрицательной селекции концентрацию клеток и поверхности (например, частиц, таких как гранулы) можно варьировать. В некоторых аспектах, может быть желательным значительное снижение объема, в котором гранулы и клетки смешивают друг с другом (например, увеличение концентрации клеток), для обеспечения максимального контакта клеток и гранул. Например, в одном аспекте используют концентрацию 2 миллиарда клеток/мл. В одном аспекте используют концентрацию 1 миллиарда клеток/мл. В следующем аспекте, используют более 100 миллионов клеток/мл. В следующем аспекте используют концентрацию клеток, составляющую 10, 15, 20, 25, 30, 35, 40, 45 или 50 миллионов клеток/мл. В следующем аспекте используют концентрацию клеток 75, 80, 85, 90, 95 или 100 миллионов клеток/мл. В следующих аспектах можно использовать концентрации, составляющие 125 или 150 миллионов клеток/мл. Использование высоких концентраций может приводить к увеличению выхода клеток, активации клеток и экспансии клеток. Кроме того, применение высоких концентраций клеток позволяет более эффективное улавливание клеток, которые могут слабо экспрессировать представляющие интерес антигены-мишени, таких как CD28-отрицательные T-клетки, или улавливание из образцов, где присутствует множество опухолевых клеток (например, кровь при лейкозе, опухолевая ткань и т.д.). Такие популяции клеток могут иметь терапевтическую ценность, и их получение может быть желательным. Например, использование высокой концентрации клеток обеспечивает более эффективную селекцию CD8+ T-клеток, которые обычно имеют более слабую экспрессию CD28.
[00369] В сходном аспекте может быть желательным снижение концентрации клеток. Путем значительного разбавления смеси T-клеток и поверхности (например, частиц, таких как гранулы), взаимодействия между частицами и клетками минимизируют. Это приводит к селекции клеток, которые экспрессируют высокие количества желаемых антигенов, подлежащих связыванию с частицами. Например, CD4+ T-клетки экспрессируют более высокие уровни CD28 и более эффективно улавливаются, чем CD8+ T-клетки в разбавленных концентрациях. В одном аспекте концентрация используемых клеток составляет 5×10 e6/мл. В других аспектах, используемая концентрация может составлять от приблизительно 1×105/мл до 1×106/мл, включая любое целое число между ними.
[00370] В других аспектах клетки можно инкубировать на вращающем устройстве в течение разных периодов времени при различных скоростях либо при 2-10°C, либо при комнатной температуре.
[00371] T-клетки, предназначенные для стимуляции, также можно замораживать после стадии промывания. Без связи с теорией полагают, что замораживание и последующее оттаивание обеспечивает более однородный продукт вследствие устранения гранулоцитов и в некоторой степени моноцитов в популяции клеток. После стадии промывания, которая устраняет плазму и тромбоциты, клетки можно суспендировать в растворе для замораживания. Хотя множество растворов и параметров для замораживания известно в данной области и пригодно в этом контексте, один способ вовлекает использование PBS, содержащего 20% DMSO и 8% сывороточный альбумин человека, или культуральной среды, содержащей 10% декстран 40 и 5% декстроза, 20% сывороточный альбумин человека и 7,5% DMSO, или 31,25% Plasmalyte-A, 31,25% декстрозу 5%, 0,45% NaCl, 10% декстран 40 и 5% декстрозу, 20% сывороточный альбумин человека, и 7,5% DMSO или другие походящие среды для замораживания клеток, содержащие, например, Hespan и PlasmaLyte A, затем клетки замораживают до -80°C со скоростью 1° в минуту и хранят в парообразной фазе емкости для хранения с жидком азоте. Можно использовать другие способы контролируемого замораживания, а также неконтролируемого замораживания сразу до -20°C или в жидком азоте.
[00372] В некоторых аспектах криосохраненные клетки размораживают и промывают, как описано в настоящем описании, и им позволяют покоиться в течение одного часа при комнатной температуре перед активацией с использованием способов по настоящему изобретению.
[00373] Также в контексте изобретения предусматривается получение образцов крови или продукта афереза от индивидуума в период до того, как клетки, описанные в настоящем описании, могут потребоваться. По существу, источник клеток, подлежащих увеличению в количестве, можно собирать в любой требуемый момент времени и желаемые клетки, такие как T-клетки, можно выделять и замораживать для последующего применения в T-клеточной терапии любого из множества заболеваний или состояний, при которых является полезной T-клеточная терапия, таких как заболевания и состояния, описанные в настоящем описании. В одном аспекте получение образца крови или продукта афереза проводят от здорового в основном индивидуума. В некоторых аспектах получение образца крови или продукта афереза проводят от здорового в основном индивидуума, который имеет риск развития заболевания, но у которого заболевание еще не развилось, и представляющие интерес клетки выделяют и замораживают для последующего применения. В некоторых аспектах T-клетки можно увеличивать в количестве, замораживать и использовать позднее. В некоторых аспектах взятие образцов проводят сразу после постановки диагноза конкретного заболевания, как описано в настоящем описании, но перед каким-либо из способов лечения. В следующем аспекте клетки выделяют из образца крови или продукта афереза от индивидуума перед любым из множества соответствующих способов лечения, включая, но не ограничиваясь ими, лечение средствами, такими как натализумаб, эфализумаб, противовирусные средства, химиотерапия, лучевая терапия, иммунодепрессивные средства, такие как циклоспорин, азатиоприн, метотрексат, микофенолат и FK506, антитела или другие иммунодепрессивные средства, такие как CAMPATH, антитела против CD3, цитоксан, флударабин, циклоспорин, FK506, рапамицин, микофеноловая кислота, стероиды, FR901228 и лучевая терапия. Эти лекарственные средства либо ингибируют кальций-зависимую фосфатазу кальциневрин (циклоспорин и FK506), либо ингибируют киназу p70S6, которая является важной для индуцируемой факторами роста передачи сигнала (рапамицин). (Liu et al., Cell 66:807-815, 1991; Henderson et al., Immun. 73:316-321, 1991; Bierer et al., Curr. Opin. Immun. 5:763-773, 1993). В следующем аспекте выделяют клетки от пациента и замораживают их для последующего применения совместно с (например, до, одновременно или после) трансплантацией костного мозга или стволовых клеток, терапией, подавляющей T-клетки, с использованием химиотерапевтических средств, таких как флударабин, лучевой терапии внешним пучком (XRT), циклофосфамида или антител, таких как OKT3 или CAMPATH. В одном аспекте клетки выделяют до и их можно замораживать для последующего применения после терапии, подавляющей B-клетки, такой как средства, которые реагируют с CD20, например, ритуксан.
[00374] В следующем аспекте настоящего изобретения T-клетки получают от пациента непосредственно после лечения, которое сохраняет у индивидуума функциональные T-клетки. В этом отношении было обнаружено, что в случае определенных способов лечения злокачественной опухоли, в частности, лечения лекарственными средствами, которые повреждают иммунную систему, вскоре после лечения в течение периода, когда пациенты в норме восстанавливаются после лечения, качество полученных T-клеток может быть оптимальным или улучшенным в отношении их способности увеличиваться в количестве ex vivo. Аналогично, после манипулирования ex vivo с использованием способов, описанных в настоящем описании, эти клетки могут быть в предпочтительном состоянии для повышения приживаемости и экспансии in vivo. Таким образом, в контексте изобретения предусматривается сбор клеток крови, в том числе T-клеток, дендритных клеток или других клеток гемопоэтического роста в процессе этой стадии восстановления. Кроме того, в некоторых аспектах, можно использовать режимы мобилизации (например, мобилизация посредством GM-CSF) и кондиционирования у индивидуума, которые способствуют репопуляции, рециркуляции, регенерации и/или экспансии конкретных типов клеток, особенно в течение определенного периода времени после терапии. Иллюстративные типы клеток включают T-клетки, B-клетки, дендритные клетки и другие клетки иммунной системы.
[00375] В одном варианте осуществления NK-клетки получают от индивидуума. В другом варианте осуществления NK-клетки представляют собой линию NK-клеток, например линию клеток NK-92 (Conkwest).
Аллогенный CAR
[00376] В вариантах осуществления, описанных в настоящем описании, иммунная эффекторная клетка может представлять собой аллогенную эффекторную клетку, например T-клетку или NK-клетку. Например, клетка может представлять собой аллогенную T-клетку, например аллогенную T-клетку, лишенную экспрессии функционального T-клеточного рецептора (TCR) и/или лейкоцитарного антигена человека (HLA), например, HLA класса I и/или HLA класса II.
[00377] Например, T-клетку, лишенную функционального TCR, можно конструировать так, чтобы она не экспрессировала какой-либо функциональный TCR на ее поверхности, можно конструировать так, что она не экспрессировала одной или более субъединиц, которые содержат функциональный TCR, или конструировать так, чтобы она продуцировала очень мало функционального TCR на ее поверхности. Альтернативно T-клетка может экспрессировать по существу нарушенный TCR, например, посредством экспрессии мутантных или укороченных форм одной или более субъединиц TCR. Термин "по существу нарушенный TCR" означает, что этот TCR не индуцирует неблагоприятную иммунную реакцию у хозяина.
[00378] T-клетку, описанную в настоящем описании, можно конструировать, например, чтобы она не экспрессировала функциональный HLA на ее поверхности. Например, T-клетку, описанную в настоящем описании, можно конструировать, чтобы подавлялась экспрессия на клеточной поверхности HLA, например, HLA класса 1 и/или HLA класса II.
[00379] В некоторых вариантах осуществления T-клетка может быть лишена функционального TCR и функционального HLA, например, HLA класса I и/или HLA класса II.
[00380] Модифицированные T-клетки, которые лишены экспрессии функционального TCR и/или HLA, можно получать любыми подходящими способами, включая нокаут или нокдаун одной или более субъединиц TCR или HLA. Например, T-клетка может включать нокдаун TCR и/или HLA с использованием миРНК, кшРНК, коротких палиндромных повторов, регулярно расположенных кластерами (CRISPR), нуклеазы, подобной активатору транскрипции (TALEN), или эндонуклеазы с цинковыми пальцами (ZFN).
[00381] В некоторых вариантах осуществления аллогенная клетка может представлять собой клетку, которая не экспрессирует или экспрессирует на низких уровнях ингибиторную молекулу, например, посредством любого способа, описанного в настоящем описании. Например, клетка может представлять собой клетку, которая не экспрессирует или экспрессирует на низких уровнях ингибиторную молекулу, например, которая может снижать способность экспрессирующей CAR клетки индуцировать иммунный эффекторный ответ. Примеры ингибиторных молекул включают PD1, PD-L1, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4 и TGFR-бета. Ингибирование ингибиторной молекулы, например, посредством ингибирования на уровне ДНК, РНК или белка, может оптимизировать эффективность экспрессирующей CAR клетки. В вариантах осуществления можно использовать ингибиторную нуклеиновую кислоту, например дцРНК, например, миРНК или кшРНК, короткие палиндромные повторы, регулярно расположенные кластерами (CRISPR), нуклеазу, подобную активатору транскрипции (TALEN) или эндонуклеазу с цинковыми пальцами (ZFN), например, как описано в настоящем описании.
миРНК и кшРНК для ингибирования TCR или HLA
[00382] В некоторых вариантах осуществления экспрессию TCR и/или экспрессию HLA можно ингибировать с использованием миРНК или кшРНК, которые нацелены на нуклеиновую кислоту, кодирующую TCR и/или HLA, в T-клетке.
[00383] Экспрессии миРНК или кшРНК в T-клетках можно достигать с использованием любой общепринятой экспрессирующей системы, например, такой как лентивирусная экспрессирующая система.
[00384] Иллюстративные кшРНК, которые подавляют экспрессию компонентов TCR, описаны, например, в публикации США № 2012/0321667. Иллюстративные миРНК и кшРНК, которые подавляют экспрессию генов HLA класса I и/или HLA класса II, описаны, например, в публикации США № US 2007/0036773.
CRISPR для ингибирования TCR или HLA
[00385] "CRISPR" или "CRISPR против TCR и/или HLA" или "CRISPR для ингибирования TCR и/или HLA", как используют в рамках изобретения, относится к набору коротких палиндромных повторов, регулярно расположенных кластерами, или к системе, содержащей такой набор повторов. "Cas", как используют в рамках изобретения, относится к ассоциированному с CRISPR белку. Система "CRISPR/Cas" относится к системе, происходящей из CRISPR и Cas, которую можно использовать для сайленсинга или мутации генов TCR и/или HLA.
[00386] Встречающиеся в природе системы CRISPR/Cas найдены приблизительно в 40% отсеквенированных геномов эубактерий и 90% отсеквенированных геномов архей. Grissa et al. (2007) BMC Bioinformatics 8: 172. Эта система представляет собой тип прокариотической иммунной системы, который сообщает устойчивость к чужеродным генетическим элементам, таким как плазмиды и фаги, и обеспечивает форму приобретенного иммунитета. Barrangou et al. (2007) Science 315: 1709-1712; Marragini et al. (2008) Science 322: 1843-1845.
[00387] Система CRISPR/Cas была модифицирована для применения в редактировании генов (сайленсинг, усиление или изменение конкретных генов) у эукариот, таких как мыши или приматы. Wiedenheft et al. (2012) Nature 482: 331-8. Это осуществили путем введения в эукариотическую клетку плазмиды, содержащей специально сконструированный CRISPR и один или более соответствующих Cas.
[00388] Последовательность CRISPR, иногда называемая локусом CRISPR, содержит чередующиеся повторы и спейсеры. Во встречающемся в природе CRISPR спейсеры обычно содержат последовательности, чужеродные для бактерии, такие как последовательность плазмиды или фага; в системе CRISPR/Cas против TCR и/или HLA спейсеры происходят из последовательностей генов TCR или HLA.
[00389] РНК из локуса CRISPR конститутивно экспрессируется и процессируется белками Cas в малые РНК. Они содержат спейсер, фланкированный последовательностями повтора. РНК направляют другие белки Cas на подавление экзогенных генетических элементов на уровне РНК или ДНК. Horvath et al. (2010) Science 327: 167-170; Makarova et al. (2006) Biology Direct 1: 7. Таким образом, спейсеры выступают в качестве матриц для молекул РНК, аналогично миРНК. Pennisi (2013) Science 341: 833-836.
[00390] Поскольку они встречаются в природе во многих различных типах бактерий, точная организация и структура CRISPR, функция и количество генов Cas и их продуктов отличаются в некоторой степени от вида к виду. Haft et al. (2005) PLoS Comput. Biol. 1: e60; Kunin et al. (2007) Genome Biol. 8: R61; Mojica et al. (2005) J. Mol. Evol. 60: 174-182; Bolotin et al. (2005) Microbiol. 151: 2551-2561; Pourcel et al. (2005) Microbiol. 151: 653-663; и Stern et al. (2010) Trends. Genet. 28: 335-340. Например, белки Cse (подтип Cas, E. coli) (например, CasA) формируют функциональный комплекс, Cascade, который процессирует РНК-транскрипты CRISPR в элементы спейсер-повтор, которые сохраняет Cascade. Brouns et al. (2008) Science 321: 960-964. В других прокариотах Cas6 процессирует транскрипт CRISPR. Инактивация фага на основе CRISPR в E. coli требует Cascade и Cas3, но не Cas1 или Cas2. Белки Cmr (модуль RAMP Cas) в Pyrococcus furiosus и других прокариотах формируют функциональный комплекс с малыми РНК CRISPR, который распознает и расщепляет РНК-мишени. Более простая система CRISPR основана на белке Cas9, который представляет собой нуклеазу с двумя активными участками расщепления, по одному для каждой цепи двойной спирали. Комбинирование Cas9 и модифицированного локуса РНК CRISPR можно использовать в системе редактирования генов. Pennisi (2013) Science 341: 833-836.
[00391] Таким образом, систему CRISPR/Cas можно использовать для редактирования гена TCR и/или HLA (присоединение или делеция пары оснований) или внесения преждевременного стоп-кодона, что, таким образом, снижает экспрессию TCR и/или HLA. Альтернативно систему CRISPR/Cas можно использовать подобно РНК-интерференции, выключая гены TCR и/или HLA обратимым образом. В клетке млекопитающего, например, РНК может направлять белок Cas на промотор TCR и/или HLA, пространственно блокируя РНК-полимеразы.
[00392] Искусственные системы CRISPR/Cas, которые ингибируют TCR и/или HLA, можно получать с использованием технологии, известной в данной области, например, которая описана в публикации США № 20140068797, и Cong (2013) Science 339: 819-823. Также можно получать другие искусственные системы CRISPR/Cas, известные в данной области, которые ингибируют TCR и/или HLA, например, системы, описанные в Tsai (2014) Nature Biotechnol., 32:6 569-576, патенты США № 8871445; 8865406; 8795965; 8771945 и 8697359.
TALEN для ингибирования TCR и/или HLA
[00393] "TALEN" или "TALEN против HLA и/или TCR" или "TALEN для ингибирования HLA и/или TCR" относится к эффекторной нуклеазе, подобной активатору транскрипции, которая представляет собой искусственную нуклеазу, которую можно использовать для редактирования гена HLA и/или TCR.
[00394] TALEN получают искусственным образом путем слияния эффекторного ДНК-связывающего домена TAL с доменом расщепления ДНК. Эффекты активатора транскрипции (TALE) можно модифицировать способами инженерии для связывания с любой желаемой последовательностью ДНК, включая часть гена HLA или TCR. Путем комбинирования модифицированных способами инженерии TALE с доменом расщепления ДНК можно получать фермент рестрикции, который является специфичным к любой желаемой последовательности ДНК, включая последовательность HLA или TCR. Затем их можно вводить в клетку, где их можно использовать для редактирования генома. Boch (2011) Nature Biotech. 29: 135-6; и Boch et al. (2009) Science 326: 1509-12; Moscou et al. (2009) Science 326: 3501.
[00395] TALE представляют собой белки, секретируемые бактериями Xanthomonas. ДНК-связывающий домен содержит повторяющуюся высококонсервативную последовательность из 33-34 аминокислот, за исключением 12-ой и 13-ой аминокислот. Эти два положения являются в высокой степени вариабельными, демонстрируя строгую корреляцию со специфическим распознаванием нуклеотидов. Таким образом, их можно модифицировать способами инженерии для связывания с желаемой последовательностью ДНК.
[00396] Для получения TALEN белок TALE подвергают слиянию с нуклеазой (N), которая представляет собой эндонуклеазу FokI дикого типа или мутантную эндонуклеазу FokI. В FokI было внесено более мутаций для ее применения в TALEN; они, например, повышают специфичность расщепления или активность. Cermak et al. (2011) Nucl. Acids Res. 39: e82; Miller et al. (2011) Nature Biotech. 29: 143-8; Hockemeyer et al. (2011) Nature Biotech. 29: 731-734; Wood et al. (2011) Science 333: 307; Doyon et al. (2010) Nature Methods 8: 74-79; Szczepek et al. (2007) Nature Biotech. 25: 786-793; и Guo et al. (2010) J. Mol. Biol. 200: 96.
[00397] Домен FokI функционирует в качестве димера, требующего две конструкции с уникальными ДНК-связывающими доменами для участков в геноме-мишени с надлежащей ориентаций и расстояниями. Как число аминокислотных остатков между ДНК-связывающим доменом TALE и доменом расщепления FokI, так и число оснований между двумя индивидуальными участками связывания TALEN, по-видимому, являются важными параметрами для достижения высоких уровней активности. Miller et al. (2011) Nature Biotech. 29: 143-8.
[00398] TALEN против HLA или TCR можно использовать внутри клетки для обеспечения двухцепочечного разрыва (DSB). Мутацию можно вносить в участке разрыва, если механизмы репарации ненадлежащим образом репарируют разрыв посредством негомологичного соединения концов. Например, ненадлежащая репарация может вносить мутацию со сдвигом рамки считывания. Альтернативно вместе с TALEN в клетку можно вводить чужеродную ДНК; в зависимости от последовательностей чужеродной ДНК и хромосомной последовательности, этот процесс можно использовать для коррекции дефекта в гене HLA или TCR или внесения такого дефекта в ген HLA или TCR wt, таким образом, снижая экспрессию HLA или TCR.
[00399] TALEN, специфичные к последовательностям в HLA или TCR можно конструировать с использованием любого способа, известного в данной области, включая различные схемы с использованием модульных компонентов. Zhang et al. (2011) Nature Biotech. 29: 149-53; Geibler et al. (2011) PLoS ONE 6: e19509.
Нуклеаза с цинковыми пальцами для ингибирования HLA и/или TCR
[00400] "ZFN" или "нуклеаза с цинковыми пальцами" или "ZFN против HLA и/или TCR" или "ZFN для ингибирования HLA и/или TCR" относятся к нуклеазе с цинковыми пальцами, которая представляет собой искусственную нуклеазу, которую можно использовать для редактирования гена HLA и/или TCR.
[00401] Подобно TALEN, ZFN содержит нуклеазный домен FokI (или его производное), слитый с ДНК-связывающим доменом. В случае ZFN ДНК-связывающий домен содержит один или более цинковых пальцев. Carroll et al. (2011) Genetics Society of America 188: 773-782; и Kim et al. (1996) Proc. Natl. Acad. Sci. USA 93: 1156-1160.
[00402] Цинковый палец представляет собой небольшой белковый структурный мотив, стабилизированный одним или более ионами цинка. Цинковый палец может содержать, например, Cys2His2, и может распознавать последовательность размером приблизительно 3 п.о. Различные цинковые пальцы известной специфичности можно комбинировать для получения полипептидов с более пальцами, которые распознают последовательности размером приблизительно 6, 9, 12, 15 или 18 п.о. Для получения цинковых пальцев (и их комбинаций), распознающих конкретные последовательности, доступны различные способы селекции и модульной сборки, включая фаговый дисплей, дрожжевые моногибридные системы, бактериальные моногибридные и двухгибридные системы и клетки млекопитающих.
[00403] Подобно TALEN, ZFN должна димеризоваться для расщепления ДНК. Таким образом, для нацеливания на непалиндромные участки ДНК требуется пара ZFN. Две индивидуальных ZFN должны связывать противоположные цепи ДНК, причем между их нуклеазами должно быть надлежащее пространство. Bitinaite et al. (1998) Proc. Natl. Acad. Sci. USA 95: 10570-5.
[00404] Также подобно TALEN, ZFN может вносить двухцепочечный разрыв в ДНК, который может создавать мутацию со сдвигом рамки считывания в случае ненадлежащей репарации, что приводит к снижению экспрессии и количества HLA и/или TCR в клетке. ZFN также можно использовать с гомологичной рекомбинацией для внесения мутаций в гены HLA или TCR.
[00405] ZFN, специфичные к последовательностям в HLA и/или TCR, можно конструировать с использованием любого способа, известного в данной области. См., например, Provasi (2011) Nature Med. 18: 807-815; Torikai (2013) Blood 122: 1341-1349; Cathomen et al. (2008) Mol. Ther. 16: 1200-7; и Guo et al. (2010) J. Mol. Biol. 400: 96; публикацию патента США 2011/0158957; публикацию патента США 2012/0060230.
Активация и увеличение в количестве клеток
[00406] Клетки можно активировать и увеличивать в количестве, в основном с использованием способов, описанных, например, в патентах США 6352694; 6534055; 6905680; 6692964; 5858358; 6887466; 6905681; 7144575; 7067318; 7172869; 7232566; 7175843; 5883223; 6905874; 6797514; 6867041 и публикации патентной заявки США № 20060121005.
[00407] Как правило, T-клетки по изобретению можно увеличивать в количестве путем контакта с поверхностью, имеющей связанное с ней средство, которое стимулирует сигнал, ассоциированный с комплексом CD3/TCR, и лиганд, который стимулирует костимулирующую молекулу на поверхности T-клеток. В частности, популяции T-клеток можно стимулировать, как описано в настоящем описании, например, путем контакта с антителом против CD3 или его антигенсвязывающим фрагментом, или антителом против CD2, иммобилизованным на поверхности, или путем контакта с активатором протеинкиназы C (например, бриостатин) совместно с ионофором кальция. Для стимуляции вспомогательной молекула на поверхности T-клеток используют лиганд, который связывает вспомогательную молекулу. Например, популяцию T-клеток можно приводить в контакт с антителом против CD3 и антителом против CD28 в условиях, пригодных для стимуляции пролиферации T-клеток. Для стимуляции пролиферации либо CD4+ T-клеток, либо CD8+ T-клеток, можно использовать антитело против CD3 и антитело против CD28. Примеры антител против CD28 включают 9.3, B-T3, XR-CD28 (Diaclone, Besançon, Франция), которые можно использовать, а также можно использовать и другие способы, широко известные в данной области (Berg et al., Transplant Proc. 30(8):3975-3977, 1998; Haanen et al., J. Exp. Med. 190(9):13191328, 1999; Garland et al., J. Immunol Meth. 227(1-2):53-63, 1999).
[00408] В некоторых аспектах первичный стимулирующий сигнал и костимулирующий сигнал для T-клеток может быть предоставлен посредством различных протоколов. Например, средства, обеспечивающие каждый сигнал, могут быть в растворе или могут быть связанными с поверхностью. Когда они связаны с поверхностью, средства могут быть связаны с одной и той же поверхностью (т.е. в "цис"-форме) или с различными поверхностями (т.е. в "транс"-форме). Альтернативно одно средство может быть связано с поверхностью, а другое средство может находиться в растворе. В одном аспекте средство, обеспечивающее костимулирующий сигнал, связано с клеточной поверхностью, и средство, обеспечивающее первичный активирующий сигнал, находится в растворе или связано с поверхностью. В некоторых аспектах оба средства могут находиться в растворе. В одном аспекте средства могут быть в растворимой форме, а затем могут быть сшити с поверхностью, такой как клетка, экспрессирующая Fc-рецепторы или антитело или другое связывающее соединение, которое будет связываться со средствами. В этом отношении, см., например, публикации патентных заявок США № 20040101519 и 20060034810 для искусственных антигенпредставляющих клеток (aAPC), которые предусматриваются для применения для активации и увеличения в количестве T-клеток в рамках настоящего изобретения.
[00409] В одном аспекте два средства иммобилизованы на гранулах, либо на одних и тех же гранулах, т.е. "цис", либо на отдельных гранулах, т.е. "транс". В качестве примера, средство, обеспечивающее первичный сигнал активации, представляет собой антитело против CD3 или его антигенсвязывающий фрагмент и средство, обеспечивающее костимулирующий сигнал, представляет собой антитело против CD28 или его антигенсвязывающий фрагмент; и оба средства совместно иммобилизованы на одних и тех же гранулах в эквивалентных молекулярных количествах. В одном аспекте используют соотношение 1:1 для каждого антитела, связанного с гранулами, для увеличения в количестве CD4+ T-клеток и роста T-клеток. В некоторых аспектах по настоящему изобретению используют соотношение антител против CD3:CD28, связанных с гранулами, так чтобы наблюдалось увеличение экспансии T-клеток по сравнению с экспансией, наблюдаемой с использованием соотношения 1:1. В одном конкретном аспекте наблюдается увеличение в от приблизительно 1 до приблизительно 3 раз по сравнению с экспансией, наблюдаемой с использованием соотношения 1:1. В одном аспекте соотношение антител против CD3:CD28, связанных с гранулами, находится в диапазоне от 100:1 до 1:100, включая все целые числа между ними. В одном аспекте настоящего изобретения с частицами связано больше антитела против CD28, чем антитела против CD3, т.е. соотношение CD3:CD28 меньше единицы. В определенных аспектах изобретения соотношение антитела против CD28 и антитела против CD3, связанного с гранулами, превышает 2:1. В одном конкретном аспекте используют соотношение антител против CD3:CD28, связанных с гранулами, равное 1:100. В одном аспекте используют соотношение антител против CD3:CD28, связанных с гранулами, равное 1:75. В следующем аспекте используют соотношение антител против CD3:CD28, связанных с гранулами, равное 1:50. В одном аспекте используют соотношение антител против CD3:CD28, связанных с гранулами, равное 1:30. В одном предпочтительном аспекте используют соотношение антител против CD3:CD28, связанных с гранулами, равное 1:10. В одном аспекте используют соотношение антител против CD3:CD28, связанных с гранулами, равное 1:3. В следующем аспекте используют соотношение антител против CD3:CD28, связанных с гранулами, равное 3:1.
[00410] Для стимуляции T-клеток и других клеток-мишеней можно использовать отношения частиц к клеткам от 1:500 до 500:1, включая любые целые числа между ними. Как будет хорошо понятно специалистам в данной области, отношение частиц к клеткам может зависеть от размера частиц относительно клетки-мишени. Например, гранулы малых размеров могут связать только более клеток, в то время как гранулы больших размеров могут связывать множество клеток. В некоторых аспектах для стимуляции T-клеток можно использовать соотношение клеток и частиц, которое находится в диапазоне от 1:100 до 100:1, включая любые целые числа между ними, и в следующих аспектах соотношение включает от 1:9 до 9:1, включая любые целые числа между ними. Соотношение частиц с антителом против CD3 и антителом против CD28 и T-клеток, которое приводит к стимуляции T-клеток, может варьироваться, как отмечалось выше, однако определенные предпочтительные величины включают 1:100, 1:50, 1:40, 1:30, 1:20, 1:10, 1:9, 1:8, 1:7, 1:6, 1:5, 1:4, 1:3, 1:2, 1:1, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1, 10:1 и 15:1, причем одно предпочтительное соотношение частиц на T-клетку составляет по меньшей мере 1:1. В одном аспекте используют соотношение частиц и клеток 1:1 или менее. В одном конкретном аспекте соотношение частица:клетка равно 1:5. В следующих аспектах соотношение частиц и клеток может варьироваться в зависимости от дня стимуляции. Например, в одном аспекте соотношение частиц и клеток составляет от 1:1 до 10:1 на первые сутки, и дополнительные частицы добавляют к клеткам каждые стуки или раз в двое суток после этого в течение вплоть до 10 суток, в конечных соотношениях от 1:1 до 1:10 (исходя из количества клеток в день добавления). В одном конкретном аспекте соотношение частиц и клеток составляет 1:1 в первый день стимуляции и его доводят до 1:5 не третьи и пятые сутки стимуляции. В одном аспекте частицы добавляют раз в сутки или раз в двое суток до конечного соотношения 1:1 на первые сутки и 1:5 на третьи и пятые сутки стимуляции. В одном аспекте соотношение частиц и клеток составляет 2:1 на первые сутки стимуляции и его доводят до 1:10 на третьи и пятые сутки стимуляции. В одном аспекте частицы добавляют раз в стуки или раз в двое суток до конечного соотношения 1:1 на первые сутки, и 1:10 на третьи и пятые сутки стимуляции. Специалисту в данной области будет понятно, что множество других соотношений может быть пригодным для применения в рамках настоящего изобретения. В частности, соотношения будут варьироваться в зависимости от размера частиц и от размера и типа клеток. В одном аспекте наиболее типичные соотношения для применения составляют около 1:1, 2:1 и 3:1 на первые сутки.
[00411] В следующих аспектах настоящего изобретения клетки, такие как T-клетки, комбинируют с покрытыми средством гранулами, затем гранулы и клетки разделяют, а затем клетки культивируют. В альтернативном аспекте перед культивированием покрытые средством гранулы и клетки не отделяют, а культивируют вместе. В следующем аспекте, гранулы и клетки сначала концентрируют с использованием силы, такой как магнитная сила, что приводит к увеличенному лигированию маркеров клеточной поверхности, тем самым индуцируя стимуляцию клеток.
[00412] В качестве примера, белки клеточной поверхности можно лигировать, позволяя парамагнитным гранулам, с которыми связаны антитело против CD3 и антитело против CD28 (гранулы 3x28) контактировать с T-клетками. В одном аспекте клетки (например, от 104 дo 109 T-клеток) и гранул (например, парамагнитные гранулы DYNABEAD® M-450 CD3/CD28 T в соотношении 1:1) комбинируют в буфере, например PBS (без двухвалентных катионов, таких как кальций и магний). Вновь, специалисту в данной области будет хорошо понятно, что можно использовать любую концентрацию клеток. Например, клетки-мишени могут быть очень редкими в образце и могут составлять только 0,01% образца, или весь образец (т.е. 100%) может состоять из представляющих интерес клеток-мишеней. Таким образом, в контексте настоящего изобретения предусматривается любое количество клеток. В некоторых аспектах может быть желательным значительное уменьшение объема, в котором частицы и клетки смешивают друг с другом (т.е. увеличение концентрации клеток) для обеспечения максимального контакта клеток и частиц. Например, в одном аспекте используют концентрацию приблизительно 2 миллиарда клеток/мл. В одном аспекте используют более 100 миллионов клеток/мл. В следующем аспекте используют концентрацию клеток, составляющую 10, 15, 20, 25, 30, 35, 40, 45 или 50 миллионов клеток/мл. В другом аспекте используют концентрацию клеток 75, 80, 85, 90, 95 или 100 миллионов клеток/мл. В следующих аспектах можно использовать концентрации 125 или 150 миллионов клеток/мл. Использование высоких концентраций может приводить к увеличению выхода клеток, активации клеток и экспансии клеток. Кроме того, применение высоких концентраций клеток позволяет более эффективное улавливание клеток, которые могут слабо экспрессировать представляющие интерес антигены-мишени, таких как отрицательные по CD28 T-клетки. Такие популяции клеток могут иметь терапевтическую ценность, и в некоторых аспектах может быть желательным их получение. Например, использование высокой концентрации клеток позволяет более эффективную селекцию CD8+ T-клеток, которые обычно имеют более слабую экспрессию CD28.
[00413] В одном аспекте настоящего изобретения смесь можно культивировать в течение от более часов (приблизительно 3 часов) до приблизительно 14 суток, включая любой часовой интервал между ними. В одном аспекте смесь можно культивировать в течение 21 суток. В одном аспекте изобретения гранулы и T-клетки культивируют вместе в течение приблизительно восьми суток. В одном аспекте гранулы и T-клетки культивируют вместе в течение 2-3 суток. Также может быть желательным более циклов стимуляции, так чтобы время культивирования T-клеток составляло 60 суток или более. Условия, пригодные для культивирования T-клеток, включают соответствующие среды (например, минимальная поддерживающая среда или среда RPMI 1640 или, X-vivo 15, (Lonza)), которые могут содержать факторы, необходимые для пролиферации и жизнеспособности, включая сыворотку (например, эмбриональная сыворотка человек или сыворотка человека), интерлейкин-2 (IL-2), инсулин, IFN-γ, IL-4, IL-7, GM-CSF, IL-10, IL-12, IL-15, TGFβ и TNF-α или любые другие добавки для роста клеток, известные специалисту в данной области. Другие добавки для роста клеток включают, но не ограничиваются ими, поверхностно-активное вещество, плазманат и восстановители, такие как N-ацетилцистеин и 2-меркаптоэтанол. Среды могут включать RPMI 1640, AIM-V, DMEM, MEM, α-MEM, F-12, X-Vivo 15 и X-Vivo 20, Optimizer, с добавлением аминокислот, пирувата натрия и витаминов, либо бессывороточные, либо дополненные соответствующем количеством сыворотки (или плазмы) или определенным набором гормонов, и/или количеством цитокина(ов), достаточным для роста и экспансии T-клеток. Антибиотики, например, пенициллин и стрептомицин, включают только в экспериментальные культуры, но не в культуры клеток, которые подлежат инфузии индивидууму. Клетки-мишени поддерживают в условиях, необходимых для поддержания роста, например, при соответствующей температуре (например, 37°C) и в соответствующей атмосфере (например, воздух плюс 5% CO2).
[00414] T-клетки, подвергнутые воздействию в течение различной длительности периодов стимуляции, могут проявлять различные характеристики. Например, типичная кровь или мононуклеарные клеточные продукты подвергнутой аферезу периферической крови имеют популяцию хелперных T-клеток (TH, CD4+), которая превышает популяцию цитотоксических или супрессорных T-клеток (TC, CD8+). Экспансия T-клеток ex vivo посредством стимуляции рецепторов CD3 и CD28 продуцирует популяцию T-клеток, которая до приблизительно 8-9 суток состоит в основном из TH-клеток, в то время как после 8-9 суток, популяция T-клеток содержит значительно более высокую популяцию TC-клеток. Таким образом, в зависимости от цели лечения, инфузия индивидууму популяции T-клеток, содержащей в основном TH-клетки, может быть преимущественной. Аналогично, если антигенспецифическая подгруппа TC-клеток является выделенной, может быть предпочтительным увеличение в количестве этой подгруппы в большей степени.
[00415] Кроме того, в дополнение к маркерам CD4 и CD8, другие фенотипические маркеры значительно варьируются, однако по большей части, являются воспроизводимыми в ходе процесса экспансии клеток. Таким образом, такая воспроизводимость обеспечивает возможность адаптации продукта в виде активированных T-клеток к конкретным целям.
[00416] После конструирования CAR против мезотелина различные анализы можно использовать для оценки активности молекулы, такой как, но не ограничиваясь ими, способность к экспансии T-клеток после стимуляции антигеном, поддержание экспансии T-клеток в отсутствие рестимуляции и активность против злокачественной опухоли в различных моделях in vitro и на животных. Анализы для оценки эффектов CAR против мезотелина более подробно описаны ниже.
[00417] Анализ с использованием вестер-блоттинга экспрессии CAR в первичных T-клетках можно использовать для обнаружения присутствия мономеров и димеров. См., например, Milone et al., Molecular Therapy 17(8): 1453-1464 (2009). В кратком изложении, T-клетки (смесь 1:1 CD4+ и CD8+ T-клеток), экспрессирующие CAR, увеличивают в количестве in vitro в течение более чем 10 суток с последующим лизисом и SDS-PAGE в восстанавливающих условиях. CAR, содержащие полноразмерный цитоплазматический домен TCR-ζ и эндогенную цепь TCR-ζ, выявляют с помощью вестер-блоттинга с использованием антитела к цепи TCR-ζ. Те же подгруппы T-клеток используют для анализа SDS-PAGE в невосстанавливающих условиях, чтобы иметь возможность оценки образования ковалентного димера.
[00418] Экспансию CAR+ T-клеток in vitro после антигенной стимуляции можно измерять проточной цитометрии. Например, смесь CD4+ и CD8+ T-клеток стимулируют αCD3/αCD28 aAPC с последующей трансдукцией лентивирусными векторами, экспрессирующими GFP под контролем промоторов, подлежащих анализу. Иллюстративные промоторы включают промоторы гена CMV IE, EF-1α, убиквитина C или фосфоглицерокиназы (PGK). Флуоресценцию GFP оценивают на 6 сутки культивирования в подгруппах CD4+ и/или CD8+ T-клеток с использованием проточной цитометрии. См., например, Milone et al., Molecular Therapy 17(8): 1453-1464 (2009). Альтернативно смесь CD4+ и CD8+ T-клеток стимулируют покрытыми αCD3/αCD28 магнитными гранулами на 0 сутки и трансдуцируют посредством CAR на 1 сутки с использованием бицистронного лентивирусного вектора, экспрессирующего CAR вместе с eGFP, с использованием рибосомальной последовательности пропуска 2A. После промывания культуры рестимулируют, например, клетками K562, экспрессирующими hCD32 и 4-1BBL, в присутствии антитела против CD3 и антитела против CD28 (K562-BBL-3/28). К культурам раз в двое суток добавляют экзогенный IL-2 в количестве 100 МЕ/мл. GFP+ T-клетки подсчитывают проточной цитометрией с использованием подсчета на основе гранул. См., например, Milone et al., Molecular Therapy 17(8): 1453-1464 (2009).
[00419] Также можно измерять длительную экспансию CAR+ T-клеток в отсутствие рестимуляции. См., например, Milone et al., Molecular Therapy 17(8): 1453-1464 (2009). В кратком изложении измеряют средний объем T-клеток (фл) на 8 сутки культивирования с использованием устройства для подсчета частиц Coulter Multisizer III после стимуляции покрытыми αCD3/αCD28 магнитными гранулами на 0 сутки и трансдукции указанным CAR на 1 сутки.
[00420] Оценка пролиферации клеток и продукции цитокинов была описана ранее, например, в Milone et al., Molecular Therapy 17(8): 1453-1464 (2009). В кратком изложении, оценку опосредуемой CAR пролиферации проводят на микропланшетах для титрования путем смешения промытых T-клеток с клетками-мишенями, такими как клетки K562-Meso, Ovcar3, Ovcar8, SW1990, Panc02.03, экспрессирующие мезотелин или CD32 и CD137 (KT32-BBL) в конечном соотношении T-клетки:клетки-мишени 1:1. К культурам с клетками KT32-BBL добавляют моноклональные антитела против CD3 (клон OKT3) и против CD28 (клон 9.3), чтобы они служили в качестве положительного контроля стимуляции пролиферации T-клеток, поскольку эти сигналы поддерживают длительную экспансию CD8+ T-клеток ex vivo. T-клетки подсчитывают в культурах с использованием флуоресцентных гранул CountBrightTM (Invitrogen, Carlsbad, CA) и проточной цитометрии, как описано изготовителем. CAR+ T-клетки идентифицируют по экспрессии GFP с использованием T-клеток, которые модифицированы связанными с eGFP-2A экспрессирующими CAR лентивирусными векторами. Для CAR+ T-клеток, не экспрессирующих GFP, CAR+ T-клетки выявляют с использованием биотинлированного рекомбинантного белка мезотелина и вторичного конъюгата авидин-PE. Также одновременно выявляют экспрессию CD4+ и CD8+ на T-клетках с использованием специфических моноклональных антител (BD Biosciences). Измерение цитокинов проводят в супернатантах, собранных через 24 часа после рестимуляции, с использованием набора цитометрических гранульных матриц для цитокинов TH1/TH2 (BD Biosciences, San Diego, CA) согласно инструкциям изготовителя. Флуоресценцию оценивают с использованием проточного цитометра FACScalibur, и данные анализируют в соответствии с инструкциями изготовителя.
[00421] Цитотоксичность можно оценивать способами, описанными в настоящем описании, например в примерах, или с использованием стандартного высвобождения 51Cr. См., например, Milone et al., Molecular Therapy 17(8): 1453-1464 (2009). В кратком изложении, клетки-мишени (например, клетки BHK или CHO, экспрессирующие мезотелин) нагружают 51Cr (таким как NaCrO4, New England Nuclear, Boston, MA) при 37°C в течение 2 часов при частом встряхивании, промывают дважды в полной RPMI и высевают на микропланшеты для титрования. Эффекторные T-клетки смешивают с клетками-мишенями в лунках в полной RPMI в различных соотношениях эффекторная клетк:клетка-мишень (E:T). Также подготавливают дополнительные лунки, содержащие только среду (самопроизвольное высвобождение, SR) или 1% раствор детергента triton-X 100 (полное высвобождение, TR). После инкубации в течение 4 часов при 37°C супернатант каждой лунки собирают. Затем измеряют высвобждение51Cr с использованием счетчика гамма-частиц (Packard Instrument Co., Waltham, MA). Каждые условия выполняют по меньшей мере в трех экземплярах, и процентный лизис вычисляют с использованием формулы: % лизис=(ER−SR)/(TR–SR), где ER представляет собой среднее количество 51Cr, высвободившееся для каждых экспериментальных условий. Также можно использовать альтернативные анализы цитотоксичности, такие как проточные анализы цитотоксичности.
[00422] Для одновременного отслеживания прогрессирования опухоли и транспорта T-клеток можно использовать красную и зеленую люциферазу жука-щелкуна, поскольку они используют один и тот же субстрат люциферин, но испускают свет в противоположных областях видимого спектра.
[00423] Также для оценки конструкций CAR против мезотелина по изобретению можно использовать другие анализы, включая анализы, описанные в разделе "Примеры" настоящего писания, а также анализы, известные в данной области.
Терапевтическое применение при экспрессирующих мезотелин заболеваниях и нарушениях
[00424] Настоящее изобретение относится к композициям и способам для лечения заболеваний и нарушений, ассоциированных с мезотелином. Примером заболевания или нарушения, ассоциированного с мезотелином, является мезотелиома.
[00425] Злокачественная мезотелиома представляет собой тип злокачественной опухоли, который возникает в тонком слое клеток, выстилающих внутренние органы организма, известном как мезотелий. Существует три признанных типа мезотелиомы. Плевральная мезотелиома (например, злокачественная плевральная мезотелиома или MPM) представляет собой наиболее распространенную форму заболевания, составляющую приблизительно 70% случаев, и она возникает в выстилке легкого, известной как плевра. Перитонеальная мезотелиома возникает в выстилке брюшной области, известной как брюшина. Перикардиальная мезотелиома возникает в перикарде, который выстилает сердце.
[00426] Индивидуум может иметь риск развития мезотелиомы, если индивидуум подвергался воздействию асбеста. Воздействие асбеста и вдыхание частиц асбеста могут вызвать мезотелиому. В большинстве случаев симптомы мезотелиомы не появляются у индивидуума, подвергнутого воздействию асбеста, в течение многих лет после воздействия.
[00427] Симптомы плевральной мезотелиомы включают, например, боль в нижней части спины или боль сбоку груди, и затруднение дыхания. Другие симптомы включают затруднение глотания, непрекращающийся кашель, лихорадку, снижение массы тела или усталость. Дополнительными симптомами, которые испытывают некоторые пациенты, являются мышечная слабость, потеря чувствительности, кровохаркание, опухание лица и рук и охриплость. На ранних стадиях заболевания, таких как мезотелиома 1 стадии, симптомы могут быть мягкими. Пациенты обычно сообщают о боли в одной области груди, которая никогда не проходит, снижении массы тела и лихорадке.
[00428] Перитонеальная мезотелиома возникает в брюшной полости и в результате этого симптомы часто включают боль в животе, снижение массы тела, тошноту и рвоту. В брюшной области может возникать скопление жидкости, также как и в результате злокачественной опухоли. Перитонеальная мезотелиома возникает в брюшной полости и часто распространяется на другие органы в области, включающей печень, селезенку или толстый кишечник. Тяжелая боль в животе является наиболее частой жалобой, которые изначально имеют пациенты. Также может присутствовать некоторый уровень дискомфорта, связанный со скоплением жидкости в животе. Другие симптомы перитонеальной мезотелиомы могут включать ухудшение моторики кишечника, тошноту и рвоту, лихорадку и опухшие ступни.
[00429] Перикардиальная мезотелиома является наименее распространенной формой мезотелиомы. Перикардиальная мезотелиома, как показывает называние, вовлекает сердце. Этот редкий тип злокачественной мезотелиомы инвазирует перикард – мешок, который окружает сердце. По мере прогрессирования злокачественной опухоли сердце не способно доставлять кислород эффективно в организма, вызывая дальнейшее ухудшение здоровья со все возрастающей скоростью. Симптомы, наиболее часто ассоциированные с перикардиальной мезотелиомой, имитируют симптомы сердечного приступа: тошнота, боль в груди и нехватка дыхания.
[00430] Индивидуумы, для которых является полезным лечение по изобретению, включают индивидуумов с мезотелиомой или индивидуумов, предположительно имеющих мезотелиому, например, о чем свидетельствует наличие одного или более симптомов, описанных в настоящем описании, и/или воздействие асбеста. В конкретных вариантах осуществления мезотелиома представляет собой плевральную мезотелиому (например, злокачественную плевральную мезотелиому). В других аспектах, можно лечить индивидуума, который имеет предзлокачественное состояние, например, такое как плевральные бляшки, доброкачественная мезотелиома или гиперплазия мезотелия.
[00431] Другим примером заболевания или нарушения, ассоциированного с мезотелином, является рак поджелудочной железы. Рак поджелудочной железы, который можно лечить способами, описанными в настоящем описании, включает, но не ограничивается ими, экзокринный рак поджелудочной железы и эндокринный рак поджелудочной железы. Экзокринный рак поджелудочной железы включает, но не ограничиваются ими, аденокарциномы, карциномы ацинарных клеток, железисто-плоскоклеточные карциномы, коллоидные карциномы, недифференцированные карциномы с подобными остеокластам гигантскими клетками, гепатоидные карциномы, внутрипротоковые папиллярные муцинозные новообразования, муцинозные кистозные новообразования, панкреатобластомы, серозные кистозные аденомы, перстневидно-клеточные карциномы, солидные и псевдопапиллярные опухоли, протоковые карциномы поджелудочной железы, и недифференцированные карциномы. В некоторых вариантах осуществления экзокринный рак поджелудочной железы представляет собой протоковую карциному поджелудочной железы. Эндокринный рак поджелудочной железы включает, но не ограничивается ими, инсулиномы и глюкагономы.
[00432] В некоторых вариантах осуществления рак поджелудочной железы представляет собой любой из рака поджелудочной железы ранней стадии, неметастазирующего рака поджелудочной железы, первичного рака поджелудочной железы, резецированного рака поджелудочной железы, развернутого рака поджелудочной железы, локально развернутого рака поджелудочной железы, метастазирующего рака поджелудочной железы, нерезектабельного рака поджелудочной железы, рака поджелудочной железы на стадии ремиссии, рецидивирующего рака поджелудочной железы, рака поджелудочной железы в адъювантных условиях или рак поджелудочной железы в неоадъювантных условиях. В некоторых вариантах осуществления рак поджелудочной железы представляет собой локально развернутый рак поджелудочной железы, нерезектабельный рак поджелудочной железы или метастазирующую протоковую карциному поджелудочной железы. В некоторых вариантах осуществления рак поджелудочной железы является резистентным к терапии на основе гемцитабина. В некоторых вариантах осуществления рак поджелудочной железы является рефрактерным к терапии на основе гемцитабина.
[00433] В других аспектах нарушение, ассоциированное с экспрессией мезотелина, представляет собой рак яичника. Рак яичника классифицируют согласно гистологии опухоли. Поверхностно эпителиальная-стромальная опухоль, также известная как эпителиальная карцинома яичника, является наиболее распространенным типом рака яичника. Она включает серозную опухоль (включая серозную папиллярную цистаденокарциному), эндометриоидную опухоль и муцинозную цистаденокарциному.
[00434] Способы, описанные в настоящем описании, можно использовать для лечения различных стадий рака яичника, например, стадии I, стадии II, стадии III или стадии IV. Определение стадии можно проводить, например, при удалении рака яичника. Стадии рака яичника являются следующими:
[00435] Рак стадии I ограничивается одним или обоими яичниками. Рак имеет стадию II, если вовлечен один или оба яичника и произошло распространение на матку и/или фаллопиевы трубы или другие области таза. Рак представляет собой рак стадии III, если вовлечен один или оба яичника и произошло распространение в лимфоузлы или другие области вне таза, но все еще в пределах брюшной полости, как например, поверхность кишечника или печени. Рак представляет собой рак стадии IV, если вовлечен один или оба яичника и злокачественная опухоль распространилась за пределы брюшной полости или внутрь печени.
[00436] В некоторых вариантах осуществления рак яичника является резистентным к одному или более химиотерапевтическим средствам. В некоторых вариантах осуществления рак яичника является рефрактерным к одному или более химиотерапевтическим средствам.
[00437] Другие злокачественные опухоли, которые можно лечить композициями CAR, описанными в настоящем описании, включают, например, рак головного мозга, рак мочевого пузыря, рак молочной железы, рак шейки матки, рак ободочной и прямой кишки, рак печени, рак почки, лимфому, лейкоз, рак легкого (например, аденокарциному легкого), меланому, метастазирующую меланому, мезотелиому, нейробластому, рак яичника, рак предстательной железы, рак поджелудочной железы, рак почки, рак кожи, тимому, саркому, неходжскинскую лимфому, лимфому Ходжкина, рак тела матки и любую их комбинацию.
[00438] Настоящее изобретение относится к способам ингибирования пролиферации или уменьшения популяции экспрессирующих мезотелин клеток, причем способы включают приведение в контакт популяции клеток, содержащей экспрессирующую мезотелин клетку, с клеткой, экспрессирующей CAR против мезотелина, по изобретению, которая связывается с экспрессирующей мезотелин клеткой. В конкретном варианте осуществления изобретение относится к способам ингибирования пролиферации или снижения популяции злокачественных клеток, экспрессирующих мезотелин, причем способы включают приведение в контакт популяции, экспрессирующих мезотелин злокачественных клеток с клеткой, экспрессирующей CAR против мезотелина, по изобретению, которая связывается с экспрессирующей мезотелин клеткой. В другом варианте осуществления изобретение относится к способам ингибирования пролиферации или снижения популяции злокачественных клеток, экспрессирующих мезотелин, причем способы включают приведение в контакт экспрессирующей мезотелин популяции злокачественных клеток с клеткой, экспрессирующей CAR против мезотелина, по изобретению, которая связывается с экспрессирующей мезотелин клеткой. В определенных вариантах осуществления клетка, экспрессирующая CAR против мезотелина, по изобретению снижает количество, численность, число или процент клеток и/или злокачественных клеток по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 65%, по меньшей мере на 75%, по меньшей мере на 85%, по меньшей мере на 95% или по меньшей мере на 99% у индивидуума с мезотелиомой или в модели на животных для мезотелиомы или другой злокачественной опухоли, ассоциированной с экспрессирующими мезотелин клетками, относительно отрицательного контроля. В одном аспекте индивидуумом является человек.
[00439] Изобретение также относится к способам предупреждения, лечения и/или управления течением нарушения, ассоциированного с экспрессирующими мезотелин клетками (например, мезотелиома), причем способы включают введение индивидууму, нуждающемуся в этом, клетки, экспрессирующей CAR против мезотелина, по изобретению, которая связывается с экспрессирующей мезотелин клеткой. В одном аспекте индивидуумом является человек.
[00440] Изобретение относится к способам предупреждения рецидива злокачественной опухоли, ассоциированной с мезотелин-экспрессирующими клетками, причем способы включают введение индивидууму, нуждающемуся в этом, клетки, экспрессирующей CAR против мезотелина, по изобретению, которая связывается с экспрессирующей мезотелин клеткой. В другом варианте осуществления способы включают введение индивидууму, нуждающемуся в этом, эффективного количества клеток, экспрессирующих CAR против мезотелина, по изобретению, которые связываются с экспрессирующей мезотелин клеткой, в комбинации с эффективным количеством другого терапевтического средства.
[00441] В одном аспекте изобретение относится к вектору, содержащему последовательность, кодирующую CAR против мезотелина, функционально связанный с промотором, для экспрессии в иммунных эффекторных клетках млекопитающих. В одном аспекте изобретение относится к рекомбинантной иммунной эффекторной клетке, экспрессирующей CAR против мезотелина, для применения для лечения экспрессирующих мезотелин опухолей. В одном аспекте клетка, экспрессирующая CAR против мезотелина, способна контактировать с опухолевой клеткой посредством по меньшей мере одного CAR против мезотелина по изобретению, экспрессируемого на ее поверхности, чтобы экспрессирующая CAR против мезотелина клетка активировалась в ответ на антиген и экспрессирующая CAR клетка нацеливалась на злокачественную клетку и происходило ингибирование роста злокачественной опухоли.
[00442] В одном аспекте изобретение относится к способу ингибирования роста экспрессирующей мезотелин злокачественной клетки, включающему приведение в контакт опухолевой клетки с клеткой, экспрессирующей CAR против мезотелина, чтобы экспрессирующая CAR клетка активировалась в ответ на антиген и нацеливалась на злокачественную клетку, где роста злокачественной клетки ингибируется. В одном аспекте активированный CART запускает и уничтожает злокачественную клетку.
[00443] В одном аспекте изобретение относится к способу лечения злокачественной опухоли у индивидуума. Способ включает введение индивидууму клетки, экспрессирующей CAR против мезотелина, чтобы происходило лечение злокачественной опухоли у индивидуума. Примером злокачественной опухоли, которая поддается лечению посредством клетки, экспрессирующей CAR против мезотелина, по изобретению является злокачественная опухоль, ассоциированная с экспрессией мезотелина. В одном аспекте злокачественная опухоль, ассоциированная с экспрессией мезотелина, выбрана из мезотелиомы, рака поджелудочной железы, рака яичника и рака легкого.
[00444] Изобретение относится к типу клеточной терапии, где иммунные эффекторные клетки, например, T-клетки или NK-клетки, генетически модифицированы для экспрессии химерного рецептора антигена (CAR), и экспрессирующую CAR клетку вводят путем инфузии реципиенту, нуждающемуся в этом. Введенная путем инфузии клетка способна уничтожать опухолевые клетки реципиента. В отличие от антительной терапии, модифицированные CAR иммунные эффекторные клетки способны реплицироваться in vivo, что приводит к длительной персистенции, которая может приводить к длительному контролю опухоли. В различных аспектах клетки, вводимые пациенту, или их потомство, сохраняются у пациента в течение по меньшей мере четырех месяцев, пяти месяцев, шести месяцев, семи месяцев, восьми месяцев, девяти месяцев, десяти месяцев, одиннадцати месяцев, двенадцати месяцев, тринадцати месяцев, четырнадцати месяцев, пятнадцати месяцев, шестнадцати месяцев, семнадцати месяцев, восемнадцати месяцев, девятнадцати месяцев, двадцати месяцев, двадцати одного месяца, двадцати двух месяцев, двадцати трех месяцев, двух лет, трех лет, четырех лет или пяти лет после введения клетки пациенту.
[00445] Также изобретение относится к типу клеточной терапии, где иммунные эффекторные клетки модифицированы, например, транскрибированной in vitro РНК, для временной экспрессии химерного рецептора антигена (CAR), и экспрессирующую CAR клетку вводят путем инфузии реципиенту, нуждающемуся в этом. Введенная путем инфузии клетка способна уничтожать опухолевые клетки реципиента. Таким образом, в различных аспектах клетки, введенные пациенту, сохраняются в течение менее чем одного месяца, например, трех недель, двух недель, одной недели после введения клеток пациенту.
[00446] Без связи с какой-либо конкретной теорией, иммунный ответ против злокачественных клеток, индуцируемый модифицированными посредством CAR иммунными эффекторными клетками, может представлять собой активный или пассивный иммунный ответ или альтернативно может быть следствием прямого против непрямого иммунного ответа. В одном аспекте трансдуцированные CAR T-клетки проявляют специфическую секрецию провоспалительных цитокинов и мощную цитолитическую активность в ответ на злокачественные клетки человека, экспрессирующие мезотелин, и опосредуют неспецифический цитолиз и опосредуют регрессию развернутой опухоли человека. Например, опухолевые клетки без антигена в гетерогенной области экспрессирующей мезотелин опухоли могут быть чувствительными к непрямому разрушению перенаправленных на мезотелин T-клеток, которые ранее реагировали с соседними положительными по антигену злокачественными клетками.
[00447] В одном аспекте содержащие полностью человеческий scFv модифицированные посредством CAR иммунные эффекторные клетки по изобретению могут представлять собой тип вакцины для иммунизации ex vivo и/или терапии in vivo у млекопитающего. В одном аспекте млекопитающим является человек.
[00448] Что касается иммунизации ex vivo, по меньшей мере одно из следующих событий происходит in vitro перед введением клетку в млекопитающего: i) увеличение клеток в количестве, ii) введение нуклеиновой кислоты, кодирующей CAR, в клетки или iii) криоконсервация клеток.
[00449] Методики ex vivo хорошо известны в данной области и более подробно рассмотрены ниже. В кратком изложении, выделяют клетки млекопитающего (например, человека) и генетически модифицируют (т.е. трансдуцируют или трансфицируют in vitro) вектором, экспрессирующим CAR, описанный в настоящем описании. Модифицированную посредством CAR клетку можно вводить реципиенту-млекопитающему для обеспечения терапевтической пользы. Реципиент-млекопитающее может представлять собой человека и модифицированная посредством CAR клетка может быть аутологичной для реципиента. Альтернативно клетки могут быть аллогенными, сингенными или ксеногенными в отношении реципиента.
[00450] Для клеток по настоящему изобретению можно использовать методику увеличения в количестве гемопоэтических стволовых клеток и клеток-предшественников ex vivo, описанную в патенте США № 5199942, включенном в настоящее описание в качестве ссылки. В данной области известны другие пригодные способы, таким образом, настоящее изобретение не ограничивается каким-либо конкретным способом увеличения клеток в количестве ex vivo. В кратком изложении, культивирование и увеличение в количестве T-клеток ex vivo включает: (1) сбор CD34+ гемопоэтических стволовых клеток и клеток-предшественников из взятого образца периферической крови или эксплантата костного мозга; и (2) увеличение таких клеток в количестве ex vivo. В дополнение к клеточным факторам роста, описанным в патенте США № 5199942, для культивирования и увеличения в количестве клеток можно использовать другие факторы, такие как flt3 L, IL-1, IL-3 и лиганд c-kit.
[00451] В дополнение к использованию клеточной вакцины с точки зрения иммунизации ex vivo, настоящее изобретение также относится к композициям и способам для иммунизации in vivo для индукции иммунного ответа, направленного против антигена, у пациента.
[00452] Как правило, клетки активированные и увеличенные в количестве, как описано в настоящем описании, можно использовать для лечения и предупреждения заболеваний, которые возникают у индивидуумов с иммунодефицитом. В частности, модифицированные посредством CAR иммунные эффекторные клетки по изобретению используют для лечения заболеваний, нарушений и состояний, ассоциированных с экспрессией мезотелина. В некоторых аспектах клетки по изобретению используют для лечения пациентов, имеющих риск развития заболеваний, нарушений и состояний, ассоциированных с экспрессией мезотелина. Таким образом, изобретение относится к способам лечения или предупреждения заболеваний, нарушений и состояний, ассоциированных с экспрессией мезотелина, включающим введение индивидууму, нуждающемуся в этом, терапевтически эффективного количества модифицированных посредством CAR T-клеток по изобретению.
[00453] Модифицированные посредством CAR T-клетки по настоящему изобретению можно вводить либо отдельно, либо в качестве фармацевтической композиции в комбинации с разбавителями и/или другими компонентами, такими как IL-2 или другие цитокины или популяции клеток.
[00454] Настоящее изобретение также относится к способам ингибирования пролиферации или снижения популяции экспрессирующих мезотелин клеткок, причем способы включают приведение в контакт популяции клеток, содержащей экспрессирующую мезотелин клетку, с клеткой, экспрессирующей CAR против мезотелина (например, CART против мезотелина, также обозначаемая в настоящем описании как "CART-MSLN") по изобретению, которая связывается с экспрессирующей мезотелин клеткой. В конкретном аспекте изобретение относится к способам ингибирования пролиферации или снижения популяции злокачественных клеток, экспрессирующих мезотелин, причем способы включают приведение в контакт популяции экспрессирующих мезотелин злокачественных клеток с клеткой, экспрессирующей CAR против мезотелина, по изобретению, которая связывается с экспрессирующей мезотелин клеткой. В одном аспекте настоящее изобретение относится к способам ингибирования пролиферации или снижения популяции злокачественных клеток, экспрессирующих мезотелин, причем способы включают приведение в контакт популяции экспрессирующих мезотелин злокачественных клеток с клеткой, экспрессирующей CAR против мезотелина, по изобретению, которая связывается с экспрессирующей мезотелин клеткой. В некоторых аспектах клетка, экспрессирующая CAR против мезотелина, по изобретению снижает количество, численность, число или процент клеток и/или злокачественных клеток по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 65%, по меньшей мере на 75%, по меньшей мере на 85%, по меньшей мере на 95%, или по меньшей мере на 99% у индивидуума или в модели на животных для мезотелиомы или другой злокачественной опухоли, ассоциироваанной с экспрессирующими мезотелин клетками, относительно отрицательного контроля. В одном аспекте индивидуумом является человек.
[00455] Настоящее изобретение также относится к способам предупреждения, лечения и/или управления течением заболевания, ассоциированного с экспрессирующими мезотелин клетками (например, мезотелиома), причем способы включают введение индивидууму, нуждающемуся в этом, клетки, экспрессирующей CAR против мезотелина, по изобретению, которая связывается с экспрессирующей мезотелин клеткой. В одном аспекте индивидуумом является человек.
[00456] Настоящее изобретение относится к способам предупреждения рецидива злокачественной опухоли, ассоциированной с экспрессирующими мезотелин клетками, причем способы включают введение индивидууму, нуждающемуся в этом, клетки, экспрессирующей CAR против мезотелина, по изобретению, которая связывается с экспрессирующей мезотелин клеткой. В одном аспекте способы включают введение индивидууму, нуждающемуся в этом, эффективного количества клетки, экспрессирующей CAR против мезотелина, по изобретению, которая связывается с экспрессирующей мезотелин клеткой, в комбинации с эффективным количеством другой терапии.
Комбинированная терапия
[00457] Экспрессирующую CAR клетку, описанную в настоящем описании, можно использовать в комбинации с другими известными агентами и способами терапии. Введение "в комбинации", как используют в рамках изобретения, означает, что два (или более) различных способа лечения осуществляют у индивидуума в процессе наличия у индивидуума нарушения, например, два или более способа лечения проводят после диагностирования у пациента нарушения и пока не произойдет излечение или устранение нарушения, или пока лечение не прекратят по другим причинам. В некоторых вариантах осуществления введение одного лекарственного средства все еще проводят, когда начинается введение второго, так что существует перекрывание с точки зрения введения. Это иногда называют в настоящем описании "одновременной" или "совместной" доставкой. В других вариантах осуществления доставка одного лекарственного средства заканчивается до начала доставки другого лекарственного средства. В некоторых вариантах осуществления в любом случае лечение является более эффективным вследствие комбинированного введения. Например, второе лекарственное средство является более эффективным, например, эквивалентный эффект наблюдают при использовании меньшего количества второго лекарственного средства, или второе лекарственное средство снижает симптомы в большей степени, чем наблюдалось бы, если бы второе лекарственное средство вводили в отсутствие первого лекарственного средства, или аналогичную ситуацию наблюдают для первого лекарственного средства. В некоторых вариантах осуществления доставка является такой, что снижение симптома или другого параметра, связанного с нарушения, является более высоким, чем наблюдалось бы при доставке одного лекарственного средства в отсутствие другого. Эффект двух способов лечения может быть частично аддитивным, полностью аддитивным или более чем аддитивным. Доставка может быть такой, что эффект первого доставляемого лекарственного средства все еще поддается обнаружению, когда доставляют второе лекарственное средство.
[00458] Экспрессирующую CAR клетку, описанную в настоящем описании, и по меньшей мере одно дополнительное лекарственное средство можно вводить одновременно, в одной или в отдельных композициях, или последовательно. Для последовательного введения сначала можно вводить экспрессирующую CAR клетку, описанную в настоящем описании, а затем можно вводить дополнительное средство, или порядок введения может быть обратным.
[00459] В следующих аспектах, экспрессирующую CAR клетку, описанную в настоящем описании, можно использовать в терапевтическом режиме в комбинации с хирургической операцией, химиотерапией, лучевой терапией, иммунодепрессивными средствами, такими как циклоспорин, азатиоприн, метотрексат, микофенолат и FK506, антителами или другими иммунодеструктивными средствами, такими как CAMPATH, антитела против CD3, или другими способами терапии на основы антител, цитоксином, флударабином, циклоспорином, FK506, рапамицином, микофеноловой кислотой, стероидами, FR901228, цитокинами и лучевой терапией, пептидной вакциной, такой как пептидная вакцина, описанная в Izumoto et al. 2008 J Neurosurg 108:963-971.
[00460] В одном варианте осуществления экспрессирующую CAR клетку, описанную в настоящем описании, можно использовать в комбинации с химиотерапевтическим средством. Иллюстративные химиотерапевтические средства включают антрациклин (например, доксорубицин (например, липосомальный доксорубицин)), алкалоид барвинка (например, винбластин, винкристин, виндезин, винорелбин), алкилирующее средство (например, циклофосфамид, декарбазин, мелфалан, ифосфамид, темозоломид), антитело против иммунных клеток (например, алемтузумаб, гемтузумаб, ритуксимаб, тозитумомаб), антиметаболит (включая, например, антагонисты фолиевой кислоты, аналоги пиримидинов, аналоги пуринов и ингибиторы аденозиндезаминазы (например, флударабин)), ингибитор mTOR, агонист индуцируемого глюкокортикоидами TNFR-родственного белка (GITR), ингибитор протеасом (например, аклациномицин A, глиотоксин или бортезомиб), иммуномодулятор, такой как талидомид или производное талидомида (например, леналидомид).
[00461] Основные химические средства, предусматриваемые для применения в комбированных способах терапии, включают анастрозол (Arimidex®), бикалутамид (Casodex®), блеомицин сульфат (Blenoxane®), бусульфан (Myleran®), бусульфан инъекционный (Busulfex®), капецитабин (Xeloda®), N4-пентоксикарбонил-5-дезокси-5-фторцитидин, карбоплатин (Paraplatin®), кармустин (BiCNU®), хлорамбуцил (Leukeran®), цисплатин (Platinol®), кладрибин (Leustatin®), циклофосфамид (Cytoxan® или Neosar®), цитарабин, цитозин арабинозид (Cytosar-U®), инъекционный липосомальный цитарабин (DepoCyt®), дакарбазин (DTIC-Dome®), дактиномицин (актиномицин D, космеган), даунорубицин гидрохлорид (Cerubidine®), инъекционный липосомальный даунорубицина цитрат (DaunoXome®), дексаметазон, доцетаксел (Taxotere®), доксорубицина гидрохлорид (Adriamycin®, Rubex®), этопозид (Vepesid®), флударабина фосфат (Fludara®), 5-фторурацил (Adrucil®, Efudex®), флутамид (Eulexin®), тезацитибин, гемцитабин (дифтордезоксицитидин), гидроксимочевину (Hydrea®), идарубицин (Idamycin®), ифосфамид (IFEX®), иринотекан (Camptosar®), L-аспарагиназу (ELSPAR®), лейковорин кальций, мелфалан (Alkeran®), 6-меркаптопурин (Purinethol®), метотрексат (Folex®), митоксантрон (Novantrone®), милотарг, паклитаксел (Taxol®), феникс (иттрий-90/MX-DTPA), пентостатин, имплантат полифепросана 20 с кармустином (Gliadel®), тамоксифена цитрат (Nolvadex®), тенипозид (Vumon®), 6-тиогуанин, тиотепу, тирапазамин (Tirazone®), топотекана гидрохлорид для инъекций (Hycamptin®), винбластин (Velban®), винкристин (Oncovin®) и винорелбин (Navelbine®).
[00462] Иллюстративные алкилирующие средства включают, но не ограничиваются ими, азотистые иприты, производные этиленимина, алкилсульфонаты, нитрозомочевину и триазены: урацил мустард (Aminouracil Mustard®, Chlorethaminacil®, Demethyldopan®, Desmethyldopan®, Haemanthamine®, Nordopan®, Uracil nitrogen mustard®, Uracillost®, Uracilmostaza®, Uramustin®, Uramustine®), хлорметин (Mustargen®), циклофосфамид (Cytoxan®, Neosar®, Clafen®, Endoxan®, Procytox®, RevimmuneTM), ифосфамид (Mitoxana®), мелфалан (Alkeran®), хлорамбуцил (Leukeran®), пипоброман (Amedel®, Vercyte®), триэтиленмеламин (Hemel®, Hexalen®, Hexastat®), триэтилентиофосфорамин, темозоломид (Temodar®), тиотепу (Thioplex®), бусульфан (Busilvex®, Myleran®), кармустин (BiCNU®), ломустин (CeeNU®), стрептозоцин (Zanosar®) и дакарбазин (DTIC-Dome®). Дополнительные иллюстративные алкилирующие средства включают, но не ограничиваются ими, оксалиплатин (Eloxatin®); темозоломид (Temodar® и Temodal®); дактиномицин (также известный как актиномицин-D, Cosmegen®); мелфалан (также известный как L-PAM, L-сарколизин и фенилаланин мустард, Alkeran®); алтретамин (также известный как гексаметилмеламин (HMM), Hexalen®); кармустин (BiCNU®); бендамустин (Treanda®); бусульфан (Busulfex® и Myleran®); карбоплатин (Paraplatin®); ломустин (также известный как CCNU, CeeNU®); цисплатин (также известный как CDDP, Platinol® и Platinol®-AQ); хлорамбуцил (Leukeran®); циклофосфамид (Cytoxan® и Neosar®); дакарбазин (также известный как DTIC, DIC и имидазол карбоксамид, DTIC-Dome®); алтретамин (также известный как гексаметилмеламин (HMM), Hexalen®); ифосфамид (Ifex®); преднумустин; прокарбазин (Matulane®); мехлорэтамин (также известный как азотистый иприт, мустин и мехлорэтамин гидрохлорид, Mustargen®); стрептозоцин (Zanosar®); тиотепу (также известную как тиофосфоамид, TESPA и TSPA, Thioplex®); Циклофосфамид (Endoxan®, Cytoxan®, Neosar®, Procytox®, Revimmune®) и бендамустин HCl (Treanda®).
[00463] Иллюстративные ингибиторы mTOR включают, например, темсиролимус; ридафоролимус (ранее известный как деферолимус, (1R,2R,4S)-4-[(2R)-2-[(1R,9S,12S,15R,16E,18R,19R,21R, 23S,24E,26E,28Z,30S,32S,35R)-1,18-дигидрокси-19,30-диметокси-15,17,21,23,29,35-гексаметил-2,3,10,14,20-пентаоксо-11,36-диокса-4-азатрицикло[30,3,1,04,9]-гексатриаконта-16,24,26,28-тетраен-12-ил]пропил]-2-метоксициклогексилдиметилфосфинат, также известный как AP23573 и MK8669, и описанный в публикации PCT № WO 03/064383); эверолимус (Afinitor® или RAD001); рапамицин (AY22989, Sirolimus®); симапимод (CAS 164301-51-3); эмсиролимус, (5-{2,4-бис[(3S)-3-метилморфолин-4-ил]пиридо[2,3-d]пиримидин-7-ил}-2-метоксифенил)метанол (AZD8055); 2-амино-8-[транс-4-(2-гидроксиэтокси)циклогексил]-6-(6-метокси-3-пиридинил)-4-метилпиридо[2,3-d]пиримидин-7(8H)-он (PF04691502, CAS 1013101-36-4) и N2-[1,4-диоксо-4-[[4-(4-оксо-8-фенил-4H-1-бензопиран-2-ил)морфолиний-4-ил]метокси]бутил]-L-аргинилглицил-L-α-аспартил-L-серин, внутренняя соль (SF1126, CAS 936487-67-1) и XL765.
[00464] Иллюстративные иммуномодуляторы включают, например, афутузумаб (доступный 5от Roche®); пегфилграстим (Neulasta®); леналидомид (CC-5013, Revlimid®); талидомид (Thalomid®), актимид (CC4047) и IRX-2 (смесь цитокинов человека, включая интерлейкин 1, интерлейкин 2 и интерферон γ, CAS 951209-71-5, доступные от IRX Therapeutics).
[00465] Иллюстративные антрациклины включают, например, доксорубицин (Adriamycin® и Rubex®); блеомицин (lenoxane®); даунорубицин (даунорубицин гидрохлорид, дауномицин и рубидомицин гидрохлорид, Cerubidine®); липосомальный даунорубицин (липосомальный даунорубицина цитрат, DaunoXome®); митоксантрон (DHAD, Novantrone®); эпирубицин (EllenceTM); идарубицин (Idamycin®, Idamycin PFS®); митомицин C (Mutamycin®); гелданамицин; гербимицин; равидомицин; и дезацетилгавидомицин.
[00466] Иллюстративные алкалоиды барвинка включают, например, винорелбина тартрат (Navelbine®), винкристин (Oncovin®) и виндезин (Eldisine®)); винбластин (также известный как винбластина сульфат, винкалейкобластин и VLB, Alkaban-AQ® и Velban®); и винорелбин (Navelbine®).
[00467] Иллюстративные ингибиторы протеасом включают бортезомиб (Velcade®); карфилзомиб (PX-171-007, (S)-4-метил-N-((S)-1-(((S)-4-метил-1-((R)-2-метилoксиран-2-ил)-1-оксопентан-2-ил)амино)-1-оксо-3-фенилпропан-2-ил)-2-((S)-2-(2-морфолиноацетамидо)-4-фенилбутанамидо)пентанамид); маризомиб (NPI-0052); иксазомиба цитрат (MLN-9708); деланзомиб (CEP-18770); и O-метил-N-[(2-метил-5-тиазолил)карбонил]-L-серил-O-метил-N-[(1S)-2-[(2R)-2-метил-2-оксиранил]-2-оксо-1-(фенилметил)этил]-L-серинамид (ONX-0912).
[00468] В одном варианте осуществления экспрессирующую CAR клетку, описанную в настоящем описании, вводят индивидууму в комбинации с молекулой, нацеленной на GITR и/или модулирующей функции GITR, такой как агонист GITR и/или антитело против GITR, которые устраняют регуляторные T-клетки (Treg). В одном варианте осуществления связывающие GITR молекулы и/или молекулы, модулирующие функции GITR (например, агонист GITR и/или антитела против GITR, устраняющие Treg) вводят до экспрессирующей CAR клетки. Например, в одном варианте осуществления агонист GITR можно вводить до афереза клеток. Иллюстративные агонисты GITR включают, например, слитые белки GITR и антитела против GITR (например, двухвалентные антитела против GITR) например, такие как слитый белок GITR, описанный в патенте США № 6111090, патенте Европы № 090505B1, патенте США № 8586023, публикации PCT № WO 2010/003118 и 2011/090754, или антитело против GITR, описанное, например, в патенте США № 7025962, патенте Европы № 1947183B1, патенте США № 7812135, патенте США № 8388967, патенте США № 8591886, патенте Европы № EP 1866339, публикации PCT № WO 2011/028683, публикации PCT № WO 2013/039954, публикации PCT № WO2005/007190, публикации PCT № WO 2007/133822, публикации PCT № WO2005/055808, публикации PCT № WO 99/40196, публикации PCT № WO 2001/03720, публикации PCT № WO99/20758, публикации PCT № WO2006/083289, публикации PCT № WO 2005/115451, патенте США № 7618632 и публикации PCT № WO 2011/051726.
[00469] В одном варианте осуществления экспрессирующую CAR клетку, описанную в настоящем описании, вводят индивидууму в комбинации с ингибитором mTOR, например, ингибитором mTOR, описанным в настоящем описании, например, рапалогом, такими как эверолимус. В одном варианте осуществления ингибитор mTOR вводят до введения экспрессируюещй CAR клетки. Например, в одном варианте осуществления ингибитор mTOR можно вводить до афереза клеток.
[00470] В одном варианте осуществления экспрессирующую CAR клетку, описанную в настоящем описании, вводят индивидууму в комбинации с агонистом GITR, например, агонистом GITR, описанным в настоящем описании. В одном варианте осуществления агонист GITR вводят до введения экспрессирующей CAR клетки. Например, в одном варианте осуществления агонист GITR можно вводить до афереза клеток.
[00471] В одном варианте осуществления экспрессирующую CAR клетку, описанную в настоящем описании, вводят индивидууму в комбинации с ингибитором протеинтирозинфосфатазы, например, ингибитором протеинтирозинфосфатазы, описанным в настоящем описании. В одном варианте осуществления ингибитор протеинтирозинфосфатазы представляет собой ингибитор SHP-1, например, ингибитор SHP-1, описанный в настоящем описании, например, такой как натрий стибоглюконат. В одном варианте осуществления ингибитор протеинтирозинфосфатазы представляет собой ингибитор SHP-2, например, ингибитор SHP-2, описанный в настоящем описании.
[00472] В одном варианте осуществления экспрессирующую CAR клетку, описанную в настоящем описании, можно использовать в комбинации с ингибитором киназы. В одном варианте осуществления ингибитор киназы представляет собой ингибитор CDK4, например, ингибитор CDK4, описанный в настоящем описании, например, ингибитор CDK4/6, например, такой как 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8H-пиридо[2,3-d]пиримидин-7-она гидрохлорид (также называемый палбоциклибом или PD0332991). В одном варианте осуществления ингибитор киназы представляет собой ингибитор BTK, например, ингибитор BTK, описанный в настоящем описании, например, такой как ибрутиниб. В одном варианте осуществления ингибитор киназы представляет собой ингибитор mTOR, например, ингибитор mTOR, описанный в настоящем описании, например, такой как рапамицин, аналог рапамицина, OSI-027. Ингибитор mTOR может представлять собой, например, ингибитор mTORC1 и/или ингибитор mTORC2, например, ингибитор mTORC1 и/или ингибитор mTORC2, описанный в настоящем описании. В одном варианте осуществления ингибитор киназы представляет собой ингибитор MNK, например, ингибитор MNK, описанный в настоящем описании, например, такой как 4-амино-5-(4-фторанилино)пиразолo[3,4-d]пиримидин. Ингибитор MNK может представлять собой, например, ингибитор MNK1a, MNK1b, MNK2a и/или MNK2b. В одном варианте осуществления ингибитор киназы представляет собой двойной ингибитор PI3K/mTOR, описанный в настоящем описании, например, такой как PF-04695102. В одном варианте осуществления ингибитор киназы представляет собой ингибитор DGK, например, ингибитор DGK, описанный в настоящем описании, например, такой как DGKinh1 (D5919) или DGKinh2 (D5794).
[00473] В одном варианте осуществления ингибитор киназы представляет собой ингибитор CDK4, выбранный из алоизина A; флавопиридола или HMR-1275, 2-(2-хлорфенил)-5,7-дигидрокси-8-[(3S,4R)-3-гидрокси-1-метил-4-пиперидинил]-4-хроменона; кризотиниба (PF-02341066; 2-(2-хлорфенил)-5,7-дигидрокси-8-[(2R,3S)-2-(гидроксиметил)-1-метил-3-пирролидинил]-4H-1-бензопиран-4-она гидрохлорида (P276-00); 1-метил-5-[[2-[5-(трифторметил)-1H-имидазол-2-ил]-4-пиридинил]окси]-N-[4-(трифторметил)фенил]-1H-бензимидазол-2-амина (RAF265); индисулама (E7070); росковитина (CYC202); пальбоциклиба (PD0332991); динациклиба (SCH727965); N-[5-[[(5-трет-бутилоксазол-2-ил)метил]тио]тиазол-2-ил]пиперидин-4-карбоксамида (BMS 387032); 4-[[9-хлор-7-(2,6-дифторфенил)-5H-пиримидо[5,4-d][2]бензазепин-2-ил]амино]бензойной кислоты (MLN8054); 5-[3-(4,6-дифтор-1H-бензимидазол-2-ил)-1H-индазол-5-ил]-N-этил-4-метил-3-пиридинметанамина (AG-024322); 4-(2,6-дихлорбензоиламино)-1H-пиразол-3-карбоновой кислоты N-(пиперидин-4-ил)амида (AT7519); 4-[2-метил-1-(1-метилэтил)-1H-имидазол-5-ил]-N-[4-(метилсульфонил)фенил]-2-пиримидинамина (AZD5438) и XL281 (BMS908662).
[00474] В одном варианте осуществления ингибитор киназы представляет собой ингибитор CDK4, например пальбоциклиб (PD0332991), и пальбоциклиб вводят в дозе приблизительно 50 мг, 60 мг, 70 мг, 75 мг, 80 мг, 90 мг, 100 мг, 105 мг, 110 мг, 115 мг, 120 мг, 125 мг, 130 мг, 135 мг (например, 75 мг, 100 мг или 125 мг) каждые сутки в течение периода времени, например, каждые сутки в течение 14-21 суток курса из 28 суток, или каждые сутки в течение 7-12 суток курса из 21 суток. В одном варианте осуществления проводят 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или более курсов пальбоциклиба.
[00475] В одном варианте осуществления ингибитор киназаы представляет собой ингибитор BTK, выбранный из ибрутиниба (PCI-32765); GDC-0834; RN-486; CGI-560; CGI-1764; HM-71224; CC-292; ONO-4059; CNX-774 и LFM-A13. В предпочтительном варианте осуществления ингибитор BTK не снижает или не ингибирует киназную активность интерлейкин-2-индуцируемой киназы (ITK), и выбран из GDC-0834; RN-486; CGI-560; CGI-1764; HM-71224; CC-292; ONO-4059; CNX-774 и LFM-A13.
[00476] В одном варианте осуществления ингибитор киназы представляет собой ингибитор BTK, например, ибрутиниб (PCI-32765), и ибрутиниб вводят в дозе приблизительно 250 мг, 300 мг, 350 мг, 400 мг, 420 мг, 440 мг, 460 мг, 480 мг, 500 мг, 520 мг, 540 мг, 560 мг, 580 мг, 600 мг (например, 250 мг, 420 мг или 560 мг) каждые сутки в течение периода времени, например, каждые сутки в течение курса из 21 суток, или каждые сутки в течение курса из 28 суток. В одном варианте осуществления проводят 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или более курсов ибрутиниба.
[00477] В одном варианте осуществления ингибитор киназы представляет собой ингибитор mTOR, выбранный из темсиролимуса; ридафоролимуса (1R,2R,4S)-4-[(2R)-2 [(1R,9S,12S,15R,16E,18R,19R,21R,23S,24E,26E,28Z,30S,32S,35R)-1,18-дигидрокси-19,30-диметокси-15,17,21,23,29,35-гексаметил-2,3,10,14,20-пентаоксо-11,36-диокса-4-азатрицикло[30,3,1,04,9]гексатриаконта-16,24,26,28-тетраен-12-ил]пропил]-2-метоксициклогексилдиметилфосфината, также известного как AP23573 и MK8669; эверолимуса (RAD001); рапамицина (AY22989); симапимода; (5-{2,4-бис[(3S)-3-метилморфолин-4-ил]пиридо[2,3-d]пиримидин-7-ил}-2-метоксифенил)метанола (AZD8055); 2-амино-8-[транс-4-(2-гидроксиэтокси)циклогексил]-6-(6-метокси-3-пиридинил)-4-метилпиридо[2,3-d]пиримидин-7(8H)-она (PF04691502); и N2-[1,4-диоксо-4-[[4-(4-оксо-8-фенил-4H-1-бензопиран-2-ил)морфолиний-4-ил]метокси]бутил]-L-аргинилглицил-L-α-аспартил-L-серина (SEQ ID NO: 272), внутренней соли (SF1126) и XL765.
[00478] В одном варианте осуществления ингибитор киназы представляет собой ингибитор mTOR, например, рапамицин, и рапамицин вводят в дозе приблизительно 3 мг, 4 мг, 5 мг, 6 мг, 7 мг, 8 мг, 9 мг, 10 мг (например, 6 мг) каждые сутки в течение периода времени, например, каждые сутки в течение курса из 21 суток или каждые сутки в течение курса из 28 суток. В одном варианте осуществления проводят 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или более курсов рапамицина. В одном варианте осуществления ингибитор киназы представляет собой ингибитор mTOR, например, эверолимус, и эверолимус вводят в дозе приблизительно 2 мг, 2,5 мг, 3 мг, 4 мг, 5 мг, 6 мг, 7 мг, 8 мг, 9 мг, 10 мг, 11 мг, 12 мг, 13 мг, 14 мг, 15 мг (например, 10 мг) каждые сутки в течение периода времени, например, каждые сутки в течение курса из 28 суток. В одном варианте осуществления проводят 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или более курсов эверолимуса.
[00479] В одном варианте осуществления ингибитор киназы представляет собой ингибитор MNK, выбранный из CGP052088; 4-амино-3-(п-фторфениламино)-пиразолo[3,4-d]пиримидина (CGP57380); циркоспорамида; ETC-1780445-2 и 4-амино-5-(4-фторанилино)пиразолo[3,4-d]пиримидин.
[00480] В одном варианте осуществления ингибитор киназы представляет собой двойной ингибитор фосфатидилинозитол-3-киназы (PI3K) и mTOR, выбранный из 2-амино-8-[транс-4-(2-гидроксиэтокси)циклогексил]-6-(6-метокси-3-пиридинил)-4-метил-пиридо[2,3-d]пиримидин-7(8H)-она (PF-04691502); N-[4-[[4-(диметиламино)-1-пиперидинил]карбонил]фенил]-N'-[4-(4,6-ди-4-морфолинил-1,3,5-триазин-2-ил)фенил]мочевины (PF-05212384, PKI-587); 2-метил-2-{4-[3-метил-2-оксо-8-(хинолин-3-ил)-2,3-дигидро-1H-имидазо[4,5-c]хинолин-1-ил]фенил}пропаннитрила (BEZ-235); апитолисиба (GDC-0980, RG7422); 2,4-дифтор-N-{2-(метилокси)-5-[4-(4-пиридазинил)-6-хинолинил]-3-пиридинил}бензолсульфонамида (GSK2126458); 8-(6-метоксипиридин-3-ил)-3-метил-1-(4-(пиперазин-1-ил)-3-(трифторметил)фенил)-1H-имидазо[4,5-c]хинолин-2(3H)-онмалеиновой кислоты (NVP-BGT226); 3-[4-(4-морфолинилпиридо[3',2':4,5]фуро[3,2-d]пиримидин-2-ил]фенола (PI-103); 5-(9-изопропил-8-метил-2-морфолино-9H-пурин-6-ил)пиримидин-2-амина (VS-5584, SB2343) и N-[2-[(3,5-диметоксифенил)амино]хиноксалин-3-ил]-4-[(4-метил-3-метоксифенил)карбонил]аминофенилсульфонамида (XL765).
[00481] Также можно использовать лекарственные средства, которые либо ингибируют кальцийзависимую фосфатазу кальциневрин (циклоспорин и FK506), либо ингибируют киназу p70S6, которая является важной для индуцируемой факторами роста передачи сигнала (рапамицин). (Liu et al., Cell 66:807-815, 1991; Henderson et al., Immun. 73:316-321, 1991; Bierer et al., Curr. Opin. Immun. 5:763-773, 1993). В следующем аспекте композиции клеток по настоящему изобретению можно вводить пациенту совместно с (например, до, одновременно или после) трансплантации костного мозга, терапией, устраняющей T-клетки, с использованием химиотерапевтических средств, таких как флударабин, лучевая терапия внешним пучком (XRT), циклофосфамид и/или антитела, такие как OKT3 или CAMPATH. В одном аспекте композиции клеток по настоящему изобретению вводят после терапии, устраняющей B-клетки, такой как средства, которые реагируют с CD20, например, ритуксан. Например, в одном варианте осуществления индивидуумы могут подвергаться стандартному лечению химиотерапией в высокой дозе с последующей трансплантацией стволовых клеток периферической крови. В определенных вариантах осуществления после трансплантации индивидуумам проводят инфузию увеличенных в количестве иммунных клеток по настоящему изобретению. В дополнительном варианте осуществления увеличенные в количестве клетки вводят до или после хирургической операции.
[00482] В одном варианте осуществления индивидууму можно вводить средство, которое снижает или смягчает побочный эффект, ассоциированный с введением экспрессирующей CAR клетки. Побочные эффекты, ассоциированные с введением экспрессирующей CAR клетки, включают, но не ограничиваются ими CRS и гемофагоцитарный лимфогистиоцитоз (HLH), также называемый синдромом активации макрофагов (MAS). Симптомы CRS включают высокую лихорадку, тошноту, временную гипотензию, гипоксию и т.п. CRS может включать клинические конституциональные признаки и симптомы, такие как лихорадка, усталость, анорексия, миалгии, артралгии, тошнота, рвота и головная боль. CRS может включать клинические кожные признаки и симптомы, такие как сыпь. CRS может включать клинические желудочно-кишечные признаки и симптомы, такие как тошнота, рвота и диарея. CRS может включать клинические респираторные признаки и симптомы, такие как тахипноэ и гипоксемия. CRS может включать клинические сердечно-сосудистые признаки и симптомы, такие как тахикардия, расширенное пульсовое давление, гипотензию, увеличенный сердечный выброс (на ранней стадии) и потенциально сниженный сердечный выброс (на поздней стадии). CRS может включать клинические признаки и симптомы свертывания, такие как повышенный уровень d-димера, гипофибриногенемия с кровотечением или без него. CRS может включать клинические признаки и симптомы, такие как азотемия. CRS может включать клинические печеночные признаки и симптомы, такие как повышение активности трансаминаз и гипербилирубинемия. CRS может включать клинические неврологические признаки и симптомы, такие как головная боль, изменения психического состояния, спутанность сознания, бред, затруднения с подбором слов или явная афазия, галлюцинации, тремор, дисметрия, изменение походки и припадки.
[00483] Таким образом, способы, описанные в настоящем описании, могут включать введение экспрессирующей CAR клетки, описанной в настоящем описании, индивидууму, и, кроме того, введение одного или более средств для контроля повышенных уровней растворимого фактора вследствие лечения экспрессирующей CAR клеткой. В одном варианте осуществления растворимый фактор, повышенный у индивидуума, представляет собой один или более из IFN-γ, TNFα, IL-2 и IL-6. В одном варианте осуществления фактор, повышенный у индивидуума, представляет собой один или более из IL-1, GM-CSF, IL-10, IL-8, IL-5 и фракталкина. Таким образом, средство, вводимое для лечения этого побочного эффекта, может представлять собой средство, которое нейтрализует один или более из этих растворимых факторов. В одном варианте осуществления средство, которое нейтрализует одну или более из этих растворимых форм, представляет собой антитело или его антигенсвязывающий фрагмент. Примеры таких средств включают, но не ограничиваются ими, стероид (например, кортикостероид), ингибитор TNFα и ингибитор IL-6. Примером ингибитора TNFα является молекула антитела против TNFα, такая как инфликсимаб, адалимумаб, цертолизумаб пегол и голимумаб. Другим примером ингибитора TNFα является слитый белок, такой как этанерцепт. Низкомолекулярный ингибитор TNFα включает, но не ограничивается ими, производные ксантина (например, пентоксифиллин) и бупропион. Примером ингибитора IL-6 является молекула антитела против IL-6 или молекула антитела против рецептора IL-6, такая как тоцилизумаб (toc), сарилумаб, элсилимомаб, CNTO 328, ALD518/BMS-945429, CNTO 136, CPSI-2364, CDP6038, VX30, ARGX-109, FE301 и FM101. В одном варианте осуществления молекула антитела против IL-6 представляет собой тоцилизумаб. Примером ингибитора на основе IL-1R является анакинра.
[00484] В некоторых вариантах осуществления индивидууму вводят кортикостероид, например, такой как метилпреднизолон, гидрокортизон, среди прочих.
[00485] В некоторых вариантах осуществления индивидууму вводят сосудосуживающее средство, например, такое как норадреналин, дофамин, фенилэфрин, адреналин, вазопрессин или их комбинация.
[00486] В одном варианте осуществления индивидууму можно вводить жаропонижающее средство. В одном варианте осуществления индивидууму можно вводить болеутоляющее средство.
[00487] В одном варианте осуществления индивидууму можно вводить средство, которое повышает активность или выносливость экспрессирующей CAR клетки. Например, в одном варианте осуществления средство может представлять собой средство, которое ингибирует молекулу, которая модулирует или регулирует, например ингибирует, T-клеточную функцию. В некоторых вариантах осуществления молекула, которая модулирует или регулирует T-клеточную функцию, представляет собой ингибиторную молекулу. Ингибиторные молекулы, например Programmed Death 1 (PD1), в некоторых вариантах осуществления могут уменьшать способность экспрессирующей CAR клетки индуцировать иммунный эффекторный ответ. Примеры ингибиторных молекул включают PD1, PD-L1, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4 и TGFR-бета. Ингибирование молекулы, которая модулирует или регулирует, например ингибирует, T-клеточную функцию, например, посредством ингибирования уровня ДНК, РНК или белка, может оптимизировать эффективность экспрессирующей CAR клетки. В вариантах осуществления для ингибирования экспрессии молекулы, которая модулирует или регулирует, например ингибирует, T-клеточную функцию в экспрессирующей CAR клетке можно использовать ингибиторную нуклеиновую кислоту, например дцРНК, например миРНК или кшРНК; ил, например, ингибиторный белок или систему, например короткие палиндромные повторы, регулярно расположенные кластерами (CRISPR), нуклеазу, подобную активатору транскрипции (TALEN) или эндонуклеазу с цинковыми пальцами (ZFN), например, как описано в настоящем описании. В одном варианте осуществления средство представляет собой кшРНК. В одном варианте осуществления средство, которое модулирует или регулирует, например ингибирует, T-клеточную функцию ингибируется в экспрессирующей CAR клетке. В этих вариантах осуществления молекула дцРНК, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например ингибирует, T-клеточную функцию, связана с нуклеиновой кислотой, которая кодирует компонент, например все компоненты, CAR. В одном варианте осуществления молекула нуклеиновой кислоты, которая кодирует молекулу дцРНК, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например ингибирует, T-клеточную функцию, функционально связана с промотором, например происходящим из H1 или U6 промотором, так что молекула дцРНК, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например ингибирует, T-клеточную функцию, экспрессируется, например экспрессируется в экспрессирующей CAR клетке. См. например, Tiscornia G., "Development of Lentiviral Vactors Expressing siRNA," Chapter 3, Gene Transfer: Delivery and Expression of DNA and RNA (eds. Friedmann и Rossi). Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, USA, 2007; Brummelkamp TR, et al. (2002) Science 296: 550–553; Miyagishi M, et al. (2002) Nat. Biotechnol. 19: 497–500. В одном варианте осуществления молекула нуклеиновой кислоты, которая кодирует молекулу дцРНК, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например ингибирует, T-клеточную функцию, находится на одном и том же векторе, например лентивирусном векторе, который содержит молекулу нуклеиновой кислоты, которая кодирует компонент, например все компоненты, CAR. В таком варианте осуществления молекула нуклеиновой кислоты, которая кодирует молекулу дцРНК, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например ингибирует, T-клеточную функцию, расположена на векторе, например лентивирусном векторе, с 5’- или 3’-стороны от нуклеиновой кислоты, которая кодирует компонент, например все компоненты, CAR. Молекула нуклеиновой кислоты, которая кодирует молекулу дцРНК, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например ингибирует, T-клеточную функцию, может транскрибироваться в том же или другом направлении, что и нуклеиновая кислота, которая кодирует компонент, например все компоненты, CAR. В одном варианте осуществления молекула нуклеиновой кислоты, которая кодирует молекулу дцРНК, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например ингибирует, T-клеточную функцию, находится на векторе, отличном от вектора, который содержит молекулу нуклеиновой кислоты, которая кодирует компонент, например все компоненты, CAR. В одном варианте осуществления молекула нуклеиновой кислоты, которая кодирует молекулу дцРНК, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например ингибирует, T-клеточную функцию, временно экспрессируется в экспрессирующей CAR клетке. В одном варианте осуществления молекула нуклеиновой кислоты, которая кодирует молекулу дцРНК, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например ингибирует, T-клеточную функцию, стабильно встраивается в геном экспрессирующей CAR клетки. На фиг.47 представлены примеры векторов для экспрессии компонента, например всех компонентов, CAR с использованием дцРНК, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например ингибирует, T-клеточную функцию.
[00488] Примеры молекул дцРНК, пригодных для ингибирования экспрессии молекулы, которая модулирует тили регулирует, например ингибирует, T-клеточную функцию, где молекула, которая модулирует или регулирует, например ингибирует, T-клеточную функцию, представляет собой PD-1, представлены ниже.
[00489] В таблице 16 ниже представлены названия средств РНК-i против PDCD1 (PD1) (определяемые их положением в последовательности гена PDCD1 мыши NM_008798.2), а также SEQ ID NO: 280-327, соответствующие последовательности ДНК. В этой таблице показаны как смысловые (S), так и антисмысловые (AS) последовательности, представленные в качестве 19-мерных и 21-мерных последовательностей. Также следует отметить, что положение (PoS, например, 176) происходит из номера положения в последовательности гена PDCD1 мыши NM_008798.2. SEQ ID NO указаны группами по 12, которые соответствуют "смысловым 19" SEQ ID NO: 280-291; "смысловым 21" SEQ ID NO: 292-303; "антисмысловым 21" SEQ ID NO: 304-315; "антисмысловым 19" SEQ ID NO: 316-327.
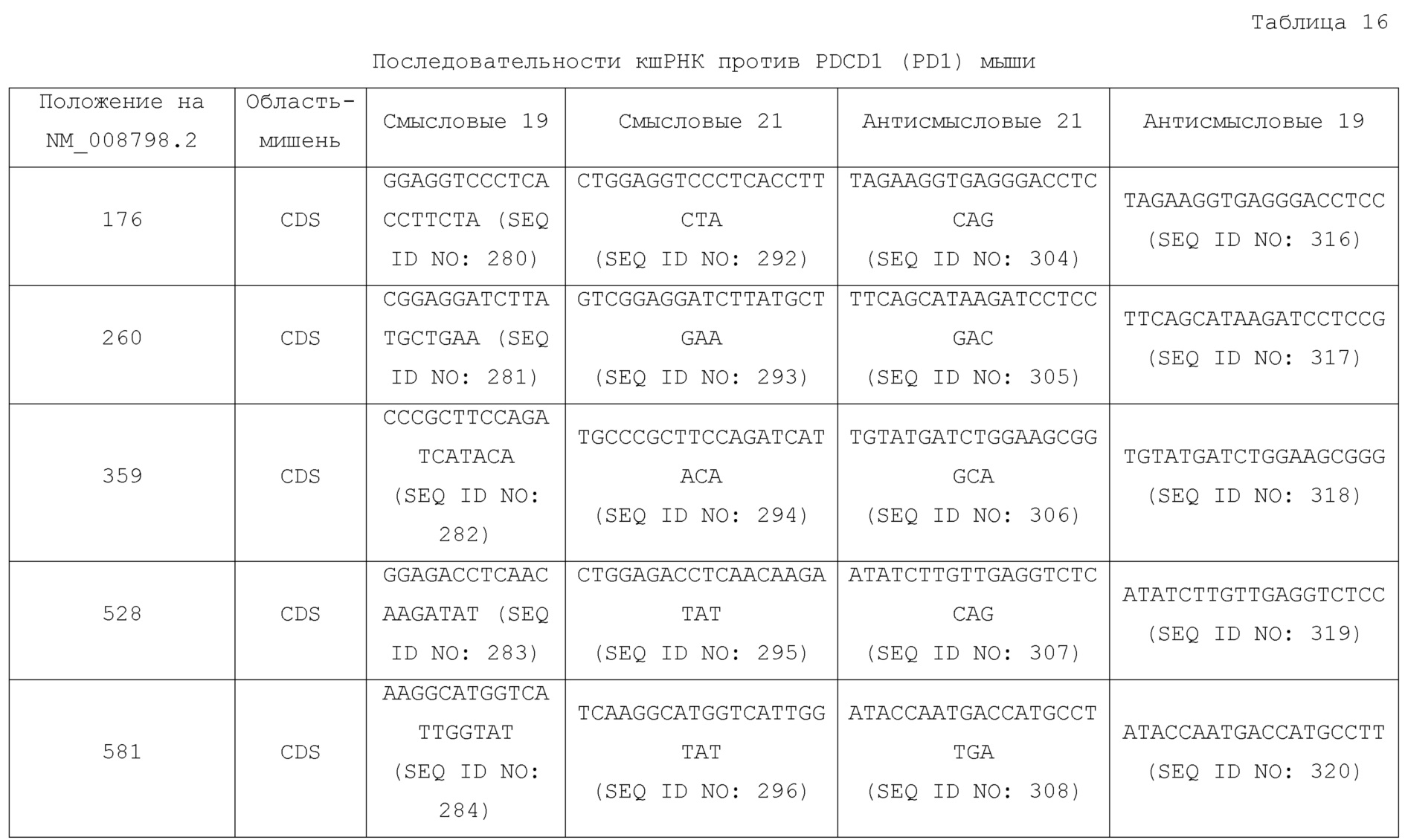

В таблице 17 ниже представлены названия средств РНК-i против PDCD1 (PD1) (определяемые их положением в последовательности гена PDCD1 человека), а также SEQ ID NO: 323-370, соответствующие последовательности ДНК. В этой таблице показаны как смысловые (S), так и антисмысловые (AS) последовательности, представленные в качестве 19-мерных и 21-мерных последовательностей. SEQ ID NO указаны группами по 12, которые соответствуют "смысловым 19" SEQ ID NO: 328-339; "смысловым 21" SEQ ID NO: 340-351; "антисмысловым 21" SEQ ID NO: 352-363; "антисмысловым 19" SEQ ID NO: 364-375.

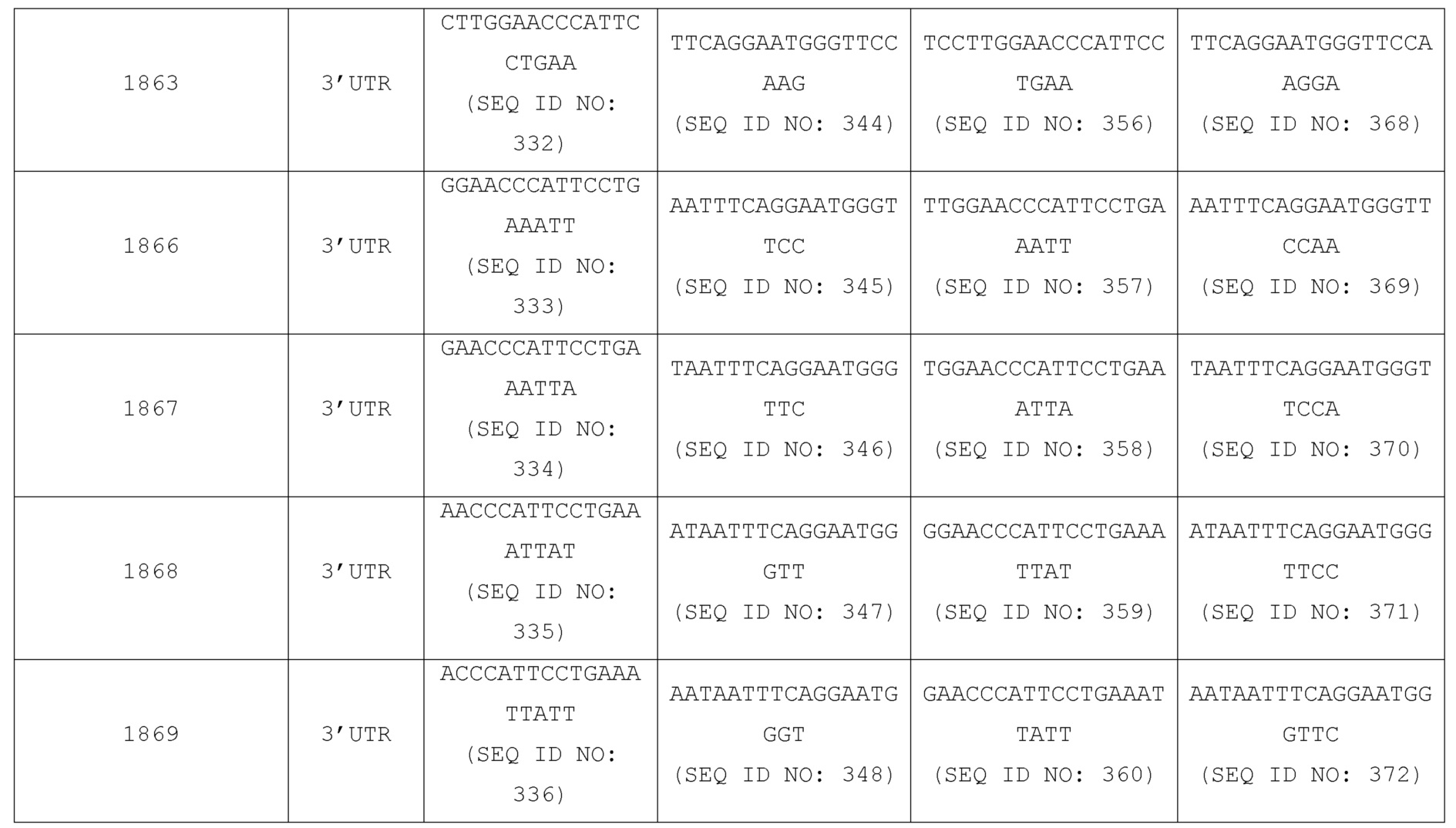

[00490] В одном варианте осуществления ингибитор ингибиторного сигнала может представлять собой, например, антитело или фрагмент антитела, которые связываются с ингибиторной молекулой. Например, средство может представлять собой антитело или фрагмент антитела, которые связываются с PD1, PD-L1, PD-L2 или CTLA4 (например, ипилимумаб (также называемый MDX-010 и MDX-101, и выпускаемый в продажу как Yervoy®; Bristol-Myers Squibb; тремелимумаб (моноклональное IgG2-антитело, доступное от Pfizer, ранее известное как тицилимумаб, CP-675.206)). В одном варианте осуществления средство представляет собой антитело или фрагмент антитела, которые связываются с TIM3. В одном варианте осуществления средство представляет собой антитело или фрагмент антитела, которые связываются с LAG3.
[00491] PD-1 представляет собой ингибиторный представитель семейства рецепторов CD28, которое также включает CD28, CTLA-4, ICOS и BTLA. PD-1 экспрессируется на активированных B-клетках, T-клетках и миелоидных клетках (Agata et al. 1996 Int. Immunol 8:765-75). Было показано, что два лиганда для PD1, PD-L1 и PD-L2, подавляют активацию T-клеток при связывании с PD1 (Freeman et a. 2000 J Exp Med 192:1027-34; Latchman et al. 2001 Nat Immunol 2:261-8; Carter et al. 2002 Eur J Immunol 32:634-43). PD-L1 распространен в злокачественных опухолях человека (Dong et al. 2003 J Mol Med 81:281-7; Blank et al. 2005 Cancer Immunol. Immunother 54:307-314; Konishi et al. 2004 Clin Cancer Res 10:5094). Иммунную супрессию можно обращать вспять путем ингибирования локального взаимодействия PD1 с PD-L1. Антитела, фрагменты антител и другие ингибиторы PD-1, PD-L1 и PD-L2 доступны в данной области и могут использоваться в комбинации с CAR по настоящему изобретению, описанным в настоящем описании. Например, ниволумаб (также обозначаемый как BMS-936558 или MDX1106; Bristol-Myers Squibb) представляет собой полностью человеческое моноклональное IgG4-антитело, которое специфически блокирует PD-1. Ниволумаб (клон 5C4) и другие моноклональные антитела человека, которые специфически связываются с PD-1, описаны в US 8008449 и WO2006/121168. Пидилизумаб (CT-011; Cure Tech) представляет собой гуманизированное моноклональное IgG1k-антитело, которое связывается с PD-1. Пидилизумаб и другие гуманизированные моноклональные антитела против PD-1 описаны в WO2009/101611. Пембролизумаб (ранее известный как ламбролизумаб и также обозначаемый как MK03475; Merck) представляет собой гуманизированное моноклональное IgG4-антитело, которое связывается с PD-1. Пембролизумаб и другие гуманизированные антитела против PD-1 описаны в US 8354509 и WO2009/114335. MEDI4736 (Medimmune) представляет собой моноклональное антитело человека, которое связывается с PDL1 и ингибирует взаимодействие лиганда с PD1. MDPL3280A (Genentech/Roche) представляет собой моноклональное IgG1-антитело с оптимизированной Fc, которое связывается с PD-L1. MDPL3280A и другие моноклональные антитела человека к PD-L1 описаны в патенте США № 7943743 и публикации США № 20120039906. Другие связывающие PD-L1 средства включают YW243.55.S70 (вариабельные области тяжелой и легкой цепей представлены в SEQ ID NO: 20 и 21 в WO2010/077634) и MDX-1 105 (также обозначаемый как BMS-936559, и, например, связывающие PD-L1 средства, описанные в WO2007/005874). AMP-224 (B7-DCIg; Amplimmune; например, описанный в WO2010/027827 и WO2011/066342), представляет собой слитый растворимый рецептор PD-L2-Fc, который блокирует взаимодействие между PD-1 и B7-H1. Другие антитела против PD-1 включают AMP 514 (Amplimmune), среди прочих, например, антитела против PD-1, описанные в US 8609089, US 2010028330 и/или US 20120114649.
[00492] TIM3 (T-клеточный иммуноглобулин 3) также подавляет T-клеточную функцию, в частности, в секретирующих IFN-γ CD4+ T-хелперных 1 и CD8+ цитотоксических T-клетках 1, и он играет важную роль в устранении T-клеток. Ингибирование взаимодействия между TIM3 и его лигандами, например галектином-9 (Gal9), фосфотидилсерином (PS) и HMGB1, может увеличить иммунный ответ. Антитела, фрагменты антител и другие ингибиторы TIM3 и его лиганды доступны в данной области и могут быть использованы в комбинации с CAR против CD19, описанным в настоящем описании. Например, антитела, фрагменты антитела, низкомолекулярные соединения или пептидные ингибиторы, которые нацелены на TIM3, связываются с IgV-доменом TIM3, ингибируя взаимодействия с его лигандами. Антитела и пептиды, которые ингибируют TIM3, описаны в WO2013/006490 и US20100247521. Другие антитела против TIM3 включают гуманизированные версии RMT3-23 (описанные в Ngiow et al., 2011, Cancer Res, 71:3540-3551) и клон 8B.2C12 (описанный в Monney et al., 2002, Nature, 415:536-541). Биспецифические антитела, которые ингибируют TIM3 и PD-1, описаны в US20130156774.
[00493] В других вариантах осуществления средство, которое повышает активность экспрессирующей CAR клетки, представляет собой ингибитор CEACAM (например, ингибитор CEACAM-1, CEACAM-3 и/или CEACAM-5). В одном варианте осуществления ингибитор CEACAM представляет собой молекулу антитела против CEACAM. Иллюстративные антитела против CEACAM-1 описаны в WO 2010/125571, WO 2013/082366 WO 2014/059251 и WO 2014/022332, напримермоноклональное антитело 34B1, 26H7 и 5F4; или их рекомбинантные формы, как описано, например, в US 2004/0047858, US 7132255 и WO 99/052552. В других вариантах осуществления антитело против CEACAM связывается с CEACAM-5, как описано, например, в Zheng et al. PLoS One. 2010 Sep 2;5(9). pii: e12529 (DOI:10:1371/journal.pone.0021146) или перекрестно реагирует с CEACAM-1 и CEACAM-5, как описано, например, в WO 2013/054331 и US 2014/0271618.
[00494] Без связи с теорией, полагают, что канцероэмбриональные антигенные молекулы клеточной адгезии (CEACAM), такие как CEACAM-1 и CEACAM-5, опосредуют, по меньшей мере частично, ингибирование противоопухолевого иммунного ответа (см. например, Markel et al. J Immunol. 2002 Mar 15;168(6):2803-10; Markel et al. J Immunol. 2006 Nov 1;177(9):6062-71; Markel et al. Immunology. 2009 Feb;126(2):186-200; Markel et al. Cancer Immunol Immunother. 2010 Feb;59(2):215-30; Ortenberg et al. Mol Cancer Ther. 2012 Jun;11(6):1300-10; Stern et al. J Immunol. 2005 Jun 1; 174(11):6692-701; Zheng et al. PLoS One. 2010 Sep 2;5(9). pii: e12529). Например, CEACAM-1 описан в качестве гетерофильного лиганда для TIM-3, играющего роль в опосредуемой TIM-3 толерантности и устранении T-клеток (см. например, WO 2014/022332; Huang, et al. (2014) Nature doi:10.1038/nature13848). В вариантах осуществления показано, что совместная блокада CEACAM-1 и TIM-3 усиливает противоопухолевый иммунный ответ в моделях с ксенотрансплантатом рака ободочной и прямой кишки (см. например, WO 2014/022332; Huang, et al. (2014), выше). В других вариантах осуществления совместная блокада CEACAM-1 и PD-1 снижает толерантность T-клеток, как описано, например, в WO 2014/059251. Таким образом, ингибиторы CEACAM можно использовать с другими иммуномодуляторами, описанными в настоящем описании (например, ингибиторы PD-1 и/или ингибиторы TIM-3) для усиления иммунного ответа против злокачественной опухоли, например, меланомы, рака легкого (например, NSCLC), рака мочевого пузыря, рака толстого кишечника, рака яичника и других злокачественных опухолей, как описано в настоящем описании.
[00495] LAG3 (ген активации лимфоцитов 3 или CD223) представляет собой молекулу клеточной поверхности, экспрессируемую на активированных T-клетках и B-клетках, для которой было показано, что она играет роль в устранении CD8+ T-клеток. Антитела, фрагменты антитела и другие ингибиторы LAG3 и его лиганды доступны в данной области, и их можно использовать в комбинации с CAR против CD19, описанным в настоящем описании. Например, BMS-986016 (Bristol-Myers Squib) представляет собой моноклональное антитело, которое нацелено на LAG3. IMP701 (Immutep) представляет собой антитело-антагонист LAG3 и IMP731 (Immutep и GlaxoSmithKline) представляет собой истощающее антитело против LAG3. Другие ингибиторы LAG3 включают IMP321 (Immutep), который представляет собой рекомбинантный слитый белок растворимой части LAG3 и Ig, который связывается с молекулами MHC класса II и активирует антигенпредставляющие клетки (APC). Другие антитела описаны, например, в WO2010/019570.
[00496] В некоторых вариантах осуществления средство, которое повышает активность экспрессирующей CAR клетки, может представлять собой, например, слитый белок, содержащий первый домен и второй домен, где первый домен представляет собой ингибиторную молекулу или ее фрагмент, и второй домен представляет собой полипептид, который ассоциирован с положительным сигналом, например, полипептид, содержащий внутриклеточный сигнальный домен, как описано в настоящем описании. В некоторых вариантах осуществления полипептид, который ассоциирован с положительным сигналом, может включать костимулирующий домен CD28, CD27, ICOS, например, внутриклеточный сигнальный домен CD28, CD27 и/или ICOS, и/или первичный сигнальный домен, например, из CD3-зета, например, описанный в настоящем описании. В одном варианте осуществления слитый белок экспрессируется той же клеткой, которая экспрессирует CAR. В другом варианте осуществления слитый белок экспрессируется клеткой, например, T-клеткой, которая не экспрессирует CAR против мезотелина.
[00497] В одном варианте осуществления средство, которое повышает активность экспрессирующей CAR клетки, описанной в настоящем описании, представляет собой miR-17-92.
Комбинирование с низкой дозой ингибитора mTOR
[00498] В одном варианте осуществления клетки, экспрессирующие молекулу CAR, например, молекулу CAR, описанную в настоящем описании, вводят в комбинации с низкой усиливающей иммунитет дозой ингибитора mTOR.
[00499] В одном варианте осуществления доза ингибитора mTOR ассоциирована с или обеспечивает ингибирование mTOR, составляющее по меньшей мере 5, но не более чем 90%, по меньшей мере 10, но не более чем 90%, по меньшей мере 15, но не более чем 90%, по меньшей мере 20, но не более чем 90%, по меньшей мере 30, но не более чем 90%, по меньшей мере 40, но не более чем 90%, по меньшей мере 50, но не более чем 90%, по меньшей мере 60, но не более чем 90%, или по меньшей мере 70, но не более чем 90%.
[00500] В одном варианте осуществления доза ингибитора mTOR ассоциирована с или обеспечивает ингибирование mTOR, составляющее по меньшей мере 5, но не более чем 80%, по меньшей мере 10, но не более чем 80%, по меньшей мере 15, но не более чем 80%, по меньшей мере 20, но не более чем 80%, по меньшей мере 30, но не более чем 80%, по меньшей мере 40, но не более чем 80%, по меньшей мере 50, но не более чем 80%, или по меньшей мере 60, но не более чем 80%.
[00501] В одном варианте осуществления доза ингибитора mTOR ассоциирована с или обеспечивает ингибирование mTOR, составляющее по меньшей мере 5, но не более чем 70%, по меньшей мере 10, но не более чем 70%, по меньшей мере 15,, но не более чем 70%, по меньшей мере 20, но не более чем 70%, по меньшей мере 30, но не более чем 70%, по меньшей мере 40, но не более чем 70%, или по меньшей мере 50, но не более чем 70%.
[00502] В одном варианте осуществления доза ингибитора mTOR ассоциирована с или обеспечивает ингибирование mTOR по меньшей мере 5, но не более чем 60%, по меньшей мере 10, но не более чем 60%, по меньшей мере 15,, но не более чем 60%, по меньшей мере 20, но не более чем 60%, по меньшей мере 30, но не более чем 60%, или по меньшей мере 40, но не более чем 60%.
[00503] В одном варианте осуществления доза ингибитора mTOR ассоциирована с или обеспечивает ингибирование mTOR, составляющее по меньшей мере 5, но не более чем 50%, по меньшей мере 10, но не более чем 50%, по меньшей мере 15, но не более чем 50%, по меньшей мере 20, но не более чем 50%, по меньшей мере 30, но не более чем 50%, или по меньшей мере 40, но не более чем 50%.
[00504] В одном варианте осуществления доза ингибитора mTOR ассоциирована или обеспечивает ингибирование mTOR по меньшей мере 5, но не более чем 40%, по меньшей мере 10, но не более чем 40%, по меньшей мере 15,, но не более чем 40%, по меньшей мере 20, но не более чем 40%, по меньшей мере 30, но не более чем 40%, или по меньшей мере 35, но не более чем 40%.
[00505] В одном варианте осуществления доза ингибитора mTOR ассоциирована с или обеспечивает ингибирование mTOR, составляющее по меньшей мере 5, но не более чем 30%, по меньшей мере 10, но не более чем 30%, по меньшей мере 15,, но не более чем 30%, по меньшей мере 20, но не более чем 30%, или по меньшей мере 25, но не более чем 30%.
[00506] В одном варианте осуществления доза ингибитора mTOR ассоциирована с или обеспечивает ингибирование mTOR, составляющее по меньшей мере 1, 2, 3, 4 или 5, но не более чем 20%, по меньшей мере 1, 2, 3, 4 или 5, но не более чем 30%, по меньшей мере 1, 2, 3, 4 или 5, но не более чем 35, по меньшей мере 1, 2, 3, 4 или 5, но не более чем 40%, или по меньшей мере 1, 2, 3, 4 или 5, но не более чем 45%.
[00507] В одном варианте осуществления доза ингибитора mTOR ассоциирована с или обеспечивает ингибирование mTOR, составляющее по меньшей мере 1, 2, 3, 4 или 5, но не более чем 90%.
[00508] Как описано в настоящем описании, степень ингибирования mTOR можно выражать в качестве степени ингибирования P70 S6, например, степень ингибирования mTOR можно определять по уровню снижения активности P70 S6, например, по снижению фосфорилирования субстрата P70 S6. Уровень ингибирования mTOR можно оценивать способом, описанным в настоящем описании, например, с использованием анализа Boulay.
ИЛЛЮСТРАТИВНЫЕ ИНГИБИТОРЫ mTOR
[00509] Как используют в рамках изобретения, термин "ингибитор mTOR" относится к соединению или лиганду, или их фармацевтически приемлемой соли, которые ингибируют киназу mTOR в клетке. В одном варианте осуществления ингибитор mTOR представляет собой аллостерический ингибитор. В одном варианте осуществления ингибитор mTOR представляет собой каталитический ингибитор.
[00510] Аллостерические ингибиторы mTOR включают нейтральное трициклическое соединение рапамицин (сиролимус), родственные рапамицину соединения, которые представляют собой соединения, имеющие структурное и функциональное сходство с рапамицином, включая, например, производные рапамицина, аналоги рапамицина (также называемые рапалогами) и другие макролидные соединения, которые ингибируют активность mTOR.
[00511] Рапамицин представляет собой известный макролидный антибиотик, продуцируемый Streptomyces hygroscopicus, имеющий структуру, показанную в формуле A.
[00512]

[00513] См., например, McAlpine, J.B., et al., J. Antibiotics (1991) 44: 688; Schreiber, S.L., et al., J. Am. Chem. Soc. (1991) 113: 7433; патент США № 3929992. Существуют различные схемы нумерации, предложенные для рапамицина. Во избежание путаницы, когда в настоящем описании упоминаются конкретные аналоги рапамицина, названия приведены относительно рапамицина с использованием схемы нумерации формулы A.
[00514] Аналоги рапамицина, пригодные в рамках изобретения, представляют собой, например, O-замещенные аналоги, в которых гидроксильная группа на циклогексильном кольце рапамицина заменена OR1, где R1 представляет собой гидроксиалкил, гидроксиалкоксиалкил, ациламиноалкил или аминоалкил; например RAD001, также известный как эверолимус, как описано в US 5665772 и WO94/09010, содержимое которых включено в качестве ссылки. Другие пригодные аналоги рапамицина включают аналоги рапамицина, замещенные в положении 26 или 28. Аналог рапамицина может представлять собой эпимер аналога, упомянутого выше, в частности, эпимер аналога, замещенного в положении 40, 28 или 26, и он необязательно может быть далее гидрогенизирован, например, как описано в US 6015815, WO95/14023 и WO99/15530, содержание которых включено в настоящее описание в качестве ссылки, например ABT578, также известный как зотаролимус, или аналог рапамицина, описанный в US 7091213, WO98/02441 и WO01/14387, содержание которых включено в качестве ссылки, например AP23573, также известный как ридафоролимус.
[00515] Примеры аналогов рапамицина, пригодных для применения в рамках настоящего изобретения, из US 5665772 включают, но не ограничиваются ими, 40-O-бензилрапамицин, 40-O-(4’-гидроксиметил)бензилрапамицин, 40-O-[4’-(1,2-дигидроксиэтил)]бензилрапамицин, 40-O-аллилрапамицин, 40-O-[3’-(2,2-диметил-1,3-диоксолан-4(S)-ил)-проп-2’-ен-1’-ил]-рапамицин, (2’E,4’S)-40-O-(4’,5’-дигидроксипент-2’-ен-1’-ил)рапамицин, 40-O-(2-гидрокси)этоксикарбонилметилрапамицин, 40-O-(2-гидрокси)этилрапамицин, 40-O-(3-гидрокси)пропилрапамицин, 40-O-(6-гидрокси)гексилрапамицин, 40-O-[2-(2-гидрокси)этокси]этилрапамицин, 40-O-[(3S)-2,2-диметилдиоксолан-3-ил]метилрапамицин, 40-O-[(2S)-2,3-дигидроксипроп-1-ил]рапамицин, 40-O-(2-ацетокси)этилрапамицин, 40-O-(2-никотиноилокси)этилрапамицин, 40-O-[2-(N-морфолино)ацетокси]этилрапамицин, 40-O-(2-N-имидазолилацетокси)этилрапамицин, 40-O-[2-(N-метил-N’-пиперазинил)ацетокси]этилрапамицин, 39-O-десметил-39,40-O,O-этиленрапамицин, (26R)-26-дигидро-40-O-(2-гидрокси)этилрапамицин, 40-O-(2-аминоэтил)рапамицин, 40-O-(2-ацетаминоэтил)рапамицин, 40-O-(2-никотинамидоэтил)рапамицин, 40-O-(2-(N-метилимидазо-2’-илкарбэтоксамидо)этил)рапамицин, 40-O-(2-этоксикарбониламиноэтил)рапамицин, 40-O-(2-толилсульфонамидоэтил)рапамицин и 40-O-[2-(4’,5’-дикарбоэтокси-1’,2’,3’-триазол-1’-ил)этил]рапамицин.
[00516] Другие аналоги рапамицина, пригодные в рамках настоящего изобретения, представляют собой аналоги, в которых гидроксильная группа на циклогексильном кольце рапамицина и/или гидроксигруппа в положении 28 заменены группой сложного гидроксиэфира, например, аналоги рапамицина, описанные в US RE44768, например темсиролимус.
[00517] Другие аналоги рапамицина, пригодные в рамках настоящего изобретения, включают аналоги, в которых метоксигруппа в положении 16 заменена другим заместителем, предпочтительно (необязательно гидрокси-замещенным) алкинилокси, бензилом, ортометоксибензил или хлорбензилом и/или где метоксигруппа в положении 39 удалена вместе с углеродом 39, так что циклогексильное кольцо рапамицина становится циклопентильным кольцом, лишенным метоксигруппы в положении 39; например, как описано в WO95/16691 и WO96/41807, содержание которых включено в качестве ссылки. Аналоги можно далее модифицировать, так что гидрокси в положении 40 рапамицина алкилирован и/или 32-карбонил восстановлен.
[00518] Аналоги рапамицина из WO95/16691 включают, но не ограничиваются ими, 16-деметокси-16-(пент-2-инил)оксирапамицин, 16-деметокси-16-(бут-2-инил)оксирапамицин, 16-деметокси-16-(пропаргил)оксирапамицин, 16-деметокси-16-(4-гидроксибут-2-инил)оксирапамицин, 16-деметокси-16-бензилокси-40-O-(2-гидроксиэтил)рапамицин, 16-деметокси-16-бензилоксирапамицин, 16-деметокси-16-ортометоксибензилрапамицин, 16-деметокси-40-O-(2-метоксиэтил)-16-пент-2-инил)оксирапамицин, 39-деметокси-40-дезокси-39-формил-42-нор-рапамицин, 39-деметокси-40-дезокси-39-гидроксиметил-42-норрапамицин, 39-деметокси-40-дезокси-39-карбокси-42-норрапамицин, 39-деметокси-40-дезокси-39-(4-метилпиперазин-1-ил)карбонил-42-норрапамицин, 39-деметокси-40-дезокси-39-(морфолин-4-ил)карбонил-42-норрапамицин, 39-деметокси-40-дезокси-39-[N-метил,N-(2-пиридин-2-илэтил)]карбамоил-42-норрапамицин и 39-деметокси-40-дезокси-39-(п-толуолсульфонилгидразонометил)-42-норрапамицин.
[00519] Аналоги рапамицина из WO96/41807 включают, но не ограничиваются ими, 32-деоксорапамицин, 16-O-пент-2-инил-32-деоксорапамицин, 16-O-пент-2-инил-32-деоксо-40-O-(2-гидроксиэтил)рапамицин, 16-O-пент-2-инил-32-(S)-дигидро-40-O-(2-гидроксиэтил)рапамицин, 32(S)-дигидро-40-O-(2-метокси)этилрапамицин и 32(S)-дигидро-40-O-(2-гидроксиэтил)рапамицин.
[00520] Другим пригодным аналогом рапамицина является умиролимус, как описано в US2005/0101624, содержание которой включено в качестве ссылки.
[00521] RAD001, иначе известный как эверолимус (Afinitor®), имеет химическое название (1R,9S,12S,15R,16E,18R,19R,21R,23S,24E,26E,28E,30S,32S,35R)-1,18-дигидрокси-12-{(1R)-2-[(1S,3R,4R)-4-(2-гидроксиэтокси)-3-метоксициклогексил]-1-метилэтил}-19,30-диметокси-15,17,21,23,29,35-гексаметил-11,36-диокса-4-азатрицикло[30,3,1,04,9]гексатриаконта-16,24,26,28-тетраен-2,3,10,14,20-пентаон
[00522] Следующие примеры аллостерических ингибиторов mTOR включают сиролимус (рапамицин, AY-22989), 40-[3-гидрокси-2-(гидроксиметил)-2-метилпропаноат]рапамицин (также называемый темсиролимусом или CCI-779) и ридафоролимус (AP-23573/MK-8669). Другие примеры аллостерических ингибиторов mTor включают зотаролимус (ABT578) и умиролимус.
[00523] Альтернативно или дополнительно, было обнаружено, что каталитические конкурирующие с ATP ингибиторы mTOR нацелены на киназный домен mTOR прямо и нацелены как на mTORC1, так и на mTORC2. Также они являются более эффективными ингибиторами mTORC1, чем такие аллостерические ингибиторы mTOR, как рапамицин, поскольку они модулируют устойчивую к рапамицину mTORC1 активность, такую как фосфорилирование 4EBP1-T37/46 и кэп-зависимая трансляция.
[00524] Каталитические ингибиторы включают: BEZ235 или 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидро-имидазо[4,5-c]хинолин-1-ил)фенил]пропионитрил, или его форму монотозилата. Синтез BEZ235 описан в WO2006/122806; CCG168 (иначе известный как AZD-8055, Chresta, C.M., et al., Cancer Res, 2010, 70(1), 288-298), который имеет химическое название {5-[2,4-бис-((S)-3-метилморфолин-4-ил)пиридо[2,3d]пиримидин-7-ил]-2-метоксифенил}метанол; 3-[2,4-бис[(3S)-3-метилморфолин-4-ил]пиридо[2,3-d]пиримидин-7-ил]-N-метилбензамид (WO09104019); 3-(2-аминобензо[d]оксазол-5-ил)-1-изопропил-1H-пиразолo[3,4-d]пиримидин-4-амин (WO10051043 и WO2013023184); N-(3-(N-(3-((3,5-диметоксифенил)амино)хиноксалин-2-ил)сульфамоил)фенил)-3-метокси-4-метилбензамид (WO07044729 и WO12006552); PKI-587 (Venkatesan, A.M., J. Med.Chem., 2010, 53, 2636-2645), который имеет химическое название 1-[4-[4-(диметиламино)пиперидин-1-карбонил]фенил]-3-[4-(4,6-диморфолино-1,3,5-триазин-2-ил)фенил]мочевина; GSK-2126458 (ACS Med. Chem. Lett., 2010, 1, 39-43), который имеет химическое название 2,4-дифтор-N-{2-метокси-5-[4-(4-пиридазинил)-6-хинолинил]-3-пиридинил}бензолсульфонамид; ; 5-(9-изопропил-8-метил-2-морфолино-9H-пурин-6-ил)пиримидин-2-амин (WO10114484); (E)-N-(8-(6-амино-5-(трифторметил)пиридин-3-ил)-1-(6-(2-цианопропан-2-ил)пиридин-3-ил)-3-метил-1H-имидазо[4,5-c]хинолин-2(3H)-илиден)цианамид (WO12007926).
[00525] Следующие примеры каталитических ингибиторов mTOR включают 8-(6-метокси-пиридин-3-ил)-3-метил-1-(4-пиперазин-1-ил-3-трифторметилфенил)-1,3-дигидроимидазо[4,5-c]хинолин-2-он (WO2006/122806) и Ku-0063794 (Garcia-Martinez JM, et al.,Biochem J., 2009, 421(1), 29-42. Ku-0063794 is a specific inhibitor of the mammalian target of rapamycin (mTOR).) WYE-354 является другим примером каталитического ингибитора mTor (Yu K, et al. (2009). Biochemical, Cellular, and In vivo Activity of Novel ATP-Competitive and Selective Inhibitors of the Mammalian Target of Rapamycin. Cancer Res. 69(15): 6232-6240).
[00526] Ингибиторы mTOR, пригодные в соответствии с настоящим изобретением, также включают пролекарства, производные, фармацевтически приемлемые соли или аналоги любого из указанных выше средств.
[00527] Ингибиторы mTOR, такие как RAD001, можно составлять для доставки на основе хорошо известных в данной области способов на основе конкретных дозировок, описанных в настоящем описании. В частности, в патенте США 6004973 (включенном в настоящее описание в качестве ссылки) представлены примеры составов, которые могут использоваться с ингибиторами mTOR, описанными в настоящем описании.
ОЦЕНКА ИНГИБИРОВАНИЯ mTOR
[00528] mTOR фосфорилирует киназу P70 S6, тем самым активируя киназу P70 S6 и позволяя ей фосфорилировать субстрат. Степень ингибирования mTOR можно выражать как степень ингибирования киназы P70 S6, например, степень ингибирования mTOR можно определять по уровню снижения активности киназы P70 S6, например, по снижению фосфорилирования субстрата киназы P70 S6. Можно определить уровень ингибирования mTOR путем измерения активности киназы P70 S6 (способность киназы P70 S6 фосфорилировать субстрат), в отсутствие ингибитора, например, перед введением ингибитора, и в присутствии ингибитора, или после введения ингибитора. Уровень ингибирования киназы P70 S6 обеспечивает уровень ингибирования mTOR. Таким образом, если киназа P70 S6 ингибируется на 40%, активность mTOR при измерении по активности киназы P70 S6, ингибируется на 40%. Степень или уровень ингибирования, упоминаемые в настоящем описании, представляют собой средний уровень ингибирования на протяжении периода дозирования. В качестве примера, если ингибитор вводят один раз в неделю, уровень ингибирования приводится как средний уровень ингибирования на протяжении этого интервала, а именно, недели.
[00529] В Boulay et al., Cancer Res, 2004, 64:252-61, включенной в настоящее описание в качестве ссылки, описан анализ, который можно использовать для оценки уровня ингибирования mTOR (упоминаемый в настоящем описании как анализ Boulay). В одном варианте осуществления анализ основан на измерении активности киназы P70 S6 из биологических образцов до и после введения ингибитора mTOR, например RAD001. Взятие образцов можно проводить в заданные моменты времени после введения ингибитора mTOR, например, через 24, 48 и 72 часов после введения. Можно использовать биологические образцы, например, из кожи или мононуклеарных клеток периферической крови (PBMC). Из образцов получают экстракты общего белка. Киназу P70 S6 выделяют из белковых экстрактов иммунопреципитацией с использованием антитела, которое специфически распознает киназу P70 S6. Активность выделенной киназы P70 S6 можно измерять в анализе киназы in vitro. Выделенную киназую можно инкубировать с субстратами, представляющими собой рибосомальные субъединицы 40S (которые представляют собой эндогенный субстрат киназы P70 S6) и гамма-32P в условиях, которые обеспечивают фосфорилирование субстрата. Затем реакционную смесь можно разделять на геле SDS-PAGE, и сигнал32P можно анализировать с использованием FluoroImager. Сигнал32P, соответствующий размеру рибосомальной субъединицы 40S, указывает на фосфорилированный субстрат и активность киназы P70 S6. Увеличение и снижение активности киназы можно вычислять путем количественного определения площади и интенсивности сигнала32P у фосфорилированного субстрата (например, с использованием ImageQuant, Molecular Dynamics), присвоения величин произвольных единиц количественно определенному сигналу и сравнения величин после введения с величинами до введения или с эталонной величиной. Например, процентное ингибирование киназной активности можно вычислять по следующей формуле: 1-(величина, полученная после введения/величина, полученная до ведения)×100. Как описано выше, степень или уровень ингибирования, упоминаемые в настоящем описании, представляют собой средний уровень ингибирования на протяжении интервала дозирования.
[00530] Способы оценки киназной активности, например, активности киназы P70 S6, также представлены в US 7727950, включенной в настоящее описание в качестве ссылки.
[00531] Уровень ингибирования mTOR также можно оценивать по изменению соотношения отрицательных по PD1 и положительных по PD1 T-клеток. T-клетки из периферической крови можно идентифицировать в качестве положительных или отрицательных по PD1 известными в данной области способами.
Ингибиторы mTOR в низкой дозе
[00532] В способах, описанных в настоящем описании, используются низкие усиливающие иммунитет дозы ингибиторов mTOR, например, аллостерических ингибиторов mTOR, включая рапалоги, такие как RAD001. Напротив, уровни ингибитора, которые полностью или практически полностью ингибируют каскад mTOR, являются иммунодепрессивными, и используются, например, для предупреждения отторжения трансплантата органа. Кроме того, высокие дозы рапалогов, которые полностью ингибируют mTOR, также ингибируют рост опухолевых клеток и используются для лечения различных злокачественных опухолей (см., например, Antineoplastic effects of mammalian target of rapamycine inhibitors. Salvadori M. World J Transplant. 2012 Oct 24;2(5):74-83; Current and Future Treatment Strategies for Patients with Advanced Hepatocellular Carcinoma: Role of mTOR Inhibition. Finn RS. Liver Cancer. 2012 Nov;1(3-4):247-256; Emerging Signaling Pathways in Hepatocellular Carcinoma. Moeini A, Cornellà H, Villanueva A. Liver Cancer. 2012 Sep;1(2):83-93; Targeted cancer therapy - Are the days of systemic chemotherapy numbered? Joo WD, Visintin I, Mor G. Maturitas. 2013 Sep 20.; Role of natural and adaptive immunity in renal cell carcinoma response to VEGFR-TKIs and mTOR inhibitor. Santoni M, Berardi R, Amantini C, Burattini L, Santini D, Santoni G, Cascinu S. Int J Cancer. 2013 Oct 2).
[00533] Настоящее изобретение основано, по меньшей мере частично, на неожиданном открытии, что дозы ингибиторов mTOR, являющиеся значительно более низкими, чем дозы, используемые в современных клинических условиях, имели улучшенный эффект в отношении повышения иммунного ответа у индивидуума и увеличения соотношения отрицательные по PD-1 T-клетки/положительные по PD-1 T-клетки. Было неожиданным, что низкие дозы ингибиторов mTOR, вызывающие только частичное ингибирование активности mTOR, способны эффективно повышать иммунный ответ у человека и повышать соотношение отрицательные по PD-1 T-клетки/положительные по PD-1 T-клетки.
[00534] Альтернативно или дополнительно, без связи с какой-либо теорией полагают, что низкая усиливающая иммунитет доза ингибитора mTOR может увеличивать количества наивных T-клеток, например, по меньшей мере временно, например, по сравнению с индивидуумом без лечения. Альтернативно или дополнительно, вновь без связи с теорией полагают, что такое лечение ингибитором mTOR после достаточного периода времени или достаточного дозирования приводит к одному или более из следующих:
увеличение экспрессии одного или более из следующих маркеров: CD62Lhigh, CD127high, CD27+ и BCL2, например, на T-клетках памяти, например, на предшественниках T-клеток памяти;
снижение экспрессии KLRG1, например, на T-клетках памяти, например, на предшественниках T-клеток памяти; и
увеличение количества предшественников T-клеток памяти, например, клеток с одной или комбинацией следующих характеристик: увеличенный уровень CD62Lhigh, увеличенный уровень CD127high, увеличенный уровень CD27+, сниженный уровень KLRG1, и увеличенный уровень BCL2;
и где любое из описанных выше изменений происходит, например, по меньшей мере временно, например, по сравнению с индивидуумом без лечения (Araki, K et al. (2009) Nature 460:108-112). Предшественники T-клеток памяти представляют собой T-клетки памяти, которые находятся на ранней стадии программы дифференцировки. Например, T-клетки памяти имеют одну или более из следующих характеристику: увеличенный уровень CD62Lhigh, увеличенный уровень CD127high, увеличенный уровень CD27+, сниженный уровень KLRG1 и/или увеличенный уровень BCL2.
[00535] В одном варианте осуществления изобретение относится к композиции или дозированной форме ингибитора mTOR, например аллостерического ингибитора mTOR, например рапалога, рапамицина или RAD001, или каталитического ингибитора mTOR, которая при введении в выбранном режиме дозирования, например, один раз в сутки или один раз в неделю, ассоциирован с: уровнем ингибирования mTOR, который не ассоциирован с полной или значительной иммунной супрессией, а ассоциирован с усилением иммунного ответа.
[00536] Ингибитор mTOR, например, аллостерический ингибитор mTOR, например рапалог, рапамицин или RAD001, или каталитический ингибитор mTOR, может быть предоставлен в составе с замедленным высвобождением. Любая из композиций или единичных дозированных форм, описанных в настоящем описании, может быть предоставлена в составе с замедленным высвобождением. В некоторых вариантах осуществления состав с замедленным высвобождением имеет более низкую биодоступность, чем состав с немедленным высвобождением. Например, в вариантах осуществления для достижения сходного терапевтического эффекта с составом с немедленным высвобождением, состав с замедленным высвобождением будет иметь в от приблизительно 2 до приблизительно 5, в от приблизительно 2,5 до приблизительно 3,5, или приблизительно в 3 раза больше количества ингибитора, чем предоставлено в составе с немедленным высвобождением.
[00537] В одном варианте осуществления предусматриваются формы с немедленным высвобождением, например RAD001, как правило, используемые для одного введения в неделю, имеющие от 0,1 до 20, от 0,5 до 10, от 2,5 до 7,5, от 3 до 6 или приблизительно 5 мг на единичную дозированную форму. Для введения один раз в неделю эти составы с немедленным высвобождением соответствуют формам с замедленным высвобождением, имеющим, соответственно, от 0,3 до 60, от 1,5 до 30, от 7,5 до 22,5, от 9 до 18, или приблизительно 15 мг ингибитора mTOR, например аллостерического ингибитора mTOR, например рапамицина или RAD001. В вариантах осуществления обе формы вводят один раз в неделю.
[00538] В одном варианте осуществления предусматриваются формы с немедленным высвобождением, например формы RAD001, как правило, используемые для одного введения в сутки, имеющие от 0,005 до 1,5, от 0,01 до 1,5, от 0,1 до 1,5, от 0,2 до 1,5, от 0,3 до 1,5, от 0,4 до 1,5, от 0,5 до 1,5, от 0,6 до 1,5, от 0,7 до 1,5, от 0,8 до 1,5, от 1,0 до 1,5, от 0,3 до 0,6, или приблизительно 0,5 мг на единичную дозированную форму. Для введения один раз в сутки эти формы с немедленным высвобождением соответствуют формам с замедленным высвобождением, имеющим, соответственно, от 0,015 до 4,5, от 0,03 до 4,5, от 0,3 до 4,5, от 0,6 до 4,5, от 0,9 до 4,5, от 1,2 до 4,5, от 1,5 до 4,5, от 1,8 до 4,5, от 2,1 до 4,5, от 2,4 до 4,5, от 3,0 до 4,5, от 0,9 до 1,8, или приблизительно 1,5 мг ингибитора mTOR, например аллостерического ингибитора mTOR, например рапамицина или RAD001. Для введения один раз в неделю эти формы с немедленным высвобождением соответствуют формам с замедленным высвобождением, имеющим, соответственно, от 0,1 до 30, от 0,2 до 30, от 2 до 30, от 4 до 30, от 6 до 30, от 8 до 30, от 10 до 30, от 1,2 до 30, от 14 до 30, от 16 до 30, от 20 до 30, от 6 до 12, или приблизительно 10 мг ингибитора mTOR, например аллостерического ингибитора mTOR, например рапамицина или RAD001.
[00539] В одном варианте осуществления предусматриваются формы с немедленным высвобождением, например формы RAD001, как правило, используемые для введения один раз в сутки, имеющие от 0,01 до 1,0 мг на единичную дозированную форму. Для введения один раз в сутки эти формы с немедленным высвобождением соответствуют формам с замедленным высвобождением, имеющим, соответственно, от 0,03 до 3 мг ингибитора mTOR, например аллостерического ингибитора mTOR, например рапамицина или RAD001. Для введения один раз в неделю эти формы с немедленным высвобождением соответствуют формам с замедленным высвобождением, имеющим, соответственно, от 0,2 до 20 мг ингибитора mTOR, например аллостерического ингибитора mTOR, например рапамицина или RAD001.
[00540] В одном варианте осуществления предусматриваются формы с немедленным высвобождением, например формы RAD001, как правило, используемые для одного введения в неделю, имеющие от 0,5 до 5,0 мг на единичную дозированную форму. Для введения один раз в неделю эти формы с немедленным высвобождением соответствуют формам с замедленным высвобождением, имеющим, соответственно, от 1,5 до 15 мг ингибитора mTOR, например аллостерического ингибитора mTOR, например, рапамицина или RAD001.
[00541] Как описано выше, одной мишенью каскада mTOR является киназа P70 S6. Таким образом, дозы ингибиторов mTOR, которые являются пригодными в способах и композициях, описанных в настоящем описании, представляют собой дозы, которые являются достаточными для достижения не более чем 80% ингибирования активности киназы P70 S6 относительно активности киназы P70 S6 в отсутствие ингибитора mTOR, например, при измерении с использованием анализа, описанного в настоящем описании, например, анализа Boulay. В следующем аспекте изобретение относится к количеству ингибитора mTOR, достаточному для достижения не более чем 38% ингибирования активности киназы P70 S6 относительно активности киназы P70 S6 в отсутствие ингибитора mTOR.
[00542] В одном аспекте доза ингибитора mTOR, пригодного в способах и композициях по изобретению, является достаточной для достижения, например, при введении человеку, 90 +/- 5% (т.е., 85-95%), 89 +/- 5%, 88 +/- 5%, 87 +/- 5%, 86 +/- 5%, 85 +/- 5%, 84 +/- 5%, 83 +/- 5%, 82 +/- 5%, 81 +/- 5%, 80 +/- 5%, 79 +/- 5%, 78 +/- 5%, 77 +/- 5%, 76 +/- 5%, 75 +/- 5%, 74 +/- 5%, 73 +/- 5%, 72 +/- 5%, 71 +/- 5%, 70 +/- 5%, 69 +/- 5%, 68 +/- 5%, 67 +/- 5%, 66 +/- 5%, 65 +/- 5%, 64 +/- 5%, 63 +/- 5%, 62 +/- 5%, 61 +/- 5%, 60 +/- 5%, 59 +/- 5%, 58 +/- 5%, 57 +/- 5%, 56 +/- 5%, 55 +/- 5%, 54 +/- 5%, 54 +/- 5%, 53 +/- 5%, 52 +/- 5%, 51 +/- 5%, 50 +/- 5%, 49 +/- 5%, 48 +/- 5%, 47 +/- 5%, 46 +/- 5%, 45 +/- 5%, 44 +/- 5%, 43 +/- 5%, 42 +/- 5%, 41 +/- 5%, 40 +/- 5%, 39 +/- 5%, 38 +/- 5%, 37 +/- 5%, 36 +/- 5%, 35 +/- 5%, 34 +/- 5%, 33 +/- 5%, 32 +/- 5%, 31 +/- 5%, 30 +/- 5%, 29 +/- 5%, 28 +/- 5%, 27 +/- 5%, 26 +/- 5%, 25 +/- 5%, 24 +/- 5%, 23 +/- 5%, 22 +/- 5%, 21 +/- 5%, 20 +/- 5%, 19 +/- 5%, 18 +/- 5%, 17 +/- 5%, 16 +/- 5%, 15 +/- 5%, 14 +/- 5%, 13 +/- 5%, 12 +/- 5%, 11 +/- 5% или 10 +/- 5%, ингибирования активности киназы P70 S6, например, при измерении с использованием анализа, описанного в настоящем описании, например, анализа Boulay.
[00543] Активность киназы P70 S6 у индивидуума можно измерять с использованием способов, известных в данной области, например, согласно способам, описанным в патенте США 7727950, посредством анализа с использованием иммуноблоттинга уровней фосфо-P70 S6K и/или уровней фосфо-P70 S6 или посредством анализа киназной активности in vitro.
[00544] Как используют в рамках изобретения, термин "приблизительно" применительно к дозе ингибитора mTOR, относится к вплоть до +/-10% вариабельности количества ингибитора mTOR, однако он может включать отсутствие вариабельности указанной дозы.
[00545] В некоторых вариантах осуществления изобретение относится к способам, включающим введение индивидууму ингибитора mTOR, например аллостерического ингибитора, например RAD001, в дозировке в пределах заданного остаточного уровня. В некоторых вариантах осуществления остаточный уровень является значительно более низким, чем остаточные уровни, ассоциированные с режимами дозирования, используемыми у пациентов с трансплантатом органа и злокачественной опухолью. В одном варианте осуществления ингибитор mTOR, например RAD001 или рапамицин, вводят для достижения остаточного уровня, который составляет менее 1/2, 1/4, 1/10 или 1/20 от остаточного уровня, который приводит к иммуносупрессии или противораковому эффекту. В одном варианте осуществления ингибитор mTOR, например RAD001 или рапамицин, вводят для достижения остаточного уровня, который составляет менее 1/2, 1/4, 1/10 или 1/20 от остаточного уровня, указанного на одобренном FDA вкладыше в упаковку для применения для иммуносупрессии или противораковых показаний.
[00546] В одном варианте осуществления способ, описанный в настоящем описании, включает введение индивидууму ингибитора mTOR, например аллостерического ингибитора, например RAD001, в дозировке, которая обеспечивает заданный остаточный уровень от 0,1 до 10 нг/мл, от 0,1 до 5 нг/мл, от 0,1 до 3 нг/мл, от 0,1 до 2 нг/мл или от 0,1 до 1 нг/мл.
[00547] В одном варианте осуществления способ, описанный в настоящем описании, включает введение индивидууму ингибитора mTOR, например аллостерического ингибитора, например RAD001, в дозировке, которая обеспечивает заданный остаточный уровень от 0,2 до 10 нг/мл, от 0,2 до 5 нг/мл, от 0,2 до 3 нг/мл, от 0,2 до 2 нг/мл или от 0,2 до 1 нг/мл.
[00548] В одном варианте осуществления способ, описанный в настоящем описании, включает введение индивидууму ингибитора mTOR, например аллостерического ингибитора, например RAD001, в дозировке, которая обеспечивает заданный остаточный уровень от 0,3 до 10 нг/мл, от 0,3 до 5 нг/мл, от 0,3 до 3 нг/мл, от 0,3 до 2 нг/мл или от 0,3 до 1 нг/мл.
[00549] В одном варианте осуществления способ, описанный в настоящем описании, включает введение индивидууму ингибитора mTOR, например аллостерического ингибитора, например RAD001, в дозировке, которая обеспечивает заданный остаточный уровень от 0,4 до 10 нг/мл, от 0,4 до 5 нг/мл, от 0,4 до 3 нг/мл, от 0,4 до 2 нг/мл или от 0,4 до 1 нг/мл.
[00550] В одном варианте осуществления способ, описанный в настоящем описании, включает введение индивидууму ингибитора mTOR, например аллостерического ингибитора, например RAD001, в дозировке, которая обеспечивает заданный остаточный уровень от 0,5 до 10 нг/мл, от 0,5 до 5 нг/мл, от 0,5 до 3 нг/мл, от 0,5 до 2 нг/мл или от 0,5 до 1 нг/мл.
[00551] В одном варианте осуществления способ, описанный в настоящем описании, включает введение индивидууму ингибитора mTOR, например аллостерического ингибитора, например RAD001, в дозировке, которая обеспечивает заданный остаточный уровень от 1 до 10 нг/мл, от 1 до 5 нг/мл, от 1 до 3 нг/мл или от 1 до 2 нг/мл.
[00552] Как используют в рамках изобретения, термин "остаточный уровень" относится к концентрации лекарственного средства в плазме непосредственно перед следующей дозой или минимальную концентрацию лекарственного средства между двумя дозами.
[00553] В некоторых вариантах осуществления заданный остаточный уровень RAD001 находится в диапазоне приблизительно от 0,1 до 4,9 нг/мл. В одном варианте осуществления заданный остаточный уровень составляет менее 3 нг/мл, например, составляет менее 0,3 или менее 3 нг/мл. В одном варианте осуществления заданный остаточный уровень составляет менее 3 нг/мл, например, составляет приблизительно от 0,3 или менее до 1 нг/мл.
[00554] В следующем аспекте в рамках изобретения может использоваться ингибитор mTOR, отличный от RAD001, в количестве, которое ассоциировано с заданным остаточным уровнем, который является биологически эквивалентным указанному заданному остаточному уровню для RAD001. В одном варианте осуществления заданный остаточный уровень для ингибитора mTOR, отличного от RAD001, представляет собой уровень, который обеспечивает тот же уровень ингибирования mTOR (например, при измерении способом, описанным в настоящем описании, например, ингибирование P70 S6), что и остаточный уровень RAD001, описанный в настоящем описании.
Фармацевтические композиции: ингибиторы mTOR
[00555] В одном аспекте настоящее изобретение относится к фармацевтическим композициям, содержащим ингибитор mTOR, например ингибитор mTOR, как описано в настоящем описании, составленный для применения в комбинации с клетками CAR, описанными в настоящем описании.
[00556] В некоторых вариантах осуществления ингибитор mTOR составляют для введения в комбинации с дополнительным средством, например, как описано в настоящем описании.
[00557] Главным образом, соединения по изобретению можно вводить в терапевтически эффективных количествах, как описано выше, любыми обычными и приемлемыми способами, известными в данной области, либо по отдельности, либо в комбинации с одним или более лекарственными средствами.
[00558] Фармацевтические составы можно получать с использованием общепринятых методик растворения и смешения. Например, нерасфасованное лекарственное вещество (например, ингибитор mTOR или стабилизированная форма соединения (например, комплекс с производным циклодекстрина или другим известным комплексообразующим средством)) растворяют в подходящем растворителе в присутствии одного или более эксципиентов, описанных в настоящем описании. Ингибитор mTOR, как правило, составляют в виде фармацевтических дозированных форм для обеспечения легко контролирования дозирования лекарственного средства и для предоставления пациенту удобного и легко используемого продукта.
[00559] Соединения по изобретению можно вводить в качестве фармацевтических композиций обычным путем, в частности, энтерально, например перорально, например, в форме таблеток или капсул, или парентерально, например, в форме инъекционных растворов или суспензий, местно, например, в форме лосьонов, гелей, мазей или кремов, или в назальной форме или в форме суппозитория. Когда ингибитор mTOR вводят в комбинации с (либо одновременно, либо отдельно) другим средством, как описано в настоящем описании, в одном аспекте оба компонента можно вводить одним и тем же путем (например, парентерально). Альтернативно другое средство можно вводить отличающимся путем относительно пути введения ингибитора mTOR. Например, ингибитор mTOR можно вводить перорально, а другое средство можно вводить парентерально.
ЗАМЕДЛЕННОЕ ВЫСВОБОЖДЕНИЕ
[00560] Ингибиторы mTOR, например, аллостерические ингибиторы mTOR или каталитические ингибиторы mTOR, описанные в настоящем описании, могут быть предоставлены в качестве фармацевтических составов в форме пероральных твердых дозированных форм, содержащих ингибитор mTOR, описанный в настоящем описании, например рапамицин или RAD001, которые удовлетворяют требованиям стабильности продукта и/или имеют благоприятные фармакокинетические свойства относительно таблеток с немедленным высвобождением (IR), такие как сниженные средние пиковые концентрации в плазме, сниженная вариабельность между пациентами и у одного пациента в отношении степени всасывания лекарственного средства и максимальной концентрации в плазме, сниженное соотношение Cmax/Cmin и/или сниженные эффекты питания. Предоставленные фармацевтические составы могут позволить более точный подбор дозы и/или снижение частоты неблагоприятных явлений, таким образом, обеспечивая более безопасное лечение пациентов ингибитором mTOR, описанным в настоящем описании, например рапамицином или RAD001.
[00561] В некоторых вариантах осуществления настоящее изобретение относится к стабильным составам с пролонгированным высвобождением ингибитора mTOR, описанного в настоящем описании, например рапамицина или RAD001, которые представляют собой системы из множества частиц и могут иметь функциональные слои и покрытия.
[00562] Термин "состав с множеством частиц с пролонгированным высвобождением", как используют в рамках изобретения, относится к составу, который обеспечивает высвобождение ингибитора mTOR, описанного в настоящем описании, например рапамицина или RAD001, в течение пролонгированного периода времени, например, в течение по меньшей мере 1, 2, 3, 4, 5 или 6 часов. Состав с пролонгированным высвобождением может содержать матрицы и покрытия из специальных эксципиентов, например, как описано в настоящем описании, которые составлены так, чтобы активный ингредиент был доступным на протяжении пролонгированного периода времени после приема.
[00563] Термин "пролонгированное высвобождение" может быть использован взаимозаменяемо с терминами "замедленное высвобождение" (SR) или "продленное высвобождение". Термин "пролонгированное высвобождение" относится к фармацевтическому составу, который не высвобождает активное вещество сразу после перорального приема, а высвобождает его в течение пролонгированного периода времени в соответствии с определением в статье фармакопеи Ph. Eur. (7-ое издание) о таблетках и капсулах и общей главе USP <1151> о фармацевтических дозированных формах. Термин "немедленное высвобождение" (IR), как используют в рамках изобретения, относится к фармацевтическому составу, который высвобождает 85% активного лекарственного вещества в течение менее чем 60 минут в соответствии с определением "Guidance for Industry: "Dissolution Testing of Immediate Release Solid Oral Dosage Forms" (FDA CDER, 1997). В некоторых вариантах осуществления термин "немедленное высвобождение" означает высвобождение эверолимуса из таблеток в пределах 30 минут, например, при измерении в анализе растворения, описанном в настоящем описании.
[00564] Стабильные составы с пролонгированным высвобождением ингибитора mTOR, описанного в настоящем описании, например рапамицина или RAD001, могут быть охарактеризованы посредством профиля высвобождения in vitro с использованием анализов, известных в данной области, таких как анализ растворения, как описано в настоящем описании: емкость для растворения заполняют 900 мл фосфатного буфера, pH 6,8, содержащего додецилсульфат натрия 0,2% при 37°C, и растворение проводят с использованием способ с использованием лопастной мешалки при 75 об/мин в соответствии с USP согласно статье USP о тестировании 711, и статье Ph.Eur. о тестировании 2.9.3, соответственно.
[00565] В некоторых вариантах осуществления стабильные составы с пролонгированным высвобождением ингибитора mTOR, описанного в настоящем описании, например рапамицина или RAD001, высвобождают ингибитор mTOR в анализе высвобождения in vitro в соответствии со следующими характеристиками высвобождения:
0,5 ч: <45%, или <40, например <30%
1 ч: 20-80%, например 30-60%
2 ч: >50%, или >70%, например >75%
3 ч: >60%, или >65%, например >85%, например >90%.
[00566] В некоторых вариантах осуществления стабильные составы с пролонгированным высвобождением ингибитора mTOR, описанного в настоящем описании, например, рапамицина или RAD001, высвобождают 50% ингибитора mTOR не ранее чем в течение 45, 60, 75, 90, 105 мин или 120 мин в анализе растворения in vitro.
Фармацевтические композиции и способы лечения
[00567] Фармацевтические композиции по настоящему изобретению могут содержать экспрессирующую CAR клетку, например, множество экспрессирующих CAR клеток, как описано в настоящем описании, в комбинации с одним или более фармацевтически или физиологически приемлемыми носителями, разбавителями или эксципиентами. Такие композиции могут содержать буферы, такие как нейтральный забуференный физиологический раствор, фосфатно-солевой буфер и т.п.; углеводы, такие как глюкоза, манноза, сахароза или декстраны, маннит; белки; полипептиды или аминокислоты, такие как глицин; антиоксиданты; хелатирующие агенты, такие как EDTA или глутатион; адъюванты (например, гидроксид алюминия) и консерванты. В одном аспекте композиции по настоящему изобретению составляют для внутривенного введения.
[00568] Фармацевтические композиции по настоящему изобретению можно вводить способом, пригодным для заболевания, подлежащего лечению (или предупреждению). Количество и частота введений будут определяться такими факторами, как состояние пациента и тип и тяжесть заболевания пациента, хотя подходящие дозировки могут быть определены в клинических испытаниях.
[00569] В одном варианте осуществления фармацевтическая композиция по существу свободна от примесей, например, отсутствуют поддающиеся обнаружению уровни примесей, например, выбранных из группы, состоящей из эндотоксина, микоплазмы, компетентного по репликации лентивируса (RCL), p24, нуклеиновой кислоты VSV-G, gag ВИЧ, остаточных гранул, покрытых антителом против CD3/антителом против CD28, антител мыши, объединенной сыворотки человека, бычьего сывороточного альбумина, бычьей сыворотки, компонентов культуральной среды, клетки для упаковывания вектора или плазмидных компонентов, бактерий и грибов. В одном варианте осуществления бактерия представляет собой по меньшей мере одну бактерию, выбранную из группы, состоящей из Alcaligenes faecalis, Candida albicans, Escherichia coli, Haemophilus influenza, Neisseria meningitides, Pseudomonas aeruginosa, Staphylococcus aureus, Streptococcuspneumoniae и Streptococcus pyogenes группы A.
[00570] Когда указано "иммунологически эффективное количество", "эффективное против злокачественной опухоли количество", "ингибирующее злокачественную опухоль эффективное количество" или "терапевтическое количество" точное количество композиций по настоящему изобретению, подлежащее введению, может определять врач с учетом индивидуальных отличий возраста, массы тела, размера опухоли, степени инфекции или метастазирования, и состояния пациента (индивидуума). Как правило, можно утверждать, что фармацевтическую композицию, содержащую иммунные эффекторные клетки, описанные в настоящем описании, можно вводить в дозировке от 104 до 109 клеток/кг массы тела, в некоторых случаях от 105 до 106 клеток/кг массы тела, включая все целые числа в этих диапазонах. Композиции иммунных эффекторных клеток также можно вводить многократно в этих дозировках. Клетки можно вводить с использованием способов инфузии, которые хорошо известны при иммунотерапии (см., например, Rosenberg et al., New Eng. J. of Med. 319:1676, 1988).
[00571] В некоторых аспектах может быть желательным введение активированных иммунных клеток индивидууму, а затем впоследствии повторное взятие крови (или проведение афереза), активация клеток из нее в соответствии с настоящим изобретением, и повторная инфузия пациенту активированных и увеличенных в количестве клеток. Этот процесс можно проводить многократно каждые более недель. В некоторых аспектах клетки могут активировать из взятой крови в объеме от 10 см3 до 400 см3. В некоторых аспектах клетки активируют из взятой крови в объеме 20 см3, 30 см3, 40 см3, 50 см3, 60 см3, 70 см3, 80 см3, 90 см3 или 100 см3.
[00572] Введение рассматриваемых композиций можно проводить любым удобным способом, включая ингаляцию аэрозоля, инъекцию, прием внутрь, трансфузию, имплантацию или трансплантацию. Композиции, описанные в настоящем описании, можно вводить пациенту трансартериально, подкожно, внутрикожно, внутрь опухоли, внутрь лимфоузла, внутрь костного мозга, внутримышечно, посредством внутривенной (в/в) инъекции или внутрибрюшинно. В одном аспекте композиции T-клеток по настоящему изобретению вводят пациенту посредством внутрикожной или подкожной инъекции. В одном аспекте композиции иммунных эффекторных клеток по настоящему изобретению вводят посредством в/в инъекции. Композиции иммунных эффекторных клеток можно инъецировать прямо в опухоль, лимфатический узел или в область инфекции.
[00573] В конкретном иллюстративном аспекте индивидуумов можно подвергать лейкоаферезу, где лейкоциты собирают, увеличивают в количестве или истощают ex vivo для селекции и/или выделения представляющих интерес клеток, например, T-клеток. Эти выделенные T-клетки можно увеличивать в количестве способами, известными в данной области, и обрабатывать так, чтобы можно было вводить одну или более конструкций CAR, тем самым, создавая CAR T-клетку по изобретению. Индивидуумов, нуждающихся в этом, можно впоследствии подвергать стандартному лечению химиотерапией в высокой дозе с последующей трансплантацией стволовых клеток периферической крови. В некоторых аспектах после или одновременно с трансплантацией индивидуумам проводят инфузию увеличенных в количестве CAR T-клеток по настоящему изобретению. В дополнительном аспекте увеличенные в количестве клетки вводят до или после хирургической операции.
[00574] Дозировка описанных выше лекарственных средств, подлежащая введению пациенту, варьируется в зависимости от точной природы состояния, подвергаемого лечению, и реципиента лечения. Увеличение дозировок в масштабе для введения человеку можно проводить в соответствии с принятой в данной области практикой. Доза CAMPATH, например, как правило, находится в диапазоне от 1 до приблизительно 100 мг для взрослого пациента, обычно вводимых в течение периода от 1 до 30 суток. Предпочтительная суточная доза составляет от 1 до 10 мг в сутки, хотя в некоторых случаях можно использовать более высокие дозы вплоть до 40 мг в сутки (как описано в патенте США № 6120766).
[00575] В одном варианте осуществления CAR вводят в иммунные эффекторные клетки, например, с использованием транскрипции in vitro, и индивидууму (например, человеку) проводят первоначальное введение экспрессирующих CAR клеток по изобретению, и одно или более последующих введений экспрессирующих CAR клеток по изобретению, где одно или более последующих введений проводят в течение менее чем 15 суток, например 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3 или 2 суток, после предшествующего введения. В одном варианте осуществления индивидууму (например, человеку) проводят более одного введения экспрессирующих CAR клеток по изобретению в неделю, например проводят 2, 3 или 4 введений экспрессирующих CAR клеток по изобретению в неделю. В одном варианте осуществления индивидууму (например, человек) проводят более одного введения экспрессирующих CAR клеток в неделю (например, 2, 3 или 4 введений в неделю) (также называемых в настоящем описании курсом), за которыми следует неделя без введения экспрессирующих CAR клеток, а затем индивидууму проводят одно или более дополнительных введений экспрессирующих CAR клеток (например, более одного введения экспрессирующих CAR клеток в неделю). В другом варианте осуществления у индивидуума (например, человеку) проводят более одного курса введения экспрессирующих CAR клеток, и время между курсами в каждом случае составляет менее 10, 9, 8, 7, 6, 5, 4 или 3 суток. В одном варианте осуществления экспрессирующие CAR клетки вводят раз в двое суток на протяжении 3 введений в неделю. В одном варианте осуществления экспрессирующие CAR клетки по изобретению вводят в течение по меньшей мере двух, трех, четырех, пяти, шести, семи, восьми или более недель.
[00576] В одном аспекте клетки, экспрессирующие CAR против мезотелина, получают с использованием вирусных векторов, таких как лентивирус. Экспрессирующие CAR клетки, полученные таким образом, будут иметь стабильную экспрессию CAR.
[00577] В одном аспекте экспресирующие CAR клетки временно экспрессируют векторы CAR в течение 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 суток после трансдукции. Временной экспрессии CAR можно достигать посредством доставки РНК-вектора с CAR. В одном аспекте РНК CAR трансдуцируют в T-клетку посредством электропорации.
[00578] В одном варианте осуществления доза и/или схема дозирования являются такими, как представлено на фиг.6.
[00579] Потенциальной проблемой, которая может возникать у пациентов, подвергаемых лечению с использованием экспрессирующих CAR клеток с временной экспрессией (в частности, клеток, экспрессирующих CAR, содержащих scFv мыши), является анафилаксия после многократных введений.
[00580] Без связи с теорией, полагают, что такой анафилактический ответ может быть вызван развитием у пациента гуморального ответа против CAR, т.е. антител против CAR, имеющих анти-IgE изотип. Считается, что антителопродуцирующие клетки пациента претерпевают переключение класса с изотипа IgG (который не вызывает анафилаксию) на изотип IgE, когда существует период перерыва в воздействии антигена, составляющий от десяти до четырнадцати суток.
[00581] Если пациент имеет высокий риск индукции антительного ответа против CAR в ходе временной терапии с использованием CAR (такой как терапия, осуществляемая посредством трансдукции РНК), перерывы между инфузиями экспрессирующих CAR клеток не должны длиться более чем от десяти до четырнадцати суток.
[00582] Использование CAR с scFv человека (вместо мыши) может снизить вероятность и интенсивность ответа у пациента против CAR.
[00583]
[00584] Таблица 2: Аминокислотные последовательности scFv и CAR человека (полужирным подчеркиванием показана лидерная последовательность и серой рамкой указана последовательность линкера). В случае scFv, остальные аминокислоты представляют собой вариабельную область тяжелой цепи и вариабельные области легкой цепи, где каждая из CDR HC (CDR1 HC, CDR2 HC, CDR3 HC) и CDR LC (CDR1 LC, CDR2 LC, LCCDR3) подчеркнута. В случае CAR, остальные аминокислоты представляют собой остальные аминокислоты CAR.
ПРИМЕРЫ
[00585] Далее изобретение подробно описано с помощью следующих экспериментальных примеров. Эти примеры предоставлены только для целей иллюстрации и не предоставлены для ограничения, если нет иных указаний. Таким образом, изобретение никоим образом не следует истолковывать как ограниченное следующими примерами, а скорее его следует истолковывать как охватывающее любые и все вариации, которые станут очевидными благодаря указаниям, представленным в настоящем описании.
Пример 1: Получение конструкций CAR
[00586] ScFv для применения в конечной конструкции CAR получали посредством пэннинга библиотек scFV человека.
Аминокислотные последовательности фрагментов scFv человека представлены в таблице 2, и последовательности нуклеиновых кислот фрагментов scFv человека представлены выше в таблице 3. Полные конструкции CAR получали с использованием фрагментов scFv, представленных в таблице 2, с дополнительными последовательностями: SEQ ID NO: 1-2, 6-7, 9-10, 12-13, 17-18, 20-21 и 36-37, представленные ниже, для получения полных конструкций CAR.
- лидерная последовательность (аминокислотная последовательность) (SEQ ID NO: 1)
MALPVTALLLPLALLLHAARP
- лидерная последовательность (последовательность нуклеиновой кислоты) (SEQ ID NO: 12)
ATGGCCCTCCCTGTCACCGCCCTGCTGCTTCCGCTGGCTCTTCTGCTCCACGCCGCTCGGCCC
- шарнирная область CD8 (аминокислотная последовательность) (SEQ ID NO: 2)
TTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACD
- шарнирная область CD8 (последовательность нуклеиновой кислоты) (SEQ ID NO: 13)
ACCACTACCCCAGCACCGAGGCCACCCACCCCGGCTCCTACCATCGCCTCCCAGCCTCTGTCCCTGCGTCCGGAGGCATGTAGACCCGCAGCTGGTGGGGCCGTGCATACCCGGGGTCTTGACTTCGCCTGCGAT
- трансмембранная область CD8 (аминокислотная последовательность) (SEQ ID NO: 6)
IYIWAPLAGTCGVLLLSLVITLYC
- трансмембранная область CD8 (последовательность нуклеиновой кислоты) (SEQ ID NO: 17)
ATCTACATTTGGGCCCCTCTGGCTGGTACTTGCGGGGTCCTGCTGCTTTCACTCGTGATCACTCTTTACTGT
Внутриклеточный домен 4-1BB (аминокислотная последовательность) (SEQ ID NO: 7)
KRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCEL
- внутриклеточный домен 4-1BB (последовательность нуклеиновой кислоты) (SEQ ID NO: 18)
AAGCGCGGTCGGAAGAAGCTGCTGTACATCTTTAAGCAACCCTTCATGAGGCCTGTGCAGACTACTCAAGAGGAGGACGGCTGTTCATGCCGGTTCCCAGAGGAGGAGGAAGGCGGCTGCGAACTG
- домен CD3-зета (аминокислотная последовательность) (SEQ ID NO: 9)
RVKFSRSADAPAYKQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
- CD3-зета (последовательность нуклеиновой кислоты) (SEQ ID NO: 20)
CGCGTGAAATTCAGCCGCAGCGCAGATGCTCCAGCCTACAAGCAGGGGCAGAACCAGCTCTACAACGAACTCAATCTTGGTCGGAGAGAGGAGTACGACGTGCTGGACAAGCGGAGAGGACGGGACCCAGAAATGGGCGGGAAGCCGCGCAGAAAGAATCCCCAAGAGGGCCTGTACAACGAGCTCCAAAAGGATAAGATGGCAGAAGCCTATAGCGAGATTGGTATGAAAGGGGAACGCAGAAGAGGCAAAGGCCACGACGGACTGTACCAGGGACTCAGCACCGCCACCAAGGACACCTATGACGCTCTTCACATGCAGGCCCTGCCGCCTCGG
- домен CD3-зета (аминокислотная последовательность; эталонная последовательность NCBI NM_000734.3) (SEQ ID NO: 10)
RVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
- CD3-зета (последовательность нуклеиновой кислоты; эталонная последовательность NCBI NM_000734.3); (SEQ ID NO: 21)
AGAGTGAAGTTCAGCAGGAGCGCAGACGCCCCCGCGTACCAGCAGGGCCAGAACCAGCTCTATAACGAGCTCAATCTAGGACGAAGAGAGGAGTACGATGTTTTGGACAAGAGACGTGGCCGGGACCCTGAGATGGGGGGAAAGCCGAGAAGGAAGAACCCTCAGGAAGGCCTGTACAATGAACTGCAGAAAGATAAGATGGCGGAGGCCTACAGTGAGATTGGGATGAAAGGCGAGCGCCGGAGGGGCAAGGGGCACGATGGCCTTTACCAGGGTCTCAGTACAGCCACCAAGGACACCTACGACGCCCTTCACATGCAGGCCCTGCCCCCTCGC
- шарнирная область IgG4 (аминокислотная последовательность) (SEQ ID NO: 36)
ESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGKM
- шарнирная область IgG4 (нуклеотидная последовательность) (SEQ ID NO: 37)
GAGAGCAAGTACGGCCCTCCCTGCCCCCCTTGCCCTGCCCCCGAGTTCCTGGGCGGACCCAGCGTGTTCCTGTTCCCCCCCAAGCCCAAGGACACCCTGATGATCAGCCGGACCCCCGAGGTGACCTGTGTGGTGGTGGACGTGTCCCAGGAGGACCCCGAGGTCCAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCACAACGCCAAGACCAAGCCCCGGGAGGAGCAGTTCAATAGCACCTACCGGGTGGTGTCCGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAGGAATACAAGTGTAAGGTGTCCAACAAGGGCCTGCCCAGCAGCATCGAGAAAACCATCAGCAAGGCCAAGGGCCAGCCTCGGGAGCCCCAGGTGTACACCCTGCCCCCTAGCCAAGAGGAGATGACCAAGAACCAGGTGTCCCTGACCTGCCTGGTGAAGGGCTTCTACCCCAGCGACATCGCCGTGGAGTGGGAGAGCAACGGCCAGCCCGAGAACAACTACAAGACCACCCCCCCTGTGCTGGACAGCGACGGCAGCTTCTTCCTGTACAGCCGGCTGACCGTGGACAAGAGCCGGTGGCAGGAGGGCAACGTCTTTAGCTGCTCCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGAGCCTGAGCCTGTCCCTGGGCAAGATG
Все из этих клонов содержали замену остатка Q/K в сигнальном домене костимулирующего домена, происходящего из зета-цепи CD3.
[00587] Затем scFv-фрагменты CAR клонировали в лентивирусные векторы для получения полноразмерной конструкции в одной кодирующей рамке с использованием промотора EF1-альфа для экспрессии (SEQ ID NO: 11).
Промотор EF1-альфа
CGTGAGGCTCCGGTGCCCGTCAGTGGGCAGAGCGCACATCGCCCACAGTCCCCGAGAAGTTGGGGGGAGGGGTCGGCAATTGAACCGGTGCCTAGAGAAGGTGGCGCGGGGTAAACTGGGAAAGTGATGTCGTGTACTGGCTCCGCCTTTTTCCCGAGGGTGGGGGAGAACCGTATATAAGTGCAGTAGTCGCCGTGAACGTTCTTTTTCGCAACGGGTTTGCCGCCAGAACACAGGTAAGTGCCGTGTGTGGTTCCCGCGGGCCTGGCCTCTTTACGGGTTATGGCCCTTGCGTGCCTTGAATTACTTCCACCTGGCTGCAGTACGTGATTCTTGATCCCGAGCTTCGGGTTGGAAGTGGGTGGGAGAGTTCGAGGCCTTGCGCTTAAGGAGCCCCTTCGCCTCGTGCTTGAGTTGAGGCCTGGCCTGGGCGCTGGGGCCGCCGCGTGCGAATCTGGTGGCACCTTCGCGCCTGTCTCGCTGCTTTCGATAAGTCTCTAGCCATTTAAAATTTTTGATGACCTGCTGCGACGCTTTTTTTCTGGCAAGATAGTCTTGTAAATGCGGGCCAAGATCTGCACACTGGTATTTCGGTTTTTGGGGCCGCGGGCGGCGACGGGGCCCGTGCGTCCCAGCGCACATGTTCGGCGAGGCGGGGCCTGCGAGCGCGGCCACCGAGAATCGGACGGGGGTAGTCTCAAGCTGGCCGGCCTGCTCTGGTGCCTGGCCTCGCGCCGCCGTGTATCGCCCCGCCCTGGGCGGCAAGGCTGGCCCGGTCGGCACCAGTTGCGTGAGCGGAAAGATGGCCGCTTCCCGGCCCTGCTGCAGGGAGCTCAAAATGGAGGACGCGGCGCTCGGGAGAGCGGGCGGGTGAGTCACCCACACAAAGGAAAAGGGCCTTTCCGTCCTCAGCCGTCGCTTCATGTGACTCCACGGAGTACCGGGCGCCGTCCAGGCACCTCGATTAGTTCTCGAGCTTTTGGAGTACGTCGTCTTTAGGTTGGGGGGAGGGGTTTTATGCGATGGAGTTTCCCCACACTGAGTGGGTGGAGACTGAAGTTAGGCCAGCTTGGCACTTGATGTAATTCTCCTTGGAATTTGCCCTTTTTGAGTTTGGATCTTGGTTCATTCTCAAGCCTCAGACAGTGGTTCAAAGTTTTTTTCTTCCATTTCAGGTGTCGTGA (SEQ ID NO: 11).
Gly/Ser (SEQ ID NO: 25)
GGGGS
Gly/Ser (SEQ ID NO: 26): эта последовательность может охватывать 1-6 повторяющихся элементов "Gly Gly Gly Gly Ser"
GGGGSGGGGS GGGGSGGGGS GGGGSGGGGS
Gly/Ser (SEQ ID NO: 27)
GGGGSGGGGS GGGGSGGGGS
Gly/Ser (SEQ ID NO: 28)
GGGGSGGGGS GGGGS
Gly/Ser (SEQ ID NO: 29)
GGGS
Поли-A (SEQ ID NO: 30)
Эта последовательность может охватывать 50-5000 остатков аденина
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 60
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 420
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 480
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 540
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 600
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 660
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 720
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 780
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 840
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 900
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 960
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1020
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1080
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1140
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1200
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1260
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1320
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1380
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1440
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1500
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1560
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1620
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1680
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1740
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1800
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1860
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1920
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1980
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2040
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2100
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2160
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2220
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2280
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2340
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2400
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2460
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2520
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2580
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2640
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2700
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2760
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2820
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2880
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2940
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3000
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3060
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3420
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3480
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3540
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3600
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3660
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3720
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3780
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3840
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3900
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3960
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4020
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4080
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4140
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4200
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4260
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4320
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4380
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4440
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4500
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4560
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4620
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4680
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4740
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4800
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4860
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4920
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4980
aaaaaaaaaa aaaaaaaaaa 5000
Поли-A (SEQ ID NO: 31)
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 60
tttttttttt tttttttttt tttttttttt tttttttttt 100
Поли-A (SEQ ID NO: 32): эта последовательность может охватывать 50-5000 остатков тимина
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 60
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 120
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 180
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 240
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 300
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 360
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 420
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 480
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 540
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 600
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 660
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 720
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 780
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 840
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 900
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 960
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1020
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1080
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1140
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1200
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1260
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1320
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1380
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1440
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1500
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1560
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1620
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1680
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1740
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1800
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1860
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1920
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1980
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2040
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2100
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2160
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2220
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2280
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2340
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2400
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2460
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2520
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2580
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2640
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2700
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2760
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2820
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2880
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2940
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3000
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3060
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3120
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3180
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3240
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3300
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3360
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3420
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3480
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3540
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3600
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3660
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3720
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3780
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3840
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3900
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3960
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4020
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4080
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4140
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4200
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4260
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4320
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4380
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4440
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4500
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4560
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4620
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4680
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4740
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4800
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4860
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4920
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4980
tttttttttt tttttttttt 5000
Поли-A (SEQ ID NO: 33): эта последовательность может охватывать 100-5000 остатков аденина
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 60
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 420
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 480
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 540
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 600
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 660
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 720
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 780
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 840
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 900
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 960
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1020
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1080
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1140
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1200
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1260
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1320
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1380
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1440
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1500
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1560
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1620
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1680
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1740
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1800
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1860
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1920
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1980
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2040
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2100
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2160
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2220
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2280
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2340
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2400
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2460
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2520
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2580
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2640
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2700
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2760
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2820
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2880
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2940
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3000
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3060
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3420
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3480
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3540
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3600
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3660
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3720
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3780
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3840
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3900
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3960
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4020
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4080
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4140
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4200
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4260
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4320
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4380
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4440
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4500
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4560
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4620
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4680
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4740
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4800
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4860
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4920
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4980
aaaaaaaaaa aaaaaaaaaa 5000
Поли-A (SEQ ID NO: 34)
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 60
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 400
Поли-A (SEQ ID NO: 35)
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 60
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 420
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 480
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 540
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 600
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 660
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 720
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 780
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 840
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 900
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 960
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1020
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1080
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1140
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1200
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1260
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1320
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1380
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1440
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1500
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1560
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1620
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1680
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1740
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1800
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1860
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1920
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1980
aaaaaaaaaa aaaaaaaaaa 2000
Gly/Ser (SEQ ID NO: 38): эта последовательность может охватывать 1-10 повторяющихся элементов "Gly Gly Gly Ser"
GGGSGGGSGG GSGGGSGGGS GGGSGGGSGG GSGGGSGGGS
[00588]
Пример 2: Экспрессия и охарактеризация конструкций scFv человека против мезотелина для терапии CAR
[00589] Дополнительный анализ проводили для охарактеризации конструкций scFv человека против мезотелина, например, масс-спектрометрический анализ, эксклюзионную хроматографию и поверхностный плазмонный резонанс (SPR). Аффинность связывания и связывание эпитопа (по сравнению с эпитопом SS1) на внеклеточном домене мезотелина определяли с исопльзованием SPR. Анализы и результаты этих анализов описаны ниже.
Экспрессия scFv-кандидатов и биотинилированного мезотелина человека
[00590] Для оценки связывания и биофизических характеристик scFv человека против мезотелина, идентифицированных посредством пэннинга фагов, конструкции scFv временно продуцировали и очищали из клеток HEK293F вместе с внеклеточным доменом мезотелина человека (ECD MSLN человека). scFv SS1, который представляет собой scFv мыши против мезотелина, также получали в качестве эталона. Исследованные scFv человека против мезотелина представляли собой M5, M11, M12, M14, M16, M17, M21 и M23 (см. таблицу 14). Плазмиды, кодирующие аминокислоты для конструкций scFv M5 (SEQ ID NO: 43), M11 (SEQ ID NO: 49), M12 (SEQ ID NO: 50), M14 (SEQ ID NO: 52), M16 (SEQ ID NO: 54), M17 (SEQ ID NO: 55), M21 (SEQ ID NO: 59), M23 (SEQ ID NO: 61) и SS1 (SEQ ID NO: 275) и ECD MSLN человека (SEQ ID NO: 276)синтезировали во внешних условиях. ScFv продуцировали с 7x или 8xHis-меткой на C-конце конструкций. Конструкции scFv человека (M5, M11, M12, M14, M16, M17, M21 и M23) имели короткую линкерную последовательность, содержащую последовательность GS, связывающую C-конец scFv с N-концом 8xHis-метки, например GSHHHHHHHH (SEQ ID NO: 277). ECD мезотелина человека получали с использованием C-концевой Avi-метки (SEQ ID NO: 276) и селективно биотинилировали в определенном участке in vitro с использованием BirA фермента от Avidity, LLC. Временную экспрессию в клетках HEK293F и очистку проводили с использованием стандартной методологии. Для scFv, в кратком изложении, 100 мл клеток HEK293F в количестве 3x106 клеток/мл трансфицировали 100 мкг плазмиды и 300 мкг полиэтиленимина. Клетки инкубировали при 37°C с 8% CO2 и вращали при 80 об/мин. Через шесть суток клетки собирали центрифугированием при 3500g в течение 20 минут. Супернатант очищали посредством связывания scFv с 200 мкл Ni-NTA агарозных гранул (Qiagen) в течение ночи при 4°C. Белок элюировали с использованием 200 мкл 300 мМ имидазола и подвергали диализу против фосфатно-солевого буфера.
[00591] Последовательность scFv SS1 с His-меткой представлена ниже:
QVQLQQSGPELEKPGASVKISCKASGYSFTGYTMNWVKQSHGKSLEWIGLITPYNGASSYNQKFRGKATLTVDKSSSTAYMDLLSLTSEDSAVYFCARGGYDGRGFDYWGQGTTVTVSSGGGGSGGGGSGGGGSDIELTQSPAIMSASPGEKVTMTCSASSSVSYMHWYQQKSGTSPKRWIYDTSKLASGVPGRFSGSGSGNSYSLTISSVEAEDDATYYCQQWSGYPLTFGAGTKLEIEFGSHHHHHHH (SEQ ID NO: 275)
[00592] Последовательность ECD мезотелина человека с C-концевой Avi-меткой представлена ниже:
DAAQPAASEVEKTACPSGKKAREIDESLIFYKKWELEACVDAALLATQMDRVNAIPFTYEQLDVLKHKLDELYPQGYPESVIQHLGYLFLKMSPEDIRKWNVTSLETLKALLEVNKGHEMSPQVATLIDRFVKGRGQLDKDTLDTLTAFYPGYLCSLSPEELSSVPPSSIWAVRPQDLDTCDPRQLDVLYPKARLAFQNMNGSEYFVKIQSFLGGAPTEDLKALSQQNVSMDLATFMKLRTDAVLPLTVAEVQKLLGPHVEGLKAEERHRPVRDWILRQRQDDLDTLGLGLQGTRGSHHHHHHEFRHDSGLNDIFEAQKIEWHE (SEQ ID NO: 276)
Масс-спектрометрический анализ
[00593] Для подтверждения идентичности очищенные scFv анализировали с использованием высокоэффективной жидкостной хроматографии, сопряженной с масс-спектрометрией (ВЭЖХ-MS). 1 мкг каждого из них инжектировали на колонку Poros R1/10 2,1 мм x 100 мм (Life Technologies), нагретую до 60°C. Разделение проводили на Waters BioAcquity UPLC. Подвижная фаза A представляла собой 0,1% муравьиную кислоту; подвижная фаза B представляла собой 0,1% муравьиную кислоту в 25% ацетонитриле, 75% изопропаноле. scFv элюировали при 0,5 мл/мин с использованием градиента подвижной фазы B 25-50% в течение 15 минут. Масс-спектрометрическую детекцию проводили с использованием устройства Waters Xevo-Tof, действующего в режиме электрораспыления для определения положительных ионов в диапазоне 600-4000 m/z с линейным изменением напряжения на конусе 20-50 В. Полученные спектры масс усредняли по ширине пика и подвергали обратной свертке с использованием алгоритма MaxEnt1 от Waters для определения масс экспрессируемых scFv.
Анализ с использованием эксклюзионной хроматографии
[00594] Эксклюзионную хроматографию проводили для определения состояния олигомеризации экспрессированных scFv. 25 мкг каждого из них инжектировали на колонку TSKGel Super SW3000, 4,6 мм x 300 мм (Tosoh Bioscience), нагретую до 35°C. scFv элюировали при 0,3 мл/мин в 750 мМ аргинин, 1 мМ EDTA, 20 мМ фосфат натрия, 250 мМ хлорид натрия, pH 7,2; мониторинг УФ-поглощения проводили при 280 нм.
Поверхностный плазмонный резонанс (SPR)
[00595] Аффинность связывания очищенных scFv измеряли на системе Biacore T200. В кратком изложении, рекомбинантный биотинилированный ECD мезотелина человека иммобилизовывали на поверхности сенсорного чипа со стрептавидином (SA) при плотности 150 RU. Очищенный scFv инжектировали над чипом при постоянной скорости потока в трехкратных серийных разведениях. Мониторинг констант скорости ассоциации и диссоциации белкового комплекса проводили в течение 270 секунд и 400 секунд, соответственно. Проводили двойное сравнение с эталоном против пустой проточной ячейки с иммобилизацией и пустого буфера. Аффинность определяли с использованием модели связывания Ленгмюра 1:1, когда это было возможно, для тех scFV, для которых точная аппроксимация не была возможной вследствие быстрых констант скорости ассоциации и диссоциации, использовали модель стационарного состояния.
[00596] Для определения относительного связывания эпитопа каждого из scFv по сравнению с SS1, 50 нМ SS1 улавливали с использованием биотинилированного ECD мезотелина, иммобилизованного на сенсорном чипе со стрептавидином, с временем контакта 180 секунд, обеспечивающим относительную плотность 70 RU. Затем очищенный scFv в концентрации 100 нМ (M5, M11, M12, M14, M16, M17, M21, или M23) сразу инжектировали над чипом для минимизации диссоциации комплекса SS1/мезотелин. Мониторинг связывания вторичного scFv проводили в течение 270 секунд.
Результаты
[00597] Наблюдаемые массы для scFv, определенные посредством ВЭЖХ-MS, соответствовали теоретическим величинам, исходя из аминокислотных последовательностей. Экспрессированные scFv имели диапазон от 43% мономера до >98% мономера, исходя из аналитической эксклюзионной хроматографии. Выбранные scFv демонстрировали аффинность в широком диапазоне от 0,9 нМ до 114 нМ по сравнению с контрольным scFV SS1, который имел кажущуюся аффинность 0,1 нМ для ECD мезотелина (таблица 14). Репрезентативные сенсограммы SPR для SS1, M5 и M11 представлены на фиг.41A, B и C, соответственно.
[00598] Относительное связывание эпитопов (фиг.42) указывает на то, что M12, M14, M16, M17, M21, M23 являются конкурирующими с SS1 связывающими соединениями в отношении мезотелина человека, в то время как оказалось, что M5 и M11 не связывались с уникальным эпитопом, исходя из увеличенного ответа в анализе при их инжектировании.
Пример 3: Анализ и активность in vitro активность CART, содержащих scFv человека
[00600] Одноцепочечные вариабельные фрагменты антител против MSLN клонируют в лентивирусные экспрессирующие CAR векторы с зета-цепью CD3 и костимулирующей молекулой 4-1BB и оптимальные конструкции отбирают, исходя из количества и качестве ответов эффекторных T-клеток T-клеток MSLN, трансдуцированных CAR ("CART-MSLN" или "CART-MSLN T-клетки") в ответ на экспрессирующие MSLN ("MSLN+") мишени. Эффекторные T-клеточные ответы включают, но не ограничиваются ими, увеличение клеток в количестве, пролиферацию, удвоение, продукцию цитокинов и уничтожение клеток-мишеней или цитолитическую активность (дегрануляция).
Получение CART-MSLN
[00601] scFv человека, кодирующий лентивирусные векторы для переноса, используют для получения геномного материала, упакованного в псевдотипированные лентивирусные частицы VSVg. ДНК лентивирусного вектора для переноса смешивают с тремя упаковывающими компонентами VSVg, gag/pol и rev в комбинации с реагентом липофектамином для трансфекции ее в клетки Lenti-X 293T (Clontech).
[00602] Через 30 часов среду собирают, фильтруют и хранят при -80°C. Терапевтические CART-MSLN получают, начиная с крови здорового подвергнутого аферезу донора, чьи наивные T-клетки были получают посредством негативной селекции T-клеток, CD4+ и CD8+ лимфоцитов. Эти клетки активируют с использованием гранул CD3x28 (Dynabead® Human T-Expander CD3/CD28, Invitrogen) в соотношении 1:3 в RPMI1640, 10% инактивированной нагреванием эмбриональной телячьей сыворотки (FCS), 2 мМ L-глутамина, 1x пенициллина/стрептомицина, 100 мкМ не неосновных аминокислот, 1 мМ пирувата Na, 10 мМ Hepes и 55 мкМ 2-меркаптоэтанола) при 37°C, 5% CO2. T-клетки культивируют в количестве 1×106 T-клеток в 0,5 мл среды на ячейку 24-ячеечного планшета. Через 24 часа T-клетки освобождают и добавляют 0,5 мл неконцентрированного или меньшие объемы концентрированного вирусного супернатанта. T-клетки начинают делиться в логарифмическом паттерне роста, мониторинг которого проводят путем измерения количеств клеток на мл, и T-клетки разбавляют свежей средой каждые двое суток. Поскольку T-клетки начинают входить в состояние покоя приблизительно через 10 суток, логарифмический рост исчезает. Комбинирование замедление скорости роста и размера T-клеток, достигающего ~300 фл, определяет состояние T клеток, подходящее для криоконсервации для последующего анализа.
[00603] Перед криоконсервацией определяют процент трансдуцированных клеток (экспрессирующих мезотелин-специфический CAR на клеточной поверхности) и их относительную интенсивность флуоресценции при этой экспрессии посредством проточно-цитометрического анализа на FACS-CantoII или FACS Fortessa. Сравнение гистограммм относительной интенсивности в FACS демонстрирует процент трансдуцированных T-клеток. Трансдукция вирусом демонстрирует сравнимые уровни экспрессии, коррелирующие с эффективностью трансдуции, процентом трансдуцированных клеток. Результаты указывают на то, что отсутствует поддающийся обнаружению отрицательный эффект на способность клеток CAR-MSLN, содержащих scFv человека нормально увеличиваться в количестве по сравнению с нетрансдуцированными T-клетками ("UTD")и SS1 CART-MSLN.
Оценка цитолитической активности и секреции цитокинов в перенацеленных CART-MSLN T-клетках
[00604] Для оценки функциональной способности CART-MSLN T-клеток уничтожать и секретировать цитокины, клетки размораживали и позволяли им восстановиться в течение ночи. В дополнение к CART-MSLN, содержащим scFv человека, в качестве контроля использовали CART-MSLN, содержащие scFv мыши "SS1" (см. WO2013/040577). Контрольные CART-MSLN, содержавшие SS1 scFV (также обозначаемые как SS1 CART-MSLN) использовали во всех анализах для сравнения варьирования анализа и/или они выступали в качестве контроля. CART-клетки, содержавшие scFV SS1, а также все другие MSLN-CART, содержавшие scFv человека, продуцировали в условиях производства исследовательской категории (т.е. не клинической категории). CD19-BBz или Iso1-BBz использовали в качестве ненацеливающего CAR для фонового эффекта CART.
[00605] Уничтожение T-клетками было направлено против K562, клеточной линии хронического миелогенного лейкоза. Клетки K652 MSLN+ (K562-Meso) получали посредством трансдукции. K5652, не экспрессировавшие MSLN, использовали в качестве контроля. Для проточного анализа цитотоксичности, клетки-мишени окрашивали карбоксифлуоресцеинсукцинимидиловым сложным эфиром (CSFE) для количественного определения их присутствия. Цитолитическую активность CART-MSLN измеряли при титировании соотношений эфффектор:клетка-мишень 10:1, 3:1 и 1:1, где эффекторы определяли как T-клетки, экспрессирующие химерный рецептор против MSLN. Анализы начинали посредством смешения соответствующего количества T-клеток с постоянным количеством клеток-мишеней. Через 20 часов планшеты центрифугировали и весь объем каждой смеси удаляли. Оставшийся клеточный осадок в каждой ячейке промывали и клетки окрашивали с использованием маркера живых/погибших клеток 7AAD. После последнего промывания осажденные клетки ресуспендировали в определенном объеме с заданным количеством гранул для подсчета. Данные окрашивания клеток получали посредством проточной цитометрии CantoII и анализировали с использованием программного обеспечения FloJo с использованием гранул для количественного определения результатов.
[00606] Строили графики проточных анализов уничтожения в течение 20 часов с использованием титрования соотношений эффектора и мишени (E:T) с эффекторными клетками CART-MSLN, нацеленными на K562Ж, меченные CSFE (фиг.3A, неэкспрессирующие MSLN контроли) и K562-Meso (фиг.3B, клетки K562, трансдуцированные для экспрессии MSLN). При сравнении этих кривых уничтожения, титрование количества эффекторных клеток демонстрирует, что эти клетки, экспрессирующие MSLN, уничтожались. T-клетки из того же донора, которые были трансдуцированы либо клетками CAR-MSLN, содержащими scFv человека, либо клетками SS1 CAR-MSLN, были способны селективно уничтожать MSLN+ мишени. Цитолитическая активность всех клеток CART-MSLN является сходной и сравнимой с SS1 CART-MSLN мыши. Они демонстрируют, что все клетки CART-MSLN становятся реактивными в отношении мезотелина при трансдукции и приобретают способность уничтожать клетки-мишени, экспрессирующие высокие уровни мезотелина. Для измерения продукции цитокинов CART-MSLN, содержащими scFv человека, клетки размораживали и позволяли им восстановиться в течение ночи. В дополнение к гуманизированным CART-MSLN, SS1 CART-MSLN (scFv мыши) использовали для целей сравнения. CD19-BBz CART использовали в качестве контроля без нацеливания для фонового эффекта CART-клеток. SS1 CART-MSLN использовали во всех анализах для сравнения варьирования анализа. T-клетки были направлены на K562, клеточную линию хронического миелогенного лейкоза(как MSLN+, так и MSLN), экспрессирующую MLSN клеточную линию рака яичника Ovcar8, и линии рака поджелудочной железы SW1990 и Panc0203. При анализе экспрессии MSLN посредством проточной цитометрии была обнаружена в 10 раз более низкая экспрессия MSLN на Ovcar8 по сравнению с клетками MSLN+ K562; SW1990 экспрессировали в 10 меньше, чем Ovcar8. Экспрессия MSLN на Panc0203 не поддавалась обнаружению проточной цитометрии, однако была положительной в анализе РНК. Кроме того, PMA/иономицин использовали для оценки потенциала T-клеток к ответу на эндогенные иммунологические сигналы. Анализ исследует только соотношение эффектор:мишень 1:1. Анализ проводят в течение 24 часов после смешения клеток, когда среду удаляют для анализа цитокинов с использованием набора IFN-γ CBA-Flex для обнаружения цитокинов человека.
[00607] Анализировали фоновые уровни цитокинов, продуцированных клетками CART-MSLN после воздействия контрольных клеток K562, не экспрессирующих MSLN. Потенциальная секреция цитокинов после стимуляции T-клеток PMA/иономицином указывает на то, что популяции клеток имеют более вариабельный потенциал к секреции цитокинов. Для устранения различий проводили нормализацию специфического высвобождения IFNγ к максимальному высвобождению (PMA/иономицин).
[00608] Данные демонстрируют, что большинство CART-MSLN, содержащих scFv человека, и SS1 CART-MSLN мыши продуцировали IFNγ при культивировании с K562, сверхэкспрессирующими MSLN. При культивирования со злокачественными клетками, эндогенно экспрессирующими MSLN (при низких уровнях), только более CART отвечали (M5, 11, 14, 15, 16, 17 и SS1), в то время как два CARTs M5 и M11 продемонстрировали увеличенные уровни IFNγ. Более низкие уровни эндогенного MSLN могут лучше отражать естественным образом экспрессируемые уровни мезотелина на опухолевых клетках, CART, имеющие эти scFV, могут иметь более высокий терапевтический ответ, чем CART, имеющие конструкцию SS1.
Пример 4: Клиническое испытание для CART, полученных с использованием лентивируса
[00609] Пациентов будут выбирать из пациентов, имеющих экспрессирующие мезотелин злокачественные опухоли, такие как тяжелый эпителиальный рак яичника, злокачественная множественная мезотелиома или рак поджелудочной железы.
[00610] Получение и анализ высвобождения клеток CART-MSLN будут проводить в Clinical Cell and Vaccine Production (CVPF) в University of Pennsylvania. Продукт CART-MSLN будут получать из продукта афереза пациентов.
[00611] Методику афереза объемом приблизительно 10 литров будут проводить в центре афереза University of Pennsylvania (за 4 недели до первой дозы CAR T-клеток). По этой методике получают PBMC от пациента для CAR T-клеток. В результате одного лейкафереза намереваются собрать по меньшей мере 5×109 лейкоцитов для получения CAR T-клеток. Также будут получать и криоконсервировать исходные лейкоциты крови в соответствии с требованиями FDA для ретроспективных исследований и для научных исследований. Ожидается, что продукт в виде модифицированных мезотелином T-клеток будет готов к выпуску приблизительно через 4 недели.
[00612] CART, полученные с использованием лентивирусов, получали, как описано в примере 2, с использованием клеток, выделенных от каждого пациента, т.е. аутологичных T-клеток. CART-MSLN, полученные из T-клеток каждого пациента, экспрессируют scFv человека (включая M5 и M11) или SS1.
[00613] В конце культивирования клеток клетки подвергают криоконсервации в инфузируемой криосреде в мешках. Доза составляет 1-5×107CAR T-клеток для группы 1, 1-5×108 трансдуцированных CAR клеток для групп 2 и 3, которая вычислена, исходя из диапазона 2-50% трансдуцированных клеток от всех клеток. Мушки, содержавшие аутологичные модифицированные продукты в виде CAR T-клеток, будут хранить в контролируемой и подвергаемой мониторингу морозильной камере в CVPF в Hospital of the University of Pennsylvania. Мешки для инфузий будут хранить в морозильной камере, пока не потребуются.
[00614] Каждую дозу будут упаковывать и криоконсервировать в 1 мешке для инфузий в объеме, зависящем от общего количества клеток, который зависит от эффективности трансдукции; минимальный объем будет составлять 10 мл на мешок. Каждый мешок будет содержать аликвоту (объем зависит от общей дозы клеток) криосреды.
[00615] В группе 1 индивидуумам (N=3-6) будут проводить одну базовую внутривенную дозу 1-5×107 аутологичных клеток CART-MSLN на 0 сутки. В группе 2 индивидуумам (N=3-6) будут вводить одну базовую внутривенную дозу 1-5×108 аутологичных клеток CART-MSLN на 0 сутки. Индивидуумам в группах 1 и 2 не будут проводить никакую истощающую лимфоциты химиотерапию до введения клеток CART-MSLN. В группе 3 (N=6) будут вводить 1,5 грамма/м2 циклофосфамида внутривенно за двое суток до одной базовой внутривенной дозы 1-5×108 аутологичных клеток CART-MSLN.
[00616] Ожидается, что пациенты, которым вводят циклофосфамид, могут испытывать тошноту и рвоту в качестве побочного эффекта лечения. Противорвотную профилактическую премедикацию от тошноты можно проводить перед инфузией химиотерапевтического средства согласно стандартам учреждения. Выбор конкретного средства будут оставлять на усмотрение исследователя, хотя кортикостероиды не следует использовать вследствие их иммунодепрессивных эффектов.
[00617] Побочные эффекты после инфузий T-клеток могут включать временную лихорадку, озноб, дрожание, миалгии/артралгии, головную боль, усталость и/или тошноту. Индивидуумам будут проводить премедикацию ацетаминофеном, 650 мг, перорально и дифенгидрамина гидрохлоридом перорально или в/в перед инфузией CAR T-клеток. Если бенадрил противопоказан, можно вводить блокатор H2, такой как ранитидин. Введение этих лекарственных средств при необходимости можно повторять каждые шесть часов. Может быть назначен курс терапии нестероидными противовоспалительными средствами, если у пациента продолжается лихорадка, не смягчаемая ацетаминофеном. Рекомендуется, чтобы пациентам не вводили системные кортикостероиды, такие как гидрокортизон, преднизон, преднизолон (Solu-Medrol) или дексаметазон (Decadron). Если кортикостероиды требуются вследствие острой инфузионной реакции, рекомендуется первоначальная доза гидрокортизона 100 мг.
- Один мешок клеток CART-MSLN будет транспортироваться координатором исследования или персоналом CVPF на сухом льду из CVPF к постели пациента в CTRC.
- Трансицированные T-клетки будут размораживаться персоналом CVPF на водяной бане при 37°C у постели пациента. Мешок будут осторожно растирать только до тех пор, пока клетки не разморозятся. Если оказывается, что продукт в виде CAR T-клеток имеет поврежденный или протекающий мешок, или иным образом кажется испорченным, его не следует инфузировать, и его следует вернуть в CVPF, как описано ниже.
- Клетки будут инфузировать индивидууму холодными в течение приблизительно 10-15 минут после оттаивания. Трансфицированные T-клетки будут инфузировать внутривенно быстро через набор для переливания крови Y-типа калибра 18, не содержащего латекс, с 3-сторонним запорным краном. Лейкоциты не фильтруют при инфузии. Дозирование проводят посредством инфузии под действием силы тяжести. Если скорость инфузии под действием силы тяжести является слишком медленной, лекарственный продукт в виде трансфицированных T-клеток можно отбирать в шприц через запорный кран и вручную инфузировать с требуемой скоростью. В мешке не должно оставаться замороженных комков.
- Перед инфузией два индивидуума независимо будут проверять информацию на ярлыке каждого мешка в присутствии индивидуума и подтверждать, что информация точно соответствует участнику.
- Пациентов будут подвергать мониторингу в процессе и после инфузии трансфицированных T-клеток. Будут получать данные о температуре, кровяном давлении, частоте сердечных сокращений, частоте дыхании и данные пульсовой оксиметрии и будут регистрировать их непосредственно перед дозированием и каждые 15 минут в течение 2 часов после завершения инфузии.
- Скоропомощное медицинское оборудование (т.е. тележка для перевозки) должно быть доступным в случае неотложной ситуации в процессе инфузии, если у индивидуума возникнет аллергический ответ или тяжелый гипотензивный криз, или любая другая реакция на инфузию.
- Если симптомы не возникают и основные показатели жизнедеятельности индивидуума остаются нормальными в течение 2 часов после инфузии индивидуума отпускают домой с инструкциями вернуться в больницу, если возникнут какие-либо симптомы. Если основные показатели жизнедеятельности не являются стабильными, будут продолжать регистрировать их приблизительно каждые 15 минут до тех пор, пока основные показатели жизнедеятельности индивидуума не стабилизируется или врач не отпустит пациента. Индивидуума будут просить не уходить до тех пор, пока врач не решит, что это безопасно для него или для нее.
- В течение 60 минут (±5 минут) после завершения дозирования трансдуцированных CAR T-клеток будут проводить взятие образца крови для определения исходного уровня количества трансдуцированных CAR T-клеток и уровней цитокинов.
- Индивидуумов проинструктируют вернуться в CTRC или Perelman Center в течение 24 часов после первой инфузии для анализа крови и дополнительного обследования в соответствии с SOE.
[00618] Для CART, содержащих scFv, дозирование клеток можно повторять при необходимости.
[00619] Для определения относительной живучести и транспорта в кровь (и необязательно в опухоль) клеток CART-MSLN будут использовать описательную статистику. Данные, касающиеся количества CAR T-клеток в крови, уровней HAMA и отслеживания уровней растворимых биомаркеров, будут представлены графически. Будет определена корреляция с радиографическими и другими стандартными показателями опухолевой нагрузки. Будут вычислены 95% доверительные интервалы для соотношений и средних значений.
[00620] Информацию о неблагоприятных явлениях будут собирать и оценивать для всех пациентов в течение определяемых протоколом периодов сообщения об AE. AE будут распределять на категории по тяжести с использованием общими критериями токсичности (v4) National Cancer Institute (NCI). Все неблагоприятные явления будут описаны и точные 95% доверительные интервалы будут получены для частот неблагоприятных явлений, как в целом, так и в основных категориях. Мониторинг данных будут проводить непрерывно в отношении признаков чрезмерной токсичности. Результаты будут занесены в таблицу и обобщены.
[00621] Уровни клинических ответов будут обобщенно представлены в виде точных 95% доверительных интервалов. Распределения выживаемости без прогрессирования и общей выживаемости и длительность клинического ответа будут представлены графически с использованием кривых Каплана-Мейера. Будут представлены показатели двухлетней выживаемости.
Предварительные доказательства эффективности будут определять путем мониторинга показателей ответа опухоли у этих индивидуумов с поддающимся измерению заболеванием. Ответ опухоли будут оценивать с использованием радиографической визуализации (т.е. визуализация CT) и сывороточных биомаркеров на 28 сутки, 3 и 6 месяцы после инфузии.
- Радиографические ответы будут измерять в соответствием с критериями оценки ответа в солидных опухолях (RECIST 1.1), модифицированными критериями RECIST для плевральной мезотелиомы и критериями иммуноопосредуемого ответа (iRRC).
- Ответы сывороточных биомаркеров будут оценивать в соответствии со стандартами для каждого заболевания; кроме того, у всех индивидуумов будут измерять SMRP. Например, индивидуумов с раком поджелудочной железы будут подвергать мониторингу уровней CA19-9, CEA и сывороточного мезотелин-родственного белка [SMRP]) после введения CAR T-клеток. У индивидуумов с раком яичника будут проводить мониторинг уровней CA125, а также SMRP. У индивидуумов с мезотелиомой будут измерять сывороточные уровни SMRP. Во всех случаях сывороточные биомаркеры не будут использоваться в качестве единственных показателей ответа опухолей, учитывая, что клетки CART-MSLN могут влиять на анализы, используемые для этих измерений биомаркеров.
- Данные будут подвергать описательному анализу для всех общих показателей ответа, выживаемости без прогрессирования и общей выживаемости.
[00622] Будут оценивать PFS и OS вплоть до 2 лет после инфузии или до начала у индивидуумов связанной со злокачественной опухолью терапии.
[00623] Будут проводить оценку безопасности, включая мониторинг в крови уровней цитокинов. Индивидуумов будут включать в исследование последовательно. Между инфузиями будет интервал для обеспечения оценки безопасности в течение 28 суток у включенных в исследование индивидуумов в каждой группе.
Пример 5: Клиническое испытание CART, полученных из РНК
Аутологичные T-клетки модифицируют способами инженерии для внеклеточной экспрессии конструкции SS1 CAR, которая распознавала мезотелин, а также трансмембранный домен, в дополнение к сигнальным доменам 4-1BB и CD3-зета человека, описанным выше. См., например, WO2013/040577, пример 1.
Получение содержащих CAR нуклеиновых кислот
[00624] SS1-CAR конструируют следующим образом. CAR, содержащие scFv человека против мезотелина, также конструируют с использованием сходных способов.
[00625] Использовали две различных плазмиды для клонирования фрагмента ss1.bbz. Фрагмент scFv мезотелина (ss1) сначала клонировали в лаборатории Translational Research Program (TRP) из ранее опубликованной конструкции Dr. Pastan (Chowdhury et al., 1998). Шарнирную область CD8α человека и трансмембранный домен вместе с последовательностью 41BB и CD3ζ клонировали способом ПЦР и плазмиды pELNS.CD19-BB-ζ, описанной ранее (Milone et al., 2009). Последовательности для шарнирной области, трансмембранного и внутриклеточного сигнального доменов описаны в настоящем описании. Фрагмент ss1.bbz первоначально клонировали в вектор pGEM.GFP.64A (предоставленный Eli Gilboa и описанный в Boczkowsk, D et al., 2000). Этот вектор был модифицирован посредством вставки двух повторов 3’UTR бета-глобина и последовательности поли-A из 150 п.о. (SEQ ID NO: 271) (заменяющей последовательность 64 поли-A (SEQ ID NO: 273) в pGEM.GFP.64A) для увеличенной экспрессии трансгена (Holtkamp 2006). Плазмиду, удовлетворяющую критериям GMP для клинического применения, получали путем субклонирования фрагмента ss1.bbz.2bgUTR.150A из pGEM в вектор pDrive. Клонирующий вектор pDrive (Qiagen) конструировали для высокоэффективного клонирования продуктов ПЦР посредством гибридизации UA. Это позволяет селекцию рекомбинантных клонов как с ампициллином, так и с канамицином, и включает участки для универсальных секвенирующих праймеров, и промоторы как T7, так и SP6, для транскрипции in vitro. Сначала ss1.bbz.2bgUTR.150A вырезали из вектора pGEM посредством Hind III и NdeI (тупые с заполнением) и субклонировали в pDrive, расщепленную KpnI и NotI (тупые с заполнением). Вставку с правильной ориентацией подтверждали секвенированием с получением pDrive.ss1.bbz.2bgUTR.150A. Ген устойчивости к ампициллину в векторе pDrive удаляли двойным расщеплением AhdI и BciVI. Для устранения потенциальных аберрантных белков, транслированных с внутренних открытых рамок считывания (ORF) внутри ORF CAR, во все внутренние ORF, которые имели размер более 60 п.о., вносили мутации посредством ПЦР с мутагенезом, в то время как ORF ss1 CAR сохраняли интактной. Полученную плазмиду обозначили D-A.ss1.bbz.OF.2bg.150A, как показано на фиг. 1.
[00626] Получение нуклеиновых кислот CAR для введения в аутологичные T-клетки проводили следующим образом. Конечную конструкцию pD-A.ss1.bbz.OF.2bg.150Aвводили в химически компетентные клетки E Coli OneShot TOP10 (Invitrogen) согласно CVPF SOP 1188. Вплоть до 10 мг плазмидной ДНК, получаемой в качестве одной партии, получали с использованием набора для выделения ДНК QIAfilter Plasmid Giga DNA isolation kit согласно SOP 1191, из 1,25 литра среды LB, содержавшей 100 мкг/мл канамицина. 1 мг ДНК линеаризовывали ферментом рестрикции SpeI за один раз в течение ночи при 37°C. Линеаризацию подтверждали гель-электрофорезом перед крупномасштабной очисткой с использованием набора Qiagen Plasmid Maxi Kit.
[00627] РНК транскрибировали с плазмид с использованием системы mScript mRNA system и выделяли с использованием набора RNeasy Maxi kit (Qiagen). Транскрибированную in vitro РНК криоконсервировали в аликвотах по 0,5 мл в концентрации 1 мг/мл. Качество РНК и количество анализировали 1% агарозным гель-электрофорезом после денатурации в течение 15 мин при 70°C в буфере для денатурации мРНК (Invitrogen, Carlsbad, CA) и количественно определяли посредством УФ-спектрофотометрии (OD260/280).
Получение продукта в виде CAR T-клеток
[00628] Процедуру афереза объемом от 7 до 12 литров проводят приблизительно за 4 недели до введения первой дозы CAR T-клеток. В ходе этой процедуры получают PBMC для CAR T-клеток. Посредством одного лейкоафереза намереваются собрать по меньшей мере 5×109 лейкоцитов для получения CAR T-клеток.
[00629] CD3+ T-клетки увеличивают в количестве из продукта лейкафереза посредством устранения моноцитов с использованием центрифужного элюирования в противотоке на CaridianBCT Elutra, в котором используется одноразовый набор с закрытой системой. На 0 сутки, процесс получения T-клеток начинают активацией посредством магнитных гранул, покрытых моноклональным антителом против CD3/CD28, и увеличение в количестве начинают в мешке для статического культивирования тканей. На 5 сутки клетки переносят в биореактор WAVE при необходимости для дополнительного увеличения в количестве. В конце культивирования из клеток удаляют магнитные гранулы, клетки промывают и концентрируют с использованием системы Haemonetics Cell Saver system. Клетки после сбора инкубируют в течение ночи при 37°C для электропорации на следующее утро. Клетки промывают и ресуспендируют в буфере для электропорации (Maxcyte) и наносят на систему для обработки Maxcyte. Клетки подвергают электропорации РНК ss1, и позволяют им восстановиться в течение 4 часов, а затем составляют в инфузионной среде для криоконсервации.
[00630] Упаковывание
[00631] 1×108 или 1×109 ±20% модифицированных CAR T-клеток будет предоставляться в мешках для в/в инфузии, поддерживаемых на влажном льду. Каждый мешок будет содержать аликвоту (объем зависит от дозы) криосреды, содержащей следующие реагенты инфузионной категории (% об./об.): 31,25 плазмалит-A, 31,25 декстроза (5%), 0,45 NaCl, вплоть до 7,50 DMSO, 1,00 декстран 40 и 5,00 сывороточный альбумин человека. Мешки можно замораживать при -135°C.
[00632] Стабильность продукта в виде CAR T-клеток
[00633] ss1 CAR T-клетки будут криоконсервировать через 4 часа после электропорации и размораживать и вводить в течение окна, составляющего три месяца, после получения T-клеток. Авторы настоящего изобретения продемонстрировали, что экспрессия scFv против мезотелина на подвергнутых криоконсервации ss1CAR T-клетках приблизительно в течение 30 суток при ≤-130°C составляла 97,4%, что является практически идентичным моменту криоконсервации (96,9%), и другие криоконсервированные T-клеточные продукты являются стабильными в течение по меньшей мере 6 месяцев. Жизнеспособность после размораживания, исходя из подсчета с трипановым синим, составляла 75,2% по сравнению с 98,7%. Данные об экспрессии указывают на то, что конечный продукт является стабильным в процессе хранения для испытания, и что запасной флакон для дополнительных доз должен удовлетворять критериям высвобождения, соответствующим 70% жизнеспособности и ≥20% экспрессии CAR. Дополнительные флаконы ss1 CAR T-клеток будут размораживать через 3, 6, 9 и 12 месяцев после криоконсервации и жизнеспособность и экспрессию трансгена будут тестировать для получения дополнительных данных о стабильности продукта.
[00634] Методика и результаты клинических испытаний: Клиническое испытание фазы I аутологичных перенацеленных на мезотелин T-клеток, введенных пациентам со злокачественной плевральной мезотелиомой, проводят следующим образом. Сходные методики можно использовать для исследования для лечения пациентов с раком поджелудочной железы.
[00635] Дозировки
[00636] Пациентам группы 1 (n=3) будут проводить однократную инфузию 1×108 с использованием фиксированной дозы CAR T-клеток с РНК против мезотелина на 0 сутки и однократную инфузию 1×109 CAR T-клеток с РНК на 7 сутки при условии, что пациенты удовлетворят определяемым протоколом параметрам оценки безопасности до инфузии на 7 сутки.
[00637] Пациентам группы 2 (n=6) будут проводить 2 курса введения модифицированных CAR T-клеток. Один курс состоит из 3 инфузий раз в двое суток (понедельник, среда, пятница). Курс 1 состоит из 3 доз по 1×108CAR T-клеток, вводимых в MWF (0, 2, 4 сутки); курс 2 состоит из 3 доз 1×109 CAR T-клеток, вводимых в MWF (7, 9, 11 сутки).
[00638] Намеченная доза на инфузию составляет 1×108 клеток (одна доза для группы 1 и дозы 1 недели для группы 2) и 1×109 ±20% клеток (одна доза для группы 1 и дозы 2 недели для группы 2). Минимально приемлемая доза составляет 1×108. Если общая экспансия клеток является меньшей, чем общая приемлемая клеточная доза, пациента можно подвергать второму аферезу в попытках достигнуть большей экспансии клеток и достигнуть общей намеченной дозы. Если существуют противопоказания для второго афереза или если второй аферез и увеличение в количестве не обеспечивают минимально приемлемую дозу, эту дозу считают производственным неуспехом. Для пациентов группы 1, будут получать/замораживать столько подвергнутых электропорации T-клеток с CAR против мезотелина, сколько возможно, чтобы снизить вероятность, что пациента будут подвергать второму лейкаферезу в случае, если они будут переведены на расширенный режим группы 1.
[00639] Снижение дозы будут проводить, если более чем у одного пациента разовьется DLT в результате инфузии модифицированных T-клеток с CAR. В случае DLT, авторы настоящего изобретения будут снижать дозу в 10 раз. Таким образом, если возникнет токсичность на 1 цикле в 108 CAR T-клетках, тогда все инфузии (дозы 1-6) снизят до 107 CAR T-клеток. В случае неуправляемой токсичности в дозе 107 CAR T-клеток испытание будет остановлено.
[00640] Потенциальной проблемой, которая может возникнуть у пациентов, подвергаемых лечению с использованием T-клеток с временной экспрессией CAR (в частности в случае CART, содержащих scFv мыши) является анафилаксия после многократных введений.
[00641] Без связи с теорией, полагают, что такой анафилактический ответ может быть вызван развитием у пациента гуморального ответа против CAR, т.е. антител против CAR, имеющих анти-IgE изотип. Считается, что антителопродуцирующие клетки пациента претерпевают переключение класса с изотипа IgG (который не вызывает анафилаксию) на изотип IgE, когда существует период перерыва в воздействии антигена, составляющий от десяти до четырнадцати суток. Таким образом, для временных CART (таких как CART, полученные посредством электропорации РНК), перерывы между инфузиями CART не должны длиться более чем от десяти до четырнадцати суток.
[00642] Кроме того, использование CAR с scFv человека (вместо мыши) может снизить вероятность и интенсивность ответа у пациента против CAR.
[00643] Методика исследования
[00644] Исследование состоит из 1) скрининговой фазы, 2) фазы вмешательства, состоящей из афереза, инфузии CAR T-клеток, оценки побочных эффектов и необязательной биопсии опухоли, и 3) посещения для наблюдения.
[00645] Скрининг и исходная оценка
[00646] Исследователь должен подробно объяснить индивидууму природу протокола исследования и риски, ассоциированные с протоколом. Перед участием в исследовании индивидуум должен подписать и датировать информированное письменное согласие. Процесс и дата получения информированного согласия будут зарегистрированы в медицинской карте пациента и на CRF. Информированное согласие должно быть получено до проведения процедур по протоколу. Если процедуру, требуемую для скрининга, будут проведены до подписания информированного согласия и процедура удовлетворяет временным пределам протокола, эту процедуру можно использовать для скрининговой оценки.
[00647] Скрининговые процедуры (не требуются для определения пригодности) будут проводить в пределах 6 недель до первой дозы CAR T-клеток (если нет иных указаний в SOE). В случае, если потребуется второй аферез для увеличения в количестве дополнительных T-клеток и достижения заданной дозы клеток, это временное окно не будет охватывать все процедуры. Таким образом, в этом конкретном случае допускают период из 6-8 недель для проведения исходного сканирования.
[00648] Процедуры скрининга включают:
- Информированное согласие
- Подтверждение показателя общего состояния ECOG ≤1
- Определение эффективности производства (для первых 2 пациентов): образец крови отсылают в CVPF для определения пригодности для получения T-клеток. Приблизительно через 1 неделю CVPF вернет результат, указывающий на то, являются ли PBMC индивидуума вероятно достаточными для крупномасштабного процесса производства CAR T-клеток. Результаты должны быть известны до проведения каких-либо дополнительных процедур исследования.
- Полный медицинский анамнез
- Физикальное обследование, включающее основные показатели жизнедеятельности, рост, массу тела и насыщение кислородом
- Обзор сопутствующих способов терапии
- Гематология (WBC с подсчетом форменных элементов, RBC, Hct, Hgb и тромбоциты)
- PT и PTT
- Химия (натрий, калий, хлорид, бикарбонат, азот мочевины, креатинин, глюкоза, общий белок, альбумин, кальций, щелочная фосфатаза, общий билирубин, ALT, AST)
- Скрининг вирусов: ВИЧ, HCV, HBV и серология в отношении CMV
- Панель аутоантител: ANA, ESR
- Общий анализ мочи
- Электрокардиограмма с 12 отведениями (ECG)
- Сывороточный βHCG беременности (для женщин детородного возраста)
- Спирометрия и DLCO
- Оценка опухоли: CT-изображение грудной клетки с контрастом, другие способы радиографической оценки, если есть клинические показания. PET/CT-сканирование является необязательным.
- Патологическое подтверждение эпителиальной или смешанной (двухфазной) мезотелиомы и окрашивание на мезотелин патологоанатомом по специальном протоколу.
[00649] Лейкаферез
[00650] Методику афереза объемом от 7 до 12 литров будут проводить в центре афереза University of Pennsylvania (за 4 недели до первой дозы CAR T-клеток). По этой методике получают PBMC от пациента для CAR T-клеток. В результате одного лейкафереза намереваются собрать по меньшей мере 5×109 лейкоцитов для получения CAR T-клеток. Если результаты сбора являются неуспешными, пациенты имеют возможность проведения второго лейкафереза. Также получают исходные лейкоциты крови вследствие требований FDA для ретроспективных исследований и для научных исследований и криоконсервируют. Ожидается, что продукт в виде модифицированных мезотелином T-клеток будет готов к выпуску приблизительно через 4 недели. У всех пациентов будут проводить стандартный скрининг для лейкафереза перед процедурой.
[00651] Оценка до инфузии (сутки -3 исследования перед первой дозой)
[00652] Эта оценка безопасности включает физикальное обследование (например, основные показатели жизнедеятельности, масса тела и т.д.), изучение сопутствующих способов лечения, показателя общего состояния, химии, CBC с подсчетом форменных элементов, тест на беременность (моча), общий анализ мочи, ЭКГ, CXR и взятие образцов крови для научных исследований.
[00653] Введение CAR T-клеток
[00654] Перед каждой инфузией CAR T-клеток у пациентов будут проводить проблемно-ориентированное PE, изучение неблагоприятных явлений, показатель общего состояния ECOG, CBC, химиический анализ и общий анализ мочи. Индивидуумов будут возвращать в HUP через 1 сутки после инфузии CAR T-клеток (D1, D3, D8 и D10), чтобы им провели ограниченное проблемно-ориентированное PE, изучение неблагоприятных явлений, сопутствующую терапию, определение показателя общего состояния ECOG, CBC и химический анализ. На 7 сутки, пациентам 1 группы также будут проводить ЭКГ. На 14 сутки пациентам 2 группы также будут проводить CXR и ЭКГ.
[00655] CAR T-клетки будут вводить, как описано выше. Основные показатели жизнедеятельности индивидуумов будут оценивать и пульсовую оксиметрию будут проводить перед введением дозы, в конце инфузии и каждые 15 минут после этого в течение 2 часов и до тех пор, пока результаты не будут стабильными.
[00656] Оценка после инфузии
[00657] Мониторинг уровней цитокинов в крови будут проводить через 1 ч, 4 ч, 1 сутки и 3 суток после первой инфузии и через 1 ч, 4 ч, 1 сутки и 3 суток, 7 суток и 14 суток после второй инфузии для пациентов группы 1. Взятие крови для анализа приживления (проточная цитометрия и ОТ-ПЦР) будут проводить через 21 сутки после первой инфузии.
[00658] Для пациентов группы 2 (и расширенной группы 1), мониторинг уровней цитокинов будут проводить через 1 ч после каждой инфузии и в дополнительные моменты времени в соответствии с SOE. Первичные данные безопасности и приживления получают в течение 35 суток после первого (0 сутки) введения CAR T-клеток.
[00659] Через 1 сутки после инфузии CAR T-клеток проводят взятие крови для проточной цитометрии и ОТ-ПЦР для оценки циркулирующих CAR T-клеток. Образцы периферической крови будут обрабатывать для выделения: a) мононуклеарные клетки периферической крови (PBMC) для оценки фенотипа и функции иммунных клеток, b) РНК для количественной оценки кратковременной живучести и распределения инфузированных CAR T-клеток и c) сыворотки для количественного определения и оценки подгруппы иммунных клеток и растворимый иммунных факторов и факторов роста, оценки развития иммунных ответов против инфузированных клеток и проведения анализа на Protoarray для оценки развития гуморальных противоопухолевых иммунных ответов посредством распространения иммунных эпитопов.
[00660] Индивидуумов будут оценивать на 2 и 3 месяцы (группа 1) и 2, 3 и 6 месяцы после последней инфузии CAR T-клеток (группа 2 и расширенная группа 1) для оценки безопасности, как описано выше.
[00661] Биопсия опухоли и миниаферез
[00662] Для группы 2 и расширенной группы 1: если опухоль поддается визуальной оценке или поддается оценке посредством биопсии с визуализацией, пригодным индивидуумам будут проводить прямую биопсию опухоли или биопсию с визуализацией для оценки присутствия CAR T-клеток и экспрессии мезотелина. Это будут планировать на 14 сутки после инфузии T-клеток для индивидуумов группы 2. Будут измерять частоту общих инфильтрирующих лимфоцитов и подгрупп T-клеток, а также экспрессию молекулярных маркеров T-клеточного противоопухолевого ответа. Это будут сравнивать с исходными величинами для сохраненных хирургических образцов опухоли, если они будут доступны. Индивидуумам будут давать возможность отказаться от биопсии опухоли. Также в качестве биоптата может быть предоставлена внутриполостная жидкость.
[00663] Миниаферез (2 л) проводят для целей исследования и для целей "ретроспективного исследования" FDA для сохранения CAR T-клеток для анализа безопасности на 21 сутки после инфузии. Вместо лейкафереза можно проводить взятие образца крови.
[00664] Оценка ответа опухоли
[00665] Ответ опухоли будут оценивать на 35 сутки и 2 месяц для группы 1 и 35 сутки, 2 и 6 месяцы после последней инфузии CAR T-клеток для группы 2 (и расширенной группы 1), или до тех пор, пока пациенту не потребуется альтернативная терапия MPM. Оценку опухоль будут проводить посредством CT-сканирования грудной клетки с контрастом и других клинических показанных процедур.
[00666] Описанный выше пример можно проводить с использованием CART, содержащих scFv человека, с использованием, например, scFv в конструкциях CAR M5, M11, M14, M15, M16 и M17.
Пример 6: CART-MSLN индуцируют противоопухолевую активность в солидных злокачественных опухолях
[00667] В этом примере представлены два описания случая продолжающихся клинических испытаний, показывающих, что адоптивный перенос T-клеток с мРНК CAR (PBMC подвергали электропорации конструкциями CAR против мезотелина), который нацелен на мезотелин (CART-MSLN) является осуществимым и безопасным без явных признаков токсичности в отношении мишени вне опухоли на нормальных тканях. Эти случаи также демонстрируют, что CART-MSLN могут инфильтрировать и имеют высокую противоопухолевую активность в солидных злокачественных опухолях, таких как злокачественная плевральная мезотелиома (MPM) и рак поджелудочной железы.
[00668] Индивидуум 17510-105 имел MPM и ему проводили 3 инфузии CARTmeso. Индивидуум 21211-101 имел метастазирующий рак поджелудочной железы (PDA) и ему вводили 8 доз CARTmeso посредством внутривенной инфузии и 2 внутриопухолевых инъекций. Оба пациента были пожилыми и имели развернутую рефрактерную к химиотерапии злокачественную опухоль с обширной опухолевой нагрузкой в момент включения в исследование.
[00669] Противоопухолевая клиническаяактивность клеток CART meso
[00670] Оба случая оценивали в отношении ответа опухоли с использованием визуализации посредством компьютерной томографии (CT). Кроме того, пациента с PDA оценивали по авидности к [18F]2-фтор-2-дезокси-D-глюкозе (FDG) при визуализации посредством позитронной эмиссионной томографии/компьютерной томографии (PET/CT) до и после инфузий (фиг.6). Пациент с MPM имел стабильное заболевание после проведения инфузий CARTmeso, однако у него развился подтвержденный частичный ответ после проведения инфузии клеток CARTmeso по схеме 2 (фиг.6A). Пациент PDA имел стабильное заболевание после внутривенной терапии CARTmeso в течение 3 недель. При визуализации с FDG посредством PET/Ct, во всех областях заболевания наблюдали снижение максимальной стандартизованной величины захвата (SUVmax). Для дальнейшего исследования этого метаболического ответа определяли изменения среднего волюметрического продукта (MVPmean) для каждого очага заболевания (фиг.6B, 6C, и 6D). Снижение MVPmean наблюдали только в перитонеальных очагах. Для дальнейшего понимания влияния клеточной терапии CARTmeso на перитонеальную опухолевую нагрузку, асцитную жидкость анализировали посредством проточной цитометрии. Анализ асцитной жидкости на сутки +3 и +15 после начала терапии выявил 40% снижение концентрации опухолевых клеток, которые коэкспрессировали мезотелин и c-met (фиг.6D). В целом, эти данные указывают на роль инфузий клеток CARTmeso в отношении индукции противоопухолевого эффекта у этих пациентов.
[00671] Также у обоих пациентов исследовали серологические опухолевые маркеры. Сывороточные уровни мезотелин-родственного пептида (SMRP) и CA19-9 измеряли до и после инфузий клеток CARTmeso. Для пациента с MPM уровни SMRP снижались после проведения первой инфузии по схеме 2, что совпадало со снижением опухолевой нагрузки, наблюдаемой посредством CT-визуализации. Для пациента PDA уровни CA19-9 медленно возрастали в ходе лечения, но оставались стабильными в течение 1 месяца. После завершения внутриопухолевых инъекций клеток CARTmeso, уровни CA19-9 росли сопоставимо с прогрессированием заболевания.
[00672] Живучесть и транспорт клеток CARTmeso in vivo
[00673] Анализ q-ПЦР разрабатывали для обнаружения и количественного определения живучести клеток CARTmeso у пациентов после инфузии. Анализы образцов периферической крови, асцитной жидкости и опухоли от двух пациентов представлены на фиг.7. Трансген CARTmeso обнаруживался у обоих пациентов сразу после каждой инфузии. В соответствии с биодеградируемой природой трансгена CARTmeso, наблюдали прогрессирующее снижение его уровней в последующие дни.
[00674] Транспорт клеток CARTmeso в опухолевые ткани оценивали у пациента PDA путем получения асцитной жидкости в последовательные моменты времени и посредством биопсии опухоли.
[00675] Индукция гуморального распространения эпитопа после инфузии клеток CARTmeso
[00676] Исследовали гипотезу, что клетки CARTmeso, если они способны распознавать и лизировать первичные опухолевые клетки in vivo, могут индуцировать системный противоопухолевый ответ. Проводили высокопроизводительный серологический анализ для измерения индукции антительных ответов на антигены для обнаружения развития поликлонального иммунного ответа, который может возникнуть в результате разрушения опухоли и распространения эпитопа. Этот анализ проводили с использованием объективного исследования индуцированных лечением IgG-ответов практически на 10000 независимых белков. У пациента с PDA были обнаружены новые ответы антител на +44 сутки не более чем на 100 белков. Аналогично, повышенные антительные ответы на подгруппу белков наблюдали у пациента с MPM. В целом, эти антительные иммунные ответы, наблюдаемые у обоих пациентов, согласуется с опосредуемым CAR T-клетками разрушением опухоли, ведущим к высвобождению собственных белков, которые перекрестно презентируются в классическом процессе распространения эпитопа.
[00677] Сыворотки обоих пациентов до и после лечения исследовали в отношении индукции противоопухолевых ответов также посредством иммуноблоттинга с использованием очищенных ассоциированных с опухолью белков или белковых лизатов из клеточных линий MPM или PDA человека. Противоопухолевые иммунные ответы определяли по присутствия новых полос или увеличению интенсивности ранее существовавших полос на иммуноблотах (фиг.9). У обоих пациентов наблюдали изменение профиля антител после лечения, например, увеличение белков для выявления антител в аллогенных опухолевых клеточных линиях. Эти данные вместе с анализом Protoarray указывают на то, что противоопухолевый гуморальный иммунный ответ индуцировался посредством инфузии клеток CARTmeso.
Пример 7: Комбинированное лечение для усиления функции CART в солидных опухолях
[00678] Иммунотерапия с использованием подвергнутых адоптивному переносу инфильтрирующих опухоль лимфоцитов (TIL) ограничивается функциональной инактивацией T-клеток в микроокружении солидной опухоли. В этом исследовании T-клетки человека, экспрессирующие meso CAR, инъецировали внутривенно иммунодефицитным мышам, имеющим крупные развернутые экспрессирующие мезотелин опухоли мезотелиомы в боковых областях. Анализ выделенных meso-CAR T-клеток (mesoCART) продемонстрировал быстрое снижение эффекторных функций, которое оказалось многофакторным. Результаты этих экспериментов демонстрируют, что ингибиторы механизмов, которые вызывают утрату эффекторной функции mesoCART, могут быть пригодными в комбинированной терапии для повышения эффективности лечения mesoCART in vivo.
[00679] Материалы и способы
[00680] Получение mesoCAR и препарата лентивирусного вектора. Лентивирусные конструкции, содержащие CAR против мезотелина ss1, получали, как описано ранее. Конструкции CAR против мезотелина человека и T-клетки, экспрессирующие их, также можно получать с использованием способов, описанных ранее.
[00681] Клеточные линии. Использовали клеточную линию мезотелиомы человека, происходящую из опухоли пациента, EMP (родительская). Поскольку EMP не имела исходной экспрессии опухолеассоциированного антигена (TAA) мезотелина, его трансфицировали посредством лентивируса для стабильной экспрессии мезотелина человека (трансдуцированная клеточная линия была названа EMMESO). Клетки также трансдуцировали для стабильной экспрессии люциферазы светлячка (называемой EMPffluc, EMMESOffluc).
[00682] Анализ эффекторныхT-клеток. Эффекторные T-клетки сокультивировали с опухолевыми клетками, экспрессирующими люциферазу светлячка, в различных соотношениях в течение определенного периода времени. В конце периода инкубации при сокультивировании супернатант сохраняли для определения уровней IFN с использованием ELISA (Biolegend #430106), лунки промывали и оставшиеся опухолевые клетки лизировали 1X буфером для лизиса клеток в течение 30 минут. Активность люциферазы в лизатах анализировали с использованием системы для анализа люциферазы на системе детекции GloMax Multi Detection System (Promega). Результаты представлены в качестве процентного уничтожения, исходя из активности люциферазы в лунках с опухолевыми, но не с T-клетками. (% уничтожение=100-((RLU из лунки с сокультурой эффекторных клеток и клеток-мишеней)/(RLU из лунок с клетками-мишенями)x100)). Соотношения эффектора и мишени соответствуют общему количеству T-клеток на клетку-мишень.
[00683] Животные. Все эксперименты на животных были одобрены соответствующим комитетом учреждения по уходу и использованию животных. Мышей NOD/scid/IL2rγ-/- (NSG) выводили в Animal Services Unit of the Wistar Institute и Children’s Hospital of Philadelphia. Для экспериментов использовали самок мы шей в возрасте от 10 до 16 недель.
[00684] Эксперименты с ксенотрансплантатамиin vivo. 5×106 опухолевых клеток EMMESO инъецировали в бок мышей NSG в растворе среды X-Vivo (Lonza) и матригеля (BD Biosciences). После развития опухолей (100-200 мм3), мышей случайным образом распределяли в одну из трех групп внутривенного (хвостовая вена) введения: 1) 20×106 нетрансдуцированных (NT) T-клеток (активированные посредством Dynabead® T-клетки), 2) 20×106 mesoCAR T-клеток (активированные посредством Dynabead® T-клетки, трансдуцированные mesoCAR) 3) физиологического раствора. Опухоли измеряли с использованием толщиномеров и объем опухоли вычисляли с использованием формулы (π/6)*(длина)*(ширина)2. Группы содержали по 10 мышей. Эксперименты in vivo повторяли три раза.
[00685] Результаты
[00686] Гипофункция, наблюдаемая в инфильтрирующих опухоль CART
[00687] Опухолевую клеточную линию мезотелиомы человека, экспрессирующую мезотелин, EMMESO инъецировали в бок мышей NSG и позволяли ей расти до размера от 100 до 200 мм3. В этом время мышам, имеющим опухоль, проводили одну внутривенную инъекцию 20 миллилонов T-клеток (экспрессия mesoCAR составляла приблизительно 50% (данные не представлены)). Значительное замедление роста опухоли наблюдали через 14 суток (фиг.10), однако в отличие от опыта авторов настоящего изобретения с другой клеточной линией мезотелиомы (Carpenito et al., Proc Natl Acad Sci USA, 106(9):3360-65 (2009), Zhao et al., Cancer Res, 70(22):9053-61 (2010).) не было замечено регрессии или излечения опухоли. Инъекция нетрансдуцированных T-клеток имела минимальные противоопухолевые эффекты по сравнению контрольной группой, в которой вводили физиологический раствор (фиг.10), что указывает на то, что снижение роста опухоли, наблюдаемое у животных, которым вводили T-клетки, экспрессирующие mesoCAR, было результатом mesoCAR.
[00688] Для понимания того, почему не наблюдали регрессии опухоли после введения CART, проводили различные анализы. Опухоли EMMESCO исследовали и было обнаружено, что mesoCART присутствует в больших количествах, однако T-клетки, презентирующие его, стали гипофункциональными. Учитывая, что уровень экспрессии CAR на TIL с CAR был равным или превышающим уровень экспрессии на клетках перед инъекцией (фиг.11A и 11B), авторы настоящего изобретения сравнили их функциональную активность. Авторы настоящего изобретения выделили и проанализировали mesoCAR TIL из опухолей EMMESO через 40 суток после инъекции (все исследования начинали сразу после выделения) и сравнивали их с той же партией mesoCAR T-клеток, которую использовали для первоначальной инъекции, и замораживали ("cryo mesoCAR"). Клетки исследовали после размораживания и инкубации при 37°C/5% CO2 в течение 18 ч. Когда cryo mesoCAR T-клетки и mesoCAR TIL из боковой области добавляли к культивируемым клеткам EMMESO, экспрессирующим люциферазу светлячка (EMMESOffluc), в соотношении 20:1 в течение 18 часов, mesoCAR T-клетки были в высокой степени эффективными в отношении уничтожения опухолевых клеток (>95%), в то время как mesoCAR TIL уничтожили только приблизительно 10% опухолевых клеток за этот же период времени (фиг.11C, p<0,001).
[00689] Дополнительный анализ также продемонстрировал, что mesoCAR T-клетки не продуцировали цитокины, такие как IL-2 и IFNg, после воздействия антигена или PMA/иономицина. Напротив, cryo-meso CAR T-клетки продуцировали цитокины. MesoCAR T-клетки продемонстрировали сниженную передачу сигнала посредством снижения или отсутствия экспрессии фосфо-ERK в иммуноблоттинге через 20 минут после воздействия гранул, покрытых антителами против CD3/CD28. Напротив, cryo-meso CAR T-клетки сохраняли экспрессию фосфо-ERK после воздействия гранул.
[00690] MesoCAR TIL человека экспрессируют повышенные уровни ингибиторных рецепторов
[00691] Далее экспрессию четырех ингибиторных рецепторов (IR), которая ранее была описана в гипофункциональных TIL, полученных от человека, оценивали с использованием проточной цитометрии на: i) cryo mesoCAR T-клетках, которые использовали для инъекции, ii) свежевыделенных mesoCAR TIL из EMMESO на 39 сутки, и iii) "выделенных" mesoCAR TIL, которые были извлечены из опухоли 24 часа до этого (таблица 6). CAR TIL экспрессировали высокие уровни ингибиторных рецепторов. Эти уровни в основном были значительно более низкими через 24 часа после выделения из микроокружения опухоли. Для CD4 CAR TIL, уровень PD-1 снижался от 73% до 53%, уровень LAG-3 снижался от 63% до 3%, и уровень TIM3 снижался от 24% до 1%. Экспрессия 2B4 была высокой и оставалась повышенной после покоя (от 67% до 88%). Для CD8 CAR TIL, уровень PD-1 снижался от 26% до 21%, уровень LAG-3 снижался от 48% до 13%, и уровень TIM3 снижался от 56% до 1%. Экспрессия 2B4 была высокой и оставалась повышенной после покоя (от 96% до 98%).
[00692]
[00693]
[00694] Три из этих IR также оценивали на T-клетках человека, которые можно было выделить из селезенок мышей EMMESO. Интересно, что уровни экспрессии всех из PD-1, TIM3 и LAG3 были ниже на T-клетках селезенки по сравнению с TIL (таблица 7), что подтверждает ключевую роль микроокружения опухоли в активации IR.
[00695]
[00696]
[00697] mesoCAR TIL человека экспрессируют увеличенные уровни внутриклеточных ингибиторных ферментов
[00698] Уровни экспрессии двух имманентных ингибиторов T-клеточной функции, которые вовлечены в дисфункцию TIL: SHP-1 и DGK, исследовали с использованием иммуноблоттинга (фиг.12). Уровни обеих изоформ DGK (альфа и зета), а также фосфорилированной формы SHP1 (pSHP1), были значительно повышенными в mesoCAR TIL, которые были свежевыделенными из опухоли EMMESO боковой области по сравнению с покоившимися в течение ночи TIL. Это также было подтверждено для DGK с использованием проточной цитометрии, где 23% свежих EMMESO TIL экспрессировали DGK. Экспрессия не поддавалась обнаружению после покоя в течение ночи.
[00699] Блокирование ингибиторов в mesoCAR T-клетках человека повышает их функцию уничтожения ex vivo.
[00700] Учитывая эти данные экспрессия, потенциальную функциональную важность конкретных ингибиторных путей в mesoCAR TIL исследовали путем введения доступных блокирующих агентов в ходе анализов уничтожения ex vivo и высвобождения цитокинов. Добавление антитела против PDL1 в значительной степени восстанавливало активность уничтожения и способность секретировать IFN посредством mesoCAR TIL (фиг.13A и 13B). Относительно высокая доза антитела против PDL1 10 мкг/мл была основана на ранее опубликованных исследованиях иммунотерапии злокачественной опухоли. Добавление ингибитора DGK либо типа I, либо типа II значительно увеличивало способность к уничтожению (фиг.13C), но без значительного увеличения индуцируемой опухолью секреции IFN (фиг.13D). Добавление ингибитора SHP1, стибоглюконата натрия (SSG), немного ингибировало способность cryo mesoCAR T-клеток к уничтожению, но значительно увеличивало ее у mesoCAR TIL (фиг.13E), а также значительно увеличивало индуцируемую опухолью секрецию IFN (фиг.13F) mesoCAR TIL. Кривые доза-эффект получали как для ингибиторов DGK, так и для SSG, и использовали наиболее высокие дозы, которые не индуцировали прямого уничтожения опухолевых клеток.
[00701] Взятые вместе, результаты этих экспериментов демонстрируют, что гипофунукция CART in vivo является обратимой. В частности, модулирование ингибиторных механизмов, которые снижают функцию CART, может увеличить эффекторную функцию и, таким образом, может повысить терапевтическую эффективность. Ингибиторы ингибиторных рецепторов, такие как PD-1, LAG3 и TIM3, можно использовать в комбинированной терапии с CART для повышения эффективности.
[00702] Пример 8: Охарактеризация meso CAR человека
[00703] Получение CART-MSLN человека
[00704] PBMC нормального индивидуума выделяли из образца крови. PBMC трансдуцировали лентивирусными конструкциями, содержавшими CAR против мезотелина человека, описанные в настоящем описании. Трансдукция и культивирование клеток для получения CART-MSLN описаны в предшествующих примерах. Полученные CART экспрессировали CAR против мезотелина с конструкциями scFv, включающими M1, M2, M3, M4, M5, M6, M7, M8, M9, M10, M11, M12, M13, M14, M15, M16, M17, M18, M19, M20, M21, M22, M23 и M24. Также получали контрольные CART, включая CART, экспрессировавшие CAR-ss1 (scFv мыши против мезотелина) (в качестве положительного контроля) и CART против CD19 (в качестве отрицательного контроля).
[00705] Анализ цитокинов
[00706] Оценивали продукцию цитокинов после стимуляции опухолевыми клетками. CART, экспрессировавшие M5, M11, M17, M21, ss1 и CAR19, смешивали с различными опухолевыми клеточными линиями в соотношении эффектора и мишени 1:1, и высевали в количестве 50000 клеток на лунку. Опухолевые клеточные линии представляли собой K562-meso (клеточная линия CML, экспрессирующая мезотелин), Ovcar3 (рак яичника), Ovcar8 (рак яичника) и SW1990 (аденокарцинома поджелудочной железы). Через 24 часа проводили анализ CBA для определения экспрессии и/или секреции цитокинов IFNγ, TNF, IL-2 и IL-4.
[00707] Как показано на фиг.15A, CART-MSLN21 (M21) приводит к наиболее высокой активации посредством K562-Meso. В CART-MSLN5 и CART-MSLN11 стимулировалась продукция IFNγ посредством SW1990. Продукция/секреция IL-2 была сходной для исследованных CART-MSLN (фиг.15C). Как показано на фиг.15D, практически отсутствовала какая-либо продукция IL-4. Другие исследования также продемонстрировали очень слабую продукцию IL-10.
[00708] Анализ уничтожения
[00709] Способность CART-MSLN нацеливаться и уничтожать опухолевые клетки также оценивали in vitro. Использовали анализ на основе люциферазы с опухолевыми клеточными линиями, экспрессируюищми люциферазные репортеры. Клетки-мишени (опухолевые клетки) высевали в количестве 20000 мишеней/лунка. CART-MSLN добавляли в различных соотношениях эффектор:мишень: 10:1, 5:1, 2,5:1, и 1:1. Клетки культивировали в течение 20 часов, и проводили детекцию люминесценции в каждой лунки для определения процента уничтоженных клеток-мишеней. В качестве клеток-мишеней использовали экспрессирующие люциферазу клеточные линии Ovcar3 (рак яичника) и U87mg (глиобластома).
[00710] Как показано на фиг.16A, CART, экспрессирующие M5, M11, M17 и ss1 были сходным образом высокоэффективными в отношении уничтожения опухолевых клеток. Для CART-MSLN21 не наблюдали уничтожения опухолевых клеток. Напротив, не наблюдали уничтожения опухолевых клеток для любых конструкций CART в случае клеток глиобластомы (фиг.16B). Сходные результаты были получены для панели клеток meso CAR человека, где M11, M5, M17 и SS1 имели наиболее высокое специфическое уничтожение клеток Ovcar3 (фиг.17A и 17B).
[00711] Модель на мышах in vivo
[00712] Противоопухолевую активность CART-MSLN оценивали in vivo в модели с ксенотрансплантатом Ovcar8. 10×106 клеток Ovcar8 имплантировали подкожно на 0 сутки мышам NSG. На 14 сутки 2×106клетокCART (CART, экспрессирующие M5, M11, M17, M21, SS1 и CD19, или нетрансдуцированных клеток; 10×106 тотальных T-клеток) в дозе 100 мкл вводили внутривенно. Мониторинг мышей и опухолей проводили в течение приблизительно 40 суток после имплантации опухолевых клеток.
[00713] Результаты этого эксперимента демонстрируют, что CART, экспрессирующие M5 и M11, проявляют мощную противоопухолевую активность в этой модели (фиг.18). По сравнению с группой имитирующего введения, мыши, которым вводили M5 и M11, проявляли статистически значимое уменьшение опухоли (p<0,05).
[00714] Второй эксперимент с ксенотрансплантацией in vivo проводили для оценки противоопухолевой активности второго набора клеток CART-MSLN. 10x106 клеток OVCAR8-mcherry инъецировали мышам NSG. После достижения опухолями 150-250 мм2, мышей случайным образом распределяли на группы введения. CART, экспрессировавшие M12, M14, M16, M23, ss1, CD19, или необработанные клетки инъецировали в дозе 10×106T-клеток в 100 мкл. Приблизительно 40% T-клеток были экспрессирующими CAR, и, таким образом, во введенной дозировке приблизительно 4×106 CART-клеток доставляли каждому животному. Результаты этого эксперимента показывают, что CART, экспрессирующие CAR человека против MSLN (M12, M14, M16 и M23), не имели эффекта на рост опухоли (фиг.19). Эти результаты, взятые вместе с результатами для первого набора оцененных CART-MSLN, указывают на то, что M5 и M11 имеют специфическую противоопухолевую активность по сравнению с другими исследованными CART-MSLN, и, таким образом, демонстрируют их потенциал для дальнейшего исследования для терапии злокачественной опухоли. Кроме того, CART-SS1 не проявляли какой-либо противоопухолевой активности в первом эксперименте с ксенотрансплантатом или втором эксперименте с ксенотрансплантатом, далее указывая на то, что CART-MSLN, содержащие M5 и M11, являются более эффективными в отношении снижения роста опухоли.
Пример 9: Ингибирование DGK повышает эффективность CART
[00715] Предшествующие исследования, например, эксперименты, рассмотренные в примере 6, позволили предположить, что CAR T-клетки утрачивают эффективность с течением времени in vivo (например, в микроокружении опухоли). В частности, mesoCAR T-клетки, которые инъецировали в модели опухоли на мышах, выделяли из опухолей после инфузии T-клеток (например, через 39 после инфузии, далее называемые инфильтрирующими опухоль лимфоцитами, TIL) и оценивали в отношении их функциональной активности по сравнению со свежеразмороженными mesoCAR T-клетками. Результаты показали, что в анализах уничтожения ex vivo и анализах высвобождения IFNγ, mesoCAR T-клетки, выделенные из опухоли, имели сниженную способность к уничтожению опухолевых клеток (фиг.20A), сниженную продукцию IFNg (фиг.20B) и сниженную передачу сигнала ERK (как показано по фосфорилированию в анализе с использованием вестерн-блоттинга, фиг.20C) в ответ на антиген или стимулы CD3/CD28 (что указывает на сниженную активацию T-клеток).
[00716] Ингибиторные механизмы, которые возможно объясняют снижение активности CAR T-клеток in vivo с течением времени, включают: растворимые факторы (TGFb, PGE2, аденозин, IL10, лиганды RAGE, и т.д.), контакт клеток с клетками (PD-1, LAG3, CTLA4, TIM3, CD160, и т.д.), и имманентные индуцируемые активацией внутриклеточные системы отрицательной обратной связи (диаглицеринкиназы: изоформы α и ζ, Egr (2 и 3), SHP-1, NFAT2, BLIMP-1, Itch, GRAIL, Cbl-b, Ikaros, и т.д.). Активация T-клеток может индуцировать факторы, такие как DGK. DGK, в свою очередь, ингибируют передачу сигнала DAG посредством фосфорилирования DAG. Это ограничивает индуцируемую DAG активацию каскада RAS-ERK-AP1, который приводит к активации T-клеток. Предшествующие исследования показали, что мыши с дефицитом DGKα или DGKζ имеют CD4 T-клетки, которые демонстрируют усиленную передачу сигнала и оказались более устойчивыми к индуцируемым анергией стимулам.
Анализы цитотоксичности и высвобождения цитокинов in vitro
[00717] Для исследования эффекта ингибирования DGK на эффективность CART-клеток, использовали трансгенных мышей с делециями генов DGK: DGKα, DGKζ или обоих из них. T-клетки селезенки из мышей дикого типа и мышей с дефицитом DGK выделяли и трансдуцировали для экспрессии mesoCAR (SS1 BBZ) с использованием ретровируса. В качестве контроля использовали CAR против MIGR1.
[00718] Анализ цитотоксичности проводили с использованием способов, сходных со способами, описанными в предшествующих примерах. Клетки дикого типа и с дефицитом DGK (KO), экспрессирующие mesoCAR, инкубировали в различных соотношениях эффектор:мишень и количественно определяли цитотоксичность (% уничтоженных клеток-мишеней) (фиг.21). Как показано на фиг.21, делеция DGK значительно усиливала эффекторную функцию CAR T-клеток, особенно при низких соотношениях эффектор:мишень.
[00719] Аналогично, исследовали высвобождение IFNγ в ответ на клетки-мишени при различных соотношениях эффектор:мишень через 18 часов. Как показано на фиг.22, было обнаружено, что делеция DGK значительно усиливает эффекторную функцию mesoCAR T-клеток, особенно при низких соотношениях эффектор:мишень.
[00720] Анализ с использованием вестерн-блоттинга mesoCAR T-клеток с дефицитом DGK по сравнению с mesoCAR T-клетками дикого типа продемонстрировал увеличенное фосфорилирование ERK (фиг.23), что указывает на то, что присутствие DGK подавляет передачу сигнала ERK, в то время как делеция DGK приводит к увеличенной передаче сигнала ERK. Увеличение передачи сигнала ERK на фоне делеции DGK указывает на то, что ингибирование DGK приводит к активации каскада Ras-ERK-AP1, и, таким образом, к активации T-клеток.
[00721] В недавних исследованиях было показано, что TGFβ модулирует функциональность инфильтрирующих опухоль CD8 T-клеток путем препятствования передаче сигнала RAS/ERK, тех же сигнальных молекул, посредством которых дефицит DGK усиленные T-клеточные эффекты. Исследовали чувствительность дефицитных по DGK mesoCAR T-клеток к TGFβ. WT и дефицитные по DGK mesoCAR T-клетки инкубировали с экспрессирующими мезотелин опухолевыми клетками AE17 + или –10 нг/мл TGFβ в течение 18 часов. Измеряли цитотоксичность и продукцию IFNg этими T-клетками. Как показано на фиг.24, TGFβ ингибировал уничтожение на 50% в WT CAR T-клетках (стрелки). Однако это индуцируемое TGFβ ингибирование не наблюдалось в CAR T-клетках с делецией DGK, что демонстрирует, что клетки с дефицитом DGK являются нечувствительными к модулированию посредством TGFβ и являются более устойчивыми к ингибиторным стимулам, таким как TGFβ, что может приводить к увеличению активности T-клеток.
Терапевтическая эффективность mesoCAR и ингибирование DGK in vivo
[00722] Далее терапевтическую эффективность mesoCAR T-клеток исследовали в контексте ингибирования или дефицита DGK. Опухолевые клетки AE17meso (клетки мезотелиомы) инъецировали подкожно мышам C57BL/6. Когда опухоли достигали 100 мм3 (приблизительно через одну неделю), инъецировали 10 миллионов mesoCAR T-клеток через хвостовую вену. Затем наблюдали объемы опухоли в течение по меньшей мере 18 суток.
[00723] MesoCAR T-клетки с дефицитом DGK продемонстрировали усиленную и пролонгированную противоопухолевую активность по сравнению с клетками mesoCAR дикого типа (WT) и клетками в отсутствие введения (фиг.25A). В частности, было показано, что в каждом из трех случаев mesoCAR T-клеток с дефицитом DGK ингибировался рост опухоли по объему по сравнению с клетками WT и клетками в отсутствие введения вплоть до 18 суток после инъекции. Также было показано, что клетки с дефицитом DGKz, экспрессирующие mesoCAR, являются живучими и пролиферируют лучше у мышей, чем meso CAR T-клетки дикого типа (фиг.25B).
[00724] Эти результаты, взятые вместе, демонстрируют, что ингибирование DGK в комбинации с введением mesoCAR T-клеток может повысить активацию mesoCAR T-клеток и противоопухолевую активность при терапии.
Пример 10: Ингибирование Ikaros усиливает противоопухолевую способность CAR T-клеток
[00725] Одной из основных проблем терапии T-клетками с CAR является активация имманентных отрицательных регуляторов T-клеточной передачи сигнала, таких как диацилглицеринкиназа (DGK). Как описано в примере 9, Было показано, что T-клетки с CAR утрачивают эффективность in vivo с течением времени. Было показано, что ингибирование отрицательных регуляторов T-клеточной функции, таких как DGK, повышает активность и функцию экспрессирующих CAR T-клеток.
[00726] Другим важным отрицательным регулятором T-клеточной функции является фактор транскрипции Ikaros. В отличие от DGK, которые действуют в основном вблизи передачи сигнала TCR, Ikaros представляет собой ДНК-связывающий белок с цинковыми пальцами, который подавляет экспрессию генов посредством привлечения ремоделирующих хроматин комплексов, таких как Sin3A, CtBP и HDAC. Ikaros играет роль в регуляции продукции цитокинов и цитолитической функции в CD4+ T-клетках и CD8+ T-клетках.
[00727] В этом примере исследовали противоопухолевую эффективность трансдуцированных ретровирусом T-леток с CAR с сниженной экспрессией Ikaros in vitro и in vivo.
[00728] Материалы и способы
[00729] Клеточные линии. Клетки мезотелиомы мыши AE17 описаны в Jackman et al., J Immunol. 2003;171:5051-63). Мезотелин человека вводили в клетки AE17 посредством лентивирусной трансдукции. Клетки 3T3Balb/C приобретали от American Type Culture Collection. Клетки мыши 3T3BALB/C, экспрессирующие FAP (3T3.FAP), получали посредством лентивирусной трансдукции родительской линии FAP-3T3 посредством FAP мыши.
[00730] Животные. Свободных от патогенов мышей C57BL/6 приобретали от Charles River Laboratories Inc. (Wilmington, MA). Мыши Ikaros DN +/- содержат один аллель Ikaros дикого типа, и один аллель Ikaros с делецией ДНК-связывающего домена (Winandy et al., Cell. 1995; 83:289-99). Мыши Ikzf1 +/- имеют один аллель Ikaros дикого типа и один аллель с делецией экзона 7 (Avitahl et al., Immunity. 1999; 10:333-43). Животные, использованные для всех экспериментов, представляли собой самок мышей в возрасте от 6 до 12 недель, и их содержали в свободных от патогенов вивариях.
[00731] Выделение, трансдукция и увеличение в количестве первичных T-лимфоцитов мыши. Первичные T-клетки селезенки мыши выделяли с использованием набора "Pan T cell Negative Selection" kit, в соответствии с рекомендациями изготовителя (Miltenyi Biotec), и активировали в 24-ячеечных планшетах (4×106 клеток/лунка в 2 мл RPMI-1640, дополненной 100 Е/мл IL-2), предварительно покрытых CD3 (1 мкг /мл) и CD28 (2 мкг/мл). Через 48 часов клетки (1×106клеток/лунка) смешивали с ретровирусом (1 мл неочищенный супернатант вируса) в 24-ячеечном планшете, покрытом ретронектином (50 мкг/мл; Clontech) и центрифугировали без торможения при комнатной температуре в течение 45 минут при 1200g. После инкубации в течение ночи клетки увеличивали в количестве с использованием 50 Е/мл IL-2 в течение дополнительных 48 часов.
[00732] Гранулы, покрытые антигеном или антителом. Рекомбинантный белок мезотелин-внеклеточный домен, бычий сывороточный альбумин (Fisher Scientific) или антитела против CD3/CD28 (eBioscience) химически сшивали с активированными тозилом 4,5-мкм Dynabead (Invitrogen, #140-13) в соответствии с инструкциями изготовителя.
[00733] Иммуноблоттинг. T-клетки, трансдуцированные CAR против мезотелина, инкубировали либо с гранулами, покрытыми либо BSA, либо с мезотелином, либо антителом против CD3 (в соотношении гранул и T-клеток 2:1) в течение 5 и 20 мин. Затем получали тотальные клеточные лизаты и подвергали их иммуноблоттингу в отношении фосфорилированной ERK, фосфорилированной AKT, фосфорилированной IKK, фосфорилированной JNK, фосфорилированной Lck, фосфорилированной PKC, фосфорилированной PLC или фосфорилированной ZAP70. Все антитела против фосфобелка приобретали от Cell Signaling, за исключением антител против фосфо-Lck, которые приобретали от Sigma Aldrich. Реактивное в отношении C-конца антитело козы против Ikaros мыши (SC-9861) и антитело козы против актина мыши (SC-1615) приобретали от Santa Cruz. Уровни экспрессии β-актина определяли для нормализации отличий в нагрузке.
[00734] Цитотоксичность и ELISA для IFN. КлеткиAE17, AE17.meso, 3T3 и 3T3.FAP трансдуцировали люциферазой, как описано (Moon et al., Clinical Cancer Research. 2011; 17:4719-30). T-клетки и клетки-мишени сокультивировали в указанных соотношениях в трех экземплярах в 96-луночных круглодонных планшетах. Через 18 часов культуральные супернатанты собирали для анализа IFN с использованием ELISA (IFN мыши, BDOpEIA). Цитотоксичность трансдуцированных T-клеток определяли посредством обнаружения остаточной люциферазной активности клеточного лизата с использованием анализа, описанного ранее (Riese et al., Cancer Res. 2013; 73:3566-77).
[00735] Перенос T-клеток с CAR мышам, имеющим развернутые опухоли. Мышам C57BL/6инъецировали подкожно 2×106 опухолевых клеток AE17.meso в дорсально-латеральную область. Мышей, имеющих крупные развившиеся опухоли (100-150 мм3) случайным образом распределяли для введения либо T-клеток с CAR дикого типа, либо T-клеток с CAR с дефицитом Ikaros, либо оставляли без введения (минимум пять мышей на группу, каждый эксперимент повторяли по меньшей мере один раз). 1×107 T-клеток вводили через хвостовую вену. Размер опухоли измеряли с использованием электронных весов и толщиномеров, соответственно.
[00736] для оценки активности T-клеток на 9 стуки селезенку и опухоли преобразовывали в суспензии отдельных клеток, как описано ранее (Moon et al., Clinical Cancer Research. 2014; 20(16):4262-73). Суспензии отдельных спленоцитов и опухолевых клеток рестимулировали растворимыми антителами против CD3/CD28 (1,0 мкг/мл) или форболовым сложным эфиром/иономицином (PMA/I: 30 нг/мл, 1 мкМ) в течение 4-6 часов в присутствии Golgi Stop (BD Biosciences, 0,66 мкл /мл), а затем собирали для проточно-цитометрического анализа.
[00737] Проточно-цитометрические анализы. Конъюгированные с флуорохромом антитела против IFN-γ мыши (XMG1), против CD25 мыши (PC61), против IL-2 мыши (JES6-1A12), против CD8 мыши (53-6.7), против CD44 мыши (IM7) и против CD4 мыши (GK1.5) приобретали от Biolegend. Фиксированную линию Live/Dead Aqua (L34957) приобретали от Invitrogen. Конъюгированное с флуорохромом антитело против гранзима B мыши (NGZB) и FoxP3 (FJK-16s) приобретали от eBioscience. Конъюгированные с флуорохромом антитела против TNF-α мыши (MP6-XT22) и против CD69 мыши (H1.2F3) приобретали от BD Biosciences. Для внутриклеточного окрашивания цитокинов клетки обрабатывали Golgi Stop (BD Biosciences, 0,66 мкг/мл) в течение 4-6 часов. После сбора клетки фиксировали 1% параформальдегидом в течение 30 минут, центрифугировали и промывали один раз буфером для FACS. Затем клетки промывали BD Perm Wash (BD Biosciences) 2 раза, а затем окрашивали антителами против цитокинов в течение 45 минут при комнатной температуре. Клетки промывали 2 раза BD Perm Wash, а затем ресуспендировали в буфере для FACS. Для окрашивания факторов транскрипции клетки подвергали поверхностному окрашиванию меченными флуорохромом первичными антителами в течение 20 минут на льду. После промывания в буфере для FACS клетки фиксировали буфером Fix/Perm от eBioscience. После фиксации обеспечивали проницаемость клеток и их окрашивали посредством APC против FoxP3 мыши. Для окрашивания Ikaros использовали антитело кролика против Ikaros мыши (Abcam, ab26083, 1:2000) после фиксации и обеспечения проницаемости посредством набора eBioscience FoxP3. После окрашивания антителом против Ikaros клетки промывали, а затем окрашивали меченным PE вторичным антителом против антител кролика (1:2000). После завершения окрашивания клетки обрабатывали на CyanADP (Beckman Coulter) для проточно-цитометрического анализа.
[00738] Статистический анализ. Все статистические тесты проводили с использованием GraphPad Prism. Двухсторонний ANOVA проводили посредством апостериорного тестирования с * p<0,05, ** p<0,01, *** p<0,001 и **** p<0,0001. Данные представлены в качестве среднего значения +/- SEM.
[00739] Результаты
[00740] Продукция цитокинови высвобождение цитолитических медиаторов в экспрессирующих CAR T-клетках со сниженными уровнями Ikaros являются усиленными
[00741] Учитывая, что цитолитические T-лимфоциты (CTL) со сниженными уровнями Ikaros имеют усиленную эффекторную функцию in vitro и in vivo (O’Brien, et al., J Immunol. 2014; 192:5118-29), проводили эксперименты для исследования того, может ли истощение Ikaros повысить эффективность терапии T-клетками с CAR. T-клетки, полученные от мышей C57BL/6 и мышей с гаплодефицитом Ikaros (Ikzf1 +/-) на фоне C57BL/6 трансдуцировали ретровирусом для экспрессии CAR против мезотелина. После активации, трансдукции и увеличения в количестве ex vivo с использованием IL2, было подтверждено, что, по сравнению с CAR T-клеткамми дикого типа (WT), Ikzf1 +/- T-клетки с CAR продолжали экспрессировать меньше белка Ikaros согласно проточной цитометрии и вестерн-блоттингу (фиг.26A).
[00742] Поскольку Ikaros является транскрипционным репрессором для множества генных локусов цитокинов (Thomas et al., J Immunol. 2007; 179:7305-15; Bandyopadhyay et al., Blood. 2006; 109:2878-2886; Thomas et al., J of Biological Chemistry. 2010; 285:2545-53; и O’Brien et al., J Immunol. 2014; 192:5118-29), далее исследовали, приводило ли снижение уровня Ikaros к аутокринной проудкции цитокинов CAR T-клетками, а также то, отвечали ли CAR T-клетки с гаплодефицитом Ikaros, лучше, чем их аналоги WT, на их антиген-мишень. CAR T-клетки как WT, так и Ikzf1 +/-, стимулировали гранулами, покрытыми либо BSA (контроль), либо мезотелином (антиген CAR) в соотношении гранулы:T-клетки 2:1 в течение 6 часов, и анализировали их способность продуцировать IFNγ, TNFβ и IL2 посредством проточной цитометрии. На исходном уровне (стимуляция BSA), происходило увеличение в ~3 раза продукции IFN в Ikzf1 +/- CAR T-клетках по сравнению с WT CAR T-клетками (4,35% против 1,4%, фиг.26B), но не было значимых отличий в % продуцирующих IL2 клеток (фиг.26D). После стимуляции покрытыми мезотелином гранулами происходило значительное увеличение % продуцирующих IFN-γ Ikzf1 +/- CAR T-клеток (25%), в то время как в WT CAR T-клетках ответ был умеренным (7%). Также наблюдали увеличение продукции TNFα (фиг.26C). Для исследования того, было ли это усиление продукции цитокинов генерализованным для различных стимулов, или оно ограничивалось антигеном CAR, как WT, так и Ikzf +/- CAR T-клетки обрабатывали PMA и иономицином в течение 6 часов. В этом случае, больше клеток, продуцирующих цитокины IFN γ, TNF-β и IL-2, наблюдали в случае Ikzf1 +/- CAR T-клеток по сравнению с их аналогами WT (фиг.26B-26D). Эти данные подтверждают гипотезу, что Ikaros является одним из ограничивающих факторов, которые подавляют продукцию цитокинов T-клетками или CAR T-клетками.
[00743] Было показано, что важный цитотоксический медиатор гранзим B активируется в активированных CD3/CD28 клетках с дефицитом Ikaros OT-I, и это увеличивало их цитолитическую активность против экспрессирующих OVA опухолевых клеток EL4 (O’Brien et al., J Immunol. 2014; 192:5118-29). Было предположено, что продукция гранзима B также будет усиливаться в Ikzf +/- T-клетках, содержащих CAR. Как WT, так и Ikzf1 +/- CAR T-клетки стимулировали гранулами, покрытыми либо BSA (исходный уровень), либо мезотелином (антиген CAR) в соотношении гранулы:T-клетки 2:1 в течение 6 часов. В качестве положительного контроля для анализа использовали PMA/иономицин. Аналогично описанным выше данным, уровень гранзима B был более высоким в Ikzf +/- CAR T-клетках, чем в WT CAR T-клетках на исходном уровне (стимуляция BSA; фиг.26E). После стимуляции либо покрытыми мезотелином гранулами, либо PMA/иономицином, уровень гранзима B возрастал как в WT, так и в Ikzf +/- CAR T-клетках, однако продукция была значительно более высокой в Ikzf +/- CAR T-клетках (фиг.26E). Для определения того, существовало ли также отличие в дегрануляции CAR T-клеток со сниженным уровнем Ikaros оценивали экспрессию CD107a после стимуляции антигеном. Трансдуцированные T-клетки дикого типа имели умеренные уровни экспрессии CD107a после рестимуляции антигеном, однако T-клетки со сниженным уровнем Ikaros продемонстрировали усиленную активацию CD107a (фиг.26F). Таким образом, в ответ на рестимуляцию CTL со сниженным уровнем Ikaros вызывают более высокое подавление и высвобождают больше цитотоксических медиаторов по сравнению с их аналогами дикого типа.
[00744] Истощение Ikaros с использованием доминантно-негативного аллеля усиливает функцию CAR T-клеток
[00745] В дополнение к клеткам с более низкими уровнями Ikaros, исследовали T-клетки от мышей, экспрессирующих один доминантно-негативный аллель Ikaros (IkDN). Трансгенные мыши, экспрессирующие IkDN, имеют нормальное развитие лимфоидной системы, но имеют периферические T-клетки со сниженной на 90% ДНК-связывающей активностью Ikaros (Thomas et al., J Immunol. 2007; 179:7305-15; и Winandy et al., Cell. 1995; 83:289-99). T-клетки, выделенные из селезенок мышей WT и IkDN, активировали связанными с планшетами антителами против CD3/CD28, трансдуцировали CAR против мезотелин, а затем увеличивали в количестве с использованием IL2. Нокдаун Ikaros в CAR T-клетках IkDN подтверждали с использованием вестер-блоттинга. WT и IkDN CAR T-клетки повторно нагружали гранулами, покрытыми либо BSA, либо мезотелином, в соотношении гранулы:T-клетки 2:1 в течение 6 часов, и анализировали их способность продуцировать IFN и IL2, а также дегранулировать в ответ на антиген CAR. Аналогично данным для Ikzf1 +/-, представленным выше, наблюдали некоторую аутокринную продукцию IFNγ на исходном уровне (фиг.27A), но не при использовании IL2 (стимуляция BSA; фиг.27B). При лигировании CAR с их антигеном-мишенью, мезотелином, T-клетки IkDN продуцировали больше IFNγ, чем WT T-клетки (стимуляция мезотелином; фиг.27A). Дегрануляция при измерении по активации CD107a, также была сходной как в CAR T-клетках дикого типа, так и в IkDN CAR T-клетках (фиг.27D).
[00746] Истощение Ikaros не усиливало активацию и передачу сигнала CAR T-клеток после стимуляции антигеном
[00747] Учитывая, что истощение Ikaros усиливало высвобождение цитокинов и увеличивало уровни гранзима B и экспрессию CD107a на CAR T-клетках, исследовали возможные механизмы. Является возможным, что эти изменения эффекторной функции могут быть следствием отличий в активации трансдуцированных T-клеток дикого типа и Ikzf1 +/-. Таким образом, уровни CD69, CD25 и 4-1BB (маркеры активации T-клеток) измеряли проточной цитометрией после стимуляции покрытыми мезотелином гранулами в течение 6 и 24 часов. CD69, ранний маркер активации, активировался в одинаковой степени как клетками дикого типа, так и клетками Ikzf1 +/- (фиг. 28A). При более длительной стимуляции экспрессирующие CAR T-клетки дикого типа и Ikzf1 +/- продолжали экспрессировать сходные уровни CD69, однако трансдуцированные T-клетки Ikzf1 +/- проявляли увеличенную экспрессию CD25 (фиг.28B). Это может непрямо указывать на различие в активации T-клеток, однако, поскольку увеличение уровня IL-2 в клетках Ikzf1 +/- (фиг.28D) может действовать посредством положительной связи в прямом направлении на CD25, IL-2Ra (Depper et al., Proc Natl Acad of Sci USA. 1985; 82:4230-4; и Nakajima et al., Immunity. 1997; 7:691-701). 4-1BB, представитель суперсемейства рецепторов TNF также экспрессируется на активированных T-клетках (Vinay et al., Seminars in Immunology. 1998; 10:481-9) и он экспрессировался на сходных уровнях трансдуцированными CAR T-клетками дикого типа и Ikzf1 +/- после стимуляции антигеном (фиг.28C). Таким образом, функциональные различия между трансдуцированными T-клетками WT и Ikzf1 +/- не были следствием различий в активации T-клеток.
[00748] Эксперименты, описанные в примере 9 и Riese et al., Cancer Research. 2013; 73:3566-77, демонстрирует, что истощение фермента диацилглицеринкиназы (DGK) в CAR T-клетках приводило к увеличению передачи сигнала RAS/ERK, которое хорошо коррелировало с усиленной активацией CAR T-клеток. Исследовали некоторые пути передачи сигнала в T-клетках WT и с дефицитом Ikaros после стимуляции TCR антителами против CD3/CD28. Лизаты стимулированных T-клетках получали и подвергали иммуноблоттингу в отношении различных фосфобелков, вовлеченных в проксимальную (PLC и Lck) и дистальную (ERK1/2, JNK, AKT и IKKa) передачу сигнала от TCR. В T-клетках с дефицитом Ikaros существовала конститутивная исходная активация на низком уровне некоторых сигнальных белков TCR, включая Lck, ERK и AKT (фиг.28D). При стимуляции TCR/CD28 все исследованные белки были фосфорилированным до некоторого уровня по сравнению с T-клетками WT и с дефицитом Ikaros, за исключением фосфо-IKK, уровень которого был более выше в T-клетках с дефицитом Ikaros через 20 минут после стимуляции. Для определения того, был ли путь NFB усилен в T-клетках со сниженным уровнем Ikaros, тот же блот повторно исследовали в отношении IB, нижеследующей мишени для IKK. Отсутствовали отличия в деградации IB между T-клетками WT и с дефицитом Ikaros. Для исследования передачи сигнала CAR T-клетки как WT, так и IkDN, трансдуцированные CAR против мезотелина рестимулировали покрытыми мезотелином гранулами. Аналогично данным, полученным при стимуляции CD3/CD28, не было найдено отличий в фосфорилировании PLC и ERK (фиг.28E). Взятые вместе, эти данные указывают на то, что истощение Ikaros не изменяет опосредуемую TCR/CAR передачу сигнала.
[00749] Снижение уровня Ikaros в CAR T-клетках усиливает их ответ на их клетки-мишени
[00750] Учитывая увеличенную продукцию эффекторных факторов CAR T-клетками со сниженным уровнем Ikaros, исследовали их эффективность против их опухолевых клеток—мишеней in vitro. T-клетки дикого типа, Ikzf1 +/- и IkDN, экспрессировавшие mesoCAR, смешивали в различных соотношениях с родительской опухолевой линией AE17 или экспрессирующей мезотелин клеточной линией AE17meso. Когда их смешивали с родительской клеточной линией все из T-клеток дикого типа, Ikzf1 +/- и IkDN не продуцировали IFN-γ или не лизировали клетки в ответ на AE17 (фиг.29A, 29B и 29C). Напротив, при реакции с AE17meso продукция IFN-γ и цитолиз T-клетками увеличивались по мере увеличения соотношения E:T (фиг.29B и 29C). Однако T-клетки как Ikzf1 +/-, и так и IkDN продуцировали значительно больше IFN-γ и имели значительно увеличенный лизис опухоли, чем T-клетки дикого типа, даже при наиболее низком соотношении E:T 1,3:1 (фиг.29B, и 29C).
[00751] Для исследования генерализуемости этого эффекта, исследовали T-клетки, экспрессирующие другую конструкцию CAR, которая нацелена на белок активации фибробластов (FAP-CAR) и имеет тот же внутриклеточный сигнальный домен, что и CAR против мезотелина, использованный выше. Эффективность сравнительно трансдуцированных посредством FAP-CAR T-клеток селезенки, выделенных из WT C57BL/6, сравнивали с эффективностью аналогичных клетокиз мышей Ikzf1 +/-. Ikzf1 +/- FAP-CAR T-клетки были более эффективными в отношении лизиса клеток 3T3.FAP (фиг.29D) и в отношении секреции IFN (фиг.29E), чем WT FAP CAR T-клетки, с сохранением специфичности in vitro.
[00752] Истощение Ikaros повышает эффективность CAR T-клеток против развернутых опухолей
[00753] Далее исследовали способность мезотелин-специфических T-клеток со сниженным уровнем Ikaros (Ikzf1 +/- и IkDN) контролировать рост развернутых опухолей AE17meso у мышей. Два миллиона опухолевых клеток AE17meso инъецировали в бок сингенных мышей C57BL/6 и позволяли им формировать крупные развернутые опухоли (~100-150 мм3). Затем десять миллионов CAR T-клеток, полученных от мышей WT или с дефицитом Ikaros (Ikzf1 +/- и IkDN), затем подвергали адоптивному переносу мышам, имеющим опухоль, а затем проводили измерения опухолей. Мягкое ингибирование роста опухоли индуцировалось T-клетками дикого типа, трансдуцированными mesoCAR, в то время как T-клетки как Ikzf1 +/-, так и IkDN, трансдуцированные mesoCAR, ингибировали рост опухолей AE17meso в значительно большей степени (фиг.30A и 30B).
[00754] Также исследовали, может ли снижение Ikaros повышать терапевтический потенциал FAP-CAR T-клеток. Мышам с развернутыми опухолями AE17meso (100-150 мм3) проводили адоптивный перенос 10 миллионов T-клеток дикого типа или Ikzf1 +/-, трансдуцированных CAR против FAP мыши. У мышей, которым вводили трансдуцированные клетки дикого типа, происходило минимально замедление роста опухолей и опухоли AE17meso продолжали расти (фиг.30C). Напротив, трансдуцированные T-клетки Ikzf1 +/-, были способны значительно замедлять рост опухоли.
[00755] Ikzf1 +/- CAR T-клетки выживаю дольше и являются более устойчивыми к иммунодепрессивному микроокружению опухоли, чем WT CAR T-клетки
[00756] Учитывая увеличенную эффективность CAR T-клеток с ингибированным Ikaros, исследовали возможные механизмы этого с использованием Ikzf1 +/- mesoCAR T-клеток. Для дальнейшего исследования того, как эти mesoCAR T-клетки функционируют в иммунодепрессивном микроокружении опухоли in vivo, опухоли через 3 и 9 суток после адоптивного переноса собирали и оценивали их количество и функциональность. Эти два момента времени позволили охарактеризацию их активности на ранних и поздних этапах противоопухолевого иммунного ответа.
[00757] На 3 сутки после переноса авторы настоящего изобретения наблюдали сходную частоту mesoCAR T-клеток дикого типа и Ikzf1 +/- как в селезенке (фиг.31A), так и в опухолях (фиг.31B). Эти сходные уровни указывают на то, что mesoCAR T-клетки как дикого типа, так и Ikzf1 +/- первоначально в равной степени хорошо транспортируются в опухоль. При оценке момента времени 9 суток, количество как mesoCAR T-клеток дикого типа, так и Ikzf1 +/- mesoCAR T-клеток, снижалось в селезенке. Однако, когда опухоли исследовали в этот момент времени, происходило значительное увеличение количества Ikzf1 +/- mesoCAR T-клеток по сравнению с WT mesoCAR T-клетками (фиг.31B). Эти данные демонстрируют, что Ikzf1 +/- mesoCAR T-клетки либо выживают, либо пролиферируют лучше, чем WT mesoCAR T-клетки, в иммунодепрессивном микроокружении.
[00758] Инфильтрирующие опухоль лимфоциты (TIL) становятся гипофункциональными в ответ на распознаваемые ими антигены в микроокружении опухоли, и это является ключевым феноменом, ассоциированным с прогрессированием опухоли (Prinz et al., J Immunol. 2012; 188:5990-6000; и Kerkar et al., Cancer Res. 2012; 72:3125-30). Хотя было больше Ikzf1 +/- mesoCAR T-клетках в опухолях на 9 сутки, они все еще могли подвергаться неблагоприятному воздействию микроокружения опухоли. Для оценки функциональности использовали антитела против CD3/CD28 для стимуляции TIL, выделенных из mesoCAR T-клеток дикого типа и Ikzf1 +/- на 9 сутки после переноса, и охарактеризовывали различия в литической продукции медиаторов. На 9 сутки после переноса mesoCAR T-клетки дикого типа в селезенке продолжали продуцировать некоторые умеренные уровни IFN (фиг.31C). Как и ожидалось, выделенные T-клетки дикого типа из опухолей продуцировали значительно меньше этого цитокина по сравнению с T-клетками дикого типа, выделенными из селезенки. Это указывает на то, что TIL дикого типа начинают становиться гипофункциональными на 9 сутки после переноса. Напротив Ikzf1 +/- mesoCAR T-клетки селезенки продолжали продуцировать больше IFN на исходном уровне и при стимуляции (фиг.31C). По сравнению с TIL дикого типа, Ikzf1 +/- TIL продуцировали более высокие количества IFNγ. Эти данные указывают на то, что Ikzf1 +/- TIL могли быть менее чувствительными к иммунодепрессивному микроокружению опухоли.
[00759] Обход проксимального дефекта передачи сигнала TCR, часто наблюдаемый в TIL (Prinz, PU et al., J. Immunol. 2012; 188:5990-6000), может достигаться с использованием PMA/иономицина (PMA/I) (Prinz et al., J Immunol. 2012; 188:5990-6000). MesoCAR T-клетки дикого типа и Ikzf1 +/- рестимулировали PMA/I для определения того, были ли нечувствительные к стимуляции TCR TIL дикого типа и Ikzf1 +/- все еще способны продуцировать цитокины в ответ на другие стимулы. На 9 сутки после переноса TIL дикого типа продемонстрировали заметное снижение продукции IFN-γ (фиг.31C), и оно частично восстанавливалось посредством стимуляции PMA/I (фиг.31D). Однако стимуляция выделенных из селезенки и опухоли Ikzf1 +/- mesoCAR T-клеток все еще приводила к увеличенным уровням IFN-γ по сравнению с перенесенными клетками дикого типа. Вследствие обхода каких-либо дефектов передачи сигнала посредством стимуляции PMA/I, эти результаты демонстрируют, что продукция IFNγ отличается на уровне хроматина и, вероятно, является следствием измененной функции Ikaros.
[00760] Ввиду увеличенной противоопухолевой активности перенесенных Ikzf1 +/- T-клеток, также исследовали влияние на композицию иммунодепрессивного микроокружения опухоли, и оценивали количество регуляторных T-клеток (Treg) и супрессорных клеток миелоидного происхождения (MDSC) на 9 сутки. На 9 сутки после переноса наблюдали сходные уровни Treg в хозяевах, которым вводили mesoCAR T-клетки дикого типа или Ikzf1 +/- (фиг.31E). Определяли присутствие Ly6G-/CD11b+/CD206+ макрофагов, которые, как правило, охарактеризовывали как иммунодепрессивные протуморогенные макрофаги M2. В группах введения на 9 сутки эта экспрессия CD206 была сходной во всех 3 группах (без введения, дикий тип и Ikzf1 +/-) (фиг.31F).
[00761] T-клетки со сниженным уровнем Ikaros являются менее чувствительными к растворимым ингибиторным факторам TGF и аденозину
[00762] Для дальнейшей охарактеризации взаимодействия иммунодепрессивного микроокружения опухоли с mesoCAR T-клетками использовали культуральную систему in vitro. Было показано, что растворимые ингибиторные факторы, такие как IDO, IL-10, аденозин и TGF-β (Wang et al., Oncoimmunology. 2013; 2:e26492) участвуют в ингибировании инфильтрации опухолевых лимфоцитов. Эффекты отдельных ингибиторных факторов in vitro на CAR T-клетки с дефицитом Ikaros исследовали для определения того, может ли иммунодепрессивное окружение влиять на их литическую функцию. CAR T-клетки дикого типа имели 50% снижение их способности продуцировать IFN-γ и имели снижение их литической функции в присутствии TGF-β и аденозина (фиг.32). CAR T-клетки со сниженными уровнями Ikaros (Ikzf1 +/- и IkDN) продолжали продуцировать больше IFN γ, чем их аналоги дикого типа, в отсутствие ингибиторов и только незначительно ингибировались в присутствии TGF β и аденозина (фиг.32A). Наблюдали увеличенную литическую функция в Ikzf1 +/- и IkDN CAR T-клетках по сравнению с T-клетками дикого типа (фиг.32B). Эти данные демонстрируют, что T-клетки со сниженными уровнями Ikaros являются менее чувствительными к ингибированию TGFβ и аденозином.
[00763] Обсуждение
[00764] В этом примере идентифицирован новых подход к обеспечению выживаемости экспрессирующмх CAR T-клеток и усилению их эффекторных функций в опухолевом окружении: инактивация транскрипционного репрессора Ikaros, о котором известно, что он ингибирует разнообразный набор генов, вовлеченных в T-клеточную функцию, например, генов цитокинов (IL2 и IFNγ), цитолитических медиаторов (гранзим B) и ключевых факторов транскрипции T-box, которые влияют на дифференцировку T-клеток (R-Bet и Eomes).
[00765] Важным открытием экспериментов, описанных выше, является то, что CAR T-клетки, которые имели дефицит функции Ikaros, оказались значительно лучшими, чем CAR T-клетки дикого типа, в отношении ограничения роста опухоли (фиг.30). Эти результаты наблюдали в более моделях опухоли и с использованием двух различных конструкций CAR. Вследствие высокого числа генов, которые регулирует Ikaros, возможно, что Ikaros может регулировать множество путей, которые обычно являются чувствительными к иммуносупрессии. Увеличенная продукция IFN-g вследствие снижения уровня Ikaros в CAR T-клетках может приводить к активации экспрессии MHC класса I на опухоли и, тем самым, повышать их иммуногенность иммуногенность, повышать антиангиогенную активность, и запускать опосредуемую STAT1 функцию Th1-клеток. Возможным эффектом увеличения уровня IFNγ может быть изменение фенотипа макрофагов в опухолях, однако не наблюдали отличий в общем количестве макрофагов, а также доле M2-подобных макрофагов (при измерении по экспрессии CD206). Увеличенная продукция IL-2 также могла увеличивать образование CD4 Treg-клеток, однако не наблюдали отличий при сравнении опухолей, в случае которых вводили WT CAR T-клетки и CAR T-клетки с дефицитом Ikaros.
[00766] Наблюдали увеличенное количество инфильтрирующих опухоль лимфоцитов через девять суток после инъекции. Было маловероятно, что это было следствием увеличенного транспорта, поскольку количество WT TIL против TIL с дефицитом Ikaros было сходным на 3 сутки. Вместо этого, эти результаты указывают на то, что TIL с дефицитом Ikaros продемонстрировали увеличенную пролиферацию или сниженную индуцируемую антигеном клеточную гибель (AICD). Исследования in vitro указывают на то, что AICD была сходной между двумя типами T-клеток, что делает более вероятным то, что отличие было следствием увеличенной пролиферации. Это согласуется с увеличенной продукцией IL-2 этими клетками. В дополнение к увеличенной выживаемости, TIL с дефицитом Ikaros оказались менее гипофункциональными. Когда инфильтрирующие опухоль CAR T-клетки рестимулировали антителом против CD3 или PMA и иономициром, CAR TIL с дефицитом Ikaros были способны продуцировать больше IFNγ, чем их аналоги дикого типа (фиг. 31C и 31D).
[00767] Исследования in vitro позволили дальнейшие исследования механистических основ наблюдаемой увеличенной противоопухолевой эффективности in vivo. В соответствии с известными ингибиторными функциями Ikaros, делеция одного аллеля Ikaros (Ikzf +/-) или замена одного из его аллелей доминантно-негативной конструкцией Ikaros (IkDN) приводили к T-клеткам, которые имели в некоторой степени увеличенную исходную аутокринную продукцию IFNγ и гранзима B (фиг.26), но, более важно, продемонстрировали значительно усиленную секрецию цитокинов и высвобождение гранул после стимуляции TCR или CAR in vitro. Это сопровождалось увеличением уничтожения опухолевых клеток in vitro. Для исследования того, имеют ли CAR T-клетки с дефицитом Ikaros более низкий порог активации, чем WT CAR T-клетки, Dynabead покрывали в 10 раз меньшим количеством белка мезотелина, и было показано, что Ikzf +/- CAR T-клетки все еще могли отвечать на антиген мезотелина при низкой плотности, продуцируя IFNγ и TNF-α, а WT CAR T-клетки отвечать не могли. CAR T-клетки с нарушенным Ikaros также были более устойчивыми к ингибированию известными иммунодепрессивными факторами, такими как TGF-β и аденозин (фиг.32). Это может быть следствием того факта, что гены этих цитокинов (т.е. IL2 и IFNγ и T-клеточного эффектора (т.е. гранзима B)) являются более доступными для трансксрипции в T-клетках с дефицитом Ikaros после активации TCR/CAR. Это, по-видимому, способствует компенсации недостаточной активации T-клеток в иммунодепрессивном микроокружении опухоли.
[00768] В предшествующих исследованиях, например, описанных в примере 9, наблюдали сходный фенотип (т.е. увеличение цитолиза и продукции IFN) в CAR T-клетках с истощением DGK ферментов, которые метаболизируют вторичный посредник диацилглицерин и ограничивают активацию RAS/ERK. Однако в случае делеции DGK наблюдали явные изменения в каскаде передачи сигнала посредством CAR/TCR. В частности, активация RAS/ERK значительно усиливалась после активации посредством как TCR, так и CAR. Это приводило к усиленной активации, измеряемой по увеличенной активации CD69, однако продукция эффекторных молекул, таких как TRAIL, FasL и IFNγ, перфорин и гранзим B, была сходной между CAR T-клетками WT и с дефицитом DGK. Значительно отличающийся фенотип наблюдали в этом исследовании с CAR T-клетками с дефицитом Ikaros. В противоположность CAR T-клеткам с дефицитом DGK, CAR T-клетки с дефицитом Ikaros имели сходную активацию посредством CAR/TCR, как показано по активации CD69 и CD25 (фиг.28), и сходную передачу сигнала посредством CAR/TCR при измерении по фосфорилированию множества молекул передачи сигнала TCR (фиг.34) и передаче сигнала кальция. В отличие от T-клеток с дефицитом DGK, CAR T-клетки с истощением Ikaros имели более высокие уровни гранзима B и IFN на исходном уровне (фиг.26 и 27), а также конститутивную активацию на низком уровне некоторых каскадов передачи сигнала TCR, таких как ERK и Akt (фиг.28). Эта исходная активация может быть следствием индукции T-bet (Thomas et al., J of Biol Chemistry. 2010; 285:2545-53), который кооперирует с другим фактором транскрипции, таким как Eomes, обеспечивая трансактивацию экспрессии генов IFN и гранзима B (Pearce et al., Science. 2003; 302:1041-3; и Intelkofer et al., Nat Immunol. 2005; 6:1236-44).
[00769] Эти данные подразумевают вероятность того, что терапевтическое нацеливание на Ikaros в трансдуцированных T-клетках человека (в клинических испытаниях) с использованием либо генетических, либо биохимических подходов может быть полезным. Генетические подходы могут имитировать эти результаты у мышей и включают нокдаун Ikaros в CAR T-клетках с использованием кшРНК или применение доминантно-негативной конструкции для конкуренции с эндогенным Ikaros. Другим вариантом может быть применение фармакологического ингибитора для временного снижения уровней Ikaros. В недавних сообщениях было показано, что иммуномодулирующее лекарственное средство леналидомид нацеливает Ikaros на опосредуемую убиквитином деградацию комплексом E3-лигазы CRL4CRBN (Gandhi et al., Br J Haematol. 2013; 164:811-21; Kronke et al, Science. 2014; 343:301-5; и Sakamaki et al., Leukemia. 2013; 28:329-37). Стимулированные CD3 T-клетки человека, обработанные леналидомидом, продуцируют больше IL-2 (Gandhi et al., Br J Haematol. 2013; 164:811-21), что является ключевым признаком T-клеток со сниженными уровнями Ikaros. В предварительных исследованиях стимулированные TCR/CD28 трансдуцированные CAR против мезотелина PBMC человека in vitro продуцируют больше IL-2 и IFNγ после предварительной обработки леналидомидом. Таким образом, комбинация терапии CAR T-клетками с введением леналидомида in vivo может обеспечить терапевтическую стратегию для реверсии гипофункции T-клеток через ингибирование Ikaros.
[00770] В заключение, этот пример впервые демонстрирует, что нацеливание на транскрипционный репрессор может повышать опосредуемый CAR противоопухолевый иммунитет. Механизмы вовлекали усиление функции цитокинов и эффекторной функции без изменения передачи сигнала. Перенос этого подхода в клинику может быть осуществлен с использованием кшРНК, доминантно-негативной конструкции, или фармакологического ингибитора (такого как леналидомид) для нацеливания на Ikaros в экспрессирующих CAR T-клетках.
Пример 11: Meso-CART при раке яичника человека
[00771] В этом примере определяли безопасность внутривенной инуфузии аутологичных T-клеток, трансдуцированных для экспрессии CAR против мезотелина, у пациента-человека с развернутым рецидивирующим серозным раком яичника.
[00772] После запланированного испытания фазы I (как описано в примере 3) моделировали протокол лечения одного пациента для оценки безопасности и осуществимости инфузии аутологичных T-клеток, экспрессирующих CAR против мезотелина (mesoCART). T-клетки от пациента трансдуцировали для экспрессии CAR, содержащего внеклеточный одноцепочечный вариабельный фрагмент (scFv) против мезотелина, слитый с сигнальными доменами 4-1BB и TCR-зета. 3x107 mesoCAR T-клеток/м2 для всего 4,65×107meso CAR T-клеток инфузировали пациенту. Перед инфузии не проводили истощения лимфатических клеток с использованием химиотерапии.
[00773] Инфузия mesoCART не имела острых токсических эффектов. Пациент испытывал билатеральные плевральные выпоты степени 3, диспноэ, лихорадку, гипотензию, и ему проводили аспирацию. Не было клинической токсичности вследствие эффектов meso CART-клеток вне опухоли/против мишени, таких как перикардит или перитонит. Пациенту вводили тоцилизумаб (антитело против IL6) на 21 сутки после инфузии вследствие предполагаемого синдрома выброса цитокинов (CRS), исходя из необъяснимой лихорадки, гипотензии, потребовавшей средств для повышения кровяного давления, повышенных сывороточных уровней ферритина (>7000 нг/мл) и CRP (>160 мг/л).
[00774] MesoCAR T-клетки поддавались обнаружению в образцах периферической крови, а также в образцах опухоли из печени и брюшины, причем наиболее высокими были количества в перикардиальной и плевральной жидкости. Оценка цитокинов продемонстрировала выраженное повышение уровня IL-6 в плевральной жидкости (увеличение >80 раз по сравнению с исходным уровнем), достигшее пика на 22-23 сутки. Оценка крови также выявила повышение уровней IL-6 в крови (увеличение в 15 раз относительно исходного уровня на 22 сутки). Не было обнаружена повышения уровней TNFα или IFNγ.
[00775] Предварительные результаты показали, что CT-визуализация брюшной полости и таза, проведенная на 21 сутки, продемонстрировали минимально улучшенный канцероматоз брюшины по сравнению с CT-визуализацией двумя неделями ранее. В частности, одна опухоль уменьшилась от 3,4×3,1 см до 3,0×2,6 см. Цитология плевральной жидкости с левой стороны продемонстрировала злокачественность на 8 сутки после инфузии, однако на 21 сутки и 26 сутки отсутствовали признаки злокачественности.
[00776] Эти результаты показали, что инфузия meso CART-клеток без истощения лимфатических клеток была осуществимой и безопасной. Не было признаков токсичности при инфузии или угрожающего жизни перикардита или перитонита. Также существовали клинические признаки эффективности лечения, о которых свидетельствует исчезновение злокачественного плеврального выпота.
Пример 12: Временная экспрессия CAR с различными внутриклеточными сигнальными доменами
[00777] В этом примере исследовали применение различных костимулирующих доменов в структуре CAR и их эффекты на живучесть клеток, дифференцировку клеток памяти и характеристики метаболизма клеток.
[00778] Была разработана новая система стимуляции T-клеток in vitro для исследования последствий одного раунда специфической стимуляции посредством CAR и анализа передачи сигнала через различные эндодомены передачи сигнала CAR. Транскрибированную in vitro мРНК, кодирующую конструкции SS1-CAR против мезотелина с различными внутриклеточным сигнальными доменами из CD3-зета, CD28:z и 4-1BB:z вводили путем электропорации в первичные покоящиеся T-клетки человека. Этим способом достигали более чем на 90% положительных по CAR популяций T-клеток. После подтверждения экспрессии CAR T-клетки стимулировали рекомбинантным мезотелином, иммобилизованным на гранулах, а затем культивировали. Поскольку РНК временно экспрессируется, CAR исчезает с поверхности клеток после одного раунда стимуляции, позволяя недвусмысленный анализ передачи сигнала через CAR отдельно (т.е. без последующей передачи сигнала вследствие дополнительных событий связывания мезотелина). Таким образом, этот подход устранял необходимость в стимуляции через эндогенный T-клеточный рецептор и впервые позволил анализ последствий передачи сигнала через суррогатный антиген CAR T-клеток. Эти эксперименты проводили на первичных периферических T-клетках крови, отсортированных наивных T-клетках и клетках пуповинной крови.
[00779] Различные конструкции CAR (SS-1 с CD3-зета, SS1 с CD28:z и SS1 с 4-1BB:z) экспрессировались на эквивалентных уровнях на поверхности T-клеток. Было продемонстрировано, что все сигнальные домены имеют сравнимую и специфическую способность к цитолизу при культивировании с клетками-мишенями, которые экспрессировали мезотелин.
[00780] Первичные T-клетки, стимулированные через содержавшие 4-1BBz CAR, продемонстрировали лучшие профили выживаемости и экспансии по сравнению с CAR на основе CD28. CAR на основе как 4-1BB, так и CD28, проявляли более 5 удвоений популяции. Однако CAR T-клетки на основе 4-1BB пролиферировали дольше in vitro. Фенотипический анализ CAR T-клеток на основе 4-1BB показал, что была получена увеличенная популяция клеток с центральными поверхностными маркерами памяти. Напротив, клетки с CAR на основе CD28 быстро дифференцировались в совокупность эффекторных клеток памяти среди CAR T-клеток.
[00781] CD28z-содержащие CAR обеспечивали значительно более высокую долю эффекторных клеток памяти с умеренным увеличением экспрессии ингибиторных молекул PD-1, TIM3 и LAG3 относительно их аналогов с 4-1BBz. Эти результаты оставались неизменными независимо от того, использовали ли исходные популяции из совокупных T-клеток периферической крови, наивных (отсортированных по CD45RO-CD95-CD62L+CCR7+) T-клеток периферической крови или T-клеток пуповинной крови.
[00782] Определение метаболического профиля стимулированных мезотелином CAR T-клеток с использованием анализа Sea-Horse (Seahorse Biosciences) в культуре выявило существенное увеличение окисления липидов в стимулированных 4-1BBz-CAR клетках по сравнению с их аналогами с CD28z. Кроме того, исследования на микрочипах выявили уникальный генный профиль в клетках, который обнаруживался после стимуляции через различные сигнальные домены CAR.
[00783] Взятые вместе, эти результаты показывают, что CAR T-клетки проявляют различную выживаемость и функцию в зависимости от костимулирующего домена. Эта система также позволяет быструю охарактеризацию и функциональный анализ новых конструкций CAR.
Пример 13: Эффекты ингибирования mTOR на старение иммунной системы у пожилых людей
[00784] Одним из каскадов, наиболее явно связанных со старением, является каскад mTOR. Было показано, что ингибитор mTOR увеличивает продолжительность жизни у мышей и вызывает улучшение при различных связанных со старением состояний у пожилых мышей (Harrison, DE et al. (2009) Nature 460:392-395; Wilkinson JE et al. (2012) Aging Cell 11:675-682; и Flynn, JM et al. (2013) Aging Cell 12:851-862). Таким образом, эти данные указывают на то, что ингибиторы mTOR могут иметь благоприятные эффекты на старение или связанные со старением состояния у человека.
[00785] Связанным со старением фенотипом, который можно исследовать в клинических испытаниях с короткими временными рамками, является старение иммунной системы. Старение иммунной системы представляет собой снижение иммунной функции, которое происходит у пожилых, что приводит к повышенной чувствительности к инфекциям и сниженному ответу на вакцинацию, в том числе вакцинацию против гриппа. Снижение иммунной функции с возрастом является следствием накопления иммунных дефектов, включающих снижение способности гемопоэтических стволовых клеток (HSC) образовывать наивные лимфоциты, и увеличение количеств истощенных положительных по PD-1 лимфоцитов, которые имеют дефектный ответ на антигенную стимуляцию (Boraschi, D et al. (2013) Sci. Transl. Med.5:185ps8; Lages, CS et al. (2010) Aging Cell 9:785-798; и Shimatani, K et al., (2009) Proc. Natl. Acad. Sci. USA 106:15807-15812). Исследования на пожилых мышах показали, что введение в течение 6 недель ингибитора mTOR рапамицина восстанавливало функцию HSC, что приводило к увеличенной продукции наивных лимфоцитов, улучшенному ответу на вакцинацию против гриппу и увеличенной продолжительности жизни (Chen, C et al. (2009) Sci. Signal. 2:ra75).
[00786] Для оценки эффектов ингибирования mTOR на связанные со старением человека фенотипы, и оценки того, смягчает ли ингибитор mTOR RAD001 старение иммунной системы, оценивали ответ вакцины против гриппа у пожилых добровольцев, которым вводили RAD001 или плацебо. Данные, представленные в настоящем описании, указывают на то, что RAD001 усиливал ответ на вакцину против гриппа у пожилых добровольцев в дозах, которые хорошо переносились. RAD001 также снижал процент положительных по programmed death (PD)-1 CD4 и CD8 T-лимфоцитов, которые накапливаются с возрастом. Эти результаты показывают, что ингибирование mTOR могло иметь благоприятные эффекты на старением иммунной системы у пожилых добровольцев.
[00787] Как описано в настоящем описании, лечение в течение 6 недель ингибитором mTOR RAD001, являющимся аналогом рапамицина, улучило ответ на вакцинацию против гриппа у пожилых людей-добровольцев.
Способы
Исследуемая выборка
[00788] Пожилых добровольцев в возрасте >= 65 лет без нестабильных основных медицинских заболеваний включали в исследование в 9 областях Новой Зеландии и Австралии. Критерии исключения при скрининге включали гемоглобин < 9,0 г/дл, количество лейкоцитов <3500/мм3, количество нейтрофилов <2000/мм3, или количество тромбоцитов <125000/мм3, неконтролируемый диабет, нестабильную ишемическую болезнь сердца, клинически значимое основное легочное заболевание, иммунодефицит в анамнезе или проведение иммуносупрессивной терапии, коагулопатию в анамнезе или медицинское состояние, требующее длительного противосвертывающего лечения, оцененную скорость гломерулярной фильтрации < 30 мл/мин, присутствие тяжелой неконтролируемой гиперхолестеринемии (>350 мг/дл, 9,1 ммоль/л) или гипертриглицеридемию (>500 мг/дл, 5,6 ммоль/л).
[00789] Исходные демографические данные между группами лечения были сходными (таблица 8). Из 218 включенных в исследование индивидуумов 211 завершили исследование. Семь индивидуумов были исключены от исследования. Пять индивидуумов отказались вследствие неблагоприятных явлений (AE), один индивидуум отменил согласие и один индивидуум покинул исследование в результате нарушения протокола.
Схема и проведение исследования
[00790] С декабря 2011 года по апрель 2012 года 218 пожилых добровольцев были включены в рандомизированное слепое для наблюдателя плацебо-контролируемое испытание. Индивидуумов случайным образом распределяли на группу лечения с использованием валидированной автоматизированной системы рандомизации с соотношением RAD001 и плацебо 5:2 в каждой группе лечения. Группы лечения представляли собой:
RAD001, 0,5 мг каждые сутки, или плацебо
RAD001, 5 мг раз в неделю, или плацебо
RAD001, 20 мг раз в неделю, или плацебо
[00791] Испытание было слепым для наблюдателя, поскольку плацебо в группах RAD001, 0,5 мг каждые сутки и 20 мг раз в неделю, незначительно отличалось от таблеток RAD001 в этих группах. Исследующий персонал, оценивающий индивидуумов, не знал об исследуемом лечении и, таким образом, был полностью слепым. Длительность лечения для всех групп составляла 6 недель, в ходе которых индивидуум подвергался оценкам безопасности в клинике каждые 2 недели. После дозирования индивидуумам в течение 4 недель измеряли стационарные уровни RAD001 до введения дозы и через один час после введения дозы. После завершения курса исследуемого лекарственного средства из 6 недель индивидуумам давали 2-недельный перерыв без лекарственных средств для реверсии какой-либо возможной индуцированной RAD001 иммуносупрессии, а затем проводили вакцинацию против гриппа сезона 2012 (Agrippal®, Novartis Vaccines and Diagnostics, Siena, Италия), включавшую штаммы H1N1 A/California/ 07/2009, H3N2 A/Victoria/210/2009, B/Brisbane/60/2008. Через четыре недели после вакцинации против гриппа проводили взятие сыворотки индивидуумов для измерения титров вируса гриппа. Титры антител к 3 вакцинным штаммам вируса гриппа, а также к 2 гетерологичным штаммам (A/штамм H1N1 A/New Jersy/8/76 и A/штамм H3N2 A/Victoria/361/11) измеряли с использованием стандартного анализа ингибирования гемагглютинации (Kendal, AP et al. (1982) Concepts and procedures for laboratory-based influenza surveillance. Atlanta: Centers for Disease Control and Prevention B17-B35). Уровни IgG и IgM, специфичных к A/H1N1/California/07/2009, измеряли в образцах сыворотки, взятых до и через 4 недели после вакцинации против гриппа, как описано ранее (Spensieri, F. et al. (2013) Proc. Natl. Acad. Sci. USA 110:14330-14335). Результаты выражали в качестве интенсивности флуоресценции.
[00792] Все индивидуумы предоставляли письменное информированное согласие. Исследование проводили в соответствии с Good Clinical Practice и было одобрено соответствующими этическими комитетами и регулирующими органами.
Безопасность
[00793] Во время посещений для исследования проводили оценку неблагоприятных явлений и сбор крови для гематологической и биохимической оценки безопасности. Информацию о неблагоприятных явлениях также получали из дневников, которые индивидуумы заполняли дома в течение 6 недель, когда они принимали исследуемое лекарственное средство. Данные обо всех неблагоприятных явления получали от времени информированного согласия до 30 суток после последнего посещения для исследования. События классифицировались исследователями как мягкие, умеренные и тяжелые.
Статистический анализ
[00794] Первичный анализ геометрических средних значений соотношений титров проводили с использованием нормальной байесовский регрессионной модели с неинформативной априорной вероятностью. Эту модель аппроксимировали к каждому титру антител на логарифмической шкале. Первичным результатом в каждой модели был результат измерения на 84 сутки. Результат измерения на 63 сутки был включен в вектор исхода. Модель аппроксимировали с использованием SAS 9.2 Proc Mixed с Prior Statement. Ковариационную структуру матрицы считали неструктурированной (тип опции=UN). Использовали Flat Prior. Для вторичного анализа уровней сероконверсии использовали логистическую регрессию.
[00795] Выборку пациентов с намерением лечиться определяли как все индивидуумы, которым вводили по меньшей мере одну полную дозу исследуемого лекарственного средства и которые не имели существенных отклонений от протокола, влияющих на данные эффективности. 199 из всего 218 индивидуумов, включенных в исследование, входили в выборку пациентов с намерением лечиться.
Иммунофенотипирование
[00796] Мононуклеарные клетки периферической крови выделяли из цельной крови, взятой в 3 момента времени: исходный уровень; через 6 недель после лечения исследуемым лекарственным средством; и в конце исследования, когда индивидуумы не принимали лекарственное средство в течение 6 недель и 4 недель после вакцинации против вируса гриппа. Семьдесят шесть субпопуляций PBMC анализировали проточной цитометрией с использованием 8-цветных панелей иммунофенотипирования в Human Immune Monitoring Center в Stanford University, CA, США, как описано ранее (Maecker, HT et al. (2012) Nat Rev Immunol. 12:191-200). Семьдесят шесть субпопуляций PBMC анализировали проточной цитометрией с использованием 8-цветных лиофилизированных панелей для иммунофенотипирования (BD Lyoplate, BD Biosciences, San Diego, CA). Образцы PBMC с жизнеспособностью >80% и выходом 2×106 клеток или более включали в анализ.
[00797] Относительные изменения иммунофенотипов от исходного уровня до 6 недели лечения лекарственным средством и от исходного уровня до конца исследования (Week 12) вычисляли для каждой из групп дозирования RAD001. T-критерий Стьюдента вычисляли, чтобы исследовать, отличалось ли относительное изменение иммунофенотипов от исходного уровня до двух моментов времени взятия образцов значимо от нуля, соответственно, в каждой группе дозирования после внесения поправки на эффект плацебо. Условную подстановку отсутствующих данных в анализе эффекта лечения не проводили. Таким образом, если пациент имел отсутствующие данные о фенотипе на исходном уровне, этого пациента не включали в анализ по этому фенотипу. Если пациент имел отсутствующие данные о фенотипе на 6 или 12 неделях, тогда этот пациент не участвовал в анализе этого фенотипа для этого момента времени с отсутствующими данными.
[00798] Проводили 608 тестов в 76 фенотипах в 3 группах дозирования для сравнения эффекта лечения против эффекта плацебо. Для контроля возникновения ложноположительных результатов, ассоциированных с множественным тестированием, и обеспечения еще большей мощности, использовали методологию стратифицированного контроля уровня ложноположительных результатов (FDR). Группу типа клеток принимали как факто стратификации и проводили вычисление FDR (величина q) в каждой группе соответственно. Все нулевые гипотезы отклоняли при уровне значимости 0,05 с соответствующим значением q≤0,1. Стратегия внесения поправки на множественное тестирование с отклонением при уровне значимости 0,05 и соответствующем q<0,1 гарантировали, что менее 10% данных были ложными.
[00799] Во втором анализе исследовали изменения иммунофенотипа между объединенными группами лечения и плацебо, где все три группы дозирования RAD001 объединяли. Для определения того, какие изменения иммунофенотипа отличались между группой введения и группой плацебо, вычисляли соотношения количеств клеток по пациентам для каждого измеренного фенотип между исходным уровнем и 6 неделей лечения исследуемым лекарственным средством и между исходным уровнем и концом исследования (12 неделя). Соотношения подвергали логарифмическому преобразованию и анализировали с использованием ковариационного анализа в каждый момент времени для обнаружения отличий между объединенными группами лечения и плацебо. Проводили 152 тестов 76 фенотипов для сравнения объединенного эффекта лечения против эффекта плацебо. Для контроля возникновения ложноположительных результатов, ассоциированных с множественным тестированием, и обеспечения еще большей мощности, использовали методологию стратифицированного контроля уровня ложноположительных результатов (FDR) (Benjamini, Y. et al. (1995) J. Roy. Statist. 57:289-300; и Sun, L. et al. (2006) Genet. Epidemiol. 30:519-530). Группу типа клеток принимали как факто стратификации и проводили вычисление FDR (величина q) в каждой группе соответственно. Все нулевые гипотезы при уровне значимости 0,05 и значении q менее 20% отклоняли. Это можно интерпретировать как отклонение только тех гипотез со значениями P менее 0,05 и вероятностью менее 20%, в которых каждый наблюдаемый значимый результат был следствием множественного тестирования.
Результаты
[00800] Главным образом, RAD001 хорошо переносился, в частности, в режимах дозирования 0,5 мг каждые сутки и 5 мг раз в неделю. В ходе исследования не произошло смертей. Три индивидуума испытали серьезные неблагоприятные явления (SAE), которые были оценены как несвязанные с RAD001. 4 SAE представляли собой кровоизлияния в сетчатку левого глаза с последующей слепотой у индивидуума с нормальным количеством тромбоцитов, которые завершили курс из 6 недель по 5 мг каждую недель RAD001 за 6 недель до этого; тяжелую боль в спине у индивидуума, которому давали плацебо, и тяжелый гастроэнтерит у индивидуума, которому давали плацебо. Перечень обусловленных лечением неблагоприятных явлений (AE) со встречаемостью >2% в любых группах введения представлен в таблице 9. Большинство распространенных связанных с RAD001 AE представляли собой язву рта, которая в большинстве случаев имела мягкую тяжесть. В целом, индивидуумы, которым вводили RAD001, имели сходную встречаемость тяжелых AE с индивидуумами, которым давали плацебо. Только одно тяжелое AE было оценено как связанные с RAD001 язвы рта у индивидуума, которому вводили 20 мг RAD001 раз в неделю.
[00801] Способность RAD001 улучшать иммунную функцию у пожилых добровольцев оценивали путем измерения серологического ответа на вакцину против гриппа сезона 2012. Геометрические средине титры (GMT) ингибирования гемагглютинации (HI) для каждого из 3 вакцинных штаммов гриппа на исходном уровне и через 4 недели после вакцинации против гриппа представлены в таблице 10. Первичной переменной анализа было соотношение HI GMT (4 недели после вакцинации/исходный уровень). Исследование было начато для возможности продемонстрировать, что по меньшей мере для 2 из 3 вакцинных штаммов происходило 1) ≥1,2-кратное увеличение GMT относительно плацебо; и 2) апостериорная вероятность не ниже 80%, что соотношение GMT с поправкой на плацебо превышало 1. Этот конечный результат был выбран, поскольку увеличение соотношения GMT для вируса гриппа в 1,2 раза, индуцированное вакцинным адъювантом MF-59, было ассоциировано со снижением заболеваемости гриппом (Iob, A et al. (2005) Epidemiol Infect 133:687-693).
Исходный уровень указывает на 2 недели до вакцинации против вируса гриппа
4 недели указывает на 4 недели после вакцинации против вируса гриппа
N представляет собой количество индивидуумов на группу
GMT представляет собой геометрического среднее значение титра
Соотношение GMT представляет собой GMT через 4 недели после вакцинации/GMT на исходном уровне
CV% указывает на коэффициент вариаций
[00802] В выборке с намерением лечиться (ITT) группы низкой усиливающей иммунитет дозы RAD001 (0,5 мг каждые сутки или 5 мг раз в неделю), но не группа более высокой дозы (20 мг раз в неделю) удовлетворили первичному результату исследования (фиг.33A). Это демонстрирует, что существует явный иммуномодулирующий механизм RAD001 при более низких дозах, и что при более высоких дозах могут вовлекаться известные иммунодепрессивные эффекты ингибирования mTOR. Более того, результаты указывают на тенденцию в направлении улучшения иммунной функции у пожилых людей после лечения низкой усиливающей иммунитет дозой RAD001.
[00804] Графики рассеяния концентрации RAD001 против повышения титров к каждому вакцинному штамму гриппа демонстрируют обратную взаимосвязь воздействие/ответ (фиг.34). Моделирование и имитация на основе опосредуемого mTOR фосфорилирования продуктов киназы S6 (S6K) прогнозируют, что режим дозирования 20 мг раз в неделю ингибирует опосредуемую mTOR активность S6K практически полностью, режим дозирования 5 мг раз в неделю ингибирует активность S6K более чем на 50%, и режим дозирования 0,5 мг каждые сутки ингибирует фосфорилирование S6K приблизительно на 38% в ходе интервала дозирования (Tanaka, C et al. (2008) J. Clin. Oncol 26:1596-1602). Таким образом, частичное ингибирование mTOR, например, опосредуемого mTOR фосфорилирования S6K низкой усиливающей иммунитет дозой RAD001 может быть настолько же, если не более, эффективным, чем практически полное ингибирование mTOR высокой дозой RAD001, в отношении усиления иммунного ответа у пожилых людей.
[00805] Также оценивали уровни сероконверсии через 4 недели после вакцинации против гриппа. Сероконверсию определяли как изменение от отрицательного титра до вакцинации (т.е. титр HI <1:10) до титра HI после вакцинации ≥1:40 или по меньшей мере 4-кратное увеличение относительно неотрицательного (≥1:10) титра HI до вакцинации. В выборке пациентов с намерением лечиться уровни сероконверсии для штаммов H3N2 и B были увеличенными в группах RAD001 по сравнению группой плацебо, хотя увеличение не удовлетворяло статистической значимости (таблица 11). В субпопуляции индивидуумов с исходными титрами вируса гриппа <= 1:40, введение RAD001 также повышало уровни сероконверсии в отношении штаммов H3N2 и B, и эти результаты достигали статистической значимости для штамма B в группе дозирования 0,5 мг каждые сутки. Эти данные далее демонстрируют, что RAD001 повышал серологический ответ на вакцинацию против гриппа у пожилых людей.
[00806] Современные сезонные вакцины против гриппа часто обеспечивают недостаточную защиту против постоянно появляющихся штаммов гриппа, которые существуют в качестве вариантов ранее циркулировавших вирусов. Однако у мышей, вакцинированных против вируса гриппа в присутствии ингибитора mTOR рапамицина по сравнению с плацебо, развивался более широкий серологический ответ на вирус гриппа. Более широкий серологический ответ включал антитела к консервативным эпитопам, экспрессируемым множеством подтипов вируса гриппа, которые обеспечили защиту от инфекции гетерологичными штаммами вируса гриппа, не содержащимися в вакцине (Keating, R et al. (2013) Nat Immunology 14:2166-2178). Для определения того, расширял ли RAD001 серологический ответ на вирус гриппа у пожилых добровольцев измеряли титры HI к 2 гетерологичным штаммам вируса гриппа, не содержащимся в вакцине против гриппа (A/штамм H1N1 A/New Jersey/8/76 и A/штамм H3N2 A/Victoria/361/11). Увеличение соотношений HI GMT для гетерологичных штаммов было более высоким в группе RAD001 по сравнению с группой плацебо (фиг.35). Кроме того, уровни сероконверсии для гетерологичных штаммов были более высокими в группе RAD001 по сравнению с группой плацебо. Увеличение сероконверсии в группах дозирования 5 и 20 мг RAD001 раз в неделю было статистически значимым для гетерологичного штамма H3N2 (Таблица 12). Уровень сероконверсии в отношении H3N2 для объединенных групп RAD001 составил 39% против 20% для группы плацебо (p=0,007). Результаты, описанные в настоящем описании, указывают на то, что ингибирование mTOR расширяет серологический ответ пожилых добровольцев на вакцинацию против гриппа и повышает титры антител к гетерологичным штаммам вируса гриппа, не содержащимся в сезонной вакцине против гриппа.
[00807] Расширенный серологический ответ на гетерологичные штаммы вируса гриппа у мышей, которым вводили рапамицин, были ассоциированы с ингибированием переключения классов B-клеток и увеличением уровней IgM против вируса гриппа (Keating, R. et al. (2013) Nat Immunol 14:2166-2178). Однако ингибирование переключения классов может быть не вовлечено в расширенный серологический ответ у людей, которым вводили RAD001, поскольку уровни IgM и IgG против вируса гриппа после вакцинации не различались между группами введения RAD001 и плацебо (фиг.36).
[00808] Для определения механизма, посредством которого RAD001 повышал иммунную функцию у пожилых добровольцев, проводили иммунофенотипирование на образцах PBMC, полученных от индивидуумов на исходном уровне, после 6 недель лечения исследуемым лекарственным средством и через 4 недели после вакцинации против гриппа (6 после прекращения введения исследуемого лекарственного средства). Хотя процент большинства подгрупп PBMC не отличался между группами RAD001 и плацебо, процент положительных по PD-1 CD4 и CD8 клеток был боле низким в группе RAD001 по сравнению с группой плацебо (фиг.37). Положительные по PD-1 CD4 и CD8 клетки накапливаются с возрастом и имеют дефектные ответы на стимуляцию антигеном, поскольку PD-1 ингибирует индуцируемую T-клеточным рецептором пролиферацию T-клеток, продукцию цитокинов и цитолитическую функцию (Lages, CS et al. (2010) Aging Cell 9:785-798). Происходило увеличение процента положительных по PD-1 T-клеток с течением времени в группе плацебо. На 12 неделе (4 недели после вакцинации) это увеличение могло быть следствием вакцинации против гриппа, поскольку было показано, что вирус гриппа повышает уровень положительных по PD-1 T-клеток (Erikson, JJ et al. (2012) JCI 122:2967-2982). Однако процент CD4 положительных по PD-1 T-клеток снижался от исходного уровня на 6 и 12 неделях во всех группах RAD001 (фиг.37A). Процент CD8 положительных по PD-1 клеток также снижался от исходного уровня как на 6, так и 12 неделях в двух группах более низкой дозы RAD001 (фиг.37B). Процент отрицательных по PD-1 CD4 T-клеток оценивали, и он был увеличен в группах RAD001 по сравнению с плацебо (фиг.37C).
[00809] При более строгом статистическом анализе, когда результаты групп RAD001 объединяли и вносили поправку на отличия в исходной экспрессии PD-1, существовало статистически значимое снижение 30,2% уровня положительных по PD-1 CD4 T-клеток на 6 неделе в объединенной группе RAD (n=84) по сравнению с группой плацебо (n=25) с p=0,03 (q=0,13) (фиг.38A). Снижение уровня положительных по PD-1 CD4 T-клеток на 12 неделе в объединенной группе RAD по сравнению с группой плацебо составляет 32,7% с p=0,05 (q=0,19). На фиг.38B показано статистически значимое снижение, составляющее 37,4%, положительных по PD-1 CD8 T-клеток на 6 неделе в объединенной группе RAD001 (n=84) по сравнению с группой плацебо (n=25) с p=0,008 (q=0,07). Снижение положительных по PD-1 CD8 T-клеток на 12 неделе в объединенной группе RAD001 по сравнению с группой плацебо составляет 41,4% с p=0,066 (q=0,21). Таким образом, результаты, представленные на фиг.37 и 38, взятые вместе, указывают на то, что ассоциированное с RAD001 снижение процента положительных по PD-1 CD4 и CD8 T-клеток может вносить вклад в усиленную иммунную функцию.
Заключение
[00810] В заключение, данные, представленные в настоящем описании, демонстрируют, что ингибитор mTOR RAD001 смягчает связанное со старением снижение иммунологической функции у пожилого человека, как оценивают по ответу на вакцинацию против гриппа, и что это смягчение достигается с приемлемым соотношением риск/польза. В исследовании пожилых мышей введение в течение 6 недель ингибитора mTOR рапамицина не только усиливало ответ на вакцинацию против гриппа, но также увеличивало продолжительность жизни, что указывает на то, что ослабление старения иммунной системы может быть маркером более широкого эффекта на связанные со старением фенотипы.
[00811] Поскольку дозирование RAD001 прекращали за 2 недели до вакцинации эффекты RAD001 в отношении усиления иммунитета могут опосредоваться изменениями соответствующей популяции клеток, которая сохраняется после прекращения введения лекарственного средства. Результаты, представленные в настоящем описании, показывают, что RAD001 снижал процент истощенных положительных по PD-1 CD4 и CD8 T-клеток по сравнению с плацебо. Экспрессия PD-1 индуцируется передачей сигнала TCR и остается высокой в условиях длительной антигенной стимуляции, включающей хроническую вирусную инфекцию. Без связи с теорией, возможно, что RAD001 снижал хроническую активацию иммунной системы у пожилых добровольцев и, тем самым, приводил к снижению экспрессии PD-1. RAD001 также может прямо ингибировать экспрессию PD-1, как описано для иммунофилина циклоспорина A (Oestreich, KJ et al. (2008) J Immunol. 181:4832-4839). Индуцированное RAD001 снижение процента положительных по PD-1 T-клеток, вероятно, повышало качество T-клеточных ответов. Это согласуется с предшествующим исследованиями, демонстрирующими, что ингибирование mTOR повышало качество CD8 T-клеток памяти в ответ на вакцинацию у мышей и приматов (Araki, K et al. (2009) Nature 460:108-112). Также было показано, что у пожилых мышей ингибирование mTOR увеличивает количество гемопоэтических стволовых клеток, что приводи к увеличению продукции наивных лимфоцитов (Chen, C et al. (2009) Sci Signal 2:ra75). Хотя значимые отличия в процентах наивных лимфоцитов в группах RAD001 против плацебо не были выявлены в этом примере, этот возможный можно далее исследовать.
[00812] Механизм, посредством которого RAD001 расширял серологический ответ на гетерологичные штаммы вируса гриппа, можно исследовать далее. Также было показано, что рапамицин ингибирует переключение классов в B-клетках после вакцинации против гриппа. В результате был получен уникальный репертуар антител против гриппа, которые стимулировали перекрестную защиту против летальной инфекции подтипами гриппа, не содержащимися в вакцине против гриппа (Keating, R et al. (2013) Nat Immunol. 14:2166-2178). Результаты, описанные в настоящем описании, не показали, что RAD001 изменял переключение класса B-клеток у пожилых индивидуумов, которые прекращали введение RAD001 за 2 недели до вакцинации против гриппа. Хотя основной механизм требует дальнейшего прояснения, увеличенный серологический ответ на гетерологичные штаммы вируса гриппа, описанные в настоящем описании, могут сообщать усиленную защиту от заболевания гриппом в те годы, когда соответствие между сезонной вакциной и циркулирующими штаммами гриппа в обществе является низким.
[00813] Эффект RAD001 на титры антител против вируса гриппа был сравним с эффектом вакцинного адъюванта MF59, который одобрен для повышения ответа у пожилых людей на вакцинацию против гриппа (Podda, A (2001) Vaccine 19:2673-2680). Таким образом, обеспечиваемое RAD001 усиление антительного ответа на вакцинацию против гриппа может быть переведено в клиническую пользу, как продемонстрировано для вакцины против гриппа с MF59 в качестве адъюванта у пожилых людей (Iob, A et al. (2005) Epidemiol Infect. 133:687-693). Однако RAD001 также используют для подавления иммунного ответа у пациентов с трансплантатами органов. Эти вроде бы пародоксальные открытия предполагают вероятность, что иммуномодулирующие эффекты ингибиторов mTOR могут быть зависимыми от дозы и/или антигена (Ferrer, IR et al. (2010) J Immunol. 185:2004-2008). В настоящем примере показана тенденция к обратной взаимосвязи воздействие RAD001/ответ на вакцинацию. Является возможным, что полное ингибирование mTOR подавляет иммунную функцию через нормальный механизм циклофилин-рапамицин, где частичное ингибирование mTOR, по меньшей мере у пожилых людей, усиливает иммунную функцию вследствие явного ингибирования связанного со старением фенотипа. Интересно, что активность mTOR возрастает в различных тканях, включая гемопоэтические стволовые клетки в моделях на стареющих животных (Chen C. et al. (2009) Sci Signal 2:ra75 и Barns, M. et al. (2014) Int J Biochem Cell Biol. 53:174-185). Таким образом, подавление активности mTOR до уровней, наблюдаемых в молодых тканях, в противоположность полному подавлению активности mTOR, может иметь клиническую пользу при связанных со старением показаниях.
[00814] Профиль безопасности ингибиторов mTOR, таких как RAD001, при лечении связанных со старением показаний, представляет интерес. Токсичность RAD001 в дозах, используемых в онкологии и при трансплантации органов, включает уровни стоматита, диареи, тошноты, цитопении, гиперлипидемии и гипергликемии, которые были бы неприемлемы для многих связанных со старением показаний. Однако эти AE связаны с остаточными уровнями RAD001 в крови. Таким образом, режимы дозирования RAD001, использованные в этом исследовании, были выбраны так, чтобы минимизировать остаточные уровни. Средние остаточные уровни RAD001 в группах дозирования 0,5 мг каждые сутки, 5 мг раз в неделю и 20 мг раз неделю составляли 0,9 нг/мл, ниже 0,3 нг/мл (нижняя граница количественного определения) и 0,7 нг/мл, соответственно. Эти остаточные уровни являются значительно более низкими, чем остаточные уровни, ассоциированные с режимами дозирования, используемыми у пациентов с трансплантацией органов и злокачественной опухолью. Кроме того, ограниченный курс лечения в течение 6 недель снижал риск неблагоприятных явлений. Эти данные указывают на то, что режимы дозирования, используемые в этом исследовании, могут иметь приемлемое соотношение риск/польза для некоторых состояний у пожилых людей. Тем не менее, у значительных количеств индивидуумов в экспериментах, описанных в настоящем описании, развивались язвы рта, даже при дозировании только 0,5 мг каждые сутки. Таким образом, профиль безопасности низкой усиливающей иммунитет дозы RAD001 требует дальнейшего исследования. Разработка ингибиторов mTOR с улучшенными профилями безопасности, чем доступные в настоящее время рапалоги, может обеспечить лучшие терапевтические режимы в будущем для связанны со старением состояний.
Пример 14: Усиление иммунного ответа на вакцину у пожилых индивидуумов
[00815] Иммунная функция снижается у пожилых людей, что приводит к увеличению встречаемости инфекции снижению ответа на вакцинацию. В качестве первой стадии при определении того, имеет ли ингибирование mTOR эффекты, направленные против старения, у человека, проводили испытание для определения того, вызывает ли ингибитор mTOR RAD001 реверсию связанного со старением снижений иммунной функции при оценке по ответу на вакцинацию у пожилых добровольцев. Во всех случаях получали соответствующие согласия от пациентов и исследования были одобрены органами общественного здравоохранения.
[00816] В исследовании использовали следующие 3 режима дозирования RAD001:
20 мг раз в неделю (остаточный уровень: 0,7 нг/мл)
5 мг раз в неделю (остаточный уровень был ниже пределов обнаружения)
0,5 мг каждые сутки (остаточный уровень: 0,9 нг/мл)
[00817] Эти режимы дозирования были выбраны, поскольку они имеют более низкие остаточные уровни, чем дозы RAD001, одобренные при трансплантации и онкологи. Остаточный уровень представляет собой наиболее низкий уровень лекарственного средства в организме. Остаточный уровень RAD001, ассоциированный с режимом дозирования при онкологии 10 мг каждые сутки, составляет приблизительно 20 нг/мл. Остаточный уровень, ассоциированный с режимом дозирования при трансплантации 0,75-1,5 мг bid, составляет приблизительно 3 нг/мл. Напротив, остаточный уровень, ассоциированный с режимами дозирования, использованными в исследованиях авторов настоящего изобретения, является в 3-20 раз более низким.
[00818] Поскольку связанные с RAD001 AE ассоциированы с остаточными уровнями, было спрогнозировано, что 3 режима дозирования будут иметь надлежащую безопасность для здоровых добровольцев. Кроме того, было спрогнозировано, что 3 дозы будут обеспечивать диапазон ингибирования mTOR. Киназа P70 S6 (P70 S6K) представляет собой нижерасположенную мишень, которая фосфорилируется посредством mTOR. Уровни фосфорилирования P70 S6K служат в качестве меры активности mTOR. Исходя из моделирования и имитации данных фосфорилирования P70 S6K, полученных в доклинических и клинических испытаниях RAD001, было спрогнозировано, что доза 20 мг раз в неделю будет практически полностью ингибировать активность mTOR в течение полной н недели, в то время как доза 5 мг раз в неделю и 0,5 мг каждые сутки будут частично ингибировать активность mTOR.
[00819] Пожилых добровольцев в возрасте >=65 лет случайным образом распределяли в одну из 3 групп лечения RAD001 (50 индивидуумов на группу) или плацебо (20 индивидуумов на группу). Индивидуумов лечили исследуемым лекарственным средством в течение 6 недель, затем давали 2-недельный перерыв, а затем проводили вакцинацию против гриппа (Aggrippal, Novartis) и пневмококка (Pneumovax 23, Merck). Ответ на вакцинацию против гриппа оценивали путем измерения геометрических средних титров (GMT) посредством анализа ингибирования гемагглютинации в отношении 3 штаммов вируса гриппа (подтипы вируса гриппа H1N1, H3N2 и B) в вакцине против гриппа через 4 недели после вакцинации. Первичные результаты исследования представляли собой (1) безопасность и переносимость и (2) увеличение в 1,2 раза титров против вируса гриппа по сравнению с плацебо для 2/3 из трех вакцинных штаммов вируса гриппа через 4 недели после вакцинации. Этот конечный результат был выбран, поскольку увеличение титров против вируса гриппа в 1,2 раза ассоциировано с со снижением заболеваемости гриппом после вакцинации, и, таким образом, он является клинически значимым. Дозы 5 мг раз в неделю и 0,5 мг каждые сутки хорошо переносились и в отличие от дозы 20 мг раз в неделю удовлетворяли первичному результату GMT (фиг.33A). RAD001 не только улучшал ответ на вакцинацию против гриппа, он также улучшал ответ у пожилых добровольцев на пневмококковую вакцинацию по сравнению с плацебо. Пневмококковая вакцина содержит антигены из 23 серотипов пневмококка. У исследуемых индивидуумов измеряли титры антител к 7 из этих серотипов. Титры антител к 6/7 серотипов были увеличены во всех 3 группах RAD по сравнению с плацебо.
[00820] Комбинрованные данные для вируса гриппа и пневмококка указывают на то, что частичное (менее чем 80-100%) ингибирование mTOR является более эффективным в отношении реверсии связанного со старением снижения иммунной функции, чем полное ингибирование mTOR.
Пример 15: Ингибирование mTOR в низкой дозе увеличивает энергию и выносливость
[00821] В доклинических моделях ингибирование mTOR рапалогом рапамицином повышает самопроизвольную физическую активность у пожилых мышей (Wilkinson et al. Rapamycin slows aging in mice. (2012) Aging Cell; 11:675-82). Интерес представляет то, что для индивидуумов в группе дозирования 0,5 мг каждые сутки, описанные в примере 2, также описаны увеличение энергии и увеличение выносливости к физической нагрузке по сравнению с плацебо в опросниках, которые давали через один год после дозирования (Фигура 39). Эти данные указывают на то, что частичное ингибирование mTOR рапалогами может иметь благоприятные эффекты на связанную с со старением заболеваемость, помимо только иммунной функции.
Пример 16: Ингибирование киназы P70 S6 посредством RAD001
[00822] Моделирование и имитацию проводили для прогнозирования суточных и недельных диапазонов доз RAD001, которые частично ингибируют активность mTOR. Как отмечалось выше, P70 S6K фосфорилируется посредством mTOR и она является нижерасположенной мишенью mTOR, которая наиболее тесно связана со старением, поскольку нокаут P70 S6K увеличивает продолжительность жизни. Таким образом, проводили моделирование доз RAD001, которые частично ингибируют активность P70 S6K. Спрогнозировано, что дозирование каждую неделю в диапазоне >= 0,1 мг и < 20 мг обеспечивает частичное ингибирование активности P70 S6K (фиг.40).
[00823] Для дозирования каждые сутки концентрации RAD001 от 30 пМ до 4 нМ частично ингибировали активность P70 S6K в клеточных линиях (таблица 13). Спрогнозировано, что эти сывороточные концентрации достигаются с использованием доз RAD001 от >=0,005 мг до <1,5 мг каждые сутки.
Заключение
[00824] Разрабатывали способы лечения связанных со старением заболеваний или общего усиления иммунного ответа с использованием доз ингибиторов mTOR, которые только частично ингибируют P70 S6K. Эффективность частичного ингибирования mTOR низкими дозами RAD001 при связанных со старением показаниях является неожиданным открытием. Доза RAD001, находящаяся в диапазоне от >=0,1 мг до <20 мг раз в неделю и от >=0,005 мг до <1,5 мг каждые сутки будет обеспечивать частичное ингибирование mTOR, таким образом, ожидается, что она будет иметь эффективность при связанных со старением заболеваниях или для усиления иммунного ответа.
Пример 17: MSLN CART при раке яичника
[00825] Противоопухолевую активность однократной дозы 2×106 T-клеток с CAR против мезотелина ранее оценивали in vivo в модели рака яичника на мышах, как описано в примере 8. Чтобы определить, можно ли увеличить противоопухолевую активность T-клеток с CAR M5 и M11 в этой модели, как описано в примере 8, CAR T-клетки вводили в более высокой дозе, составляющей 4×106 T-клеток с CAR против мезотелина, через 14 суток после имплантации опухоли, когда объемы опухоли в среднем достигали 150 мм3, и вводили идентичную дозу CAR T-клеток для наблюдения. Половине мышей вводили вторую идентичную дозу CAR T-клеток через пять суток, чтобы видеть, повышает ли это противоопухолевую активность, выявленную ранее в этой модели.
Материалы и способы:
[00826] Клеточная линия: OVCAR8 представляет собой клеточную линию рака яичника человека, которая была получена от пациента-женщины в возрасте 64 лет с аденокарциномой яичника, и был трансдуцирована для экспрессии mCherry. Клетки выращивали в среде RMPI, содержавшей 10% эмбриональную телячью сыворотку. Эта клеточная линия растет прикрепленной во флаконах для культивирования тканей. Эта клеточная линия образует опухоли у мышей, когда ее имплантируют подкожно в бок и смешивают с матригелем. Добавление матригеля к клеткам в ходе имплантации позволяет в боку мыши развиться матриксу, который обеспечивает структуру для начала роста опухолевых клеток. В течение 10-12 суток, вкладыш из матригеля деградирует и солидная опухоль, которая остается, состоит из опухолевых клеток и окружающих стромальных клеток. Клетки OVCAR8 были модифицированы для экспрессии mCherry, так что рост опухолевых клеток также можно подвергать мониторингу посредством визуализации мышей.
[00827] Мыши: мышей NSG в возрасте 6 недель (NOD.Cg-PrkdcscidIl2rgtm1Wjl/SzJ) получали от Jackson Laboratory (номер партии 005557). Животным позволяли акклиматизироваться в виварии Novartis NIBRI в течение по меньшей мере 3 суток перед проведением экспериментов. Животных содержали в соответствии с правилами и нормативами Novartis ACUC. За сутки до имплантации опухоли в левый бок имплантировали электронные передатчики для идентификации животных. Перед имплантации опухоли правый бок мыши брили.
[00828] Имплантация опухоли: Клетки OVCAR8 в логарифмической фазе собирали после трипсинизации посредством 0,25% трипсин-EDTA. Клетки промывали в 50-мл пробирках falcon при 1200 об/мин в течение 5 минут, один раз в среде для роста, а затем два раза в холодном стерильном PBS. Клетки ресуспендировали в PBS в концентрации 100×106 на мл и держали на льду. Затем раствор PBS, содержавший клетки, смешивали 1:1 с матригелем до конечной концентрации 50×106 клеток на мл PBS-матригеля. Клетки помещали на лед и сразу имплантировали мышам. Опухоли имплантировали подкожно в объеме 200 мкл в правый бок.
[00829] Модель OVCAR8 эндогенно экспрессирует мезотелин и, таким образом, ее можно использовать для исследования эффективности in vivo направленных на мезотелин CAR T-клеток. Опухоль в этой модели хорошо растет при имплантации подкожно в бок мышей, и ее можно измерять толщиномером для определения объема опухоли. При имплантации 10×106 опухолевых клеток в смеси 50:50 PBS и матригеля, развиваются опухоли и их можно точно измерить через одну неделю. Через 13-15 суток средний объем опухоли составляет 100-200 мм3 причем опухоли достигают конечного объема (1000-1200 мм3) через 60-65 суток. Противоопухолевую активность лекарственных средств часто тестируют, поскольку опухоли полностью приживаются и матригель резорбируется. Таким образом, существует большое окно в этой модели, в течение которого можно наблюдать противоопухолевую активность CAR T-клеток.
[00830] ДозированиеCAR T-клеток: Мышам дозировали 4×106 CAR T-клеток (13,3×106 тотальных T-клеток) через 14 суток после имплантации опухоли. Клетки частично размораживали на водяной бане при 37 градусах Цельсия, а затем полностью размораживали добавлением в пробирку, содержавшую клетки, 1 мл холодного стерильного PBS. Размороженные клетки переносили в 15-мл пробирку Falcon и доводили до конечного объема 10 мл посредством PBS. Клетки промывали два раза при 1000 об/мин в течение 10 минут каждый раз, а затеи подсчитывали на гемоцитометре. Затем T-клетки ресуспендировали в концентрации 133×106 клеток на мл холодного PBS и держали на льду до тех пор, пока не вводили мышам. Мышам проводили внутривенную инъекцию через хвостовую вену 100 мкл T-клеток в дозе 4×106 CAR T-клеток (13,3×106 тотальных T-клеток) на мышь. Семи мышам на группу вводили либо 100 мкл PBS отдельно (PBS), либо T-клетки, трансдуцированные изотипическим CAR (изотип). 14 мышам на группу вводили либо T-клетки с CAR SS1 против мезотелина, либо T-клетки с CAR M5 против мезотелина, либо T-клетки с CAR M11 против мезотелина. Через пять суток группы SS1, M5 и M11 разделяли пополам и семи мышам в каждой группе вводили идентичную вторую дозу CAR T-клеток. Группы были идентифицированы как SS1 однократная (одна доза SS1 CAR T-клеток), SS1 двукратная (две дозы SS1 CAR T-клеток), M5 однократная (одна доза M5 CAR T-клеток), M5 двукратная (две дозы M5 CAR T-клеток), M11 однократная (одна доза M11 CAR T-клеток), M11 двукратная (две дозы M11 CAR T-клеток). Все из изотипических T-клеток, SS1 T-клеток, M5 T-клеток и M11 T-клеток получали из одного и того же донора параллельно.
[00831] Мониторинг животных: Мониторинг состояния здоровья мышей проводили ежедневно, включая измерение массы тела два раза в неделю. Процентное изменение массы тела вычисляли как (BWтекущая – BWисходная)/(BWисходная) × 100%. Мониторинг опухолей проводили 2-3 раза в неделю посредством измерения толщиномером, и объем опухолей (TV) вычисляли с использованием формулы для эллипсоида: TV(мм3)=((длина × ширина2) × 3,14159))/6. Объемы опухоли представлены в качестве среднего значения +/- стандартная ошибка среднего значения (SEM). Процентные величины лечение/контроль (T/C) вычисляли с использованием следующей формулы:
% T/C=100 × ΔT/ΔC, если ΔT≥0;
% регрессия=100 × ΔT/Tисходный,если ΔT<0;
где T=средний объем опухоли в группе введения лекарственного средства в последний день исследования; Tисходный=средний объем опухоли в группе введения лекарственного средства в первоначальный день дозирования; ΔT=средний объем опухоли в группе введения лекарственного средства в последний день исследования – средний объем опухоли в группе введения лекарственного средства в первоначальный день дозирования; C=средний объем опухоли в контрольной группе в последний день исследования; и ΔC=средний объем опухоли в контрольной группе в последний день исследования – средний объем опухоли в контрольной группе в первоначальный день дозирования. Величины T/C в диапазоне 100%–42% интерпретируют как не имеющие или наличие минимальной противоопухолевой активности; величины T/C, которые составляют ≤42% и >10%, интерпретируют как наличие противоопухолевой активности или ингибирование роста опухоли. Величины T/C≤10% или величины регрессии ≥-10% интерпретируют как стаз опухоли. Величины регрессии < -10% описывают как регрессию.
Результаты:
[00832] Противоопухолевую активность T-клеток с CAR против мезотелина оценивали в модели с подкожным ксенотрансплантатом аденокарциномы яичника. После имплантации опухолевых клеток на 0 сутки, мышей, имеющих опухоль, случайным образом распределяли на группы введения и им вводили 4×106 CAR T-клеток (13,3×106 тотальных T-клеток) внутривенно через латеральную хвостовую вену на 14 сутки после имплантации опухоли. Половине мышей через 5 суток вводили вторую идентичную дозу T-клеток. Мониторинг роста опухоли и состояния здоровья животных проводили до тех пор, пока животные не достигали конечного результата. Мышей во всех группах умерщвляли между 57 и 62 сутками, когда опухоли начинали демонстрировать признаки изъязвления, которые приводили к изменению показателей состояния организма животного.
[00833] Среднее значение объема опухоли +/- SEM для всех групп введения нанесен на график на фиг.43. Группа введения PBS, в которой не вводили T-клетки, демонстрирует базовую кинетику роста опухоли OVCAR8 у мышей NSG при подкожной имплантации. В группе изотипического введения вводили T-клетки, трансдуцированные контрольным CAR. Эти клетки служат в качестве контроля в виде T-клеток, чтобы продемонстрировать неспецифический ответ донорных T-клеток человека в этой модели. Как PBS, так и группа изотипического введения, демонстрируют непрерывное прогрессирование опухоли в этом исследовании. Группа изотипического введения демонстрирует более замедленный рост опухоли вследствие фоновой активности донорных T-клеток. Аналогично предшествующим исследованиям, однократная доза 4×106 CAR+ T-клеток приводит к отсутствию изменений роста опухоли для группы введения SS1. Двойная доза SS1 CAR T-клеток аналогично приводила к отсутствию изменений роста опухоли OVCAR8. Группы однократных доз M5 и M11 демонстрируют явную противоопухолевую активность, как и ранее, когда дозировали 2×106 CAR+ T-клеток. Группы двукратных доз как M5, так и M11, продемонстрировали увеличенную противоопухолевую активность по сравнению с группами однократной дозы. Опухоли в этих группах демонстрируют регрессию в противоположность ингибированию роста опухоли. Группа двукратной дозы M5 демонстрирует полную регрессию у четырех из семи мышей без поддающейся определению опухоли в множество моментов времени.
[00834] Изменение объема опухоли против группы изотипического введения (дельта T/C %) вычисляли на 52 сутки, которые являются последним измерением объема опухоли перед умерщвлением мышей вследствие изъязвлением. В таблице 14 показаны величины дельта T/C для каждой группы. Группы как однократной, так и двукратной дозы SS1 продемонстрировали отсутствие противоопухолевой активности, аналогично группе введения контроля в виде PBS. Группа однократной дозы M5 демонстрирует ингибирование роста опухоли с величиной дельта T/C 30,28%, в то время как группа двукратной дозы M5 демонстрирует регрессию с величиной регрессии -63,90%. Групп однократной дозы M11 демонстрирует минимальную противоопухолевую активность с величиной дельта T/C 52,91%, в то время как группа двукратной дозы M11 также демонстрирует регрессию с величиной регрессии -15,80%.
Обсуждение:
[00835] Это исследование продемонстрировало, что специфичные к мезотелину CAR T-клетки (M5 и M11) при дозировании второй раз через пять суток после первоначальной дозы T-клеток способны приводить к регрессии опухолей OVCAR8. Этот ответ вместе с противоопухолевой активностью после однократной дозы T-клеток с CAR как M5, так и M11, является длительным. Кроме того, четыре из семи мышей в группе двукратного введения M5 продемонстрировали полную регрессию опухоли без поддающейся измерению опухоли толщинометром или пальпации.
[00836] Как наблюдалось ранее, например, в примере 8, однократная доза 2×106 T-клеток с CAR M5 или M11 демонстрирует противоопухолевую активность и, по-видимому, стаз в модели с ксенотрансплантатом OVCAR8 у мышей NSG. В этом исследовании однократная доза 4×106 T-клеток с CAR M5 или M11 демонстрирует тот же результат. По сравнению с изотипическими CAR T-клетками или SS1 CAR T-клетками, группы M5 и M11 демонстрируют явную противоопухолевую активность даже в однократной дозе (фиг.43). Введение второй дозы SS1 CAR T-клеток не демонстрирует увеличенного противоопухолевого ответа. Однако введение второй дозы T-клеток с CAR M5 или M11 приводит к усилению противоопухолевого ответа и приводит к регрессии опухолей в обеих из этих групп.
[00837] Увеличенная противоопухолевая активность T-клеток с CAR M5 и M11 может быть объяснена более механизмами. Первый состоит в том, что более высокая доза CAR T-клеток достигает регрессии в модели OVCAR8. Увеличение дозы CAR T-клеток, например, до 8×106 CAR T-клеток, например, в однократной дозе, может увеличить противоопухолевую активность и привести к регрессии. Другим механизмом является то, что дополнительные дозы CAR T-клеток повышают противоопухолевую активность и регрессию опухоли. Например, первоначальная доза может приводить к некоторой противоопухолевой активности вследствие экспансии CAR T-клеток и продукции T-клетками цитокинов. Введение дополнительной дозы, например второй дозы через пять суток, в то время как клетки все еще претерпевают экспансию, может увеличить активность клеток вследствие цитокинов, уже продуцированных ранее введенными CAR T-клетками.
[00838] Кроме того, предшествующие исследования показали инфильтрацию CAR T-клеток в опухоли OVCAR8. Инфильтрацию CAR T-клеток также исследовали у мышей, которым вводили двукратную дозу CAR T-клеток для определения того, происходит ли более высокая инфильтрация CD8+ (цитотоксических) T-клеток. Также оценивают живучесть CAR T-клеток с использованием анализа клеток в селезенке и костном мозге этих мышей.
Пример 18: Картирование эпитопа масс-спектрометрией водородно-дейтериевого обмена
[00839] Масс-спектрометрию водородно-дейтериевого обмена (HDX) проводили для прогнозирования областей мезотелина, которые вносят вклад в эпитопы, распознаваемые конструкциями scFv SS1 и M5. При HDX, атомы водорода амидного остова белка-мишени заменяются на дейтерий. Взаимодействие между белком-мишенью и связывающим белком, например антителом, "защищает" области белка-мишени от доступа растворителя, тем самым, препятствуя обмену водорода на поверхности контакта между белком-мишенью и связывающим белком. Таким образом, масс-спектрометрию HDX можно использовать для картирования поверхностей связывания белков, например, прогнозирования эпитопа антитела.
[00840] Как описано в примере 2, анализ конструкций scFv M5, M11, M12, M14, M16, M17, M21 и M23 сортировкой эпитопов на основе SPR против SS1 показал, что M5 и M11 связываются с эпитопом, отличающимся от эпитопа SS1. Для определения областей мезотелина человека, которые могут связываться SS1 и M5, проводили масс-спектрометрию HDX следующим образом.
[00841] Клонирование экспрессирующих плазмид
[00842] Фрагмент ДНК, соответствующий аминокислотам Val 297–Gly 588 мезотелина (Uniprot Q13421) клонировали в экспрессирующий вектор млекопитающих с использованием участков рестрикции HindIII и EcoRI на 5’- и 3’-концах, соответственно. Затем секреторную сигнальную последовательность встраивали на N-конце, соответствующем аминокислотам METDTLLLWVLLLWVPGSTGDAAQPAASE (SEQ ID NO: 376). На С-конце также встраивали V5-His-метку, соответствующую аминокислотам TRGSGKPIPNPLLGLDSTRTGHHHHHHHHHHHH (SEQ ID NO: 377). В эти три спрогнозированных участка гликозилирование вносили мутации: N388Q, N496Q и N523Q. Конечная экспрессированная последовательность представлена ниже:
Мезотелин с дефицитом гликозилирования (296-588; N388Q, N496Q, N523Q)
METDTLLLWVLLLWVPGSTGDAAQPAASEVEKTACPSGKKAREIDESLIFYKKWELEACVDAALLATQMDRVNAIPFTYEQLDVLKHKLDELYPQGYPESVIQHLGYLFLKMSPEDIRKWQVTSLETLKALLEVNKGHEMSPQVATLIDRFVKGRGQLDKDTLDTLTAFYPGYLCSLSPEELSSVPPSSIWAVRPQDLDTCDPRQLDVLYPKARLAFQNMQGSEYFVKIQSFLGGAPTEDLKALSQQQVSMDLATFMKLRTDAVLPLTVAEVQKLLGPHVEGLKAEERHRPVRDWILRQRQDDLDTLGLGLQGTRGSGKPIPNPLLGLDSTRTGHHHHHHHHHHHH (SEQ ID NO: 378)
[00843] scFv, соответствующий M5 IgG (например, SEQ ID NO: 43) аналогичным образом клонировали в экспрессирующий вектор млекопитающих с N-концевой лидерной последовательностью MALPVTALLLPLALLLHAARP (SEQ ID NO: 379) и C-концевой меткой для очистки из восьми остатков гистидина GSHHHHHHHH (SEQ ID NO: 380). Конечная экспрессированная последовательность представлена ниже:
MALPVTALLLPLALLLHAARPQVQLVQSGAEVEKPGASVKVSCKASGYTFTDYYMHWVRQAPGQGLEWMGWINPNSGGTNYAQKFQGRVTMTRDTSISTAYMELSRLRSDDTAVYYCASGWDFDYWGQGTLVTVSSGGGGSGGGGSGGGGSGGGGSDIVMTQSPSSLSASVGDRVTITCRASQSIRYYLSWYQQKPGKAPKLLIYTASILQNGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCLQTYTTPDFGPGTKVEIKGSHHHHHHHH (SEQ ID NO: 381).
[00844] Экспрессия и очистка белка
[00845] Как мезотелин, так и scFv M5 экспрессировали под контролем промотора CMV в экспрессирующей системе Expi293 (Life Technologies). Плазмиды мезотелина и scFv котрансфицировали в клетки Expi293 объемом 2 л при плотности 2,3×106 клеток/мл и жизнеспособности >97% с использованием 1 мг каждой очищенной плазмиды и 5 мг полиэтиленимина (PEI) в среде Opti-MEM (Life Technologies). Также мезотелин трансфицировали отдельно по сходному протоколу, но в 1 л клеток, с использованием 1 мг плазмидной ДНК и 2,5 мг PEI. Трансфекцию проводили в течение 5 суток, а затем клетки собирали, когда жизнеспособность достигала 80%.
[00846] После снижения жизнеспособности до 80% клетки и кондиционированные среды собирали и осаждали центрифугированием при 4000 xg в течение 10 минут. Затем кондиционированные среды фильтровали через 0,22-мкм фильтр для удаления какого-либо дебриса, а затем перемешивали в течение ночи со смолой для очистки Roche’s cOmplete His-Tag Purification Resin при 4°C. К среде, кондиционированной scFv-M5/мезотелином, добавляли 3 мл гранул, и к среде с мезотелином отдельно добавляли 1,5 мл гранул.
[00847] На следующее утра гранулы загружали в колонку Bio-Rad Econo-Column и промывали 15 объемами 50 мМ Tris.Cl, pH=8,0, 300 мМ NaCl, а затем 8 объемами колонки 50 мМ Tris.Cl, pH=8,0, 300 мМ NaCl, 20 мМ имидазолом. Затем белки элюировали с колонки с использованием 50 мМ Tris.Cl, pH=8,0, 300 мМ NaCl, 250 мМ имидазола. Элюированный образец собирали и концентрировали до 6 мл и загружали в колонку Superdex 75 16/60, подсоединенную к AKTAxpress (GE) в 20 мМ HEPES, pH=7,4, 150 мМ NaCl. Элюиаты, соответствующие ожидаемому размеру комплекса мезотелин:M5 или мезотелину отдельно, собирали и концентрировали до 5 мг/мл.
[00848] Картирование эпитопов водород-дейтериевым обменом/масс-спектрометрией
[00849] Водород-дейтериевый обмен (HDx) в комбинации с масс-спектрометрией (MS) (Woods VL, Hamuro Y (2001) High Resolution, High-Throughput Amide Deuterium Exchange-Mass Spectrometry (DXMS) Determination of Protein Binding Site Structure and Dynamics: Utility in Pharmaceutical Design. J. Cell. Biochem. Supp.; 84(37): 89-98.) использовали для картирования предполагаемого участка связывания scFv-антител M5 и SS1 на мезотелине человека (296-588), обозначаемом в настоящем описании как hMSLN296-588(SEQ ID No 278). В HDx, поддающиеся замену атомы водорода амида заменяют дейтерием. Этот процесс является чувствительным к структуре/динамике белка и доступа растворителя и, таким образом, он способен указать на положения, которые претерпевают снижение захвата дейтерия при связывании лиганда.
[00850] Эксперименты HDx/MS проводили с использованием способов, сходных со способами, описанными в литературе (Chalmers MJ, Busby SA, Pascal BD, He Y, Hendrickson CL, Marshall AG, Griffin PR (2006) Probing protein ligand interactions by automated hydrogen/deuterium exchange mass spectrometry. Anal. Chem.; 78(4): 1005-1014.Chalmers, 2006). Эксперименты проводили на платформе Waters HDx/MS, которая включала автоматический дозатор LEAP, nanoACQUITY UPLC и масс-спектрометр Synapt G2. Дейтериевый буфер, использованный для мечения остова белка hMSLN296-588 дейтерием, представлял собой 25 мМ HEPES, 150 мМ NaCl, pH 7,4; общий процент дейтерия в растере составлял 94,5%. Для экспериментов с мечением дейтерием hMSLN296-588в отсутствие антитела 400 пмоль hMSLN296-588 в объеме 6,9 мкл разбавляли с использованием 100 мкл дейтериевого буфера в течение 15 минут при 4°C. Затем реакцию мечения гасили 100 мкл охлажденного буфера для гашения при 2°C в течение трех минут, с последующим инжектированием на систему LC-MS для автоматизированного расщепления пепсином и анализа пептидов.
[00851] Для экспериментов с мечением дейтерием hMSLN296-588 в присутствии scFv M5 400 пмоль hMSLN296-588, коэкспрессированного с M5, в объеме 6,9 мкл разбавляли с использованием 100 мкл дейтериевого буфера в течение 15 минут при 4°C. Затем реакцию мечения гасили 100 мкл охлажденного буфера для гашения при 2°C в течение трех минут, с последующим инжектированием на систему LC-MS для автоматизированного расщепления пепсином и анализа пептидов. Для экспериментов с мечением дейтерием hMSLN296-588 в присутствии scFv SS1 400 пмоль hMSLN296-588 объединяли с 480 пмоль scFv SS1. После инкубации SS1 с hMSLN296-588 в течение 30 минут при 4°C общий объем 6,9 мкл разбавляли с использованием 100 мкл дейтериевого буфера в течение 15 минут при 4°C. Затем реакцию мечения гасили 100 мкл охлажденного буфера для гашения при 2°C в течение трех минут, с последующим инжектированием на систему LC-MS для автоматизированного расщепления пепсином и анализа пептидов.
[00852] Во всех экспериментах по обмену дейтерия гашение проводили с использованием 0,5 M TCEP и 3 M мочевина (pH=2,6). После гашения подвергнутый обмену антиген подвергали расщеплению пепсином в режиме онлайн с использованием колонки с иммобилизованным пепсином Poroszyme Immobilized Pepsin column (2,1×30 мм) при 12°C с последующим улавливанием на колонку для улавливания Waters Vanguard HSS T3. Пептиды элюировали с улавливающей колонки и разделяли на колонке Waters BEH C18 1×100 мм (поддерживаемой при 1°C) при скорости потока 40 мкл/мин с использованием бинарного 8,4-минутного градиента от 2 до 35% B (подвижная фаза A представляла собой 99,9% воду и 0,1% муравьиную кислоту; подвижная фаза B представляла собой 99,9% ацетонитрил и 0,1% муравьиную кислоту).
[00853] Пептиды из hMSLN296-588, мониторинг которых проводили с использованием экспериментов с дейтериевым обменом, представлены на фиг.44 (каждая планка соответствует пептиду). Был достигнут более чем 80% охват hMSLN296-588.
[00854] Для дифференциальных экспериментов между связанным и несвязанным состояниями антитела (M5 или SS1), является информативным исследование различий в захвате дейтерия между двумя этими состояниями. На фиг.45A и 45B отрицательная величина указывает на то, что комплекс мезотелин-антитело претерпевает меньший захват дейтерия, чем мезотелин отдельно. Снижение захвата дейтерия может быть следствием защиты области от замещающего дейтерия или стабилизации сети водородных связей. Напротив, положительная величина указывает на то, что комплекс претерпевает более высокий захват дейтерия относительно мезотелина отдельно. Увеличение захвата дейтерия может быть следствием дестабилизации сетей водородных связей (т.е. локализованное разворачивание белка).
[00855] Дифференциальный дейтериевый обмен между мезотелином и мезотелином в комплексе либо с SS1, либо с M5, считали значимым, если: 1) если отличие составляет более 0,75 Да или в случаях, когда отличие является равным или меньшим, чем 0,75 Да, 2) отличие превышает 0,2 Да и является статистически значимым (p<0,01) при использовании критерия Тьюки. См., например, Houde D, Berkowitz SA, Engen JR (2010) The Utility of Hydrogen/Deuterium Exchange Mass Spectrometry in Biopharmaceutical Comparability Studies. J. Pharma. Sci.; 100(6): 2071-2086; Chalmers, MJ, Pascal BD, Willis S, Zhang J, iturria SJ, Dodge JA, Griffin PR (2011) Methods for the Analysis of High Precision Differential Hydrogen Deuterium Exchange Data Int. J. Mass Spectrom.; 302(1-3): 59-68.
[00856] На фиг.45A показан дифференциальный захват дейтерия комплексом M5-мезотелин (черные столбики) и дифференциальный захват комплекса SS1-мезотелин (серые столбики) в аминокислотных положениях с 297 по 464 на мезотелине. В этой области связывание M5 с мезотелином вызывало отсутствие защиты и наблюдали некоторую очень небольшую дестабилизации. Напротив, связывание SS1 с мезотелином вызывало значительную защиту в следующих пептидах: 297-315, 315-322, 316-325, 337-346, 337-349, 350-375 и 369-376. Защита в пептидах 297-315, 315-322, 316-325, 337-346, 337-349 согласуется с опубликованной кристаллографической структурой, где остатки E313, F317, K319, P343 и Y346 формируют значительную часть эпитопа (Ma J, Tang WK, Esser L, Pastan I, Xia D (2012) Recognition of Mesotehlin by the Therapuetic Antibody MORAb-009 J. Biol. Chem.; (287)40: 33123-33131). На фиг.45B показан дифференциальный захват дейтерия для положения аминокислот 458-586 на мезотелине. В этой области связывание M5 вызывало значительную защиту в следующих пептидах: 481-490, 483-490, 498-510, 501-507, 531-540, 532-540, 532-546, 537-546, 545-558, 546-569, 547-560, 558-571, 561-572. Посредством сравнения защиты перекрывающихся пептидов авторы настоящего изобретения установили, что области 485-490, 498-507, 532-537 и 545-572 являются в значительной степени защищенными в комплексе M5-мезотелин. Напротив, комплекс SS1-мезотелин не содержит каких-либо пептидов в области 458-586, которые являются в значительной степени защищенными при использовании критериев, указанных выше.
[00857] На фиг.46 представлено обобщение защищенных областей для комплекса как M5, так и SS1. Эти данные указывают на то, что M5 защищает исключительно C-концевую сторону мезотелина, и что аминокислотные остатки 485-490, 498-507, 532-537 и 545-572 могут участвовать во взаимодействии с M5-мезотелином. Напротив, SS1 защищает исключительно N-концевую сторону мезотелина, и отсутствовало наблюдаемое перекрывание областей, защищенных SS1, и областей, защищенных M5. Наблюдение двух различных паттернов защиты для SS1 и M5 указывает на то, что M5 вероятно связывается с эпитопом, отличающимся от эпитопа, связываемого SS1. Ожидается, что M11 связывается со сходной областью MSLN по сравнению с M5, и M11 и M5 обладают высокой гомологией как тяжелых, так и легких цепей, включая идентичные области CDR3.
ЭКВИВАЛЕНТЫ
[00858] Содержание каждого патента, патентной заявки и публикации, цитированных в настоящем описании, включено в настоящее описание в качестве ссылки в полном объеме. Хотя это изобретение описано в отношении конкретных аспектов, очевидно, что другие аспекты и вариации настоящего изобретения могут быть установлены другими специалистами без отклонения от истинной сущности и объема изобретения. Подразумевают, что прилагаемую формулу изобретения следует истолковывать как включающую все такие аспекты и эквивалентные вариации.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> NOVARTIS AG
THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA
<120> ХИМЕРНЫЕ РЕЦЕПТОРЫ АНТИГЕНА ПРОТИВ МЕЗОТЕЛИНА ЧЕЛОВЕКА И ИХ ПРИМЕНЕНИЕ
<130> N2067-7033WO4
<140>
<141>
<150> PCT/CN2014/090509
<151> 2014-11-06
<150> PCT/CN2014/082610
<151> 2014-07-21
<150> PCT/CN2013/089979
<151> 2013-12-19
<160> 402
<170> PatentIn version 3.5
<210> 1
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 1
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro
20
<210> 2
<211> 45
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 2
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
1 5 10 15
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
20 25 30
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp
35 40 45
<210> 3
<211> 230
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 3
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys Met
225 230
<210> 4
<211> 282
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 4
Arg Trp Pro Glu Ser Pro Lys Ala Gln Ala Ser Ser Val Pro Thr Ala
1 5 10 15
Gln Pro Gln Ala Glu Gly Ser Leu Ala Lys Ala Thr Thr Ala Pro Ala
20 25 30
Thr Thr Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Lys Glu Lys
35 40 45
Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys Pro
50 55 60
Ser His Thr Gln Pro Leu Gly Val Tyr Leu Leu Thr Pro Ala Val Gln
65 70 75 80
Asp Leu Trp Leu Arg Asp Lys Ala Thr Phe Thr Cys Phe Val Val Gly
85 90 95
Ser Asp Leu Lys Asp Ala His Leu Thr Trp Glu Val Ala Gly Lys Val
100 105 110
Pro Thr Gly Gly Val Glu Glu Gly Leu Leu Glu Arg His Ser Asn Gly
115 120 125
Ser Gln Ser Gln His Ser Arg Leu Thr Leu Pro Arg Ser Leu Trp Asn
130 135 140
Ala Gly Thr Ser Val Thr Cys Thr Leu Asn His Pro Ser Leu Pro Pro
145 150 155 160
Gln Arg Leu Met Ala Leu Arg Glu Pro Ala Ala Gln Ala Pro Val Lys
165 170 175
Leu Ser Leu Asn Leu Leu Ala Ser Ser Asp Pro Pro Glu Ala Ala Ser
180 185 190
Trp Leu Leu Cys Glu Val Ser Gly Phe Ser Pro Pro Asn Ile Leu Leu
195 200 205
Met Trp Leu Glu Asp Gln Arg Glu Val Asn Thr Ser Gly Phe Ala Pro
210 215 220
Ala Arg Pro Pro Pro Gln Pro Gly Ser Thr Thr Phe Trp Ala Trp Ser
225 230 235 240
Val Leu Arg Val Pro Ala Pro Pro Ser Pro Gln Pro Ala Thr Tyr Thr
245 250 255
Cys Val Val Ser His Glu Asp Ser Arg Thr Leu Leu Asn Ala Ser Arg
260 265 270
Ser Leu Glu Val Ser Tyr Val Thr Asp His
275 280
<210> 5
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 5
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10
<210> 6
<211> 24
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 6
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
1 5 10 15
Ser Leu Val Ile Thr Leu Tyr Cys
20
<210> 7
<211> 42
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 7
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
1 5 10 15
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
20 25 30
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
35 40
<210> 8
<211> 48
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 8
Gln Arg Arg Lys Tyr Arg Ser Asn Lys Gly Glu Ser Pro Val Glu Pro
1 5 10 15
Ala Glu Pro Cys Arg Tyr Ser Cys Pro Arg Glu Glu Glu Gly Ser Thr
20 25 30
Ile Pro Ile Gln Glu Asp Tyr Arg Lys Pro Glu Pro Ala Cys Ser Pro
35 40 45
<210> 9
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 9
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210> 10
<211> 112
<212> БЕЛОК
<213> Homo sapiens
<400> 10
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210> 11
<211> 1184
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 11
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaag gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacctggctg cagtacgtga ttcttgatcc cgagcttcgg gttggaagtg 360
ggtgggagag ttcgaggcct tgcgcttaag gagccccttc gcctcgtgct tgagttgagg 420
cctggcctgg gcgctggggc cgccgcgtgc gaatctggtg gcaccttcgc gcctgtctcg 480
ctgctttcga taagtctcta gccatttaaa atttttgatg acctgctgcg acgctttttt 540
tctggcaaga tagtcttgta aatgcgggcc aagatctgca cactggtatt tcggtttttg 600
gggccgcggg cggcgacggg gcccgtgcgt cccagcgcac atgttcggcg aggcggggcc 660
tgcgagcgcg gccaccgaga atcggacggg ggtagtctca agctggccgg cctgctctgg 720
tgcctggcct cgcgccgccg tgtatcgccc cgccctgggc ggcaaggctg gcccggtcgg 780
caccagttgc gtgagcggaa agatggccgc ttcccggccc tgctgcaggg agctcaaaat 840
ggaggacgcg gcgctcggga gagcgggcgg gtgagtcacc cacacaaagg aaaagggcct 900
ttccgtcctc agccgtcgct tcatgtgact ccacggagta ccgggcgccg tccaggcacc 960
tcgattagtt ctcgagcttt tggagtacgt cgtctttagg ttggggggag gggttttatg 1020
cgatggagtt tccccacact gagtgggtgg agactgaagt taggccagct tggcacttga 1080
tgtaattctc cttggaattt gccctttttg agtttggatc ttggttcatt ctcaagcctc 1140
agacagtggt tcaaagtttt tttcttccat ttcaggtgtc gtga 1184
<210> 12
<211> 63
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический олигонуклеотид
<400> 12
atggccctgc ctgtgacagc cctgctgctg cctctggctc tgctgctgca tgccgctaga 60
ccc 63
<210> 13
<211> 135
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 13
accacgacgc cagcgccgcg accaccaaca ccggcgccca ccatcgcgtc gcagcccctg 60
tccctgcgcc cagaggcgtg ccggccagcg gcggggggcg cagtgcacac gagggggctg 120
gacttcgcct gtgat 135
<210> 14
<211> 690
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 14
gagagcaagt acggccctcc ctgcccccct tgccctgccc ccgagttcct gggcggaccc 60
agcgtgttcc tgttcccccc caagcccaag gacaccctga tgatcagccg gacccccgag 120
gtgacctgtg tggtggtgga cgtgtcccag gaggaccccg aggtccagtt caactggtac 180
gtggacggcg tggaggtgca caacgccaag accaagcccc gggaggagca gttcaatagc 240
acctaccggg tggtgtccgt gctgaccgtg ctgcaccagg actggctgaa cggcaaggaa 300
tacaagtgta aggtgtccaa caagggcctg cccagcagca tcgagaaaac catcagcaag 360
gccaagggcc agcctcggga gccccaggtg tacaccctgc cccctagcca agaggagatg 420
accaagaacc aggtgtccct gacctgcctg gtgaagggct tctaccccag cgacatcgcc 480
gtggagtggg agagcaacgg ccagcccgag aacaactaca agaccacccc ccctgtgctg 540
gacagcgacg gcagcttctt cctgtacagc cggctgaccg tggacaagag ccggtggcag 600
gagggcaacg tctttagctg ctccgtgatg cacgaggccc tgcacaacca ctacacccag 660
aagagcctga gcctgtccct gggcaagatg 690
<210> 15
<211> 847
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 15
aggtggcccg aaagtcccaa ggcccaggca tctagtgttc ctactgcaca gccccaggca 60
gaaggcagcc tagccaaagc tactactgca cctgccacta cgcgcaatac tggccgtggc 120
ggggaggaga agaaaaagga gaaagagaaa gaagaacagg aagagaggga gaccaagacc 180
cctgaatgtc catcccatac ccagccgctg ggcgtctatc tcttgactcc cgcagtacag 240
gacttgtggc ttagagataa ggccaccttt acatgtttcg tcgtgggctc tgacctgaag 300
gatgcccatt tgacttggga ggttgccgga aaggtaccca cagggggggt tgaggaaggg 360
ttgctggagc gccattccaa tggctctcag agccagcact caagactcac ccttccgaga 420
tccctgtgga acgccgggac ctctgtcaca tgtactctaa atcatcctag cctgccccca 480
cagcgtctga tggcccttag agagccagcc gcccaggcac cagttaagct tagcctgaat 540
ctgctcgcca gtagtgatcc cccagaggcc gccagctggc tcttatgcga agtgtccggc 600
tttagcccgc ccaacatctt gctcatgtgg ctggaggacc agcgagaagt gaacaccagc 660
ggcttcgctc cagcccggcc cccaccccag ccgggttcta ccacattctg ggcctggagt 720
gtcttaaggg tcccagcacc acctagcccc cagccagcca catacacctg tgttgtgtcc 780
catgaagata gcaggaccct gctaaatgct tctaggagtc tggaggtttc ctacgtgact 840
gaccatt 847
<210> 16
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический олигонуклеотид
<400> 16
ggtggcggag gttctggagg tggaggttcc 30
<210> 17
<211> 72
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический олигонуклеотид
<400> 17
atctacatct gggcgccctt ggccgggact tgtggggtcc ttctcctgtc actggttatc 60
accctttact gc 72
<210> 18
<211> 126
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 18
aaacggggca gaaagaaact cctgtatata ttcaaacaac catttatgag accagtacaa 60
actactcaag aggaagatgg ctgtagctgc cgatttccag aagaagaaga aggaggatgt 120
gaactg 126
<210> 19
<211> 123
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 19
aggagtaaga ggagcaggct cctgcacagt gactacatga acatgactcc ccgccgcccc 60
gggcccaccc gcaagcatta ccagccctat gccccaccac gcgacttcgc agcctatcgc 120
tcc 123
<210> 20
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 20
agagtgaagt tcagcaggag cgcagacgcc cccgcgtaca agcagggcca gaaccagctc 60
tataacgagc tcaatctagg acgaagagag gagtacgatg ttttggacaa gagacgtggc 120
cgggaccctg agatgggggg aaagccgaga aggaagaacc ctcaggaagg cctgtacaat 180
gaactgcaga aagataagat ggcggaggcc tacagtgaga ttgggatgaa aggcgagcgc 240
cggaggggca aggggcacga tggcctttac cagggtctca gtacagccac caaggacacc 300
tacgacgccc ttcacatgca ggccctgccc cctcgc 336
<210> 21
<211> 336
<212> ДНК
<213> Homo sapiens
<400> 21
agagtgaagt tcagcaggag cgcagacgcc cccgcgtacc agcagggcca gaaccagctc 60
tataacgagc tcaatctagg acgaagagag gagtacgatg ttttggacaa gagacgtggc 120
cgggaccctg agatgggggg aaagccgaga aggaagaacc ctcaggaagg cctgtacaat 180
gaactgcaga aagataagat ggcggaggcc tacagtgaga ttgggatgaa aggcgagcgc 240
cggaggggca aggggcacga tggcctttac cagggtctca gtacagccac caaggacacc 300
tacgacgccc ttcacatgca ggccctgccc cctcgc 336
<210> 22
<211> 373
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 22
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr
145 150 155 160
Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala
165 170 175
Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe
180 185 190
Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val
195 200 205
Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys
210 215 220
Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr
225 230 235 240
Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu
245 250 255
Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro
260 265 270
Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly
275 280 285
Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro
290 295 300
Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr
305 310 315 320
Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly
325 330 335
Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln
340 345 350
Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln
355 360 365
Ala Leu Pro Pro Arg
370
<210> 23
<211> 1182
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 23
atggccctcc ctgtcactgc cctgcttctc cccctcgcac tcctgctcca cgccgctaga 60
ccacccggat ggtttctgga ctctccggat cgcccgtgga atcccccaac cttctcaccg 120
gcactcttgg ttgtgactga gggcgataat gcgaccttca cgtgctcgtt ctccaacacc 180
tccgaatcat tcgtgctgaa ctggtaccgc atgagcccgt caaaccagac cgacaagctc 240
gccgcgtttc cggaagatcg gtcgcaaccg ggacaggatt gtcggttccg cgtgactcaa 300
ctgccgaatg gcagagactt ccacatgagc gtggtccgcg ctaggcgaaa cgactccggg 360
acctacctgt gcggagccat ctcgctggcg cctaaggccc aaatcaaaga gagcttgagg 420
gccgaactga gagtgaccga gcgcagagct gaggtgccaa ctgcacatcc atccccatcg 480
cctcggcctg cggggcagtt tcagaccctg gtcacgacca ctccggcgcc gcgcccaccg 540
actccggccc caactatcgc gagccagccc ctgtcgctga ggccggaagc atgccgccct 600
gccgccggag gtgctgtgca tacccgggga ttggacttcg catgcgacat ctacatttgg 660
gctcctctcg ccggaacttg tggcgtgctc cttctgtccc tggtcatcac cctgtactgc 720
aagcggggtc ggaaaaagct tctgtacatt ttcaagcagc ccttcatgag gcccgtgcaa 780
accacccagg aggaggacgg ttgctcctgc cggttccccg aagaggaaga aggaggttgc 840
gagctgcgcg tgaagttctc ccggagcgcc gacgcccccg cctataagca gggccagaac 900
cagctgtaca acgaactgaa cctgggacgg cgggaagagt acgatgtgct ggacaagcgg 960
cgcggccggg accccgaaat gggcgggaag cctagaagaa agaaccctca ggaaggcctg 1020
tataacgagc tgcagaagga caagatggcc gaggcctact ccgaaattgg gatgaaggga 1080
gagcggcgga ggggaaaggg gcacgacggc ctgtaccaag gactgtccac cgccaccaag 1140
gacacatacg atgccctgca catgcaggcc cttccccctc gc 1182
<210> 24
<211> 394
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 24
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro
20 25 30
Trp Asn Pro Pro Thr Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly
35 40 45
Asp Asn Ala Thr Phe Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe
50 55 60
Val Leu Asn Trp Tyr Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu
65 70 75 80
Ala Ala Phe Pro Glu Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe
85 90 95
Arg Val Thr Gln Leu Pro Asn Gly Arg Asp Phe His Met Ser Val Val
100 105 110
Arg Ala Arg Arg Asn Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser
115 120 125
Leu Ala Pro Lys Ala Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg
130 135 140
Val Thr Glu Arg Arg Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser
145 150 155 160
Pro Arg Pro Ala Gly Gln Phe Gln Thr Leu Val Thr Thr Thr Pro Ala
165 170 175
Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser
180 185 190
Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr
195 200 205
Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala
210 215 220
Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys
225 230 235 240
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
245 250 255
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
260 265 270
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg
275 280 285
Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn
290 295 300
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
305 310 315 320
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
325 330 335
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
340 345 350
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
355 360 365
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
370 375 380
Ala Leu His Met Gln Ala Leu Pro Pro Arg
385 390
<210> 25
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 25
Gly Gly Gly Gly Ser
1 5
<210> 26
<211> 30
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<220>
<221> дополнительный признак
<222> (1)..(30)
<223> Эта последовательность может охватывать 1-6 повторяющихся элементов "Gly Gly Gly Gly Ser", где некоторые положения могут отсутствовать
<220>
<223> См. поданное описание для подробного описания замен и предпочтительных вариантов осуществления
<400> 26
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
20 25 30
<210> 27
<211> 20
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 27
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser
20
<210> 28
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 28
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 29
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 29
Gly Gly Gly Ser
1
<210> 30
<211> 5000
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<221> дополнительный признак
<222> (1)..(5000)
<223> Эта последовательность может охватывать 50-5000 нуклеотидо, где некоторые положения могут отсутствовать
<220>
<223> См. поданное описание для подробного описания замен и предпочтительных вариантов осуществления
<400> 30
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 60
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 420
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 480
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 540
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 600
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 660
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 720
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 780
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 840
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 900
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 960
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1020
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1080
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1140
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1200
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1260
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1320
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1380
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1440
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1500
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1560
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1620
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1680
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1740
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1800
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1860
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1920
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1980
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2040
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2100
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2160
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2220
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2280
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2340
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2400
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2460
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2520
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2580
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2640
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2700
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2760
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2820
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2880
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2940
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3000
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3060
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3420
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3480
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3540
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3600
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3660
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3720
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3780
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3840
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3900
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3960
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4020
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4080
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4140
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4200
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4260
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4320
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4380
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4440
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4500
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4560
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4620
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4680
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4740
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4800
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4860
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4920
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4980
aaaaaaaaaa aaaaaaaaaa 5000
<210> 31
<211> 100
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 31
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 60
tttttttttt tttttttttt tttttttttt tttttttttt 100
<210> 32
<211> 5000
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<221> дополнительный признак
<222> (1)..(5000)
<223> Эта последовательность может охватывать 50-5000 нуклеотидов, где некоторые положения могут отсутствовать
<220>
<223> См. поданное описание для подробного описания замен и предпочтительных вариантов осуществления
<400> 32
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 60
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 120
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 180
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 240
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 300
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 360
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 420
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 480
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 540
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 600
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 660
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 720
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 780
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 840
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 900
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 960
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1020
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1080
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1140
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1200
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1260
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1320
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1380
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1440
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1500
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1560
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1620
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1680
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1740
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1800
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1860
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1920
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1980
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2040
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2100
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2160
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2220
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2280
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2340
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2400
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2460
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2520
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2580
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2640
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2700
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2760
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2820
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2880
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2940
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3000
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3060
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3120
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3180
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3240
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3300
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3360
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3420
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3480
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3540
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3600
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3660
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3720
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3780
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3840
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3900
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3960
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4020
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4080
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4140
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4200
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4260
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4320
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4380
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4440
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4500
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4560
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4620
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4680
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4740
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4800
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4860
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4920
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4980
tttttttttt tttttttttt 5000
<210> 33
<211> 5000
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<221> дополнительный признак
<222> (1)..(5000)
<223> Эта последовательность может охватывать 100-5000 нуклеотидов, где некоторые положения могут отсутствовать
<220>
<223> См. поданное описание для подробного описания замен и предпочтительных вариантов осуществления
<400> 33
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 60
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 420
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 480
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 540
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 600
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 660
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 720
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 780
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 840
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 900
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 960
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1020
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1080
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1140
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1200
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1260
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1320
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1380
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1440
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1500
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1560
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1620
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1680
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1740
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1800
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1860
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1920
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1980
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2040
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2100
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2160
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2220
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2280
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2340
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2400
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2460
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2520
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2580
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2640
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2700
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2760
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2820
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2880
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2940
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3000
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3060
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3420
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3480
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3540
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3600
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3660
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3720
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3780
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3840
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3900
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3960
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4020
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4080
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4140
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4200
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4260
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4320
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4380
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4440
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4500
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4560
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4620
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4680
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4740
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4800
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4860
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4920
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4980
aaaaaaaaaa aaaaaaaaaa 5000
<210> 34
<211> 400
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<221> дополнительный признак
<222> (1)..(400)
<223> Эта последовательность может охватывать 100-400 нуклеотидов, где некоторые положения могут отсутствовать
<220>
<223> См. поданное описание для подробного описания замен и предпочтительных вариантов осуществления
<400> 34
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 60
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 400
<210> 35
<211> 2000
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<221> дополнительный признак
<222> (1)..(2000)
<223> Эта последовательность может охватывать 50-2000, где некоторые положения могут отсутствовать
<220>
<223> См. поданное описание для подробного описания замен и предпочтительных вариантов осуществления
<400> 35
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 60
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 420
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 480
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 540
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 600
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 660
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 720
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 780
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 840
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 900
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 960
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1020
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1080
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1140
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1200
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1260
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1320
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1380
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1440
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1500
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1560
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1620
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1680
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1740
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1800
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1860
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1920
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1980
aaaaaaaaaa aaaaaaaaaa 2000
<210> 36
<211> 230
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 36
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys Met
225 230
<210> 37
<211> 690
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 37
gagagcaagt acggccctcc ctgcccccct tgccctgccc ccgagttcct gggcggaccc 60
agcgtgttcc tgttcccccc caagcccaag gacaccctga tgatcagccg gacccccgag 120
gtgacctgtg tggtggtgga cgtgtcccag gaggaccccg aggtccagtt caactggtac 180
gtggacggcg tggaggtgca caacgccaag accaagcccc gggaggagca gttcaatagc 240
acctaccggg tggtgtccgt gctgaccgtg ctgcaccagg actggctgaa cggcaaggaa 300
tacaagtgta aggtgtccaa caagggcctg cccagcagca tcgagaaaac catcagcaag 360
gccaagggcc agcctcggga gccccaggtg tacaccctgc cccctagcca agaggagatg 420
accaagaacc aggtgtccct gacctgcctg gtgaagggct tctaccccag cgacatcgcc 480
gtggagtggg agagcaacgg ccagcccgag aacaactaca agaccacccc ccctgtgctg 540
gacagcgacg gcagcttctt cctgtacagc cggctgaccg tggacaagag ccggtggcag 600
gagggcaacg tctttagctg ctccgtgatg cacgaggccc tgcacaacca ctacacccag 660
aagagcctga gcctgtccct gggcaagatg 690
<210> 38
<211> 40
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<220>
<221> дополнительный признак
<222> (1)..(40)
<223> Эта последовательность может охватывать 1-10 повторяющихся элементов "Gly Gly Gly Ser", где некоторые положения могут отсутствовать
<220>
<223> См. поданное описание для подробного описания замен и предпочтительных вариантов осуществления
<400> 38
Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser
20 25 30
Gly Gly Gly Ser Gly Gly Gly Ser
35 40
<210> 39
<211> 244
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 39
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Arg Tyr Tyr Gly Met Asp Val Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Leu Thr Gln Ser
130 135 140
Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Ile Ser Cys
145 150 155 160
Arg Ala Ser Gln Ser Val Ser Ser Asn Phe Ala Trp Tyr Gln Gln Arg
165 170 175
Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Asp Ala Ser Asn Arg Ala
180 185 190
Thr Gly Ile Pro Pro Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
195 200 205
Thr Leu Thr Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala Ala Tyr Tyr
210 215 220
Cys His Gln Arg Ser Asn Trp Leu Tyr Thr Phe Gly Gln Gly Thr Lys
225 230 235 240
Val Asp Ile Lys
<210> 40
<211> 253
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 40
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Leu Arg Arg Thr Val Val Thr Pro Arg Ala Tyr Tyr Gly
100 105 110
Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Gly Gly
115 120 125
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Asp Ile Gln Leu Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser
145 150 155 160
Val Gly Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Asp Ile Ser
165 170 175
Asn Ser Leu Asn Trp Tyr Gln Gln Lys Ala Gly Lys Ala Pro Lys Leu
180 185 190
Leu Ile Tyr Asp Ala Ser Thr Leu Glu Thr Gly Val Pro Ser Arg Phe
195 200 205
Ser Gly Ser Gly Ser Gly Thr Asp Phe Ser Phe Thr Ile Ser Ser Leu
210 215 220
Gln Pro Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln His Asp Asn Leu
225 230 235 240
Pro Leu Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
245 250
<210> 41
<211> 246
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 41
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Pro Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Glu Trp Asp Gly Ser Tyr Tyr Tyr Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Val Leu
130 135 140
Thr Gln Thr Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr
145 150 155 160
Ile Thr Cys Arg Ala Ser Gln Ser Ile Asn Thr Tyr Leu Asn Trp Tyr
165 170 175
Gln His Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ala Ala Ser
180 185 190
Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly
195 200 205
Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala
210 215 220
Thr Tyr Tyr Cys Gln Gln Ser Phe Ser Pro Leu Thr Phe Gly Gly Gly
225 230 235 240
Thr Lys Leu Glu Ile Lys
245
<210> 42
<211> 242
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 42
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Val Pro Gly Lys Gly Leu Val Trp Val
35 40 45
Ser Arg Ile Asn Thr Asp Gly Ser Thr Thr Thr Tyr Ala Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Asp Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Gly Gly His Trp Ala Val Trp Gly Gln Gly Thr Thr Val Thr Val
100 105 110
Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln Ser Pro Ser Thr
130 135 140
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser
145 150 155 160
Gln Ser Ile Ser Asp Arg Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys
165 170 175
Ala Pro Lys Leu Leu Ile Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val
180 185 190
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr
195 200 205
Ile Ser Ser Leu Gln Pro Asp Asp Phe Ala Val Tyr Tyr Cys Gln Gln
210 215 220
Tyr Gly His Leu Pro Met Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu
225 230 235 240
Ile Lys
<210> 43
<211> 241
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 43
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Glu Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Gly Trp Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Asp Ile Val Met Thr Gln Ser Pro Ser
130 135 140
Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala
145 150 155 160
Ser Gln Ser Ile Arg Tyr Tyr Leu Ser Trp Tyr Gln Gln Lys Pro Gly
165 170 175
Lys Ala Pro Lys Leu Leu Ile Tyr Thr Ala Ser Ile Leu Gln Asn Gly
180 185 190
Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu
195 200 205
Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Leu
210 215 220
Gln Thr Tyr Thr Thr Pro Asp Phe Gly Pro Gly Thr Lys Val Glu Ile
225 230 235 240
Lys
<210> 44
<211> 253
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 44
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Arg Leu Ile Ala Val Ala Gly Asp Tyr Tyr Tyr Tyr Gly
100 105 110
Met Asp Val Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly
115 120 125
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser
145 150 155 160
Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Val Gly
165 170 175
Arg Trp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Thr Ala Pro Lys Leu
180 185 190
Leu Ile Tyr Ala Ala Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe
195 200 205
Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Asn Leu
210 215 220
Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ala Asn Ser Phe
225 230 235 240
Pro Leu Thr Phe Gly Gly Gly Thr Arg Leu Glu Ile Lys
245 250
<210> 45
<211> 250
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 45
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Trp Lys Val Ser Ser Ser Ser Pro Ala Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val
130 135 140
Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala
145 150 155 160
Ile Leu Ser Cys Arg Ala Ser Gln Ser Val Tyr Thr Lys Tyr Leu Gly
165 170 175
Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Asp
180 185 190
Ala Ser Thr Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly Ser Gly
195 200 205
Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Arg Leu Glu Pro Glu Asp
210 215 220
Phe Ala Val Tyr Tyr Cys Gln His Tyr Gly Gly Ser Pro Leu Ile Thr
225 230 235 240
Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
245 250
<210> 46
<211> 246
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 46
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Thr Ser Gly Tyr Pro Phe Thr Gly Tyr
20 25 30
Ser Leu His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp His Tyr Gly Gly Asn Ser Leu Phe Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Leu Thr
130 135 140
Gln Ser Pro Ser Ser Ile Ser Ala Ser Val Gly Asp Thr Val Ser Ile
145 150 155 160
Thr Cys Arg Ala Ser Gln Asp Ser Gly Thr Trp Leu Ala Trp Tyr Gln
165 170 175
Gln Lys Pro Gly Lys Ala Pro Asn Leu Leu Met Tyr Asp Ala Ser Thr
180 185 190
Leu Glu Asp Gly Val Pro Ser Arg Phe Ser Gly Ser Ala Ser Gly Thr
195 200 205
Glu Phe Thr Leu Thr Val Asn Arg Leu Gln Pro Glu Asp Ser Ala Thr
210 215 220
Tyr Tyr Cys Gln Gln Tyr Asn Ser Tyr Pro Leu Thr Phe Gly Gly Gly
225 230 235 240
Thr Lys Val Asp Ile Lys
245
<210> 47
<211> 248
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 47
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Glu Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Gly Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val His
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Tyr Ser Ser Ser Ser Asp Ala Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln
130 135 140
Met Thr Gln Ser Pro Pro Ser Leu Ser Ala Ser Val Gly Asp Arg Val
145 150 155 160
Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Ser Ala Leu Ala Trp
165 170 175
Tyr Gln Gln Lys Pro Gly Thr Pro Pro Lys Leu Leu Ile Tyr Asp Ala
180 185 190
Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser
195 200 205
Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe
210 215 220
Ala Thr Tyr Tyr Cys Gln Gln Phe Ser Ser Tyr Pro Leu Thr Phe Gly
225 230 235 240
Gly Gly Thr Arg Leu Glu Ile Lys
245
<210> 48
<211> 255
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 48
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Gly Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Ser Ala Tyr Asn Gly Asn Thr Asn Tyr Ala Gln Lys Leu
50 55 60
Gln Gly Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Val Ala Gly Gly Ile Tyr Tyr Tyr Tyr Gly Met Asp Val Trp
100 105 110
Gly Gln Gly Thr Thr Ile Thr Val Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile
130 135 140
Val Met Thr Gln Thr Pro Asp Ser Leu Ala Val Ser Leu Gly Glu Arg
145 150 155 160
Ala Thr Ile Ser Cys Lys Ser Ser His Ser Val Leu Tyr Asn Arg Asn
165 170 175
Asn Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
180 185 190
Lys Leu Leu Phe Tyr Trp Ala Ser Thr Arg Lys Ser Gly Val Pro Asp
195 200 205
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
210 215 220
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Phe Cys Gln Gln Thr Gln
225 230 235 240
Thr Phe Pro Leu Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Asn
245 250 255
<210> 49
<211> 241
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 49
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Asn Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Gly Trp Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Asp Ile Arg Met Thr Gln Ser Pro Ser
130 135 140
Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala
145 150 155 160
Ser Gln Ser Ile Arg Tyr Tyr Leu Ser Trp Tyr Gln Gln Lys Pro Gly
165 170 175
Lys Ala Pro Lys Leu Leu Ile Tyr Thr Ala Ser Ile Leu Gln Asn Gly
180 185 190
Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu
195 200 205
Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Leu
210 215 220
Gln Thr Tyr Thr Thr Pro Asp Phe Gly Pro Gly Thr Lys Val Glu Ile
225 230 235 240
Lys
<210> 50
<211> 246
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 50
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Thr Thr Ser Tyr Ala Phe Asp Ile Trp Gly Gln Gly Thr
100 105 110
Met Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Leu Thr Gln
130 135 140
Ser Pro Ser Thr Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr
145 150 155 160
Cys Arg Ala Ser Gln Ser Ile Ser Thr Trp Leu Ala Trp Tyr Gln Gln
165 170 175
Lys Pro Gly Lys Ala Pro Asn Leu Leu Ile Tyr Lys Ala Ser Thr Leu
180 185 190
Glu Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu
195 200 205
Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp Asp Phe Ala Thr Tyr
210 215 220
Tyr Cys Gln Gln Tyr Asn Thr Tyr Ser Pro Tyr Thr Phe Gly Gln Gly
225 230 235 240
Thr Lys Leu Glu Ile Lys
245
<210> 51
<211> 249
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 51
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Glu Ala Ser Gly Phe Ile Phe Ser Asp Tyr
20 25 30
Tyr Met Gly Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Gly Arg Ser Gly Ser Ser Met Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Phe Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ser Pro Val Val Ala Ala Thr Glu Asp Phe Gln His Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Val
130 135 140
Met Thr Gln Thr Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala
145 150 155 160
Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Thr Ser Asn Tyr Leu Ala
165 170 175
Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Leu Phe Gly
180 185 190
Ala Ser Thr Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly Ser Gly
195 200 205
Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Arg Leu Glu Pro Glu Asp
210 215 220
Phe Ala Met Tyr Tyr Cys Gln Gln Tyr Gly Ser Ala Pro Val Thr Phe
225 230 235 240
Gly Gln Gly Thr Lys Leu Glu Ile Lys
245
<210> 52
<211> 249
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 52
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Arg Ala Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Phe Thr Phe Arg Gly Tyr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Arg Ala Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Asp Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Thr Ala Ser Cys Gly Gly Asp Cys Tyr Tyr Leu Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile
130 135 140
Gln Met Thr Gln Ser Pro Pro Thr Leu Ser Ala Ser Val Gly Asp Arg
145 150 155 160
Val Thr Ile Thr Cys Arg Ala Ser Glu Asn Val Asn Ile Trp Leu Ala
165 170 175
Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Lys
180 185 190
Ser Ser Ser Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly
195 200 205
Ser Gly Ala Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp Asp
210 215 220
Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Gln Ser Tyr Pro Leu Thr Phe
225 230 235 240
Gly Gly Gly Thr Lys Val Asp Ile Lys
245
<210> 53
<211> 244
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 53
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Asn Ser Gly Ser Ile Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Gly Ser Ser Ser Trp Ser Trp Gly Tyr Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Ser Glu Leu Thr Gln Asp
130 135 140
Pro Ala Val Ser Val Ala Leu Gly Gln Thr Val Arg Thr Thr Cys Gln
145 150 155 160
Gly Asp Ala Leu Arg Ser Tyr Tyr Ala Ser Trp Tyr Gln Gln Lys Pro
165 170 175
Gly Gln Ala Pro Met Leu Val Ile Tyr Gly Lys Asn Asn Arg Pro Ser
180 185 190
Gly Ile Pro Asp Arg Phe Ser Gly Ser Asp Ser Gly Asp Thr Ala Ser
195 200 205
Leu Thr Ile Thr Gly Ala Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys
210 215 220
Asn Ser Arg Asp Ser Ser Gly Tyr Pro Val Phe Gly Thr Gly Thr Lys
225 230 235 240
Val Thr Val Leu
<210> 54
<211> 246
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 54
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Asn Ser Gly Ser Thr Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Lys Asp Ser Ser Ser Trp Tyr Gly Gly Gly Ser Ala Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly Gly Gly Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Ser Glu Leu Thr Gln
130 135 140
Glu Pro Ala Val Ser Val Ala Leu Gly Gln Thr Val Arg Ile Thr Cys
145 150 155 160
Gln Gly Asp Ser Leu Arg Ser Tyr Tyr Ala Ser Trp Tyr Gln Gln Lys
165 170 175
Pro Gly Gln Ala Pro Val Leu Val Ile Phe Gly Arg Ser Arg Arg Pro
180 185 190
Ser Gly Ile Pro Asp Arg Phe Ser Gly Ser Ser Ser Gly Asn Thr Ala
195 200 205
Ser Leu Ile Ile Thr Gly Ala Gln Ala Glu Asp Glu Ala Asp Tyr Tyr
210 215 220
Cys Asn Ser Arg Asp Asn Thr Ala Asn His Tyr Val Phe Gly Thr Gly
225 230 235 240
Thr Lys Leu Thr Val Leu
245
<210> 55
<211> 246
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 55
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Asn Ser Gly Ser Thr Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Lys Asp Ser Ser Ser Trp Tyr Gly Gly Gly Ser Ala Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly Gly Gly Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Ser Glu Leu Thr Gln
130 135 140
Asp Pro Ala Val Ser Val Ala Leu Gly Gln Thr Val Arg Ile Thr Cys
145 150 155 160
Gln Gly Asp Ser Leu Arg Ser Tyr Tyr Ala Ser Trp Tyr Gln Gln Lys
165 170 175
Pro Gly Gln Ala Pro Val Leu Val Ile Tyr Gly Lys Asn Asn Arg Pro
180 185 190
Ser Gly Ile Pro Asp Arg Phe Ser Gly Ser Ser Ser Gly Asn Thr Ala
195 200 205
Ser Leu Thr Ile Thr Gly Ala Gln Ala Glu Asp Glu Ala Asp Tyr Tyr
210 215 220
Cys Asn Ser Arg Gly Ser Ser Gly Asn His Tyr Val Phe Gly Thr Gly
225 230 235 240
Thr Lys Val Thr Val Leu
245
<210> 56
<211> 251
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 56
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Val Trp Val
35 40 45
Ser Arg Ile Asn Ser Asp Gly Ser Ser Thr Ser Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Arg Thr Gly Trp Val Gly Ser Tyr Tyr Tyr Tyr Met Asp Val Trp
100 105 110
Gly Lys Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile
130 135 140
Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly Glu Arg
145 150 155 160
Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn Tyr Leu
165 170 175
Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Arg Leu Leu Ile Tyr
180 185 190
Asp Val Ser Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly Gly
195 200 205
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro Glu
210 215 220
Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Pro Pro Trp
225 230 235 240
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
245 250
<210> 57
<211> 250
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 57
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Gly Tyr Ser Arg Tyr Tyr Tyr Tyr Gly Met Asp Val Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val
130 135 140
Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala
145 150 155 160
Ile Leu Ser Cys Arg Ala Ser Gln Ser Val Tyr Thr Lys Tyr Leu Gly
165 170 175
Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Asp
180 185 190
Ala Ser Thr Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly Ser Gly
195 200 205
Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Arg Leu Glu Pro Glu Asp
210 215 220
Phe Ala Val Tyr Tyr Cys Gln His Tyr Gly Gly Ser Pro Leu Ile Thr
225 230 235 240
Phe Gly Gln Gly Thr Lys Val Asp Ile Lys
245 250
<210> 58
<211> 249
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 58
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Arg Glu Ala Ala Ala Gly His Asp Trp Tyr Phe Asp Leu Trp
100 105 110
Gly Arg Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile
130 135 140
Arg Val Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg
145 150 155 160
Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn
165 170 175
Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ala
180 185 190
Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly
195 200 205
Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp
210 215 220
Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Ile Pro Leu Thr Phe
225 230 235 240
Gly Gln Gly Thr Lys Val Glu Ile Lys
245
<210> 59
<211> 247
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 59
Gln Val Gln Leu Val Gln Ser Trp Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Asn Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Pro Arg Val Thr Thr Gly Tyr Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Leu
130 135 140
Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly Asp Arg Val Thr
145 150 155 160
Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp Leu Ala Trp Tyr
165 170 175
Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Lys Ala Ser
180 185 190
Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly
195 200 205
Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp Asp Phe Ala
210 215 220
Thr Tyr Tyr Cys Gln Gln Tyr Ser Ser Tyr Pro Leu Thr Phe Gly Gly
225 230 235 240
Gly Thr Arg Leu Glu Ile Lys
245
<210> 60
<211> 253
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 60
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Arg Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Arg Ala Ser Gly Asp Thr Ser Thr Arg His
20 25 30
Tyr Ile His Trp Leu Arg Gln Ala Pro Gly Gln Gly Pro Glu Trp Met
35 40 45
Gly Val Ile Asn Pro Thr Thr Gly Pro Ala Thr Gly Ser Pro Ala Tyr
50 55 60
Ala Gln Met Leu Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr
65 70 75 80
Arg Thr Val Tyr Met Glu Leu Arg Ser Leu Arg Phe Glu Asp Thr Ala
85 90 95
Val Tyr Tyr Cys Ala Arg Ser Val Val Gly Arg Ser Ala Pro Tyr Tyr
100 105 110
Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly
115 120 125
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser
145 150 155 160
Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser
165 170 175
Asp Tyr Ser Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu
180 185 190
Leu Ile Tyr Ala Ala Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe
195 200 205
Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Tyr Leu
210 215 220
Gln Ser Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Ser Tyr
225 230 235 240
Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Asp Ile Lys
245 250
<210> 61
<211> 249
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 61
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Tyr Thr Thr Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Leu Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ile Arg Ser Cys Gly Gly Asp Cys Tyr Tyr Phe Asp Asn Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile
130 135 140
Gln Leu Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly Asp Arg
145 150 155 160
Val Thr Ile Thr Cys Arg Ala Ser Glu Asn Val Asn Ile Trp Leu Ala
165 170 175
Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Lys
180 185 190
Ser Ser Ser Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly
195 200 205
Ser Gly Ala Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp Asp
210 215 220
Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Gln Ser Tyr Pro Leu Thr Phe
225 230 235 240
Gly Gly Gly Thr Lys Val Asp Ile Lys
245
<210> 62
<211> 246
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 62
Gln Ile Thr Leu Lys Glu Ser Gly Pro Ala Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ala
20 25 30
Gly Val His Val Gly Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala Leu Ile Ser Trp Ala Asp Asp Lys Arg Tyr Arg Pro Ser
50 55 60
Leu Arg Ser Arg Leu Asp Ile Thr Arg Val Thr Ser Lys Asp Gln Val
65 70 75 80
Val Leu Ser Met Thr Asn Met Gln Pro Glu Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Leu Gln Gly Phe Asp Gly Tyr Glu Ala Asn Trp Gly Pro Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Val Met Thr
130 135 140
Gln Ser Pro Ser Ser Leu Ser Ala Ser Ala Gly Asp Arg Val Thr Ile
145 150 155 160
Thr Cys Arg Ala Ser Arg Gly Ile Ser Ser Ala Leu Ala Trp Tyr Gln
165 170 175
Gln Lys Pro Gly Lys Pro Pro Lys Leu Leu Ile Tyr Asp Ala Ser Ser
180 185 190
Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr
195 200 205
Asp Phe Thr Leu Thr Ile Asp Ser Leu Glu Pro Glu Asp Phe Ala Thr
210 215 220
Tyr Tyr Cys Gln Gln Ser Tyr Ser Thr Pro Trp Thr Phe Gly Gln Gly
225 230 235 240
Thr Lys Val Asp Ile Lys
245
<210> 63
<211> 488
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 63
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Gly Tyr Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Arg Ile Asn Pro Asn Ser Gly Gly Thr Asn
65 70 75 80
Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser
85 90 95
Ile Ser Thr Ala Tyr Met Glu Leu Ser Arg Leu Arg Ser Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Arg Tyr Tyr Gly Met Asp Val Trp
115 120 125
Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile
145 150 155 160
Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg
165 170 175
Ala Thr Ile Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn Phe Ala
180 185 190
Trp Tyr Gln Gln Arg Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Asp
195 200 205
Ala Ser Asn Arg Ala Thr Gly Ile Pro Pro Arg Phe Ser Gly Ser Gly
210 215 220
Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro Glu Asp
225 230 235 240
Phe Ala Ala Tyr Tyr Cys His Gln Arg Ser Asn Trp Leu Tyr Thr Phe
245 250 255
Gly Gln Gly Thr Lys Val Asp Ile Lys Thr Thr Thr Pro Ala Pro Arg
260 265 270
Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg
275 280 285
Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly
290 295 300
Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr
305 310 315 320
Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg
325 330 335
Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro
340 345 350
Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu
355 360 365
Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala
370 375 380
Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu
385 390 395 400
Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly
405 410 415
Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu
420 425 430
Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser
435 440 445
Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly
450 455 460
Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu
465 470 475 480
His Met Gln Ala Leu Pro Pro Arg
485
<210> 64
<211> 497
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 64
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Gly Tyr Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn
65 70 75 80
Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser
85 90 95
Ile Ser Thr Ala Tyr Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Asp Leu Arg Arg Thr Val Val Thr Pro
115 120 125
Arg Ala Tyr Tyr Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr
130 135 140
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
145 150 155 160
Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Leu Thr Gln Ser Pro Ser
165 170 175
Thr Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Gln Ala
180 185 190
Ser Gln Asp Ile Ser Asn Ser Leu Asn Trp Tyr Gln Gln Lys Ala Gly
195 200 205
Lys Ala Pro Lys Leu Leu Ile Tyr Asp Ala Ser Thr Leu Glu Thr Gly
210 215 220
Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Ser Phe
225 230 235 240
Thr Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr Cys Gln
245 250 255
Gln His Asp Asn Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Val Glu
260 265 270
Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr
275 280 285
Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala
290 295 300
Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile
305 310 315 320
Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser
325 330 335
Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr
340 345 350
Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu
355 360 365
Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu
370 375 380
Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln
385 390 395 400
Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu
405 410 415
Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly
420 425 430
Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln
435 440 445
Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu
450 455 460
Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr
465 470 475 480
Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro
485 490 495
Arg
<210> 65
<211> 490
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 65
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Ala Pro Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Gly Tyr Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn
65 70 75 80
Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser
85 90 95
Ile Ser Thr Ala Tyr Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Glu Trp Asp Gly Ser Tyr Tyr Tyr
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
145 150 155 160
Ser Asp Ile Val Leu Thr Gln Thr Pro Ser Ser Leu Ser Ala Ser Val
165 170 175
Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Asn Thr
180 185 190
Tyr Leu Asn Trp Tyr Gln His Lys Pro Gly Lys Ala Pro Lys Leu Leu
195 200 205
Ile Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser
210 215 220
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln
225 230 235 240
Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Phe Ser Pro Leu
245 250 255
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Thr Thr Thr Pro Ala
260 265 270
Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser
275 280 285
Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr
290 295 300
Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala
305 310 315 320
Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys
325 330 335
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
340 345 350
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
355 360 365
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg
370 375 380
Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn
385 390 395 400
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
405 410 415
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
420 425 430
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
435 440 445
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
450 455 460
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
465 470 475 480
Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 66
<211> 486
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 66
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Ser Tyr Trp Met His Trp Val Arg Gln Val Pro Gly Lys
50 55 60
Gly Leu Val Trp Val Ser Arg Ile Asn Thr Asp Gly Ser Thr Thr Thr
65 70 75 80
Tyr Ala Asp Ser Val Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Asp Asp Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Val Gly Gly His Trp Ala Val Trp Gly Gln Gly
115 120 125
Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
130 135 140
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr
145 150 155 160
Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile
165 170 175
Thr Cys Arg Ala Ser Gln Ser Ile Ser Asp Arg Leu Ala Trp Tyr Gln
180 185 190
Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Lys Ala Ser Ser
195 200 205
Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr
210 215 220
Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp Asp Phe Ala Val
225 230 235 240
Tyr Tyr Cys Gln Gln Tyr Gly His Leu Pro Met Tyr Thr Phe Gly Gln
245 250 255
Gly Thr Lys Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 67
<211> 485
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 67
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Glu Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Asp Tyr Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn
65 70 75 80
Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser
85 90 95
Ile Ser Thr Ala Tyr Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Ser Gly Trp Asp Phe Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Val Met
145 150 155 160
Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr
165 170 175
Ile Thr Cys Arg Ala Ser Gln Ser Ile Arg Tyr Tyr Leu Ser Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Thr Ala Ser
195 200 205
Ile Leu Gln Asn Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala
225 230 235 240
Thr Tyr Tyr Cys Leu Gln Thr Tyr Thr Thr Pro Asp Phe Gly Pro Gly
245 250 255
Thr Lys Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr
260 265 270
Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala
275 280 285
Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe
290 295 300
Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val
305 310 315 320
Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys
325 330 335
Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr
340 345 350
Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu
355 360 365
Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro
370 375 380
Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly
385 390 395 400
Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro
405 410 415
Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr
420 425 430
Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly
435 440 445
Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln
450 455 460
Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln
465 470 475 480
Ala Leu Pro Pro Arg
485
<210> 68
<211> 497
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 68
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser
65 70 75 80
Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser
85 90 95
Thr Ser Thr Val Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Tyr Arg Leu Ile Ala Val Ala Gly Asp
115 120 125
Tyr Tyr Tyr Tyr Gly Met Asp Val Trp Gly Gln Gly Thr Met Val Thr
130 135 140
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
145 150 155 160
Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln Ser Pro Ser
165 170 175
Ser Val Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala
180 185 190
Ser Gln Gly Val Gly Arg Trp Leu Ala Trp Tyr Gln Gln Lys Pro Gly
195 200 205
Thr Ala Pro Lys Leu Leu Ile Tyr Ala Ala Ser Thr Leu Gln Ser Gly
210 215 220
Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu
225 230 235 240
Thr Ile Asn Asn Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln
245 250 255
Gln Ala Asn Ser Phe Pro Leu Thr Phe Gly Gly Gly Thr Arg Leu Glu
260 265 270
Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr
275 280 285
Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala
290 295 300
Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile
305 310 315 320
Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser
325 330 335
Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr
340 345 350
Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu
355 360 365
Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu
370 375 380
Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln
385 390 395 400
Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu
405 410 415
Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly
420 425 430
Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln
435 440 445
Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu
450 455 460
Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr
465 470 475 480
Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro
485 490 495
Arg
<210> 69
<211> 494
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 69
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val
20 25 30
Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Ser Tyr Ala Met His Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Trp Lys Val Ser Ser Ser Ser Pro Ala
115 120 125
Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly
130 135 140
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
145 150 155 160
Gly Ser Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser
165 170 175
Pro Gly Glu Arg Ala Ile Leu Ser Cys Arg Ala Ser Gln Ser Val Tyr
180 185 190
Thr Lys Tyr Leu Gly Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg
195 200 205
Leu Leu Ile Tyr Asp Ala Ser Thr Arg Ala Thr Gly Ile Pro Asp Arg
210 215 220
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Arg
225 230 235 240
Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln His Tyr Gly Gly
245 250 255
Ser Pro Leu Ile Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Thr
260 265 270
Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser
275 280 285
Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly
290 295 300
Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp
305 310 315 320
Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile
325 330 335
Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys
340 345 350
Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys
355 360 365
Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val
370 375 380
Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn
385 390 395 400
Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val
405 410 415
Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg
420 425 430
Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys
435 440 445
Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg
450 455 460
Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys
465 470 475 480
Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 70
<211> 490
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 70
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Thr Ser Gly Tyr
35 40 45
Pro Phe Thr Gly Tyr Ser Leu His Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn
65 70 75 80
Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser
85 90 95
Ile Ser Thr Ala Tyr Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Asp His Tyr Gly Gly Asn Ser Leu Phe
115 120 125
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly
130 135 140
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
145 150 155 160
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Ile Ser Ala Ser Val Gly
165 170 175
Asp Thr Val Ser Ile Thr Cys Arg Ala Ser Gln Asp Ser Gly Thr Trp
180 185 190
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Asn Leu Leu Met
195 200 205
Tyr Asp Ala Ser Thr Leu Glu Asp Gly Val Pro Ser Arg Phe Ser Gly
210 215 220
Ser Ala Ser Gly Thr Glu Phe Thr Leu Thr Val Asn Arg Leu Gln Pro
225 230 235 240
Glu Asp Ser Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Tyr Pro Leu
245 250 255
Thr Phe Gly Gly Gly Thr Lys Val Asp Ile Lys Thr Thr Thr Pro Ala
260 265 270
Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser
275 280 285
Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr
290 295 300
Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala
305 310 315 320
Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys
325 330 335
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
340 345 350
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
355 360 365
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg
370 375 380
Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn
385 390 395 400
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
405 410 415
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
420 425 430
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
435 440 445
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
450 455 460
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
465 470 475 480
Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 71
<211> 492
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 71
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Ala Ser Val Glu Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Gly
65 70 75 80
Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser
85 90 95
Thr Ser Thr Val His Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Gly Tyr Ser Ser Ser Ser Asp Ala
115 120 125
Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly
130 135 140
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
145 150 155 160
Gly Ser Asp Ile Gln Met Thr Gln Ser Pro Pro Ser Leu Ser Ala Ser
165 170 175
Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser
180 185 190
Ser Ala Leu Ala Trp Tyr Gln Gln Lys Pro Gly Thr Pro Pro Lys Leu
195 200 205
Leu Ile Tyr Asp Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe
210 215 220
Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu
225 230 235 240
Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Phe Ser Ser Tyr
245 250 255
Pro Leu Thr Phe Gly Gly Gly Thr Arg Leu Glu Ile Lys Thr Thr Thr
260 265 270
Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro
275 280 285
Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val
290 295 300
His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro
305 310 315 320
Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu
325 330 335
Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro
340 345 350
Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys
355 360 365
Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe
370 375 380
Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu
385 390 395 400
Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp
405 410 415
Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys
420 425 430
Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala
435 440 445
Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys
450 455 460
Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr
465 470 475 480
Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 72
<211> 499
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 72
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Gly Ile Ser Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Trp Ile Ser Ala Tyr Asn Gly Asn Thr Asn
65 70 75 80
Tyr Ala Gln Lys Leu Gln Gly Arg Val Thr Met Thr Thr Asp Thr Ser
85 90 95
Thr Ser Thr Ala Tyr Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Val Ala Gly Gly Ile Tyr Tyr Tyr Tyr
115 120 125
Gly Met Asp Val Trp Gly Gln Gly Thr Thr Ile Thr Val Ser Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
145 150 155 160
Gly Gly Ser Asp Ile Val Met Thr Gln Thr Pro Asp Ser Leu Ala Val
165 170 175
Ser Leu Gly Glu Arg Ala Thr Ile Ser Cys Lys Ser Ser His Ser Val
180 185 190
Leu Tyr Asn Arg Asn Asn Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys
195 200 205
Pro Gly Gln Pro Pro Lys Leu Leu Phe Tyr Trp Ala Ser Thr Arg Lys
210 215 220
Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
225 230 235 240
Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Phe
245 250 255
Cys Gln Gln Thr Gln Thr Phe Pro Leu Thr Phe Gly Gln Gly Thr Arg
260 265 270
Leu Glu Ile Asn Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala
275 280 285
Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg
290 295 300
Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys
305 310 315 320
Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu
325 330 335
Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu
340 345 350
Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln
355 360 365
Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly
370 375 380
Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr
385 390 395 400
Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg
405 410 415
Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met
420 425 430
Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu
435 440 445
Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys
450 455 460
Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu
465 470 475 480
Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu
485 490 495
Pro Pro Arg
<210> 73
<211> 485
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 73
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Gly Tyr Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn
65 70 75 80
Tyr Ala Gln Asn Phe Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser
85 90 95
Ile Ser Thr Ala Tyr Met Glu Leu Arg Arg Leu Arg Ser Asp Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Ser Gly Trp Asp Phe Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Arg Met
145 150 155 160
Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr
165 170 175
Ile Thr Cys Arg Ala Ser Gln Ser Ile Arg Tyr Tyr Leu Ser Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Thr Ala Ser
195 200 205
Ile Leu Gln Asn Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala
225 230 235 240
Thr Tyr Tyr Cys Leu Gln Thr Tyr Thr Thr Pro Asp Phe Gly Pro Gly
245 250 255
Thr Lys Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr
260 265 270
Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala
275 280 285
Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe
290 295 300
Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val
305 310 315 320
Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys
325 330 335
Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr
340 345 350
Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu
355 360 365
Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro
370 375 380
Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly
385 390 395 400
Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro
405 410 415
Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr
420 425 430
Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly
435 440 445
Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln
450 455 460
Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln
465 470 475 480
Ala Leu Pro Pro Arg
485
<210> 74
<211> 490
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 74
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Gly Tyr Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Arg Ile Asn Pro Asn Ser Gly Gly Thr Asn
65 70 75 80
Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Met Thr Thr Asp Thr Ser
85 90 95
Thr Ser Thr Ala Tyr Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Thr Thr Thr Ser Tyr Ala Phe Asp Ile
115 120 125
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly Gly Gly Ser
130 135 140
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp
145 150 155 160
Ile Gln Leu Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly Asp
165 170 175
Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Thr Trp Leu
180 185 190
Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Asn Leu Leu Ile Tyr
195 200 205
Lys Ala Ser Thr Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
210 215 220
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
225 230 235 240
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Thr Tyr Ser Pro Tyr
245 250 255
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Thr Thr Thr Pro Ala
260 265 270
Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser
275 280 285
Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr
290 295 300
Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala
305 310 315 320
Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys
325 330 335
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
340 345 350
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
355 360 365
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg
370 375 380
Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn
385 390 395 400
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
405 410 415
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
420 425 430
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
435 440 445
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
450 455 460
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
465 470 475 480
Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 75
<211> 493
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 75
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Gly Gly Leu
20 25 30
Val Lys Pro Gly Gly Ser Leu Arg Leu Ser Cys Glu Ala Ser Gly Phe
35 40 45
Ile Phe Ser Asp Tyr Tyr Met Gly Trp Ile Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Tyr Ile Gly Arg Ser Gly Ser Ser Met Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Phe Ser Arg Asp Asn Ala
85 90 95
Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Ala Ser Pro Val Val Ala Ala Thr Glu Asp
115 120 125
Phe Gln His Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly
130 135 140
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
145 150 155 160
Gly Ser Asp Ile Val Met Thr Gln Thr Pro Ala Thr Leu Ser Leu Ser
165 170 175
Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Thr
180 185 190
Ser Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg
195 200 205
Leu Leu Leu Phe Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Asp Arg
210 215 220
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Arg
225 230 235 240
Leu Glu Pro Glu Asp Phe Ala Met Tyr Tyr Cys Gln Gln Tyr Gly Ser
245 250 255
Ala Pro Val Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Thr Thr
260 265 270
Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln
275 280 285
Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala
290 295 300
Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala
305 310 315 320
Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr
325 330 335
Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln
340 345 350
Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser
355 360 365
Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys
370 375 380
Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln
385 390 395 400
Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu
405 410 415
Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg
420 425 430
Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met
435 440 445
Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly
450 455 460
Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp
465 470 475 480
Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 76
<211> 493
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 76
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Arg Ala Pro Gly Ala Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Phe
35 40 45
Thr Phe Arg Gly Tyr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Ile Ile Asn Pro Ser Gly Gly Ser Arg Ala
65 70 75 80
Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser
85 90 95
Thr Ser Thr Val Tyr Met Glu Leu Ser Ser Leu Arg Ser Asp Asp Thr
100 105 110
Ala Met Tyr Tyr Cys Ala Arg Thr Ala Ser Cys Gly Gly Asp Cys Tyr
115 120 125
Tyr Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
145 150 155 160
Gly Gly Ser Asp Ile Gln Met Thr Gln Ser Pro Pro Thr Leu Ser Ala
165 170 175
Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Glu Asn Val
180 185 190
Asn Ile Trp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys
195 200 205
Leu Leu Ile Tyr Lys Ser Ser Ser Leu Ala Ser Gly Val Pro Ser Arg
210 215 220
Phe Ser Gly Ser Gly Ser Gly Ala Glu Phe Thr Leu Thr Ile Ser Ser
225 230 235 240
Leu Gln Pro Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Gln Ser
245 250 255
Tyr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Asp Ile Lys Thr Thr
260 265 270
Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln
275 280 285
Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala
290 295 300
Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala
305 310 315 320
Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr
325 330 335
Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln
340 345 350
Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser
355 360 365
Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys
370 375 380
Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln
385 390 395 400
Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu
405 410 415
Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg
420 425 430
Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met
435 440 445
Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly
450 455 460
Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp
465 470 475 480
Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 77
<211> 488
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 77
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Asp Asp Tyr Ala Met His Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Gly Ile Ser Trp Asn Ser Gly Ser Ile Gly
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala
85 90 95
Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Lys Asp Gly Ser Ser Ser Trp Ser Trp Gly
115 120 125
Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Ser
145 150 155 160
Glu Leu Thr Gln Asp Pro Ala Val Ser Val Ala Leu Gly Gln Thr Val
165 170 175
Arg Thr Thr Cys Gln Gly Asp Ala Leu Arg Ser Tyr Tyr Ala Ser Trp
180 185 190
Tyr Gln Gln Lys Pro Gly Gln Ala Pro Met Leu Val Ile Tyr Gly Lys
195 200 205
Asn Asn Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser Gly Ser Asp Ser
210 215 220
Gly Asp Thr Ala Ser Leu Thr Ile Thr Gly Ala Gln Ala Glu Asp Glu
225 230 235 240
Ala Asp Tyr Tyr Cys Asn Ser Arg Asp Ser Ser Gly Tyr Pro Val Phe
245 250 255
Gly Thr Gly Thr Lys Val Thr Val Leu Thr Thr Thr Pro Ala Pro Arg
260 265 270
Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg
275 280 285
Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly
290 295 300
Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr
305 310 315 320
Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg
325 330 335
Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro
340 345 350
Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu
355 360 365
Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala
370 375 380
Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu
385 390 395 400
Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly
405 410 415
Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu
420 425 430
Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser
435 440 445
Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly
450 455 460
Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu
465 470 475 480
His Met Gln Ala Leu Pro Pro Arg
485
<210> 78
<211> 490
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 78
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Asp Asp Tyr Ala Met His Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Gly Ile Ser Trp Asn Ser Gly Ser Thr Gly
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala
85 90 95
Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Leu Tyr Tyr Cys Ala Lys Asp Ser Ser Ser Trp Tyr Gly Gly Gly
115 120 125
Ser Ala Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
130 135 140
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser
145 150 155 160
Ser Glu Leu Thr Gln Glu Pro Ala Val Ser Val Ala Leu Gly Gln Thr
165 170 175
Val Arg Ile Thr Cys Gln Gly Asp Ser Leu Arg Ser Tyr Tyr Ala Ser
180 185 190
Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Phe Gly
195 200 205
Arg Ser Arg Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser Gly Ser Ser
210 215 220
Ser Gly Asn Thr Ala Ser Leu Ile Ile Thr Gly Ala Gln Ala Glu Asp
225 230 235 240
Glu Ala Asp Tyr Tyr Cys Asn Ser Arg Asp Asn Thr Ala Asn His Tyr
245 250 255
Val Phe Gly Thr Gly Thr Lys Leu Thr Val Leu Thr Thr Thr Pro Ala
260 265 270
Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser
275 280 285
Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr
290 295 300
Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala
305 310 315 320
Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys
325 330 335
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
340 345 350
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
355 360 365
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg
370 375 380
Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn
385 390 395 400
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
405 410 415
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
420 425 430
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
435 440 445
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
450 455 460
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
465 470 475 480
Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 79
<211> 490
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 79
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Asp Asp Tyr Ala Met His Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Gly Ile Ser Trp Asn Ser Gly Ser Thr Gly
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala
85 90 95
Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Leu Tyr Tyr Cys Ala Lys Asp Ser Ser Ser Trp Tyr Gly Gly Gly
115 120 125
Ser Ala Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
130 135 140
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser
145 150 155 160
Ser Glu Leu Thr Gln Asp Pro Ala Val Ser Val Ala Leu Gly Gln Thr
165 170 175
Val Arg Ile Thr Cys Gln Gly Asp Ser Leu Arg Ser Tyr Tyr Ala Ser
180 185 190
Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr Gly
195 200 205
Lys Asn Asn Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser Gly Ser Ser
210 215 220
Ser Gly Asn Thr Ala Ser Leu Thr Ile Thr Gly Ala Gln Ala Glu Asp
225 230 235 240
Glu Ala Asp Tyr Tyr Cys Asn Ser Arg Gly Ser Ser Gly Asn His Tyr
245 250 255
Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu Thr Thr Thr Pro Ala
260 265 270
Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser
275 280 285
Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr
290 295 300
Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala
305 310 315 320
Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys
325 330 335
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
340 345 350
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
355 360 365
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg
370 375 380
Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn
385 390 395 400
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
405 410 415
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
420 425 430
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
435 440 445
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
450 455 460
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
465 470 475 480
Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 80
<211> 495
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 80
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Ser Tyr Trp Met His Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Val Trp Val Ser Arg Ile Asn Ser Asp Gly Ser Ser Thr Ser
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Val Arg Thr Gly Trp Val Gly Ser Tyr Tyr Tyr
115 120 125
Tyr Met Asp Val Trp Gly Lys Gly Thr Thr Val Thr Val Ser Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
145 150 155 160
Gly Gly Ser Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu
165 170 175
Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val
180 185 190
Ser Ser Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
195 200 205
Arg Leu Leu Ile Tyr Asp Val Ser Thr Arg Ala Thr Gly Ile Pro Ala
210 215 220
Arg Phe Ser Gly Gly Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
225 230 235 240
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser
245 250 255
Asn Trp Pro Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
260 265 270
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
275 280 285
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
290 295 300
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile
305 310 315 320
Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val
325 330 335
Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe
340 345 350
Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly
355 360 365
Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg
370 375 380
Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln
385 390 395 400
Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp
405 410 415
Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro
420 425 430
Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp
435 440 445
Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg
450 455 460
Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr
465 470 475 480
Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490 495
<210> 81
<211> 494
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 81
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val
20 25 30
Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Ser Tyr Gly Met His Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Lys Gly Tyr Ser Arg Tyr Tyr Tyr Tyr Gly
115 120 125
Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Gly Gly
130 135 140
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
145 150 155 160
Gly Ser Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser
165 170 175
Pro Gly Glu Arg Ala Ile Leu Ser Cys Arg Ala Ser Gln Ser Val Tyr
180 185 190
Thr Lys Tyr Leu Gly Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg
195 200 205
Leu Leu Ile Tyr Asp Ala Ser Thr Arg Ala Thr Gly Ile Pro Asp Arg
210 215 220
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Arg
225 230 235 240
Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln His Tyr Gly Gly
245 250 255
Ser Pro Leu Ile Thr Phe Gly Gln Gly Thr Lys Val Asp Ile Lys Thr
260 265 270
Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser
275 280 285
Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly
290 295 300
Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp
305 310 315 320
Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile
325 330 335
Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys
340 345 350
Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys
355 360 365
Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val
370 375 380
Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn
385 390 395 400
Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val
405 410 415
Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg
420 425 430
Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys
435 440 445
Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg
450 455 460
Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys
465 470 475 480
Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 82
<211> 493
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 82
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Ser Tyr Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Lys Arg Glu Ala Ala Ala Gly His Asp Trp
115 120 125
Tyr Phe Asp Leu Trp Gly Arg Gly Thr Leu Val Thr Val Ser Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
145 150 155 160
Gly Gly Ser Asp Ile Arg Val Thr Gln Ser Pro Ser Ser Leu Ser Ala
165 170 175
Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile
180 185 190
Ser Ser Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys
195 200 205
Leu Leu Ile Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg
210 215 220
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser
225 230 235 240
Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser
245 250 255
Ile Pro Leu Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Thr Thr
260 265 270
Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln
275 280 285
Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala
290 295 300
Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala
305 310 315 320
Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr
325 330 335
Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln
340 345 350
Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser
355 360 365
Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys
370 375 380
Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln
385 390 395 400
Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu
405 410 415
Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg
420 425 430
Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met
435 440 445
Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly
450 455 460
Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp
465 470 475 480
Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 83
<211> 491
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 83
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Trp Ala Glu Val
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser
65 70 75 80
Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser
85 90 95
Thr Ser Thr Val Tyr Met Glu Leu Ser Asn Leu Arg Ser Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Ser Pro Arg Val Thr Thr Gly Tyr Phe
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
145 150 155 160
Ser Asp Ile Gln Leu Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val
165 170 175
Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser
180 185 190
Trp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu
195 200 205
Ile Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser
210 215 220
Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln
225 230 235 240
Pro Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Ser Tyr Pro
245 250 255
Leu Thr Phe Gly Gly Gly Thr Arg Leu Glu Ile Lys Thr Thr Thr Pro
260 265 270
Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu
275 280 285
Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His
290 295 300
Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu
305 310 315 320
Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr
325 330 335
Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe
340 345 350
Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg
355 360 365
Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser
370 375 380
Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr
385 390 395 400
Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys
405 410 415
Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn
420 425 430
Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu
435 440 445
Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly
450 455 460
His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr
465 470 475 480
Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 84
<211> 497
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 84
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Arg Arg Pro Gly Ala Ser Val Lys Ile Ser Cys Arg Ala Ser Gly Asp
35 40 45
Thr Ser Thr Arg His Tyr Ile His Trp Leu Arg Gln Ala Pro Gly Gln
50 55 60
Gly Pro Glu Trp Met Gly Val Ile Asn Pro Thr Thr Gly Pro Ala Thr
65 70 75 80
Gly Ser Pro Ala Tyr Ala Gln Met Leu Gln Gly Arg Val Thr Met Thr
85 90 95
Arg Asp Thr Ser Thr Arg Thr Val Tyr Met Glu Leu Arg Ser Leu Arg
100 105 110
Phe Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Ser Val Val Gly Arg
115 120 125
Ser Ala Pro Tyr Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
130 135 140
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
145 150 155 160
Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln Ser Pro Ser
165 170 175
Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala
180 185 190
Ser Gln Gly Ile Ser Asp Tyr Ser Ala Trp Tyr Gln Gln Lys Pro Gly
195 200 205
Lys Ala Pro Lys Leu Leu Ile Tyr Ala Ala Ser Thr Leu Gln Ser Gly
210 215 220
Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu
225 230 235 240
Thr Ile Ser Tyr Leu Gln Ser Glu Asp Phe Ala Thr Tyr Tyr Cys Gln
245 250 255
Gln Tyr Tyr Ser Tyr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Asp
260 265 270
Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr
275 280 285
Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala
290 295 300
Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile
305 310 315 320
Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser
325 330 335
Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr
340 345 350
Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu
355 360 365
Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu
370 375 380
Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln
385 390 395 400
Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu
405 410 415
Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly
420 425 430
Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln
435 440 445
Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu
450 455 460
Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr
465 470 475 480
Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro
485 490 495
Arg
<210> 85
<211> 493
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 85
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Asn Tyr Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Ile Ile Asn Pro Ser Gly Gly Tyr Thr Thr
65 70 75 80
Tyr Ala Gln Lys Phe Gln Gly Arg Leu Thr Met Thr Arg Asp Thr Ser
85 90 95
Thr Ser Thr Val Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Ile Arg Ser Cys Gly Gly Asp Cys Tyr
115 120 125
Tyr Phe Asp Asn Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
145 150 155 160
Gly Gly Ser Asp Ile Gln Leu Thr Gln Ser Pro Ser Thr Leu Ser Ala
165 170 175
Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Glu Asn Val
180 185 190
Asn Ile Trp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys
195 200 205
Leu Leu Ile Tyr Lys Ser Ser Ser Leu Ala Ser Gly Val Pro Ser Arg
210 215 220
Phe Ser Gly Ser Gly Ser Gly Ala Glu Phe Thr Leu Thr Ile Ser Ser
225 230 235 240
Leu Gln Pro Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Gln Ser
245 250 255
Tyr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Asp Ile Lys Thr Thr
260 265 270
Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln
275 280 285
Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala
290 295 300
Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala
305 310 315 320
Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr
325 330 335
Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln
340 345 350
Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser
355 360 365
Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys
370 375 380
Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln
385 390 395 400
Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu
405 410 415
Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg
420 425 430
Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met
435 440 445
Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly
450 455 460
Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp
465 470 475 480
Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 86
<211> 490
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 86
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Ile Thr Leu Lys Glu Ser Gly Pro Ala Leu
20 25 30
Val Lys Pro Thr Gln Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe
35 40 45
Ser Leu Ser Thr Ala Gly Val His Val Gly Trp Ile Arg Gln Pro Pro
50 55 60
Gly Lys Ala Leu Glu Trp Leu Ala Leu Ile Ser Trp Ala Asp Asp Lys
65 70 75 80
Arg Tyr Arg Pro Ser Leu Arg Ser Arg Leu Asp Ile Thr Arg Val Thr
85 90 95
Ser Lys Asp Gln Val Val Leu Ser Met Thr Asn Met Gln Pro Glu Asp
100 105 110
Thr Ala Thr Tyr Tyr Cys Ala Leu Gln Gly Phe Asp Gly Tyr Glu Ala
115 120 125
Asn Trp Gly Pro Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly
130 135 140
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
145 150 155 160
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Ala Gly
165 170 175
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Arg Gly Ile Ser Ser Ala
180 185 190
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Pro Pro Lys Leu Leu Ile
195 200 205
Tyr Asp Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
210 215 220
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asp Ser Leu Glu Pro
225 230 235 240
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Thr Pro Trp
245 250 255
Thr Phe Gly Gln Gly Thr Lys Val Asp Ile Lys Thr Thr Thr Pro Ala
260 265 270
Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser
275 280 285
Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr
290 295 300
Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala
305 310 315 320
Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys
325 330 335
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
340 345 350
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
355 360 365
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg
370 375 380
Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn
385 390 395 400
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
405 410 415
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
420 425 430
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
435 440 445
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
450 455 460
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
465 470 475 480
Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 87
<211> 732
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 87
caagtccaac tgcagcagtc aggagcggaa gtgaagaaac caggagcgtc agtcaaagtg 60
tcgtgcaagg ctagcggcta caccttcacc ggctactaca tgcactgggt tcgacaggct 120
ccagggcagg gtctggagtg gatgggccgc atcaacccga attccggtgg gactaactac 180
gcccagaagt tccagggaag agtgaccatg actagggaca cgtcgatcag cactgcgtac 240
atggaactga gccgcctgcg gtccgaggat actgccgtct actactgcgc acgcggaagg 300
tactatggaa tggacgtgtg gggccaaggg actatggtga ctgtgagctc gggaggggga 360
ggctccggtg gcgggggatc aggaggagga ggatcagggg gaggaggttc cgaaattgtc 420
ctcacccaga gcccggcaac cctctcactt tccccgggag agcgcgcaac catctcttgc 480
cgggctagcc aatccgtgtc gtccaatttc gcctggtacc agcaacggcc gggacaagcc 540
cctagactcc tgatctacga cgccagcaac agagcgactg gaattcctcc acgcttttcg 600
ggatcaggct ccggtaccga cttcaccctg actatctcgt cgctcgaacc cgaggatttc 660
gccgcctact actgtcatca gcggtcgaac tggttgtata cgtttggcca gggcaccaag 720
gtggatatca ag 732
<210> 88
<211> 759
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 88
caagtccaac tcgtccagtc aggagcagaa gtcaagaaac caggtgctag cgtgaaagtg 60
tcgtgcaagg cgtcgggata cactttcacc ggatactaca tgcactgggt ccgccaggcc 120
cccggacaag gactggaatg gatgggctgg atcaacccga atagcggggg aactaattac 180
gcccagaagt ttcagggacg agtgaccatg acccgcgata cctctatctc gaccgcctac 240
atggagctct ccagactgcg ctccgacgat actgcagtgt actactgcgc ccgggacctg 300
aggcggactg tggttactcc tcgcgcctat tatggcatgg acgtgtgggg ccaaggaact 360
actgtgactg tgagctcggg aggcggtggg tcaggcggag gagggtcggg cggtggtggc 420
tcgggagggg gaggaagcga cattcaactt acgcagagcc cgtcaaccct gtcagcgtca 480
gtgggagatc gggtgaccat cacgtgtcag gccagccagg atatctccaa ctcgctcaac 540
tggtaccagc aaaaggcggg taaagctccg aagctgctga tctacgacgc ttccaccctc 600
gagactggag tcccatccag attttccggg tcaggaagcg gcaccgattt ctccttcacc 660
atttcgtcct tgcaaccgga ggacatcgca acctactact gccagcagca tgacaacttg 720
cctctgacgt tcgggcaggg caccaaggtg gaaatcaag 759
<210> 89
<211> 738
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 89
caagtccaac tcgtccaatc aggagcggaa gtcaaaaagc ccggagctcc agtgaaagtg 60
tcatgcaagg cctccggcta caccttcacc ggttactata tgcactgggt gcggcaggcc 120
ccgggccagg ggttggaatg gatgggatgg atcaatccaa actcgggtgg gactaactac 180
gcccagaagt tccaaggacg ggtgaccatg actagggaca cctcgatctc caccgcatac 240
atggagctta gcagactccg ctccgacgat accgcagtct actattgcgc gcggggagag 300
tgggacggat cgtactacta cgattactgg ggccagggaa ctctggtgac tgtttcctcg 360
ggtggaggag gttcaggcgg aggcggctcg ggcgggggag gatctggagg aggagggtcc 420
gacattgtgc tgacccaaac tccttcgtcc ctgtcggcca gcgtgggcga ccgcgtgacg 480
attacgtgca gagctagcca atccatcaat acttacctca actggtacca gcataagccg 540
gggaaagcac caaagctgct gatctacgcc gcctcatcct tgcagagcgg tgtgccttca 600
cgctttagcg gatcgggatc gggaacggat ttcaccctga ctatcagctc cctccagccg 660
gaggattttg cgacctacta ctgtcagcag agcttctcac cgctgacttt cggcggcggg 720
accaagctgg aaatcaag 738
<210> 90
<211> 726
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 90
caagtgcaac tcgttgaatc aggtggaggt ttggtgcaac ccggaggatc tctcagactg 60
tcgtgtgcgg cgtccgggtt caccttttcg tcctactgga tgcactgggt gcgccaggtg 120
ccgggaaaag gactggtgtg ggtgtccaga atcaacaccg acgggtcaac gactacctac 180
gcagatagcg tggaaggtcg gttcaccatt tcgcgggaca acgctaaaaa cactctgtac 240
cttcagatga attcactgcg cgatgacgac accgcagtct actactgcgt cggtggacac 300
tgggcggtct ggggacaggg aactacggtg actgtgtcca gcggcggggg aggaagcggc 360
ggagggggga gcggaggcgg aggatcagga ggaggcggct ccgatatcca gatgacccag 420
tcgccatcga ccctctccgc tagcgtgggg gatagggtca ctatcacttg ccgagccagc 480
caatccatta gcgaccggct tgcctggtac caacagaaac ctggaaaggc cccgaagctg 540
ctcatctaca aggcctcgtc actggagtcg ggagtcccgt cccgcttttc cggctcgggc 600
tcaggcaccg agttcactct gaccatctcg agcctgcagc cggacgattt cgccgtgtat 660
tactgccagc aatacggaca tctcccaatg tacacgttcg gtcagggcac caaggtcgaa 720
atcaag 726
<210> 91
<211> 723
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 91
caagtccaac tcgttcaatc aggcgcagaa gtcgaaaagc ccggagcatc agtcaaagtc 60
tcttgcaagg cttccggcta caccttcacg gactactaca tgcactgggt gcgccaggct 120
ccaggccagg gactggagtg gatgggatgg atcaacccga attccggggg aactaactac 180
gcccagaagt ttcagggccg ggtgactatg actcgcgata cctcgatctc gactgcgtac 240
atggagctca gccgcctccg gtcggacgat accgccgtgt actattgtgc gtcgggatgg 300
gacttcgact actgggggca gggcactctg gtcactgtgt caagcggagg aggtggatca 360
ggtggaggtg gaagcggggg aggaggttcc ggcggcggag gatcagatat cgtgatgacg 420
caatcgcctt cctcgttgtc cgcatccgtg ggagacaggg tgaccattac ttgcagagcg 480
tcccagtcca ttcggtacta cctgtcgtgg taccagcaga agccggggaa agccccaaaa 540
ctgcttatct atactgcctc gatcctccaa aacggcgtgc catcaagatt cagcggttcg 600
ggcagcggga ccgactttac cctgactatc agcagcctgc agccggaaga tttcgccacg 660
tactactgcc tgcaaaccta caccaccccg gacttcggac ctggaaccaa ggtggagatc 720
aag 723
<210> 92
<211> 759
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 92
caagtgcaac tcgtccagtc aggtgcagaa gtgaagaaac ccggagcgtc agtcaaagtg 60
tcatgcaagg cgtcaggcta caccttcacc agctactaca tgcactgggt gcggcaggcc 120
ccaggccaag gcttggagtg gatgggaatc attaacccgt caggaggctc cacctcctac 180
gcccagaagt ttcagggaag agtgacgatg actcgggata cgtcgacctc gaccgtgtac 240
atggaactga gctcgctgcg ctccgaggac actgctgtgt actactgcgc acggtacaga 300
ctcattgccg tggcaggaga ctactactac tatggcatgg acgtctgggg gcagggcact 360
atggtcactg tgtcgtccgg cggaggaggc tcgggtggag gaggtagcgg aggaggggga 420
agcggagggg ggggctccga tatccagatg actcagtcgc cttcctccgt gtcggcctcg 480
gttggagatc gcgtcaccat cacttgtcga gcttcccaag gagtcggtag gtggctggcg 540
tggtaccagc aaaagccggg aactgccccg aagctcctga tctacgcggc tagcaccctg 600
cagtcgggag tgccatcccg cttcagcgga tctgggtcag gtaccgactt cacccttacg 660
atcaacaatc tccagccgga ggactttgcc acctattact gccaacaggc caacagcttc 720
cctctgactt tcggaggggg cactcgcctg gaaatcaag 759
<210> 93
<211> 750
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 93
caagtgcaat tggttcaatc aggaggagga gtggtgcaac ctggaagatc tctcagactg 60
tcgtgtgcgg catcgggatt cactttctca tcatacgcaa tgcactgggt ccgccaggcc 120
ccgggcaaag gcttggaatg ggtggcggtc atttcatacg acggctcgaa caagtactac 180
gctgacagcg tgaagggacg ctttactatt tcccgggaca attcgaagaa cactctgtac 240
ctccagatga actcccttag ggctgaggac accgccgtct actactgcgc acgctggaaa 300
gtgtcgtcca gctccccagc ttttgactac tggggacagg gaacccttgt gaccgtgtcg 360
tccggtggag ggggaagcgg cggaggggga tcaggtggcg gcggatcggg aggcggggga 420
tcagaaatcg tgctgactca gtccccggcc acgctgtctc tcagcccggg agagagagcg 480
atcctgtcct gccgcgcctc gcagagcgtg tacactaagt acctggggtg gtaccagcag 540
aaaccgggtc aagcgcctcg gctgctgatc tacgatgcct ccacccgggc caccggaatc 600
cccgatcggt tctccggcag cggctcggga actgatttca cgctgaccat caatcgcctg 660
gagccggaag atttcgccgt ctattactgc cagcattacg gcgggagccc actcatcacc 720
ttcggtcaag gaacccgact cgaaatcaag 750
<210> 94
<211> 738
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 94
caagtccaac tccagcagtc aggtgcagaa gtcaaaaagc caggagcatc cgtgaaggtt 60
tcgtgcaaga cttccggcta cccttttacc gggtactccc tccattgggt gagacaagca 120
ccgggccagg gactggagtg gatgggatgg atcaacccaa attcgggcgg caccaactat 180
gcgcagaagt tccagggacg ggtgaccatg actcgcgaca cttcgatctc cactgcctac 240
atggagctgt cccgcttgag atctgacgac acggccgtct actactgcgc ccgggatcac 300
tacggaggta attcgctgtt ctactggggg cagggaaccc ttgtgactgt gtcctcgggt 360
ggtggagggt caggaggcgg aggctcaggg ggaggaggta gcggaggagg cggatcagac 420
atccaactga cccagtcacc atcctccatc tcggctagcg tcggagacac cgtgtcgatt 480
acttgtaggg cctcccaaga ctcagggacg tggctggcgt ggtatcagca aaaaccgggc 540
aaagctccga acctgttgat gtacgacgcc agcaccctcg aagatggagt gcctagccgc 600
ttcagcggaa gcgcctcggg cactgaattc acgctgactg tgaatcggct ccagccggag 660
gattcggcga cctactactg ccagcagtac aacagctacc ccctgacctt tggaggcggg 720
accaaggtgg atatcaag 738
<210> 95
<211> 744
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 95
caagtgcaac tcgtccagtc aggtgcagaa gtgaagaaac caggagcgtc cgtcgaagtg 60
tcgtgtaagg cgtccggcta cactttcacc tcgtactaca tgcactgggt gcggcaggcc 120
ccgggacaag gcctcgaatg gatgggaatc atcaacccga gcggaggctc gactggttac 180
gcccagaagt tccagggaag ggtgacgatg acccgcgata cctcgacttc gaccgttcat 240
atggagctct cgtccctgcg gagcgaggac actgctgtct actattgcgc gcggggagga 300
tactctagct cctccgatgc atttgacatt tggggccagg gaactatggt gaccgtgtca 360
tcaggcggag gtggatcagg aggaggaggg tcgggagggg gaggcagcgg cgggggtggg 420
tcggacattc agatgacgca gtcccctcct agcctgagcg cctcggtggg tgacagagtg 480
accatcactt gcagagcctc gcaagacatc tcctccgcat tggcttggta ccagcaaaag 540
ccgggcactc cgccgaaact gctcatctac gatgcctcct cactggagtc aggagtccca 600
tctcgcttct cggggtcagg aagcggcacc gattttaccc ttaccatctc cagcctgcag 660
cccgaggact tcgccacgta ctactgccaa cagttcagct cctacccact gaccttcggg 720
ggcggaactc gcctggaaat caag 744
<210> 96
<211> 765
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 96
caagtgcaac tcgtccagag cggagcagaa gtcaagaagc caggagcgtc agtgaaagtg 60
tcatgcaagg ccagcggcta tacctttact tcgtatggga tctcctgggt gcggcaggca 120
ccgggccaag gactggagtg gatgggatgg atctcagcct acaacggtaa caccaactac 180
gcccagaagc tgcaaggacg cgtgaccatg actactgata cgagcacctc cactgcctac 240
atggaattgc ggtcccttcg gtcggacgat actgctgtgt actactgcgc aagagtcgcc 300
ggagggatct actactacta cggcatggac gtctggggac agggaaccac cattacggtg 360
tcgagcggag ggggaggctc ggggggagga ggaagcggag gtggcggctc cgggggcggc 420
ggatcggaca ttgtgatgac ccagactcct gactccctgg ctgtttcgtt gggagagcgc 480
gcgactatct cgtgtaagtc cagccactca gtcctgtaca atcgcaataa caagaactac 540
ctcgcgtggt accagcaaaa accgggtcag ccgcctaaac tcctgttcta ctgggcctcc 600
accagaaaga gcggggtgcc agatcgattc tctggatcag gatcaggtac cgactttacg 660
ctgaccatct cgtccctgca gccggaggat ttcgcgactt acttctgcca gcagactcag 720
actttccccc tcaccttcgg tcaaggcacc aggctggaaa tcaat 765
<210> 97
<211> 723
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 97
caagtccaat tgcagcagag cggagcagaa gtgaagaagc caggagcgtc agtcaaagtg 60
tcgtgtaagg cgtcaggata caccttcacg ggatactaca tgcactgggt gcgccaggcc 120
ccgggccaag gactcgagtg gatgggctgg atcaacccta actctggagg caccaactac 180
gcccagaatt tccaaggcag agtgaccatg acccgggaca cctccatctc gactgcctat 240
atggaactgc ggcggctgcg ctcggacgat actgctgtgt attactgcgc cagcggctgg 300
gactttgact actggggaca gggtactctg gtgactgttt cctcgggagg aggcggatcg 360
ggtggaggag gtagcggggg aggggggtcg ggaggcggag gcagcgatat tcgcatgact 420
caatcgccgt cctccctgag cgctagcgtg ggagatcgag tcaccatcac ttgcagagcg 480
tcacagtcga ttcgctacta cctgtcctgg taccagcaga aaccgggaaa ggcaccaaag 540
cttctgatct acacggcctc catcctgcaa aatggtgtcc catcaaggtt ctccgggtca 600
gggagcggca ctgacttcac tctcaccatc tcctcactcc agcccgagga ctttgcaacc 660
tactactgcc tccagacgta caccaccccg gatttcggtc ctggaaccaa ggtggaaatc 720
aaa 723
<210> 98
<211> 738
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 98
caagtccaac tcgtccaaag cggagcagaa gtcaaaaagc caggagcgtc ggtgaaagtg 60
tcttgcaaag ccagcggcta caccttcacg ggttactaca tgcactgggt gcgccaggcg 120
ccgggccagg ggctggagtg gatgggccgg attaacccta acagcggggg aactaattac 180
gctcagaagt tccagggtag agtcaccatg actacggaca cttccacttc caccgcctat 240
atggaactgc gctccctccg ctcagatgat actgccgtgt attactgcgc gcggactacc 300
acgtcatacg catttgacat ctggggccag ggaactatgg tgaccgtgag ctcgggcgga 360
ggcggttcag ggggaggagg aagcggagga ggaggatcgg gaggaggtgg ctccgatatc 420
cagctgactc agtccccgag caccctgtcg gcgtcggtgg gggacagggt taccatcacc 480
tgtagagctt cccaatccat ttcgacttgg ctggcctggt accagcaaaa gccgggaaag 540
gcccctaatt tgcttatcta caaggcatcg accctcgaaa gcggtgtgcc ctcccggttt 600
tcgggatcag gatcagggac cgagttcacc ctgaccatct catccctcca gccggacgac 660
ttcgccactt actactgcca gcagtacaac acctactcgc catacacttt cggccaaggc 720
accaagctgg agatcaag 738
<210> 99
<211> 747
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 99
caagttcaac tcgtgcaatc aggtggagga ctcgtcaaac ccggaggatc attgagactg 60
tcatgcgaag cgagcggttt tatcttctcc gattactata tgggatggat tcggcaggcc 120
ccgggaaagg gactcgaatg ggtgtcatac atcggaaggt caggctcgtc catgtactac 180
gcagactcgg tgaaaggcag attcaccttt agccgggaca acgccaagaa ttccctctac 240
ttgcagatga acagcctgcg agccgaggat actgctgtct actactgtgc cgcgtcgccg 300
gtggtggcag ctactgaaga tttccagcac tggggacagg gaactctggt cacggtgtcg 360
agcggtgggg gcggaagcgg aggcggagga tcgggcggcg gaggttcggg ggggggaggg 420
tctgacatcg tgatgaccca aaccccagcc accctgagcc tctcccctgg agagcgcgcg 480
actctttcgt gccgcgcttc ccagtcagtg accagcaatt acttggcttg gtaccaacag 540
aagccgggac aggcgccacg gctgctgctt tttggtgcca gcactcgcgc caccggaatc 600
ccggatcgct tctcgggctc agggtccggg acggacttca ccctgactat caaccggctg 660
gaacctgagg acttcgcgat gtactactgc cagcagtacg gctccgcacc agtcactttc 720
ggacaaggca ccaagctgga gatcaag 747
<210> 100
<211> 747
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 100
caagtccaac tcgtccagtc gggagcagaa gttagagcac caggagcgtc agtgaaaatc 60
tcatgcaagg cctcgggctt cacgttccgc ggatactaca tccactgggt gcgccaagcc 120
ccgggtcagg gattggagtg gatgggaatc attaacccat caggagggag ccgggcttac 180
gcgcagaagt tccagggacg cgtcactatg acccgagata cttccacctc gactgtgtac 240
atggaactct cgtccctgag gtccgacgac actgcgatgt attactgtgc tcggactgcc 300
agctgcggtg gggactgtta ctacctcgat tactggggcc agggaactct ggtgaccgtg 360
tccagcggag gtggcgggtc agggggtggc ggaagcggag gcggcggttc aggcggagga 420
ggctcggaca tccaaatgac gcaatcgccg cctaccctga gcgcttccgt gggagatcgg 480
gtgaccatta cttgcagagc atccgagaac gtcaatatct ggctggcctg gtaccaacag 540
aagccgggga aggcccctaa actgctgatc tacaagtcga gcagccttgc ctctggagtg 600
ccctcccgct tctcgggctc gggatcagga gcggaattca ccctcaccat ctcctccctg 660
cagccagatg actttgccac ctactactgc cagcagtacc agagctatcc gttgaccttt 720
gggggaggca ctaaagtgga catcaag 747
<210> 101
<211> 732
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 101
caagttcaac tcgttcaatc aggtggagga ctcgtgcaac caggaagatc actcagactc 60
agctgcgccg cgtcgggatt cactttcgat gactacgcaa tgcactgggt gcggcaggcc 120
ccgggcaaag gactggaatg ggtgagcgga attagctgga actcggggtc catcgggtac 180
gccgactcgg tgaagggacg ctttacgatc tcccgggaca atgccaagaa ctccctgtat 240
ttgcagatga actccttgag ggctgaggac accgccgtgt actactgcgc taaagatgga 300
tcatcgtcct ggtcctgggg atacttcgat tactggggcc agggcactct ggtgaccgtg 360
tcgtcaggcg gtggagggtc gggcggagga ggtagcggag gcggagggag cagctctgaa 420
ctgacccaag acccggcggt gtcggtcgcc cttggtcaga ctgtgcggac tacctgtcag 480
ggggacgcgc tgcgctcgta ctacgcttca tggtaccagc agaagcccgg acaggcacct 540
atgctggtca tctacggaaa gaataaccgc ccatccggca tcccggatcg cttctcgggt 600
tcggacagcg gcgacaccgc atccctgacg atcactggag cgcaggccga ggatgaagcc 660
gactactact gcaattcccg agattcaagc ggctaccctg tgtttgggac cggaactaag 720
gtcaccgtcc tg 732
<210> 102
<211> 738
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 102
gaagtgcaac tcgtggaatc tggtggagga cttgtgcaac ctggaagatc gttgagactc 60
tcatgtgctg cctccgggtt cacctttgac gactacgcca tgcactgggt gcgccaggca 120
ccaggaaagg gtctggagtg ggtttcgggt atctcgtgga actccgggag cactggctac 180
gctgattcgg tgaaaggccg gtttaccatc tcccgagaca atgcgaagaa ttccctctat 240
ctgcagatga acagcctccg ggccgaggat actgccctgt actactgcgc caaggatagc 300
tcatcatggt acggaggtgg atcggctttc gatatctggg gccagggcac gatggtcacc 360
gtgtcctcgg ggggcggagg ctccggggga ggaggtagcg gaggaggagg atcgagctca 420
gagttgactc aagaacccgc agtgtccgtg gcactgggcc aaaccgtcag gatcacttgc 480
cagggagaca gcctgaggtc gtactacgcg tcctggtacc agcagaagcc gggacaggcc 540
ccggtcctgg tcattttcgg acgctcaaga cgcccatcgg gcatcccgga ccggttcagc 600
ggaagctcct cgggaaacac cgcgtcactt atcattaccg gcgcacaggc tgaggacgaa 660
gcggattact actgcaactc ccgcgacaat actgccaacc attacgtgtt cgggaccgga 720
acgaaactga ctgtcctg 738
<210> 103
<211> 738
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 103
gaagttcaat tggtggaatc tggaggagga cttgtgcaac ccggtagatc tctgagactg 60
tcctgtgcgg catcgggatt caccttcgac gactacgcta tgcactgggt gagacaagcc 120
cctggaaaag gactggagtg ggtgtcaggc atctcctgga atagcgggtc cactggatac 180
gccgattcgg tcaagggtcg cttcaccatt tcccgggaca atgccaagaa ctccctgtac 240
cttcaaatga actccctccg ggccgaggat accgccctct actactgcgc caaagacagc 300
tcgtcatggt atggcggagg gtcggcattt gacatctggg gacagggaac tatggtgact 360
gtgtcatcag gaggcggcgg aagcggcggc ggcgggtccg gcggaggagg gtcgtccagc 420
gaactcaccc aagatccagc agtgagcgtc gcgctgggcc agaccgtcag gatcacgtgc 480
cagggagatt cactgcgctc atactacgcg tcctggtacc agcagaagcc ggggcaggcc 540
ccggtcctcg tgatctacgg aaagaacaac cgcccgtcgg gtatcccaga ccgcttttcg 600
ggtagctcca gcggaaatac ggctagcctg accatcactg gagcacaggc tgaggatgaa 660
gcggactact actgcaattc gcggggctca tcggggaacc attacgtgtt cggaactggt 720
accaaggtga ctgtcctg 738
<210> 104
<211> 753
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 104
caagtgcagc tcgttcaatc aggcggagga ctcgttcaac caggaggatc attgcgactc 60
tcatgtgcgg cctctggatt cacgtttagc tcatattgga tgcactgggt gcggcaggcg 120
ccggggaaag gtctggtgtg ggtcagccgc atcaactcag acggctcctc gacttcgtac 180
gccgactccg tgaagggacg ctttaccatt tcccgcgaca acgccaagaa taccctttac 240
cttcagatga actccctccg cgctgaggat accgccgtgt actactgcgt gaggactggc 300
tgggtcggca gctactacta ctacatggac gtgtggggca aaggaactac tgtcaccgtg 360
tcaagcggcg gtggaggttc cggcggggga ggatcggggg ggggcggatc gggtggcgga 420
ggatcggaga tcgtgttgac ccagtcgccg ggaaccctgt cgctgtcgcc tggggagaga 480
gcaactctgt cctgccgggc ttcccagtcg gtgtcgagca attacctggc atggtaccaa 540
cagaagccgg gacagccgcc acgcctgctg atctatgacg tgtcaactcg ggcaactgga 600
atccctgcgc ggttcagcgg cggagggagc ggtaccgatt tcaccctgac tatttcctcc 660
ctcgaaccag aagatttcgc cgtctactac tgccagcaga gaagcaactg gccgccctgg 720
acgttcggac aaggaaccaa ggtcgaaatc aag 753
<210> 105
<211> 750
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 105
caagtgcaat tggttcaatc aggaggagga gtcgtgcagc ccggaagatc gttgagactg 60
tcatgtgccg cgagcggctt tactttctca agctacggaa tgcattgggt gcgacaggct 120
ccgggaaaag gactggaatg ggtcgcagtg atctcatacg acggctcgaa caagtactac 180
gccgactccg tcaagggtcg gttcacgatt tcgcgcgata attccaagaa cactctgtac 240
ctccaaatga acagcctccg ggcagaggac accgccgtct actactgcgc taagggatac 300
tcgcgctact actactatgg aatggatgtg tggggccagg gaactaccgt gacggtgtcg 360
tccggcggcg gtgggtcggg cggaggcgga tcaggtggag gtggaagcgg aggaggaggg 420
agcgaaatcg tcatgactca gtcccctgct accctttctc tgtcgccggg agaaagagcc 480
atcctgagct gccgggcctc ccagagcgtg tacaccaaat acctgggatg gtaccagcag 540
aagccggggc aggcaccaag gctcctgatc tacgatgcgt ccacccgcgc gactggtatc 600
ccagaccgct tttccggctc ggggtcaggg actgacttca cccttactat caatcggctc 660
gagcctgagg atttcgccgt gtattactgc cagcactacg gagggtcccc gctgattacc 720
ttcggccaag gcaccaaagt ggacatcaag 750
<210> 106
<211> 747
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 106
caagtgcaac ttgttcaatc aggaggagga ctcgttcaac ccggaggatc actgcgactc 60
tcatgtgcag cgtcggggtt caccttctcc agctacgcaa tgtcctgggt gcgccaagcc 120
cctggaaaag gcctggagtg ggtgtcggcc atctctggga gcgggggatc aacttactac 180
gctgactccg tcaagggccg ctttaccatc tcccgggaca acagcaagaa cactctctat 240
ctccagatga actcgctgag agccgaagat accgctgtct actactgcgc gaagagagaa 300
gctgccgcag ggcacgattg gtacttcgac ttgtggggca ggggcaccct tgtgaccgtg 360
tcctccggtg gaggcggatc aggaggtggg ggatcgggtg gaggaggaag cggaggcggc 420
ggttcggaca ttcgcgtcac ccagtcaccg agctccctca gcgcatcggt gggcgaccgg 480
gtcactatca cttgccgggc gtcccagtcg atctcatcgt atctgaattg gtaccagcag 540
aaaccgggaa aggcgccgaa gctgttgatc tacgctgcca gctccctgca gtcgggtgtg 600
ccatcacgct tttccggctc gggatcggga accgatttca ctctgacgat ctctagcctg 660
cagccagaag atttcgccac ttactactgc cagcagtcct acagcatccc tctgactttc 720
ggacaaggga cgaaagtgga gattaag 747
<210> 107
<211> 741
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 107
caagtccaac tcgttcagtc atgggcagaa gtcaagaaac ccggtgcaag cgtcaaagtg 60
tcgtgtaagg cctccggcta cactttcact tcctactaca tgcactgggt gcgccaagcc 120
ccgggacagg gccttgaatg gatgggcatc atcaacccat caggaggttc cacgagctac 180
gcgcagaagt tccaggggag agtgacgatg actagagata cctccacgag caccgtctac 240
atggagctgt cgaatctgcg gtcagaggac actgctgtgt attactgcgc gcgctccccg 300
cgggtgacca ctggctactt tgactactgg ggacaaggga ccctggtgac cgtcagctcg 360
ggaggcggag gatcgggagg tggagggtcc ggtggaggcg gctctggagg aggcgggtcg 420
gacattcaat tgacccagag cccatccacc ctctcagcct cggtggggga tagggtgact 480
atcacttgcc gggcctccca gtcaatttcc agctggctgg cttggtacca gcaaaagcct 540
ggaaaggcac cgaagctcct gatctacaag gcctcatctc tggaatcagg agtgccttcg 600
cgcttcagcg gaagcggctc gggaactgag tttaccctga ccatctcgag cctgcagcca 660
gatgacttcg cgacctatta ctgccagcag tactcgtcct acccgttgac tttcggagga 720
ggtacccgcc tcgaaatcaa a 741
<210> 108
<211> 759
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 108
caagtccaac tcgtccagtc cggtgcagaa gtcagaaggc caggagcaag cgtgaagatc 60
tcgtgtagag cgtcaggaga caccagcact cgccattaca tccactggct gcgccaggct 120
ccgggccaag ggccggagtg gatgggtgtg atcaacccga ctacgggacc ggctaccgga 180
agccctgcgt acgcacagat gctgcaggga cgggtgacta tgacccgcga tactagcact 240
aggaccgtgt acatggaact ccgctcgttg cggttcgaag ataccgccgt ctactactgc 300
gcccggtccg tggtgggccg aagcgcccct tactacttcg attactgggg acagggcact 360
ctggtgaccg ttagctccgg tgggggaggc tcgggtggag gcggatcggg aggaggaggc 420
agcggtggag ggggatcgga cattcagatg acccagtcac cctcctccct ctcagcctcg 480
gtcggggacc gggtgaccat tacgtgcaga gcctcacaag ggatctcgga ctactccgcc 540
tggtaccagc agaaaccggg aaaagcgcca aagctcctga tctacgccgc gagcaccctg 600
caatcaggag tgccatcgcg cttttctgga tcgggctcag ggactgactt cacgctgact 660
atctcctacc ttcagtccga ggatttcgct acctactact gccaacagta ttactcctat 720
cccctgacct ttggcggagg cactaaggtg gacatcaag 759
<210> 109
<211> 747
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 109
caagtccaac tccagcaatc gggagcagaa gtcaagaaac caggcgcatc ggtgaaagtg 60
tcgtgtaagg cgtcagggta caccttcacc aactactata tgcactgggt gcgccaggct 120
ccaggccagg ggttggagtg gatggggatc atcaatccgt caggtggcta caccacttac 180
gctcagaagt tccagggacg cctcactatg actcgcgata ctagcacctc cacggtgtac 240
atggaactgt catcgctgag gtccgaagat accgccgtct actactgcgc acggatcaga 300
tcctgcggag gagattgtta ctactttgac aactggggac agggcaccct tgttactgtg 360
tcatcgggag gagggggaag cggaggaggt ggatcaggcg gcggtggcag cgggggcgga 420
ggatcggaca ttcagctgac tcagtccccc tccactttgt cggccagcgt gggagacaga 480
gtgaccatca cttgccgggc gtccgagaac gtcaatatct ggctggcctg gtaccagcaa 540
aagcctggaa aagccccgaa gctgctcatc tataagtcat ccagcctggc gtctggtgtg 600
ccgtcgcggt tctccggcag cgggagcgga gccgagttca ctctcaccat ttcgagcctt 660
caaccggacg atttcgccac ctactactgc cagcagtacc aatcctaccc tctgacgttt 720
ggaggtggaa ccaaggtgga catcaag 747
<210> 110
<211> 738
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 110
caaatcactc tgaaagaatc tggaccggcc ctggttaagc cgactcaaac gctcaccctt 60
acttgcacct tcagcggatt ctcactcagc actgctggtg tgcacgtcgg atggattaga 120
cagccgcctg gaaaggccct ggaatggctc gccctcatct cctgggccga tgacaagaga 180
tacaggccct cgcttcgatc ccggttggac attacccggg tgacctcgaa agatcaggtg 240
gtgctctcaa tgaccaatat gcagccggag gacaccgcta cgtactactg cgcactgcaa 300
ggatttgacg gctacgaggc taactgggga ccaggtactc tggtcaccgt gagctccggc 360
gggggaggat caggcggggg ggggtcagga ggcggaggct ccggtggagg aggatcggat 420
atcgtcatga cccagtcccc aagctcgctg agcgcgtcag cgggcgaccg cgtgactatc 480
acttgccggg ccagccgcgg catctcctcc gcactggcgt ggtaccagca gaagcctgga 540
aaaccgccaa agctcctgat ctatgatgcc tccagcctgg agtcaggtgt ccccagccgc 600
ttctcgggtt cgggctcggg aaccgacttc actttgacca tcgactcgct ggaaccggaa 660
gatttcgcaa cctactactg tcagcagtcc tactcgaccc cttggacttt tggacaaggg 720
acgaaggtgg acatcaag 738
<210> 111
<211> 1464
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 111
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtcc aactgcagca gtcaggagcg gaagtgaaga aaccaggagc gtcagtcaaa 120
gtgtcgtgca aggctagcgg ctacaccttc accggctact acatgcactg ggttcgacag 180
gctccagggc agggtctgga gtggatgggc cgcatcaacc cgaattccgg tgggactaac 240
tacgcccaga agttccaggg aagagtgacc atgactaggg acacgtcgat cagcactgcg 300
tacatggaac tgagccgcct gcggtccgag gatactgccg tctactactg cgcacgcgga 360
aggtactatg gaatggacgt gtggggccaa gggactatgg tgactgtgag ctcgggaggg 420
ggaggctccg gtggcggggg atcaggagga ggaggatcag ggggaggagg ttccgaaatt 480
gtcctcaccc agagcccggc aaccctctca ctttccccgg gagagcgcgc aaccatctct 540
tgccgggcta gccaatccgt gtcgtccaat ttcgcctggt accagcaacg gccgggacaa 600
gcccctagac tcctgatcta cgacgccagc aacagagcga ctggaattcc tccacgcttt 660
tcgggatcag gctccggtac cgacttcacc ctgactatct cgtcgctcga acccgaggat 720
ttcgccgcct actactgtca tcagcggtcg aactggttgt atacgtttgg ccagggcacc 780
aaggtggata tcaagaccac taccccagca ccgaggccac ccaccccggc tcctaccatc 840
gcctcccagc ctctgtccct gcgtccggag gcatgtagac ccgcagctgg tggggccgtg 900
catacccggg gtcttgactt cgcctgcgat atctacattt gggcccctct ggctggtact 960
tgcggggtcc tgctgctttc actcgtgatc actctttact gtaagcgcgg tcggaagaag 1020
ctgctgtaca tctttaagca acccttcatg aggcctgtgc agactactca agaggaggac 1080
ggctgttcat gccggttccc agaggaggag gaaggcggct gcgaactgcg cgtgaaattc 1140
agccgcagcg cagatgctcc agcctacaag caggggcaga accagctcta caacgaactc 1200
aatcttggtc ggagagagga gtacgacgtg ctggacaagc ggagaggacg ggacccagaa 1260
atgggcggga agccgcgcag aaagaatccc caagagggcc tgtacaacga gctccaaaag 1320
gataagatgg cagaagccta tagcgagatt ggtatgaaag gggaacgcag aagaggcaaa 1380
ggccacgacg gactgtacca gggactcagc accgccacca aggacaccta tgacgctctt 1440
cacatgcagg ccctgccgcc tcgg 1464
<210> 112
<211> 1491
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 112
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtcc aactcgtcca gtcaggagca gaagtcaaga aaccaggtgc tagcgtgaaa 120
gtgtcgtgca aggcgtcggg atacactttc accggatact acatgcactg ggtccgccag 180
gcccccggac aaggactgga atggatgggc tggatcaacc cgaatagcgg gggaactaat 240
tacgcccaga agtttcaggg acgagtgacc atgacccgcg atacctctat ctcgaccgcc 300
tacatggagc tctccagact gcgctccgac gatactgcag tgtactactg cgcccgggac 360
ctgaggcgga ctgtggttac tcctcgcgcc tattatggca tggacgtgtg gggccaagga 420
actactgtga ctgtgagctc gggaggcggt gggtcaggcg gaggagggtc gggcggtggt 480
ggctcgggag ggggaggaag cgacattcaa cttacgcaga gcccgtcaac cctgtcagcg 540
tcagtgggag atcgggtgac catcacgtgt caggccagcc aggatatctc caactcgctc 600
aactggtacc agcaaaaggc gggtaaagct ccgaagctgc tgatctacga cgcttccacc 660
ctcgagactg gagtcccatc cagattttcc gggtcaggaa gcggcaccga tttctccttc 720
accatttcgt ccttgcaacc ggaggacatc gcaacctact actgccagca gcatgacaac 780
ttgcctctga cgttcgggca gggcaccaag gtggaaatca agaccactac cccagcaccg 840
aggccaccca ccccggctcc taccatcgcc tcccagcctc tgtccctgcg tccggaggca 900
tgtagacccg cagctggtgg ggccgtgcat acccggggtc ttgacttcgc ctgcgatatc 960
tacatttggg cccctctggc tggtacttgc ggggtcctgc tgctttcact cgtgatcact 1020
ctttactgta agcgcggtcg gaagaagctg ctgtacatct ttaagcaacc cttcatgagg 1080
cctgtgcaga ctactcaaga ggaggacggc tgttcatgcc ggttcccaga ggaggaggaa 1140
ggcggctgcg aactgcgcgt gaaattcagc cgcagcgcag atgctccagc ctacaagcag 1200
gggcagaacc agctctacaa cgaactcaat cttggtcgga gagaggagta cgacgtgctg 1260
gacaagcgga gaggacggga cccagaaatg ggcgggaagc cgcgcagaaa gaatccccaa 1320
gagggcctgt acaacgagct ccaaaaggat aagatggcag aagcctatag cgagattggt 1380
atgaaagggg aacgcagaag aggcaaaggc cacgacggac tgtaccaggg actcagcacc 1440
gccaccaagg acacctatga cgctcttcac atgcaggccc tgccgcctcg g 1491
<210> 113
<211> 1470
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 113
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtcc aactcgtcca atcaggagcg gaagtcaaaa agcccggagc tccagtgaaa 120
gtgtcatgca aggcctccgg ctacaccttc accggttact atatgcactg ggtgcggcag 180
gccccgggcc aggggttgga atggatggga tggatcaatc caaactcggg tgggactaac 240
tacgcccaga agttccaagg acgggtgacc atgactaggg acacctcgat ctccaccgca 300
tacatggagc ttagcagact ccgctccgac gataccgcag tctactattg cgcgcgggga 360
gagtgggacg gatcgtacta ctacgattac tggggccagg gaactctggt gactgtttcc 420
tcgggtggag gaggttcagg cggaggcggc tcgggcgggg gaggatctgg aggaggaggg 480
tccgacattg tgctgaccca aactccttcg tccctgtcgg ccagcgtggg cgaccgcgtg 540
acgattacgt gcagagctag ccaatccatc aatacttacc tcaactggta ccagcataag 600
ccggggaaag caccaaagct gctgatctac gccgcctcat ccttgcagag cggtgtgcct 660
tcacgcttta gcggatcggg atcgggaacg gatttcaccc tgactatcag ctccctccag 720
ccggaggatt ttgcgaccta ctactgtcag cagagcttct caccgctgac tttcggcggc 780
gggaccaagc tggaaatcaa gaccactacc ccagcaccga ggccacccac cccggctcct 840
accatcgcct cccagcctct gtccctgcgt ccggaggcat gtagacccgc agctggtggg 900
gccgtgcata cccggggtct tgacttcgcc tgcgatatct acatttgggc ccctctggct 960
ggtacttgcg gggtcctgct gctttcactc gtgatcactc tttactgtaa gcgcggtcgg 1020
aagaagctgc tgtacatctt taagcaaccc ttcatgaggc ctgtgcagac tactcaagag 1080
gaggacggct gttcatgccg gttcccagag gaggaggaag gcggctgcga actgcgcgtg 1140
aaattcagcc gcagcgcaga tgctccagcc tacaagcagg ggcagaacca gctctacaac 1200
gaactcaatc ttggtcggag agaggagtac gacgtgctgg acaagcggag aggacgggac 1260
ccagaaatgg gcgggaagcc gcgcagaaag aatccccaag agggcctgta caacgagctc 1320
caaaaggata agatggcaga agcctatagc gagattggta tgaaagggga acgcagaaga 1380
ggcaaaggcc acgacggact gtaccaggga ctcagcaccg ccaccaagga cacctatgac 1440
gctcttcaca tgcaggccct gccgcctcgg 1470
<210> 114
<211> 1458
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 114
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtgc aactcgttga atcaggtgga ggtttggtgc aacccggagg atctctcaga 120
ctgtcgtgtg cggcgtccgg gttcaccttt tcgtcctact ggatgcactg ggtgcgccag 180
gtgccgggaa aaggactggt gtgggtgtcc agaatcaaca ccgacgggtc aacgactacc 240
tacgcagata gcgtggaagg tcggttcacc atttcgcggg acaacgctaa aaacactctg 300
taccttcaga tgaattcact gcgcgatgac gacaccgcag tctactactg cgtcggtgga 360
cactgggcgg tctggggaca gggaactacg gtgactgtgt ccagcggcgg gggaggaagc 420
ggcggagggg ggagcggagg cggaggatca ggaggaggcg gctccgatat ccagatgacc 480
cagtcgccat cgaccctctc cgctagcgtg ggggataggg tcactatcac ttgccgagcc 540
agccaatcca ttagcgaccg gcttgcctgg taccaacaga aacctggaaa ggccccgaag 600
ctgctcatct acaaggcctc gtcactggag tcgggagtcc cgtcccgctt ttccggctcg 660
ggctcaggca ccgagttcac tctgaccatc tcgagcctgc agccggacga tttcgccgtg 720
tattactgcc agcaatacgg acatctccca atgtacacgt tcggtcaggg caccaaggtc 780
gaaatcaaga ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 115
<211> 1455
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 115
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtcc aactcgttca atcaggcgca gaagtcgaaa agcccggagc atcagtcaaa 120
gtctcttgca aggcttccgg ctacaccttc acggactact acatgcactg ggtgcgccag 180
gctccaggcc agggactgga gtggatggga tggatcaacc cgaattccgg gggaactaac 240
tacgcccaga agtttcaggg ccgggtgact atgactcgcg atacctcgat ctcgactgcg 300
tacatggagc tcagccgcct ccggtcggac gataccgccg tgtactattg tgcgtcggga 360
tgggacttcg actactgggg gcagggcact ctggtcactg tgtcaagcgg aggaggtgga 420
tcaggtggag gtggaagcgg gggaggaggt tccggcggcg gaggatcaga tatcgtgatg 480
acgcaatcgc cttcctcgtt gtccgcatcc gtgggagaca gggtgaccat tacttgcaga 540
gcgtcccagt ccattcggta ctacctgtcg tggtaccagc agaagccggg gaaagcccca 600
aaactgctta tctatactgc ctcgatcctc caaaacggcg tgccatcaag attcagcggt 660
tcgggcagcg ggaccgactt taccctgact atcagcagcc tgcagccgga agatttcgcc 720
acgtactact gcctgcaaac ctacaccacc ccggacttcg gacctggaac caaggtggag 780
atcaagacca ctaccccagc accgaggcca cccaccccgg ctcctaccat cgcctcccag 840
cctctgtccc tgcgtccgga ggcatgtaga cccgcagctg gtggggccgt gcatacccgg 900
ggtcttgact tcgcctgcga tatctacatt tgggcccctc tggctggtac ttgcggggtc 960
ctgctgcttt cactcgtgat cactctttac tgtaagcgcg gtcggaagaa gctgctgtac 1020
atctttaagc aacccttcat gaggcctgtg cagactactc aagaggagga cggctgttca 1080
tgccggttcc cagaggagga ggaaggcggc tgcgaactgc gcgtgaaatt cagccgcagc 1140
gcagatgctc cagcctacaa gcaggggcag aaccagctct acaacgaact caatcttggt 1200
cggagagagg agtacgacgt gctggacaag cggagaggac gggacccaga aatgggcggg 1260
aagccgcgca gaaagaatcc ccaagagggc ctgtacaacg agctccaaaa ggataagatg 1320
gcagaagcct atagcgagat tggtatgaaa ggggaacgca gaagaggcaa aggccacgac 1380
ggactgtacc agggactcag caccgccacc aaggacacct atgacgctct tcacatgcag 1440
gccctgccgc ctcgg 1455
<210> 116
<211> 1491
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 116
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtgc aactcgtcca gtcaggtgca gaagtgaaga aacccggagc gtcagtcaaa 120
gtgtcatgca aggcgtcagg ctacaccttc accagctact acatgcactg ggtgcggcag 180
gccccaggcc aaggcttgga gtggatggga atcattaacc cgtcaggagg ctccacctcc 240
tacgcccaga agtttcaggg aagagtgacg atgactcggg atacgtcgac ctcgaccgtg 300
tacatggaac tgagctcgct gcgctccgag gacactgctg tgtactactg cgcacggtac 360
agactcattg ccgtggcagg agactactac tactatggca tggacgtctg ggggcagggc 420
actatggtca ctgtgtcgtc cggcggagga ggctcgggtg gaggaggtag cggaggaggg 480
ggaagcggag gggggggctc cgatatccag atgactcagt cgccttcctc cgtgtcggcc 540
tcggttggag atcgcgtcac catcacttgt cgagcttccc aaggagtcgg taggtggctg 600
gcgtggtacc agcaaaagcc gggaactgcc ccgaagctcc tgatctacgc ggctagcacc 660
ctgcagtcgg gagtgccatc ccgcttcagc ggatctgggt caggtaccga cttcaccctt 720
acgatcaaca atctccagcc ggaggacttt gccacctatt actgccaaca ggccaacagc 780
ttccctctga ctttcggagg gggcactcgc ctggaaatca agaccactac cccagcaccg 840
aggccaccca ccccggctcc taccatcgcc tcccagcctc tgtccctgcg tccggaggca 900
tgtagacccg cagctggtgg ggccgtgcat acccggggtc ttgacttcgc ctgcgatatc 960
tacatttggg cccctctggc tggtacttgc ggggtcctgc tgctttcact cgtgatcact 1020
ctttactgta agcgcggtcg gaagaagctg ctgtacatct ttaagcaacc cttcatgagg 1080
cctgtgcaga ctactcaaga ggaggacggc tgttcatgcc ggttcccaga ggaggaggaa 1140
ggcggctgcg aactgcgcgt gaaattcagc cgcagcgcag atgctccagc ctacaagcag 1200
gggcagaacc agctctacaa cgaactcaat cttggtcgga gagaggagta cgacgtgctg 1260
gacaagcgga gaggacggga cccagaaatg ggcgggaagc cgcgcagaaa gaatccccaa 1320
gagggcctgt acaacgagct ccaaaaggat aagatggcag aagcctatag cgagattggt 1380
atgaaagggg aacgcagaag aggcaaaggc cacgacggac tgtaccaggg actcagcacc 1440
gccaccaagg acacctatga cgctcttcac atgcaggccc tgccgcctcg g 1491
<210> 117
<211> 1482
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 117
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtgc aattggttca atcaggagga ggagtggtgc aacctggaag atctctcaga 120
ctgtcgtgtg cggcatcggg attcactttc tcatcatacg caatgcactg ggtccgccag 180
gccccgggca aaggcttgga atgggtggcg gtcatttcat acgacggctc gaacaagtac 240
tacgctgaca gcgtgaaggg acgctttact atttcccggg acaattcgaa gaacactctg 300
tacctccaga tgaactccct tagggctgag gacaccgccg tctactactg cgcacgctgg 360
aaagtgtcgt ccagctcccc agcttttgac tactggggac agggaaccct tgtgaccgtg 420
tcgtccggtg gagggggaag cggcggaggg ggatcaggtg gcggcggatc gggaggcggg 480
ggatcagaaa tcgtgctgac tcagtccccg gccacgctgt ctctcagccc gggagagaga 540
gcgatcctgt cctgccgcgc ctcgcagagc gtgtacacta agtacctggg gtggtaccag 600
cagaaaccgg gtcaagcgcc tcggctgctg atctacgatg cctccacccg ggccaccgga 660
atccccgatc ggttctccgg cagcggctcg ggaactgatt tcacgctgac catcaatcgc 720
ctggagccgg aagatttcgc cgtctattac tgccagcatt acggcgggag cccactcatc 780
accttcggtc aaggaacccg actcgaaatc aagaccacta ccccagcacc gaggccaccc 840
accccggctc ctaccatcgc ctcccagcct ctgtccctgc gtccggaggc atgtagaccc 900
gcagctggtg gggccgtgca tacccggggt cttgacttcg cctgcgatat ctacatttgg 960
gcccctctgg ctggtacttg cggggtcctg ctgctttcac tcgtgatcac tctttactgt 1020
aagcgcggtc ggaagaagct gctgtacatc tttaagcaac ccttcatgag gcctgtgcag 1080
actactcaag aggaggacgg ctgttcatgc cggttcccag aggaggagga aggcggctgc 1140
gaactgcgcg tgaaattcag ccgcagcgca gatgctccag cctacaagca ggggcagaac 1200
cagctctaca acgaactcaa tcttggtcgg agagaggagt acgacgtgct ggacaagcgg 1260
agaggacggg acccagaaat gggcgggaag ccgcgcagaa agaatcccca agagggcctg 1320
tacaacgagc tccaaaagga taagatggca gaagcctata gcgagattgg tatgaaaggg 1380
gaacgcagaa gaggcaaagg ccacgacgga ctgtaccagg gactcagcac cgccaccaag 1440
gacacctatg acgctcttca catgcaggcc ctgccgcctc gg 1482
<210> 118
<211> 1470
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 118
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtcc aactccagca gtcaggtgca gaagtcaaaa agccaggagc atccgtgaag 120
gtttcgtgca agacttccgg ctaccctttt accgggtact ccctccattg ggtgagacaa 180
gcaccgggcc agggactgga gtggatggga tggatcaacc caaattcggg cggcaccaac 240
tatgcgcaga agttccaggg acgggtgacc atgactcgcg acacttcgat ctccactgcc 300
tacatggagc tgtcccgctt gagatctgac gacacggccg tctactactg cgcccgggat 360
cactacggag gtaattcgct gttctactgg gggcagggaa cccttgtgac tgtgtcctcg 420
ggtggtggag ggtcaggagg cggaggctca gggggaggag gtagcggagg aggcggatca 480
gacatccaac tgacccagtc accatcctcc atctcggcta gcgtcggaga caccgtgtcg 540
attacttgta gggcctccca agactcaggg acgtggctgg cgtggtatca gcaaaaaccg 600
ggcaaagctc cgaacctgtt gatgtacgac gccagcaccc tcgaagatgg agtgcctagc 660
cgcttcagcg gaagcgcctc gggcactgaa ttcacgctga ctgtgaatcg gctccagccg 720
gaggattcgg cgacctacta ctgccagcag tacaacagct accccctgac ctttggaggc 780
gggaccaagg tggatatcaa gaccactacc ccagcaccga ggccacccac cccggctcct 840
accatcgcct cccagcctct gtccctgcgt ccggaggcat gtagacccgc agctggtggg 900
gccgtgcata cccggggtct tgacttcgcc tgcgatatct acatttgggc ccctctggct 960
ggtacttgcg gggtcctgct gctttcactc gtgatcactc tttactgtaa gcgcggtcgg 1020
aagaagctgc tgtacatctt taagcaaccc ttcatgaggc ctgtgcagac tactcaagag 1080
gaggacggct gttcatgccg gttcccagag gaggaggaag gcggctgcga actgcgcgtg 1140
aaattcagcc gcagcgcaga tgctccagcc tacaagcagg ggcagaacca gctctacaac 1200
gaactcaatc ttggtcggag agaggagtac gacgtgctgg acaagcggag aggacgggac 1260
ccagaaatgg gcgggaagcc gcgcagaaag aatccccaag agggcctgta caacgagctc 1320
caaaaggata agatggcaga agcctatagc gagattggta tgaaagggga acgcagaaga 1380
ggcaaaggcc acgacggact gtaccaggga ctcagcaccg ccaccaagga cacctatgac 1440
gctcttcaca tgcaggccct gccgcctcgg 1470
<210> 119
<211> 1476
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 119
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtgc aactcgtcca gtcaggtgca gaagtgaaga aaccaggagc gtccgtcgaa 120
gtgtcgtgta aggcgtccgg ctacactttc acctcgtact acatgcactg ggtgcggcag 180
gccccgggac aaggcctcga atggatggga atcatcaacc cgagcggagg ctcgactggt 240
tacgcccaga agttccaggg aagggtgacg atgacccgcg atacctcgac ttcgaccgtt 300
catatggagc tctcgtccct gcggagcgag gacactgctg tctactattg cgcgcgggga 360
ggatactcta gctcctccga tgcatttgac atttggggcc agggaactat ggtgaccgtg 420
tcatcaggcg gaggtggatc aggaggagga gggtcgggag ggggaggcag cggcgggggt 480
gggtcggaca ttcagatgac gcagtcccct cctagcctga gcgcctcggt gggtgacaga 540
gtgaccatca cttgcagagc ctcgcaagac atctcctccg cattggcttg gtaccagcaa 600
aagccgggca ctccgccgaa actgctcatc tacgatgcct cctcactgga gtcaggagtc 660
ccatctcgct tctcggggtc aggaagcggc accgatttta cccttaccat ctccagcctg 720
cagcccgagg acttcgccac gtactactgc caacagttca gctcctaccc actgaccttc 780
gggggcggaa ctcgcctgga aatcaagacc actaccccag caccgaggcc acccaccccg 840
gctcctacca tcgcctccca gcctctgtcc ctgcgtccgg aggcatgtag acccgcagct 900
ggtggggccg tgcatacccg gggtcttgac ttcgcctgcg atatctacat ttgggcccct 960
ctggctggta cttgcggggt cctgctgctt tcactcgtga tcactcttta ctgtaagcgc 1020
ggtcggaaga agctgctgta catctttaag caacccttca tgaggcctgt gcagactact 1080
caagaggagg acggctgttc atgccggttc ccagaggagg aggaaggcgg ctgcgaactg 1140
cgcgtgaaat tcagccgcag cgcagatgct ccagcctaca agcaggggca gaaccagctc 1200
tacaacgaac tcaatcttgg tcggagagag gagtacgacg tgctggacaa gcggagagga 1260
cgggacccag aaatgggcgg gaagccgcgc agaaagaatc cccaagaggg cctgtacaac 1320
gagctccaaa aggataagat ggcagaagcc tatagcgaga ttggtatgaa aggggaacgc 1380
agaagaggca aaggccacga cggactgtac cagggactca gcaccgccac caaggacacc 1440
tatgacgctc ttcacatgca ggccctgccg cctcgg 1476
<210> 120
<211> 1497
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 120
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtgc aactcgtcca gagcggagca gaagtcaaga agccaggagc gtcagtgaaa 120
gtgtcatgca aggccagcgg ctataccttt acttcgtatg ggatctcctg ggtgcggcag 180
gcaccgggcc aaggactgga gtggatggga tggatctcag cctacaacgg taacaccaac 240
tacgcccaga agctgcaagg acgcgtgacc atgactactg atacgagcac ctccactgcc 300
tacatggaat tgcggtccct tcggtcggac gatactgctg tgtactactg cgcaagagtc 360
gccggaggga tctactacta ctacggcatg gacgtctggg gacagggaac caccattacg 420
gtgtcgagcg gagggggagg ctcgggggga ggaggaagcg gaggtggcgg ctccgggggc 480
ggcggatcgg acattgtgat gacccagact cctgactccc tggctgtttc gttgggagag 540
cgcgcgacta tctcgtgtaa gtccagccac tcagtcctgt acaatcgcaa taacaagaac 600
tacctcgcgt ggtaccagca aaaaccgggt cagccgccta aactcctgtt ctactgggcc 660
tccaccagaa agagcggggt gccagatcga ttctctggat caggatcagg taccgacttt 720
acgctgacca tctcgtccct gcagccggag gatttcgcga cttacttctg ccagcagact 780
cagactttcc ccctcacctt cggtcaaggc accaggctgg aaatcaatac cactacccca 840
gcaccgaggc cacccacccc ggctcctacc atcgcctccc agcctctgtc cctgcgtccg 900
gaggcatgta gacccgcagc tggtggggcc gtgcataccc ggggtcttga cttcgcctgc 960
gatatctaca tttgggcccc tctggctggt acttgcgggg tcctgctgct ttcactcgtg 1020
atcactcttt actgtaagcg cggtcggaag aagctgctgt acatctttaa gcaacccttc 1080
atgaggcctg tgcagactac tcaagaggag gacggctgtt catgccggtt cccagaggag 1140
gaggaaggcg gctgcgaact gcgcgtgaaa ttcagccgca gcgcagatgc tccagcctac 1200
aagcaggggc agaaccagct ctacaacgaa ctcaatcttg gtcggagaga ggagtacgac 1260
gtgctggaca agcggagagg acgggaccca gaaatgggcg ggaagccgcg cagaaagaat 1320
ccccaagagg gcctgtacaa cgagctccaa aaggataaga tggcagaagc ctatagcgag 1380
attggtatga aaggggaacg cagaagaggc aaaggccacg acggactgta ccagggactc 1440
agcaccgcca ccaaggacac ctatgacgct cttcacatgc aggccctgcc gcctcgg 1497
<210> 121
<211> 1455
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 121
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtcc aattgcagca gagcggagca gaagtgaaga agccaggagc gtcagtcaaa 120
gtgtcgtgta aggcgtcagg atacaccttc acgggatact acatgcactg ggtgcgccag 180
gccccgggcc aaggactcga gtggatgggc tggatcaacc ctaactctgg aggcaccaac 240
tacgcccaga atttccaagg cagagtgacc atgacccggg acacctccat ctcgactgcc 300
tatatggaac tgcggcggct gcgctcggac gatactgctg tgtattactg cgccagcggc 360
tgggactttg actactgggg acagggtact ctggtgactg tttcctcggg aggaggcgga 420
tcgggtggag gaggtagcgg gggagggggg tcgggaggcg gaggcagcga tattcgcatg 480
actcaatcgc cgtcctccct gagcgctagc gtgggagatc gagtcaccat cacttgcaga 540
gcgtcacagt cgattcgcta ctacctgtcc tggtaccagc agaaaccggg aaaggcacca 600
aagcttctga tctacacggc ctccatcctg caaaatggtg tcccatcaag gttctccggg 660
tcagggagcg gcactgactt cactctcacc atctcctcac tccagcccga ggactttgca 720
acctactact gcctccagac gtacaccacc ccggatttcg gtcctggaac caaggtggaa 780
atcaaaacca ctaccccagc accgaggcca cccaccccgg ctcctaccat cgcctcccag 840
cctctgtccc tgcgtccgga ggcatgtaga cccgcagctg gtggggccgt gcatacccgg 900
ggtcttgact tcgcctgcga tatctacatt tgggcccctc tggctggtac ttgcggggtc 960
ctgctgcttt cactcgtgat cactctttac tgtaagcgcg gtcggaagaa gctgctgtac 1020
atctttaagc aacccttcat gaggcctgtg cagactactc aagaggagga cggctgttca 1080
tgccggttcc cagaggagga ggaaggcggc tgcgaactgc gcgtgaaatt cagccgcagc 1140
gcagatgctc cagcctacaa gcaggggcag aaccagctct acaacgaact caatcttggt 1200
cggagagagg agtacgacgt gctggacaag cggagaggac gggacccaga aatgggcggg 1260
aagccgcgca gaaagaatcc ccaagagggc ctgtacaacg agctccaaaa ggataagatg 1320
gcagaagcct atagcgagat tggtatgaaa ggggaacgca gaagaggcaa aggccacgac 1380
ggactgtacc agggactcag caccgccacc aaggacacct atgacgctct tcacatgcag 1440
gccctgccgc ctcgg 1455
<210> 122
<211> 1470
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 122
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtcc aactcgtcca aagcggagca gaagtcaaaa agccaggagc gtcggtgaaa 120
gtgtcttgca aagccagcgg ctacaccttc acgggttact acatgcactg ggtgcgccag 180
gcgccgggcc aggggctgga gtggatgggc cggattaacc ctaacagcgg gggaactaat 240
tacgctcaga agttccaggg tagagtcacc atgactacgg acacttccac ttccaccgcc 300
tatatggaac tgcgctccct ccgctcagat gatactgccg tgtattactg cgcgcggact 360
accacgtcat acgcatttga catctggggc cagggaacta tggtgaccgt gagctcgggc 420
ggaggcggtt cagggggagg aggaagcgga ggaggaggat cgggaggagg tggctccgat 480
atccagctga ctcagtcccc gagcaccctg tcggcgtcgg tgggggacag ggttaccatc 540
acctgtagag cttcccaatc catttcgact tggctggcct ggtaccagca aaagccggga 600
aaggccccta atttgcttat ctacaaggca tcgaccctcg aaagcggtgt gccctcccgg 660
ttttcgggat caggatcagg gaccgagttc accctgacca tctcatccct ccagccggac 720
gacttcgcca cttactactg ccagcagtac aacacctact cgccatacac tttcggccaa 780
ggcaccaagc tggagatcaa gaccactacc ccagcaccga ggccacccac cccggctcct 840
accatcgcct cccagcctct gtccctgcgt ccggaggcat gtagacccgc agctggtggg 900
gccgtgcata cccggggtct tgacttcgcc tgcgatatct acatttgggc ccctctggct 960
ggtacttgcg gggtcctgct gctttcactc gtgatcactc tttactgtaa gcgcggtcgg 1020
aagaagctgc tgtacatctt taagcaaccc ttcatgaggc ctgtgcagac tactcaagag 1080
gaggacggct gttcatgccg gttcccagag gaggaggaag gcggctgcga actgcgcgtg 1140
aaattcagcc gcagcgcaga tgctccagcc tacaagcagg ggcagaacca gctctacaac 1200
gaactcaatc ttggtcggag agaggagtac gacgtgctgg acaagcggag aggacgggac 1260
ccagaaatgg gcgggaagcc gcgcagaaag aatccccaag agggcctgta caacgagctc 1320
caaaaggata agatggcaga agcctatagc gagattggta tgaaagggga acgcagaaga 1380
ggcaaaggcc acgacggact gtaccaggga ctcagcaccg ccaccaagga cacctatgac 1440
gctcttcaca tgcaggccct gccgcctcgg 1470
<210> 123
<211> 1479
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 123
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagttc aactcgtgca atcaggtgga ggactcgtca aacccggagg atcattgaga 120
ctgtcatgcg aagcgagcgg ttttatcttc tccgattact atatgggatg gattcggcag 180
gccccgggaa agggactcga atgggtgtca tacatcggaa ggtcaggctc gtccatgtac 240
tacgcagact cggtgaaagg cagattcacc tttagccggg acaacgccaa gaattccctc 300
tacttgcaga tgaacagcct gcgagccgag gatactgctg tctactactg tgccgcgtcg 360
ccggtggtgg cagctactga agatttccag cactggggac agggaactct ggtcacggtg 420
tcgagcggtg ggggcggaag cggaggcgga ggatcgggcg gcggaggttc ggggggggga 480
gggtctgaca tcgtgatgac ccaaacccca gccaccctga gcctctcccc tggagagcgc 540
gcgactcttt cgtgccgcgc ttcccagtca gtgaccagca attacttggc ttggtaccaa 600
cagaagccgg gacaggcgcc acggctgctg ctttttggtg ccagcactcg cgccaccgga 660
atcccggatc gcttctcggg ctcagggtcc gggacggact tcaccctgac tatcaaccgg 720
ctggaacctg aggacttcgc gatgtactac tgccagcagt acggctccgc accagtcact 780
ttcggacaag gcaccaagct ggagatcaag accactaccc cagcaccgag gccacccacc 840
ccggctccta ccatcgcctc ccagcctctg tccctgcgtc cggaggcatg tagacccgca 900
gctggtgggg ccgtgcatac ccggggtctt gacttcgcct gcgatatcta catttgggcc 960
cctctggctg gtacttgcgg ggtcctgctg ctttcactcg tgatcactct ttactgtaag 1020
cgcggtcgga agaagctgct gtacatcttt aagcaaccct tcatgaggcc tgtgcagact 1080
actcaagagg aggacggctg ttcatgccgg ttcccagagg aggaggaagg cggctgcgaa 1140
ctgcgcgtga aattcagccg cagcgcagat gctccagcct acaagcaggg gcagaaccag 1200
ctctacaacg aactcaatct tggtcggaga gaggagtacg acgtgctgga caagcggaga 1260
ggacgggacc cagaaatggg cgggaagccg cgcagaaaga atccccaaga gggcctgtac 1320
aacgagctcc aaaaggataa gatggcagaa gcctatagcg agattggtat gaaaggggaa 1380
cgcagaagag gcaaaggcca cgacggactg taccagggac tcagcaccgc caccaaggac 1440
acctatgacg ctcttcacat gcaggccctg ccgcctcgg 1479
<210> 124
<211> 1479
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 124
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtcc aactcgtcca gtcgggagca gaagttagag caccaggagc gtcagtgaaa 120
atctcatgca aggcctcggg cttcacgttc cgcggatact acatccactg ggtgcgccaa 180
gccccgggtc agggattgga gtggatggga atcattaacc catcaggagg gagccgggct 240
tacgcgcaga agttccaggg acgcgtcact atgacccgag atacttccac ctcgactgtg 300
tacatggaac tctcgtccct gaggtccgac gacactgcga tgtattactg tgctcggact 360
gccagctgcg gtggggactg ttactacctc gattactggg gccagggaac tctggtgacc 420
gtgtccagcg gaggtggcgg gtcagggggt ggcggaagcg gaggcggcgg ttcaggcgga 480
ggaggctcgg acatccaaat gacgcaatcg ccgcctaccc tgagcgcttc cgtgggagat 540
cgggtgacca ttacttgcag agcatccgag aacgtcaata tctggctggc ctggtaccaa 600
cagaagccgg ggaaggcccc taaactgctg atctacaagt cgagcagcct tgcctctgga 660
gtgccctccc gcttctcggg ctcgggatca ggagcggaat tcaccctcac catctcctcc 720
ctgcagccag atgactttgc cacctactac tgccagcagt accagagcta tccgttgacc 780
tttgggggag gcactaaagt ggacatcaag accactaccc cagcaccgag gccacccacc 840
ccggctccta ccatcgcctc ccagcctctg tccctgcgtc cggaggcatg tagacccgca 900
gctggtgggg ccgtgcatac ccggggtctt gacttcgcct gcgatatcta catttgggcc 960
cctctggctg gtacttgcgg ggtcctgctg ctttcactcg tgatcactct ttactgtaag 1020
cgcggtcgga agaagctgct gtacatcttt aagcaaccct tcatgaggcc tgtgcagact 1080
actcaagagg aggacggctg ttcatgccgg ttcccagagg aggaggaagg cggctgcgaa 1140
ctgcgcgtga aattcagccg cagcgcagat gctccagcct acaagcaggg gcagaaccag 1200
ctctacaacg aactcaatct tggtcggaga gaggagtacg acgtgctgga caagcggaga 1260
ggacgggacc cagaaatggg cgggaagccg cgcagaaaga atccccaaga gggcctgtac 1320
aacgagctcc aaaaggataa gatggcagaa gcctatagcg agattggtat gaaaggggaa 1380
cgcagaagag gcaaaggcca cgacggactg taccagggac tcagcaccgc caccaaggac 1440
acctatgacg ctcttcacat gcaggccctg ccgcctcgg 1479
<210> 125
<211> 1464
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 125
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagttc aactcgttca atcaggtgga ggactcgtgc aaccaggaag atcactcaga 120
ctcagctgcg ccgcgtcggg attcactttc gatgactacg caatgcactg ggtgcggcag 180
gccccgggca aaggactgga atgggtgagc ggaattagct ggaactcggg gtccatcggg 240
tacgccgact cggtgaaggg acgctttacg atctcccggg acaatgccaa gaactccctg 300
tatttgcaga tgaactcctt gagggctgag gacaccgccg tgtactactg cgctaaagat 360
ggatcatcgt cctggtcctg gggatacttc gattactggg gccagggcac tctggtgacc 420
gtgtcgtcag gcggtggagg gtcgggcgga ggaggtagcg gaggcggagg gagcagctct 480
gaactgaccc aagacccggc ggtgtcggtc gcccttggtc agactgtgcg gactacctgt 540
cagggggacg cgctgcgctc gtactacgct tcatggtacc agcagaagcc cggacaggca 600
cctatgctgg tcatctacgg aaagaataac cgcccatccg gcatcccgga tcgcttctcg 660
ggttcggaca gcggcgacac cgcatccctg acgatcactg gagcgcaggc cgaggatgaa 720
gccgactact actgcaattc ccgagattca agcggctacc ctgtgtttgg gaccggaact 780
aaggtcaccg tcctgaccac taccccagca ccgaggccac ccaccccggc tcctaccatc 840
gcctcccagc ctctgtccct gcgtccggag gcatgtagac ccgcagctgg tggggccgtg 900
catacccggg gtcttgactt cgcctgcgat atctacattt gggcccctct ggctggtact 960
tgcggggtcc tgctgctttc actcgtgatc actctttact gtaagcgcgg tcggaagaag 1020
ctgctgtaca tctttaagca acccttcatg aggcctgtgc agactactca agaggaggac 1080
ggctgttcat gccggttccc agaggaggag gaaggcggct gcgaactgcg cgtgaaattc 1140
agccgcagcg cagatgctcc agcctacaag caggggcaga accagctcta caacgaactc 1200
aatcttggtc ggagagagga gtacgacgtg ctggacaagc ggagaggacg ggacccagaa 1260
atgggcggga agccgcgcag aaagaatccc caagagggcc tgtacaacga gctccaaaag 1320
gataagatgg cagaagccta tagcgagatt ggtatgaaag gggaacgcag aagaggcaaa 1380
ggccacgacg gactgtacca gggactcagc accgccacca aggacaccta tgacgctctt 1440
cacatgcagg ccctgccgcc tcgg 1464
<210> 126
<211> 1470
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 126
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaagtgc aactcgtgga atctggtgga ggacttgtgc aacctggaag atcgttgaga 120
ctctcatgtg ctgcctccgg gttcaccttt gacgactacg ccatgcactg ggtgcgccag 180
gcaccaggaa agggtctgga gtgggtttcg ggtatctcgt ggaactccgg gagcactggc 240
tacgctgatt cggtgaaagg ccggtttacc atctcccgag acaatgcgaa gaattccctc 300
tatctgcaga tgaacagcct ccgggccgag gatactgccc tgtactactg cgccaaggat 360
agctcatcat ggtacggagg tggatcggct ttcgatatct ggggccaggg cacgatggtc 420
accgtgtcct cggggggcgg aggctccggg ggaggaggta gcggaggagg aggatcgagc 480
tcagagttga ctcaagaacc cgcagtgtcc gtggcactgg gccaaaccgt caggatcact 540
tgccagggag acagcctgag gtcgtactac gcgtcctggt accagcagaa gccgggacag 600
gccccggtcc tggtcatttt cggacgctca agacgcccat cgggcatccc ggaccggttc 660
agcggaagct cctcgggaaa caccgcgtca cttatcatta ccggcgcaca ggctgaggac 720
gaagcggatt actactgcaa ctcccgcgac aatactgcca accattacgt gttcgggacc 780
ggaacgaaac tgactgtcct gaccactacc ccagcaccga ggccacccac cccggctcct 840
accatcgcct cccagcctct gtccctgcgt ccggaggcat gtagacccgc agctggtggg 900
gccgtgcata cccggggtct tgacttcgcc tgcgatatct acatttgggc ccctctggct 960
ggtacttgcg gggtcctgct gctttcactc gtgatcactc tttactgtaa gcgcggtcgg 1020
aagaagctgc tgtacatctt taagcaaccc ttcatgaggc ctgtgcagac tactcaagag 1080
gaggacggct gttcatgccg gttcccagag gaggaggaag gcggctgcga actgcgcgtg 1140
aaattcagcc gcagcgcaga tgctccagcc tacaagcagg ggcagaacca gctctacaac 1200
gaactcaatc ttggtcggag agaggagtac gacgtgctgg acaagcggag aggacgggac 1260
ccagaaatgg gcgggaagcc gcgcagaaag aatccccaag agggcctgta caacgagctc 1320
caaaaggata agatggcaga agcctatagc gagattggta tgaaagggga acgcagaaga 1380
ggcaaaggcc acgacggact gtaccaggga ctcagcaccg ccaccaagga cacctatgac 1440
gctcttcaca tgcaggccct gccgcctcgg 1470
<210> 127
<211> 1470
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 127
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaagttc aattggtgga atctggagga ggacttgtgc aacccggtag atctctgaga 120
ctgtcctgtg cggcatcggg attcaccttc gacgactacg ctatgcactg ggtgagacaa 180
gcccctggaa aaggactgga gtgggtgtca ggcatctcct ggaatagcgg gtccactgga 240
tacgccgatt cggtcaaggg tcgcttcacc atttcccggg acaatgccaa gaactccctg 300
taccttcaaa tgaactccct ccgggccgag gataccgccc tctactactg cgccaaagac 360
agctcgtcat ggtatggcgg agggtcggca tttgacatct ggggacaggg aactatggtg 420
actgtgtcat caggaggcgg cggaagcggc ggcggcgggt ccggcggagg agggtcgtcc 480
agcgaactca cccaagatcc agcagtgagc gtcgcgctgg gccagaccgt caggatcacg 540
tgccagggag attcactgcg ctcatactac gcgtcctggt accagcagaa gccggggcag 600
gccccggtcc tcgtgatcta cggaaagaac aaccgcccgt cgggtatccc agaccgcttt 660
tcgggtagct ccagcggaaa tacggctagc ctgaccatca ctggagcaca ggctgaggat 720
gaagcggact actactgcaa ttcgcggggc tcatcgggga accattacgt gttcggaact 780
ggtaccaagg tgactgtcct gaccactacc ccagcaccga ggccacccac cccggctcct 840
accatcgcct cccagcctct gtccctgcgt ccggaggcat gtagacccgc agctggtggg 900
gccgtgcata cccggggtct tgacttcgcc tgcgatatct acatttgggc ccctctggct 960
ggtacttgcg gggtcctgct gctttcactc gtgatcactc tttactgtaa gcgcggtcgg 1020
aagaagctgc tgtacatctt taagcaaccc ttcatgaggc ctgtgcagac tactcaagag 1080
gaggacggct gttcatgccg gttcccagag gaggaggaag gcggctgcga actgcgcgtg 1140
aaattcagcc gcagcgcaga tgctccagcc tacaagcagg ggcagaacca gctctacaac 1200
gaactcaatc ttggtcggag agaggagtac gacgtgctgg acaagcggag aggacgggac 1260
ccagaaatgg gcgggaagcc gcgcagaaag aatccccaag agggcctgta caacgagctc 1320
caaaaggata agatggcaga agcctatagc gagattggta tgaaagggga acgcagaaga 1380
ggcaaaggcc acgacggact gtaccaggga ctcagcaccg ccaccaagga cacctatgac 1440
gctcttcaca tgcaggccct gccgcctcgg 1470
<210> 128
<211> 1485
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 128
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtgc agctcgttca atcaggcgga ggactcgttc aaccaggagg atcattgcga 120
ctctcatgtg cggcctctgg attcacgttt agctcatatt ggatgcactg ggtgcggcag 180
gcgccgggga aaggtctggt gtgggtcagc cgcatcaact cagacggctc ctcgacttcg 240
tacgccgact ccgtgaaggg acgctttacc atttcccgcg acaacgccaa gaataccctt 300
taccttcaga tgaactccct ccgcgctgag gataccgccg tgtactactg cgtgaggact 360
ggctgggtcg gcagctacta ctactacatg gacgtgtggg gcaaaggaac tactgtcacc 420
gtgtcaagcg gcggtggagg ttccggcggg ggaggatcgg gggggggcgg atcgggtggc 480
ggaggatcgg agatcgtgtt gacccagtcg ccgggaaccc tgtcgctgtc gcctggggag 540
agagcaactc tgtcctgccg ggcttcccag tcggtgtcga gcaattacct ggcatggtac 600
caacagaagc cgggacagcc gccacgcctg ctgatctatg acgtgtcaac tcgggcaact 660
ggaatccctg cgcggttcag cggcggaggg agcggtaccg atttcaccct gactatttcc 720
tccctcgaac cagaagattt cgccgtctac tactgccagc agagaagcaa ctggccgccc 780
tggacgttcg gacaaggaac caaggtcgaa atcaagacca ctaccccagc accgaggcca 840
cccaccccgg ctcctaccat cgcctcccag cctctgtccc tgcgtccgga ggcatgtaga 900
cccgcagctg gtggggccgt gcatacccgg ggtcttgact tcgcctgcga tatctacatt 960
tgggcccctc tggctggtac ttgcggggtc ctgctgcttt cactcgtgat cactctttac 1020
tgtaagcgcg gtcggaagaa gctgctgtac atctttaagc aacccttcat gaggcctgtg 1080
cagactactc aagaggagga cggctgttca tgccggttcc cagaggagga ggaaggcggc 1140
tgcgaactgc gcgtgaaatt cagccgcagc gcagatgctc cagcctacaa gcaggggcag 1200
aaccagctct acaacgaact caatcttggt cggagagagg agtacgacgt gctggacaag 1260
cggagaggac gggacccaga aatgggcggg aagccgcgca gaaagaatcc ccaagagggc 1320
ctgtacaacg agctccaaaa ggataagatg gcagaagcct atagcgagat tggtatgaaa 1380
ggggaacgca gaagaggcaa aggccacgac ggactgtacc agggactcag caccgccacc 1440
aaggacacct atgacgctct tcacatgcag gccctgccgc ctcgg 1485
<210> 129
<211> 1482
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 129
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtgc aattggttca atcaggagga ggagtcgtgc agcccggaag atcgttgaga 120
ctgtcatgtg ccgcgagcgg ctttactttc tcaagctacg gaatgcattg ggtgcgacag 180
gctccgggaa aaggactgga atgggtcgca gtgatctcat acgacggctc gaacaagtac 240
tacgccgact ccgtcaaggg tcggttcacg atttcgcgcg ataattccaa gaacactctg 300
tacctccaaa tgaacagcct ccgggcagag gacaccgccg tctactactg cgctaaggga 360
tactcgcgct actactacta tggaatggat gtgtggggcc agggaactac cgtgacggtg 420
tcgtccggcg gcggtgggtc gggcggaggc ggatcaggtg gaggtggaag cggaggagga 480
gggagcgaaa tcgtcatgac tcagtcccct gctacccttt ctctgtcgcc gggagaaaga 540
gccatcctga gctgccgggc ctcccagagc gtgtacacca aatacctggg atggtaccag 600
cagaagccgg ggcaggcacc aaggctcctg atctacgatg cgtccacccg cgcgactggt 660
atcccagacc gcttttccgg ctcggggtca gggactgact tcacccttac tatcaatcgg 720
ctcgagcctg aggatttcgc cgtgtattac tgccagcact acggagggtc cccgctgatt 780
accttcggcc aaggcaccaa agtggacatc aagaccacta ccccagcacc gaggccaccc 840
accccggctc ctaccatcgc ctcccagcct ctgtccctgc gtccggaggc atgtagaccc 900
gcagctggtg gggccgtgca tacccggggt cttgacttcg cctgcgatat ctacatttgg 960
gcccctctgg ctggtacttg cggggtcctg ctgctttcac tcgtgatcac tctttactgt 1020
aagcgcggtc ggaagaagct gctgtacatc tttaagcaac ccttcatgag gcctgtgcag 1080
actactcaag aggaggacgg ctgttcatgc cggttcccag aggaggagga aggcggctgc 1140
gaactgcgcg tgaaattcag ccgcagcgca gatgctccag cctacaagca ggggcagaac 1200
cagctctaca acgaactcaa tcttggtcgg agagaggagt acgacgtgct ggacaagcgg 1260
agaggacggg acccagaaat gggcgggaag ccgcgcagaa agaatcccca agagggcctg 1320
tacaacgagc tccaaaagga taagatggca gaagcctata gcgagattgg tatgaaaggg 1380
gaacgcagaa gaggcaaagg ccacgacgga ctgtaccagg gactcagcac cgccaccaag 1440
gacacctatg acgctcttca catgcaggcc ctgccgcctc gg 1482
<210> 130
<211> 1479
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 130
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtgc aacttgttca atcaggagga ggactcgttc aacccggagg atcactgcga 120
ctctcatgtg cagcgtcggg gttcaccttc tccagctacg caatgtcctg ggtgcgccaa 180
gcccctggaa aaggcctgga gtgggtgtcg gccatctctg ggagcggggg atcaacttac 240
tacgctgact ccgtcaaggg ccgctttacc atctcccggg acaacagcaa gaacactctc 300
tatctccaga tgaactcgct gagagccgaa gataccgctg tctactactg cgcgaagaga 360
gaagctgccg cagggcacga ttggtacttc gacttgtggg gcaggggcac ccttgtgacc 420
gtgtcctccg gtggaggcgg atcaggaggt gggggatcgg gtggaggagg aagcggaggc 480
ggcggttcgg acattcgcgt cacccagtca ccgagctccc tcagcgcatc ggtgggcgac 540
cgggtcacta tcacttgccg ggcgtcccag tcgatctcat cgtatctgaa ttggtaccag 600
cagaaaccgg gaaaggcgcc gaagctgttg atctacgctg ccagctccct gcagtcgggt 660
gtgccatcac gcttttccgg ctcgggatcg ggaaccgatt tcactctgac gatctctagc 720
ctgcagccag aagatttcgc cacttactac tgccagcagt cctacagcat ccctctgact 780
ttcggacaag ggacgaaagt ggagattaag accactaccc cagcaccgag gccacccacc 840
ccggctccta ccatcgcctc ccagcctctg tccctgcgtc cggaggcatg tagacccgca 900
gctggtgggg ccgtgcatac ccggggtctt gacttcgcct gcgatatcta catttgggcc 960
cctctggctg gtacttgcgg ggtcctgctg ctttcactcg tgatcactct ttactgtaag 1020
cgcggtcgga agaagctgct gtacatcttt aagcaaccct tcatgaggcc tgtgcagact 1080
actcaagagg aggacggctg ttcatgccgg ttcccagagg aggaggaagg cggctgcgaa 1140
ctgcgcgtga aattcagccg cagcgcagat gctccagcct acaagcaggg gcagaaccag 1200
ctctacaacg aactcaatct tggtcggaga gaggagtacg acgtgctgga caagcggaga 1260
ggacgggacc cagaaatggg cgggaagccg cgcagaaaga atccccaaga gggcctgtac 1320
aacgagctcc aaaaggataa gatggcagaa gcctatagcg agattggtat gaaaggggaa 1380
cgcagaagag gcaaaggcca cgacggactg taccagggac tcagcaccgc caccaaggac 1440
acctatgacg ctcttcacat gcaggccctg ccgcctcgg 1479
<210> 131
<211> 1473
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 131
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtcc aactcgttca gtcatgggca gaagtcaaga aacccggtgc aagcgtcaaa 120
gtgtcgtgta aggcctccgg ctacactttc acttcctact acatgcactg ggtgcgccaa 180
gccccgggac agggccttga atggatgggc atcatcaacc catcaggagg ttccacgagc 240
tacgcgcaga agttccaggg gagagtgacg atgactagag atacctccac gagcaccgtc 300
tacatggagc tgtcgaatct gcggtcagag gacactgctg tgtattactg cgcgcgctcc 360
ccgcgggtga ccactggcta ctttgactac tggggacaag ggaccctggt gaccgtcagc 420
tcgggaggcg gaggatcggg aggtggaggg tccggtggag gcggctctgg aggaggcggg 480
tcggacattc aattgaccca gagcccatcc accctctcag cctcggtggg ggatagggtg 540
actatcactt gccgggcctc ccagtcaatt tccagctggc tggcttggta ccagcaaaag 600
cctggaaagg caccgaagct cctgatctac aaggcctcat ctctggaatc aggagtgcct 660
tcgcgcttca gcggaagcgg ctcgggaact gagtttaccc tgaccatctc gagcctgcag 720
ccagatgact tcgcgaccta ttactgccag cagtactcgt cctacccgtt gactttcgga 780
ggaggtaccc gcctcgaaat caaaaccact accccagcac cgaggccacc caccccggct 840
cctaccatcg cctcccagcc tctgtccctg cgtccggagg catgtagacc cgcagctggt 900
ggggccgtgc atacccgggg tcttgacttc gcctgcgata tctacatttg ggcccctctg 960
gctggtactt gcggggtcct gctgctttca ctcgtgatca ctctttactg taagcgcggt 1020
cggaagaagc tgctgtacat ctttaagcaa cccttcatga ggcctgtgca gactactcaa 1080
gaggaggacg gctgttcatg ccggttccca gaggaggagg aaggcggctg cgaactgcgc 1140
gtgaaattca gccgcagcgc agatgctcca gcctacaagc aggggcagaa ccagctctac 1200
aacgaactca atcttggtcg gagagaggag tacgacgtgc tggacaagcg gagaggacgg 1260
gacccagaaa tgggcgggaa gccgcgcaga aagaatcccc aagagggcct gtacaacgag 1320
ctccaaaagg ataagatggc agaagcctat agcgagattg gtatgaaagg ggaacgcaga 1380
agaggcaaag gccacgacgg actgtaccag ggactcagca ccgccaccaa ggacacctat 1440
gacgctcttc acatgcaggc cctgccgcct cgg 1473
<210> 132
<211> 1491
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 132
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtcc aactcgtcca gtccggtgca gaagtcagaa ggccaggagc aagcgtgaag 120
atctcgtgta gagcgtcagg agacaccagc actcgccatt acatccactg gctgcgccag 180
gctccgggcc aagggccgga gtggatgggt gtgatcaacc cgactacggg accggctacc 240
ggaagccctg cgtacgcaca gatgctgcag ggacgggtga ctatgacccg cgatactagc 300
actaggaccg tgtacatgga actccgctcg ttgcggttcg aagataccgc cgtctactac 360
tgcgcccggt ccgtggtggg ccgaagcgcc ccttactact tcgattactg gggacagggc 420
actctggtga ccgttagctc cggtggggga ggctcgggtg gaggcggatc gggaggagga 480
ggcagcggtg gagggggatc ggacattcag atgacccagt caccctcctc cctctcagcc 540
tcggtcgggg accgggtgac cattacgtgc agagcctcac aagggatctc ggactactcc 600
gcctggtacc agcagaaacc gggaaaagcg ccaaagctcc tgatctacgc cgcgagcacc 660
ctgcaatcag gagtgccatc gcgcttttct ggatcgggct cagggactga cttcacgctg 720
actatctcct accttcagtc cgaggatttc gctacctact actgccaaca gtattactcc 780
tatcccctga cctttggcgg aggcactaag gtggacatca agaccactac cccagcaccg 840
aggccaccca ccccggctcc taccatcgcc tcccagcctc tgtccctgcg tccggaggca 900
tgtagacccg cagctggtgg ggccgtgcat acccggggtc ttgacttcgc ctgcgatatc 960
tacatttggg cccctctggc tggtacttgc ggggtcctgc tgctttcact cgtgatcact 1020
ctttactgta agcgcggtcg gaagaagctg ctgtacatct ttaagcaacc cttcatgagg 1080
cctgtgcaga ctactcaaga ggaggacggc tgttcatgcc ggttcccaga ggaggaggaa 1140
ggcggctgcg aactgcgcgt gaaattcagc cgcagcgcag atgctccagc ctacaagcag 1200
gggcagaacc agctctacaa cgaactcaat cttggtcgga gagaggagta cgacgtgctg 1260
gacaagcgga gaggacggga cccagaaatg ggcgggaagc cgcgcagaaa gaatccccaa 1320
gagggcctgt acaacgagct ccaaaaggat aagatggcag aagcctatag cgagattggt 1380
atgaaagggg aacgcagaag aggcaaaggc cacgacggac tgtaccaggg actcagcacc 1440
gccaccaagg acacctatga cgctcttcac atgcaggccc tgccgcctcg g 1491
<210> 133
<211> 1479
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 133
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtcc aactccagca atcgggagca gaagtcaaga aaccaggcgc atcggtgaaa 120
gtgtcgtgta aggcgtcagg gtacaccttc accaactact atatgcactg ggtgcgccag 180
gctccaggcc aggggttgga gtggatgggg atcatcaatc cgtcaggtgg ctacaccact 240
tacgctcaga agttccaggg acgcctcact atgactcgcg atactagcac ctccacggtg 300
tacatggaac tgtcatcgct gaggtccgaa gataccgccg tctactactg cgcacggatc 360
agatcctgcg gaggagattg ttactacttt gacaactggg gacagggcac ccttgttact 420
gtgtcatcgg gaggaggggg aagcggagga ggtggatcag gcggcggtgg cagcgggggc 480
ggaggatcgg acattcagct gactcagtcc ccctccactt tgtcggccag cgtgggagac 540
agagtgacca tcacttgccg ggcgtccgag aacgtcaata tctggctggc ctggtaccag 600
caaaagcctg gaaaagcccc gaagctgctc atctataagt catccagcct ggcgtctggt 660
gtgccgtcgc ggttctccgg cagcgggagc ggagccgagt tcactctcac catttcgagc 720
cttcaaccgg acgatttcgc cacctactac tgccagcagt accaatccta ccctctgacg 780
tttggaggtg gaaccaaggt ggacatcaag accactaccc cagcaccgag gccacccacc 840
ccggctccta ccatcgcctc ccagcctctg tccctgcgtc cggaggcatg tagacccgca 900
gctggtgggg ccgtgcatac ccggggtctt gacttcgcct gcgatatcta catttgggcc 960
cctctggctg gtacttgcgg ggtcctgctg ctttcactcg tgatcactct ttactgtaag 1020
cgcggtcgga agaagctgct gtacatcttt aagcaaccct tcatgaggcc tgtgcagact 1080
actcaagagg aggacggctg ttcatgccgg ttcccagagg aggaggaagg cggctgcgaa 1140
ctgcgcgtga aattcagccg cagcgcagat gctccagcct acaagcaggg gcagaaccag 1200
ctctacaacg aactcaatct tggtcggaga gaggagtacg acgtgctgga caagcggaga 1260
ggacgggacc cagaaatggg cgggaagccg cgcagaaaga atccccaaga gggcctgtac 1320
aacgagctcc aaaaggataa gatggcagaa gcctatagcg agattggtat gaaaggggaa 1380
cgcagaagag gcaaaggcca cgacggactg taccagggac tcagcaccgc caccaaggac 1440
acctatgacg ctcttcacat gcaggccctg ccgcctcgg 1479
<210> 134
<211> 1470
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 134
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaaatca ctctgaaaga atctggaccg gccctggtta agccgactca aacgctcacc 120
cttacttgca ccttcagcgg attctcactc agcactgctg gtgtgcacgt cggatggatt 180
agacagccgc ctggaaaggc cctggaatgg ctcgccctca tctcctgggc cgatgacaag 240
agatacaggc cctcgcttcg atcccggttg gacattaccc gggtgacctc gaaagatcag 300
gtggtgctct caatgaccaa tatgcagccg gaggacaccg ctacgtacta ctgcgcactg 360
caaggatttg acggctacga ggctaactgg ggaccaggta ctctggtcac cgtgagctcc 420
ggcgggggag gatcaggcgg gggggggtca ggaggcggag gctccggtgg aggaggatcg 480
gatatcgtca tgacccagtc cccaagctcg ctgagcgcgt cagcgggcga ccgcgtgact 540
atcacttgcc gggccagccg cggcatctcc tccgcactgg cgtggtacca gcagaagcct 600
ggaaaaccgc caaagctcct gatctatgat gcctccagcc tggagtcagg tgtccccagc 660
cgcttctcgg gttcgggctc gggaaccgac ttcactttga ccatcgactc gctggaaccg 720
gaagatttcg caacctacta ctgtcagcag tcctactcga ccccttggac ttttggacaa 780
gggacgaagg tggacatcaa gaccactacc ccagcaccga ggccacccac cccggctcct 840
accatcgcct cccagcctct gtccctgcgt ccggaggcat gtagacccgc agctggtggg 900
gccgtgcata cccggggtct tgacttcgcc tgcgatatct acatttgggc ccctctggct 960
ggtacttgcg gggtcctgct gctttcactc gtgatcactc tttactgtaa gcgcggtcgg 1020
aagaagctgc tgtacatctt taagcaaccc ttcatgaggc ctgtgcagac tactcaagag 1080
gaggacggct gttcatgccg gttcccagag gaggaggaag gcggctgcga actgcgcgtg 1140
aaattcagcc gcagcgcaga tgctccagcc tacaagcagg ggcagaacca gctctacaac 1200
gaactcaatc ttggtcggag agaggagtac gacgtgctgg acaagcggag aggacgggac 1260
ccagaaatgg gcgggaagcc gcgcagaaag aatccccaag agggcctgta caacgagctc 1320
caaaaggata agatggcaga agcctatagc gagattggta tgaaagggga acgcagaaga 1380
ggcaaaggcc acgacggact gtaccaggga ctcagcaccg ccaccaagga cacctatgac 1440
gctcttcaca tgcaggccct gccgcctcgg 1470
<210> 135
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 135
Gly Gly Gly Gly Ser
1 5
<210> 136
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 136
Gly Tyr Thr Phe Thr Gly Tyr Tyr Met His
1 5 10
<210> 137
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 137
Gly Phe Thr Phe Ser Ser Tyr Trp Met His
1 5 10
<210> 138
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 138
Gly Tyr Thr Phe Thr Asp Tyr Tyr Met His
1 5 10
<210> 139
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 139
Gly Tyr Thr Phe Thr Ser Tyr Tyr Met His
1 5 10
<210> 140
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 140
Gly Phe Thr Phe Ser Ser Tyr Ala Met His
1 5 10
<210> 141
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 141
Gly Tyr Pro Phe Thr Gly Tyr Ser Leu His
1 5 10
<210> 142
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 142
Gly Tyr Thr Phe Thr Ser Tyr Tyr Met His
1 5 10
<210> 143
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 143
Gly Tyr Thr Phe Thr Ser Tyr Gly Ile Ser
1 5 10
<210> 144
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 144
Gly Tyr Thr Phe Thr Gly Tyr Tyr Met His
1 5 10
<210> 145
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 145
Gly Phe Ile Phe Ser Asp Tyr Tyr Met Gly
1 5 10
<210> 146
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 146
Gly Phe Thr Phe Arg Gly Tyr Tyr Ile His
1 5 10
<210> 147
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 147
Gly Phe Thr Phe Asp Asp Tyr Ala Met His
1 5 10
<210> 148
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 148
Gly Phe Thr Phe Ser Ser Tyr Trp Met His
1 5 10
<210> 149
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 149
Gly Phe Thr Phe Ser Ser Tyr Gly Met His
1 5 10
<210> 150
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 150
Gly Phe Thr Phe Ser Ser Tyr Ala Met Ser
1 5 10
<210> 151
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 151
Gly Tyr Thr Phe Thr Ser Tyr Tyr Met His
1 5 10
<210> 152
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 152
Gly Asp Thr Ser Thr Arg His Tyr Ile His
1 5 10
<210> 153
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 153
Gly Tyr Thr Phe Thr Asn Tyr Tyr Met His
1 5 10
<210> 154
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 154
Gly Phe Ser Leu Ser Thr Ala Gly Val His Val Gly
1 5 10
<210> 155
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 155
Arg Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 156
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 156
Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 157
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 157
Arg Ile Asn Thr Asp Gly Ser Thr Thr Thr Tyr Ala Asp Ser Val Glu
1 5 10 15
Gly
<210> 158
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 158
Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe Gln
1 5 10 15
<210> 159
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 159
Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 160
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 160
Ile Ile Asn Pro Ser Gly Gly Ser Thr Gly Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 161
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 161
Trp Ile Ser Ala Tyr Asn Gly Asn Thr Asn Tyr Ala Gln Lys Leu Gln
1 5 10 15
<210> 162
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 162
Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Asn Phe Gln
1 5 10 15
Gly
<210> 163
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 163
Arg Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 164
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 164
Tyr Ile Gly Arg Ser Gly Ser Ser Met Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 165
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 165
Ile Ile Asn Pro Ser Gly Gly Ser Arg Ala Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 166
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 166
Gly Ile Ser Trp Asn Ser Gly Ser Ile Gly Tyr Ala Asp Ser Val Lys
1 5 10 15
<210> 167
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 167
Gly Ile Ser Trp Asn Ser Gly Ser Thr Gly Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 168
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 168
Arg Ile Asn Ser Asp Gly Ser Ser Thr Ser Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 169
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 169
Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 170
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 170
Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 171
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 171
Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 172
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 172
Val Ile Asn Pro Thr Thr Gly Pro Ala Thr Gly Ser Pro Ala Tyr Ala
1 5 10 15
Gln Met Leu Gln Gly
20
<210> 173
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 173
Ile Ile Asn Pro Ser Gly Gly Tyr Thr Thr Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 174
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 174
Leu Ile Ser Trp Ala Asp Asp Lys Arg Tyr Arg Pro Ser Leu Arg Ser
1 5 10 15
<210> 175
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 175
Gly Arg Tyr Tyr Gly Met Asp Val
1 5
<210> 176
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 176
Asp Leu Arg Arg Thr Val Val Thr Pro Arg Ala Tyr Tyr Gly Met Asp
1 5 10 15
Val
<210> 177
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 177
Gly Glu Trp Asp Gly Ser Tyr Tyr Tyr Asp Tyr
1 5 10
<210> 178
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 178
Gly His Trp Ala Val
1 5
<210> 179
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 179
Gly Trp Asp Phe Asp Tyr
1 5
<210> 180
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 180
Tyr Arg Leu Ile Ala Val Ala Gly Asp Tyr Tyr Tyr Tyr Gly Met Asp
1 5 10 15
Val
<210> 181
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 181
Trp Lys Val Ser Ser Ser Ser Pro Ala Phe Asp Tyr
1 5 10
<210> 182
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 182
Asp His Tyr Gly Gly Asn Ser Leu Phe Tyr
1 5 10
<210> 183
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 183
Gly Gly Tyr Ser Ser Ser Ser Asp Ala Phe Asp Ile
1 5 10
<210> 184
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 184
Val Ala Gly Gly Ile Tyr Tyr Tyr Tyr Gly Met Asp Val
1 5 10
<210> 185
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 185
Gly Trp Asp Phe Asp Tyr
1 5
<210> 186
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 186
Thr Thr Thr Ser Tyr Ala Phe Asp Ile
1 5
<210> 187
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 187
Ser Pro Val Val Ala Ala Thr Glu Asp Phe Gln His
1 5 10
<210> 188
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 188
Thr Ala Ser Cys Gly Gly Asp Cys Tyr Tyr Leu Asp Tyr
1 5 10
<210> 189
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 189
Asp Gly Ser Ser Ser Trp Ser Trp Gly Tyr Phe Asp Tyr
1 5 10
<210> 190
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 190
Asp Ser Ser Ser Trp Tyr Gly Gly Gly Ser Ala Phe Asp Ile
1 5 10
<210> 191
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 191
Asp Ser Ser Ser Trp Tyr Gly Gly Gly Ser Ala Phe Asp Ile
1 5 10
<210> 192
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 192
Thr Gly Trp Val Gly Ser Tyr Tyr Tyr Tyr Met Asp Val
1 5 10
<210> 193
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 193
Gly Tyr Ser Arg Tyr Tyr Tyr Tyr Gly Met Asp Val
1 5 10
<210> 194
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 194
Arg Glu Ala Ala Ala Gly His Asp Trp Tyr Phe Asp Leu
1 5 10
<210> 195
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 195
Ser Pro Arg Val Thr Thr Gly Tyr Phe Asp Tyr
1 5 10
<210> 196
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 196
Ser Val Val Gly Arg Ser Ala Pro Tyr Tyr Phe Asp Tyr
1 5 10
<210> 197
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 197
Ile Arg Ser Cys Gly Gly Asp Cys Tyr Tyr Phe Asp Asn
1 5 10
<210> 198
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 198
Gln Gly Phe Asp Gly Tyr Glu Ala Asn
1 5
<210> 199
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 199
Arg Ala Ser Gln Ser Val Ser Ser Asn Phe Ala
1 5 10
<210> 200
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 200
Gln Ala Ser Gln Asp Ile Ser Asn Ser Leu Asn
1 5 10
<210> 201
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 201
Arg Ala Ser Gln Ser Ile Asn Thr Tyr Leu Asn
1 5 10
<210> 202
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 202
Arg Ala Ser Gln Ser Ile Ser Asp Arg Leu Ala
1 5 10
<210> 203
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 203
Arg Ala Ser Gln Ser Ile Arg Tyr Tyr Leu Ser
1 5 10
<210> 204
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 204
Arg Ala Ser Gln Gly Val Gly Arg Trp Leu Ala
1 5 10
<210> 205
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 205
Arg Ala Ser Gln Ser Val Tyr Thr Lys Tyr Leu Gly
1 5 10
<210> 206
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 206
Arg Ala Ser Gln Asp Ser Gly Thr Trp Leu Ala
1 5 10
<210> 207
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 207
Arg Ala Ser Gln Asp Ile Ser Ser Ala Leu Ala
1 5 10
<210> 208
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 208
Lys Ser Ser His Ser Val Leu Tyr Asn Arg Asn Asn Lys Asn Tyr Leu
1 5 10 15
Ala
<210> 209
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 209
Arg Ala Ser Gln Ser Ile Arg Tyr Tyr Leu Ser
1 5 10
<210> 210
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 210
Arg Ala Ser Gln Ser Ile Ser Thr Trp Leu Ala
1 5 10
<210> 211
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 211
Arg Ala Ser Gln Ser Val Thr Ser Asn Tyr Leu Ala
1 5 10
<210> 212
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 212
Arg Ala Ser Glu Asn Val Asn Ile Trp Leu Ala
1 5 10
<210> 213
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 213
Gln Gly Asp Ala Leu Arg Ser Tyr Tyr Ala Ser
1 5 10
<210> 214
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 214
Gln Gly Asp Ser Leu Arg Ser Tyr Tyr Ala Ser
1 5 10
<210> 215
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 215
Gln Gly Asp Ser Leu Arg Ser Tyr Tyr Ala Ser
1 5 10
<210> 216
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 216
Arg Ala Ser Gln Ser Val Ser Ser Asn Tyr Leu Ala
1 5 10
<210> 217
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 217
Arg Ala Ser Gln Ser Val Tyr Thr Lys Tyr Leu Gly
1 5 10
<210> 218
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 218
Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn
1 5 10
<210> 219
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 219
Arg Ala Ser Gln Ser Ile Ser Ser Trp Leu Ala
1 5 10
<210> 220
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 220
Arg Ala Ser Gln Gly Ile Ser Asp Tyr Ser
1 5 10
<210> 221
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Description of Искусственная последовательность: Synthetic
peptide
<400> 221
Arg Ala Ser Glu Asn Val Asn Ile Trp Leu Ala
1 5 10
<210> 222
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 222
Arg Ala Ser Arg Gly Ile Ser Ser Ala Leu Ala
1 5 10
<210> 223
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 223
Asp Ala Ser Asn Arg Ala Thr
1 5
<210> 224
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 224
Asp Ala Ser Thr Leu Glu Thr
1 5
<210> 225
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 225
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 226
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 226
Lys Ala Ser Ser Leu Glu
1 5
<210> 227
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 227
Thr Ala Ser Ile Leu Gln Asn
1 5
<210> 228
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 228
Ala Ala Ser Thr Leu Gln Ser
1 5
<210> 229
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 229
Asp Ala Ser Thr Arg Ala Thr
1 5
<210> 230
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 230
Asp Ala Ser Thr Leu Glu Asp
1 5
<210> 231
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 231
Asp Ala Ser Ser Leu Glu Ser
1 5
<210> 232
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 232
Trp Ala Ser Thr Arg Lys Ser
1 5
<210> 233
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 233
Thr Ala Ser Ile Leu Gln Asn
1 5
<210> 234
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 234
Lys Ala Ser Thr Leu Glu Ser
1 5
<210> 235
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 235
Gly Ala Ser Thr Arg Ala Thr
1 5
<210> 236
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 236
Lys Ser Ser Ser Leu Ala Ser
1 5
<210> 237
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 237
Gly Lys Asn Asn Arg Pro Ser
1 5
<210> 238
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 238
Gly Arg Ser Arg Arg Pro Ser
1 5
<210> 239
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 239
Gly Lys Asn Asn Arg Pro Ser
1 5
<210> 240
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 240
Asp Val Ser Thr Arg Ala Thr
1 5
<210> 241
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 241
Asp Ala Ser Thr Arg Ala Thr
1 5
<210> 242
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 242
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 243
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 243
Lys Ala Ser Ser Leu Glu Ser
1 5
<210> 244
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 244
Ala Ala Ser Thr Leu Gln Ser
1 5
<210> 245
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 245
Lys Ser Ser Ser Leu Ala Ser
1 5
<210> 246
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 246
Asp Ala Ser Ser Leu Glu Ser
1 5
<210> 247
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 247
His Gln Arg Ser Asn Trp Leu Tyr Thr
1 5
<210> 248
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 248
Gln Gln His Asp Asn Leu Pro Leu Thr
1 5
<210> 249
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 249
Gln Gln Ser Phe Ser Pro Leu Thr
1 5
<210> 250
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 250
Gln Gln Tyr Gly His Leu Pro Met Tyr Thr
1 5 10
<210> 251
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 251
Leu Gln Thr Tyr Thr Thr Pro Asp
1 5
<210> 252
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 252
Gln Gln Ala Asn Ser Phe Pro Leu Thr
1 5
<210> 253
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 253
Gln His Tyr Gly Gly Ser Pro Leu Ile Thr
1 5 10
<210> 254
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 254
Gln Gln Tyr Asn Ser Tyr Pro Leu Thr
1 5
<210> 255
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 255
Gln Gln Phe Ser Ser Tyr Pro Leu Thr
1 5
<210> 256
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 256
Gln Gln Thr Gln Thr Phe Pro Leu Thr
1 5
<210> 257
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 257
Leu Gln Thr Tyr Thr Thr Pro Asp
1 5
<210> 258
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 258
Gln Gln Tyr Asn Thr Tyr Ser Pro Tyr Thr
1 5 10
<210> 259
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 259
Gln Gln Tyr Gly Ser Ala Pro Val Thr
1 5
<210> 260
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 260
Gln Gln Tyr Gln Ser Tyr Pro Leu Thr
1 5
<210> 261
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 261
Asn Ser Arg Asp Ser Ser Gly Tyr Pro Val
1 5 10
<210> 262
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 262
Asn Ser Arg Asp Asn Thr Ala Asn His Tyr Val
1 5 10
<210> 263
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 263
Asn Ser Arg Gly Ser Ser Gly Asn His Tyr Val
1 5 10
<210> 264
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 264
Gln Gln Arg Ser Asn Trp Pro Pro Trp Thr
1 5 10
<210> 265
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 265
Gln His Tyr Gly Gly Ser Pro Leu Ile Thr
1 5 10
<210> 266
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 266
Gln Gln Ser Tyr Ser Ile Pro Leu Thr
1 5
<210> 267
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 267
Gln Gln Tyr Ser Ser Tyr Pro Leu Thr
1 5
<210> 268
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 268
Gln Gln Tyr Tyr Ser Tyr Pro Leu Thr
1 5
<210> 269
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 269
Gln Gln Tyr Gln Ser Tyr Pro Leu Thr
1 5
<210> 270
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 270
Gln Gln Ser Tyr Ser Thr Pro Trp Thr
1 5
<210> 271
<211> 150
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 271
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 60
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 150
<210> 272
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 272
Arg Gly Asp Ser
1
<210> 273
<211> 64
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический олигонуклеотид
<400> 273
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 60
aaaa 64
<210> 274
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 274
Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 275
<211> 239
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 275
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Glu Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Gly Tyr
20 25 30
Thr Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Leu Ile Thr Pro Tyr Asn Gly Ala Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Asp Leu Leu Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Gly Gly Tyr Asp Gly Arg Gly Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Asp Ile Glu Leu Thr Gln Ser Pro Ala Ile
130 135 140
Met Ser Ala Ser Pro Gly Glu Lys Val Thr Met Thr Cys Ser Ala Ser
145 150 155 160
Ser Ser Val Ser Tyr Met His Trp Tyr Gln Gln Lys Ser Gly Thr Ser
165 170 175
Pro Lys Arg Trp Ile Tyr Asp Thr Ser Lys Leu Ala Ser Gly Val Pro
180 185 190
Gly Arg Phe Ser Gly Ser Gly Ser Gly Asn Ser Tyr Ser Leu Thr Ile
195 200 205
Ser Ser Val Glu Ala Glu Asp Asp Ala Thr Tyr Tyr Cys Gln Gln Trp
210 215 220
Ser Gly Tyr Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Ile
225 230 235
<210> 276
<211> 324
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 276
Asp Ala Ala Gln Pro Ala Ala Ser Glu Val Glu Lys Thr Ala Cys Pro
1 5 10 15
Ser Gly Lys Lys Ala Arg Glu Ile Asp Glu Ser Leu Ile Phe Tyr Lys
20 25 30
Lys Trp Glu Leu Glu Ala Cys Val Asp Ala Ala Leu Leu Ala Thr Gln
35 40 45
Met Asp Arg Val Asn Ala Ile Pro Phe Thr Tyr Glu Gln Leu Asp Val
50 55 60
Leu Lys His Lys Leu Asp Glu Leu Tyr Pro Gln Gly Tyr Pro Glu Ser
65 70 75 80
Val Ile Gln His Leu Gly Tyr Leu Phe Leu Lys Met Ser Pro Glu Asp
85 90 95
Ile Arg Lys Trp Asn Val Thr Ser Leu Glu Thr Leu Lys Ala Leu Leu
100 105 110
Glu Val Asn Lys Gly His Glu Met Ser Pro Gln Val Ala Thr Leu Ile
115 120 125
Asp Arg Phe Val Lys Gly Arg Gly Gln Leu Asp Lys Asp Thr Leu Asp
130 135 140
Thr Leu Thr Ala Phe Tyr Pro Gly Tyr Leu Cys Ser Leu Ser Pro Glu
145 150 155 160
Glu Leu Ser Ser Val Pro Pro Ser Ser Ile Trp Ala Val Arg Pro Gln
165 170 175
Asp Leu Asp Thr Cys Asp Pro Arg Gln Leu Asp Val Leu Tyr Pro Lys
180 185 190
Ala Arg Leu Ala Phe Gln Asn Met Asn Gly Ser Glu Tyr Phe Val Lys
195 200 205
Ile Gln Ser Phe Leu Gly Gly Ala Pro Thr Glu Asp Leu Lys Ala Leu
210 215 220
Ser Gln Gln Asn Val Ser Met Asp Leu Ala Thr Phe Met Lys Leu Arg
225 230 235 240
Thr Asp Ala Val Leu Pro Leu Thr Val Ala Glu Val Gln Lys Leu Leu
245 250 255
Gly Pro His Val Glu Gly Leu Lys Ala Glu Glu Arg His Arg Pro Val
260 265 270
Arg Asp Trp Ile Leu Arg Gln Arg Gln Asp Asp Leu Asp Thr Leu Gly
275 280 285
Leu Gly Leu Gln Gly Thr Arg Gly Ser His His His His His His Glu
290 295 300
Phe Arg His Asp Ser Gly Leu Asn Asp Ile Phe Glu Ala Gln Lys Ile
305 310 315 320
Glu Trp His Glu
<210> 277
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 277
Gly Ser His His His His His His His His
1 5 10
<210> 278
<211> 293
<212> БЕЛОК
<213> Homo sapiens
<400> 278
Glu Val Glu Lys Thr Ala Cys Pro Ser Gly Lys Lys Ala Arg Glu Ile
1 5 10 15
Asp Glu Ser Leu Ile Phe Tyr Lys Lys Trp Glu Leu Glu Ala Cys Val
20 25 30
Asp Ala Ala Leu Leu Ala Thr Gln Met Asp Arg Val Asn Ala Ile Pro
35 40 45
Phe Thr Tyr Glu Gln Leu Asp Val Leu Lys His Lys Leu Asp Glu Leu
50 55 60
Tyr Pro Gln Gly Tyr Pro Glu Ser Val Ile Gln His Leu Gly Tyr Leu
65 70 75 80
Phe Leu Lys Met Ser Pro Glu Asp Ile Arg Lys Trp Asn Val Thr Ser
85 90 95
Leu Glu Thr Leu Lys Ala Leu Leu Glu Val Asn Lys Gly His Glu Met
100 105 110
Ser Pro Gln Ala Pro Arg Arg Pro Leu Pro Gln Val Ala Thr Leu Ile
115 120 125
Asp Arg Phe Val Lys Gly Arg Gly Gln Leu Asp Lys Asp Thr Leu Asp
130 135 140
Thr Leu Thr Ala Phe Tyr Pro Gly Tyr Leu Cys Ser Leu Ser Pro Glu
145 150 155 160
Glu Leu Ser Ser Val Pro Pro Ser Ser Ile Trp Ala Val Arg Pro Gln
165 170 175
Asp Leu Asp Thr Cys Asp Pro Arg Gln Leu Asp Val Leu Tyr Pro Lys
180 185 190
Ala Arg Leu Ala Phe Gln Asn Met Asn Gly Ser Glu Tyr Phe Val Lys
195 200 205
Ile Gln Ser Phe Leu Gly Gly Ala Pro Thr Glu Asp Leu Lys Ala Leu
210 215 220
Ser Gln Gln Asn Val Ser Met Asp Leu Ala Thr Phe Met Lys Leu Arg
225 230 235 240
Thr Asp Ala Val Leu Pro Leu Thr Val Ala Glu Val Gln Lys Leu Leu
245 250 255
Gly Pro His Val Glu Gly Leu Lys Ala Glu Glu Arg His Arg Pro Val
260 265 270
Arg Asp Trp Ile Leu Arg Gln Arg Gln Asp Asp Leu Asp Thr Leu Gly
275 280 285
Leu Gly Leu Gln Gly
290
<210> 279
<211> 239
<212> БЕЛОК
<213> Mus musculus
<400> 279
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Glu Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Gly Tyr
20 25 30
Thr Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Leu Ile Thr Pro Tyr Asn Gly Ala Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Asp Leu Leu Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Gly Gly Tyr Asp Gly Arg Gly Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Asp Ile Glu Leu Thr Gln Ser Pro Ala Ile
130 135 140
Met Ser Ala Ser Pro Gly Glu Lys Val Thr Met Thr Cys Ser Ala Ser
145 150 155 160
Ser Ser Val Ser Tyr Met His Trp Tyr Gln Gln Lys Ser Gly Thr Ser
165 170 175
Pro Lys Arg Trp Ile Tyr Asp Thr Ser Lys Leu Ala Ser Gly Val Pro
180 185 190
Gly Arg Phe Ser Gly Ser Gly Ser Gly Asn Ser Tyr Ser Leu Thr Ile
195 200 205
Ser Ser Val Glu Ala Glu Asp Asp Ala Thr Tyr Tyr Cys Gln Gln Trp
210 215 220
Ser Gly Tyr Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Ile
225 230 235
<210> 280
<211> 19
<212> ДНК
<213> Mus musculus
<400> 280
ggaggtccct caccttcta 19
<210> 281
<211> 19
<212> ДНК
<213> Mus musculus
<400> 281
cggaggatct tatgctgaa 19
<210> 282
<211> 19
<212> ДНК
<213> Mus musculus
<400> 282
cccgcttcca gatcataca 19
<210> 283
<211> 19
<212> ДНК
<213> Mus musculus
<400> 283
ggagacctca acaagatat 19
<210> 284
<211> 19
<212> ДНК
<213> Mus musculus
<400> 284
aaggcatggt cattggtat 19
<210> 285
<211> 19
<212> ДНК
<213> Mus musculus
<400> 285
gcatggtcat tggtatcat 19
<210> 286
<211> 19
<212> ДНК
<213> Mus musculus
<400> 286
ggtcattggt atcatgagt 19
<210> 287
<211> 19
<212> ДНК
<213> Mus musculus
<400> 287
cctagtgggt atccctgta 19
<210> 288
<211> 19
<212> ДНК
<213> Mus musculus
<400> 288
gaggatggac attgttctt 19
<210> 289
<211> 19
<212> ДНК
<213> Mus musculus
<400> 289
gcatgcaggc tacagttca 19
<210> 290
<211> 19
<212> ДНК
<213> Mus musculus
<400> 290
ccagcacatg cactgttga 19
<210> 291
<211> 19
<212> ДНК
<213> Mus musculus
<400> 291
cacatgcact gttgagtga 19
<210> 292
<211> 21
<212> ДНК
<213> Mus musculus
<400> 292
ctggaggtcc ctcaccttct a 21
<210> 293
<211> 21
<212> ДНК
<213> Mus musculus
<400> 293
gtcggaggat cttatgctga a 21
<210> 294
<211> 21
<212> ДНК
<213> Mus musculus
<400> 294
tgcccgcttc cagatcatac a 21
<210> 295
<211> 21
<212> ДНК
<213> Mus musculus
<400> 295
ctggagacct caacaagata t 21
<210> 296
<211> 21
<212> ДНК
<213> Mus musculus
<400> 296
tcaaggcatg gtcattggta t 21
<210> 297
<211> 21
<212> ДНК
<213> Mus musculus
<400> 297
aggcatggtc attggtatca t 21
<210> 298
<211> 21
<212> ДНК
<213> Mus musculus
<400> 298
atggtcattg gtatcatgag t 21
<210> 299
<211> 21
<212> ДНК
<213> Mus musculus
<400> 299
gccctagtgg gtatccctgt a 21
<210> 300
<211> 21
<212> ДНК
<213> Mus musculus
<400> 300
atgaggatgg acattgttct t 21
<210> 301
<211> 21
<212> ДНК
<213> Mus musculus
<400> 301
gagcatgcag gctacagttc a 21
<210> 302
<211> 21
<212> ДНК
<213> Mus musculus
<400> 302
ttccagcaca tgcactgttg a 21
<210> 303
<211> 21
<212> ДНК
<213> Mus musculus
<400> 303
agcacatgca ctgttgagtg a 21
<210> 304
<211> 21
<212> ДНК
<213> Mus musculus
<400> 304
tagaaggtga gggacctcca g 21
<210> 305
<211> 21
<212> ДНК
<213> Mus musculus
<400> 305
ttcagcataa gatcctccga c 21
<210> 306
<211> 21
<212> ДНК
<213> Mus musculus
<400> 306
tgtatgatct ggaagcgggc a 21
<210> 307
<211> 21
<212> ДНК
<213> Mus musculus
<400> 307
atatcttgtt gaggtctcca g 21
<210> 308
<211> 21
<212> ДНК
<213> Mus musculus
<400> 308
ataccaatga ccatgccttg a 21
<210> 309
<211> 21
<212> ДНК
<213> Mus musculus
<400> 309
atgataccaa tgaccatgcc t 21
<210> 310
<211> 21
<212> ДНК
<213> Mus musculus
<400> 310
atggtcattg gtatcatgag t 21
<210> 311
<211> 21
<212> ДНК
<213> Mus musculus
<400> 311
gccctagtgg gtatccctgt a 21
<210> 312
<211> 21
<212> ДНК
<213> Mus musculus
<400> 312
atgaggatgg acattgttct t 21
<210> 313
<211> 21
<212> ДНК
<213> Mus musculus
<400> 313
gagcatgcag gctacagttc a 21
<210> 314
<211> 21
<212> ДНК
<213> Mus musculus
<400> 314
ttccagcaca tgcactgttg a 21
<210> 315
<211> 21
<212> ДНК
<213> Mus musculus
<400> 315
agcacatgca ctgttgagtg a 21
<210> 316
<211> 19
<212> ДНК
<213> Mus musculus
<400> 316
tagaaggtga gggacctcc 19
<210> 317
<211> 19
<212> ДНК
<213> Mus musculus
<400> 317
ttcagcataa gatcctccg 19
<210> 318
<211> 19
<212> ДНК
<213> Mus musculus
<400> 318
tgtatgatct ggaagcggg 19
<210> 319
<211> 19
<212> ДНК
<213> Mus musculus
<400> 319
atatcttgtt gaggtctcc 19
<210> 320
<211> 19
<212> ДНК
<213> Mus musculus
<400> 320
ataccaatga ccatgcctt 19
<210> 321
<211> 19
<212> ДНК
<213> Mus musculus
<400> 321
atgataccaa tgaccatgc 19
<210> 322
<211> 19
<212> ДНК
<213> Mus musculus
<400> 322
atggtcattg gtatcatga 19
<210> 323
<211> 19
<212> ДНК
<213> Mus musculus
<400> 323
gccctagtgg gtatccctg 19
<210> 324
<211> 19
<212> ДНК
<213> Mus musculus
<400> 324
atgaggatgg acattgttc 19
<210> 325
<211> 19
<212> ДНК
<213> Mus musculus
<400> 325
gagcatgcag gctacagtt 19
<210> 326
<211> 19
<212> ДНК
<213> Mus musculus
<400> 326
ttccagcaca tgcactgtt 19
<210> 327
<211> 19
<212> ДНК
<213> Mus musculus
<400> 327
agcacatgca ctgttgagt 19
<210> 328
<211> 19
<212> ДНК
<213> Homo sapiens
<400> 328
ggccaggatg gttcttaga 19
<210> 329
<211> 19
<212> ДНК
<213> Homo sapiens
<400> 329
gcttcgtgct aaactggta 19
<210> 330
<211> 19
<212> ДНК
<213> Homo sapiens
<400> 330
gggcgtgact tccacatga 19
<210> 331
<211> 19
<212> ДНК
<213> Homo sapiens
<400> 331
caggcctaga gaagtttca 19
<210> 332
<211> 19
<212> ДНК
<213> Homo sapiens
<400> 332
cttggaaccc attcctgaa 19
<210> 333
<211> 19
<212> ДНК
<213> Homo sapiens
<400> 333
ggaacccatt cctgaaatt 19
<210> 334
<211> 19
<212> ДНК
<213> Homo sapiens
<400> 334
gaacccattc ctgaaatta 19
<210> 335
<211> 19
<212> ДНК
<213> Homo sapiens
<400> 335
aacccattcc tgaaattat 19
<210> 336
<211> 19
<212> ДНК
<213> Homo sapiens
<400> 336
acccattcct gaaattatt 19
<210> 337
<211> 19
<212> ДНК
<213> Homo sapiens
<400> 337
cccattcctg aaattattt 19
<210> 338
<211> 19
<212> ДНК
<213> Homo sapiens
<400> 338
ctgtggttct attatatta 19
<210> 339
<211> 19
<212> ДНК
<213> Homo sapiens
<400> 339
aaatatgaga gcatgctaa 19
<210> 340
<211> 19
<212> ДНК
<213> Homo sapiens
<400> 340
tctaagaacc atcctggcc 19
<210> 341
<211> 19
<212> ДНК
<213> Homo sapiens
<400> 341
taccagttta gcacgaagc 19
<210> 342
<211> 19
<212> ДНК
<213> Homo sapiens
<400> 342
tcatgtggaa gtcacgccc 19
<210> 343
<211> 19
<212> ДНК
<213> Homo sapiens
<400> 343
tgaaacttct ctaggcctg 19
<210> 344
<211> 19
<212> ДНК
<213> Homo sapiens
<400> 344
ttcaggaatg ggttccaag 19
<210> 345
<211> 19
<212> ДНК
<213> Homo sapiens
<400> 345
aatttcagga atgggttcc 19
<210> 346
<211> 19
<212> ДНК
<213> Homo sapiens
<400> 346
taatttcagg aatgggttc 19
<210> 347
<211> 19
<212> ДНК
<213> Homo sapiens
<400> 347
ataatttcag gaatgggtt 19
<210> 348
<211> 19
<212> ДНК
<213> Homo sapiens
<400> 348
aataatttca ggaatgggt 19
<210> 349
<211> 19
<212> ДНК
<213> Homo sapiens
<400> 349
aaataatttc aggaatggg 19
<210> 350
<211> 19
<212> ДНК
<213> Homo sapiens
<400> 350
taatataata gaaccacag 19
<210> 351
<211> 19
<212> ДНК
<213> Homo sapiens
<400> 351
ttagcatgct ctcatattt 19
<210> 352
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 352
gcggccagga tggttcttag a 21
<210> 353
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 353
gagcttcgtg ctaaactggt a 21
<210> 354
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 354
acgggcgtga cttccacatg a 21
<210> 355
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 355
tgcaggccta gagaagtttc a 21
<210> 356
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 356
tccttggaac ccattcctga a 21
<210> 357
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 357
ttggaaccca ttcctgaaat t 21
<210> 358
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 358
tggaacccat tcctgaaatt a 21
<210> 359
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 359
ggaacccatt cctgaaatta t 21
<210> 360
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 360
gaacccattc ctgaaattat t 21
<210> 361
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 361
aacccattcc tgaaattatt t 21
<210> 362
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 362
ccctgtggtt ctattatatt a 21
<210> 363
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 363
ttaaatatga gagcatgcta a 21
<210> 364
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 364
tctaagaacc atcctggccg c 21
<210> 365
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 365
taccagttta gcacgaagct c 21
<210> 366
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 366
tcatgtggaa gtcacgcccg t 21
<210> 367
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 367
tgaaacttct ctaggcctgc a 21
<210> 368
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 368
ttcaggaatg ggttccaagg a 21
<210> 369
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 369
aatttcagga atgggttcca a 21
<210> 370
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 370
taatttcagg aatgggttcc a 21
<210> 371
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 371
ataatttcag gaatgggttc c 21
<210> 372
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 372
aataatttca ggaatgggtt c 21
<210> 373
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 373
aaataatttc aggaatgggt t 21
<210> 374
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 374
taatataata gaaccacagg g 21
<210> 375
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 375
ttagcatgct ctcatattta a 21
<210> 376
<211> 29
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 376
Met Glu Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Val Pro
1 5 10 15
Gly Ser Thr Gly Asp Ala Ala Gln Pro Ala Ala Ser Glu
20 25
<210> 377
<211> 33
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 377
Thr Arg Gly Ser Gly Lys Pro Ile Pro Asn Pro Leu Leu Gly Leu Asp
1 5 10 15
Ser Thr Arg Thr Gly His His His His His His His His His His His
20 25 30
His
<210> 378
<211> 346
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 378
Met Glu Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Val Pro
1 5 10 15
Gly Ser Thr Gly Asp Ala Ala Gln Pro Ala Ala Ser Glu Val Glu Lys
20 25 30
Thr Ala Cys Pro Ser Gly Lys Lys Ala Arg Glu Ile Asp Glu Ser Leu
35 40 45
Ile Phe Tyr Lys Lys Trp Glu Leu Glu Ala Cys Val Asp Ala Ala Leu
50 55 60
Leu Ala Thr Gln Met Asp Arg Val Asn Ala Ile Pro Phe Thr Tyr Glu
65 70 75 80
Gln Leu Asp Val Leu Lys His Lys Leu Asp Glu Leu Tyr Pro Gln Gly
85 90 95
Tyr Pro Glu Ser Val Ile Gln His Leu Gly Tyr Leu Phe Leu Lys Met
100 105 110
Ser Pro Glu Asp Ile Arg Lys Trp Gln Val Thr Ser Leu Glu Thr Leu
115 120 125
Lys Ala Leu Leu Glu Val Asn Lys Gly His Glu Met Ser Pro Gln Val
130 135 140
Ala Thr Leu Ile Asp Arg Phe Val Lys Gly Arg Gly Gln Leu Asp Lys
145 150 155 160
Asp Thr Leu Asp Thr Leu Thr Ala Phe Tyr Pro Gly Tyr Leu Cys Ser
165 170 175
Leu Ser Pro Glu Glu Leu Ser Ser Val Pro Pro Ser Ser Ile Trp Ala
180 185 190
Val Arg Pro Gln Asp Leu Asp Thr Cys Asp Pro Arg Gln Leu Asp Val
195 200 205
Leu Tyr Pro Lys Ala Arg Leu Ala Phe Gln Asn Met Gln Gly Ser Glu
210 215 220
Tyr Phe Val Lys Ile Gln Ser Phe Leu Gly Gly Ala Pro Thr Glu Asp
225 230 235 240
Leu Lys Ala Leu Ser Gln Gln Gln Val Ser Met Asp Leu Ala Thr Phe
245 250 255
Met Lys Leu Arg Thr Asp Ala Val Leu Pro Leu Thr Val Ala Glu Val
260 265 270
Gln Lys Leu Leu Gly Pro His Val Glu Gly Leu Lys Ala Glu Glu Arg
275 280 285
His Arg Pro Val Arg Asp Trp Ile Leu Arg Gln Arg Gln Asp Asp Leu
290 295 300
Asp Thr Leu Gly Leu Gly Leu Gln Gly Thr Arg Gly Ser Gly Lys Pro
305 310 315 320
Ile Pro Asn Pro Leu Leu Gly Leu Asp Ser Thr Arg Thr Gly His His
325 330 335
His His His His His His His His His His
340 345
<210> 379
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 379
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro
20
<210> 380
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 380
Gly Ser His His His His His His His His
1 5 10
<210> 381
<211> 272
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 381
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Glu Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Asp Tyr Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn
65 70 75 80
Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser
85 90 95
Ile Ser Thr Ala Tyr Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Ser Gly Trp Asp Phe Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Val Met
145 150 155 160
Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr
165 170 175
Ile Thr Cys Arg Ala Ser Gln Ser Ile Arg Tyr Tyr Leu Ser Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Thr Ala Ser
195 200 205
Ile Leu Gln Asn Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala
225 230 235 240
Thr Tyr Tyr Cys Leu Gln Thr Tyr Thr Thr Pro Asp Phe Gly Pro Gly
245 250 255
Thr Lys Val Glu Ile Lys Gly Ser His His His His His His His His
260 265 270
<210> 382
<211> 132
<212> БЕЛОК
<213> Homo sapiens
<400> 382
Asp Val Pro Asp Tyr Ala Ser Leu Gly Gly Pro Ser Ser Pro Lys Lys
1 5 10 15
Lys Arg Lys Val Ser Arg Gly Val Gln Val Glu Thr Ile Ser Pro Gly
20 25 30
Asp Gly Arg Thr Phe Pro Lys Arg Gly Gln Thr Cys Val Val His Tyr
35 40 45
Thr Gly Met Leu Glu Asp Gly Lys Lys Phe Asp Ser Ser Arg Asp Arg
50 55 60
Asn Lys Pro Phe Lys Phe Met Leu Gly Lys Gln Glu Val Ile Arg Gly
65 70 75 80
Trp Glu Glu Gly Val Ala Gln Met Ser Val Gly Gln Arg Ala Lys Leu
85 90 95
Thr Ile Ser Pro Asp Tyr Ala Tyr Gly Ala Thr Gly His Pro Gly Ile
100 105 110
Ile Pro Pro His Ala Thr Leu Val Phe Asp Val Glu Leu Leu Lys Leu
115 120 125
Glu Thr Ser Tyr
130
<210> 383
<211> 108
<212> БЕЛОК
<213> Homo sapiens
<400> 383
Val Gln Val Glu Thr Ile Ser Pro Gly Asp Gly Arg Thr Phe Pro Lys
1 5 10 15
Arg Gly Gln Thr Cys Val Val His Tyr Thr Gly Met Leu Glu Asp Gly
20 25 30
Lys Lys Phe Asp Ser Ser Arg Asp Arg Asn Lys Pro Phe Lys Phe Met
35 40 45
Leu Gly Lys Gln Glu Val Ile Arg Gly Trp Glu Glu Gly Val Ala Gln
50 55 60
Met Ser Val Gly Gln Arg Ala Lys Leu Thr Ile Ser Pro Asp Tyr Ala
65 70 75 80
Tyr Gly Ala Thr Gly His Pro Gly Ile Ile Pro Pro His Ala Thr Leu
85 90 95
Val Phe Asp Val Glu Leu Leu Lys Leu Glu Thr Ser
100 105
<210> 384
<211> 93
<212> БЕЛОК
<213> Homo sapiens
<400> 384
Ile Leu Trp His Glu Met Trp His Glu Gly Leu Glu Glu Ala Ser Arg
1 5 10 15
Leu Tyr Phe Gly Glu Arg Asn Val Lys Gly Met Phe Glu Val Leu Glu
20 25 30
Pro Leu His Ala Met Met Glu Arg Gly Pro Gln Thr Leu Lys Glu Thr
35 40 45
Ser Phe Asn Gln Ala Tyr Gly Arg Asp Leu Met Glu Ala Gln Glu Trp
50 55 60
Cys Arg Lys Tyr Met Lys Ser Gly Asn Val Lys Asp Leu Thr Gln Ala
65 70 75 80
Trp Asp Leu Tyr Tyr His Val Phe Arg Arg Ile Ser Lys
85 90
<210> 385
<211> 95
<212> БЕЛОК
<213> Homo sapiens
<400> 385
Ile Leu Trp His Glu Met Trp His Glu Gly Leu Ile Glu Ala Ser Arg
1 5 10 15
Leu Tyr Phe Gly Glu Arg Asn Val Lys Gly Met Phe Glu Val Leu Glu
20 25 30
Pro Leu His Ala Met Met Glu Arg Gly Pro Gln Thr Leu Lys Glu Thr
35 40 45
Ser Phe Asn Gln Ala Tyr Gly Arg Asp Leu Met Glu Ala Gln Glu Trp
50 55 60
Cys Arg Lys Tyr Met Lys Ser Gly Asn Val Lys Asp Leu Thr Gln Ala
65 70 75 80
Trp Asp Leu Tyr Tyr His Val Phe Arg Arg Ile Ser Lys Thr Ser
85 90 95
<210> 386
<211> 95
<212> БЕЛОК
<213> Homo sapiens
<400> 386
Ile Leu Trp His Glu Met Trp His Glu Gly Leu Leu Glu Ala Ser Arg
1 5 10 15
Leu Tyr Phe Gly Glu Arg Asn Val Lys Gly Met Phe Glu Val Leu Glu
20 25 30
Pro Leu His Ala Met Met Glu Arg Gly Pro Gln Thr Leu Lys Glu Thr
35 40 45
Ser Phe Asn Gln Ala Tyr Gly Arg Asp Leu Met Glu Ala Gln Glu Trp
50 55 60
Cys Arg Lys Tyr Met Lys Ser Gly Asn Val Lys Asp Leu Thr Gln Ala
65 70 75 80
Trp Asp Leu Tyr Tyr His Val Phe Arg Arg Ile Ser Lys Thr Ser
85 90 95
<210> 387
<211> 95
<212> БЕЛОК
<213> Homo sapiens
<400> 387
Ile Leu Trp His Glu Met Trp His Glu Gly Leu Glu Glu Ala Ser Arg
1 5 10 15
Leu Tyr Phe Gly Glu Arg Asn Val Lys Gly Met Phe Glu Val Leu Glu
20 25 30
Pro Leu His Ala Met Met Glu Arg Gly Pro Gln Thr Leu Lys Glu Thr
35 40 45
Ser Phe Asn Gln Ala Tyr Gly Arg Asp Leu Met Glu Ala Gln Glu Trp
50 55 60
Cys Arg Lys Tyr Met Lys Ser Gly Asn Val Lys Asp Leu Leu Gln Ala
65 70 75 80
Trp Asp Leu Tyr Tyr His Val Phe Arg Arg Ile Ser Lys Thr Ser
85 90 95
<210> 388
<211> 95
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> МОДИФИЦИРОВАННЫЙ ОСТАТОК
<222> (12)..(12)
<223> Любая аминокислота
<220>
<221> МОДИФИЦИРОВАННЫЙ ОСТАТОК
<222> (78)..(78)
<223> Любая аминокислота
<400> 388
Ile Leu Trp His Glu Met Trp His Glu Gly Leu Xaa Glu Ala Ser Arg
1 5 10 15
Leu Tyr Phe Gly Glu Arg Asn Val Lys Gly Met Phe Glu Val Leu Glu
20 25 30
Pro Leu His Ala Met Met Glu Arg Gly Pro Gln Thr Leu Lys Glu Thr
35 40 45
Ser Phe Asn Gln Ala Tyr Gly Arg Asp Leu Met Glu Ala Gln Glu Trp
50 55 60
Cys Arg Lys Tyr Met Lys Ser Gly Asn Val Lys Asp Leu Xaa Gln Ala
65 70 75 80
Trp Asp Leu Tyr Tyr His Val Phe Arg Arg Ile Ser Lys Thr Ser
85 90 95
<210> 389
<211> 95
<212> БЕЛОК
<213> Homo sapiens
<400> 389
Ile Leu Trp His Glu Met Trp His Glu Gly Leu Ile Glu Ala Ser Arg
1 5 10 15
Leu Tyr Phe Gly Glu Arg Asn Val Lys Gly Met Phe Glu Val Leu Glu
20 25 30
Pro Leu His Ala Met Met Glu Arg Gly Pro Gln Thr Leu Lys Glu Thr
35 40 45
Ser Phe Asn Gln Ala Tyr Gly Arg Asp Leu Met Glu Ala Gln Glu Trp
50 55 60
Cys Arg Lys Tyr Met Lys Ser Gly Asn Val Lys Asp Leu Leu Gln Ala
65 70 75 80
Trp Asp Leu Tyr Tyr His Val Phe Arg Arg Ile Ser Lys Thr Ser
85 90 95
<210> 390
<211> 95
<212> БЕЛОК
<213> Homo sapiens
<400> 390
Ile Leu Trp His Glu Met Trp His Glu Gly Leu Leu Glu Ala Ser Arg
1 5 10 15
Leu Tyr Phe Gly Glu Arg Asn Val Lys Gly Met Phe Glu Val Leu Glu
20 25 30
Pro Leu His Ala Met Met Glu Arg Gly Pro Gln Thr Leu Lys Glu Thr
35 40 45
Ser Phe Asn Gln Ala Tyr Gly Arg Asp Leu Met Glu Ala Gln Glu Trp
50 55 60
Cys Arg Lys Tyr Met Lys Ser Gly Asn Val Lys Asp Leu Leu Gln Ala
65 70 75 80
Trp Asp Leu Tyr Tyr His Val Phe Arg Arg Ile Ser Lys Thr Ser
85 90 95
<210> 391
<211> 383
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 391
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu
20 25 30
Glu Lys Pro Gly Ala Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Ser Phe Thr Gly Tyr Thr Met Asn Trp Val Lys Gln Ser His Gly Lys
50 55 60
Ser Leu Glu Trp Ile Gly Leu Ile Thr Pro Tyr Asn Gly Ala Ser Ser
65 70 75 80
Tyr Asn Gln Lys Phe Arg Gly Lys Ala Thr Leu Thr Val Asp Lys Ser
85 90 95
Ser Ser Thr Ala Tyr Met Asp Leu Leu Ser Leu Thr Ser Glu Asp Ser
100 105 110
Ala Val Tyr Phe Cys Ala Arg Gly Gly Tyr Asp Gly Arg Gly Phe Asp
115 120 125
Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly
130 135 140
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Glu Leu Thr
145 150 155 160
Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly Glu Lys Val Thr Met
165 170 175
Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met His Trp Tyr Gln Gln
180 185 190
Lys Ser Gly Thr Ser Pro Lys Arg Trp Ile Tyr Asp Thr Ser Lys Leu
195 200 205
Ala Ser Gly Val Pro Gly Arg Phe Ser Gly Ser Gly Ser Gly Asn Ser
210 215 220
Tyr Ser Leu Thr Ile Ser Ser Val Glu Ala Glu Asp Asp Ala Thr Tyr
225 230 235 240
Tyr Cys Gln Gln Trp Ser Gly Tyr Pro Leu Thr Phe Gly Ala Gly Thr
245 250 255
Lys Leu Glu Ile Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala
260 265 270
Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg
275 280 285
Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys
290 295 300
Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu
305 310 315 320
Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu
325 330 335
Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln
340 345 350
Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly
355 360 365
Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala
370 375 380
<210> 392
<211> 717
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 392
caagtccagc tccagcagtc gggcccagag ttggagaagc ctggggcgag cgtgaagatc 60
tcatgcaaag cctcaggcta ctcctttact ggatacacga tgaattgggt gaaacagtcg 120
catggaaagt cactggaatg gatcggtctg attacgccct acaacggcgc ctccagctac 180
aaccagaagt tcaggggaaa ggcgaccctt actgtcgaca agtcgtcaag caccgcctac 240
atggacctcc tgtccctgac ctccgaagat agcgcggtct acttttgtgc acgcggaggt 300
tacgatggac ggggattcga ctactggggc cagggaacca ctgtcaccgt gtcgagcgga 360
ggcggaggga gcggaggagg aggcagcgga ggtggagggt cggatatcga actcactcag 420
tccccagcaa tcatgtccgc ttcaccggga gaaaaggtga ccatgacttg ctcggcctcc 480
tcgtccgtgt catacatgca ctggtaccaa caaaaatcgg ggacctcccc taagagatgg 540
atctacgata ccagcaaact ggcttcaggc gtgccgggac gcttctcggg ttcggggagc 600
ggaaattcgt attcgttgac catttcgtcc gtggaagccg aggacgacgc aacttattac 660
tgccaacagt ggtcaggcta cccgctcact ttcggagccg gcactaagct ggagatc 717
<210> 393
<211> 1149
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 393
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtcc agctccagca gtcgggccca gagttggaga agcctggggc gagcgtgaag 120
atctcatgca aagcctcagg ctactccttt actggataca cgatgaattg ggtgaaacag 180
tcgcatggaa agtcactgga atggatcggt ctgattacgc cctacaacgg cgcctccagc 240
tacaaccaga agttcagggg aaaggcgacc cttactgtcg acaagtcgtc aagcaccgcc 300
tacatggacc tcctgtccct gacctccgaa gatagcgcgg tctacttttg tgcacgcgga 360
ggttacgatg gacggggatt cgactactgg ggccagggaa ccactgtcac cgtgtcgagc 420
ggaggcggag ggagcggagg aggaggcagc ggaggtggag ggtcggatat cgaactcact 480
cagtccccag caatcatgtc cgcttcaccg ggagaaaagg tgaccatgac ttgctcggcc 540
tcctcgtccg tgtcatacat gcactggtac caacaaaaat cggggacctc ccctaagaga 600
tggatctacg ataccagcaa actggcttca ggcgtgccgg gacgcttctc gggttcgggg 660
agcggaaatt cgtattcgtt gaccatttcg tccgtggaag ccgaggacga cgcaacttat 720
tactgccaac agtggtcagg ctacccgctc actttcggag ccggcactaa gctggagatc 780
accactaccc cagcaccgag gccacccacc ccggctccta ccatcgcctc ccagcctctg 840
tccctgcgtc cggaggcatg tagacccgca gctggtgggg ccgtgcatac ccggggtctt 900
gacttcgcct gcgatatcta catttgggcc cctctggctg gtacttgcgg ggtcctgctg 960
ctttcactcg tgatcactct ttactgtaag cgcggtcgga agaagctgct gtacatcttt 1020
aagcaaccct tcatgaggcc tgtgcagact actcaagagg aggacggctg ttcatgccgg 1080
ttcccagagg aggaggaagg cggctgcgaa ctgcgcgtga aattcagccg cagcgcagat 1140
gctccagcc 1149
<210> 394
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 394
Gly Tyr Ser Phe Thr Gly Tyr Thr Met Asn
1 5 10
<210> 395
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 395
Leu Ile Thr Pro Tyr Asn Gly Ala Ser Ser Tyr Asn Gln Lys Phe Arg
1 5 10 15
Gly
<210> 396
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 396
Gly Gly Tyr Asp Gly Arg Gly Phe Asp Tyr
1 5 10
<210> 397
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 397
Ser Ala Ser Ser Ser Val Ser Tyr Met His
1 5 10
<210> 398
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 398
Asp Thr Ser Lys Leu Ala Ser
1 5
<210> 399
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 399
Gln Gln Trp Ser Gly Tyr Pro Leu Thr
1 5
<210> 400
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусствевнной последовательности: синтетическая 7xHis-метка
<400> 400
His His His His His His His
1 5
<210> 401
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусствевнной последовательности: синтетическая 8xHis-метка
<400> 401
His His His His His His His His
1 5
<210> 402
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<220>
<221> МОДИФИЦИРОВАННЫЙ ОСТАТОК
<222> (1)..(1)
<223> L-аргинил
<220>
<221> МОДИФИЦИРОВАННЫЙ ОСТАТОК
<222> (2)..(2)
<223> Глицил
<220>
<221> МОДИФИЦИРОВАННЫЙ ОСТАТОК
<222> (3)..(3)
<223> L-бета-аспартил
<400> 402
Arg Gly Asp Ser
1
<---
Реферат
Настоящая группа изобретений относится к адоптивной терапии. Предложены химерные рецепторы антигена (CAR), содержащие мезотелин-связывающий домен, а также кодирующие их нуклеиновые кислоты, вектор и клетка. Кроме того, представлен способ получения Т-клетки и популяций клеток, а также способы обеспечения противоракового иммунитета и способы лечения заболевания, ассоциированного с экспрессией мезотелина. Данная группа изобретений может найти дальнейшее применение в терапии рака. 21 н. и 71 з.п. ф-лы, 48 ил., 17 табл., 18 пр.

Комментарии