Применение комбинации вируса миксомы и рапамицина для терапевтического лечения - RU2461630C2
Код документа: RU2461630C2
Чертежи








































Описание
Перекрестная ссылка на родственную заявку
Эта заявка претендует на положительный эффект и приоритет предварительной заявки на патент США № 60/658,816, поданной 7 марта 2005, содержание которой включено сюда в качестве ссылки.
Область, к которой относится изобретение
Настоящее изобретение относится в целом к терапевтическому применению вируса миксомы и рапамицина.
Описание предшествующего уровня техники
Современные способы лечения, используемые для лечения различных типов рака, имеют тенденцию осуществляться отравлением или уничтожением раковых клеток. К сожалению, способы лечения, которые токсичны для раковых клеток, обычно имеют тенденцию быть токсичными также для здоровых клеток. Более того, гетерогенная природа опухолей представляет собой одну из первичных причин того, что эффективные способы лечения по поводу рака еще не найдены. Современные основные способы лечения, такие как химиотерапия и лучевая терапия, имеют тенденцию применяться в пределах узкого терапевтического диапазона токсичности. Эти виды лечения считаются «тупыми инструментами», у которых ограниченная применимость вследствие меняющихся типов опухолевых клеток и ограниченного диапазона, в котором могут проводиться эти способы лечения.
Разрабатываемые современные виды противораковой терапии пытаются селективно нацеливаться на опухолевые клетки, в то же время оказывая менее токсичное действие на здоровые клетки, в результате чего повышается вероятность избавиться от воздействия на здоровые клетки.
Онколитическая вирусная терапия представляет собой один подход, который нацелен на использование клеточных различий между опухолевыми клетками и нормальными клетками. При таком лечении в качестве противораковых средств используются подходящие для репликации, селективные к опухолям вирусные векторы. Онколитический вирус либо специфично нацелен на раковые клетки для инфекции, либо больше подходит для эффективной репликации в раковых клетках по сравнению со здоровыми клетками. Такие подходящие для репликации онколитические вирусы являются или естественно встречающимися, или полученными методами генной инженерии для того, чтобы быть высоко селективными и сильнодействующими средствами, нацеленными на гетерогенную опухолевую популяцию. Поскольку репликационно селективный онколитический вирус эффективно не реплицируется в нормальных клетках, токсичность для пациента должна быть низкой, особенно по сравнению с традиционными видами лечения, такими как лучевая терапия и химиотерапия.
В многочисленных исследованиях сообщалось об онколитической активности различных вирусных штаммов, причем самыми перспективными онколитическими вирусами являются естественно встречающийся или генетически модифицированный вариант аденовируса, вируса простого герпеса 1 ("HSV1"), реовируса, вируса коровьей оспы, вируса везикулярного стоматита ("VSV") или вируса полиомиелита. Модифицированные онколитические вирусы, исследуемые в настоящее время в качестве противораковых средств, включают HSV, аденовирус, вирус ньюкастлской болезни ("NDV"), реовирус и вирус коровьей оспы, кори, VSV и вирус полиомиелита. Различные онколитические вирусы проходят I фазу и II фазу клинических испытаний, причем некоторые из них проявляют длительную эффективность. Однако неизвестно, какие вирусы наилучшим образом будут выполнять онколитические цели длительной репликации, специфичности и высокой литической активности. Полностью эффективным кандидатом на онколитический вирусный вектор был бы тот, который имеет короткий жизненный цикл, быстро образует зрелые вирионы, эффективно распространяется от клетки к клетке и имеет большой геном, готовый для вставок. Также имеющиеся доказательства свидетельствуют о том, что ингибирование раннего природного иммунного ответа и замедление развития реакций Th1 важны для эффективности онколитической терапии. Ясно, что человеческие вирусы являются высоко иммуногенными, по данным измерения высокого уровня антитела и реакций Т клеток, которые наблюдаются в здоровой популяции по многим из вирусов, рассматриваемым для разработки онколитических вирусов.
Клиническая работа показала, что современные онколитические вирусы действительно безопасны, но недостаточно сильнодействующие в качестве видов монотерапии для того, чтобы быть полностью клинически эффективными. Поскольку обычно наблюдается недостаточная или неэффективная инфекция опухолевых клеток, современное движение направлено в сторону перспективных вирусов путем воздействия на них методами генной инженерии для экспрессии терапевтических трансгенов с целью увеличения их эффективности. Большинство из указанных выше онколитических вирусов в настоящее время испытывается в комбинации с другими обычными видами онколитической терапии.
Аденовирус можно легко подвергнуть генетическим манипуляциям, и он выполняет хорошо известную ассоциированную функцию вирусного белка. Кроме того, он связан с достаточно легким заболеванием. Человеческий аденовирус ONYX-015 (Onyx Pharmaceuticals Inc.) представляет собой один из наиболее обширно испытуемых онколитических вирусов, который был оптимизирован для клинического применения. Считают, что он реплицируется предпочтительно в р53-отрицательных опухолях и проявляет перспективность в клинических испытаниях у пациентов, страдающих раком головы и шеи. Однако сообщения показывают, что ONYX-015 вызвал объективную клиническую реакцию только у 14% получавших лечение пациентов (Nemunaitis J, Khuri F, Ganly I, Arseneau J, Posner M, Vokes E, Kuhn J, McCarty T, Landers S, Blackburn A, Romel L, Randlev B, Kaye S, Kirn D. J. Clin. Oncol. 2001 Jan 15;19(2):289-98).
В документах WO96/03997 и W097/26904 описан мутантный онколитический HSV, который ингибирует рост опухолевых клеток и специфичен к нейронным клеткам. Другие преимущества состоят в том, что HSV можно с легкостью генетически модифицировать, и существуют лекарственные препараты, для выключения любой нежелательной вирусной репликации. Однако применение такого обычного человеческого патогена ограничено, поскольку имеется вероятность того, что общая популяция контактировала с этим вирусом и приобрела иммунную реакцию на него, которая ослабила бы литический эффект вируса. HSV может также вызвать тяжелые побочные эффекты или потенциально летальное заболевание.
Реовирус III типа связан с относительно легкими заболеваниями, и его вирусная генная функция достаточно хорошо изучена и понятна. Реовирус III типа в настоящее время разрабатывается фирмой Oncolytic Biotech в качестве терапевтического противоракового средства, которое проявляет свойства усиленной репликации в клетках, экспрессирующих мутантный ras онкоген и предпочтительно растет в клетках PKR -/- (Strong J.E. and P.W. Lee, J. Virology, 1996. 70:612-616). Однако реовирусом трудно генетически манипулировать, и его вирусную репликацию нельзя с легкостью отключить.
VSV связан с относительно легкими заболеваниями и также выполняет хорошо известную вирусную генную функцию. В документе WO99/04026 раскрыто применение VSV в качестве вектора при генной терапии для экспрессии, широко используемого при лечении разнообразных расстройств. Однако VSV связан с такими же проблемами как реовирус, заключающимися в том, что им трудно генетически манипулировать, и его вирусную репликацию нельзя с легкостью отключить.
Вирус коровьей оспы и вирус полиомиелита представляют собой другие перспективные онколитические вирусы, описанные в данной области, но они были связаны с тяжелым или потенциально летальным заболеванием.
В патенте США № 4806347 раскрыто применение гамма интерферона и фрагмента IFNγ против человеческих опухолевых клеток. В документе WO99/18799 раскрыт способ лечения заболевания у млекопитающего, при котором пораженные клетки имеют дефекты опосредованной интерфероном противовирусной реакции, причем способ включает введение млекопитающему терапевтически эффективного количества чувствительного к интерферону, репликационно компетентного клонального вируса. В WO99/18799, в частности, раскрыто, что частицы VSV обладают токсической активностью против опухолевых клеток, но что облегчение цитотоксичности VSV в здоровых клетках происходит в присутствии интерферона. В документе WO99/18799 также раскрывается, что вызванная NDV чувствительность наблюдалась у опухолевых клеток, обработанных интерфероном, но что добавление интерферона к нормальным клеткам делает эти клетки устойчивыми к NDV. Этот способ нацелен на то, чтобы сделать клетки чувствительными к интерферону инфицированием их чувствительными к интерферону вирусами.
Краткое описание сущности изобретения
Настоящее изобретение основано на неожиданном обнаружении того, что вирус кроличьей миксомы, включая новый вирус миксомы, который не экспрессирует функциональный белок M135R, может селективно инфицировать клетки, включая человеческие опухолевые клетки, которые имеют недостаточную природную противовирусную реакцию, включая клетки, которые не реагируют на интерферон, и что такая инфекция усиливается обработкой таких клеток лекарственным препаратом рапамицином. Используемый в настоящем контексте термин «природный» описывает неспецифическую к антигену иммунную реакцию. Поскольку вирус миксомы эффективно не реплицируется в нормальных человеческих клетках, то его можно поэтому использовать в качестве лечебного средства при различных расстройствах и состояниях, характеризуемых клетками, которые имеют недостаточную природную противовирусную реакцию, включая клетки, которые не реагируют на интерферон, например, в качестве онколитического лечения по поводу рака. Этот вирус можно также применять для идентификации клеток, которые имеют недостаточную природную противовирусную реакцию, и для визуализации этих клеток in vivo.
В одном аспекте, настоящее изобретение предоставляет способ ингибирования клетки, которая имеет недостаточную природную противовирусную реакцию, включающий введение в клетку эффективного количества комбинации вируса миксомы и рапамицина.
В одном аспекте, настоящее изобретение предоставляет способ лечения патологического состояния, характеризуемого наличием клеток, которые имеют недостаточную природную противовирусную реакцию, включающий введение нуждающемуся в нем пациенту эффективного количества комбинации вируса миксомы и рапамицина.
Настоящее изобретение, кроме того, предоставляет применение эффективного количества комбинации вируса миксомы и рапамицина для ингибирования клетки, которая имеет недостаточную природную противовирусную реакцию, и для изготовления лекарственного средства для ингибирования клетки, которая имеет недостаточную природную противовирусную реакцию.
Настоящее изобретение, кроме того, предоставляет применение эффективного количества комбинации вируса миксомы и рапамицина для лечения патологического состояния у пациента, причем патологическое состояние характеризуется наличием клеток, которые имеют недостаточную природную противовирусную реакцию, и для изготовления лекарственного средства для лечения такого патологического состояния у пациента.
В другом аспекте, настоящее изобретение предоставляет фармацевтическую композицию, включающую вирус миксомы и рапамицин. Фармацевтическую композицию можно применять для ингибирования клетки, которая имеет недостаточную природную противовирусную реакцию или для лечения патологического состояния, характеризуемого наличием клеток, которые имеют недостаточную природную противовирусную реакцию.
В другом аспекте, настоящее изобретение предоставляет набор, включающий вирус миксомы, рапамицин и инструкции для ингибирования клетки, которая имеет недостаточную природную противовирусную реакцию или для лечения патологического состояния, характеризуемого наличием клеток, которые имеют недостаточную природную противовирусную реакцию. Патологические состояния включают рак и хроническую вирусную инфекцию.
Настоящее изобретение, кроме того, предоставляет способ выявления клетки, которая имеет недостаточную природную противовирусную реакцию, включающий контакт популяции клеток с комбинацией вируса миксомы и рапамицина; предоставление вирусу возможности инфицировать клетку, которая имеет недостаточную природную противовирусную реакцию; и определение инфекции любых клеток популяции клеток вирусом миксомы.
Настоящее изобретение, кроме того, основано на неожиданном обнаружении того, что белок M135R вируса кроличьей миксомы участвует в вызове иммунной реакции у кроликов и что штамм вируса миксомы, который не экспрессирует функциональный M135R, может уничтожать клетки in vitro, но не вызывает миксоматозного заболевания у животных. Такой вирусный штамм можно применять для обработки клеток, имеющих недостаточную природную противовирусную реакцию, включая клетки, которые не реагируют на интерферон, и включая виды лечения, проводимые с лекарственным препаратом рапамицином, без необходимости в повышенном содержании вируса, что приводит к повышенной безопасности.
В одном аспекте, настоящее изобретение предоставляет способ ингибирования клетки, которая имеет недостаточную природную противовирусную реакцию, включающий введение в клетку эффективного количества вируса миксомы, который не экспрессирует функциональный M135R, необязательно, в комбинации с эффективным количеством рапамицина.
В одном аспекте, изобретение предоставляет способ лечения патологического состояния, характеризуемого наличием клеток, которые имеют недостаточную природную противовирусную реакцию, включающий введение пациенту, нуждающемуся в нем, эффективного количества вируса миксомы, который не экспрессирует функциональный M135R, необязательно, в комбинации с эффективным количеством рапамицина.
Настоящее изобретение, кроме того, предоставляет применение эффективного количества вируса миксомы, который не экспрессирует функциональный M135R, необязательно в комбинации с эффективным количеством рапамицина, для ингибирования клетки, которая имеет недостаточную природную противовирусную реакцию, и при изготовлении лекарственного препарата для ингибирования клетки, которая имеет недостаточную природную противовирусную реакцию.
Настоящее изобретение, кроме того, предоставляет применение эффективного количества вируса миксомы, который не экспрессирует функциональный M135R, необязательно в комбинации с эффективным количеством рапамицина, для лечения патологического состояния у пациента, причем патологическое состояние характеризуется наличием клеток, которые имеют недостаточную природную противовирусную реакцию, и при изготовлении лекарственного препарата для лечения такого патологического состояния у пациента.
В еще одном аспекте, настоящее изобретение предоставляет вирус миксомы, который не экспрессирует функциональный M135R.
В другом аспекте, настоящее изобретение предоставляет фармацевтическую композицию, включающую вирус миксомы, который не экспрессирует функциональный M135R. Фармацевтическую композицию можно применять для ингибирования клетки, которая имеет недостаточную природную противовирусную реакцию, или для лечения патологического состояния, характеризуемого наличием клеток, которые имеют недостаточную природную противовирусную реакцию. Фармацевтическая композиция может, кроме того, включать рапамицин.
В другом аспекте, настоящее изобретение предоставляет набор, включающий вирус миксомы, который не экспрессирует функциональный M135R, и инструкции для ингибирования клетки, которая имеет недостаточную природную противовирусную реакцию, или для лечения патологического состояния, характеризуемого наличием клеток, которые имеют недостаточную природную противовирусную реакцию. Набор может, кроме того, включать рапамицин. Патологическое состояние включает рак и хроническую вирусную инфекцию.
Настоящее изобретение, кроме того, предоставляет способ выявления клетки, которая имеет недостаточную природную противовирусную реакцию, включающий контакт популяции клеток с комбинацией вируса миксомы, который не экспрессирует функциональный M135R, необязательно в комбинации с рапамицином; предоставление вирусу возможности инфицировать клетку, которая имеет недостаточную природную противовирусную реакцию; и определение инфекции любых клеток популяции клеток вирусом миксомы.
Другие аспекты настоящего изобретения станут очевидны средним специалистам в данной области после анализа следующего описания конкретных вариантов осуществления изобретения в сочетании с сопровождающими чертежами. Однако следует понимать, что подробное описание и определенные примеры, хотя и указывающие предпочтительные варианты осуществления изобретения, приведены только в качестве иллюстрации, поскольку для специалистов в данной области на основании этого подробного описания станут очевидными изменения и модификации в пределах сущности и объема изобретения.
Краткое описание чертежей
На чертежах, которые иллюстрируют варианты осуществления настоящего изобретения, только в виде примера.
Фиг.1 представляет собой схематический график опосредованной интерфероном схемы передачи противовирусных сигналов, вызванной после вирусной инфекции клетки;
Фиг.2 представляет собой контрастную по фазе микрофотографию не пермиссивных мышиных эмбриональных фибробластов WT ("MEF") после контакта с вирусом миксомы, демонстрирующую, что MEF становятся пермиссивными после ингибирования интерферона α/β нейтрализующим антителом;
Фиг.3 представляет собой вестерн блот, показывающий состояния фосфорилирования (активации) STAT1 и STAT2 после инфекции вирусом миксомы, демонстрирующий, что не пермиссивные инфекции клеток MEF связаны с активацией STAT1 и STAT2;
Фиг.4 представляет собой вестерн блот, показывающий состояния фосфорилирования (инактивации) STAT3, STAT4, STAT5 и STAT6 после инфекции вирусом миксомы, демонстрирующий, что не пермиссивные инфекции клеток MEF не активирует ни один из этих видов;
Фиг.5 представляет собой контрастную по фазе микрофотографию IFNα/β R -/- MEF и STAT1 -/- MEF, показывающую, что инактивация передачи сигналов IFN/STAT/JAK после инфекции вирусом миксомы делает клетки пермиссивными для инфекции вирусом миксомы;
Фиг.6 представляет собой вестерн блот, показывающий состояния фосфорилирования PKR в MEF не пермиссивного дикого типа после инфекции вирусом миксомы, демонстрирующий, что PKR не активируется инфекцией вирусом миксомы;
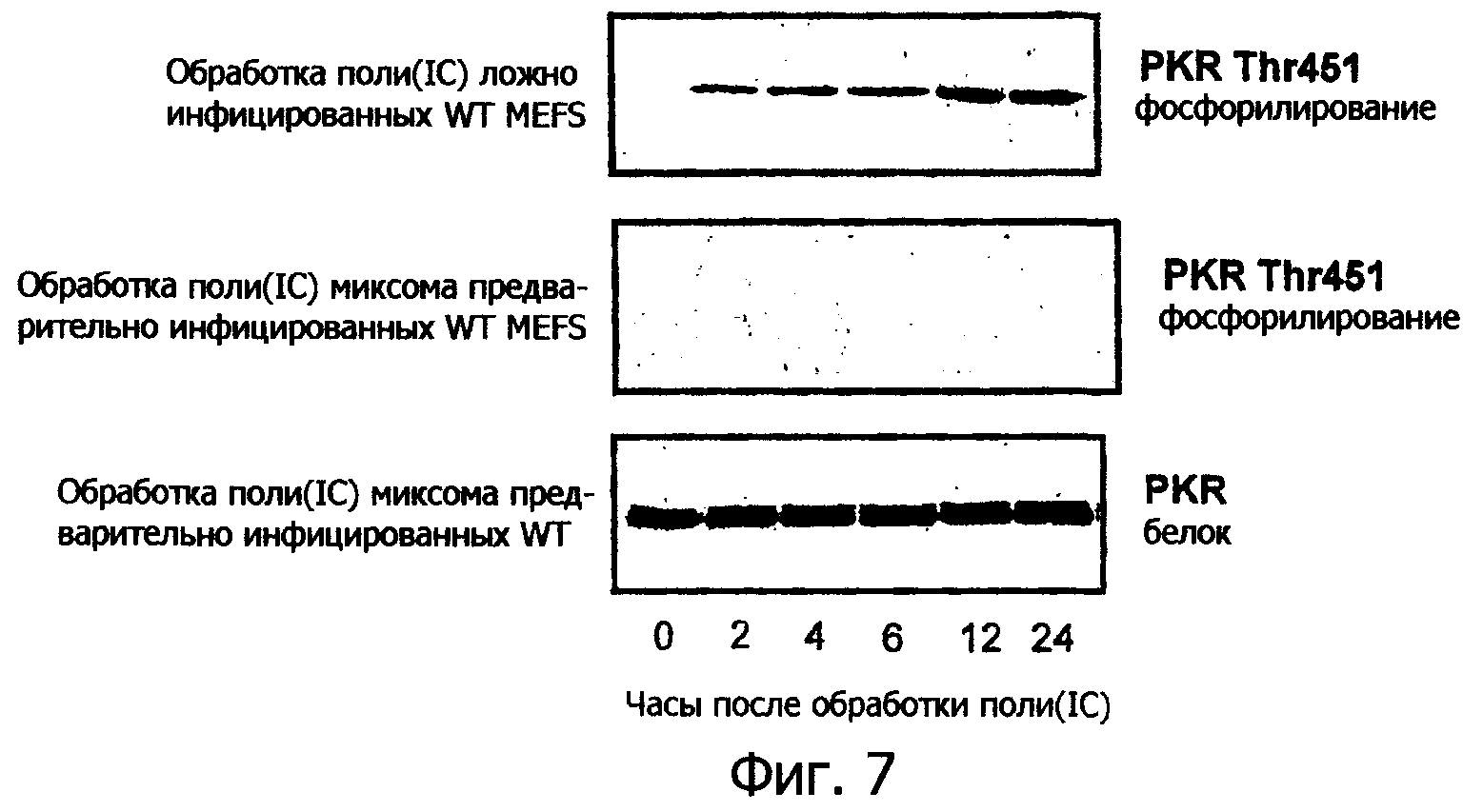
Фиг.7 представляет собой вестерн блот, показывающий состояния фосфорилирования PKR в MEF дикого типа, или ложно инфицированные, или предварительно инфицированные вирусом миксомы, показывающий, что вирус миксомы блокирует активацию PKR в клетках MEF;
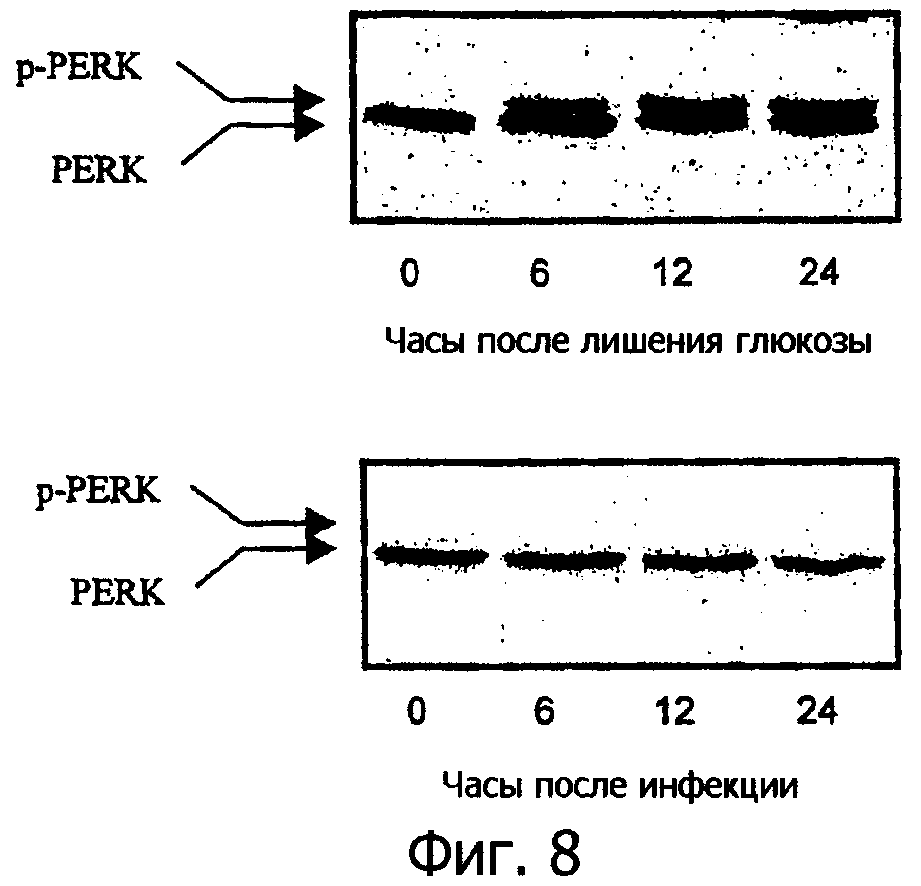
Фиг.8 представляет собой вестерн блот, показывающий состояния фосфорилирования PERK в MEF дикого типа после инфекции вирусом миксомы, показывающий, что вирус миксомы блокирует активацию PEKR в клетках MEF;
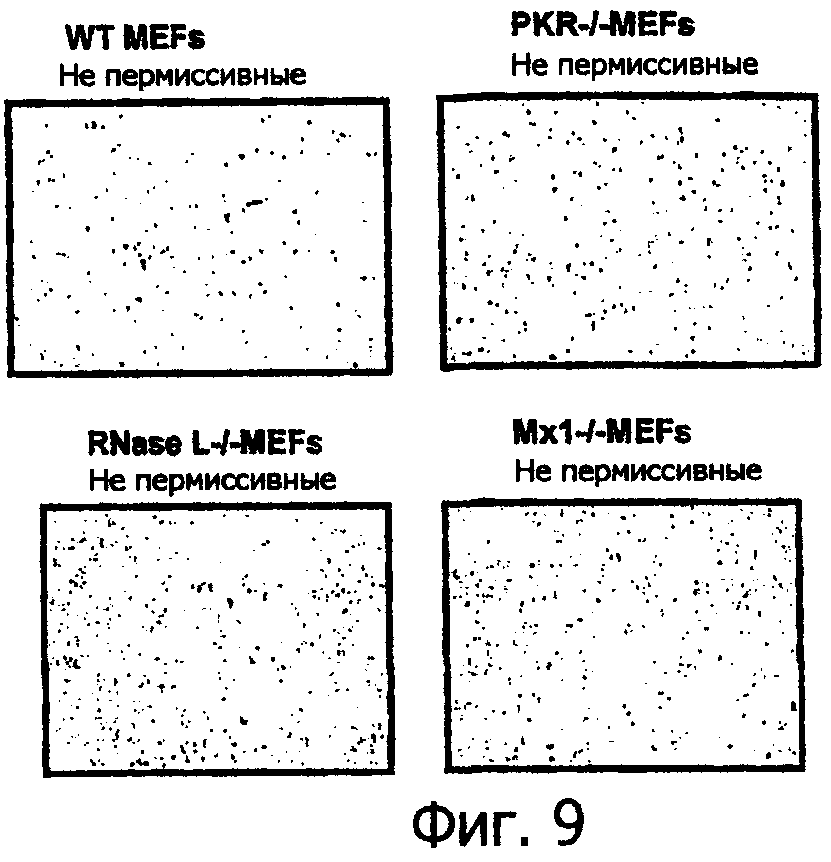
Фиг.9 представляет собой контрастную по фазе микрофотографию PKR-/-, РНазу L-/- и Mx1 -/- тройного «нокаута» после контакта с вирусом миксомы, показывающую, что противовирусное состояние у клеток MEF опосредовано определенным путем;
Фиг.10 представляет собой контрастную по фазе микрофотографию PKR-/-, РНазу L-/- и Mx1 -/- тройного «нокаута» после контакта с вирусом миксомы;
Фиг.11 представляет собой контрастную по фазе микрофотографию PKR-/-, РНазу L-/- и Mx1 -/- тройного «нокаута» после обработки нейтрализующим антителом к IFNα/β и после контакта с вирусом миксомы;
Фиг.12 представляет собой вестерн блот, показывающий уровни фосфорилирования eIF2α и PKR в не пермиссивных MEF после обработки нейтрализующим антителом к IFNα/β и после контакта с вирусом миксомы, показывающий, что фосфорилирование eIF2α в не пермиссивных клетках катализируется путем, независимым от PKR;
Фиг.13 представляет собой вестерн блот, показывающий состояния фосфорилирования STAT1 при тройном «нокауте» PKR-/-, РНазу L-/- и Mx1 -/- после инфекции вирусом миксомы, указывающий на нормальные реакции передачи сигналов, вызванные IFN;
Фиг.14 представляет собой контрастную по фазе микрофотографию, иллюстрирующую субклеточную локализацию фосфорилированного тирозином STAT1, в не пермиссивных клетках PKR-/-, РНазу L-/- и Mx1 -/- через 12 ч после инфекции, указывающую на то, что активированный STAT локализуется в ядре, как прогнозируется для нормальных реакций передачи сигналов IFN/STAT;
Фиг.15 представляет собой флюоресцентное изображение головного мозга бесшерстных мышей, имеющих внутричерепные глиомы, ложно инфицированные или инфицированные мертвым или живым вирусом миксомы, экспрессирующим GFP (гамма-фетопротеин), показывающее нацеливание вируса миксомы на клетки глиомы;
Фиг.16 представляет собой флюоресцентное изображение и фотографию тонких срезов мышиной глиомы, инфицированной вирусом миксомы, экспрессирующим GFP, показывающее, что вирус миксомы реплицировался только в опухолевых клетках;
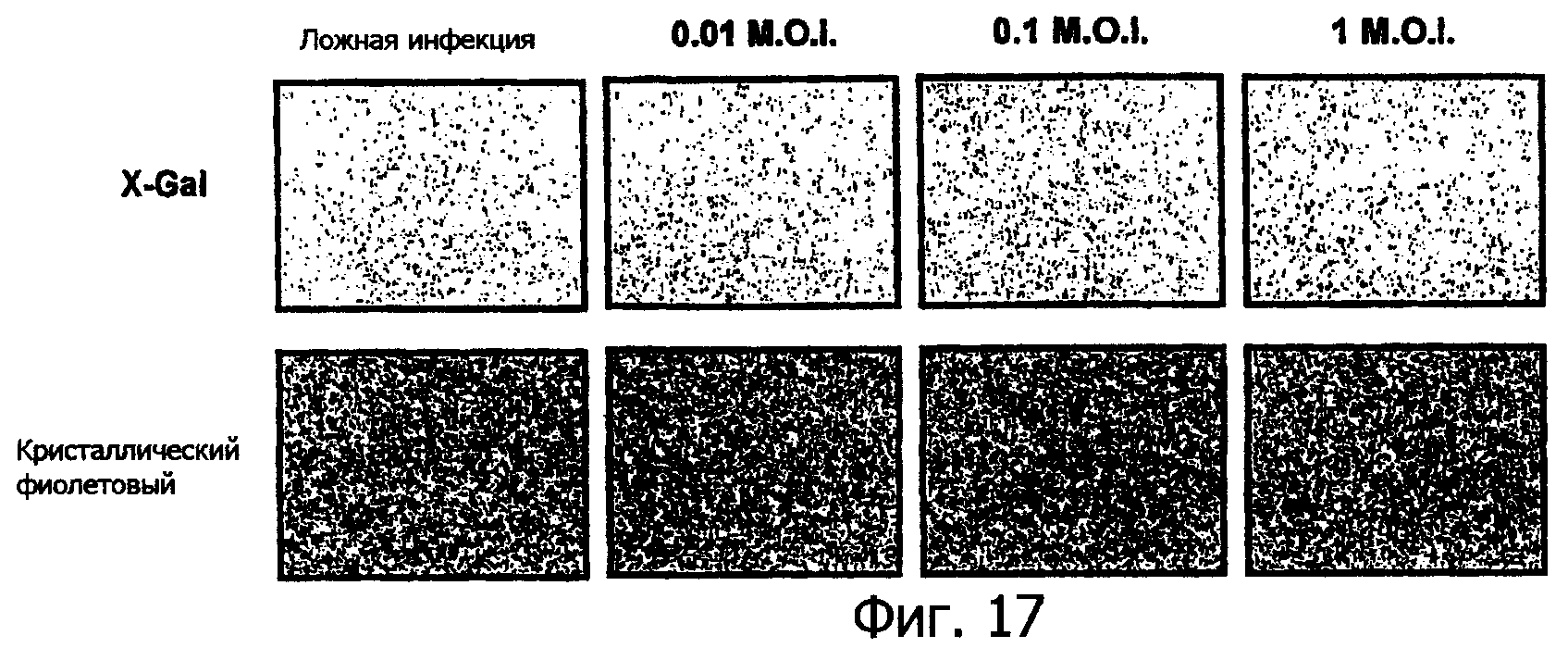
Фиг.17 представляет собой контрастную по фазе микрофотографию клеток человеческой опухоли НТ29, окрашенных или X-Gal, или кристальным фиолетовым после инфекции вирусом миксомы, показывающую пример не пермиссивной инфекции человеческих клеток;
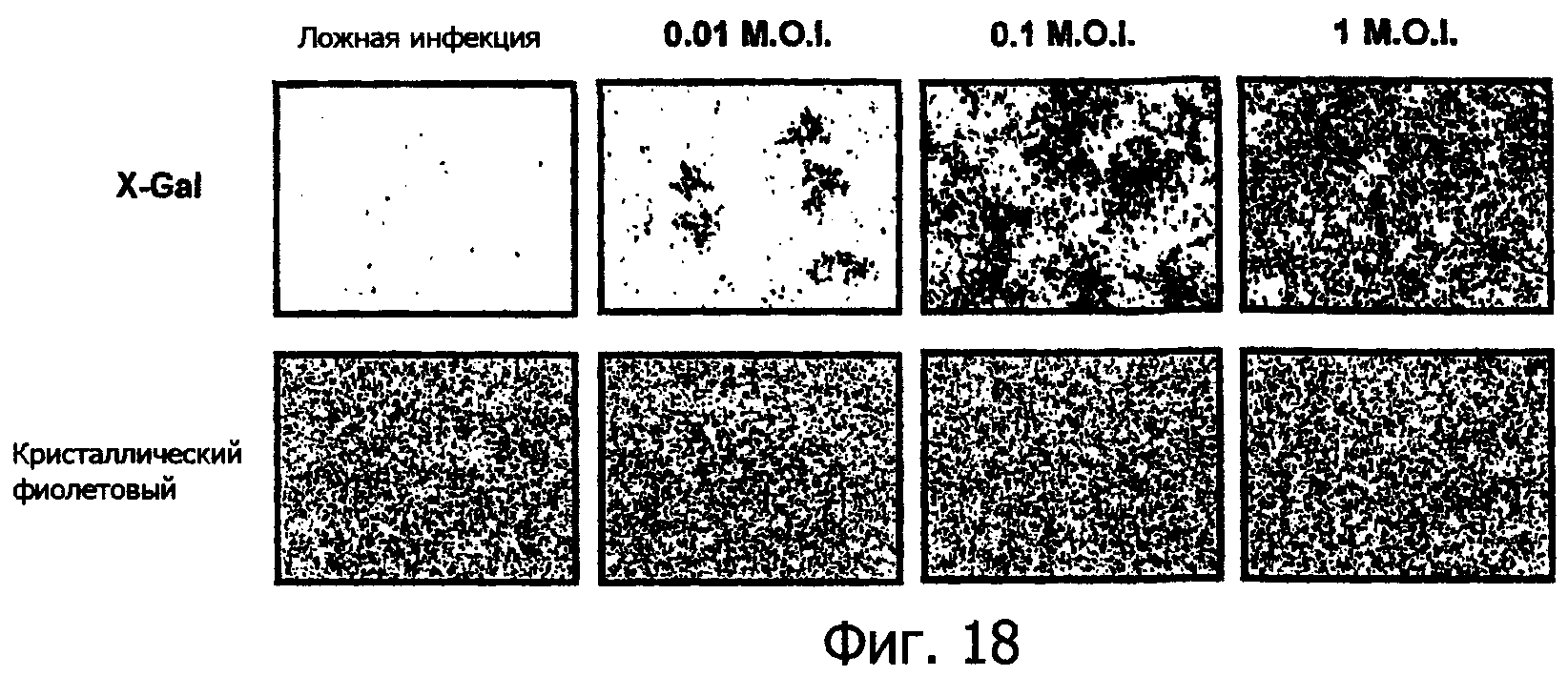
Фиг.18 представляет собой контрастную по фазе микрофотографию клеток человеческой опухоли НОР92, окрашенных X-Gal или кристальным фиолетовым после инфекции вирусом миксомы, показывающую пример пермиссивной инфекции человеческих клеток;
Фиг.19 представляет собой контрастную по фазе микрофотографию клеток человеческой опухоли OVCAR4, окрашенных или X-Gal, или кристальным фиолетовым после инфекции вирусом миксомы, показывающую пример пермиссивной инфекции человеческих клеток;
Фиг.20 представляет собой контрастную по фазе микрофотографию клеток человеческой опухоли SK-MEL3, окрашенных или X-Gal, или кристальным фиолетовым после инфекции вирусом миксомы, показывающую пример пермиссивной инфекции человеческих клеток;
Фиг.21 представляет собой контрастную по фазе микрофотографию клеток человеческой опухоли SK-MEL28, окрашенных или X-Gal, или кристальным фиолетовым после инфекции вирусом миксомы, показывающую пример полупермиссивной инфекции человеческих клеток;
Фиг.22 представляет собой контрастную по фазе микрофотографию клеток BGMK, окрашенных или X-Gal, или кристальным фиолетовым после инфекции вирусом миксомы, показывающую типичную пермиссивную контрольную инфекцию;
Фиг.23 представляет собой контрастную по фазе микрофотографию положительных контрольных клеток BGMK и линий клеток опухолей человека U87, A172 и U373, инфицированных увеличивающимися концентрациями вируса миксомы, экспрессирующего белок LacZ, окрашенных X-Gal, показывающую, что все эти клетки глиомы человека были пермиссивны в отношении репликации вируса миксомы;
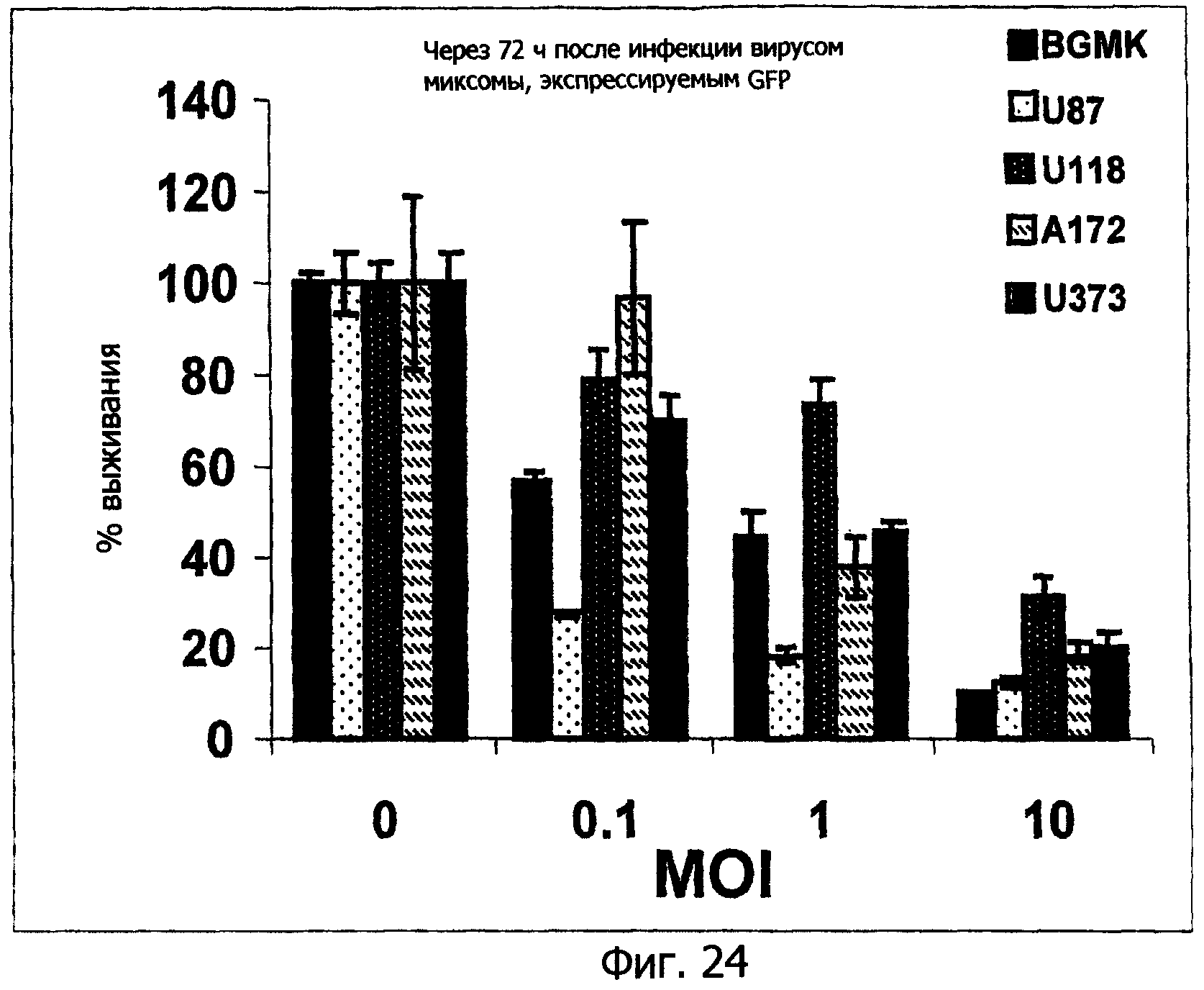
Фиг.24 представляет собой графическое изображение, показывающее частоту выживания клеток BGMK, U87, A172 и U373, инфицированных вирусом миксомы, через 72 ч после инфекции, в увеличивающихся концентрациях вируса, демонстрирующее способность вируса миксомы уничтожать все эти клетки;
Фиг.25 представляет собой контрастную по фазе микрофотографию и флюоресцентную микрофотографию клеток астроцитомы SF04 1585, инфицированных MV GFP, показывающую инфекцию в клетках первичной глиомы человека;
Фиг.26 представляет собой контрастную по фазе микрофотографию клеток глиомы U373, инфицированных вирусом миксомы, экспрессирующим белок LacZ, и окрашенных X-Gal, показывающую инфекцию этих опухолевых клеток человека;
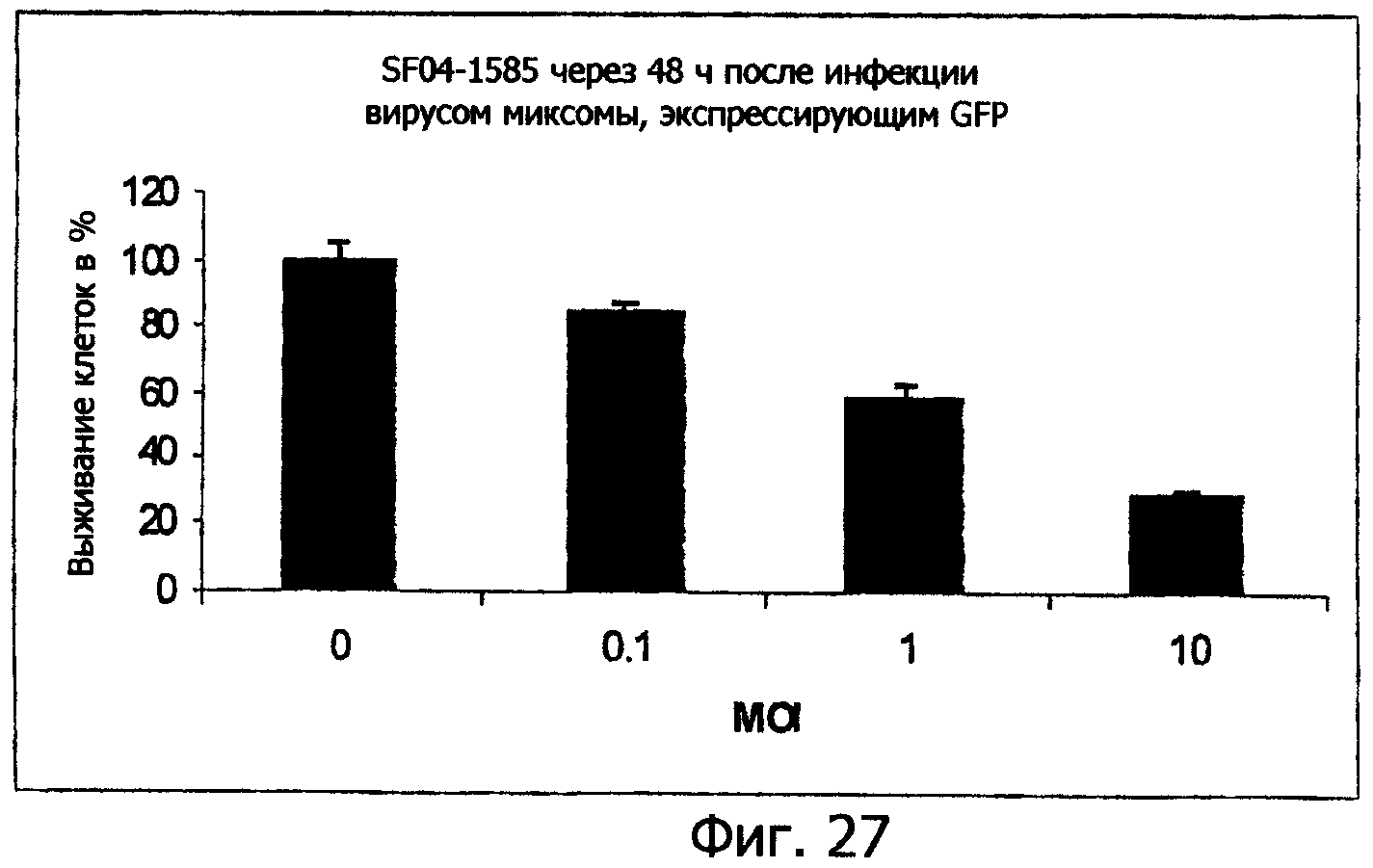
Фиг.27 представляет собой графическое изображение, показывающее частоту выживания клеток SF04 1585, инфицированных MV GFP, через 48 ч после инфекции, показывающее уничтожение этих инфицированных человеческих опухолевых клеток;
Фиг.28 представляет собой флюоресцентную микрофотографию линий клеток медуллобластомы Daoy и D384, инфицированных вирусом миксомы, экспрессирующим GFP, показывающую инфекцию этих человеческих опухолевых клеток;
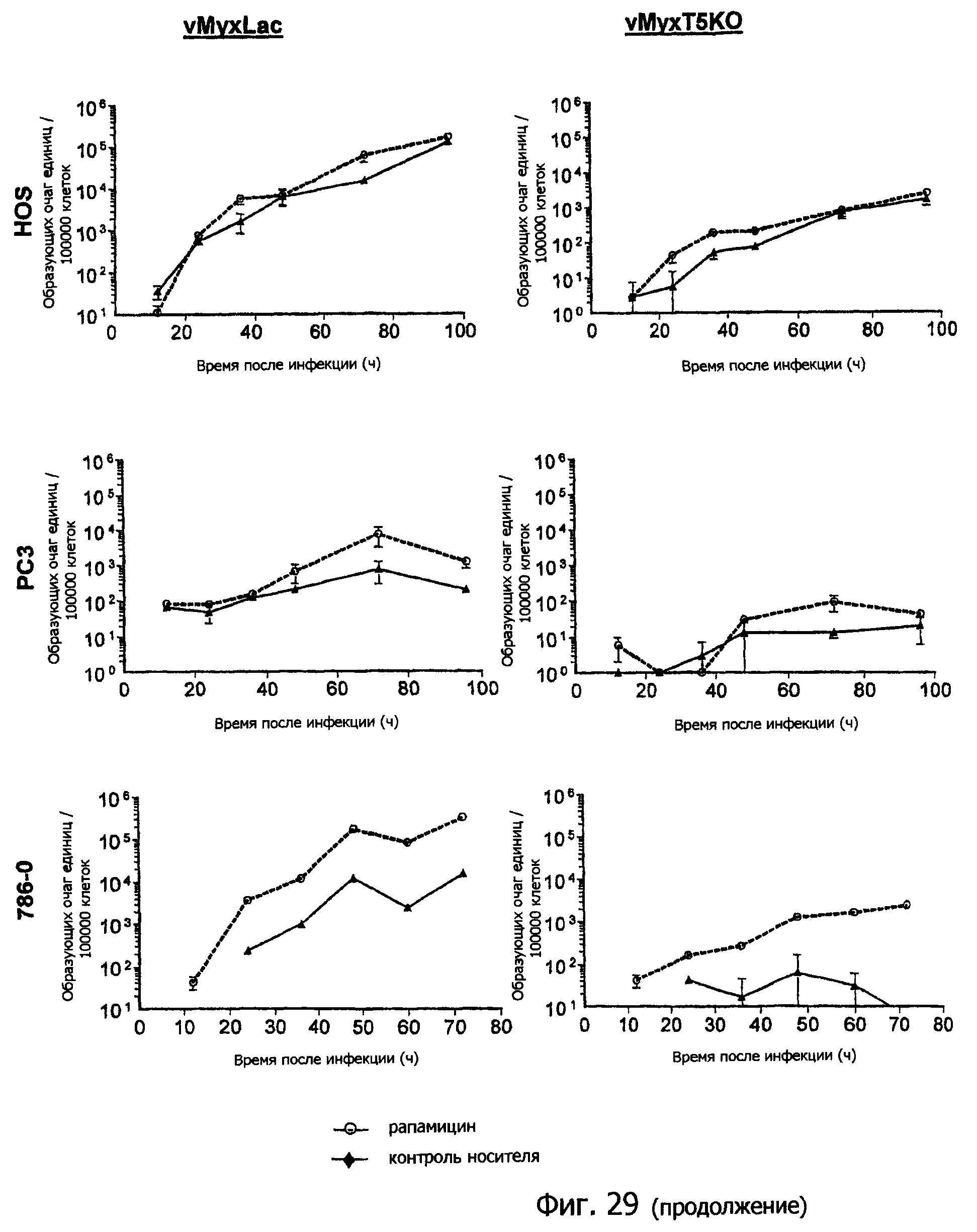
Фиг.29 представляет собой графическое изображение скорости продукции вируса в различных линиях клеток при предварительной обработке рапамицином или без нее: BGMK (контрольная линия клеток приматов); RK-13 и RL5 (контрольные линии кроличьих клеток); 4T1 и B16F10 (линии мышиных раковых клеток); HOS, PC3, 786-0, HCT116, ACHN, MCF-7, M14 и COLO205 (линии человеческих раковых клеток); с использованием вируса vMyxLac дикого типа и «выключающего» М-Т5 вируса vMyxT5KO, как указано;
Фиг.30 представляет собой фотографии инфицированных вирусами линий клеток, инфицированных или vMyxLac дикого типа, или «выключающим» М-Т5 вирусом vMyxLacT5-;
Фиг.31 представляет собой графическое изображение скорости продукции вируса в различных линиях клеток (BGMK; A9; MCF-7; MDA-MB-435; M14; и COLO205) с предварительной обработкой рапамицина и без нее;
Фиг.32 представляет собой (А) схематическую выверку белка M135R вируса миксомы и белка B18R белка вируса коровьей оспы и (В) выверку аминокислотной последовательности между M135R и первыми 179 аминокислотами B18R;
Фиг.33 представляет собой (А) вестерн блот M135R, экспрессированного в клетках BGMK, инфицированных вирусом миксомы Lausanne (vMyxLau) и (В) вестерн блот M135R, экспрессированного в клетках BGMK, инфицированных вирусом vMyxLau и обработанных araC, туникамицином или моненсином;
Фиг.34 представляет собой (А) флюоресцентную микрофотографию клеток BGMK, ложно инфицированных или инфицированных вирусом миксомы и окрашенных для выявления M135R, и (В) вестерн блот против иммунопреципитаций или клеточных лизатов клеток, инфицированных вирусом миксомы дикого типа (vMyxgfp), или штаммом «выключенного» M135R (vMyx135KO) с использованием антитела против M135R;
Фиг.35 представляет собой (А) схематическую диаграмму стратегии клонирования для получения vMyx135KO, (В) - агарозный гель продукта вставки PCR (полимеразной реакции синтеза цепи) и (С) - вестерн блот клеток, инфицированных вирусом миксомы дикого типа и вирусом миксомы с «выключением» M135R;
Фиг.36 представляет собой кривую роста вирусных очагов в клетках BGMK, инфицированных vMyxgfp или vMyx135KO;
Фиг.37 представляет собой световую и флюоресцентную микрофотографии фибробластов кроличьего эмбриона, инфицированных vMyxgfp или vMyx135KO;
Фиг.38 представляет собой световую и флюоресцентную микрофотографии кроличьих фибробластов HIG82, инфицированных vMyxgfp или vMyx135KO;
Фиг.39 представляет собой световую и флюоресцентную микрофотографии первичных фибробластов человека, инфицированных vMyxgfp или vMyx135KO;
Фиг.40 представляет собой график температуры тела кроликов, инфицированных vMyxLau или vMyx135KO;
Фиг.41 представляет собой график эмиссий125I клеток, ложно инфицированных или инфицированных vMyxgfp или vMyx135KO и обработанных кроличьим интерфероном α/β, меченным125I;
Фиг.42 представляет собой график очагов, образованных инфицированием клеток RK13 или BGMK vMyxgfp или vMyx135KO, причем клетки были не обработаны или обработаны кроличьим интерфероном α/β за 24 ч до инфекции; и
Фиг.43 представляет собой фотографии вестерн блотов при использовании клеточных лизатов из клеток рака человека 786-0, которые были предварительно обработаны или 20 нМ рапамицина (R), или контролем носителя (D), зондированные с использованием антител, направленных против указанных белков.
Подробное описание
Ранее заявители обнаружили, что вирус миксомы дикого типа, вирус, который обычно инфицирует кроликов, может селективно инфицировать и уничтожать клетки, включая человеческие клетки, которые имеют недостаточную природную противовирусную реакцию, например клетки, которые не реагируют на интерферон, как описано в заявке PCT/CA2004/000341, которая полностью включена сюда в качестве ссылки. Вирус миксомы эффективно не реплицируется в нормальных клетках человека. Поскольку многие заболевания или состояния характеризуются наличием клеток, которые имеют недостаточную природную противовирусную реакцию, например, включая клетки, которые не реагируют на интерферон, например раковые клетки, вирус миксомы можно применять для лечения таких заболеваний и состояний, включая рак, при низкой токсичности для нормальных, здоровых клеток. Вирус миксомы можно также применять для лечения хронически инфицированных клеток, поскольку такие клетки имеют недостаточную природную противовирусную реакцию. Например, многие вирусы кодируют генные продукты, которые функционируют для ингибирования противовирусной, интерфероновой реакции клеток; вирус миксомы может селективно инфицировать такие клетки.
Вирус миксомы ("MV") представляет собой этиологический агент миксоматоза у кроликов. MV относится к роду Leporipoxvirus семейства Poxviridae, самого крупного из вирусов ДНК. MV вызывает заболевание у своего естественного хозяина, кролика Sylvilagus, в Северной и Южной Америке. Однако он представляет собой вирулентный и специфичный в отношении хозяина поксвирус, который вызывает летальное заболевание у европейских кроликов, характеризуемое поражениями, обнаруживаемыми системно, и особенно вокруг областей слизистых оболочек (Cameron C, Hota-Mitchell S, Chen L, Barrett J, Cao JX, Macaulay C, Willer D, Evans D, McFadden G. Virology 1999, 264(2): 298-318; Kerr P & McFadden G. Viral Immunology 2002, 15(2): 229-246).
MV представляет собой крупный вирус с геномом двухнитевой ДНК из 163 т.п.н., который реплицируется в цитоплазме инфицированных клеток (B. N. Fields, D. M. Knipe, P. M. Howley, Eds., Virology Lippincott Raven Press, New York, 2nd ed., 1996). Известно, что MV кодирует разнообразные клеточно-ассоциированные и секретируемые белки, которые, как считали, участвуют в подавляющей регуляции иммунных и воспалительных реакций хозяина и ингибировании апоптоза инфицированных вирусом клеток. MV может захватываться всеми соматическими клетками человека. Однако в отличие от нормальных соматических кроличьих клеток, если клетки имеют нормальную природную противовирусную реакцию, вирус не будет способен продуктивно инфицировать клетку, это означает, что вирус будет неспособен реплицироваться и вызывать гибель клетки.
Интерфероны ("IFNs") представляют собой семейство цитокинов, которые секретируются в ответ на разнообразные стимулы. Интерфероны связываются с рецепторами клеточной поверхности, активируя каскад передачи сигналов, который ведет к многочисленным клеточным реакциям, включая противовирусную реакцию и индукцию ингибирования роста и/или апоптозные сигналы. Интерфероны классифицируются или как I типа, или II типа. IFNs I типа включают IFN-α, -β, -τ и -ω, которые все являются мономерными; единственный IFN II типа представляет собой IFN-γ, димер. 12 различных подтипов IFN-α продуцируются 14 генами, но все другие IFNs являются моногенными (Arduini et al., 1999). IFNs оказывают прямое противоопухолевое действие посредством модуляции экспрессии онкогена. Избыточная экспрессия стимулирующих рост онкогенов или потеря онкогенов-опухолевых супрессоров может привести к злокачественной трансформации. Некоторые онкогены, участвующие в развитии рака, представляют собой p53, Rb, PC, NF1, WT1, DCC.
Вирус миксомы, так же как другие онколитические вирусы, такие как реовирус и VSV, должен обойти противовирусные защитные механизмы, которые существуют в нормальных, здоровых клетках, для того чтобы быть способным реплицироваться внутри клеток. MV и другие онколитические вирусы вызывают продукцию интерферона и в целом чувствительны к противовирусному эффекту пути IFN. Релевантные белки, индуцируемые противовирусной реакцией IFN и которые, главным образом, воздействуют на размножение вируса, включают PKR, OAS синтетазу и L нуклеазу РНазы. PKR активирует eIF2α, приводя к ингибированию трансляции и индукции апоптоза. Схематическое представление пути реакции IFN изображено на фиг.1. В нормальных клетках на MV непосредственно воздействует PKR и eIF2α.
Пути противовирусной реакции часто прерваны в раковых клетках. Например, сниженная или дефектная реакция на IFN представляет собой генетический дефект, который часто возникает во время процесса трансформации и опухолевого развития. Более 80% линий опухолевых клеток не реагируют на интерферон или проявляют нарушенные реакции на него (Stojdl et al., Cancer Cell (2003) 4: 263-275 и приведенные в документе ссылки; Wong et al. J Biol Chem. (1997) 272(45):28779-85; Sun et al. Blood. (1998) 91(2):570-6; Matin et al. Cancer Res. (2001) 61(5):2261-6; Balachandran et al. Cancer Cell (2004) 5(1):51-65). Как ранее описано в документе PCT/CA2004/000341, MV может инфицировать и уничтожать раковые клетки, включая человеческие опухолевые клетки, и без ограничения какой-либо конкретной теорией, считают, что MV может инфицировать эти клетки, потому что у них имеется недостаточная природная противовирусная реакция.
Имеющиеся данные свидетельствуют о том, что ингибирование ранней природной иммунной реакции и замедление развития реакций Th1 важны для эффективности онколитической терапии. Хотя вирус миксомы представляет собой вирулентный вирус, он специфичен в отношении хозяина и имеет очень узкий диапазон хозяев; он не инфицирует людей или мышей. Без ограничения какой-либо конкретной теорией, считают, что поскольку вирус миксомы представляет собой не человеческий вирус, он не должен столкнуться с ранее существовавшим иммунным распознаванием у людей. Поэтому его потенциал в качестве онколитического вируса будет меньше скомпрометирован, и вирус миксомы должен будет обеспечить более сильную инфекцию пермиссивных опухолевых клеток, чем нативные человеческие вирусы, и посредством этого может обеспечить эффективное онколитическое лечение рака.
Представляется, что ген М-Т5 диапазона хозяев вируса миксомы играет решающую роль во время инфекции вирусом миксомы многих линий клеток человеческих опухолей (Sypula et al, (2004) Gene Ther. Mol. Biol. 8:103). Ген МТ-5 кодирует белок повтора анкирина, который требуется для репликации вируса миксомы в кроличьих лимфоцитах, и вирус миксомы с делецией гена МТ-5 не может вызвать миксоматоз у восприимчивых кроликов (Mossman et al, (1996) J. Virol. 70: 4394). Имеющиеся доказательства свидетельствуют о том, что различия во внутриклеточной передаче сигналов внутри инфицированной человеческой опухолевой клетки имеют решающее значение для различения человеческих опухолевых клеток, которые пермиссивны к инфекции вирусом миксомы и продуктивной репликации (Johnston et al, (2003) J. Virol. 77: 5877).
Кроме того, вирус миксомы имеет белок, M135R, который проявляет гомологию с аминоконцевой частью рецептора интерферона α/β ("IFNα/β-R"). Предполагалось, что M135R имитирует IFNα/β-R хозяина для предотвращения запуска IFNα/β противовирусной реакции хозяина (Barrett et al., Seminars in Immunology (2001)13:73-84). Прогноз основан на гомологии последовательности с вирусным IFNα/β-R от вируса коровьей оспы, B18R, и было продемонстрировано, что вирус коровьей оспы ("VV") использует такую стратегию ухода от иммунных реакций. Однако M135R имеет только половину размера B18R VV и всех других гомологов IFNα/β-R из секвенированных поксвирусов и во всех случаях совпадает только с аминоконцевой половиной гомолога.
Заявители обнаружили, что даже хотя результаты иммунофлюоресценции свидетельствуют, что M135R локализуется на клеточной поверхности, попытки продемонстрировать способность M135R взаимодействовать с IFNα/β были отрицательными. Несмотря на эти результаты, заявители обнаружили, что делеция M135R резко ослабляет способность вируса миксомы вызвать заболевание у животных-хозяев, хотя вирус миксомы, имеющий такую делецию, одинаково эффективен в плане инфицирования и уничтожения клеток in vitro, в сравнении с MV дикого типа. Таким образом, в одном аспекте, изобретение относится к открытию, что вирус миксомы, который не экспрессирует функциональный M135R, можно использовать для обработки клеток, имеющих недостаточную природную противовирусную реакцию, включая применение для онколитических исследований, поскольку этот вирус предоставляет более безопасную альтернативу для онколитической вирусной терапии, поскольку для пациентов, подвергающихся лечению, не потребовались бы необычные стратегии сдерживания.
В другом аспекте, настоящее изобретение относится к открытию того, что противораковое средство рапамицин действует для усиления уровней инвазионной способности вируса миксомы в человеческих опухолевых клетках, которые пермиссивны в отношении инфекции вирусом миксомы, и что рапамицин обеспечивает возможность репликации определенных штаммов вируса миксомы в человеческих опухолевых клетках, которые без рапамицина рестриктивны в отношении репликации этих штаммов вируса миксомы. Клетка, которая пермиссивна в отношении инфекции вирусом миксомы, представляет собой клетку, в которую вирус может войти и в которой вирус может продуктивно воспроизводиться. Пермиссивная клетка может иметь дефекты мутаций в одном или более путей, которые вовлекают белки PTEN, PDK, AKT, GSK, Raf, mTOR или P70S6K. Рестриктивная клетка представляет собой клетку, которая пермиссивна в отношении вируса миксомы только в определенных условиях, но не допускает продуктивной инфекции в других условиях. Например, рестриктивная клетка может быть пермиссивной к штаммам дикого типа вируса, но не допускает продуктивного воспроизведения определенных мутантных штаммов вируса миксомы, например штамма, имеющего «выключенный» ген МТ-5. В другом примере, клетка, рестриктивная в отношении вируса миксомы, может не допустить продуктивной инфекции одного вируса миксомы, но при обработке рапамицином тот же вирус миксомы способен продуктивно инфицировать клетку. Линии абортивных клеток не пермиссивны в отношении инфекции вирусом миксомы, означая, что вирус может быть способен войти в клетку, но продуктивно не инфицирует клетку.
Таким образом, рапамицин при использовании в комбинации с вирусом миксомы усиливает инвазионную способность вируса миксомы в отношении клеток, имеющих недостаточную природную противовирусную реакцию. Настоящее изобретение относится к применению рапамицина в комбинации с вирусом миксомы для обработки клеток, имеющих недостаточную природную противовирусную реакцию.
Рапамицин представляет собой макроциклический лактон, который, как было показано, представляет собой активное противогрибковое соединение, очищенное из почвенной бактерии Streptomyces hygroscopicus. Используемый здесь термин «рапамицин» относится к рапамицину (также именуемому сиролимусом) и его аналогам или производным, способным образовывать комплексы с FKBP12 и ингибировать mTOR, включая аналоги CCI-779 (также именуемый как ингибитор клеточного цикла-779 или рапамицин-42,2,2-бис(гидроксиметил)пропионовая кислота) и RAD001 (также именуемый как эверолимус или 40-О-(2-гидроксиэтил)рапамицин). Рапамицин, CCI-779 и RAD001 имеются в продаже, и рапамицин имеется под названием «РапамунТМ» от компании Wyeth-Ayerst. Термин «рапамицин», кроме того, включает фармацевтически приемлемые соли и сложные эфиры рапамицина, его гидраты, сольваты, полиморфы, аналоги или производные, а также пролекарства или предшественники, которые метаболизируются или превращаются в рапамицин или его аналоги или производные во время применения, например при введении пациенту.
Рапамицин в качестве ингибитора передачи сигналов клетками является высоко специфичным: он входит в клетку и связывается с клеточным белком, известным как FKBP12. Затем комплекс рапамицин/FKBP12 связывается с определенной клеточной мишенью mTOR (мишень рапамицина млекопитающих). Было показано, что многие формы рака развиваются в результате избыточной активности передающих сигналы молекул, таких как P13K, или потери гена PTEN, подавляющего опухоли. Обе эти молекулы находятся выше mTOR. Было показано, что mTOR является центральным регулятором пролиферации, роста, дифференциации, миграции и выживания клеток, и он поэтому является идеальной мишенью при сдерживании неконтролируемого роста раковых клеток. Линии раковых клеток, которые чувствительны к рапамицину, в целом представляют собой те, которые появились в результате активации пути через mTOR.
Рапамицины используются в первую очередь у пациентов после трансплантации в качестве лечения, альтернативного или дополнительного к лечению циклоспорином. У пациентов после трансплантации лечение рапамицином дает меньшее количество побочных эффектов, чем циклоспорином А или FK506. Кроме того, ретроспективные исследования указали на то, что у пациентов, получающих лечение рапамицином, меньше развиваются раковые опухоли, и у них реже возникает инфекция CMV (цитомегаловирусом; вирусом герпеса). Поэтому удивительно, что лечение рапамицином усиливает инфекцию раковых клеток вирусом миксомы, в частности, в свете исследования, постулирующего, что репликация CMV должна уменьшаться рапамицином (обзор Ponticelli: "The pleiotropic effects of mTOR inhibitors" in J Nephrology 2004; 17: 762). Без ограничения конкретной теорией, возможно, что вирус миксомы использует преимущество аберратной передачи сигналов через путь mTOR, который может быть связан с неопластическим фенотипом этих клеток. Манипуляция этим путем ингибиторами mTOR может затем быть селективным преимуществом для вируса.
Таким образом, предоставляется способ ингибирования клетки, которая имеет недостаточность природной противовирусной реакции, включающий введение в клетку эффективного количества вируса миксомы. В еще одном варианте осуществления, вирус вводится в комбинации с эффективным количеством рапамицина.
Вирус миксомы может представлять собой любой вирус, который относится к виду Leporipoxvirus поксвирусов и который является репликационно компетентным. Вирус миксомы может представлять собой штамм дикого типа вируса миксомы, или он может представлять собой генетически модифицированный штамм вируса миксомы, включая штамм вируса миксомы с «выключенным» МТ-5. Вирус миксомы может представлять собой штамм, который оказывает ослабленное воздействие на кроликов, посредством этого вызывая меньший риск заболевания, включая штамм, который не экспрессирует функциональный белок М135, как описано ниже.
В определенном варианте осуществления, вирус миксомы представляет собой вирус миксомы, который не экспрессирует функциональный M135R.
Вирус миксомы, который не экспрессирует функциональный M135R, включает вирус миксомы, который имеет часть или всю открытую рамку считывания, кодирующую M135R, подвергнутую делеции, замещению или прерыванию так, что не экспрессируется ни генный продукт, ни устойчивый генный продукт или не функциональный генный продукт. Такой вирус также включает вирус миксомы, который имеет часть, или всю регуляторную область гена, подвергнутую делеции, замещению или прерыванию так, что ни один белок не может быть экспрессирован из гена, кодирующего M135R. Функциональный белок M135R представляет собой M135R, который подвергнут транскрипции, трансляции, укладке, пост-трансляционной модификации и локализации внутри клетки и который дает возможность вирусу миксомы вызвать миксоматоз у инфицированного хозяина. Если белок M135R не подвергнут или неправильно или недостаточно подвергнут транскрипции, трансляции, укладке, пост-трансляционной модификации или локализации внутри клетки, так что у инфицированного хозяина не развивается миксоматоз, то функциональный белок M135R не экспрессирован в клетке.
В еще одном варианте осуществления клетка не реагирует на интерферон.
В определенных вариантах осуществления, клетка представляет собой раковую клетку млекопитающего. В одном варианте осуществления, клетка представляет собой раковую клетку человека, включая клетку солидной опухоли человека.
В другом варианте осуществления, клетка хронически инфицирована вирусом.
«Комбинация» рапамицина и вируса миксомы для введения может составляться вместе с такой же лекарственной формой или может быть составлена в отдельные лекарственные формы, и отдельные лекарственные формы могут представлять собой такую же форму или другие формы для введения таким же путем или другими путями введения. Кроме того, введение комбинации рапамицина и вируса миксомы, когда они не включены вместе в одну и ту же лекарственную форму, означает, что рапамицин и вирус миксомы вводятся одновременно подвергаемому лечению млекопитающему, и их можно вводить в одно и то же время или последовательно в любом порядке или в различные точки времени. Таким образом, рапамицин и вирус миксомы можно вводить отдельно, но достаточно близко по времени с тем, чтобы обеспечить желательный терапевтический эффект.
Используемый здесь термин «эффективное количество» означает количество, эффективное в дозировках и в течение периодов времени, необходимых для достижения желаемого результата.
Используемый здесь термин «клетка, которая имеет недостаточную природную противовирусную реакцию» относится к клетке, которая при контакте с вирусом или при инвазии вирусом не вызывает противовирусных защитных механизмов, которые включают ингибирование вирусной репликации, продукцию интерферона, индукцию пути реакции интерферона и апоптоз, который может не быть или быть опосредованным интерфероном и ввиду этого может инфицироваться MV, отдельно или в комбинации с обработкой рапамицином. Этот термин включает клетку, которая имеет сниженную или дефектную природную противовирусную реакцию при воздействии инфекции вирусом по сравнению с нормальной клеткой, например не инфицированной или не раковой клеткой. Он включает клетку, которая не реагирует на интерферон, и клетку, которая имеет сниженную или дефективную апоптозную реакцию или индукцию апоптозного пути. Недостаточность может быть вызвана различными причинами, включая инфекцию, генетический дефект или экологический стресс. Однако следует понимать, что, когда недостаточность вызвана ранее существовавшей инфекцией, суперинфекция MV может быть исключена, и специалист в данной области может легко идентифицировать такие случаи. Специалист в данной области может легко определить без ненужного экспериментирования, будет ли любой данный тип клеток иметь недостаточную природную противовирусную реакцию, и поэтому, может ли он инфицироваться вирусом миксомы, отдельно или в комбинации с обработкой рапамицином. Например, VSV обычно используется для измерения противовирусной реакции клетки.
Для оценки того, имеет ли данный тип клеток, например данный тип раковых клеток, недостаточную природную противовирусную реакцию, специалист в данной области может взять эксплантат, вырастить некоторые из клеток in vitro и определить возможность инфекции VSV или альтернативно, вирусом миксомы, включая вирус миксомы в комбинации с рапамицином.
Термин «клетка, которая не реагирует на интерферон», используемый во всем описании, означает клетку, которая не реагирует на активность интерферона, например противовирусную или противоопухолевую активность интерферона, или которая имеет аномальную реакцию на интерферон, например сниженную или неэффективную реакцию на интерферон, или аномальную передачу сигналов интерферона, по данным измерения, например, фосфорилирования или активации передающих сигналы молекул, таких как транскрипционные факторы, например STAT1. Например, без ограничения, клетка может не подвергаться ингибированию пролиферации или она может не уничтожаться при контакте с уровнями интерферона, достаточными для индукции такой реакции в клетке, которая реагирует на интерферон. Клетка, которая не реагирует на интерферон, может иметь дефект во внутриклеточном пути передачи сигналов, или путей, которые обычно активируются в реагирующих клетках. Обычно восприимчивость к инфекции VSV указывает на отсутствие реакций на интерферон, и специалист в данной области может легко определить, является ли конкретная клетка не реагирующей на интерферон по его способности (или ее отсутствию) ингибировать инфекцию VSV в присутствии интерферона или с использованием других маркеров активности интерферона, известного в данной области, например, уровня экспрессии генов, стимулированных IFN, таких как PKR, STAT, OAS, MX.
Термин «подходящий (компетентный) для репликации», используемый во всем описании, относится к вирусу, который способен инфицировать и реплицироваться внутри определенной клетки-хозяина. Он включает вирус, который ограничен для репликации в определенной клетке-хозяине, но когда клетка-хозяин обработана рапамицином, вирус затем может продуктивно инфицировать эту клетку.
Используемый здесь термин «клетка» включает одну клетку, а также множество или популяцию клеток. Введение агента в клетку включает введение и in vitro, и in vivo.
Используемый здесь термин «животное» включает всех членов мира животных, включая, в частности, млекопитающих, особенно людей.
Термин «ингибирование» клетки, которая имеет недостаточную природную противовирусную реакцию, включает гибель клетки под воздействием лизиса или апоптоза или других механизмов гибели клеток, в дополнение к приданию клетке неспособности роста или деления или уменьшения или задержки клеточного роста или деления.
Геном вируса миксомы можно легко модифицировать для экспрессирования одного или более терапевтических трансгенов с использованием стандартных методик молекулярной биологии, известных специалисту в данной области, и описанных, например, в документе Sambrook et al. ((2001) Molecular Cloning: a Laboratory Manual, 3rd ed., Cold Spring Harbour Laboratory Press). Специалист в данной области сможет легко определить, какая часть генома вируса миксомы может быть подвергнута делеции так, чтобы вирус все же был способен к продуктивной инфекции. Например, несущественные области вирусного генома, которые могут быть удалены, определяют за счет сравнения опубликованной последовательности вирусного генома с геномами других достаточно охарактеризованных вирусов (см., например, C. Cameron, S. Hota-Mitchell, L. Chen, J. Barrett, J.-X. Cao, C. Macaulay, D. Willer, D. Evans, and G. McFadden, Virology (1999) 264: 298-318)).
Используемый здесь термин «терапевтический ген» или «терапевтические трансгены» предназначен для широкого описания любого гена, экспрессия которого воздействует на желаемый результат, например противораковый эффект. Например, вирус может быть модифицирован для ношения гена, который усилит противораковый эффект вирусного лечения. Такой ген может представлять собой ген, который участвует в запуске апоптоза или участвует в нацеливании инфицированной клетки для иммунного разрушения, такой как ген, который восстанавливает отсутствие реакции на интерферон или который приводит к экспрессии маркера клеточной поверхности, который стимулирует реакцию антитела, такого как антигена бактериальной клеточной поверхности. Вирус может быть также модифицирован для экспрессии генов, участвующих в отключении пролиферации и роста неопластической или раковой клетки, посредством этого предотвращая деление клетки. Вирус может быть также модифицирован для включения терапевтических генов, таких как гены, участвующие в синтезе химиотерапевтических средств, или он может быть модифицирован для того, чтобы иметь повышенные уровни репликации в клетках определенного вида, от которого получены клетки, подлежащие ингибированию или уничтожению, например человеческие клетки. Определенные примеры генов, которые могут быть вставлены в вирус миксомы для увеличения его противоракового эффекта, включают человеческий ген для белка TRAIL, или аденовирусный ген, который кодирует полипептид E4 orf4, причем оба белка участвуют в уничтожении человеческих опухолевых клеток.
Следует понимать, что терапевтический эффект вируса миксомы, включая применение в комбинации с рапамицином, может быть достигнут лизисом клетки вирусом или доставкой терапевтических продуктов вирусом. Включение рапамицина в комбинацию с вирусом миксомы должно обеспечить возможность усиления эффекта одного вируса миксомы. То есть вирус миксомы при введении в комбинации с рапамицином должен быть способен продуктивно инфицировать большее число клеток-мишеней, имеющих недостаточную природную противовирусную реакцию, которые являются рестриктивными в отношении продуктивной инфекции вирусом миксомы в отсутствие рапамицина.
Вирус можно получить, используя стандартные методики, известные в данной области. Например, вирус можно получить инфицированием культивированных кроличьих клеток штаммом вируса миксомы, который предстоит использовать, давая возможности инфекции прогрессировать, так что вирус реплицируется в культивированных клетках и может высвобождаться стандартными способами, известными в данной области, для разрушения клеточной поверхности и посредством этого высвобождения вирусных частиц для сбора. После сбора вирус титра можно определить инфицированием слившейся культуры кроличьих клеток и выполнением анализа бляшки (см. Mossman et al. (1996) Virology 215:17-30).
Предоставляется также способ лечения патологического состояния, характеризуемого наличием клеток, которые имеют недостаточную природную противовирусную реакцию у пациента, нуждающегося в таком лечении, включающий введение пациенту эффективного количества вируса миксомы в комбинации с рапамицином. Пациент может представлять собой любое животное, включая млекопитающее, включающее человека.
Используемый здесь термин «патологическое состояние, характеризуемое наличием клеток, которые имеют недостаточную природную противовирусную реакцию», включает любое заболевание, расстройство или состояние, которое связано, относится или для которого характерно присутствие клеток, которые имеют недостаточную природную противовирусную реакцию, и такое заболевание, расстройство, состояние или симптомы, которые можно лечить уничтожением этих клеток. Например, патологическое состояние может представлять собой рак. Патологическое состояние может также включать хроническую инфекцию вирусом.
«Лечение» патологического состояния относится к подходу для получения благоприятных или желательных результатов, включая клинические результаты. Благоприятные или желательные клинические результаты могут означать, без ограничения, облегчение или смягчение одного или более симптомов или состояний, уменьшение степени заболевания, стабилизацию состояния или заболевания, предотвращение развития заболевания, предотвращение распространения заболевания, задержку или замедление прогрессирования заболевания, задержку или замедление начала заболевания, ослабление или паллиативное лечение патологического состояния и ремиссию (частичную или полную). «Лечение» может также означать продление выживания пациента сверх срока, ожидаемого в отсутствие лечения. «Лечение» может также означать ингибирование прогрессирования заболевания, временное замедление прогрессирования заболевания, хотя предпочтительнее, оно включает постоянное прекращение прогрессирования заболевания.
В одном варианте осуществления, патологическое состояние представляет собой рак. Рак может представлять собой любой тип рака, при котором, по меньшей мере, некоторые клетки, хотя необязательно все клетки, имеют недостаточную природную противовирусную реакцию. В одном варианте осуществления, рак может представлять собой рак, при котором, по меньшей мере, некоторые из клеток не реагируют на интерферон. Используемые здесь термины «опухоль», «опухолевые клетки», «рак» и «раковые клетки» (используемые взаимозаменяемо) относятся к клеткам, которые проявляют аномальный рост, характеризуемый значительной потерей регуляции клеточной пролиферации или клеток, которые были иммортализованы. Термин «рак» или «опухоль» включает метастатический, а также не метастатический рак или опухоли. Используемый здесь термин «неопластический» или «новообразование» широко относится к клетке или клеткам, которые пролиферируют без нормальных механизмов ингибирования роста, и поэтому включает доброкачественные опухоли, в дополнение к раку, а также диспластические или гиперпластические клетки.
Рак можно диагностировать, используя критерии, в целом принятые в данной области, включая наличие злокачественной опухоли.
Типы рака, которые можно лечить в соответствии с настоящим изобретением, включают без ограничения формы рака из гематопоэтических клеток, включая лейкозы и лимфомы, рак ободочной кишки, рак легких, рак почек, рак поджелудочной железы, рак эндометрия, рак щитовидной железы, рак ротовой полости, рак яичников, рак гортани, печеночноклеточный рак, рак желчных протоков, плоскоклеточную карциному, рак молочных желез, рак шейки матки, рак ободочной и прямой кишки, меланомы и другие опухоли. Солидные опухоли, такие как саркомы и карциномы, включают без ограничения фибробластому, миксосаркому, липосаркому, хондросаркому, остеогенную саркому и другие саркомы, синовиому, мезотелиому, опухоль Эвинга, лейомиосаркому, рабдомиосаркому, карциному ободочной кишки, злокачественные поражения лимфоидной ткани, рак поджелудочной железы, рак молочных желез, раковые опухоли легких, рак яичников, рак предстательной железы, печеночноклеточную карциному, плоскоклеточную карциному, базальноклеточную карциному, аденокарциному, карциному потовых желез, карциному сальных желез, папиллярную карциному, папиллярные аденокарциномы, медуллярную карциному, бронхогенную карциному, почечноклеточную карциному, гепатому, карциному желчных протоков, хорнокарциному, опухоль Уилмса, рак шейки матки, опухоль семенников, карциному мочевого пузыря и опухоли ЦНС (такие как глиома, астроцитома, медуллобластома, краниофарингиома, эпендимома, пиеалома, гемангидобластома, неврома слухового нерва, олигодендроглиома, менангиома, меланома, нейробластома и ретинобластома).
В другом варианте осуществления, патологическое состояние представляет собой хроническую вирусную инфекцию.
Хронически инфицирующий вирус может представлять собой любой вирус, который инфицирует и реплицируется в клетках животного устойчивым образом в течение длительного периода так, чтобы вызвать патологическое состояние. Хронически инфицирующий вирус может представлять собой вирус, который связан или коррелируется с развитием рака.
Хроническую инфекцию вирусом можно диагностировать с использованием стандартных способов, известных в данной области. Например, хроническую вирусную инфекцию можно выявить по присутствию противовирусных антител у пациента или положительного теста на присутствие вирусной РНК или ДНК в клетках пациента.
При введении пациенту эффективное количество вируса миксомы и, необязательно, комбинации вируса миксомы с рапамицином представляет собой требуемое количество, в дозировках и в течение достаточного периода времени для того, чтобы облегчить, улучшить, приглушить, ослабить, стабилизировать, предотвратить распространение вируса, замедлить или отсрочить прогрессирование или излечить заболевание. Например, оно может представлять собой количество, достаточное для достижения эффекта уменьшения количества или разрушения раковых клеток или неопластических клеток, или уменьшения количества или разрушения клеток, хронически инфицированных вирусом, или ингибирования роста и/или пролиферации таких клеток.
Эффективное количество, подлежащее введению, может варьироваться, в зависимости от многих факторов, таких как фармакодинамические свойства вируса миксомы и, необязательно, рапамицина, путей введения, возраста, состояния здоровья и массы пациента, природы и степени патологического состояния, частоты лечения и типа сопутствующего лечения, если оно проводится, и вирулентности и титра вируса.
Специалист в данной области может определить соответствующее количество вируса миксомы для введения на основании указанных выше факторов. Вирус можно вводить первоначально в подходящем количестве, которое можно подобрать в соответствии с требованиями, в зависимости от клинической реакции пациента. Эффективное количество вируса можно определить эмпирически, и оно зависит от максимального количества вируса, которое можно безопасно ввести, и минимального количества вируса, которое дает желаемый результат.
Вирус миксомы можно ввести пациенту, используя стандартные способы введения. В одном варианте осуществления, вирус вводится системно, в другом варианте осуществления, вирус вводится инъекцией в пораженный патологическим процессом участок. В определенном варианте осуществления, патологическое состояние представляет собой солидную опухоль, и вирус вводится инъекцией в участок опухоли. В различных вариантах осуществления, вирус можно вводить перорально или парентерально, или любым стандартным способом, известным в данной области.
Для получения такого же клинического эффекта при системном введении вируса как эффект, достигаемый посредством инъекции вируса в пораженный патологическим процессом участок, может потребоваться введение значительно больших количеств вируса. Однако соответствующий уровень дозы должен представлять собой минимальное количество, которое бы достигло желательного результата.
Концентрация подлежащего введению вируса будет варьироваться в зависимости от вирулентности конкретного штамма вируса миксомы, который предстоит ввести, и от природы клеток, на которые происходит нацеливание. В одном варианте осуществления, человеку-пациенту вводится доза, менее чем примерно 109 бляшкообразующих единиц ("pfu"). В различных вариантах осуществления, в одной дозе можно вводить от примерно 102 до примерно 109 pfu, от примерно 102 до примерно 107 pfu, от примерно 103 до примерно 106 pfu или от примерно 104 до примерно 105 pfu.
Специалист в данной области может также определить, используя указанные выше факторы, соответствующее количество рапамицина для введения пациенту. Эффективное количество рапамицина можно определить эмпирически, и оно будет зависеть от количеств и штамма вводимого вируса, максимального количества рапамицина, которое можно безопасно ввести, и минимального количества рапамицина, которое можно ввести для достижения усиления инфицирующей способности вируса миксомы.
Рапамицин можно вводить пациенту, используя стандартные способы введения. В одном варианте осуществления, рапамицин вводится системно. В другом варианте осуществления, рапамицин вводится инъекцией в пораженный патологическим процессом участок. В определенном варианте осуществления, патологическое состояние представляет собой солидную опухоль, и рапамицин вводится инъекцией в участок опухоли. В различных вариантах осуществления, рапамицин можно вводить перорально, или парентерально, или любым стандартным способом, известным в данной области.
Общее количество рапамицина можно вводить в одной дозе или в множественных дозах, распределенных в пределах одного дня или нескольких дней. Частоту и длительность введения доз можно легко определить. Схема введения будет зависеть от длительности периода времени, в течение которого предстоит вводить вирус миксомы. Например, рапамицин можно вводить пациенту однократно или 2-4 раза/день.
В различных вариантах осуществления доза рапамицина может составлять от примерно 0,01 до примерно 250 мг/кг масс тела/день, от примерно 0,01 до примерно 50 мг/кг масс тела/день, от примерно 0,05 до примерно 10 мг/кг масс тела/день или от примерно 0,1 до 7,5 мг/кг масс тела/день.
Эффективные количества комбинации вируса миксомы и рапамицина можно вводить повторно, в зависимости от эффекта первоначальной схемы лечения. Введения обычно проводятся периодически под контролем любой реакции. Специалисту в данной области будет понятно, что можно вводить более низкие или более высокие дозировки, чем те, которые указаны выше, в соответствии с выбранными схемами и путями введения.
Вирус миксомы, необязательно в комбинации с рапамицином, можно вводить в качестве единственного лечения, или их можно вводить в комбинации с другими способами лечения, включая химиотерапию, лучевую терапию или другие виды противовирусной терапии. Например, вирус миксомы, необязательно в комбинации с рапамицином, можно вводить или перед, или после хирургического удаления первичной опухоли, или перед, одновременно или после такого лечения, как назначение лучевой терапии или обычного химиотерапевтического средства. В одном варианте осуществления, вирус миксомы, необязательно в комбинации с рапамицином, можно вводить в комбинации или последовательно с другими онколитическими вирусами, которые могут демонстрировать специфичность в отношении меняющихся типов опухолевых клеток.
Для содействия введению вирус миксомы, необязательно в комбинации с рапамицином, можно включать в качестве ингредиента в фармацевтическую композицию. Поэтому, в еще одном варианте осуществления, предоставляется фармацевтическая композиция, включающая вирус миксомы и, необязательно, рапамицин и фармацевтически приемлемый разбавитель. Изобретение в одном аспекте также включает такие фармацевтические композиции для применения при ингибировании клетки, которая имеет недостаточную природную противовирусную реакцию, или лечении патологического состояния, характеризуемого наличием клеток, которые имеют недостаточную природную противовирусную реакцию. Композиции могут обычно содержать фармацевтически приемлемые концентрации солей, буферных агентов, консервантов и различных совместимых носителей. Для всех форм доставки рекомбинантный вирус миксомы может быть включен в препаративную форму в физиологическом солевом растворе.
Фармацевтические композиции могут содержать дополнительные терапевтические агенты, такие как дополнительные противораковые агенты. В одном варианте осуществления, композиции включают химиотерапевтический агент. Химиотерапевтический агент, например, может по существу представлять собой любое средство, которое проявляет онколитический эффект против раковых клеток или неопластических клеток пациента и которое не ингибирует или уменьшает уничтожающий опухоль эффект вируса миксомы. Например, химиотерапевтический агент может представлять собой без ограничения антрациклин, алкилирующий агент, алкилсульфонат, азиридин, этиленимин, метилметамин, азотистый иприт, нитрозомочевину, антибиотик, антиметаболит, аналог фолиевой кислоты, аналоги пурина, аналог пиримидина, фермент, подофиллотоксин, средство, содержащее платину, или цитокин. Предпочтительно химиотерапевтический агент эффективен против определенного типа клеток, которые являются раковыми или неопластическими.
Доля и идентичность фармацевтически приемлемого разбавителя определяется выбранным путем введения, совместимостью с живым вирусом и, если необходимо, совместимостью с химической устойчивостью рапамицина, и стандартной фармацевтической практикой. В целом, фармацевтическую композицию следует составлять компонентами, которые существенно не нарушат биологические свойства живого вируса миксомы или вызовут деградацию или снизят устойчивость или эффективность рапамицина при его включении.
Фармацевтическую композицию можно получить известными способами получения фармацевтически приемлемых композиций, подходящих для введения пациентам так, чтобы эффективное количество активного вещества или веществ объединялось в смесь с фармацетивчески приемлемым носителем. Подходящие носители описаны, например, в руководстве Remington's Pharmaceutical Sciences (Remington's Pharmaceutical Sciences, Mack Publishing Company, Easton, Pa., USA 1985). На этом основании композиции включают, хотя и не обязательно, растворы вируса миксомы, необязательно, с рапамицином, в сочетании с одним или более фармацевтически приемлемым носителем или разбавителем и содержатся в буферных растворах с подходящим рН и изоосмотичны физиологическим жидкостям.
Фармацевтическую композицию можно вводить пациенту в разнообразных формах, в зависимости от выбранного пути введения, как будет понятно специалистам в данной области. Композицию по изобретению можно вводить перорально или парентерально. Парентеральное введение включает внутривенный, внутрибрюшинный, подкожный, внутримышечный, трансэпителиальный, интраназальный, внутрилегочный, внутритрахеальный, ректальный и местный способы введения. Парентеральное введение может представлять собой непрерывное вливание в течение выбранного периода времени.
Фармацевтическую композицию можно вводить перорально, например, с инертным разбавителем или ассимилируемым носителем, или ее можно заключить в желатиновые капсулы с твердой или мягкой оболочкой, или ее можно спрессовать в таблетки. Для перорального терапевтического введения вирус миксомы может быть включен, необязательно вместе с рапамицином, с эксципиентом и может применяться в форме принимаемых внутрь таблеток, буккальных таблеток, лепешек, пастилок, капсул, эликсиров, суспензий, сиропов, вафель и им подобных форм.
Растворы вируса миксомы, необязательно вместе с рапамицином, могут быть получены в физиологически подходящем буфере. В обычных условиях хранения и применения эти препараты содержат консервант для предотвращения роста микроорганизмов, но он не должен инактивировать живой вирус. Специалисту в данной области должно быть известно, как получить подходящие препаративные формы. Обычные процедуры и ингредиенты для выбора и получения подходящих препаративных форм описаны, например, в руководстве Remington's Pharmaceutical Sciences and in The United States Pharmacopeia: The National Formulary (USP 24 NF19) published in 1999.
В различных вариантах осуществления композиция вводится инъекцией (подкожно, внутривенно, внутримышечно и т.д.) непосредственно в участок поражения, например в участок опухоли, или путем перорального введения, альтернативно, трансдермальным введением.
Формы фармацевтической композиции, подходящие для инъекционного применения, включают стерильные водные растворы или дисперсии и стерильные порошки для приготовления перед применением стерильных водных растворов или дисперсий, причем термин «стерильные дозы» не распространяется на сам живой вирус миксомы, который предстоит вводить. Во всех случаях форма должна быть стерильной и должна быть жидкой в той степени, пока она может быть легко набрана в шприц.
Доза фармацевтической композиции, которую предстоит применить, зависит от конкретного состояния, подвергаемого лечению, тяжести состояния, индивидуальных показателей пациента, включающих возраст, физического состояния, размера и массы, длительности лечения, природы сопутствующего лечения (если оно имеет место), определенного пути введения и других аналогичных факторов, которые находятся в пределах знаний и компетенции медицинского работника. Эти факторы известны специалистам в данной области, и их можно определить при минимальном обычном экспериментировании.
Вирус миксомы, необязательно в комбинации с рапамицином, или фармацетивческие композиции, включающие вирус миксомы и рапамицин, или вместе в одной и той же препаративной форме, или в различных препаративных формах, могут также быть упакованы в виде набора, содержащего инструкции по применению вируса миксомы и рапамицина, включая применение вируса миксомы, или применение вируса миксомы в комбинации с рапамицином, для ингибирования клетки, которая имеет недостаточную природную противовирусную реакцию, или применение вируса миксомы в комбинации с рапамицином, для лечения патологического состояния, характеризуемого наличием клеток, которые имеют недостаточную природную противовирусную реакцию, у нуждающегося в нем пациента. Патологическое состояние может представлять собой рак, или оно может представлять собой хроническую вирусную инфекцию.
Настоящее изобретение также предусматривает применение вируса миксомы, необязательно в комбинации с рапамицином, для ингибирования клетки, которая имеет недостаточную природную противовирусную реакцию. В одном варианте осуществления, клетка не реагирует на интерферон. Кроме того, предоставляется применение вируса миксомы, необязательно в комбинации с рапамицином, для лечения заболевания, характеризуемого наличием клеток, которые имеют недостаточную природную противовирусную реакцию, у нуждающегося пациента. В одном варианте осуществления, патологическое состояние представляет собой рак. Предлагается также применение вируса миксомы, необязательно в комбинации с рапамицином, для изготовления лекарственного препарата для ингибирования клетки, которая имеет недостаточную природную противовирусную реакцию или для лечения заболевания, характеризуемого наличием клеток, которые имеют недостаточную природную противовирусную реакцию, у нуждающегося пациента.
MV может селективно инфицировать клетки животных, отличных от естественного хозяина MV или полученных у них, из популяции клеток, которые имеют недостаточную природную противовирусную реакцию. Эта способность MV обеспечивает применение MV при выявлении клеток из популяции клеток, или в культуре, или у животного, которые имеют недостаточную природную противовирусную реакцию, включая клетки, которые не реагируют на интерферон. Иначе, такие клетки могут быть трудно выявляемыми, например определенные раковые клетки, которые еще не развились в пальпируемую опухоль, или еще не вызывали выявляемые симптомы у животного.
Таким образом, в одном варианте осуществления предоставляется способ выявления клеток, которые имеют недостаточную природную противовирусную реакцию у пациента, включающий введение пациенту вируса миксомы, модифицированного для экспрессии выявляемого маркера, необязательно, в комбинации с рапамицином; предоставление вирусу возможности инфицировать клетку, которая имеет недостаточную природную противовирусную реакцию, у пациента; и выявление клетки, экспрессирующей выявляемый маркер у пациента.
Инфицированные клетки можно выявить, используя любой обычный способ визуализации диагностических изображений. Способ выявления будет зависеть от конкретного выявляемого маркера, который используется. Например, клетки, инфицированные вирусом миксомы, генетически модифицированного для экспрессии флюоресцентного белка можно выявить, используя флюоресцентную цифровую визуализирующую микроскопию. Другие способы включают компьютерную томографию (CT), сканирование всего тела, такое как позитронно-эмиссионная томография (PET), магнитно-резонансная визуализация (MRI), и ультразвуковое исследование. Специалисты в данной области смогут определить соответствующий способ выявления определенного выявляемого маркера.
Выявляемый маркер включает без ограничения любой маркер, для которого гены для экспрессии или синтеза можно вставить в геном миксомы для того, чтобы привести к экспрессии или синтезу маркера внутри клеток, которые инфицированы модифицированным вирусом. Например, в одном варианте осуществления, выявляемый маркер может представлять собой флюоресцентный белок. Инфицированные клетки можно выявить через подходящий интервал времени после введения модифицированного вируса пациенту для того, чтобы дать возможность вирусу инфицировать любые клетки, которые имеют недостаточную природную противовирусную реакцию, и экспрессировать выявляемый маркер в таких клетках на уровнях, которые обеспечивают возможность выявления. Например, выявление может происходить в любое время между 2 и 20 днями после введения пациенту вируса, генетически модифицированного для экспрессии флюоресцентного белка.
Способ выявления можно проводить повторно через интервалы у пациента для мониторинга присутствия клеток, которые имеют недостаточную природную противовирусную реакцию, у этого пациента. Например, способ выявления таких клеток с использованием вируса миксомы можно проводить у пациента через интервалы 6 мес, 1 год или 2 года в соответствии с необходимостью, в зависимости от природы клеток, которые имеют недостаточную природную противовирусную реакцию, и природы любого патологического состояния, вызванного в результате присутствия таких клеток у пациента. Повторение способа в течение периода времени позволяет проводить мониторинг прогрессирования или ремиссии патологического состояния или распространения заболевания в организме пациента.
Вирус миксомы способен селективно инфицировать клетки, которые имеют недостаточную природную противовирусную реакцию, и может применяться в качестве индикатора такой недостаточности в клетках. Таким образом, клетки, взятые у пациента, можно анализировать на наличие недостаточной природной противовирусной реакции, используя способы по настоящему изобретению. Такое определение может при комбинации с другими индикаторами указать на то, что пациент может страдать определенным патологическим состоянием, например раком.
В одном варианте осуществления, предоставляется способ выявления в образце клетки, которая имеет недостаточную природную противовирусную реакцию, включающий культивирование клетки, контакт культивированной клетки с вирусом миксомы, необязательно, в комбинации с рапамицином; и определение инвазионной способности клеток вирусом миксомы.
Клетки могут быть удалены у индивидуума, включая человека, с использованием методов биопсии. Способ биопсии будет зависеть от локализации и типа клеток, которые предстоит тестировать.
Клетки культивируются в соответствии с известными методиками культивирования и контактируют с MV и, необязательно, рапамицином, добавлением вируса миксомы и, необязательно, рапамицина к культуральной среде. Когда вирус миксомы добавляется в комбинации с рапамицином, то вирус и рапамицин можно добавлять или одновременно, или последовательно. Множественность инфекции ("MOI"), включая присутствие рапамицина, может варьироваться для определения оптимальной MOI для данного типа клеток, плотности и методики культивирования, и определенной концентрации рапамицина, используя положительную контрольную клеточную культуру, которая известна как инфицированная после контакта с MV.
Количество рапамицина и определение времени добавления рапамицина и вируса миксомы к культивируемым клеткам может варьироваться, в зависимости от типа клеток, способа культивирования и штамма вируса. Такие параметры можно легко тестировать и регулировать при минимальном тестировании с использованием обычных способов.
Инвазионную способность культивированных клеток MV, включая в присутствии рапамицина, можно определить различными способами, известными специалисту в данной области, включая способность MV вызывать гибель клеток. Возможно также включать добавление реагентов к клеточной культуре для завершения ферментативного или химического взаимодействия с продуктом вирусной экспрессии. Продукт вирусной экспрессии может быть экспрессирован из гена-репортера, который был вставлен в геном MV.
В одном варианте осуществления, MV может быть модифицирован для облегчения выявления состояния инфекции. Например, MV может быть генетически модифицирован для экспрессии маркера, который может быть легко выявлен фазовоконтрастной микроскопией, флюоресцентной микроскопией или радиовизуализацией. Маркер может представлять собой экспрессированный флюоресцентный белок или экспрессированный фермент, который может участвовать в калориметрической реакции или реакции радиоактивной метки. В другом варианте осуществления, маркер может представлять собой генный продукт, который прерывает или ингибирует определенную функцию тестируемых клеток.
Изобретение далее иллюстрируется следующими не ограничивающими примерами.
ПРИМЕРЫ
Пример 1. Заражение линий мышиных и человеческих клеток вирусом миксомы
Штаммы вируса
Используемые штаммы вируса включают MV дикого типа, MV, модифицированный для экспрессии или белка зеленой флюоресценции ("FGP"), или β-галактозидазы ("LacZ"), и убитый («мертвый») MV. Вирусы получали и титровали, используя стандартные методики.
Линии клеток
Эксперименты на мышах выполняли с использованием фибробластов мышиных эмбрионов ("MEF"), полученных из мышей дикого типа, и из следующих генно-модифицированных мышей («нокаутов»): гомозиготный «нокаут» рецептора IFNα/β; гомозиготный «нокаут» STAT1; гетерозиготный «нокаут» PKR; гетерозиготный «нокаут» РНазыL; гетерозиготный «нокаут» Mx1; тройной гомозиготный «нокаут» PKR/РНазыL/Mx1.
Эксперименты на людях выполняли на контрольных клетках BGMK и линиях клеток опухолей человека HT29, HOP92, OVCAR4, OVCAR5, SK-MEL3, SK-MEL28, M14, SKOV3, PC3, DU145, CAKI-1, 786-0, T47D, MDAMB 435, SF04, U87, A172, U373, Daoy и D384, как описано в публикации Stojdl et al., Cancer Cell (2003) 4: 263-275.
Методы
В целом, анализы и эксперименты выполняли, как описано в публикациях Lalani et al. Virology (1999) 256: 233-245; Johnston et al. J Virology (2003) 77(13): 7682-7688; and Sypula et al. Gen Ther Mol Biol (2004) 8: 103.
Для исследований на мышах in vivo «Голым» мышам имплантировали внутричерепные человеческие глиомы U87. Через 15 дней после имплантации мышам в опухоль инъецировали живой или мертвый GFP MV при титре 5х106, или ложно инфицировали. Через 72 ч после инфекции животных умерщвляли, головной мозг удаляли, заливали в ОСТ (соединение с оптимальной температурой резки) и нарезали срезы в замороженном состоянии. GFP миксомы визуализировали в срезах цельного мозга флюоресцентной микроскопией. Затем срезы фиксировали и окрашивали H&E (гематоксилином и эозином) для визуализации опухоли.
Для анализов человеческих опухолевых клеток опухоли трипсонизировали и высевали на чашки сразу после операции и инфицировали вирусом на следующий день при MOI 0,1, 1,0 или 10. Получали данные в отношении цитотоксичности и вирусной экспрессии с использованием фазовой микроскопии и флюоресцентной микроскопии соответственно через 24 и 48 ч после инфекции. Анализы с использованием желтой соли тетразолия МТТ (бромид 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия) выполняли для количественного определения % выживания клеток (в виде процентной доли клеток, выживших после ложной инфекции) через 48, 72 или 96 ч после инфекции.
Линии клеток человеческой детской медуллобластомы, Daoy и D384, инфицировали 10 M.O.I. GFP миксомы. Через 72 ч измеряли жизнеспособность клеток, используя MTT.
Результаты. Инфекции линий мышиных клеток
Предыдущие исследования показали, что некоторые клоны мышиных клеток 3Т3, трансфицированных рецепторами хемокина, могли инфицироваться вирусом миксомы, в то время как другие клоны не могли. Для исследования того, зависел ли тропизм вируса миксомы у других мышиных клеток от каких-либо определенных рецепторов, заявители использовали первичные фибробласты мышиных эмбрионов (MEFs) от мышей дикого типа (WT) и различных «нокаутов».
Поскольку IFNs играют ключевую роль в развитии противовирусных реакций, заявители выдвинули гипотезу, что рестриктивный фенотип был связан с «противовирусным состоянием», опосредованным IFN. Прерывание цепи явлений системы IFN, за счет нейтрализации циркулирующей IFN антителами или за счет генерирования мышей, негативных в отношении рецепторов IFN, или мышей с делецией генов во внутриклеточном пути передачи сигналов, резко снизило бы устойчивость хозяина к вирусу миксомы, который обычно не инфицирует нормальные мышиные клетки.
Для испытания этой гипотезы заявителям нужно было продемонстрировать, было ли отсутствие инфективности вируса миксомы в не пермиссивных клетках связано с противовирусным действием IFNs. Различные типы клеток MEF, имеющие «нокауты» одного или более белков, участвующих в реакции внутриклеточной передачи сигналов IFN, были испытаны для выявления влияния инфекции MV на путь IFN.
Эксперименты, выполненные на первичных MEF, продемонстрировали, что MEF дикого типа ("WT") инфицируемы вирусом миксомы. MEF полностью инфицируемы вирусом миксомы, когда путь IFN блокирован нейтрализующим антителом к IFNα/β (фиг.2). Однако MEF, подверженные контакту с нейтрализующими антителами к IFNγ, оставались не пермиссивными. Это выделило значение IFNα/β, но не IFNγ, в создании вирусу миксомы пермиссивной среды для инфекции MEF in vitro. В литературе были идентифицированы различные внутриклеточные пути передачи сигналов для IFNα/β и IFNγ. Однако в отличие от культивированных фибробластов у инфицированных хозяев и IFNα/β, и IFNγ, вероятно, играют важную роль. Заявители прогнозируют, что человеческие опухоли с недостаточностью или пути IFNα/β, и/или пути IFNγ будут восприимчивы к инфекции вирусом миксомы in vivo.
Заявители исследовали активность STAT1 и STAT2 у не пермиссивных MEF WT, которые были инфицированы MV. Результаты, показанные на фиг.3, указали, что STAT1 и STAT2 были активированы. Дальнейшее исследование показало, что STAT3, STAT4 и STAT5 не активированы (фиг.4).
Для подтверждения значения внутриклеточного пути IFNα/β в поддержании не пермиссивного состояния у MEF были выполнены исследования генетических делеций для обеспечения разрывов в рецепторах IFNα/β и во внутриклеточном каскаде. Была выполнена генетическая делеция рецепторов IFN или JAK1 или STAT1. MV использовали для инфекции MEF WT, MEF IFNα/β R-/- и MEF STAT1 -/-. MEF IFNα/β R-/- и MEF STAT1 -/- были пермиссивными к MV, демонстрируя, что каскады передачи сигналов IFNα/β и STAT1 имеют решающее значение для инфекции MV (фиг.5).
Протеин-киназа R (PKR) представляет собой фермент, индуцированный IFNα/β в широком разнообразии клеток. Эта киназа, в присутствии дсРНК, подвергается автофосфорилированию и затем фосфорилирует несколько клеточных белков, включая фактор инициации синтеза эукариотического белка (eIF-2α), чье фосфорилирование может вызвать ингибирование трансляции белка и апоптоз. PKR также указан в активации РНазыL. Заявители исследовали активацию PKR в не пермиссивных MEF после инфекции MV. PKR не фосфорилируется в не пермиссивных MEF, у которых антивирусное состояние хорошо установлено (фиг.6). Кроме того, инфекция MV ингибирует фосфорилирование PKR (фиг.7), К тому же, PERK (подобная PKR, ER-киназа) не фосфорилируется в первичных MEF WT после инфекции вирусом миксомы (фиг.8).
MV использовали для инфекции MEF «нокаутами» одного гена PKR, РНазаL и Mx1 (фиг.9). Было обнаружено, что PKR, РНазаL и Mx1 несущественны для поддержания неспособности к развитию инфекции (непермиссивности к инфекции) вирусом миксомы. Для дополнительного подтверждения несущественной роли PKR, РНазыL и Mx1 в MEF выполняли тройной «нокаут» PKR-/-, РНазыL-/- и Mx1-/-. Тройной «нокаут» PKR-/-, РНазыL-/- и Mx1-/- не поддерживает инфекцию вирусом миксомы (фиг.10), однако MEF с тройным «нокаутом» PKR, РНазыL и Mx1, обработанные нейтрализующим антителом к интерферону α/β, становится способным к развитию инфекции (пермиссивным к инфекции) вирусом миксомы (сравните фиг.10 и 11). Эти эксперименты демонстрируют, что PKR, РНазаL и Mx1 не существенны в опосредовании не пермиссивности MEF к MV.
Дополнительные исследования выполнялись для исследования активации eIF-2α и PKR в не пермисссивных MEF дикого типа и пермиссивных MEF IFNα/β R-/- и MEF STAT1 -/- после инфекции MV. После инфекции MV, eIF-2α фосфорилируется в не пермиссивных и пермиссивных MEF, хотя PKR не фосфорилируется ни в одном случае (фиг.12). Это демонстрирует, что без вовлечения PKR и PERK противовирусное состояние опосредуется другим путем, который вызывает фосфорилирование eIF-2α.
STAT1 фосфорилируется и серином и тирозином после инфекций миксомой в не пермиссивных MEF с тройным «нокаутом» PKR, РНазыL и Mx1 (фиг.13). Также показана субклеточная локализация фосфорилированного тирозином STAT1 в не пермиссивных MEF PKR-/- + РНазыL-/- + Mx1-/- после инфекции вирусом миксомы (фиг.14).
Резюмируя, эти результаты указывают на то, что параллельный, независимый от PKR/PERK антивирусный путь, вовлекающий IFN/STAT1, имеет решающее значение для тропизма поксвируса. Кроме того, фосфорилирование eIF-2α представляет собой наилучший маркер противовирусного действия IFN.
Результаты. Исследования человеческих опухолей
Заявители исследовали способность MV инфицировать человеческие опухолевые клетки в системе in vivo. «Голым» мышам инъецировали клетки глиомы человека, и у них впоследствии развились внутричерепные глиомы. Живой вирус был способен инфицировать эти человеческие опухоли, но не инфицировал окружающие клетки (фиг.15). Локализация флюоресцентного сигнала от GFP к опухоли изображена на фиг.16.
Учитывая, что многие человеческие опухоли не реагируют на интерферон и что опухолевые клетки не имеют нормальных каскадов передачи сигналов IFN по сравнению с теми, которые обнаруживаются в нормальных человеческих клетках, были выполнены исследования для изучения воздействия вируса миксомы на человеческие опухоли. Результаты обобщены ниже.
Первоначально вирус миксомы использовали для изучения инфективности и цитолитических эффектов на различные контрольные и человеческие опухолевые клеточные линии: BGMK, HT29, HOP92, OVCAR4, SK-MEL3 и SK-MEL28. MV проявил различную инфективность и дал различные цитолитические результаты: HT29 (Фиг.17), HOP92 (Фиг.18), OVCAR4 (Фиг.19), SK-MEL3 (Фиг.20), SK-MEL28 (Фиг.21) и BGMK (Фиг.22).
Были испытаны дополнительные опухолевые клетки, и в таблице 1 классифицируются различные типы испытанных опухолей как пермиссивные и не пермиссивные.
Различные линии человеческих опухолевых клеток продемонстрировали варьирующуюся реактивность на инфекцию возрастающими концентрациями MV-LacZ. Например, клетки U373 требовали более высоких титров вируса для достижения уровней уничтожения клеток, достигнутых более низкими титрами вируса у клеток U87 (фиг.23 и фиг.24). Вирус миксомы эффективно инфицировал клетки астроцитомы (фиг.25) и клетки глиомы (фиг.26). Вирус миксомы был эффективен через 48 ч после инфекции при уничтожении клеток астроцитомы человека и детской медуллобластомы (фиг.27 и 28).
Пример 2. Воздействие рапамицина на кинетику репликации вируса миксомы в линиях рестриктивных клеток
Использованные вирусные штаммы включают MV ("vMyxLac") и MV, модифицированный для наличия «выключенного» гена МТ-5 ("vMyxLacT5-"). Вирусы готовили и титровали с использованием стандартных методик.
Линии клеток
Эксперименты на людях выполняли на контрольных клетках BGMK приматов, кроличьих контрольных клетках RK-13 и нормальных человеческих фибробластах А9, линиях рестриктивных человеческих опухолевых клеток 786-0 (почечных), ACHN (почечных), HCT116 (ободочной кишки), MCF-7 (молочной железы), MDA-MB-435 (молочной железы), M14 (меланомы) и COLO205 (ободочной кишки).
Методы
В целом, анализы и эксперименты выполняли, как описано в публикациях Lalani et al. Virology (1999) 256: 233-245; Johnston et al. J Virology (2003) 77(13): 7682-7688; и Sypula et al. Gen Ther Mol Biol (2004) 8: 103.
Для получения кривых вирусного роста клетки выращивали in vitro в монослое и предварительно обрабатывали 20 нМ рапамицина или контролем (разведение 1:5000 DMSO (диметилсульфоксидом)) перед инфекцией вирусом.
Образцы указанных линий клеток, инфицированных указанным вирусным штаммом, брали через 72 ч после инфекции и лизировали. Вирус, содержащийся внутри клеточных лизатов, титровали и использовали для инфицирования монослоев BGMK. Через 48 ч после инфекции клетки фиксировали и окрашивали, используя X-gal.
Результаты
Ранее заявители продемонстрировали, что вирус миксомы способен инфицировать и реплицироваться во многих типах человеческих опухолевых клеток (Sypula et al. (2004) Gene Ther. Mol. Biol. 8:103). Этот специфический для кроликов вирус может предпочтительно инфицировать большинство (приблизительно 70%) линий человеческих раковых клеток из эталонной коллекции NCI (Национального Института Рака). Кроме того, было обнаружено, что ген диапазона хозяев М-Т5 играет решающую роль во время инфекции вирусом миксомы многих из этих линий клеток.
В настоящем исследовании потенциальных внутриклеточных молекул, которые могут воздействовать на способность вируса миксомы селективно реплицироваться внутри человеческих опухолевых клеток, было испытано воздействие рапамицина.
Как видно на фиг.29, изучение способности вируса миксомы реплицироваться и распространяться после низкой множественности инфекции (MOI), выполняли, используя многоступенчатую кривую роста, используя BGMK (контрольные линии клеток приматов); RK-13 и RL5 (контрольные линии кроличьих клеток); 4Т1 и B16F10 (линии мышиных раковых клеток); HOS и PC3 (линии пермиссивных человеческих раковых клеток); 786-0, HCT116 и ACHN (линии рестриктивных человеческих раковых клеток); MCF-7, M14 и COLO205 (линии абортивных человеческих раковых клеток). И vMyxLac дикого типа, и вирус vMyxT5KO с «выключенным» M-T5 были испытаны для исследования способности обоих вирусов инфицировать и распространяться по монослою в присутствии и в отсутствие предварительной обработки рапамицином. Титр вируса оценивали по образованию очагов на клетках BGMK. Клетки предварительно обрабатывали 20 нМ рапамицина или соответствующим контролем носителя (разведение 1:5000 DMSO) в течение 6 ч перед инфекцией.
Как продемонстрировано, рапамицин не оказывает эффекта на контрольные клетки BGMK и на испытанные линии кроличьих клеток, включая клетки RL-5, которые не пермиссивны для вируса с «выключенным» МТ-5. Однако рапамицин не усиливает репликацию вируса миксомы в линиях мышиных опухолевых клеток и вызывает ее пограничное усиление в линиях пермиссивных клеток (I типа), таких как РС-3. Рапамицин оказывает меньший эффект на высоко пермиссивные клетки, такие как клетки HOS, вероятно, вследствие того, что такие линии клеток уже максимально пермиссивны для вируса миксомы. Наибольший эффект при использовании рапамицина наблюдался в линиях рестриктивных клеток (II типа) (786-0, HCT116 и ACHN), которые являются пермиссивными для вируса дикого типа, но не пермиссивными для штамма vMyxT5KO. Некоторый эффект наблюдался даже в линиях абортивных клеток (III типа) MCF-7 и COLO205, хотя не в линии абортивных клеток М14.
Затем собирали и лизировали образцы клеток BGMK и 786-0 и выделенный вирус использовали для инфекции монослоев клеток BGMK (Фиг.30). Инфицированные вирусом клетки визуализировали, используя окрашивание X-Gal.
Предварительная обработка опухолевых клеток, которые являются «рестриктивными» для заражения вирусом миксомы, т.е. те клетки, которые допускают репликацию вируса миксомы дикого типа, но не вируса с «выключенным» МТ-5, при использовании рапамицина привела к восстановлению способности вируса миксомы реплицироваться в этих линиях раковых клеток, которые включают линии клеток рака почек, ободочной кишки и яичников (фиг.29 и 30).
Кроме того, обработка рапамицином усиливала способность вируса дикого типа реплицироваться в этих же клетках, но не в контрольных кроличьих клетках или клетках приматов. Эти результаты указывают на то, что рапамицин действует для усиления инфекции вирусом миксомы. Кроме того, представляется, что рапамицин влияет на способность раковых клеток, которые плохо инфицируемы этим вирусом, для обеспечения возможности репликации вируса.
В последующих экспериментах исследовали воздействие обработки рапамицином на человеческие опухолевые клетки, которые не могли поддерживать инфекцию вирусом миксомы дикого типа (фиг. 31). Предварительная обработка оказывала небольшое воздействие на контрольные клетки приматов или нормальные человеческие фибробласты, но при этом могла усилить заражающую способность вируса в нескольких линиях клеток, включая линии клеток рака молочной железы MCF-7. Поскольку несколько из линий человеческих опухолевых клеток оставались устойчивыми к обработке рапамицином так же, как контрольные линии клеток, маловероятно, что обработка рапамицином могла дать возможность вирусу миксомы продуктивно инфицировать не трансформированную ткань.
Пример 3. Вариант вируса миксомы M135KO как усовершенствованный кандидат онколитического вируса
M135R экспрессирован в вирусе миксомы в качестве раннего гена
Вирус миксомы кодирует белок (M135R), идентифицированный в результате секвенирования генома MV (Cameron et al. Virology (1999) 264: 298-318), который, по прогнозам, имитирует рецептор IFNα/β хозяина, и предотвращает запуск под воздействием IFNα/β противовирусной реакции хозяина (Barrett et al. Seminars in Immunology (2001) 13:73-84). Этот прогноз основан на гомологии последовательности с гомологом вирусного рецептора IFNα/β из вируса коровьей оспы (B18R), который, как было продемонстрировано, использует такую стратегию иммунной инвазии (Symons et al. Cell (1995) 81:551-560). Однако M135R имеет только половину размера B18R VV и всех других гомологов IFNα/β-R из секвенированных поксвирусов и во всех случаях совпадает только с аминоконцевой половиной гомологов IFNα/β-R поксвирусов. На фиг.32 указаны прогнозированная структура и аналогия последовательности между M135R из MV и B18R из VV. В выверке последовательности показаны только первые 179 аминокислотных остатков B18R. В таблице 2 показан % идентичности между M135R и указанными гомологами IFNα/β-R поксвирусов. Цифры над диагональю представляют % идентичности, а цифры под диагональю представляют % сходства между любыми двумя видами. Цифры в скобках по верху представляют количество аминокислот в предполагаемых белках. Сравнение проводили между прогнозируемой копией M135R полной длины (178 аминокислот) и только первыми 178 остатками каждого гомолога.
Синтезировали пептиды против прогнозированных иммуногенных областей M135R и использовали для генерирования поликлональных антител у кроликов, которые использовали в анализе вестерн блоттинга, иммунопреципитации и иммунофлюоресценции. Иммуноблоттинг подтвердил, что M135R синтезируется в качестве раннего гена, чью экспрессию можно выявить уже через 3 ч после инфекции (фиг.33А; полоса 1: ложно инфицированные клетки BGMK; полосы 2-6: клетки BGMK, инфицированные vMyxLau соответственно через 0, 3, 6, 18 и 36 ч после инфекции). Обработка инфицированных клеток AraC указывает на то, что синтез M135R не был изменен ингибированием поздней экспрессии белка, и поэтому он является ранним геном (фиг.33В). Однако обработка туникамицином указывает на то, что M135R является N-связанным гликозилированным, вероятно, в одном сайте, прогнозированном по последовательности (фиг.33В). Обработка моненсином свидетельствует о том, что нет О-связанного гликозилирования. Для получения результатов, показанных на фиг.33, клетки BGMK инфицировали вирусом миксомы при MOI 10. Клетки обрабатывали AraC в концентрации 40 мкг/мл, туникамицином в концентрации 1 мкг/мл или не обрабатывали в указанные точки времени. M135R выявляли пептидным антителом.
M135R кодирует последовательность сигналов, но не секретируется
Анализ последовательности M135R указывает на присутствие прогнозируемой последовательности сигналов (фиг.32В). Однако имеется также прогнозируемый домен на карбокси конце (фиг.32В). Иммуноблоты надосадочных жидкостей из инфицированных клеток BGMK указывают на то, что M135R не секретируется. Однако M135R легко выявляется в лизатах цельных клеток (фиг.33). Для испытания того, функционировала ли последовательность сигналов для стимуляции M135R двигаться к клеточной поверхности, заявители провели делецию трансмембранного домена и клонировали мутант в систему экспрессии бакуловируса. Сравнение надосадочных жидкостей, инфицированных AcM135R и Ac135ΔTM, указало на то, что в клеточном лизате обнаруживается M135R полной длины, где нет доказательств их секреции. Напротив, Ac135ΔTM секретируется и подтверждает, что сигнальная последовательность функционирует для стимуляции поступления M135R во внеклеточную среду (данные не показаны).
Белок M135R локализация на поверхности инфицированных клеток
Наблюдение, что M135R имеет функциональную сигнальную последовательность, а также трансмембранный домен, вынудила заявителей испытать локализацию M135R. Два доказательства указывают на то, что M135R локализуется на клеточной поверхности. Во-первых, клетки BGMK высевали на стеклянные покровные стекла и инфицировали vMyxLau (MOI 10) в течение 24 ч, затем M135R выявляли иммуноокрашиванием аффинно очищенным M135R с последующим использованием конъюгированного с FITC (флюоресцеином изоцианатом) вторичного антитела (фиг.34А). Тип окрашивания M135R указывает на локализацию в клеточной поверхности инфицированных клеток. vMyxLau представляет собой действительный штамм вируса миксомы дикого типа, который не был изменен вставкой гена β-gal или EGFP.
Второе доказательство локализации M135R на клеточной поверхности следует из биотинилирования белков клеточной поверхности клеток GHOST, инфицированных или vMyxgfp, или vMyx135KO. Через 24 ч после инфекции получали клеточные лизаты. Шарики стрептавидин-агарозы смешивали с 500 мкг всего клеточного белка из клеточных лизатов в течение 45 мин. Шарики промывали и отделяли на 15% геле PAGE-SDS (полиакриламидном геле с додецилсульфатом натрия) и затем зондировали анти-M135R. 50 мкг всего белка из лизатов инфицированных клеток использовали в качестве контролей. Иммунопреципитация биотинилированных поверхностных белков указывает на то, что M135R находится на поверхности инфицированных клеток (фиг.34В).
M135R не существен для репликации вируса миксомы in vitro
Для испытания способности M135R действовать в качестве фактора вирулентности заявители сконструировали рекомбинантный вирус, в котором была произведена делеция M135R, и он был замещен кассетой, кодирующей EGFP и gpt в качестве ранних/позних промотеров VV (была произведена делеция 460 нуклеотидов или 86% orf). Стратегия клонирования и кассета показана на фиг.35А. Рекомбинант был очищен от бляшек выбором клонов вируса, экспрессирующих EGFP. Чистоту рекомбинанта подтверждали PCR (фиг.35В; полоса 1 представляет собой 1 т.п.о. плюс лестницу ДНК, полоса 2 представляет область, в которой была произведена делеция области, кодирующей M135R, и в которую был вставлен маркер EGFP/gpt. Полоса 2 представляет собой бляшку 1, и полоса 3 представляет собой бляшку 2. Полоса 4 представляет ту же область и охватывает нативный, не прерванный локус M135R). Иммуноблоттинг клеток BGMK, инфицированных или vMyxLau, или vMyx135KO, подтвердил, vMyx135KO утратил экспрессию M135R (Фиг.35C; динамика экспрессии M135R: полоса 1 представляет собой неинфицированные клетки BGMK. Полосы 2-6 представляют клетки BGMK, инфицированные vMyxLau в точки времени 0 (полоса 2), 3 (полоса 3), 6 (полоса 4), 18 (полоса 5) и 36 ч после инфекции (полоса 6). Полосы 7 и 8 представляют клетки BGMK, инфицированные vMyx135KO через 6 (полоса 7) и 18 (полоса 8) ч после инфекции. Полоса 9 представляет собой положительный контроль с M135R, экспрессированным в AcNPV).
Одноэтапные кривые роста использовали для испытания способности vMyx135KO реплицироваться в клетках BGMK. Клетки BGMK инфицировали vMyxgfp или vMyx135KO при moi 5 и клетки собирали в указанные точки времени. Титры вируса определяли на клетках BGMK. Не было различия типа репликации между vMyxgfp и vMyx135KO (фиг.36). Эти результаты указывают на то, что для репликации in vitro M135R не требуется.
Во время исследований способности другого гена вируса миксомы влиять на репликацию вируса миксомы в кроличьих первичных эмбриональных фибробластах (REF) заявители использовали vMyx135KO как контроль «нокаута» и наблюдали курьезный феномен. Инфекция REF vMyxgfp привела к нормальному очагу инфекции, однако vMyx135KO давал подобную бляшке зону инфекции (фиг.37). Когда заявители испытывали другие клетки для подтверждения этого фенотипа, они смогли реплицировать образование бляшки в других кроличьих фибробластах (HIG-82, фиг.38) и человеческих первичных фибробластах (ccd922-sk, фиг.39).
M135R представляет собой решающий фактор вирулентности для патогенеза у кроликов
Заявители затем испытали способность vMyx135KO вызывать миксоматоз у лабораторных кроликов. В отличие от животных, которым инъецировали vMyxLau или vMyxgfp, которые вызывали развитие нормального миксоматоза и должны были подвергаться эвтаназии через 9-10 дней после инъекции, кролики, которым проводили инъекцию vMyx135KO, полностью выздоровели (таблица 3). Для подтверждения того, что утрата M135R вызвала ослабление vMyx135KO, заявители генерировали ревертантный вирус, в котором был восстановлен M135R, и испытали способность этого ревертанта (vMyx135REV) восстанавливать способность вызывать миксоматоз. Все 4 группы кроликов, получавших лечение, реагировали одинаковым образом в течение первых шести дней после инъекции соответствующих вирусов (таблица 3). Заявители наблюдали крупное, красное, выступающее над поверхностью поражение в участке инъекции у всех групп лечения к 4-му дню после инфекции. Однако, начиная с шести дней и продолжаясь в течение следующих 3-4 дней, различия между различными вирусами стали очевидными. У тех животных, которым инъецировали вирус дикого типа или ревертантный вирус, имелись множественные вторичные поражения в ушах, глазах и носу, которые не наблюдались у животных, которым инъецировали vMyx135KO (таблица 3). Заявители сделали вывод, что утрата M135R резко ослабляла MV на экспериментальных моделях, это указывает на то, что M135R представляет собой решающий фактор вирулентности.
Температуру тела кроликов измеряли ежедневно в течение трех дней, предшествующих исследованию. Ее величины считали исходными температурами тела животных. Заявители продолжали измерять температуру ежедневно у каждого животного в течение всего исследования. Однако не было различия температуры тела между группами лечения (фиг.40). Это свидетельствует о том, что M135R не играет роли в лихорадочной реакции инфицированных животных.
M135R не связывает или не ингибирует кроличий IFNα/β
Последовательность M135R аналогична B18R вируса коровьей оспы, имитатора рецептора IFN Заявители испытали способность M135R связывать кроличий IFN типа 1. Заявители сначала йодировали кроличий IFN (5 мкг, используя йодные шарики) и испытывали способность клеток, инфицированных vMyx135KO, связывать кроличий IFN, меченный125I, в сравнении с клетками, инфицированными vMyxgfp (moi 10). Клетки собирали, промывали подсчитывали в гамма-счетчике. Делеция M135R не воздействовала на связывание IFNα/β с инфицированными клетками, и заявители не наблюдали никакого различия количества IFN, связанного с клеточной поверхностью или клеток RK13, или клеток BGMK (фиг.41). Обработка клеток RK13 или BGMK экзогенным кроличьим IFN типа 1 также не воздействовала на инфекцию клеток vMyx135KO (фиг.42; клетки высевали в 12-луночные чашки и инфицировали указанным вирусом при moi 0,01; флюоресцентные очаги подсчитывали через 72-96 ч после инфекции; 200 единиц кроличьего IFNα/β или добавляли за 24 ч до инфекции, или клетки не обрабатывали). Такой же результат наблюдался, когда клетки были предварительно обработаны за 24 ч до инфекции для индукции противовирусного состояния в клетке. Заявители не отметили какого-либо значимого различия очагов, образованных после инфекции или клеток RK13, или клеток BGMK (данные не показаны). Этот феномен был также действителен, если клетки обрабатывали человеческим IFNA/D (данные не показаны). Заявители также не могли наблюдать какое-либо связывание, когда надосадочные жидкости Ac135ΔTM наносили на кроличий IFNα/β, сцепленный с чипом BIAcore (данные не показаны).
Пример 3. Молекулярные последствия ингибирования mTOR в контексте инфекции вирусом миксомы
Анализ вестернблоттинга (фиг.43) выполняли, используя клеточные лизаты из клеток 786-0, линии раковых клеток типа II, в которых рапамицин усиливает инфекцию вирусом миксомы. Лизаты собирали через 16 ч после инфекции или vMyxLac, или vMyxT5KO при MOI 3, или без вирусной инфекции. Указанные полосы содержат белок из клеток, которые были предварительно обработаны 20 нМ рапамицина (обозначенные как R) или соответствующим контролем носителя (разведение 1:5000 DMSO, обозначение D) в течение 6 ч перед инфекцией. Блоты зондировали, используя первичные антитела, направленные против указанных белков.
Как продемонстрировано, инфекция вирусом миксомы воздействует на многие из путей передачи сигналов, которые сходятся на mTOR, физиологической мишени рапамицина. В контексте заражения вирусом дикого типа (vMyxLac) или вирусом с дефицитом MT-5 (vMyxT5KO), где рапамицин оказывает благоприятный эффект на репликацию вируса, во многих случаях наблюдались глобальные эффекты у молекул, передающих сигналы, которые не могли быть спрогнозированными на основании обработки одним рапамицином (см. полосы при ложной инфекции). Эти эффекты включают увеличение активности киназы AKT-1, Raf-1, GSK-3β и самого mTOR, а также уменьшение активности киназы PTEN и p70S6K. Эти данные указывают на то, что эти пути, вероятно, играют роль в пермиссивности вируса миксомы у линий человеческих раковых клеток.
Как понятно специалисту в данной области, возможны множественные модификации описанных здесь иллюстративных вариантов осуществления. Изобретение скорее предназначено для включения в его объем всех таких модификаций, как определено формулой изобретения.
Хотя здесь описаны различные варианты осуществления изобретения, в соответствии с обычными общими знаниями специалистов в данной области в объем изобретения можно внести много приспособлений и модификаций. Такие модификации включают замещение известных эквивалентов любым аспектом изобретения для достижения аналогичного результата по существу таким же путем. При отсутствии других определений все использованные здесь технические и научные термины имеют такое же значение, которое обычно понятно специалисту в данной области, к которой относится настоящее изобретение.
Все приведенные здесь источники информации полностью включены в качестве ссылки.
Реферат
Настоящее изобретение относится к терапевтическому лечению раковых заболеваний и касается применения вируса миксомы в комбинации с рапамицином. Представлены способы ингибирования раковой клетки, способы лечения рака с использованием комбинации вируса миксомы или его аналога, который не экспрессирует функциональный M135R, и рапамицина, фармацевтические композиции и наборы, содержащие комбинацию вирус миксомы или его аналог, который не экспрессирует функциональный M135R, и рапамицин. Обработка рапамицином усиливает способность вируса миксомы селективно инфицировать клетки, которые имеют недостаточную природную противовирусную реакцию, включая клетки, которые не реагируют на интерферон. Представленные изобретения возможно применять для лечения раковых заболеваний при менее токсичном воздействии на здоровые клетки. 19 н. и 57 з.п. ф-лы, 43 ил., 3 табл., 3 пр.

Комментарии