Фармацевтическая композиция, содержащая экстракт жимолости и антибиотик, фармацевтический набор и применение экстракта жимолости для получения лекарственных препаратов - RU2571281C2
Код документа: RU2571281C2
Чертежи









Описание
Область техники
Настоящее изобретение относится к области фармацевтики. В частности, настоящее изобретение относится к фармацевтической композиции, содержащей антибиотик и экстракт жимолости, который получают путем экстракции из традиционных в китайской медицине жимолостных лекарственнных растений, исходного растения Lonicera japonica или растений, относящихся к этому же роду, и очистки; а также к применению фармацевтической композиции для получения препаратов для профилактики и/или лечения заболеваний, вызываемых бактериями. Кроме того, настоящее изобретение также относится к применению экстракта жимолости для получения лекарственных препаратов.
Предшествующий уровень техники
В последние годы проблема интенсивного использования большого количества антибиотиков в медицинской практике становится все более серьезной. Неправильное использование антибиотиков оказывает селективное эволюционное давление на микроорганизмы, особенно бактерии, что приводит к резкому увеличению числа и разновидностей резистентных бактерий, даже к появлению “Супербактерии”, обладающей резистентностью к различным антибиотикам. В общем, большинство новых антибиотиков потеряет свою первоначальную эффективность в течение ряда лет за счет появления у патогенных микроорганизмов резистентности (устойчивости) к лекарственным препаратам. Например, устойчивый к пенициллину Streptococcus pneumoniae очень чувствительный к таким препаратам, как пенициллин, эритромицин и сульфаниламиды в прошлом, в настоящее время является резистентным к этим препаратам. В качестве другого примера можно привести такие распространенные источники инфекции, как Staphylococcus aureus, Streptococcus pneumoniae, Genus Enterococcus и Pseudomona aeruginosa, которые постепенно приобретают мультирезистентность (множественную лекарственную устойчивость) и нечувствительны к обычно используемым β-лактамам, хинолинону, новым макролидам и цефалоспоринам и даже к ванкомицину. В качестве еще одного примера можно привести данные, показывающие, что резистентность Pseudomonas aeruginosa к восьми антибиотикам, таким как амоксициллин и Зинацеф, достигает 100%; устойчивость Klebsiella pneumoniae к 16 высококачественным антибиотикам, таким как Зинацеф и Фортум, достигает 51.85-100%; в то время как метициллинустойчивый Staphylococcus aureus можно вылечить только ванкомицином.
Возникновение большого количества резистентных бактерий ведет к появлению все большего числа неизлечимых инфекций, в результате чего все больше увеличиваются риски бактериальных инфекций и возрастают затраты на лечение инфекционных заболеваний. Снижение резистентности бактерий к антибиотикам и повышение чувствительности бактерий к антибиотикам является серьезной проблемой в области медицины.
Название китайского традиционного лекарственного растения “Жимолость” происходит из справочника “Compendium of Materia Medica” и является общим обозначением китайских лечебных трав и растений. Среди жимолостных растений известна Lonicera japonica, которая является многолетней полувечнозеленой вьющейся древесной лианой из семейства жимолостных (Caprifoliaceae). Lonicera japonica названа жимолостью в связи с тем, что цветет изначально белым цветком, который затем превращается в желтый цветок. Лекарственное растительное сырье жимолость представляет собой растение Lonicera japonica или lonicera linn семейства жимолостных (Caprifoliaceae) и сушеные бутоны или первичные цветы растений, относящихся к этому же роду.
Жимолость с древних времен признана отличным лекарственным средством, выводящим из организма излишнее тепло, и обладает детоксикационным действием, и является одним из лечебных средств, обычно используемых для выведения излишнего тепла и детоксикации в традиционной китайской медицине. На протяжении тысячелетий жимолость играла заметную роль в клинике и была очень популярна среди врачей и пациентов. Жимолость, сладкая на вкус, холодная по своей природе и имеющая ароматический запах, способна выводить излишнее тепло, не повреждая желудок, и не только имеет ароматный запах, но и может устранять патогенные факторы. Жимолость может не только снимать напряжение, но также хороша для детоксикации крови и поэтому используется для лечения различных лихорадочных заболеваний, таких как лихорадка, сыпь, повреждения кожи, болезненные отеки и опухоли и больное горло, и лечебный эффект является значительным. Современные исследования предварительно обсуждают выведение излишнего тепла и детоксикационные механизмы действия жимолости. Например, жимолость оказывает значительные жаропонижающее и противовоспалительное действия, внутрибрюшинное введение 0.25 г/кг экстракта жимолости может снять отек ног, вызванный каррагинаном у крыс; инъекция 30-40 г/кг экстракта жимолости может уменьшить степень опухания ног из-за недостатка белка; инъекция 8 г/кг экстракта жимолости два раза в день также оказывает значительное антиэксудативное и антипролиферативное действие на вызванные кротоновым маслом гранулемные образования у крыс. Также считается, что жимолость оказывает важное регуляторное действие на иммунную систему, и отвар жимолости способствует фагоцитозу лейкоцитов; внутрибрюшинное введение жимолости также имеет существенное влияние на стимуляцию фагоцитоза воспалительных клеток.
Исследования химического состава жимолости показывают, что жимолость содержит органические кислоты, тритерпеновые сапонины, флавоноиды и их гликозиды, иридоидные гликозиды, эфирные масла и так далее. Было проведено исследование по извлечению активных ингредиентов жимолости и доказательству их эффективности, но до сих пор не было никаких сообщений об использовании экстракта жимолости в сочетании с антибиотиками для повышения чувствительности бактерий к антибиотикам.
Краткое описание изобретения
Задачей настоящего изобретения является обеспечение фармацевтической композиции, содержащей экстракт жимолости и антибиотик, где экстракт жимолости получают путем экстрагирования из жимолости из исходного Lonicera japonica или других растений, относящихся к этому же роду, причем секологановая кислота является активным ингредиентом экстракта.
Еще одной задачей настоящего изобретения является обеспечение фармацевтического набора, включающего экстракт жимолости и антибиотик, которые размещены отдельно.
Еще одной задачей настоящего изобретения является обеспечение применения фармацевтической композиции и фармацевтического набора для получения лекарственных препаратов для профилактики и/или лечения заболеваний, вызываемых бактериями.
Еще одной задачей настоящего изобретения является обеспечение применения экстракта жимолости, содержащего иридоидные соединения, для получения лекарственных препаратов, направленных на реверсию резистентности бактерий.
Технические решения по настоящему изобретению представляют собой следующие.
В одном аспекте настоящее изобретение обеспечивает фармацевтическую композицию для профилактики и/или лечения заболеваний, вызываемых бактериями, фармацевтическая композиция включает в себя экстракт жимолости, содержащий иридоидные соединения и антибиотики.
Предпочтительно фармацевтическая композиция дополнительно включает фармацевтически приемлемый носитель и/или эксципиент.
Профилактика и/или лечение заболеваний, вызванных бактериями, достигается путем реверсии резистентности бактерий. Таким образом, когда бактерии вырабатывают резистентность к антибиотикам, фармацевтическая композиция может реверсировать ее или противостоять резистентности бактерий к лекарствам.
В другом аспекте настоящее изобретение обеспечивает фармацевтический набор для профилактики и/или лечения заболеваний, вызываемых бактериями, фармацевтический набор включает в себя экстракт жимолости, содержащий иридоидные соединения и антибиотик, которые размещены отдельно. Набор может быть использован для профилактики и/или лечения заболеваний, вызываемых бактериями у пациента, где экстракт жимолости и антибиотик могут быть введены пациенту одновременно, непрерывно или последовательно с временным интервалом. Эксперименты показывают, что экстракт жимолости может повысить, восстановить и/или улучшить чувствительность бактерий к антибиотикам и реверсировать и противостоять резистентности бактерий к антибиотикам, таким образом усиливая действие антибиотиков, направленное на уничтожение или подавление бактерий.
В приведенной выше фармацевтической композиции и фармацевтическом наборе, экстракт жимолости содержит иридоидные соединения, представленные следующими структурными формулами:




где в формуле (1) X1 и X2, каждый независимо, представляют собой O, и R представляет собой Н, соединение представляет собой секологановую кислоту;
В формуле (2), формуле (3) и формуле (4) X1 и X2, каждый независимо, представляют собой H, низший C1-6 алкил или низший C2-6 алкенил. Основной активный ингредиент экстракта жимолости представляет собой секологановую кислоту.
Предпочтительно экстракт жимолости содержит 50 масс.% или более секологановой кислоты, предпочтительно экстракт жимолости содержит 70 масс.% или более секологановой кислоты, более предпочтительно экстракт жимолости содержит 80 масс.% или более секологановой кислоты и наиболее предпочтительно экстракт жимолости содержит 90 масс.% или более секологановой кислоты.
Экстракт жимолости по данному изобретению может быть получен в соответствии со способом, описанным в патентной заявке ZL 200610083556.7, которая включена здесь в качестве ссылки в полном объеме. В соответствии с вариантами осуществления настоящего изобретения экстракт жимолости получают способом, включающим следующие стадии:
(1) измельчение жимолости, исходного Lonicera japonica или других растений, относящихся к этому же роду, с последующей экстракцией водой и/или водным раствором C1-C6 алкилового спирта, содержащим не более 95 об.% спирта с получением экстракта;
(2) концентрирование и сушка экстракта, полученного на стадии (1) при нормальном или пониженном давлении, с получением экстракта или распылительная сушка экстракта, полученного на стадии (1), с получением порошка, и растворение экстракта или порошка в воде, а затем проведение осаждения или отстаивания с водным раствором C1-C6-алкилового спирта, содержащим не более 95 об.% спирта с получением осадка или растворение жидкого концентрата;
(3) выделение и очистка осадка или растворение жидкого концентрата, полученного на стадии (2) с помощью хроматографии, сбор элюента, содержащего иридоидные соединения, где вид хроматографии выбирают из колоночной хроматографии с макропористой адсорбирующей смолой, хроматографии с силикагелем нормальной фазы или хроматографии с силикагелем обращенной фазы.
Предпочтительно экстракт жимолости получают способом, включающим следующие стадии:
(1) измельчение жимолости и затем проведение экстракции 50 об./об. водным раствором этанола с получением жидкого экстракта;
(2) концентрирование экстрагированной жидкости, полученной на стадии (1) при пониженном давлении, с получением экстракта, растворение экстракта в воде, фильтрация и концентрирование раствора досуха, а также растворение путем добавления 95 об./об.% водного раствора этанола и добавление дистиллированной воды до получения 75 об./об.% раствора этанола, фильтрация после отстаивания и извлечение этанола из фильтрата с получением жидкого экстракта;
(3) растворение жидкого экстракта, полученного на стадии (2) путем добавления воды, фильтрация с получением фильтрата, пропускание фильтрата через хроматографическую колонку со стироловой адсорбирующей макропористой смолой, а затем элюирование колонки последовательно водой и 20 об./об.% водным раствором этанола и извлечение этанола из элюента, то есть из 20 об./об.% водного раствора этанола;
более предпочтительно способ дополнительно включает стадию очистки элюента, содержащего иридоидные соединения, полученного на стадии (3), путем гель-хроматографии;
наиболее предпочтительно способ дополнительно включает стадию очистки элюента, содержащего иридоидные соединения, полученного на стадии (3), с помощью гель-хроматографической колонки Sephadex LH-20, и сбор водного элюента.
Предпочтительно антибиотик по настоящему изобретению выбирают из одной или более групп, состоящих из ампициллина, пенам сульфона, пиперациллина, тазобактама, амоксициллина, клавулановой кислоты, цефазолина, цефуроксима, цефтриаксона, цефуроксима натрия, сульперазона, левофлоксацина, цефотаксима, цефтазидима, имипенема, цефепима, цефокситина, гентамицина, амикацина, ципрофлоксацина, хлорамфеникола, триметоприм-сульфаметоксазола, тетрациклина, нитрофурантоина,
азтреонама, ципрофлоксацина, норфлоксацина, аммиака, сульбактама, тикарциллина, клавулановой кислоты, тобрамицина, тазоцина, имипенема, миноциклина, меропенема, пенициллина, оксациллина, эритромицина, ванкомицина, рифампицина и клиндамицина.
Предпочтительно антибиотик представляет собой ампициллин и/или эритромицин.
В другом аспекте настоящее изобретение обеспечивает применение фармацевтической композиции и фармацевтического набора для получения препаратов для профилактики и/или лечения заболеваний, вызываемых бактериями.
Предпочтительно бактерия представляет собой бактерию, резистентную к антибиотикам, предпочтительно мультирезистентную бактерию, более предпочтительно бактерия представляет собой мультирезистентную грамотрицательную бактерию; дополнительно предпочтительно мультирезистентную грамотрицательную бактерию выбирают из одной или нескольких групп, состоящих из Escherichia coli, Pseudomona aeruginosa, Klebsiella pneumoniae, Acinetobacter baumannii, Proteus bacillus, enterobacteriaceae, Haemophilus influenzae, pneumobacillus и catarrhalis, более предпочтительно мультирезистентная грамотрицательная бактерия представляет собой Escherichia coli, Pseudomona aeruginosa и/или Klebsiella pneumoniae.
Альтернативно, бактерия представляет собой мультирезистентную к антибиотикам грамположительную бактерию, предпочтительно мультирезистентную к антибиотикам грамположительную бактерию выбирают из одной или более групп, состоящих из: Staphylococcus aureus, метициллинустойчивый Staphylococcus aureus, Streptococcus pyogenes группа A, Streptococcus pneumoniae, Bacillus subtilis и Staphylococcus epidermidis; дополнительно предпочтительно мультирезистентная к антибиотикам грамположительная бактерия представляет собой метициллинустойчивый Staphylococcus aureus и/или Staphylococcus aureus.
Кроме того, по настоящему изобретению болезнь, вызываемая бактерией, представляет собой инфекционное заболевание, вызываемое бактерией, особенно инфекционное заболевание, вызываемое резистентными к антибиотикам бактериями, такое как инфекция пищеварительной системы; инфекция кровеносной системы; инфекция дыхательной системы; инфекция мочевыводящих путей; инфекция центральной нервной системы; инфекция костей и суставов; инфекция уха, инфекция сосцевидного отростка и пазух, инфекция кожи и мягких тканей, предпочтительно болезнь, вызываемая бактерией, представляет собой инфекцию дыхательной системы, вызываемую бактерией, резистентной к антибиотикам.
Заболевание, вызываемое бактерией может быть инфекцией дыхательной системы, вызванной мультирезистентной к антибиотикам грамотрицательной бактерией, предпочтительно заболевание, вызываемое бактериями, представляет собой инфекционную пневмонию, вызванную мультирезистентной к антибиотикам грамотрицательной бактерией; дополнительно предпочтительно заболевание, вызываемое бактерией, представляет собой внутрибольничную инфекционную пневмонию, вызванную мультирезистентной к антибиотикам грамотрицательной бактерией, более предпочтительно болезнь, вызываемая бактерией, представляет собой внутрибольничную инфекционную пневмонию, вызываемую мультирезистентной к антибиотикам Klebsiella pneumoniae.
Также заболевание, вызываемое бактерией, может представлять собой инфекцию дыхательной системы, вызываемую мультирезистентной к антибиотикам грамположительной бактерией, предпочтительно заболевание, вызываемое бактерией, представляет собой пневмонию, вызываемую мультирезистентными к антибиотикам грамположительными бактериями; дополнительно предпочтительно заболевание, вызываемое бактериями, представляет собой пневмонию, вызываемую метициллинустойчивым Staphylococcus aureus.
В еще одном аспекте настоящее изобретение также обеспечивает применение экстракта жимолости, содержащего иридоидные соединения для приготовления лекарственных препаратов для реверсии резистентности бактерий. Эксперименты показывают, что экстракт жимолости может повысить, восстановить и/или улучшить чувствительность бактерий к антибиотикам и тем самым может быть использован для приготовления препаратов для реверсии резистентности бактерий. Препарат при введении пациенту может реверсировать или противостоять устойчивости к антибиотикам резистентных бактерий (даже мультирезистентных к антибиотикам бактерий) в теле пациента, а также может предотвратить развитие устойчивости к антибиотикам бактерий в организме пациента.
Экстракт жимолости содержит иридоидные соединения, представленные следующими структурными формулами:




где в формуле (1) X1 и X2, каждый независимо, представляют собой O, и R представляет собой H;
в формуле (2), формуле (3) и формуле (4) X1 и X2, каждый независимо, представляют собой H, низший C1-6 алкил или низший C2-6 алкенил.
Предпочтительно экстракт жимолости содержит 50 масс.% или более секологановой кислоты, представленной формулой (1); еще более предпочтительно экстракт жимолости содержит 70 масс.% или более секологановой кислоты, более предпочтительно экстракт жимолости содержит 80 масс.% или более секологановой кислоты и наиболее предпочтительно экстракт жимолости содержит 90 масс.% или более секологановой кислоты.
Экстракт жимолости по данному изобретению может быть получен в соответствии со способом, описанным в патентной заявке ZL 200610083556.7, которая включена здесь в качестве ссылки в полном объеме. В соответствии с вариантами осуществления настоящего изобретения экстракт жимолости получают способом, включающим следующие стадии:
(1) измельчение жимолости, исходного Lonicera japonica или других растений, относящихся к тому же роду, с последующим осуществлением экстракции водой и/или водным раствором C1-C6 алкилового спирта, содержащим не более 95 об.% спирта для получения экстракта;
(2) концентрирование экстракта, полученного на стадии (1) при нормальном или пониженном давлении с получением экстракта или распылительная сушка экстракта, полученного на стадии (1) с получением порошка, и растворение экстракта или порошка в воде, затем осаждение или отстаивание с водным раствором C1-C6 алкилового спирта, содержащим не более 95 об.% спирта, с получением осадка или растворение жидкого концентрата;
(3) выделение и очистка осадка или растворение жидкого концентрата, полученного на стадии (2) с помощью хроматографии, и сбор элюента, содержащего иридоидные соединения, где вид хроматографии выбирают из колоночной хроматографии с макропористой адсорбирующей смолой, хроматографии с силикагелем нормальной фазы или хроматографии с силикагелем обращенной фазы;
Предпочтительно экстракт жимолости получают способом, включающим следующие стадии:
(1) измельчение жимолости в водном растворе этанола 50 об./об.% с получением жидкого экстракта;
(2) концентрирование экстрагированной жидкости, полученной на стадии (1) при пониженном давлении, с получением экстракта, растворение экстракта в воде, фильтрация и концентрирование раствора досуха, а также растворение с добавлением 95% (V/V) водного раствора этанола и добавлением дистиллированной воды до содержания этанола 75% (V/V), фильтрация после отстаивания и извлечение этанола из фильтрата с получением жидкого экстракта;
(3) растворение жидкого экстракта, полученного на стадии (2) путем добавления воды и фильтрация с получением фильтрата, и пропускание фильтрата через хроматографическую колонку со стироловой адсорбирующей макропористой смолой, а затем элюирование колонки последовательно водой и 20 об./об.% водным раствором этанола и извлечение этанола из элюента, то есть из 20 об./об.% водного раствора;
Более предпочтительно способ дополнительно включает стадию очистки элюента, содержащего иридоидные соединения, полученного на стадии (3), путем гель-хроматографии;
наиболее предпочтительно способ дополнительно включает очистку элюента, содержащего иридоидные соединения, полученного на стадии (3) с помощью гель-хроматографической колонки Sephadex LH-20, и сбор водного элюента.
При применении по настоящему изобретению резистентность бактерий представляет собой резистентность бактерий к антибиотикам; предпочтительно резистентность бактерий представляет собой мультирезистентность бактерий к антибиотикам;
дополнительно предпочтительно антибиотик по настоящему изобретению выбирают из одной или более из групп, состоящих из ампициллина, пенам сульфона, пиперациллина, тазобактама, амоксициллина, клавулановой кислоты, цефазолина, цефуроксима, цефтриаксона, цефуроксима натрия, сульперазона, левофлоксацина, цефотаксима, цефтазидима, имипенема, цефепима, цефокситина, гентамицина, амикацина, ципрофлоксацина, хлорамфеникола, триметоприм-сульфаметоксазола, тетрациклина, нитрофурантоина, азтреонама, ципрофлоксацина, норфлоксацина, аммиака, сульбактама, тикарциллина, клавулановой кислоты, тобрамицина, тазоцина, имипенема, миноциклина, меропенема, пенициллина, оксациллина, эритромицина, ванкомицина, рифампицина и клиндамицина.
Предпочтительно антибиотик представляет собой ампициллин и/или эритромицин.
Кроме того, препарат может дополнительно содержать антибиотик, предпочтительно антибиотик выбирают из одной или более групп, состоящих из ампициллина, пенам сульфона, пиперациллина, тазобактама, амоксициллина, клавулановой кислоты, цефазолина, цефуроксима, цефтриаксона, цефуроксима натрия, сульперазона, левофлоксацина, цефотаксима, цефтазидима, имипенема, цефепима, цефокситина, гентамицина, амикацина, ципрофлоксацина, хлорамфеникола, триметоприм-сульфаметоксазола, тетрациклина, нитрофурантоина, азтреонама, ципрофлоксацина, норфлоксацина, аммиака, сульбактама, тикарциллина, клавулановой кислоты, тобрамицина, тазоцина, имипенема, миноциклина, меропенема, пенициллина, оксациллина, эритромицина, ванкомицина, рифампицина и клиндамицина; еще более предпочтительно антибиотик представляет собой ампициллин и/или эритромицин.
После того, как было признано, что хлорогеновая кислота и ее производные имеют антибактериальную и антивирусную активность, фундаментальные исследования веществ жимолости, способных выводить из организма лишнее тепло и обладающих детоксикационным действием, достигли кульминации, ряд научно-исследовательских институтов или лабораторий сосредоточились на экстрагировании активных ингредиентов жимолости.
В ходе большого числа экспериментов авторы настоящего изобретения получили экстракт жимолости, содержащий, главным образом, секологановую кислоту, очистили экстракт и обнаружили в экспериментах, комбинирующих антибиотики, что, экстракт жимолости может значительно повысить, восстановить и/или улучшить чувствительность к антибиотикам мультирезистентных бактерий и реверсировать или противостоять устойчивости к антибиотикам мультирезистентных бактерий, которая проявляется в том, что антибиотик, теряющий свою первоначальную антибактериальную эффективность из-за резистентности бактерий, восстанавливает свое антибактериальное действие при добавлении экстракта жимолости при таком же количестве антибиотиков, что доказывает, что экстракт жимолости может восстанавливать или улучшать чувствительность бактерий, устойчивых к антибиотикам и поэтому, может быть использован для адъювантной терапии инфекционных заболеваний, вызванных резистентными бактериями.
Краткое описание чертежей
В дальнейшем примеры осуществления настоящего изобретения будут проиллюстрированы более подробно, в сочетании с прилагаемыми чертежами:
Фигура 1 показывает ВЭЖХ-хроматограмму (ВЭЖХ - высокоэффективная жидкостная хроматография) экстракта жимолости N1, полученного в примере 1, по настоящему изобретению, который, как было определено, содержит 90,67% (по весу) секологановой кислоты;
Фигура 2 показывает экспериментальные результаты повышения чувствительности Klebsiella pneumoniae к антибиотику “ампициллин” с помощью экстракта жимолости;
Фигура 3 показывает экспериментальные результаты повышения чувствительности Staphylococcus aureus к антибиотику “эритромицин” с помощью экстракта жимолости;
Фигура 4 показывает экспериментальные результаты повышения чувствительности Escherichia coli к антибиотику “ампициллин” с помощью экстракта жимолости;
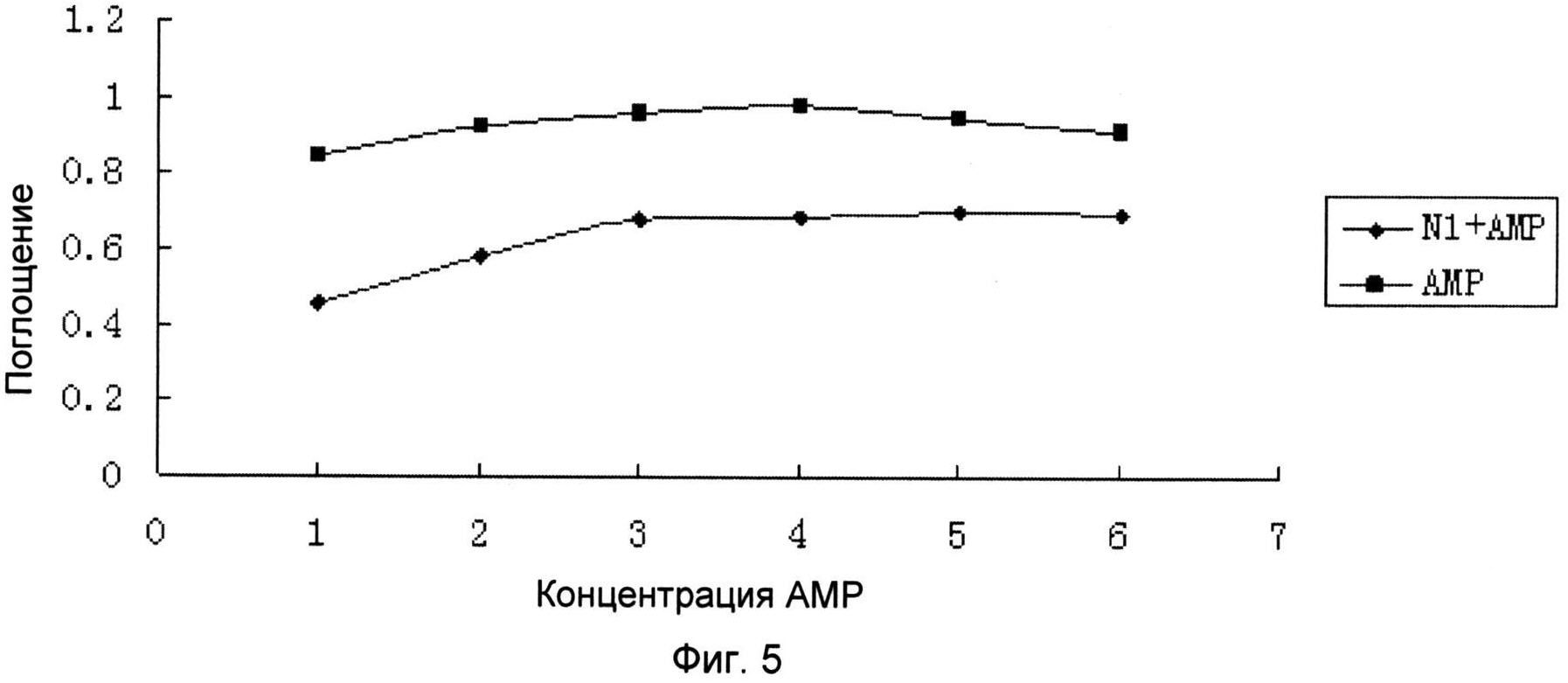
Фигура 5 показывает экспериментальные результаты улучшения чувствительности Pseudomona aeruginosa к антибиотику “ампициллин” с помощью экстракта жимолости;
Фигура 6 показывает ВЭЖХ-хроматограмму секологановой кислоты с чистотой 98,03% (по массе) в качестве стандарта, используемого в примере настоящего изобретения.
Подробное описание изобретения
Настоящее изобретение будет далее описано более подробно в связи с конкретными вариантами осуществления, приведенные примеры предназначены только для иллюстрации настоящего изобретения, а не ограничения объема настоящего изобретения.
Экспериментальные методы в следующих примерах представляют собой методы, известные из уровня техники, если иное не указано. Экспериментальные материалы такие, как лекарственные материалы и реагенты, используемые в следующих примерах, могут быть приобретены в обычных магазинах биохимических реактивов или на фармацевтических торговых предприятиях, если иное не указано.
Лекарственное сырье из жимолости, используемое в примерах, было приобретено в сети аптек Tongrentang в Пекине, произведено в провинции Хэнань и переработано на заводе “Божоу Сити Бейджин Анхуэй Чайниз Медицин Иньпянь Фэктори” (Bozhou City Beijing Anhui Chinese Medicine Yinpian Factory), номер партии 200502014. Лекарственное сырье из жимолости было определено как высушенные бутоны Lonicera japonica Thunb. семейства Caprifoliaceae Институтом Materia Medica Китайской академии медицинских наук.
Секологановую кислоту, используемую в примерах, в качестве стандарта для определения содержания экстракта получают в соответствии со способом, описанным в патентной заявке ZL 200610083556.7, Рисеч Депатмент оф Нэчерал Медикал Кемистри (Research Department of Natural Medicinal Chemistry) Института Материа Медика (Materia Medica) Китайской академии медицинских наук. Путем измерений, ее содержание определено как 98,03% (хроматограмма показана на фигуре 6).
В примерах содержание секологановой кислоты в экстракте жимолости определяется в соответствии с методом внешнего стандарта ВЭЖХ, и, в частности, для измерения используют следующие приборы и условия:
(1) Инструмент: жидкостный хроматограф Agilent 1100, включающий насос для четырехкомпонентных смесей, автоматический пробоотборник, детектор DAD и рабочую станцию Chemstation;
(2) Условия хроматографии и проверка пригодности системы: хроматографическая колонка представляет собой Prevail C18 5 мкл (250 mm X 4.6 mm) Alltech, США]; ацетонитрил-1% водный раствор ледяной уксусной кислоты (13:87) используют в качестве подвижной фазы, используют градиентное элюирование; скорость потока составляет 0,9 мл/мин, время остановки 40 минут, время установления равновесия составляет 10 минут, а длина волны детекции составляет 242 нм. Число теоретических тарелок, рассчитанных с помощью JYH пика должно быть не меньше чем 1000.
(3) Реагенты: ацетонитрил градиентной чистоты для хроматографии; чистая вода; ч.д.а. (чистая для анализа) уксусная кислота.
Бактерии Escherichia coli, Pseudomona aeruginosa, Klebsiella pneumonia и Staphylococcus aureus, используемые в примерах, все представляют собой клинические изоляты (мультирезистентные бактерии), которые были предоставлены клинической лабораторией Четвертой Народной больницы Цзинань в провинции Шаньдун; резистентности бактерий показаны ниже в таблицах 1, 2, 3, 4 и 5.


Примечания к таблице 1 и таблице 2:
R: Резистентный, S: Чувствительный, I: Средний, по степени резистентности (Умеренно Резистентный).
AMP: ампициллин; PIP: пиперациллин; TZP: пиперациллин/тазобактам; АМС: амоксициллин/клавулановая кислота; CZO: цефазолин; СХМ: цефуроксим; СТХ: цефотаксим; CAZ: цефтазидим; CRO: цефтриаксон; IPM: имипенем; FEP: цефепим; FOX: цефокситин; GEN: гентамицин; АМК: амикацин; CIP: ципрофлоксацин; CHL: хлорамфеникол; SXT: триметоприм-сульфаметоксазол; TCY: тетрациклин; NIT: нитрофурантоин.

Примечания: R: резистентный, S: Чувствительный, I: Умеренно резистентный.
А.К.: амикацин; ATM: азтреонам; AMP: ампициллин; CRO: цефтриаксон; CLS: сульперазон; СХМ: цефуроксим натрия; CAZ: цефтазидим; СТХ: цефотаксим; CFP: цефоперазон; CIP: ципрофлоксацин; CN: гентамицин; FEP: цефепим; LEV: левофлоксацин; NOR: норфлоксацин; PIP: пиперациллин; SAM: ампициллин/сульбактам; ТИМ: тикарциллин/клавулановая кислота; ТОВ: тобрамицин; TZP: тазоцин; IPM: имипенем; МН: миноциклин; MEM: меропенем.

Примечания:
R: Резистентный; S: Чувствительный, I: Умеренно резистентный. PEN: пенициллин; ОХА: оксациллин; SAM: ампициллин/пенам сульфон; FOX: цефокситин; GEN: гентамицин; АМК: амикацин; CIP: ципрофлоксацин; ERY: эритромицин; VAN: ванкомицин; RIF: рифампицин; SXT: триметоприм-сульфаметоксазол; TCY: тетрациклин; CLI: клиндамицин; NIT: нитрофурантоин.
Питательная среда: среда МН.
Оборудование, используемое в примерах: Инкубатор с постоянной температурой: продукт “Юэцзинь Медикал Девайс Фэктори 1” (Yuejin Medical Device Factory 1).
Рабочее место для асептического приготовления лекарственного препарата: продукт “Цзинань Лонгхонг Корпорейшн” (Jinan Longhong Corporation).
Микропланшетный ридер: продукт “Финланд Лейбо Корпорейшн” (Finland Leibo Corporation).
722 спектрофотометр: продукт компании “Шанхай Пресижн & Сайентифик Инструмент Ко., Лтд.” (Shanghai Precision & Scientific Instrument Co., Ltd) Холодильная установка на -80°C: продукт “Америкэн ФОМАС Корпорейшн” American FOMAS Corporation.
Пример 1. Получение экстракта жимолости
Лекарственное сырье из жимолости (500 г) грубо измельчали и дважды экстрагировали 50 об./об.% водным раствором этанола, взятым в количестве, в 13 раз превышающем вес сухой жимолости, каждую экстракцию проводили в течение 1 часа. Экстракты объединяли и концентрировали при пониженном давлении с получением густого экстракта, затем к экстракту добавляли 450 мл дистиллированной воды и растворяли при нагревании, затем охлаждали до комнатной температуры, выдерживали в течение 24 ч и фильтровали с получением прозрачного раствора.
Прозрачный раствор концентрировали при пониженном давлении досуха и добавляли 1600 мл 95 об./об.% водного раствора этанола и перемешивали до растворения, а также к раствору медленно добавляли дистиллированную воду до содержания 75 об./об.% этанола, затем выдерживали в течение 24 ч и фильтровали, чтобы собрать фильтрат, затем этанол отделяли от фильтрата при пониженном давлении до тех пор, пока не был сформирован жидкий экстракт.
К жидкому экстракту добавляли 500 мл воды, растворяли и фильтровали, затем фильтрат пропускали через предварительно обработанную хроматографическую колонку со стироловой адсорбирующей макропористой смолой SP-825, колонку элюировали последовательно 5-кратным объемом (по сравнению с объемом колонки) воды и 6-кратным объемом 20 об./об.% водного раствора этанола, а затем этанол отделяли от элюента при пониженном давлении, пока не исчезнет запах спирта, и проводили лиофилизацию.
Дальнейшую очистку проводили с помощью хроматографической колонки Sephadex LH-20 с силикагелем, включая: элюирование водой, сбор жидкого образца, восстановление при пониженном давлении, лиофилизацию; очистку проводили несколько раз через гель-хроматографическую колонку, с получением экстракта жимолости N1. Было определено, что экстракт жимолости N1, содержит 90,67% секологановой кислоты в соответствии с методом внешнего стандарта ВЭЖХ с помощью секологановой кислоты в качестве эталонного объекта (хроматограмма показана на фигуре 1).
Пример 2. Проверка ингибирования бактерий антибиотиками
В этом примере были измерены антибактериальные действия антибиотиков в отношении четырех мультирезистентных бактерий в таблицах 1-4.
Активированная бактериальная суспензия была разбавлена до концентрации, эквивалентной значению 0,5 стандарта мутности по Мак-Фарленду и разбавлена культуральной средой MH в соотношении 1:1000, а затем добавлена в каждую лунку в количестве 100 мкл на лунку.
Антибиотики, к которым были резистентны эти четыре вида мультирезистентных бактерий с начальной концентрацией 1 мг/мл, разбавляли до 1:2048 (2-11) путем двухкратных разбавлений, затем исходный раствор и различные концентрации разбавленных антибиотиков добавляли в лунки, содержащие бактериальную суспензию, в каждую лунку было добавлено по 100 мкл антибиотика, и фиксировали минимальную ингибирующую концентрацию (MIC) каждого антибиотика.
Между тем, были приготовлены бактериальный контроль (т.е. раствор бактерий плюс равный объем культуральной среды) и контроль, представляющий собой чистую культуральную среду.
Культивирование проводили при 37°C в течение 20 часов, детекцию проводили с помощью микропланшет-ридера при 630 нм, степень ингибирования бактерий вычисляли по формуле (2) и полученные данные подставляли в формулу (1) для вычисления конкретной дистанции, а конкретную дистанцию добавляли к индексу разведения вируса со степенью патогенности менее 50%, с получением половины ингибирующей концентрации (метод Рида-Менча).
Конкретная дистанция = (степень ингибирования более чем 50% - 50%) / (степень ингибирования более чем 50% - степень ингибирования менее чем 50%)…формула (1).
Степень ингибирования = (значение ОП проверки ингибирования бактерий - значение ОП лекарственного контроля) / (значение ОП бактериального контроля - значение ОП контроля чистой среды)…формула (2).
Результаты показывают, что все вышеупомянутые четыре вида бактерий являются устойчивыми к антибиотикам за исключением Klebsiella pneumoniae, которая ингибировалась антибиотиком ампициллином в первых двух разбавлениях (1 мг/мл, 0.5 мг/мл), остальные бактерии были резистентны к антибиотикам во всех разбавлениях.
Пример 3. Исследование антибактериального действия фармацевтической композиции по настоящему изобретению
Были проведены эксперименты по комбинированному действию экстракта жимолости N1 и следующих антибиотиков на бактерии:
Антибиотики в таблице 5 с начальной концентрацией 1 мг/мл разбавляли путем 2-кратных разведений до 2-5, а затем добавляли в 96-луночный планшет последовательно в поперечном направлении в количестве 100 мкл на лунку. Каждое разбавление антибиотика добавляли в три лунки. Тестируемый образец экстракта жимолости N1, полученный в примере 1, разводили раствором фосфатно-солевого буферного раствора (PBS) до концентрации 40 мг/мл и затем делали серию 2-кратных разбавлений (1:2, 1:4, 1:08, 1:16, 1: 32, 1:64, 1:128) и вносили в каждую лунку по 100 мкл.
Между тем, были приготовлены контроль антибиотика (заменяющий экстракт жимолости N1 на чистую культуральную среду), бактериальный контроль и контроль чистой культуральной среды.
Культивирование проводили при 37°C в течение 20 часов, и поглощение определяли с помощью спектрофотометра при длине волны 600 нм.
Результаты показаны на фигуре 2, на фигуре 5, где антибиотик в каждой фигуре разбавляли до 2-5 с 1 мг/мл (начальная концентрация) путем 2-кратных разбавлений, следовательно, абсциссы 1-6 на каждой фигуре представляют концентрации 2-1-2-5, соответственно. Как видно на фигурах, добавление экстракта жимолости значительно повышает чувствительность четырех видов мультирезистентных бактерий к соответствующим антибиотикам, следовательно, экстракт жимолости может быть превращен в фармацевтическую композицию путем смешивания с антибиотиком или введения в сочетании с антибиотиком и, таким образом, быть использован для профилактики и/или лечения заболеваний, вызываемых резистентными бактериями.
ДОПОЛНИТЕЛЬНЫЕ ПРИМЕРЫ
Пример 4. Приготовление экстракта жимолости и водного лечебного, отвара жимолости.
В данном примере были приготовлены экстракты жимолости с различным содержанием секологановой кислоты и водный лечебный отвар жимолости.
(1) Приготовление экстракта жимолости
Лекарственное сырье из жимолости (500 г) грубо измельчали и дважды экстрагировали 50 об./об.% водным раствором этанола, взятом в количестве, в 13 раз превышающем вес сухой жимолости, каждую экстракцию проводили в течение 1 часа. Экстракты объединяли и концентрировали при пониженном давлении с получением густого экстракта, затем к экстракту добавляли 450 мл дистиллированной воды и растворяли при нагревании, затем охлаждали до комнатной температуры, выдерживали в течение 24 ч и фильтровали с получением прозрачного раствора.
Прозрачный раствор концентрировали при пониженном давлении досуха и добавляли 1600 мл 95 об./об.% водного раствора этанола и перемешивали до растворения, а также к раствору медленно добавляли дистиллированную воду до содержания 75 об./об.% этанола, затем выдерживали в течение 24 ч и фильтровали, чтобы собрать фильтрат, затем этанол отделяли от фильтрата при пониженном давлении до тех пор, пока не был сформирован жидкий экстракт.
К жидкому экстракту добавляли 500 мл воды, растворяли и фильтровали, затем фильтрат пропускали через предварительно обработанную хроматографическую колонку со стироловой адсорбирующей макропористой смолой SP-825, колонку элюировали последовательно 5-кратным объемом (по сравнению с объемом колонки) воды и 6-кратным объемом 20 об./об.% водного раствора этанола, а затем этанол отделяли от элюента при пониженном давлении, пока не исчезнет запах спирта, и проводили лиофилизацию с получением 4,31 г экстракта жимолости (экстракт жимолости N4). Было определено, что экстракт жимолости N4 содержит 52% секологановой кислоты в соответствии с методом внешнего стандарта ВЭЖХ с помощью секологановой кислоты в качестве эталонного объекта (хроматограмма показана на фигуре 7).
Дальнейшую очистку экстракта жимолости N4 проводили с помощью хроматографической колонки Sephadex LH-20 с силикагелем, включая: элюирование водой, сбор жидкого образца, восстановление при пониженном давлении, лиофилизацию; очистку проводили несколько раз через гель-хроматографическую колонку, с получением экстракта жимолости N3 (2,80 г, содержащий 79,3% секологановой кислоты, хроматограмма показана на фигуре 8), N2 (2,55 г, содержащий 84,7% секологановой кислоты, хроматограмма показана на фигуре 9) и N1 (2,40 г, содержащий 90,67% секологановой кислоты, хроматограмма показана на фигуре 10) соответственно. Указанные концентрации были измерены в соответствии с методом внешнего стандарта ВЭЖХ с помощью секологановой кислоты в качестве эталонного объекта.
(2) Приготовление водного лечебного отвара жимолости.
Лекарственное сырье из жимолости (500 г) грубо измельчили и добавили 5000 мл. воды, затем травяной раствор выпаривали до объема 500 мл, и концентрация лекарственного вещества в травяном растворе составила 1 г/мл, и данный раствор был назван водным лечебным отваром жимолости W.
Пример 5. Исследование антибактериального действия экстрактов жимолости N1-N4 и водного лечебного отвара жимолости W по настоящему изобретению в сочетании с антибиотиками.
Данный пример изучает антимикробные эффекты экстрактов жимолости N1-N4 in vivo, соответственно, в сочетании с антибиотиками, и сравнение антимикробных эффектов с эффектами водного лечебного отвара жимолости W в сочетании с антибиотиком.
Экспериментальный штамм Klebsiella pneumoniae был выделен из мокроты пациента Четвертой Народной больницы Цзинань в 2010 г., и лекарственная устойчивость штамма показана в таблице 6 .

Примечания: R: резистентный, S: чувствительный, I: умеренно резистентный (умеренно резистентный).
AMP: ампициллин; PIP: пиперациллин; TZP: пиперациллин/тазобактам; АМС: амоксициллин/клавулановая кислота; CZO: цефазолин; СХМ: цефуроксим; СТХ: цефотаксим; CAZ: цефтазидим; CRO: цефтриаксон; IPM: имипенем; FEP: цефепим; FOX: цефокситин; GEN: гентамицин; АМК: амикацин; CIP: ципрофлоксацин; CHL: хлорамфеникол; SXT: триметоприм-сульфаметоксазол; TCY: тетрациклин; NIT: нитрофурантоин.
Контрольным штаммом является клинически изолированный АМР-чувствительный штамм, выделенный из образца мокроты пациента Четвертой Народной больницы Цзинань в 2010 г., не сохранившийся до настоящего момента.
Мыши КМ были приобретены в Экспериментал Энимал Центр оф Шандун Юниверсити (Experimental Animal Center of Shandong University), массой 16-18 г, половина - особи мужского пола, другая половина - женского, лицензия номер SCXK (Lu) 20090001.
Группировка животных:
5 контрольных групп, по 10 мышей в каждой группе: стандартная контрольная группа, контрольная группа контроля качества АМР-чувствительных бактерий (AMPS), и ее лечебная группа, контрольная группа АМР-устойчивых бактерий и ее лечебная группа.
15 контрольных групп, по 10 мышей в каждой группе: образцы N1-N4 и W в сочетании соответственно с AMP группой высокой дозировки, AMP группой средней дозировки и AMP группой низкой дозировки. Вводимые дозы показаны в таблице 7.



После группировки животные были инъецированы 2.5×107 (Klebsiella pneumoniae)∗100 мкл-1 (на 1 животное) внутрибрюшинно и затем немедленно было введено лекарство, пути введения чередовали между внутривенным через хвост и внутрибрюшинным (стерильный физиологический раствор использовали в качестве растворителя лекарства, за исключением водного лечебного отвара жимолости W, так как непрерывные внутривенные инъекции в хвост повреждают вены в хвосте, таким образом, внутрибрюшинные и внутривенные инъекции чередовали), животных непрерывно инъецировали один раз в день в течение 5 дней. Эффективность каждой группы оценивали по смертности животных и внутрибрюшинному количеству бактерий.
Результаты эксперимента:
1. Смертности животных показаны в таблице 8.

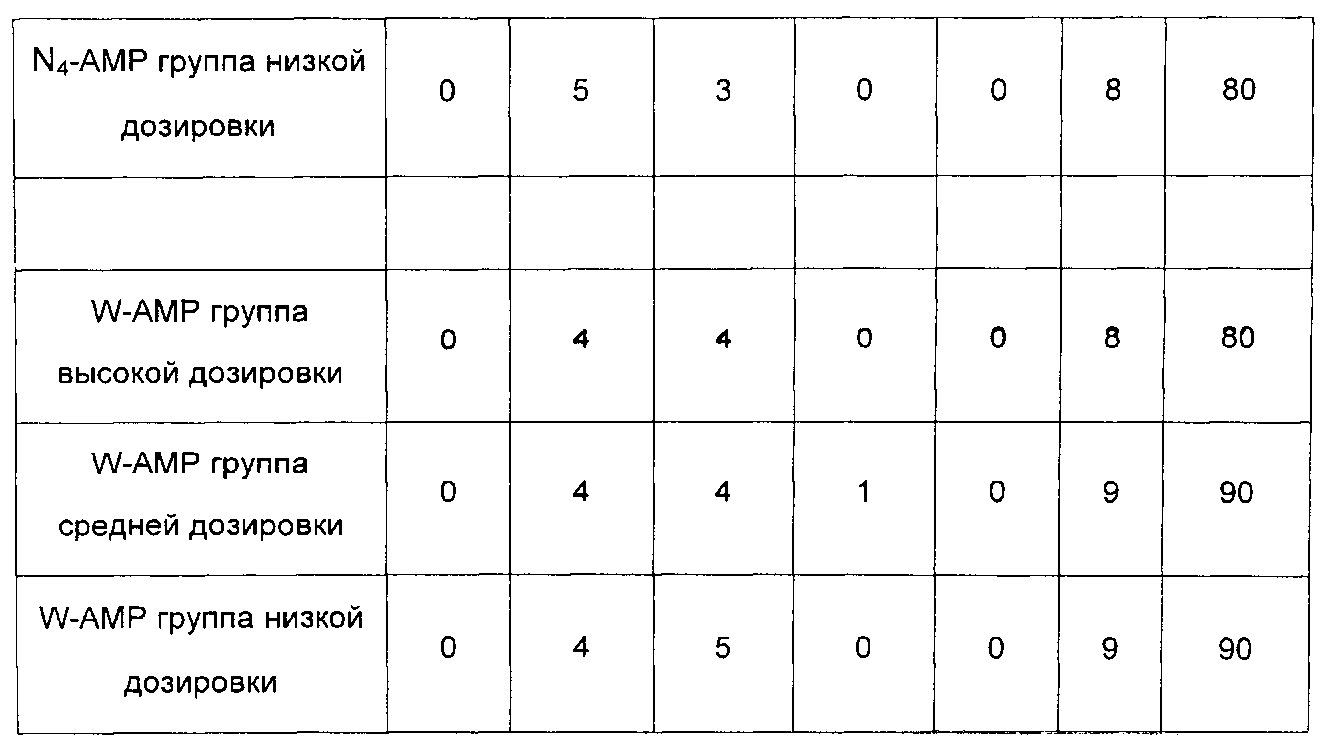
Анализ результатов в таблице 3: как видно из таблицы 3, смертность животных в контрольной группе с АМР-устойчивой бактериальной инфекцией и в контрольной группе с АМР-чувствительной бактериальной инфекцией выше 90%, что говорит о том, что модели созданы успешно. В то же время животные с АМР-чувствительной бактериальной инфекцией, которым вводили AMP, были хорошо защищены, в то время как животные с бактериальной инфекцией, устойчивой к AMP, которым вводили AMP, не были защищены (все животные умерли), что говорит о том, что экспериментальная система была нормальной.
Как можно увидеть из приведенных выше результатов, когда образцы от N1-N4 и W использовали в комбинации с AMP, образцы N1-N4 дают возможность животным с инфекцией, устойчивой к AMP, избежать смерти, показывая что тестовый образец изменяет чувствительность экспериментальной бактерии к антибиотикам, где N1 имеет самый выдающийся эффект. Напротив, сочетание W и AMP имеет худший эффект, с высокой смертностью животных, таким образом существенно не имеющий влияние на изменение чувствительности бактерий к антибиотикам.
2. Подсчет внутрибрюшинной колонии бактерий у животных
Подсчет внутрибрюшинного количества бактерий у мертвых животных: сразу после смерти животным вводили внутрибрюшинно 1 мл стерильного физиологического раствора, содержимое брюшных полостей осторожно смешивали до однородной массы в течение 1 минуты, асциты извлекали и накрывали в чашке Петри после градиентного разбавления и культивировали при 37°C в течение ночи, затем подсчитывали колонии.
Подсчет внутрибрюшинных колоний бактерий у выживших животных: мышей инъецировали непрерывно в течение 5 дней и затем умерщвляли через 2 часа после последнего инъецирования, затем вводили внутрибрюшинно 1 мл стерильного физиологического раствора и содержимое брюшных полостей осторожно смешивали до однородной массы в течение 1 минуты, асциты извлекали и накрывали в чашке Петри после градиентного разбавления и культивировали при 37°C в течение ночи, затем подсчитывали колонии, результаты подсчета колоний у контрольных групп показаны в таблице 9 ниже, и результаты подсчета для экспериментальных групп показаны в таблице 10.

Как можно увидеть из таблицы 9, чувствительная модель инфекции мыши к ампициллину является чувствительной к ампициллину, в то время как устойчивая к ампициллину модель инфекции мыши не контролируется ампициллином, и экспериментальная система нормальна.


Примечания: приведенные в таблице значения являются средними от подсчета асцитных колоний каждой мыши, в единицах КОЕ/мл.


Из результатов подсчета внутрибрюшинных колоний у животных в таблице 5 можно видеть, что применение образцов N1-N4 и W в сочетании с ампициллином может контролировать ампициллин-устойчивую бактерию в различной степени. При использовании в сочетании с AMP N1 имеет наилучший эффект и W имеет наихудший. Анализ эффекта доз показывает, что меньшие дозы дают плохой эффект, и что существенной разницы между группами, где применяли среднюю и высокую дозу, нет.
Рассматривая данные смертности животных и подсчета внутрибрюшинных колоний бактерий в целом, контрольные группы (такие как стандартная контрольная группа, модельная контрольная группа с АМР-устойчивой бактериальной инфекцией и ее группа с применением AMP, модельная контрольная группа с АМР-чувствительной бактериальной инфекцией и ее группа с применением AMP) были созданы в качестве системы контроля качества в эксперименте, смертность животных в модельной контрольной группе выше 90%, что указывает, что модель создана успешно. В то же время животные с моделью АМР-чувствительной бактериальной инфекции были хорошо защищены, тогда как животные с моделью АМР-устойчивой бактериальной инфекции и ее группы с применением AMP не были защищены, показывая, что экспериментальная система нормальна.
Эксперимент позволяет проанализировать терапевтический эффект ампициллина в сочетании с образцами N1-N4 и W главным образом через данные смертности животных и подсчета бактерий, и данные показывают, что когда образцы N1-N4 и W используются в сочетании с ампициллином, N1-N4 могут эффективно защищать животных с экспериментальной АМР-устойчивой бактериальной инфекцией от смерти, показывая, что тестовый образец изменяет чувствительность экспериментальной бактерии к антибиотикам, где N1 имеет наиболее выдающийся эффект, N4 имеет наихудший эффект, что свидетельствует о том, что содержание секологановой кислоты в экстракте жимолости имеет значительную положительную корреляцию с эффектом. В то же время эксперимент демонстрирует хорошее соотношение между эффектом и дозой, такое, что эффект высокой дозы и средней дозы существенно лучше, чем эффект низкой дозы. Хотя W также показывает определенный эффект, этот эффект значительно ниже, чем в экстракте.
Реферат
Изобретение относится к фармацевтической промышленности, в частности к фармацевтической композиции для профилактики и/или лечения заболевания, вызываемого бактерией, включающей экстракт жимолости, содержащий секологановую кислоту в определенном количестве и антибиотик. Фармацевтический набор для профилактики и/или лечения заболевания, вызываемого бактерией, включающий экстракт жимолости, содержащий иридоидные соединения, и антибиотик. Применение фармацевтической композиции или фармацевтического набора для получения препаратов для профилактики и/или лечения заболевания, вызываемого бактерией. Применение экстракта жимолости, содержащего иридоидные соединения, для получения лекарственных средств для реверсии резистентности бактерий, где экстракт жимолости содержит секологановую кислоту в определенном количестве. Вышеописанные композиция и набор эффективны для профилактики и/или лечения заболевания, вызываемого бактерией, реверсируют резистентность бактерий. 4 н. и 46 з.п. ф-лы, 10 ил., 10 табл., 4 пр.
Формула

где в формуле (1) X1 и Х2, каждый независимо, представляют собой О, и R представляет собой Н;
причем экстракт жимолости содержит 50 масс. % или более секологановой кислоты, представленной формулой (1), бактерия является мультирезистентной к антибиотикам грамотрицательной бактерией, выбранной из одной или более из группы, состоящей из Escherichia coli, Pseudomona aeruginosa, Klebsiella pneumoniae, Acinetobacter baumannii, Proteus bacillus, enterobacteriaceae, Haemophilus influenzae, pneumobacillus и catarrhalis; или мультирезистентной к антибиотикам грамположительной бактерией, выбранной из одной или более из группы, состоящей из Staphylococcus aureus, метициллинустойчивого Staphylococcus aureus, Streptococcus pyogenes группы A, Streptococcus pneumoniae, Bacillus subtilis и Staphylococcus epidermidis.
(1) измельчение жимолостных растений, исходного Lonicera japonica или других растений, относящихся к этому же роду, с последующей экстракцией водным раствором С1-С6 алкилового спирта, содержащим не более 95 об. % спирта, с получением экстракта;
(2) концентрирование экстракта, полученного на стадии (1) при нормальном или пониженном давлении с получением экстракта, или распылительная сушка экстракта, полученного на стадии (1), с получением порошка и растворение экстракта или порошка в воде, затем проведение осаждения или отстаивания с водным раствором С1-С6 алкилового спирта, содержащим не более 95 об. % спирта, с получением осадка или растворение жидкого концентрата;
(3) выделение и очистка осадка или растворение жидкого концентрата, полученного на стадии (2), с помощью хроматографии и сбор элюента, содержащего иридоидные соединения, где вид хроматографии выбирают из одного или нескольких из следующих: колоночной хроматографии с макропористой адсорбирующей смолой, хроматографии с силикагелем нормальной фазы и хроматографии с силикагелем обращенной фазы.
(1) измельчение жимолости и затем проведение экстракции 50 об./об. % водным раствором этанола с получением жидкого экстракта;
(2) концентрирование экстрагированной жидкости, полученной на стадии (1), при пониженном давлении с получением экстракта, растворение экстракта в воде, фильтрация и концентрирование раствора досуха, а также растворение путем добавления 95 об./об. % водного раствора этанола и добавление дистиллированной воды до получения раствора, содержащего 75 об./об. % этанола, фильтрация после отстаивания и извлечение этанола из фильтрата с получением жидкого экстракта;
(3) растворение жидкого экстракта, полученного на стадии (2), путем добавления воды, фильтрация с получением фильтрата, пропускание фильтрата через хроматографическую колонку со стироловой адсорбирующей макропористой смолой, затем элюирование колонки последовательно водой и 20 об./об. % водным раствором этанола, извлечение этанола из элюента, то есть из 20 об./об. % водного раствора этанола.
причем экстракт жимолости содержит секологановую кислоту, представленную следующей структурной формулой (1):

где в формуле (1) X1 и Х2, каждый независимо, представляют собой О, и R представляет собой Н;
причем экстракт жимолости содержит 50 масс. % или более секологановой кислоты, представленной формулой (1), бактерия является мультирезистентной к антибиотикам грамотрицательной бактерией, выбранной из одной или более из группы, состоящей из Escherichia coli, Pseudomona aeruginosa, Klebsiella pneumoniae, Acinetobacter baumannii, Proteus bacillus, enterobacteriaceae, Haemophilus influenzae, pneumobacillus и catarrhalis; или мультирезистентной к антибиотикам грамположительной бактерией, выбранной из одной или более из группы, состоящей из Staphylococcus aureus, метициллинустойчивого Staphylococcus aureus, Streptococcus pyogenes группы A, Streptococcus pneumoniae, Bacillus subtilis и Staphylococcus epidermidis.
(1) измельчение жимолостных растений, исходного Lonicera japonica или других растений, относящихся к этому же роду, с последующей экстракцией водным раствором C1-С6 алкилового спирта, содержащим не более 95 об. % спирта, с получением экстракта;
(2) концентрирование экстракта, полученного на стадии (1) при нормальном или пониженном давлении с получением экстракта, или распылительная сушка экстракта, полученного на стадии (1), с получением порошка и растворение экстракта или порошка в воде, затем проведение осаждения или отстаивания с водным раствором С1-С6 алкилового спирта, содержащим не более 95 об. % спирта, с получением осадка или растворение жидкого концентрата;
(3) выделение и очистка осадка или растворение жидкого концентрата, полученного на стадии (2), с помощью хроматографии и сбор элюента, содержащего иридоидные соединения, где вид хроматографии выбирают из одного или нескольких из следующих: колоночной хроматографии с макропористой адсорбирующей смолой, хроматографии с силикагелем нормальной фазы и хроматографии с силикагелем обращенной фазы.
(1) измельчение жимолости и затем проведение экстракции 50 об./об. % водным раствором этанола с получением жидкого экстракта;
(2) концентрирование экстрагированной жидкости, полученной на стадии (1), при пониженном давлении с получением экстракта, растворение экстракта в воде, фильтрация и концентрирование раствора досуха, а также растворение путем добавления 95 об./об. % водного раствора этанола и добавление дистиллированной воды до получения раствора, содержащего 75 об./об. % этанола, фильтрация после отстаивания и извлечение этанола из фильтрата с получением жидкого экстракта;
(3) растворение жидкого экстракта, полученного на стадии (2), путем добавления воды, фильтрация с получением фильтрата, пропускание фильтрата через хроматографическую колонку со стироловой адсорбирующей макропористой смолой, затем элюирование колонки последовательно водой и 20 об./об. % водным раствором этанола, извлечение этанола из элюента, то есть из 20 об./об. % водного раствора этанола.

где в формуле (1) X1 и Х2, каждый независимо, представляют собой О, и R представляет собой Н;
причем экстракт жимолости содержит 50 масс. % или более секологановой кислоты, представленной формулой (1), бактерия является мультирезистентной к антибиотикам грамотрицательной бактерией, выбранной из одной или более из группы, состоящей из Escherichia coli, Pseudomona aeruginosa, Klebsiella pneumoniae, Acinetobacter baumannii, Proteus bacillus, enterobacteriaceae, Haemophilus influenzae, pneumobacillus и catarrhalis; или мультирезистентной к антибиотикам грамположительной бактерией, выбранной из одной или более из группы, состоящей из Staphylococcus aureus, метициллинустойчивого Staphylococcus aureus, Streptococcus pyogenes группы A, Streptococcus pneumoniae, Bacillus subtilis и Staphylococcus epidermidis.
(1) измельчение жимолости, исходного Lonicera japonica или других растений, относящихся к этому же семейству, с последующей экстракцией водным раствором C1-С6 алкилового спирта, содержащим не более 95 об. % спирта, с получением экстракта;
(2) концентрирование экстракта, полученного на стадии (1), при нормальном или пониженном давлении, с получением экстракта, или распылительная сушка экстракта, полученного на стадии (1), с получением порошка, и растворение экстракта или порошка в воде, затем проведение осаждения или отстаивания с водным раствором C1-C6 алкилового спирта, содержащим не более 95 об. % спирта с получением осадка, или растворение жидкого концентрата;
(3) выделение и очистка осадка или растворение жидкого концентрата, полученного на стадии (2) с помощью хроматографии, и сбор элюента, содержащего иридоидные соединения, где вид хроматографии выбирают из одного или нескольких из следующих: колоночной хроматографии с макропористой адсорбирующей смолой, хроматографии с силикагелем нормальной фазы или хроматографии с силикагелем обращенной фазы.
(1) измельчение жимолостного лекарственного сырья в 50 об./об. % водном растворе этанола с получением жидкого экстракта;
(2) концентрирование экстрагированной жидкости, полученной на стадии (1) при пониженном давлении, с получением экстракта, растворение экстракта в воде, фильтрация и концентрирование раствора досуха, а также растворение путем добавления 95 об./об. % водного раствора этанола, добавление дистиллированной воды до содержания в полученном растворе 75 об./об. % этанола, фильтрация после отстаивания и извлечение этанола из фильтрата с получением жидкого экстракта;
(3) растворение жидкого экстракта, полученного на стадии (2), путем добавления воды, фильтрация с получением фильтрата, пропускание фильтрата через хроматографическую колонку со стироловой адсорбирующей макропористой смолой, а затем элюирование колонки последовательно водой и 20 об./об. % водным раствором этанола и извлечение этанола из элюента, то есть из 20 об./об. % водного раствора этанола.

Комментарии