Новые цианиновые красители на основе n-метил-2-метилмеркаптобензтеллуразолия иодида, обладающие биологической активностью - RU2677662C1
Код документа: RU2677662C1
Чертежи
Описание
Изобретение относится к области химии гетероциклических соединений, а именно к новым цианиновым красителям на основе N-метил-2-метилмеркап-тобензтеллуразолия иодида веществ, обладающие биологической активностью.
Цианины характеризуются очень высокими коэффициентами экстинкции. Они используются в биологических исследованиях для мечения водорастворимых белков, антител, ДНК и олигонуклеотидов, пептидов и других биологических молекул в области биохимии, молекулярной биологии, иммунологии и гистохимии. Такие оптические свойства цианиновых красителей, как длина волны поглощения, фотостабильность и флуоресценция, можно изменять с помощью различных заместителей, а также путем изменения количества полиметиновых цепочек (Фомина М.В., Никифоров А.С., Громов С.П. Современные подходы к синтезу и перспективы использования цианиновых красителей, содержащих функциональные группы в N-заместителях // Успехи химии. 2016. Т. 85. С. 684-699; Dobretsov G., Polyak В., Smolina N., Babushkina Т., Syrejshchikova T., Klimova Т., Sverbil V., Peregudov A., Gryzunov Y., Sarkisov O. Interaction of a fluorescent probe, CAPIDAN, with human serum albumin // J. Photochem. Photobiol. A: Chemistry, 2013. Vol. 25 LP. 134-140; Tatikolov A.S. Polymethine dyes as spectral-fluorescent probes forbiomacromolecules // J. Photochem. Photobiol. C:Photochem.Reviews. 2012. Vol. 13. P. 55-90; Lindberg D.J., Wranne M.S., Gatty M.G., Westerlund F., Esbjorner E.K., Steady-state and time-resolved Thioflavin-T fluorescence can report on 35morphological differences in amyloid fibrils formed by Ab(1-40) and Ab(1-42) // Biochem. Biophys. Res. Comm., 2015. Vol. 458. P. 418-423; Veiksina S., Kopanchuk S., Rinken A. Fluorescence anisotropy assay forpharmacological characterization of ligand binding dynamics to melanocortin 4 receptors // Anal.Biochem. 2010. Vol. 402. P. 32-39; Gerasov A., Shandura M., Kovtun Y., Losytskyy M., Negrutska V., Dubey I. Fluorescent labeling of proteins with amine-specific 1,3,2-(2H)-Dioxaborinepolymethine dye // Analyt. Biochem. 2011. Vol. 420. P. 115-120; Zadeh P.S.N., Mallak K.A., Carlsson N., Akerman B. A fluores-cencespectroscopy assay for real-time monitoring of enzyme immobilizationinto-mesoporous silica particles // Analyt.Biochem. 2015. Vol. 476. P. 51-58; Deligeorgiev T.G., Gadjev N.I., Timtcheva I.I., Maximova V.A., Katerinopoulos H.E., Foukaraki E. Synthesisohomodimericmonomethine cyanine dyes as noncovalent-nucleic acid labels and their absorption and fluorescencespectral characteristics // Dyes and Pigments. 2000. Vol. 44. P. 131-136; Степанов Б.И. Введение в химию и технологию органических красителей. М.: Химия, 1971. С.448).
Круг задач, решаемых с помощью цианиновых красителей, непрерывно растет, и они могут быть использованы для конструирования новых лекарственных препаратов. Поэтому получение и изучение свойств новых соединений, обладающих флуоресцентными свойствами, остается предметом постоянного внимания исследователей.
Известен способ получения 1-(3-бромпропил)-4-[(3-метил-2,3-дигидро 1,3-бензотиазол-2-илиден)метил]пиридиний йодида. В 15 мл изопропанола растворяли при комнатной температуре 1.2 г (0.004 моль)1-(3-бромпропил)-4-метилпиридин-1-ий бромида, к раствору добавляют 1.3 г(0.004 моль) 3-метил-2-(метилсульфанил)-бензтиазол-3-ий иодида и при непрерывном перемешивании нагревают до 50°С (растворения соли не наблюдалось). К суспензии по каплям в течение 10 минут добавляют раствор перегнанноготриэтиламина в изопропаноле (0.6 мл (0.43 г, 0.004 моль) триэтиламинав 3.0 мл изопропанола и доводят до кипения. При добавлении триэтиламинареакционная масса приобретает ярко-желтый цвет, а соль растворяется. Реакционную массу выдерживают при кипячении в течение 2.5 часов. При остывании из раствора выпадает осадок оранжевого цвета, который отфильтровывают горячим, промывают от четвертичной соли триэтиламина на фильтре теплым изопропаноломи высушивают в вакуум-эксикаторе. Выход технического продукта 1.2 г (60%) (Седунова П.А. Получение новых полиметиновых красителей на основе бензоксазола и бензотиазола // Дисс. канд. хим. наук. - Санкт-Петербург. - 2012. - 108 с.; Deligeorgiev T.G., Zaneva D.A., Katerinopoulos H.E., Kolev V.N. Anovelmethodforthepreparationofmonomethinecyaninedyes // Dyesand Pigments. 1999. Vol. 41. P. 49-54.).
Известен также способ получения3-метил-2-((I-метил пиридин-4(1H)-илиден)метил) бензотиазол-3-ий иодида3-метил-2-(метилсульфанил)-бензтиазол-3-ий йодид, 1,4-диметилпиридиний иодид и триэтиламин), добавленный в один прием, кипятят с обратным холодильником при перемешивании в 15 мл изопропанола в течение 2 часов. Выпавший осадок отфильтровывают горячим, промывают изопропанолом, высушивают в вакуум-эксикаторе. Выход 0.60 г (40%) (Седунова П.А. Получение новых полиметиновых красителей на основе бензоксазола и бензотиазола // Дисс. канд. хим. наук - Санкт-Петербург, 2012. - 112 с.; Deligeorgiev T.G., Zaneva D.A.,. Katerinopoulos H.E., Kolev V.N. Anovelmethodforthepreparationofmonomethinecyanine-dyes /// DyesandPigments. 1999. V. 41. P.49-54).
Известен также способ получения 3-метил-2-((3-метилбензоксазол-2(3H)-илиден)метил)бензотиазол-3-ий иодида взаимодействием 3-метил-2-(метилсульфанил)-бензтиазол-3-ий йодид, 2,3-диметилбензоксазолий йодид и триэтиламина, кипятят с обратным холодильником при перемешивании в 15 мл изопропанола в течение 2 часов. Выпавший осадок отфильтровывают горячим, промывают горячим изопропанолом, высушивают на воздухе. Выход-чистого соединения 0.45 г (69%) (Седунова П.А. Получение новых полиметиновых красителей на основе бензоксазола и бензотиазола // Дисс. канд. хим. наук - Санкт-Петербург, 2012. - 108 с.; Пат. US 3149105 США. Novel synthesis of cyanines and merocyanines / H. Larive, R. Dennilauler (Франция). - №138003; заявл. 14.09.61; опубл. 15.09.64. - 5 с.).
Известен способ получения бис[3-метилбензотеллуразол-(2)]-триметинцианиниодида, который является цианиновым красителем. При нагревании 2-метилбензотеллуразола с избытком йодистого метила в запаянной ампуле образуется йодистый 2,3-диметилбензотеллуразолий, взаимодействием которого с ортомуравьиным эфиром и 2-метилзамещенными N - четверточными гетероциклами получены симметричный и несимметричные цианиновые красители (Садеков И.Д., Абакаров Г.М., Шнейдер А.А., Курень С.Г., Стариков А.Г., Гарновский А.Д., Минкин В.И. Азот-теллур содержащие гетероциклы. Подходы к синтезу 2-замещенных бензотеллуразолов // Химия гетероциклических соединении. 1989. №1. С. 120; Абакаров Г.М., Шабсон А.А., Садеков И.Д., Гарновский А.Д., Минкин В.И. Азот-теллур содержащие гетероциклы. 1. Синтезбензотеллуразолов и их производных // Химия гетероциклических соединений. 1988. №2. C. 276-278; Singh H.B., Khanna P.K. Synthesi-sof-1,2-ditellurane // J. Organomet. Chem. 1988. Vol. 338. P. 9-12)].
Однако все вышеуказанные способы для получения цианиновых красителей на основе N-метил-2-метилмеркаптобензтеллуразолия иодида могут быть использованы только в видоизмененном виде.
Ранее нами были синтезированы 2-меркаптобензтеллуразол и N-метил-2-метилмеркаптобензтеллуразолия иодида, которые являются исходными веществами (патент: RU 2546674 С2 10.04.2015) и производные 2-меркаптобезтеллуразола, которые являются близкими аналогами для заявленных соединений (патент: RU 2602499 С1. 2016. Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Дагестанский государственный университет»; Ali A.А.М., Ramazanova Р.А., Abakarov G.M., Tarakanova A.V., Anisimov A.V. // Russ. J. Gen. Chem. 2015. Vol. 85. No 3. P. 722; Али A.A.M., Рамазанова П.А., Абакаров Г.М., Тараканова А.В., Анисимов А.В. // ЖОХ. 2015. Т. 85. №3. С. 570; Ali А.А.М., Ramazanova Р.А., Abakarov G.М., Tarakanova А.V., Anisimov А.V. // Russ. J. Gen. Chem. 2016. Vol. 86. No. 4. P. 830; Али А.А.М., Рамазанова П.А., Абакаров Г.М., Тараканова А.В., Анисимов А.В. // ЖОХ. 2016. Т. 86. №4. С. 643).
Задача-синтез новых гетероциклических соединений, а именно новых цианиновых красителей на основе N-метил-2-метилмеркаптобензтеллуразолия иодида веществ, обладающих биологически активным действием, а также поиск биологически активных веществ, среди азотсодержащих гетероциклических соединений теллура.
Технический результат заключается в разработке новых цианиновых красителей, биологически активных производных класса 2-меркаптобензтеллуразолов.
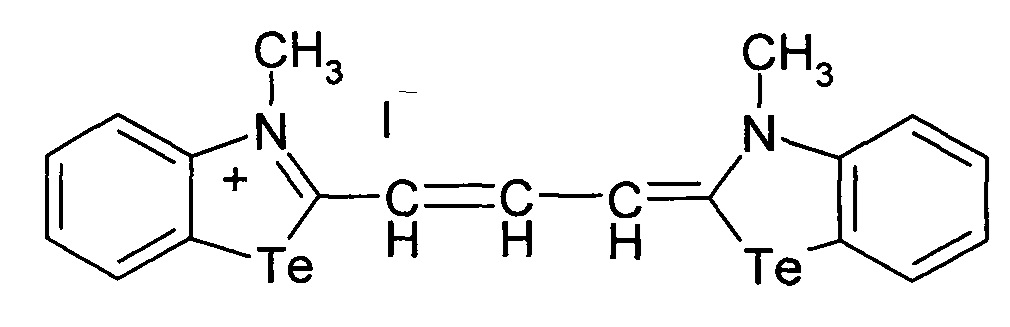
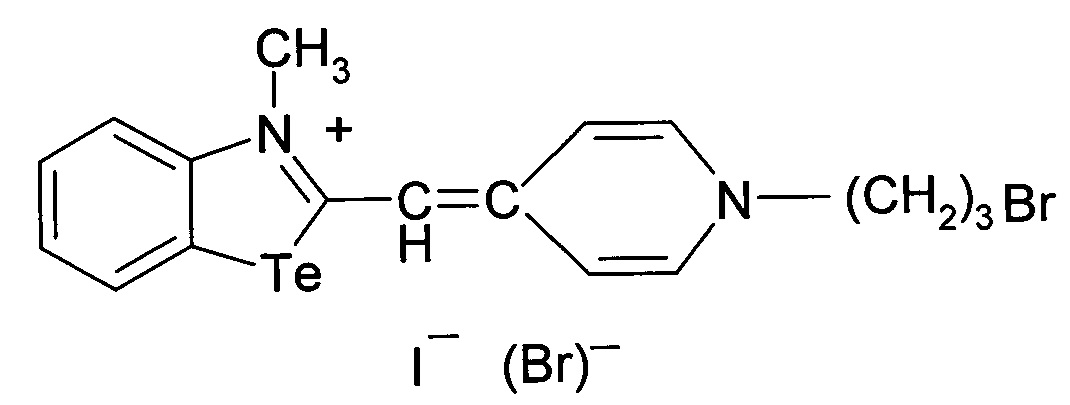
Сущность изобретения состоит в том, что синтезируютцианиновый краситель 1-(3-бромпропил)-4-((3-метил-2,3-дигидро-1,3-бензотеллуразол-2-илиден)метил]пиридинийиодид, имеющий структурную формулу:
1.
при этом способ получения цианинового красителя обладающего биологической активностью включает взаимодействие N-метил-2-метилмеркаптобензтеллуразолия иодидас 1-(3-бромпропил)-4-метилпиридин-1-ий бромидом при кипячении в течение 2.5 часов.
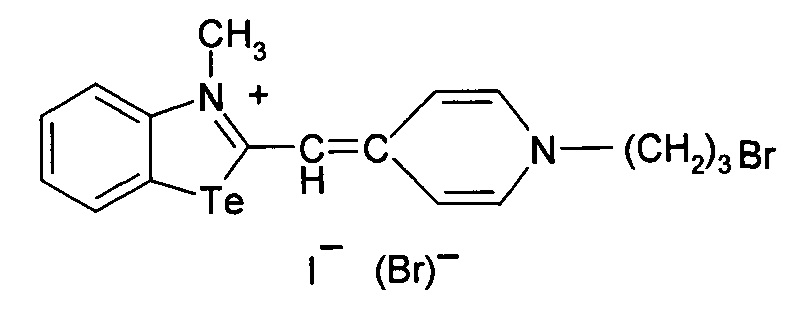
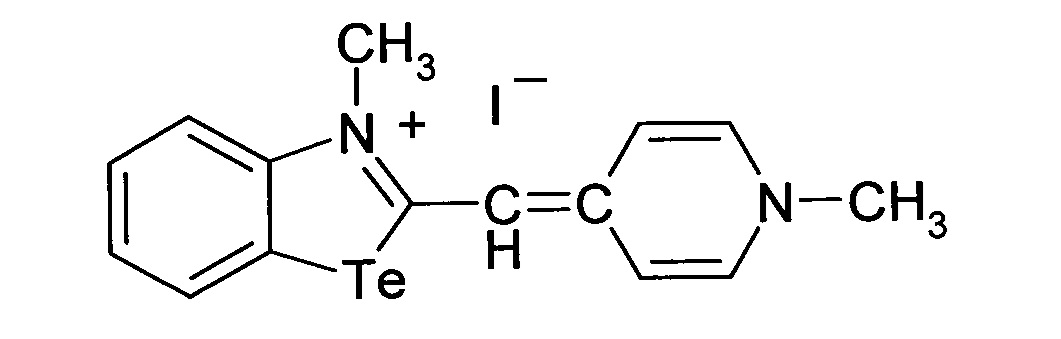
Способ получения 3-метил-2-((1-метилпиридин-4(1Н)-илиден)метил)бензотеллуразол-3-ий иодида
2.

при этом способ получения цианинового красителя обладающего биологической активностью включает взаимодействие 3-метил-2-(метилсульфанил)-бензотеллуразол-3-ий иодида с 1,4-диметилпиридиний иодидом при кипячении в течение 3 часов.
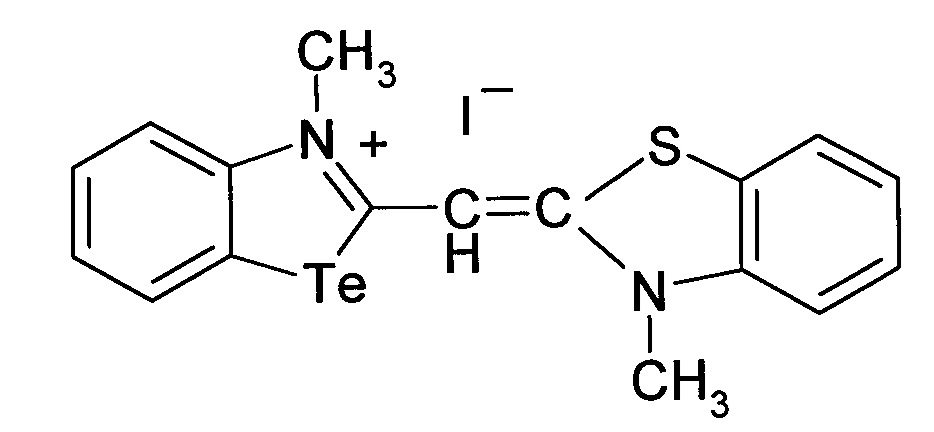
Способ получения 3-метил-2-((3-метилбензотиазол)-2(3H)илиден)метил)бензотеллуразол-3-ий йодид
3.
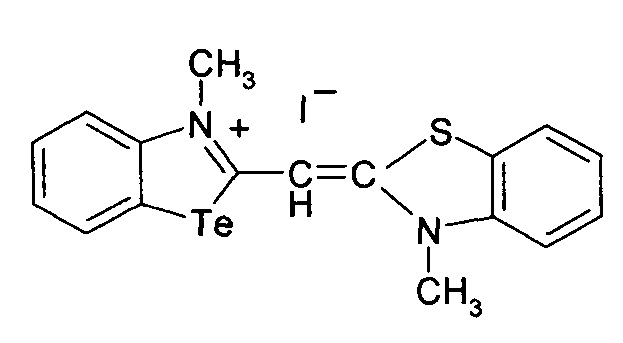
при этом способ получения цианинового красителя обладающего биологической активностью включает взаимодействие N-метил-2-метил-меркаптобензтеллуразолия иодидас 2,3-диметил-1,3-бензотиазол-3-ий иодидом при кипячении в течение 4 часов.
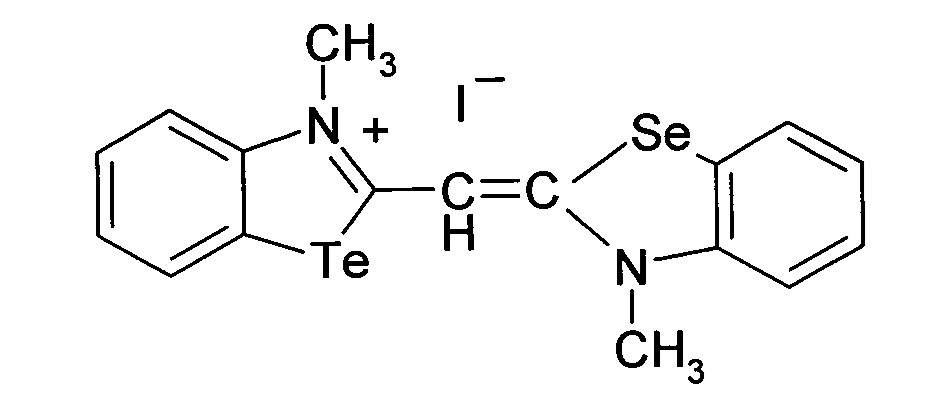
Способ получения 3-метил-2-((3-метилбензоселеназол)2(3H)-илиден)метил)бензотеллуразол-3-ий йодид
4.
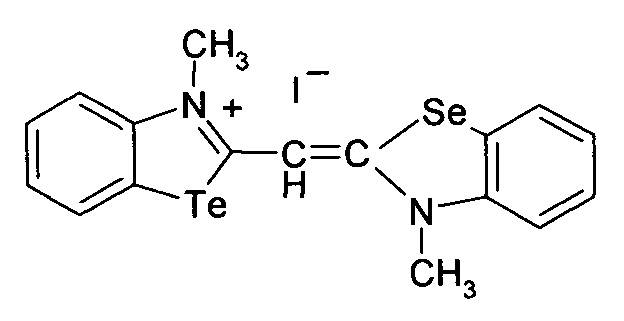
при этом способ получения цианинового красителя обладающего биологической активностью включает взаимодействие N-метил-2-метилмеркаптобензтеллуразолия иодидас2,3-диметилбензселеназолий иодидом при кипячении в течение 5 часов.
Таким образом, нам удалось синтезировать 4-х веществ:
1.1-(3-бромпропил)-4-((3-метил-2,3-дигидро-1,3-бензотеллуразол-2-илиден)метил]пиридиний йодид;
2.3-метил-2-((1-метилпиридин-4(1H)-илиден)метил)бензотеллуразол-3-ий йодид;
3.3-метил-2-((3-метилбензотиазол)-2(3H)илиден)метил)бензотеллуразол-3-ий йодид;
4.3-метил-2-((3-метилбензоселеназол)-2(3H)илиден)метил)бензотеллуразол-3-ий йодид.
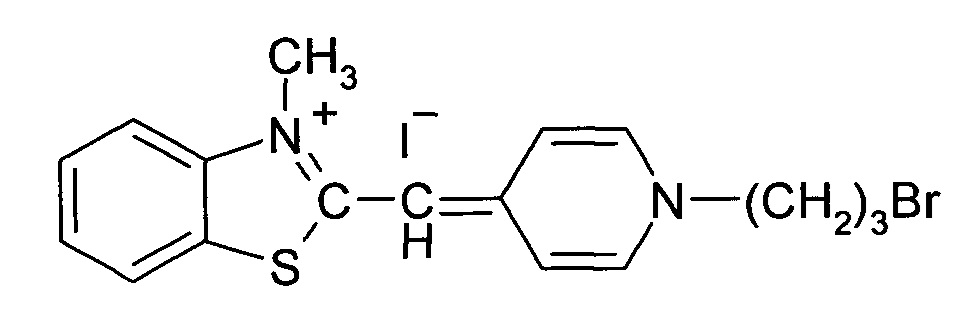
1-(3-Бромпропил)-4-((3-метил-2,3-дигидро-1,3-бензотеллуразол-2илиден)-метил]пиридиний йодид полученный взаимодействием N-метил-2-метилмеркаптобензтеллуразолия иоди дав изопропиловом спирте с 1-(3-бромпропил)-4-метилпиридин-1-ий бромидом в присутствии триэтиламина имеет структурную формулу:
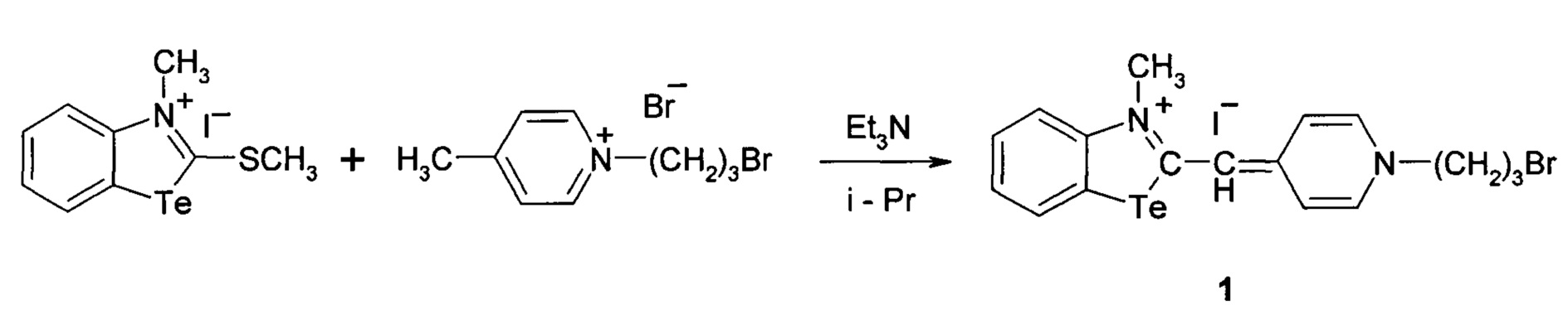
Синтез 1-(3-бромпропил)-4-((3-метил-2,3-дигидро-1,3-бензотеллуразол-2-илиден)метил]пиридинийиодида, заключается в том, что в реакционную смесь из изопропанола и 1-(3-бромпропил)-4-метилпиридин-1-ий бромида добавляют N-метил-2-метилмеркаптобензтеллуразолия иодида и при температуре 50°С по каплям в течение 10 минут добавляют раствор триэтиламина в изопропаноле. Смесь кипятят в течение 2.5 часов, отфильтровывают горячим, промывают на фильтре горячим изопропанолом, сушат и перекристаллизовывают.
Пример 1.
В двугорлую колбу, снабженную обратным холодильником и капельной воронкой, помещали 0.30 г. (1.2 ммоль) 1-(3-бромпропил)-4-метилпиридин-1-ий бромида растворенного в 20 мл изопропанола, к раствору добавляли 0.53 г (1.2 ммоль) N-метил-2-метилмеркаптобензтеллуразолия иодида при температуре 50°С идобавлялипо каплям в течение 10 минут раствор триэтиламина0.43 г (0.4 ммоль) в 3.0 мл изопропанола. Реакционную массу выдерживали при кипячении в течение 2.5 часов, отфильтровывали горячим, промывали от четвертичной соли триэтиламина на фильтре горячим изопропанолом, сушили и перекристаллизовывали из тетрагидрофурана. Выход 0.62 г (1 ммоль, 88%),темно-оранжевые кристаллы т.пл. 239-241°С. ИК спектр, ν, см-1, 3050 (СН=), 2955, 1512, 1480, 1431, 1378, 1279 (CHAr), 2890 (СН3), 1654, 1617, 1560, 1444 (N=C в цикле), 990, 906, (NTeC), 779,754, 747 (CH2Br). Спектр ЯМР1Н, δ, м.д.: 8.63 д д (1Н, СН4, J 8.4 Гц), 8.36 д (1Н, СН7, J 7.10 Гц), 8.09 д (1Н, СН5, J 7.8 Гц), 7.85-7.79 м (2Н, СН13,15), 7.58-7.43 м (1Н, СН6), 7.30-7.15 м (2Н, СН12,16), 6.71 с (1Н, СН10), 4.33 т (2H, N14CH2, J 7.0 Гц), 4.03 д (2Н, СН218, J 6.6 Гц), 3.81-3.67 м (2Н, -CH2Br), 2.51 с (3H, N3CH3). Спектр ЯМР13С, δ, м.д.: 157.54 (С11), 152.58 (С13,15), 145.65 (С2), 142.08 (С9), 128.66 (С7), 123.67 (С5), 119.04 (С6), 119.04 (С4), 114.82 (С8), 114.82 (С12,16), 75.48. (С10), 55.64 (N14CH2), 42.26 (CH2Br), 36.22 (СН218). 33.13 (N3CH3).
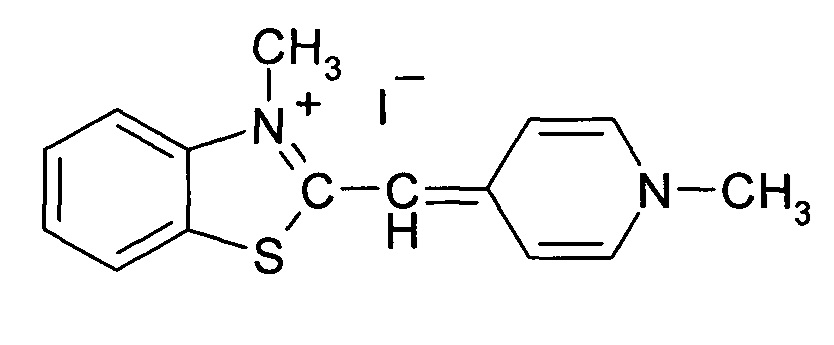
3-Метил-2-((1-метилпиридин-4(1Н)-илиден)метил)бензотеллуразол-3-ийиодид, полученный взаимодействием N-метил-2-метилмеркаптобензте-ллуразолия иодида в изопропиловом спирте с 1,4-диметилпиридиний иодидом в присутствии триэтиламина имеет структурную формулу:
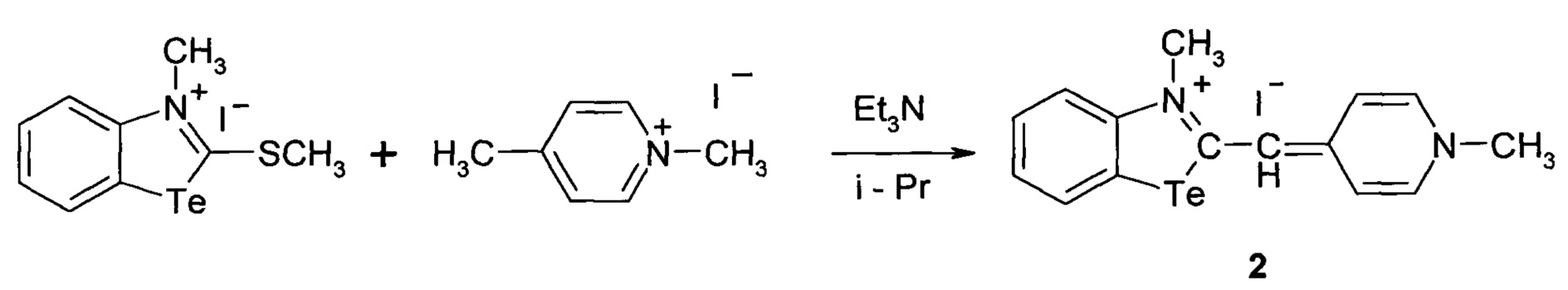
Синтез 3-метил-2-((1-метилпиридин-4(1Н)-илиден)метил)бензотеллуразол-3-и иодида, заключается в том, что к раствору из изопропанола, N-метил-2-метилмеркаптобензтеллуразолия иодида и 1,4-диметилпиридиний иодида при температуре 50°С добавляют раствор триэтиламина в изопропаноле. Смесь кипятят в течение 3 часов, промывают на фильтре горячим изопропанолом, высушивают и перекристаллизовывают.
Пример 2.
В двугорлую колбу, снабженную обратным холодильником и капельной воронкой, помещали 0.53 г (0.62 ммоль) N-метил-2-метилмер-каптобензтеллуразолия иодида и 0.28 г (0.12 ммоль) 1,4-диметилпиридиний иодида в 20 мл изопропанола. К полученной суспензии при температуре 50°С прилилитриэтиламин 0.14 г (1.4 ммоль) растворенный в 3.0 мл изопропанола по каплям в течение 10 минут. Смесь кипятили в течение 3 ч., промывали на фильтре горячим изопропанолом, высушивали и перекристаллизовывали из тетрагидрофурана. Выход 0.67 г (5 ммоль, 97%), красно-оранжевые кристаллы т.пл. 227-229°С. ИК спектр, ν, см-1, 3030 (СН=), 3997, 2962, 1459, 1403, 1348, 1258(CHAr), 2865 (СН3), 1620, 1516, 1442 (N=C в цикле), 981, 895, 787 (NTeC). Спектр ЯМР1Н, δ, м. д.:8.55 д д (1Н, СН7, J 8.0 Гц), 8.29д (1Н, СН4, J 7.2 Гц), 8.09-8.07 м (1Н, СН5), 7.46 д(1Н, СН6, J 7.2 Гц), 7.22 м (2Н, СН13,15), 7.16 м (2Н, СН12,16), 6.67 с (1H, СН10), 3.98 с (3H, N3CH3), 3.70 с (3Н, N14CH3). Спектр ЯМР13С, δ, м.д.: 156.12(С11), 151.82(С9), 146.27(С2), 142.42(С13,15), 132.07(С7), 128.16(С5), 123.05(С6), 118.44(С4), 114.67(С8), 112.22(С10), 101.43(С12,16),45.03(С17), 35.37(С18).
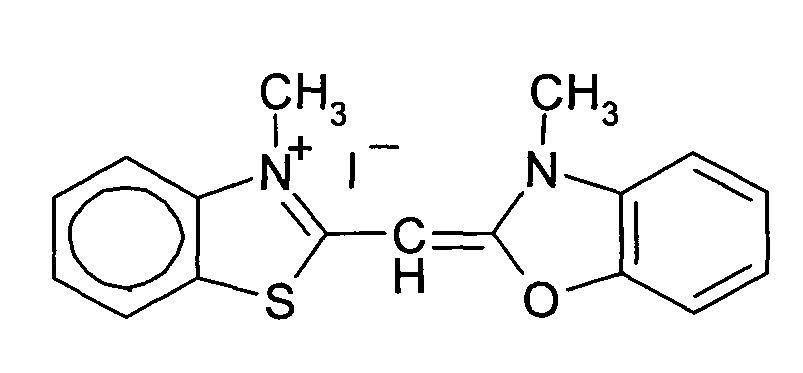
3-Метил-2-((3-метилбензотиазол)-2(3H)илиден)метил)бензотеллуразол-3-ий йодид полученный взаимодействием N-метил-2-метилмер-каптобензтеллуразолия иодида в изопропиловом спирте с 2,3-диметил-1,3-бензотиазол-3-ий йодидом в присутствии триэтиламина имеет структурную формулу:
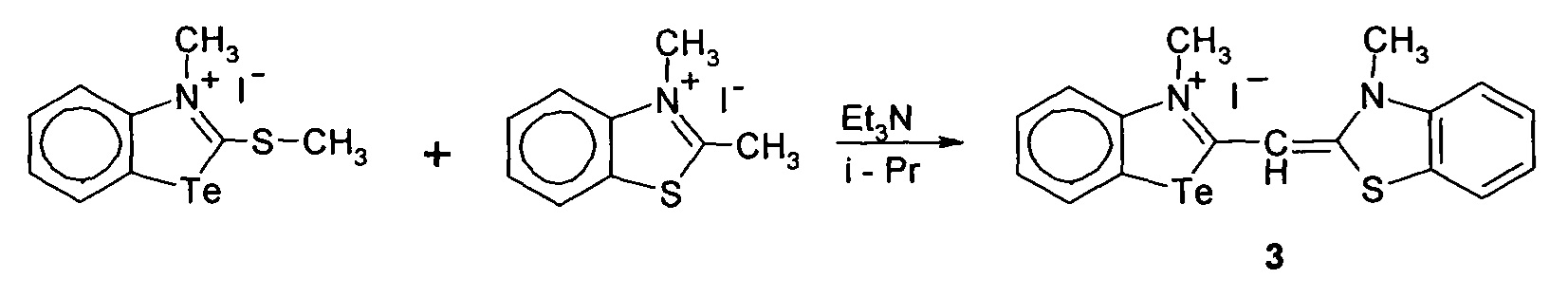
Синтез 3-метил-2-((3-метилбензотиазол)-2(3H)илиден)метил)бензотеллуразол -3-ий иодида, заключается в том, к реакционной смеси из изопролпанола, 2,3-диметил-1,3-бензотиазол-3-ий иодида и N-метил-2-метилмеркаптобензтел-луразолия иодида добавляют триэтиламин в изопропаноле при температуре 50°С. Смесь кипятят в течение 4 часов. Осадок отфильтровывают горячим, промывают горячим изопропанолом, высушивают и перекристаллизовывают.
Пример 3.
В двугорлую колбу, снабженную обратным холодильником и капельной воронкой, помещали 0.34 г (0.12 ммоль) 2,3-диметил-1,3-бензотиазол-3-ий йодид, 0.53 г (1.2 ммоль) N-метил-2-метилмеркаптобензтеллуразолия иодида. В реакционную смесь добавляли триэтиламин 0,21 г (0.28 мл, 2 ммоль) растворенного в 3 мл изопропанола при температуре 50°С. Смесь кипятили в течение 4 ч. После охлаждения выпавший осадок отфильтровывали горячим, промывали горячим изопропанолом, высушивали на воздухе и перекристаллизовывали из смеси ацетонитрила и тетрагидрофурана в соотношении 1:1. Выход 0.33 г (0.6 ммоль 52%), золотистые кристаллы, т.пл. 329-331°С. ИК спектр, ν, см-1, 3030 (СН=), 2924, 1466, 1314 (CHAr), 2800 (СН3), 1629, 1617, 152, 1502 (N=Свцикле), 741, 559 (NTeC). Спектр ЯМР1Н, δ, м.д.: 8.33 дд (1Н, СН7, J 7.8, 1.2 Гц), 8.24 д(1Н, СН4, J 7.7 Гц), 7.88 д(1Н, CH13, J 8.3 Гц), 7.82 д(1H, CH5, J 8.4 Гц), 7.66 дд(1Н, СН16, J 11.5 Гц), 7.59 м(1Н, СН14), 7.49 т (1H, СН15, J 7.6 Гц), 7.32 т(1Н, СН6, J 7.5 Гц), 7.00 с (1Н, СН10), 4.00 с(6Н,СН3).Спектр ЯМР13С, δ, м. д.: 170(С11), 167.16(С2), 163.66(С17), 146.53(С13), 141.21(С9), 7 132.19(С15), 128.56(С7), 128.47(С5), 124.83, (С6) 124.07(С14), 123.76(С16), 117.90(С4), 117.05(С18), 113.72(С8), 59.76(С10), 36.78(N3CH3), 34.12 (N19CH3).
3-Метил-2-((3-метилбензоселеназол)-2(3H)илиден)метил)бензотеллуразол-3-ий йодид полученный взаимодействием N-метил-2-метилмеркаптобензтеллуразолия иодида в изопропиловом спирте с 2,3-диметил-1,3-бензоселеназол-3-ий иодидом в присутствии триэтиламина имеет структурную формулу:
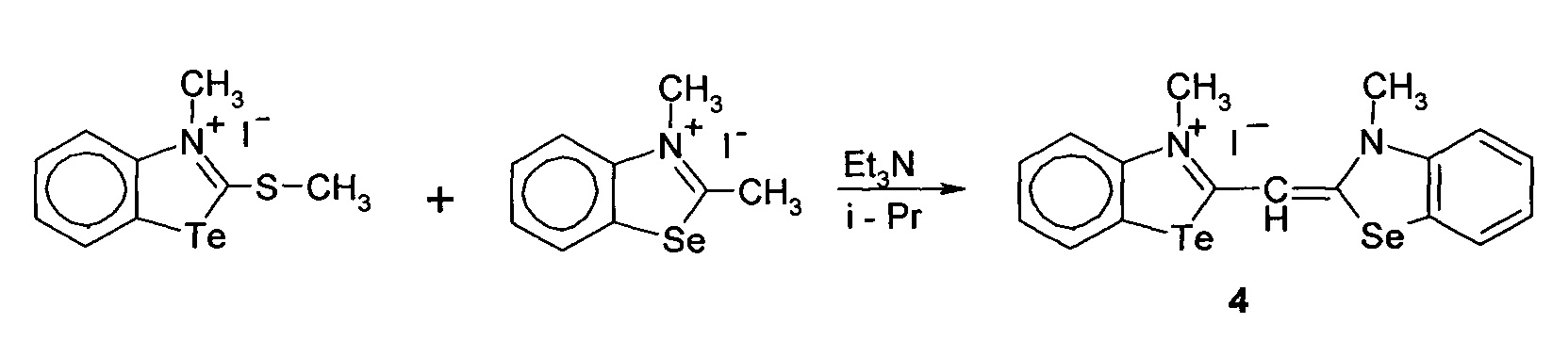
Синтез 3-метил-2-((3-метилбензоселеназол)2(3H)илиден)метил)-бензо-теллуразол-3-ий иодида, заключается в том, что к реакционной смеси из изопропанола, N-метил-2-метилмеркаптобензтеллуразолия иодида и 2,3-диметил-1,3-бензоселеназол-3-ий иодида добавляют триэтиламин в изопропаноле при температуре 50°С. Смесь кипятили в течение 5 часов. Осадок отфильтровывают горячим, промывают горячим изопропанолом, сушат и перекристаллизовывают.
Пример 4.
В двугорлую колбу снабженную обратным холодильником и капельной воронкой помещали 0.52 г (0.12 ммоль) N-метил-2-метилмеркапто-бензтеллуразолия иодида, 0.42 г (1.2 ммоль) и 2,3-диметил-1,3-бензо-селеназол-3-ий иодиди 0.21 г (0.3 мл, 2.1 ммоль) растворенного в 15 мл. изопропилового спирта. К полученной реакционной смеси добавляли триэтиламин, растворенный в 3 мл изопропанола при температуре 50°С. Смесь кипятили в течение 5 часов. Выпавший осадок отфильтровывали горячим, промывали горячим изопропанолом, высушивали на воздухе и перекристаллизовывали из смеси ацетонитрила и тетрагидрофурана 1:1. Выход 0.53 г (0.9 ммоль, 75%), красные кристаллы с золотистым оттенком, т.пл. 305-307°С. ИК спектр, ν, см-1, 3020 (СН=), 2960, 2910, 1561, 1383, 1253(CHAr), 2840 (СН3), 1685, 1502, 1438(N=C в цикле), 720, 645 (NTeC). Спектр ЯМР1H, δ, м.д.: 8.35-8.33 м (1Н, СН16), 8.24 д(1Н, СН4, J 7.8 Hz, 1Н), 7.87 д(1Н, СН7, J=8.3 Гц), 7.81 д(1H, СН5, J=8.4 Гц), 7.66 т (1H, СН13, J 7.5 Гц), 7.63-7.53 м(1Н, СН14), 7.32 т(1Н, СН15, J 7.6 Гц), 7.32 т (1Н, СН6, J 7.4 Гц), 6.99 с (1Н, СН10), 4.00 с (3H,N3CH3), 3.35 с(3Н, N17CH3). Спектр ЯМР13С, δ, м.д.: 167.65 (С11), 164.10 (С2), 147.00 (С18), 141.67 (С9), 132.68 (С17), 129.31 (С16), 128.97 (С7), 125.50, (С14), 125.28 С5), 124.53 (С6), 124.23 (С15), 118.35 (С13), 117.50 (С4), 114.18 (С8), 94.23 (С10), 37.25 (N3CH3), 34.59 (N19CH3).
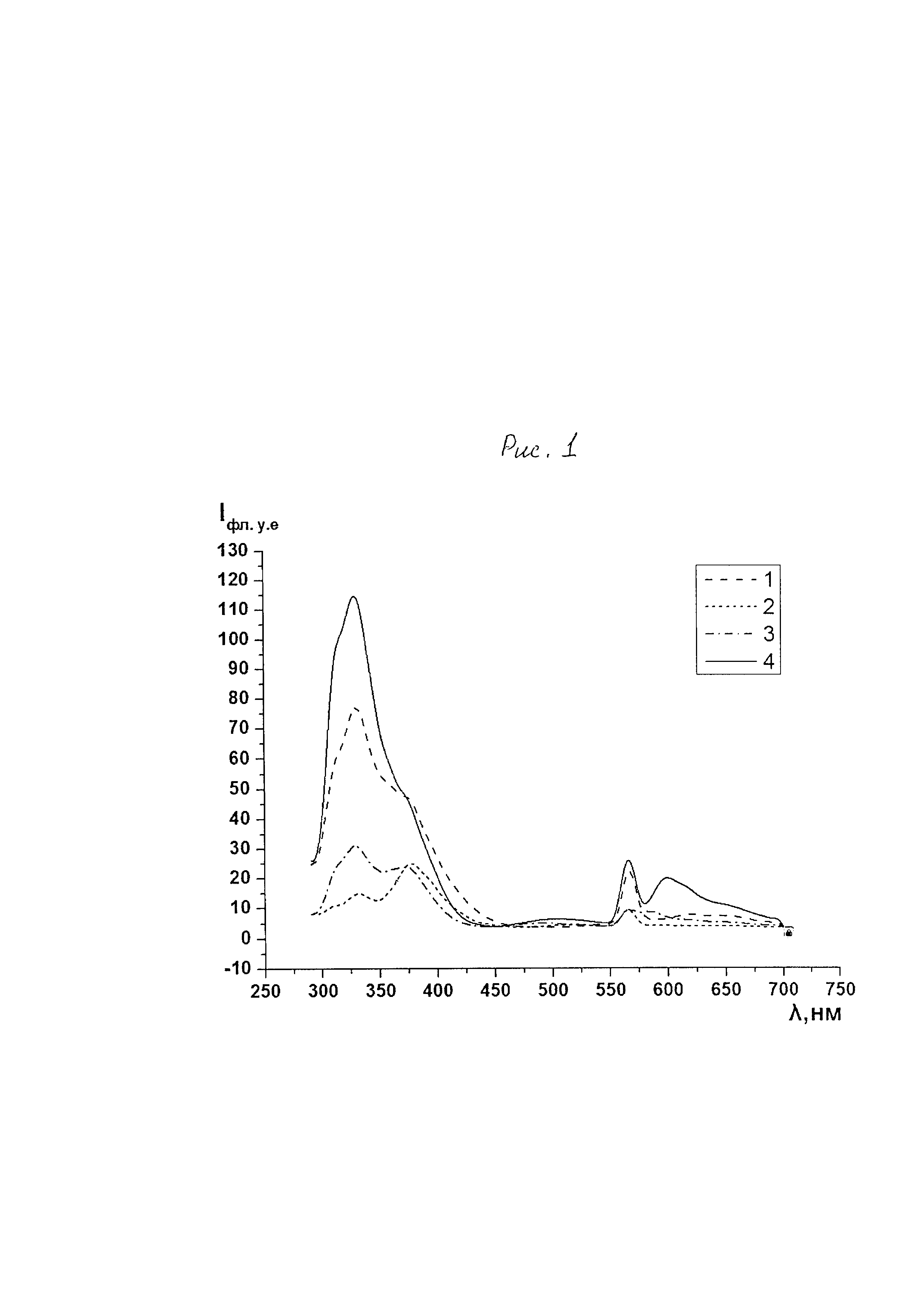
Используя спектрофлуориметр F7000 FL (Япония) у исследуемых веществ анализировали спектр флуоресценции в диапазоне 290-700 нм при длине волны возбуждения 280 нм (рис. 1). Спектр флуоресценции вещества 1 характеризуется наличием основного максимума при λ=330.2 нм и правого плеча при λ=375 нм, а также второго максимума при λ=566А нм. Спектр флуоресценции вещества 2 характеризуется наличием основного максимума при λ=375 нм и левого плеча при λ=330,8 нм, а также второго максимума при λ=565 нм. Спектр флуоресценции вещества 3 характеризуется наличием основного максимума при λ=327 нм и правого плеча при λ=375 нм, а также второго максимума при λ=565,6 нм. Спектр флуоресценции вещества 4 характеризуется наличием основного максимума при λ=327.8 нм и второго максимума при λ=565,4 нм.
Рис. 1: Спектр флуоресценции веществ 1-4. Длина волны возбуждения 280 нм, спектральные щели 5×5 нм, концентрация веществ 0,25 мкмоль/мл.
Таким образом, полученные вещества, как и все цианиновые красители, характеризуются наличием флуоресценции.
Мы провели испытания биологической активности синтезированных новых теллуроорганических соединений в лаборатории биохимии кафедры биохимии и биофизики Дагестанского государственного университета (акт прилагается).
Испытание было проведено на эритроцитах и мембранах синаптических окончаний (синаптосомах) нейронов коры головного мозга крыс. В эритроцитах определяли содержание главного внутриклеточного антиоксиданта - восстановленного глутатиона, а также активность ключевых антиоксидантных ферментов - супероксиддисмутазы (СОД) и каталазы. В мембранах синаптосом, выделенных из коры головного мозга методом ультрацентрифугирования в градиенте плотности сахарозы, определяли концентрацию редокс-активных тиоловых групп белков и активность АХЭ - ключевого фермента холинергической нейромедиаторной системы мозга.
Эксперименты выполнены на беспородных лабораторных крысах, содержащихся в виварии ФГБОУ ВО «Дагестанский государственный университет» на стандартном рационе. В эксперименте были использованы половозрелые самцы весом от 180 до 200 г.
Были проведены следующие серии испытаний:
1. Контроль. Изучение содержание глутатиона, активность СОД и каталазы в эритроцитах, а также содержание SH-групп в белках и активность АХЭ в мембранах синаптосом в присутствии растворителя диметилсульфоксида (ДМСО).
2. Опыт. Изучение влияния новых синтезированных теллуроорганических веществ (вещества 1-4), растворенных в ДМСО, на содержание глутатиона, активность СОД и каталазы в эритроцитах, а также содержание SH-групп в белках и активность АХЭ в мембранах синаптосом.
Были проведены испытания биологической активности следующих вновь синтезированных теллуроорганических соединений:
Вещество 1: 1-(3-бромпропил)-4-[(3-метил-2,3-дигидро-1,3-бензоте-ллуразол-2-илиден)метил]пиридиний йодид.
Вещество 2: 3-метил-2-((1-метилпиридин-4(1H)-илиден)метил)-бензотеллуразол-3-ий йодид.
Вещество 3: 3-метил-2-((3-метилбензотиазол)-2(3H)илиден)-метил)бензотел-луразол-3-ий йодид.
Вещество 4: 3-метил-2-((3-метилбензоселеназол)-2(3H)илиден)метил)бензотел-луразол-3-ий йодид.
Испытываемые вещества, растворенные в ДМСО, добавляли в конечной концентрации 250 мкмоль/л к гемолизату или мембранам синаптосом и через 30 мин проводили анализ. Результаты экспериментальных исследований представлены как среднее ± стандартная ошибка, полученных из шести независимых экспериментов. Все испытания проводились в трехкратной повторности. При выполнении экспериментов с лабораторными животными соблюдались все правила гуманного обращения с ними. Результаты были подвергнуты вариационно-статистической обработке с использованием t-критерия Стьюдента. Различия считались достоверными при р<0,05.
Получены следующие результаты:
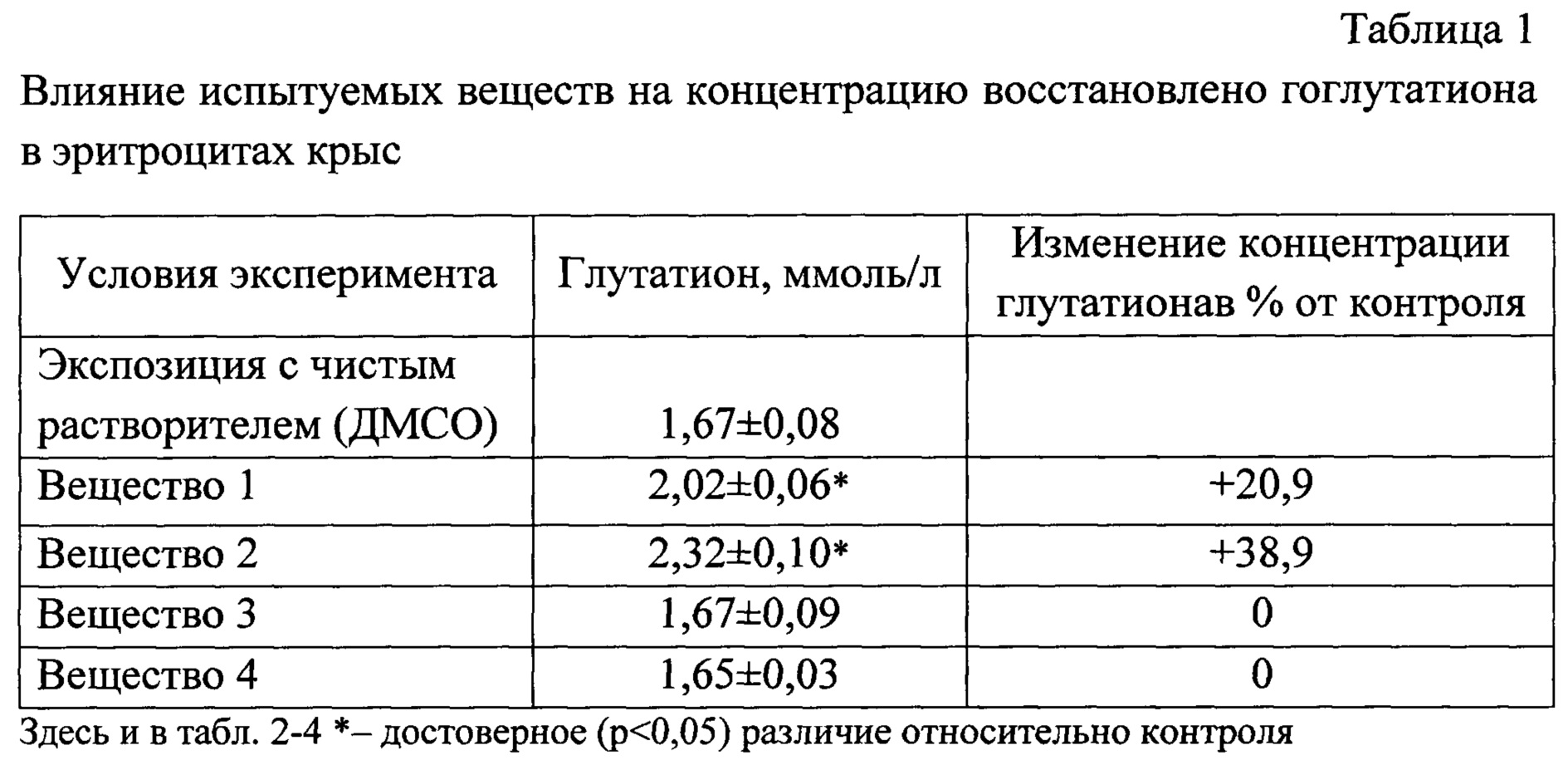
Как видно из таблицы 1, присутствие вещества 1 и 2 в среде инкубации достоверно повышается содержание восстановленного глутатиона в эритроцитах.
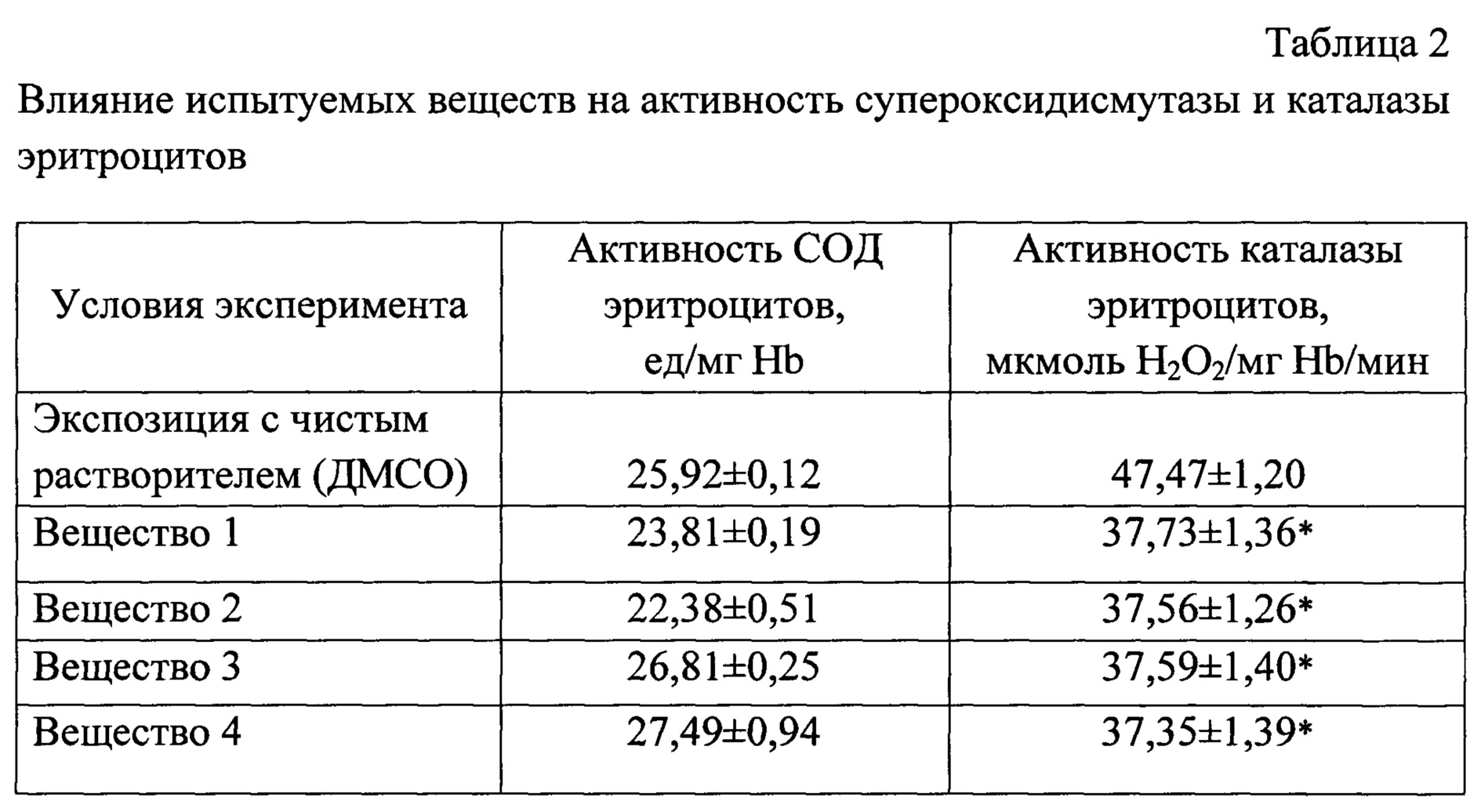
Все исследуемые вещества не оказали влияния на активность СОД, но примерно на 21% снизили активность каталазы в эритроцитах по сравнению с контролем (табл. 2).
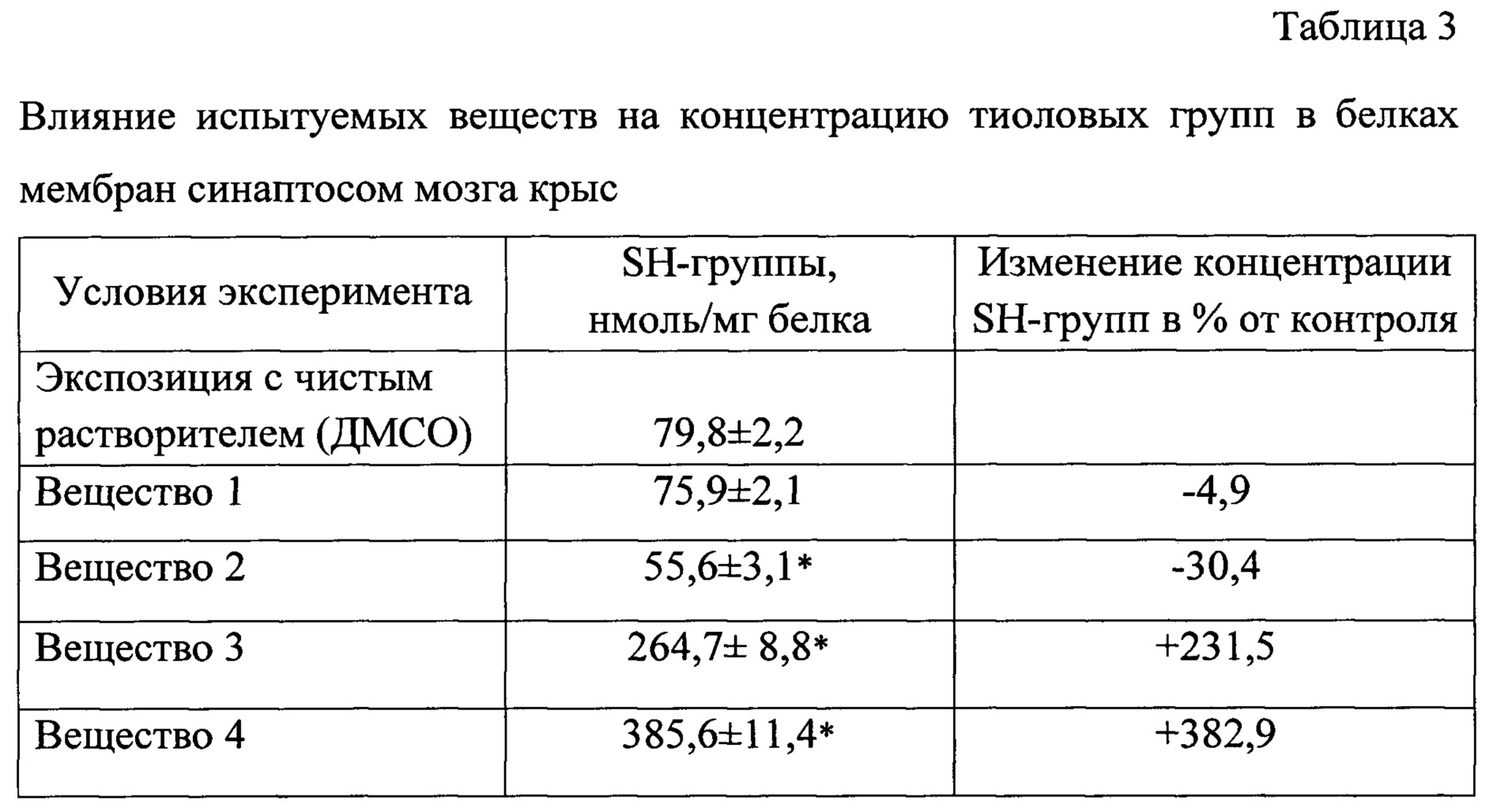
Анализ влияния испытуемых веществ на SH-групп в белках мембран синаптосом показал (табл. 3), что вещество 2 достоверно снижает их концентрацию, а вещества 3 и 4, наоборот, значительно повышают содержание тиоловых групп в белках.
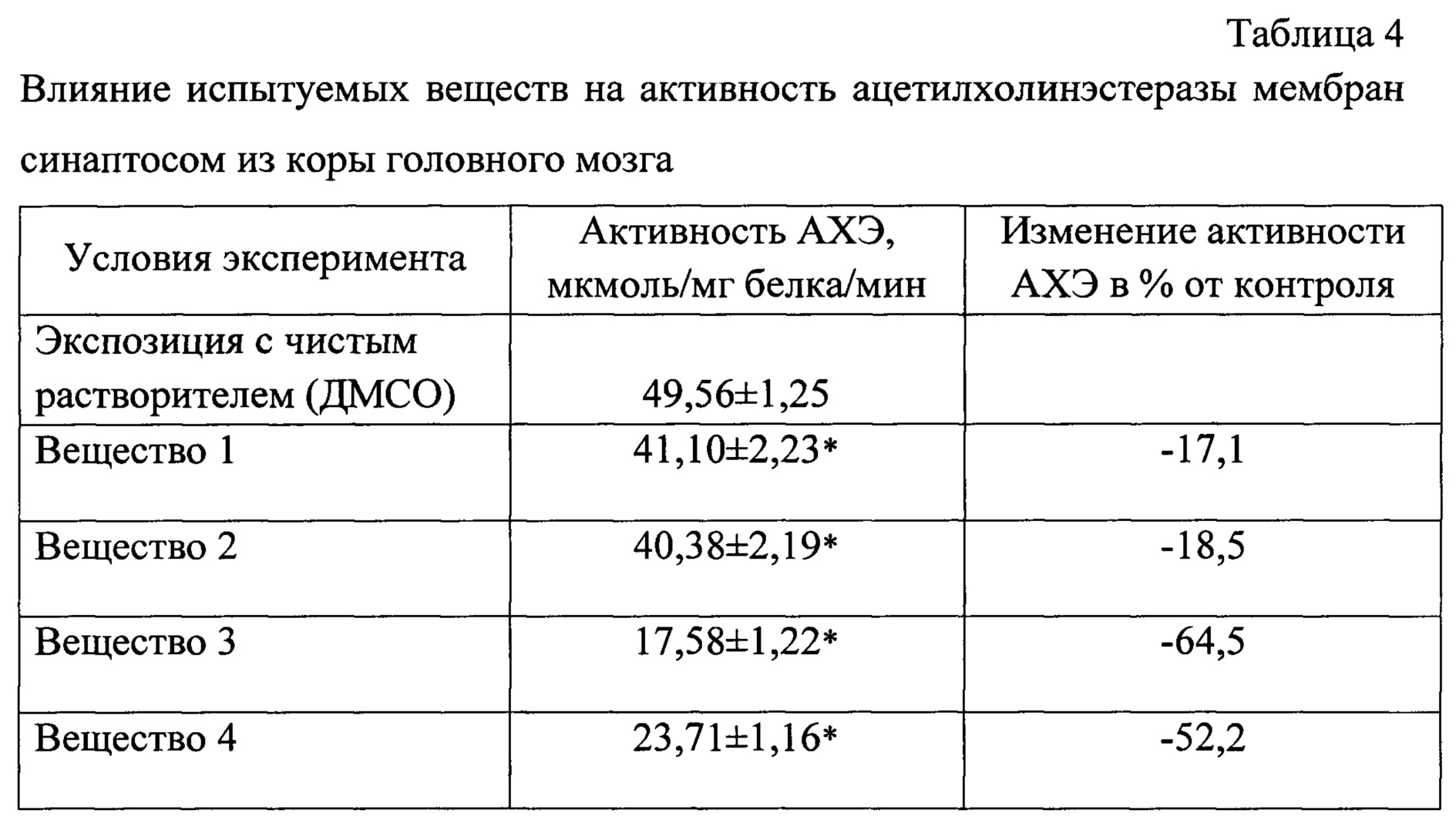
Данные табл.4 свидетельствуют о том, что все испытуемые вещества снижают активность АХЭ мембран синаптосом из мозга. При этом ингибирующий эффект веществ 3 и 4 значительно выше.
Рабочая комиссия сделала следующие выводы:
1. Вещества 1 и 2 способствуют повышению концентрации восстановленного глутатиона в эритроцитах, а вещества 3 и 4 существенно повышают концентрацию тиоловых групп в белках мембран синаптосом. В то же время вещества 1-4 не оказали существенного влияния на активность СОД и достоверно снижали активность каталазы эритроцитов. Вещества 1-4 можно использовать для повышения активности неферментативного звена антиоксидантной защиты организма при состояниях, сопровождающихся окислительным стрессом.
2. Вещества 3 и 4 оказывают существенное ингибиторное воздействие на АХЭ мембран синаптических окончаний нейронов. Поскольку ингибиторы АХЭ эффективно лечат болезнь Альцгеймера, то вещества 3 и 4 можно рекомендовать для разработки лекарственных препаратов, направленных на лечение болезни Альцгеймера.
Реферат
Изобретение относится к новым цианиновым красителям, имеющим следующие структурные формулы (1-4):1234Предлагаемые соединения можно использовать для повышения активности неферментативного звена антиоксидантной защиты организма при состояниях, сопровождающихся окислительным стрессом. 1 ил., 4 табл., 4 пр.
Формула

Комментарии