Промотор для специфической экспрессии трансгенов в эпидермисе растений - RU2382079C2
Код документа: RU2382079C2
Чертежи




















Описание
Данное изобретение относится к областям промотора, под контролем которых можно экспримировать трансгены в растениях. Далее, изобретение относится к рекомбинантным молекулам нуклеиновых кислот, которые охватывают эти области промотора, к трансгенным растениям и клеткам растений, которые трансформированы этими молекулами нуклеиновых кислот, а также к способу их получения. Кроме того, данное изобретение относится к молекулам нуклеиновых кислот, включая промотор согласно данному изобретению и последовательности нуклеиновых кислот или трансгены, которые могут способствовать устойчивости к возбудителям болезней, а также к трансформированным этими молекулами нуклеиновых кислот растениям и клеткам растений и к способу их получения.
В качестве промоторов, вообще, указываются те области ДНК гена, которые расположены перед точкой начала транскрипции и через которые устанавливается точка и частота инициации транскрипции и, тем самым, сила экспрессии и образец экспрессии контролируемого гена. К промоторам привязываются РНК-полимераза и специфические, активирующие РНК-полимеразу, факторы транскрипции, чтобы инициировать транскрипцию вместе с базальным транскрипционным комплексом. Часто эффективность промоторов устанавливается и регулируется за счет дополнительных последовательностей ДНК, энхансер-последовательностей, положение которых в противоположность положению промоторов не установлено. Эти регуляторные элементы могут располагаться до экспримированного гена, после него или в интронной части экспримированного гена.
В рекомбинантной ДНК-технологии промоторы вводятся в экспрессионные векторы, чтобы управлять экспрессией трансгена, который, как правило, не является геном, регулируемым естественно посредством промотора. При этом очень важна специфичность промотора, которая определяет, в какой момент времени, в каком типе ткани и с какой интенсивностью экспримируется переносимый методом генной инженерии ген.
В растениеводстве часто используется рекомбинантная ДНК-технология для того, чтобы перенести определенные нужные свойства на полезные растения, что должно привести к более высокому урожаю, например, за счет повышенной устойчивости к возбудителям болезней растений или к улучшению свойств продукта урожая. Часто при этом желательно, чтобы переносимый ген экспримировался не повсеместно, а только в ткани, в которой ожидается активность трансгена, так как присутствие продукта, вырабатываемого трансгеном, может отрицательно сказаться на нормальных физиологических процессах. Так, смогли показать, что суперэкспрессия анионной пероксидазы под контролем действующего повсеместно 35S-промотора приводит к увяданию трансгенных растений табака, так как имеет место слабый рост корня и поэтому образуется небольшая корневая масса (Lagrimini et al. The consequence of peroxidase overexpression in transgenic plants on root growth and development. Plant. Mol. Biol. 1997, 33 (5), стр.887-895). Суперэкспрессия spi2-пepoкcидaзы под контролем также действующего повсеместно промотора убиквитина ведет к уменьшенному образованию эпикотиля и уменьшенному росту в длину по сравнению с контрольными растениями (Elfstrand, M. et al. Overexpression of the endogenous peroxidase-like gene spi2 in transgenic Norway spruce plants results in increased total peroxidase activity and reduced growth. Plant Cell Reports, 2001, 20 (7), стр.596-603). Несмотря на отрицательное воздействие на физиологические процессы, при резистентном выращивании часто нужно избегать того, чтобы трансгенный продукт имелся также в собираемых в качестве урожая частях растения.
Поэтому в прошедшие годы выделяли промоторы, которые воздействовали либо тканеспецифически, либо индуцировано. К тканеспецифическим промоторам относятся специфические для семян, клубней и плодов промоторы. Индуцируемые промоторы могут активироваться, например, химической индукцией, световой индукцией или другими стимулирующими средствами.
Также желательно модулировать экспрессию гена специфично в эпидермисе. Эпидермис представляет собой покровную ткань надземных органов высших растений. В качестве таковой задача эпидермиса заключается в следующем: с одной стороны, давать возможность осуществляться обмену воды и веществ в растениях и, с другой стороны, препятствовать проникновению возбудителей болезней (патогенов) в растения. Через измененную экспрессию генов в эпидермисе с помощью подходящих промоторов и управляемых ими генов эти функции можно целенаправленно модулировать. В двудольных растениях такие специфические для эпидермиса промоторы уже описаны. Так, показано, что промотор CTR6-(CUT1-)-гена Арабидопсис, который кодирует конденсирующий энзим при синтезе воска, может обладать специфической для эпидермиса экспрессией гена-репортера β-глукуронидазы (Hooker et al. Significance of the expression of the CER6 condensing enzyme for cuticular wax production in Arabidopsis, Plant Physiol. 2002, 129 (4), стр.1568-1580; Kunst et al. Expression of the wax-specific condensing enzyme CUT1 in Arabidopsis, Biochem. Soc. Trans., 2000, 28 (6), стр.651-654).
Однако до сих пор не удалось идентифицировать подходящие специфические промоторы для эпидермиса однодольных растений, которые были бы пригодны для экспрессии трансгенов в однодольные растения, в частности в злаковые. Поэтому до сих пор используются конститутивные промоторы, такие как промотор убиквитина из кукурузы, чтобы экспримировать протеины в эпидермисе (см. В. Oldach et al. Heterologous expression of genes mediating enhanced fungal resistance in transgenic wheat, Mol Plant Microbe Interact. 2001, 14 (7), стр.832-838). Но это может, как описано выше, привести к нежелательным побочным эффектам у трансгенных растений вследствие присутствия продукта, вырабатываемого трансгеном, в других тканях или органах, а не только в эпидермисе.
Задача изобретения заключается в следующем: предоставить средство, которое позволяет осуществить специфичную экспрессию гена в эпидермисе однодольных, предпочтительно в зерновых растениях.
Эта задача решается предоставлением вариантов исполнения изобретения, охарактеризованных в формуле изобретения.
Тем самым, данное изобретение относится к области промотора со специфичностью для эпидермиса растений, включающей первую последовательность, происходящую из промотора гена глутатион-S-трансферазы A1 (GSTA 1), и вторую последовательность, происходящую из интрона гена WIR1a. GSTA 1 относится к гену, описанному в работе Dudler et al. A pathogen-induced wheat gene encodes a protein homologous to glutathione-S-transferases, Mol. Plant Microbe Interact., 1991, 4 (1), стр.14-18. В частности, речь идет в случае такого гена о гене пшеницы, но может также речь идти о гомологичном гене других зерновых растений, прежде всего ячменя, со сравнимым экспрессионным образцом и аналогичным продуктом, вырабатываемом геном. WIR1a означает ген, который описан в работе Bull et al. Sequence and expression of a wheat gene that encodes a novel protein associated with pathogen defense, Mol. Plant Microbe Interact. 1992, 5 (6). стр.516-519.
Предпочтительно речь идет в случае первой последовательности о SEQ №1 и в случае второй последовательности о SEQ ID №2.
Между первой и второй последовательностями расположены другие, не транслированные последовательности, которые имеют длину от 10 пн до 1000 пн, предпочтительно от 20 пн до 800 пн, особенно предпочтительно от 30 пн до 500 пн и наиболее предпочтительно от 40 пн до 300 пн.
Наиболее предпочтительно речь идет в случае области промотора согласно данному изобретению об области промотора, выбранной из группы, состоящей из
а) областей промотора, которые охватывают последовательность нуклеиновых кислот, указанную под SEQ ID №3;
б) областей промотора, которые охватывают функциональную часть последовательности нуклеиновых кислот, указанную под SEQ ID №3, или
в) областей промотора, которые имеют последовательность, которая при обязательных условиях гибридизуется с последовательностью нуклеиновых кислот, указанной под SEQ ID №3.
В рамках данного изобретения под областями промотора следует понимать последовательность нуклеиновых кислот, которая охватывает регуляторные последовательности, необходимые для экспрессии кодирующей последовательности (трансген). Регуляторные последовательности образуют ту часть гена, которая определяет экспрессию кодирующей последовательности, то есть, прежде всего, уровень и образец экспрессии. Регуляторные последовательности обладают, по меньшей мере, комбинацией последовательности, к которой привязывают специфические факторы транскрипции и РНК-полимеразу, собирая в транскрипционный комплекс, и эффективно инициируют транскрипцию последовательности нуклеиновых кислот, контролируемую областями промотора.
Области промотора согласно данному изобретению основываются на установлении факта, что через слияние промотора гена GSTA1 пшеницы с интронной последовательностью гена WIR1a пшеницы могут быть получены промоторы с новыми свойствами.
При экспресс-анализе гена-репортера в листьях пшеницы с геном β-глукуронидазы (GUS-геном) E.coli в качестве гена-репортера проверялись различные комбинации промотора и интрона WIR1a и промотора GST. Поразительным образом оказалось, что промотор GST и интрон WIR1a оказывают синергическое воздействие на активность гена-репортера. Возрастание транскрипционной активности было сравнимым с транскрипционной активностью, достигнутой за счет повсеместно экспримированного 35S-промотора.
В рамках данного изобретения понятие «специфический для эпидермиса» следует понимать таким образом, что последовательность нуклеиновых кислот, находящаяся под контролем области промотора согласно данному изобретению, экспримируется в эпидермисе побега растений. В частности, специфичность для эпидермиса в смысле данного изобретения задается также тогда, когда область промотора согласно данному изобретению способствует экспрессии чужеродного гена в эпидермисе по сравнению с другими типами клеток и влечет за собой экспрессию большую, по меньшей мере, в 2 раза, предпочтительно, по меньшей мере, в 5 раз и особенно предпочтительно, по меньшей мере, в 10 раз и наиболее предпочтительно в 50 раз, по сравнению с другими типами клеток. Величина экспрессии может определяться с помощью обычной, самой по себе известной, техники обнаружения.
Понятие «эпидермис растения» является общепринятым у специалистов. Подробную информацию можно найти в любой книге по анатомии и физиологии растений, например, в Учебнике по ботанике Штрасбургера, 35-е издание 2002 г., академическое изд-во Spektrum (Strasburger, Lehrbuch der Botanik, 35. Auflage 2002, Spektrum Akademischer Verlag).
Был обнаружен поразительный факт, что область промотора, которая охватывает как регуляторные последовательности гена GSTA1 пшеницы, так и последовательности интрона гена WIR1a пшеницы, вызывает специфическую для эпидермиса экспрессию находящейся под их контролем кодирующей последовательности нуклеиновых кислот.
Наряду с областью промотора, которая имеет последовательность нуклеиновых кислот, представленную под SEQ ID №3, данное изобретение относится также к областям промотора, которые имеют функциональные части этой последовательности и вызывают в растениях специфическую для эпидермиса экспрессию контролируемой ими кодирующей последовательности нуклеиновых кислот.
Под понятием «функциональная часть» в этом контексте следует понимать последовательности, к которым транскрипционный комплекс еще может привязываться, несмотря на слегка отличающуюся последовательность нуклеиновых кислот, и может вызвать специфическую для эпидермиса экспрессию. Функциональные части последовательности промотора охватывают также такие варианты промотора, активность которых, по сравнению с диким типом, ослаблена или усилена. Под функциональной частью понимают, в частности, природные или искусственные варианты последовательности области промотора, указанные в SEQ ID №3. Мутации охватывают замещения, присоединения, делеции, обмены и/или внедрения одного или нескольких нуклеотидных остатков. Функциональные части области промотора в рамках данного изобретения охватывают встречающиеся в природе варианты SEQ ID №3, а также искусственные, т.е. полученные химическим синтезом, последовательности нуклеотидов.
Используемый промотор в каждом случае содержит ТАТА-бокс (позиции от 2063 до 2069 в SEQ ID №. 1 и №3) и предпочтительно также два СААТ-бокса (позиции от 1047 до 1051 или от 1895 до 1899 в SEQ ID №1 и №3). Далее, по меньшей мере, один, предпочтительно два или три, особенно предпочтительно, по меньшей мере, четыре, пять и шесть и наиболее предпочтительно семь и восемь следующих комбинаций последовательностей содержится в промоторе:
а) GTGGGGG
б) ACGTGGA
в) ТССАССТ
г) ТАТССАТ
д) CATGCATG
е) TGTAAAG
ж) ССТАССА
з) AATAGTA
Комбинации последовательностей предпочтительно находятся в позициях, которые соответствуют следующим позициям в SEQ ID №3:
а) 185-191 и 217-223 пн
б) 455-461 пн
в) 508-514 пн
г) 564-570 пн
д) 1514-1521 пн
е) 1520-1526 пн
ж) 1569-1575 пн
з) 1610-1616 пн
Можно измерить активность промотора вариантов области промотора с помощью генов-маркеров, закодированная последовательность которых находится под контролем исследуемой области промотора. Подходящими генами-маркерами являются, например, (GUS)-ген β-глукуронидазы E.coli, ген флуоресценции, такой как (ОРР)-ген протеина зеленой флуоресценции Aequoria victoria, ген люциферазы Phothinus pyralis или (lacZ)-ген β-галактозидазы E.coli. Абсолютная активность промотора определяется путем сравнения с растением дикого типа. Специфичность к ткани или клетке можно легко определить путем сравнения с интенсивностью экспрессии вышеназванных генов-маркеров в соответствующих тканях или клетках.
Данное изобретение относится также к областям промотора с последовательностью нуклеиновых кислот, которая гибридизуется при обязательных условиях с последовательностью нуклеиновых кислот, указанной под SEQ ID №3. Понятие «гибридизация при обязательных условиях» означает в контексте данного изобретения, что гибридизация осуществляется при условиях in vitro, которые достаточно обязательны, чтобы гарантировать специфическую гибридизацию. Такие обязательные условия гибридизации известны специалистам и с ними можно познакомиться в литературе (Sambrook et al. Molecular Cloning: A Laboratory Manual, 2001, 3-е издание. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York).
Вообще «специфически гибридизировать» означает, что молекула при обязательных условиях привязывается предпочтительно к определенной последовательности нуклеотидов, если эта последовательность имеется в комплексной смеси (например, всех) ДНК или РНК. Понятие «обязательные условия» существует вообще для условий, при которых последовательность нуклеиновых кислот предпочтительно гибридизуется с ее целевой последовательностью и в очень незначительном размере или почти не гибридизуется с другими последовательностями. Обязательные условия отчасти зависят от последовательности и могут отличаться при различных обстоятельствах. Более длинные последовательности специфически гибридизуются при более высоких температурах. В общем случае обязательные условия выбираются таким образом, чтобы температура была примерно на 5°С ниже точки плавления (Тm) для специфичной последовательности при определенной ионной силе и определенной величине рН. Tm - это температура (при определенной ионной силе, рН и концентрации нуклеиновых кислот), при которой 50% молекул, комплементарных к целевой последовательности, гибридизуются в состоянии равновесия с целевой последовательностью. Обычно обязательные условия - это такие условия, при которых концентрация солей составляет приблизительно от 0,01 до 1,1 М концентрации натриевых ионов (или другой соли) при величине рН от 7,0 до 8,3 и температура составляет, по меньшей мере, 30°С для коротких молекул (например, 10-50 нуклеотидов). Дополнительно обязательные условия могут достигаться путем добавления дестабилизирующих агентов, таких как, например, формамид.
Подходящие обязательные условия гибридизации, например, описаны в Sambrook et al., см. выше. Так, гибридизация может иметь место при следующих условиях:
- буфер для гибридизации: 2х раствор хлорида и цитрата натрия, 10х раствор Денхардта (фикол 400 + полиэтиленгликоль + альбумин бычьей сыворотки); соотношение 1:1:1), 0,1% додецилсульфат натрия, 5 мМ ЭДТК, 50 мМ Na2HPO4, 250 µг/мл ДНК спермы сельди; 50 µг/мл tPHK или 0,25 М натрийфосфатный буфер рН 7,2, 1 мМ ЭДТК, 7% додецилсульфат натрия при температуре гибридизации от 65°С до 68°С,
- буфер для промывания: 2х раствор хлорида и цитрата натрия, 0,1% додецилсульфат натрия при температуре промывания от 65°С до 68°С.
Такого рода варианты промотора имеют идентичность последовательности, по меньшей мере, 50%, предпочтительно, по меньшей мере, 70%, особенно предпочтительно, по меньшей мере, 90% и наиболее предпочтительно, по меньшей мере, 95% последовательности промотора, приведенной в SEQ ID №3, или части его, в расчете на всю последовательность ДНК, указанную в SEQ ID №3. Предпочтительно идентичность последовательности такого рода последовательностей в промоторе определяется путем сравнения с последовательностью нуклеиновых кислот, указанной в SEQ ID №3. Если две последовательности нуклеиновых кислот различной длины сравниваются между собой, идентичность последовательности предпочтительно относится к процентному содержанию нуклеотидных остатков более коротких последовательностей, которые идентичны соответствующим нуклеотидным остаткам более длинной последовательности.
Идентичности последовательностей устанавливаются обычно по различным программам выверки, таким как, например, CLUSTAL. Вообще в распоряжении специалистов для определения идентичности последовательности находятся подходящие алгоритмы, например, также программа, которая доступна из Интернета http://www.ncbi.nlm.nih.gov/BLAST (например, Link "Standard nucleotide-nucleotide BLAST [blastn]").
Вышеприведенная для SEQ ID №3 процентная степень идентичности справедлива также для первой и второй последовательности области промотора согласно данному изобретению, показанных в SEQ ID №1 и №2.
В предпочтительном варианте исполнения изобретения область промотора согласно данному изобретению имеет всю указанную под SEQ ID №3 последовательность в 2552 нуклеотида.
Данное изобретение относится также к химерным генам области промотора согласно данному изобретению и к кодирующей последовательности, их экспрессии, которая естественно регулируется не через область промотора согласно данному изобретению, в химерном гене регулируется областью промотора согласно данному изобретению, в оперативном соединении, а также к рекомбинантной молекуле нуклеиновой кислоты, которая содержит химерный ген.
Понятие «последовательность нуклеиновых кислот, экспрессия которой регулируется областью промотора согласно данному изобретению», означает, что экспрессия последовательности нуклеиновых кислот под контролем области промотора согласно данному изобретению в клетках, в которых область промотора активна, может возрастать, по меньшей мере, в 5 раз, предпочтительно, по меньшей мере, в 10 раз и наиболее предпочтительно, по меньшей мере, в 50 раз по сравнению с клетками дикого типа.
В случае последовательности нуклеиновых кислот, экспрессия которых регулируется последовательностью нуклеиновых кислот согласно данному изобретению, речь может идти о кодирующей области трансгена, например гена резистентности, вырабатываемый которым продукт желателен в эпидермисе. За счет экспрессии трансгена можно увеличить содержание закодированного им продукта, вырабатываемого геном, по меньшей мере, в 2 раза, предпочтительно, по меньшей мере, в 5 раз, особенно предпочтительно, по меньшей мере, в 10 раз и наиболее предпочтительно, по меньшей мере, в 50 раз.
Однако область промотора согласно данному изобретению может вводиться также в PHKi-конструкты для РНК-интерференции, чтобы добиться специфического в эпидермисе сайленсинга определенного гена, вырабатываемые которым продукты общепринято не должны находиться в эпидермисе или должны находиться в очень незначительном количестве. И последнего, естественно, можно добиться также с помощью классических антисмысловых или косупрессивных конструктов при использовании областей промотора согласно данному изобретению. Экспрессия эндогенного гена за счет сайленсинг-конструктов снижается, по меньшей мере, на 50%, предпочтительно, по меньшей мере, на 70%, особенно предпочтительно, по меньшей мере, на 90% и наиболее предпочтительно, по меньшей мере, на 95%.
В конструкте, который должен использоваться для интерференции РНК, обычно имеются палиндромные последовательности ДНК, которые после транскрипции формируют двухнитевые РНК. Эти двухнитевые РНК за счет Dicer-энзима переходят в более короткие куски РНК, которые привязывают к эндогенной РНК и на строение которых влияют с помощью RISC (PHK-индуцированный сайленсинговый комплекс - RNA-induced silencing complex) (Hannon, RNA interference. Nature, 2002, т.418, стр.244-251).
Воздействие генных сайленсинг-конструктов на экспрессию эндогенного гена можно доказать с помощью обычных методов молекулярной биологии, которые известны специалисту. Так, для исследований имеются в распоряжении нозерн-блоттинг уровней РНК (RNA-Levels Northem-Blot) и RT-PCR-метод, белок можно определить путем вестерн-блоттинга, иммунофлуоресценцией, и, если в случае белка речь идет об энзиме, количественным анализом энзиматической активности.
В понятие «трансген» в рамках данного изобретения включены такие гены, продукты, вырабатываемые которыми, должны содержаться в эпидермисе или должны быть подавлены при сайленсинге генов.
В случае последовательности нуклеиновых кислот, экспрессия которых находится под контролем промотора согласно данному изобретению, предпочтительно речь идет о последовательности нуклеиновых кислот, которая способствует устойчивости к возбудителям болезней, так как эпидермис представляет собой первый барьер, который должен преодолеть возбудитель болезни при проникновении в растение.
В рамках данного изобретения под понятием «рекомбинантная молекула нуклеиновой кислоты» следует понимать вектор, который содержит химерный ген согласно данному изобретению или область промотора согласно данному изобретению и может вызвать зависящую от промотора экспрессию находящейся под контролем области промотора согласно данному изобретению последовательности нуклеиновых кислот в клетках растений и в растениях. В предпочтительном варианте исполнения изобретения рекомбинантная молекула нуклеиновой кислоты согласно данному изобретению содержит дополнительно транскрипционные терминальные последовательности. Под понятием «транскрипционные терминальные последовательности» следует понимать последовательности ДНК, которые расположены на конце за кодирующей последовательностью и вызывают остановку транскрипции РНК-полимеразой.
Далее, изобретение относится к способу получения трансгенных растений со специфической экспрессией в эпидермисе, регулируемой с помощью области промотора согласно данному изобретению последовательностью нуклеиновых кислот, включающему стадии:
а) получение молекулы рекомбинантной нуклеиновой кислоты, в которой область промотора согласно данному изобретению находится в оперативном соединении с кодирующей последовательностью,
б) перенос молекулы нуклеиновой кислоты из а) в растительные клетки и
в) регенерация полностью трансформированных растений и, при необходимости, размножение растений.
Для подготовки введения чужеродных генов в высшие растения или их клетки имеется в распоряжении большое количество клонированных векторов, которые содержат репликационный сигнал для E.coli и ген-маркер для селекции трансформированных бактериальных клеток. Примерами таких векторов являются pBR322, pUC-серия, М13mp-серия, pACYC184 и т.п. Химерный ген может вводиться в вектор на подходящие сайты рестрикции. Полученная плазмида затем используется для трансформации клеток E.coli. Трансформированные клетки E.coli культивируются в подходящей среде и затем отделяются и подвергаются лизису, и затем вновь выделяются плазмиды. В качестве аналитических методов для характеристики полученных ДНК-плазмид используются вообще рестрикционный анализ, гель-электрофорез и другие методы биохимии и молекулярной биологии. После каждой манипуляции ДНК-плазмиду можно расщепить и полученные из нее фрагменты ДНК можно соединить с другими последовательностями ДНК.
Как уже упоминалось, для введения ДНК в растительные клетки-хозяева существует множество технологий, причем специалист может без труда подобрать соответствующие подходящие методы. Эти технологии охватывают трансформацию растительных клеток с помощью Т-ДНК при использовании Agrobacterium tumefaciens или Agrobacterium rhizogenes в качестве трансформирующей среды, слияние протопластов, инъекцию, электропорацию, прямой перенос гена изолированной ДНК в протопласты, внесение ДНК с помощью биолистического метода, а также другие возможности, которые уже в течение нескольких лет хорошо работают и относятся к обычному набору методик специалиста, работающего в области молекулярной биологии или биотехнологии растений. Биолистический метод переноса генов применяется, прежде всего, для однодольных растений. Здесь специалист найдет для себя полезную информацию для осуществления этого метода в литературе, например, Vasil et al. Bio/Technology, 1992, 10, стр.667-674; Vasil et al. Bio/Technology, 1993, 11, стр.1153-1158; Nehra et al. Plant J. 1994, 5, стр.285-297; Becker et al. Plant J., 1994, 5, стр.299-307; Altpeter et al. Plant Cell Reports, 1996, 16, стр.12-17; Ortiz et al. Plant Cell Reports, 1996, 15, стр.877-81; Rasco-Gaunt et al. J. Exp.Bot., 2001, 52; стр.865-874.
Само собой, при инъекции и электропорации ДНК в клетки растений не устанавливается никаких специальных требований к применяемым плазмидам.
Аналогичное справедливо и для прямого переноса генов. Могут применяться простые плазмиды, такие как, например, pUC-производные.
Но, если из таких трансформированных клеток должны регенерироваться растения целиком, рекомендуется наличие селекционного гена-маркера. Специалисту известны наиболее распространенные селекционные маркеры, и для него не представляет проблемы выбрать подходящий маркер.
В зависимости от способа введения нужного гена в клетку растения могут потребоваться другие последовательности ДНК. Если для трансформации растительных клеток используется Ti- или Ri-плазмида, то с вводимыми генами должно быть связано, по меньшей мере, правое ограничение, но часто правое и левое ограничение содержащихся Т-ДНК в Ti- или Ri-плазмиде в качестве боковых областей. Если для трансформации используются агробактерии, то вводимая ДНК должна клонироваться в специальных плазмидах, а именно либо в промежуточном, либо в бинарном векторе. Промежуточные векторы на основании последовательностей, которые гомологичны последовательностям в Т-ДНК, могут интегрироваться путем гомологичной рекомбинации в Ti- или Ri-плазмиду агробактерии. Она содержит, кроме того, vir-область, необходимую для переноса Т-ДНК. Правда, промежуточные векторы нельзя реплицировать в агробактерии. С помощью вспомогательной плазмиды можно перенести промежуточный вектор в Agrobacterium tumefaciens (конъюгация). Бинарные векторы, напротив, можно реплицировать как в E.coli, так и в агробактерии. Они содержат селекционный ген-маркер и линкер или полилинкер, которые обрамляют правую и левую пограничные зоны Т-ДНК. Они могут трансформироваться непосредственно в агробактерии. Агробактерия, являющаяся клеткой-хозяином, должна содержать плазмиду, несущую химерный ген внутри Т-ДНК, которая переносится в растительную клетку. Может иметься дополнительная Т-ДНК. Преобразованная таким образом агробактерия используется для трансформации растительных клеток. Применение Т-ДНК для трансформации растительных клеток подробно изучено и в достаточной мере описано в известных обзорных статьях и учебниках по трансформации растений. Для однодольных растений для эффективного переноса гена в агробактерию должны применятся различные протоколы, которые описаны, например, в Cheng et al., Plant Physiol., 1997, 115, стр.971-980; Khanna and Daggard, Plant Cell Reports, 2003, 21, стр.429-436; Wu et al., Plant Cell Reports, 2003, 21, стр.659-668; Hu et al., Plant Cell Reports, 2003, 21, стр.1010-1019. Для переноса ДНК в растительную клетку могут культивироваться растения-эксплантаты с Agrobacterium tumefaciens или Agrobacterium rhizogenes. Из инфицированного растительного материала (например, кусочки листьев, сегменты стеблей, корней, а также протопласты или суспензионно культивируемые растительные клетки) затем в подходящей среде, которая может содержать антибиотики или биоциды для селекции трансформированных клеток, можно снова регенерировать растение целиком.
Если введенная ДНК однажды интегрирована в геном растительной клетки, то там она, как правило, стабильна и остается в потомках первоначально трансформированной клетки. Она обычно содержит селекционный маркер, который придает трансформированной растительной клетке устойчивость к биоциду или антибиотику, такому как канамицин, G 418, блеомицин, гигромицин, метотрексат, глифозат, стрептомицин, сульфонилмочевина, гентамицин или фосфинотрицин и т.д. Поэтому индивидуально выбранный маркер должен позволять осуществлять селекцию трансформированных клеток по отношению к клеткам, в которых отсутствует введенная ДНК. Для этого пригодны также альтернативные маркеры, такие как пищевые маркеры или маркеры отбора (GFP, зеленый флуоресцентный белок). Само собой разумеется, можно также совершенно отказаться от селекционных маркеров, что, правда, сопровождается довольно высокой потребностью в скрининге. Если нужны трансгенные растения, не содержащие маркеров, у специалиста имеется в распоряжении стратегия, позволяющая дополнительно удалять ген-маркер, например котрансформация или специфичные для последовательностей рекомбиназы.
Регенерация трансгенных растений из трансгенных растительных клеток происходит по обычным методикам регенерации с применением известных питательных сред. Растения, полученные таким образом, затем с помощью обычных способов, включая методы молекулярной биологии, такие как PCR (ПЦР), блоттинг-анализы, могут исследоваться на наличие и тканевую специфичность введенных последовательностей нуклеиновых кислот, экспрессия которых контролируется промотором согласно данному изобретению или эндогенной РНК, зависящей от них, и протеинов.
Далее, изобретение относится к трансгенным растениям, которые содержат последовательность нуклеиновых кислот, регулируемую с помощью области промотора согласно данному изобретению, и экспримируют их специфично в эпидермисе.
В случае растений согласно данному изобретению речь идет предпочтительно об однодольных растениях, в частности зерновых растениях, таких как рожь, кукуруза и овес, наиболее предпочтительно о пшенице или ячмене, а также о трансгенных частях этих растений и их трансгенном материале для размножения, таком как протопласты, растительные клетки, каллусы, семена, клубни или черенки, а также трансгенных потомках этих растений. Но также для других злаковых, таких как, например, кормовые травы, можно использовать область промотора согласно данному изобретению для получения соответствующих растений со специфичной экспрессией трансгенов в эпидермисе.
Под контролем промотора согласно данному изобретению, специфического для эпидермиса, можно экспримировать гены для продуцирования эпикутикулярного воска, чтобы повысить толерантность растений к засухе. Кроме того, можно экспримировать под контролем промотора согласно данному изобретению гены для производства антоцианов или других УФ-абсорбирующих веществ для повышения устойчивости к ультрафиолету. Как уже излагалось выше, под контролем промотора согласно данному изобретению предпочтительно экспримируются гены устойчивости к возбудителям болезней.
В качестве возбудителей болезней растений называются среди прочих бактерии, вирусы и грибы, которые инфицируют растения и вследствие этого отрицательно влияют на обмен веществ.
К таким возбудителям болезней растений относятся грибы, которые у зерновых растений, таких как пшеница и ячмень, вызывают, среди прочего, болезни настоящей мучнистой росы и ломкость стеблей. Эти болезни в зависимости от степени поражения могут быть причиной потери значительной части урожая (до 50%).
Традиционно для борьбы с названными выше, а также с другими грибковыми заболеваниями растений используют фунгициды, которые, как известно, обладают такими недостатками, как попадание в грунтовые воды и накапливание в пищевой цепи.
Однако в последние годы были идентифицированы также некоторые гены, которые могут определять устойчивость к определенным возбудителям или к нескольким возбудителям одновременно. Понятие «передача устойчивости к возбудителям болезней» так, как оно здесь используется, означает, что растения, в которых повышена экспрессия упомянутых генов, по сравнению с растениями, в которых экспрессия упомянутых генов является нормальной, менее восприимчивы к инфекциям, вызванным определенными возбудителями болезней. К генам, которые дают защиту от возбудителей болезней, относятся также такие гены, экспрессия которых включается при инфицировании возбудителем болезни.
К таким генам относятся пероксидазы и оксалат-оксидазы. Оксалат-оксидазы, которые относятся к семейству germinartigen протеинов, катализируют окисление оксалата, в результате чего образуется пероксид водорода. Пероксид водорода действует микробицидно и может стимулировать лигнификацию клеточных стенок, в результате чего затрудняется проникновение вредителей. Кроме того, это может вызвать в небольших концентрациях гибель сверхчувствительных клеток. Пероксидазы используют либо молекулярный кислород, либо пероксид водорода для окисления клеточных субстратов и за счет этого для обеззараживания.
Возбудители болезней, к воздействию которых может передать устойчивость растениям экспрессия оксалат-оксидазы и пероксидазы в эпидермисе, включают, например, настоящую мучнистую росу, Fusarium spp. (фузариозные гнили), Rynchosporium secalis (ринхоспорозная пятнистость) и Pyrenophora teres (сетчатая пятнистость).
Другими генами, которые могут передать устойчивость растениям к воздействию возбудителей болезней, являются хитиназы, Ag-AFP, GSTA1 и WIR1a.
За счет экспрессии в эпидермисе трансгенных растений закодированной для энзимов последовательности нуклеиновых кислот с помощью области промотора согласно данному изобретению можно получать растения с повышенной устойчивостью к возбудителям болезней.
В противоположность генам, содействующим устойчивости к возбудителям болезней, имеются также собственные гены растений, которые способствуют проникновению возбудителя болезни. К таким генам относится Mlo-ген, который кодирует для семи-трансмембранного рецептора, который, по-видимому, способствует проникновению грибов мучнистой росы в эпидермис. В этом случае имеет смысл помешать экспрессии Mlo-гена, чтобы препятствовать проникновению грибов в растение. Это может происходить, например, с помощью описанного выше PHKi-метода. То, что интерференция с экспрессией Mlo-гена пригодна для затруднения проникновения грибов мучнистой росы в растения, показано in vitro на сегментах листьев ячменя, которые были бомбардированы частицами вольфрама, покрытыми Mlo-dsPHK (Schweizer et al. Double-stranded RNA interferes with gene function at the single-cell level in cereals, The Plant Journal, 2000, 24 (6), стр.895-903). Однако до сих пор не смогли показать, что аналогичный эффект в трансгенных растениях имеет специфичная для эпидермиса интерференция с экспрессией Мlо.
Другими генами растений, которые содействуют взаимодействию возбудителя болезни с растением и, тем самым, могут способствовать проникновению возбудителя болезни в растение, являются, например, гены-транспортеры аминокислот, или сахаров, или инвертазы. Эти гены пригодны также в качестве пунктов воздействия для сайленсинга гена. Тем самым, данное изобретение касается способа получения растений, устойчивых к возбудителям болезней, включающему стадии:
а) получение рекомбинантной молекулы нуклеиновой кислоты, в которой имеется промотор согласно данному изобретению в оперативном соединении с последовательностью нуклеиновых кислот, которая содействует устойчивости к возбудителям болезней,
б) перенос молекулы рекомбинантной нуклеиновой кислоты из а) на растительную клетку и
с) регенерация полностью трансформированных растений и, при необходимости, размножение растений.
В случае последовательности нуклеиновых кислот, содействующей устойчивости к болезням, предпочтительно речь идет о кодирующей области гена пероксидазы, или оксалат-оксидазы, или о последовательности, которая интерферирует с эндогенной Mlo-РНК.
Нижеследующие примеры служат для пояснения изобретения, и их не следует рассматривать в качестве ограничивающих изобретение.
Иллюстрации:
1) Последовательность нуклеиновых кислот промотора GSTA1 (SEQ ID №1).
2) Последовательность нуклеиновых кислот WIRla-Introns (SEQ ID №2).
3) Последовательность нуклеиновых кислот предпочтительной области промотора (SEQ ID №3).
4) Последовательность нуклеиновых кислот TAPERO (пероксидаза) кДНК (SEQ ID №4).
5) TAPERO экспрессионный вектор pPS41.
а) Последовательность нуклеиновых кислот (SEQ ID №5).
b) Векторная карта.
6) Последовательность нуклеиновых кислот Gennin 9f-2.8 (оксалат-оксидаза) кДНК (SEQ ID №6).
7) Germin-экспрессионный вектор pPS24.
а) Последовательность нуклеиновых кислот (SEQ ID №7).
b) Векторная карта.
8) Последовательность Mlo-PHKi-конструкта (SEQ ID №8).
9) Mlo-PHKi-экспрессионный вектор pWIR5-TaMlo-PHKi.
а) Последовательность нуклеиновых кислот (SEQ ID №9).
b) Векторная карта.
10) Активность оксалат-оксидазы in situ в pPS24-трансгенных растениях.
Листья растений дикого типа Bobwhite (BW) и трансгенных линий №157 и №170 нарезали и определяли активность оксалат-оксидазы in situ. Левый столбец=реакция с оксалатным субстратом; правый столбец=реакция контроля без оксалатного субстрата. Сильное фиолетовое окрашивание указывает на активность оксалат-оксидазы в эпидермисе трансгенных линий.
11) Доказательство трансгена TAPERO в трансгенных растениях pPS41.
а) В нозерн-блоттинге.
Доказательство накапливания TAPERO РНК с помощью гибридизации WIR3-пробы в нозерн-блоттинге из трансгенной линии пшеницы Т2-генерации, которая несет конструкт pPS41. Анализировали по 2 сублинии из 4 выбранных линий плюс дикий тип (BW) на стадии взрослого растения. Лист 1=флаговый лист. Листья 2-4=по возрастающей старше. TaGer-4 зонд гибридизует с группой индуцированных стрессом генов пшеницы и применялся, чтобы проверить плейотропные побочные эффекты суперэкспрессии TAPERO. Никаких заметных побочных воздействий не обнаружено. EtBr=контроль нагрузки на гель, окрашенный с помощью этидиумбромида.
b) В вестерн-блоттинге.
Доказательство накапливания протеина TAPERO с помощью реакции с антителами в вестерн-блоттинге трансгенной линии пшеницы генерации Т2, которая несет конструкт pPS41. Трансгенный продукт TAPERO имеет ожидаемый размер 31 кД. В Bobwhite, лист 3, можно наблюдать повышенную базальную активность гена TAPERO. Лист 1=флаговый лист. Coomassie stain=контроль заряда на геле, окрашенном с помощью кумасси голубого (Coomassie Blau R250).
12) Доказательство специфичной для эпидермиса экспрессии трансгенов.
а) Путем нозерн-блоттинга.
Доказательство накопления оксалат-оксидазы (слева) и TAPERO (справа) -mРНК в эпидермисе листьев трансгенных растений, которые несут pPS24- или pPS41-конструкт, с помощью специального зонда. W=РНК из всего листа; Е=РНК из эпидермиса листа. EtBr=окрашенный этидиумбромидом гель в качестве контроля заряда; 26S РНК=последующая гибридизация блота с помощью зонда против 26S рибосомальной РНК в качестве контроля заряда.
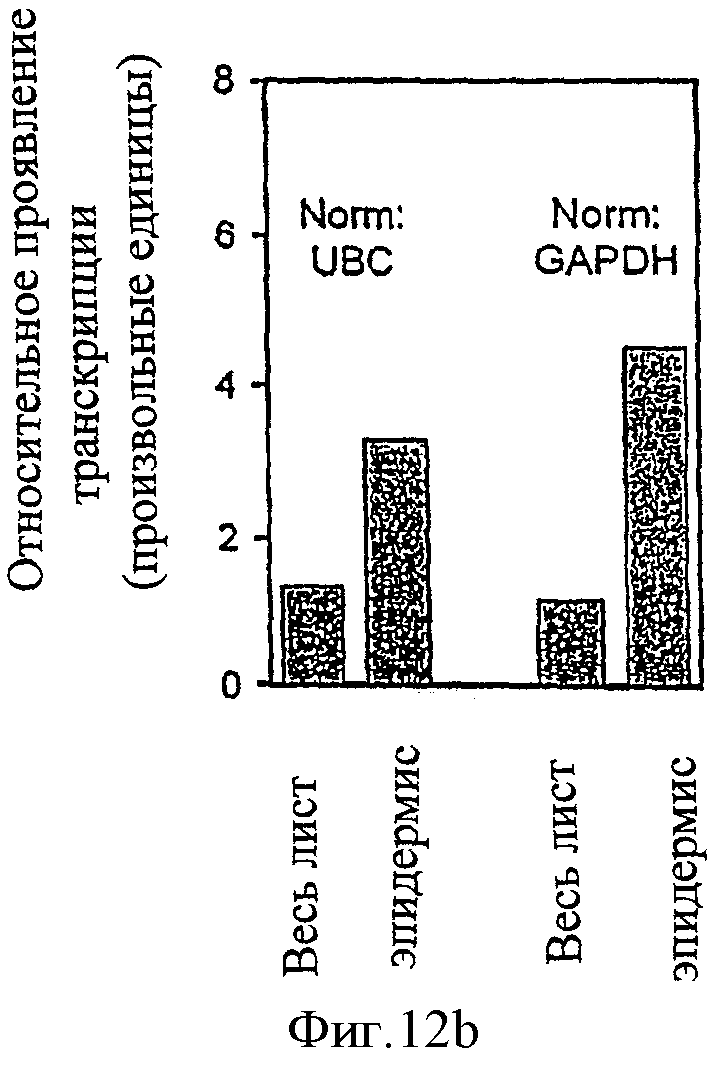
b) Путем обратного ПНР-анализа в режиме реального времени.
Определяли концентрацию TaPERO mPHK во всем листе и в эпидермисе трансгенной линии №2013 (трансформированной конструктом pPS41). Данные нормализовали на основании конститутивно экспримированных контрольных генов UBC (повсеместно конъюгированный энзим) и GAPDH (глицеральдегид-фосфат дегидрогеназа). Остающаяся во всем листе экспрессия принадлежит не снятому верхнему эпидермису и флоэме (побочная активность промотора).
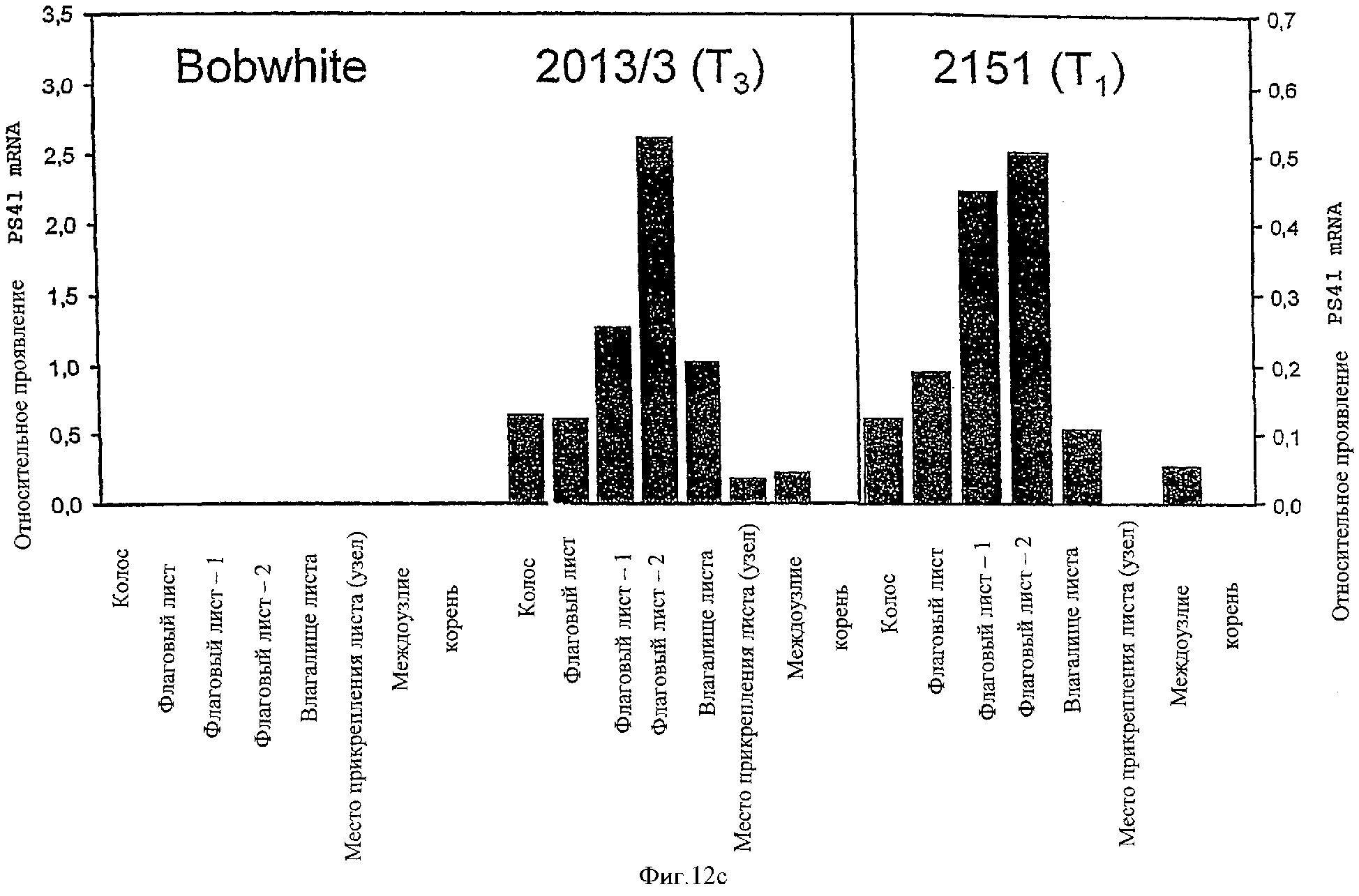
с) Путем обратного ПЦР-анализа в режиме реального времени.
Анализировали растения дикого типа (Bobwhite) и трансгенные линии №2013 и №2151 (трансформированные с помощью pPS41-конструкта) на стадии взрослого растения. Промотор сильно экспримируется прежде всего в листьях и колосьях. В стеблях и корнях трансген не экспримируется или экспримируется слабо.
13) Исследование pPS41-трансгенных растений на устойчивость к мучнистой росе
Флаговый лист взрослых растений отрезали и инокулировали в «исследовании отделенного листа» («detached leaf assay») мучнистой росой пшеницы вместе с диким видом растений Bobwhite. Спустя 7 суток после инокуляции оценивали поражение мучнистой росой. Среднее значение из 3 независимых экспериментов по инокуляции с растениями Т2 и Т3 генерации. Сублиния 2088/2 не экспримируется TAPERO и не является повышенно резистентной. Среднее значение "non-silenced"=среднему значению из всех линий, кроме 2088/2 и всех экспериментов.
14) Рост побегов pPS41-трансгенных растений.
Растения Т2 генерации сеяли вместе с диким видом растений Bobwhite и фотографировали в стадии взрослого растения.
15) Исследование устойчивости к мучнистой росе трансгенных растений pWIR5-TaMlo-RNAi.
Флаговый лист взрослых растений отрезали и инокулировали в «исследовании отделенного листа» мучнистой росой пшеницы вместе с диким видом растений Bobwhite. Спустя 7 суток после инокуляции оценивали поражение мучнистой росой. Каждые 2 сублинии в линии проверяли.
Примеры
В нижеследующих примерах использовались стандартные методы молекулярной биологии, такие как трансформация E.coli, переваливание рестракционными энзимами, лигирование, экстракция ДНК, ПЦР и т.п., какие известны к настоящему времени, например, из Sambrook и др. (2001), см. выше. Для всех ПЦР-реакций применяли проверочное считывание ("proofreading") Pwo полимеразой (Roche).
1) Получение конструкта промотора из промотора GSTA1 и интрона WIR1a (pPS18)
Получение происходило многостадийно через следующие предварительные конструкты: pPS1, pPS3, pPS15. Все конструкты содержали GUS ген-репортер, чтобы можно было их непосредственно тестировать с помощью экспресс-анализа.
pPS1
Фрагмент 1.9 кб промотора WIR1a гена вырезали с PstI из рекомбинантного pBluescript клона и клонировали в PstI-место разреза экспрессионной кассеты перед GUS-геном. Экспрессионная кассета основывалась на pBluescript и содержала GUS-ген вслед за терминатором транскрипции GSTA1-гена пшеницы. Так как GUS-ген и GSTA1-терминатор транскрипции в используемом конечном конструкте (см. пример 2) больше не содержались, детальное описание этой экспрессионной кассеты опускается. Полученный в результате конструкт содержал трансляционное слияние WIR1a::GUS.
pPS3
С помощью адаптер-праймеров 5' АТА ТАТ СТG CAG GGA GGC ACG GCC GTC САС и 5' TAT CCC GGG CCC GTG CCT GGA CGG GAA получали ПЦР фрагмент около 240 пн и его концы отрезали с помощью SmaI и PstI (на адаптер). В качестве PCR «матрицы» служил геномный клон WIR1a. Фрагмент PCR содержал последние 15 аминокислот первого экзона WIR1a и интрон, включая акцептор сайта сращивания ("splice site"), и лигировали в pPSI отрезанный с помощью PstI (частично) и SmaI и очищенный через гель-электрофорез на агарозе. Полученный в результате конструкт содержал трансляционное слияние WIR1a::GUS с интроном WIR1 перед геном GUS. Кроме того, проводили делецию аминокислот №18-35 первого экзона WIR1a, чтобы воспрепятствовать отделению белка слияния WIR1a::GUS (путем удаления сигнального пептида).
pPS15
Промотор WIR1a заменяли фрагментом PCR промотора GSTA1. Для этой цели pPS3 подвергался воздействию XhoI и SnaSI (частично), и векторная связка очищалась с помощью гель-электрофореза на агарозе. Фрагмент промотора GSTA1 длиной около 2.3 кб амплифицировали с помощью адаптер-праймеров 5' АТА ТАТ СТС GAG TCT AGA ACT AGT GGA TCC и 5' АТА ТАТ ТАС GТА GTT TGT CCG TGA ACT TCA из геномного клона GSTA1 посредством PCR и отрезали на концах с помощью XhoI и SnaBI. Фрагмент PCR лигировали с гель-элюированной pPS3 полосой, в результате получающейся в трансляционном слиянии содержащего интрон фрагмента гена WIR1a с GUS, под контролем промотора GSTA1.
pPS18
pPS15 обрабатывали с помощью PstI и SnaBI (частично), векторные полосы очищали гель-электрофорезом на агарозе и лигировали двухнитевым олигонуклеотидом (5' GTA CAC AGG CAG СТА GCT CTC GAA АСС TCG СТС GAA ACG СА плюс 5' CAT GTG TCC GTC GAT CGA GAG CTT TGG AGC GAG CTT TGC GT). Он замещал часть WIR1a гена около начала трансляции (46 пн перед началом трансляции до 53 пн после начала трансляции) с 42 пн 5'UTR гена WIR1a без кодона инициации трансляции ATG. Получающийся в результате конструкт содержит транскрипционное слияние содержащего интрон фрагмента гена WIR1a с GUS под контролем промотора GSTA1.
2) Получение использованных конструктов
а) Вектор экспрессии pPS24 (экспрессия оксалат-оксидазы под контролем промотора согласно данному изобретению)
Фрагмент HindIII/SphI длиной 745 пн гена пшеницы gf-2.8 (оксалат-оксидаза; Асc. Nr. M63223), содержащий все открытые рамки считывания (ORF), субклонировали в растительные экспрессионные кассеты pGY1, что дает в результате конструкт pGermin (описан в работе Schweizer и др., 1999). Для такого клонирования лигировали фрагмент оксалат-оксидазы в промежуточный вектор, чтобы можно было лигировать фрагмент с помощью сайтов рестрикции BamHI и PstI в pGY1. Из pGermin фрагмент SmaI/EcoRI длиной около 1 кб, содержащий ген оксалат-оксидазы и терминатор CamV 35S, лигировали в отрезанный SmaI/EcoRI и очищенный гель-электрофорезом на агарозе вектор pPS18. Полученный в результате конструкт содержит транскрипционное слияние содержащего интрон фрагмента гена WIR1a с геном оксалат-оксидазы под контролем промотора GstA1. По отношению к pPS18 конструкт больше не содержит GstA1 терминатор транскрипции, а содержит терминатор транскрипции гена CamV 35S.
б) Вектор экспрессии pPS41 (TAPERO-экспрессия под контролем промотора согласно данному изобретению)
Из pWIR3 (содержащего транскрипционное слияние между промотором CamV 35S и TAPERO; Schweizer и др., 1999) выделяли TAPERO-фрагмент длиной 1.2 кб путем рестрикционной обработки с помощью SmaI и PstI. TAPERO-фрагмент лигировали в вектор pPS24, который обрабатывали с помощью SmaI и PstI (частично) и очищали гель-электрофорезом на агарозе. Это было получено в транскрипционном слиянии содержащего интрон фрагмента гена WIRIa с TAPERO-геном (Асc. №Х56011) под контролем промотора GstA1, в котором ген оксалат-оксидазы был заменен TAPERO-геном. Как и pPS24, pPS41 содержит терминатор транскрипции гена CamV 35S.
в) Вектор экспрессии pWIR5-TaMlo-RNAi (экспрессия конструкта Мlо-RNAi под контролем промотора согласно данному изобретению)
Сначала выделяли с помощью EcoRI и PstI субклонированный в векторе pGEM-Teasy третий интрон гена резистентности Mla1 ячменя (около 1.1 кб) и лигировали в аналогично отрезанный ЈcoRI и PstI вектор pBSw41 (производное pBluescript с частичным кДНК TaMlo1, клонированный Candace Elliott в рамках его диссертации; GenBank асc. №АF361933). Из этого конструкта выделяли Mla1 интрон вместе с частью кодирующей последовательности TaMlo1-гена примерно в 1.55 кб фрагмент PstI/MscI (=фрагмент 1). Параллельно с этим амплифицировали большой фрагмент размером около 450 пн через PCR из плазмиды pBSw41 с олигонуклеотидами Т3 (стандартный секвенированный праймер для pBluescript) и TaMlo1-1 (5' GTC GCATGC СТG ТСС АСА CGA ААТ GTG С 3' (подчеркнуто место сайта рестрикции SphI). После этого PCR-фрагмент обрабатывали рестрикционными энзимами PstI и SphI (=фрагмент 2). Вектор pPS24 (промотор+оксалат-оксидаза, см. выше) открывали путем рестрикционной обработки и вырезанный фрагмент гена оксалат-оксидазы удаляли. В трехкомпонентном сшивании затем лигировали описанные выше фрагменты 1 и 2 в отрезанный SmaI/SphI вектор pPS24. При этом сшивании концы MscI и SmaI отрезанных компонентов являются совместимыми, так как в обоих случаях речь идет о так называемых «тупых концах». Получающийся в результате конструкт (pTaMlo1 RNAi) содержит около 300 пн гена TaMlo1, а также около 150 пн последовательности полилинкер/адаптер в качестве „инвертированных повторов", разделенных интроном Mla1. Контроль этой транскрипционной единицы поддается влиянию промотора GstA1.
Примечание. Ген, обозначенный здесь как TaMlo1, исходя из исторических основ, позднее получил обозначение TaMloA1 (Elliott et al., 2002). Mol. Plant Microbe Interact., 2002, 15: 1069-1077.
3) Трансформация растений пшеницы
Растения пшеницы (Bobwhite) проращивали в фотокамерах 40 суток при температуре 15°С днем и 12°С ночью в условия короткого дня (10 ч/сутки, около 600 µE) и затем в теплице при 18/16°С и фотопериоде не менее 16 часов. Колосья использовали либо непосредственно, либо хранили до 5 суток при 4°С. Снятые с колоса зерновки подвергали поверхностной стерилизации в течение 2 мин 70%-ным этанолом и затем 15-20 мин смесью 5%-ного раствора гипохлорита натрия и 0,1% Tween 20 и, наконец, четырежды промывали стерильной бидистиллированной водой. Из зерновок при стерильных условиях выделяли незрелые эмбрионы размером от 0,5 до 1,5 мм и клали вместе со щитком сверху на среду для индукции каллусов в чашки Петри (основная среда по Murashig и Skoog (1962) с 2 мг/л 2,4-D, 40 г моногидрата мальтозы,, 500 мг/л L-глутамина, 100 мг/л казеина гидролизата, 5 µМ CuSO4 и 0,25% фитагель). Культуры инкубировали при 25°С в темноте.
Спустя 5-7 суток после выделения эмбрионов осуществляли биолистическую трансформацию. За 5-6 часов перед бомбардировкой частицами переносили уже пролиферировавшие эмбрионы на новую среду с уменьшенным водным потенциалом (как выше, с добавлением 0,3 М маннитола) и инкубировали при 25°С в темноте.
Плазмиду рАНС20 (Christensen и Quail 1996), которая содержит кодирующий фосфинотрицинацетилтрансферазу bar-ген, смешивали в мольном соотношении 1:1 с со-трансформирующим вектором. В совокупности осаждали затем 10 µл раствора ДНК-плазмиды на частицы в 25 µл суспензии частиц золота (60 мг/л). Для бомбардировки наносили 30 µг частиц в 5 µл этанола на носитель Makrocarrier. Бомбардировка происходила в соответствии с рекомендациями изготовителя прибора DuPont PDS-1000/He.
Спустя 12-16 часов после бомбардировки частицами переносили эксплантаты на новую среду для индукции каллусов (такую же, как для предварительной культуры эмбрионов) и 10 суток инкубировали при 25°С в темноте.
Каллусы переносили затем на разделяющую среду (основная среда по Murashig и Skoog (1962) с 20 г/л сахарозы, 5 µМ CuSO4, 0,25% фитагеля и 3 мг/л биалафоса) и инкубировали при фотопериоде 16 часов при 200 µE и 25°С.
Через 2 недели осуществляли перенос не побуревших каллусов на регенерирующую среду (основная среда по Murashig и Skoog (1962) с 20 г/л сахарозы, 0,25% фитагеля и 4 мг/л биалафоса) и последующее инкубирование при фотопериоде 16 часов при 200 µЕ и 25°С.
Спустя 2 последующие недели расчленяли образовавшиеся побеги, переносили в пробирки со средой для регенерации и далее культивировали при фотопериоде 16 часов при 200 µЕ и 25°С.
Идентификация трансгенного регенерата происходила посредством теста на РАТ-активность экстрактов из листьев по Spencer и др. (1990) или путем амплификации специфических для трансгенов последовательностей из геномной ДНК растений-кандидатов и/или с помощью саузерн-блоттинга с применением соответствующего зонда.
Эффективность трансформации метода в зависимости от качества исходного материала составляла от 0,5 до 3 трансгенных растений на 100 культивированных эмбрионов.
4) Активность оксалат-оксидазы in situ в растениях с рР824-конструктом
Сегменты листьев растений дикого типа Bobwhite или pPS24-трансгенных растений пшеницы Т3-генерации инфильтрировали под вакуумом с помощью раствора для обнаружения оксалат-оксидазы (2.5 мМ щавелевой кислоты, 3.5 мМ свободной ЭДТК, 0.6 мг/мл 4-хлор-1-нафтола, 50 мг/мл пероксидазы из хрена, 20% (объемных) этанола, величина рН устанавливается с Tris буфером на величину 4.0) и инкубировали в течение ночи при +37°С. После удаления раствора для обнаружения инкубировали листья в течение последующих 24 часов при +4°С в Н2О. Затем листья нарезали вручную с помощью скальпеля на тонкие сегменты и рассматривали в микроскоп. Световая микроскопия с фазовым контрастом осуществлялась с помощью прибора Zeiss Axiophot при 100-кратном увеличении. Клетки с экспрессией оксалат-оксидазы имеют окрашенные в фиолетовый цвет стенки клеток.
5) Доказательство трансгена TAPERO в pPS41-трансгенных растениях с помощью нозерн-блоттинга
Листья Bobwhite и pPS41-трансгенных растений Т2 генерации (примерно по 1 г свежих листьев), оба в стадии флагового листа, гомогенизировали в жидком азоте до тех пор, пока не получали тонкий порошок. Порошок добавляли к 3 мл буферного раствора для экстракции ДНК (0,5 М Tris-Cl с рН 8; 0,25 М Na-ЭДТК; 5 вес.% додецилсульфата натрия) и 1,5 мл насыщенного буфером фенола (15 мл пластиковая пробирка) и хорошо встряхивали. Экстракты центрифугировали 30 мин при 4000-5000 об/мин, 20°С (swing out, Heraeus Varifuge). Добавляли 15 мл хлороформа (до этого сливали надосадочную жидкость) и трубку несколько раз переворачивали. Экстракты вновь центрифугировали 30 мин при 4000-5000 об/мин, 20°С и жидкость сверху осторожно слили в новую пробирку (15 мл пластиковая пробирка). За счет добавления 3 мл 6 М раствора LiCl ДНК осаждается (в течение ночи, 4°С). Выпавшую ДНК центрифугировали 30 мин при 12500 об/мин, 4°С (Festrotor, Hermle Z260K), частицы РНК извлекали 500-1000 µл 70%-ного этанола (РНК не растворяется) и переводили в пробирки Эппендорфа. Пробы центрифугировали 10 мин при 14000 об/мин, 4°С (Festrotor, Eppendorf Centrifuge 5417R) и удаляли то, что находилось сверху. Частицы РНК сушили 5 мин при 37°С, извлекали 100-200 µл ТЕ и растворяли в течение 5 мин при 75°С.Денатурирующий гель-электрофорез РНК на агарозе в содержащем формальдегид геле и перенос на нейлоновые мембраны (Hybond N, Amersham) осуществляли в соответствии со стандартными протоколами (Sambrook et al., см. выше). С каждого образца получали 10 µг РНК.
Радиоактивная зондовая маркировка с помощью α32P-dCTR осуществлялась методом мечения случайным маркером «random prime labeling» с применением набора инструментов (Roche). Гибридизация происходила спустя ночь при 65°С в CHURCH-буфере (0,5 М фосфата натрия рН 7,2; 1 вес.% додецилсульфата натрия; 7% мМ Na2ЭДТК). Блот промывали дважды по 15 мин в промывном растворе (0.1 раствора хлорида и цитрата натрия; 0.1 вес.% додецилсульфата натрия) при 65°С и затем 16-48 часов экспонировали на фотоматериалы. Экспонированные фотоматериалы сканировали с помощью прибора Phosporimager (FujiFilm FLA 300) и в виде рисуночных данных переводили в формат TIFF.
6) Доказательство трансгена TAPERO в pPS41-трансгенных растениях с помощью нозерн-блоттинга
Верхушки листьев Bobwhite и pPS41-трансгенных растений Т2 генерации, оба в стадии флагового листа, гомогенизировали в IWF буфере (32 мМ фосфата натрия; 84 мМ цитрата; рН 2.8; на кончике шпателя поливинилпирролидон). Полученные гомогенные образцы центрифугировали 15 мин при 13000 об/мин и 4°С. То, что находилось сверху, смешивали с 0.5 г/мл ацетата аммония, и растворимые в кислоте протеины, спустя ночь при 4°С, осаждались. Протеины центрифугировали 30 мин при 13000 об/мин и 4°С.Частицы белков извлекали 50 µл/г свежеприготовленного буфера для ресуспендирования (50 мМ Tris-Cl с рН 7.5; 20% (объемных) глицерина). К пробе в 20 µл добавляли 5 µл 4-кратно концентрированного буферного раствора с додецилсульфатом натрия и образцы смешивали с таким количеством (1-5 µл) насыщенного Tris-раствора, пока на произойдет изменение окраски бромфенолового синего в синий цвет 12,5 µл Прокипяченного образца разделяли на полосы денатурирующим гель-электрофорезом в додецилсульфате натрия-полиакриламиде (15%-ный разделительный гель) по стандартной методике с применением аппаратуры фирмы Bio-Rad. После электрофореза окрашивали гель либо кумасси (в качестве контроля наполнения), либо переносили на нитроцеллюлозную мембрану с помощью стандартной методики (geblottet). Мембраны инкубировали по стандартной методике с помощью первых поликлональных антител (разбавление 1:2000), направленных против протеина Рrх8 ячменя (протеин-гомолог TAPERO), затем с помощью вторых антител (разбавление 1:2000), которые направлены против антител кролика и присоединены к щелочной фосфатазе. Протеиновые связи TAPERO определяли с помощью активности локализированной щелочной фосфатазы (красящие растворы BCIP/NBT; готовые таблетки (Roche)).
7) Доказательство специфической в эпидермисе экспрессии трансгенов с помощью норзерн-блоттнига и PCR-анализа в режиме реального времени
Экстракцию РНК и нозерн-блотинг осуществляли, как описано в примере 5. PCR-анализы в режиме реального времени проводили с помощью прибора LightCycler® (Roche, Маннхайм, Германия) в соответствии с данными изготовителя.
8) Устойчивость к мучнистой росе в pPS41- или pWIR5-TaMlo-PHKi-трансгенных растениях
Для теста на резистентность использовали взрослые, выращенные в теплице, pPS41- или pWIR5-TaMlo-PHKi-трансгенные растения пшеницы с полностью развившимся, свежевыращенным флаговым листом. В качестве контроля служили одновременно выращенные растения дикого вида Bobwhite. Верхушечную половину флагового листа отрезали и помещали в поликарбонатные чашки размером 20×20 см на 0,5 вес.% фитоагара, который смешан с 20 ppm бензимидазола. В каждую чашку помещали одну трансгенную сублинию (по 20 листьев) плюс дикий тип Bobwhite (по 6 листьев). Сегменты листьев инокулировали в инокуляционном потоке спорами мучнистой росы, в то время как споры от 4 сильно инокулированных листьев пшеницы вдували в колонку. Через 5 мин чашки убирали, закрывали и инкубировали при 20°С и непрямом дневном свете. Спустя 7 суток после инокуляции поражение мучнистой росой оценивали с применением системы классовой оценки (Schweizer et al., 1995). Устойчивость рассчитывалась в расчете на контрольные листья, находящиеся на соответствующей пластинке фитоагара.
Литература:
Christensen and Quail (1996) Transgenic Res. 5: 213-218.
Elliott et al. (2002). Molecular Plant Microbe Interactions 15: 1069-1077.
Murashige and Skoog (1962) Physiologia Plantarum 15: 473-497.
Schweizer, P., Vallélian-Bindschedler, L., and Mosinger, E. (1995). Heat-induced resistance in barley to the powdery mildew fungus Erysiphe graminis f.sp. hordei. Physiological and Molecular Plant Pathology 47, 51-66.
Schweizer, P., Pokomy, J., Abderhalden, O., and Dudler, R. (1999). A transient assay system for the functional assessment of defense-related genes in wheat, Mol Plant-Microbe Interact 72, 647-654.
Spencer et al. (1990) TAG 79: 625-631.











Реферат
Изобретение относится к биотехнологии. Описана область промотора, под контролем которого можно специфически выявлять трансгены в эпидермисе растений. Раскрыта рекомбинантная молекула нуклеиновой кислоты, которая содержит в себе описанные промоторы. Представлены трансгенные растения и растительные клетки, которые трансформировались с помощью раскрытой молекулы нуклеиновой кислоты. Предложен способ получения представленных растений и клеток. Изобретение позволяет получать растения, устойчивые к возбудителям болезней. 5 н. и 5 з.п. ф-лы, 15 ил.
Формула
а) GTGGGGG
б) ACGTGGA
в) ТССАССТ
г) ТАТССАТ
д) CATGCATG
е) TGTAAAG
ж) ССТАССА
з) AATAGTA.
а) GTGGGGG
б) ACGTGGA
в) ТССАССТ
г) ТАТССАТ
д) CATGCATG
e) TGTAAAG
ж) ССТАССА
з) AATAGTA.
а) областей промотора, которые включают в себя указанную под SEQ ID №3 последовательность нуклеиновых кислот,
б) областей промотора, которые включают в себя функциональную часть указанной под SEQ ID №3 последовательности нуклеиновых кислот, и
в) областей промотора, имеющих последовательность, которая при обязательных условиях гибридизуется с указанной под SEQ ID №3 последовательностью нуклеиновых кислот, или последовательность области промотора имеет идентичность, составляющую, по меньшей мере, 90% по сравнению с последовательностью по SEQ ID №3.
а) получения рекомбинантной молекулы нуклеиновой кислоты по п.4 или 5,
б) переноса рекомбинантной молекулы нуклеиновой кислоты из а) на растительные клетки и
в) регенерации полностью трансформированных растений и при необходимости размножение растений.

Комментарии