Лекарственное средство против гиперактивного мочевого пузыря, включающее производное анилида уксусной кислоты в качестве активного ингредиента - RU2321401C2
Код документа: RU2321401C2
Чертежи

Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к лекарственному средству против гиперактивного мочевого пузыря, включающему анилид (R)-2-(2-аминотиазол-4-ил)-4'-[2-[(2-гидрокси-2-фенилэтил)амино]-этил]уксусной кислоты или его соль в качестве активного ингредиента.
Предпосылки создания изобретения
Мочевой пузырь млекопитающих находится под двойным контролем пучка вегетативных нервных волокон и сжимателя, расслабляющегося через β-адреналиновый рецептор путем стимуляции симпатического нерва после мочеиспускания, тогда как во время выделения мочи он сокращается через мускариновый рецептор путем стимуляции парасимпатического нерва. В качестве лекарственного средства против гиперактивного мочевого пузыря, возникающего тогда, когда двойной контроль как таковой разбалансирован, в настоящее время используют главным образом антихолинергические агенты, такие как пропиверингидрохлорид и оксибутинингидрохлорид. Однако имеются трудноизлечимые случаи заболевания, при которых проявляется резистентность к таким соединениям, и имеются побочные эффекты, вызываемые антихолинергическими агентами, такие как дисфункция мочеиспускания и ксеростомия, следовательно, имеется "текущее" состояние, при котором не всегда достигают удовлетворительных клинических результатов.
Далее как результат увеличения у населения людей пожилого возраста в последние годы, количество пациентов, страдающих от гиперактивного мочевого пузыря, возрастает каждый год и, с точки зрения качества жизни пациентов, существует настоятельная потребность в нахождении новых лекарственных средств.
Авторы настоящего изобретения в примере 41 в публикации Международной патентной заявки WO-99/20607 сообщают, что дигидрохлорид анилида (R)-2-(2-аминотиазол-4-ил)-4'-[2-[(2-гидрокси-2-фенилэтил)амино]этил]-уксусной кислоты обладает как стимулирующим воздействием на секрецию инсулина, так и усиливающим воздействием в отношении чувствительности к инсулину, и, далее, обладает действием против ожирения и антигиперлипемическим действием, вследствие чего является пригодным соединением для лечения сахарного диабета, однако не приводится ни указания, ни раскрытия в отношении терапевтического использования для лечения гиперактивного мочевого пузыря (см. патентный документ 1).
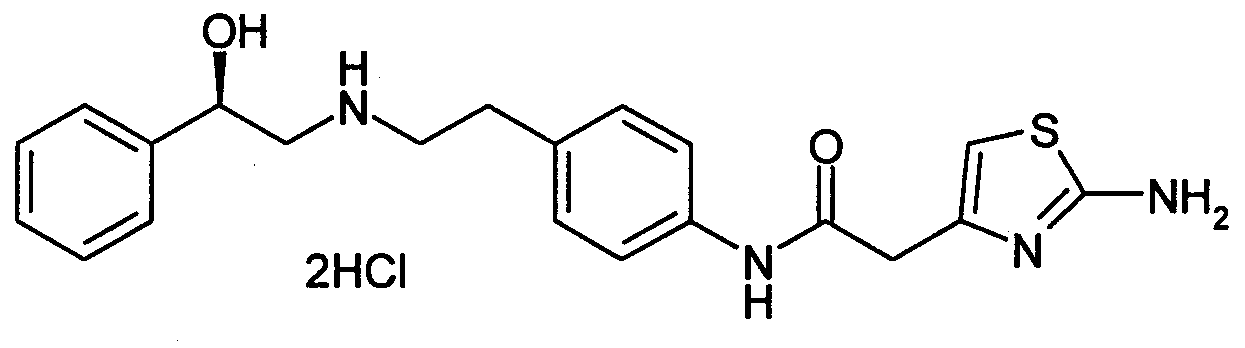
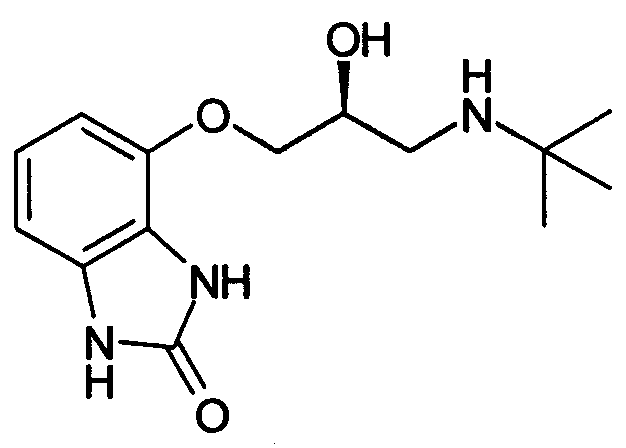
Между тем, в публикации Международной патентной заявки WO-98/07445 в качестве агента для профилактики и лечения частоты мочеиспускания и недержания мочи, включающего лекарственное средство, обладающее стимулирующим воздействием на β3-адреналиновый рецептор, в качестве активного ингредиента указан CGP-12,177A нижеследующей химической структурной формулы, обладающий релаксирующим воздействием на мочевой пузырь (см. патентный документ 2). CGP-12,177A известен как селективное лекарственное средство, оказывающее стимулирующее воздействие на β3-адреналиновый рецептор (см. непатентные документы 1 и 2).
В публикации Международной патентной заявки WO-99/31045 указываются соединения, отвечающие нижеследующей формуле, как обладающие стимулирующим воздействием на β3-адреналиновый рецептор и в качестве средства для предотвращения или лечения заболеваний, вызванных ожирением, гипергликемией и ускорением действия кишечника, и заболеваний, вызываемых частотой мочеиспускания или недержанием мочи, меланхолией, желчным конкрементом или ускорением действия желчных протоков (см. патентный документ 3).
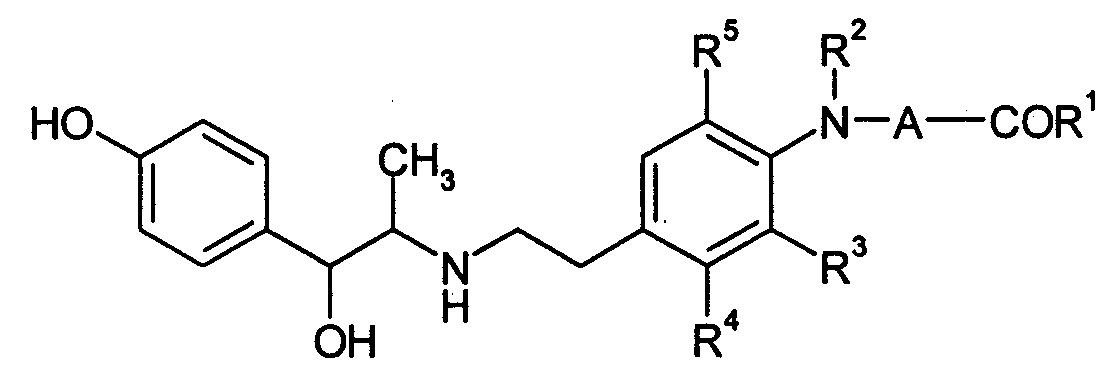
(В формуле R1 означает гидроксильную группу, низшую алкильную группу, аралкоксильную группу, аминогруппу и т.д.; R2 означает гидроксильную группу или низшую алкильную группу; R3 означает атом водорода или атом галогена; R4 и R5, каждый, означает атом водорода, атом галогена или низшую алкильную группу; и А означает низшую алкиленовую группу.)
В публикации Международной патентной заявки WO-99/52856 указываются соединения нижеследующей формулы, обладающие стимулирующим воздействием на β3-адреналиновый рецептор и в качестве средства для предотвращения или лечения заболеваний, вызванных ожирением, гипергликемией и ускорением действия кишечника, и заболеваний, вызываемых частотой мочеиспускания или недержанием мочи, меланхолией, желчным конкрементом или ускорением действия желчных протоков (см. патентный документ 4).
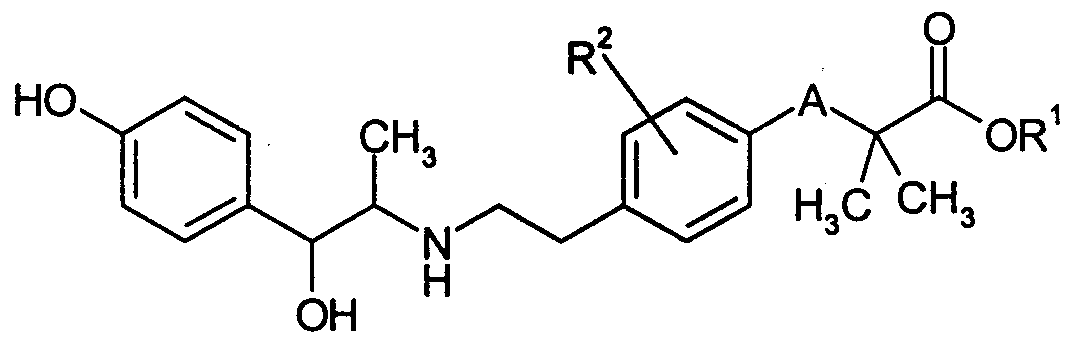
(В формуле R1 означает атом водорода, низшую алкильную группу или аралкильную группу; R2 означает атом водорода, низшую алкильную группу или атом галогена; А означает атом кислорода или иминогруппу.)
В публикации Международной патентной заявки WO-00/02846 указываются соединения нижеследующей формулы, обладающие стимулирующим воздействием на β3-адреналиновый рецептор и в качестве средства для предотвращения или лечения заболеваний, вызванных ожирением, гипергликемией и ускорением действия кишечника, и заболеваний, вызываемых частотой мочеиспускания или недержанием мочи, меланхолией, желчным конкрементом или ускорением действия желчных протоков (см. патентный документ 5).
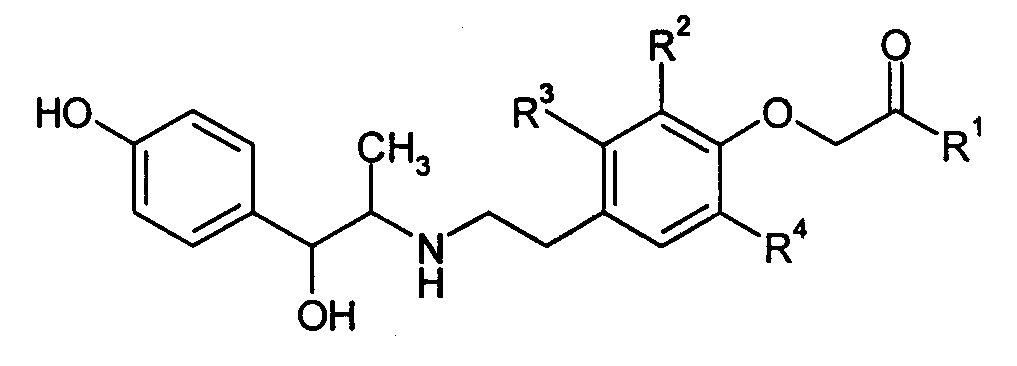
(В формуле R1 означает гидроксильную группу и т.д.; один из R2 и R3 означает атом водорода, атом галогена и т.д., а другой означает атом водорода; и R4 означает атом галогена и т.д.)
Патентный документ 1: публикация Международной патентной заявки WO-99/20607.
Патентный документ 2: публикация Международной патентной заявки WO-98/07445.
Патентный документ 3: публикация Международной патентной заявки WO-99/31045.
Патентный документ 4: публикация Международной патентной заявки WO-99/52856.
Патентный документ 5: публикация Международной патентной заявки WO-00/02846.
Непатентный документ 1: Drugs of the Future, 1993, том 18, № 6, с. 542.
Непатентный документ 2: The American Society for Pharmacology and Experimental Therapeutics, 1993, том 44, с. 1100.
Раскрытие изобретения
Авторами настоящего изобретения проведены интенсивные исследования в отношении выявления новых фармакологических воздействий анилида (R)-2-(2-аминотиазол-4-ил)-4'-[2-[(2-гидрокси-2-фенилэтил)амино]этил]уксусной кислоты или его соли (в дальнейшем называется как "активный ингредиент согласно настоящему изобретению"), который пригоден в качестве лекарственного средства для лечения сахарного диабета, и в результате ими было найдено, что активный ингредиент согласно настоящему изобретению пригоден в качестве лекарственного средства особенно для лечения гиперактивного мочевого пузыря. Согласно настоящему изобретению гиперактивный мочевой пузырь определяют как заболевание, при котором часто возникает позыв на мочеиспускание. Хотя доброкачественная гиперплазия предстательной железы служит примером одной из причин гиперактивного мочевого пузыря, имеется много случаев, где причина неясна, и их называют идиопатическим гиперактивным мочевым пузырем. Хотя гиперактивный мочевой пузырь иногда сопровождается частотой мочеиспускания и недержанием мочи, это не ограничивается заболеванием, которое всегда сопровождается частотой мочеиспускания и недержанием мочи. Так, в случае слабо гиперактивного мочевого пузыря пациент чувствителен в отношении ощущения желания к мочеиспусканию и часто имеет ощущение позыва на мочеиспускание, однако на самом деле он/она в состоянии удерживать свою мочу в течение промежутка времени. Однако, даже в случае слабо гиперактивного мочевого пузыря решительно требуется его положительная динамика, принимая во внимание качество жизни пациента. С другой стороны, "тяжелый" гиперактивный мочевой пузырь иногда сопровождается частотой мочеиспускания и недержанием мочи. Частота мочеиспускания представляет собой состояние, при котором число раз мочеиспускания больше, чем обычный один раз, и показано, что должно быть не меньше, чем примерно два раза ночью, и не меньше, чем примерно 8 раз в течение 24 часов. При недержании мочи происходит непроизвольное истечение мочи и это определяют как состояние, где имеется проблема в социальном или гигиеническом отношении и классифицируется как недержание мочи при напряжении, которое наблюдается, когда прикладывается внутрибрюшное давление, такое как кашель и чиханье; неотложное недержание мочи, при котором внезапно проявляется позыв на мочеиспускание и моча подтекает до достижения туалета; и недержание мочи смешанного типа, при котором присутствуют как недержание мочи, так и при напряжении неотложное недержание мочи.
Отличительным признаком настоящего изобретения является то, что активный ингредиент согласно настоящему изобретению главным образом уменьшает частое появление позывов на мочеиспускание у пациента и число раз мочеиспускания и нормализует состояние мочеиспускания. Это происходит без указания на то, что гиперактивный мочевой пузырь согласно настоящему изобретению включает не только тот, который возникает в результате доброкачественной гиперплазии предстательной железы, но и также тот, который сопровождается позывом на мочеиспускание, недержанием мочи и поллакиурией.
В соответствии с патентным документом 1 активный ингредиент согласно настоящему изобретению пригоден в дополнение к лечению диабета в качестве средства для профилактики и лечения других заболеваний, где улучшение в отношении симптома может быть достигнуто путем уменьшения симптома ожирения и гиперлипемии, такого как артериосклероз, ишемического заболевания сердца, такого как инфаркт сердца и стенокардия, артериального склероза головного мозга, такого как инфаркт мозга, аневризма и т.д. Однако совершенно не приводится ни описания, ни указания на то, что активный ингредиент согласно настоящему изобретению пригоден в качестве лекарственного средства против гиперактивного мочевого пузыря.
В патентном документе 2 также не указывается на использование для лечения гиперактивного мочевого пузыря. В патентном документе 2 приводится описание того, что только CGP-12,177A оказывает релаксирующее воздействие на мочевой пузырь как соединение, обладающее селективным стимулирующим воздействием на β3-адреналиновый рецептор. Однако по сравнению с CGP-12,177A активный игредиент согласно настоящему изобретению обладает намного более сильным релаксирующим воздействием на мочевой пузырь. Кроме того, в патентном документе 2 не приводится описание тестов in vivo, показывающих полезность для лечения гиперактивного мочевого пузыря, таких как "тест на определение ритмичного сокращения мочевого пузыря крысы" и "тест на определение функции мочеиспускания на модели гиперактивного мочевого пузыря, индуцированного циклофосфамидом у крыс".
Далее, в патентных документах 3-5 также не указывается на использование против гиперактивного мочевого пузыря. Соединения, указанные в патентных документах 3-5, и активный ингредиент согласно настоящему изобретению различаются по их основным структурам в том отношении, что соединения, указанные в документах, всегда содержат фенольный цикл, однако не включают тиазольного цикла и также не содержат амидной связи. Кроме того, в патентных документах 3-5 нет описания тестов in vivo, показывающих полезность для лечения гиперактивного мочевого пузыря, таких как "тест на определение ритмичного сокращения мочевого пузыря крысы" и "тест на определение функции мочеиспускания на модели гиперактивного мочевого пузыря, индуцированного циклофосфамидом у крысы".
Настоящее изобретение теперь будет подробно пояснено ниже.
Согласно настоящему изобретению активным ингредиентом является анилид (R)-2-(2-аминотиазол-4-ил)-4'-[2-[(2-гидрокси-2-фенилэтил)амино]этил]уксусной кислоты или его соль. Отличительным признаком настоящего изобретения является то, что найдено, что активный ингредиент согласно настоящему изобретению пригоден в качестве лекарственного средства против гиперактивного мочевого пузыря, что представляет собой его новое применение.
В особенности предпочтительно, что активный ингредиент согласно настоящему изобретению представляет собой свободное вещество, не являющееся солью. Однако он может образовывать соль с кислотой, и примерами соли являются аддитивные соли с неорганической кислотой, такой как хлористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, азотная кислота и фосфорная кислота, и с органической кислотой, такой как муравьиная кислота, уксусная кислота, пропионовая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота, лимонная кислота, винная кислота, угольная кислота, пикриновая кислота, метансульфокислота, этансульфокислота и глутаминовая кислота. Активный ингредиент согласно настоящему изобретению, являющийся солью, может быть легко получен из свободного вещества путем обычной реакции солеобразования. Активный ингредиент, согласно настоящему изобретению, далее включает гидрат, сольват и обладает полиморфизмом. Активный ингредиент согласно настоящему изобретению далее еще включает фармакологически приемлемое пролекарство. Что касается группы для образования пролекарства, то примером может служить указанное в Prog. Med., 5, 2157-2161 (1985) и "Iyakuhin no Kaihatsu" (Разработка лекарств)(Hirokawa Shoten, 1990), том 7, Molecule Design, 163-198.
Лекарственное средство, содержащее активный ингредиент, согласно настоящему изобретению может быть в любой из форм для перорального введения, как таблетки, пилюли, капсулы, гранулы, разбавляемые порошки и т.д., и для парентерального введения, как лекарственная форма для ингаляции и т.д. В качестве твердой композиции для перорального введения используют таблетки, разбавляемые порошки, гранулы и т.д. В твердой композиции, как таковой, один или более активных ингредиентов смешаны по меньшей мере с одним инертным эксципиентом, таким как лактоза, маннит, глюкоза, гидроксипропилцеллюлоза, микрокристаллическая целлюлоза, крахмал, поливинилпирролидон и метасиликаталюминат магния. Композиция обычно может содержать инертную добавку, такую как смазывающее вещество (например, стеарат магния), дезинтегрирующий агент (например, натриевая соль карбоксиметилкрахмала), солюбилизирующий агент и т.д. Таблетки и пилюли, если необходимо, могут быть покрыты оболочкой из сахара или средством, дающим внутрижелудочно- или энтеросолюбильную оболочку. Доза может быть соответственно определена для каждого случая, принимая во внимание симптом, возраст и пол субъекта, которому должна быть введена, и т.д. Обычно она составляет от примерно 0,01 мг/кг до 100 мг/кг в сутки для взрослого в случае перорального введения и вводится либо один раз, либо путем разделения на количество частей от двух до четырех.
Активный ингредиент согласно настоящему изобретению может быть легко получен способом, указанным в патентном документе 1, однако так как способ получения свободного вещества, которое является предпочтительным в качестве активного ингредиента согласно настоящему изобретению, там конкретно не указан, такой способ получения представлен в примерах получения. Схема получения поясняется нижеследующим образом.
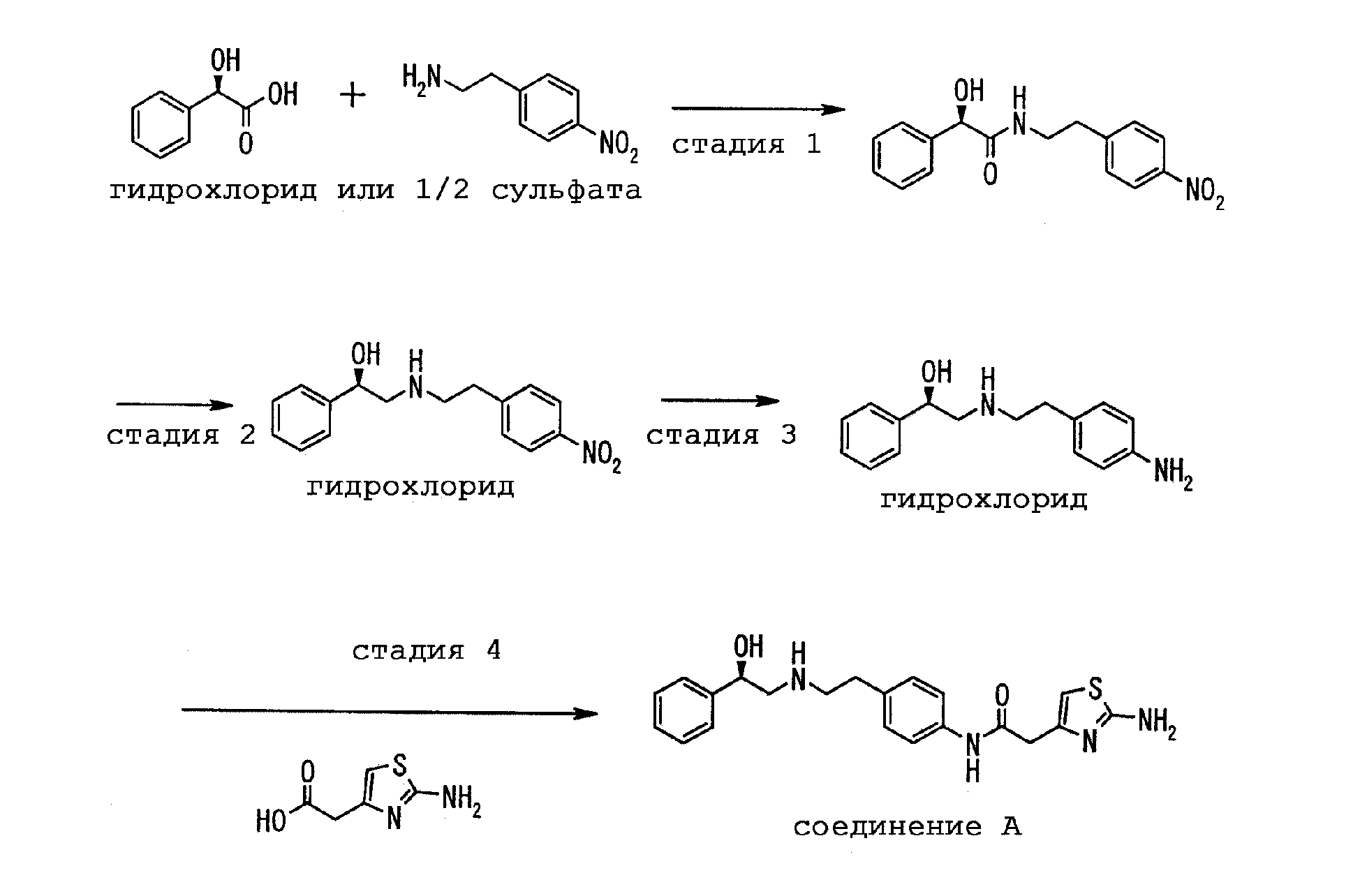
Примеры получения (способ получения активного ингредиента согласно настоящему изобретению)
Стадия 1
К смеси 5,90 кг моногидрохлорида 4-нитрофенилэтиламина, 4,43 кг (R)-миндальной кислоты, 2,94 кг триэтиламина и 22 л N,N-диметилформамида добавляют 3,93 кг гидроксибензтриазола и 5,58 кг моногидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDC), после чего перемешивают примерно при комнатной температуре в течение 2 часов. Затем туда добавляют 0,28 кг EDC, и смесь перемешивают примерно при комнатной температуре в течение одной ночи. Реакционный раствор разбавляют с помощью 10 л воды и экстрагируют этилацетатом (60 л, 30 л). Органический слой последовательно промывают с помощью 60 л 1 М хлористоводородной кислоты, 60 л 20%-ного водного раствора карбоната калия и воды (60 л, 60 л) и концентрируют в вакууме при температуре от 10°С до 19°С. Остаток растворяют в 35 л толуола при нагревании до 87°С, охлаждают и перемешивают при температуре 20°С в течение одной ночи. Полученные в результате кристаллы отфильтровывают и промывают с помощью 10 л толуола. Их высушивают в вакууме, получая 7,66 кг (R)-2-гидрокси-N-[2-(4-нитрофенил)этил]-2-фенилацетамида в виде кристаллов слегка желтого цвета.
1Н-ЯМР (ДМСО-d6, 400 МГц)δ(м.д.)=2,87(2Н, т, J=7,2 Гц), 3,30-3,46 (2Н, м), 4,85(1Н, д, J=4,8 Гц), 6,12(1Н, д, J=4,8 Гц), 7,20-7,33(5Н, м), 7,40 (2Н, д, J=8,0 Гц), 8,04-8,12 (3Н, м).
Масс-спектр (FAB (ионизация бомбардировкой быстрыми атомами)) m/z: 301 (М+Н)+.
Стадия 2
Смесь 7,51 кг (R)-2-гидрокси-N-[2-(4-нитрофенил)этил]-2-фенилацетамида, 23 л 1,3-диметил-2-имидазолидинона и 23 л тетрагидрофурана охлаждают до температуры -18°С и к смеси прикапывают 49,4 кг 1 М раствора борана в тетрагидрофуране при температуре не выше чем -7°С. После этого температуру смеси повышают до 70°С с последующим перемешиванием в течение 5 часов. Реакционную смесь охлаждают до температуры -12°С и добавляют 2,9 кг метанола и 5,9 кг концентрированной соляной кислоты при температуре не выше чем 5°С. После перемешивания при температуре 68°С в течение 1 часа смесь концентрируют в вакууме вплоть до объема, составляющего 50 л. Туда добавляют 60 кг 30%-ного водного раствора К2СО3 и 6 л воды, после чего экстрагируют с помощью 75 л этилацетата. Органический слой промывают с помощью 75 л воды и концентрируют в вакууме. К остатку добавляют 75 л изопропанола, смесь растворяют при температуре 40°С и добавляют 2,46 кг концентрированной соляной кислоты для кристаллизации при последующем перемешивании при температуре 23°С в течение одной ночи. Кристаллы отфильтровывают и промывают с помощью 38 л изопропанола. Их высушивают в вакууме, получая 7,29 кг (R)-2-[[2-(4-нитрофенил)этил]амино]-1-фенилэтанолмоногидрохлорида.
1Н-ЯМР (ДМСО-d6, 400 МГц)δ(м.д.)=3,00-3,08 (1Н, м), 3,15-3,30 (5Н, м), 5,00-5,05 (1Н, м), 6,23 (1Н, д, J=4,0 Гц), 7,29-7,35 (1Н, м), 7,36-7,43 (4Н, м), 7,57 (2Н, д, J=8,4 Гц), 8.21 (2Н, д, J=8,4 Гц), 9,12 (2Н, ушир.).
Масс-спектр (FAB) m/z: 287 (М+Н)+.
Стадия 3
Смесь 11,0 кг (R)-2-[[2-(4-нитрофенил)этил]амино]-1-фенилэтанолмоногидрохлорида, 110 л метанола и 1,20 кг влажного 10 %-ного палладия-на-угле (степень смачивания: 54,2%) перемешивают в атмосфере водорода вплоть до прекращения поглощения водорода. Реакционный раствор отфильтровывают и фильтрат концентрируют в вакууме. К остатку добавляют 40 л метанола для растворения при температуре 40°С и осуществляют кристаллизацию путем добавления к полученному раствору 220 л диизопропилового эфира при последующем перемешивании при температуре 20°С в течение одной ночи. Кристаллы отфильтровывают и промывают с помощью 30 л диизопропилового эфира. Их высушивают в вакууме, получая 9,43 кг (R)-2-[[2-(4-аминофенил)этил]амино]-1-фенилэтанол-моногидрохлорида.
1Н-ЯМР (ДМСО-d6, 400 МГц)δ(м.д.)=2,76-2,90 (2Н, м), 2,95-3,16 (4Н, м), 4,95-5,11 (3Н, м), 6,20 (1Н, д, J=4,0 Гц), 6,53 (2Н, д, J=8,4 Гц), 6,89 (2Н, д, J=8,4 Гц), 7,28-7,43 (5Н, м), 8,97 (1Н, ушир.), 9,29 (1Н, ушир.).
Масс-спектр (FAB) m/z: 257 (М+Н)+.
Стадия 4
К смеси 8,00 г (R)-2-[[2-(4-аминофенил)этил]амино]-1-фенилэтанолмоногидрохлорида, 4,32 г 2-аминотиазол-4-илуксусной кислоты, 2,64 г концентрированной соляной кислоты и 120 мл воды при комнатной температуре добавляют 5,76 г моногидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDC), после чего перемешивают в течение 1 часа. Для кристаллизации к реакционному раствору прикапывают смешанный раствор 2,40 г гидроксида натрия и 40 мл воды. Полученные кристаллы отфильтровывают, промывают водой и высушивают в вакууме, получая 9, 93 г анилида (R)-2-(2-аминотиазол-4-ил)-4'-[2-[(2-гидрокси-2-фенилэтил)амино]этил]уксусной кислоты (в дальнейшем называется как "соединение А").
1Н-ЯМР (ДМСО-d6, 500 МГц)δ(м.д.)=1,60 (1Н, с), 2,59-2,66 (4Н, м), 2,68-2,80 (2Н, м), 3,45 (2Н, с), 4,59 (1Н, ушир.), 5,21 (1Н, ушир.), 6,30 (1Н, с), 6,89 (2Н, с), 7,11 (2Н, д, J=8,5 Гц), 7,19-7,23 (1Н, м), 7, 27-7,33 (4Н, м), 7,49 (2Н, д, J=8,5 Гц), 9,99 (1Н, с).
Масс-спектр (FAB) m/z: 397 (М+Н)+.
Наилучший вариант осуществления изобретения
Настоящее изобретение теперь конкретно будет пояснено путем нижеследующих примеров, однако настоящее изобретение не ограничивается содержанием этих примеров.
Пример 1
(Тест на гладкомышечную релаксацию изолированного мочевого пузыря крысы)
Методика осуществления теста
Тест осуществляли согласно The Journal of Urology, 1999, том 161, с. 680.
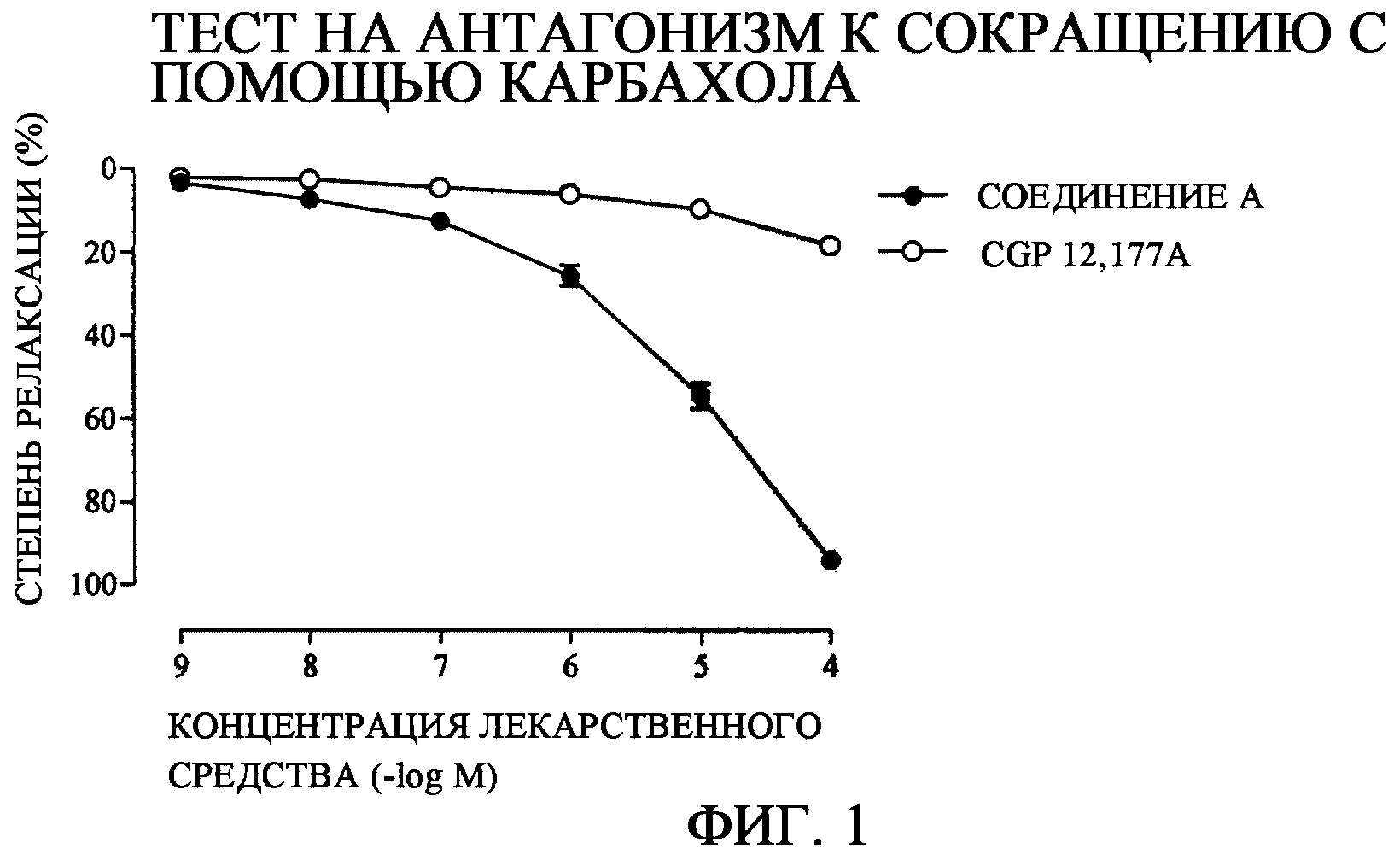
Самцов крыс линии Wistar в возрасте от 10 до 11 недель умерщвляли путем обескровливания, мочевой пузырь целиком извлекали путем лапаротомии и секции мочевого пузыря, каждую размером примерно 3х10 мм, препарировали в питательном растворе, который был оксигенирован 95% О2 и 5% СО2 (раствор Кребса-Хенселейта (118,4 мМ NaCl, 4,7 мМ KCl, 1,2 мМ КН2РО4, 1,2 мМ MgSO4, 2,5 мМ CaCl2, 25,0 мМ NaHCO3 и 11,1 мМ глюкозы)). Секцию подвешивали в пробирке Magnus, в которой питательный раствор (раствор Кребса-Хенселейта) при температуре 37°С, в который аэрировали 95% О2 и 5% СО2, стабилизировали в течение 30-60 минут с нагрузкой 1 г и туда неоднократно вводили 10-6 М карбахола (CCh) или 40 мМ хлорида калия (KCl) до тех пор, пока не убеждались, что реакционная способность в отношении CCh или KCl становилась почти постоянной. После того как было индуцировано сокращение с помощью 10-6 М CCh или 40 мМ KCl и было стабилизировано генерируемое напряжение, тестируемое лекарственное средство - соединение А или (CGP-12,177A) кумулятивно вводили в 10-кратном соотношении с интервалами примерно 10 минут и наблюдали реакцию релаксации. После завершения наблюдения реакции релаксации при максимальной концентрации тестируемого лекарственного средства добавляли 10-4 М папаверина для индуцирования максимальной релаксации и рассчитывали степень релаксации, где реакцию релаксации определяли как 100%.
Результаты
Как результат вышеуказанного теста соединение А, которое представляет собой активный ингредиент, согласно настоящему изобретению показало сильное релаксирующее воздействие при испытании на антагонизм к сокращению с помощью карбахола и при испытании на антагонизм к сокращению за счет хлорида калия в тесте на гладкомышечную релаксацию изолированного мочевого пузыря крысы. Кроме того, соединение А проявило значительно более сильное релаксирующее воздействие по сравнению с CGP-12,177A (контрольное соединение).
Степени релаксации для концентрации лекарственного средства - соединения А, которое представляет собой активный ингредиент согласно настоящему изобретению, и контрольного соединения - представлены на фиг.1 (тест на антагонизм к сокращению с помощью карбахола) и на фиг.2 (тест на антагонизм к сокращению с помощью хлорида калия) соответственно. Далее, ЕС50 и максимальная степень релаксации тестируемого лекарственного средства в тесте на антагонизм к сокращению с помощью карбахола представлены в таблице 1, тогда как сравнение по концентрации соединения А, проявляющего максимальную степень релаксации, и CGP-12,177A представлено в таблице 2. Соединение А показывает 270-кратную силу воздействия по сравнению с CGP-12,177A (контрольное соединение). Подобным образом ЕС50 и максимальная степень релаксации тестируемого лекарственного средства в тесте на антагонизм к сокращению с помощью хлорида калия представлены в таблице 3, тогда как сравнение по концентрации соединения А, проявляющего максимальную степень релаксации, и CGP-12,177A представлено в таблице 4. Соединение А показывает 383-кратную силу воздействия по сравнению с CGP-12,177A (контрольное соединение).
Пример 2
(Тест на определение ритмичного сокращения
мочевого пузыря крысы)
Тест осуществляли согласно Eropean Journal of Pharmacology, 2000, том 407, с. 175
1. Методика определения
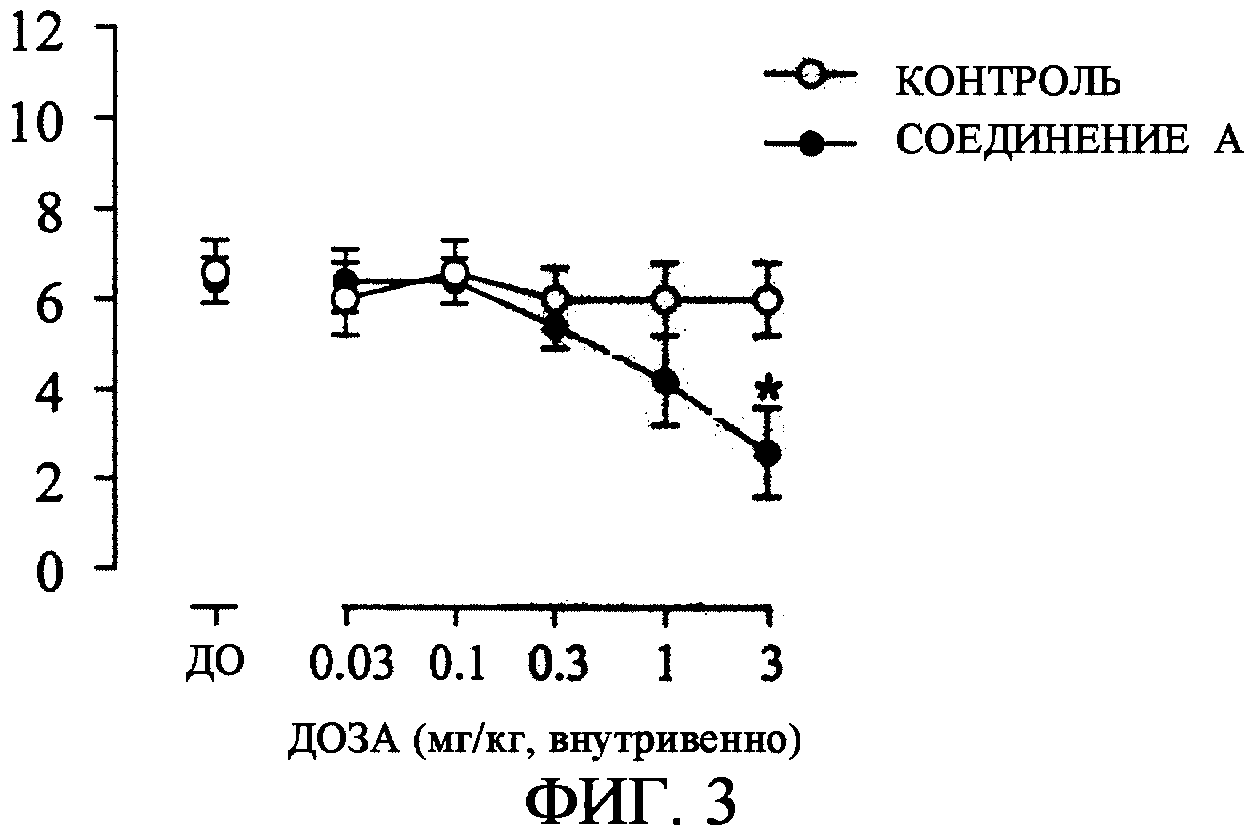
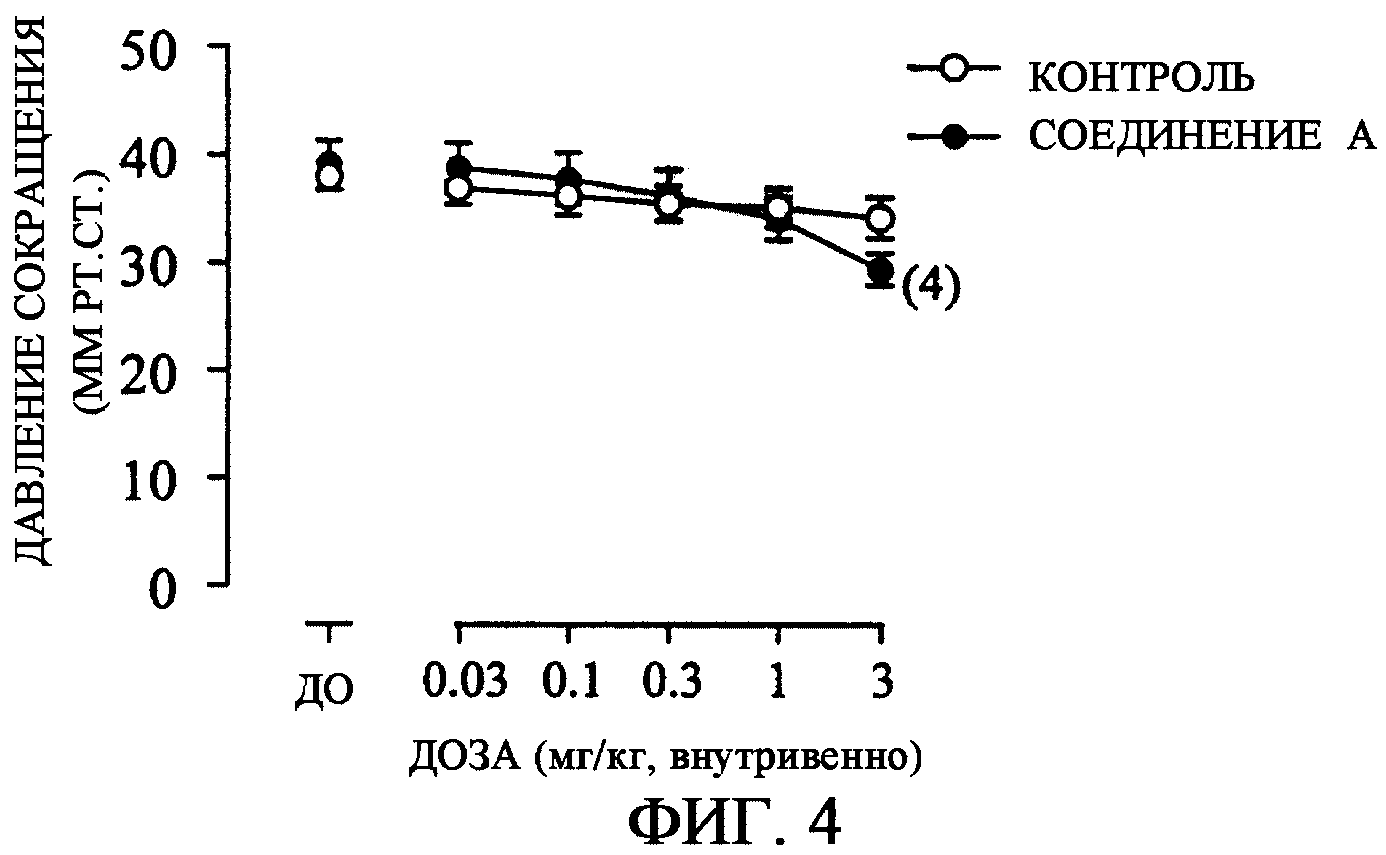
Для теста использовали самок крыс (225-290 г) линии Wistar. Под анестезией с помощью уретана правый и левый мочеточники лигировали и отрезали и после этого вставляли полиэтиленовую канюлю в наружное отверстие мочеиспускательного канала и фиксировали. Один конец фиксированной канюли соединяли с датчиком давления через трехходовой краник и измеряли давление в мочевом пузыре. Другой конец канюли соединяли со шприц-насосом и физиологический раствор вливали с постоянной скоростью в мочевой пузырь до тех пор, пока не индуцировали ритмичное сокращение мочевого пузыря. Непрерывное вливание физиологического раствора прекращали после того, как отмечали ритмичное сокращение мочевого пузыря. После стабилизации ритмичного сокращения мочевого пузыря вводили лекарственное средство или носитель через катетер для введения лекарственного средства, вставленный в бедренную вену.
2. Лекарственное средство
Соединение А вводили внутривенно в увеличиваемых дозах, где соотношение составляло 3 (0,03, 0,1, 0,3, 1 и 3 мг/кг). Группу, которой вводили носитель, использовали в качестве контрольной группы.
3. Оцениваемые пункты и статистический анализ
Параметрами для оценки были число раз и давление сокращения мочевого пузыря, сокращение в течение 10 минут спустя 5-15 минут после введения лекарственного средства, и каждая группа состояла из n = 5. Результат представляли в виде среднего значения ± стандартная погрешность, и для сравнения между двумя группами служил t - критерий Стьюдента.
Результаты
За счет внутривенного введения соединения А частота ритмичного сокращения мочевого пузыря уменьшалась зависимым от дозы образом (фиг. 3). Воздействие в отношении уменьшения частоты сокращения за счет внутривенной инъекции 3 мг/кг соединения А было значительным по сравнению с контрольной группой. С другой стороны, соединение А не ухудшало давления сокращения вплоть до внутривенного введения 3 мг/кг (фиг. 4). Факт отсутствия влияния на давление сокращения представляет собой предпочтительное свойство с той точки зрения, что задержка мочи не индуцируется или что остаточная моча не выходит после мочеиспускания.
Полагают, что подавляющее воздействие на частоту сокращения с помощью соединения А обусловлено увеличением объема мочевого пузыря за счет стимуляции соединением А β3-рецептора, находящегося в мочевом пузыре. Полагают, что увеличение функционального объема мочевого пузыря, показывающее объем мочи, которым может быть наполнен мочевой пузырь, является клинически пригодным для лечения пациентов, страдающих от гиперактивного мочевого пузыря, и, следовательно, полагают, что соединение А является клинически эффективным в качестве лекарственного средства против гиперактивного мочевого пузыря.
Пример 3
(Тест на определение функции мочеиспускания в случае служащей в качестве модели крысы, страдающей от гиперактивного мочевого пузыря, индуцированного циклофосфамидом)
Служащих моделью крыс с гиперактивным мочевым пузырем, индуцированным циклофосфамидом, получали согласно British Journal of Pharmacology, 2000, том 130, с. 331, и проводили следующий тест.
Методика осуществления теста
1. Методика определения
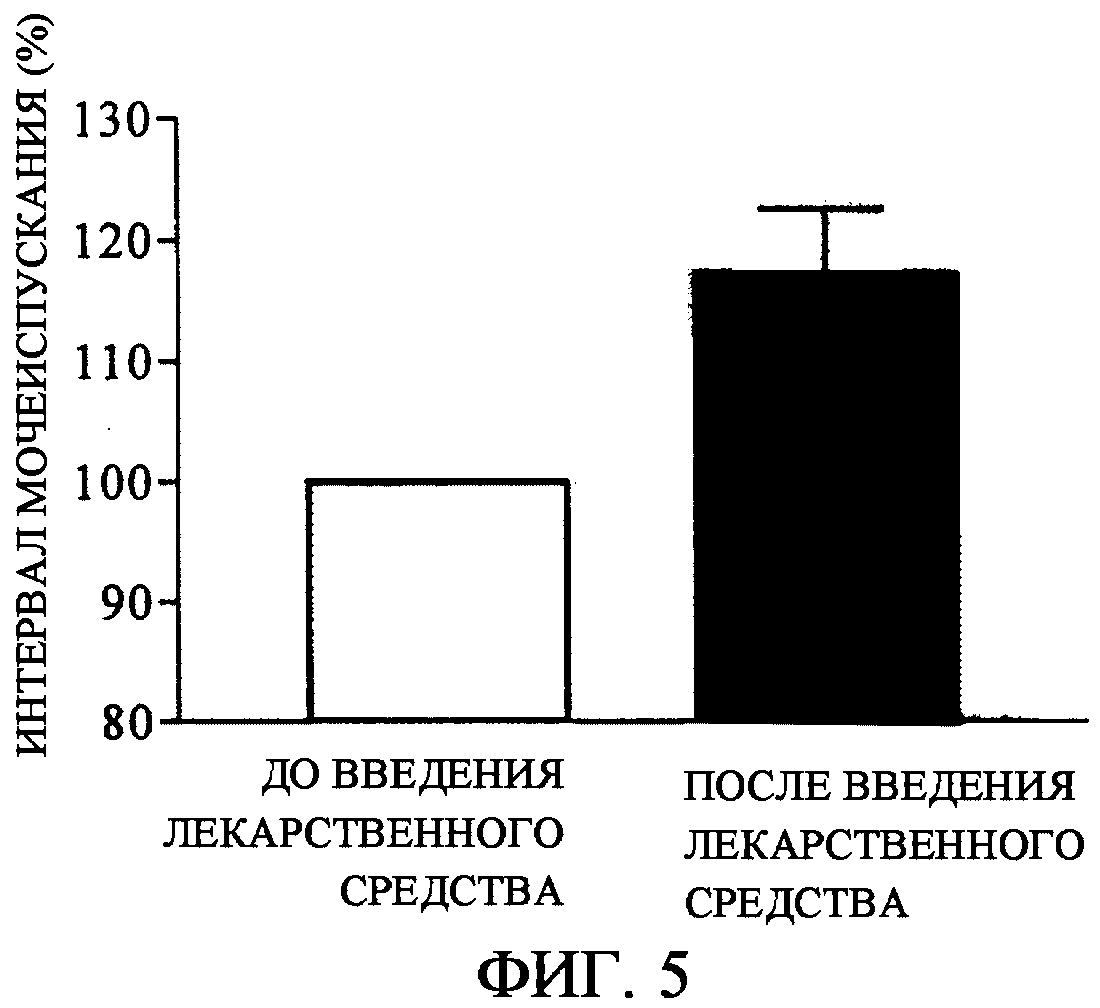
Для теста использовали самок крыс (220-230 г) линии Wistar. Под анестезией с помощью натрийпентобарбитала катетер для вливания физиологического раствора и для измерения давления в мочевом пузыре вставляли в мочевой пузырь, в верхнюю часть мочевого пузыря и фиксировали, тогда как катетер для введения лекарственного средства вставляли в каротидную вену и фиксировали. Циклофосфамид (CYP) вводили в брюшную полость и после приведения в норму крыс возвращали в клетки для кормления. На следующий день после операции один конец катетера, вставленного в мочевой пузырь крысы, соединяли с шприц-насосом через трехходовой краник и непрерывно вливали физиологический раствор, индуцируя рефлекс мочеиспускания. Другой конец соединяли с датчиком давления и измеряли давление в мочевом пузыре. После стабилизации рефлекса мочеиспускания вводили 1 мг/кг соединения А через катетер для введения лекарственного средства, который вставлен в каротидную вену.
2. Оцениваемые пункты и статистический анализ
Параметром для оценки являлся средний интервал мочеиспускания от введения лекарственного средства вплоть до 30 минут после этого. Результат представлен в виде среднего интервала мочеиспускания после введения лекарственного средства по отношению к среднему интервалу мочеиспускания до введения лекарственного средства, где средний интервал мочеиспускания в течение 30 минут до введения лекарственного средства принимали за 100% и выражали в виде среднего значения для n=3.
Результаты
Как результат внутривенного введения соединения А (1 м/кг), интервал мочеиспускания в случае служащих моделью крыс с гиперактивным мочевым пузырем, индуцированным циклофосфамидом, удлинен на 17,3% (фиг. 5). Отсюда полагают, что соединение А, которое пролонгирует интервал мочеиспускания в случае служащих в качестве модели крыс, является клинически эффективным как лекарственное средство против гиперактивного мочевого пузыря.
Таким образом, активный ингредиент согласно настоящему изобретению, проявляет сильное релаксирующее воздействие на мочевой пузырь в "тесте на гладкомышечную релаксацию изолированного мочевого пузыря крысы", уменьшает частоту ритмичного сокращения мочевого пузыря зависимым от дозы образом в "тесте на определение ритмичного сокращения мочевого пузыря крысы" и пролонгирует интервал мочеиспускания в "тесте на определение функции мочеиспускания на модели гиперактивного мочевого пузыря, индуцированного циклофосфамидом у крыс", вследствие чего он клинически пригоден в качестве лекарственного средства против гиперактивного мочевого пузыря. В дополнение к гиперактивному мочевому пузырю как результату доброкачественной гиперплазии предстательной железы он также может быть использован в качестве лекарственного средства против гиперактивного мочевого пузыря, сопровождающегося позывом на мочеиспускание, недержанием мочи и поллакиурией.
Пример 4
(Пример приготовления лекарственного средства)
Пример приготовления лекарственного средства в качестве перорального агента
Таблетка массой 100 мг
200,0 г Активного ингредиента согласно настоящему изобретению и 399,0 лактозы смешивают в полиэтиленовом пакете. Смесь перемешивают и дезинтегрируют в обычной мельнице (выпускается фирмой Hosokawa Vicron). Дезинтегрированную смесь в количестве 450,0 г и 60,1 г кукурузного крахмала гомогенно смешивают в аппарате для нанесения покрытия при гранулировании в псевдоожиженном слое (выпускается фирмой Ogawara Seisakusho). После этого 192 г 10%-ного раствора гидроксипропилцеллюлозы наносят путем распыления на гранулят. После высушивания вышеполученный гранулят пропускают через сито 20 меш, к нему добавляют 2,3 г стеарата магния и из смеси получают таблетки, причем каждая включает 350 мг, с помощью ротационной таблетировочной машины (выпускается фирмой Hata Tekkosho), используя ступку 9,0 мм х 10,8 R. Таблетки опрыскивают с помощью 150 г раствора для нанесения покрытия, содержащего 8,7 г гидроксипропилметилцеллюлозы, 1,2 г полиэтиленгликоля 6000, 4,8 г диоксида титана и 0,3 г талька, в аппарате для нанесения покрытия (выпускается фирмой Freund Sangyo), получая покрытые пленкой таблетки, причем каждая имеет покрытие массой 15 мг.
Промышленная применимость
Как указано выше в данном контексте, анилид (R)-2-(2-аминотиазол-4-ил)-4'-[2-[(2-гидрокси-2-фенилэтил)амино]этил]-уксусной кислоты или его соль, который является активным ингредиентом согласно настоящему изобретению, проявляет значительно более сильное релаксирующее воздействие по сравнению с контрольным соединением в "тесте на гладкомышечную релаксацию изолированного мочевого пузыря крысы". Далее, он уменьшает частоту ритмичного сокращения мочевого пузыря зависимым от дозы образом в "тесте на определение ритмичного сокращения мочевого пузыря крысы". Кроме того, он пролонгирует интервал мочеиспускания у служащей моделью крысы с гиперактивным мочевым пузырем, индуцированным циклофосфамидом, в "тесте на определение функции мочеиспускания в случае служащей в качестве модели крысы с гиперактивным мочевым пузырем, индуцированным циклофосфамидом".
Следовательно, анилид (R)-2-(2-аминотиазол-4-ил)-4'-[2-[(2-гидрокси-2-фенилэтил)амино]этил]уксусной кислоты или его соль, который является активным ингредиентом, согласно настоящему изобретению может быть использован в качестве лекарственного средства для лечения гиперактивного мочевого пузыря. В дополнение к гиперактивному мочевому пузырю как результату доброкачественной гиперплазии предстательной железы он также может быть использован в качестве лекарственного средства для лечения гиперактивного мочевого пузыря, сопровождающегося позывом на мочеиспускание, недержанием мочи и поллакиурией.
Краткое описание рисунков
Фиг. 1: Воздействия соединения А и контрольного соединения в тесте на гладкомышечную релаксацию изолированного мочевого пузыря крысы (тест на антагонизм к сокращению с помощью карбахола).
Фиг. 2: Воздействия соединения А и контрольного соединения в тесте на гладкомышечную релаксацию изолированного мочевого пузыря крысы (тест на антагонизм к сокращению с помощью хлорида калия).
Фиг. 3: Воздействие соединения А на ритмичное сокращение мочевого пузыря крысы (воздействие на частоту сокращения (*:р< 0,05)).
Фиг. 4: Воздействие соединения А на ритмичное сокращение мочевого пузыря крысы (воздействие на давление сокращения).
Фиг. 5: Воздействие соединения А на функцию мочеиспускания служащей на модели гиперактивного мочевого пузыря, индуцированного циклофосфамидом у крысы (интервал мочеиспускания после введения лекарственного средства, причем интервал мочеиспускания до введения лекарственного средства принимают за 100%).
Реферат
Изобретение относится к лекарственным средствам и касается лекарственного средства для лечения гиперактивного мочевого пузыря, включающего анилид (R)-2-(2-аминотиазол-4-ил)-4'-[2-[(2-гидрокси-2-фенилэтил)амино]этил]уксусной кислоты или его соль в качестве активного ингредиента. Изобретение позволяет расширить арсенал средств для лечения гиперактивного мочевого пузыря. 2 н. и 8 з.п. ф-лы, 5 ил., 5 табл.

Комментарии