Фенильные производные и их применение в качестве иммуномодуляторов - RU2442780C2
Код документа: RU2442780C2
Описание
Область изобретения
Настоящее изобретение относится к агонистам S1P1/EDG1 рецептора (липидактивируемый, сопряженный с G-белком, специфичный в отношении сфингозин-1-фосфата рецептор) формулы (I) и их применению в качестве активных ингредиентов при получении фармацевтических композиций. Изобретение также касается родственных аспектов, включающих способы получения соединений, фармацевтических композиций, содержащих соединение формулы (I), и их применение в качестве соединений, улучшающих сосудистую функцию, и в качестве иммуномоделирующих агентов, либо самостоятельно, либо в комбинации с другими активными соединениями или методами лечения.
Предпосылки создания изобретения
Человеческая иммунная система призвана защищать организм от посторонних микроорганизмов и субстанций, вызывающих инфекцию или болезнь. Комплексные регуляторные механизмы обеспечивают направленность иммунного ответа против внедрившейся субстанции или организма, но не направленного против хозяина. В некоторых случаях в таких контрольных механизмах нарушается регуляция, что может приводить к возникновению аутоиммунных ответов. Следствием неконтролируемого ответа на воспаление является серьезная опасность для органа, клетки, ткани или сустава. При современных методах лечения иммунная система в таких случаях в целом обычно подавляется, и способность организма реагировать на инфекцию также подвергается при этом серьезному риску. Типичные лекарства, применяемые в этом случае, включают азатиоприн, хлорамбуцил, циклофосфамид, циклоспорин или метотрексат. Кортикостероиды, которые ослабляют воспаление и подавляют иммунный ответ, могут вызывать побочные эффекты при длительном лечении. Нестероидные противовоспалительные препараты (НПВП) могут уменьшать боль и воспаление, однако, они также проявляют нежелательные побочные эффекты. Альтернативные методы лечения включают применение агентов, активирующих или блокирующих цитокиновую передачу сигнала.
Орально активные соединения с иммуномоделирующими свойствами без опасных иммунных ответов и с пониженными побочными эффектами значительно улучшают современные методы лечения воспалительных болезней.
В области трансплантации органов иммунный ответ хозяина должен быть супрессирован для предотвращения отторжения органа. Трансплантируемый орган реципиента может подвергаться риску частичного отторжения даже при использовании иммунодепрессивных лекарств. Отторжение чаще всего происходит в первые несколько недель после трансплантации, но случаи отторжения могут наступить также и после нескольких месяцев или даже лет после трансплантации. Комбинации вплоть до трех или четырех лекарственных препаратов, используемых вместе, максимально защищают от отторжения и при этом минимизируют побочные эффекты. Современные стандартные лекарства, используемые для лечения отторжения трансплантируемых органов, входят во взаимодействие с дискретным метаболизмом при активации Т-типа или В-типа лимфоцитов. Примерами таких лекарств служат циклоспорин, даклицумаб, вазиликсимаб, эверолимус или FK506, которые взаимодействуют с процессами цитокиновой секреции или передачи сигнала; азатиоприн или лефлуномид, которые ингибирует синтез нуклеотидов; или 15-деоксиспергуалин, являющийся ингибитором дифференцировки лейкоцитов.
Наилучшие результаты, полученные при иммуносупрессивной терапии крови, относятся к действию, оказываемому этими лекарственными препаратами; однако, генерализованная иммуносупрессия, которая достигается с помощью этих лекарств, ослабляет иммунную защиту организма против инфекции и злокачественных новообразований. Кроме того, стандартные иммуносупрессивные лекарства часто используются в больших дозах и могут быть причиной или ускорять повреждение органа.
Описание изобретения
Настоящее изобретение предлагает новые соединения формулы (I), которые являются агонистами для G белок-сопряженного рецептора S1P1/EDG1 и обладают сильнодействующим и продолжительным иммуномоделирующим эффектом, который достигается посредством сокращения числа циркулирующих и инфильтрацирующих Т- и В-лимфоцитов, без оказания при этом повреждающего воздействия на их созревание, память или экспансию. Сокращение циркуляции Т- и В-лимфоцитов в результате S1P1/EDG1 агонизма возможно в комбинации с наблюдаемым улучшением функции эндотелиального клеточного слоя, ассоциируемого с S1P1/EDG1 активацией, делает возможным применение таких соединений для лечения неконтролируемой воспалительной болезни и улучшения сосудистой функции.
Соединения по настоящему изобретению могут применяться самостоятельно или в комбинации со стандартными лекарствами, ингибирующими Т-клеточную активацию, предоставляя новую иммуномоделирующую терапию с пониженной предрасположенностью к инфекциям по сравнению со стандартной иммуносупрессивной терапией. Кроме того, соединения по настоящему изобретению могут применяться в комбинации с пониженными дозами лекарств, традиционно используемых в иммуносупрессивной терапии для достижения иммуномоделирующей активности, что является очень важным, учитывая, с другой стороны, что снижение повреждения пересаженного органа ассоциируется с применением более высоких доз иммуносупрессивных лекарств. Результаты наблюдения по улучшению функции эндотелиального клеточного слоя, ассоциируемого с S1P1/EDG1 активацией, дополнительно свидетельствуют в пользу рассматриваемых соединений в связи с вызываемым ими улучшением сосудистой функции.
Нуклеотидная и аминокислотная последовательности для человеческого S1P1/EDG1 рецептора известны из области техники и публикаций, например, в: Нlа, Т., and Maciag, Т.J., Biol. Chem., 265 (1990), 9308-9313; WO 91/15583 (опубликован 17 октября 1991 г.); WO 99/46277 (опубликован 16 сентября 1999 г.). Потенциальная возможность и эффективность соединений формулы (I) исследовались с помощью GTPγS анализа для определения ЕС50 величин и посредством измерения циркулирующих лимфоцитов у крыс после орального введения, соответственно (см. примеры).
Общие термины, используемые выше и далее, имеют в этом описании следующие значения, если не указано иначе.
При использовании множественной формы соединений, солей, фармацевтических композиций, болезней и им подобных терминов имеется в виду также единичная форма соединения, соли или им подобных.
Любая ссылка, используемая выше и далее, на соединение формулы (I) подразумевает также ссылку на соли, в частности, фармацевтически приемлемые соли соединения формулы (I), как уместную и целесообразную.
Термин «С1-5алкил», самостоятельно или в комбинации с другими группами, подразумевает насыщенные, разветвленные или линейные группы с числом атомов углерода от одного до пяти. Предпочтительные примеры C1-5алкильных групп представляют собой метил, этил, н-пропил, изопропил, н-бутил, изобутил, н-пентил и изопентил.
Аналогично, термин «С1-4алкил», самостоятельно или в комбинации с другими группами, подразумевает насыщенные, разветвленные или линейные группы с числом атомов углерода от одного до четырех. Предпочтительные примеры С1-4алкильных групп представляют собой метил, этил, н-пропил, изопропил, н-бутил и изобутил.
Аналогично, термин «C1-3алкил», самостоятельно или в комбинации с другими группами, подразумевает насыщенные, разветвленные или, предпочтительно линейные, группы с числом атомов углерода от одного до трех, и представляет собой метил, этил, н-пропил или изопропил.
Аналогично, термин «С2-5алкил», самостоятельно или в комбинации с другими группами, подразумевает насыщенные, разветвленные или линейные группы с числом атомов углерода от двух до пяти. Предпочтительные примеры С2-5алкильных групп представляют собой этил, н-пропил, изопропил, н-бутил, изобутил, н-пентил и изопентил.
Аналогично, термин «С2-4алкил», самостоятельно или в комбинации с другими группами, подразумевает насыщенные, разветвленные или линейные группы с числом атомов углерода от двух до четырех. Предпочтительные примеры С2-4алкильных групп представляют собой этил, н-пропил, изопропил, н-бутил и изобутил.
Термин «С1-4алкоксигруппа», самостоятельно или в комбинации с другими группами, подразумевает R-O-группу, где R обозначает С1-4алкил. Предпочтительные примеры С1-4алкоксигрупп представляют собой этоксигруппу, пропоксигруппу, изопропоксигруппу и изобутоксигруппу.
Термин «С1-3алкоксигруппа», самостоятельно или в комбинации с другими группами, подразумевает R-O-группу, где R обозначает С1-3алкил.
Термин «С2-5алкоксигруппа», самостоятельно или в комбинации с другими группами, подразумевает R-O-группу, где R обозначает С2-5алкил. Примеры С2-5алкоксигрупп представляют собой этоксигруппу, пропоксигруппу, изопропоксигруппу, изобутоксигруппу и изопентоксигруппу.
Термин «галоген» подразумевает фтор, хлор, бром или йод, предпочтительно фтор или хлор.
Соли представляют собой предпочтительно фармацевтически приемлемые соли соединений формулы (I).
Термин "фармацевтически приемлемые соли" относится к нетоксичным, неорганическим или органическим кислотно- и/или основно-аддитивным солям, см., например: "Salt selection for basic drugs", Int. J. Pharm., (1986), 33, 201-217.
Соединения формулы (I) могут содержать один или более стерео- или асимметрических центров, таких как один или более асимметрических атомов углерода. Соединения формулы (I) могут таким образом присутствовать в виде смеси стереоизомеров или, предпочтительно, в виде чистых стереоизомеров. Смеси стереоизомеров могут быть разделены с использованием методов, известных специалистам в области техники.
i) Изобретение относится к пиридин-3-ил производным формулы (I),

где символ # указавает на два атома углерода фенильного кольца, несущего R1, R2 и R3, к любому из которых может быть присоединена группа А; и где
А представляет собой








или
где звездочки указывают на связь, через которую осуществляется соединение с фенильным кольцом формулы (I), несущим R1, R2 и R3;
R1 представляет собой водород, C1-3алкил, фтор, хлор, метоксигруппу или цианогруппу;
R2 представляет собой С2-5алкил или С1-4алкоксигруппу;
R3 представляет собой водород, и в случае, когда группа А присоединена в п-положение относительно R2 фенильного кольца формулы (I), несущего R1, R2 и R3, R3 дополнительно может представлять собой метильную группу;
R4 представляет собой водород, С1-3алкил, С1-3алкоксигруппу или галоген;
R5 представляет собой водород, С1-3алкил, C1-3алкоксигруппу или галоген;
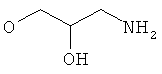
R6 представляет собой гидроксиС1-5алкил, 2,3-дигидроксипропил, ди-(гидpoкcи-C1-4aлкил)C1-4aлкил, -CH2-(CH2)k-NR61R62, -(CH2)nCH(OH)-CH2-NR61R62, -CH2-(CH2)n-NHSO2R63, -(CH2)nCH(OH)-CH2-NHSO2R63, -CH2-(CH2)n-NHCOR64, -(CH2)nCH(OH)-CH2-NHCOR64, гидроксигруппу, гидроксиС2-3алкоксигруппу, ди-(гидроксиС1-4алкил)-С1-4алкоксигруппу, 2,3-дигидроксипропоксигруппу, 2-гидрокси-3-метоксипропоксигруппу, -OCH2-(CH2)m-NR61R62, -OCH2-CH(OH)-CH2-NR61R62, -OCH2-(CH2)m-NHSO2R63, -OCH2-CH(OH)-CH2-NHSO2R63, -ОCH2-(CH2)m-NHCOR64 или -OCH2-CH(OH)-CH2-NHCOR64;
R61 представляет собой водород, С1-3алкил, 2-гидроксиэтил, 2-гидрокси-1-гидроксиметилэтил, 2,3-дигидроксипропил, карбоксиметил, 1-(С1-5алкилкарбокси)метил, 2-карбоксиэтил или 2-(С1-5алкилкарбокси)этил;
R62 представляет собой водород, метил или этил;
R63 представляет собой С1-3алкил, метиламиногруппу, этиламиногруппу или диметиламиногруппу;
R64 представляет собой гидроксиметил, 2-гидроксиэтил, 2-гидрокси-1-гидроксиметилэтил или 2,3-дигидроксипропил;
k представляет собой целое число 1, 2 или 3;
m представляет собой целое число 1 или 2;
n представляет собой 0, 1 или 2; и
R7 представляет собой водород, С1-6алкил, или галоген;
и их солям.
ii) Особый вариант осуществления изобретения относится к фенильным производным согласно варианту i), где А представляет собой





или
где звездочки указывают на связь, через которую осуществляется соединение с фенильным кольцом формулы (I), несущим R1, R2 и R3;
и их солям.
iii) Другой особый вариант осуществления изобретения относится к фенильным производным согласно варианту i), где А представляет собой



где звездочки указывают на связь, через которую осуществляется соединение с фенильным кольцом формулы (I), несущим R1, R2 и R3;
и их солям.
iv) Другой особый вариант осуществления изобретения относится к фенильным производным согласно варианту i), где А представляет собой


где звездочки указывают на связь, через которую осуществляется соединение с фенильным кольцом формулы (I), несущим R1, R2 и R3;
и их солям.
v) Другой особый вариант осуществления изобретения относится к фенильным производным согласно варианту i), где А представляет собой

и их солям.
vi) Предпочтительный вариант осуществления изобретения относится к фенильным производным согласно одному из вариантов i)-v), где R1 представляет собой метильную группу, и их солям.
vii) Другой предпочтительный вариант осуществления изобретения относится к фенильным производным согласно одному из вариантов i)-vi), где R2 представляет собой н-пропил, н-бутил, изобутил, изоамил, пропоксигруппу или изопропоксигруппу, и их солям.
viii) Другой предпочтительный вариант осуществления изобретения относится к фенильным производным согласно одному из вариантов i)-vi), где R2 представляет собой изобутил или изопропоксигруппу, и их солям.
ix) Предпочтительный вариант осуществления изобретения относится к фенильным производным согласно одному из вариантов i)-viii), где R3 представляет собой водород, и их солям.
х) Другой предпочтительный вариант осуществления изобретения относится к фенильным производным согласно одному из вариантов i)-ix), где R4 представляет собой водород, R5 представляет собой метил, этил или метоксигруппу, и R7 представляет собой метил, этил или галоген, и их солям.
xi) Другой предпочтительный вариант осуществления изобретения относится к фенильным производным согласно одному из вариантов i)-ix), где R4 представляет собой водород, и R5 и R7 представляют собой метильную группу, и их солям.
xii) Особый предпочтительный вариант осуществления изобретения относится к фенильным производным согласно одному из вариантов i)-ix), где R4 представляет собой водород, R5 представляет собой метильную группу, и R7 представляет собой этильную группу, и их солям.
xiii) Другой предпочтительный вариант осуществления изобретения относится к фенильным производным согласно одному из вариантов i)-ix), где R4 представляет собой водород, R5 представляет собой метоксигруппу, и R7 представляет собой атом хлора, и их солям.
xiv) Другой предпочтительный вариант осуществления изобретения относится к фенильным производным согласно одному из вариантов i)-xiii), где R6 представляет собой гидроксиС1-5алкил, 2,3-дигидроксипропил, -CH2-(CH2)k-NR61R62, -(CH2)nCH(OH)-CH2-NR61R62, -CH2-(CH2)n-NHCOR64, -(CH2)nCH(OH)-CH2-NHCOR64, гидроксигруппу, гидроксиС2-5алкоксигруппу, ди-(гидроксиС1-4алкил)-С1-4алкоксигруппу, 2,3-дигидроксипропоксигруппу, 2-гидрокси-3-мeтoкcипpoпoкcигpyппу, -OCH2-(CH2)m-NR61R62, -OCH2-CH(OH)-CH2-NR61R62, -OCH2-(CH2)m-NHSO2R63, -OCH2-CH(OH)-CH2-NHSO2R63, -OCH2-(CH2)m-NHCOR64 или -OCH2-CH(OH)-CH2-NHCOR64, и их солям.
xv) Другой предпочтительный вариант осуществления изобретения относится к фенилпроизводным согласно одному из вариантов i)-xiii), где R6 представляет собой гидроксигруппу, гидроксиС2-5алкоксигруппу, ди-(гидроксиС1-4алкил)-С1-4алкоксигруппу, 2,3-дигидроксипропоксигруппу, 2-гидрокси-3-метоксипропоксигруппу, -OCH2-(CH2)m-NHCOR64 или -OCH2-CH(OH)-CH2-NHCOR64, и их солям.
xvi) Другой предпочтительный вариант осуществления изобретения относится к фенильным производным согласно одному из вариантов i)-xiii), где R6 представляет собой 3-гидрокси-2-гидроксиметилпропоксигруппу, 2,3-дигидроксипропоксигруппу или -OCH2-CH(OH)-CH2-NHCOR, и их солям.
xvii) Другой предпочтительный вариант осуществления изобретения относится к фенильным производным согласно одному из вариантов i)-xiii), где R6 представляет собой -OCH2-CH(OH)-CH2-NHCOR64 и R64 представляет собой гидроксиметил, и их солям.
xviii) Другой предпочтительный вариант осуществления изобретения относится к фенильным производным согласно одному из вариантов i)-xvii), где группу А присоединена в п-положение относительно R2 фенильного кольца формулы (I), несущему R1, R2 и R3, и их солям.
xix) Особо предпочтительный вариант осуществления изобретения относится к фенильным производным согласно варианту i), где А представляет собой



где звездочки указывают на связь, через которую осуществляется соединение с фенильным кольцом формулы (I), несущим R1, R2 и R3; R1 представляет собой метил; R2 представляет собой изобутил или изопропоксигруппу; R3 представляет собой водород; R4 представляет собой водород или метоксигруппу; R5 представляет собой водород, метил, этил или метоксигруппу; R6 представляет собой 3-гидрокси-2-гидроксиметилпропоксигруппу, 2,3-дигидроксипропоксигруппу или -ОCH2-CH(OH)-CH2-NHCOR64; и R7 представляет собой водород, метил, этил или хлор; и их солям.
хх) Другой очень предпочтительный вариант осуществления изобретения относится к фенильным производным согласно варианту i), где А представляет собой


где звездочки указывают на связь, через которую осуществляется соединение с фенильным кольцом формулы (I), несущим R1, R2 и R3;
R1 представляет собой водород или С1-3алкил;
R2 представляет собой С2-5алкил или С1-4алкоксигруппу;
R3 представляет собой водород, и в случае, когда группа А присоединена в п-положение относительно R2 фенильного кольца формулы (I), несущего R1, R2 и R3, R3 дополнительно может представлять собой метильную группу;
R4 представляет собой водород;
R5 представляет собой С1-3алкил;
R6 представляет собой гидроксигруппу, 2,3-дигидроксипропоксигруппу, -OCH2-CH(OH)-CH2-NR61R62, или -OCH2-CH(OH)-CH2-NHCOR64;
R61 и R62 оба представляют собой водород; и
R7 представляет собой С1-3алкил;
и их солям.
xxi) Особенно предпочтительными фенильными соединениями согласно формуле (I) являются:
2-гидрокси-N-((2R)-2-гидрокси-3-{4-[5-(4-изопропокси-3-метилфенил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропил)ацетамид,
2-гидрокси-N-((2S)-2-гидрокси-3-{4-[5-(4-изопропокси-3-метилфенил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропил)ацетамид,
N-((2R)-3-{2-этил-4-[5-(4-изопропокси-3-метилфенил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид,
N-((2S)-3-{2-этил-4-[5-(4-изопропокси-3-метилфенил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид,
2-гидрокси-N-((2R)-2-гидрокси-3-{4-[5-(3-изопропокси-4-метилфенил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропил)ацетамид,
2-гидрокси-N-((2S)-2-гидрокси-3-{4-[5-(3-изопропокси-4-метилфенил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропил)ацетамид, 2-гидрокси-N-((2R)-2-гидрокси-3-{4-[5-(4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропил)ацетамид,
2-гидрокси-N-((2S)-2-гидрокси-3-{4-[5-(4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропил)ацетамид,
2-гидрокси-N-((2R)-2-гидрокси-3-{4-[5-(4-изобутил-3-метилфенил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропил)ацетамид,
2-гидрокси-N-((2S)-2-гидрокси-3-{4-[5-(4-изобутил-3-метилфенил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропил)ацетамид, N-((2R)-3-{2-этил-4-[5-(4-изопропокси-3-метилфенил)-[1,3,4]оксадиазол-2-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид, и
N-((2S)-3-{2-этил-4-[5-(4-изoпpoпoкcи-3-мeтилфeнил)-[l,3,4]oкcaдиaзoл-2-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид,
и соли этих соединений.
Соединения формулы (I) и их фармацевтически приемлемые соли могут быть применены в качестве лекарственных средств, например, в форме фармацевтических композиций для энтерального и парентерального введения.
Приготовление фармацевтических композиций может быть осуществлено с использованием методов, известных любому специалисту в области техники (см., например: Mark Gibson, Editor, Pharmaceutical Preformulation and Formulation, IHS Health Group, Englewood, CO, USA, 2001; Remington, The Science and Practice of Pharmacy, 20th Edition, Philadelphia College of Pharmacy and Science) посредством введения соединений формулы (I) или их фармацевтически приемлемых солей, необязательно в комбинации с другими терапевтически полезными субстанциями, в лекарственно вводимую форму вместе с соответствующим, нетоксичным, инертным, фармацевтически приемлемым твердым или жидким веществом, используемым в качестве носителя, и, если необходимо, стандартными фармацевтическими наполнителями.
Фармацевтические композиции, включающие соединение формулы (I), применяются для профилактики и/или лечения болезней и заболеваний, ассоциируемых с активированной иммунной системой.
Такие болезни или заболевания выбирают из группы, включающей: отторжение пересаженных органов, тканей или клеток; болезни «трансплантат против хозяина», возникающие при трансплантации; аутоиммунные синдромы, включая ревматоидный артрит; системную красную волчанку; антифосфолипидный синдром; тироидит Хашимото; лимфотический тироидит; рассеянный склероз; тяжелую псевдопаралитическую миастению; диабет типа I; увеит (воспаление сосудистой оболочки глаза); эписклерит; склерит; болезнь Кавасаки, увеоритинит; задний увеит; увеит, связанный с болезнью Бехчета; синдром увеоменингита; аллергический энцефаломиелит; хроническую аллотрансплантатную васкулопатию; постинфекционные аутоиммунные болезни, включая ревматическую лихорадку и постинфекционный гломерулонифрит; воспалительные и гиперпролиферативные кожные болезни; псориаз; псориатический артрит; атопический дерматит; миопатию; миозит; остеомиелит; контактный дерматит; экзематозный дерматит; себоррейный дерматит; плоский лишай; пузырчатку; буллезную пузырчатку; врожденный буллезный эпидермолиз; крапивницу; ангиодему; васкулит; эритему; кожную эозинофилию; угри; склеродерму; гнездную алопецию; кератоконьюктивит; хронический двухсторонний коньюктивит; кератит; герпический кератит; эпителиальную дистрофию роговицы; лейкому роговицы; глазную пузырчатку; язву Мурена; язвенный керотит; склерит; офтальмопатию Гравса; синдром Вогта-Коунаги-Харада; саркоидоз; сенную лихорадку; обратимую обструктивную болезнь дыхательных путей; бронхиальную астму; аллергическую астму; врожденную астму; полученную извне астму; пылевую астму; хроническую или застарелую астму; позднюю астму и гипервосприимчивость дыхательных путей; бронхиолит; бронхит; эндометриоз; орхит; язву желудка; ишемические болезни кишечника; воспалительные болезни кишечника; некротический энтероколит; повреждения кишечного тракта, связанные с термальными ожогами; болезнь брюшины; проктит; эозинофильный гастроэнтерит; мастоцитоз; болезнь Крона; язвенный колит; сосудистые повреждения, вызванные ишемической болезнью и тромбозом; атеросклероз; тучное сердце; миокардит; инфаркт миокарда; синдром воспаленной аорты; общий упадок сил, вызванный вирусной болезнью; тромбоз сосудов; мигрень; ринит; экзему; интерстициальный нефрит; IgA-индуцированную нефропатию; синдром Гудрасчера; гемолитико-уремический синдром; диабетическую нефропатию; гломерулосклероз; гломерулонефрит; табулоинтерстициальный нефрит; интерстициальный цистит; дерматомиозит; синдром Гийена-Барре; болезнь Миньера; полиневрит; мультиплетный неврит; миелит; мононеврит; радикулопатию; гипертиоридизм; Базедову болезнь; тиротоксикоз; беспримесную красноклеточную аплазию; апластическую анемию; гипопластическую анемию; идиопатическую тромбоцитопеническую пурпуру; аутоиммунную гемолитическую анемию; аутоиммунную тромбоцитопению; агранулоцитоз; злокачественную анемию; мегалобластическую анемию; анеритроплазию; остеопароз; фиброидное легкое; идиопатическую интерстициальную пневмонию; дерматит; лейкодерму vulgaris; диффузную кератому vulgaris; фотоаллергическую чувствительность; кожную Т-клеточную лимфому; нодозный полиартрит; хорею Хантингтона; хорею Сиденхама; миокардоз; миокардит; склеродерму; гранулему Вегенера; синдром Шегрена; адипоз; эозинофильный фасцит; повреждения десен, периодонта, альвеольной соединительной ткани, зубной субстанции при лечении; мужскую очаговую алопецию или старческую алопецию; мускульную дистрофию; пиодерму; синдром Сезари; гипофизит; хроническую недостаточность надпочечников; болезнь Аддисона; ишемически-реперфузионное повреждение органов, имеющее место при хранении; эндотоксический шок; псевдомембранный колит; колит, вызываемый лекарством или радиацией; острую ишемическую почечную недостаточность; хроническую почечную недостаточность; рак легкого; злокачественность лимфоидного происхождения; острую или хроническую лимфотическую лейкемию; лимфому; энфизему легких; катаракту; сидероз; воспаление сетчатой оболочки глаза; старческую пятнистую дегенерацию; рубцевание стекловидного тела; щелочной ожог роговицы; дерматитную эритему; буллезный дерматит; цементный дерматит; воспаление десен; периодонтит; сепсис; панкреатит; болезнь периферийных артерий; карциогенез; твердые раковые опухоли; метастаз карциномы; гепербаропатию; аутоиммунный гепатит; первичный цирроз печени; склеротический холангит; частичную резекцию печени; острый некроз печени; цирроз; алкогольный цирроз; печеночную недостаточность; скоротечную печеночную недостаточность; скрытую печеночную недостаточность; и "нацеленную на хроническую" печеночную недостаточность.
Предпочтительные болезни и заболевания, подлежащие лечению и/или профилактике с помощью соединений формулы (I), выбирают из группы, включающей отторжение пересаженных органов таких, как почка, печень, сердце, легкое, поджелудочная железа, роговица и кожа; болезни «трансплантат против хозяина», возникающие при трансплантации клеток спинного мозга; аутоиммунные синдромы, включающие ревматоидный артрит, рассеянный склероз, воспалительные заболевания кишечника такие, как болезнь Крона и язвенный колит, псориаз, псориатический артрит, тироидит такой, как тироидит Хашимото, увеоретинит; атопические болезни такие, как ринит, коньюктивит, дерматит; астму; диабет типа I; постинфекционные аутоиммунные болезни, включая ревматоидную лихорадку и постинфекционный гломерулонефрит; твердые виды рака и опухолевое метастазирование.
Особенно предпочтительные болезни или заболевания, подлежащие лечению и/или профилактике с помощью соединений формулы (I), выбирают из группы, включающей отторжение пересаженных органов таких, как почка, печень, сердце и легкое; болезнь «трансплантат против хозяина», возникающуя при трансплантации клеток спинного мозга; аутоиммунные синдромы, включающие ревматоидный артрит, рассеянный склероз, псориаз, псориатический артрит, болезнь Крона и тироидит Хашимото; и атопический дерматит.
Настоящее изобретение относится также к способу профилактики или лечения болезни или заболевания, перечисленных в описании выше, заключающемуся во введении субъекту фармацевтически активного количества соединения формулы (I).
Кроме того, соединения формулы (I) также применяются в комбинации с одним или несколькими иммуномоделирующими агентами, используемыми для профилактики и/или лечения болезней или заболеваний, перечисленных в описании выше. Согласно предпочтительному варианту осуществления изобретения, названные агенты выбираются из группы, включающей иммуносупрессанты, кортикостероиды, НПВП, цитотоксические лекарства, ингибиторы молекулярной адгезии, цитокины, ингибиторы цитокинов, антагонисты рецептора цитокина и рекомбинантные рецепторы цитокина.
Настоящее изобретение относится также к применению соединения формулы (I) для получения фармацевтической композиции, необязательно для применения в комбинации с одним или несколькими иммуномоделирующими агентами, используемыми для профилактики и/или лечения болезней или заболеваний, упомянутых в описании выше.
Соединения формулы (I) могут быть получены методами, приведенными ниже, методами, приведенными в примерах, или аналогичными методами. Оптимальные реакционные условия варьируются в зависимости от применяемых реагентов или растворителей, причем такие условия могут быть выбраны специалистом в области техники с помощью ряда оптимизирующих методик.
Соединения формулы (I) по настоящему изобретению могут быть получены согласно общей последовательности реакций, представленной ниже. Далее описаны только несколько из возможных синтетических путей, приводящих к соединениям формулы (I).


Соединения формулы (I), которые представляют собой производное [1,2,4]оксадиазола структуры (1), получают посредством реакции соединения структуры (2) в растворителе таком, как ксилол, толуол, бензол, пиридин, ДМФ, дихлорметан, уксусная кислота, трифторуксусная кислота, и тому подобные, при комнатной или повышенной температурах в присутствии или отсутствии вспомогательных веществ таких, как кислоты (например, ТФК, уксусная кислота, HCl, и тому подобные), основания (например, NaH, NaOAc, Na2CO3, К2СО3, триэтиламин, и тому подобные), соли тетраалкиламмония, или обезвоженные агенты (например, оксалилхлорид, ангидрид карбоновой кислоты, РОСl3, РСl5, Р4O10, молекулярные сита, гидроксид метоксикарбонилсульфамоилтриэтиламмония (Реагент Бургесса), и тому подобные) (литература: например, С.Т.Brain, J.M.Paul, Y.Loong, P.J.Oakley, Tetrahedron Lett., 40 (1999), 3275-3278; A.R.Gangloff, J.Litvak, E.J.Shelton, D.Sperandio, V.R.Wang, K.D.Rice, Tetrahedron Lett., 42 (2001), 1441-1443; Т.Suzuki, К.Iwaoka, N.Imanishi, Y.Nagakura, K.Miyta, H.Nakahara, M.Ohta, T.Mase, Chem. Pharm. Bull., 47 (1999), 120-122; R.F.Poulain, A.L.Tartar, B.P.Deprez, Tetrahedron Lett., 42 (2001), 1495-1498; R.M.Srivastava, F.J.S.Oliveira, D.S.Machado, R.M.Souto-Maior, Synthetic Commun., 29 (1999), 1437-1450; E.О.John, J.M.Shreeve, Inorganic Chemistry, 27 (1988), 3100-3104; В.Kaboudin, К.Navaee, Heterocycles, 60 (2003), 2287-2292).

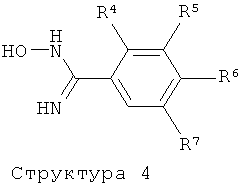
Соединения структуры (2) могут быть получены посредством реакции соединения структуры (3) с соединением структуры (4) в растворителе таком, как ДМФ, ТГФ, ДХМ, и им подобных, в присутствии или отсутствии одного или более конденсирующих агентов таких, как ТБТУ, ДЦК, ЭДК, ГБТУ, РуБОФ, КДИ, и им подобных, и в присутствии или отсутствии основания, такого, как триэтиламин, основание Хюнига, NaH, К2СО3, и тому подобных


Аналогично, циклизация промежуточного гидроксиамидинового эфира, который образуется при реакции гидроксиамидиновой структуры (5) с бензойной кислотой структуры (6), делает доступными [1,2,4]оксадиазольные производные структуры (7).

Соединения структуры (4) и (5) могут быть получены посредством реакции соединения структуры (9) и (8), соответственно, с гидроксиламином или одной из его солей в растворителе таком, как метанол, этанол, пиридин, и тому подобных, в присутствии или отсутствии основания такого, как Nа2СО3, К2СО3, трет-бутилат калия, триэтиламин, и тому подобных (литература: например, Т.Suzuki, К.Iwaoka, N.Imanishi, Y.Nagakura, К.Miyta, H.Nakahara, M.Ohta, Т.Mase, Chem. Pharm. Bull., 47 (1999), 120-122; J.Cui, D.Crich, D.Wink, M.Lam, A.L.Rheingold, D.A.Case, W.T.Fu, Y.Zhou, M.Rao, A.J.Olson, M.E.Johnson, Bioorg. Med. Chem., 11 (2003), 3379-3392; R.Miller. F.Lang, Z.J.Song, D.Zewge, WO 2004/035538 (Merck & Co., Inc., USA); B.Kaboudin, K.Navaee, Heterocycles, 60 (2003), 2287-2292).
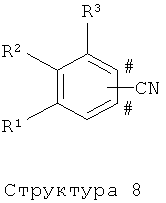

В зависимости от природы функциональных групп, присутствующих в остатках R4-R7 в структурах (1), (2), (4), (6), (7) и (9), эти функциональные группы могут нуждаться во временной защите. Подходящие защитные группы известны специалистам в области техники и включают, например: бензильную или триалкилсилильную группу для защиты спирта, кетальную группу для защиты диола, и т.д.. Эти защитные группу могут использоваться в соответствие со стандартными методами (см., например: Т.W.Greene, P.G.M.Wuts, Protective Groups in Organic Synthesis, 3rd Edition, Wiley New York, 1991; P.J.Kocienski, Protecting Groups, Thieme Stuttgart, 1994). Альтернативно, нужные остатки R4-R7, в частности R6, могут быть также введены на поздних стадиях, которые следуют за конденсацией фенильных соединений структуры (4) и (6) или с фенильными производными структуры (3) и (5), соответственно, с использованием соответствующего предшественника соединения структуры (4) и (6). Фенильные соединения структуры (4), (6) и (9) или их предшественники либо коммерчески доступны, либо могут быть получены согласно методам, известным специалистам из области техники.


Соединения формулы (I), представляющие собой [1,3,4]оксадиазольное или [1,3,4]тиадиазольное производное получают подобным образом посредством реакции соединения структуры (3) с гидразином (с использованием конденсирующего агента такого, как ТБТУ, ДЦК, ЭДК, ГБТУ, РуБОФ, HOBt, КДИ и им подобных) с образованием соединения структуры (10), которое затем конденсируют с соединением структуры (6), получая соединение структуры (11). Соединение структуры (11) может быть также получено в обратной реакционной последовательности: например, конденсацией вначале соединения структуры (6) с гидразином, а затем реакцией соответствующего промежуточного гидразида с соединеним структуры (3). Дегидратацию до нужного [1,3,4]оксадиазольного производного проводят с помощью обработки соединения структуры (11) таким реагентом, как РОСl3, ССl4 или СВr4 в комбинации с трифенилфосфином, Р2О3, реагентом Бургесса, и тому подобными, в растворителе таком, как толуол, ацетонитрил, диоксан, ТГФ, СHCl3, и тому подобные, в температурном интервале от 20 до 120°С с использованием или без использования микроволнового облучения, (литература: например, М.A.Garcia, S.Martin-Santamaria, М.Cacho, F.Moreno de la Llave, М.Julian, A.Martinez, B.De Pascual-Teresa, A.Ramos, J. Med. Chem., 48 (2005) 4068-4075; С.Т.Brain, J.М.Paul, Y.Loong, P.J.Oakley, Tetrahedron Lett., 40 (1999) 3275-3278). Подобным образом [1,3,4]тиадиазольные производные получают путем циклизации соединения структуры (11) с реагентом Лавессона, необязательно в комбинации с P2S5, в присутствии или отсутствии растворителя такого, как пиридин, толуол, ТГФ, ацетонитрил, и тому подобных, при повышенных температурах с использованием или без использования микроволнового облучения (литература: например, A.A.Kiryanov, P.Sampson, A.J.Seed, J. Органические Chem. 66 (2001) 7925-7929).


Соединения формулы (I), представляющие собой оксазольное или тиазольное производное, получают обработкой соединения структуры (12) или (13) либо с помощью POCl3, РСl5, I2 в комбинации с трифенилфосфином или триэтиламином, реагентом Бургесса, ангидридом трифторуксусной кислоты, и тому подобных, в растворителе таком, как толуол, бензол, диоксан, ТГФ, и тому подобных, в температурном интервале от 20 до 120°С, либо с реагентом Лавессона, необязательно в комбинации с P2S5, в присутствии или отсутствии растворителя такого, как пиридин, толуол, ТГФ, ацетонитрил, и тому подобных, при повышенных температурах с использованием или без использования микроволнового облучения, как отмечено выше (Lit.: например, N.Sato, Т.Shibata, M.Jitsuoka, Т.Ohno, Т.Takahashi, Т.Hirohashi, Т.Kanno, H.Iwaasa, A.Kanatani, T.Fukami, Takehiro, Bioorg. & Med. Chem. Lett., 14 (2004) 1761-1764). Соединения структуры (12) и (13) получают посредством реакции соединения структуры (14) и (15) с соединением структуры (6) и (3), соответственно.


Аминокетоны структуры (14) и (15) могут быть получены с применением следующих литературных методов (например, R.A.Glennon, M.L.Bondarev, N.Khorana, R.Young, J.A.May, M.R.Hellberg, M.A.McLaughlin, N.A.Sharif, J. Med. Chem., 47, (2004), 6034-6041).
Альтернативно, связь между любым из двух фенильных колец и центральным 5-членным гетероароматическим кольцом может быть образована с применением катализируемых палладием реакций поперечного сочетания.
Соединения структуры (3), (5) и (8) могут быть получены с использованием следующих литературных методов: например, катализируемые палладием реакции конденсации по Сузуки, Хеку или Штиллю, алкилирование по Фриделю-Крафтсу, алкилирование по Гриньяру, реакция фенольного алкилирования, присоединение электрофилов к фениллитиевым производным, и тому подобных, в одну или более стадий из коммерчески доступных исходных соединений. Методы эффективного превращения соединений структуры (3) в соединения структуры (8), или наоборот, известны специалистам в области техники.
Примеры
Следующие примеры иллюстрируют изобретение, не лимитируя его объема.
Все температуры измерены в °С. Соединения охарактеризованы с помощью1Н-ЯМР (300 МГц) или13С-ЯМР (75 МГц) (Varian Oxford; химические сдвиги приведены в м.д. относительно используемого растворителя; мультиплеты: s = одиночный, d = дублет, t = триплет; р = пентлет, hex = гексет, hept = гептет, m = мультиплет, br = расширенный, константы сопряжения приведены в Гц); с помощью ЖХ-МС (Finnigan Navigator with HP 1100 Binary Pump and DAD, колонка: 4,6×50 мм, Zorbax SB-AQ, 5 мкм, 120 Ǻ, градиент: 5-95% ацетонитрила в воде, 1 мин, с 0,04% трифторуксусной кислоты, скорость течения: 4,5 мл/мин), tR (время удерживания) приведено в мин; с помощью ТСХ (ТСХ-пластины от фирмы Merck, Silica gel 60 F254); или температурой плавления. Соединения очищают с помощью препаративной ВЭХЖ (колонка: X-terra RP18, 50×19 мм, 5 мкм, градиент: 10-95% ацетонитрила в воде, содержащей 0,5% муравьиной кислоты) или с помощью СДЖХ (жидкостная хроматография среднего давления) (Labomatic MD-80-100 насос, Linear UVIS-201 детектор, колонка: 350×18 мм, Labogel-RP-18-5s-100, градиент: от 10% метанола в воде до 100% метанола).
Аббревиатуры (используемые в данном описании):
водн. - водный, БСА - бычий сывороточный альбумин, Вu - бутил, КХ - колоночная хроматография, СДИ - карбонилдиимидазол, ДКД -дициклогексилкарбодиимид, ДХМ - дихлорметан, ДИРЭА -диизопропилэтиламин, ДМФ - диметилформамид, ДМСО - диметилсульфоксид, ЭА - этилацетат, ЭДК - N-(3-диметиламинопропил)-N'-этилкарбодиимид, ЕtOН - этанол, ч - час(ы), ГБТУ - гексафторфосфат O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония, ГОБТ - 1-гидроксибензотриазол, ВЭХЖ -высокоэффективная жидкостная хроматография, ВВ - условия высокого вакуума, ЖХ-МС - жидкостная хроматография - масс-спектрометрия, мин - минута(ы), СДЖХ- жидкостная хроматография среднего давления, NaOAc -ацетат натрия, N-MO - N-метилморфолин-N-оксид, орг. - органический, преп. - препаративный, РуБОФ - гексафторфосфат бензотриазол-1-илокси-трис-пирролидинфосфония, кт - комнатная температура, насыщ. - насыщенный, S1P - сфингозин 1-фосфат, ТБТУ - тетрафторборат 2-(1Н-бензотриазол-1-ил)-1,2,3,3-тетраметилурония, ТФК - трифторуксусная кислота, ТГФ - тетрагидрофуран, ТСХ - тонкослойная хроматография, tR - время удерживания.
4-Изопропоксибензойной кислота

4-Изопропоксибензойная кислота является коммерчески доступной.
4-Изопропокси-3-метилбензойная кислота

К раствору 4-гидрокси-3-метилбензойной кислоты (2,00 г, 13,15 ммолей) в ДМФ (50 мл) добавляют К2СО3 (8,17 г, 59,15 ммолей), а затем 2-йодпропан (6,70 г, 39,44 ммолей). Суспензию нагревают с обратным холодильником в течение 20 ч. Смесь фильтруют и растворитель фильтрата выпаривают. Остаток растворяют в этилацетате и промывают водой. Органический экстракт концентрируют и затем выделяют с помощью колоночной хроматографии на силикагеле, элюируя смесью гептан:этилацетат в соотношении 5:1 и получая изопропил-4-изопропокси-3-метилбензоат, который растворяют в метаноле (50 мл) и 2-нормальном водном растворе LiOH (10 мл). Смесь перемешивают при температуре 80°С в течение 5 ч, после чего подкисляют 1-нормальным водным раствором HCl, разбавляют водой и экстрагируют этилацетатом. Органический экстракт промывают водой и концентрируют. Кристаллический продукт высушивают в высоком вакууме, получая 4-изопропокси-3-метилбензойную кислоту (1,77 г) в виде белых кристаллов;
ЖХ-МС: tR=0,90 мин, [M+1]+=195,14.
4-Изопропокси-3,5-диметилбензойная кислота

Смесь 4-бром-2,6-диметилфенола (4,69 г, 23,3 ммолей), 2-йодпропана (15,81 г, 93,0 ммолей) в изопропаноле (200 мл) и 1-нормальном водном растворе NaOH (50 мл) перемешивают при комнатной температуре в течение 24 ч. Смесь затем разбавляют диэтиловым эфиром, промывают 1-нормальным водным раствором HCl и 1-нормальным водным раствором NaOH, высушивают над Na2SO4, фильтруют и концентрируют, получая сырой 5-бром-2-изопропокси-1,3-диметилбензол (4,62 г) в виде оранжевого масла; ЖХ-МС: tR=1,07 мин. После этого арилбромид растворяют в ТГФ (100 мл) и охлаждают до температуры -78°С. Затем медленно добавляют к нему BuLi (15 мл 1,6-нормального раствора в гексане) в течение 30 мин и смесь перемешивают при температуре -78°С в течение 30 мин. После этого смесь переносят с помощью шприца в охлажденный (0°С) раствор диметилкарбоната (10,7 г, 118,8 ммолей) в ТГФ (50 мл). Смесь перемешивают в течение 15 ч, гасят 3-нормальным водным раствором LiOH (100 мл) и перемешивают при температуре 60°С в течение 24 ч. Затем смесь разбавляют эфиром (200 мл) и 1-молярным водным раствором NaOH (100 мл), фазы разделяют и органическую фазу вновь экстрагируют NaOH (50 мл). Водные фазы промывают диэтиловым эфиром (дважды по 50 мл) и осторожно подкисляют до pH 3, используя 25%-ную HCl. Органические фазы отделяют, водную фазу экстрагируют ДХМ (пять раз по 75 мл). Органические экстракты высушивают над Na2SO4, фильтруют и выпаривают, получая 4-изопропокси-3,5-диметилбензойную кислоту (2,23 г) в виде бежевого твердого вещества;
ЖХ-МС: tR=0,91 мин, [M+1]+=209,07,1Н ЯМР (CDCl3): δ 1,34 (d, J=6,3 Гц, 6Н), 2,34 (s, 6Н), 4,32 (гептет, J=6,0 Гц, 1Н), 7,81 (s, 2H).
3-Изопропокси-4-метилбензойная кислота

3-Изопропокси-4-метилбензойную кислоту (1,70 г) получают аналогично получению 4-изопропокси-3-метилбензойной кислоты, исходя из 3-гидрокси-4-метилбензойной кислоты (2,00 г);
ЖХ-МС: tR=0,91 мин.
4-Изобутилбензойная кислота
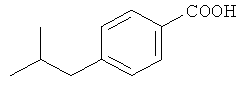
4-Изобутилбензойная кислота является коммерчески доступной.
4-Изобутил-3-метилбензойная кислота

Смесь метил-4-бром-3-метилбензоата (9,47 г, 39,3 ммолей), 2-метилпропилбороновой кислоты (2,0 г, 9,62 ммолей), К2СО3 (8,13 г, 58,9 ммолей) и Ag2O (10,9 г, 47,1 ммолей) в диоксане (150 мл) дегазируют, пропускают азот, после чего добавляют комплекс 1,1-бис(дифенилфосфино)ферроцен-палладий(II)дихлорид в дихлорметане (808 мг, 0,99 ммолей) и смесь перемешивают при температуре 75°С в течение 24 ч, после чего добавляют еще одну порцию комплекса 1,1-бис(дифенилфосфино)ферроцен-палладий(II)дихлорид в дихлорметане (808 мг, 0,99 ммолей) и перемешивание продолжают при температуре 75°С в течение 20 ч. Затем смесь фильтруют через целит и растворитель фильтрата выпаривают. Сырой продукт очищают с помощью преперативной ВЭЖХ, получая метил 4-изобутил-3-метилбензоат (1,65) в виде бесцветного масла. Это масло растворяют в метаноле (50 мл) и 2-нормальном водном растворе LiOH (10 мл) и перемешивают при комнатной температуре в течение 20 ч. Смесь затем подкисляют с помощью водного раствора HCl и дважды экстрагируют этилацетатом. Объединенные органические экстракты высушивают над MgSO4, фильтруют и выпаривают, получая 4-изобутил-3-метилбензойную кислоту (1,65 г) в виде белых кристаллов;
ЖХ-МС: tR=0,93 мин, [M+1+CH3CN]+=234,16,1H ЯМР (CDCl3): δ 0,87 (d, J=6,4 Гц, 6H), 1,75-1,91 (m, 1H), 2,29 (s, 3H), 2,47 (d, J=7,3 Гц, 2H), 7,12 (d, J=7,6 Гц, 1H), 7,79 (d, J=7,9 Гц, 1H), 7,82 (s, 1H).
3-Изобутилбензойная кислота

В высушенной в печи круглодонной колбе суспендируют стружку Mg (1,13 г, 46,6 ммолей) в ТГФ (1 мл). 1-Бром-3-метилбутан (6,37 г, 46,5 ммолей) осторожно добавляют к суспензии, нагревая ее при этом с обратным холодильником. Реакционную смесь перемешивают в течение приблизительно 30 мин до полного растворения Mg. Затем смесь переносят в охлажденный (5°С) раствор ZnBr2 (10,47 г, 46,5 ммолей) в ТГФ (80 мл). Вязкую суспензию перемешивают при температуре 0°С в течение 20 мин, после чего ее охлаждают до температуры -75°С. Затем добавляют комплекс 1,1-бис(дифенилфосфино)ферроцен/палладий(II)дихлорид в дихлорметане (184 мг, 0,225 ммолей), а потом метил-3-бромбензоат (5,0 г, 23,3 ммолей). Смесь нагревают до КТ и перемешивают в течение 24 ч. Реакционную смесь затем разбавляют водой и экстрагируют этилацетатом. Органический экстракт высушивают над MgSO4, фильтруют и выпаривают. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле, элюируя смесью гептан:этилацетат в соотношении 20:1 и получая метил 3-изобутилбензоат (4,34 г) в виде бесцветного масла. Этот продукт растворяют в метаноле (50 мл) и 2 - нормальном водном растворе LiOH (10 мл) и перемешивают при КТ в течение 16 ч. Смесь затем подкисляют, добавляя 1-нормальный водный раствор HCl, и экстрагируют этилацетатом. Органические экстракты высушивают над MgSO4, фильтруют и выпаривают, получая 3-изобутилбензойную кислоту (3,84 г) в виде бесцветного масла;
ЖХ-МС: tR=0,91 мин;1Н ЯМР (СDСl3): δ 0,87 (d, J=6,7 Гц, 6H), 1,77-1,94 (m, 1H), 2,48 (d, J=7,0 Гц, 2H), 7,29-7,35 (m, 2H), 7,86 (s, 1H), 7,88-7,94 (m, 1H).
4,N-Дигидрокси-3,5-диметилбензамидин

Названное в заголовке соединение получают из коммерчески доступного 4-гидрокси-3,5-диметилбензонитрила согласно литературным методикам (например, Е.Меуеr, А.С.Joussef, Н.Gallardo, Synthesis, 2003, 899-905);
1H ЯМР (CD3OD): δ 7,20 (s, 2H), 2,20 (s, 6H).
4-Аллилокси-N-гидрокси-3,5-диметилбензамидин

Названное в заголовке соединение получают аллилированием коммерчески доступного 4-гидрокси-3,5-диметилбензонитрила с помощию аллилбромида в присутствии NaOH в изопропаноле при комнатной температуре. Нитрил затем превращают в гидроксиамидин согласно литературным методикам (например, Е.Меуеr, А.С.Joussef, H.Gallardo, Synthesis, 2003, 899-905);
1Н ЯМР (CD3OD): δ 7,27 (s, 2H), 6,10 (m, 1H), 5,42 (m, 1H), 5,26 (m, 1H), 4,31 (dt, J=5,6, 1,5 Гц, 2H), 2,29 (s, 6H).
3-Этил-4,N-дигидрокси-5-метилбензамидин

Названное в заголовке соединение получают из коммерчески доступного 2-этил-6-метилфенола, используя следующие литературные методики: G.Trapani, A.Latrofa, M.Franco, С.Altomare, Е.Sanna, M.Usala, G.Biggio, G.Liso, J. Med. Chem., 41, (1998), 1846-1854; А.К.Chakraborti, G.Kaur, Tetrahedron, 55, (1999), 13265-13268; Е.Меуеr, А.С.Joussef, H.Gallardo, Synthesis, 2003, 899-905;
ЖХ-МС: tR=0,55 мин;1Н ЯМР (D6-ДМСО): δ 9,25 (s расширенный, 1Н), 7,21 (s, 2H), 5,56 (s, 2H), 2,55 (q, J=7,6 Гц, 2Н), 2,15 (s, 3H), 1,10 (t, J=7,6 Гц, 3H).
4-Аллилокси-3-этил-N-гидрокси-5-метилбензамидин

Названное в заголовке соединение получают аллилированием 3-этил-4-гидрокси-5-метилбензальдегида, который получают из 2-этил-6-метилфенола, следуя литературным методикам (см.: 3-этил-4,N-дигидрокси-5-метилбензамидин). Альдегид затем превращают в соответствующий гидроксиамидин согласно литературным методикам (см.: 3-этил-4,N-дигидрокси-5-метилбензамидин);
ЖХ-МС: tR=0,72 мин, [M+1]+=235,09,1Н ЯМР(СD3ОD): δ 7,31 (s, 1H), 7,29 (s, 1H), 6,10 (m, 1H), 5,43 (dd, J=17,0, 1,5 Гц, 1H), 5,27 (dd, J=10,3, 1,2 Гц, 1H), 4,81 (s расширенный, 3H), 4,31 (d, J=5,6 Гц, 2H), 2,67 (q, J=7,6 Гц, 2H), 2,30 (s, 3H), 1,23 (t, J=7,6 Гц, 4H).
3,5-Диэтил-4,N-дигидроксибензамидин

Названное в заголовке соединение получают из коммерчески доступного 2,6-диэтиланилина, следуя литературным методикам (G.G.Ecke, J.P.Napolitano, A.H.Filbey, A.J.Kolka, J. Org. Chem., 22, (1957) 639-642; и литературе, цитируемой при получении 3-этил-4,N-дигидрокси-5-метилбензамидина).
4-Аллилокси-N-гидрокси-2-метоксибензамидин
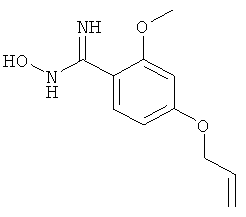
Названное в заголовке соединение получают из коммерчески доступного 4-гидрокси-2-метоксибензальдегида, следуя литературным методикам (см. ссылки, цитируемые при получении 3-этил-4,N-дигидрокси-5-метилбензамидина);
ЖХ-МС: tR=0,64 мин, [M+1]+=223,24,1Н ЯМР (D6-ДМСО): δ 9,33 (s расширенный, 1Н), 7,30 (d, J=8,2 Гц, 1Н), 6,60 (d, J=2,3 Гц, 1Н), 6,50 (dd, J=2,3, 8,2 Гц, 1Н), 6,10-5,94 (m, 1Н), 5,50 (s, 2H), 5,40 (d, J=17,0 Гц, 1Н). 5,24 (d, J=10,6 Гц, 1Н), 4,57 (d, J=4,7 Гц, 2H), 3,76 (s, 3H).
Гидразид 4-аллилокси-3,5-диметилбензойной кислоты

а) Смесь 4-бром-2,6-диметил-фенола (20,1 г, 100 ммолей) и аллилхлорида (32,7 г, 428 ммолей) в 3-нормальном водном растворе NaOH (100 мл) и изопропаноле (250 мл) перемешивают при температуре 60°С в течение 15 ч, после чего ее разбавляют 1-нормальным водным раствором NaOH (100 мл). Смесь затем экстрагируют диэтиловым эфиром (300 мл, 150 мл) и объединенные органические экстракты промывают 1 -нормальным водным раствором NaOH (дважды по 100 мл), 1-молярным водным раствором NaH2PO4 (50 мл), высушивают над Na2SO4, фильтруют и концентрируют, получая 2-аллилокси-5-бром-1,3-диметилбензол (23,6 г) в виде желтого масла;
ЖХ-МС: tR=1,08 мин. [M+1]+=241,20.
б) К раствору 2-аллилокси-5-бром-1,3-диметилбензола (23,6 г, 98,0 ммолей) в ТГФ (150 мл) добавляют при температуре -75°С раствор н-BuLi (90 мл, 1,5-молярный в диэтиловом эфире). Температуру при этом поддерживают при -75°С. Смесь перемешивают в течение 30 мин и затем через сдвоенный шприц переносят в охлажденный (0°С) раствор диметилкарбоната (21,4 г, 238 ммолей) в ТГФ (90 мл). Смесь перемешивают в течение 2 ч при 0°С, затем оставляют самопроизвольно нагреваться до комнатной температуры в течение 15 ч. Растворитель из смеси выпаривают и затем вновь выпаривают с EtOH (200 мл) для удаления большей части бутилацетата, являющегося побочным продуктом. Смесь переносят в 2-нормальный водный раствор LiOH (150 мл) и EtOH (200 мл) и перемешивают при комнатной температуре в течение 2 ч, а затем при 60°С в течение 1 ч. EtOH выпаривают и оставшуюся смесь разбавляют 0,5-нормальным водным раствором NaOH и экстрагируют диэтиловым эфиром (200 мл). Органический экстракт промывают 1-молярным водным раствором NaOH (5 раз по 50 мл) и объединенные промывные воды вновь экстрагируют эфиром (100 мл). Водную фазу подкисляют 25%-ным водным раствором HCl и экстрагируют ДХМ (5 раз по 50 мл). Объединенные органические экстракты высушивают над Na2SO4, фильтруют, выпаривают и высушивают в вакууме при температуре 60°С в течение 15 ч и получая 4-аллилокси-3,5-диметилбензойную кислоту (8,0 г) в виде желто-коричневого твердого вещества. ЖХ-МС: tR=0,90 мин.
в) К раствору 4-аллилокси-3,5-диметилбензойной кислоты (5,26 г, 25,5 ммолей) в СHCl3 (75 мл) добавляют при комнатной температуре тионилхлорид (7,5 мл, 103 ммолей). Смесь нагревают с обратным холодильником в течение 2 ч, после чего растворитель выпаривают и получают сырой хлорангидрид 4-аллилокси-3,5-диметилбензойной кислоты в виде коричневатого масла. К раствору хлорангидрида кислоты в ДХМ (50 мл) добавляют гидразин (75 мл 1-молярного раствора в ТГФ) в ДХМ (250 мл) при 0°С. Смесь перемешивают при комнатной температуре в течение 5 ч, после чего ее разбавляют диэтиловым эфиром и экстрагируют 1-нормальным водным раствором HCl (75 мл, затем 5 раз по 50 мл). Объединенные водные экстракты подщелачивают, добавляя 33%-ный водный раствор КОН, и экстрагируют ДХМ (5 раз по 50 мл). Объединенные ДХМ экстракты высушивают над Na2SO4, фильтруют и выпаривают, получая гидразид 4-аллилокси-3,5-диметилбензойной кислоты (5,39 г) в виде белого твердого вещества;
ЖХ-МС: tR=0,71 мин, [M+1]+=221,20,1Н ЯМР (D6-ДМСО): δ 2,22 (s, 6H), 4,28-4,37 (m, 2H), 4,39 (s, 2H), 5,19-5,28 (m, 1H), 5,36-5,47 (m, 1H), 6,00-6,15 (m, 1Н), 7,49 (s, 2H), 9,55 (s, 1H).
Гидразид 4-бензилокси-3-этил-5-метилбензойной кислоты

а) 3-Этил-4-гидрокси-5-метилбензальдегид получают из коммерчески доступного 2-этил-6-метилфенола, следуя литературным методикам (G.Trapani, A.Latrofa, M.Franco, С.Altomare, Е.Sanna, M.Usala, G.Biggio, G.Liso, J. Med. Chem., 41 (1998), 1846-1854; А.К.Chakraborti, G.Kaur, Tetrahedron, 55 (1999) 13265-13268; Е.Меуеr, А.С.Joussef, H.Gallardo, Synthesis, 2003, 899-905);
1Н ЯМР (СDСl3): δ 9,83 (s, 1Н), 7,58-7,53 (m, 2H), 5,30 (s расширенный, 1Н), 2,69 (q, J=7,6 Гц, 2H), 2,32 (s, 3H), 1,28 (t, J=7,6 Гц, 3H).
б) К раствору 3-этил-4-гидрокси-5-метилбензальдегида (8,00 г, 48,7 ммолей) в ацетоне (130 мл) прибавляют К2СО3 (20,2 г, 146.2 ммолей), а затем бензилбромид (12,5 г, 73,1 ммолей). Суспензию перемешивают при нагревании с обратным холодильником в течение 16 ч, после чего ее фильтруют, а растворитель из фильтрата удаляют в вакууме. Остаток выделяют с помощью колоночной хроматографии на силикагеле, получая 4-бензилокси-3-этил-5-метилбензальдегид (9,07 г) в виде бледно-желтого масла;
ЖХ-МС: tR=1,09 мин, [М+1]+=255,08.
в) К раствору 4-бензилокси-3-этил-5-метилбензальдегида (5,6 г, 22,0 ммолей) в ацетоне (150 мл) прибавляют КМnO4 (4,52 г, 28,6 ммолей). Смесь при этом слегка разогревается (45°С) и ее перемешивают в течение 90 мин при КТ. Затем смесь фильтруют и фильтрат выпаривают. Остаток обрабатывают водой и 10%-ным водным раствором лимонной кислоты и дважды экстрагируют этилацетатом. Объединенные органические экстракты высушивают над MgSO4, фильтруют, концентрируют и высушивают в высоком вакууме, получая 4-бензилокси-3-этил-5-метилбензойную кислоту (4,38 г) в виде белого твердого вещества;
ЖХ-МС: tR=1,00 мин, [М+1+СН3СН]+=312,09.
г) К раствору 4-бензилокси-3-этил-5-метилбензойной кислоты (4,38 г, 17,2 ммолей) в хлороформе (60 мл) прибавляют тионилхлорид (5 мл, 68,9 ммолей). Смесь нагревают с обратным холодильником в течение 2,5 ч, после чего растворитель выпаривают в вакууме. Оставшееся красное масло растворяют в ТГФ (150 мл) и затем по каплям прибавляют к раствору гидразингидрата (3,46 г, 69,3 ммолей) в ТГФ (80 мл). Смесь перемешивают в течение 2 ч при КТ, разбавляют диэтиловым эфиром, промывают 1 - нормальным водным раствором HCl, высушивают над MgSO4, фильтруют, концентрируют и высушивают, получая гидразид 4-бензилокси-3-этил-5-метилбензойной кислоты (1,16 г) в виде белого твердого вещества;
ЖХ-МС: tR=0,82 мин, [M+1]+=285,47,1H ЯМР (CDCl3): δ 0,98 (t, J=7,3 Гц, 3Н), 1,98 (s, 3H), 2,39 (q, J=7,3 Гц, 2H), 4,49 (s, 2H), 7,20-7,32 (m, 5H) 7,57 (s, 1H), 7,65 (s, 1H), 11,23 (s, 1H).
2,2-Диметил-[1,3]диоксан-5-илметиловый эфир метансульфоновой кислоты

Названное в заголовке соединени получают, следуя методикам, приведенным в публикациях: В.Xu, A.Stephens, G.Kirschenheuter, A.F.Greslin, X.Cheng, J.Sennelo, M.Cattaneo, M.L.Zighetti, A.Chen, S.-A.Kim, H.S.Kim, N.Bischofberger, G.Cook, K.A.Jacobson, J.Med. Chem., 45, (2002), 5694-5709.
Пример 1

а) К раствору 4,N-дигидрокси-3,5-диметилбензамидина (2,29 г, 8,88 ммолей) и 4-изопропоксибензойной кислоты (2,00 г, 11,1 ммолей) в ДМФ (50 мл) прибавляют ТБТУ (4,64 г, 14,4 ммолей) и ДИПЭА (5,02 г, 38.8 ммолей). Смесь перемешивают при комнатной температуре в течение 16 ч, после чего растворитель удаляют в вакууме. Остаток разбавляют этилацетатом, промывают водой, высушивают над MgSO4, фильтруют и концентрируют. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле, элюируя смесью гептан:этилацетат в соотношении от 4:1 до 1:1 и получая (4,N-дигидрокси-3,5-диметилбензамидин)эфир 4-изопропоксибензойной кислоты (1,36 г) в виде оранжевого твердого вещества;
ЖХ-МС: tR=0,93 мин, [M+1]+=343,19.
б) Раствор (4,N-дигидрокси-3,5-диметилбензамидин)эфира4-изопропоксибензойной кислоты (1,36 г, 3,97 ммолей) в ацетонитриле (25 мл) и толуоле (25 мл) перемешивают при температуре 90°С в течение 72 ч. Растворитель затем выпаривают и сырой продукт очищают с помощью колоночной хроматографии на силикагеле, элюируя смесью гептан:этилацетат в соотношении 17:3 и получая 4-[5-(4-изопропоксифенил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенол (380 мг) в виде коричневатого кристаллическогой твердого вещества;
ЖХ-МС: tR=1,08 мин, [M+1]+=325,13,1Н ЯМР (СDСl3): δ 8,14 (d, J=5,9 Гц, 2Н), 7,81 (s, 2Н), 7,00 (d, J=5,6 Гц, 2Н), 4,91 (s расширенный, 1Н), 4,72-4,62 (m, 1Н), 2,32 (s, 6H), 1,39 (s, 6H).
Пример 2

а) Смесь 4-[5-(4-изопропоксифенил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенола (370 мг, 1,14 ммолей) и эпихлоргидрина (317 мг, 3,42 ммолей) в изопропаноле (5 мл) и 3-нормальном водном растворе NaOH (1,5 мл) перемешивают при комнатной температуре в течение 16 ч. Реакционную смесь затем разбавляют этилацетатом, промывают водой, высушивают над MgSO4, фильтруют и концентрируют. Сырой продукт очищают с помощью препаративной ТСХ, используя смесь гептан:этилацетат в соотношении 3:1 и получая 3-(3,5-диметил-4-оксиранилметоксифенил)-5-(4-изопропоксифенил)-[1,2,4]оксадиазол (256 мг) в виде белого твердого вещества;
ЖХ-МС: tR=1,14 мин, [M+1]+=381,18.
б) Раствор 3-(3,5-диметил-4-оксиранилметоксифенил)-5-(4-изопропоксифенил)-[1,2,4]оксадиазола (250 мг, 0,657 ммолей) в 7-нормальном растворе NН3 в метаноле (10 мл) перемешивают при температуре 60°С в течение 16 ч. Растворитель выпаривают и образовавшийся осадок высушивают в высоком вакууме, получая 1-амино-3-{4-[5-(4-изопропоксифенил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропан-2-ол (278 мг) в виде бежевого масла; ЖХ-МС: tR=0,86 мин, [M+1]+=398,44.
Пример 3

Раствор 1-амино-3-{4-[5-(4-изопропоксифенил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропан-2-ола (277 мг, 0,698 ммолей), гликолевой кислоты (80 мг, 1,05 ммолей), ДИПЭА (362 мг, 2,80 ммолей) и ТБТУ (382 мг, 1,19 ммолей) в ДМФ (10 мл) перемешивают при комнатной температуре в течение 16 ч, после чего ее разбавляют этилацетатом, промывают водой и концентрируют. Сырой продукт очищают с помощью препаративной ТСХ, используя ДХМ, содержащий 10% метанола, и получая 2-гидрокси-N-(2-гидрокси-3-{4-[5-(4-изопропоксифенил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропил)ацетамид (64 мг) в виде бледно-желтого твердого вещества,
ЖХ-МС: tR=0,94 мин, [М+1]+=456,18,1Н ЯМР (D6-ДМСО): δ 1,30 (d, J=5,9 Гц, 6H), 2,31 (s, 6H), 3,16-3,25 (m, 2H), 3,63-3,79 (m, 2H), 3,81 (d, J=5,6 Гц, 2H), 3,86-3,97 (m, 1H), 4,72-4,83 (m, 1H), 5,28 (d, J=5,3 Гц, 1H), 5,54 (t, J=5,9 Гц, 1H), 7,14 (d,,7=9,1 Гц, 2H). 7,68 (t, J=5,6 Гц, 1Н), 7,73 (s, 2H), 8,08 (d, J=9,1 Гц, 2H).
Примеры 4-9

Соединения следующих примеров получают аналогично получению соединений предыдущих примеров, исходя из 4-изопропокси-3-метилбензойной кислоты и либо 4,N-дигидрокси-3,5-диметилбензамидина (примеры 4-6), либо 4,N-дигидрокси-3-этил-5-метилбензамидина (примеры 7-9):
Пример 6
1Н ЯМР (D6-ДМСО): δ 1,31 (d, J=6,2 Гц, 6H), 2,21 (s, 3H), 2,31 (s, 6H), 3,13-3,26 (m, 1H), 3,36-3,47 (m, 1H), 3,65-3,78 (m, 2H), 3,81 (d, J=5,3 Гц, 2H), 3,86-3,99 (m, 1H), 4,69-4,82 (m, 1H), 5,28 (d, J=5,0 Гц, 1H), 5,54 (t, J=5,9 Гц, 1H), 7,18 (d, J=9,4 Гц, 1H), 7,68 (t, J=5,9 Гц, 1Н), 7,73 (s, 2H), 7,94-7,99 (m, 2H).
Пример 9
1Н ЯМР (D6-ДМСО): δ 1,20 (t, J=7,3 Гц, 3H), 1,32 (d, J=6,2 Гц, 6H), 2,21 (s, 3H), 2,32 (s, 3H), 2,70 (q, J=7,6 Гц, 2H), 3,14-3,25 (m, 1H), 3,37-3,46 (m, 1H), 3,68-3,77 (m, 2H), 3,81 (d, J=5,6 Гц, 2H), 3,89-3,98 (m, 1H), 4,69-4,81 (m, 1H), 5,27 (d, J=5,3 Гц, 1H), 5,52 (t, J=5,6 Гц, 1H), 7,18 (d, J=9,4 Гц, 1H), 7,66 (t расширенный, J=5,9 Гц, 1H), 7,74 (s, 2H), 7,93-8,00 (m, 2H).
Пример 10

а) К смеси 4-изопропокси-3,5-диметилбензойной кислоты (175 мг, 794 мкмолей), 4-аллилокси-N-гидрокси-3,5-диметилбензамидина (165 мг, 792 мкмолей) и ДИПЭА (128 мг, 993 мкмолей) в ДХМ (10 мл) прибавляют ТБТУ (321 мг, 1,00 ммолей) при температуре 0°С. Смесь перемешивают при 0°С в течение 1 ч, затем при КТ в течение 5 ч, после чего ее разбавляют этилацетатом (100 мл) и промывают насыщенным водным раствором NaHCO3 (дважды по 30 мл). Органический экстракт высушивают над Na2SO4, фильтруют и выпаривают. Остаток растворяют в диоксане (10 мл) и перемешивают при температуре 90°С в течение 2 дней. Затем растворитель выпаривают, а остаток высушивают, получая сырой 3-(4-аллилокси-3,5-диметилфенил)-5-(4-изопропокси-3,5-диметилфенил)-[1,2,4]оксадиазол (346 мг);
ЖХ-МС: tR=1,25 мин, [M+1]+=393,47.
б) К раствору сырого 3-(4-аллилокси-3,5-диметилфенил)-5-(4-изопропокси-3,5-диметилфенил)-[1,2,4]оксадиазола (346 мг, 0,794 ммолей) в смеси ацетона (10 мл) и воды (1 мл) прибавляют N-MO (535 мг, 3,96 ммолей) и OsO4 (36 мг, 4 мкмолей, 2,5%-ный раствор в бутаноле). Смесь перемешивают при комнатной температуре в течение 2 дней, после чего ее разбавляют водой (50 мл) и экстрагируют этилацетатом (100 мл, дважды по 50 мл). Объединенные органические экстракты высушивают над Na2SO4, фильтруют и концентрируют. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле, элюируя этилацетатом и получая 3-{4-[5-(4-изопропокси-3,5-диметилфенил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропан-1,2-диол (175 мг) в виде бесцветного, медленно затвердевающегося масла;
ЖХ-МС: tR=1,07 мин, [M+1]+=427,19,1Н ЯМР (D6-ДМСО): δ 1,27 (d, J=6,3 Гц, 6H), 2,31 (s, 6H), 2,33 (s, 6H), 3,51 (t, J=5,5 Гц, 2H), 3,71-3,78 (m, 1H), 3,80-3,89 (m, 2H), 4,31 (гептет, J=6,0 Гц), 4,64 (t, J=5,5 Гц, 1H), 4,96 (d, J=5,3 Гц, 1H), 7,74 (s, 2H), 7,84 (s, 2H).
Пример 11

3-{2-Этил-4-[5-(4-изопропокси-3,5-диметилфенил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси} пропан-1,2-диол получают аналогично получению примера 10, исходя из 4-изопропокси-3,5-диметилбензойной кислоты и 4-аллилокси-3-этил-N-гидрокси-5-метилбензамидина;
ЖХ-МС: tR=1,09 мин, [М+1]+=441,25.
Примеры 12-23

Соединения следующих примеров получают аналогично получению соединений предыдущих примеров, исходя из 4,N-дигидрокси-3,5-диметилбензамидина и либо 3-изопропокси-4-метилбензойной кислоты (примеры 12-14), 4-изобутилбензойной кислоты (примеры 15-17), 4-изобутил-3-метилбензойнойя кислоты (примеры 18-20), либо 3-изобутилбензойной кислоты (примеры 21-23):
Пример 12
1Н ЯМР (CDCl3: δ 1,40 (d, J=6,2 Гц, 6H), 2,28 (s, 3H), 2,33 (s, 6H), 4,71 (гептет, J=5,9 Гц, 1Н), 4,98 (s, 1H), 7,28 (d, J=7,6 Гц, 1H), 7,63 (d, J=1,5 Гц, 1H), 7,69 (dd, J=7,9, 1,5 Гц, 1H), 7,82 (s, 2H).
Пример 15
1Н ЯМР (D6-DSMO): δ 0,87 (d, J=6,4 Гц, 6H), 1,82-1,96 (m, 1H), 2,24 (s, 6H), 2,55 (d, J=7,3 Гц, 2H), 7,42 (d, J=8,2 Гц, 2H), 7,65 (s, 2H), 8,06 (d, J=8,2 Гц, 2H), 8,95 (s, 1H).
Пример 20
1H ЯМР (CDCl3: δ 0,95 (d, J=6,4 Гц, 6H), 1,82-1,99 (m, 1H), 2,35 (s, 6H), 2,39 (s, 3H), 2,55 (d, J=7,3 Гц, 2H), 3,41-3,57 (m, 2H), 3,71-3,91 (m, 3H), 4,18 (s, 2H), 7,04 (t, J=5,6 Гц, 1Н), 7,25 (d. J=7,9 Гц, 1Н), 7,83 (s, 2H), 7,93 (d, J=7,9 Гц), 7,97 (s, 1H).
Пример 24

а) К раствору 4-изопропокси-3-метилбензойной кислоты (1,35 г, 6,95 ммолей) в хлороформе (20 мл) прибавляют тионилхлорид (2,48 г, 20,9 ммолей). Смесь нагревают с обратным холодильником в течение 2 ч, после чего растворители удаляют в вакууме и получают сырой хлорангидрид 4-изопропокси-3-метилбензойной кислоты;
ЖХ-МС: tR=1,00 мин.
б) К суспензии гидразида 4-бензилокси-3-этил-5-метилбензойной кислоты (1,12 г, 3,95 ммолей) в ДХМ (20 мл) прибавляют триэтиламин (500 мг, 4,94 ммолей). Прозрачный раствор охлаждают до температуры 5°С, после чего по каплям добавляют раствор хлорангидрида 4-изопропокси-3-метилбензойной кислоты (700 мг, 3,29 ммолей) в ДХМ (10 мл). Суспензию перемешивают при комнатной температуре в течение 1 ч, после чего ее разбавляют этилацетатом, промывают 1-нормальным водным раствором HCl, а затем водой, высушивают над MgSO4, фильтруют, концентрируют и высушивают, получая N'-(4-изопропокси-3-метилбензоил)гидразид 4-бензилокси-3-этил-5-метилбензойной кислоты (1,57 г) в виде белого твердого вещества;
ЖХ-МС: tR=1,05 мин, [М+1]+=461,66.
в) Раствор N'-(4-изопропокси-3-метилбензоил)гидразида 4-бензилокси-3-этил-5-метилбензойной кислоты (1,57 г, 3,40 ммолей) и реагента Бургесса (1,06 г, 4,43 ммолей) в ТГФ (30 мл) нагревают до температуры 110°C с помощью микроволнового облучения в течение 3 мин. Смесь охлаждают, разбавляют диэтиловым эфиром, промывают водой, высушивают над MgSO4, фильтруют и концентрируют. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле, элюируя смесью гептан:этилацетат в соотношении 5:1 и получая 2-(4-бензилокси-3-этил-5-метилфенил)-5-(4-изопропокси-3-метилфенил)-[1,3,4]оксадиазол (1,25 г) в виде бесцветного масла;
ЖХ-МС: tR=1,24 мин, [M+1]+=443,58.
г) К раствору 2-(4-бензилокси-3-этил-5-метилфенил)-5-(4-изопропокси-3-метилфенил)-[1,3,4]оксадиазола (1,25 г, 2,82 ммолей) в ТГФ (10 мл) прибавляют Pd/C (100 мг, 10% Pd) в EtOH (10 мл). Смесь перемешивают при комнатной температуре под давлением водорода (1 атм) в течение 16 ч, после чего катализатор удаляют посредством фильтрования. Фильтрат затем концентрируют и выделяют с помощью колоночной хроматографии на силикагеле, элюируя смесью гептан:этилацетат в соотношении от 4:1 до 1:1, 2-этил-4-[5-(4-изопропокси-3-метилфенил)-[1,3,4]оксадиазол-2-ил]-6-метилфенол (0,79 г) в виде зеленоватого твердого вещества;
ЖХ-МС: tR=1,12 мин, [M+1]+=353,17,1H ЯМР (D6-ДМСО): δ 9,02 (s расширенный, 1Н), 7,90-7,86 (m, 2Н), 7,70-7,66 (m, 2Н), 7,13 (d, J=9,4 Гц, 1Н), 4,72 (гептет, J=5,0-9 Гц, 1Н), 2,65 (q, J=7,6 Гц, 2Н), 2,26 (s, 3H), 2,20 (s, 3H), 1,31 (d, J=5,9 Гц, 6H), 1,17 (t, J=7,6 Гц, 3H).
Пример 25

1-Амино-3-{2-этил-4-[5-(4-изопропокси-3-метилфенил)-[1,3,4]оксадиазол-2-ил]-6-метилфенокси}пропан-2-ол получают аналогично получению примера 2, исходя из 2-этил-4-[5-(4-изопропокси-3-метилфенил)-[1,3,4]оксадиазол-2-ил]-6-метилфенола;
ЖХ-МС: tR=0,84 мин, [M+1]+=426,45.
Пример 26

N-(3-{2-Этил-4-[5-(4-изопропокси-3-метилфенил)-[1,3,4]оксадиазол-2-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид получают аналогично получению примера 3, исходя из 1-амино-3-{2-этил-4-[5-(4-изопропокси-3-метилфенил)-[1,3,4]оксадиазол-2-ил]-6-метилфенокси}пропан-2-ола;
ЖХ-МС: tR=0,98 мин, [M+1]+=484,24.
Пример 27: GTPγS анализ определения EC50 величин
Анализы GТРγS-связывания проводят в 96-ячеистых титровальных планшетах (Nunc, 442587) с конечным объемом 200 мкл, с использованием мембранных препаратов СНО клеток, экспрессирующих рекомбинантный человеческий S1P1 рецептор. Условия проведения анализа: 20 мМ Hepes (фирма Fluka, 54461), 100 мМ NaCl (фирма Fluka, 71378), 5 мМ MgCl2 (фирма Fluka, 63064), 0,1% БСА (фирма Calbiochem, 126609), 1 мкМ GDP (фирма Sigma, G-7127), 2.5% ДМСО (фирма Fluka, 41644), 50 pM35S-GTPγS (фирма Amersham Biosciences, SJ1320), pH 7,4. Тестируемые соединения растворяют и разбавляют в 100% ДМСО и предварительно инкубируют при комнатной температуре в течение 30 мин в 150 мкл названного выше буфера для анализа, в отсутствии35S-GTPγS. После добавления 50 мкл35S-GTPγS анализируемую смесь инкубируют в течение 1 ч при комнатной температуре. Анализ останавливают посредством переноса реакционной смеси в Multiscreen планшет (Millipore, MAHFC1H60, используя коллектор клеток от фирмы Packard Biosciences, после чего планшеты промывают охлажденным льдом раствором 10 мМ Na2HPO4/NaH2PO4 (в соотношении 70%:30%), высушивают, герметизируют в нижнем отделе и, после добавления 25 мкл MicroScint20 (Packard Biosciences, order# 6013621), герметизируют в верхней части. Мембранное связывание35S-GTPγS измеряют с помощью TopCount от фирмы Packard Biosciences.
ЕС50 представляет собой концентрацию агониста, включающую 50% максимального специфического35S-GTPγS связывания. Специфическое связывание определяется вычитанием неспецифического связывания из максимального связывания. Максимальное связывание представляет собой число импульсов в мин, связанных с Multiscreen планшетом в присутствии 10 мкМ S1P. Неспецифическое связывание представляет собой число связываний в отсутствии агониста при анализе.
В таблице 1 представлены ЕС50 величины некоторых соединений по настоящему изобретению. ЕС50 величины были определены с помощью метода, описанного выше.
Пример 28: Оценка эффективности в условиях in vivo
Эффективность соединений формулы (I) оценивалась измерением циркулирующих лимфоцитов после орального введения от 3 до 30 мг/кг соединения формулы (I) нормотензивным мужским особям крыс Wistar. Животные содержались в условиях с контролируемым климатом с 12-часовым свет/темнота-циклом и имели доступ к нормальной крысиной пище и питьевой воде. Кровь отбиралась перед и через 3, 6 и 24 ч после введения лекарства. Вся кровь подвергалась гематологическому анализу с использованием Advia Hematology system (Bayer Diagnostics, Zurich, Switzerland).
Все данные представлены, как средние ± SEM. Статистические анализы проводились с помощью вариантного анализа (ANOVA) с использованием Statistica (StatSoft) и Student-Newman-Keuls метода для мультиплетных сравнений. Сводящаяся к нулю гипотеза отбрасывалась, когда p<0,05.
В виде примера в таблице 2 представлен эффект, оказываемый на лимфоциты, через 6 ч после введения 10 мг/кг некоторых соединений по настоящему изобретению нормотензивным мужским особям крыс Wistar по сравнению с группой животных, обрабатываемых только растворителем.
Реферат
Изобретение относится к новым фенильным производным формулы (I) ! ! где символ # указывает на два атома углерода фенильного кольца, несущего R1, R2 и R3, к каждому из которых может быть присоединена группа А; и где А представляет собой ! , или , ! где звездочки указывают на связь, через которую осуществляется соединение с фенильным кольцом формулы (I), несущим R1, R2 и R3; R1 представляет собой водород или C1-3-алкил; R2 представляет собой C2-5-алкил или С1-4-алкоксигруппу; R3 представляет собой водород, и в случае, когда группа А присоединена в пара-положении относительно R2 фенильного кольца Формулы (I), несущего R1, R2 и R3, R3 дополнительно может представлять собой метальную группу; R4 представляет собой водород; R5 представляет собой C1-3-алкил; R6 представляет собой гидроксигруппу, ди-(гидрокси-С1-4-алкил)-С1-4-алкоксигруппу, 2,3-дигидроксипропоксигруппу, -OCH2-CH(OH)-CH2-NR61R62 или -ОСН2-СН(ОН)-СН2-NHCOR64; R61 представляет собой водород; R62 представляет собой водород; R64 представляет собой гидроксиметил; и R7 представляет собой C1-3-алкил; и к его соли. Изобретение также относится к фармацевтической композиции, обладающей агонистической активностью в отношении рецептора S1P1/EDG1, на основе указанных соединений. Технический результат - получены новые соединения и фармацевтическая композиция на их основе, которые могут найти применение в медицине в качестве иммуномоделирующих агентов. 3 н. и 16 з.п. ф-лы, 4 табл.
Формула

где символ # указывает на два атома углерода фенильного кольца, несущего R1, R2 и R3, к каждому из которых может быть присоединена группа А; и где
А представляет собой



где звездочки указывают на связь, через которую осуществляется соединение с фенильным кольцом формулы (I), несущим R1, R2 и R3;
R1 представляет собой водород или C1-3-алкил;
R2 представляет собой С2-5-алкил или C1-4-алкоксигруппу;
R3 представляет собой водород, и в случае, когда группа А присоединена в пара-положении относительно R2 фенильного кольца формулы (I), несущего R1, R2 и R3, R3 дополнительно может представлять собой метильную группу;
R4 представляет собой водород;
R5 представляет собой С1-3-алкил;
R6 представляет собой гидроксигруппу, ди-(гидрокси-С1-4-алкил)-С1-4-алкоксигруппу, 2,3-дигидроксипропоксигруппу, -ОСН2-СН(ОН)-СН2-NR61R62 или -OCH2-CH(OH)-CH2-NHCOR64;
R61 представляет собой водород;
R62 представляет собой водород;
R64 представляет собой гидроксиметил; и
R7 представляет собой С1-3-алкил;
и его соли.


где звездочки указывают на связь, через которую осуществляется соединение с фенильным кольцом формулы (I), несущим R1, R2 и R3; и его соли.

и его соли.



где звездочки указывают на связь, через которую осуществляется соединение с фенильным кольцом формулы (I), несущим R1, R2 и R3; R1 представляет собой метил; R2 представляет собой изобутил или изопропоксигруппу; R3 представляет собой водород; R5 представляет собой метил или этил; R6 представляет собой 3-гидрокси-2-гидроксиметилпропоксигруппу, 2,3-дигидроксипропоксигруппу или -OCH2-CH(OH)-CH2-NHCOR64; и R7 представляет собой метил или этил; и его соли.
2-гидрокси-N-((2R)-2-гидрокси-3-{4-[5-(4-изопропокси-3-метилфенил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропил)ацетамид,
2-гидрокси-N-((2S)-2-гидрокси-3-{4-[5-(4-изопропокси-3-метилфенил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропил)ацетамид,
N-((2R)-3-{2-этил-4-[5-(4-изопропокси-3-метилфенил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид,
N-((2S)-3-{2-этил-4-[5-(4-изопропокси-3-метилфенил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид,
2-гидрокси-N-((2R)-2-гидрокси-3-{4-[5-(3-изопропокси-4-метилфенил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропил)ацетамид,
2-гидрокси-N-((2S)-2-гидрокси-3-{4-[5-(3-изопропокси-4-метилфенил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропил)ацетамид,
2-гидрокси-N-((2R)-2-гидрокси-3-{4-[5-(4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропил)ацетамид,
2-гидрокси-N-((2S)-2-гидрокси-3-{4-[5-(4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропил)ацетамид,
2-гидрокси-N-((2R)-2-гидрокси-3-{4-[5-(4-изобутил-3-метилфенил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропил)ацетамид,
2-гидрокси-N-((2S)-2-гидрокси-3-{4-[5-(4-изобутил-3-метилфенил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропил)ацетамид,
N-((2R)-3-{2-этил-4-[5-(4-изопропокси-3-метилфенил)-[1,3,4]оксадиазол-2-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид, и
N-((2S)-3-{2-этил-4-[5-(4-изопропокси-3-метилфенил)-[1,3,4]оксадиазол-2-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид, и соли этих соединений.


Комментарии