Сульфонамидное соединение или его соль - RU2732572C2
Код документа: RU2732572C2
Чертежи


Описание
[ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ К ИЗОБРЕТЕНИЮ]
[0001]
Настоящее изобретение относится к новому сульфонамидному соединению, обладающему ингибирующей рибонуклеотидредуктазу активностью, или его соли, и к фармацевтической композиции, содержащей его в качестве активного ингредиента.
[ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ]
[0002]
Рибонуклеотидредуктаза (называемая далее также как RNR) состоит из гетероолигомера большой субъединицы M1 и небольшой субъединицы M2, и для проявления ферментативной активности необходима экспрессия их обеих. RNR распознает рибонуклеозид-5'-дифосфат (называемый далее также как NDP) в качестве субстрата и катализирует реакцию восстановления до 2'-дезоксирибонуклеозид-5'-дифосфата (называемого далее также как dNDP). Поскольку RNR является ограничивающим скорость ферментом в пути синтеза dNTP de novo, RNR играет важную роль в синтезе и восстановлении ДНК (непатентный документ 1).
Ферментативная активность RNR тесно связана с пролиферацией клеток, и имеется сообщение о том, что ферментативная активность особенно высока при злокачественном новообразовании (непатентный документ 2). Действительно, для различных видов солидных опухолей и рака крови сообщалось о многочисленных корреляциях с гиперэкспрессией M2, субъединицы RNR, и их прогнозе (непатентные документы 3 и 4). Кроме того, ингибирование роста клеток путем ингибирования RNR и противоопухолевое действие in vivo было зарегистрировано на клеточных линиях, полученных из нескольких видов злокачественных новообразований и на неклинических моделях (непатентные документы 5 и 6), таким образом убедительно указывается на то, что RNR является одной из важных молекул-мишеней при лечении злокачественного новообразования.
[0003]
Обычно гидроксимочевина (называемая далее также как HU) и тиосемикарбазон 3-аминопиридин-2-карбоксальдегида (называемый далее также как 3-AP) известны как соединения, обладающие ингибирующей RNR активностью. Эти соединения отличаются по структуре от сульфонамидных соединений по настоящему изобретению. Хотя HU используется клинически более 30 лет, ее ингибирующая RNR активность очень слаба, и ее влияние ограничено (непатентный документ 7). Кроме того, переносимость использования HU также считается проблемой (непатентный документ 8). Между тем, 3-AP имеет структуру, обладающую способностью образовывать хелаты с ионами металлов, и известно, что 3-AP образует хелаты главным образом с ионами железа, тем самым ингибируя RNR (непатентный документ 9). Однако было высказано предположение о том, что 3-AP имеет эффект нецелевого воздействия на различные другие белки, для образования которых требуются ионы железа, и известно, что в клинических случаях вызывались побочные эффекты, такие как гипоксия, одышка, метгемоглобинемия и тому подобное (непатентный документ 10).
Поэтому являлось весьма желательным разработать ингибитор RNR, который обладает лучшей ингибирующей RNR активностью и структурой, которая не образует хелаты с ионами металлов, а также может использоваться лечения для заболеваний, связанных с RNR, таких как опухоли.
[0004]
Между тем, в качестве соединения, имеющего сульфонамидную структуру, в непатентном документе 11 описано соединение (4а-е), имеющее следующую формулу:
[0005]
[Химическая формула 1]
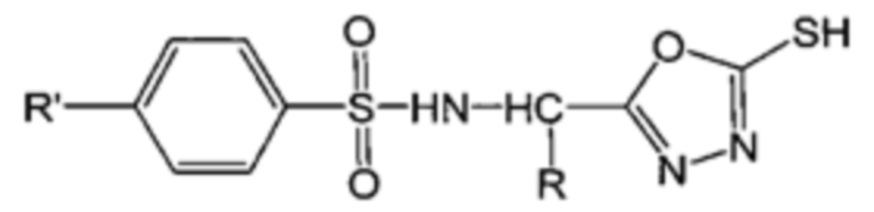
[0006]
(где R представляет собой CH2Ph и R' представляет собой Me). Однако соединение (4а-е) является промежуточным продуктом при получении производных 5-бензилтио-1,3,4-оксадиазола в качестве целевого соединения, обладающего активностью против ВИЧ. В непатентном документе 11 не описывается физиологическая активность соединения (4a-e) и не указывается ингибирующая RNR активность и противоопухолевое действие соединения (4a-e).
[ДОКУМЕНТ ПРЕДШЕСТВУЮЩЕГО УРОВНЯ ТЕХНИКИ]
[НЕПАТЕНТНЫЙ ДОКУМЕНТ]
[0007]
[Непатентный документ 1] Annu. Rev. Biochem. 67, 71-98. (1998)
[Непатентный документ 2] J. Biol. Chem. 245, 5228-5233. (1970)
[Непатентный документ 3] Nat. Commun. 5, 3128 doi: 10,1038/ncomms 4128 (2014)
[Непатентный документ 4] Clin. Sci. 124, 567-578 (2013)
[Непатентный документ 5] Expert. Opin. Ther. Targets 17, 1423-1437 (2013)
[Непатентный документ 6] Biochem. Pharmacol. 59, 983-991 (2000)
[Непатентный документ 7] Biochem. Pharmacol. 78, 1178-11 85 (2009)
[Непатентный документ 8] Cancer Res. 54, 3686-3691 (1994)
[Непатентный документ 9] Pharmacol. Rev. 57, 547-583 (2005)
[Непатентный документ 10] Future Oncol. 8, 145-150 (2012)
[Непатентный документ 11] J. Enzym. Inhib. Med. Chem. 26, 5, 668-680 (2011)
[СУЩНОСТЬ ИЗОБРЕТЕНИЯ]
[ЗАДАЧИ, РЕШАЕМЫЕ ИЗОБРЕТЕНИЕМ]
[0008]
Объектом настоящего изобретения является новое соединение, которое селективно и сильно ингибирует RNR и может быть использовано в качестве противоопухолевого агента и терапевтического средства для лечения других заболеваний, связанных с RNR.
[СПОСОБЫ, РЕШАЕМЫЕ ИЗОБРЕТЕНИЕМ]
[0009]
В результате обширных исследований по решению вышеупомянутых проблем авторы настоящего изобретения обнаружили, что группа соединений, обладающих структурой сульфонамида, представленных следующей формулой (I), обладает превосходной ингибирующей RNR активностью и может быть использована в качестве противоопухолевого агента и т.д., и разработали настоящее изобретение.
[0010]
Настоящее изобретение относится к следующему: от [1] до [33].
[1]
Соединение, представленное следующей формулой (I):
[0011]
[Химическая формула 2]

[0012]
[В формуле
X1 представляет собой атом кислорода или атом серы;
X2 представляет собой атом кислорода или -NH-;
X3 представляет собой -NH- или атом кислорода;
X4 представляет собой атом водорода или C1-C6 алкильную группу;
R1 представляет собой -C(R11)(R12)- или -C(=CH2)-;
R11 и R12 являются одинаковыми или различными и представляют собой атом водорода, атом галогена, или гидрокси группу, или C1-C6 алкильную группу, альтернативно, могут быть взяты вместе с атомами углерода, к которым присоединены R11 и R12, с образованием насыщенного углеводородного кольца, имеющего от 3 до 8 атомов углерода;
R2 представляет собой C6-C14 ароматическую углеводородную группу или 9 или 10 членную полностью ненасыщенную гетероциклическую группу,
где R2 может иметь заместители, и, когда R2 имеет два заместителя на атомах углерода, являющихся соседними по отношению друг к другу в ароматическом углеводородном кольце, заместители могут быть связаны с атомами углерода, к которым присоединены заместители, с образованием насыщенного или частично ненасыщенного 4-8 членного углеводородного кольца или гетероциклического кольца, причем каждое может иметь заместители,
R3 представляет собой C6-C14 ароматическую углеводородную группу или 5-10 членную полностью ненасыщенную гетероциклическую группу,
где R3 может иметь заместители, и, когда R3 имеет два заместителя на атомах углерода, являющихся соседними по отношению друг к другу в ароматическом углеводородном кольце, заместители могут быть связаны с атомами углерода, к которым присоединены заместители, с образованием насыщенного или частично ненасыщенного 4-8 членного углеводородного кольца или гетероциклического кольца, причем каждое может иметь заместители; и
R4 представляет собой атом водорода или C1-C6 алкильную группу;
(при условии, что X1 представляет собой атом кислорода, когда X2 представляет собой атом кислорода, X3 представляет собой -NH-, X4 представляет собой атом водорода, R1 представляет собой -CH2-, R2 представляет собой фенильную группу, R3 представляет собой 4-метилфенильную группу, и R4 представляет собой атом водорода)]
или его соль.
[2]
Соединение или его соль в соответствии с [1], где в формуле (I):
R11 представляет собой атом галогена, гидрокси группу или C1-C6 алкильную группу;
R12 представляет собой атом водорода, атом галогена, гидрокси группу или C1-C6 алкильную группу или
R11 и R12 могут быть взяты вместе с атомами углерода, к которым ы R11 и R12 присоединены, с образованием насыщенного углеводородного кольца, имеющего от 3 до 8 атомов углерода.
[3]
Соединение или его соль в соответствии с [1] или [2], где в формуле (I) X1 представляет собой атом кислорода.
[4]
Соединение или его соль в соответствии с любым из [1]-[3], где в формуле (I) X2 представляет собой атом кислорода.
[5]
Соединение или его соль в соответствии с любым из [1]-[4], где в формуле (I) X3 представляет собой -NH-.
[6]
Соединение или его соль в соответствии с любым из [1]-[5], где в формуле (I) X4 представляет собой атом водорода.
[7]
Соединение или его соль в соответствии с любым из [1]-[6], где в формуле (I) R1 представляет собой -C (R11)(R12)- (где R11 представляет собой C1-C6 алкильную группу и R12 представляет собой атом водорода).
[8]
Соединение или его соль в соответствии с любым из [1]-[7], где в формуле (I):
R2 представляет собой C6-C14 ароматическую углеводородную группу или 9-10 членную полностью ненасыщенную гетероциклическую группу, где R2 может быть замещен R21, и, когда R2 имеет два заместителя на атомах углерода, являющихся соседними по отношению друг к другу в ароматическом углеводородном кольце, заместители могут быть связаны с атомами углерода, к которым присоединены заместители, с образованием насыщенного или частично ненасыщенного 4-8 членного углеводородного кольца или гетероциклического кольца, причем каждое может быть замещено Rz;
R21 представляет собой: атом галогена; аминокарбонильную группу; циано группу; C1-C6 алкильную группу, необязательно замещенную Rx; C3-C6 циклоалкильную группу, необязательно замещенную Rx; C2-C6 алкинильную группу, необязательно замещенную Rx; C6-C14 ароматическую углеводородную группу, необязательно замещенную Ry; или 5-10 членную ненасыщенную гетероциклическую группу, необязательно замещенную Rz;
Rx представляет собой атом галогена или C6-C14 ароматическую углеводородную группу;
Ry представляет собой атом галогена или C1-C6 алкокси группу;
Rz представляет собой атом галогена, C1-C6 алкильную группу, галоген C1-C6 алкильную группу, C3-C6 циклоалкильную группу, C1-C6 алкокси группу, C6-C14 ароматическую углеводородную группу, азотсодержащую насыщенную гетероциклическую группу или азотсодержащую насыщенную гетероциклическую карбонильную группу.
[9]
Соединение или его соль в соответствии с любым из [1]-[8], где в формуле (I):
R3 представляет собой C6-C14 ароматическую углеводородную группу или 5-10 членную полностью ненасыщенную гетероциклическую группу, где R3 может быть замещен R31, и, когда R3 имеет два заместителя на атомах углерода, являющихся соседними по отношению друг к другу в ароматическом углеводородном кольце, заместитель может быть связан с атомами углерода, к которым присоединены заместители, с образованием насыщенного или частично ненасыщенного 4-8 членного углеводородного кольца или гетероциклического кольца, причем каждое может быть замещено Rc;
R31 представляет собой атом галогена; циано группу; нитро группу; карбоксильную группу; тиоамидную группу; C1-C6 алкильную группу, необязательно замещенную Ra; амино группу, необязательно замещенную Ra; C3-C6 циклоалкильную группу, необязательно замещенную Rb; C1-C6 алкокси группу, необязательно замещенную Rb; C2-C7 алкоксикарбонильную группу; C1-C14 ацильную группу, необязательно замещенную Rb; C6-C14 ароматическую углеводородную группу, необязательно замещенную Rb; 5-10 членную ненасыщенную гетероциклическую группу, необязательно замещенную Rc; аминокарбонильную группу, необязательно замещенную Rd и Re; или -S(=O)2Rf;
Ra представляет собой атом галогена, гидрокси группу, C1-C14 ацильную группу, C1-C14 ацилокси группу, C2-C6 алкинильную группу или C1-C6 алкокси C1-C6 алкокси группу;
Rb представляет собой атом галогена, амино группу или C1-C6 алкокси группу;
Rc представляет собой атом галогена; гидрокси группу; амино группу; оксо группу; C1-C6 алкильную группу, необязательно замещенную гидрокси группой; галоген C1-C6 алкильные группы; C1-C14 ацильные группы; C1-C14 ациламино группу; C1-C14 ацилокси группу или C7-C13 аралкилокси группу;
Rd и Re являются одинаковыми или различными и представляют собой: атом водорода; гидрокси группу; C7-C13 аралкилокси группу или C1-C6 алкильную группу, необязательно замещенную гидроксильной группой; альтернативно, взятые вместе с атомом азота, который является соседним по отношению к Rd и Re, образуют насыщенную или ненасыщенную 4-10 членную гетероциклическую кольцевую группу, необязательно замещенную амино группой, спиро гетероциклическую кольцевую группу или мостиковую гетероциклическую кольцевую группу; и
Rf представляет собой амино группу, C1-C6 алкильную группу или 4-10 членную насыщенную гетероциклическую группу.
[10]
Соединение или его соль в соответствии с любым из [1]-[9], где в формуле (I):
R2 представляет собой C6-C14 ароматическую углеводородную группу или бициклическую 9-10 членную полностью ненасыщенную гетероциклическую кольцевую группу, имеющую 1-3 гетероатома, выбранные из группы, включающей атом азота, атом серы и атом кислорода, где R2 может быть замещен R21, и, когда R2 имеет два заместителя на атомах углерода, являющихся соседними по отношению друг к другу в ароматическом углеводородном кольце, заместители могут быть связаны с атомами углерода, к которым присоединены заместители, с образованием насыщенного или частично ненасыщенного моноциклического углеводородного кольца, имеющего 4-8 атомов углерода, (необязательно замещенного C1-C6 алкильной группой), или насыщенного или частично ненасыщенного моноциклического 4-8 членного гетероциклического кольца, имеющего 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода, (необязательно замещенного C1-C6 алкильной группой);
R21 представляет собой атом галогена, аминокарбонильную группу, циано группу, C1-C6 алкильную группу (необязательно замещенную атомами галогена), C3-C6 циклоалкильную группу, C2-C6 алкинильную группу (необязательно замещенную C6-C14 ароматическими углеводородными группами), C6-C14 ароматическую углеводородную группу (необязательно замещенную группой, выбранной из атома галогена и C1-C6 алкокси группы) или ненасыщенную моноциклическую или бициклическую 5-10 членную гетероциклическую группу, имеющую 1-3 гетероатома, выбранных из группы, включающей атом азота, атом серы и атом кислорода, (необязательно замещенную группой, выбранной из группы, включающей атом галогена, C1-C6 алкильную группу, галоген C1-C6 алкильную группу, C3-C6 циклоалкильную группу, C1-C6 алкокси группу, C6-C14 ароматическую углеводородную группу, азотсодержащую насыщенную гетероциклическую группу и азотсодержащую насыщенную гетероциклическую карбонильную группу).
[11]
Соединение или его соль в соответствии с любым из [1]-[10], где в формуле (I):
R2 представляет собой C6-C14 ароматическую углеводородную группу, где R2 может быть замещен R21, и, когда R2 имеет два заместителя на атомах углерода, являющихся соседними по отношению друг к другу в ароматическом углеводородном кольце, заместители могут быть связаны с атомами углерода, к которым присоединены заместители, с образованием насыщенного или частично ненасыщенного моноциклического углеводородного кольца, имеющего 4-8 атомов углерода, (необязательно замещенного C1-C6 алкильной группой);
R21 представляет собой атом галогена, циано группу, C1-C6 алкильную группу (необязательно замещенную атомом галогена), C3-C6 циклоалкильную группу, фенильную группу (необязательно замещенную группой, выбранной из группы, включающей атом галогена и C1-C6 алкокси группу) или ненасыщенную моноциклическую или бициклическую 5-10 членную гетероциклическую группу, имеющую 1-3 гетероатома, выбранных из группы, включающей атом азота, атом серы и атом кислорода, (необязательно замещенную группой, выбранной из группы, включающей атом галогена, C1-C6 алкильную группу, галоген C1-C6 алкильную группу, C3-C6 циклоалкильную группу, C1-C6 алкокси группу, морфолино группу, пиперидинильную группу и морфолинокарбонильную группу).
[12]
Соединение или его соль в соответствии с любым из [1]-[11], где в формуле (I):
R2 представляет собой C6-C10 ароматическую углеводородную группу, где R2 может быть замещен R21, и, когда R2 имеет два заместителя на атомах углерода, являющихся соседними по отношению друг к другу в ароматическом углеводородном кольце, заместители могут быть связаны с атомами углерода, к которым присоединены заместители, с образованием насыщенного или частично ненасыщенного моноциклического углеводородного кольца, имеющего 5 или 6 атомов углерода, (необязательно замещенного C1-C6 алкильной группой);
R21 представляет собой атом галогена, C1-C6 алкильную группу или моноциклическую 5 или 6 членную ненасыщенную гетероциклическую группу, имеющую 1-3 атома азота, (необязательно замещенную C1-C6 алкильной группой).
[13]
Соединение или его соль в соответствии с любым из [1]-[12], где в формуле (I):
R3 представляет собой C6-C14 ароматическую углеводородную группу или моноциклическую или бициклическую 5-10 членную полностью ненасыщенную гетероциклическую группу, имеющую 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода, где R3 может быть замещен R31, и, когда R3 имеет два заместителя на атомах углерода, являющихся соседними по отношению друг к другу в ароматическом углеводородном кольце, заместители могут быть связаны с атомами углерода, к которым присоединены заместители, с образованием насыщенного или частично ненасыщенного моноциклического углеводородного кольца, имеющего 4-8 атомов углерода, (необязательно замещенного группой, выбранной из группы, включающей атом галогена; гидрокси группу; амино группу; оксо группу; C1-C6 алкильную группу, необязательно замещенную гидрокси группой; галоген C1-C6 алкильную группу; C1-C14 ацильную группу; C1-C14 ациламино группу; C1-C14 ацилокси группу и C7-C13 аралкилокси группу), или насыщенного или частично ненасыщенного моноциклического 4-8 членного гетероциклического кольца, имеющего 1-4 гетероатома, выбранных из атома азота, атома серы и атома кислорода, (необязательно замещенного группой, выбранной из группы, включающей атом галогена, гидрокси группу, амино группу, оксо группу, C1-C6 алкильную группу, необязательно замещенную гидрокси группой; галоген C1-C6 алкильную группу; C1-C14 ацильную группу; C1-C14 ациламино группу; C1-C14 ацилокси группу и C7-C13 аралкилокси группу);
R31 представляет собой атом галогена, циано группу, нитро группу, карбоксильную группу, тиоамидную группу, C1-C6 алкильную группу (необязательно замещенную группой, выбранной из группы, включающей атом галогена, гидрокси группу, C1-C14 ацильную группу, C1-C14 ацилокси группу, C2-C6 алкинильную группу и C1-C6 алкокси C1-C6 алкокси группу), амино группу (необязательно замещенную C1-C14 ацильную группу), C3-C6 циклоалкильную группу (необязательно замещенную амино группой), C1-C6 алкокси группу (необязательно замещенную атомом галогена), C2-C7 алкоксикарбонильную группу, C1-C14 ацильную группу (необязательно замещенную атомом галогена), C6-C14 ароматическую углеводородную группу (необязательно замещенную группой, выбранной из группы, включающей атом галогена, амино группу и C1-C6 алкокси группу), моноциклическую или бициклическую 5-10 членную ненасыщенную гетероциклическую группу, имеющую 1-4 гетероатома, выбранных из атома азота, атома серы и атома кислорода, (необязательно замещенную группой, выбранную из группы, включающей атом галогена, оксо группу и C1-C6 алкильную группу), аминокарбонильную группу, необязательно замещенную Rd и Re (где Rd и Re являются одинаковыми или различными и представляют собой атом водорода, гидрокси группу, C7-C13 аралкилокси группу или C1-C6 алкильную группу, необязательно замещенную гидрокси группой, альтернативно, взятые вместе с соседним атомом азота образуют насыщенную или ненасыщенную моноциклическую или бициклическую 4-10 членную гетероциклическую группу, необязательно замещенную амино группой, имеющую 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода; спиро гетероциклическую группу или мостиковую гетероциклическую группу), или -S(=O)2Rf (где Rf представляет собой амино группу, C1-C6 алкильную группу или 4-10 членную насыщенную гетероциклическую группу).
[14]
Соединение или его соль в соответствии с любым из [1]-[13], где в формуле (I):
R3 представляет собой C6-C10 ароматическую углеводородную группу или полностью ненасыщенную моноциклическую или бициклическую 5-10 членную гетероциклическую группу, имеющую 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода, где R3 может быть замещен R31, когда R3 имеет два заместителя на атомах углерода, являющихся соседними по отношению друг к другу в ароматическом углеводородном кольце, R3 может быть связан с атомами углерода, к которым присоединены заместители, с образованием насыщенного или частично ненасыщенного моноциклического углеводорода, имеющего 4-8 атомов углерода, (необязательно замещенного группами, выбранными из группы, включающей атом галогена, гидрокси группу, амино группу, оксо группу, C1-C6 алкильную группу (которая необязательно замещена гидрокси группой), галоген C1-C6 алкильную группу, C1-C14 ацильную группу, C1-C14 ациламино группу и C1-C14 ацилокси группу), или насыщенного или частично ненасыщенного моноциклического 4-8 членного гетероциклического кольца, имеющего 1-3 гетероатома, выбранные из группы, включающей атом азота, атом серы и атом кислорода, (необязательно замещенного группой, выбранной из группы, включающей: атом галогена; гидрокси группу; амино группу; оксо группу и C1-C6 алкильную группу, необязательно замещенную гидрокси группой; галоген C1-C6 алкильную группу; C1-C14 ацильную группу; C1-C14 ациламино группу и C1-C14 ацилокси группу);
R31 представляет собой атом галогена, циано группу, нитро группу, карбоксильную группу, тиоамидную группу, C1-C6 алкильную группу (необязательно замещенную группой, выбранной из группы, включающей атом галогена, гидрокси группу, C1-C14 ацильную группу, C1-C14 ацилокси группу, C2-C6 алкинильную группу и C1-C6 алкокси C1-C6 алкокси группу), амино группу, C3-C6 циклоалкильную группу (необязательно замещенную амино группой), C1-C6 алкокси группу (необязательно замещенную атомом галогена), C2-C7 алкоксикарбонильную группу, C1-C14 ацильную группу (необязательно замещенную атомом галогена), C6-C10 ароматическую углеводородную группу (необязательно замещенную атомом галогена), ненасыщенную моноциклическую или бициклическую 5-10 членную гетероциклическую группу, имеющую от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, (необязательно замещенную группой, включающей C1-C6 алкильную группу и оксо группу), -CONH2 группу, (моно- или ди-C1-C6 алкил)аминокарбонильную группу, гидроксиамино карбонильную группу, (C7-C13 аралкилокси)оксиаминокарбонильную группу, аминосульфонильную группу, C1-C6 алкилсульфонильную группу или пиперидинoсульфонильную группу.
[15]
Соединение или его соль в соответствии с любым из [1]-[14], где в формуле (I):
R3 представляет собой C6-C10 ароматическую углеводородную группу (где C6-C10 ароматическая углеводородная группа может быть замещена R31, и, когда C6-C10 ароматическая углеводородная группа имеет два заместителя на атомах углерода, являющихся соседними по отношению друг к другу в ароматическом углеводородном кольце, заместители могут быть связаны с атомами углерода, к которым присоединены заместители, с образованием насыщенного или частично ненасыщенного моноциклического 4-6 членного гетероциклического кольца, имеющего 1-3 гетероатома, выбранных из атома азота, атома серы и атомов кислорода, (необязательно замещенного группой, выбранной из группы, включающей гидрокси группу, амино группу, оксо группу, C1-C6 алкильную группу, галоген C1-C6 алкильную группу; C1-C14 ациламино группу и C1-C14 ацилокси группу)), альтернативно, представляет собой полностью ненасыщенное моноциклическое 5 или 6 членное гетероциклическое кольцо, имеющее 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода, (необязательно замещенное группой, выбранной из группы, включающей: атом галогена; C1-C6 алкильную группу, необязательно замещенную гидрокси группой; C1-C6 алкокси группу; C2-C7 алкоксикарбонильную группу; -CONH2 группу; (моно- или ди-C1-C6 алкил)аминокарбонильную группу; пирролидин-1-илкарбонильную группу; морфолин-4-илкарбонильную группу; 2-окса-7-азаспиро[3,5]нонанильную группу; 3-окса-8-азабицикло[3,2,1]октанильную группу и 8-окса-3-азабицикло[3,2,1]октанильную группу),
R31 представляет собой атом галогена, амино группу, C1-C6 алкильную группу (необязательно замещенную группой, выбранной из группы, включающей атом галогена и гидрокси группу), C1-C6 алкокси группу (необязательно замещенную атомом галогена), ненасыщенную моноциклическую 5 или 6 членную гетероциклическую группу, имеющую от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, -CONH2 группу, (моно или ди-C1-C6 алкил)аминокарбонильную группу или гидроксиамино карбонильную группу.
[16]
Соединение или его соль в соответствии с любым из [1]-[15], где в формуле (I):
X1 представляет собой атом кислорода,
X2 представляет собой атом кислорода,
X3 представляет собой -NH-,
X4 представляет собой атом водорода,
R1 представляет собой -C(R11)(R12)- (где R11 представляет собой C1-C6 алкильную группу, и R12 представляет собой атом водорода), и
R2 представляет собой C6-C10 ароматическую углеводородную группу, где R2 может быть замещен R21, и, когда R2 имеет два заместителя на атомах углерода, являющихся соседними по отношению друг к другу в ароматическом углеводородном кольце, заместители могут быть связаны с атомами углерода, к которым присоединены заместители, с образованием насыщенного или частично ненасыщенного моноциклического углеводородного кольца, имеющего 5 или 6 атомов углерода, (необязательно замещенного C1-C6 алкильной группой); и
R21 представляет собой атом галогена, C1-C6 алкильную группу или моноциклическую 5 или 6 членную ненасыщенную гетероциклическую группу, имеющую 1-3 атома азота, (необязательно замещенную C1-C6 алкильной группой);
R3 представляет собой C6-C10 ароматическую углеводородную группу (где C6-C10 ароматическая углеводородная группа может быть замещена R31, и, когда C6-C10 ароматическая углеводородная группа имеет два заместителя на атомах углерода, являющихся соседними по отношению друг к другу в ароматическом углеводородном кольце, заместители могут быть связаны с атомами углерода, к которым присоединены заместители, с образованием насыщенного или частично ненасыщенного моноциклического 4-6 членного гетероциклического кольца, имеющего 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода, (необязательно замещенного группой, выбранной из группы, включающей гидрокси группу, амино группу, оксо группу, C1-C6 алкильную группу, галоген C1-C6 алкильную группу, C1-C14 ациламино группу и C1-C14 ацилокси группу)), альтернативно, представляет собой полностью ненасыщенное моноциклическое 5 или 6 членное гетероциклическое кольцо, имеющее 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода, (необязательно замещенное группой, выбранной из группы, включающей атом галогена, C1-C6 алкильную группу, необязательно замещенную гидрокси группой, C1-C6 алкокси группу, C2-C7 алкоксикарбонильную группу, -CONH2 группу, (моно- или ди-C1-C6 алкил)аминокарбонильную группу, пирролидин-1-илкарбонильную группу, морфолин-4-илкарбонильную группу, 2-окса-7-азаспиро[3,5]нонанильную группу, 3-окса-8-азабицикло[3,2,1]октанильную группу и 8-окса-3-азабицикло[3,2,1]октанильную группу),
R31 представляет собой атом галогена, амино группу, C1-C6 алкильную группу (необязательно замещенную группой, выбранной из группы, включающей атом галогена и гидрокси группу), C1-C6 алкокси группу (необязательно замещенную атомом галогена), моноциклическую 5 или 6 членную ненасыщенную гетероциклическую группу, имеющую от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, -CONH2 группу, (моно или ди-C1-C6 алкил)аминокарбонильную группу или гидроксиамино карбонильную группу.
R4 представляет собой атом водорода.
[17]
Соединение или его соль в соответствии с любым из [1]-[16], где в формуле (I):
X1 представляет собой атом кислорода,
X2 представляет собой атом кислорода,
X3 представляет собой -NH-,
X4 представляет собой атом водорода,
R1 представляет собой -C(R11)(R12)- (где R11 представляет собой метильную группу, и R12 представляет собой атом водорода), и
R2 представляет собой фенильную группу или нафтильную группу, где R2 может быть замещен R21, и, когда R2 имеет два заместителя на атомах углерода, являющихся соседними по отношению друг к другу в ароматическом углеводородном кольце, заместители могут быть связаны с атомами углерода, к которым заместители присоединены, с образованием насыщенного или частично ненасыщенного моноциклического углеводородного кольца, имеющего 5 или 6 атомов углерода, (необязательно замещенного C1-C6 алкильной группой); и
R21 представляет собой атом галогена или C1-C6 алкильную группу;
R3 представляет собой фенильную группу (где фенильная группа может быть замещена R31, и, когда фенильная группа имеет два заместителя на атомах углерода, являющихся соседними по отношению друг к другу на бензольном кольце, заместители могут быть связаны с атомами углерода, к которым присоединены заместители, с образованием насыщенного или частично ненасыщенного моноциклического 6 членного гетероциклического кольца, имеющего 1 или 2 атома кислорода, (необязательно замещенную группой, выбранной из группы, включающей гидрокси группу и C1-C6 алкильную группу)) или пиридильную группу (необязательно замещенную -CONH2 группой, (моно- или ди-C1-C6 алкил)аминокарбонильная группа или пирролидин-1-илкарбонильная группа);
R31 представляет собой атом галогена, амино группу, C1-C6 алкильную группу или -CONH2 группу;
R4 представляет собой атом водорода.
[18]
Соединение или его соль в соответствии с любым из пп.1-17, где соединение выбрано из следующих соединений (1)-(19):
(1) 5-бром-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(2) 5-хлор-2-(N-((1S,2R)-2-(2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(3) 5-бром-2-(N-((1S,2R)-2-(2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(4) 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид
(5) 5-хлор-2-(N-((1S,2R)-2-(2-фторнафталин-1-ил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(6) 5-хлор-2-(N-((1S,2R)-2-(3-этил-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(7) 5-хлор-2-(N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(8) 5-бром-2-(N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(9) 2-(N-((1S,2R)-2-(3-бром-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-5-хлор-бензамид;
(10) 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-6-(пирролидин-1-карбонил)пиридин-2-сульфонамид;
(11) 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метил-d3-хроман-8-сульфонамид;
(12) 5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метил-хроман-8-сульфонамид;
(13) N-((1S,2R)-2-(3-бром-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-5-хлор-4-гидрокси-4-метилхроман-8-сульфонамид;
(14) 5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метил-d3-хроман-8-сульфонамид;
(15) 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидроксихроман-8-сульфонамид;
(16) 3-хлор-6-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-N,N-диметилпиколинамид;
(17) 4-Амино-2-метокси-N-((1S,2R)-2-(8-метилнафталин-1-ил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)бензолсульфонамид;
(18) 4-амино-N-((1S,2R)-2-(2,3-дигидро-1H-инден-4-ил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-2-метоксибензолсульфонамид; или
(19) 5-хлор-2-((1S,2R)-метил-d3-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид.
[19]
Ингибитор рибонуклеотидредуктазы, содержащий соединение или его соль в соответствии с любым из [1]-[16] в качестве активного ингредиента.
[20]
Лекарственное средство, содержащее соединение или его соль в соответствии с любым из [1]-[18].
[21]
Фармацевтическая композиция, содержащая соединение или его соль в соответствии с любым из [1]-[18] и фармацевтически приемлемый носитель.
[22]
Противоопухолевый агент, содержащий соединение или его соль в соответствии с любым из [1]-[18] в качестве активного ингредиента.
[23]
Противоопухолевый агент для перорального введения, содержащий соединение или его соль в соответствии с любым из [1]-[18] в качестве активного ингредиента.
[24]
Применение соединения или его соли в соответствии с любым из [1]-[18] для изготовления ингибитора рибонуклеотидредуктазы.
[25]
Применение соединения или его соли в соответствии с любым из [1]-[18] для изготовления фармацевтической композиции.
[26]
Применение соединения или его соли в соответствии с любым из [1]-[18] для изготовления противоопухолевого агента.
[27]
Применение соединения или его соли в соответствии с любым из [1]-[18] для изготовления противоопухолевого агента для перорального введения.
[28]
Соединение или его соль в соответствии с любым из [1]-[18] для применения для ингибирования рибонуклеотидредуктазы.
[29]
Соединение или его соль в соответствии с любым из [1]-[18] для применения в качестве лекарственного средства.
[30]
Соединение или его соль в соответствии с любым из [1]-[18] для применения для предупреждения и/или лечения опухолей.
[31]
Соединение или его соль в соответствии с любым из [1]-[18] для применения для предупреждения и/или лечения опухолей путем перорального введения.
[32]
Способ ингибирования рибонуклеотидредуктазы, включающий введение эффективного количества соединения или его соли в соответствии с любым из [1]-[18] нуждающемуся в этом субъекту.
[33]
Способ предупреждения и/или лечения опухолей, включающий введение эффективного количества соединения или его соли в соответствии с любым из [1]-[18] нуждающемуся в этом субъекту.
[ЭФФЕКТ ИЗОБРЕТЕНИЯ]
[0013]
Согласно настоящему изобретению предложены новые сульфонамидные соединения, представленные вышеуказанной формулой (I), или их соли, которые могут использоваться в качестве ингибиторов RNR.
Соединения по настоящему изобретению или их соли обладают превосходной ингибирующей RNR активностью и демонстрируют ингибирующее рост линий раковых клеток действие. Соответственно, соединения по настоящему изобретению или их соли могут быть использованы в качестве противоопухолевого агента и терапевтического средства при лечении других заболеваний, в которых участвует RNR.
[КРАТКОЕ ОПИСАНИЕ РИСУНКОВ]
[0014]
[ФИГУРА 1] Представляет собой диаграмму, иллюстрирующую ежедневное изменение относительного объема опухоли (указываемое далее также в настоящем документе как «RTV») с соединением по настоящему изобретению.
[ФИГУРА 2] Представляет собой диаграмму, показывающую ежедневное изменение RTV с соединением по настоящему изобретению.
[ФИГУРА 3] Представляет собой диаграмму, показывающую ежедневное изменение RTV с соединением по настоящему изобретению.
[ФИГУРА 4] Представляет собой диаграмму, показывающую ежедневное изменение RTV с соединением по настоящему изобретению.
[ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ]
[0015]
Соединения по настоящему изобретению, представленные формулой (I), являются соединениями, имеющими структуру сульфонамида, и представляют собой новые соединения, которые не описаны в литературных источниках предшествующего уровня техники, упомянутых далее.
[0016]
«CA-CB», как используется в настоящем документе, относится к группе по настоящему описанию, имеющей A-B число атомов углерода. Например, «C1-C6 алкильная группа» представляет собой алкильную группу, имеющую от 1 до 6 атомов углерода. Термин «A-B членный» указывает, что число атомов, составляющих кольцо (члены кольца), равно A-B. Например, «5-10 членная ненасыщенная гетероциклическая группа» означает ненасыщенную гетероциклическую группу, в которой число кольцевых членов составляет 5-10.
[0017]
«Заместители», как используется в настоящем документе, относится к атому галогена, гидрокси группе, амино группе, оксо группе, циано группе, нитро группе, карбоксильной группе, аминокарбонильной группе, тиоамидной группе, C1-C6 алкильной группе, C2-C6 алкинильной группе, C3-C6 циклоалкильной группе, C1-C6 алкокси группе, C1-C6 алкокси C1-C6 алкокси группе, галоген C1-C6 алкильной группе, галоген C1-C6 алкокси группе, C6-C14 ароматической углеводородной группе, ненасыщенной гетероциклической группе, насыщенной гетероциклической группе, азотсодержащей насыщенной гетероциклической группе, азотсодержащей насыщенной гетероциклической карбонильной группе, C1-C14 ацильной группе, C1-C14 ациламино группе, C2-C7 алкоксикарбонильной группе, C1-C14 ацилокси группе, C7-C13 аралкилокси группе и тому подобное.
[0018]
«Атом галогена», как используется в настоящем документе, относится к атому фтора, атому хлора, атому брома и атому йода.
[0019]
«С1-С6 алкильная группа», как используется в настоящем документе, относится к прямой или разветвленной насыщенной углеводородной группе, имеющей от 1 до 6 атомов углерода, такой как метильная группа, этильная группа, н-пропильная группа, изопропильная группа, н-бутильная группа, изобутильная группа, трет-бутильная группа, н-пентильная группа, изопентильная группа, гексильная группа и тому подобное.
[0020]
«С2-С6 алкинильная группа», как используется в настоящем документе, относится к ненасыщенной углеводородной группе с прямой или разветвленной цепью, содержащей от 2 до 6 атомов углерода и по меньшей мере одну тройную связь, например, этинильная, 1- или 2-пропинильная группу, 1-, 2 или 3-бутинильная группа, 1-метил-2-пропинильная группа и тому подобное.
[0021]
«C3-C6-циклоалкильная группа», как используется в настоящем документе, относится к насыщенной циклической углеводородной группе, содержащей от 3 до 6 атомов углерода, например, циклопропильная группа, циклобутильная группа, циклопентильная группа, циклогексильная группа и тому подобное.
[0022]
«C1-C6 алкоксигруппа», как используется в настоящем документе, относится к оксигруппе, к которой присоединена прямая или разветвленная насыщенная углеводородная группа, содержащая от 1 до 6 атомов углерода, например, метоксигруппа, этоксигруппа, пропоксигруппа, изопропоксигруппа, н-бутоксигруппа, изобутоксигруппа, трет-бутоксигруппа, пентилоксигруппа, изопентилоксигруппа, гексилоксигруппа и тому подобное.
[0023]
«C1-C6 алкокси C1-C6 алкоксигруппа», как используется в настоящем документе, относится к C1-C6 алкоксигруппе, в которой один из атомов водорода C1-C6 алкоксигруппы замещен C1-C6 алкоксигруппой, например, метоксиметоксигруппа, метоксиэтоксигруппа, метоксипропоксигруппа, этоксиметоксигруппа, этоксиэтоксигруппа, пропоксиметоксигруппа и тому подобное.
[0024]
«Галоген C1-C6 алкильная группа», как используется в настоящем документе, относится к C1-C6-алкильной группе, в которой один или несколько атомов водорода замещены атомом галогена, например, фторметильная группа, дифторметильная группа, трифторметильная группа, трихлорметильная группа, фторэтильная группа, 1,1,1-трифторэтильная группа, монофтор-н-пропильная группа, перфтор-н-пропильная группа, перфтор-изопропильная группа и тому подобное.
[0025]
«C6-C14 ароматическая углеводородная группа», как используется в настоящем документе, относится к моноциклической или полициклической ароматической углеводородной группе, имеющей от 6 до 14 атомов углерода, например, фенильная группа, нафтильная группа, антраценильная группа, фенантрильная группа, флуоренильная группа и тому подобное.
[0026]
«Ненасыщенная гетероциклическая группа», как используется в настоящем документе, относится к моноциклической или полициклической ненасыщенной гетероциклической группе, имеющей по меньшей мере один гетероатом, выбранный из атома азота, атома серы и атома кислорода (предпочтительно от 1 до 4, более предпочтительно, от 1 до 3). Ненасыщенная гетероциклическая группа включает полностью ненасыщенную гетероциклическую группу (полностью ненасыщенную гетероциклическую группу) и частично ненасыщенную гетероциклическую группу (частично ненасыщенную гетероциклическую группу).
Полностью ненасыщенная гетероциклическая группа включает, например, пирролильную группу, имидазолильную группу, пиразолильную группу, триазолильную группу, тетразолил, фуранил (фурильную группу), оксазолильную группу, изоксазолильную группу, оксадиазолильную группу, тиофильную группу (тиенильную группу), тиазолильную группу, изотиазолильную группу, тиадиазолильную группу, пиридинильную группу (пиридильную группу), пиримидинильную группу (пиримидильную группу), пиразинильную группу (пиразильную группу), пиридазинильную группу, индолильную группу, изоиндолильную группу, индазолильную группу (бензпиразольную группу), бензимидазолильную группу, бензотриазолильную группу, азаиндолильную группу, пирролопиридинильную группу, имидазопиридинильную группу, пиразолопиридинильную группу, триазолопиридинильную группу, пирролопиримидинильную группу, имидазопиримидинильную группу, пиразолопиримидинильную группу, бензофуранильную группу, бензоксазолильную группу, бензотиофенильную группу (бензотиенильную группу), бензотиазолильную группу, бензотиадиазолильную группу, бензофуранильную группу (бензофурильную группу), хинолильную группу, изохинолильную группу, хиназолинильную группу, хиноксалильную группу и тому подобное.
[0027]
Частично ненасыщенная гетероциклическая группа включает, например, дигидропиранильную группу, дигидротриазолильную группу, дигидрофуранильную группу, дигидрооксадиазолильную группу, дигидрохинолильную группу, дигидрохиназолинильную группу, индолинильную группу, тетрагидроизохинолильную группу, метилендиоксифенильную группу, этилендиоксифенильную группу, дигидробензофуранильную группу, дигидробензоксазолильную группу, дигидропиридоксазинильную группу и тому подобное.
[0028]
«Насыщенная гетероциклическая группа», как используется в настоящем документе, относится к одно или полициклической полностью насыщенной гетероциклической группе, имеющей по меньшей мере один гетероатом, выбранный из атома азота, атома серы и атома кислорода (предпочтительно от 1 до 4, более предпочтительно, от 1 до 3), и включает, например, азетидинильную группу, пирролидинильную группу, пиперидинильную группу, пиперазинильную группу, гексаметилениминогруппу, морфолиногруппу, тиоморфолиногруппу, гомопиперазинильную группу, тетрагидрофуранильную группу, тетрагидропиранильную группу, тетрагидротиофенильную группу, тиазолидинильную группу, оксазолидинильную группу и тому подобное.
[0029]
«Используемая в настоящем документе азотсодержащая насыщенная гетероциклическая группа» относится к насыщенной гетероциклической группе, имеющей один или несколько атомов азота, которая необязательно включает гетероатом, отличный от атома азота, и включает, например, морфолиногруппу.
[0030]
Используемый в настоящем документе термин «азотсодержащая насыщенная гетероциклическая карбонильная группа» относится к карбонильной группе, к которой присоединена азотсодержащая насыщенная гетероциклическая группа, и включает, например, морфолинокарбонильную группу.
[0031]
Термин «C1-C14-ацильная группа», как используется в настоящем документе, относится к карбонильной группе, к которой присоединен атом водорода, C1-C6-алкильная группа, C6-C14-ароматическая углеводородная группа или ненасыщенная гетероциклическая группа и включает, например: формильную группу; (C1-C6-алкил) карбонильную группу, такую как ацетильная группа, пропаноильная группа, бутаноильная группа; (C3-C6-циклоалкил) карбонильную группу, такую как циклопропаноильная группа, циклобутаноильная группа; или (C6-C13) арилкарбонильную группу, такую как бензоильная группа, нафтилкарбонильная группа, флуоренилкарбонильная группа.
[0032]
Термин «C1-C14 ациламиногруппа», как используется в настоящем документе, относится к аминогруппе, в которой один или два атома водорода замещены C1-C14-ацильной группой и включает, например, ацетиламиногруппу, пропаноиламиногруппу, бутаноиламиногруппу, циклопропаноиламиногруппу.
[0033]
Термин «С2-С7 алкоксикарбонильная группа», как используется в настоящем документе, относится к карбонильной группе, к которой присоединена С1-С6-алкоксигруппа, и включает, например, метоксикарбонильную группу, этоксикарбонильную группу, н-пропоксикарбонильную группу, изопропоксикарбонильную группу, н-бутоксикарбонильную группу, трет-бутоксикарбонильную группу и тому подобное.
[0034]
Термин «C1-C14 ацилоксигруппа», как используется в настоящем документе, относится, например, к формилоксигруппе; (C1-C6-алкил) карбонилоксигруппе, такой как метилкарбонилоксигруппа, этилкарбонилоксигруппа, н-пропилкарбонилоксигруппа, изопропилкарбонилоксигруппа, н-бутилкарбонилоксигруппа, изобутилкарбонилоксигруппа, трет-бутилкарбонилоксигруппа, н-пентилкарбонилоксигруппа, изо-пентилкарбонилоксигруппа, гексилкарбонилоксигруппа и тому подобное; (C3-C6-циклоалкил) карбонилоксигруппе, такой как циклопропаноилоксигруппа, циклобутаноилоксигруппа и тому подобное; (C6-C13 арил) карбонилоксигруппе, такой как фенилкарбонилоксигруппа, нафтилкарбонилоксигруппа, флуоренилкарбонилоксигруппа и тому подобное.
[0035]
Термин «C7-C13 аралкилоксигруппа», как используется в настоящем документе, относится к алкилоксигруппе, в которой один атом водорода замещен арильной группой, и включает, например, бензилоксигруппу, фенетилоксигруппу, нафтилметилоксигруппу, флуоренилметилоксигруппу и тому подобное.
[0036]
Выражение «насыщенное или частично ненасыщенное углеводородное кольцо», как используется в настоящем документе, относится к моноциклическому или полициклическому насыщенному или частично ненасыщенному углеводородному кольцу и включает, например, циклопропановое кольцо, циклобутановое кольцо, циклопентановое кольцо, циклогексановое кольцо, циклогептановое кольцо, циклооктановое кольцо, циклобутеновое кольцо, циклопентеновое кольцо, циклогексеновое кольцо, циклогептеновое кольцо, циклооктадиеновое кольцо и тому подобное.
[0037]
Выражение «насыщенное или частично ненасыщенное гетероциклическое кольцо», как используется в настоящем документе, относится к моноциклическому или полициклическому насыщенному или частично ненасыщенному гетероциклическому кольцу, имеющему гетероатом, выбранный из атомов азота, атома серы и атома кислорода, и включает, например, оксирановое кольцо, азецидиновое кольцо, пирролидиновое кольцо, имидазолидиновое кольцо, пиперидиновое кольцо, пиперазиновое кольцо, морфолиновое кольцо, тетрагидрофурановое кольцо, тетрагидропирановое кольцо, диоксановое кольцо, тетрагидротиофеновое кольцо, дигидропирановое кольцо, дигидрофурановое кольцо и тому подобное.
[0038]
Термин «спиро-гетероциклическая группа», как используется в настоящем документе, относится к насыщенной или ненасыщенной спиро-гетероциклической группе, имеющей спиро-атом углерода и гетероатом, выбранный из атома азота, атома серы и атома кислорода, и включает, например, 2-окса-6-азаспиро[3,4]октанильную группу, 2-окса-7-азаспиро[3,5]нонанильную группу и тому подобное.
[0039]
Используемый в настоящем документе термин «мостиковая гетероциклическая группа» относится к мостиковой гетероциклической группе, имеющей более одного кольца, которые имеют два атома углерода в голове мостика и гетероатом, выбранный из атома азота, атома серы и атома кислорода, и включает, например, 3-окса-8-азабицикло[3.2.1]октанильную группу, 8-окса-3-азабицикло[3.2.1]октанильную группу и тому подобное.
[0040]
В соединениях, представленных формулой (I) по настоящему описанию, X1 представляет собой атом кислорода или атом серы. X1 предпочтительно представляет собой атом кислорода.
[0041]
В соединениях, представленных формулой (I) по настоящему описанию, X2 представляет собой атом кислорода или -NH-. X2 предпочтительно представляет собой атом кислорода.
[0042]
В соединениях, представленных формулой (I) по настоящему описанию, X3 представляет собой -NH- или атом кислорода. X3 предпочтительно представляет собой -NH-.
[0043]
В соединения формулы (I) X4 представляет собой атом водорода или C1-C6 алкильную группу.
«C1-C6 алкильная группа», представленная X4, предпочтительно представляет собой C1-C3 алкильную группу, более предпочтительно, метильную группу.
X4 предпочтительно представляет собой атом водорода или метильную группу, более предпочтительно, атом водорода.
[0044]
В соединениях формулы (I) R1 представляет собой -C(R11)(R12)- или -C(=CH2)-.
В -C(R11)(R12)- R11 и R12 являются одинаковыми или различными и представляют собой атом водорода, атом галогена, гидрокси группу или C1-C6 алкильную группу, альтернативно, взятые вместе с атомами углерода, к которым они присоединены, образуют насыщенное углеводородное кольцо, имеющее от 3 до 8 атомов углерода.
«Атом галогена», представленный R11 и R12, предпочтительно представляет собой атом фтора, атом хлора, атом брома, более предпочтительно, атом фтора.
«C1-C6 алкильная группа», указанная в R11 и R12, предпочтительно представляет собой C1-C3 алкильную группу, более предпочтительно, метильную группу или этильную группу, более предпочтительно, метильную группу.
«Насыщенное углеводородное кольцо, содержащее от 3 до 8 атомов углерода», которое образовано путем объединения R11 и R12 вместе с атомами углерода, к которым они присоединены, предпочтительно, представляет собой моноциклическое насыщенное углеводородное кольцо с 3-6 атомами углерода и, более предпочтительно, циклопропановое кольцо.
Предпочтительно, R11 представляет собой атом галогена, гидрокси группу или C1-C6 алкильную группу и R12 представляет собой атом водорода, атом галогена, гидрокси группу или C1-C6 алкильную группу, альтернативно, R11 и R12, взятые вместе с атомами углерода, к которым они присоединены, образуют насыщенное углеводородное кольцо, имеющее от 3 до 8 атомов углерода. Более предпочтительно, R11 представляет собой C1-C6 алкильную группу и R12 представляет собой атом водорода, и, более предпочтительно, R11 представляет собой метильную группу и R12 представляет собой атом водорода.
R1, предпочтительно, представляет собой -C(R11)(R12)-, R11 представляет собой атом галогена, гидрокси группу или C1-C6 алкильную группу и R12 представляет собой атом водорода, атом галогена, гидрокси группу или C1-C6 алкильную группу, альтернативно, R11 и R12, взятые вместе с атомами углерода, к которым они присоединены, образуют насыщенное углеводородное кольцо, имеющее от 3 до 8 атомов углерода. Более предпочтительно, -C(R11)(R12)- и R11 представляют собой C1-C6 алкильную группу, R12 представляет собой атом водорода. Даже более предпочтительно, он представляет собой -CH(CH3)-.
[0045]
В соединениях формулы (I) R2 представляет собой C6-C14 ароматическую углеводородную группу или 9-10 членную полностью ненасыщенную гетероциклическую группу.
«C6-C14 ароматическая углеводородная группа» представленная R2, предпочтительно, представляет собой C6-C10 ароматическую углеводородную группу, более предпочтительно, фенильную группу или нафтильную группу, даже более предпочтительно, фенильную группу.
Более того, «полностью ненасыщенная гетероциклическая группа, являющаяся 9-10 членной», представленная R2, предпочтительно, представляет собой бициклическую 9-10 членную полностью ненасыщенную гетероциклическую группу, имеющую 1-3 гетероатома, выбранную из атома азота, атома серы и атома кислорода, более предпочтительно, бициклическую 9-10 членную полностью ненасыщенную гетероциклическую группу, имеющую 1-2 гетероатома, выбранных из атома азота и атом серы, даже более предпочтительно, бензотиофенильную группу, бензотиазолильную группу, хинолильную группу.
[0046]
В соединениях формулы (I) R2 может быть незамещенным или иметь заместитель. Кроме того, когда R2 имеет два заместителя на атомах углерода, соседних по отношению друг к другу в ароматическом углеводородном кольце, R2 может образовывать 4-8-членное насыщенное или частично ненасыщенное углеводородное кольцо или гетероциклическое кольцо, имеющее заместитель(и), где заместители конденсированы с образованием кольца вместе с атомом углерода, к которому они присоединены.
Когда R2 имеет заместитель, положение заместителя особо не ограничивается, но, например, предпочтительным является 2, 3, 5, или 6-положение, когда R2 представляет собой фенильную группу. Более того, число заместителей особо не ограничивается, но, предпочтительно, равно нулю, то есть нет замещения, или составляет 1-4 заместителя, и, более предпочтительно, 1-4 или 1-3. Когда число заместителей составляет два или более, виды заместителей могут быть одинаковыми или различными.
В соединениях формулы (I), предпочтительно, R2 может быть замещен «заместителем», более предпочтительно, R2 может быть замещен R21. Также, предпочтительно, когда R2 имеет два заместителя на атомах углерода, соседних по отношению друг к другу в ароматическом углеводородном кольце, заместители могут быть связаны вместе с атомом углерода, к которому они присоединены, с образованием насыщенного или частично ненасыщенного 4-8 членного углеводородного кольца или гетероциклического кольца, необязательно замещенного Rz.
R21, который может быть заместителем R2, представляет собой атом галогена, аминокарбонильную группу, циано группу, C1-C6 алкильную группу, которая может быть замещена Rx, C3-C6 циклоалкильную группу, которая может быть замещена Rx, C2-C6 алкинильную группу, которая может быть замещена Rx, C6-C14 ароматическую углеводородную группу, которая может быть замещена Ry, или ненасыщенное 5-10 членное гетероциклическое кольцо, которое может быть замещено Rz.
Положение, в котором R21 является заместителем, особо не ограничивается, но находится, например, предпочтительно, во 2, 3, 5, или 6-положении, когда R2 представляет собой фенильную группу. Более того, число заместителей R21 особо не ограничивается, но, предпочтительно, равно нулю, то есть нет замещения или составляет 1-4 заместителя, более предпочтительно, 1-4 или 1-3. Когда число заместителей R21 составляет два или более, виды заместителей могут быть одинаковыми или различными.
[0047]
«Атом галогена», указанный в R21, предпочтительно, представляет собой атом фтора, атом хлора или атом брома.
[0048]
«C1-C6 алкильная группа» в «C1-C6 алкильной группе, которая может быть замещена Rx», указанной в R21, предпочтительно, представляет собой C1-C3 алкильную группу, более предпочтительно, метильную группу или этильную группу.
Заместитель Rx в «C1-C6 алкильной группе, которая может быть замещена Rx», указанной в R21, представляет собой атом галогена или C6-C14 ароматическую углеводородную группу. Заместитель Rx, предпочтительно, представляет собой атом галогена, более предпочтительно, атом фтора. Число Rx, которые являются заместителями в C1-C6 алкильной группе, особо не ограничивается, но, предпочтительно, равно нулю, то есть, нет замещения, или 1-3. Когда число заместителей Rx составляет 2 или более, виды заместителей могут быть одинаковыми или различными.
[0049]
«C3-C6 циклоалкильная группа» в «C3-C6 циклоалкильной группе, которая может быть замещена Rx», указанной в R21, предпочтительно, представляет собой циклопропильную группу.
Rx в «C3-C6 циклоалкильной группе, которая может быть замещена Rx», указанной в R21, представляет собой атом галогена как указано выше, или C6-C14 ароматическую углеводородную группу, предпочтительно, атом галогена, более предпочтительно, атом фтора. Число Rx заместителей в C3-C6 циклоалкильной группе особо не ограничивается, но, предпочтительно, равно нулю, то есть нет замещения, или составляет 1 заместитель, более предпочтительно, 0. Когда число заместителей Rx составляет 2 или более, виды заместителей могут быть одинаковыми или различными.
[0050]
«C2-C6 алкинильная группа» в «C2-C6 алкинильной группе, которая может быть замещена Rx», указанной в R21, предпочтительно, представляет собой C2-C4 алкинильную группу, более предпочтительно, этинильную группу.
Заместитель Rx в «C2-C6 алкинильной группе, которая может быть замещена Rx», указанной в R21, представляет собой атом галогена, как указано выше, или C6-C14 ароматическую углеводородную группу, предпочтительно, C6-C14 ароматическую углеводородную группу, более предпочтительно, C6-C10 ароматическую углеводородную группу, более предпочтительно, фенильную группу.
Число Rx заместителей в C2-C6 алкинильной группе особо не ограничивается, но, предпочтительно, равно нулю, то есть нет замещения, или составляет 1 заместитель, более предпочтительно, 1. Когда число заместителей Rx составляет 2 или более, виды заместителей могут быть одинаковыми или различными.
[0051]
«C6-C14 ароматическая углеводородная группа» в «C6-C14 ароматической углеводородной группе, которая может быть замещена Ry», указанной в R21, предпочтительно, представляет собой C6-C10 ароматическую углеводородную группу, более предпочтительно, фенильную группу.
Заместитель Ry в «C6-C14 ароматической углеводородной группе, которая может быть замещена Ry», указанной в R21, представляет собой атом галогена или C1-C6 алкокси группу.
Атом галогена, указанный в Ry, предпочтительно, представляет собой атом фтора или атом хлора. Также, C1-C6 алкокси группа, указанная в Ry, предпочтительно, представляет собой C1-C3 алкокси группу, более предпочтительно, метокси группу. Заместитель Ry в «C6-C14 ароматической углеводородной группе, которая может быть замещена Ry», указанной в R21, предпочтительно, представляет собой атом фтора, атом хлора или C1-C3 алкокси группу, более предпочтительно, атом фтора, атом хлора или метокси группу. Число Ry заместителей в C6-C14 ароматической углеводородной группе особо не ограничивается, но, предпочтительно, равно нулю, то есть нет замещения, или составляет 1 или 2. Когда число заместителей Ry составляет 2 или более, виды заместителей могут быть одинаковыми или различными.
[0052]
«5-10-членная ненасыщенная гетероциклическая группа» в «5-10-членной ненасыщенной гетероциклической группе, необязательно замещенной Rz», указанной в R21, предпочтительно, представляет собой полностью или частично ненасыщенную моноциклическую или бициклическую 5-10 членную гетероциклическую группу, имеющую 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода, более предпочтительно, моноциклическую или бициклическую 5-10-членную ненасыщенную гетероциклическую группу, имеющую 1-3 гетероатома, выбранных из атома азота, атома серы или атома кислорода, более предпочтительно, моноциклическую 5-6 членную ненасыщенную гетероциклическую группу, имеющую 1-3 атома азота или атома кислорода. Предпочтительно, она представляет собой пирролильную группу, имидазолильную группу, пиразолильную группу, пиридильную группу, пиримидильную группу, оксазолильную группу, дигидропиридооксазинильную группу, более предпочтительно, пиразолильную группу, пиридильную группу, пиримидильную группу, оксазолильную группу, дигидропиридооксазинильную группу, более предпочтительно, пиразолильную группу.
Заместитель Rz в «5-10-членной ненасыщенной гетероциклической группе, необязательно замещенной Rz», указанной в R21, представляет собой атом галогена, C1-C6 алкильную группу, галоген C1-C6 алкильную группу, C3-C6 циклоалкильную группу, C1-C6 алкокси группу, C6-C14 ароматическую углеводородную группу, азотсодержащую насыщенную гетероциклическую группу или азотсодержащую насыщенную гетероциклическую карбонильную группу.
«Атом галогена», указанный в Rz, предпочтительно, представляет собой атом фтора или атом хлора.
«C1-C6 алкильная группа», указанная в Rz, предпочтительно, представляет собой C1-C3 алкильную группу, более предпочтительно, метильную группу или этильную группу.
«Галоген C1-C6 алкильная группа», указанная в Rz, предпочтительно, представляет собой галоген C1-C3 алкильную группу, более предпочтительно, дифторметильную группу или трифторметильную группу.
«C3-C6 циклоалкильная группа», указанная в Rz, предпочтительно, представляет собой циклопропильную группу или циклобутильную группу.
«C1-C6 алкокси группа», указанная в Rz, предпочтительно, представляет собой C1-C3 алкокси группу, более предпочтительно, метокси группу.
«C6-C14 ароматическая углеводородная группа», указанная в Rz, предпочтительно, представляет собой фенильную группу.
«Азотсодержащая насыщенная гетероциклическая группа», представленная Rz, предпочтительно, представляет собой морфолино группу или пиперидинильную группу.
«Азотсодержащая насыщенная гетероциклическая карбонильная группа», указанная в Rz, предпочтительно, представляет собой морфолинокарбонильную группу.
Заместитель Rz в «5-10-членной ненасыщенной гетероциклической группе, необязательно замещенной Rz», предпочтительно, представляет собой атом галогена, C1-C6 алкильную группу, галоген C1-C6 алкильную группу, C3-C6 циклоалкильную группу, C1-C6 алкокси группу, фенильную группу, морфолино группу, пиперидинильную группу или морфолинокарбонильную группу, более предпочтительно, C1-C6 алкильную группу, более предпочтительно, метильную группу. Число Rz, который является заместителем 5-10-членной ненасыщенной гетероциклической группы, особо не ограничивается, но, предпочтительно, равно нулю, то есть нет замещения, или, предпочтительно, составляет1 или 2. Когда число заместителей Rz равно 2 или более, виды заместителей может быть одинаковыми или различными.
[0053]
R21, который может быть заместителем в R2, предпочтительно, представляет собой, атом галогена, аминокарбонильную группу, циано группу, C1-C6 алкильную группу (необязательно замещенную атомом галогена), C3-C6 циклоалкильную группу, C2-C6 алкинильную группу (необязательно замещенную C6-C14 ароматической углеводородной группой), C6-C14 ароматическую углеводородную группу (необязательно замещенную группой, выбранной из атома галогена и C1-C6 алкокси группы) или моноциклическую или бициклическую 5-10-членную ненасыщенную гетероциклическую группу, имеющую от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, (необязательно замещенную группой, выбранной из атома галогена, C1-C6 алкильной группы, галоген C1-C6 алкильной группы, C3-C6 циклоалкильной группы, C1-C6 алкокси группы, C6-C14 ароматической углеводородной группы, азотсодержащей насыщенной гетероциклической группы и азотсодержащей насыщенной гетероциклической карбонильной группы).
Более предпочтительно, это атом галогена, циано группа, C1-C6 алкильная группа (необязательно замещенная атомом галогена), C3-C6 циклоалкильная группа, фенильная группа (необязательно замещенная группой, выбранной из группы, включающей атом галогена или C1-C6 алкокси группу), или моноциклическая или бициклическая 5-10-членная ненасыщенная гетероциклическая группа, имеющая от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, (необязательно замещенная группой, выбранной из атома галогена, C1-C6 алкильной группы, галоген C1-C6 алкильной группы, C3-C6 циклоалкильной группы, C1-C6 алкокси группы, морфолино группы, пиперидинильной группы и морфолинокарбонильной группы).
Более предпочтительно, это атом галогена, C1-C6 алкильная группа или моноциклическая 5 или 6-членная ненасыщенная гетероциклическая группа, имеющая от 1 до 3 атомов азота (необязательно замещенная C1-C6 алкильной группой).
Более предпочтительно, это атом галогена или C1-C6 алкильная группа.
[0054]
В соединениях формулы (I), когда число заместителей в R2 составляет 2 или более, и имеются два заместителя на атомах углерода, которые являются соседними по отношению друг к другу в ароматическом углеводородном кольце, «4-8-членное насыщенное или частично ненасыщенное углеводородное кольцо или гетероциклическое кольцо, которые могут иметь заместитель(и)», которое образуется путем объединения заместителей и атома углерода, к которым они присоединены, представляет собой кольцо, например, кольцо, конценсированное с бензольным кольцом». Насыщенное или частично ненасыщенное 4-8-членное углеводородное кольцо или гетероциклическое кольцо» в «4-8 членном насыщенном или частично ненасыщенном углеводородном кольце или гетероциклическом кольце, которое может иметь заместитель(и)», предпочтительно, представляет собой моноциклическое насыщенное или частично ненасыщенное углеводородное кольцо или моноциклического 4-8-членное насыщенное или частично ненасыщенное гетероциклическое кольцо, имеющее от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атомов кислорода, более предпочтительно, насыщенное или частично ненасыщенное углеводородное кольцо, имеющее 4-8 атомов углерода, более предпочтительно, моноциклическое насыщенное или частично ненасыщенное углеводородное кольцо, имеющее от 4 до 6 атомов углерода или моноциклическое 4-6 членное насыщенное или частично ненасыщенное гетероциклическое кольцо, имеющее от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, и, даже более предпочтительно, моноциклическое насыщенное или частично ненасыщенное углеводородное кольцо, имеющее 5 или 6 атомов углерода, более предпочтительно, насыщенное углеводородное кольцо, имеющее 5 атомов углерода.
Заместитель Rz в «4-8-членном насыщенном или частично ненасыщенном углеводородном кольце или гетероциклическом кольце, необязательно замещенном Rz», представляет собой, как указано выше, атом галогена, C1-C6 алкильную группу, галоген C1-C6 алкильную группу, C3-C6 циклоалкильную группу, C1-C6 алкокси группу, C6-C14 ароматическую углеводородную группу, азотсодержащую насыщенную гетероциклическую группу или азотсодержащую насыщенную гетероциклическую карбонильную группу, предпочтительно, C1-C6 алкильную группу, и, более предпочтительно, C1-C3 алкильную группу, и, даже более предпочтительно, метильную группу. Число Rz, которые являются заместителями в насыщенном или частично ненасыщенном углеводородном кольце или гетероциклическом кольце особо не ограничивается, но, предпочтительно, равно нулю, то есть нет замещения, или равно одному, более предпочтительно, равно нулю, то есть нет замещения. Когда число заместителей Rz составляет 2 или более, виды заместителей могут быть одинаковыми или различными.
[0055]
«Насыщенное или частично ненасыщенное 4-8 членное углеводородное кольцо или гетероциклическое кольцо, необязательно замещенное Rz», предпочтительно, представляет собой моноциклическое насыщенное или частично ненасыщенное углеводородное кольцо, имеющее 4-8 атомов углерода, которое необязательно замещено Rz, или моноциклическое 4-8 членное насыщенное или частично ненасыщенное гетероциклическое кольцо, имеющее от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, более предпочтительно, моноциклическое насыщенное или частично ненасыщенное углеводородное кольцо, имеющее 4-8 атомов углерода, (которое может быть замещено C1-C6 алкильной группой) или моноциклическое насыщенное или частично ненасыщенное 4-8 членное гетероциклическое кольцо, имеющее 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода, (необязательно замещенное C1-C6 алкильной группой), более предпочтительно, насыщенное или частично ненасыщенное моноциклическое углеводородное кольцо, имеющее 4-8 атомов углерода, (необязательно замещенное C1-C6 алкильной группой), более предпочтительно, моноциклическое насыщенное или частично ненасыщенное углеводородное кольцо, имеющее 5 или 6 атомов углерода, (необязательно замещенное C1-C6 алкильной группой).
[0056]
В соединениях, представленных формулой (I), конденсированное кольцо, которое образуется, когда соединение имеет два заместителя на атомах углерода, соседних по отношению друг к другу в ароматическом углеводородном кольце, R2, представляет собой, например, дигидроинденовое кольцо, тетрагидронафталиновое кольцо, дигидробензофурановое кольцо.
[0057]
В соединениях, представленных формулой (I), R2, предпочтительно, представляет собой C6-C14 ароматическую углеводородную группу или бициклическую полностью ненасыщенную 9-10 членную гетероциклическую группу, имеющую от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атомов кислорода, и R2 может быть замещен R21, и, когда R2 имеет два заместителя на атомах углерода, соседних по отношению друг к другу в ароматическом углеводородном кольце, R2 может представлять собой моноциклическое насыщенное или частично ненасыщенное углеводородное кольцо, имеющее 4-8 атомов углерода, (необязательно замещенное C1-C6 алкильной группой), где заместители конденсированы вместе с атомом углерода, к которому присоединен каждый из заместителей, или моноциклическое 4-8 членное насыщенное или частично ненасыщенное гетероциклическое кольцо, имеющее от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атомов кислорода (необязательно замещенное C1-C6 алкильной группой); и
R21 представляет собой атом галогена, аминокарбонильную группу, циано группу, C1-C6 алкильную группу (необязательно замещенную атомом галогена), C3-C6 циклоалкильную группу, C2-C6 алкинильную группу (необязательно замещенную C6-C14 ароматической углеводородной группой), C6-C14 ароматическую углеводородную группу (необязательно замещенную группой, выбранной из группы, включающей атом галогена и C1-C6 алкокси группу) или моноциклическое или бициклическое 5-10 членное ненасыщенное гетероциклическое кольцо, имеющее от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, (необязательно замещенное группой, выбранной из группы, включающей атом галогена, C1-C6 алкильную группу, галоген C1-C6 алкильную группу, C3-C6 циклоалкильную группу, C1-C6 алкокси группу, C6-C14 ароматическую углеводородную группу, азотсодержащую насыщенную гетероциклическую группу и азотсодержащую насыщенную гетероциклическую карбонильную группу).
[0058]
В соединениях, представленных формулой (I), R2, более предпочтительно, представляет собой C6-C14 ароматическую углеводородную группу, где R2 может быть замещен R21, и, когда R2 имеет два заместителя на атомах углерода, соседних по отношению друг к другу в ароматическом углеводородном кольце, R2 может образовывать моноциклическое насыщенное или частично ненасыщенное углеводородное кольцо, имеющее 4-8 атомов углерода, (необязательно замещенное C1-C6 алкильной группой), где заместители конденсированы вместе с атомом углерода, к которому присоединен каждый из заместителей;
R21 представляет собой атом галогена, циано группу, C1-C6 алкильную группу (необязательно замещенную атомом галогена), C3-C6 циклоалкильную группу, фенильную группу (необязательно замещенную группой, выбранной из группы, включающей атом галогена и C1-C6 алкокси группу) или моноциклическое или бициклическое 5-10 членное ненасыщенное гетероциклическое кольцо, имеющее от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, (необязательно замещенное группой, выбранной из группы, включающей атом галогена, C1-C6 алкильную группу, галоген C1-C6 алкильную группу, C3-C6 циклоалкильную группу, C1-C6 алкокси группу, морфолино группу, пиперидинильную группу и морфолинокарбонильную группу).
[0059]
Также в соединениях, представленных формулой (I), R2, более предпочтительно, представляет собой C6-C10 ароматическую углеводородную группу, где R2 может быть замещен R21, и, когда R2 имеет два заместителя на атомах углерода, соседних по отношению друг к другу в ароматическом углеводородном кольце, R2 может образовывать моноциклическое насыщенное или частично ненасыщенного углеводородное кольцо, имеющее 5 или 6 атомов углерода, (необязательно замещенное C1-C6 алкильной группой), где заместители конденсированы вместе с атомом углерода, к которому присоединен каждый из заместителей; и
R21 представляет собой атом галогена, C1-C6 алкильную группу или моноциклическое 5 или 6-членное ненасыщенное гетероциклическое кольцо, имеющее 1-3 атома азота, (необязательно замещенное C1-C6 алкильной группой).
[0060]
Также в соединениях, представленных формулой (I), R2 особенно предпочтительно представляет собой фенильную группу или нафтильную группу (необязательно замещенную группой, выбранной из группы, включающей атом галогена и C1-C6 алкильную группу); инданильную группу (2,3-дигидро-1H-инденильную группу) или тетрагидронафтильную группу.
[0061]
В соединениях, представленных формулой (I), R3 представляет собой C6-C14 ароматическую углеводородную группу или 5-10-членную полностью ненасыщенную гетероциклическую группу.
«C6-C14 ароматическая углеводородная группа», указанная в R3, предпочтительно, представляет собой C6-C10 ароматическую углеводородную группу, более предпочтительно, фенильную группу или нафтильную группу, особенно предпочтительно, фенильную группу.
[0062]
«5-10-членная полностью ненасыщенная гетероциклическая группа», указанная в R3, представляет собой моноциклическую или бициклическую 5-10-членную полностью ненасыщенную гетероциклическую группу, имеющую 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода, более предпочтительно, моноциклическую или бициклическую 5-7-членную полностью ненасыщенную гетероциклическую группу, имеющую 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода, особенно предпочтительно, моноциклическое 5-6-членное полностью ненасыщенное гетероциклическое кольцо, имеющее 1-3 гетероатома, выбранных из атома азота, атома серы и атомов кислорода. Предпочтительно, имидазолильную группу, пиридильную группу, тиофенильную группу, индолильную группу, индазолильную группу, бензопиранильную группу, бензотриазолильную группу, бензотиадиазолильную группу, изоксазолильную группу, хинолильную группу, более предпочтительно, имидазолильную группу, пиридильную группу, тиофенильную группу, индолильную группу, индазолильную группу, бензопиранильную группу, бензотриазолильную группу, бензотиадиазолильную группу, хинолильную группу, более предпочтительно, пиридильную группу, тиофенильную группу, индолильную группу, индазолильную группу, бензопиранильную группу, бензотриазолильную группу, хинолильную группу, более предпочтительно, пиридильную группу.
[0063]
В соединениях, представленных формулой (I), R3 может быть незамещенным или иметь заместитель. Также, когда R3 имеет два заместителя на атомах углерода, соседних по отношению друг к другу в ароматическом углеводородном кольце, R3 может образовывать 4-8-членное насыщенное или частично ненасыщенное углеводородное кольцо или гетероциклическое кольцо, которое может быть замещено, где заместители конденсированы вместе с атомом углерода, к которому присоединен каждый из заместителей; и
когда R3 имеет заместитель, положение заместителя особо не ограничивается. Хотя число заместителей не ограничивается, особенно предпочтительно, оно равно 0, то есть замещение отсутствует. Альтернативно, число заместителей составляет от 1 до 4, более предпочтительно, от 1 до 3. Когда число заместителей составляет два или более, виды заместителей могут быть одинаковыми или различными.
В соединениях, представленных формулой (I), предпочтительно, R3 может быть замещен «заместителем», более предпочтительно, R3 может быть замещен R31. Также, предпочтительно, когда R3 имеет два заместителя на атомах углерода, соседних по отношению друг к другу в ароматическом углеводородном кольце, R3 может образовывать 4-8-членное насыщенное или частично ненасыщенное углеводородное кольцо или гетероциклическое кольцо, которое может быть замещено Rc, где заместители конденсированы вместе с атомом углерода, к которому присоединен каждый из заместителей.
R31, который может быть замещен R3, представляет собой атом галогена, циано группу, нитро группу, карбоксильную группу, тиоамидную группу, C1-C6 алкильную группу, которая может быть замещена Ra, амино группу, которая может быть замещена Ra, C3-C6 циклоалкильную группу, которая может быть замещена Rb, C1-C6 алкокси группу, которая может быть замещена Rb, C2-C7 алкоксикарбонильную группу, C1-C14 ацильную группу, которая может быть замещена Rb, C6-C14 ароматическую углеводородное кольцо, которое может быть замещено Rb, 5-10-членное ненасыщенное гетероциклическое кольцо, которое может быть замещено Rc, аминокарбонильную группу, которая может быть замещена Rd и Re, или -S(=O)2Rf.
Хотя число заместителей не ограничивается, особенно предпочтительно, оно равно 0, то есть замещение отсутствует. Альтернативно, число заместителей составляет от 1 до 4, более предпочтительно, от 1 до 3. Когда число заместителей составляет два или более, виды заместителей могут быть одинаковыми или различными.
[0064]
«Атом галогена», указанный в R31, предпочтительно, представляет собой атом фтора, атом хлора или атом брома, более предпочтительно, том хлора или атом брома.
[0065]
«C1-C6 алкильная группа» в «C1-C6 алкильной группе, которая может быть замещена Ra», указанной в R31, предпочтительно, представляет собой C1-C3 алкильную группу, более предпочтительно, метильную группу.
Заместитель Ra в «C1-C6 алкильной группе, которая может быть замещена Ra», указанной в R31, представляет собой атом галогена, гидрокси группу, C1-C14 ацильную группу, C1-C14 ацилокси группу, C2-C6 алкинильную группу или C1-C6 алкокси C1-C6 алкокси группу.
«Атом галогена», указанный в Ra, предпочтительно, представляет собой атом фтора.
«C1-C14 ацильная группа», указанная в Ra, предпочтительно, представляет собой ацетильную группу.
«C1-C14 ацилокси группа», указанная в Ra, предпочтительно, представляет собой ацетилокси группу.
«C2-C6 алкинильная группа», указанная в Ra, предпочтительно, представляет собой этинильную группу, 1-пропинильную группу.
«C1-C6 алкокси C1-C6 алкокси группа», указанная в Ra, предпочтительно, представляет собой метоксиметокси группу.
Заместитель Ra в «C1-C6 алкильной группе, которая может быть замещена Ra», указанной в R31, предпочтительно, представляет собой атом галогена, гидрокси группу, C1-C6 ацилокси группу, C2-C6 алкинильную группу или C1-C6 алкокси C1-C6 алкокси группу, более предпочтительно, атом галогена или гидрокси группу. Хотя число Ra, которым замещена C1-C6 алкильная группа, особо не ограничивается, предпочтительно, оно равно 0, то есть замещение отсутствует, или составляет один или более. Когда число заместителей Ra составляет 2 или более, виды заместителей могут быть одинаковыми или различными.
[0066]
Ra в «амино группе, необязательно замещенной Ra», указанной в R31, представляет собой атом галогена, гидрокси группу, C1-C14 ацильную группу, C1-C14 ацилокси группу, C2-C6 алкинильную группу или C1-C6 алкокси C1-C6 алкокси группу, предпочтительно, C1-C14 ацильную группу, более предпочтительно, ацетильную группу.
Число Ra заместителей амино группы особо не ограничивается, предпочтительно, оно равно 0, то есть замещение отсутствует, или составляет 1, более предпочтительно, 0.
[0067]
«C3-C6 циклоалкильная группа» в «C3-C6 циклоалкильной группе, необязательно замещенной Rb», указанной в R31, предпочтительно, представляет собой циклопропильную группу.
Rb в «C3-C6 циклоалкильной группе, необязательно замещенной Rb», указанной в R31, представляет собой атом галогена, амино группу или C1-C6 алкокси группу.
«Атом галогена», указанный в Rb, предпочтительно, представляет собой атом фтора.
«C1-C6 алкокси группа», указанная в Rb, предпочтительно, представляет собой C1-C3 алкокси группу, более предпочтительно, метокси группу.
Rb в «C3-C6 циклоалкильной группе, необязательно замещенной Rb», указанной в R31, предпочтительно,представляет собой амино группу. Число Rb заместителей в C3-C6 циклоалкильной группе особо не ограничивается, предпочтительно, оно равно 0, то есть замещение отсутствует, или составляет 1, более предпочтительно, 0. Когда число заместителей Rb составляет два или более, виды заместителей могут быть одинаковыми или различными.
[0068]
«C1-C6 алкокси группа» в «C1-C6 алкокси группе, необязательно замещенной Rb», указанной в R31, предпочтительно, представляет собой C1-C3 алкокси группу, более предпочтительно, метокси группу.
Rb в «C1-C6 алкокси группе, необязательно замещенной Rb», указанной в R31, представляет собой, как указано выше, атом галогена, амино группу или C1-C6 алкокси группу, предпочтительно, атом галогена, более предпочтительно, атом фтора. Хотя число Rb заместителей в C1-C6 алкокси группе не ограничивается, оно равно 0, то есть замещение отсутствует, или составляет один или два. Когда число заместителей Rb составляет два или более, виды заместителей могут быть одинаковыми или различными.
[0069]
«C2-C7 алкоксикарбонильная группа», указанная в R31, предпочтительно, представляет собой C2-C4 алкоксикарбонильную группу, более предпочтительно, метоксикарбонильную группу.
[0070]
«C1-C14 ацильная группа» в «C1-C14 ацильной группе, необязательно замещенной Rb», указанной в R31, предпочтительно, представляет собой ацетильную группу.
Rb в «C1-C14 ацильной группе, необязательно замещенной Rb», указанной в R31, представляет собой, как указано выше, атом галогена, амино группу или C1-C6 алкокси группу, предпочтительно, атом галогена, более предпочтительно, атом фтора. Хотя число Rb заместителей в C1-C14 ацильной группе не ограничивается, оно может быть равно 0, то есть замещение отсутствует, или составлять от одного до трех. Когда число заместителей Rb составляет два или более, виды заместителей могут быть одинаковыми или различными.
[0071]
«Тиоамидная группа», указанная в R31, предпочтительно, представляет собой -C(=S)-NH2.
[0072]
«C6-C14 ароматическая углеводородная группа» в «C6-C14 ароматической углеводородной группе, необязательно замещенной Rb», указанной в R31, предпочтительно, представляет собой C6-C10 ароматическую углеводородную группу, и, более предпочтительно, фенильную группу.
Заместитель Rb в «C6-C14 ароматической углеводородной группе, необязательно замещенной Rb», указанной в R31, представляет собой, как указано выше, атом галогена, амино группу или C1-C6 алкокси группу, и, предпочтительно, атом галогена или C1-C3 алкокси группу, и, более предпочтительно, атом галогена, и, более предпочтительно, атом фтора. Хотя число Rb заместителей в C6-C14 ароматической углеводородной группе особо не ограничивается, предпочтительно, равно нулю, то есть замещение отсутствует, или равно одному. Когда число заместителей Rb составляет 2 или более, виды групп могут быть одинаковыми или различными.
[0073]
«5-10-членная ненасыщенная гетероциклическая группа» в «5-10-членной ненасыщенной гетероциклической группе, необязательно замещенной Rc», указанной в R31, предпочтительно, представляет собой моноциклическую или бициклическую 5-10 членную полностью или частично ненасыщенную гетероциклическую группу, имеющую от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, более предпочтительно, моноциклическую 5-6-членную ненасыщенную гетероциклическую группу, имеющую от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода. Предпочтительно, представляет собой пирролильную группу, имидазолильную группу, пиразолильную группу, тетразолильную группу, изоксазолильную группу, оксадиазолильную группу, дигидрооксадиазолильную группу, предпочтительно, пиразолильную группу, 1,3,4-оксадиазолильную группу, 2,3-дигидро-1,3,4-оксазолильную группу.
Заместитель Rc в «5-10 членной ненасыщенной гетероциклической группе, необязательно замещенной одним или более Rc», указанной в R31, представляет собой атом галогена, гидрокси группу, амино группу, оксо группу, C1-C6 алкильную группу, необязательно замещенную гидрокси группой, галоген C1-C6 алкильную группу, C1-C14 ацил, или C1-C14 ациламино группу, C1-C14 ацилокси группу или C7-C13 аралкилокси группу.
«Атом галогена», указанный в Rc, предпочтительно, представляет собой атом фтора.
«C1-C6 алкильные группы, необязательно замещенные гидрокси группой», указанные в Rc, предпочтительно, представляют собой C1-C3 алкильную группу, необязательно замещенную гидрокси группой, и, более предпочтительно, метильную группу или гидроксиэтильную группу.
«Галоген C1-C6 алкильная группа», представленная Rc, предпочтительно, представляет собой галоген C1-C3 алкильную группу, более предпочтительно, трифторметильную группу, дифторэтильную группу.
«C1-C14 ацильная группа», указанна в Rc, предпочтительно, представляет собой ацетильную группу или циклопропаноильную группу.
«C1-C14 ациламино группа», указанная в Rc, предпочтительно, представляет собой ацетиламино группу.
«C1-C14 ацилокси группа», указанная в Rc, предпочтительно, представляет собой ацетилокси группу.
«C7-C13 аралкилокси группа», указанная в Rc, предпочтительно, представляет собой бензилокси группу.
Rc в «5-10-членной ненасыщенной гетероциклической группе, необязательно замещенной Rc», указанной в R31, предпочтительно, представляет собой атом галогена, C1-C6 алкильную группу или оксо группу, более предпочтительно, C1-C6 алкильную группу или оксо группу, более предпочтительно, C1-C6 алкильную группу. Хотя число Rc заместителей в 5-10-членной ненасыщенной гетероциклической группе особо не ограничивается, предпочтительно, оно равно нулю, то есть замещение отсутствует, или, предпочтительно, составляет один или более 2, более предпочтительно, равно нулю. Когда число заместителей Rc составляет 2 или более, виды групп могут быть одинаковыми или различными.
[0074]
«Аминокарбонильная группа, необязательно замещенная Rd и Re», указанная в R31, конкретно представлена следующей группой (II).
[0075]
[Формула 3]

[0076]
Rd и Re являются одинаковыми или различными и представляют собой: атом водорода; гидрокси группу; C7-C13 аралкилокси группу или C1-C6 алкильную группу, необязательно замещенную гидроксильными группами; альтернативно, взятые вместе с атомом азота, который является соседним по отношению к Rd и Re, образуют насыщенную или ненасыщенную 4-10-членную гетероциклическую кольцевую группу, необязательно замещенную амино группой, спиро гетероциклическую кольцевую группу или мостиковую гетероциклическую кольцевую группу.
«C7-C13 аралкилокси группа», указанная в Rd или Re, предпочтительно, представляет собой бензилокси группу.
«C1-C6 алкильная группа, необязательно замещенная гидрокси группами», указанная в Rd или Re, предпочтительно, представляет собой C1-C3 алкильную группу, необязательно замещенную гидрокси группой, более предпочтительно, метильную группу или гидроксиэтильную группу.
«Насыщенная гетероциклическая группа» в «4-10-членной насыщенной гетероциклической группе, необязательно замещенной амино группой», в Rd или Re, предпочтительно, представляет собой моноциклическую или бициклическую 4-10-членную насыщенную гетероциклическую группу, имеющую от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, предпочтительно, 5-6-членную моноциклическую насыщенную гетероциклическую группу, имеющую от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, более предпочтительно, азетидинильную группу, пирролидинильную группу, пиперидинo группу, пиперазинильную группу, морфолино группу.
«Ненасыщенная гетероциклическая группа» в «4-10-членной насыщенной или ненасыщенной гетероциклической группе, необязательно замещенной амино группой», которая образуется вместе с Rd или Re и соседними атомами азота, предпочтительно, представляет собой моноциклическую или бициклическую или 5-10-членную ненасыщенную гетероциклическую группу, имеющую от 1 до 3 гетероатомов, выбранных из атома азота, атом серы, атома кислорода, более предпочтительно, моноциклическую 5-6-членную ненасыщенную гетероциклическую группу, имеющую от 1 до 3 гетероатомов, выбранных из атома азота, атома серы, атома кислорода, особенно предпочтительно, пирролильную группу.
«Спиро гетероциклическая группа», образованная вместе с Rd или Re и соседним атомом азота, предпочтительно, представляет собой моноспиро гетероциклическую группу, более предпочтительно, оксоазаспиро нонанилкарбамоильную группу или азаспиро октанилкарбамоильную группу.
«Мостиковая гетероциклическая группа», образованная вместе с указанными Rd или Re и соседним атома азота, предпочтительно, представляет собой бициклическую мостиковую гетероциклическую группу, более предпочтительно, оксоазабициклооктанил карбамоильную группу.
Заместители Rd и Re в «аминокарбонильной группе, необязательно замещенной Rd и Re», указанной в R31, являются, предпочтительно, одинаковыми или различными и представляют собой гидрокси группу или C1-C6 алкильную группу, альтернативно, взятые вместе с соседним атомом азота, образуют моноциклическую 5-6-членную насыщенную гетероциклическую группу, которая может быть замещена амино группой, имеющей от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, моноспиро гетероциклическую группу или бициклическую мостиковую гетероциклическую группу.
«Аминокарбонильная группа, необязательно замещенная Rd и Re», указанная в R31, предпочтительно, представляет собой -CONH2 группу, (моно или ди-C1-C6 алкил)аминокарбонильную группу, гидроксиамино группу, (C7-C13 аралкил)оксиаминокарбонильную группу или циклическую аминокарбонильную группу, более предпочтительно, -CONH2 группу, (моно или ди-C1-C3 алкил)аминокарбонильную группу, гидроксиаминокарбонильную группу, бензилоксикарбонильную группу, пирролидин-1-илкарбонильную группу, пиперидин-1-илкарбонильную группу, пиперазин-1-илкарбонильную группу, морфолин-4-илкарбонильную группу, азетидин-1-илкарбонильную группу, оксо азабициклооктанилкарбонильную группу, оксо азаспиро нонанилкарбонильную группу, азаспиро октанилкарбонильную группу, более предпочтительно, -CONH2 группу, диметиламинокарбонильную группу или пирролидин-1-илкарбонильную группу.
[0077]
Rf в «-S(=O)2Rf», указанный в R31, представляет собой амино группу, C1-C6 алкильную группу или 4-10-членную насыщенную гетероциклическую группу.
C1-C6 алкильная группа, указанная в Rf, предпочтительно, представляет собой C1-C3 алкильную группу, более предпочтительно, метильную группу.
4-10-членная насыщенная гетероциклическая группа, указанная в Rf, предпочтительно, представляет собой моноциклическую или бициклическую 4-10-членную насыщенную гетероциклическую группу, имеющую от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, более предпочтительно, моноциклическую 5-6-членную насыщенную гетероциклическую группу, имеющую от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, более предпочтительно, пирролидинильную группу, пиперидинo группу или пиперазинильную группу.
«-S(=O)2Rf», указанный в R31, предпочтительно, представляет собой аминосульфонильную группу, метилсульфонильную группу или пиперидинoсульфонильную группу.
[0078]
R31, который может быть замещен R3, предпочтительно, представляет собой атом галогена, циано группу, нитро группу, карбоксильную группу, тиоамидную группу, C1-C6 алкильную группу (которая может быть замещена группой, выбранной из группы, включающей атом галогена, гидрокси группу, C1-C14 ацильную группу, C1-C14 ацилокси группу, C2-C6 алкинил и C1-C6 алкокси C1-C6 алкокси группу), амино группу (которая может быть замещена C1-C14 ацильной группой), C3-C6 циклоалкильную группу (которая может быть замещена амино группой), C1-C6 алкокси группу (которая может быть замещена атомами галогена), C2-C7 алкоксикарбонильную группу, C1-C14 ацильную группу (которая может быть замещена атомами галогена), C6-C14 ароматическую углеводородную группу (которая может быть замещена группой, выбранной из группы, включающей атом галогена, амино группу и C1-C6 алкокси группу), моноциклическое или бициклическое 5-10 членное ненасыщенное гетероциклическое кольцо, имеющее от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, (которое может быть замещено группой, включающей атом галогена, оксо группу и C1-C6 алкильную группу), аминокарбонильную группу, необязательно замещенную Rd и Re (где Rd и Re являются одинаковыми или различными и представляют собой атом водорода, гидрокси группу, C7-C13 аралкилокси группу или C1-C6 алкильную группу, которая может быть замещена гидроксильной группой, альтернативно, взятые вместе с соседним атомом азота образуют моноциклическую или бициклическую 4-10 членную насыщенного или ненасыщенную гетероциклическую группу, имеющую от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, спиро гетероциклическую группу или мостиковую гетероциклическую группу) или -S(=O)2Rf (где Rf представляет собой амино группу, C1-C6 алкильную группу или 4-10 членную насыщенную гетероциклическую группу).
Более предпочтительно, он представляет собой атом галогена, циано группу, нитро группу, карбоксильную группу, тиоамидную группу, C1-C6 алкильную группу (которая может быть замещена группой, выбранной из группы, включающей атом галогена, гидрокси группу, C1-C14 ацилокси группу, C2-C6 алкинильную группу и C1-C6 алкокси C1-C6 алкокси группу), амино группу, C3-C6 циклоалкильную группу (которая может быть замещена амино группой), C1-C6 алкокси группу (которая может быть замещена атомом галогена), C2-C7 алкоксикарбонильную группу, C1-C14 ацильную группу (которая может быть замещена атомом галогена), C6-C10 ароматическую углеводородную группу (которая может быть замещена атомом галогена), моноциклическую или бициклическую 5-10-членную ненасыщенную гетероциклическую группу, имеющую от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, (которая может быть замещена группой, выбранной из группы, включающей C1-C6 алкильную группу и оксо группу), -CONH2 группу, (моно- или ди-C1-C6 алкил)аминокарбонильную группу, гидроксиаминокарбонильную группу, (C7-C13 аралкил)оксиаминокарбонильную группу, циклическую аминокарбонильную группу, аминосульфонильную группу, C1-C6 алкилсульфонильную группу или пиперидинoсульфонильную группу.
Более предпочтительно, он представляет собой атом галогена, амино группу, C1-C6 алкильную группу (которая может быть замещена группой, выбранной из группы, включающей атом галогена и гидрокси группу), C1-C6 алкокси группу (которая может быть замещена атомами галогена), моноциклическую 5 или 6-членную ненасыщенную гетероциклическую группу, имеющую от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, -CONH2 группу, (моно или ди C1-C6 алкил)аминокарбонильную группу или гидроксиамино группу.
Более предпочтительно, он представляет собой атом галогена, амино группу, C1-C6 алкокси группу или -CONH2 группу.
[0079]
Когда соединение формулы (I) имеет два или более заместителей на R3 и два заместителя на атомах углерода, соседних по отношению друг к другу в ароматическом углеводородном кольце R3, «4-8-членное насыщенное или частично ненасыщенное углеводородное кольцо или гетероциклическое кольцо, которое может быть замещено», образованное с атомами углерода, к которым они присоединены, представляет собой кольцо, например, кольцо, конденсированное с бензольным кольцом. «4-8-членное насыщенное или частично ненасыщенное углеводородное кольцо или гетероциклическое кольцо» в «4-8-членном насыщенном или частично ненасыщенном углеводородном кольце или гетероциклическом кольце, которое может быть замещено», предпочтительно, представляет собой моноциклическое насыщенное или частично ненасыщенное углеводородное кольцо, имеющее 4-8 атомов углерода, или 4-8-членное насыщенное или частично ненасыщенное гетерокольцо, имеющее от 1 до 4 гетероатомов, выбранных из группы, включающей атом азота, атом серы и атом кислорода, более предпочтительно, моноциклическое от 4 до 6-членное насыщенное или частично ненасыщенное гетероциклическое кольцо, имеющее от 1 до 3 гетероатомов, выбранных из группы, включающей атом азота, атом серы и атом кислорода, более предпочтительно, моноциклическое 6-членное насыщенное или частично ненасыщенное гетероциклическое кольцо, имеющее один или два атома кислорода.
Заместитель Rc в «4-8-членном насыщенном или частично ненасыщенном углеводородном кольце или гетероциклическом кольце, которое необязательно замещено Rc», представляет собой атом галогена, гидрокси группу, амино группу, оксо группу, C1-C6 алкильную группу, которая необязательно замещена гидрокси группой, галоген C1-C6 алкильную группу, C1-C14 ацильную группу, C1-C14 ациламино группу, C1-C14 ацилокси группу или C7-C13 аралкилокси группу, предпочтительно, гидрокси группу, амино группу, оксо группу или C1-C6 алкильную группу, которая необязательно замещена гидрокси группой, галоген C1-C6 алкильную группу, C1-C14 ацильную группу, C1-C14 ацилокси группу, более предпочтительно, гидрокси группу или C1-C6 алкильную группу. Число заместителей Rc в насыщенном или частично ненасыщенном углеводородном кольце или гетероциклическом кольце особо не ограничивается, но предпочтительно составляет от 1 до 3. Когда число заместителей Rc равно 2 или более, виды групп могут быть одинаковыми или различными.
[0080]
«4-8-членное насыщенное или частично ненасыщенное углеводородное кольцо или гетероциклическое кольцо, которое необязательно замещено Rc», предпочтительно, представляет собой моноциклическое насыщенное или частично ненасыщенное углеводородное кольцо (которое необязательно замещено группой, выбранной из группы, включающей атом галогена, гидрокси группу, амино группу, оксо группу, C1-C6 алкильную группу, необязательно замещенную гидрокси группой, галоген C1-C6 алкильную группу, C1-C14 ацильную группу, C1-C14 ациламино группу, C1-C14 ацилокси группу и C7-C13 аралкилокси группу), моноциклическое 4-8-членное насыщенное или частично ненасыщенное гетероциклическое кольцо, имеющее от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, (которое необязательно замещено группой, выбранной из группы, включающей атом галогена, гидрокси группу, амино группу, оксо группу, C1-C6 алкильную группу, необязательно замещенную гидрокси группой, галоген C1-C6 алкильную группу, C1-C14 ацильную группу, C1-C14 ациламино группу, C1-C14 ацилокси группу и C7-C13 аралкилокси группу).
Более предпочтительно, моноциклическое насыщенное или частично ненасыщенное углеводородное кольцо, имеющее 4-8 атомов углерода, (которое необязательно замещено группой, выбранной из группы, включающей атом галогена, гидрокси группу, амино группу, оксо группу и C1-C6 алкильную группу, необязательно замещенную гидрокси группой, галоген C1-C6 алкильную группу, C1-C14 ацильную группу, C1-C14 ациламино группу и C1-C14 ацилокси группу), или моноциклическое 4-8-членное насыщенное или частично ненасыщенное гетероциклического кольцо, имеющее от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, (которое необязательно замещено группой, выбранной из группы, включающей атом галогена, гидрокси группу, амино группу, оксо группу, C1-C6 алкильную группу, необязательно замещенную гидрокси группой, галоген C1-C6 алкильную группу, C1-C14 ацильную группу, C1-C14 ациламино группу и C1-C14 ацилокси группу).
Более предпочтительно, моноциклическое 4-6-членное гетероциклическое кольцо, имеющее от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, (которое необязательно замещено группой, выбранной из группы, включающей гидрокси группу, амино группу, оксо группу, C1-C6 алкильную группу, галоген C1-C6 алкильную группу, C1-C14 ациламино группу и C1-C14 ацилокси группу).
Более предпочтительно, моноциклическое 6-членное насыщенное или частично ненасыщенное гетероциклическое кольцо, имеющее 1 или два атома кислорода, (которое необязательно замещено группой, выбранной из группы, включающей гидроксильную группу и C1-C6 алкильную группу).
[0081]
В соединениях, представленных формулой (I), конденсированное кольцо, которое образуется, когда имеются два заместителя на атомах углерода, соседних по отношению друг к другу в ароматическом углеводородном кольце R3, например, представляет собой хромановое кольцо, дигидробензоксазиновое кольцо, дигидроинденовое кольцо, индолиновое кольцо, тетрагидрохиноксалиновое кольцо, дигидробензодиоксановое кольцо, тетрагидронафталиновое кольцо, тетрагидрохинолиновое кольцо, тетрагидроизохинолиновое кольцо, дигидробензотиофеновое кольцо, изоиндолиновое кольцо, дигидроизобензофурановое кольцо, дигидробензоимидазольное кольцо и тому подобное.
[0082]
В соединениях, представленных формулой (I), R3, предпочтительно, представляет собой C6-C14 ароматическую углеводородную группу или моноциклическую или бициклическую 5-10-членную полностью ненасыщенную гетероциклическую группу, имеющую от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, где R3 может быть замещен R31, или, когда R3 имеет два заместителя на атомах углерода, являющихся соседними по отношению друг к другу в ароматическом углеводородном кольце, заместители могут быть связаны с атомами углерода, к которым присоединены заместители, с образованием моноциклического насыщенного или частично ненасыщенного углеводородного кольца, имеющего 4-8 атомов углерода, (которое необязательно замещено группой, включающей группу, выбранную из атома галогена, гидрокси группы, амино группы, оксо группы, C1-C6 алкильной группы, необязательно замещенной гидрокси группой, галоген C1-C6 алкильной группы, C1-C14 ацильной группы, C1-C14 ациламино группы, C1-C14 ацилокси группы и C7-C13 аралкилокси группы) или моноциклического 4-8-членного насыщенного или частично ненасыщенного гетероциклического кольца, имеющего от 1 до 4 гетероатомов, выбранных из атома азота, атома серы или атома кислорода, (необязательно замещенного группой, выбранной из группы, включающей атом галогена, гидрокси группу, амино группу, оксо группу, C1-C6 алкильную группу, необязательно замещенную гидрокси группой, галоген C1-C6 алкильные группы, C1-C14 ацильную группу, C1-C14 ациламино группу, C1-C14 ацилокси группу, C7-C13 аралкилокси группу);
R31 представляет собой атом галогена, циано группу, нитро группу, карбоксильную группу, тиоамидную группу, C1-C6 алкильную группу (необязательно замещенную группой, выбранной из группы, включающей атом галогена, гидрокси группу, C1-C14 ацильную группу, C1-C14 ацилокси группу, C2-C6 алкинильную группу и C1-C6 алкокси C1-C6 алкокси группу), амино группу (необязательно замещенную C1-C14 ацильной группой), C3-C6 циклоалкильную группу (необязательно замещенную амино группой), C1-C6 алкокси группу (необязательно замещенную атомами галогена), C2-C7 алкоксикарбонильную группу, C1-C14 ацильную группу (необязательно замещенную атомом галогена), C6-C14 ароматическую углеводородную группу (необязательно замещенную группой, выбранной из группы, включающей атом галогена, амино группу и C1-C6 алкокси группу), моноциклическую или бициклическую 5-10-членную ненасыщенную гетероциклическую группу, имеющую от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, (необязательно замещенную группой, выбранной из группы, включающей атом галогена, оксо группу и C1-C6 алкильную группу), аминокарбонильную группу, необязательно замещенную Rd и Re (где Rd и Re являются одинаковыми или различными и представляют собой атом водорода, гидрокси группу, C7-C13 аралкилокси группу, C1-C6 алкильную группу, которая необязательно замещена гидроксильной группой, альтернативно, взятые вместе с соседним атомом азота образуют моноциклическую или бициклическую 4-10-членную насыщенную или ненасыщенную гетероциклическую группу, имеющую от 1 до 3 гетероатомов, выбранных из атомов азота, серы и кислорода, которая может быть замещена амино группой, спиро гетероциклическую группу или мостиковую гетероциклическую группу) или -S(=O)2Rf (где Rf представляет собой амино группу, C1-C6 алкильную группу или 4-10-членную насыщенную гетероциклическую группу).
[0083]
В соединениях, представленных формулой (I), R3, более предпочтительно, представляет собой C6-C10 ароматическую углеводородную группу или моноциклическую или бициклическую 5-10-членную полностью ненасыщенную гетероциклическую группу, имеющую от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, где R3 необязательно замещен R31, и, когда он имеет два заместителя на атомах углерода, являющихся соседними по отношению друг к другу в ароматическом углеводородном кольце, заместители могут быть связаны с атомами углерода, к которым присоединены заместители, с образованием моноциклического насыщенного или частично ненасыщенного углеводородное кольца, имеющего 4-8 атомов углерода, (которое необязательно замещено группой, состоящей из группы, выбранной из атома галогена, гидрокси группы, амино группы, оксо группы, C1-C6 алкильной группы, необязательно замещенной гидрокси группой, галоген C1-C6 алкильной группы, C1-C14 ацильной группы, C1-C14 ациламино группы и C1-C14 ацилокси группы), или моноциклического 4-8-членного насыщенного или частично ненасыщенного гетероциклического кольца, имеющего от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, (необязательно замещенного группой, выбранной из группы, включающей атом галогена, гидрокси группу, амино группу, оксо группу, C1-C6 алкильную группу, необязательно замещенную гидрокси группой; галоген C1-C6 алкильные группы; C1-C14 ацильную группу; C1-C14 ациламино группу; C1-C14 ацилокси группу);
R31 представляет собой атом галогена, циано группу, нитро группу, карбоксильную группу, тиоамидную группу, C1-C6 алкильную группу (необязательно замещенную группой, выбранной из группы, включающей атом галогена, гидрокси группу, C1-C14 ацилокси группу, C2-C6 алкинильную группу и C1-C6 алкокси C1-C6 алкокси группу), амино группу, C3-C6 циклоалкильную группу (необязательно замещенную амино группой), C1-C6 алкокси группу (необязательно замещенную атомом галогена), C2-C7 алкоксикарбонильную группу, C1-C14 ацильную группу (необязательно замещенную атомом галогена), C6-C10 ароматическую углеводородную группу (которая может быть замещена атомом галогена), моноциклическую или бициклическую 5-10-членную ненасыщенную гетероциклическую группу, имеющую от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, (необязательно замещенную группой, выбранной из группы, включающей C1-C6 алкильную группу или оксо группу), -CONH2 группу, (моно- или ди-C1-C6 алкил)аминокарбонильную группу, гидроксиамино группу, (C7-C13 аралкил) окси аминокарбонильную группу, циклическую амино карбонильную группу, аминосульфонильную группу, C1-C6 алкилсульфонильную группу или пиперидинoсульфонильную группу.
[0084]
В соединениях, представленных формулой (I), R3, более предпочтительно, представляет собой C6-C10 ароматическую углеводородную группу (где C6-C10 ароматическая углеводородная группа необязательно замещена R31, и, когда C6-C10 ароматическая углеводородная группа имеет два заместителя на атомах углерода, являющихся соседними по отношению друг к другу в ароматическом углеводородном кольце, заместители могут быть связаны с атомами углерода, к которым присоединены заместители, с образованием моноциклического 4-6-членного насыщенного или частично ненасыщенного гетерокольца, имеющего от 1 до 3 гетероатомов, (которое необязательно замещено группой, состоящей из гидрокси группы, амино группы, оксо группы, C1-C6 алкильной группы, галоген C1-C6 алкильной группы, C1-C14 ациламино группы и C1-C14 ацилокси группы) или моноциклической 5-6-членной полностью ненасыщенной гетероциклической группы, имеющей от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, (которая необязательно замещена группой, выбранной из группы, включающей атом галогена, C1-C6 алкильную группу, необязательно замещенную гидроксильной группой, C1-C6 алкокси группу, C2-C7 алкоксикарбонильную группу, -CONH2 группу (моно- или ди-C1-C6 алкил)аминокарбонильную группу, пирролидин-1-илкарбонильную группу, морфолин-4-илкарбонильную группу, 2-окса-7-азаспиро[3,5]нонанильную группу, 3-окса-8-азабицикло[3,2,1]октанильную группу и 8-окса-3-азабицикло[3,2,1]октанильную группу);
R31 представляет собой атом галогена, амино группу, C1-C6 алкильную группу (которая необязательно замещена группой, выбранной из группы, включающей атом галогена и гидрокси группу), C1-C6 алкокси группу (которая необязательно замещена атомом галогена), 5 или 6-членную ненасыщенную гетероциклическую группу, имеющую от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, -CONH2 группу, (моно или ди-C1-C6 алкил)аминокарбонильную группу или гидроксиамино группу.
[0085]
Также в соединениях, представленных формулой (I), R3 представляет собой, особенно предпочтительно, фенильную группу (где фенильная группа может быть замещена R31, и, когда фенильная группа имеет два заместителя на атомах углерода, являющихся соседними по отношению друг к другу на бензольном кольце, заместители могут быть связаны с атомами углерода, к которым присоединены заместители, с образованием моноциклического 6-членного насыщенного или частично ненасыщенного гетерокольца, имеющего один или два атома кислорода, (которое необязательно замещенного группой, выбранной из группы, включающей гидрокси группу и C1-C6 алкильную группу)) или пиридильную группу (необязательно замещенную -CONH2 группой, (моно или ди C1-C6 алкил)аминокарбонильной группой или пирролидин-1-илкарбонильной группой);
R31 представляет собой атом галогена, амино группу, C1-C6 алкокси группу или -CONH2 группу.
[0086]
В соединениях, представленных формулой (I), R4 представляет собой атом водорода или C1-C6 алкильную группу.
«C1-C6 алкильная группа», указанная в R4, предпочтительно, представляет собой C1-C3 алкильную группу, более предпочтительно, метильную группу.
R4, предпочтительно, представляет собой атом водорода или метильную группу, более предпочтительно, атом водорода.
[0087]
Среди соединений формулы (I) по настоящему изобретению предпочтительные соединения включают следующее:
в формуле (I)
X1 представляет собой атом кислорода или атом серы;
X2 представляет собой атом кислорода;
X3 представляет собой -NH-;
X4 представляет собой атом водорода или метильную группу;
R1 представляет собой -C(R11)(R12) (где R11 и R12 являются одинаковыми или различными и представляют собой атом водорода или C1-C6 алкильную группу);
R2 представляет собой C6-C14 ароматическую углеводородную группу, где R2 может быть замещен R21, и, когда R2 имеет два заместителя на атомах углерода, являющихся соседними по отношению друг к другу в ароматическом углеводородном кольце, заместители могут быть связаны с атомами углерода, к которым присоединены заместители, с образованием моноциклического насыщенного или частично ненасыщенного углеводородного кольца, имеющего 4-8 атомов углерода, (которое необязательно замещено C1-C6 алкильной группой);
R21 представляет собой атом галогена, циано группу, C1-C6 алкильную группу (которая необязательно замещена атомом галогена), C3-C6 циклоалкильную группу, фенильную группу (которая необязательно замещена группой, выбранной из группы, включающей атом галогена и C1-C6 алкокси группу) или моноциклическую или бициклическую 5-10-членную ненасыщенную гетероциклическую группу, имеющую от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, (которая необязательно замещена группой, выбранной из группы, включающей атом галогена, C1-C6 алкильную группу, галоген C1-C6 алкильную группу, C3-C6 циклоалкильную группу, C1-C6 алкокси группу, морфолино группу, пиперидинильную группу и морфолинокарбонильную группу);
R3 представляет собой C6-C10 ароматическую углеводородную группу или моноциклическую или бициклическую 5-10-членную полностью ненасыщенную гетероциклическую группу, имеющую от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, где R3 необязательно замещен R31, и, когда R3 имеет два заместителя на атомах углерода, являющихся соседними по отношению друг к другу в ароматическом углеводородном кольце, заместители могут быть связаны с атомами углерода, к которым присоединены заместители, с образованием моноциклического насыщенного или частично ненасыщенного углеводородного кольца, имеющего 4-8 атомов углерода, (которое необязательно замещено группой, состоящей из группы, выбранной из атома галогена, гидрокси группы, амино группы, оксо группы, C1-C6 алкильной группы, необязательно замещенной гидрокси группой, галоген C1-C6 алкильной группы, C1-C14 ацильной группы, C1-C14 ациламино группы и C1-C14 ацилокси группы) или моноциклического 4-8-членного насыщенного или частично ненасыщенного гетероциклического кольца, имеющего от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, (необязательно замещенного группой, выбранной из группы, включающей атом галогена, гидрокси группу, амино группу, оксо группу, C1-C6 алкильную группу, необязательно замещенную гидрокси группой; галоген C1-C6 алкильную группу; C1-C14 ацильную группу; C1-C14 ациламино группу и C1-C14 ацилокси группу);
R31 представляет собой атом галогена, циано группу, нитро группу, карбоксильную группу, тиоамидную группу, C1-C6 алкильную группу (необязательно замещенную группой, выбранной из группы, включающей атом галогена, гидрокси группу, C1-C14 ацилокси группу, C2-C6 алкинильную группу и C1-C6 алкокси C1-C6 алкокси группу), амино группу, C3-C6 циклоалкильную группу (необязательно замещенную амино группой), C1-C6 алкокси группу (необязательно замещенную атомом галогена), C2-C7 алкоксикарбонильную группу, C1-C14 ацильную группу (необязательно замещенную атомом галогена), C6-C10 ароматическое углеводородное кольцо (необязательно замещенное атомом галогена), моноциклическую или бициклическую 5-10-членную ненасыщенную гетероциклическую группу, имеющую от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, (необязательно замещенную группой, выбранной из группы, включающей C1-C6 алкильную группу и оксо группу), -CONH2 группу, (моно- или ди-C1-C6 алкил)аминокарбонильную группу, гидроксиаминокарбонильную группу, (C7-C13 аралкилокси)оксиамино карбонильную группу, циклическую аминокарбонильную группу, аминосульфонильную группу, C1-C6 алкилсульфонильную группу или пиперидинoсульфонильную группу; и
R4 представляет собой атом водорода;
или его соль.
[0088]
Более того, среди соединений формулы (I) по настоящего изобретения более предпочтительные соединения включают следующее:
в формуле (I)
X1 представляет собой атом кислорода;
X2 представляет собой атом кислорода;
X3 представляет собой -NH-;
X4 представляет собой атом водорода;
R1 представляет собой -C(R11)(R12) (где R11 представляет собой C1-C6 алкильную группу и R12 представляет собой атом водорода);
R2 представляет собой C6-C10 ароматическую углеводородную группу, где R2 может быть замещен R21, и, когда R2 имеет два заместителя на атомах углерода, являющихся соседними по отношению друг к другу в ароматическом углеводородном кольце, заместители могут быть связаны с атомами углерода, к которым присоединены заместители, с образованием моноциклического насыщенного или частично ненасыщенного углеводородного кольца, имеющего 5 или 6 атомов углерода, (которое необязательно замещено C1-C6 алкильной группой);
R21 представляет собой атом галогена, C1-C6 алкильную группу или моноциклическую 5-6-членную ненасыщенную гетероциклическую группу, имеющую от 1 до 3 атомов азота, (которая необязательно замещена C1-C6 алкильной группой);
R3 представляет собой C6-C10 ароматическую углеводородную группу (где C6-C10 ароматическая углеводородная группа необязательно замещена R31, и, когда C6-C10 ароматическая углеводородная группа имеет два заместителя на атомах углерода, являющихся соседними по отношению друг к другу в ароматическом углеводородном кольце, заместители могут быть связаны с атомами углерода, к которым присоединены заместители, с образованием моноциклического 4-6-членного насыщенного или частично ненасыщенного гетероциклического кольца, имеющего от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, (необязательно замещенного группой, выбранной из группы, включающей гидрокси группу, амино группу, оксо группу, C1-C6 алкильную группу, галоген C1-C6 алкильную группу, C1-C14 ацильную группу, C1-C14 ациламино группу и C1-C14 ацилокси группу) или моноциклическую 5-6-членную полностью ненасыщенную гетероциклическую группу, имеющую от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, (которая необязательно замещена группой, выбранной из группы, включающей атом галогена, C1-C6 алкильную группу, необязательно замещенную гидроксильной группой, C1-C6 алкокси группу, C2-C7 алкоксикарбонильную группу, -CONH2 группу, (моно- или ди-C1-C6 алкил)аминокарбонильную группу, пирролидин-1-илкарбонильную группу, морфолин-4-илкарбонильную группу, 2-окса-7-азаспиро[3,5]нонанильную группу, 3-окса-8-азабицикло[3,2,1]октанильную группу и 8-окса-3-азабицикло[3,2,1]октанильную группу);
R31 представляет собой атом галогена, амино группу, C1-C6 алкильную группу (необязательно замещенную группой, выбранной из группы, включающей атом галогена и гидрокси группу), C1-C6 алкокси группу (необязательно замещенную атомом галогена), моноциклическую 5-6-членную ненасыщенную гетероциклическую группу, имеющую от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, -CONH2 группу, (моно- или ди-C1-C6 алкил)аминокарбонильную группу, гидроксиамино карбонильную группу; и
R4 представляет собой атом водорода;
или его соль.
[0089]
Среди соединений формулы (I) по настоящему изобретению более предпочтительные соединения включают следующее:
в формуле (I)
X1 представляет собой атом кислорода;
X2 представляет собой атом кислорода;
X3 представляет собой -NH-;
X4 представляет собой атом водорода;
R1 представляет собой -C(R11)(R12) (где R11 представляет собой метильную группу и R12 представляет собой атом водорода);
R2 представляет собой фенильную группу или нафтильную группу, где R2 может быть замещен R21, и, когда R2 имеет два заместителя на атомах углерода, являющихся соседними по отношению друг к другу в ароматическом углеводородном кольце, заместители могут быть связаны с атомами углерода, к которым присоединены заместители, с образованием моноциклического насыщенного или частично ненасыщенного углеводородного кольца, имеющего 5 или 6 атомов углерода, (которое необязательно замещено C1-C6 алкильной группой);
R21 представляет собой атом галогена или C1-C6 алкильную группу;
R3 представляет собой фенильную группу (где фенильная группа необязательно замещена R31, и, когда фенильная группа имеет два заместителя на атомах углерода, являющихся соседними по отношению друг к другу на бензольном кольце, заместители могут быть связаны с атомами углерода, к которым присоединены заместители, с образованием моноциклического 6-членного насыщенного или частично ненасыщенного гетероциклического кольца, имеющего 1 или 2 атома кислорода, (необязательно замещенного группой, выбранной из группы, включающей гидроксильную группу и C1-C6 алкильную группу) или пиридильную группу (необязательно замещенную -CONH2 группой, (моно- или ди-C1-C6 алкил)аминокарбонильной группой, пирролидин-1-илкарбонильной группой);
R31 представляет собой атом галогена, амино группу, C1-C6 алкокси группу, -CONH2 группу; и
R4 представляет собой атом водорода;
или его соль.
[0090]
Особенно предпочтительные соединения по настоящему изобретению включают следующие:
(1) 5-бром-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(2) 5-хлор-2-(N-((1S,2R)-2-(2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(3) 5-бром-2-(N-((1S,2R)-2-(2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(4) 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(5) 5-хлор-2-(N-((1S,2R)-2-(2-фторнафтален-1-ил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(6) 5-хлор-2-(N-((1S,2R)-2-(3-этил-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(7) 5-хлор-2-(N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(8) 5-бром-2-(N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(9) 2-(N-((1S,2R)-2-(3-бром-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-5-хлор-бензамид;
(10) 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-6-(пирролидин-1-карбонил)пиридин-2-сульфонамид;
(11) 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метил-d3-хроман-8-сульфонамид;
(12) 5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метил-хроман-8-сульфонамид;
(13) N-((1S,2R)-2-(3-бром-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-5-хлор-4-гидрокси-4-метил-хроман-8-сульфонамид;
(14) 5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метил-d3-хроман-8-сульфонамид;
(15) 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидроксихроман-8-сульфонамид;
(16) 3-хлор-6-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-N,N-диметилпиколинамид;
(17) 4-амино-2-метокси-N-((1S,2R)-2-(8-метилнафталин-1-ил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)бензолсульфонамид;
(18) 4-амино-N-((1S,2R)-2-(2,3-дигидро-1H-инден-4-ил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-2-метоксибензолсульфонамид; и
(19) 5-хлор-2-((1S,2R)-метил-d3-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид.
[0091]
Способ получения соединения в соответствии с настоящим изобретением описан в представленных примерах. Соединения формулы (I) по настоящему изобретению, например, могут быть получены следующим способом получения. Однако, настоящее изобретение не ограничивается этим способом.
[0092]
[Формула 4]
[Стадия A]

[0093]
[где L1 представляет собой удаляемую группу. Символы имеют те же значения, что определены выше.]
[0094]
[A-1]
В этом способе соединение, представленное общей формулой (4), может быть получено путем взаимодействия соединения, представленного общей формулой (1), с металлоорганическим реагентом (3), таким как реактив Гриньяра, представленный формулой R11MgHal.
Hal представляет собой атом галогена.
Количество реагента Гриньяра (3) составляет от 0,8 до 20 эквивалентов относительно соединения (1), предпочтительно, от 1,0 до 10 эквивалентов. Температура реакции составляет от -80°C до 100°C, предпочтительно, от -78°C до 50°C. Время реакции составляет от 0,1 до 24 часов, предпочтительно, от 0,1 до 3 часов.
[0095]
На этой стадии соединение, представленное общей формулой (4), где R11 представляет собой H, может быть получено путем взаимодействия соединения, представленного формулой (1), с хорошо известным восстановителем вместо реактива Гриньяра (3).
Восстановители, которые должны использоваться, включают, например, боргидрид натрия, боргидрид лития, литий алюминий гидрид, диэтокси алюминий литий гидрид, триэтокси литий алюминий гидрид, три-трет-бутокси литий алюминий гидрид, алюминий магний гидрид, алюминий гидрид магний хлорид, натрий алюминий гидрид, натрий триэтоксиалюминий гидрид, бис(2-метоксиэтокси) алюминий натрий гидрид, диизобутил алюминий гидрид (далее DIBAL-H) и тому подобное, и, предпочтительно, боргидрид натрия.
Реакционный растворитель, который должен быть использован, особо не ограничивается, пока это не оказывает негативного влияния на реакцию, например, включает простые эфиры (диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан и тому подобное), спирты (метанол, этанол и тому подобное) и воду, и предпочтительным является метанол.
Количество используемого восстановителя составляет от 0,8 до 10 эквивалентов относительно соединения (1), предпочтительно, от 1 до 5 эквивалентов.
Температура реакции составляет от 0°C до температуры точки кипения растворителя, предпочтительно, от 0 до 40°C. Время реакции составляет от 0,05 до 24 часов, предпочтительно, 0,2-2 часа. При этом соединение, представленное общей формулой (4), полученное вышеуказанным способом, может быть подвергнуто следующей стадии, с выделением или без выделения, и очистке с помощью хорошо известных путей выделения, описанных далее.
[0096]
[A-2]
На этой стадии соединение, представленное общей формулой (4), может быть получено путем взаимодействия соединения, представленного общей формулой (2), с хорошо известными восстановителями.
Восстановители, которые должны быть использованы, включают боргидрид натрия.
Реакционные растворители, которые должны быть использованы, особо не ограничиваются, пока это не оказывает негативного влияния на реакцию, и представляют собой, например, простые эфиры (диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан и т.д.), спирты (метанол, этанол, 2-пропанол, трет-бутанол, этиленгликоль и т.д.), воду и тому подобное, предпочтительно, метанол или этанол.
Количество восстановителя составляет от 0,8 до 10 эквивалентов относительно соединения (2), предпочтительно, от 1 до 5 эквивалентов.
Температура реакции составляет между 0°C и температурой точки кипения растворителя, предпочтительно, от 0 до 40°C. Время реакции составляет от 0,5 до 24 часов, предпочтительно, 0,2-2 часа. При этом полученное соединение, представленное общей формулой (4), может быть подвергнуто следующей стадии с выделением или без выделения, и очистке с помощью хорошо известных путей выделения, описанных далее.
[0097]
[A-3]
В этом способе соединение, представленное общей формулой (5), может быть получено путем взаимодействия соединения, представленного общей формулой (4), с галогенирующим агентом или сульфонилгалогенид углеводородами.
Удаляемые группы, представленные L1, представляют собой, например, атом галогена, такой как атом хлора, атом брома или атом йода, метилсульфонилокси группу, трифторметилсульфонилокси группу, органическую сульфонилокси группу, такую как п-толилсульфонилокси группу.
Реакционные растворители, которые должны быть использованы, особо не ограничиваются, пока это не оказывает негативного влияния на реакцию, например, представляют собой простые эфиры (диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан и т.д.), галогенированные углеводороды (дихлорметан, хлороформ, 1,2-дихлорэтан, тетрахлорид углерода и т.д.), ароматические углеводороды (бензол, толуол, ксилол, пиридин и т.д.), и предпочтительными являются простые эфиры.
Галогенирующие агенты, которые должны быть использованы, представляют собой, например, тионилхлорид, оксалилхлорид, пентахлорид фосфора, трихлорид фосфора, тионилбромид, трибромид фосфора и тому подобное. Предпочтительно, представляют собой тионилхлорид или трибромид фосфора. Сульфонил галогенид углеводороды представляют собой, например, метансульфонилхлорид, этансульфонилхлорид, п-толуолсульфонилхлорид или фенилсульфонилхлорид и тому подобное.
Реакционные растворители, которые должны быть использованы, особо не ограничиваются, пока это не оказывает негативного влияния на реакцию, и представляют собой, например, простые эфиры (диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан и т.д.), галогенированные углеводороды (дихлорметан, хлороформ, 1,2-дихлорэтан, тетрахлорид углерода), ароматические углеводороды (бензол, толуол, ксилол, и т.д.), и предпочтительным является дихлорметан.
Количество галогенирующего агента или сульфонил галогенид углеводородов составляет от 0,3 эквивалентов до 20 эквивалентов относительно соединения (4), предпочтительно, от 0,3 до 4 эквивалентов.
Температура реакции составляет от -20°C до 100°C, предпочтительно, от 0°C до 100°C. Время реакции составляет обычно от 0,01 до 200 часов, предпочтительно, от 0,5 часа до 24 часов. Таким образом, полученное соединение, представленное общей формулой (5), может быть подвергнуто следующей стадии с выделением или без выделения, и очистке с помощью хорошо известных путей выделения, описанных далее.
[0098]
[Формула 5]
[Стадия B]

[0099]
[Символы в формуле определены выше]
[0100]
[B-1]
В этом способе никелевый комплекс, представленный общей формулой (7), получают путем взаимодействия соединения, представленного общей формулой (1) или (5), с легко доступным соединением, представленным формулой (6).
Реакционные растворители, которые должны быть использованы, особо не ограничиваются, пока это не оказывает негативного влияния на реакцию, и представляют собой, например, органические растворители или их смеси, такие как простые эфиры (диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан и т.д.), галогенированные углеводороды (дихлорметан, хлороформ, 1,2-дихлорэтан, тетрахлорид углерода), ароматические углеводороды (бензол, толуол, ксилол и т.д.), алифатические углеводороды (гексан, пентан, циклогексан и т.д.), нитрилы (ацетонитрил, проптонитрил и т.д.), амиды (N,N-диметилформамид (указываемый далее как ДМФ), N,N-диметилацетамид, N-метилпирролидинон, и предпочтительным является ДМФ.
Основания, которые должны быть использованы, представляют собой, например: органические амины, такие как триэтиламин, трипропиламин, диизопропилэтиламин, N-метилморфолин, пиридин, лутидин или коллидин; соли щелочных металлов, такие как карбонат натрия, карбонат калия, карбонат цезия, фосфат натрия, фосфат калия, гидроксид натрия, гидроксид калия; алкоксиды щелочных металлов, такие как метоксид натрия, этоксид натрия, трет-бутоксид натрия, трет-бутоксид калия; сильноосновной амид лития, такой как литий диизопропиламид; сильноосновной гексаметилдисилазан, такой как гексаметилдисилазан лития, гексаметилдисилазан натрия, гексаметилдисилазан калия; и, предпочтительно, гидроксид натрия, гидроксид калия, трет-бутоксид калия и тому подобное.
Количество основания, которое должно быть использовано, обычно составляет от 0,1 до 100 эквивалентов относительно соединения (6), предпочтительно, от 1 до 20 эквивалентов.
Количество соединения (1) или (5) составляет 0,5-10 эквивалентов относительно соединения (6), предпочтительно, от 1 до 5 эквивалентов.
Температура реакции составляет от -80 до 50°C, предпочтительно, от -60 до 40°C. Время реакции составляет 0,2-24 часов, предпочтительно, от 0,5 до 6 часов. Давление, используемое в вышеуказанном способе получения, не может быть особо ограничено, и его примеры включают, примерно от 0,1 до 10 атм. Никелевый комплекс, представленный общей формулой (7), который получат в этом способе, может быть подвергнут следующей стадии с выделением или без выделения, и очистке с помощью хорошо известных путей выделения, описанных далее.
[0101]
[B-2]
На этой стадии аминокислота, представленная общей формулой (8), может быть получена путем взаимодействия никелевого комплекса или его соли с кислотой, представленной общей формулой (7).
Кислоты, которые должны быть использованы, особо не ограничиваются, но включают общеизвестные кислоты. Кислоты могут представлять собой неорганические кислоты или органические кислоты. Неорганические кислоты включают, например, соляную кислоту, азотную кислоту, серную кислоту и перхлорную кислоту. Органические кислоты включают, например, уксусную кислоту, трифторуксусную кислоту, метансульфоновую кислоту, трифторметансульфоновую кислоту, щавелевую кислоту, пропионовую кислоту, масляную кислоту, валериановую кислоту и тому подобное. Предпочтительно, кислота представляет собой соляную кислоту, серную кислоту, трифторуксусную кислоту или метансульфоновую кислоту, более предпочтительно, соляную кислоту или метансульфоновую кислоту.
Количество кислоты особо не ограничивается, и обычно составляет от 0,1 до 50 эквивалентов относительно никелевого комплекса, представленного общей формулой (7), и, предпочтительно, от 0,3 до 10 эквивалентов.
Растворитель, который должен быть использован, предпочтительно, представляет собой спирт, более предпочтительно, метанол или этанол.
Температура реакции составляет обычно от 0°C до 100°C, и, предпочтительно, от 40 до 80°C. Время реакции составляет обычно от 0,1 до 72 часов, и, предпочтительно, от 0,1 до 10 часов. Давление, используемое в вышеуказанном способе получения, особо не ограничивается, и его примеры включают, от 0,1 до 10 атм. Аминокислота, представленная общей формулой (8), полученная в настоящем способе, может быть подвергнута следующей стадии способа с выделением или без выделения, и очистке с помощью хорошо известных путей выделения и очистки, описанных далее, или трансформации между введением защиты и удалением защиты.
[0102]
[Формула 6]
[Стадия C]

[0103]
[Символы в формуле определены выше.]
[0104]
[C-1]
На этой стадии соединение, представленное общей формулой (10), может быть получено путем взаимодействия соединения, представленного общей формулой (9), с хорошо известным восстановителем.
Восстановителем является три(этокси) литий алюминий гидрид, три(втор-бутил)боргидрид лития или DIBAL-H, и тому подобное, и предпочтительным является DIBAL-H.
Количество восстановителя обычно составляет от 1 до 10 эквивалентов относительно соединения (9), предпочтительно, от 2,0 до 10 эквивалентов.
Растворитель, которые должен быть использован, представляет собой любой вид растворителей (тетрагидрофуран, 1,4-диоксан и т.д.), апротонные полярные растворители (N,N-диметилформамид, диметилсульфоксид, ацетонитрил и т.д.), галогеновые растворители (дихлорметан, хлороформ и т.д.), ароматические углеводородные растворители (толуол, ксилол и т.д.) или смешанный растворитель и тому подобное, и, предпочтительно, дихлорметан.
Температура реакции составляет от -100°C до 50°C, предпочтительно, от -100 до 10°C. Время реакции составляет от 0,1 до 24 часов, предпочтительно, 0,2-5 часов.
Давление, используемое в вышеуказанном способе получения, не может быть особо ограничено, и его примеры включают, примерно от 0,1 до 10 атм.
Соединение, представленное общей формулой (10), которое получают по этому способу, может быть подвергнуто следующей стадии с выделением или без выделения, и очистке с помощью хорошо известных путей выделения, описанных далее.
Соединение, представленное общей формулой (9), может быть получено способами, описанными в ссылочной литературе (международная публикация № WO2011/071565), или, если необходимо, объединяя способы, описанные в ссылочных примерах и примерах.
[0105]
[C-2]
На этой стадии соединение, представленное общей формулой (11), получают путем взаимодействия с соединением, представленным общей формулой (10), с цианидным агентом и аммиаком. Цианидный агент, который должен быть использован, представляет собой, например, гидроцианид, цианиды металлов, соединения циангидрина, ацил цианиды, галоген цианиды и тому подобное. Цианиды металлов представляют собой, например, цианиды щелочных металлов, такие как цианиды натрия, цианиды калия; цианиды щелочноземельных металлов, такие как цианид кальция; цианиды переходных металлов, такие как цианид меди. Предпочтительным является цианид калия.
Аммиак, используемый на данной стадии, может представлять собой газообразный аммиак, жидкий амммиак, или водный раствор аммиака, и водный раствор аммиака является желательным с точки зрения того, что он не требует сложного реакционного устройства.
Растворитель, который должен быть использован, особо не ограничивается, пока это не оказывает негативного влияния на реакцию, и он включает простые эфиры (тетрагидрофуран, 1,4-диоксан и т.д.), апротонные полярные растворители (N,N-диметилформамид, диметил сульфоксиды, ацетонитрил и т.д.), галогеновые растворители (дихлорметан, хлороформ и т.д.), ароматические углеводородные растворители, такие как толуол, спиртовые растворители (метанол, этанол и т.д.), воду и смешанные растворители, и, предпочтительно, воду и смешанный растворитель с метанолом.
Количество цианидного агента, которое должно быть использовано, обычно составляет от 1 до 10 эквивалентов относительно соединения (10), предпочтительно, от 2,0 до 5,0 эквивалентов. Количество аммиака, используемого в реакции, предпочтительно, составляет 1,5-10 эквивалентов относительно соединения (10) и, более предпочтительно, от 1,8 до 2,5 эквивалентов. При необходимости добавляют хлорид аммония. Его количество составляет обычно 0,2-2,0 эквивалента относительно соединения (10), предпочтительно, от 0,1 до 0,5 эквивалента.
Температура реакции составляет от -100°C до 100°C, предпочтительно, от 0 до 60°C. Время реакции составляет от 0,1 до 24 часов, предпочтительно, 0,2-5 часов. Давление, используемое в вышеуказанном способе получения, не может быть особо ограничено, и его примеры включают примерно от 0,1 до 10 атм. Соединение, представленное общей формулой (11), может быть подвергнуто следующей стадии с выделением или без выделения и очистке хорошо известными путями выделения и очистки, как описано далее.
[0106]
[C-3]
В этом способе соединение, представленное общей формулой (12), получают таким же образом, как в [B-2], описанном выше, используя соединение, представленное общей формулой (11). Соединение, представленное общей формулой (12), может быть подвергнуто следующей стадии с выделением или без выделения и очистке хорошо известными путями выделения и очистки, как описано далее. Дальнейшее осуществление способа для соединений, представленных общими формулами (8) и (12), описано в качестве примера.
Более того, в настоящем способе R1 и R2 могут быть преобразованы в структуры, соответствующие группам с введенной защитой/удаленной защитой по настоящему изобретению.
[0107]
[Формула 7]
[Стадия D]

[0108]
[В формуле L2 представляет собой удаляемую группу. Символы имеют те же значения, что определены выше.]
[0109]
[D-1]
На этой стадии карбоновая кислота, представленная общей формулой (14), может быть получена путем взаимодействия аминокислоты, представленной общей формулой (12), с галогенангидридом сульфоновой кислоты, представленным общей формулой (13), в присутствии основания.
Основания, которые должны быть использованы, представляют собой соли щелочных металлов, такие как карбонат натрия, карбонат калия, карбонат цезия, фосфат натрия, фосфат калия, гидроксид натрия, или органические амины, такие как триметиламин или гидроксид калия, триэтиламин, трипропиламин, диизопропилэтиламин, N-метилморфолин, пиридин, лутидин и коллидин, в качестве примера, и, предпочтительно, триэтиламин.
Реакционный растворитель, который должен быть использован, особо не ограничивается, пока это не оказывает негативного влияния на реакцию, и он представляет собой органические растворители или воду и т.д., такие как простые эфиры (диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан и т.д.), галогенированные углеводороды (дихлорметан, хлороформ, 1,2-дихлорэтан, тетрахлорид углерода), ароматические углеводороды (бензол, толуол, ксилол и т.д.), алифатические углеводороды (гексан, пентан, циклогексан и т.д.), нитрилы (ацетонитрил, проптонитрил и т.д.), амиды (ДМФ, N,N-диметилацетамид, N-метилпирролидинон и тому подобное. Эти растворители могут быть использованы в смеси при соответствующем соотношении.
Число эквивалентов основания и амина составляет 0,5-10 эквивалентов, соответственно, предпочтительно, от 1,0 до 5,0 эквивалентов.
Количество галогенангидрида сульфоновой кислоты устанавливают подходящим в соответствии с соединениями, представленными общей формулой (12), но не ограничивается, и обычно составляет от 1,0 до 5,0 эквивалентов по отношению к соединению, представленному общей формулой (12), более предпочтительно, от 1,0 до 2,5 эквивалентов.
Температуру реакции устанавливают в соответствии с соединениями, представленными общей формулой (12), но не ограничивают, и она составляет, например, от -20 до 70°C, предпочтительно, от 0 до 40°C. Время реакции составляет обычно от 0,1 до 24 часов, предпочтительно, 0,2-6,0 часов. Соединение, представленное общей формулой (14), может быть подвергнуто следующей стадии с выделением или без выделения и очистке с помощью хорошо известных путей выделения и очистки, описанных далее.
Соединение, представленное общей формулой (13), может быть получено способами, описанными в ссылочной литературе (Tetrahedron Lett. 51,418-421 (2010)), или, если необходимо, объединяя способы, описанные в ссылочных примерах и примерах.
[0110]
[D-2]
На этой стадии соединение, представленное общей формулой (15), может быть получено путем взаимодействия карбоновой кислоты, представленной общей формулой (14), с конденсирующим агентом и гидразином. Альтернативно, оно может быть получено путем взаимодействия производного гидразина, имеющего соответствующую защитную группу, с карбоновой кислотой, представленной общей формулой (14), таким же образом, и затем осуществляя реакцию удаления защитной группы.
Конденсирующим агентом является, например, 1,1'-карбонилдиимидазол (далее, CDI), дициклогексилкарбодиимид, 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид и тому подобное, предпочтительно, CDI.
Растворитель, который должен быть использован, особо не ограничивается, пока это не оказывает негативного влияния на реакцию, например, представляет собой органические растворители, такие как простые эфиры (диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан и т.д.), галогенированные углеводороды (дихлорметан, хлороформ, 1,2-дихлорэтан, тетрахлорид углерода), ароматические углеводороды (бензол, толуол, ксилол и т.д.), алифатические углеводороды (гексан, пентан, циклогексан и т.д.), нитрилы (ацетонитрил, проптонитрил и т.д.) и амиды (ДМФ, N,N-диметилацетамид, N-метилпирролидинон), и они могут быть использованы отдельно или в комбинации.
Количество конденсирующего агента по отношению к соединению, представленному формулой (14), составляет обычно от 1 до 50 эквивалентов, предпочтительно, примерно от 1 до 5. Количество гидразина относительно соединения, представленного общей формулой (14), составляет обычно от 1 до 100 эквивалентов, предпочтительно, 1-5 эквивалентов. Основание представляет собой органическое основание, такое как триэтиламин, пиридин, 4-диметиламинопиридин, диазабициклоундецен и тому подобное.
Температура реакции составляет от -20 до 80°C, предпочтительно, от 0 до 40°C. Время реакции составляет обычно от 0,05 до 24 часов, более предпочтительно, от 0,05 до 6 часов. Соединение, представленное общей формулой (15), может быть подвергнуто следующей стадии с выделением или без выделения и очистке с помощью хорошо известных путей выделения и очистки, описанных далее.
[0111]
[D-3]
На этой стадии соединение, представленное общей формулой (16), по настоящему изобретению, может быть получено путем циклизации соединения, представленного общей формулой (15), с ацилирующим агентом.
Ацилирующий агент представляет собой, например, изобутил хлорформиат, CDI, фосген, трифосген и тому подобное, предпочтительно, CDI. Основание представляет собой органическое основание, такое как триэтиламин, N,N-диизопропилэтиламин, пиридин, 4-диметиламинопиридин, и такое как диазабициклоундецен и тому подобное.
Количество ацилирующего агента по отношению к соединению, представленному формулой (15), обычно представляет собой, предпочтительно, от 1 до 50 эквивалентов и, более предпочтительно, от 1 до 5 эквивалентов.
Растворитель, который должен быть использован, особо не ограничивается, пока это не оказывает негативного влияния на реакцию, например, представляет собой органические растворители, такие как простые эфиры (диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан и т.д.), галогенированные углеводороды (дихлорметан, хлороформ, 1,2-дихлорэтан, тетрахлорид углерода), ароматические углеводороды (бензол, толуол, ксилол и т.д.), алифатические углеводороды (гексан, пентан, циклогексан и т.д.), нитрилы (ацетонитрил, проптонитрил и т.д.), амиды (ДМФ, N,N-диметилацетамид, N-метилпирролидинон и т.д.) и тому подобное, и они могут использоваться отдельно или в виде смеси.
Температура реакции составляет от -20 до 80°C, предпочтительно, от 0 до 50°C. Время реакции составляет обычно от 0,5 до 24 часов, предпочтительно, от 0,5 до 8 часов. Соединение, представленное общей формулой (16), может быть подвергнуто следующей стадии с выделением или без выделения и очистке с помощью хорошо известных путей выделения и очистки, описанных далее.
Соединение, представленное общей формулой (16) по настоящему изобретению, может быть синтезировано 1) путем защиты аминогруппы аминокислоты соединения, представленного выше общей формулы (12), хорошо известной подходящей защитной группой, 2) преобразованием группы карбоновой кислоты в оксадиазолоновое кольцо таким же способом как и в [D-2], 3) удалением защитной группы хорошо известным способом, 4) сульфонамидированием таким же образом как и в [D-1].
[0112]
[Формула 8]
[Стадия E]
[0113]
[В формуле символы имеют те же значения, что определены выше.]
[0114]
[E-1]
На этой стадии соединение, представленное общей формулой (17) по настоящему изобретению, может быть получено путем взаимодействия соединения, представленного общей формулой (15), с дисульфидом углерода.
Основания, используемое в данной реакции, представляют собой, например, соли щелочных металлов, такие как гидроксид натрия, гидроксид калия, органические амины, такие как триэтиламин, алкоксиды щелочных металлов, такие как метоксид натрия, этоксид натрия, трет-бутоксид натрия, трет-бутоксид калия, амиды металлов, такие как диизопропиламид лития, и, предпочтительно, гидроксид калия.
Количество основания, которое должно быть использовано, по отношению к соединению, представленному формулой (15), составляет обычно от 1 до 20 эквивалентов, предпочтительно, от 1 до 5 эквивалентов. Количество дисульфида углерода по отношению к соединению, представленному формулой (15), составляет обычно от 1 до 20 эквивалентов, предпочтительно, от 1 до 5 эквивалентов.
Растворитель, который должен быть использован, особо не ограничивается, пока это не оказывает негативного влияния на реакцию, например, представляет собой органические растворители, воду, например, спирты (метанол, этанол, пропанол), простые эфиры (диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан), галогенированные углеводороды (дихлорметан, хлороформ, 1,2-дихлорэтан, тетрахлорид углерода), ароматические углеводороды (бензол, толуол, ксилол и т.д.), алифатические углеводороды (гексан, пентан, циклогексан), амиды (ДМФ, N,N-диметилацетамид, N-метилпирролидинон и тому подобное), и они могут быть использованы отдельно или в виде смеси.
Температура реакции составляет от 0 до 150°C, предпочтительно, между 20 и 100°C. Время реакции составляет обычно от 0,5 до 24 часов, предпочтительно, от 1,0 до 12 часов. Соединение, представленное общей формулой (17) по настоящему изобретению, может быть выделено и очищено хорошо известными путями выделения и очистки.
[0115]
[Формула 9]
[Стадия F]

[0116]
[В формуле символы имеют те же значения, что определены выше.]
[0117]
[F-1]
На этой стадии соединение общей формулы (18) может быть получено путем конденсации и одновременной циклизации соединения, представленного общей формулой (14), и тиосемикарбазида.
Конденсирующий агент представляет собой, например, CDI, дициклогексилкарбодиимид, 1-этил-3-(3-диметиламинопропил)-карбодиимид гидрохлорид и тому подобное, предпочтительно, 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид.
Растворитель, который должен быть использован, особо не ограничивается, пока это не оказывает негативного влияния на реакцию, например, представляет собой органические растворители, такие как простые эфиры (диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан и т.д.), галогенированные углеводороды (дихлорметан, хлороформ, 1,2-дихлорэтан, тетрахлорид углерода), ароматические углеводороды (бензол, толуол, ксилол и т.д.), алифатические углеводороды (гексан, пентан, циклогексан и т.д.), нитрилы (ацетонитрил, проптонитрил и т.д.), амиды (ДМФ, N,N-диметилацетамид, N-метилпирролидинон и тому подобное). Они могут использоваться отдельно или в виде смеси.
Количество конденсирующего агента относительно соединения, представленного общей формулой (14), составляет от 1,0 до 50 эквивалентов, предпочтительно, от 1 до 5 эквивалентов. Количество тиосемикарбазида относительно соединения, представленного общей формулой (14), составляет обычно от 1 до 100 эквивалентов, предпочтительно, от 1,0 до 5,0 эквивалентов. Основание представляет собой органические основания, такие как триэтиламин, N,N-диизопропилэтиламин, пиридин, 4-диметиламинопиридин, диазабициклоундецен и тому подобное.
Температура реакции составляет от -20 до 180°C, предпочтительно, от 0 до 100°C. Время реакции составляет обычно от 0,05 до 24 часов, предпочтительно, от 0,05 до 6 часов. Соединение, представленные формулой (18) по настоящему изобретению, может быть выделено и очищено хорошо известными путями выделения и очистки, как описано далее.
[0118]
[Формула 10]
[Стадия G]
[0119]
[В формуле символы имеют те же значения, что определены выше.]
[0120]
[G-1]
На этой стадии соединение, представленное общей формулой (19), может быть получено путем взаимодействия карбоновой кислоты, представленной общей формулой (14), с конденсирующим агентом и аммиаком.
Конденсирующий агент представляет собой, например, 1,1'-карбонилдиимидазол (далее, CDI), дициклогексилкарбодиимид, 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид и тому подобное, предпочтительно, CDI.
Растворитель, который должен быть использован, особо не ограничивается, пока это не оказывает негативного влияния на реакцию, например, представляет собой органические растворители, такие как простые эфиры (диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан и т.д.), галогенированные углеводороды (дихлорметан, хлороформ, 1,2-дихлорэтан, тетрахлорид углерода), ароматические углеводороды (бензол, толуол, ксилол и т.д.), алифатические углеводороды (гексан, пентан, циклогексан и т.д.), нитрилы (ацетонитрил, проптонитрил и т.д.), амиды (ДМФ, N,N-диметилацетамид, N-метилпирролидинон и тому подобное). Они могут использоваться отдельно или в виде смеси.
Количество конденсирующего агента относительно соединения, представленного общей формулой (14), составляет обычно от 1 до 50 эквивалентов, предпочтительно, от 1 до 5 эквивалентов. Аммиак используется в виде водного раствора или соли соляной кислоты, и его количество относительно соединения, представленного общей формулой (14), составляет обычно от 1 до 100 эквивалентов, предпочтительно, от 1,0 до 5,0 эквивалентов. Основания включают, например, органические основания, такие как триэтиламин, пиридин, 4-диметиламинопиридин, диазабициклоундецен и тому подобное.
Температура реакции составляет от -20 до 80°C, предпочтительно, от 0 до 40°C. Время реакции составляет обычно от 0,05 до 24 часов, предпочтительно, от 0,05 до 6 часов. Соединение, представленное общей формулой (19), может быть подвергнуто следующей стадии с выделением или без выделения и очистке с помощью хорошо известных путей выделения и очистки, описанных далее.
[0121]
[G-2]
На этой стадии нитрил, представленный общей формулой (20), может быть получен исходя из соединения амида, представленного общей формулой (19).
Дегидратирующие агенты включают, например, оксалилхлорид, тионилхлорид, хлорангидрид циануровой кислоты и тому подобное, предпочтительным является хлорангидрид циануровой кислоты.
Растворитель, который должен быть использован, особо не ограничивается, пока это не оказывает негативного влияния на реакцию, например, представляет собой органические растворители, такие как простые эфиры (диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан и т.д.), галогенированные углеводороды (дихлорметан, хлороформ, 1,2-дихлорэтан, тетрахлорид углерода), ароматические углеводороды (бензол, толуол, ксилол и т.д.), алифатические углеводороды (гексан, пентан, циклогексан и т.д.), нитрилы (ацетонитрил, пропионитрил и т.д.), амиды (ДМФ, N,N-диметилацетамид, N-метилпирролидинон и тому подобное). Они могут использоваться отдельно или в виде смеси.
Количество дегидратирующего агента относительно соединения, представленного общей формулой (19), составляет обычно от 1 до 50 эквивалентов.
Температура реакции составляет от -20 до 80°C, предпочтительно, между от 0 до 40°C. Время реакции составляет обычно от 0,05 до 24 часов, предпочтительно, от 0,5 до 3 часов. Соединение, представленное общей формулой (20), может быть подвергнуто следующей стадии с выделением или без выделения и очистке с помощью хорошо известных путей выделения и очистки, описанных далее.
[0122]
[G-3]
На этой стадии производное амидоксима получают из производного нитрила, представленного общей формулой (20), путем добавления гидроксиламина и далее взаимодействия с ацилирующим агентом с последующей циклизацией при нагревании и получением соединения, представленного общей формулой (21).
Количество гидроксиламина, которое должно быть использовано для получения амидоксима, составляет в реакции обычно от 1 до 50 эквивалентов по отношению к соединению, представленному общей формулой (20).
Растворитель, который должен быть использован, особо не ограничивается, пока это не оказывает негативного влияния на реакцию, например, представляет собой органический растворитель, такой как простые эфиры (диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан и т.д.), галогенированные углеводороды (дихлорметан, хлороформ, 1,2-дихлорэтан, тетрахлорид углерода), ароматические углеводороды (бензол, толуол, ксилол и т.д.), алифатические углеводороды (гексан, пентан, циклогексан и т.д.), нитрилы (ацетонитрил, проптонитрил и т.д.), амиды (ДМФ, N,N-диметилацетамид, N-метилпирролидинон и тому подобное). Они могут использоваться отдельно или в виде смеси.
Температура реакции составляет от -20 до 100°C, предпочтительно, от 0 до 60°C. Время реакции составляет обычно от 0,5 до 3 дней, предпочтительно, от 0,05 до 12 часов. Полученное производное амидоксима, представленное общей формулой (20), может быть подвергнуто следующей стадии с выделением или без выделения и очистке с помощью хорошо известных путей выделения и очистки, описанных далее.
Ацилирующий агент, используемый для амидоксима, представляет собой, например, хлорформиат, 2-этилгексил, CDI, фосген, трифосген и тому подобное, предпочтительно, хлорформиат, 2-этилгексил. Основание, которое должно быть использовано, включает органические основания, такие как триэтиламин, N,N-диизопропилэтиламин, пиридин, 4-диметиламинопиридин, диазабициклоундецен и тому подобное.
Количество ацилирующего агента составляет обычно от 1 до 50 эквивалентов относительно производного амидоксима, и, более предпочтительно, примерно от 1 до 3 эквивалентов.
Растворитель, который должен быть использован, особо не ограничивается, пока это не оказывает негативного влияния на реакцию, например, представляет собой органические растворители, такие как простые эфиры (диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан и т.д.), галогенированные углеводороды (дихлорметан, хлороформ, 1,2-дихлорэтан, тетрахлорид углерода), ароматические углеводороды (бензол, толуол, ксилол и т.д.), алифатические углеводороды (гексан, пентан, циклогексан и т.д.), нитрилы (ацетонитрил, проптонитрил и т.д.), амиды (ДМФ, N,N-диметилацетамид, N-метилпирролидинон и т.д.) и тому подобное, и они могут быть использованы отдельно или в виде смеси, и в процессе реакции они могут быть заменены на другие растворители.
Температура взамодействия с ацилирующим агентом составляет от -20 до 80°C, предпочтительно, от 0 до 40°C. Время реакции составляет обычно от 0,5 до 24 часов, предпочтительно, от 0,5 до 3 часов. Температура реакции, используемая при реакции циклизации полученного ацилированного соединения, составляет от 0 до 150°C, предпочтительно, от 0 до 120°C. Время реакции составляет обычно от 0,5 до 24 часов, предпочтительно, от 0,5 до 12 часов. Полученное соединение, представленное общей формулой (21), может быть подвергнуто следующей стадии с выделением или без выделения и очистке с помощью хорошо известных путей выделения и очистки, описанных далее.
[0123]
Соединение, представленное формулой (I) по настоящему изобретению, и его промежуточные продукты могут быть выделены и очищены хорошо известными путями выделения и очистки, такими как перекристаллизация, кристаллизация, дистилляция или колоночная хроматография. Соединение по настоящему изобретению и его синтетические промежуточные продукты обычно могут образовывать фармакологически приемлемую соль хорошо известным способом, и также могут быть преобразованы друг в друга.
[0124]
Когда в соединении по настоящему изобретению присутствуют оптические изомеры, стереоизомеры, таутомеры или поворотные изомеры, соединение по настоящему изобретению охватывает эти изомеры или их смесь. Например, когда в соединении по настоящему изобретению присутствует оптический изомер, если не указано иное, соединением по настоящему изобретению также охватываются рацемат и оптический изомер, выделенный из рацемата. Эти изомеры могут быть получены хорошо известным синтетическим способом, методами разделения (концентрирование, экстракция растворителем, колоночная хроматография, перекристаллизация и тому подобное), соответственно, с одним соединением. В соединении по настоящему изобретению, например, когда X1=атом кислорода, X2=атом кислорода, X3=NH, имеются таутомеры, показанные далее, все изомеры также включены в настоящее изобретение.
[0125]
[Формула 11]

[0126]
Соединение по настоящему изобретению или его соль могут быть в аморфной (аморфное) или кристаллической форме, и кристаллическая форма может быть в виде монокристаллической формы или полиморфической смеси, охватываемыми соединением по настоящему изобретению или его солью. Кристаллы могут быть получены путем применения хорошо известного способа кристаллизации.
Более того, соединение по настоящему изобретению или его соль могут представлять собой сольват (например, гидрат и т.д.) или не быть сольватом, они оба охватываются соединением по настоящему изобретению или его солью. Соединения, меченные изотопами (например, дейтерием,3H,14C,35S,125I и т.д.) и тому подобное, также охватываются соединением по настоящему изобретению или его солью.
[0127]
Хотя пролекарства соединения по настоящему изобретению или его соль также включены в настоящее изобретение, пролекарства относятся к соединениям, которые преобразуются в соединение по настоящему изобретению или его соль путем взаимодействия с ферментом или желудочной кислотой в физиологическом состоянии в живом организме, то есть, соединения, которые преобразуются в соединение по настоящему изобретению или его соль путем ферментативного окисления, восстановления или гидролиза и тому подобное, или соединения, которые преобразуются в соединение по настоящему изобретению или его соль с помощью желудочной кислоты. Более того, пролекарство соединения по настоящему изобретению или его соль может представлять собой соединения, которые преобразуются в соединения по настоящему изобретению или его соль в физиологических условиях, как описано в работе Hirokawa Shoten 1990 annual «Development of Pharmaceuticals» Volume 7 Molecular Design pages 163-198.
[0128]
Соль соединения по настоящемму изобретению подразумевает соль, которая является фармацевтически приемлемой.
[0129]
Соединение по настоящему изобретению или его соль обладают ингибирующей активностью против RNR. Соединение по настоящему изобретению или его соль могут быть использованы в качестве лекарственного средства для профилактики или лечения заболеваний, связанных с RNR, без проявления побочных эффектов, основанных на побочном действии белков, для образования которых требуются ионы железа, благодаря его превосходной ингибирующей RNR активности и его структуре, которая не образует хелаты с ионами металлов. «Связанное с RNR заболевание» включает болезни, возникновение которых может быть снижено, или симптомы которых находятся в состоянии ремиссии, или они могут быть облегчены и/или полностью излечены путем выключения или подавления и/или ингибирования функций RNR. Такими заболеваниями являются, например, злокачественные опухоли. Представляющие интерес злокачественные опухоли особо не ограничиваются, представляют собой рак головы и шеи, рак желудочно-кишечного тракта (рак пищевода, рак желудка, дуоденальный рак, рак печени, рак желчных путей (рак желчного пузыря, желчных протоков и т.д.), рак поджелудочной железы, колоректальный рак (рак толстой кишки, рак прямой кишки и т.д.), рак легких (немелкоклеточный рак легкого, мелкоклеточный рак легкого, мезотелиома и т.д.), рак молочной железы, рак половых органов (рак яичников, рак матки (рак шейки матки, рак эндометрия и т.д.), рак мочевой системы (рак почки, рак мочевого пузыря, рак предстательной железы, опухоль яичек и т.д.), гемопоэтические опухоли (лейкемия, злокачественная лимфома, множественная миелома и т.д.), опухоли костных и мягких тканей, рак кожи, опухоль головного мозга и тому подобное.
В настоящем документе «RNR» включает RNR человека или не человека, предпочтительно, RNR человека.
Соответственно, настоящее изобретение относится к ингибитору RNR, включающему соединение по настоящему изобретению или его соль в качестве активного ингредиента. Кроме того, настоящее изобретение относится к применению соединения по настоящему изобретению или его соли для получения ингибиторов RNR. Настоящее изобретение также относится к применению соединения по настоящему изобретению или его соли в качестве ингибиторов RNR. Кроме того, настоящее изобретение относится к соединению по настоящему изобретению или его соли для использования в качестве ингибиторов RNR.
[0130]
В еще одном варианте осуществления настоящее изобретение относится к лекарственному средству, содержащему соединение по настоящему изобретению или его соль в качестве активного ингредиента. Более того, настоящее изобретение относится к применению соединения по настоящему изобретению или его соли для изготовления лекарственного средства. Кроме того, настоящее изобретение относится к применению соединения по настоящему изобретению или его соли в качестве лекарственных средств. Кроме того, настоящее изобретение относится к соединению по настоящему изобретению или его соли для применения в качестве лекарственного средства.
[0131]
В еще одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей соединение по настоящему изобретению или его соль и фармацевтически приемлемый носитель.
В предпочтительном варианте осуществления лекарственное средство или фармацевтическая композиция представляют собой терапевтический агент для лечения связанных с RNR заболеваний, в более предпочтительном варианте осуществления лекарственное средство или фармацевтическая композиция представляют собой противоопухолевый агент.
[0132]
В еще одном варианте осуществления настоящее изобретение включает введение эффективного количества соединения по настоящему изобретению или его соли субъекту для обеспечения способа подавления активности RNR. Кроме того, настоящее изобретение включает введение эффективного количества соединения по настоящему изобретению или его соли субъекту для обеспечения способа лечения заболеваний, связанных с RNR. В предпочтительном варианте осуществления способ лечения заболеваний, связанных с RNR, является способом лечения опухолей. В способе лечения субъекты включают человека или животных, не являющихся людьми, нуждающихся в этом способе.
[0133]
При использовании соединения по настоящему изобретению или его соли в качестве фармацевтического средства их, необязательно, можно приготовить с фармацевтически приемлемым носителем, и в зависимости от профилактических или терапевтических целей могут быть подходящими различные лекарственные формы, в качестве лекарственных форм включают, например, пероральные средства, инъекции, суппозитории, мази и любые накладки. Так как соединение по настоящему изобретению или его соль обладают превосходной способностью к всасыванию в полости рта, предпочтительными являются пероральные средства. Эти лекарственные формы могут быть получены способами получения, широко известными для специалиста в данной области.
Что касается фармацевтически приемлемых носителей, то в качестве фармацевтических материалов используются обычные различные органические или неорганические вещества-носители, которые вводятся как: вспомогательные вещества, связующие вещества, разрыхляющие агенты, смазывающие вещества, красители для твердых препаратов; растворители, солюбилизирующие агенты, суспендирующие агенты, изотонические агенты, буферы, успокаивающее средство для жидких препаратов и тому подобное. Кроме того, при необходимости могут быть использованы фармацевтические добавки, которые включают, например, консерванты, антиоксиданты, красители, подслащивающие агенты, ароматизаторы, стабилизирующие агенты.
[0134]
Что касается фармацевтически приемлемых носителей и фармацевтических добавок, обычно они включают, например, в качестве вспомогательного вещества лактозу, сахарозу, хлорид натрия, глюкозу, крахмал, карбонат кальция, каолин, микрокристаллическую целлюлозу, кремниевую кислоту и тому подобное; в качестве связующих воду, этанол, пропанол, сахарный сироп, раствор глюкозы, раствор крахмала, раствор желатина, карбоксиметилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропил крахмал, метилцеллюлозу, этилцеллюлозу, шеллак, фосфат кальция, поливинилпирролидон и тому подобное; в качестве разрыхлителей сухой крахмал, альгинат натрия, порошок агара, гидрокарбонат натрия, карбонат кальция, лаурилсульфат натрия, моноглицерид стеариновой кислоты, лактозу и тому подобное; в качестве лубрикантов очищенный стеарат талька, буру, полиэтиленгликоль и тому подобное; в качестве красителя оксид титана, оксид железа и тому подобное; в качестве ароматизирующих агентов сахарозу, апельсиновую цедру, лимонную кислоту, виноградную кислоту и тому подобное.
[0135]
При составлении перорального твердого препарата он может быть подготовлен добавлением вспомогательного вещества к соединению по настоящему изобретению и, при необходимости, добавлением связующих веществ, разрыхлителей, смазывающих веществ, красителей или ароматизаторов и тому подобное, с последующим формованием в виде таблеток, покрытых оболочкой таблеток, гранул, порошков, капсул и тому подобное.
При составлении инъецируемых форм они могут быть подготовлены добавлением агентов, регулирующих рН, буферов, стабилизаторов, изотонических агентов, местных анестетиков и тому подобное, к соединению по настоящему изобретению с последующим изготовлением в виде подкожных, внутримышечных и внутривенных инъекций обычным способом.
[0136]
Количество соединения по настоящему изобретению, которое должно быть включено в состав каждой из единичных дозированных форм, описанных выше, на единичную дозированную форму, как правило, может составлять от 0,05 до 1000 мг для пероральной дозы, от 0,01 до 500 мг для инъекций, от 1 до 1000 мг для суппозиториев, при условии, что они могут быть изменены в зависимости от симптомов у пациентов, которые их принимают, или их дозированных форм.
[0137]
Кроме того, суточная доза лекарственного средства в лекарственной форме относительно соединения по настоящему изобретению составляет от 0,05 до 5000 мг в день для взрослых (масса тела 50 кг), предпочтительно, от 0,1 до 2000 мг и, предпочтительно, вышеуказанное количество вводится один или два раза в день, при условии, что оно может быть изменено в зависимости от симптомов у пациентов, веса, возраста или пола и тому подобного.
Примеры
[0138]
Настоящее изобретение описано далее более подробно спредоставлением примеров и примеров исследований, но настоящее изобретение не ограничивается этими примерами.
Различные реагенты, используемые в примерах, являются коммерчески доступными продуктами, если не указано иное. Для колоночной хроматографии на силикагеле использовали заполненную силикагелем колонку Biotage Ltd. SNAP-ULTRA (зарегистрированный товарный знак), или для обращенно-фазовой колоночной хроматографии на силикагеле использовали изготовленную Biotage заполненную силикагелем колонку SNAP KP-C18-HS (зарегистрированная торговая марка). ВЭЖХ, очищенная препаративной хроматографией с обращенной фазой, проводилась при следующих условиях. Объем и градиент впрыска выполнялись соответствующим образом.
Колонка: YMC-Actus Triart C18, 30×50 мм, 5 мкМ
УФ детекция: 254 нм
Скорость потока колонки: 40 мл/мин
Подвижная фаза: вода/ацетонитрил (0,1% муравьиная кислота)
Объем впрыска: 1,0 мл
Градиент: вода/ацетонитрил (от 10% до 90%)
Для получения ЯМР спектра использовали AL400 (400 MГц; JEOL (JEOL)) и Mercury400 (400 MГц; Agilent Technologies), и в качестве внутреннего стандарта использовали тетраметилсилан, при условии, что тетраметилсилан был в составе слаболетучего растворителя, в противном случае измерение проводили с использованием растворителя для ЯМР в качестве внутреннего стандарта, выражая все значение δ в м.д. Кроме того, ЖХМС спектры получали в следующих условиях, используя ACQUITY SQD изготовленный Waters (квадрупольный).
Колонка: изготовленная Waters ACQUITY UPLC (зарегистрированная торговая марка) BEH C18, 2,1×50 мм, 1,7 мкМ
МС детекция: ESI отрицательный
УФ детекция: 254 и 280 нм
Скорость потока колонки: 0,5 мл/мин
Подвижная фаза: вода/ацетонитрил (0,1% муравьиная кислота)
Объем впрыска: 1 мкл
Градиент (таблица 1)
Значения сокращений показаны далее.
с: синглет
д: дублет
т: триплет
кв: квартет
дд: двойной дублет
дт: двойной триплет
тд: триплет дублет
тт: триплет
ддд: двойной двойной дублет
ддт: двойной двойной триплет
дтд: двойной триплет дублет
тдд: триплет-двойной дублет
м: мультиплет
шир.: широкий
шир. с: широкий синглет
ДМСО-d6: дейтерированный диметилсульфоксид
CDCl3: дейтерированный хлороформ
CD3OD: дейтерированный метанол
CDI: 1,1'-карбоксиметил сульфонил диимидазол
DAST: трифторид N,N-диэтиламиносеры
DIBAL-H: диизобутилалюминийгидрид
ДМФ: диметилформамид
ДМСО: диметилсульфоксид
ТГФ: Тетрагидрофуран
WSC=EDCI=1-этил-3-(3-диметиламинопропил)карбодиимид
HOBt=1-гидроксибензотриазол
[0139]
Ссылочный пример A1. 2-(1-Бромэтил)-1-фтор-3,4-диметилбензол
[0140]
[Формула 12]

[0141]
(Стадия 1) 1-(6-фтор-2,3-диметилфенил)этанол
После добавления по каплям при температуре 0°C раствора метилмагний бромида в диэтиловом эфире (3,0 M, 70 мл) к раствору в ТГФ 6-фтор-2,3-диметилбензальдегида (22,0 г) (300 мл) реакционную смесь перемешивали при комнатной температуре в течение 1 часа. При охлаждении на ледяной бане добавляли по каплям насыщенный водный раствор хлорида аммония (150 мл) и добавляли этилацетат (200 мл), и продукт реакции разделяли на разные слои. Органический слой промывали последовательно HCl (1 M, 200 мл), водой (200 мл) и насыщенным солевым раствором (200 мл), и затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением 1-(6-фтор-2,3 диметилфенил)этанола (23,7 г).
[0142]
(Стадия 2)
К раствору в хлороформе (120 мл) 1-(6-фтор-2,3-диметилфенил)этанола (23,7 г), полученного на вышеуказанной стадии 1, при температуре 0°C добавляли по каплям трибромид фосфора (26,5 мл), и реакционный раствор перемешивали в течение 30 минут при температуре 0°C. К охлаждаемому на льду насыщенному водному бикарбонату натрия (1 л) добавляли реакционную смесь. После добавления к смеси хлороформа (500 мл) продукт реакции разделяли на разные слои, и органический слой последовательно промывали водой (200 мл) и насыщенным солевым раствором (200 мл). Органический слой сушили над безводным сульфатом магния с получением указанного в заголовке соединения (29,5 г) путем концентрирования при пониженном давлении.
[0143]
Ссылочные примеры A2-A41
Альдегид и метилмагний бромид в качестве исходных продуктов вместе подвергали взаимодействию таким же образом, как в ссылочном примере A1, стадия 1 и стадия 2, и затем продукт реакции подвергали взаимодействию с трибромидом фосфора с получением соединения по ссылочному примеры A2-A41. Однако соединения по ссылочным примерам A40 и A41 получали тем же способом, используя этилмагний бромид и метилйодид-d3-магний, соответственно, вместо метилмагний бромида.
[0144]
[Таблица 1-1]
[0145]
[Таблица 1-2]
[0146]
[Таблица 1-3]
[0147]
Ссылочный пример B1. 2-(1-Бромэтил)-4-этил-1-фтор-3-метилбензол
[0148]
[Формула 13]

[0149]
(Стадия 1) 2-бром-3-этил-6-фторбензальдегид
К раствору в ТГФ (150 мл) 2-бром-1-этил-4-фторбензола (14,4 г) при температуре -78°C добавляли по каплям раствор в ТГФ диизопропиламида лития (1,5 M, 54 мл). После перемешивания реакционного раствора в течение 30 минут добавляли ДМФ (6,5 мл) и смесь затем перемешивали в течение 20 минут. В реакционный раствор последовательно добавляли по каплям воду (50 мл) и соляную кислоту (6 M, 50 мл), и смесь два раза экстрагировали гексаном (100 мл). Объединенный органический слой два раза промывали насыщенным солевым раствором (50 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, и получали 2-бром-3-этил-6-фторбензальдегид (14,5 г).
[0150]
(Стадия 2) 3-этил-6-фтор-2-метилбензальдегид
К раствору в 1,4-диоксане (200 мл) 2-бром-3-этил-6-фторбензальдегида, полученного на стадии 1, описанной выше, (14,5 г), добавляли воду (90 мл), трикалий фосфат (32,0 г), метилбороновую кислоту (6,4 г) и аддукт дихлорида [бис(дифенилфосфино)ферроцен]палладия (II) и дихлорметана (1,75 г), и реакционный раствор нагревали при кипячении при температуре 110°C в течение 2 часов. Реакционному раствору давали охладиться до комнатной температуры, и смесь затем перемешивали в течение 2 часов, затем добавляли гексан (90 мл). Реакционный раствор фильтровали через CELITE и отделяли фильтрат, затем остаток промывали гексаном. Органический слой промывали два раза насыщенным солевым раствором (100 мл), и затем сушили над безводным сульфатом натрия, концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) и получали 3-этил-6-фтор-2-метилбензальдегид (8,4 г).
[0151]
(Стадия 3)
В соответствии со способами ссылочного примера A1, стадии 1 и 2, используя 3-этил-6-фтор-2-метилбензальдегид (8,4 г), полученный на вышеуказанной стадии 2, осуществляли ту же операцию с получением указанного в заголовке соединения.
[0152]
Ссылочные примеры B2-B6
В соответствии со способами ссылочного примера B1, стадии 1 и 2, и ссылочного примера A1, стадии 1 и 2, были синтезированы следующие соединения ссылочных примеров B2-B5. Также, в соответствии со способами ссылочного примера B1, стадия 1, и ссылочного примера A1, стадии 1 и 2, было синтезировано соединение ссылочного примера B6.
[0153]
[Таблица 2]
[0154]
Ссылочный пример C1. 7-(1-Хлорэтил)-1-метил-2,3-дигидро-1H-инден
[0155]
[Формула 14]

[0156]
К раствору в метаноле (5,0 мл) 1-(3-метил-2,3-дигидро-1H-инден-4-ил)этанона (1,0 г) добавляли боргидрид натрия (261 мг), и смесь перемешивали при комнатной температуре в течение 30 минут. Реакционный раствор добавляли в воду (10 мл) и затем экстрагировали два раза этилацетатом (20 мл). Объединенный органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток растворяли в дихлорметане (5,0 мл), при комнатной температуре добавляли тионилхлорид (2,0 мл), и реакционный раствор перемешивали при температуре 50°C в течение 30 минут. В реакционный раствор добавляли воду, и смесь экстрагировали два раза этилацетатом (20 мл). Объединенный органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,1 г).
[0157]
Ссылочные примеры C2-C4
В соответствии со способом по ссылочному примеру C1 были синтезированы следующие соединения ссылочных примеров C2-C4.
[0158]
[Таблица 3]
[0159]
Ссылочный пример D1. (2S,3R)-2-Амино-3-(6-фтор-2,3-диметилфенил)бутановая кислота
[0160]
[Формула 15]

[0161]
Раствор в ДМФ (50 мл) 2-(1-бромэтил)-1-фтор-3,4-диметилбензола (14,0 г), полученного в ссылочном примере A1, добавляли по каплям к раствору в ДМФ (50 мл) (S)-2-[о-[(N-бензилпролил)амино]фенил]бензилиденамино-ацетата (2-)-N,N,N-никеля (II) (14,5 г) и гидроксида калия (16,3 г), и смесь перемешивали при той же температуре в течение 1 часа. В реакционный раствор добавляли раствор насыщенного хлорида аммония (50 мл) и этилацетата (50 мл), слои разделяли, и водный слой экстрагировали два раза этилацетатом (50 мл). Объединенные органические слои промывали последовательно водой (50 мл) и насыщенным солевым раствором (50 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: этилацетат/гексан). Полученное соединение растворяли в метаноле (120 мл), добавляли соляную кислоту (3 M, 90 мл), и смесь перемешивали при температуре 80°C в течение 45 минут. Метанол отгоняли при пониженном давлении, и к остатку добавляли хлороформ (50 мл) и воду (50 мл). Водный слой промывали хлороформом (50 мл) и концентрировали при пониженном давлении. Остаток очищали с помощью обращенно фазовой хроматографии на колонке с силикагелем (метанол/вода) с получением указанного в заголовке соединения (2,0 г).1H ЯМР (CD3OD) δ: 7,03 (дд, J=8,2, 5,7 Гц, 1H), 6,79 (дд, J=11,7, 8,4 Гц, 1H), 3,74-3,87 (м, 2H), 2,29 (с, 3H), 2,25 (с, 3H), 1,40 (дд, J=6,8, 2,4 Гц, 3H)
[0162]
Ссылочные примеры D2-D58
После осуществления взаимодействия алкилирующего агента, полученного в ссылочных примерах A2-A41, ссылочных примерах B1-B6 и ссылочных примерах C1-C4, и (S)-2-[о-[(N-бензилпролил)амино]фенил]-бензилиденамино-ацетата (2-)-N,N,N-никеля (II), путем кислотного гидролиза получали соединения ссылочных примеров D2-D58, показанные далее. Однако в случае соединения ссылочного примера D56 в качестве исходного продукта был использован 6-фтор-2,3-диметилбензальдегид, и соединения ссылочных примеров D57 и 58 получали таким же способом, используя (R)-2-[о-[(N-бензилпролил)амино]фенил]-бензилиденамино-ацетат (2-)-N,N,N-никеля (II) вместо (S)-2-[о-[(N-бензилпролил)амино]фенил]-бензилиденамино-ацетата (2-)-N,N,N-никеля (II).
[0163]
[Таблица 4-1]
[0164]
[Таблица 4-2]
[0165]
[Таблица 4-3]
[0166]
[Таблица 4-4]
[0167]
[Таблица 4-5]
[0168]
Ссылочный пример D59. Моногидрохлорид 2-амино-3-(6-фтор-2,3-диметилфенил)-3-метилбутановой кислоты
[0169]
[Формула 16]

[0170]
(Стадия 1) 2-(6-фтор-2,3-диметилфенил)-2-метилпропаналь
2-(6-Фтор-2,3-диметилфенил)-2-метилпропаннитрил (700 мг) растворяли в дихлорметане (35 мл) и охлаждали до температуры -78°C. Добавляли раствор в толуоле (1,0 M, 10 мл) диизобутилалюминийгидрида, и реакционный раствор перемешивали в течение 1 часа при той же температуре. Последовательно добавляли метанол (5,0 мл) и CELITE (20 г), и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор фильтровали через CELITE, промывали смесью гексан/этилацетат=1/1 (30 мл), и фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением 2-(6-фтор-2,3-диметилфенил)-2-метилпропаналя (400 мг).
[0171]
(Стадия 2) 2-амино-3-(6-фтор-2,3-диметилфенил)-3-метилбутанонитрил
2-(6-Фтор-2,3-диметилфенил)-2-метилпропаналь (400 мг), полученный на вышеуказанной стадии 1, растворяли в метаноле (7,0 мл) и воде (10 мл), добавляли 28%-ный водный раствор аммиака (280 мкл), цианид калия (130 мг) и хлорид аммония (110 мг), и реакционный раствор перемешивали в течение 12 часов при температуре 70°C. В реакционный раствор добавляли насыщенный водный раствор гидрокарбоната натрия (5,0 мл), и смесь экстрагировали этилацетатом (20 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением 2-амино-3-(6-фтор-2,3-диметилфенил)-3-метилбутанонитрила (380 мг).
[0172]
(Стадия 3)
2-Амино-3-(6-фтор-2,3-диметилфенил)-3-метилбутанонитрил (380 мг), полученный на вышеуказанной стадии 2, растворяли в соляной кислоте (12M, 5,0 мл), и реакционный раствор перемешивали в течение 12 часов при температуре 100°C. Реакционный раствор охлаждали до комнатной температуры и концентрировали при пониженном давлении с получением указанного в заголовке соединения (300 мг).
[0173]
Ссылочный пример D60. Моногидрохлорид 2-амино-2-(1-(6-фтор-2,3-диметилфенил)циклопропил)уксусной кислоты
[0174]
[Формула 17]

[0175]
Указанное в заголовке соединение было синтезировано в соответствии со способом по ссылочному примеру D59, используя 1-(6-фтор-2,3-диметилфенил)циклопропанкарбонитрил вместо 2-(6-фтор-2,3-диметилфенил)-2-метилпропаннитрила.
[0176]
Ссылочный пример D61. Моногидрохлорид 2-амино -3-(6-фтор-2,3-диметилфенил)-3-бутеновой кислоты
[0177]
[Формула 18]

[0178]
(Стадия 1) 2-(6-фтор-2,3-диметил)-2-гидрокси-пропаннитрил
В раствор в дихлорметане (20 мл) 1-(6-фтор-2,3-диметилфенил)этанона (1,3 г) добавляли йодид цинка (480 мг) и триметилсилил цианид (2,0 мл), и реакционную смесь перемешивали в течение 12 часов при комнатной температуре. В реакционный раствор добавляли водный раствор гидроксида натрия (2 M, 10 мл), и смесь экстрагировали смесью этилацетат/гексан=1/1 (20 мл). Органический слой промывали соляной кислотой (2 M, 20 мл) и насыщенным солевым раствором (20 мл), в этом порядке, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением 2-(6-фтор-2,3-диметил)-2-гидрокси-пропаннитрила (1,4 г).
[0179]
(Стадия 2) 2-фтор-2-(6-фтор-2,3-диметилфенил)пропаннитрил
К раствору в дихлорметане (5,0 мл) 2-(6-фтор-2,3-диметил)-2-гидрокси-пропаннитрила (170 мг), полученного на вышеуказанной стадии 1, добавляли DAST (150 мкл), и реакционный раствор перемешивали при комнатной температуре в течение 12 часов. В реакционный раствор добавляли насыщенный водный раствор гидрокарбоната натрия (10 мл), и смесь экстрагировали смесью этилацетат/гексан=1/1 (20 мл). Органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением 2-фтор-2-(6-фтор-2,3-диметилфенил)пропаннитрила (100 мг).
[0180]
(Стадия 3) 2-амино-3-фтор-3-(6-фтор-2,3-диметилфенил)-бутаннитрил
Исходя из 2-фтор-2-(6-фтор-2,3-диметилфенил)пропаннитрила, полученного на вышеуказанной стадии 2, в соответствии со способом по ссылочному примеру D59, стадии 1-2, получали 2-амино-3-фтор-3-(6-фтор-2,3-диметилфенил)-бутаннитрил.
(Стадия 4) Моногидрохлорид 2-амино-3-(6-фтор-2,3-диметилфенил)-3-бутеновой кислоты
2-Амино-3-фтор-3-(6-фтор-2,3-диметилфенил)-бутаннитрил (460 мг), полученный на вышеуказанной стадии 3, растворяли в соляной кислоте (12 M, 3,0 мл), и смесь перемешивали в течение 12 часов при температуре 100°C. Смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении с получением указанного в заголовке соединения.
[0181]
Ссылочный пример E1. 5-Хлор-8-(хлорсульфонил)-4-метил-d3-хроман-4-ил ацетат
[0182]
[Формула 19]

[0183]
(Стадия 1) 8-бром-5-хлор-4-метилхроман-4-ол
К раствору в диэтиловом эфире (1,0 M, 63 мл) метил йодид-d3-магния добавляли ТГФ (50 мл), и при комнатной температуре добавляли по каплям раствор в ТГФ (50 мл) 8-бром-5-хлорхроман-4-она (7,5 г). Реакционный раствор перемешивали в течение 10 минут при той же температуре, на ледяной бане медленно добавляли по каплям соляную кислоту (1 M, 50 мл) и этилацетат (50 мл) для разделения слоев. Водный слой экстрагировали этилацетатом (50 мл), и объединенный органический слой промывали насыщенным солевым раствором (50 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением 8-бром-5-хлор-4-метилхроман-4-ола (7,7 г).
[0184]
(Стадия 2) 8-бром-5-хлор-4-метил-d3-хроман-4-ил ацетат
К безводному раствору в уксусной кислоте (100 мл) 8-бром-5-хлор-4-метилхроман-4-ола (7,7 г), полученного на вышеуказанной стадии 1, и при температуре -40°C добавляли по каплям раствор в ацетонитриле (12 мл) трифторметансульфоната скандия (III) (340 мг), и реакционный раствор перемешивали в течение 30 минут при той же температуре. В реакционный раствор последовательно добавляли насыщенный водный раствор гидрокарбоната натрия (100 мл) и этилацетат (100 мл), и слои разделяли. Водный слой экстрагировали этилацетатом (100 мл), и объединенные органические слои промывали два раза насыщенным водным раствором гидрокарбоната натрия (100 мл) и один раз насыщенным солевым раствором (100 мл). Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением 8-бром-5-хлор-4-метил-d3-хроман-4-ил ацетата (8,9 г).
[0185]
(Стадия 3) 8-(бензилтио)-5-хлор-4-метил-d3-хроман-4-ил ацетат
К раствору в 1,4-диоксане (70 мл) 8-бром-5-хлор-4-метил-d3-хроман-4-ил ацетата (6,7 г), полученного на вышеуказанной стадии 2, добавляли 4,5-бис(дифенилфосфино)-9,9-диметилксантен (600 мг), трис(дибензилиденацетон)дипалладий (0) (480 мг), N,N-диизопропилэтиламин (7,2 мл) и бензилмеркаптан (2,8 мл), и реакционный раствор перемешивали в течение 2 часов при температуре 90°C. Реакционному раствору давали охладиться до комнатной температуры и фильтровали через CELITE. После промывания остатка гексаном (50 мл) к фильтрату для расслоения добавляли воду (50 мл). Органический слой промывали насыщенным солевым раствором (50 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Реакционный раствор концентрировали при пониженном давлении, и остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением 8-(бензилтио)-5-хлор-4-метил-d3-хроман-4-ил ацетата (6,3 г).
[0186]
(Стадия 4)
К раствору в ацетонитриле (100 мл) 8-(бензилтио)-5-хлор-4-метил-d3-хроман-4-ил ацетата (6,3 г), полученного на вышеуказанной стадии 3, добавляли воду (3 мл), уксусную кислоту (4,3 мл) и 1,3-дихлор-5,5-диметилгидантоин (7,2 г), и реакционный раствор перемешивали в течение 30 минут при той же температуре. В реакционный раствор добавляли насыщенный водный раствор гидрокарбоната натрия (70 мл) и этилацетат (70 мл), и слои разделяли. Водный слой экстрагировали этилацетатом (70 мл). Объединенный органический слой промывали насыщенным солевым раствором (70 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением указанного в заголовке соединения (5,3 г).
[0187]
Ссылочный пример E5. 5-Хлор-8-(хлорсульфонил)-4-(трифторметил)хроман-4-ил ацетат
[0188]
[Формула 20]

[0189]
(Стадия 1) 8-бром-5-хлор-4-(трифторметил)хроман-4-ол
К раствору в ТГФ (4 мл) 8-бром-5-хлор-хроманон-4-она (398,2 мг) при комнатной температуре добавляли фторид цезия (340,2 мг) и трифторметилтриметилсилан (0,68 мл), и реакционный раствор перемешивали в течение 4 часов. В реакционный раствор добавляли водный раствор хлорид аммония (5 мл), и смесь экстрагировали смесью этилацетат/гексан=1/1 (15 мл). Органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали путем колоночной хроматографии (элюент: гексан/этилацетат) с получением 8-бром-5-хлор-4-(трифторметил)хроманон-4-ола (139,2 мг).
(Стадия 2)
Исходя из 8-бром-5-хлор-4-(трифторметил)хроман-4-ола, полученного на вышеуказанной стадии 1, получали указанное в заголовке соединение в соответствии со способом по ссылочному примеру E1, стадии 2-4.
[0190]
Ссылочный пример E6 8-(хлорсульфонил)-4-(трифторметил)хроман-4-илацетат
Используя 8-бром-хроман-4-он в качестве исходного материала, получали указанное в заголовке соединение в соответствии со способом, описанным в ссылочном примере E5, стадии 1 и 2.
Ссылочные примеры E2-E4 и от E7 до E34
В соответствии со способом по ссылочному примеру E1, стадии 1-4, были синтезированы соединения ссылочных примеров E2-E4. В соответствии со способом по ссылочному примеру E1, стадия 3 и 4, были синтезированы соединения ссылочных примеров от E7 до E32. В соответствии со способом по ссылочному примеру E1, стадии 2-4, были синтезированы соединения ссылочных примеров E33 и E34. Соединения ссылочных примеров E2-E4 и E7-E34 и исходные продукты перечислены в следующей таблице.
[0191]
[Таблица 5-1]
[0192]
[Таблица 5-2]
[0193]
[Таблица 5-3]
[0194]
Ссылочный пример E35. 5-Хлор-6-(пирролидин-1-карбонил)пиридин-2-сульфонилхлорид
[0195]
[Формула 21]

[0196]
(Стадия 1) метил 6-(бензилтио)-3-хлорпиколинат
В соответствии со способом по ссылочному примеру E1, стадия 3, исходя из метил 6-бром-3-хлорпиколината получали метил 6-(бензилтио)-3-хлорпиколинат.
[0197]
(Стадия 2) 6-(бензилтио)-3-хлорпиколиновая кислота
Метил 6-(бензилтио)-3-хлорпиколинат (1,0 г), полученный на вышеуказанной стадии 1, растворяли в ТГФ (5,0 мл) и воде (1,0 мл), добавляли гидроксид лития (165 мг), и реакционный раствор перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор добавляли в соляную кислоту (1 M, 10 мл) и экстрагировали два раза этилацетатом (20 мл). Органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением 6-(бензилтио)-3-хлорпиколиновой кислоты (920 мг).
[0198]
(Стадия 3) (6-(бензилтио)-3-хлорпиридин-2-ил)(пирролидин-1-ил)метанон
6-(Бензилтио)-3-хлорпиколиновую кислоту (100 мг), полученную на вышеуказанной стадии 2, растворяли в ДМФ (2,5 мл), добавляли CDI (116 мг), реакционный раствор перемешивали при комнатной температуре в течение 10 минут, и затем добавляли триэтиламин (150 мкл) и пирролидин (60 мкл), и реакционный раствор перемешивали в течение 12 часов при температуре 50°C. Реакционный раствор добавляли в воду (20 мл) и экстрагировали этилацетатом (20 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением (6-(бензилтио)-3-хлорпиридин-2-ил)(пирролидин-1-ил)метанона (105 мг).
[0199]
(Стадия 4)
Исходя из (6-(бензилтио)-3-хлорпиридин-2-ил)(пирролидин-1-ил)метанона, полученного на вышеуказанной стадии 3 в соответствии со способом по ссылочному примеру E1, стадия 4, получали указанное в заголовке соединение.
[0200]
Ссылочные примеры E36-E43
В соответствии со способом по ссылочным примерам E35, стадия 3, и E1, стадия 4, исходя из 6-(бензилтио)-3-хлорпиколиновой кислоты, полученной в ссылочном примере E35, стадия 2, были синтезированы соединения ссылочных примеров E36-E43, показанные далее.
[0201]
[Таблица 5-4]
[0202]
Ссылочный пример E44. 1-(6-Хлор-3-(хлорсульфонил)-2-метоксифенил)этилацетат
[0203]
[Формула 22]

[0204]
(Стадия 1) 3-бром-6-хлор-2-метоксибензальдегид
В соответствии со способом по ссылочному примеру B1, стадия 1, исходя из 1-бром-4-хлор-2-метоксибензола получали 3-бром-6-хлор-2-метоксибензальдегид.
[0205]
(Стадия 2) 1-(3-бром-6-хлор-2-метоксифенил)этанол
Исходя из 3-бром-6-хлор-2-метоксибензальдегида, полученного на вышеуказанной стадии 1, в соответствии со способом по ссылочному примеру A1, стадия 1, получали 1-(3-бром-6-хлор-2-метоксифенил)этанол.
[0206]
(Стадия 3) 1-(3-бром-6-хлор-2-метоксифенил)этилацетат
1-(3-Бром-6-хлор-2-метоксифенил)этанол (1,9 г), полученный на вышеуказанной стадии 2, растворяли в дихлорметане (20 мл), последовательно добавляли триэтиламин (2,0 мл), N,N-диметил-4-аминопиридин (100 мг) и безводную уксусную кислоту (1,2 мл), и реакционный раствор перемешивали в течение 30 минут при комнатной температуре. Реакционный раствор концентрировали при пониженном давлении, и остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением 1-(3-бром-6-хлор-2-метоксифенил)этилацетата (2,2 г).
[0207]
(Стадия 4)
Исходя из 1-(3-бром-6-хлор-2-метоксифенил)этилацетата, полученного на вышеуказанной стадии 3, в соответствии со способом по ссылочным примерам E1, стадии 3 и 4, получали указанное в заголовке соединение.
[0208]
Ссылочный пример E45. 1-(5-Хлор-2-(хлорсульфонил)-3-метоксипиридин-4-ил)этилацетат
[0209]
[Формула 23]

[0210]
В соответствии с каждым из способов по ссылочному примеру B1, стадия 1, ссылочному примеру A1, стадия 1, ссылочному примеру E44, стадия 3, и ссылочному примеру E1, стадии 3 и 4, используя 2-бром-5-хлор-3-метоксипиридин вместо 1-бром-4-хлор-2-метоксибензола получали указанное в заголовке соединение.
[0211]
Ссылочный пример E46. 2-(6-Хлор-3-(хлорсульфонил)-2-метоксифенил)пропан-2-ил ацетат
[0212]
[Формула 24]

[0213]
(Стадия 1) 1-(3-бром-6-хлор-2-метоксифенил)этанон
К раствору в дихлорметане (30 мл) 1-(3-бром-6-хлор-2-метоксифенил)этанола (2,8 г), полученного по ссылочному примеру E44, стадия 2, добавляли 1,1,1-триацетокси-1,1-дигидро-1,2-бензйодоксол-3-(1H)-он (5,4 г), и реакционный раствор перемешивали в течение 20 минут при комнатной температуре. Реакционный раствор добавляли по каплям к перемешиваемому раствору смеси насыщенный водный раствор гидрокарбоната натрия/раствор гидросульфита натрия=1/1 (50 мл) на ледяной бане, и слои разделяли. Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением 1-(3-бром-6-хлор-2-метоксифенил)этанона (2,7 г).
[0214]
(Стадия 2) 2-(3-бром-6-хлор-2-метоксифенил)пропан-2-илацетат
Исходя из 1-(3-бром-6-хлор-2-метоксифенил)этанона, полученного на вышеуказанной стадии 1, в соответствии со способом по ссылочному примеру E1, стадии 1 и 2, получали 2-(3-бром-6-хлор-2-метоксифенил)пропан-2-илацетат.
[0215]
(Стадия 3)
Исходя из 2-(3-бром-6-хлор-2-метоксифенил) пропан-2-илацетата (500 мг), полученного на вышеуказанной стадии 2, в соответствии со способом по ссылочному примеруы E1, стадии 3 и 4, получали указанное в заголовке соединение.
[0216]
Ссылочный пример E47. 4-Хлор-2-(2,2-дифторэтокси)бензол-1-сульфонилхлорид
[0217]
[Формула 25]

[0218]
(Стадия 1) 1-бром-4-хлор-2-(2,2-дифторэтокси)бензол
К раствору в ДМФ (5 мл) 2-бром-5-хлорфенола (244 мг) добавляли карбонат калия (325 мг) и 2,2-дифторэтил 4-метилбензолсульфонат (320 мг), и реакционный раствор перемешивали в течение 3 часов при температуре 95°C. В водный раствор гидроксида натрия (1 M, 20 мл) добавляли реакционный раствор и экстрагировали смесью толуол/этилацетат=1/1 (20 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением 1-бром-4-хлор-2-(2,2-дифторэтокси)бензола (315 мг).
[0219]
(Стадия 2)
Исходя из 1-бром-4-хлор-2-(2,2-дифторэтокси)бензола, полученного на вышеуказанной стадии 1 в соответствии со способом по ссылочному примеруы E1, стадии 3 и 4, было синтезировано указанное в заголовке соединение.
[0220]
Ссылочные примеры E48 и E49
В соответствии со способами ссылочного примера E47, стадия 1, и ссылочного примера E1, стадии 3 и 4, были синтезированы соединения ссылочных примеров E48 и 49, показанные далее. Однако, что касается ссылочного примера 48, вместо 2,2-дифторэтил 4-метилбензолсульфоната натрия использовали хлордифторацетат.
[0221]
[Таблица 5-5]
[0222]
Ссылочный пример E50. 4-Хлор-2-(изоксазол-5-ил)бензол-1-сульфонилхлорид
[0223]
[Формула 26]

[0224]
(Стадия 1) 5-(2-бром-5-хлорфенил)изоксазол
Диметилацеталь N,N-диметилформамидный раствор (6,0 мл) 1-(2-бром-5-хлорфенил)этанона (400 мг) перемешивали в течение 16 часов при температуре 140°C. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении и образовавшийся остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат). Полученное соединение растворяли в метаноле (4,0 мл), добавляли гидрохлорид гидроксиламина (175 мг), и реакционный раствор перемешивали при комнатной температуре в течение 16 часов. В водный раствор бикарбоната натрия (20 мл) добавляли реакционный раствор и экстрагировали этилацетатом (20 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем для очистки (элюент: гексан/этилацетат) с получением 5-(2-бром-5-хлорфенил)изоксазола (430 мг).
[0225]
(Стадия 2)
Исходя из 5-(2-бром-5-хлорфенил)изоксазола, полученного на вышеуказанной стадии 1, в соответствии со способом по ссылочному примеру E1, стадии 3, 4, получали указанное в заголовке соединение.
[0226]
Ссылочный пример E51. трет-Бутил бензилокси(5-хлор-2-(хлорсульфонил)бензоил)карбамат
[0227]
[Формула 27]

[0228]
(Стадия 1) N-(бензилокси)-2-(бензилтио)-5-хлорбензамид
В соответствии со способом по ссылочному примеру E1, стадия 3, исходя из N-(бензилокси)-2-бром-5-хлорбензамида был синтезирован N-(бензилокси)-2-(бензилтио)-5-хлорбензамид.
[0229]
(Стадия 2) трет-бутил бензилокси (2-(бензилтио)-5-хлор-бензоил)карбамат
К раствору в дихлорметане (10 мл) N-(бензилокси)-2-(бензилтио)-5-хлорбензамида (433 мг), полученного в ссылочном примере 1, добавляли N,N-диметил-4-аминопиридин (280 мг) и ди-трет-бутил дикарбонат (740 мг), и реакционный раствор перемешивали в течение 16 часов при температуре 55°C. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением трет-бутилбензилокси (2-(бензилтио)-5-хлорбензоил)карбамата (549 мг).
[0230]
(Стадия 3)
Исходя из трет-бутилбензилокси (2-(бензилтио)-5-хлорбензоил)карбамата, полученного на вышеуказанной стадии 2, в соответствии со способом по ссылочному примеру E1, стадия 4, получали указанное в заголовке соединение.
[0231]
Ссылочный пример E52. трет-Бутил (5-хлор-2-(хлорсульфонил)бензоил)(метил)карбамат
[0232]
[Формула 28]

[0233]
(Стадия 1) 2-бром-5-хлор-N-метилбензамид
Исходя из 2-бром-5-хлорбензойной кислоты и метиламина, в соответствии со способом по ссылочному примеру E35, стадия 3, получали 2-бром-5-хлор-N-метилбензамид.
[0234]
(Стадия 2) трет-бутил (2-бром-5-хлорбензоил)(метил)карбамат
Исходя из 2-бром-5-хлор-N-метилбензамида, полученного на вышеуказанной стадии 1, в соответствии со способом по ссылочному примеру E51, стадия 2, получали (2-бром-5-хлорбензоил)(метил)карбамат.
[0235]
(Стадия 3)
Исходя из трет-бутил (2-бром-5-хлорбензоил)(метил)карбамата, полученного на вышеуказанной стадии 2, в соответствии со способом по ссылочному примеру E1, стадии 3 и 4, получали указанное в заголовке соединение.
[0236]
Ссылочный пример E53. Метил 5-хлор-2-(хлорсульфонил)-4-нитробензоат
[0237]
[Формула 29]

[0238]
(Стадия 1) метил 2-бром-5-хлор-4-нитробензоат
К раствору в 2-метил-2-пропаноле (5 мл) 1-бром-4-хлор-2-метил-5-нитробензола (1,0 г), добавляли воду (5 мл), анизол (2,5 мл) и перманганат калия (1,6 г), и реакционный раствор перемешивали при температуре 100°C в течение 20 часов. Реакционный раствор охлаждали до комнатной температуры, фильтровали через CELITE, и промывали водой (10 мл) и этилацетатом (10 мл). Объединенные фильтраты добавляли в соляную кислоту (1 M, 20 мл), и слои разделяли. Водный слой экстрагировали три раза этилацетатом (20 мл). Объединенный органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток растворяли в метаноле (5,0 мл), добавляли дихлорметан (10 мл) и раствор в гексане триметилсилилдиазометана (0,6 M, 6,0 мл), и реакционный раствор перемешивали при комнатной температуре в течение 20 минут. Реакционный раствор концентрировали при пониженном давлении, и остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением метил 2-бром-5-хлор-4-нитробензоата (529 мг).
[0239]
(Стадия 2)
Исходя из метил 2-бром-5-хлор-4-нитробензоата, полученного на вышеуказанной стадии 1, в соответствии со способом по ссылочному примеру E1, стадии 3 и 4, получали указанное в заголовке соединение.
[0240]
Ссылочный пример E54. 4-Хлор-2-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)бензол-1-сульфонилхлорид
[0241]
[Формула 30]

[0242]
(Стадия 1) 5-(2-бром-5-хлорфенил)-1,3,4-оксадиазол-2(3H)-он
К суспензии в ТГФ (6,0 мл) 2-бром-5-хлорбензойной кислоты (300 мг) добавляли CDI (310 мг), и реакционный раствор перемешивали при комнатной температуре в течение 20 минут. Реакционный раствор охлаждали на льду, добавляли моногидрат гидразина (160 мкл), и реакционный раствор перемешивали при той же температуре в течение 20 минут. Реакционный раствор добавляли в воду (15 мл) и экстрагировали этилацетатом (15 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток растворяли в 1,4-диоксане (6,0 мл), добавляли CDI (310 мг), и реакционный раствор перемешивали при температуре 45°C в течение 2 часов. Реакционный раствор добавляли в воду (15 мл) и экстрагировали этилацетатом (15 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением 5-(2-бром-5-хлорфенил)-1,3,4-оксадиазол-2(3H)-она (300 мг).
[0243]
(Стадия 2)
Исходя из 5-(2-бром-5-хлорфенил)-1,3,4-оксадиазол-2(3H)-она, полученного на вышеуказанной стадии 1, в соответствии со способом стадий 3 и 4 ссылочного примера E1 получали указанное в заголовке соединение.
[0244]
Ссылочный пример E55. трет-Бутил N-трет-бутоксикарбонил-N-(1-(5-хлор-2-хлорсульфонил-фенил)циклопропил]карбамат
[0245]
[Формула 31]

[0246]
(Стадия 1) 1-(2-бензилсульфанил-5-хлорфенил)циклопропанамин
К суспензии в ТГФ (10 мл) 2-(бензилтио)-5-хлорбензонитрила (1,0 г) и тетраизопропоксида титана (1,3 мл) при температуре -78°C добавляли по каплям раствор в диэтиловом эфире (3,0 M, 3,0 мл) метилмагний бромида, и реакционный раствор перемешивали при той же температуре в течение 10 минут. В реакционный раствор добавляли комплекс трифторид бора с диэтиловым эфиром (1,1 мл), и смесь затем перемешивали при комнатной температуре в течение 1 часа, и затем для разделения слоев добавляли воду (5 мл) и водный раствор гидроксида натрия (1 M, 5 мл), водный слой экстрагировали диэтиловым эфиром (20 мл). Объединенные органические слои промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением 1-(2-бензилсульфанил-5-хлор-фенил)циклопропанамина (490 мг).
[0247]
(Стадия 2) трет-бутил N-[1-(2-бензилсульфанил-5-хлор-фенил)-циклопропил]-N-трет-бутоксикарбонил-карбамат
К раствору в 1,2-дихлорэтане (10 мл) 1-(2-бензилсульфанил-5-хлор-фенил)циклопропанамина (490 мг), полученного на вышеуказанной стадии 1, добавляли N,N-диметил-4-аминопиридин (210 мг) и ди-трет-бутил дикарбонат (1,8 г), и реакционный раствор перемешивали при температуре 50°C в течение 16 часов. Реакционный раствор добавляли в соляную кислоту (1 M, 10 мл) и экстрагировали этилацетатом (15 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан) с получением трет-бутил N-[1-(2-бензилсульфанил-5-хлор-фенил)циклопропил]-N-трет-бутоксикарбонил-карбамата (502 мг).
[0248]
(Стадия 3)
Исходя из трет-бутил N-[1-(2-бензилсульфанил-5-хлор-фенил)циклопропил]-N-трет-бутоксикарбонил-карбамата, полученного на вышеуказанной стадии 2, в соответствии со способом ссылочного примера E1, стадия 4, получали указанное в заголовке соединение.
[0249]
Ссылочный пример E56. Метил 6-(бис(трет-бутоксикарбонил)амино)-3-хлорсульфонил-2-метокси-бензоат
[0250]
[Формула 32]

[0251]
(Стадия 1) метил 6-(бис(трет-бутоксикарбонил)амино)-3-бром-2-метоксибензоат
Исходя из метил 6-амино-3-бром-2-метоксибензоата, в соответствии со способом по ссылочному примеру E55, стадия 2, получали метил 6-(бис(трет-бутоксикарбонил)амино)-3-бром-2-метоксибензоат.
[0252]
(Стадия 2)
Исходя из метил 6-(бис(трет-бутоксикарбонил)амино)-3-бром-2-метоксибензоата, полученного на вышеуказанной стадии 1, в соответствии со способом по ссылочному примеру E1, стадии 3 и 4, получали указанное в заголовке соединение.
[0253]
Ссылочный пример E57. 5-Хлор-4,4-дифторхроман-8-сульфонилхлорид
[0254]
[Формула 33]

[0255]
(Стадия 1) 8-(бензилтио)-5-хлорхроман-4-он
Исходя из 8-бром-5-хлорхроман-4-она, в соответствии со способом по ссылочному примеру E1, стадия 3, получали 8-(бензилтио)-5-хлорхроман-4-он.
[0256]
(Стадия 2) 8-(бензилтио)-5-хлор-4,4-дифторхроман
Исходя из 8-(бензилтио)-5-хлорхроман-4-она (125 мг), полученного на вышеуказанной стадии 1, в соответствии со способом по ссылочному примеру D61, стадия 2, получали 8-(бензилтио)-5-хлор-4,4-дифторхроман.
[0257]
(Стадия 3)
Исходя из 8-(бензилтио)-5-хлор-4,4-дифторхромана, полученного на вышеуказанной стадии 2, в соответствии со способом по ссылочному примеру E1, стадия 4, получали указанное в заголовке соединение.
[0258]
Ссылочный пример E58. трет-Бутил 5-хлор-8-(хлорсульфонил)-2H-бензо[b][1,4]оксазин-4(3H)-карбоксилат
[0259]
[Формула 34]

[0260]
(Стадия 1) 8-бром-5-хлор-3,4-дигидро-2H-бензоксазин
К раствору в ДМФ (6 мл) 2-амино-6-бром-3-хлорфенола (1,3 г) добавляли 1,2-дибромэтан (500 мкл) и карбонат калия (3,0 г), и реакционный раствор перемешивали в течение 12 часов при температуре 100°C. Реакционному раствору давали охладиться до комнатной температуры, в реакционный раствор добавляли насыщенный водный раствор хлорида аммония (10 мл) и этилацетат (10 мл), слои разделяли, и водный слой экстрагировали этилацетатом (20 мл). Объединенный органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением 8-бром-5-хлор-3,4-дигидро-2H-бензоксазина (400 мг).
[0261]
(Стадия 2) трет-бутил 8-бром-5-хлор-2H-бензо[b][1,4]оксазин-4(3H)-карбоксилат
К раствору в диоксане (5 мл) 8-бром-5-хлор-3,4-дигидро-2H-1,4-бензоксазина (223 мг) при комнатной температуре добавляли 4-диметиламинопиридин (44 мг), триэтиламин (0,25 мл) и ди-трет-бутил дикарбамат (458 мг), и реакционный раствор перемешивали в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении, и остаток очищали путем колоночной хроматографии (элюент: гексан/этилацетат) с получением трет-бутил 8-бром-5-хлор-2H-бензо[b][1,4]оксазин-4(3H)-карбоксилата (140 мг).
[0262]
(Стадия 3)
Исходя из трет-бутил 8-бром-5-хлор-2H-бензо[b][1,4]оксазин-4(3H)-карбоксилата, полученного на вышеуказанной стадии 2, в соответствии со способом стадий 3 и 4 ссылочного примера E1 получали указанное в заголовке соединение.
[0263]
Ссылочный пример E59. трет-Бутил 8-(хлорсульфонил)-2H-бензо[b][1,4]оксазин-4(3H)-карбоксилат
[0264]
[Формула 35]

[0265]
(Стадия 1) трет-бутил 8-бром-2H-бензо[b][1,4]оксазин-4(3H)-карбоксилат
Исходя из 8-бром-3,4-дигидро-2H-бензо[b][1,4]оксазина в соответствии со способом по ссылочному примеру E58, стадия 2, получали трет-бутил 8-бром-2H-бензо[b][1,4]оксазин-4(3H)- карбоксилат.
[0266]
(Стадия 2)
Исходя из трет-бутил 8-бром-2H-бензо[b][1,4]оксазин-4(3H)-карбоксилата, полученного на вышеуказанной стадии 1 в соответствии со ссылочным примером E1, стадии 3 и 4, получали указанное в заголовке соединение.
[0267]
Ссылочный пример E60. трет-Бутил 4-(хлорсульфонил)-1H-индол-1-карбоксилат
[0268]
[Формула 36]

[0269]
Исходя из коммерчески доступного трет-бутил 4-бром-1H-индол-1-карбоксилата (Ark Pharm, Inc.) в соответствии со способом по ссылочному примеру E1, стадии 3 и 4, получали указанное в заголовке соединение.
[0270]
Ссылочный пример E61. 5-Хлор-4-этил-3,4-дигидро-2H-бензо[b][1,4]оксазин-8-сульфонилхлорид
[0271]
[Формула 37]

[0272]
(Стадия 1) 8-бром-5-хлор-4-этил-2,3-дигидро-1,4-бензоксазин
К раствору в ДМСО (2,0 мл) 8-бром-5-хлор-3,4-дигидро-2H-бензоксазина (380 мг), полученного в ссылочном примере E58, стадия 1, добавляли гидроксид калия (120 мг) и этил йодид (100 мкл), и реакционный раствор перемешивали при температуре 100°C в течение 2 часов. Реакционному раствору давали охладиться до комнатной температуры, для разделения слоев добавляли насыщенный водный раствор хлорида аммония (10 мл) и этилацетат (10 мл), и водный слой экстрагировали этилацетатом (10 мл). Объединенный органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Реакционный раствор концентрировали при пониженном давлении, и остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением 8-бром-5-хлор-4-этил-2,3-дигидро-1,4-бензоксазина (105 мг).
[0273]
(Стадия 2)
Исходя из 8-бром-5-хлор-4-этил-2,3-дигидро-1,4-бензоксазина, полученного на вышеуказанной стадии 1, в соответствии со способом по ссылочному примеруы E1, стадии 3 и 4, получали указанное в заголовке соединение.
[0274]
Ссылочный пример E62. 4-(Циклопропанкарбонил)-3,4-дигидро-2H-бензо[b][1,4]оксазин-8-сульфонилхлорид
[0275]
[Формула 38]

[0276]
(Стадия 1) (8-бром-2H-бензо[b][1,4]оксазин-4(3H)-ил)(циклопропил)метанон
К раствору в ТГФ (2,0 мл) 8-бром-3,4-дигидро-2H-бензо[b][1,4]оксазина (62 мг) при температуре 0°C добавляли гидрид натрия (18 мг), и реакционный раствор перемешивали в течение 30 минут. В реакционный раствор добавляли циклопропанкарбонил хлорид (170 мкл), и смесь затем перемешивали при комнатной температуре в течение 2 часов. В реакционный раствор для разделения слоев последовательно добавляли насыщенный водный раствор хлорида аммония (10 мл) и этилацетат (10 мл), и водный слой экстрагировали этилацетатом (10 мл). Объединенный органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением (8-бром-2H-бензо[b][1,4]оксазин-4(3H)-ил)(циклопропил)метанона (87 мг).
[0277]
(Стадия 2)
Исходя из (8-бром-2H-бензо[b][1,4]оксазин-4(3H)-ил)(циклопропил)метанона, полученного на вышеуказанной стадии 1, в соответствии со способом стадий 3 и 4 ссылочного примера E1, получали указанное в заголовке соединение.
[0278]
Ссылочный пример E63. 5-Хлор-4-(2,2-дифторэтил)-3-оксо-3,4-дигидро-2H-бензо[b][1,4]оксазин-8-сульфонилхлорид
[0279]
[Формула 39]

[0280]
(Стадия 1) 8-бром-5-хлор-2H-бензо[b][1,4]оксазин-3(4H)-он
2-Амино-6-бром-3-хлорфенол (140 мг) растворяли в ТГФ (2,0 мл), добавляли хлорацетил хлорид (100 мкл) и гидрокарбонат натрия (240 мг), и реакционный раствор перемешивали при комнатной температуре в течение 3 часов. В реакционный раствор добавляли карбонат калия (440 мг), и смесь затем перемешивали при температуре 80°C в течение 5 часов. Реакционному раствору давали охладиться до комнатной температуры, и для разделения слоев добавляли насыщенный водный раствор хлорида аммония (10 мл) и этилацетат (10 мл), и водный слой экстрагировали этилацетатом (20 мл). Объединенный органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением 8-бром-5-хлор-2H-бензо[b][1,4]оксазин-3(4H)-она (160 мг).
[0281]
(Стадия 2) 8-бром-5-хлор-4-(2,2-дифторэтил)-2H-бензо[b][1,4]оксазин-3(4H)-он
К раствору в ДМФ (2,5 мл) 8-бром-5-хлор-2H-бензо[b][1,4]оксазин-3(4H)-она (69 мг), полученного на вышеуказанной стадии 1, последовательно добавляли карбонат калия (420 мг) и 2,2-дифторэтил пара-толуол сульфонат (500 мг), и реакционный раствор перемешивали при температуре 100°C в течение 3 часов. Реакционному раствору давали охладиться до комнатной температуры, и для разделения слоев добавляли насыщенный водный раствор хлорида аммония (10 мл) и этилацетат (10 мл), и водный слой экстрагировали этилацетатом (10 мл). Объединенный органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением 8-бром-5-хлор-4-(2,2-дифторэтил)-2H-бензо[b][1,4]оксазин-3(4H)-она (85 мг).
[0282]
(Стадия 3) 8-(бензилтио)-5-хлор-4-(2,2-дифторэтил)-2H-бензо[b][1,4]оксазин-3(4H)-он
Исходя из 8-бром-5-хлор-4-(2,2-дифторэтил)-2H-бензо[b][1,4]оксазин-3(4H)-она, полученного на вышеуказанной стадии 2, в соответствии со способом по ссылочному примеру E1, стадия 3, получали 8-(бензилтио)-5-хлор-4-(2,2-дифторэтил)-2H-бензо[b][1,4]оксазин-3 (4H)-он.
[0283]
(Стадия 4)
Исходя из 8-(бензилтио)-5-хлор-4-(2,2-дифторэтил)-2H-бензо[b][1,4]оксазин-3(4H)-она в соответствии со способом по ссылочному примеру E1, стадия 4, на вышеуказанной стадии 3 получали указанное в заголовке соединение.
[0284]
Ссылочные примеры E64 и E65
Из 8-Бром-5-хлор-2H-бензо[b][1,4]оксазин-3(4H)-она, полученного в ссылочном примере E63, стадия 1, в соответствии со способом ссылочного примера E63, стадия 2, и ссылочного примера E1, стадии 3 и 4, были синезированы следующие соединения ссылочных примеров E64 и E65.
[0285]
[Таблица 5-6]
[0286]
Ссылочный пример E66. 5-Хлор-4-(2,2-дифторэтил)-3,4-дигидро-2H-бензо[b][1,4]оксазин-8-сульфонилхлорид
[0287]
[Формула 40]

[0288]
(Стадия 1) 8-(бензилтио)-5-хлор-4-(2,2-дифторэтил)-3,4-дигидро-2H-бензо[b][1,4]оксазин
К раствору в ТГФ (5 мл) 8-(бензилтио)-5-хлор-4-(2,2-дифторэтил)-2H-бензо[b][1,4]оксазин-3(4H)-она (270 мг), полученного в ссылочном примере 63 стадия 3, добавляли диметилсульфид боран (1,0 мл), и реакционный раствор перемешивали при температуре 70°C в течение 4 часов. Реакционному раствору давали охладиться до комнатной температуры, для разделения слоев добавляли метанол (5 мл), этилацетат (10 мл) и воду (10 мл), и водный слой экстрагировали этилацетатом (10 мл). Объединенный органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением 8-(бензилтио)-5-хлор-4-(2,2-дифторэтил)-3,4-дигидро-2H-бензо[b][1,4]оксазина (154 мг).
[0289]
(Стадия 2)
Исходя из 8-(бензилтио)-5-хлор-4-(2,2-дифторэтил)-3,4-дигидро-2H-бензо[b][1,4]оксазина, полученного на вышеуказанной стадии 1, в соответствии со способом по ссылочному примеру E1, стадия 4, получали указанное в заголовке соединение.
[0290]
Ссылочный пример E67. 2-Циано-5-(морфолин-4-карбонил)бензол-1-сульфонилхлорид
[0291]
[Формула 41]

[0292]
(Стадия 1) этил 3-(бензилтио)-4-цианобензоат
Исходя из этил 3-бром-4-цианобензоата в соответствии со способом по ссылочному примеру E1, стадия 3, получали этил 3-(бензилтио)-4-цианобензоат.
[0293]
(Стадия 2) 6-(бензилтио)-4-циано-бензойная кислота
К раствору в ТГФ (4,0 мл) этил 3-(бензилтио)-4-цианобензоата (344 мг), полученного на вышеуказанной стадии 1, добавляли водный раствор гидроксида натрия (3 M, 4,0 мл), и реакционный раствор перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор добавляли в соляную кислоту (1 M, 15 мл) и экстрагировали два раза этилацетатом (20 мл). Объединенный органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением 6-(бензилтио)-4-цианобензойной кислоты (210 мг).
[0294]
(Стадия 3) 2-(бензилтио)-4-(морфолин-4-карбонил)бензонитрил
Используя 6-(бензилтио)-4-циано-бензойную кислоту, полученную на вышеуказанной стадии 2, и морфолин, в соответствии со ссылочным примером E35, стадия 3, получали 2-(бензилтио)-4-(морфолин-4-карбонил)бензонитрил.
(Стадия 4)
Исходя из 2-(бензилтио)-4-(морфолин-4-карбонил)бензонитрила, полученного на вышеуказанной стадии 3, в соответствии со способом по ссылочному примеру E1, стадия 4, получали указанное в заголовке соединение.
[0295]
Ссылочный пример E68. 2-Циано-5-(диметилкарбамоил)бензол-1-сульфонилхлорид
[0296]
[Формула 42]

[0297]
(Стадия 1) 2-(бензилтио)-4-циано-N,N-диметилбензамид
В соответствии со способом по ссылочному примеру E35, стадия 3, исходя из 6-(бензилтио)-4-цианобензойной кислоты, полученной в ссылочном примере E67, стадия 2, и диметиламина получали 2-(бензилтио)-4-циано-N,N-диметилбензамид.
[0298]
(Стадия 2)
Исходя из 2-(бензилтио)-4-циано-N,N-диметилбензамида, полученного на вышеуказанной стадии 1, в соответствии со способом по ссылочному примеру E1, стадия 4, получали указанное в заголовке соединение.
[0299]
Ссылочный пример E69. 4-Хлор-2-циано-5-(диметилкарбамоил)бензол-1-сульфонилхлорид
[0300]
[Формула 43]

[0301]
Исходя из метил 5-бром-2-хлор-4-цианобензоата в соответствии с каждым из способов ссылочного примера E1, стадия 3, ссылочного примера E67, стадия 2, ссылочного примера E35, стадия 3, и ссылочного примера E1, стадия 4, было синтезировано указанное в заголовке соединение.
[0302]
Ссылочный пример E70. трет-Бутил (5-хлор-8-(хлорсульфонил)хроман-4-ил)карбамат
[0303]
[Формула 44]

[0304]
(Стадия 1) 8-бензил-сульфанил-5-хлорхроман-4-он
Исходя из 8-бром-5-хлорхроман-4-она в соответствии со способом по ссылочному примеру E1, стадия 3, получали 8-бензилсульфанил-5-хлорхроман-4-он.
[0305]
(Стадия 2) 8-бензил-сульфанил-5-хлорхроман-4-амин
8-Бензилсульфанил-5-хлорхроман-4-он (460 мг), полученной на вышеуказанной стадии 1, растворяли в метаноле (3,0 мл), добавляли хлорид аммония (1,2 г), и реакционный раствор перемешивали при комнатной температуре в течение 2 часов. В реакционный раствор добавляли цианоборгидрид натрия (670 мг), и смесь затем перемешивали при температуре 80°C в течение 14 часов. Для разделения слоев в реакционный раствор последовательно добавляли насыщенный водный раствор гидрокарбоната натрия (10 мл), водный раствор гидроксида натрия (5 M, 10 мл) и хлороформ (20 мл), и водный слой два раза экстрагировали хлороформом (20 мл). Объединенный органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (этилацетат) с получением 8-бензилсульфанил-5-хлорхроман-4-амина (216 мг).
[0306]
(Стадия 3) трет-бутил (8-(бензилтио)-5-хлорхроман-4-ил)карбамат
Исходя из 8-бензилсульфанил-5-хлор-хроман-4-амина (216 мг), полученного на вышеуказанной стадии 2, получали трет-бутил (8-(бензилтио)-5-хлорхроман-4-ил)карбамат в соответствии со ссылочным примером E58, стадия 2.
[0307]
(Стадия 4)
Исходя из трет-бутил (8-(бензилтио)-5-хлорхроман-4-ил)карбамата, полученного на вышеуказанной стадии 3, в соответствии со способом по ссылочному примеру E1, стадия 4, получали указанное в заголовке соединение.
[0308]
Ссылочный пример E71. 4-Ацетамидо-5-хлорхроман-8-сульфонилхлорид
[0309]
[Формула 45]

[0310]
(Стадия 1) N-(8-бром-5-хлорхроманон-4-ил)ацетамид
8-Бром-5-хлорхроманон-4-амин (250 мг) растворяли в ДМФ (2,0 мл) и ТГФ (7,0 мл), последовательно добавляли N,N-диметил-4-аминопиридин (45 мг), триэтиламин (400 мкл) и уксусный ангидрид (200 мкл), и смесь перемешивали при комнатной температуре в течение 2 часов. В реакционный раствор добавляли воду (10 мл), и смесь экстрагировали этилацетатом (10 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением N-(8-бром-5-хлорхроманон-4-ил)ацетамида (260 мг).
[0311]
(Стадия 2)
Исходя из N-(8-бром-5-хлорхроманон-4-ил)ацетамида, полученного на вышеуказанной стадии 1, получали указанное в заголовке соединение в соответствии со способом по ссылочному примеруы E1, стадии 3 и 4.
[0312]
Ссылочный пример E72. 1-(3-Хлор-6-(хлорсульфонил)пиридин-2-ил)-2,2,2-трифторэтилацетат
[0313]
[Формула 46]

[0314]
(Стадия 1) 1-(6-бром-3-хлорпиридин-2-ил)-2,2,2-трифторэтанол
К раствору в ТГФ (10 мл) 6-бром-3-хлорпиколинальдегида (770 мг) добавляли фторид цезия (700 мг) и (трифторметил)триметилсилан (700 мкл), и реакционный раствор перемешивали при комнатной температуре в течение 4 часов. В реакционный раствор добавляли насыщенный водный раствор гидрокарбоната натрия (10 мл), и смесь экстрагировали этилацетатом (20 мл). Органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением 1-(6-бром-3-хлорпиридин-2-ил)-2,2,2-трифторэтанола (600 мг).
[0315]
(Стадия 2)
Исходя из 1-(6-бром-3-хлорпиридин-2-ил)-2,2,2-трифторэтанола, полученного на вышеуказанной стадии 1, в соответствии со способом по ссылочному примерам E44, стадия 3, и E1, стадии 3-4, получали указанное в заголовке соединение.
[0316]
Ссылочный пример E73. Метил 5-бром-2-(хлорсульфонил)никотинат
[0317]
[Формула 47]

[0318]
(Стадия 1) метил 2-(бензилтио)-5-бром-никотинат
К раствору в ТГФ (5,0 мл) бензилмеркаптана (700 мкл) при температуре 0°C добавляли гидрид натрия (285 мг), и реакционный раствор перемешивали при комнатной температуре в течение 15 мин. В реакционный раствор добавляли по каплям раствор в ТГФ (3,0 мл) метил 2,5-дибромникотината (1,59 г), и смесь перемешивали при температуре 0°C в течение 20 минут. Реакционный раствор добавляли в воду (10 мл) и экстрагировали этилацетатом (20 мл). Органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением метил 2-(бензилтио)-5-бромникотината (1,5 г).
[0319]
(Стадия 2)
Исходя из метил 2-(бензилтио)-5-бромникотината, полученного на вышеуказанной стадии 1, получали указанное в заголовке соединение в соответствии со способом по ссылочному примеру E1, стадия 4.
[0320]
Ссылочный пример F1. Моногидрохлорид 5-((1S,2R)-1-амино-2-(6-фтор-2,3-диметилфенил)пропил)-1,3,4-оксадиазол-2 (3H)-она
[0321]
[Формула 48]

[0322]
(Стадия 1) (2S,3R)-2-((трет-бутоксикарбонил)амино)-3-(6-фтор-2,3-диметилфенил)бутановая кислота
К (2S,3R)-2-амино-3-(6-фтор-2,3-диметилфенил)бутановой кислоте (515 мг), полученной в ссылочном примере D1, последовательно добавляли воду (9 мл), 1,4-диоксан (9 мл) и триэтиламин (955 мкл), и смесь охлаждали до температуры 0°C. В реакционный раствор при той же температуре добавляли ди-трет-бутил дикарбонат (650 мг), и смесь перемешивали в течение 45 минут. Реакционный раствор добавляли в соляную кислоту (1 M, 20 мл) и экстрагировали этилацетатом (20 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат/2%-ная уксусная кислота) с получением (2S,3R)-2-((трет-бутоксикарбонил)амино)-3-(6-фтор-2,3-диметилфенил)бутановой кислоты (745 мг).
[0323]
(Стадия 2) трет-бутил ((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)карбамат
К раствору в ТГФ (14,0 мл) (2S,3R)-2-(трет-бутоксикарбониламино)-3-(6-фтор-2,3-диметилфенил)бутановой кислоты (440 мг), полученной на вышеуказанной стадии 1, добавляли CDI (302 мг), и реакционный раствор перемешивали при комнатной температуре в течение 20 минут. Реакционный раствор охлаждали до температуры 0°C, добавляли моногидрат гидразина (200 мкл), и смесь перемешивали при той же температуре в течение 30 минут. Реакционный раствор добавляли в воду (20 мл) и экстрагировали этилацетатом (20 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. К раствору в 1,4-диоксане (14 мл) полученного остатка добавляли CDI (560 мг), и реакционный раствор перемешивали при комнатной температуре в течение 30 минут. Реакционный раствор добавляли в воду (20 мл) и экстрагировали этилацетатом (20 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением трет-бутил ((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)карбамата (356 мг).
[0324]
(Стадия 3)
трет-Бутил ((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)карбамат (550 мг), полученной на вышеуказанной стадии 2, растворяли в растворе хлористоводородной кислоты в 1,4-диоксане (4 M, 5,0 мл), и реакционный раствор перемешивали при комнатной температуре в течение 1,5 часов. Реакционный раствор концентрировали при пониженном давлении с получением указанного в заголовке соединения.
[0325]
Ссылочные примеры F2-F10
В соответствии со способом по ссылочному примеру F1, стадии 1-3, были синтезированы следующие соединения ссылочных примеров F2-F10.
[0326]
[Таблица 6]
[0327]
Пример 1
5-Бром-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид
[0328]
(Стадия 1)
К раствору в 1,4-диоксане (5,0 мл) и воде (5,0 мл) (2S,3R)-2-амино-3-(6-фтор-2,3-диметилфенил)бутановой кислоты (300 мг), полученной в ссылочном примере D1, добавляли триэтиламин (570 мкл) и затем охлаждали до температуры 0°C. В реакционный раствор добавляли 4-бром-2-цианобензол-1-сульфонилхлорид (362 мг), и смесь перемешивали при той же температуре в течение 45 минут. Реакционный раствор добавляли в соляную кислоту (1 M, 15 мл) и экстрагировали этилацетатом (15 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат/2%-ная уксусная кислота) с получением (2S,3R)-2-(4-бром-2-цианофенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутановой кислоты (465 мг).
[0329]
(Стадия 2)
К раствору в ТГФ (5,0 мл) (2S,3R)-2-(4-бром-2-цианофенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутановой кислоты (465 мг), полученной на вышеуказанной стадии 1, добавляли CDI (210 мг), и реакционный раствор перемешивали при комнатной температуре в течение 20 минут. Реакционный раствор охлаждали до температуры 0°C, добавляли гидразин моногидрат (200 мкл), и смесь перемешивали при той же температуре в течение 20 минут. Реакционный раствор добавляли в воду (20 мл) и экстрагировали этилацетатом (20 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении.
К раствору в 1,4-диоксане (4,0 мл) полученного остатка добавляли CDI (211 мг), и реакционный раствор перемешивали при температуре 45°C в течение 1 часа. Реакционный раствор добавляли в воду (20 мл) и экстрагировали этилацетатом (20 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением 4-бром-2-циано-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)бензолсульфонамида (386 мг).
[0330]
(Стадия 3)
К раствору в ДМСО (5,0 мл) 4-бром-2-циано-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)бензолсульфонамида (386 мг), полученного на вышеуказанной стадии 2, на ледяной бане последовательно добавляли водный пероксид водорода (1,0 мл) и карбонат калия (420 мг), и реакционный раствор перемешивали при температуре 60°C в течение 2,5 часов. Реакционный раствор на ледяной бане медленно добавляли в соляную кислоту (1 M, 15 мл) и затем экстрагировали этилацетатом (15 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением указанного в заголовке соединения.
[0331]
Примеры 2-128
Соединения по примерам 2-43 были синтезированы в соответствии со способом по примеру 1, стадии 1-3. Соединения по примерам 44-128 были синтезированы в соответствии со способом по примеру 1, стадии 1 и 2. Необходимые исходные продукты перечислены в следующей таблице.
[0332]
[Таблица 7-1]
[0333]
[Таблица 7-2]
[0334]
[Таблица 7-3]
[0335]
[Таблица 7-4]
[0336]
[Таблица 7-5]
[0337]
[Таблица 7-6]
[0338]
[Таблица 7-7]
[0339]
[Таблица 7-8]
[0340]
[Таблица 7-9]
[0341]
[Таблица 7-10]
[0342]
[Таблица 7-11]
[0343]
[Таблица 7-12]
[0344]
[0344]
Пример 129
5-Хлор-8-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-4-метил-d3-хроман-4-ил ацетат
[0345]
К раствору в пиридине (1,5 мл) моногидрохлорида 5-((1S,2R)-1-амино-2-(6-фтор-2,3-диметилфенил)пропил)-1,3,4-оксадиазол-2(3H)-она (45 мг), полученного в ссылочном примере F1, добавляли 5-хлор-8-(хлорсульфонил)-4-метил-d3-хроман-4-илацетат (80 мг), полученный в ссылочном примере E1, и реакционный раствор перемешивали при комнатной температуре в течение 12 часов. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением указанного в заголовке соединения (59 мг) в виде смеси диастереомеров 1:1.
[0346]
Примеры 130-185
В соответствии со способом по примеру 129 были синтезированы следующие соединения по примерам 130-185. Необходимые исходные продукты перечислены в следующей таблице.
[0347]
[Таблица 8-1]
[0348]
[Таблица 8-2]
[0349]
[Таблица 8-3]
[0350]
[Таблица 8-4]
[0351]
[Таблица 8-5]
[0352]
[Таблица 8-6]
[0353]
[Таблица 8-7]
[0354]
Пример 186
2,4-Дифтор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-3-(2-гидроксипропан-2-ил)бензолсульфонамид
[0355]
(Стадия 1)
К раствору в пиридине (1,0 мл) добавляли метил 3-(хлорсульфонил)-2,6-дифторбензоат (33 мг) моногидрохлорида 5-((1S,2R)-1-амино-2-(6-фтор-2,3-диметилфенил)пропил)-1,3,4-оксадиазол-2(3H)-она (20 мг), полученного в ссылочном примере F1, и реакционный раствор перемешивали в течение 12 часов при комнатной температуре. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением метил 2,6-дифтор-3-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензоата (12,5 мг).
[0356]
(Стадия 2)
К раствору в ТГФ (2,0 мл) метил 2,6-дифтор-3-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензоата (12,5 мг), полученного на вышеуказанной стадии 1, при температуре 0°C добавляли по каплям раствор в диэтиловом эфире (3,0 M, 84 мкл) метилмагний бромида, и реакционный раствор перемешивали в течение 1 часа при комнатной температуре. На ледяной бане добавляли по каплям насыщенный водный раствор хлорида аммония (10 мл), добавляли этилацетат (10 мл), и слои разделяли. Органический слой последовательно промывали соляной кислотой (1 M, 10 мл), водой (10 мл) и насыщенным солевым раствором (10 мл), сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением указанного в заголовке соединения.
[0357]
Примеры 187-195
В соответствии со способом по примеру 186 были синтезированы следующие соединения по примерам 187-195. Необходимые исходные продукты перечислены в следующей таблице.
[0358]
[Таблица 9]
[0359]
Пример 196
5-Фтор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-4-(2-гидроксипропан-2-ил)бензамид
[0360]
(Стадия 1)
Исходя из моногидрохлорида 5-((1S,2R)-1-амино-2-(6-фтор-2,3-диметилфенил)пропил)-1,3,4-оксадиазол-2(3H)-она (60 мг), полученного в ссылочном примере F1, и метил 2-фтор-5-(хлорсульфонил)-4-цианобензоата (94 мг), полученного в ссылочном примере E15, в соответствии со способом по примеру 129 получали метил 4-(циано-2-фтор-5-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензоат (49 мг).
[0361]
(Стадия 2)
Исходя из метил 4-циано-2-фтор-5-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензоата (49 мг), полученного на вышеуказанной стадии 1, в соответствии со способом по примеру 186, стадия 2, получали 2-циано-4-фтор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-5-(2-гидроксипропан-2-ил)бензолсульфонамид (27,5 мг).
[0362]
(Стадия 3)
Исходя из 2-циано-4-фтор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-5-(2-гидроксипропан-2-ил)бензолсульфонамида (27,5 мг), полученного на вышеуказанной стадии 2, в соответствии со способом по примеру 1, стадия 3, получали указанное в заголовке соединение.
[0363]
Примеры 197-199
В соответствии со способом по примеру 129, примеру 186, стадия 2, примеру 1, стадия 3, были синтезированы следующие соединения по примерам 197-199. Необходимые исходные продукты перечислены в следующей таблице. Однако, в случае примера 199 синтез осуществляют с использованием 1-пропинилмагнийбромида вместо метилмагнийбромида.
[0364]
[Таблица 10]
[0365]
Пример 200
5-Хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метил-d3-хроман-8-сульфонамид, изомер A и изомер B
[0366]
Смесь диастереомеров 1:1 5-хлор-8-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-4-метил-d3-хроман-4-ил ацетата (59 мг), полученного по примеру 129, растворяли в метаноле (2,0 мл) и воде (1,0 мл), добавляли гидроксид лития (5 мг), и реакционный раствор перемешивали при температуре 55°C в течение 1 часа. После концентрирования реакционного раствора к остатку добавляли соляную кислоту (1 M, 10 мл) и этилацетат (10 мл), и слои разделяли. Водный слой экстрагировали этилацетатом (10 мл), и объединенные органические слои промывали насыщенным солевым раствором (10 мл). Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью обращенно-фазовой ВЭЖХ (вода/ацетонитрил), и фракции концентрировали с получением каждого из двух диастереомерных продуктов. Вещество, элюируемое первым, обозначали как соединение A, и вещество, элюируемое позднее, обозначали как соединение B.
[0367]
Примеры 201-229
В соответствии со способом по примеру 200 были синтезированы следующие соединения по примерам 201-229. В случае разделения диастереомеров элюируемое раньше соединение обозначали как A и элюируемое позднее соединение как B. Соотношение диастереомеров представляет собой смесь 1:1, если не указано иное. Необходимые исходные продукты перечислены в следующей таблице.
[0368]
[Таблица 11-1]
[0369]
[Таблица 11-2]
[0370]
[Таблица 11-3]
[0371]
[Таблица 11-4]
[0372]
Пример 230
5-Фтор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидроксихроман-8-сульфонамид, изомер A и изомер B
[0373]
(Стадия 1)
Используя моногидрохлорид 5-((1S,2R)-1-амино-2-(6-фтор-2,3-диметилфенил)пропил)-1,3,4-оксадиазол-2(3H)-она (40 мг), полученный в ссылочном примере F1, и 5-фтор-4-оксохроман-8-сульфонилхлорид (60 мг), полученный в ссылочном примере E8, в соответствии со способом по примеру 129 получали 5-фтор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-оксохроман-8-сульфонамид (44 мг).
[0374]
(Стадия 2)
К раствору в этаноле (13,5 мг) боргидрида натрия (2,0 мл) добавляли 5-фтор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-оксохроман-8-сульфонамид (44 мг), полученный на вышеуказанной стадии 1, и реакционный раствор перемешивали при комнатной температуре в течение 30 минут. После концентрирования реакционного раствора при пониженном давлении к остатку добавляли воду (10 мл) и этилацетат (10 мл), разделяли, и водный слой экстрагировали этилацетатом (10 мл). Объединенный органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью обращенно-фазовой ВЭЖХ (вода/ацетонитрил), и фракции концентрировали с получением каждого из двух диастереомерных продуктов. Вещество, элюируемое первым, обозначали как соединение A, и вещество, элюируемое позднее, обозначали как соединение B.
[0375]
Примеры 231-244
В соответствии со способом по примеру 129 и примеру 230, стадия 2, были синтезированы соединения по примерам 231-244, показанные далее. В случае разделения диастереомеров, первое элюируемое соединение обозначали как A и элюируемое позднее соединение как B. Соотношение диастереомеров представляет собой смесь 1:1, если не указано иное. Необходимые исходные продукты перечислены в следующей таблице.
[0376]
[Таблица 12-1]
[0377]
[Таблица 12-2]
[0378]
Пример 245
5-Хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)никотинамид
[0379]
(Стадия 1)
Используя (2S,3R)-2-амино-3-(6-фтор-2,3-диметилфенил)бутановую кислоту (100 мг), полученную в ссылочном примере D1, и метил 5-хлор-2-(хлорсульфонил)никотинат (140 мг), полученный в ссылочном примере E11, в соответствии со способом по примеру 1, стадии 1, 2, получали метил 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)никотинат (174 мг).
[0380]
(Стадия 2)
Метил 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)никотинат (174 мг), полученный на вышеуказанной стадии 1, растворяли в ТГФ (2,5 мл) и воде (2,5 мл), добавляли гидроксид лития (30 мг), и реакционный раствор перемешивали при температуре 50°C в течение 16 часов. Реакционный раствор добавляли в соляную кислоту (1 M, 15 мл) и экстрагировали этилацетатом (15 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат/2%-ная уксусная кислота) с получением 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)никотиновой кислоты (145 мг).
[0381]
(Стадия 3)
К раствору в толуоле (1,2 мл) 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)никотиновой кислоты (10 мг), полученной на вышеуказанной стадии 2, последовательно добавляли ДМФ (30 мкл) и тионилхлорид (60 мкл), и реакционный раствор перемешивали при температуре 95°C в течение 40 минут. Реакционному раствору давали охладиться до комнатной температуры и затем концентрировали при пониженном давлении. Раствор в ТГФ (2,0 мл) остатка медленно добавляли по каплям к 28%-ному водному раствору аммиака (1,0 мл) при температуре -10°C, и реакционный раствор перемешивали при комнатной температуре в течение 30 мин. Реакционный раствор добавляли в соляную кислоту (1 M, 10 мл) и экстрагировали этилацетатом (10 мл). Органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением указанного в заголовке соединения.
[0382]
Примеры 246-264
Соединения по примерам 246-264, показанные далее, были синтезированы в соответствии со способами по примеру 1, стадии 1 и 2, и примеру 245, стадии 2 и 3. Необходимые исходные продукты перечислены в следующей таблице.
[0383]
[Таблица 13-1]
[0384]
[Таблица 13-2]
[0385]
[Таблица 13-3]
[0386]
Пример 265
4-Амино-N-((1S,2R)-2-(2-фторнафталин-1-ил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-2-метоксибензолсульфонамид
[0387]
(Стадия 1)
Используя (2S,3R)-2-амино-3-(2-фторнафталин-1-ил)бутановую кислоту (45 мг), полученную в ссылочном примере D3, и 2-метокси-4-нитробензол-1-сульфонилхлорид (60 мг), в соответствии со способом по примеру 1, стадии 1 и 2, получали N-((1S,2R)-2-(2-фторнафталин-1-ил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-2-метокси-4-нитробензолсульфонамид (32 мг).
[0388]
(Стадия 2)
N-((1S,2R)-2-(2-Фторнафталин-1-ил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-2-метокси-4-нитробензолсульфонамид (32 мг), полученный на вышеуказанной стадии 1, растворяли в этаноле (2,0 мл) и воде (1,0 мл), последовательно добавляли железо (30 мг) и хлорид аммония (20 мг), и реакционный раствор перемешивали при температуре 80°C в течение 1 часа. Реакционный раствор фильтровали через CELITE, и остаток промывали этилацетатом (10 мл). Объединенные фильтраты концентрировали и остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением указанного в заголовке соединения.
[0389]
Примеры 266-272
Соединения по примерам 266-272, показанные далее, были синтезированы в соответствии со способом по примеру 1, стадии 1 и 2, и примеру 265, стадия 2. Необходимые исходные продукты перечислены в следующей таблице.
[0390]
[Таблица 14]
[0391]
Пример 273
5-Хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-(2-гидроксиэтил)-3-оксо-3,4-дигидро-2H-бензо[b][1,4]оксазин-8-сульфонамид
[0392]
(Стадия 1)
Используя (2S,3R)-2-амино-3-(6-фтор-2,3-диметилфенил)бутановую кислоту (50 мг), полученную в ссылочном примере D1, и 4-(2-(бензилокси)этил)-5-хлор-3,4-дигидро-2H-бензо[b][1,4]оксазин-8-сульфонилхлорид (142 мг), полученный в ссылочном примере E65, в соответствии со способом по примеру 1, стадии 1 и 2, получали 4-(2-(бензилокси)этил)-5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-3-оксо-3,4-дигидро-2H-бензо[b][1,4]оксазин-8-сульфонамид (22 мг).
[0393]
(Стадия 2)
К раствору в ТГФ (1,5 мл) 4-(2-(бензилокси)этил)-5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-3-оксо-3,4-дигидро-2H-бензо[b][1,4]оксазин-8-сульфонамида (20 мг), полученного на вышеуказанной стадии 1, добавляли 20 масс% гидроксида палладия (30 мг), и реакционную смесь перемешивали при комнатной температуре в течение 30 минут в атмосфере водорода. Реакционный раствор фильтровали через CELITE, и остаток промывали смесью гексан/этилацетат=1/1 (10 мл), и объединенный фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением указанного в заголовке соединения.
[0394]
Пример 274
N-(5-Хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)фенил)ацетамид
[0395]
К раствору в дихлорметане (1,0 мл) 2-амино-4-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)бензолсульфонамида (5,0 мг), полученного по примеру 271, последовательно добавляли пиридин (5,0 мкл) и уксусный ангидрид (4,0 мкл), и реакционный раствор перемешивали при комнатной температуре в течение 3 часов. Реакционный раствор добавляли в соляную кислоту (1 M, 5,0 мл) и экстрагировали этилацетатом (10 мл). Органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением указанного в заголовке соединения.
[0396]
Пример 275
5-Хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-3,4-дигидро-2H-бензо[b][1,4]оксазин-8-сульфонамид
[0397]
(Стадия 1)
Исходя из моногидрохлорида 5-((1S,2R)-1-амино-2-(6-фтор-2,3-диметилфенил)пропил)-1,3,4-оксадиазол-2(3H)-она (14,3 мг), полученного в ссылочном примере F1, и трет-бутил 5-хлор-8-(хлорсульфонил)-2H-бензо[b][1,4]оксазин-4(3H)-карбоксилата (25,3 мг), полученного в ссылочном примере E58, в соответствии со способом по примеру 129, получали трет-бутил 5-хлор-8-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-2H-бензо[b][1,4]оксазин-4(3H)-карбоксилат (30.4 мг).
[0398]
(Стадия 2)
К трет-бутил 5-хлор-8-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-2H-бензо[b][1,4]оксазин-4(3H)-карбоксилату (30,4 мг), полученному на вышеуказанной стадии 1, добавляли раствор хлористоводородной кислоты в 1,4-диоксане (4 M, 5,0 мл), и реакционный раствор перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали с помощью обращенно-фазовой ВЭЖХ (вода/ацетонитрил) с получением указанного в заголовке соединения.
[0399]
Примеры 276-283
Соединения по примерам 276-283, показанные далее, были синтезированы в соответствии со способом по примеру 129 и примеру 275, стадия 2. Необходимые исходные продукты перечислены в следующей таблице.
[0400]
[Таблица 15]
[0401]
Пример 284
4-Ацетил-5-хлор-N-((1S,2R)-2-(2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-3,4-дигидро-2H-бензо[b][1,4]оксазин-8-сульфонамид
[0402]
К раствору в дихлорметане (1,0 мл) 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-3,4-дигидро-2H-бензо[b][1,4]оксазин-8-сульфонамида (31,5 мг), полученного в примере 275, последовательно добавляли триэтиламин (40 мкл) и уксусный ангидрид (20 мкл), и реакционный раствор перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали с помощью обращенно-фазовой ВЭЖХ (вода/ацетонитрил) с получением указанного в заголовке соединения.
[0403]
Пример 285
2-(N-((1S,2R)-2-(6-Фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-N-гидроксибензамид
[0404]
(Стадия 1)
Используя (2S,3R)-2-амино-3-(6-фтор-2,3-диметилфенил)бутановую кислоту (125 мг), полученную в ссылочном примере D1, и трет-бутилбензилокси (5-хлор-2-(хлорсульфонил)бензоил)карбамат (280 мг), полученный в ссылочном примере E51, в качестве исходного продукта, в соответствии со способом по примеру 1, стадия 1, была синтезирована (2S,3R)-2-(2-((бензилокси)(трет-бутоксикарбонил)карбамоил)-4-хлорфенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутановая кислота (250 мг).
[0405]
(Стадия 2)
(2S,3R)-2-(2-((Бензилокси)(трет-бутоксикарбонил)карбамоил)-4-хлорфенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутановую кислоту (250 мг), полученную на вышеуказанной стадии 1, растворяли в растворе хлористоводородной кислоты в 1,4-диоксане (4 M, 4 мл), и реакционный раствор перемешивали при температуре 45°C в течение 2,5 часов. Реакционный раствор концентрировали при пониженном давлении и остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат/2%-ная уксусная кислота) с получением (2S,3R)-2-(2-((бензилокси)карбамоил)-4-хлорфенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутановой кислоты (215 мг).
[0406]
(Стадия 3)
Исходя из (2S,3R)-2-(2-((бензилокси)карбамоил)-4-хлорфенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутановой кислоты (215 мг), полученной на вышеуказанной стадии 2, в соответствии со способом по примеру 1, стадия 2, получали N-(бензилокси)-5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид (75 мг).
[0407]
(Стадия 4)
К раствору в метаноле (4,0 мл) N-(бензилокси)-5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамида (75 мг), полученного на вышеуказанной стадии 3, добавляли 10%-ный палладий-углерод (55 мг), и реакционный раствор перемешивали в атмосфере водорода в течение 1,5 часов. Нерастворимое вещество удаляли с помощью фильтрования через CELITE, и остаток промывали метанолом (10 мл). Объединенный фильтрат концентрировали при пониженном давлении, и остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением указанного в заголовке соединения.
[0408]
Пример 286
5-Хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-N-гидроксибензамид
[0409]
К раствору в дихлорметане (3,0 мл) N-(бензилокси)-5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамида (66 мг), полученного по примеру 285, стадия 3, при температуре -60°C добавляли трибромид бора (1,0 M, 170 мкл), и реакционный раствор перемешивали при температуре 0°C в течение 1 часа. В реакционный раствор добавляли метанол (1,0 мл), и смесь концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат/2%-ная уксусная кислота) с получением указанного в заголовке соединения.
[0410]
Пример 287
5-Хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензотиоамид
[0411]
К раствору в толуоле (500 мкл) 5-хлор-2-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(2-оксо-3H-1,3,4-оксадиазол-5-ил)пропил)сульфамоил)бензамида (15 мг), полученного в примере 5, при комнатной температуре добавляли реактив Лавессона (20 мг), и реакционный раствор перемешивали при температуре 100°C в течение 12 часов. После охлаждения до комнатной температуры и концентрирования при пониженном давлении полученный остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением указанного в заголовке соединения.
[0412]
Пример 288
5-Хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-метил-3,4-дигидро-2H-бензо[b][1,4]оксазин-8-сульфонамид
[0413]
К раствору в метаноле (1,0 мл) 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-3,4-дигидро-2H-бензо[b][1,4]оксазин-8-сульфонамида (48 мг), полученного в примере 275, последовательно добавляли уксусную кислоту (20 мкл) и 37%-ный водный раствор формальдегида (30 мкл), и реакционный раствор перемешивали при комнатной температуре в течение 30 минут. В реакционный раствор добавляли боргидрид натрия (12 мг), и смесь затем перемешивали в течение 20 минут. В реакционный раствор добавляли воду (15 мл), и смесь экстрагировали смесью этилацетат/гексан=1/1 (15 мл). Органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью обращенно-фазовой ВЭЖХ (вода/ацетонитрил) с получением указанного в заголовке соединения.
[0414]
Пример 289
5-Хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-метил-3,4-дигидро-2H-бензо[b][1,4]оксазин-8-сульфонамид
[0415]
(Стадия 1)
Исходя из моногидрохлорида 5-((1S,2R)-1-амино-2-(3-хлор-6-фтор-2-метилфенил)пропил)-1,3,4-оксадиазол-2(3H)-она (10,3 мг), полученного в ссылочном примере F7, и трет-бутил 5-хлор-8-(хлорсульфонил)-2H-бензо[b][1,4]оксазин-4(3H)-карбоксилата (25,3 мг), полученного в ссылочном примере E58, в соответствии со способом по примеру 129 получали трет-бутил 5-хлор-8-(N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-2H-бензо[b][1,4]оксазин-4(3H)-карбоксилат (25,4 мг).
[0416]
(Стадия 2)
К трет-бутил 5-хлор-8-(N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-2H-бензо[b][1,4]оксазин-4(3H)-карбоксилату (25,4 мг), полученному на вышеуказанной стадии 1, добавляли раствор хлористоводородной кислоты в 1,4-диоксане (4 M, 5,0 мл), и реакционный раствор перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали с помощью обращенно-фазовой ВЭЖХ (вода/ацетонитрил) с получением 5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-3,4-дигидро-2H-бензо[b][1,4]оксазин-8-сульфонамида (15,2 мг).
[0417]
(Стадия 3)
Исходя из 5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-3,4-дигидро-2H-бензо[b][1,4]оксазин-8-сульфонамида (15,2 мг), полученного на вышеуказанной стадии 2, в соответствии со способом по примеру 288, было синтезировано указанное в заголовке соединение.
[0418]
Пример 290
4-Хлор-N-((1S)-2-(6-фтор-2,3-диметилфенил)-2-гидрокси-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)этил)-2-метоксибензолсульфонамид
[0419]
(Стадия 1)
Используя (2S)-2-амино-3-(6-фтор-2,3-диметилфенил)-3-гидроксипропионовую кислоту (139 мг), полученную в ссылочном примере D56, и 4-хлор-2-метоксибензолсульфонилхлорид (175 мг) в соответствии со способом по примеру 1, стадия 1, была синтезирована (2S)-2-(4-хлор-2-метоксифенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)-3-гидроксипропионовая кислота (163 мг).
[0420]
(Стадия 2)
К раствору в ДМФ (10 мл) (2S)-2-(4-хлор-2-метоксифенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)-3-гидроксипропионовой кислоты (163 мг), полученной на вышеуказанной стадии 1, последовательно добавляли имидазол (753 мг) и трет-бутилдиметилхлорсилан (563 мг), и реакционный раствор перемешивали при температуре 60°C в течение 12 часов. Реакционный раствор добавляли в воду (20 мл) и экстрагировали смесью этилацетат/гексан=1/1 (30 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток растворяли в метаноле (10 мл) и ТГФ (2,0 мл), добавляли карбонат калия (1,0 г) и воду (2,0 мл), и реакционный раствор перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор добавляли в соляную кислоту (1 M, 20 мл) и экстрагировали смесью этилацетат/гексан=1/1 (30 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением (2S)-3-((трет-бутилдиметилсилил)окси)-2-(4-хлор-2-метоксифенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)пропионовой кислоты (175 мг).
[0421]
(Стадия 3)
Исходя из (2S)-3-((трет-бутилдиметилсилил)окси)-2-(4-хлор-2-метоксифенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)пропионовой кислоты (175 мг), полученной на вышеуказанной стадии 2, в соответствии со способом по примеру 1, стадия 2, получали N-((1S)-2-((трет-бутилдиметилсилил)окси)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)этил)-4-хлор-2-метоксибензолсульфонамид (126 мг).
[0422]
(Стадия 4)
К раствору в ТГФ (6,0 мл) N-((1S)-2-((трет-бутилдиметилсилил)окси)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)этил)-4-хлор-2-метоксибензолсульфонамида (126 мг), полученного на вышеуказанной стадии 3, последовательно добавляли уксусную кислоту (600 мкл) и тетра-н-бутиламмоний фторид (6,0 мл), и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор добавляли в воду (20 мл) и экстрагировали смесью этилацетат/гексан=1/1 (30 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением указанного в заголовке соединения в виде смеси диастереомеров.
[0423]
Пример 291
4-Хлор-N-((1R)-2-фтор-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)этил)-2-метоксибензолсульфонамид
[0424]
К раствору в дихлорметане (200 мкл) 4-хлор-N-((1S)-2-(6-фтор-2,3-диметилфенил)-2-гидрокси-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)этил)-2-метоксибензолсульфонамида (5,6 мг), полученного по примеру 290, добавляли DAST (10 мкл), и смесь перемешивали при комнатной температуре в течение 2 часов. В реакционный раствор добавляли насыщенный водный раствор гидрокарбоната натрия (5,0 мл), и смесь экстрагировали смесью этилацетат/гексан=1/1 (10 мл). Органический слой промывали насыщенным солевым раствором (5,0 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью обращенно-фазовой ВЭЖХ (вода/ацетонитрил) с получением указанного в заголовке соединения в виде смеси диастереомеров.
[0425]
Пример 292
5-Хлор-4-фтор-N-((1S,2R)-2-(2-фторнафталин-1-ил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)хроман-8-сульфонамид
[0426]
Исходя из 5-хлор-N-((1S,2R)-2-(2-фторнафталин-1-ил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидроксихроман-8-сульфонамида (13 мг), полученного в примере 233, в соответствии со способом по примеру 291 получали указанное в заголовке соединение в виде смеси диастереомеров 1:1.
[0427]
Пример 293
5-Хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-6-(2,2,2-трифторацетил)пиридин-2-сульфонамид
[0428]
Исходя из 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-6-(2,2,2-трифтор-1-гидроксиэтил)пиридин-2-сульфонамида (15,6 мг), полученного в примере 221, в соответствии со способом по ссылочному примеру E46, стадия 1, получали указанное в заголовке соединение.
[0429]
Пример 294
3-Ацетил-4-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-2-метоксибензолсульфонамид
[0430]
Исходя из 4-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-3-(1-гидроксиэтил)-2-метоксибензолсульфонамида, полученного в примере 204, получали указанное в заголовке соединение в соответствии со способом по ссылочному примеру E46, стадия 1.
[0431]
Пример 295
5-Хлор-N-((1S,2R)-2-(2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-2H-хромен-8-сульфонамид
[0432]
(Стадия 1)
Исходя из (2S,3R)-2-амино-3-(2,3-диметилфенил)бутановой кислоты (58 мг), полученной в ссылочном примере D6, и 5-хлор-4-оксохроман-8-сульфонилхлорида (88 мг), полученного в ссылочном примере E7, в соответствии со способом по примеру 1, стадии 1 и 2, получали 5-хлор-N-((1S,2R)-2-(2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-оксохроман-8-сульфонамид (63,4 мг).
[0433]
(Стадия 2)
Исходя из 5-хлор-N-((1S,2R)-2-(2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-оксохроман-8-сульфонамида (63,4 мг), полученного на стадии 1, описанной выше, в соответствии со способом по примеру 230, стадия 2, получали 5-хлор-N-((1S,2R)-2-(2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидроксихроман-8-сульфонамид (48 мг) в виде смеси диастереомеров.
[0434]
(Стадия 3)
К раствору в толуоле (2,0 мл) 5-хлор-N-((1S,2R)-2-(2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидроксихроман-8-сульфонамида (10 мг), полученного на вышеуказанной стадии 2, добавляли моногидрат п-толуолсульфоновой кислоты (2,0 мг), и реакционный раствор перемешивали при температуре 110°C в течение 30 минут. Реакционный раствор добавляли в воду (5 мл) и экстрагировали этилацетатом (10 мл). Органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением указанного в заголовке соединения.
[0435]
Пример 296
4-Хлор-N-((1S,2R)-2-(2,3-дигидро-1H-инден-4-ил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-2-(гидроксиметил)бензолсульфонамид
[0436]
(Стадия 1)
Используя (2S,3R)-2-амино-3-(2,3-дигидро-1H-инден-4-ил)бутановую кислоту (50 мг), полученную в ссылочном примере D10, и метил 5-хлор-2-(хлорсульфонил)бензоат (71 мг), в соответствии со способом на стадии 1 и 2 примера 1 получали метил 5-хлор-2-(N-((1S,2R)-2-(2,3-дигидро-1H-инден-4-ил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензоат (43 мг).
[0437]
(Стадия 2)
К раствору в ТГФ (2,0 мл) метил 5-хлор-2-(N-((1S,2R)-2-(2,3-дигидро-1H-инден-4-ил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензоата (15 мг), полученного на вышеуказанной стадии 1, добавляли раствор в ТГФ боргидрида лития (2 M, 100 мкл), и реакционный раствор перемешивали при температуре 60°C в течение 1 часа. Реакционный раствор добавляли в воду (10 мл) и экстрагировали этилацетатом (15 мл). Органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением указанного в заголовке соединения.
[0438]
Пример 297
4-Хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-2-метокси-3-(1-(метоксиметокси)этил)бензолсульфонамид
[0439]
К раствору в толуоле (1,5 мл) 4-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-3-(1-гидроксиэтил)-2-метоксибензолсульфонамида (10 мг), полученного по примеру 204, последовательно добавляли N,N-диизопропилэтиламин (25 мкл) и хлорметилметиловый эфир (10 мкл), и реакционный раствор перемешивали при комнатной температуре в течение 3 часов. Реакционный раствор концентрировали при пониженном давлении, и остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением указанного в заголовке соединения.
[0440]
Пример 298
4-Хлор-N-((1S,2R)-2-(4-фтор-4'-метокси-2-метил-[1,1'-бифенил]-3-ил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-2-метоксибензолсульфонамид
[0441]
(Стадия 1)
Используя (2S,3R)-2-амино-3-(3-бром-6-фтор-2-метилфенил)бутановую кислоту (200 мг), полученную в ссылочном примере D5, и 4-хлор-2-метоксибензолсульфонилхлорид (280 мг), в соответствии со способом на стадии 1 и 2 примера 1 был синтезирован N-((1S,2R)-2-(3-бром-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-хлор-2-метоксибензолсульфонамид (262 мг).
[0442]
(Стадия 2)
К раствору в 1,4-диоксане (1,0 мл) N-((1S,2R)-2-(3-бром-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-хлор-2-метоксибензолсульфонамида (11 мг), при комнатной температуре последовательно добавляли 4-метоксифенилбороновую кислоту (5,0 мг), аддукт дихлорида [1,1'-бис(дифенилфосфино)ферроцен]палладия (II) и дихлорметана (4,0 мг) и водный раствор карбоната натрия (2 M, 100 мкл), и реакционный раствор перемешивали при температуре 100°C в течение 1 часа. Реакционному раствору давали охладиться до комнатной температуры, нерастворимое вещество удаляли с помощью фильтрования через CELITE, и остаток промывали смесью гексан/этилацетат=1/1 (10 мл). Объединенный фильтрат концентрировали при пониженном давлении, и полученный остаток очищали с помощью обращенно-фазовой ВЭЖХ (вода/ацетонитрил) с получением указанного в заголовке соединения.
[0443]
Примеры 299-324
Используя N-((1S,2R)-2-(3-бром-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-хлор-2-метоксибензолсульфонамид, полученный по примеру 298, стадия 1, в соответствии со способом по примеру 298, стадия 2, были синтезированы соединения по примерам 299-324, показанные далее. Используемые бороновые кислоты или сложные эфиры бороновых кислот перечислены в следующей таблице.
[0444]
[Таблица 16-1]
[0445]
[Таблица 16-2]
[0446]
[Таблица 16-3]
[0447]
Пример 325
4-Хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-3-(1-метил-1H-пиразол-4-ил)бензолсульфонамид
[0448]
(Стадия 1)
Исходя из (2S,3R)-2-амино-3-(6-фтор-2,3-диметилфенил)бутановой кислоты (200 мг), полученной в ссылочном примере D1, и 3-бром-4-хлорбензолсульфонилхлорида (306 мг) в соответствии со способом на стадии 1 и 2 примера 1 был синтезирован 3-бром-4-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)бензолсульфонамид (274 мг).
[0449]
(Стадия 2)
К раствору в 1,4-диоксане (0,7 мл) 3-бром-4-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)бензолсульфонамида (5,6 мг), полученного на вышеуказанной стадии 1, при комнатной температуре последовательно добавляли (1-метил-1H-пиразол-4-ил)бороновую кислоту (6,2 мг), аддукт дихлорида [1,1'-бис(дифенилфосфино)ферроцен]палладия (II) и дихлорметана (5,0 мг), водный раствор карбоната натрия (2 M, 100 мкл), и реакционный раствор перемешивали в течение 4 часов при температуре 100°C. Реакционному раствору давали охладиться до комнатной температуры, нерастворимое вещество удаляли с помощью фильтрования через CELITE, и остаток промывали смесью гексан/этилацетат=1/1 (10 мл). Объединенный фильтрат концентрировали при пониженном давлении, и полученный остаток очищали с помощью обращенно-фазовой ВЭЖХ (вода/ацетонитрил) с получением указанного в заголовке соединения.
[0450]
Пример 326
6-Хлор-2'-фтор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-[1,1'-бифенил]-3-сульфонамид
[0451]
Используя 3-бром-4-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)бензолсульфонамид, полученный по примеру 325, стадия 1, и (2-фторфенил)бороновую кислоту было синтезировано указанное в заголовке соединение в соответствии со способом по примеру 325, стадия 2.
[0452]
Пример 327
4-Хлор-N-((1S,2R)-2-(6-фтор-2-метил-3-(фенилэтинил)фенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-2-метоксибензолсульфонамид
[0453]
К раствору в ДМФ (1,0 мл) N-((1S,2R)-2-(3-бром-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-хлор-2-метоксибензолсульфонамида (10,9 мг), полученного по примеру 298, стадия 1, при комнатной температуре последовательно добавляли дихлорбис(трифенилфосфин)палладий (II) (1,5 мг), йодид меди (I) (1,5 мг), триэтиламин (30 мкл) и этинилбензол (20 мкл), реакционный раствор нагревали до температуры 100°C, и смесь перемешивали в течение 4 часов. Реакционному раствору давали охладиться до комнатной температуры, и нерастворимое вещество удаляли с помощью фильтрования через CELITE, и остаток промывали смесью гексан/этилацетат=1/1 (10 мл). Объединенный фильтрат концентрировали при пониженном давлении, и полученный остаток очищали с помощью обращенно-фазовой ВЭЖХ (вода/ацетонитрил) с получением указанного в заголовке соединения.
[0454]
Пример 328
4-Амино-5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-метилхроман-8-сульфонамид
[0455]
К раствору в бензоле (1,5 мл) 5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метилхроман-8-сульфонамида (17 мг), полученного по примеру 209A, последовательно добавляли триметилсилилазид (50 мкл), комплекс трифторид бора-диметиловый эфир (100 мкл), и реакционный раствор перемешивали в течение 1 часа при комнатной температуре. В реакционный раствор добавляли насыщенный водный раствор бикарбоната натрия (10 мл), и смесь экстрагировали смесью этилацетат/гексан=1/1 (10 мл). Органический слой промывали насыщенным солевым раствором (10 мл), сушили безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток растворяли в ТГФ (1,5 мл) и воде (50 мкл). К остатку добавляли трифенилфосфин (15 мг), и реакционный раствор перемешивали в течение 2 часов при комнатной температуре. Нерастворимое вещество удаляли с помощью фильтрования через CELITE, и остаток промывали смесью этилацетат/гексан=1/1 (10 мл). Объединенный фильтрат концентрировали при пониженном давлении, и полученный остаток очищали с помощью обращенно-фазовой ВЭЖХ (вода/ацетонитрил) с получением указанного в заголовке соединения в виде смеси диастереомеров 1:1.
[0456]
Пример 329
4-Амино-N-((1S,2R)-2-(3-бром-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-5-хлор-4-метил-хроман-8-сульфонамид
[0457]
Указанное в заголовке соединение получали, используя N-((1S,2R)-2-(3-бром-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-5-хлор-4-гидрокси-4-метилхроман-8-сульфонамид, полученный в примере 222A, в соответствии со способом по примеру 328.
[0458]
Пример 330
4-Амино-5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-метил хроман-8-сульфонамид, изомер A и изомер B
[0459]
К раствору в 1,4-диоксане (1,0 мл) диастереомерной смеси 4-амино-5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-метилхроман-8-сульфонамида (6,4 мг), полученного в примере 328, при комнатной температуре добавляли триэтиламин (100 мкл) и ди-трет-бутил дикарбонат (54 мг), и реакционный раствор перемешивали в течение 4 часов. Реакционный раствор концентрировали при пониженном давлении, полученный остаток очищали с помощью обращенно-фазовой ВЭЖХ (вода/ацетонитрил), и фракции концентрировали с получением каждого из двух диастереомерных продуктов. Вещество, элюируемое первым, обозначали как соединение A, и вещество, элюируемое позднее, обозначали как соединение B. Полученные соединения A и B растворяли каждое в растворе хлористоводородной кислоты в диоксане (4 M, 2,0 мл), и реакционный раствор перемешивали при температуре 70°C в течение 4 часов. Реакционному раствору давали охладиться до комнатной температуры и концентрировали при пониженном давлении. Вещество, полученное из соединения A, обозначали как соединение 330A, и вещество, полученное из соединения B, как соединение 330B.
[0460]
Пример 331
2-(N-((1S,2R)-2-(6-Фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-4-(1,3,4-оксадиазол-2-ил)бензамид
[0461]
(Стадия 1)
Используя (2S,3R)-2-амино-3-(6-фтор-2,3-диметилфенил)бутановую кислоту (80 мг), полученную в ссылочном примере D1, и этил 3-(хлорсульфонил)-4-цианобензоат (146 мг), полученный в ссылочном примере E13, в соответствии со способом на стадии 1 и 2 примера 1, получали этил 4-циано-3-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензоат (40 мг).
[0462]
(Стадия 2)
К раствору в ДМСО (1 мл) этил 4-циано-3-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензоата (40 мг), полученного на вышеуказанной стадии 1, добавляли 30%-ный водный растрор перксида водорода (0,5 мл) и карбонат калия (20 мг), и реакционный раствор перемешивали при температуре 70°C в течение 1 часа. В реакционный раствор добавляли 1M соляную кислоту, и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, концентрировали при пониженном давлении, и полученный остаток очищали с помощью обращенно-фазовой ВЭЖХ (вода/ацетонитрил) с получением 4-карбамоил-3-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензойной кислоты (8,9 мг).
[0463]
(Стадия 3)
К раствору в дихлорметане (1,5 мл) 4-карбамоил-3-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензойной кислоты (16 мг), полученной на вышеуказанной стадии 2, добавляли (изоцианоимино) трифенилфосфоран (36 мг), и реакционный раствор перемешивали при комнатной температуре в течение 72 часов. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали с помощью обращенно-фазовой ВЭЖХ (вода/ацетонитрил) с получением указанного в заголовке соединения (1,1 мг).
[0464]
Пример 332
5-Бром-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-тиоксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид
[0465]
(Стадия 1)
(2S,3R)-2-Амино-3-(6-фтор-2,3-диметилфенил)бутановую кислоту (300 мг), полученную в ссылочном примере D1, растворяли в воде (5,0 мл) и 1,4-диоксане (5,0 мл), добавляли триэтиламин (570 мкл) и охлаждали до температуры 0°C. В реакционный раствор добавляли 4-бром-2-цианобензол-1-сульфонилхлорид (362 мг), и смесь перемешивали при той же температуре в течение 45 минут. Реакционный раствор добавляли в соляную кислоту (1 M, 15 мл) и экстрагировали этилацетатом (15 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат/2%-ная уксусная кислота) с получением (2S,3R)-2-(4-бром-2-цианофенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутановой кислоты (465 мг).
[0466]
(Стадия 2)
К раствору в ТГФ (1,5 мл) (2S,3R)-2-(4-бром-2-цианофенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутановой кислоты (22 мг), полученной на вышеуказанной стадии 1, добавляли CDI (13 мг), реакционный раствор перемешивали при комнатной температуре в течение 30 минут, затем добавляли моногидрат гидразина (12 мкл), и смесь перемешивали в течение 20 минут. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток растворяли в этаноле (1,2 мл), последовательно добавляли дисульфид углерода (10 мкл) и гидроксид калия (10 мг), и реакционный раствор перемешивали при температуре 90°C в течение 12 часов. Реакционный раствор добавляли в соляную кислоту (1 M, 10 мл) и экстрагировали этилацетатом (10 мл). Органический слой промывали насыщенным солевым раствором(10 мл), сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением указанного в заголовке соединения.
[0467]
Примеры 333-335
В соответствии со способом по примеру 332, стадии 1 и 2, были синтезированы соединения по примерам 333-335, показанные далее. Исходные вещества перечислены в следующей таблице.
[0468]
[Таблица 17]
[0469]
Пример 336
4-Хлор-N-((1S,2R)-2-(2,3-дигидро-1H-инден-4-ил)-1-(5-тиоксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-3-(2-гидроксипропан-2-ил)бензолсульфонамид
[0470]
(Стадия 1)
Используя (2S,3R)-2-амино-3-(2,3-дигидро-1H-инден-4-ил)бутановую кислоту (20 мг) и 3-ацетил-4-хлорбензол-1-сульфонилхлорид (20 мг), полученный в ссылочном примере D10, в соответствии со способом по примеру 332, стадии 1 и 2, получали 3-ацетил-4-хлор-N-((1S,2R)-2-(2,3-дигидро-1H-инден-4-ил)-1-(5-тиоксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)бензолсульфонамид (12 мг).
[0471]
(Стадия 2)
Исходя из 3-ацетил-4-хлор-N-((1S,2R)-2-(2,3-дигидро-1H-инден-4-ил)-1-(5-тиоксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)бензолсульфонамида (12 мг), полученного на вышеуказанной стадии 1, получали указанное в заголовке соединение в соответствии со способом по примеру 186, стадия 2.
[0472]
Пример 337
5-Хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-N-метилсульфамоил)бензамид
[0473]
(Стадия 1)
Используя (2S,3R)-2-амино-3-(6-фтор-2,3-диметилфенил)бутановую кислоту (530 мг), полученную в ссылочном примере D1, и 4-хлор-2-цианобензол-1-сульфонилхлорид (660 мг), в соответствии со способом по примеру 1, стадия 1, получали (2S,3R)-2-(4-хлор-2-цианофенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутановую кислоту (777 мг).
[0474]
(Стадия 2)
[0475]
К раствору в ТГФ (500 мкл) (2S,3R)-2-(4-хлор-2-цианофенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутановой кислоты (11 мг), полученной на вышеуказанной стадии 1, добавляли CDI (15 мг), и реакционный раствор перемешивали в течение 1 часа при комнатной температуре. В реакционный раствор добавляли метанол (1,0 мл), и смесь затем перемешивали в течение 16 часов. Реакционный раствор добавляли в воду (10 мл) и экстрагировали диэтиловым эфиром (15 мл). Органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением метил (2S,3R)-2-(4-хлор-2-цианофенил)-3-(6-фтор-2,3-диметилфенил)бутаноата (12 мг).
[0476]
(Стадия 3)
К метил (2S,3R)-2-(4-хлор-2-цианофенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутаноату (100 мг), полученному на вышеуказанной стадии 2, последовательно добавляли метанол (2 мл), дихлорметан (2 мл), и раствор в гексане триметилсилил диазометана (0,6 M, 800 мкл), и реакционный раствор перемешивали при комнатной температуре в течение 1 часа. Путем концентрирования реакционного раствора при пониженном давлении получали метил (2S,3R)-2-(4-хлор-2-циано-N-метилфенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутаноат (101 мг).
[0477]
(Стадия 4)
Метил (2S,3R)-2-(4-хлор-2-циано-N-метилфенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутаноат (101 мг), полученный на стадии 3, описанной выше, в соответствии со способом по примеру 245, стадия 2, получали (2S,3R)-2-(4-хлор-2-циано-N-метилфенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутановую кислоту (8,5 мг).
[0478]
(Стадия 5)
К (2S,3R)-2-(4-хлор-2-циано-N-метилфенилсульфонамид)-3-(6-фтор-2,3-диметилфенил)бутановой кислоте (8,5 мг), полученной на вышеуказанной стадии 4, в соответствии со способом по примеру 1, стадия 2, получали 4-хлор-2-циано-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-N-метилбензолсульфонамид (6,0 мг).
[0479]
(Стадия 6)
Исходя из 4-хлор-2-циано-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-N-метилбензолсульфонамида (6,0 мг), полученного на вышеуказанной стадии 5, в соответствии со способом по примеру 1, стадия 3, получали указанное в заголовке соединение.
[0480]
Пример 344
6-Хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4'-метокси-[1,1'-бифенил]-3-сульфонамид
Используя 3-бром-4-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)бензолсульфонамид и (4-метоксифенил)бороновую кислоту, полученную по примеру 325, стадия 1, было синтезировано указанное в заголовке соединение в соответствии со способом по примеру 325, стадия 2.
[0481]
Пример 345
3-N-((1S,2R)-2-(6-Фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-2'-метокси-[1,1'-бифенил]-4-карбоксамид
(Стадия 1)
Исходя из (2S,3R)-2-амино-3-(6-фтор-2,3-диметилфенил)бутановой кислоты, полученной в ссылочном примере D1, и 5-бром-2-цианобензолсульфонилхлорида, в соответствии со способом на стадии 1 и 2 примера 1, был синтезирован 5-бром-2-циано-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)бензолсульфонамид.
(Стадия 2)
Используя 5-бром-2-циано-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)бензолсульфонамид, полученный на вышеуказанной стадии 1, и 2-метоксифенилбороновую кислоту, в соответствии со способом по примеру 325, стадия 2, и по примеру 1, стадия 3, получали указанное в заголовке соединение.
[0482]
Пример 346
4-(N-((1S,2R)-2-(6-Фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-3-метоксибензамид
Исходя из 4-циано-N-((1S,2R)-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-2-метоксибензолсульфонамида, полученного в примере 342, получали указанное в заголовке соединение в соответствии со способом по примеру 1, стадия 3.
[0483]
Пример 347
4-(N-((1S,2R)-(6-Фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид
Исходя из 4-циано-N-((1S,2R)-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)бензолсульфонамида, полученного в примере 341, в соответствии со способом по примеру 1, стадия 3, получали указанное в заголовке соединение.
[0484]
Пример 348
4-Бром-N-((1S,2R)-2-(нафталин-1-ил)-1-(5-оксо-4,5-дигидро-1,2,4-оксадиазол-3-ил)пропил)бензолсульфонамид
(Стадия 1)
Используя (2S,3R)-2-амино-3-(нафталин-1-ил)бутановую кислоту, полученную в ссылочном примере D11, и 4-бромбензолсульфонилхлорид, в соответствии со способом на стадии 1, пример 1, получали (2S,3R)-2-((4-бромфенил)сульфонамидо)-3-(нафталин-1-ил)бутановую кислоту.
(Стадия 2)
К раствору в ДМФ (2,5 мл) (2S,3R)-2-((4-бромфенил)сульфонамидо)-3-(нафталин-1-ил)бутановой кислоты (283 мг), полученной на вышеуказанной стадии 1, добавляли хлорид аммония (41 мг), HOBt (103 мг), триэтиламин (0,264 мл) и WSC (146 мг), и реакционный раствор перемешивали при комнатной температуре в течение 3 часов. Реакционный раствор добавляли в воду и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением (2S,3R)-2-((4-бромфенил)сульфонамидо)-3-(нафталин-1-ил)бутанамида в виде сырого продукта.
(Стадия 3)
К раствору в ДМФ (2 мл) (2S,3R)-2-((4-бромфенил)сульфонамидо)-3-(нафталин-1-ил)бутанамида, полученного на вышеуказанной стадии 2, при температуре 0°C добавляли хлорангидрид циануровой кислоты (59 мг), и реакционный раствор перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор добавляли в воду и экстрагировали смешанным растворителем из этилацетата/толуола. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением 4-бром-N-((1S,2R)-1-циано-2-(нафталин-1-ил)пропил)бензолсульфонамида (137 мг).
(Стадия 4)
К раствору в этаноле (2 мл) 4-бром-N-((1S,2R)-1-циано-2-(нафталин-1-ил)пропил)бензолсульфонамида (137 мг), полученного на вышеуказанной стадии 3, добавляли воду (0,66 мл) и 50%-ный водный раствор гидроксиламина (0,060 мл), и реакционный раствор перемешивали при комнатной температуре в течение ночи. Реакционный раствор концентрировали при пониженном давлении, добавляли в воду и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением (2S,3R)-2-((4-бромфенил)сульфонамидо)-N-гидрокси-(3-нафталин-1-ил)бутанамида (130 мг) в виде сырого продукта.
(Стадия 5)
К раствору в ДМФ (1,0 мл) (2S,3R)-2-((4-бромфенил)сульфонамидо)-N-гидрокси-3-(нафталин-1-ил)бутанамида (20 мг), полученного на вышеуказанной стадии 4, добавляли пиридин (0,004 мл) и 2-этилгексил хлорформиат (0,009 мл), и реакционный раствор перемешивали при комнатной температуре в течение 1 часа. Затем добавляли ксилол, и реакционный раствор перемешивали в течение ночи при температуре 100яяC. В реакционный раствор добавляли воду, и смесь экстрагировали смешанным растворителем из этилацетата/гексана. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток подвергали хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением указанного в заголовке соединения (37 мг).
[0485]
Пример 349
4-Хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,2,4-оксадиазол-3-ил)пропил)-2-метоксибензолсульфонамид
(Стадия 1)
Используя (2S,3R)-2-амино-3-(6-фтор-2,3-диметилфенил)бутановую кислоту, полученную в ссылочном примере D1, и 4-хлор-2-метоксибензолсульфонилхлорид, в соответствии со способом по примеру 1, стадия 1, получали (2S,3R)-2-((4-хлор-2-метоксифенил)сульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутановую кислоту.
(Стадия 2)
Исходя из (2S,3R)-2-((4-хлор-2-метоксифенил)сульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутановой кислоты, полученной на вышеуказанной стадии 1, в соответствии со способом по примеру 348, стадия 2-стадия 5, получали указанное в заголовке соединение.
[0486]
Пример 350
(2S,3R)-2-((4-Хлор-2-метоксифенил)сульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутановую кислоту (142 мг), полученную по примеру 348, стадия 1, растворяли в ДМФ (3,3 мл), и последовательно добавляли WSC (130 мг), HOBt (100 мг), N,N-диизопропилэтиламин (200 мкл) и тиосемикарбазид (70 мг), и реакционный раствор перемешивали при температуре 80°C в течение 4 часов. Реакционный раствор добавляли к насыщенному водному раствору хлорида аммония (15 мл) и экстрагировали этилацетатом (20 мл). Органический слой промывали насыщенным солевым раствором (15 мл), сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат). Полученный остаток растворяли в этаноле (1,5 мл), добавляли 20%-ный водный раствор гидроксида натрия (2,0 мл), и реакционный раствор перемешивали при температуре 80°C в течение 12 часов. Реакционный раствор добавляли в соляную кислоту (1 M, 5,0 мл) и экстрагировали этилацетатом (10 мл). Органический слой промывали насыщенным солевым раствором (5,0 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат) с получением указанного в заголовке соединения.
[0487]
Сравнительный пример 1
В соответствии со способом, описанным в непатентном документе 11, получали соединение следующей формулы.
[0488]
[Формула 49]

[0489]
1H ЯМР (CD3OD) δ: 7,54 (д, J=8,4 Гц, 2H), 7,17-7,29 (м, 5H), 7,08-7,14 (м, 2H), 4,55-4,61 (м, 1H), 3,00-3,13 (м, 2H), 2,39 (с, 3H)
[0490]
Ниже приводятся структурные формулы и физические свойства соединений по примерам от 1 до 350.
[0491]
[Таблица 18-1]
[0492]
[Таблица 18-2]
[0493]
[Таблица 18-3]
[0494]
[Таблица 18-4]
[0495]
[Таблица 18-5]
[0496]
[Таблица 18-6]
[0497]
[Таблица 18-7]
[0498]
[Таблица 18-8]
[0499]
[Таблица 18-9]
[0500]
[Таблица 18-10]
[0501]
[Таблица 18-11]
[0502]
[Таблица 18-12]
[0503]
[Таблица 18-13]
[0504]
[Таблица 18-14]
[0505]
[Таблица 18-15]
[0506]
[Таблица 18-16]
[0507]
[Таблица 18-17]
[0508]
[Таблица 18-18]
[0509]
[Таблица 18-19]
[0510]
[Таблица 18-20]
[0511]
[Таблица 18-21]
[0512]
[Таблица 18-22]
[0513]
[Таблица 18-23]
[0514]
[Таблица 18-24]
[0515]
[Таблица 18-25]
[0516]
[Таблица 18-26]
[0517]
[Таблица 18-27]
[0518]
[Таблица 18-28]
[0519]
[Таблица 18-29]
[0520]
[Таблица 18-30]
[0521]
[Таблица 18-31]
[0522]
[Таблица 18-32]
[0523]
[Таблица 18-33]
[0524]
[Таблица 18-34]
[0525]
[Таблица 18-35]
[0526]
[Таблица 18-36]
[0527]
[Таблица 18-37]
[0528]
[Таблица 18-38]
[0529]
[Таблица 18-39]
[0530]
[Таблица 18-40]
[0531]
[Таблица 18-41]
[0532]
[Таблица 18-42]
[0533]
[Таблица 18-43]
[0534]
[Таблица 18-44]
[0535]
[Таблица 18-45]
[0536]
[Таблица 18-46]
[0537]
[Таблица 18-47]
[0538]
[Таблица 18-48]
[0539]
[Таблица 18-49]
[0540]
[Таблица 18-50]
[0541]
[Таблица 18-51]
[0542]
[Таблица 18-52]
[0543]
[Таблица 18-53]
[0544]
[Таблица 18-54]
[0545]
[Таблица 18-55]
[0546]
[Таблица 18-56]
[0547]
[Таблица 18-57]
[0548]
[Таблица 18-58]
[0549]
[Таблица 18-59]
[0550]
[Таблица 18-60]
[0551]
[Таблица 18-61]
[0552]
[Таблица 18-62]
[0553]
[Таблица 18-63]
[0554]
[Таблица 18-64]
[0555]
[Таблица 18-65]
[0556]
[Таблица 18-66]
[0557]
[Таблица 18-67]
[0558]
[Таблица 18-68]
[0559]
[Таблица 18-69]
[0560]
[Таблица 18-70]
[0561]
[Таблица 18-71]
[0562]
[Таблица 18-72]
[0563]
[Таблица 18-73]
[0564]
[Таблица 18-74]
[0565]
Пример исследования
Соединение в соответствии с настоящим изобретением оценивали с использованием следующего метода исследований.
[0566]
Пример исследования 1. Ингибирующее RNR человека действие
Ингибирующую активность в отношении реакции восстановления рибонуклеотида (далее называемая реакцией RNR) исследуемого соединения определяли путем определения образования деоксицитидиндифосфата (далее называемого dCDP) из цитидиндифосфата (далее называемого CDP) следующим способом.
Субъединицу M1 человека и субъединицу M2 человека (мутант, лишенный аминоконцевых 59 аминокислот), которые были слиты с гистидиновой меткой на аминоконце, сверхэкспрессировали в Escherichia coli и солюбилизировали после сбора, и меченные гистидином белки M1 и M2 человека очищали на никель-хелатной колонке.
Для измерения ингибирующей активности исследуемого соединения в отношении реакции RNR рассматривался способ, описанный в документе [CANCER RESEARCH 64, 1-6, 2004].
Сначала исследуемые соединения серийно разбавляли ДМСО. Затем белок M1 человека и белок M2 человека добавляли к водному раствору альбумина, полученному из 0,02% фетальной бычьей сыворотки, добавляли раствор в ДМСО соединения по настоящему изобретению или контрольный раствор ДМСО (конечная концентрация ДМСО составляла 1%), и смесь оставляли стоять в течение 20 минут. После этого добавляли реакционный буфер [50 мМ буфера HEPES (рН 7,2) при конечной концентрации, 4 мМ ацетата магния при конечной концентрации, 100 мМ хлорида калия при конечной концентрации, 6 мМ дитиотреитола при конечной концентрации, 2 мМ аденозинтрифосфата при конечной концентрации 0,24 мМ никотинамидадениндинуклеотидфосфата при конечной концентрации] и 10 мкМ CDP при конечной концентрации и инкубировали при 37°С в течение 30 минут для проведения реакции RNR. Сразу же после взаимодействия реакцию останавливали нагреванием при 100°С в течение 15 минут с последующим центрифугированием при 10000 об/мин в течение 10 минут. После центрифугирования часть (5 мкл) полученного супернатанта анализировали с помощью высокоэффективной жидкостной хроматографии (Shimadzu Corporation, Prominence) с использованием Shim-pack XR-ODS (производства Shimadzu GLC Co., 3,0×100 мм). Элюирование осуществляли с измерением на длине волны 265 нм со скоростью потока 0,5 мл/мин с помощью 9-минутного градиента концентрации от смеси 12:13 подвижной фазы А (10 мМ дигидрофосфата калия (рН 6,7), 10 мМ тетрабутиламмония, 0,25% метанола) и подвижной фазы В (50 мМ дигидрофосфата калия (рН 6,7), 5,6 мМ тетрабутиламмония, 30% метанола) к той же смеси 2:3 для измерения субстрата CDP (RT 5,9 мин) и продукта реакции dCDP (RT 6,2 мин).
Ингибирующую активность исследуемого соединения определяли согласно следующему уравнению, и концентрации исследуемых соединений, ингибирующих реакцию RNR на 50%, показаны как IC50 мкМ) в таблицах от 19-1 до 19-3.
[0567]
[Математическая формула 1]

[0568]
В результате из следующей таблицы видно, что соединение по настоящему изобретению обладает превосходным ингибирующим RNR действием. Напротив, соединение сравнительного примера 1 имеет IC50 43 мкМ и не проявляет ингибирующей активности в отношении RNR, как показано в примерах соединений по настоящему изобретению.
[0569]
[Таблица 19-1]
[0570]
[Таблица 19-2]
[0571]
[Таблица 19-3]
[0572]
Пример исследования 2. Ингибирующее клеточную пролиферацию действие на линию клеток рака молочной железы.
Клетки клеточной линии HCC 1806 рака молочной железы человека ежедневно пассировали при плотности клеток, не превышающей 80% в среде ATCC, рекомендованной Roswell Park Memorial Institute (RPMI-1640), содержащей 10% фетальной бычьей сыворотки (FBS). Для того, чтобы начать исследование ингибирующей пролиферацию клеток активности, клетки HCC 1806 суспендировали в вышеуказанной среде, проводя наблюдения при 180 мкл в каждой лунке 96-луночного планшета с плоским дном, так что количество клеток на лунку составляло 2000, клетки культивировали при 37°С в течение 1 дня в инкубаторе, содержащем 5% газообразного диоксида углерода. На следующий день исследуемое соединение растворяли в ДМСО и в каждую лунку культурального планшета для клеток добавляли по 20 мкл раствора добавки лекарственного средства, разбавленного последовательно дистиллированной водой в 10 раз конечной концентрации, и клетки культивировали при температуре 37°С в течение 72 часов в инкубаторе, содержащем 5% углекислого газа. После культивирования в течение 72 часов в каждую лунку добавляли 20 мкл глутаральдегида и оставляли на 30 минут, затем планшет промывали 10 раз водой и сушили. В каждую лунку добавляли 100 мкл раствора красителя (0,05% кристаллического фиолетового в 20% метанольном растворе) и оставляли на 30 минут, затем планшет промывали 10 раз водой и сушили. В каждую лунку добавляли 100 мкл экстрагирующего раствора (0,1 N NaH2 PO4:100% этанол=1:1) и перемешивали, и смесь измеряли на длине волны 540 нм с использованием планшетного ридера (MTP-450 производства Corona Electric Co., Ltd.). Скорость ингибирования роста рассчитывали по следующей формуле и определяли концентрацию (IC50 (мкМ)) исследуемого соединения, ингибирующую на 50%. Результаты представлены в таблице 20.
Скорость ингибирования роста (%)={(CB)-(TB)}/(CB)×100
T: поглощение лунки, в которую добавляли исследуемое соединение
C: поглощение лунок, в которые не было добавлено исследуемое соединения
B: поглощение лунок, в которым не добавляли клеточную суспензию
В результате, как видно из следующей таблицы, было обнаружено, что соединения по настоящему изобретению обладают ингибирующей рост активностью в отношении раковых клеток.
[0573]
[Таблица 20]
[0574]
Исследуемый пример 3. Ингибирующее пролиферацию клеток действие на раковые клеточные линии рака человека
В соответствии со способом по примеру 2 оценивали ингибирующее пролиферацию клеток действие на различных линиях раковых клеток, как представлено в таблице 21.
В результате, как видно из следующей таблицы, было обнаружено, что соединения по настоящему изобретению обладают ингибирующей рост активностью в отношении различных видов раковых клеток человека.
[0575]
[Таблица 21]
[0576]
Пример испытания 4 Оценка противоопухолевого эффекта с использованием клеточной линии рака крови человека (MV-4-11) Модель подкожной трансплантации (in vivo)
Клеточную линию рака крови человека MV-4-11 трансплантировали подкожно голой мыши и в то время, когда объем опухоли у голой мыши, которой привита опухоль, достигал от 100 до 300 мм3, случайным образом распределяли в группы по четыре мыши, так что средние объемы опухолей в каждой группе были равномерными (день 0), и ежедневно со скоростью 100 мг/кг/день перорально вводили соединение по настоящему изобретению один раз в день в течение 14 дней.
Чтобы сравнить хронологически трансформацию пролиферации опухоли при введении каждого исследуемого соединения, относительный объем опухоли (RTV), устанавливающий объем опухоли на момент распределения как 1, скорость пролиферации опухоли рассчитывали в соответствии со следующей формулой, и трансформация среднего значения RTV каждого индивида показан на фигурах от 1 до 4.
RTV= объем опухоли в день измерения объема опухоли)/(объем опухоли на момент распределения)
Среднее значение RTV для группы, которой вводили соединение по настоящему изобретению, в день окончательной оценки меньше среднего значения RTV для контрольной группы, и когда показана статистически значимая разница (тест Стьюдента-t), было определено, что соединение по настоящему изобретению является значительно эффективным, и статически значимая разница отмечена * на фигуре (*: p <0,05).
В результате было обнаружено, что соединение по настоящему изобретению демонстрирует значительный противоопухолевый эффект.
Реферат
Изобретение относится к новому сульфонамидному соединению формулы (I), обладающему ингибирующей рибонуклеотидредуктазy активностью, и к фармацевтическим композициям, содержащим его в качестве активного ингредиента. Технический результат: получены новые соединения, обладающие ингибирующей рибонуклеотидредуктазy активностью, которые могут быть применимы в качестве противоопухолевого агента, где опухоль выбрана из группы, состоящей из рака молочной железы, рака желудка, рака легкого, рака поджелудочной железы, саркомы Юинга, глиобластомы, рака печени, мезотелиомы, рака простаты, рака яичников, рака почки, рака толстой и прямой кишки, меланомы и рака крови. 12 н. и 19 з.п. ф-лы, 4 ил., 21 табл., 354 пр.[Формула 1]
Формула





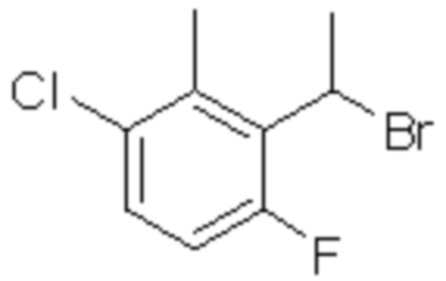




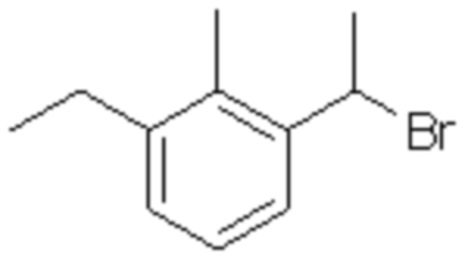



















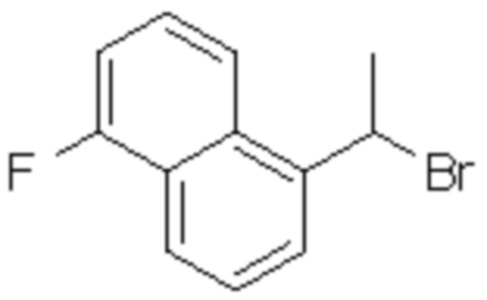






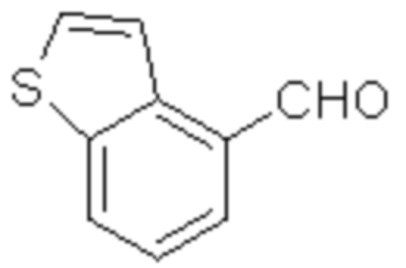
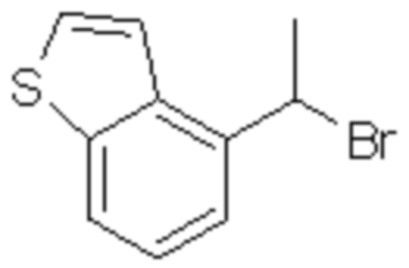


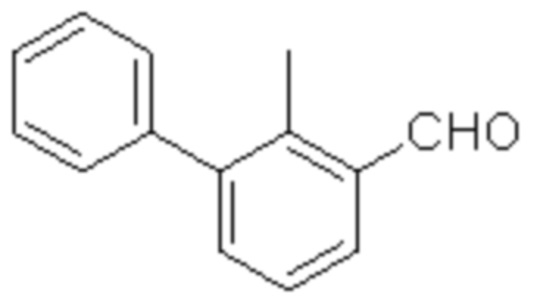
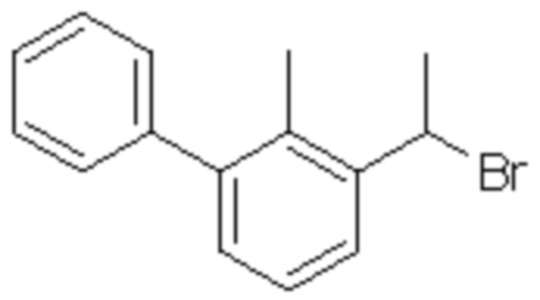






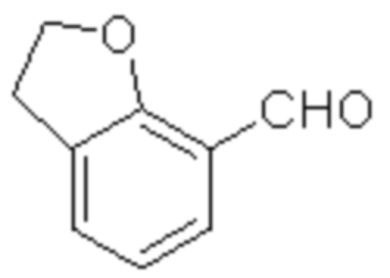
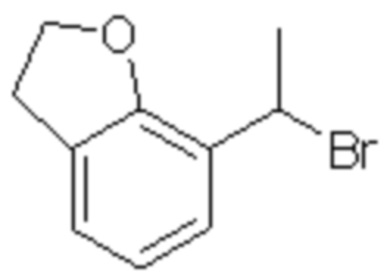













































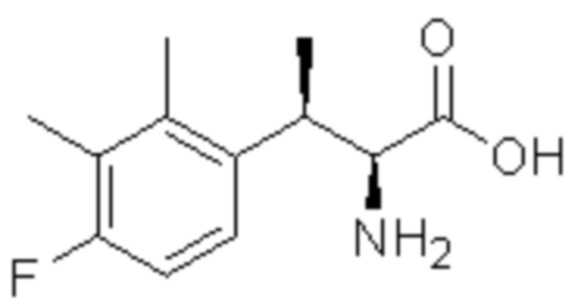


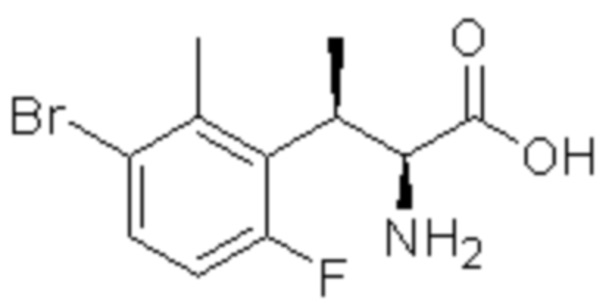


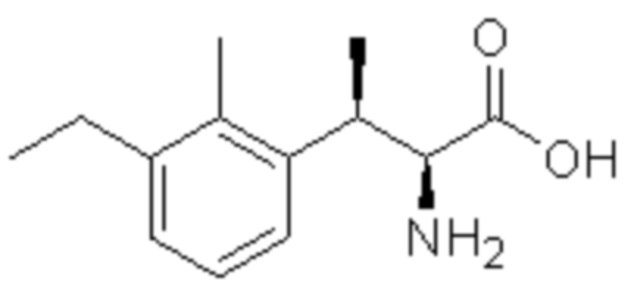






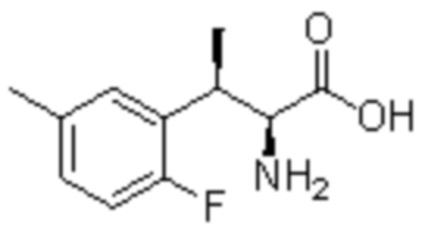


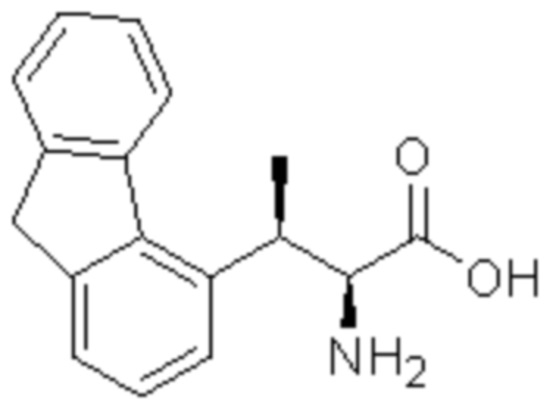



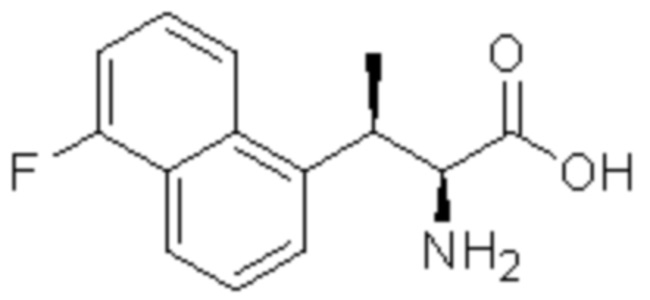



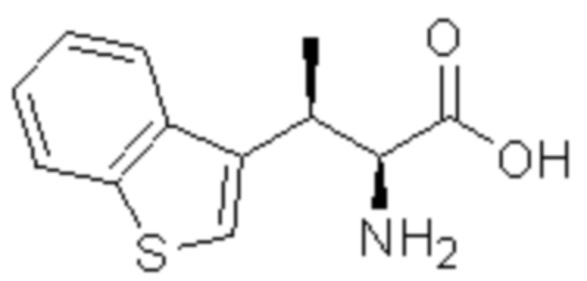
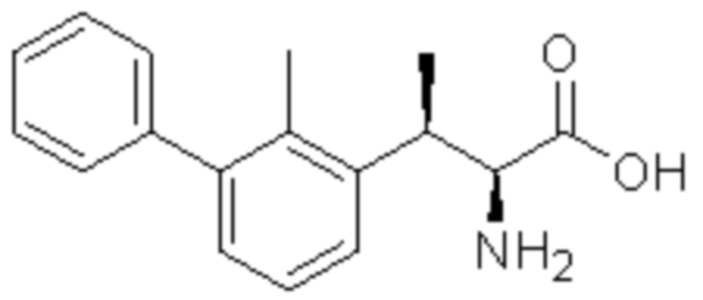
















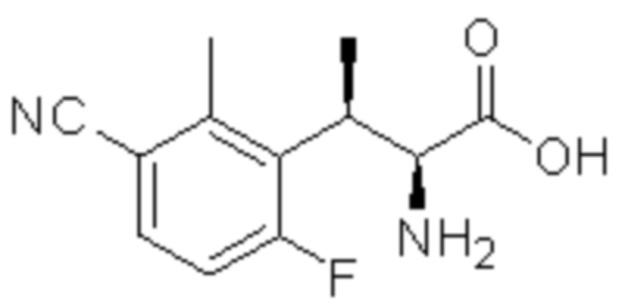











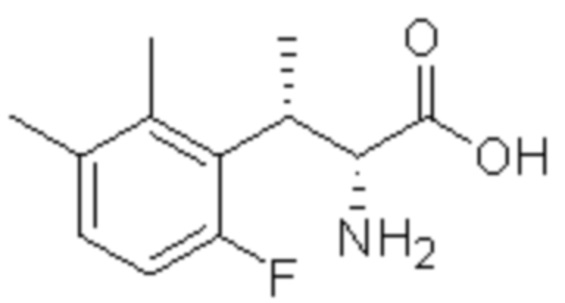

































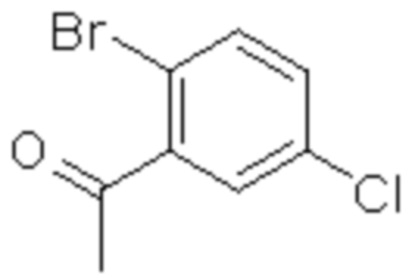
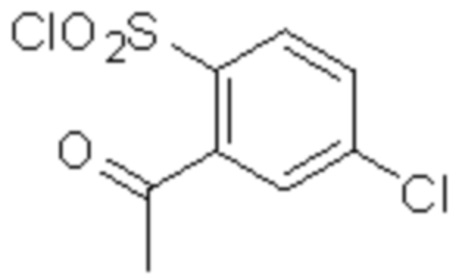









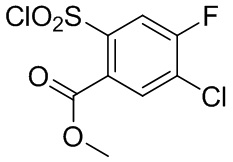





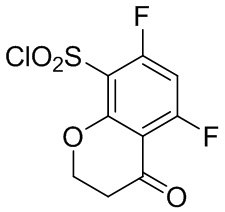





















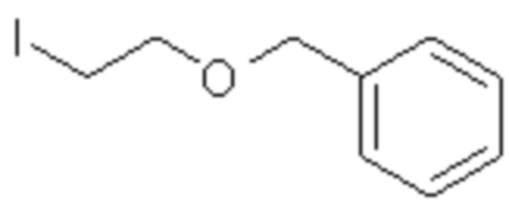







































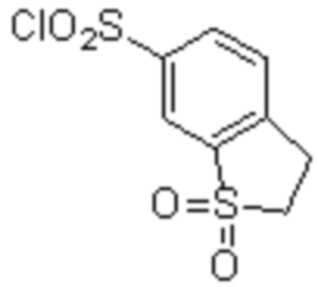
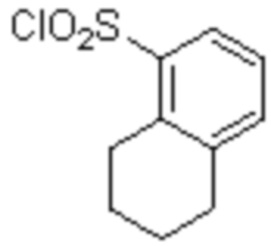





















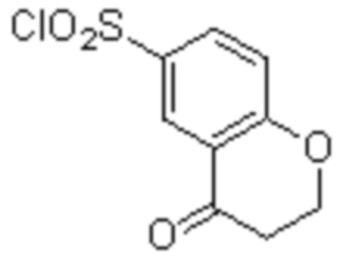
















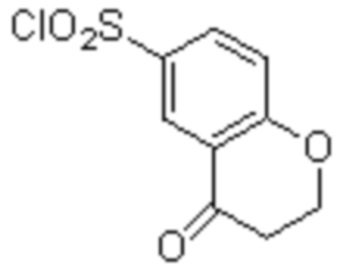
































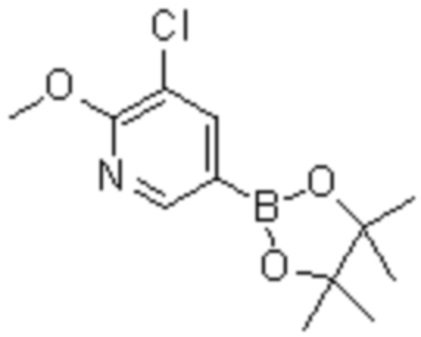




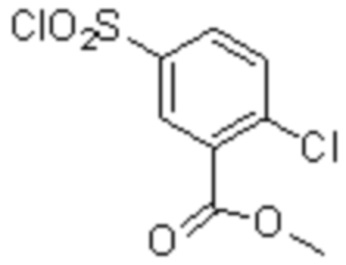






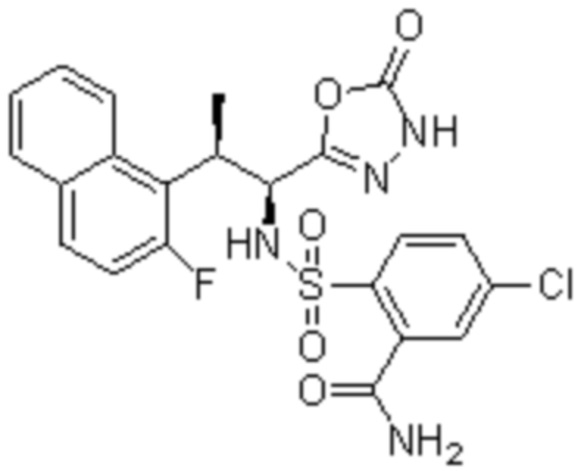



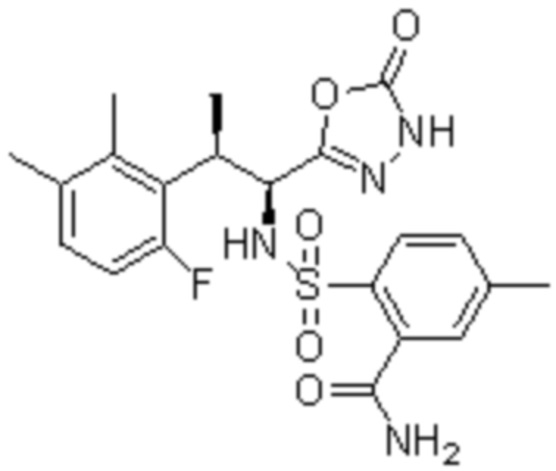










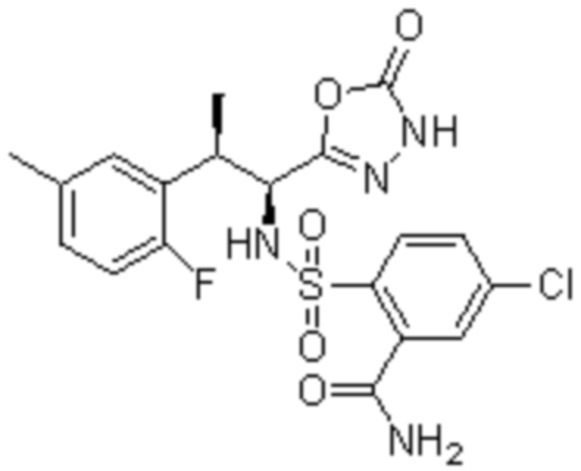


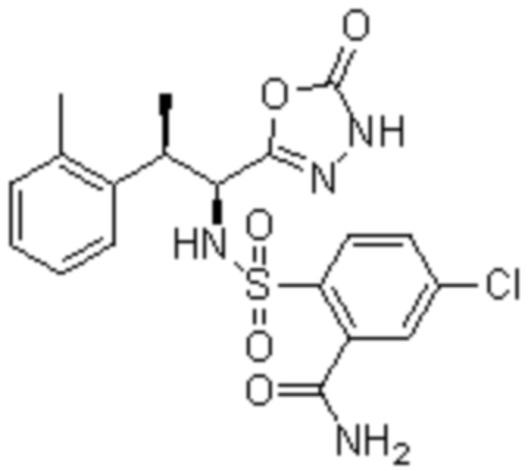

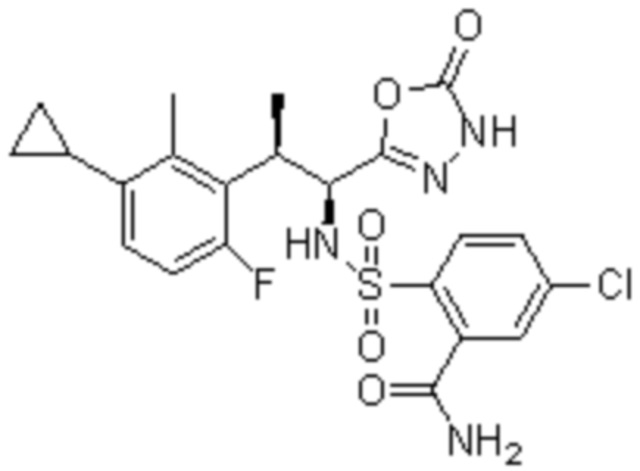

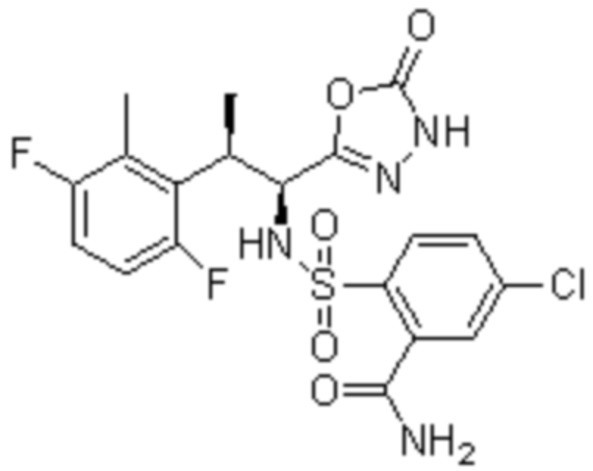

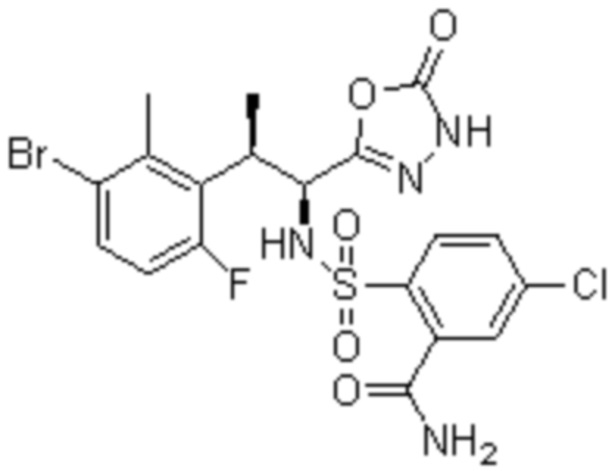




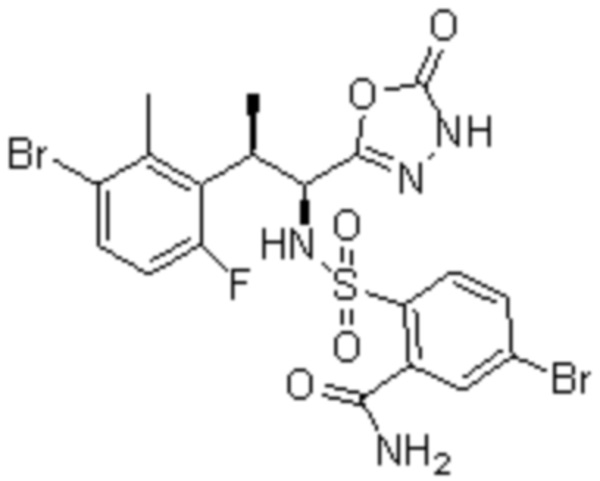













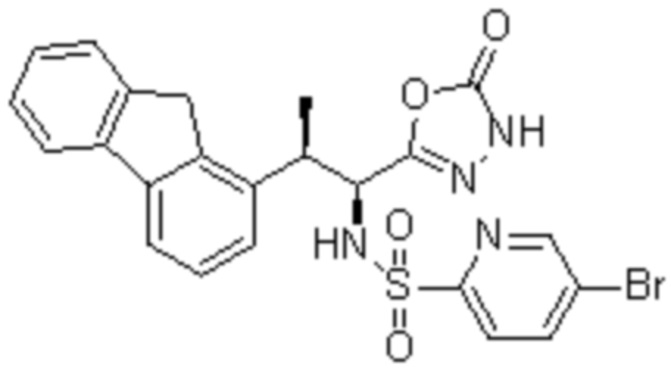







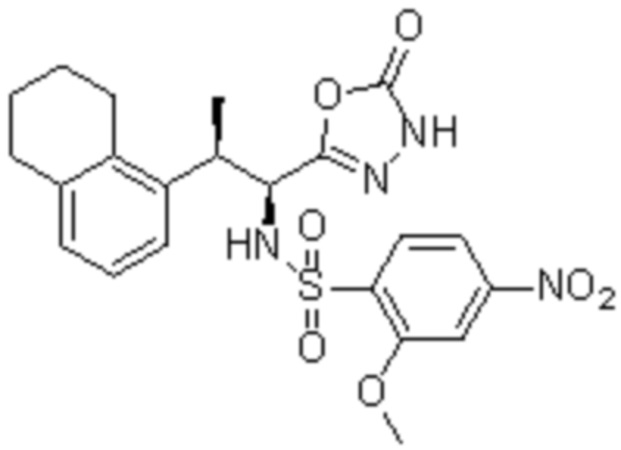

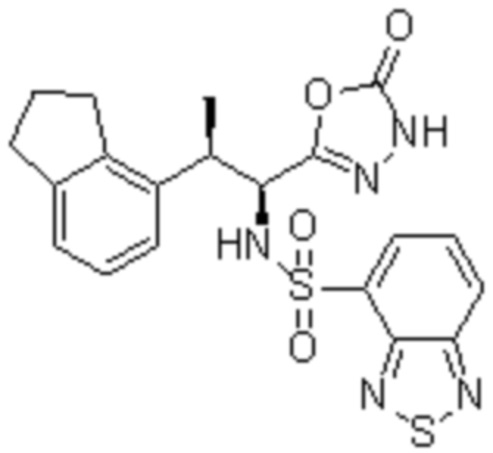




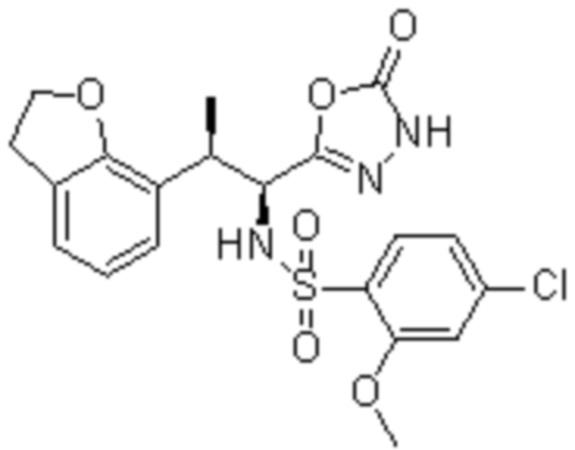



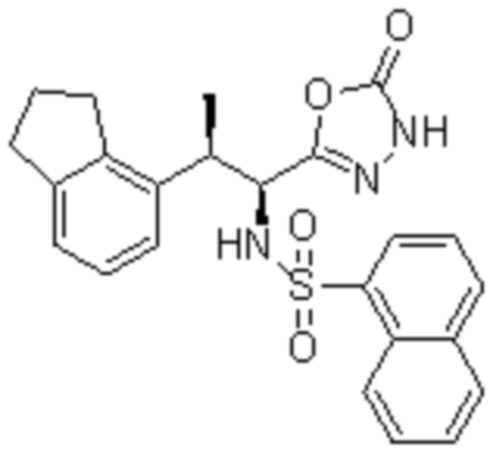






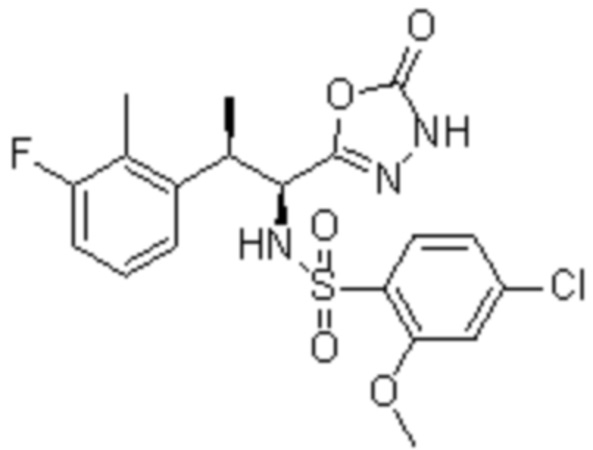







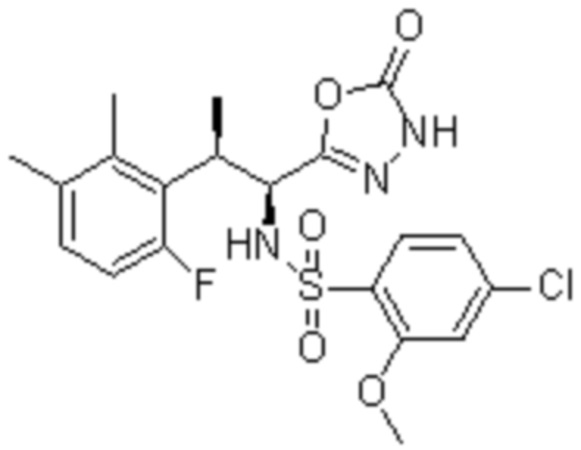















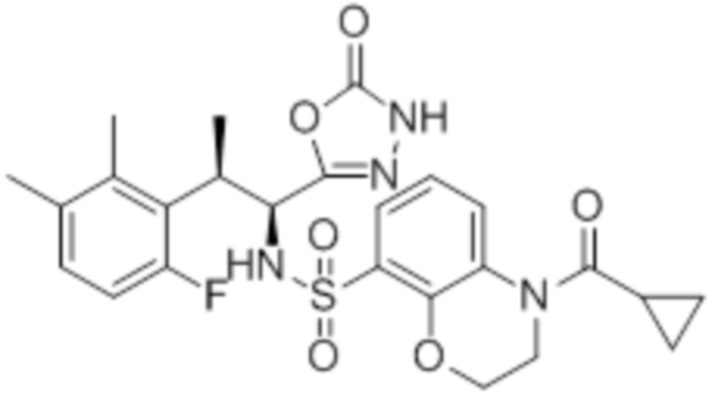






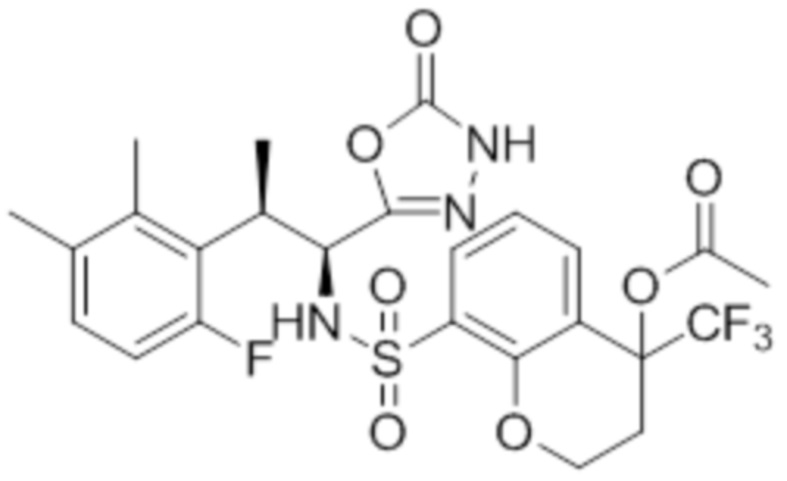


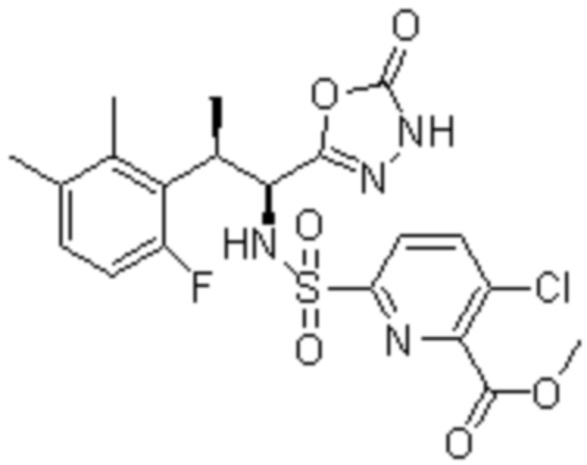




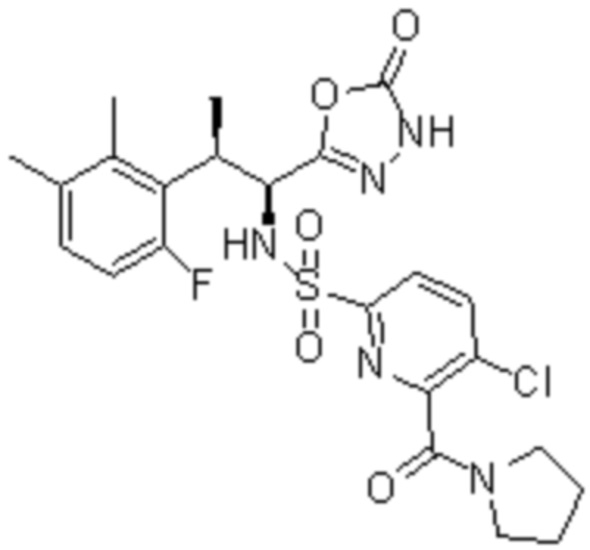


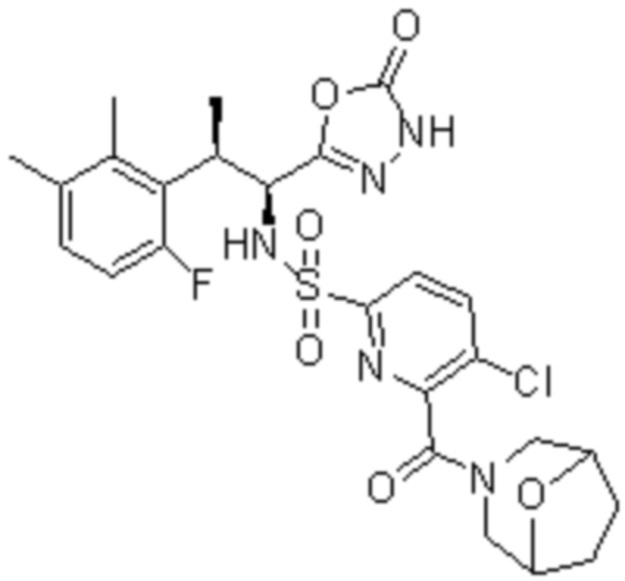























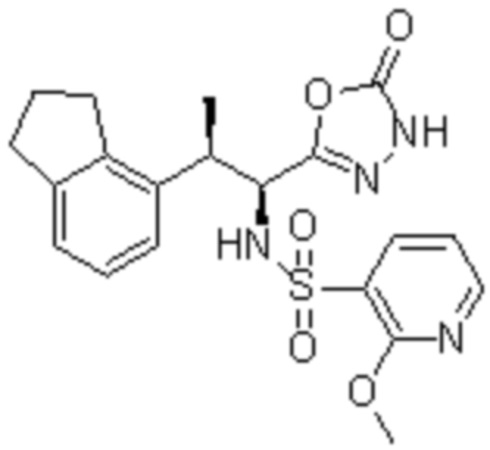








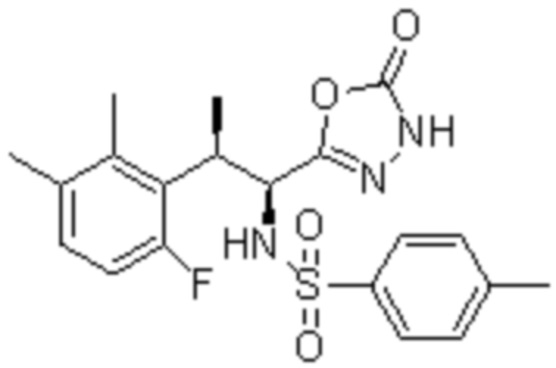

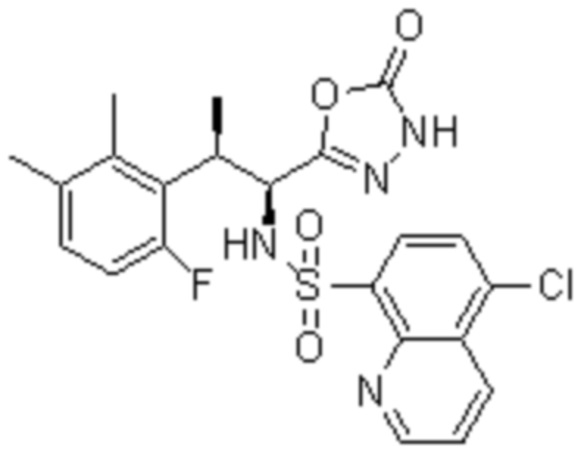












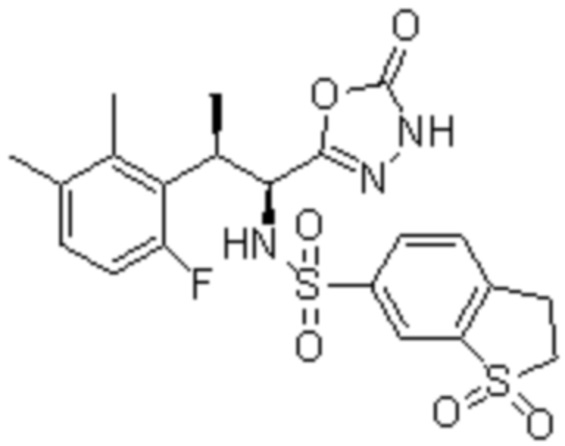












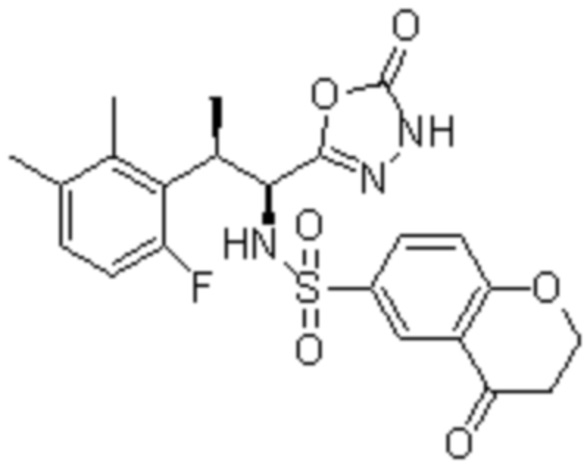








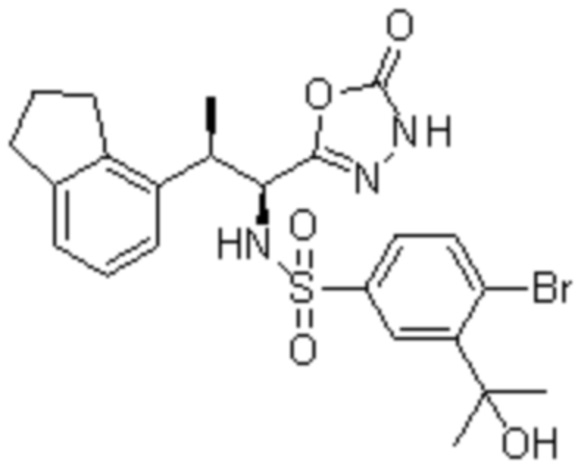

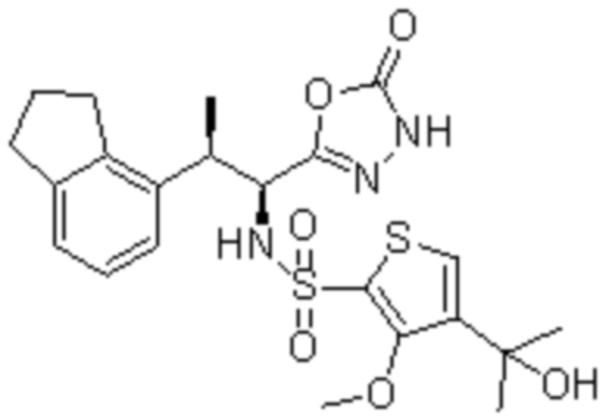








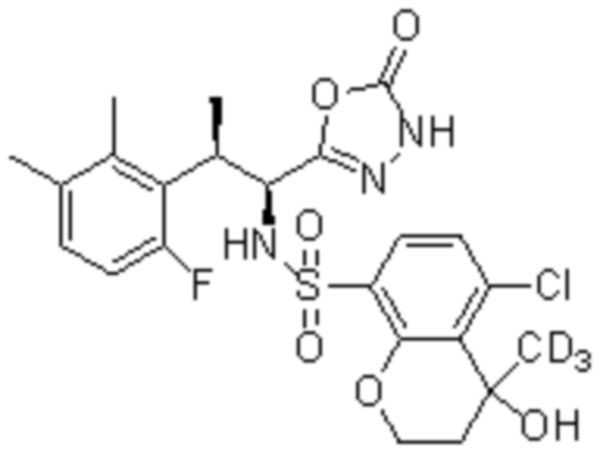











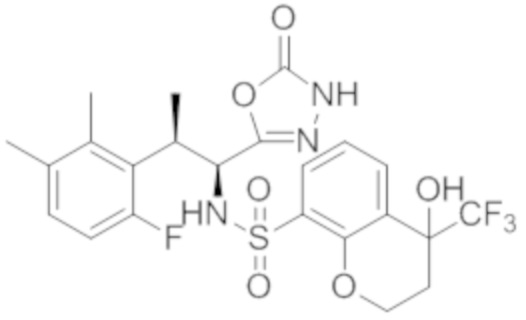


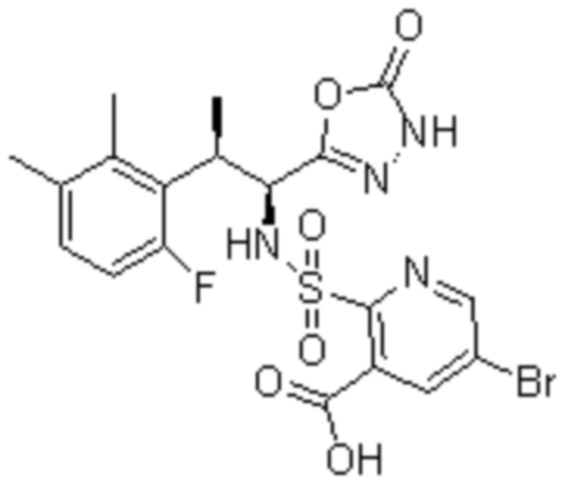




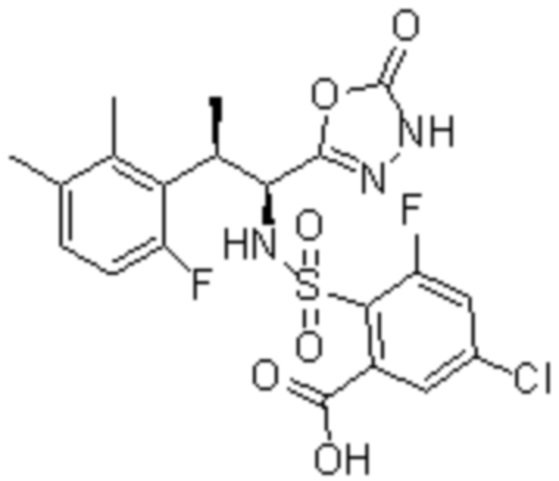














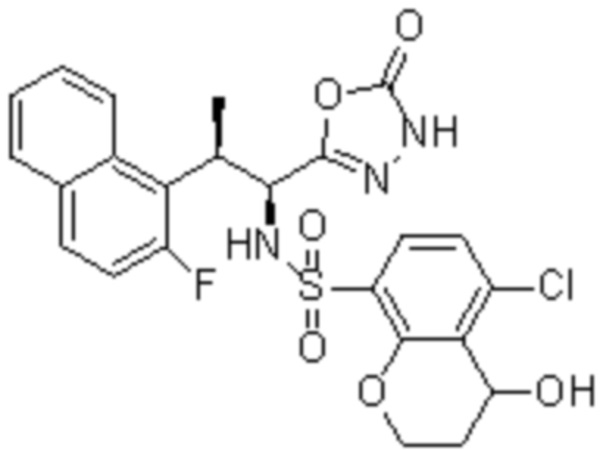
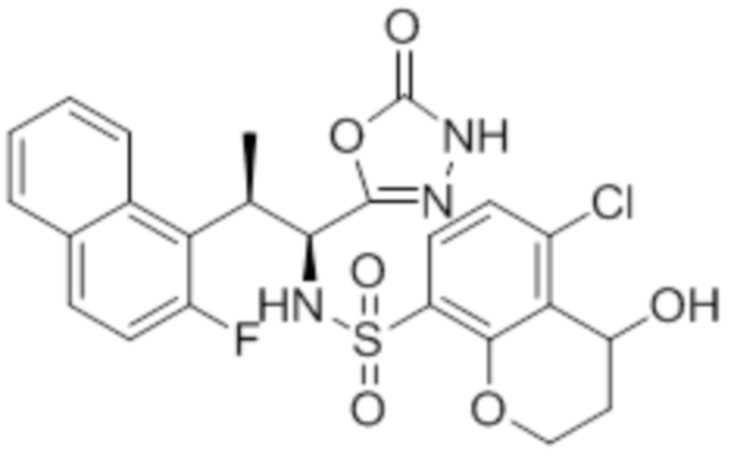
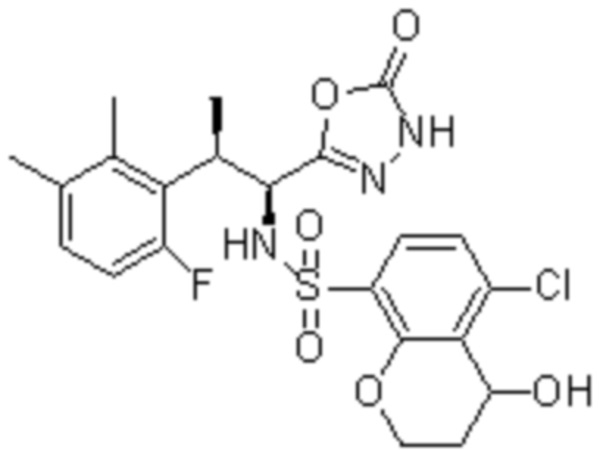
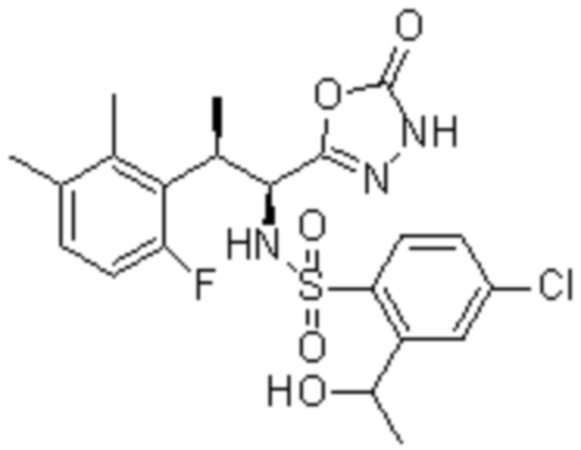



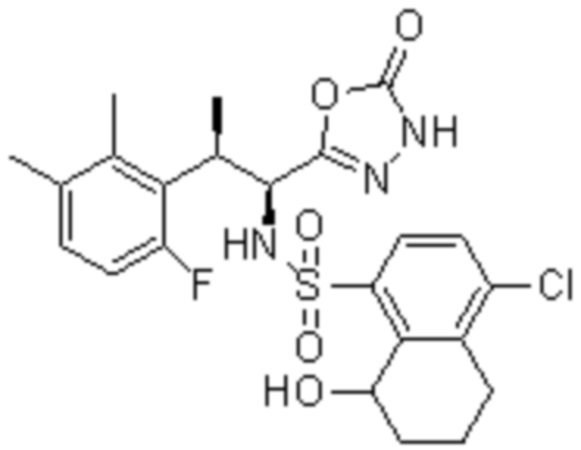








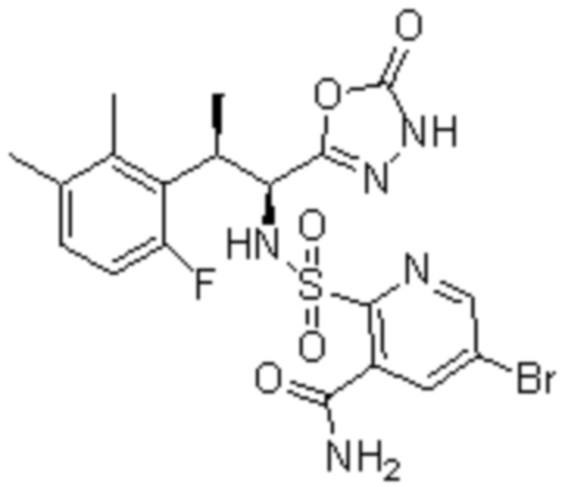
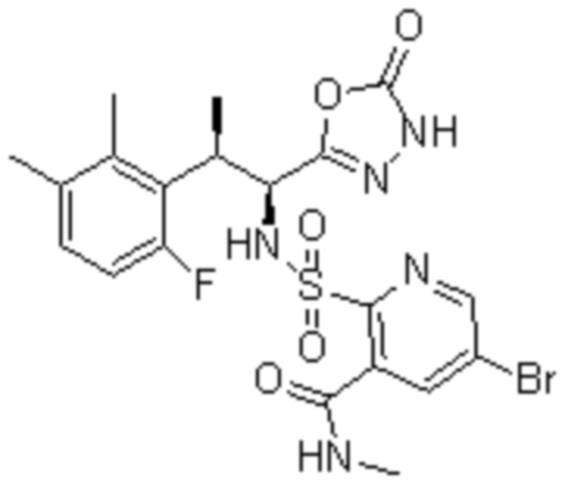


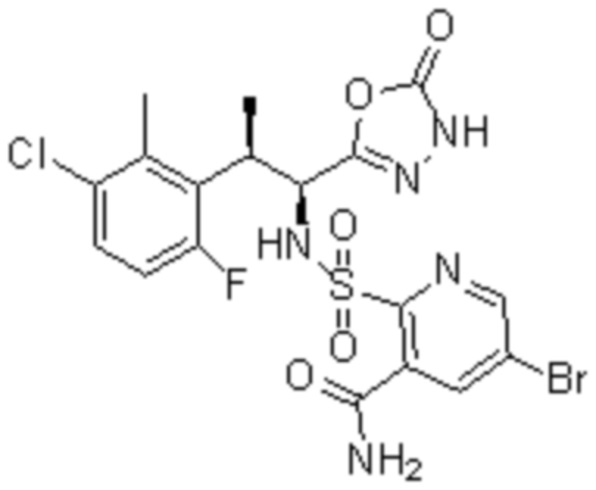










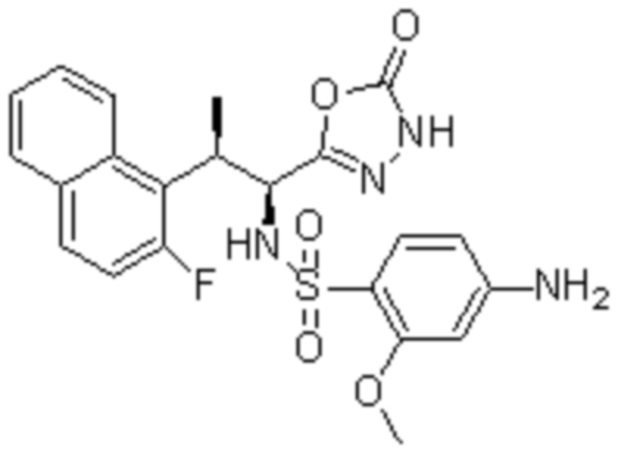








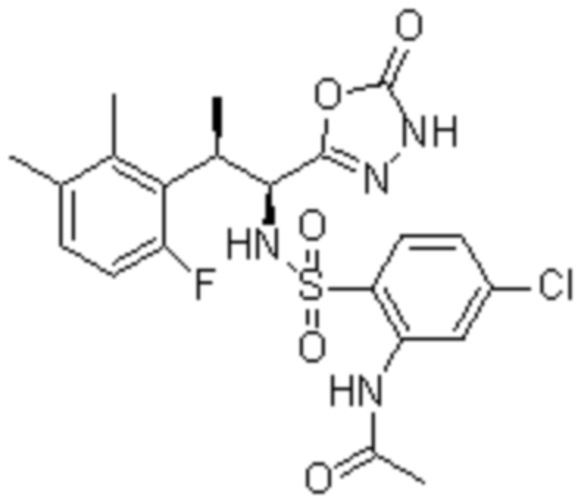



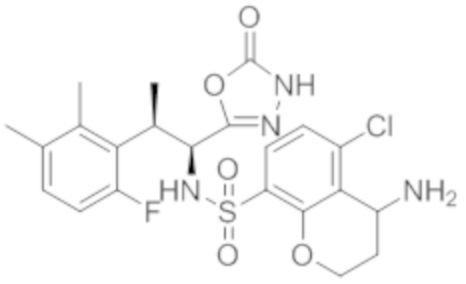

























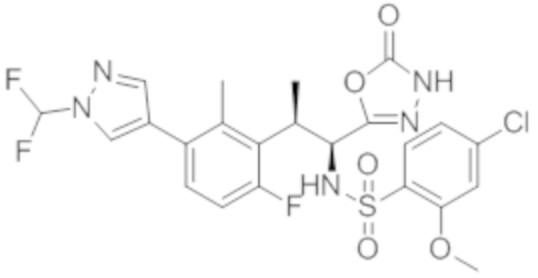





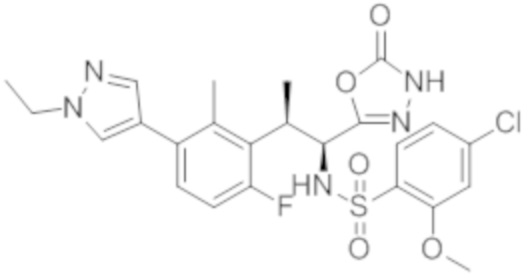
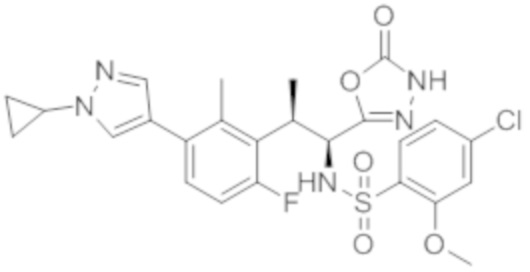




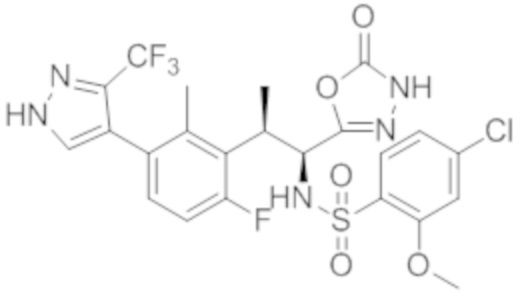



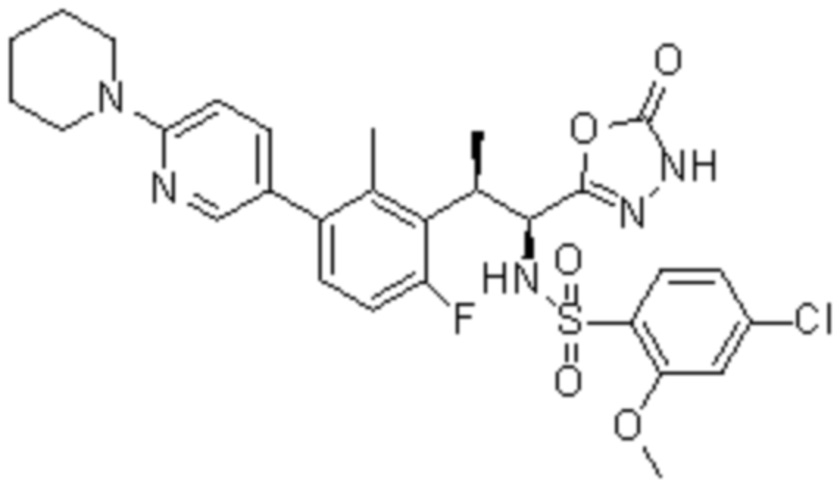






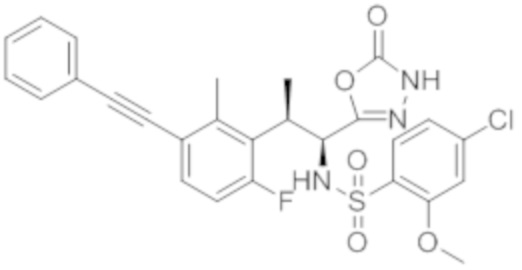





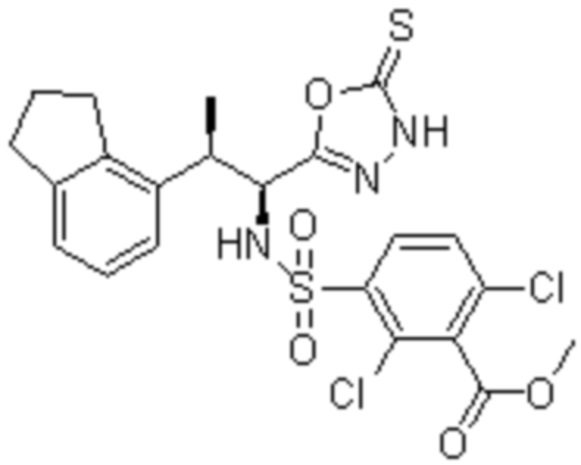














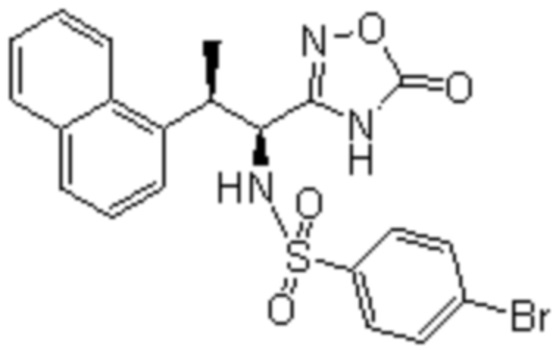
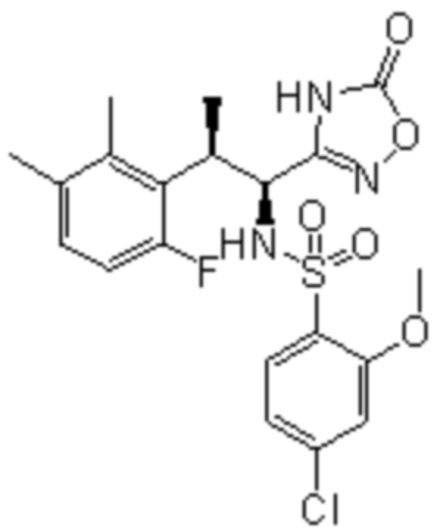


Комментарии