Производное циклогексана и его фармацевтическое применение - RU2478621C2
Код документа: RU2478621C2
Чертежи







Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к производным циклогексана и к их медицинскому применению.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ
Боль является случаем, который сопровождается неприятным ощущением или неприятными эмоциями, которые имеют место, когда ткань повреждается или может быть повреждена. Боль грубо подразделяется на ноцицептивную боль и невропатическую боль в зависимости от ее причины.
Термин “ноцицептивная боль” обозначает боль, вызываемую, когда ткани тела повреждаются или когда на ткани тела воздействует ноцицептивный стимул, который может вызвать такую боль, и ноцицептивная боль вызывается через воздействие ноцицептора. Примеры ноцицептивной боли включают в себя физиологические боли и воспалительные боли.
Термин “невропатическая боль” обозначает патологическую боль вследствие функциональной аномалии периферических нервов или самой центральной нервной системы, и невропатическая боль вызывается непосредственно повреждением нервов или давлением на них без воздействия ноцицептивного стимула на ноцицептор.
Примеры терапевтических лекарственных средств от ноцицептивной боли включают в себя нестероидные противовоспалительные лекарственные средства (NSAID) и наркотические анальгетические средства (например, опиоид), и примеры терапевтических средств от невропатической боли включают антиконвульсивные агенты, антидепрессанты, противотревожные агенты и антиэпилептики, такие как габапентин и прегабалин.
Далее, в последние годы сообщается, что производные пиразола являются эффективными в качестве анальгетического или терапевтического лекарственного средства от невропатической боли (Патентный документ 1) и что производное циклогексана следующей ниже формулы, имеющее сульфонил в ароматическом кольце, связанном с пиразольным кольцом, оказывает анальгетическое действие на невропатическую боль (Патентный документ 2).

ДОКУМЕНТЫ ПРЕДШЕСТВУЮЩЕГО УРОВНЯ ТЕХНИКИ
Патентные документы
[Патентный документ 1] WO 08/105383
[Патентный документ 2] WO 00/066562
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ПРОБЛЕМЫ, РЕШАЕМЫЕ ИЗОБРЕТЕНИЕМ
Однако, что касается производных циклогексана, не было обнаружено соединений, имеющих или не имеющих серных функциональных групп в ароматическом кольце, связанном с пиразольным кольцом, которые оказывают анальгетическое действие, и пока не предполагалась возможность того, что такие соединения оказывают анальгетическое действие.
Далее, известно, что введение нестероидного противовоспалительного лекарственного средства сопровождается побочными эффектами, такими как желудочно-кишечная дисфункция и ренальные расстройства, а введение наркотического анальгетика сопровождается такими побочными эффектами, как констипация (замедленное, затрудненное или систематически недостаточное опорожнение кишечника), сонливость, тошнота и рвота. Далее, указывалось, что введение описанных выше терапевтических лекарственных средств от невропатической боли часто сопровождается побочными эффектами центральной нервной системы, такими как вертиго (головокружение), тошнота и рвота, и поэтому их длительное введение затруднено.
Далее, поскольку механизм, по которому вызывается боль, в огромной степени различен между ноцицептивной болью и невропатической болью, пока еще не разработаны соединения, обладающие сильным анальгетическим действием на обе боли.
Таким образом, настоящее изобретение направлено на создание соединения, оказывающего сильное анальгетическое действие как на ноцицептивную боль, так и на невропатическую боль и проявляющего меньше побочных эффектов, и на его медицинское применение.
СРЕДСТВА РЕШЕНИЯ ПРОБЛЕМ
Настоящие изобретатели провели интенсивные исследования по решению указанных выше проблем и нашли циклогексановые производные, оказывающие сильное анальгетическое действие как на ноцицептивную, так и на невропатическую боль, и указанные циклогексановые производные обладают отличной метаболической стабильностью и безопасностью.
А именно, настоящее изобретение предоставляет производное циклогексана, представленное общей формулой (I):

[в которой
А представляет собой заместитель, представленный общей формулой (IIa) или (IIb):

R1 и R2, каждый независимо, представляет атом водорода, атом хлора, С1-С3 галогеналкил, С1-С4 алкил, С1-С4 алкокси или циано;
R3 представляет атом водорода или атом хлора;
R4 представляет атом фтора, гидроксиметил или гидроксил;
R5 и R6, каждый независимо, представляет атом водорода, атом фтора, С1-С3 галогеналкил, карбоксил, метоксикарбонил, этоксикарбонил, С1-С4 алкокси, гидроксил или С2-С5 алкилкарбонилокси, или R5 и R6 могут вместе образовывать оксо группу;
R7 и R8, каждый независимо, представляет атом водорода или атом фтора;
Y представляет атом кислорода или серы; и
Z представляет атом азота или метин]
или его фармацевтически приемлемую соль или пролекарство.
Предпочтительно, в указанном выше производном циклогексана R1 и R2, каждый независимо, представляет собой атом водорода, атом хлора, С1-С3 галогеналкил, С1-С4 алкил или С1-С4 алкокси; R5 и R6, каждый независимо, представляет атом водорода, атом фтора, С1-С3 галогеналкил, карбоксил, С1-С4 алкокси, гидроксил или С2-С5 алкилкарбонилокси, или R5 и R6 могут вместе образовывать оксо группу; и R7 и R8 представляют атомы водорода.
Более предпочтительно, в указанном выше производном циклогексана R1 и R2, каждый независимо, представляет трифторметил, метил или метокси; R3 представляет атом водорода; R4 представляет гидроксиметил или гидроксил; R5 и R6, каждый независимо, представляет атом водорода, атом фтора, трифторметил, карбоксил, метокси, гидроксил или ацетилокси (или R5 и R6 вместе могут образовывать оксо группу).
Настоящее изобретение предоставляет также фармацевтическую композицию или средство, включающую эффективное количество указанного выше производного циклогексана или его фармацевтически приемлемой соли или пролекарства.
Фармацевтическое средство является предпочтительно анальгетическим, более предпочтительно, терапевтическим лекарственным средством от невропатической и/или ноцицептивной боли. Более предпочтительно, указанное выше фармацевтическое средство оказывает сильное анальгетическое действие также на диабетическую невропатическую боль и может подходящим образом применяться в качестве терапевтического средства от диабетической невропатической боли.
ЭФФЕКТ ИЗОБРЕТЕНИЯ
Поскольку производное циклогексана настоящего изобретения, или его фармацевтически приемлемая соль, или пролекарство оказывает анальгетическое действие на ноцицептивную и невропатическую боль, также как и на диабетическую невропатическую боль, терапевтическое действие в отношении боли может быть оказано пациентам, страдающим от боли, этиология которой не известна. Далее, производное циклогексана настоящего изобретения, или его фармацевтически приемлемая соль, или пролекарство оказывает сильное анальгетическое действие и имеет меньше побочных эффектов, оно может вводиться в качестве фармацевтического средства от широкого ряда болевых симптомов, включая диабетическую невропатическую боль.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
Фиг. 1 представляет собой диаграмму, показывающую действие соединения Примера 2-А на модели мышей с частичным перевязыванием седалищного или ишиалгического нерва (оральное введение).
Фиг. 2 представляет диаграмму, показывающую действие соединения Примера 2-В на модели мышей с частичным перевязыванием седалищного нерва (оральное введение).
Фиг. 3 представляет диаграмму, показывающую действие соединения Примера 62 настоящего изобретения на модели мышей с частичным перевязыванием седалищного нерва (оральное введение).
Фиг. 4 представляет диаграмму, показывающую действие соединения Сравнительного Примера 29 на модели мышей с частичным перевязыванием седалищного нерва (оральное введение).
Фиг. 5 представляет диаграмму, показывающую действие соединения Примера 2-В настоящего изобретения на мышах с болью вследствие диабетической невралгии, вызванной стрептозотоцином (STZ) (оральное введение).
Фиг. 6 представляет диаграмму, показывающую изменение в плазме уровня соединения Примера 2-В настоящего изобретения на мышах, которым вводили соединение Примера 2-В.
Фиг. 7 представляет диаграмму, показывающую изменение в плазме уровня соединения сравнительного Примера 29 на мышах, которым вводили соединение сравнительного Примера 29.
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Следующие термины, используемые в настоящем описании, определяются, как описано ниже, если не указано иное.
Производное циклогексана настоящего изобретения представлено общей формулой (I):

[в которой
А представляет собой заместитель, представленный ниже общей формулой (IIa) или (IIb):

R1 и R2, каждый независимо, представляет атом водорода, атом хлора, С1-С3 галогеналкил, С1-С4 алкил, С1-С4 алкокси или циано;
R3 представляет собой атом водорода или хлора;
R4 представляет атом фтора, гидроксиметил или гидроксил;
R5 и R6, каждый независимо, представляет атом водорода, атом фтора, С1-С3 галогеналкил, карбоксил, метоксикарбонил, этоксикарбонил, С1-С4 алкокси, гидроксил или С2-С5 алкилкарбонилокси, или R5 и R6 могут вместе образовывать оксо группу;
R7 и R8, каждый независимо, представляет атом водорода или атом фтора;
Y представляет атом кислорода или серы; и
Z представляет атом азота или метин].
“С1-С4 алкил” обозначает линейную, разветвленную или циклическую алкильную группу, имеющую 1-4 атома углерода, и примеры ее включают в себя метил, этил, н-пропил, изопропил, циклопропил, циклопропилметил, н-бутил, втор-бутил и трет-бутил.
“С1-С4 алкокси” обозначает линейную, разветвленную или циклическую алкил-окси группу, имеющую 1-4 атома углерода, и примеры ее включают в себя метокси, этокси, н-пропилокси, изопропилокси, циклопропилокси, н-бутокси, втор-бутокси и трет-бутокси.
“С1-С3 галогеналкил” обозначает линейную алкильную группу, имеющую 1-3 атома углерода, в которой атомы водорода в группе частично или полностью замещены атомом (атомами) галогена (атом галогена обозначает атом фтора, хлора, брома или йода), и примеры ее включают монохлорметил, монофторметил, дифторметил, трифторметил, трихлорметил и пентафторэтил.
Примеры “С2-С5 алкилкарбонилокси” включают ацетилокси, этаноилокси, пропаноилокси, изопропаноилокси, бутаноилокси, изобутаноилокси и пивалоилокси.
В общей формуле (I) А предпочтительно представляет собой (IIc).
Y предпочтительно представляет атом серы.
R1 и R2, каждый независимо, представляют собой предпочтительно атом водорода, атом хлора, трифторметил, метил, этил, н-пропил, изопропил, метокси, этокси, н-пропилокси, изопропилокси или циано и, более предпочтительно, трифторметил, метил или метокси.
R3 предпочтительно представляет атом водорода.
R4 представляет предпочтительно гидроксил.
Предпочтительно, R5 и R6, каждый независимо, представляет собой атом водорода, атом фтора, трифторметил, карбоксил, метоксикарбонил, этоксикарбонил, метокси, этокси, н-пропилокси, изопропилокси, гидроксил, ацетилокси, пропаноилокси, бутаноилокси, изобутаноилокси или пивалоилокси, или R5 и R6 вместе образуют оксо группу. Более предпочтительно, R5 и R6, представляют собой атом водорода, атом фтора, трифторметил, карбоксил, метокси, гидроксил или ацетилокси, или R5 и R6 вместе образуют оксо группу.
R7 и R8, каждый независимо, представляет предпочтительно атом водорода или атом фтора и, более предпочтительно, атом водорода.
Конкретные предпочтительные примеры соединений, представленных общей формулой (I), и их фармацевтически приемлемых солей (называемых в описании ниже Соединения (I)) показаны в Таблице 1, но они не ограничивают настоящее изобретение.




В случаях, когда в Соединении (I) существуют асимметрические атомы углерода, в объем настоящего изобретения включены все энантиомеры и их смеси.
Далее, в случаях, когда в Соединении (I) существуют стереоизомеры, в объем настоящего изобретения включены все стереоизомеры и их смеси.
Примеры “фармацевтически приемлемой соли” включают соли неорганических кислот, такие как гидрохлорид, сульфат, фосфат и гидробромид; соли органических кислот, такие как оксалат, малонат, цитрат, фумарат, лактат, малат, сукцинат, тартрат, ацетат, трифторацетат, малеат, глюконат, бензоат, аскорбат, метансульфонат, п-толуолсульфонат и циннамат; соли неорганических оснований, такие как натриевая, калиевая, кальциевая, магниевая и аммониевая соль; соли органических оснований, такие как метиламиновая, диэтиламиновая, триметиламиновая, триэтиламиновая, пиридиниевая, триэтаноламиновая, этилендиаминовая и гуанидиевая соли. Далее, Соединение (I) может образовывать гидрат, сольват или кристаллический полиморф.
Соединение (I) можно синтезировать, например, в соответствии с способом получения, описанным ниже. Символы в каждой реакционной формуле имеют значения, определенные выше, если не указано иное.
В случаях, когда сырьевой материал соединения имеет карбоксильную группу или гидроксильную группу, может быть введена обычно используемая защитная группа, и после реакции, если требуется, защитная группа может быть удалена. Примеры защитной группы для гидроксильной группы включают С1-С4 алкил, фенил, тритил, С1-С4 аралкил (например, бензил), ацил (например, формил, ацетил и бензоил), С7-С10 аралкил-карбонил (например, бензилкарбонил) и замещенный силил (например, триметилсилил, триэтилсилил и трет-бутилдиметилсилил). Примеры защитной группы карбоксильной группы включают С1-С4 алкил.
Способ удаления защитной группы варьирует в зависимости от типа защитной группы, и удаление может осуществляться в соответствии с способом, описанным в документе предшествующего уровня техники (PROTECTIVE GROUPS IN ORGANIC SYNTHESIS (WILEY-INTERSCIENCE)), или соответствующим ему способом.
В способе получения, описываемом ниже, может использоваться в качестве сырьевого соединения соль. Примеры солей включают соли, описанные выше как фармацевтически приемлемые соли.
Соединение (I), получаемое по способу получения, описываемому ниже, может выделяться и очищаться согласно общепринятым способам, и примеры данных способов включают экстракцию растворителем, перекристаллизацию и хроматографию.
В случаях, когда Соединение (I) имеет оптические изомеры, стереоизомеры, региоизомеры и/или ротамеры, каждый из них может быть получен в виде единственных отдельных соединений с помощью общепринятого способа синтеза и способа отделения.
(Способ получения 1: Способ получения Соединения (Ic), Соединения (Id), Соединения (Ie) и Соединения (If))

[где R5a и R6a, каждый независимо, представляет атом водорода, С1-С3 галогеналкил, карбоксил или аналогичные; R7 и R8, каждый независимо, представляет С1-С4 алкил или аналогичные; а другие символы имеют те же значения, что определены выше].
Соединение (Ic) может быть получено алкилированием Соединения (Ia), а Соединение (Id) может быть получено алкилированием Соединения (Ib). Соединение (Ie) может быть получено ацилированием Соединения (Ia), а Соединение (If) может быть получено ацилированием Соединения (Ib).
(Стадия 1 и Стадия 2)
Реакция алкилирования Соединения (Ia) или Соединения (Ib) обычно осуществляется с помощью реакции Соединения (Ia) или Соединения (Ib) с галогенированным алкилом в растворителе в присутствии основания, и растворитель выбирается соответствующим образом так, чтобы он не ингибировал реакцию. Примеры растворителя, который не ингибирует реакцию, включают простые эфиры, такие как тетрагидрофуран, 1,4-диоксан и простой диметиловый эфир этиленгликоля; ацетон; ацетонитрил; и N,N-диметилформамид; и в качестве растворителя могут также использоваться их смеси.
Примеры основания включают кислые карбонаты щелочных металлов, такие как кислый карбонат натрия и кислый карбонат калия; карбонаты щелочных металлов, такие как карбонат калия и карбонат цезия; амины, такие как триэтиламин, диизопропилэтиламин и пиридин; трет-бутоксид калия; и гидрид натрия.
Количество используемого основания составляет предпочтительно 0,5-6 молей, более предпочтительно, 0,8-3 моля по отношению к 1 молю Соединения (Ia) или Соединения (Ib).
Количество используемого галогенированного алкила составляет предпочтительно 0,5-5 молей, более предпочтительно, 0,8-2 моля по отношению к 1 молю Соединения (Ia) или Соединения (Ib).
Температура реакции алкилирования составляет предпочтительно -78-200°С, более предпочтительно, -20-100°С.
Время реакции алкилирования варьирует в зависимости от условий реакции и предпочтительно составляет от 5 минут до 78 часов, более предпочтительно, от 30 минут до 48 часов.
(Стадия 3 и Стадия 4)
Реакция ацилирования Соединения (Ia) или Соединения (Ib) обычно осуществляется с помощью реакции Соединения (Ia) или Соединения (Ib) с ацилирующим агентом, таким как галогенангидрид кислоты или ангидрид кислоты в растворителе в присутствии основания, и растворитель выбирается соответственно так, чтобы он не ингибировал реакцию. Примеры растворителя, который не ингибирует реакцию, включают галогенированные углеводороды, такие как дихлорметан, хлороформ, тетрахлорид углерода и 1,2-дихлорэтан; и простые эфиры, такие как тетрагидрофуран, 1,2-диметоксиэтан и 1,4-диоксан; и в качестве растворителя могут также использоваться их смеси.
Примеры основания включают пиридин, триэтиламин, диизопропилэтиламин и N,N-диметиламинопиридин.
Количество используемого галогенангидрида кислоты или ангидрида кислоты составляет предпочтительно 0,5-3 моля, более предпочтительно, 0,8-1,5 моля по отношению к 1 молю Соединения (Ia) или Соединения (Ib).
Количество используемого основания составляет предпочтительно 0,1-6 молей, более предпочтительно, 0,8-3 моля по отношению к 1 молю Соединения (Ia) или Соединения (Ib).
Температура реакции ацилирования составляет предпочтительно -20-150°С, более предпочтительно, 0-100°С.
Время реакции ацилирования варьирует в зависимости от условий реакции и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно, от 30 минут до 48 часов.
(Способ получения 2: Способ получения Соединения (Ih))

[где R5b и R6b, каждый независимо, представляют атом водорода, атом фтора, С1-С3 галогеналкил, С1-С4 алкокси, С2-С5 алкилкарбонилокси или аналогичные; а другие символы имеют те же значения, что определены выше].
Соединение (Ih) может быть получено фторированием Соединения (Ig).
(Стадия 5)
Фторирование Соединения (Ig) обычно осуществляется с помощью реакции Соединения (Ig) с фторирующим агентом в растворителе, и растворитель выбирается соответствующим образом так, чтобы он не ингибировал реакцию. Примеры растворителя, который не ингибирует реакцию, включают углеводороды, такие как октан, гексан, бензол и толуол; галогенированные углеводороды, такие как дихлорметан, хлороформ, тетрахлорид углерода и 1,2-дихлорэтан; простые эфиры, такие как тетрагидрофуран, 1,2-диметоксиэтан и 1,4-диоксан; и алкилнитрилы, такие как ацетонитрил; и в качестве растворителя могут также использоваться их смеси.
Примеры фторирующего агента включают трифториды алкиламиносеры, такие как трифторид (диметиламино)серы (DAST) и трифторид бис(2-метоксиэтил)аминосеры со свойствами кислоты.
Количество используемого фторирующего агента составляет предпочтительно от 0,25 до 20 молей, более предпочтительно, от 0,5 до 4 молей по отношению к 1 молю Соединения (Ig).
Температура реакции фторирования составляет предпочтительно -20-150°С, более предпочтительно, 0-100°С.
Время реакции фторирования варьирует в зависимости от условий реакции и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно, от 30 минут до 48 часов.
(Способ получения 3: Способ получения Соединения (Ij))

[где символы имеют те же значения, что определены выше].
Соединение (Ij) может быть получено фторированием Соединения (Ii).
(Стадия 6)
Реакция фторирования Соединения (Ii) обычно осуществляется с помощью реакции Соединения (Ii) с фторирующим агентом в растворителе, и растворитель выбирается соответствующим образом так, чтобы он не ингибировал реакцию. Примеры растворителя, который не ингибирует реакцию, включают углеводороды, такие как октан, гексан, бензол и толуол; галогенированные углеводороды, такие как дихлорметан, хлороформ, тетрахлорид углерода и 1,2-дихлорэтан; простые эфиры, такие как тетрагидрофуран, 1,2-диметоксиэтан и 1,4-диоксан; и алкилнитрилы, такие как ацетонитрил; и в качестве растворителя могут также использоваться их смеси.
Примеры фторирующего агента включают трифториды алкиламиносеры, такие как трифторид (диметиламино)серы (DAST) и трифторид бис(2-метоксиэтил)аминосеры со свойствами кислоты.
Количество используемого фторирующего агента составляет предпочтительно от 0,25 до 20 молей, более предпочтительно, от 0,5 до 4 молей по отношению к 1 молю Соединения (Ii).
Температура реакции фторирования составляет предпочтительно -20-150°С, более предпочтительно, 0-100°С.
Время реакции фторирования варьирует в зависимости от условий реакции и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно, от 30 минут до 48 часов.
(Способ получения 4: Способ получения Соединения (Ik) и Соединения (Il))
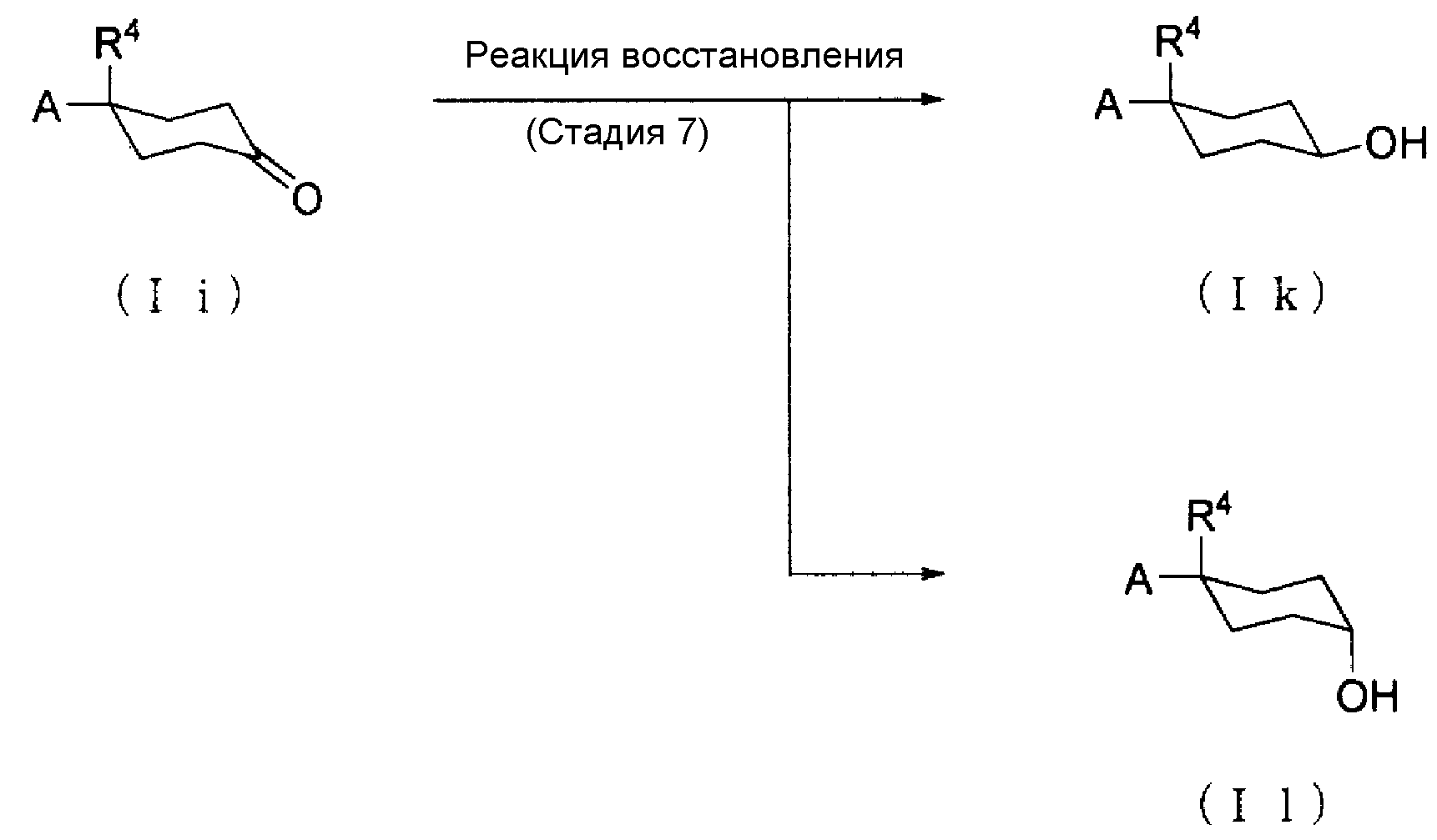
[где символы имеют те же значения, что определены выше].
Соединение (Ik) и Соединение (Il) могут быть получены восстановлением Соединения (Ii).
(Стадия 7)
Реакция восстановления Соединения (Ii) обычно осуществляется с помощью реакции Соединения (Ii) с восстанавливающим агентом в растворителе, и растворитель выбирается соответствующим образом так, чтобы он не ингибировал реакцию. Примеры растворителя, который не ингибирует реакцию, включают углеводороды, такие как октан, гексан, бензол и толуол; простые эфиры, такие как тетрагидрофуран, 1,4-диоксан, простой диметиловый эфир этиленгликоля и диэтиловый эфир; и спирты, такие как метанол, этанол и изопропиловый спирт; и в качестве растворителя могут также использоваться их смеси.
Примеры восстанавливающего агента включают боргидрид натрия, боргидрид лития, диизобутилалюминийгидрид, литийалюминийгидрид, литийтриэтилгидрид, натрий-бис(2-метоксиэтокси)алюминийгидрид и борановые комплексы.
Количество используемого восстанавливающего агента составляет предпочтительно от 0,25 до 100 молей, более предпочтительно, от 0,5 до 20 молей по отношению к 1 молю Соединения (Ii).
Температура реакции восстановления составляет предпочтительно -78-150°С, более предпочтительно, -78-100°С.
Время реакции восстановления варьирует в зависимости от условий реакции, таких как температура реакции и количество восстанавливающего агента, и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно, от 30 минут до 24 часов.
(Способ получения 5: Способ получения Соединения (Im) и Соединения (In))

[где символы имеют те же значения, что определены выше].
Соединение (Im) и Соединение (In) могут быть получены трифторметилированием Соединения (Ii).
(Стадия 8)
Примеры трифторметилирующего реагента включают органосиликоновые соединения, такие как (трифторметил)триметилсилан. Реакция трифторметилирования с использованием органосиликонового соединения может осуществляться по способу, описанному в документе предшествующего уровня техники (Journal of the American Chemical Society, 1989, Vol. 39, стр. 393-395), или по соответствующему ему способу.
(Способ получения 6: Способ получения Соединения (Io))

[где символы имеют те же значения, что определены выше].
Соединение (SI) получают с помощью воздействия реагента Виттига (LI) на Соединение (Ii), с последующим гидролизом получающегося в результате соединения. Применяемый реагент Виттига (LI) может быть промышленно доступным, но реагент можно также синтезировать в соответствии с способом, очевидным специалистам в данной области. Соединение (Io) получают окислением Соединения (SI).
(Стадия 9)
Реакция Виттига Соединения (Ii) обычно осуществляется с помощью реакции Соединения (Ii) с реагентом Виттига в растворителе в присутствии основания, и растворитель выбирается соответствующим образом так, чтобы он не ингибировал реакцию. Примеры растворителя, который не ингибирует реакцию, включают углеводороды, такие как октан, гексан, бензол и толуол; и простые эфиры, такие как тетрагидрофуран, 1,4-диоксан, простой диметиловый эфир этиленгликоля и диэтиловый эфир; и в качестве растворителя могут также использоваться их смеси.
Примеры основания включают диизопропиламид лития, трет-бутоксид калия, гидрид натрия, фениллитий и трет-бутиллитий.
Количество используемого основания составляет предпочтительно 0,5-3 моля, более предпочтительно, 0,8-2 моля по отношению к 1 молю Соединения (Ii).
Количество используемого Соединения (LI) составляет предпочтительно 0,5-3 моля, более предпочтительно, 0,8-2 моля по отношению к 1 молю Соединения (Ii).
Температура реакции Виттига составляет предпочтительно -78 - 100°С, более предпочтительно, -78-50°С.
Время реакции Виттига варьирует в зависимости от условий реакции и предпочтительно составляет от 5 минут до 48 часов, более предпочтительно, от 30 минут до 24 часов.
Реакция гидролиза для получения Соединения (SI) осуществляется в выбираемом соответствующим образом растворителе, который не ингибирует реакцию. Примеры растворителя, который не ингибирует реакцию, включают в себя простые эфиры, такие как тетрагидрофуран, 1,4-диоксан и простой диметиловый эфир этиленгликоля; спирты, такие как метанол, этанол и трет-бутанол; ацетонитрил; и воду; и в качестве растворителя могут также использоваться их смеси.
Концентрация кислоты, используемой в реакции гидролиза, составляет предпочтительно 0,1-12 М, а количество используемой кислоты составляет предпочтительно 1 моль - избыточное количество по отношению к 1 молю Соединения (Ii).
Примеры используемой в реакции гидролиза кислоты включают неорганические кислоты, такие как соляная кислота и серная кислота; и органические кислоты, такие как уксусная кислота.
Температура реакции гидролиза составляет предпочтительно -20-200°С, более предпочтительно, 0-100°С.
Время реакции гидролиза варьирует в зависимости от условий реакции и предпочтительно составляет от 5 минут до 48 часов, более предпочтительно, от 30 минут до 24 часов.
(Стадия 10)
Примеры окисляющего агента, используемого в реакции окисления соединения (SI), включают оксид хрома (VI)-уксусную кислоту, реагент Джонса и хлорид натрия. Реакция окисления осуществляется в соответствии со способом, очевидным специалистам в данной области.
(Способ получения 7: Способ получения Соединения (Ii))

[где R9 и R10, каждый независимо, представляют метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил или аналогичные, или R9 и R10вместе образуют этиленовую группу (-СН2-СН2-) или пропиленовую группу (-СН2СН2СН2-); и другие символы имеют значения, определенные выше.]
Соединение (Ii) получают посредством удаления защитной группы Соединения (Ip).
(Стадия 11)
Реакция удаления защитной группы Соединения (Ip) может осуществляться в соответствии со способом, описанным в документе предшествующего уровня техники (PROTECTIVE GROUPS IN ORGANIC SYNTHESIS (WILEY-INTERSCIENCE)), или соответствующим ему способом.
(Способ получения 8: Способ получения соединения (IIIb))

[где символы имеют те же значения, что определены выше].
Соединение (IIIb) может быть получено хлорированием Соединения (IIIa).
(Стадия 12)
Реакция хлорирования Соединения (IIIa) обычно осуществляется с помощью реакции Соединения (IIIa) с хлорирующим агентом в растворителе, и растворитель выбирается соответствующим образом так, чтобы он не ингибировал реакцию. Примеры растворителя, который не ингибирует реакцию, включают галогенированные углеводороды, такие как дихлорметан, хлороформ, тетрахлорид углерода и 1,2-дихлорэтан; ацетонитрил; и этилацетат; и в качестве растворителя могут также использоваться их смеси.
Примеры хлорирующего агента включают N-хлорсукцинимид (NCS).
Количество используемого хлорирующего агента составляет предпочтительно 0,5-2 моля, более предпочтительно, 0,8-1,2 моля по отношению к 1 молю Соединения (IIIa).
Температура реакции хлорирования составляет предпочтительно 0-200°С, более предпочтительно, 0-120°С.
Время реакции хлорирования варьирует в зависимости от условий реакции, таких как температура реакции, и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно, от 30 минут до 48 часов.
(Способ получения 9: Способ получения Соединения (IIIa))

[где символы имеют те же значения, что определены выше].
Соединение (IIIa) может быть получено циклизацией Соединения (LII) и Соединения (SII). Соединение (LII) может быть промышленно доступным, но его можно также синтезировать в соответствии со способом, очевидным специалистам в данной области.
(Стадия 13)
Реакция циклизации Соединения (LII) и Соединения (SII) обычно осуществляется в растворителе, выбираемом соответствующим образом так, чтобы он не ингибировал реакцию. Примеры растворителя, который не ингибирует реакцию, включают спирты, такие как метанол, этанол и изопропиловый спирт; галогенированные углеводороды, такие как дихлорметан, хлороформ, тетрахлорид углерода и 1,2-дихлорэтан; простые эфиры, такие как тетрагидрофуран, 1,2-диметоксиэтан и 1,4-диоксан; бензол; толуол; уксусную кислоту; и воду; и в качестве растворителя могут также использоваться их смеси.
Количество используемого Соединения (LII) составляет предпочтительно 0,5-1,5 моля, более предпочтительно, 0,8-1,2 моля по отношению к 1 молю Соединения (SII).
В реакции циклизации может использоваться катализатор, и примеры катализатора включают органические основания, такие как триэтиламин и пиридин; неорганические кислоты, такие как соляная кислота и серная кислота; и органические кислоты, такие как уксусная кислота.
Количество используемого катализатора составляет предпочтительно 0,1-3 моля по отношению к 1 молю Соединения (SII).
Температура реакции циклизации составляет предпочтительно 0-200°С, более предпочтительно, 0-120°С.
Время реакции циклизации варьирует в зависимости от условий реакции, таких как температура реакции, и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно, от 30 минут до 48 часов.
(Способ получения 10: Способ получения Соединения (IV))

[где символы имеют те же значения, что определены выше].
Соединение (IV) может быть получено с помощью депротонирования и окисления Соединения (SIII). Реакция окисления может осуществляться в соответствии со способом, описанным в документе известного уровня техники (Tetrahedron, 1989, vol. 45, стр. 5703-5742), или соответствующим ему способом.
(Стадия 14)
Реакция депротонирования и реакция окисления обычно осуществляются с помощью реакции Соединения (SIII) с основанием и окисляющим агентом в безводном растворителе, и растворитель выбирается соответствующим образом так, чтобы он не ингибировал реакцию. Примеры растворителя, который не ингибирует реакцию, включают углеводороды, такие как октан, гексан, и гептан; и простые эфиры, такие как тетрагидрофуран, 1,4-диоксан, простой диметиловый эфир этиленгликоля и диэтиловый эфир; и в качестве растворителя могут также использоваться их смеси.
Примеры основания включают бутиллитий, такой как н-бутиллитий, втор-бутиллитий и трет-бутиллитий.
Количество используемого основания составляет предпочтительно 0,8-5 молей, более предпочтительно, 0,9-3 моля по отношению к 1 молю Соединения (SIII).
Количество используемого Соединения (LIII) составляет предпочтительно 0,8-5 молей, более предпочтительно, 0,9-3 моля по отношению к 1 молю Соединения (SIII).
Примеры окисляющего агента, используемого в реакции гидролиза, включают 3-фенил-2-(фенилсульфонил)-1,2-оксазиридин.
Температура реакции депротонирования и реакции окисления составляет предпочтительно -78-150°С, более предпочтительно, 0-50°С.
Время реакции депротонирования и реакции окисления варьирует в зависимости от условий реакции и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно, от 30 минут до 48 часов.
(Способ получения 11: Способ получения Соединения (VI))

[где символы имеют те же значения, что определены выше].
Соединение (VI) может быть получено с помощью реакции Соединения (LIV) с Соединением (LV) с последующим сольволизом получающегося в результате Соединения (V). Соединение (LIV) и Соединение (LV) могут быть промышленно доступными, но их можно также синтезировать в соответствии с способом, очевидным специалистам в данной области.
(Стадия 15)
Реакция Соединения (LIV) с Соединением (LV) обычно осуществляется в безводном растворителе в присутствии основания, и растворитель выбирается соответствующим образом так, чтобы он не ингибировал реакцию. Примеры растворителя, который не ингибирует реакцию, включают углеводороды, такие как октан, гексан, бензол и толуол; и простые эфиры, такие как тетрагидрофуран, 1,4-диоксан, простой диметиловый эфир этиленгликоля и диэтиловый эфир; и в качестве растворителя могут также использоваться их смеси.
Примеры основания включают алкиллитиевые соединения, такие как метиллитий и н-бутиллитий; и соли диалкиламинов, такие как диизопропиламид лития, бис(триметилсилил)амид лития и бис(триметилсилил)амид калия.
Количество используемого основания составляет предпочтительно 0,8-5 молей, более предпочтительно, 0,9-3 моля по отношению к 1 молю Соединения (LIV).
Количество используемого соединения (LV) составляет предпочтительно 0,8-5 молей, более предпочтительно, 0,9-3 моля по отношению к 1 молю Соединения (LIV).
Температура реакции между Соединением (LIV) и Соединением (LV) составляет предпочтительно -78-150°С, более предпочтительно, -78-100°С.
Время реакции между Соединением (LIV) и Соединением (LV) варьирует в зависимости от условий реакции и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно, от 30 минут до 48 часов.
(Стадия 16)
Реакция сольволиза обычно осуществляется в растворителе в присутствии основания, и растворитель выбирается соответствующим образом так, чтобы он не ингибировал реакцию. Примеры растворителя, который не ингибирует реакцию, включают спирты, такие как метанол и этанол; и воду; и в качестве растворителя могут также использоваться их смеси.
Примеры основания включают карбонат калия, карбонат натрия, гидроксид калия и гидроксид натрия.
Количество используемого основания составляет предпочтительно 0,5-10 молей, более предпочтительно, 0,8-3 моля по отношению к 1 молю Соединения (V).
Температура реакции сольволиза составляет предпочтительно -20-150°С, более предпочтительно, 0-100°С.
Время реакции сольволиза варьирует в зависимости от условий реакции и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно, от 30 минут до 48 часов.
(Способ получения 12: Способ получения промежуточного Соединения (SIIa))

[где R11 представляет атом хлора; имидазолильную группу; N-метокси-N-метиламино группу; или алкокси группу, такую как метокси или этокси группа; а другие символы имеют те же значения, что определены выше].
Соединение (SIIa) может быть получено с помощью реакции Соединения (VI) с Соединением (LVI), с последующим окислением получающегося в результате Соединения (VII). Соединение (SIIa) может быть также получено по реакции Соединения (VI) с Соединением (LVII). Соединение (LVI) и Соединение (LVII) могут быть промышленно доступными, но они могут быть также синтезированы в соответствии со способами, очевидными специалистам в данной области.
(Стадия 17 или Стадия 18)
Реакция Соединения (VI) с Соединением (LVI) или Соединением (LVII) обычно осуществляется в безводном растворителе в присутствии основания, и растворитель выбирается соответствующим образом так, чтобы он не ингибировал реакцию. Примеры растворителя, который не ингибирует реакцию, включают углеводороды, такие как октан, гексан, бензол и толуол; и простые эфиры, такие как тетрагидрофуран, 1,4-диоксан, простой диметиловый эфир этиленгликоля и диэтиловый эфир; и в качестве растворителя могут также использоваться их смеси.
Примеры основания включают алкиллитиевые соединения, такие как метиллитий и н-бутиллитий; и соли диалкиламинов, такие как диизопропиламид лития, бис(триметилсилил)амид лития и бис(триметилсилил)амид калия.
Количество используемого основания составляет предпочтительно 0,8-5 молей, более предпочтительно, 0,9-3 моля по отношению к 1 молю Соединения (VI).
Количество используемого Соединения (LVI) или Соединения (LVII) составляет предпочтительно 0,8-5 молей, более предпочтительно, 0,9-3 моля по отношению к 1 молю Соединения (VI).
Температура реакции Соединения (VI) с Соединением (LVI) или с Соединением (LVII) составляет предпочтительно -78-150°С, более предпочтительно, 0-50°С.
Время реакции Соединения (VI) с Соединением (LVI) или с Соединением (LVII) варьирует в зависимости от условий реакции и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно, от 30 минут до 48 часов.
(Стадия 19)
Реакция окисления Соединения (VII) обычно осуществляется с помощью реакции Соединения (VII) с окисляющим агентом в растворителе, и растворитель выбирается соответствующим образом так, чтобы он не ингибировал реакцию. Примеры растворителя, который не ингибирует реакцию, включают углеводороды, такие как октан, гексан, бензол и толуол; галогенированные углеводороды, такие как дихлорметан, хлороформ, тетрахлорид углерода и 1,2-дихлорэтан; простые эфиры, такие как тетрагидрофуран, 1,2-диметоксиэтан и 1,4-диоксан; алкилнитрилы, такие как ацетонитрил; трифторуксусная кислота; пиридин; и ацетон; и в качестве растворителя могут также использоваться их смеси.
Примеры окисляющего агента включают промышленно доступные реагенты, такие как диоксид марганца; триоксид серы-пиридин; активированный диметилсульфоксид; и реагент Десс-Мартина.
Количество используемого окисляющего агента составляет предпочтительно 0,5-3 молей, более предпочтительно, 0,8-2 моля по отношению к 1 молю Соединения (VII).
Температура реакции окисления варьирует в зависимости от типа окисляющего агента и составляет предпочтительно -78-100°С, более предпочтительно, -78-40°С.
Время реакции окисления варьирует в зависимости от условий реакции, таких как тип окисляющего агента и температура реакции, и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно, от 1 до 24 часов.
(Способ получения 13: Способ получения промежуточного Соединения (IX))

[где Х1 представляет собой атом галогена; PG представляет защитную группу, такую как метил или бензил; R12 представляет алкокси группу, такую как метокси или этокси группа; а другие символы имеют те же значения, что определены выше].
Соединение (IX) может быть получено с помощью реакции Соединения (VIII) с Соединением (LVIII). Соединение (VIII) и Соединение (LVIII) могут быть промышленно доступными, но они могут быть также синтезированы в соответствии с способами, очевидными специалистам в данной области.
(Стадия 20)
Реакция Соединения (VIII) с Соединением (LVIII) обычно осуществляется в безводном растворителе в присутствии основания, и растворитель выбирается соответствующим образом так, чтобы он не ингибировал реакцию. Примеры растворителя, который не ингибирует реакцию, включают углеводороды, такие как октан, гексан, бензол и толуол; и простые эфиры, такие как тетрагидрофуран, 1,4-диоксан, простой диметиловый эфир этиленгликоля и диэтиловый эфир; и в качестве растворителя могут также использоваться их смеси.
Примеры основания включают диизопропиламид лития, бис(триметилсилил)амид лития и бис(триметилсилил)амид калия.
Количество используемого основания составляет предпочтительно 0,8-4 моля, более предпочтительно, 0,9-3,5 моля по отношению к 1 молю Соединения (VIII).
Количество используемого Соединения (LVIII) составляет предпочтительно 0,8-5 молей, более предпочтительно, 0,9-3 моля по отношению к 1 молю Соединения (VIII).
Температура реакции Соединения (VIII) с Соединением (LVIII) составляет предпочтительно -78-150°С, более предпочтительно, 0-50°С.
Время реакции Соединения (VIII) с Соединением (LVIII) варьирует в зависимости от условий реакции и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно, от 30 минут до 48 часов.
(Способ получения 14: Способ получения промежуточного Соединения (XI))

[где символы имеют те же значения, что определены выше].
Соединение (XI) может быть получено с помощью восстановления Соединения (IX) с последующим окислением получающегося в результате Соединения (Х).
(Стадия 21)
Реакция восстановления Соединения (IX) обычно осуществляется с помощью реакции Соединения (IX) с восстанавливающим агентом в растворителе, и растворитель выбирается соответствующим образом так, чтобы он не ингибировал реакцию. Примеры растворителя, который не ингибирует реакцию, включают углеводороды, такие как октан, гексан, бензол и толуол; простые эфиры, такие как тетрагидрофуран, 1,4-диоксан, простой диметиловый эфир этиленгликоля и диэтиловый эфир; и спирты, такие как метанол, этанол и изопропиловый спирт; и в качестве растворителя могут также использоваться их смеси.
Примеры восстанавливающего агента включают боргидрид лития, диизобутилалюминийгидрид, литийалюминийгидрид, триэтилгидрид лития, бис(2-метоксиэтокси)алюминийгидрид натрия и борановые комплексы.
Количество используемого восстанавливающего агента составляет предпочтительно 0,25-100 молей, более предпочтительно, 0,5-20 молей по отношению к 1 молю Соединения (IX).
Температура реакции восстановления составляет предпочтительно -78-150°С, более предпочтительно, -78-100°С.
Время реакции восстановления варьирует в зависимости от условий реакции, таких как температура реакции и количество восстанавливающего агента, и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно, от 30 минут до 24 часов.
(Стадия 22)
Реакция окисления Соединения (Х) обычно осуществляется с помощью реакции Соединения (Х) с окисляющим агентом в растворителе, и растворитель выбирается соответствующим образом так, чтобы он не ингибировал реакцию. Примеры растворителя, который не ингибирует реакцию, включают трифторуксусную кислоту, пиридин, ацетон, углеводороды, такие как октан, гексан, бензол и толуол; галогенированные углеводороды, такие как дихлорметан, хлороформ, тетрахлорид углерода и 1,2-дихлорэтан; простые эфиры, такие как тетрагидрофуран, 1,2-диметоксиэтан и 1,4-диоксан; и алкилнитрилы, такие как ацетонитрил; и в качестве растворителя могут также использоваться их смеси.
Примеры окисляющего агента включают промышленно доступные реагенты, такие как триоксид серы-пиридин; активированный диметилсульфоксид; и реагент Десс-Мартина.
Количество используемого окисляющего агента составляет предпочтительно 0,5-3 моля, более предпочтительно, 0,8-2 моля по отношению к 1 молю Соединения (Х).
Температура реакции окисления варьирует в зависимости от типа окисляющего агента и составляет предпочтительно -78-100°С, более предпочтительно, -78-40°С.
Время реакции окисления варьирует в зависимости от условий реакции, таких как тип окисляющего агента и температура реакции, и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно, от 1 до 24 часов.
(Способ получения 15: Способ получения промежуточного Соединения (XII))

[где символы имеют те же значения, что определены выше].
(Стадия 23)
Соединение (XII) может быть получено с помощью превращения Соединения (XI) в алкин. Примеры реагента, используемого в реакции превращения, включают диметил-1-диазо-2-оксопропилфосфонат. Реакция превращения может осуществляться в соответствии с способом, описанным в документе известного уровня техники (Tetrahedron Letters, 2006, vol. 47, стр. 1729-1731), или соответствующим ему способом.
(Способ получения 16: Способ получения промежуточного Соединения (SIIb))
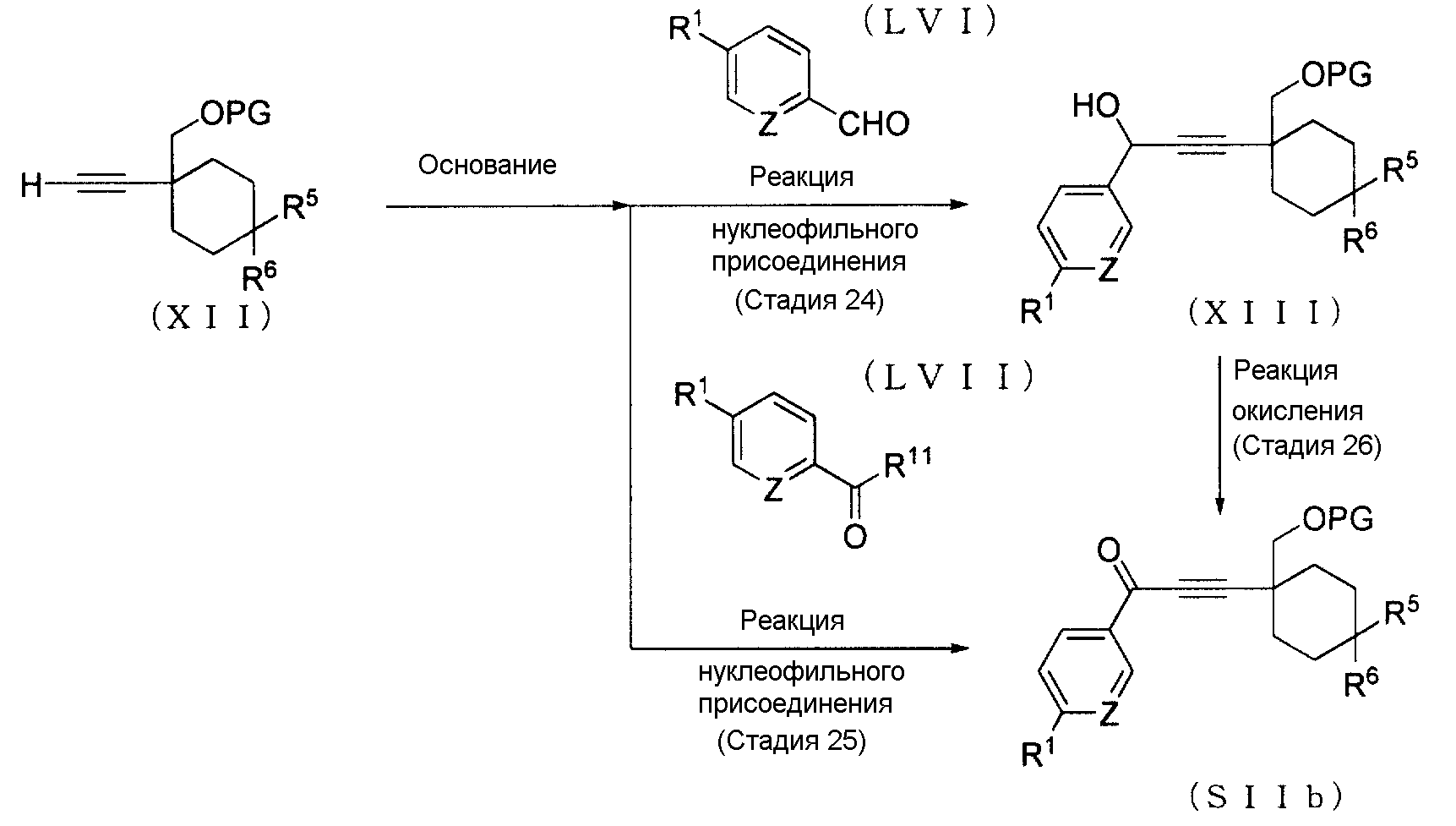
[где символы имеют те же значения, что определены выше].
Соединение (SIIb) может быть получено с помощью реакции Соединения (XII) с Соединением (LVI), с последующим окислением получающегося в результате Соединения (XIII). Соединение (SIIb) может быть также получено по реакции Соединения (XII) с Соединением (LVII). Соединение (LVI) и Соединение (LVII) могут быть промышленно доступными, но они могут быть также синтезированы в соответствии со способами, очевидными специалистам в данной области.
(Стадия 24 или Стадия 25)
Реакция нуклеофильного присоединения Соединения (XII) обычно осуществляется в безводном растворителе в присутствии основания, и растворитель выбирается соответствующим образом так, чтобы он не ингибировал реакцию. Примеры растворителя, который не ингибирует реакцию, включают углеводороды, такие как октан, гексан, бензол и толуол; и простые эфиры, такие как тетрагидрофуран, 1,4-диоксан, простой диметиловый эфир этиленгликоля и диэтиловый эфир; и в качестве растворителя могут также использоваться их смеси.
Примеры основания включают алкиллитиевые соединения, такие как метиллитий и н-бутиллитий; и соли диалкиламинов, такие как диизопропиламид лития, бис(триметилсилил)амид лития и бис(триметилсилил)амид калия.
Количество используемого основания составляет предпочтительно 0,8-5 молей, более предпочтительно, 0,9-3 моля по отношению к 1 молю Соединения (XII).
Количество используемого Соединения (LVI) или Соединения (LVII) составляет предпочтительно 0,8-5 молей, более предпочтительно, 0,9-3 моля по отношению к 1 молю Соединения (XII).
Температура реакции нуклеофильного присоединения составляет предпочтительно -78-150°С, более предпочтительно, 0-50°С.
Время реакции нуклеофильного присоединения варьирует в зависимости от условий реакции и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно, от 30 минут до 48 часов.
(Стадия 26)
Реакция окисления Соединения (XIII) обычно осуществляется с помощью реакции Соединения (XIII) с окисляющим агентом в растворителе, и растворитель выбирается соответствующим образом так, чтобы он не ингибировал реакцию. Примеры растворителя, который не ингибирует реакцию, включают трифторуксусную кислоту, пиридин, ацетон, углеводороды, такие как октан, гексан, бензол и толуол; галогенированные углеводороды, такие как дихлорметан, хлороформ, тетрахлорид углерода и 1,2-дихлорэтан; простые эфиры, такие как тетрагидрофуран, 1,2-диметоксиэтан и 1,4-диоксан; и алкилнитрилы, такие как ацетонитрил; и в качестве растворителя могут также использоваться их смеси.
Примеры окисляющего агента включают промышленно доступные реагенты, такие как диоксид марганца; триоксид серы-пиридин; активированный диметилсульфоксид; и реагент Десс-Мартина.
Количество используемого окисляющего агента составляет предпочтительно 0,5-3 моля, более предпочтительно, 0,8-2 моля по отношению к 1 молю Соединения (XIII).
Температура реакции окисления варьирует в зависимости от типа окисляющего агента и составляет предпочтительно -78-100°С, более предпочтительно, -78-40°С.
Время реакции окисления варьирует в зависимости от условий реакции, таких как тип окисляющего агента и температура реакции, и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно, от 1 до 24 часов.
(Способ получения 17: Способ получения промежуточного Соединения (SIIIa))

[где символы имеют те же значения, что определены выше].
Соединение (SIIIa) может быть получено алкилированием Соединения (XIV) Соединением (LX) или ацилированием Соединения (XVI), получаемого из Соединения (XIV), Соединением (LXI), с последующим получением Соединения (XV), которое затем циклизуют. Соединения (XIV) и (LX) могут синтезироваться по способам, очевидным специалистам в данной области. Соединение (LXI) может быть промышленно доступным, а может также синтезироваться согласно способу, очевидному специалистам в данной области.
(Стадия 27)
Реакция алкилирования Соединения (XIV) обычно осуществляется с помощью реакции Соединения (XIV) с галогенированным алкилом в растворителе в присутствии основания, и растворитель выбирается соответствующим образом так, чтобы он не ингибировал реакцию. Примеры растворителя, который не ингибирует реакцию, включают простые эфиры, такие как тетрагидрофуран, 1,4-диоксан и простой диметиловый эфир этиленгликоля; ацетон; ацетонитрил; и N,N-диметилформамид; и в качестве растворителя могут также использоваться их смеси.
Примеры основания включают кислые карбонаты щелочных металлов, такие как кислый карбонат натрия и кислый карбонат калия; карбонаты щелочных металлов, такие как карбонат калия и карбонат цезия; амины, такие как триэтиламин, диизопропилэтиламин и пиридин; трет-бутоксид калия; и гидрид натрия.
Количество используемого основания составляет предпочтительно 0,5-6 молей, более предпочтительно, 0,8-3 моля по отношению к 1 молю Соединения (XIV).
Количество используемого Соединения (LX) составляет предпочтительно 0,5-5 молей, более предпочтительно, 0,8-2 моля по отношению к 1 молю Соединения (XIV).
Температура реакции алкилирования составляет предпочтительно -78-200°С, более предпочтительно, -20-100°С.
Время реакции алкилирования варьирует в зависимости от условий реакции и предпочтительно составляет от 5 минут до 78 часов, более предпочтительно, от 30 минут до 48 часов.
(Стадия 28)
Соединение (XVI) можно синтезировать из Соединения (XIV) в соответствии, например, со способом использования тионилхлорида, оксалилхлорида или аналогичных, который очевиден специалистам в данной области техники.
(Стадия 29)
Реакция ацилирования Соединения (LXI) Соединением (XVI) обычно осуществляется в растворителе в присутствии основания, и растворитель выбирается соответственно так, чтобы он не ингибировал реакцию. Примеры растворителя, который не ингибирует реакцию, включают галогенированные углеводороды, такие как дихлорметан, хлороформ, тетрахлорид углерода и 1,2-дихлорэтан; и простые эфиры, такие как тетрагидрофуран, 1,2-диметоксиэтан и 1,4-диоксан; и в качестве растворителя могут также использоваться их смеси.
Примеры основания включают пиридин, триэтиламин, диизопропилэтиламин и N,N-диметиламинопиридин.
Количество используемого основания составляет предпочтительно 0,1-6 молей, более предпочтительно, 0,8-3 моля по отношению к 1 молю Соединения (XVI).
Количество используемого соединения (LXI) составляет 0,5-3 моля, более предпочтительно, 0,8-1,5 моля по отношению к 1 молю Соединения (XVI).
Температура реакции ацилирования составляет предпочтительно -20-150°С, более предпочтительно, 0-100°С.
Время реакции ацилирования варьирует в зависимости от условий реакции и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно, от 30 минут до 48 часов.
(Стадия 30)
Реакция циклизации Соединения (XV) обычно осуществляется в растворителе в присутствии аммониевой соли, и растворитель выбирается так, чтобы он не ингибировал реакцию. Примеры растворителя, которые не ингибируют реакцию, включают уксусную кислоту и муравьиную кислоту; и в качестве растворителя могут также использоваться их смеси.
Примеры аммониевой соли включают ацетат аммония, формиат аммония и карбонат аммония, которые являются промышленно доступными реагентами.
Количество используемой аммониевой соли составляет предпочтительно 1-20 молей, более предпочтительно, 2-15 молей по отношению к 1 молю Соединения (XV).
Температура реакции циклизации составляет предпочтительно 0-200°С, более предпочтительно, 0-120°С.
Время реакции циклизации варьирует в зависимости от условий реакции и предпочтительно составляет от 5 минут до 100 часов, более предпочтительно, от 30 минут до 48 часов.
(Способ получения 18: Способ получения промежуточного Соединения (SIIIb))

[где символы имеют те же значения, что определены выше].
Соединение (SIIIb) может быть получено с помощью реакции амидирования Соединения (XIV), а затем тиоамидированием получающегося в результате Соединения (XVII) с получением Соединения (XVIII), которое затем циклизуют с использованием Соединения (LX). Соединение (XIV) может быть синтезировано согласно способу, очевидному специалистам в данной области техники. Соединение (LX) можно также синтезировать согласно способу, очевидному специалистам в данной области.
(Стадия 31)
Реакция амидирования Соединения (XIV) обычно осуществляется с помощью образования смешанного ангидрида в растворителе в присутствии основания с использованием эфира хлормуравьиной кислоты или аналогичных с последующей реакцией водного аммиака со смешанным ангидридом. Растворитель выбирается соответствующим образом так, чтобы он не ингибировал реакцию. Примеры растворителя, который не ингибирует реакцию, включают простые эфиры, такие как тетрагидрофуран, 1,4-диоксан и простой диметиловый эфир этиленгликоля; галогенированные углеводороды, такие как дихлорметан и хлороформ; и N,N-диметилформамид; и в качестве растворителя могут также использоваться их смеси.
Примеры эфира хлормуравьиной кислоты включают метилхлорформиат, этилхлорформиат, изопропилхлорформиат и втор-бутилхлорформиат.
Количество эфира хлормуравьиной кислоты составляет предпочтительно 0,5-4 моля, более предпочтительно, 0,9-2 моля по отношению к 1 молю Соединения (XIV).
Примеры основания включают неорганические основания, такие как кислый карбонат натрия, карбонат натрия, карбонат калия и карбонат цезия; и органические основания, такие как триэтиламин, диизопропилэтиламин и пиридин.
Количество используемого основания составляет предпочтительно 0,5-5 молей, более предпочтительно, 0,9-2,5 моля по отношению к 1 молю Соединения (XIV).
Температура реакции амидирования составляет предпочтительно -78-200°С, более предпочтительно, -20-100°С с точки зрения образования смешанного ангидрида. Что касается реакции после добавления водного аммиака, температура составляет предпочтительно -78-200°С, более предпочтительно, -20-100°С.
Время реакции амидирования варьирует в зависимости от условий реакции и предпочтительно составляет от 5 минут до 48 часов, более предпочтительно, от 30 минут до 24 часов с точки зрения образования смешанного ангидрида. Что касается реакции после добавления водного аммиака, время реакции предпочтительно составляет от 5 минут до 72 часов, более предпочтительно, от 30 минут до 48 часов.
(Стадия 32)
Реакция тиоамидирования Соединения (XVII) обычно осуществляется с помощью реакции Соединения (XVII) c реагентом Лоуссона или пентасульфатом фосфора, которые являются промышленно доступными реагентами, в растворителе. Растворитель выбирается соответствующим образом так, чтобы он не ингибировал реакцию. Примеры растворителя, который не ингибирует реакцию, включают насыщенные углеводороды, такие как бензол и толуол; галогенированные растворители, такие как дихлорметан и хлороформ; и простые эфиры, такие как тетрагидрофуран и 1,4-диоксан; и в качестве растворителя могут также использоваться их смеси.
Количество используемого реагента Лоуссона или пентасульфида фосфора составляет предпочтительно 0,3-4 моля, более предпочтительно, 0,4-2 моля по отношению к 1 молю Соединения (XVII).
Температура реакции тиоамидирования составляет предпочтительно -20-200°С, более предпочтительно, 0-120°С.
Время реакции тиоамидирования варьирует в зависимости от условий реакции и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно, от 30 минут до 48 часов.
(Стадия 33)
Реакция циклизации Соединения (XVIII) обычно осуществляется в растворителе, выбираемом соответственно так, чтобы он не ингибировал реакцию. Примеры растворителя, который не ингибирует реакцию, включают спирты, такие как метанол и этанол; простые эфиры, такие как тетрагидрофуран и 1,4-диоксан; и ацетонитрил; и в качестве растворителя могут также использоваться их смеси.
Количество используемого Соединения (LX) составляет предпочтительно 0,5-4 моля, более предпочтительно, 0,9-1,5 моля, по отношению к 1 молю Соединения (XVIII).
Температура реакции циклизации составляет предпочтительно -20-200°С, более предпочтительно, 0-100°С.
Время реакции циклизации варьирует в зависимости от условий реакции и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно, от 30 минут до 48 часов.
В случаях, когда Соединение (I) получают в свободной форме, его можно превратить в желаемую соль согласно известному способу или соответствующему ему способу. Наоборот, когда оно получается в виде соли, ее можно превратить в свободную форму или какую-либо другую желаемую соль согласно известному способу или соответствующему ему способу.
Соединение (I) может также использоваться в виде пролекарства, и примеры пролекарства Соединения (I) включают соединения, которые превращаются в Соединение (I) по реакции с ферментами, желудочной кислотой или аналогичными в физиологических условиях в живом организме, т.е. соединения, которые подвергаются ферментативному окислению, восстановлению или гидролизу с превращением в Соединение (I); и соединения, которые подвергаются гидролизу под действием желудочной кислоты или аналогичных с превращением в Соединение (I) настоящего изобретения, которые соответствуют соединениям, в которых гидроксильная группа Соединения (I) ацилируется, алкилируется, фосфорилируется или борируется. Предпочтительные конкретные примеры пролекарства в случаях, когда R5 или R6 Соединения (I) представляет собой гидроксильную группу, показаны в Таблице 2, но данные примеры не ограничивают настоящее изобретение.

Пролекарство Соединения (I) можно синтезировать в соответствии с известным способом из Соединения (I) настоящего изобретения. Далее, пролекарством Соединения (I) может быть соединение, которое превращается в Соединение (I) в физиологических условиях, описанных в известном документе ('Iyakuhin no Kaihatsu' (Development of Drugs), Hirokawa Shoten, 1990, vol. 7, стр.163-198; Prog. Med. 5, 1985, стр. 2157-2161). При использовании Соединения (I) в качестве пролекарства его растворимость и/или абсорбционная способность может быть улучшена.
Превосходное анальгетическое действие, или терапевтическое действие на невропатическую боль, или терапевтическое действие на диабетическую невропатическую боль Соединения (I) можно оценить с использованием соответствующей животной модели. Примеры соответствующих животных моделей, что касается ноцицептивной боли, включают модель мышей, которые корчатся от боли под действием уксусной кислоты, крысиная или мышиная модель испытания с формалином, крысиная модель воспаления, вызываемого каррагенином, испытание на острую боль на крысах с горячей пластиной и испытание на острую боль с подергиванием хвостом на крысах.
Примеры соответствующих животных моделей на невропатическую боль включают мышиную или крысиную модель с частичным перевязыванием седалищного нерва и мышиную или крысиную модель с перевязыванием спинного нерва, и примеры соответствующей животной модели на диабетическую невропатическую боль включают мышиную или крысиную модель диабетической невропатии, вызываемой стрептозотоцином (STZ).
Поскольку Соединение (I) обладает превосходным анальгетическим действием или терапевтическим действием на невропатическую боль, или терапевтическим действием на диабетическую невропатическую боль, данное соединение может применяться в качестве фармацевтического средства и предпочтительно используется как анальгетическое, терапевтическое лекарственное средство от невропатической боли или терапевтическое лекарственное средство от диабетической невропатической боли.
В случаях, когда Соединение (I) используется как анальгетик, оно предпочтительно применяется от ноцицептивной боли. Примеры ноцицептивной боли включают боль вследствие повреждений, таких как переломы и резаные раны; послеоперационной боли; спинной боли; боли от ушибов; суставной боли; боли в нижней части спины; мышечной боли; боли после удаления зубов; зубной боли; аппендицита; хронического ревматоидного артрита; ревматической лихорадки; остеоартрита; анкилозирующего спондилита; деформирующего спондилеза; шейно-плечевого синдрома; периартрита; целлюлита; острого отита; простатита; альвеолярного периостита; и боль вследствие воспалительных заболеваний, таких как вагинит. В дополнение, описанная выше ноцицептивная боль включает глубинную боль и висцеральную боль (например, головную боль; боль в животе; спинную боль; сидром хронической тазовой боли; боль вследствие эндометриоза; боль вследствие уролитиаза или мочекаменной болезни или уретральных конкрементов; болевые колики вследствие заболевания пищеварительных органов; тазовую боль; и боль при урологических заболеваниях). В случаях, когда Соединение (I) используется как анальгетик, примеры более предпочтительных заболеваний, о которых идет речь, включают хронический ревматоидный артрит, остеоартрит, постоперационнную боль, боль суставов, боль в нижней части спины, мышечную боль и зубную боль.
Соединение (I) используется как терапевтическое лекарственное средство от невропатической боли, а также как терапевтическое лекарственное средство от диабетической невропатической боли. Примеры невропатической боли здесь включают раковую боль, боль при опоясывающем герпесе, постгерпетическую невралгию, невралгию, связанную со СПИД'ом и тригеминальную невралгию. Диабетическая невропатическая боль обозначает здесь боль вследствие диабетической невралгии.
Соединение (I) полезно также для лечения острой и хронической боли. Острая боль обычно продолжается в течение короткого периода времени, и примеры ее включают постоперативную боль, боль после удаления зубов и тригеминальную невралгию. Хроническая боль определяется как боль, которая продолжатся в течение 3-6 месяцев. Она включает соматогенную боль и психогенную боль, и примеры ее включают хронический ревматоидный артрит, остеоартрит и постгерпетическую невралгию.
Фармацевтическая композиция, содержащая Соединение (I), показывает отличное анальгетическое действие или терапевтическое действие на невропатическую боль или диабетическую невропатическую боль в случаях, когда она вводится млекопитающим (например, мышам, крысам, хомякам, кроликам, кошкам, собакам, коровам, овцам, обезьянам или людям), особенно людям.
В дополнение, Соединение (I) может использоваться не только как анальгетическое или терапевтическое лекарственное средство от невропатической боли, но также в терапевтических способах от боли или невропатической боли, или при терапевтическом применении от боли или невропатической боли. Далее, Соединение (I) может применяться в терапевтических способах или при терапевтическом использовании от диабетической невропатической боли.
Дозировочная форма Соединения (I) может применяться для орального или парентерального введения Соединения (I) как оно есть, или после смешения с ним фармацевтически приемлемого носителя.
Примеры дозировочной формы лекарственного продукта, содержащего Соединение (I), в случаях, когда он вводится орально, включают таблетки (например, таблетки с сахарным и таблетки с пленочным покрытием), пилюли, гранулы, порошки, капсулы (например, мягкие капсулы и микрокапсулы), сиропы, эмульсии и суспензии; примеры дозировочной формы в случаях, когда она вводится парентерально, включают инъекции, пропитывающие агенты, капли и медицинские свечи. Соединение эффективно также для формулирования лекарственного средства в виде препарата замедленного высвобождения путем комбинирования лекарственного средства с соответствующей основой (например, полимером масляной кислоты, полимером гликолевой кислоты, сополимером масляной кислоты - гликолевой кислоты, смесью полимера масляной кислоты и полимера гликолевой кислоты, или сложного эфира полиглицерина жирной кислоты).
Получение лекарственного продукта, содержащего Соединение (I), в виде описанной выше дозировочной формы может осуществляться известным способом, используемым обычно в области составления лекарственных рецептур. В таком случае рецептура может получаться путем включения эксципиента или наполнителя, связующего, смазочного агента, дезинтегрирующего агента, подсластителя, поверхностно-активного вещества, суспендирующего агента, эмульгатора и/или аналогичных, которые обычно используются в области составления лекарств.
Получение таблеток, содержащих Соединение (I), может осуществляться путем включения эксципиента, связующего, дезинтегрирующего агента, смазочного агента и/или аналогичных; а получение пилюли или гранулы может осуществляться путем включения эксципиента, связующего, дезинтегрирующего агента и/или аналогичных. Получение порошка или капсулы может осуществляться путем включения эксципиента и/или аналогичных; получение сиропа может осуществляться путем включения подсластителя и/или аналогичных; и получение эмульсии или суспензии может осуществляться путем включения поверхностно-активного вещества, суспендирующего агента, эмульгатора и/или аналогичных.
Примеры эксципиента или наполнителя включают лактозу, глюкозу, крахмал, сахарозу, микрокристаллическую целлюлозу, порошкообразный солодковый (лакричный) корень, манит, кислый карбонат натрия, фосфат кальция и сульфат кальция.
Примеры связующего агента включают растворы крахмальной пасты, растворы аравийской камеди, растворы желатина, растворы трагаканта, растворы карбоксиметилцеллюлозы, растворы альгината натрия и глицерин.
Примеры дезинтегрирующего агента включают крахмал и карбонат кальция.
Примеры смазочного агента включают стеарат магния, стеариновую кислоту, стеарат кальция и очищенный тальк.
Примеры подслащивающего агента включают глюкозу, фруктозу, инвертный сахар, сорбит, ксилит, глицерин и простой сироп.
Примеры поверхностно-активного агента включают лаурилсульфат натрия, полисорбат 80, сорбитановый эфир моножирной кислоты и полиоксил 40-стеарат.
Примеры суспендирующего агента включают аравийскую камедь, альгинат натрия, натриевую карбоксиметилцеллюлозу, метилцеллюлозу и бентонит.
Примеры эмульгирующего агента включают аравийскую камедь, трагакант, желатин и полисорбат 80.
Далее, в случаях, когда лекарственное средство, содержащее Соединение (I), формулируется в описанную выше дозировочную форму, может добавляться окрашивающий агент, консервант, ароматический агент, модификатор лекарственных веществ, стабилизатор, загуститель и/или аналогичные, которые используются обычно в области составления лекарственных рецептур.
Дневная доза рецептуры варьирует в зависимости от состояния и веса тела пациента, типа соединения, пути введения и аналогичных и составляет предпочтительно 1 мг-1000 мг в случае орального введения взрослому (с весом тела около 60 кг), которая вводится в одно и то же время или раздельно несколько раз. В случаях, когда рецептура вводится парентерально, дневная доза составляет предпочтительно 0,01 мг - 100 мг на 1 кг веса тела, которая вводится внутривенно.
Соединение (I) может также использоваться после смешения, или в комбинации с еще одним лекарством в соответствующем количестве для того, чтобы дополнить или усилить терапевтическое или профилактическое действие, или чтобы снизить дозу. Соединение (I) может использоваться в комбинации, например, со следующими лекарственными средствами.
Примеры противокашлевых агентов, отхаркивающих и противокашлевых отхаркивающих агентов включают декстрометорфан, бенпроперин, димеморфан, клофеданол, эфедрин, хускод, фоминобен, метилэфедрин, ацетилцистеин, амброксол, карбоцистеин, бромгексин, эпразинон, экстракт вишневой коры, кодеин, дигидрокодеин и типепидин.
Примеры бронхорасширяющих агентов включают кленбутерол, кромогликат, салбутамол, салметерол, тулобутерол, теофиллин и прокатерол.
Примеры язвенных антисептических лекарственных средств включают азулен, алдиокса, ирсогладин, екабет, омепразол, орнопростил, циметидин, сукралфат, сулпиридин, цетраксат и фамотидин.
Примеры антибиотиков включают амоксициллин, азитромицин, эритромицин, кларитромицин, тетрациклин и доксициклин.
Примеры наркотических анальгетических агентов включают алкалоид опия, этилморфин, оксикодон, морфин, кокаин, фентанил и петидин.
ПРИМЕРЫ
Настоящее изобретение будет сейчас описано более подробно со ссылкой на Ссылочные Примеры и Примеры. Однако данное изобретение на ограничивается ими.
Названия растворителей, заключенные в скобках в данных ЯМР, указывают растворители, используемые для измерений.
Для измерения 400 МГц ЯМР спектра использовали аппарат ядерно-магнитного резонанса типа JNM-AL400 производства фирмы JEOL LTD. Химические сдвиги приводились для тетраметилсилана и выражались в δ (единица: млн.дол.) Каждый сигнал выражался в s - с (синглет), d - д (дублет), t - т (триплет), q - кв (квартет), quint - квинт (квинтет), sept - септ (септет), m - м (мультиплет), br - шир (широкий), dd - дд (двойной дублет), dt - дт (двойной триплет), ddd - ддд (двойной дублет дублетов), dq - дкв (двойной квартет), td - тд (триплет дублетов) или tt - тт (триплет триплетов). IR - ИК спектр измеряли с использованием устройства FT/IR-410 производства JASCO Corporation, а ESI-MS спектр измеряли с использованием устройства Micromass ZQ2K производства Waters или устройства 1200LC/MSD производства Agilent Technology. Все используемые растворители были промышленно доступны. YFLC W-prep2XY производства Yamazen Corporation использовали для флэш-хроматографии.
Исходные материалы соединений настоящего изобретения и синтез промежуточных соединений описываются в Ссылочных Примерах далее. Среди соединений, используемых для синтеза соединений Ссылочных Примеров, для которых способ синтеза не описывается, использовали промышленно доступные соединения.
(Ссылочный Пример 1)
8-Этинил-1,4-диоксаспиро[4.5]декан-8-ол

К раствору триметилсилилацетилена (27,1 мл, 0,192 моль) в тетрагидрофуране (300 мл) по каплям, при -76°С, в течение 30 минут добавляли 2,77 М н-бутиллитий (раствор в гексане, 69,3 мл, 0,192 моль), и полученный раствор перемешивали при той же температуре в течение 30 минут. По каплям, при -74°С, в течение 30 минут добавляли раствор 1,4-диоксаспиро[4.5]декан-8-она (25,0 г, 0,160 моль) в тетрагидрофуране (100 мл), и полученный раствор перемешивали при той же температуре в течение 1 часа и 30 минут. Реакционный раствор вливали в насыщенный водный раствор хлорида аммония, и полученный раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении.
Для растворения остатка добавляли метанол (320 мл), и туда добавляли карбонат калия (55,3 г, 0,400 моль). Полученный раствор перемешивали при комнатной температуре в течение 2 часов, и получившийся реакционный раствор концентрировали при пониженном давлении. К остатку добавляли дистиллированную воду, и продукт реакции экстрагировали этилацетатом. Органический слой промывали дистиллированной водой и солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке (целевое) соединение (29,1 г, 0,160 моль, 100%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,75-2,03 (9H, м), 2,49 (1H, м), 3,95 (4H, с).
ESI-MS: m/z=165 (M-OH)+.
(Ссылочный Пример 2)
1-(3-Гидрокси-3-(п-толил)пропин-1-ил)циклогексанол

К раствору 1-этинилциклогексанола (500 мг, 4,02 ммоль) в тетрагидрофуране (20 мл), по каплям при -78°С добавляли 2,77М н-бутиллитий (раствор в н-гексане, 3,6 мл, 9,90 ммоль), и полученный раствор перемешивали при той же температуре в течение 1 часа. К реакционному раствору при -78°С добавляли п-толуальдегид (0,52 мл, 4,40 ммоль), и полученному раствору давали постепенно нагреться до комнатной температуры при перемешивании. К реакционному раствору добавляли дистиллированную воду и 1М соляную кислоту, чтобы сделать смесь кислотной, и продукт реакции экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (598 мг, 2,44 ммоль, 61%) в виде бледно-желтого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,18-1,30 (1H, м), 1,47-1,74 (7H, м), 1,89-1,98 (2H, м), 2,08 (1H, шир.с), 2,22 (1H, шир.с), 2,36 (3H, с), 5,47 (1H, с), 7,19 (2H, д, J=8,0 Гц), 7,43 (2H, д, J=8,0 Гц).
ESI-MS: m/z=227 (M-OH)+.
(Ссылочный Пример 3)
8-(3-Гидрокси-3-(п-толил)пропин-1-ил)-1,4-диоксаспиро[4.5]декан-8-ол

К раствору 8-этинил-1,4-диоксаспиро[4.5]декан-8-ола (Ссылочный Пример 1) (15,0 г, 82,3 ммоль) в тетрагидрофуране (165 мл), по каплям при -72°С, в течение 25 минут добавляли 2,77М н-бутиллитий (раствор в н-гексане, 62,4 мл, 172,9 ммоль), и полученный раствор перемешивали при той же температуре в течение 30 минут. После чего к реакционному раствору, по каплям, при -72°С, в течение 5 минут добавляли п-толуальдегид (10,2 мл, 86,4 ммоль), и полученный раствор перемешивали при той же температуре в течение 30 минут. Реакционному раствору давали нагреться до комнатной температуры и вливали в насыщенный водный раствор хлорида аммония. Реакционный раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (17,7 г, 58,5 ммоль, 71%) в виде аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,72-1,85 (4H, м), 1,90-2,04 (4H, м), 2,35 (3H, с), 2,55 (1H, с), 2,78 (1H, д, J=6,0 Гц), 3,93 (4H, с), 5,44 (1H, д, J=6,0 Гц), 7,17 (2H, д, J=8,0 Гц), 7,40 (2H, д, J=8,0 Гц).
ESI-MS: m/z= 285 (M-OH)+.
(Ссылочный Пример 4)
8-(3-Гидрокси-3-(4-метоксифенил)пропин-1-ил)-1,4-диоксаспиро[4.5]декан-8-ол

К раствору 8-этинил-1,4-диоксаспиро[4.5]декан-8-ола (Ссылочный Пример 1) (5,02 г, 27,6 ммоль) в тетрагидрофуране (100 мл), по каплям, при -72°С, в течение 15 минут добавляли 2,63М н-бутиллитий (раствор в н-гексане, 22,0 мл, 57,9 ммоль), и полученный раствор перемешивали при той же температуре в течение 60 минут. После чего, по каплям, при -72°С, в течение 10 минут добавляли 4-метоксиальдегид (3,52 мл, 28,9 ммоль), и полученный раствор перемешивали при той же температуре в течение 60 минут. Реакционному раствору давали нагреться до комнатной температуры и вливали в насыщенный водный раствор хлорида аммония. Реакционный раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (7,46 г, 23,4 ммоль, 85%) в виде аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,73-1,85 (4H, м), 1,91-2,04 (4H, м), 2,32 (1H, с), 2,52 (1H, д, J=6,1 Гц), 3,81 (3H, с), 3,94 (4H, с), 5,44 (1H, д, J=6,1 Гц), 6,89 (2H, д, J=8,5 Гц), 7,44 (2H, д, J=8,5 Гц).
(Ссылочный Пример 5)
8-(3-(4-Хлорфенил)-3-гидроксипропин-1-ил)-1,4-диоксаспиро[4.5]декан-8-ол

К раствору 8-этинил-1,4-диоксаспиро[4.5]декан-8-ола (Ссылочный Пример 1) (5,03 г, 27,6 ммоль) в тетрагидрофуране (100 мл), по каплям, при -72°С, в течение 15 минут добавляли 2,63М н-бутиллитий (раствор в н-гексане, 22,1 мл, 57,9 ммоль), и полученный раствор перемешивали при той же температуре в течение 60 минут. После чего, по каплям, при -72°С, в течение 10 минут добавляли 4-хлорбензальдегид (4,06 мл, 28,9 ммоль), и полученный раствор перемешивали при той же температуре в течение 60 минут. Реакционному раствору давали нагреться до комнатной температуры и вливали в насыщенный водный раствор хлорида аммония. Реакционный раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (8,13 г, 25,2 ммоль, 91%) в виде аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,68-1,81 (4H, м), 1,86-1,90 (4H, м), 3,55 (1H, с), 3,90 (4H, с), 4,03 (1H, д, J=4,2 Гц), 5,41 (1H, д, J=4,2 Гц), 7,28 (2H, д, J=8,3 Гц), 7,41 (2H, д, J=8,3 Гц).
Следующие соединения были получены тем же способом, как описано выше.
(Ссылочный Пример 14)
3-(1-Гидроксициклогексил)-1-(п-толил)-2-пропин-1-он

К раствору 1-(3-гидрокси-3-(п-толил)пропин-1-ил)циклогексанола (Ссылочный Пример 2) (593 мг, 2,42 ммоль) в дихлорметане (20 мл) добавляли диоксид магния (1,15 г, 13,2 ммоль), и полученный раствор перемешивали при комнатной температуре в течение 5 часов. Реакционный раствор фильтровали через Целит, и фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (534 мг, 2,20 ммоль, 91%) в виде светло-желтого маслянистого продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,28-1,39 (1H, м), 1,55-1,84 (7H, м), 2,02-2,11 (2H, м), 2,23 (1H, шир.с), 2,43 (3H, с), 7,28 (2H, д, J=8,0 Гц), 8,02 (2H, д, J=8,0 Гц).
(Ссылочный Пример 15)
3-(8-Гидрокси-1,4-диоксаспиро[4.5]декан-8-ил)-1-(п-толил)-2-пропин-1-он

К раствору 8-(3-гидрокси-3-(п-толил)пропин-1-ил)-1,4-диоксаспиро[4.5]декан-8-ола (Ссылочный Пример 3) (17,5 г, 57,9 ммоль) в дихлорметане (289 мл) добавляли диоксид магния (29,6 г, 289 ммоль), и полученный раствор перемешивали при комнатной температуре в течение 15 часов. Реакционный раствор фильтровали через Целит, и фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (14,3 г, 47,6 ммоль, 82%) в виде маслянистого продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,79-1,85 (2H, м), 1,87-1,93 (2H, м), 2,04-2,15 (4H, м), 2,20 (1H, с), 2,43 (3H, с), 3,97 (4H, с), 7,28 (2H, д, J=8,0 Гц), 8,00 (2H, д, J=8,0 Гц).
ESI-MS: m/z=284 (M-OH)+.
(Ссылочный Пример 16)
3-(8-Гидрокси-1,4-диоксаспиро[4.5]декан-8-ил)-1-(6-метилпиридин-3-ил)-2-пропин-1-он

К раствору 8-этинил-1,4-диоксаспиро[4.5]декан-8-ола (Ссылочный Пример 1) (592 мг, 3,25 ммоль) в тетрагидрофуране (6 мл), по каплям, при -78°С, в течение 5 минут добавляли 2,63М н-бутиллитий (раствор в н-гексане, 2,6 мл, 6,82 ммоль), и полученный раствор перемешивали при той же температуре в течение 30 минут. После чего, по каплям, при -78°С, в течение 20 минут добавляли раствор N-метокси-N-метил-6-метилникотинамида (614,5 мг, 3,41 ммоль) в тетрагидрофуране (5 мл), и полученный раствор перемешивали при той же температуре в течение 30 минут. Реакционному раствору давали нагреться до комнатной температуры и вливали в насыщенный водный раствор хлорида аммония. Реакционный раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (626,3 мг, 2,08 ммоль, 65%) в виде бледно-желтого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,76-1,83 (2H, м), 1,87-1,94 (2H, м), 2,04-2,10 (2H, м), 2,12-2,19 (2H, м), 2,30 (1H, с), 2,66 (3H, с), 3,97 (4H, с), 7,29 (1H, д, J=8,0 Гц), 8,22 (1H, дд, J=2,4, 8,0 Гц), 9,21 (1H, д, J=2,4 Гц).
ESI-MS: m/z= 284 (M-OH)+.
(Ссылочный Пример 17)
8-(3-Гидрокси-1,4-диоксаспиро[4.5]декан-8-ил)-1-(4-метоксифенил)-2-пропин-1-он
К раствору 8-(3-гидрокси-3-(4-метоксифенил)пропин-1-ил)-1,4-диоксаспиро[4.5]декан-8-ола (Ссылочный Пример 4) (7,10 г, 22,3 ммоль) в дихлорметане (100 мл) добавляли диоксид магния (9,69 г, 112 ммоль), и полученный раствор перемешивали при комнатной температуре в течение 18 часов. Реакционный раствор фильтровали через Целит, и фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (5,45 мг, 17,2 ммоль, 77%) в виде маслянистого продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,78-1,93 (4H, м), 2,03-2,17 (4H, м), 2,27 (1H, с), 3,89 (3H, с), 3,97 (4H, с), 6,95 (2H, д, J=9,0 Гц), 8,08 (2H, д, J=9,0 Гц).
ESI-MS: m/z= 299 (M-OH)+.
(Ссылочный Пример 18)
1-(4-Хлорфенил)-3-(8-гидрокси-1,4-диоксаспиро[4.5]декан-8-ил)-2-пропин-1-он

К раствору 8-(3-(4-хлорфенил)-3-гидроксипропин-1-ил)-1,4-диоксаспиро[4.5]декан-8-ола (Ссылочный Пример 5) (7,70 г, 23,9 ммоль) в дихлорметане (120 мл) добавляли диоксид магния (10,4 г, 119 ммоль), и полученный раствор перемешивали при комнатной температуре в течение 18 часов. Реакционный раствор фильтровали через Целит, и фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (5,45 мг, 17,0 ммоль, 71%) в виде маслянистого продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,77-1,94 (4H, м), 2,04-2,19 (4H, м), 2,15 (1H, с), 3,98 (4H, с), 7,47 (2H, д, J=8,5 Гц), 8,04 (2H, д, J=8,5 Гц).
ESI-MS: m/z= 303 (M-OH)+.
Следующие соединения были получены тем же способом, как описано выше.
(Ссылочный Пример 30)
8-(1-(4-Метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-1,4-диоксаспиро[4.5]декан-8-ол

К раствору гидрохлорида 4-метоксифенилгидразина (7,53 г, 42,1 ммоль) в этаноле (76,6 мл), по каплям, добавляли триэтиламин (5,87 мл, 42,1 ммоль), и полученный раствор перемешивали при комнатной температуре в течение 30 минут. К реакционному раствору по каплям добавляли раствор 3-(8-гидрокси-1,4-диоксаспиро[4.5]декан-8-ил)-1-(п-толил)-2-пропин-1-она (Ссылочный Пример 15) (11,5 г, 38,3 ммоль) в этаноле (76,6 мл), и полученный раствор перемешивали при комнатной температуре в течение 15 часов. После чего реакционный раствор концентрировали при пониженном давлении. К остатку добавляли воду, и продукт реакции экстрагировали этилацетатом. Органический слой промывали 1М соляной кислотой, дистиллированной водой и солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (14,7 г, 35,0 ммоль, 91%) в виде аморфного продукта.
1Н-ЯМР (400 МГц, CDCl3) δ: 1,71-1,74 (2H, м), 1,99-2,25 (6H, м), 2,33 (3H, с), 2,71 (1H, с), 3,81 (3H, с), 3,96-4,01 (4H, м), 6,39 (1H, с), 6,84 (2H, д, J=8,0 Гц), 7,09 (4H, с), 7,21 (2H, д, J=8,0 Гц).
ESI-MS: m/z=421 (M+H)+.
(Ссылочный Пример 31)
8-(1-(4-Метоксифенил)-5-(6-метилпиридин-3-ил)-1Н-пиразол-3-ил)-1,4-диоксаспиро[4.5]декан-8-ол

К раствору гидрохлорида 4-метоксифенилгидразина (359 мг, 2,06 ммоль) в этаноле (4 мл) по каплям добавляли триэтиламин (286 мкл, 2,06 ммоль), и полученный раствор перемешивали при комнатной температуре в течение 30 минут. К реакционному раствору по каплям добавляли раствор 3-(8-гидрокси-1,4-диоксаспиро[4.5]декан-8-ил)-1-(6-метилпиридин-3-ил)-2-пропин-1-она (Ссылочный Пример 16) (563,7 мг, 1,87 ммоль) в этаноле (5,4 мл), и полученный раствор перемешивали при комнатной температуре в течение 22 часов. После чего реакционный раствор концентрировали при пониженном давлении. К остатку добавляли воду, и продукт реакции экстрагировали этилацетатом. Органический слой промывали дистиллированной водой и солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (177 мг, 0,42 ммоль, 22%) в виде аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,72-1,75 (2H, м), 2,00-2,03 (2H, м), 2,07-2,14 (2H, м), 2,19-2,26 (2H, м), 2,55 (3H, с), 2,65 (1H, с), 3,81 (3H, с), 3,96-4,03 (4H, м), 6,47 (1H, с), 6,86 (2H, д, J=8,8 Гц), 7,06 (1H, д, J=8,0 Гц), 7,20 (2H, д, J=8,8 Гц), 7,33 (1H, дд, J=2,2, 8,0 Гц), 8,40 (1H, д, J=2,2 Гц).
ESI-MS: m/z=422 (M+H)+.
(Ссылочный Пример 32)
8-(1,5-Бис(4-метоксифенил)-1Н-пиразол-3-ил)-1,4-диоксаспиро[4.5]декан-8-ол

К раствору 3-(8-гидрокси-1,4-диоксаспиро[4.5]декан-8-ил)-1-(4-метоксифенил)-2-пропин-1-она (Ссылочный Пример 17) (700 мг, 2,24 ммоль) в этаноле (4,5 мл) добавляли раствор гидрохлорида 4-метоксифенилгидразина (470 мг, 2,69 ммоль) и триэтиламина (0,74 мл, 5,41 ммоль) в этаноле (4,5 мл), и полученный раствор перемешивали при комнатной температуре в течение 20 часов. Реакционный раствор концентрировали при пониженном давлении. К остатку добавляли дистилированную воду, и продукт реакции экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (864 мг, 1,98 ммоль, 88%) в виде белого аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,68-1,77 (2H, м), 1,96-2,26 (6H, м), 2,70 (1H, шир.с), 3,80 (3H, с), 3,81 (3H, с), 3,94-4,04 (4H, м), 6,37 (1H, с), 6,81 (2H, д, J=8,8 Гц), 6,85 (2H, д, J=8,8 Гц), 7,13 (2H, д, J=8,8 Гц), 7,21 (2H, д, J=8,8 Гц).
ESI-MS: m/z=437 (M+H)+.
(Ссылочный Пример 33)
8-(5-(4-Хлорфенил)-1-(4-метоксифенил)-1Н-пиразол-3-ил)-1,4-диоксаспиро[4.5]декан-8-ол

К раствору гидрохлорида 4-метоксифенилгидразина (457 мг, 2,62 ммоль) в этаноле (4,4 мл) по каплям добавляли триэтиламин (0,730 мл, 5,24 ммоль), и полученный раствор перемешивали при комнатной температуре в течение 30 минут. К реакционному раствору по каплям добавляли раствор 1-(4-хлорфенил)-3-(8-гидрокси-1,4-диоксаспиро[4.5]декан-8-ил)-2-пропин-1-она (Ссылочный Пример 18) (700 мг, 2,18 ммоль) в этаноле (4,4 мл), и полученный раствор перемешивали при комнатной температуре в течение 14 часов. После чего реакционный раствор концентрировали при пониженном давлении. К остатку добавляли воду, и продукт реакции экстрагировали этилацетатом. Органический слой промывали 1М соляной кислотой, дистиллированной водой и солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (756 мг, 1,71 ммоль, 79%) в виде аморфного продукта.
1Н-ЯМР (400 МГц, CDCl3) δ: 1,69-1,76 (2H, м), 1,97-2,25 (6H, м), 2,66 (1H, шир.с), 3,82 (3H, с), 3,94-4,03 (4H, м), 6,43 (1H, с), 6,85-6,87 (2H, м), 7,13 (2H, д, J=8,4 Гц), 7,19 (2H, д, J=8,4 Гц), 7,25-7,27 (2H, м).
ESI-MS: m/z=441 (M+H)+.
(Ссылочный Пример 34)
8-(1-(4-Хлорфенил)-5-(п-толил)-1Н-пиразол-3-ил)-1,4-диоксаспиро[4.5]декан-8-ол

К раствору гидрохлорида 4-хлорфенилгидразина (418 мг, 2,33 ммоль) в этаноле (4,8 мл) по каплям добавляли триэтиламин (5,87 мл, 42,1 ммоль), и полученный раствор перемешивали при комнатной температуре в течение 30 минут. К реакционному раствору по каплям добавляли раствор 3-(8-гидрокси-1,4-диоксаспиро[4.5]декан-8-ил)-1-(п-толил)-2-пропин-1-она (Ссылочный Пример 15) (698 мг, 2,32 ммоль) в этаноле (4,7 мл), и полученный раствор перемешивали при комнатной температуре в течение 14 часов. После чего реакционный раствор концентрировали при пониженном давлении. К остатку добавляли воду, и продукт реакции экстрагировали этилацетатом. Органический слой промывали дистиллированной водой и солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (948 мг, 2,23 ммоль, выход: 96%) в виде аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,71-1,75 (2H, м), 1,98-2,14 (4H, м), 2,17-2,25 (2H, м), 2,36 (3H, с), 2,62 (1H, с), 3,96-4,03 (4H, м), 6,41 (1H, с), 7,09 (2H, д, J=8,0 Гц), 7,13 (2H, д, J=8,0 Гц), 7,22-7,30 (4H, м).
ESI-MS: m/z=407 (M-OH)+.
Следующие соединения были получены тем же способом, как описано выше.
Следующие соединения были получены тем же способом, как в Примерах 37-41, описанных ниже.
(Ссылочный Пример 78)
Диацетат 1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-цис-1,4-диила

К суспензии 1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-цис-1,4-диола (Пример 2-В) (300 мг, 0,793 ммоль) в дихлорметане (2,6 мл) добавляли уксусный ангидрид (0,187 мл, 1,98 ммоль), пиридин (0,192 мл, 2,38 ммоль) и 4-диметиламинопиридин (48,4 мг, 0,396 ммоль), и полученный раствор перемешивали при комнатной температуре в течение 60 часов. Снова добавляли 4-диметиламинопиридин (48,4 мг, 0,396 ммоль), и полученный раствор перемешивали при комнатной температуре в течение дополнительных 6 часов. Реакцию гасили путем добавления к реакционному раствору воды, и полученный раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (297 мг, 0,642 ммоль, 81%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,74-1,82 (2H, м), 1,92-1,98 (2H, м), 2,01-2,08 (5H, м), 2,10 (3H, с), 2,32 (3H, с), 2,70-2,77 (2H, м), 3,80 (3H, с), 4,80-4,89 (1H, м), 6,38 (1H, с), 6,83 (2H, д, J=8,8 Гц), 7,08 (4H, с), 7,20 (2H, д, J=8,8 Гц).
ESI-MS: m/z=463 (M+H)+.
(Ссылочный Пример 79)
Ацетат с-4-метокси-1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-r-1-ила
К раствору ацетата с-4-гидрокси-1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-r-1-ила (Сравнительный Пример 26) (0,150 г, 0,357 ммоль) в N,N-диметилформамиде (1,8 мл) добавляли 55% гидрид натрия (23,4 мг, 0,535 ммоль) и метилйодид (29,0 мкл, 0,464 ммоль) при перемешивании с охлаждением льдом, и полученный раствор перемешивали при комнатной температуре в течение 9 часов. Реакцию гасили путем добавления к реакционному раствору воды при перемешивании с охлаждением льдом, и полученный раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (124 мг, 0,284 ммоль, 80%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,60-1,68 (2H, м), 1,94-2,03 (4H, м), 2,08 (3H, с), 2,32 (3H, с), 2,69-2,76 (2H, м), 3,24-3,33 (1H, м), 3,39 (3H, с), 3,80 (3H, с), 6,37 (1H, с), 6,83 (2H, д, J=8,8 Гц), 7,08 (4H, с), 7,20 (2H, д, J=8,8 Гц).
ESI-MS: m/z=435 (M+H)+.
(Ссылочный Пример 80)
Ацетат 4-(4-фтор-1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-с-4-гидроксициклогексан-r-1-ила

К раствору ацетата с-4-гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-r-1-ила (Ссылочный Пример 57) (130 мг, 0,309 ммоль) в ацетонитриле (3,09 мл) добавляли SelectfluorTM(120 мг, 0,340 ммоль), и полученный раствор перемешивали при комнатной температуре в течение 3 часов. К реакционному раствору добавляли насыщенный водный раствор тиосульфата натрия, и полученный раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (61 мг, 0,140 ммоль, 45%) в виде светло-желтого аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,89-2,15 (11H, м), 2,35 (3H, м), 2,73 (1H, с), 3,81 (3H, с), 4,82-4,89 (1H, м), 6,84-6,86 (2H, м), 7,10-7,18 (6H, м).
ESI-MS: m/z=439 (M+H)+.
(Ссылочный Пример 81)
Ацетат 1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-4-оксоциклогексан-1-ила

К раствору ацетата с-4-гидрокси-1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-r-1-ила (Сравнительный Пример 26) (142 мг, 0,338 ммоль) в дихлорметане (3,38 мл) добавляли реагент Десс-Мартина (172 мг, 0,405 ммоль), и полученный раствор перемешивали при 0°С в течение 2 часов. Реакционный раствор фильтровали через Целит и остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (120 мг, 0,287 ммоль, 85%) в виде белого аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 2,13 (3H, с), 2,33 (3H, с), 2,44-2,52 (4H, м), 2,59-2,65 (2H, м), 2,93-2,96 (2H, м), 3,81 (3H, с), 6,45 (1H, с), 6,84 (2H, д, J=8,8 Гц), 7,08 (4H, с), 7,20 (2H, д, J=8,8 Гц).
ESI-MS: m/z=419 (M+H)+.
(Ссылочный Пример 82)
с-4-Гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-цис-циклогексан-r-1-карбальдегид

К раствору хлорида (метоксиметил)трифенилфосфония (546,3 мг, 1,59 ммоль) в тетрагидрофуране (1,3 мл), по каплям, при -40°С, добавляли трет-бутоксид калия (178,7 мг, 1,59 ммоль), и полученный раствор перемешивали при той же температуре в течение 60 минут. К реакционному раствору по каплям, при -40°С добавляли раствор 4-гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-1-она (Пример 37) (200 мг, 0,53 ммоль) в тетрагидрофуране (1,35 мл), и полученный раствор перемешивали при комнатной температуре в течение 1,5 часов. К реакционному раствору при 0°С добавляли 6М водную соляную кислоту, и полученный раствор перемешивали в течение 12 часов. К реакционному раствору добавляли дистиллированную воду, и полученный раствор экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором бикарбоната натрия и солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (87,5 мг, 0,23 ммоль, 42%) в виде бесцветного маслянистого продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,88-1,96 (6H, м), 2,09-2,11 (2H, м), 2,25-2,36 (5H, м), 3,80 (3H, с), 6,39 (1H, с), 6,84 (2H, д, J=8,8 Гц), 7,09-7,14 (4H, м), 7,20 (2H, д, J=8,8 Гц), 9,66 (1H, д, J=2,0 Гц).
ESI-MS: m/z=391 (M+H)+.
(Ссылочный Пример 83)
Этил 1,4-диоксаспиро[4.5]декан-8-карбоксилат

К раствору этил 4-оксоциклогексанкарбоксилата (10,0 г, 58,8 ммоль) в толуоле (196 мл) добавляли этиленгликоль (3,6 мл, 64,6 ммоль) и моногидрат п-толуолсульфоновой кислоты (1,12 г, 5,88 ммоль), и полученный раствор нагревали с обратным холодильником при 150°С. Полученный раствор перемешивали в течение 18 часов. Реакцию гасили путем добавления к реакционному раствору насыщенного раствора бикарбоната натрия, и полученный раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (12,3 г, 57,4 ммоль, 98%) в виде бесцветного маслянистого соединения.
1H-ЯМР (400 МГц, CDCl3) δ: 1,25 (3H, т, J=7,2 Гц), 1,51-1,61 (2H, м), 1,75-1,86 (4H, м), 1,90-1,98 (2H, м), 2,29-2,38 (1H, с), 3,95 (4H, с), 4,13 (2H, кв, J=7,2 Гц).
ESI-MS: m/z=215 (M+H)+.
(Ссылочный Пример 84)
Этил 8-(бензилоксиметил)-1,4-диоксаспиро[4.5]декан-8-карбоксилат

К раствору этил 1,4-диоксаспиро[4.5]декан-8-карбоксилата (Ссылочный Пример 83) (500 мг, 2,33 ммоль) в тетрагидрофуране (7,8 мл) при -78°С добавляли 0,5М бис(триметилсилил)амид калия (раствор в толуоле, 4,67 мл, 2,33 ммоль), и полученный раствор перемешивали в течение 20 минут. После чего добавляли бензилхлорметиловый эфир (0,379 мл, 2,45 ммоль), и полученный раствор перемешивали при -78°С в течение 30 минут и при комнатной температуре в течение 1,5 часов. К реакционному раствору добавляли насыщенный водный раствор хлорида аммония, и полученный раствор экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. К остатку добавляли 3М водный раствор гидроксида натрия (1,0 мл), и полученный раствор перемешивали в течение 4 часов. Реакционный раствор экстрагировали простым эфиром, и органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (279 мг, 0,834 ммоль, 36%) в виде бесцветного маслянистого соединения.
1H-ЯМР (400 МГц, CDCl3) δ: 1,24 (3H, т, J=7,2 Гц), 1,52-1,68 (6H, м), 2,16-2,23 (2H, м), 3,46 (2H, с), 3,88-3,96 (4H, м), 4,17 (2H, кв, J=7,2 Гц), 4,49 (2H, с), 7,25-7,39 (5H, м).
ESI-MS: m/z=335 (M+H)+.
(Ссылочный Пример 85)
(8-(Бензилоксиметил)-1,4-диоксаспиро[4.5]декан-8-ил)метанол

К раствору этил 8-(бензилоксиметил)-1,4-диоксаспиро[4.5]декан-8-карбоксилата (Ссылочный Пример 84) (279 г, 0,834 ммоль) в тетрагидрофуране (4,2 мл) добавляли боргидрид лития (91,0 мг, 4,17 ммоль) при перемешивании с охлаждением льдом, и полученный раствор перемешивали при 70°С в течение 4 часов. Реакцию гасили путем добавления к реакционному раствору водного раствора хлорида аммония, и полученный раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (183 мг, 0,625 ммоль, 75%) в виде бесцветного маслянистого соединения.
1H-ЯМР (400 МГц, CDCl3) δ: 1,48-1,66 (8H, м), 2,76 (1H, т, J=6,0 Гц), 3,43 (2H, с), 3,60 (2H, д, J=6,0 Гц), 3,91-3,95 (4H, м), 4,52 (2H, с), 7,27-7,38 (5H, м).
ESI-MS: m/z=293 (M+H)+.
(Ссылочный Пример 86)
8-(Бензилоксиметил)-1,4-диоксаспиро[4.5]декан-8-карбальдегид

К раствору (8-(бензилоксиметил)-1,4-диоксаспиро[4.5]декан-8-ил)метанола (Сравнительный Пример 85) (183 г, 0,625 ммоль) в диметилсульфоксиде (2,1 мл) добавляли 50% трехокисно серно-пиридиновый комплекс (596 мг, 1,87 ммоль) и триэтиламин (0,522 мл, 3,75 ммоль), и полученный раствор перемешивали при комнатной температуре в течение 20 минут. Реакцию гасили путем добавления к реакционному раствору воды, и полученный раствор экстрагировали этилацетатом. Органический слой промывали последовательно 20% водным раствором лимонной кислоты, насыщенным раствором бикарбоната натрия и солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (172 мг, 0,592 ммоль, 95%) в виде бесцветного маслянистого соединения.
1H-ЯМР (400 МГц, CDCl3) δ: 1,55-1,67 (6H, м), 2,03-2,11 (2H, м), 3,45 (2H, с), 3,90-3,95 (4H, м), 4,47 (2H, с), 7,25-7,36 (5H, м), 9,60 (1H, с).
ESI-MS: m/z=291 (M+H)+.
(Ссылочный Пример 87)
8-(Бензилоксиметил)-8-этинил-1,4-диоксаспиро[4.5]декан

К раствору 8-(бензилоксиметил)-1,4-диоксаспиро[4.5]декан-8-карбальдегида (Ссылочный Пример 86) (100 мг, 0,344 ммоль) в метаноле (5,2 мл) добавляли карбонат калия (143 мг, 1,03 ммоль) и диметил-1-диазо-2-оксопропилфосфонат (165 мг, 0,861 ммоль) при перемешивании с охлаждением льдом, и полученный раствор перемешивали при комнатной температуре в течение 1 часа. Реакцию гасили путем добавления к реакционному раствору воды, и полученный раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (88,9 мг, 0,310 ммоль, 90%) в виде бесцветного маслянистого соединения.
1H-ЯМР (400 МГц, CDCl3) δ: 1,52-1,71 (4H, м), 1,77-1,85 (2H, м), 1,94-2,04 (2H, м), 2,19 (1H, с), 3,38 (2H, с), 3,89-3,99 (4H, с), 4,61 (2H, с), 7,25-7,37 (5H, м).
ESI-MS: m/z=287 (M+H)+.
(Ссылочный Пример 88)
3-(8-(Бензилоксиметил)-1,4-диоксаспиро[4.5]декан-8-ил)-1-(п-толил)пропин-1-ол

К раствору 8-(бензилоксиметил)-8-этинил-1,4-диоксаспиро[4.5]декана (Ссылочный Пример 87) (393 мг, 1,37 ммоль) в тетрагидрофуране (4,6 мл), при -78°С добавляли 2,6М н-бутиллитий (раствор в н-гексане, 0,555 мл, 1,44 ммоль), и полученный раствор перемешивали в течение 10 минут. Затем добавляли 4-метилбензальдегид (0,178 мл, 1,51 ммоль), и полученному раствору давали постепенно нагреться до комнатной температуры при перемешивании в течение 1 часа. К реакционному раствору добавляли насыщенный водный раствор хлорида аммония, и полученный раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (459 мг, 1,13 ммоль, 82%) в виде бесцветного маслянистого соединения.
1H-ЯМР (400 МГц, CDCl3) δ: 1,62-1,71 (4H, м), 1,79-1,86 (2H, м), 1,92-2,02 (2H, м), 2,23 (1H, шир.с), 2,34 (3H, с), 3,41 (2H, с), 3,89-3,98 (4H, м), 4,59 (2H, м), 5,44 (1H, д, J=5,2 Гц), 7,15 (2H, д, J=8,0 Гц), 7,25-7,35 (5H, м), 7,43 (2H, д, J=8,0 Гц).
ESI-MS: m/z=407 (M+H)+.
(Ссылочный Пример 89)
3-(8-(Бензилоксиметил)-1,4-диоксаспиро[4.5]декан-8-ил)-1-(п-толил)пропин-1-он

К раствору 3-(8-(бензилоксиметил)-1,4-диоксаспиро[4.5]декан-8-ил)-1-(п-толил)пропин-1-ола (Ссылочный Пример 88) (585 мг, 1,44 ммоль) в дихлорметане (7,2 мл) добавляли диоксид магния (625 мг, 7,19 ммоль), и полученный раствор перемешивали при комнатной температуре в течение 13 часов. Реакционный раствор фильтровали через Целит и фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (540 мг, 1,33 ммоль, 93%) в виде бесцветного маслянистого соединения.
1H-ЯМР (400 МГц, CDCl3) δ: 1,71-1,80 (4H, м), 1,97-2,03 (4H, м), 2,41 (3H, с), 3,52 (2H, с), 3,91-4,00 (4H, м), 4,63 (2H, м), 7,21 (2H, д, J=8,0 Гц), 7,25-7,38 (5H, м), 8,03 (2H, д, J=8,0 Гц).
ESI-MS: m/z=405 (M+H)+.
(Ссылочный пример 90)
3-(8-(Бензилоксиметил)-1,4-диоксаспиро[4.5]декан-8-ил)-1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол

К раствору гидрохлорида 4-метоксифенилгидразина (280 мг, 1,60 ммоль) в этаноле (2,7 мл) по каплям добавляли триэтиламин (0,447 мл, 3,20 ммоль), и полученный раствор перемешивали при комнатной температуре в течение 30 минут. К реакционному раствору по каплям добавляли раствор 3-(8-(бензилоксиметил)-1,4-диоксаспиро[4.5]декан-8-ил)-1-(п-толил)пропин-1-она (Ссылочный Пример 89) (540 мг, 1,33 ммоль) в этаноле (2,7 мл), и полученный раствор перемешивали при комнатной температуре в течение 14 часов. После чего реакционный раствор концентрировали при пониженном давлении. К остатку добавляли воду, и продукт реакции экстрагировали этилацетатом. Органический слой промывали 1М соляной кислотой, дистиллированной водой и солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (458 мг, 0,872 ммоль, 65%) в виде белого аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,64-1,72 (2H, м), 1,76-1,85 (2H, м), 1,89-1,98 (2H, м), 2,27-2,35 (5H, м), 3,50 (2H, с), 3,80 (3H, с), 3,90-3,99 (4H, м), 4,49 (2H, с), 6,38 (1H, с), 6,80-6,85 (2H, м), 7,06-7,31 (11H, м).
ESI-MS: m/z=525 (M+H)+.
(Ссылочный Пример 91)
4-(Бензилоксиметил)-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-1-он
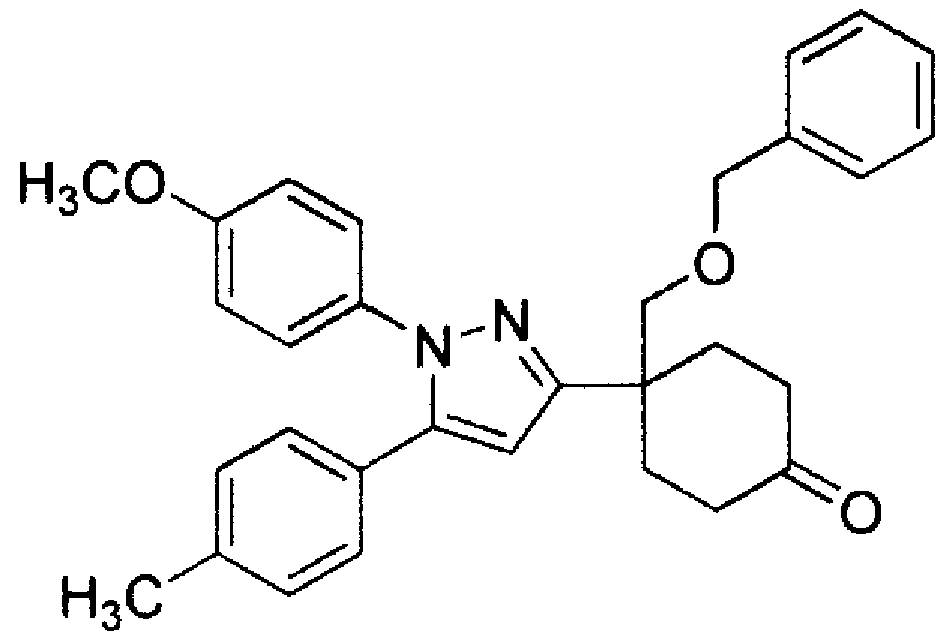
К раствору 3-(8-(бензилоксиметил)-1,4-диоксаспиро[4.5]декан-8-ил)-1-(4-метоксифенил)-5-(п-толил)-1Н-пиразола (Ссылочный Пример 90) (458 мг, 0,872 ммоль) в тетрагидрофуране (2,2 мл), добавляли 6М соляную кислоту (4,4 мл), и полученный раствор перемешивали при комнатной температуре в течение 15 часов. Реакционный раствор охлаждали на льду и по каплям при 0°С к нему добавляли 50% водный раствор гидроксида натрия, пока он не становился щелочным. После чего полученный раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (387 мг, 0,804 ммоль, 92%) в виде белого аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 2,11-2,21 (2H, м), 2,31-2,39 (5H, м), 2,52-2,68 (4H, м), 3,57 (2H, с), 3,81 (3H, с), 4,51 (2H, с), 6,44 (1H, с), 6,83-6,88 (2H, м), 7,08-7,34 (11H, м).
ESI-MS: m/z=481 (M+H)+.
(Ссылочный Пример 92)
8-(4,5-(Бис(4-метоксифенил)оксазол)2-ил)-1,4-диоксаспиро[4.5]декан-8-ол

К раствору 2-хлор-1,4-бис(4-метоксифенил)оксазола (1,01 г, 3,20 ммоль), который синтезировали известным способом получения (WO2007111323), в тетрагидрофуране (32 мл), при 0°С добавляли 1,09М боран-тетрагидрофурановый комплекс (4,0 мл, 4,36 ммоль), и полученный раствор перемешивали при той же температуре в течение 1 часа. К реакционному раствору при -78°С добавляли 2,66М н-бутиллитий (1,47 мл, ммоль), и полученный раствор перемешивали при той же температуре в течение 1 часа. К реакционному раствору добавляли 1,4-циклогександионмоноэтиленкеталь (524 мг, 3,36 ммоль), и полученный раствор оставляли для постепенного нагрева до комнатной температуры при перемешивании. К реакционному раствору добавляли 1М соляную кислоту для подкисления смеси, и полученный раствор экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (844 мг, 1,92 ммоль, 60%) в виде светло-желтого аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,71-1,80 (2H, м), 2,01-2,11 (4H, м), 2,30-2,41 (2H, м), 2,76 (1H, с), 3,83 (3H, с), 3,84 (3H, с), 3,99 (4H, дд, J=Гц), 6,89 (2H, д, J=8,8 Гц), 6,90 (2H, д, J=8,8 Гц), 7,50 (2H, д, J=8,8 Гц), 7,56 (2H, д, J=8,8 Гц).
(Ссылочный Пример 93)
1,4-Диоксаспиро[4.5]декан-8-карбоксамид

К раствору 1,4-диоксаспиро[4.5]декан-8-карбоновой кислоты (823 мг, 4,42 ммоль) в тетрагидрофуране (22 мл) при 0°С добавляли триэтиламин (5,87 мл, 42,1 ммоль) и н-пропилхлорформиат, и полученный раствор перемешивали при той же температуре в течение 1 часа. После добавления по каплям полученный раствор перемешивали при комнатной температуре в течение 30 минут. К реакционному раствору добавляли 28% водный раствор аммиака (1,5 мл), и полученный раствор перемешивали при комнатной температуре в течение 1 часа. Органический слой отделяли от реакционного раствора, сушили над сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (694 мг, 3,75 ммоль, 85%) в виде бесцветного аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,53-1,61 (2H, м), 1,72-1,86 (4H, м), 1,91-1,98 (2H, м), 2,17-2,25 (1H, м), 3,95 (4H, с), 5,29 (1H, шир.с), 5,46 (1H, шир.с).
ESI-MS: m/z=186 (M+H)+.
(Ссылочный Пример 94)
1,4-Диоксаспиро[4.5]декан-8-карботиоамид

К раствору 1,4-диоксаспиро[4.5]декан-8-карбоксамида (Ссылочный Пример 93) (281 мг, 1,52 ммоль) в толуоле (5 мл) добавляли реагент Лоуссона (337 мг, 0,834 ммоль), и полученный раствор перемешивали при 100°С в течение 1 часа, перед его охлаждением до комнатной температуры. К реакционному раствору добавляли метанол, и полученный раствор концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (147 мг, 0,730 ммоль, 48%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,57-1,66 (2H, м), 1,79-1,90 (4H, м), 1,97-2,03 (2H, м), 2,64-2,72 (1H, м), 3,96 (4H, с), 6,89 (1H, шир.с), 7,46 ( 1H, шир.с).
ESI-MS: m/z=202 (M+H)+.
(Ссылочный Пример 95)
8-(4-(4-Метоксифенил)-5-(п-толил)-тиазол-2-ил)-1,4-диоксаспиро[4.5]декан

Раствор 1,4-диоксаспиро[4.5]декан-8-карботиоамида (Ссылочный Пример 94) (389 мг, 1,93 ммоль) и 2-бром-1-(4-метоксифенил)-2-(п-толил)этанона (588 мг, 1,84 ммоль) в ацетонитриле (9,2 мл) перемешивали при комнатной температуре в течение 4 часов. К реакционному раствору добавляли насыщенный водный раствор бикарбоната натрия, и полученный раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (630 мг, 1,49 ммоль, 81%) в виде бесцветного аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,68-1,76 (2H, м), 1,88-1,98 (4H, м), 2,18-2,24 (2H, м), 2,35 (3H, с), 3,05-3,13 (1H, м), 3,80 (3H, с), 3,99 (4H, с), 6,79-6,82 (2H, м), 7,11 (2H, д, J=8,0 Гц), 7,22 (2H, д, J=8,0 Гц), 7,43-7,46 (2H, м).
ESI-MS: m/z=422 (M+H)+.
(Ссылочный Пример 96)
8-(4-(4-Метоксифенил)-5-(п-толил)тиазол-2-ил)-1,4-диоксаспиро[4.5]декан-8-ол

К раствору 8-(4-(4-метоксифенил)-5-(п-толил)тиазол-2-ил)-1,4-диоксаспиро[4.5]декана (Ссылочный Пример 95) (734 мг, 1,74 ммоль) в тетрагидрофуране (8,7 мл) при -78°С добавляли 1,63М н-бутиллитий/раствор в н-гексане (1,17 мл), и полученный раствор перемешивали при той же температуре в течение 1 часа. Реакционный раствор при -78°С добавляли к раствору 3-фенил-2-(фенилсульфонил)-1,2-оксазиридина (546 мг, 2,09 ммоль) в тетрагидрофуране (8,7 мл), и полученный раствор оставляли для постепенного нагрева до комнатной температуры при перемешивании. К реакционному раствору добавляли дистиллированную воду, и полученный раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (417 мг, 0,954 ммоль, 55%) в виде бесцветного аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,73-1,79 (2H, м), 2,03-2,10 (4H, м), 2,32-2,39 (2H, м), 2,37 (3H, с), 2,78 (1H, с), 3,84 (3H, с), 3,97-4,02 (4H, м), 6,88-6,92 (2H, м), 7,16 (2H, д, J=8,4 Гц), 7,47 (2H, д, J=8,4 Гц), 7,55-7,58 (2H, м).
ESI-MS: m/z=438 (M+H)+.
(Ссылочный Пример 97)
Ацетат 4-гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-цис-циклогексил 2-бензилоксикарбониламино

К раствору 1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-цис-1,4-диола (Пример 2-В) (76,0 мг, 0,201 ммоль) в дихлорметане (2,00 мл) при комнатной температуре добавляли триэтиламин (0,084 мл, 0,60 ммоль), 2-бензилоксикарбониламиноуксусную кислоту (46,2 мг, 0,241 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (46,2 мг, 0,241 ммоль) и 1-гидроксибензотриазол (15,4 мг, 0,100 ммоль), и полученный раствор перемешивали в течение 20 часов. К реакционному раствору добавляли дистиллированную воду, и полученный раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (33,2 мг, 0,058 ммоль, 29%) в виде бесцветного аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,91-2,07 (8H, м), 2,33 (3H, с), 2,75 (1H, с), 3,80 (3H, с), 3,98-3,99 (2H, м), 4,89-4,94 (1H, м), 5,14 (2H, с), 5,33-5,35 (1H, м), 6,36 (1H, с), 6,82-6,86 (2H, м), 7,08-7,10 (4H, м), 7,17-7,21 (2H, м), 7,29-7,38 (5H, м).
ESI-MS: m/z=552 (M-OH)+.
(Ссылочный Пример 98)
(S)-4-Гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-цис-циклогексил 2-(бензилоксикарбониламино)-3-метилбутаноат синтезировали тем же способом, как описано в Ссылочном Примере 97.

1H-ЯМР (400 МГц, CDCl3) δ: 0,92 (3H, д, J=6,4 Гц), 0,99 (3H, д, J=6,4 Гц), 1,89-2,10 (8H, м), 2,16-2,24 (1H, м), 2,34 (3H, с), 2,63 (1H, с), 3,81 (3H, с), 4,30-4,33 (1H, м), 4,88-4,95 (1H, м), 5,12 (2H, с), 5,28-5,30 (1H, м), 6,36 (1H, с), 6,78-6,82 (2H, м), 7,09-7,10 (4H, м), 7,18-7,24 (2H, м), 7,29-7,38 (5H, м).
ESI-MS: m/z=594 (M-OH)+.
(Ссылочный Пример 99)
(S)-4-Гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексил)метил 2-(бензилоксикарбониламино)-3-метилбутаноат

К раствору 1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-цис-1,4-диола (Пример 2-В) (199 мг, 0,506 ммоль) в дихлорметане (3,00 мл) при комнатной температуре добавляли молекулярные сита 4А (300 мг) и диизопропилэтиламин (0,210 мл, 1,21 ммоль), и полученный раствор охлаждали до -50°С. При той же температуре последовательно добавляли (S)-йодометил 2-бензилоксикарбониламино-3-метилбутаноат (0,187 мл, 1,26 мммоль) и трифторметансульфонат серебра (232 мг, 0,904 ммоль), и полученный раствор перемешивали в течение 2 часов. После чего полученный раствор перемешивали при -30°С в течение 14 часов. К реакционному раствору добавляли насыщенный раствор бикарбоната натрия, и полученный раствор фильтровали через Целит. Фильтрат промывали солевым раствором, и органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (123 мг, 0,192 ммоль, 64%) в виде бесцветного аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 0,92 (3H, д, J=6,4 Гц), 1,01 (3H, д, J=6,4 Гц), 1,88-1,99 (6H, м), 2,02-2,09 (2H, м), 2,20-2,26 (1H, м), 2,34 (3H, с), 2,50 (1H, с), 3,66-3,72 (1H, м), 3,81 (3H, с), 4,32-4,36 (1H, м), 5,12 (2H, с), 5,38 (1H, д, J=6,4 Гц), 5,50 (1H, д, J=6,4 Гц), 6,37 (1H, с), 6,83-6,87 (2H, м), 7,08-7,11 (4H, м), 7,18-7,24 (2H, м), 7,29-7,38 (5H, м).
ESI-MS: m/z=624 (M-OH)+.
(Ссылочный Пример 100)
Дибензил 4-гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-цис-циклогексилфосфат
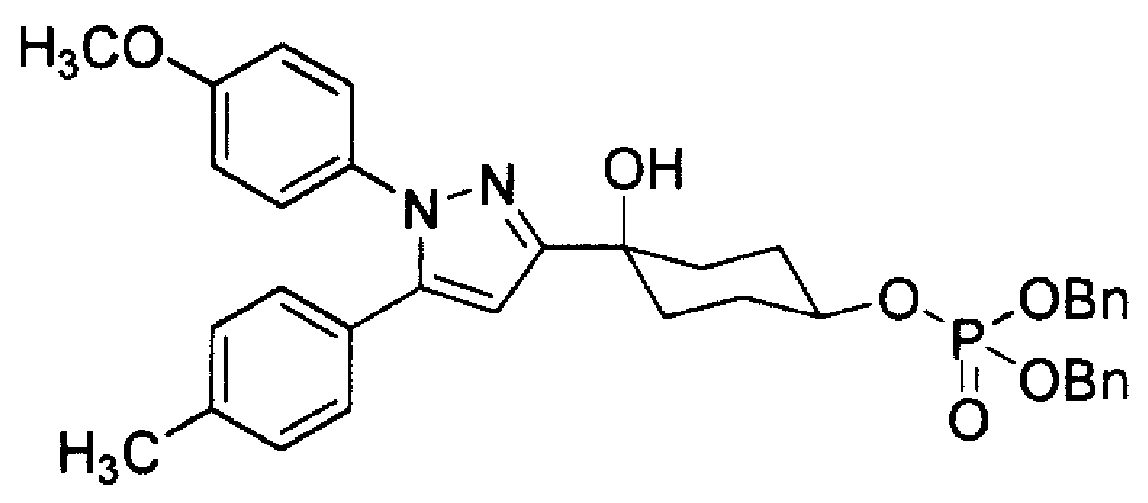
К раствору 1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-цис-1,4-диола (Пример 2-В) (200 мг, 0,528 ммоль) в тетрагидрофуране (2,6 мл) последовательно добавляли 55% гидрид натрия (55,3 мг, 1,27 ммоль) и тетрабензилпирофосфонат (370 мг, 0,687 ммоль) при перемешивании с охлаждением льдом, и полученный раствор перемешивали при комнатной температуре в течение 15 часов. Реакционный раствор охлаждали на льду и к нему добавляли воду. Полученный раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (251 мг, 0,393 ммоль, 74%) в виде бесцветного прозрачного маслянистого соединения.
1H-ЯМР (400 МГц, CDCl3) δ: 1,87-2,11 (8H, м), 2,33 (3H, с), 3,79 (3H, с), 4,42-4,51 (1H, м), 5,00-5,12 (4H, м), 6,34 (1H, с), 6,81-6,87 (2H, м), 7,09 (4H, с), 7,16-7,23 (2H, м), 7,29-7,37 (10H, м).
ESI-MS: m/z=639 (M+H)+.
Что касается соединений настоящего изобретения, то были синтезированы соединения следующих Примеров 1-71 и Сравнительных Примеров 1-30. В качестве соединений, используемых для синтеза соединений Примеров, для которых способ синтеза не описывается, использовались промышленно доступные соединения.
(Пример 1)
1-(1-(4-Метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексанол

К суспензии 4-метоксифенилгидразина (165 мг, 0,944 ммоль) в этаноле (5,0 мл) добавляли триэтиламин (258 мкл, 1,88 ммоль), и полученный раствор перемешивали при комнатной температуре в течение 30 минут. Полученный раствор добавляли к раствору 3-(1-гидроксициклогексил)-1-(4-толил)-2-пропин-1-она (Ссылочный Пример 14) (214 мг, 0,883 ммоль) в этаноле (3,0 мл), и полученный раствор перемешивали при комнатной температуре в течение 20 часов. Реакционный раствор концентрировали при пониженном давлении и к остатку добавляли дистиллированную воду. Полученный раствор экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (141 мг, 0,389 ммоль, 44%) в виде желтого аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,31-1,42 (1H, м), 1,54-2,03 (9H, м), 2,33 (3H, с), 2,52 (1H, шир.с), 3,81 (3H, с), 6,40 (1H, с), 6,84 (2H, д, J=8,8 Гц), 7,09 (4H, с), 7,21 (2H, д, J=8,8 Гц).
(Пример 2)
1-(1-(4-Метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-транс-1,4-диол (2-А)

1-(1-(4-Метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-цис-1,4-диол (2-В)

К раствору 4-гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-1-она (Пример 37) (8,00 г, 21,3 ммоль) в метаноле (200 мл) добавляли боргидрид натрия (804 мг, 21,3 ммоль). Полученный раствор перемешивали при комнатной температуре в течение 2 часов, а затем вливали в 1М соляную кислоту. Реакционный раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение 2-А (1,66 г, 4,39 ммоль, 21%) в виде белого твердого вещества, и соединение 2-В (4,85 г, 12,8 ммоль, 60%) в виде белого твердого вещества.
2-A:1H-ЯМР (400 МГц, CDCl3) δ: 1,36 (1H, д, J=3, 6 Гц), 1,64-1,72 (2H, м), 1,77-1,83 (2H, м), 2,04-2,12 (2H, м), 2,32-2,39 (5H, м), 2,56 (1H, с), 3,81 (3H, с), 4,03-4,06 (1H, м), 6,43 (1H, с), 6,85 (2H, д, J=8,8 Гц), 7,10 (4H, с), 7,21 (2H, д, J=8,8 Гц).
IR (KBr, см-1): 3344, 2929, 2875, 1740, 1516, 1443, 1369, 1251, 1032, 1001, 832.
ESI-MS: m/z=379 (M+H)+.
Т.пл. 151-153°C.
Анал. вычислено для C23H26N2O3: C, 72,99; H, 6,92; N, 7,40, найдено: C, 72,97; H, 6,92; N, 7,34.
2-B:1H-ЯМР (400 МГц, CDCl3) δ: 1,44 (1H, с), 1,81-1,99 (6H, м), 2,04-2,12 (2H, м), 2,33 (3H, с), 2,56 (1H, с), 3,70-3,77 (1H, м), 3,80 (3H, с), 6,37 (1H, с), 6,85 (2H, д, J=8,8 Гц), 7,09 (4H, с), 7,20 (2H, д, J=8,8 Гц).
IR (KBr, см-1): 3303, 2918, 1517, 1442, 1366, 1248, 1063, 1026, 837, 807.
ESI-MS: m/z=379 (M+H)+.
Т.пл. 164-166°C.
Анал. вычислено для C23H26N2O3: C, 72,99; H, 6,92; N, 7,40, найдено: C, 72,87; H, 6,86; N, 7,22.
(Пример 3)
1-(1-(4-Метоксифенил)-5-(6-метилпиридин-3-ил)-1Н-пиразол-3-ил)циклогексан-цис-1,4-диол

К раствору 4-гидрокси-4-(1-(4-метоксифенил)-5-(6-метилпиридин-3-ил)-1Н-пиразол-3-ил)циклогексан-1-она (Пример 38) (109,5 мг, 0,29 ммоль) в метаноле (1,5 мл) добавляли боргидрид натрия (12,1 мг, 0,32 ммоль). Полученный раствор перемешивали при комнатной температуре в течение 40 минут, и затем к нему добавляли 1М соляную кислоту. Реакционный раствор промывали этилацетатом, и водный слой подщелачивали 1М водным раствором гидроксида натрия, с последующим экстрагированием полученной смеси дважды этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, этилацетат), получая указанное в заголовке соединение (30,6 мг, 0,81 ммоль, 28%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,59 (1H, шир.с), 1,81-2,00 (6H, м), 2,05-2,08 (2H, м), 2,55 (3H, с), 2,61 (1H, с), 3,71-3,78 (1H, м), 3,81 (3H, с), 6,46 (1H, с), 6,86 (2H, д, J=8,8 Гц), 7,06 (1H, д, J=8,0 Гц), 7,18 (2H, д, J=8,8 Гц), 7,32 (1H, дд, J=2,0, 8,0 Гц), 8,40 (1H, д, J=2,0 Гц).
IR (KBr, см-1): 3444, 2933, 2858, 1516, 1249, 1067, 968, 839.
ESI-MS: m/z=380 (M+H)+.
(Пример 4)
1-(1,5-Бис(4-метоксифенил)-1Н-пиразол-3-ил)циклогексан-транс-1,4-диол (4-А)

1-(1,5-Бис(4-метоксифенил)-1Н-пиразол-3-ил)циклогексан-цис-1,4-диол (4-В)
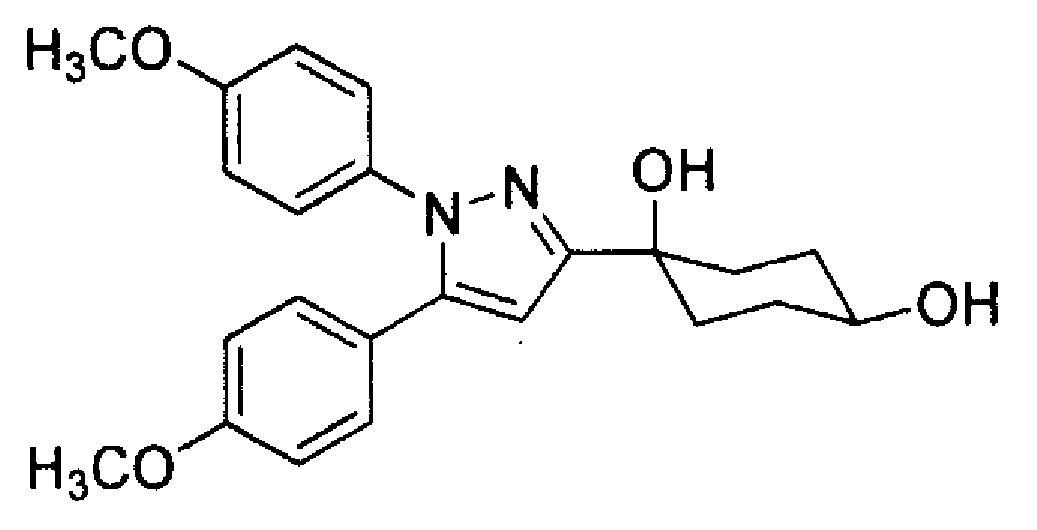
К раствору 4-(1,5-бис(4-метоксифенил)-1Н-пиразол-3-ил)-4-гидроксициклогексан-1-она (Пример 39) (523 мг, 1,38 ммоль) в метаноле добавляли боргидрид натрия (65 мг, 1,7 ммоль). Полученный раствор перемешивали при комнатной температуре в течение 1,5 часов и концентрировали при пониженном давлении. К остатку добавляли дистиллированную воду, и полученный раствор экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии для разделения на низкополярный компонент и высокополярный компонент. Низкополярный компонент очищали с помощью перекристаллизации (этилацетат/н-гексан = 2/1), получая указанное в заголовке соединение 4-А (79 мг, 0,20 ммоль, 14%) в виде белых кристаллов. Высокополярный компонент очищали с помощью перекристаллизации (этилацетат/н-гексан = 2/1), получая указанное в заголовке соединение 4-В (186 мг, 0,471 ммоль, 34%) в виде белых кристаллов.
4-A:1H-ЯМР (400 МГц, CDCl3) δ: 1,33 (1H, д, J=3,4 Гц), 1,63-1,73 (2H, м), 1,75-1,84 (2H, м), 2,03-2,13 (2H, м), 2,30-2,39 (2H, м), 2,5 (1H, с), 3,80 (3H, с), 3,81 (3H, с), 4,02-4,08 (1H, м), 6,40 (1H, с), 6,82 (2H, д, J=8,8 Гц), 6,85 (2H, д, J=8,8 Гц), 7,14 (2H, д, J=8,8 Гц), 7,21 (2H, д, J=8,8 Гц).
IR (KBr, см-1): 3379, 1613, 1517, 1503, 1251, 1180, 1032, 1001, 835.
ESI-MS: m/z=395 (M+H)+.
4-B:1H-ЯМР (400 МГц, CDCl3) δ: 1,41 (1H, д, J=4,1 Гц), 1,79-2,55 (8H, м), 2,55 (1H, с), 3,69-3,78 (1H, м), 3,80 (3H, с), 3,81 (3H, с), 6,34 (1H, с), 6,81 (2H, д, J=8,8 Гц), 6,85 (2H, д, J=8,8 Гц), 7,13 (2H, д, J=8,8 Гц), 7,20 (2H, д, J=8,8 Гц).
IR (KBr, см-1): 3385, 1613, 1517, 1503, 1250, 1064, 1031, 970, 835.
ESI-MS: m/z=395 (M+H)+.
(Пример 5)
1-(5-(4-Хлорфенил)-1-(4-метоксифенил)-1Н-пиразол-3-ил)циклогексан-транс-1,4-диол (5-А)

1-(5-(4-Хлорфенил)-1-(4-метоксифенил)-1Н-пиразол-3-ил)циклогексан-цис-1,4-диол (5-В)

К раствору 4-(5-(4-хлорфенил)-1-(4-метоксифенил)-1Н-пиразол-3-ил)-4-гидроксициклогексан-1-она (Пример 40) (619 мг, 1,56 ммоль) в метаноле (15,6 мл) добавляли боргидрид натрия (59,0 мг, 1,56 ммоль). Полученный раствор перемешивали при комнатной температуре в течение 1 часа, а затем вливали в 1М соляную кислоту. Реакционный раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанные в заголовке соединение 5-А (131 мг, 0,328 ммоль, 21%) в виде белого твердого вещества и соединение 5-В (291 мг, 0,730 ммоль, 47%) в виде белого твердого вещества.
5-A:1H-ЯМР (400 МГц, CDCl3) δ: 1,32 (1H, д, J=3,2 Гц), 1,63-1,73 (2H, м), 1,76-1,84 (2H, м), 2,03-2,12 (2H, м), 2,30-2,39 (2H, м), 2,50 (1H, с), 3,82 (3H, с), 4,02-4,09 (1H, м), 6,46 (1H, с), 6,84-6,87 (2H, м), 7,14 (2H, д, J=8,8 Гц), 7,19 (2H, д, J=8,8 Гц), 7,26-7,28 (2H, м).
ESI-MS: m/z=399 (M+H)+.
5-B:1H-ЯМР (400 МГц, CDCl3) δ: 1,41 (1H, д, J=5,2 Гц), 1,82-2,09 (8H, м), 2,49 (1H, с), 3,70-3,78 (1H, с), 3,82 (3H, с), 6,41 (1H, с), 6,85-6,87 (2H, м), 7,13 (2H, д, J=8,4 Гц), 7,18 (2H, д, J=8,4 Гц), 7,25-7,27 (2H, м).
ESI-MS: m/z=399 (M+H)+.
(Пример 6)
1-(1-(4-Хлорфенил)-5-п-толил-1Н-пиразол-3-ил)циклогексан-транс-1,4-диол (6-А)

1-(1-(4-Хлорфенил)-5-п-толил-1Н-пиразол-3-ил)циклогексан-цис-1,4-диол (6-В)

К раствору 4-гидрокси-4-(1-(4-хлорфенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-1-она (Пример 41) (510 мг, 1,34 ммоль) в метаноле (13 мл) добавляли боргидрид натрия (53 мг, 1,40 ммоль), и полученный раствор перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении, а затем растворяли в этилацетате и промывали дистиллированной водой и солевым раствором. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение 6-А (114 мг, 0,298 ммоль, 22%) в виде белого твердого вещества и соединение 6-В (360 мг, 0,940 ммоль, 70%) в виде белого твердого вещества.
6-A:1H-ЯМР (400 МГц, CDCl3) δ: 1,36 (1H, шир), 1,65-1,72 (2H, м), 1,77-1,82 (2H, м), 2,04-2,11 (2H, м), 2,31-2,38 (2H, м), 2,36 (3H, с), 2,51 (1H, с), 4,03-4,08 (1H, м), 6,44 (1H, с), 7,10 (2H, д, J=8,8 Гц), 7,13 (2H, д, J=8,8 Гц), 7,22-7,30 (4H, м),
IR (KBr, см-1): 3349, 2918, 1497, 1440, 1366, 1240, 1098, 1007, 969, 833, 810.
ESI-MS: m/z=383 (M+H)+.
6-B:1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (1H, шир), 1,80-1,99 (6H, м), 2,03-2,07 (2H, м), 2,35 (3H, с), 2,51 (1H, с), 3,70-3,80 (1H, м), 6,39 (1H, с), 7,09 (2H, д, J=8,4 Гц), 7,13 (2H, д, J=8,4 Гц), 7,21-7,24 (2H, м), 7,27-7,31 (2H, м).
IR (KBr, см-1): 3365, 2946, 1496, 1442, 1368, 1241, 1095, 1059, 1014, 970, 887.
ESI-MS: m/z=365 (М-ОН)+.
Соединения следующих Примеров были получены с помощью той же процедуры, как описано выше.
(Пример 37)
4-Гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-1-он

К раствору 8-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-1,4-диоксаспиро[4.5]декан-8-ола (Ссылочный Пример 30) (14,6 г, 34,7 ммоль) в тетрагидрофуране (69,4 мл) добавляли 6М соляную кислоту (138,9 мл), и полученный раствор перемешивали при комнатной температуре в течение 15 часов. Реакционный раствор охлаждали на льду, и по каплям, при 0°С добавляли 50% водный раствор гидроксида натрия, пока он не становился щелочным. После чего полученный раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью перекристаллизации (н-гексан/этилацетат, 70°С), получая указанное в заголовке соединение (10,5 г, 27,9 ммоль, 80%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,33-2,43 (9H, м), 2,87-2,95 (3H, м), 3,82 (3H, с), 6,39 (1H, с), 6,86 (2H, д, J=8,8 Гц), 7,10 (4H, с), 7,22 (2H, д, J=8,8 Гц).
IR (KBr, см-1): 3321, 2929, 1712, 1518, 1463, 1299, 1249, 1179, 1114, 1027, 961, 821.
ESI-MS: m/z=377 (M+H)+.
(Пример 38)
4-Гидрокси-4-(1-(4-метоксифенил)-5-(6-метилпиридин-3-ил)-1Н-пиразол-3-ил)циклогексан-1-он

К раствору 8-(1-(4-метоксифенил)-5-(6-метилпиридин-3-ил)-1Н-пиразол-3-ил)-1,4-диоксаспиро[4.5]декан-8-ола (Ссылочный Пример 31) (128,8 мг, 0,30 ммоль) в тетрагидрофуране (0,6 мл) добавляли 6М соляную кислоту (1,2 мл), и полученный раствор перемешивали при комнатной температуре в течение 3 часов. Реакционный раствор охлаждали на льду, и по каплям, при 0°С добавляли 50% водный раствор гидроксида натрия, пока он не становился щелочным. После чего полученный раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (109,5 мг, 0,29 ммоль, 96%) в виде аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 2,34-2,44 (6H, м), 2,55 (3H, с), 2,87-2,95 (2H, м), 3,18 (1H, с), 3,82 (3H, с), 6,49 (1H, с), 6,87 (2H, д, J=8,8 Гц), 7,08 (1H, д, J=8,1 Гц), 7,19 (2H, д, J=8,8 Гц), 7,35 (1H, дд, J=2,2, 8,1 Гц), 8,40 (1H, д, J=2,2 Гц).
ESI-MS: m/z=378 (M+H)+.
(Пример 39)
4-(1,5-Бис(4-метоксифенил)-1Н-пиразол-3-ил)-4-гидроксициклогексан-1-он

К раствору 8-(1,5-бис(4-метоксифенил)-1Н-пиразол-3-ил)-1,4-диоксаспиро[4.5]декан-8-ола (Ссылочный Пример 32) (658 мг, 1,50 ммоль) в тетрагидрофуране (3,75 мл) при 0°С добавляли 6М соляную кислоту (7,5 мл), и полученный раствор перемешивали при комнатной температуре в течение 5 часов. Реакционный раствор нейтрализовали путем вливания в охлажденный льдом 10% водный раствор гидроксида натрия. Полученный раствор подщелачивали путем добавления насыщенного раствора бикарбоната натрия и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (523 мг, 1,33 ммоль, 89%) в виде аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 2,30-2,45 (6H, м), 2,86-2,96 (2H, м), (1H, с), 3,80 (3H, с), 3,82 (3H, с), 6,36 (1H, с), 6,82 (2H, д, 8 Гц), 6,87 (2H, д, J=8,8 Гц), 7,13 (2H, д, J=8,8 Гц), 7,21 (2H, J=8,8 Гц).
ESI-MS: m/z=393 (M+H)+.
(Пример 40)
4-(5-(4-Хлорфенил)-1-(4-метоксифенил)-1Н-пиразол-3-ил)гидроксициклогексан-1-он

К раствору 8-(5-(4-Хлорфенил)-1-(4-метоксифенил)-1Н-пиразол-3-ил)-1,4-диоксаспиро[4.5]декан-8-ола (Ссылочный Пример 33) (756 мг, 1,71 ммоль) в тетрагидрофуране (4,3 мл) добавляли 6М соляную кислоту (8,6 мл), и полученный раствор перемешивали при комнатной температуре в течение 15 часов. Реакционный раствор охлаждали на льду, и по каплям, при 0°С добавляли 50% водный раствор гидроксида натрия, пока он не становился щелочным. После чего полученный раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (619 мг, 1,56 ммоль, 91%) в виде аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 2,31-2,45 (6H, м), 2,85-2,98 (3H, м), 3,82 (3H, с), 6,43 (1H, с), 6,86-6,90 (2H, м), 7,14 (2H, д, J=8,8 Гц), 7,19 (2H, д, J=8,8 Гц), 7,26-7,29 (2H, м).
ESI-MS: m/z=397 (M+H)+.
(Пример 41)
4-Гидрокси-4-(1-(4-хлорфенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-1-он

К раствору 8-(1-(4-Хлорфенил)-5-(п-толил)-1Н-пиразол-3-ил)-1,4-диоксаспиро[4.5]декан-8-ола (Ссылочный Пример 34) (931 мг, 2,19 ммоль) в тетрагидрофуране (5,5 мл) добавляли 6М соляную кислоту (11 мл), и полученный раствор перемешивали при комнатной температуре в течение 15 часов. Реакционный раствор подщелачивали путем вливания в насыщенный водный раствор бикарбоната натрия, и полученный раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (513 мг, 1,35 ммоль, 61%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,32-2,36 (4H, м), 2,36 (3H, с), 2,38-2,44 (2H, м), 2,87-2,95 (2H, м), 2,90 (1H, с), 6,41 (1H, с), 7,10 (2H, д, J=8,0 Гц), 7,14 (2H, д, J=8,0 Гц), 7,23 (2H, д, J=8,8 Гц), 7,31 (2H, д, J=8,8 Гц).
ESI-MS: m/z=381 (M+H)+.
Следующие соединения были получены с помощью той же процедуры, как описано выше.
(Пример 57)
Ацетат с-4-гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-r-1-ила
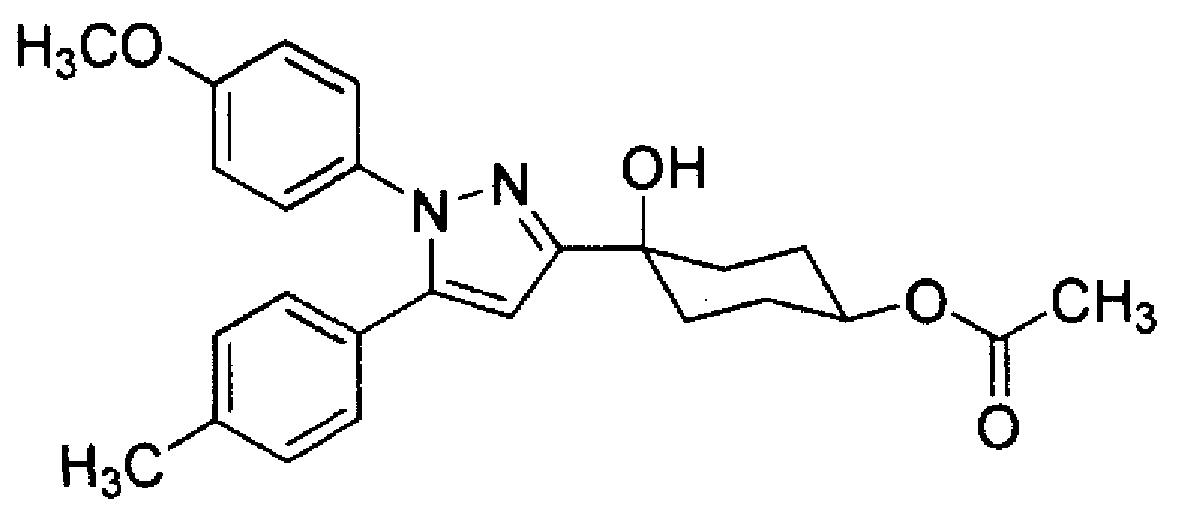
К суспензии 1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-цис-1,4-диола (Пример 2-В) (500 мг, 1,32 ммоль) в дихлорметане (4,4 мл) добавляли уксусный ангидрид (0,312 мл, 3,30 ммоль), пиридин (0,267 мл, 3,30 ммоль) и 4-диметиламинопиридин (16,1 мг, 0,132 ммоль), и полученный раствор перемешивали при комнатной температуре в течение 45 минут. Для гашения реакции к реакционному раствору добавляли воду, и полученный раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (556 мг, 1,32 ммоль, четвертичный) в виде аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,89-2,08 (11H, м), 2,34 (3H, с), 2,64 (1H, шир.с), 3,81 (3H, с), 4,80-4,88 (1H, м), 6,36 (1H, с), 6,85 (2H, д, J=8,8 Гц), 7,00 (4H, с), 7,20 (2H, д, J=8,8 Гц).
ESI-MS: m/z=421 (M+H)+.
(Пример 58)
Ацетат 4-(4-хлор-1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-с-4-гидроксициклогексан-r-1-ила

К раствору ацетата с-4-гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-r-1-ила (Пример 57) (140 мг, 0,333 ммоль) в ацетонитриле (1,66 мл) добавляли N-хлорсукцинимид (49 мг, 0,366 ммоль). Полученный раствор перемешивали при 80°С в течение 15 часов и охлаждали до комнатной температуры. К реакционному раствору добавляли солевой раствор, и полученный раствор экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (67 мг, 0,147 ммоль, 44%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,92-2,04 (6H, м), 2,28-2,36 (8H, м), 3,10 (1H, с), 3,79 (3H, с), 4,85-4,88 (1H, м), 6,80-6,82 (2H, м), 7,11-7,16 (6H, м).
(Пример 59)
1-(4-Хлор-1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-цис-1,4-диол

К раствору ацетата 4-(4-хлор-1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-с-4-гидроксициклогексан-r-1-ила (Пример 58) (67 мг, 0,147 ммоль) в метаноле (1,5 мл) добавляли карбонат калия (102 мг, 0,736 ммоль), и полученный раствор перемешивали при комнатной температуре в течение 2 часов. К реакционному раствору добавляли воду для гашения реакции, и полученный раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (58 мг, 1,140 ммоль, 95%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (1H, с), 1,83-2,05 (6H, м), 2,21-2,23 (2H, м), 2,36 (3H, с), 3,04 (1H, с), 3,76-3,79 (4H, м), 6,79-6,83 (2H, м), 7,11-7,16 (6H, м).
ESI-MS: m/z=395, 397 (M-OH)+.
(Пример 60)
t-4-Фтор-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-r-1-ол

К раствору ацетата с-4-гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-r-1-ила (Пример 57) (100 мг, 0,238 ммоль) в дихлорметане (1,19 мл) добавляли DeoxofluorTM (48 мкл, 0,262 ммоль), и полученный раствор перемешивали при комнатной температуре в течение 15 минут. К реакционному раствору добавляли 1М соляную кислоту, и полученный раствор экстрагировали хлороформом. Органический слой промывали солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении, получая остаток.
К раствору полученного остатка в метаноле (2,4 мл) добавляли карбонат калия (164 мг, 1,18 ммоль), и полученный раствор перемешивали при комнатной температуре в течение 2 часов. К реакционному раствору добавляли воду для гашения реакции, и полученный раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (22,4 мг, 0,058 ммоль, 25%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,37 (1H, м), 1,72-1,77 (2H, м), 2,02-2,14 (4H, м), 2,34 (3H, с), 2,38-2,49 (2H, м), 3,81 (3H, с), 4,11 (1H, м), 6,52 (1H, м), 6,84 (2H, д, J=8,8 Гц), 7,22 (2H, д, J=8,8 Гц), 7,26 (4H, с).
ESI-MS: m/z=381 (M+H)+.
(Пример 61)
4,4-Дифтор-1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексанол

К раствору ацетата 1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-4-оксоциклогексан-1-ила (Ссылочный Пример 81) (110 мг, 0,263 ммоль) в дихлорметане (2,63 мл) добавляли трехфтористую (диметиламино)серу (DAST) (104 мкл, 0,578 ммоль), и полученный раствор перемешивали при комнатной температуре в течение 2 часов. К реакционному раствору добавляли 1М соляную кислоту, и полученный раствор экстрагировали хлороформом. Органический слой промывали солевым раствором, а затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении, получая остаток.
К раствору полученного остатка в тетрагидрофуране (193 мкл) и метаноле (386 мкл) добавляли водный раствор гидроксида натрия (193 мкл, 0,772 ммоль), и полученный раствор перемешивали при комнатной температуре в течение 6 часов. К реакционному раствору добавляли воду для гашения реакции, и полученный раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (41,0 мг, 0,103 ммоль, 39%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,01-2,31 (8H, м), 2,34 (3H, с), 2,77 (1H, с), 3,81 (3H, с), 6,37 (1H, с), 6,86 (2H, д, J=8,8 Гц), 7,10 (4H, с), 7,21 (2H, д, J=8,8 Гц).
ESI-MS: m/z=399 (M+H)+.
(Пример 62)
1-(1-(4-Метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-4-(трифторметил)циклогексан-цис-1,4-диол

К раствору 4-гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексанона (Пример 37) (620 мг, 1,65 ммоль) в тетрагидрофуране (6,60 мл) при 0°С добавляли (трифторметил)триметилсилан (535 мкл, 3,62 ммоль). После чего по каплям к нему добавляли фторид тетра-н-бутиламмония (TBAF, 1М раствор в тетрагидрофуране) (362 мкл, 0,36 ммоль), и полученный раствор перемешивали при комнатной температуре в течение 6 часов. К реакционному раствору добавляли фторид тетра-n-бутиламмония (TBAF, 1М раствор в тетрагидрофуране) (3,29 мл, 3,29 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 1 часа, и затем вливали в 1М соляную кислоту. Реакционный раствор экстрагировали диэтиловым эфиром. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (410 мг, 0,92 ммоль, 56%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,60 (1H, с), 1,87-2,02 (4H, м), 2,09-2,02 (2H, м), 2,34-2,40 (6H, м), 3,82 (3H, с), 6,47 (1H, с), 6,86 (2H, д, J=8,8 Гц), 7,08-7,11 (4H, м), 7,20 (2H, д, J=8,8 Гц).
IR (KBr, см-1): 3402, 2954, 1517, 1463, 1305, 1250, 1249, 1179, 1121, 1056, 1024, 834.
ESI-MS: m/z=447 (M+H)+.
(Пример 63)
4-Метокси-1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексанол

К раствору ацетата с-4-метокси-1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-r-1-ила (Ссылочный Пример 79) (124 мг, 0,284 ммоль) в метаноле (2,8 мл) добавляли карбонат калия (197 мг, 1,42 ммоль), и полученный раствор перемешивали при комнатной температуре в течение 18 часов. К реакционному раствору добавляли воду для гашения реакции, и полученный раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (102 мг, 0,260 ммоль, 91%) в виде белого аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,78-1,88 (2H, м), 1,90-1,99 (4H, м), 2,03-2,09 (2H, м), 2,33 (3H, с), 2,49 (1H, с), 3,24-3,32 (1H, м), 3,39 (3 H, с), 3,81 (3H, с), 6,39 (1H, с), 6,85 (2H, д, J=8,8 Гц), 7,09 (4H, с), 7,20 (2H, д, J=8,8 Гц).
IR (KBr, см-1): 3425, 2937, 1516, 1443, 1369, 1300, 1249, 1171, 1099, 1030, 968, 834, 801.
ESI-MS: m/z=393 (M+H)+.
(Пример 64)
4-Гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-цис-циклогексанкарбоновая кислота

К раствору с-4-гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-цис-циклогексан-r-1-карбальдегида (Ссылочный Пример 82) (124,9 мг, 0,32 ммоль) в т-бутаноле (2,4 мл) добавляли дистиллированную воду (0,8 мл) и 2-метил-2-бутен (101 мкл, 0,96 ммоль), и полученный раствор охлаждали на льду. При 0°С к нему добавляли дигидрофосфат натрия (42,1 мг, 0,35 ммоль) и хлористокислый натрий (72,3 мг, 0,80 ммоль), и полученную смесь перемешивали в течение 5 минут. Смесь нагревалась до комнатной температуры и ее перемешивали в течение 1 часа, а затем охлаждали до 0°С. После чего к ней добавляли водный раствор тиосульфата натрия, и полученную смесь перемешивали. К смеси добавляли 1М соляную кислоту и этилацетат, и полученный раствор экстрагировали. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (116,6 мг, 0,29 ммоль, 93%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,87-2,11 (9H, м), 2,33 (3H, с), 2,40-2,43 (1Н, м), 3,81 (3H, с), 6,38 (1H, с), 6,84 (2H, д, J=9,2 Гц), 7,09-7,09 (4H, м), 7,20 (2H, д, J=9,2 Гц).
IR (KBr, см-1): 3523, 2928, 1706, 1517, 1252, 831.
ESI-MS: m/z=407 (M+H)+.
(Пример 65)
4-(Гидроксиметил)-4-(1-(4-метоксифенил)-5-п-толил-1Н-пиразол-3-ил)-транс-1,4-циклогексанол (65-А)

4-(Гидроксиметил)-4-(1-(4-метоксифенил)-5-п-толил-1Н-пиразол-3-ил)-цис-1,4-циклогексанол (65-В)

К раствору 4-(бензилоксиметил)-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-1-она (Ссылочный Пример 91) (387 мг, 0,804 ммоль) в метаноле (8,0 мл) добавляли боргидрид натрия (30,4 мг, 0,804 ммоль). Полученный раствор перемешивали при комнатной температуре в течение 1 часа, и затем вливали в 1М соляную кислоту. Реакционный раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, получая остаток.
К раствору полученного остатка в метаноле (8,0 мл), в атмосфере водорода добавляли 10% палладий на угле (86,0 мг, 0,080 ммоль), и полученный раствор перемешивали при комнатной температуре в течение 3 часов. Реакционный раствор фильтровали через Целит и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (амин силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение 65-А (51,6 мг, 0,131 ммоль, 16%) в виде белого твердого вещества и указанное в заголовке соединение 65-В (164 мг, 0,418 ммоль, 52%) в виде белого аморфного продукта.
65-A:1H-ЯМР (400 МГц, CDCl3) δ: 1,43 (1H, шир.с), 1,54-1,67 (2H, м), 1,83-1,91 (4H, м), 2,00-2,08 (2H, м), 2,34 (3H, с), 3,24-3,33 (1H, м), 3,78-3,86 (6H, м), 6,32 (1H, с), 6,84 (2H, д, J=8,8 Гц), 7,10 (4H, с), 7,19 (2H, д, J=8,8 Гц).
ESI-MS: m/z=393 (M+H)+.
65-B:1H-ЯМР (400 МГц, CDCl3) δ: 1,39 (1H, д, J=4,8 Гц), 1,46-1,60 (4H, м), 1,85-1,95 (2H, м), 2,33-2,40 (5H, м), 2,71 (1H, т, J=6,4 Гц), 3,55 (2H, д, J=6,4 Гц), 3,71-3,83 (4H, м), 6,37 (1H, с), 6,85 (2H, д, J=8,8 Гц), 7,10 (4H, с), 7,20 (2H, д, J=8,8 Гц).
ESI-MS: m/z=393 (M+H)+.
(Пример 66)
4-(4,5-Бис(4-метоксифенил)оксазол-2-ил)-4-гидроксициклогексанон

К раствору 8-(4,5-(бис(4-метоксифенил)оксазол)2-ил)-1,4-диоксаспиро[4.5]декан-8-ола (Ссылочный Пример 92) (781 мг, 1,78 ммоль) в тетрагидрофуране (4,5 мл) при 0°С добавляли 6М соляную кислоту (9,0 мл), и полученный раствор перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор охлаждали до 0°С и подщелачивали путем добавления 10% водного раствора гидроксида натрия и насыщенного раствора бикарбоната натрия. Полученный раствор экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью перекристаллизации (этилацетат/н-гексан), получая указанное в заголовке соединение (445 мг, 1,13 ммоль, 63%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,32-2,54 (6H, м), 2,81-2,92 (2H, м), 3,17 (1H, м), 3,84 (6H, с), 6,90 (2H, д, J=8,8 Гц), 6,91 (2H, д, J=8,8 Гц), 7,49 (2H, д, J=8,8 Гц), 7,56 (2H, д, J=8,8 Гц).
ESI-MS: m/z=394 (M+H)+.
(Пример 67)
4-(4,5-Бис(4-метоксифенил)оксазол-2-ил)циклогексан-транс-1,4-диол (67-А)

4-(4,5-Бис(4-метоксифенил)оксазол-2-ил)циклогексан-цис-1,4-диол (67-В)

К раствору 4-гидрокси-4-(4,5-бис(4-метоксифенил)оксазол-2-ил)циклогексан-1-она (Пример 66) (395 мг, 1,00 ммоль) в метаноле (20 мл) добавляли боргидрид натрия (47 мг, 1,24 ммоль), и полученный раствор перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор концентрировали при пониженном давлении и к остатку добавляли дистиллированную воду. Полученный раствор экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение 67-А (73 мг, 0,18 ммоль, 18%) в виде белого твердого вещества и указанное в заголовке соединение 67-В (207 мг, 0,523 ммоль, 52%) в виде белого твердого вещества.
67-A:1H-ЯМР (400 МГц, CDCl3) δ: 1,63-1,75 (2H, м), 1,78-1,88 (2H, м), 2,01-2,12 (2H, м), 2,44-2,53 (2H, м), 2,67 (1H, с), 4,00-4,07 (1H, м), 6,89 (2H, д, J=8,8 Гц), 6,90 (2H, д, J=8,8 Гц), 7,51 (2H, д, J=8,8 Гц), 7,57 (2H, д, J=8,8 Гц).
IR (KBr, см-1): 3356, 1613, 1600, 1520, 1503, 1254, 1182, 1033, 999, 966, 834.
ESI-MS: m/z=396 (M+H)+.
67-B:1H-ЯМР (400 МГц, CDCl3) δ: 1,49 (1H, шир.с), 1,78-2,13 (8H, м), 2,76 (1H, с), 3,72-3,78 (1H, м), 3,83 (6H, с), 6,89 (2H, д, J=8,8 Гц), 6,90 (2H, д, J=8,8 Гц), 7,49 (2H, д, J=8,8 Гц), 7,55 (2H, д, J=8,8 Гц).
IR (KBr, см-1): 3364, 1615, 1599, 1520, 1500, 1302, 1252, 1176, 1069, 1053, 1028, 965, 833.
ESI-MS: m/z=396 (M+H)+.
(Пример 68)
4-Гидрокси-4-(4-(4-метоксифенил)-5-(п-толил)тиазол-2-ил)циклогексан-1-он

К раствору 8-(4-(4-метоксифенил)-5-(п-толил)тиазол-2-ил)-1,4-диоксаспиро[4.5]декан-8-ола (Ссылочный Пример 96) (469 мг, 1,07 ммоль) в тетрагидрофуране (5,4 мл) при 0°С добавляли 6М соляную кислоту (5,4 мл), и полученный раствор перемешивали при комнатной температуре в течение 14 часов. Реакционный раствор подщелачивали путем вливания в насыщенный водный раствор бикарбоната натрия, и полученный раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (352 мг, 0,895 ммоль, 83%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,33-2,51 (6H, м), 2,37 (3H, с), 2,86-2,95 (2H, м), 3,50 (1H, с), 3,81 (3H, с), 6,81-6,84 (2H, м), 7,14 (2H, д, J=8,0 Гц), 7,24 (2H, д, J=8,0 Гц), 7,44-7,48 (2H, м).
ESI-MS: m/z=394 (M+H)+.
(Пример 69)
1-(4-(4-Метоксифенил)-5-(п-толил)тиазол-2-ил)циклогексан-транс-1,4-диол (69-А)

1-(4-(4-Метоксифенил)-5-п-толилтиазол-2-ил)циклогексан-цис-1,4-диол (69-В)

К раствору 4-гидрокси-4-(4-(4-метоксифенил)-5-(п-толил)тиазол-2-ил)циклогексан-1-она (Пример 68) (186 мг, 0,471 ммоль) в метаноле (4,7 мл) добавляли боргидрид натрия (36 мг, 0,943 ммоль), и полученный раствор перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор концентрировали при пониженном давлении, затем растворяли в этилацетате и промывали дистиллированной водой и солевым раствором. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение 69-А (42 мг, 0,106 ммоль, 23%) в виде белого твердого вещества и указанное в заголовке соединение 69-В (136 мг, 0,344 ммоль, 73%) в виде белого твердого вещества.
69-A:1H-ЯМР (400 МГц, CDCl3) δ: 1,53-1,57 (1H, м), 1,76-1,87 (4H, м), 2,05-2,12 (2H, м), 2,35-2,42 (2H, м), 2,36 (3H, с), 3,15 (1H, шир), 3,80 (3H, с), 4,10-4,14 (1H, м), 6,80-6,84 (2H, м), 7,13 (2H, д, J=8,0 Гц), 7,24 (2H, д, J=8,0 Гц), 7,45-7,49 (2H, м).
IR (KBr, см-1): 3409, 2923, 1613, 1515, 1252, 1179, 1004, 815.
ESI-MS: m/z=396 (M+H)+.
69-B:1H-ЯМР (400 МГц, CDCl3) δ: 1,48 (1H, д, J=4,8 Гц), 1,82-1,89 (2H, м), 1,95-2,01 (2H, м), 2,05-2,09 (4H, м), 2,36 (3H, с), 3,01 (1H, с), 3,76-3,82 (1H, м), 3,80 (3H, с), 6,80-6,83 (2H, м), 7,13 (2H, д, J=8,0 Гц), 7,22 (2H, д, J=8,0 Гц), 7,43-7,47 (2H, м).
IR (KBr, см-1): 3418, 2938, 1611, 1515, 1249, 1177, 1058, 816.
ESI-MS: m/z=396 (M+H)+.
(Пример 70)
1-(4-(4-Метоксифенил)-5-п-толилтиазол-2-ил)-4-(трифторметил)циклогексан-транс-1,4-диол (70-А)

1-(4-(4-Метоксифенил)-5-(п-толил)тиазол-2-ил)-4-(трифторметил)циклогексан-цис-1,4-диол (70-В)
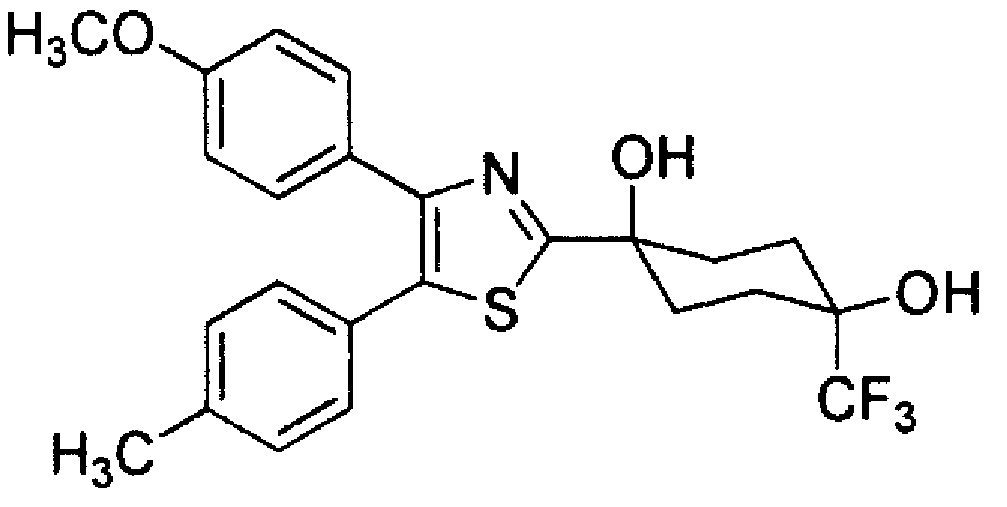
К раствору 4-гидрокси-4-(4-(4-метоксифенил)-5-п-толилтиазол-2-ил)циклогексан-1-она (Пример 68) (199 мг, 0,506 ммоль) и реагента Рупперта (0,187 мл, 1,26 ммоль) в тетрагидрофуране (2,5 мл) при комнатной температуре добавляли раствор 1,0М фторида тетрабутиламмония/тетрагидрофурана (0,051 мл, 0,051 ммоль), и полученный раствор перемешивали в течение 10 минут. Реакционный раствор концентрировали при пониженном давлении и растворяли в тетрагидрофуране (3,0 мл). К нему добавляли дистиллированную воду (0,2 мл) и раствор 1,0М фторида тетрабутиламмония/тетрагидрофурана (1,02 мл, 1,02 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 30 минут. К реакционному раствору добавляли дистиллированную воду, и полученный раствор экстрагировали этилацетатом, с последующей промывкой солевым раствором. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение 70-А (70 мг, 0,151 ммоль, 30%) в виде белого твердого вещества и указанное в заголовке соединение 70-В (132 мг, 0,285 ммоль, 56%) в виде белого твердого вещества.
70-A:1H-ЯМР (400 МГц, CDCl3) δ: 1,79-1,84 (2H, м), 1,90 (1H, с), 1,96-2,01 (2H, м), 2,21-2,33 (4H, м), 2,37 (3H, с), 3,28 (1H, с), 3,80 (3H, с), 6,80-6,84 (2H, м), 7,13 (2H, д, J=8,0 Гц), 7,23 (2H, д, J=8,0 Гц), 7,44-7,48 (2H, м).
IR (KBr, см-1): 3460, 2940, 1610, 1515, 1494, 1442, 1310, 1245, 1175, 1035, 1005, 837, 813.
ESI-MS: m/z=464 (M+H)+.
70-B:1H-ЯМР (400 МГц, CDCl3) δ: 1,90-1,96 (2H, м), 1,97 (1H, шир), 2,16-2,23 (2H, м), 2,28-2,36 (4H, м), 2,37 (3H, с), 2,81 (1H, шир), 3,80 (3H, с), 6,80-6,83 (2H, м), 7,14 (2H, д, J=8,0 Гц), 7,26 (2H, д, J=8,0 Гц), 7,44-7,48 (2H, м).
IR (KBr, см-1): 3419, 2940, 1611, 1515, 1443, 1290, 1250, 1175, 1120, 1066, 993, 837, 814.
ESI-MS: m/z=464 (M+H)+.
(Пример 71)
Этил 4-гидрокси-4-(1-(4-метоксифенил)-5-п-толил-1Н-пиразол-3-ил)-цис-циклогексанкарбоксилат

К раствору 4-гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-цис-циклогексанкарбоновой кислоты (Пример 64) (41,6 мг, 0,10 ммоль) в ДМФ (1,0 мл) добавляли карбонат калия (41,4 мг, 0,3 ммоль) и этилйодид (24,8 мкл, 0,3 ммоль), и полученный раствор перемешивали в течение 2 часов. К реакционному раствору добавляли солевой раствор, и полученный раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (44,1 мг, 0,10 ммоль, 97%) в виде белого аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,27 (3H, т, J=6,8 Гц), 1,85-2,09 (8H, м), 2,33 (3H, с), 2,34-2,41 (1H, м), 2,59 (1H, с), 3,80 (3H, с), 4,15 (2H, кв, J=6,8 Гц), 6,38 (1H, с), 6,84 (2H, д, J=8,8 Гц), 7,09-7,09 (4H, м), 7,20 (2H, д, J=8,8 Гц).
ESI-MS: m/z=435 (M+H)+.
Соединения следующих Сравнительных Примеров 1-25 были получены с помощью той же процедуры, как в Примерах 2-6, описанных выше.
(Сравнительный Пример 26)
Ацетат с-4-гидрокси-1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-r-1-ила

К раствору диацетата 1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-цис-1,4-диила (Ссылочный Пример 78) (297 г, 0,642 ммоль) в метаноле (4,3 мл) добавляли карбонат калия (89,0 мг, 0,642 ммоль), и полученный раствор перемешивали при комнатной температуре в течение 4 часов. К реакционному раствору добавляли воду для гашения реакции, и полученный раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (213 мг, 0,507 ммоль, 79%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,49 (1H, д, J=4,4 Гц), 1,65-1,74 (2H, м), 1,90-1,98 (4H, м), 2,10 (3H, с), 2,32 (3H, с), 2,71-2,78 (2H, м), 3,74-3,81 (4H, м), 6,37 (1H, с), 6,83 (2H, д, J=9,2 Гц), 7,08 (4H, с), 7,20 (2H, д, J=9,2 Гц).
ESI-MS: m/z=421 (M+H)+.
(Сравнительный Пример 27)
4-Метокси-4-(1-(4-метоксифенил)-5-п-толил-1Н-пиразол-3-ил)циклогексанол
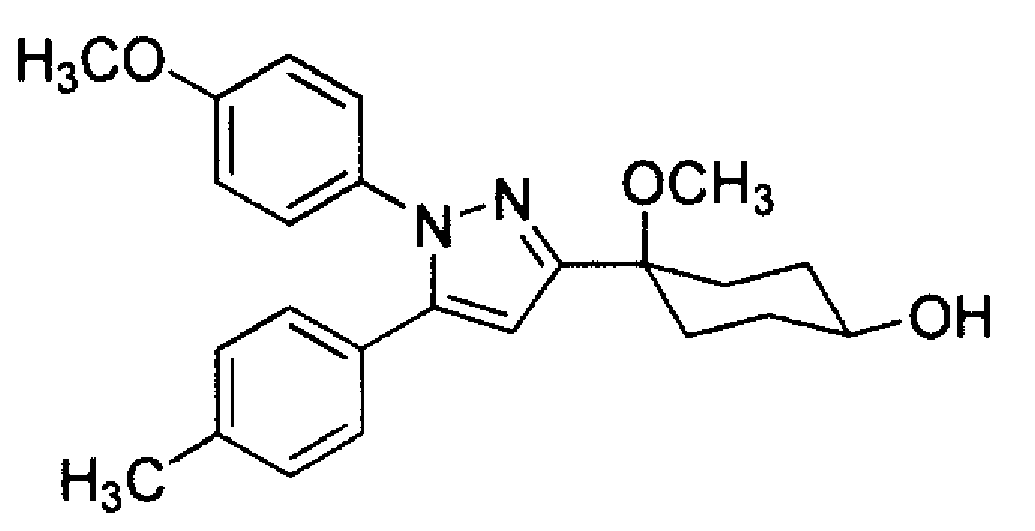
К раствору ацетата с-4-гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-r-1-ила (Пример 57) (200 мг, 0,476 ммоль) в N,N-диметилформамиде (2,4 мл) добавляли 55% гидрид натрия (31,1 мг, 0,713 ммоль) и метилйодид (39,0 мкл, 0,618 ммоль) при перемешивании с охлаждением льдом. Полученный раствор перемешивали при комнатной температуре в течение 60 часов. К реакционному раствору добавляли воду при перемешивании с охлаждением льдом, и полученный раствор перемешивали в течение 15 минут с последующим экстрагированием этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), и далее очищали с помощью переосаждения и промывки (н-гексан/диэтиловый эфир), получая указанное в заголовке соединение (60,5 мг, 0,139 ммоль, 29%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,42 (1H, шир.с), 1,70-1,78 (2H, м), 1,84-1,95 (4H, м), 2,25-2,34 (5H, м), 3,18 (3H, с), 3,68-3,77 (1H, м), 3,81 (3H, с), 6,43 (1H, с), 6,84 (2H, д, J=8,8 Гц), 7,10 (4H, с), 7,20 (2H, д, J=8,8 Гц).
IR (KBr, см-1): 3407, 2937, 1516, 1457, 1368, 1298, 1249, 1185, 1071, 1035, 969, 833.
ESI-MS: m/z=393 (M+H)+.
(Сравнительный Пример 28)
1-(4-Фтор-1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-цис-1,4-диол

К раствору ацетата 4-(4-фтор-1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-с-4-гидроксициклогексан-r-1-ила (Ссылочный Пример 80) (90 мг, 0,205 ммоль) в метаноле (2,0 мл) добавляли карбонат калия (142 мг, 1,03 ммоль), и полученный раствор перемешивали при комнатной температуре в течение 2 часов. К реакционному раствору добавляли воду для гашения реакции, и полученный раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/этилацетат), получая указанное в заголовке соединение (62 мг, 0,156 ммоль, 76%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (1H, с), 1,83-1,95 (4H, м), 2,06-2,08 (4H, м), 2,36 (3H, с), 2,70 (1H, с), 3,77-3,81 (4H, м), 6,83-6,86 (2H, м), 7,12-7,19 (6H, м).
ESI-MS: m/z=379 (М-ОН)+.
(Сравнительный Пример 29)
4-(4-Фтор-1-(4-метоксифенил)-5-(4-толил)-1Н-пиразол-3-ил)-1-(N-гидрокси-N-метилкарбамоил)-4-пиперидинол

К раствору 4-(4-фтор-1-(4-метоксифенил)-5-(4-толил)-1Н-пиразол-3-ил)-4-пиперидинола (3,61 г, 9,46 ммоль) в тетрагидрофуране (946 мл) при 0°С добавляли трифосген (1,12 г, 3,78 ммоль) и триэтиламин (1,65 мл, 11,8 ммоль), и полученный раствор перемешивали при той же температуре в течение 40 минут. К реакционному раствору добавляли гидрохлорид N-метилгидроксиламина (988 мг, 11,8 ммоль) и триэтиламин (3,43 мл, 24,6 ммоль), и полученную смесь перемешивали при 80°С в течение 3 часов. Реакционный раствор охлаждали до комнатной температуры, и к реакционному раствору добавляли дистиллированную воду. Полученный раствор экстрагировали этилацетатом. Органический слой промывали 1М соляной кислотой, насыщенным раствором бикарбоната натрия и солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью перекристаллизации (н-гексан/этилацетат, 80°С), получая указанное в заголовке соединение (2,96 г, 6,51 ммоль, 68%) в виде бледно-желтого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,94-1,98 (2H, м), 2,23-2,31 (2H, м), 2,35 (3H, с), 2,86 (1H, с), 3,00 (3H, с), 3,50-3,56 (2H, м), 3,81 (3H, с), 3,92-3,95 (2H, м), 6,84-6,87 (3H, м), 7,10-7,19 (6H, м).
IR (KBr, см-1): 3382, 1630, 1513, 1440, 1251, 1164, 1108, 1031, 836.
ESI-MS: m/z=438 (M-OH)+.
(Сравнительный Пример 30)
4-(3-Циклогексил-5-фенил-1Н-пиразол-1-ил)-2-(гидроксиметил)бензолсульфонамид

К суспензии 4-гидразин-2-(гидроксиметил)бензолсульфонамида (224 мг, 0,884 ммоль) в этаноле (4,0 мл) добавляли триэтиламин (246 мкл, 1,77 ммоль) и 1-циклогексил-3-фенилпропан-1,3-дион (185 мг, 0,803 ммоль), и полученный раствор перемешивали при 100°С в течение 72 часов. К реакционному раствору добавляли воду, и полученный раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, н-гексан/хлороформ/ацетон), получая указанное в заголовке соединение (51,5 мг, 0,125 ммоль, 16%) в виде белого аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,18-1,89 (8H, м), 1,98-2,09 (2H, м), 2,69-2,79 (1H, м), 3,28 (1H, шир), 4,94 (2H, д, J=5,2 Гц), 5,56-5,63 (2H, м), 6,35 (1H, с), 7,05-7,38 (6H, м), 7,48-7,54 (1H, м), 7,83 (1H, д, J=8,8 Гц).
ESI-MS: m/z=412 (M+H)+.
(Пример 72)
Действие на ноцицептивную боль
Исследовали Соединение (I) с использованием модели мышей с корчами от действия уксусной кислоты, на которой можно оценить ноцицептивную боль.
1. Экспериментальный способ
Самцов мышей ddY возрастом 5-6 недель держали в голоде в течение не менее 16 часов, в течение которых воду давали без ограничения. После этого вводили орально раствор испытуемого соединения или наполнитель (10 мл/кг). В качестве наполнителя раствора испытуемого соединения использовали диметилсульфоксид (называемый здесь далее как ДМСО):Твин 80:дистиллированную воду (1:1:8) или 27% гидроксипропил-β-циклодекстрин (называемый здесь далее как HP-β-CD). Через сорок пять минут после введения наполнителя или испытуемого соединения интраперитонеально вводили 0,6% раствор уксусной кислоты (10 мл/кг), чтобы вызвать ответные реакции в виде корчей (поведение такое, как будто тело вытягивается и изгибается назад). В течение 10 минут подсчитывали число корчей, имеющих место, спустя 10 минут после введения раствора уксусной кислоты, и число корчей использовали в качестве показателя боли.
Среднее число корчей, получаемое в группе с наполнителем, определяли в 100%, а доза испытуемого соединения, при которой подавлялось 50% корчей, представляли в виде показателя ED50.
2. Результаты
Результаты показаны в Таблице 10.
Все соединения Примеров 1, 2-А, 2-В, 3, 6-А, 28-31, 33, 35, 37, 57, 59, 60, 62-64, 65-А, 67-В, 69-А, 70-В и 71, описанные в таблице 10, показали величины ED50 0,41-9,92 мг/кг. Что касается Сравнительных Примеров 1-28, величины ED50 были >10 мг/кг. Данные результаты указывают на то, что Соединение (I) оказывает превосходное анальгетическое действие. Далее, соединение Сравнительного Примера 30 не вызвало значительного снижения числа корчей даже при введении 10 мг/кг соединения (t-тест).
(Пример 73)
Действие или эффект на модели мыши с перевязыванием седалищного нерва
Исследовали анальгетическое действие Соединения (I) модели мыши с перевязыванием седалищного нерва (модель Seltzer).
Приготавливали модель невропатической боли в соответствии с способом Seltzer и др. Самцов ICR мышей возрастом 5 недель анестезировали пентобарбиталом натрия (70 мг/кг, и.п.), и обнажали седалищный нерв в бедренной области правой задней конечности, с последующим тройным и тугим перевязыванием седалищного нерва под микроскопом так, чтобы сдавливалась только половина ее толщины, шелковой нитью 8-0 (NATSUME SEISAKUSHO), обеспечивая группу с перевязыванием. Группу, в которой седалищный нерв обнажали, но не перевязывали, предоставляли в качестве контрольной группы (Sham). Что касается оценки невропатической боли (называемой здесь далее von Frey испытание), мышей держали в акриловых клетках (NATSUME SEISAKUSHO), помещенных на сетках в течение, по крайней мере, 1 часа для привыкания, и использовали нить (North Coast Medical Inc. CA, USA), которая оказывает давление 0,16 г, для механического стимулирования обеих подошвенных задних лапок сдавливанием их нитью 3 раза в течение 3 секунд/время с интервалами в 3 секунды. Отмечали поведение, выражающееся в избегании или спасении, имевшее место после применения механической стимуляции, 0: отсутствие реакции, 1: показывали медленное и слабое поведение по избеганию в ответ на стимуляцию, 2: показывали быстрое поведение по избеганию без вздрагивания (поведение со встряхиванием ног быстро и продолжительно) или облизывания (поведение с облизыванием ног), 3: показывали поведение с быстрым избеганием со вздрагиванием или облизыванием), и все оценки, полученные в повторяемых трижды испытаниях по сдавливанию, использовали в качестве показателя боли. Испытание von Frey осуществляли через 7 дней после операции по перевязыванию седалищного нерва для получения предварительной оценки до орального введения испытуемого соединения, а также осуществляли, спустя 1 час, 2 часа и 3 часа после орального введения, с получением величин, используемых в качестве показателей анальгетического действия. Для обеспечения положительного контроля использовали габапентин (30 мг/кг, оральное введение).
Результаты показаны на Фиг. 1-4 и в Таблице 11. На Фиг. 1-4 ордината показывает общую оценку в испытании von Frey, и более высокая оценка указывает на более сильную боль. Абсцисса указывает на время (в часах) после введения испытуемого соединения. В качестве наполнителя раствора испытуемого соединения в экспериментах Фиг. 1, Фиг. 3 и Фиг. 4 использовали 27% HP-β-CD, а в эксперименте Фиг. 2 использовали ДМСО:Твин 80:дистиллированная вода (1:1:8). Фармакологическое действие оценивали по способу статистического анализа с помощью множественного непарного t-теста, скорректированного по способу Дуннетта с использованием группы носителя (Перевязывание + Наполнитель) в каждое время измерения в качестве контроля. Символы “*” на Фигурах указывают статистическую значимость (**: р<0,01, ***: р<0,001).
На основе результатов теста von Frey с соединениями Примера 2-А (Фиг. 1), Примера 2-В (Фиг. 2), Примера 62 (Фиг. 3) и Сравнительного Примера 29 (Фиг. 4) габапентин и соединение Сравнительного Примера 29, которые являлись положительными контролями, показали наиболее сильный анальгетический эффект через 1 час после орального введения, и анальгетический эффект резко снижался через 3 часа после орального введения. С другой стороны, в случаях орального введения соединения Примера 2-А в количестве 0,3 мг/кг и орального введения соединений Примера 2-В и Примера 62 в количествах 0,3 и 1,0 мг/кг соответственно, сильный анальгетический эффект сохранялся даже спустя 3 часа после орального введения. Из данных результатов видно, что Соединение (I), имеющее циклогексановый скелет, оказывает длительное эффективное действие на невропатическую боль.
Как показано в Таблице 11, на основании результатов испытания von Frey, осуществляемого, спустя 1 час после орального введения соединений Примера 4-В, Примера 30, Примера 31, Примеров 59, 64 и 67-В, все указанные соединения значительно улучшали общую оценку von Frey относительно группы с наполнителем. Таким образом, обнаружено, что данные соединения являются эффективными против невропатической боли.
В случаях, когда использовали наполнитель А или В, соединение вводили в виде раствора испытуемого соединения, а в случаях, когда использовали наполнитель С, соединение вводили в виде суспензии испытуемого соединения.
Оценку степени улучшения вычисляли следующим образом:
Оценка степени улучшения = 100 - (оценка группы с вводимым соединением - оценка контрольной группы)/(оценка группы с наполнителем - оценка контрольной группы) × 100.
Символы “*” в таблице указывают на статистическую значимость (*: р<0,05, **: р<0,01, ***: р<0,001) на основе сравнения с группой с наполнителем (множественный непарный t-тест, скорректированный по способу Дуннетта).
(Пример 74)
Действие на модели мыши с болью вследствие диабетической невралгии
Исследовали анальгетическое действие Соединения (I) с использованием модели мыши с болью вследствие действия стрептозотоцина (называемой здесь далее диабетическая невралгия, вызываемая STZ), на которой можно было оценить диабетическую невропатическую боль.
Самцам мышей ICR 5-недельного возраста вводили интраперитонеально STZ (250 мг/кг) или физиологический раствор для подготовки мышей с диабетом и контрольной группы. Мыши с диабетом означают здесь мышей, у которых уровень глюкозы в крови при полном питании составляет не менее 350 мг/дл, когда берут небольшое количество крови из хвостовой вены через 6 дней после введения STZ, и измеряли уровень глюкозы в крови с использованием глюкометра крови Precision Xceed и электрода для измерения глюкозы в крови Smartblue (Abbott).
Через семь дней после введения STZ проводили испытание von Frey на мышах с диабетом, как в описанном выше случае оценки невропатической боли, и отбирали отдельных особей, показывающих общую оценку 5 или выше, в качестве особей с болезненным состоянием вследствие диабетической невралгии. Отобранных особей разделяли на группы так, чтобы общая оценка стала равной среди групп, с последующим оральным введением испытуемых соединений. Через один час после орального введения дополнительно проводили испытание von Frey, и полученную оценку использовали как показатель анальгетического действия. В качестве положительного контроля использовали прегабалин (10 мг/кг, оральное введение).
Результаты показаны на Фиг. 5. На Фиг. 5 ордината показывает общую оценку в испытании von Frey, и более высокая оценка указывает на более сильную боль. В качестве наполнителя суспензии испытуемого соединения использовали 0,5% метилцеллюлозу. Фармакологическое действие оценивали по способу статистического анализа с использованием в качестве контроля группы с введением STZ + с введением наполнителя с помощью теста Вильямса для группы с введением соединения Примера 2-В и непарного t-теста для группы с введением прегабалина. Символы “*” и “#” на Фигуре указывают статистическую значимость на основе сравнения с группой с введением STZ + с введением наполнителя (*: р<0,25, #: р<0,05).
На основе результатов теста von Frey, полученных с соединением Примера 2-В, введение 1 и 10 мг/кг соединения значительно улучшало общую оценку испытания von Frey. По данным этих испытаний обнаружено, что Соединение (I) является эффективным от боли вследствие диабетической невралгии.
(Пример 75)
Анализ микросомной стабильности печени человека и мыши
Проводили анализ микросомной стабильности печени, который, как известно, является in vitro анализом для оценки стабильности соединений против печеночного метаболизма, для оценки стабильности Соединения (I) против печеночного метаболизма человека и мыши.
Эксперименты проводили в целом 4 раза для сочетаний соединения Примера 2-В или соединения Сравнительного Примера 29 в качестве испытуемого соединения и микросом печени человека (Xenotech) или микросом печени мыши (Xenotech) в качестве микросом печени.
Соответствующие реагенты, используемые для анализа микросомной стабильности печени, получали следующим образом. А именно, соответствующее количество D-глюкоз-6-фосфатдинатриевой соли (называемой здесь далее G6P) растворяли в дистиллированной воде в количестве 100 ммоль/л с получением 100 ммоль/л водного раствора G6P. В 5 мл дистиллированной воды растворяли 1000 единиц глюкозо-6-фосфатдегидрогеназы из дрожжей (называемой здесь далее G6PDH) с получением 200 единиц/мл водного раствора G6PDH. Растворяли соответствующее количество MgCl2 в дистиллированной воде 100 ммоль/л с получением 100 ммоль/л водного раствора MgCl2. К 500 мл 200 ммоль/л водного раствора K2HPO4 добавляли 200 ммоль/л водного раствора KH2PO4 (около 130 мл), и рН доводили до 7,4 с получением 200 ммоль/л KH2PO4|K2HPO4 буфера pH 7,4 (называемого здесь далее 200 ммоль/л PB). Фосфат β-никотинамид-адениндинуклеотида, восстановленный из тетранатриевой соли (называемой здесь далее NADPH), растворяли в дистиллированной воде так, чтобы содержание NADPH стало 10 ммоль/л на основе чистоты (чистота NADPH) в данных анализа, описанного в прилагаемом документе, с получением 10 ммоль/л водного раствора NADPH.
Анализ микросомной стабильности печени осуществляли в соответствии со следующей процедурой. Сначала реагенты, перечисленные в Таблице 12 (исключая микросомы), смешивали вместе с получением реакционной смеси, и добавляли аликвоты реакционной смеси в 130-мкл объемах в 4 лунки (которые играют роль соответственно как лунка для 0-минутной реакции, лунка для 30-минутной реакции, лунка для 20-минутной реакции и лунка для 10-минутной реакции) на 96-луночной трубчатой планшете (BM Equipment Co., Ltd; называемой здесь далее планшета). Всю планшету покрывали силиконовой крышкой и планшету подвергали предварительной инкубации путем погружения в водную ванну при 37°С на 10 минут.
После предварительной инкубации в лунку добавляли 3,75 мкл 20 мг/мл суспензии микросом + 16,25 мкл дистиллированной воды (20 мкл всего) для 30-минутной реакции, и планшету закрывали крышкой с последующим погружением планшеты в водную ванну при 37°С для инициирования реакции.
Через десять минут после начала реакции в лунку для 20-минутной реакции добавляли 3,75 мкл 20 мг/мл суспензии микросом + 16,25 мкл дистиллированной воды (20 мкл всего), а через 20 минут после начала реакции в лунку для 10-минутной реакции добавляли 3,75 мкл 20 мг/мл суспензии микросом + 16,25 мкл дистиллированной воды (20 мкл всего). Реакцию далее продолжали при сохранении планшеты, погруженной в водную ванну при 37°С.
Через тридцать минут после начала реакции планшету удаляли из водной ванны, и в каждую лунку добавляли 120 мкл ацетонитрила с последующим закрыванием планшеты крышкой, взбалтыванием планшеты в течение 10 секунд прямым миксером и остановкой реакции 10-минутным охлаждением льдом. После того как реакцию остановили, в лунку для 0-минутной реакции добавляли 3,75 мкл 20 мг/мл суспензии микросом + 16,25 мкл дистиллированной воды (20 мкл всего).
Реакционную жидкость в каждой лунке центрифугировали при 4°С при 2500 оборотах в минуту в течение 10 минут, и супернатант переносили в покрытую стеклом микропланшету (TOMSIC Plate+), начиная LC/MS/MS анализ. Условия для LC/MS/MS анализа были следующими.
Для хроматограммы реакционной жидкости, получаемой с помощью LC/MS/MS анализа, утверждали площадь пика испытуемого соединения, и вычисляли остаточную величину испытуемого соединения (%) в каждый момент реакции (мин), принимая площадь пика в момент реакции 0 мин за 100%. Остаточную величину испытуемого соединения наносили полулогарифмически на график против времени реакции и приводили к Уравнению 1 по способу наименьших квадратов, вычисляя тем самым константу k степени устранения (л/мин). Далее, полученную величину k делили на концентрацию белка в микросомах, вычисляя присущий клиренс печени CLint (мл/мин/мг) (Уравнение 2).
Остаточная степень субстрата = А × exp(-kt)… Уравнение 1
Clint = k/концентрация белка в микросомах … Уравнение 2
Величины присущего клиренса печени, полученные в результате 4-кратного анализа стабильности микросом печени, показаны в Таблице 13 и Таблице 14. Более высокая величина присущего клиренса печени указывает на более быстрый метаболизм соединения в микросомах печени.
Как показано в Таблице 13, величина присущего клиренса печени, полученная в анализе стабильности микросом печени с использованием соединения Примера 2-В в качестве испытуемого соединения, гораздо меньше, чем величина, полученная с использованием соединения Сравнительного Примера 29 в качестве испытуемого соединения. По результатам данных испытаний обнаружено, что Соединение (I), имеющее циклогексановый скелет, заметно улучшает метаболическую стабильность в печени.
Таблица 14 показывает результаты анализа стабильности микросом печени человека. По сравнению со Сравнительным Примером 29 в Таблице 13, Примеры 2-А, 4-В, 28, 30, 33, 35, 59, 62, 64 и 67-В показали более низкий присущий клиренс печени, указывая на то, что метаболическая стабильность в печени улучшалась.
(Пример 76)
Испытание фармакокинетики (РК)
Соединение Примера 2-В или Сравнительного Примера 29 вводили орально мышам, и после введения измеряли уровень в плазме для изучения влияния улучшения метаболической стабильности в печени на изменение уровня соединения в плазме.
Самцов мышей CD1 (ICR) 7 недельного возраста, которых ранее кормили без ограничения гранулами (Oriental Yeast Co., Ltd.) и водопроводной водой, перед введением держали в голоде в течение 17 часов. Кормление мышей начинали снова через 4 часа после введения.
Соединение Примера 2-В растворяли в ДМСО:Твин 80:дистиллированная вода (1:1:8), или соединение сравнительного Примера 29 растворяли в 27% водном растворе HP-β-CD, получая каждый предназначенный для введения раствор, который содержал соединение в концентрации 0,2 мг/мл.
В случае внутривенного введения раствора животное фиксировали держателем, и введение осуществляли через хвостовую вену без анестезии, с использованием шприца с приложенной к нему инъекционной иглой (25 G). В случае орального введения использовали шприц с приложенной к нему питающей иглой без анестезии, для ускорения попадания раствора в желудок.
Что касается мышей, которым раствор вводили внутривенно, кровь брали в целом 8 раз из яремной вены или из сердца, спустя 5, 15 и 30 минут и 1, 2, 4, 8 и 24 часа после внутривенного введения. Что касается мышей, которым раствор вводили орально, кровь брали 8 раз из яремной вены или из сердца, спустя 15, 30 и 45 минут и 1, 2, 4, 8 и 24 часа после орального введения. Дополнительно, из яремной вены или из сердца мышей, которым раствор не вводили, кровь брали в качестве пустого опыта. Собранную кровь центрифугировали при 4°С при 12000 об/мин в течение 5 минут, и полученную плазму мыши и плазму пустого опыта хранили примерно при -20°С до приготовления образцов или проб для анализа.
К 50 мкл образца мышиной плазмы или образца мышиной плазмы, разбавленного холостой плазмой, добавляли раствор внутреннего стандарта и 150 мкл метанола, и получающуюся смесь перемешивали с последующим охлаждением смеси при 4°С в течение 20 минут. Что касается образцов для калибровочной кривой, таким же способом приготавливали холостую плазму, к которой добавляли стандартный раствор. Каждый образец после охлаждения центрифугировали (Hitachi Kokai Co., Ltd.) при 4°С при 2000 об/мин в течение 10 минут, и супернатант переносили на 0,20 мкм фильтровальную планшету (Whatman) c последующим фильтрованием в центрифуге (Hitachi Kokai Co., Ltd.) при 4°С при 2000 об/мин в течение 10 минут. Полученный фильтрат подвергали LC/MS/MS анализу. Условия LC/MS/MS анализа были теми же, что и в описанном выше анализе стабильности микросом печении человека и мыши.
По результатам LC/MS/MS анализа подготавливали калибровочную кривую с использованием анализа 1.4 (Applied Biosystems). На основе LC/MS/MS анализа и подготовленной калибровочной кривой вычисляли концентрацию в каждом образце для измерения с использованием анализа 1.4. Для каждого из экспериментов с внутривенным и оральным введением 3-кратно вычисляли средний уровень в плазме в каждой временной точке, и осуществляли РК анализ с использованием полученных величин (Фиг. 6 и 7; каждый график указывает средний уровень в плазме в каждой временной точке и его ± стандартное отклонение; i.v. показывает данные опыта с внутривенным введением; и р.о. показывает данные опыта с оральным введением). РК параметр вычисляли с использованием WinNonlin (Pharsight) с помощью анализа независимого от моделей (внутривенное введение: Модель 201, оральное введение: Модель 200). Дополнительно, вычисляли биодоступность (ВА) с помощью стандартизации путем деления AUC0-24hr от временной точки внутривенного введения или орального введения до временной точки конечного отбора крови дозами.
Как показано на Фиг. 6 и 7, средний уровень в плазме у мышей, которым вводили соединение Примера 2-В, был выше, чем средний уровень в плазме у мышей, которым вводили соединение Сравнительного Примера 29, во всех временных точках. Далее, ВА, который указывает коэффициент оральной абсорбции, составлял 88% для соединения Примера 2-В, но для соединения Сравнительного Примера 29 он был ниже, чем 54%. Общий клиренс тела, который указывает на степень исчезновения соединения, составлял 971 мл/час/кг для соединения Примера 2-В, а для соединения Сравнительного Примера 29 он был выше, чем 5672 мл/час/кг. Из данных результатов испытания явствует, что Соединение (I), имеющее циклогексановый скелет, заметно улучшает метаболическую стабильность по сравнению с похожими соединениями, не имеющими циклогексанового скелета.
(Пример 77)
Оценка безопасности с использованием мышей
1. Экспериментальная методика
Мышам Crlj:CD1 (ICR) 7-недельного возраста повторно вводили орально Соединение Примера 2-В или Сравнительного Примера 29 в течение 5 дней, и проводили наблюдение клинических признаков, измерение веса тела, гематологию, химию крови, объемистую аутопсию, измерение веса органов и гистопатологию. Дополнительно, в день 1 и день 5 после введения проводили измерение ТК. Подтверждалась подверженность воздействию соответствующих соединений.
Дозы соединения Примера 2-В были 0, 40, 200 и 1000 мг/кг/день, а дозы соединения Сравнительного Примера 29 были 0, 30, 100 и 300 мг/кг/день. Вводимый раствор приготавливали с использованием 0,5% водного раствора метилцеллюлозы в качестве наполнителя, так чтобы объем введения составлял 10 мл/кг.
2. Результаты
У животных, которым вводили соединение Примера 2-В, вероятность индуцирования гепатотоксичности, действий на иммунные органы/ткани и индуцирования желудочно-кишечной токсичности предполагали при дозе 1000 мг/кг/день и допускали, что уровень вредного воздействия не наблюдается при 200 мг/кг/день.
С другой стороны, у животных, которым вводили соединение Сравнительного Примера 29, предполагалась вероятность индуцирования гепатотоксичности и вызываемого лекарством фосфолипидоза при дозе не менее чем 30 мг/кг/день, и допускалось, что уровень вредного воздействия не наблюдается при менее чем 30 мг/кг/день. По данным результатам можно ожидать, что циклогексановое производное (I), представленное в Примере 2-В, ввиду безопасности превосходит соединение, описанное в Патентном Документе 1.
(Пример 78)
Синтезировали пролекарства Примера 2-В.
4-Гидрокси-4-(1-(4-метоксифенил)-5-п-толил-1Н-пиразол-3-ил)-цис-циклогексилдиметилкарбамат (78-А)

Раствор 1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-цис-1,4-диола (Пример 2В) (230 мг, 0,60 ммоль) в тетрагидрофуране (6,0 мл) перемешивали на льду в течение 10 минут. К реакционной жидкости добавляли гидрид натрия (26,4 мг, 0,66 ммоль), и получающуюся смесь перемешивали при той же температуре в течение 20 минут, с последующим добавлением к ней по каплям диметилкарбамоилхлорида (84 мкл, 0,9 ммоль). Получающуюся смесь перемешивали при комнатной температуре в течение 3 часов, и к реакционной жидкости добавляли солевой раствор, с последующей экстракцией этилацетатом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия, с последующим концентрированием при пониженном давлении. Остаток очищали с помощью флэш-хроматографии на колонке (силикагель, н-гексан/этилацетат), получая искомое соединение (95,6 мг, 0,21 ммол, 35%) в виде бледно-желтого аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,93-2,04 (8Н, м), 2,33 (3Н, с), 2,71 (1Н, с), 2,92 (6Н, с), 3,80 (3Н, с), 4,73-4,79 (1Н, м), 6,37 (1Н, с), 6,84 (2Н, д, J=8,8 Гц), 7,09-7,09 (4H, м), 7,20 (2H, J=8,8 Гц).
ESI-MS: m/z= 450 (M+H)+.
Циклогексил-4-гидрокси-4-(1-(4-метоксифенил)-5-п-толил-1Н-пиразол-3-ил)-цис-циклогексилкарбонат (78-В)

Раствор 1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-цис-1,4-диола (Пример 2-В) (250 мг, 0,66 ммоль) в тетрагидрофуране (2,2 мл) охлаждали на льду, и к нему добавляли гидрид натрия (63,4 мг, 1,45 ммоль), с последующим перемешиванием получающейся смеси при той же температуре в течение 10 минут. Затем к смеси добавляли циклогексил-1-йодэтилкарбонат (354 мг, 1,18 ммоль), и получающуюся смесь перемешивали при комнатной температуре в течение 12 часов. К реакционной жидкости добавляли солевой раствор, и получающуюся смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия, с последующим концентрированием при пониженном давлении. Остаток очищали с помощью флэш-хроматографии на колонке (силикагель, н-гексан/этилацетат), получая искомое соединение (161 мг, 0,29 ммол, 44%) в виде белого аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,23-1,28 (4H, м), 1,31-1,40 (2H, м), 1,44-1,56 (4H, м), 1,70-1,79 (4H, м), 1,93-2,08 (4H, м), 2,32 (3H, с), 2,82 (1H, с), 3,79 (3H, с), 4,57-4,64 (1H, м), 4,67-4,71 (1H, м), 6,38 (1H, с), 6,84 (2H, д, J=8,4 Гц), 7,08-7,08 (4H, м), 7,19 (2H, J=8,4 Гц).
ESI-MS: m/z= 505 (M+H)+.
Следующие соединения были получены тем же способом, как описано выше.
Моно-4-гидрокси-4-(1-(4-метоксифенил)-5-п-толил-1Н-пиразол-3-ил)-цис-циклогексиловый эфир янтарной кислоты (78-Е)

К раствору 1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-цис-1,4-диола (Пример 2В) (250 мг, 0,66 ммоль) в ДМФ (3,3 мл) добавляли гидрид натрия (63,4 мг, 1,45 ммоль), и получающуюся смесь перемешивали в течение 30 минут. Затем к смеси добавляли янтарный ангидрид (99 мг, 0,99 ммоль), и получающуюся смесь перемешивали в течение 12 часов, с последующим добавлением к реакционной жидкости 1М соляной кислоты и этилацетата и экстракцией этилацетатом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия, с последующим концентрированием при пониженном давлении. Остаток очищали с помощью флэш-хроматографии на колонке (силикагель, н-гексан/этилацетат), получая искомое соединение (87,0 мг, 0,18 ммол, 28%) в виде белого аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,86-1,88 (2H, м), 1,96-2,02 (4H, м), 2,08-2,11 (3H, м), 2,32 (3H, с), 2,58-2,64 (4H, м), 3,81 (3H, с), 4,82-4,88 (1H, м), 6,38 (1H, с), 6,84 (2H, д, J=8,0 Гц), 7,09-7,09 (4H, м), 7,18 (2H, J=8,0 Гц).
ESI-MS: m/z= 479 (M+H)+.
Циклогексил-(4-гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-цис-циклогексилокси)этилкарбонат (78-F)

К раствору 1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-цис-1,4-диола (Пример 2-В) (400 мг, 1,05 ммоль) в дихлорметане (5,4 мл) добавляли циклогексил 1-йодоэтилкарбонат (567 мг, 1,90 ммоль), диизопропилэтиламин (460 мкл, 2,64 ммоль) и хлорид серебра (273 мг, 1,90 ммоль), и получающуюся смесь перемешивали при 80°С в течение 12 часов, с последующим охлаждением смеси до комнатной температуры и фильтрованием реакционной жидкости через целит. К фильтрату добавляли 1М соляную кислоту и этилацетат, и получающуюся смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия, с последующим концентрированием при пониженном давлении. Остаток очищали с помощью флэш-хроматографии на колонке (силикагель, н-гексан/этилацетат), получая искомое соединение (31,9 мг, 0,058 ммол, 5,1%) в виде белого аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,15-1,34 (9H, м), 1,48-1,65 (4H, м), 1,83-1,98 (8H, м), 2,33 (3H, с), 2,49 (1H, с), 3,52-3,58 (1H, м), 3,64-3,71 (1H, м), 3,81 (3H, с), 4,92 (1H, кв, J=5,2 Гц), 6,39 (1H, с), 6,84 (2H, д, J=8,8 Гц), 7,09-7,09 (4H, м), 7,19 (2H, J=8,8 Гц).
ESI-MS: m/z=549 (M+H)+.
С помощью той же процедуры, что описана выше, получали следующие соединения.
4-Гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-цис-циклогексил-2-аминоацетат (78-I)

К раствору 4-гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-цис-циклогексил-2-бензилоксикарбониламиноацетата (Ссылочный Пример 97) (33,2 мг, 0,058 ммоль) в метаноле (2,0 мл) добавляли 10% палладий/уголь (6,16 мг, 50 вес.%) при комнатной температуре, и получающуюся смесь перемешивали в течение 14 часов в атмосфере водорода. Реакционную жидкость фильтровали через целит, и фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии на колонке (NH силикагель, хлороформ/метанол), получая искомое соединение (18,4 мг, 0,042 ммол, 73%) в виде бесцветного аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,58-1,82 (2H, м), 1,88-2,12 (9H, м), 2,33 (3H, с), 3,43 (2H, с), 3,81 (3H, с), 4,88-4,94 (1H, м), 6,37 (1H, с), 6,83-6,87 (2H, м), 7,09-7,11 (4H, м), 7,18-7,22 (2H, м).
ESI-MS: m/z= 436 (М+Н)+.
С помощью той же самой процедуры, описанной выше, получали следующее соединение.
(S)-4-Гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-цис-циклогексил-2-амино-3-метилбутаноат (78-К)

К смешанному раствору (S)-4-гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-цис-циклогексил-2-бензилоксикарбониламино-3-метилбутаноата (Ссылочный Пример 99) (122 мг, 0,190 ммоль) в смеси диоксан/этанол (2,0 мл/2,0 мл) при комнатной температуре добавляли 2,2'-бипиридил (15,0 мг, 0,096 ммоль) и 10% палладий/уголь (49,0 мг, 40 вес.%), и получающуюся смесь перемешивали в течение 14 часов в атмосфере водорода. Реакционную жидкость фильтровали через целит, и фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии на колонке (силикагель, хлороформ/метанол), получая искомое соединение (38,6 мг, 0,076 ммоль, 40%) в виде бесцветного аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 0,92 (3H, д, J=6,8 Гц), 1,02 (3H, д, J=6,8 Гц), 1,90-2,12 (9H, м), 2,34 (3H, с), 3,32-3,34 (1H, м), 3,67-3,76 (1H, м), 3,81 (3H, с), 5,41 (1H, д, J=6,4 Гц), 5,47 (1H, д, J=6,4 Гц), 6,38, (1H, с), 6,83-6,87 (2H, м), 7,09-7,12 (4H, м), 7,18-7,22 (2H, м).
ESI-MS: m/z=490 (M-OH)+.
4-Гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-цис-циклогексилдиводородфосфат (78-L)

К смешанному раствору дибензил-4-гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-цис-циклогексилфосфата (Ссылочный Пример 100) (251 мг, 0,393 ммоль), метанола (2,6 мл) и этилацетата (2,6 мл) добавляли 10% палладий/уголь (41,8 мг, 50 вес.%), и получающуюся смесь перемешивали при комнатной температуре в течение 2,5 часов в атмосфере водорода. Реакционную жидкость фильтровали через целит, и фильтрат концентрировали при пониженном давлении. Остаток перекристаллизовывали из смеси дихлорметан/диэтиловый эфир, получая искомое соединение (97,2 мг, 0,212 ммоль, 54%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, ДМСО-d6) δ: 1,68-1,98 (8H, м), 2,28 (3H, с), 3,76 (3H, с), 4,13 (1H, шир), 4,92 (1H, шир), 6,53 (1H, с), 6,91-6,95 (2H, м), 7,08-7,17 (6H, м).
ESI-MS: m/z=459 (M+H)+.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Циклогексановое производное настоящего изобретения или его фармацевтически приемлемая соль или пролекарство может оказывать анальгетическое действие против ноцицептивной боли, невропатической боли и диабетической невропатической боли и имеет меньше побочных действий, поэтому оно может применяться в качестве фармацевтического средства от широкого ряда болевых симптомов.
Реферат
Настоящее изобретение относится к производным циклогексана, представленным общей формулой (I), в которой заместитель А является группой общей формулы (IIa) или (IIb), где радикалы и символы определены в формуле изобретения. Соединения формулы (I) обладают сильным анальгетическим действием как на ноцицептивную боль, так и на невропатическую боль и в меньшей степени побочными действиями. Описано также их фармацевтическое применение. 5 н. и 12 з.п. ф-лы, 43 табл., 7 ил., 99 ссылочных пр., 78 пр.
Формула

[в которой
А представляет собой заместитель, представленный общей формулой (IIa) или (IIb):

R1 и R2 каждый независимо представляет атом водорода, атом хлора, С1-С3галогеналкил, С1-С4алкил, С1-С4алкокси или циано;
R3 представляет атом водорода или атом хлора;
R4 представляет атом фтора, гидроксиметил или гидроксил;
R5 и R6 каждый независимо представляет атом водорода, атом фтора, С1-С3галогеналкил, карбоксил, метоксикарбонил, этоксикарбонил, С1-С4алкокси, гидроксил, С2-С5алкилкарбонилокси, диметилкарбамоилокси группу, этоксикарбонилокси группу, циклогексилоксикарбонилокси группу, 3-карбоксипропаноилокси группу, аминоацетокси группу, (s)-2-амино-3-метилбутаноилокси группу, пивалоилоксиметокси группу, 1-(циклогексилоксикарбонил-окси)этокси группу, 1-(этоксикарбонилокси)этокси группу, (s)-2-амино-3-метилбутаноилоксиметокси группу или дигидроксифосфорилокси группу, или могут вместе образовывать оксо группу;
R7 и R8 каждый независимо представляет атом водорода или атом фтора;
Y представляет атом кислорода или серы; и
Z представляет атом азота или метин],
или его фармацевтически приемлемая соль.
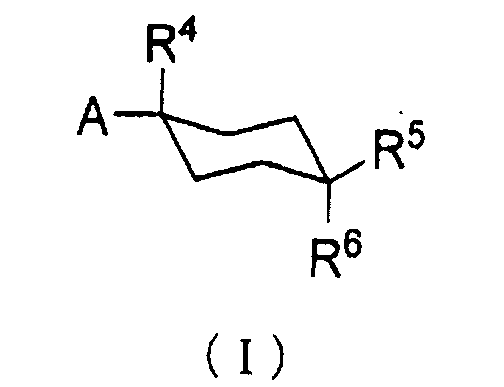
в которой
А представляет собой заместитель, представленный общей формулой (IIc) или (IId):

R1 и R2 каждый независимо представляет атом водорода, атом хлора, С1-С3галогеналкил, С1-С4алкил или С1-С4алкокси;
R3 представляет атом водорода или атом хлора;
R4 представляет атом фтора, гидроксиметил или гидроксил;
R5 и R6 каждый независимо представляет атом водорода, атом фтора, С1-С3галогеналкил, карбоксил, С1-С4алкокси, гидроксил или С2-С5алкилкарбонилокси, диметилкарбамоилокси группу, этоксикарбонилокси группу, циклогексилоксикарбонилокси группу, 3-карбоксипропаноилокси группу, аминоацетокси группу, (s)-2-амино-3-метилбутаноилокси группу, пивалоилоксиметокси группу, 1-(циклогексилоксикарбонил-окси)этокси группу, 1-(этоксикарбонилокси)этокси группу, (s)-2-амино-3-метилбутаноилоксиметокси группу или дигидроксифосфорилокси группу, или R5 и R6 могут вместе образовывать оксо группу;
Y представляет атом кислорода или серы; и
Z представляет атом азота или метин],
или его фармацевтически приемлемая соль.
















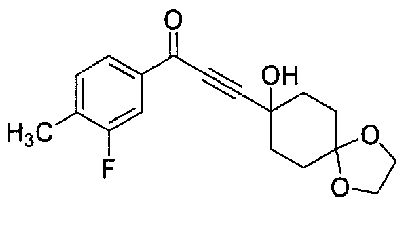















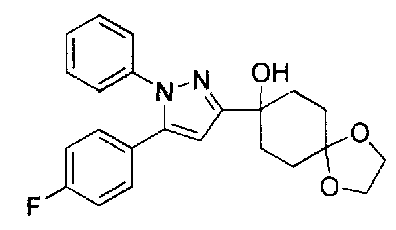




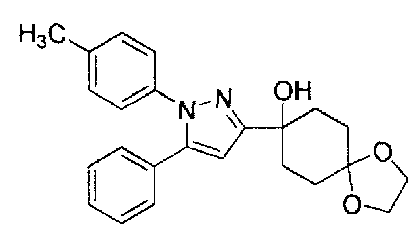













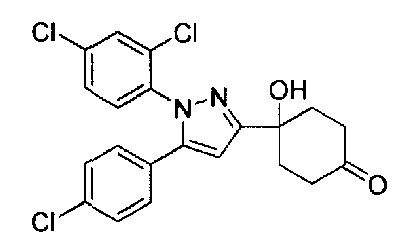




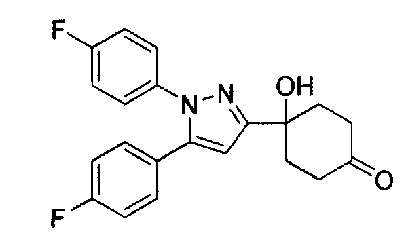
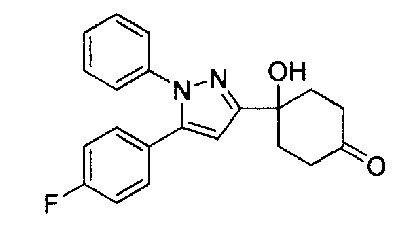













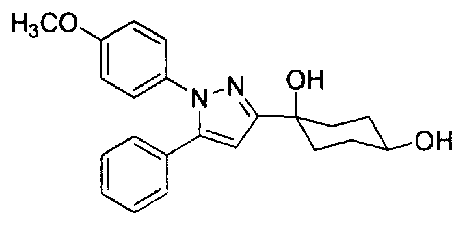







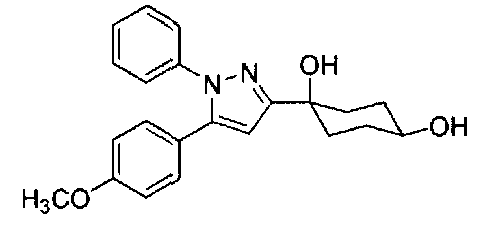



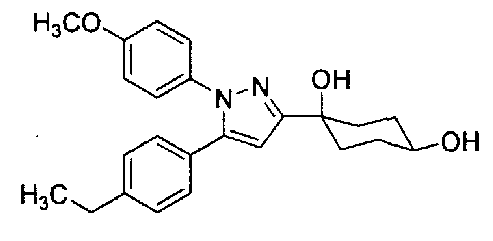




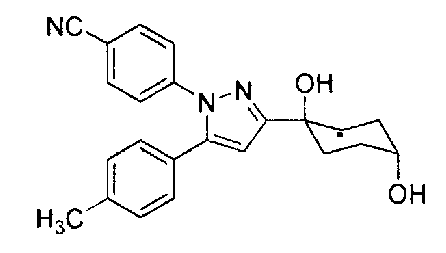



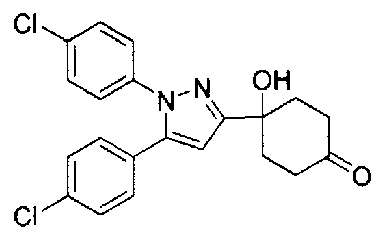


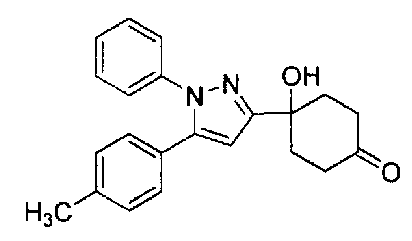





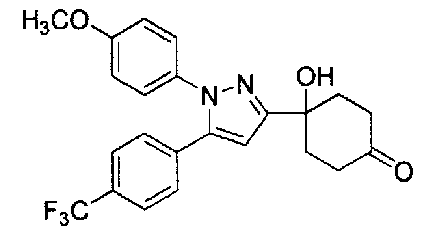

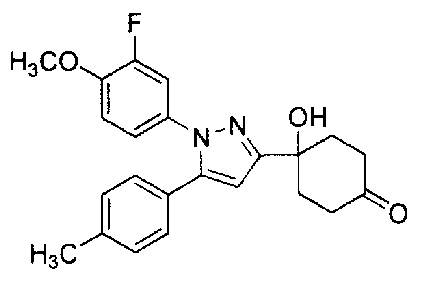







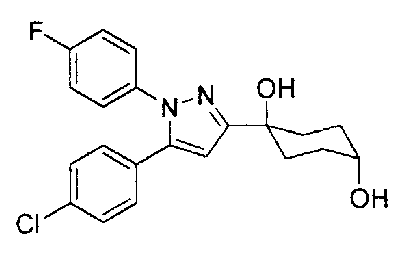





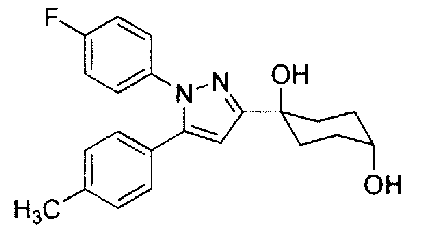


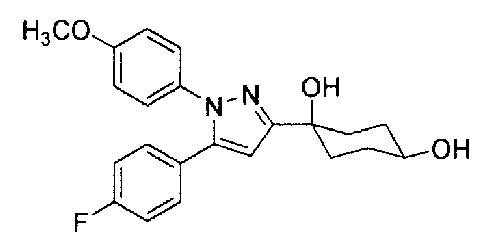

















Комментарии