Циклоалкениларильные производные для ингибирования транспортного белка холестериновых эфиров - RU2597266C2
Код документа: RU2597266C2
Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к новым циклоалкениларильным производным, и в частности, к новым циклоалкениларильным производным, обладающим ингибирующей активностью по отношению к транспортному белку холестериновых эфиров (СЕТР), их изомерам, фармацевтически приемлемым солям, гидратам или сольватам, а также к их применению при приготовлении фармацевтических составов, содержащих эти соединения, способам лечения заболеваний с помощью этих составов и способам получения новых циклоалкениларильных производных.
УРОВЕНЬ ТЕХНИКИ
Гиперлипидемия относится к повышенному уровню холестерина в крови и является бессимптомной. Тем не менее, гиперлипидемия является очень серьезным состоянием, вызывающим стенокардию, инфаркт миокарда и атеросклероз. Статины - медикаменты, обычно применяемые для лечения гиперлипидемии - проявляют терапевтический эффект, в основном, благодаря понижению уровня холестерина липопротеинов низкой плотности (LDL-C), но их профилактический эффект в отношении сердечнососудистых заболеваний находится на очень недостаточном уровне. Недавние исследования показали, что повышенная концентрация липопротеинов высокой плотности (HDL-C) очень эффективна для предотвращения сердечнососудистых заболеваний - также как и пониженный уровень холестерина липопротеинов низкой плотности (LDL-C) (Goldbourt et al, 1997, 17, 107-113). Среди медикаментов, используемых для повышения HDL-C, наиболее эффективным является ниацин. Однако, этот препарат необходимо принимать в относительно больших дозах, что сопровождается такими побочными эффектами, как покраснение лица (Taylor et al, Circulation, 2004, 110, 3512-3517).
Между тем, транспортный белок холестериновых эфиров (СЕТР) является белком, участвующим в обратном транспорте холестерина (обратном транспорте холестерина из периферийных тканей к печени). При ингибировании СЕТР уровень HDL-C можно эффективно увеличить, тем самым предотвращая сердечнососудистые заболевания. Соответственно, очень важной задачей является разработка соединений, способных ингибировать активность СЕТР (Barter et al., Arterioscler Thromb Vase Biol, 2003, 23, 160-167).
Ингибиторы CETP, известные на сегодняшний день, можно разделить по структурным признакам на торцетрапиб (WO 02/088085) и анацетрапиб (WO 2006/014357), являющиеся производными 3,5-бис-трифторметил-бензола, и далцетрапиб (WO 98/35937), являющийся производным бензолтиола.
Однако, из этих ингибиторов СЕТР торцетрапиб вызывает повышение кровяного давления и увеличение смертности, в результате чего его клинические исследования были прекращены. Сообщалось, что эти побочные эффекты стали следствием повышения торцетрапибом уровня таких гормонов, как альдостерон и кортизол, которые связаны с существенным повышением кровяного давления, и увеличения толщины стенок сосудов, что вызывало воспаление и, как следствие, увеличение смертности (Forrest et al, British Journal of Pharmacology, 2008, 1-9). В отношении другого ингибитора СЕТР, далцетрапиба, о таких побочных эффектах не сообщалось, но он повышает уровень HDL-C в недостаточной степени (Hisashi Shinkai. Expert Opinion on Therapeutic Patents, 2009, 19(9), 112-1237). Из упомянутых ингибиторов СЕТР в отношении анацетрапиба и далцетрапиба проводятся клинические исследования связанные с возможностью их использования для лечения гиперлипидемии и сердечнососудистых заболеваний путем увеличения уровня HDL-C и понижения уровня LDL-C (Niesor et al, Journal of lipid Research, 2010, 51, 3443-3453).
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ПРОБЛЕМА
Целью данного изобретения является получение новых циклоалкениларильных производных, их изомеров, фармацевтически приемлемых солей, гидратов и сольватов, и способов их получения.
Другой целью данного изобретения является получение новых циклоалкенильных производных, обладающих меньшим количеством побочных эффектов и способных эффективно ингибировать СЕТР, а также их изомеров, фармацевтически приемлемых солей, гидратов и сольватов, и способов их получения.
Еще одной целью данного изобретения является создание способов получения новых циклоалкенильных производных.
ТЕХНИЧЕСКОЕ РЕШЕНИЕ
Для достижения вышеописанных целей данное изобретение представляет циклоалкениларильные производные формулы 1, их изомеры, фармацевтически приемлемые соли, гидраты и сольваты, а также способы их получения.
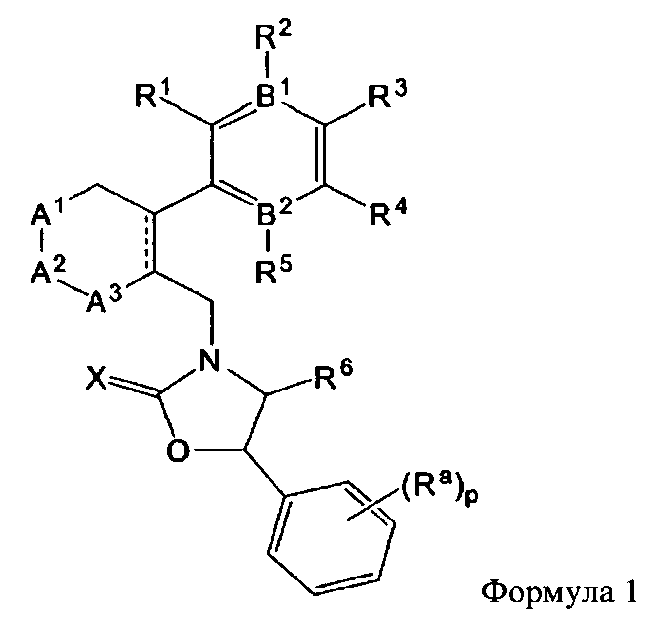
при этом
B1 и B2 каждый независимо являются N или С, при этом оба B1 и B2 не могут одновременно являться N, и если один из B1 и B2 является N, то R2 или R5 отсутствует;
R1 и R2 каждый независимо являются H, -F, -OH, -NH2, -C(=O)H, -CH2OH, -OC1-С6алкилом, -SC1-С6алкилом, -СН2ОС1-С6алкилом, -NH(C1-С6алкил), -NH(C=O)(C1-С6алкил), -N(C1-C6алкил)2, или

R1 и R2 вместе с атомами углерода, с которыми они связаны, могут образовывать 5- или 6-членное гетероциклическое ароматическое или неароматическое циклическое соединение, имеющее от 1 до 3 гетероатомов, независимо выбираемых из группы, состоящей из N, O, S, и C(=O), причем гетероциклическое ароматическое или неароматическое циклическое соединение может быть возможно замещенным R8;
R3 является -H, -F, -OH, -C1-С6алкилом, или -OC1-С6алкилом;
R4 является -H, галогеном, -CN, -NO2, -C1-С6алкилом, -C2-С6алкенилом, -C3-С6циклоалкилом,












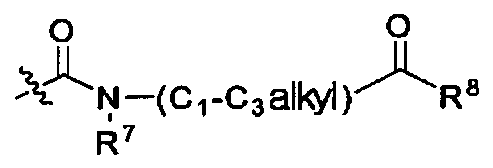

R3 и R4 вместе с атомами углерода, с которыми они связаны, могут образовывать 5- или 6-членное циклоалкильное или гетероциклическое соединение, имеющее от 0 до 3 гетероатомов, независимо выбираемых из группы, состоящей из N, O, S, и C(=O), причем циклоалкильное или гетероциклическое соединение может быть возможно замещенным R8;
Ar является C6 моноциклическим ароматическим соединением, которое является незамещенным или возможно замещенным одним или несколькими заместителями, выбираемыми из группы, состоящей из галогена, -OH, -NH2, -C1-С6алкила и -OC1-С6алкила;
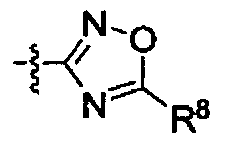
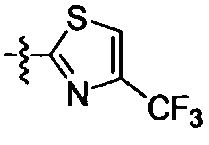
Het является 5- или 6-членным гетероциклическим соединением, содержащим от 0 до 2 двойных связей и от 1 до 4 гетероатомов, независимо выбираемых из группы, состоящей из N, О, S, С(=O) и C(=S), и может быть незамещенным или может быть возможно замещенным R8;
R5 является -H, -F, -OH, -CF3, -C1-С6алкилом, или -OC1-C6 алкилом;
R6 является -H или -C1-C6 алкилом;
R7 является -H, галогеном, -C(=O)(C1-С3алкил), -C1-С6алкилом, -OC1-С6алкилом, -C3-С6циклоалкилом, или -OC(=O)(C1-С3алкил);
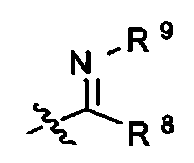
R8 является -H, галогеном, -OH, -CN, -NH2, -NH (C1-С3алкил), -C(=O)NH2, -СО2Н,






R9 является -H, -CN, -C1-С6алкилом, -OC1-С6алкилом, или -C(=O)(C1-С3алкил);
R10 является -NH(C1-С3алкил), -N(C1-С3алкил)2, или -S(C1-С3алкил);
Z является -CH2-,



Ra является -H, -Cl или -CF3;
p является целым числом в интервале от 0 до 2;
A1 и A2 каждый независимо являются -O-, -(CR11R12)-, или -NR13, при этом R11 и R12 каждый независимо являются -H, -F, или -C1-С6алкилом, или R11 и R12 вместе образуют 3- или 4-членное спироциклическое или неароматическое циклическое соединение и
R13 является -H, -C1-С6алкилом, -C(=O)(C1-С6алкил), -CO2(C1-С6алкил), -SO2(C1-С6алкил), или -C3-С6циклоалкилом;
A3 является -(CH2)n-;
X является S или O;
m является целым числом в интервале от 0 до 3;
n является целым числом в интервале от 0 до 2;
q является целым числом в интервале от 1 до 3;
при этом упомянутый -C1-С3алкил, -C3-С6циклоалкил -C1-С6алкил или -C2-С6алкенил является незамещенным или замещенным одним или несколькими заместителями, выбираемыми из группы, состоящей из галогена, -OH, -CF3, CN, -СО2Н, -C(=O)CH3, -ОС(=O)СН3, -C1-С3алкила, -OC1-С3алкила и -Ph.
Предпочтительным образом, данное изобретение представляет циклоалкениларильные производные, в соответствии с приведенным выше определением, их изомеры, фармацевтически приемлемые соли, гидраты и сольваты: при этом
B1 и В2 каждый независимо являются N или C, с той оговоркой, что оба В1 и В2 не могут одновременно являться N, и если любой из В1 и В2 является N, R2 или R5 отсутствует;
R1 является -F, -OH, -NH2, -C(=O)H, -CH2OH, -OCH3, -OCF3, -SCH3, -CH2OCH3, -NHCH3,


R2 является -H; или
R1 и R2 вместе с атомами углерода, с которыми они связаны, могут образовывать 5- или 6-членное гетероциклическое ароматическое или неароматическое циклическое соединение, имеющее от 1 до 3 гетероатомов, независимо выбираемых из группы, состоящей из N, О, S, и С(=O), при этом гетероциклическое ароматическое или неароматическое циклическое соединение может быть возможно замещенным R8;
R3 является -H, -F, -ОН, -CH3, -CF3, -СН2СН3,или -ОСН3;
R4 является -H, -F, -Cl, -CN, -NO2, -СН3, -СН2СН3, -CH(СН3)2, -C(СН3)3, -CF3, -CH(CF3)2, -CH(CH3)(CF3), -C(OCH3)(CF3)2, -CH(OH)CH3, -C(OH)(CH3)2, -C(OH)(CF3)2, -C(=CF2)CF3, -циклопропилом,










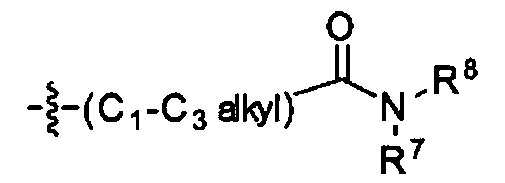


Ar или Het; или
R3 и R4 вместе с атомами углерода, с которыми они связаны, могут образовывать 5- или 6-членное циклоалкильное или гетероциклическое соединение, имеющее от 0 до 3 гетероатомов, независимо выбираемых из группы, состоящей из N, О, S, и C(=O), при этом циклоалкильное или гетероциклическое соединение может быть возможно замещенным R8;
Ar является C6 моноциклическим ароматическим соединением, незамещенным или возможно замещенным одним или несколькими заместителями, выбираемыми из группы, состоящей из -F, -Cl, -OH, -NH2, -CH3 и -OCH3;
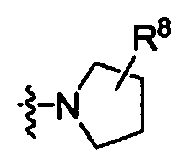
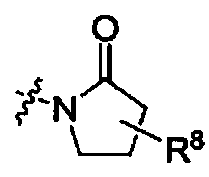
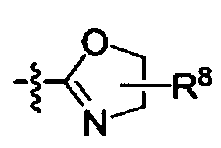
Het выбирают из













R5 является -H;
R6 является -H или -CH3;
R7 является -H, галогеном, -C(=O)(C1-С3алкил), -C1-С6алкилом, -OC1-С6алкилом, -C3-С6циклоалкилом, или -OC(=O)(C1-С3алкил);
R8 является -H, галогеном, -OH, -CN, -NH2, -NH(C1-С3алкил), -C(=O)NH2, -CO2H,





R9 является -H, -CN, -C1-С6алкилом, -OC1-С6алкилом, или -С(=O)(C1-С3алкил);
R10 является -NH(C1-С3алкил), -N(C1-С3алкил)2, или -S(C1-С3алкил);
Z является -CH2-,




Ra является -H, -Cl или -CF3;
p равняется 2;
A1 является -CH2-, -C(СН3)2-, или -NR13;
A2 является -O-, -(CR11R12)-, или -NR13, при этом R11 и R12 каждый независимо являются -H, -F, -CH3, -CF3, -CH2CH3, -СН(СН3)2, или -С(СН3)3, или R11 и R12 вместе образуют 3- или 4-членное спироциклическое или неароматическое циклическое соединение, и R13 является -H, -CH3, -CF3, -CH2CH3, -СН(СН3)2, -CH2CF3, -C(=O)CH3, -C(=O)CF3, -CO2C(СН3)3, -SO2CH3, -SO2CF3, или

A3 является -(CH2)n-;
X является S или O;
m является целым числом в интервале от 0 до 3;
n является целым числом в интервале от 0 до 2;
q является целым числом в интервале от 1 до 3;
при этом упомянутый -C1-С3алкил, -C3-С6циклоалкил, -C1-С6алкил или -C2-С6алкенил является незамещенным или замещенным одним или несколькими заместителями, выбираемыми из группы, состоящей из -F, -Cl, -Br, -OH, -CF3, -CN, -СО2Н, -C(=O)CH3, -ОС(=O)CH3, -C1-С3алкила, -OC1-С3алкила, и -Ph.
Отдельные примеры предпочтительных соединений формулы 1 по данному изобретению включают:
Отдельные примеры более предпочтительных соединений формулы 1 по данному изобретению включают:
Получение соединений
Способы получения соединений
Соединения формулы I по данному изобретению могут быть получены различными способами, описанными в различных литературных источниках (WO 2006/014357 A1). Способы получения соединений формулы I далее будут подробно описаны со ссылками на соответствующие схемы.
[Реакционная Схема 1]

где A1, A2, A3, B1, B2, R1, R2, R3, R4, R5, R6, Ra, p и X соответствуют вышеприведенному описанию; Y является уходящей группой, предпочтительно галогенидной группой (например, хлоридом или бромидом); и Q может являться -B(ОН)2 или

Как показано на реакционной схеме 1 выше, исходное соединение II реагирует с трибромидом фосфора (PBr3) или оксихлоридом фосфора (POCl3) в диметилформамиде (DMF), что представляет собой реакцию Вильсмайера для введения галогена в соединение II.
В реакции получения соединения II в качестве растворителя можно использовать метиленхлорид, температура реакции 0-70°C, предпочтительным образом 0~45°C.
Соединение V можно получить из соединения III и соединения IV с помощью реакции Сузуки (Morris, G.A., et al, Tetrahedron Lett., 2001, 42, 2093) или реакции Ульмана (Martin G. Banwell et al. Org. Lett. 2004, 6, 2741). Кроме того, соединение IV, используемое в процессе синтеза, можно получить по описанной в литературе методике (WO 2006/014357 A1, Erin F. DiMauro et al., J. Med. Chem. 2006, 49, 5671).
В реакции получения соединения V в качестве растворителя можно использовать диметоксиэтан (DME), диметилсульфоксид (DMSO), воду и т.п., температура реакции составляет 80~150°C, и предпочтительным образом 80~100°C. Полученные соединения V и III можно подвергнуть восстановительному аминированию с амино-спиртовым соединением VI, полученным в соответствии с описанной в литературе методикой (WO 2006/014357 A1, Jingjun Yin et al., J. Org. Chem. 2006, 840), получив при этом соединения VII и VIII соответственно.
Полученные соединения VII и VIII можно конвертировать в желаемые соединения I и IX соответственно, с помощью реакции с тиофосгеном или трифосгеном. Кроме того, полученное соединение IX также можно конвертировать в желаемое соединение I с помощью реакции Сузуки с соединением IV.
Как описано выше, соединения формулы I в целом получены в соответствии со способом, показанным на реакционной схеме 1. Кроме того, соединения из примеров по данному изобретению также могут быть получены в соответствии с реакционными схемами 2, 3, 4 и 5.
[Реакционная Схема 2]

Соединение 15, X=S, R2 = 2-метокси-5-изопропилбензол
Соединение 16, X=S, R2 = 2-метоксибензол
Соединение 17, X=S, R2 = 2-метокси-4-фтор-5-изопропилбензол
Соединение 18, Х=O, R2 = 2-метоксибензол
Соединение 36, Х=O, R2 = 2-метокси-5-метилбензоат
Соединение 41, Х=O, R2 = 2-метокси-4-фтор-5-метилбензоат
Соединение 51, Х=O, R2 = 4-индол
Соединение 56, Х=O, R2 = 2-метокси-5-диметилбензоламин
Соединение 97, Х=O, R2 = 2-фтор-5-трифторметилбензол
Соединение 115, Х=O, R2 = 2-метокси-5-трет-бутилбензол
Соединение 117, Х=O, R2 = 2-метокси-5-трифторметоксибензол
На реакционной схеме 2 показан общий способ получения соединений 15, 16, 17, 18, 36, 41, 51, 56, 97, 115 и 117 по данному изобретению, другие соединения по данному изобретению также могут быть получены в соответствии с реакционной схемой 2. Как показано на реакционной схеме 2, диметилформамид (DMF) и трибромид фосфора (PBr3) по каплям добавляли к исходному диметилциклогексанону для получения соединения 2, после чего его подвергли реакции Сузуки с коммерчески доступным производным бороновой кислоты в присутствии палладиевого катализатора, получив таким образом соединение 3. Полученное соединение 3конвертировали в соединение 5 путем реакции с соединением 4, приготовленным в соответствии с методикой, описанной в литературе (2006/014357 A1, Jingjun Yin et al., J. Org. Chem. 2006, 840). Полученное соединение 5 можно конвертировать в желаемое соединение 6 путем реакции с тиофосгеном или трифосгеном. [Реакционная Схема 3]
[Реакционная Схема 3]

На реакционной схеме 3изображен общий процесс получения соединений 57, 60, 61 и 79 по данному изобретению; другие соединения по данному изобретению также могут быть получены в соответствии с реакционной схемой 3. Исходное соединение 7 реагирует с соединением 4, уксусной кислотой и цианоборгидридом натрия с образованием соединения 8, которое затем в результате реакции с трифосгеном приводит к соединению 9. Полученное соединение 9 может далее вступать в реакцию Сузуки (Morris, G.A., et al., Tetrahedron Lett., 2001, 42, 2093) с различными бороновыми кислотами, приводя к получению желаемых соединений.
[Реакционная Схема 4]

На приведенной выше реакционной схеме 4 показан общий процесс синтеза соединений 133и 134 по данному изобретению; другие соединения по данному изобретению также могут быть получены в соответствии с реакционной схемой 4. Как показано на реакционной схеме 4, исходное соединение 10 реагирует с йодом (I2) и сульфатом серебра с образованием соединения 11, которое далее реагирует с бис(пинаколато)дибороном в присутствии палладиевого катализатора с образованием соединения 12. Соединение 9 и бороновую кислоту можно по каплям добавить к полученному соединению 12, после чего провести реакцию Сузуки (Morris, G.A., et al, Tetrahedron Lett., 2001, 42, 2093), получив таким образом соединение 133. Полученное соединение 133можно превратить в соединение 134 путем гидролиза с гидроксидом лития (LiOH).
[Реакционная Схема 5]

На приведенной выше реакционной схеме 5 показан общий процесс синтеза соединений 110, 112,128, 136, 137, 138, 141, 163и 177 по данному изобретению; другие соединения по данному изобретению также могут быть получены в соответствии с реакционной схемой 5. Как показано выше на реакционной схеме 5, исходное производное бороновой кислоты 13 вступает в реакцию Сузуки (Morris, G.A., et al., Tetrahedron Lett., 2001, 42, 2093) с соединением 2 с образованием соединения 14, которое затем нитруют азотной кислотой, получив таким образом соединение 15. Полученное соединение 15 вступает в реакции, показанные на реакционной схеме 2, приводя таким образом к соединению 16 и соединению 52. Полученное соединение 52 можно обработать металлическим никелем для восстановления нитрогруппы, после чего провести реакцию с различными ацилхлоридными или сульфонилхлоридными соединениями, с получением различных продуктов. Полученные соединения 110, 136 и 137 могут реагировать с йодометаном, приводя таким образом к соединениям 112, 128, 138, 141 и 177.
[Реакционная Схема 6]

На приведенной выше реакционной схеме 6 показан общий процесс синтеза соединений 286 и 311 по данному изобретению; другие соединения по данному изобретению также могут быть получены в соответствии с реакционной схемой 6. Как показано на реакционной схеме 6, исходный 4-метоксифенэтил бромид или 4-метоксибензил хлорид вступает в реакцию, описанную в литературе (Akio Baba et al., Tetrahedron 2009, 65, 5462), приводя таким образом к соединению 19. Полученное соединение 19 реагирует с йодом (1 г) и сульфатом серебра с образованием соединения 20, которое далее реагирует с бис(пинаколато)дибороном в присутствии палладиевого катализатора с образованием соединения 21. Соединение 2 по каплям добавляют к полученному соединению 21, после чего проводят реакцию Сузуки (Morris, G.A., et al., Tetrahedron Lett., 2001, 42, 2093), получив таким образом соединение 22. Полученное соединение 22 подвергают реакциям, изображенным на реакционной схеме 2 (восстановительное аминирование и циклизация), для получения соединений 285 и 310, которые затем гидролизуют гидроксидом лития (LiOH), с получением желаемых соединений 286 и 311.
[Реакционная Схема 7]

На приведенной выше реакционной схеме 7 показан общий процесс синтеза соединений 349 и 350 по данному изобретению; другие соединения по данному изобретению также могут быть получены в соответствии с реакционной схемой 7. Как показано на реакционной схеме 7, ключевое промежуточное соединение 29 может быть синтезировано описанным способом в соответствии с литературной методикой (US 2010/0081673 A1). Исходная 6-гидроксиникотиновая кислота реагирует с бромом (Br2) с образованием соединения 24, которое затем подвергают эстерификации, получив таким образом соединение 25. Полученное соединение 25 реагирует с солью Меервейна (US 5929094 A1) с образованием соединения 26. Полученное соединение 26 восстанавливают с помощью диизобутилалюминий гидрида (DIBAL-H) для получения соединения 27, которое затем хлорируют хлоридом титана (TiCl4), получив таким образом соединение 28. Полученное соединение 28 вступает в реакцию с реагентами, описанными в литературном источнике (Akio Baba et al., Tetrahedron 2009, 65, 5462), приводя таким образом к ключевому промежуточному соединению 29. После этого, соединение 29 вступает в реакции, показанные на реакционных схемах 4 и 6, приводя в итоге к желаемым соединениям 349 и 350.
[Реакционная Схема 8]

На приведенной выше реакционной схеме δ показан общий процесс синтеза соединения 366 по данному изобретению; другие соединения по данному изобретению также можно синтезировать по реакционной схеме 8. Как показано на реакционной схеме 8, исходный 2-бром-3-пиридинол реагирует с йодом (b) с образованием соединения 33, которое затем метилируют, получая таким образом соединение 34. Полученное соединение 34 вступает в реакцию Сузуки (Morris, G.A., et al., Tetrahedron Lett., 2001, 42, 2093) с образованием соединения 35, которое затем реагирует с промежуточным соединением 36, приводя таким образом к соединению 37. Далее, в результате ряда различных реакций (гидроксилирование, окисление (N-оксид)/восстановление (DIBAL-H), и окисление (Десс-Мартин)) образуется промежуточное соединение 41. Далее, в результате реакций, показанных на реакционной схеме 6, образуется соединение 43. Индий (In) и насыщенный водный раствор хлорида аммония по каплям добавляли к соединению 43, получив в результате соединение 366.
Циклоалкениларильные производные формулы I могут содержать он или несколько ассиметричных атомов углерода, и могут существовать в виде рацематов, рацемических смесей, отдельных энантиомеров, смесей диастереомеров и индивидуальных диастереомеров. Такие изомеры могут быть разделены способами, известным из уровня техники. Например, изомеры циклоалкениларильных производных формулы I можно разделить с помощью колоночной хроматографии или жидкостной хроматографии высокого давления (HPLC). Альтернативным образом, любой энантиомер соединения формулы I может быть получен с помощью стереоспецифического синтеза с использованием оптически чистых исходных материалов или реагентов известной конфигурации.
Некоторые соединения по данному изобретению в ЯМР спектрах наблюдаются как смеси атропоизомеров (ротамеров). Отдельные атропоизомеры, а также их смеси, являются включенными в число соединений по данному изобретению.
Соединения формулы I по данному изобретению могут быть в форме фармацевтически приемлемых солей, происходящих от неорганических или органических кислот. Предпочтительные примеры кислот, которые могут быть использованы для образования фармацевтически приемлемых солей присоединения кислоты, включают соляную кислоту, бромоводородную кислоту, серную кислоту, фосфорную кислоту, азотную кислоту, уксусную кислоту, гликолевую кислоту, молочную кислоту, пировиноградную кислоту, малоновую кислоту, янтарную кислоту, глутаровую кислоту, фумаровую кислоту, яблочную кислоту, миндальную кислоту, винную кислоту, лимонную кислоту, аскорбиновую кислоту, пальмитиновую кислоту, малеиновую кислоту, гидроксималеиновую кислоту, бензойную кислоту, гидроксибензойную кислоту, фенилуксусную кислоту, коричную кислоту, салициловую кислоту, метансульфоновую кислоту, бензолсульфоновую кислоту и толуолсульфоновую кислоту.
Далее в этом документе данное изобретение будет проиллюстрировано примерами. Следует понимать, что эти примеры служат исключительно иллюстративным целям и не могут рассматриваться как ограничивающие объем данного изобретения.
Полезные эффекты
Данное изобретение представляет новые циклоалкениларильные производные, их изомеры, фармацевтически приемлемые соли, гидраты и сольваты, а также способы их получения.
Кроме того, данное изобретение представляет новые циклоалкениларильные производные, обладающие небольшими побочными эффектами и способными эффективно ингибировать СЕТР, их изомеры, фармацевтически приемлемые соли, гидраты и сольваты, а также способы их получения.
Примеры
В дальнейшем в этом документе, данное изобретение будет описано в деталях со ссылками на примеры. Необходимо понимать, что эти примеры используются только в иллюстративных целях и не должны восприниматься как ограничивающие объем данного изобретения.
Соединение 15
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-изопропил-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-тион
Как показано на реакционной схеме 2, было синтезировано промежуточное соединение 5. Тиофосген (5 мл) и триэтиламин (66 мкл, 0,44 ммоль) добавили по каплям к полученному промежуточному соединению 5 (53 мг, 0,095 ммоль), после чего реакционную смесь кипятили при перемешивании в течение ночи при температуре 100°C. По окончанию реакции, реакционную смесь разбавили метиленхлоридом (CH2Cl2), промыли насыщенным раствором гидрокарбоната натрия и соляным раствором и высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (SiO2, 5% Hex/EA), получив в результате соединение 15 (10 мг, 18%).
1H ЯМР (400 МГц, CDCl3); 1:1,5 смесь атропоизомеров; δ 7,77 (s, 1H), 7,65 (s, 2Н), 6,98-6,95 (m, 1Н), 6,72-6,62 (m, 2Н), 5,63-5,60 (m, 1H), 4,50 (bd, 1H), 4,14-4,11 (m, 0,6Н), 4,01-3,97 (m, 0,4Н), 3,66 (s, 1H), 3,61 (s, 2Н), 2,75-2,67 (m, 1H), 2,46-2,42 (bm, 1Н), 2,18-2,16 (bm, 1H), 2,01-1,77 (m, 3H), 1,45-1,36 (m, 2Н), 1,11-1,04 (m, 6Н), 0,94-0,92 (m, 6Н), 0,31 (d, 1,2Н, J=6,6), 0,19 (d, 1,8Н, J=6,6). MS (ESI) m/z 600 (M++H).
Соединение 16
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-тион
Соединение 16 (21 мг, 39%) в виде твердого вещества желтого цвета было получено способом, аналогичным способу получения соединения 15.
1H ЯМР (400 МГц, CDCl3); 1:1,7 смесь атропоизомеров; δ 7,77 (s, 1H), 7,65 (s, 2Н), 7,15 (m, 1Н), 6,89-6,71 (m, 3H), 5,62 (d, 1H, J=8,3), 4,52 (s, 0,5Н), 4,48 (s, 0,5Н), 4,16-3,97 (m, 1Н), 3,70 (bd, 0,7Н), 3,69-3,64 (bd, 3H), 3,58 (bd, 0,4Н), 2,19-2,14 (bm, 1Н), 2,01-1,76 (m, 3H), 1,42-1,34 (m, 2Н), 0,93 (m, 6Н), 0,34 (d, 1,1Н, J=6,6), 0,21 (d, 1,9Н, J=6,6).
Соединение 17
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-5-изопропил-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-тион
Соединение 17 (38 мг, 70%) в виде твердого вещества желтого цвета было получено способом, аналогичным способу получения соединения 15.
1H ЯМР (400 МГц, CDCl3); 1:1,5 смесь атропоизомеров; δ 7,78 (s, 1Н), 7,65 (s, 2Н), 6,89-6,67 (m, 1Н), 6,43 (m, 1H), 5,63 (d, 1Н, J=8,4), 4,52-4,46 (m, 1Н), 4,11-4,07 (m, 0,5H), 4,01-3,97 (m, 0,4H), 3,66 (bd, 0,6H), 3,65 (s, 1H), 3,59 (s, 2H), 3,56 (bd, 0,4H), 3,05-2,99 (m, 1H), 2,20-2,00 (bm, 1H), 1,91-1,77 (m, 2H), 1,42-1,37 (m, 2H), 1,12 (d, 3H, J=6,9), 1,08 (d, 1,5H, J=6,9), 1,02 (d, 1,3U,J=6,9), 0,93 (m, 6H), 0,34 (d, 1,2H, J=6,6), 0,24 (d, 1,8H, J=6,6). MS (ESI) m/z 618 (M++H).
Соединение 18
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Как показано на реакционной схеме 2, было синтезировано промежуточное соединение 5. Полученное промежуточное соединение 5 (43 мг, 0,083 ммоль) растворили в метиленхлориде (3 мл). Трифосген (13 мг, 0,04 ммоль) и диизопропилэтиламин (0,09 мл, 0,49 ммоль) добавили по каплям к полученной реакционной смеси, и затем перемешивали при комнатной температуре в течение 1 часа. По окончанию реакции, реакционную смесь разбавили этилацетатом, промыли соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью колоночной хроматографии, получив в результате соединение 18 (36 мг, 80%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3); 1:1,5 смесь атропоизомеров; δ 7,74 (s, 1H), 7,62 (s, 2Н), 7,14-7,09 (m, 1H), 6,89-6,71 (m, 3H), 5,50-5,46 (m, 1Н), 3,92-3,79 (m, 2Н), 3,66 (s, 1,3H), 3,63 (s, 1,8Н), 3,48 (bd, 0,6Н), 3,33 (bd, 0,4Н), 2,20-2,00 (m, 1Н), 2,00-1,81 (m, 3H), 1,41-1,35 (m, 2Н), 0,94 (d, 3H, J=6), 0,91 (s, 3H), 0,31 (d, 1,2Н, J=6,6), 0,19 (d, 1,8Н, J=6,5). MS (ESI) m/z 542 (M++H).
Соединение 19
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-5-изопропил-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 19 (37 мг, 100%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); 1:1,2 смесь атропоизомеров; δ 7,75 (s, 1H), 7,62 (s, 2Н), 6,68 (dd, 1H, J=8,7, 10,9), 6,42 (dd, 1H, J=12, 17), 5,50 (t, 1H, J=6,8), 3,91-3,77 (m, 2H), 3,62 (s, 1,4H), 3,59 (s, 1,7H), 3,44 (bd, 0,6H), 3,31 (bd, 0,4H), 3,09-2,97 (m, 1H), 2,39-2,34 (bm, 0,5H), 2,12-2,01 (bm, 1H), 1,95-1,90 (bm, 0,6H), 1,82-1,80 (m, 2H), 1,43-1,32 (m, 2H), 1,11-1,01 (m, 6H), 0,94 (s, 3H), 0,90 (d, 3H, J=6,6), 0,31 (d, 1,4H, J=6,5), 0,22 (d, 1,6H, J=6,5). MS (ESI) m/z 602,0 (M++H).
Соединение 25
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-5-изопропил-2-метоксифенил)-5-метилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 25 (33 мг, 87%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); 1:1 смесь атропоизомеров; δ 7,83 (s, 1H), 7,71 (s, 2Н), 6,79-6,73 (m, 1H), 6,55-6,47 (m, 1H), 5,62-5,56 (m, 1Н), 3,98-3,85 (m, 2Н), 3,70 (s, 1,4Н), 3,67 (d, 1,6Н, J=3,9), 3,59-3,35 (m, 1Н), 3,13-3,07 (m, 1Н), 2,25-2,02 (m, 2Н), 1,82-1,71 (m, 3H), 1,35-1,28 (m, 1Н), 1,19-1,09 (m, 6Н), 1,04-1,02 (m, 3H), 0,39 (dd, 1,38Н, J=1,7, 6,5), 0,34 (d, 0,79Н, J=6,5), 0,30 (d, 0,82Н, J=6,5).
Соединение 26
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-5-изопропил-2-метоксифенил)-5-метилциклогекс-1-енил)метил)-4-метилоксазолидин-2-тион
Соединение 26 (22 мг, 73%) в виде твердого вещества желтого цвета было получено способом, аналогичным способу получения соединения 15.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,88 (s, 1H), 7,76 (s, 2Н), 6,82-6,78 (m, 1Н), 6,59-6,49 (m, 1H), 5,78-5,73 (m, 1H), 4,75-4,25 (m, 1Н), 4,40-4,07 (m, 1H), 3,82 (d, 0,3H), 3,75 (s, 1,5Н), 3,71-3,58 (m, 0,7Н), 3,69 (d, 1,5Н, J=4,1), 3,15-3,10 (m, 1H), 2,60-2,05 (bm, 3H), 1,85-1,77 (bm, 3H), 1,43-1,33 (m, 1Н), 1,19-1,08 (m, 6Н), 1,06 (d, 3H, J=4,4), 0,46 (m, 1,1Н), 0,40 (d, 0,7Н, J=6,6), 0,34 (d, 0,8Н, J=6,6).
Соединение 27
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-5-изопропил-2-метоксифенил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 27 (91 мг, 93%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); 1:1,1 смесь атропоизомеров; δ 7,86 (s, 1H), 7,73 (s, 2Н), 6,80 (dd, 1Н, J=11,6, 8,7), 6,54 (dd, 1Н, J=16,9, 12,2), 5,61 (d, 1H,J=8,1), 4,01-3,87 (m, 2H), 3,73 (s, 1,4H), 3,70 (s, 1,6H), 3,54 (d, 0,6H, J=14,5), 3,43 (d, 0,4H, J=14,9), 3,17-3,08 (m, 1H), 2,43-1,99 (bm, 4H), 1,81-1,73 (bm, 4H), 1,24-1,18 (m, 5H), 1,14 (d, 1H, J=6,9), 0,42 (d, 1,4H, J=6,5), 0,35 (d, 1,6H, J=6,5). MS (ESI) m/z 574 (M++H).
Соединение 28
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-5-изопропил-2-метоксифенил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-тион
Соединение 28 (75 мг, 82%) в виде масла желтого цвета было получено способом, аналогичным способу получения соединения 15.
1H ЯМР (400 МГц, CDCl3); 1:1,3 смесь атропоизомеров; δ 7,87 (s, 1H), 7,76 (s, 2Н), 6,81-6,54 (t, IU,J=8,8), 6,54 (dd, 1H, J=12,2, 21,1), 5,77 (t, 1H, J=8,7), 4,64-4,56 (bm, 1H), 4,22-4,08 (m, 1H), 3,78-3,68 (m, 1H), 3,75 (s, 1,23H), 3,69 (s, 1,64H), 3,17-3,09 (m, 1H), 2,44-2,00 (bm, 4H), 1,79-1,71 (bm, 4H), 1,31-1,12 (m, 6H), 0,46 (d, 1,3H, J=6,6), 0,38 (d, 1,7H, J=6,6). MS (ESI) m/z 590 (M++H).
Соединение 29
(4S,5R,Z)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-5-изопропил-2-метоксифенил)циклогепт-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 29 (99 мг, 62%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); 1:1,7 смесь атропоизомеров; δ 7,84 (s, 1Н), 7,72 (s, 2Н), 6,75 (2d, 1H, J=8,6), 6,52 (2d, 1Н, J=12,2), 5,60 (dd, 1Н, J=8,1, 12,5), 4,04-3,87 (m, 2H), 3,72 (s, 1H), 3,69 (s, 2H), 3,47 (dd, 1H, J=14,6), 3,15-3,05 (m, 1H), 2,47-2,24 (m, 4H), 1,84-1,80 (m, 2H), 1,72-1,48 (m, 4H), 1,21-1,11 (m, 6H), 0,40 (d, 1,1H, J=6,5), 0,27 (d, 1,9H, J=6,5). MS (ESI) m/z 588 (M++H).
Соединение 30
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((4-(4-фтор-5-изопропил-2-метоксифенил)-5,6-дигидро-2Н-пиран-3-ил)метил)-4-метилоксазолидин-2-он
Соединение 30 (35 мг, 61%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86 (s, 1Н), 7,71 (s, 2Н), 6,56-6,89 (m, 1Н), 6,53-6,61 (m, 1Н), 5,60 (d, J=8,0, 1Н), 4,15 (s, 2H), 3,84-4,03 (m, 4H), 3,76 (s, 3H), 3,45-3,63 (m, 1H), 3,12-3,17 (m, 1H), 2,12-2,66 (m, 2H), 1,21-1,28 (m, 6H), 0,38-0,39 (m, 3H). MS (ESI) m/z 620 (M++H).
Соединение 31
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-5-изопропил-2-метоксифенил)циклопент-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 31 (0,13 г, 81%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86 (s, 1H), 7,71 (s, 2Н), 6,88 (d, J=8,7, 1H), 6,57 (d, J=12,2, 1H), 5,46 (d, J- 8,0, 1H), 4,20 (d, J=15,0, 1H), 3,76-3,95 (m, 1H), 3,65 (s, 3H), 3,11-3,17 (m, 1H), 2,53-2,80 (m, 4H), 1,21-1,28 (m, 6H), 0,40 (m, 3H). MS (ESI) m/z 604 (M++45).
Соединение 32
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-изопропил-2-метоксифенил)циклопент-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 32 (0,22 г, 89%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3) δ 7,85 (s, 1H), 7,69 (s, 2Н), 7,08-7,10 (m, 1Н), 6,90-6,91 (m, 1Н), 6,81 (d, J=8,4, 1H), 5,36 (d, J=8,1, 1Н), 4,23 (d, J=14,8, 1H), 3,87-3,94 (m, 1H), 3,68 (m, 3H), 2,54-2,87 (m, 5H), 1,97-2,05 (m, 2H), 1,20-1,22 (m, 6H), 0,40 (m, 3H). MS (ESI) m/z 587 (M++H).
Соединение 34
3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)циклогекс-1-енил)-4-метоксибензойная кислота
Соединение 36 (20 мг, 0,035 ммоль) растворили в тетрагидрофуране/вода (3 мл, в объемном соотношении 1:1). Гидроксид лития (избыточное количество) добавили по каплям к полученному раствору, после чего реакционную смесь кипятили при перемешивании при комнатной температуре в течение 2 часов. По окончанию реакции, реакционную смесь разбавили этилацетатом, промыли водой и соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении, получив в результате соединение 34 (16 мг, 60%) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, бензол-d6); 1:1 смесь атропоизомеров; δ 8,19-8,14 (m, 1Н), 8,03-8,01 (m, 1H), 7,63 (s, 1H), 7,41-7,15 (m, 2Н), 6,39-6,35 (m, 1Н), 4,78-4,76 (d, J=8,0, 0,5Н), 4,72-4,70 (d, J=8,0, 0,5Н), 4,19-4,16 (d, J=13,6, 0,5H), 4,04-4,00 (d, J=13,6,0,5H), 3,49-3,31 (m, 2H), 3,14 (s, 1,5H), 3,11 (s, 1,5H), 2,38-1,98 (m, 4H), 1,67-1,56 (m, 5H), (-)0,09-(-)0,11 (d, J=6,5, 1,5H), (-)0,15-(-)0,17 (d, J=6,5, 1,5H). MS (ESI) m/z 558 (M++H).
Соединение 36
метил 3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)циклогекс-1-енил)-4-метоксибензоат
Соединение 36 (40 мг, 63%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, бензол-d6); 1:1 смесь атропоизомеров; δ 8,11-8,05 (m, 1Н), 7,96-7,91 (d, J=2,2, 0,5Н), 7,95-7,94 (d, J=2,2, 0,5Н), 7,62 (s, 1H), 7,38-7,36 (d, J=6,4, 1H), 6,41-6,35 (dd, J=8,6, 8,6, 1H), 4,76-4,74 (d, J=8,0, 0,5H), 4,70-4,68 (d, J=8,0, 0,5H), 4,20-4,16 (d, J=15,6, 0,5H), 4,01-3,98 (d, J=15,6, 0,5H), 3,58 (s, 1,5H), 3,52 (s, 1,5H), 3,43-3,30 (m, 3H), 3,16 (s, 1,5H), 3,12 (s, 1,5H), 2,16-2,07 (m, 3H), 1,67-1,55 (m, 4H), (-)0,12-(-)0,13 (d, J=6,5, 1,5H), (-)0,17-(-)0,19 (d, J=6,5, 1,5H). MS (ESI) m/z 573 (M++H).
Соединение 37
3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксибензойная кислота
Соединение 37 (19 мг, 80%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 34.
1H ЯМР (400 МГц, бензол-d6); 1:1 смесь атропоизомеров; δ 8,19-8,14 (m, 1Н), 8,03-8,01 (m, 1Н), 7,63 (s, 1Н), 7,41-7,15 (d, 2Н), 6,39-6,35 (m, 1Н), 4,83-4,81 (d, J=8,4, 0,5Н), 4,77-4,75 (d, J=8,4, 0,5Н), 4,17-4,13 (d, J=15,2, 0,5Н), 4,00-3,96 (d, J=15,2, 0,5H), 3,49-3,31 (m, 2H), 3,14 (s, 1,5H), 3,11 (s, 1,5H), 2,42-1,90 (m, 3H), 1,46-1,23 (m, 4H), 1,06-0,83 (m, 6H), (-)0,06-(-)0,08 (d, J=6,5, 1,5H), (-)0,13-(-)0,15 (d, J=6,5, 1,5H). MS (ESI) m/z 586 (M++H).
Соединение 41
метил 3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксибензоат
Соединение 41 (45 мг, 70%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, бензол-d6); 1:1 смесь атропоизомеров; δ 8,11-8,05 (m, 1Н), 7,96-7,91 (d, 0,5Н), 7,95-7,94 (d, 0,5Н), 7,62 (s, 1H), 7,38-7,36 (d, 1H), 6,41-6,35 (dd, J=8,6, 8,6, 1Н), 4,80-4,78 (d, J=8,0, 0,5H),4,76-4,74 (d, J=8,0, 0,5H), 4,16-4,13 (d, J=15,0, 0,5H), 3,98-3,94 (d, J=15,0, 0,5H), 3,58 (s, 1,5H), 3,52 (s, 1,5H), 3,43-3,30 (m, 2H), 3,16 (s, 1,5H), 3,12 (s, 1,5H), 2,04-1,93 (m, 3H), 1,42-1,22 (m, 4H), 1,02-0,86 (m, 6H), (-)0,09-(-)0,10 (d, J=6,5, 1,5H), (-)0,16-(-)0,18 (d, J=6,5, 1,5H). MS (ESI) m/z 600 (M++H).
Соединение 42
(4S,5R,Z)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-изопропил-2-метоксифенил)циклогепт-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 42 (0,11 г, 75%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); 1:1,9 смесь атропоизомеров; δ 7,84 (s, 1H), 7,73 (s, 2Н), 7,04 (dd, 1Н, J=8,3, 2,0), 6,81-6,71 (m, 2Н), 5,58 (2d, 1Н, J=8,0), 4,05-3,90 (m, 2Н), 3,73 (d, 3H, J=11,3), 3,51 (2d, IU,J=14,2), 2,85-2,76 (m, 1H), 2,52-2,27 (m, 4H), 1,85-1,82 (m, 2H), 1,71-1,51 (m, 4H), 1,20-1,14 (m, 6H), 0,38 (d, 1H, J=6,5), 0,23 (d, 1,9H, J=6,5). MS (ESI) m/z 574 (M++H).
Соединение 43
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((5-этил-2-(4-фтор-5-изопропил-2-метоксифенил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 43 (0,12 г, 80%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86 (s, 1Н), 7,74 (s, 2Н), 6,76-6,81 (m, 1Н), 6,49-6,58 (m, 1H), 3,92-4,14 (m, 2Н), 3,69-3,75 (m, 3H), 3,37-3,59 (m, 1H), 3,10-3,15 (m, 1H), 1,82-2,22 (m, 4H), 1,40-1,43 (m, 2H), 0,87-1,00 (m, 6H), 0,40 (m, 3H). MS (ESI) m/z 647 (M++H).
Соединение 44
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-изопропил-2-метоксифенил)-4,4-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 44 (2 мг, 4%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); 1:1,3 смесь атропоизомеров; δ 7,81 (s, 1Н), 7,68 (s, 2Н), 7,03-7,00 (m, 1Н), 6,76-6,69 (m, 2Н), 5,56 (d, 1Н, J=8,2), 3,96-3,83 (m, 2Н), 3,69 (d, 3H, J=11,1), 3,51 (2d, 1Н, J=14,6, 14,7), 2,61-2,74 (m, 1Н), 2,18-2,12 (m, 2Н), 1,98-1,82 (m, 2Н), 1,50-1,45 (m, 5Н), 1,18-1,11 (m, 6Н), 0,99-0,94 (m, 6Н), 0,37 (d, 1,3H, J=6,6), 0,28 (d, 1,7Н, J=6,5). MS (ESI) m/z 584 (M++H).
Соединение 46
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-(гидроксиметил)-2-метоксифенил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 36 (30 мг, 0,052 ммоль) растворили в безводном тетрагидроригап (5 мл). Гидроксид лития (5 мг, 0,08 ммоль) добавили по каплям к полученному раствору при-78°C, и затем перемешивали при комнатной температуре в течение 5 часов. По окончанию реакции, реакцию погасили с помощью 1М раствора HCl (гидрохлорид). Реакционную смесь разбавили этилацетатом, промыли водой и соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении, получив в результате соединение 46 (20 мг, 60%) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, бензол-d6); 1:1 смесь атропоизомеров; δ 7,62 (s, 1Н), 7,40-7,38 (d, J=10,7, 2Н), 7,10-6,96 (m, 2Н), 6,51-6,45 (m, 1Н), 4,73-4,71 (d, J=7,9, 1H), 4,40-4,36 (m, 2H), 4,21-4,15 (m, 1H), 3,49-3,41 (m, 2H), 2,54-2,39 (m, 1H), 2,18-2,05 (m, 3H), 1,73-1,52 (m, 5H),-0,07-(-)0,08 (d, J=6,5, 1,5H), (-)0,16-(-)0,18 (d, J=6,5, 1,5H). MS (ESI) m/z 544 (M++H).
Соединение 47
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(метоксиметил)фенил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 46 (6,8 мг, 0,013 ммоль) растворили в безводном тетрагидроригап (2 мл). Гидрид натрия (1 мг, 0,03 ммоль) добавили по каплям к полученному раствору при 0°C, и затем перемешивали при комнатной температуре в течение 30 минут. Йодометан (избыточное количество) медленно добавили по каплям к реакционной смеси при 0°C, и затем перемешивали при комнатной температуре в течение 3 часов. По окончанию реакции, реакционную смесь разбавили этилацетатом, промыли соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью колоночной хроматографии, получив в результате соединение 47 (5 мг, 97%) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, бензол-d6); 1:1 смесь атропоизомеров; δ 7,61 (s, 1Н), 7,39-7,38 (m, 2Н), 7,13-7,10 (m, 0,5Н), 7,06-7,04 (m, 1Н), 6,99-6,98 (m, 0,5Н), 6,51-6,44 (m, 1Н), 4,75-4,68 (dd, J=7,9, 7,9, 1H), 4,22-4,13 (m, 3H), 3,53-3,44 (m, 2Н), 3,25 (s, 1,5Н), 3,23 (s, 1,5Н), 3,19 (s, 1,5Н), 3,10 (s, 1,5Н), 2,51-2,47 (m, 1H), 2,22-2,09 (m, 3H), 1,71-1,61 (m, 4Н), (-)0,07-(-)0,09 (d, J=6,5, 1,5Н), (-)0,18-(-)0,20 (d, J=6,5, 1,5Н). MS (ESI) m/z 558 (M++H).
Соединение 48
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-5-изопропил-2-метоксифенил)-5-(трифторметил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 48 (0,2 г, 79,5%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,76 (s, 1Н), 7,63-7,61 (m, 2Н), 7,15-6,64 (m, 1H), 6,49-6,40 (m, 1H), 5,57-5,47 (m, 1Н), 3,91-3,77 (m, 2Н), 3,63-3,59 (m, 3H), 3,56-3,29 (m, 1Н), 3,05-3,00 (m, 1H), 2,35-1,97 (m, 6Н), 1,80-1,50 (m, 1H), 1,15-1,00 (m, 6Н), 0,34-0,21 (ddd, J=6,5, 3H). MS (ESI) m/z 642 (M++H).
Соединение 49
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(3′-хлор-4,6′-диметоксибифенил-3-ил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 49 (2 мг, 33%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); 1:1,5 смесь атропоизомеров; δ 7,82 (s, 1Н), 7,70 (s, 2Н), 7,37-7,32 (m, 1Н), 7,22-7,11 (m, 3H), 6,90-6,81 (m, 2Н), 4,01-3,87 (m, 2Н), 3,78-3,70 (m, 6Н), 3,68-3,50 (m, 1Н), 2,28-2,02 (m, 4Н), 1,79-1,72 (m, 4Н), 0,41 (d, 1,2Н, J=6,5), 0,34 (d, 1,8Н, J=6,5). MS (ESI) m/z 654 (M++H).
Соединение 50
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-хлор-2-метоксифенил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 50 (84 мг, 94%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); 1:1,1 смесь атропоизомеров; δ 7,83 (s, 1H), 7,73 (d, 2Н, J=4,9), 7,17-7,13 (m, 1H), 6,95 (t, 1Н, J=2,4), 6,76 (dd, 1H, J=8,8, 16,3), 5,59 (2d, 1H, J=8,0), 3,98-3,88 (m, 2H), 3,73 (d, 3H, J=11,8), 3,47 (2d, 1H, J=14,7), 2,38-2,02 (m, 4H), 1,77-1,67 (m, 4H), 0,45 (d, 1,4H, J=6,5), 0,36 (d, 1,6H, J=6,5). MS (ESI) m/z 548(M++H).
Соединение 51
(4S,5R)-3-((2-(1Н-индол-4-ил)-5,5-диметилциклогекс-1-енил)метил)-5-(3,5-бис(трифторметил)фенил)-4-метилоксазолидин-2-он
Соединение 51 (95 мг, 38%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 8,29 (bs, 1Н), 7,80 (d, 1Н, J=7,4), 7,65 (d, 2Н, J=17), 7,26 (d, 1Н, J=8), 7,18-7,07 (m, 2H), 6,84 (dd, 1H, J=17, 7), 6,36-6,29 (bm, 1H), 5,48 (t, 1H, J=8,0), 4,00-3,43 (m, 3H), 2,65-2,24 (m, 2H), 2,02-1,94 (m, 2H), 1,07 (t, 6H, J=13), 0,25 (2d, 3H, J=6,5).
Соединение 52
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-нитрофенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Как показано на реакционной схеме 5, промежуточное соединение 16 подвергли реакции с трифосгеном, получив в результате соединение 52 (0,13 г, 62%) в виде масла желтого цвета.
1H ЯМР (400 МГц, CDCl3); 1:1 смесь атропоизомеров; δ 8,16-8,20 (m, 1H), 7,90-7,92 (m, 1Н), 7,87 (s, 1H), 7,74 (d, J=8,0, 1Н), 6,95 (t, J=9,2, 1H), 5,67 (d, J=8,3, 0,51H), 5,58 (d, J=8,1, 0,43H), 3,91-4,04(m, 2H), 3,54 (d, J=13,9, 0,45H), 3,32 (d, J=15,0, 0,54H), 2,10-2,27 (m, 2H), 1,89-2,00 (m, 2H), 1,49-1,54 (m, 2H), 1,03-1,10 (m, 6H), 0,42-0,48 (m, 3H). MS (ESI) m/z 633 (M+45)-.
Соединение 55
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((4-(2-метоксифенил)-5,6-дигидро-2Н-пиран-3-ил)метил)-4-метилоксазолидин-2-он
Соединение 55 (0,8 г, 99%) в виде масла желтого цвета было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86 (s, 1Н), 7,71 (s, 2Н), 7,27-7,29 (m, 1Н), 6,86-7,05 (m, 3H), 5,58 (d, J=8,0, 1Н), 4,26 (s, 2H), 3,86-4,15 (m, 4H), 3,86 (m, 3H), 3,65 (d, J=15,2, 0,58H), 3,49 (d, J=15,9, 0,42H), 2,13-2,71 (m, 2H), 0,4 (d, J=6,4, 1,3H), 0,28 (d, J=6,5, 1,3H). MS (ESI) m/z 560 (М+45)-.
Соединение 56
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-(диметиламино)-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 56 (50 мг, 62%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); 1:2 смесь атропоизомеров; δ 7,85 (s, 1H), 7,73 (m, 2Н), 6,81 (d, J=8,9, 0,35Н), 6,74 (d, J=8,9, 0,65Н), 6,60-6,66 (m, 1H), 6,44 (d, J=3,0, 0,35Н), 6,41 (d, J=3,1, 0,65Н), 5,57-5,59 (m, 1Н), 3,89-4,08 (m, 2Н), 3,67-3,70 (m, 3H), 3,51-3,67 (m, 1Н), 2,81-2,86 (m, 6Н), 2,06-2,51 (m, 2Н) 1,93 (s, 2Н), 1,43-1,55 (m, 2Н), 1,01-1,05 (m, 6Н), 0,47 (d, J=0,6, 1H), 0,32 (d, J=6,5, 2H). MS (ESI) m/z 630 (M+45)-.
Соединение 57
2-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)циклогекс-1-енил)-5-метоксибензальдегид
Как показано на реакционной схеме 3, было синтезировано промежуточное соединение 9. Полученное промежуточное соединение 9 (0,13 г, 0,20 ммоль) подвергли реакции Сузуки с бороновой кислотой (58 мг, 0,33 ммоль), получив в результате соединение 57 (0,11 г, 75%) в виде коричневого масла.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 10,05 (s, 0,49Н), 10,00 (s, 0,47Н), 7,86 (s, 1Н), 7,73 (s, 2Н), 7,37-7,42 (m, 1H), 7,70-7,17 (m, 2Н), 5,62-5,64 (m, 1H), 3,83-4,03 (m, 2Н), 3,86 (d, J=3,0, 3H), 2,15-2,39 (m, 4Н), 1,72-1,88 (m, 4Н), 3,82 (d, J=3,4, 3H), 2,03-2,38 (m, 4Н), 1,75 (d, J=3,8, 4Н), 0,37-0,42 (m, 3H). MS (ESI) m/z 542 (М++Н).
Соединение 58
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-(гидроксиметил)-4-метоксифенил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 57 (94 мг, 0,17 ммоль) растворили в метаноле (2 мл). Боргидрид натрия (10 мг, 0,19 ммоль) медленно добавили по каплям к полученному раствору при комнатной температуре, и затем перемешивали при комнатной температуре в течение 2 часов. По окончанию реакции, реакцию погасили насыщенным аммиачным раствором. Реакционную смесь разбавили этилацетатом, промыли соляным раствором, высушили с помощью безводного сульфата натрия, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью колоночной хроматографии, получив в результате соединение 58 (85 мг, 90%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,87 (s, 1Н), 7,74 (d, J=12,0, 2Н), 6,75-7,08 (m, 3H), 5,47-5,68 (m, 1H), 4,53-4,57 (m, 2Н), 3,87-4,03 (m, 2Н), 3,82 (d, J=5,4, 3H), 3,62 (d, J=15,1, 0,37Н), 3,31 (d, J=14,7, 0,61Н), 2,09-2,21 (m, 4Н), 1,73-1,77 (m, 4Н), 0,46-0,57 (m, 3H). MS (ESI) m/z 544 (М++Н).
Соединение 59
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-метокси-2-(метоксиметил)фенил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 59 (85 мг, 90%) в виде масла желтого цвета было получено способом, аналогичным способу получения соединения 47.
1H ЯМР (400 МГц, CDCl3); 1:1,9 смесь атропоизомеров; δ 7,86 (s, 1Н), 7,75 (d, J=5,9, 2Н), 6,75-7,00 (m, 3H), 5,65 (d, J=8,0, 0,63Н), 5,58 (d, J=8,0, 0,31Н), 4,28 (d, J=5,6, 0,67H), 4,25 (d, J=3,9, 1Д5Н), 3,83-4,00 (m, 2H), 3,80-3,81 (m, 3H), 3,78 (d, J=12,7, 0,32H), 3,40-3,42 (m, 3H), 3,34 (d, J=14,7, 4H), 2,05-2,25 (m, 4H), 1,70-1,76(m, 4H), 0,54 (d, J=6,5, 0,95H), 0,40 (d, J=6,5, 1,9H). MS (ESI) m/z 558 (M++H).
Соединение 60
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-3-((2-(хинолин-8-ил)циклогекс-1-енил)метил)оксазолидин-2-он
Соединение 60 (8 мг, 22%) в виде масла желтого цвета было получено способом, аналогичным способу получения соединения 57.
1H ЯМР (400 МГц, CDCl3); 1:2 смесь атропоизомеров; δ 8,94-8,86 (m, 1Н), 8,17-8,10 (m, 1Н), 7,90 (bd, 1H, J=14), 7,75-7,72 (m, 1Н), 7,67-7,62 (bm, 2Н), 7,44-7,31 (m, 3H), 3,52-3,34 (m, 1H), 4,13-3,98 (m, 2H), 3,52-3,34 (m, 1H), 2,85-2,60 (m, 1H), 2,40-2,15 (m, 3H), 1,85-1,62 (m, 4H), 0,46 (d, 1H, J=6,6), (-)0,34 (d, 2H, J=6,4). MS (ESI) m/z 535 (M++H).
Соединение 61
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-3-((2-(1-метил-1Н-индазол-4-шрциклогекс-1-енил)метил)оксазолидин-2-он
Соединение 61 (16 мг, 46%) в виде масла желтого цвета было получено способом, аналогичным способу получения соединения 57.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,80 (d, 2H, J=11), 7,66 (s, 2Н), 7,34-7,25 (m, 2Н), 6,82 (d, 1H, J=6,7), 5,53 (d, 1H, J=15), 3,86 (bs, 1H), 3,8-3,4 (bm, 1H), 2,6-2,18 (brm, 2H), 2,15 (s, 2H), 1,76 (bs, 4H), 0,38-0,11 (brm, 3H).
Соединение 62
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-(3-изопропил-1,2,4-оксадиазол-5-ил)-2-метоксифенил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Гидроксиизобутиламидин (9 мг, 0,08 моль) растворили в тетрагидрофуране (0,5 мл). Гидрид натрия (8 мг, 0,17 ммоль) добавили по каплям к полученному раствору при комнатной температуре, и перемешивали при температуре 50°C в течение 2 часов. Соединение 36 (25 мг, 0,044 ммоль) добавили по каплям к раствору, и кипятили при перемешивании при температуре 90°C в течение ночи. По окончанию реакции, реакционную смесь разбавили этилацетатом, промыли соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью колоночной хроматографии, получив в результате соединение 62 (17 мг, 63%) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 8,03-8,00 (m, 1Н), 7,85 (s, 1H), 7,78-7,73 (m, 3H), 6,98 (dd, 1H, J=11,9, 8,7), 5,63 (m, 1H), 4,05-3,97 (m, 2Н), 3,87 (d, 3H, J=12,4), 3,48 (m, 1Н), 3,17-3,05 (m, 1H), 2,25-2,05 (bm, 4Н), 1,83-1,75 (bm, 4Н), 1,40-1,25 (m, 6Н), 0,44-0,39 (m, 3H). MS (ESI) m/z 624 (М++Н).
Соединение 63
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-2-гидрокси-5-изопропилфенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 19 (21 мг, 0,035 ммоль) растворили в метиленхлориде (1 мл). Трибромид бора (0,07 мл, 0,07 ммоль) медленно добавили по каплям к полученному раствору при-78°C, и перемешивали при комнатной температуре в течение 3 часов. По окончанию реакции, реакцию погасили насыщенным раствором карбоната натрия. Реакционную смесь экстрагировали метиленхлоридом, промыли водой и соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью колоночной хроматографии, получив в результате соединение 63 (5 мг, 25%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3); 1:1,6 смесь атропоизомеров; δ 7,89 (d, J=7,4, 1H), 7,74 (s, 2H), 6,72-6,75 (m, 1H), 6,57-6,64 (m, 1H), 6,04-6,06 (m, 1H), 5,72 (d, J=8,0, 0,61H), 5,62 (d, J=8,3, 0,37H), 3,98-4,06 (m, 1,65H), 3,75 (d, J=14,7, 0,39H), 3,60 (s, 0,38H), 3,37 (d, J=14,8, 0,61H), 3,10-3,15 (m, 1H), 1,48-2,26 (m, 6H), 0,67 (d, J=6,5, 1,18H), 0,50 (d, J=6,6, 1,94H). MS (ESI) m/z 588 (M++H).
Соединение 64
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-2-гидрокси-5-изопропилфенил)-5-метилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 64 (24 мг, 52%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 63.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,89 (d, J=5,4, 1Н), 7,74 (s, 2H), 6,72-6,78 (m, 1H), 6,56-6,64 (m, 1H), 5,65-5,75 (m, 0,8H), 3,94-4,06 (m, 1,46H), 3,69 (m, 0,73H), 3,37 (d, J=14,8, 0,5H), 3,10-3,13 (m, 1H), 1,29-2,28 (m, 7H), 1,04-1,28 (m, 6H), 0,89 (t, J=6,7, 1H), 0,67 (t, J=6,7, 0,99H), 0,47-0,52 (m, 1,5H). MS (ESI) m/z 574 (M++H).
Соединение 65
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-2-гидрокси-5-изопропилфенил)-5-(трифторметил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 65 (15 мг, 60%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 63.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,89 (s, 1Н), 7,75 (d, J=9,3, 2Н), 6,57-6,78 (m, 3H), 5,66-5,86 (m, 1Н), 3,96-4,10 (m, 2H), 3,41-3,73 (m, 1H), 2,10-2,48 (m, 6H), 1,75 (m, 1H), 1,15-1,20 (m, 1H), 0,55-0,69 (m, 3H). MS (ESI) m/z 628 (M++H).
Соединение 66
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-морфолинофенил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 50 (40,0 мг, 0,073 ммоль), ацетат палладия (0,8 мг, 0,0037 ммоль), бифенильный лиганд (2,2 мг, 0,007 ммоль), трет-бутоксид натрия (10,5 мг, 0,11 ммоль) и морфолин (10,9 мг, 0,13 ммоль) растворили в толуоле (1,0 мл). Полученный раствор кипятили в микроволновом реакторе при перемешивании при температуре 100°C в течение 20 минут. По окончанию реакции, реакционную смесь разбавили этилацетатом, промыли водой и соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (4 г силикагеля, 4:1=гексан:EtOAc), получив в результате соединение 66 (12,8 мг, 29%) в виде твердого вещества коричневого цвета.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,87-7,73 (m, 3H), 6,84-6,60 (m, 3H), 5,62, 5,57 (2d, 1Н, J=8,0), 4,05-3,81 (m, 7Н), 3,74, 3,70 (2s, 3H), 3,07-2,99 (m, 4Н), 2,25-2,03 (m, 4Н), 1,84-1,74 (m, 4Н), 0,48, 0,34 (2s, 3H). MS (ESI): 599 (M+).
Соединение 67
3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)циклогекс-1-енил)-4-метокси-N-метилбензамид
Соединение 34 (20 мг, 0,036 ммоль), метиламин (13,5 мкл, 0,02 ммоль) и 1-гидроксибензотриазол (5,6 мг, 0,04 ммоль) растворили в метиленхлориде (0,5 мл). 1-Этил-3-(3-диметилпропил)карбодиимид (7,9 мг, 0,04 ммоль) добавили по каплям к полученному раствору при 0°C, и перемешивали при комнатной температуре в течение ночи. По окончанию реакции, реакционную смесь нейтрализовали насыщенным раствором гидрокарбоната натрия. Реакционную смесь экстрагировали метиленхлоридом, промыли водой и соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (силикагель, 1%Å3% DCM/MeOH, получив в результате соединение 67 (3 мг, 15%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86 (d, 1H, J=5,0), 7,75-7,57 (m, 3H), 7,54-7,48 (m, 1Н), 6,89 (dd, 1Н, J=8,6, 6,5), 6,30-6,16 (m, 1H), 5,54 (m, 1Н), 4,07-3,93 (m, 2H), 3,85 (d, 3H, J=16,0), 3,48-3,36 (m, 1H), 2,99 (dd, 3H, J=15,5, 4,8), 2,40-2,01 (bm, 4H), 1,84-1,75 (bm, 4H), 0,45 (t, 3H,J=6,9).
Соединение 68
3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)циклогекс-1-енил)-N-этил-4-метоксибензамид
Соединение 68 (11 мг, 61%) в виде твердого вещества желтого цвета было получено способом, аналогичным способу получения соединения 67.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86 (d, 1Н, J=4,8), 7,75-7,58 (m, 3H), 7,51 (m, 1Н), 6,89 (dd, 1H, J=8,5, 6,4), 6,27-6,12 (m, 1H), 5,54 (m, 1H), 4,07-4,02 (m, 2H), 3,83 (d, 3H, J=15,6), 3,52-3,37 (m, 3H), 2,17-2,05 (bm, 4H), 1,82-1,62 (bm, 4H), 1,28-1,20 (m, 2H), 0,47-0,43 (m, 3H).
Соединение 69
3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)циклогекс-1-енил)-4-метокси-N-(2,2,2-трифторэтил)бензамид
Соединение 69 (23 мг, 100%) в виде масла желтого цвета было получено способом, аналогичным способу получения соединения 67.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,87 (d, 1Н, J=6,8), 7,73 (d, 2Н, J=18,8), 7,67 (dd, 1Н, J=8,5, 2,4), 7,58 (dd, 1H, J=8,3, 2,4), 6,93 (t, 1H, J=8,8), 6,88-6,55 (m, 1H), 5,65-5,42 (m, 1H), 4,24-3,94 (m, 4H), 3,85 (d, 3H, J=18,3), 3,39 (dd, 1H, J=18,0, 15,3), 2,42-2,05 (bm, 4H), 1,83-1,76 (bm, 4H), 0,51-0,46 (m, 3H). MS (ESI) m/z 639 (M++H).
Соединение 70
3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)циклогекс-1-енил)-N-изопропил-4-метоксибензамид
Соединение 70 (24 мг, 100%) в виде твердого вещества желтого цвета было получено способом, аналогичным способу получения соединения 67.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86 (d, 1Н, J=4,0), 7,74 (d, 2Н, J=9,4), 7,71-7,56 (m, 1Н), 7,48 (m, 1H), 6,88 (m, 1H), 6,00 (m, 1H), 5,55 (m, 1H), 4,30-4,20 (m, 1H), 4,07-3,93 (m, 2H), 3,83 (d, 3H, J=15,6), 3,43 (q, 1H, J=15,0), 2,30-2,04 (bm, 4H), 1,82-1,74 (bm, 4H), 1,28-1,22 (m, 6H), 0,45 (dd, 3H, J=12,9, 6,5). MS (ESI) m/z 599 (M++H).
Соединение 71
N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)циклогекс-1-енил)-4-метоксифенил)ацетамид
Как показано на реакционной схеме 5, (4S,5R)-3-((2-(5-амико-2-метоксифенил)циклогекс-1-енил)метил)-5-(3,5-бис(трифторметил)фенил)-4-оксооксазолидин-2-он (29 мг, 0,05 ммоль) и диизопропиламин (0,01 мл, 0,08 ммоль) растворили в тетрагидрофуране (1 мл). Ацетил хлорид (5 мкл, 0,08 ммоль) медленно добавили по каплям к полученному раствору при комнатной температуре, и перемешивали при комнатной температуре в течение 2 часов. По окончанию реакции, реакцию погасили насыщенным аммиачным раствором. Реакционную смесь экстрагировали этилацетатом, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (12 г силикагеля, 2:1 = Гексан:EtOAc), получив в результате соединение 71 (21 мг, 68%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3); 1:1 смесь атропоизомеров; δ 7,84 (d, J=9,8, 2Н), 7,79 (s, 1H), 6,77-7,,33 (m, 3H), 5,62 (d, J=7,9, 0,5H), 5,52 (d, J=8,0, 0,5H) 4,06-4,16 (m, 2H), 3,98 (t,y=15,0, 1H), 3,76 (d, J=7,8, 3H), 3,58 (d, J=14,9, 0,5H), 3,38 (d, J=14,8, 0,5H), 1,71-2,39 (m, 8H), 2,14 (d, J=15,9, 3H), 0,44 (d, J=6,5, 1,5H), 0,32 (d, J=6,4, 1,5H). MS (ESI) m/z 571 (M++H).
Соединение 72
N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)циклогекс-1-енил)-4-метоксифенил)изобутирамид
Соединение 72 (24 мг, 79%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 71.
1H ЯМР (400 МГц, CDCl3); 1:1,1 смесь атропоизомеров; δ 7,84 (s, 1H), 7,78 (s, 2Н), 7,58 (d, J=2,6, 0,5Н), 7,25- 7,27 (m, 0,5Н), 7,22 (s, 0,5Н), 7,13 (s, 0,5Н), 7,03 (dd, J=8,6, 2,7, 0,5Н), 6,80 (t, J=8,3,1H), 5,63 (d, J=8,0, 0,44H), 5,51 (d, J=8,0, 0,54H), 4,04-4,15 (m, 2H), 3,76 (d, J=4,1, 3H), 3,54 (d, J=14,8, 0,6H), 3,41 (d, J=14,8, 0,4H), 2,44-2,53 (m, 1H), 1,71- 2,34 (m, 4H), 1,15- 1,30 (m, 6H), 0,44 (d, J=6,5, 1,6H), 0,36 (d, J=6,4, 1,4H). (ESI) m/z 599 (M++H).
Соединение 76
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-(3-циклопропил-1,2,4-оксадиазол-5-ил)-2-метоксифенил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 76 (14 мг, 52%) в виде масла желтого цвета было получено способом, аналогичным способу получения соединения 62.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,99-7,96 (m, 1Н), 7,86 (s, 1Н), 7,75-7,72 (m, 3H), 6,97 (dd, 1Н, J=8,7, 11,7), 5,62 (2d, 1Н, J=8,0, 8,0), 4,04-3,97 (m, 2Н), 3,86 (d, 3H, J=12,3), 3,47 (2d, 1H, J=14,8, 14,9), 2,24-2,05 (m, 5Н), 1,76-1,75 (m, 4Н), 1,60-1,58 (m, 2Н), 1,16-0,97 (m, 2Н), 0,42-0,39 (m, 3H).
Соединение 79
3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)циклогекс-1-енил)-4-метоксибензальдегид
Как показано на реакционной схеме 4, было синтезировано пинаколатовое соединение, после чего его подвергли реакции Сузуки с соединением 9, получив в результате соединение 79 (65 мг, 35%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 9,86 (s, 1Н), 9,81 (s, 1Н), 7,83(s, 1Н), 7,82-7,71 (m, 3H), 7,56-7,53 (dd, 1H), 7,00-6,95 (dd, 1H), 5,64-5,54 (dd, 1H), 4,00-3,92 (m, 1Н), 3,87 (s, 1,5Н), 3,84 (s, 1,5Н), 3,52-3,49 (d, 0,5Н), 3,35-3,31 (d, 0,5Н), 2,20-2,19 (m, 1Н), 1,80-1,72 (m, 5Н), 0,40-0,37 (m, 3H). MS (ESI) m/z 406 (М++Н).
Соединение 80
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-(1-гидроксиэтил)-2-метоксифенил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 79 (65 мг, 0,117 ммоль) растворили в тетрагидрофуране (3 мл). Метилмагний хлорид (56 мкл, 0,17 ммоль) добавили по каплям к полученному раствору при 0°C, и перемешивали при комнатной температуре в течение 2 часов. По окончанию реакции, реакционную смесь разбавили метиленхлоридом, промыли водой и соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью колоночной хроматографии (силикагель; Гексан/EtOAC=6:1~3:1), получив в результате соединение 80 (88 мг, 98%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3); 1:1 смесь атропоизомеров; δ 7,83 (s, 1Н), 7,73-7,69 (m, 2Н), 7,21-7,17 (m, 1H), 7,07 (m, 0,5Н), 7,00-6,97 (m, 0,5Н), 6,85-6,78 (dd, 1Н), 5,59-5,56 (m, 0,5Н), 5,50-5,44 (dd, 0,5Н), 4,83-4,79 (m, 1H), 4,11-3,94 (m, 2Н), 3,78-3,77 (d, 1,5Н), 3,72 (s, 1,5Н), 3,55-3,39 (m, 1H), 2,17-2,20 (m, 4Н), 1,71 (brs, 4Н), 1,46-1,39 (m, 3H), 0,43-0,33 (m, 3H). MS (ESI) m/z 557 (М++Н).
Соединение 81
(4S,5R)-3-((2-(5-ацетил-2-метоксифенил)циклогекс-1-енил)метил)-5-(3,5-бис(трифторметил)фенил)-4-метилоксазолидин-2-он
Соединение 80 (88 мг, 0,158 ммоль) растворили в метиленхлориде (2 мл). Перйодат Десса-Мартина (0,17 мг, 0,35 ммоль) добавили по каплям к полученному раствору при комнатной температуре, и перемешивали при комнатной температуре в течение 1 часа. По окончанию реакции, реакционную смесь разбавили этилацетатом, промыли соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью колоночной хроматографии (силикагель; гексан/EtOAC=5:1~3:1), получив в результате соединение 81 (45 мг, 90%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,84 (m, 0,5Н), 7,78 (m, 0,5Н), 7,75-7,72 (m, 0,5Н), 7,64-7,58 (m, 1,5Н), 7,43-7,41 (m, 2Н), 6,42-6,39 (m, 1H), 4,83-4,17 (m, 1Н), 4,17-4,02 (dd, 1Н), 3,45-3,24 (m, 2Н), 3,23 (s, 1,5Н), 3,19 (s, 1,5Н), 2,41-1,99 (m, 4Н), 2,27 (s, 1,5Н), 2,23 (s, 1,5Н), 1,69-1,57 (m, 4Н), (-)0,07-(-)0,12 (m, 3H). MS (ESI) m/z 556 (М++Н).
Соединение 82
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-(2-гидроксипропан-2-ил)-2-метоксифенил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 82 (8,2 мг, 36%) в виде масла желтого цвета было получено способом, аналогичным способу получения соединения 80.
1H ЯМР (400 МГц, CDCl3); 1:1 смесь атропоизомеров; δ 7,62-7,61 (m, 1Н), 7,40-7,29 (m, 3H), 7,291-7,18 (m, 1Н), 6,53-6,49 (m, 1Н), 4,74-4,69 (m, 1H), 4,28-4,19 (m, 1H), 3,56-3,33 (m, 2Н), 3,30 (s, 1,5Н), 3,26 (s, 1,5Н), 2,54-2,10 (m, 4Н), 1,74-1,65 (m, 4Н), 1,42-1,37 (m, 6Н), (-)0,07-(-) 0,16 (m, 3H). MS (ESI) m/z 572 (М++Н).
Соединение 83
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-3-((2-(2-(трифторметокси)фенил)циклогекс-1-енил)метил)оксазолидин-2-он
Соединение 83 (96 мг, 95%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86 (s, 1H), 7,75 (s, 2Н), 7,33-7,22 (m, 3H), 7,17-7,14 (m, 1Н), 5,64 (dd, J=4,4, 8,0, 1Н), 4,04-3,88 (m, 2H), 3,54, 3,42 (2d, J=15,0, 1H), 2,36-2,04 (m, 4H), 1,81-1,73 (m, 4H), 0,49, 0,43 (2d, J=6,5, 3H). MS (ESI) m/z 568(M++H).
Соединение 84 (4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-фтор-5-(трифторметил)фенил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 84 (0,14 г, 79%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,87 (s, 1Н), 7,75 (s, 2Н), 7,55-7,54 (m, 1H), 7,40-7,38 (m, 1H), 7,21-7,14 (m, 1Н), 5,64 (d, J=7,9, 1H), 4,15-3,92 (m, 2Н), 3,51-3,47 (m, 1H), 2,39-2,20 (m, 4Н), 1,78 (bs, 4Н), 0,46 (d, J=6,5, 3H). MS (ESI) m/z 570 (M++H).
Соединение 85
1-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)циклогекс-1-енил)-4-метоксифенил)этилацетат
Соединение 80 (65,0 мг, 0,117 ммоль) растворили в тетрагидрофуране (2 мл). Метилмагний хлорид (56 мкл, 0,16 ммоль) добавили по каплям к полученному раствору при 0°C, и перемешивали при комнатной температуре в течение 5 часов. По окончанию реакции, к реакционной смеси по каплям добавили этилацетат. После этого, реакционную смесь промыли водой и соляным раствором, и упарили при пониженном давлении. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (15% Гексан/EtOAc), получив в результате соединение 85 (30 мг, 70%) в виде белой пены.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,82 (s, 1Н), 7,73 (d, J=7,3, 1H), 7,25-7,17 (m, 1H), 6,99-6,93 (m, 1Н), 6,84-6,77 (m, 1H), 5,82-5,71 (m, 1H), 5,60-5,55 (m, 1H), 3,99-3,87 (m, 2H), 3,75 (s, 1,5H), 3,72 (d, J=9,4, 1,5H), 3,58-3,39 (m, 1H), 2,41-1,63 (m, 11H), 1,49-1,42 (m, 3H), 0,40-0,31 (m, 3H). MS (ESI) m/z 540,0 (M++H-OAc).
Соединение 86
N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)(фенил)-4-метил-2-оксооксазолидин-3-ил)метил)циклогекс-1-енил)-4-метоксифенил)-N-метилизобутирамид
Соединение 86 (5 мг, 35%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 47.
1H ЯМР (400 МГц, CDCl3); 1:1,1 смесь атропоизомеров; δ 7,87 (s, 1Н), 7,75 (d, J=7,2, 2Н), 7,06-6,84 (m, 3H), 5,65-5,60 (m, 1Н), 4,06-3,89 (m, 2H), 3,80 (d, J=13,7, 3H), 3,54-3,44 (m, 1H), 3,18 (d, J=24,4, 3H), 2,50-2,42 (m, 1H), 2,27-1,75 (m, 4H), 1,03-0,83 (m, 6H), 0,48 (d, J=6,5, 1,4H), 0,39 (d, J=6,4, 1,6H). MS (ESI) m/z 613 (M++H).
Соединение 87
3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)циклогекс-1-енил)-N-изопропил-4-метокси-N-метилбензамид
Соединение 87 (11 мг, 79%) в виде твердого вещества желтого цвета было получено способом, аналогичным способу получения соединения 47.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,77 (d, J=6,7, 2Н), 7,29-7,25 (m, 1H), 7,12, 7,07 (2d, J=2,0, 1H), 6,86 (dd, J=7,1, 8,4, 1H), 5,63-5,49 (m, 1H), 4,04-3,92 (m, 2H), 3,81 (d, J=9,4, 3H), 3,53, 3,41 (2d, J=15,0, 1H), 2,88-2,85 (m, 3H), 2,25-2,05 (m, 4H), 1,74 (bs, 4H), 1,20-1,15 (m, 6H), 0,44 (dd, J=6,5, 15,2, 3H). MS (ESI) m/z 613 (M++H).
Соединение 96
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(трифторметил)фенил)-5-метилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 96 (57 мг, 69%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,87 (s, 1Н,), 7,75-7,73 (m, 2Н), 7,52-7,49 (m, 1H), 7,25-7,23 (m, 1Н), 6,96-6,90 (m, 1Н), 5,67, 5,65, 5,61, 5,49 (4d, J=7,8, 7,9, 8,1, 8,2, 1Н), 4,05-3,89 (m, 2Н), 4,05-3,89 (m, 2Н), 3,84, 3,82, 3,80 (3s, 3H), 3,55, 3,47, 3,38, 3,32 (4d, J=15,0, 14,8, 14,9, 14,9, 1Н), 2,29-2,19 (m, 3H), 1,87-1,71 (m, 3H), 1,45-1,26 (m, 1H), 1,08-1,06 (m, 3H), 0,42-0,37 (m, 3H). MS (ESI) m/z 596 (М++Н).
Соединение 97
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(трифторметил)фенил)-5,5-диметилпиклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 97 (77,8 мг, 75%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); 1:1 смесь атропоизомеров; δ 7,87 (s, 1Н,), 7,75, 7,73 (2s, 2Н), 7,51 (dm, 1Н), 7,23 (d, 1Н), 6,94 (d, J=8,7, 0,5Н), 6,91 (d, J=8,7, 0,5Н), 5,65 (d, J=8,1, 0,5H), 5,55 (d, J=8,2, 0,5H), 3,99-3,89 (m, 2H), 3,50 (d, J=14,9, 0,5H), 3,33 (d, J=15,0, 0,5H), 3,84 (s, 1,5H), 3,81 (s, 1,5H), 2,49-2,15 (m, 2H), 1,99-1,88 (m, 2H), 1,55-1,43 (m, 2H), 1,06, 1,02 (2s, 6H3), 0,40 (d, 6,6, 1,5H), 0,37 (d, J=6,5, 1,5H). MS (ESI) m/z 610 (M++H).
Соединение 101
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((5-трет-бутил-2-(4-фтор-5-изопропил-2-метоксифенил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 101 (0,31 г, 89%) в виде твердого вещества желтого цвета было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,90-7,73 (m, 3H), 6,81-6,75 (m, 1Н), 6,58-6,49 (m, 1H), 5,65-5,55 (m, 1Н), 4,14-3,91 (m, 2Н), 3,74-3,69 (m, 3H), 3,65-3,40 (m, 1H), 3,20-3,10 (m, 1H), 2,58-2,12 (m, 4Н), 1,91-1,87 (m, 3H), 1,22-1,18 (m, 6Н), 0,95 (d, J=2,6, 9Н), 0,41-0,28 (m, 3H). MS (ESI) m/z 630 (М++Н).
Соединение 103
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-(1-гидроксиэтил)-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 103 (65 мг, 73%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 80.
1H ЯМР (400 МГц, CDCl3); 1:1 смесь атропоизомеров; δ 7,84 (s, 1Н), 7,71 (m, 2Н), 7,21-7,06 (m, 1Н), 7,05-6,98 (m, 0,5Н), 6,97-6,85 (m, 0,5Н), 6,83-6,78 (m, 1H), 5,59-5,30 (m, 1H), 4,85-4,78 (m, 1Н), 4,04-3,92 (m, 2Н), 3,78-3,72 (m, 3H), 3,55-3,49 (m, 1H), 3,41-3,33 (m, 1Н), 2,43-1,90 (m, 6Н), 147-1,41 (m, 6Н), 1,04-1,01 (m, 3H), 0,42-0,30 (m, 3H). MS (ESI) m/z 568,0 (M-OH).
Соединение 104
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-(2-гидроксипропан-2-ил)-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 104 (6 мг, 53%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 80.
1H ЯМР (400 МГц, CDCl3); 1:1 смесь атропоизомеров; δ 7,84 (s, 1Н), 7,71 (d, J=8,3, 2Н), 7,33-7,30 (m, 1Н), 7,18-7,17 (m, 0,5H), 7,078-7,072 (m, 0,5H), 6,82 (d, J=8,5, 0,5H), 6,77 (d, J=8,5, 0,5H), 5,57 (d, J=8,1, 0,5H), 5,48 (d, J=8,1, 0,5H), 4,05-3,90 (m, 2H), 3,77 (s, 1,5H), 3,72 (s, 1,5H), 3,53 (d, J=14,5, 0,5H), 3,38 (d, J=14,5, 0,5H), 2,60-1,70 (m, 6H), 1,55-1,1,51 (m, 6H), 1,04-1,00 (m, 6H), 0,40 (d, J=6,6, 1,5H), 0,30 (d, J=6,6, 1,5H). MS (ESI) m/z 583 (M+-OH).
Соединение 107
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-изопропил-2-метоксифенилУ5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 107 (34 мг, 48%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,84 (s, 1Н), 7,72 (s, 2Н), 7,06 (dd, J=8,4, 2,2, 1Н), 6,82-6,72 (m, 2H), 5,60-5,57 (m, 1H), 4,01-3,89 (m, 2H), 3,73, 3,70 (2s, 3H), 3,58, 3,44 (2d, J=14,6, 1H), 2,86-2,75 (m, 1H), 2,53-1,86 (m, 4H), 1,54-1,42 (m, 2H), 1,20-1,14 (m, 6H), 1,06-1,01 (m, 6H), 0,38, 0,28 (2d, J=6,5, 3H). MS (ESI) m/z 584 (M++H).
Соединение 108
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-изопропил-2-метоксифенил)-5-(трифторметил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 108 (80 мг, 55%) в виде масла желтого цвета было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); 1:1 смесь атропоизомеров; δ 7,63 (m, 1H), 7,43-7,32 (m, 2Н), 7,04-6,95 (m, 1H), 6,85-6,78 (m, 1H), 6,57-6,45 (m, 1Н), 4,77-4,72 (m, 1H), 4,24-4,15 (m, 0,5Н), 4,03-3,93 (m, 0,5Н), 3,68-3,62 (m, 0,5Н), 3,51-3,43 (m, 1,5Н), 3,35-3,28 (m, 1,5Н), 3,27-3,19 (m, 1,5Н), 2,84-2,63 (m, 1H), 2,54-2,38 (m, 2Н), 2,33-2,10 (m, 2Н), 1,99-1,65 (m, 2Н), 1,53-1,39 (m, 1H), 1,24-1,11 (m, 6Н), (-)0,01-(-)0,27 (m, 3H). MS (ESI) m/z 625 (М++Н).
Соединение 109
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-5-изопропил-2-метоксифенил)-4,4-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 109 (87 мг, 93%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,72 (s, 2Н), 6,76 (dd, J=8,7, 3,6, 1H), 6,54, 6,50 (2d, J=12,2, 1Н), 5,61 (d, J=8,1, 1H), 3,98-3,87 (m, 2H), 3,70 (d, J=11,7, 3H), 3,55, 3,46 (2d, J=14,7, 1H), 3,15-3,07 (m, 1H), 2,21-2,11 (m, 2H), 1,95-1,81 (m, 2H), 1,53-1,46 (m, 2H), 1,20-1,12 (m, 6H), 1,00-0,86 (m, 6H), 0,42, 0,35 (2d, J=6,5, 3H). MS (ESI) m/z 602 (M++H).
Соединение 110
N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)ацетамид
Как показано на реакционной схеме 5, было синтезировано промежуточное соединение 17. Промежуточное соединение 17 (48,0 мг, 0,078 ммоль) и диизопропиламин (30,0 мкл, 0,17 ммоль) растворили в метиленхлориде (1,5 мл). Ацетил хлорид (12,3 мкл, 0,17 ммоль) медленно добавили по каплям к полученному раствору при комнатной температуре, и перемешивали при комнатной температуре в течение 2 часов. По окончанию реакции, реакцию погасили насыщенным аммиачным раствором. Реакционную смесь экстрагировали этилацетатом, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (4 г силикагеля, 4:1=гексан/EtOAc), получив в результате соединение 110 (21,6 мг, 42%) в виде твердого пенистого вещества белого цвета.
1H ЯМР (400 МГц, CDCl3); 1:1 смесь атропоизомеров; δ 7,85, 7,84 (2s, 1H), 7,82, 7,77 (2s, 2Н), 7,49 (d, J=2,7, 0,5Н), 7,35 (dd, J=8,8, 2,7, 0,5Н), 7,13 (d, J=2,7, 0,5Н), 7,12, 7,06 (2brs, 1H), 7,02 (dd, J=8,8, 2,7, 1H), 6,82-6,78 (m, 1H), 5,61, 5,52 (2d, J=8,0, 1H), 4,14-3,92 (m, 2H), 3,76, 3,74 (2s, 3H), 3,57, 3,39 (2d, J=14,8, 1H), 2,49-2,21 (m, 2H), 2,16-2,12 (2s, 3H3), 1,96-1,92 (br m, 2H), 1,54-1,41 (m, 2H), 1,04, 1,03, 1,02, 1,00 (4s, 0,41, 0,40, 0,35, 0,33 (4s, 3H, CH3, 6H). MS (ESI) m/z 600 (M++H).
Соединение 111
N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)изобутирамид
Соединение 111 (38,8 мг, 72%) в виде твердого пенистого вещества желтого цвета было получено способом, аналогичным способу получения соединения 110.
1H ЯМР (400 МГц, CDCl3); 1:1 смесь атропоизомеров; δ 7,85 (s, 1Н), 7,79, 7,77 (2s, 2Н), 7,56 (d, J=2,7, 0,5Н), 7,32 (dd, J=8,8, 2,7, 0,5Н), 7,22 (d, J=2,7, 0,5H), 7,08 (brs, 0,5H), 7,04 (dd, J=8,8, 2,7, 0,5H), 7,02 (brs, 0,5H), 6,82-6,78 (m, 1H), 5,62, 5,51 (2s, 3H), 3,54, 3,41 (2d,J=14,8, 1H), 2,52-2,08 (m, 3H), 1,94-1,92 (br m, 2H), 1,54-1,41 (m, 2H), 1,24-1,18 (m, 6H), 1,04, 1,03, 1,02, 1,00 (4s, 6H), 0,41, 0,40, 0,38, 0,37 (4s, 3H). MS (ESI) m/z 627 (M++H).
Соединение 112
N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-N-метилацетамид
Соединение 110(18 мг, 0,03 ммоль) растворили в безводном тетрагидрофуране (1 мл). Гидрид натрия (4 мг, 0,09 ммоль) добавили по каплям к полученному раствору при 0°C, и перемешивали при комнатной температуре в течение 30 минут. Йодометан (9,4 мкл, 0,15 ммоль) медленно добавили по каплям к реакционной смеси при 0°C, и затем перемешивали при комнатной температуре в течение 3 часов. По окончанию реакции, реакционную смесь разбавили этилацетатом, промыли соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью колоночной хроматографии, получив в результате соединение 112 (14 мг, 76%) в виде твердого пенистого вещества белого цвета.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,88 (s, 1Н), 7,74 (s, 2Н), 7,08-7,05 (m, 1H), 6,90-6,82 (m, 2Н), 5,64 (d, J=7,9, 1Н), 4,05-3,91 (m, 2Н), 3,81, 3,78 (2s, 3H), 3,53, 3,43 (2d, J=14,8, 1Н), 3,23, 3,17 (2s, 3H), 2,54-2,19 (m, 2H), 1,85, 1,82 (2s, 3H), 1,57-1,43 (m, 2H), 1,07, 1,05, 1,03, 1,02 (4s, 6H), 0,48, 0,46, 0,36, 0,35 (4s, 3H). MS (ESI) m/z 613 (M++H).
Соединение 113
N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-N-метилизобутирамид
Соединение 113 (28 мг, 86%) в виде желтой пены было получено способом, аналогичным способу получения соединения 112.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,88 (s, 1Н), 7,75 (s, 2Н), 7,07 (m, 1H), 6,90-6,82 (m, 2Н), 5,63 (d, J=8,1, 1H), 4,06-3,92 (m, 2Н), 3,81, 3,78 (2s, 3H), 3,53, 3,43 (2d, J=14,8, 1H), 3,21, 3,15 (2s, 3H), 2,52-2,15 (m, 3H), 1,99-1,87 (m, 2Н), 1,56-1,40 (m, 2Н), 1,06-0,94 (m, 12Н), 0,47, 0,45, 0,37, 0,35 (4s, 3H). MS (ESI) m/z 641 (М++Н).
Соединение 114
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-(метоксиметил)-4-(трифторметил)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 9 подвергли реакции Сузуки с 6-(трифторметил)бензо[c][1,2]оксаборол-1(3H)-олом, после этого, полученное промежуточное соединение было использовано таким же способом, как указано в описании синтеза соединения 47, для получения соединения 114 (60 мг, 74%) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86 (s, 1Н), 7,73 (s, 3H), 7,55-7,47 (m, 1H), 7,13 (d, J=7,8, 1Н), 5,64, 5,57 (2d, J=8,1, 1H), 4,36-4,26 (m, 2H), 4,01-3,81 (m, 2H), 3,71-3,21 (m, 1H), 3,43 (d, J=4,1, 3H), 2,23-2,18 (m, 2H), 1,99-1,90 (m, 2H), 1,55-1,46 (m, 2H), 1,07-0,87 (m, 6H), 0,55, 0,38 (2d, J=6,5, 3H). MS (ESI) m/z 624 (M++H).
Соединение 115
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-трет-бутил-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 115 (9 мг, 39%) в виде твердого вещества серого цвета было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,84 (s, 1Н), 7,71 (s, 2Н), 7,22-7,19 (m, 1Н), 6,95 (dd, J=12,6, 2,5, 1Н), 6,80-6,72 (m, 1Н), 5,60-5,54 (m, 1Н), 4,00-3,86 (m, 2Н), 3,73 (d, J=9,9, 3H), 3,57, 3,43 (2d, J=14,7, 1Н), 2,55-2,04 (m, 2H), 1,93-1,91 (m, 2H), 1,52-1,42 (m, 2H), 1,28-1,23 (m, 9H), 1,04-1,00 (m, 6H), 0,36, 0,26 (2d,J=6,5, 3H). MS (ESI) m/z 598 (M++H).
Соединение 116
N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксибензил)-N-(2,2,2-трифторэтил)ацетамид
3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксибензальдегид (32 мг, 0,06 ммоль), являющийся исходным веществом, и 2,2,2-трифторэтан амин (5,4 мкл, 0,067 ммоль) растворили в метиленхлориде (2 мл). Полученный раствор перемешивали при комнатной температуре в течение ночи. Цианоборгидрид натрия (4 мг, 0,056 ммоль) и уксусную кислоту (3,2 мкл, 0,06 ммоль) добавили по каплям к раствору, и перемешивали при комнатной температуре в течение 1 часа. По окончанию реакции, реакционную смесь нейтрализовали насыщенным раствором гидрокарбоната натрия, проэкстрагировали метиленхлоридом, промыли водой и соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Полученное промежуточное соединение (39 мг, 0,06 ммоль) растворили в метиленхлориде (2 мл). Диизопропилэтиламин (26 мкл, 0,15 ммоль) и ацетил хлорид (4,6 мкл, 0,06 ммоль) осторожно добавили по каплям к полученному раствору, и перемешивали при комнатной температуре в течение 2 часов. Реакцию погасили водой. Реакционную смесь экстрагировали метиленхлоридом, промыли соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (силикагель, 20~50% Гексан/EtOAc), получив в результате соединение 116 (25 мг, 61%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,72 (d, J=12,2, 2Н), 7,08-6,98 (m, 1Н), 6,88-6,75 (m, 2H), 5,62-5,54 (m, 1H), 4,67-4,53 (m, 2H), 4,03-3,90 (m, 4H), 3,78-3,69 (m, 3H), 3,50-3,31 (m, 1H), 2,21-2,15 (m, 2H), 2,04 (s, 3H), 1,92-1,88 (m, 2H), 1,52-1,45 (m, 2H), 1,05-1,00 (m, 6H), 0,43, 0,34 (dt, J=5,9, 6,5, 3H). MS (ESI) m/z 695 (M++H).
Соединение 117
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(трифторметокси)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 117 (27,8 мг, 67%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,87 (s, 1Н), 7,74 (s, 2Н), 7,11-7,08 (m, 1Н), 6,89-6,81 (m, 2Н), 4,01-3,89 (m, 2Н), 3,79, 3,77 (2s, 3H), 3,56, 3,39 (2d, J=14,8, 1Н), 2,50-2,04 (m, 2Н), 1,99-1,89 (m, 2Н), 1,54-1,45 (m, 2Н), 1,05, 1,05, 1,02, 1,019 (4s, 6Н), 0,40, 0,39, 0,37, 0,35 (4s, 3H). MS (ESI) m/z 626 (М++Н).
Соединение 118
N-ацетил-N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)ацетамид
Соединение 118 (0,15 г, 79%) в виде твердого вещества желтого цвета было получено способом, аналогичным способу получения соединения 71.
MS (ESI) m/z 641 (М++Н).
Соединение 120
N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-2,2,2-трифтор-N-метилацетамид
Как показано на реакционной схеме 5, было синтезировано промежуточное соединение 17. Промежуточное соединение 17 (0,16 г, 0,29 ммоль), в качестве исходного вещества, подвергли реакции с ди-трет-бутил карбоксилатом. Полученное промежуточное соединение подвергли метилированию, и затем снятию защиты с помощью хлороводорода, получив таким образом (4S,5R)-5-(бис(трифторметил)фенил)-3-((2-(2-метокси-5-(метиламино)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксооксазолидин-2-он. Полученное соединение (40 мг, 0,07 ммоль), в качестве исходного вещества, растворили в метиленхлориде (1,5 мл). Ангидрид трифторуксусной кислоты (TFAA) (20 мкл, 0,14 ммоль) добавили по каплям к полученному раствору при комнатной температуре диизопропиламин (37 мкл, 0,21 ммоль), и перемешивали при комнатной температуре в течение 2 часов. По окончанию реакции, реакцию погасили водой. Реакционную смесь экстрагировали этилацетатом, промыли соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью препаративной тонкослойной хроматографии (Prep TLC) (силикагель, 25% гексан/EtOAc), получив в результате соединение 120 (37 мг, 80%) в виде масла желтого цвета.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,72 (s, 2Н), 7,12-7,09 (m, 1Н), 6,89-6,83 (m, 2Н), 5,61 (d, J=8,0, 1H), 4,01-3,84 (m, 2Н), 3,81, 3,78 (2s, 3H), 3,54-3,42 (m, 1Н), 3,32 (s, 1,8Н), 3,27 (s, 1,2Н), 2,50-1,90 (m, 4Н), 1,53-1,42 (m, 2Н), 1,38, 1,29 (2d, J=6,5, 3H), 1,04-0,99 (m, 6Н).
Соединение 121
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(2-оксопирролидин-1-ил)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Как показано на реакционной схеме 4,3-йодо-4-метоксианилин, в качестве исходного вещества, подвергли ацилированию с помощью ацил хлорида и затем подвергли реакции с метоксидом натрия, основанием, для синтеза циклического соединения. Полученное соединение подвергли реакции с бис(пинаколато)дибораном для получения пинаколатного промежуточного соединения. Полученное пинаколатное соединение (0,05 г, 0,16 ммоль) подвергли реакции Сузуки с соединением 9 (0,09 г, 0,138 ммоль), получив в результате соединение 121 (29 мг, 30%) в виде коричневого масла.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,84 (d, J=7,4, 2Н), 7,77 (m, 1H), 7,09-7,60 (m, 2Н), 6,84 (t, J=1,0, 1Н), 5,62 (d, J=7,9, 0,5H), 5,52 (d, J=8,0, 0,5H) 3,70-4,12 (m, 4H), 3,80-3,82 (m, 3H), 2,12-2,60 (m, 6H), 2,05-2,11 (m, 2H), 1,45-2,11 (m, 2H), 1,01-1,04 (m, 6H), 0,31-0,42 (m, 3H). MS (ESI) m/z 626 (M++H).
Соединение 122
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(2-оксопиперидин-1-ил)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 122 (18 мг, 21%) в виде коричневого масла было получено способом, аналогичным способу получения соединения 121.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,83 (s, 1H), 7,81 (s, 2Н), 6,82-7,17 (m, 3H), 5,58 (d, J=8,0, 0,5Н), 5,47 (d, J=7,9, 0,5Н), 3,95-4,02 (m, 2Н), 3,78 (d, J=4,6, 3H), 3,44-3,75 (m, 3H), 2,50-2,55 (m, 2Н), 2,05-2,15 (m, 2Н), 1,91-1,96 (m, 6Н), 1,43-1,49 (m, 2Н), 0,99-1,03 (m, 6Н), 0,37-0,42 (m, 3H). MS (ESI) m/z 640 (М++Н).
Соединение 123
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((5,5-дифтор-2-(4-фтор-5-изопропил-2-метоксифенил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 123 (45 мг, 58%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); 1:1 смесь атропоизомеров; δ 7,85 (s, 1Н), 7,72 (s, 2Н), 6,81-6,77 (m, 1H), 6,59-6,51 (m, 1H), 5,65-5,62 (m, 1H), 3,99-3,86 (m, 3H), 3,73 (s, 1,5Н), 3,70 (s, 1,5Н), 3,57 (d, J=14,8, 1Н), 3,46 (d, J=14,8, 1H), 3,15-3,09 (m, 1H), 2,70-2,47 (m, 6H), 1,32-1,13 (m, 6H), 0,40 (d, J=6,5, 1,5H), 0,33 (d, J=6,5, 1,5H).
Соединение 124
метил 3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил(метил)карбамат
Соединение 124 (18 мг, 55%) в виде масла желтого цвета было получено способом, аналогичным способу получения соединения 120.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,84 (s, 1Н), 7,75 (s, 2Н), 7,07-7,03 (m, 1Н), 7,00-6,83 (m, 1H), 6,84-6,77 (m, 1H), 5,60-5,51 (m, 1Н), 4,00-3,90 (m, 2Н), 3,76 (d, J=5,4, 3H), 3,68-3,57 (m, 3H), 3,55-3,42 (m, 1Н), 3,34, 3,25 (2s, 3H), 2,40-2,04 (m, 2Н), 1,92-1,88 (m, 2Н), 1,52-1,41 (m, 2Н), 1,03-1,00 (m, 6Н), 0,41, 0,36 (2d,6,0, 3H).
N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-N-метилметансульфонамид
Соединение 128 (30 мг, 59%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 112.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86 (d, J=3,8, 1Н), 7,76 (d, J=10,2, 2Н), 7,02-7,24 (m, 2Н), 6,83-6,88 (m, 1Н), 5,58 (t, J=9,6, 1H), 3,92-4,02 (m, 2H), 3,82 (d, J=1,0, 3H), 3,38-3,57 (m, 1H), 3,28 (d, J=13,8, 3H), 2,81 (d, J=28,0, 3H), 2,10-2,47 (m, 2H), 1,94-2,02 (m, 2H), 1,44-1,51 (m, 2H), 1,02-1,06 (m, 6H), 1,36-1,48 (m, 3H). MS (ESI) m/z 650 (M++H).
Соединение 130
N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-3,3,3-трифтор-N-метилпропанамид
Соединение 130 (17 мг, 43%) в виде масла желтого цвета было получено способом, аналогичным способу получения соединения 120.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86 (s, 1H), 7,72 (d, J=5,0, 2Н), 7,07-7,03 (m, 1Н), 6,92-6,83 (m, 2H), 5,61 (t, J=8,0, 1H), 4,05-3,91 (m, 2H), 3,82, 3,78 (2s, 3H), 3,51-3,35 (m, 1H), 3,26, 3,19 (2s, 3H), 2,98-2,88 (m, 2H), 2,48-1,97 (m, 2H), 1,93-1,86 (m, 2H), 1,55-1,44 (m, 2H), 1,03-0,97 (m, 6H), 0,47, 0,39 (2d, J=6,0, 3H). MS (ESI) m/z 681, 682 (M++1, M++2).
Соединение 132
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-2-метокси-5-(1,1,1-трифторпропан-2-ил)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
2-Фтор-4-метоксиацетофенон, в качестве исходного вещества, подвергли нескольким химическим реакциям для получения пинаколатового соединения. Полученное пинаколатовое соединение подвергли реакции Сузуки с соединением 2, получив таким образом альдегидное соединение. Полученное альдегидное соединение подвергли реакции с соединением 4 для получения аминоспиртового соединения, в качестве промежуточного соединения. Полученное аминоспиртовое соединение подвергли реакции с трифосгеном, получив в результате соединение 132 (24 мг, 68%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86 (s, 1Н), 7,73 (s, 2Н), 6,94-6,96 (m, 1Н), 6,57-6,64 (m, 2Н), 5,53-5,62 (m, 1H), 3,80-3,99 (m, 2Н), 3,77-3,78 (m, 3H), 3,75-3,80 (m, 1Н), 1,20-2,50 (m, 6Н), 1,45-1,52 (m, 3H), 1,00-1,05 (m, 6Н), 0,30-0,43 (m, 3H). MS (ESI) m/z 657 (М++Н).
Соединение 133
Метил 2-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)ацетат
Как показано на реакционной схеме 4, было синтезировано пинаколато соединение. Полученное пинакОлатовое соединение (0,1 г, 0,33 ммоль), соединение 9 (0,17 г, 0,167 ммоль), палладиевый катализатор (10 мг, 0,02 ммоль) и карбонат натрия (70 мг, 0,65 ммоль) растворили в смеси диметоксиэтан/вода (5 мл). Полученный раствор кипятили при перемешивании в микропробирке при температуре 120°C for 15 минут. По окончанию реакции, реакцию погасили насыщенным раствором хлорида аммония. Реакционный продукт экстрагировали этилацетатом, промыли соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (12 г силикагеля, 1:1=Гексан/EtOAc), получив в результате соединение 133 (91 мг, 45%) в виде коричневого масла.
1H ЯМР (400 МГц, CDCl3); 1:1 смесь атропоизомеров; δ 7,85 (s, 1H), 7,76 (d, J=7,0, 2Н), 7,09-7,13 (m, 1Н), 6,76-6,93 (m, 2H), 5,61 (d, J=8,1, 0,5H), 5,55 (d, J=8,0, 0,5H), 3,90-4,03 (m, 2H), 3,75 (d, J=7,3, 3H), 3,64 (d, J=38,0, 3H), 3,41-3,68 (m, 2H), 3,41-3,68 (m, 1H), 2,04-2,53 (m, 2H), 1,89-1,98 (m, 2H), 1,42-1,54 (m, 2H), 1,01-1,04 (m, 6H), 0,33-0,37 (m, 3H). MS (ESI) m/z 615 (M++H).
Соединение 134
2-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)уксусная кислота
Соединение 133 (0,08 г, 0,13 ммоль) растворили в смеси диоксан/вода (5 мл в объемном отношении 2:1). Гидроксид лития (0,06 г, 1,32 ммоль) добавили по каплям к полученному раствору при комнатной температуре, и перемешивали при комнатной температуре в течение 6 часов. По окончанию реакции, реакцию погасили насыщенным аммиачным раствором. Реакционную смесь экстрагировали этилацетатом, промыли соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (12 г силикагеля, 1:1=Гексан/EtOAc), получив в результате соединение 134 (60 мг, 76%) в виде коричневого масла.
1H ЯМР (400 МГц, CDCl3); 1:1,3 смесь атропоизомеров; δ 7,85 (s, 1H), 7,74 (d, J=5,4, 2Н), 7,09-7,13 (m, 1H), 6,77-6,91 (m, 2H), 5,58 (t, J=7,7, 1H), 3,92-4,02 (m, 2H), 3,70-3,76 (m, 3H), 3,41-3,60 (m, 2H), 3,41-3,60 (m, 1H), 2,17-2,50 (m, 2H), 1,88-1,97 (m, 2H), 1,41-1,54 (m, 2H), 1,04-1,07 (m, 6H), 0,41 (d, J=6,5, 1,3H), 0,33 (d, J=6,5, 1,7H). MS (ESI) m/z 601 (M++H).
Соединение 136
N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)циклопропансульфонамид
Соединение 136 (37 мг, 63%) в виде твердого вещества желтого цвета было получено способом, аналогичным способу получения соединения 110.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,84 (s, 1Н), 7,74 (d, J=6,4, 2Н), 7,16, 7,08 (2dd, J=8,7, 2,7, 1H), 7,04, 6,94 (2d, J=2,7, 1H), 6,83-6,78 (m, 1H), 6,35-6,28 (m, 1H), 5,59 (dd, J=4,5, 8,0, 1H), 4,04-3,92 (m, 2H), 3,76, 3,74 (2s, 3H), 3,54, 3,39 (2d, J=14,0, 1H), 2,46-2,01 (m, 3H), 1,92 (bs, 2H), 1,53-1,43 (m, 2H), 1,12-1,06 (m, 2H), 1,06-1,03 (m, 6H), 1,02-0,82 (m, 2H), 0,43, 0,38 (2d, J=6,5, 3H).
Соединение 137
N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-трифторметансульфонамид
Соединение 137 (43 мг, 98%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 110.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,72 (d, J=4,9, 2Н), 7,29-7,25 (m, 1Н), 7,21-6,99 (m, 1H), 6,96-6,81 (m, 1H), 5,63-5,51 (m, 1H), 3,98-3,87 (m, 2H), 3,84 (d, J=5,2, 2H), 3,77 (d, J=8,3, 1H), 3,56, 3,37 (2d, J=15,0, 1H), 2,46-1,99 (m, 2H), 1,95-1,91 (m, 2H), 1,55-1,40 (m, 2H), 1,04-0,95 (m, 6H), 0,37-0,33 (m, 3H). MS (ESI) m/z 689 (M++H).
Соединение 138
N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-N-метилциклопропансульфонамид
Соединение 138 (21 мг, 66%) в виде твердого вещества желтого цвета было получено способом, аналогичным способу получения соединения 112.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,84 (s, 1Н), 7,75 (d, J=4,6, 2Н), 7,27-7,20 (m, 1H), 7,10, 7,04 (2d, J=2,7, 1H), 6,83 (dd, J=12,1, 8,8, 1H), 5,57 (dd, J=14,9, 8,0, 1H), 4,01-3,91 (m, 2H), 3,77 (d, J=7,1, 3H), 3,56, 3,41 (2d, J=14,6, 1H), 3,30, 3,25 (2s, 3H), 2,47-2,22 (m, 3H), 1,92 (bm, 2H), 1,51-1,44 (m, 2H), 1,11-0,84 (m, 4H), 1,02-1,00 (m, 6H), 0,39 (dd, J=6,5, 2,4, 3H). MS (ESI) m/z 675 (M++H).
Соединение 140
1-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-3-метилтиомочевина
Как показано на реакционной схеме 5, было синтезировано промежуточное соединение 17. Промежуточное соединение 17 (30 мг, 0,049 ммоль) растворили в этаноле. Изотиоцианат метан (избыточное количество) добавили по каплям к полученному раствору, после чего кипятили с одновременным перемешиванием. По окончанию реакции, реакционную смесь экстрагировали этилацетатом, промыли соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (12 г силикагеля, 15%~35% = гексан/EtOAc), получив в результате соединение 140 (20 мг, 59%) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, CDCl3); 1:2 смесь атропоизомеров; δ 7,86 (s, 1Н), 7,75 (s, 1Н), 7,72 (s, 1H), 7,08-6,96 (m, 1H), 6,92-6,87 (m, 2Н), 5,63 (m, 0,5Н), 5,42-5,40 (m, 0,5Н), 4,32-4,29 (m, 0,5Н), 4,18-4,10 (m, 1Н), 3,96-3,92 (m, 0,5Н), 3,87 (s, 2Н), 3,76 (s, 1Н), 3,18-3,10 (m, 3H), 2,45-2,39 (m, 1H), 2,2,08-1,87 (m, 2Н), 1,80-1,71 (m, 3H), 1,03-1,00 (m, 6Н), 0,62-0,60 (d, J=6,4, 2Н), 0,52-0,51 (d, J=6,4, 1Н). MS (ESI) 630 (М+Н)+.
Соединение 141
N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)трифтор-N-метилметансульфонамид
Соединение 141 (23 мг, 62%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 112.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,84 (s, 1Н), 7,73 (d, J=4,1, 2Н), 7,24-7,17 (m, 1Н), 7,03, 6,99 (2d, J=2,7, 1H), 6,86 (dd, J=13,4, 8,8, 1H), 5,58, 5,52 (2d, J=8,0, 1H), 3,97-3,81 (m, 2H), 3,79 (d, J=7,0, 3H), 3,56 (d, J=15,0, 0,5H), 3,42 (d, J=15,3, 3H), 3,36 (d, J=14,9, 0,5H), 2,46-2,04 (m, 2H), 1,99-1,94 (m, 2H), 1,55-1,42 (m, 2H), 1,02 (d, J=11,6, 6H), 0,37, 0,32 (2d, J=6,5, 3H). MS (ESI) m/z 703 (M++H).
Соединение 142
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(2-оксоимидазолидин-1-ил)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Как показано на реакционной схеме 5, было синтезировано промежуточное соединение 17. Промежуточное соединение 17 (50 мг, 0,081 ммоль) подвергли реакции с 2-бромэтан амином (20 мг, 0,10 ммоль) для получения промежуточного соединения. Полученное промежуточное соединение (0,1 г, 0,167 ммоль), диизопропилэтиламин (43 мкл, 0,25 ммоль) и трифосген (25 мг, 0,08 ммоль) растворили в метиленхлориде (3 мл). Полученный раствор перемешивали при комнатной температуре. По окончанию реакции, реакцию погасили насыщенным аммиачным раствором. Реакционную смесь экстрагировали этилацетатом, промыли соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (12 г силикагеля, 10%~20% = гексан/EtOAc), получив в результате соединение 142 (61,6 мг, 59%) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,83 (s, 1Н), 7,73 (s, 2Н), 7,54-7,53 (m, 0,5Н), 7,32-7,25 (m, 0,5Н), 7,10-7,07 (m, 0,5Н), 6,88-6,83 (m, 1H), 5,59-5,51 (dd, J=8,2, 23,7, 1Н), 5,50-5,48 (d, J=7,9, 0,5H), 4,09-3,86 (m, 2H), 3,74-3,67 (m, 3H), 3,57-3,53 (d, J=14,7, 0,5H), 3,41-3,37 (d, J=4,7, 0,5H), 2,45-2,41 (m, 0,5H), 2,24-2,22 (m, 1H), 2,17-2,13 (m, 0,5H), 1,93-1,91 (m, 3H), 1,61 (brs, 2H), 1,51-1,41 (m, 3H), 1,02-1,00 (m, 6H), 0,39-0,35 (m, 3H). MS (ESI) m/z 626 (M++H).
Соединение 143
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(2-оксооксазолидин-3-ил)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 143 (10 мг, 32%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 142.
1H ЯМР (400 МГц, CDCl3); 1:1 смесь атропоизомеров; δ 7,83 (s, 1H), 7,77-7,72 (m, 2Н), 7,29 (m, 0,5Н), 7,17-7,16 (m, 0,5Н), 7,14-7,07 (m, 0,5Н), 6,97-6,94 (0,5Н), 6,80-6,75 (m, 1Н), 6,49-6,44 (m, 1Н), 5,61-5,59 (d, J=7,9, 0,5Н), 5,50-5,48 (d, J=7,9, 0,5Н), 4,09-3,86 (m, 2Н), 3,74-3,67 (m, 3H), 3,57-3,53 (d, J=14,7, 0,5Н), 3,41-3,37 (d, J=14,7, 0,5Н), 2,45-2,41 (m, 0,5Н), 2,24-2,22 (m, 1Н), 2,17-2,13 (m, 0,5Н), 1,93-1,91 (m, 3H), 1,61 (brs, 2Н), 1,51-1,41 (m, 3H), 1,02-1,00 (m, 6Н), 0,39-0,35 (m, 3H). MS (ESI) m/z 627 (М++Н).
Соединение 144
(4S,5R)-3-((2-(2-амино-5-изопропилфенил)-5,5-диметилциклогекс-1-енил)метил)-5-(3,5-бис(трифторметил)фенил)-4-метилоксазолидин-2-он
Соединение 144 (54 мг, 50%) в виде коричневого масла было получено способом, аналогичным способу получения соединения 132.
1H ЯМР (400 МГц, CDCl3); 1:2 смесь атропоизомеров; δ 7,86 (s, 1Н), 7,73 (s, 2Н), 6,63-6,96 (m, 3H), 5,63 (d, J=8,0, 0,68Н), 5,54 (d, J=8,1, 0,32Н), 3,71-4,04 (m, 2Н), 3,49 (d, J=14,6, 1H), 2,70-2,81 (m, 1H), 2,21-2,31 (m, 2Н), 1,90-2,05 (m, 2Н), 1,48-1,55 (m, 2Н), 1,10-1,31 (m, 6Н), 1,04-1,09 (m, 6Н), 0,57 (d, J=6,5, 1H), 0,33 (d, J=6,5, 2H). MS (ESI) m/z 569 (M++H).
Соединение 145
N-(2-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-изопропилфенил)-N-метилацетамид
Способом, аналогичным способу получения соединения 110, соединение 166 было синтезировано и затем подвергнуто реакции с йодометаном для получения соединения 145 (10 мг, 45%) в виде масла желтого цвета.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,90 (s, 1Н), 7,79 (d, J=15,0, 2Н), 6,90-7,20 (m, 3H), 5,70-5,73 (m, 1Н), 3,94-4,13 (m, 2H), 3,13-3,41 (m, 1H), 2,87-3,24 (m, 3H), 2,82-3,00 (m, 1H), 1,62-2,30 (m, 4H), 1,44-1,49 (m, 2H), 1,17-1,29 (m, 6H), 1,00-1,29 (m, 6H), 0,42-0,72 (m, 3H). MS (ESI) m/z 625 (M++H).
Соединение 146
3-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-1,1-диметилмочевина
Соединение 146 (21 мг, 55%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 110.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,82 (s, 1Н), 7,79 (d, J=6,2, 2Н), 7,77-7,11 (m, 1Н), 7,09-6,92 (m, 1H), 6,76 (t, J=9,0, 1H), 6,14 (d, J=14,4, 1H), 5,59, 5,44 (2d, J=7,9, 1H), 4,05-3,91 (m, 2H), 3,73 (s, 3H), 3,52-3,41 (m, 1H), 3,00 (d, J=15,4, 6H), 2,42-2,09 (m, 2H), 1,93-1,89 (m, 2H), 1,50-1,41 (m, 2H), 1,01-0,99 (m, 6H), 0,40, 0,36 (2d, 7=6,5, 3H). MS (ESI) m/z 628 (M++H).
Соединение 147
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(метилтио)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Как показано на реакционной схеме 5, было синтезировано промежуточное соединение 17. Промежуточное соединение 17 (50 мг, 0,076 ммоль), в качестве исходного вещества, растворили в хлороформе (1,5 мл). Диметил сульфид (10 мкл, 0,11 ммоль) и трет-бутил нитрил (18 мкл, 0,15 ммоль) добавили по каплям к полученному раствору при комнатной температуре, и перемешивали при комнатной температуре в течение 30 минут, после чего кипятили с одновременным перемешиванием и нагреванием в течение 3 часов. По окончанию реакции, реакционную смесь охладили до комнатной температуры, разбавили n-гексаном, и немедленно очистили с помощью колоночной хроматографии (силикагель, 20% Гексан/EtOAc), получив в результате соединение 147 (9 мг, 21%) в виде масла желтого цвета.
(ESI) m/z (586,2 neg.(M+-H).
Соединение 148
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((5,5-диметил-2-(2-(метилтио)-5-(трифторметокси)фенил)циклогекс-1-енил)метил)-4-метилоксазолщщн-2-он
Соединение 148 (25 мг, 50%) в виде твердого вещества желтого цвета было получено способом, аналогичным способу получения соединения 57.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1H), 7,73 (s, 2Н), 7,12-7,10 (m, 2Н), 6,85-6,83 (m, 1Н), 5,64, 5,61 (2d, J=8,0, 1Н), 4,10-4,05 (m, 1Н), 3,91-3,83 (m, 1Н), 3,54, 3,28 (2d, J=15,0, 1Н), 2,60-2,00 (m, 2Н), 2,41 (s, 3H), 1,94 (bm, 2Н), 1,56-1,46 (m, 2Н), 1,08-1,03 (m, 6Н), 0,50, 0,37 (2d, J=6,5, 3H).
Соединение 151
(E)-1-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-2-циано-3-метилгуанидин
Как показано на реакционной схеме 5, было синтезировано промежуточное соединение 17. Промежуточное соединение 17 (70 мг, 0,113 ммоль), в качестве исходного вещества, подвергли реакции с дифенилцианокарбоимидатом для получения промежуточного соединения. Полученное промежуточное соединение (70 мг, 0,1 ммоль) и метиламин (13 мг, 0,2 ммоль) растворили в ацетонитриле (3 мл). Полученный раствор кипятили при перемешивании при температуре 80°C. По окончанию реакции, реакционную смесь разбавили метиленхлоридом, промыли соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (12 г силикагеля, 25%~35% = Гексан/EtOAc), получив в результате соединение 151 (30 мг, 47%) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, CDCl3); 1:2 смесь атропоизомеров; δ 7,85 (s, 1Н), 7,73 (s, 1Н), 7,67 (s, 1H), 7,09-7,05 (m, 1Н), 6,95-6,87 (m, 2Н), 5,40-5,38 (m, 1Н), 4,36-4,32 (m, 0,5Н), 4,22-4,18 (m, 1H), 3,94-3,91 (m, 0,5Н), 3,88 (s, 2Н), 3,76 (s, 1H), 3,08-3,05 (m, 1Н), 2,84-2,80 (m, 3H), 2,50-2,37 (m, 1H), 2,08-1,91 (m, 3H), 1,69 (brs, 2Н), 1,56-1,42 (m, 2Н), 1,03-0,97 (m, 6Н), 0,64-0,62 (d, J=6,6, 2Н), 0,57-0,56 (d, J=6,5, 1Н). MS (ESI) 638 (M+H)+.
Соединение 149
(2)-3-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-2-циано-1,1-диметилгуанидин
Соединение 149 (20 мг, 51%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 151.
1H ЯМР (400 МГц, CDCl3); 1:1 смесь атропоизомеров; δ 7,85 (s, 1Н), 7,74-7,72 (m, 2Н), 6,95-6,91 (m, 1Н), 6,84-6,75 (m, 1Н), 6,70-6,68 (m, 1H), 5,61-5,55 (dd, J=8,1, 17,2, 1H), 4,07-3,92 (m, 2Н), 3,88 (s, 1,5Н), 3,76 (s, 1,5Н), 3,63-3,59 (d, J=14,6, 0,5Н), 3,51-3,47 (d, J=14,6, 0,5H), 2,95-2,92 (m, 6H), 2,45-2,22 (m, 2H), 1,92 (s, 2H), 1,65 (brs, 2H), 1,49-1,43 (m, 1H), 1,03-0,94 (m, 6H), 0,52-0,50 (d, J=6,5, 1,5H), 0,42-0,41 (d, J=6,5, 1,5H). MS (ESI) m/z 652 (M++H).
Соединение 153
(E)-1-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-2-циано-1,3,3-триметилгуанидин
Соединение 153 (5 мг, 25%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 47.
1H ЯМР (400 МГц, CDCl3); 1:1 смесь атропоизомеров; δ 7,85 (s, 1Н), 7,74-7,72 (m, 2Н), 6,89-6,79 (m, 2Н), 6,67-6,62 (m, 1Н), 5,63-5,58 (m, 1H), 4,04-3,89 (m, 2Н), 3,76-3,73 (m, 3H), 3,55-3,43 (m, 1H), 3,37-3,31 (m, 3H), 2,81-2,79 (m, 6Н), 2,40-2,20 (m, 1H), 1,99 (s, 2Н), 1,53-1,49 (m, 4Н), 1,04-0,96 (m, 6Н), 0,49-0,48 (d, J=6,5, 1,5Н), 0,39-0,37 (d, J=6,5, 1,5Н). MS (ESI) m/z 666 (M++H).
Соединение 156
(Z)-метил N-3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил-N′-метилкарбамимидотиоат
Соединение 156 (16 мг, 64%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 47.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,72 (d, J=9,1, 2Н), 7,11-7,08 (m, 1Н), 6,90-6,83 (m, 2H), 5,60, 5,53 (2d, J=8,0, 1H), 4,64-4,63 (m, 0,5H), 4,29-4,27 (m, 0,5H), 4,19-3,95 (m, 2H), 3,82, 3,75 (2s, 3H), 3,45, 3,21 (2d, J=15,0, 1H), 3,21, 3,16 (2s, 3H), 2,71 (dd, J=14,7, 4,7, 3H), 2,45-2,0 (m, 2H), 1,92 (s, 2H), 1,51-1,46 (m, 2H), 1,04-1,00 (m, 6H), 0,53, 0,41 (2d, J=6,6 Гц, 3H).
Соединение 157
1-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-1,3,3-триметилмочевина
Соединение 157 (8 мг, 44%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 112.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,73 (s, 2Н), 6,95-6,91 (m, 1Н), 6,79, 6,77 (dd, J=8,8, 1H), 6,72 (dd, J=13,0, 2,7, 1H), 5,61 (dd, J=4,4, 8,0, 1H), 4,02-3,89 (m, 2H), 3,74 (d, J=8,9, 3H), 3,53, 3,44 (2d, J=14,0, 1H), 3,13, 3,06 (2s, 3H), 2,65 (d, J=12,3, 6H), 2,50-2,00 (m, 2H), 2,07-2,04 (m, 2H), 1,50-1,45 (m, 2H), 1,04-0,99 (m, 6H), 0,43, 0,33 (2d, J=6,5, 3H). MS (ESI) m/z 642 (M++H).
Метил 2-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)пропаноат
Соединение 159 (30 мг, 32%) в виде коричневого масла было получено способом, аналогичным способу получения соединения 133.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,73-7,75 (m, 2Н), 7,13-7,16 (m, 1H), 6,77-6,96 (m, 2Н), 5,31-5,61 (m, 1H), 3,89-4,00 (m, 2Н), 3,73-3,75 (m, 3H), 3,53-3,68 (m, 3H), 3,53-3,68 (m, 1H), 3,37-3,68 (m, 1Н), 1,94-2,47 (m, 6Н), 1,44-1,59 (m, 3H), 1,01-1,25 (m, 6Н), 0,27-0,38 (m, 3H). MS (ESI) m/z 628 (М++Н).
Соединение 160
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(1,1,1-трифторпропан-2-иламино)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Способом, аналогичным способу получения соединения 133, 3-йодо-4-метоксианилин, в качестве исходного вещества, подвергли нескольким химическим реакциям с целью получения пинаколатового соединения. Полученное пинаколатовое соединение подвергли реакции с соединением 4 для получения аминоспиртового соединения, которое является промежуточным соединением. Полученное аминоспиртовое соединение подвергли реакции с трифосгеном, получив в результате соединение 160 (72 мг, 38%) в виде коричневого масла.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,73 (m, 2Н), 6,67-6,77 (m, 1H), 6,52-6,56 (m, 1H), 6,33-6,36 (m, 1Н), 5,57-5,60 (m, 1Н), 4,00-4,04 (m, 1H), 3,84-3,99 (m, 2Н), 3,69 (d, J=8,2, 3H), 3,46-3,64 (m, 1Н), 3,34 (br s,1Н), 1,43-2,50 (m, 6Н), 1,33-1,41 (m, 3H), 0,97-1,04 (m, 6Н), 0,32-0,46 (m, 3H), 1,01-1,04 (m, 6Н), 0,33-0,37 (m, 3H). MS (ESI) m/z 653 (М++Н).
Соединение 161
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(метил(1,1,1-трифторпропан-2-ил)амино)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 161 (25 мг, 54%) в виде масла желтого цвета было получено способом, аналогичным способу получения соединения 112.
1H ЯМР (400 МГц, CDCl3); 1:1 смесь атропоизомеров; δ 7,86 (s, 1H), 7,73 (s, 2Н), 6,69-6,81 (m, 2Н), 6,48-6,52 (m, 1H), 5,56-5,60 (m, 1Н), 4,10-4,14 (m, 1Н), 3,90-4,02 (m, 2Н), 3,69-3,72 (m, 3H), 3,43-3,69 (m, 1Н), 2,80 (d, J=15,6, 3H), 2,05-2,48 (m, 2Н), 1,93 (s, 2Н), 1,47-1,55 (m, 2H), 1,34-1,48 (m, 3H), 1,01-1,05 (m, 6H), 0,31-0,45 (m, 3H). MS (ESI) m/z 666 (M++H).
Соединение 162
N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-2,2,2-трифторацетамид
Соединение 162 (0,21 мг, 92%) в виде желтой пены было получено способом, аналогичным способу получения соединения 18. MS (ESI) m/z 653 (М++Н).
Соединение 163
N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-2-бромацетамид
Соединение 163 (44 мг, 100%) в виде масла желтого цвета было получено способом, аналогичным способу получения соединения 110.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 8,11, 8,04 (2S, 1Н), 7,84 (d, J=5,5, 1Н), 7,79, 7,74 (2S, 1H), 7,43-7,36 (m, 1H), 7,15-7,09 (m, 1H), 6,82 (t, J=9,1, 1H), 5,60, 5,52 (2d, J=8,0, 1H), 4,08-3,90 (m, 4H), 3,75 (d, J=7,3, 3H), 3,57, 3,38 (2d, J=14,7, 1H), 2,24-2,03 (m, 2H), 1,93 (d, J=11,2, 2H), 1,51-1,41 (m, 2H), 1,01 (dd, J=10,0, 4,4, 6H), 0,39, 0,34 (2d, J=6,5, 3H). MS (ESI) m/z 676,0, 679,0 (M+-1, M++2).
Соединение 166
N-(2-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-изопропилфенил)ацетамид
Соединение 166 (25 мг, 44%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 110.
1H ЯМР (400 МГц, CDCl3); 1:1,2 смесь атропоизомеров; δ 7,88 (s, 1Н), 7,78 (s, 2Н), 6,98-7,25 (m, 3H), 5,64-5,67 (m, 1H), 3,77-4,02 (m, 2Н), 3,41-3,49 (m, 1Н), 2,86-2,98 (m, 1Н), 2,52 (s, 1H), 2,47 (s, 2Н), 2,14-2,22 (m, 2Н), 1,83-1,99 (m, 2Н), 1,41-1,50 (m, 2Н), 1,22- 1,31 (m, 6Н), 0,90-1,03 (m, 6Н), 0,71 (d, J=6,4, 1H), 0,57 (d, J=6,5, 2H). MS (ESI) m/z 611 (M++H).
Соединение 167
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-изопропил-2-(метиламино)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 167 (13 мг, 11%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 47.
1H ЯМР (400 МГц, CDCl3); 1:1 смесь атропоизомеров; δ 7,87 (d, J=5,2, 1Н), 7,72 (d, J=7,4, 2H), 7,00-7,07 (m, 1H), 6,54-6,70 (m, 2H), 5,63 (d, J=8,1, 0,5H), 5,49 (d, J=8,2, 0,5H), 3,98 (d, J=14,7, 0,5H), 3,83-3,92 (m, 1H), 3,71-3,73 (m, 1H), 3,42 (d, J=14,6, 0,5H), 2,81 (d, J=8,4, 3H), 2,72-2,78 (m, 1H), 2,18-2,29 (m, 2H), 1,87-1,98 (m, 2H), 1,47-1,54 (m, 2H), 0,74-1,35 (m, 15H), 0,55 (d, J=6,5, 1,7H), 0,32 (d, J=6,5, 1,3H). MS (ESI) m/z 583 (M++H).
Соединение 168
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-(диметиламино)-5-изопропилфенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 144 (34 мг, 0,06 ммоль), параформальдегид (1 мл) и цианоборгидрид натрия (7 мг, 0,12 ммоль) растворили в ацетонитриле (2 мл). Уксусную кислоту (7,4 мкл, 0,12 ммоль) медленно добавили по каплям к полученному раствору при комнатной температуре, и перемешивали при комнатной температуре в течение 2 часов. По окончанию реакции, реакционную смесь разбавили этилацетатом, промыли соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (12 г силикагеля, 4:1 = Гексан/EtOAc), получив в результате соединение 168 (30 мг, 85%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3); 1:3,2 смесь атропоизомеров; δ 7,84 (s, 1Н), 7,73 (s, 2Н), 6,99-7,02 (m, 1Н), 6,80-6,86 (m, 2Н), 5,59-5,61 (m, 1Н), 3,40-3,82 (m, 3H), 2,75-2,78 (m, 1H), 2,67 (d, J=10,2, 3H), 2,15-2,25 (m, 2Н), 1,88-2,05 (m, 2Н), 1,52-1,56 (m, 2Н), 1,27-1,33 (m, 6Н), 1,12-1,19 (m, 6Н), 1,04-1,07 (m, 6Н), 0,61 (d, J=6,6, 0,7Н), 0,16 (d, J=6,5, 2,3H). MS (ESI) m/z 597 (M++H).
Соединение 170
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(2,2,2-трифторацетил)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксибензальдегид (0,18 г, 0,32 ммоль), в качестве исходного вещества, растворили в диметоксиэтане (5,0 мл). Фторид цезия (5 мг, 0,03 ммоль) и триметилсилил три фторид (0,05 мл, 0,36 ммоль) медленно добавили по каплям к полученному раствору при комнатной температуре, и перемешивали при комнатной температуре в течение 2 часов. По окончанию реакции, реакцию погасили 1М раствором HCl (гидрохлорид). Реакционную смесь разбавили этилацетатом, промыли соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (12 г силикагеля, 4:1 = Гексан/EtOAc), получив таким образом промежуточное соединение (0,14 г, 68%) в виде бесцветного масла. Полученное промежуточное соединение (0,14 г, 0,22 ммоль) и перйодат Десса-Мартина (0,14 мг, 0,33 ммоль) растворили в метиленхлориде (5,0 мл), и перемешивали при комнатной температуре в течение 2 часов. По окончанию реакции, реакцию погасили водой. Реакционную смесь экстрагировали метиленхлоридом. Полученный органический слой высушили с помощью безводного сульфата натрия, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (12 г силикагеля, 3:1 = гексан/EtOAc), получив в результате соединение 170 (0,1 г, 70%), которое является промежуточным соединением, в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3); 1:1,2 смесь атропоизомеров; δ 8,03 (d, J=7,6, 1H), 7,87 (s, 1H), 7,73 (d, J=7,5, 3H), 6,99 (t, J=9,0, 1H), 5,66 (d, J=7,6, 0,55H), 5,55 (d, J=7,9, 0,45H), 3,91-4,03 (m, 2H), 3,90 (d, J=10,4, 3H), 3,54 (d, J=15,0, 0.45H), 3,31 (d, J=14,8, 0,55H), 2,21-2,26 (m, 2H), 1,52-1,53 (m, 2H), 1,48-1,51 (m, 2H), 1,02-1,06 (m, 6H), 0,39-0,43 (m, 3H). MS (ESI) m/z 638 (M++H).
Соединение 171
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(перфторпроп-1-ен-2-ил)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 170 (0,1 г, 0,149 ммоль) растворили в диметилформамиде (5 мл). Трифенилфосфин (0,08 г, 0,3 ммоль) и хлордифторацетат натрия (0,05 г, 0,3 ммоль) добавили по каплям по порядку к полученному раствору при комнатной температуре, и затем кипятили при перемешивании при температуре 135°C в течение 6 часов. По окончанию реакции, реакцию погасили водой. Реакционную смесь экстрагировали этилацетатом. Полученный органический слой высушили с помощью безводного сульфата натрия, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (4 г силикагеля, 3:1 = гексан/EtOAc), получив таким образом промежуточное соединение 171 (17 мг, 20%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86 (s, 1Н), 7,72 (s, 2Н), 7,18-7,22 (m, 1H), 6,86-6,96 (m, 2Н), 5,55-5,62 (m, 1Н), 3,84-3,99 (m, 2Н), 3,80 (d, J=8,6, 3H), 3,58 (d, J=12,2, 0,5Н), 3,39 (d, J=14,9, 0,5H), 2,08-2,51 (m, 2H), 1,88 (s, 2H), 1,49-1,55 (m, 6H), 1,01-1,05 (m, 6H), 0,31-0,34 (m, 3H). MS (ESI) m/z 672 (M++H).
Соединение 172
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-(1,1,1,3,3,3-гексафторпропан-2-ил)-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 172 (14 мг, 14%) в виде масла желтого цвета было получено способом, аналогичным способу получения соединения 171.
1H ЯМР (400 МГц, CDCl3); 1:1 смесь атропоизомеров; δ 7,86 (s, 1Н), 7,72 (s, 2Н), 7,24-7,31 (m, 1Н), 7,01-7,06 (m, 1H), 6,87-6,92 (m, 1Н), 5,55-5,63 (m, 1Н), 3,83-4,03 (m, 2Н), 3,83-4,03 (m, 1Н), 3,80 (d, J=7,2, 3H), 3,55 (d, J=14,7, 0,5Н), 3,37 (d, J=14,8, 0,5H), 2,21-2,53 (m, 2H), 1,89-1,99 (m, 2H), 1,44-1,52 (m, 2H), 1,04 (d, J=13,4, 6H), 0,27-0,33 (m, 3H). MS (ESI) m/z 692 (M++H).
Соединение 173
трет-Бутил 3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил(изопропил)карбамат
Соединение 173 (50 мг, 56%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 112.
1H ЯМР (400 МГц, CDCl3); 1:1,2 смесь атропоизомеров; δ 7,84 (s, 1H), 7,72 (s, 2Н), 6,92-6,90 (m, 1Н), 6,81-6,74 (m, 1H), 6,68-6,66 (m, 1Н), 5,62-5,56 (m, 1Н), 4,47 (brs, 1Н), 3,99-3,90 (m, 2Н), 3,89-3,87 (m, 3H), 3,60-3,48 (m, 1H), 2,54-2,49 (m, 1Н), 2,24-2,02 (m, 1Н), 1,92 (s, 2Н), 1,53-1,42 (m, 2Н), 1,33-1,21 (m, 9Н), 1,19-1,00 (m, 12Н), 0,46 (d, J=6,6, 1Н), 0,27 (d, J=6,3, 2H). MS (ESI) m/z 699 (M++H).
Соединение 174
трет-Бутил 3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил(этил)карбамат
Соединение 174 (45 мг, 52%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 112.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,84 (s, 1Н), 7,79 (s, 2Н), 6,95 (s, 1Н), 6,81 (m, 2Н), 5,57 (m, 1Н), 3,99-3,85 (m, 2Н), 3,75-3,74 (m, 3H), 3,63-3,41 (m, 3H), 2,47-1,86 (m, 4Н), 1,58-1,23 (m, 11H), 1,16-0,88 (m, 9Н), 0,44-0,22 (m, 4Н). MS (ESI) m/z 684 (М++Н).
Соединение 177
N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенилУК-этилацетамид
Соединение 177 (15 мг, 79%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 112.
1H ЯМР (400 МГц, CDCl3); 1:1,3 смесь атропоизомеров; δ 7,85 (s, 1Н), 7,72 (s, 2Н), 7,03-7,01 (m, 1Н), 6,99-6,77 (m, 2Н), 5,62-5,60 (d, J=8,0, 1H), 4,06-3,87 (m, 2Н), 3,79 (s, 1,2Н), 3,76 (s, 1,8Н), 3,74-3,61 (m, 2Н), 3,54-3,34 (m, 1H), 2,51-2,47 (m, 0,5Н), 2,29-2,08 (m, 1,5Н), 2,06-2,01 (m, 1Н), 1,93-1,79 (m, 3H), 1,79 (s, 1,5Н), 1,75 (s, 1,5Н), 1,55-1,43 (m, 2Н), 1,17-0,92 (m, 6Н), 0,46-0,44 (d, J=6,2, 1,3H), 0,34-0,32 (d, J=6,2, 1,7Н). MS (ESI) m/z 627 (M++H).
Соединение 178
(4S,5R,Z)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(2,2,2-трифтор-1-(метоксиимино)этил)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 170 (0,1 г, 0,157 ммоль) и метиламин (26 мг, 0,31 ммоль) растворили в метаноле (5 мл). Пиридин (25 мкл, 0,31 ммоль) медленно добавили по каплям к полученному раствору при комнатной температуре, и перемешивали при температуре 60°C в течение 12 часов. По окончанию реакции, реакцию погасили водой. Реакционную смесь экстрагировали метиленхлоридом. Полученный органический слой высушили с помощью безводного сульфата натрия, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (12 г силикагеля, 3:1 = гексан/EtOAc), получив в результате соединение 178 (35 мг, 30%), которое является промежуточным соединением, в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3); 1:3,2 смесь атропоизомеров; δ 7,84 (s, 1H), 7,73 (s, 2Н), 6,99-7,02 (m, 1Н), 6,80-6,86 (m, 2Н), 5,59-5,61 (m, 1Н), 3,40-3,82 (m, 3H), 2,75-2,78 (m, 1Н), 2,67 (d, J=10,2, 3H), 2,15-2,25 (m, 2H), 1,88-2,05 (m, 2H), 1,52-1,56 (m, 2H), 1,27-1,33 (m, 6H), 1,12-1,19 (m, 6H), 1,04-1,07 (m, 6H), 0,61 (d, J=6,6, 0,7H), 0,16 (d, J=6,5, 2,3H). MS (ESI) m/z 685 (M++H).
Соединение 179
N-(3-(2-(((4S,5R)-5-(3,5-бис(три(фторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-N-(2-гидрокси-2-метилпропил)ацетамид
Соединение 179 (10 мг, 50%) в виде бесцветного масла получено таким же способом, как соединение 112, за исключением использования изобутилен оксида вместо йодометана.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,88 (s, 1Н), 7,82-7,78 (m, 1H), 7,48-7,45 (m, 0,5Н), 7,24-7,23 (m, 0,5Н), 7,17-7,00 (m, 2Н), 6,82-6,79 (m, 1H), 4,99-4,98 (d, J=5,5, 1H), 3,93-3,41 (m, 7Н), 2,38-2,32 (m, 1Н), 2,17-2,15 (m, 3H), 1,97-1,83 (m, 3H), 1,50-1,42 (m, 2Н), 1,38-1,22 (m, 6Н), 1,15-1,05 (m, 3H), 0,89-0,86 (m, 3H), 0,69-0,61 (m, 3H). MS (ESI) 671 (М++Н).
Соединение 180
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-(3,3-дифторазетидин-1-карбонил)-2-метоксифенил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 180 (17 мг, 77%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 67.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,84 (s, 1Н), 7,73 (s, 2Н), 7,55-7,44 (m, 1H), 7,43-7,33 (m, 1Н), 6,88 (dd, J=8,6, 3,9, 1Н), 5,60, 5,53 (2d, 7=8,0, 1H), 4,55-4,47 (m, 4H), 4,01-3,93 (m, 2H), 3,83, 3,80 (2s, 3H), 3,48, 3,35 (2d, J=14,9, 1H), 2,39-2,01 (m, 4H), 1,80-1,73 (m, 4H), 0,42 (dd, J=15,7, 6,5, 3H). MS (ESI) m/z 633, 634 (M++H, M++2).
Соединение 181
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-(1,1,1,3,3,3-гексафтор-2-гидроксипропан-2-ил)-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 181 (37 мг, 72%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 170.
1H ЯМР (400 МГц, CDCl3); 1:3,2 смесь атропоизомеров; δ 7,84 (s, 1Н), 7,73 (s, 2Н), 6,99-7,02 (m, 1H), 6,80-6,86 (m, 2Н), 5,59-5,61 (m, 1Н), 3,40-3,82 (m, 3H), 2,75-2,78 (m, 1H), 2,67 (d, J=10,2, 3H), 2,15-2,25 (m, 2Н), 1,88-2,05 (m, 2Н), 1,52-1,56 (m, 2Н), 1,27-1,33 (m, 6Н), 1,12-1,19 (m, 6Н), 1,04-1,07 (m, 6Н), 0,61 (d, J=6,6, 0,7Н), 0,16 (d, J=6,5, 2,3H). MS (ESI) m/z 708 (M++H).
Соединение 182
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-(1,1,1,3,3,3-гексафтор-2-метоксипропан-2-ил)-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 182 (12 мг, 47%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 47.
1H ЯМР (400 МГц, CDCl3); 1:3,2 смесь атропоизомеров; δ 7,84 (s, 1Н), 7,73 (s, 2Н), 6,99-7,02 (m, 1Н), 6,80-6,86 (m, 2Н), 5,59-5,61 (m, 1Н), 3,40-3,82 (m, 3H), 2,75-2,78 (m, 1H), 2,67 (d, J=10,2, 3H), 2,15-2,25 (m, 2Н), 1,88-2,05 (m, 2Н), 1,52-1,56 (m, 2Н), 1,27-1,33 (m, 6Н), 1,12-1,19 (m, 6Н), 1,04-1,07 (m, 6Н), 0,61 (d, J=6,6, 0,7Н), 0,16 (d, J=6,5, 2,3H). MS (ESI) m/z 722 (M++H).
Соединение 183
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-((2-гидрокси-2-метилпропил)(метил)амино)-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 183 (8 мг, 24%) в виде масла желтого цвета было получено способом, аналогичным способу получения соединения 120.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,88 (s, 1Н), 7,78 (s, 2Н), 6,76-6,72 (m, 1Н), 6,52-6,49 (m, 1Н), 6,24 (dd, 7=10,1, 2,9, 1Н), 4,99-4,97 (m, 1Н), 3,94-3,83 (m, 1Н), 3,67-3,61 (2s, 3H), 3,70-3,53 (m, 2Н), 2,79, 2,77 (2s, 3H), 2,39-1,91 (m, 4Н), 1,86, 1,81 (2s, 1Н), 1,60-1,52 (m, 2Н), 1,53, 1,49 (2s, 1Н), 1,47-1,25 (m, 6Н), 1,04-0,97 (m, 6Н), 0,79, 0,55 (2s, 3H).
Соединение 184
(4S,5R)-3-((2-(5-ацетил-4-фтор-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-5-(3,5-бис(трифторметил)фенил)-4-метилоксазолидин-2-он
Как показано на реакционной схеме 4, было синтезировано соединение 12. Полученное соединение 12 (0,24 г, 0,83 ммоль) подвергли реакции Сузуки с соединением 9 (0,39 г, 0,756 ммоль) для получения соединения 184 (0,11 г, 25%) в виде коричневого масла.
MS (ESI) m/z 602 (М++Н).
Соединение 185
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-(4,5-дигидрооксазол-2-илУ2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксибензальдегид (35 мг, 0,06 ммоль), в качестве исходного вещества, растворили в трет-бутиловом спирте (2 мл). Этаноламин (4 мкл, 0,07 ммоль) добавили по каплям к полученному раствору при комнатной температуре, и перемешивали в течение 30 минут при комнатной температуре. Карбонат калия (25 мг, 0,18 ммоль) и йод (31 мг, 0,12 ммоль) добавили по каплям к полученной реакционной смеси. Полученную реакционную смесь кипятили при перемешивании при температуре 70°C в течение ночи. По окончанию реакции, ее погасили насыщенным раствором тиосульфата натрия, добавленного по каплям к реакционной смеси. Реакционную смесь экстрагировали этилацетатом. Полученный органический слой высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью колоночной хроматографии, получив таким образом промежуточное соединение 185 (11 мг, 30%) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,84 (s, 1Н), 7,82-7,77 (m, 1H), 7,74, 7,71 (2s, 2Н), 7,61 (dd, J=13,5, 2,1, 1Н), 6,87 (dd, J=8,6, 11,3,1H), 5,62, 5,49 (2d, J=8,1, 1H), 4,42-4,32 (m, 2H), 4,04-3,83 (m, 4H), 3,81, 3,79 (2s, 3H), 3,53, 3,35 (d, J=14,8, 1H), 2,41-2,04 (m, 2H), 1,91 (bs, 2H), 1,52-1,42 (m, 2H), 1,03-1,00 (m, 6H), 0,35 (dd, J=8,9, 6,5, 3H). MS (ESI) m/z 611 (M++H).
Соединение 187
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-(3-гидроксиазетидин-1-карбонил)-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 187 (16 мг, 52%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 67.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1H), 7,74 (d, J=4,0, 2Н), 7,54 (dd, J=8,5, 2,2, 0,5Н), 7,47 (dd, J=8,5, 2,1, 0,5H), 7,41 (d, J=2,1, 0,5H), 7,30 (d, J=2,2, 0,5H), 6,86 (dd, J=8,6, 4,0, 1H), 5,61, 5,56 (2d, J=8,0, 1H), 4,69 (bm, 1H), 4,44 (bs, 2H), 4,15-3,93 (m, 3H), 3,82, 3,79 (2s, 3H), 3,52, 3,37 (2d, J=14,6, 1H), 3,13, 3,03 (2d, J=5,4, 1H), 2,47-2,08 (m, 2H), 1,92 (bs, 2H), 1,53-1,44 (m, 2H), 1,04-1,01 (m, 6H), 0,44, 0,37 (2d, J=6,5, 3H). MS (ESI) m/z 642, 663 ((M+H)+, (M+H)++21).
Соединение 188
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-((R)-4-изопропил-4,5-дигидрооксазол-2-ил)-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 188 (14 мг, 40%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 185.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,84-7,77 (m, 2Н), 7,74, 7,71 (2s, 2Н), 7,59 (dd, J=12,1, 2,1, 1Н), 6,85 (dd, J=8,6, 12,4, 1H), 5,63, 5,50 (2d, J=8,0, 1H), 4,38-4,30 (m, 1H), 4,12-3,93 (m, 4H), 3,80, 3,78 (2s, 3H), 3,52, 3,36 (2d, J=14,8, 1H), 2,47-2,12 (m, 2H), 1,92 (bs, 2H), 1,87-1,71 (m, 1H), 1,50-1,45 (m, 2H), 1,06-1,01 (m, 7,5H), 0,91-0,89 (m, 3H), 0,80 (d, J=6,7, 1,5H), 0,36 (2d, J=6,5, 3H). MS (ESI) m/z 653 (M++H).
Соединение 189
1-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)циклопропанкарбонитрил
Способом, аналогичным способу получения соединения 12 по реакционной схеме 4, было синтезировано пинаколатовое соединение. Далее для получения соединения 189 (0,25 г, 81%) в виде зеленой пены использовалась такая же процедура, как показано на реакционной схеме 2.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1H), 7,74 (d, J=5,7, 2Н), 7,16 (dd, J=8,5, 2,5, 0,5Н), 7,07 (d, J=2,4, 0,5H), 7,02 (dd, J=8,5, 2,5, 0,5H), 6,90 (d, J=2,5, 0,5H), 6,81 (dd, J=8,5, 11,4, 1H), 5,59 (dd, J=8,3, 10,4, 1H), 4,00-3,94 (m, 2H), 3,76, 3,73 (2s, 3H), 3,50, 3,35 (2d, J=14,7, 1H), 2,50-2,04 (m, 2H), 1,92 (bs, 2H), 1,68-1,56 (m, 2H), 1,50-1,47 (m, 2H), 1,34-1,23 (m, 2H), 1,04-1,00 (m, 6H), 0,43, 0,36 (2d, J=6,5, 3H). MS (ESI) m/z 607 (M++H).
Соединение 190
1-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)циклопропанкарбоксамид
Соединение 189 (0,1 г, 0,165 ммоль), 30% перекись водорода (0,6 мл) и 7М гидроксид натрия (60 мкл) растворили в этаноле (1 мл). Полученный раствор перемешивали при температуре 85°C в течение 4 часов. По окончанию реакции, реакционную смесь разбавили этилацетатом, промыли соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью колоночной хроматографии, получив таким образом промежуточное соединение (27 мг, 28%). Полученное промежуточное соединение (26 мг, 0,04 ммоль) растворили в безводном метиленхлориде (1 мл). Диизопропиламин (45 мкл, 0,26 ммоль) и трифосген (6 мг, 0,02 ммоль) добавили по каплям к полученному раствору при 0°C, и перемешивали при комнатной температуре в течение 2 часов. По окончанию реакции, реакционную смесь разбавили этилацетатом, промыли соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью колоночной хроматографии, получив в результате соединение 190 (19 мг, 70%) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1H), 7,72 (d, J=7,6, 2Н), 7,30-7,27 (m, 1H), 7,07, 7,03 (2d, J=2,3, 1Н), 6,86, 6,81 (2d, 7=8,4, 1H), 5,88 (bs, 0,5Н), 5,61, 5,54 (2d, J=8,3, 1Н), 5,52-5,42 (bm, 1,5Н), 4,20-3,93 (m, 2Н), 3,81 (s, 1,7Н), 3,74 (s, 1,3H), 3,44, 3,20 (2d, J=14,5, 1H), 2,50-2,03 (m, 2Н), 1,93 (bs, 2Н), 1,59-1,46 (m, 4Н), 1,04-1,02 (m, 6Н), 1,00-0,94 (m, 2Н), 0,53, 0,38 (2d, J=6,5, 3H). MS (ESI) m/z 625 (М++Н).
Соединение 191
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((,2-(4-фтор-2-метокси-5-(2,2,2-трифторацетил)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 191 (33 мг, 55%) в виде масла желтого цвета было получено способом, аналогичным способу получения соединения 170.
MS (ESI) m/z 656 (М++Н).
Соединение 192
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-(циклопропанкарбонил)-4-фтор-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Способом, аналогичным способу получения соединения 133, 2-бром-4-фторфенол, в качестве исходного вещества, подвергли нескольким химическим реакциям с целью получения пинаколатового соединения. Полученное пинаколатовое соединение подвергли реакции с соединением 4, для получения аминоспиртового соединения, которое является промежуточным соединением. Полученное аминоспиртовое соединение подвергли реакции с трифосгеном для получения соединения 192 (4 мг, 48%) в виде коричневого масла.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86 (s, 1Н), 7,73 (s, 2Н), 6,76-6,79 (m, 1Н), 6,50-6,57 (m, 1H), 5,59-5,62 (m, 1Н), 3,90-3,98 (m, 2Н), 3,73 (s, 3H), 3,53-3,73 (m, 1Н), 3,10-3,16 (m, 1H), 2,02-2,45 (m, 2Н), 1,91-1,93 (m, 2Н), 1,50-1,54 (m, 2Н), 1,01-1,05 (m, 6Н), 0,32-0,42 (m, 3H). MS (ESI) m/z 628 (М++Н).
Соединение 193
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(трифторметил)фенил)-5-(трифторметил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 193 (1 г, 99%) в виде твердого вещества желтого цвета было получено способом, аналогичным способу получения соединения 18.
MS (ESI) m/z 560 (М++Н).
Соединение 194
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-нитрофенил)-5-(трифторметил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 194 (0,1 г, 80%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 52.
MS (ESI) m/z 627 (М++Н).
Соединение 195
(4S,5R)-3-((2-(5-амино-2-метоксифенил)-5-(трифторметил)циклогекс-1-енил)метил)-5-(3,5-бис(трифторметил)фенил)-4-метилоксазолидин-2-он
Соединение 194 (0,1 г, 0,16 ммоль) растворили в метаноле (3 мл). Никель Ренея (3 мл) добавили по каплям к полученному раствору при комнатной температуре, и перемешивали при комнатной температуре под шариком водорода. По окончанию реакции, реакционную смесь отфильтровали через цеолиты, и упарили при пониженном давлении. Реакционную смесь разбавили этилацетатом, промыли соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (12 г силикагеля, 1:1 = гексан/EtOAc), получив в результате соединение 195 (35 г, 35%) в виде твердого вещества желтого цвета.
MS (ESI) m/z 597 (М++Н).
Соединение 196
N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4-(трифторметил)циклогекс-1-енил)-4-метоксифенил)ацетамид
Соединение 196 (40 мг, 70%) в виде масла желтого цвета было получено способом, аналогичным способу получения соединения 110.
MS (ESI) m/z 640 (М++Н).
Соединение 197
Метил 5-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енилУ 2-фтор-4-метоксибензоат
Способом, аналогичным способу получения соединения 133, 2-фтор-4-метоксибензойную кислоту, в качестве исходного вещества, подвергли нескольким химическим реакциям с целью получения пинаколатового соединения. Полученное пинаколатовое соединение подвергли реакции с соединением 4 для получения аминоспиртового соединения, которое является промежуточным соединением. Полученное аминоспиртовое соединение подвергли реакции с трифосгеном, получив в результате соединение 197 (0,21 г, 88%) в виде масла желтого цвета.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86 (s, 1Н), 7,74 (s, 1Н), 7,71 (s, 1Н), 7,57 (dd, J=8,3, 10,2, 1H), 6,61 (dd, J=8,8, 12,6, 1H), 5,64, 5,55 (2d, J=8,1, 1H), 3,98-3,89 (m, 2H), 3,84, 3,82 (2s, 3H), 3,80, 3,79 (2s, 3H), 3,53, 3,33 (2d, J=14,6, 1H), 2,41-2,01 (m, 2H), 1,92-1,87 (bm, 2H), 1,51-1,42 (m, 2H), 1,02 (dd, 13,0, 2,0, 6H), 0,43, 0,39 (2d, J=6,5, 3H). MS (ESI) m/z 618 (M++H).
Соединение 204
5-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енилУ2-фтор-4-метоксибензойная кислота
Соединение 204 (83 мг, 45%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 34.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,73 (d, J=8,2, 2Н), 7,63 (dd, J=8,4, 3,9, 1H), 6,65 (dd, J=9,0, 12,6, 1H), 5,65, 5,56 (2d, J=8,0, 1H), 4,00-3,92 (m, 2H), 3,83 (d, J=11,2, 3H), 3,53, 3,31 (2d, 7=14,8, 1H), 2,41-2,04 (m, 2H), 1,97-1,84 (m, 2H), 1,50-1,44 (m, 2H), 1,04-1,00 (m, 6H), 0,43 (t, J=6,8, 3H). MS (ESI) m/z 604(M++H).
Соединение 206
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-нитро-4-(трифторметил)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Как показано на реакционной схеме 1, 4-метокси-1-нитро-2-(трифторметил)бензол, в качестве исходного вещества, подвергли йодированию с помощью йода. Полученное соединение подвергли реакции Ульмина с соединением 2 (Martin G. Banwell et al. Org. Lett. 2004, 6, 2741), для получения соединения, и затем способом, аналогичным способу получения соединения 52, было получено соединение 206 (0,65 г, 83%) в виде желтой пены.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,87 (s, 1Н), 7,74 (d, J=4,9, 2Н), 7,69 (d, J=2,4, 1H), 7,22 (d, J=11,4, 1H), 5,66, 5,77 (2d, J=8,2,1H), 4,03-3,93 (m, 2H), 3,94, 3,93 (2s, 3H), 3,50, 3,31 (2d, J=14,9, 1H), 2,40-2,03 (m, 2H), 1,95 (bs, 2H), 1,53-1,47 (m, 2H), 1,05-1,01 (m, 6H), 0,50 (t, J=6,8, 3H).
Соединение 207
(4S,5R)-3-((2-(,5-амино-2-метокси-4-(трифторметил)фенил)-5,5-диметилциклогекс-1-енил)метил)-5-(3,5-бис(трифторметил)фенил)-4-метилоксазолидин-2-он
Соединение 207 (0,33 мг, 56%) в виде белой пены было получено способом, аналогичным способу получения соединения 195.
MS (ESI) m/z 625 (M++Н).
Соединение 209
N-(5-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил-)метил)-4,4-диметилциклогекс-1-енил)-4-метокси-2-(трифторметил)фенил)трифтор-N-метилметансульфонамид
Соединение 209 (27 мг, 56%) в виде твердого вещества желтого цвета было получено способом, аналогичным способу получения соединения 112.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86 (d, J=9,6, 1Н), 7,74-7,70 (m, 2H), 7,17-7,13 (m, 1H), 7,06 (d, J=4,8, 1H), 5,65-5,46 (m, 1H), 4,03-3,53 (m, 6H), 3,41-3,29 (m, 3H), 2,22-2,06 (m, 2H), 2,02-1,87 (m, 2H), 1,52-1,46 (m, 2H), 1,04-0,99 (m, 2H), 1,50-0,47 (m, 1H), 0,38 (d, J=6,5, 1H), 0,32 (d, J=6,5, 1H). MS (ESI) m/z 771 (M++H).
Соединение 210
N-(5-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метокси-2-(трифторметил)фенил)-N-метилацетамид
Способом, аналогичным способу получения соединения 112, было получено соединение 210 (31 мг, 84%) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86 (s, 1Н), 7,72 (s, 2Н), 7,16-7,13 (m, 1Н), 6,95 (d, J=6,2, 1Н), 5,63 (dd, J=4,4, 8,0, 1H), 4,03-3,91 (m, 2H), 3,86, 3,83 (2s, 3H), 3,45-3,26 (m, 1H), 3,17-3,05 (m, 3H), 2,46-2,03 (m, 2H), 1,97-1,90 (bm, 2H), 1,76-1,71 (m, 3H), 1,53-1,45 (m, 2H), 1,04-0,96 (m, 6H), 0,50-0,36 (m, 3H). MS (ESI) m/z 681 (M++H).
Соединение 212
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(метил(4-(трифторметил)тиазол-2-ил)амино)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 212 (58,2 мг, 40,3%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 112.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86 (s, 1Н), 7,73, 7,72 (2s, 2Н), 7,22, 7,19 (2dd, J=2,8, 0,9, 1Н), 7,02, 7,00 (2d, J=2,7,1H), 6,92,6,89 (2d, J=8,8,1H), 6,84, 6,79 (2t, J=1,0, 1H), 5,61 (d, J=8,1, 1H), 4,01 (m, 2H), 3,81, 3,78 (2s, 3H), 3,59, 3,47 (2d, J=14,6, 15,0, 1H), 3,50, 3,44 (2s, 3H), 2,55-1,86 (brm, 4H), 1,51 (m, 2H), 1,27 (m, 2H), 1,05, 1,03, 1,00 (3s, 6H). MS (ESI) m/z 766 (M+K)+.
Соединение 213
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(4-(трифторметил)тиазол-2-иламино)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Как показано на реакционной схеме 5, было синтезировано промежуточное соединение 17. Промежуточное соединение 17 (0,3 г, 0,486 ммоль) растворили в смеси хлороформ/насыщенный раствор карбоната натрия (10 мл, в объемном отношении 3:1). Тиофосген (62,5 мкл) добавили по каплям к полученному раствору при комнатной температуре, и перемешивали при комнатной температуре в течение 2 часов. По окончанию реакции, реакционную смесь разбавили этилацетатом. Полученный органический слой промыли водой и соляным раствором. Органический слой высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении для удаления растворителя. Остаток растворили в метаноле (3 мл). Раствор аммиака (0,5 мл) добавили по каплям к полученному раствору при комнатной температуре, и перемешивали при комнатной температуре в течение 5 часов. По окончанию реакции, реакционную смесь упарили при пониженном давлении для удаления растворителя. Остаток кристаллизовали, получив таким образом промежуточное соединение (0,3 г, 87,2%) в виде твердого вещества белого цвета. Полученное промежуточное соединение (0,16 г, 0,27 ммоль) растворили в этаноле (3 мл). 3-Бром-1,1,1-трифторпропан-2-он (44,6 мкл) добавили по каплям к полученному раствору при комнатной температуре, и затем кипятили при перемешивании при температуре 90°C в течение 2 часов. По окончанию реакции, реакционную смесь охладили до комнатной температуры. Реакционную смесь разбавили этилацетатом. После этого, полученный органический слой промыли насыщенным раствором гидрокарбоната натрия, водой и соляным раствором. Органический слой высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении, получив в результате соединение 213 (0,18 г, 93,1%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 8,23, 8,06 (2brs, 1Н), 7,85, 7,84 (2s, 1H), 7,72 (s, 2Н), 7,27-7,15 (m, 1,5Н), 6,99-6,84 (m, 2,5Н), 5,60 (d, J=8,1, 1H), 4,01 (m, 2Н), 3,80, 3,78 (2s, 3H), 3,68, 3,42 (2d, J=14,2, 1Н), 2,51-1,88 (brm, 6Н), 1,50 (m, 2Н), 1,04 (m, 6Н), 0,42, 0,35 (2d, J=5,4, 6,5, 3H).
Соединение 215
N-(5-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фени л)-4-метил-2-оксооксазо лидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-2-фтор-4-метоксифенил)-N-метилацетамид
Соединение 215 (21 мг, 31%) в виде белой пены было получено способом, аналогичным способу получения соединения 112.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,87 (s, 1Н), 7,73 (s, 2Н), 6,86 (m, 1H), 6,68 (m, 1H), 5,64, 5,62 (2s, 1H), 3,97 (m, 2Н), 3,79, 3,76 (2s, 3H), 3,51-3,33 (brm, 2Н), 3,19, 3,18, 3,08 (3s, 3H), 2,46-1,62 (brm, 9Н), 1,46 (m, 2), 1,00 (m, 6Н), 0,49-0,36 (m, 3H). MS (ESI) m/z 631 (М++Н).
Соединение 216
N-(5-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-2-фтор-4-метоксифенш0ацетамид
Соединение 216 (82 мг, 79%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 110.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,79-7,76 (m, 4Н), 7,21, 7,18 (2s, 1Н), 6,64, 6,61 (2d, J=7,4, 1H), 5,63, 5,46 (2d, J=7,9, 1H), 4,12 (m, 1H), 3,94 (m, 1H), 3,56, 3,30 (2d, J=15,0, 1H), 2,19, 2,14 (2s, 3H), 1,93, 1,90 (2s, 2Н), 1,45 (m, 2Н), 1,01, 1,00, 0,99, 0,98 (4s, 6Н), 0,46, 0,32 (2d, J=6,5, 3H). MS (ESI) m/z 617 (M++Н).
Соединение 217
(4S,5R)-3-((2-(5-амино-4-фтор-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-5-(3,5-бис(трифторметил)фенил)-4-метилоксазолидин-2-он
Соединение 217 (0,12 г, 99%) в виде масла желтого цвета было получено способом, аналогичным способу получения соединения 195.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,73 (s, 2Н), 6,58, 6,54 (2d, J=12,6, 1Н), 6,44, 6,41 (2d, J=6,1, 1Н), 5,60, 5,58 (2d, J=2,9, 1H), 4,0-3,89 (m, 2Н), 3,67, 3,64 (2s, 3H), 3,58, 3,47 (2d, J=14,6, 1H), 3,37 (brs, 2Н), 2,42-1,89 (brm, 6Н), 1,45 (m, 2Н), 0,99 (m, 6Н), 0,48, 0,34 (2d, J=6,6, 6,5, 3H). MS (ESI) m/z 575 (М++Н).
Соединение 218
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-2-метокси-5-нитрофенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 218 (0,3 г, 80%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 206.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86 (s, 1H), 7,78, 7,77 (2d, J=4,4, 1H), 7,72, 7,71 (2s, 2Н), 6,74, 6,71 (2d, J=7,6, 1Н), 5,56, 5,59 (2d, J=5,4, 1H), 3,96 (m, 2Н), 3,89, 3,86 (2s, 3H), 3,52, 3,30 (2d, J=15,0, 1Н), 2,38-1,87 (brm, 6Н), 1,48 (m, 2Н), 1,09, 1,08, 1,00, 0,99 (4s, 6Н), 0,47 (t, J=6,7, 3H). MS (ESI) m/z 649 (M++K).
Соединение 219
трет-Бутил 3-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4-(4-фтор-5-изопропил-2-метоксифенил)-5,6-дигидропиридин-1(2H)-карбоксилат
1-трет-бутил 3-этил 4-(трифторметилсульфонилоху)-5,6-дигидропиридин-1,3(2Н)-дикарбоксилат, было синтезировано в качестве исходного вещества, и затем подвергнуто реакции Сузуки с бороновой кислотой. Полученное соединение подвергли восстановлению с помощью литий алюмогидрида, и оксидированию с помощью перйодата Десса-Мартина. Полученное соединение подвергли реакции с соединением 4 для получения аминоспиртового соединения, которое является промежуточным соединением. Полученное аминоспиртовое соединение подвергли реакции с трифосгеном для получения соединения 219 (39 мг, 45%) в виде белой пены.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,72 (s, 2Н), 6,82 (m, 1H), 6,57, 6,53 (2d, J=12,1, 1H), 3,99 (m, 4Н), 3,74, 3,70 (2s, 3H), 3,12 (m, 1Н), 2,6-2,01 (m, 2Н), 1,51 (s, 9Н), 1,19 (m, 6Н), 0,40, 0,30 (2d, J=6,5, 3H).
Соединение 222
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-2-метокси-5-(2,2,2-трифторэтокси)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Способом, аналогичным способу получения соединения 133, 2-фтор-4-метоксифенол, в качестве исходного вещества, подвергли нескольким химическим реакциям с целью получения йодобензольного соединения. Полученное соединение подвергли реакции Ульмана с соединением 2, получив таким образом альдегидное соединение. Полученное альдегидное соединение подвергли реакции с соединением 4 для получения аминоспиртового соединения, которое является промежуточным соединением. Полученное аминоспиртовое соединение подвергли реакции с трифосгеном, получив в результате соединение 222 (7 мг, 47%) в виде твердого вещества желтого цвета.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86 (s, 1Н), 7,72 (s, 2Н), 6,75 (dd, J=15,5, 9,2, 1Н), 6,65 (dd, J=12,7, 11,4, 1H), 5,60 (dd, J=8,1, 3,0, 1H), 4,38-4,28 (m, 2H), 3,99-3,88 (m, 2H), 3,74, 3,70 (2s, 3H), 3,52, 3,39 (2d, J=14,6, 1H), 2,45-1,99 (m, 2H), 1,95-1,89 (m, 2H), 1,52-1,41 (m, 2H), 1,03-0,98 (m, 6H), 0,41 (2d, J=6,5, 3H). MS (ESI) m/z 658 (M++H).
Соединение 223
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(6-метоксибензо[d][1,3]диоксол-5-ил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Способом, аналогичным способу получения соединения 133, бензо[d][1,3]диоксол-5-ол, в качестве исходного вещества, подвергли нескольким химическим реакциям с целью получения пинаколатового соединения. Полученное пинаколатовое соединение подвергли реакции Сузуки с соединением 2, получив таким образом альдегидное соединение. Полученное альдегидное соединение подвергли реакции с соединением 4 для получения аминоспиртового соединения, которое является промежуточным соединением. Полученное аминоспиртовое соединение подвергли реакции с трифосгеном, получив в результате соединение 223 (4 мг, 49%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3); 1:1,5 смесь атропоизомеров; δ 7,86 (s, 1H), 7,74 (s, 2Н), 6,45-6,52 (m, 2Н), 5,87-5,92 (m, 2Н), 5,62 (t, J=1,1, 1Н), 3,90-4,03 (m, 2Н), 3,70 (d, J=7,6, 3H), 3,65 (d, J=3,8, 0,6Н), 3,50 (d, J=14,9, 0,4H), 2,01-2,45 (m, 2H), 1,89-1,91 (m, 2H), 1,44-1,49 (m, 2H), 1,00-1,04 (m, 6H), 0,49 (d, J=6,6, 1,2H), 0,38 (d, J=6,5, 1,8H). MS (ESI) m/z 586 (M++H).
Соединение 224
N-(5-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метокси-2-(трифторметил)фенил)-N-метилизобутирамид
Соединение 224 (49 мг, 74%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 112.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86 (s, 1Н), 7,73 (d, J=4,5, 2Н), 7,17-7,13 (m, 1Н), 6,95 (d, J=10,4, 1H), 5,64-5,62 (m, 1H), 4,04-3,91 (m, 2H), 3,86-3,81 (m, 3H), 3,46-3,30 (m, 1H), 3,15-3,03 (m, 3H), 2,45-2,03 (m, 3H), 1,97-1,90 (m, 2H), 1,51-1,45 (m, 2H), 1,04-0,87 (m, 12H), 0,56-0,37 (m, 3H). MS (ESI) m/z 709, 710 (M++H, M++2).
Соединение 225
N-(5-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метокси-2-(трифторметил)фенил)-N-метилпропионамид
Соединение 225 (33 мг, 70%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 112.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86 (s, 1Н), 7,73 (d, J=4,5, 2Н), 7,15 (d, J=13,2, 1Н), 6,92 (d, J=1,2, 1H), 5,64 (dd, J=8,0, 3,3, 1H), 4,03-3,91 (m, 2H), 3,85 (2d, J=12,6, 1,3, 3H), 3,45-3,32 (m, 1H), 3,16 (s, 1H), 3,04 (s, 1H), 2,45-2,02 (m, 2H), 1,97-1,86 (m, 4H), 1,53-1,45 (m, 2H), 1,04-0,96 (m, 9H), 0,50-0,37 (m, 3H). MS (ESI) m/z 695 (M++H).
Соединение 226
N-(5-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метокси-2-(трифторметил)фенил)-N-метилметансульфонамид
Способом, аналогичным способу получения соединения 112, было получено соединение 226 (20 мг, 39%) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,84 (m, 1Н), 7,75 (d, J=12,1, 2Н), 7,45-7,06 (m, 2Н), 5,63-5,41 (m, 1Н), 4,00-3,70 (m, 2Н), 3,88-3,80 (m, 3H), 2,50-3,24 (m, 1Н), 3,18-3,02 (m, 3H), 2,98, 2,87 (2s, 3H), 2,40-2,03 (m, 2Н), 1,97-1,94 (m, 2Н), 1,51-1,42 (m, 2Н), 1,03-0,97 (m, 6Н), 0,54-0,33 (m, 3H). MS (ESI) m/z 717 (М++Н).
Соединение 227
N-(5-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метокси-2-(трифторметил)фенил)-2,2,2-трифтор-N-метилацетамид
Соединение 227 (8 мг, 73%) в виде твердого вещества желтого цвета было получено способом, аналогичным способу получения соединения 112.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,87 (s, 1Н), 7,76-7,72 (m, 2Н), 7,17-7,13 (m, 1H), 7,02-6,95 (m, 1H), 5,66-5,60 (m, 1Н), 4,03-3,81 (m, 2Н), 3,88-3,84 (m, 3H), 3,52-3,33 (m, 1H), 3,31-3,19 (m, 3H), 2,45-1,99 (m, 2Н), 1,97-1,90 (m, 2Н), 1,53-1,42 (m, 2Н), 1,05-0,89 (m, 6Н), 0,53-0,32 (m, 3H). MS (ESI) m/z 735 (M+).
Соединение 228
N-(5-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метокси-2-Гтрифторметил)фенил)трифторметансульфонамид
Соединение 228 (61 мг, 73%) в виде масла желтого цвета было получено способом, аналогичным способу получения соединения 110.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,84 (s, 1Н), 7,73 (d, J=7,2, 2Н), 7,32-7,27 (m, 1H), 7,10 (d, J=9,8, 1H), 5,62, 5,51 (2d, J=8,0, 1H), 4,00-3,88 (m, 2H), 3,84 (d, J=5,6, 3H), 3,57, 3,26 (2d, J=14,9, 1H), 2,40-2,07 (m, 2H), 1,93 (bs, 2H), 1,51-1,44 (m, 2H), 1,03-0,98 (m, 6H), 0,44, 0,33 (2d, J=6,5, 3H). MS (ESI) m/z 757, 758 (M+, M++H).
Соединение 229
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2,4-диметокси-5-нитрофенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 229 (89 мг, 74%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 110.
1H ЯМР (400 МГц, CDCl3); 1:1,7 смесь атропоизомеров; δ 7,87 (s, 1Н), 7,69-7,78 (m, 2Н), 6,49 (d, J=9,1, 1H), 5,67 (d, J=7,4, 0,7H), 5,55 (d, J=8,2, 0,4H), 3,95-4,07 (m, 2H), 4,00-3,97 (m, 3H) 3,86-3,90 (m, 3H), 3,58 (d, J=14,8, 0,5H), 3,34 (d, J=14,9, 0,5H), 2,18-2,38 (m, 2H), 1,87. MS (ESI) m/z 617 (M++H).
Соединение 230
N-(5-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енилУ2,4-диметоксифенилУН-метилацетамид
Соединение 230 (4 мг, 85%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 112.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,87 (s, 1Н), 7,74 (s, 2Н), 6,76-6,81 (m, 1H), 6,44-6,48 (m, 1Н), 5,61-5,64 (m, 1Н), 3,91-4,04 (m, 2Н), 3,74-3,85 (m, 6Н), 3,40-3,59 (m, 1H), 3,13 (s, 2Н), 3,01 (s, 1Н), 2,07-2,49 (m, 2Н), 1,95-2,10 (m, 3H), 1,78-1,81 (m, 3H), 1,50-1,59 (m, 2Н), 1,01-1,08 (m, 6Н), 0,07-0,47 (m, 3H). MS (ESI) m/z 643 (М++Н).
Соединение 231
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((4-(4-фтор-5-изопропил-2-метоксифенил)-1-метил-1,2,5,6-тетрагидропиридин-3-ил)метил)-4-метилоксазолидин-2-он
Соединение 219 (0,45 г, 0,67 ммоль) растворили в метиленхлориде (3 мл). Трифторуксусную кислоту (1 мл) добавили по каплям к полученному раствору при 0°C, и затем перемешивали при комнатной температуре в течение 3 часов. По окончанию реакции, реакционную смесь упарили при пониженном давлении для удаления растворителя. Остаток разбавили метиленхлоридом, промыли насыщенным раствором гидрокарбоната натрия и соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток кристаллизовали, получив таким образом промежуточное соединение (0,32 мг, 88%) в виде твердого вещества белого цвета. Полученное соединение подвергли реакции способом, аналогичным способу получения соединения 47, для получения соединения 231 (1,0 мг, 10%) в виде бесцветного масла.
MS (ESI) m/z 589 (М++К).
Соединение 232
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-гидрокси-2-метокси-5-нитрофенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 218 (0,12 г, 0,2 ммоль) и 2-(метилсульфонилэтанол) (32 мг) растворили в диметилформамид (3 мл). Гидрид натрия (15,3 мг) осторожно добавили по каплям к полученному раствору при комнатной температуре, и перемешивали при комнатной температуре в течение ночи. По окончанию реакции, реакционную смесь разбавили этилацетатом, промыли насыщенным раствором хлорида аммония и соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток кристаллизовали, получив в результате соединение 232 (91 мг, 77%) в виде твердого вещества желтого цвета.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 10,98, 10,96 (2s, 1Н), 7,86 (s, 1Н), 7,79-7,71 (m, 3H), 6,53, 6,51 (2s, 1Н), 5,63 (2d, J=8,1, 1Н), 4,02-3,93 (m, 2Н), 3,87, 3,86 (2s, 3H), 3,45 (2d, J=14,9, 1Н), 2,39-1,86 (m, 4Н), 1,52-1,43 (m, 2Н), 1,01 (2d, J=3,8, 6Н), 0,46 (2d, J=6,6, 3H). MS (ESI) m/z 603 (М++Н).
Соединение 233
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(метиламино)-4-(трифторметил)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 233 (46 мг, 85%) в виде масла желтого цвета было получено способом, аналогичным способу получения соединения 120.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,72 (s, 2Н), 6,96, 6,89 (2s, 1Н), 6,37 (d, J=8,0, 1Н), 5,61 (d, J=7,2, 1H), 4,03-3,92 (m, 2H), 3,70 (d, J=7,6, 3H), 3,60-3,49 (m, 1H), 2,84, 2,80 (2s, 3H), 2,49-2,02 (m, 2H), 1,92 (bs, 2H), 1,52-1,46 (m, 2H), 1,04-0,98 (m, 6H), 0,52, 0,36 (2d, J=0,3, 3H). MS (ESI) m/z 639 (M++H).
Соединение 234
N-(5-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-2-этил-4-метоксифенил)-N-метилацетамид
Соединение 234 (1,4 мг, 74%) в виде масла желтого цвета было получено способом, аналогичным способу получения соединения 112.
1H ЯМР (400 МГц, CDCl3); 1:1 смесь атропоизомеров; δ 7,86 (s, 1Н), 7,63 (s, 2Н), 6,77 (m, 2Н), 5,62 (m, 1Н), 4,04-3,90 (m, 2Н), 3,80, 3,77, 3,76 (3s, 3H), 3,56-3,89 (m, 2Н), 3,16, 3,15, 3,03 (3s, 3H), 2,51 (m, 2Н), 2,50-1,25 (m, 4Н), 1,22 (m, 4Н), 1,03 (m, 6Н), 0,45-0,33 (m, 3H). MS (ESI) m/z 641 (М++Н).
Соединение 235
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-((2-гидрокси-2-метилпропил)(метил)амино)-2-метокси-4-(трифторметил)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 235 (7 мг, 39%) в виде твердого вещества желтого цвета было получено способом, аналогичным способу получения соединения 120.
MS (ESI) m/z 639 (М++Н).
Соединение 237
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-циклопропил-4-фтор-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Способом, аналогичным способу получения соединения 133, 3-фтор-4-броманизол, в качестве исходного вещества, подвергли нескольким химическим реакциям с целью получения соединения бороновой кислоты. Полученное соединение подвергли реакции Сузуки с соединением 2. Полученное соединение подвергли реакции с соединением 4, для получения аминоспиртового соединения, которое является промежуточным соединением. Полученное аминоспиртовое соединение подвергли реакции с трифосгеном, получив в результате соединение 237 (2 мг, 22%) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, CDCl3); 1:1,3 смесь атропоизомеров; δ 7,85 (s, 1Н), 7,73-7,72 (m, 2Н), 6,57-6,44 (m, 2Н), 5,60 (t, J=8,0, 1H), 3,98-3,88 (m, 2Н), 3,71, 3,68 (2s, 3H), 3,50, 3,38 (2d, J=14,5, 1Н), 2,45-1,87 (m, 4Н), 1,49-1,40 (m, 2Н), 1,02-0,92 (m, 6Н), 0,91-0,82 (m, 4Н), 0,63-0,59 (m, 1H), 0,40 (d, J=6,5, 1,3H), 0,32 (d, J=6,5, 1,7Н). MS (ESI) m/z 600 (M++H).
Соединение 240
1-((5-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метокси-2-(трифторметил)фенил)(метил)амино)-2-метил-1-оксопропан-2-ил ацетат
Соединение 240 (28 мг, 53%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 110.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85-7,74 (m, 3H), 7,11-7,07 (m, 1Н), 6,86-6,78 (m, 1H), 5,65, 5,44 (2d, J=7,6, 1Н), 4,12-3,32 (m, 6Н), 3,26 (d, J=9,4, 3H), 2,45-1,88 (m, 7Н), 1,49-1,47 (m, 6Н), 1,45-1,39 (m, 2Н), 1,02-0,97 (m, 6Н), 0,65-0,36 (m, 3H). MS (ESI) m/z 767 (М++Н).
Соединение 241
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-5-изопропокси-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Способом, аналогичным способу получения соединения 133, 2-фтор-4-метоксифенол, в качестве исходного вещества, подвергли нескольким химическим реакциям с целью получения соединения бороновой кислоты. Полученное соединение подвергли реакции Сузуки с соединением 2. После этого полученное соединение подвергли реакции с соединением 4, для получения аминоспиртового соединения, которое является промежуточным соединением. Полученное аминоспиртовое соединение подвергли реакции с трифосгеном, получив в результате соединение 241 (3 мг, 60%) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, CDCl3); 1:1,5 смесь атропоизомеров; δ 7,85 (s, 1Н), 7,72 (s, 2Н), 6,66-6,58 (m, 2Н), 5,61 (dd, J=8,0, 4,6, 1H), 4,39-4,21 (m, 1H), 4,02-3,88 (m, 2Н), 3,70, 3,67 (2s, 3H), 3,56, 3,46 (2d, J=14,5, 1Н), 2,47-1,99 (m, 2Н), 1,94-1,88 (m, 2Н), 1,51-1,40 (m, 2Н), 1,31 (d, J=6,0, 3H), 1,21-1,17 (m, 3H), 1,03-0,98 (m, 6Н), 0,44 (d, J=6,5, 1,2Н), 0,33 (d, J=6,5, 1,8Н). MS (ESI) m/z 618 (M++H).
Соединение 243
1-((3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)(метил)амино)-2-метил-1-оксопропан-2-ил ацетат
Соединение 243 (32 мг, 50%) в виде твердого вещества желтого цвета было получено способом, аналогичным способу получения соединения 110.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,83 (s, 1H), 7,75 (s, 2Н), 7,05 (d, J=8,6, 1Н), 6,85-6,78 (m, 2H), 5,62-5,57 (m, 1H), 4,02-3,90 (m, 2H), 3,77, 3,74 (2s, 3H), 3,52 (d, J=14,7, 0,6H), 3,40 (d, J=14,7, 0,4H), 3,38-3,00 (bm, 3H), 2,42-2,07 (m, 2H), 2,02-1,87 (m, 2H), 1,70-1,40 (bm, 9H), 1,02-0,98 (m, 6H), 0,44-0,38 (m, 3H). MS (ESI) m/z 699 (M++H).
Соединение 244
N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-2-гидрокси-N,2-диметилпропанамид
Соединение 243 (19 мг, 0,027 ммоль) добавили к метанолу (0,8 мл). Раствор карбоната калия (4 мг, 0,029 ммоль) в воде (0,2 мл) добавили по каплям к полученной смеси, и перемешивали при комнатной температуре в течение ночи. По окончанию реакции, реакционную смесь упарили при пониженном давлении, разбавили метиленхлоридом, промыли соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью препаративной тонкослойной хроматографии (PTLC) (силикагель, 70% Гексан/EtOAc), получив в результате соединение 244 (11 мг, 65%) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,87 (s, 1H), 7,74 (d, J=5,7, 2Н), 7,12-7,09 (m, 1Н), 6,91-6,84 (m, 2H), 5,61 (dd, J=8,0, 2,1, 1H), 4,36 (bs, 1H), 4,06-3,93 (m, 2H), 3,82, 3,79 (2s, 3H), 3,53, 3,42 (2d, J=14,6, 1H), 3,29, 3,22 (2s, 3H), 2,47-1,99 (m, 2H), 1,94-1,92 (m, 2H), 1,56-1,46 (m, 2H), 1,20-1,10 (bm, 6H), 1,06-1,02 (m, 6H), 0,50, 0,41 (2d, J=6,5, 3H). MS (ESI) m/z 657 (M++H).
Соединение 245
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((4-(4-фтор-5-изопропил-2-метоксифенилУ1-(трифторметил)-1,2,5,6-тетрагидропиридин-3-ил)метил)-4-метилоксазолидин-2-он
Соединение 219 (0,45 г, 0,67 ммоль) растворили в метиленхлориде (3 мл). Трифторуксусную кислоту (1 мл) добавили по каплям к полученному раствору при 0°C, и перемешивали при комнатной температуре в течение 1 часа. По окончанию реакции, реакционную смесь упарили при пониженном давлении для удаления растворителя. Остаток разбавили метиленхлоридом, промыли насыщенным раствором гидрокарбоната натрия и соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток кристаллизовали, получив таким образом промежуточное соединение (0,32 г, 88%) в виде твердого вещества белого цвета. Полученное соединение растворили в тетрагидрофуране (5 мл). Литий диизопропил силан (0,35 мл) добавили к полученному раствору при -78°C, и перемешивали в течение 10 минут. Сероуглерод (24,6 мкл) и йодометан (34,3 мкл) добавили по каплям к реакционной смеси, и затем перемешивали при комнатной температуре в течение 30 минут. По окончанию реакции, реакционную смесь упарили при пониженном давлении для удаления растворителя. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (силикагель, 12 г, 20%~60%, Гексан/EtOAc), получив таким образом промежуточное соединение (0,21 г, 85%) в виде бесцветного масла. Полученное промежуточное соединение (83,5 мг, 0,13 ммоль) растворили в метиленхлориде (5 мл). Раствор TBAH2F3 (0,19 г) и DBH (0,14 г) в метиленхлориде (2 мл) медленно добавили по каплям к полученному раствору при 0°C, и затем перемешивали при температуре 0°C в течение 30 минут. По окончанию реакции, реакционную смесь разбавили этилацетатом, промыли водой и соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении для удаления растворителя. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (4 г силикагеля, 3:1, Гексан/EtOAc), получив в результате соединение 245 (12,5 мг, 15%) в виде белой пены.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86 (s, 1Н), 7,72 (s, 2Н), 6,84-6,80 (m, 1H), 6,61-6,52 (m, 1H), 5,67-5,62 (m, 1H), 4,17-3,15 (m, ПН), 3,11 (m, 1Н), 2,42-2,39 (m, 2Н), 1,27-1,11 (m, 6Н), 0,40-0,29 (m, 3H).
Соединение 246
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-4-метил-5-нитрофенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 246 (0,13 г, 69,1%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 206.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86 (s, 1Н), 7,76 (d, J=8,0, 1Н), 7,73 (d, J=7,3, 2H), 6,72 (d, J=10,5, 1H), 5,60 (dd, J=38,2, 8,1, 1H), 3,97 (m, 2H), 3,87, 3,83 (2s, 3H), 3,55, 3,34 (2d, J=14,9, 1H), 2,64, 2,63 (2s, 3H), 2,40-1,92 (m, 4H), 1,50 (m, 2H), 1,05, 1,04, 1,01 (3s, 6H), 0,47, 0,45, 0,44, 0,43 (4s, 3H). MS (ESI) m/z 601 (M++H).
Соединение 247
(4S,5R)-3-((2-(5-амино-2-метокси-4-метилфенил)-5,5-диметилциклогекс-1-енил)метил)-5-(3,5-бис(трифторметил)фенил)-4-метилоксазолидин-2-он
Соединение 247 (76,6 мг, 73%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 195.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,84 (s, 1Н), 7,73 (s, 2Н), 6,60, 6,54 (2s, 1H), 6,33, 6,31 (2s, 1Н), 5,59, 5,57 (2d, J=8,0, 1Н), 4,05-3,84 (m, 2Н), 3,67-3,50 (m, 4Н), 3,33 (brs, 2Н), 2,49-1,90 (m, 7Н), 1,50-1,41 (m, 2Н), 1,03, 1,01, 0,99 (3s, 6Н), 0,47, 0,31 (2d, J=6,6, 6,5, 3H). MS (ESI) m/z 571 (М++Н).
Соединение 248
N-(5-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метокси-2-метилфенил)ацетамид
Соединение 248 (28,8 мг, 67,1%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 110.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,83-7,79 (m, 3H), 7,40, 7,21 (2s, 1Н), 6,82, 6,76 (2s, 1Н), 6,68, 6,65 (2s, 1H), 5,59, 5,46 {2d, J=8,0, 1H), 4,07 (m, 1H), 3,94 (m, 1Н), 3,74, 3,73 (2s, 3H), 3,61, 3,39 (2d, J=14,7, 1H), 2,23-1,91 (m, ЮН), 1,45 (m, 2Н), 1,01, 1,00, 0,98 (3s, 6Н), 0,44, 0,31 (2d, J=6,5, 3H). MS (ESI) m/z 613 (М++Н).
Соединение 249
N-(5-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил")-4-метокси-2-метилфенил)-N-метилацетамид
Соединение 249 (9,2 мг, 45,8%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 112.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86 (s, 1Н), 7,73 (s, 2Н), 6,77-6,70 (m, 2Н), 5,61 (m, 1Н), 4,03-3,91 (m, 2Н), 3,78, 3,75, 3,74 (3s, 3H), 3,55-3,27 т, 1H), 3,15, 3,14, 3,03 (3s, 3H), 2,50-1,45 (m, 12Н), 1,13-0,96 (m, 6Н). 0,48-0,31 (m, 3H). MS (ESI) m/z 627 (М++Н).
Соединение 250
N-(5-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метокси-2-метилфенил)трифторметансульфонамид
Соединение 250 (24,2 мг, 57,3%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 110.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,84 (d, J=4,0, 1Н), 7,72 (d, J=6,9, 2H), 7,01, 6,94 (2s, 1H), 6,72, 6,70 (2s, 1H), 5,60, 5,53 (2d, J=8,0, 1H), 3,93 (m, 2H), 3,77, 3,76 (2s, 3H), 3,57, 3,34 (2d, J=14,7, 1H), 2,43-1,91 (m, 7H), 1,47 (m, 2H), 1,02, 0,99, 0,98 (3s, 6H), 0,36, 0,29 (2d, J=6,5, 3H). MS (ESI) m/z 703 (M++H).
Соединение 251
N-(5-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метокси-2-метилфенил)трифтор-N-метилметансульфонамид
Соединение 251 (9,5 мг, 42,8%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 112.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86, 7,84 (2s, 1Н), 7,74, 7,71 (2s, 2Н), 6,90-6,73 (m, 2Н), 5,58-5,46 (m, 1Н), 4,02-3,25 (m, 9Н), 2,41-1,95 (m, 7Н), 1,49 (m, 2Н), 1,03, 1,01, 1,00 (3s, 6Н), 0,44-0,32 (m, 3H). MS (ESI) m/z 717 (М++Н).
Соединение 259
N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-N-метилэтантиоамид
Соединение 112 (35 мг, 0,057 ммоль) растворили в толуоле (1,3 мл). Реагент Лавессона (23 мг, 0,06 ммоль) добавили по каплям к раствору, и затем перемешивали при температуре 80°C в течение ночи. По окончанию реакции, реакционную смесь упарили при пониженном давлении для удаления растворителя. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (10-20% гексан/ EtOAc), получив в результате соединение 259 (28 мг, 78%) в виде твердого вещества.
1H ЯМР (400 МГц, CDCl3): смесь атропоизомеров; δ 7,86 (s, 1 Н), 7,73 (d, 2H, J=4,6 Гц), 7,06-7,03 (m, 1H), 6,91-6,86 (m, 1H), 6,83 (q, 1 Н, J=2,7 Гц), 5,62 (dd, 1 Н, J=4,1, 8,4 Гц), 4,05-3,91 (m, 2H), 3,81, 3,78 (2s, 3H), 3,70, 3,64 (2s, 3H), 3,49, 3,39 (2d, 1H, J=14,5 Гц), 2,49-2,43 (m, 1H), 2,38, 2,34 (2s, 3H), 2,29-2,00 (m, 2H), 1,93-1,85 (m, 2H), 1,53-1,43 (m, 2H), 1,05-1,01 (m, 6H), 0,47, 0,36 (2d, 3H, J=6,6 Гц); MS (ESI) m/z 629,0 (М++Н).
Соединение 261
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((4-(4-фтор-5-изопропил-2-метоксифенил)-1-(2,2,2-трифторацетил)-1,2,5,6-тетрагидропиридин-3-ил)метил)-4-метилоксазолидин-2-он
Соединение 267 (0,05 г, 0,087 ммоль) растворили в безводном метиленхлориде (20 мл). Триэтиламин (0,02 мл) и ангидрид трифторускусной кислоты (0,02 г) добавили по каплям к полученному раствору при комнатной температуре, и перемешивали при комнатной температуре в течение ночи. По окончанию реакции, реакционную смесь промыли насыщенным раствором хлорида аммония и водой, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (силикагель, 4:1 = гексан:EtOAc), получив в результате соединение 261 (0,04 г, 72%) в виде твердого пенистого вещества белого цвета.
1H ЯМР (400 МГц, MeOD); смесь атропоизомеров; δ 7,99 (s, 1Н), 7,93 (m, 2H), 7,06 (m, 1Н), 6,79 (m, 1Н), 5,87 (m, 1Н), 4,20-3,62 (m, 10Н), 3,16 (m, 1Н), 2,75-2,30 (m, 2Н), 1,21 (m, 6Н), 0,43 (m, 3H).
Соединение 262
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((4-(4-фтор-5-изопропил-2-метоксифенил)-1-(трифторметилсульфонил)-1,2,5,6-тетрагидропиридон-3-ил)метил)-4-метилоксазолидин-2-он
Соединение 262 (37 мг, 60%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 261.
1H ЯМР (400 МГц, MeOD); смесь атропоизомеров; δ 7,99 (s, 1Н), 7,90 (m, 2H), 7,06 (m, 1Н), 7,79 (m, 1Н), 5,87 (m, 1Н), 4,86 (s, 2H), 4,29-3,57 (m, 10H), 3,16 (m, 1Н), 2,7-2,25 (m, 2H), 1,2(m, 6H), 0,43 (m, 3H).
Соединение 263
(4S,5R)-3-((1-ацетил-4-(4-фтор-5-изопропил-2-метоксифенил)-1,2,5,6-тетрагидропиридин-3-ил)метил)-5-(3,5-бис(трифторметил)фенил)-4-метилоксазолидин-2-он
Соединение 263 (42 мг, 78%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 261.
1H ЯМР (400 МГц, MeOD); смесь атропоизомеров; δ 7,98 (s, 1Н), 7,93 (m, 2H), 7,03 (m, 1Н), 6,78 (m, 1Н), 5,86 (m, 1Н), 4,20-3,52 (m, 10H), 3,15 (m, 1Н), 2,70-2,30 (m, 2H), 2,20 (m, 3H), 1,21 (m, 6H), 0,43 (m, 3H); MS (ESI): 616,0 (M)+.
Соединение 264
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((4-(4-фтор-5-изопропил-2-метоксифенил)-1-(метилсульфонил)-1,2,5,6-тетрагидропиридин-3-ил)метил)-4-метилоксазолидин-2-он
Соединение 264 (45 мг, 79%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 261.
1H ЯМР (400 МГц, MeOD); смесь атропоизомеров; δ 7,98 (s, 1Н), 7,92 (s, 2H), 7,05, 6,98 (2d, 1Н, J=8,64, 8,64 Гц), 6,78, 6,75 (2d, 1Н, J=8,44, 8,40 Гц), 4,2-3,0 (m, 12Н), 2,70-2,20 (m, 2Н), 1,26 (m, 6Н), 0,42 (m, 3H); MS (ESI): 652,0 (M)+.
Соединение 265
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((4-(4-фтор-5-изопропил-2-метоксифенил)-1-изопропил-1,2,5,6-тетрагидропиридин-3-ил)метил)-4-метилоксазолидин-2-он
Соединение 267 (0,05 г, 0,087 ммоль) растворили в метаноле (20 мл). 2-Йодопропан (0,02 мл) добавили по каплям к полученному раствору, и перемешивали при комнатной температуре в течение ночи. По окончанию реакции, реакционную смесь упарили при пониженном давлении для удаления растворителя. Остаток разделили с помощью препаративной тонкослойной хроматографии (PTLC) (SiO2, EA:DCM:MeOH=5:4:1, получив в результате соединение 265 (3 мг, 6%) в виде твердого пенистого вещества белого цвета.
1H ЯМР (400 МГц, MeOD); смесь атропоизомеров; δ 8,00 (s, 1Н), 7,92 (s, 2H), 7,05 (m, 1H), 6,78 (m, 1Н), 5,90 (m, 1Н), 4,30-2,20 (m, 11Н), 1,26 (m, 6Н), 0,42 (m, 3H); MS (ESI): 616,7 (M)+.
Соединение 267
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((4-(4-фтор-5-изопропил-2-метоксифенил)-1,2,5,6-тетрагидропиридин-3-ил)метил)-4-метилоксазолидин-2-он
Соединение 219 (1,65 г, 2,46 ммоль) растворили в метиленхлориде (10 мл). Трифторуксусную кислоту (3 мл) добавили по каплям к полученному раствору при комнатной температуре, и перемешивали при комнатной температуре в течение 1 часа. По окончанию реакции, к реакционной смеси по каплям добавили этилацетат. После этого, полученную реакционную смесь промыли насыщенным раствором гидрокарбоната натрия, водой и соляным раствором и упарили при пониженном давлении. Полученный остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (SiO2, 5%-20% DCM/MeOH), получив в результате соединение 267 (1,0 г, 71%) в виде белой пены.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,84 (s, 1Н), 7,72 (s, 2H), 6,89, 6,84 (2d, J=8,6, 8,5 Гц, 1Н), 6,57, 6,53 (2d, J=12,1 Гц, 1Н), 5,70, 5,67 (2d, J=8,0 Гц, 1Н), 4,03-3,99 (m, 2H), 3,76, 3,71 (2s, 3H), 3,60-3,41 (m, 4H), 3,28-3,06 (m, 3H), 2,66-2,12 (m, 4H), 1,26-1,10 (m, 6H), 0,33, 0,29 (2d, J=6,5 Гц, 3H); MS (ESI): 575 (М++Н).
Соединение 268
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((4-(4-фтор-5-изопропил-2-метоксифенил)-1-(2,2,2-трифторэтил)-1,2,5,6-тетрагидропиридин-3-ил)метил)-4-метилоксазолидин-2-он
Соединение 268 (14 мг, 25%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 265.
1H ЯМР (400 МГц, MeOD); смесь атропоизомеров; δ 7,87 (s, 1Н), 7,72 (s, 2H), 6,91, 6,86 (2d, 1Н, J=8,56, 8,60 Гц), 6,60, 6,56 (2d, 1Н, J=12,12, 12,08 Гц), 5,60 (m, 1Н), 4,0 (m, 2H), 3,80-2,80 (m, 11Н), 2,70-2,30 (m, 2H), 1,21 (m, 6H), 0,40, 0,33 (2d, 3H, J=6,52, 6,56 Гц); MS (ESI): 656,7 (M)+.
Соединение 271
N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-тиоксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-N-метилацетамид
Соединение 112 (60 мг, 0,098 ммоль) растворили в 2-пропаноле (0,6 мл). Раствор гидроксида натрия (28 мг) в воде (0,1 мл) добавили по каплям к полученному раствору при комнатной температуре, и перемешивали при температуре 80°C в течение ночи. По окончанию реакции, реакционную смесь охладили до комнатной температуры, и упарили при пониженном давлении для удаления растворителя. К остатку по каплям добавили этилацетат. Полученную смесь промыли водой и соляным раствором, и упарили при пониженном давлении. Полученный остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (SiO2, 10%-70% Гексан/EtOAc), получив таким образом аминоспиртовое соединение (26 мг, 45%) в виде бесцветного масла. Полученное аминоспиртовое соединение растворили в метиленхлориде (1,5 мл). Тиофосген (2 мкл, 0,02 ммоль) и диизопропиламин (0,05 мл, 0,27 ммоль) добавили по каплям к полученному раствору, и затем перемешивали при комнатной температуре в течение 2 часов. По окончанию реакции, реакционную смесь разбавили метиленом, и промыли водой и соляным раствором. Органический слой высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (SiO2, 30%-90% гексан/EtOAc), получив в результате соединение 271 (12 мг, 43%) в виде твердого вещества желтого цвета.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,88 (s, 1Н), 7,75 (s, 2H), 7,06 (dt, 1H, J=2,4, 8,6 Гц), 6,90-6,81 (m, 2H), 5,77-5,74 (m, 1Н), 4,66-4,63 (m, 1Н), 4,25-4,09 (m, 1Н), 3,83, 3,79 (2s, 3H), 3,72, 3,66 (2d, 1 Н, J=14,8 Гц), 3,22, 3,14 (2s, 3H), 2,53-1,89 (m, 4H), 1,84, 1,79 (2s, 3H), 1,53-1,44 (m, 2H), 1,05-1,02 (m, 6H), 0,51, 0,37 (2d, 1H, J=6,7 Гц); MS (ESI) m/z 628,8 (M+).
Соединение 272
Метил 3-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)пропаноат
Соединение 272 (0,12 г, 95,9%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 133.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,75 (m, 2H), 7,27 (2d, 1H, J=2,12, 2,08 Гц), 6,83 (m, 2Н), 5,60 (m, 1Н), 4,05-3,41 (m, 9 Н), 2,89 (m, 2H), 2,6 (m, 2H), 2,50-2,00 (m, 2H), 1,89 (m, 2H), 1,50 (m, 2H), 1,05 (m, 6H), 0,40 (m, 3H).
Соединение 273
3-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)пропановая кислота
Соединение 273 (2 мг, 1,9%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 134.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86 (s, 1Н), 7,73 (s, 2Н), 7,05-7,07 (m, 1Н), 6,74-6,85 (m, 2H), 5,56-5,61 (m, 1Н), 3,72-3,89 (m, 3H), 3,42-3,58 (m, 1Н), 2,83-2,90 (m, 2H), 2,61-2,66 (m, 2H), 2,26-2,59 (m, 2H), 1,87-1,93 (m, 2H), 1,44-1,53 (m, 2H), 1,01-1,05 (m, 6H), 0,30, 0,45 (2d, 3H, J=4,86, 4,92 Гц); MS (ESI) m/z 614,2 (М++Н).
Соединение 274
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((6-(4-фтор-5-изопропил-2-метоксифенил)спиро[2,5]окт-5-ен-5-ил)метил)-4-метилоксазолидин-2-он
Соединение 274 (0,12 г, 76,5%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86 (s, 1Н), 7,72 (d, J=0,4 Гц, 2 Н), 6,84, 6,80 (2d, J=8,7 Гц, 1Н), 6,56, 6,52 (2d, J=12,2 Гц, 1Н), 5,59 (t, J=8,4 Гц, 1Н), 4,01-3,88 (m, 2H), 3,73, 3,71 (2s, 3H), 3,59, 3,46 (2d, J=14,6 Гц, 1Н), 3,13 (m, 1Н), 2,44-1,13 (m, 16 Н), 0,44-0,34 (m, 7Н); MS (ESI): 600 (М++Н).
Соединение 275
трет-Бутил 6-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-5-метоксииндолине-1-карбоксилат
трет-Бутил 5-метокси-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолине-1-карбоксилат был синтезирован с использованием 4-метоксииндолина в качестве исходного соединения, после этого соединение 275 (0,24 г, 72,1%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 133.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,84, 7,77, 7,73 (3s, 3 Н), 7,53-7,05 (brs, 1Н), 6,70, 6,66 (2s, 1Н), 5,65-5,58 (m, 1Н), 4,10-3,88 (m, 4H), 3,71-3,39 (m, 4H), 3,07-3,02 (m, 2H), 2,45-1,85 (m, 4H), 1,51-1,18 (m, 16 Н), 1,02-0,94 (m, 6H), 0,85 (m, 3H), 0,43, 0,37 (2d, 3H, J=6,5, 6,3 Гц); MS (ESI): 683 (М++Н).
Соединение 276
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-метоксииндолин-6-ил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 276 (0,13 г, 63,5%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 267.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,84 (s, 1Н), 7,73 (s, 2H), 6,74, 6,67 (2s, 1Н), 6,31, 6,29 (2s, 1Н), 5,59, 5,58 (2s, 1Н), 4,05-3,87 (m, 2H), 3,67-3,63 (m, 4H), 3,55-2,48 (m, 3H), 3,01-2,97 (m, 2H), 2,45-1,86 (m, 4H), 1,45 (m, 2H), 1,03, 1,01, 0,99 (3s, 6 Н), 0,48, 0,33 (2d, 3H, J=6,5 Гц); MS (ESI): 583 (М++Н).
Соединение 277
(4S,5R)-3-((2-(1-ацетил-5-метоксииндолин-6-ил)-5,5-диметилциклогекс-1-енил)метил)-5-(3,5-бис(трифторметил)фенил)-4-метилоксазолидин-2-он
Соединение 277 (18 мг, 64,6%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 261.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,91-7,74 (m, 4H), 6,71 (d, 1H, J=12,7 Гц), 6,54, 5,50 (2d, 1 Н, J=8,08, 8,04 Гц), 4,12-3,91 (m, 4H), 3,73, 3,72 (2s, 3H), 3,59, 3,37 (2d, 1H, J=14,7 Гц), 3,17 (m, 2H), 2,37-1,91 (m, 6H), 1,46 (m, 2H), 1,02, 1,00, 0,99 (3s, 6 Н), 0,41, 0,38 (2d, 3H, J=6,5 Гц); MS (ESI): 625 (М++Н).
Соединение 278
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-метокси-1-(2,2,2-трифторэтил)индолин-6-ил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 278 (4 мг, 11,3%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 261.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,73 (s, 2H), 6,74, 6,68 (2s, 1Н), 6,12 (s, 1Н), 5,58, 5,56 (2d, 1H, J=4,2 Гц), 4,03-3,85 (m, 2H), 3,69, 3,67 (2s, 3H), 3,63-3,38 (m, 5Н), 3,02-2,98 (m, 2H), 2,47-1,87 (m, 6H), 1,47 (m, 2H), 1,25 (m, 6H), 0,37, 0,35 (2d, 3H, J=6,5 Гц); MS (ESI): 665 (М++Н).
Соединение 280
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-метокси-1-(метилсульфонил)индолин-6-ил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 280 (19 мг, 64,4%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 261.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,74 (s, 2H), 7,06 (d, 1H, J=16,2 Гц), 6,75 (d, 1H, J=13,6 Гц), 5,59 (2d, 1H, J=8,2 Гц), 3,99-3,87 (m, 4H), 3,75-3,72 (2s, 3H), 3,52, 3,33 (2d, 1H, J=14,9, 14,6 Гц), 3,14-3,09 (m, 2H), 2,84, 2,79 (2s, 3H), 2,38-1,91 (m, 4H), 1,45 (m, 2H), 1,03, 1,01, 1,00 (3s, 6 Н), 0,47, 0,41 (2d, 3H, J=6,5 Гц); MS (ESI): 661, 683 (М++Н).
Соединение 281
трет-Вутил 4-(((4S,5R)-5-(3,5-бис(грифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-3-(4-фтор-5-изопропил-2-метоксифенил)-5,6-дигидропиридин-1(2H)-карбоксилат
Соединение 281 (0,38 г, 88%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 219.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86 (s, 1Н), 7,71 (s, 2H), 6,87 (dd, 1 Н, J=13,4, 8,7 Гц), 6,57 (dd, 1 Н, J=14,8, 12,0 Гц), 5,61 (d, 1H, J=7,9 Гц), 4,25-3,83 (m, 4H), 3,71, 3,68 (2s, 3H), 3,47-3,44 (m, 1Н), 3,15-3,10 (m, 1Н), 2,30-2,25 (m, 2H), 1,48 (s, 9 Н), 1,24-1,12 (m, 6H), 0,42, 0,37 (2d, 3H, J=6,5 Гц).
Соединение 282
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((3-(4-фтор-5-изопропил-2-метоксифенил)-1,2,5,6-тетрагидропиридин-4-ил)метил)-4-метилоксазолидин-2-он
Соединение 282 (0,19 г, 61%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 267.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,82 (s, 1Н), 7,74 (d, 2H,J=5,5 Гц), 6,92, 6,83 (2d, 1Н,J=8,4 Гц), 6,55 (dd, 1H,J=18,5, 12,0 Гц), 5,69 (dd, 1H,J=13,5, 8,0 Гц), 5,44 (brs, 1Н), 4,18-4,01 (m, 2H), 3,84 (d, 0,6 Н, J=16,7 Гц), 3,73, 3,72 (2s, 3H), 3,69-3,35 (m, 3,4 Н), 3,20-3,07 (m, 2H), 2,62-2,52 (m, 1Н), 2,33-2,27 (m, 1Н), 1,24-1,09 (m, 6H), 0,38, 0,31 (2d, 1H, J=6,6 Гц).
Соединение 283
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((3-(4-фтор-5-изопропил-2-метоксифенил)-1-(2,2,2-трифторэтил)-1,2,5,6-тетрагидропиридин-4-ил)метил)-4-метилоксазолидин-2-он
Соединение 283 (40 мг, 88%) в виде коричневого масла было получено способом, аналогичным способу получения соединения 265.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,72 (s, 2H), 6,85 (t, 1 Н, J=9,0 Гц), 6,55 (dd, 1 Н, J=16,5, 12,0 Гц), 5,62 (dd, 1 Н, J=7,9, 6,0 Гц), 4,05-3,95 (m, 2H), 3,74, 3,71 (2s, 3H), 3,56-3,22 (m, 2,5 Н), 3,19-3,06 (m, 3,5 Н), 3,03-2,98 (m, 1Н), 2,94-2,87 (m, 1Н), 2,39-2,25 (m, 2H), 1,25-1,12 (m, 6H), 0,43, 0,35 (2d, 1H, J=6,6 Гц).
Соединение 284
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((3-(4-фтор-5-изопропил-2-метоксифенил)-1-(трифторметилсульфонил)-1,2,5,6-тетрагидропиридин-4-ил)метил)-4-метилоксазолидин-2-он
Соединение 284 (27 мг, 54%) в виде коричневого масла было получено способом, аналогичным способу получения соединения 261.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,87 (s, 1Н), 7,72 (s, 2H), 6,84 (t, 1 Н, J=8,4 Гц), 5,63 (t, 1 Н, J=9,1 Гц), 4,41 (brd, 0,5H, J=16,6 Гц), 4,12-3,80 (m, 5Н), 3,74, 3,73 (2s, 3H), 3,58 (brd, 1,5 Н, J=14,8 Гц), 3,17-3,08 (m, 1Н), 2,53-2,34 (m, 2H), 1,25-1,09 (m, 6H), 0,49, 0,37 (2d, 1H, J=6,6 Гц); MS (ESI) m/z 706,8 (M+).
Соединение 285
Метил 3-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-2,2-диметилпропаноат
Как показано на реакционной схеме 6, было синтезировано соединение 22, которое является промежуточным соединением, после чего его подвергли реакции восстановительного аминирования с соединением 4, которое является амино-спиртовым соединением, для получения соединения 23. Полученное соединение 23 (0,21 г, 0,34 ммоль) растворили в метиленхлориде (3 мл). Диизопропиламин (0,36 мл) и трифосген (0,15 г) добавили по каплям по порядку к полученному раствору при комнатной температуре, и перемешивали при комнатной температуре в течение 2 часов. По окончанию реакции, реакционную смесь разбавили этилацетатом, промыли водой и соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении для удаления растворителя. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (12 г силикагеля, 3:1 = n-гексан:EtOAc), получив в результате соединение 285 (0,1 г, 45%) в виде твердого пенистого вещества белого цвета.
1H ЯМР (400 МГц, DMSO-d6); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,73 (d, 1H, J=9,4 Гц), 6,92-6,95 (m, 1Н), 6,67-6,77 (m, 2H), 5,58-5,61 (m, 1Н), 3,87-4,01 (m, 2H), 3,71, 3,73 (2s, 3H), 3,63, 3,64 (2s, 3H), 3,50, 3,59 (2d, 1H, J=11,25, 10,86 Гц), 2,73-2,77 (m, 2H), 2,15-2,50 (m, 2H), 1,90-2,05 (m, 2H), 1,45-1,50 (m, 2H), 1,12-1,15 (m, 6H), 0,90-1,04 (m, 6H), 0,28, 0,41 (2d, 3H, J=4,86, 4,92 Гц); MS (ESI) m/z 656 (М++Н).
Соединение 286
3-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-2,2-диметилпропановая кислота
Соединение 286 (27 мг, 42,4%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 134.
1H ЯМР (400 МГц, DMSO-d6); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,73-7,75 (m, 2H), 6,99-7,02 (m, 1Н), 6,72-6,81 (m, 2H), 5,61 (d, 1H, J=8,1 Гц), 3,88-4,02 (m, 2H), 3,71-3,74 (m, 3H), 3,52, 3,58 (2d, 1H, J=14,96, 14,52 Гц), 2,72-2,87 (m, 2H), 2,00-2,50 (m, 2H), 1,93 (m, 2H), 1,14-1,17 (m, 6H), 0,99-1,04 (m, 6H), 0,28, 0,44 (d, 3H,J=6,52, 6,56 Гц); MS (ESI) m/z 656, 547 (M++H).
Соединение 291
(R)-N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-3,3,3-трифтор-2-метокси-2-фенилпропанамид
Соединение 291 (53 мг, 76%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 110.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 8,55, 8,53 (2s, 1Н), 7,87-6,81 (m, 11Н, ArH), 5,60 (d, 0,5Н, J=8,2), 5,53 (d, 0,5Н, J=8,1), 4,08-3,93 (m, 2Н), 3,77, 3,76 (2s, 3H), 3,52-3,56 (m, 4Н), 2,48-2,08 (m, 3H), 1,92 (широкий сигнал, 2Н), 1,55-1,39 (m, 2Н), 1,04, 1,01 (2s, 6Н), 0,40 (d, 1,5Н, J=6,5), 0,36 (d, 1,5Н, J=6,5); MS (ESI) m/z 773,2 (M++H).
Соединение 292
(S)-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-3,3,3-трифтор-2-метокси-2-фенилпропанамид
Соединение 292 (54 мг, 78%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 110.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 8,54, 8,50 (2s, 1Н), 7,87-6,80 (m, 11Н, ArH), 5,59 (d, 0,5Н, J=8,1), 5,55 (d, 0,5Н, J=8,1), 4,06-3,94 (m, 2Н), 3,77, 3,76 (2s, 3H), 3,55-3,37 (m, 4Н), 2,48-2,06 (m, 3H), 1,91 (широкий сигнал, 2Н), 1,54-1,40 (m, 2Н), 1,04, 1,03, 1,01 (3s, 6Н), 0,39 (d, 1,5Н, J=6,5), 0,33 (d, 1,5Н, J=6,5); MS (ESI) m/z 773,2 (M++H).
Соединение 293
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((6-(2-метоксифенил)спиро[2,5]окт-5-ен-5-ил)метил)-4-метилоксазолидин-2-он
Соединение 293 (0,73 г, 71%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,72 (s, 2H), 7,25-7,20 (m, 1Н), 7,04-6,83 (m, 3H), 5,58 (t, 1 Н, J=8,5 Гц), 4,03-3,90 (m, 2H), 3,75, 3,74 (2s, 3H), 3,59, 3,48 (2d, 1H, J=15,0, 14,6 Гц), 2,47-1,21 (m, ЮН), 0,44-0,31 (m, 7Н); MS (ESI): 542 (М++Н).
Соединение 294
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((6-(2-метокси-5-нитрофенил)спиро[2,5]окт-5-ен-5-ил)метил)-4-метилоксазолидин-2-он
Соединение 294 (0,73 г, 71%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 52.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 8,18-8,14 (m, 1Н), 7,94 (dd, 1 Н, J=9,8, 2,8 Гц), 7,85 (s, 1Н), 7,71 (d, 2H, J=А,1 Гц), 6,95 (t, 1H, J=9,4 Гц), 5,63, 5,58 (2d, 1H, J=8,1 Гц), 4,01-3,94 (m, 2H), 3,91, 3,88 (2s, 3H), 3,53, 3,36 (2d, 1H, J=15,0 Гц), 2,39-1,31 (m, 7Н), 0,46-0,35 (m, 7Н); MS (ESI) m/z 585 (М++Н).
Соединение 295
(4S,5R)-3-((6-(5-амино-2-метоксифенил)спиро[2,5]окт-5-ен-5-ил)метил)-5-(3,5-бис(трифторметил)фенил)-4-метилоксазолидин-2-он
Соединение 294 (0,21 г, 0,36 ммоль) растворили в метаноле (3 мл). Никель Ренея (3 мл) добавили по каплям к полученному раствору при комнатной температуре, и перемешивали в атмосфере водорода в течение ночи. По окончанию реакции, реакционную смесь отфильтровали через цеолиты, и упарили при пониженном давлении для удаления растворителя. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (25%-60% n-гексан/EtOAc), получив в результате соединение 295 (0,12 г, 60%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,84 (s, 1Н), 7,71 (d, 2H, J=4,1 Гц), 6,73-6,46 (m, 2H), 5,59, 5,53 (2d, 1H, J=8,0 Гц), 4,09-3,89 (m, 2H), 3,74, 3,70 (2s, 3H), 3,70-3,49 (m, 1Н), 2,47-1,23 (m, 7Н), 0,50-0,35 (m, 7Н); MS (ESI) m/z 555 (М++Н).
Соединение 296
(R)-N-(3-(5-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)спиро[2,5]окт-5-ен-6-ил)-4-метоксифенил)-3,3,3-трифтор-2-метокси-2-фенилпропанамид
Соединение 296 (15 мг, 15%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 110.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 8,56 (s, 1Н), 7,97-7,94 (m, 1Н), 7,85-7,69 (m, 3H), 7,51 (m, 2H), 7,44-7,34 (m, 4H), 6,84 (t, 1H, J=8,6 Гц), 5,56, 5,52 (2d, 1H, J=8,2 Гц), 4,11-3,89 (m, 3H), 3,77, 3,76 (2s, 3H), 3,56-3,34 (m, 4H), 2,44-1,24 (m, 11Н), 0,46-0,29 (m, 9Н); MS (ESI) m/z 771 (М++Н).
Соединение 297
(S)-N-(3-(5-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)спиро[2,5]окт-5-ен-6-ил)-4-метоксифенил)-3,3,3-трифтор-2-метокси-2-фенидпропанамид
Соединение 297 (17 мг, 21%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 110.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 8,55, 8,53 (2s, 1Н), 7,84 (s, 1Н), 7,72-7,65 (m, 3H), 7,56 (m, 1Н), 7,43-7,40 (m, 3H), 7,33-7,17 (m, 3H), 6,84, 6,81 (2d, 1H, J=8,9 Гц), 5,54 (d, 1H, J=8,1 Гц), 4,04-3,89 (m, 3H), 3,77, 3,76 (2s, 3H), 3,57-3,39 (m, 4H), 2,45-1,23 (m, 9Н), 0,46-0,34 (m, 8Н); MS (ESI) m/z 771 (М++Н).
Соединение 298
(R)-N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-3,3,3-трифтор-2-метокси-N-метил-2-фенилпропанамид
Соединение 298 (30 мг, 82%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 112.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (m, 1Н), 7,72-7,78 (m, 2H), 7,59-7,60 (m, 1Н), 7,41-7,45 (m, 2H), 7,30-7,36 (m, 2H), 7,01-7,04 (m, 1Н), 6,84-6,90 (m, 2H), 5,57-5,59 (m, 1Н), 3,90-4,10 (m, 2H), 3,82-3,85 (m, 3H), 3,47-3,65 (m, 3H), 3,47-3,65 (m, 3H), 2,91-3,29 (m, 3H), 2,10-2,50 (m, 2H), 1,80-2,00 (m, 2H), 1,46-1,50 (m, 2H), 0,94-1,04 (m, 6H), 0,29-0,50 (m, 3H); MS (ESI) m/z 787 (М++Н).
Соединение 299
3-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)пропанамид
Соединение 273 (0,48 г, 0,78 ммоль) растворили в метиленхлориде (5 мл). Тионил хлорид (0,1 мл) и диметилформамид (1 капля) добавили по каплям к полученному раствору, и перемешивали в течение 5 часов. По окончанию реакции, реакционную смесь охладили до комнатной температуры, и упарили при пониженном давлении для удаления растворителя. Остаток растворили в тетрагидрофуране (10 мл). Раствор аммиака (2 мл) добавили по каплям к полученному раствору, и перемешивали в течение 1 часа при комнатной температуре. К реакционной смеси по каплям добавили этилацетат. После этого, полученную реакционную смесь промыли водой и соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (SiO2, 4:1 гексан/EtOAc), получив в результате соединение 299 (0,39 г, 84%) в виде бесцветного масла.
1H ЯМР (400 МГц, DMSO-d6); смесь атропоизомеров; δ 7,86 (s, 1Н), 7,73 (d, 1H, J=4,6 Гц), 7,04-7,08 (m, 1Н), 6,73-6,87 (m, 2H), 5,47-5,62 (m, 3H), 3,93-3,97 (m, 2H), 3,71, 3,77 (2s, 3H), 3,38, 3,55 (2d, 1H, J=11,25, 10,89 Гц), 2,85-2,91 (m, 2H), 2,44-2,51 (m, 2H), 1,90-2,30 (m, 4H), 1,45-1,48 (m, 2Н), 1,01-1,05 (m, 6H), 0,33, 0,47 (2d, 3H, J=4,89,4,92 Гц); MS (ESI) m/z 613,2 (М++Н).
Соединение 300
3-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)пропаннитрил
Соединение 299 (0,19 г, 0,32 ммоль) растворили в пиридин (5 мл). Фосфорил хлорид (0,12 мл) и имидазоле (40 мг) добавили по каплям к полученному раствору, и перемешивали при температуре- 20°C в течение 1 часа. Реакцию погасили при помощи 1М раствора HCl (гидрохлорид). Реакционную смесь экстрагировали этилацетатом, промыли водой и соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (SiO2, 4:1 гексан/EtOAc), получив в результате соединение 300 (0,14 г, 74%) в виде белого масла.
1H ЯМР (400 МГц, DMSO-d6); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,74 (s, 2H), 7,06-7,12 (m, 1Н), 6,79-6,93 (m, 2H), 5,58, 5,61 (2d, 1H, J=6,18, 6,09 Гц), 3,89-4,00 (m, 2H), 3,74, 3,77 (2s, 3H), 3,46, 3,60 (2d, 1H, J=11,28, 10,98 Гц), 2,82-2,90 (m, 2H), 2,60-2,62 (m, 2H), 2,20-2,59 (m, 2H), 1,94 (m, 2H), 1,47-1,51 (m, 2H), 1,01-1,05 (m, 6H), 0,35, 0,42 (2d, 3H, J=4,86, 4,92 Гц); MS (ESI) m/z 595,2 (M++H).
Соединение 301
(4S,5R)-3-((2-(5-(2-(2Н-тетразол-5-ил)этил)-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-5-(3,5-бис(трифторметил)фенил)-4-метилоксазолидин-2-он
Соединение 300 (0,1 г, 0,16 ммоль) растворили в диметилформамиде (5 мл). Азид натрия (0,04 г) и хлорид аммония (0,04 г, 0,82 ммоль) добавили по каплям к полученному раствору, и перемешивали при температуре 120°C в течение ночи. После этого реакцию погасили при помощи 1М раствора HCl (гидрохлорид), реакционную смесь экстрагировали этилацетатом, промыли водой и соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (SiO2, 20:1 DCM/MeOH), получив в результате соединение 301 (11 мг, 11%) в виде белого масла.
1H ЯМР (400 МГц, DMSO-d6); смесь атропоизомеров; δ 7,88 (s, 1Н), 7,69-7,77 (m, 2H), 6,73-6,83 (m, 2H), 6,60-6,67 (m, 1Н), 5,41, 5,74 (2d, 1H, J=6,42, 5,97 Гц), 4,49-4,95 (m, 1Н), 4,15-4,33 (m, 1Н), 3,70, 3,84 (2s, 3H), 2,90-3,36 (m, 4H), 1,98-2,50 (m, 2H), 1,90-1,98 (m, 2H), 1,46-1,50 (m, 2H), 1,00-1,05 (m, 6H), 0,60-0,70 (2d, 3H, J=4,92, 4,98 Гц); MS (ESI) m/z 638,2 (М++Н).
Соединение 302
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-2-метокси-5-(1-метилциклопропил)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 302 (0,12 г, 88,4%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86 (s, 1Н), 7,73 (d, 1H, J=3,6 Гц), 6,86, 6,83 (2d, 1H, J=8,7 Гц), 6,53, 6,49 (2d, 1H, J=12,2 Гц), 5,60 (t, 1H, J=7,5 Гц), 3,99-3,89 (m, 2H), 3,72, 3,68 (2s, 3H), 3,51, 3,39 (2d, 1H, J=14,6 Гц), 2,42-1,89 (m, 4H), 1,45 (m, 2H), 1,29-1,23 (m, 6H), 1,03-0,85 (m, 5Н), 0,73-0,60 (m, 4H), 0,38, 0,31 (2d, 3H, J=6,5 Гц); MS (ESI): 614 (М++Н).
Соединение 303
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((6-(4-фтор-2-метокси-5-(1-метилциклопропил)фенил)спиро[2,5]окт-5-ен-5-ил)метил)-4-метилоксазолидин-2-он
Соединение 303 (80 мг, 54,7%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,72 (s, 2H), 6,92, 6,88 (2d, 1H, J=8,8, 8,7 Гц), 6,55, 6,51 (2d, 1H, J=12,2, 12,1 Гц), 5,59 (t, 1H, J=7,8 Гц), 4,00-3,95 (m, 2H), 3,73, 3,70 (2s, 3H), 3,54, 3,44 (2d, 1H, J=14,9, 14,6 Гц), 2,42-1,24 (m, 10H), 0,74-0,61 (m, 4H), 0,44-0,37 (m, 7H); MS (ESI): 612 (М++Н).
Соединение 304
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(3,5-дифтор-4-метокси-4-(метоксиметокси)бифенил-3-ил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
3′-(2-(Бромметил)-4,4-дициклогекс-1-енил)-3,5-дифтор-4′-метокси-4-(метокси метокси)бифенил, который является промежуточным соединением, растворили в диметилформамиде (DMF). (4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-оксазолидин-2-он и гидрид натрия добавили по каплям к полученному раствору при комнатной температуре. По окончанию реакции, реакционную смесь экстрагировали этилацетатом, промыли водой и соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (SiO2, 5:1 n-гексан:EtOAc), получив в результате соединение 304 (60 мг, 46%) в виде белого масла.
1H ЯМР (400 МГц, DMSO-d6); смесь атропоизомеров; δ 7,86 (s, 1Н), 7,79 (s, 2H), 7,36-7,39 (m, 1Н), 6,88-6,95 (m, 3H), 5,57-5,62 (m, 1Н), 5,17 (d, 1H, J=9,9 Гц), 3,96-4.04 (m, 2H), 3,79-3,82 (2s, 3H), 3,58-3,62 (m, 3H), 3,44-3,58 (m, 1Н), 2,00-2,50 (m, 2H), 1,93-1,95 (m, 2H), 1,50-1,55 (m, 2H), 1,02-1,07 (m, 6H), 0,37, 0,43 (2d, 3H, J=6,6, 6.5 Гц); MS (ESI) m/z 714 (M++Н).
Соединение 305
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(3′,5′-дифтор-4′-гидрокси-4-метоксибифенил-3-ил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 304 (0,03 г, 0,04 ммоль), в качестве исходного вещества, растворили в метаноле (2 мл). К полученному раствору по каплям добавили раствор хлороводорода в метаноле (0,5 мл), и перемешивали при комнатной температуре в течение 3 часов. По окончанию реакции, реакционную смесь экстрагировали этилацетатом, промыли водой и соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (SiO2, 5:1 n-гексан:EtOAc), получив в результате соединение 305 (20 мг, 71%) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, DMSO-d6); смесь атропоизомеров; δ 7,86 (s, 1Н), 7,72 (s, 2H), 7,34-7,37 (m, 1Н), 6,99-7,12 (m, 3H), 6,89, 6,94 (2d, 1H, J=8,60, 8,60 Гц), 5,95 (br s, 1Н), 5,61 (t, 1 Н, J=7,8 Гц), 3,93-4,05 (m, 2H), 3,78, 3,81 (2s, 3H), 3,49, 3,63 (2d, 1H, J=15,04, 14,64 Гц), 2,10-2,54 (m, 2H), 1,95 (m, 2H), 1,47-1,55 (m, 2H), 1,02-1,06 (m, 6H), 0,37, 0,43 (2d, 3H, J=6,48, 6,56 Гц); MS (ESI) m/z 670 (М++Н).
Соединение 306
3-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-2,2-диметилпропанамид
Соединение 306 (42 мг, 56%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 299.
1H ЯМР (400 МГц, DMSO-d6); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,73-7,74 (m, 2H), 7,00-7,03 (m, 1Н), 6,70-6,81 (m, 1Н), 5,52-5,60 (m, 3H), 3,88-4,03 (m, 2H), 3,71, 3,75 (2s, 3H), 3,39, 3,58 (2d, 1H, J=14,84, 14,48 Гц), 2,65-2,82 (m, 2H), 2,00-2,50 (m, 2H), 1,92 (m, 2H), 1,45-1,50 (m, 2H), 1,14-1,18 (m, 6H), 1,01-1,64 (m, 6H), 0,29, 0,46 (2d, 3H, J=6,48, 6,56 Гц); MS (ESI) m/z 641 (М++Н).
Соединение 307
3-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-2,2-диметилпропаннитрил
Соединение 307 (12 мг, 48%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 300.
1H ЯМР (400 МГц, DMSO-d6); смесь атропоизомеров; δ 7,73-7,93 (m, 3H), 6,82-7,16 (m, 3H), 5,58-5,60 (m, 1Н), 3,89-4,02 (m, 2H), 3,75-3,77 (m, 3H), 3,43-3,67 (m, 1Н), 2,57-2,86 (m, 2H), 1,85-2,47 (m, 4H), 1,94 (m, 2H), 1,21-1,78 (m, 6H), 0,85-0,89 (m, 6H), 0,30-0,40 (m, 3H); MS (ESI) m/z 623,3 (М++Н).
Соединение 308
Метил 3-(3-(2-(((4S.5Ю-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-3-метилбутаноат
Было синтезировано промежуточное соединение метил 3-(4-метоксифенил)-3-метилбутаноат, после этого соединение 308 (0,9 г, 66,5%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 285.
1Н ЯМР (400 МГц, DMSO-d6); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,73 (s, 2H), 7,18-7,21 (m, 1Н), 6,92-6,96 (m, 1Н), 6,74-6,81 (m, 1Н), 5,58-5,61 (m, 1Н), 3,87-4,00 (m, 2H), 3,73, 3,74 (2s, 3H), 3,47, 3,60 (2d, 1H, J=11,22 10,89 Гц), 3,49, 3,50 (2s, 3H), 2,54-2,59 (m, 2H), 2,00-2,30 (m, 2H), 1,93-1,94 (m, 2H), 1,46-1,48 (m, 2H), 1,38-1,41 (m, 6H), 1,01-1,05 (m, 6H), 0,28, 0,41 (2d, 3H, J=4,89, 4,92 Гц); MS (ESI) m/z 656,3 (М++Н).
Соединение 309
3-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-3-метилбутановая кислота
Соединение 309 (0,24 г, 32,7%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 134.
1H ЯМР (400 МГц, DMSO-d6); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,73 (s, 2H), 7,20-7,23 (m, 1Н), 6,94-6,98 (m, 1Н), 6,75-6,82 (m, 1Н), 5,57-5,60 (m, 1Н), 3,85-4,01 (m, 2H), 3,73, 3,75 (2s, 3H), 3,49,3,58 (2d, 1H, J=10,98, 10,83 Гц), 2,55-2,64 (m, 2H), 2,05-2,08 (m, 2H), 1,92-1,94 (m, 2H), 1,47-1,51 (m, 2H), 1,43-1,44 (m, 6H), 1,00-1,05 (m, 6H), 0,26, 0,43 (2d, 3H, J=4,95, 4,86 Гц); MS (ESI) m/z 642,2 (М++Н).
Соединение 310
Метил 4-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-2,2-диметилбутаноат
Соединение 310 (0,7 г, 96,1%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 285.
1H ЯМР (400 МГц, DMSO-d6); смесь атропоизомеров; δ 7,86 (s, 1Н), 7,73-7,75 (m, 2H), 6,99-7,02 (m, 1Н), 6,71-6,79 (m, 2H), 5,59-5,62 (m, 1Н), 3,91-4,02 (m, 2H), 3,71, 3,74 (2s, 3H), 3,63, 3,68 (2s, 3H), 3,47, 3,59 (2d, 1H, J=11,10, 10,95 Гц), 2,40-2,47 (m, 2H), 2,00-2,38 (m, 2H), 1,91-1,93 (m, 2H), 1,76-1,80 (m, 2H), 1,46-1,49 (m, 2H), 1,24-1,28 (m, 6 H), 1,19 (d, 1 H, J=3,4 Гц), 1,01-1,05 (m, 6 H), 0,31, 0,43 (2d, 3 H, J=4,86, 4,95 Гц); MS (ESI) m/z 670,2 (M++H).
Соединение 311
4-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил>)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-2,2-диметилбутановая кислота
Соединение 311 (0,11 г, 20%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 134.
1H ЯМР (400 МГц, DMSO-d6); смесь атропоизомеров; δ 7,86 (s, 1Н), 7,73-7,75 (m, 2H), 7,70-7,04 (m, 1Н), 6,72-6,76 (m, 2H), 5,59-5,61 (m, 1Н), 3,95-4,00 (m, 2H), 3,71-3,80 (m, 3H), 3,40-3,59 (m, 1Н), 2,46-2,54 (m, 2H), 2,00-2,15 (m, 4H), 1,84-1,93 (m, 2H), 1,70-1,84 (m, 2H), 1,46-1,49 (m, 2H), 1,22-1,24 (m, 6H), 0,31, 0,44 (2d, 3H,J=5,01, 4,83 Гц); MS (ESI) m/z 656,3 (М++Н).
Соединение 312
Этил 1-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксибензил)циклобутанкарбоксилат
Соединение 312 (0,38 г, 85%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 285.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,84, 7,77, 7,73 (3 brs, 3 Н), 7,70-6,95 (m, 1Н), 6,76-6,69 (m, 2H), 5,58 (t, 1H, J=8,0 Гц), 4,13-4,05 (m, 2H), 3,99-3,85 (m, 2H), 3,72, 3,70 (2s, 3H), 3,56, 3,45 (2d, 1H, J=14,9, 14,5 Гц), 2,99-2,94 (m, 2H), 2,37-1,97 (m, 11Н), 1,46 (m, 2H), 1,27-1,18 (m, 5Н), 1,03-0,86 (m, 6H), 0,34, 0,25 (2d, 3H, J=6,5 Гц); MS (ESI): 726 (М++Н).
Соединение 313
1-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксибензил)циклобутанкарбоновая кислота
Соединение 313 (0,15 г, 47,4%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 134.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,84, 7,75, 7,72 (3s, 3H), 7,04-7,01 (m, 1Н), 6,82-6,70 (m, 2H), 5,58 (d, 1H, J=8,1 Гц), 3,99-3,86 (m, 2H), 3,72, 3,70 (2s, 3H), 3,56, 3,46 (2d, 1H, J=14,9, 14,6 Гц), 3,04-2,96 (m, 2Н), 2,47-1,81 (m, 12 Н), 1,46 (m, 2H), 1,03-0,98 (m, 6H), 0,38, 0,25 (2d, 3H, J=6,5 Гц); MS (ESI): 654 (М++Н).
Соединение 314
1-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксибензил)циклобутанкарбоксамид
Соединение 314 (0,04 г, 59,5%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 299.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,73 (s, 2H), 7,06, 7.03 (2d, 1H, J=7,06, 7,04 Гц), 6,84, 6,79 (2d, 1H, J=6,84, 6,79 Гц), 6,77, 6,72 (2d, 1H, J=8,4 Гц), 5,58, 5,50 (2d, 1H, J=8,1, 8,0 Гц), 5,34-5,26 (brs, 2Н), 4,12-3,85 (m, 2H), 3,77, 3,70 (2s, 3H), 3,54, 3,30 (2d, 1H, J=14,8, 14,5 Гц), 2,96 (d, 2H, J=10,6 Гц), 2,75-1,79 (m, 11Н), 1,46 (m, 2H), 1,02-1,00 (m, 3H); MS (ESI): 697 (М++Н).
Соединение 315
Метил 2-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-2-метилпропаноат
Было синтезировано промежуточное соединение метил 2-(4-метоксифенил)-2-метилпропаноат, после чего соединение 315 (0,16 г, 76,8%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 285.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,73 (d, 2H, J=4.4 Гц), 7,19, 7,17 (2t, 1 Н, J=2,7 Гц), 6,94, 6,90 (2d, 1H, J=2,5 Гц), 6,81, 6,76 (2d, 1H, J=8,7 Гц), 5,59, 5,55 (2d, 1H, J=8,2 Гц), 3,96-3,88 (m, 2H), 3,75, 3,73 (2s, 3H), 3,63, 3,55 (2s, 3H), 3,54, 3,40 (2d, 1H, J=14,8, 13,3 Гц), 2,52-1,93 (m, 5Н), 1,55-1,44 (m, 10H), 1,04, 1,02, 1,00 (3s, 6 Н), 0,35, 0,27 (2d, 3H, J=6,7,6,5 Гц); MS (ESI): 642 (М++Н).
Соединение 316
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(трифторметил)пиридин-3-ил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 316 (0,08 г, 30,6%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 8,37 (m, 1Н), 7,88 (s, 1Н), 7,74 (s, 2Н), 7,49 (m, 1H), 5,64 (m, 1Н), 4,02-3,94 (m, 5Н), 3,47-3,36 (m, 1Н), 2,60-2,00 (m, 2H), 1,94 (s, 2H), 1,55 (m, 2H), 1,10 (m, 6H), 0,40 (m, 3H); MS (ESI): 611,2 (М+Н)+.
Соединение 317
Метил 2-(7-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)бензо[d][1,3]диоксол-5-ил)ацетат
Соединение 317 (0,2 г, 77%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86 (s, 1Н), 7,76 (s, 2H), 6,67 (m, 1H), 6,50 (m, 1Н), 5,95 (2d, 2Н, J=1,04, 1,32 Гц), 5,57 (m, 1Н), 4,09 (m, 1Н), 3,95 (m, 1Н), 3,64 (m, 4H), 3,50 (s, 2H), 2,40-2,20 (m, 2H), 1,95 (s, 2H), 1,51 (m, 2H), 1,03 (m, 6H), 0,41 (m, 3H); MS (ESI): 628,1 (М+Н)+.
Соединение 318
2-(7-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)бензо[d][1,3]диоксол-5-ил)уксусная кислота
Соединение 318 (0,09 г, 76,7%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 134.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,73 (s, 2H), 6,65 (m, 1Н), 6,46 (m, 1H), 5,93 (m, 2Н), 5,59 (m, 1Н), 4,09-3,91 (m, 2H), 3,66 (m, 1Н), 3,49 (s, 2H), 2,40-2,18 (m, 2H), 1,93 (s, 2H), 1,50 (m, 2H), 1,03 (m, 6H), 0,42 (m, 3H); MS (ESI): 614,1 (М+Н)+.
Соединение 319
2-(7-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)бензо[d][1,3]диоксол-5-ил)-N-метилацетамид
Соединение 318 (0,06 г, 0,1 ммоль) растворили в метиленхлориде (10 мл). Метиламин (0,02 г), 1-(3-диметиламинопропил)-3-этилкарбодиимид (0,04 г) и гидроксибензотриазол (0,03 г) добавили к полученному раствору при комнатной температуре, и перемешивали при комнатной температуре в течение ночи. По окончанию реакции, к реакционной смеси по каплям добавили этилацетат. Полученную реакционную смесь промыли насыщенным раствором гидрокарбоната натрия и соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (SiO2, 4:1 гексан/EtOAc), получив в результате соединение 319 (0,03 г, 49%) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86 (s, 1Н), 7,75 (s, 2H), 6,64 (m, 1H), 6,49 (m, 1Н), 5,96 (2d, 2Н, J=1,16, 1,28 Гц), 5,69 (br s, 1Н), 5,56 (m, 1Н), 4,17 (m, 1Н), 4,03 (m, 1Н), 3,53 (m, 1Н), 3,34 (s, 2H), 2,74 (m, 3H), 2,40-2,20 (m, 2H), 1,94 (s, 2H), 1,51 (m, 2H), 1,02 (m, 6H), 0,49 (m, 3H).
Соединение 320
2-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-2-метилпропановая кислота
Соединение 320 (0,05 г, 31,4%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 134.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,84 (s, 1Н), 7,71 (d, 2U, J=4,6 Гц), 7,24-7,21 (m, 1Н), 6,97, 6,96 (2d, 1Н, J=2,6 Гц), 6,82, 6,77 (2d, 1Н,J=8,7 Гц), 5,55 (t, 2 Н, J=7,9 Гц), 3,98-3,85 (m, 2H), 3,75, 3,73 (2s, 3H), 3,54, 3,39 (2d, 1H, J=15,0, 14,6 Гц), 2,56-1,92 (m, 5Н), 1,54-1,44 (m, 5Н), 1,04, 1,01, 1,00 (3s, 6 Н), 0,38, 0,28 (2d, 3H, J=6,6, 6,5 Гц); MS (ESI): 628 (М++Н).
Соединение 321
3-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-N,2,2-триметилпропанамид
Соединение 321 (78 мг, 76,4%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 319.
1H ЯМР (400 МГц, DMSO-d6); смесь атропоизомеров; δ 7,86 (s, 1Н), 7,73-7,75 (m, 2H), 6,94-6,98 (m, 1Н), 6,71-6,76 (m, 2H), 5,31-5,60 (m, 2H), 3,88-4,06 (m, 2H), 3,71, 3,76 (2s, 3H), 3,37, 3,56 (2d, 1H, J=14,92, 14,40 Гц), 2,47-2,84 (m, 2H), 2,67-2,76 (m, 3H), 2,00-2,50 (m, 2H), 1,93 (m, 2H), 1,44-1,57 (m, 6H), 1,11-1,14 (m, 6H), 1,01-1,05 (m, 6H), 0,29, 0,46 (2d, 3H, J=6,48, 6,56 Гц); MS (ESI) m/z 655 (М++Н).
Соединение 323
Метил 1-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксибензил)циклопентанкарбоксилат
Соединение 323 (81 мг, 51%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 285.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,84 (s, 1Н), 7,77, 7,72 (2s, 2H), 6,94-6,90 (m, 1Н), 6,74-6,66 (m, 2H), 5,59 (t, 1 Н, J=8,0 Гц), 3,99-3,84 (m, 2H), 3,75, 3,70 (2s, 3 H), 3,63, 3,59 (2s, 3 H), 3,57, 3,46 (2d, 1H, J=14,5 Гц), 2,85, 2,81 (2d, 1H, J=3,7 Гц), 2,53-2,42 (m, 1Н), 2,24-2,16 (m, 1Н), 2,02-1,93 (m, 5Н), 1,64-1,44 (m, 7H), 1,03-0,99 (m, 6H), 0,38, 0,26 (2d, 3H, J=6,6 Гц); MS (ESI) m/z 682,2, 704,1 (M++H, M++Na).
Соединение 324
1-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксибензил)циклопентанкарбоновая кислота
Соединение 324 (6 мг, 9,4%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 134.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,84 (s, 1Н), 7,73 (s, 2H), 7,03-6,99 (m, 1Н), 6,84 (dd, 1 Н, J=9,9, 2,2 Гц), 6,73 (dd, 1H, J=16,4, 8,4 Гц), 5,62-5,58 (m, 1Н), 3,99-3,89 (m, 2H), 3,73, 3,70 (2s, 3H), 3,54-3,50 (m, 1Н), 2,99-2,77 (m, 2H), 2,17-1,88 (m, 7H), 1,66-1,32 (m, 7H), 1,03-0,98 (m, 6H), 0,47, 0,32 (2d, 3H, J=6,6 Гц); MS (ESI) m/z 668,1, 690,1 (М++Н, M++Na).
Соединение 325
3-(5-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-2-фтор-4-метоксифенил)-2,2-диметилпропановая кислота
Соединение 325 (1,07 г, 90%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 134.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,74 (d, 2Н, J=7,0 Гц), 6,92 (t, 0 Н, J=58,5 Гц), 6,57-6,51 (m, 1Н), 5,62 (dd, 1 Н, J=8,2, 2,3 Гц), 4,00-3,81 (m, 2H), 3,73, 3,70 (2s, 3H), 3,51-3,47 (m, 1Н), 2,88-2,79 (m, 2H), 2,49-2,41 (m, 1Н), 2,14-2,11 (m, 1Н), 1,90-1,88 (m, 2H), 1,49-1,40 (m, 2H), 1,29-1,10 (m, 6H), 1,02-0,95 (m, 6H), 0,46 (2d, 3H, J=6,6 Гц); MS (ESI) m/z 660,2 (М++Н).
Соединение 326
Метил 7-(2-(((4S,5R)-5-(3,5-бис(трифт6рметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енилУб-метокси-1,2,3,4-тетрагидронафталин-2-карбоксилат
Был синтезирован метил 6-метокси-1,2,3,4-тетрагидронафталин-2-карбоксилат, который является промежуточным соединением, после чего соединение 326 (0,21 г, 65%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 285.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (d, 1H, J=5,0 Гц), 7,73 (d, 2H, J=4,5 Гц), 6,67-6,50 (m, 2H), 5,62-5,58 (m, 1Н), 4,02-3,90 (m, 2H), 3,72-3,41 (m, 7 Н), 2,90-1,78 (m, 10H), 1,46 (m, 2H), 1,28 (m, 5Н), 1,03-0,96 (m, 6H), 0,45 (t, 1,3H, J=5,9 Гц), 0,33 (d, 1,7H, J=6,5 Гц); MS(ESI): 654 (М++Н).
Соединение 327
7-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-6-метокси-1,2,3,4-тетрагидронафталин-2-карбоновая кислота
Соединение 327 (0,07 г, 38,7%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 134.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,73 (d, 2H, J=4,3 Гц), 6,67, 6,66 (2d, 1H, J=2,2, 1,6 Гц), 6,56, 6,51, 6,50 (3s, 1Н), 5,60 (t, 1 Н, J=6,6 Гц), 4,02-3,90 (m, 2H), 3,71, 3,69, 3,68 (3s, 3 Н), 3,62-3,43 (m, 3H), 2,52-1,81 (m, 4H), 1,46 (m, 2H), 1,04, 1,03, 0,99 (3s, 6 Н), 0,48-0,33 (m, 3H); MS(ESI): 640 (М++Н).
Соединение 328
Метил 3-(5-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-2-фтор-4-метоксифенил)-2,2-диметилпропаноат Соединение 328 (1,52 г, 98%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 285.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,76, 7,72 (2s, 2H), 6,67 (dd, 1 Н, J=16,1, 8,6 Гц), 6,53 (dd, 1H, J=14,7, 11,7 Гц), 5,60 (t, 1H, J=7,4 Гц), 3,98-3,84 (m, 2H), 3,72, 3,70 (2s, 3H), 3,64 (s, 3H), 3,54, 3,44 (2d, 1H, J=14,4 Гц), 2,85-2,72 (m, 2H), 2,47-2,41 (m, 1Н), 2,23-2,14 (m, 1Н), 2,00-1,91 (m, 2H), 1,52-1,41 (m, 2H), 1,18-1,12 (m, 6H), 1,05-0,98 (m, 6H), 0,41, 0,31 (2d, 3H, 6,6 Гц); MS (ESI) m/z 674 (М++Н).
Соединение 329
3-(5-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-2-фтор-4-метоксифенил)-2,2-диметилпропанамид
Соединение 329 (23 мг, 23%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 299.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,84 (s, 1Н), 7,73 (d, 1H, J=7,2 Гц), 6,82 (dd, 1H, J=17,7, 8,6 Гц), 6,54 (dd, 1H, J=15,4, 11,6 Гц), 5,68 (brs, 0,47H), 5,59 (dd, 1H, J=8,1, 3,0 Гц), 5,55 (brs, 0,13H), 5,41 (brs, 0,4H), 4,00-3,86 (m, 2H), 3,73, 3,69 (2s, 3H), 3,53, 3,32 (2d, 1H, J=14,6 Гц), 2,88-2,72 (m, 2H), 2,45-1,97 (m, 2H), 1,89 (brs, 2H), 1,50-1,39 (m, 2H), 1,17 (t, 6H, J=9,9 Гц), 1,00 (dd, 6H, J=5,3, 12,1 Гц), 0,44, 0,31 (2d, 3H, J=6,6 Гц); MS (ESI) m/z 659,1 (М++Н).
Соединение 330
Этил 1-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенэтил)циклобутанкарбоксилат
Соединение 330 (0,03 г, 72,2%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 285.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86 (s, 1Н), 7,74 (s, 2H), 7,03 (m, 1Н), 6,79 (m, 2Н), 5,62 (m, 1Н), 4,20-3,90 (m, 4H), 3,75 (m, 3H), 3,60 (m, 1Н), 2,50-1,83 (m, 13 Н), 1,50 (m, 2H), 1,30 (m, 5Н), 1,05 (m, 6H), 0,44 (2d, 3H, J=6,56, 6,52 Гц).
Соединение 331
1-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенэтил)циклобутанкарбоновая кислота
Соединение 331 (3 мг, 10,4%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 286.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,74 (s, 2H), 7,05 (m, 1Н), 6,80 (m, 2Н), 5,62 (m, 1Н), 4,04-3,90 (m, 2H), 3,76 (m, 3H), 3,60 (m, 1Н), 2,50-1,83 (m, 13H), 1,50 (m, 2H), 1,30 (m, 5Н), 1,05 (m, 6H), 0,46 (m, 3H).
Соединение 332
3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксибензонитрил
Соединение 332 (0,2 г, 56,1%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,88 (s, 1Н), 7,75 (m, 2H), 7,59 (m, 1H), 7,29 (m, 1H), 6,95 (m, 1Н), 5,66, 5,60 (2d, 1H, J=8,20, 8,08 Гц), 4,01-4,90 (m, 2Н), 3,85 (m, 3H), 3,52-3,30 (m, 1Н), 2,20-2,04 (m, 2H), 1,52-1,47 (m, 2H), 1,05-0,98 (m, 6H), 1,47 (m, 3H); MS (ESI): 610,1 (М+Н)+.
Соединение 333
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(2Н-тетразол-5-ил)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 333 (0,01 г, 18,6%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 301.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 8,13 (m, 1Н), 7,92-7,72 (m, 4H), 7,03-6,99 (m, 1H), 5,77, 5,62 (2d, 1H, J=8,00, 8,24 Гц), 4,20-4,03 (m, 2Н), 3,86 (m, 3H), 3,12 (m, 1Н), 2,60-2,04 (m, 2H), 1,54-1,41 (m, 2H), 1,05-0,98 (m, 6H), 1,52, 0,46 (2d, 3H, J=6,56, 6,52 Гц); MS (ESI): 610,1 (М+Н)+.
Соединение 334
(4R,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-5-изопропил-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
(1R,2R)-2-амино-1-(3,5-бис(трифторметил)фенил)пропанол был синтезирован по способу, описанному в литературе (Cameron J. Smith et al., J. Med. Chem. 2011 54 4880), после чего соединение 334 (0,11 г, 61,1%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, DMSO-d6); смесь атропоизомеров; δ 7,91 (s, 1Н), 7,79 (s, 2H), 6,74-6,78 (m, 2H), 6,54-6,58 (m, 2H), 5,00 (t, 1 Н, J=5,7 Гц), 3,85-3,94 (m, 1Н), 3,66-3,73 (2s, 3H), 3,44-3,60 (m, 1Н), 3,34-3,50 (m, 1Н), 3,12-3,19 (m, 1Н), 2,12-2,40 (m, 2H), 1,85-2,07 (m, 2H), 1,15-1,45 (m, 2H), 1,20-1,38 (m, 6H), 0,95-1,19 (m, 3H), 0,60-1,00 (m, 6H); MS (ESI) m/z 602 (М++Н).
Соединение 335
(4S,5S)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-5-изопропил-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
(1S,2S)-2-амино-1-(3,5-бис(трифторметил)фенил)пропанол был синтезирован по способу, описанному в литературе (Cameron J. Smith et al., J. Med. Chem. 2011 54 4880), после чего соединение 335 (0,16 г, 86%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,89 (s, 1Н), 7,78 (s, 2H), 6,75 (dd, 1 Н, J=5,6, 8,6 Гц), 6,55 (dd, 1 Н, J=12,2, 3,2 Гц), 4,99 (t, 0H,.J=5,6 Гц), 3,93-3,84 (m, 1Н), 3,73, 3,65 (2s, 3H), 3,59-3,32 (m, 2H), 3,16-3,11 (m, 1Н), 2,34-2,11 (m, 2H), 1,94-1,84 (m, 2H), 1,44-1,25 (m, 2H), 1,22-1,16 (m, 6H), 1,09, 0,98 (2d, 3H, J=6,2 Гц), 0,94 (s, 1,3H), 0,90 (s, 1,7H), 0,77 (s, 1,3H), 0,59 (s, 1,7H); MS (ESI) m/z 602,1 (М++Н). (ratio=1:1,25).
Соединение 336
(4R,5S)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-5-изопропил-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
(1S,2R)-2-амино-1-(3,5-бис(трифторметил)фенил)пропанол был синтезирован по способу, описанному в литературе (Cameron J. Smith et al., J. Med. Chem. 2011 54 4880), после чего соединение 336 (0,09 г, 57%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,73 (s, 2H), 6,81 (2d, 1Н, J=12,64, 12,68 Гц), 6,56 (2d, 1Н, J=12,24, 12,12 Гц), 5,63 (m, 1Н), 4,01-3,90 (m, 2Н), 3,72(m, 3H), 3,56 (m, 1Н), 3,14 (m, 1Н), 2,50-2,00 (m, 2H), 1,92 (m, 2Н), 1,51-1,47 (m, 2Н), 1,20 (m, 6Н), 1,04 (m, 6Н), 0,40 (m, 3H).
Соединение 337
7-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-6-метокси-1,2,3,4-тетрагидронафталин-2-карбоксамид
Соединение 337 (0,03 г, 79,5%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 299.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,73 (d, 2H, J=4,3 Гц), 6,67, 6,66 (2d, 1H, J=2,2, 1,6 Гц), 6,56, 6,51, 6,50 (3s, 1Н), 5,60 (t, 1 Н, J=6,6 Гц), 4,02-3,90 (m, 2H), 3,71, 3,69, 3,68 (3s, 3 Н), 3,62-3,43 (m, 3H), 2,52-1,81 (m, 4H), 1,46 (m, 2Н), 1,04, 1,03 (m, 6Н).
Соединение 338
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(2-метил-2Н-тетразол-5-ил)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 333 (0,03 г, 0,048 ммоль) растворили в ацетонитриле (10 мл). К полученному раствору добавили карбонат калия (7 мг) и йодометан (7 мг), и затем перемешивали при температуре 100°C в течение ночи. По окончанию реакции, реакционную смесь упарили при пониженном давлении для удаления растворителя. Остаток разделили с помощью препаративной тонкослойной хроматографии (PTLC) (SiO2, гексан: этил ацетат=1:1), получив в результате соединение 338 (0,01 г, 39,1%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 8,04 (m, 1Н), 7,85-7,71 (m, 4H), 6,99-6,94 (m, 1H), 5,66, 5,54 (2d, 1Н, J=8,04, 8,04 Гц), 4,40 (m, 3H), 4,03 (m, 2Н), 3,83 (m, 3H), 3,62-3,40 (m, 1Н), 2,53-2,05 (m, 2H), 1,95 (m, 2H), 1,50 (m, 2Н), 1,06 (m, 6Н), 0,38 (m, 3H); MS (ESI): 624,1 (М+Н)+.
Соединение 339
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(1-метил-1Н-тетразол-5-ил)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 339 (0,01 г, 39,1%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 338.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,75 (m, 2H), 7,65-7,48 (m, 2Н), 7,06-7,02 (m, 1Н), 5,63, 5,57 (2d, 1H, J=8,24, 8,04 Гц), 4,21 (m, 3H), 4,10-3,95 (m, 2H), 3,90-3,82 (m, 3H), 3,58-3,35 (m, 1Н), 2,53-2,05 (m, 2H), 1,95 (m, 2H), 1,50 (m, 2Н), 1,06 (m, 6Н), 0,48, 0,44 (2d, 1Н, J=6,60, 6,62 Гц); MS (ESI): 624,1 (М+Н)+.
Соединение 340
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(2-метил-2-(2Н-тетразол-5-ил)пропил)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 340 (0,04 г, 26,7%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 301.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 8,00 (s, 1Н), 7,86, 7,84 (2s, 1Н), 7,73, 7,71 (2s, 1Н), 6,72-6,33 (m, 2H), 5,62, 5,50 (2d, 1H, J=8,0 Гц), 4,37-4,04 (m, 2H), 3,80, 3,66 (2s, 3H), 3,10, 2,83 (2d, 1H, J=15, 8,4 Гц), 2,38-1,89 (m, 4Н), 1,60-1,31 (m, 5Н), 1,03-0,97 (m, 6H), 0,64, 0,38 (2d, 3H, J=6,6 Гц); MS (ESI): 666 (М++Н).
Соединение 341
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(2-метил-2-(2-метил-2Н-тетразол-5-ил)пропил)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 341 (6 мг, 32,6%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 338.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,76, 7,72 (2s, 2 Н), 6,82-6,79 (m, 1Н), 6,68, 6,64 (2d, 1H, J=8,4 Гц), 6,43, 6,41 (2d, 1H, J=2,2 Гц), 5,60, 5,56 (2d, 1H, J=8,2 Гц), 4,27, 4,26 (2s, 3H), 3,93-3,73 (m, 2H), 3,70, 3,68 (2s, 3H), 3,42, 3,35 (2d, 1H, J=14,9 Гц), 3,03-2,85 (m, 2H), 2,48-1,64 (m, 6Н), 1,46-1,20 (m, 5Н), 1,06-0,98 (m, 6H), 0,38, 0,21 (2d, 3H, J=6,5 Гц); MS (ESI): 680 (М++Н).
Соединение 342
трет-Бутил 2-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксибензамидо)ацетат Соединение 37 (0,1 г, 0,17 ммоль) растворили в метиленхлориде (3 мл). К полученному раствору по каплям добавили трет-бутил 2-аминоацетатоНС1 (37 мг, 0,22 ммоль), диизопропилэтиламин (0,09 мл, 0,51 ммоль) и гидроксибензотриазол (46 мг, 0,34 ммоль), и перемешивали при комнатной температуре 10 минут. К реакционной смеси по каплям добавили 1-(3-диметиламинопропил)-3-этилкарбодиимид (66 мг, 0,34 ммоль), и затем смесь перемешивали при комнатной температуре в течение 1 часа. По окончанию реакции, реакционную смесь разбавили метиленхлоридом, и промыли водой и соляным раствором. Органические слои собрали, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (SiO2, 20%-30% Гексан/ EtOAc), получив в результате соединение 342 (0,1 г, 87%) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,82 (d, 1H, J=4,7 Гц), 7,73-7,70 (m, 2,5 Н), 7,65 (dd, 0,5 Н,.J=8,6, 2,3 Гц), 7,53, 7,47 (2d, 1H, J=2,4 Гц), 6,86 (t, 1H, J=8,6 Гц), 6,67-6,60 (m, 1Н), 5,56 (dd, 1H, J=16,3, 8,1 Гц), 4,12-4,03 (m, 2H), 3,99-3,92 (m, 2H), 3,80, 3,77 (2s, 3H), 3,47, 3,32 (2d, 1H, J=14,8 Гц), 2,45-2,00 (m, 2H), 1,90 (brs, 2 Н), 1,48-1,44 (m, 11Н), 1,00 (dd, 6H, J=11,0, 2,3 Гц), 0,41, 0,34 (2d, 3H, J=6,5 Гц); MS (ESI) m/z 699,1 (М++Н).
Соединение 343
трет-Бутил 2-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метокси-N-метилбензамидо)ацетат
Соединение 343 (21 мг, 21%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 112.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,84 (s, 1Н), 7,74 (s, 2H), 7,41-7,34 (m, 1Н), 7,20-7,12 (m, 1Н), 6,86-6,83 (m, 1Н), 5,62, 6,83 (2d, 1H, J=8,1 Гц), 4,13-3,82 (m, 4H), 3,79, 3,77 (2s, 3H), 3,52-3,34 (m, 1Н), 3,05-3,02 (m, 3H), 2,39-2,04 (m, 2H), 1,92 (brs, 2 Н), 1,51-1,45 (m, 11Н), 1,03-1,00 (m, 6H), 0,43, 0,37 (d, 3 Н, J=6,6 Гц); MS (ESI) m/z 713,1 (М++Н).
Соединение 344
(R)-метил 2-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксибензамидо)-3-метилбутаноат
Соединение 344 (96 мг, 81%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 342.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,84 (s, 1Н), 7,73 (s, 2H), 7,71 (dd, 0,5 Н, J=8,6, 2,4 Гц), 7,65 (dd, 0,5 Н, J=8,6, 2,4 Гц), 7,53, 7,48 (2d, 1H, J=2,3 Гц), 6,89 (t, 1 Н, J=8,8 Гц), 6,58-6,54 (m, 1Н), 5,55 (dd, 1 Н, J=19,5, 8,0 Гц), 4,76-4,69 (m, 1Н), 4,01-3,93 (m, 2H), 3,83, 3,80 (2s, 3H), 3,77, 3,74 (2s, 3H), 3,50, 3,33 (2d, 1H, J=15,0 Гц), 2,45-2,21 (m, 2H), 1,93 (brs, 2H), 1,52-1,46 (m, 2H), 1,04-0,89 (m, 12H), 0,41 (t, 3 Н, J=6,7 Гц); MS (ESI) m/z 699,1 (M++Н).
Соединение 345
(R)-метил 2-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метокси-N-метилбензамидо)-3-метилбутаноат
Соединение 345 (50 мг, 55%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 112.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,84 (s, 1Н), 7,74 (d, 2H,J=8,5 Гц), 7,32 (dd, 1 Н, J=8,5, 2,2 Гц), 7,12 (dd, 1H, J=10,5, 2,2 Гц), 6,88-6,53 (m, 1Н), 5,61 (d, 0,5H, J=8,4 Гц), 5,46 (d, 0,5 Н, J=7,2 Гц), 4,08-3,90 (m, 3H), 3,82-3,73 (m, 6H), 3,68-3,36 (m, 2H), 3,01-2,96 (m, 3H), 2,44-2,19 (m, 2H), 1,96-1,87 (m, 2H), 1,53-1,41 (m, 2H), 1,03-0,75 (m, 12H), 0,41, 0,36 (2d, 3H, J=6,5 Гц); MS (ESI) m/z 713,2 (M++H).
Соединение 346
(R)-2-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксибензамидо)-3-метилбутановая кислота
Соединение 346 (21 мг, 48%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 134.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,73 (s, 2H), 7,43-7,37 (m, 1Н), 7,22-7,09 (m, 1Н), 6,90-6,86 (m, 1Н), 5,63-5,48 (m, 1Н), 4,23-3,95 (m, 4H), 3,82, 3,80 (2s, 3H), 3,51-3,32 (m, 1Н), 3,06 (brs, 3 Н), 2,56-2,17 (m, 2H), 1,92-1,87 (m, 2H), 1,49-1,41 (m, 2H), 1,10-0,84 (m, 12H), 0,43, 0,38 (2d, 3H, J=6,0 Гц); MS (ESI) m/z 699,1 (М++Н).
Соединение 347
Метил 3-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-2,2-диметилпропаноат
Соединение 313 (0,03 г, 0,046 ммоль) растворили в диметилформамиде (3 мл). Карбонат калия (8,2 мг) и йодометан (4,0 мкл) добавили по каплям к полученному раствору при комнатной температуре, и перемешивали при комнатной температуре в течение 2 часов. По окончанию реакции, реакционную смесь разбавили этилацетатом, промыли водой и соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении для удаления растворителя. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (SiO2, 5%-20% n-гексан/EtOAc), получив в результате соединение 347 (0,02 г, 75,1%) в виде твердого пенистого вещества белого цвета.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,84 (s, 1Н), 7,77, 7,73 (2s, 2 Н), 6,96-6,93 (m, 1Н), 6,76-6,69 (m, 2H), 5,58 (t, 1 Н, J=8,2 Гц), 3,98-3,84 (m, 2H), 3,72, 3,70 (2s, 3H), 3,63, 3,61 (2s, 3H), 3,55, 3,46 (2d, 1H, J=14,5 Гц), 3,00-2,94 (m, 2H), 2,39-1,81 (m, 11Н), 1,46 (m, 2H), 1,03-0,99 (m, 6H), 0,35, 0,25 (2d, 3H, J=6,5 Гц); 668 (М++Н).
Соединение 348
2-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метокси-N-метилбензамидо)уксусная кислота Соединение 348 (1,4 мг, 8%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 134.
MS (ESI) m/z 657,1 (М++Н).
Соединение 349
Метил 3-(5-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-6-метоксипиридин-3-ил)-2,2-диметилпропаноат
Как показано на реакционной схеме 7, было синтезировано промежуточное соединение 31, после чего соединение 349 (0,28 г, 69,5%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 285.
1H ЯМР (400 МГц, DMSO-d6); смесь атропоизомеров; δ 7,86 (m, 1Н), 7,81, 7,83 (2d, 1H, J=1,77, 1,83 Гц), 7,74-7,75 (m, 2H), 7,02, 7,05 (2d, 1H, J=1,77, 1,77 Гц), 5,60, 5,63 (2d, 1H, J=5,94, 6,00 Гц), 3,91-4,03 (m, 2H), 3,85, 3,88 (2d, 3 Н), 3,64, 3,65 (2s, 3H), 3,46-3,52 (m, 1Н), 2,73-2,80 (m, 2H), 1,90-1,95 (m, 2H), 1,43-1,48 (m, 2H), 1,16-1,20 (m, 6H), 1,01-1,09 (m, 6H), 0,28, 0,49 (2d, 3H, J=4,89, 4,89 Гц); MS (ESI) m/z 657,2 (М++Н).
Соединение 350
3-(5-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-6-метоксипиридин-3-ил)-2,2-диметилпропановая кислота
Соединение 350 (75 мг, 54%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 134.
1H ЯМР (400 МГц, DMSO-d6); смесь атропоизомеров; δ 7,90, 7,90 (2d, 1H, J=2,36, 2,36 Гц), 7,85-7,86 (m, 1Н), 7,73-7,74 (2s, 2 Н), 7,13, 7,15 (2d, 1H, J=2,40, 2,36 Гц), 5,60, 5,64 (2d, 1H, J=8,16, 8,00 Гц), 3,91-4,02 (m, 2H), 3,85-3,88 (2s, 3H), 3,50, 3,55 (2d, 1H, J=14,64, 15,16 Гц), 2,71-2,86 (m, 2H), 2,00-2,53 (m, 2Н), 1,86-1,95 (m, 2H), 1,46-1,49 (m, 2H), 1,12-1,18 (m, 6H), 1,00-1,04 (m, 6H), 0,30, 0,52 (2d, 3H, J=6,52, 6,60 Гц); MS (ESI) m/z 643,2 (М++Н).
Соединение 353
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-хлор-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 353 (1,2 г, 62,6%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 18.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,87 (s, 1Н), 7,75 (m, 2H), 7,20-7,17 (m, 1Н), 6,96 (m, 1H), 6,81, 6,77 (2d, 1Н, J=8,80, 8,80 Гц), 5,65, 5,59 (2d, 1H, J=8,16, 8,24 Гц), 4,01-3,90 (m, 2Н), 3,76(m, 3H), 3,58-3,38 (m, 1Н), 2,50-2,00 (m, 2H), 1,92 (m, 2Н), 1,50-1,40 (m, 2Н), 1,04 (m, 6Н), 0,40 (m, 3H); MS (ESI): 576,0 (М+Н)+.
Соединение 354
трет-Бутил 4-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-5,6-дигидропиридин-1(2Н)-карбоксилат
Соединение 353 (0,1 г, 0,174 ммоль), трет-бутил 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5,6-дигидропиридин-1(2Н)-карбоксилат (0,05 г, 0,17 ммоль), карбонат натрия (0,06 г) и палладий (0,01 г) растворили в смеси диметоксиэтан/вода (0,8 мл, в объемном соотношении 3:1). Полученный раствор перемешивали в микроволновом реакторе при температуре 120°C в течение 30 минут. По окончанию реакции, реакционную смесь охладили до комнатной температуры, разбавили EtOAc, промыли водой и соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении для удаления растворителя. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (SiO2, 10:1 гексан/EtOAc), получив в результате соединение 354 (10 мг, 8%) в виде бесцветного масла.
1H ЯМР (400 МГц, DMSO-d6); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,73 (s, 2H), 7,24 (m, 1H), 7,00 (m, 1Н), 6,85, 6,80 (2d, 1Н, J=8,68, 8,68 Гц), 5,90 (m, 1H), 5,59 (m, 1H), 4,10-3,85 (m, 4H), 3,74 (m, 3H), 3,60-3,40 (m, 3H), 2,60-2,03 (m, 5H), 1,92 (m, 2H), 1,44 (m, 9H), 1,03-1,00 (m, 6H), 0,40 (m, 3H).
Соединение 355
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-(3,6-дигидро-2Н-пиран-4-ил)-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 355 (30 мг, 27,7%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 354.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86 (s, 1Н), 7,73 (s, 2H), 7,25 (m, 1H), 7,02 (m, 1Н), 6,85, 6,81 (2d, 1Н, J=8,60, 8,64 Гц), 6,04-5,96 (m, 1H), 5,61 (m, 1H), 4,32-4,26 (m, 1Н), 4,00-3,48 (m, 5Н), 2,48 (m, 2H), 2,40-2,03 (m, 2Н), 1,94 (m, 2Н), 1,50 (m, 2Н), 1,03-1,00 (m, 6Н), 0,40, 0,33 (2d, 3H, J=6,56, 6,52 Гц).
Соединение 356
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-(гидроксиметил)-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Альдегидное соединение было синтезировано способом, аналогичным способу получения соединения 79. Полученное альдегидное соединение (0,03 г, 0,05 ммоль) и (S)-3-фторпирролидин (5 мг) растворили в метиленхлориде (10 мл). К полученному раствору добавили по каплям уксусную кислоту (30 мкл), и перемешивали в течение 1 часа при комнатной температуре. К реакционной смеси по каплям добавили цианоборгидрид натрия (4 мг). Реакционную смесь перемешивали в течение ночи, разбавили метиленхлорид, промыли насыщенным раствором гидрокарбоната натрия, водой и соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении для удаления растворителя. Остаток разделили с помощью препаративной тонкослойной хроматографии (PTLC) (SiO2, Hx:EA=1:1, получив таким образом "побочный продукт" соединение 356 (0,01 г, 33,2%) в виде твердого пенистого вещества белого цвета.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,73 (m, 2H), 7,24 (m, 1Н), 7,06-6,98 (m, 1Н), 6,87, 6,82 (2d, 1H, J=8,44, 8,40 Гц), 5,59, 5,51 (2d, 1H, J=7,96, 8,16 Гц), 4,62-4,53 (m, 2H), 4,07-3,92 (m, 2H), 3,79-3,74 (m, 3H), 3,56-3,37 (m, 1Н), 2,51-2,05 (m, 2H), 1,93 (m, 2H), 1,53 (m, 2H), 1,05-1,02 (m, 6H), 0,45, 0,34 (2d, 3H, J=6,60, 6,52 Гц).
Соединение 357
Метил 3-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-1,2,4-оксадиазол-5-карбоксилат
Соединение 332 (0,03 г, 0,053 ммоль) растворили в этаноле (20 мл). Карбонат натрия (22 мг) и гидроксиламин (11 мг) добавили по каплям к полученному раствору при комнатной температуре, и перемешивали при температуре 90°C в течение ночи. По окончанию реакции, реакционную смесь охладили до комнатной температуры, и упарили при пониженном давлении для удаления растворителя. Остаток растворили в пиридине (5 мл). Метил 2-хлор-2-оксоацетат (20 мг) добавили по каплям к полученному раствору при комнатной температуре, и перемешивали при температуре 40°C в течение ночи. По окончанию реакции, реакционную смесь охладили до комнатной температуры. Реакционную смесь разбавили EtOAc, промыли насыщенным аммиачным раствором и соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении для удаления растворителя. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (SiO2, Hx:EA=4:1, получив в результате соединение 357 (5 мг, 45%) в виде твердого пенистого вещества белого цвета.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 8,07 (m, 1Н), 7,87 (m, 2H), 7,74 (m, 2H), 7,00, 6,97 (2d, 1H, J=8,64, 8,68 Гц), 5,66, 5,56 (2d, 1H, J=8,12, 8,24 Гц), 4,12 (m, 3H), 4,03 (m, 2H), 3,86 (m, 3H), 3,58-3,36 (m, 1Н), 2,45-2,03 (m, 2H), 1,95 (m, 2H), 1,55-1,46 (m, 2H), 1,06-1,01 (m, 6H), 0,39 (m, 3H).
Соединение 358
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(1,2,3,6-тетрагидропиридин-4-ил)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 354 (0,03 г, 0,042 ммоль) растворили в смеси метанол/раствор HCl. Полученный раствор перемешивали при комнатной температуре в течение ночи. По окончанию реакции, реакционную смесь упарили при пониженном давлении. Остаток разделили с помощью колоночной хроматографии, получив в результате соединение 358 (0,02 г, 77%) в виде твердого вещества желтого цвета.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,99 (m, 1Н), 7,92 (m, 2H), 7,40 (m, 1Н), 7,20-6,98 (m, 2H), 6,10-6,00 (m, 1Н), 5,90-5,80 (m, 1Н), 4,20 (m, 1Н), 3,82-3,78 (m, 5H), 3,60-3,40 (m, 3H), 2,80 (m, 2H), 2,45-1,85 (m, 4H), 1,55-1,46 (m, 2H), 1,09-1,01 (m, 6H), 0,48, 0,38 (2d, 1H, J=5,64, 6,40 Гц).
Соединение 359
Метил 4-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-5,6-дигидропиридин-1(2H)-карбоксилат
Соединение 359 (20 мг, 62,5%) в виде твердого вещества белого цвета было получено способом, аналогичным способу получения соединения 110.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,86 (s, 1Н), 7,73 (s, 2H), 7,24 (m, 1Н), 7,00 (m, 1Н), 6,85, 6,80 (2d, 1H, J=8,68, 8,64 Гц), 6,00-6,84 (m, 1Н), 5,61 (m, 1Н), 4,11-3,90 (m, 4H), 3,80-3,44 (m, 9H), 2,52-1,91 (m, 6H), 1,52-1,45 (m, 2H), 1,06-1,01 (m, 6H), 0,39 (2d, 3H); MS (ESI): 681,1 (М+Н)+.
Соединение 360
(S)-метил 1-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксибензил)пирролидин-2-карбоксилат
Соединение 360 (65 мг, 54%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 356.
MS (ESI) m/z 683,2 (М++Н).
Соединение 361
(R)-метил 2-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксибензиламино)-3-метилбутаноат
Соединение 361 (68 мг, 57%) в виде масла желтого цвета было получено способом, аналогичным способу получения соединения 356.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,84 (s, 1Н), 7,72 (s, 2H), 7,16 (dd, 1 Н, J=8,4, 2,2 Гц), 6,92 (dd, 1 Н, J=7,4, 2,2 Гц), 6,81-6,74 (m, 1Н), 5,60 (dd, 1 Н, J=3,6, 8,1 Гц), 4,03-3,86 (m, 2,5 Н), 3,75-3,68 (m, 7 Н), 3,65-3,41 (m, 2,5 Н), 3,00-2,94 (m, 1Н), 2,45-2,05 (m, 2H), 1,91-1,81 (m, 2H), 1,51-1,42 (m, 2H), 1,03-1,00 (m, 6H), 0,94-0,83 (m, 6H), 0,42, 0,30 (2d, 3H, J=6,6 Гц); MS (ESI) m/z 685,2 (М++Н).
Соединение 362
4-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)циклогекс-3-енекарбоновая кислота
Метил 4-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксоокса-золидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)циклогекс-3-енекарбоксилат, полученный способом, аналогичным способу получения соединения 354, растворили в смеси диоксан/вода (5 мл, в объемном соотношении 2:1). Гидроксид лития (10 мг) добавили по каплям к полученному раствору при комнатной температуре, и перемешивали при комнатной температуре в течение 5 часов. По окончанию реакции, реакционную смесь подкислили с помощью 2 М раствора HCl. Реакционную смесь разбавили EtOAc, промыли водой и соляным раствором. Органические слои собрали, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении для удаления растворителя. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (3:1 гексан:EtOAc), получив в результате соединение 362 (30 мг, 24%) в виде твердого пенистого вещества белого цвета.
1H ЯМР (400 МГц, DMSO-d6); смесь атропоизомеров; δ 7,86 (s, 1Н), 7,73 (s, 2H), 7,21-7,25 (m, 1Н), 6,99-7,00 (m, 1Н), 6,78, 6,83 (2d, 1H, J=8,68, 8,68 Гц), 5,94-6,03 (m, 1Н), 5,58, 5,61 (2d, 1H, J=8,04, 8,20 Гц), 3,91-4,01 (m, 2H), 3,72-3,78 (m, 3H), 3,49, 3,61 (2d, 1H, J=15,08, 14,68 Гц), 2,10-2,70 (m, 5Н), 1,90-1,93 (m, 2H), 1,43-1,53 (m, 2H), 1,01-1,05 (m, 6H), 0,32-0,43 (2d, 3H, J=6,48, 5,76 Гц); MS (ESI) m/z 666 (М++Н).
Соединение 363
(R)-метил 2-((3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксибензил)(метил)амино)-3-метилбутаноат
Соединение 363 (13 мг, 21%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 112.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (d, 1H, 4,9 Гц), 7,72 (s, 2H), 7,16 (d, 1H, J=8,4 Гц), 6,90 (d, 1H, J=2,0 Гц), 6,78 (dd, 1 Н, J=18,2, 8,4 Гц), 5,61-5,57 (m, 1Н), 4,03-3,88 (m, 2H), 3,74-3,69 (m, 6H), 3,65-3,30 (m, 3H), 2,79 (dd, 1 Н, J=7,0, 10,7 Гц), 2,52-2,18 (m, 3H), 2,10-2,01 (m, 3H), 1,92-1,90 (m, 2H), 1,51-1,44 (m, 2H), 1,04-0,95 (m, 9 Н), 0,87-0,81 (m, 3H), 0,40, 0,27 (2d, 3H, J=6,6 Гц); MS (ESI) m/z 699,2 (М++Н).
Соединение 364
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(((R)-2-(трифторметил)пирролидин-1-ил)метил)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 364 (22 мг, 36%) в виде бесцветного масла было получено способом, аналогичным способу получения соединения 356.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,84 (s, 1Н), 7,73 (d, 1 H,J=4,2 Гц), 7,18 (dd, 0,5 Н, J=8,4, 2,1 Гц), 7,10 (dd, 0,5 Н, J=8,3, 2,0 Гц), 6,94, 6,88 (2d, 1H, J=2,0 Гц), 6,77 (d, 1H, J=8,4 Гц), 5,60 (dd, 1 Н, J=14,2, 8,1 Гц), 4,08-3,88 (m, 3H), 3,74, 3,72 (2s, 3H), 3,58, 3,50 (2d, 1H, J=14,8 Гц), 3,42-3,36 (m, 1Н), 3,23-3,18 (m, 1Н), 2,92-2,70 (m, 1Н), 2,47-2,05 (m, 3H), 2,07-1,76 (m, 6H), 1,53-1,43 (m, 2H), 1,03 (d, 6 Н, J=12,1 Гц), 0,37, 0,29 (2d, 3H, J=6,6 Гц); MS (ESI) m/z 693,1 (М++Н).
Соединение 366
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(6-изопропил-3-метоксипиридин-2-ил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Как показано на реакционной схеме 8, 2-бромпиридин-3-ол, в качестве исходного соединения, подвергли нескольким химическим реакциям для получения 2-(2-(этоксикарбонил)-4,4-диметилциклогекс-1-енил)-6-диизопропил-3-метоксипиридин 1-оксида. Полученное соединение подвергли реакции с диизобутилалюминий гидридом (DIBAL-H) и перйодатом Десса-Мартина (DMP), получив таким образом альдегидное соединение. Полученное альдегидное соединение подвергли восстановительному аминированию с помощью аминоспирта, тем самым синтезировав аминоспиртовое соединение. Исходное соединение 2-(2-(этоксикарбонил)-4,4-диметилциклогекс-1-енил)-6-диизопропил-3-метоксипиридин-1-оксид (62 мг, 0,11 ммоль), растворили в метиленхлориде (5 мл). Диизопропиламин (0,11 мл) и трифосген (0,05 г, 0,16 ммоль) добавили по каплям к полученному раствору при комнатной температуре, и перемешивали при комнатной температуре в течение 2 часов. По окончанию реакции, реакционную смесь разбавили EtOAc, промыли водой и соляным раствором, высушили с помощью безводного сульфата магния, отфильтровали, и упарили при пониженном давлении для удаления растворителя. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (12 г силикагеля, 3:1=n-гексан:EtOAc, получив в результате соединение 43 (32 мг, 48,4%) в виде бесцветного масла. Соединение 43 (32 мг, 0,05 ммоль) растворили в этаноле (5 мл). Индий (7 мг) и насыщенный раствор аммиака (4 мл) добавили по каплям к полученному раствору, и перемешивали при температуре 80°C в течение ночи. По окончанию реакции, реакционную смесь охладили до комнатной температуры. Реакционную смесь разбавили EtOAc, промыли водой и соляным раствором, высушили с помощью безводного сульфата натрия, отфильтровали, и упарили при пониженном давлении для удаления растворителя. Остаток разделили с помощью жидкостной хроматографии среднего давления (MPLC) (4 г силикагеля, 1:1=n-гексан:EtOAc, получив в результате соединение 366 (5 мг, 16,1%) в виде бесцветного масла.
1H ЯМР (400 МГц, DMSO-d6); δ 7,85 (s, 1Н), 7,73 (s, 2H), 7,10 (d, 1H, J=8,6 Гц), 7,02 (d, 1H, J=8,5 Гц), 5,54 (d, 1H, J=7,6 Гц), 3,97-4,05 (m, 2H), 3,77 (m, 3H), 3,40 (d, 1H, J=15,0 Гц), 2,94-3,01 (m, 1Н), 2,18-2,48 (m, 2H), 1,95 (m, 2H), 1,41-1,55 (m, 2H), 1,20-1,25 (m, 6H), 0,33 (d, 3 Н, J=6,5 Гц); MS (ESI) m/z 585 (M++H).
Соединение 367
(4S,5R)-5-(3,5-бис(трифт6рметил)фенил)-3-((2-(5-(((S)-3-фторпирролидин-1-ил)метил)-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он
Соединение 367 (10 мг, 30%) в виде твердого пенистого вещества белого цвета было получено способом, аналогичным способу получения соединения 356.
1H ЯМР (400 МГц, CDCl3); смесь атропоизомеров; δ 7,85 (s, 1Н), 7,74 (m, 2H), 7,21-6,95 (m, 2H), 6,82 (2d, 1H, J=8,52, 8,36 Гц), 5,62 (m, 1Н), 5,30-5,03 (m, 1Н), 4,04-3,91 (m, 2H), 3,76 (m, 3H), 3,70-3,42 (m, 3H), 2,82-2,40 (m, 3H), 2,30-1,98 (m, 4H), 1,94 (m, 2H), 1,53-1,44 (m, 2H), 1,05-1,01 (m, 6H), 0,40 (2d, 1H, J=6,56, 6,52 Гц); MS (ESI): 643,1 (М+Н)+.
В таблицах 1-45, приведенных ниже, показаны химические структуры описанных выше соединений 15-367.
Измерение активности соединения по данному изобретению - протоколы экспериментов
С целью проверки действия соединения формулы I по данному изобретению на предотвращение и лечение атеросклероза и гиперлипидемии и его безопасности, были проведены сравнительные тесты с использованием известных материалов в качестве контроля.
Экспериментальный пример 1: In vitro тест на способность к ингибированию переноса холестеринового эфира.
1. Подготовка донора холестеринового эфира
С целью приготовления донора холестеринового эфира для использования в тесте, синтезировали радиомеченый рекомбинантный липопротеин высокой плотности (HDL), содержащий [3H]-холестерил олеат (GE healthcare, TRK886, 3,5 µCi/мг of apoA-1) и apoA-1. Затем в тесте использовали rHDL-агарозу, полученную путем иммобилизации рекомбинантного HDL на CNBr-активированной сефарозной 4B смоле (Amersham Biosciences, Sweden).
2. Тест переноса холестеринового эфира
В качестве источника транспортного белка холестеринового эфира использовали лазму здорового человека, и в качестве рецептора холестеринового эфира спользовали липопротеин низкой плотности (LDL) здорового человека. Каждое из проверяемых соединений разбавили до конечной концентрации 16, 80, 400, 2000 и 0000 нМ и проверяли дважды. Для проверки переноса холестеринового эфира 20 мкл плазмы, 50 мкл LDL (0,25 мг/мл) и 50 мкл rHDL-агарозы (0,25 мг/мл) смешивали друг с другом, после чего добавляли раствор проверяемого соединения и проводили реакцию: при температуре 37°C. После этого, реакционный раствор центрифугировали при температуре 4°C в течение 3 минут, тем самым прекращая реакцию. 150 мкл надосадочной жидкости переносили на 96-луночный планшет для измерения радиоактивности, и измеряли радиоактивность с помощью детектора бета-излучения.
3. Статистическая обработка
Определяли количество [3H]-холестерил олеата, перенесенного от HDL к LDL, и а основе определенного количества рассчитывали значение IC50 для каждого соединения с помощью GraphPad Prism 5.0. Результаты показаны ниже в Таблице 46.


Экспериментальный пример 2: In vitro тест на анти-гиперлипидемическую активность у хомячков
1. Экспериментальные животные
Для использования в эксперименте были приобретены хомячки мужского пола породы «golden syrian» в возрасте 8 недель. Животные содержались при постоянной температуре и влажности с соблюдением 12-ти часового светового цикла и неограниченном доступе к воде и пище.
2. Проверка на анти-гиперлипидемическую активность у хомячков
Животных использовали в эксперименте после акклиматизации в течение 1 недели. В зависимости от веса, животных разделили на несколько групп по 5-8 особей в каждой. Каждому животному вводили орально 3 мг/кг каждого проверяемого соединения (ингибитора СЕТР). Каждое проверяемое соединение суспендировали в жидком носителе, который представлял собой смесь из 5% этанола, 10% солютола и 85% деионизированной воды (DW). Каждое проверяемое соединение, суспендированное в жидком носителе, вводили мышам в течение 5 дней. Контрольной группе вводили только жидкий носитель. Через 4 часа после последнего введения собирали образцы крови посредством сердечной пункции. Собранные образцы крови центрифугировали при 3000 об/мин в течение 15 минут и измеряли концентрацию HDL-холестерина (Biosystem) в отделенной сыворотке с помощью биохимического анализатора (ILab 300 plus, Instrumentation Laboratory).
3. Статистическая обработка
Все результаты отображали как среднее значение ± стандартная погрешность (SEM), и для каждой проверяемой группы и контрольной группы сравнивали с помощью одностороннего теста ANOVA (тест Даннетта, p<0.001) с целью определения эффекта в каждой проверяемой группе. Результаты показаны в Таблице 47 ниже.

Реферат
Изобретение относится к циклоалкениларильным производным формулы 1 или их изомерам, в которых Ви Вкаждый независимо являются N или С, при этом оба Ви Вне могут одновременно являться N, и если один из Ви Вявляется N, то Rили Rотсутствует; Rи Rкаждый независимо являются Н, -F, -OH, -NH, -C(=O)H, -CHOH, -OC-Салкилом, -SC-Салкилом и т.д.; Rи Rвместе с атомами углерода, с которыми они связаны, могут образовывать 5- или 6-членное гетероциклическое ароматическое или неароматическое циклическое соединение, имеющее от 1 до 2 гетероатомов, независимо выбираемых из группы, состоящей из N и О, возможно замещенное R; Rявляется -Н, -F, -ОН, -C-Cалкилом или -OC-Салкилом; Rявляется -H, галогеном, -CN, -NO, -C-Салкилом, -С-Сциклоалкилом, -циклопроп-1-ил-R, -циклопроп-1-ил-C(O)-NRR, -OR, -CHOR, -CHNRR, -SR, -C(=O)R, -COR, -CHRCOR, -C(=O)NRRи т.д; Rявляется -Н; Rявляется -Н или -C-Салкилом; Rявляется -CF; p является целым числом в интервале от 0 до 2; Аи Акаждый независимо являются -О-, -(CRR)- или -NR; Аявляется -(СН)-; X является S или О; m является целым числом в интервале от 0 до 3; n является целым числом в интервале от 0 до 2; q является целым числом в интервале от 1 до 3, в котором упомянутые -C-Салкил, -С-Сциклоалкил или -C-Салкил являются незамещенным или замещенным одним или несколькими заместителями, выбираемыми из группы, состоящей из галогена, -ОН, CN, -СОН, -С(=O)CH, -ОС(=O)СН, -C-Салкила и -Ph. Циклоалкениларильные производные формулы 1 предназначены для получения фармацевтической композиции для предотвращения или лечения дислипидемии и атеросклероза, ассоциированного с дислипидемией, посредством повышения уровня холестерина липопротеинов высокой плотности (HDL-C) и понижения уровня холестерина липопротеинов низкой плотности (LDL-C) путем ингибирования активности СЕТР, включающая циклоалкениларильные производные Формулы 1 или их изомеры вместе с фармацевтически
Формула
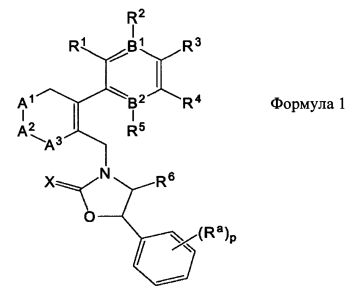
в которых
В1 и В2 каждый независимо являются N или С, при этом оба В1 и В2 не могут одновременно являться N, и если один из В1 и В2 является N, то R2 или R5 отсутствует, R1 и R2 каждый независимо являются Н, -F, -OH, -NH2, -C(=O)H, -CH2OH, -OC1-С6алкилом, -SC1-С6алкилом, -CH2OC1-C6алкилом, -NH(C1-C6алкил), -NH(C=O)(C1-C6алкил), -N(C1-C6алкил)2 или

R1 и R2 вместе с атомами углерода, с которыми они связаны, могут образовывать 5- или 6-членное гетероциклическое ароматическое или неароматическое циклическое соединение, имеющее от 1 до 2 гетероатомов, независимо выбираемых из группы, состоящей из N и О, в котором гетероциклическое ароматическое или неароматическое циклическое соединение может быть возможно замещенным R8,
R3 является -Н, -F, -ОН, -C1-C6алкилом или -OC1-С6алкилом,
R4 является -H, галогеном, -CN, -NO2, -C1-С6алкилом, -С3-С6циклоалкилом,






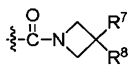







R3 и R4 вместе с атомами углерода, с которыми они связаны, могут образовывать 5- или 6-членное циклоалкильное или гетероциклическое соединение, имеющее от 0 до 2 гетероатомов О,
Ar является С6 моноциклическим ароматическим соединением, которое является замещенным одним или несколькими заместителями, выбираемыми из группы, состоящей из галогена, -ОН и -OC1-С6алкила,
Het является 5- или 6-членным гетероциклическим соединением, содержащим от 0 до 2 двойных связей и от 2 до 4 гетероатомов, независимо выбираемых из группы, состоящей из N, О и С(=O), и может быть незамещенным или может быть возможно замещенным R8,
R5 является -Н,
R6 является -Н или -C1-С6алкилом,
R7 является -Н, галогеном, -C(=O)(C1-С3алкил), -C1-С6алкилом, -OC1-С6алкилом или -С3-С6циклоалкилом,
R8 является -Н, галогеном, -ОН, -CN, -NH2, -NH(С1-С3алкил), -C(=O)NH2, -CO2H,


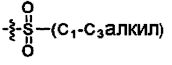



R9 является -Н, -CN, -C1-С6алкилом или -ОС1-С6алкилом,
R10 является -NH(C1-C3алкил), -N(C1-C3алкил)2 или -S(C1-C3алкил),
Z является -СН2- или
Ra является -CF3,
p является целым числом в интервале от 0 до 2,
А1 и А2 каждый независимо являются -О-, -(CR11R12)- или -NR13, в котором R11 и R12 каждый независимо являются -Н, -F или -C1-C6алкилом или R11 и R12 вместе образуют 3- или 4-членное спироциклическое или неароматическое циклическое соединение и R13 является -Н, -C1-С6алкилом, -C(=O)(C1-C6алкил), -CO2(C1-C6алкил), -SO2(C1-C6алкил) или -С3-С6циклоалкилом,
А3 является -(СН2)n-,
X является S или О,
m является целым числом в интервале от 0 до 3,
n является целым числом в интервале от 0 до 2,
q является целым числом в интервале от 1 до 3,
в котором упомянутые -C1-С3алкил, -С3-С6циклоалкил или -C1-С6алкил является незамещенным или замещенным одним или несколькими заместителями, выбираемыми из группы, состоящей из галогена, - ОН, CN, -СО2Н, -С(=O)CH3, -ОС(=O)СН3, -C1-С3алкила и -Ph.
в которых
В1 и В2 каждый независимо являются N или С, при этом оба В1 и В2 не могут одновременно являться N, и если любой из В1 и В2 является N, то R2 или R5 отсутствует,
R1 является -F, -ОН, -NH2, -С(=O)Н, -СН2ОН, -ОСН3, -OCF3, -SCH3, -СН2ОСН3, -NHCH3,

R2 является -Н,
R1 и R2 вместе с атомами углерода, с которыми они связаны, могут образовывать 5- или 6-членное гетероциклическое ароматическое или неароматическое циклическое соединение, имеющее от 1 до 2 гетероатомов, независимо выбираемых из группы, состоящей из N и О, в котором гетероциклическое ароматическое или неароматическое циклическое соединение может быть возможно замещенным R8,
R3 является -Н, -F, -ОН, -СН3, -CF3, -СН2СН3 или -ОСН3,
R4 является -Н, -F, -Cl, -CN, -NO2, -СН3, -СН2СН3, -СН(СН3)2, -С(СН3)3, -CF3, -CH(CF3)2, -CH(CH3)(CF3), -C(OCH3)(CF3)2, -CH(OH)CH3, -C(OH)(CH3)2,
-C(OH)(CF3)2, -циклопропилом,

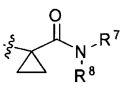




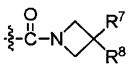



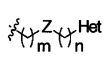



R3 и R4 вместе с атомами углерода, с которыми они связаны, могут образовывать 5- или 6-членное циклоалкильное или гетероциклическое соединение, имеющее от 0 до 2 гетероатомов О,
Ar является С6 моноциклическим ароматическим соединением, которое является замещенным одним или несколькими заместителями, выбираемыми из группы, состоящей из -F, -Cl, -ОН и -ОСН3,
Het выбирают из









R5 является -Н,
R6 является -Н или -СН3,
R7 является -Н, галогеном, -С(=O)(С1-С3алкил), -C1-С6алкилом, -OC1-С6алкилом или -С3-С6циклоалкилом,
R8 является -Н, галогеном, -ОН, -CN, -NH2, -NH(C1-C3алкил), -C(=O)NH2, -CO2H,




R9 является -H, -CN, -C1-С6алкилом или -ОС1-С6алкилом,
R10 является -NH(C1-C3алкил), -N(C1-C3алкил)2 или -S(C1-C3алкил),
Z является -СН2- или

Ra является -CF3,
p равняется 2,
А1 является -СН2-, -С(СН3)2- или -NR13,
А2 является -О-, -(CR11R12)- или -NR13, в котором R11 и R12 каждый независимо являются -Н, -F, -СН3, -CF3, -СН2СН3, -СН(СН3)2 или -С(СН3)3 или R11 и R12 вместе образуют 3- или 4-членное спироциклическое или неароматическое циклическое соединение и R13 является -Н, -СН3, -CF3, -СН2СН3, -СН(СН3)2, -CH2CF3, -С(=O)СН3, -C(=O)CF3, -CO2C(СН3)3, -SO2CH3, -SO2CF3 или
А3 является -(СН2)n-,
X является S или О,
m является целым числом в интервале от 0 до 3,
n является целым числом в интервале от 0 до 2,
q является целым числом в интервале от 1 до 3,
в котором упомянутый -C1-C3алкил, -С3-С6циклоалкил или -C1-С6алкил является незамещенным или замещенным одним или несколькими заместителями, выбираемыми из группы, состоящей из -F, -Cl, -Br, -ОН, -CN, -CO2H, -С(=O)CH3, -ОС(=O)СН3, -С1-С3алкила и -Ph.
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-изопропил-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-тион,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-5-изопропил-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-тион,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-5-изопропил-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-5-изопропил-2-метоксифенил)-5-метилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-5-изопропил-2-метоксифенил)-5-метилциклогекс-1-енил)метил)-4-метилоксазолидин-2-тион,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-5-изопропил-2-метоксифенил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-5-изопропил-2-метоксифенил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-тион,
метил 3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)циклогекс-1-енил)-4-метоксибензоат,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-изопропил-2-метоксифенил)-4,4-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-5-изопропил-2-метоксифенил)-5-(трифторметил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)циклогекс-1-енил)-4-метоксибензальдегид,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-(1-гидроксиэтил)-2-метоксифенил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-(2-гидроксипропан-2-ил)-2-метоксифенил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)циклогекс-1-енил)-4-метоксифенил)-N-метилизобутирамид,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(трифторметил)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((5-трет-бутил-2-(4-фтор-5-изопропил-2-метоксифенил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-(1-гидроксиэтил)-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-(2-гидроксипропан-2-ил)-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-изопропил-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-изопропил-2-метоксифенил)-5-(трифторметил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-5-изопропил-2-метоксифенил)-4,4-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)ацетамид,
N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-N-метилацетамид,
N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-N-метилизобутирамид,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-трет-бутил-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(трифторметокси)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((5,5-дифтор-2-(4-фтор-5-изопропил-2-метоксифенил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
метил 3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил(метил)карбамат,
N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-N-метилметансульфонамид,
N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-3,3,3-трифтор-N-метилпропанамид,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-2-метокси-5-(1,1,1-трифторпропан-2-ил)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)трифторметансульфонамид,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-(1,1,1,3,3,3-гексафтор-2-гидроксипропан-2-ил)-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-(1,1,1,3,3,3-гексафтор-2-метоксипропан-2-ил)-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
(4S,5R)-3-((2-(5-ацетил-4-фтор-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-5-(3,5-бис(трифторметил)фенил)-4-метилоксазолидин-2-он,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-(4,5-дигидрооксазол-2-ил)-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-((R)-4-изопропил-4,5-дигидрооксазол-2-ил)-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
1-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)циклопропанкарбонитрил,
1-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)циклопропанкарбоксамид,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-2-метокси-5-(2,2,2-трифторацетил)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-(циклопропанкарбонил)-4-фтор-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(трифторметил)фенил)-5-(трифторметил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-нитрофенил)-5-(трифторметил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
(4S,5R)-3-((2-(5-амино-2-метоксифенил)-5-(трифторметил)циклогекс-1-енил)метил)-5-(3,5-бис(трифторметил)фенил)-4-метилоксазолидин-2-он,
N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4-(трифторметил)циклогекс-1-енил)-4-метоксифенил)ацетамид,
N-(5-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метокси-2-(трифторметил)фенил)трифтор-N-метилметансульфонамид,
N-(5-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метокси-2-(трифторметил)фенил)-N-метилацетамид,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(метил(4-(трифторметил)тиазол-2-ил)амино)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
N-(5-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-2-фтор-4-метоксифенил)-N-метилацетамид,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-2-метокси-5-(2,2,2-трифторэтокси)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(6-метоксибензо[d][1,3]диоксол-5-ил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
N-(5-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метокси-2-(трифторметил)фенил)-2,2,2-трифтор-N-метилацетамид,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((4-(4-фтор-5-изопропил-2-метоксифенил)-1-метил-1,2,5,6-тетрагидропиридин-3-ил)метил)-4-метилоксазолидин-2-он,
N-(5-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-2-этил-4-метоксифенил)-N-метилацетамид,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-циклопропил-4-фтор-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-5-изопропокси-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
1-((3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)(метил)амино)-2-метил-1-оксопропан-2-ил ацетат,
N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-2-гидрокси-N,2-диметилпропанамид,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((4-(4-фтор-5-изопропил-2-метоксифенил)-1-(трифторметил)-1,2,5,6-тетрагидропиридин-3-ил)метил)-4-метилоксазолидин-2-он,
N-(5-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метокси-2-метилфенил)-N-метилацетамид,
N-(5-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метокси-2-метилфенил)трифтор-N-метилметансульфонамид,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((4-(4-фтор-5-изопропил-2-метоксифенил)-1-(трифторметилсульфонил)-1,2,5,6-тетрагидропиридин-3-ил)метил)-4-метилоксазолидин-2-он,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((4-(4-фтор-5-изопропил-2-метоксифенил)-1-изопропил-1,2,5,6-тетрагидропиридин-3-ил)метил)-4-метилоксазолидин-2-он,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((4-(4-фтор-5-изопропил-2-метоксифенил)-1-(2,2,2-трифторэтил)-1,2,5,6-тетрагидропиридин-3-ил)метил)-4-метилоксазолидин-2-он,
метил 3-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)пропаноат,
3-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)пропановая кислота,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((6-(4-фтор-5-изопропил-2-метоксифенил)спиро[2,5]окт-5-ен-5-ил)метил)-4-метилоксазолидин-2-он,
метил 3-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-2,2-диметилпропаноат,
3-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-2,2-диметилпропановая кислота,
3-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)пропаннитрил,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-2-метокси-5-(1-метилциклопропил)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((6-(4-фтор-2-метокси-5-(1-метилциклопропил)фенил)спиро[2,5]окт-5-ен-5-ил)метил)-4-метилоксазолидин-2-он,
метил 3-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-3-метилбутаноат,
1-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксибензил)циклобутанкарбоновая кислота,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(трифторметил)пиридин-3-ил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
метил 2-(7-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)бензо[d][1,3]диоксол-5-ил)ацетат,
3-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-N,2,2-триметилпропанамид,
метил 1-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксибензил)циклопентанкарбоксилат,
1-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксибензил)циклопентанкарбоновая кислота,
3-(5-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-2-фтор-4-метоксифенил)-2,2-диметилпропанамид,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(2-метил-2Н-тетразол-5-ил)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(2-метил-2-(2Н-тетразол-5-ил)пропил)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(2-метил-2-(2-метил-2Н-тетразол-5-ил)пропил)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
3-(5-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-6-метоксипиридин-3-ил)-2,2-диметилпропановая кислота,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-хлор-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(6-изопропил-3-метоксипиридин-2-ил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он.
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-5-изопропил-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-5-изопропил-2-метоксифенил)-5-метилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
метил 3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)циклогекс-1-енил)-4-метоксибензоат,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-5-изопропил-2-метоксифенил)-5-(трифторметил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(2-метокси-5-(трифторметил)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-изопропил-2-метоксифенил)-5-(трифторметил)циклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
N-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-N-метилацетамид,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(5-трет-бутил-2-метоксифенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-2-метокси-5-(1,1,1-трифторпропан-2-ил)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((6-(4-фтор-5-изопропил-2-метоксифенил)спиро[2,5]окт-5-ен-5-ил)метил)-4-метилоксазолидин-2-он,
3-(3-(2-(((4S,5R)-5-(3,5-бис(трифторметил)фенил)-4-метил-2-оксооксазолидин-3-ил)метил)-4,4-диметилциклогекс-1-енил)-4-метоксифенил)-2,2-диметилпропановая кислота,
(4S,5R)-5-(3,5-бис(трифторметил)фенил)-3-((2-(4-фтор-2-метокси-5-(1-метилциклопропил)фенил)-5,5-диметилциклогекс-1-енил)метил)-4-метилоксазолидин-2-он.
обеспечение вступления соединения нижеследующей Формулы 2 в реакцию Вильсмайера для получения соединения нижеследующей Формулы 3,
обеспечение вступления полученного соединения Формулы 3 в реакцию Сузуки с соединением нижеследующей Формулы 4 в присутствии палладия для получения соединения нижеследующей Формулы 5 и
обеспечение вступления полученного соединения Формулы 5 и соединения нижеследующей Формулы 6 в реакцию восстановления для получения соединения нижеследующей Формулы 7, после этого обеспечение вступления полученного соединения Формулы 7 в реакцию циклообразования:






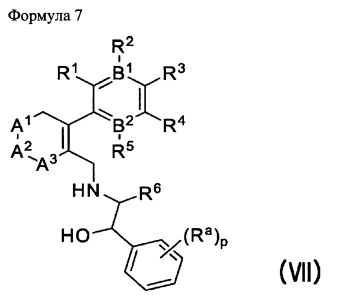
где А1, А2, А3, В1, В2, R1, R2, R3, R4, R5, R6, Ra, p и X соответствуют определению, данному в п. 1, Y является Cl или Br и Q является -В(ОН)2 или

обеспечение вступления соединения нижеследующей формулы 3 и соединения нижеследующей Формулы 6 в реакцию восстановления для получения соединения нижеследующей Формулы 8, после этого обеспечение вступления полученного соединения Формулы 8 в реакцию циклообразования и
обеспечение вступления полученного соединения Формулы 9 в реакцию Сузуки с соединением нижеследующей Формулы 4 в присутствии палладия для получения соединения нижеследующей Формулы 1:




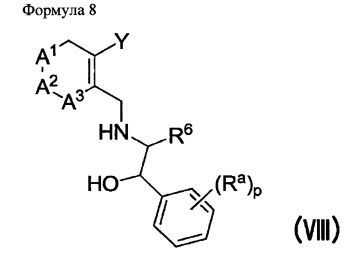

где А1, А2, А3, В1, В2, R1, R2, R3, R4, R5, R6, Ra, p и X соответствуют определению, данному в п. 1, Y является Cl или Br и Q является -В(ОН)2 или




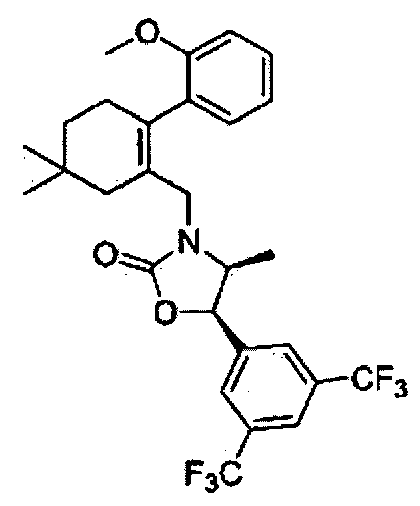






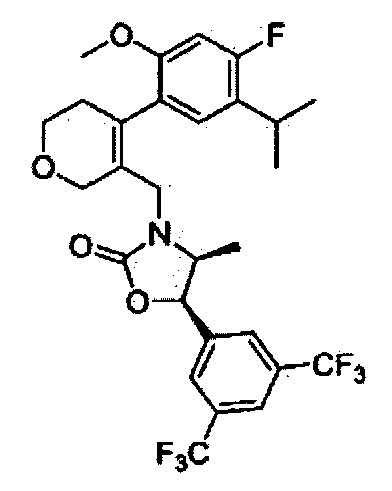

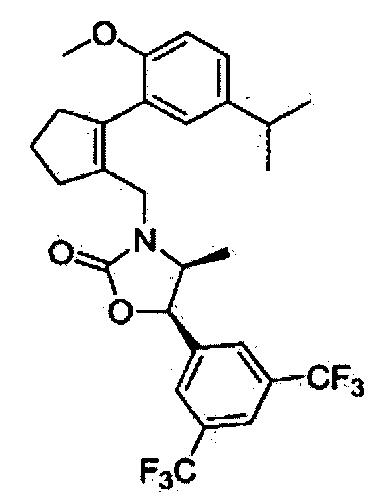






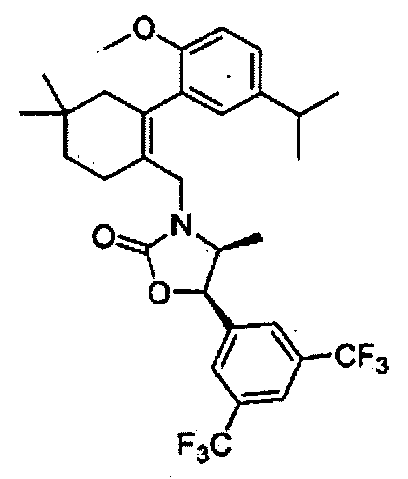




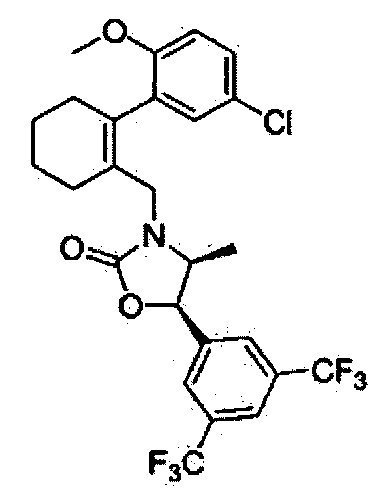
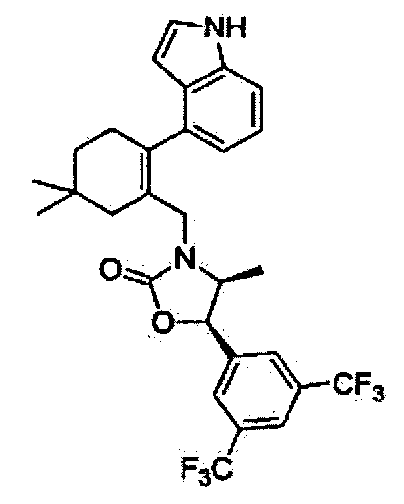






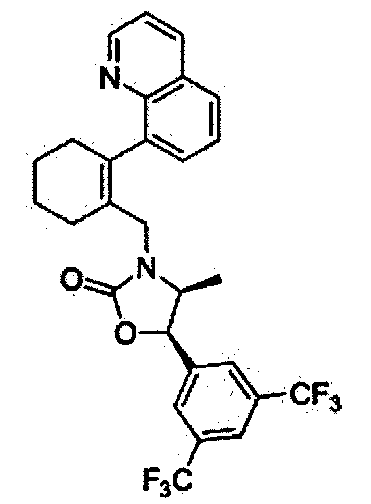


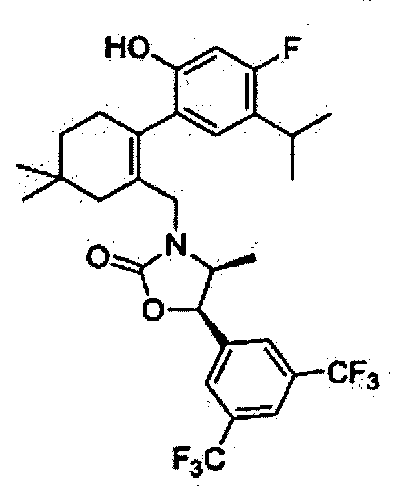











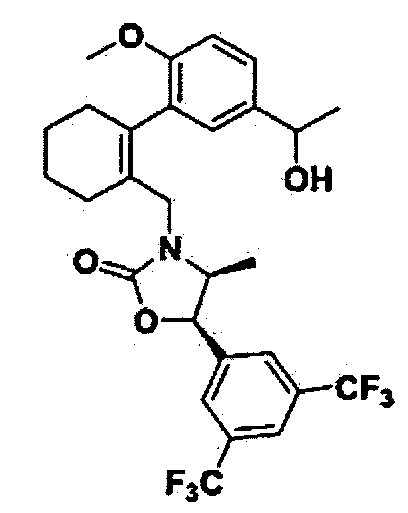



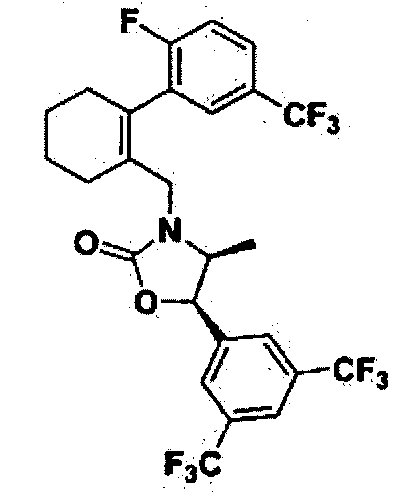


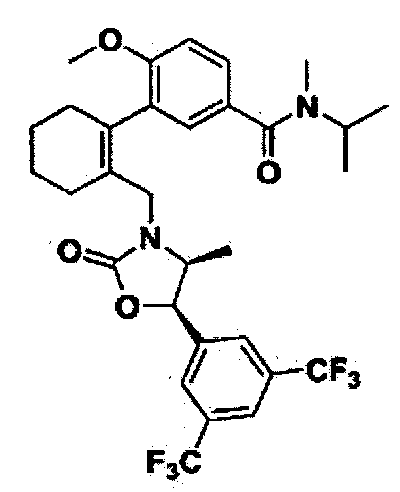



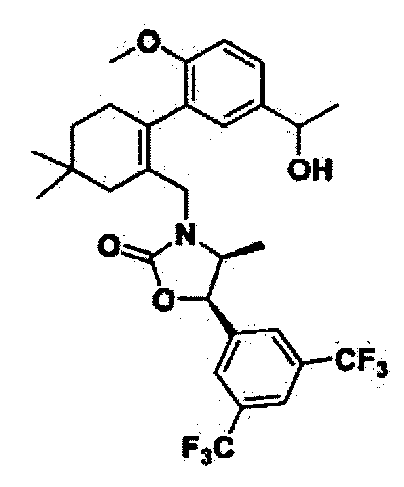










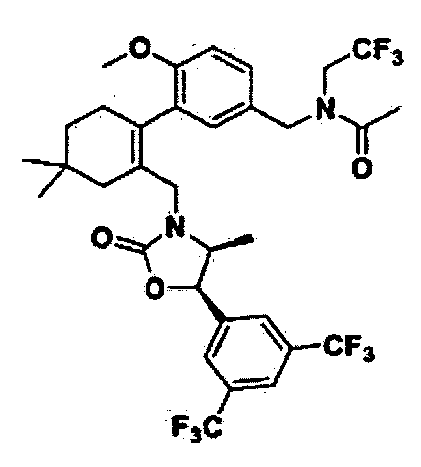










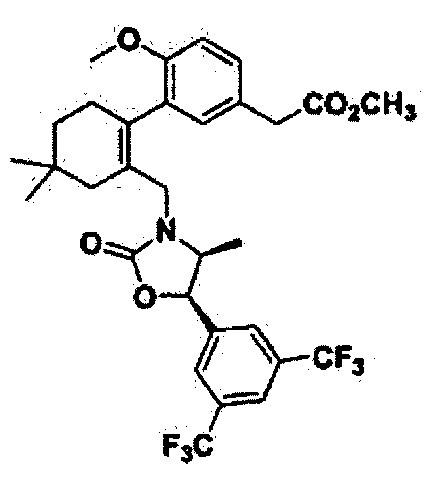










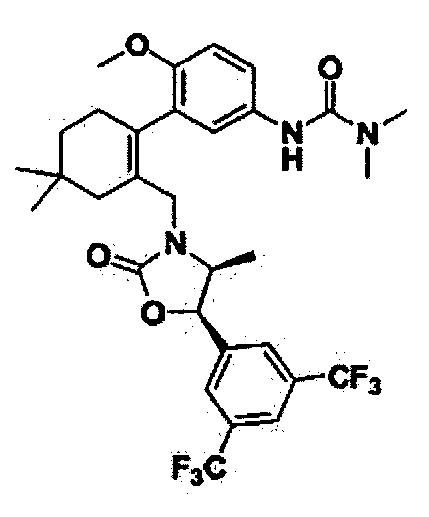












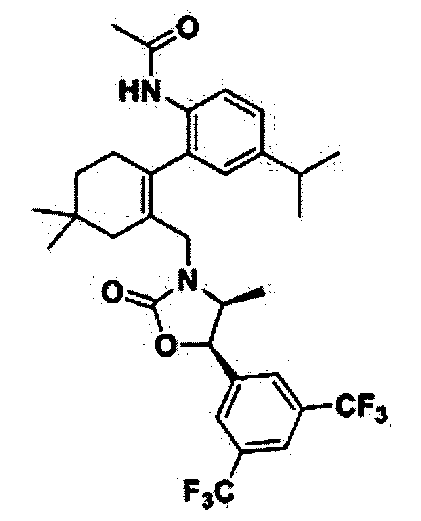

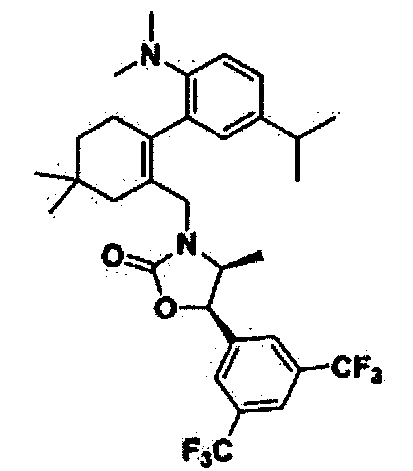







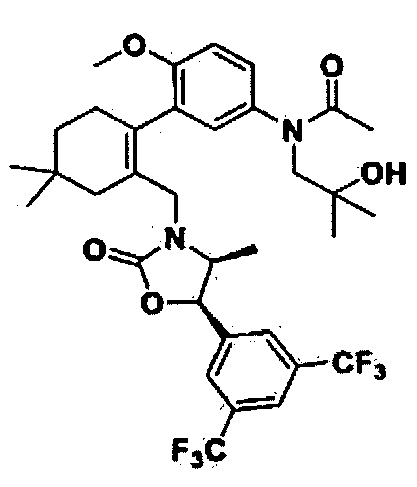






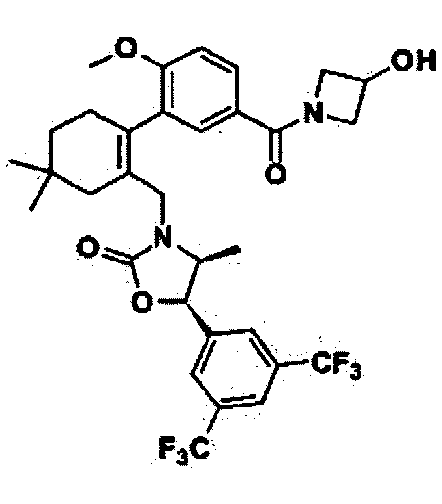

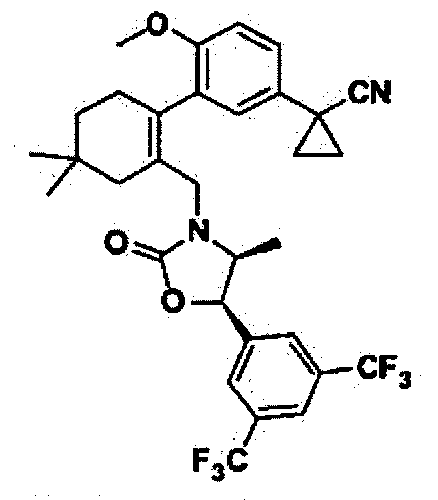
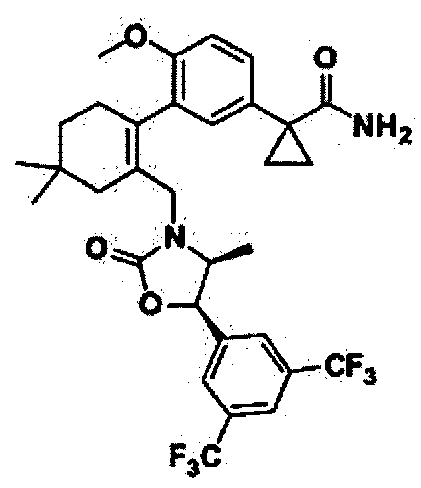





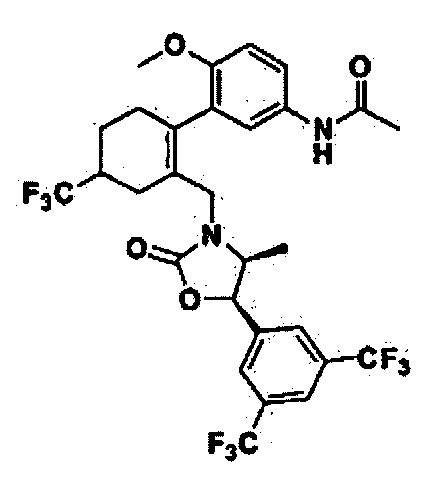


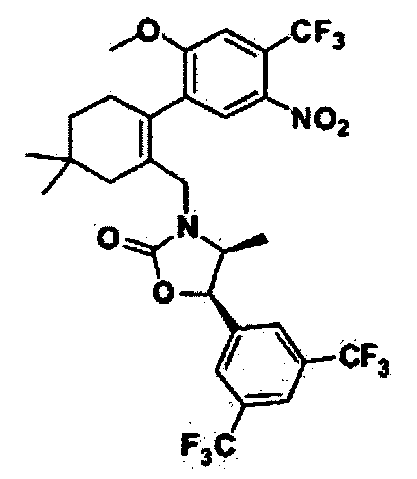







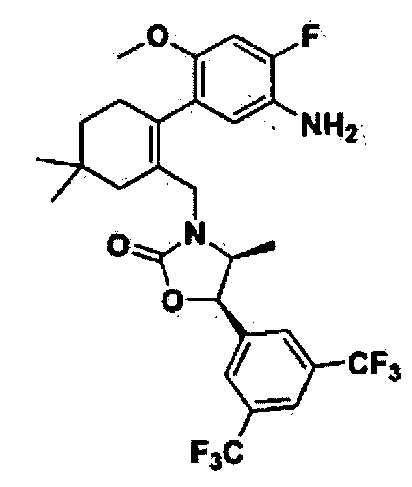



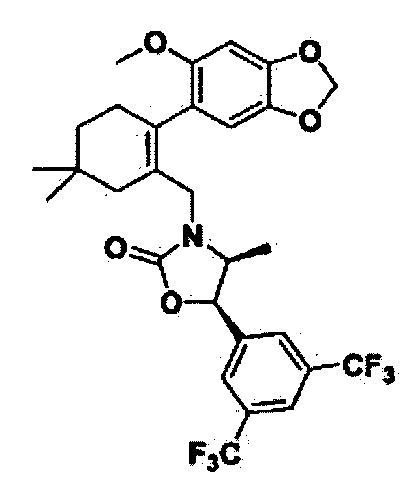


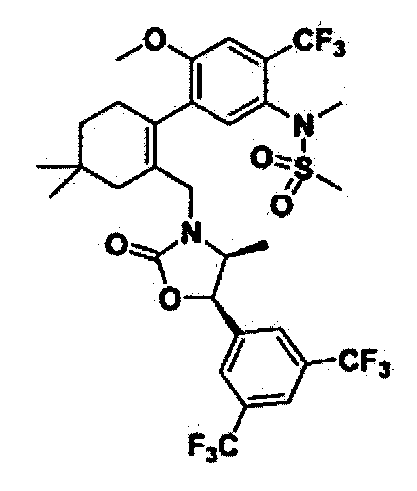


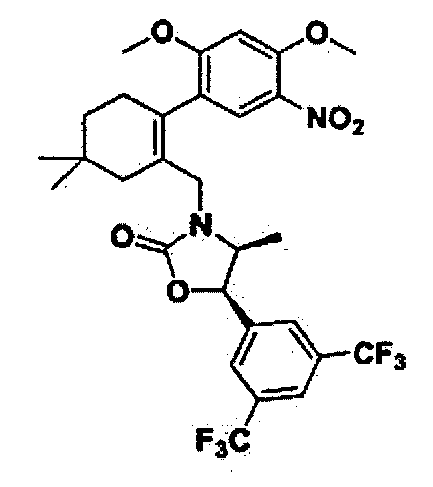













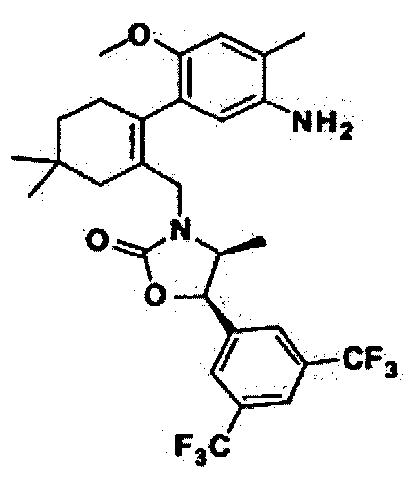











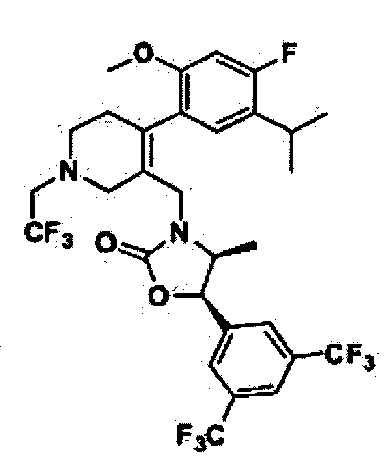





















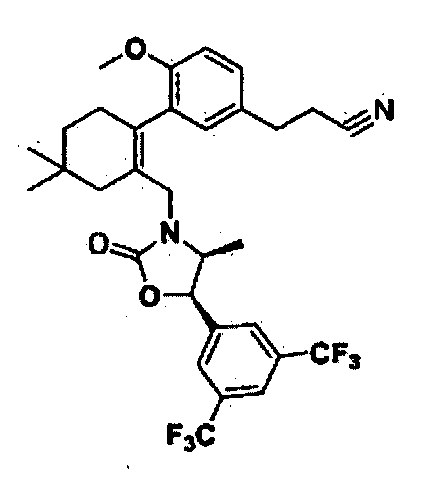

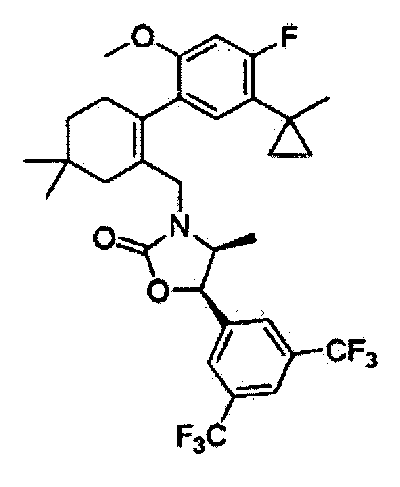




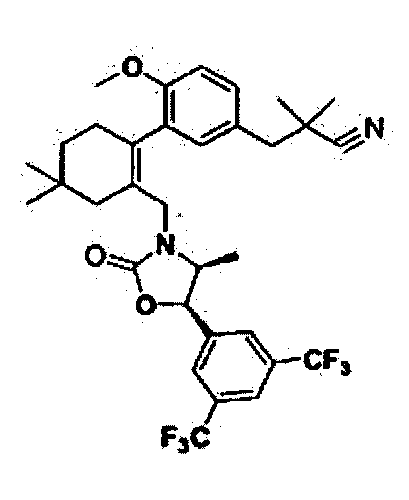





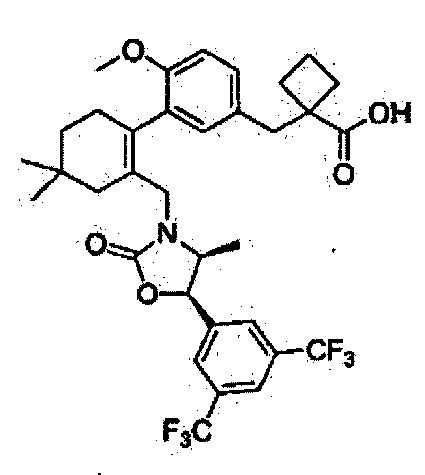




















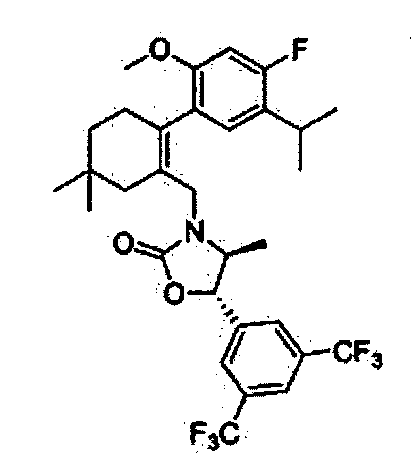
















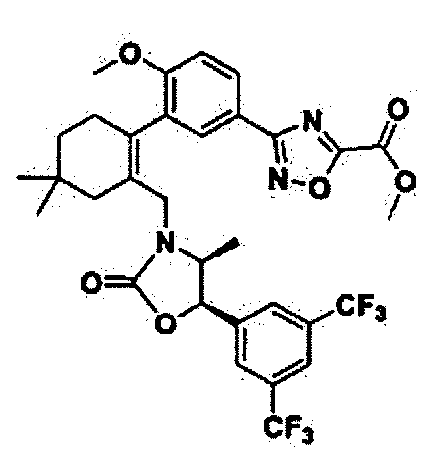
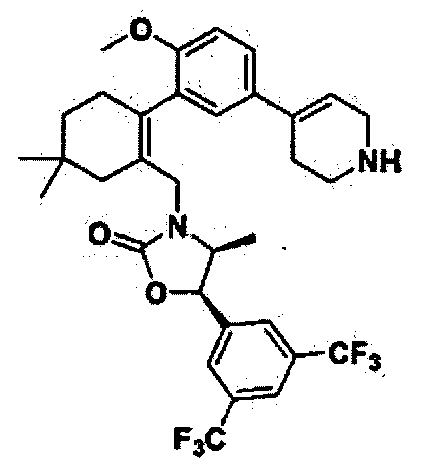
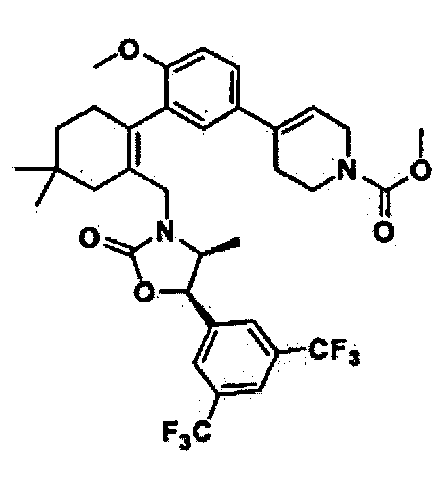
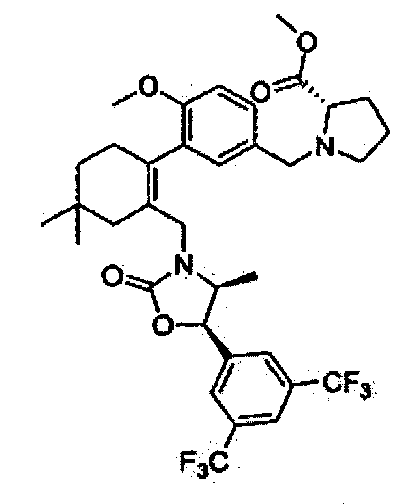







Комментарии