Буферы для стабилизации лентивирусных препаратов - RU2747231C2
Код документа: RU2747231C2
Чертежи








































Описание
Область изобретения
Настоящее изобретение относится к лентивирусным препаратам, проявляющим улучшенную способность к трансдукции и стабильность при хранении, а также к способам экспрессии гетерологичных генов в клетках-мишенях.
Предпосылки изобретения
С прогрессом технологий генной терапии применение терапевтических вирусных векторов представляет собой все более эффективную парадигму лечения заболеваний человека. Среди вирусных векторов, доступных для использования в генной терапии, можно назвать лентивирусные векторы. Такие векторы включают реконструированную вирусную векторную систему, полученную из вируса иммунодефицита человека-1 (ВИЧ-1), с помощью которой интересующий ген можно встраивать в первичные клетки или линии клеток животных и человека. Геномы лентивирусных векторов включают кодирующую цепь РНК, подвергаемую обратной транскрипции в ДНК после проникновения в цитоплазму клетки-хозяина с помощью вирусной обратной транскриптазы таким образом, что образуется преинтеграционный комплекс ДНК. Этот комплекс транспортируется в ядро клетки-хозяина, где затем часть вирусной ДНК встраивается в геном клетки-хозяина. Затем встроенная ДНК может транскрибироваться в РНК, такую как кодирующая белок мРНК, которая, в конечном итоге, может транспортироваться в цитоплазму для последующей экспрессии интересующего белка.
Опосредованную лентивирусными векторами экспрессию генов можно использовать для достижения постоянной и стабильной продукции белка, т.к. интересующий ген встроен в геном клетки-хозяина и, таким образом, реплицируется при делении клетки. Лентивирусные векторы могут эффективно инфицировать неделящиеся клетки, а также клетки, активно проходящие через клеточный цикл. В отличие от этого, другие вирусные векторы, такие как аденовирусные векторы, векторы на основе аденоассоциированных вирусов и классические ретровирусные векторы, способны инфицировать лишь делящиеся клетки. Ткани и клетки, в которых может происходить опосредованная лентивирусными векторами постоянная экспрессия интересующего гена, включают, помимо прочего, головной мозг, печень, мышечные клетки, сетчатку, гемопоэтические стволовые клетки, мезенхимальные стволовые клетки костного мозга и макрофаги.
Получение лентивирусных векторов затруднено из-за нескольких проблем, одной из которых является низкая стабильность векторов. Производство лентивирусных векторов включает несколько стадий: получение, очистку, хранение и применение в переносе генов (Carmo et al., J. Gene Med. 11:670-678, 2009). Лентивирусные векторы восприимчивы к инактивации в течение этих стадий, что может вносить свой вклад в снижение качества конечного продукта и эффективность препарата вектора. В предыдущих исследованиях показано, что одним из механизмов инактивации вирусных векторов является утрата вирусом способности осуществлять обратную транскрипцию (Carmo et al., Hum. Gene Ther. 20:1168-76, 2009; и Carmo et al., J. Gene Med. 10:383-391, 2008). Кроме того, сохраняется потребность в способах стабилизации препаратов лентивирусных векторов для предотвращения необратимой агрегации, которой может сопутствовать утрата инфективности. Кроме того, при очистке лентивирусных векторов из лентивирусного препарата удаляют стабилизирующие компоненты, что может делать вектор все более нестабильным. Таким образом, также существует потребность в лентивирусных составах, поддерживающих стабильность вектора на всем протяжении очистки.
При очистке и хранении векторы зачастую хранят при 4°C (Rodrigues et al., J. Biotechnol. 127:520-541, 2007). Сообщали, что лентивирусные векторы обладают дополнительной потребностью в стабилизирующих компонентах, таких как сывороточный альбумин человека (HSA) (Carmo et al., J. Gene Med. 11:670-678, 2009). Это резко отличает их от гамма-ретровирусов, в случае которых простое добавление экзогенных белков возвращает им стабильность, сравнимую с супернатантом культуры клеток. Липопротеины являются комплексными структурами, состоящими из нескольких липидов, включая холестерин, фосфолипидов и белков (Olson, J. Nutr. 128:S439-S443, 1998). Они действуют как транспортеры липидов в крови вместе с HSA. Возможно, структура липопротеин-HSA образует защитную структуру вокруг мембраны лентивирусных векторов (Carmo et al., J. Gene Med. 11:670-678, 2009). Т.к. известно, что альбумин также тесно связан с поверхностью клеток (Dziarski et al.,J. Biol. Chem. 269:20431-20436, 1994), эти комплексы липопротеин/HSA могут связываться с мембраной вектора, схожей с мембраной клеток. Эта связь может обеспечивать защиту этой структуры и предотвращать конформационные изменения эффективнее, чем HSA в отдельности.
Для обеспечения стабильности при хранении стоки инфективных вирусных векторов, как правило, хранят при низких температурах (например, при -80°C) по причине их комплексности. Предполагают, что вирусы с липидной оболочкой хорошо выживают при температурах ниже -60°C, и что хранение при -20°C или 4°C необходимо использовать, только если "сохранение инфективности вируса не является необходимым" (Gould et al., Mol. Biotechnol. 13:57-66, 1999). Другие исследования показали, что для сохранения инфективности конкретные вирусные векторы необходимо хранить при -70°C или ниже (Harper, Virology Ed. BIOS Scientific Publishers Limited, Oxford, UK, 1993). Как правило, препараты лентивирусных векторов содержат белки, кодируемые вирусным геномом, включая белки оболочки, заключенные в липидную бислойную мембрану. При низких температурах белок может быть склонен к денатурации, а липидный бислой - к утрате структурной целостности. Таким образом, существует потребность в лентивирусных составах, способных повышать стабильность препарата вирусного вектора при низкой температуре в течение длительных периодов времени.
Лентивирусные векторы зачастую держат при этих низких температурах для долговременного хранения, т.к. повторяющееся замораживание и размораживание вирусных векторов может приводить к утрате способности к трансдукции. В связи с этим, сохраняется потребность в лентивирусных препаратах, сохраняющих инфективность после прохождения множества циклов замораживания-размораживания.
В дополнение к стабильности при очистке и хранении, желательно, чтобы лентивирусный вектор, применимый ex vivo, например, для терапии T-клетками с химерным антигенным рецептором (CART), сохранял стабильность при физиологически значимых температурах, таких как 37°C, температуре, при которой лентивирусные векторы можно инкубировать с клетками-хозяевами для осуществления трансдукции. Таким образом, также существует потребность в лентивирусных препаратах, поддерживающих структурную целостность вирусного вектора при переносе генов ex vivo.
В дополнение к указанным выше биологическим аргументам, препараты лентивирусных векторов, сохраняющие стабильность вирусного вектора, дополнительно могут быть применимы с коммерческой точки зрения. Если рекомбинантные лентивирусные векторы хранят при низких температурах в течение избыточных периодов времени, или если рекомбинантный вектор подвергают множеству циклов замораживания-размораживания в рамках эксперимента или производства, биологическая активность значительно снижается. Это приводит к снижению восстановления инфекционных частиц, дополнительно повышая стоимость товара (COG). Кроме того, более высокая склонность векторных частиц к утрате активности может приводить к неточным результатам в доклинических или клинических исследованиях. В клинических условиях использование устройства для хранения при сверхнизкой температуре (например, -60°C или ниже) является дополнительным бременем расходов и логистической проблемой в больницах и других местах оказания медицинской помощи. Как правило, ожидают, что эти учреждения будут иметь устройства для замораживания при сверхнизкой температуре для доставки лекарственного средства. Таким образом, существует потребность в препаратах рекомбинантных лентивирусных векторов, сохраняющих стабильность вектора так, чтобы способствовать эффективности производства, и витальных способах хранения при низкой температуре.
Сущность изобретения
Изобретение относится к водным композициям, каждая из которых включает лентивирусные векторы, буфер 1,4-пиперазиндиэтансульфоновой кислоты (PIPES) и соль.
В различных вариантах осуществления буфер PIPES присутствует в концентрации от приблизительно 10 до приблизительно 50 мМ (например, приблизительно 20 мМ); pH водной композиции составляет от приблизительно 6,0 до приблизительно 7,0 (например, приблизительно 6,5); и/или соль выбрана из группы, состоящей из хлорида натрия, хлорида магния и хлорида кальция. Концентрация соли в водной композиции может составлять, например, от приблизительно 25 мМ до приблизительно 150 мМ (например, приблизительно 50 мМ или приблизительно 75 мМ). В конкретных вариантах осуществления водные композиции включают лентивирусные векторы, 20 мМ PIPES и 75 мМ хлорида натрия и имеют pH приблизительно 6,5.
Водные композиции могут дополнительно включать углевод, например, невосстанавливающий углевод, например, сахарозу или трегалозу. В различных вариантах осуществления углевод присутствует в концентрации от приблизительно 1% до приблизительно 10% (например, от приблизительно 2% до приблизительно 5% или приблизительно 2,5%) по массе на объем водной композиции. В конкретных вариантах осуществления водные композиции включают лентивирусные векторы, 20 мМ PIPES, 75 мМ хлорида натрия и 2,5% сахарозы по массе на объем водной композиции, и водная композиция имеет pH приблизительно 6,5.
В различных вариантах осуществления осмоляльность водных композиций составляет от приблизительно 270 мосмоль/кг до приблизительно 330 мосмоль/кг (например, от приблизительно 275 мосмоль/кг до приблизительно 300 мосмоль/кг, или приблизительно 285 мосмоль/кг), и/или лентивирусные векторы присутствует в концентрации от приблизительно 2×108 единиц трансдукции на миллилитр (TU/мл) до приблизительно 1×109 TU/мл (например, от приблизительно 3×108 TU/мл до приблизительно 5×108 TU/мл).
Лентивирусные векторы могут являться рекомбинантными вирусами иммунодефицита человека (например, ВИЧ-1) и, необязательно, могут включать G-белок вируса везикулярного стоматита (VSV-G) (например, присутствующий на поверхности лентивирусных векторов). Кроме того, лентивирусные векторы могут включать один или несколько трансгенов, включая, например, трансгены, кодирующие белки (например, один или несколько химерных антигенных рецепторов (CAR)).
В различных вариантах осуществления каждый из CAR включает, в направлении с N-конца к C-концу, антигенсвязывающий домен, трансмембранный домен и один или несколько сигнальных доменов. Сигнальные домены могут включать один или несколько первичных сигнальных доменов (например, стимуляторный домен CD3-дзета) и/или один или несколько костимуляторных сигнальных доменов (например, внутриклеточный домен, выбранный из костимуляторного белка, выбранного из группы, состоящей из CD27, CD28, 4-1BB (CD137), OX40, GITR, CD30, CD40, ICOS, BAFFR, HVEM, ICAM-1, лимфоцитарный функциональный антиген-1 (LFA-1), CD2, CDS, CD7, CD287, LIGHT, NKG2C, NKG2D, SLAMF7, NKp80, NKp30, NKp44, NKp46, CD160, B7-H3 и лиганд, специфически связывающийся с CD83.
Антигенсвязывающий домен CAR, необязательно, может являться scFv или включать его. Кроме того, антигенсвязывающий домен, необязательно, может связываться с антигеном, выбранным из группы, состоящей из CD19; CD123; CD22; CD30; CD171; CS-1; лектин-подобной молекулы-1 C-типа, CD33; варианта III рецептора эпидермального фактора роста (EGFRvIII); ганглиозида G2 (GD2); ганглиозида GD3; члена семейства рецепторов ФНО B-клеточного антигена созревания (BCMA); антигена Tn ((Tn Ag) или (GalNAcα-Ser/Thr)); простат-специфического мембранного антигена (PSMA); тирозинкиназа-подобного орфанного рецептора 1 (ROR1); Fms-подобной тирозинкиназы 3 (FLT3); опухоле-ассоциированного гликопротеина 72 (TAG72); CD38; CD44v6; карциноэмбрионального антигена (CEA); эпителиальной молекулы адгезии (EPCAM); B7H3 (CD276); KIT (CD117); субъединицы альфа-2 рецептора интерлейкина-13; мезотелина; альфа-рецептора интерлейкина-11 (IL-11Ra); антигена стволовых клеток простаты (PSCA); сериновой протеазы 21; рецептора 2 фактора роста эндотелия сосудов (VEGFR2); антигена Льюиса (Y); CD24; бета-рецептора тромбоцитарного фактора роста (PDGFR-бета); стадиеспецифичного эмбрионального антигена-4 (SSEA-4); CD20; рецептора фолата альфа; рецепторной тирозиновой протеинкиназы ERBB2 (Her2/neu); муцина 1, ассоциированного с поверхностью клетки (MUC1); рецептор эпидермального фактора роста (EGFR); молекулы адгезии нервных клеток (NCAM); простазы; простатической кислой фосфатазы (PAP); мутантного фактора элонгации 2 (ELF2M); эфрина B2; белка активации фибробластов альфа (FAP); рецептора инсулиноподобного фактора роста 1 (рецептора IGF-I), карбоангидразы IX (CAIX); субъединицы протеасомы (просомы, макропаина), тип бета, 9 (LMP2); гликопротеина 100 (gp100); онкогенного слитого белка, состоящего из кластерного региона точечных разрывов (BCR) и гомолога 1 онкогена вируса мышиного лейкоза Абельсона (Abl) (bcr-abl); тирозиназы; рецептора эфрина 2 типа A (EphA2); фукозил-GM1; сиалилового антигена Льюиса (sLe); ганглиозида GM3; трансглутаминазы 5 (TGS5); высокомолекулярного меланома-ассоциированного антигена (HMWMAA); o-ацетил-GD2-ганглиозида (OAcGD2); рецептора фолата бета; опухолевого эндотелиального маркера 1 (TEM1/CD248); белка, родственного опухолевому эндотелиальному маркеру 7 (TEM7R); клаудина 6 (CLDN6); рецептора тиреотропного гормона (TSHR); сопряженного с G-белком рецептора класса C группы 5, член D (GPRC5D); открытой рамки считывания 61 хромосомы X (CXORF61); CD97; CD179a; киназы анапластической лимфомы (ALK); полисиаловой кислоты; плацента-специфического белка 1 (PLAC1); гексасахаридной части гликоцерамида globoH (GloboH); антигена дифференцировки молочной железы (NY-BR-1); уроплакина 2 (UPK2); клеточного рецептора 1 вируса гепатита A (HAVCR1); адренорецептора бета 3 (ADRB3); паннексина 3 (PANX3); сопряженного с G-белком рецептора 20 (GPR20); комплекса лимфоцитарного антигена 6, локус K 9 (LY6K); обонятельного рецептора 51E2 (OR51E2); белка альтернативной рамки считывания TCR-гамма (TARP); белка опухоли Вильмса (WT1); раково-тестикулярного антигена 1 (NY-ESO-1); раково-тестикулярного антигена 2 (LAGE-1a); меланома-ассоциированного антигена 1 (MAGE-A1); варианта транслокации гена ETS 6, локализованного на хромосоме 12p (ETV6-AML); белка спермы 17 (SPA17); члена 1A семейства X-антигенов (XAGE1); ангиопоэтин-связывающего рецептора поверхности клеток 2 (Tie 2); раково-тестикулярного антигена меланомы-1 (MAD-CT-1); раково-тестикулярного антигена меланомы-2 (MAD-CT-2); Fos-родственного антигена 1; опухолевого белка p53 (p53); мутанта p53; простеина; сурвивина; теломеразы; антигена карциномы предстательной железы-1, антигена меланомы, распознаваемого T-клетками 1; мутантного белка саркомы Rat (Ras); теломеразной обратной транскриптазы человека (hTERT); транслокационного варианта антигена саркомы с точечными разрывами; меланомного ингибитора апоптоза (ML-IAP); ERG (слитого гена трансмембранной протеазы, сериновой 2 (TMPRSS2) ETS); N-ацетил-глюкозамил-трансферазы V (NA17); белка семейства спаренных боксов Pax-3 (PAX3); андрогенового рецептора; циклина B1; нейробластомного гомолога онкогена v-myc вируса миелоцитоматоза птиц (MYCN); члена C семейства гомологов Ras (RhoC); тирозиназа-родственного белка 2 (TRP-2); цитохрома P450 1B1 (CYP1B1); подобного CCCTC-связывающему фактору (белку с цинковыми пальцами) антигена 3 плоскоклеточной карциномы, распознаваемого T-клетками (SART3); белка семейства спаренных боксов Pax-5 (PAX5); проакросин-связывающего белка sp32 (OY-TES1); лимфоцит-специфической тирозиновой протеинкиназы (LCK); якорного белка A-киназы 4 (AKAP-4); белка синовиальной саркомы, X с точечными разрывами 2 (SSX2); рецептора конечных продуктов гликирования (RAGE-1); почечного убиквитинового антигена 1 (RU1); почечного убиквитинового антигена 2 (RU2); легумаина; белка вируса папилломы человека E6 (HPV E6); белка вируса папилломы человека E7 (HPV E7); кишечной карбоксилэстеразы; мутантного белка теплового шока 70-2 (mut hsp70-2); CD79a; CD79b; CD72; лейкоцит-ассоциированного иммуноглобулин-подобного рецептора 1 (LAIR1); рецептора Fc-фрагмента IgA (FCAR или CD89); члена 2 подсемейства A лейкоцитарных иммуноглобулин-подобнобных рецепторов (LILRA2); члена f семейства CD300-подобных молекул (CD300LF); члена A семейства 12 белков с лектиновыми доменами C-типа (CLEC12A); антигена стромальных клеток костного мозга 2 (BST2); EGF-подобного, содержащего модули, муцин-подобного, подобного рецептору гормонов белка 2 (EMR2); лимфоцитарного антигена 75 (LY75); глипикана-3 (GPC3); Fc-рецептор-подобного белка 5 (FCRL5) и подобного иммуноглобулину лямбда полипептида 1 (IGLL1).
В конкретных вариантах осуществления антигенсвязывающий домен связывается с CD19, мезотелином или CD123. В дополнительном конкретном варианте осуществления CAR включает антитело против CD19 или его фрагмент, трансмембранный домен 4-1BB (CD137) и сигнальный домен CD3-дзета.
В различных вариантах осуществления водные композиции не содержат один или несколько (например, все) белки, например, один или несколько (например, все) из белков, выбранных из группы, состоящей из сывороточного альбумина человека (HSA), рекомбинантного сывороточного альбумина человека (rHSA), бычьего сывороточного альбумина (BSA) и липопротеина; и/или лентивирусные векторы получают в клетках, культивируемых в отсутствие сыворотки.
В определенных вариантах осуществления лентивирусные векторы отличаются гидродинамическим радиусом 100±25 нм, как измеряют с помощью динамического рассеяния света (DLS). Например, лентивирусные векторы могут сохранять гидродинамический радиус 100±25 нм в диапазоне температур от 25°C до 55°C.
В определенных вариантах осуществления лентивирусные векторы отличаются полидисперсностью от 10% до 25%. Например, лентивирусные векторы могут сохранять полидисперсность от 10% до 25% в диапазоне температур от 25°C до 55°C.
В различных вариантах осуществления лентивирусные векторы сохраняют концентрацию после 3, 6 или 9 циклов замораживания-размораживания от приблизительно 70% до приблизительно 100% относительно концентрации лентивирусных векторов в водной композиции до циклов замораживания-размораживания, где каждый из циклов замораживания-размораживания включает замораживание водной композиции и последующее размораживание водной композиции при комнатной температуре.
Изобретение также относится к водным композициям, каждая из которых включает лентивирусные векторы, буфер, выбранный из группы, состоящей из фосфатного буфера, буфера цитрата натрия, буфера 2-(N-морфолино)этансульфоновой кислоты (MES), буфера 3-морфолинопропан-1-сульфоновой кислоты (MOPS), и соль (например, хлорид натрия, хлорид магния или хлорид кальция). Эти композиции могут дополнительно включать углевод, например, невосстанавливающий углевод (например, сахарозу или трегалозу).
Настоящее изобретение дополнительно включает высушенные или лиофилизированные композиции, получаемые посредством высушивания или лиофилизации водных композиций, представленных в настоящем описании, а также водные композиции, получаемые посредством восстановления таких высушенных или лиофилизированных композиций в буфере, представленном в настоящем описании (или другом, стандартном средстве для введения).
Настоящее изобретение также включает способы очистки лентивирусных векторов. В этих способах водную композицию, как представлено в настоящем описании, пропускают через фильтр, таким образом, получая водную композицию, по существу, не содержащую микроорганизмы. В различных вариантах осуществления фильтр включает множество пор, например, пор с диаметром приблизительно 0,2 мкм. В различных вариантах осуществления водная композиция, по существу, не содержащая микроорганизмы, включает лентивирусные векторы в концентрации приблизительно 80% относительно концентрации лентивирусных векторов в водной композиции до приведения в контакт.
Изобретение также относится к способам очистки лентивирусных векторов, включающим (a) приведение водной композиции, как представлено в настоящем описании, в контакт с материалом, включающим множество частиц; и (b) отделение веществ, проходящих через материал, от веществ, остающихся в материале, и, таким образом, получение водной композиции, обогащенной лентивирусными векторами.
Кроме того, изобретение относится к способам очистки лентивирусных векторов, включающим приведение водной композиции, как представлено в настоящем описании, в контакт с нуклеазой и, таким образом, получение водной композиции, по существу, не содержащей контаминирующие полинуклеотиды.
Настоящее изобретение также относится к способам экспрессии одного или нескольких трансгенов в клетке, включающим приведение клетки в контакт с водной композиции, как представлено в настоящем описании. В различных вариантах осуществления клетка представляет собой клетку млекопитающего (например, T-клетку, такую как T-клетка человека). В конкретных вариантах осуществления клетка является клеткой 293T, T-клеткой Jurkat или первичной T-клеткой человека.
Настоящее изобретение также включает наборы, включающие водную композицию, как представлено в настоящем описании, и, необязательно, вкладыш в упаковку, например, вкладыш в упаковку с инструкциями для пользователя по использованию набора для экспрессии трансгена в клетке способом, представленным в настоящем описании. Наборы, необязательно, могут дополнительно включать один или несколько реагентов, которые можно использовать для культивирования клеток, как представлено в настоящем описании.
Настоящее изобретение дополнительно включает применение водной композиции, как представлено в настоящем описании, в способах доставки вирусного вектора, необязательно, включающего трансген, в клетку индивидуума, включающее введение композиции индивидууму. Способы профилактики или лечения заболевания или состояний, например, как представлено в настоящем описании, и/или доставки трансгенов (например, генов, кодирующих CARS), например, как представлено в настоящем описании, также включены в настоящее изобретение и могут включать введение композиций, представленных в настоящем описании.
Определения
В рамках изобретения, термин "приблизительно" относится к значению на 10% выше или ниже описываемого значения. Например, значение "приблизительно 50 мМ" означает концентрацию от 45 мМ до 55 мМ.
В рамках изобретения, термин "буфер" относится к смеси слабой кислоты и его сопряженного основания или слабого основания и его сопряженной кислоты. Например, в рамках изобретения, термин "буфер 1,4-пиперазиндиэтансульфоновой кислоты" относится к смеси, включающей 1,4-пиперазиндиэтансульфоновую кислоту и анион 1,4-пиперазиндиэтансульфоната (например, 1,4-пиперазиндиэтансульфоната натрия). Аналогично, в рамках изобретения, термин "буфер цитрата натрия" относится к смеси, включающей цитрат натрия, а также его сопряженную кислоту - лимонную кислоту. Благодаря химическому равновесию, устанавливающемуся между слабой кислотой и ее сопряженным основанием, раствор, содержащий буфер, устойчив к внезапным изменениям pH после добавления в раствор небольших количеств кислоты или основания.
В рамках изобретения, термин "контаминирующий полинуклеотид" относится к полинуклеотиду, полученному не из лентивирусных векторов. Контаминирующие полинуклеотиды могут включать, например, нелентивирусные полинуклеотиды, полученные из клетки, в которой продуцируются лентивирусные векторы, такие как хромосомная ДНК млекопитающего (например, ДНК человека), не включенная в трансген или другой компонент лентивирусных векторов.
В рамках изобретения, термин "цикл замораживания-размораживания" относится к подверганию жидкой смеси, такой как водный раствор или суспензия, воздействию температуры на уровне ее точки замерзания или ниже до замораживания смеси с последующим размораживанием смеси при температуре, превышающей ее точку замерзания. Стадию замораживания можно осуществлять, например, помещая смесь в среду, в которой температура составляет от приблизительно -80°C до приблизительно -20°C. Смесь остается замороженной, например, в течение периода одного или нескольких дней, недель, месяцев или лет перед размораживанием. Стадию размораживания можно осуществлять, подвергая смесь воздействию условий, при которых температура составляет от приблизительно 2°C до приблизительно 8°C, или храня смесь при комнатной температуре (например, температуре окружающей среды в лаборатории или приблизительно 25°C). Альтернативно, размораживание можно осуществлять с использованием водяной бани (например, при 37°C).
В рамках изобретения, термин "гидродинамический радиус" относится к кажущемуся радиусу (Rhв нм) частицы в растворе, как следует из диффузионных характеристик частицы. Гидродинамический радиус вирусной частицы является одним из факторов, определяющих скорость диффузии вирусной частицы в водном растворе, а также способность частицы мигрировать в гелях макромолекул. Гидродинамический радиус вирусной частицы частично определяют по массе и молекулярной структуре каждого из компонентов частицы, а также по ее состоянию гидратации. Способы определения гидродинамического радиуса вирусной частицы хорошо известны в этой области и включают использование динамического рассеяния света и эксклюзионную хроматографию.
В рамках изобретения, термин "невосстанавливающий углевод" относится к углеводу, не существующему в состоянии химического равновесия с альдегидом, и, таким образом, у него отсутствует способность окисляться до карбоновой кислоты под действием катионов переходных металлов, таких как серебро (Ag+) и медь (Cu2+). Неограничивающие примеры невосстанавливающих углеводов включают дисахариды, такие как сахароза, трегалоза и палатинитол, трисахариды, такие как рафиноза и мелецитоза, а также тетрасахариды, такие как стахиоза. Невосстанавливающие углеводы дополнительно включают производные моносахаридов, такие как сорбит, маннит, эритритол и ксилит, производные дисахаридов, такие как лактитол и мальтитол, альдоновые кислоты и их лактоны, такие как глюконовая кислота, γ-лактон глюконовой кислоты, альдаровые кислоты и их лактоны, такие как рибаровая кислота, арабиновая кислота и галактаровая кислота, уроновые кислоты, такие как глюкуроновая кислота, галактуроновая кислота и itiannuronic acid, сложноэфирные производные, такие как октаацетат трегалозы, октаацетат сахарозы и октаацетат целлобиозы, и производные-простые эфиры, в которых гидроксильные группы являются O-алкилированными. Невосстанавливающие углеводы включают углеводы, имеющие D- или L-стереохимическую ориентацию.
В рамках изобретения, термин "осмоляльность" относится к мере осмотического давления растворенных частиц в водном растворе. Растворенные частицы включают ионы, а также неионизированные молекулы. Осмоляльность выражают как концентрацию осмотически активных частиц (т.е. осмоли), растворенных в 1 кг растворителя (т.е. воды). Осмоляльность в настоящем описании выражают в единицах миллиосмолей на 1 кг воды (мосмоль/кг).
В рамках изобретения, термин "процент по массе на объем" или "% масс./об." означает процентную долю массы (в граммах) одного компонента относительно общего объема смеси, содержащей компонент. Например, 500 мг компонента в общем объеме 8 мл составляют 6,25% масс./об., и 500 мг компонента в общем объеме 5 мл составляют 10% масс./об.
В рамках изобретения, термин "полидисперсность" относится к степени гомогенности размеров частиц, таких как лентивирусные частицы, в образце. Более высокая полидисперсность свидетельствует о меньшей гомогенности, а более низкая полидисперсность свидетельствует о более высоком уровне гомогенности. Например, если уровень гомогенности высок, можно считать, что лентивирусные частицы приближены к идентичным размерам и, таким образом, являются монодисперсными. Специалисту в этой области будет понятно, что со снижением полидисперсности уровень гомогенности повышается. В связи с этим, более низкая полидисперсность свидетельствует о более высоком уровне гомогенности. Например, состав с 15% полидисперсности имеет меньшую гомогенность, чем состав с 10% полидисперсности. Если уровень гомогенности низок, популяцию частиц можно считать содержащей значимо отличающиеся размеры и, таким образом, полидисперсной.
В рамках изобретения, термин "scFv" относится к одноцепочечному антителу Fv, в котором вариабельные домены тяжелой цепи и легкой цепи антитела соединены с образованием одной цепи. scFv-фрагменты содержат одну полипептидную цепь, включающую вариабельную область легкой цепи (VL) антитела (например, CDR-L1, CDR-L2 и/или CDR-L3) и вариабельную область тяжелой цепи (VH) антитела (например, CDR-H1, CDR-H2 и/или CDR-H3), разделенные линкером. Линкер, соединяющий области VL и VH scFv-фрагмента, может являться пептидным линкером, состоящим из протеиногенных аминокислот. Можно использовать альтернативные линкеры для повышения устойчивости scFv-фрагмента к протеолитической деградации (например, линкеры, содержащие D-аминокислоты), для повышения растворимости scFv-фрагмента (например, гидрофильные линкеры, такие как полиэтиленгликоль-содержащие линкеры или полипептиды, содержащие повторяющиеся остатки глицина и серина), для улучшения биофизической стабильности молекулы (например, линкер, содержащий остатки цистеина, образующие внутримолекулярные или межмолекулярные дисульфидные связи) или для снижения иммуногенности scFv-фрагмента (например, линкеры, содержащие участки гликозилирования). Молекулы ScFv известны в этой области и описаны, например, в патенте США № 5892019; Flo et al. (Gene 77:51, 1989); Bird et al. (Science 242:423, 1988); Pantoliano et al. (Biochemistry 30:10117, 1991); Milenic et al. (Cancer Research 51:6363, 1991); и Takkinen et al. (Protein Engineering 4:837, 1991). Домены VL и VH молекулы scFv можно получать из одной или нескольких молекул антител. Специалисту в этой области также будет понятно, что вариабельные области молекул scFv по изобретению можно модифицировать таким образом, что они отличаются по аминокислотной последовательности от молекулы антител, из которой их получают. Например, в одном из вариантов осуществления можно осуществлять замены нуклеотидов или аминокислот, приводящие к консервативным заменам или изменениям аминокислотных остатков (например, в CDR и/или каркасных остатках). Альтернативно или дополнительно, осуществляют мутации в аминокислотных остатках CDR для оптимизации связывания антигена известными в этой области способами. ScFv-фрагменты описаны, например, в WO 2011/084714, включенном в настоящее описание в качестве ссылки.
В рамках изобретения, фразы "специфически связывается" и "связывается" относятся к реакции связывания, определяющей для наличия конкретного белка в гетерогенной популяции белков и других биологических молекул, распознаваемых, например, лигандом с характерной особенностью. Лиганд (например, белок, протеогликан или гликозаминогликан), специфически связывающийся с белком, будет связываться с белком с KD менее 500 нМ. Например, лиганд, специфически связывающийся с белком, будет связываться с белком с KD до 500 нМ (например, от 1 пМ до 500 нМ). Лиганд, не проявляющий специфического связывания с белком или его доменом, будет проявлять KD более 500 нМ (например, более 600 нм, 700 нМ, 800 нМ, 900 нМ, 1 мкм, 100 мкм, 500 мкм или 1 мМ) для этого конкретного белка или его домена. Можно использовать множество форматов анализов для определения аффинности лиганда к конкретному белку. Например, для идентификации лигандов, специфически связывающихся с белком-мишенью, общепринято используют твердофазные анализы ELISA. Описание форматов анализов и условий, которые можно использовать для определения связывания конкретного белка, см., например, в Harlow & Lane, Antibodies, A Laboratory Manual, Cold Spring Harbor Press, New York (1988) и Harlow & Lane, Using Antibodies, A Laboratory Manual, Cold Spring Harbor Press, New York (1999).
В рамках изобретения, термин "трансген" может относится к последовательности нуклеиновой кислоты, кодирующей белок или функциональный РНК-продукт, в природе не экспрессирующийся в клетке, в которую встраивают трансген. Альтернативно, трансген может быть гомологичным эндогенному гену клетки, в которую встраивают трансген, но сконструирован для встраивания в геном клетки-мишени так, чтобы изменить геном клетки, в который его встраивают. Например, трансген может быть гомологичным эндогенному гену клетки-мишени, но подлежит встраиванию в участок генома клетки-мишени, отличающийся от локализации природного гена.
В рамках изобретения, термин "G-белок вируса везикулярного стоматита" или "G-белок VSV" относится к выделенному полипептиду, обладающему значительной гомологией по отношению к G-белку вируса везикулярного стоматита. Полипептид обладает значительной гомологией по отношению к G-белку VSV, например, если он проявляет свойства слияния с мембраной G-белка VSV дикого типа. G-белок VSV может являться, например, полноразмерный G-белком VSV или полипептидом, содержащим его фрагменты, при условии, что полипептид сохраняет способность связываться с частицами нуклеиновой кислоты-липида и облегчать трансфекцию.
В рамках изобретения, термин "титр вируса" относится к количеству инфекционных векторных частиц или "единицам трансдукции", приводящему к продукции продукта трансгена в клетке-мишени. Титр вируса можно измерять с помощью функционального анализа, такого как анализ, описываемый в Xiao et al., Exp. Neurobiol. 144:113-124, 1997 или Fisher et al., J. Virol. 70:520-532, 1996, описания которых включены в настоящее описание в качестве ссылки. Альтернативно, титр вируса можно измерять посредством определения количества вирусной ДНК, встраиваемой в геном клетки-хозяина, например, способами полимеразной цепной реакции (ПЦР), известными в этой области.
В рамках изобретения, термин "вирусный вектор" относится к вирусной частице, имеющей способность встраивать молекулу нуклеиновой кислоты в хозяина. "Лентивирусные векторы" включают вирусные векторы, включающие последовательности, полученные из ВИЧ-1. Лентивирусные векторы, несущие экзогенные гены, упаковываются в инфекционную вирусную частицу посредством упаковки вируса с помощью упаковывающих плазмид с использованием конкретных линий клеток. Инфекционная вирусная частица инфицирует клетку для достижения экспрессии экзогенного гена. Термин "рекомбинантный" вирусный вектор относится к вирусному вектору, конструируемому с помощью технологий рекомбинантных генов. Рекомбинантный вирусный вектор можно конструировать известными в этой области способами, такими как трансдукция линии упаковывающих клеток с использованием нуклеиновой кислоты, кодирующей вирусный геном, и последующее выделение новых упакованных вирусных частиц.
Краткое описание чертежей
Фигура 1 является схемой операций, на которой проиллюстрированы стратегии идентификации буферов, с помощью которых можно стабилизировать лентивирусные препараты. Ступенчатый подход (слева) идентификации буфера включает осуществление анализов стабильности, таких как динамическое рассеяние света (DLS), и определение титра лентивируса (в единицах трансдукции, TU) в клетках, трансдуцированных с использованием лентивирусных векторов, необязательно, после одного или нескольких циклов замораживания-размораживания (F/T) для анализа широкого диапазона условий буфера, соли и pH и для постепенной селекции условий, оптимально способствующих стабильности хранения и способности к трансдукции. При параллельном подходе (справа) различные условия получения лентивирусов анализируют одновременно, а затем выбирают условия, наиболее эффективно предотвращающие агрегацию лентивирусов и сохраняющие инфективность, например, для применения в химерном антигенном T-клеточном рецепторе (CART).
Фигура 2 является графиком, на котором показан титр лентивируса (в TU/мл) клеток, трансдуцированных с использованием лентивирусных препаратов, содержащих различные буферы и соли и демонстрирующих диапазон значений pH от 6,0 до 8,0.
Фигура 3 является серией графиков, на которых показаны различные распределения гидродинамического радиуса. Одномодальное монодисперсное распределение (сверху) отличается наличием одного типа, вероятно, являющегося лентивирусным мономером. Одномодальное полидисперсное распределение (в середине), как правило, свидетельствует о наличии множества типов, которые зачастую нельзя разрешать с помощью динамического рассеяния света, и они могут являться проявлением повышенной агрегации лентивирусных частиц относительно одномодального монодисперсного распределения. Полимодальное полидисперсное распределение (внизу) свидетельствует о наличии множества агрегированных типов лентивирусных частиц, которые можно разрешать с помощью динамического рассеяния света.
Фигура 4 является серией графиков, на которых показан эффект повышения температуры в отношении гидродинамического радиуса и полидисперсности лентивирусных препаратов, содержащих гистидиновый буфер.
Фигура 5 является серией графиков, на которых показан эффект повышения температуры в отношении гидродинамического радиуса и полидисперсности лентивирусных препаратов, содержащих буфер PIPES.
Фигура 6 является серией графиков, на которых показан эффект повышения температуры в отношении гидродинамического радиуса и полидисперсности лентивирусных препаратов, содержащих буфер цитрата натрия.
Фигура 7 является серией графиков, на которых показан эффект повышения температуры в отношении гидродинамического радиуса и полидисперсности лентивирусных препаратов, содержащих буфер HEPES.
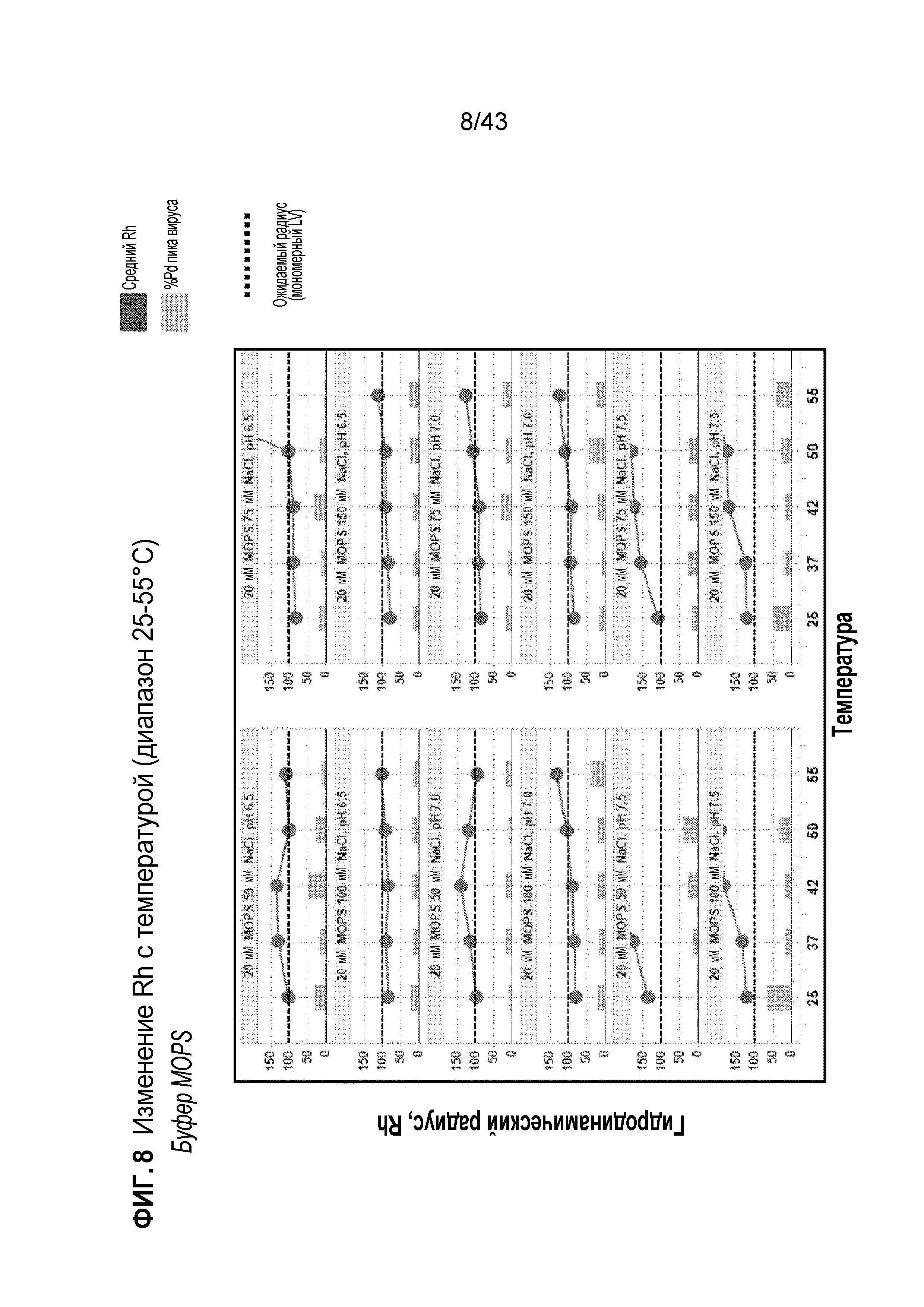
Фигура 8 является серией графиков, на которых показан эффект повышения температуры в отношении гидродинамического радиуса и полидисперсности лентивирусных препаратов, содержащих буфер MOPS.
Фигура 9 является серией графиков, на которых показан эффект повышения температуры в отношении гидродинамического радиуса и полидисперсности лентивирусных препаратов, содержащих буфер MES.
Фигура 10 является серией графиков, на которых показан эффект повышения температуры в отношении гидродинамического радиуса и полидисперсности лентивирусных препаратов, содержащих фосфатный буфер.
Фигура 11 является серией графиков, на которых показан эффект повышения температуры в отношении гидродинамического радиуса и полидисперсности лентивирусных препаратов, содержащих буфер 3-[4-(2-гидроксиэтил)пиперазин-1-ил]пропан-1-сульфоновой кислоты (HEPPS).
Фигура 12 является серией графиков, на которых показан эффект повышения температуры в отношении гидродинамического радиуса и полидисперсности лентивирусных препаратов, содержащих 2-амино-2-гидроксиметил-пропан-1,3-диоловый (Трис) буфер.
Фигура 13 является серией графиков, на которых показан эффект изменений pH и концентрации хлорида натрия в отношении гидродинамических радиусов лентивирусных препаратов, содержащих гистидиновый буфер (сверху, слева), цитратный буфер (сверху, в середине), буфер MOPS (сверху, справа), буфер PIPES (снизу, слева), буфер HEPES (снизу, в середине) или буфер MES (снизу, справа). Условия, помеченные звездочкой, означают значения pH и концентрации соли, приводящие к наиболее высокому титру лентивируса в экспериментах по трансдукции, осуществленных при повышенных температурах (см., например, фигуры 15 и 16).
Фигура 14 является серией графиков, на которых показан эффект изменений pH и концентрации хлорида натрия в отношении гидродинамических радиусов лентивирусных препаратов, содержащих фосфатный буфер (слева), буфер HEPPS (в середине) и буфер Трис (справа). Условия, помеченные звездочкой, означают значения pH и концентрации соли, приводящие к наиболее высокому титру лентивируса в экспериментах по трансдукции, осуществленных при повышенных температурах (см., например, фигуры 17 и 18).
Фигура 15 является серией графиков, на которых показан эффект изменений pH и концентрации хлорида натрия в отношении способности к трансдукции лентивирусных препаратов, содержащих гистидиновый буфер (сверху) или буфер PIPES (снизу), при повышенных температурах 42°C (обозначено как "TU42") и 50°C (обозначено как "TU50"). Представленные значения TU42 и TU50 означают титр лентивируса для клеток, трансдуцированных с использованием указанного лентивирусного препарата при указанной температуре, выраженный как процентная доля титра лентивируса для клеток, трансдуцированных с использованием указанного лентивирусного препарата при 37°C.
Фигура 16 является серией графиков, на которых показан эффект изменений pH и концентрации хлорида натрия в отношении способности к трансдукции лентивирусных препаратов, содержащих цитратный буфер (сверху) или буфер HEPES (снизу), при повышенных температурах 42°C (обозначено как "TU42") и 50°C (обозначено как "TU50"). Представленные значения TU42 и TU50 означают титр лентивируса для клеток, трансдуцированных с использованием указанного лентивирусного препарата при указанной температуре, выраженный как процентная доля титра лентивируса для клеток, трансдуцированных с использованием указанного лентивирусного препарата при 37°C.
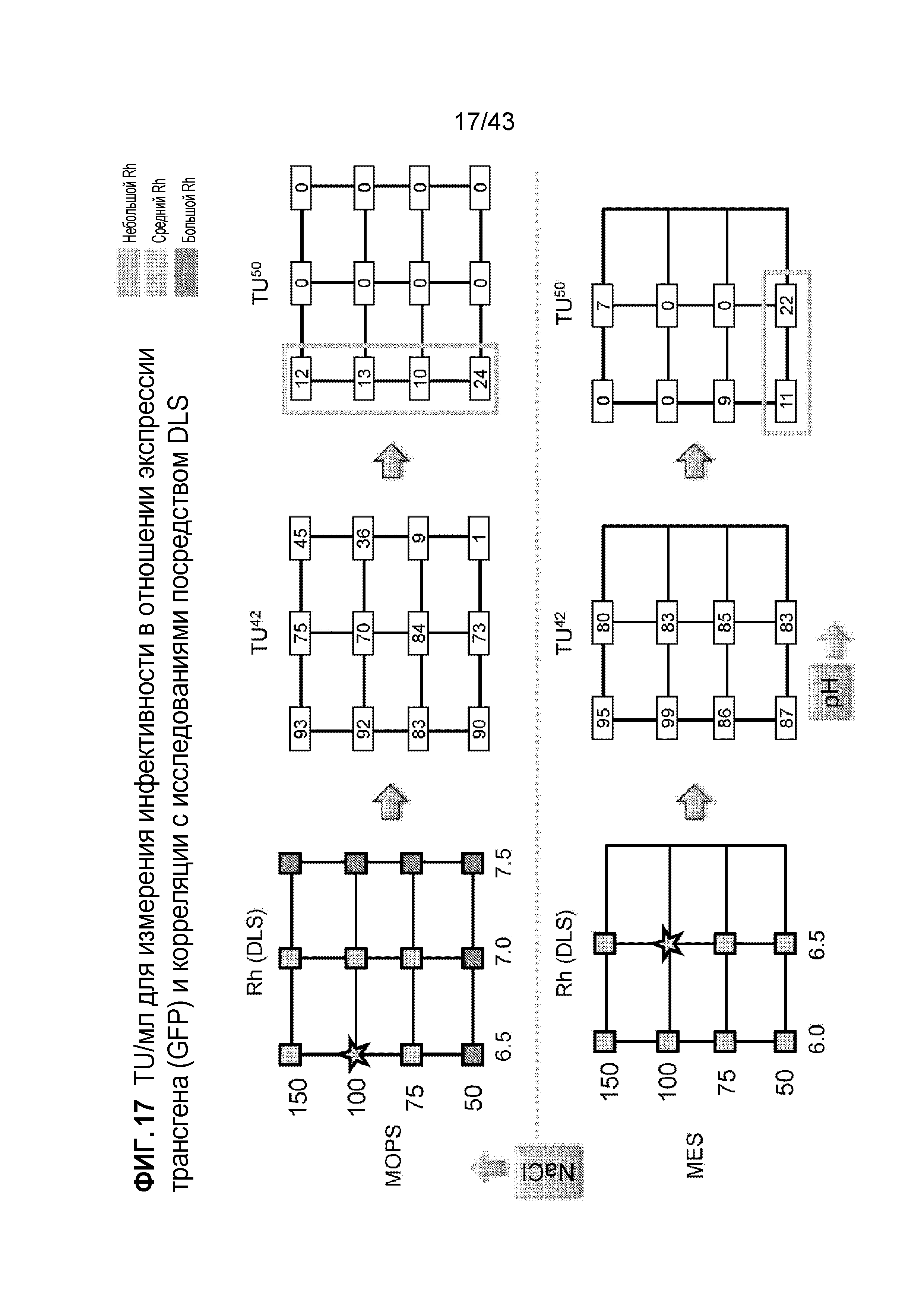
Фигура 17 является серией графиков, на которых показан эффект изменений pH и концентрации хлорида натрия в отношении способности к трансдукции лентивирусных препаратов, содержащих буфер MOPS (сверху) или буфер MES (снизу), при повышенных температурах 42°C (обозначено как "TU42") и 50°C (обозначено как "TU50"). Представленные значения TU42 и TU50 означают титр лентивируса для клеток, трансдуцированных с использованием указанного лентивирусного препарата при указанной температуре, выраженный как процентная доля титра лентивируса для клеток, трансдуцированных с использованием указанного лентивирусного препарата при 37°C.
Фигура 18 является серией графиков, на которых показан эффект изменений pH и концентрации хлорида натрия в отношении способности к трансдукции лентивирусных препаратов, содержащих фосфатный буфер (сверху) или буфер HEPPS (снизу), при повышенных температурах 42°C (обозначено как "TU42") и 50°C (обозначено как "TU50"). Представленные значения TU42 и TU50 означают титр лентивируса для клеток, трансдуцированных с использованием указанного лентивирусного препарата при указанной температуре, выраженный как процентная доля титра лентивируса для клеток, трансдуцированных с использованием указанного лентивирусного препарата при 37°C.
Фигура 19 является серией графиков, на которых показан эффект изменений pH и концентрации хлорида натрия в отношении способности к трансдукции лентивирусных препаратов, содержащих буфер Трис, при повышенных температурах 42°C (обозначено как "TU42") и 50°C (обозначено как "TU50"). Представленные значения TU42 и TU50 означают титр лентивируса для клеток, трансдуцированных с использованием указанного лентивирусного препарата при указанной температуре, выраженный как процентная доля титра лентивируса для клеток, трансдуцированных с использованием указанного лентивирусного препарата при 37°C.
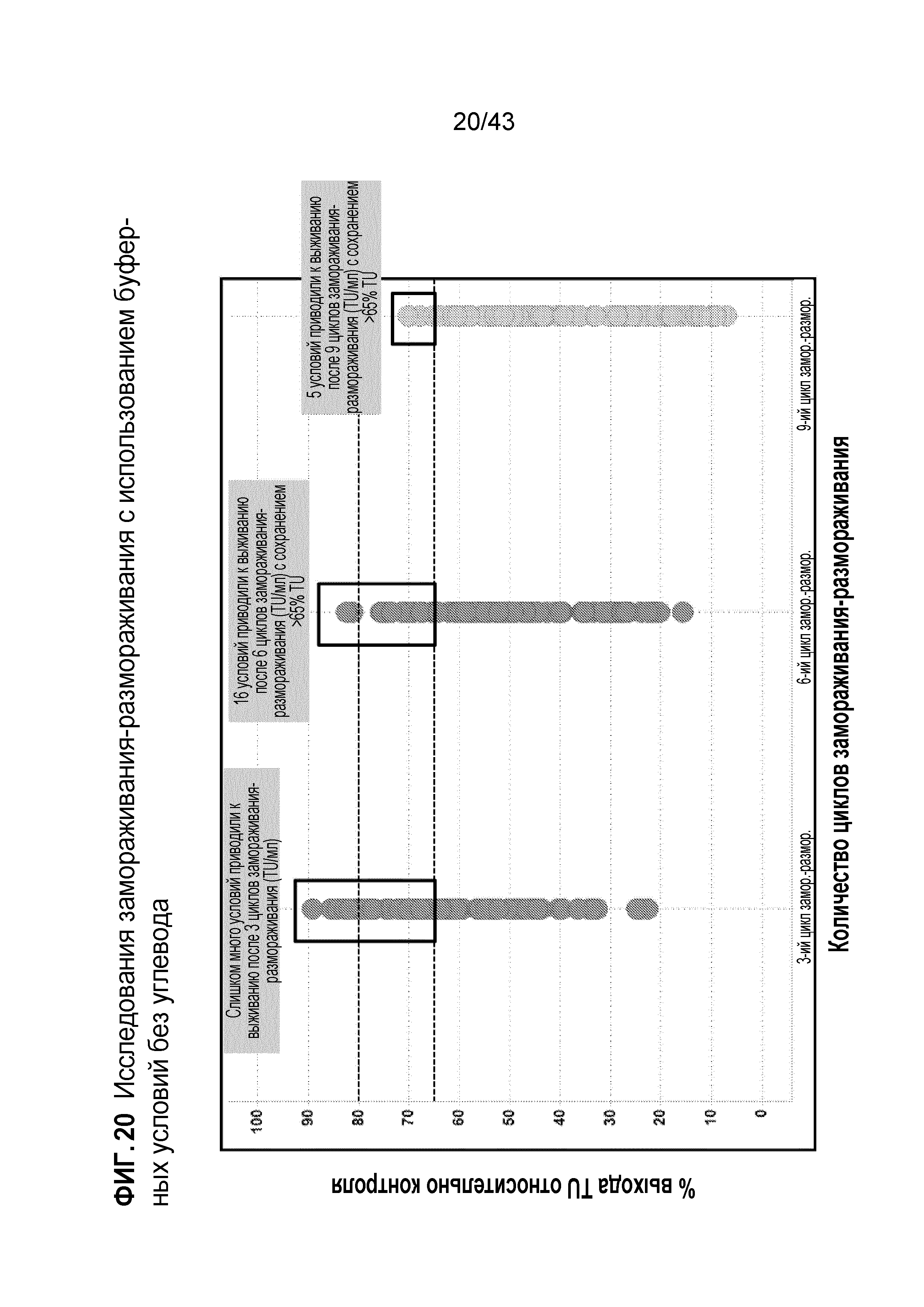
Фигура 20 является графиком, на котором показана способность различных препаратов лентивирусных векторов поддерживать инфективность в отсутствие углевода после 3 (слева), 6 (в середине) или 9 (справа) циклов замораживания-размораживания. Инфективность измеряют как количество единиц трансдукции лентивирусных векторов, присутствующих в каждом препарате после соответствующего количества циклов замораживания-размораживания, в виде процентной доли количества единиц трансдукции в препарате лентивирусных векторов перед первым замораживанием-размораживанием.
Фигура 21 является графиком, на котором показаны относительные инфективности препаратов лентивирусных векторов, подвергаемых скринингу, в отсутствие углевода после 3, 6 или 9 циклов замораживания-размораживания. Инфективность измеряют как количество единиц трансдукции лентивирусных векторов в каждом препарате после соответствующего количества циклов замораживания-размораживания в виде процентной доли количества единиц трансдукции в препарате лентивирусных векторов перед первым замораживанием-размораживанием.
Фигура 22 является таблицей, в которой показаны относительные инфективности препаратов лентивирусных векторов, подвергаемых скринингу, в отсутствие углевода после 3, 6 или 9 циклов замораживания-размораживания. Инфективность измеряют как количество единиц трансдукции лентивирусных векторов, присутствующих в каждом препарате после соответствующего количества циклов замораживания-размораживания, в виде процентной доли количества единиц трансдукции в препарате лентивирусных векторов перед первым замораживанием-размораживанием.
Фигура 23 является таблицей, в которой показаны относительные инфективности выбранных препаратов лентивирусных векторов в отсутствие углевода после 3, 6 или 9 циклов замораживания-размораживания. Инфективность измеряют как количество единиц трансдукции лентивирусных векторов, присутствующих в каждом препарате после соответствующего количества циклов замораживания-размораживания, в виде процентной доли количества единиц трансдукции в препарате лентивирусных векторов перед первым замораживанием-размораживанием.
Фигура 24 является графиком, на котором показана способность препаратов лентивирусных векторов, подвергнутых скринингу, поддерживать инфективность в присутствие углевода после 3, 6 или 9 циклов замораживания-размораживания. Инфективность измеряют как количество единиц трансдукции лентивирусных векторов, присутствующих в каждом препарате после соответствующего количества циклов замораживания-размораживания, в виде процентной доли количества единиц трансдукции в препарате лентивирусных векторов перед первым замораживанием-размораживанием.
Фигура 25 является таблицей, в которой показаны относительные инфективности препаратов лентивирусных векторов, подвергнутых скринингу, в присутствие углевода после 3, 6 или 9 циклов замораживания-размораживания. Инфективность измеряют как количество единиц трансдукции лентивирусных векторов, присутствующих в каждом препарате после соответствующего количества циклов замораживания-размораживания, в виде процентной доли количества единиц трансдукции в препарате лентивирусных векторов перед первым замораживанием-размораживанием.
Фигура 26 является таблицей, в которой показаны относительные инфективности выбранных препаратов лентивирусных векторов в присутствие углевода после 3, 6 или 9 циклов замораживания-размораживания. Инфективность измеряют как количество единиц трансдукции лентивирусных векторов, присутствующих в каждом препарате после соответствующего количества циклов замораживания-размораживания, в виде процентной доли количества единиц трансдукции в препарате лентивирусных векторов перед первым замораживанием-размораживанием.
Фигура 27 является таблицей, в которой показаны относительные инфективности выбранных лентивирусных препаратов в первичных T-клетках. Детали, касающиеся измерения титра лентивируса, представлены в примере 7 ниже.
Фигура 28 является таблицей, в которой представлено сравнение стабильности лентивирусных векторов в буфере PIPES, буфере HEPES и гистидиновом буфере, оцениваемой по степени агрегации, активности при высокой температуре, стабильности при замораживании-размораживании и трансдукции первичных T-лимфоцитов.
Фигура 29 является таблицей, в которой показаны уровни титра лентивируса (% TU), сохраняющегося после очистки в указанных условиях, при использовании буфера PIPES, гистидинового буфера или буфера HEPES.
Фигура 30 является таблицей, в которой показано сохранение титра двух разных лентивирусных векторов (1 и 2), очищенных в буфере на основе PIPES.
На фигуре 31 показан анализ динамического рассеяния света (DLS) статуса агрегации лентивирусных векторов (вектор 1).
На фигуре 32 показан анализ динамического рассеяния света (DLS) статуса агрегации лентивирусных векторов (вектор 2).
Фигура 33 является графиком, на котором показана стабильность лентивирусных векторов (вектор 2) после 0, 7, 14 и 21 дня при 4°C.
Фигура 34 является графиком, на котором показана стабильность лентивирусных векторов (вектор 2) после 1, 3, 6 и 9 циклы замораживания-размораживания.
Подробное описание
Настоящее изобретение основано на открытии того, что лентивирусные препараты, содержащие буфер PIPES, проявляют улучшенные биологические свойства относительно лентивирусных препаратов, содержащих общепринятый буфер для лентивирусного состава, такой как HEPES. Эти улучшенные биологические характеристики включают повышенную устойчивость к агрегации при диапазоне температур и концентраций соли, улучшенную способность к трансдукции при физиологических и повышенных температурах (таких как 42°C и 50°C) и более высокую устойчивость к утрате инфективности при многочисленных циклах замораживания-размораживания. Другие буферы, применимые в комбинации с лентивирусными препаратами по изобретению, включают фосфатные буферы, буферы цитрата натрия, буферы MES и буферы MOPS. Лентивирусные препараты по изобретению, необязательно, могут включать соль, такую как хлорид натрия, и углевод, такой как невосстанавливающий углевод (см. ниже). Как представлено в настоящем описании, лентивирусные векторы для использования с композициями и способами по изобретению могут включать трансген, например, ген, кодирующий трансген, предназначенный для встраивания в хромосомную ДНК клетки-хозяина. Кроме того, лентивирусные препараты, представленные в настоящем описании, можно использовать в комбинации со способами очистки, такими как фильтрация и хроматография, для очистки лентивирусных векторов с улучшенным выходом. Способы по изобретению также включают способы трансдукции клеток-хозяев, таких как клетки млекопитающих (например, T-клетки человека).
Компоненты лентивирусного препарата
Препараты лентивирусных векторов по изобретению могут включать множество компонентов, таких как одна или несколько солей и/или углеводов. Неожиданно, для препаратов лентивирусных векторов, представленных в настоящем описании, не требуется дополнительный белковый компонент для улучшения стабильности вируса. Таким образом, каждую из композиций, представленных в настоящем описании, необязательно, можно охарактеризовывать как несодержащую дополнительные белковые компоненты. Ряд различных типов альбумина тестируют на их способность улучшать стабильность лентивирусных векторов (например, бычий сывороточный альбумин (BSA), сывороточный альбумин человека (HAS) и рекомбинантный HSA (rHSA)). Например, rHSA часто включают в лентивирусные препараты, т.к. его получают в генетически модифицированных дрожжах, и, таким образом, он обеспечивает более высокий уровень безопасности, т.к. он имеет неживотное происхождение (Chuang et al., Pharm. Res. 19:569-577, 2002). Что касается применения по настоящему изобретению, в препаратах лентивирусных векторов можно избегать HSA и схожих белковых компонентов, т.к. они могут мешать аналитической характеризации векторов. Настоящее изобретение частично является уникальным из-за способности буферов, представленных в настоящем описании, придавать стабильность лентивирусным векторам в отсутствие дополнительных белковых компонентов. Как показано, например, на фигуре 2-19, буферы, представленные в настоящем описании, могут предотвращать агрегацию вирусов, способствовать повышенной способности к трансдукции и сохранять инфективность после множества циклов замораживания-размораживания. Композиции, представленные в настоящем описании, необязательно, также можно охарактеризовывать как включающие или не включающие дополнительные углеводные компоненты.
Препараты лентивирусных векторов по изобретению могут являться водными смесями, такими как водные растворы или суспензии. Препараты лентивирусных векторов, необязательно, могут включать соль, такую как хлорид натрия, хлорид магния или хлорид кальция. Соль может присутствовать в водном лентивирусном препарате, например, в концентрации от приблизительно 1 мМ до приблизительно 1 M (например, 1 мМ, 2 мМ, 3 мМ, 4 мМ, 5 мМ, 6 мМ, 7 мМ, 8 мМ, 9 мМ, 10 мМ, 15 мМ, 20 мМ, 25 мМ, 30 мМ, 35 мМ, 40 мМ, 45 мМ, 50 мМ, 55 мМ, 60 мМ, 65 мМ, 70 мМ, 75 мМ, 80 мМ, 85 мМ, 90 мМ, 100 мМ, 125 мМ, 150 мМ, 175 мМ, 200 мМ, 225 мМ, 250 мМ, 275 мМ, 300 мМ, 325 мМ, 350 мМ, 375 мМ, 400 мМ, 450 мМ, 475 мМ, 500 мМ, 525 мМ, 575 мМ, 600 мМ, 625 мМ, 650 мМ, 675 мМ, 700 мМ, 725 мМ, 750 мМ, 775 мМ, 800 мМ, 825 мМ, 850 мМ, 875 мМ, 900 мМ, 925 мМ, 950 мМ, 957 мМ или 1 M). В некоторых вариантах осуществления концентрация соли составляет от приблизительно 25 мМ до приблизительно 250 мМ, от приблизительно 50 мМ до приблизительно 75 мМ, от приблизительно 50 мМ до приблизительно 200 мМ или от приблизительно 100 мМ до приблизительно 150 мМ (например, 25 мМ, 30 мМ, 35 мМ, 40 мМ, 45 мМ, 50 мМ, 55 мМ, 60 мМ, 65 мМ, 70 мМ, 75 мМ, 80 мМ, 85 мМ, 90 мМ, 100 мМ, 125 мМ или 150 мМ). В некоторых вариантах осуществления концентрация соли, при желании, может составлять 50 мМ или 75 мМ.
Препараты лентивирусных векторов, представленные в настоящем описании, могут иметь pH, например, от приблизительно 5,0 до приблизительно 8,0, например, от 6,0 до приблизительно 7,0 (например, 6,0, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9 или 7,0). В некоторых вариантах осуществления pH препарата лентивирусных векторов составляет 6,5.
Препарат лентивирусных векторов по изобретению, необязательно, может содержать углевод, такой как невосстанавливающий углевод, как представлено в настоящем описании. Примеры невосстанавливающих углеводов включают, помимо прочего, сахарозу и трегалозу. При включении в препарат лентивирусных векторов углевод может присутствовать в концентрации, например, от приблизительно 1% до приблизительно 10%, от приблизительно 2,5% до приблизительно 10% или от приблизительно 2,5% до приблизительно 5% по массе на объем (масс./об.) водного лентивирусного препарата. Например, углевод, такой как невосстанавливающий углевод, представленный в настоящем описании, может присутствовать в водном лентивирусном препарате в концентрации 1% масс./об., 1,5% масс./об., 2% масс./об., 2,5% масс./об., 3% масс./об., 3,5% масс./об., 4% масс./об., 4,5% масс./об., 5% масс./об., 5,5% масс./об., 6% масс./об., 6,5% масс./об., 7% масс./об., 7,5% масс./об., 8% масс./об., 8,5% масс./об., 9% масс./об., 9,5% масс./об. или 10% масс./об.
Лентивирусные векторы могут присутствовать в лентивирусном препарате по изобретению в диапазоне концентраций. Например, лентивирусные векторы могут присутствовать в лентивирусном препарате в концентрации, например, от приблизительно 2×108 единиц трансдукции на миллилитр (TU/мл) до приблизительно 1×109 TU/мл (например, 2×108TU/мл, 2,5×108TU/мл, 3×108TU/мл, 3,5×108TU/мл, 4× 108TU/мл, 4,5×108TU/мл, 5×108TU/мл, 5,5×108TU/мл, 6×108TU/мл, 6,5×108TU/мл, 7×108TU/мл, 7,5×108TU/мл, 8×108TU/мл, 8,5×108TU/мл, 9×108TU/мл, 9,5×108TU/мл или 1×109TU/мл). При желании, лентивирусный препарат может содержать лентивирусные векторы в концентрации от приблизительно 3×108 TU/мл до приблизительно 5×108 TU/мл (например, 3×108TU/мл, 3,5×108TU/мл, 4×108TU/мл, 4,5×108TU/мл или 5×108TU/мл).
Экспрессия трансгена
Лентивирусные векторы для применения с композициями и способами по изобретению могут включать трансген, такой как кодирующий белок трансген, предназначенный для встраивания в хромосомную ДНК клетки-мишени. Примеры трансгенов включают трансгены, кодирующие химерный антигенный рецептор (CAR). CAR может включать несколько доменов, таких как антигенсвязывающий домен, трансмембранный домен и один или несколько сигнальных доменов. В этих случаях, сигнальные домены могут содержать один или несколько первичных сигнальных доменов (таких как стимуляторный домен CD3-дзета) и/или один или несколько костимуляторных сигнальных доменов (таких как CD27, CD28, 4-1BB (CD137), OX40, GITR, CD30, CD40, ICOS, BAFFR, HVEM, ICAM-1, лимфоцитарный функциональный антиген-1 (LFA-1), CD2, CDS, CD7, CD287, LIGHT, NKG2C, NKG2D, SLAMF7, NKp80, NKp30, NKp44, NKp46, CD160, B7-H3 или лиганд, специфически связывающийся с CD83.
В конкретных случаях трансген может включать антигенсвязывающий домен (такой как scFv), связывающийся с конкретным белком- или углеводом-мишенью. Примеры антигенов включают CD19, CD123, CD22, CD30, CD171, CS-1, лектин-подобную молекулу-1 C-типа, CD33, вариант III рецептора эпидермального фактора роста (EGFRvIII), ганглиозид G2 (GD2), ганглиозид GD3, член семейства рецепторов ФНО B-клеточного антигена созревания (BCMA), антиген Tn ((Tn Ag) или (GalNAcα-Ser/Thr)), простат-специфический мембранный антиген (PSMA), тирозинкиназа-подобный орфанный рецептор 1 (ROR1), Fms-подобную тирозинкиназу 3 (FLT3), опухоле-ассоциированный гликопротеин 72 (TAG72), CD38, CD44v6, карциноэмбриональный антиген (CEA), эпителиальную молекулу адгезии (EPCAM), B7H3 (CD276), KIT (CD117), субъединицу альфа-2 рецептора интерлейкина-13, мезотелин, альфа-рецептор интерлейкина-11 (IL-11Ra), антиген стволовых клеток простаты (PSCA), сериновую протеазу 21, рецептор 2 фактора роста эндотелия сосудов (VEGFR2), антиген Льюиса (Y), CD24, бета-рецептор тромбоцитарного фактора роста (PDGFR-бета), стадиеспецифичный эмбриональный антигена-4 (SSEA-4), CD20, рецептор фолата альфа, рецепторную тирозиновую протеинкиназу ERBB2 (Her2/neu), муцин 1, ассоциированный с поверхностью клетки (MUC1), рецептор эпидермального фактора роста (EGFR), молекулу адгезии нервных клеток (NCAM), простазу, простатическую кислую фосфатазу (PAP), мутантный фактор элонгации 2 (ELF2M), эфрин B2, белок активации фибробластов альфа (FAP), рецептор инсулиноподобного фактора роста 1 (IGF-I рецептор), карбоангидразу IX (CAIX), субъединицу протеасомы (просомы, макропаина), тип бета, 9 (LMP2), гликопротеин 100 (gp100), онкогенный слитый белок, состоящий из кластерного региона точечных разрывов (BCR) и гомолога 1 онкогена вируса мышиного лейкоза Абельсона (Abl) (bcr-abl), тирозиназу, рецептор эфрина 2 типа A (EphA2), фукозил-M1, сиалиловый антиген Льюиса (sLe), ганглиозид GM3, трансглутаминазу 5 (TGS5), высокомолекулярный меланома-ассоциированный антиген (HMWMAA), o-ацетил-GD2-ганглиозид (OAcGD2), рецептор фолата бета, опухолевый эндотелиальный маркер 1 (TEM1/CD248), белок, родственный опухолевому эндотелиальному маркеру 7 (TEM7R), клаудин 6 (CLDN6), рецептор тиреотропного гормона (TSHR), сопряженный с G-белком рецептор класса C группы 5, член D (GPRC5D), открытую рамку считывания 61 хромосомы X (CXORF61), CD97, CD179a, киназу анапластической лимфомы (ALK), полисиаловую кислоту; плацента-специфический белок 1 (PLAC1), гексасахаридную часть гликоцерамида globoH (GloboH), антиген дифференцировки молочной железы (NY-BR-1), уроплакин 2 (UPK2), клеточный рецептор 1 вируса гепатита A (HAVCR1), адренорецептор бета 3 (ADRB3), паннексин 3 (PANX3), сопряженный с G-белком рецептор 20 (GPR20), комплекс лимфоцитарного антигена 6, локус K 9 (LY6K), обонятельный рецептор 51E2 (OR51E2), белок альтернативной рамки считывания TCR-гамма (TARP), белок опухоли Вильмса (WT1), раково-тестикулярный антиген 1 (NY-ESO-1), раково-тестикулярный антиген 2 (LAGE-1a), меланома-ассоциированный антиген 1 (MAGE-A1), вариант транслокации гена ETS 6, локализованный на хромосоме 12p (ETV6-AML), белок спермы 17 (SPA17), член 1A семейства X-антигенов (XAGE1), ангиопоэтин-связывающий рецептор поверхности клеток 2 (Tie 2), раково-тестикулярный антиген меланомы-1 (MAD-CT-1), раково-тестикулярный антиген меланомы-2 (MAD-CT-2), Fos-родственный антиген 1, опухолевый белок p53 (p53), мутант p53, простеин, сурвивин, теломеразу, антиген карциномы предстательной железы-1, антиген меланомы, распознаваемый T-клетками 1, мутантный белок саркомы Rat (Ras), теломеразную обратную транскриптазу человека (hTERT), транслокационный вариант антигена саркомы с точечными разрывами, меланомный ингибитор апоптоза (ML-IAP), ERG (слитый ген трансмембранной протеазы, сериновой 2 (TMPRSS2) ETS), N-ацетил-глюкозамил-трансферазу V (NA17), белок семейства спаренных боксов Pax-3 (PAX3), андрогеновый рецептор, циклин B1, нейробластомный гомолог онкогена v-myc вируса миелоцитоматоза птиц (MYCN), член C семейства гомологов Ras (RhoC), тирозиназа-родственный белок 2 (TRP-2), цитохром P450 1B1 (CYP1B1), подобный CCCTC-связывающему фактору (белку с цинковыми пальцами) антиген 3 плоскоклеточной карциномы, распознаваемый T-клетками (SART3), белок семейства спаренных боксов Pax-5 (PAX5), проакросин-связывающий белок sp32 (OY-TES1), лимфоцит-специфическую тирозиновую протеинкиназу (LCK), якорный белок A-киназы 4 (AKAP-4), белок синовиальной саркомы, X с точечными разрывами 2 (SSX2), рецептор конечных продуктов гликирования (RAGE-1), почечный убиквитиновый антиген 1 (RU1), почечный убиквитиновый антиген 2 (RU2), легумаин, вирус папилломы E6 человека (HPV E6), вирус папилломы E7 человека (HPV E7), кишечную карбоксилэстеразу, мутантный белок теплового шока 70-2 (mut hsp70-2), CD79a, CD79b, CD72, лейкоцит-ассоциированный иммуноглобулин-подобный рецептор 1 (LAIR1), рецептор Fc-фрагмента IgA (FCAR или CD89), член 2 подсемейства A лейкоцитарных иммуноглобулин-подобнобных рецепторов (LILRA2), член f семейства CD300-подобных молекул (CD300LF), член A семейства 12 белков с лектиновыми доменами C-типа (CLEC12A), антиген стромальных клеток костного мозга 2 (BST2), EGF-подобный, содержащий модули, муцин-подобный, подобный рецептору гормонов белок 2 (EMR2), лимфоцитарный антиген 75 (LY75), глипикан-3 (GPC3), Fc-рецептор-подобный белок 5 (FCRL5) и подобный иммуноглобулину лямбда полипептид 1 (IGLL1).
Способы очистки лентивирусных векторов
Способы по изобретению включают способы очистки лентивирусных векторов с улучшенной эффективностью, например, таким образом, что выделяют более высокие количества лентивирусных векторов относительно очистки лентивирусных препаратов, содержащих общепринятые буферы (например, HEPES). Например, препараты лентивирусных векторов, представленные в настоящем описании можно очищать посредством фильтрации (например, микрофильтрации или ультрафильтрации) и/или хроматографии (например, эксклюзионной хроматографии) с высоким выходом лентивируса. Способы фильтрации, такие как описываемые и известные в этой области, можно использовать для получения лентивирусных препаратов, по существу, не содержащих микроорганизмы и клетки (например, клетки млекопитающих), из которых получают лентивирусные векторы. Дополнительно или альтернативно, препараты лентивирусных векторов по изобретению можно обрабатывать нуклеазами для получения препарата, по существу, не содержащего контаминирующие полинуклеотиды (например, нелентивирусные полинуклеотиды, полученные из клетки, в которой продуцируются лентивирусные векторы, такие как хромосомная ДНК млекопитающего, ДНК человека, РНК или другие полинуклеотиды, не включенные в лентивирусный трансген).
Примеры
Следующие примеры использованы для предоставления специалистам в этой области описания того, как композиции и способы, представленные в настоящем описании, можно использовать, осуществлять и оценивать, и предназначены исключительно для иллюстрирования изобретения, а не ограничения объема того, что авторы настоящего изобретения подразумевают под своим изобретением.
Пример 1. Получение лентивирусных векторов в бессывороточной культуре клеток
Получали вектор для переноса генов GFP, упаковывающий вектор, экспрессирующий вектор rev и экспрессирующий вектор VSV-G. Вектор для переноса генов содержит элементы cPPT и WPRE. Более подробно, лентивирусные векторы, используемые в исследовании, являлись самоинактивирующейся конструкцией для переноса pELPS-EGFP, основанной на трансферной конструкции pRRL (Dull et al., J. Virol. 72(11):8463-8471, 1998). pELPS-EGFP конструировали с использованием pELPS-19-BBz (Milone et al., Mol. Ther. 17(8):1453-1464, 2009), заменяя трансген CAR EGFP. Лентивирус получали с использованием системы упаковки третьего поколения, состоящей из плазмид pMDLgpRRE, pRSV-Rev и pMD.G (Dull et al., выше), ген резистентности к ампициллину заменяли геном резистентности к канамицину, геном неомицин-фосфотрансферазы II.
Получение вируса осуществляли в масштабе 10 литров. Реагенты, необходимые для получения 10 литров супернатанта, описаны ниже. Клетки Expi293F (Life Technologies) высевали при плотности клеток 5-6×106 клетки/мл с 96% жизнеспособности, используя среду Freestyle (Life Technologies) без сыворотки. 12,5 мл PEIpro (Polyplus) добавляли к 0,25 литрам среды и медленно добавляли к смеси плазмид (12,8 мг плазмид в 0,25 литрах). Через 15 минут инкубации трансфекционную смесь объемом 0,5 литра разделяли по 2 5-литровым колбам с добавлением еще 2,25 литров сред FreeStyle на колбу. Через 24 часа инкубации клетки центрифугировали при 2000 об./мин. в течение 5 минут и выбрасывали супернатант. Затем добавляли среды с pH 6 (среды FreeStyle, скорректированный pH) с 8 мМ бутирата натрия (Sigma). Через 48 часов после трансфекции клетки центрифугировали при 2000 об./мин. в течение 5 минут и сохраняли супернатант для очистки (сбор 1). Еще 2,5 литров сред с pH 6,0 добавляли в каждую из встряхиваемых колб для инкубации на ротационном шейкере (инкубатор Infors HT, скорость встряхивания 100 об./мин., 8% CO2, 37°C). Второй сбор (сбор 2) собирали через 72 часа с последующим центрифугированием на низкой скорости. Сборы через 48 и 72 часа объединяли и обрабатывали для дальнейшей очистки. Частично объединенный материал, при необходимости, хранили при 4°C.
В случае одной среды в объеме 2×2,5 литров использовали 6 мкг вектора для переноса генов GFP, 3 мкг упаковывающего вектора, 3 мкг экспрессирующего вектора rev и 0,75 мкг экспрессирующего вектора VSVG. После добавления трансфекционной смеси к клеткам встряхиваемые колбы осторожно встряхивали для достижения однородного перемешивания. Затем осуществляли инкубацию клеток, как описано выше.
Пример 2. Очистка лентивирусных векторов, полученных в бессывороточной культуре клеток
Частично центрифугированный 48- и 72-часовой сбор пропускали через три дифференциальных фильтра переменной плотности, 5 мкм стеклянный фильтр (GE Healthcare), 1,2 мкм полипропиленовый фильтр (Sartorius) и 0,6/0,2 мкм полиэфирсульфоновый фильтр (GE Healthcare). С помощью последовательности фильтров удаляли клетки-продуценты, клеточный детрит и органеллы. После этого осуществляли фильтрацию тангенциальным потоком с использованием половолоконных мембран 500 MWCO (GE Healthcare) для 100-кратного концентрирования супернатанта, содержащего вирус. Осуществляли обработку бензоназой (EMD-Millipore) в количестве 50 ед./мл при комнатной температуре в течение 30 минут с последующим центрифугированием при 3000 об./мин. в течение 20 минут. Белый осадок был видимым, но наблюдали минимальную потерю (<5%) вирусных частиц в супернатанте. После стерильной фильтрации с использованием фильтров 0,2 мкм (EMD Millipore) осуществляли эксклюзионную хроматографию с использованием PIPES и других буферов (в случае которых наблюдали высокую стабильность векторов, представленных в настоящем описании).
Пример 3. Образец препарата для высокопроизводительного скрининга на стабильность лентивирусных препаратов
Центрифужные планшет для обессоливания ZEBA™ (7K MWCO, Life Technologies) 4 раза подвергали замене буфера с использованием 250 мкл конкретных буферов и солей. 100 мкл стокового раствора вируса наносили в каждую лунку, а затем центрифугировали при 1000×g в течение 2 минут. Не наблюдали потери объема после замены буфера. Для каждого из анализов (исследования DLS, инфективность и замораживания-размораживания) использовали 20-100 мкл. Для исследования эффекта температуры в отношении инфективности векторов использовали температурный шок в 96-луночных тонкостенных планшетах для ПЦР в термоциклере C-1000 Touch (диапазон от 25 до 55°C в течение часа).
Пример 4. Анализ лентивирусной агрегации посредством динамического рассеяния света в рамках высокопроизводительного скрининга
20 мкл очищенных рекомбинантных лентивирусных векторов (106-107 TU/мл) с помощью пипетки переносили в 384-луночный планшет (черный полистироловый гидрофильный планшет, Greiner Bio). Планшет центрифугировали для удаления пузырьков воздуха при 2000 об./мин. в течение 3 минут при комнатной температуре, а затем запаивали с помощью Microseal "B" (Bio-Rad). Его помещали в спектрофотометр для чтения планшетов DynaPro (Wyatt Technology Corporation, CA, USA), оборудованный лазером 830 нм и модулем контроля температуры. Для получения и анализа запланированных данных использовали программное обеспечение Dynamics® (версия 7.1.8.93, Wyatt Technology Corporation). Осуществляли пять 5-секундных измерений для каждой лунки. Измерение в одном запаянном 384-луночном планшете осуществляют при 25°C, а затем его инкубируют при 37°C в течение 2 часов и осуществляют измерение, как описано. Эту же операцию повторяют для 42°C, 50°C и 55°C. Анализ регуляризации осуществляли с использованием алгоритма, совмещенного с программным обеспечением DynamicsR. Верхнее и нижнее пороговые значения корреляционной функции составляли 0,5 и 1×106мкс, соответственно. Гидродинамический радиус, соответствующий пику лентивируса, определяли как 50-200 нм.
Пример 5. Определение титра лентивируса в рамках высокопроизводительного скрининга
Титр лентивирусных векторов включает функциональный титр, вычисленный по количеству клеток, экспрессирующих белок GFP, кодируемый переносимым геном (TU/мл). Клетки HEK293T высевали при конкретной плотности (2×104/лунку) в 96-луночный планшет (Corning, плоскодонный) при объеме 50 мкл среды D-MEM (Life Technologies), содержащей 10% эмбриональной телячьей сыворотки (Life Technologies) и 8 мкг/мл полибрена (EMD Millipore). Разбавленный GFP-стандарт вируса и образцы получают в полной DMEM и добавляют (50 мкл) к клеткам.
10-кратные серийные разведения растворов вирусов получают в серии разведений с DMEM в качестве дилюента. 96-луночные планшеты инкубировали в инкубаторе с CO2 при 37°C в течение 72 часов. Клетки обрабатывали трипсином, а затем добавляли 200 мкл полной DMEM. Планшет центрифугировали при 1000 об./мин. в течение 10 минут и среды заменяли 200 мкл проточного буфера autoMACS (подвижный буфер, Miltenyi Biotec). Затем осуществляли анализ GFP с помощью Guava Viacount (EMD Millipore). Количество клеток и состояние нетрансдуцированных клеток подвергали мониторингу во время сбора.
Пример 6. Анализ лентивирусной стабильности после повторяющихся циклов замораживания-размораживания
Для анализа утраты инфективности при повторяющихся циклах замораживания-размораживания небольшие аликвоты (~100 мкл) лентивирусных векторов замораживали при -80°C в течение 20 минут, а затем медленно размораживали при комнатной температуре в течение 20 минут (что представляет собой наихудший сценарий). Циклы замораживания-размораживания осуществляли 3, 6, 9 раз и сравнивали активность вектора с контролем. Анализ тенденции осуществляли с использованием Spotfire, при этом высокое значение означало сохранение активности лентивирусных векторов.
Пример 7. Определение титра лентивируса в первичных T-клетках
Сосуды, содержащие PBMC от трех здоровых доноров, размораживали, центрифугировали и ресуспендировали в среде X-Vivo (Lonza), дополненной 2% сыворотки AB человека (Access) и ИЛ-2 (Prometheus Ther.). Клетки подсчитывали и высевали при плотности 1,6×106 клеток/мл в 100 мкл в двух параллелях для каждого донора. Частицы с антителами против CD3/CD28 (Life Technologies) промывали в простой среде X-vivo и доводили до конечной плотности 4,8×105 частиц/лунку. Клетки помещали в инкубатор при 37°C и 5% CO2.
Аликвоты лентивирусных векторов размораживали при комнатной температуре и получали серийные разведения 1:3 в среде X-Vivo. Используемыми аликвотами векторов являлись GFP (сток 26Sept14, JDG, 250 мкл), Lentigen (Lentigen Corp, hCART019, LN0127-0214-064) и следующие четыре различных состава вектора GFP: AD1 (20 мМ гистидина, 100 мМ NaCl, 2,5% сахарозы, pH6,5), AD2 (20 мМ цитрата, 75 мМ NaCl, 2,5% сахарозы, pH 6,5), AD3 (20 мМ HEPES, 75 мМ NaCl, 2,5% сахарозы, pH 7) и AD4 (20 мМ PIPES, 75 мМ NaCl, 2,5% сахарозы, pH 6,5).
Клетки разделяли в соотношении 1:3 в день 3 посредством ресуспендирования клеток и добавления 60 мкл суспензии клеток в 120 мкл простой среды X-vivo в соответствующих лунках нового планшета. Клетки возвращали в инкубатор. Клетки снова разделяли в день 5 в соотношении 1:2 в новых планшетах (90 мкл клеток в 110 мкл простой среды X-Vivo) и возвращали в инкубатор.
Объединяли клетки из каждого планшета; аликвоту очищали от частиц, помещая суспензию клеток на магнит, отбирая супернатант и используя раствор Guava Viacount в разведении 1:10. Затем 200 мкл клеток центрифугировали при 1000 об./мин. в течение 5 минут при 20°C и ресуспендировали в 200 мкл буфера AutoMacs (Miltenyi), переносили в новый 96-луночный планшет с U-образным дном и измеряли флуоресценцию GFP с использованием устройства Guava (Millipore). Вычисляли процент GFP-трансдуцированных клеток. Клетки, трансдуцированные с использованием вектора Lentigen, центрифугировали при 1000 об./мин. в течение 5 минут при 20°C и окрашивали с использованием смеси буфера AutoMacs и PE-меченого антиидиотипического антитела в разведении 1:160 (при этом одну лунку оставляли неокрашенной). Препарат оставляли в темноте при комнатной температуре и дважды промывали 200 мкл буфера AutoMacs. Клетки ресуспендировали в 200 мкл буфера AutoMacs и подвергали мониторингу с использованием устройства Guava. Титры в виде TU/мл для GFP и Lentigen вычисляли по формуле: клетки при D0* (% трансдуцированных клеток/100)/объем вируса (мл).
Пример 8. Обобщение результатов экспериментов - исследования стабильности
Скрининговые исследования осуществляли с использованием параллельного подхода (фиг. 1) для определения условий, которые можно использовать для стабилизации лентивирусных векторов. Стабильность коммерчески доступных лентивирусных векторов (Lentigen) оценивали с помощью скрининга с различными условиями буфера, pH и соли, как показано на фиг. 2. Лентивирусные векторы инкубировали в течение ночи (приблизительно 18 часов) при комнатной температуре (приблизительно 25°C). Стабильность определяли посредством оценки титра (TU/мл) способом, описанным в примере 5 выше. Буфер PIPES с NaCl стабилизировал вектор почти до той же степени, что и контрольный состав (состав Lentigen), который может включать эксципиенты в дополнение к буферу и соли. Лентивирусными векторами, используемыми в этом эксперименте, являлись CAR19 LV от Lentigen. Во всех других исследованиях, описанных в этом примере, использовали GFP-LV, описанный в примере 1 выше.
Для оценки уровней агрегации лентивирусных векторов определяли распределения гидродинамических радиусов различных составов (фиг. 3) способами, описанными в примере 4 выше.
На фиг. 4 показано, что гистидиновый буфер (20 мМ гистидина, 50-150 мМ NaCl, pH 6,0, 6,5 и 7,0) имеет очень низкую тенденцию к агрегации лентивирусных векторов с повышением температуры (подвергаемой мониторингу по изменению Rh). На фиг. 5 показано, что лентивирусные векторы в 20 мМ PIPES, pH 6,5, с концентрациями NaCl в диапазоне от 50-150 мМ не демонстрировали тенденцию к агрегации при всех температурах (за исключением 100 мМ NaCl при 55°C). Также, лентивирусные векторы в 20 мМ PIPES, pH 7,0, с NaCl в диапазоне от 50-150 мМ демонстрировали тенденцию к агрегации при температурах 42-55°C. На фиг. 6 показано, что цитратный буфер (20 мМ цитрата, 50-150 мМ NaCl, pH 6,0, 6,5) имел очень низкую тенденцию к агрегации лентивирусных векторов с повышением температуры (подвергаемой мониторингу по изменению Rh). На фиг. 7 показано, что буфер HEPES (20 мМ HEPES, 50-150 мМ NaCl, pH 7,0, 7,5 и 8,0) обладает значительной склонностью к агрегации при pH 7,5 и 8,0, в то время как pH 7,0 позволяет сохранять мономерный вирус при различных температурах. На фиг. 8 показано, что буфер MOPS (20 мМ MOPS, 50-150 мМ NaCl, pH 6,5, 7,0 и 7,5) имеет высокую склонность к агрегации при pH 6,5 и 7,0 при 50 мМ NaCl и всех условиях при pH 7,5. Только в случае 20 мМ MOPS, 75 мМ NaCl, pH 6,5, наблюдали агрегацию при высокой температуре (55°C, что является очень высоким значением, т.к. вирус никогда не подвергнется воздействию такой температуры в реальных условиях). На фиг. 9 показано, что буфер MES (20 мМ MES, 50-150 мМ NaCl, pH 6,0 и 6,5) имеет низкую склонность к агрегации лентивирусного вектора в этих условиях. На фиг. 10 показано, что фосфатный буфер (20 мМ фосфат, 50-150 мМ NaCl, pH 6,5, 7,0, 7,5, 8,0) имеет низкую склонность к агрегации лентивирусного вектора при pH 6,5; при всех других условиях pH наблюдали более высокую склонность к агрегации. На фиг. 11 показано, что в случае буфера HEPPS (20 мМ HEPPS, 50-150 мМ NaCl, pH 7,5 и 8,0) все условия способствовали агрегации LV (за исключением 25°C). На фиг. 12 показано, что в случае буфера Трис (20 мМ Трис, 50-150 мМ NaCl, pH 7,5 и 8,0) все условия способствовали агрегации LV (за исключением 25°C).
Эти результаты свидетельствуют о том, что улучшенной стабильности лентивирусных векторов можно достигать при использовании гистидинового буфера, цитратного буфера, буферов MOPS, PIPES и MES. Для измерения гидродинамического радиуса лентивирусных частиц использовали DLS. Т.к. DLS является полуколичественным анализом, авторы настоящего изобретения полагались на анализ тенденций в отношении агрегации при различных температурах (от низкой до высокой).
Дополнительный анализ осуществляли для определения устойчивости Rh при различных буферных условиях (фиг. 13-19). Анализы включали DLS (см., например, пример 4 выше) и определение титра (см. пример 5 выше). На фиг. 13 показано, что гистидиновый буфер, цитратный буфер, буферы MOPS, PIPES, HEPES и MES селективно способствовали стабильности лентивирусных векторов в стабилизирующих мономерах, что оценивали только с помощью DLS. На фиг. 14 показано, что буферы на основе фосфата, HEPPS и Трис не защищали от агрегации при высокой температуре, что оценивали только с помощью DLS.
На фиг. 15-19 представлены результаты исследований, в которых два критерия (защиту от агрегации и защиту от утраты инфективности при высоких температурах) анализировали совместно. На фиг. 15 показано, что гистидиновый буфер и буфер PIPES обеспечивают стабильность даже при высоких температурах, сохраняя инфективность (при использовании уникальных комбинаций pH и соли). На фиг. 16 показано, что цитратный буфер обеспечивает защиту от утраты инфективности по сравнению с HEPES при высоких температурах, в то время как на фиг. 17 показано, что буферы MOPS и MES обеспечивают защиту от утраты инфективности при высоких температурах. На фиг. 18 показано, что фосфатный буфер обеспечивает защиту от утраты инфективности по сравнению с HEPPS при высоких температурах, в то время как на фиг. 19 показано, что буфер Трис не обеспечивает защиту от утраты инфективности при высоких температурах. Эти результаты свидетельствуют о том, что выбранные буферы (например, гистидиновый, PIPES, цитратный и т.д.) обладают значительными стабилизирующими эффектами в отношении сохранения инфективности и мономеров, что определяют двумя независимыми способами анализа.
Исследования замораживания-размораживания осуществляли для дополнительной оценки стабильности. Используемые способы описывают в примере 6 выше. На фиг. 20 представлено количество условий, в которых лентивирусные векторы выживали после трех, шести и девяти циклов замораживания-размораживания при более чем 65% сохранения титра. На фиг. 21 показано, что кинетика инактивации лентивирусных векторов после третьего, шестого и девятого циклов замораживания-размораживания позволяла дифференцировать буферы, обеспечивающие высокую или низкую стабильность векторов. С помощью анализа данных (см., например, фиг. 22) определяли пять условий, в которых лентивирусные векторы выживали после девяти циклов замораживания-размораживания с более чем 65% сохранением титра. Подробности этих условий приведены на фиг. 23.
Осуществляли дополнительные исследования для оценки эффектов включения углевода сахарозы в отношении поддержания стабильности после множества циклов замораживания-размораживания. Для этих экспериментов использовали способы из примера 6 выше. В случае буферов на основе цитрата, HEPES и PIPES не наблюдали утрату активности лентивирусных векторов по сравнению с гистидиновым буфером, в случае которого наблюдали утрату приблизительно 20% активности после девятого цикла замораживания-размораживания (см. фиг. 24 и 25). Примеры выбранных стабилизирующих буферных условий при использовании углевода представлены на фиг. 26.
Титры вируса в первичных T-клетках оценивали способами, описываемыми в примере 7 выше. Результаты представлены на фиг. 27. Обнаруживали, что буфер PIPES и цитратный буфер обеспечивали очень высокий титр в первичных клетках, что свидетельствует об эффективности трансдукции в клетках. Буфер HEPES и гистидиновый буфер также обеспечивали высокий титр. Все из идентифицированных условий превосходили коммерческий вектор, приобретенный в Lentigen Corp. (коммерческий состав, неизвестный).
Сравнение конкретных результатов исследований стабильности с использованием буферов PIPES, HEPES и гистидинового буфера приведено на фиг. 28. Результаты исследования агрегации свидетельствовали о повышении гидродинамического радиуса лентивирусного вектора как функции температуры, что измеряли посредством DLS. Представлены средние значения при конкретном pH (с 50-150 мМ NaCl). Активность лентивирусного вектора при высокой температуре оценивали с использованием клеток 293T. Значения при 50°C сравнивали со значениями при 25°C. Представлены средние значения при конкретном pH (с 50-150 мМ NaCl). Активность лентивирусного вектора в клетках 293T после девятого цикла замораживания-размораживания представлена в качестве примера для демонстрации стабильности лентивирусного вектора (>100% активность означает отсутствие утраты активности; анализ, представляющий собой переменную, является анализом in vivo). Анализ активности лентивирусного вектора в первичных T-клетках представлен в качестве дополнительного теста на способность к трансдукции. С помощью лентивирусных векторов в буфере PIPES можно было трансфицировать на ~25% и ~35% больше первичных T-клеток по сравнению с лентивирусными векторами в буфере HEPES и гистидиновом буфере, соответственно. Таким образом, буфер PIPES представляет собой альтернативу стандартному составу на основе HEPES, т.к., например, лентивирусные векторы более стабильны в буфере PIPES. Кроме того, с помощью лентивирусных векторов в буфере PIPES можно было трансфицировать на ~20-25% больше первичных T-клеток по сравнению с буфером HEPES и гистидиновым буфером.
Пример 9. Очистка лентивирусных векторов в буфере PIPES, гистидиновом буфере и буфере HEPES
Лентивирусные векторы получали и очищали способами, описанными в примерах 1 и 2 выше. Для поддержания стерильности осуществляли стадию постхроматографической очистки, включающей пропускание через фильтр 0,2 мкм. Т.к. низкий выход может являться результатом очистки по причине агрегации, для идентификации условий, приводящих к оптимальному выходу, тестировали различные буферы. Как показано на фиг. 29, в случае буфера PIPES получали выход, превосходящий выход в случае с буфера HEPES и гистидинового буфера.
Пример 10. Стабилизация дополнительных лентивирусных векторов
Как указано выше, указанные выше исследования осуществляли с использованием лентивирусных векторов GFP (за исключением исследований стабильности, приведенных на фиг. 2, как указано выше). Авторы настоящего изобретения осуществляли дополнительные эксперименты, показавшие, что буфер на основе PIPES (20 мМ PIPES, pH 6,5, 75 мМ NaCl, 2,5% сахарозы) эффективен в стабилизации двух дополнительных лентивирусных векторов (векторов 1 и 2), экспрессирующих другой трансген.
Два лентивирусных вектора, присутствующих в буфере на основе PIPES (20 мМ PIPES, pH 6,5, 75 мМ NaCl, 2,5% сахарозы) очищали способом, включающим стадии микрофильтрации, фильтрации тангенциальным потоком (TFF), обработки бензоназой, центрифугирования, эксклюзионной хроматографии (SEC) и стерильной фильтрации. Образцы получали из ретентата TFF и хранили в течение 4 дней при -80°C или +4°C. Кроме того, образцы получали из элюата SEC и хранили в течение 3 дней при -80°C или +4°C. Титры вирусов получали из образцов до и после периодов хранения. Оба вектора являлись стабильными в буфере PIPES в течение очистки. Как показано на фиг. 30, не наблюдали значимых различий в активности, измеряемой при определении титра, в течение кратковременного хранения образцов TFF и SEC при -80°C или +4°C.
Динамическое рассеяние света использовали для оценки статуса агрегации векторов, хранящихся в буфере PIPES (20 мМ PIPES, pH 6,5, 75 мМ NaCl, 2,5% сахарозы). Как показано на фиг. 31 и 32, Обнаруживали, что оба вектора являлись мономерными в составе PIPES при 25°C, при этом определенное д.нм составляло приблизительно 140 нм. Использованные способы описаны в примере 4 выше.
Стабильность очищенного вектора 2 оценивали после хранения в буфере PIPES (20 мМ PIPES, pH 6,5, 75 мМ NaCl, 2,5% сахарозы) при 4°C в течение трех недель. Как показано на фиг. 33, этот вектор сохранял высокую стабильность в этих условиях, что измеряли посредством определения титров в клетках 293T, а также процентной доли сохраняющейся активности по сравнению с контролем (4°C, день 0; первый столбик на фиг.33, активность контроля принимали за 100%). Столбики по оси x означают активность в дни 14 и 21, соответственно (выраженную как процент относительно контроля).
В дополнительных исследованиях оценивали стабильность при замораживании-размораживании вектора 2 в буфере PIPES (20 мМ PIPES, pH 6,5, 75 мМ NaCl, 2,5% сахарозы) (способы см. в примере 6 выше). Как показано на фиг. 34, этот вектор сохранял высокую стабильность после множества циклов замораживания-размораживания (осуществляли до 9 циклов), измеряемую посредством определения титров в клетках 293T, а также процентной доли сохраненной активности по сравнению с контролем (титр после 1 цикла замораживания-размораживания, т.к. очищенный лентивирусный образец хранят при -80°C сразу после очистки). Активность контрольного образца принимали за 100%, что представляет собой первый столбик на фиг. 34. Столбики по оси x означают остаточную активность (в процентах) после 3, 6 и 9 циклов замораживания-размораживания (выраженную как процент относительно контроля).
Другие варианты осуществления
Все публикации, патенты и патентные заявки, упомянутые в настоящем описании, включены в настоящее описание в качестве ссылок в той же степени, как если бы каждая независимая публикация или патентная заявка была конкретно и индивидуально указана как включенная в качестве ссылки.
Хотя настоящее изобретение описано применительно к конкретным вариантам его осуществления, следует понимать, что можно осуществлять дополнительные модификации, и настоящая заявки предназначена для покрытия любых вариантов, применения или адаптаций изобретения, в целом, следующих принципам изобретения и включающих такие отклонения от изобретения, которые входят в известную или обычную практику в области, к которой принадлежит изобретение, и могут быть применимы к необходимым признакам, изложенным выше, и следуют объему формулы изобретения.
Реферат
Изобретение относится к области биотехнологии, конкретно к водной композиции, содержащей лентивирусный вектор, буфер 1,4-пиперазиндиэтансульфоновой кислоты (PIPES) и соль. Полученная композиция может быть использована для хранения и очистки вирусного вектора, а также для эффективной доставки трансгена в клетку. 7 н. и 56 з.п. ф-лы, 34 ил., 10 пр.

Комментарии