Нелинейные саморасщепляющиеся линкеры и их конъюгаты - RU2755899C2
Код документа: RU2755899C2
Чертежи






Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к соединениям 'линкер-лекарственное средство' (LD) и конъюгатам антитело-лекарственное средство (ADC), включающим расщепляемый или преобразуемый нелинейный саморасщепляющийся линкер.
УРОВЕНЬ ТЕХНИКИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Конъюгаты антитело-лекарственное средство (ADC) представляют собой новый класс мишень-направленных терапевтических средств, в которых объединена специфичность антител и активность цитотоксических молекул.
В дополнение к выбору антитела и клетки-мишени, в центре внимания в ходе разработки ADC находятся лекарственные средства и линкеры. В связи с этим, антитела подвергают конъюгированию с разнообразными цитотоксическими лекарственными средствами посредством либо расщепляемых, либо нерасщепляемых линкеров.
Примеры ADC, уже одобренных для лечения человеческих пациентов, включают Mylotarg™ (гемтузумаб озогамицин, Wyeth), содержащий гуманизированное антитело против CD33, конъюгированное посредством расщепляемого, гидролизуемого кислотой линкера с калихеамицином, который был одобрен в 2000 году управлением по контролю за продуктами и лекарствами США (FDA) для лечения острого миелоидного лейкоза; Adcetris™ (брентуксимаб ведетин, Seattle Genetics), ADC, содержащий химерное антитело к CD30, конъюгированное посредством расщепляемого ферментом линкера с монометилауристатином E (MMAE), который был одобрен в 2011 году управлением FDA для лечения лимфомы Ходжкина и анапластической крупноклеточной лимфомы; и Kadcyla™ (T-DM1, адо-трастузумаб эмтанзин или трастузумаб эмтанзин, Roche), ADC, в котором гуманизированное антитело против HER2 конъюгировано посредством нерасщепляемого тиоэфирного линкера с мертанзином (производным майтанзина, также именуемым как DM1), который был одобрен управлением FDA в феврале 2013 года для лечения пациентов с HER2-позитивным метастатическим раком молочной железы, которые получили предварительное лечение трастузумабом и таксаном.
В сравнении с ADC с химически-расщепляемым линкером, расщепляемые ферментом линкеры могут позволить достигнуть более хорошего контроля за высвобождением лекарственного средства. Однако, повышенная сопутствующая гидрофобность некоторых расщепляемых ферментом линкеров может приводить к агрегации ADC, в частности, с сильно гидрофобными лекарственными средствами. Кроме того, ADC, которые являются более гидрофобными, выводятся более быстро из кровотока в экспериментальных моделях на животном. Такое более быстрое выведение позволяет предположить возникновение неких помех в фармакокинетике (PK) для таких ADC.
Как раскрыто в WO2014/124316 (Novartis) и WO2015/177360 (Synthon Biopharmaceuticals), гидрофобность ADC может быть снижена в результате конъюгирования (гидрофобных) соединений 'линкер-лекарственное средство' со встроенными остатками цистеина в конкретных сайтах в Fab- и/или Fc-участках как тяжелых, так и легких цепей антител. При конъюгировании с этими остатками цистеина соединение 'линкер-лекарственное средство' становится огражденным от гидрофильной водной среды, окружающей антитело, что делает ADC менее гидрофобным.
Альтернативно, гидрофобность соединения 'линкер-лекарственное средство' и получающегося в результате ADC может быть снижена в результате подбора соответственного линкера. Например, Seattle Genetics в WO2015/123679 использовала линкер, содержащий только гидрофильные аминокислоты, для поддержания гидрофильности конъюгата, сходной с гидрофильностью неконъюгированного антитела. В альтернативном подходе водорастворимые группы, такие как полиэтиленгликолевые полимеры, были включены в линкеры, например, между лекарственным средством и точкой прикрепления антитела как в WO2014/100762 (Bioalliance and Abgenomics) или в параллельном местоположении как в WO2015/057699 (Seattle Genetics). Третий подход минимизирования гидрофобности состоял в прикреплении соединений лекарственное средство-полимер к антителу, где каждый полимер содержит большое число молекул лекарственного средства как в WO2012/171020 (Mersana). Однако, прикрепление солюбилизирующих групп большого размера повышает сложность изготовления таких конъюгатов.
Несмотря на наличие вышеописываемых подходов к снижению гидрофобности соединений 'линкер-лекарственное средство' и/или ADC, существует потребность в новых стратегиях снижения упомянутой гидрофобности ADC с целью (дополнительного) уменьшения агрегации ADC и преодоления сопутствующих недостатков фармакокинетики (PK).
КРАТКОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к соединениям 'линкер-лекарственное средство' (LD) и конъюгатам антитело-лекарственное средство (ADC), содержащим нелинейный саморасщепляющийся линкер, который расщепляется или преобразуется в соответствующих условиях и, который снижает гидрофобность конъюгата антитело-лекарственное средство.
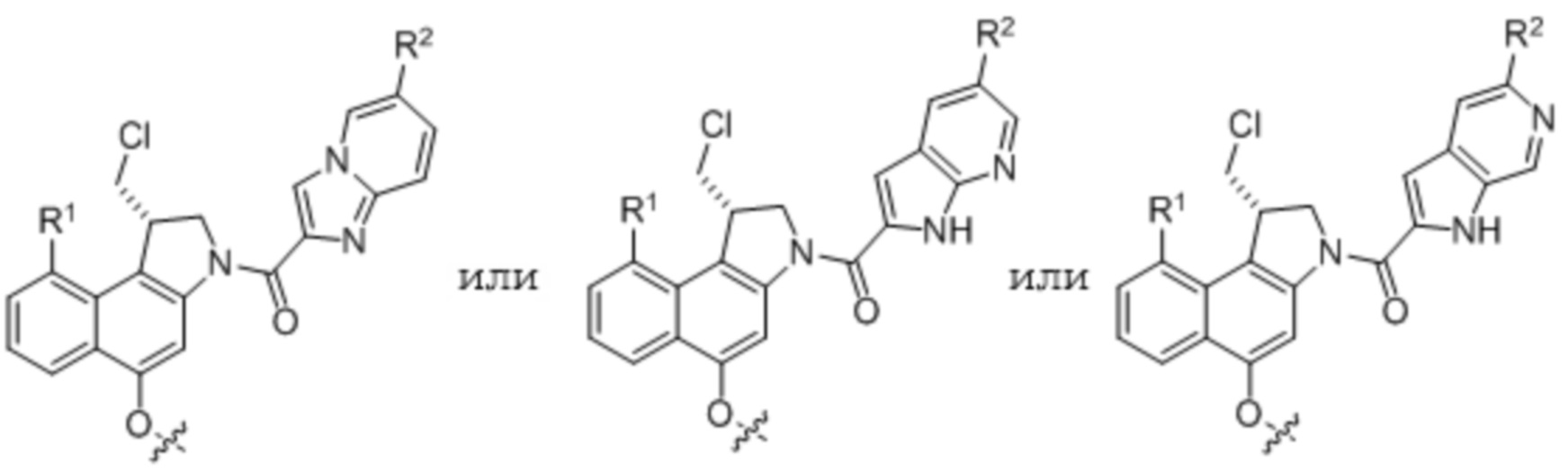
В первом аспекте, настоящее изобретение относится к соединению 'линкер-лекарственное средство' формулы (I)
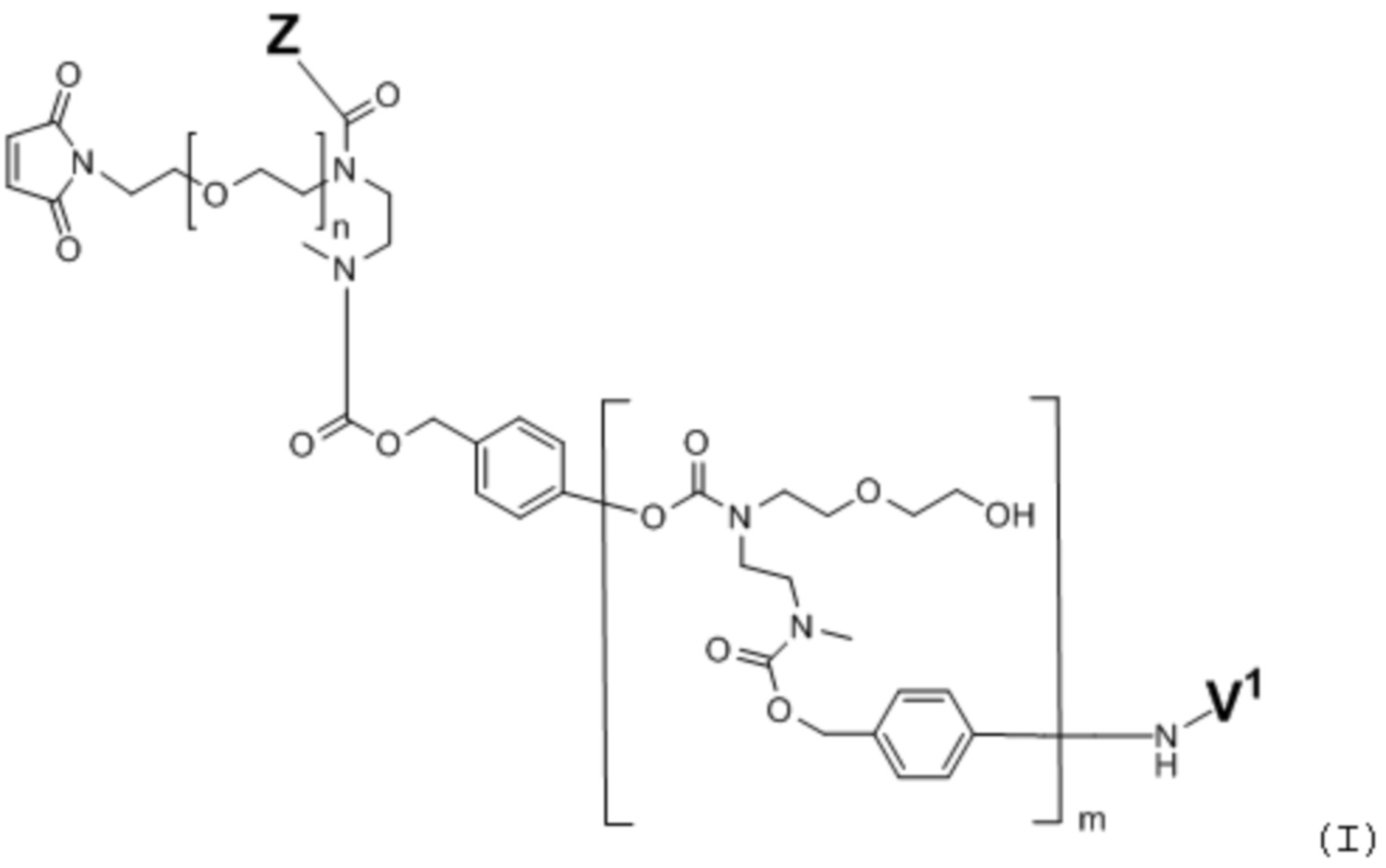
или его фармацевтически приемлемой соли, гидрату или сольвату, где
V1 представляет собой расщепляемый при определенных условиях или преобразуемый при определенных условиях фрагмент, который может быть расщеплен или преобразован в результате химического, фотохимического, физического, биологического или ферментативного процесса;
Z означает цитотоксическое лекарственное средство, включающее фенольную гидроксильную группу, посредством которой Z прикрепляется к линкеру, предпочтительно, Z представляет собой дуокармицин или димерное производное CBI, более предпочтительно Z представляет собой производное дуокармицина;
n имеет значение 0, 1, 2, или 3; и
m имеет значение 0 или 1.
Во втором аспекте, настоящее изобретение относится к конъюгату антитело-лекарственное средство, содержащему соединение 'линкер-лекарственное средство' формулы (I).
Другие аспекты настоящего изобретения включают фармацевтические композиции с соединением 'линкер-лекарственное средство' или с конъюгатом антитело-лекарственное средство и их применение в качестве лекарственного препарата, в частности, в лечении человеческих солидных опухолей и гематологических злокачественных опухолей.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1. Структурные формулы соединений 'линкер-лекарственное средство'.
Фигура 2. Относительная гидрофобность ADC, содержащих соединения 'нелинейный линкер-лекарственное средство' по изобретению, в сопоставлении с ADC сравнения, содержащими линейный vc-seco-DUBA (соединение 'линкер-лекарственное средство' 1).
Фигура 3А. Относительная гидрофобность ADC антитела против простатического специфического мембранного антигена (PSMA) дикого типа и со встроенным цистеином, содержащих соединения 'нелинейный линкер-лекарственное средство' по изобретению, в сопоставлении с ADC антитела против PSMA сравнения, содержащими линейный vc-seco-DUBA (соединение 'линкер-лекарственное средство' 1).
Фигура 3В. Относительная гидрофобность ADC антитела против PSMA со встроенным цистеином, содержащих соединения 'нелинейный линкер-лекарственное средство' по изобретению или линейный vc-seco-DUBA (соединение 'линкер-лекарственное средство' 1), в сопоставлении с ADC (PSMA) неизмененного антитела против PSMA wt (дикий тип) сравнения, содержащим упомянутые соединения 'линкер-лекарственное средство'.
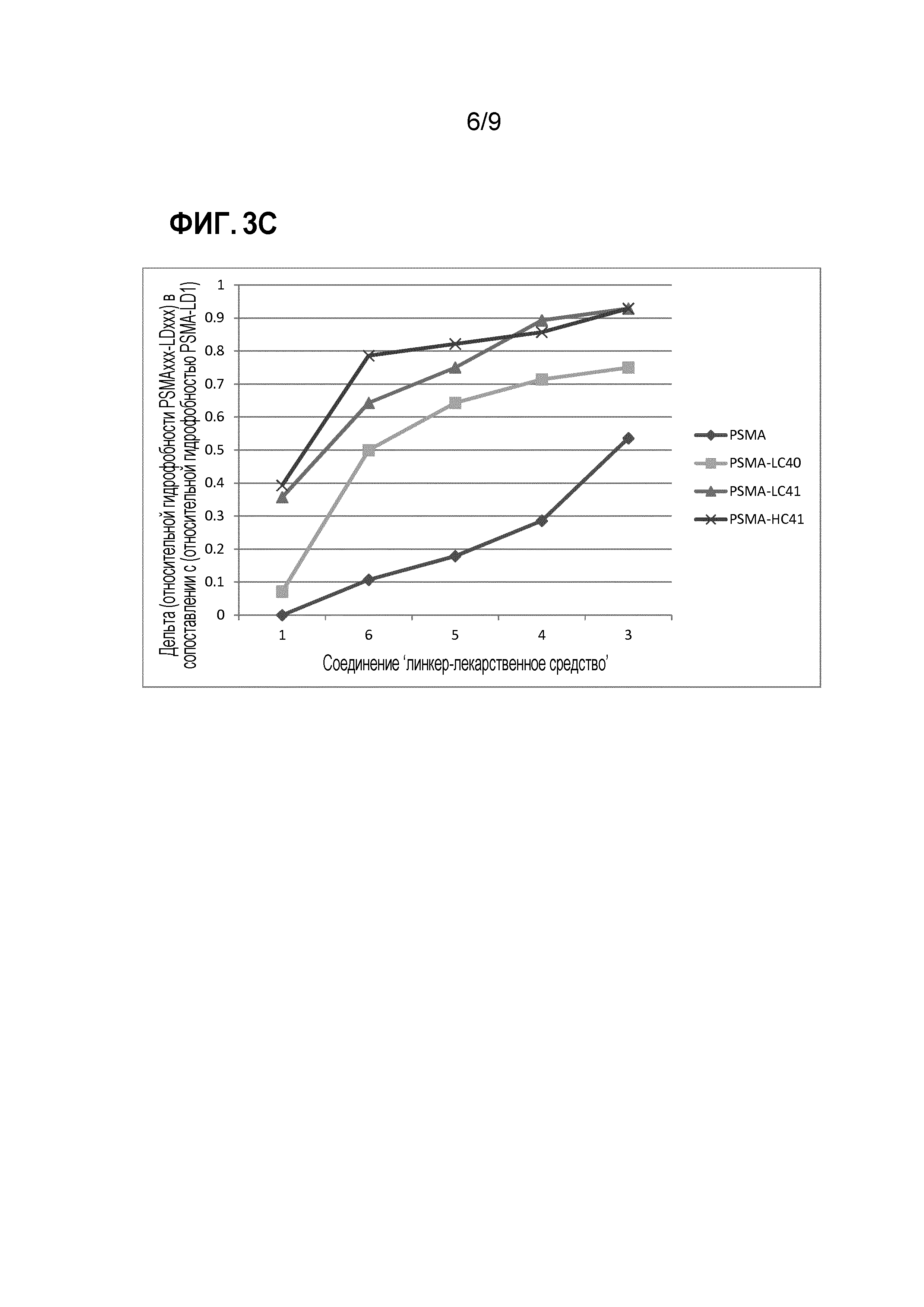
Фигура 3С. Дельта относительной гидрофобности для ADC антитела против PSMA дикого типа и со встроенным цистеином, содержащих соединения 'нелинейный линкер-лекарственное средство' по изобретению или линейный vc-seco-DUBA (соединение 'линкер-лекарственное средство' 1), в сопоставлении с ADC (PSMA) неизмененного антитела против PSMA wt (дикий тип) сравнения, содержащим линейный vc-seco-DUBA (соединение 'линкер-лекарственное средство' 1).
Фигура 4. HIC-хроматограмма для ADC антитела против PSMA со встроенным цистеином, содержащих соединения 'нелинейный линкер-лекарственное средство' по изобретению.
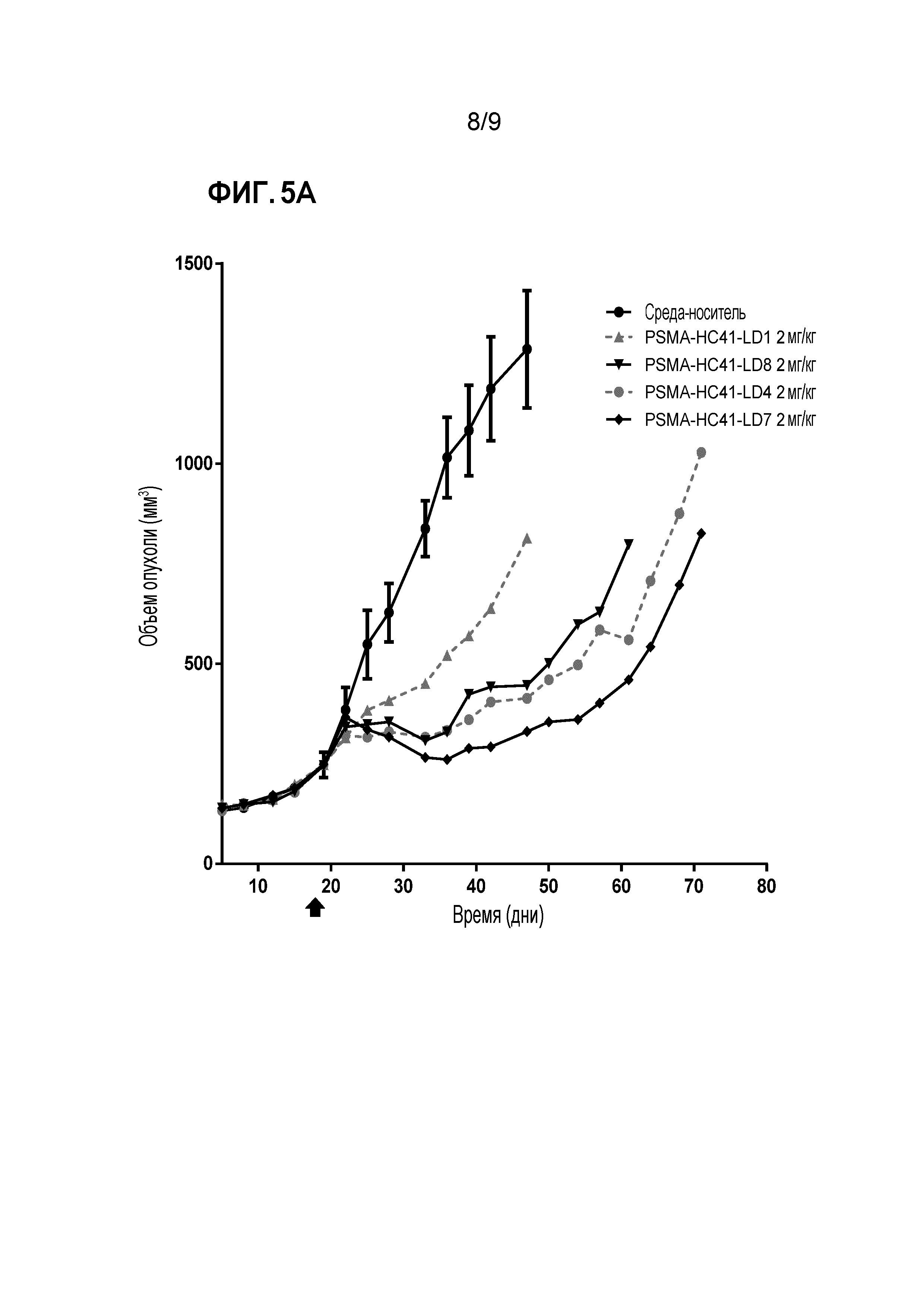
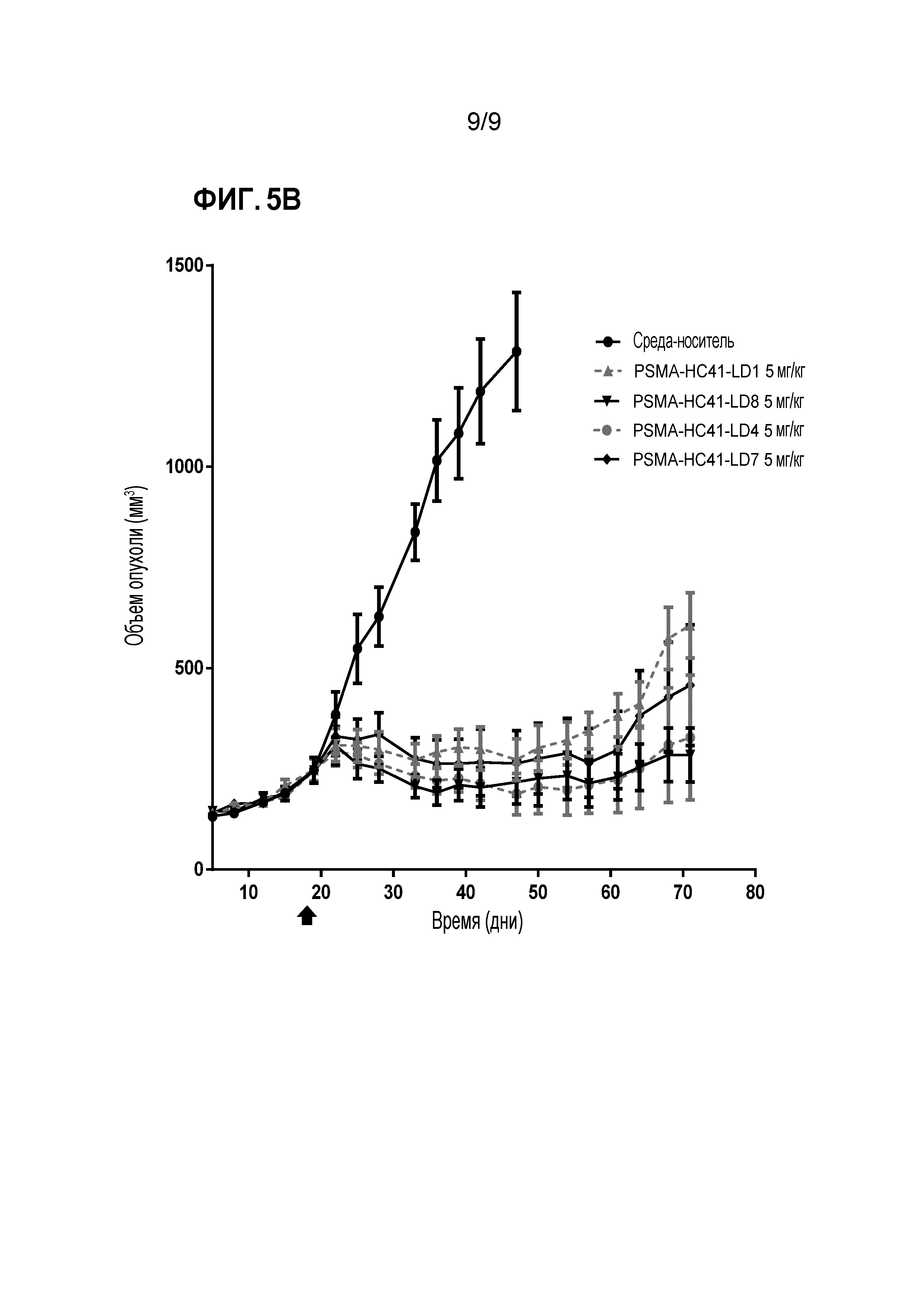
Фигура 5. Эффективность in vivo в случае ксенотрансплантата клеточной линии LNCaP-C4.2 у мышей: ADC антитела против PSMA со встроенным цистеином (VH S41C), содержащие соединения 'линкер-лекарственное средство' 4, 7 или 8, в сопоставлении с контролем растворителя, и ADC антитела против PSMA со встроенным цистеином (VH S41C) сравнения, содержащим линейный vc-seco-DUBA (соединение 'линкер-лекарственное средство' 1), после однократной инъекции 2 мг/кг (Фигура 5A) или 5 мг/кг (Фигура 5В) каждого.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Конъюгаты антитело-лекарственное средство (ADC) разрабатываются в качестве нового класса противораковых терапевтических средств, которые сочетают эффективность низкомолекулярных терапевтических средств с возможностью нацеливания на мишень, обеспечиваемой антителами. В результате объединения этих двух компонентов в одну новую молекулярную субстанцию, обладающие высокой цитотоксичностью низкомолекулярные лекарственные средства могут быть доставлены к раковым тканям-мишеням, посредством чего повышается эффективность при одновременном снижении потенциальных системных токсических побочных эффектов малых молекул.
Антитела были конъюгированы со множеством цитотоксических лекарственных средств, включая малые молекулы, которые связываются с ДНК (например, антрациклины), алкилируют или сшивают ДНК (например, дуокармицины или димеры CBI или пирролобензодиазепина, соответственно), вызывают разрывы нити ДНК (например, калихеамицины) или разрывают микротрубки (например, майтанзиноиды, ауристатины и тубулизины).
Лекарственные средства могут быть прикреплены к антителу посредством специфических соединений, соединяющих боковую цепь аминокислотного остатка антитела, например, боковую цепь остатка цистеина или лизина, и лекарственное средство. Такое связывающее соединение, то есть, линкер, может быть расщепляемым, так что высвобождение лекарственного средства, которое может контролироваться во времени, происходит в заданном месте, например, внутри лизосомы раковой клетки, со снижением в результате этого системных токсических эффектов лекарственного средства.
Настоящее изобретение относится к соединению 'линкер-лекарственное средство', то есть, к лекарственному средству с линкером, формулы (I), содержащему нелинейный саморасщепляющийся линкер

или его фармацевтически приемлемой соли, гидрату или сольвату.
V1 представляет собой расщепляемый при определенных условиях или преобразуемый при определенных условиях фрагмент.
Z означает цитотоксическое лекарственное средство, содержащее фенольную гидроксильную группу, посредством которой Z прикрепляется к линкеру.
Каждый n и m независимо представляют собой 0 или положительное целое число.
Малеимидный фрагмент используют для конъюгации соединения 'линкер-лекарственное средство' с антителом или с его антиген-связывающим фрагментом.
Саморасщепляющийся линкер может быть определен как бифункциональный химический или биохимический фрагмент, который способен ковалентно связывать два находящихся на расстоянии друг от друга химических фрагмента в обычно стабильную трехчастную молекулу. Можно достигать высвобождение одного из разнесенных в пространстве химических фрагментов, из этой трехчастной молекулы посредством, например, ферментативного расщепления; а после такого ферментативного расщепления, можно получать спонтанное отщепление от остатка молекулы с высвобождением другого из разнесенных в пространстве химических фрагментов. Линкер считается нелинейным в том случае, когда сайт для (ферментативного) расщепления не находится между первым химическим фрагментом и точкой прикрепления второго химического фрагмента, в противоположность линейному линкеру.
Настоящее изобретение основано, отчасти, на обнаружении того, что некоторые комбинации линкеров и цитотоксических лекарственных средств могут быть использованы для получения ADC, которые имеют гидрофобность, сходную с гидрофобностью неконъюгированного (оголенного) антитела или антиген-связывающего фрагмента. При разработке конъюгатов, для получения гидрофобности, сходной с гидрофобностью неконъюгированного антитела, могут быть сохранены некоторые желательные характеристики оголенного антитела, такие как благоприятный фармакокинетический профиль in vivo, в том числе сниженное выведение in vivo, и/или повышенное воздействие на клетку(-и)-мишень(-и). Преимущественно, такие конъюгаты могут быть разработаны с возможностью иметь гидрофобность, сходную с гидрофобностью оголенного антитела, без необходимости включать дополнительные солюбилизирующие группы, такие как полиэтиленгликоль или другие водорастворимые полимеры.
Нелинейный саморасщепляющийся линкер в соединении формулы (I) разрабатывают с возможностью снизить гидрофобность ADC. Авторы настоящего изобретения обнаружили, что при снижении числа атомов в линкере между цитотоксическим лекарственным средством и точкой прикрепления антитела, гидрофобность ADC пропорционально снижается также.
Без привязки к какой-либо теории, авторы настоящего изобретения полагают, что в результате перегруппировки в линкере по изобретению, приводящей к более короткому расстоянию между гидрофобным лекарственным средством и антителом, лекарственное средство оказывается экранированным антителом от гидрофильной водной среды, окружающей антитело, что делает ADC менее гидрофобным.
Линкер обеспечивает эффективное высвобождение цитотоксического лекарственного средства на или в клетки-мишени, достаточное для индуцирования цитотоксичности или цитостатического эффекта. Обычно, линкеры разрабатывают с возможностью эффективного высвобождения лекарственного средства сразу после поглощения конъюгата клетками-мишенями.
V1 представляет собой расщепляемый при определенных условиях или преобразуемый при определенных условиях фрагмент, который может быть расщеплен или преобразован в результате химического, фотохимического, физического, биологического или ферментативного процесса. Другими словами, он предназначен для преобразования и/или расщепления в ходе химического, фотохимического, физического, биологического или ферментативного процесса при приведении в определенное состояние или при определенном условии. Такое условие может представлять собой, например, перенос соединения по изобретению в водную среду, что приводит к гидролизу V1, или перенос соединения по изобретению в среду, которая содержит фермент, который распознает и расщепляет V1, или перенос соединения по изобретению в восстановительные условия, что приводит к восстановлению и/или удалению V1, или перенос соединения по изобретению в окислительные условия, что приводит к окислению и/или удалению V1, или приведение соединения по изобретению в контакт с излучением, например, УФ-светом, что дает в результате преобразование и/или расщепление, или приведение соединения по изобретению в контакт с источником тепла, что дает в результате преобразование и/или расщепление, или перенос соединения по изобретению в условия пониженного давления, что приводит к преобразованию, например, ретроциклоприсоединению, и/или расщеплению, или перенос соединения по изобретению в условия повышенного или высокого давления, что приводит к преобразованию и/или расщеплению. Такое условие может быть обеспечено после введения соединения по этому изобретению млекопитающему, например, человеку.
Предпочтительно, V1 представляет собой расщепляемый при определенных условиях фрагмент. Более предпочтительно, V1 представляет собой расщепляемый ферментом фрагмент.
Подходящие сайты распознавания для высвобождения лекарственного средства в результате расщепления включают те сайты распознавания, которые обеспечивают эффективное отделение лекарственного средства от линкера. Предпочтительно, сайт распознавания представляет собой сайт расщепления пептида. Примеры сайтов расщепления пептида включают сайты расщепления, распознаваемые внутриклеточными протеазами, как например, протеазами, присутствующими в лизосомах.
В одном варианте осуществления, V1 представляет собой пептид.
В предпочтительном варианте осуществления, V1 представляет собой ди-, три- или тетра-пептид, то есть, пептид, составленный из двух, трех или четырех аминокислотных остатков, распознаваемый и расщепляемый протеолитическим ферментом (протеазой), например, плазмином, катепсином, катепсином В, простат-специфическим антигеном (PSA), активатором плазминогена урокиназного типа (u-PA), или членом семейства матриксных металлопротеиназ, присутствующих в непосредственной близости от клеток-мишеней или внутри них, например, опухолевых клеток. Подходящие пептиды для V1 включают, без ограничения, аланилфенилаланиллизин, валиллейциллизин, аланиллейциллизин, валилфенилаланиллизин, валилтриптофаниллизин, аланилтриптофаниллизин, аланилфенилаланилцитруллин, валиллейцилцитруллин, аланиллейцилцитруллин, валилфенилаланилцитруллин, валилтриптофанилцитруллин, аланилтриптофанилцитруллин, фенилаланиллизин,валиллизин, валилаланин, глицилфенилаланиллизин, аланиллизин, валилцитруллин, фенилаланилцитруллин, изолейцилцитруллин, триптофаниллизин, триптофанилцитруллин, фенилаланиларгинин, фенилаланилаланин, аланиллейцилаланиллейцин, аланиларгиниларгинин, лейциллизин, и лейцилцитруллин. Предпочтительно, V1 выбирают из валилаланина, валиллизина, валилцитруллина, фенилаланиллизина, и аланилфенилаланиллизина. Более предпочтительно, V1 выбирают из валилцитруллина и валилаланина.
V1 прикрепляют к нелинейному линкеру посредством его С-концевой стороны, оставляя N-концевую сторону открытой для взаимодействия. Необязательно, N-концевую сторону V1 блокируют амин-блокирующей группой. Подходящие примеры амин-блокирующих групп включают С1-С6-алкил, С1-С8-ацил, (алкокси)карбонил (например, трет-бутоксикарбонил, именуемый Boc), (арилалкокси)карбонил (например, бензилоксикарбонил или карбобензилоксигруппу, именуемый(-ую) Cbz) и 9-флуоренилметилоксикарбонил, именуемый Fmoc).
В одном варианте осуществления, N-концевую сторону V1 блокируют водорастворимой группой, такой как линейный полиэтиленгликолевый (PEG) олигомер. Предпочтительно, линейный PEG-олигомер содержит от 1 до 20 этиленгликолевых фрагментов, более предпочтительно от 3 до 10, еще более предпочтительно от 5 до 7.
Z представляет собой цитотоксическое лекарственное средство, содержащее фенольную гидроксильную группу, посредством которой Z прикрепляется к линкеру. Предпочтительно, Z представляет собой дуокармицин или димерное производное CBI. Более предпочтительно, Z является производным дуокармицина.
Дуокармицины, составляющие класс структурно родственных токсинов, исходно выделенных из культуральной жидкости видов Streptomyces, являются членами семейства противоопухолевых антибиотиков, которое включает дуокармицин A, дуокармицин SA и CC-1065.
Дуокармицины связываются с малой бороздкой ДНК и впоследствии вызывают необратимое алкилирование ДНК. Это нарушает архитектуру нуклеиновых кислот, что в итоге приводит к гибели опухолевых клеток.
WO2010/062171 раскрывает целый ряд новых аналогов ДНК-алкилирующего агента СС-1065. Эти производные дуокармицина подходят для применения в соответствии с настоящим изобретением. Химический синтез ряда таких лекарственных средств описан в Примерах 1-22 в WO2010/062171.
Димеры CBI (димеры 1,2,9,9а-тетрагидроциклопропа[c]бенз[е]индол-4-она]) также относятся к группе высокотоксичных антибиотиков, являющихся производными от СС-1065, но тогда как дуокармицины вызывают алкилирование ДНК, структурно родственные димеры CBI вызывают межнитевую поперечную сшивку, что приводит к гибели клеток.
В одном варианте осуществления, Z представляет собой

где R1, R2 и R3 независимо выбирают из H, OH, SH, NH2, N3, NO2, NO, CF3, CN, C(O)NH2, C(O)H, C(O)OH, галогена, Ra, SRa, S(O)Ra, S(O)2Ra, S(O)ORa, S(O)2ORa, OS(O)Ra, OS(O)2Ra, OS(O)ORa, OS(O)2ORa, ORa, NHRa, N(Ra)Rb,+N(Ra)(Rb)Rc, P(O)(ORa)(ORb), OP(O)(ORa)(ORb), SiRaRbRc, C(O)Ra, C(O)ORa, C(O)N(Ra)Rb, OC(O)Ra, OC(O)ORa, OC(O)N(Ra)Rb, N(Ra)C(O)Rb, N(Ra)C(O)ORb, N(Ra)C(O)N(Rb)Rc, и водорастворимой группы, где
Ra, Rb, и Rc независимо выбирают из H и необязательно замещенного (CH2CH2O)aaCH2CH2X1Ra1, C1-15-алкила, C1-15-гетероалкила, C3-15-циклоалкила, C1-15-гетероциклоалкила, C5-15-арила, или C1-15-гетероарила, где aa выбирают из диапазона от 1 до 1000, X1 выбирают из O, S, и NRb1, и Rb1 и Ra1 независимо выбирают из H и C1-3-алкила, где один или более из необязательных заместителей в Ra, Rb, и/или Rc необязательно является(-ются) водорастворимой группой, два или более из Ra, Rb, и Rc необязательно являются соединенными одной или более связями с образованием одного или более необязательно замещенного(-ых) карбоцикла(-ов) и/или гетероцикла(-ов).
Термин «водорастворимая группа» относится к функциональной группе, которая хорошо сольватируется в водных средах и, которая придает улучшенную растворимость в воде соединению, к которому ее прикрепляют. Примеры водорастворимых групп включают полиспирты, прямоцепочечные или циклические сахариды, первичные, вторичные, третичные или четвертичные амины и полиамины, сульфатные группы, сульфонатные группы, сульфинатные группы, карбоксилатные группы, фосфатные группы, фосфонатные группы, фосфинатные группы, аскорбатные группы, гликоли, включая полиэтиленгликоли, и простые полиэфиры. Предпочтительными водорастворимыми группами являются первичные, вторичные, третичные и четвертичные амины, карбоксилаты, фосфонаты, фосфаты, сульфонаты, сульфаты, -(CH2CH2O)yyCH2CH2X2Ryy, -(CH2CH2O)yyCH2CH2X2-, -X2(CH2CH2O)yyCH2CH2-, гликоль, олигоэтиленгликоль и полиэтиленгликоль, где yy выбирают из диапазона от 1 до 1000, X2 выбирают из O, S и NRzz, и Rzz и Ryy независимо выбирают из H и C1-3-алкила, но не ограничиваются этим.
Термин «замещенный», когда используется в качестве прилагательного к термину «алкил», «гетероалкил», «циклоалкил», «гетероциклоалкил», «арил», «гетероарил» или тому подобному, указывает, что упомянутый «алкил», «гетероалкил», «циклоалкил», «гетероциклоалкил», «арил», «гетероарил», или подобная группа содержит один или несколько заместителей (введенные замещением водорода). Примеры заместителей включают OH, =O, =S, =NRd, =N-ORd, SH, NH2, NO2, NO, N3, CF3, CN, OCN, SCN, NCO, NCS, C(O)NH2, C(O)H, C(O)OH, галоген, Rd, SRd, S(O)Rd, S(O)ORd, S(O)2Rd, S(O)2ORd, OS(O)Rd, OS(O)ORd, OS(O)2Rd, OS(O)2ORd, S(O)N(Rd)Re, OS(O)N(Rd)Re, S(O)2N(Rd)Re, OS(O)2N(Rd)Re, OP(O)(ORd)(ORe), P(O)(ORd)(ORe), ORd, NHRd, N(Rd)Re,+N(Rd)(Re)Rf, Si(Rd)(Re)(Rf), C(O)Rd, C(O)ORd, C(O)N(Rd)Re, OC(O)Rd, OC(O)ORd, OC(O)N(Rd)Re, N(Rd)C(O)Re, N(Rd)C(O)ORe, N(Rd)C(O)N(Re)Rf, водорастворимую группу и тиопроизводные этих заместителей, и протонированные, имеющие заряд, и депротонированные формы любых из этих заместителей, где Rd, Re и Rf независимо выбирают из H и необязательно замещенного -(CH2CH2O)yyCH2CH2X2Ryy, C1-15-алкила, C1-15-гетероалкила, C3-15-циклоалкила, C1-15-гетероциклоалкила, C5-15-арила или C1-15-гетероарила, или их комбинации, где yy выбирают из диаазона от 1 до 1000, X2 независимо выбирают из O, S и NRzz, и Rzz и Ryy независимо выбирают из H и C1-3-алкила, два или более Rd, Re и Rf необязательно соединены одной или несколькими связями с образованием одного или нескольких необязательно замещенных карбоциклов и/или гетероциклов, но не ограничиваются этим. В том случае, когда присутствует более одного заместителя, каждый заместитель выбирают независимо. Два или более заместителей могут быть связаны друг с другом посредством замены одного или нескольких атомов водорода в каждом заместителе на одну или несколько соединяющих связей, которые могут быть одинарными, двойными или тройными связями, или, если возможны резонансные структуры, кратность связи в упомянутых связях может отличаться в двух или нескольких этих резонансных структурах. Таким образом, два заместителя могут быть связаны в результате образования одного или нескольких колец.
В том случае, когда заместители могут быть «связаны одной или несколькими связями с образованием одного или нескольких необязательно замещенных карбоциклов и/или гетероциклов», это означает, что заместители могут быть связаны друг с другом посредством замены одного или нескольких атомов водорода в каждом из заместителей на одну или несколько соединяющих связей.
Термин «арил», в контексте данного документа, относится к карбоциклическому ароматическому заместителю, содержащему от 5 до 24 кольцевых атомов углерода, которые могут иметь заряд или могут не иметь заряда и, которые могут состоять из одного кольца или двух или более конденсированных колец. Примеры арильных групп включают фенил, нафтил и антраценил, но не ограничиваются этим.
Термин «гетероарил», в контексте настоящего документа, относится к гетероциклическому ароматическому заместителю, содержащему от 1 до 24 кольцевых атомов углерода и, по меньшей мере, один кольцевой гетероатом, например, кислород, азот, серу, кремний или фосфор, где азот и сера могут быть необязательно окислены, и азот может быть необязательно кватернизирован, который может состоять из одного кольца или двух или более конденсированных колец. Гетероатомы могут быть непосредственно связаны друг с другом. Примеры гетероарильных групп включают пиридинил, пиримидил, фуранил, пирролил, триазолил, пиразолил, пиразинил, оксазолил, изоксазолил, тиазолил, имидазолил, тиенил, индолил, бензофуранил, бензимидазолил, бензотиазолил, пуринил, индазолил, бензотриазолил, бензизоксазолил, хиноксалинил, изохинолил и хинолил, но не ограничиваются этим. В одном из вариантов осуществления, гетероарильная группа содержит от 1 до 4 гетероатомов. Следует отметить, что выражение «C1-гетероарильная группа» означает, что имеется только один атом углерода, присутствующий в кольцевой системе гетероароматической группы (атомы углерода в необязательных заместителях, таким образом, не учитываются). Примером такой гетероароматической группы является тетразолильная группа.
Группы «арил» и «гетероарил» также охватывают кольцевые системы, в которых одно или несколько неароматических колец конденсированы с арильным или гетероарильным кольцом или кольцевой системой.
Термин «алкил», в контексте настоящего документа, относится к насыщенному или ненасыщенному углеводородному (гидрокарбильному) заместителю с прямой или разветвленной цепью. Примеры алкильных групп включают метил, этил, пропил, бутил, пентил, гексил, октил, децил, изопропил, втор-бутил, изобутил, трет-бутил, изопентил, 2-метилбутил, винил, аллил, 1-бутенил, 2-бутенил, изобутиленил, 1-пентенил, 2-пентенил и 1-бутинил, но не ограничиваются этим.
Термин «гетероалкил», в контексте данного документа, относится к насыщенному или ненасыщенному углеводородному (гидрокарбильному) заместителю с прямой или разветвленной цепью, в котором, по меньшей мере, один атом углерода заменен гетероатомом, например, кислородом, азотом, серой, кремнием или фосфором, где азот и сера могут быть необязательно окислены, и азот может быть необязательно кватернизирован. Гетероатомы могут быть непосредственно связаны друг с другом. Примеры включают метоксигруппу, этоксигруппу, пропоксигруппу, изопропоксигруппу, н-бутилоксигруппу, трет-бутилоксигруппу, метилоксиметил, этилоксиметил, метилоксиэтил, этилоксиэтил, метиламинометил, диметиламинометил, метиламиноэтил, диметиламиноэтил, метилтиометил, этилтиометил, этилтиоэтил и метилтиоэтил, но не ограничиваются этим.
Термин «циклоалкил», в контексте данного документа, относится к насыщенному или ненасыщенному неароматическому циклическому углеводородному (гидрокарбильному) заместителю, который может состоять из одного кольца или двух или более конденсированных колец. Примеры включают циклопропил, циклобутил, циклопентил, циклопентенил, циклопентадиенил, циклогексил, циклогексенил, 1,3-циклогексадиенил, декалинил и 1,4-циклогексадиенил, но не ограничиваются этим.
Термин «гетероциклоалкил», в контексте данного документа, относится к насыщенному или ненасыщенному неароматическому циклическому углеводородному (гидрокарбильному) заместителю, который может состоять из одного кольца или двух или более конденсированных колец, где, по меньшей мере, один атом углерода в одном из колец заменен гетероатомом, например, кислородом, азотом, серой, кремнием или фосфором, где азот и сера могут быть необязательно окислены, и азот может быть необязательно кватернизирован. Гетероатомы могут быть непосредственно связаны друг с другом. Примеры включают тетрагидрофуранил, пирролидинил, пиперидинил, 1,4-диоксанил, декагидрохинолинил, пиперазинил, оксазолидинил и морфолинил, но не ограничиваются этим. Следует отметить, что выражение «C1-гетероциклоалкильная группа» означает, что имеется только один атом углерода, присутствующий в кольцевой системе гетероциклоалкана (атомы углерода в необязательных заместителях, таким образом, не учитываются). Примером такой группы является диоксиранильная группа.
Термин «ацил», в контексте данного документа, относится к группе, имеющей прямую, разветвленную или циклическую конфигурацию или комбинацию таковых, прикрепленной к исходной структуре посредством карбонильной функциональной группы. Такие группы могут быть насыщенными или ненасыщенными, алифатиченскими или ароматическими, и карбоциклическими или гетероциклическими. Примеры С1-С8-ацильной группы включают ацетил-, бензоил-, никотиноил-, пропионил-, изобутирил-, оксалил-, и тому подобное.
Количество атомов углерода, которое могут содержать «алкил», «гетероалкил», «циклоалкил», «гетероциклоалкил», «арил», «гетероарил», «ацил» и тому подобное, указывается с помощью обозначения, предшествующего упомянутым терминам, то есть, C1-10-алкил означает, что указанный алкил может содержать от одного до десяти атомов углерода (атомы углерода в необязательных заместителях, присоединенных к этому алкилу, не учитываются).
Термин «карбоцикл» в настоящем документе относится к насыщенному или ненасыщенному циклоалкановому или ареновому фрагменту, где термины «циклоалкан» и «арен» определены, соответственно, как исходные фрагменты заместителей «циклоалкил» и «арил», которые определены в настоящем документе выше.
Термин «гетероцикл» в настоящем документе относится к насыщенному или ненасыщенному гетероциклоалкановому или гетероареновому фрагменту, где термины «гетероциклоалкан» и «гетероарен» определены, соответственно, как исходные фрагменты заместителей «гетероциклоалкил» и «гетероарил», которые определены в настоящем документе выше.
Окончание «-илен» в отличие от «-ил», например, в термине «алкилен» в сравнении с «алкил» показывает, что упомянутый, например, «алкилен» является двухвалентным (или многовалентным) фрагментом, связанным с одним или несколькими другими фрагментами посредством, по меньшей мере, одной или нескольких двойных связей, или двух или более одинарных связей, в отличие от того, что в упомянутом, например, «алкиле» имеется одновалентная группа, связанная с одним фрагментом посредством одной одинарной связи. Термин «алкилен», таким образом, относится к насыщенному или ненасыщенному углеводородному (гидрокарбиленовому) фрагменту с прямой или разветвленной цепью; термин «гетероалкилен», в контексте данного документа, относится к насыщенному или ненасыщенному углеводородному (гидрокарбиленовому) фрагменту с прямой или разветвленной цепью, в котором, по меньшей мере, один углерод заменен на гетероатом; термин «арилен», в контексте данного документа, относится к карбоциклическому ароматическому фрагменту, который может состоять из одного кольца или двух или более конденсированных колец; термин «гетероарилен», в контексте данного документа, относится к карбоциклическому ароматическому фрагменту, который может состоять из одного кольца или двух или более конденсированных колец, где, по меньшей мере, один атом углерода в одном из колец заменен гетероатомом; термин «циклоалкилен», в контексте данного документа, относится к насыщенному или ненасыщенному неароматическому циклическому углеводородному (гидрокарбиленовому) фрагменту, который может состоять из одного кольца или двух или более конденсированных колец; термин «гетероциклоалкилен», в контексте данного документа, относится к насыщенному или ненасыщенному неароматическому циклическому углеводородному (гидрокарбиленовому) фрагменту, который может состоять из одного кольца или двух или более конденсированных колец, где, по меньшей мере, один атом углерода в одном из колец заменен гетероатомом. Примеры двухвалентных фрагментов включают те примеры, приведенные для одновалентных групп, описываемых здесь выше, в которых один атом водорода удален.
Приставка «поли» в «полиалкилен», «полигетероалкилен», «полиарилен», «полигетероарилен», «полициклоалкилен», «полигетероциклоалкилен» и тому подобном показывает, что два или более таких "-иленовых" фрагментов, например, алкиленовые фрагменты, связаны вместе с образованием разветвленного или неразветвленного многовалентного фрагмента, содержащего две или более точки присоединения смежных фрагментов. Подобно тому, приставка «олиго», например, в олигоэтиленгликоле, показывает, что два или более этиленгликолевых фрагмента связаны друг с другом с образованием разветвленного или неразветвленного многовалентного фрагмента. Различие между приставками «олиго» и «поли» состоит в том, что приставка «олиго» наиболее часто используется для обозначения относительно небольшого количества повторяющихся звеньев, тогда как приставка «поли» обычно относится к относительно большому количеству повторяющихся звеньев.
Каждый m и n независимо равен 0 или представляет собой целое число. Предпочтительно, n имеет значение 0, 1, 2, или 3, а m равно 0 или 1. Более предпочтительно, n имеет значение 0, 1, 2, или 3, а m равно 0.
В одном варианте осуществления, изобретение относится к соединению 'линкер-лекарственное средство' формулы (I) или его фармацевтически приемлемой соли, гидрату или сольвату, где
V1 представляет собой расщепляемый при определенных условиях или преобразуемый при определенных условиях фрагмент, который может быть расщеплен или преобразован в результате химического, фотохимического, физического, биологического или ферментативного процесса;
Z означает цитотоксическое лекарственное средство, включающее фенольную гидроксильную группу, посредством которой Z прикрепляется к линкеру, предпочтительно, Z представляет собой дуокармицин или димерное производное CBI, более предпочтительно Z представляет собой производное дуокармицина;
n имеет значение 0, 1, 2, или 3; и
m имеет значение 0 или 1.
В одном варианте осуществления, Z представляет собой

где R1, R2 и R3 независимо выбирают из H, OH, SH, NH2, N3, NO2, NO, CF3, CN, C(O)NH2, C(O)H, C(O)OH, галогена, Ra, SRa, S(O)Ra, S(O)2Ra, S(O)ORa, S(O)2ORa, OS(O)Ra, OS(O)2Ra, OS(O)ORa, OS(O)2ORa, ORa, NHRa, N(Ra)Rb,+N(Ra)(Rb)Rc, P(O)(ORa)(ORb), OP(O)(ORa)(ORb), SiRaRbRc, C(O)Ra, C(O)ORa, C(O)N(Ra)Rb, OC(O)Ra, OC(O)ORa, OC(O)N(Ra)Rb, N(Ra)C(O)Rb, N(Ra)C(O)ORb, N(Ra)C(O)N(Rb)Rc, и водорастворимой группы, где
Ra, Rb, и Rc независимо выбирают из H и необязательно замещенного (CH2CH2O)aaCH2CH2X1Ra1, C1-15-алкила, C1-15-гетероалкила, C3-15-циклоалкила, C1-15-гетероциклоалкила, C5-15-арила, или C1-15-гетероарила, где aa выбирают из диапазона от 1 до 1000, X1 выбирают из O, S, и NRb1, и Rb1 и Ra1 независимо выбирают из H и C1-3-алкила, где один или более из необязательных заместителей в Ra, Rb, и/или Rc необязательно является(-ются) водорастворимой группой, два или более из Ra, Rb, и Rc необязательно являются соединенными одной или более связями с образованием одного или более необязательно замещенного(-ых) карбоцикла(-ов) и/или гетероцикла(-ов).
В одном варианте осуществления, Z представляет собой
В предпочтительном варианте осуществления, Z представляет собой





В одном варианте осуществления, R1 выбирают из Н, метила и метоксигруппы. Предпочтительно, R1 представляет собой метил.
В более предпочтительном варианте осуществления, Z представляет собой

В особенно предпочтительном варианте осуществления, Z представляет собой

В еще одном варианте осуществления, Z представляет собой

В предпочтительном варианте осуществления, Z представляет собой

В одном варианте осуществления, R1 выбирают из Н, метила и метоксигруппы. Предпочтительно, R1 представляет собой метил.
В более предпочтительном варианте осуществления, Z представляет собой

В одном варианте осуществления, соединение формулы (I) представлено

где V1, Z и n являются такими, как определено в предыдущих вариантах осуществления.
В предпочтительном варианте осуществления, соединение формулы (Ia) представляет собой

где R4 и R5 независимо представляют собой Н или блокирующую аминогруппу.
В более предпочтительном варианте осуществления, соединение формулы (Ia) представляет собой

В другом предпочтительном варианте осуществления, соединение формулы (Ia) представляет собой
В дополнительном предпочтительном варианте осуществления, соединение формулы (Ia) представляет собой

В одном варианте осуществления, соединение формулы (I) представлено

где V1, Z и n являются такими же, как определено в предыдущих вариантах осуществления.
В предпочтительном варианте осуществления, соединение формулы (Ib) представляет собой

Настоящее изобретение, кроме того, относится к конъюгату антитело-лекарственное средство (ADC), где соединение 'линкер-лекарственное средство' согласно изобретению (формула I) является конъюгированным с антителом или его антиген-связывающим фрагментом посредством цистеина, присутствующего в антителе или в антиген-связывающем фрагменте.
Среднее отношение лекарственного средства к антителу (DAR) в ADC, то есть, среднее число молекул лекарственного средства, конъюгированных с антителом, обычно находится в диапазоне от 1 до 6. Как известно в данной области, DAR и распределение лекарственного нагрузки могут быть определены, например, при использовании хроматографии гидрофобного взаимодействия (HIC) или высокоэффективной жидкостной хроматографии с обращенными фазами (RP-HPLC). HIC в особенности подходит для определения среднего DAR. Предпочтительно, среднее DAR находится в диапазоне от 1 до 4, более предпочтительно от 1 до 3, наиболее предпочтительно от 1,5 до 2.
Соединения 'линкер-лекарственное средство' согласно настоящему изобретению разрабатываются из условия, чтобы гидрофобность ADC, содержащих такие соединения 'линкер-лекарственное средство', была более сопоставима с гидрофобностью оголенных антител или их антиген-связывающих фрагментов, чем в случае гидрофобности ADC, содержащих соединения 'линейный линкер-лекарственное средство'. Регулировка гидрофобности может быть использована для управления фармакокинетическими параметрами ADC.
В результате сравнения гидрофобности конъюгата с гидрофобностью неконъюгированного антитела или его антиген-связывающего фрагмента может быть определена гидрофобность ADC, именуемая относительной гидрофобностью. В некоторых вариантах осуществления, время удерживания конъюгата превышает не более, чем на три минуты время удерживания неконъюгированного антитела или его антиген-связывающего фрагмента, что определяют способом, описанным в Таблицах 1А и 1В в Примерах. В некоторых других вариантах осуществления, время удерживания конъюгата превышает не более, чем на две минуты время удерживания неконъюгированного антитела или его антиген-связывающего фрагмента, что определяют способом, описанным в Таблицах 1А и 1В в Примерах. В некоторых других вариантах осуществления, время удерживания конъюгата превышает не более, чем на полторы минуты время удерживания неконъюгированного антитела или его антиген-связывающего фрагмента, что определяют способом, описанным в Таблицах 1А и 1В в Примерах. В некоторых других вариантах осуществления, время удерживания конъюгата превышает не более, чем на одну минуту время удерживания неконъюгированного антитела или его антиген-связывающего фрагмента, что определяют способом, описанным в Таблицах 1А и 1В.
Воздействие линкера по настоящему изобретению на относительную гидрофобность будет проявлено более отчетливо в вариантах осуществления, где лекарственные средства являются более гидрофобными по своей природе.
В контексте настоящего изобретения, любое антитело - в частности, любое антитело, известное наличием терапевтической активности, или любое антитело, известное в области ADC, или любой его антиген-связывающий фрагмент, например, фрагмент F(ab')2 или Fab', одноцепочечное (sc) антитело, scFv, однодоменное (sd) антитело, диатело, или миниантитело, может быть использовано для (дикого типа или сайт-специфической) конъюгации соединения 'линкер-лекарственное средство', заявляемого в данном документе. Антитела могут представлять собой любой изотип, как например, антитела IgG, IgA или IgM. Предпочтительно, антитело представляет собой антитело IgG, более предпочтительно антитело IgG1 или IgG2.
Антитело может представлять собой моноспецифическое (то есть, специфическое для одного антигена; такой антиген может быть общим среди видов или может иметь близкородственные антигены среди видов) антитело или биспецифическое (то есть, специфическим для двух различных антигенов) антитело. В одном варианте осуществления настоящего изобретения, антитело является моноспецифическим антителом или его антиген-связывающим фрагментом.
Эти антитела могут быть получены рекомбинантно, синтетически или другими подходящими способами, известными в данной области.
Предпочтительно, антитело связывается с антигеном-мишенью, который экспрессируется в или на клеточной мембране (например, на поверхности клеток) опухолевой клетки. Более предпочтительно, ADC поглощается клеткой после связывания антитела с (антигеном)-мишенью, после чего цитотоксическое лекарственное средство высвобождается внутри клетки.
В одном варианте осуществления, антитело, которое должно быть использовано согласно настоящему изобретению, представляет собой моноспецифическое антитело (или его антиген-связывающий фрагмент) против одной из мишеней, выбираемых из группы, состоящей из аннексина А1, CA242 (ракового антигена 242), CD19, CD22, CD30 (фактора некроза опухоли 8), CD33, CD37, CD38 (гидролазы циклической аденозиндифосфо-рибозы), CD44, CD47 (интегрин-ассоциированного белка), CD56 (молекулы адгезии нервных клеток), CD70, CD74, CD79, CD115 (рецептора колониестимулирующего фактора 1), CD123 (рецептора интерлейкина-3), CD138 (Синтекана 1), CD203c (ENPP3), CD303, CD333, CEACAM, CLL-1 (лектин-подобной молекулы-1 C-типа), c-MET (рецептора фактора роста гепатоцитов), Cripto, DLL3, EGFR, EPCAM, EphA2, EphB3, ETBR (рецептора эндотелина В-типа), FAP, FcRL5 (Fc-рецептор-подобного белка 5, CD307), FGFR3, FOLR1 (рецептора фолиевой кислоты альфа), GCC (гуанилатциклазы C), GPNMB, HER2, HMW-MAA (меланома-ассоциированного антигена высокой молекулярной массы), интегрина, антиген Lea-карбогидрата, Lewis Y (CD174), LIV1, мезотелина (MSLN), MN (CA9), MUC1, MUC16, NaPi2b, Nectin-4, PSMA, SLC44A4, STEAP-1, антигена 5T4, Tag72, тканевого фактора (TF, тромбопластина, CD142), TF-Ag, TROP2 (опухоль-ассоциированного трансдуктора кальциевого сигнала 2), и VLA.
В еще одном варианте осуществления, антитело, которое должно быть использовано в соответствии с настоящим изобретением, представляет собой биспецифическое антитело (или его антиген-связывающий фрагмент) против комбинации двух мишеней, выбираемых из группы, приведенной выше.
Примеры подходящих антител включают блинатумомаб (CD19), эпратузумаб (CD22), иратумумаб и брентуксимаб (CD30), вадастуксимаб (CD33), тетулумаб (CD37), изатуксимаб (CD38), биватузумаб (CD44), лорвотузумаб (CD56), ворсетузумаб (CD70), милатузумаб (CD74), полатузумаб (CD79), ровалпитузумаб (DLL3), футуксимаб (EGFR), опортузумаб (EPCAM), фарлетузумаб (FOLR1), глембатумумаб (GPNMB), трастузумаб и пертузумаб (HER2), этарацизумаб (интегрин), анетумаб (мезотелин), панкомаб (MUC1), энфортумаб (Nectin-4), и H8, A1 и А3 (антиген 5Т4)/.
Антитело, которое должно быть использовано согласно настоящему изобретению, предпочтительно представляет собой моноклональное антитело (mAb) и может быть химерным, гуманизированным или человеческим mAb. Более предпочтительно, согласно настоящему изобретению используют гуманизированное или человеческое mAb, еще более предпочтительно гуманизированное или человеческое mAb класса IgG, наиболее предпочтительно гуманизированное или человеческое mAb класса IgG1. Предпочтительно, упомянутое антитело имеет легкие цепи κ (каппа), то есть, представляет собой гуманизированное или человеческое антитело класса IgG1-κ.
В гуманизированных антителах, антиген-связывающие комплементарность-определяющие участки (CDRs) в вариабельных областях тяжелой цепи (HC) и легкой цепи (LC) получают из антител видов нечеловеческого происхождения, обычно из мыши, крысы или кролика. Эти нечеловеческие CDRs могут быть размещены в пределах человеческого каркасного участка вариабельных областей (каркасного участка FR1, FR2, FR3 и FR4) тяжелой цепи (HC) и легкой цепи (LC). Выбранные аминокислоты в человеческих каркасных участках могут быть обменены на соответствующие исходные аминокислоты видов нечеловеческого происхождения с тем, чтобы улучшить аффинность связывания при одновременном сохранении низкой иммуногенности. Таким образом гуманизированные вариабельные области комбинируются с человеческими константными областями. Альтернативно, нечеловеческие вариабельные области, включающие нечеловеческие каркасные участки, комбинируются с человеческой константной областью легкой цепи и человеческой константной областью тяжелой цепи. В этом случае, выбранные аминокислоты исходных каркасных участков видов нечеловеческого происхождения обменивают на их соответствующие человеческие аминокислоты с тем, чтобы снизить иммуногенность при одновременном сохранении аффинности связывания антитела. В менее предпочтительных вариантах осуществления, аминокислоты, расположенные в пределах CDRs, могут быть обменены со снижением иммуногенности в отсутствии снижения аффинности антитела. Аминокислотная последовательность в этих гуманизированных антителах может быть пронумерована согласно системе нумерации Kabat (вариабельные области антитела и константная область легкой цепи) и согласно системе Kabat Eu (константные области тяжелой цепи антитела).
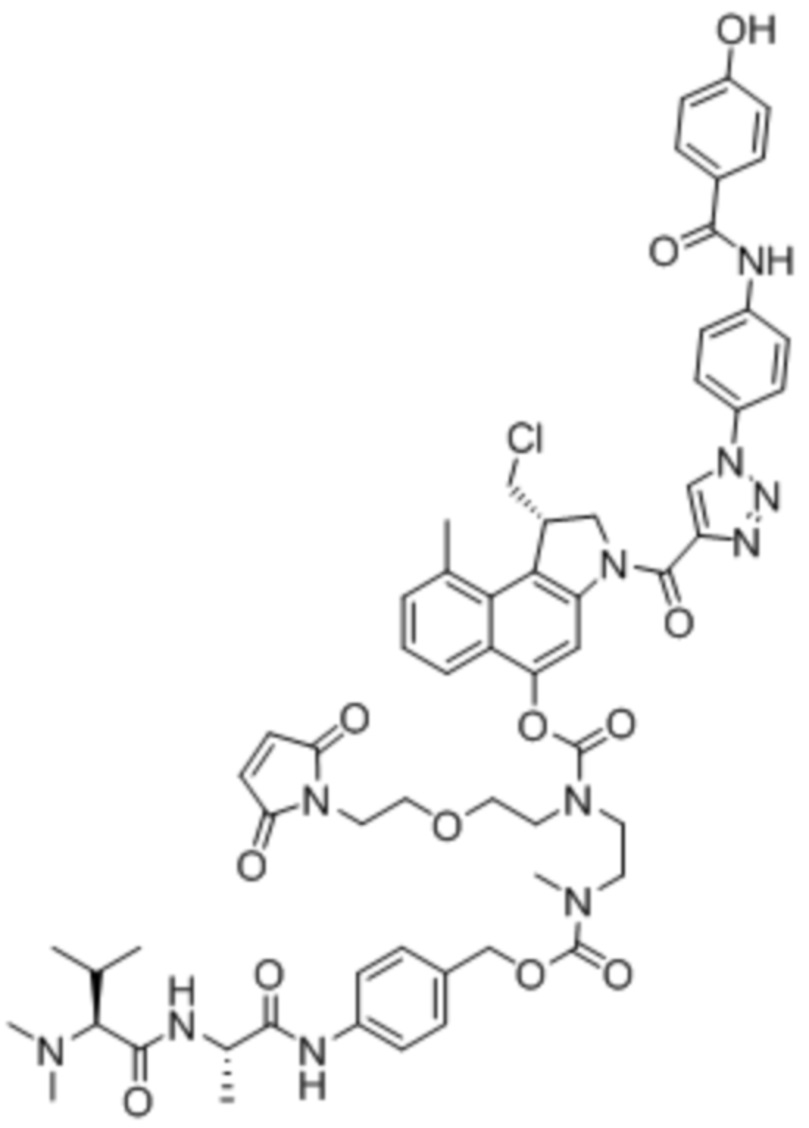
Антитела и их антиген-связывающие фрагменты конъюгируют с разнообразными цитотоксическими лекарственными средствами посредством либо расщепляемых, либо нерасщепляемых линкеров. Примеры соединений 'линкер-лекарственное средство', известных специалисту в данной области, включают vc-seco-DUBA (то есть, SYD980), mc-vc-PAB-MMAE (также имеющее сокращенные названия mc-vc-MMAE и vc-MMAE), mc-MMAF, и mc-vc-MMAF. Эти сокращенные наименования хорошо известны специалисту в данной области (см. также WO2015/177360). Соединение 'линкер-лекарственное средство' vc-seco-DUBA раскрыто в WO2011/133039 как соединение 18b на стр. 210, ll. 21-27.
Общая молекулярная структура ADC на основе vc-seco-DUBA отражена ниже.
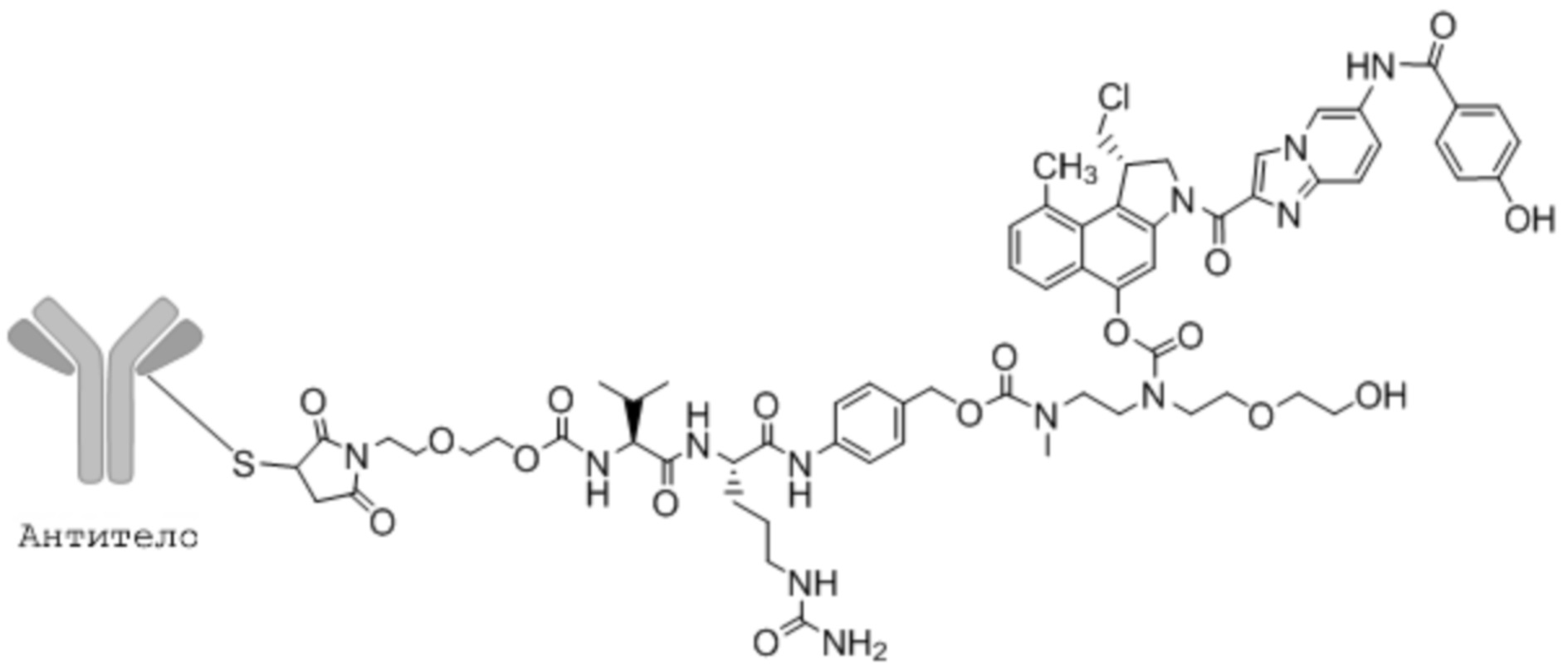
Молекулярная структура ADC на основе vc-seco-DUBA
Линкер, используемый согласно настоящему изобретению представляет собой расщепляемый линкер в противоположность, например, нерасщепляемому малеимидокапроилу (mc), и может содержать, например, расщепляемый дипептид, такой как валинцитруллин (vc) или валиналанин (va).
Многие из линкеров известного уровня техники представляют собой линейные линкеры, то есть, имеют сайт для расщепления между лекарственным средством и точкой прикрепления антитела или его антиген-связывающего фрагмента. Эти линкеры авторы настоящего изобретения определяют как «эндо-линкеры» (внутренние линкеры). Известные в данной области подходы к улучшению гидрофобности соединения 'линкер-лекарственное средство' и, соответственно, получающегося в результате ADC включают прикрепление водорастворимых групп, таких как полиэтиленгликолевые полимеры, к линкерам, либо между лекарственным средством и антителом или антиген-связывающим фрагментом, либо в параллельном положении (в качестве боковой группы в линкере). Однако, введение солюбилизирующих групп непременно повышает сложность молекулы линкера и в случае крупных солюбилизирующих групп даже повышает сложность изготовления конъюгатов.
Неожиданно, авторы настоящего изобретения обнаружили, что гидрофобность ADC может быть улучшена без необходимости встраивания (объемных) водорастворимых групп в результате использования нелинейных линкеров, то есть, линкеров, не имеющих сайт для расщепления между лекарственным средством и антителом или антиген-связывающим фрагментом (определяемых авторами настоящего изобретения как «экзо-линкеры»). Без привязки к какой-либо теории, полагают, что перегруппировка в линкере, используемом согласно изобретению, может приводить к обеспечению более короткого расстояния между гидрофобным лекарственным средством и антителом или антиген-связывающим фрагментом. В результате этого, лекарственное средство оказывается экранированным от гидрофильной водной среды, окружающей антитело или антиген-связывающий фрагмент, что делает ADC менее гидрофобным.
Этот снижающий гидрофобность эффект повышается в том случае, когда число атомов между атомом серы антитела (или антиген-связывающего фрагмента) и атомом кислорода лекарственного средства снижается, как показано в Таблице А ниже.
Например, в ADC на основе vc-seco-DUBA имеются 29 атомов между S-атомом антитела и O-атомом лекарственного средства.
Таблица А
*ADC дикого типа; vc-seco-DUBA представляет собой линейное соединение 'линкер-лекарственное средство' сравнения.
**Относительная гидрофобность определена так, как описано в Таблице 1А в Примерах.
В одном варианте осуществления, настоящее изобретение относится к ADC, где соединение «линкер-лекарственное средство» согласно изобретению подвергают сайт-специфической конъюгации с антителом посредством встроенного цистеина.
В соответствии с настоящим изобретением, термин «встроенный цистеин» означает замену нецистеиновой аминокислоты в тяжелой цепи (HC) или легкой цепи (LC) антитела на цистеин, введение цистеина между имеющимися аминокислотами или замену нативного цистеина с межцепочечной дисульфидной связью на нецистеиновую аминокислоту, например, серин, соответственно, с получением свободного «встроенного» цистеина в другой цепи. Как известно специалисту в данной области техники, цистеин-встроенное антитело может быть экспрессировано в клетках хозяина способами рекомбинантного клонирования или может быть получено при использовании обычно применяемых методов молекулярного клонирования, или домен(-ы) HC или LC антитела, несущий(-ие) мутацию(-ии) цистеина, может(гут) быть синтезирован(-ы) как таковой(-ые) при использовании известных оборудования и методик для синтеза (пептида или ДНК). Обычно, используют методики, аналогичные методикам, раскрытым в WO2015/177360.
Антитела, содержащие встроенные цистеины, которые предоставляют возможность получения сайт-специфических ADC, могут обеспечивать положения для конъюгации, которые показывают хорошую реакционную способность в отношении соединения 'линкер-лекарственное средство' и одновременно с тем могут иметь сниженный риск образования дополнительных дисульфидных связей между антителами (приводящих к агрегации) или нарушения структуры антитела. Введение цистеинового остатка в подходящее положение в антителе позволяет контролировать сайт конъюгации, а получаемые сайт-специфические конъюгаты являются более гомогенными, чем конъюгаты, полученные обычно применяемыми способами, то есть, конъюгацией посредством цистеинов с межцепочечными дисульфидными связями дикого типа. Такие обычно применяемые способы дают в результате гетерогенную смесь ADC, которая может требовать очистки, например, для удаления неконъюгированного антитела. Некоторые отдельно взятые составляющие смеси ADC, полученных обычной конъюгацией, могут иметь плохие рабочие характеристики in vivo. Рабочие характеристики in vivo для ADC с точки зрения эффективности, безопасности и стабильности могут быть улучшены, если соединение 'линкер-лекарственное средство' в ADC является сайт-специфически конъюгированным посредством встроенных цистеинов согласно B.-Q. Shen et al. in Nature Biotechnology, Vol. 30, Number 2, 2012, pages 184-189.
Как показано в Таблице B ниже, снижающий гидрофобность эффект соединений 'линкер-лекарственное средство' по изобретению также отчетливо виден в ADC, где соединение 'линкер-лекарственное средство' является сайт-специфически конъюгированным в положении, где соединение 'линкер-лекарственное средство' ориентировано в направлении вовне.
Таблица B.
*Встроенный цистеин в положении 120 в тяжелой цепи.
**vc-seco-DUBA представляет собой линейное соединение 'линкер-лекарственное средство' сравнения.
Авторы настоящего изобретения заметили, что снижение гидрофобности является даже более выраженным в том случае, когда соединение 'линкер-лекарственное средство' сайт-специфически конъюгировано в положениях Fab- или Fc-полости. Этот эффект показан в Таблице С для положений 40 и 41 в легкой цепи, и для положения 41 в тяжелой цепи. Значения относительной гидрофобности вычисляют с использованием гидрофобности ADC на основе конъюгированного PSMA-vc-seco-DUBA дикого типа в качестве референс-значения (где первая колонка показывает значения для сайт-специфически конъюгированных ADC) или с использованием гидрофобности соответственного сайт-специфически конъюгированного ADC (где вторая колонка показывает значения для сайт-специфически конъюгированных ADC). Референс-значения привязаны к 1,0.
Таблица С.
*Встроеннный цистеин в положении 40 в легкой цепи, 41 в легкой цепи и 41 в тяжелой цепи, соответственно.
**vc-seco-DUBA представляет собой линейное соединение 'линкер-лекарственное средство' сравнения.
В одном варианте осуществления, настоящее изобретение относится к ADC, где соединение 'линкер-лекарственное средство' подвергнуто сайт-специфической конъюгации с антителом посредством встроенного цистеина в одном или более положениях в упомянутом антителе, выбираемых из 40, 41, 89 (нумерация Kabat), 152, 153, 155, 171, 247, 297, 339, 375 и 376 (нумерация Eu) в тяжелой цепи, и 40, 41, 165 и 168 в легкой цепи (нумерация Kabat).
В контексте настоящего изобретения, нумерацию Kabat используют для указания положений аминокислот встроенных цистеинов в вариабельных областях тяжелой цепи (HC) и вариабельных и константных областях легкой цепи (LC), и нумерацию Eu используют для указания положений в константных областях тяжелой цепи антитела.
Выражение «нумерация Kabat» обозначает систему нумерации, используемую для вариабельных доменов тяжелой цепи или вариабельных или константных доменов легкой цепи при компиляции антител в Kabat, E.A. et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991). При использовании этой системы нумерации, фактическая линейная последовательность аминокислот может содержать меньше аминокислот или может содержать дополнительные аминокислоты, соответствующие укорачиванию, или вставке в каркасный участок (FR) или комплементарность-определяющий участок (CDR) вариабельного домена. Нумерация Kabat для остатков может быть определена для заданного антитела с помощью выравнивания в областях гомологии последовательности антитела со «стандартной» пронумерованной по Kabat последовательностью.
Выражение «нумерация Eu» означает индекс Eu как и в Kabat, E.A. et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD., NIH publication no. 91-3242, pp. 662, 680, 689 (1991). «Индекс Eu как в Kabat» относится к нумерации остатков человеческого антитела IgG1 Eu (Edelman, G.M. et al., Proc. Natl. Acad. Sci. USA, 63, 78-85 (1969)).
Положения 40, 41 и 89 тяжелой цепи располагаются в вариабельной области, и положения 152, 153, 155, 171, 247, 297, 339, 375 и 376 тяжелой цепи располагаются в константной области антитела. Положения 40 и 41 легкой цепи располагаются в вариабельной области, и положения 165 и 168 легкой цепи располагаются в константной области антитела.
Положения 40, 41, 89, 152, 153, 155 и 171 тяжелой цепи и положения 40, 41, 165 и 168 легкой цепи располагаются на Fab-участке, и положения 247, 297, 339, 375 и 376 тяжелой цепи располагаются на Fc-участке антитела.
Авторы настоящего изобретения неожиданно обнаружили, что полученные сайт-специфической конъюгацией ADC по настоящему изобретению демонстрируют улучшенные физико-химические, фармакологические и/или фармакокинетические свойства по сравнению с обычно применяемыми ADC, в которых соединение 'линейный линкер-лекарственное средство' конъюгировано посредством нативных (то есть, эндогенных) образующих межцепочечные дисульфидные связи цистеинов антитела.
Модификации вариабельных доменов антитела, помимо гуманизации, обычно избегают, поскольку это может привести к частичной или полной потере антиген-связывающих свойств. Однако, конкретные аминокислотные остатки в каркасных участках тяжелых и легких цепей антитела, в случае обмена на цистеин, и подходят для конъюгации, и не приводят к (значительному) снижению связывания антигена после конъюгации соединения соединения 'линкер-лекарственное средство'. Кроме того, конъюгация в этих положениях в Fab-участке также обеспечивает использование антиген-связывающих фрагментов вместо полностью интактных антител. Конъюгация на Fab-участке является предпочтительной относительно конъюгации на Fc-участке, поскольку ассоциированные с опухолью протеазы в микросреде опухоли могут частично расщеплять константные домены Fc под шарнирной областью. Такое расщепление константных доменов Fc могло бы привести к потере Fc-конъюгированных соединений 'линкер-лекарственное средство', так как они не являются поглощенными раковой клеткой, что, в свою очередь, могло бы привести к снижению активности ADC in vivo. (Fan et al. Breast Cancer Res. 2012; 14: R116 и Brezsky et al. PNAS 2009; 106: 17864-17869).
Поэтому, в предпочтительном варианте осуществления, настоящее изобретение относится к конъюгату антитело-лекарственное средство (ADC), где соединение 'линкер-лекарственное средство' подвергнуто сайт-специфической конъюгации с антителом посредством встроенного цистеина в одном или более положениях упомянутого антитела, выбираемых из положений 40, 41 и 89 тяжелой цепи и 89 и положений 40 и 41 легкой цепи.
В более предпочтительном варианте осуществления, настоящее изобретение относится к ADC, где соединение 'линкер-лекарственное средство' подвергнуто сайт-специфической конъюгации с антителом посредством встроенного цистеина в одном или более положениях упомянутого антитела, выбираемых из положения 41 тяжелой цепи и положений 40 и 41 легкой цепи.
В особенно предпочтительном варианте осуществления, настоящее изобретение относится к ADC, где соединение 'линкер-лекарственное средство' подвергнуто сайт-специфической конъюгации с антителом посредством встроенного цистеина в положении 41 тяжелой цепи.
В качестве одного репрезентативного примера, антитело, которое должно быть использовано согласно настоящему изобретению, представляет собой антитело против PSMA, имеющее встроенный цистеин в положении 41 тяжелой цепи (то есть, PSMA-HC41), которое раскрыто в WO2015/177360 как SYD1030 (тяжелая цепь содержит аминокислотную последовательность SEQ ID NO:2, и легкая цепь содержит аминокислотную последовательность SEQ ID NO:5).
В качестве другого репрезентативного примера, антитело, которое должно быть использовано согласно настоящему изобретению, представляет собой антитело против антигена 5Т4, имеющее встроенный цистеин в положении 41 тяжелой цепи, которое раскрыто в WO2015/177360 как H8-HC41 (тяжелая цепь содержит аминокислотную последовательность SEQ ID NO:8, и легкая цепь содержит аминокислотную последовательность SEQ ID NO:11).
Конъюгаты ADC согласно настоящему изобретению могут быть получены в соответствии со способами и методиками, которые хорошо известны специалисту в данной области.
Подходящий способ для сайт-неспецифической (дикого типа) конъюгации соединений 'линкер-лекарственное средство' на основе дуокармицина, то есть, конъюгации с эндогенным цистеином, образующим межцепочечные дисульфидные связи, раскрыт в Примере 15 в WO2011/133039.
Подходящий способ для сайт-неспецифической (дикого типа) конъюгации соединений 'линкер-лекарственное средство' на основе димера CBI раскрыт в WO2015/110935.
Конъюгаты ADC согласно настоящему изобретению имеют аффинность связывания, сходную с оголенными антителами, превосходную токсичность in vitro, и хорошую эффективность in vivo. Примечательно, что было обнаружено, что эти ADC, как правило, являются менее гидрофобными и менее предрасположенными к расщеплению под действием катепсина В и, следовательно, вероятно, и под действием других внутри- или внеклеточных ферментов/протеаз в опухолевой массе (в микросреде опухоли), чем ADC, которые получены конъюгированием с соединением 'линейный линкер-лекарственное средство' vc-seco-DUBA, известные из существующего уровня техники, но при этом показывают сходную цитотоксичность in vitro.
Неожиданно, конъюгаты ADC согласно настоящему изобретению показывают улучшенную эффективность in vivo в ксенотрансплантатной модели опухоли у животных по сравнению с ADC, которые получены конъюгированием с соединением 'линейный линкер-лекарственное средство' vc-seco-DUBA.
В конкретном варианте осуществления, настоящее изобретение относится к ADC формулы (II)

где «Антитело» представляет собой антитело или его антиген-связывающий фрагмент, либо без встроенного цистеина, либо, по меньшей мере, с одним встроенным цистеином, которое(-ый) раскрывают в данном документе;
n имеет значение 0, 1, 2 или 3;
y отражает среднее значение DAR от 1 до 6, предпочтительно от 1 до 4, более предпочтительно от 1 до 3, наиболее предпочтительно от 1,5 до 2; и
V1 и Z являются такими, как определено в предыдущих вариантах осуществления.
В предпочтительном варианте осуществления, настоящее изобретение относится к ADC формулы (III)

где «Антитело» представляет собой антитело или его антиген-связывающий фрагмент, либо без встроенного цистеина, либо, по меньшей мере, с одним встроенным цистеином, которое(-ый) раскрывают в данном документе;
n имеет значение 0, 1, 2 или 3;
y отражает среднее значение DAR от 1 до 6, предпочтительно от 1 до 4, более предпочтительно от 1 до 3, наиболее предпочтительно от 1,5 до 2; и
R выбирают из

В особенно предпочтительном варианте осуществления, настоящее изобретение относится к ADC формулы (II) или (III), содержащему антитело с встроенным цистеином в одном или более положениях, выбираемых из положений 40 и 41 тяжелой цепи, и положений 40 и 41 в легкой цепи. Предпочтительно, упомянутый встроенный цистеин находится в положении 41 тяжелой цепи или в положении 40 или 41 легкой цепи, более предпочтительно в положении 41 тяжелой цепи.
Настоящее изобретение дополнительно относится к фармацевтической композиции, содержащей соединение 'линкер-лекарственное средство' или конъюгат 'антитело-лекарственное средство' (ADC), которые описаны выше по тексту в данном документе, и один или более фармацевтически приемлемых эксципиентов. Обычные фармацевтические составы терапевтических белков, таких как моноклональные антитела и конъюгаты '(моноклональное) антитело-лекарственное средство', принимают форму лиофилизированных таблеток (лиофилизированных порошков), которые требуют (водного) растворения (то есть, восстановления влагосодержания) перед внутривенным вливанием, или замороженных (водных) растворов, которые требуют размораживания перед использованием.
Как правило, фармацевтическую композицию согласно настоящему изобретению предоставляют в форме лиофилизированной таблетки. Подходящие фармацевтически приемлемые эксципиенты для включения в фармацевтическую композицию (перед лиофильной сушкой) включают буферные растворы (например, цитрат-, гистидин- или сукцинат-содержащих солей в воде), лиопротекторы (например, сахарозу, трегалозу), регуляторы тоничности (например, хлорид натрия), поверхностно-активные вещества (например, полисорбат) и объемообразующие агенты (например, маннитол, глицин). Эксципиенты, используемые для подвергаемых лиофильной сушке белковых составов, выбирают по их способности предотвращать денатурацию белка во время процесса лиофильной сушки, а также во время хранения. Например, состав в форме стерильного лиофилизированного порошка для однократного применения Kadcyla™ (Roche) содержит - после восстановления с использованием бактериостатической или стерилизованной воды для инъекций (BWFI или SWFI) - 20 мг/мл адо-трастузумаб эмтанзина, 0,02% масс./объем полисорбата 20, 10 мМ сукцината натрия и 6% масс./объем сахарозы с pH, равным 5,0.
Настоящее изобретение дополнительно относится к соединению 'линкер-лекарственное средство', конъюгату ADC или фармацевтической композиции, которые описаны выше по тексту в данном документе, для применения в качестве лекарственного препарата.
В одном варианте осуществления, настоящее изобретение относится к соединению 'линкер-лекарственное средство', ADC или фармацевтической композиции, которые описаны выше по тексту в данном документе, для использования в лечении солидных опухолей и гематологических злокачественных опухолей у человека.
В первом предпочтительном варианте осуществления, настоящее изобретение относится к соединению 'линкер-лекарственное средство', ADC или фармацевтической композиции, которые описаны выше по тексту в данном документе, для использования в лечении человеческих солидных опухолей, выбираемых из группы, состоящей из рака молочной железы, рака головного мозга (например, глиобластомы), рака головы и шеи, рака щитовидной железы, рака надпочечников, рака кости, рака глаза, рака пищевода, рака желудка, рака тонкой кишки, рака ободочной и прямой кишки, рака уротелия (например, рака мочевого пузыря или почки), рака яичников, рака матки, рака влагалища и шейки матки, рака легких (в особенности, немелкоклеточного рака легких (NSCLC) и мелкоклеточного рака легких (SCLC)), мезотелиомы (в особенности, злокачественной плевральной мезотелиомы), рака печени, рака поджелудочной железы, рака кожи, рака яичка и рака простаты.
Во втором предпочтительном варианте осуществления, настоящее изобретение относится к соединению 'линкер-лекарственное средство', ADC или фармацевтической композиции, которые описаны выше по тексту в данном документе, для использования в лечении человеческих солидных опухолей, выбираемых из группы, состоящей из рака молочной железы, рака желудка, рака ободочной и прямой кишки, рака уротелия (например, рака мочевого пузыря), рака яичников, рака матки, рака легких (в особенности, немелкоклеточного рака легких (NSCLC) и мелкоклеточного рака легких (SCLC)), мезотелиомы (в особенности, злокачественной плевральной мезотелиомы), рака печени, рака поджелудочной железы и рака простаты.
В третьем предпочтительном варианте осуществления, настоящее изобретение относится к соединению 'линкер-лекарственное средство', ADC или фармацевтической композиции, которые описаны выше по тексту в данном документе, для использования в лечении человеческих гематологических злокачественных опухолей, в частности лейкемии, в большей степени лейкемиии, выбранной из группы, состоящей из острой лимфобластной и миелоидной лейкемии (ALL и AML, соответственно).
Настоящее изобретение дополнительно относится к последовательно или одновременно вводимой комбинации соединения 'линкер-лекарственное средство', ADC или фармацевтической композиции, которые описаны выше по тексту в данном документе, с одним или более другими терапевтическими агентами, как например, с терапевтическим антителом, химиотерапевтическим агентом, и/или ADC против мишени, имеющей отношение к раку, для лечения человеческих солидных опухолей и гематологических злокачественных опухолей, которые описаны в данном документе выше по тексту.
В одном варианте осуществления настоящего изобретения, терапевтическое антитело представляет собой адекатумумаб, алемтузумаб, аматуксимаб, бевацизумаб, цетуксимаб, деносумаб, этарацизумаб, фарлетузумаб, гемтузумаб, лабетузумаб, мапатумумаб, минретумомаб, нимотузумаб, ниволумаб, ореговомаб, панитумумаб, пемтумомаб, пертузумаб, рамуцирумаб, сибротузумаб, трастузумаб или волоциксимаб, и химиотерапевтическое средство представляет собой: i) алкилирующий агент, в частности азотистые иприты, такие как мехлорэтамин, хлорамбуцил, циклофосфамид, ифосфамид и мелфалан; нитрозомочевины, такие как стрептозоцин, кармустин и ломустин; алкилсульфонаты, такие как бусульфан; триазины, такие как дакарбазин и темозоломид; этиленимины, такие как тиотепа и алтретамин; или платиновые препараты, такие как цисплатин, карбоплатин и оксалиплатин; ii) анти-метаболит (ингибитор обмена веществ), в частности, 5-фторурацил, 6-меркаптопурин, капецитабин, цитарабин, флоксуридин, флударабин, гемцитабин, гидроксимочевину, метотрексат или пеметрексед; iii) противопухолевый антибиотик, в частности, даунорубицин, доксорубицин, эпирубицин, идарубицин, актиномицин D, блеомицин, митомицин-C или митоксантрон; iv) ингибитор топоизомеразы, в частности, ингибитор топоизомеразы I, такой как топотекан и иринотекан, или ингибиторы топоизомеразы II, такие как этопозид, тенипозид и митоксантрон; v) митотический ингибитор, в частности, таксаны, такие как паклитаксел, карбазитаксел и доцетаксел; эпотилоны, такие как иксабепилон; алкалоиды барвинка, такие как винбластин, винкристин и винорелбин; или эстрамустин; vi) ингибитор сигнального каскада, в частности, ингибиторы mTOR (мишень рапамицина в клетках млекопитающих), такие как темсиролимус и эверолимус; или ингибиторы тирозинкиназы, такие как гефитиниб, эрлотиниб, иматиниб, пазопаниб, церитиниб, кризотиниб, лапатиниб и афатиниб; vii) кортикостероид, в частности, преднизон, метилпреднизолон или дексаметазон; viii) гормональное терапевтическое средство, в частности, модуляторы андрогенных рецепторов, такие как бикалутамид, энзалутамид и абиратерон-ацетат; антиэстрогены, такие как тамоксифен; или ингибирующие ароматазу или модифицирующие стеродиды средства, такие как анастрозол, летрозол, фулвестрант и экземестан; ix) ингибитор PARP, в частности, олапариб; или x) другое химиотерапевтическое лекарственное средство, в частности, L-аспарагиназу или бортезомиб. Специалист в данной области техники не будет испытывать затруднения в выборе подходящей комбинированной терапии для применения в лечении человеческих солидных опухолей и гематологических злокачественных опухолей, которые описаны в данном документе выше по тексту.
Терапевтически эффективное количество ADC в соответствии с настоящим изобретением находится в диапазоне от приблизительно 0,01 до приблизительно 15 мг/кг массы тела, в частности, в диапазоне от приблизительно 0,1 до приблизительно 10 мг/кг массы тела, более конкретно, в диапазоне от приблизительно 0,3 до приблизительно 10 мг/кг массы тела. Этот последний диапазон примерно соответствует фиксированной дозе в диапазоне от 20 до 800 мг соединения 'линкер-лекарственное средство' или конъюгата ADC. Соединение по настоящему изобретению может быть введено раз в неделю, раз в две недели, раз в три недели, раз в месяц, или раз за шесть недель. Подходящие схемы лечения зависят от тяжести заболевания, возраста пациента, вводимого соединения, и подобных других факторов, которые мог бы принять во внимание лечащий врач.
ПРИМЕРЫ
Материалы и Способы
Антитела со встроенным цистеином получают с использованием материалов и методик, описанных в WO2015/177360. Реагенты и буферные растворы закупают у промышленных поставщиков.
HIC (Хроматографии гидрофобного взаимодействия) - Для аналитической HIC, 5-10 мкл образца (1 мг/мл) впрыскивают в колонку TSKgel Butyl-NPR column (4,6 мм ID (внутренний диаметр) × 3,5 см L (длина), Tosoh Bioscience, каталожный номер 14947). Способ элюирования предусматривает линейный градиент от 100% Буферного раствора А (25 мМ фосфат натрия, 1,5 М сульфат аммония, рН 6,95) до 100% Буферного раствора В (25 мМ фосфат натрия, рН 6,95, 20% изопропанол) при скорости 0,4 мл/мин за 20 минут. Температуру колонки поддерживают при 25°С. Используют систему для сверхэффективной жидкостной хроматографии (UPLC) Waters Acquity H-Class, оснащенную детектором с фотодиодной матрицей и программным обеспечением Empower. Поглощение измеряют на 214 нм для получения количественной оценки среднего значения DAR и для получения относительной гидрофобности различных ADC.
SEC (Эксклюзионная хроматография) - Для аналитической SEC, 5 мкл образца (1 мг/мл) впрыскивают в колонку TSKgel G3000SWXL (5 мкм, 7,8 мм ID (внутренний диаметр) × 30 см L (длина), Tosoh Bioscience, каталожный номер 08541), оснащенную колонкой TSKgel SWXL Guard (7 мкм, 6,0 мм ID (внутренний диаметр) × 4,0 см L (длина), Tosoh Bioscience, каталожный номер 08543). Способ элюирования предусматривает элюирование посредством 100% состава, включающего 50 мМ фосфат натрия, 300 мМ NaCl, рН 7,5 при 0,6 мл/мин в течение 30 минут. Температуру колонки поддерживают при 25°С. Используют систему для UPLC Waters Acquity H-Class, оснащенную детектором с фотодиодной матрицей и программным обеспечением Empower. Поглощение измеряют на 214 нм для получения количественной оценки собственно количества молекул с HMW (высокой молекулярной массой).
SHPC (Хроматография с экранированной гидрофобной фазой) - Образцы приготавливают смешиванием 70 мкл раствора ADC с 30 мкл DMA. 50 мкл образцов впрыскивают в колонку с экранированной гидрофобной фазой (SUPELCOSIL LC-HISEP 5 мкм, 4,6 мм ID (внутренний диаметр) × 15 см L (длина), Supelco (Sigma-Aldrich), каталожный номер 58935), встроенную в систему для UPLC Waters Acquity H-Class, оснащенную детектором с фотодиодной матрицей и программным обеспечением Empower. Способ элюирования предусматривает линейный градиент от 90% Буферного раствора А (100 мМ ацетат аммония, рН 4,0) и 10% Буферного раствора В (ацетонитрил) до 32% Буферного раствора А и 68% Буферного раствора В при скорости 1Ю0 мл/мин за 10 минут. Температуру колонки поддерживают на уровне 45°С. Поглощение измеряют при 325 нм для получения количественной оценки собственно количества свободного соединения 'линкер-лекарственное средство'.
Синтез соединений 'экзо-линкер-лекарственное средство'
Используемые растворители имеют степень чистоты «чистый для анализа» или «для ВЭЖХ». ЯМР-спектры записывают на приборе Bruker AVANCE400 (400 МГц для1H; 100 МГц для13C). Химические сдвиги даны в миллионных долях (ppm) относительно тетраметилсилана в качестве внутреннего стандарта.
Сырые соединения 'линкер-лекарственное средство' очищают путем растворения соединений 'линкер-лекарственное средство' в DMA и введения раствора в колонку Waters SunFire™ Prep C18 OBD™ (размер частиц 5 мкм, 50 × 150 мм) с последующим элюированием при скорости потока 117 мл/мин с использованием линейного градиента от 20% буферного раствора А до 70% буферного раствора А. Буферный раствор А представляет собой ацетонитрил. Буферный раствор В представляет собой 0,1%-ный раствор TFA в воде. Степени чистоты оценивают методом UPLC с использованием колонки Waters ACQUITY UPLC© BEH C18 (размер частиц 1,7 мкм, 2,1 × 50 мм) при скорости потока 0,4 мл/мин.
Как правило, синтез соединений 'линкер-лекарственное средство' начинается из соединения 11 и модуля циклизации, синтез которого описан в Elgersma et al. Mol. Pharmaceutics, 2015; 12: 1813-1835 and WO 2011/133039.

Синтез соединений
Соединение 12

Соединение 75, защищенный малеимид, синтезируют так, как описано в Elduque et al. Bioconjugate Chem. 2013; 24: 832-839. Спектр ЯМР идентичен спектру в литературной ссылке.
Boc-Mom-защищенное соединение 'CS-лекарственное средство' (11) (1,0 г, 1,16 ммоль, 1 экв.) и защищенный малеимид 75 (0,34 г, 1,75 ммоль, 1,5 экв.) растворяют в обезвоженном THF (20 мл), с последующими концентрированием в вакууме и сушкой в вакууме. Твердый остаток повторно растворяют в обезвоженном THF (20 мл) в атмосфере азота, добавляют трифенилфосфин (0,46 г, 1,75 ммоль, 1,5 экв.), и получающуюся в результате смесь охлаждают на ледяной бане. Далее, к смеси добавляют по каплям диизопропил-азодикарбоксилат (DIAD) (0,35 г, 1,75 ммоль, 1,5 экв.), и постепенно нагревают до комнатной температуры (RT), перемешивание проводят в течение 30 минут при комнатной температуре (RT). Смесь концентрируют в вакууме, очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 95:5, масс./масса), фракции, содержащие продукт, объединяют и концентрируют в вакууме, подвергают совместному выпариванию с толуолом и сушат в вакууме, что дает соединение 12 (1,06 ммоль, 91%) в виде белой пены.
1H ЯМР (DMSO-d6, 400 МГц): δ=1,30-1,44 (9H, м, CH3, Boc), 1,53 (3H, с, CCH3), 1,56 (3H, с, CCH3), 2,78-2,94 (8H, м, ArCH3, NCH3, 2 × CHэкзо), 3,35-3,74 (13H, м, CHCl, 4 × NCH2, 2 × OCH2), 3,41 (3H, с, OCH3) 3,79-3,84 (1H, м, CHCl), 4,45 (1H, т, H1), 4,62-4,67 (1H, м, H2), 5,16-5,21 (1H, м, H2), 5,30 (2H, с, OCH2O), 6,35 (2H, д, HC=CH), 7,17 (2H, д, H3''), 7,31-7,37 (1H, м, H7), 7,39-7,40 (1H, м, H8), 7,57-7,59 (1H, м, H8'), 7,71-7,82 (2H, м, H6, H7'), 7,99 (2H, д, H2''), 8,35 (1H, шир. с, H4), 8,68 (1H, с, H3'), 9,46 (1H, с, H5'), 10,30 (1H, с, Ar-NHC(O)-Ar).
13C ЯМР (DMSO-d6, 100 МГц): δ=15,6, 15,7 (CCH3), 22,4 (Ar-CH3), 28,0, 28,1 (CH3, Boc), 34,1, 34,6 (NCH3), 37,5, 37,6 ((C=O)2NCH2CH2), 44,2 (C1), 45,1, 45,5, 45,9, 46,3, 47,0 (NCH2), 47,4 (CH2Cl), 52,1 (CHэкзо), 54,5 (C2), 55,8 (OCH3), 66,6, 68,0, 68,3 (OCH2), 78,6, 78,6 (CBoc), 86,9 (Cэкзо), 93,7 (OCH2O), 110,6, 110,6 (C4), 115,6 (C3''), 117,3 (C5'), 117,5 (C7'), 119,0 (C3'), 120,7 (C6), 122,3 (C9b), 123,1 (C8'), 124,6 (C7), 125,8 (C5a), 127,3 (C6'), 127,4 (C1''), 129,6 (C2''), 129,7 (C9a), 130,5 (C8), 132,9, 132,9 (C9), 140,5 (C8a'), 140,6 (C=Cэкзо), 141,4 (C2'), 141,9 (C3a), 148,0, 148,1 (Ar-OC(O)N), 153,7 (C=OBoc), 154,7, 155,0 (C5), 159,6 (C4''), 161,9 (NC=O), 165,1 (Ar-NHC(O)-Ar), 174,7, 174,7 (C=Oэкзо).
Масс-спектрометрия (MS) с ионизацией электрораспылением (ESI) m/z; вычисленное значение: 1034,41 [M+H]+, найденное значение: 1034,84 [M+H]+
Соединение 17

Раствор соединения 13 (2,01 г, 9,65 ммоль, 1 экв.) в THF (25 мл) охлаждают до 0°C на ледяной бане, после чего добавляют 4-нитрофенилхлорформиат (2,14 г, 10,62 ммоль, 1,1 экв.) и Et3N (2,69 мл, 19,30 ммоль, 2 экв.), и получающуюся в результате смесь перемешивают в течение 2 часов, давая ей нагреваться до RT. Смесь концентрируют в вакууме и очищают колоночной хроматографией на силикагеле (DCM/EtOAc, от 1:0 до 1:1, масс./масса), фракции, содержащие продукт, объединяют и концентрируют в вакууме, что дает промежуточное соединение 14 (2,5 г, 6,70 ммоль, 69%) в виде желтого масла. Соединение 14 (1,34 г, 3,58 ммоль, 1,05 экв.) и H-Val-Ala-PABA 15 (синтезированный так, как описано в US2014/0363454 (Igenica Biotherapeutics), 1,0 г, 3,41 ммоль, 1 экв.) в DMF (20 мл) охлаждают до 0°C на ледяной бане, к раствору добавляют N,N-диизопропилэтиламин (DIPEA) (1,49 мл, 8,52 ммоль, 2,5 экв.), и смесь перемешивают в течение 18 часов, давая ей постепенно нагреться до RT. Смесь концентрируют в вакууме, очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 9:1, масс./масса), что дает соединение 16 (1,4 г, 2,65 ммоль, 78%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ=0,89 (3H, д, CH3,Val), 0,91 (3H, д, CH3,Val), 1,34 (3H, д, CH3,Ala), 1,98-2,03 (1H, м, β-HVal), 3,25 (3H, с, OCH3), 3,41-3,62 (14H, м, O-CH2), 3,92 (1H, т, α-HVal), 4,08-4,12 (2H, м, CH2OC(O)NH), 4,44-4,49 (3H, м, Ar-CH2, α-HAla), 5,10-5,14 (1H, м, -OH), 7,12-7,30 (3H, м, H3, NHVal), 7,57 (2H, д, H2), 8,14 (1H, д, NHAla), 9,91 (1H, с, NHPABA).
13C ЯМР (DMSO-d6, 100 МГц): δ=18,1 (CH3,Val), 18,2 (CH3,Ala), 19,2 (CH3,Val), 30,4 (β-CHVal), 49,0 (α-CHAla), 58,1 (OCH3), 60,1 (α-CHVal), 62,7 (Ar-CH2), 63,6 (CH2OC(O)NH), 68,9 (OCH2), 69,7 (OCH2), 69,9 (OCH2), 69,9 (OCH2), 71,4 (OCH2), 119,0 (C2), 127,0 (C3), 137,5 (C4), 137,6 (C1), 156,4 (OC(O)NH) 171,0 (C=OAla), 171,1 (C=OVal).
MS (ESI) m/z; вычисленное значение: 528,62 [M+H]+, найденное значение: 510,47 (-H2O) [M+H]+
Раствор соединения 16 (1,3 г, 2,46 ммоль, 1 экв.) в DMF (20 мл) охлаждают до 0°C на ледяной бане, и добавляют бис(4-нитрофенил)карбонат (1,50 г, 4,93 ммоль, 2 экв.) и DIPEA (0,65 мл, 3,70 ммоль, 1,5 экв.). Смесь перемешивают в течение 3 часов и постепенно нагревают до RT. Сырую смесь концентрируют в вакууме, очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 9:1, масс./масса), что дает соединение 17 (1,7 г, 2,45 ммоль, количественный выход) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ =0,87 (3H, д, CH3,Val), 0,92 (3H, д, CH3,Val), 1,35 (3H, д, CH3,Ala), 1,99-2,04 (1H, м, β-HVal), 3,26 (3H, с, OCH3), 3,36-3,62 (14H, м, O-CH2), 3,92 (1H, т, α-CHVal), 4,08-4,12 (2H, м, CH2OC(O)NH), 4,47 (1H, м, α-CHAla), 5,27 (2H, с, Ar-CH2), 7,16-7,30 (1H, м, NHVal), 7,44 (2H, д, H3), 7,59 (2H, д, H6), 7,68 (2H, д, H2), 8,19 (1H, д, NHAla), 8,33 (2H, д, H7), 10,09 (1H, с, NHPABA).
13C ЯМР (DMSO-d6, 100 МГц): δ=18,0 (CH3,Val), 18,1 (CH3,Ala), 19,2 (CH3,Val), 30,4 (β-CHVal), 49,1 (α-CHAla), 58,0 (OCH3), 60,0 (α-CHVal), 63,5 (CH2OC(O)NH), 68,8 (OCH2), 69,6 (OCH2), 69,8 (OCH2), 69,8 (OCH2), 70,3 (Ar-CH2), 71,3 (OCH2), 119,1 (C2), 122,6 (C6), 125,4 (C7), 129,3 (C4), 129,5 (C3), 139,5 (C1), 145,2 (C5), 152,0 (OC(O)O), 155,3 (C8), 156,3 (OC(O)NH) 171,1 (C=OVal), 171,3 (C=OAla).
MS (ESI) m/z; вычисленное значение: 693,73 [M+H]+, найденное значение: 693,63 [M+H]+
Соединение 19

К раствору H-Val-Ala-PABA 15 (синтезированного так, как описано в US2014/0363454 (Igenica Biotherapeutics), 1,4 г, 4,77 ммоль, 1 экв.) в MeCN/H2O (1:1) (100 мл) последовательно добавляют N-метилморфолин (1,05 мл, 9,54 ммоль, 2 экв.), формальдегид (3,55 мл, 47,7 ммоль, 10 экв.) и NaCNBH3(0,9 г, 14,32 ммоль, 3 экв.) с последующим введением по каплям уксусной кислоты (0,55 мл, 9,54 ммоль, 2 экв.). Получающуюся в результате смесь перемешивают в течение 30 минут. Затем, сырую смесь концентрируют в вакууме, подвергают совместному выпариванию с толуолом и очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 7:3, масс./масса), что дает соединение 18 (1,55 г, количественный выход) в виде белого воскообразного твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ=0,84 (3H, д, CH3,Val), 0,97 (3H, с, CH3,Val), 1,35 (3H, д, CH3,Ala), 1,98-2,11 (1H, м, β-HVal), 2,39 (6H, шир. с, N(CH3)2), 3,20-3,60 (α-CHVal), 4,45 (2H, ArCH2), 4,46-4,55 (1H, м, α-CHAla), 5,12 (1H, с, OH), 7,26 (2H, д, H3), 7,56 (2H, д, H2), 8,29 (1H, шир. с, NHAla), 10,01 (1H, с, NHPABA).
MS (ESI) m/z; вычисленное значение: 322,21 [M+H]+, найденное значение: 322,16 [M+H]+
Раствор соединения 18 (1,53 г, 4,77 ммоль, 1 экв.) в DMF (20 мл) охлаждают до 0°C на ледяной бане, добавляют бис(4-нитрофенил)карбонат (2,90 г, 9,54 ммоль, 2 экв.) и DIPEA (1,25 мл, 7,16 ммоль, 1,5 экв.). Получающуюся в результате смесь перемешивают в течение 3 часов и постепенно нагревают до RT. Смесь концентрируют в вакууме, очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 8:2, масс./масса), что дает соединение 19 (2,2 г, 4,52 ммоль, 95%) в виде желтого воскообразного твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ=0,81 (3H, д, CH3,Val), 0,91 (3H, д, CH3,Val), 1,34 (3H, д, CH3,Ala), 1,93-2,01 (1H, м, β-HVal), 2,29 (6H, шир. с, N(CH3)2), 3,20-3,60 (α-CHVal), 4,50 (1H, м, α-CHAla), 5,24 (2H, с, ArCH2), 7,42 (2H, д, H3), 7,56 (2H, д, H2'), 7,64 (2H, д, H2), 8,24 (1H, шир. с, NHAla), 8,30 (2H, д, H3'), 10,14 (1H, с, NHPABA).
13C ЯМР (DMSO-d6, 100 МГц): δ=18,8 (CH3,Ala), 20,0 (CH3,Val), 27,1 (β-CHVal), 41,8 (N(CH3)2), 49,3 (α-CHAla), 70,7 (Ar-CH2), 73,1 (α-CHVal), 119,5 (C2), 122,9, 123,0 (C2'), 125,8 (C3'), 129,7 (C4), 130,0 (C3), 139,9 (C1), 145,6 (C1'), 152,4 (OC(O)O), 155,8 (C4'), 162,8 (C=OVal), 171,8 (C=OAla).
MS (ESI) m/z; вычисленное значение: 487,22 [M+H]+, найденное значение: 487,60 [M+H]+
Соединение 24

К раствору H-Val-Lys(Boc)-PABA 20 (синтезированного так, как описано в WO2013/67597, стр. 80-82 (Ascend Biopharmaceuticals), 1,26 г, 2,80 ммоль, 1 экв.) в MeCN/H2O (1:1) (50 мл) добавляют N-метилморфолин (0,62 мл, 5,59 ммоль, 2 экв.), формаьдегид (2,08 мл, 28,0 ммоль, 10 экв.) и NaCNBH3 (0,53 г, 8,39 ммоль, 3 экв.) с последующим введением по каплям уксусной кислоты (0,32 мл, 5,59 ммоль, 2 экв.). Смесь перемешивают в течение 30 минут. Смесь концентрируют в вакууме и подвергают совместному выпариванию с толуолом. Сырой продукт очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 7:3 масс./масса), что дает соединение 21 (1,13 г, 2,36 ммоль, 84%) в виде белого воскообразного твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ=0,80 (3H, д, CH3,Val), 0,91 (3H, д, CH3,Val), 1,22-1,53 (13H, м, CH3,Boc 2 × CH2,Lys), 1,62-1,73 (2H, м, CH2,Lys), 1,84-1,96 (1H, м, β-CHVal), 2,26 (6H, шир. с, 2 × NCH3), 2,52 (1H, с, α-CHVal), 3,41 (2H, т, CH2,Lys), 4,45 (3H, с, Ar-CH2, α-CHLys), 6,77 (1H, шир. с, ε-NHLys), 7,25 (2H, д, H3), 7,54 (2H, д, H2), 8,09 (1H, шир. с, NHLys), 10,00 (1H, с, NHPABA), 11,99 (1H, шир. с, OH).
13C ЯМР (DMSO-d6, 100 МГц): δ=20,0 (CH3,Val), 23,4 (CH2,Lys), 27,2 (β-CHVal), 28,7 (CH3, Boc), 29,6 (CH2,Lys), 32,0 (CH2,Lys), 39,8 (CH2,Lys), 41,8 (NCH3), 53,5 (α-CHLys), 63,0 (Ar-CH2), 73,4 (α-CHVal), 77,8 (CBoc), 119,3 (C2), 127,4 (C3), 137,8 (C4), 138,1 (C1), 156,0 (C=OBoc), 171,2 (C=OVal, C=OLys).
MS (ESI) m/z; вычисленное значение: 479,32 [M+H]+, найденное значение: 479,67 [M+H]+
Раствор соединения 21 (1,06 г, 2,22 ммоль, 1 экв.) в DCM (20 мл) охлаждают до 0°C на ледяной бане, добавляют TFA (15 мл) и перемешивают в течение 30 минут, затем разбавляют посредством DCM, концентрируют в вакууме и подвергают совместному выпариванию с DCM (дважды). Полученную TFA-соль растворяют в THF (10 мл), добавляют малеимид-карбамат 22 (0,34 г, 2,22 ммоль, 1 экв.) с последующим введением Et3N (1,24 мл, 8,86 ммоль, 4 экв.). Реакционную смесь перемешивают в течение 48 часов при 50°C, после чего вводят дополнительные 0,5 экв. Et3N и перемешивают в течение дополнительных 24 часов. Смесь концентрируют в вакууме, и сырой продукт очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 7:3 масс./масса), что дает соединение 23, которое сразу же используют на следующей стадии.
MS (ESI) m/z; вычисленное значение: 459,26 [M+H]+, найденное значение: 459,53 [M+H]+
Раствор соединения 23 (1,0 г, 2,18 ммоль, 1 экв.) в DMF (10 мл) охлаждают до 0°C на ледяной бане, и добавляют бис(4-нитрофенил)карбонат (1,33 г, 4,36 ммоль, 2 экв.) и DIPEA (0,57 мл, 3,27 ммоль, 1,5 экв.), и получающуюся в результате смесь перемешивают в течение 3 часов при 0°C на ледяной бане. Затем, смесь концентрируют в вакууме, и сырой продукт очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 8:2 масс./масса), что дает соединение 24 (0,55 г, 0,88 ммоль, 40%) в виде грязно-белого твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ=0,77 (3H, д, CH3,Val), 0,88 (3H, д, CH3,Val), 1,20-1,42 (2H, м, CH2,Lys), 1,44-1,76 (4H, м, 2 × CH2,Lys), 1,84-1,96 (1H, м, β-CHVal), 2,18 (6H, шир. с, 2 × NCH3), 2,60 (1H, д, α-CHVal), 3,41 (2H, т, CH2,Lys), 4,39 (1H, м, α-CHLys), 5,25 (2H, с, Ar-CH2), 7,00 (2H, с, HC=CH), 7,42 (2H, д, H3), 7,57 (2H, д, H6), 7,62 (2H, д, H2), 8,04 (1H, д, NHLys), 8,32 (2H, д, H7), 10,12 (1H, с, NHPABA).
13C ЯМР (DMSO-d6, 100 МГц): δ=19,4, 19,5 (CH3,Val), 23,0 (CH2,Lys), 26,7 (β-CHVal), 27,6 (CH2,Lys), 31,1 (CH2,Lys), 37,0 (CH2,Lys), 41,3 (NCH3), 52,8 (α-CHLys), 70,2 (Ar-CH2), 72,9 (α-CHVal), 119,0 (C2), 122,6 (C6), 125,4 (C7), 129,2 (C4), 129,5 (C3), 134,4 (HC=CH) 139,4 (C1), 145,2 (C5), 151,9 (OC(O)O), 155,3 (C8), 170,1 (C=OVal), 171,0 (C=Omaleimide), 171,1 (C=OLys).
MS (ESI) m/z; вычисленное значение: 624,27 [M+H]+, найденное значение: 624,61 [M+H]+
Соединение 34

К смеси этан-1,2-диамина 26 (2,15 мл, 32,1 ммоль, 4 экв.), йодида калия (1,33 г, 8,03 ммоль, 1 экв.) и карбоната калия (2.,22 г, 16,06 ммоль, 2 экв.) в MeCN (25 мл) добавляют по каплям раствор 2-(2-хлорэтокси)этанола 25 (0,85 мл, 8,03 ммоль, 1 экв.). Получающуюся в результате смесь перемешивают при 60°C в течение 2 дней. Далее, сырую смесь концентрируют в вакууме, подвергают совместному выпариванию с толуолом, и остаток смывают в EtOAc и перемешивают в течение 10 минут. Суспензию фильтруют, и фильтрат концентрируют в вакууме, что дает соединение 27 2-(2-(2-аминоэтиламино)этокси)этанол (750 мг, 5,06 ммоль, 63%) в виде бесцветного масла.
MS (ESI) m/z; вычисленное значение: 149,13 [M+H]+, найденное значение: 149,23 [M+H]+
К охлажденному (0°C) раствору 2,2,2-трифторацетата (602 мкл, 5,06 ммоль, 1 экв.) в THF (10 мл) добавляют по каплям раствор 2-(2-(2-аминоэтиламино)этокси)этанола 27 (750 мг, 5,06 ммоль, 1 экв.) в THF (5 мл), и смесь перемешивают в течение 45 минут. Затем, добавляют по каплям ди-трет-бутилдикарбонат (1,33 г, 6,07 ммоль, 1,2 экв.) в THF (5 мл) с последующим введением Et3N (846 мкл, 6,07 ммоль, 1,2 экв.) и перемешивают в течение 1 часа. Смесь концентрируют в вакууме и очищают колоночной хроматографией на силикагеле (DCM/EtOAc, от 1:0 до 1:1, масс./масса), что дает соединение 28 (980 мг, 2,85 ммоль, 56%) в виде желтого масла.
1H ЯМР (DMSO-d6, 400 МГц): δ=1,38 (9H, с, CH3,Boc), 3,25-3,36 (6H, м, CH2NBoc, CH2N), 3,39-3,43 (2H, м, CH2O), 3,46-3,52 (4H, м, CH2OH, CH2O), 4,62 (1H, т, OH).
13C ЯМР (DMSO-d6, 100 МГц): δ=28,2, 28,4 (CH3,Boc), 38,2, 38,4 (CH2NH), 46,2, 46,5, 46,8, 47,2 (CH2NBoc), 60,6 (CH2OH), 68,8, 69,2 (NCH2CH2O), 72,6 (CH2O), 79,3 (CBoc), 112,1, 114,9, 117,8, 120,7 (CF3), 155,0, 155,3 (C=OBoc), 156,3, 156,7, 157,0, 157,4 (C=O).
MS (ESI) m/z; вычисленное значение: 367,15 [M+Na]+, найденное значение: 245,18 [M-Boc]+, 367,29 [M+Na]+
К раствору соединения 28 (900 мг, 2,61 ммоль, 1 экв.) в MeOH (10 мл) добавляют, NaOH (157 мг, 3,92 ммоль, 1,5 экв., растворенный в воде (5 мл)), и смесь перемешивают в течение 4 часов при RT. Смесь концентрируют в вакууме, и добавляют DCM и воду (насыщенную посредством NaCl). DCM-слой сушат над MgSO4, фильтруют и концентрируют в вакууме, что дает соединение 29 (660 мг, 100%) в виде желтого масла.
1H ЯМР (DMSO-d6, 400 МГц): δ=1,39 (9H, с, CH3,Boc), 2,64 (2H, т, CH2NH2), 3,10 (3H, шир. с, NH2, OH), 3,12-3,19 (2H, м, CH2NBoc), 3,27-3,33 (2H, м, CH2NBoc), 3,39-3,44 (2H, м, CH2O), 3,45-3,51 (4H, м, CH2OH, CH2O).
13C ЯМР (DMSO-d6, 100 МГц): δ=28,5 (CH3,Boc), 40,9 (CH2NH2), 47,3, 47,4 (CH2NBoc), 50,6, 51,1 (CH2NBoc), 60,7 (CH2OH), 68,9, 69,3 (NCH2CH2O), 72,6 (CH2O), 78,9 (CBoc), 155,2 (C=OBoc).
MS (ESI) m/z; вычисленное значение: 249,18 [M+H]+, найденное значение: 249,30 [M+H]+
К раствору соединения 29 (650 мг, 2,62 ммоль, 1 экв.) и NaHCO3 (440 мг, 5,24 ммоль, 2 экв.) в воде (6 мл) добавляют Fmoc-Ala-OSu (1,18 г, 2,88 ммоль, 1,1 экв.) в THF (6 мл), и смесь перемешивают при RT в течение ночи. Затем, THF выпаривают, добавляют воду, и экстрагируют посредством EtOAc (дважды). Объединенный органический слой промывают соляным раствором, сушат (над MgSO4), фильтруют и концентрируют в вакууме. Сырой продукт очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 9:1, масс./масса), что дает соединение 30 (1,2 г, 2,22 ммоль, 85%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ=1,21 (3H, д, CH3,Ala), 1,39 (9H, с, CH3,Boc), 3,11-3,52 (12H, м, CH2NH, CH2NBoc, CH2O, CH2OH), 3,94-4,06 (1H, м, α-CHAla), 4,18-4,30 (3H, м, CHFmoc, CH2,Fmoc), 4,60 (1H, т, OH), 7,31-7,36 (2H, м, CHAr), 7,39-7,50 (3H, м, CHAr, NHAla), 7,71-7,76 (2H, м, CHAr), 7,86-7,95 (3H, м, CHAr, NH).
13C ЯМР (DMSO-d6, 100 МГц): δ=18,7 (CH3,Ala), 28,5 (CH3,Boc), 37,7, 38,0 (CH2NH), 47,1 (CHFmoc), 47,3, 47,5 (CH2NBoc), 50,6 (α-CHAla), 60,7 (CH2OH), 66,1 (CH2,Fmoc), 68,8, 69,2 (NCH2CH2O), 72,6 (CH2O), 79,1 (CBoc), 120,6 (CHAr), 125,8 (CHAr),127,5 (CHAr), 128,1 (CHAr), 141,2 (CAr), 144,3, 144,4 (CAr), 155,1, 155,2 (C=OBoc), 156,1 (C=OFmoc), 173,0 (C=OAla).
MS (ESI) m/z; вычисленное значение: 564,27 [M+Na]+, найденное значение: 442,47 [M-Boc]+, 564,55 [M+Na]+
К раствору соединения 30 (1,2 г, 2,16 ммоль, 1 экв.) в DMF (10 мл) добавляют пиперидин (4,4 мл, 44,3 ммоль, 20 экв.) и перемешивают в течение 90 минут. Смесь концентрируют в вакууме, подвергают совместному выпариванию с толуолом и повторно растворяют в воде (12 мл), и экстрагируют дважды диэтиловым эфиром. Раствор Fmoc-Val-OSu (0,94 г, 2,16 ммоль, 1 экв.) в THF (16 мл) затем добавляют к водному слою, с последующим введением бикарбоната натрия (0,2 г, 2,38 ммоль, 1,1 экв.), и получающуюся в результате смесь перемешивают в течение 4 часов при RT. Далее, THF выпаривают, воду добавляют и экстрагируют дважды посредством EtOAc. Объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют в вакууме. Сырой продукт очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 9:1, масс./масса), что дает соединение 31 (1,4 г, 2,19 ммоль, количественный выход) в виде белой пены.
1H ЯМР (DMSO-d6, 400 МГц): δ=0,83-0,89 (6H, м, CH3,Val), 1,21 (3H, д, CH3,Ala), 1,39 (9H, с, CH3,Boc), 1,95-2,03 (1H, м, β-HVal), 3,10-3,51 (14H, м, CH2NH2, CH2NBoc, CH2O, CH2OH), 4,18-4,30 (4H, м, α-CHAla, CHFmoc, CH2,Fmoc), 4,60 (1H, т, OH), 7,30-7,36 (2H, м, CHAr), 7,39-7,47 (3H, м, CHAr, NHVal), 7,72-7,77 (2H, м, CHAr), 7,87-7,99 (4H, м, CHAr, NHAla, NH).
13C ЯМР (DMSO-d6, 100 МГц): δ=18,6 (CH3,Val), 18,9 (CH3,Ala), 19,7 (CH3,Val), 28,5 (CH3,Boc), 30,8 (β-CHVal), 37,5, 38,0 (CH2NH), 47,2 (CHFmoc), 47,0, 47,3 (CH2NBoc), 48,6 (α-CHAla), 60,5 (α-CHVal), 60,7 (CH2OH), 66,2 (CH2,Fmoc), 68,9, 69,2 (NCH2CH2O), 72,6 (CH2O), 79,1 (CBoc), 120,5 (CHAr), 125,8 (CHAr), 127,5 (CHAr), 128,1 (CHAr), 141,2, 141,2 (CAr), 144,2, 144,4 (CAr), 155,1 (C=OBoc), 156,6 (C=OFmoc), 171,1 (C=OVal), 172,5 (C=OAla).
MS (ESI) m/z; вычисленное значение: 641,35 [M+H]+, найденное значение: 641,59 [M+H]+
К раствору соединения 31 (1,4 г, 2,19 ммоль, 1 экв.) в DMF (10 мл) добавляют пиперидин (4,3 мл, 43,7 ммоль, 20 экв.) и перемешивают в течение 2 часов. Сырую смесь концентрируют в вакууме, подвергают выпариванию с толуолом, и твердый остаток промывают посредством Et2O, фильтруют и сушат в вакууме, что дает соединение 32 (0,68 г, 1,63 ммоль, 74%) в виде серого твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ=0,76 (3H, д, CH3,Val), 0,88 (3H, д, CH3,Val), 1,18 (3H, д, CH3,Ala), 1,39 (9H, с, CH3,Boc), 1,90-1,97 (1H, м, β-HVal), 2,99 (1H, д, α-CHVal), 3,10-3,52 (12H, м, CH2NH, CH2NBoc, CH2O, CH2OH), 4,22-4,30 (1H, м, α-CHAla), 4,62 (1H, шир. с, OH), 7,98-8,05 (2H, м, NHAla, NH).
13C ЯМР (DMSO-d6, 100 МГц): δ=17,2 (CH3,Val), 19,3 (CH3,Ala), 19,9 (CH3,Val), 28,5 (CH3,Boc), 31,7 (β-CHVal), 37,6, 38,0 (CH2NH), 47,0, 47,2, 47,4 (CH2NBoc), 48,1 (α-CHAla), 60,1 (α-CHVal), 60,7 (CH2OH), 68,9, 69,2 (NCH2CH2O), 72,6 (CH2O), 79,1 (CBoc), 155,1, 155,2 (C=OBoc), 172,7 (C=OAla), 174,3 (C=OVal).
MS (ESI) m/z; вычисленное значение: 419,29 [M+H]+, найденное значение: 419,58 [M+H]+
К раствору соединения 32 (680 мг, 1,63 ммоль, 1 экв.) в MeCN/H2O (50 мл, 1:1, масс./масса) последовательно добавляют N-метилморфолин (357 мкл, 3,25 ммоль, 2 экв.), формальдегид (1,21 мл, 16,25 ммоль, 10 экв.) и NaCNBH3 (306 мг, 4,87 ммоль, 3 экв.) с последующим введением по каплям уксусной кислоты (186 мкл, 3,25 ммоль, 2 экв.). Получающуюся в результате смесь перемешивают в течение 15 минут. Сырую смесь концентрируют в вакууме, подвергают совместному выпариванию с толуолом, и очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 8:2, масс./масса). Продукт повторно подвергают совместному выпариванию с толуолом, что дает соединение 33 (680 мг, 1,52 ммоль, 94%) в виде бесцветного масла.
1H ЯМР (DMSO-d6, 400 Мгц): δ=0,77 (3H, д, CH3,Val), 0,88 (3H, д, CH3,Val), 1,20 (3H, д, CH3,Ala), 1,38 (9H, с, CH3,Boc), 1,89-1,98 (1H, м, β-HVal), 2,24 (6H, с, N(CH3)2), 2,63-2,72 (1H, д, α-CHVal), 3,08-3,62 (12H, м, CH2NH, CH2NBoc, CH2O, CH2OH), 4,28-4,34 (1H, м, α-CHAla), 7,87-8,01 (2H, м, NHAla, NH).
13C ЯМР (DMSO-d6, 100 МГц): δ=19,4 (CH3,Val), 19,4 (CH3,Ala), 20,0 (CH3,Val), 27,0 (β-CHVal), 28,5 (CH3,Boc), 37,5, 37,9 (CH2NH), 41,8 (NCH3), 46,9, 47,3, 47,5 (CH2NBoc), 48,2 (α-CHAla), 60,7 (CH2OH), 68,9, 69,2 (NCH2CH2O), 72,6 (CH2O), 73,4 (α-CHVal), 79,1 (CBoc), 155,1 (C=OBoc), 169,2 (C=OVal), 172,6 (C=OAla).
MS (ESI) m/z; вычисленное значение: 447,32 [M+H]+, найденное значение: 447,85 [M+H]+
Раствор соединения 33 (680 мг, 1,52 ммоль, 1 экв.) в обезвоженном THF (20 мл) помещают под атмосферу азота, и добавляют малеимид (192 мг, 1,98 ммоль, 1,3 экв.) и трифенилфосфин (519 мг, 1,98 ммоль, 1,3 экв.). Смесь охлаждают до 0°C на ледяной бане, и добавляют по каплям DEAD (2,2 M в толуоле) (900 мкл, 1,98 ммоль, 1,3 экв.) и перемешивают в течение 30 минут при RT. Сырую смесь концентрируют в вакууме и очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 9:1, масс./масса), что дает соединение 34 (280 мг, 0,53 ммоль, 35%) в виде бесцветного воскообразного твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ=0,76 (3H, дд, CH3,Val), 0,87 (3H, дд, CH3,Val), 1,13-1,30 (3H, м, CH3,Ala), 1,38 (9H, с, CH3,Boc), 1,86-2,01 (1H, м, β-HVal), 2,18 (6H, шир. с, N(CH3)2), 2,57 (1H, д, α-CHVal), 3,05-3,71 (12H, м, NCH2, OCH2), 4,27-4,35 (1H, м, α-CHAla), 7,02 (2H, с, HC=CH), 7,87 (2H, шир. с, NHAla, C(=O)NHCH2).
13C ЯМР (DMSO-d6, 100 МГц): δ=19,4 (CH3,Ala), 19,7 (CH3,Val), 20,0 (CH3,Val), 27,1 (β-CHVal), 28,5 (CH3,Boc), 37,3, 37,4 ((C=O)2NCH2CH2), 37,8 (NHCH2), 41,8 (N(CH3)2), 46,9, 47,1, 46,5 (NCH2), 48,0 (α-CHAla), 67,3, 68,6, 68,9 (OCH2), 73,5 (α-CHVal), 79,1 (CBoc), 135,0 (HC=CH), 155,7 (C=OBoc), 169,7 (C=OVal), 171,3 (C=Oмалеимид), 172,7 (C=OAla).
MS (ESI) m/z; вычисленное значение: 526,32 [M+H]+, найденное значение: 526,65 [M+H]+
Соединение 40
Синтез фталимид-тетраэтиленгликоль-тозилата 37 описан в методиках нескольких литературных источников. Например, в Kim et al. Organic Letters, 2007, 9 (22): 4419-4422.
Смесь трет-бутил-2-(бензиламино)этил(метил)карбамата 38 (664 мг, 2,51 ммоль, 1 экв.), фталимид-тетраэтиленгликоль-тозилата 37 (1,2 г, 2,51 ммоль, 1 экв.), K2CO3 (695 мг, 5,03 ммоль, 2 экв.) и KI (417 мг, 2,51 ммоль, 1 экв.) в ацетонитриле (20 мл) кипятят с обратным холодильником в течение 3 дней. Смесь концентрируют в вакууме, и сырой продукт очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 8:2, масс./масса), что дает соединение 39 (1,4 г, 2,46 ммоль, 98%) в виде бесцветного масла.
MS (ESI) m/z; вычисленное значение: 570,32 [M+H]+, найденное значение: 570,50 [M+H]+
Палладий на углероде (262 мг, 0,25 ммоль, 0,1 экв.) суспендируют в MeOH (10 мл) с последующим добавлением соединения 39 (1,4 г, 2,46 ммоль, 1 экв. в MeOH (10 мл)) и уксусной кислоты (422 мкл, 7,37 ммоль, 3 экв.). Получающуюся в результате смесь перемешивают в атмосфере водорода в течение 3 часов. Смесь фильтруют через Целит, концентрируют в вакууме, подвергают совместному выпариванию с толуолом и сушат в вакууме, что дает соединение 40 (850 мг, 1,77 ммоль, 72%).
1H ЯМР (DMSO-d6, 400 МГц): δ=1,38 (CH3,Boc), 2,59-2,65 (4H, м, CH2NHCH2), 2,77 (3H, шир. с, NCH3), 3,19 (2H, т, NCH2), 3,35-3,68 (10H, м, OCH2), 3,62 (2H, т, (C=O)2NCH2CH2), 3,75 (2H, т, (C=O)2NCH2), 7,82-7,89 (4H, м, HAr).
13C ЯМР (DMSO-d6, 100 МГц): δ=28,5 (CH3,Boc), 34,7 (NCH3), 37,6 ((C=O)2NCH2CH2), 47,5 (NHCH2), 48,8 (NCH2), 67,4 ((C=O)2NCH2CH2O), 70,0, 70,0, 70,1, 70,2, 70,4 (OCH2), 78,7 (CBoc), 123,5 (CHAr), 132,0 (CAr), 134,9 (CHAr), 155,3 (C=OBoc), 168,2 (C=OФталимид).
MS (ESI) m/z; вычисленное значение: 480,27 [M+H]+, найденное значение: 480,44 [M+H]+
Соединение 50

К раствору соединения 15 (3,58 г, 10,2 ммоль, 1 экв.) в DMF (20 мл) добавляют соединение 48 (3,16 г, 10,2 ммоль, 1 экв.) и DIPEA (2,0 мл, 11,5 ммоль, 1,1 экв.), и получающуюся в результате смесь перемешивают в течение 2 часов. Затем, бис-(4-нитрофенил)карбонат (4,68 г, 15,4 ммоль, 1,5 экв.) и перемешивают в течение 18 часов. Смесь концентрируют в вакууме, и сырой продукт очищают колоночной хроматографией на силикагеле (DCM/MeOH, 1:0, 9:1, масс./масса), смывают в диоксан/воду и подвергают лиофильной сушке, что дает соединение 50 (5,16 г, 7,7 ммоль, 75%) в виде грязно-белого твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ=0,82-0,90 (6H, м, CH3,Val), 1,32 (3H, д, CH3,Ala), 1,92-2,03 (1H, м, β-HVal), 3,50-3,60 (6H, м, NCH2, OCH2), 3,85-3,91 (1H, м, α-CHVal), 3,96-4,07 (2H, м, CH2OC(O)NH), 4,38-4,47 (1H, м, α-CHAla), 5,25 (1H, с, Ar-CH2), 7,02 (2H, с, HC=CH), 7,17 (1H, д, NHVal), 7,42 (2H, д, H3), 7,57 (2H, д, H2'), 7,64 (2H, д, H2), 8,16 (1H, д, NHAla), 8,31 (2H, д, H3'), 10,06 (1H, с, NHPABA).
13C ЯМР (DMSO-d6, 100 МГц): δ=18,5 (CH3,Val, CH3,Ala), 19,6 (CH3,Val), 30,8 (β-CHVal), 37,1 ((C=O)2NCH2CH2), 49,5 (α-CHAla), 60,4 (α-CHVal), 63,8 (CH2OC(O)NH), 67,4, 68,8 (OCH2), 70,7 (ArCH2O), 119,5 (C2), 123,1 (C2'), 125,9 (C3'), 129,8 (4), 129,9 (C3), 135,0 (HC=CH), 139,9 (C1), 145,6 (C1'), 152,4 (OC(O)O), 155,8 (C4'), 156,6 (OC(O)NH), 171,3 (C=Oмалеимид), 171,5 (C=OVal), 171,7 (C=OAla).
MS (ESI) m/z; вычисленное значение: 670,24 [M+H]+, найденное значение: 670,30 [M+H]+
Соединение 56
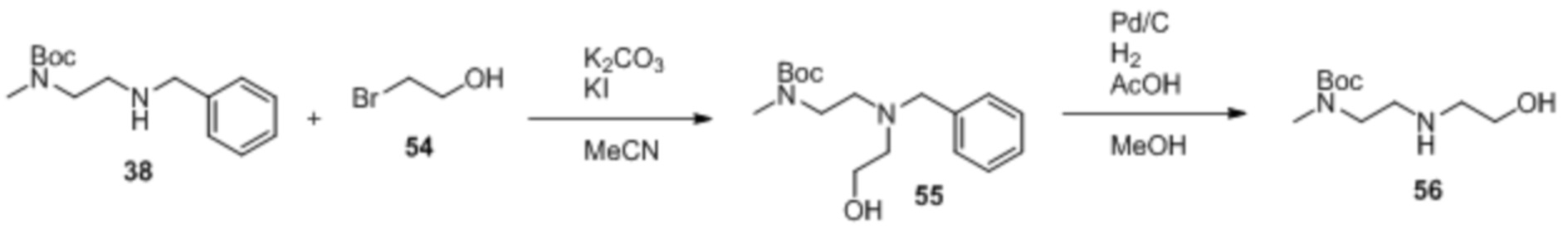
Смесь соединения 38 (2,05 г, 7,75 ммоль, 1 экв.), 2-бромэтанола (54, 551 мкл, 7,75 ммоль, 1 экв.), K2CO3 (2,14 г, 15,5 ммоль, 2 экв.) и KI (1,29 г, 7,75 ммоль, 1 экв.) растворяют в ацетонитриле (20 мл) и нагревают до температуры кипения и кипятят с обратным холодильником в течение 72 часов. Смесь охлаждают до RT, концентрируют в вакууме. Сырой продукт растворяют в DCM, промывают водой (2×) и соляным раствором, сушат над MgSO4, фильтруют и концентрируют в вакууме. Сырой продукт очищают колоночной хроматографией на силикагеле (гептан/EtOAc, от 1:0 до 0:1 масс./масса), фракции, содержащие продукт, объединяют и концентрируют в вакууме, что дает соединение 55 (1 г, 3,24 ммоль, 42%) в виде оранжевого масла.
MS (ESI) m/z; вычисленное значение: 309,22 [M+H]+, найденное значение: 309,38 [M+H]+
К суспензии катализатора Pd/C (345 мг, 0,32 ммоль, 0,1 экв.) в MeOH (50 мл) добавляют раствор соединения 55 (1 г, 3,24 ммоль, 1 экв. в MeOH 50 мл) с последующим введением уксусной кислоты (557 мкл, 9,73 ммоль, 3 экв.). Получающуюся в результате смесь перемешивают в течение 4 часов под атмосферой водорода. Затем, смесь фильтруют через Целит, концентрируют в вакууме, подвергают совместному выпариванию с толуолом и очищают колоночной хроматографией на силикагеле (DCM/MeOH, градиент), фракции, содержащие продукт, объединяют и концентрируют в вакууме, что дает OEGCS (56) (720 мг, 3,3 ммоль, количественный выход) в виде масла.
1H ЯМР (DMSO-d6, 400 МГц): δ=1,39 (9H, с, CH3,Boc), 2,63 (2H, т, NCH2CH2OH), 2,68 (2H, т, NCH2CH2N), 2,78 (3H, шир. с, NCH3), 3,24 (2H, т, NCH2), 3,46 (2H, т, CH2OH), 4,25 (2H, шир. с, NH, OH).
13C ЯМР (DMSO-d6, 100 МГц): δ=28,5 (CH3,Boc), 34,7 (NCH3), 46,8, 47,2, 47,8, 48,3 (NHCH2), 51,5 (NCH2), 60,3 (CH2OH), 78,8 (CBoc), 155,3 (C=OBoc).
MS (ESI) m/z; вычисленное значение: 219,17 [M+H]+, найденное значение: 219,28 [M+H]+
Соединение 57

Соединение A коммерчески доступно в Acros Organics (CAS-номер 836-43-1, suppl. Code 18196).
Раствор соединения A (2,73 г, 12,7 ммоль, 1 экв.) в DCM (20 мл) охлаждают до 0°C на ледяной бане, и добавляют DIPEA (6,68 мл, 38,2 ммоль, 3 экв.) с последующим введением по каплям MOM-Cl (1,45 мл, 19,1 ммоль, 1,5 экв.). Смесь перемешивают в течение 24 часов при RT. Далее, добавляют воду и DCM, и слои разделяют. DCM-слой промывают 1M-ным HCl-раствором, насыщенным NaHCO3-раствором, водой и соляным раствором, и сушат над Na2SO4. DCM-слой фильтруют, и фильтрат концентрируют в вакууме. Сырой продукт очищают колоночной хроматографией на силикагеле (C7/EtOAc, от 1:0 до 9:1, масс./масса), и фракции, содержащие продукт, объединяют и концентрируют в вакууме, что дает соединение B (2,6 г, 10,1 ммоль, 79%) в виде бесцветного масла.
1H ЯМР (CDCl3, 400 МГц): 3,40 (3H, с, OCH3), 4,52 (2H, с, ArCH2), 4,68 (2H, с, OCH2O), 5,06 (ArCH2,бензил), 6,96 (2H, д, H2), 7,26-7,44 (7H, м, H3, Hбензил).
К суспензии катализатора Pd/C (0,21 г, 2,01 ммоль, 0,2 экв.) в MeOH (6 мл) добавляют соединение B (2,6 г, 10,07 ммоль, 1 экв.) в THF (12 мл). Смесь продувают водородом 3 раза и перемешивают в атмосфере водорода в течение 4 часов. Суспензию фильтруют через Целит, концентрируют в вакууме и очищают колоночной хроматографией на силикагеле (C7/EtOAc, от 1:0 до 3:1, масс./масса). Фракции, содержащие продукт, объединяют и концентрируют в вакууме, что дает соединение 57 (1,68 г, 9,99 ммоль, 99%) в виде бесцветного масла.
1H ЯМР (CDCl3, 400 МГц): 3,42 (3H, с, OCH3), 4,52 (2H, с, ArCH2), 4,70 (2H, с, OCH2O), 6,55 (1H, шир. с, OH), 6,75 (2H, д, H2), 7,20 (2H, д, H3).
Соединение 61
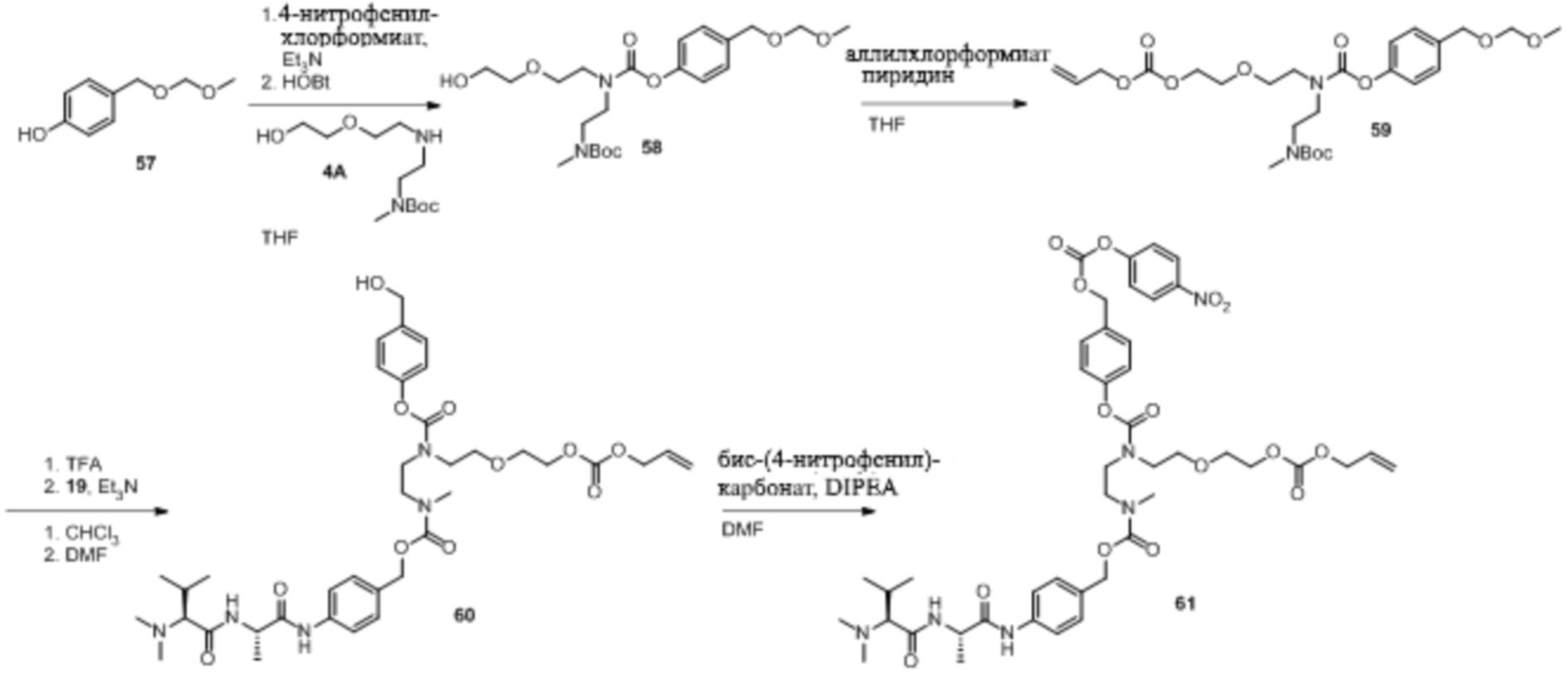
Раствор соединения 57 (1,68 г, 10 ммоль, 1 экв.) в THF (25 мл) охлаждают до 0°C на ледяной бане, и добавляют 4-нитрофенилхлорформиат (2,12 г, 10,5 ммоль, 1,05 экв.) и Et3N (4,18 мл, 30 ммоль, 3 экв.), и смесь перемешивают при 0°C на ледяной бане в течение 30 минут. Далее, добавляют HOBt (1,53 г, 10 ммоль, 1 экв.) и спейсер циклизации 4A (синтезированный так, как описано в WO2011/133039, пример 1 (Syntarga), 2,62 г, 10 ммоль, 1 экв. в THF (10 мл)) и перемешивают при 50°C в течение 90 минут. Смесь концентрируют в вакууме, и сырой продукт очищают колоночной хроматографией на силикагеле (DCM/EtOAc, от 1:0 до 1:1, масс./масса), фракции, содержащие продукт, объединяют и концентрируют в вакууме, что дает соединение 58 (3,1 г, 6,8 ммоль, 68%) в виде желтого масла.
1H ЯМР (DMSO-d6, 400 МГц): δ=1,34-1,43 (9H, м, CH3,Boc), 2,80-2,87 (3H, м, NCH3), 3,31 (3H, с, OCH3), 3,29-3,66 (12H, м, CH2N, CH2O), 4,52 (2H, с, ArCH2), 4,66 (2H, с, OCH2O), 7,06-7,11 (2H, м, H2), 7,33-7,38 (2H, м, H3).
13C ЯМР (DMSO-d6, 100 МГц): δ=28,4 (CH3,Boc), 34,4, 34,7, 34,9 (NCH3), 45,7, 46,5, 46,6, 47,1, 47,3, 47,4 (NCH2), 55,2 (OCH3), 60,7, 60,7 (CH2OH), 68,4 (ArCH2), 68,7, 69,2 (NCH2CH2O), 72,7, 72,8 (OCH2), 79,0, 79,0 (CBoc), 95,7 (OCH2O), 122,0, 122,2 (C2), 128,9, 129,0 (C3), 135,4 (C4), 151,0 (C1), 154,3 (C=O), 155,2 (C=OBoc).
MS (ESI) m/z; вычисленное значение: 457,25 [M+H]+, найденное значение: 357,16 (-Boc), 457,58 [M+H]+
Раствор соединения 58 (1 г, 2,19 ммоль, 1 экв.) в THF (20 мл) охлаждают на ледяной бане, и добавляют по каплям аллилхлорформиат (0,26 мл, 2,41 ммоль, 1,1 экв.) и пиридин (0,35 мл, 4,38 ммоль, 2 экв.). Смесь перемешивают в течение 5 часов при 0°C на ледяной бане. Сырую смесь концентрируют в вакууме и очищают колоночной хроматографией на силикагеле (DCM/EtOAc, от 1:0 до 1:1, масс./масса), фракции, содержащие продукт, объединяют и концентрируют в вакууме, что дает соединение 59 (1,1 г, 2,0 ммоль, 92%) в виде бесцветного масла.
1H ЯМР (DMSO-d6, 400 МГц): δ=1,33-1,41 (9H, м, CH3,Boc), 2,78-2,86 (3H, м, NCH3), 3,30 (3H, с, OCH3), 3,29-3,70 (10H, м, CH2N, CH2O), 4,22-4,26 (2H, м, (C=O)OCH2CH2O), 4,51 (2H, с, ArCH2), 4,57-4,62 (2H, м, CH2,Aloc), 4,65 (2H, с, OCH2O), 5,22-5,35 (2H, м, C=CH2,Aloc), 5,86-5,99 (1H, м, CHAloc), 7,05-7,11 (2H, м, H2), 7,32-7,36 (2H, м, H3).
13C ЯМР (DMSO-d6, 100 МГц): δ=28,5 (CH3,Boc), 34,5, 35,0 (NCH3), 45,7, 46,5, 47,2 (NCH2), 55,2 (OCH3), 67,2 (C=O)OCH2CH2O), 68,3 (CH2,Aloc), 68,4 (ArCH2), 68,6, 69,2 (OCH2), 79,0, 79,0 (CBoc), 95,7 (OCH2O), 118,8 (C=CH2,Aloc), 122,0, 122,2 (C2), 129,0 (C3), 132,6 (CHAloc), 135,5 (C4), 151,0 (C1), 154,3 (C=O), 154,9 (C=OAloc), 155,2 (C=OBoc).
MS (ESI) m/z; вычисленное значение: 563,26 [M+Na]+, найденное значение: 441,50 [M-Boc]+, 563,57 [M+Na]+
Соединение 59 (250 мг, 0,46 ммоль, 1 экв.) растворяют в хлороформе (6 мл), охлаждают до 0°C на ледяной бане, добавляют TFA (6 мл) и перемешивают в течение 8 часов. Смесь разбавляют хлороформом, концентрируют в вакууме, подвергают выпариванию с толуолом и сушат в вакууме. Получающуюся в результате TFA-соль повторно растворяют в обезвоженном DMF (2 мл), охлаждают до 0°C на ледяной бане. Добавляют раствор соединения 19 (225 мг, 0,46 ммоль, 1 экв.) в обезвоженном DMF (2 мл) с последующим введением по каплям Et3N (0,14 мл, 1,39 ммоль, 3 экв.). Получающуюся в результате смесь перемешивают в течение 3 часов с последующим добавлением MeOH (2 мл) и дополнительным перемешиванием в течение 15 минут. Смесь концентрируют в вакууме и очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 8:2, масс./масса), фракции, содержащие продукт, объединяют и концентрируют в вакууме, что дает соединение 60 (190 мг, 0,26 ммоль, 55%) в виде светло-желтого масла.
1H ЯМР (DMSO-d6, 400 МГц): δ=0,82-0,86 (3H, м, CH3,Val), 0,94-0,98 (3H, м, CH3,Val), 1,33-1,37 (3H, м, CH3,Ala), 2,06 (1H, шир. с, β-HVal), 2,30 (6H, шир. с, N(CH3)2), 2,85-2,90 (3H, м, NCH3), 3,30-3,72 (10H, м, CH2N, CH2O), 4,21-4,26 (2H, м, (C=O)OCH2CH2O), 4,46-4,61 (5H, м, α-CHAla, ArCH2, CH2,Aloc), 4,95-5,03 (2H, м, CH2,PABA) 5,20-5,35 (2H, м, OH, C=CH2,Aloc), 5,86-5,96 (1H, м, CHAloc), 6,96-7,04 (2H, м, H2'), 7,23-7,32 (4H, м, H3, H3'), 7,52-7,61 (2H, м, H2), 8,55 (1H, шир. с, NHAla), 9,74 (1H, шир. с, OH), 10,16 (NHPABA).
13C ЯМР (DMSO-d6, 100 МГц): δ=18,6 (CH3,Val), 18,6 (CH3,Ala), 19,8 (CH3,Val), 27,1 (β-CHVal), 34,5, 34,7, 35,1, 35,2 (NCH3), 41,7 (NCH3,Val), 45,7, 46,4, 46,7, 47,1, 47,3 (NCH2), 49,5 (α-CHAla), 62,9 (ArCH2OH), 66,5, 66,7 (ArCH2,PABA), 67,2 (C=O)OCH2CH2O), 68,3, 68,3 (CH2,Aloc), 68,5, 68,6, 69,1 (OCH2), 72,7 (α-CHVal), 118,7 (C=CH2,Aloc), 119,5 (C2) 121,8 (C2'), 127,6, 127,7 (C3), 128,9 (C3'), 132,0, 132,1 (C4, C4'), 132,6 (CHAloc), 139,2 (C1), 139,8 (C4'), 150,3 (C1'), 154,3 (Ar-OC(O)N), 154,9 (C=OAloc), 156,0, 156,1 (Ar-CH2OC(O)N), 171,4 (C=OAla).
MS (ESI) m/z; вычисленное значение: 744,38 [M+H]+, найденное значение: 744,72 [M+H]+
Раствор соединения 60 (190 мг, 0,26 ммоль, 1 экв.) в обезвоженном DMF (2 мл) охлаждают до 0°C на ледяной бане, и добавляют бис(4-нитрофенил)карбонат (155 мг, 0,51 ммоль, 2 экв.) и DIPEA (67 мкл, 0,38 ммоль, 1,5 экв.) и перемешивают в течение 4 часов. Смесь концентрируют в вакууме и очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 9:1, масс./масса), фракции, содержащие продукт, объединяют и концентрируют в вакууме, что дает соединение 61 (202 мг, 0,22 ммоль, 87%).
1H ЯМР (DMSO-d6, 400 МГц): δ=0,80 (3H, д, CH3,Val), 0,90 (3H, д, CH3,Val), 1,32 (3H, д, CH3,Ala), 1,94 (1H, шир. с, β-HVal), 2,25 (6H, шир. с, N(CH3)2), 2,85-2,91 (3H, м, NCH3), 3,30-3,71 (10H, м, CH2N, CH2O), 4,23 (2H, шир. с, (C=O)OCH2CH2O), 4,45-4,54 (1H, м, α-CHAla), 4,59 (2H, шир. с, CH2,Aloc), 4,95-5,03 (2H, м, CH2,PABA), 5,31 (2H, с, ArCH2), 5,20-5,34 (2H, м, C=CH2,Aloc), 5,86-5,96 (1H, м, CHAloc), 7,07-7,15 (2H, м, H2'), 7,23-7,33 (2H, м, H3), 7,45-7,49 (2H, м, H3'), 7,52-7,60 (4H, м, H2, H2''), 8,14 (1H, шир. с, NHAla), 8,29-8,35 (2H, м, H3''), 10,09 (NHPABA).
13C ЯМР (DMSO-d6, 100 МГц): δ=18,5 (CH3,Ala), 20,0 (CH3,Val), 27,1 (β-CHVal), 34,5, 34,8, 35,1, 35,3 (NCH3), 41,8 (NCH3,Val), 45,7, 45,9, 46,4, 46,7, 47,1, 47,43 (NCH2), 49,2 (α-CHAla), 66,5, 66,7 (ArCH2,PABA), 67,2 (C=O)OCH2CH2O), 68,3 (CH2,Aloc), 68,5, 68,6, 69,0 (OCH2), 70,4 (ArCH2), 73,3 (α-CHVal), 118,8 (C=CH2,Aloc), 119,5 (C2) 122,3, 122,4 (C2'), 123,0 (C2''), 125,9 (C3''), 128,9, 128,9 (C3), 130,1 (C3'), 131,9, 132,0 (C4, C4'), 132,6 (CHAloc), 139,2 (C1), 145,7 (C1''), 151,9 (C1'), 152,4 (OC(O)O) 154,3 (Ar-OC(O)N), 154,9 (C=OAloc), 155,8 (C4''), 156,0, 156,1 (Ar-CH2OC(O)N), 171,7 (C=OAla).
MS (ESI) m/z; вычисленное значение: 909,39 [M+H]+, найденное значение: 909,77 [M+H]+
Соединение 68

Раствор (S)-2-(((9H-флуорен-9-ил)метокси)карбониламино)пропановой кислоты (5 г, 16,1 ммоль) и (4-аминофенил)метанола (2,77 г, 22,5 ммоль, 1,4 экв.) в DCM (90 мл) и MeOH (30 мл) охлаждают до 0°C, добавляют этил-2-этоксихинолин-1(2H)-карбоксилат (7,94 г, 32,1 ммоль, 2 экв.) и перемешивают в течение 18 часов. Смесь концентрируют в вакууме, перемешивают в диэтиловом эфире (100 мл) и фильтруют, что дает (S)-(9H-флуорен-9-ил)метил 1-(4-(гидроксиметил)фениламино)-1-оксопропан-2-илкарбамат (6 г, 14,41 ммоль, 90%) в виде грязно-белого твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ=1,32 (3H, д, CH3,Ala), 4,17-4,29 (4H, м, α-CHAla,CHFmoc,CH2 Fmoc), 4,44 (2H, с, ArCH2), 7,24-7,90 (13H, м, CHArFmoc, H2, H3, NHAla), 9,95 (1H, с, NHPABA).
13C ЯМР (DMSO-d6, 100 МГц): δ=18,1 (CH3,Ala), 46,6 (CH2,Fmoc), 50,7 (α-CHAla), 62,6 (CH2), 65,6 (CH2 Fmoc), 118,9 (C2), 120,1 (CHFmoc), 125,3 (CHFmoc), 126,9 (CHFmoc), 127,1 (C3), 127,6 (CHFmoc), 137,4, 137,6 (C1, C4), 140,7 (CFmoc), 143,8 (CFmoc), 143,9 (CFmoc), 155,8 (C=OFmoc), 171,4 (C=OAla).
MS (ESI) m/z; вычисленное значение: 417,18 [M+H]+, найденное значение: 417,48 [M+H]+
(S)-(9H-флуорен-9-ил)метил 1-(4-(гидроксиметил)фениламино)-1-оксопропан-2-илкарбамат (6 г, 14,41 ммоль) растворяют в DMF (25 мл), добавляют пиперидин (9,81 г, 115 ммоль) и перемешивают в течение 1 часа. Смесь концентрируют и подвергают совместному выпариванию с толуолом. Сырой продукт (твердое вещество) перемешивают в диэтиловом эфире (150 мл) в течение 1 часа и фильтруют. Эту процедуру повторяют один раз, и полученный твердый продукт сушат в высоком вакууме, что дает незащищенное соединение 66 (2,4 г, 12,36 ммоль, 86%) в виде белого твердого вещества, которое используют непосредственно на следующей стадии.
Раствор соединения 65 (224 мг, 1,55 ммоль, 1 экв.) и незащищенного соединения 66 (300 мг, 1,55 ммоль, 1 экв.) в DMF (5 мл) охлаждают до 0°C на ледяной бане, и добавляют EDAC (474 мг, 2,47 ммоль, 1,6 экв.), HOBt (284 мг, 1,85 ммоль, 1,2 экв.) и DIPEA (1,35 мл, 7,72 ммоль, 5 экв.). Получающуюся в результате смесь перемешивают в течение 18 часов, давая ей нагреться до RT. Сырую смесь концентрируют в вакууме и очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 9:1, масс./масса), что дает соединение 67 с количественным выходом.
MS (ESI) m/z; вычисленное значение: 336,19 [M+H]+, найденное значение: 336,36 [M+H]+
Соединение 67 (150 мг, 0,45 ммоль, 1 экв.) растворяют в DMF (2,5 мл), охлаждают до 0°C на ледяной бане, и добавляют бис(4-нитрофенил)карбонат (272 мг, 0,89 ммоль, 2 экв.) и DIPEA (117 мкл, 0,67 ммоль, 1,5 экв.), и получающийся в результате раствор перемешивают в течение 3 часов, давая ему нагреться до RT. Затем, смесь концентрируют в вакууме, и сырой продукт очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 95:5, масс./масса), что дает соединение 68 (200 мг, 0,4 ммоль, 89%) в виде грязно-белого твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ=0,85 (3H, д, CH3,Val), 0,89 (3H, д, CH3,Val), 1,32 (3H, д, CH3,Ala), 1,89 (3H, с, CH3,Acetyl), 1,90-1,99 (1H, м, β-HVal), 4,15-4,21 (1H, м, α-CHVal), 4,37-4,43 (1H, м, α-CHAla), 5,25 (2H, с, ArCH2), 7,42 (2H, д, H3), 7,57 (2H, д, H2'), 7,65 (2H, д, H2), 7,90 (1H, д, NHVal), 8,23 (1H, д, NHAla), 8,31 (2H, д, H3'), 9,99 (1H, с, NHPABA).
13C ЯМР (DMSO-d6, 100 МГц): δ=18,3 (CH3,Ala), 18,7 (CH3,Val), 19,6 (CH3,Val), 23,1 (CH3,Ацетил), 30,9 (β-CHVal), 49,5 (α-CHAla), 58,2 (α-CHVal), 70,7 (Ar-CH2), 119,5 (C2), 123,1 (C2'), 125,9 (C3'), 129,7 (C4), 129,9 (C3), 139,9 (C1), 145,7 (C1'), 152,4 (OC(O)O),
MS (ESI) m/z; вычисленное значение: 501,20 [M+H]+, найденное значение: 501,40 [M+H]+
Соединение 73

Синтез H-Lys(Boc)-PABA, соединения 70, описан в Nair et al. Chem. Commun. 2015; 51: 2403-2406.
Соединение 71 получают в качестве побочного продукта реакции связывания H-Lys(Boc)-PABA 70 (1 экв.) и Me2ValOH (1,2 экв.) при использовании EDAC (1,6 экв.), HOBt (1,2 экв.) и DIPEA (5 экв.) в DMF (20 мл) в течение 18 часов. Протекание реакции с образованием этого побочного продукта вызвано присутствием AcOH в Me2ValOH. Смесь концентрируют в вакууме и очищают колоночной хроматографией на силикагеле (DCM/ MeOH, от 1:0 до 9:1, масс./масса), фракции, содержащие продукт, объединяют и концентрируют в вакууме, что дает соединение 71 (540 мг, 1,37 ммоль, 40%) в виде белого твердого вещества после кристаллизации из диэтилового эфира.
MS (ESI) m/z; вычисленное значение: 394,24 [M+H]+, найденное значение: 394,23 [M+H]+
Раствор соединения 71 (540 мг, 1,37 ммоль, 1 экв.) в хлороформе (12 мл) охлаждают до 0°C на ледяной бане, разбавляют посредством TFA (8 мл), и смесь перемешивают в течение 45 минут. Затем, реакционную смесь разбавляют посредством DCM, концентрируют в вакууме и очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 1:1, масс./масса), фракции, содержащие продукт, объединяют и концентрируют в вакууме, что дает промежуточный амин (300 мг, 1,02 ммоль, 75%) в виде светло-желтого масла. Масло суспендируют в THF (20 мл), охлаждают до 0°C на ледяной бане, и добавляют соединение 22 (159 мг, 1,02 ммоль, 1 экв.) и Et3N (570 мкл, 4,09 ммоль, 4 экв.) и перемешивают в течение 20 минут. Реакционную смесь нагревают до 50°C в течение 48 часов. Смесь концентрируют в вакууме, и сырой продукт очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 9:1, масс./масса), фракции, содержащие продукт, объединяют и концентрируют в вакууме, что дает соединение 72 (90 мг, 0,24 ммоль, 24%) в виде бесцветного воскообразного твердого вещества.
MS (ESI) m/z; вычисленное значение: 374,17 [M+H]+, найденное значение: 374,38 [M+H]+
Раствор соединения 72 (90 мг, 0,24 ммоль, 1 экв.) в DMF (2,5 мл) охлаждают до 0°C на ледяной бане, и добавляют бис(4-нитрофенил)карбонат (147 мг, 0,48 ммоль, 2 экв.) и DIPEA (63 мкл, 0,36 ммоль, 1,5 экв.), и получающийся в результате раствор перемешивают в течение 3 часов, давая ему постепенно нагреться до RT. Затем, смесь концентрируют в вакууме и очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 9:1 масс./масса), фракции, содержащие продукт, объединяют и концентрируют в вакууме, что дает соединение 73 (56 мг, 0,10 ммоль, 43%) в виде бесцветного твердого вещества.
MS (ESI) m/z; вычисленное значение: 539,18 [M+H]+, найденное значение: 539,40 [M+H]+
Синтез соединений 'линкер-лекарственное средство'
Соединение 'линкер-лекарственное средство' 3

Соединение 11 (530 мг, 0,93 ммоль, 1 экв.) растворяют в обезвоженном THF (15 мл), охлаждают до 0°C на ледяной бане, добавляют 4-нитрофенилхлорформиат (206 мг, 1,02 ммоль, 1,1 экв.) и Et3N (647 мкл, 1,49 ммоль, 5 экв.) и перемешивают в течение 45 минут. Затем добавляют соединение 56 (263 мг, 1,21 ммоль, 1,3 экв.) в обезвоженном THF (3 мл) и HOBt (156 мг, 1,02 ммоль, 1,1 экв.), и получающуюся в результате смесь нагревают до 45°C в течение 2 часов. После этого сырую смесь охлаждают до RT, концентрируют в вакууме и очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 93:7, масс./масса), фракции, содержащие продукт, объединяют и концентрируют в вакууме, что дает продукт 46 (580 мг, 0,71 ммоль, 77%) в виде белой пены.
1H ЯМР (DMSO-d6, 400 МГц): δ=1,32-1,45 (9H, м, CH3,Boc), 2,78-2,95 (6H, м, ArCH3, NCH3), 3,30-3,79 (9H, м, CHCl, NCH2, OCH2), 3,41 (3H, с, OCH3), 3,81-3,86 (1H, м, CHCl), 4,47 (1H, т, H1), 4,64-4,70 (1H, м, H2), 4,89, 5,04 (1H, 2 × шир. с, OH), 5,17-5,21 (1H, м, H2), 5,31 (2H, с, OCH2O), 7,18 (2H, д, H3''), 7,31-7,37 (1H, м, H7), 7,37-7,44 (1H, м, H8), 7,56-7,60 (1H, м, H8'), 7,71-7,86 (2H, м, H6, H7'), 8,00 (2H, д, H2''), 8,37 (1H, шир. с, H4), 8,70 (1H, с, H3'), 9,47 (1H, с, H5'), 10,32 (1H, с, Ar-NHC(O)-Ar).
13C ЯМР (DMSO-d6, 100 МГц): δ=22,9 (Ar-CH3), 28,5, 28,6 (CH3, Boc), 34,5 (NCH3), 44,7 (C1), 45,8, 46,2, 46,4 (NCH2), 48,0 (CH2Cl), 55,1 (C2), 56,3 (OCH3), 59,1, 59,7 (CH2OH), 79,1, 79,2 (CBoc), 93,7 (OCH2O), 111,0, 111,1 (C4), 116,2 (C3''), 117,8 (C5'), 118,0 (C7'), 119,6 (C3'), 121,3 (C6), 122,8 (C9b), 123,6 (C8'), 125,1 (C7), 126,3 (C5a), 127,8 (C6'), 127,9 (C1''), 130,1 (C2''), 130,3 (C9a), 131,0 (C8), 133,4 (C9), 141,0 (C2'), 141,9 (C8a'), 142,4 (C3a), 148,6, 148,6 (Ar-OC(O)N), 154,3, 154,4 (C5), 155,2 (C=OBoc), 160,1 (C4''), 162,4 (NC=O), 165,6 (Ar-NHC(O)-Ar).
MS (ESI) m/z; вычисленное значение: 815,32 [M+H]+, найденное значение: 815,60 [M+H]+
Раствор соединения 46 (200 мг, 0,25 ммоль, 1 экв.), малеимида (31 мг, 0,32 ммоль, 1,3 экв.) и трифенилфосфина (84 мг, 0,32 ммоль, 1,3 экв.) в обезвоженном THF (4 мл) охлаждают до 0°C на ледяной бане, и добавляют по каплям DEAD (2,2 M в толуоле, 145 мкл, 0,32 ммоль, 1,3 экв.), и эту смесь перемешивают в течение 45 минут при RT. Смесь концентрируют в вакууме и очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 95:5, масс./масса), фракции, содержащие продукт, объединяют и концентрируют в вакууме, подвергают совместному выпариванию с толуолом, что дает соединение 47 (150 мг, 0,17 ммоль, 68%) в виде белой пены.
MS (ESI) m/z; вычисленное значение: 894,32 [M+H]+, найденное значение: 894,62 [M+H]+
Раствор соединения 47 (150 мг, 0,17 ммоль, 1 экв.) в хлороформе (4 мл) охлаждают до 0°C на ледяной бане и разбавляют посредством TFA (2 мл) и перемешивают в течение 3 часов. Смесь концентрируют в вакууме, подвергают совместному выпариванию с толуолом и сушат в вакууме. Промежуточное соединение растворяют в обезвоженном DMF (2 мл) и охлаждают до 0°C на ледяной бане с последующим добавлением активированного линкера 19 (98 мг, 0,20 ммоль, 1,2 экв.) и Et3N (47 мкл, 0,34 ммоль, 2 экв.). Реакционную смесь перемешивают в течение 2 часов. Смесь концентрируют в вакууме и очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 7:3, масс./масса), фракции, содержащие продукт, объединяют и концентрируют в вакууме, что дает сырое соединение 3, которое дополнительно очищают препаративной высокоэффективной жидкостной хроматографией (HPLC) (Sunfire C-18, MeCN/ MilliQ 0,1% масс./масса TFA). Ацетонитрил выпаривают, и водный остаток подвергают лиофильной сушке, полученное твердое вещество смывают в диоксан/воду (6 мл, 2:1) и подвергают лиофильной сушке, что дает TFA-соль соединения 'линкер-лекарственное средство' 3 (69 мг, 0,06 ммоль, 38%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ=0,89 (3H, д, CH3,Val), 1,07 (3H, д, CH3,Val), 1,37 (3H, д, CH3,Ala), 2,24-2,34 (1H, м, β-HVal), 2,78 (6H, шир. с, N(CH3)2), 2,84 (3H, шир. с, ArCH3), 2,84-2,98 (3H, д, C(O)NCH3), 3,35-3,88 (11H, м,CH2Cl, α-CHVal, NCH2), 4,44-4,51 (1H, м, H1), 4,55 (1H, т, α-CHAla), 4,61-4,69 (1H, м, H2), 4,97-5,10 (3H, м, H2, Ar-CH2), 6,92 (2H, д, H3''), 6,98 (1H, с, HC=CH), 7,08 (1H, с, HC=CH), 7,19-7,80 (9H, м, H6, H7, H8, H7', H8', H2''', H3'''), 7,91 (2H, д, H2''), 8,21-8,32 (1H, м, H4), 8,78-8,83 (1H, м, H3'), 8,99 (1H, д, NHAla), 9,54-9,68 (2H, м, H5', OH), 10,11-10,20 (1H, м, NHPABA), 10,30 (1H, с, Ar-NHC(O)-Ar).
13C ЯМР (DMSO-d6, 100 МГц): 17,1 (CH3,Val), 18,5 (CH3,Ala), 19,6 (CH3,Val), 22,8 (Ar-CH3), 27,0 (β-CHVal), 34,7 (NCH3), 35,5 ((C=O)2NCH2CH2), 41,5 (NCH3,Val), 42,1 (NCH3,Val), 44,8 (C1), 45,6 (NCH2), 47,9 (CH2Cl), 49,8 (α-CHAla), 54,9 (C2), 66,4 (Ar-CH2OC(O)N), 72,0 (α-CHVal), 111,0 (C4), 115,6 (C3''), 117,0 (C7'), 117,8 (C5'), 119,3 (C3'), 119,5 (C2'''), 121,1 (C6), 123,1 (C9b), 125,0 (C1''), 125,3 (C7, C8'), 126,3 (5a), 128,7 (C6'), 128,9 (C3'''), 130,2 (C9a), 130,3 (C2''), 131,1 (C8), 132,3 (C4'''), 133,4 (C9), 135,1, 135,2 (HC=CH), 138,9 (C1'''), 141,1 (C2', C8a'), 142,1 (C3a), 148,4 (Ar-OC(O)N), 154,2 (C5), 154,7 (Ar-CH2OC(O)N), 161,4 (NC=O), 161,4 (C4''), 165,4 (C=OVal), 165,9 (Ar-NHC(O)-Ar), 170,7 (C=OAla), 171,4, 171,5 (C=Oмалеимид).
MS (ESI) m/z; вычисленное значение: 1097,43 [M+H]+, найденное значение: 1097,76 [M+H]+
Соединение 'линкер-лекарственное средство' 4

Раствор соединения 12 (990 мг, 0,96 ммоль, 1 экв.) в DCM (5 мл) охлаждают до 0°C на ледяной бане и разбавляют посредством TFA (5 мл). Смесь перемешивают в течение 2,5 часов и затем разбавляют посредством DCM, концентрируют в вакууме и подвергают совместному выпариванию с толуолом. Активированное соединение 19 (512 мг, 1,05 ммоль, 1,1 экв.) растворяют в обезвоженном DMF (10 мл), охлаждают до 0°C на ледяной бане и после этого добавляют Et3N (533 мкл, 4,06 ммоль, 4 экв.) с последующим введением по каплям TFA-соли (которую растворяют в обезвоженном DMF (10 мл)). Получающуюся в результате смесь перемешивают в течение 3 часов и постепенно нагревают от 0°C на ледяной бане до RT. Далее, смесь концентрируют в вакууме, и сырой продукт очищают колоночной хроматографией на силикагеле (DCM/MeOH, градиент), фракции, содержащие продукт, объединяют, концентрируют в вакууме и подвергают совместному выпариванию с толуолом. Затем, полученное твердое вещество суспендируют в толуоле (120 мл) и постепенно нагревают до 90°C за 5 часов. Смесь концентрируют в вакууме, и сырой продукт очищают препаративной HPLC (Sunfire C-18, MeCN/ MilliQ 0,1% масс./масса TFA). Ацетонитрил выпаривают, и водный остаток подвергают лиофильной сушке. Полученный продукт растворяют в растворителе диоксан/вода (18 мл, 2:1) и подвергают лиофильной сушке, что дает TFA-соль соединения 'линкер-лекарственное средство' 4 (475 мг, 0,42 ммоль, 44%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ=0,88 (3H, д, CH3,Val), 1,06 (3H, д, CH3,Val), 1,36 (3H, д, CH3,Ala), 2,25-2,30 (1H, м, β-HVal), 2,77 (6H, шир. с, N(CH3)2), 2,85 (3H, шир. с, ArCH3), 2,85-2,92 (3H, д, C(O)NCH3), 3,33-3,71 (14H, м, CHCl, α-CHVal, NCH2, OCH2), 3,83 (1H, д, CHCl), 4,47-4,51 (1H, м, H1), 4,51-4,57 (1H, м, α-CHAla), 4,63-4,69 (1H, м, H2), 4,96-5,07 (3H, м, H2, Ar-CH2), 6,89-6,97 (3H, м, HC=CH, H3''), 7,03 (1H, д, CH=CH), 7,17-7,59 (6H, м, H7, H8, H2''', H3'''), 7,62-7,80 (3H, м, H6, H7', H8'), 7,91 (2H, д, H2''), 8,28-8,39 (1H, м, H4), 8,79-8,81 (1H, м, H3'), 8,99 (1H, д, NHAla), 9,55-9,62 (2H, м, H5', OH), 10,11-10,18 (1H, м, NHPABA), 10,30 (1H, с, Ar-NHC(O)-Ar).
13C ЯМР (DMSO-d6, 100 МГц): δ=17,1 (CH3,Val), 18,5 (CH3,Ala), 19,6 (CH3,Val), 22,9 (Ar-CH3), 27,0 (β-CHVal), 34,4, 34,8, 35,2 (NCH3), 37,1, 37,4 ((C=O)2NCH2CH2), 41,5 (NCH3,Val), 42,1 (NCH3,Val), 44,8 (C1), 47,4, 47,6 (NCH2), 47,9 (CH2Cl), 49,8 (α-CHAla), 54,9 (C2), 66,4, 66,5 (Ar-CH2OC(O)N), 67,6, 68,4, 68,6 (OCH2), 71,9 (α-CHVal), 111,0 (C4), 115,6 (C3''), 117,0 (C7'), 117,8 (C5'), 119,5 (C3', C2'''), 121,2 (C6), 123,0 (C9b), 124,9 (C1''), 125,3 (C7, C8'), 126,3 (C5a), 128,8 (C6'), 128,9, 129,0 (C3'''), 130,2 (C9a), 130,3 (C2''), 131,1 (C8), 132,4 (C4'''), 133,5 (C9), 134,9, 135,0 (HC=CH), 138,9 (C1'''), 139,0 (C2'), 140,9 (C8a'), 142,1 (C3a), 148,5 (Ar-OC(O)N), 154,1, 154,3 (C5), 156,2 (Ar-CH2OC(O)N), 161,3 (NC=O), 161,4 (C4''), 165,4 (C=OVal), 165,9 (Ar-NHC(O)-Ar), 170,8 (C=OAla), 171,4 (C=Oмалеимид).
MS (ESI) m/z; вычисленное значение: 1141,45 [M+H]+, найденное значение: 1141,90 [M+H]+
Соединение 'линкер-лекарственное средство' 5

Раствор соединения 44 (720 мг, 0,80 ммоль, 1 экв.), малеимида (10 мг, 1,04 ммоль, 1,3 экв.) и трифенилфосфина (272 мг, 1,04 ммоль, 1,3 экв.) в обезвоженном THF (10 мл) охлаждают до 0°C на ледяной бане, и добавляют по каплям DEAD (2,2 M в толуоле, 471 мкл, 1,04 ммоль, 1,3 экв.) и перемешивают в течение 45 минут при RT. Смесь концентрируют в вакууме и очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 95:5, объем/объем), фракции, содержащие продукт, объединяют и концентрируют в вакууме, подвергают совместному выпариванию с толуолом, что дает соединение 45 (590 мг, 0,60 ммоль, 75%) в виде белой пены.
1H ЯМР (DMSO-d6, 400 МГц): δ=1,29-1,45 (9H, м, CH3,Boc), 2,78-2,95 (6H, м, ArCH3, NCH3), 3,42 (3H, с, OCH3), 3,35-3,74 (17H, м, CHCl, NCH2, OCH2), 3,80-3,86 (1H, м, CHCl), 4,47 (1H, т, H1), 4,63-4,70 (1H, м, H2), 5,16-5,21 (1H, м, H2), 5,31 (2H, с, OCH2O), 6,97-7,02 (2H, м, HC=CH), 7,18 (2H, д, H3''), 7,31-7,44 (2H, м, H7, H8), 7,57-7,61 (1H, м, H8'), 7,68-7,84 (2H, м, H6, H7'), 7,99 (2H, д, H2''), 8,35 (1H, шир. с, H4), 8,70 (1H, с, H3'), 9,47 (1H, с, H5'), 10,32 (1H, с, Ar-NHC(O)-Ar).
13C ЯМР (DMSO-d6, 100 МГц): δ=22,9 (Ar-CH3), 28,5, 28,6 (CH3, Boc), 34,6 (NCH3), 37,2, 37,3 ((C=O)2NCH2CH2), 44,7 (C1), 45,5, 46,0, 47,5 (NCH2), 47,9 (CH2Cl), 55,1 (C2), 56,3 (OCH3), 67,5, 68,6, 69,1, 69,9, 70,2, 70,3 (OCH2), 79,1, 79,1 (CBoc), 94,2 (OCH2O), 111,0, 111,1 (C4), 116,2 (C3''), 117,8 (C5'), 118,0 (C7'), 119,6 (C3'), 121,2 (C6), 122,8 (C9b), 123,6 (C8'), 125,1 (C7), 126,3 (C5a), 127,8 (C6'), 127,9 (C1''), 130,1 (C2''), 130,3 (C9a), 131,0 (C8), 133,5 (C9), 134,9, 134,9 (HC=CH), 141,0 (C2'), 141,9 (C8a'), 142,4 (C3a), 148,5, 148,6 (Ar-OC(O)N), 154,3 (C5), 155,2 (C=OBoc), 160,1 (C4''), 162,3 (NC=O), 165,6 (Ar-NHC(O)-Ar), 171,3, 171,3 (C=OМалеимид).
MS (ESI) m/z; вычисленное значение: 982,37 [M+H]+, найденное значение: 982,80 [M+H]+
Раствор соединения 45 (200 мг, 0,20 ммоль, 1 экв.) в хлороформе (2 мл) охлаждают до 0°C на ледяной бане и разбавляют посредством TFA (2 мл) и перемешивают в течение 3 часов. Смесь концентрируют в вакууме, подвергают совместному выпариванию с толуолом и сушат в вакууме. Прромежуточное соединение растворяют в обезвоженном DMF (2 мл), охлаждают до 0°C на ледяной бане, и добавляют активированный линкер 19 (119 мг, 0,24 ммоль, 1,2 экв.) и Et3N (85 мкл, 0,61 ммоль, 3 экв.), и эту смесь перемешивают в течение 2 часов. Смесь концентрируют в вакууме и очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 7:3, объем/объем), что дает сырое соединение 5, которое очищают препаративной HPLC (Sunfire C-18, MeCN/ MilliQ 0,1% масс./масса TFA). MeCN выпаривают, и водный остаток подвергают лиофильной сушке, полученное твердое вещество смывают в диоксан/воду (6 мл, 2:1) и подвергают лиофильной сушке, что дает TFA-соль соединения 'линкер-лекарственное средство' 5 (18 мг, 0,013 ммоль, 7%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ=0,88 (3H, д, CH3,Val), 1,06 (3H, д, CH3,Val), 1,37 (3H, д, CH3,Ala), 2,23-2,33 (1H, м, β-HVal), 2,77 (6H, шир. с, N(CH3)2), 2,85 (3H, шир. с, ArCH3), 2,85-2,98 (3H, д, C(O)NCH3), 3,36-3,99 (19H, м, CH2Cl, α-CHVal, NCH2, OCH2), 4,46-4,51 (1H, м, H1), 4,55 (1H, т, α-CHAla), 4,63-4,69 (1H, м, H2), 4,97-5,18 (3H, м, H2, Ar-CH2), 6,91 (2H, д, H3''), 6,95-7,01 (2H, м, HC=CH), 7,18-7,59 (6H, м, H7, H8, H2''', H3'''), 7,62-7,80 (3H, m, H6, H7', H8'), 7,91 (2H, д, H2''), 8,28-8,39 (1H, м, H4), 8,72 (1H, с, H3'), 8,99 (1H, д, NHAla), 9,50(1H, шир. с, H5'), 9,64 (1H, шир. с, OH), 10,11-10,30 (2H, м, NHPABA, Ar-NHC(O)-Ar).
13C ЯМР (DMSO-d6, 100 МГц): δ=17,2 (CH3,Val), 18,5 (CH3,Ala), 19,7 (CH3,Val), 22,9 (Ar-CH3), 27,0 (β-CHVal), 34,9, 35,3 (NCH3), 37,3 ((C=O)2NCH2CH2), 41,6 (NCH3,Val), 42,0 (NCH3,Val), 44,8 (C1), 47,4, 47,6 (NCH2), 47,9 (CH2Cl), 49,8 (α-CHAla), 55,0 (C2), 66,5 (Ar-CH2OC(O)N), 67,5, 69,0, 69,8, 70,1, 70,3 (OCH2), 71,9 (α-CHVal), 111,0 (C4), 115,5 (C3''), 117,7 (C7'), 117,7 (C5'), 119,5 (C3', C2'''), 121,3 (C6), 122,9 (C9b), 124,1 (C8'), 125,1 (C7), 126,3 (C5a, C1''), 128,3 (C6'), 128,8 (C3'''), 130,3 (C9a), 130,3 (C2''), 131,1 (C8), 132,6 (C4'''), 133,5 (C9), 134,9, 135,0 (HC=CH), 138,9 (C1'''), 141,6 (C2', C8a'), 142,3 (C3a), 148,5 (Ar-OC(O)N), 154,5 (C5), 156,3 (Ar-CH2OC(O)N), 158,1, 158,4, 158,8, 159,1 (TFA), 161,4 (NC=O), 161,4 (C4''), 165,4 (C=OVal), 165,9 (Ar-NHC(O)-Ar), 170,7 (C=OAla), 171,3 (C=Oмалеимид).
MS (ESI) m/z; вычисленное значение: 1185,48 [M+H]+, найденное значение: 1186,79 [M+H]+
Соединение 'линкер-лекарственное средство' 6

Раствор соединения 35 (170 мг, 0,30 ммоль, 1 экв.) в обезвоженном THF (5 мл) охлаждают до 0°C на ледяной бане, и добавляют 4-нитрофенилхлорформиат (66 мг, 0,33 ммоль, 1,1 экв.) и Et3N (207 мкл, 1,49 ммоль, 5 экв.) и перемешивают в течение 30 минут. Далее, добавляют раствор соединения 40 (186 мг, 0,39 ммоль, 1,3 экв.) в обезвоженном THF (3 мл) и HOBt (50 мг, 0,33 ммоль, 1,1 экв.), и получающуюся в результате смесь нагревают до 45°C в течение 2 часов. Смесь охлаждают до RT, концентрируют в вакууме, и сырой продукт очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 95:5, объем/объем), что дает соединение 41 (325 мг, количественный выход).
1H ЯМР (DMSO-d6, 400 МГц): δ=1,30-1,44 (9H, м, CH3, Boc), 2,78-2,95 (6H, м, ArCH3, NCH3), 3,35-3,77 (21H, м, CHCl, 4 × NCH2, 6 × OCH2), 3,41 (3H, с, OCH3) 3,79-3,85 (1H, м, CHCl), 4,42-4,48 (1H, м, H1), 4,62-4,69 (1H, м, H2), 5,16-5,21 (1H, м, H2), 5,30 (2H, с, OCH2O), 7,18 (2H, д, H3''), 7,29-7,41 (2H, м, H7, H8), 7,56-7,80 (1H, м, H8'), 7,67-7,86 (6H, м, H6, H7', HФталимид), 7,99 (2H, д, H2''), 8,36 (1H, шир. с, H4), 8,68 (1H, с, H3'), 9,46 (1H, с, H5'), 10,30 (1H, с, Ar-NHC(O)-Ar).
13C ЯМР (DMSO-d6, 100 МГц): δ=22,9 (Ar-CH3), 28,4, 28,6 (CH3, Boc), 34,5 (NCH3), 37,5, 37,6 ((C=O)2NCH2CH2), 44,7 (C1), 45,5, 46,0, 46,4, 47,5 (NCH2), 47,9 (CH2Cl), 55,1 (C2), 56,3 (OCH3), 67,4, 68,5, 69,1, 70,0, 70,0, 70,2, 70,3, 70,3 (OCH2), 79,1, 79,1 (CBoc), 94,2 (OCH2O), 111,0, 111,1 (C4), 116,1 (C3''), 117,8 (C5'), 118,0 (C7'), 121,2 (C3'), 121,3 (C6), 122,8 (C9b), 123,4 (CHФталимид) 123,5 (C8'), 125,1 (C7), 126,3 (C5a), 127,8 (C6'), 127,9 (C1''), 130,1 (C2''), 130,2 (C9a), 131,0 (C8), 132,0 (CФталимид), 133,4, 133,4 (C9), 134,8 (CHФталимид) 141,0 (C2'), 141,9 (C8a'), 142,4 (C3a), 148,5, 148,6 (Ar-OC(O)N), 154,3 (C5), 155,2, 155,5 (C=OBoc), 160,1 (C4''), 162,3 (NC=O), 165,6 (Ar-NHC(O)-Ar), 168,2, 168,2 (C=OФталимид).
MS (ESI) m/z; вычисленное значение: 1076,42 [M+H]+, найденное значение: 1076,77 [M+H]+
К раствору соединения 41 (323 мг, 0,3 ммоль, 1 экв.) в DMF (3 мл) добавляют гидразин (44 мкл, 0,9 ммоль, 3 экв.), и смесь нагревают до 35°C в течение 5,5 часов при регулярном добавлении свежего гидразина (30 мкл, 0,6 ммоль, 2 экв.) каждые 45 минут. Сырую смесь концентрируют в вакууме и очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 7:3, объем/объем), что дает соединение 42 (284 мг, 0,17 ммоль, 56%) в виде желтого/оранжевого воскообразного твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ=1,29-1,45 (9H, м, CH3, Boc), 2,74-2,96 (8H, м, ArCH3, NCH3, CH2NH2), 3,34 (2H, шир. с, NH2), 3,41 (3H, с, OCH3), 3,40-3,79 (19H, м, CHCl, NCH2, OCH2), 3,81-3,86 (1H, м, CHCl), 4,48 (1H, т, H1), 4,64-4,71 (1H, м, H2), 5,15-5,20 (1H, м, H2), 5,31 (2H, с, OCH2O), 7,18 (2H, д, H3''), 7,34-7,46 (2H, м, H7, H8), 7,63-8,08 (5H, м, H6, H7', H8', H2''), 8,35 (1H, шир. с, H4), 8,70 (1H, с, H3'), 9,49 (1H, с, H5'), 10,43 (1H, с, Ar-NHC(O)-Ar).
13C ЯМР (DMSO-d6, 100 МГц): δ=22,9 (Ar-CH3), 28,5, 28,6 (CH3, Boc), 34,6 (NCH3), 39,1 (CH2NH2), 44,7 (C1), 45,5, 45,9, 47,4 (NCH2), 48,0 (CH2Cl), 55,1 (C2), 56,3 (OCH3), 67,3, 68,4, 69,0, 70,2, 70,2, 70,4 (OCH2), 79,1, 79,2 (CBoc), 94,2 (OCH2O), 111,0, 111,1 (C4), 116,1 (C3''), 117,8 (C5'), 118,0 (C7'), 119,5 (C3'), 121,2, 121,3 (C6), 122,9 (C9b), 123,7 (C8'), 125,1 (C7), 126,3 (C5a), 127,7 (C6'), 128,0 (C1''), 130,1 (C2''), 130,3 (C9a), 131,0 (C8), 133,5 (C9), 141,0 (C2'), 141,9 (C8a'), 142,4 (C3a), 148,5, 148,6 (Ar-OC(O)N), 154,3 (C5), 155,2 (C=OBoc), 160,1 (C4''), 162,4 (NC=O), 165,6 (Ar-NHC(O)-Ar).
MS (ESI) m/z; вычисленное значение: 946,41 [M+H]+, найденное значение: 946,71 [M+H]+
Соединение 42 (160 мг, 0,17 ммоль, 1 экв.) растворяют в смеси THF (5 мл) и насыщенного раствора NaHCO3 (1 мл), охлаждают до 0°C на ледяной бане, и добавляют малеимид-карбамат 22 (26 мг, 0,17 ммоль, 1 экв.). Смесь перемешивают в течение 30 минут. Затем, добавляют Na2CO3 (1 M в H2O) (169 мкл, 0,17 ммоль, 1 экв.) и перемешивают в течение дополнительныъ 45 мин. Затем, к смеси добавляют H2O, экстрагируют дважды посредством EtOAc и сушат над MgSO4. Раствор фильтруют и концентрируют в вакууме с последующей очисткой сырого продукта колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 95:5 объем/объем), что дает соединение 43 (100 мг, 0,10 ммоль, 58%) в виде белого воскообразного твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ=1,31-1,45 (9H, м, CH3, Boc), 2,76-2,95 (6H, м, ArCH3, NCH3), 3,41 (3H, с, OCH3), 3,40-3,79 (21H, м, CHCl, NCH2, OCH2), 3,79-3,85 (1H, м, CHCl), 4,46 (1H, т, H1), 4,63-4,70 (1H, м, H2), 5,16-5,21 (1H, м, H2), 5,30 (2H, с, OCH2O), 6,99 (2H, д, HC=CH), 7,11-7,27 (4H, д, H3''), 7,32-7,43 (2H, м, H7, H8), 7,56-7,60 (1H, м, H8'), 7,68-7,84 (2H, м, H6, H7'), 7,99 (2H, д, H2''), 8,35 (1H, шир. с, H4), 8,69 (1H, с, H3'), 9,47 (1H, с, H5'), 10,31 (1H, с, Ar-NHC(O)-Ar).
13C ЯМР (DMSO-d6, 100 МГц): δ=22,9 (Ar-CH3), 28,5, 28,6 (CH3, Boc), 34,5 (NCH3), 37,2, 37,3 ((C=O)2NCH2CH2), 44,7 (C1), 45,5, 46,0, 46,4, 47,5 (NCH2), 47,9 (CH2Cl), 55,1 (C2), 56,3 (OCH3), 67,4, 67,4, 68,5, 69,1, 69,9, 69,9, 70,2, 70,2, 70,3, 70,4 (OCH2), 79,1, 79,1 (CBoc), 94,2 (OCH2O), 111,0, 111,1 (C4), 116,2 (C3''), 117,8 (C5'), 118,0 (C7'), 119,5 (C3'), 121,2, 121,3 (C6), 122,8 (C9b), 123,6 (C8'), 125,1 (C7), 126,3 (C5a), 127,8 (C6'), 127,9 (C1''), 130,1 (C2''), 130,3 (C9a), 131,0 (C8), 133,5 (C9), 135,0 (HC=CH), 141,0 (C2'), 141,9 (C8a'), 142,4 (C3a), 148,5, 148,6 (Ar-OC(O)N), 154,3 (C5), 155,2, 155,5 (C=OBoc), 160,1 (C4''), 162,4 (NC=O), 165,6 (Ar-NHC(O)-Ar), 171,3 (C=OМалеимид).
MS (ESI) m/z; вычисленное значение: 1026,40 [M+H]+, найденное значение: 1026,59 [M+H]+
Раствор соединения 43 (100 мг, 0,097 ммоль, 1 экв.) в хлороформе (4 мл) охлаждают до 0°C на ледяной бане, разбавляют посредством TFA (2 мл) и перемешивают в течение 3 часов. Смесь концентрируют в вакууме, подвергают совместному выпариванию с толуолом и сушат в вакууме. Затем, промежуточное соединение растворяют в обезвоженном DMF (2 мл), охлаждают до 0°C на ледяной бане, и добавляют активированный линкер 19 (57 мг, 0,117 ммоль, 1,2 экв.) и Et3N (27 мкл, 0,195 ммоль, 2 экв.), и смесь перемешивают в течение 2 часов. Смесь концентрируют в вакууме, и сырой продукт очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 7:3, объем/объем), что дает соединение 6, которое дополнительно очищают препаративной HPLC (Sunfire C-18, MeCN/ MilliQ 0,1% масс./масса TFA). Ацетонитрил выпаривают, и водный остаток подвергают лиофильной сушке, полученное твердое вещество смывают в растворитель диоксан/вода (6 мл, 2:1) и подвергают лиофильной сушке, что дает TFA-соль соединения 'линкер-лекарственное средство' 6 (19 мг, 0,015 ммоль, 15%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ=0,88 (3H, д, CH3,Val), 1,06 (3H, д, CH3,Val), 1,37 (3H, д, CH3,Ala), 2,18-2,32 (1H, м, β-HVal), 2,77 (6H, шир. с, N(CH3)2), 2,85 (3H, шир. с, ArCH3), 2,85-2,98 (3H, д, C(O)NCH3), 3,39-4,11 (23H, м, CH2Cl, α-CHVal, NCH2, OCH2), 4,46-4,51 (1H, м, H1), 4,51-4,58 (1H, м, α-CHAla), 4,63-4,69 (1H, м, H2), 4,97-5,15 (3H, м, H2, Ar-CH2), 6,91 (2H, д, H3''), 6,99 (2H, с, HC=CH), 7,18-7,59 (6H, м, H7, H8, H2''', H3'''), 7,63-7,82 (3H, м, H6, H7', H8'), 7,91 (2H, д, H2''), 8,28-8,39 (1H, м, H4), 8,76 (1H, с, H3'), 8,97 (1H, д, NHAla), 9,53(2H, шир. с, H5', OH), 10,11-10,30 (2H, м, NHPABA, Ar-NHC(O)-Ar).
13C ЯМР (DMSO-d6, 100 МГц): δ=17,1 (CH3,Val), 18,6 (CH3,Ala), 19,7 (CH3,Val), 22,9 (Ar-CH3), 27,0 (β-CHVal), 34,6, 35,2 (NCH3), 37,2 ((C=O)2NCH2CH2), 41,5 (NCH3,Val), 42,2 (NCH3,Val), 44,8 (C1), 47,4, 47,6 (NCH2), 47,9 (CH2Cl), 49,8 (α-CHAla), 55,0 (C2), 66,5 (Ar-CH2OC(O)N), 67,4, 68,5, 69,9, 70,2, 70,3 (OCH2), 72,0 (α-CHVal), 111,1 (C4), 115,5 (C3''), 117,4 (C7'), 117,7 (C5'), 119,5 (C3', C2'''), 121,2 (C6), 122,9 (C9b), 124,4 (C8'), 125,0 (C1''), 125,2 (C7), 126,3 (C5a), 128,5 (C6'), 128,8 (C3'''), 130,3 (C9a), 130,3 (C2''), 131,0 (C8), 132,5 (C4'''), 133,5 (C9), 135,0 (HC=CH), 138,8 (C1'''), 141,4 (C2'), 141,4 (C8a'), 142,2 (C3a), 148,5 (Ar-OC(O)N), 154,2, 154,5 (C5), 156,2 (Ar-CH2OC(O)N), 158,1, 158,4, 158,8, 159,1 (TFA), 161,4 (NC=O), 161,4 (C4''), 165,4 (C=OVal), 165,9 (Ar-NHC(O)-Ar), 170,7 (C=OAla), 171,3 (C=Oмалеимид).
MS (ESI) m/z; вычисленное значение: 1229,51 [M+H]+, найденное значение: 1229,82 [M+H]+
Соединение 'линкер-лекарственное средство' 7

Раствор защищенного соединения 'лекарственное средство-CS' 12 (1,05 г, 1,02 ммоль, 1 экв.) в DCM (5 мл) охлаждают до 0°C на ледяной бане, после чего добавляют TFA (5 мл), и получающуюся в результате смесь перемешивают в течение 2,5 часов, затем разбавляют посредством DCM, концентрируют в вакууме и подвергают совместному выпариванию с толуолом. Далее, активированный линкер 17 (0,70 г, 1,02 ммоль, 1 экв.) растворяют в обезвоженном DMF (10 мл), охлаждают до 0°C на ледяной бане, добавляют Et3N (0,57 мл, 4,06 ммоль, 4 экв.) с последующим введением по каплям TFA-соли в обезвоженном DMF (10 мл). Получающуюся в результате сменсь перемешивают в течение 3 часов, давая смеси нагреться до RT. Смесь концентрируют в вакууме и очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 7:3, объем/объем), фракции, содержащие продукт, объединяют, концентрируют в вакууме и подвергают совместному выпариванию с толуолом. Затем, твердое вещество суспендируют в толуоле (120 мл) и постепенно нагревают до 90°C на протяжении 3 часов. Далее, смесь концентрируют в вакууме и очищают препаративной HPLC (Sunfire C-18, MeCN/ MilliQ 0,1% масс./масса TFA). Ацетонитрил из собранных фракций выпаривают, и водный остаток подвергают лиофильной сушке. Полученное твердое вещество растворяют в растворителе диоксан/вода (18 мл, 2:1) и подвергают лиофильной сушке второй раз, что дает TFA-соль соединения 7 (0,50 г, 0,37 ммоль, 37%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ=0,82 (3H, д, CH3,Val), 0,87 (3H, д, CH3,Val), 1,28 (3H, д, CH3,Ala), 1,93-1,98 (1H, м, β-HVal), 2,85 (3H, шир. с, Ar-CH3), 2,84-2,93 (3H, м, NCH3), 3,22 (3H, с, OCH3), 3,34-3,72 (27H, м, CHCl, NCH2, OCH2), 3,82-3,89 (2H, м, CHCl, α-CHVal), 4,03-4,06 (2H, м, CH2OC(O)NH), 4,40 (1H, т, α-CHAla), 4,48-4,50 (1H, м, H1), 4,65-4,69 (1H, м, H2), 4,95-5,05 (3H, м, H2, Ar-CH2), 6,89-6,97 (3H, м, CH=CH, H3''), 7,03 (1H, д, HC=CH), 7,17-7,58 (7H, м, H7, H8, H2''', H3''', NHVal), 7,67-7,83 (3H, м, H6, H7', H8'), 7,91 (2H, д, H2''), 8,13-8,15 (1H, м, NHAla), 8,28-8,39 (1H, м, H4), 8,84-8,88 (1H, м, H3'), 9,59, (1H, с, H5'), 9,96-10,00 (1H, м, NHPABA), 10,15-10,40 (1H, шир. с, OH), 10,33 (1H, с,, Ar-NHC(O)-Ar).
13C ЯМР (DMSO-d6, 100 МГц): δ=18,5 (CH3,Val), 18,6 (CH3,Ala), 19,6 (CH3,Val), 22,8 (Ar-CH3), 30,8 (β-CHVal), 34,4, 35,2 (NCH3), 37,1, 37,4 ((C=O)2NCH2CH2), 44,8 (C1), 47,4, 47,6 (NCH2), 47,9 (CH2Cl), 49,4 (α-CHAla), 54,9 (C2), 58,5 (OCH3), 60,4 (α-CHVal), 63,9 (CH2OC(O)NH), 66,5 (Ar-CH2OC(O)N), 66,6 (Ar-CH2OC(O)N), 68,4, 68,5, 68,7 (OCH2,малеимид ПЭГ), 69,3, 70,0, 70,2, 70,3, 71,7 (OCH2), 111,0 (C4), 115,6 (C3''), 116,4 (C7'), 117,9 (C5'), 119,4 (C3', C2'''), 121,2 (C6), 123,1 (C9b), 124,9 (C1''), 125,4 (C7), 126,4 (C8'), 126,5 (C5a) 128,8, 129,0 (C3'''), 129,1 (C6'), 130,2 (C9a), 130,4 (C2''), 131,1 (C8), 132,2 (C4'''), 133,5, 133,6 (C9), 134,9, 135,0 (HC=CH), 139,0 (C1'''), 139,1 (C2'), 140,4 (C8a'), 141,9 (C3a), 148,5 (Ar-OC(O)N), 154,1, 154,3 (C5), 155,8, 155,9 (Ar-CH2OC(O)N) 156,7 (OC(O)NH), 158,4, 158,8 (TFA), 161,5 (C4''), 165,9 (Ar-NHC(O)-Ar), 171,4 (C=OVal), 171,5 (C=Oмалеимид), 171,5 (C=OAla).
MS (ESI) m/z; вычисленное значение: 1347,53 [M+H]+, найденное значение: 1347,84 [M+H]+
Соединение 'линкер-лекарственное средство' 8
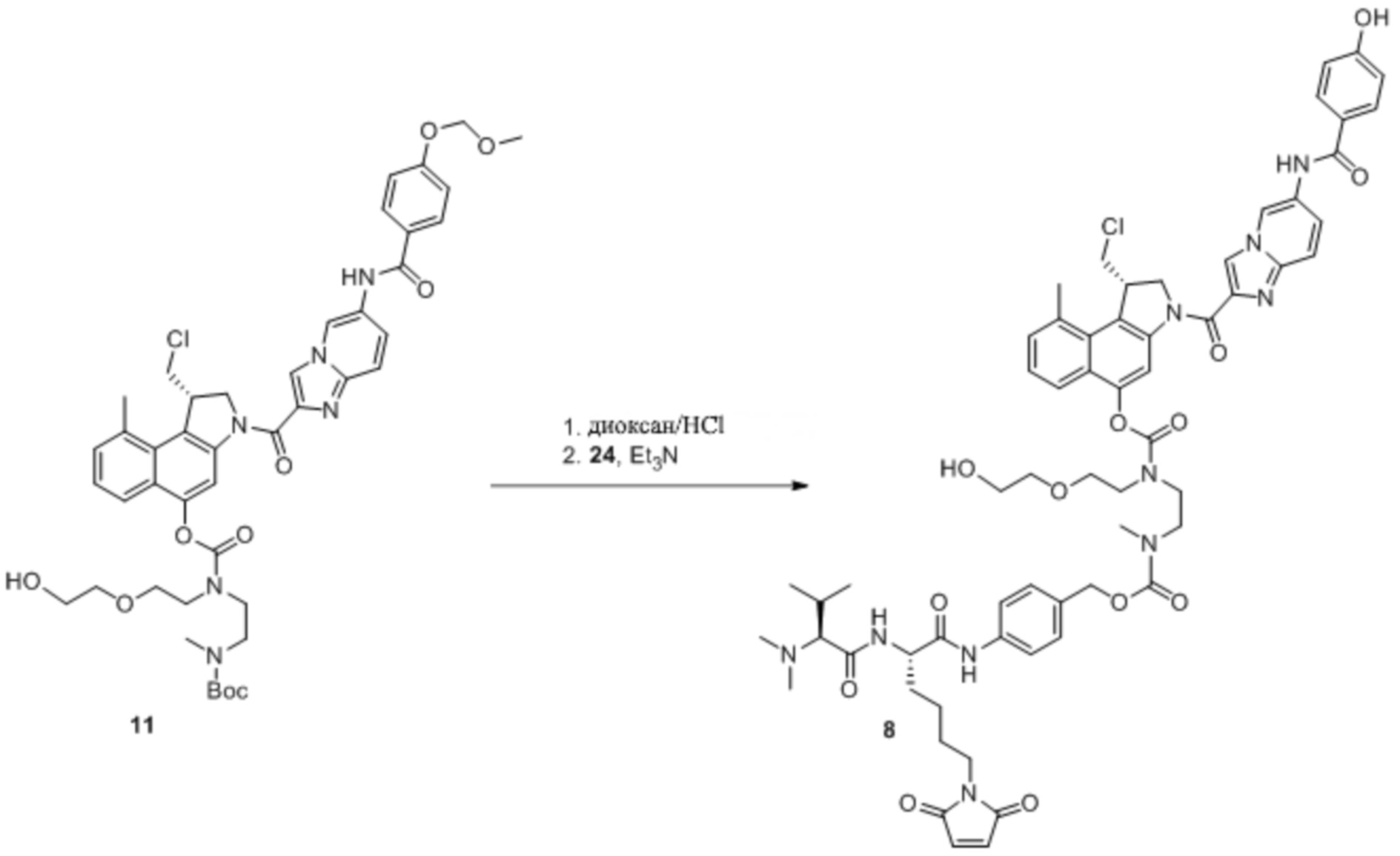
К раствору соединения 11 (630 мг, 0,73 ммоль, 1 экв.) в диоксане (6 мл) добавляют 4M-ный HCl в диоксане (15 мл), и смесь перемешивают в течение 2 часов. Затем, смесь концентрируют и сушат в вакууме. Далее, активированное соединение 24 (503 мг, 0,81 ммоль, 1,1 экв.) растворяют в обезвоженном DMF (5 мл), охлаждают до 0°C на ледяной бане и добавляют Et3N (307 мкл, 2,20 ммоль, 3 экв.). Затем, HCl-соль (растворенную в 5 мл DMF) добавляют по каплям, и смесь перемешивают в течение 3 часов и постепенно нагревают до RT. Далее, смесь концентрируют в вакууме, и сырой продукт очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 7:3, объем/объем), что дает сырое соединение 8, которое дополнительно очищают препаративной HPLC (Sunfire C-18, MeCN/MilliQ 0,1% масс./масса TFA). Ацетонитрил из собранных фракций выпаривают, и водный остаток подвергают лиофильной сушке. Полученное твердое вещество растворяют в растворителе диоксан/вода (12 мл, 2:1), иподвергают лиофильной сушке второй раз, что дает TFA-соль соединения 'линкер-лекарственное средство' 8 (217 мг, 0,18 ммоль, 25%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ=0,88 (3H, д, CH3,Val), 1,04 (3H, д, CH3,Val), 1,20-1,38 (2H, м, CH, Lys), 1,46-1,59 (2H, м, CH2,Lys), 1,61-1,81 (2H, м, CH2 Lys), 2,26-2,32 (1H, м, β-HVal), 2,78 (6H, шир. с, N(CH3)2), 2,85 (3H, шир. с, ArCH3), 2,85-2,98 (3H, д, C(O)NCH3), 3,36-3,86 (17H, м, 2 × CHCl, α-CHVal, CH2,Lys, 2 × NCH2, OCH2), 4,48-4,53 (2H, м, H1, α-CHLys), 4,63-4,69 (1H, м, H2), 4,97-5,08 (3H, м, H2, Ar-CH2), 6,92 (2H, д, H3''), 6,99 (2H, с, HC=CH), 7,19-7,58 (6H, м, H7, H8, H2''', H3'''), 7,70-7,81 (3H, м, H6, H7', H8'), 7,92 (2H, д, H2''), 8,30-8,42 (1H, м, H4), 8,79-8,81 (1H, м, H3'), 8,94 (1H, д, NHLys), 9,56 (1H, с, H5'), 9,62 (1H, шир. с, OH), 10,14-10,22 (1H, м, NHPABA), 10,30 (1H, с, Ar-NHC(O)-Ar).
13C ЯМР (DMSO-d6, 100 МГц): δ=17,2 (CH3,Val), 19,7 (CH3,Val), 22,9 (Ar-CH3), 23,2 (CH2Lys), 27,0 (β-CHVal), 28,1 (CH2Lys), 31,8 (CH2Lys), 34,4, 34,8, 35,2 (NCH3), 37,4 (CH2,Lys), 41,6, 41,9 (NCH3,Val), 44,8 (C1), 47,5, 47,7 (NCH2), 47,9 (CH2Cl), 53,7 (α-CHLys), 54,9 (C2), 60,7, 60,7 (CH2OH) 66,5 (ArCH2), 68,5, 69,1 (NCH2CH2O), 72,0 (α-CHVal), 72,7, 72,9 (OCH2), 111,0 (C4), 115,6 (C3''), 117,0 (C7'), 117,8 (C5'), 119,6 (C3', C2'''), 121,3 (C6), 123,0 (C9b), 125,0 (C1''), 125,0 (C7), 125,3 (C8'), 126,3, 126,4 (C5a), 128,8 (C6'), 128,8 (C3'''), 130,2 (C9a), 130,3 (C2''), 131,1 (C8), 132,5 (C4'''), 133,5 (C9), 134,9 HC=CH), 138,7 (C2', C1'''), 141,1 (C8a'), 142,1 (C3a), 148,5 (Ar-OC(O)N), 154,2, 154,4 (C5), 156,2 (Ar-CH2OC(O)N), 161,3 (NC=O), 161,5 (C4''), 165,8 (C=OVal), 165,9 (Ar-NHC(O)-Ar), 170,1 (C=OLys), 171,4 (C=Oмалеимид).
MS (ESI) m/z; вычисленное значение: 1199,50 [M+H]+, найденное значение: 1199,93 [M+H]+
Соединение 'ликер-лекарственное средство' 9

Раствор соединения 51 (200 мг, 0,35 ммоль, 1 экв.) в обезвоженном THF (5 мл) охлаждают до 0°C на ледяной бане, и добавляют 4-нитрофенилхлорформиат (78 мг, 0,39 ммоль, 1,1 экв.) и Et3N (245 мкл, 1,76 ммоль, 5 экв.) и перемешивают в течение 30 минут. Затем, добавляют раствор спейсера циклизации 4A (синтезированного так, как описано в WO2011/133039, пример 1 (Syntarga), 138 мг, 0,53 ммоль, 1,5 экв.) в обезвоженном THF (3 мл) и HOBt (60 мг, 0,39 ммоль, 1,1 экв.), и получающуюся в результате смесь нагревают до 50°C в течение 2 часов. Смесь охлаждают до RT, концентрируют в вакууме, и сырой продукт очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 93:7, объем/объем), что дает соединение 52 (250 мг, 0,28 ммоль, 80%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 100 МГц): δ=1,33-1,45 (9H, м, CH3,Boc), 2,86 (3H, с, Ar-CH3), 2,79-2,96 (3H, м, NCH3), 3,41(3H, с, OCH3), 3,39-3,80 (13H, м, CHCl, CH2OH, OCH2, NCH2), 3,84-3,91 (1H, м, CHCl), 4,50-4,55 (1H, м, H1), 4,62-4,73 (2H, м, H2, OH), 5,01-5,06 (1H, м, H2), 5,31 (2H, с, OCH2O), 7,18 (2H, д, H3''), 7,37-7,46 (2H, м, H7, H8), 7,68-7,89 (1H, м, H6), 7,97-8,06 (6H, м, H2', H3', H2''), 8,31-8,42 (1H, м, H4), 9,43 (1H, с, Hтриазол), 10,41 (1H, с, Ar-NHC(O)-Ar).
13C ЯМР (DMSO-d6, 100 МГц): δ=22,8 (Ar-CH3), 28,5, 28,6 (CH3,Boc), 34,6 (NCH3), 44,6 (C1), 45,5, 46,0, 47,6 (NCH2), 48,1 (CH2Cl), 54,8 (C2), 56,3 (OCH3), 60,7, 60,7 (CH2OH), 68,5, 69,0, 72,7, 72,9 (OCH2), 79,1 (CBoc), 94,2 (OCH2O), 110,8, 110,9 (C4), 116,1 (C3''), 121,2 (C6), 121,4, 121,5 (C2', C3'), 123,2 (C9b), 125,4 (C7), 125,5 (C1''), 126,5 (C5a), 127,6 (CHтриазол), 130,1 (C2''), 130,3 (C9a), 131,2 (C8), 131,9 (C4'), 133,5 (C9), 140,7 (C1'), 141,8 (C3a), 145,0 (Cтриазол), 148,6 (Ar-OC(O)N), 154,3 (C5), 155,2 (C=OBoc), 159,3 (NC(O)C), 160,0 (C4''), 165,6 (Ar-NHC(O)-Ar).
MS (ESI) m/z; вычисленное значение: 886,35 [M+H]+, найденное значение: 886,68 [M+H]+
Раствор соединения 52 (125 мг, 0,14 ммоль, 1 экв.) в диоксане (2 мл) разбавляют 4 M-ным HCl в диоксане (8 мл) и перемешивают в течение 10 минут при RT. Смесь концентрируют в вакууме, подвергают совместному выпариванию с DCM и сушат в вакууме. Полученную HCl-соль растворяют в обезвоженном DMF (2,5 мл), охлаждают до 0°C на ледяной бане, с последующим добавлением активированного соединения 50 (142 мг, 0,21 ммоль, 1,5 экв.) и Et3N (39 мкл, 0,28 ммоль, 2 экв.). Смесь перемешивают в течение 1,5 часов, давая ей нагреться до RT. Смесь концентрируют в вакууме, и сырой продукт очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 7:3, объем/объем), фракции, содержащие продукт, объединяют и концентрируют в вакууме, что дает соединение 9, которое очищают дополнительно препаративной HPLC (Sunfire C-18, MeCN/MilliQ 0,1% масс./масса TFA, градиент). Ацетонитрил выпаривают, и водный остаток подвергают лиофильной сушке, полученное твердое вещество смывают в растворитель диоксан/вода и подвергают лиофильной сушке, что дает TFA-соль соединения 'линкер-лекарственное средство' 9 (57 мг, 0,05 ммоль, 32%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ=0,82 (3H, д, CH3,Val), 0,86 (3H, д, CH3,Val), 1,29 (3H, д, CH3,Ala), 1,89-2,02 (1H, м, β-HVal), 2,85 (3H, шир. с, ArCH3), 2,83-2,99 (3H, м, NCH3), 3,20-3,80 (20H, м, CHCl, CH2OH, OCH2, NCH2), 3,82-3,90 (2H, м, CHCl, α-CHVal), 3,98-4,03 (2H, м, CH2OC(O)NH), 4,40 (1H, т, α-CHAla), 4,49-4,55 (1H, м, H1), 4,67-4,73 (1H, м, H2), 4,95-5,07 (3H, м, H2, Ar-CH2), 6,90 (2H, д, H3''), 7,00 (2H, с, HC=CH), 7,15-7,58 (7H, м, H7, H8, H2''', H3''', NHVal), 7,69-7,83 (1H, м, H6), 7,90 (2H, д, H2''), 7,97-8,05 (4H, м, H2', H3'), 8,13 (1H, д, NHAla), 8,30-8,42 (1H, м, H4), 9,37-9,42 (1H, м, Hтриазол), 9,88-10,02 (1H, м, NHPABA), 10,19 (1H, шир. с, Ar-OH), 10,30 (1H, с, Ar-NHC(O)-Ar).
13C ЯМР (DMSO-d6, 100 МГц): δ=18,5 (CH3,Val, CH3,Ala), 19,6 (CH3,Val), 22,8 (Ar-CH3), 30,8 (β-CHVal), 35,2 (NCH3), 37,1 ((C=O)2NCH2CH2), 44,6 (C1), 47,7 (NCH2), 48,1 (CHCl), 49,4 (α-CHAla), 54,8 (C2), 60,4 (α-CHVal), 60,7, 60,7 (CH2OH), 63,8 (CH2OC(O)NH), 66,6 (Ar-CH2OC(O)N), 68,4, 68,8, 68,9, 72,7, 72,9 (OCH2), 110,8 (C4), 115,5 (C3''), 119,4 (C2'''), 121,3 (C6), 121,5 (C2', C3'), 123,2 (C9b), 125,4 (C7), 125,5 (C1''), 126,4 (C5a), 127.7 (CHтриазол), 128,8, 129,0 (C3'''), 130,2 (C9a), 130,3 (C2''), 131,1 (C8), 131,7 (C4'), 132,2 (C4'''), 133,5 (C9), 135,0 (HC=CH), 139,0 (C1'''), 140,8 (C1'), 141,8 (C3a), 145,0 (Cтриазол), 148,6 (Ar-OC(O)N), 154,2 (C5), 154,4 (Ar-CH2OC(O)N), 156,6 (OC(O)NH), 159,3 (NC(O)C), 161,3 (C4''), 165,8 (Ar-NHC(O)-Ar), 171,3 (C=OVal), 171,4 (C=Oмалеимид), 171,5 (C=OAla).
MS (ESI) m/z; вычисленное значение: 1272,48 [M+H]+, найденное значение: 1272,57 [M+H]+
Соединение 'линкер-лекарственное средство' 10

Соединение 52 (200 мг, 0,23 ммоль, 1 экв.), малеимид (29 мг, 0,29 ммоль, 1,3 экв.) и трифенилфосфин (77 мг, 0,29 ммоль, 1,3 экв.) растворяют в обезвоженном THF (5 мл), охлаждают до 0°C на ледяной бане, и добавляют по каплям DEAD (2,2 M в толуоле, 133 мкл, 0,29 ммоль, 1,3 экв.). Смесь перемешивают в течение 100 минут при RT. Смесь концентрируют в вакууме, и сырой продукт очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 97:3, объем/объем), фракции, содержащие продукт, объединяют и концентрируют в вакууме, что дает соединение 53 (100 мг, 0,10 ммоль, 46%) в виде оранжевой пены.
MS (ESI) m/z; вычисленное значение: 965,36 [M+H]+, найденное значение: 965,70 [M+H]+
Раствор соединения 53 (80 мг, 0,08 ммоль, 1 экв.) в хлороформе (2 мл) охлаждают до 0°С на ледяной бане, разбавляют посредством TFA (2 мл) и перемешивают в течение 3 часров. Смесь затем концентрируют в вакууме, подвергают совместному выпариванию с толуолом и сушат в вакууме. Полученную TFA-соль растворяют в обезвоженном DMF (2 мл), охлаждают до 0°C на ледяной бане, и добавляют активированное соединение 19 (48 мг, 0,10 ммоль, 1,2 экв.) и Et3N (58 мкл, 0,41 ммоль, 5 экв.), и смесь перемешивают в течение 2 часов. Смесь концентрируют в вакууме и очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 7:3, объем/объем), фракции, содержащие продукт, объединяют и концентрируют в вакууме, что дает сырое соединение 10, которое дополнительно очищают препаративной HPLC (Sunfire C-18, MeCN/ MilliQ 0,1% масс./масса TFA). MeCN выпаривают, и водный остаток подвергают лиофильной сушке, полученное твердое вещество смывают в растворитель диоксан/вода (6 мл, 2:1), и подвергают лиофильной сушке, что дает TFA-соль соединения 'линкер-лекарственное средство' 10 (33 мг, 0,03 ммоль, 34%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ=0,94 (3H, д, CH3,Val), 1,11 (3H, д, CH3,Val), 1,42 (3H, д, CH3,Ala), 2,28-2,36 (1H, м, β-HVal), 2,82 (6H, шир. с, N(CH3)2), 2,91 (3H, шир. с, ArCH3), 2,90-3,02 (3H, д, C(O)NCH3), 3,38-3,80 (14H, м, CHCl, α-CHVal, NCH2, OCH2), 3,89-3,94 (1H, м, CHCl), 4,55-4,63 (2H, м, H1, α-CHAla), 4,71-4,79 (1H, м, H2), 5,03-5,12 (3H, м, H2, Ar-CH2), 6,96 (2H, д, H3''), 7,01 (1H, д, CH=CH), 7,08 (1H, д, CH=CH), 7,23-7,64 (6H, м, H7, H8, H2''', H3'''), 7,72-7,83 (1H, м, H6), 7,96 (2H, д, H2''), 8,03-8,11 (4H, м, H2', H3'), 8,36-8,45 (1H, м, H4), 9,02 (1H, д, NHAla), 9,42-9,48 (1H, м, Hтриазол), 9,61 (1H, шир. с, CN(CH3)2H+ CF3COO-), 10,16-10,28 (2H, м, NHPABA, OH), 10,36 (1H, с, Ar-NHC(O)-Ar).
13C ЯМР (DMSO-d6, 100 МГц): δ=17,1 (CH3,Val), 18,6 (CH3,Ala), 19,7 (CH3,Val), 22,8 (Ar-CH3), 27,0 (β-CHVal), 34,5, 34,8 (NCH3), 37,2, 37,4 ((C=O)2NCH2CH2), 41,5 (NCH3,Val), 42,2 (NCH3,Val), 44,6 (C1), 45,9, 46,4, 47,4 (NCH2), 48,0 (CH2Cl), 49,8 (α-CHAla), 54,8 (C2), 66,5 (Ar-CH2OC(O)N), 67,5, 68,4, 68,7 (OCH2), 72,0 (α-CHVal), 110,9 (C4), 115,5 (C3''), 119,5 (C2'''), 121,3 (C6), 121,3, 121,5 (C2', C3'), 123,1 (C9b), 125,4 (C7), 125,5 (C1''), 126,4 (C5a), 127,7 (CHтриазол), 128,8, 129,0 (C3'''), 130,2 (C9a), 130,3 (C2''), 131,1 (C8), 131,7 (C4'), 132,4 (C4'''), 133,6 (C9), 134,9, 135,0 (HC=CH), 138,8 (C1'''), 140,9 (C1'), 141,8 (C3a), 145,0 (Cтриазол), 148,5 (Ar-OC(O)N), 154,1, 154,3 (C5), 155,7, 156,1 (Ar-CH2OC(O)N), 159,3 (NC(O)C), 161,3 (C4''), 165,4 (C=OVal), 165,9 (Ar-NHC(O)-Ar), 170,7 (C=OAla), 171,4 (C=Oмалеимид).
MS (ESI) m/z; вычисленное значение: 1168,47 [M+H]+, найденное значение: 1168,79 [M+H]+
Соединение 'линкер-лекарственное средство' 36

Раствор соединения 34 (140 мг, 0,27 ммоль, 1 экв.) в хлороформе (4 мл) охлаждают до 0°C на ледяной бане, и добавляют TFA (2 мл) с последующим перемешиванием смеси в течение 1 часа. Смесь концентрируют в вакууме, подвергают совместному выпариванию с толуолом и сушат в вакууме. Отдельно, соединение 35 (152 мг, 0,27 ммоль, 1 экв.) растворяют в обезвоженном THF (3 мл), охлаждают до 0°C на ледяной бане, и добавляют 4-нитрофенилхлорформиат (59 мг, 0,29 ммоль, 1,1 экв.) и Et3N (186 мкл, 1,33 ммоль, 5 экв.) и перемешивают в течение 15 минут. Затем HOBt (41 мг, 0,27 ммоль, 1 экв.) и TFA-соль (незащищенного соединения 34) в THF (3 мл) добавляют к раствору, который нагревают до 50°C в течение 1 часа. Сырую смесь концентрируют в вакууме и очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 7:3, объем/объем), фракции, содержащие продукт, объединяют и концентрируют в вакууме. Оставшееся твердое вещество, растворенное в хлороформе (3 мл), охлаждают до 0°C на ледяной бане, добавляют TFA (3 мл) и перемешивают в течение 2 часов. Затем концентрируют в вакууме и очищают колоночной хроматографией на силикагеле (DCM/MeOH, градиент), фракции, содержащие продукт, объединяют и концентрируют в вакууме, что дает сырой продукт 36, который очищают препаративной HPLC (Sunfire C-18, MeCN/MilliQ 0,1% масс./масса TFA). Ацетонитрил выпаривают, и водный остаток подвергают лиофильной сушке, полученное твердое вещество смывают в растворитель диоксан/вода (6 мл, 2:1, объем/объем) и подвергают лиофильной сушке, что дает TFA-соль соединения 'линкер-лекарственное средство' 36 (65 мг, 0,07 ммоль, 25%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ=0,87 (3H, дд, CH3,Val), 1,02 (3H, дд, CH3,Val), 1,26-1,33 (3H, м, CH3,Ala), 2,22-2,30 (1H, м, β-HVal), 2,76 (6H, шир. с, N(CH3)2), 2,85 (3H, шир. с, ArCH3), 3,26-3,77 (14H, CHCl, α-CHVal, NCH2, OCH2), 3,84 (1H, д, CHCl), 4,36-4,46 (1H, м, α-CHAla), 4,49 (1H, т, H1), 4,68 (1H, т, H2), 5,09 (1H, д, H2), 6,91 (2H, д, H3''), 6,95 (1H, с, HC=CH), 7,05 (1H, с, HC=CH), 7,32-7,39 (1H, м, H7), 7,40-7,46 (1H, м, H8), 7,66-7,72 (1H, м, H8'), 7,75-7,83 (2H, м, H6, H7'), 7,91 (2H, д, H2''), 8,25-8,44 (2H, м, H4, (C=O)NH-CH2), 8,78 (1H, с, H3'), 8,86 (1H, д, NHAla), 9,54 (1H, с, H5'), 9,57 (1H, шир. с, OH), 10,28 (1H, с, Ar-NHC(O)-Ar).
13C ЯМР (DMSO-d6, 100 МГц): δ=17,1, 17,1 (CH3,Val), 18,8, 18,9 (CH3,Ala), 19,6, 19,6 (CH3,Val), 22,9 (Ar-CH3), 26,9, 26,9 (β-CHVal), 37,1, 37,3 ((C=O)2NCH2CH2), 38,1 (CH2NH), 41,5 (NCH3,Val), 42,1 (NCH3,Val), 44,7 (C1), 47,4, 47,7 (NCH2), 48,0 (CH2Cl), 48,2 (NCH2), 49,0 (α-CHAla), 55,0 (C2), 68,3, 68,5, 68,7, 68,9 (OCH2,малеимид ПЭГ), 72,0 (α-CHVal), 111,0, 111,1 (C4), 115,6 (C3''), 117,3 (C7'), 117,7 (C5'), 119,3 (C3'), 121,3, 121,4 (C6), 122,9, 123,0 (C9b), 124,7 (C8'), 125,0 (C1''), 125,2 (C7), 126,4, 126,4 (C5a) 128,6 (C6'), 130,2 (C9a), 130,3 (C2''), 131,1 (C8), 133,5, 133,5 (C9), 134,9, 135,0 (HC=CH), 139,3 (C2'), 141,3 (C8a'), 142,2 (C3a), 148,5, 148,6 (Ar-OC(O)N), 154,1, 154,3 (C5), 161,4 (NC=O), 161,6 (C4''), 165,2 (C=OVal), 165,9 (Ar-NHC(O)-Ar), 171,4 (C=Oмалеимид), 172,0, 172,1 (C=OAla).
MS (ESI) m/z; вычисленное значение: 978,39 [M+H]+, найденное значение: 978,70 [M+H]+
Соединение 'линкер-лекарственное средство' 64
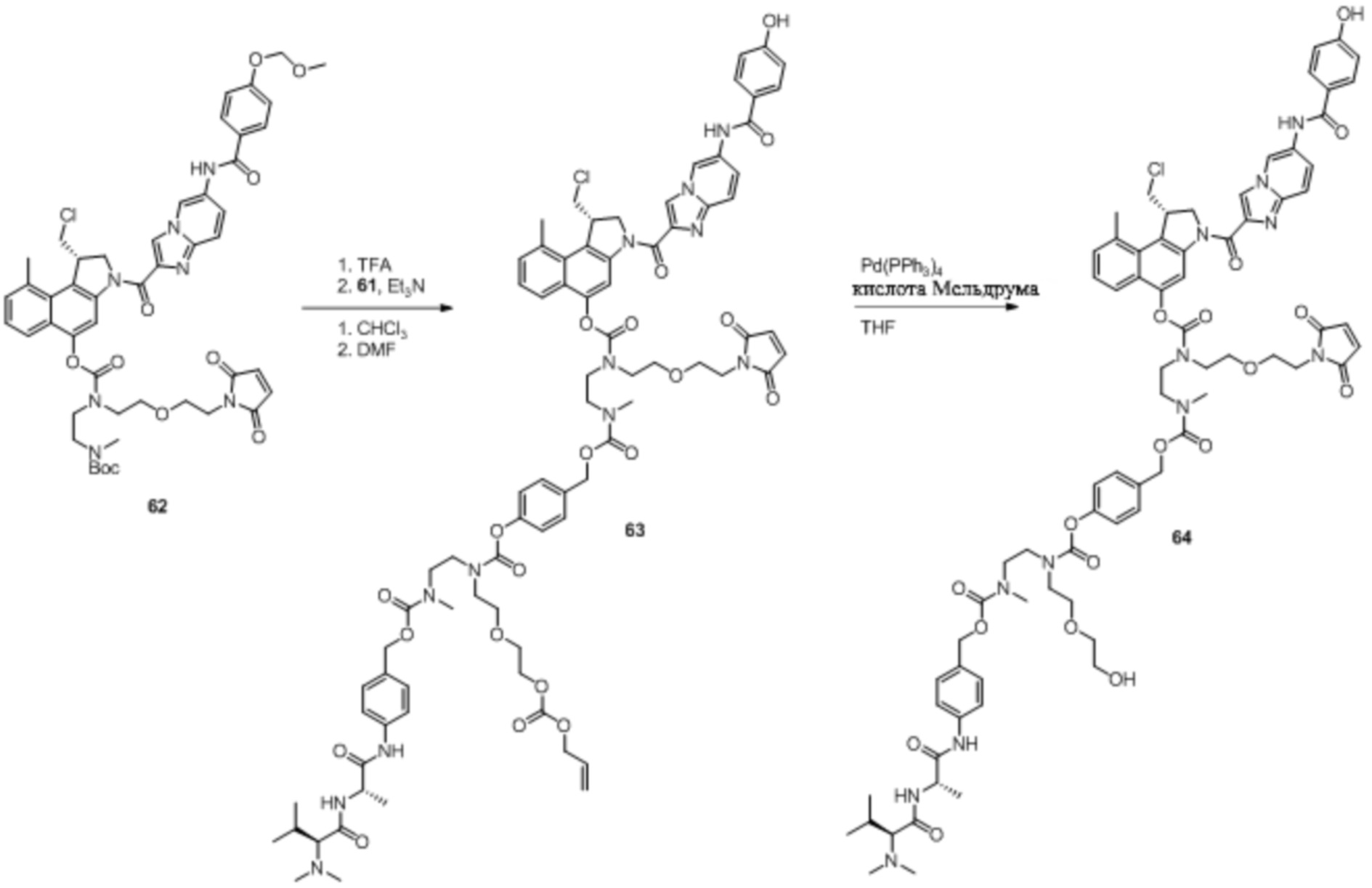
Раствор соединения 62 (60 мг, 0,06 ммоль, 1 экв.) в DCM (2 мл) охлаждают до 0°C на ледяной бане и разбавляют посредством TFA (2 мл), и смесь перемешивают в течение 2 часов. Смесь концентрируют в вакууме, подвергают совместному выпариванию с толуолом и сушат в вакууме. Далее, раствор соединения 61 (64 мг, 0,07 ммоль, 1,1 экв.) в DMF (1 мл) охлаждают до 0°C на ледяной бане, и добавляют Et3N (36 мл, 0,26 ммоль, 4 экв.) с последующим введением по каплям TFA-соли (растворенной в 1 мл DMF). Получающуюся в результате смесь перемешивают в течение 2 часов. Смесь концентрируют в вакууме и очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 7:3, объем/объем), фракции, содержащие продукт, объединяют и концентрируют в вакууме, что дает промежуточное соединение 63.
(MS (ESI) m/z; вычисленное значение: 1563,62 [M+H]+, найденное значение: 1563,31 [M+H]+)
Промежуточное соединение 63 растворяют (30 мг, 0,02 ммоль, 1 экв.) в THF (5 мл), добавляют Pd(PPh3)4 (11 мг, 9,6 мкмоль, 0,5 экв.), после этого 2,2-диметил-1,3-диоксан-4,6-дион (28 мг, 0,19 ммоль, 10 экв.), и смесь перемешивают в течение 3 часов при RT в атмосфере азота. Смесь концентрируют в вакууме и очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 7:3, объем/объем), фракции, содержащие продукт, объединяют и концентрируют в вакууме, что дает сырой продукт 64, который дополнительно очищают препаративной HPLC (Sunfire C-18, MeCN/ MilliQ 0,1% масс./масса TFA). MeCN выпаривают, и водный остаток подвергают лиофильной сушке, полученное твердое вещество смывают в растворитель диоксан/вода (6 мл, 2:1) и подвергают лиофильной сушке, что дает TFA-соль соединения 'линкер-лекарственное средство' 64 (6 мг, 3,9 мкмоль, 20%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ=0,87 (3H, м, CH3,Val), 1,05 (3H, м, CH3,Val), 1,34-1,39 (3H, м, CH3,Ala), 2,24-2,33 (1H, шир. с, β-HVal), 2,76 (6H, шир. с, N(CH3)2,Val), 2,84 (3H, с, ArCH3), 2,82-2,97 (6H, м, NCH3), 3,30-3,96 (26H, м, CH2Cl, CH2N, CH2O), 4,43-4,49 (1H, м, H1), 4,50-4,59 (1H, м, α-CHAla), 4,60-4,69 (1H, м, H2), 4,92-5,12 (5H, м, H2, ArCH2,PABA, ArCH2), 6,86-7,04 (6H, м, HC=CH, H3'', H2'''), 7,22-7,43 (6H, м, H7, H8, H3''', H3''''), 7,49-7,76 (5H, м, H6, H7', H8', H2''''), 7,90 (2H, д, H2''), 8,30-8,38 (1H, м, H4), 8,71 (1H, шир. с, H3'), 8,96 (1H, д, NHAla), 9,46-9,57 (2H, м, H5', OH), 1,13-10,26 (3H, м, NHPABA, Ar-NHC(O)-Ar).
13C ЯМР (DMSO-d6, 100 МГц): δ=17,1 (CH3,Val), 18,6 (CH3,Ala), 19,6 (CH3,Val), 22,9 (Ar-CH3), 27,0 (β-CHVal), 35,2 (NCH3), 37,2, 37,4 ((C=O)2NCH2CH2), 41,5, 42,2 (NCH3,Val), 44,7 (C1), 46,0, 46,7, 47,4 (NCH2), 47,9 (CH2Cl), 49,8 (α-CHAla), 55,0 (C2), 60,7 (CH2OH), 66,3 (Ar-CH2OC(O)N), 67,6, 68,4, 68,6, 69,1 (OCH2), 72,0 (α-CHVal), 72,7 (OCH2), 111,1 (C4), 115,5 (C3''), 117,7 (C5', C7'), 119,6 (C3', C2''''), 121,2 (C6), 122,1 (C2'''), 122,9 (C9b), 124,0 (C8'), 125,1 (C1''), 125,2 (C7), 126,3 (C5a), 128,3 (C6'), 128,9, 129,1 (C3''', C3''''), 130,3 (C2''), 131,0 (C8), 131,7 (C9a), 132,4 (C4''', C4''''), 133,5 (C9), 134,9, 135,0 (HC=CH), 138,9 (C1''''), 140,4 (C2'), 141,7 (8a'), 142,3 (C3a), 148,5 (Ar-OC(O)N), 151,1 (C1'''), 154,1, 154,3 (C5), 155,9, 156,1 (Ar-CH2OC(O)N), 161,4 (C4''), 162,1 (NC=O), 165,4 (C=OVal), 165,9 (Ar-NHC(O)-Ar), 170,7 (C=OAla), 171,4 (C=Oмалеимид).
MS (ESI) m/z; вычисленное значение: 1479,60 [M+H]+, найденное значение: 1480,86 [M+H]+
Соединение 'линкер-лекарственное средство' 69

Раствор соединения 62 (110 мг, 0,12 ммоль, 1 экв.) в хлороформе (3 мл) охлаждают до 0°C на ледяной бане, разбавляют посредством TFA (3 мл) и перемешивают в течение 3 часов. Реакционную смесь концентрируют в вакууме, подвергают совместному выпариванию с толуолом и сушат в вакууме. Затем, получающуюся в результате TFA-соль растворяют в обезвоженном DMF (2 мл), охлаждают до 0°C на ледяной бане, и добавляют активированный линкер 68 (65 мг, 0,13 ммоль, 1,1 экв.) и Et3N (33 мкл, 0,23 ммоль, 2 экв.), и смесь перемешивают в течение 3 часов. Реакционную смесь концентрируют в вакууме, и сырой продукт очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 7:3, объем/объем), фракции, содержащие продукт, объединяют и концентрируют в вакууме, что дает сырое соединение 69, которое очищают препаративной HPLC (Sunfire C-18, MeCN/ MilliQ 0,1% масс./масса TFA). Ацетонитрил выпаривают, и водный остаток подвергают лиофильной сушке, полученное твердое вещество смывают в растворитель диоксан/вода (6 мл, 2:1) и подвергают лиофильной сушке, что дает TFA-соль соединения 'линкер-лекарственное средство' 69 (28 мг, 0,02 ммоль, 21%) в виде белого твердого вещества.
MS (ESI) m/z; вычисленное значение: 1155,43 [M+H]+, найденное значение: 1155,65 [M+H]+
Соединение 'линкер-лекарственное средство' 74
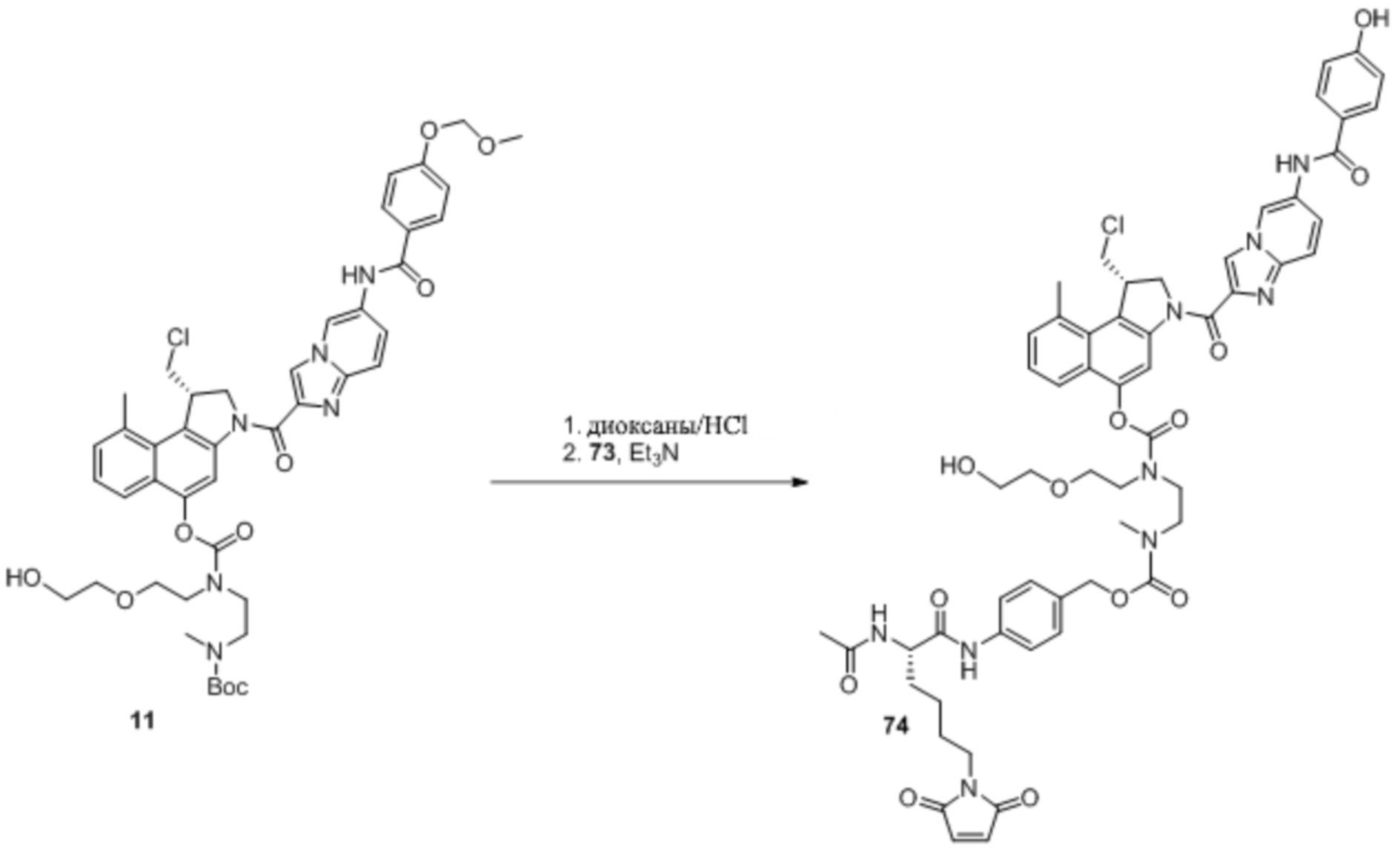
Раствор соединения 11 (75 мг, 0,09 ммоль, 1 экв.) в диоксане (2 мл) разбавляют 4 M-ным HCl в диоксане (6 мл) и перемешивают в течение 2 часов. Смесь концентрируют в вакууме и сушат в вакууме. Полученную HCl-соль растворяют в DMA (2 мл), охлаждают до 0°C на ледяной бане, и добавляют соединение 73 (56 мг, 0,10 ммоль, 1,2 экв.) и Et3N (24 мкл, 0,17 ммоль, 2 экв.), и смесь перемешивают в течение 1,5 часов. Смесь концентрируют в вакууме и очищают колоночной хроматографией на силикагеле (DCM/MeOH, от 1:0 до 7:3, объем/объем), фракции, содержащие продукт, объединяют и концентрируют в вакууме, что дает сырое соединение 74, которое очищают препаративной HPLC (Sunfire C-18, MeCN/ MilliQ 0,1% масс./масса TFA). Ацетонитрил выпаривают, и водный остаток подвергают лиофильной сушке. Полученное твердое вещество смывают в растворитель диоксан/вода (6 мл, 2:1) и подвергают лиофильной сушке, что дает соединение 'линкер-лекарственное средство' 74 (26 мг, 0,02 ммоль, 27%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ=1,15-1,28 (2H, м, CH, Lys), 1,37-1,69 (4H, м, 2 × CH2,Lys), 1,86 (3H, с, CH3,Ацетил), 2,85 (3H, шир. с, ArCH3), 2,85-3,00 (3H, д, NCH3), 3,37 (2H, т, (C=O)2NCH2,Lys), 3,36-4,05 (17H, м, CHCl, NCH2, OCH2), 4,29-4,36 (1H, м, α-CHLys), 4,46-4,52 (1H, м, H1), 4,64-4,70 (1H, м, H2), 4,96-5,07 (3H, м, H2, Ar-CH2), 6,92 (2H, д, H3''), 6,98 (2H, с, HC=CH), 7,15-7,59 (6H, м, H7, H8, H2''', H3'''), 7,69-7,82 (3H, м, H6, H7', H8'), 7,92 (2H, д, H2''), 8,10 (1H, д, NHLys), 8,30-8,42 (1H, м, H4), 8,84 (1H, шир. с, H3'), 9,57 (1H, с, H5'), 9,96-10,04 (1H, м, NHPABA), 10,24 (1H, шир. с, OH), 10,30 (1H, с, Ar-NHC(O)-Ar).
13C ЯМР (DMSO-d6, 100 МГц): δ=22,9 (Ar-CH3), 23,2 (CH2Lys), 28,2 (CH2Lys), 30,9 (CH3,Ацетил), 32,0 (CH2Lys), 34,4, 35,0, 35,3 (NCH3), 37,4 ((C=O)2NCH2,Lys), 44,8 (C1), 46,7, 47,5, 47,7 (NCH2), 47,9 (CH2Cl), 53,7 (α-CHLys), 54,9 (C2), 60,7, 60,7 (CH2OH), 66,5 (ArCH2), 68,5, 69,1 (OCH2), 72,7, 72,9 (OCH2), 111,0 (C4), 115,6 (C3''), 116,8 (C7'), 117,9 (C5'), 119,6 (C3', C2'''), 121,3 (C6), 123,1 (C9b), 125,0 (C1''), 125,4 (C7, C8'), 126,3 (C6'), 126,5 (C5a), 128,7 (C3'''), 130,2 (C9a), 130,3 (C2''), 131,1 (C8), 132,2 (C4'''), 133,5, 133,6 (C9), 134,9 (HC=CH), 138,9 (C1'''), 140,9 (C2', C8a'), 142,0 (C3a), 148,5 (Ar-OC(O)N), 154,2, 154,4 (C5), 156,3 (Ar-CH2OC(O)N), 161,4 (NC=O), 161,5 (C4''), 165,9 (Ar-NHC(O)-Ar), 169,9 (C=OАцетил), 171,3 (C=OLys), 171,4 (C=Oмалеимид).
MS (ESI) m/z; вычисленное значение: 1114,41 [M+H]+, найденное значение: 1114,66 [M+H]+
Протоколы для сайт-специфической конъюгации и конъюгации дикого типа
Общий протокол конъюгации для конъюгации через частично восстановленные эндогенные дисульфилы (конъюгация дикого типа (wt))
Раствор антитела (5-10 мг/мл в 4,2 mM гистидине, 50 мМ трегалозе, pH 6) разбавляют посредством EDTA (25 мМ в воде, 4% объем/объем). pH корректируют до ~7,4 с использованием TRIS (1 M в воде, pH 8), после чего добавляют TCEP (10 мМ в воде, 1-3 эквивалента, в зависимости от антитела и желательного DAR), и получающуюся в результате смесь инкубируют при RT в течение 1-3 часов. Добавляют DMA, после этого раствор соединения 'линкер-лекарственное средство' (10 мМ в DMA). Конечная концентрация DMA составляет 5-10%. Получающуюся в результате смесь инкубируют при RT в отсутствии света в течение 1-16 часов. В целях удаления избытка соединения 'линкер-лекарственное средство' добавляют активированный уголь, и смесь инкубируют при RT в течение 1 часа. Уголь удаляют с использованием PES-фильтра на 0,2 мкм, и получающийся в результате ADC приготавливают в виде состава в 4,2 мМ гистидине, 50 мМ трегалозе, pH 6 с помощью центрифужного концентратора Vivaspin (отсечение 30 кДа, PES). Наконец, раствор ADC подвергают стерильной фильтрации с применением PES-фильтра на 0,22 мкм.
Общий протокол сайт-специфической конъюгации
Сайт-специфические конъюгаты синтезируют согласно методике, описываемой либо в Протоколе A, либо в Протоколе B.
1) Протокол A
Раствор антитела со встроенным цистеином (5-10 мг/мл в 4,2 мМ гистидине, 50 мМ трегалозе, pH 6) разбавляют посредством EDTA (25 мМ в воде, 4% объем/объем). pH корректируют до ~7,4 с использованием TRIS (1 M в воде, pH 8), после чего добавляют TCEP (10 мМ в воде, 20 эквивалентов), и получающуюся в результате смесь инкубируют при комнатной температуре (RT) в течение 1-3 часов. Избыточный TCEP удаляют либо с помощью колонки для обессоливания PD-10, либо с помощью центрифужного концентратора (фильтр Vivaspin, отсечение 30 кДа, PES) с использованием 4,2 мМ гистидина, 50 мМ трегалозы, pH 6.
pH получающегося в результате раствора антитела повышают до ~7,4 с использованием TRIS (1 М в воде, pH 8), после чего добавляют дегидроаскорбиновую кислоту (10 мМ в воде, 20 эквивалентов), и получающуюся в результате смесь инкубируют при RT в течение 1-2 часов. При RT или 37°C, добавляют DMA, после этого раствор соединения 'линкер-лекарственное средство' (10 мМ в DMA). Конечная концентрация DMA составляет 5-10%. Получающуюся в результате смесь инкубируют при RT или 37°C в отсутствии света в течение 1-16 часов. В целях удаления избытка соединения 'линкер-лекарственное средство' добавляют активированный уголь, и смесь инкубируют при RT в течение 1 часа. Уголь удаляют с использованием PES-фильтра на 0,2 мкм, и получающийся в результате ADC приготавливают в виде состава в 4,2 мМ гистидине, 50 мМ трегалозе, pH 6 с помощью центрифужного концентратора Vivaspin (отсечение 30 кДа, PES). Наконец, раствор ADC подвергают стерильной фильтрации с применением PES-фильтра на 0,22 мкм.
2) Протокол B
Раствор антитела со встроенным цистеином (500 мкл, 40 мг/мл в 15 мМ гистидине, 50 мМ сахарозе, 0,01% полисорбат-20, pH 6) разбавляют посредством 100 мМ гистидина, pH 5 (1300 мкл). Добавляют 2-(дифенилфосфино)бензолсульфоновую кислоту (DPPBS) (426 мкл, 10 мМ в воде, 32 эквивалента), и получающуюся в результате смесь инкубируют RT в течение 16-24 часов. Избыточную DPPBS удаляют с применением центрифужного концентратора (фильтр Vivaspin, отсечение 30 кДа, PES) с использованием 4,2 мМ гистидина, 50 мМ трегалозы, pH 6.
pH получающегося в результате раствора антитела повышают до ~7,4 с использованием TRIS (1 M в воде, pH 8). При RT или 37°C, добавляют DMA, после этого раствор соединения 'линкер-лекарственное средство' (10 мМ в DMA). Конечная концентрация DMA составляет 5-10%. Получающуюся в результате смесь инкубируют при RT или 37°C в отсутствии света в течение 1-16 часов. В целях удаления избытка соединения 'линкер-лекарственное средство' добавляют активированный уголь, и смесь инкубируют при RT в течение 1 часа. Уголь удаляют с использованием PES-фильтра на 0,2 мкм, и получающийся в результате ADC приготавливают в виде состава в 4,2 мМ гистидине, 50 мМ трегалозе, pH 6 с помощью центрифужного концентратора Vivaspin (отсечение 30 кДа, PES). Наконец, раствор ADC подвергают стерильной фильтрации с применением PES-фильтра на 0,22 мкм.
При использовании вышеупомянутых общих методик конъюгации, синтезируют ADC со встроенным цистеином и дикого типа на основе соединений 'линкер-лекарственное средство' по изобретению и соединения 'линкер-лекарственное средство' vc-seco-DUBA (SYD980, соединения 'линкер-лекарственное средство' 1) и получают характеристики с применением хроматографии гидрофобного взаимодействия (HIC), эсклюзионной хроматографии (SEC) и хроматографии с экранированной гидрофобной фазой (SHPC).
Как видно из аналитической HIC, имеются различия во временах удерживания (RTs) для молекул различных ADC с DAR2 (Таблицы 1А и 1В). Наиболее интересно, что конъюгация лекарственного средства с антителом посредством нелинейного экзо-линкера обуславливает (резкое) снижение времени удерживания по сравнению с лекарственными средствами, которые конъюгированы с помощью известного линейного линкера. Такое снижение более выражено в конъюгатах, содержащих нелинейные экзо-линкеры, где лекарственное средство расположено ближе к антителу, то есть, число атомов в линкере между лекарственным средством и антителом меньше (где число атомов увеличивается от 7 для соединения 'линкер-лекарственное средство' 3 вплоть до 16 для соединения 'линкер-лекарственное средство' 6).
Как показано в WO2015/177360, конъюгация соединения 'линкер-лекарственное средство' в конкретных сайтах в Fab-полости или Fc-полости антитела снижает время удерживания по сравнению с ADC, которые конъюгированы через частично восстановленные эндогенные дисульфиды. Конъюгация соединений 'линкер-лекарственное средство' по изобретению в этих конкретных сайтах дополнительно снижает время удерживания, то есть, дополнительно уменьшает различие в гидрофобности между конъюгированным и неконъюгированным антителом.
В целях получения дополнительной количественной оценки такого эффекта, вводят термин «относительная гидрофобность», которая определяется как:
(RTDAR2 - RTDAR0)/(RTDAR2, стандарт-ADC - RTDAR0, стандарт-ADC).
По существу, относительная гидрофобность представляет собой меру, которая на основе данных HIC позволяет легко сравнить гидрофобность ADC, содержащих соединения 'линкер-лекарственное средство', где линкер представляет собой линейный линкер, и ADC, содержащих соединения 'линкер-лекарственное средство', имеющие нелинейный экзо-линкер. Данные сведены в Таблицах 1А и 1В.
Таблица 1А. Относительная гидрофобность ADC, содержащих различные антитела дикого типа (wt) и различные соединения 'линкер-лекарственное средство' (LD), на ранее заданной аналитической колонке HIC.
1 Случайная - сайт-неспецифическая конъюгация
2 Соединение 'линкер-лекарственное средство' с линейным линкером
3 HMW представляют собой молекулы с высокой молекулярной массой, отражающие число образованных агрегатов
4 Определена как (RTDAR2-RTDAR0)/(RTDAR2,стандарт-ADC-RTDAR0,стандарт-ADC), где RT означает время удерживания; соответственное антитело, связанное с соединением 'линкер-лекарственное средство' 1, представляет собой стандарт-ADC
Фигура 2 графически показывает данные Таблицы 1А. (Относительная) гидрофобность ADC повышается с длиной линкера, то есть, чем меньше число атомов между S-атомом антитела и О-атомом лекарственного средства, тем ниже (относительная) гидрофобность. ADC с соединением 'линкер-лекарственное средство' 3 показывают наименьшую относительную гидрофобность. Хотя ADC с соединением 'линкер-лекарственное средство' 7 имеют меньшую относительную гидрофобность, чем ADC сравнения с соединением 'линкер-лекарственное средство' 1, полярная PEG-группа, прикрепленная к сайту расщепления в соединении 'линкер-лекарственное средство' 7, не снижает дополнительно относительную гидрофобность ADC, в сравнении с ADC, содержащими соединение 'линкер-лекарственное средство' 4, которое имеет подобный линкер, но не содержит PEG-группу.
Таблица 1В. Относительная гидрофобность ADC, содержащих антитела против PSMA дикого типа (wt) и со встроенным цистеином и различные соединения 'линкер-лекарственное средство' (LD), на ранее заданной аналитической колонке HIC
1 Случайная - сайт-неспецифическая конъюгация
2 Соединение 'линкер-лекарственное средство' с линейным линкером
3 HMW соответствует молекулам с высокой молекулярной массой, отражает число образованных агрегатов
4 Определена как (RTDAR2 - RTDAR0)/(RTDAR2,стандарт-ADC - RTDAR0,стандарт-ADC), где RT означает время удерживания; PSMA, связанный с соединением 'линкер-лекарственное средство' 1, представляет собой стандарт-ADC
5 ADC сравнения с соединением 'линкер-лекарственное средство', конъюгированным с остатком цистеина, ориентированным в направлении вовне
Фигуры 3А-С и 4 графически показывают данные Таблицы 1В.
На Фигуре 3А, соединения 'линкер-лекарственное средство' по горизонтальной оси расположены в порядке снижения гидрофобности соединения 'линкер-лекарственное средство'. ADC сравнения представляет собой ADC с тем же самым антителом дикого типа или со встроенным цистеином, которое конъюгировано с соединением 'линейный линкер-лекарственное средство' 1. (Относительная) гидрофобность ADC с соединениями 'линкер-лекарственное средство' по изобретению снижена относительно ADC сравнения. Это снижение гидрофобности является более выраженным в ADC, в которых соединение 'линкер-лекарственное средство' конъюгировано при цистеине, расположенном в Fab-полости.
На Фигуре 3В, значения гидрофобности ADC на основе конъюгированного PSMA wt, содержащих соединения 'линкер-лекарственное средство' по изобретению и стандартное соединение 'линкер-лекарственное средство' 1, принимают за референс-значения. Эта диаграмма более ясно визуализирует отличия между различными соединениями 'линкер-лекарственное средство' в случае одного антитела. Особенно для ADC, в которых соединения 'линкер-лекарственное средство' конъюгированы при цистеине, расположенном в Fab-полости, имеет место относительно большое отличие относительной гидрофобности соединений 'линкер-лекарственное средство' по изобретению в сравнении со стандартным соединением 'линейный линкер-лекарственное средство' 1.
Фигура 3С показывает различие относительной гидрофобности разнообразных конъюгатов относительно стандартного ADC PSMA-LD1. Различие между разнообразными антителами, содержащими одно и то же соединение 'линкер-лекарственное средство' по изобретению при цистине, расположенном в Fab-полости, является небольшим, но отмечается значительное снижение относительно тех же самых антител, включающих стандартное соединение 'линейный линкер-лекарственное средство' 1. Таким образом, потенциальный экранирующий эффект Fab-полости оптимально используется в комбинации с нелинейными линкерами и соединениями 'линкер-лекарственное средство' по изобретению.
Фигура 4 предоставляет хроматограмму HIC, показывающую различие относительной гидрофобности разнообразных конъюгатов относительно варианта со стандартным оголенным антителом против PSMA-HC41. (Относительная) гидрофобность ADC с соединениями 'линкер-лекарственное средство' по изобретению является повышенной относительно варианта с оголенным антителом. Однако, это повышение проявляется меньше, когда расстояние между антителом и лекарственным средством меньше, то есть, число атомов между S-атомом антитела и О-атомом лекарственного средства меньше.
Клеточное связывание
Три конъюгата ADC против PSMA PSMA-LD1, PSMA-HC41-LD1 и PSMA-HC120-LD1 имеют равные значения аффинности связывания на PSMA-экспрессирующих клетках LNCaP-C4.2 (EC50 в диапазоне 0,1-0,2 мкг/мл), аналогичные антителу дикого типа, и все три конъюгата ADC не способны связываться с PSMA-отрицательными клетками DU-145 (EC50>10 мкг/мл).
Два конъюгата ADC против 5T4 H8-LD1 и H8-HC40-LD1 имеют равные значения аффинности связывания на 5T4-экспрессирующих клетках MDA-MB-468 (EC50 в диапазоне 0,1-1,2 мкг/мл), аналогичные антителу H8, и оба конъюгата ADC не способны связываться с 5T4-отрицательными клетками SK-MEL-30 (EC50 >10 мкг/мл).
На связывание ADC, таким образом, не оказывает влияния прикрепленное соединение 'линкер-лекарственное средство' на основе производного дуокармицина.
Цитотоксичность in vitro
Активности ADC против PSMA, содержащих соединения 'нелинейный линкер-лекарственное средство' по изобретению (IC50 в диапазоне 0,2-2,1 нМ, на основании эквивалентов лекарственного средства, см. Таблицу 2А ниже), будь то дикого типа, или сайт-специфически конъюгированных, аналогичны активностям соответственных ADC против PSMA сравнения, содержащих стандартное соединение 'линейный линкер-лекарственное средство' 1, на PSMA-экспрессирующих клетках LNCaP-C4.2.
Все ADC неактивны на PSMA-отрицательных клетках DU-145 (IC50 >70 нМ), что указывает на селективное уничтожение опухолевых клеток через PSMA.
Четыре конъюгата ADC несвязывающего контроля, дикого типа и сайт-специфических, являются, по меньшей мере, в 15 раз менее активными, чем соответственные ADC против PSMA, содержащие соединения 'нелинейный линкер-лекарственное средство' по настоящему изобретению.
Таблица 2А. Цитотоксичность in vitro ADC против PSMA в человеческих опухолевых клетках, экспрессирующих PSMA
1 Случайная - сайт-неспецифическая конъюгация
2 Соединение 'линкер-лекарственное средство' с линейным линкером
3 95% CI является доверительным интервалом с доверительной вероятностью 0,95
4 Эффективность в процентах приведена для самой высокой испытуемой концентрации (~100 нМ) и вычислена путем деления измеренной люминесценции для каждого лекарственного средства или ADC на среднее значение необработанных клеток (только среда для выращивания), умноженное на 100.
5 ADC сравнения с соединением 'линкер-лекарственное средство', конъюгированным с остатком цистеина, ориентированным в направлении вовне
6 n.a. означает, что нет данных
7 Относительные значения IC50 вычислены как концентрация, которая дает ответ, соответствующий середине между нижней и верхней точками кривой, при использовании нелинейного регрессионного уравнения доза-ответ, описывающего сигмоидную форму кривой, при варьируемом наклоне для подгонки кривой в GraphPad Prism.
Активности ADC против HER2 дикого типа, содержащих соединения 'линкер-лекарственное средство' по изобретению сходны с активностями ADC трастузумаб-LD1 на HER2-экспрессирующих клетках SK-BR-3 (IC50 между 0,1 и 0,3 нМ, Таблица 2В). Конъюгаты ADC против HER2 неактивны на HER2-отрицательных клетках SW620 (IC50 >90 нМ).
Три конъюгата ADC несвязывающего контроля являются, по меньшей мере, в 200 раз менее активными, чем ADC против HER2.
Таблица 2В. Цитотоксичность in vitro ADC против HER2 в человеческих опухолевых клетках, экспрессирующих HER2
1 Случайная - сайт-неспецифическая конъюгация
2 Соединение 'линкер-лекарственное средство' с линейным линкером
3 95% CI является доверительным интервалом с доверительной вероятностью 0,95
4 Эффективность в процентах приведена для самой высокой испытуемой концентрации (~100 нМ) и вычислена путем деления измеренной люминесценции для каждого лекарственного средства или ADC на среднее значение необработанных клеток (только среда для выращивания), умноженное на 100.
5 n.a. означает, что нет данных
6 Относительные значения IC50 вычислены как концентрация, которая дает ответ, соответствующий середине между нижней и верхней точками кривой, при использовании нелинейного регрессионного уравнения доза-ответ, описывающего сигмоидную форму кривой, при варьируемом наклоне для подгонки кривой в GraphPad Prism.
В совокупности, эти данные показывают, что ADC, содержащие соединения 'линкер-лекарственное средство' по изобретению имеют превосходную активность в уничтожении опухолевых клеток. Кроме того, сайт-специфическое сцепление упомянутых соединений 'линкер-лекарственное средство' в вариабельной области Fab-участка не оказывает влияние на цитотоксичность in vitro относительно сайт-специфического сцепления соединения 'линейный линкер-лекарственное средство' 1 сравнения, которое высвобождает после расщепления ту же самую часть молекулы лекарственного средства на основе дуокармицина.
Модель ксенотрансплантата опухоли животных
Эффективность in vivo четырех конъюгатов ADC против PSMA оценивают в ксенотрансплантатной модели LNCaP-C4.2 рака предстательной железы. Клеточная линия LnCaP-C4.2 представляет собой линию человеческих эпителиальных клеток карциномы предстательной железы, полученную из ксенотрансплантата, который был последовательно распространен у мышей после вызванной кастрацией регрессии и рецидива парентеральной, андроген-зависимой клеточной линии ксенотрансплантата LnCaP-FGC.
Опухоли индуцируют подкожно путем введения инъекцией 1×107 клеток LnCap-C4.2 в 200 мкл RPMI-раствора 1640, содержащего матригель (50:50, объем:объем), в правый бок мышей-самцов CB17-SCID. Имплантацию опухолевых клеток LnCaP-C4.2 выполняют спустя 24-72 часа после облучения всего тела источником γ-излучения (1,44 Гр,60Co, BioMep,

Во всех группах отмечают кахексию; существенных различий во влиянии на массы тела среди четырех конъюгатов ADC не отмечают.
Фигуры 5А и 5В ясно демонстрируют то, что ADC PSMA-H41C-LD4, -LD7, и -LD8 имеют более хорошую эффективность in vivo, чем ADC PSMA-H41C-LD1.
В совокупности, эти даные показывают, что антитела, связанные с соединениями 'нелинейный линкер-лекарственное средство' по настоящему изобретению (давая в результате ADC со сниженной гидрофобностью) обладают преимущественными свойствами in vivo в отношении их противоопухолевой активности.
Реферат
Изобретение относится к соединениям 'линкер-лекарственное средство' (LD) и конъюгатам антитело-лекарственное средство (ADC), содержащим нелинейный саморасщепляющийся линкер, который может расщепляться или преобразовываться в соответственных условиях и который снижает гидрофобность конъюгата антитело-лекарственное средство. 6 н. и 8 з.п. ф-лы, 2 табл., 5 ил.
Формула







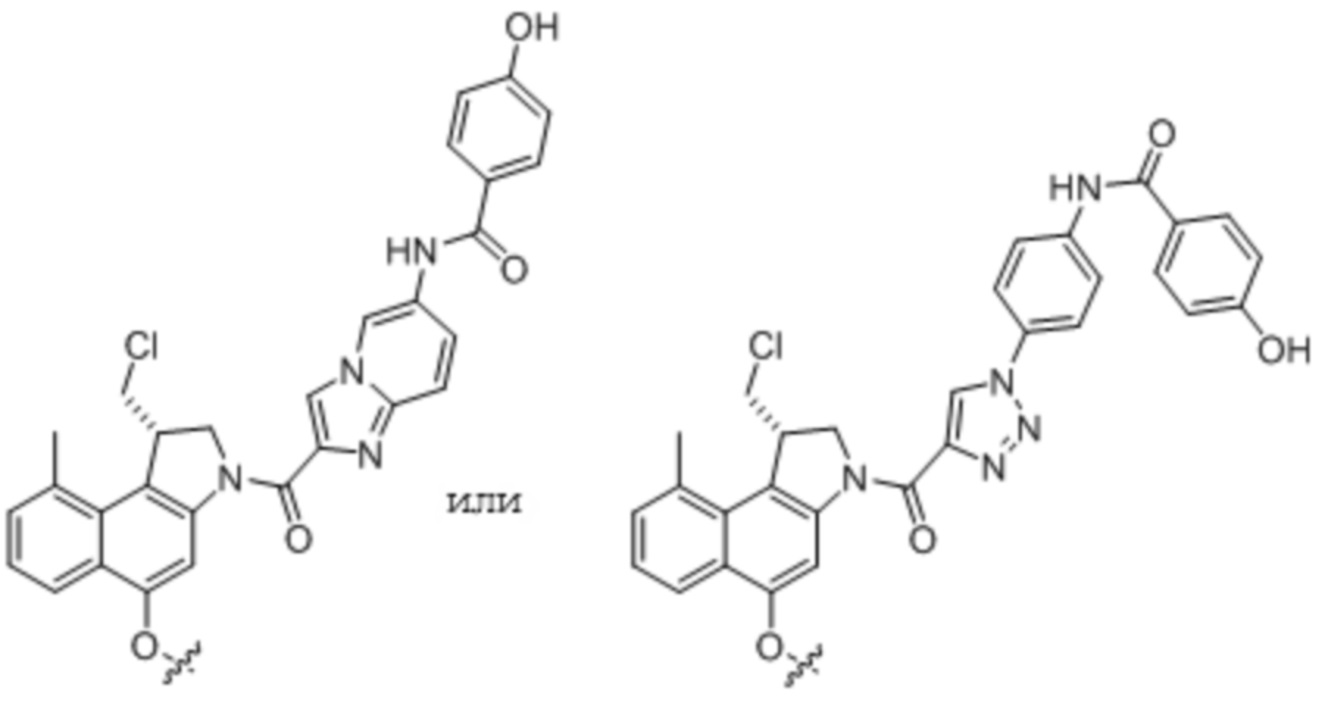

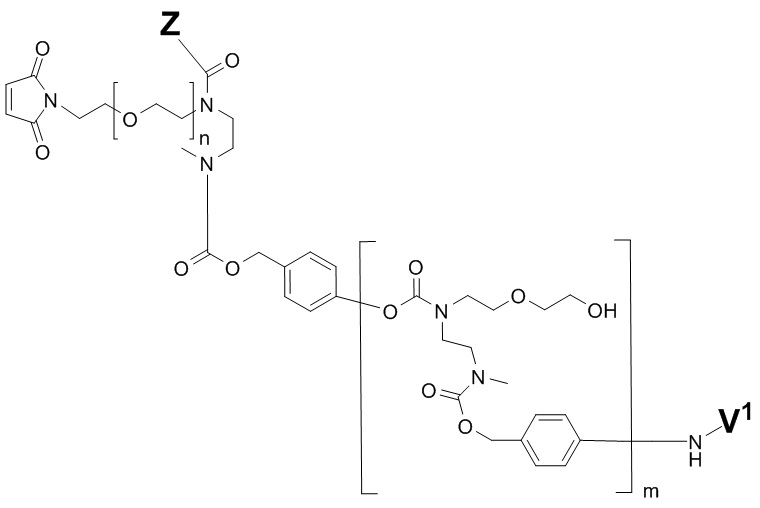






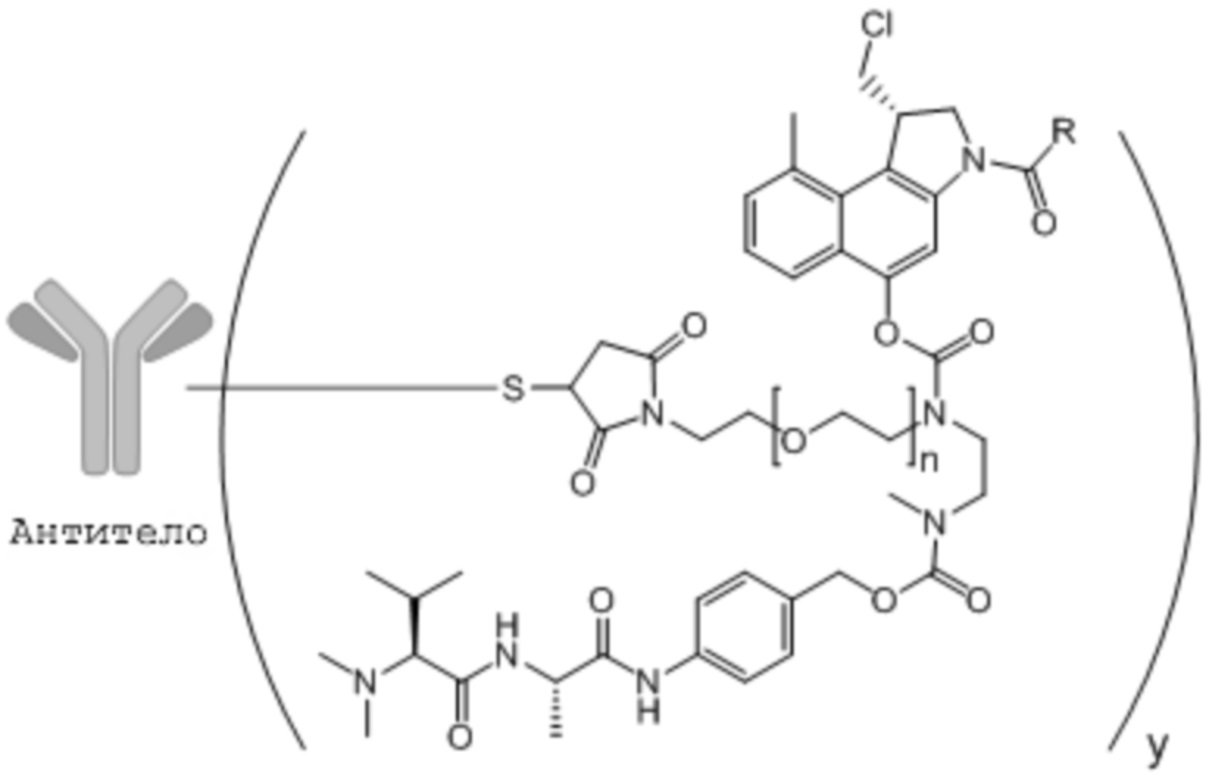


Комментарии