Ингибиторы неприлизина - RU2650114C2
Код документа: RU2650114C2
Описание
Предпосылки создания изобретения
Область техники, к которой относится изобретение
Настоящее изобретение относится к новым соединениям, обладающим ингибирующей неприлизин активностью или которые метаболизируются in vivo до соединений, обладающих такой активностью. Данное изобретение также относится к фармацевтическим композициям, содержащим эти соединения, способам и промежуточным продуктам для получения этих соединений и способам применения этих соединений для лечения заболеваний, таких как гипертензия, сердечная недостаточность, легочная гипертензия и заболевания почек.
Уровень техники
В публикации переуступаемого патента США под номером 2012/0213806, поданной 16 февраля 2012 года Fleury и др., описываются новые соединения, которые обладают активностью в качестве ингибиторов неприлизина, раскрытие которой включено в данный контекст путем ссылки. В частности, описаны соединения вида:

В зависимости от переменных, соединения этого вида могут быть упомянуты как находящиеся в активной форме или как находящиеся в пролекарственной форме, которая метаболизируется in vivo, генерируя активную форму соединения.
Однако, несмотря на эти соединения, остается необходимость в соединениях и пролекарствах в пределах этого вида, которые обладают различными метаболическими свойствами и свойствами расщепления. Например, остается необходимость в активных соединениях и/или пролекарственных формах соединений, обладающих улучшенной пероральной абсорбцией, и в пролекарственных формах соединений, которые подвергаются быстрому расщеплению с образованием активного соединения. Данное изобретение направлено на эту потребность.
Краткое изложение сущности изобретения
Один аспект данного изобретения относится к соединению формулы I:

где:
(i) Х означает


(а) Ra и Rb означают Н; R2 означает Н; и R7 выбирают из -CH2CF2CH3, -CH2CF2CF3, -(CH2)5CH3, -(CH2)6CH3, и

или R2 означает -С1-6-алкил или -С(О)-С1-6-алкил, и R7 означает Н; или
(b) Ra выбирают из -СН3, -ОСН3 и Cl, и Rb означает Н; или Ra выбирают из Н, -СН3, Cl и F, и Rb означает Cl; или Ra означает Н и Rb выбирают из -СН3 и -CN; R2 выбирают из Н, -С1-6-алкила, -(СН2)2-3ORe и -(CH2)2-3NReRe; и R7выбирают из Н, -С1-6-алкила, -[(CH2)2O]1-3CH3, -CHRcOC(O)-C1-4-алкила, -СН2ОС(О)СНRd-NH2, -СН2ОС(О)СНRd-NHС(О)О-С1-6-алкила, -СHRcOC(O)O-С2-4-алкила, -СHRcOC(O)O-циклогексила, -CH2CH(NH2)C(O)OCH3, -С2-4-алкилен-N(CH3)2, -С0-6-алкиленморфолинила и
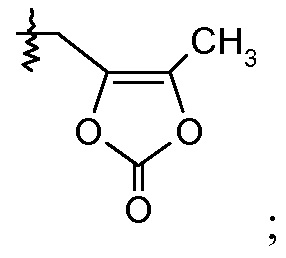
(с) Ra означает Н и Rb означает F; или Ra означает F и Rb означает Н; R2 выбирают из Н, -С1-6-алкила, -(СН2)2-3ORe и -(CH2)2-3NReRe; и R7выбирают из -С1-6-алкила, -[(CH2)2O]1-3CH3, -CHRcOC(O)-C1-4-алкила, -СН2ОС(О)СНRd-NH2, -СН2ОС(О)СНRd-NHС(О)О-С1-6-алкила, -СHRcOC(O)O-С2-4-алкила, -СHRcOC(O)O-циклогексила, -CH2CH(NH2)C(O)OCH3, -С2-4-алкилен-N(CH3)2, -С0-6-алкиленморфолинила и

(ii) Х означает

(а) Ra означает Cl и Rb означает Н; или Ra означает Н и Rb выбирают из Cl, F, -СН3 и -CN; или Ra означает F и Rb означает Cl; R2 выбирают из Н, -С1-6-алкила, -(СН2)2-3ORe и -(CH2)2-3NReRe; R4 выбирают из -ОН, -ОСН3, -ОСН2СH3 и -С1-4-алкила; и R7выбирают из Н, -С1-6-алкила, -[(CH2)2O]1-3CH3, -CHRcOC(O)-C1-4-алкила, -СН2ОС(О)СНRd-NH2, -СН2ОС(О)СНRd-NHС(О)О-С1-6-алкила, -СHRcOC(O)O-С2-4-алкила, -СHRcOC(O)O-циклогексила, -CH2CH(NH2)C(O)OCH3, -С2-4-алкилен-N(CH3)2, -С0-6-алкиленморфолинила и

(b) Ra означает F и Rb означает Н; R2 означает Н; R4 означает -ОН; и R7выбирают из -С1-6-алкила, -[(CH2)2O]1-3CH3, -CHRcOC(O)-C1-4-алкила, -СН2ОС(О)СНRd-NH2, -СН2ОС(О)СНRd-NHС(О)О-С1-6-алкила, -СHRcOC(O)O-С2-4-алкила, -СHRcOC(O)O-циклогексила, -CH2CH(NH2)C(O)OCH3, -С2-4-алкилен-N(CH3)2, -С0-6-алкиленморфолинила и

(iii) Х означает

(а) Ra означает Cl и Rb означает Н; или Ra означает Н и Rb выбирают из Cl, F, -СН3 и -CN; или Ra означает F и Rb означает Cl; R2 выбирают из Н, -С1-6-алкила, -(СН2)2-3ORe и -(CH2)2-3NReRe; и R7выбирают из Н, -С1-6-алкила, -[(CH2)2O]1-3CH3, -CHRcOC(O)-C1-4-алкила, -СН2ОС(О)СНRd-NH2, -СН2ОС(О)СНRd-NHС(О)О-С1-6-алкила, -СHRcOC(O)O-С2-4-алкила, -СHRcOC(O)O-циклогексила, -CH2CH(NH2)C(O)OCH3, -С2-4-алкилен-N(CH3)2, -С0-6-алкиленморфолинила и

(b) Ra означает F и Rb означает Н; R2 означает Н; и R7выбирают из -С1-6-алкила, -[(CH2)2O]1-3CH3, -CHRcOC(O)-C1-4-алкила, -СН2ОС(О)СНRd-NH2, -СН2ОС(О)СНRd-NHС(О)О-С1-6-алкила, -СHRcOC(O)O-С2-4-алкила, -СHRcOC(O)O-циклогексила, -CH2CH(NH2)C(O)OCH3, -С2-4-алкилен-N(CH3)2, -С0-6-алкиленморфолинила и

(iv) Х означает

(а) Ra и Rb означают Н; R2 выбирают из -С1-6-алкила, -(СН2)2-3ORe и -(CH2)2-3NReRe; R3 выбирают из -ОН, -ОСН3, -ОСН2СН3 и -С1-4-алкила; и R7 означает Н; или
(b) Ra выбирают из Cl и F и Rb означает Н; или Ra означает Н и Rb выбирают из Cl, F, -CH3 и -CN; или Ra означает F и Rb означает Cl; R2 выбирают из Н, -С1-6-алкила, -(СН2)2-3ORe и -(CH2)2-3NReRe; R3 выбирают из -ОН, -ОСН3, -ОСН2СН3 и -С1-4-алкила; и R7выбирают из Н, -С1-6-алкила, -[(CH2)2O]1-3CH3, -CHRcOC(O)-C1-4-алкила, -СН2ОС(О)СНRd-NH2, -СН2ОС(О)СНRd-NHС(О)О- С1-6-алкила, -СHRcOC(O)O-С2-4-алкила, -СHRcOC(O)O-циклогексила, -CH2CH(NH2)C(O)OCH3, -С2-4-алкилен-N(CH3)2, -С0-6-алкиленморфолинила и
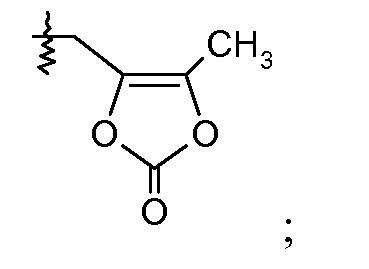
(v) Х означает

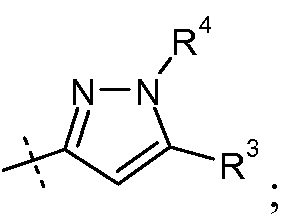
Ra выбирают из Cl и F и Rb означает Н; или Ra означает Н и Rb выбирают из Cl, F, -CH3 и -CN; или Ra означает F и Rb означает Cl; R2 выбирают из Н, -С1-6-алкила, -(СН2)2-3ORe и -(CH2)2-3NReRe; R3 выбирают из -ОН, -ОСН3, -ОСН2СН3 и -С1-4-алкила; R4 выбирают из Н, -С1-6-алкила и фенила; и R7выбирают из Н, -С1-6-алкила, -[(CH2)2O]1-3CH3, -CHRcOC(O)-C1-4-алкила, -СН2ОС(О)СНRd-NH2, -СН2ОС(О)СНRd-NHС(О)О-С1-6-алкила, -СHRcOC(O)O-С2-4-алкила, -СHRcOC(O)O-циклогексила, -CH2CH(NH2)C(O)OCH3, -С2-4-алкилен-N(CH3)2, -С0-6-алкиленморфолинила и

(vi) Х означает
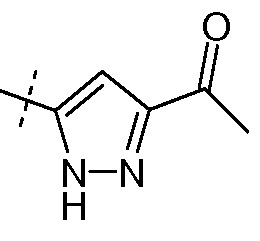

Ra выбирают из Cl и F и Rb означает Н; или Ra означает Н и Rb выбирают из Cl, F, -CH3 и -CN; или Ra означает F и Rb означает Cl; R2 выбирают из Н, -С1-6-алкила, -(СН2)2-3ORe и -(CH2)2-3NReRe; R4 выбирают из Н, -С1-6-алкила и фенила; и R7выбирают из Н, -С1-6-алкила, -[(CH2)2O]1-3CH3, -CHRcOC(O)-C1-4-алкила, -СН2ОС(О)СНRd-NH2, -СН2ОС(О)СНRd-NHС(О)О-С1-6-алкила, -СHRcOC(O)O-С2-4-алкила, -СHRcOC(O)O-циклогексила, -CH2CH(NH2)C(O)OCH3, -С2-4-алкилен-N(CH3)2, -С0-6-алкиленморфолинила и
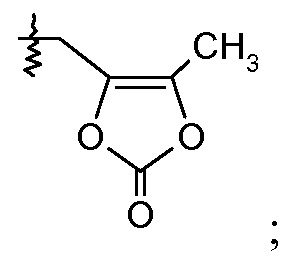
(vii) Х означает

Ra выбирают из Cl и F и Rb означает Н; или Ra означает Н и Rb выбирают из Cl, F, -CH3 и -CN; или Ra означает F и Rb означает Cl; R2 выбирают из Н, -С1-6-алкила, -(СН2)2-3ORe и -(CH2)2-3NReRe; и R7выбирают из Н, -С1-6-алкила, -[(CH2)2O]1-3CH3, -CHRcOC(O)-C1-4-алкила, -СН2ОС(О)СНRd-NH2, -СН2ОС(О)СНRd-NHС(О)О-С1-6-алкила, -СHRcOC(O)O-С2-4-алкила, -СHRcOC(O)O-циклогексила, -CH2CH(NH2)C(O)OCH3, -С2-4-алкилен-N(CH3)2, -С0-6-алкиленморфолинила и

(viii) Х означает
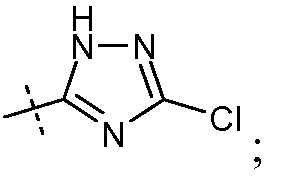
Ra выбирают из Cl и F и Rb означает Н; или Ra означает Н и Rb выбирают из Cl, F, -CH3 и -CN; или Ra означает F и Rb означает Cl; R2 выбирают из Н, -С1-6-алкила, -(СН2)2-3ORе и -(CH2)2-3NRеRе; и R7выбирают из Н, -С1-6-алкила, -[(CH2)2O]1-3CH3, -CHRcOC(O)-C1-4-алкила, -СН2ОС(О)СНRd-NH2, -СН2ОС(О)СНRd-NHС(О)О-С1-6-алкила, -СHRcOC(O)O-С2-4-алкила, -СHRcOC(O)O-циклогексила, -CH2CH(NH2)C(O)OCH3, -С2-4-алкилен-N(CH3)2, -С0-6-алкиленморфолинила и
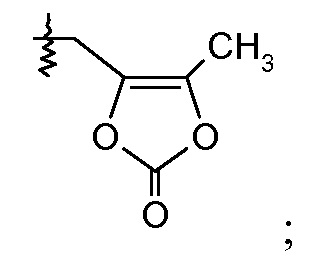
где каждый Rc независимо означает Н или -С1-3-алкил; каждый Rd независимо означает Н, -СН3, -СН(СН3)2, фенил или бензил; и каждый Re независимо означает Н или -СН3; или его фармацевтически приемлемой соли.
Настоящее изобретение относится к соединениям, которые метаболизируются in vivo до соединений, в случае которых обнаружено, что они обладают активностью, ингибирующей фермент неприлизин (NEP). Соответственно, предполагают, что соединения согласно данному изобретению являются пригодными и полезными в качестве терапевтических агентов для лечения пациентов, страдающих от заболевания или нарушения, которое подвергают лечению путем ингибирования фермента NEP или путем увеличения уровней его пептидных субстратов. Таким образом, один аспект данного изобретения относится к способу лечения гипертензии, сердечной недостаточности или заболевания почек, включающему введение пациенту терапевтически эффективного количества соединения согласно данному изобретению.
Другой аспект данного изобретения относится к фармацевтическим композициям, содержащим фармацевтически приемлемый носитель и соединение согласно данному изобретению.
Еще один аспект данного изобретения относится к способам и промежуточным продуктам, пригодным для получения соединений согласно данному изобретению. Другой аспект данного изобретения относится к способу получения фармацевтически приемлемой соли соединения формулы I, включающему введение в контакт соединения формулы I в форме свободной кислоты или основания с фармацевтически приемлемым основанием или кислотой. В других аспектах, данное изобретение относится к продуктам, получаемым с помощью любого способа, описанного в данном контексте, а также к новым промежуточным продуктам, используемым в случае такого способа.
Еще один другой аспект данного изобретения относится к применению соединения формулы I или его фармацевтически приемлемой соли для получения лекарственного средства, особенно, для получения лекарственного средства, пригодного для лечения гипертензии, сердечной недостаточности или заболевания почек. Другой аспект данного изобретения относится к применению соединения согласно данному изобретению для ингибирования фермента NEP у млекопитающего. Еще один другой аспект данного изобретения относится к применению соединения согласно данному изобретению в качестве инструмента для исследования. Другие аспекты и воплощения согласно данному изобретению описаны в данном контексте.
Подробное описание данного изобретения
Когда описывают соединения, композиции, методики и способы согласно данному изобретению, следующие термины имеют следующие значения, за исключением иначе указанного. Дополнительно, как используется в данном контексте, формы единственного числа включают и соответствующие формы множественного числа, если в контексте определенно не предписывается использование другим образом. Подразумевают, что термины «содержащий», «включающий» и «имеющий» включают и означают, что могут быть дополнительные элементы, другие, чем перечисленные элементы. Должно быть понятно, что все цифры, выражающие количества ингредиентов, свойства, такие как молекулярная масса, условия реакций и т.д., используемые в данном контексте, являются видоизменяемыми во всех случаях посредством термина «примерно», за исключением иначе указанного. Соответственно, цифры, приводимые в данном контексте, являются приближениями, которые могут изменяться в зависимости от желательных свойств, которых стремятся достичь согласно настоящему изобретению. По меньшей мере, а не в качестве попытки ограничения заявки относительно теории эквивалентов в рамках формулы изобретения, каждая цифра, по меньшей мере, должна быть истолкована в свете представленных значащих цифр и путем применения обычных способов округления.
Термин «алкил» означает одновалентную насыщенную углеводородную группу, которая может быть линейной или разветвленной цепью. За исключением иначе определенного, такие алкильные группы обычно содержат от 1 до 10 атомов углерода и включают, например, -С1-6-алкил, имея в виду алкильную группу, включающую 1-6 атомов углерода, где атомы углерода находятся в любой приемлемой конфигурации. Типичные алкильные группы включают, в качестве примера, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил, н-гексил и т.п.
Как используется в данном контексте, выражение «формула» или «имеющий формулу» или «имеющий структуру» не предназначено для ограничения и используется таким же образом, как обычно используется термин «включающий». Например, если изображена одна структура, подразумевают, что охвачены все стереоизомерные и таутомерные формы, за исключением иначе указанного.
Термин «фармацевтически приемлемый» относится к веществу, которое не является биологически или иным образом неприемлемым, когда используется в данном изобретении. Например, термин «фармацевтически приемлемый носитель» относится к веществу, которое может быть включено в композицию и введено пациенту, не вызывая неприемлемых биологических влияний или взаимодействия неприемлемым образом с другими компонентами композиции. Такие фармацевтически приемлемые вещества обычно удовлетворяют требуемым стандартам токсикологического и производственного тестирования и включают такие вещества, идентифицированные как подходящие неактивные ингредиенты, согласно указаниям Управления по контролю за качеством пищевых продуктов и лекарственных средств США.
Термин «фармацевтически приемлемая соль» означает соль, получаемую при использовании основания или кислоты, которая является приемлемой для введения пациенту, такому как млекопитающее (например, соли, обладающие приемлемой безопасностью для млекопитающего в целях установления схемы приема). Однако, подразумевают, что соли, охватываемые данным изобретением, необязательно являются фармацевтически приемлемыми солями, как, например, соли промежуточных соединений, которые не предназначены для введения пациенту. Фармацевтически приемлемые соли могут быть получены при использовании фармацевтически приемлемых неорганических и органических оснований и фармацевтически приемлемых неорганических или органических кислот. В дополнение, когда соединение формулы I содержит как основной фрагмент, как, например, амин, пиридин или имидазол, так и кислотный фрагмент, как, например, карбоновая кислота или тетразол, могут быть образованы цвиттер-ионы и включены в термин «соль», как используется в данном контексте. Соли, получаемые при использовании фармацевтически приемлемых неорганических оснований, включают соли аммония, кальция, меди, железа(III), железа(II), лития, магния, марганца(III), марганца(II), калия, натрия и цинка, и т.п. Соли, получаемые при использовании фармацевтически приемлемых органических оснований, включают соли первичных, вторичных и третичных аминов, включая замещенные амины, циклические амины, встречающиеся в природе амины и т.п., такие как аргинин, бетаин, кофеин, холин, N,N'-дибензилэтилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин, полиаминовые смолы, прокаин, пурины, теобромин, триэтиламин, триметиламин, трипропиламин, трометамин и т.п. Соли, получаемые при использовании фармацевтически приемлемых неорганических кислот, включают соли борной, карбоновой, галогенводородных кислот (бромоводородная, соляная, фтороводородная или иодоводородная кислоты), азотной, фосфорной, сульфаминовой и серной кислот. Соли, получаемые при использовании фармацевтически приемлемых органических кислот, включают соли алифатических гидроксикислот (например, лимонная, глюконовая, гликолевая, молочная, лактобионовая, яблочная и винная кислоты), алифатических монокарбоновых кислот (например, уксусная, масляная, муравьиная, пропионовая и трифторуксусная кислоты), аминокислот (например, аспарагиновая и глутаминовая кислоты), ароматических карбоновых кислот (например, бензойная, п-хлорбензойная, дифенилуксусная, гентизиновая, гиппуровая и трифенилуксусная кислоты), ароматических гидроксикислот (например, о-гидроксибензойная, п-гидроксибензойная, 1-гидроксинафталин-2-карбоновая и 3-гидроксинафталин-2-карбоновая кислоты), аскорбиновой кислоты, дикарбоновых кислот (например, фумаровая, малеиновая, щавелевая и янтарная кислоты), глюкуроновой, миндальной, слизевой, никотиновой, оротовой, памоевой, пантотеновой, сульфоновой кислот (например, бензолсульфоновая, камфорсульфоновая, эдизиловая, этансульфоновая, изетионовая, метансульфоновая, нафталинсульфоновая, нафталин-1,5-дисульфоновая, нафталин-2,6-дисульфоновая и п-толуолсульфоновая кислоты), ксинафоевой кислоты и т.п.
Термин «пролекарство» предназначен для обозначения неактивного (или значительно менее активного) предшественника лекарственного средства, который превращается в свою активную форму в организме при физиологических условиях, например, при обычных метаболических процессах. Такие соединения могут необязательно обладать фармакологической активностью по отношению к NEP, но они могут быть введены перорально или парентерально и после этого метаболизированы в организме до образования соединения, которое является фармакологически активным по отношению к NEP.
Термин «терапевтически эффективное количество» означает количество, достаточное для эффективного лечения, когда вводят пациенту, нуждающемуся в этом, то есть, количество лекарственного средства, необходимое для получения желательного терапевтического эффекта. Например, терапевтически эффективное количество для лечения гипертензии представляет собой количество соединения, необходимое, например, для ослабления, подавления, устранения или предупреждения симптомов гипертензии или для лечения основной причины гипертензии. В одном воплощении, терапевтически эффективное количество представляет собой количество лекарственного средства, необходимое для снижения кровяного давления, или количество лекарственного средства, необходимое для поддерживания нормального кровяного давления. С другой стороны, термин «эффективное количество» означает количество, достаточное для получения желательного результата, который может быть необязательно терапевтическим результатом. Например, при исследовании системы, включающей фермент NEP, «эффективное количество» может представлять собой количество, необходимое для ингибирования фермента.
Термин «лечить» или «лечение», как используется в данном контексте, означает лечение заболевания или медицинского состояния (такого как гипертензия) у пациента, такого как млекопитающее (особенно, человек), которое включает одно или более из следующего: (а) предупреждение от проявления заболевания или медицинского состояния, то есть, предупреждение от повторного проявления заболевания или медицинского состояния, или профилактическое лечение пациента, который является предрасположенным к этому заболеванию или медицинскому состоянию; (b) ослабление заболевания или медицинского состояния, то есть, устранение или вызывание регрессии заболевания или медицинского состояния у пациента; (с) подавление заболевания или медицинского состояния, то есть, замедление или прекращение развития заболевания или медицинского состояния у пациента; или (d) облегчение симптомов заболевания или медицинского состояния у пациента. Например, термин «лечить гипертензию» включает предупреждение от проявления гипертензии, ослабление гипертензии, подавление гипертензии и облегчение симптомов гипертензии (например, снижение кровяного давления). Подразумевают, что термин «пациент» включает млекопитающих, таких как люди, которые нуждаются в лечении или предупреждении заболевания или которые в настоящий момент подвергаются лечению для предупреждения заболевания или лечению конкретного заболевания или медицинского состояния, а также, тест-субъектов, которых оценивают в отношении кристаллического соединения или используют при анализе, как, например, животная модель.
Подразумевают, что все другие термины, используемые в данном контексте, имеют свои обычные значения, которые понятны квалифицированному специалисту в данной области, к которой они имеют отношение.
Соединения согласно данному изобретению содержат один или более хиральных центров и, следовательно, эти соединения могут быть получены и использованы в различных стереоизомерных формах. В некоторых воплощениях, для того, чтобы оптимизировать терапевтическую активность соединений согласно данному изобретению, например, для лечения гипертензии, может быть желательным, чтобы атомы углерода имели, в частности, (R,R)-, (S,S)-, (S,R)- или (R,S)-конфигурацию или являлись обогащенными стереоизомерной формой, имеющей такую конфигурацию. В других воплощениях, соединения согласно данному изобретению находятся в виде рацемических смесей. Соответственно, данное изобретение также относится к рацемическим смесям, чистым стереоизомерам (например, энантиомеры и диастереоизомеры), обогащенным стереизомером смесям и т.п., за исключением иначе указанного. Когда в данном контексте представлена химическая структура без какой-либо стереохимии, подразумевают, что такая структура охватывает все возможные стереоизомеры. Подобным образом, когда в данном контексте представлен или указан конкретный стереоизомер, квалифицированному специалисту в данной области должно быть понятно, что в композициях согласно данному изобретению могут присутствовать незначительные количества других стереоизомеров, за исключением иначе указанного, при условии, что полезность композиции, в целом, не исключается от присутствия таких других изомеров. Индивидуальные стереоизомеры могут быть получены многочисленными способами, которые хорошо известны в данной области, включая хиральную хроматографию при использовании подходящей хиральной неподвижной фазы или носителя, или путем химического превращения их в диастереоизомеры, разделения диастереоизомеров стандартными способами, как, например, хроматография или перекристаллизация, затем регенерации первоначального стереоизомера.
Дополнительно, где применимо, все цис-транс- или Е/Z-изомеры (геометрические изомеры), таутомерные формы и топоизомерные формы соединений согласно данному изобретению включены в рамки данного изобретения, за исключением иначе указанного. Например, хотя формула представлена как:

подразумевают, что соединение также может существовать в таутомерной форме, такой как:

и что обе формы охватываются данным изобретением. Также подразумевают, что один таутомер может быть преобладающим.
Соединения согласно данному изобретению, а также такие соединения, которые используются при их синтезе, также могут включать меченные изотопами соединения, то есть, где один или более атомов обогащены атомами, имеющими атомную массу, отличающуюся от атомной массы, преимущественно встречающейся в природе. Примеры изотопов, которые могут быть включены в соединения формулы I, например, включают, но не исчерпывающим образом,2Н,3Н,13С,14С,15N,18O,17O,35S,36Cl и18F. Особый интерес представляют собой соединения формулы I, обогащенные тритием или углеродом-14, которые могут быть использованы, например, при исследованиях распределения в тканях; соединения согласно данному изобретению, обогащенные дейтерием, особенно, в месте метаболизма, приводят, например, к соединениям, имеющим гораздо большую метаболическую стабильность; и соединения формулы I, обогащенные эмиттирующими позитроны изотопами, такими как11С,18F,15O и13N, которые могут быть использованы, например, при исследованиях с помощью позитронно-эмиссионной томографии (РЕТ).
Номенклатура, используемая в данном контексте для названия соединений согласно данному изобретению, пояснена в Примерах согласно данному контексту. Эту номенклатуру получают, используя коммерчески доступное программное обеспечение AutoNom (MDL, San Leandro, California).
В публикации патента США под номером 2012/0213806 конкретно раскрывается (2S,4R)-5-бифенил-4-ил-2-гидроксиметил-2-метил-4-[(3Н-[1,2,3]триазол-4-карбонил)амино]пентановая кислота, которая представлена формулой I' (где Ra и Rb означают Н):

Соединения, такие, как это, могут существовать в таутомерной форме, например, в виде (2S,4R)-5-бифенил-4-ил-2-гидроксиметил-2-метил-4-[(1Н-[1,2,3]триазол-4-карбонил)амино]-пентановой кислоты. В одном воплощении, это соединение упоминают как активную форму и вводят в виде пролекарства, которое метаболизируется in vivo до образования соединения формулы I'. В публикации патента США под номером 2012/0213806 также раскрываются некоторые пролекарства соединения формулы I', такие как этиловый эфир, пропиловый эфир, изопропиловый эфир, бутиловый эфир, изобутиловый эфир, 3-метилбутиловый эфир, пентиловый эфир, медоксомиловый эфир, 2-морфолин-4-илэтиловый эфир, 2-морфолин-4-ил-2-оксоэтиловый эфир, 2-метоксиэтиловый эфир, 2-(2-метоксиэтокси)этиловый эфир, 2-метансульфонилэтиловый эфир, 2-диметиламиноэтиловый эфир, 2-пиперидин-1-илэтиловый эфир, индан-5-иловый эфир, оксетан-3-иловый эфир, диметилкарбамоилметиловый эфир, метоксикарбонилметиловый эфир, ацетоксиметиловый эфир, бутирилоксиметиловый эфир, бензилоксикарбонилметиловый эфир, 2-(2-оксопирролидин-1-ил)этиловый эфир, этоксикарбонилоксиметиловый эфир, бензиловый эфир, (S)-2-амино-3-метилбутирилоксиметиловый эфир, (S)-2-метоксикарбониламино-3-метилбутирилоксиметиловый эфир, (R)-1-циклогексилоксикарбонилоксиэтиловый эфир, (S)-1-циклогексилоксикарбонилоксиэтиловый эфир; и 5-метил-2-оксо-[1,3]диоксол-4-илметиловый эфир.
Один аспект данного изобретения относится к другим пролекарствам и вариантам соединения формулы I'. Эти соединения представляют собой соединения формулы I, где Х означает:
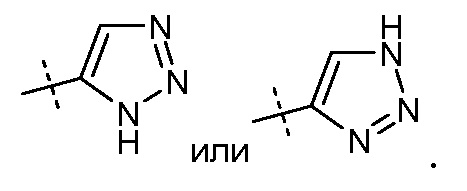
Эти соединения представлены формулой IIa или IIb:
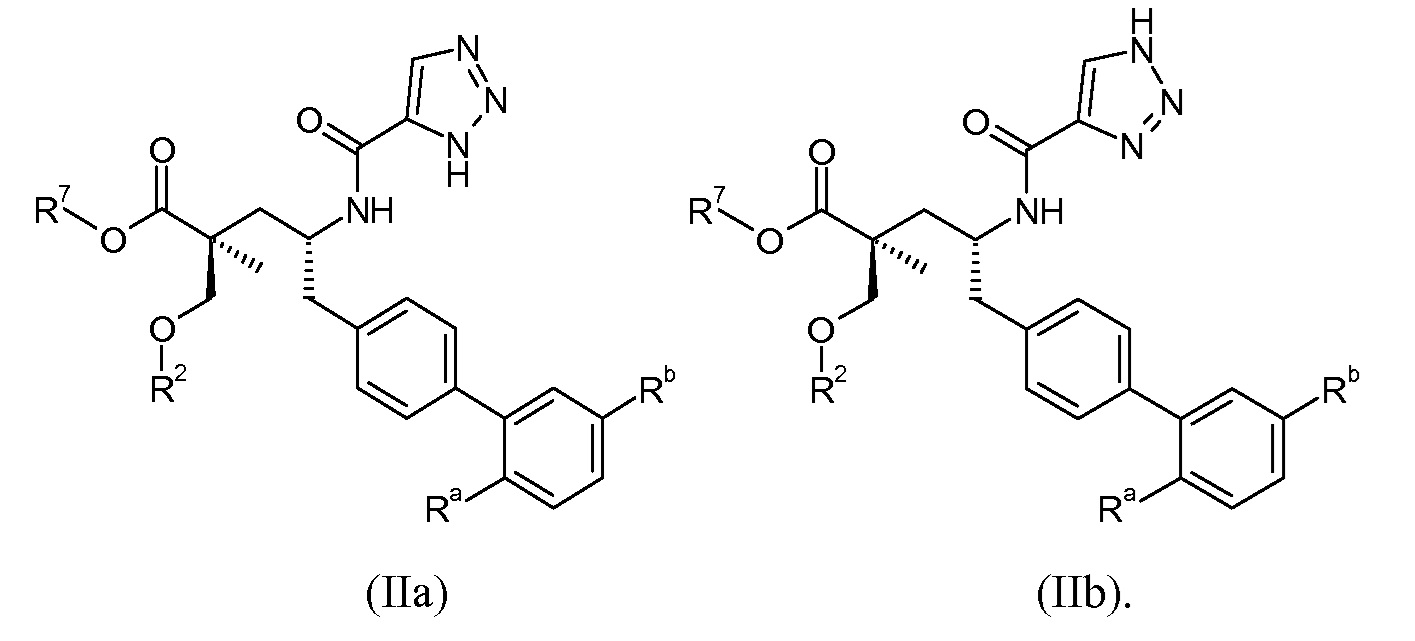
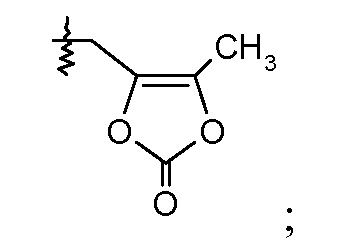
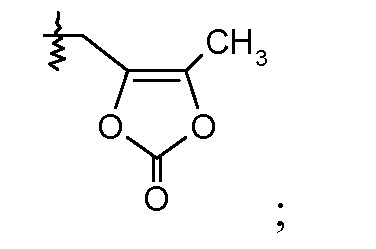
В одном воплощении соединений формулы IIa и формулы IIb, Ra и Rb означают Н; R2 означает Н; и R7 выбирают из -CH2CF2CH3, -CH2CF2CF3, -(CH2)5CH3, -(CH2)6CH3 и
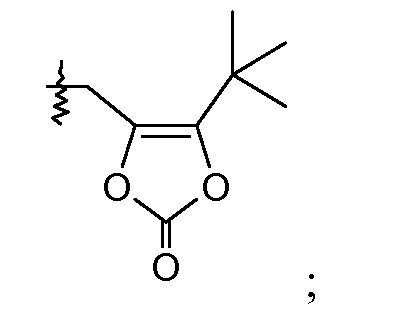
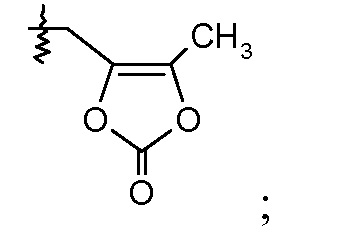
или R2 означает -С1-6-алкил или -С(О)-С1-6-алкил и R7 означает Н. В одном конкретном воплощении, R2 означает Н и R7 выбирают из -CH2CF2CH3, -CH2CF2CF3, -(CH2)5CH3, -(CH2)6CH3 и

R2 выбирают из -СН3, -СН2СН3, -С(О)СН3, -С(О)СН(СН3)2 и -С(О)СН2СН(СН3)2;
и R7 означает Н.
В другом воплощении соединений формул IIa и IIb, Raвыбирают из -СН3, -ОСН3 и Cl, и Rb означает Н; или Raвыбирают из Н, -СН3, Cl и F, и Rb означает Cl; или Ra означает Н и Rb выбирают из -СН3 и -CN; R2 выбирают из Н, -С1-6-алкила, -(СН2)2-3ORe и -(CH2)2-3NReRe; и R7выбирают из Н, -С1-6-алкила, -[(CH2)2O]1-3CH3, -CHRcOC(O)-C1-4-алкила, -СН2ОС(О)СНRd-NH2, -СН2ОС(О)СНRd-NHС(О)О-С1-6-алкила, -СHRcOC(O)O-С2-4-алкила, -СHRcOC(O)O-циклогексила, -CH2CH(NH2)C(O)OCH3, -С2-4-алкилен-N(CH3)2, -С0-6-алкиленморфолинила и
где каждый Rснезависимо означает Н или -С1-3-алкил; каждый Rdнезависимо означает Н, -СН3, -СН(СН3)2, фенил или бензил; и каждый Rенезависимо означает Н или -СН3. В одном конкретном воплощении, Raвыбирают из -СН3, -ОСН3 и Cl, и Rb означает Н; или Raвыбирают из Н, -СН3, Cl и F, и Rb означает Cl; или Ra означает Н и Rb выбирают из -СН3 и -CN; R2 выбирают из Н, -С1-6-алкила (например, -СН3, -СН2СН3, -СН(СН3) или -(СН2)4СН3) и -(СН2)2-3ORe, где Rеозначает Н (например, -(СН2)2ОН и -(СН2)3ОН) или -СН3 (например, -(СН2)2ОСН3); и R7 означает Н.
В публикации патента США под номером 2012/0213806 также раскрываются соединения формулы I', где Raозначает Н и Rb означает F, (2S,4R)-5-(3'-фторбифенил-4-ил)-2-гидроксиметил-2-метил-4-[(3Н-[1,2,3]триазол-4-карбонил)амино]пентановая кислота, и где Raозначает F и Rb означает Н, (2S,4R)-5-(2'-фторбифенил-4-ил)-2-гидроксиметил-2-метил-4-[(3Н-[1,2,3]триазол-4-карбонил)амино]-пентановая кислота. Таким образом, другой аспект данного изобретения относится к пролекарствам таких соединений. Следовательно, в другом воплощении соединений формулы IIa и формулы IIb, Ra означает Н и Rb означает F; или Raозначает F и Rb означает Н; R2 выбирают из Н, -С1-6-алкила, -(СН2)2-3ORe и -(CH2)2-3NReRe; и R7выбирают из -С1-6-алкила, -[(CH2)2O]1-3CH3, -CHRcOC(O)-C1-4-алкила, -СН2ОС(О)СНRd-NH2, -СН2ОС(О)СНRd-NHС(О)О-С1-6-алкила, -СHRcOC(O)O-С2-4-алкила, -СHRcOC(O)O-циклогексила, -CH2CH(NH2)C(O)OCH3, -С2-4-алкилен-N(CH3)2, -С0-6-алкиленморфолинила и

где каждый Rснезависимо означает Н или -С1-3-алкил; каждый Rdнезависимо означает Н, -СН3, -СН(СН3)2, фенил или бензил; и каждый Rенезависимо означает Н или -СН3.
Другой аспект данного изобретения относится к соединениям формулы I, где Х означает:
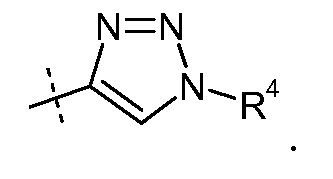
Эти соединения представлены формулой III:

В одном воплощении соединений формулы III, Ra означает Cl и Rb означает Н; или Ra означает Н и Rb выбирают из Cl, F, -CH3 и -CN; или Ra означает F и Rb означает Cl; R2 выбирают из Н, -С1-6-алкила, -(СН2)2-3ORe и -(CH2)2-3NReRe; R4 выбирают из -ОН, -ОСН3, -ОСН2СH3 и -С1-4-алкила; и R7выбирают из Н, -С1-6-алкила, -[(CH2)2O]1-3CH3, -CHRcOC(O)-C1-4-алкила, -СН2ОС(О)СНRd-NH2, -СН2ОС(О)СНRd-NHС(О)О-С1-6-алкила, -СHRcOC(O)O-С2-4-алкила, -СHRcOC(O)O-циклогексила, -CH2CH(NH2)C(O)OCH3, -С2-4-алкилен-N(CH3)2, -С0-6-алкиленморфолинила и

где каждый Rснезависимо означает Н или -С1-3-алкил; каждый Rdнезависимо означает Н, -СН3, -СН(СН3)2, фенил или бензил; и каждый Rенезависимо означает Н или -СН3. В одном конкретном воплощении, Ra означает F, Rb означает Cl, R2 означает Н, R4 означает -ОСН3или -ОСН2СH3 и R7означает Н.
В публикации патента США под номером 2012/0213806 раскрывается соединение формулы III, где Ra означает F, Rb означает Н, R2 означает Н и R7означает Н, (2S,4R)-5-(2'-фтордифенил-4-ил)-2-гидроксиметил-4-[(1-гидрокси-1Н-[1,2,3]триазол-4-карбонил)амино]-2-метилпентановая кислота. Таким образом, другой аспект данного изобретения относится к пролекарствам этого соединения.
Следовательно, в другом воплощении соединений формулы III, Ra означает F и Rb означает Н; R2 означает Н; R4 означает -ОН; и R7выбирают из -С1-6-алкила, -[(CH2)2O]1-3CH3, -CHRcOC(O)-C1-4-алкила, -СН2ОС(О)СНRd-NH2, -СН2ОС(О)СНRd-NHС(О)О-С1-6-алкила, -СHRcOC(O)O-С2-4-алкила, -СHRcOC(O)O-циклогексила, -CH2CH(NH2)C(O)OCH3, -С2-4-алкилен-N(CH3)2, -С0-6-алкиленморфолинила и

где каждый Rснезависимо означает Н или -С1-3-алкил; каждый Rdнезависимо означает Н, -СН3, -СН(СН3)2, фенил или бензил.
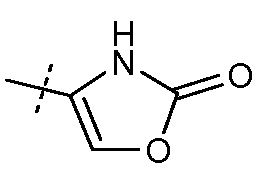
Другой аспект данного изобретения относится к соединениям формулы I, где Х означает:

Эти соединения представлены формулой IVa или IVb:
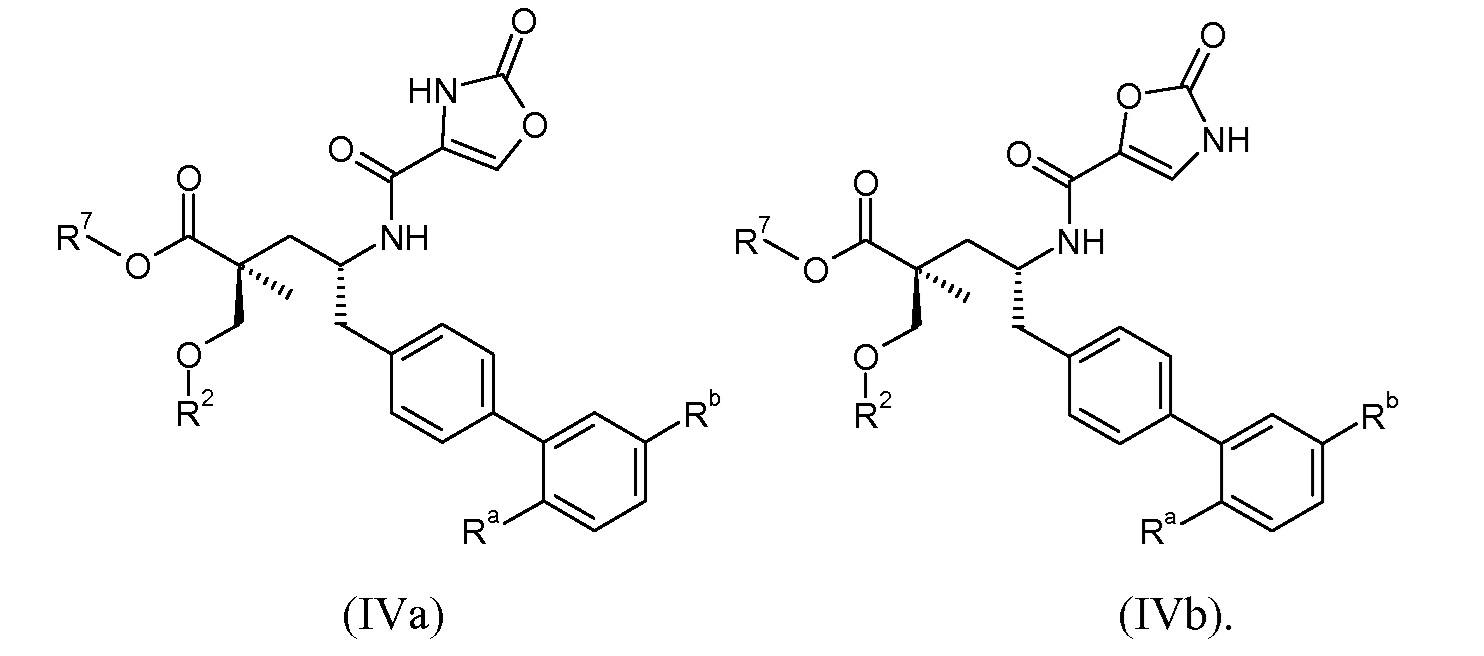
В одном воплощении соединений формул IVa и IVb, Ra означает Cl и Rb означает Н; или Ra означает Н и Rb выбирают из Cl, F, -CH3 и -CN; или Ra означает F и Rb означает Cl; R2 выбирают из Н, -С1-6-алкила, -(СН2)2-3ORe и -(CH2)2-3NReRe; и R7выбирают из Н, -С1-6-алкила, -[(CH2)2O]1-3CH3, -CHRcOC(O)-C1-4-алкила, -СН2ОС(О)СНRd-NH2, -СН2ОС(О)СНRd-NHС(О)О-С1-6-алкила, -СHRcOC(O)O-С2-4-алкила, -СHRcOC(O)O-циклогексила, -CH2CH(NH2)C(O)OCH3, -С2-4-алкилен-N(CH3)2, -С0-6-алкиленморфолинила и

где каждый Rснезависимо означает Н или -С1-3-алкил; каждый Rdнезависимо означает Н, -СН3, -СН(СН3)2, фенил или бензил; и каждый Rенезависимо означает Н или -СН3. В одном конкретном воплощении, Ra означает F, Rb означает Cl, R2 означает Н и R7означает Н.
В публикации патента США под номером 2012/0213806 раскрывается соединение формулы IVa, где Ra означает F, Rb означает Н, R2 означает Н и R7означает Н, (2S,4R)-5-(2'-фторбифенил-4-ил)-2-гидроксиметил-2-метил-4-[(2-оксо-2,3-дигидрооксазол-4-карбонил)амино]пентановая кислота, и соединение формулы IVb, где Ra означает F, Rb означает Н, R2 означает Н и R7означает Н, (2S,4R)-5-(2'-фторбифенил-4-ил)-2-гидроксиметил-2-метил-4-[(2-оксо-2,3-дигидрооксазол-5-карбонил)амино]пентановая кислота. Таким образом, другой аспект данного изобретения относится к пролекарствам этих соединений. Следовательно, в другом воплощении соединений формул IVa и IVb, Ra означает F и Rb означает Н; R2 означает Н; и R7выбирают из -С1-6-алкила, -[(CH2)2O]1-3CH3, -CHRcOC(O)-C1-4-алкила, -СН2ОС(О)СНRd-NH2, -СН2ОС(О)СНRd-NHС(О)О-С1-6-алкила, -СHRcOC(O)O-С2-4-алкила, -СHRcOC(O)O-циклогексила, -CH2CH(NH2)C(O)OCH3, -С2-4-алкилен-N(CH3)2, -С0-6-алкиленморфолинила и
где каждый Rснезависимо означает Н или -С1-3-алкил; каждый Rdнезависимо означает Н, -СН3, -СН(СН3)2, фенил или бензил.
В публикации патента США под номером 2012/0213806 конкретно раскрывается (2S,4R)-5-бифенил-4-ил-4-[(3-гидроксиизоксазол-5-карбонил)амино]-2-гидроксиметил-2-метилпентановая кислота, которая представлена формулой V' (где Ra и Rb означают Н и R3 означает -ОН):

В публикации патента США под номером 2012/0213806 также раскрываются некоторые пролекарства соединения формулы V', такие как этиловый эфир. Один аспект данного изобретения относится к другим пролекарствам и вариантам соединения формулы V'. Эти соединения представляют собой соединения формулы I, где Х означает:

Эти соединения представлены формулой V:

В одном воплощении соединений формулы V, Ra и Rb означают Н; R2 выбирают из -С1-6-алкила, -(СН2)2-3ORe и -(CH2)2-3NReRe; R3 выбирают из -ОН, -ОСН3, -ОСН2СН3 и -С1-4-алкила; и R7 означает Н; где каждый Rенезависимо означает Н или -СН3. В одном конкретном воплощении соединений формулы V, Ra и Rb означают Н; R2 означает -СН3, R3 означает -ОН или -ОСН3 и R7 означает Н.
В другом воплощении соединений формулы V, Ra выбирают из Cl и F, и Rb означает Н; или Ra означает Н и Rb выбирают из Cl, F, -CH3 и -CN; или Ra означает F и Rb означает Cl; R2 выбирают из Н, -С1-6-алкила, -(СН2)2-3ORe и -(CH2)2-3NReRe; R3 выбирают из -ОН, -ОСН3, -ОСН2СН3 и -С1-4-алкила; и R7выбирают из Н, -С1-6-алкила, -[(CH2)2O]1-3CH3, -CHRcOC(O)-C1-4-алкила, -СН2ОС(О)СНRd-NH2, -СН2ОС(О)СНRd-NHС(О)О-С1-6-алкила, -СHRcOC(O)O-С2-4-алкила, -СHRcOC(O)O-циклогексила, -CH2CH(NH2)C(O)OCH3, -С2-4-алкилен-N(CH3)2, -С0-6-алкиленморфолинила и
где каждый Rснезависимо означает Н или -С1-3-алкил; каждый Rdнезависимо означает Н, -СН3, -СН(СН3)2, фенил или бензил; и каждый Rенезависимо означает Н или -СН3. В одном конкретном воплощении соединений формулы V, Ra означает Н, Rb означает Cl, R2 означает Н, -СН3, -СН2СН3 или -(СН2)2ОН, R3 означает -ОН или -ОСН3, и R7означает Н; или Ra означает F, Rb означает Cl, R2 означает Н или -С1-6-алкил (например, -СН3 или -СН2СН3), R3 означает -ОН, -ОСН3 или -С1-4-алкил (например, -СН2СН3, -(СН2)2СН3 или -СН2СН(СН3)2) и R7означает Н.
Другой аспект данного изобретения относится к соединениям формулы I, где Х означает:

Эти соединения представлены формулой VIa или VIb:
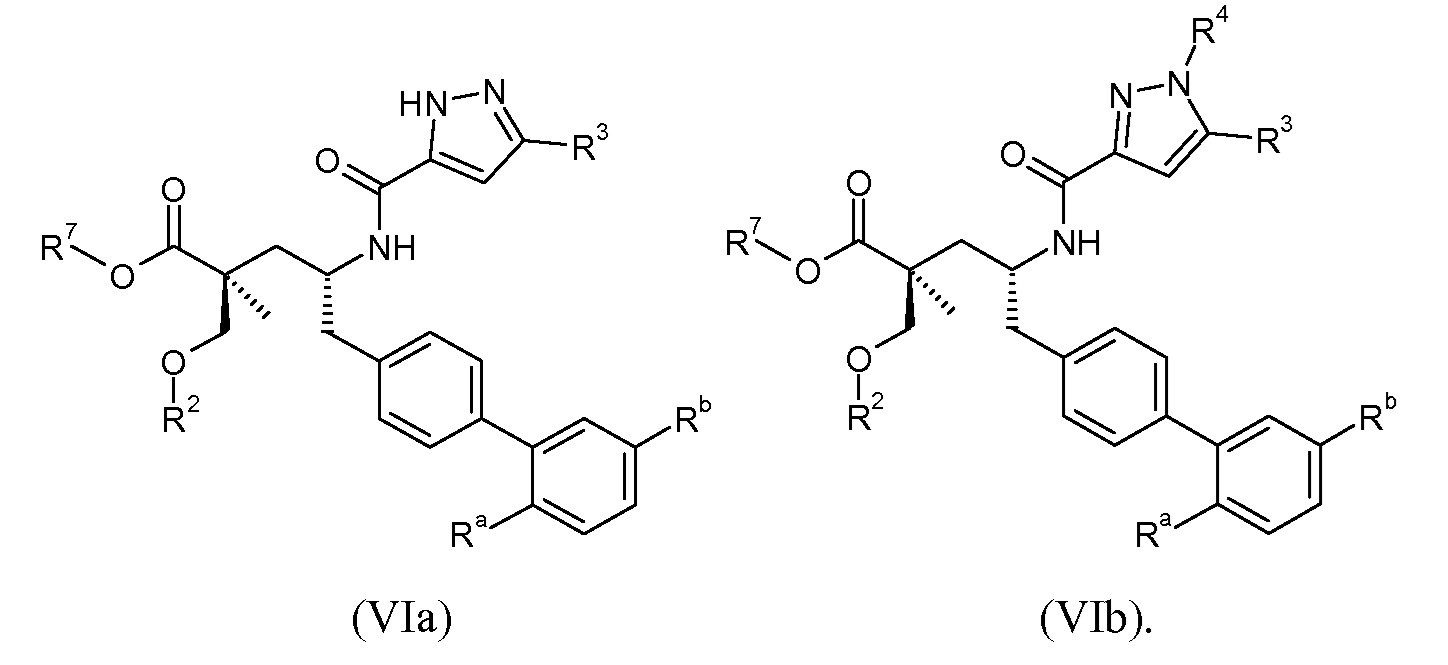
В одном воплощении соединений формулы VI, Ra выбирают из Cl и F, и Rb означает Н; или Ra означает Н и Rb выбирают из Cl, F, -CH3 и -CN; или Ra означает F и Rb означает Cl; R2 выбирают из Н, -С1-6-алкила, -(СН2)2-3ORe и -(CH2)2-3NReRe; R3 выбирают из -ОН, -ОСН3, -ОСН2СН3 и -С1-4-алкила; R4 выбирают из Н, -С1-6-алкила и фенила; и R7выбирают из Н, -С1-6-алкила, -[(CH2)2O]1-3CH3, -CHRcOC(O)-C1-4-алкила, -СН2ОС(О)СНRd-NH2, -СН2ОС(О)СНRd-NHС(О)О-С1-6-алкила, -СHRcOC(O)O-С2-4-алкила, -СHRcOC(O)O-циклогексила, -CH2CH(NH2)C(O)OCH3, -С2-4-алкилен-N(CH3)2, -С0-6-алкиленморфолинила и

где каждый Rснезависимо означает Н или -С1-3-алкил; каждый Rdнезависимо означает Н, -СН3, -СН(СН3)2, фенил или бензил; и каждый Rенезависимо означает Н или -СН3. В одном конкретном воплощении соединений формул VIa и VIb, Ra означает Н или F; Rb означает Cl; R2 означает Н или -С1-6-алкил (например, -СН3); R3 означает -ОСН3, -ОСН2СН3 или -С1-4-алкил (например, -СН(СН3)2 или -СН2СН(СН3)2); R4, если присутствует, означает Н; и R7означает Н.
Другой аспект данного изобретения относится к соединениям формулы I, где Х означает:

Эти соединения представлены формулой VIIa или VIIb:
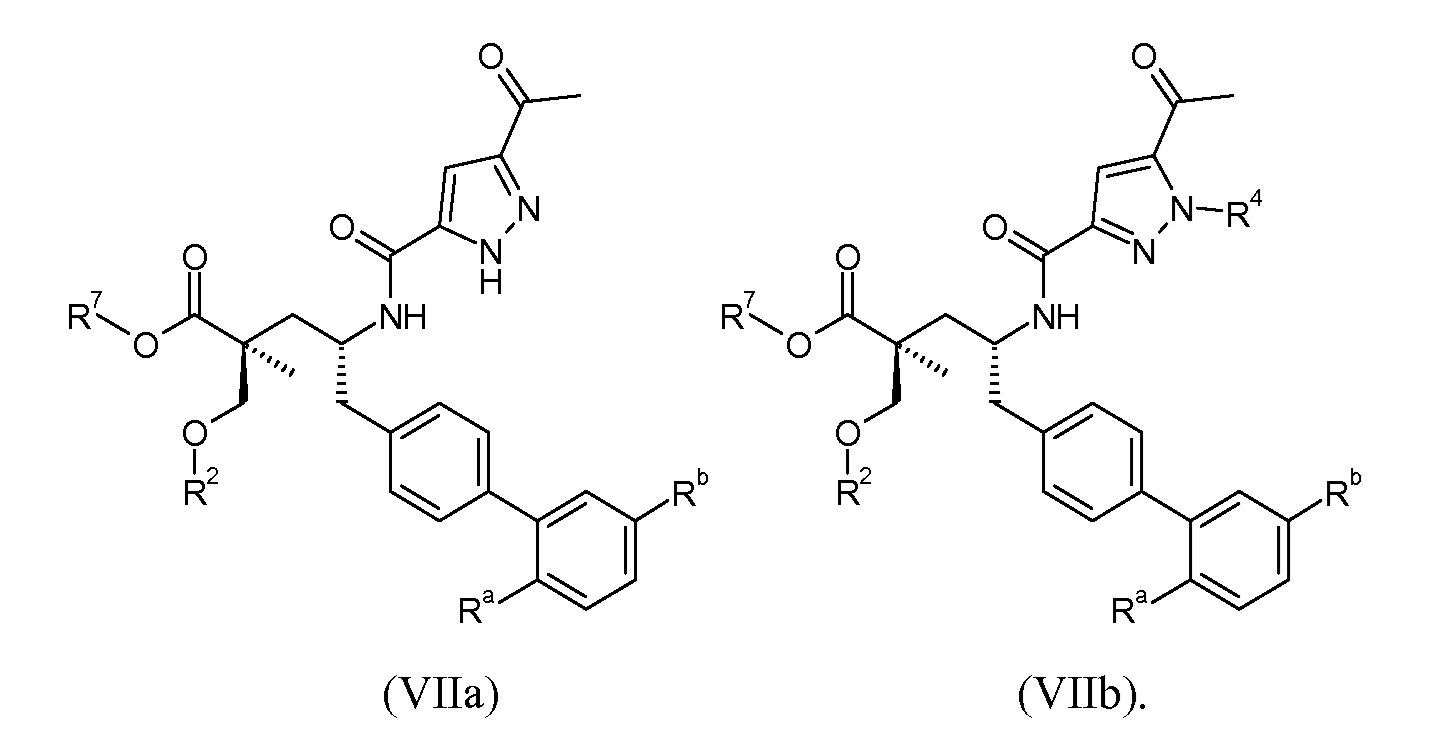
В одном воплощении соединений формулы VII, Ra выбирают из Cl и F, и Rb означает Н; или Ra означает Н и Rb выбирают из Cl, F, -CH3 и -CN; или Ra означает F и Rb означает Cl; R2 выбирают из Н, -С1-6-алкила, -(СН2)2-3ORe и -(CH2)2-3NReRe; R4 выбирают из Н, -С1-6-алкила и фенила; и R7выбирают из Н, -С1-6-алкила, -[(CH2)2O]1-3CH3, -CHRcOC(O)-C1-4-алкила, -СН2ОС(О)СНRd-NH2, -СН2ОС(О)СНRd-NHС(О)О-С1-6-алкила, -СHRcOC(O)O-С2-4-алкила, -СHRcOC(O)O-циклогексила, -CH2CH(NH2)C(O)OCH3, -С2-4-алкилен-N(CH3)2, -С0-6-алкиленморфолинила и
где каждый Rснезависимо означает Н или -С1-3-алкил; каждый Rdнезависимо означает Н, -СН3, -СН(СН3)2, фенил или бензил; и каждый Rенезависимо означает Н или -СН3. В одном конкретном воплощении соединений формул VIIa и VIIb, Ra означает F, Rb означает Cl, R2 означает Н или -С1-6-алкил (например, -СН3 или -СН2СН3), R4, если присутствует, означает Н, и R7означает Н.
Другой аспект данного изобретения относится к соединениям формулы I, где Х означает:

Эти соединения представлены формулой VIII:

В одном воплощении соединений формулы VIII, Ra выбирают из Cl и F, и Rb означает Н; или Ra означает Н и Rb выбирают из Cl, F, -CH3 и -CN; или Ra означает F и Rb означает Cl; R2 выбирают из Н, -С1-6-алкила, -(СН2)2-3ORe и -(CH2)2-3NReRe; и R7выбирают из Н, -С1-6-алкила, -[(CH2)2O]1-3CH3, -CHRcOC(O)-C1-4-алкила, -СН2ОС(О)СНRd-NH2, -СН2ОС(О)СНRd-NHС(О)О-С1-6-алкила, -СHRcOC(O)O-С2-4-алкила, -СHRcOC(O)O-циклогексила, -CH2CH(NH2)C(O)OCH3, -С2-4-алкилен-N(CH3)2, -С0-6-алкиленморфолинила и

где каждый Rснезависимо означает Н или -С1-3-алкил; каждый Rdнезависимо означает Н, -СН3, -СН(СН3)2, фенил или бензил; и каждый Rенезависимо означает Н или -СН3.
Другой аспект данного изобретения относится к соединениям формулы I, где Х означает:
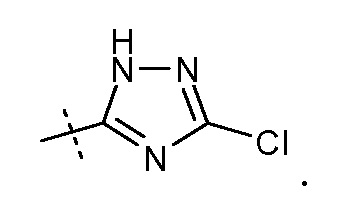
Эти соединения представлены формулой IX:

В одном воплощении соединений формулы IX, Ra выбирают из Cl и F, и Rb означает Н; или Ra означает Н и Rb выбирают из Cl, F, -CH3 и -CN; или Ra означает F и Rb означает Cl; R2 выбирают из Н, -С1-6-алкила, -(СН2)2-3ORe и -(CH2)2-3NReRe; и R7выбирают из Н, -С1-6-алкила, -[(СН2)2О]1-3СН3, -СНRcOCO-С1-4-алкила, -СН2ОС(О)СНRd-NH2, -CH2OC(O)CHRd-NHC(O)O-C1-6-алкила, -CHRсOC(O)O-C2-4-алкила, -CHRcOC(O)O-циклогексила, -СН2СН(NH2)C(O)OCH3, -C2-4-алкилен-N(CH3)2, -C0-6-алкиленморфолинила и

где каждый Rc независимо означает Н или -С1-3-алкил; каждый Rd независимо означает Н, -СН3, -СН(СН3)2, фенил или бензил; и каждый Re независимо означает Н или -СН3.
Общие способы синтеза
Соединения согласно данному изобретению могут быть получены из легко доступных исходных веществ, используя следующие общие способы, изложенные в Примерах методики, или путем использования других способов, реагентов и исходных веществ, которые известны квалифицированному специалисту в данной области. Хотя следующие способы могут иллюстрировать отдельное воплощение данного изобретения, понятно, что другие воплощения данного изобретения могут быть подобным образом получены, используя те же самые или подобные способы, или путем использования других способов, реагентов и исходных веществ, известных квалифицированному специалисту в данной области. Также должно быть понятно, что, где указываются типичные или предпочтительные условия способа (например, температуры реакции, времена, молярные соотношения, растворители, давления и т.д.), также могут быть использованы другие условия способа, за исключением иначе указанного. В некоторых случаях реакции осуществляют при комнатной температуре и не считают актуальным измерение температуры. Понятно, что имеют в виду, что комнатная температура может быть температурой в диапазоне, обычно ассоциированном с комнатной температурой в окружающей среде лаборатории и типично должна быть в диапазоне от примерно 18°С до примерно 30°С. В других случаях, реакции проводят при комнатной температуре и температуру действительно измеряют и регистрируют. Тогда как оптимальные условия реакции типично могут варьироваться в зависимости от различных параметров реакции, как, например, определенные реагенты, растворители и используемые количества, квалифицированный специалист в данной области легко может определять подходящие условия реакции, используя обычные способы оптимизации.
Дополнительно, как должно быть очевидно квалифицированному специалисту в данной области, могут быть необходимыми или желательными обычные защитные группы для препятствования некоторым функциональным группам подвергаться нежелательным реакциям. Выбор подходящей защитной группы для конкретной функциональной группы, а также выбор подходящих условий и реагентов для защиты и удаления защиты в случае таких функциональных групп хорошо известны в уровне техники. Могут быть использованы, если желательно, защитные группы, другие, чем таковые, проиллюстрированные в описанных в данном контексте способах. Например, многочисленные защитные группы и их введение и удаление описаны в руководстве T.W. Greene и G.M. Wuts, Protective Groups in Organic Synthesis, четверое издание, Wiley, Нью-Йорк, 2006, и цитированных в этом отношении ссылках.
Защитные для карбоксила группы являются подходящими для предотвращения нежелательных реакций по карбоксильной группе и их примеры включают, но не исчерпывающим образом, метил, этил, трет-бутил, бензил (Bn), п-метоксибензил (РМВ), 9-флуоренилметил (Fm), триметилсилил (TMS), трет-бутилдиметилсилил (TBDMS), дифенилметил (бензгидрил, DPM) и т.п. Защитные для аминогруппы группы являются подходящими для предотвращения нежелательных реакций по аминогруппе и их примеры включают, но не исчерпывающим образом, трет-бутоксикарбонил (ВОС), тритил (Tr), бензилоксикарбонил (Cbz), 9-флуоренилметоксикарбонил (Fmoc), формил, триметилсилил (TMS), трет-бутилдиметилсилил (TBDMS) и т.п. Защитные для гидроксила группы являются подходящими для предотвращения нежелательных реакций по гидроксильной группе и их примеры включают, но не исчерпывающим образом, С1-6-алкильные группы, силильные группы, включающие три-С1-6-алкилсилильные группы, как, например, триметилсилил (TMS), триэтилсилил (TES), трет-бутилдиметилсилил (TBDMS); сложноэфирные группы (ацильные группы), включающие С1-6-алканоильные группы, как, например, формил, ацетил и пивалоил, и ароматические ацильные группы, как, например, бензоил; арилметильные группы, как, например, бензил (Bn), п-метоксибензил (РМВ), 9-флуоренилметил (Fm) и дифенилметил (бензгидрил, DPM); и т.п.
Для удаления защитных групп используют стандартные способы удаления защиты и реагенты и они могут варьироваться в зависимости от того, какая группа использована. Например, гидроксид натрия или калия обычно используют, когда защитной для карбоксила группой является метил, кислоту, такую как TФУК или HCl (например, 4,0М HCl в 1,4-диоксане) обычно используют, когда защитной для карбоксила группой является этил или трет-бутил, и Н2/Pd/C может быть использован, когда защитной для карбоксила группой является бензил. Защитная для аминогруппы группа ВОС может быть удалена при использовании кислотного реагента, как, например, ТФУК или HCl в 1,4-диоксане, тогда как защитная для аминогруппы группа Cbz может быть удалена путем использования условий каталитического гидрирования, как, например, Н2 (1 атм) и 10%-ый Pd/C в спиртовом растворителе («Н2/Pd/C»). Н2/Pd/C обычно используют, когда защитной для гидроксила группой является бензил, тогда как NaOH обычно используют, когда защитной для гидроксила группой является ацильная группа.
Удаляемые группы представляют собой функциональные группы или атомы, которые могут быть заменены другой функциональной группой или атомом по реакции замещения, такой как реакция нуклеофильного замещения. В качестве примера, типичные удаляемые группы включают хлор-, бром- и иод-группы; группы эфира сульфоновой кислоты, такие как мезилат, тозилат, брозилат, нозилат и т.п.; и ацилоксигруппы, как, например, ацетокси, трифторацетокси и т.п.
Подходящие основания, для использования в этих схемах, включают, в качестве иллюстрации, а не ограничения, карбонат калия, карбонат кальция, карбонат натрия, триэтиламин (Et3N), пиридин, 1,8-диазабицикло-{5,4,0]ундец-7-ен (DBU), N,N-диизопропилэтиламин (DIPEA), 4-метилморфолин, гидроксид натрия, гидроксид калия, трет-бутоксид калия и гидриды металлов.
Подходящие инертные разбавители или растворители для использования в этих схемах включают, в качестве иллюстрации, а не ограничения, тетрагидрофуран (ТГФ), ацетонитрил (MeCN), N,N-диметилформамид (ДМФА), N,N-диметилацетамид (DMA), диметилсульфоксид (ДМСО), толуол, дихлорметан (DCM), хлороформ (CHCl3), тетрахлорид углерода (CCl4), 1,4-диоксан, метанол, этанол, воду, диэтиловый эфир, ацетон и т.п.
Подходящие реагенты связывания карбоновая кислота/амин включают бензотриазол-1-илокситрис(диметиламино)фосфоний гексафторфосфат (ВОР), бензотриазол-1-илокситрипирролидинофосфонийгексафторфосфат (PyBOP), N,N,N',N'-тетраметил-О-(7-азабензотриазол-1-ил)уронийгексафторфосфат (HATU), 1,3-дициклогексилкарбодиимид (DCC). N-диметиламинопропил)-N'-этилкарбодиимид (EDC), карбонилдиимидазол (CDI), 1-гидроксибензотриазол (HOBt) и т.п. Реакции связывания проводят в инертном разбавителе в присутствии основания, такого как DIPEA, и осуществляют при обычных условиях образования амидной связи.
Все реакции типично проводят при температуре в пределах диапазона от примерно 78°С до 100°С, например, при комнатной температуре. Реакции могут быть контролируемыми путем использования тонкослойной хроматографии (ТСХ), высокоэффективной жидкостной хроматографии (ВЭЖХ) и/или LCMS до завершения. Реакции могут быть завершены в течение минут или могут длиться часами, типично от 1-2 часов и вплоть до 48 часов. После завершения, полученная в результате смесь или продукт реакции могут быть подвергнуты дальнейшей обработке для получения желательного продукта. Например, полученная в результате смесь или продукт реакции могут быть подвергнуты одной или более следующим операциям: концентрирование или распределение (например, между этилацетатом и водой или между 5% ТГФ в EtOAc и 1М фосфорной кислотой), экстракция (например, с помощью EtOAc, CHCl3, DCM, хлороформа); промывка (например, с помощью насыщенного водного раствора NaCl, насыщенного водного раствора NaHCO3, водного раствора Na2CO3 (5%), CHCl3 или 1М раствора NaOH); высушивание (например, над MgSO4, Na2SO4 или в вакууме); фильтрация; кристаллизация (например, из этилацетата и гексанов); концентрирование (например, в вакууме); и/или очистка (например, хроматография на силикагеле, флэш-хроматография, препаративная ВЭЖХ, ВЭЖХ с обращенными фазами или кристаллизация).
В качестве иллюстрации, соединения формулы (I), а также их соли, могут быть получены, как представлено на схемах I-IV.
Схема I

Схема I представляет собой реакции переэтерификации. Обычно, эта реакция включает введение во взаимодействие, при нагревании, сложного эфира, желательного спирта (HO-R7) и подходящего кислотного ктализатора, например, хлороводородной кислоты. Спирты HO-R7 являются либо коммерчески доступными, либо могут быть получены способами, которые известны в уровне техники или описаны в данном контексте. Типичные группы HO-R7 включают HO-CH2CF2CH3, HO-CH2CF2CF3 и
Схема II

Схема II представляет собой реакцию нуклеофильного замещения, где L означает подходящую удаляемую группу. Обычно, эту реакцию осуществляют в присутствии подходящего основания, как, например, триэтиламин, в подходящем инертном разбавителе или растворителе, таком как ацетон. Соединение L-R7 является либо коммерчески доступным, либо может быть получено способами, которые известны в уровне техники или описаны в данном контексте.
Схема III

Схема III представляет собой реакцию нуклеофильного замещения, где L означает подходящую удаляемую группу. Обычно, эту реакцию осуществляют в присутствии подходящего основания, как, например, N,N-диизопропилэтиламин, в подходящем инертном разбавителе или растворителе, таком как дихлорметан. Соединение L-R2 является либо коммерчески доступным, либо может быть получено способами, которые известны в уровне техники или описаны в данном контексте. Типичные соединения L-R2 включают Cl-C(O)-CH3, Cl-C(O)-CH(CH3)2 и Cl-C(O)-CH2CH(CH3)2.
Схема IV

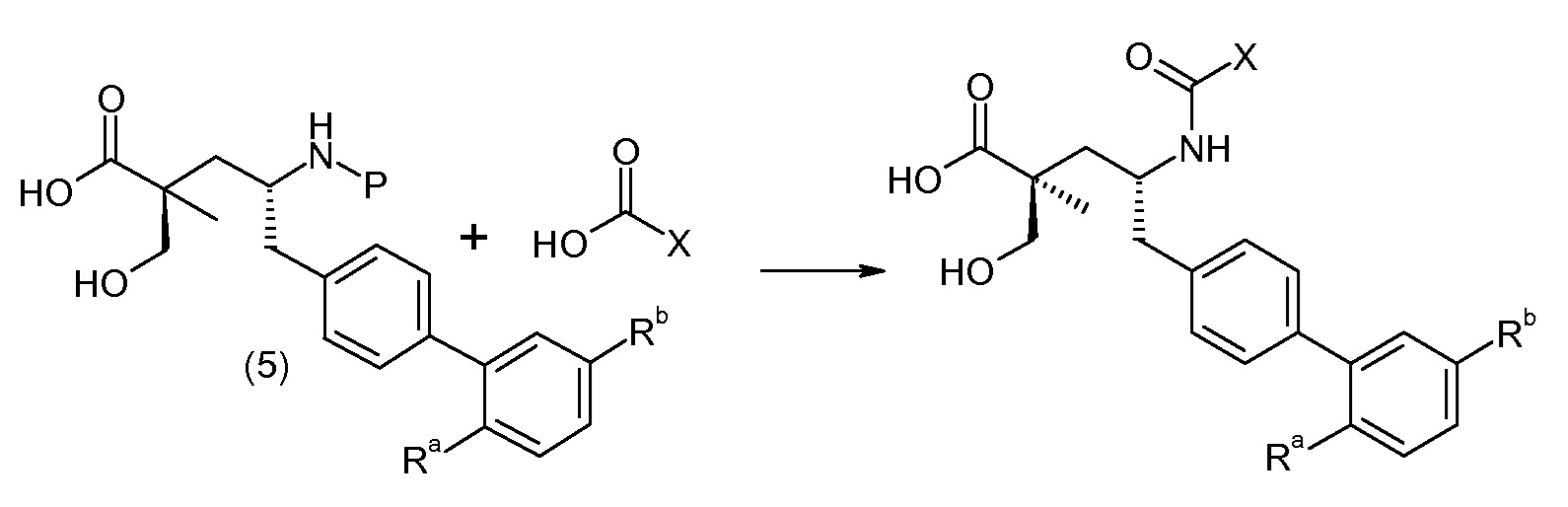
Схема IV представляет собой реакцию связывания, где Р означает Н или подходящую защитную для аминогруппы группу. Когда Р является защитной для аминогруппы группой, способ далее включает удаление защиты от соединения, до или in situ, по отношению к стадии связывания. Типичные связывающие реагенты включают HATU и HOВt с EDC. Обычно, эту реакцию осуществляют в присутствии основания, как, например, DIPEA или 4-метилморфолин, и инертного разбавителя или растворителей, как, например, ДМФА или DMA. Исходные карбоновые кислоты обычно являются либо коммерчески доступными, либо могут быть получены, используя способы, которые известны в данной области.
В качестве иллюстрации, соединения формул II-X, а также их соли, могут быть получены, как представлено на схеме V.
Схема V

(R)-3-(4-бромфенил)-2-трет-бутоксикарбониламинопропионовую кислоту и желательную галогенфенилбороновую кислоту комбинируют с палладиевым катализатором в инертном разбавителе в присутствии подходящего основания, как, например, карбонат калия или карбонат натрия. Типичные галогенфенилбороновые кислоты представляют собой 2-фторфенилбороновую кислоту, 3-фторфенилбороновую кислоту, 2-хлорфенилбороновую кислоту, 3-хлорфенилбороновую кислоту и 2-фтор-5-хлорфенилбороновую кислоту. Типичные палладиевые катализаторы включают 1,1-бис(дифенилфосфино)ферроценпалладийхлорид, дихлорбис(трифенилфосфин)палладий(II), бис(трет-бутилфосфин)палладий(0) и тетракис(трифениофосфин)палладий(0).
Соединение (1) затем превращают в соединение 5 (где Р означает Н или подходящую защитную для аминогруппы группу) путем осуществляемого в несколько стадий способа, который подробно представлен в разделе Примеры.

В заключение, соединение (5) связывают с желательной Х-группой, как представлено выше на схеме IV:
Дальнейшие подробности относительно конкретных условий реакции и других способов для получения типичных соединений согласно данному изобретению или их промежуточных продуктов описаны в нижеприводимых примерах.
ПОЛЕЗНОСТЬ
Соединение формулы I' обладает активностью как ингибитор неприлизина и полагают, что оно обладает терапевтической полезностью в качестве ингибитора неприлизина. Предполагают, что пролекарства этого соединения, как только метаболизируются in vivo, обладают такой же полезностью. Таким образом, когда обсуждают активность соединений согласно изобретению, понятно, что эти пролекарства обладают предполагаемой активностью, как только метаболизируются.
Типичные анализы включают, в качестве иллюстрации, а не ограничения, анализы, в случае которых определяют NEP-ингибирование. Пригодные вспомогательные анализы включают анализы в отношении определения АСЕ-ингибирования и ингибирования аминопептидазы Р (АРР) (например, как описано Sulpizio и др, (2005), JPET, 315, 1306-1313). Фармакодинамический анализ для оценки in vivo ингибирующих активностей в отношении АСЕ и NEP в случае анестезированных крыс описан Seymour и др. (1985), Hypertension 7 (дополнение I): I-35-I-42, и Wigle и др. (1992) Can. J. Physiol. Pharmacol., 70, 1525-1528), где АСЕ-ингибирование определяют в виде ингибирования в процентах вазопрессорного ответа на ангиотензин I и ингибирование NEP определяют в виде увеличивающегося выхода мочевого циклического гуанизин-3',5'-монофосфата (сGMP).
Также имеется множество in vivo анализов, которые могут быть использованы. Модель находящейся в сознании спонтанно гипертензивной крысы (SHR) представляет собой модель ренинзависимой гипертензии. См., например, Intengan и др. (1999), Circulation, 100 (22), 2267-2275, и Badyal и др., (2003), Indian Journal of Pharmacology, 35, 349-362. Модель находящейся в сознании крысы с дезоксикортикостеронацетатной солью (DOCA-соль) представляет собой модель объем-зависимой гипертензии, которая пригодна для определения активности NEP. См., например, Trapani и др. (1989), J. Cardiovasc. Pharmacol., 14, 419-424, Intengan и др. (1999), Hypertension, 34 (4), 907-913, и Badyal и др., (2003), см. выше. Модель DOCA-соли особенно пригодна для оценки способности тестируемого соединения снижать кровяное давление, а также для определения способности тестируемого соединения для предотвращения или замедления повышения кровяного давления. Модель чувствительной к Dahl-соли (DSS) гипертензивной крысы представляет собой модель гипертензии, которая чувствительна к поваренной соли (NaCl) и описана, например, Rapp (1982), Hypertension, 4, 753-763. Монокроталиновая крысиная модель легочной артериальной гипертензии, описанная, например, Kato и др. (2008), J. Cardiovasc. Pharmacol., 51 (1), 18-23, является надежным показателем клинической эффективности для лечения легочной артериальной гипертензии. Животные модели сердечной недостаточности включают DSS крысиную модель сердечной недостаточности и модель аорто-кавальной фистулы (AV-шунт), последняя из которых описана, например, Norling и др. (1996), J. Amer. Soc. Nephrol., 7, 1038-1044. Другие животные модели, как, например, тесты на горячую пластинку, на резкое движение хвостом и на формалин, могут быть использованы для определения аналгезирующих свойств соединения, а также модель лигирования спинно-мозгового нерва (SNL) относительно нейрогенной боли. См., например, Malmberg и др. (1999), Current Protocols in Neuroscience, 8.9.1-8.9.15. Другие свойства и полезности соединений могут быть продемонстрированы, используя различные in vitro и in vivo анализы, хорошо известные квалифицированному специалисту в данной области.
Предполагают, что соединения согласно данному изобретению пригодны для лечения и/или предотвращения медицинских состояний, восприимчивых к ингибированию NEP. Таким образом, предполагают, что пациенты, страдающие от заболевания или нарушения, которых подвергают лечению путем ингибирования NEP-фермента или путем повышения уровней его пептидных субстратов, могут быть подвергнуты лечению путем введения терапевтически эффективного количества соединения согласно данному изобретению. Например, полагают, что путем ингибирования NEP соединение потенцирует биологические воздействия эндогенных пептидов, которые метаболизируются посредством NEP, как, например, натрийуретические пептиды, бомбезин, брадикинины, кальцитонин, эндотелины, энкефалины, нейротензин, вещество Р и вазоактивный интестинальный пептид. Таким образом, полагают, что соединения обладают другими физиологическими воздействиями, например, на почечную, центральную нервную, репродуктивную и желудочно-кишечную системы.
Сердечно-сосудистые заболевания
Полагают, что за счет потенцирования воздействий вазоактивных пептидов, подобных натрийуретическим пептидам и брадикинину, соединения согласно данному изобретению являются полезными при лечении и/или предотвращении медицинских состояний, как, например, сердечно-сосудистые заболевания. См., например, Roques и др. (1993), Pharmacol. Rev., 45, 87-146, и Dempsey и др. (2009), Amer. J. of Pathology, 174 (3), 782-796. Сердечно-сосудистые заболевания, представляющие интерес, включают гипертензию и сердечную недостаточность. Гипертензия включает, в качестве иллюстрации, а не ограничения, первичную гипертензию, которая также упоминается как первичная артериальная гипертензия или гипертоническая болезнь; симптоматическую артериальную гипертензию; гипертензию с сопровождающим заболеванием почек; тяжелую гипертензию с сопровождающим заболеванием почек или без него; легочную гипертензию, включающую легочную артериальную гипертензию; и резистентную гипертензию. Сердечная недостаточность включает, в качестве иллюстрации, а не в качестве ограничения, застойную сердечную недостаточность; острую сердечную недостаточность; хроническую сердечную недостаточность, например, с уменьшенной долей левожелудочкового выброса (также упоминаемую как систолическая сердечная недостаточность) или с сохраненной долей левожелудочкового выброса (также упоминаемую как диастолическая сердечная недостаточность); и острую и хроническую декомпенсированную сердечную недостаточность с сопровождающим заболеванием почек или без него. Таким образом, одно воплощение данного изобретения относится к способу лечения гипертензии, особенно первичной гипертензии или легочной артериальной гипертензии, включающему введение пациенту терапевтически эффективного количества соединения согласно данному изобретению.
Для лечения первичной гипертензии, терапевтически эффективное количество типично представляет собой количество, которое является достаточным для снижения кровяного давления у пациентов. Эта гипертензия включает как от легкой до умеренной гипертензию, так и тяжелую гипертензию. Когда используют для лечения гипертензии, соединение может быть введено в комбинации с терапевтическими агентами, как, например, антагонисты альдостерона, ингибиторы ангиотензинконвертирующего фермента и двойного действия ингибиторы ангиотензинконвертирующего фермента/неприлизина, активаторы и стимуляторы ангиотензинконвертирующего фермента 2 (АСЕ2), ангиотензин-II-вакцины, антидиабетические агенты, антилипидные агенты, антитромботические агенты, антагонисты рецептора АТ1 и двойного действия ингибиторы антагониста рецептора АТ1/неприлизина, антагонисты β1-адренергического рецептора, двойного действия антагонисты β-адренергического рецептора/α1-рецептора, блокаторы кальциевого канала, диуретики, антагонисты эндотелинового рецептора, ингибиторы эндотелинконвертирующего фермента, ингибиторы неприлизина, натрийуретические пептиды и их аналоги, антагонисты рецептора клиренса натрийуретического пептида, доноры оксида азота, нестероидные противовоспалительные агенты, ингибиторы фосфодиэстеразы (особенно ингибиторы PDE-V), агонисты рецептора простагландина, ингибиторы ренина, стимуляторы и активаторы растворимой гуанилатциклазы и их комбинации. В одном отдельном воплощении данного изобретения, соединение согласно данному изобретению комбинируют с антагонистом рецептора АТ1, диуретиком, блокатором кальциевого канала или их комбинацией и используют для лечения первичной гипертензии. В другом отдельном воплощении данного изобретения, соединение согласно данному изобретению комбинируют с антагонистом рецептора АТ1 и используют для лечения гипертензии с сопровождающим заболеванием почек.
Для лечения легочной артериальной гипертензии, терапевтически эффективное количество типично представляет собой количество, которое является достаточным для уменьшения легочной васкулярной резистентности. Другими целями терапии являются улучшение способности пациентов к физическим нагрузкам. Например, при клиническом регулировании, терапевтически эффективное количество может представлять собой количество, которое улучшает способность пациентов к комфортабельности ходьбы в течение периода времени 6 минут (покрывая расстояние приблизительно 20-40 метров). Когда используют для лечения легочной артериальной гипертензии, соединение может быть введено в комбинации с другими терапевтическими агентами, как, например, α-адренергические антагонисты, антагонисты β1-адренергического рецептора, агонисты β2-адренергического рецептора, ингибиторы ангиотензинконвертирующего фермента, антикоагулянты, блокаторы кальциевого канала, диуретики, антагонисты рецептора эндотелина, ингибиторы PDE-V, аналоги простагландина, селективные ингибиторы повторного поглощения серотонина и их комбинации. В одном отдельном воплощении данного изобретения, соединение согласно данному изобретению комбинируют с ингибитором PDE-V или селективным ингибитором повторного поглощения серотонина и используют для лечения легочной артериальной гипертензии.
Другое воплощение данного изобретения относится к способу лечения сердечной недостаточности, в особенности, застойной сердечной недостаточности (включая как систолическую, так и диастолическую застойную сердечную недостаточность), включающему введение пациенту терапевтически эффективного количества соединения согласно данному изобретению. Типично, терапевтически эффективное количество представляет собой количество, которое является достаточным для снижения кровяного давления и/или улучшения функций почек. При клиническом регулировании, терапевтически эффективное количество может быть количеством, которое является достаточным для улучшения сердечных гемодинамик, подобных, например, снижению заклинивающего давления, правого предсердного давления, давления наполнения и васкулярной резистентности. В одном воплощении, соединение вводят в виде внутривенной лекарственной формы. Когда используют для лечения сердечной недостаточности, соединение может быть введено в комбинации с другими терапевтическими агентами, как, например, антагонисты рецептора аденозина, разрушители конечного продукта повышенного гликозилирования, антагонисты альдостерона, антагонисты рецептора АТ1, антагонисты β1-адренергического рецептора, двойного действия антагонисты β-адренергического рецептора/α1-рецептора, ингибиторы химазы, дигоксин, диуретики, ингибиторы эндотелинконвертирующего фермента (ЕСЕ), антагонисты рецептора эндотелина, натрийуретические пептиды и их аналоги, антагонисты рецептора клиренса натрийуретического пептида, доноры оксида азота, аналоги простагландина, ингибиторы PDE-V, активаторы и стимуляторы растворимой гуанилатциклазы и антагонисты рецептора вазопрессина. В одном отдельном воплощении данного изобретения, соединение согласно данному изобретению комбинируют с антагонистом альдостерона, антагонистом β1-адренергического рецептора, антагонистом рецептора АТ1 или диуретиком и используют для лечения застойной сердечной недостаточности.
Диарея
Предполагают, что в качестве ингибиторов NEP, соединения согласно данному изобретению ингибируют деградацию эндогенных энкефалинов и, таким образом, такие соединения также могут являться полезными для лечения диареи, включая инфекционную и секреторную/с водянистым стулом диарею. См., например, Baumer и др. (1992), Gut., 33, 753-758; Farthing (2006), Digestive Diseases, 24, 47-58; и Marçais-Collado (1987), Eur. J. Pharmacol., 144 (2), 125-132. Когда используют для лечения диареи, соединения согласно данному изобретению могут быть комбинированы с одной или более дополнительными антидиарейными терапиями.
Заболевания почек
Предполагают, что за счет потенцирования воздействий вазоактивных пептидов, подобных найтрийуретическим пептидам и брадикинину, соединения согласно данному изобретению усиливают функцию почек (см. Chen и др. (1999), Circulation, 100, 2443-2448; Lipkin и др. (1997), Kidney Int., 52, 792-801; и Dussaule и др. (1993), Clin. Sci., 84, 31-39) и являются полезными при лечении и/или предотвращении заболеваний почек. Заболевания почек, представляющие особенный интерес, включают диабетическую нефропатию, хроническое заболевание почек, протеинурию и особенно критическое повреждение почки или острую почечную недостаточность (см. Sharkovska и др. (2011), Clin. Lab., 57, 507-515, и Newaz и др. (2010)Ю Renal Failure, 32, 384-390). Когда используют для лечения заболевания почек, соединение может быть введено в комбинации с другими терапевтическими агентами, как, например, ингибиторы ангиотензинконвертирующего фермента, антагонисты рецептора АТ1 и диуретики.
Превентивная терапия
Предполагают, что за счет потенцирования эффектов натрийуретических пептидов соединения согласно данному изобретению также являются пригодными при превентивной терапии благодаря антигипертрофическим и антифибротическим эффектам натрийуретических пептидов (см. Potter и др. (2009), Handbook of Experimental Pharmacology, 191, 341-366), например, при предотвращении прогрессирования сердечной недостаточности после инфаркта миокарда, предотвращении артериального рестеноза после ангиопластики, предотвращении утолщения стенок кровеносных сосудов после операций в случае сосудов, предотвращении атеросклероза и предотвращении диабетической ангиопатии.
Глаукома
Предполагают, что за счет потенцирования эффектов натрийуретических пептидов соединения согласно данному изобретению также являются пригодными при лечении глаукомы. См., например, Diestelhorst и др. (1989), International Ophtalmology, 12, 99-101. Когда используют для лечения глаукомы, соединения согласно данному изобретению могут быть комбинированы с одним или более дополнительными средствами против глаукомы.
Ослабление боли
Подразумевают, что в качестве ингибиторов NEP соединения согласно данному изобретению ингибируют деградацию эндогенных энкефалинов и, таким образом, такие соединения также могут быть полезными в качестве аналгетиков. См., например, Roques и др. (1980), Nature, 288, 286-288, и Thanawala и др. (2008), Current Drug Targets, 9, 887-894. Когда используют для лечения боли, соединения согласно данному изобретению могут быть комбинированы с одним или более дополнительными антиноницептивными лекарственными средствами, как, например, ингибиторы аминопептидазы N или дипептидилпептидазы III, нестероидные противовоспалительные агенты, ингибиторы повторного поглощения моноамина, мышечные релаксанты, антагонисты рецептора NMDA, агонисты опиоидного рецептора, агонисты рецептора серотонина 5-НТ1D и трициклические антидепрессанты.
Другие полезности
Подразумевают, что вследствие их свойств ингибирования NEP соединения согласно данному изобретению также являются пригодными в качестве противокашлевых агентов, а также являются полезными при лечении портальной гипертензии, ассоциированной с циррозом печени (см. Sansoe и др. (2005), J. Hepatol., 43, 791-798), рака (см. Vesely (2005), J. Investigative Med., 53, 360-365), депрессии (см. Noble и др. (2007), Exp. Opin. Ther. Targets, 11, 145-159), менструальных нарушений, преждевременных родов, преэклампсии, эндометриоза, репродуктивных нарушений (например, мужское и женское бесплодие, синдром поликистозных яичников, имплантационная недостаточность) и мужской и женской половой дисфункции, включая мужскую эрективную дисфункцию и нарушение женской половой активации. Более конкретно, подразумевают, что соединения согласно данному изобретению являются пригодными при лечении женской половой дисфункции (см. Pryde и др. (2006), J. Med. Chem., 49, 4409-4424), которую часто определяют как затруднение или неспособность женщин находить удовлетворение в половой экспрессии. Это включает множество различных половых нарушений у женщин, включая, в качестве иллюстрации, а не ограничения, нарушение в отношении гипоактивности полового желания, нарушение половой активации, нарушение оргазма и нарушение в отношении половой боли. Когда используют для лечения таких нарушений, особенно женской половой дисфункции, соединения согласно данному изобретению могут быть комбинированы с одним или более следующих вспомогательных агентов: ингибиторы PDE-V, агонисты допамина, агонисты и/или антагонисты рецептора эстрогена, андрогены и эстрогены. Подразумевают, что, вследствие их свойств ингибирования NEP, соединения согласно данному изобретению также обладают противовоспалительными свойствами, и предполагают, что они обладают полезностью как таковая, особенно, когда используют в комбинации со статинами.
Недавние исследования наводят на мысль, что NEP играет роль в регуляции нервной функции при инсулинзависимом сахарном диабете и индуцируемом диетой ожирении. Coppey и др. (2011), Neuropharmacology, 60, 259-266. Следовательно, предполагают, что, вследствие их свойств ингибирования NEP, соединения согласно данному изобретению являются пригодными в отношении обеспечения защиты от нервного ухудшения, вызываемого диабетом или индуцируемым диетой ожирением.
Количество соединения согласно данному изобретению, вводимое на дозу, или общее количество, вводимое в сутки, может быть предопределено или может быть установлено на основе индивидуального пациента путем принятия во внимание многочисленных факторов, включая природу и тяжесть состояния пациента, подвергаемое лечению состояние, возраст и общее состояние здоровья пациента, толерантность пациента к активному агенту, путь введения, фармакологические факторы, как, например, активность, эффективность, фармакокинетитические и токсикологические профили соединения, и любые вводимые вспомогательные агенты, и т.п. Лечение пациента, страдающего от заболевания или медицинского состояния (как, например, гипертензия), можно начинать с предопределенной дозы или дозы, установленной лечащим врачом, и можно продолжать в течение периода времени, необходимого для предотвращения, ослабления, подавления или облегчения симптомов заболевания или медицинского состояния. Пациентов, подвергающихся такому лечению, можно типично контролировать на обычной основе для определения эффективности терапии. Например, при лечении гипертензии, измерения кровяного давления могут быть использованы для определения эффективности лечения. Подобные указатели для других заболеваний и состояний, описанных выше, хорошо известны и легко доступны лечащему врачу. Непрерывный мониторинг врачом может обеспечивать то, что должно быть введено в любое заданное время оптимальное количество соединения согласно данному изобретению, а также облегчение установления продолжительности лечения. Это имеет особое значение, когда также вводят дополнительные агенты, так как их выбор, доза и продолжительность лечения также могут требовать регулирования. В этом отношении, расписание режима лечения и дозы может быть корректировано в процессе лечения, так, чтобы вводилось самое низкое количество активного агента, которое показывает желательную эффективность, и, далее, чтобы введение являлось непрерывным только настолько продолжительно, как необходимо для успешного лечения заболевания или медицинского состояния.
Инструменты для исследования
Так как соединения согласно данному изобретению метаболизируются in vivo до соединений, обладающих активностью в качестве ингибиторов неприлизина, они также могут быть пригодны в качестве инструментов для исследования в целях изучения или исследования биологических систем или образцов, включающих NEP-фермент, например, для исследования заболеваний, где играют роль NEP-фермент или его пептидные субстраты. Соответственно, один аспект данного изобретения относится к способу использования соединения согласно данному изобретению в качестве инструмента для исследования, включающему проведение биологического теста, используя соединение согласно данному изобретению. Любая подходящая биологическая система или образец, включающая(ий) NEP-фермент, может быть использована(использован) в таких исследованиях, которые могут быть осуществлены либо in vitro, либо in vivo. Типичные биологические системы или образцы, подходящие для таких исследований, включают, но не исчерпывающим образом, клетки, клеточные экстракты, цитоплазматические мембраны, образцы тканей, изолированные органы, млекопитающих (как, например, мыши, крысы, морские свинки, кролики, собаки, свиньи, люди и т.д.) и т.п., с представляющими особый интерес млекопитающими. В одном отдельном воплощении данного изобретения, активность NEP-фермента у млекопитающего ингибируют путем введения ингибирующего NEP количества соединения согласно данному изобретению. Эти соединения также могут быть использованы в качестве инструментов для исследования посредством осуществления биологических тестов, используя такие соединения.
Когда используют в качестве инструмента для исследования, биологическую систему или образец, включающую(ий) NEP-фермент, типично вводят в контакт с ингибирующим NEP-фермент количеством соединения согласно данному изобретению. После подвергания биологической системы или образца воздействию соединения, определяют эффекты ингибирования NEP-фермента, используя обычные способы и оборудование, как, например, путем определения связывания рецептора в тесте на связывание или определения опосредуемых лигандом изменений в функциональном тесте. Подвергание воздействию включает введение в контакт клеток или ткани с соединением, введение кристаллического соединения млекопитающему, например, путем интраперитонеального, перорального, внутривенного, подкожного или посредством ингаляции введения, и т.д. Эта стадия определения может включать определение ответа (количественный анализ) или может включать осуществление наблюдения (качественный анализ). Определение ответа включает, например, установление воздействий соединения на биологическую систему или образец, используя обычные способы и оборудование, как, например, тесты в отношении активности фермента и определение опосредуемых ферментным субстратом или продуктом изменений в функциональных тестах. Результаты теста могут быть использованы для определения уровня активности, а также количества соединения, необходимого для достижения желательного результата, то есть, ингибирующего NEP-фермент количества. Типично, стадия определения включает определение эффектов ингибирования NEP-фермента.
Дополнительно, соединения согласно данному изобретению могут быть использованы в качестве инструментов для исследования в целях оценки других химических соединений и, таким образом, также являются пригодными в скрининг-тестах для обнаружения, например, новых соединений, обладающих NEP-ингибирующей активностью. Таким образом, другой аспект данного изобретения относится к способу оценки тестируемого соединения в биологическом тесте, включающем: (а) осуществление биологического теста с тестируемым соединением для обеспечения первого значения теста; (b) проведение биологического теста с соединением согласно данному изобретению для обеспечения второго значения теста; где стадию (а) осуществляют либо до, после, либо конкурентно со стадией (b); и (с) сравнение первого значения теста со стадии (а) со вторым значением теста со стадии (b). Типичные биологические тесты включают тест в отношении ингибирования фермента NEP. Таким образом, соединения согласно данному изобретению используют в качестве стандартов в случае теста на сравнение результатов, получаемых с тестируемым соединением и с соединением согласно данному изобретению, чтобы идентифицировать такие тестируемые соединения, которые имеют примерно эквивалентную или превосходящую активность, если это имеет место. Например, данные pKi для тестируемого соединения или группы тестируемых соединений сравнивают с данными pKi для соединения согласно данному изобретению, чтобы идентифицировать такие тестируемые соединения, которые имеют желательные свойства, например, тестируемые соединения, имеющие значение pKi примерно эквивалентное или превосходящее по отношению к соединению согласно данному изобретению, если это имеет место. Этот аспект данного изобретения включает, в виде отдельных воплощений, как генерирование сравнительных данных (используя соответствующие тесты), так и анализ тест-данных в отношении идентифицирования представляющих интерес тестируемых соединений.
Еще один другой аспект данного изобретения относится к способу исследования биологической системы или образца, содержащей(его) фермент NEP, причем способ включает: (а) введение в контакт биологической системы или образца с соединением согласно данному изобретению; и (b) определение эффектов, вызываемых соединением в биологической системе или образце.
Фармацевтические композиции и готовые лекарственные формы
Соединения согласно данному изобретению обычно вводят пациенту в виде фармацевтической композиции или готовой лекарственной формы. Такие фармацевтические композиции могут быть введены пациенту любым приемлемым путем введения, включая, но не исчерпывающим образом, пероральный, ректальный, вагинальный, назальный, в виде ингаляции, местный (включая трансдермальный), глазной и парентеральный пути введения. Далее, соединения согласно данному изобретению могут быть введены, например, перорально, в виде множественных доз в сутки (например, два, три или четыре раза в сутки), в разовой суточной дозе или разовой недельной дозе. Должно быть понятно, что любая форма соединений согласно данному изобретению (то есть, свободное основание, свободная кислота, фармацевтически приемлемая соль, сольват и т.д.), которая является подходящей для конкретного способа введения, может быть использована в фармацевтических композициях, обсуждаемых в данном контексте.
Соответственно, в одном воплощении, данное изобретение относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и соединение согласно данному изобретению. Композиции могут содержать другие терапевтические агенты и/или агенты, используемые для получения готовой лекарственной формы, если желательно. Когда обсуждают композиции, «соединение согласно данному изобретению» также может быть упомянуто в данном контексте как «активный агент» для отличия его от других компонентов готовой лекарственной формы, таких как носитель. Таким образом, подразумевают, что термин «активный агент» включает соединения формулы I, а также фармацевтически приемлемые соли, сольваты и пролекарства таких соединений.
Фармацевтические композиции согласно данному изобретению обычно содержат терапевтически эффективное количество соединения согласно данному изобретению. Квалифицированному специалисту в данной области, однако, известно, что фармацевтическая композиция может содержать более, чем терапевтически эффективное количество, как, например, композиции в массе, или менее, чем терапевтически эффективное количество, то есть, индивидуальные унифицированные дозы, предназначенные для многочисленного введения в целях достижения терапевтически эффективного количества. Типично, композиция содержит от приблизительно 0,01% масс. до 95% масс. активного агента, включая от приблизительно 0,01% масс. до 30% масс., как, например, от приблизительно 0,01% масс. до 10% масс., с действительным количеством, зависящим от самой готовой лекарственной формы, пути введения, частоты дозирования и т.д. В одном воплощении, композиция, подходящая для пероральной лекарственной формы, например, может содержать приблизительно 5-70% масс. или от приблизительно 10% масс. до 60% масс. активного агента.
В фармацевтических композициях согласно данному изобретению может быть использован любой стандартный носитель или эксципиент. Выбор конкретного носителя или эксципиента, или комбинаций носителей или эксципиентов, зависит от способа введения, используемого для лечения конкретного пациента или типа медицинского состояния или статуса заболевания. В этом отношении, получение подходящей композиции для конкретного способа введения полностью входит в сферу знаний квалифицированного специалиста в фармацевтической области. Дополнительно, носители или эксципиенты, используемые в таких композициях, являются коммерчески доступными. В целях дальнейшей иллюстрации, стандартные технологии приготовления лекарственных средств описаны в Remington: The Science and Practice of Pharmacy, 20-е изд., Lippincott Williams & White, Baltimore, Maryland (2000); и H.C. Ansel и др., Pharmaceutical Dosage Forms and Drug Delivery Systems, 7-ое изд., Lippincott Williams & White, Baltimore, Maryland (1999).
Типичные примеры веществ, которые могут служить в качестве фармацевтически приемлемых носителей, включают, но не исчерпывающим образом, следующее: сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлоза, такая как микрокристаллическая целлюлоза, и ее производные, такие как натрийкарбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; порошкообразный трагакант; солод; желатин; тальк; эксципиенты, такие как масло какао и воскообразные суппозитории; масла, такие как арахисовое масло, хлопковое масло, подсолнечное масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль; полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; забуферивающие агенты, такие как гидроксид магния и гидроксид алюминия; альгиновая кислота; непирогенная вода; изотонический насыщенный солевой раствор; раствор Рингера; этиловый спирт; забуференные фосфатом растворы; сжатые газы-пропелленты, такие как хлор-фторуглероды и гидрофторуглероды; и другие нетоксичные совместимые вещества, применяемые в фармацевтических композициях.
Фармацевтические композиции обычно получают путем тщательного и тесного перемешивания или смешения активного агента с фармацевтически приемлемым носителем и одним или более необязательными ингредиентами. Полученная, однородно составленная смесь затем может быть формована или введена в таблетки, капсулы, пилюли, канистры, картриджи, распределители и т.п., используя стандартные способы и оборудование.
В одном воплощении, фармацевтические композиции являются подходящими для перорального введения. Пригодные для перорального введения композиции могут быть в форме капсул, таблеток, пилюль, лепешек, облаток, драже, порошков, гранул; растворов или суспензий, в водной или неводной жидкой среде; жидких эмульсий типа «масло-в-воде» или «вода-в-масле»; эликсиров или сиропов; и т.п.; причем, каждая форма содержит предопределенное количество активного агента.
Когда предназначена для перорального введения в твердой лекарственной форме (капсулы, таблетки, пилюли и т.п.), композиция обычно содержит активный агент и один или более фармацевтически приемлемых носителей, таких как цитрат натрия или дикальцийфосфат. Твердые лекарственные формы также могут включать: наполнители или разбавители, такие крахмалы, микрокристаллическая целлюлоза, лактоза, сахароза, глюкоза, маннит и/или кремниевая кислота; связующие вещества, такие как карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и/или гуммиарабик; увлажнители, такие как глицерин; дезинтегрирующие агенты, такие как агар-агар, карбонат кальция, картофельный крахмал или крахмал из тапиоки, альгиновая кислота, некоторые силикаты и/или карбонат натрия; замедляющие растворение агенты, такие как парафин; ускорители абсорбции, такие как соединения четвертичного аммония; смачиватели, такие как цетиловый спирт и/или глицеринмоностеарат; абсорбенты, такие как каолиновая глина и/или бентонит; смазочные вещества, такие как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и/или их смеси; красители; и забуферивающие агенты.
Высвобождающие агенты, смачиватели, агенты для нанесения покрытия, подсластители, вкусовые добавки и ароматизаторы, консерванты и антиоксиданты также могут присутствовать в фармацевтических композициях. Типичные агенты для нанесения покрытия, в случае таблеток, капсул, пилюль и т.п., включают таковые, используемые для энтеросолюбильных покрытий, как, например, ацетатфталатцеллюлоза, поливинилацетатфталат, гидроксипропилфталатметилцеллюлоза, сополимеры метакриловой кислоты и эфира метакриловой кислоты, тримеллитатацетатцеллюлоза, карбоксиметилэтилцеллюлоза, ацетатсукцинат гидроксипропилметилцеллюлозы и т.п. Примеры фармацевтически приемлемых антиоксидантов включают: водорастворимые антиоксиданты, такие как аскорбиновая кислота, цистеингидрохлорид, бисульфат натрия, метабисульфат натрия, сульфит натрия и т.п.; маслорастворимые антиоксиданты, такие как аскорбилпальмитат, бутилированный гидроксианизол, бутилированный гидрокситолуол, лецитин, пропилгаллат, альфа-токоферол и т.п.; и металлхелатирующие агенты, такие как лимонная кислота, этилендиаминтетрауксусная кислота, сорбит, винная кислота, фосфорная кислота и т.п.
Композиции также могут быть составлены для обеспечения медленного или контролируемого высвобождения активного агента, используя, в качестве примера, гидроксипропилметилцеллюлозу в изменяющихся пропорциях или другие полимерные матрицы, липосомы и/или микросферы. В дополнение, фармацевтические композиции согласно данному изобретению могут содержать замутняющие агенты и могут быть составлены так, что они высвобождают активный агент только, или предпочтительно, в определенной части желудочно-кишечного тракта, необязательно, пролонгированным образом. Примеры вводимых композиций, которые могут быть использованы, включают полимерные вещества и воски. Активный агент также может быть в микроинкапсулированной форме, необязательно, с одним или более вышеописанными эксципиентами.
Подходящие жидкие лекарственные формы для перорального введения включают, в качестве иллюстрации, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Жидкие лекарственные формы обычно содержат активный агент и инертный разбавитель, такой как, например, вода или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, масла (например, хлопковое масло, арахисовое масло, кукурузное масло, масло из ростков пшеницы, оливковое масло, касторовое масло и кунжутное масло), глицерин, тетрагидрофуриловый спирт, полиэтиленгликоли и сорбитановые эфиры жирных кислот, и их смеси. Суспензии могут содержать суспендирующие агенты, такие как, например, этоксилированные изостеариловые спирты, полиоксиэтиленсорбит и сложные сорбитановые эфиры, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, и их смеси.
Когда предназначены для перорального введения, фармацевтические композиции согласно данному изобретению могут быть получены в унифицированной лекарственной форме. Термин «унифицированная лекарственная форма» относится к физически дискретной единице, подходящей для дозирования пациенту, то есть, каждая единица содержит предопределенное количество активного агента, рассчитанное для получения желательного терапевтического эффекта, или одна или в комбинации с одной или более дополнительными единицами. Например, такие унифицированные лекарственные формы могут представлять собой капсулы, таблетки, пилюли и т.п.
В другом воплощении, композиции согласно данному изобретению являются подходящими для введения путем ингаляции, и обычно находятся в форме аэрозоля или порошка. Такие композиции обычно вводят, используя хорошо известные устройства доставки, такие как распылитель, ингалятор с сухим порошком или ингалятор с дозированным распылением. Распыляющие устройства создают струю воздуха с высокой скоростью, которая вызывает распыление композиции в виде тумана, переносимого в дыхательные пути пациента. Типичная готовая лекарственная форма для распыления включает активный агент, растворенный в носителе с образованием раствора или микронизированный и комбинированный с носителем с образованием суспензии из микронизированных частиц пригодного для вдыхания размера. Ингаляторы с сухим порошком снабжают активным агентом в виде свободно текучего порошка, который диспергируется в воздушной струе у пациента во время вдыхания. Типичные готовые лекарственные формы с сухим порошком содержат активный агент, смешанный в сухом состоянии с эксципиентом, таким как лактоза, крахмал, маннит, декстроза, полимолочная кислота, сополимер лактида с гликолидом и их комбинации. Ингаляторы с дозированным распылением выпускают отмеренное количество активного агента, используя сжатый газ-пропеллент. Типичная готовая лекарственная форма с дозированным распылением содержат раствор или суспензию активного агента в сжиженном пропелленте, таком как хлорфторуглерод или гидрофторалкан. Необязательные компоненты таких готовых лекарственных форм включают сорастворители, такие как этанол или пентан, и поверхностно-активные вещества, такие как сорбитантриолеат, олеиновая кислота, лецитин, глицерин и лаурилсульфат натрия. Такие композиции обычно получают путем добавления охлажденного или находящегося под высоким давлением гидро-фторалкана в подходящий контейнер, содержащий активный агент, этанол (если присутствует) и поверхностно-активное вещество (если присутствует). Для получения суспензии, активный агент подвергают микронизации и затем комбинируют с пропеллентом. Альтернативно, готовая лекарственная форма в виде суспензии может быть получена путем напыления в сухом состоянии покрытия из поверхностно-активного вещества на микронизированные частицы активного агента. Готовую лекарственную форму затем загружают в аэрозольный баллончик, который формирует порцию из ингалятора.
Соединения согласно данному изобретению также могут быть введены парентерально (например, в виде подкожной, внутривенной, внутримышечной или интраперитонеальной инъекции). Для такого введения, активный агент приготовляют в стерильном растворе, суспензии или эмульсии. Типичные растворители для получения таких готовых лекарственных форм включают воду, солевой насыщенный раствор, спирты с низкой молекулярной массой, такие как пропиленгликоль, полиэтиленгликоль, масла, желатин, эфиры жирных кислот, такие как этилолеат и т.п. Парентеральные готовые лекарственные формы также могут содержать один или более антиоксидантов, солюбилизаторов, стабилизаторов, консервантов, смачивателей, эмульгаторов и диспергирующих агентов. Поверхностно-активные вещества, дополнительные стабилизирующие агенты или агенты, регулирующие значение рН (кислоты, основания или буферы), и антиоксиданты особенно пригодны для обеспечения стабильности готовой лекарственной формы, например, для сведения к минимуму или избежания гидролиза сложноэфирной или амидной связей, или димеризации тиолов, которые могут присутствовать в композиции. Эти готовые лекарственные формы могут быть сделаны стерильными путем использования стерильной среды для инъекции, стерилизующего агента, фильтрации, излучения или нагревания. В одном отдельном воплощении, парентеральная готовая лекарственная форма содержит водный раствор циклодекстрина в качестве фармацевтически приемлемого носителя. Подходящие циклодекстрины включают циклические молекулы, содержащие шесть или более единиц α-D-глюкопиранозы, соединенные в 1,4-положениях связями, как в амилазе, β-циклодекстрине или циклогептаамилозе. Типичные циклодекстрины включают производные циклодекстрина, такие как гидроксипропиловый и сульфобутиловый простые эфиры циклодекстринов, как, например, гидроксипропил-β-циклодекстрин и простой сульфобутиловый эфир β-циклодекстрина. Типичные буферы для таких готовых лекарственных форм включают буферы на основе карбоновой кислоты, такие как цитратные, лактатные и малеатные буферные растворы.
Соединения согласно данному изобретению также могут быть введены трансдермально, используя известные трансдермальные системы доставки и эксципиенты. Например, соединение может быть смешано с агентами, усиливающими проникновение, такими как пропиленгликоль, полиэтиленгликольмонолаурат, азациклоалкан-2-оны и т.п., и может быть введено в пластырь или подобную систему доставки. Если желательно, в таких трансдермальных композициях могут быть использованы дополнительные эксципиенты, включающие загустители, эмульгаторы и буферы.
Вторичные агенты
Соединения согласно данному изобретению могут быть пригодны в качестве единственного лечения заболевания или могут быть комбинированы с одним или более дополнительными терапевтическими агентами, для того, чтобы получить желательный терапевтический эффект. Таким образом, в одном воплощении, фармацевтические композиции согласно данному изобретению содержат другие лекарственные средства, которые вводят совместно с соединением согласно данному изобретению. Например, композиция, далее, может содержать одно или более лекарственных средств (также упоминают как «вторичный(е) агент(ы)»). Такие терапевтические агенты являются хорошо известными в данной области и включают антагонисты рецептора аденозина, антагонисты α-адренергического рецептора, антагонисты β1-адренергического рецептора, агонисты β2-адренергического рецептора, антагонисты двойного действия β-адренергического рецептора/антагонисты α1-рецептора, разрушители конечного продукта повышенного гликозилирования, антагонисты альдостерона, ингибиторы альдостеронсинтазы, ингибиторы N-аминопептидазы, андрогены, ингибиторы ангиотензинконвертирующего фермента и ингибиторы двойного действия ангиотензинконвертирующего фермента/неприлизина, активаторы и стимуляторы ангиотензинконвертирующего фермента 2, ангиотензин II-вакцины, антикоагулянты, антидиабетические агенты, антидиарейные агенты, агенты против глаукомы, антилипидные агенты, антиноцицептивные агенты, антитромботические агенты, антагонисты рецептора АТ1 и двойного действия ингибиторы антагониста рецептора АТ1/неприлизина, и многофункциональные блокаторы рецептора ангиотензина, антагонисты рецептора брадикинина, блокаторы кальциевых каналов, ингибиторы химазы, дигоксин, диуретики, агонисты допамина, ингибиторы эндотелинконвертирующего фермента, антагонисты рецептора эндотелина, ингибиторы HMG-CoA-редуктазы, эстрогены, агонисты и/или антагонисты рецептора эстрогена, ингибиторы повторного поглощения моноамина, мышечные релаксанты, натрийуретические пептиды и их аналоги, антагонисты рецептора клиренса натрийуретических пептидов, ингибиторы неприлизина, доноры оксида азота, нестероидные противовоспалительные агенты, антагонисты рецептора N-метил-d-аспартата, агонисты опиоидных рецепторов, ингибиторы фосфодиэстеразы, аналоги простагландина, агонисты рецептора простагландина, ингибиторы ренина, селективные ингибиторы повторного поглощения серотонина, блокаторы натриевого канала, стимуляторы и активаторы растворимой гуанилатциклазы, трициклические антидепрессанты, антагонисты рецептора вазопрессина и их комбинации. Конкретные примеры этих агентов подробно описаны в данном контексте.
Соответственно, еще в одном другом аспекте данного изобретения, фармацевтическая композиция содержит соединение согласно данному изобретению, вторичный активный агент и фармацевтически приемлемый носитель. Также, в композицию могут быть включены третий, четвертый и т.д. активные агенты. В комбинированной терапии, количество соединения согласно данному изобретению, которое вводят, а также количество вторичных агентов, может быть меньше, чем количество, обычно вводимое в монотерапии.
Соединения согласно данному изобретению могут быть физически смешаны с вторичным активным агентом с образованием композиции, содержащей оба агента; или каждый агент может присутствовать в раздельных и индивидуальных композициях, которые вводят пациенту одновременно или в разное время. Например, соединение согласно данному изобретению может быть комбинировано с вторичным активным агентом, используя стандартные способы и оборудование, с образованием комбинации активных агентов, содержащей соединение согласно данному изобретению и вторичный активный агент. Дополнительно, активные агенты могут быть комбинированы с фармацевтически приемлемым носителем с образованием фармацевтической композиции, содержащей соединение согласно данному изобретению, вторичный активный агент и фармацевтически приемлемый носитель. В этом воплощении, компоненты композиции обычно перемешивают или смешивают до создания физической смеси. Физическую смесь затем вводят в терапевтически эффективном количестве, используя любой из путей, описанных в данном контексте.
Альтернативно, активные агенты могут находиться раздельно и индивидуально перед введением пациенту. В этом воплощении, агенты физически не смешивают вместе, перед введением, но их вводят одновременно или в разное время в виде раздельных композиций. Такие композиции могут быть упакованы раздельно или могут быть упакованы вместе в виде набора. Когда вводят в разное время, вторичный агент обычно должен быть введен менее чем через 24 часа после введения соединения согласно данному изобретению, где-нибудь в этих пределах, из-за совпадения с введением соединения согласно данному изобретению через примерно 24 часа от последней дозы. Это также упоминают как последовательное введение. Таким образом, соединение согласно данному изобретению может быть введено перорально, одновременно или последовательно с другим активным агентом, используя две таблетки, по одной таблетке для каждого активного агента, где «последовательно» может означать введение непосредственно после введения соединения согласно данному изобретению или спустя некоторое предопределенное время (например, позже на один час или позже на три часа). Также предполагают, что вторичный агент может быть введен более чем через 24 часа после введения соединения согласно данному изобретению. Альтернативно, комбинация может быть введена различными путями введения, то есть один - пероральный, а другой - путем ингаляции.
В одном воплощении, набор включает первую лекарственную форму, содержащую соединение согласно данному изобретению и, по меньшей мере, одну дополнительную лекарственную форму, содержащую один или более из вторичных агентов, указанных в данном контексте, в количествах, достаточных для осуществления способов согласно данному изобретению. Первая лекарственная форма и вторичная (или третья и т.д.) лекарственная форма, вместе, содержат терапевтически эффективное количество активных агентов для лечения или предупреждения заболевания или медицинского состояния у пациента.
Вторичный(ые) агент(ы), если включен(ы), присутствует(ют) в терапевтически эффективном количестве, таком, что его(их) обычно вводят в количестве, чтобы получить терапевтически полезный эффект, когда вводят совместно с соединением согласно данному изобретению. Вторичный агент может быть в форме фармацевтически приемлемой соли, сольвата, оптически чистого стереоизомера и т.д. Вторичный агент также может быть в форме пролекарства, например, соединения, имеющего группу карбоновой кислоты, которая является этерифицированной. Таким образом, вторичные агенты, перечисленные в данном контексте, предназначены для включения всех таких форм и являются коммерчески доступными или их можно получать, используя стандартные способы и реагенты.
В одном воплощении, соединения согласно данному изобретению вводят в комбинации с антагонистом рецептора аденозина, типичные примеры которого включают, но не исчерпывающим образом, наксифиллин, ролофиллин, SLV-320, теофиллин и тонапофиллин.
В одном воплощении, соединения согласно данному изобретению вводят в комбинации с антагонистом α-адренергического рецептора, типичные примеры которого включают, но не исчерпывающим образом, доксазозин, празозин, тамсулозин и теразозин.
Соединения согласно данному изобретению также могут быть введены в комбинации с антагонистом β1-адренергического рецептора («β1-блокаторы»). Типичные β1-блокаторы включают, но не исчерпывающим образом, ацебутолол, альпренолол, амосулалол, аротинолол, атенолол, бефунолол, бетаксолол, бевантолол, бисопролол, бопиндолол, буциндолол, букумолол, буфетолол, буфуралол, бунитролол, бупранолол, бубридин, бутофилолол, каразолол, картеолол, карведилол, целипролол, цетамолол, клоранолол, дилевалол, эпанолол, эсмолол, инденолол, лабетолол, левобунолол, мепиндолол, метипранолол, метопролол, такой как метопрололсукцинат и метопрололтартрат, мопролол, надолол, надоксолол, небивалол, нипрадилол, окспренолол, пенбутолол, пербутолол, пиндолол, практолол, пронеталол, пропранолол, соталол, суфиналол, талиндол, тертатолол, тилизолол, тимолол, толипролол, ксибенолол и их комбинации. В одном конкретном воплощении, β1-антагонист выбирают из атенолола, бисопролола, метопролола, пропранолола, соталола и их комбинаций. Типично, β1-блокатор вводят в количестве, достаточном для обеспечения примерно 2-900 мг на дозу.
В одном воплощении, соединения согласно данному изобретению вводят в комбинации с агонистом β2-адренергического рецептора, типичные примеры которого включают, но не исчерпывающим образом, альбутерол, битолтерол, фенотерол, формотерол, индакатерол, изоэтарин, левалбутерол, метапротеренол, пирбутерол, сальбутамол, сальмефамол, сальметерол, тербуталин, вилантерол и т.п. Типично, агонист β2-адренергического рецептора вводят в количестве, достаточном для обеспечения примерно 0,05-500 мкг на дозу.
В одном воплощении, соединения согласно данному изобретению вводят в комбинации с прерывателем прогрессирующего гликозилирования конечного продукта (AGE), примеры которых включают, в качестве иллюстрации и без ограничения, алагебриум (или ALT-711) и TRС4149.
В другом воплощении, соединения согласно данному изобретению вводят в комбинации с антагонистом альдостерона, типичные примеры которого включают, но не исчерпывающим образом, эплеренон, спиронолактон и их комбинации. Типично, антагонист альдостерона вводят в количестве, достаточном для обеспечения примерно 5-300 мг в сутки.
В одном воплощении, соединения согласно данному изобретению вводят в комбинации с ингибитором N-аминопептидазы или дипептидилпептидазы III, примеры которых включают, в качестве иллюстрации и без ограничения, бестатин и РС18 (2-амино-4-метилсульфонилбутантиол, метионинтиол).
Соединения согласно данному изобретению также могут быть введены в комбинации с ингибитором ангиотензинконвертирующего фермента (АСЕ). Типичные ингибиторы АСЕ включают, но не исчерпывающим образом, аккуприл, алацеприл, беназеприл, беназеприлат, каптоприл, церанаприл, цилазаприл, делаприл, эналаприл, эналаприлат, фозиноприл, фозиноприлат, имидаприл, лизиноприл, моэксиприл, моноприл, мовелтиприл, пентоприл, периндоприл, квинаприл, квинаприлат, рамиприл, рамиприлат, саралазинацетат, спираприл, темокаприл, трандолаприл, зофеноприл, и их комбинации.
В отдельном воплощении, ингибитор АСЕ выбирают из: беназеприла, каптоприла, эналаприла, лизиноприла, рамиприла и их комбинаций. Типично, ингибитор АСЕ вводят в количестве, достаточном для обеспечения примерно 1-150 мг в сутки. В другом воплощении, соединения согласно данному изобретению вводят в комбинации с ингибитором двойного действия ангиотензинконвертирующего фермента/неприлизина (АСЕ/NEP), примеры которого включают, но не исчерпывающим образом: AVE-0848 ((4S,7S,12bR)-7-[3-метил-2(S)-сульфанилбутирамидо]-6-оксо-1,2,3,4,6,7,8,12b-октагидропиридо[2,1-а][2]-бензазепин-4-карбоновая кислота); AVE-7688 (илепатрил) и его исходное соединение; BMS-182657 (2-[2-оксо-3(S)-[3-фенил-2(S)-сульфанилпропионамидо]-2,3,4,5-тетрагидро-1Н-1-бензазепин-1-ил]уксусная кислота); CGS-35601 (N-[1-[4-метил-2(S)-сульфанилпентанамидо]циклопентилкарбонил]-L-триптофан); фазидотрил; фазидотрилат; эналаприлат; ER-32935 ((3R,6S,9aR)-6-[3(S)-метил-2(S)-сульфанилпентанамидо]-5-оксопергидротиазоло[3,2-a]азепин-3-карбоновая кислота]; гемпатрилат; MDL-101264 ((4S,7S,12bR)-7-[2(S)-(2-морфолиноацетилтио)-3-фенилпропионамидо]-6-оксо-1,2,3,4,6,7,8,12b-октагидропиридо[2,1-a][2]бензазепин-4-карбоновая кислота); MDL-101287 ([4S-[4α,7α(R*),12bβ]]-7-[2-(карбоксиметил)-3-фенилпропионамидо]-6-оксо-1,2,3,4,6,7,8,12b-октагидропиридо[2,1-a][2]бензазепин-4-карбоновая кислота); омапатрилат; RB-105 (N-[2(S)-(меркаптометил)-3(R)-фенилбутил]-L-аланин); сампатрилат; SA-898 ((2R,4R)-N-[2-(2-гидроксифенил)-3-(3-меркаптопропионил)-тиазолидин-4-илкарбонил]-L-фенилаланин); Sch-50690 (N-[1(S)-карбокси-2-[N2-(метансульфонил)-L-лизиламино]этил]-L-валил-L-тирозин); и их комбинации. В одном отдельном воплощении, ингибитор АСЕ/NEP выбирают из: AVE-7688, эналаприлата, фазидотрила, фазидотрилата, омапатрилата, сампатрилата и их комбинаций.
В одном воплощении, соединения согласно данному изобретению вводят в комбинации с активатором или стимулятором ангиотензинконвертирующего фермента 2 (АСЕ2).
В одном воплощении, соединения согласно данному изобретению вводят в комбинации с ангиотензин-II-вакциной, примеры которой включают, но не исчерпывающим образом, ATR12181 и CYT006-AngQb.
В одном воплощении, соединения согласно данному изобретению вводят в комбинации с антикоагулянтом, типичные примеры которого включают, но не исчерпывающим образом, кумарины, такие как варфарин; гепарин; и прямые ингибиторы тромбина, такие как аргатробан, бивалирудин, дабигатран и лепирудин.
Еще в одном другом воплощении, соединения согласно данному изобретению вводят в комбинации с антидиабетическим агентом. Типичные антидиабетические агенты включают лекарственные средства для инъекции, а также эффективные перорально лекарственные средства и их комбинации. Примеры лекарственных средств для инъекции включают, но не исчерпывающим образом, инсулин и производные инсулина. Примеры эффективных перорально лекарственных средств включают, но не исчерпывающим образом, бигуаниды, такие как метформин; антагонисты глюкагона; ингибиторы α-глюкозидазы, такие как акарбоза и миглитол; ингибиторы дипептидилпептидазы IV (ингибиторы DPP-IV), такие как алоглиптин, денаглиптин, линаглиптин, саксаглиптин, ситаглиптин и вилдаглиптин; меглитиниды, такие как репаглинид; оксадиазолидиндионы; сульфонилмочевины, такие как хлорпропамид, глимепирид, глипизид, глибурид и толазамид; тиазолидиндионы, такие как пиоглитазон и розиглитазон; и их комбинации.
В другом воплощении, соединения согласно данному изобретению вводят в комбинации с антидиарейными терапиями. Типичный курс лечения включает, но не исчерпывающим образом, пероральные растворы для регидратации (ORS), лоперамид, дифеноксилат и субсалицилат висмута.
В еще одном другом воплощении, соединение согласно данному изобретению вводят в комбинации с агентом против глаукомы. Типичные агенты против глаукомы включают, но не исчерпывающим образом, агонисты α-адренергического рецептора, такие как бримонидин; антагонисты β1-адренергического рецептора; местные β1-блокаторы, такие как бетаксолол, левобунолол и тимолол; ингибиторы карбоангидразы, такие как ацетазоламид, бринзоламид или дорзоламид; холинергические агонисты, такие как цевимелин и DMXB-анабазин; эпинефриновые соединения; миотические средства, такие как пилокаприн; и аналоги простагландина.
В еще одном другом воплощении, соединения согласно данному изобретению вводят в комбинации с антилипидным агентом. Типичные антилипидные агенты включают, но не исчерпывающим образом, ингибиторы белка переноса холестерилового эфира (CETP), такие как анацетрапиб, далцетрапиб и торцетрапиб; статины, такие как аторвастатин, флувастатин, ловастатин, правастатин, розувастатин и симвастатин; и их комбинации.
В одном воплощении, соединения согласно данному изобретению вводят в комбинации с антитромботическим агентом. Типичные антитромботические агенты включают, но не исчерпывающим образом, аспирин; антитромбоцитарные агенты, такие как клопидогрел, празугрел и тиклопидин; гепарин, и их комбинации.
В одном воплощении, соединения согласно данному изобретению вводят в комбинации с антагонистом рецептора АТ1, также известным как блокатор рецептора ангиотензина II типа 1 (ARB). Типичные ARB включают, но не исчерпывающим образом, абитесартан, азилсартан (например, азилсартанмедоксомил), бензиллосартан, кандесартан, кандесартанцилексетил, элисартан, эмбусартан, энолтазосартан, эпросартан, ЕХР3174, фонсартан, форасартан, глициллосартан, ирбесартан, изотеолин, лосартан, медоксомил, милфасартан, олмесартан (например, олмесартанмедоксомил), опомисартан, пратосартан, риписартан, саприсартан, саралазин, сармезин, ТАК-591, тазосартан, телмисартан, валсартан, золасартан и их комбинации. В конкретном воплощении, АRB выбирают из азилсартанмедоксомила, кандесартанцилексетила, эпросартана, ирбесартана, лосартана, олмесартанмедоксомила, саприсартана, тазосартана, телмисартана, валсартана и их комбинаций. Типичные соли и/или пролекарства включают кандесартанцилексетил, эпросартанмезилат, калиевую соль лосартана и олмесартанмедоксомил. Типично, ARB вводят в количестве, достаточном для обеспечения примерно 4-600 мг на дозу, с типичным диапазоном суточных доз, составлящим 20-320 мг в сутки.
Соединения согласно данному изобретению также могут быть введены в комбинации с агентом двойного действия, таким как ингибитор антагониста рецептора АТ1/неприлизина (ARB/NEP), примеры которого включают, но не исчерпывающим образом, соединения, описанные в опубликованных патентах США под номерами 2008/0269305 и 2009/0023228, оба из которых принадлежат Allegretti и др., зарегистрированные 23 апреля 2008 года, как, например, соединение 4'-{2-этокси-4-этил-5-[((S)-2-меркапто-4-метилпентаноиламино)-метил]имидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота.
Соединения согласно данному изобретению также могут быть введены в комбинации с многофункциональными блокаторами рецептора ангиотензина, как описано Kurtz и Klein (2009), Hypertension Research, 32:826-834.
В одном воплощении, соединения согласно данному изобретению вводят в комбинации с антагонистом рецептора брадикинина, как, например, икатибант (НОЕ-140). Предполагают, что эта комбинированная терапия может иметь преимущество в отношении предупреждения отека Квинке или в случае других нежелательных последствий повышенных уровней брадикинина.
В одном воплощении, соединения согласно данному изобретению вводят в комбинации с блокатором кальциевого канала. Типичные блокаторы кальциевого канала включают, но не исчерпывающим образом, амлодипин, анипамил, аранипин, барнидипин, бенциклан, бенидипин, бепридил, клентиазем, цилнидипин, циннаризин, дилтиазем, эфонидипин, элгодипин, этафенон, фелодипин, фендилин, флунаризин, галлопамил, исрадипин, лацидипин, лерканидипин, лидофлазин, ломеризин, манидипин, мибефрадил, никардипин, нифедипин, нигулдипин, нилудипин, нилвадипин, нимодипин, нисолдипин, нитрендипин, нивалдипин, пергексилин, прениламин, риосидин, семотиадил, теродилин, тиапамил, верапамил, и их комбинации. В отдельном воплощении, блокатор кальциевого канала выбирают из амлодипина, бепридила, дилтиазема, фелодипина, исрадипина, лацидипина, никардипина, нифедипина, нигулдипина, нилудипина, нимодипина, нисолдипина, риосидина, верапамила и их комбинаций. Типично, блокатор кальциевого канала вводят в количестве, достаточном для обеспечения примерно 2-500 мг на дозу.
В одном воплощении, соединения согласно данному изобретению вводят в комбинации с ингибитором химазы, таким как ТРС-806 и 2-(5-формиламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-[{3,4-диоксо-1-фенил-7-(2-пиридилокси)}-2-гептил]ацетамид (NK3201).
В одном воплощении, соединения согласно данному изобретению вводят в комбинации с диуретиком. Типичные диуретики включают, но не исчерпывающим образом, ингибиторы карбоангидразы, такие как ацетазоламид и дихлорфенамид; петлевые диуретики, которые включают производные сульфонамида, такие как ацетазоламид, амбузид, азосемид, буметанид, бутазоламид, хлораминофенамид, клофенамид, клопамид, клорексолон, дисульфамид, этоксзоламид, фуросемид, мефрузид, метазоламид, пиретанид, торсемид, трипамид и ксипамид, а также несульфонамидные диуретики, такие как этакриновая кислота и другие соединения феноксиуксусной кислоты, такие как тиениловая кислота, индакринон и квинкарбат; осмотические диуретики, такие как маннит; калийсберегающие диуретики, которые включают антагонисты альдостерона, такие как спиронолактон, и ингибиторы каналов Na+, такие как амилорид и триамтерен; тиазидные и подобные тиазидным диуретики, такие как альтиазид, бендрофлуметиазид, бензилгидрохлортиазид, бензтиазид, бутиазид, хлорталидон, хлоротиазид, циклопентиазид, циклотиазид, эпитиазид, этиазид, фенквизон, флуметиазид, гидрохлоротиазид, гидрофлуметиазид, индапамид, метилклотиазид, метикран, метолазон, парафлутизид, политиазид, квинетазон, теклотиазид и трихлорометиазид; и их комбинации. В отдельном воплощении, диуретик выбирают из амилорида, буметанида, хлоротиазида, хлорталидона, дихлорфенамида, этакриновой кислоты, фуросемида, гидрохлоротиазида, гидрофлуметиазида, индапамида, метилклотиазида, метолазона, торсемида, триамтерена и их комбинаций. Диуретик вводят в количестве, достаточном для обеспечения примерно 5-50 мг в сутки, более типично, 6-25 мг в сутки, с обычными дозами, составляющими 6,25 мг, 12,5 мг или 25 мг в сутки.
Соединения согласно данному изобретению также могут быть введены в комбинации с ингибитором эндотелинконвертирующего фермента (ЕСЕ), примеры которого включают, но не исчерпывающим образом, фосфорамидон, CGS 26303 и их комбинации.
В отдельном воплощении, соединения согласно данному изобретению вводят в комбинации с антагонистом рецептора эндотелина. Типичные антагонисты рецептора эндотелина включают, но не исчерпывающим образом, селективные антагонисты рецептора эндотелина, которые повреждают рецепторы эндотелина А, такие как авосентан, амбрисентан, атрасентан, BQ-123, клазосентан, дарусентан, ситаксентан и зиботентан; и двойные антагонисты рецептора эндотелина, которые повреждают как рецепторы эндотелина А, так и рецепторы эндотелина В, такие как босентан, мацитентан, тезосентан.
В еще одном другом воплощении, соединение согласно данному изобретению вводят в комбинации с одним или более ингибиторами HMG-CoA-редуктазы, которые также известны как статины. Типичные статины включают, но не исчерпывающим образом, аторвастатин, флувастатин, ловастатин, питавастатин, правастатин, розувастатин и симвастатин.
В одном воплощении, соединения согласно данному изобретению вводят в комбинации с ингибитором повторного поглощения моноамина, примеры которого включают, в качестве иллюстрации и без ограничения, ингибиторы повторного поглощения норэпинефрина, такие как атомоксетин, бупроприон и метаболит бупроприона гидроксибупроприон, мапротилин, ребоксетин и вилоксазин; селективные ингибиторы повторного поглощения серотонина (SSRI), такие как циталопрам и метаболит циталопрама десметилциталопрам, дапоксетин, эсциталопрам (например, эсциталопрамоксалат), флуоксетин и метаболит десметилфлуоксетина норфлуоксетин, флувоксамин (например, флувоксаминмалеат), пароксетин, сертралин и метаболит сертралина деметилсертралин; двойные ингибиторы повторного поглощения серотонина-норэпинефрина (SNRI), такие как бицифадин, дулоксетин, милнаципран, нефазодон и венлафаксин; и их комбинации.
В другом воплощении, соединения согласно данному изобретению вводят в комбинации с мышечным релаксантом, примеры которого включают, но не исчерпывающим образом, каризопродол, хлорзоксазон, циклобензаприн, дифлунизал, метаксалон, метокарбамол и их комбинации.
В одном воплощении, соединения согласно данному изобретению вводят в комбинации с натрийуретическим пептидом или его аналогом, примеры которых включают, но не исчерпывающим образом, карперитид, CD-NP (Nile Therapeutics), CU-NP, несиритид, PL-3994 (Palatin Technologies, Inc.), уларитид, цендеритид и соединения, описанные Ogawa и др. (2004), J. Biol. Chem., 279, 28625-31). Эти соединения также упоминают как агонисты рецептора-А натрийуретического пептида (NPR-A). В другом воплощении, соединения согласно данному изобретению вводят в комбинации с антагонистом рецептора клиренса натрийуретического пептида (NPR-C), как, например, SC-46542, cANF (4-23) и АР-811 (Veale (2000), Bioorg. Med. Chem. Lett, 10, 1949-52). Например, АР-811 проявляет синергизм, когда его комбинируют с ингибитором NEP, тиорфаном (Wegner (1995), Clin. Exper. Hypert., 17, 861-876).
В другом воплощении, соединения согласно данному изобретению вводят в комбинации с ингибитором неприлизина (NEP). Типичные ингибиторы NEP включают, но не исчерпывающим образом, AHU-377; кандоксатрил; кандоксатрилат; дексекадотрил (бензиловый эфир (+)-N-[2(R)-(ацетилтиометил)-3-фенилпропионил]глицина); CGS-24128 (3-[3-(бифенил-4-ил)-2-(фосфонометиламино)пропионамидо]пропионовая кислота); CGS-24592 ((S)-3-[3-(бифенил-4-ил)-2-(фосфонометиламино)пропионамидо]-пропионовая кислота); CGS-25155 (бензиловый эфир N-[9(R)-(ацетилтиометил)-10-оксо-1-азациклодекан-2(S)-илкарбонил]-4(R)-гидрокси-L-пролина); производные 3-(1-карбамоилциклогексил)-пропионовой кислоты, описанные в Международной заявке на патент под номером WO 2006/027680, Hepworth и др. (Pfizer Inc.); JMV-390-1 (2(R)-бензил-3-(N-гидроксикарбамоил)пропионил-L-изолейцил-L-лейцин); экадотрил, фосфорамидон; ретротиорфан; RU-42827 (2-(меркаптометил)-N-(4-пиридинил)бензолпропионамид); RU-44004 (N-(4-морфолинил)-3-фенил-2-(сульфанилметил)пропионамид); SCH-32615 ((S)-N-[N-(1-карбокси-2-фенилэтил)-L-фенилаланил]-β-аланин) и его пролекарство SCH-34826 ((S)-N-[N-[1-[[(2,2-диметил-1,3-диоксолан-4-ил)метокси]карбонил]-2-фенилэтил]-L-фенилаланил]-β-аланин); сиалорфин; SCH-42495 (этиловый эфир N-[2(S)-(ацетилсульфанилметил)-3-(2-метилфенил)пропионил]-L-метионина); спинорфин; SQ-28132 (N-[2-(меркаптометил)-1-оксо-3-фенилпропил]-лейцин); SQ-28603 (N-[2-(меркаптометил)-1-оксо-3-фенилпропил]-β-аланин); SQ-29072 (7-[[2-(меркаптометил)-1-оксо-3-фенилпропил]амино]гептановая кислота); тиорфан и его пролекарство рацекадотрил; UK-69578 (цис-4-[[[1-[2-карбокси-3-(2-метоксиэтокси)пропил]циклопентил]карбонил]амино]циклогексан-карбоновая кислота); UK-447841 (2-{1-[3-(4-хлорфенил)пропилкарбамоил]циклопентилметил}-4-метоксимасляная кислота); UK-505749 ((R)-2-метил-3-{1-[3-(2-метилбензотиазол-6-ил)пропилкарбамоил]циклопентил}пропионовая кислота); 5-бифенил-4-ил-4-(3-карбоксипропиониламино)-2-метилпентановую кислоту и этиловый эфир 5-бифенил-4-ил-4-(3-карбоксипропиониламино)-2-метилпентановой кислоты (WO 2007/056546); даглутрил [(3S,2'R)-3-{1-[2'-(этоксикарбонил)-4'-фенилбутил]циклопентан-1-карбониламино}-2,3,4,5-тетрагидро-2-оксо-1Н-1-бензазепин-1-уксусная кислота], описанный в Международной заявке на патент под номером WO 2007/106708, Khder и др. (Novartis AG); и их комбинации. В отдельном воплощении, ингибитор NEP выбирают из AHU-377, кандоксатрила, кандоксатрилата, CGS-24128, фосфорамидона, SCH-32615, SCH-34826, SQ-28603, тиорфана и их комбинаций. В отдельном воплощении, ингибитор NEP представляет собой соединение, такое как даглутрил или CGS-26303 ([N-[2-(бифенил-4-ил)-1(S)-(1Н-тетразол-5-ил)этил]амино]метилфосфоновая кислота), которые обладают активностью как ингибиторы эндотелинконвертирующего фермента (ЕСЕ), так и NEP. Также могут быть использованы другие соединения двойного действия на ЕСЕ/NEP. Ингибитор NEP вводят в количестве, достаточном для обеспечения примерно 20-800 мг в сутки, с типичным диапазоном суточных доз, составляющим 50-700 мг в сутки, более типично, 100-600 мг в сутки или 100-300 мг в сутки.
В одном воплощении, соединения согласно данному изобретению вводят в комбинации с донором оксида азота, примеры которого включают, но не исчерпывающим образом, никорандил; органические нитраты, такие как пентаэритритолтетранитрат; и сиднонимины, такие как линсидомин и молсидомин.
В еще одном другом воплощении, соединения согласно данному изобретению вводят в комбинации с нестероидным противовоспалительным агентом (NSAID). Типичные NSAID включают, но не исчерпывающим образом, ацеметацин, ацетилсалициловую кислоту, алклофенак, алминопрофен, амфенак, амиприлозу, алоксиприн, аниролак, апазон, азапропазон, бенорилат, беноксапрофен, безпиперилон, броперамол, буклоксовую кислоту, карпрофен, клиданак, диклофенак, дифлунизал, дифталон, эноликам, этодолак, эторикоксиб, фенбуфен, фенклофенак, фенклозовую кислоту, фенопрофен, фентиазак, фепразон, флуфенамовую кислоту, флуфенизал, флупрофен, флурбипрофен, фурофенак, ибуфенак, ибупрофен, индометацин, индопрофен, изоксепак, изоксикам, кетопрофен, кеторолак, лофемизол, лорноксикам, меклофенамат, меклофенамовую кислоту, мефенамовую кислоту, мелоксикам, мезаламин, миропрофен, мофебутазон, набуметон, напроксен, нифлумовую кислоту, оксапрозин, окспинак, оксифенбутазон, фенилбутазон, пироксикам, пирпрофен, пранопрофен, салзалат, судоксикам, сульфасалазин, сулиндак, супрофен, теноксикам, тиопинак, тиапрофеновую кислоту, тиоксапрофен, толфенамовую кислоту, толметин, трифлумидат, зидометацин, зомепирак и их комбинации. В отдельном воплощении, NSAID выбирают из этодолака, флурбипрофена, ибупрофена, индометацина, кетопрофена, кеторолака, мелоксикама, напроксена, оксапрозина, пироксикама и их комбинаций.
В одном воплощении, соединения согласно данному изобретению вводят в комбинации с антагонистом рецептора N-метил-d-аспартата (NMDA), примеры которого включают, в качестве иллюстрации и без ограничения, включая амантадин, декстрометорфан, декстропропоксифен, кетамин, кетобемидон, мемантин, метадон и т.д.
В еще одном другом воплощении, соединения согласно данному изобретению вводят в комбинации с агонистом опиоидного рецептора (также упоминают как опиоидные аналгетики). Типичные агонисты опиодного рецептора включают, но не исчерпывающим образом, бупренорфин, буторфанол, кодеин, дигидрокодеин, фентанил, гидрокодон, гидроморфон, леваллорфан, леворфанол, меперидин, метадон, морфин, налбуфин, налмефен, налорфин, налоксон, налтрексон, налорфин, оксикодон, оксиморфон, пентазоцин, пропоксифен, трамадол и их комбинации. В некоторых воплощениях, агонист опиоидного рецептора выбирают из кодеина, дигидрокодеина, гидрокодона, гидроморфона, морфина, оксикодона, оксиморфона, трамадола и их комбинаций.
В отдельном воплощении, соединения согласно данному изобретению вводят в комбинации с ингибитором фосфодиэстеразы (PDE), в особенности, с ингибитором PDE-V. Типичные ингибиторы PDE-V включают, но не исчерпывающим образом, аванафил, лоденафил, мироденафил, силденафил (Revatio®), тадалафил (Adcirca®), варденафил (Levitra®) и уденафил.
В другом воплощении, соединения согласно данному изобретению вводят в комбинации с аналогом простагландина (также упоминают как простаноиды или аналоги простациклина). Типичные аналоги простагландина включают, но не исчерпывающим образом, берапрост-натрий, биматопрост, эпопростенол, илопрост, латанопрост, тафлупрост, травопрост и трепростинил, особый интерес представляют биматопрост, латанопрост и тафлупрост.
В еще одном другом воплощении, соединения согласно данному изобретению вводят в комбинации с агонистом рецептора простагландина, примеры которого включают, но не исчерпывающим образом, биматопрост, латанопрост, травопрост и т.д.
Соединения согласно данному изобретению также могут быть введены в комбинации с ингибитором ренина, примеры которого включают, но не исчерпывающим образом, алискирен, эналкирен, ремикирен, и их комбинации.
В другом воплощении, соединения согласно данному изобретению вводят в комбинации с селективным ингибитором повторного поглощения серотонина (SSRI). Типичные SSRI включают, но не исчерпывающим образом, циталопрам и метаболит циталопрама десметилциталопрам, дапоксетин, эсциталопрам (например, эсциталопрамоксалат), флуоксетин и метаболит десметилфлуоксетина норфлуоксетин, флувоксамин (например, флувоксаминмалеат), пароксетин, сертралин и метаболит сертралина деметилсерталин, и их комбинации.
В одном воплощении, соединения согласно данному изобретению вводят в комбинации с агонистом рецептора 5-HT1D серотонина, примеры которого включают, в качестве иллюстрации и без ограничения, триптаны, такие как алмотриптан, авитриптан, элетриптан, фроватриптан, наратриптан, ризатриптан, суматриптан и золмитриптан.
В одном воплощении, соединения согласно данному изобретению вводят в комбинации с блокатором натриевого канала, примеры которого включают, в качестве иллюстрации и без ограничения, карбамазепин, фосфенитоин, ламотригин, лидокаин, мексилетин, окскарбазепин, фенитоин, и их комбинации.
В одном воплощении, соединения согласно данному изобретению вводят в комбинации с активатором или стимулятором растворимой гуанилатциклазы, примеры которого включают, но не исчерпывающим образом, атацигуат, риоцигуат и их комбинации.
В одном воплощении, соединения согласно данному изобретению вводят в комбинации с трициклическим антидепрессантом (ТСА), примеры которого включают, в качестве иллюстрации и без ограничения, амитриптилин, амитриптилиноксид, бутриприлин, кломипрамин, демексиптилин, дезипрамин, дибензепин, диметакрин, досулепин, доксепин, имипрамин, имипраминоксид, лофепрамин, мелитрацен, метапрамин, нитроксазепин, нортриптилин, ноксиптилин, пипофезин, пропизепин, протриптилин, квинупрамин и их комбинации.
В одном воплощении, соединения согласно данному изобретению вводят в комбинации с антагонистом рецептора вазопрессина, примеры которого включают, в качестве иллюстрации и без ограничения, кониваптан и толваптан.
Комбинированы ее вторичные терапевтические агенты вместе с соединениями согласно данному изобретению также могут быть полезны в дальнейшей комбинированной терапии. Например, соединения согласно данному изобретению могут быть комбинированы с диуретиками и ARB, или с блокатором кальциевого канала и ARB, или с диуретиком и ингибитором АСЕ, или с блокатором кальциевого канала и статином. Конкретные примеры включают комбинацию ингибитора АСЕ эналаприла (в форме малеата) и диуретика гидрохлоротиазида, который коммерчески доступен под торговой маркой Vaseretic®, или комбинацию блокатора кальциевого канала амлодипина (в форме безилата) и ARB олмесартана (в форме пролекарства медоксомила), или комбинацию блокатора кальциевого канала и статина, причем, все они также могут быть использованы вместе с соединениями согласно данному изобретению. Другие терапевтические агенты, такие как агонисты α2-адренергического рецептора и антагонисты рецептора вазопрессина, также могут быть полезны в комбинированной терапии. Типичные агонисты α2-адренергического рецептора включают клонидин, дексмедетомидин и гуанфацин.
Следующие технологии приготовления лекарственных средств иллюстрируют типичные фармацевтические композиции согласно данному изобретению.
Типичные твердые желатиновые капсулы для перорального введения
Соединение согласно данному изобретению (50 г), 440 г высушенной распылением лактозы и 10 г стеарата магния тщательно смешивают. Полученную композицию затем загружают в твердые желатиновые капсулы (500 мг композиции на капсулу). Альтернативно, соединение согласно данному изобретению (20 мг) тщательно смешивают с крахмалом (89 мг), микрокристаллической целлюлозой (89 мг) и стеаратом магния (2 мг). Смесь затем пропускают через сито № 45 меш U.S. и загружают в твердую желатиновую капсулу (200 мг композиции на капсулу).
Альтернативно, соединение согласно данному изобретению (30 г), вторичный агент (20 г), 440 г высушенной распылением лактозы и 10 г стеарата магния тщательно смешивают и обрабатывают, как описано выше.
Типичное приготовление желатиновой капсулы для перорального введения
Соединение согласно данному изобретению (100 мг) тщательно смешивают с полиоксиэтиленсорбитанмоноолеатом (50 мг) и порошкообразным крахмалом (250 мг). Смесь затем загружают в желатиновую капсулу (400 мг композиции на капсулу). Альтернативно, соединение согласно данному изобретению (70 мг) и вторичный агент (30 мг) тщательно смешивают с полиоксиэтиленсорбитанмоноолеатом (50 мг) и порошкообразным крахмалом (250 мг), и полученную смесь загружают в желатиновую капсулу (400 мг композиции на капсулу).
Альтернативно, соединение согласно данному изобретению (40 мг) тщательно смешивают с микрокристаллической целлюлозой (Avicel PH 103; 259,2 мг) и стеаратом магния (0,8 мг). Смесь затем загружают в желатиновую капсулу (размер № 1, белая, непрозрачная) (300 мг композиции на капсулу).
Типичное приготовление таблетки для перорального введения
Соединение согласно данному изобретению (10 мг), крахмал (45 мг) и микрокристаллическую целлюлозу (35 мг) пропускают через сито № 20 меш U.S. и тщательно смешивают. Таким образом полученные гранулы высушивают при температуре 50-60°С и пропускают через сито № 16 меш U.S. Раствор поливинилпирролидона (4 мг, в виде 10%-ого раствора в стерильной воде) смешивают с натрийкарбоксиметилкрахмалом (4,5 мг), стеаратом магния (0,5 мг) и тальком (1 мг), и эту смесь затем пропускают через сито № 16 меш U.S. Затем к гранулам добавляют натрийкарбоксиметилкрахмал, стеарат магния и тальк. После перемешивания, смесь прессуют в таблетировочной машине, получая таблетку массой 100 мг.
Альтернативно, соединение согласно данному изобретению (250 мг) тщательно смешивают с микрокристаллической целлюлозой (400 мг), пирогенным диоксидом кремния (10 мг) и стеариновой кислотой (5 мг). Смесь затем прессуют до получения таблеток (665 мг композиции на таблетку).
Альтернативно, соединение согласно данному изобретению (400 мг) тщательно смешивают с кукурузным крахмалом (50 мг), кроскармеллозой натрия (25 мг), лактозой (120 мг) и стеаратом магния (5 мг). Смесь затем прессуют до получения таблетки с одной насечкой (600 мг композиции на таблетку).
Альтернативно, соединение согласно данному изобретению (100 мг) тщательно смешивают с кукурузным крахмалом (100 мг) в водном растворе желатина (20 мг). Смесь высушивают и размалывают до получения мелкозернистого порошка. Микрокристаллическую целлюлозу (50 мг) и стеарат магния (5 мг) затем смешивают с желатиновой композицией, гранулируют и полученную смесь прессуют до получения таблеток (100 мг соединения согласно данному изобретению на таблетку).
Типичное приготовление суспензии для перорального введения
Следующие ингредиенты смешивают до образования суспензии, содержащей 100 мг соединения согласно данному изобретению на 10 мл суспензии:
Типичное приготовление жидкой лекарственной формы для перорального введения
Подходящая жидкая лекарственная форма представляет собой таковую с буфером на основе карбоновой кислоты, как, например, цитратные, лактатные и малеатные буферные растворы. Например, соединение согласно данному изобретению (которое может быть предварительно смешано с ДМСО) смешивают со 100 мМ аммонийцитратным буфером и доводят значение рН до 5, или смешивают со 100 мМ раствором лимонной кислоты и значение рН доводят до 2. В такие растворы также можно включать солюбилизирующий эксципиент, такой как циклодекстрин, например, раствор может включать 10% масс. гидроксипропил-β-циклодекстрина.
Другие подходящие жидкие лекарственные формы включают 5%-ый раствор NaHCO3, вместе с циклодекстрином или без него.
Типичное приготовление инъецируемой лекарственной формы для введения путем инъекции
Соединение согласно данному изобретению (0,2 г) смешивают с 0,4М буферным раствором ацетата натрия (2,0 мл). Значение рН полученного раствора доводят до 4, используя 0,5 н водный раствор хлороводорода или 0,5 н водный раствор гидроксида натрия, как необходимо, и затем добавляют достаточное для инъекции количество воды, получая общий объем 20 мл. Смесь затем отфильтровывают через стерильный фильтр (0,22 микрон), получая стерильный раствор, подходящий для введения путем инъекции.
Типичные композиции для введения путем ингаляции
Соединение согласно данному изобретению (0,2 мг) тонко измельчают и затем смешивают с лактозой (25 мг). Эту комбинированную смесь потом загружают в желатиновый картридж для ингаляции. Содержимые картриджа вводят, используя, например, ингалятор для сухого порошка.
Альтернативно, микронизированное соединение согласно данному изобретению (10 г) диспергируют в растворе, полученном путем растворения лецитина (0,2 г) в деминерализованной воде (200 мл). Полученную суспензию высушивают распылением и затем тонко измельчают с получением микронизированной композиции, содержащей частицы, имеющие средний диаметр меньше, чем примерно 1,5 мкм. Микронизированную композицию затем загружают в картриджи ингаляторов с дозированным распылением, содержащие 1,1,1,2-тетрафторэтан под повышенным давлением, в количестве, достаточном для обеспечения от примерно 10 мкг до примерно 500 мкг соединения согласно данному изобретению на дозу, которую вводят путем ингаляции.
Альтернативно, соединение согласно данному изобретению (25 мг) растворяют в забуференном цитратом (рН=5) изотоническом насыщенном солевом растворе (125 мл). Смесь перемешивают и диспергируют с помощью ультразвука до тех пор, пока соединение не растворится. Проверяют значение рН раствора и доводят, если необходимо, до 5 путем медленного добавления 1 н водного раствора NaOH. Полученный раствор вводят, используя аэрозольное устройство, которое обеспечивает от примерно 10 мкг до примерно 500 мкг соединения согласно данному изобретению на дозу.
ПРИМЕРЫ
Следующие получения и примеры предусмотрены для иллюстрации конкретных воплощений данного изобретения. Эти конкретные воплощения, однако, не предназначены для ограничения рамок данного изобретения каким-либо путем, за исключением особо указанного.
Следующие аббревиатуры имеют следующие значения, за исключением иначе указанного, и любые другие аббревиатуры, используемые в данном контексте и не определенные, имеют их стандартное общепринятое значение:
За исключением иначе указанного, все вещества, такие как реагенты, исходные вещества и растворители, приобретали у коммерческих поставщиков (таких как Sigma-Aldrich, Fluka Riedel-de Haën и т.п.) и использовали без дальнейшей очистки.
Реакции осуществляли в атмосфере азота, за исключением иначе указанного. Протекание реакций контролировали с помощью тонкослойной хроматографии (ТСХ), аналитической высокоэффективной жидкостной хроматографии (аналитическая ВЭЖХ) и масс-спектрометрии, подробности относительно которых даны в конкретных примерах. Растворители, используемые в случае аналитической ВЭЖХ, являлись следующими: растворитель А представляет собой 98% Н2О/2% MeCN/1,0 мл/л ТФУК; растворитель В представляет собой 90% MeCN/10% H2O/1,0 мл/л ТФУК.
Реакции осуществляли, как конкретно описано в каждом примере получения; обычно реакционные смеси очищали путем экстрации и других способов очистки, таких как зависимая от температуры и растворителя кристаллизация и осаждение. В дополнение, реакционные смеси обычно очищали с помощью препаративной ВЭЖХ, типично используя наполнители колонки Microsorb C18 и Microsorb BDS и стандартные элюенты. Протекание реакций типично определяли с помощью жидкостной хроматографии с масс-спектрометрией (LCMS). Охарактеризовывание изомеров выполняли с помощью спектроскопии ядерного эффекта Оверхаузера (NOE). Охарактеризовывание продуктов реакции обычно осуществляли с помощью масс-спектрометрии и1Н-ЯМР-спектроскопии. Для измерения с помощью ЯМР, образцы растворяют в дейтерированном растворителе (CD3OD, CDCl3 или ДМСО-d6) и данные1Н-ЯМР-спектра получали с помощью прибора Varian Gemini 2000 (400 МГц) при стандартных условиях наблюдения. Идентификацию соединений посредством масс-спектрометрии обычно проводили, используя метод ионизации электрораспылением (ESMS), с помощью прибора Applied Biosystems (Foster City, CA), модель прибора API 150 EX, или с помощью прибора Agilent (Palo Alto, CA), модель 1200 LC/MSD.
Получение 1: 1-Тритил-1Н-1,2,3-триазол-4-карбоновая кислота
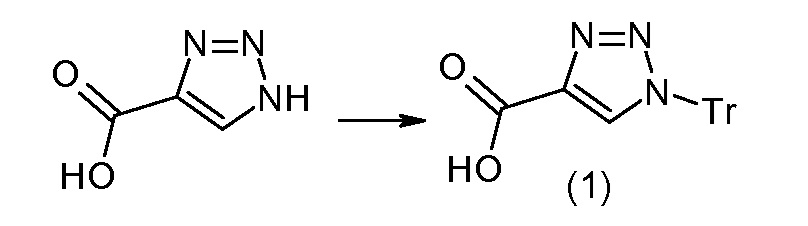
1Н-1,2,3-Триазол-4-карбоновую кислоту (20,0 г, 177 ммоль) объединяют с ДМФА (200 мл, 2,6 моль) и пиридином (100 мл, 1,2 моль), и полученную смесь охлаждают до температуры 0°С. В виде порций, добавляют трифенилметилхлорид (54 г, 190 ммоль) и смесь перемешивают при комнатной температуре в течение 24 часов. Полученную суспензию отфильтровывают и осадок на фильтре промывают водой (2 раза по 200 мл) и высушивают на воздухе, получая не совсем белого цвета твердое вещество (60 г). Твердое вещество суспендируют в ТГФ (800 мл) при комнатной температуре, в течение 4 часов, затем отфильтровывают. Фильтрат после этого концентрируют с помощью роторного испарителя, получая вязкое масло. Добавляют EtOAc (500 мл) и объем уменьшают до ~200 мл. Полученную густую суспензию отфильтровывают и высушивают, получая указанное в заголовке соединение (35,5 г).
Получение 2: (2S,4R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метил-2-(тетрагидропиран-2-илоксиметил)пентановая кислота

(R)-3-бифенил-4-ил-2-трет-бутоксикарбониламинопропионовую кислоту (5,0 г, 15 ммоль) и 2,2-диметил-1,3-диоксан-4,6-дион (2,3 г, 16,1 ммоль) объединяют с DMAP (3,2 г, 26,4 ммоль). Добавляют дополнительное количество DMAP (2,0 г, 16,1 ммоль) и DCM (50 мл), и полученную смесь перемешивают и охлаждают до температуры -5°С (продувка азотом) в течение 30 минут. В виде порций, добавляют EDCI (HCl; (3,1 г, 16,1 ммоль), все время поддерживая внутреннюю температуру ниже 0°С, при перемешивании. Смесь затем охлаждают до температуры -5°С, перемешивают при этой температуре в течение 3 часов, затем выдерживают при температуре -20°С в течение ночи. Смесь затем промывают 0,4М водным раствором KHSO4 (80 мл) и насыщенным водным раствором NaCl (20 мл), потом сушат над MgSO4 в течение ночи. Твердые вещества отфильтровывают и фильтрат затем выпаривают досуха, получая сырое Соединение 1 (3,2 г).
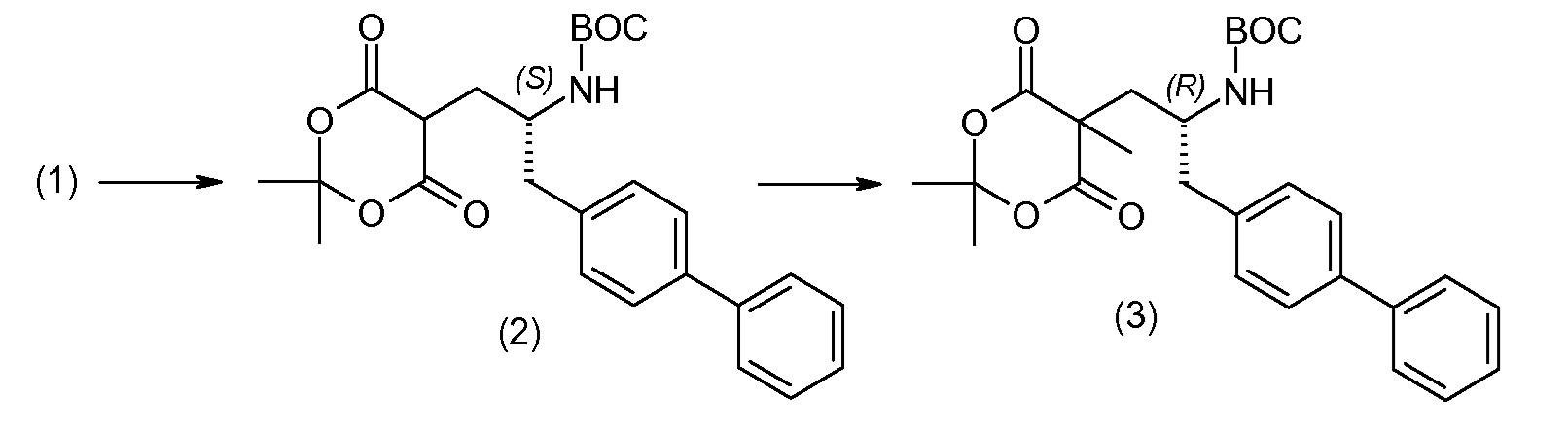
АсОН (8,6 мл) добавляют к раствору сырого соединения 1 (6,4 г, 14 ммоль, 1,0 экв.) в безводном MeCN (90 мл) при температуре -5°С, в атмосфере азота. Смесь перемешивают при температуре -5°С в течение 30 минут, затем, в виде небольших порций, добавляют боргидрид натрия (1,3 г, 34,5 ммоль, 2,5 экв.) в течение 2 часов. После перемешивания в течение следующего 1 часа при температуре -5°С, добавляют насыщенный водный раствор NaCl и 1,7М раствор NaCl в воде (30 мл). Слои разделяют и органический слой промывают насыщенным водным раствором NaCl (2 раза по 30 мл) и водой (2 раза по 30 мл), сушат над MgSO4, отфильтровывают и выпаривают. Полученный сырой продукт далее очищают с помощью хроматографии (5:1, гептан: EtOAc), получая Соединение 2 (1,1 г, чистота: 98,4%) в виде твердого вещества светло-желтого цвета.
Соединение 2 (5,0 г, 11 ммоль, 1,0 экв.) и К2СО3 (1,8 г, 13,2 ммоль, 1,2 экв.) растворяют в ДМФА (33,9 мл) и охлаждают до температуры 0°С, при перемешивании, в атмосфере азота. Добавляют метилиодид (892 мкл, 1,3 экв.) и полученную смесь перемешивают при температуре 0°С в течение 1 часа. Смесь оставляют нагреваться до комнатной температуры (23°С) и выдерживают в течение ночи. Добавляют насыщенный водный раствор NaCl (35 мл) и EtOAc (35 мл) и полученную смесь перемешивают в течение 2 минут. Слои разделяют и органический слой выпаривают. Остаток растирают в EtOAc (20 мл). Твердое вещество отфильтровывают и высущивают в вакууме. Фильтрат концентрируют и снова растирают в EtOAc, получая Соединение 3 (3,9 г), трет-бутиловый эфир [(R)-2-бифенил-4-ил-1-(2,2,5-триметил-4,6-диоксо-[1,3]диоксан-5-илметил)этил]-карбаминовой кислоты.
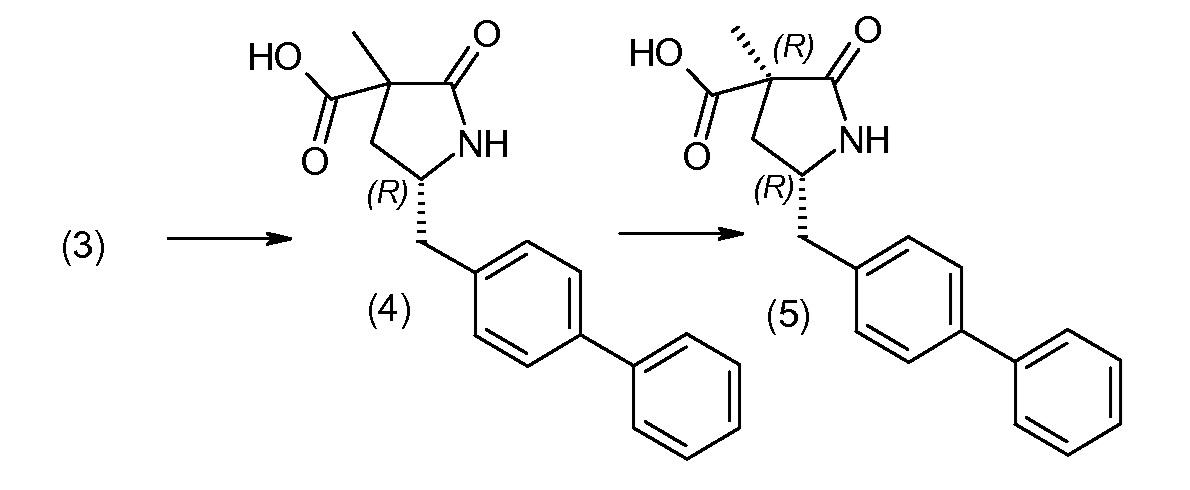
Соединение 3 (400,0 г, 855,5 ммоль) объединяют с СРМЕ (2 л) с получением суспензии. Суспензию охлаждают до температуры 0°С и добавляют 3,0М раствор HCl в СРМЕ (2,0 л). Полученную смесь перемешивают при комнатной температуре в течение 24 часов, получая свободно текучую суспензию. Фильтрование и высушивание приводят к получению Соединения 4 в виде смеси диастереоизомеров в соотношении 93:7 (общий выход: 206 г). Повторное суспендирование в МеTHF (1 л) при комнатной температуре с последующим добавлением СРМЕ (1 л; суспендирование в течение ночи при комнатной температуре) приводит к получению Соединения 5 (170 г и чистота 98%).

Соединение 5 (25,0 г, 80,8 ммоль) объединяют с ТГФ (500 мл) и NMМ (25 мл, 230 ммоль). Полученную смесь охлаждают до температуры 0°С (температура рубашки установлена при -5°С) и, по каплям, через капельную воронку добавляют изобутилхлорформиат (21,0 мл, 162 ммоль), все время поддерживая внутреннюю температуру ниже 5°С. Смесь перемешивают при температуре 0°С в течение 20 минут. По каплям, добавляют боргидрид натрия (12,2 г, 323 ммоль), растворенный в воде (40 мл), и смесь перемешивают при температуре 0°С в течение 20 минут (конверсия >98%). Реакционную смесь гасят 1М водным раствором HCl (300 мл) и смесь перемешивают при комнатной температуре в течение 1 часа. Наибольшее количество растворителя отгоняют, оставляя суспензию белого цвета. Суспензию перемешивают в течение 60 минут и затем отфильтровывают (мелкие частицы, медленная фильтрация), получая Соединение 6 в виде твердого вещества белого цвета (23 г, чистота: >98%).

Соединение 6 (300 г, 1,0 моль) и DCM (3,8 л) объединяют и полученную смесь охлаждают до температуры 0°С. Добавляют дигидропиран (185 мл, 2,0 моль) и п-толуолсульфоновую кислоту (52,5 г, 305 ммоль) и смесь перемешивают при комнатной температуре в течение 2 часов. Добавляют водный насыщенный раствор NaHCO3 (10:90, NaHCO3:вода, 3 л) и фазы разделяют. Органический слой сушат над Na2SO4 с последующим удалением растворителя до объема, составляющего приблизительно 500 мл. К сырому продукту добавляют диизопропиловый эфир (2 л) и затравочные кристаллы. Полученную суспензию перемешивают в течение ночи при комнатной температуре. Фильтрование и высушивание приводят к получению кристаллического Соединения 7 (320 г, чистота: >98%).
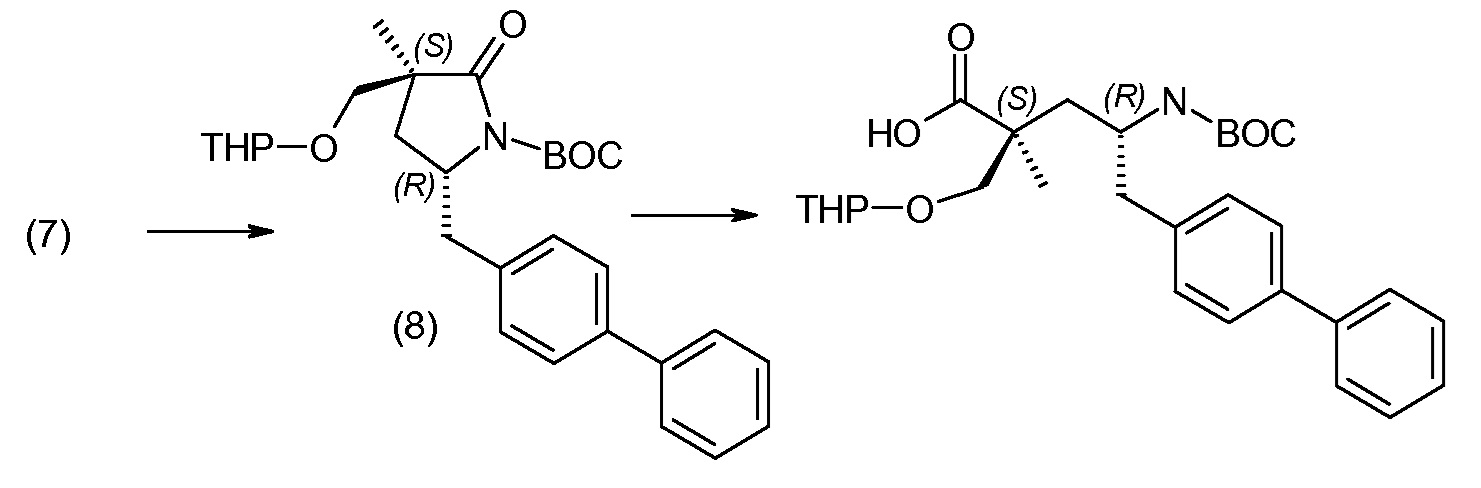
Соединение 7 (320,0 г, 843,2 ммоль) растворяют в ТГФ (2,5 л), получая прозрачный раствор, который продувают азотом. Раствор охлаждают до температуры 0°С и, по каплям, добавляют 1,0М раствор NaHMDS в ТГФ (920 мл, 920 ммоль) в течение 30 минут. Смесь перемешивают при температуре 0°С в течение 15 минут, затем, по каплям, добавляют ди-трет-бутилдикарбонат (202 г, 926 ммоль), растворенный в ТГФ (500 мл), в течение 1 часа, все время поддерживая внутреннюю температуру ниже 5°С. Смесь оставляют нагреваться до комнатной температуры (конверсия в Соединение 8 составляет >99%). Смесь охлаждают до температуры <5°С с последующим добавлением 1,0М водного раствора LiOH (2,5 л, 2,5 моль). Охлаждающую баню убирают и смесь перемешивают в течение ночи при температуре 27°С (остается ~4% исходного вещества). Смесь нагревают при температуре 35°С в течение 4 часов (конверсия >98%), затем охлаждают до температуры 15°С. Смесь разбавляют с помощью EtOAc (3 л) и насыщенного водного раствора NH4Cl (0,37:0,63, NH4Cl:вода, 3 л). Фазы разделяют и органический слой промывают насыщенным водным раствором NH4Cl (3 л) и насыщенным водным раствором NaСl (3 л). Органический слой сушат над Na2SO4 (1 кг) с последующим удалением растворителя, получая сырое, указанное в заголовке, соединение (463 г) в виде стекловидного клейкого твердого вещества.
Получение 3: (2S,4R)-5-бифенил-4-ил-2-метил-2-(тетрагидропиран-2-илоксиметил)-4-[(1-тритил-1Н-1,2,3-триазол-4-карбонил)амино]пентановая кислота

(2S,4R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метил-2-(тетрагидропиран-2-илоксиметил)пентановую кислоту (10,0 г, 20,1 ммоль) объединяют с ДМФА (50 мл, 600 ммоль) и перемешивают. Добавляют К2СО3 (3,3 г, 24 ммоль) и полученную смесь охлаждают до температуры 0°С. Добавляют бензилбромид (3,0 мл, 25 ммоль) и смесь перемешивают при температуре в диапазоне от 0°С до комнатной температуры и затем в течение ночи. Добавляют 1,0М раствор HCl в воде (250 мл, 250 ммоль) и EtOAc (300 мл, 3,0 моль). Фазы разделяют и органический слой промывают насыщенным водным раствором NaCl (200 мл) и сушат над Na2SO4 с последующим удалением растворителя. Добавляют DCM (50 мл) и 3,0М раствор HCl в СРМЕ (100 мл, 300 ммоль) и полученную смесь перемешивают при комнатной температуре в течение ночи. Объем уменьшают до половины с помощью роторного испарителя, получая свободно текучую суспензию, которую отфильтровывают. Колбу и фильтровальный осадок промывают с помощью СРМЕ (20 мл) и высушивают. Остаток растворяют в DCM (50 мл, 800 ммоль) и полученную суспензию охлаждают до температуры 0-10°С. Добавляют дигидропиран (3,7 мл, 40,2 ммоль) и п-толуолсульфоновую кислоту (692 мг, 4,0 ммоль) и полученную смесь перемешивают при температуре 0°С в течение 2 часов, затем перемешивают в течение ночи при температуре охлаждающей среды. Объем уменьшают до ~20 мл с помощью роторного испарителя. Добавляют МТВЕ (~30 мл), потом затравочные кристаллы, получая жидкую суспензию после 15 минут перемешивания. Объем уменьшают до половины и добавляют дополнительное количество МТВЕ (20 мл), все время перемешивая при комнатной температуре до получения густой суспензии. Добавляют дополнительное количество МТВЕ (до объема 100 мл) и смесь перемешивают в течение 1 часа. Фильтрование и высушивание приводят к получению Соединения 1 (8,9 г) в виде гидрохлорида.

1-Тритил-1Н-1,2,3-триазол-4-карбоновую кислоту (9,2 г, 26 ммоль) растворяют в ТГФ (200 мл, 2,0 моль). Добавляют DIPEA (9,0 мл, 52 ммоль) и полученную смесь охлаждают до температуры 0°С. В виде порций, добавляют HCTU (11 г, 26 ммоль) и смесь перемешивают при температуре 0°С в течение 15 минут. Добавляют Соединение 1 (гидрохлорид; 9,0 г, 17 ммоль) и полученную смесь перемешивают при температуре в диапазоне от 0°С до комнатной температуры. Реакцию контролируют и гасят водой (200 мл) спустя 90 минут. Добавляют EtOAc (200 мл). Органический слой промывают насыщенным водным раствором NaCl (200 мл), сушат над Na2SO4 и растворитель удаляют. Остаток (15 г) растворяют в DCM (100 мл), твердые вещества отфильтровывают и прозрачный раствор очищают (300 г SiG колонка; элюирование 10-30% EtOAc в гексанах), получая Соединение 2 (7,5 г).

Соединение 2 (0,20 г, 0,24 ммоль) объединяют с EtOAc (3 мл, 30 ммоль). Добавляют NaHCO3 (50 мг, 0,6 ммоль) и полученный прозрачный раствор продувают азотом. Добавляют 10%-ый Pd/C (0,05:0,45, палладий:углеродная сажа, 50 мг, 0,05 ммоль) и полученную смесь продувают водородом и затем гидрируют в течение ночи при комнатной температуре. Твердые вещества отфильтровывают и растворитель удаляют с помощью роторного испарителя, получая указанное в заголовке соединение.
Получение 4: (2S,4R)-5-бифенил-4-ил-2-метил-2-(тетрагидропиран-2-илоксиметил)-4-[(1Н-1,2,3-триазол-4-карбонил)амино]пентановая кислота
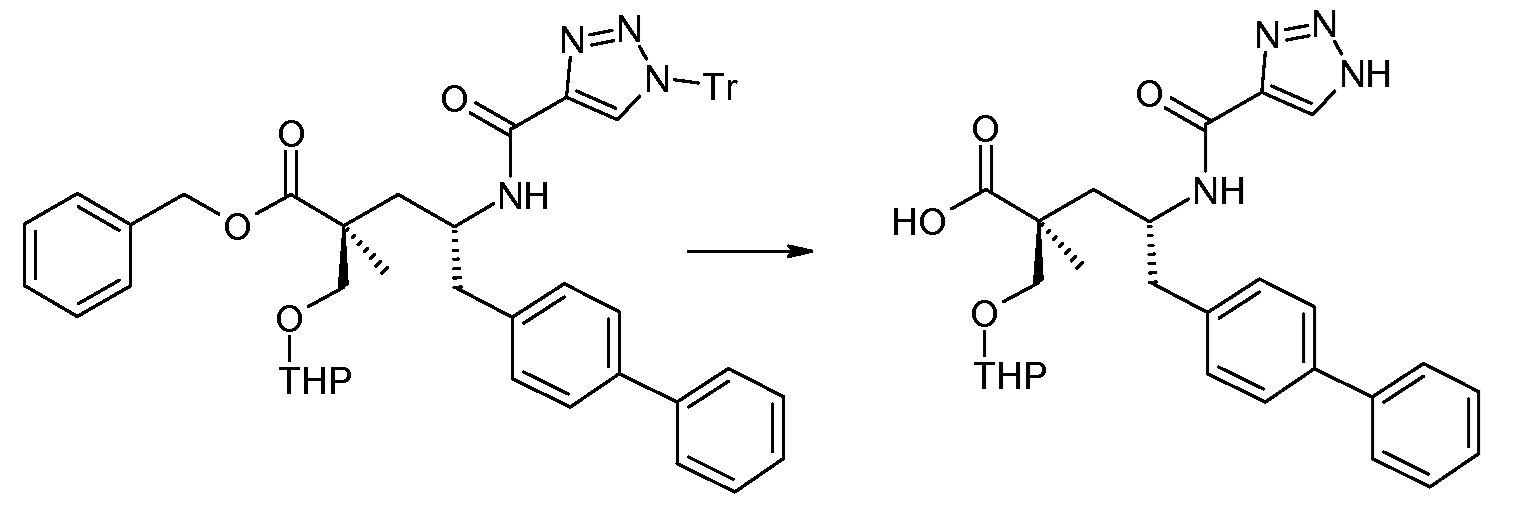
Бензиловый эфир (2S,4R)-5-бифенил-4-ил-2-метил-2-(тетрагидропиран-2-илоксиметил)-4-[(1-тритил-1Н-1,2,3-триазол-4-карбонил)амино]пентановой кислоты (7,5 г, 9,1 ммоль) объединяют с EtOAc (80 мл, 800 ммоль). Полученный прозрачный раствор продувают азотом и добавляют 10%-ый Pd/C (0,05:0,45, палладий:углеродная сажа, 1,0 г, 0,94 ммоль). Полученную смесь продувают водородом и затем гидрируют в течение ночи при комнатной температуре. Смесь продувают азотом, твердые вещества отфильтровывают и растворитель удаляют с помощью роторного испарителя, получая указанное в заголовке соединение (7 г).
Получение 5: (R)-3-(4-бромфенил)-2-трет-бутоксикарбониламинопропионовая кислота
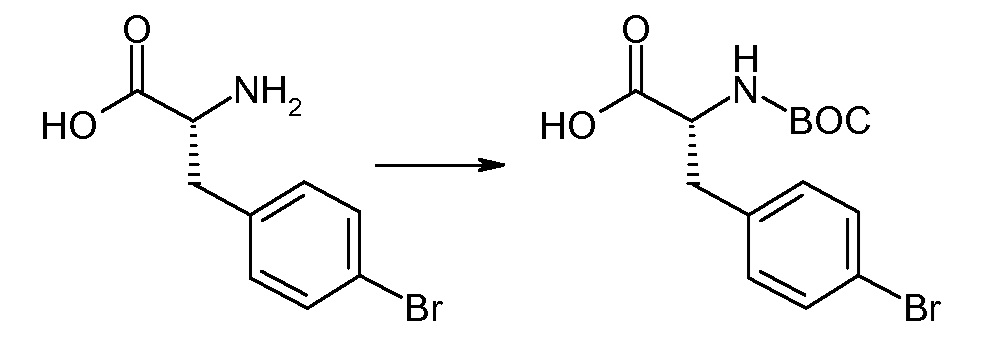
К раствору (R)-2-амино-3-(4-бромфенил)пропионовой кислоты (50 г, 0,2 моль) в MeCN (700 мл) добавляют раствор NaOH (16,4 г, 0,4 моль) в воде (700 мл), при температуре -5°С. После перемешивания в течение 10 минут, добавляют раствор (ВОС)2О (44,7 г, 0,2 моль) в MeCN (100 мл). Смесь нагревают до комнатной температуры и перемешивают в течение ночи. После выпаривания MeCN, остаток разбавляют с помощью DCM (800 мл) и подкисляют 1М раствором HCl до рН=2, при температуре -5°С. Водный слой экстрагируют с помощью DCM (3 раза по 200 мл). Объединенные органические слои промывают насыщенным водным раствором NaCl (500 мл), сушат над безводным Na2SO4 и концентрируют, получая указанное в заголовке соединение в виде твердого вещества белого цвета (64,2 г).
LC-MS: [M+Na]: 366, [2M+Na]: 709.
Получение 6: трет-Бутиловый эфир [(R)-1-(3'-фторбифенил-4-илметил)-2-(2,2,5-триметил-4,6-диоксо-[1,3]диоксан-5-ил)этил]карбаминовой кислоты
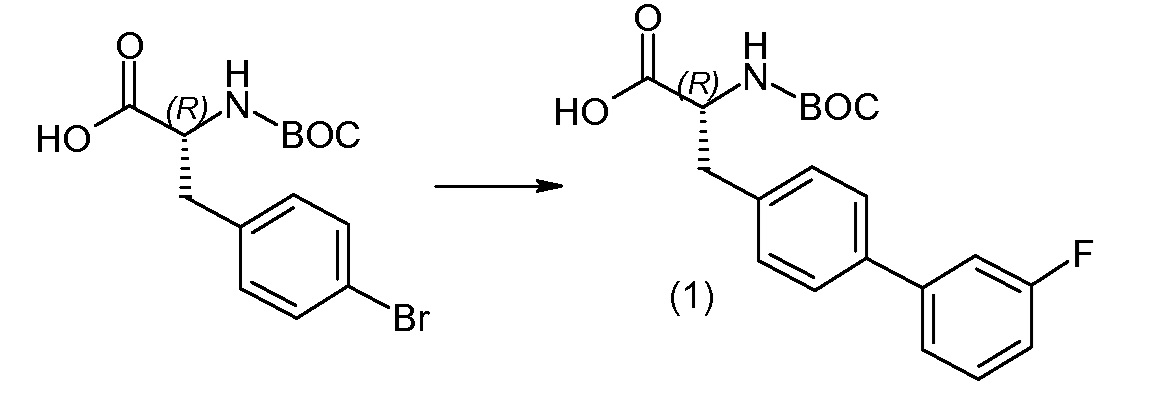
К раствору (R)-3-(4-бромфенил)-2-трет-бутоксикарбониламинопропионовой кислоты (64,2 г, 187 ммоль) в 1,4-диоксане (500 мл) добавляют 3-фторфенилбороновую кислоту (31,3 г, 224 ммоль) и Pd(dppf)2Cl2 (13,7 г, 19 ммоль), при комнатной температуре, в атмосфере азота. После перемешивания в течение 10 минут, добавляют раствор К2СО3 (51,7 г, 374 ммоль) в воде (250 мл). Смесь нагревают до температуры 100°С и перемешивают в течение ночи. После выпаривания растворителя, добавляют воду (200 мл). Водный слой подкисляют 1М раствором HCl до рН=2 и экстрагируют с помощью EtOAc (3 раза по 200 мл). Объединенные органические слои промывают насыщенным водным раствором NaCl (400 мл), сушат над безводным Na2SO4 и концентрируют, получая сырой продукт, который далее очищают с помощью колоночной хроматографии (гексаны:EtOAc=4:1), получая Соединение 1 в виде масла светло-желтого цвета (45 г).
LC-MS: [M+Na]: 382, [2M+Na]: 741.
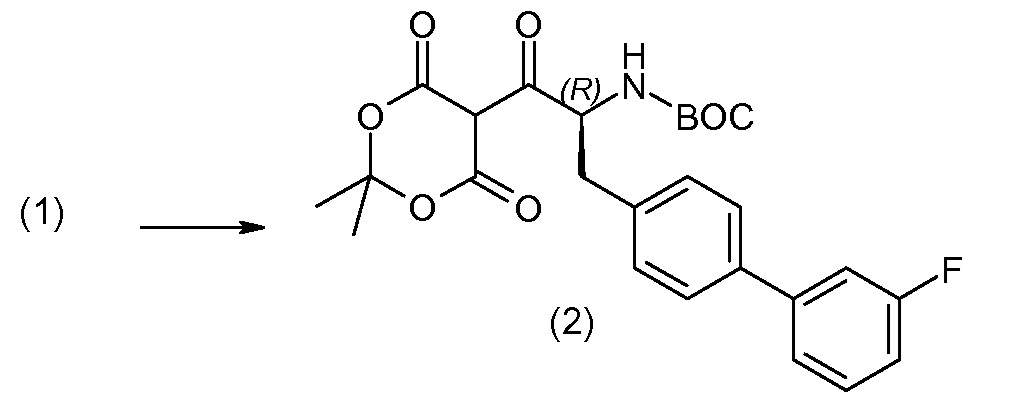
К раствору Соединения 1 (45 г, 125 ммоль), кислоты Мельдрума (23,5 г, 163 ммоль) и DMAP (26,0 г, 213 ммоль) в безводном DCM (500 мл) добавляют раствор DСC (33,3 г, 163 ммоль) в безводном DCM (200 мл) в течение 1 часа, при температуре -5°С, в атмосфере азота. Смесь перемешивают при температуре -5°С в течение 8 часов, затем охлаждают в течение ночи, причем в течение этого времени осаждаются очень мелкие кристаллы дициклогексилмочевины. После фильтрации, смесь промывают 5%-ым раствором KHSO4 (4 раза по 200 мл) и насыщенным водным раствором NaCl (1 раз, 200 мл), затем сушат, при охлаждении, над безводным MgSО4 в течение ночи. Раствор выпаривают, получая сырое Соединение 2 в виде масла светло-желтого цвета (57,7 г).
LC-MS: [M+Na]: 508, [2M+Na]: 993.
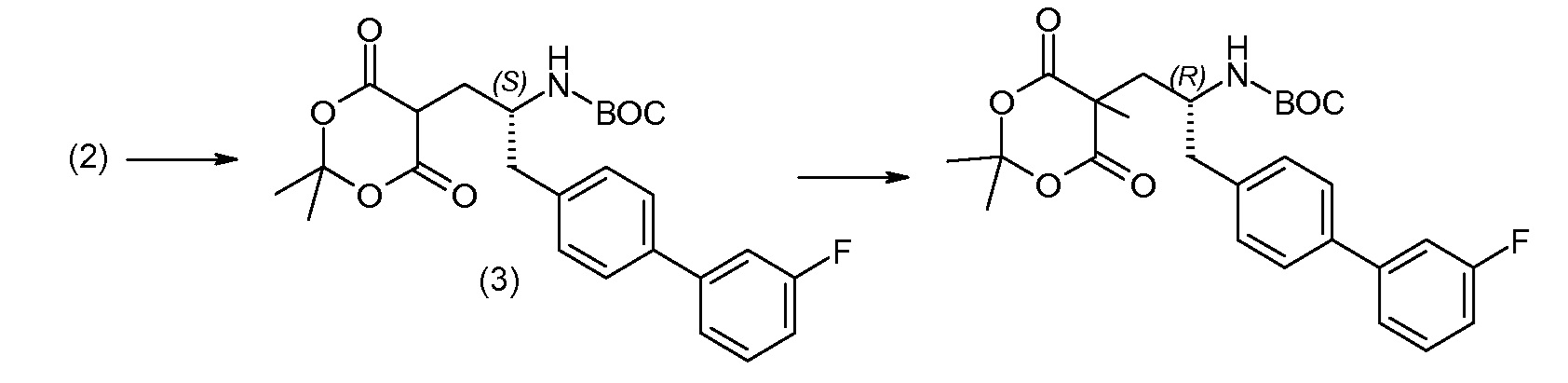
К раствору Соединения 2 (57,7 г, 119 ммоль) в безводном DCM (1 л) добавляют АсОН (78,4 г, 1,3 моль), при температуре -5°С, в атмосфере азота. Смесь перемешивают при температуре -5°С в течение 0,5 часа, затем, в виде небольших порций, добавляют NaBH4 (11,3 г, 0,3 моль) в течение 1 часа. После перемешивания в течение дополнительного 1 часа при температуре -5°С, добавляют насыщенный водный раствор NaCl (300 мл). Органический слой промывают насыщенным водным раствором NaCl (2 раза по 300 мл) и водой (2 раза по 300 мл), сушат над безводным MgSО4, отфильтровывают и концентрируют, получая сырой продукт, который далее очищают с помощью хроматографии (гексаны:EtOAc=6:1), получая Соединение 3 в виде масла светло-желтого цвета (28 г).
LC-MS: [M+Na]: 494, [2M+Na]: 965.
К раствору Соединения 3 (28 г, 60 ммоль) в безводном ДМФА (250 мл) добавляют К2СО3 (9,9 г, 72 ммоль) и метилиодид (25,6 г, 180 ммоль), при температуре 0°С, в атмосфере азота. После перемешивания в течение 1 часа при температуре 0°С, смесь нагревают до комнатной температуры и перемешивают в течение ночи. Смесь разбавляют водой (3 л) и экстрагируют с помощью EtOAc (3 раза по 300 мл). Объединенные органические слои промывают насыщенным водным раствором NaCl (500 мл), сушат над безводным Na2SO4 и концентрируют, получая сырой продукт, который далее очищают с помощью хроматографии (гексаны:EtOAc=5:1), получая указанное в заголовке соединение в виде твердого вещества светло-желтого цвета (11,7 г).
LC-MS: [M+Na]: 508, [2M+Na]: 993.1H ЯМР (300 МГц, CD3OD): δ 7,52-7,49 (м, 2H), 7,41-7,39 (м, 2H), 7,32-7,27 (м, 3H), 7,07-7,01 (м, 1H), 6,21-6,18 (д, 1H), 3,79 (м, 1H), 2,78-2,61 (м, 2H), 2,35-2,20 (м, 2H), 1,76 (с, 6H), 1,59 (с, 3H), 2,21 (с, 1H), 1,28 (с, 9H).
Получение 7: (2S,4R)-4-трет-бутоксикарбониламино-5-(3'-фторбифенил-4-ил)-2-гидроксиметил-2-метилпентановая кислота (Соединение 1) и (2S,4R)-4-амино-5-(3'-фторбифенил-4-ил)-2-гидроксиметил-2-метилпентановая кислота (Соединение 2)

Дистиллированную воду (181 мл) продувают азотом в течение 1 часа, затем, посредством канюли, вводят в сосуд, содержащий 0,1М раствор дииодида самария в ТГФ (800 мл). Все время поддерживая атмосферу азота, подобным образом дегазированный раствор трет-бутилового эфира [(R)-1-(3'-фторбифенил-4-илметил)-2-(2,2,5-триметил-4,6-диоксо-[1,3]диоксан-5-ил)этил]карбаминовой кислоты (4,9 г, 10,0 ммоль, 1,0 экв.) в ТГФ добавляют через канюлю. Полученную смесь перемешивают в течение 15 минут, затем подвергают воздействию воздуха. Растворитель выпаривают и добавляют EtOAc (200 мл), насыщенный водный раствор NaCl (50 мл) и 10%-ый раствор лимонной кислоты (20 мл). Смесь перемешивают в течение 5 минут, затем оба слоя извлекают. Органический слой сушат над Na2SO4 и концентрируют в вакууме. Сырой продукт очищают с помощью хроматографии (330 г Au-колонка, 1:1, простой эфир:EtOAc с 0,5% АсОН), получая указанное в заголовке Соединение 1 (1,5 г). Порцию Соединения 1 растворяют в 4М растворе HCl в диоксане (6 мл) и MeCN (10 мл). Растворитель выпаривают в вакууме, получая указанное в заголовке Соединение 2.
Получение 8: трет-Бутиловый эфир [(R)-1-(4-бромбензил)-2-(2,2,5-триметил-4,6-диоксо-[1,3]диоксан-5-ил)этил]карбаминовой кислоты

К смеси (R)-2-амино-3-(4-бромфенил)пропионовой кислоты (100 г, 410 мкмоль) с MeCN (600 мл), по каплям, добавляют раствор NaOH (32,8 г, 820 мкмоль) в воде (800 мл), при температуре 0°С. Полученный раствор перемешивают в течение 30 минут. Добавляют раствор (ВОС)2О (93,8 г, 430 мкмоль) в MeCN (200 мл) и полученную смесь нагревают до комнатной температуры и перемешивают в течение ночи. MeCN выпаривают и остаток растворяют в DCM (1 л) и подкисляют 2М раствором HCl до рН=2, при температуре -5°С. Водный слой извлекают и объединенные органические слои промывают насыщенным водным раствором NaCl (500 мл), сушат над безводным Na2SO4 и концентрируют, получая сырое Соединение 1 (141 г, выход 100%) в виде твердого вещества желтого цвета. LC-MS: 366 [M+Na]+.
Соединение 1 (20 г, 58,1 ммоль) объединяют с 2,2-диметил-1,3-диоксан-4,6-дионом (9,2 г, 63,9 ммоль), DMAP (10,7 г, 87,2 ммоль) и безводным DCM (400 мл) и охлаждают до температуры 0°С. После перемешивания в течение 30 минут, по каплям, добавляют раствор DCC (13,2 г, 63,9 ммоль) в DCM (50 мл) при температуре 0°С, в атмосфере азота. После добавления, баню со льдом убирают и смесь перемешивают при комнатной температуре в течение ночи. Раствор охлаждают до температуры -20°С в течение 1 часа и затем твердые вещества отфильтровывают. Фильтрат промывают 5%-ым раствором KHSO4 (4 раза по 100 мл) и насыщенным водным раствором NaCl (200 мл). Органический слой сушат над безводным Na2SO4 и выпаривают, получая сырое Соединение 2 (27,5 г) в виде твердого вещества серого цвета. LC-MS: 492 [M+Na]+.

К раствору Соединения 2 (27,5 г, 58,1 ммоль) в безводном DCM (400 мл) добавляют АсОН (38,4 г, 639,1 ммоль), при температуре -5°С, в атмосфере азота. Смесь перемешивают при температуре -5°С в течение 30 минут. В виде порций, добавляют NaBH4 (5,5 г, 145,2 ммоль) в течение 30 минут и полученный раствор перемешивают при комнатной температуре в течение 3 часов. Добавляют насыщенный водный раствор NaCl (300 мл) для гашения реакционной смеси. Органический слой промывают насыщенным водным раствором NaCl (2 раза по 200 мл), сушат над безводным Na2SO4 и концентрируют, получая сырое Соединение 3 (22,6 г). LC-MS: 478 [M+Na]+.
К раствору Соединения 3 (22,6 г, 49,6 ммоль) и К2СО3 (8,3 г, 59,5 ммоль) в безводном ДМФА (160 мл), по каплям, добавляют метилиодид (14 г, 99,2 ммоль), при температуре 0°С. После добавления, раствор перемешивают при комнатной температуре в течение ночи. Смесь выпаривают и остаток растворяют в EtOAc (500 мл) и промывают насыщенным водным раствором NaCl (2 раза по 200 мл). Органический раствор сушат над безводным Na2SO4 и концентрируют, получая сырой продукт, который растирают с этиловым эфиром (100 мл), затем отфильтровывают, получая указанное в заголовке соединение (14,5 г) в виде твердого вещества белого цвета. LC-MS: 492 [M+Na]+.
Получение 9: (2S,4R)-4-трет-бутоксикарбониламино-5-(3'-хлорбифенил-4-ил)-2-гидроксиметил-2-метилпентановая кислота

Смесь трет-бутилового эфира [(R)-1-(4-бромбензил)-2-(2,2,5-триметил-4,6-диоксо-[1,3]диоксан-5-ил)этил]карбаминовой кислоты (8 г, 17 ммоль), 3-хлорфенилбороновой кислоты (3 г, 18,7 ммоль), Pd(dppf)2Cl2 (400 мг, 550 мкмоль) и фторида калия (2 г, 34 ммоль) в воде (80 мл) и диоксане (80 мл) перемешивают при температуре 60°С, в атмосфере аргона, в течение 3 часов. Смесь концентрируют, диспергируют в воде (150 мл), экстрагируют с помощью EtOAc (2 раза по 100 мл), сушат над безводным Na2SO4 и выпаривают, получая сырой продукт, который очищают с помощью колоночной хроматографии (РЕ:EtOAc=10:1), получая Соединение 1 (7 г) в виде твердого вещества белого цвета. LC-MS: 524 [M+Na]+.
Порошкообразный самарий (50 г, 330 мкмоль) продувают аргоном (20 минут). Добавляют безводный ТГФ (1,5 л) и через полученную суспензию барботируют аргон (15 минут). Добавляют иод (70 г, 270 ммоль) и смесь снова продувают аргоном (10 минут). Смесь закрывают алюминиевой фольгой и нагревают при температуре 65°С в течение ночи, затем оставляют охлаждаться до комнатной температуры. Раствор Соединения 1 (7 г, 13,9 ммоль) в ТГФ (200 мл) и воде (100 мл) герметично закрывают и продувают аргоном (10 минут), охлаждают до температуры -70°С, продувают аргоном (10 минут), охлаждают до температуры -70°С и продувают аргоном (30 минут). Затем к охлажденному раствору добавляют раствор порошкообразного самария (1,5 л), посредством канюли, и перемешивают при комнатной температуре в течение 2 часов. Раствор выпаривают и остаток растворяют в EtOAc (200 мл), промывают раствором винной кислоты (10%-ый раствор, 150 мл), сушат над безводным Na2SO4, концентрируют и очищают с помощью колоночной хроматографии (РЕ:EtOAc=0-30%, с добавлением 0,05% АсОН), получая указанное в заголовке соединение (3 г) в виде твердого вещества белого цвета. LC-MS: 470 [M+Na]+.1H ЯМР (300 МГц, CD3OD): δ 7,28~7,56 (м, 8H), 3,94 (с, 1H), 3,56~3,66 (м, 2H), 2,69~2,82 (м, 2H), 1,70~1,90 (м, 2H), 1,17~1,31 (м, 12H).
Получение 10: (2S,4R)-4-трет-бутоксикарбониламино-5-(2'-хлорбифенил-4-ил)-2-гидроксиметил-2-метилпентановая кислота
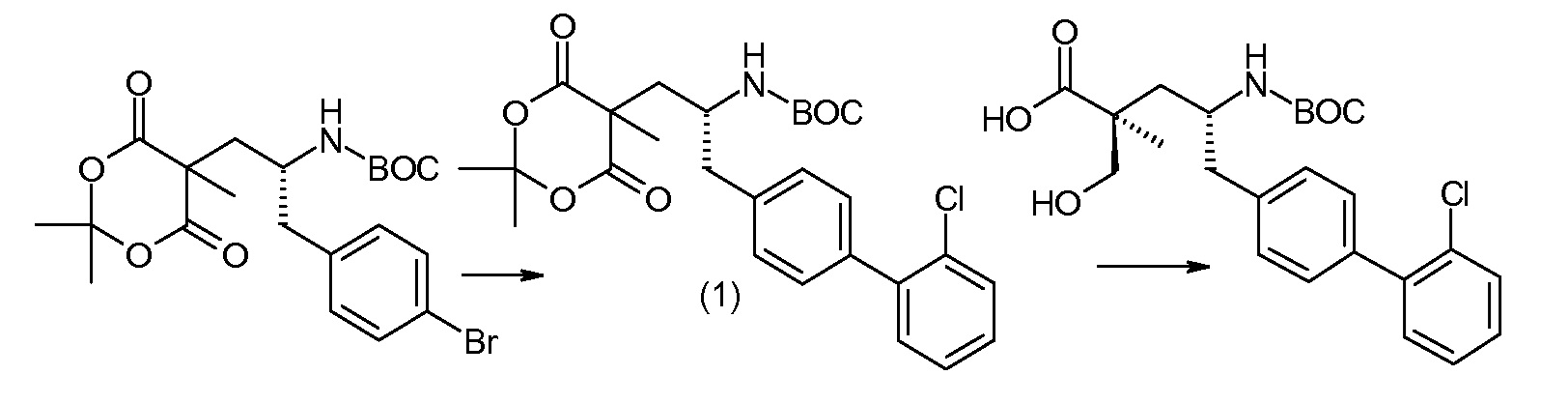
Смесь трет-бутилового эфира [(R)-1-(4-бромбензил)-2-(2,2,5-триметил-4,6-диоксо-[1,3]диоксан-5-ил)этил]карбаминовой кислоты (4,8 г, 30,6 ммоль), 2-хлорфенилбороновой кислоты, Pd(dppf)2Cl2 (1,0 г, 1,3 ммоль) и фторида калия (2,9 г, 51 ммоль) в воде (50 мл) и диоксане (250 мл) перемешивают при температуре 60°С в атмосфере аргона в течение 3 часов. Смесь концентрируют, растворяют в воде (150 мл), экстрагируют с помощью EtOAc (2 раза по 200 мл), сушат над безводным Na2SO4 и выпаривают, получая сырой продукт, который очищают с помощью колоночной хроматографии (РЕ:EtOAc=3:1), получая Соединение 1 (10 г) в виде твердого вещества белого цвета. LC-MS: 402 [M-Вос]+.1H ЯМР (300 МГц, CDCl3): δ 7,47 (м, 1H), 7,38 (д, J=8,0 Гц, 2H), 7,31 (м, 3H), 7,23 (дд, J=9,9, 5,7 Гц, 2H), 4,18 (д, J=10,2 Гц, 1H), 4,01 (c, 1H), 2,87 (дд, J=13,8, 5,7 Гц, 1H), 2,71 (дд, J=13,7, 6,6 Гц, 1H), 2,30 (м, 2H), 1,75 (c, 6H), 1,65 (c, 3H), 1,33 (д, J=11,7 Гц, 9H).
Порошкообразный самарий (50 г, 330 мкмоль) продувают аргоном (20 минут). Добавляют безводный ТГФ (1,5 л) и через полученную суспензию барботируют аргон (15 минут). Добавляют иод (70 г, 270 ммоль) и смесь снова продувают аргоном (10 мин). Смесь закрывают алюминиевой фольгой и нагревают при температуре 65°С в течение ночи, затем оставляют охлаждаться до комнатной температуры. Раствор Соединения 1 (7 г, 13,9 ммоль) в ТГФ (200 мл) и воде (100 мл) герметично закрывают и продувают аргоном (10 минут), охлаждают до температуры -70°С, продувают аргоном (10 минут), охлаждают до температуры -70°С и продувают аргоном (30 минут). Затем к охлажденному раствору добавляют раствор порошкообразного самария (1,5 л), посредством канюли, и перемешивают при комнатной температуре в течение 2 часов. Раствор выпаривают и остаток растворяют в EtOAc (200 мл), промывают раствором винной кислоты (10%-ый раствор, 150 мл), сушат над безводным Na2SO4, концентрируют и очищают с помощью колоночной хроматографии (РЕ:EtOAc=0-30%, с добавлением 0,05% АсОН), получая указанное в заголовке соединение (2,8 г) в виде не совсем белого цвета твердого вещества. LC-MS: 348 [M-Вос]+.1H ЯМР (300 МГц, CD3OD): δ 7,46 (м, 1H), 7,28 (м, 7H), 3,97 (c, 1H), 3,63 (м, 2H), 2,82 (м, 1H), 2,69 (м, 1H), 1,89 (м, 1H), 1,74 (м, 1H), 1,33 (м, 7H), 1,22 (м, 5H).
Получение 11: (2S,4R)-4-трет-бутоксикарбониламино-5-(2'-фторбифенил-4-ил)-2-гидроксиметил-2-метилпентановая кислота

Смесь трет-бутилового эфира [(R)-1-(4-бромбензил)-2-(2,2,5-триметил-4,6-диоксо-[1,3]диоксан-5-ил)этил]карбаминовой кислоты (12 г, 25,6 ммоль), 2-фторфенилбороновой кислоты (4,3 г, 30,7 ммоль), Pd(dppf)2Cl2 (950 мг, 1,3 ммоль) и фторида калия (3,0 г, 51,2 ммоль) в воде (50 мл) и диоксане (100 мл) перемешивают при температуре 60°С в атмосфере аргона в течение 2 часов. Смесь концентрируют, растворяют в воде (100 мл), экстрагируют с помощью EtOAc (3 раза по 100 мл), сушат над безводным Na2SO4 и выпаривают, получая сырой продукт, который очищают с помощью колоночной хроматографии (РЕ:EtOAc=3:1), получая Соединение 1 (10 г). LC-MS: 386,1 [M-Вос]+.1H ЯМР (300 МГц, CDCl3): δ 7,43 (м, 3H), 7,21 (м, 6H), 4,15 (д, J=10,6 Гц, 1H), 3,99 (c, 1H), 2,83 (м, 1H), 2,70 (дд, J=13,8, 6,8 Гц, 1H), 2,26 (м, 2H), 1,74 (c, 6H), 1,63 (c, 3H), 1,27 (м, 9H).
Порошкообразный самарий (50 г, 330 мкмоль) продувают аргоном (20 минут). Добавляют безводный ТГФ (1,5 л) и через полученную суспензию барботируют аргон (15 минут). Добавляют иод (70 г, 270 ммоль) и смесь снова продувают аргоном (10 минут). Смесь закрывают алюминиевой фольгой и нагревают при температуре 65°С в течение ночи, затем оставляют охлаждаться до комнатной температуры. Раствор Соединения 1 (7 г, 14,4 ммоль) в ТГФ (200 мл) и воде (100 мл) герметично закрывают и продувают аргоном (10 минут), охлаждают до температуры -70°С, продувают аргоном (10 минут), охлаждают до температуры -70°С и продувают аргоном (30 минут). Затем к охлажденному раствору добавляют раствор порошкообразного самария (1,5 л), посредством шприца, и перемешивают при комнатной температуре в течение 2 часов. Раствор выпаривают и остаток растворяют в EtOAc (200 мл), промывают раствором винной кислоты (10%-ый раствор, 150 мл), сушат над безводным Na2SO4, концентрируют и очищают с помощью колоночной хроматографии (РЕ:EtOAc=0-30%, с добавлением 0,05% АсОН), получая указанное в заголовке соединение (2,6 г) в виде не совсем белого цвета твердого вещества. LC-MS: 332,0 [M-Вос]+.1H ЯМР (CD3OD, 300 МГц,): δ 7,29 (м, 8H), 3,96 (c, 1H), 3,62 (м, 2H), 2,81 (м, 1H), 2,68 (м, 1H), 1,89 (м, 1H), 1,73 (м, 1H), 1,31 (м, 7H), 1,23 (м, 5H).
Получение 12: (2S,4R)-4-амино-5-(2'-фторбифенил-4-ил)-2-гидроксиметил-2-метилпентановая кислота

(2S,4R)-4-трет-бутоксикарбониламино-5-(2'-фторбифенил-4-ил)-2-гидроксиметил-2-метилпентановую кислоту (114 мг, 265 мкмоль) объединяют с DIPEA (3 экв.) в ДМФА (0,2 мл) получая указанное в заголовке соединение.
Получение 13: (2S,4R)-5-(4-бромфенил)-4-трет-бутоксикарбониламино)-2-(гидроксиметил)-2-метилпентановая кислота
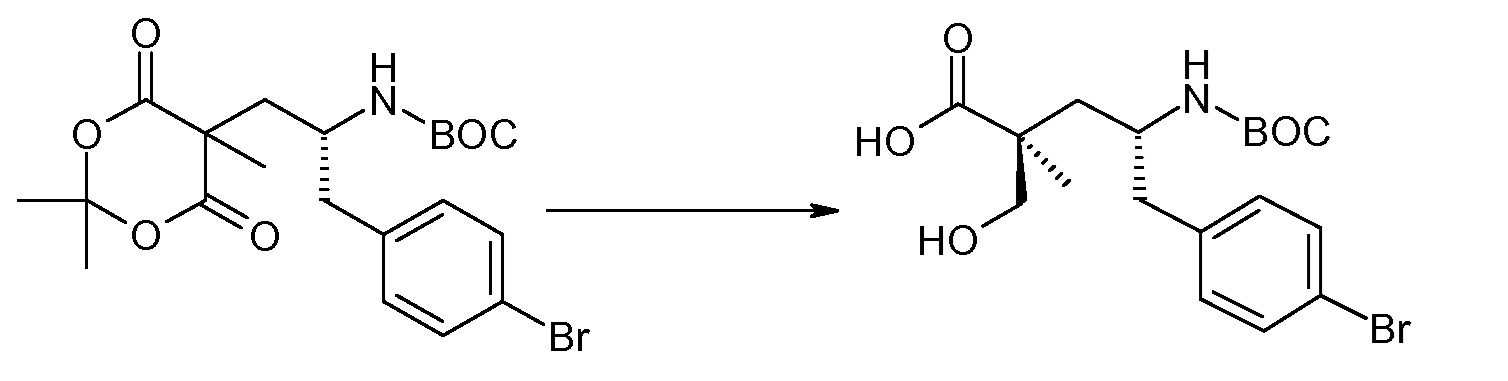
Порошкообразный самарий (32 г, 210 ммоль) вводят в высушенную в сушильном шкафу колбу и колбу герметично закрывают и продувают аргоном в течение 20 минут. Добавляют безводный ТГФ (800 мл) и через полученную суспензию барботируют аргон в течение 15 минут. Добавляют иод (44,8 г, 176 ммоль) и колбу снова продувают аргоном в течение 10 минут. Колбу закрывают и нагревают при температуре 65°С в течение ночи, затем оставляют охлаждаться до комнатной температуры. Полученный раствор SmI2 непосредственно используют на следующей стадии.
Раствор трет-бутилового эфира [(R)-1-(4-бромбензил)-2-(2,2,5-триметил-4,6-диоксо-[1,3]диоксан-5-ил)этил]карбаминовой кислоты (4 г, 8,5 ммоль) в ТГФ (200 мл) и воде (100 мл) герметично закрывают и продувают аргоном в течение 10 минут, затем охлаждают до температуры -70°С и продувают аргоном в течение следующих 10 минут, после чего снова охлаждают до температуры -70°С и продувают аргоном в течение следующих 30 минут. Затем добавляют раствор SmI2 (800 мл) и полученный раствор перемешивают при комнатной температуре в течение 2 часов. Раствор выпаривают, разбавляют с помощью EtOAc (200 мл), промывают раствором винной кислоты (10%-ый раствор, 150 мл), сушат, концентрируют и очищают с помощью колоночной хроматографии (РЕ:EA=0-30%, с добавлением 0,05% уксусной кислоты), получая указанное в заголовке соединение (1,7 г) в виде не совсем белого цвета твердого вещества. LC-MS: [M-Вос]+: 316.1H ЯМР (300 МГц, CD3OD): δ 7,36 (м, 2H), 7,12 (м, 2H), 3,97 (c, 1H), 3,60 (м, 2H), 2,6~2,7 (м, 2H), 1,69~1,81 (м, 2H), 1,15~1,37 (м, 12H).
Получение 14: (2S,4R)-5-(4-бромфенил)-2-гидроксиметил-2-метил-4-[(1Н-[1,2,3]триазол-4-карбонил)амино]пентановая кислота

(2S,4R)-5-(4-бромфенил)-4-трет-бутоксикарбониламино)-2-(гидроксиметил)-2-метилпентановую кислоту (1,0 г, 2,4 ммоль) объединяют с MeCN (20 мл). Добавляют 4 н раствор HCl в диоксане (1,8 мл, 7,2 ммоль). Полученную смесь перемешивают в течение 30 минут, затем концентрируют при пониженном давлении.
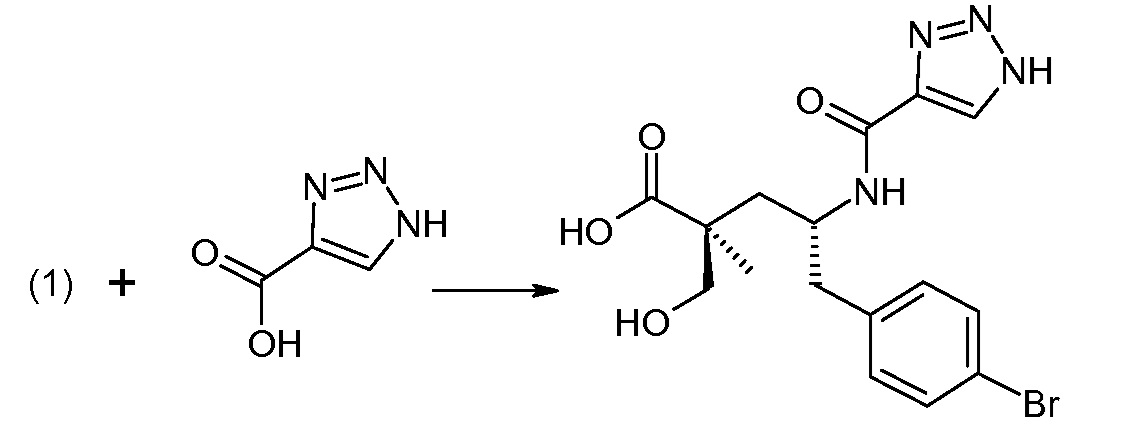
1Н-[1,2,3]Триазол-4-карбоновую кислоту (272 мг, 2,4 ммоль) и HATU (959 мг, 2,5 ммоль) объединяют в ДМФА (2 мл) и перемешивают в течение 10 минут. Добавляют DIPEA (1,3 мл, 7,2 ммоль) и Соединение 1 в ДМФА (2 мл) и полученную смесь перемешивают в течение 30 минут, затем концентрируют. Остаток очищают с помощью хроматографии с обращенными фазами (20-100% MeCN в воде), получая указанное в заголовке соединение (287 мг).
Получение 15: Этиловый эфир (2S,4R)-4-амино-5-(5'-хлор-2'-фторбифенил-4-ил)-2-гидроксиметил-2-метилпентановой кислоты (Соединение 2) и этиловый эфир (2S,4R)-4-трет-бутоксикарбониламино-5-(5'-хлор-2'-фторбифенил-4-ил)-2-гидроксиметил-2-метилпентановой кислоты (Соединение 3)

(2S,4R)-5-(4-бромфенил)-4-((трет-бутоксикарбонил)амино)-2-(гидроксиметил)-2-метилпентановую кислоту (1,3 мг, 3,1 ммоль) объединяют с 5-хлор-2-фторфенилбороновой кислотой (708 мг, 4,1 ммоль), карбонатом натрия (993 мг, 9,4 ммоль), водой (0,2 мл) и диоксаном (1,5 мл). Реакционный сосуд герметично закрывают, воздух удаляют посредством вакуума и сосуд продувают азотом. Быстро добавляют тетракис(трифенилфосфин)палладий(0) (541 мг, 468 мкмоль) и воздух удаляют посредством вакуума. Смесь нагревают при температуре 90°С в течение 45 минут. Смесь подкисляют, с помощью 1 н раствора HCl в воде, до рН=~4, затем экстрагируют с помощью EtOAc. Растворитель удаляют и остаток растворяют в АсОН и очищают с помощью хроматографии с обращенными фазами, получая Соединение 1.
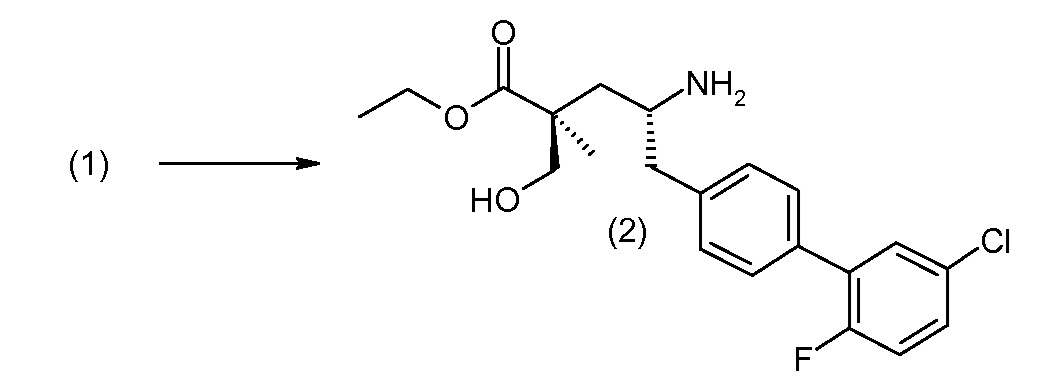
Соединение 1 (1,0 г, 2,1 ммоль) растворяют в EtOH (4 мл) и 4 н растворе HCl в диоксане (4 мл) и перемешивают в течение 3 часов при температуре 60°С. Растворитель выпаривают, получая сырое Соединение 2, которое непосредственно используют на следующей стадии.

Соединение 2 (800 мг, 2,0 ммоль) растворяют в DCM и (ВОС)2О (472 мкл, 2,0 ммоль), затем добавляют Et3N (566 мкл, 4,1 ммоль) и DMAP (1 хлопьевидная частица). Полученную смесь перемешивают в течение 3 часов. Растворитель удаляют и сырой продукт растирают в DCM и отфильтровывают, получая Соединение 3 (800 г), которое используют без дальнейшей очистки.
Получение 16: (2S,4R)-4-амино-5-(5'-хлор-2'-фторбифенил-4-ил)-2-гидроксиметил-2-метилпентановая кислота
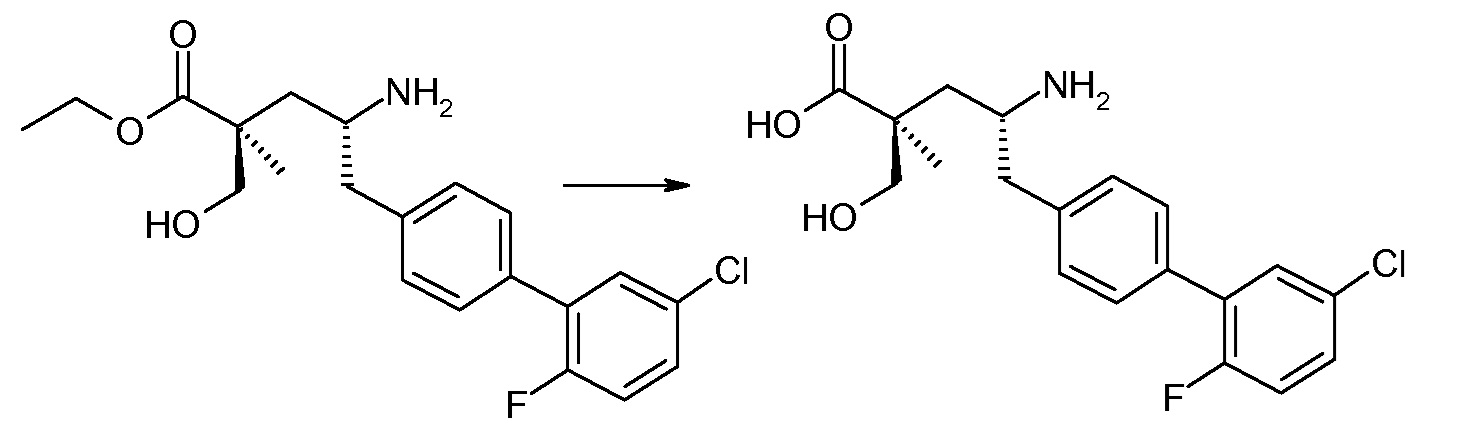
Указанное в заголовке соединение может быть получено путем снятия защиты с этилового эфира (2S,4R)-4-амино-5-(5'-хлор-2'-фторбифенил-4-ил)-2-гидроксиметил-2-метилпентановой кислоты.
Получение 17: (2S,4R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-гидроксиметил-2-метилпентановая кислота (Р2=ВОС) и (2S,4R)-4-амино-5-бифенил-4-ил-2-гидроксиметил-2-метилпентановая кислота (Р2 удален)
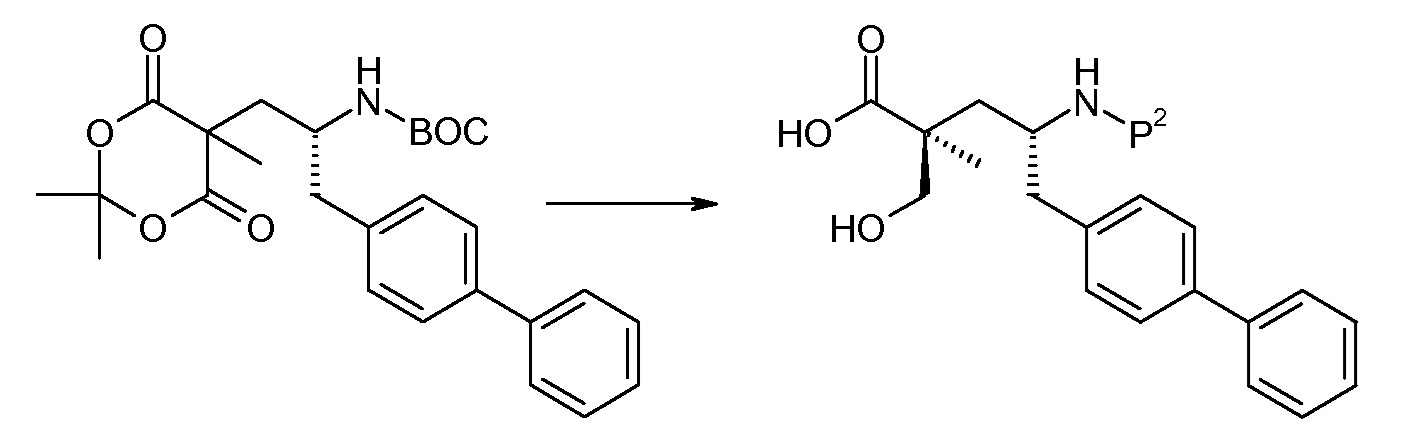
Дистиллированную воду (140 мл) продувают азотом в течение 30 минут, затем, посредством канюли, вводят в сосуд, содержащий 0,1М раствор дииодида самария в ТГФ (800 мл), соблюдая осторожность, чтобы не позволять какому-либо количеству воздуха вступать в контакт с раствором. Все время поддерживая атмосферу азота, через канюлю добавляют дегазированный раствор трет-бутилового эфира [(R)-2-бифенил-4-ил-1-(2,2,5-триметил-4,6-диоксо-[1,3]диоксинан-5-илметил)этил]карбаминовой кислоты (3,7 г, 8,0 ммоль, 1,0 экв.) в ТГФ (100 мл). Полученную смесь перемешивают в течение 15 минут, затем подвергают воздействию воздуха. Добавляют насыщенный водный раствор NaCl (12 мл), 10%-ый раствор лимонной кислоты (6 мл) и EtOAc (30 мл). Смесь перемешивают в течение 5 минут, затем оба слоя извлекают. Органический слой сушат над Na2SO4 и концентрируют в вакууме. Сырой продукт очищают с помощью хроматографии (330 г Au-колонка, градиент: 50% EtOAc c 0,5% АсОН/диэтиловый эфир), получая ВОС-защищенную кислоту (Р2=ВОС) (1,4 г). ВОС-защищенную кислоту растворяют в MeCN (10 мл), затем добавляют 4 н раствор HCl в диоксане (10 мл). Растворитель выпаривают и продукт подвергают азеотропной перегонке с толуолом (2 раза), получая кислоту (Р2 удален) (1,0 г).
Получение 18: Этиловый эфир (2S,4R)-4-амино-5-бифенил-4-ил-2-метоксиметил-2-метилпентановой кислоты
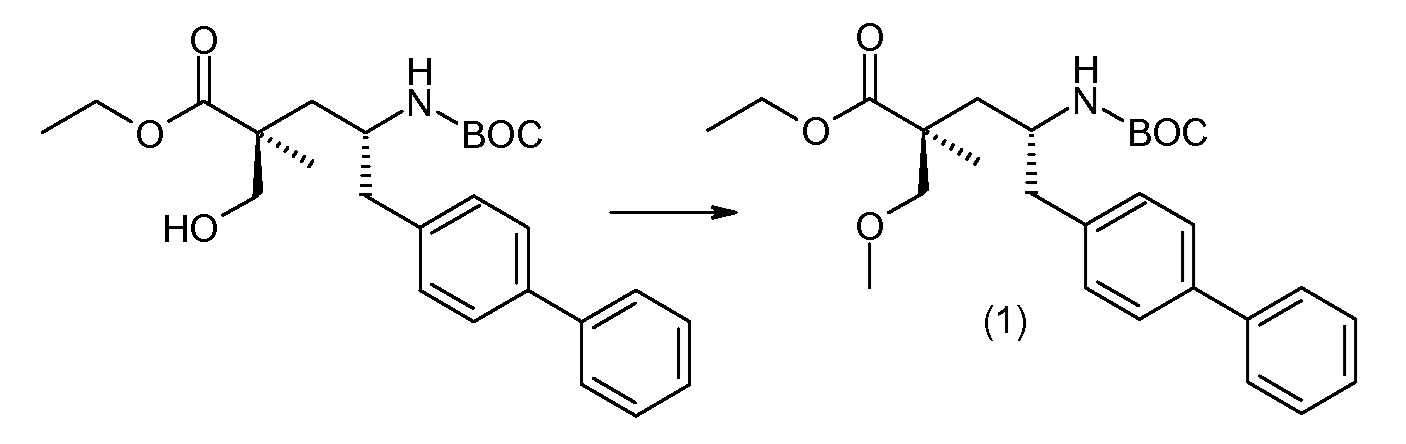
Этиловый эфир (2S,4R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-гидроксиметил-2-метилпентановой кислоты (100 мг, 226 мкмоль) и тетрабутиламмонийгидросульфат (15 мг, 45 мкмоль) объединяют с DCM (1 мл) и NaOH (159 мкл, 1,6 ммоль). Добавляют диметилсульфат (114 мг, 906 мкмоль) и реакционный сосуд герметично закрывают и энергично перемешивают в течение ночи. Смесь затем концентрируют при пониженном давлении и остаток растворяют в АсОН и очищают с помощью хроматографии с обращенными фазами (30-100% MeCN в воде), получая Соединение 1 (30 мг).

Соединение 1 (30 мг, 66 мкмоль) объединяют с MеCN (1 мл) и 4 н раствором HCl в диоксане (0,3 мл) и перемешивают в течение 10 минут, затем концентрируют при пониженном давлении, получая указанное в заголовке соединение (23 мг).
Получение 19: Этиловый эфир (2S,4R)-4-трет-бутоксикарбониламино-5-(3'-хлорбифенил-4-ил)-2-гидроксиметил-2-метилпентановой кислоты

(2S,4R)-4-трет-бутоксикарбониламино-5-(3'-хлорбифенил-4-ил)-2-гидроксиметил-2-метилпентановую кислоту (860 мг, 1,9 ммоль) растворяют в EtOH (4 мл) и 4 н растворе HCl в диоксане (4 мл) и перемешивают в течение 3 часов при температуре 60°С. Растворитель выпаривают и сырое Соединение 1 используют на следующей стадии.

Соединение 1 (722 мг, 1,9 ммоль) растворяют в DCM и (ВОС)2О (446 мкл, 1,9 ммоль). Добавляют Et3N (535 мкл, 3,8 ммоль) и DMAP (1 хлопьевидная частица) и полученную смесь перемешивают в течение 3 часов. Растворитель выпаривают и остаток очищают (хроматография с обычной фазой, 0-60%, EtOAc/гексаны), получая указанное в заголовке соединение (800 мг).
Получение 20: Этиловый эфир (2S,4R)-4-амино-5-(3'-хлорбифенил-4-ил)-2-метоксиметил-2-метилпентановой кислоты
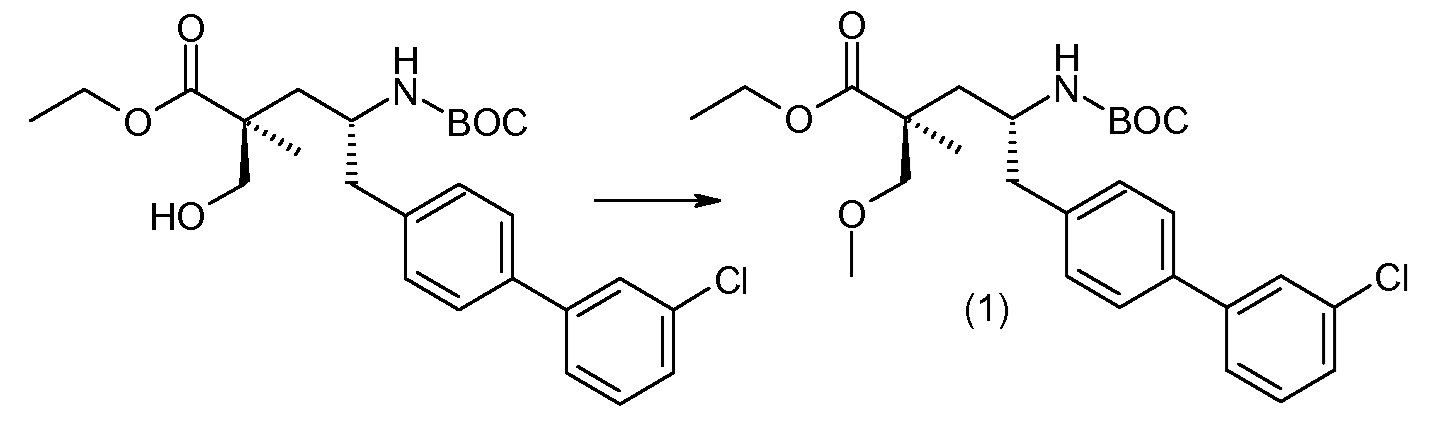
Этиловый эфир (2S,4R)-4-трет-бутоксикарбониламино-5-(3'-хлорбифенил-4-ил)-2-гидроксиметил-2-метилпентановой кислоты (100 мг, 226 мкмоль) и тетрабутиламмонийгидросульфат (15 мг, 45 мкмоль) объединяют с DCM (1 мл) и NaOH (159 мкл, 1,6 ммоль). Добавляют диметилсульфат (114 мг, 906 мкмоль) и реакционный сосуд герметично закрывают и энергично перемешивают в течение ночи. Смесь затем концентрируют при пониженном давлении и остаток растворяют в АсОН и очищают с помощью хроматографии с обращенными фазами (30-100% MeCN в воде), получая Соединение 1 (32 мг).
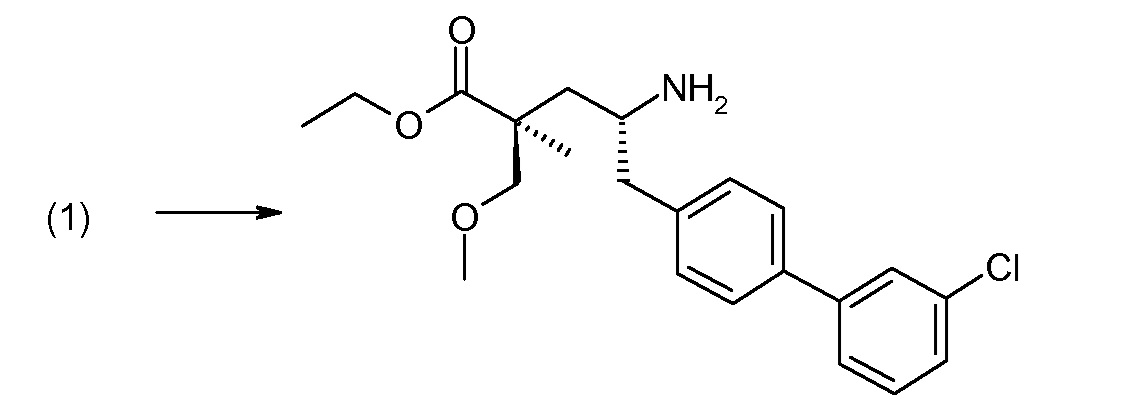
Соединение 1 (32 мг, 66 мкмоль) объединяют с MeCN (1 мл) и 4 н раствором HCl в диоксане (0,3 мл) и перемешивают в течение 10 минут, затем концентрируют при пониженном давлении, получая указанное в заголовке соединение (26 мг).
Получение 21: Этиловый эфир (2S,4R)-4-амино-5-(5'-хлор-2'-фторбифенил-4-ил)-2-метоксиметил-2-метилпентановой кислоты

Этиловый эфир (2S,4R)-4-трет-бутоксикарбониламино-5-(5'-хлор-2'-фторбифенил-4-ил)-2-гидроксиметил-2-метилпентановой кислоты (415 мг, 840 мкмоль) и тетрабутиламмонийгидросульфат (57 мг, 168 мкмоль) объединяют с DCM (1 мл) и NaOH (588 мкл, 5,9 ммоль). Добавляют диметилсульфат (424 мг, 3,4 ммоль) и реакционный сосуд герметично закрывают и энергично перемешивают в течение ночи. Смесь экстрагируют с помощью DCM и воды, очищают (хроматография с обычной фазой; 0-60, EtOAc/гексаны) и концентрируют при пониженном давлении, получая Соединение 1 (220 мг).
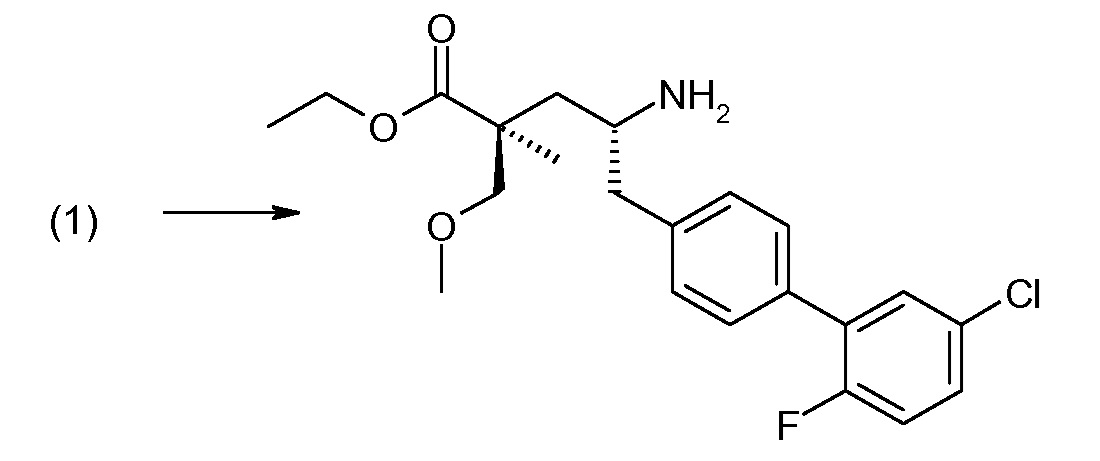
Соединение 1 (88 мг, 173 мкмоль) объединяют с MeCN (1 мл) и 4 н раствором HCl в диоксане (0,3 мл) и перемешивают в течение 10 минут, затем концентрируют при пониженном давлении, получая указанное в заголовке соединение (34 мг).
Получение 22: Этиловый эфир (2S,4R)-4-амино-5-(5'-хлор-2'-фторбифенил-4-ил)-2-этоксиметил-2-метилпентановой кислоты
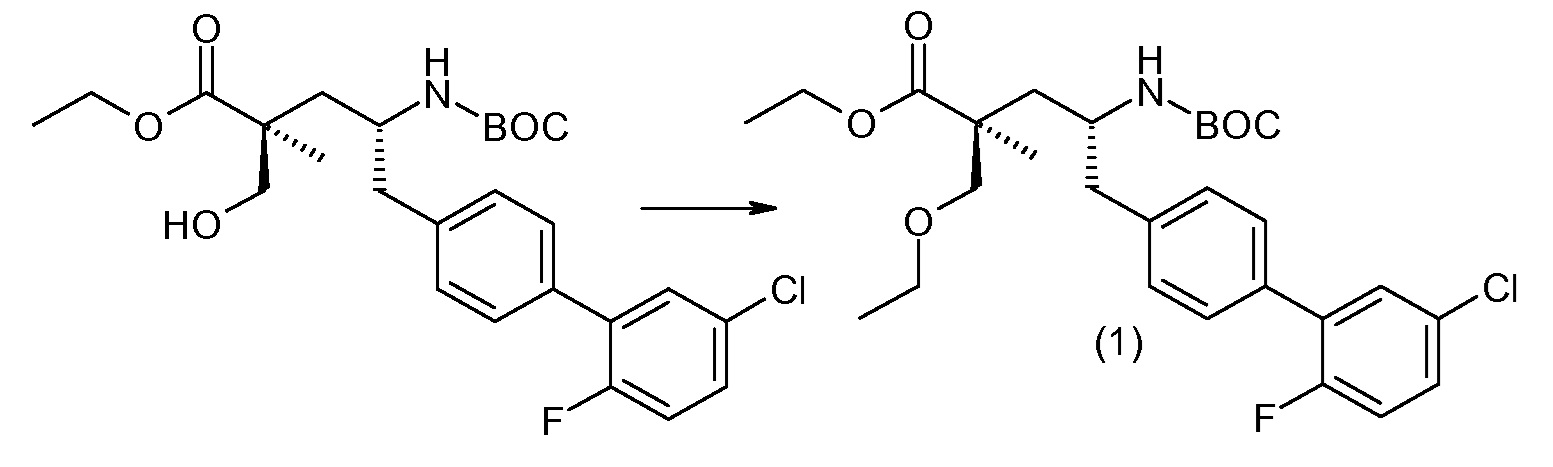
Этиловый эфир (2S,4R)-4-трет-бутоксикарбониламино-5-(5'-хлор-2'-фторбифенил-4-ил)-2-гидроксиметил-2-метилпентановой кислоты (415 мг, 840 мкмоль) и тетрабутиламмонийгидросульфат (57 мг, 168 мкмоль) объединяют с DCM (1 мл) и NaOH (588 мкл, 5,9 ммоль). Добавляют диэтилсульфат (518 мг, 3,4 ммоль) и реакционный сосуд герметично закрывают и энергично перемешивают в течение ночи. Смесь экстрагируют DCM и водой, очищают (хроматография с обычной фазой; 0-60, EtOAc/гексаны) и концентрируют при пониженном давлении, получая Соединение 1 (110 мг).
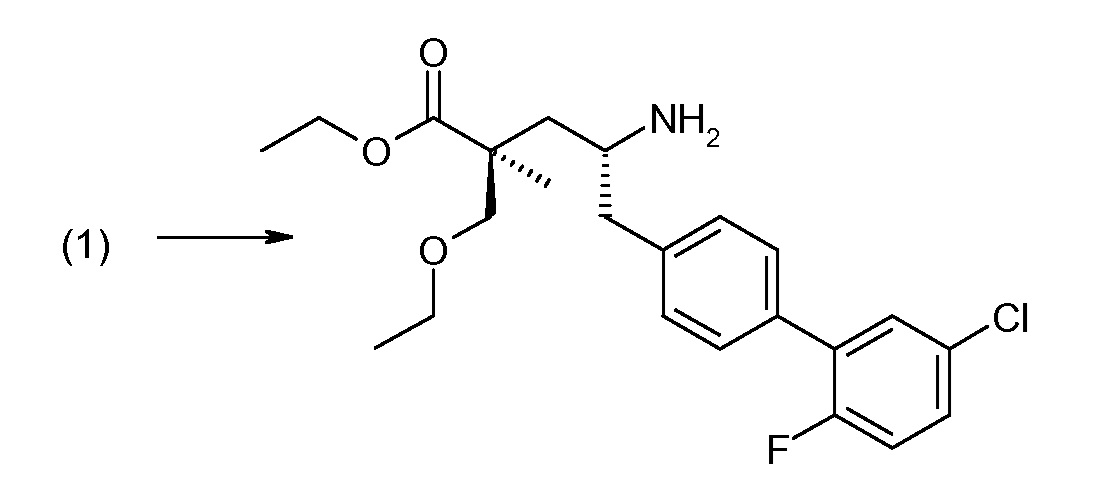
Соединение 1 (90 мг, 173 мкмоль) объединяют с MeCN (1 мл) и 4 н раствором HCl в диоксане (0,3 мл) и перемешивают в течение 10 минут, затем концентрируют при пониженном давлении, получая указанное в заголовке соединение (35,2 мг).
Пример 1
Подразумевают, что соединения Примера 1 могут существовать в таутомерной форме и что обе формы включены в этот пример. Например, в примере 1А описан 5-трет-бутил-2-оксо-[1,3]диоксол-4-илметиловый эфир (2S,4R)-5-бифенил-4-ил-2-гидроксиметил-2-метил-4-[(1H-[1,2,3]триазол-4-карбонил)амино]пентановой кислоты, однако, подразумевают, что это соединение может существовать в таутомерной форме, например, в виде 5-трет-бутил-2-оксо-[1,3]диоксол-4-илметилового эфира (2S,4R)-5-бифенил-4-ил-2-гидроксиметил-2-метил-4-[(3H-[1,2,3]триазол-4-карбонил)амино]-пентановой кислоты. То же самое верно для соединений в Примерах 1В-1J.
1А: 5-трет-бутил-2-оксо-[1,3]диоксол-4-илметиловый эфир (2S,4R)-5-бифенил-4-ил-2-гидроксиметил-2-метил-4-[(1H-[1,2,3]триазол-4-карбонил)амино]пентановой кислоты

(2S,4R)-5-бифенил-4-ил-2-метил-2-(тетрагидропиран-2-илоксиметил)-4-[(1-тритил-1Н-1,2,3-триазол-4-карбонил)амино]-пентановую кислоту (57 мг, 77 мкмоль) объединяют с HOBt (31 мг, 230 мкмоль) и EDC (41 мкл, 230 мкмоль) в DCM (5 мл) и перемешивают в течение 15 минут. Добавляют ДМФА (0,7 мл, 10 ммоль) и полученную смесь перемешивают в течение 15 минут. Добавляют 4-трет-бутил-5-гидроксиметил-1,3-диоксол-2-он (40 мг, 230 мкмоль) и 4-метилморфолин (34 мкл, 0,31 ммоль) и смесь перемешивают при комнатной температуре в течение ночи. Добавляют воду и смесь экстрагируют с помощью EtOAc (20 мл), органический слой сушат и растворитель выпаривают. Реакцию контролируют, затем гасят (1 н раствор HCl в воде с MeCN). Добавляют 1,2М раствор HCl в МеОН (10-20 объемов) и смесь перемешивают в течение 2 часов, затем очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение (1,6 мг).
MS m/z [M+H]+: рассчитано для С30Н34N4O7: 563,24; найдено: 563.
1В: 2,2,3,3,3-Пентафторпропиловый эфир (2S,4R)-5-бифенил-4-ил-2-гидроксиметил-2-метил-4-[(1H-[1,2,3]триазол-4-карбонил)амино]пентановой кислоты

(2S,4R)-5-бифенил-4-ил-2-метил-2-(тетрагидропиран-2-илоксиметил)-4-[(1-тритил-1Н-1,2,3-триазол-4-карбонил)амино]-пентановую кислоту (57 мг, 77 мкмоль) объединяют с HOBt (31 мг, 230 мкмоль) и EDC (41 мкл, 230 мкмоль) в DCM (5 мл) и перемешивают в течение 15 минут. Добавляют ДМФА (0,7 мл, 10 ммоль) и полученную смесь перемешивают в течение 15 минут. Добавляют 2,2,3,3,3-пентафтор-1-пропанол (23,2 мкл, 230 мкмоль) и 4-метилморфолин (34 мкл, 0,31 ммоль) и смесь перемешивают при комнатной температуре в течение ночи. Добавляют воду и смесь экстрагируют с помощью EtOAc (20 мл), органический слой сушат и растворитель выпаривают. Реакцию контролируют, затем гасят (1 н раствор HCl в воде с MeCN). Добавляют 1,2М раствор HCl в МеОН (10-20 объемов) и смесь перемешивают в течение 2 часов, затем очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение (1,2 мг).
MS m/z [M+H]+: рассчитано для С25Н25F5N4O4: 541,18; найдено: 541.
1С: 2,2-Дифторпропиловый эфир (2S,4R)-5-бифенил-4-ил-2-гидроксиметил-2-метил-4-[(1H-[1,2,3]триазол-4-карбонил)амино]пентановой кислоты

(2S,4R)-5-бифенил-4-ил-2-метил-2-(тетрагидропиран-2-илоксиметил)-4-[(1-тритил-1Н-1,2,3-триазол-4-карбонил)амино]-пентановую кислоту (57 мг, 77 мкмоль) объединяют с HOBt (31 мг, 230 мкмоль) и EDC (41 мкл, 230 мкмоль) в DCM (5 мл) и перемешивают в течение 15 минут. Добавляют ДМФА (0,7 мл, 10 ммоль) и полученную смесь перемешивают в течение 15 минут. Добавляют 2,2-дифторпропанол (22,3 мг, 230 мкмоль) и 4-метилморфолин (34 мкл, 0,31 ммоль) и смесь перемешивают при комнатной температуре в течение ночи. Добавляют воду и смесь экстрагируют с помощью EtOAc (20 мл), органический слой сушат и растворитель выпаривают. Реакцию контролируют, затем гасят (1 н раствор HCl в воде с MeCN). Добавляют 1,2М раствор HCl в МеОН (10-20 объемов) и смесь перемешивают в течение 2 часов, затем очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение (1,4 мг).
MS m/z [M+H]+: рассчитано для С25Н28F2N4O4: 487,21; найдено: 487.
1D: (2S,4R)-2-ацетоксиметил-5-бифенил-4-ил-2-метил-4-[(3H-[1,2,3]триазол-4-карбонил)амино]пентановая кислота

(2S,4R)-5-бифенил-4-ил-2-метил-2-(тетрагидропиран-2-илоксиметил)-4-[(1Н-1,2,3-триазол-4-карбонил)амино]пентановую кислоту (126 мг, 255 мкмоль) объединяют с 4 н раствором HCl в диоксане (191 мкл, 765 мкмоль) с MeCN (0,7 мл, 10 ммоль). Смесь затем концентрируют при пониженном давлении и остаток очищают с помощью хроматографии с обращенными фазами. Добавляют DCM (1 мл, 20 ммоль) и ацетилхлорид (24 мг, 306 мкмоль), потом DIPEA (133 мкл, 765 мкмоль). Полученную смесь перемешивают в течение 10 минут. Растворитель выпаривают и остаток растворяют в АсОН и очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение (5 мг).
MS m/z [M+H]+: рассчитано для С24Н26N4O5: 451,19; найдено: 451.
1Е: (2S,4R)-5-бифенил-4-ил-2-изобутирилоксиметил-2-метил-4-[(3H-[1,2,3]триазол-4-карбонил)амино]пентановая кислота
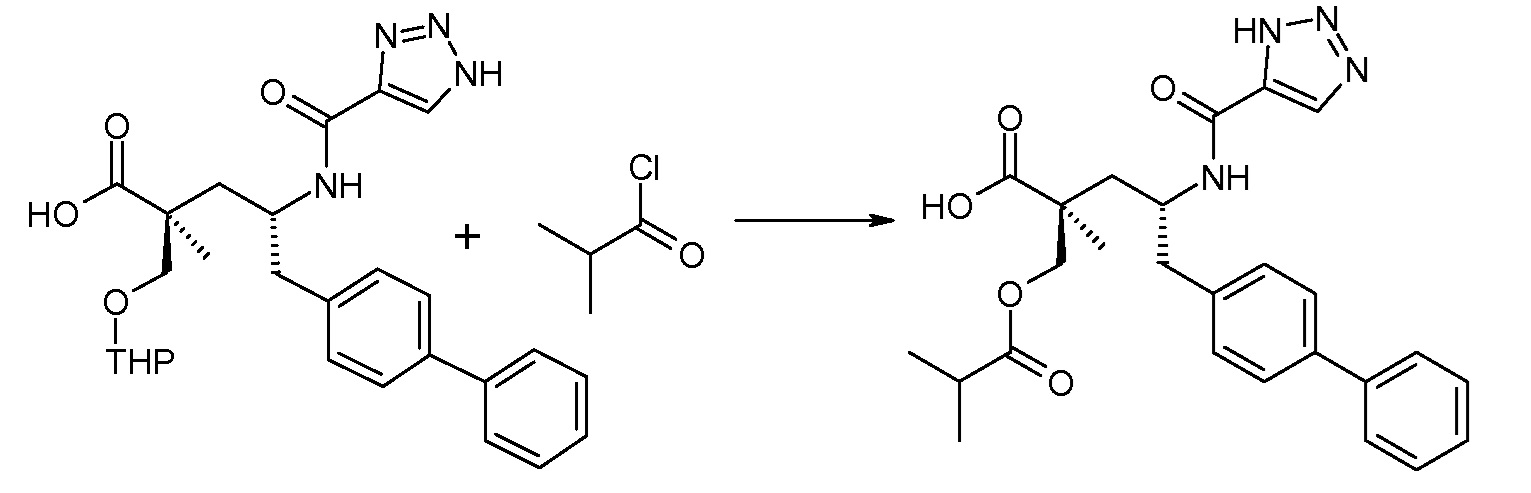
(2S,4R)-5-бифенил-4-ил-2-метил-2-(тетрагидропиран-2-илоксиметил)-4-[(1Н-1,2,3-триазол-4-карбонил)амино]пентановую кислоту (126 мг, 255 мкмоль) объединяют с 4 н раствором HCl в диоксане (191 мкл, 765 мкмоль) с MeCN (0,7 мл, 10 ммоль). Смесь затем концентрируют при пониженном давлении и остаток очищают с помощью хроматографии с обращенными фазами. Добавляют DCM (1 мл, 20 ммоль) и изобутирилхлорид (32,6 мг, 306 мкмоль), потом DIPEA (133 мкл, 765 мкмоль). Полученную смесь перемешивают в течение 10 минут. Растворитель выпаривают и остаток растворяют в АсОН и очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение (5 мг).
MS m/z [M+H]+: рассчитано для С26Н30N4O5: 479,22; найдено: 479.
1F: (2S,4R)-5-бифенил-4-ил-2-метил-2-(3-метилбутирилоксиметил)-4-[(3H-[1,2,3]триазол-4-карбонил)амино]пентановая кислота

(2S,4R)-5-бифенил-4-ил-2-метил-2-(тетрагидропиран-2-илоксиметил)-4-[(1Н-1,2,3-триазол-4-карбонил)амино]пентановую кислоту (126 мг, 255 мкмоль) объединяют с 4 н раствором HCl в диоксане (191 мкл, 765 мкмоль) с MeCN (0,7 мл, 10 ммоль). Смесь затем концентрируют при пониженном давлении и остаток очищают с помощью хроматографии с обращенными фазами. Добавляют DCM (1 мл, 20 ммоль) и изовалерилхлорид (39,9 мг, 306 мкмоль), потом DIPEA (133 мкл, 765 мкмоль). Полученную смесь перемешивают в течение 10 минут. Растворитель выпаривают и остаток растворяют в АсОН и очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение (3 мг).
MS m/z [M+H]+: рассчитано для С27Н32N4O5: 493,24; найдено: 493.
1G: Гексиловый эфир (2S,4R)-5-бифенил-4-ил-2-гидроксиметил-2-метил-4-[(1H-[1,2,3]триазол-4-карбонил)амино]пентановой кислоты

(2S,4R)-5-бифенил-4-ил-2-метил-2-(тетрагидропиран-2-илоксиметил)-4-[(1Н-1,2,3-триазол-4-карбонил)амино]пентановую кислоту (100 мг, 0,2 ммоль) объединяют с 1-гексанолом (0,3 мл, 2 ммоль) и 4М раствором HCl в 1,4-диоксане (0,3 мл, 1 ммоль). Смесь перемешивают в течение 2 часов при температуре 60°С. Смесь концентрируют при пониженном давлении и остаток очищают с помощью хроматографии с обращенными фазами, получая указанное в заголовке соединение (51 мг).
MS m/z [M+H]+: рассчитано для С28Н36N4O4: 493,27; найдено: 493.
1Н: Гептиловый эфир (2S,4R)-5-бифенил-4-ил-2-гидроксиметил-2-метил-4-[(1H-[1,2,3]триазол-4-карбонил)амино]пентановой кислоты
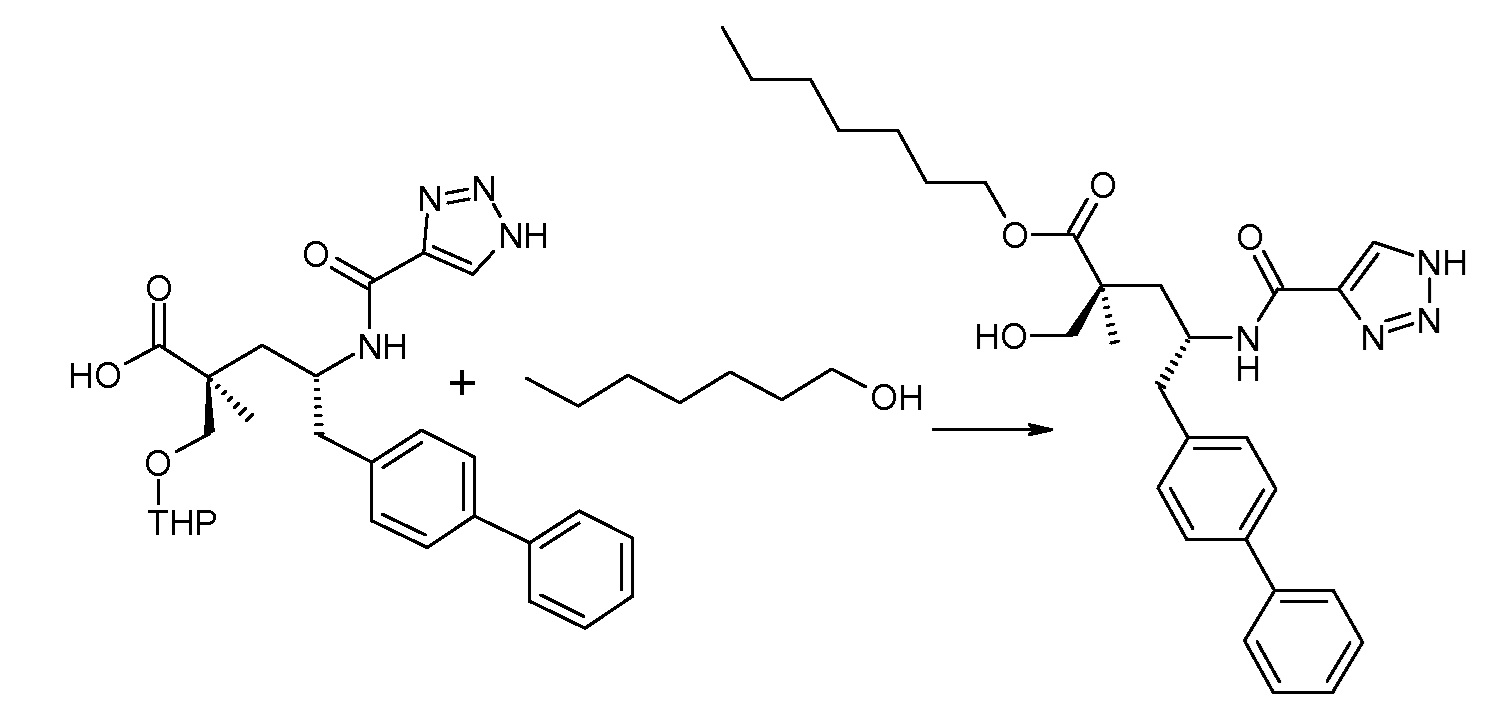
(2S,4R)-5-бифенил-4-ил-2-метил-2-(тетрагидропиран-2-илоксиметил)-4-[(1Н-1,2,3-триазол-4-карбонил)амино]пентановую кислоту (100 мг, 0,2 ммоль) объединяют с 1-гептанолом (0,3 мл, 2 ммоль) и 4М раствором HCl в 1,4-диоксане (0,3 мл, 1 ммоль). Смесь перемешивают в течение 2 часов при температуре 60°С. Смесь концентрируют при пониженном давлении и остаток очищают с помощью хроматографии с обращенными фазами, получая указанное в заголовке соединение (60 мг).
MS m/z [M+H]+: рассчитано для С29Н38N4O4: 507,29; найдено: 507.
1I: (2S,4R)-5-бифенил-4-ил-2-этоксиметил-2-метил-4-[(1H-[1,2,3]триазол-4-карбонил)амино]пентановая кислота

Осуществляют введение во взаимодействие 1Н-[1,2,3]триазол-4-карбоновой кислоты и (2S,4R)-4-амино-5-бифенил-4-ил-2-этоксиметил-2-метилпентановой кислоты, как описано в данном контексте, получая указанное в заголовке соединение (0,8 мг).
MS m/z [M+H]+: рассчитано для С24Н28N4O4: 437,21; найдено: 437,2.
1J: (2S,4R)-5-бифенил-4-ил-2-метоксиметил-2-метил-4-[(1H-[1,2,3]триазол-4-карбонил)амино]пентановая кислота
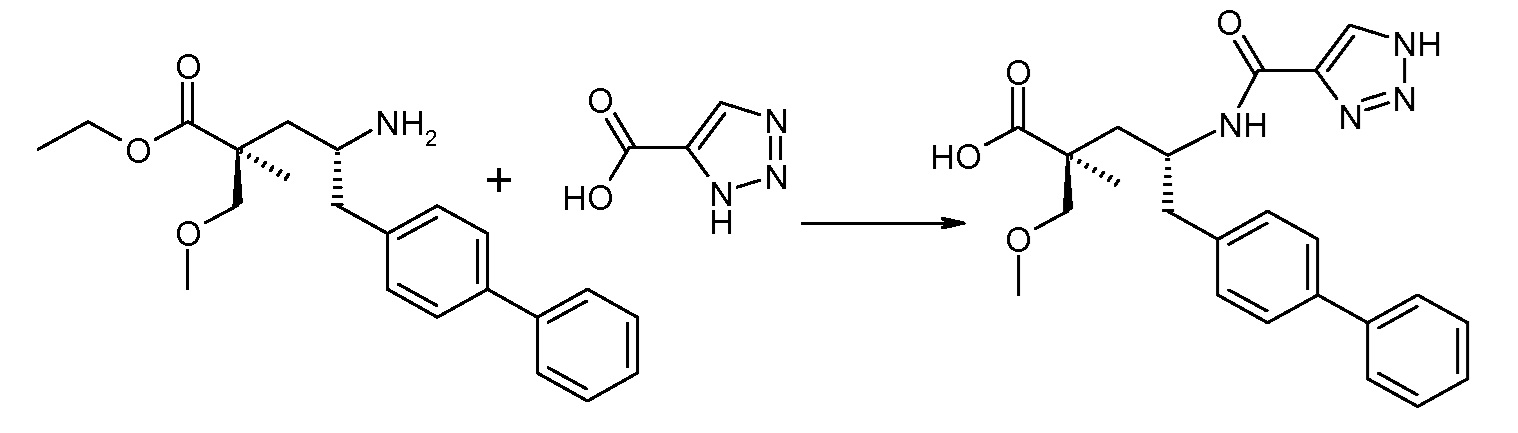
3Н-[1,2,3]Триазол-4-карбоновую кислоту (3,5 мг, 31 мкмоль) и HATU (12 мг, 31 мкмоль) объединяют с ДМФА (0,5 мл) и перемешивают в течение 5 минут. Добавляют раствор этилового эфира (2S,4R)-4-амино-5-бифенил-4-ил-2-метоксиметил-2-метилпентановой кислоты (11 мг, 31 мкмоль) и DIPEA (16 мкл, 93 мкмоль) в ДМФА (0,5 мл), и полученную смесь перемешивают в течение 20 минут, затем концентрируют при пониженном давлении.
Остаток объединяют с ТГФ (0,6 мл) и NaOH (124 мкл, 124 мкмоль) и перемешивают при температуре 60°С в течение 2 часов, затем концентрируют при пониженном давлении. Остаток растворяют в АсОН и соединения очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение (1 мг).
MS m/z [M+H]+: рассчитано для С23Н26N4O4: 423,20; найдено: 423,2.
Пример 2
Подразумевают, что соединения Примера 2 могут существовать в таутомерной форме и что обе формы включены в этот пример. Например, в примере 2А описана (2S,4R)-2-гидроксиметил-5-(2'-метоксибифенил-4-ил)-2-метил-4-[(1H-[1,2,3]триазол-4-карбонил)амино]пентановая кислота, однако, подразумевают, что это соединение может существовать в таутомерной форме, например, в виде (2S,4R)-2-гидроксиметил-5-(2'-метоксибифенил-4-ил)-2-метил-4-[(3H-[1,2,3]триазол-4-карбонил)амино]пентановой кислоты. То же самое верно для соединений в Примерах 2В-2S.
2А: (2S,4R)-2-гидроксиметил-5-(2'-метоксибифенил-4-ил)-2-метил-4-[(1H-[1,2,3]триазол-4-карбонил)амино]пентановая кислота

(2S,4R)-5-(4-бромфенил)-2-гидроксиметил-2-метил-4-[(1H-[1,2,3]триазол-4-карбонил)амино]пентановую кислоту (38 мг, 92 мкмоль) объединяют с 2-метоксифенилбороновой кислотой (28,1 мг, 185 мкмоль), карбонатом натрия (29,4 мг, 277 мкмоль), водой (0,2 мл) и диоксаном (1,5 мл). Реакционный сосуд герметично закрывают, воздух удаляют посредством вакуума и сосуд продувают азотом. Быстро добавляют тетракис(трифенилфосфин)палладий(0) (21,4 мг, 18 мкмоль) и воздух удаляют посредством вакуума. Смесь нагревают при температуре 90°С в течение 45 минут. Смесь подкисляют до рН~3 и отфильтровывают, и сольват концентрируют. Остаток растворяют в АсОН (0,7 мл) и очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение (12,5 мг).
MS m/z [M+H]+: рассчитано для С23Н26N4О5: 439,19; найдено: 439,2.
2В: (2S,4R)-5-(2'-хлорбифенил-4-ил)-2-гидроксиметил-2-метил-4-[(1H-[1,2,3]триазол-4-карбонил)амино]пентановая кислота
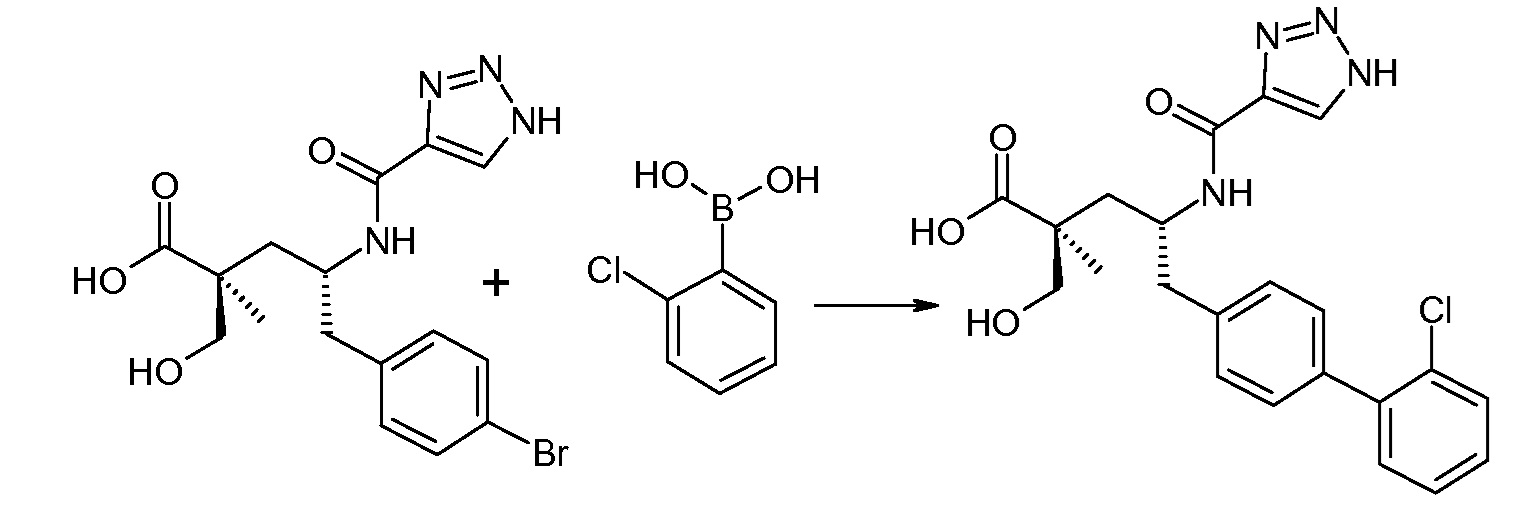
(2S,4R)-5-(4-бромфенил)-2-гидроксиметил-2-метил-4-[(1H-[1,2,3]триазол-4-карбонил)амино]пентановую кислоту (38 мг, 92 мкмоль) объединяют с 2-хлорфенилбороновой кислотой (28,9 мг, 185 мкмоль), карбонатом натрия (29,4 мг, 277 мкмоль), водой (0,2 мл) и диоксаном (1,5 мл). Реакционный сосуд герметично закрывают, воздух удаляют посредством вакуума и сосуд продувают азотом. Быстро добавляют тетракис(трифенилфосфин)палладий(0) (21,4 мг, 18 мкмоль) и воздух удаляют посредством вакуума. Смесь нагревают при температуре 90°С в течение 45 мин. Смесь подкисляют до рН~3 и отфильтровывают, и сольват концентрируют. Остаток растворяют в АсОН (0,7 мл) и очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение (18,2 мг).
MS m/z [M+H]+: рассчитано для С22Н23ClN4O4: 443,14; найдено: 443,2.
2С: (2S,4R)-2-гидроксиметил-2-метил-5-(2'-метилбифенил-4-ил)-4-[(1H-[1,2,3]триазол-4-карбонил)амино]пентановая кислота
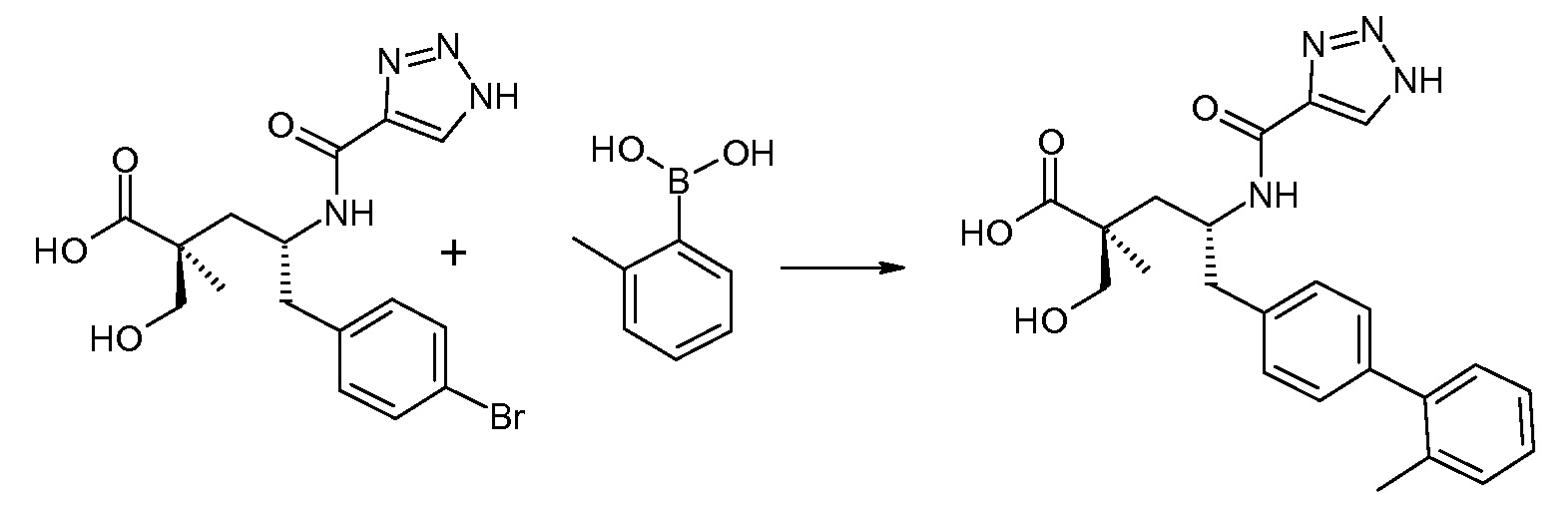
(2S,4R)-5-(4-бромфенил)-2-гидроксиметил-2-метил-4-[(1H-[1,2,3]триазол-4-карбонил)амино]пентановую кислоту (38 мг, 92 мкмоль) объединяют с 2-метилфенилбороновой кислотой (25,1 мг, 185 мкмоль), карбонатом натрия (29,4 мг, 277 мкмоль), водой (0,2 мл) и диоксаном (1,5 мл). Реакционный сосуд герметично закрывают, воздух удаляют посредством вакуума и сосуд продувают азотом. Быстро добавляют тетракис(трифенилфосфин)палладий(0) (21,4 мг, 18 мкмоль) и воздух удаляют посредством вакуума. Смесь нагревают при температуре 90°С в течение 45 минут. Смесь подкисляют до рН~3 и отфильтровывают, и сольват концентрируют. Остаток растворяют в АсОН (0,7 мл) и очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение (13,3 мг).
MS m/z [M+H]+: рассчитано для С23Н26N4O4: 423,20; найдено: 423,2.
2D: (2S,4R)-5-(3'-хлорбифенил-4-ил)-2-гидроксиметил-2-метил-4-[(1H-[1,2,3]триазол-4-карбонил)амино]пентановая кислота

(2S,4R)-5-(4-бромфенил)-2-гидроксиметил-2-метил-4-[(1H-[1,2,3]триазол-4-карбонил)амино]пентановую кислоту (38 мг, 92 мкмоль) объединяют с 3-хлорфенилбороновой кислотой (28,9 мг, 185 мкмоль), карбонатом натрия (29,4 мг, 277 мкмоль), водой (0,2 мл) и диоксаном (1,5 мл). Реакционный сосуд герметично закрывают, воздух удаляют посредством вакуума и сосуд продувают азотом. Быстро добавляют тетракис(трифенилфосфин)палладий(0) (21,4 мг, 18 мкмоль) и воздух продувают посредством вакуума. Смесь нагревают при температуре 90°С, в течение 45 минут. Смесь подкисляют до рН~3 и отфильтровывают, и сольват концентрируют. Остаток растворяют в АсОН (0,7 мл) и очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение (8,1 мг).
MS m/z [M+H]+: рассчитано для С22Н23ClN4O4: 443,14; найдено: 443,2.
2Е: (2S,4R)-5-(5'-хлор-2'-фторбифенил-4-ил)-2-гидроксиметил-2-метил-4-[(1H-[1,2,3]триазол-4-карбонил)амино]пентановая кислота

(2S,4R)-5-(4-бромфенил)-2-гидроксиметил-2-метил-4-[(1H-[1,2,3]триазол-4-карбонил)амино]пентановую кислоту (38 мг, 92 мкмоль) объединяют с 5-хлор-2-фторфенилбороновой кислотой (32,2 мг, 185 мкмоль), карбонатом натрия (29,4 мг, 277 мкмоль), водой (0,2 мл) и диоксаном (1,5 мл). Реакционный сосуд герметично закрывают, воздух удаляют посредством вакуума и сосуд продувают азотом. Быстро добавляют тетракис(трифенилфосфин)палладий(0) (21,4 мг, 18 мкмоль) и воздух удаляют посредством вакуума. Смесь нагревают при температуре 90°С в течение 45 минут. Смесь подкисляют до рН~3 и отфильтровывают, и сольват концентрируют. Остаток растворяют в АсОН (0,7 мл) и очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение (2 мг).
MS m/z [M+H]+: рассчитано для С22Н22ClFN4O4: 461,13; найдено: 461,2.
2F: (2S,4R)-5-(2',5'-дихлорбифенил-4-ил)-2-гидроксиметил-2-метил-4-[(1H-[1,2,3]триазол-4-карбонил)амино]пентановая кислота
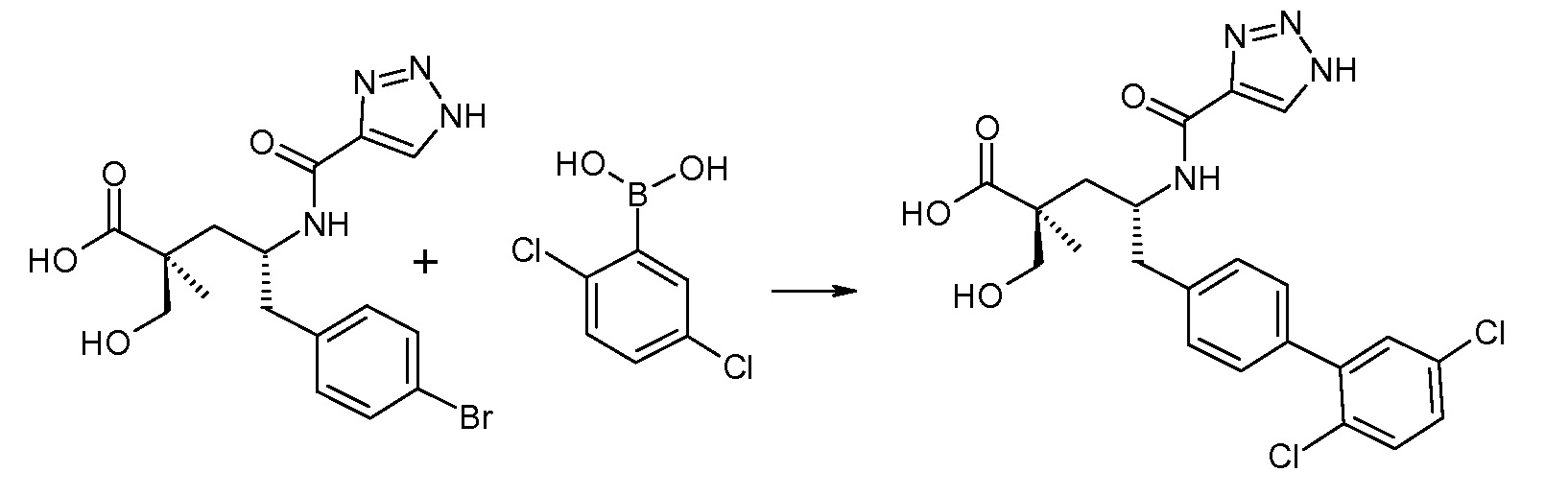
(2S,4R)-5-(4-бромфенил)-2-гидроксиметил-2-метил-4-[(1H-[1,2,3]триазол-4-карбонил)амино]пентановую кислоту (38 мг, 92 мкмоль) объединяют с 2,5-дихлорфенилбороновой кислотой (35,3 мг, 185 мкмоль), карбонатом натрия (29,4 мг, 277 мкмоль), водой (0,2 мл) и диоксаном (1,5 мл). Реакционный сосуд герметично закрывают, воздух удаляют посредством вакуума и сосуд продувают азотом. Быстро добавляют тетракис(трифенилфосфин)палладий(0) (21,4 мг, 18 мкмоль) и воздух удаляют посредством вакуума. Смесь нагревают при температуре 90°С в течение 45 минут. Смесь подкисляют до рН~3 и отфильтровывают, и сольват концентрируют. Остаток растворяют в АсОН (0,7 мл) и очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение (4,6 мг).
MS m/z [M+H]+: рассчитано для С22Н22Cl2N4O4: 477,10; найдено: 478,2.
2G: (2S,4R)-5-(5'-хлор-2'-метилбифенил-4-ил)-2-гидроксиметил-2-метил-4-[(1H-[1,2,3]триазол-4-карбонил)амино]пентановая кислота
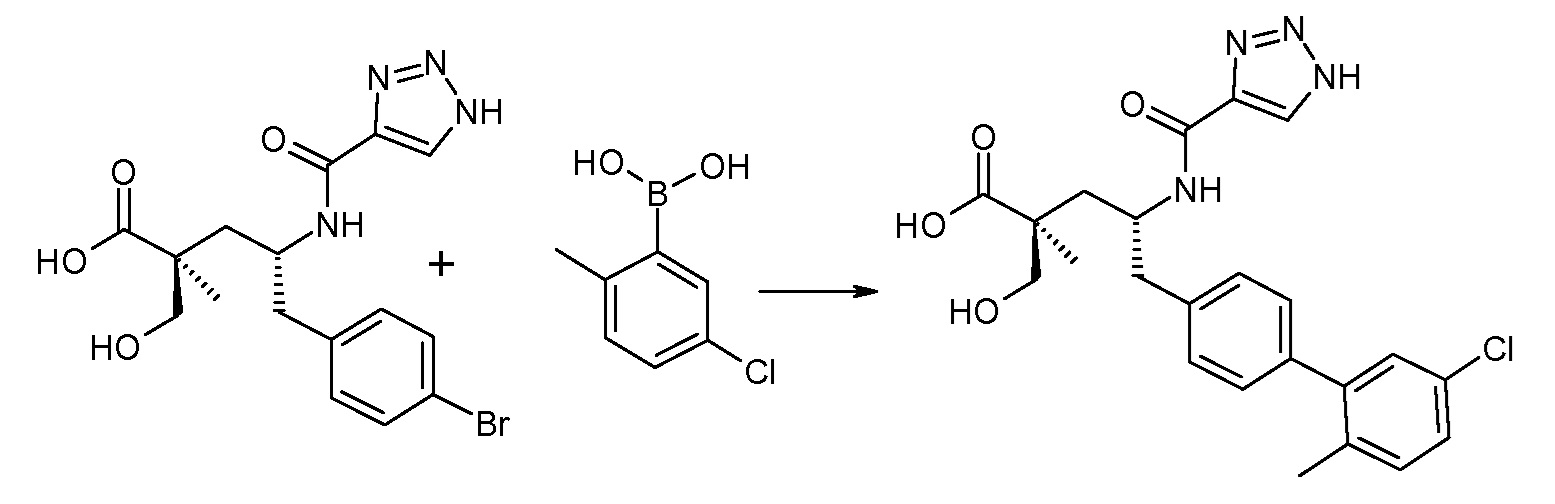
(2S,4R)-5-(4-бромфенил)-2-гидроксиметил-2-метил-4-[(1H-[1,2,3]триазол-4-карбонил)амино]пентановую кислоту (38 мг, 92 мкмоль) объединяют с 5-хлор-2-метилфенилбороновой кислотой (31,4 мг, 185 мкмоль), карбонатом натрия (29,4 мг, 277 мкмоль), водой (0,2 мл) и диоксаном (1,5 мл). Реакционный сосуд герметично закрывают, воздух удаляют посредством вакуума и сосуд продувают азотом. Быстро добавляют тетракис(трифенилфосфин)палладий(0) (21,4 мг, 18 мкмоль) и воздух удаляют посредством вакуума. Смесь нагревают при температуре 90°С в течение 45 минут. Смесь подкисляют до рН=~3 и отфильтровывают, и сольват концентрируют. Остаток растворяют в АсОН (0,7 мл) и очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение (12,1 мг).
MS m/z [M+H]+: рассчитано для С23Н25ClN4O4: 457,16; найдено: 457,2.
2Н: (2S,4R)-5-(3'-цианобифенил-4-ил)-2-гидроксиметил-2-метил-4-[(1H-[1,2,3]триазол-4-карбонил)амино]пентановая кислота
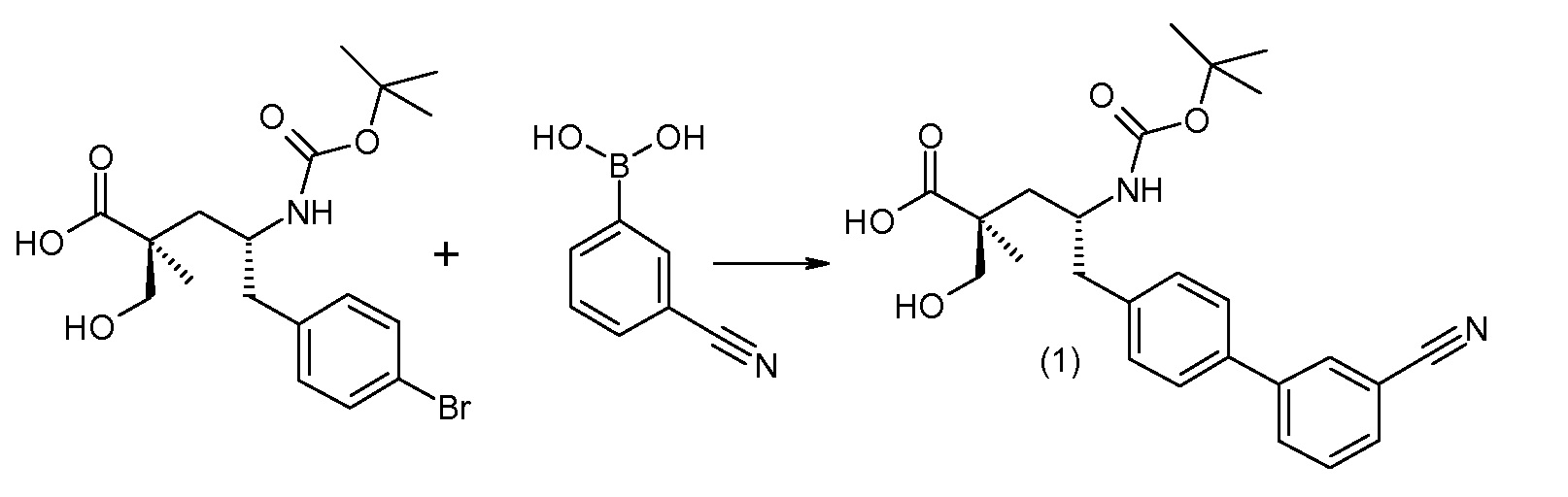
(2S,4R)-5-(4-бромфенил)-4-трет-бутоксикарбониламино-2-гидроксиметил-2-метилпентановую кислоту (40 мг, 96 мкмоль) объединяют с 3-цианофенилбороновой кислотой (14 мг, 96 мкмоль), карбонатом натрия (10,2 мг, 96 мкмоль), водой (0,5 мл) и диоксаном (2 мл). Реакционный сосуд герметично закрывают, воздух удаляют посредством вакуума и сосуд продувают азотом. Быстро добавляют тетракис(трифенилфосфин)палладий(0) (11 мг, 9,6 мкмоль), воздух удаляют посредством вакуума и сосуд продувают азотом. Смесь нагревают при температуре 90°С, в течение 45 минут. Смесь отфильтровывают и сольват концентрируют. Остаток растворяют в АсОН и очищают с помощью хроматографии с обращенными фазами, получая Соединение 1 (30 мг).

Соединение 1 (30 мг, 68 мкмоль) объединяют с MeCN (1 мл) и 4М раствором HCl в 1,4-диоксане (103 мкл, 410 мкмоль) и перемешивают в течение 10 минут. Смесь затем концентрируют при пониженном давлении, получая Соединение 2 (27 мг).
3Н-[1,2,3]Триазол-4-карбоновую кислоту (9,1 мг, 80 мкмоль) объединяют с HATU (30 мг, 80 мкмоль) в ДМФА (0,5 мл) и перемешивают в течение 5 минут. Добавляют соединение 2 (27 мг, 80 мкмоль), потом DIPEA (42 мкл, 240 мкмоль) и полученную смесь перемешивают в течение 30 минут. Растворитель выпаривают и остаток растворяют в АсОН и очищают с помощью хроматографии с обращенными фазами, получая указанное в заголовке соединение (3 мг).
MS m/z [M+H]+: рассчитано для С23Н23N5O4: 434,18; найдено: 434.
2I: (2S,4R)-2-гидроксиметил-2-метил-5-(3'-метилбифенил-4-ил)-4-[(1H-[1,2,3]триазол-4-карбонил)амино]пентановая кислота

(2S,4R)-5-(4-бромфенил)-2-гидроксиметил-2-метил-4-[(1H-[1,2,3]триазол-4-карбонил)амино]пентановую кислоту (38 мг, 92 мкмоль) объединяют с 3-метилфенилбороновой кислотой (25,1 мг, 185 мкмоль), карбонатом натрия (29,4 мг, 277 мкмоль), водой (0,2 мл) и диоксаном (1,5 мл). Реакционный сосуд герметично закрывают, воздух удаляют посредством вакуума и сосуд продувают азотом. Быстро добавляют тетракис(трифенилфосфин)палладий(0) (21,4 мг, 18 мкмоль) и воздух удаляют посредством вакуума. Смесь нагревают при температуре 90°С в течение 45 минут. Смесь подкисляют до рН~3 и отфильтровывают, и сольват концентрируют. Остаток растворяют в АсОН (0,7 мл) и очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение (10 мг).
2J: (2S,4R)-5-(3'-хлорбифенил-4-ил)-2-метоксиметил-2-метил-4-[(1H-[1,2,3]триазол-4-карбонил)амино]пентановая кислота

3Н-[1,2,3]Триазол-4-карбоновую кислоту (3,5 мг, 31 мкмоль) и HATU (12 мг, 31 мкмоль) объединяют в ДМФА (0,5 мл) и перемешивают в течение 5 минут. Добавляют раствор этилового эфира (2S,4R)-4-амино-5-(3'-хлорбифенил-4-ил)-2-метоксиметил-2-метилпентановой кислоты (12 мг, 31 мкмоль) и DIPEA (16 мкл, 93 мкмоль) в ДМФА (0,5 мл) и полученную смесь перемешивают в течение 20 минут, затем концентрируют при пониженном давлении.
Остаток объединяют с ТГФ (0,6 мл) и NaOH (124 мкл, 124 мкмоль) и перемешивают при температуре 60°С в течение 2 часов, затем концентрируют при пониженном давлении. Остаток растворяют в АсОН и очищают с помощью хроматографии с обращенными фазами, получая указанное в заголовке соединение (4,0 мг).
MS m/z [M+H]+: рассчитано для С23Н25ClN4O4: 457,16; найдено: 457,2.
2К: (2S,4R)-5-(3'-хлорбифенил-4-ил)-2-этоксиметил-2-метил-4-[(3H-[1,2,3]триазол-4-карбонил)амино]пентановая кислота

В пробирку вводят этиловый эфир (2S,4R)-4-трет-бутоксикарбониламино-5-(3'-хлорбифенил-4-ил)-2-гидроксиметил-2-метилпентановой кислоты (400 мг, 840 мкмоль), тетрабутиламмонийгидросульфат (57 мг, 168 мкмоль), DCM (1 мл) и NaOH (588 мкл, 5,9 ммоль), затем диэтилсульфат (518 мг, 3,4 ммоль). Реакционный сосуд закрывают и энергично перемешивают в течение ночи. Смесь экстрагируют DCM и водой, очищают (хроматография с обычной фазой, 0-60% EtOAc:гексаны), потом концентрируют при пониженном давлении, получая Соединение 1 (180 мг).

Соединение 1 (87 мг, 173 мкмоль), в MeCN (1 мл), объединяют с 4 н раствором HCl в диоксане (0,3 мл). Смесь перемешивают в течение 10 минут, затем концентрируют при пониженном давлении, получая Соединение 2.

Соединение 2 (33,7 мг, 83 мкмоль) объединяют с HATU (38,0 мг, 100 мкмоль), 3Н-[1,2,3]триазол-4-карбоновой кислотой (12,3 мг, 108 мкмоль), в ДМФА (0,5 мл). Добавляют DIPEA (43,7 мкл, 250 мкмоль) и смесь перемешивают в течение 2 часов. Добавляют EtOAc, потом насыщенный водный раствор NH4Cl. Смесь перемешивают в течение 10 минут, затем концентрируют при пониженном давлении, получая Соединение 3.
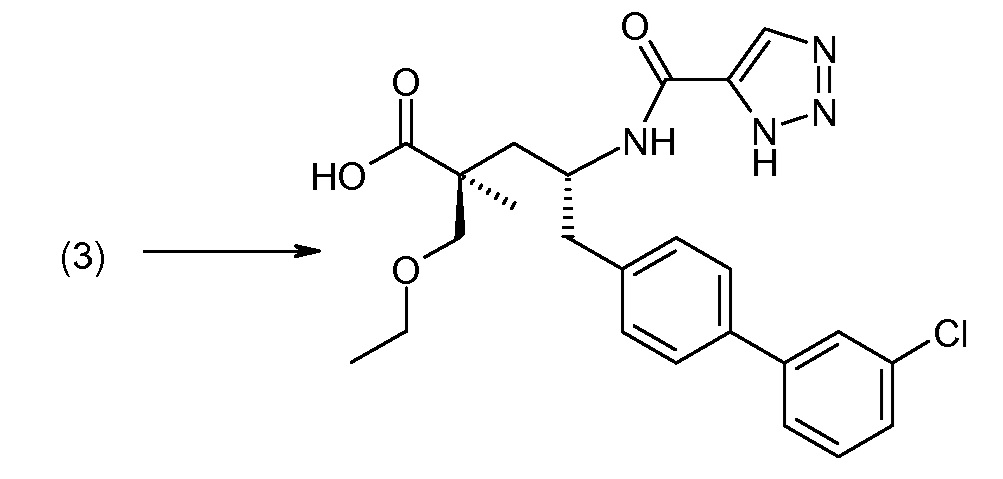
Соединение 3 (40,7 мг, 82 мкмоль) объединяют с ТГФ (0,6 мл) и NaOH (326 мкл, 326 мкмоль) и несколькими каплями МеОН. Полученную смесь перемешивают при температуре 60°С в течение 2 часов, затем концентрируют при пониженном давлении. Остаток растворяют в АсОН и очищают с помощью хроматографии с обращенными фазами, получая указанное в заголовке соединение (12 мг).
MS m/z [M+H]+: рассчитано для С24Н27ClN4O4: 471,17; найдено: 471,2.
2L: (2S,4R)-5-(3'-хлорбифенил-4-ил)-2-(2-гидроксиэтоксиметил)-2-метил-4-[(1H-[1,2,3]триазол-4-карбонил)амино]пентановая кислота

В пробирку вводят этиловый эфир (2S,4R)-4-трет-бутоксикарбониламино-5-(3'-хлорбифенил-4-ил)-2-гидроксиметил-2-метилпентановой кислоты (400 мг, 840 мкмоль), тетрабутиламмонийгидросульфат (57 мг, 168 мкмоль), DCM (1 мл) и NaOH (588 мкл, 5,9 ммоль), затем [1,3,2]диоксатиолан-2,2-диоксид (417 мг, 3,4 ммоль). Реакционный сосуд закрывают и энергично перемешивают в течение ночи. Смесь экстрагируют DCM и водой, очищают (хроматография с обычной фазой, 0-60% EtOAc:гексаны), потом концентрируют при пониженном давлении, получая Соединение 1 (90 мг).
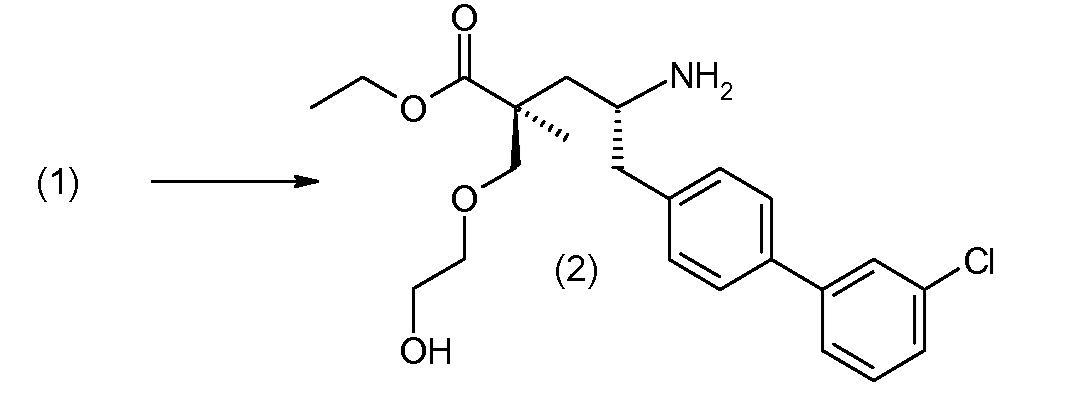
Соединение 1 (90 мг, 173 мкмоль) в MeCN (1 мл) объединяют с 4 н раствором HCl в диоксане (0,3 мл). Смесь перемешивают в течение 10 минут, затем концентрируют при пониженном давлении, получая Соединение 2.
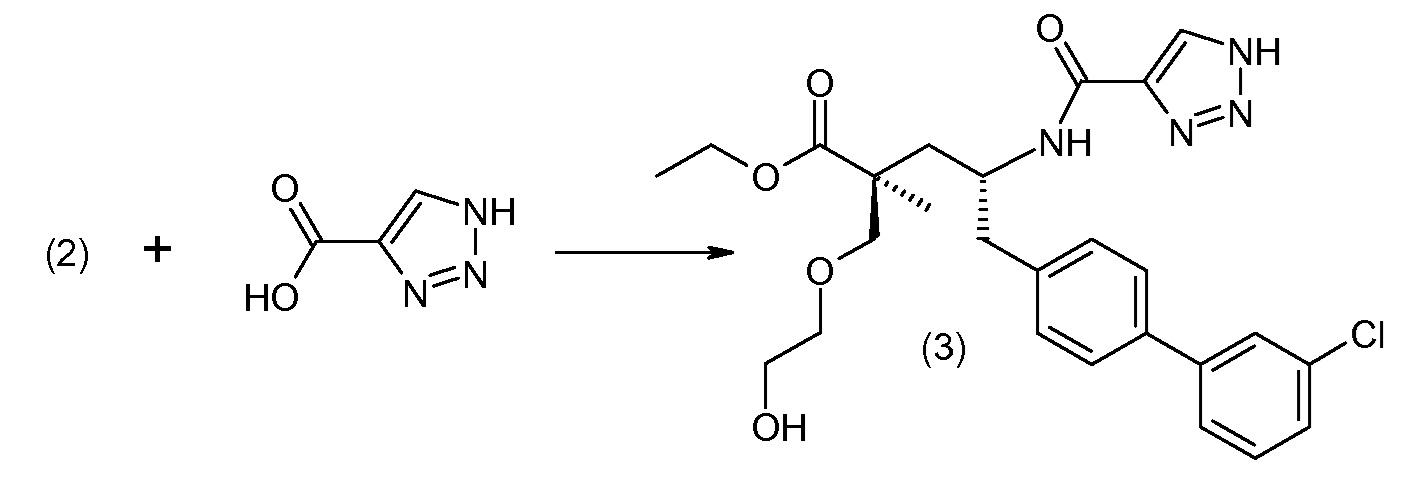
Соединение 2 (35 мг, 83 мкмоль) объединяют с HATU (38,0 мг, 100 мкмоль), 1Н-[1,2,3]триазол-4-карбоновой кислотой (12,3 мг, 108 мкмоль) в ДМФА (0,5 мл). Добавляют DIPEA (43,7 мкл, 250 мкмоль) и смесь перемешивают в течение 2 часов. Добавляют EtOAc, потом насыщенный водный раствор NH4Cl. Смесь перемешивают в течение 10 минут, затем концентрируют при пониженном давлении, получая Соединение 3.
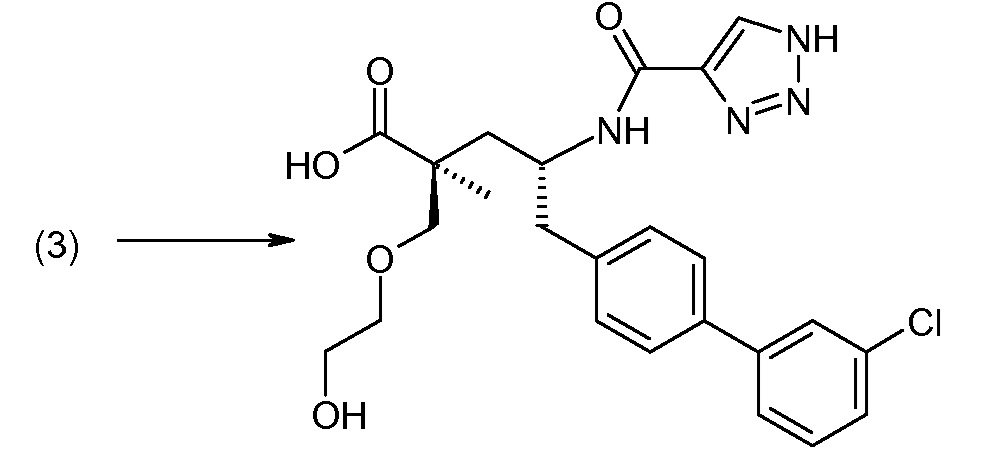
Соединение 3 (42 мг, 82 мкмоль) объединяют с ТГФ (0,6 мл) и NaOH (326 мкл, 326 мкмоль) и несколькими каплями МеОН. Полученную смесь перемешивают при температуре 60°С в течение 2 часов, затем концентрируют при пониженном давлении. Остаток растворяют в АсОН и очищают с помощью хроматографии с обращенными фазами, получая указанное в заголовке соединение (11 мг).
MS m/z [M+H]+: рассчитано для С24Н27ClN4O5: 487,17; найдено: 487,2.
2М: (2S,4R)-5-(3'-хлорбифенил-4-ил)-2-(3-гидроксипропоксиметил)-2-метил-4-[(1H-[1,2,3]триазол-4-карбонил)амино]пентановая кислота
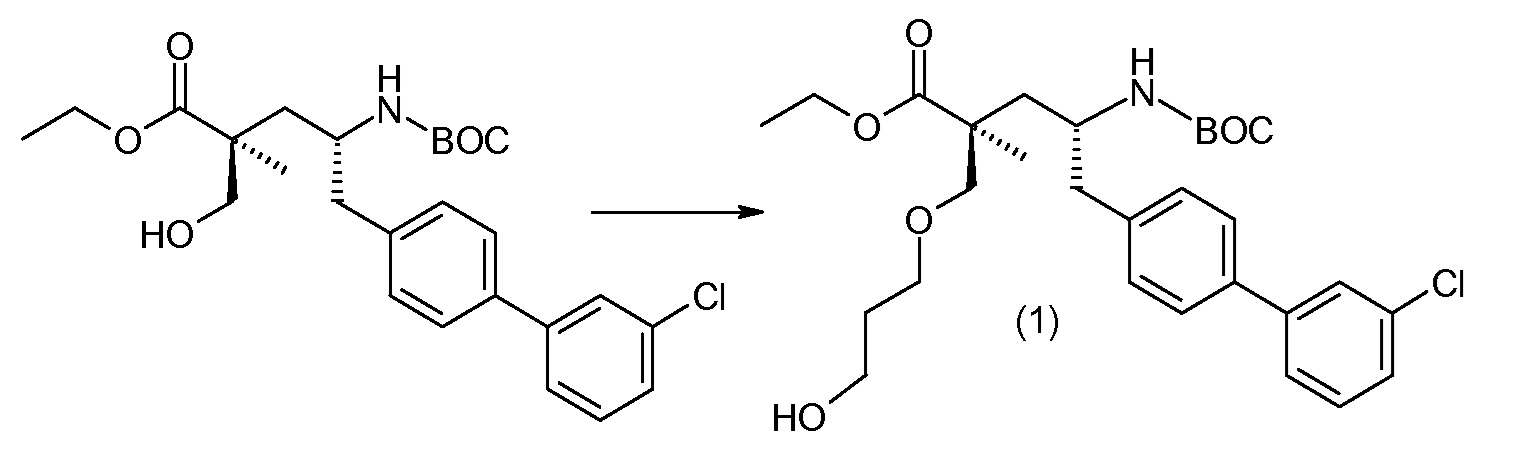
В пробирку вводят этиловый эфир (2S,4R)-4-трет-бутоксикарбониламино-5-(3'-хлорбифенил-4-ил)-2-гидроксиметил-2-метилпентановой кислоты (67 мг, 140 мкмоль), тетрабутиламмонийгидросульфат (9,5 мг, 28 мкмоль), DCM (1 мл) и NaOH (98 мкл, 982 мкмоль), затем циклический сульфат 1,3-пропандиола (78 мг, 561 мкмоль). Смесь перемешивают в течение ночи, затем экстрагируют с помощью DCM и очищают (хроматография с обычной фазой, 0-100%, EtOAc:гексаны), получая Соединение 1 (7 мг).

Соединение 1 (26,3 мг, 49 мкмоль) в MeCN (0,3 мл) объединяют с 4 н раствором HCl в диоксане (0,3 мл). Смесь перемешивают в течение 10 минут, затем концентрируют при пониженном давлении, получая Соединение 2.

Соединение 2 (18 мг, 47 мкмоль) растворяют в ДМФА (0,3 мл) и 1Н-[1,2,3]триазол-4-карбоновой кислоте (5,3 мг, 47 мкмоль). Добавляют HATU (18 мг, 47 мкмоль), потом DIPEA (25 мкл, 141 мкмоль). Смесь перемешивают в течение 30 минут, затем концентрируют при пониженном давлении, получая Соединение 3, которое используют без дальнейшей очистки.
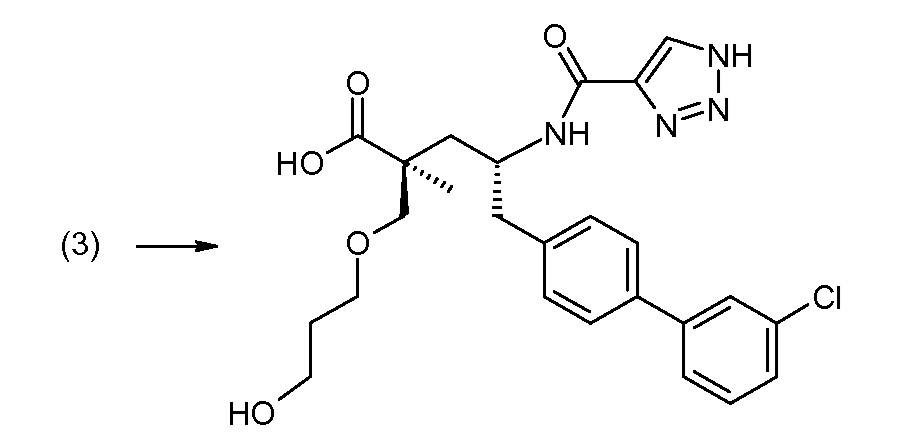
Соединение 3 (23 мг, 47 мкмоль) растворяют в ТГФ и добавляют NaOH (188 мкл, 188 мкмоль), и смесь перемешивают при температуре 60°С в течение ночи. Остаток растворяют в АсОН и очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение (1,2 мг).
MS m/z [M+H]+: рассчитано для С25Н29ClN4O5: 501,18; найдено: 502,2.
2N: (2S,4R)-5-(5'-хлор-2'-фторбифенил-4-ил)-2-метоксиметил-2-метил-4-[(1H-[1,2,3]триазол-4-карбонил)амино]пентановая кислота

В пробирку вводят этиловый эфир (2S,4R)-4-трет-бутоксикарбониламино-5-(5'-хлор-2'-фторбифенил-4-ил)-2-гидроксиметил-2-метилпентановой кислоты (82 мг, 166 мкмоль), тетрабутиламмонийгидросульфат (11 мг, 33 мкмоль), DCM (1 мл) и NaOH (116 мкл, 1,2 ммоль), затем диметилсульфат (84 мг, 664 ммоль). Реакционный сосуд закрывают и энергично перемешивают в течение ночи. Смесь экстрагируют с помощью DCM и концентрируют при пониженном давлении. Остаток растворяют в АсОН и очищают с помощью хроматографии с обращенными фазами (30-100% MeCN в воде), получая Соединение 1 (30 мг).
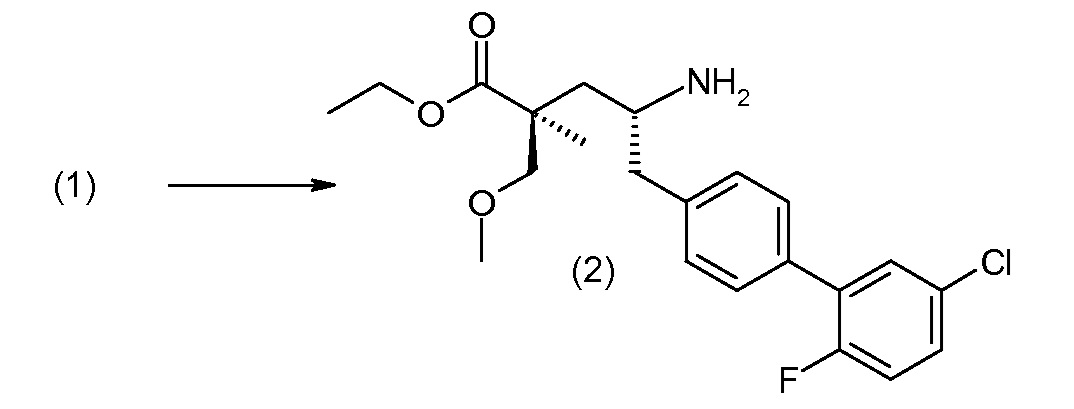
Соединение 1 (84 мг, 166 мкмоль) в MeCN (1 мл) объединяют с 4 н раствором HCl в диоксане (0,3 мл). Смесь перемешивают в течение 10 минут, затем концентрируют при пониженном давлении, получая Соединение 2.
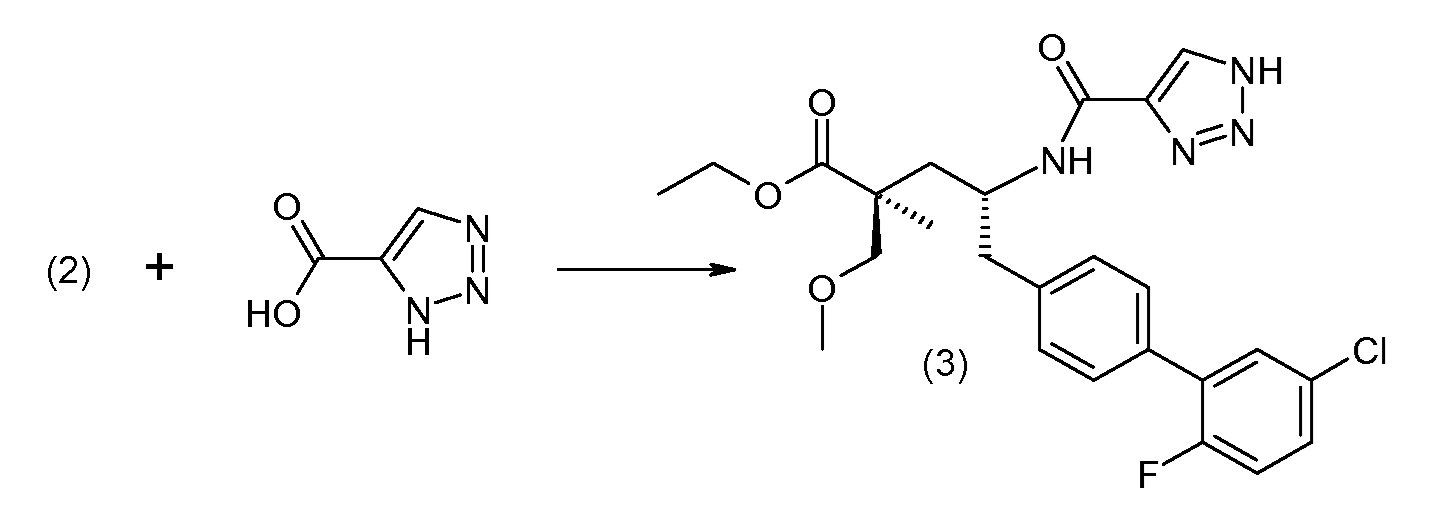
3Н-[1,2,3]триазол-4-карбоновую кислоту (21 мг, 183 мкмоль) объединяют с HATU (69 мг, 183 мкмоль) в ДМФА (0,5 мл) добавляют Соединение 2 (68 мг, 166 мкмоль) и DIPEA (87 мкмоль, 498 мкмоль). Полученную смесь перемешивают в течение 20 минут, затем концентрируют при пониженном давлении. Остаток очищают (хроматография с обычной фазой, 0-80%, EtOAc:гексаны), получая Соединение 3.
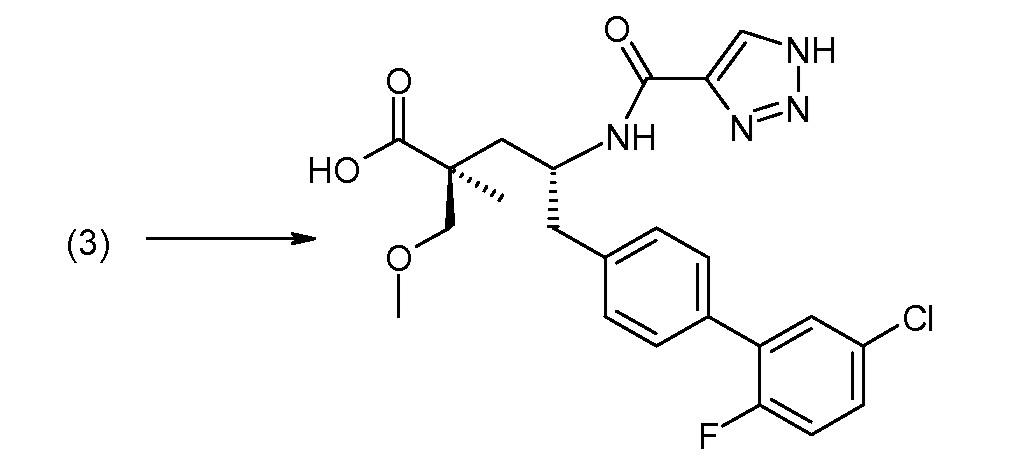
Соединение 3 (65 мг, 129 мкмоль) объединяют с ТГФ (0,6 мл) и NaOH (516 мкл, 516 мкмоль). Полученную смесь перемешивают при температуре 60°С в течение 2 часов. Добавляют небольшое количество NaOH и МеОН и смесь перемешивают в течение ночи. Смесь подкисляют концентрированной HCl до рН~4, затем концентрируют при пониженном давлении. Остаток растворяют в АсОН и очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение (35 мг).
MS m/z [M+H]+: рассчитано для С23Н24ClFN4O4: 475,15; найдено: 475,2.
2О: (2S,4R)-5-(5'-хлор-2'-фторбифенил-4-ил)-2-этоксиметил-2-метил-4-[(1H-[1,2,3]триазол-4-карбонил)амино]пентановая кислота

В пробирку вводят этиловый эфир (2S,4R)-4-трет-бутоксикарбониламино-5-(5'-хлор-2'-фторбифенил-4-ил)-2-гидроксиметил-2-метилпентановой кислоты (415 мг, 840 мкмоль), тетрабутиламмонийгидросульфат (57 мг, 168 мкмоль), DCM (1 мл) и NaOH (588 мкл, 5,9 ммоль), затем диэтилсульфат (518 мг, 3,4 ммоль). Реакционный сосуд закрывают и энергично перемешивают в течение ночи. Смесь экстрагируют DCM и водой, очищают (хроматография с обычной фазой, 0-60%, EtOAc:гексаны), затем концентрируют при пониженном давлении, получая Соединение 1 (110 мг).

Соединение 1 (90 мг, 173 мкмоль) в MeCN (1 мл) объединяют с 4 н раствором HCl в диоксане (0,3 мл). Смесь перемешивают в течение 10 минут, затем концентрируют при пониженном давлении, получая Соединение 2.
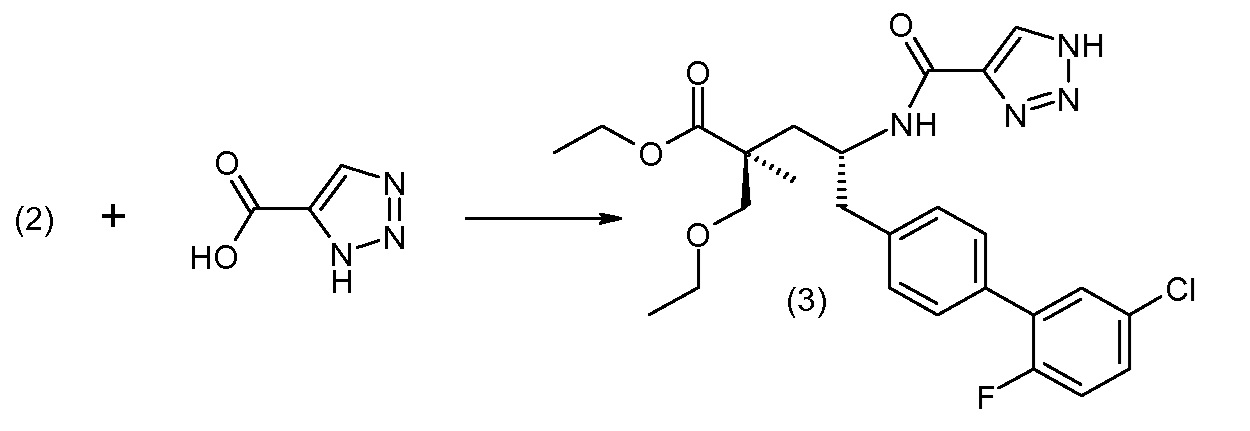
Соединение 2 (35,2 мг, 83 мкмоль) объединяют с HATU (38,0 мг, 100 мкмоль), 3Н-[1,2,3]триазол-4-карбоновой кислотой (12,3 мг, 108 мкмоль) в ДМФА (0,5 мл). Добавляют DIPEA (43,7 мкл, 250 мкмоль) и смесь перемешивают в течение 2 часов. Добавляют EtOAc, потом насыщенный водный раствор NH4Cl. Смесь перемешивают в течение 10 минут, затем концентрируют при пониженном давлении, получая Соединение 3.

Соединение 3 (42,2 мг, 82 мкмоль) объединяют с ТГФ (0,6 мл) и NaOH (326 мкл, 326 мкмоль) и несколькими каплями МеОН. Полученную смесь перемешивают при температуре 60°С в течение 2 часов, затем концентрируют при пониженном давлении. Остаток растворяют в АсОН и очищают с помощью хроматографии с обращенными фазами, получая указанное в заголовке соединение (23 мг).
MS m/z [M+H]+: рассчитано для С24Н26ClFN4O4: 489,16; найдено: 489,2.
2Р: (2S,4R)-5-(5'-хлор-2'-фторбифенил-4-ил)-2-(3-гидроксипропоксиметил)-2-метил-4-[(3H-[1,2,3]триазол-4-карбонил)амино]пентановая кислота

Также получают указанное в заголовке соединение (4 мг).
MS m/z [M+H]+: рассчитано для С25Н28ClFN4O5: 519,17; найдено: 519.
2Q: (2S,4R)-5-(5'-хлор-2'-фторбифенил-4-ил)-2-метил-2-пентилоксиметил-4-[(3H-[1,2,3]триазол-4-карбонил)амино]пентановая кислота

Также получают указанное в заголовке соединение (6 мг).
MS m/z [M+H]+: рассчитано для С27Н32ClFN4O4: 531,21; найдено: 531.
2R: (2S,4R)-5-(5'-хлор-2'-фторбифенил-4-ил)-2-изопропоксиметил-2-метил-4-[(3H-[1,2,3]триазол-4-карбонил)амино]пентановая кислота

Также получают указанное в заголовке соединение (7 мг).
MS m/z [M+H]+: рассчитано для С25Н28ClFN4O4: 503,18; найдено: 503.
2S: (2S,4R)-5-(5'-хлор-2'-фторбифенил-4-ил)-2-(2-гидроксиэтоксиметил)-2-метил-4-[(3H-[1,2,3]триазол-4-карбонил)амино]пентановая кислота
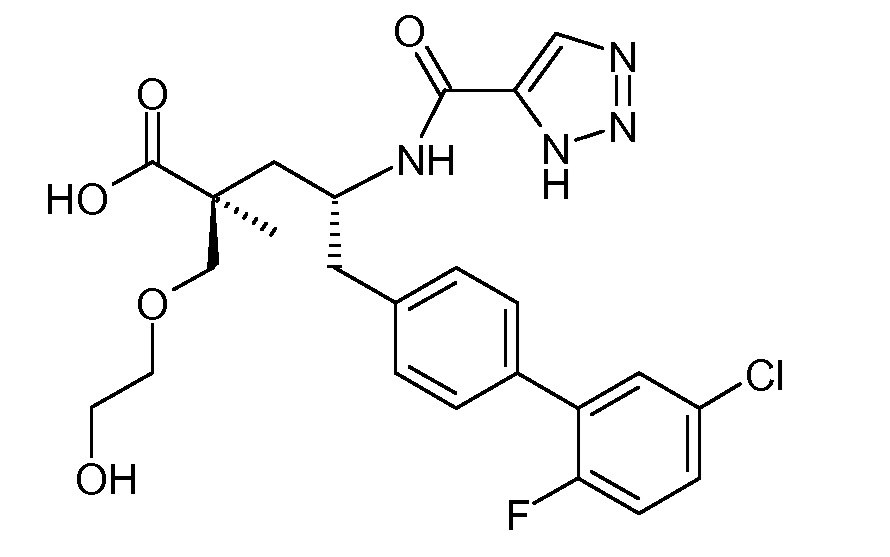
Также получают указанное в заголовке соединение (4 мг).
MS m/z [M+H]+: рассчитано для С24Н24FN7O2: 462,20; найдено: 462,2.
Пример 3
Подразумевают, что соединения Примера 3 могут существовать в таутомерной форме и что обе формы включены в этот пример. Например, в Примере 3А описана (2S,4R)-5-(3'-фторбифенил-4-ил)-2-гидроксиметил-2-метил-4-[(3H-[1,2,3]триазол-4-карбонил)амино]-пентановая кислота, однако, подразумевают, что это соединение может существовать в таутомерной форме, например, в виде (2S,4R)-5-(3'-фторбифенил-4-ил)-2-гидроксиметил-2-метил-4-[(1H-[1,2,3]триазол-4-карбонил)амино]пентановой кислоты. То же самое верно для соединения в Примере 3В.
3А: (2S,4R)-5-(3'-фторбифенил-4-ил)-2-гидроксиметил-2-метил-4-[(3H-[1,2,3]триазол-4-карбонил)амино]пентановая кислота

1,2,3-Триазол-4-карбоновую кислоту (27,3 мг, 241 мкмоль) объединяют с EDC (42,7 мкл, 241 мкмоль), 4-метилморфолином (1 экв.) и HOBt (32,6 мг, 241 мкмоль) в ДМФА (0,2 мл). Полученную смесь перемешивают в течение 5 минут при комнатной температуре. Добавляют раствор (2S,4R)-4-амино-5-(3'-фторбифенил-4-ил)-2-гидроксиметил-2-метилпентановой кислоты (80 мг, 240 мкмоль) и 4-метилморфолина (53,1 мкл, 483 мкмоль) в ДМФА (0,3 мл), и полученную смесь перемешивают в течение 15 минут. Реакционную смесь гасят с помощью АсОН и продукт очищают посредством препаративной ВЭЖХ и лиофилизируют, получая указанное в заголовке соединение (30 мг).
MS m/z [M+H]+: рассчитано для С22Н23FN4O4: 427,17; найдено: 427,2.
3В: (2S,4R)-5-(2'-фторбифенил-4-ил)-2-гидроксиметил-2-метил-4-[(3H-[1,2,3]триазол-4-карбонил)амино]пентановая кислота

1,2,3-Триазол-4-карбоновую кислоту (30 мг, 260 мкмоль) объединяют с DIPEA (92,4 мкл, 531 мкмоль) и HATU (101 мг, 265 мкмоль) в ДМФА (0,2 мл). Полученную смесь перемешивают в течение 5 минут при комнатной температуре. Добавляют раствор (2S,4R)-4-трет-бутоксикарбониламино-5-(2'-фторбифенил-4-ил)-2-гидроксиметил-2-метилпентановой кислоты (114 мг, 265 мкмоль) и DIPEA (3 экв.) в ДМФА (0,2 мл), и полученную смесь перемешивают в течение 15 минут. Реакционную смесь гасят с помощью АсОН и продукт очищают посредством препаративной ВЭЖХ и лиофилизируют, получая указанное в заголовке соединение (16 мг).
MS m/z [M+H]+: рассчитано для С22Н23FN4O4: 427,17; найдено: 427,2.
Пример 4
4А: (2S,4R)-5-(2'-фторбифенил-4-ил)-2-гидроксиметил-4-[(1-гидрокси-1Н-[1,2,3]триазол-4-карбонил)амино]-2-метилпентановая кислота

1-Гидрокси-1Н-1,2,3-триазол-4-карбоновую кислоту (15 мг, 116 мкмоль) объединяют с DIPEA (40,5 мкл, 232 мкмоль) и HATU (44,2 мг, 116 мкмоль) в ДМФА (0,2 мл). Полученную смесь перемешивают в течение 5 минут при комнатной температуре. Добавляют раствор (2S,4R)-4-амино-5-(2'-фторбифенил-4-ил)-2-гидроксиметил-2-метилпентановой кислоты (38,5 мг, 166 мкмоль) и DIPEA (3 экв.) в ДМФА (0,2 мл), и полученную смесь перемешивают в течение 15 минут. Реакционную смесь гасят с помощью АсОН и продукт очищают посредством препаративной ВЭЖХ и лиофилизируют, получая указанное в заголовке соединение (8 мг).
MS m/z [M+H]+: рассчитано для С22Н23FN4O5: 443,17; найдено: 443,2.
4В: (2S,4R)-5-(5'-хлор-2'-фторбифенил-4-ил)-2-гидроксиметил-4-[(1-метокси-1Н-[1,2,3]триазол-4-карбонил)амино]-2-метилпентановая кислота
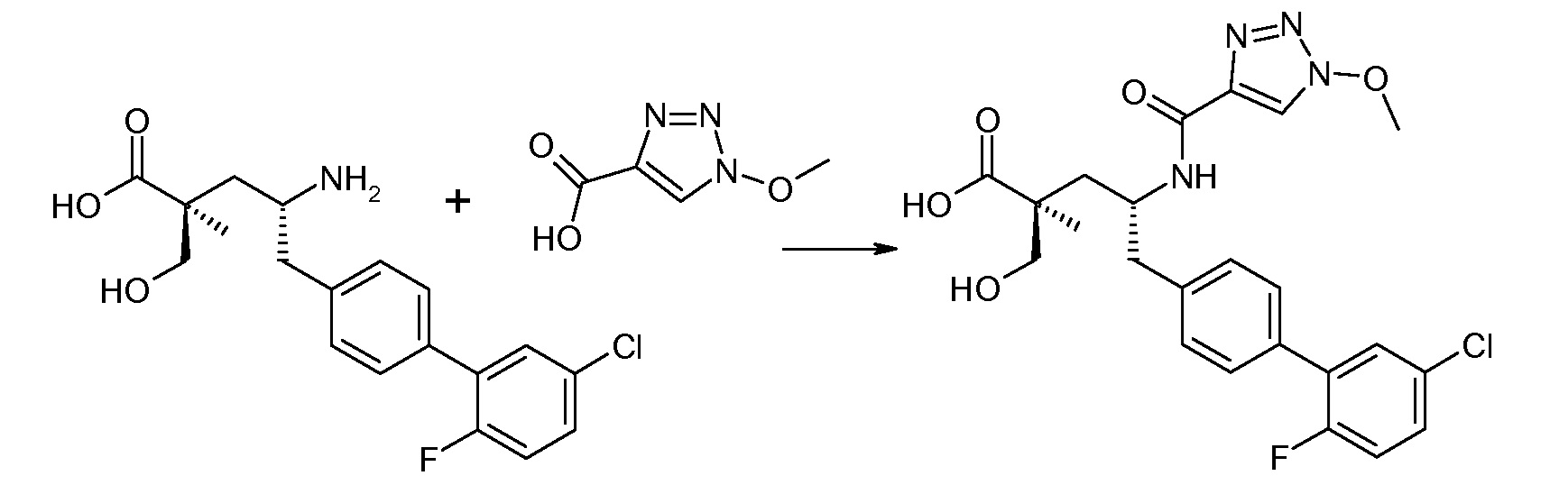
1-Метокси-1Н-[1,2,3]триазол-4-карбоновую кислоту (4,3 мг, 30 мкмоль) и HATU (11,4 мг, 30 мкмоль) объединяют в ДМФА (1 мл) и перемешивают при комнатной температуре в течение 15 минут. Добавляют (2S,4R)-4-амино-5-(5'-хлор-2'-фторбифенил-4-ил)-2-гидроксиметил-2-метилпентановую кислоту (10 мг, 27 мкмоль) и DIPEA (14 мкл, 82 мкмоль), и полученную смесь перемешивают в течение 15 минут при комнатной температуре. Растворитель удаляют в вакууме и остаток очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение (1,1 мг).
MS m/z [M+H]+: рассчитано для С23Н24ClFN4O5: 491,14; найдено: 491,2.
4С: (2S,4R)-5-(5'-хлор-2'-фторбифенил-4-ил)-4-[(1-этокси-1Н-[1,2,3]триазол-4-карбонил)амино]-2-гидроксиметил-2-метилпентановая кислота

1-Этокси-1Н-[1,2,3]триазол-4-карбоновую кислоту (4,7 мг, 30 мкмоль) и HATU (11,4 мг, 30 мкмоль) объединяют в ДМФА (1 мл) и перемешивают при комнатной температуре в течение 15 минут. Добавляют (2S,4R)-4-амино-5-(5'-хлор-2'-фторбифенил-4-ил)-2-гидроксиметил-2-метилпентановую кислоту (10 мг, 27 мкмоль) и DIPEA (14 мкл, 82 мкмоль), и полученную смесь перемешивают в течение 15 минут при комнатной температуре. Растворитель удаляют в вакууме и остаток очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение (2 мг).
MS m/z [M+H]+: рассчитано для С24Н26ClFN4O5: 505,16; найдено: 505,1.
Пример 5
5А: (2S,4R)-5-(2'-фторбифенил-4-ил)-2-гидроксиметил-2-метил-4-[(2-оксо-2,3-дигидрооксазол-4-карбонил)амино]пентановая кислота

ТГФ (1 мл, 10 ммоль), этил-2-оксо-2,3-дигидрооксазол-4-карбоксилат (12 мг, 76,4 мкмоль) и 1М раствор NaOH в воде (229 мкл, 229 мкмоль) объединяют и перемешивают вплоть до завершения реакции. Смесь подкисляют до рН~5 с помощью 1 н раствора HCl, растворитель выпаривают в вакууме и продукт подвергают азеотропной перегонке с толуолом и высушивают в вакууме. К этому продукту добавляют раствор DIPEA (26,6 мкл, 153 мкмоль) и HATU (29,0 мг, 76,4 мкмоль) в ДМФА (0,2 мл), и полученную смесь перемешивают в течение 5 минут при комнатной температуре. Добавляют (2S,4R)-4-амино-5-(2'-фторбифенил-4-ил)-2-гидроксиметил-2-метилпентановую кислоту (25,3 мг, 76,4 мкмоль) и полученную смесь перемешивают в течение 15 минут. Реакционную смесь гасят с помощью EtOAc и насыщенного раствора NH4Cl. Продукт экстрагируют и высушивают. Добавляют АсОН и продукт очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение (2,5 мг).
MS m/z [M+H]+: рассчитано для С23Н23FN2O6, 443,15; найдено - 443,2.
5В: (2S,4R)-5-(2'-фторбифенил-4-ил)-2-гидроксиметил-2-метил-4-[(2-оксо-2,3-дигидрооксазол-5-карбонил)амино]пентановая кислота

ТГФ (1 мл, 10 ммоль), этил-2-оксо-2,3-дигидрооксазол-5-карбоксилат (12 мг, 76,4 мкмоль) и 1М раствор NaOH в воде (229 мкл, 229 мкмоль) объединяют и перемешивают вплоть до завершения реакции. Смесь подкисляют до рН~5 с помощью 1 н раствора HCl, растворитель выпаривают в вакууме и продукт подвергают азеотропной перегонке с толуолом и высушивают в вакууме. К этому продукту добавляют раствор DIPEA (26,6 мкл, 153 мкмоль) и HATU (29,0 мг, 76,4 мкмоль) в ДМФА (0,2 мл), и полученную смесь перемешивают в течение 5 минут при комнатной температуре. Добавляют (2S,4R)-4-амино-5-(2'-фторбифенил-4-ил)-2-гидроксиметил-2-метилпентановую кислоту (25,3 мг, 76,4 мкмоль) и полученную смесь перемешивают в течение 15 минут. Реакционную смесь гасят с помощью EtOAc и насыщенного раствора NH4Cl. Продукт экстрагируют и высушивают. Добавляют АсОН и продукт очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение (5 мг).
MS m/z [M+H]+: рассчитано для С23Н23FN2O6: 443,15; найдено: 443,2.
5С: (2S,4R)-5-(5'-хлор-2'-фторбифенил-4-ил)-2-гидроксиметил-2-метил-4-[(2-оксо-2,3-дигидрооксазол-4-карбонил)амино]пентановая кислота

2-Оксо-2,3-дигидрооксазол-4-карбоновую кислоту (7 мг, 55 мкмоль) и HATU (20,8 мг, 55 мкмоль) объединяют в ДМФА (0,2 мл) и выдерживают при комнатной температуре в течение 10 минут. Добавляют (2S,4R)-4-амино-5-(5'-хлор-2'-фторбифенил-4-ил)-2-гидроксиметил-2-метилпентановую кислоту (20 мг, 55 мкмоль) в ДМФА и DIPEA (28,6 мкл, 164 мкмоль) и полученную смесь перемешивают в течение 20 минут при комнатной температуре. Смесь концентрируют при пониженном давлении и остаток растворяют в АсОН, очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение (0,6 мг).
MS m/z [M+H]+: рассчитано для С23Н22ClFN2O6: 477,12; найдено: 477,2.
5D: (2S,4R)-5-(5'-хлор-2'-фторбифенил-4-ил)-2-гидроксиметил-2-метил-4-[(2-оксо-2,3-дигидрооксазол-5-карбонил)амино]пентановая кислота
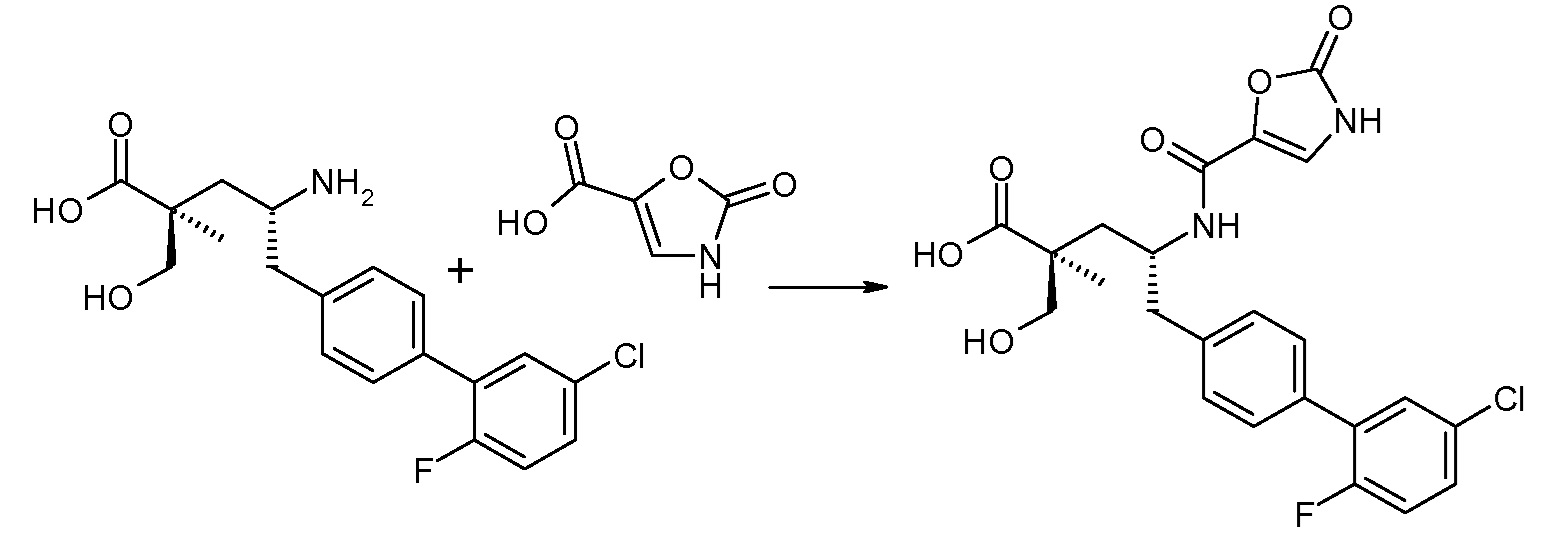
2-Оксо-2,3-дигидрооксазол-5-карбоновую кислоту (7,1 мг, 55 мкмоль) и HATU (21 мг, 55 мкмоль) объединяют с ДМФА (0,3 мл) и перемешивают при комнатной температуре в течение 5 минут. Добавляют (2S,4R)-4-амино-5-(5'-хлор-2'-фторбифенил-4-ил)-2-гидроксиметил-2-метилпентановую кислоту (20 мг, 55 мкмоль) в ДМФА (0,5 мл) и DIPEA (29 мкл, 164 мкмоль), и полученную смесь перемешивают в течение 10 минут при комнатной температуре. Смесь концентрируют при пониженном давлении и остаток растворяют в АсОН, очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение (3 мг).
MS m/z [M+H]+: рассчитано для С23Н22ClFN2O6: 477,12; найдено: 477.
Пример 6
6А: (2S,4R)-5-(3'-хлорбифенил-4-ил)-2-гидроксиметил-4-[(3-метоксиизоксазол-5-карбонил)амино]-2-метилпентановая кислота

3-Метоксиизоксазол-5-карбоновую кислоту (9 мг, 32 мкмоль) объединяют с HATU (12 мг, 32 мкмоль) и ДМФА (0,2 мл), и полученную смесь перемешивают в течение 5 минут. Добавляют DIPEA (17 мкл, 96 мкмоль) и (2S,4R)-4-амино-5-(3'-хлорбифенил-4-ил)-2-гидроксиметил-2-метилпентановую кислоту (79 мг, 38 мкмоль), предварительно растворенную в ДМФА и полученную смесь перемешивают в течение 15 минут, затем концентрируют. Остаток растворяют в АсОН и очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение (2,2 мг).
MS m/z [M+H]+: рассчитано для С24Н25ClN2O6: 473,14; найдено: 473,2.
6В: (2S,4R)-5-(3'-хлорбифенил-4-ил)-4-[(3-метоксиизоксазол-5-карбонил)амино]-2-метоксиметил-2-метилпентановая кислота
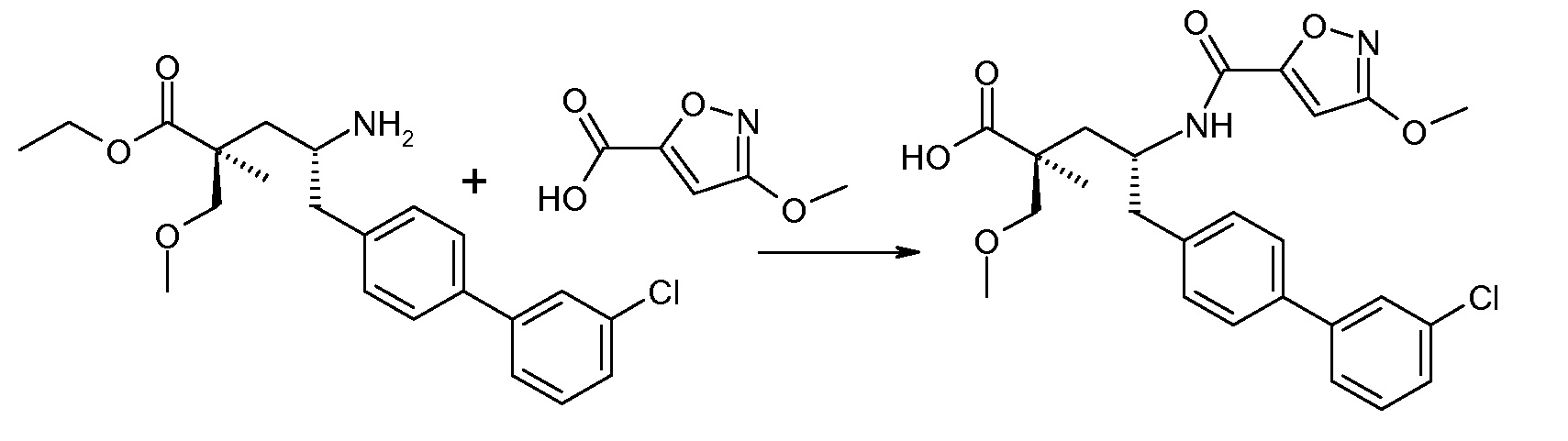
3-Метоксиизоксазол-5-карбоновую кислоту (4,4 мг, 31 мкмоль) и HATU (12 мг, 31 мкмоль) объединяют в ДМФА (0,5 мл) и перемешивают в течение 5 минут. Добавляют раствор этилового эфира (2S,4R)-4-амино-5-(3'-хлорбифенил-4-ил)-2-метоксиметил-2-метилпентановой кислоты (12 мг, 31 мкмоль) и DIPEA (16 мкл, 93 мкмоль) в ДМФА (0,5 мл) и полученную смесь перемешивают в течение 20 минут, затем концентрируют при пониженном давлении.
Остаток объединяют с ТГФ (0,6 мл) и NaOH (124 мкл, 124 мкмоль) и перемешивают при температуре 60°С в течение 2 часов, затем концентрируют при пониженном давлении. Остаток растворяют в АсОН и соединение очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение (1 мг).
MS m/z [M+H]+: рассчитано для С25Н27ClN2O6, 487,16; найдено - 487,2.
6С: (2S,4R)-5-(3'-хлорбифенил-4-ил)-2-этоксиметил-4-[(3-метоксиизоксазол-5-карбонил)амино]-2-метилпентановая кислота

Осуществляют введение во взаимодействие 3-метоксиизоксазол-5-карбоновой кислоты и (2S,4R)-4-амино-5-(3'-хлорбифенил-4-ил)-2-этоксиметил-2-метилпентановой кислоты, как описано в данном контексте, получая указанное в заголовке соединение (2 мг).
MS m/z [M+H]+: рассчитано для С26Н29ClN2O6: 501,17; найдено: 501,2.
6D: (2S,4R)-5-бифенил-4-ил-4-[(3-гидроксиизоксазол-5-карбонил)амино]-2-гидроксиметил-2-метилпентановая кислота
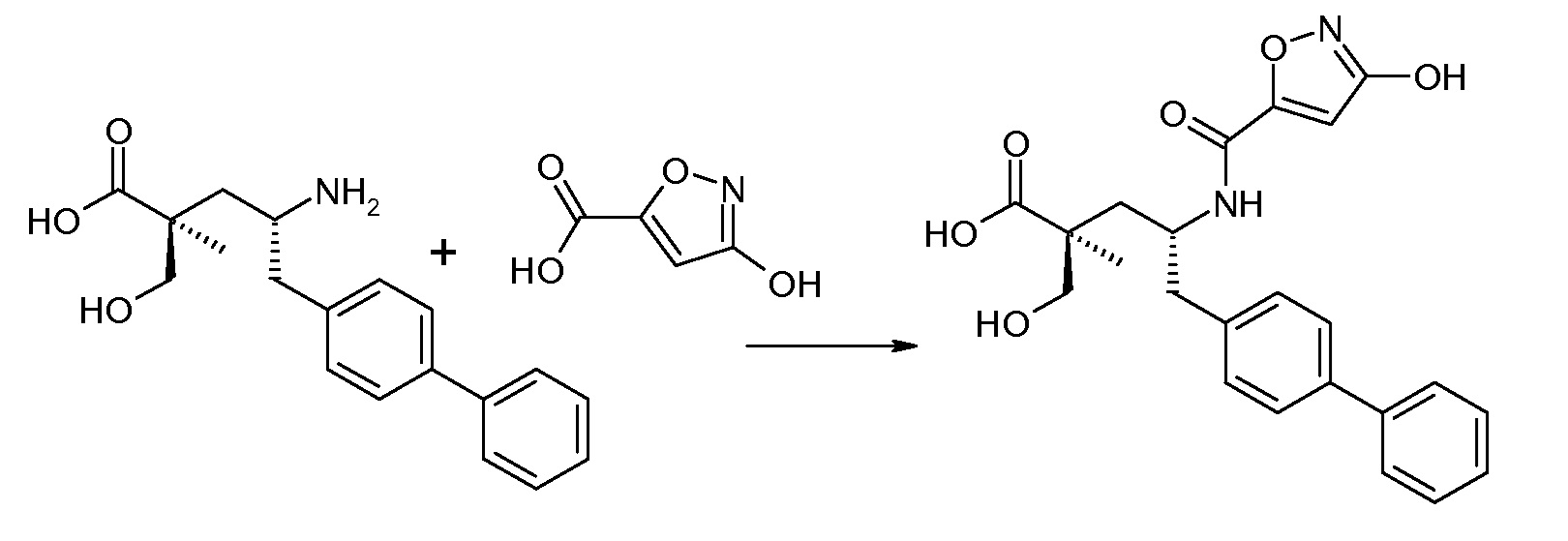
3-Гидроксиизоксазол-5-карбоновую кислоту (10,6 мг, 82 мкмоль), EDC (14,5 мкл, 82 мкмоль) и HOBt (11,1 мг, 82 мкмоль) объединяют в ДМФА (0,2 мл) и перемешивают в течение 5 минут. Добавляют (2S,4R)-4-амино-5-бифенил-4-ил-2-гидроксиметил-2-метилпентановую кислоту (26 мг, 82 мкмоль) и полученную смесь перемешивают в течение 18 часов. Реакционную смесь гасят с помощью АсОН и продукт очищают с помощью препаративной ВЭЖХ, затем лиофилизируют, получая указанное в заголовке соединение в виде ТФУК-соли (7 мг).
MS m/z [M+H]+: рассчитано для С23Н24N2O6: 425,16; найдено: 425,4.
6Е: (2S,4R)-5-бифенил-4-ил-4-[(3-гидроксиизоксазол-5-карбонил)амино]-2-метоксиметил-2-метилпентановая кислота

Осуществляют введение во взаимодействие 3-гидроксиизоксазол-5-карбоновой кислоты и этилового эфира (2S,4R)-4-амино-5-бифенил-4-ил-2-метоксиметил-2-метилпентановой кислоты, как описано в данном контексте, получая указанное в заголовке соединение (2,4 мг).
MS m/z [M+H]+: рассчитано для С24Н26N2O6: 439,18; найдено: 439,2.
6F: (2S,4R)-5-бифенил-4-ил-4-[(3-метоксиизоксазол-5-карбонил)амино]-2-метоксиметил-2-метилпентановая кислота
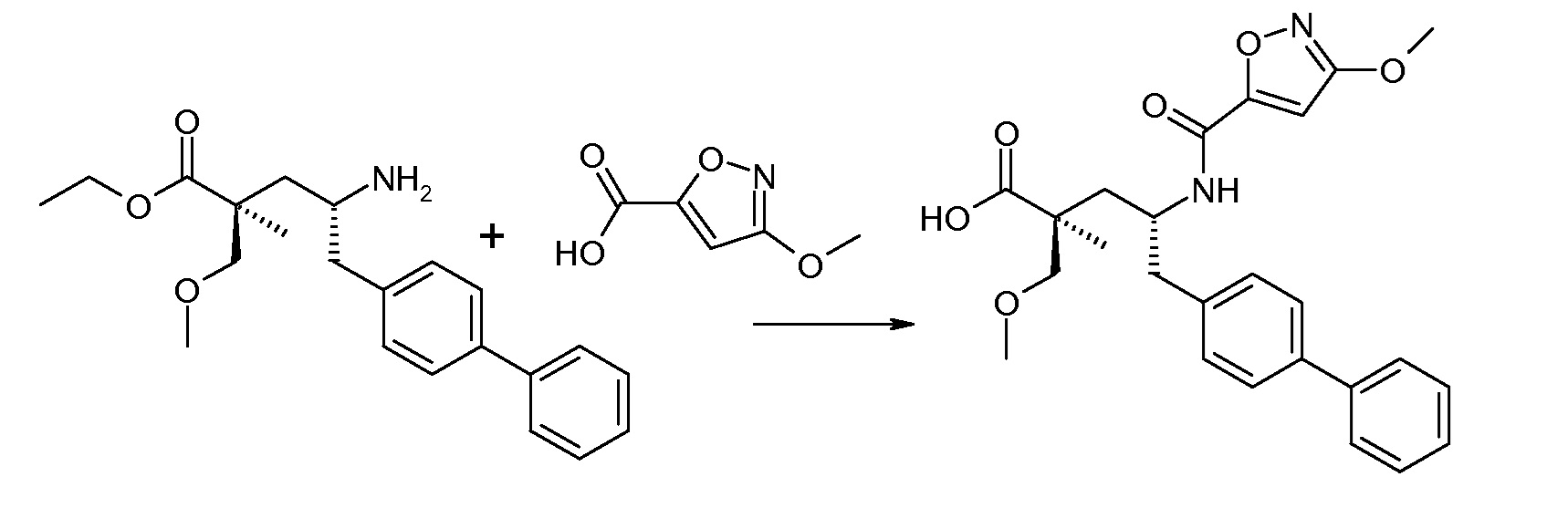
3-Метоксиизоксазол-5-карбоновую кислоту (4,4 мг, 31 мкмоль) и HATU (12 мг, 31 мкмоль) объединяют в ДМФА (0,5 мл) и перемешивают в течение 5 минут. Добавляют раствор этилового эфира (2S,4R)-4-амино-5-бифенил-4-ил-2-метоксиметил-2-метилпентановой кислоты (11 мг, 31 мкмоль) и DIPEA (16 мкл, 93 мкмоль) в ДМФА (0,5 мл) и полученную смесь перемешивают в течение 20 минут, затем концентрируют при пониженном давлении.
Остаток объединяют с ТГФ (0,6 мл) и NaOH (124 мкл, 124 мкмоль) и перемешивают при температуре 60°С в течение 2 часов, затем концентрируют при пониженном давлении. Остаток растворяют в АсОН и соединения очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение (1 мг).
MS m/z [M+H]+: рассчитано для С25Н28N2O6: 453,19; найдено: 453.
6G: (2S,4R)-5-(5'-хлор-2'-фторбифенил-4-ил)-2-гидроксиметил-4-[(3-метоксиизоксазол-5-карбонил)амино]-2-метилпентановая кислота

3-Метоксиизоксазол-5-карбоновую кислоту (8 мг, 55 мкмоль) и HATU (20,8 мг, 55 мкмоль) объединяют в ДМФА (0,2 мл) и выдерживают при комнатной температуре в течение 10 минут. Добавляют (2S,4R)-4-амино-5-(5'-хлор-2'-фторбифенил-4-ил)-2-гидроксиметил-2-метилпентановую кислоту (20 мг, 55 мкмоль) в ДМФА и DIPEA (28,6 мкл, 164 мкмоль) и полученную смесь перемешивают в течение 20 минут при комнатной температуре. Смесь концентрируют при пониженном давлении и остаток растворяют в АсОН, очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение (5,4 мг).
MS m/z [M+H]+: рассчитано для С24Н24ClFN2O6: 491,13; найдено: 491,2.
6Н: (2S,4R)-5-(5'-хлор-2'-фторбифенил-4-ил)-4-[(3-этилизоксазол-5-карбонил)амино]-2-гидроксиметил-2-метилпентановая кислота
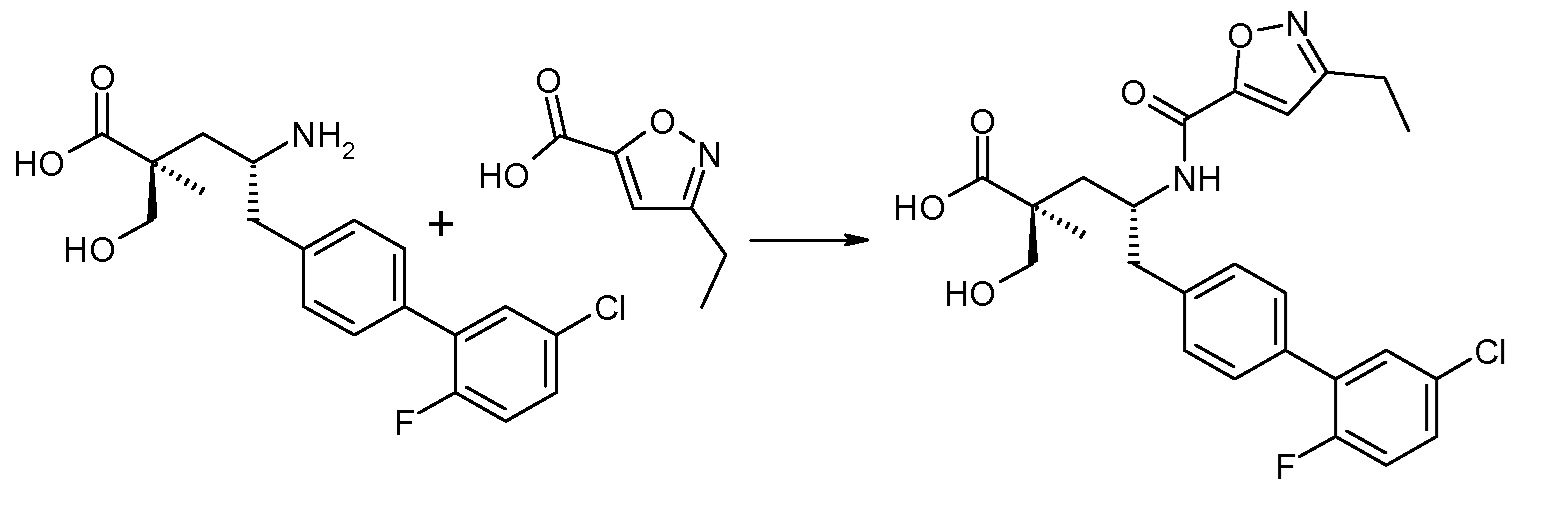
3-Этилизоксазол-5-карбоновую кислоту (8 мг, 55 мкмоль) и HATU (20,8 мг, 55 мкмоль) объединяют в ДМФА (0,2 мл) и выдерживают при комнатной температуре в течение 10 минут. Добавляют (2S,4R)-4-амино-5-(5'-хлор-2'-фторбифенил-4-ил)-2-гидроксиметил-2-метилпентановую кислоту (20 мг, 55 мкмоль) в ДМФА и DIPEA (28,6 мкл, 164 мкмоль), и полученную смесь перемешивают в течение 20 минут при комнатной температуре. Смесь концентрируют при пониженном давлении и остаток растворяют в АсОН, очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение (3,6 мг).
MS m/z [M+H]+: рассчитано для С25Н26ClFN2O5: 489,15; найдено: 490,2.
6I: (2S,4R)-5-(5'-хлор-2'-фторбифенил-4-ил)-2-гидроксиметил-4-[(3-изобутилизоксазол-5-карбонил)амино]-2-метилпентановая кислота
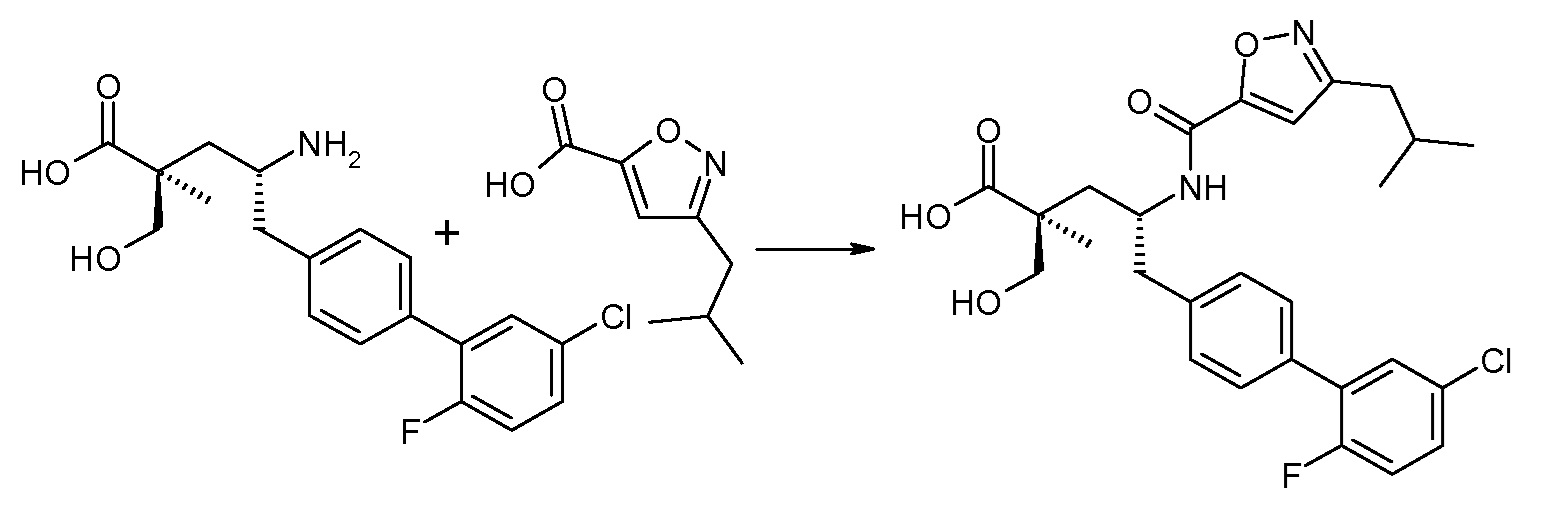
3-Изобутилизоксазол-5-карбоновую кислоту (9 мг, 55 мкмоль) и HATU (20,8 мг, 55 мкмоль) объединяют в ДМФА (0,2 мл) и выдерживают при комнатной температуре в течение 10 минут. Добавляют (2S,4R)-4-амино-5-(5'-хлор-2'-фторбифенил-4-ил)-2-гидроксиметил-2-метилпентановую кислоту (20 мг, 55 мкмоль) в ДМФА и DIPEA (28,6 мкл, 164 мкмоль), и полученную смесь перемешивают в течение 20 минут при комнатной температуре. Смесь концентрируют при пониженном давлении и остаток растворяют в АсОН, очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение (0,3 мг).
MS m/z [M+H]+: рассчитано для С27Н30ClFN2O5: 517,18; найдено: 517,2.
6J: (2S,4R)-5-(5'-хлор-2'-фторбифенил-4-ил)-2-гидроксиметил-4-[(3-пропилизоксазол-5-карбонил)амино]пентановая кислота
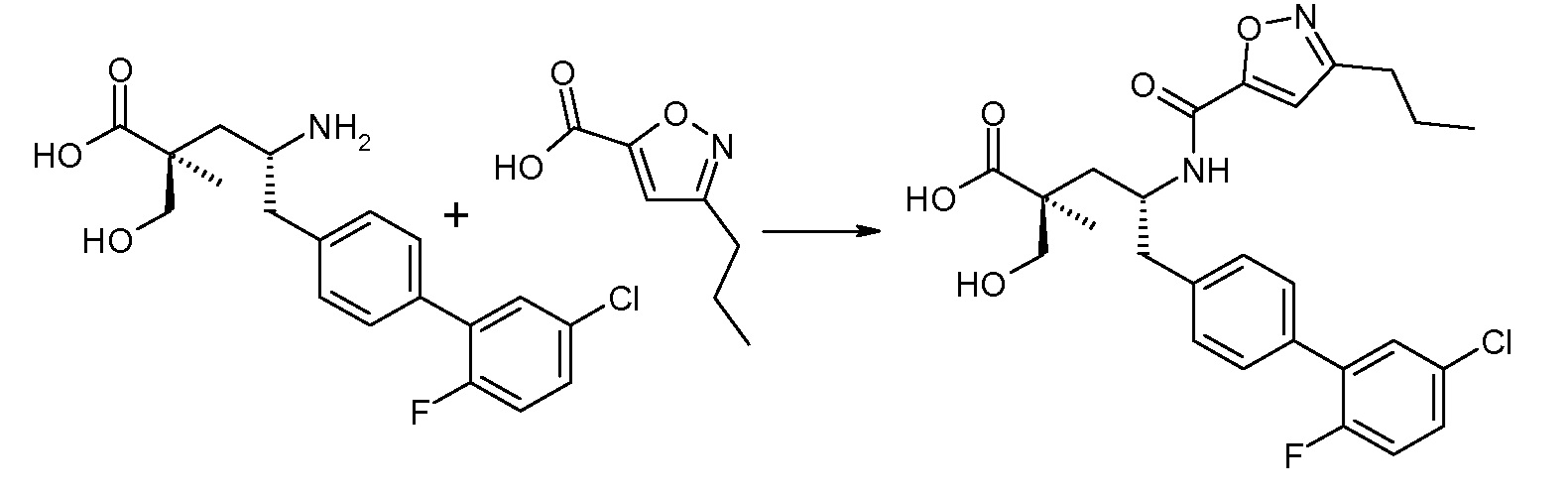
3-Пропилизоксазол-5-карбоновую кислоту (9 мг, 55 мкмоль) и HATU (20,8 мг, 55 мкмоль) объединяют в ДМФА (0,2 мл) и выдерживают при комнатной температуре в течение 10 минут. Добавляют (2S,4R)-4-амино-5-(5'-хлор-2'-фторбифенил-4-ил)-2-гидроксиметил-2-метилпентановую кислоту (20 мг, 55 мкмоль) в ДМФА и DIPEA (28,6 мкл, 164 мкмоль), и полученную смесь перемешивают в течение 20 минут при комнатной температуре. Смесь концентрируют при пониженном давлении и остаток растворяют в АсОН, очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение (0,5 мг).
MS m/z [M+H]+: рассчитано для С26Н28ClFN2O5: 503,17; найдено: 504,2.
6К: (2S,4R)-5-(5'-хлор-2'-фторбифенил-4-ил)-4-[(3-гидроксиизоксазол-5-карбонил)амино]-2-метоксиметил-2-метилпентановая кислота

3-Гидроксиизоксазол-5-карбоновую кислоту (4 мкг, 0,03 мкмоль) и HATU (11 мкг, 0,03 мкмоль) объединяют с этиловым эфиром (2S,4R)-4-амино-5-(5'-хлор-2'-фторбифенил-4-ил)-2-метоксиметил-2-метилпентановой кислоты (10 мкг, 0,03 мкмоль) в ДМФА (0,5 мл) и перемешивают в течение 5 минут. Добавляют DIPEA (0,01 мкл, 0,07 мкмоль) и полученную смесь перемешивают в течение 20 минут и выпаривают, получая сырое Соединение 1, которое непосредственно используют на следующей стадии.
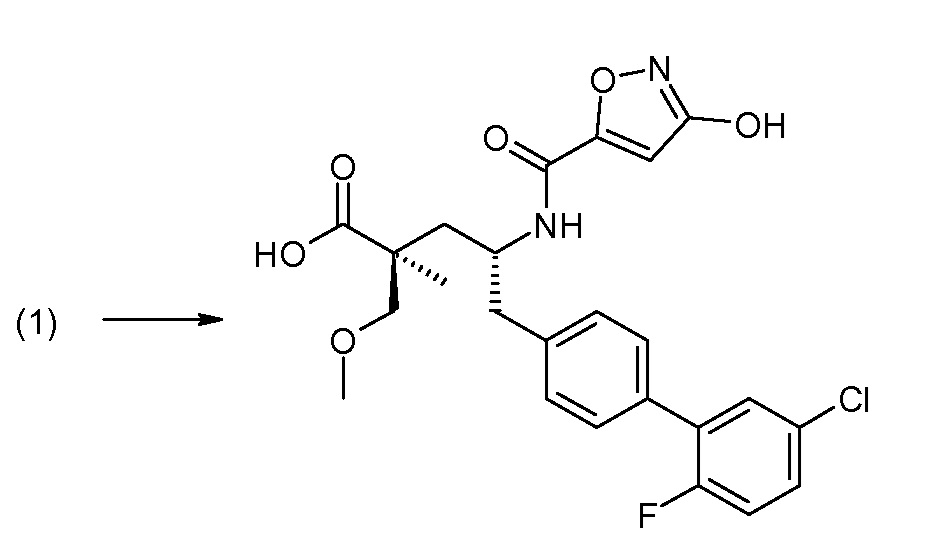
Соединение 1 (10 мг) в ТГФ (1 мл) объединяют с 1 н раствором NaOH (0,3 мл) и полученную смесь перемешивают при температуре 60°С в течение 3 часов. Добавляют АсОН и продукт очищают (хроматография с обращенными фазами), получая указанное в заголовке соединение (1 мг).
MS m/z [M+H]+: рассчитано для С24Н24ClFN2O6: 491,13; найдено: 491.
6L: (2S,4R)-5-(3'-хлорбифенил-4-ил)-2-(2-гидроксиэтоксиметил)-4-[(3-гидроксиизоксазол-5-карбонил)амино]-2-метилпентановая кислота
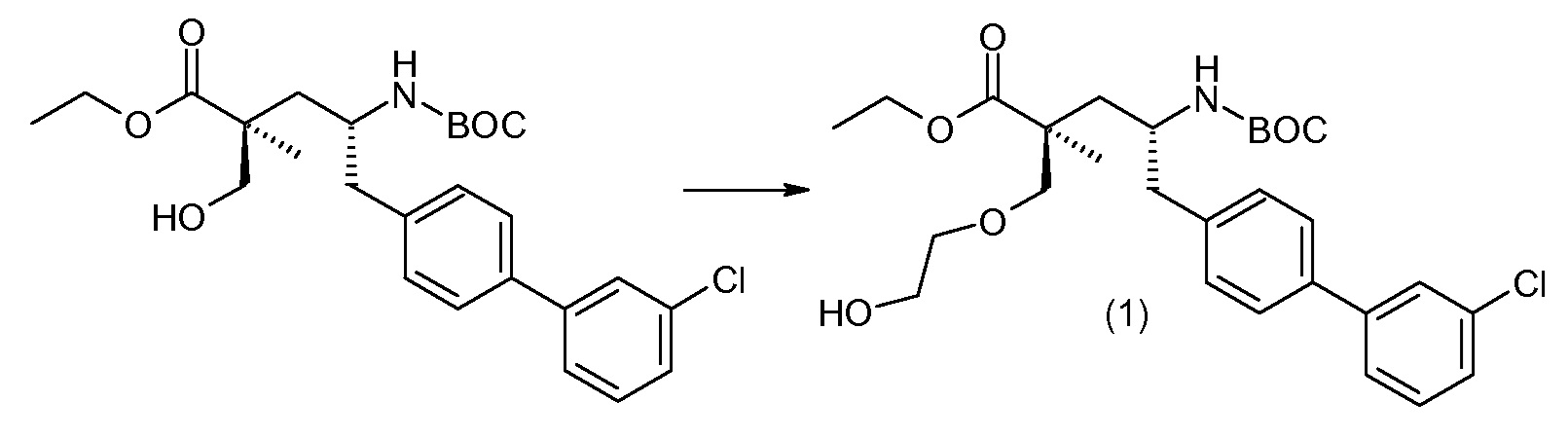
Этиловый эфир (2S,4R)-4-трет-бутоксикарбониламино-5-(3'-хлорбифенил-4-ил)-2-гидроксиметил-2-метилпентановой кислоты (415 мг, 840 мкмоль) и тетрабутиламмонийгидросульфат (57 мг, 168 мкмоль) объединяют с DCM (1 мл) и NaOH (588 мкл, 5,9 ммоль). Добавляют [1,3,2]диоксатиолан-2,2-диоксид (424 мг, 3,4 ммоль) и реакционный сосуд герметично закрывают и энергично перемешивают в течение ночи. Смесь экстрагируют с помощью DCM и воды, затем очищают (хроматография с обычной фазой, 0-60%, EtOAc-гексаны), получая Соединение 1 (90 мг).

Соединение 1 (90 мг, 173 мкмоль) объединяют с MeCN (1 мл) и 4 н раствором HCl в диоксане (0,3 мл) и перемешивают в течение 10 минут, затем концентрируют при пониженном давлении, получая Соединение (2).
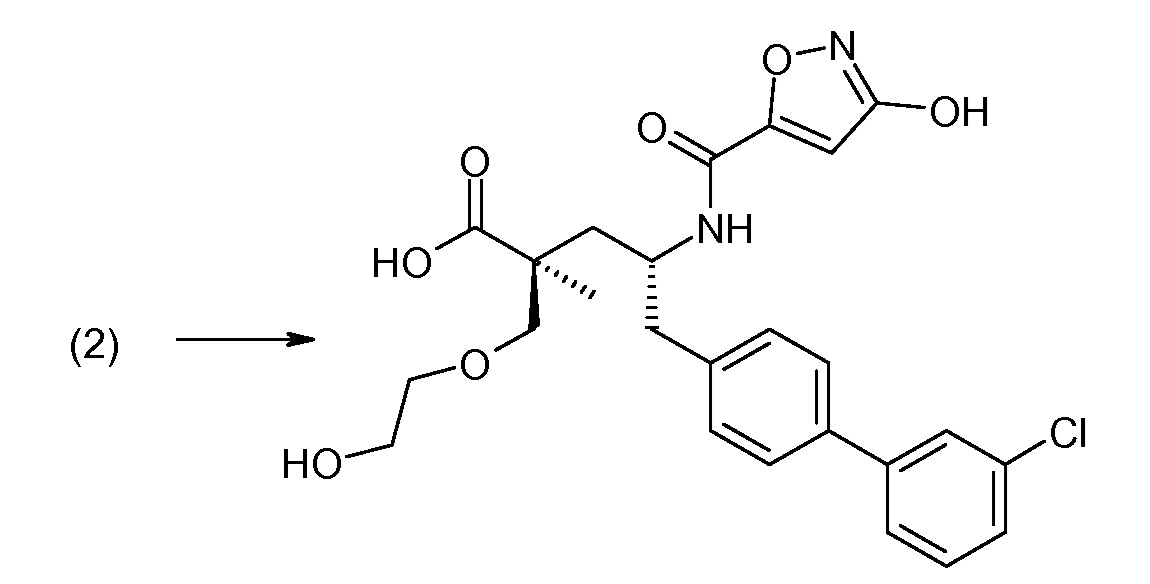
Соединение 2 (35 мг, 83 мкмоль), HATU (38,0 мг, 100 мкмоль), 3-гидроксиизоксазол-5-карбоновую кислоту (12,3 мг, 108 мкмоль) и ДМФА (0,5 мл) объединяют, потом добавляют DIPEA (43,7 мкл, 250 мкмоль). Полученную смесь перемешивают в течение 2 часов. Добавляют EtOAc, затем насыщенный водный раствор NH4Cl. Смесь затем концентрируют при пониженном давлении. Остаток объединяют с ТГФ (0,6 мл) и NaOH (326 мкл, 326 мкмоль) и несколькими каплями МеОН и перемешивают при температуре 60°С в течение 2 часов. Смесь потом концентрируют при пониженном давлении. Остаток растворяют в АсОН и очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение (8 мг).
MS m/z [M+H]+: рассчитано для С25Н27ClN2O7: 503,15; найдено: 503.
6М: (2S,4R)-5-(3'-хлорбифенил-4-ил)-2-этоксиметил-4-[(3-гидроксиизоксазол-5-карбонил)амино]-2-метилпентановая кислота
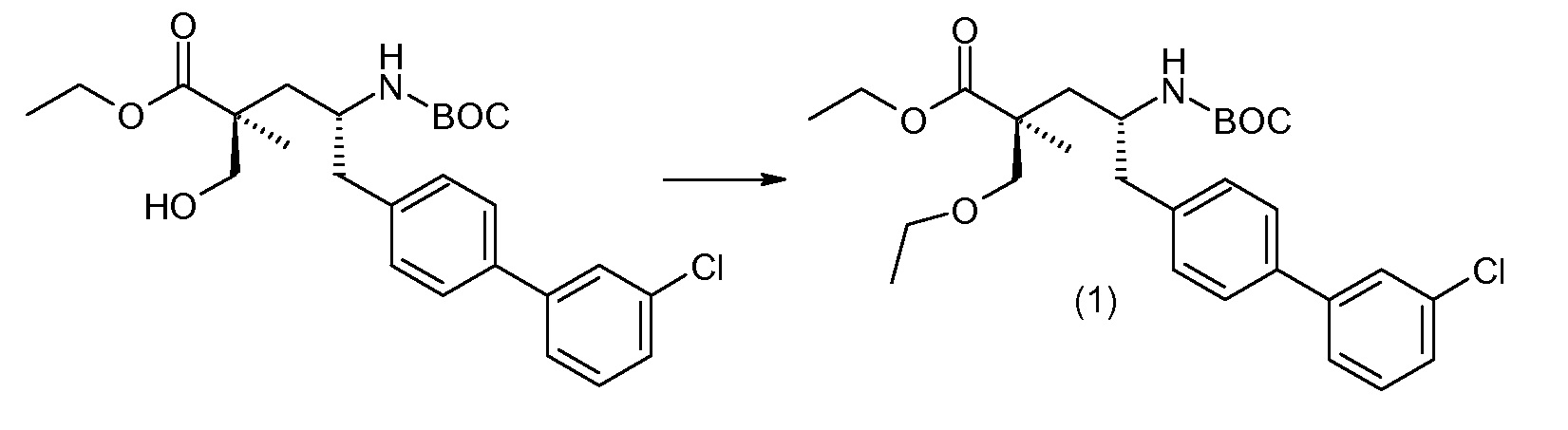
Этиловый эфир (2S,4R)-4-трет-бутоксикарбониламино-5-(3'-хлорбифенил-4-ил)-2-гидроксиметил-2-метилпентановой кислоты (415 мг, 840 мкмоль) и тетрабутиламмонийгидросульфат (57 мг, 168 мкмоль) объединяют с DCM (1 мл) и NaOH (588 мкл, 5,9 ммоль). Добавляют диэтилсульфат (518 мг, 3,4 ммоль) и реакционный сосуд герметично закрывают и энергично перемешивают в течение ночи. Смесь экстрагируют с помощью DCM и воды, затем очищают (хроматография с обычной фазой, 0-60%, EtOAc-гексаны), получая Соединение 1 (180 мг).

Соединение 1 (87 мг, 73 мкмоль) объединяют с MeCN (1 мл) и 4 н раствором HCl в диоксане (0,3 мл) и перемешивают в течение 10 минут, затем концентрируют при пониженном давлении, получая Соединение (2).

Соединение 2 (33,7 мг, 83 мкмоль), HATU (38,0 мг, 100 мкмоль), 3-гидроксиизоксазол-5-карбоновую кислоту (12,3 мг, 108 мкмоль) и ДМФА (0,5 мл) объединяют, потом добавляют DIPEA (43,7 мкл, 250 мкмоль). Полученную смесь перемешивают в течение 2 часов. Добавляют EtOAc, затем насыщенный водный раствор NH4Cl. Смесь затем концентрируют при пониженном давлении. Остаток объединяют с ТГФ (0,6 мл) и NaOH (326 мкл, 326 мкмоль) и несколькими каплями МеОН и перемешивают при температуре 60°С в течение 2 часов. Смесь потом концентрируют при пониженном давлении. Остаток растворяют в АсОН и очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение (8 мг).
MS m/z [M+H]+: рассчитано для С25Н27ClN2O6: 487,16; найдено: 486,9.
6N: (2S,4R)-5-(5'-хлор-2'-фторбифенил-4-ил)-2-этоксиметил-4-[(3-гидроксиизоксазол-5-карбонил)амино]-2-метилпентановая кислота

Бензиловый эфир (2S,4R)-4-трет-бутоксикарбониламино-5-(5'-хлор-2'-фторбифенил-4-ил)-2-этоксиметил-2-метилпентановой кислоты (720 мг, 1,2 ммоль) объединяют с MeCN (6 мл), затем добавляют 4 н раствор HCl в диоксане (5 мл). Полученную смесь перемешивают в течение 10 минут, затем концентрируют при пониженном давлении, получая Соединение 1.

3-Гидроксиизоксазол-5-карбоновую кислоту (53,3 мг, 413 мкмоль) объединяют с HATU (157 мг, 413 мкмоль) и ДМФА (0,5 мл), и полученную смесь перемешивают в течение 20 минут. Добавляют N-этил-N-изопропилпропан-2-амин (1 экв.) и полученную смесь перемешивают в течение 1 минуты. Затем добавляют Соединение 1 (100 мг, 207 мкмоль), предварительно растворенное в ДМФА (2 мл), и DIPEA (108 мкл, 620 мкмоль) и полученную смесь перемешивают в течение ночи, потом концентрируют при пониженном давлении. Этот продукт затем очищают с помощью хроматографии с обычной фазой (40% EtOAc/гексаны), получая Соединение 2 (90 мг).
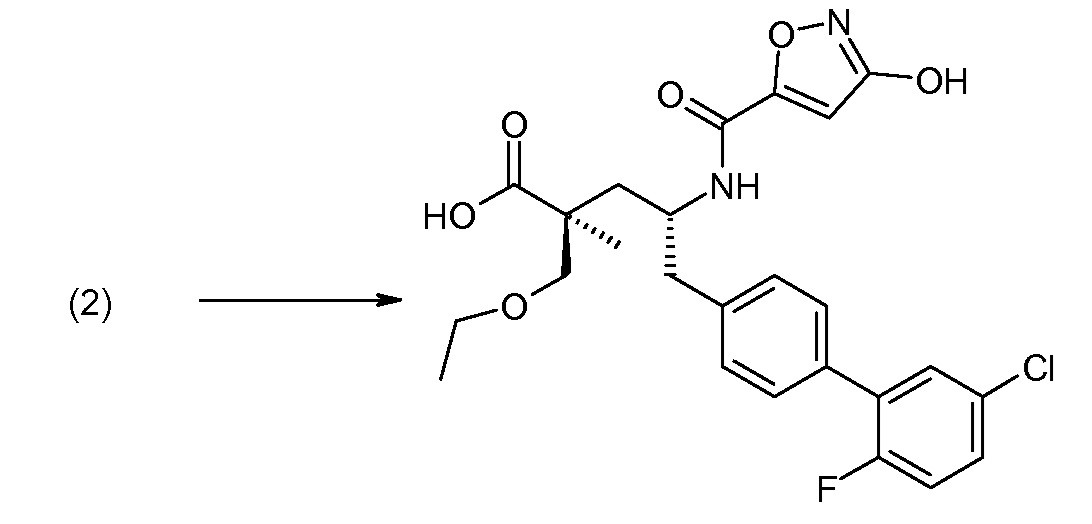
Соединение 2 (90 мг, 151 мкмоль) объединяют с палладием-на-угле (16,1 мг, 30 мкмоль), растворенным в EtOAc (1 мл) и АсОН (1 мл). Полученный раствор дегазируют в вакууме и продувают водородом. Раствор перемешивают в течение 2 часов. Водород удаляют и раствор продувают азотом. Раствор отфильтровывают, избыток растворителя удаляют из фильтрата и остаток очищают с помощью хроматографии с обращенными фазами, получая указанное в заголовке соединение (60 мг).
MS m/z [M+H]+: рассчитано для С25Н26ClFN2O6: 505,15; найдено: 505.
6О: (2S,4R)-5-(5'-хлор-2'-фторбифенил-4-ил)-2-этоксиметил-4-[(3-этилизоксазол-5-карбонил)амино]-2-метилпентановая кислота

(2S,4R)-4-трет-бутоксикарбониламино-5-(5'-хлор-2'-фторбифенил-4-ил)-2-этоксиметил-2-метилпентановую кислоту (220 мг, 445 мкмоль) объединяют с MeCN (5 мл), затем добавляют 4 н раствор HCl в диоксане (4 мл). Полученную смесь перемешивают в течение 10 минут, затем концентрируют при пониженном давлении, получая Соединение 1.

3-Этилизоксазол-5-карбоновую кислоту (6,0 мг, 42 мкмоль) объединяют с HATU (16,1 мг, 42 мкмоль) и ДМФА (0,5 мл) и полученную смесь перемешивают в течение 10 минут. Добавляют N-этил-N-изопропилпропан-2-амин (1 экв.) и полученную смесь перемешивают в течение 1 минуты. Затем добавляют Соединение 1 (20 мг, 51 мкмоль), предварительно растворенное в ДМФА (0,5 мл), и DIPEA (22,2 мкл, 127 мкмоль) и полученную смесь перемешивают в течение 30 минут. Смесь потом концентрируют при пониженном давлении, удаляют примерно половину растворителя. К остатку добавляют АсОН и вещество очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение (2,5 мг).
MS m/z [M+H]+: рассчитано для С27Н30ClFN2O5: 517,18; найдено: 518,2.
Следуя методикам, описанным в предыдущих примерах, и заменяя соответствующие исходные вещества и реагенты, также могут быть получены следующие соединения.
6Р: (2S,4R)-5-(5'-хлор-2'-фторбифенил-4-ил)-4-[(3-гидроксиизоксазол-5-карбонил)амино]-2-гидроксиметил-2-метилпентановая кислота
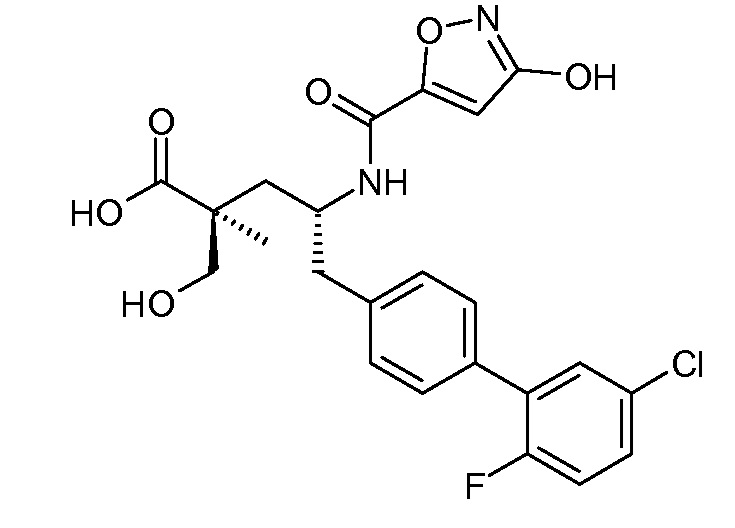
6Q: (2S,4R)-5-(5'-хлор-2'-фторбифенил-4-ил)-4-[(3-этилизоксазол-5-карбонил)амино]-2-метоксиметил-2-метилпентановая кислота
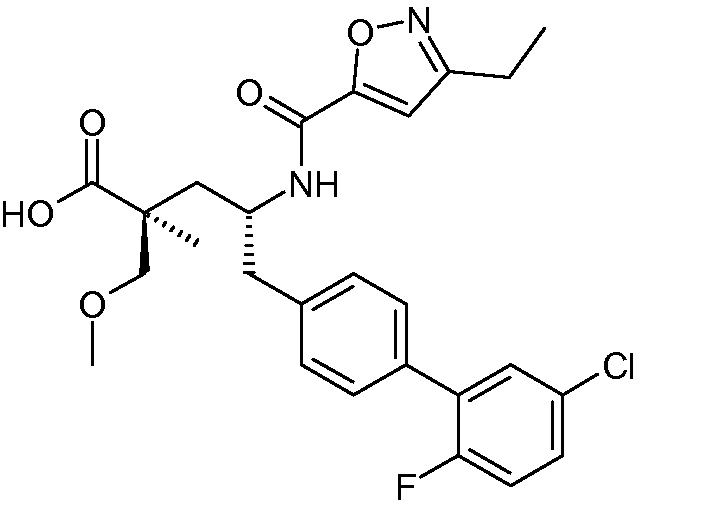
Пример 7
7А: (2S,4R)-5-(3'-хлорбифенил-4-ил)-4-[(5-этокси-1Н-пиразол-3-карбонил)амино]-2-гидроксиметил-2-метилпентановая кислота

5-Этокси-1Н-пиразол-3-карбоновую кислоту (10 мг, 32 мкмоль) объединяют с HATU (12 мг, 32 мкмоль) в ДМФА (0,2 мл) и полученную смесь перемешивают в течение 5 минут. Добавляют DIPEA (17 мкл, 96 мкмоль) и (2S,4R)-4-амино-5-(3'-хлорбифенил-4-ил)-2-гидроксиметил-2-метилпентановую кислоту (79 мг, 38 мкмоль), предварительно растворенную в ДМФА и полученную смесь перемешивают в течение 15 минут, затем концентрируют. Остаток растворяют в АсОН и очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение в виде ТФУК-соли (1 мг).
MS m/z [M+H]+: рассчитано для С25Н28ClN3O5: 486,17; найдено: 486,2.
7В: (2S,4R)-5-(5'-хлор-2'-фторбифенил-4-ил)-4-[(5-этокси-1Н-пиразол-3-карбонил)амино]-2-гидроксиметил-2-метилпентановая кислота
5-Этокси-1Н-пиразол-3-карбоновую кислоту (8,5 мг, 55 мкмоль) объединяют с HATU (21 мг, 55 мкмоль) в ДМФА (0,3 мл) и полученную смесь перемешивают в течение 5 минут. Добавляют DIPEA (29 мкл, 164 мкмоль) и (2S,4R)-4-амино-5-(5'-хлор-2'-фторбифенил-4-ил)-2-гидроксиметил-2-метилпентановую кислоту (20 мг, 55 мкмоль), предварительно растворенную в ДМФА (0,5 мл), и полученную смесь перемешивают в течение 10 минут, затем концентрируют. Остаток растворяют в АсОН и очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение в виде ТФУК-соли (2 мг).
MS m/z [M+H]+: рассчитано для С25Н27ClFN3O5: 504,16; найдено: 503,9.
7С: (2S,4R)-5-(5'-хлор-2'-фторбифенил-4-ил)-2-гидроксиметил-4-[(5-изопропил-2Н-пиразол-3-карбонил)амино]-2-метилпентановая кислота
5-Изопропил-2Н-пиразол-3-карбоновую кислоту (8 мг, 55 мкмоль) и HATU (20,8 мг, 55 мкмоль) объединяют в ДМФА (0,2 мл) и выдерживают при комнатной температуре в течение 10 минут. Добавляют (2S,4R)-4-амино-5-(5'-хлор-2'-фторбифенил-4-ил)-2-гидроксиметил-2-метилпентановую кислоту (20 мг, 55 мкмоль) в ДМФА и DIPEA (28,6 мкл, 164 мкмоль), и полученную смесь перемешивают в течение 20 минут при комнатной температуре. Смесь концентрируют при пониженном давлении и остаток растворяют в АсОН, очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение в виде ТФУК-соли (2 мг).
MS m/z [M+H]+: рассчитано для С26Н29ClFN3O4: 502,18; найдено: 503,2.
7D: (2S,4R)-5-(5'-хлор-2'-фторбифенил-4-ил)-4-[(5-этокси-2Н-пиразол-3-карбонил)амино]-2-метоксиметил-2-метилпентановая кислота

Этиловый эфир (2S,4R)-5-(5'-хлор-2'-фторбифенил-4-ил)-4-[(5-этокси-2Н-пиразол-3-карбонил)амино]-2-метоксиметил-2-метилпентановой кислоты (11 мг) в ТГФ (1 мл) объединяют с 1 н раствором NaOH (0,3 мл) и полученную смесь перемешивают при температуре 60°С в течение 3 часов. Добавляют АсОН и продукт очищают (хроматография с обращенными фазами), получая указанное в заголовке соединение в виде ТФУК-соли (4 мг).
MS m/z [M+H]+: рассчитано для С26Н29ClFN3O5: 518,18; найдено: 518.
7Е: (2S,4R)-5-(5'-хлор-2'-фторбифенил-4-ил)-2-гидроксиметил-4-[(5-метокси-1Н-пиразол-3-карбонил)амино]-2-метилпентановая кислота

Этиловый эфир (2S,4R)-4-амино-5-(5'-хлор-2'-фторбифенил-4-ил)-2-гидроксиметил-2-метилпентановой кислоты (30 мг, 76 мкмоль), HATU (29,0 мг, 0,076 ммоль) и DIPEA (39,9 мкл, 0,228 ммоль) объединяют с 1Н-[1,2,4]триазол-3-карбоновой кислотой (8,61 мг, 0,076 ммоль) в ДМФА (0,5 мл). Полученную смесь перемешивают в течение 2 часов, затем концентрируют при пониженном давлении. Остаток объединяют с ТГФ (1 мл) и NaOH (456 мкл, 456 мкмоль) и перемешивают в течение 2 суток при температуре 40°С. Реакционную смесь гасят с помощью АсОН и продукт очищают посредством препаративной ВЭЖХ, получая указанное в заголовке соединение в виде ТФУК-соли (16,4 мг).
MS m/z [M+H]+: рассчитано для С24Н25ClFN3O5: 490,15; найдено: 490,2.
7F: (2S,4R)-5-(5'-хлор-2'-фторбифенил-4-ил)-2-гидроксиметил-4-[(5-изобутил-2Н-пиразол-3-карбонил)амино]-2-метилпентановая кислота
5-Изобутил-2Н-пиразол-3-карбоновую кислоту (10,1 мг, 60 мкмоль) и HATU (22,9 мг, 60 мкмоль) объединяют, затем перемешивают в ДМФА (1 мл) в течение 15 минут при комнатной температуре. (2S,4R)-4-Амино-5-(5'-хлор-2'-фторбифенил-4-ил)-2-гидроксиметил-2-метилпентановую кислоту (20 мг, 55 мкмоль) и Et3N (38 мкл, 273 мкмоль) предварительно перемешивают вместе и затем добавляют к реакционному раствору. Полученную смесь перемешивают в течение 1 часа при комнатной температуре. Растворитель удаляют в вакууме и остаток очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение, в виде соли ТФУК (13,3 мг).
MS m/z [M+H]+: рассчитано для С27Н31ClFN3O4: 516,20; найдено: 516,2.
Пример 8
8А: (2S,4R)-4-[(5-ацетил-2Н-пиразол-3-карбонил)амино]-5-(5'-хлор-2'-фторбифенил-4-ил)-2-гидроксиметил-2-метилпентановая кислота
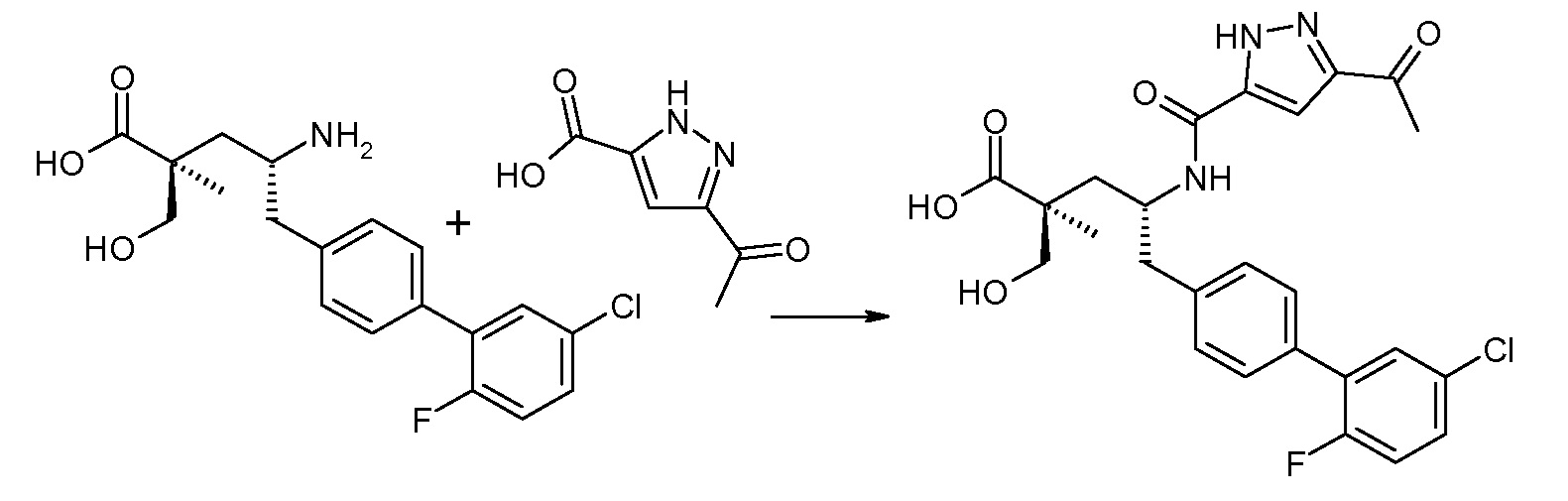
5-Ацетил-2Н-пиразол-3-карбоновую кислоту (8 мг, 55 мкмоль) и HATU (20,8 мг, 55 мкмоль) объединяют в ДМФА (0,2 мл) и выдерживают при комнатной температуре в течение 10 минут. Добавляют (2S,4R)-4-амино-5-(5'-хлор-2'-фторбифенил-4-ил)-2-гидроксиметил-2-метилпентановую кислоту (20 мг, 55 мкмоль) в ДМФА и DIPEA (28,6 мкл, 164 мкмоль) и полученную смесь перемешивают в течение 20 минут при комнатной температуре. Смесь концентрируют при пониженном давлении и остаток растворяют в АсОН, очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение в виде ТФУК-соли (2,1 мг).
MS m/z [M+H]+: рассчитано для С25Н25ClFN3O5: 502,15; найдено: 503,2.
8В: (2S,4R)-4-[(5-ацетил-2Н-пиразол-3-карбонил)амино]-5-(5'-хлор-2'-фторбифенил-4-ил)-2-метоксиметил-2-метилпентановая кислота

В пробирку вводят этиловый эфир (2S,4R)-4-трет-бутоксикарбониламино-5-(5'-хлор-2'-фторбифенил-4-ил)-2-гидроксиметил-2-метилпентановой кислоты (415 мг, 840 мкмоль), тетрабутиламмонийгидросульфат (57 мг, 168 мкмоль), DCM (1 мл) и NaOH (588 мкл, 5,9 ммоль), затем диэтилсульфат (518 мг, 3,4 ммоль). Реакционный сосуд закрывают, и энергично перемешивают в течение ночи. Смесь экстрагируют с помощью DCM и воды, очищают (хроматография с обычной фазой, 0-60%, EtOAc:гексаны), затем концентрируют при пониженном давлении, получая Соединение 1 (220 мг).
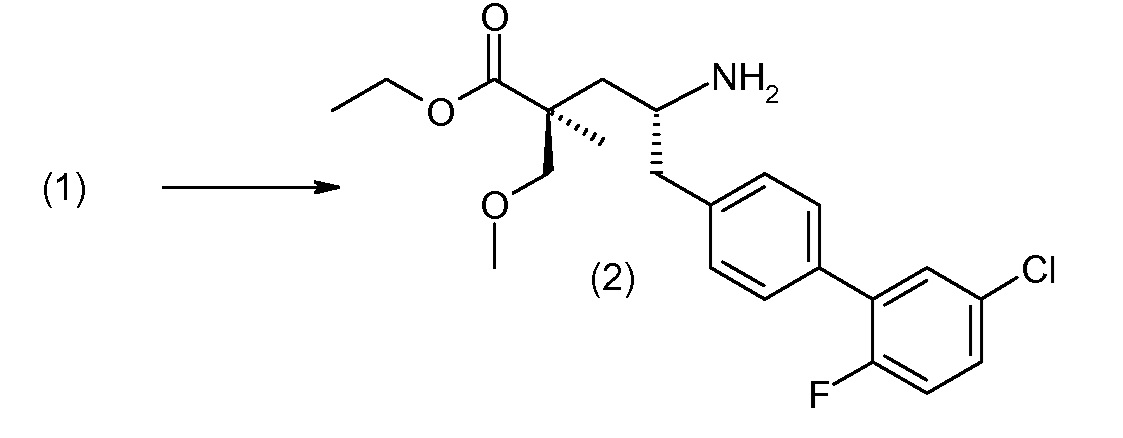
Соединение 1 (88 мг, 173 мкмоль) в MeCN (1 мл) объединяют с 4 н раствором HCl в диоксане (0,3 мл). Смесь перемешивают в течение 10 минут, затем концентрируют при пониженном давлении, получая Соединение 2.

Соединение 2 (10 мкг, 0,03 мкмоль) в ДМФА (0,5 мл) объединяют с HATU (11 мкг, 0,03 мкмоль) и 5-ацетил-2Н-пиразол-3-карбоновой кислотой (4 мкг, 0,03 мкмоль), и полученную смесь перемешивают в течение 5 минут. Добавляют DIPEA (0,01 мкл, 0,07 мкмоль) и смесь перемешивают в течение 20 минут. Растворитель выпаривают, получая Соединение 3, которое используют без дальнейшей очистки.

Соединение 3 (11 мг, 20 мкмоль) объединяют с ТГФ (1 мл) и 1 н раствором NaOH (0,3 мл). Полученную смесь перемешивают при температуре 60°С в течение 3 часов. Добавляют АсОН и продукт очищают с помощью ВЭЖХ с обращенными фазами, получая указанное в заголовке соединение в виде ТФУК-соли (2 мг).
MS m/z [M+H]+: рассчитано для С26Н27ClFN3O5: 516,16; найдено: 516.
8С: (2S,4R)-4-[(5-ацетил-1Н-пиразол-3-карбонил)амино]-5-(5'-хлор-2'-фторбифенил-4-ил)-2-этоксиметил-2-метилпентановая кислота
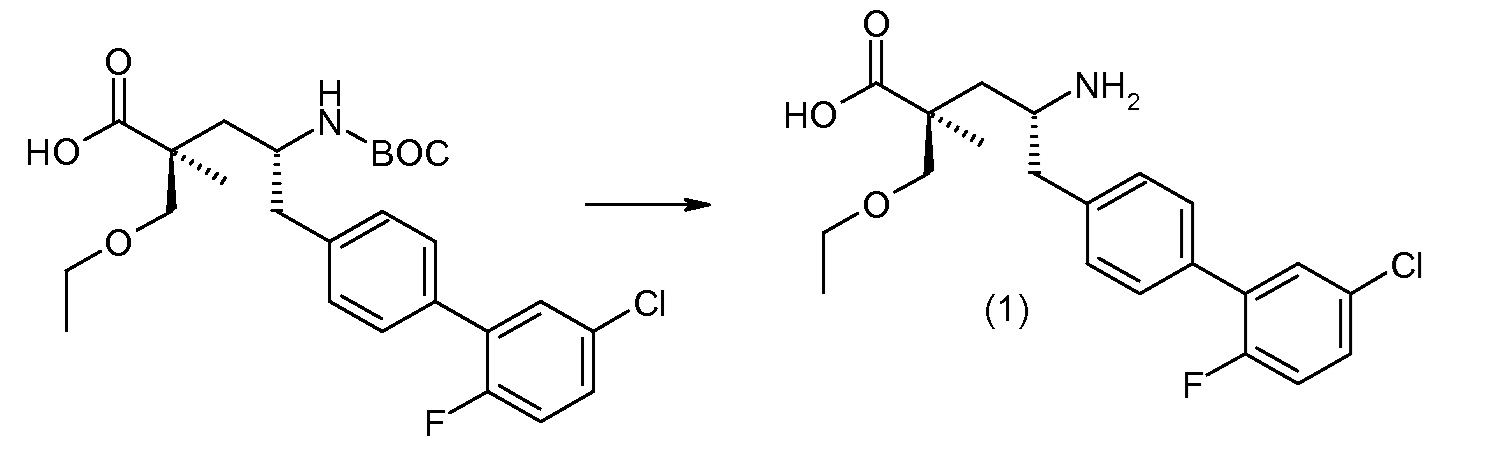
(2S,4R)-4-трет-бутоксикарбониламино-5-(5'-хлор-2'-фторбифенил-4-ил)-2-этоксиметил-2-метилпентановую кислоту (220 мг, 445 мкмоль) объединяют с MeCN (5 мл), затем добавляют 4 н раствор HCl в диоксане (4 мл). Полученную смесь перемешивают в течение 10 минут, затем концентрируют при пониженном давлении, получая Соединение 1.
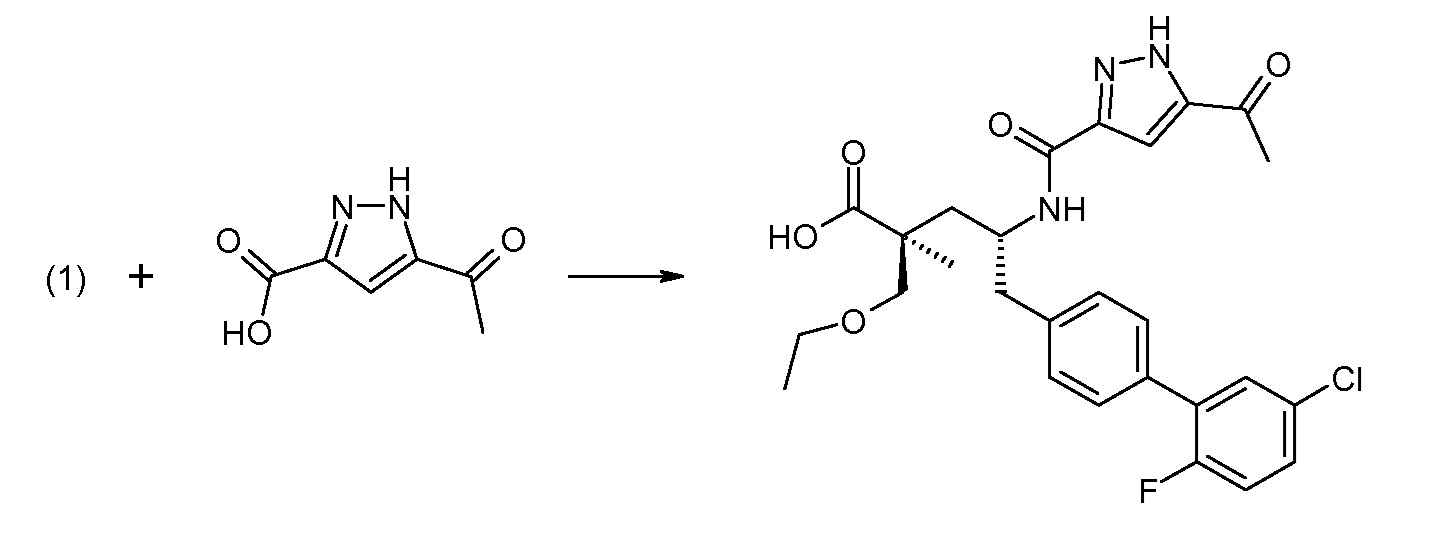
5-Ацетил-1Н-пиразол-3-карбоновую кислоту (6,5 мг, 42 мкмоль) объединяют с HATU (16,1 мг, 42 мкмоль) и ДМФА (0,5 мл), и полученную смесь перемешивают в течение 10 минут. Добавляют N-этил-N-изопропилпропан-2-амин (1 экв.) и полученную смесь перемешивают в течение 1 минуты. Затем добавляют Соединение 1 (20 мг, 51 мкмоль), предварительно растворенное в ДМФА (0,5 мл), и DIPEA (22,2 мкл, 127 мкмоль), полученную смесь перемешивают в течение 30 минут. Смесь потом концентрируют при пониженном давлении, удаляя примерно половину растворителя. К остатку добавляют АсОН и продукт очищают с помощью препаративной ВЭЖХ, получая указанное в заголовке соединение в виде ТФУК-соли (3,1 мг).
MS m/z [M+H]+: рассчитано для С27Н29ClFN3O5: 530,18; найдено: 531,2.
Анализ
Анализы in vitro для количественного определения ингибирующих активностей (IC50) в отношении человеческого и крысиного NEP и человеческого АСЕ
Ингибирующие активности соединений в отношении человеческого и крысиного неприлизина (ЕС 3.4.24.11; NEP) и человеческого ангиотензинконвертирующего фермента (АСЕ) определяли, используя нижеописанные анализы in vitro.
Получение NEP-активности из крысиных почек
Крысиный NEP получали из почек взрослых крыс Sprague Dawley. Целые почки промывали в забуференном фосфатом холодном солевом растворе (РВS) и вносили в охлажденный льдом буфер для лизиса (1% Triton X-114, 150 мМ NaCl, 50 мМ трис(гидроксиметил)-аминометана (Tris), рН=7,5; Bordier (1981), J. Biol. Chem., 256, 1604-1607) в отношении 5 мл буфера на каждый грамм почки. Образцы гомогенизировали на льду, используя ручной измельчитель ткани политрон. Гомогенаты центрифугировали при ускорении 1000×g в подвесном лопастном роторе в течение 5 минут при температуре 3°С. Осадок после центрифугирования ресуспендировали в 20 мл охлажденного льдом буфера для лизиса и инкубировали на льду в течение 30 минут. Образцы (15-20 мл) затем расслаивали в 25 мл охлажденного льдом амортизирующего буфера (6%масс/об. сахарозы, 50 мМ Tris с рН=7,5, 150 мМ NaCl, 0,06% Triton X-114), нагревали до 37°С в течение 3-5 минут и центрифугировали при ускорении 1000×g в подвесном лопастном роторе при комнатной температуре в течение 3 минут. Два верхних слоя аспирировали, оставляя вязкий маслянистый преципитат, содержащий обогащенную мембранную фракцию. Добавляли глицерин до концентрации 50% и образцы хранили при температуре -20°С. Концентрации белка количественно определяли, используя систему детектирования ВСА с бычьим сывороточным альбумином (BSA) в качестве стандарта.
Анализы в отношении ингибирования фермента
Рекомбинантный человеческий NEP и рекомбинантный человеческий АСЕ получали из коммерческих источников (R&D Systems, Minneapolis, MN, номера по каталогу 1182-ZN и 929-ZN, соответственно). Флуорогенный пептидный субстрат Mca-D-Arg-Arg-Leu-Dap-(Dnp)-OH (Medeiros и др. (1997), Braz. J. Med. Biol. Res., 30, 1157-62; Anaspec, San Jose, CA) и Abz-Phe-Arg-Lys(Dnp)-Pro-OH (Araujo и др. (2000), Biochemistry, 39, 8519-8525; Bachem, Torrance, CA) использовали при анализах в отношении NEP и АСЕ, соответственно.
Анализы осуществляли при использовании 384-луночных белых непрозрачных планшетов при температуре 37°С, используя флуорогенные пептидные субстраты при концентрации 10 мкМ в буфере для анализа (NEP: 50 мМ HEPES, pH=7,5, 100 мМ NaCl, 0,01% полиэтиленгликольсорбитанмонолаурата (Tween-20), 10 мкМ ZnSO4; АСЕ: 50 мМ HEPES, pH=7,5, 100 мМ NaCl, 0,01% Tween-20, 1 мкМ ZnSO4). Соответственные ферменты использовали в концентрациях, которые приводили к количественному протеолизу 1 мкМ субстрата спустя 20 минут при температуре 37°С.
Тестируемые соединения анализировали в диапазоне концентраций от 10 мкМ до 20 пМ. Тестируемые соединения добавляли к ферментам и инкубировали в течение 30 минут при температуре 37°С до инициирования реакции посредством добавления субстрата. Реакции заканчивали после 20 минут инкубации при температуре 37°С посредством добавления ледяной уксусной кислоты в конечной концентрации 3,6% (об/об).
Планшеты считывали на флуориметре при длине волны возбуждения и длине волны эмиссии, установленных при 320 нм и 405 нм, соответственно. Константы ингибирования получали путем нелинейной регрессии данных, используя уравнение (GraphPad Software, Inc., San Diego, CA):
ν=ν0/[1+(I/K')]
где ν означает скорость реакции, ν0 означает скорость неингибируемой реакции, I означает концентрацию ингибитора и K' означает кажущуюся константу ингибирования.
Соединение формулы I', где Ra и Rb означают Н, тестировали в случае этого анализа и найдено, что значение pKi в случае человеческого NEP составляет ≥9,0. Найдено, что следующие соединения имеют значения pKi в отношении человеческого NEP, как следует ниже:
Остающиеся соединения не тестировали (n.d.), так как в случае этого in vitro анализа активность не должна быть ожидаема, однако, базируясь на активности активных форм, полагают, что соответствующие пролекарства обладают in vivo активностью в отношении NEP.
Соединение формулы I', где Ra означает Н и Rb означает F (пример 3А), и соединение формулы I', где Ra означает F и Rb означает Н (пример 3В), оба были тестированы в случае этого анализа и найдено, что они имеют значение pKi в отношении человеческого NEP≥9,0. Базируясь на активности этих активных форм, полагают, что соответствующие пролекарственные формы соединений обладают in vivo активностью в отношении NEP.
Соединение формулы II, где Ra означает F, Rb означает Н, R2 означает Н, R7 означает Н (пример 4А), тестировали в случае этого анализа и найдено, что оно имеет значение pKi в отношении человеческого NEP≥9,0. Базируясь на активности этой активной формы, полагают, что соответствующие пролекарственные формы соединений обладают in vivo активностью в отношении NEP. Также найдено, что в отношении человеческого NEP соединения имеют значения pKi:
Соединение формулы IIIa, где Ra означает F, Rb означает Н, R2 означает Н и R7 означает Н (пример 5А), и соединение формулы IIIb, где Ra означает F, Rb означает Н, R2 означает Н и R7 означает Н (пример 5В), оба были тестированы в случае этого анализа и найдено, что они имеют значение pKi в отношении человеческого NEP≥9,0. Базируясь на активности этих активных форм, полагают, что соответствующие пролекарственные формы соединений обладают in vivo активностью в отношении NEP. В дополнение, также найдено, что в отношении человеческого NEP следующие соединения имеют значения pKi:
Соединение формулы V, где Ra означает Н, Rb означает Cl, R2 означает Н, R3 означает -ОСН3 и R7 означает Н (пример 6А), и соединение формулы V' (где Ra и Rb означают Н и R3 означает ОН; пример 6D) оба были тестированы в случае этого анализа и найдено, что они имеют значение pKi в отношении человеческого NEP≥9,0. Базируясь на активности этих активных форм, полагают, что соответствующие пролекарственные формы соединений обладают in vivo активностью в отношении NEP. В дополнение, также найдено, что в отношении человеческого NEP следующие соединения имеют значения pKi:
Остающиеся соединения либо не были тестированы, либо не проявили активность в случае этого in vitro анализа (n.d.), так как активность не должна быть ожидаема, однако, базируясь на активности активных форм, полагают, что эти соответствующие пролекарства обладают in vivo активностью в отношении NEP.
Соединения формулы VI тестировали в случае этого анализа и найдено, что они имеют значения pKi в отношении человеческого NEP, как следует ниже:
Базируясь на активности этих активных форм, полагают, что соответствующие пролекарственные формы соединений обладают in vivo активностью в отношении NEP.
Соединения формулы VII тестировали в случае этого анализа и найдено, что они имеют значения pKi в отношении человеческого NEP, как следует ниже:
Базируясь на активности этой активной формы, полагают, что соответствующие пролекарственные формы соединений обладают in vivo активностью в отношении NEP.
Тогда как настоящее изобретение описано относительно его конкретных аспектов или воплощений, квалифицированному специалисту в данной области должно быть понятно, что могут быть произведены различные изменения или могут быть использованы замены эквивалентами, не выходя за пределы сущности и объема изобретения. Дополнительно, в пределах, позволяемых правовыми патентными законодательствами и регламентированиями порядка выдачи патентов, все публикации, патенты и заявки на патенты, цитированные в данном контексте, таким образом, включены путем ссылки во всей их полноте в том же самом объеме, как если каждый документ индивидуально включен в данный контекст путем ссылки.
Реферат
Изобретение относится к соединению формулы IIa или IIbв которых a) Rи Rозначают H; и Rозначает H; и Rозначает -CHCFCHили -CHCFCF; или Rозначает -Cалкил или -C(O)-Cалкил и Rозначает H; или b) Rвыбирают из -CH, -OCHи Cl и Rозначает H; или Rвыбирают из H, -CH, Cl и F и Rозначает Cl; или Rозначает H и Rвыбирают из -CHи -CN; и Rвыбирают из -Cалкила и -(CH)OH и Rвыбирают из H и -Cалкила; или c) Rозначает H и Rозначает F; или Rозначает F и Rозначает H; Rвыбирают из -Cалкила и -(CH)OН; и Rвыбирают из H и -Cалкила. Изобретение также относится к соединению формулы III, соединению формулы V, к индивидуальному соединению, к соединению формулы VIa или VIb, к соединению формулы VIIa или VIIb, к фармацевтической композиции, обладающей способностью ингибировать активность неприлизина ((NEP), к применению соединения. Технический результат: получены новые соединения, обладающие способностью ингибировать активность неприлизина (NEP) и которые могут найти применение при лечении гипертензии, сердечной недостаточности или заболевания почек. 8 н. и 5 з.п. ф-лы, 8 пр.
Формула

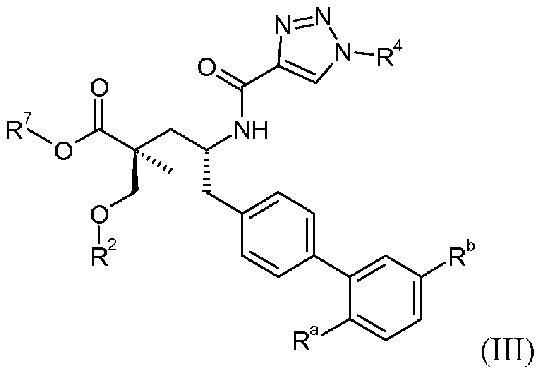
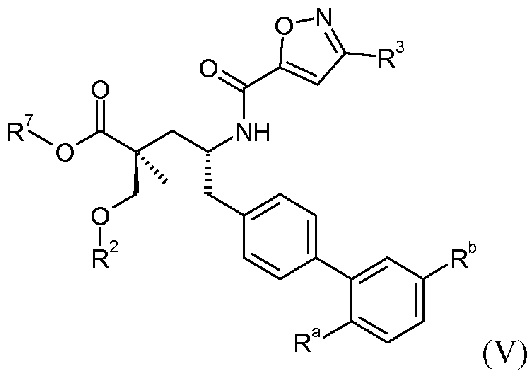



Комментарии