Конденсированное с гетерокольцом имидазольное производное, обладающее активирующим амрк действием - RU2635662C2
Код документа: RU2635662C2
Описание
Область изобретения
Настоящее изобретение относится к соединению, которое обладает активирующим аденозинмонофосфат-активированную протеинкиназу (здесь и далее указываемую как AMPK) действием и которое может быть использовано в качестве лекарственного средства.
Предпосылки изобретения
AMPK является серин-треонинкиназой, которая активирована AMP и состоит из трех субъединиц, α, β и γ. Для каждой субъединицы существуют разные изоформы (α1, α2, β1, β2, γ1, γ2 и γ3).
AMPK вовлечена в различные физиологические функции, такие как супрессия глюконеогенеза и ингибирование синтеза жирных кислот в печени и включения сахаров, и увеличение окисления жирных кислот в скелетных мышцах, в качестве датчика энергии в живых организмах, и привлекла к себе внимание в качестве молекулы-мишени для терапевтического агента при лечении диабета. Таким образом, предполагается, что активатор AMPK является эффективным при лечении диабета в качестве лекарственного средства, усиливающего резистентность инсулина, которое обладает инсулиннезависимым гипогликемическим эффектом и улучшающим липидный обмен действием (непатентный документ 1).
В патентных документах 1-4 описаны различные соединения, обладающие активирующим AMPK действием; однако конденсированное с гетерокольцом имидазольное производное, подобное соединению по настоящему изобретению, не было раскрыто ни в одном из документов.
В патентном документе 5 описаны следующие производные имидазопиридина, обладающие высокой активностью при обработке листьев в качестве гербицидов.
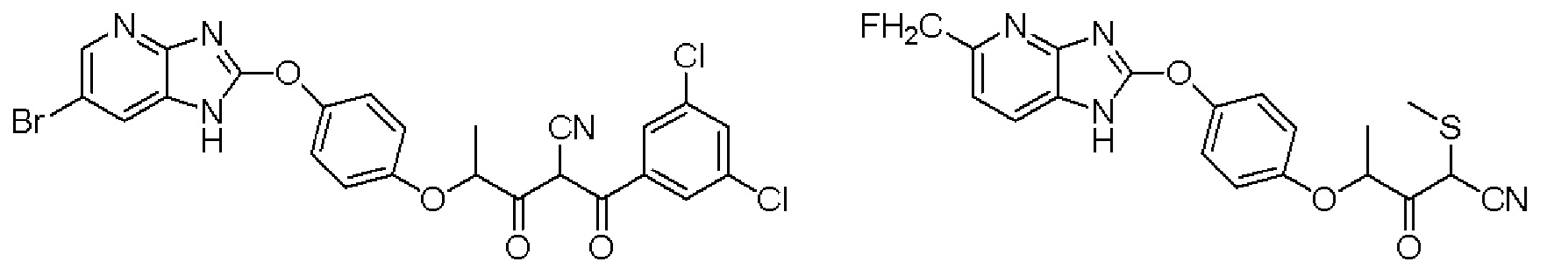
Однако в патентном документе 5 эффект активирования AMPK не описан.
Документ предшествующего уровня техники
Патентный документ
Патентный документ 1: WO2010/036613
Патентный документ 2: WO2010/047982
Патентный документ 3: WO2010/051176
Патентный документ 4: WO2010/051206
Патентный документ 5: JP05-339224
[Непатентный документ]
Непатентный документ 1: Cell Metabolism Vol. 9, Issue 5, 407-416, 2009
Раскрытие изобретения
Задачи, решаемые изобретением
Настоящее изобретение касается полезного активатора AMPK.
Средства для решения проблемы
Авторы настоящего изобретения провели интенсивные исследования синтеза превосходных соединений, обладающих активирующим AMPK действием.
Таким образом, настоящее изобретение относится к следующему.
[1]
Соединение, представленное формулой (I):

его фармацевтически приемлемая соль или сольват,
где
группа, представленная формулой:

является группой, представленной формулой:

R1, в каждом случае независимо, представляет собой галоген, гидрокси, циано, нитро, карбокси, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный гетероциклил, замещенный или незамещенный алкилокси, замещенный или незамещенный арилокси, замещенный или незамещенный гетероарилокси, замещенный или незамещенный циклоалкилокси, замещенный или незамещенный циклоалкенилокси, замещенный или незамещенный гетероциклилокси, замещенный или незамещенный алкилтио, замещенный или незамещенный арилтио, замещенный или незамещенный гетероарилтио, замещенный или незамещенный циклоалкилтио, замещенный или незамещенный циклоалкенилтио, замещенный или незамещенный гетероциклилтио, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный арилсульфонил, замещенный или незамещенный гетероарилсульфонил, замещенный или незамещенный циклоалкилсульфонил, замещенный или незамещенный циклоалкенилсульфонил, замещенный или незамещенный гетероциклилсульфонил, замещенный или незамещенный ацил, замещенный или незамещенный карбамоил, замещенный или незамещенный сульфамоил или замещенный или незамещенный амино;
m равно целому числу от 0 до 3;
R2 представляет собой водород или замещенный или незамещенный алкил;
X представляет собой -O-; и
Y представляет собой замещенный или незамещенный арил, или замещенный или незамещенный гетероарил; при условии, что исключены соединения, показанные далее:

[2]
Соединение в соответствии с вышеуказанным [1], его фармацевтически приемлемая соль или сольват, где Y представляет собой

где R4 является группой, представленной формулой -(CR6R7)q-Z;
R6, в каждом случае независимо, представляет собой водород, гидрокси, замещенный или незамещенный алкил или замещенный или незамещенный амино;
R7, в каждом случае независимо, представляет собой водород, гидрокси, замещенный или незамещенный алкил или замещенный или незамещенный амино;
q равно целому числу от 0 до 4;
Z представляет собой
(1) -COOH,
(2) -COOR8,
(3) -OH,
(4) -C(=O)-NR9R10,
(5) -NR9-C(=O)-R11,
(6) -NR9-SO2-R8,
(7) -SO2-NR9R10,
(8) -SO2-NR9-C(=O)-R8,
(9) -SO2-NR9-COOR8,
(10) -SO2-NR9-C(=O)-NR9R10,
(11) -C(=O)-NR9-SO2-R8,
(12) -NR9-C(=O)-NR9R10,
(13) -P(=O)(-OH)2,
(14) -P(=O)H(-OH),
(15) -P(=O)(-R11)2,
(16) -P(=O)(-OR11)2,
(17) -P(=O)(-OH)(-R11),
(18) -P(=O)(-OH)(-OR11),
(19) -P(=O)(-R11)(-OR11),
(20) -P(=O)(-OH)(-O-(CR6R7)0-4-R12),
(21) -P(=O)(-NR9-CR13R14-COOH)2,
(22) -P(=O)(-NR9-CR13R14-COOR11)2,
(23) -P(=O)(-OH)(-NR9-CR13R14-COOH),
(24) -P(=O)(-OH)(-NR9-CR13R14-COOR11),
(25) -P(=O)(-NR9-CR13R14-COOR11)(-O-R8),
(26) -P(=O)(-O-CR13R14-O-C(=O)-R11)2,
(27) -P(=O)(-OH)(-O-CR13R14-O-C(=O)-R11),
(28) -P(=O)(-OH)(-O-(CR6R7)1-4-S(=O)-R11),
(29) -P(=O)(-O-(CR6R7)1-4-S(=O)-R11)2,
(30) -P(=O)(-OH)(-O-(CR6R7)1-4-S-C(=O)-R11),
(31) -P(=O)(-O-(CR6R7)1-4-S-C(=O)-R11)2,
(32) -NR9-C(=O)-O-R11
или
(33)

R8 представляет собой замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил или замещенный или незамещенный гетероциклил;
R9 и R10, каждый независимо, представляют собой водород или замещенный или незамещенный алкил;
R11 и R12, каждый независимо, представляют собой замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил или замещенный или незамещенный гетероциклил;
R13 и R14, каждый независимо, представляют собой водород или замещенный или незамещенный алкил;
R15 и R16, каждый независимо, представляют собой -O- или -NH-;
R17 представляет собой замещенный или незамещенный арил, или замещенный или незамещенный гетероарил;
R5 представляет собой галоген, гидрокси, циано, нитро, карбокси, замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный гетероциклил, замещенный или незамещенный алкилокси, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный карбамоил или замещенный или незамещенный амино; и
p равно целому числу от 0 до 2.
[3]
Соединение в соответствии с вышеуказанным [2], его фармацевтически приемлемая соль или сольват, где q равно 1.
[4]
Соединение в соответствии с вышеуказанным [3], его фармацевтически приемлемая соль или сольват, где R6 и R7, каждый независимо, представляют собой замещенный или незамещенный алкил.
[5]
Соединение в соответствии с любым из вышеуказанных [2]-[4], его фармацевтически приемлемая соль или сольват, где Z представляет собой -NR9-C(=O)-R11.
[6]
Соединение в соответствии с любым из вышеуказанных [1]-[5], его фармацевтически приемлемая соль или сольват, где группа, представленная формулой:

является группой, представленной формулой:

R1 имеет те же значения, что указаны выше в [1]; n равно целому числу от 0 до 2; и R1X представляет собой галоген.
[7]
Соединение в соответствии с любым из вышеуказанных [1]-[6], его фармацевтически приемлемая соль или сольват, где m равно целому числу от 1 до 3 или n равно 1 или 2; и по меньшей мере один из R1 представляет собой замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил или замещенный или незамещенный гетероциклил.
[8]
Соединение в соответствии с любым из вышеуказанных [1]-[7], его фармацевтически приемлемая соль или сольват, где m равно целому числу от 1 до 3 или n равно 1 или 2; и по меньшей мере один из R1 представляет собой замещенный или незамещенный арил.
[9]
Соединение в соответствии с любым из вышеуказанных [1]-[8], его фармацевтически приемлемая соль или сольват, где группа, представленная формулой:

является группой, представленной формулой:

R1 представляет собой замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил или замещенный или незамещенный гетероциклил; и R1Xпредставляет собой галоген.
[10]
Соединение в соответствии с вышеуказанным [9], его фармацевтически приемлемая соль или сольват, где R1 представляет собой замещенный или незамещенный арил.
[11]
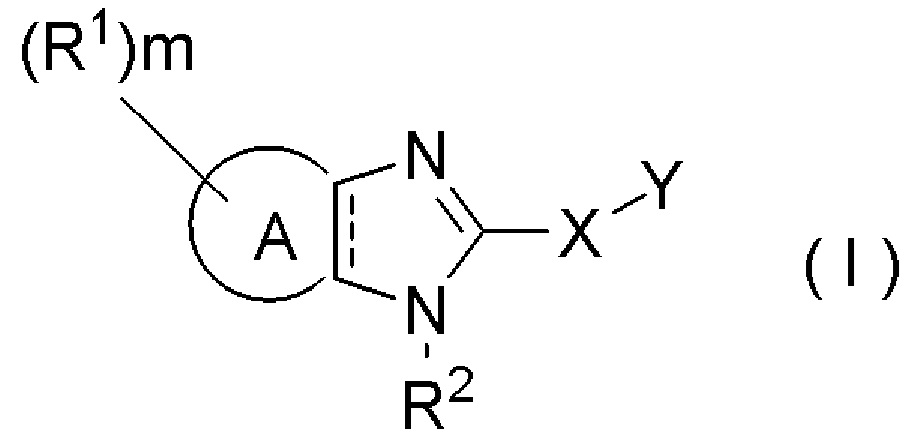
Фармацевтическая композиция, обладающая активирующим действием на аденозинмонофосфат-активированную протеинкиназу, которая содержит соединение, представленное формулой (I):

его фармацевтически приемлемую соль или сольват,
где
кольцо A представляет собой ароматический гетероцикл или неароматический гетероцикл;
пунктирная линия показывает наличие или отсутствие связи;
R1, в каждом случае независимо, представляет собой галоген, гидрокси, циано, нитро, карбокси, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный гетероциклил, замещенный или незамещенный алкилокси, замещенный или незамещенный арилокси, замещенный или незамещенный гетероарилокси, замещенный или незамещенный циклоалкилокси, замещенный или незамещенный циклоалкенилокси, замещенный или незамещенный гетероциклилокси, замещенный или незамещенный алкилтио, замещенный или незамещенный арилтио, замещенный или незамещенный гетероарилтио, замещенный или незамещенный циклоалкилтио, замещенный или незамещенный циклоалкенилтио, замещенный или незамещенный гетероциклилтио, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный арилсульфонил, замещенный или незамещенный гетероарилсульфонил, замещенный или незамещенный циклоалкилсульфонил, замещенный или незамещенный циклоалкенилсульфонил, замещенный или незамещенный гетероциклилсульфонил, замещенный или незамещенный ацил, замещенный или незамещенный карбамоил, замещенный или незамещенный сульфамоил или замещенный или незамещенный амино;
m равно целому числу от 0 до 7;
R2 представляет собой водород или замещенный или незамещенный алкил;
X представляет собой одинарную связь, -S-, -O-, -NR3-, -C(=O)-, -NR3C(=O)-, -C(=O)NR3-, -NR3-SO2-, -SO2-NR3- или -C(=O)-O-;
R3 представляет собой водород или замещенный или незамещенный алкил; и
Y представляет собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил или замещенный или незамещенный гетероциклил.
[12]
Фармацевтическая композиция в соответствии с вышеуказанным [11], где в формуле (I)
группа, представленная формулой:

является группой, представленной формулой:


R1 имеет те же значения, что указаны выше в [11], m равно целому числу от 0 до 3;
R1a, в каждом случае независимо, представляет собой водород, галоген, гидрокси, циано, нитро, карбокси, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный гетероциклил, замещенный или незамещенный алкилокси, замещенный или незамещенный арилокси, замещенный или незамещенный гетероарилокси, замещенный или незамещенный циклоалкилокси, замещенный или незамещенный циклоалкенилокси, замещенный или незамещенный гетероциклилокси, замещенный или незамещенный алкилтио, замещенный или незамещенный арилтио, замещенный или незамещенный гетероарилтио, замещенный или незамещенный циклоалкилтио, замещенный или незамещенный циклоалкенилтио, замещенный или незамещенный гетероциклилтио, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный арилсульфонил, замещенный или незамещенный гетероарилсульфонил, замещенный или незамещенный циклоалкилсульфонил, замещенный или незамещенный циклоалкенилсульфонил, замещенный или незамещенный гетероциклилсульфонил, замещенный или незамещенный ацил, замещенный или незамещенный карбамоил, замещенный или незамещенный сульфамоил, или замещенный или незамещенный амино; и
n равно целому числу от 0 до 6.
[13]
Фармацевтическая композиция в соответствии с вышеуказанным [12], где в формуле (I)
группа, представленная формулой:

является группой, представленной формулой:

R1 и m имеют те же значения, что указаны выше в [12].
[14]
Фармацевтическая композиция в соответствии с любым из вышеуказанных [11]-[13], где X представляет собой одинарную связь, -S-, -O- или -NR3-.
[15]
Фармацевтическая композиция в соответствии с вышеуказанным [14], где X представляет собой -S- или -O-.
[16]
Фармацевтическая композиция в соответствии с вышеуказанным [15], где X представляет собой -O-.
[17]
Фармацевтическая композиция в соответствии с любым из вышеуказанных [11]-[16], где Y представляет собой замещенный или незамещенный арил, или замещенный или незамещенный гетероарил.
[18]
Фармацевтическая композиция в соответствии с вышеуказанным [17], где Y представляет собой замещенный или незамещенный арил.
[19]
Фармацевтическая композиция в соответствии с вышеуказанным [17], где Y представляет собой
группу, представленную формулой:

R4 является группой, представленной формулой: -(CR6R7)q-Z;
R6, в каждом случае независимо, представляет собой водород, гидрокси, замещенный или незамещенный алкил или замещенный или незамещенный амино;
R7, в каждом случае независимо, представляет собой водород, гидрокси, замещенный или незамещенный алкил или замещенный или незамещенный амино;
q равно целому числу от 0 до 4;
Z представляет собой
(1) -COOH,
(2) -COOR8,
(3) -OH,
(4) -C(=O)-NR9R10,
(5) -NR9-C(=O)-R11,
(6) -NR9-SO2-R8,
(7) -SO2-NR9R10,
(8) -SO2-NR9-C(=O)-R8,
(9) -SO2-NR9-COOR8,
(10) -SO2-NR9-C(=O)-NR9R10,
(11) -C(=O)-NR9-SO2-R8,
(12) -NR9-C(=O)-NR9R10,
(13) -P(=O)(-OH)2,
(14) -P(=O)H(-OH),
(15) -P(=O)(-R11)2,
(16) -P(=O)(-OR11)2,
(17) -P(=O)(-OH)(-R11),
(18) -P(=O)(-OH)(-OR11),
(19) -P(=O)(-R11)(-OR11),
(20) -P(=O)(-OH)(-O-(CR6R7)0-4-R12),
(21) -P(=O)(-NR9-CR13R14-COOH)2,
(22) -P(=O)(-NR9-CR13R14-COOR11)2,
(23) -P(=O)(-OH)(-NR9-CR13R14-COOH),
(24) -P(=O)(-OH)(-NR9-CR13R14-COOR11),
(25) -P(=O)(-NR9-CR13R14-COOR11)(-O-R8),
(26) -P(=O)(-O-CR13R14-O-C(=O)-R11)2,
(27) -P(=O)(-OH)(-O-CR13R14-O-C(=O)-R11),
(28) -P(=O)(-OH)(-O-(CR6R7)1-4-S(=O)-R11),
(29) -P(=O)(-O-(CR6R7)1-4-S(=O)-R11)2,
(30) -P(=O)(-OH)(-O-(CR6R7)1-4-S-C(=O)-R11),
(31) -P(=O)(-O-(CR6R7)1-4-S-C(=O)-R11)2,
(32) -NR9-C(=O)-O-R11
или
(33)

R8 представляет собой замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил или замещенный или незамещенный гетероциклил;
R9 и R10, каждый независимо, представляют собой водород или замещенный или незамещенный алкил;
R11 и R12, каждый независимо, представляют собой замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил или замещенный или незамещенный гетероциклил;
R13 и R14, каждый независимо, представляют собой водород или замещенный или незамещенный алкил;
R15 и R16, каждый независимо, представляют собой -O- или -NH-;
R17 представляет собой замещенный или незамещенный арил, или замещенный или незамещенный гетероарил;
R5 представляет собой галоген, гидрокси, циано, нитро, карбокси, замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный гетероциклил, замещенный или незамещенный алкилокси, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный карбамоил, или замещенный или незамещенный амино; и
p равно целому числу от 0 до 2.
[20]
Фармацевтическая композиция в соответствии с любым из вышеуказанных [11]-[16], где Y представляет собой замещенный или незамещенный алкил.
[21]
Фармацевтическая композиция в соответствии с любым из вышеуказанных [11]-[16], где Y представляет собой замещенный или незамещенный алкил, где замещенный или незамещенный алкил является группой, представленной формулой: -(CR18R19)r-Z;
R18, в каждом случае независимо, представляет собой водород, галоген, гидрокси, циано, нитро, карбокси, замещенный или незамещенный алкил, замещенный или незамещенный алкилокси, замещенный или незамещенный алкилоксикарбонил, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный карбамоил или замещенный или незамещенный амино;
R19, в каждом случае независимо, представляет собой водород, галоген, гидрокси, циано, нитро, карбокси, замещенный или незамещенный алкил, замещенный или незамещенный алкилокси, замещенный или незамещенный алкилоксикарбонил, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный карбамоил или замещенный или незамещенный амино;
r равно целому числу от 1 до 4;
Z представляет собой
(1) -COOH,
(2) -COOR8,
(3) -OH,
(4) -C(=O)-NR9R10,
(5) -NR9-C(=O)-R11,
(6) -NR9-SO2-R8,
(7) -SO2-NR9R10,
(8) -SO2-NR9-C(=O)-R8,
(9) -SO2-NR9-COOR8,
(10) -SO2-NR9-C(=O)-NR9R10,
(11) -C(=O)-NR9-SO2-R8,
(12) -NR9-C(=O)-NR9R10,
(13) -P(=O)(-OH)2,
(14) -P(=O)H(-OH),
(15) -P(=O)(-R11)2,
(16) -P(=O)(-OR11)2,
(17) -P(=O)(-OH)(-R11),
(18) -P(=O)(-OH)(-OR11),
(19) -P(=O)(-R11)(-OR11),
(20) -P(=O)(-OH)(-O-(CR6R7)0-4-R12),
(21) -P(=O)(-NR9-CR13R14-COOH)2,
(22) -P(=O)(-NR9-CR13R14-COOR11)2,
(23) -P(=O)(-OH)(-NR9-CR13R14-COOH),
(24) -P(=O)(-OH)(-NR9-CR13R14-COOR11),
(25) -P(=O)(-NR9-CR13R14-COOR11)(-O-R8),
(26) -P(=O)(-O-CR13R14-O-C(=O)-R11)2,
(27) -P(=O)(-OH)(-O-CR13R14-O-C(=O)-R11),
(28) -P(=O)(-OH)(-O-(CR6R7)1-4-S(=O)-R11),
(29) -P(=O)(-O-(CR6R7)1-4-S(=O)-R11)2,
(30) -P(=O)(-OH)(-O-(CR6R7)1-4-S-C(=O)-R11),
(31) -P(=O)(-O-(CR6R7)1-4-S-C(=O)-R11)2,
(32) -NR9-C(=O)-O-R11
или
(33)

R6, в каждом случае независимо, представляет собой водород, гидрокси, замещенный или незамещенный алкил или замещенный или незамещенный амино;
R7, в каждом случае независимо, представляет собой водород, гидрокси, замещенный или незамещенный алкил или замещенный или незамещенный амино;
R8 представляет собой замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил или замещенный или незамещенный гетероциклил;
R9 и R10, каждый независимо, представляют собой водород или замещенный или незамещенный алкил;
R11 и R12, каждый независимо, представляют собой замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил или замещенный или незамещенный гетероциклил;
R13 и R14, каждый независимо, представляют собой водород или замещенный или незамещенный алкил;
R15 и R16, каждый независимо, представляют собой -O- или -NH-; и
R17 представляет собой замещенный или незамещенный арил, или замещенный или незамещенный гетероарил.
[22]
Фармацевтическая композиция в соответствии с любым из вышеуказанных [11]-[21], где m равно целому числу от 1 до 2, и по меньшей мере один из R1 представляет собой галоген.
[23]
Фармацевтическая композиция в соответствии с любым из вышеуказанных [11]-[22], где m равно целому числу от 1 до 2, и по меньшей мере один из R1 представляет собой замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил или замещенный или незамещенный гетероциклил.
[24]
Фармацевтическая композиция в соответствии с любым из вышеуказанных [11]-[23], где R2 представляет собой водород.
[25]
Фармацевтическая композиция в соответствии с вышеуказанным [11], где m равно 2;
один из R1 представляет собой галоген, и другой из R1 представляет собой замещенный или незамещенный арил;
R2 представляет собой водород;
X представляет собой -O-; и
Y представляет собой замещенный или незамещенный арил или замещенный или незамещенный гетероарил.
[26]
Фармацевтическая композиция, содержащая соединение в соответствии с любым из вышеуказанных [1]-[10], его фармацевтически приемлемая соль или сольват.
[27]
Фармацевтическая композиция в соответствии с вышеуказанным [26], которая обладает активирующим действием на аденозинмонофосфат-активированную протеинкиназу.
[28]
Фармацевтическая композиция в соответствии с любым из вышеуказанных [11]-[27] для лечения и/или предупреждения диабета.
[29]
Способ предупреждения или лечения диабета, включающий введение соединения в соответствии с любым из вышеуказанных [1]-[25], его фармацевтически приемлемая соли или сольвата.
[30]
Соединение в соответствии с любым из вышеуказанных [1]-[25], его фармацевтически приемлемая соль или сольват для лечения и/или предупреждения диабета.
Далее, настоящее изобретение относится к следующему.
[1A]
Соединение, представленное формулой (I):

его фармацевтически приемлемая соль или сольват,
где
группа, представленная формулой:

является группой, представленной формулой:

R1 представляет собой галоген, гидрокси, циано, нитро, карбокси, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный гетероциклил, замещенный или незамещенный алкилокси, замещенный или незамещенный арилокси, замещенный или незамещенный гетероарилокси, замещенный или незамещенный циклоалкилокси, замещенный или незамещенный циклоалкенилокси, замещенный или незамещенный гетероциклилокси, замещенный или незамещенный алкилтио, замещенный или незамещенный арилтио, замещенный или незамещенный гетероарилтио, замещенный или незамещенный циклоалкилтио, замещенный или незамещенный циклоалкенилтио, замещенный или незамещенный гетероциклилтио, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный арилсульфонил, замещенный или незамещенный гетероарилсульфонил, замещенный или незамещенный циклоалкилсульфонил, замещенный или незамещенный циклоалкенилсульфонил, замещенный или незамещенный гетероциклилсульфонил, замещенный или незамещенный ацил, замещенный или незамещенный карбамоил, замещенный или незамещенный сульфамоил или замещенный или незамещенный амино;
m равно целому числу от 0 до 3;
R2 представляет собой водород или замещенный или незамещенный алкил;
X представляет собой -O-; и
Y представляет собой замещенный или незамещенный арил, или замещенный или незамещенный гетероарил; при условии, что исключены соединения, показанные далее:

[2A]
Соединение в соответствии с вышеуказанным [1A], его фармацевтически приемлемая соль или сольват, где Y представляет собой

где R4 является группой, представленной формулой: -(CR6R7)q-Z;
R6 и R7, каждый независимо, представляют собой водород, гидрокси, замещенный или незамещенный алкил или замещенный или незамещенный амино;
q равно целому числу от 0 до 4;
Z представляет собой
(1) -COOH,
(2) -COOR8,
(3) -OH,
(4) -C(O)NHR9,
(5) -NHC(O)R11,
(6) -NHSO2R8,
(7) -SO2NHR9,
(8) -SO2NHC(O)R8,
(9) -SO2NHCOOR8,
(10) -SO2NHCONR9R10,
(11) -C(O)NHSO2R8,
(12) -NHC(O)NR9R10,
(13) -P(O)(OH)2,
(14) -P(O)H(OH),
(15) -P(O)(R11)2,
(16) -P(O)(OR11)2,
(17) -P(O)(OH)(R11),
(18) -P(O)(OH)(OR11),
(19) -P(O)(R11)(OR11),
(20) -P(O)(OH)(O-(CR6R7)0-4-R12),
(21) -P(O)(NR9CR13R14COOH)2,
(22) -P(O)(NR9CR13R14COOR11)2,
(23) -P(O)(OH)(NR9CR13R14COOH)2,
(24) -P(O)(OH)(NR9CR13R14COOR11),
(25) -P(O)(NR9CR13R14COOR11)(O-R8),
(26) -P(O)(OCR13R14OC(O)R11)2,
(27) -P(O)(OH)(OCR13R14OC(O)R11),
(28) -P(O)(OH)(-O-(CR6R7)1-4-S(O)R11),
(29) -P(O)(-O-(CR6R7)1-4-S(O)R11)2,
(30) -P(O)(OH)(-O-(CR6R7)1-4-SC(O)R11),
(31) -P(O)(-O-(CR6R7)1-4-SC(O)R11)2,
(32)

или
(33) -NHC(O)OR11;
R8 представляет собой замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил или замещенный или незамещенный гетероциклил;
R9 и R10, каждый независимо, представляют собой водород или замещенный или незамещенный алкил;
R11 и R12, каждый независимо, представляют собой замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил или замещенный или незамещенный гетероциклил;
R13 и R14, каждый независимо, представляют собой водород или замещенный или незамещенный алкил;
R15 и R16, каждый независимо, представляют собой -O- или -NH-;
R17 представляет собой замещенный или незамещенный арил или замещенный или незамещенный гетероарил;
R5 представляет собой галоген, гидрокси, циано, нитро, карбокси, замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный гетероциклил, замещенный или незамещенный алкилокси, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный карбамоил или замещенный или незамещенный амино; и
p равно целому числу от 0 до 2.
[3A]
Соединение в соответствии с вышеуказанным [2A], его фармацевтически приемлемая соль или сольват, где q равно 1.
[4A]
Соединение в соответствии с вышеуказанным [3A], его фармацевтически приемлемая соль или сольват, где R6 и R7, каждый независимо, представляют собой замещенный или незамещенный алкил.
[5A]
Соединение в соответствии с любым из вышеуказанных [2A]-[4A], его фармацевтически приемлемая соль или сольват, где Z представляет собой -NHC(O)R11.
[6A]
Соединение в соответствии с любым из вышеуказанных [1A]-[5A], его фармацевтически приемлемая соль или сольват, где группа, представленная формулой:

является группой, представленной формулой:

R1 имеет те же значения, что указаны выше в [1A], n равно целому числу от 0 до 2, и R1X представляет собой галоген.
[7A]
Соединение в соответствии с любым из вышеуказанных [1A]-[6A], его фармацевтически приемлемая соль или сольват, где m равно целому числу от 1 до 3 или n равно 1 или 2; и по меньшей мере один из R1 представляет собой замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил или замещенный или незамещенный гетероциклил.
[8A]
Соединение в соответствии с любым из вышеуказанных [1A]-[7A], его фармацевтически приемлемая соль или сольват, где m равно целому числу от 1 до 3 или n равно 1 или 2; и по меньшей мере один из R1 представляет собой замещенный или незамещенный арил.
[9A]
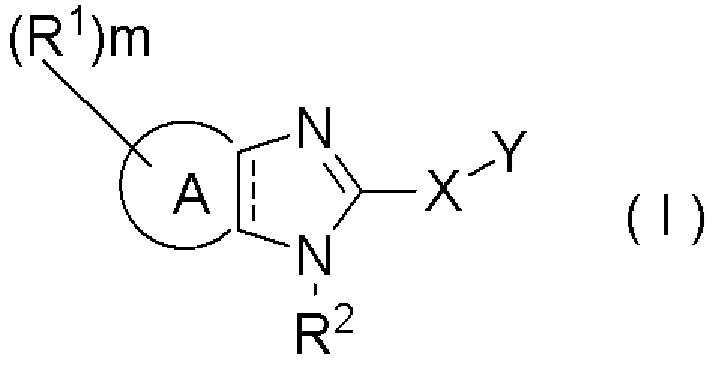
Фармацевтическая композиция, обладающая активирующим действием на аденозинмонофосфат-активированную протеинкиназу, которая содержит соединение, представленное формулой (I):
его фармацевтически приемлемую соль или сольват,
где
кольцо A представляет собой ароматический гетероцикл или неароматический гетероцикл;
пунктирная линия показывает наличие или отсутствие связи;
R1 представляет собой галоген, гидрокси, циано, нитро, карбокси, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный гетероциклил, замещенный или незамещенный алкилокси, замещенный или незамещенный арилокси, замещенный или незамещенный гетероарилокси, замещенный или незамещенный циклоалкилокси, замещенный или незамещенный циклоалкенилокси, замещенный или незамещенный гетероциклилокси, замещенный или незамещенный алкилтио, замещенный или незамещенный арилтио, замещенный или незамещенный гетероарилтио, замещенный или незамещенный циклоалкилтио, замещенный или незамещенный циклоалкенилтио, замещенный или незамещенный гетероциклилтио, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный арилсульфонил, замещенный или незамещенный гетероарилсульфонил, замещенный или незамещенный циклоалкилсульфонил, замещенный или незамещенный циклоалкенилсульфонил, замещенный или незамещенный гетероциклилсульфонил, замещенный или незамещенный ацил, замещенный или незамещенный карбамоил, замещенный или незамещенный сульфамоил или замещенный или незамещенный амино;
m равно целому числу от 0 до 7;
R2 представляет собой водород или замещенный или незамещенный алкил;
X представляет собой одинарную связь, -S-, -O-, -NR3-, -C(=O)-, -NR3C(=O)-, -C(=O)NR3-, -NR3-SO2-, -SO2-NR3- или -C(=O)-O-;
R3 представляет собой водород или замещенный или незамещенный алкил; и
Y представляет собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил или замещенный или незамещенный гетероциклил.
[10A]
Фармацевтическая композиция в соответствии с вышеуказанным [9A], где в формуле (I)
группа, представленная формулой:

является группой, представленной формулой:


R1 имеет те же значения, что указаны выше в [9A], m равно целому числу от 0 до 3;
R1a представляет собой водород, галоген, гидрокси, циано, нитро, карбокси, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный гетероциклил, замещенный или незамещенный алкилокси, замещенный или незамещенный арилокси, замещенный или незамещенный гетероарилокси, замещенный или незамещенный циклоалкилокси, замещенный или незамещенный циклоалкенилокси, замещенный или незамещенный гетероциклилокси, замещенный или незамещенный алкилтио, замещенный или незамещенный арилтио, замещенный или незамещенный гетероарилтио, замещенный или незамещенный циклоалкилтио, замещенный или незамещенный циклоалкенилтио, замещенный или незамещенный гетероциклилтио, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный арилсульфонил, замещенный или незамещенный гетероарилсульфонил, замещенный или незамещенный циклоалкилсульфонил, замещенный или незамещенный циклоалкенилсульфонил, замещенный или незамещенный гетероциклилсульфонил, замещенный или незамещенный ацил, замещенный или незамещенный карбамоил, замещенный или незамещенный сульфамоил или замещенный или незамещенный амино; и
n равно целому числу от 0 до 6.
[11A]
Фармацевтическая композиция в соответствии с вышеуказанным [10A], где в формуле (I)
группа, представленная формулой:

является группой, представленной формулой:

R1 и m имеют те же значения, что указаны выше в [10A].
[12A]
Фармацевтическая композиция в соответствии с любым из вышеуказанных [9A]-[11A], где X представляет собой одинарную связь, -S-, -O- или -NR3-.
[13A]
Фармацевтическая композиция в соответствии с вышеуказанным [12A], где X представляет собой -S- или -O-.
[14A]
Фармацевтическая композиция в соответствии с вышеуказанным [13A], где X представляет собой -O-.
[15A]
Фармацевтическая композиция в соответствии с любым из вышеуказанных [9A]-[14A], где Y представляет собой замещенный или незамещенный арил или замещенный или незамещенный гетероарил.
[16A]
Фармацевтическая композиция в соответствии с вышеуказанным [15A], где Y представляет собой замещенный или незамещенный арил.
[17A]
Фармацевтическая композиция в соответствии с вышеуказанным [16A], где Y представляет собой
группу, представленная формулой:

R4 является группой, представленной формулой: -(CR6R7)q-Z;
R6 и R7, каждый независимо, представляют собой водород, гидрокси, замещенный или незамещенный алкил или замещенный или незамещенный амино;
q равно целому числу от 0 до 4;
Z представляет собой
(1) -COOH,
(2) -COOR8,
(3) -OH,
(4) -C(O)NHR9,
(5) -NHC(O)R11,
(6) -NHSO2R8,
(7) -SO2NHR9,
(8) -SO2NHC(O)R8,
(9) -SO2NHCOOR8,
(10) -SO2NHCONR9R10,
(11) -C(O)NHSO2R8,
(12) -NHC(O)NR9R10,
(13) -P(O)(OH)2,
(14) -P(O)H(OH),
(15) -P(O)(R11)2,
(16) -P(O)(OR11)2,
(17) -P(O)(OH)(R11),
(18) -P(O)(OH)(OR11),
(19) -P(O)(R11)(OR11),
(20) -P(O)(OH)(O-(CR6R7)0-4-R12),
(21) -P(O)(NR9CR13R14COOH)2,
(22) -P(O)(NR9CR13R14COOR11)2,
(23) -P(O)(OH)(NR9CR13R14COOH)2,
(24) -P(O)(OH)(NR9CR13R14COOR11),
(25) -P(O)(NR9CR13R14COOR11)(O-R8),
(26) -P(O)(OCR13R14OC(O)R11)2,
(27) -P(O)(OH)(OCR13R14OC(O)R11),
(28) -P(O)(OH)(-O-(CR6R7)1-4-S(O)R11),
(29) -P(O)(-O-(CR6R7)1-4-S(O)R11)2,
(30) -P(O)(OH)(-O-(CR6R7)1-4-SC(O)R11),
(31) -P(O)(-O-(CR6R7)1-4-SC(O)R11)2,
(32)

или
(33) -NHC(O)OR11;
R8 представляет собой замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил или замещенный или незамещенный гетероциклил;
R9 и R10, каждый независимо, представляют собой водород или замещенный или незамещенный алкил;
R11 и R12, каждый независимо, представляют собой замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил или замещенный или незамещенный гетероциклил;
R13 и R14, каждый независимо, представляют собой водород или замещенный или незамещенный алкил;
R15 и R16, каждый независимо, представляют собой -O- или -NH-;
R17 представляет собой замещенный или незамещенный арил, или замещенный или незамещенный гетероарил;
R5 представляет собой галоген, гидрокси, циано, нитро, карбокси, замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный гетероциклил, замещенный или незамещенный алкилокси, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный карбамоил или замещенный или незамещенный амино; и
p равно целому числу от 0 до 2.
[18A]
Фармацевтическая композиция в соответствии с любым из вышеуказанных [9A]-[14A], где Y представляет собой замещенный или незамещенный алкил.
[19A]
Фармацевтическая композиция в соответствии с вышеуказанным [18A], где Y является группой, представленной формулой: -(CR18R19)r-Z;
R18 и R19, каждый независимо, представляют собой водород, галоген, гидрокси, циано, нитро, карбокси, замещенный или незамещенный алкил, замещенный или незамещенный алкилокси, замещенный или незамещенный алкилоксикарбонил, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный карбамоил или замещенный или незамещенный амино;
r равно целому числу от 0 до 4, и Z имеет те же значения, что указаны выше в [17A].
[20A]
Фармацевтическая композиция в соответствии с любым из вышеуказанных [9A]-[19A], где m равно целому числу от 1 до 2, и по меньшей мере один из R1 представляет собой галоген.
[21A]
Фармацевтическая композиция в соответствии с любым из вышеуказанных [9A]-[20A], где m равно целому числу от 1 до 2, и по меньшей мере один из R1 представляет собой замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил или замещенный или незамещенный гетероциклил.
[22A]
Фармацевтическая композиция в соответствии с любым из вышеуказанных [9A]-[21A], где R2 представляет собой водород.
[23A]
Фармацевтическая композиция в соответствии с вышеуказанным [9A], где m равно 2;
один из R1 представляет собой галоген, и другой из R1 представляет собой замещенный или незамещенный арил;
R2 представляет собой водород;
X представляет собой -O-; и
Y представляет собой замещенный или незамещенный арил, или замещенный или незамещенный гетероарил.
[24A]
Фармацевтическая композиция, содержащая соединение в соответствии с любым из вышеуказанных [1A]-[8A], его фармацевтически приемлемая соль или сольват.
[25A]
Фармацевтическая композиция в соответствии с вышеуказанным [24A], которая обладает активирующим действием на аденозинмонофосфат-активированную протеинкиназу.
[26A]
Фармацевтическая композиция в соответствии с любым из вышеуказанных [9A]-[23A] и [25A] для лечения и/или предупреждения диабета.
[27A]
Способ предупреждения или лечения диабета, включающий введение соединения в соответствии с любым из вышеуказанных [1A]-[23A], его фармацевтически приемлемой соли или сольвата.
[28A]
Соединение в соответствии с любым из вышеуказанных [1A]-[23A], его фармацевтически приемлемая соль или сольват для лечения и/или предупреждения диабета.
[1B]
Фармацевтическая композиция, обладающая активирующим действием на аденозинмонофосфат-активированную протеинкиназу, которая содержит соединение, представленное формулой (I):

его фармацевтически приемлемую соль или сольват,
где
кольцо A представляет собой ароматический гетероцикл или неароматический гетероцикл;
пунктирная линия показывает наличие или отсутствие связи;
R1 представляет собой галоген, гидрокси, циано, нитро, карбокси, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный гетероциклил, замещенный или незамещенный алкилокси, замещенный или незамещенный арилокси, замещенный или незамещенный гетероарилокси, замещенный или незамещенный циклоалкилокси, замещенный или незамещенный циклоалкенилокси, замещенный или незамещенный гетероциклилокси, замещенный или незамещенный алкилтио, замещенный или незамещенный арилтио, замещенный или незамещенный гетероарилтио, замещенный или незамещенный циклоалкилтио, замещенный или незамещенный циклоалкенилтио, замещенный или незамещенный гетероциклилтио, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный арилсульфонил, замещенный или незамещенный гетероарилсульфонил, замещенный или незамещенный циклоалкилсульфонил, замещенный или незамещенный циклоалкенилсульфонил, замещенный или незамещенный гетероциклилсульфонил, замещенный или незамещенный ацил, замещенный или незамещенный карбамоил, замещенный или незамещенный сульфамоил или замещенный или незамещенный амино;
m равно целому числу от 0 до 7;
R2 представляет собой водород или замещенный или незамещенный алкил;
X представляет собой одинарную связь, -S-, -O-, -NR3-, -C(=O)-, -NR3C(=O)-, -C(=O)NR3-, -NR3-SO2-, -SO2-NR3- или -C(=O)-O-;
R3 представляет собой водород или замещенный или незамещенный алкил; и
Y представляет собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил или замещенный или незамещенный гетероциклил.
[2B]
Фармацевтическая композиция в соответствии с вышеуказанным [1B], где в формуле (I)
группа, представленная формулой:

является группой, представленной формулой:

R1 имеет те же значения, что указаны выше в [1B], m равно целому числу от 0 до 3;
R1a представляет собой водород, галоген, гидрокси, циано, нитро, карбокси, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный гетероциклил, замещенный или незамещенный алкилокси, замещенный или незамещенный арилокси, замещенный или незамещенный гетероарилокси, замещенный или незамещенный циклоалкилокси, замещенный или незамещенный циклоалкенилокси, замещенный или незамещенный гетероциклилокси, замещенный или незамещенный алкилтио, замещенный или незамещенный арилтио, замещенный или незамещенный гетероарилтио, замещенный или незамещенный циклоалкилтио, замещенный или незамещенный циклоалкенилтио, замещенный или незамещенный гетероциклилтио, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный арилсульфонил, замещенный или незамещенный гетероарилсульфонил, замещенный или незамещенный циклоалкилсульфонил, замещенный или незамещенный циклоалкенилсульфонил, замещенный или незамещенный гетероциклилсульфонил, замещенный или незамещенный ацил, замещенный или незамещенный карбамоил, замещенный или незамещенный сульфамоил или замещенный или незамещенный амино; и
n равно целому числу от 0 до 6.
[3B]
Фармацевтическая композиция в соответствии с вышеуказанным [2B], где в формуле (I)
группа, представленная формулой:

является группой, представленной формулой:

R1 и m имеют те же значения, что указаны выше в [2B].
[4B]
Фармацевтическая композиция в соответствии с любым из вышеуказанных [1B]-[3B], где X представляет собой одинарную связь, -S-, -O- или -NR3-.
[5B]
Фармацевтическая композиция в соответствии с вышеуказанным [4B], где X представляет собой -S- или -O-.
[6B]
Фармацевтическая композиция в соответствии с вышеуказанным [5B], где X представляет собой -O-.
[7B]
Фармацевтическая композиция в соответствии с любым из вышеуказанных [1B]-[6B], где Y представляет собой замещенный или незамещенный арил или замещенный или незамещенный гетероарил.
[8B]
Фармацевтическая композиция в соответствии с вышеуказанным [7B], где Y представляет собой замещенный или незамещенный арил.
[9B]
Фармацевтическая композиция в соответствии с вышеуказанным [8B], где Y представляет собой
группу, представленную формулой:

R4 является группой, представленной формулой: -(CR6R7)q-Z;
R6 и R7, каждый независимо, представляют собой водород, гидрокси, замещенный или незамещенный алкил или замещенный или незамещенный амино;
q равно целому числу от 0 до 4;
Z представляет собой
(1) -COOH,
(2) -COOR8,
(3) -OH,
(4) -C(O)NHR9,
(5) -NHC(O)R11,
(6) -NHSO2R8,
(7) -SO2NHR9,
(8) -SO2NHC(O)R8,
(9) -SO2NHCOOR8,
(10) -SO2NHCONR9R10,
(11) -C(O)NHSO2R8,
(12) -NHC(O)NR9R10,
(13) -P(O)(OH)2,
(14) -P(O)H(OH),
(15) -P(O)(R11)2,
(16) -P(O)(OR11)2,
(17) -P(O)(OH)(R11),
(18) -P(O)(OH)(OR11),
(19) -P(O)(R11)(OR11),
(20) -P(O)(OH)(O-(CR6R7)0-4-R12),
(21) -P(O)(NR9CR13R14COOH)2,
(22) -P(O)(NR9CR13R14COOR11)2,
(23) -P(O)(OH)(NR9CR13R14COOH)2,
(24) -P(O)(OH)(NR9CR13R14COOR11),
(25) -P(O)(NR9CR13R14COOR11)(O-R8),
(26) -P(O)(OCR13R14OC(O)R11)2,
(27) -P(O)(OH)(OCR13R14OC(O)R11),
(28) -P(O)(OH)(-O-(CR6R7)1-4-S(O)R11),
(29) -P(O)(-O-(CR6R7)1-4-S(O)R11)2,
(30) -P(O)(OH)(-O-(CR6R7)1-4-SC(O)R11),
(31) -P(O)(-O-(CR6R7)1-4-SC(O)R11)2
или
(32)

R8 представляет собой замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил или замещенный или незамещенный гетероциклил;
R9 и R10, каждый независимо, представляют собой водород или замещенный или незамещенный алкил;
R11 представляет собой замещенный или незамещенный алкил;
R12 представляет собой замещенный или незамещенный арил;
R13 и R14, каждый независимо, представляют собой водород или замещенный или незамещенный алкил;
R15 и R16, каждый независимо, представляют собой -O- или -NH-;
R17 представляет собой замещенный или незамещенный арил, или замещенный или незамещенный гетероарил;
R5 представляет собой галоген, гидрокси, циано, нитро, карбокси, замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный гетероциклил, замещенный или незамещенный алкилокси, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный карбамоил или замещенный или незамещенный амино; и
p равно целому числу от 0 до 2.
[10B]
Фармацевтическая композиция в соответствии с любым из вышеуказанных [1B]-[6B], где Y представляет собой замещенный или незамещенный алкил.
[11B]
Фармацевтическая композиция в соответствии с вышеуказанным [10B], где Y является группой, представленной формулой: -(CR18R19)r-Z;
R18 и R19, каждый независимо, представляют собой водород, галоген, гидрокси, циано, нитро, карбокси, замещенный или незамещенный алкил, замещенный или незамещенный алкилокси, замещенный или незамещенный алкилоксикарбонил, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный карбамоил или замещенный или незамещенный амино;
r равно целому числу от 0 до 4, и Z имеет те же значения, что указаны выше в [9B].
[12B]
Фармацевтическая композиция в соответствии с любым из вышеуказанных [1B]-[11B], где m равно целому числу от 1 до 2, и по меньшей мере один из R1 представляет собой галоген.
[13B]
Фармацевтическая композиция в соответствии с любым из вышеуказанных [1B]-[12B], где m равно целому числу от 1 до 2, и по меньшей мере один из R1 представляет собой замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил или замещенный или незамещенный гетероциклил.
[14B]
Фармацевтическая композиция в соответствии с любым из вышеуказанных [1B]-[13B], где R2 представляет собой водород.
[15B]
Соединение, представленное формулой (I):

его фармацевтически приемлемая соль или сольват,
где
группа, представленная формулой:

является группой, представленной формулой:

пунктирная линия показывает наличие или отсутствие связи;
R1 представляет собой галоген, гидрокси, циано, нитро, карбокси, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный гетероциклил, замещенный или незамещенный алкилокси, замещенный или незамещенный арилокси, замещенный или незамещенный гетероарилокси, замещенный или незамещенный циклоалкилокси, замещенный или незамещенный циклоалкенилокси, замещенный или незамещенный гетероциклилокси, замещенный или незамещенный алкилтио, замещенный или незамещенный арилтио, замещенный или незамещенный гетероарилтио, замещенный или незамещенный циклоалкилтио, замещенный или незамещенный циклоалкенилтио, замещенный или незамещенный гетероциклилтио, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный арилсульфонил, замещенный или незамещенный гетероарилсульфонил, замещенный или незамещенный циклоалкилсульфонил, замещенный или незамещенный циклоалкенилсульфонил, замещенный или незамещенный гетероциклилсульфонил, замещенный или незамещенный ацил, замещенный или незамещенный карбамоил, замещенный или незамещенный сульфамоил или замещенный или незамещенный амино;
m равно целому числу от 0 до 3,
R2 представляет собой водород или замещенный или незамещенный алкил;
X представляет собой -O-; и
Y представляет собой замещенный или незамещенный арил; при условии, что исключены соединения, показанные далее:

[16B]
Соединение в соответствии с вышеуказанным [15B], его фармацевтически приемлемая соль или сольват, где Y представляет собой

где R4 является группой, представленной формулой: -(CR6R7)q-Z;
R6 и R7, каждый независимо, представляют собой водород, гидрокси, замещенный или незамещенный алкил или замещенный или незамещенный амино;
q равно целому числу от 0 до 4;
Z представляет собой
(1) -COOH,
(2) -COOR8,
(3) -OH,
(4) -C(O)NHR9,
(5) -NHC(O)R11,
(6) -NHSO2R8,
(7) -SO2NHR9,
(8) -SO2NHC(O)R8,
(9) -SO2NHCOOR8,
(10) -SO2NHCONR9R10,
(11) -C(O)NHSO2R8,
(12) -NHC(O)NR9R10,
(13) -P(O)(OH)2,
(14) -P(O)H(OH),
(15) -P(O)(R11)2,
(16) -P(O)(OR11)2,
(17) -P(O)(OH)(R11),
(18) -P(O)(OH)(OR11),
(19) -P(O)(R11)(OR11),
(20) -P(O)(OH)(O-(CR6R7)0-4-R12),
(21) -P(O)(NR9CR13R14COOH)2,
(22) -P(O)(NR9CR13R14COOR11)2,
(23) -P(O)(OH)(NR9CR13R14COOH)2,
(24) -P(O)(OH)(NR9CR13R14COOR11),
(25) -P(O)(NR9CR13R14COOR11)(O-R8),
(26) -P(O)(OCR13R14OC(O)R11)2,
(27) -P(O)(OH)(OCR13R14OC(O)R11),
(28) -P(O)(OH)(-O-(CR6R7)1-4-S(O)R11),
(29) -P(O)(-O-(CR6R7)1-4-S(O)R11)2,
(30) -P(O)(OH)(-O-(CR6R7)1-4-SC(O)R11),
(31) -P(O)(-O-(CR6R7)1-4-SC(O)R11)2
или
(32)

R8 представляет собой замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил или замещенный или незамещенный гетероциклил;
R9 и R10, каждый независимо, представляют собой водород или замещенный или незамещенный алкил;
R11 представляет собой замещенный или незамещенный алкил;
R12 представляет собой замещенный или незамещенный арил;
R13 и R14, каждый независимо, представляют собой водород или замещенный или незамещенный алкил;
R15 и R16, каждый независимо, представляют собой -O- или -NH-;
R17 представляет собой замещенный или незамещенный арил, или замещенный или незамещенный гетероарил;
R5 представляет собой галоген, гидрокси, циано, нитро, карбокси, замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный гетероциклил, замещенный или незамещенный алкилокси, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный карбамоил или замещенный или незамещенный амино; и
p равно целому числу от 0 до 2.
[17B]
Соединение в соответствии с вышеуказанным [15B] или [16B], его фармацевтически приемлемая соль или сольват, где группа, представленная формулой:

является группой, представленной формулой:

R1 имеет те же значения, что указаны выше в [15B], n равно целому числу от 0 до 2, и R1X представляет собой галоген.
[18B]
Соединение в соответствии с любым из вышеуказанных [15B]-[17B], его фармацевтически приемлемая соль или сольват, где по меньшей мере один из R1 представляет собой замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил или замещенный или незамещенный гетероциклил.
[19B]
Фармацевтическая композиция, содержащая соединение в соответствии с любым из вышеуказанных [15B]-[18B], его фармацевтически приемлемая соль или сольват.
[20B]
Фармацевтическая композиция в соответствии с вышеуказанным [19B], которая обладает активирующим действием на аденозинмонофосфат-активированную протеинкиназу.
[21B]
Фармацевтическая композиция в соответствии с любым из вышеуказанных [1B]-[14B] и [20B] для лечения и/или предупреждения диабета.
[22B]
Способ предупреждения или лечения диабета, включающий введение соединения в соответствии с любым из вышеуказанных [1B]-[18B], его фармацевтически приемлемой соли или сольвата.
[23B]
Соединение в соответствии с любым из вышеуказанных [1B]-[18B], его фармацевтически приемлемая соль или сольват для лечения и/или предупреждения диабета.
[1C]
Фармацевтическая композиция, обладающая активирующим действием на аденозинмонофосфат-активированную протеинкиназу, которая содержит соединение, представленное формулой (I):

его фармацевтически приемлемую соль или сольват,
где
кольцо A представляет собой ароматический гетероцикл или неароматический гетероцикл;
пунктирная линия показывает наличие или отсутствие связи;
R1 представляет собой галоген, гидрокси, циано, нитро, карбокси, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный гетероциклил, замещенный или незамещенный алкилокси, замещенный или незамещенный арилокси, замещенный или незамещенный гетероарилокси, замещенный или незамещенный циклоалкилокси, замещенный или незамещенный циклоалкенилокси, замещенный или незамещенный гетероциклилокси, замещенный или незамещенный алкилтио, замещенный или незамещенный арилтио, замещенный или незамещенный гетероарилтио, замещенный или незамещенный циклоалкилтио, замещенный или незамещенный циклоалкенилтио, замещенный или незамещенный гетероциклилтио, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный арилсульфонил, замещенный или незамещенный гетероарилсульфонил, замещенный или незамещенный циклоалкилсульфонил, замещенный или незамещенный циклоалкенилсульфонил, замещенный или незамещенный гетероциклилсульфонил, замещенный или незамещенный ацил, замещенный или незамещенный карбамоил, замещенный или незамещенный сульфамоил или замещенный или незамещенный амино;
m равно целому числу от 0 до 7;
R2 представляет собой водород или замещенный или незамещенный алкил;
X представляет собой одинарную связь, -S-, -O-, -NR3-, -C(=O)-, -NR3C(=O)-, -C(=O)NR3-, -NR3-SO2-, -SO2-NR3- или -C(=O)-O-;
R3 представляет собой водород или замещенный или незамещенный алкил; и
Y представляет собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил или замещенный или незамещенный гетероциклил.
[2C]
Фармацевтическая композиция в соответствии с вышеуказанным [1C], где в формуле (I)
группа, представленная формулой:

является группой, представленной формулой:

R1 имеет те же значения, что указаны выше в [1C], m равно целому числу от 0 до 3;
R1a представляет собой водород, галоген, гидрокси, циано, нитро, карбокси, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный гетероциклил, замещенный или незамещенный алкилокси, замещенный или незамещенный арилокси, замещенный или незамещенный гетероарилокси, замещенный или незамещенный циклоалкилокси, замещенный или незамещенный циклоалкенилокси, замещенный или незамещенный гетероциклилокси, замещенный или незамещенный алкилтио, замещенный или незамещенный арилтио, замещенный или незамещенный гетероарилтио, замещенный или незамещенный циклоалкилтио, замещенный или незамещенный циклоалкенилтио, замещенный или незамещенный гетероциклилтио, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный арилсульфонил, замещенный или незамещенный гетероарилсульфонил, замещенный или незамещенный циклоалкилсульфонил, замещенный или незамещенный циклоалкенилсульфонил, замещенный или незамещенный гетероциклилсульфонил, замещенный или незамещенный ацил, замещенный или незамещенный карбамоил, замещенный или незамещенный сульфамоил или замещенный или незамещенный амино; и
n равно целому числу от 0 до 6.
[3C]
Фармацевтическая композиция в соответствии с вышеуказанным [2C], где в формуле (I)
группа, представленная формулой:

является группой, представленной формулой:

R1 и m имеют те же значения, что указаны выше в [2C].
[4C]
Фармацевтическая композиция в соответствии с любым из вышеуказанных [1C]-[3C], где X представляет собой одинарную связь, -S-, -O- или -NR3-.
[5C]
Фармацевтическая композиция в соответствии с вышеуказанным [4C], где X представляет собой -S- или -O-.
[6C]
Фармацевтическая композиция в соответствии с вышеуказанным [5C], где X представляет собой -O-.
[7C]
Фармацевтическая композиция в соответствии с любым из вышеуказанных [1C]-[6C], где Y представляет собой замещенный или незамещенный арил или замещенный или незамещенный гетероарил.
[8C]
Фармацевтическая композиция в соответствии с вышеуказанным [7C], где Y представляет собой замещенный или незамещенный арил.
[9C]
Фармацевтическая композиция в соответствии с вышеуказанным [8C], где Y представляет собой
группу, представленную формулой:

R4 является группой, представленной формулой: -(CR6R7)q-Z;
R6 и R7, каждый независимо, представляют собой водород, гидрокси, замещенный или незамещенный алкил или замещенный или незамещенный амино;
q равно целому числу от 0 до 4;
Z представляет собой
(1) -COOH,
(2) -COOR8,
(3) -OH,
(4) -C(O)NHR9,
(5) -NHC(O)R11,
(6) -NHSO2R8,
(7) -SO2NHR9,
(8) -SO2NHC(O)R8,
(9) -SO2NHCOOR8,
(10) -SO2NHCONR9R10,
(11) -C(O)NHSO2R8,
(12) -NHC(O)NR9R10,
(13) -P(O)(OH)2,
(14) -P(O)H(OH),
(15) -P(O)(R11)2,
(16) -P(O)(OR11)2,
(17) -P(O)(OH)(R11),
(18) -P(O)(OH)(OR11),
(19) -P(O)(R11)(OR11),
(20) -P(O)(OH)(O-(CR6R7)0-4-R12),
(21) -P(O)(NR9CR13R14COOH)2,
(22) -P(O)(NR9CR13R14COOR11)2,
(23) -P(O)(OH)(NR9CR13R14COOH)2,
(24) -P(O)(OH)(NR9CR13R14COOR11),
(25) -P(O)(NR9CR13R14COOR11)(O-R8),
(26) -P(O)(OCR13R14OC(O)R11)2,
(27) -P(O)(OH)(OCR13R14OC(O)R11),
(28) -P(O)(OH)(-O-(CR6R7)1-4-S(O)R11),
(29) -P(O)(-O-(CR6R7)1-4-S(O)R11)2,
(30) -P(O)(OH)(-O-(CR6R7)1-4-SC(O)R11),
(31) -P(O)(-O-(CR6R7)1-4-SC(O)R11)2
или
(32)

R8 представляет собой замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил или замещенный или незамещенный гетероциклил;
R9 и R10, каждый независимо, представляют собой водород или замещенный или незамещенный алкил;
R11 представляет собой замещенный или незамещенный алкил;
R12 представляет собой замещенный или незамещенный арил;
R13 и R14, каждый независимо, представляют собой водород или замещенный или незамещенный алкил;
R15 и R16, каждый независимо, представляют собой -O- или -NH-;
R17 представляет собой замещенный или незамещенный арил, или замещенный или незамещенный гетероарил;
R5 представляет собой галоген, гидрокси, циано, нитро, карбокси, замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный гетероциклил, замещенный или незамещенный алкилокси, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный карбамоил, или замещенный или незамещенный амино; и
p равно целому числу от 0 до 2.
[10C]
Фармацевтическая композиция в соответствии с любым из вышеуказанных [1C]-[6C], где Y представляет собой замещенный или незамещенный алкил.
[11C]
Фармацевтическая композиция в соответствии с вышеуказанным [10C], где Y является группой, представленной формулой: -(CR18R19)r-Z;
R18 и R19, каждый независимо, представляют собой водород, галоген, гидрокси, циано, нитро, карбокси, замещенный или незамещенный алкил, замещенный или незамещенный алкилокси, замещенный или незамещенный алкилоксикарбонил, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный карбамоил или замещенный или незамещенный амино;
r равно целому числу от 0 до 4, и Z имеет те же значения, что указаны выше в [9C].
[12C]
Фармацевтическая композиция в соответствии с любым из вышеуказанных [1C]-[11C], где m равно целому числу от 1 до 2, и по меньшей мере один из R1 представляет собой галоген.
[13C]
Фармацевтическая композиция в соответствии с любым из вышеуказанных [1C]-[12C], где m равно целому числу от 1 до 2, и по меньшей мере один из R1 представляет собой замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил или замещенный или незамещенный гетероциклил.
[14C]
Фармацевтическая композиция в соответствии с любым из вышеуказанных [1C]-[13C], где R2 представляет собой водород.
[15C]
Соединение, представленное формулой (I):
[Chem. 57]
его фармацевтически приемлемая соль или сольват,
где
группа, представленная формулой:

является группой, представленной формулой:

пунктирная линия показывает наличие или отсутствие связи;
R1 представляет собой галоген, гидрокси, циано, нитро, карбокси, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный гетероциклил, замещенный или незамещенный алкилокси, замещенный или незамещенный арилокси, замещенный или незамещенный гетероарилокси, замещенный или незамещенный циклоалкилокси, замещенный или незамещенный циклоалкенилокси, замещенный или незамещенный гетероциклилокси, замещенный или незамещенный алкилтио, замещенный или незамещенный арилтио, замещенный или незамещенный гетероарилтио, замещенный или незамещенный циклоалкилтио, замещенный или незамещенный циклоалкенилтио, замещенный или незамещенный гетероциклилтио, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный арилсульфонил, замещенный или незамещенный гетероарилсульфонил, замещенный или незамещенный циклоалкилсульфонил, замещенный или незамещенный циклоалкенилсульфонил, замещенный или незамещенный гетероциклилсульфонил, замещенный или незамещенный ацил, замещенный или незамещенный карбамоил, замещенный или незамещенный сульфамоил или замещенный или незамещенный амино;
m равно целому числу от 0 до 3,
R2 представляет собой водород или замещенный или незамещенный алкил;
X представляет собой -O-; и
Y представляет собой замещенный или незамещенный арил; при условии, что исключены соединения, показанные далее:

[16C]
Соединение в соответствии с вышеуказанным [15C], его фармацевтически приемлемая соль или сольват, где Y представляет собой

где R4 является группой, представленной формулой: -(CR6R7)q-Z;
R6 и R7, каждый независимо, представляют собой водород, гидрокси, замещенный или незамещенный алкил или замещенный или незамещенный амино;
q равно целому числу от 0 до 4;
Z представляет собой
(1) -COOH,
(2) -COOR8,
(3) -OH,
(4) -C(O)NHR9,
(5) -NHC(O)R11,
(6) -NHSO2R8,
(7) -SO2NHR9,
(8) -SO2NHC(O)R8,
(9) -SO2NHCOOR8,
(10) -SO2NHCONR9R10,
(11) -C(O)NHSO2R8,
(12) -NHC(O)NR9R10,
(13) -P(O)(OH)2,
(14) -P(O)H(OH),
(15) -P(O)(R11)2,
(16) -P(O)(OR11)2,
(17) -P(O)(OH)(R11),
(18) -P(O)(OH)(OR11),
(19) -P(O)(R11)(OR11),
(20) -P(O)(OH)(O-(CR6R7)0-4-R12),
(21) -P(O)(NR9CR13R14COOH)2,
(22) -P(O)(NR9CR13R14COOR11)2,
(23) -P(O)(OH)(NR9CR13R14COOH)2,
(24) -P(O)(OH)(NR9CR13R14COOR11),
(25) -P(O)(NR9CR13R14COOR11)(O-R8),
(26) -P(O)(OCR13R14OC(O)R11)2,
(27) -P(O)(OH)(OCR13R14OC(O)R11),
(28) -P(O)(OH)(-O-(CR6R7)1-4-S(O)R11),
(29) -P(O)(-O-(CR6R7)1-4-S(O)R11)2,
(30) -P(O)(OH)(-O-(CR6R7)1-4-SC(O)R11),
(31) -P(O)(-O-(CR6R7)1-4-SC(O)R11)2
или
(32)

R8 представляет собой замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил или замещенный или незамещенный гетероциклил;
R9 и R10, каждый независимо, представляют собой водород или замещенный или незамещенный алкил;
R11 представляет собой замещенный или незамещенный алкил;
R12 представляет собой замещенный или незамещенный арил;
R13 и R14, каждый независимо, представляют собой водород или замещенный или незамещенный алкил;
R15 и R16, каждый независимо, представляют собой -O- или -NH-;
R17 представляет собой замещенный или незамещенный арил, или замещенный или незамещенный гетероарил;
R5 представляет собой галоген, гидрокси, циано, нитро, карбокси, замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный гетероциклил, замещенный или незамещенный алкилокси, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный карбамоил или замещенный или незамещенный амино; и
p равно целому числу от 0 до 2.
[17C]
Фармацевтическая композиция, содержащая соединение в соответствии с вышеуказанным [15C] или [16C], его фармацевтически приемлемая соль или сольват.
[18C]
Фармацевтическая композиция в соответствии с вышеуказанным [17C], которая обладает активирующим действием на аденозинмонофосфат-активированную протеинкиназу.
[19C]
Фармацевтическая композиция в соответствии с любым из вышеуказанных [1C]-[14C] и [18C] для лечения и/или предупреждения диабета.
[20C]
Способ предупреждения или лечения диабета, включающий введение соединения в соответствии с любым из вышеуказанных [1C]-[16C], его фармацевтически приемлемая соль или сольват.
[21C]
Соединение в соответствии с любым из вышеуказанных [1C]-[16C], его фармацевтически приемлемая соль или сольват для лечения и/или предупреждения диабета.
Эффект изобретения
Поскольку настоящее соединение обладает активирующим AMPK действием, фармацевтические композиции, содержащие настоящее соединение, являются весьма полезными в качестве лекарственных средств, в частности, в качестве лекарственных средств для лечения и/или предупреждения диабета II типа, гипергликемии, метаболического синдрома, ожирения, гиперхолестеринемии и/или гипертензии. Кроме того, настоящее соединение обладает эффективностью в качестве лекарственного средства. В данном документе понятие эффективность в качестве лекарственного средства включает высокую метаболическую стабильность, слабую индукцию фермента, метаболизирующего лекарственное средство, слабое ингибирование метаболизирующего лекарственное средство фермента, который метаболизирует другое лекарственное средство, высокую пероральную абсорбцию, низкий клиренс, длительный период полувыведения, достаточный для проявления эффективности лекарственного средства, высокую ферментативную активность, высокая максимальная скорость активации, низкий уровень связывания с белками, высокое проникновение в ткани-мишени, высокую растворимость, высокую безопасность и т.д.
Способ осуществления изобретения
Далее разъясняются значения терминов, используемых в настоящем описании. Каждый термин имеет одни и те же значения, когда используется самостоятельно или в сочетании с другим термином по данному описанию.
“Галоген” включает фтор, хлор, бром или йод.
“Алкил” подразумевает от C1 до C10 прямую или разветвленную алкильную группу, и пример включает метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил, изогексил, н-гептил, н-октил, н-нонил, н-децил или тому подобное. Предпочтительным является от C1 до C6 или от C1 до C4 алкил, и пример включает метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил или изогексил.
“Алкенил” подразумевает от C2 до C8 прямой или разветвленный алкенил, содержащий одну или несколько двойных связей в вышеуказанном “алкиле”, и пример включает винил, 1-пропенил, 2-пропенил, 1-бутенил, 2-бутенил, 3-бутенил, 1,3-бутадиенил, 3-метил-2-бутенил или тому подобное.
“Алкинил” подразумевает от C2 до C8 прямой или разветвленный алкинил, содержащий одну или несколько тройных связей в вышеуказанном “алкиле”, и пример включает этинил, пропинил, бутинил или тому подобное. Кроме того, “алкинил” может содержать двойную связь.
“Циклоалкил” подразумевает от C3 до C15 циклическую насыщенную углеводородную группу, и пример включает циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, мостиковую циклическую углеводородную группу, спироуглеводородную группу или тому подобное. Предпочтительным является циклопропил, циклобутил, циклопентил, циклогексил или мостиковая циклическая углеводородная группа.
“Мостиковая циклическая углеводородная группа” включает группу, которая образуется путем удаления одного атома водорода от C5 до C8 алифатического цикла, состоящего из двух или более колец, которые имеют два или более общих атома углерода. Пример включает бицикло[2,1,0]пентил, бицикло[2,2,1]гептил, бицикло[2,2,2]октил, бицикло[3,2,1]октил, трицикло[2,2,1,0]гептил или тому подобное.
“Спироуглеводородная группа” включает группу, которая образуется путем удаления одного атома водорода в цикле, состоящего из двух углеводородных колец, которые имеют два или более общих атомов углерода. Пример включает спиро[3,4]октил или тому подобное.
“Циклоалкенил” подразумевает от C3 до C10 циклическую ненасыщенную алифатическую углеводородную группу, и пример включает циклопропенил (например: 1-циклопропенил), циклобутенил (например: 1-циклобутенил), циклопентенил (например: 1-циклопентен-1-ил, 2-циклопентен-1-ил или 3-циклопентен-1-ил), циклогексенил (например: 1-циклогексен-1-ил, 2-циклогексен-1-ил или 3-циклогексен-1-ил), циклогептенил (например: 1-циклогептенил), циклооктенил (например: 1-циклооктенил) или тому подобное. Предпочтительным является циклопропенил, циклобутенил, циклопентенил или циклогексенил. Циклоалкенил также включает мостиковую циклическую углеводородную группу и спироуглеводородную группу, которые содержат в кольце ненасыщенную связь.
“Арил” подразумевает моноциклическую ароматическую углеводородную группу (например: фенил) и полициклическую ароматическую углеводородную группу (например: 1-нафтил, 2-нафтил, 1-антрил, 2-антрил, 9-антрил, 1-фенантрил, 2-фенантрил, 3-фенантрил, 4-фенантрил или 9-фенантрил). Предпочтительным является фенил или нафтил (1-нафтил или 2-нафтил).
«Гетероарил» подразумевает моноциклическую ароматическую гетероциклическую группу и конденсированную ароматическую гетероциклическую группу.
«Моноциклическая ароматическая гетероциклическая группа» подразумевает группу, которая образована из 5-8-членного ароматического кольца, содержащего один или несколько одинаковых или различных гетероатомов, необязательно выбранных из атомов кислорода, серы и азота в кольце, и эта группа может иметь связь в любом подходящем положении.
«Конденсированная ароматическая гетероциклическая группа» подразумевает группу, в которой 5-8-членное ароматическое кольцо, содержащее в кольце один или несколько одинаковых или различных гетероатомов, необязательно выбранных из атомов кислорода, серы и азота, конденсировано с от одного до четырех 5-8-членными ароматическими карбоциклическими кольцами или другим 5-8-членным ароматическим гетерокольцом, и эта группа может иметь связь в любом подходящем положении.
Пример “гетероарила” включает фурил (например: 2-фурил или 3-фурил), тиенил (например: 2-тиенил или 3-тиенил), пирролил (например: 1-пирролил, 2-пирролил или 3-пирролил), имидазолил (например: 1-имидазолил, 2-имидазолил или 4-имидазолил), пиразолил (например: 1-пиразолил, 3-пиразолил или 4-пиразолил), триазолил (например: 1,2,4-триазол-1-ил, 1,2,4-триазол-3-ил или 1,2,4-триазол-4-ил), тетразолил (например: 1-тетразолил, 2-тетразолил или 5-тетразолил), оксазолил (например: 2-оксазолил, 4-оксазолил или 5-оксазолил), изоксазолил (например: 3-изоксазолил, 4-изоксазолил или 5-изоксазолил), тиазолил (например: 2-тиазолил, 4-тиазолил или 5-тиазолил), тиадиазолил, изотиазолил (например: 3-изотиазолил, 4-изотиазолил или 5-изотиазолил), пиридил (например: 2-пиридил, 3-пиридил или 4-пиридил), пиридазинил (например: 3-пиридазинил или 4-пиридазинил), пиримидинил (например: 2-пиримидинил, 4-пиримидинил или 5-пиримидинил), фуразинил (например: 3-фуразинил), пиразинил (например: 2-пиразинил), оксадиазолил (например: 1,3,4-оксадиазол-2-ил), бензофурил (например: 2-бензо[b]фурил, 3-бензо[b]фурил, 4-бензо[b]фурил, 5-бензо[b]фурил, 6-бензо[b]фурил или 7-бензо[b]фурил), бензотиенил (например: 2-бензо[b]тиенил, 3-бензо[b]тиенил, 4-бензо[b]тиенил, 5-бензо[b]тиенил, 6-бензо[b]тиенил или 7-бензо[b]тиенил), бензимидазолил (например: 1-бензимидазолил, 2-бензимидазолил, 4-бензимидазолил или 5-бензимидазолил), дибензофурил, бензоксазолил, бензотиазолил, хиноксалинил (например: 2-хиноксалинил, 5-хиноксалинил или 6-хиноксалинил), циннолинил (например: 3-циннолинил, 4-циннолинил, 5-циннолинил, 6-циннолинил, 7-циннолинил или 8-циннолинил), хиназолинил (например: 2-хиназолинил, 4-хиназолинил, 5-хиназолинил, 6-хиназолинил, 7-хиназолинил или 8-хиназолинил), хинолил (например: 2-хинолил, 3-хинолил, 4-хинолил, 5-хинолил, 6-хинолил, 7-хинолил или 8-хинолил), фталазинил (например: 1-фталазинил, 5-фталазинил или 6-фталазинил), изохинолил (например: 1-изохинолил, 3-изохинолил, 4-изохинолил, 5-изохинолил, 6-изохинолил, 7-изохинолил или 8-изохинолил), пурил, птеридинил (например: 2-птеридинил, 4-птеридинил, 6-птеридинил или 7-птеридинил), карбазолил, фенантридинил, акридинил (например: 1-акридинил, 2-акридинил, 3-акридинил, 4-акридинил или 9-акридинил), индолил (например: 1-индолил, 2-индолил, 3-индолил, 4-индолил, 5-индолил, 6-индолил или 7-индолил), изоиндолил, фенадинил (например: 1-фенадинил или 2-фенадинил), фенотиадинил (например: 1-фенотиадинил, 2-фенотиадинил, 3-фенотиадинил или 4-фенотиадинил) или тому подобное.
«Гетероциклил» подразумевает неароматическую гетероциклическую группу, которая может иметь связь в любом подходящем положении кольца, которое содержит по меньшей мере один или несколько атомов азота, кислорода или серы в кольце, или кольца, где такое кольцо конденсировано с циклоалканом (предпочтительно 5-6-членным), бензольным кольцом и/или кольцом, которое содержит по меньшей мере один или несколько атомов азота, кислорода или серы в кольце. “Неароматическая гетероциклическая группа” может быть насыщенной или ненасыщенной, но не является ароматической. Предпочтительным является 5-8-членное кольцо. Пример включает 1-пирролинил, 2-пирролинил, 3-пирролинил, 1-пирролидинил, 2-пирролидинил, 3-пирролидинил, 1-имидазолинил, 2-имидазолинил, 4-имидазолинил, 1-имидазолидинил, 2-имидазолидинил, 4-имидазолидинил, 1-пиразолинил, 3-пиразолинил, 4-пиразолинил, 1-пиразолидинил, 3-пиразолидинил, 4-пиразолидинил, пиперидино, 2-пиперидинил, 3-пиперидинил, 4-пиперидинил, 1-пиперадинил, 2-пиперадинил, 2-морфолинил, 3-морфолинил, морфолино, тетрагидропиранил, 1,2,3,4-тетрагидроизохинолинил, 1,2,3,4-тетрагидрохинолинил, 1,3-дигидро-2H-изоиндол-5-ил или тому подобное.
«Гетероциклил», кроме того, включает мостиковую группу или образующую спирокольцо группу, показанные далее.

“Ацил” подразумевает формил, замещенный или незамещенный алкилкарбонил, замещенный или незамещенный алкенилкарбонил, замещенный или незамещенный циклоалкилкарбонил, замещенный или незамещенный циклоалкенилкарбонил, замещенный или незамещенный арилкарбонил, замещенный или незамещенный гетероарилкарбонил или замещенный или незамещенный гетероциклилкарбонил.
Алкильная часть “алкилкарбонила”, алкенильная часть “алкенилкарбонила”, циклоалкильная часть “циклоалкилкарбонила”, циклоалкенильная часть “циклоалкенилкарбонила”, арильная часть “арилкарбонила”, гетероарильная часть “гетероарилкарбонила” и гетероциклильная часть “гетероциклилкарбонила”, соответственно, подразумевает вышеуказанный “алкил”, вышеуказанный “алкенил”, вышеуказанный “циклоалкил”, вышеуказанный “циклоалкенил”, вышеуказанный “арил”, вышеуказанный “гетероарил” и вышеуказанный “гетероциклил”.
Алкильная часть «алкилокси», «алкилтио», «алкилсульфонил» и «алкилоксикарбонил» подразумевает вышеуказанный «алкил».
Арильная часть «арилокси», «арилтио» и «арилсульфонил» подразумевает вышеуказанный «арил».
Гетероарильная часть «гетероарилокси», «гетероарилтио» и «гетероарилсульфонил» подразумевает вышеуказанный «гетероарил».
Циклоалкильная часть «циклоалкилокси», «циклоалкилтио» и «циклоалкилсульфонил» подразумевает вышеуказанный «циклоалкил».
Циклоалкенильная часть «циклоалкенилокси», «циклоалкенилтио» и «циклоалкенилсульфонил» подразумевает вышеуказанный «циклоалкенил».
Гетероциклильная часть «гетероциклилокси», «гетероциклилтио» и «гетероциклилсульфонил» подразумевает вышеуказанный «гетероциклил».
“Ароматическое гетерокольцо” подразумевает ароматическое кольцо, которое содержит в кольце один или несколько гетероатомов, выбранных из группы, состоящей из атомов азота, серы и кислорода, иных, чем атом углерода. Кольцо включает моноцикл или конденсированное кольцо.
В качестве “ароматического гетерокольца” пример включает кольцо, производное вышеуказанного “гетероарила”, и, в частности, 6-членное кольцо является предпочтительным. Пример включает пиридин, пиридазин, пиримидин, пиразин или тому подобное.
“Неароматическое гетерокольцо” подразумевает неароматическое кольцо, которое содержит в кольце один или несколько гетероатомов, выбранные из группы, состоящей из атомов азота, серы и кислорода, отличные от атома углерода. Кольцо подразумевает 5-10 членное кольцо, которое может содержать насыщенную или частично ненасыщенную связь и может быть конденсировано с арилом или ароматическим гетерокольцом.
«Замещенный алкил», «замещенный алкенил», «замещенный алкинил», «замещенный арил», «замещенный гетероарил», «замещенный циклоалкил», «замещенный циклоалкенил», «замещенный гетероциклил», «замещенный алкилокси», «замещенный арилокси», «замещенный гетероарилокси», «замещенный циклоалкилокси», «замещенный циклоалкенилокси», «замещенный гетероциклилокси», «замещенный алкилтио», «замещенный арилтио», «замещенный гетероарилтио», «замещенный циклоалкилтио», «замещенный циклоалкенилтио», «замещенный гетероциклилтио», «замещенный алкилсульфонил», «замещенный арилсульфонил», «замещенный гетероарилсульфонил», «замещенный циклоалкилсульфонил», «замещенный циклоалкенилсульфонил», «замещенный гетероциклилсульфонил», «замещенный ацил», «замещенный карбамоил», «замещенный сульфамоил», «замещенный амино» или «замещенный алкилоксикарбонил» могут быть замещены от 1 до 4 заместителями, выбранными из группы, включающей, например,
галоген; гидрокси; карбокси; нитро; циано;
замещенный или незамещенный алкил (пример заместителя для замещенного алкила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил, гетероциклил, замещенный или незамещенный амино (пример заместителя для замещенного амино включает алкил, алкилсульфонил, ацил или алкилоксикарбонил), замещенный или незамещенный карбамоил (пример заместителя для замещенного карбамоила включает гидроксиалкил, алкилоксиалкил или алкилокси), замещенный или незамещенный алкилкарбамоил (пример заместителя для замещенного алкилкарбамоила включает гидрокси или алкиламино), алкилоксикарбамоил, замещенный или незамещенный ациламино (пример заместителя для замещенного ациламино включает гидрокси, циано, алкилокси, замещенный или незамещенный амино (пример заместителя для замещенного амино включает алкил)), алкилокси, алкилсульфониламино, алкилоксикарбониламино, гидроксиимино или алкилоксиимино, например, метил, этил, изопропил, трет-бутил или CF3);
замещенный или незамещенный алкенил (пример заместителя для замещенного алкенила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил, например, винил);
замещенный или незамещенный алкинил (пример заместителя для замещенного алкинила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил, например, этинил);
замещенный или незамещенный арил (пример заместителя для замещенного арила включает галоген, гидрокси, карбокси, нитро, циано, замещенный или незамещенный алкил (пример заместителя для замещенного алкила включает гидрокси или алкилокси), арил, циклоалкил, циклоалкенил, гетероарил, гетероциклил, алкилокси, арилокси, арилалкил, карбамоил, ациламино, алкилсульфониламино или амино, например, фенил или нафтил);
замещенный или незамещенный циклоалкил (пример заместителя для замещенного циклоалкила включает галоген, гидрокси, карбокси, нитро, циано, замещенный или незамещенный алкил (пример заместителя для замещенного алкила включает галоген, гидрокси, алкилокси, ациламино, алкиламино или алкилкарбонилокси), арил, циклоалкил, циклоалкенил, гетероарил, гетероциклил, карбамоилоксиалкил, ациламино, карбамоил или алкилсульфониламино, например, циклопропил или циклобутил);
замещенный или незамещенный циклоалкенил (пример заместителя для замещенного циклоалкенила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил, гетероциклил, амино или ациламино, например, циклопропенил);
замещенный или незамещенный гетероарил (пример заместителя для замещенного гетероарила включает галоген, гидрокси, карбокси, нитро, циано, замещенный или незамещенный алкил (пример заместителя для замещенного алкила включает карбокси), арил, циклоалкил, циклоалкенил, гетероарил, гетероциклил или алкилокси);
замещенный или незамещенный гетероциклил (пример заместителя для замещенного гетероциклила включает галоген, гидрокси, карбокси, нитро, циано, замещенный или незамещенный алкил (пример заместителя для замещенного алкила включает гидрокси), арил, циклоалкил, циклоалкенил, гетероарил, гетероциклил, ацил, алкиламино, алкилокси или ациламино);
замещенный или незамещенный алкилокси (пример заместителя для замещенного алкилокси включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил, гетероциклил, алкилокси, алкилоксикарбонил, ациламино, замещенный или незамещенный карбамоиламино (пример заместителя для замещенного карбамоиламино включает алкил) или ацил, например, метокси или этокси);
замещенный или незамещенный арилокси (пример заместителя для замещенного арилокси включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил, например, фенилокси);
замещенный или незамещенный циклоалкилокси (пример заместителя для замещенного циклоалкилокси включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный циклоалкенилокси (пример заместителя для замещенного циклоалкенилокси включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный гетероарилокси (пример заместителя для замещенного гетероарилокси включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный гетероциклилокси (пример заместителя для замещенного гетероциклилокси включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный арилалкил (пример заместителя для замещенного арилалкила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил, например, бензил);
замещенный или незамещенный арилалкилокси (пример заместителя для замещенного арилалкилокси включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил, например, бензилокси);
замещенный или незамещенный циклоалкилалкилокси (пример заместителя для замещенного циклоалкилалкилокси включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный силилокси;
замещенный или незамещенный амино (например, замещенный или незамещенный алкиламино (пример заместителя для замещенного алкиламино включает алкилокси, гетероциклил, циклоалкил или гидрокси, например, метиламино, этиламино, диметиламино), замещенный или незамещенный ациламино (пример заместителя для замещенного ациламино включает карбокси, например, ацетиламино или бензоиламино), ариламино, арилалкиламино (например, бензиламино или тритиламино), гидроксиамино, алкилоксикарбониламино, алкилсульфониламино, замещенный или незамещенный карбамоиламино (пример заместителя для замещенного карбамоиламино включает бензил), гетероциклилкарбониламино, арилсульфониламино, гетероарилсульфониламино или замещенный или незамещенный сульфамоиламино (пример заместителя для замещенного сульфамоиламино включает алкил));
замещенный или незамещенный карбамоил (пример заместителя для замещенного карбамоила включает гидрокси, циано, замещенный или незамещенный алкил (пример заместителя для замещенного алкила включает гидрокси, алкилокси, алкиламино или диметиламино), арил, циклоалкил, циклоалкенил, гетероарил, гетероциклил, гетероциклилалкил, C2H4OH или алкилокси, например, алкилкарбамоил (например, метилкарбамоил, этилкарбамоил, диметилкарбамоил, фенилэтилкарбамоил, диметиламиноэтилкарбамоил, изопропилкарбамоил или гидроксиэтилкарбамоил), алкилсульфонилкарбамоил, гетероарилалкилкарбамоил или замещенный или незамещенный алкилоксикарбамоил);
замещенный или незамещенный карбамоилокси (пример заместителя для замещенного карбамоилокси включает галоген, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный ацил (пример заместителя для замещенного ацила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил, например, алкилкарбонил, арилкарбонил, гетероарилкарбонил, гетероциклилкарбонил, формил или ацетил);
замещенный или незамещенный алкилсульфонил (пример заместителя для замещенного алкилсульфонила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил, например, метансульфонил или этансульфонил);
замещенный или незамещенный арилсульфонил (пример заместителя для замещенного арилсульфонила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный циклоалкилсульфонил (пример заместителя для замещенного циклоалкилсульфонила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный циклоалкенилсульфонил (пример заместителя для замещенного циклоалкенилсульфонила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный гетероарилсульфонил (пример заместителя для замещенного гетероарилсульфонила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный гетероциклилсульфонил (пример заместителя для замещенного гетероциклилсульфонила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный сульфамоил (пример заместителя для замещенного сульфамоила включает галоген, замещенный или незамещенный алкил (пример заместителя для замещенного алкила включает гидрокси), арил, циклоалкил, циклоалкенил, гетероарил, гетероциклил, ацил или C2H4OH);
замещенный или незамещенный алкилоксикарбонил (пример заместителя для замещенного алкилоксикарбонила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил, например, метоксикарбонил, этоксикарбонил или трет-бутоксикарбонил);
замещенный или незамещенный арилоксикарбонил (пример заместителя для замещенного арилоксикарбонила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный циклоалкилоксикарбонил (пример заместителя для замещенного циклоалкилоксикарбонила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный циклоалкенилоксикарбонил (пример заместителя для замещенного циклоалкенилоксикарбонила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный гетероарилоксикарбонил (пример заместителя для замещенного гетероарилоксикарбонила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный гетероциклилоксикарбонил (пример заместителя для замещенного гетероциклилоксикарбонила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный алкилоксиарил (пример заместителя для замещенного алкилоксиарила включает ациламино);
алкилсульфинил; циклоалкилсульфинил; арилсульфинил; гетероарилсульфинил; гетероциклилсульфинил;
нитрозо;
алкенилокси (например, винилокси или аллилокси);
азидо;
изоциано; изоцианато; тиоцианато; изотиоцианато; меркапто;
алкилтио (например, метилтио);
P(=O)(OH)2,
P(=O)(OCH2CH3)2,
C(=O)C(=O)OH,
C(CH3)=N-O-CH3,
C(CH3)=N-OH,
формилокси; галогенформил; оксало; тиоформил; тиокарбокси; дитиокарбокси; тиокарбамоил; сульфино; сульфо; сульфоамино; гидразин; уреидо; амидино; гуанидин; фталимидо; оксо и тому подобное.
Предпочтительный пример заместителя «замещенный карбамоил», «замещенный сульфамоил» или «замещенный амино» включает
замещенный или незамещенный алкил (пример заместителя для замещенного алкила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный алкенил (пример заместителя для замещенного алкенила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный арил (пример заместителя для замещенного арила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный гетероарил (пример заместителя для замещенного гетероарила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный циклоалкил (пример заместителя для замещенного циклоалкила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный циклоалкенил (пример заместителя для замещенного циклоалкенила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный гетероциклил (пример заместителя для замещенного гетероциклила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный арилалкил (пример заместителя для замещенного арилалкила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный алкилокси (пример заместителя для замещенного алкилокси включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный арилокси (пример заместителя для замещенного арилокси включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный циклоалкилокси (пример заместителя для замещенного циклоалкилокси включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный циклоалкенилокси (пример заместителя для замещенного циклоалкенилокси включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный гетероарилокси (пример заместителя для замещенного гетероарилокси включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный гетероциклилокси (пример заместителя для замещенного гетероциклилокси включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный ацил (пример заместителя для замещенного ацила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный алкилоксикарбонил (пример заместителя для замещенного алкилоксикарбонила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
арилоксикарбонил; циклоалкилоксикарбонил; циклоалкенилоксикарбонил; гетероарилоксикарбонил; гетероциклилоксикарбонил;
замещенный или незамещенный сульфамоил (пример заместителя для замещенного сульфамоила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный алкилсульфонил (пример заместителя для замещенного алкилсульфонила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный арилсульфонил (пример заместителя для замещенного арилсульфонила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный гетероарилсульфонил (пример заместителя для замещенного гетероарилсульфонила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный циклоалкилсульфонил (пример заместителя для замещенного циклоалкилсульфонила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный циклоалкенилсульфонил (пример заместителя для замещенного циклоалкенилсульфонила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный гетероциклилсульфонил (пример заместителя для замещенного гетероциклилсульфонила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
замещенный или незамещенный карбамоил (пример заместителя для замещенного карбамоила включает галоген, гидрокси, карбокси, нитро, циано, алкил, арил, циклоалкил, циклоалкенил, гетероарил или гетероциклил);
галоген; гидрокси; карбокси; нитро; циано; алкилсульфинил; циклоалкилсульфинил; циклоалкенилсульфинил; арилсульфинил; гетероарилсульфинил; гетероциклилсульфинил; амино или тому подобное.
Алкильная часть «алкиламино», «арилалкиламино», «алкилоксикарбониламино», «алкилсульфониламино», «алкилкарбамоила», «алкилсульфонилкарбамоила», «гетероарилалкилкарбамоила», «алкилоксикарбамоила», «алкилкарбонила», «гидроксиалкила», «алкилоксиалкила», «алкилоксиимино», «карбамоилоксиалкила», «алкилоксиарила», «алкилкарбонилокси» и «алкилсульфинила» подразумевает вышеописанный «алкил».
Алкенильная часть «алкенилокси» подразумевает вышеописанный «алкенил».
Арильная часть «арилалкила», «арилалкилокси», «ариламино», «арилалкиламино», «арилсульфониламино», «арилкарбонила», «арилоксикарбонила», «алкилоксиарила» и «арилсульфинила» подразумевает вышеописанный «арил».
Гетероарильная часть «гетероарилсульфониламино», «гетероарилалкилкарбамоила», «гетероарилкарбонила», «гетероарилоксикарбонила» и «гетероарилсульфинила» подразумевает вышеописанный «гетероарил».
Циклоалкильная часть «циклоалкилсульфинила» и «циклоалкилоксикарбонила» подразумевает вышеописанный «циклоалкил».
Циклоалкенильная часть «циклоалкенилоксикарбонила» подразумевает вышеописанный «циклоалкенил».
Гетероциклильная часть «гетероциклилкарбониламино», «гетероциклилалкила», «гетероциклилкарбонила», «гетероциклилоксикарбонила» и «гетероциклилсульфинила» подразумевает вышеописанный «гетероциклил».
Из соединений по настоящему изобретению предпочтительными являются следующие варианты.
Кольцо A включает ароматический гетероцикл или неароматический гетероцикл, который конденсирован со смежным 5-членным кольцом.
Кольцо A в формуле (I) включает ароматический гетероцикл или неароматический гетероцикл, который конденсирован со смежным 5-членным кольцом. Хотя кольцо A содержит не только моноцикл, но также конденсированное кольцо (от 2 до 3 конденсированное кольцо), особенно предпочтительным является моноцикл. Подходящее произвольно выбранное положение в кольце A может быть замещено от 1 до 7 R1.
В качестве предпочтительного варианта осуществления изобретения примеры кольца A включают следующие кольца. Подходящее произвольно выбранное положение в кольце A может быть замещено от 1 до 3 R1.

где R1a имеет те же значения, что указаны выше.
R1, в каждом случае независимо, представляет собой галоген, гидрокси, циано, нитро, карбокси, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный гетероциклил, замещенный или незамещенный алкилокси, замещенный или незамещенный арилокси, замещенный или незамещенный гетероарилокси, замещенный или незамещенный циклоалкилокси, замещенный или незамещенный циклоалкенилокси, замещенный или незамещенный гетероциклилокси, замещенный или незамещенный алкилтио, замещенный или незамещенный арилтио, замещенный или незамещенный гетероарилтио, замещенный или незамещенный циклоалкилтио, замещенный или незамещенный циклоалкенилтио, замещенный или незамещенный гетероциклилтио, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный арилсульфонил, замещенный или незамещенный гетероарилсульфонил, замещенный или незамещенный циклоалкилсульфонил, замещенный или незамещенный циклоалкенилсульфонил, замещенный или незамещенный гетероциклилсульфонил, замещенный или незамещенный ацил, замещенный или незамещенный карбамоил, замещенный или незамещенный сульфамоил или замещенный или незамещенный амино.
m равно целому числу от 0 до 7. Предпочтительно, m равно целому числу от 0 до 3. В частности, предпочтительнее, когда m равно целому числу от 1 до 2 и по меньшей мере один из R1 представляет собой галоген, и, когда m равно целому числу от 1 до 2 и по меньшей мере один из R1 представляет собой замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил или замещенный или незамещенный гетероциклил. В дополнение, является предпочтительным, когда m равно 2, один из R1 представляет собой галоген и другой из R1 представляет собой замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил или замещенный или незамещенный гетероциклил.
R2 представляет собой водород или замещенный или незамещенный алкил, и, предпочтительно, водород.
X представляет собой одинарную связь, -S-, -O-, -NR3-, -C(=O)-, -NR3C(=O)-, -C(=O)NR3-, -NR3-SO2-, -SO2-NR3- или -C(=O)-O-, и, предпочтительно, одинарную связь, -S- или -O-. Далее предпочтительно, когда X представляет собой -O-.
R3 представляет собой водород или замещенный или незамещенный алкил, и, предпочтительно, водород.
Y представляет собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил или замещенный или незамещенный гетероциклил.
Предпочтительно, Y представляет собой замещенный или незамещенный алкил, замещенный или незамещенный арил, или замещенный или незамещенный гетероарил.
Далее предпочтительно, когда Y представляет собой замещенный или незамещенный арил или замещенный или незамещенный гетероарил.
R1a, в каждом случае независимо, представляет собой водород, галоген, гидрокси, циано, нитро, карбокси, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный гетероциклил, замещенный или незамещенный алкилокси, замещенный или незамещенный арилокси, замещенный или незамещенный гетероарилокси, замещенный или незамещенный циклоалкилокси, замещенный или незамещенный циклоалкенилокси, замещенный или незамещенный гетероциклилокси, замещенный или незамещенный алкилтио, замещенный или незамещенный арилтио, замещенный или незамещенный гетероарилтио, замещенный или незамещенный циклоалкилтио, замещенный или незамещенный циклоалкенилтио, замещенный или незамещенный гетероциклилтио, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный арилсульфонил, замещенный или незамещенный гетероарилсульфонил, замещенный или незамещенный циклоалкилсульфонил, замещенный или незамещенный циклоалкенилсульфонил, замещенный или незамещенный гетероциклилсульфонил, замещенный или незамещенный ацил, замещенный или незамещенный карбамоил, замещенный или незамещенный сульфамоил или замещенный или незамещенный амино.
n равно целому числу от 0 до 6. Предпочтительно, n равно целому числу от 0 до 2.
R4 является группой, представленной формулой: -(CR6R7)q-Z.
R6, в каждом случае независимо, представляет собой водород, гидрокси, замещенный или незамещенный алкил или замещенный или незамещенный амино.
R7, в каждом случае независимо, представляет собой водород, гидрокси, замещенный или незамещенный алкил или замещенный или незамещенный амино.
Предпочтительно R6, в каждом случае независимо, представляет собой замещенный или незамещенный алкил.
Предпочтительно R7, в каждом случае независимо, представляет собой замещенный или незамещенный алкил.
q равно целому числу от 0 до 4. Предпочтительно q равно 0 или 1, и далее предпочтительно, когда q равно 1.
Z представляет собой
(1) -COOH,
(2) -COOR8,
(3) -OH,
(4) -C(=O)-NR9R10,
(5) -NR9-C(=O)-R11,
(6) -NR9-SO2-R8,
(7) -SO2-NR9R10,
(8) -SO2-NR9-C(=O)-R8,
(9) -SO2-NR9-COOR8,
(10) -SO2-NR9-C(=O)-NR9R10,
(11) -C(=O)-NR9-SO2-R8,
(12) -NR9-C(=O)-NR9R10,
(13) -P(=O)(-OH)2,
(14) -P(=O)H(-OH),
(15) -P(=O)(-R11)2,
(16) -P(=O)(-OR11)2,
(17) -P(=O)(-OH)(-R11),
(18) -P(=O)(-OH)(-OR11),
(19) -P(=O)(-R11)(-OR11),
(20) -P(=O)(-OH)(-O-(CR6R7)0-4-R12),
(21) -P(=O)(-NR9-CR13R14-COOH)2,
(22) -P(=O)(-NR9-CR13R14-COOR11)2,
(23) -P(=O)(-OH)(-NR9-CR13R14-COOH),
(24) -P(=O)(-OH)(-NR9-CR13R14-COOR11),
(25) -P(=O)(-NR9-CR13R14-COOR11)(-O-R8),
(26) -P(=O)(-O-CR13R14-O-C(=O)-R11)2,
(27) -P(=O)(-OH)(-O-CR13R14-O-C(=O)-R11),
(28) -P(=O)(-OH)(-O-(CR6R7)1-4-S(=O)-R11),
(29) -P(=O)(-O-(CR6R7)1-4-S(=O)-R11)2,
(30) -P(=O)(-OH)(-O-(CR6R7)1-4-S-C(=O)-R11),
(31) -P(=O)(-O-(CR6R7)1-4-S-C(=O)-R11)2,
(32) -NR9-C(=O)-O-R11
или
(33)
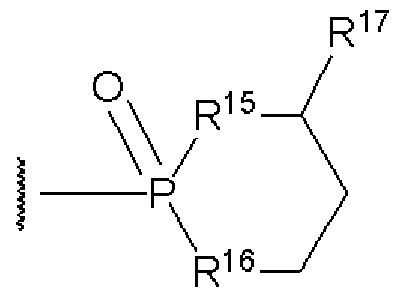
Предпочтительным является,
(1) -COOH,
(3) -OH,
(4) -C(=O)-NR9R10, или
(5) -NR9-C(=O)-R11.
R8 представляет собой замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил или замещенный или незамещенный гетероциклил.
R9 и R10, каждый независимо, представляют собой водород или замещенный или незамещенный алкил.
Предпочтительно, R9 и R10 представляют собой водород.
R11 представляет собой замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил или замещенный или незамещенный гетероциклил.
Предпочтительно, R11 представляет собой замещенный или незамещенный алкил.
R12 представляет собой замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил или замещенный или незамещенный гетероциклил.
R13 и R14, каждый независимо, представляют собой водород или замещенный или незамещенный алкил.
R15 и R16, каждый независимо, представляют собой -O- или -NH-.
R17 представляет собой замещенный или незамещенный арил, или замещенный или незамещенный гетероарил.
R5 представляет собой галоген, гидрокси, циано, нитро, карбокси, замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный гетероциклил, замещенный или незамещенный алкилокси, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный карбамоил или замещенный или незамещенный амино.
Предпочтительно, R5 представляет собой замещенный или незамещенный алкил.
p равно целому числу от 0 до 2.
R18, в каждом случае независимо, представляет собой водород, галоген, гидрокси, циано, нитро, карбокси, замещенный или незамещенный алкил, замещенный или незамещенный алкилокси, замещенный или незамещенный алкилоксикарбонил, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный карбамоил или замещенный или незамещенный амино.
R19, в каждом случае независимо, представляет собой водород, галоген, гидрокси, циано, нитро, карбокси, замещенный или незамещенный алкил, замещенный или незамещенный алкилокси, замещенный или незамещенный алкилоксикарбонил, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный карбамоил или замещенный или незамещенный амино.
r равно целому числу от 1 до 4. Предпочтительно, r равно 1.
R1X представляет собой галоген.
Среди соединений по настоящему изобретению, когда R2 представляет собой водород, соединение, представленное формулой (I), является соединением, представленным формулой (I’), или соединением, представленным формулой (I").

Один или несколько атомов водорода, углерода или других атомов соединения формулы (I) по настоящему изобретению могут быть заменены на изотоп водорода, углерода или других атомов.
Например, соединения формулы (I) включают все виды меченых радиоизотопов соединений формулы (I). “Меченые радиоизотопы”, “виды меченых радиоизотопов” и тому подобные соединения формулы (I) охватываются настоящим изобретением и могут быть использованы в качестве инструмента исследования и/или диагностики в фармакокинетических исследованиях метаболизма и в анализах связывания.
Примеры изотопов, которые могут быть введены в соединение формулы (I) по настоящему изобретению включают изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора и хлора, такие как 2H, 3H, 13C, 14C, 15N, 18O, 17O, 31P, 32P, 35S, 18F и 36Cl, соответственно. Меченые радиоизотопы соединений по настоящему изобретению могут быть получены способами, известными в данной области. Например, тритированные соединения формулы (I) могут быть получены путем введения трития в конкретное соединение формулы (I), например, путем каталитического дегалогенирования тритием. Данный способ может включать взаимодействие подходящего галоген-замещенного предшественника соединения формулы (I) с газообразным тритием в присутствии подходящего катализатора, такого как Pd/C, в присутствии или в отсутствие основания. Другие подходящие способы получения тритированного соединения могут быть найдены в Isotopes in the Physical and Biomedical Sciences, Vol. 1, Labeled Compounds (Part A), Chapter 6 (1987). 14C-меченные соединения могут быть получены при использовании исходных продуктов, имеющих 14C углерод.
В качестве фармацевтически приемлемой соли настоящего соединения могут быть включены следующие соли.
В качестве соли основания, пример включает соль щелочного металла, такую как соль натрия или соль калия; соль щелочноземельного металла, такую как соль кальция или соль стронция; соль металла, такую как соль бериллия, соль магния, соль цинка или соль переходного металла; соль аммония; соль алифатического амина, такую как соль триметиламина, соль триэтиламина, соль дициклогексиламина, соль этаноламина, соль диэтаноламина, соль триэтаноламина, соль прокаина, соль меглумина, соль диэтаноламина или соль этилендиамина; соль аралкиламина, такую как соль N,N-дибензилэтилендиамина или соль бенетамина; соль гетероцилического ароматического амина, такую как соль пиридина, соль пиколина, соль хинолина или соль изохинолина; соль четвертичного аммония, такую как соль тетраметиламмония, соль тетраэтиламмония, соль бензилтриметиламмония, соль бензилтриэтиламмония, соль бензилтрибутиламмония, соль метилтриоктиламмония или соль тетрабутиламмония; соль основной аминокислоты, такую как соль аргинина или соль лизина или тому подобное.
В качестве соли кислоты пример включает соль неорганической кислоты, такую как гидрохлорид, сульфат, нитрат, фосфат, карбонат, гидрокарбонат или перхлорат; соль органической кислоты, такую как ацетат, пропионат, лактат, малеат, фумарат, тартрат, малат, цитрат или аскорбат; сульфонат, такой как метансульфонат, изетионат, бензолсульфонат или п-толуолсульфонат; соль кислой аминокислоты, такую как аспартат или глутамат или тому подобное.
Термин “сольват” подразумевает сольват соединения по настоящему изобретению или его фармацевтически приемлемую соль, и пример включает спиртовой (например, этанол) сольват, гидрат или тому подобное. Пример гидрата включает моногидрат, дигидрат или тому подобное.
Соединение, представленное формулой (I), по настоящему изобретению, его фармацевтически приемлемая соль или сольват могут образовывать пролекарство, и настоящее изобретение охватывает также такие различные типы пролекарств. Пролекарства представляют собой производное соединения по настоящему изобретению, которое имеет химически или метаболически разлагаемую группу, и соединение, которое преобразуется в соединение по настоящему изобретению, являющееся фармацевтически активным, с помощью сольволиза или in vivo в физиологических условиях. Пролекарства включают соединение, которое преобразуется в соединение, представленное формулой (I), путем ферментативного окисления, восстановления, гидролиза и тому подобное в живых организмах в физиологических условиях; соединение, которое преобразуется в соединение, представленное формулой (I), путем гидролиза с помощью, например, желудочной кислоты; и тому подобное. Способ выбора и способ получения соответствующего пролекарственного производного описаны, например, в работе Design of Prodrugs, Elsevier, Amsterdam 1985. Пролекарства могут обладать активностью сами по себе.
Когда соединение, представленное формулой (I), его фармацевтически приемлемая соль или сольват имеют гидроксильную группу, примерами пролекарств являются такие, как ацилоксипроизводное и сульфонилоксипроизводное, и эти производные получают, например, путем взаимодействия соединения, имеющего гидроксигруппу, и соответствующего ацилгалогенида, соответствующего ангидрида кислоты, соответствующего сульфонилхлорида, соответствующего сульфонилангидрида и смешанного ангидрида, или реакцией с использованием конденсирующего агента. Их примеры включают CH3COO-, C2H5COO-, трет-BuCOO-, C15H31COO-, PhCOO-, (м-NaOOCPh)COO-, NaOOCCH2CH2COO-, CH3CH(NH2)COO-, CH2N(CH3)2COO-, CH3SO3-, CH3CH2SO3-, CF3SO3-, CH2FSO3-, CF3CH2SO3-, п-CH3-O-PhSO3-, PhSO3- и п-CH3PhSO3-.
Термин «активирование» подразумевает, что соединение по настоящему изобретению активирует действие AMPK.
Термин «фармацевтически приемлемый» подразумевает профилактическую или терапевтическую безвредность.
Общий способ получения соединения по настоящему изобретению проиллюстрирован далее. Для экстракции, очистки и тому подобного может быть использована обработка, осуществляемая общеизвестными в органической химии экспериментами.
Соединение, представленное формулой (I-H), может быть синтезировано следующим образом.

где каждый символ имеет те же значения, что указаны выше, и в качестве соединения, представленного формулой (I-1), может быть использовано известное соединение и соединение, которое получают из известного соединения общеизвестным способом. «ak» представляет собой C1-C3 алкил, «Hal» представляет собой галоген, Pro представляет собой защитную группу. Pro включает бензильную группу, бензоильную группу и SEM (триметилсилилэтоксиметил) и тому подобное.
Первая стадия
Первой стадией является стадия получения соединения, представленного формулой (I-2), путем восстановления соединения, представленного формулой (I-1).
В качестве растворителя пример включает N,N-диметилформамид, диметилсульфоксид, ароматические углеводороды (например, толуол, бензол, ксилол и т.д.), насыщенные углеводороды (например, циклогексан, гексан и т.д.), галогенированные углеводороды (например, дихлорметан, хлороформом, 1,2-дихлорэтан и т.д.), простые эфиры (например, тетрагидрофуран, диэтиловый эфир, диоксан, 1,2-диметоксиэтан и т.д.), сложные эфиры (например, метилацетат, этилацетат и т.д.), кетоны (например, ацетон, метилэтилкетон и т.д.), нитрилы (например, ацетонитрил и т.д.), спирты (например, метанол, этанол, трет-бутанол и т.д.), вода, смешанный растворитель или тому подобное.
Предпочтительно могут быть использованы галогенированные углеводороды (например, дихлорметан, хлороформом, 1,2-дихлорэтан и т.д.), простые эфиры (например, тетрагидрофуран, диэтиловый эфир, диоксан, 1,2-диметоксиэтан и т.д.), сложные эфиры (например, метилацетат, этилацетат и т.д.), нитрилы (например, ацетонитрил и т.д.), спирты (например, метанол, этанол, трет-бутанол и т.д.) или вода.
Реакция может быть осуществлена в присутствии Fe, Pd/C, Sn или тому подобного при температуре от комнатной до 100°C в течение от 0,5 до 12 часов.
Хотя может быть использована кислота, нет необходимости в ее использовании. Предпочтительно кислота включает хлористоводородную кислоту, хлорид аммония или тому подобное.
Данная стадия может быть осуществлена с использованием условий реакции, которая известна как реакция гидрирования. Восстановление, например, может быть осуществлено в присутствии Pd/C.
Данная стадия также может быть осуществлена с использованием органической химической реакции, которая известна как способ восстановления нитрогруппы.
Данная стадия может быть осуществлена в условиях, при которых заместитель на кольце A соответствующим образом защищен.
Вторая стадия
Второй стадией является стадия получения соединения, представленного формулой (I-3), путем взаимодействия соединения, представленного формулой (I-2), и соединения, представленного формулой: (akO)3CH.
В качестве растворителя может быть использован растворитель, описанный на первой стадии. Предпочтительно, могут быть использованы галогенированные углеводороды (например, дихлорметан, хлороформом, 1,2-дихлорэтан и т.д.), спирты (например, метанол, этанол, трет-бутанол и т.д.) или тому подобное.
Хотя может быть использована кислота, нет необходимости в ее использовании. Предпочтительно, кислота включает хлористоводородную кислоту, NH3SO3 или тому подобное.
Реакция может быть осуществлена при температуре от комнатной до 150°C в течение от 0,5 до 12 часов.
В качестве соединения, представленного формулой: (akO)3CH, примером является (MeO)3CH, (EtO)3CH или тому подобное.
Третья стадия
Третьей стадией является стадия получения соединения, представленного формулой (I-4), исходя из соединения, представленного формулой (I-3).
В качестве растворителя может быть использован растворитель, описанный на первой стадии. Предпочтительно, могут быть использованы N,N-диметилформамид, простые эфиры (например, тетрагидрофуран, диэтиловый эфир, диоксан, 1,2-диметоксиэтан и т.д.), галогенированные углеводороды (например, дихлорметан, хлороформом, 1,2-дихлорэтан и т.д.), нитрилы (например, ацетонитрил и т.д.) или тому подобное.
В качестве основания примером являются гидриды металлов (например, гидрид натрия и т.д.), гидроксиды металлов (например, гидроксид натрия, гидроксид калия, гидроксид лития, гидроксид бария и т.д.), карбонаты металлов (например, карбонат натрия, карбонат кальция, карбонат цезия и т.д.), алкоксиды металлов (например, метоксид натрия, этоксид натрия, трет-бутоксид калия и т.д.), гидрокарбонат натрия, металлический натрий, амиды металлов, органические амины (например, триэтиламин, диизопропилэтиламин, DBU, 2,6-лутидин и т.д.), пиридин, алкиллитий (н-BuLi, втор-BuLi, трет-BuLi) или тому подобное.
Предпочтительно, может быть использован металлический натрий, органические амины (например, триэтиламин, диизопропилэтиламин, DBU, 2,6-лутидин и т.д.), пиридин или тому подобное.
Реакция может быть осуществлена при температуре 0 до 100°C в течение от 0,5 до 12 часов.
Четвертая стадия
Четвертой стадией является стадия получения соединения, представленного формулой (I-5), путем галогенирования соединения, представленного формулой (I-4).
В качестве растворителя может быть использован растворитель, описанный на первой стадии. Предпочтительно, могут быть использованы N-диметилформамид, галогенированные углеводороды (например, дихлорметан, хлороформом, 1,2-дихлорэтан и т.д.), простые эфиры (например, тетрагидрофуран, диэтиловый эфир, диоксан, 1,2-диметоксиэтан и т.д.), нитрилы (например, ацетонитрил и т.д.) или тому подобное. Далее предпочтительно, когда могут быть использованы спирты (например, метанол, этанол, трет-бутанол и т.д.).
В качестве основания могут быть использованы основания, описанные на третьей стадии. Предпочтительно, могут быть использованы гидриды металлов (например, гидрид натрия и т.д.), амиды металлов, алкиллитий (н-BuLi, втор-BuLi, трет-BuLi) или тому подобное.
Реакция может быть осуществлена при температуре от -78 до 50°C в течение от 0,5 до 24 часов.
В качестве галогенирующего агента могут быть использованы I2, Br2, NIS (N-йодсукцинимид), NBS (N-бромсукцинимид) или NCS (N-хлорсукцинимид).
Среди соединений, представленных формулой (I-6), соединение, где X представляет собой -S-, -O- или -NR3, может быть синтезировано следующим образом.
Пятая стадия
Пятой стадией является стадия получения соединения, представленного формулой (I-6), путем взаимодействия соединения, представленного формулой (I-5), и соединения, представленного формулой: H-X-Y.
Когда X представляет собой -O-, пример соединения, представленного формулой: H-O-Y, включает фенол, метанол, этанол или тому подобное.
Когда X представляет собой -S-, пример соединения, представленного формулой: H-S-Y, включает тиофенол, метантиол, этантиол или тому подобное.
Когда X представляет собой -NR3-, пример соединения, представленного формулой: H-NR3-Y, включает анилин, метиламин, этиламин или тому подобное.
В качестве растворителя может быть использован растворитель, описанный на первой стадии. Предпочтительно, может быть использован N-диметилформамид, диметилсульфоксид, простые эфиры (например, тетрагидрофуран, диэтиловый эфир, диоксан, 1,2-диметоксиэтан и т.д.), нитрилы (например, ацетонитрил и т.д.) или тому подобное.
В качестве основания могут быть использованы основания, описанные на третьей стадии. Предпочтительно, могут быть использованы гидриды металлов (например, гидрид натрия и т.д.), карбонаты металлов (например, карбонат натрия, карбонат кальция, карбонат цезия и т.д.), амиды металлов, органические амины (например, триэтиламин, диизопропилэтиламин, DBU, 2,6-лутидин и т.д.), пиридин, алкиллитий (н-BuLi, втор-BuLi, трет-BuLi) или тому подобное.
Далее предпочтительно, когда могут быть использованы гидриды металлов (например, гидрид натрия и т.д.) или карбонаты металлов (например, карбонат натрия, карбонат кальция, карбонат цезия и т.д.).
Реакция может быть осуществлена при температуре 0 до 100°C в течение от 0,5 до 12 часов.
(Когда Hal представляет собой бром или йод)
Реакция может быть осуществлена с использований условий для проведения реакции, которая известна как реакция Ульмана.
В качестве растворителя может быть использован растворитель, описанный на первой стадии. Предпочтительно, могут быть использованы N-диметилформамид, диметилсульфоксид, простые эфиры (например, тетрагидрофуран, диэтиловый эфир, диоксан, 1,2-диметоксиэтан и т.д.), нитрилы (например, ацетонитрил и т.д.) или тому подобное.
В качестве основания могут быть использованы основания, описанные на третьей стадии. Предпочтительно, могут быть использованы гидриды металлов (например, гидрид натрия и т.д.), карбонаты металлов (например, карбонат натрия, карбонат кальция, карбонат цезия и т.д.), амиды металлов, органические амины (например, триэтиламин, диизопропилэтиламин, DBU, 2,6-лутидин и т.д.), пиридин, алкиллитий (н-BuLi, втор-BuLi, трет-BuLi) или тому подобное.
Далее предпочтительно, когда могут быть использованы карбонаты металлов (например, карбонат натрия, карбонат кальция, карбонат цезия и т.д.).
В качестве катализатора может быть использован йодид меди.
Реакция может быть осуществлена при температуре от комнатной до 100°C в течение от 0,5 до 12 часов.
Шестая стадия
Шестой стадией является стадия получения соединения, представленного формулой (I-H), путем удаления защитной группы у соединения, представленного формулой (I-6).
В качестве растворителя может быть использован растворитель, описанный на первой стадии. Предпочтительно, могут быть использованы N-диметилформамид, галогенированные углеводороды (например, дихлорметан, хлороформом, 1,2-дихлорэтан и т.д.), простые эфиры (например, тетрагидрофуран, диэтиловый эфир, диоксан, 1,2-диметоксиэтан и т.д.), сложные эфиры (например, метил ацетат, этилацетат и т.д.), нитрилы (например, ацетонитрил и т.д.), спирты (например, метанол, этанол, трет-бутанол и т.д.) или тому подобное.
Реакция может быть осуществлена в присутствии хлористоводородной кислоты, ТФУ (трифторуксусной кислоты), TBAF (фторида тетрабутиламмония) или тому подобное при температуре 0 до 100°C в течение от 0,5 до 24 часов.
Из соединений, представленных формулой (I), соединение, где R2 представляет собой замещенный или незамещенный алкил, может быть синтезировано, например, исходя из соединения, представленного формулой (I-H), путем реакции алкилирования с использованием гидрида натрия и алкилгалогенида.
Соединение, представленное формулой (I-12), может быть синтезировано следующим образом.


где каждый символ имеет те же значения, что указаны выше, и в качестве соединения, представленного формулой (I-7), может быть использовано известное соединение и может быть использовано соединение, которое получают из известного соединения общеизвестным способом. «Hal» представляет собой галоген, и Pro’ представляет собой защитную группу. Pro’ включает бензильную группу и тому подобное.
Седьмая стадия
Седьмой стадией является стадия получения соединения, представленного формулой (I-8), путем взаимодействия соединения, представленного формулой (I-7), и соединения, представленного формулой: H2N-Pro’.
В качестве растворителя может быть использован растворитель, описанный на первой стадии. Предпочтительно, могут быть использованы N,N-диметилформамид, простые эфиры (например, тетрагидрофуран, диэтиловый эфир, диоксан, 1,2-диметоксиэтан и т.д.), спирты (например, метанол, этанол, трет-бутанол и т.д.) или тому подобное.
В качестве основания может быть использовано основание, описанное на третьей стадии. Предпочтительно, могут быть использованы гидриды металлов (например, гидрид натрия и т.д.), карбонаты металлов (например, карбонат натрия, карбонат кальция, карбонат цезия и т.д.), органические амины (например, триэтиламин, диизопропилэтиламин, DBU, 2,6-лутидин и т.д.) или тому подобное.
Реакция может быть осуществлена при температуре от комнатной до температуры, при которой используемый растворитель подвергают кипению с обратным холодильником, в течение от 0,5 до 24 часов.
Пример соединения, представленного формулой: H2N-Pro’, включает бензиламин или тому подобное.
Восьмая стадия
Восьмой стадией является стадия получения соединения, представленного формулой (I-9), путем восстановления соединения, представленного формулой (I-8).
В качестве растворителя может быть использован растворитель, описанный на первой стадии. Предпочтительно, могут быть использованы простые эфиры (например, тетрагидрофуран, диэтиловый эфир, диоксан, 1,2-диметоксиэтан и т.д.), спирты (например, метанол, этанол, трет-бутанол и т.д.), смешанный растворитель или тому подобное.
Количество используемого растворителя не ограничено, и может быть использовано любое количество, которое позволяет получить раствор, в котором может протекать реакция. В приготовленный таким образом раствор добавляют гетерогенный катализатор, и каталитическое восстановление может быть осуществлено в присутствии газообразного водорода.
В качестве гетерогенного катализатора может быть использован, например, гидроксид палладия, катализатор палладий/углерод, оксид платины, катализатор платина/углерод или тому подобное.
Реакция может быть осуществлена при температуре от комнатной до 100°C в течение от 0,5 до 24 часов.
Девятая стадия
Девятой стадией является стадия получения соединения, представленного формулой (I-10), путем удаления защитной группы у соединения, представленного формулой (I-9).
В качестве растворителя может быть использован растворитель, описанный на первой стадии. Предпочтительно, могут быть использованы простые эфиры (например, тетрагидрофуран, диэтиловый эфир, диоксан, 1,2-диметоксиэтан и т.д.), спирты (например, метанол, этанол, трет-бутанол и т.д.), смешанный растворитель или тому подобное.
Количество используемого растворителя не ограничено, и может быть использовано любое количество, которое позволяет получить раствор, в котором может протекать реакция. В приготовленный таким образом раствор добавляют гетерогенный катализатор, и каталитическое восстановление может быть осуществлено в присутствии газообразного водорода.
В качестве гетерогенного катализатора может быть использован, например, гидроксид палладия, катализатор палладий/углерод, оксид платины, катализатор платина/углерод или тому подобное.
Реакция может быть осуществлена при температуре от комнатной до 100°C в течение от 0,5 до 24 часов.
Десятая стадия
Десятой стадией является стадия получения соединения, представленного формулой (I-11) путем взаимодействия соединения, представленного формулой (I-10) и карбонилдиимидазола (CDI).
Вместо карбонилдиимидазола (CDI) в реакции могут быть использованы фосген, трифосген или тому подобное.
В качестве растворителя может быть использован растворитель, описанный на первой стадии. Предпочтительно, могут быть использованы N,N-диметилформамид, галогенированные углеводороды (например, дихлорметан, хлороформом, 1,2-дихлорэтан и т.д.), простые эфиры (например, тетрагидрофуран, диэтиловый эфир, диоксан, 1,2-диметоксиэтан и т.д.), нитрилы (например, ацетонитрил и т.д.) или тому подобное.
Реакция может быть осуществлена при температуре 0 до 100°C в течение от 0,5 до 12 часов.
Одиннадцатая стадия
Одиннадцатой стадией является стадия получения соединения, представленного формулой (I-12), путем взаимодействия соединения, представленного формулой (I-11), и галогенирующего агента.
Хотя в качестве растворителя может быть использован растворитель, описанный на первой стадии, не требуется использование какого-либо растворителя.
Галогенирующий агент включает оксихлорид фосфора, пентахлорид фосфора, оксалил хлорид, тионил хлорид, сульфурил хлорид, дихлортрифенил фосфоран или тому подобное. В частности, предпочтительным галогенирующим агентом является оксихлорид фосфора, пентахлорид фосфора, оксалил хлорид или тионил хлорид.
Реакция может быть осуществлена при температуре 0 до 120°C в течение от 0,5 до 24 часов.
Заместитель R1 на кольце A может быть введен следующим образом. Заместитель R1 может быть введен на любой из вышеописанных от первой до одиннадцатой стадий.

где каждый символ имеет те же значения, что указаны выше, и в качестве соединения, представленного формулой (I-1-1), может быть использовано известное соединение, и может быть использовано соединение, которое получают из известного соединения общеизвестным способом. «Hal» представляет собой галоген.
Двенадцатая стадия
Двенадцатой стадией является стадия получения соединения, представленного формулой (I-1-2), путем взаимодействия соединения, представленного формулой (I-1-1), и соединения, представленного формулой R1-B(OH)2, в присутствии палладиевого катализатора. В качестве соединения, представленного формулой R1-B(OH)2, может быть использован эфир бороновой кислоты.
В качестве растворителя может быть использован растворитель, описанный на первой стадии. Предпочтительно, могут быть использованы N-диметилформамид, ароматические углеводороды (например, толуоле, бензол, ксилол и т.д.) или простые эфиры (например, тетрагидрофуран, диэтиловый эфир, диоксан, 1,2-диметоксиэтан и т.д.).
В качестве основания может быть использовано основание, описанное на третьей стадии. Предпочтительно, могут быть использованы карбонаты металлов (например, карбонат натрия, карбонат кальция, карбонат цезия и т.д.) или органические амины (например, триэтиламин, диизопропилэтиламин, DBU, 2,6-лутидин и т.д.).
Реакция может быть осуществлена в присутствии палладиевого катализатора (например, Pd(PPh3)4, PdCl2, Pd(OAc)2, Pd(dba)2 и т.д.) и фосфинового лиганда (например, PPh3, BINAP и т.д.) при температуре, при которой используемый растворитель кипит, в течение от 0,5 до 12 часов.
При использовании микроволнового излучения реакция может быть осуществлена при температуре от 80 до 200°C в течение от 5 минут до одного часа.
Пример соединения, представленного формулой: R1-B(OH)2, включает фенилбороновую кислоту или тому подобное.
Могут быть введены различные типы заместителей в соединения по настоящему изобретению, как указано в ссылках (1) Alan R. Katriszly et al., Comprehensive Heterocyclic Chemistry, (2) Alan R. Katriszly et al., Comprehensive Heterocyclic Chemistry II, (3) RODD’S CHEMISTRY OF CARBON COMPOUNDS VOLUME IV HETEROCYCLIC COMPOUNDS, или тому подобное.
Соединение по настоящему изобретению обладает превосходным активирующим AMPK действием. Таким образом, соединение может быть использовано для лечения или предупреждения заболевания, касающегося AMPK, в частности, заболевания, такого как диабет II типа, гиперкликемия, метаболический синдром, ожирение, гиперхолестеринемия и/или гипертензия. В частности, соединение может быть использовано при лечении или предупреждении диабета II типа, гипергликемии, метаболического синдрома или ожирения.
Соединение, используемое в настоящем изобретении, может быть введено перорально или парентерально. Для перорального введения, соединение, используемое по настоящему изобретению, может быть использовано в виде дозированной формы обычных препаратов, например, твердых препаратов, таких как таблетка, порошок, гранула, капсула или тому подобное; водных препаратов; масляных суспензий; или жидких препаратов, таких как сироп или эликсир. Для парентерального введения соединение, используемое по настоящему изобретению, может быть использовано в виде водной или масляной суспензии для инъекции или в виде назального раствора. При получении таких препаратов, необязательно, могут быть использованы общеизвестные инертный наполнитель, связующее, смазывающий агент, водный растворитель, масляный растворитель, эмульгирующий агент, суспендирующий агент, консервант, стабилизатор и тому подобное. В частности, предпочтительным является использование в виде перорального препарата.
Препарат соединения, используемого по настоящему изобретению, может быть получен путем объединения (например, смешивания) соединения, используемого по настоящему изобретению, в терапевтически эффективном количестве с фармацевтически приемлемым носителем или разбавителем. Препарат соединения, используемого по настоящему изобретению, может быть получен известным способом с использованием хорошо известных и легко доступных ингредиентов.
Доза соединения, используемого по настоящему изобретению, отличается в зависимости от способа введения, возраста пациента, массы тела, состояния пациента и вида заболевания, и обычно при пероральном введении могут быть введены, обычно от около 0,05 мг до 3000 мг, предпочтительно от около 0,1 мг до 1000 мг в день для взрослого, если необходимо, раздельными дозами. При парентеральном введении могут быть введены от около 0,01 мг до 1000 мг, предпочтительно от около 0,05 мг до 500 мг в день для взрослого. Когда вводят соединение, используемое по настоящему изобретению, оно может быть использовано вместе с другими терапевтическими агентами.
Соединение по настоящему изобретению может быть использовано в сочетании с усилителем секреции инсулина (например, лекарственное средство на основе сульфонилмочевины (SU)), быстродействующим усилителем секреции инсулина (например, производное фенилаланина), ингибитором поглощения глюкозы (например, ингибитор α-глюкозидазы (лекарственное средство на основе α-GI)), лекарственным средством, усиливающим инсулиновую резистентность (например, лекарственное средство на основе бигуанида (BG лекарственное средство), тиазолидиновым производным (TZD лекарственное средство)), препаратом инсулина, ингибитором пептидилпептидазы IV (DPP-IV), агонистом рецептора GLP-1, ингибитором натрий-зависимого транспортера глюкозы 1 (SGLT1), ингибитором натрий-зависимого транспортера глюкозы 2 (SGLT 2) и тому подобное (здесь и далее указаны в качестве сопутствующих лекарственных средств в виде аббревиатур) с целью повышения эффективности соединения, снижения дозы соединения или тому подобное. В этом случае время, в течение которого вводят соединение по настоящему изобретению и сопутствующее лекарственное средство, не ограничено, и они могут быть введены субъекту введения одновременно или с интервалами. Кроме того, соединение по настоящему изобретению и сопутствующий препарат можно вводить в виде двух видов препарата, содержащего, каждый, активный ингредиент, и в виде одного препарата, содержащего оба активных ингредиента.
Доза сопутствующего лекарственного средства может быть соответствующим образом подобрана на основе клинически используемой дозы. В дополнение, соотношение смеси соединения по настоящему изобретению и сопутствующего лекарственного средства может быть соответствующим образом подобрано в зависимости от субъекта, которому ее вводят, пути введения, подвергаемой лечению болезни, симптомов, сочетания и тому подобное. Когда субъектом введения является человек, может быть использовано, например, от 0,01 до 100 массовых частей сопутствующего лекарственного средства на массовую часть соединения по настоящему изобретению.
Настоящее изобретение далее разъяснено с помощью последующих примеров, которые не предназначены для ограничения объема настоящего изобретения.
Представлены данные спектров ЯМР соединений по настоящему изобретению и промежуточных для их синтеза соединений. ЯМР анализ осуществляют в каждом примере регистрацией при 300 МГц или 400 МГц, и используя CDCl3 или диметилсульфоксид (d6-ДМСО).
LC/MS определяли в следующих условиях.
Способ A
Колонка: ACQUITY UPLC BEH C18 (1,7 мкм вн. диам. 2,1×50 мм) (произведено Waters)
Скорость потока: 0,8 мл/мин
УФ длина волны определения: 254 нм
Подвижная фаза: [A] 0,1% содержащий муравьиную кислоту водный раствор, [B] 0,1% содержащий муравьиную кислоту ацетонитрильный раствор
Градиент: линейный градиент растворителя [B] от 10 до 100% осуществляют в течение 3,5 минут, и растворитель [B] при температуре 100% поддерживают в течение 0,5 минут.
Способ B
Колонка: Shim-pack XR-ODS (2,2 мкм, вн. диам. 50×3,0 мм) (произведено Shimadzu)
Скорость потока: 1,6 мл/мин
УФ длина волны определения: 254 нм
Подвижная фаза: [A] 0,1% содержащий муравьиную кислоту водный раствор, [B] 0,1% содержащий муравьиную кислоту ацетонитрильный раствор
Градиент: линейный градиент растворителя [B] от 10 до 100% осуществляют в течение 3 минут и растворитель [B] при температуре 100% поддерживают в течение 1 минуты.
Значение каждого термина в примерах является следующим.
SEMCl: триметилсилил этоксиметил хлорид
ТГФ: тетрагидрофуран
LiHMDS: гексаметилдисилазид лития
PdCl2(PPh3)2: дихлор бистрифенилфосфин палладий
Pd2(dba)3: трис(дибензилиденацетон)дипалладий
RuPhos: 2-дициклогексилфосфино-2’,6’-диизопропокси-1,1’-бифенил
ДМФ: диметилформамид
TBAF: фторид тетрабутиламмония
TBS: трет-бутилдиметилсилил
ТФУ: трифторуксусная кислота
NaHMDS: гексаметилдисилазид натрия
DPPA: дифенилфосфорил азид
DIPEA: диизопропилэтиламин
TMSCH2CH2OH: 2-триметилсилилэтанол
DCM: дихлорметан
AcCl: ацетилхлорид
DOX: 1,4-диоксан
CDI: карбонилдиимидазол
Пример 1


В суспензию 6-хлор-3-нитропиридин-2-амина 1 (20 г, 115 ммоль) в безводном этаноле (970 мл) барботировали газообразный хлор при перемешивании при температуре 0°C в течение одного часа. После этого в реакционную смесь барботировали газообразный азот при перемешивании при комнатной температуре в течение одного часа и затем перемешивали при температуре 0°C в течение 30 минут. Реакционную суспензию фильтровали, и полученный остаток промывали диизопропиловым эфиром с получением твердого продукта. Из полученного фильтрата при пониженном давлении удаляли растворитель, и выпавший в осадок продукт фильтровали, а полученное твердое вещество затем промывали диизопропиловым эфиром и получали твердый продукт. Вышеописанные два собранных твердых продукта объединяли с получением соединения 2 (18,1 г, 76%) в виде твердого вещества желтого цвета.
Соединение 2;1H-ЯМР (ДМСО-d6) δ: 8,33 (ушир.с, 2H), 8,59 (с, 1H).
К раствору соединения 2 (36,2 г, 174 ммоль) в этаноле (775 мл) и воде (310 мл) добавляли железо (48,6 г, 870 ммоль) и хлорид аммония (46,5 г, 870 ммоль) и реакционную смесь перемешивали при температуре 60°C в течение 3 часов. Реакционную суспензию фильтровали через целит, затем промывали этанолом, и этанол из фильтрата удаляли при пониженном давлении. Полученный остаток экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, и сушили над сульфатом магния. Растворитель удаляли при пониженном давлении. К остатку добавляли гексан, затем фильтровали. Полученный остаток промывали гексаном с получением соединения 3 (28,46 г, 92%) в виде твердого вещества коричневого цвета.
Соединение 3;1H-ЯМР (ДМСО-d6) δ: 5,10 (с, 2H), 6,02 (с, 2H), 6,82 (с, 1H).
К раствору соединения 3 (28,1 г, 158 ммоль) в метаноле (840 мл) последовательно добавляли сульфаминовую кислоту (765 мг, 7,88 ммоль) и триэтиловый эфир ортомуравьиной кислоты (39,3 мл, 236 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 7,5 часов. Реакционную суспензию фильтровали, затем промывали метанолом, и при пониженном давлении из фильтрата удаляли растворитель. К остатку добавляли гексан, затем фильтровали. Полученный остаток промывали гексаном с получением соединения 4 (24,3 г, 82%) в виде твердого вещества серого цвета.
Соединение 4;1H-ЯМР (ДМСО-d6) δ: 8,40 (с, 1H), 8,58 (с, 1H).
К раствору соединения 4 (15 г, 80 ммоль) в N,N-диметилформамиде (150 мл) последовательно добавляли диизопропилэтиламин (20,9 мл, 120 ммоль) и SEMCl (17,0 мл, 96 ммоль), и реакционную смесь перемешивали при температуре 80°C в течение 2 часов. Реакционный раствор экстрагировали водой и этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, и сушили над сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали путем хроматографии на колонке с силикагелем с получением соединения 5 (11,6 г, 46%).
Соединение 5;1H-ЯМР (ДМСО-d6) δ: 0,00 (с, 9H), 0,94 (т, J=8,0 Гц, 2H), 3,68 (т, J=8,0 Гц, 2H), 5,71 (с, 2H), 8,64 (с, 1H), 8,83 (с, 1H).
К раствору соединения 5 (6,5 г, 20,4 ммоль) в безводном ТГФ (65 мл) добавляли по каплям раствор LiHMDS в ТГФ (1M, 42,8 мл, 42,8 ммоль) в атмосфере азота при температуре -60°C в течение 20 минут. После этого реакционную смесь перемешивали при температуре -60°C в течение 30 минут и в смесь добавляли йод (25,9 г, 102 ммоль). Реакционную смесь перемешивали при температуре -60°C в течение 30 минут. Реакционный раствор экстрагировали насыщенным водным раствором хлорида аммония и этилацетатом. Органический слой промывали 10%-м водным раствором тиосульфата натрия, водой и насыщенным солевым раствором и сушили над сульфатом магния. Растворитель удаляли при пониженном давлении с получением соединения 6 в виде сырого твердого вещества коричневого цвета.
Соединение 6;1H-ЯМР (ДМСО-d6) δ: 0,00 (с, 9H), 0,95 (т, J=8,0 Гц, 2H), 3,69 (т, J=8,0 Гц, 2H), 5,61 (с, 2H), 8,57 (с, 1H).
В раствор сырого продукта соединения 6, полученного выше, в 1,4-диоксане (90 мл) последовательно добавляли трет-бутиловый сложный эфир 5-гидроксил-2-метилбензойной кислоты (4,67 г, 22,4 ммоль), йодид меди(I) (582 мг, 3,1 ммоль), 2-диметиламиноуксусную кислоту (1,26 г, 12,2 ммоль) и карбонат цезия (13,3 г, 40,8 ммоль), и реакционную смесь перемешивали при температуре 90°C в течение 3,5 часов. Реакционную суспензию экстрагировали водой и этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили над сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали путем хроматографии на колонке с силикагелем с получением соединения 7 (5,33 г, 50%, 2 стадии) в виде твердого вещества белого цвета.
Соединение 7;1H-ЯМР (ДМСО-d6) δ: 0,00 (с, 9H), 0,98 (т, J=8,0 Гц, 2H), 1,61 (с, 9H), 2,59 (с, 3H), 3,79 (т, J=8,0 Гц, 2H), 5,64 (с, 2H), 7,51 (д, J=8,0 Гц, 1H), 7,61 (дд, J=8,0, 2,4 Гц, 1H), 7,79 (д, J=2,4 Гц, 1H), 8,31 (с, 1H).
К раствору соединения 7 (300 мг, 0,57 ммоль) в этаноле (3 мл) добавляли 4-морфолинобензолбороновую кислоту (130 мг, 0,63 ммоль), PdCl2(PPh3)2 (20,1 мг, 0,029 ммоль) и водный раствор карбоната калия (2 M, 0,72 мл, 1,43 ммоль) и реакционную смесь перемешивали при воздействии микроволнового излучения при температуре 130°C в течение 10 минут. Реакционную суспензию экстрагировали водой и этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, и сушили над сульфатом магния. Растворитель удаляли при пониженном давлении, и остаток очищали путем хроматографии на колонке с силикагелем с получением соединения 8 (258 мг, 69%) в виде твердого вещества желтого цвета.
Соединение 8;1H-ЯМР (ДМСО-d6) δ: 0,00 (с, 9H), 1,00 (т, J=8,0 Гц, 2H), 1,64 (с, 9H), 2,62 (с, 3H), 3,30 (т, J=4,8 Гц, 4H), 3,81-3,88 (м, 6H), 5,69 (с, 2H), 7,13 (д, J=8,4 Гц, 2H), 7,54 (д, J=8,4 Гц, 1H), 7,65 (дд, J=8,4, 2,4 Гц, 1H), 7,70 (д, J=8,4 Гц, 2H), 7,83 (д, J=2,4 Гц, 1H), 8,13 (с, 1H).
К раствору соединения 8 (250 мг, 0,38 ммоль) в метиленхлориде (1,3 мл) добавляли трифторуксусную кислоту (1,3 мл) и реакционную смесь перемешивали при комнатной температуре в течение 1,5 часа. Растворитель удаляли при пониженном давлении. К остатку добавляли 2н водный раствор гидроксида натрия до достижения pH 10. Водный слой промывали этилацетатом, и затем в водный слой добавляли 2н соляную кислоту до достижения pH 4. Выпавшие в осадок вещество фильтровали, и полученный твердый продукт последовательно промывали водой и этилацетатом с получением соединения A-1 (97 мг, 54%) в виде твердого вещества белого цвета.
Соединение A-1;1H-ЯМР (ДМСО-d6) δ: 2,56 (с, 3H), 3,19 (т, J=4,8 Гц, 4H), 3,76 (т, J=4,8 Гц, 4H), 7,02 (д, J=8,4 Гц, 2H), 7,42 (д, J=8,4 Гц, 1H), 7,53 (дд, J=8,4, 2,4 Гц, 1H), 7,57 (д, J=8,4 Гц, 2H), 7,83 (д, J=2,4 Гц, 1H), 7,94 (с, 1H), 13,2 (ушир. с, 2H).
Соединение, показанное далее, было синтезировано таким же способом.
Пример 2
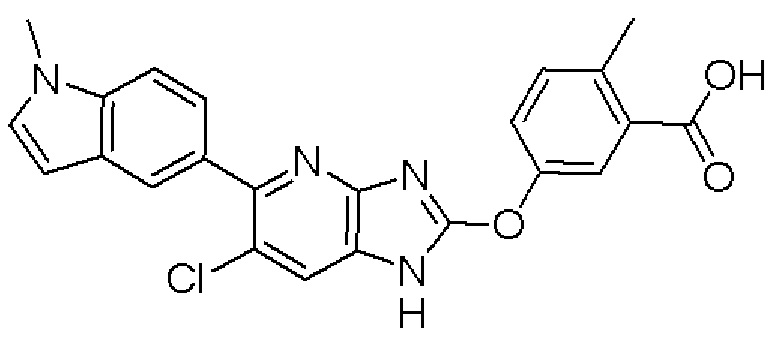
Соединение A-2;1H-ЯМР (ДМСО-d6) δ: 2,56 (с, 3H), 3,84 (с, 3H), 6,51 (д, J=4,0 Гц, 1H), 7,38-7,45 (м, 3H), 7,49-7,51 (м, 2H), 7,82 (с, 2H), 7,96 (с, 1H).
Пример 3


10
К раствору соединения 5 (4,23 г, 13,29 ммоль) в этаноле (43 мл) добавляли 4-морфолинобензолбороновую кислоту (2,75 г, 13,29 ммоль), PdCl2(PPh3)2 (467 мг, 0,67 ммоль) и водный раствор карбоната калия (2 M, 16,6 мл, 33,23 ммоль), и реакционную смесь перемешивали при воздействии микроволнового излучения при температуре 130°C в течение 15 минут. Реакционную суспензию экстрагировали водой и этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, и сушили над сульфатом магния. Растворитель удаляли при пониженном давлении, и остаток очищали путем хроматографии на колонке с силикагелем с получением соединения 9 (5,51 г, 93%) в виде твердого вещества желтого цвета.
Соединение 9;1H-ЯМР (ДМСО-d6) δ: 0,00 (с, 9H), 0,97 (т, J=8,0 Гц, 2H), 3,32 (т, J=4,8 Гц, 4H), 3,74 (т, J=8,0 Гц, 2H), 3,88 (т, J=4,8 Гц, 4H), 5,75 (с, 2H), 7,15 (д, J=8,4 Гц, 2H), 7,73 (д, J=8,4 Гц, 2H), 8,45 (с, 1H), 8,78 (с, 1H).
К раствору соединения 9 (4,7 г, 10,56 ммоль) в безводном ТГФ (47 мл) добавляли TMEDA (4,8 мл, 31,70 ммоль). В реакционную смесь добавляли по каплям раствор LiHMDS в ТГФ (1M, 22,2 мл, 22,2 ммоль) в атмосфере азота при температуре -60°C в течение 15 минут. После этого реакционную смесь перемешивали при температуре -60°C в течение 45 минут, и затем добавляли йод (13,4 г, 52,8 ммоль). Реакционную смесь перемешивали при температуре -60°C в течение 30 минут. Реакционный раствор экстрагировали насыщенным водным раствором хлорида аммония и этилацетатом. Органический слой промывали 10%-м водным раствором тиосульфата натрия, водой и насыщенным раствором хлорида натрия и сушили над сульфатом магния. Растворитель удаляли при пониженном давлении, и остаток очищали путем хроматографии на колонке с силикагелем. Растворитель удаляли при пониженном давлении, и к остатку добавляли гексан, затем фильтровали. Полученный остаток промывали гексаном с получением соединения 10 (4,69 г, 78%) в виде твердого вещества желтого цвета.
Соединение 10;1H-ЯМР (ДМСО-d6) δ: 0,00 (с, 9H), 0,98 (т, J=8,0 Гц, 2H), 3,32 (т, J=4,8 Гц, 4H), 3,75 (т, J=8,0 Гц, 2H), 3,88 (т, J=4,8 Гц, 4H), 5,68 (с, 2H), 7,15 (д, J=8,4 Гц, 2H), 7,74 (д, J=8,4 Гц, 2H), 8,40 (с, 1H).
Пример 4
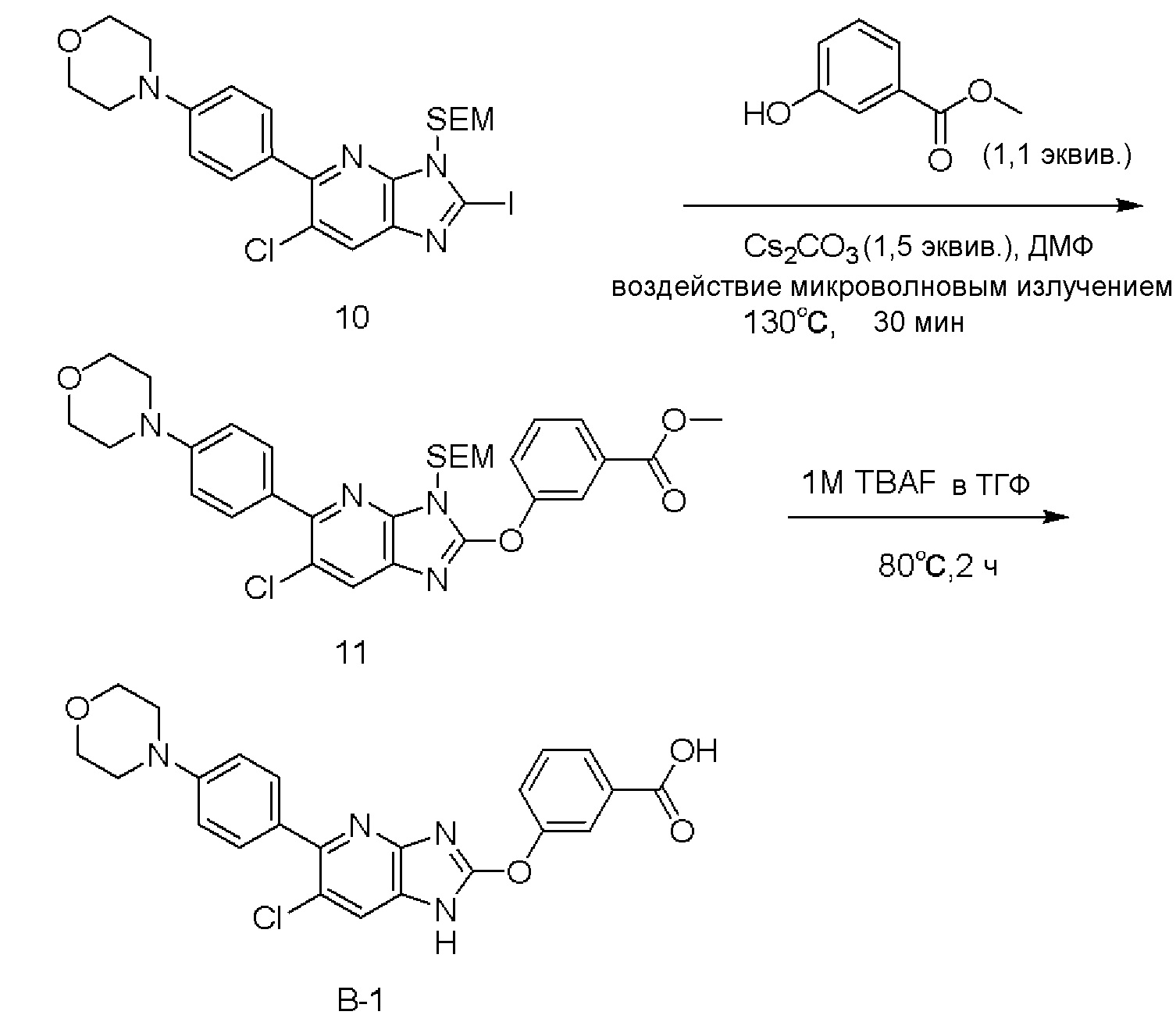
К раствору соединения 10 (25,0 мг, 0,044 ммоль) в безводном ДМФ (0,5 мл) добавляли карбонат цезия (21,4 мг, 0,066 ммоль) и метил 3-гидроксибензоат (7,33 мг, 0,048 ммоль) и реакционную смесь перемешивали при воздействии микроволнового излучения при температуре 130°C в течение 30 минут. Реакционную суспензию экстрагировали водой и этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, и сушили над сульфатом натрия. Растворитель удаляли при пониженном давлении с получением соединения 11 в виде бесцветного масла. Следующую реакцию проводили без очистки.
К вышеописанному соединению 11 добавляли 1M TBAF в ТГФ (0,439 мл, 0,439 ммоль), и реакционную смесь перемешивали в атмосфере азота при температуре 80°C в течение 2 часов. Реакционный раствор экстрагировали насыщенным водным раствором KHSO4 и этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили над сульфатом натрия. Растворитель удаляли при пониженном давлении, и остаток очищали путем обращенно фазовой жидкостной хроматографии (10 мМ карбонат аммония, содержащий раствор вода/ацетонитрил; градиент 15-35%, 10 мин) с получением соединения B-1 (3,3 мг, 0,007 ммоль, 17%) в виде твердого вещества белого цвета.
Соединение B-1;
MS (ESI) m/z =450,9 (M+H)+.
LC/MS время удерживания = 1,74 мин.
Способ B
Пример 5

В суспензию гидрида натрия (60% масс., 15,4 мг, 0,39 ммоль) в N,N-диметилформамиде (150 мл) добавляли 3-бутин-2-ол (30 мкл, 0,39 ммоль) в атмосфере азота при температуре 0°C и реакционную смесь перемешивали при комнатной температуре в течение 5 минут. После этого в смесь при комнатной температуре добавляли соединение 10 (100 мг, 0,18 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 30 минут. Реакционный раствор экстрагировали насыщенным водным раствором хлорида аммония и этилацетатом. Органический слой промывали насыщенным солевым раствором, и сушили над сульфатом магния. Растворитель удаляли при пониженном давлении, и остаток очищали путем хроматографии на колонке с силикагелем с получением соединения 12 (54 мг, 60%) в виде маслянистого вещества желтого цвета.
К соединению 12 (52 мг, 0,10 ммоль) при комнатной температуре добавляли раствор фторида тетрабутиламмония в ТГФ (1M, 1 мл, 1,0 ммоль) и реакционную смесь перемешивали при температуре 50°C в течение 6 часов. Реакционный раствор экстрагировали насыщенным водным раствором хлорида аммония и хлороформом. Органический слой сушили над сульфатом магния. Растворитель удаляли при пониженном давлении, и остаток очищали путем хроматографии на колонке с силикагелем с получением соединения B-2 (9 мг, 23%) в виде твердого вещества желтого цвета.
Соединение B-2;1H-ЯМР (ДМСО-d6) δ: 1,64 (д, J=6,6 Гц, 3H), 3,18 (м, 4H), 3,68 (д, J=2,0 Гц, 1H), 3,77 (м, 4H), 5,78 (квд, J=6,6, 2,0 Гц, 1H), 7,01 (д, J=8,9 Гц, 2H), 7,56 (д, J=8,9 Гц, 2H), 7,91 (с, 1H), 12,8 (с, 1H).
Пример 6

К раствору соединения 7 (15,0 мг, 0,029 ммоль) в безводном толуоле (0,5 мл) добавляли пиперидин (0,0042 мл, 0,043 ммоль), Pd2(dba)3 (1,3 мг, 0,0014 ммоль), RuPhos (1,3 мг, 0,0028 ммоль) и NaOtBu (5,5 мг, 0,057 ммоль) и реакционную смесь перемешивали при воздействии микроволнового излучения при температуре 120°C в течение 15 минут. Реакционную суспензию экстрагировали водой и этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, и сушили над сульфатом натрия. Растворитель удаляли при пониженном давлении с получением соединения 13 в виде бесцветного масла. Следующую реакцию проводили без очистки.
В раствор вышеописанного соединения 13 в метиленхлориде (0,500 мл) добавляли ТФУ (0,500 мл, 6,49 ммоль) и реакционную смесь перемешивали в атмосфере азота при комнатной температуре в течение одного часа. Реакционный раствор концентрировали при пониженном давлении и остаток очищали путем обращенно фазовой жидкостной хроматографии (водный раствор, содержащий 10 мМ карбоната аммония/ацетонитрил; градиент 20-40%, 10 мин) с получением соединения B-3 (2,0 мг, 0,005 ммоль, 18%) в виде твердого вещества белого цвета.
Соединение B-3;
MS (ESI) m/z =386,9 (M+H)+.
LC/MS время удерживания = 2,04 мин.
Способ B
Пример 7

Соединение 14 описано как соединение 52 в J. Med. Chem. 1996, 39, 2795-2811.
К раствору соединения 14 (9 г, 33,9 ммоль) в этилацетате (180 мл) добавляли насыщенный водный раствор гидрокарбоната натрия (180 мл). В реакционную смесь при энергичном перемешивании добавляли по каплям ацетилхлорид (4,84 мл, 67,8 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 40 минут.
Реакционный раствор подвергали фракционному разделению, затем сушили над сульфатом магния. Растворитель удаляли при пониженном давлении с получением соединения 15 (11,7 г, колич.) в виде масла бледно-желтого цвета.
Соединение 15;1H-ЯМР (CDCl3) δ: 0,19 (6H, с), 0,98 (9H, с), 1,69 (6H, с), 1,95 (3H, с), 5,62 (1H, с), 6,78 (2H, д, J=8,62 Гц), 7,25 (3H, д, J=5,58 Гц).
К раствору соединения 15 (9,26 г, 30,1 ммоль) в ТГФ (90 мл) добавляли фторид тетрабутиламмония (15,75 г, 60,2 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение одного часа. Реакционный раствор экстрагировали 1 M HCl и этилацетатом. Водный слой экстрагировали один раз 200 мл этилацетата и два раза 100 мл этилацетата. Органический слой сушили над сульфатом магния и растворитель удаляли при пониженном давлении. К полученному твердому продукту добавляли гексан, затем фильтровали и полученный остаток промывали гексаном с получением соединения 16 (3,92 г, 41%) в виде твердого вещества белого цвета.
Соединение 16;1H-ЯМР (ДМСО-d6) δ: 1,49 (6H, с), 1,79 (3H, с), 6,65 (2H, д, J=8,62 Гц), 7,09 (2H, д, J=8,62 Гц), 9,13 (1H, с).
Пример 8

К раствору соединения 10 (1 г, 1,75 ммоль) в N,N-диметилформамиде (100 мл) добавляли карбонат цезия (0,856 г, 2,63 ммоль) и соединение 16 (0,406 г, 2,10 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение одного часа. Реакционный раствор экстрагировали водой и этилацетатом. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали путем хроматографии на колонке с силикагелем с получением соединения 17 (1,10 г, 99%).
Соединение 17;1H-ЯМР (ДМСО-d6) δ: -0,09 (с, 9H), 0,91 (т, J=7,9 Гц, 2H), 1,57 (с, 6H), 1,64 (с, 4H), 1,85 (с, 3H), 3,25 (т, J=5,1 Гц, 4H), 3,74 (т, J=7,9 Гц, 2H), 5,58 (с, 2H), 7,00 (д, J=9,1 Гц, 2H), 7,31 (д, J=8,6 Гц, 2H), 7,42 (д, J=8,6 Гц, 2H), 7,58 (д, J=8,6 Гц, 2H), 8,02 (с, 1H), 8,10 (с, 1H).
К раствору соединения 17 (1 г, 1,75 ммоль) в метиленхлориде (5 мл) добавляли трифторуксусную кислоту (5 мл, 54,9 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение одного часа. Реакционный раствор добавляли к насыщенной бикарбонатом натрия воде, затем экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. Остаток промывали смесью этилацетат/гексан с получением соединения C-119 (0,78 г, 89%).
Соединение C-119;1H-ЯМР (ДМСО-d6) δ: 1,57 (с, 6H), 1,84 (с, 3H), 3,19 (т, J=4,8 Гц, 4H), 3,76 (т, J=4,6 Гц, 4H), 7,02 (д, J=9,1 Гц, 2H), 7,31 (д, J=8,6 Гц, 2H), 7,40 (д, J=8,6 Гц, 2H), 7,57 (д, J=8,6 Гц, 2H), 7,92 (с, 1H), 8,09 (с, 1H), 13,18 (с, 1H).
Пример 9


В раствор этил изобутирата (3,86 мл, 28,6 ммоль) в толуоле (50 мл) добавляли по каплям 1,9 M раствор NaHMDS в толуоле (27,3 мл, 52,0 ммоль) при охлаждении льдом, и реакционную смесь перемешивали в течение 15 минут. После этого в смесь добавляли соединение 18 (5 г, 26,0 ммоль), которое оставалось в виде порошка и реакционную смесь перемешивали при температуре 0°C в течение еще 5 часов. Реакцию гасили насыщенным водным раствором хлорида аммония, затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом магния. Растворитель удаляли при пониженном давлении, и остаток затем два раза очищали путем хроматографии на колонке с силикагелем (гексан/EtOAc = 10:1) с получением соединения 19 (6,18 г, 87%) в виде масла желтого цвета.
Соединение 19;1H-ЯМР (CDCl3) δ: 1,19 (т, J=7,10 Гц, 3H), 1,59 (с, 6H), 4,14 (кв, J=7,10 Гц, 2H), 7,20 (д, J=8,11 Гц, 1H), 7,76 (дд, J=8,11, 2,03 Гц, 1H), 8,59 (д, J=2,03 Гц, 1H).
К раствору соединения 19 (2,09 г, 7,68 ммоль) в этаноле (20 мл) добавляли 2н водный раствор NaOH (4,22 мл, 8,45 ммоль) и реакционную смесь перемешивали при температуре 50°C в течение 3 часов. Растворитель удаляли при пониженном давлении и к остатку добавляли 20 мл хлороформа и суспендировали. Полученную суспензию фильтровали с получением соединения 20 (1,81 г, 89%) в виде твердого вещества белого цвета.
Полученную Na соль 20 (1,81 г, 6,80 ммоль) растворяли в 15 мл дистиллированной воды, и затем в смесь добавляли по каплям 2н водный раствор HCl (3,4 мл, 6,80 ммоль) при охлаждении льдом. Реакционную смесь перемешивали при комнатной температуре в течение 10 минут. Полученное твердое вещество фильтровали и полученный твердый продукт промывали три раза водой со льдом с получением соединения 21 (1,5 г, 90%).
Соединение 21;1H-ЯМР (CDCl3) δ: 1,65 (с, 6H), 7,37 (д, J=8,62 Гц, 1H), 7,90 (дд, J=8,62, 2,53 Гц, 1H), 8,62 (д, J=2,53 Гц, 1H).
К раствору соединения 21 (1,49 г, 6,10 ммоль) в толуоле (15 мл) последовательно добавляли DPPA (1,44 мл, 6,71 ммоль) и DIPEA (2,35 мл, 13,43 ммоль) при комнатной температуре. Реакционную смесь перемешивали в течение 20 минут и затем нагревали до 70°C и перемешивали в течение еще 1,5 часа. Реакционной смеси давали охладиться до комнатной температуры, и затем в смесь добавляли 2-триметилсилилэтанол (8,75 мл, 61 ммоль) и реакционную смесь перемешивали при температуре 110°C в течение 10 часов. Реакционной смеси давали охладиться до комнатной температуры и в смесь добавляли 20 мл дистиллированной воды, затем экстрагировали этилацетатом, промывая насыщенным солевым раствором и высушиванием сульфатом натрия. Растворитель удаляли при пониженном давлении. Концентрированный остаток очищали путем хроматографии на колонке с силикагелем (гексан/этилацетат = 1:4) с получением соединения 22 (1,44 г, 66%) в виде бесцветного масла.
Соединение 22;1H-ЯМР (CDCl3) δ: 0,03 (с, 9H), 0,96 (т, J=8,11 Гц, 2H), 1,68 (с, 6H), 4,10 (т, J=8,11 Гц, 2H), 6,02 (с, 1H), 7,32 (д, J=8,62 Гц, 1H), 7,78 (дд, J=8,62, 2,53 Гц, 1H), 8,57 (д, J=2,53 Гц, 1H).
К раствору соединения 22 (600 мг, 1,67 ммоль) в DCM (3 мл) добавляли ТФУ (3 мл, 38,9 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение одного часа. ТФУ удаляли путем азеотропной отгонки с толуолом, и остаток затем разбавляли дистиллированной водой и нейтрализовали насыщенной бикарбонатом натрия водой. Смесь экстрагировали три раза хлороформом, затем высушивали над сульфатом натрия. Растворитель удаляли при пониженном давлении. Концентрированный остаток растворяли в ТГФ (3 мл), и в смесь при охлаждении льдом последовательно добавляли DIPEA (0,437 мл, 2,51 ммоль) и AcCl (0,125 мл, 1,75 ммоль), и реакционную смесь перемешивали при температуре 0°C в течение одного часа. Реакционный раствор экстрагировали дистиллированной водой и этилацетатом, затем промывали насыщенным солевым раствором и сушили над сульфатом натрия. Растворитель удаляли при пониженном давлении. Концентрированный остаток очищали путем хроматографии на колонке с силикагелем (хлороформ/метанол = 10:1) с получением соединения 24 (385 мг, 90%) в виде твердого вещества белого цвета.
Соединение 24;1H-ЯМР (CDCl3) δ: 1,72 (с, 6H), 2,03 (с, 3H), 7,15 (с, 1H), 7,31 (д, J=8,62 Гц, 1H), 7,81 (дд, J=8,62, 2,53 Гц, 1H), 8,56 (д, J=2,03 Гц, 1H).
К раствору соединения 24 (340 мг, 1,32 ммоль) в толуоле (3 мл) добавляли йодид меди(I) (25,2 мг, 0,13 ммоль), карбонат цезия (646 мг, 1,98 ммоль), бензиловый спирт (1,38 мл, 13,22 ммоль) и 1,10-фенантролин (48 мг, 0,26 ммоль) и реакционную смесь перемешивали при воздействии микроволнового излучения при температуре 130°C в течение 5,5 часов. В реакционную жидкость добавляли дистиллированную воду, и водный слой экстрагировали этилацетатом, затем промывали насыщенным солевым раствором и сушили над сульфатом натрия. Растворитель удаляли при пониженном давлении. Концентрированный остаток очищали путем хроматографии на колонке с силикагелем (гексан:этилацетат = 1:4, и второй раз хлороформ:метанол = 10:1) с получением соединения 25 в виде смеси с приблизительно 10% соединения 24 (376 мг, 100%).
Соединение 25;1H-ЯМР (CDCl3) δ: 1,72 (с, 6H), 2,03 (с, 3H), 5,11 (с, 2H), 7,28-7,51 (м, 8H), 8,25 (д, J=2,03 Гц, 1H).
К раствору соединения 25 (376 мг, 1,32 ммоль) в метаноле (4 мл) добавляли 10% Pd/C (50% влажн.) (281 мг, 0,132 ммоль) и реакционную смесь перемешивали в атмосфере водорода при комнатной температуре в течение 2 часов. Реакционную смесь фильтровали через целит и растворитель затем удаляли при пониженном давлении с получением сырого кристаллического продукта 26. Кристаллический продукт использовали в следующей реакции без дополнительной очистки.
Пример 10

К раствору соединения 10 (100 мг, 0,175 ммоль) в ДМФ (1 мл) добавляли соединение 26 (45 мг, 0,210 ммоль (из расчета приблизительно 90%-й по массе)) и карбонат цезия (74,2 мг, 0,228 ммоль), и реакционную смесь перемешивали при температуре 80°C в течение 2 часов. В реакционную смесь добавляли дистиллированную воду, затем экстрагировали этилацетатом, промывая три раза дистиллированной водой и один раз насыщенной бикарбонатом натрия водой, и сушили над сульфатом натрия. Растворитель удаляли при пониженном давлении. Концентрированный остаток очищали путем хроматографии на колонке с силикагелем (хлороформ:метанол = 10:1) с получением соединения 27 (112 мг, 100%) в виде бесцветного аморфного вещества.
Соединение 27;1H-ЯМР (CDCl3) δ: -0,03 (с, 9H), 0,99 (т, J=8,11 Гц, 2H), 1,79 (с, 6H), 2,05 (с, 3H), 3,26 (т, J=4,82 Гц, 4H), 3,80 (т, J=8,11 Гц, 2H), 3,89 (т, J=4,82 Гц, 4H), 5,67 (с, 2H), 6,99 (д, J=8,62 Гц, 2H), 7,39 (с, 1H), 7,53 (д, J=9,12 Гц, 1H), 7,72 (д, J=8,62 Гц, 2H), 7,83-7,89 (м, 2H), 8,63 (д, J=3,04 Гц, 1H).
К раствору соединения 27 (110 мг, 0,173 ммоль) в DCM (0,5 мл) добавляли ТФУ (0,5 мл, 6,49 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 3 часов. После этого в смесь добавляли метанол (0,5 мл) и реакционную смесь перемешивали в течение еще одного часа. ТФУ удаляли путем азеотропной отгонки с толуолом. Полученный остаток нейтрализовали 2н водн. NaOH, затем экстрагировали дважды этилацетатом, промывая насыщенным солевым раствором, и сушили над сульфатом натрия. Растворитель удаляли при пониженном давлении. Концентрированный остаток очищали путем хроматографии на колонке с силикагелем (хлороформ:метанол = 10:1) и кристаллизовали из смеси хлороформ/гексан с получением соединения D-1 (53 мг, 61%) в виде твердого вещества белого цвета.
Соединение D-1;1H-ЯМР (ДМСО-d6) δ: 1,58 (с, 6H), 1,86 (с, 3H), 3,19 (т, J=4,82 Гц, 4H), 3,76 (т, J=4,82 Гц, 4H), 7,02 (д, J=8,62 Гц, 2H), 7,47 (д, J=8,62 Гц, 1H), 7,57 (д, J=8,62 Гц, 2H), 7,84 (дд, J=8,62, 3,04 Гц, 1H), 7,96 (с, 1H), 8,20 (с, 1H), 8,58 (д, J=3,04 Гц, 1H), 13,35 (с, 1H).
Пример 11

Соединение 28 описано как соединение 23a в Tetrahedron 65 (2009) 757-764.
К раствору соединения 28 (3,7 г, 16,0 ммоль) в ТГФ (40 мл) добавляли по каплям 1M раствор LiHMDS в ТГФ (48 мл, 48,0 ммоль) при температуре -60°C и реакционную смесь перемешивали в течение 30 минут. После этого в смесь добавляли MeI (3,0 мл, 48,0 ммоль) и реакционную смесь перемешивали в течение 2 часов при нагревании до комнатной температуры. Реакционную смесь опять охлаждали до температуры -60°C, и затем добавляли по каплям 1M раствор LiHMDS в ТГФ (32 мл, 32,0 ммоль), и реакционную смесь перемешивали в течение 30 минут. После этого в смесь добавляли MeI (3,0 мл, 48,0 ммоль) и реакционную смесь перемешивали в течение 2 часов при нагревании до комнатной температуры. Реакционную смесь охлаждали до температуры 0°C и реакцию гасили насыщенным водным раствором хлорида аммония, затем экстрагировали этилацетатом, промывая насыщенным солевым раствором и сушили над сульфатом натрия. Растворитель удаляли при пониженном давлении. Концентрированный остаток очищали путем хроматографии на колонке с силикагелем (гексан:этилацетат = 5:1) с получением соединения 29 (3,85 г, 93%) в виде масла желтого цвета.
Соединение 29;1H-ЯМР (CDCl3) δ: 1,63 (с, 6H), 3,70 (с, 3H), 8,73 (с, 2H).
К раствору соединения 29 (3,8 г, 14,67 ммоль) в MeOH (40 мл) добавляли 2н водный раствор NaOH (8,07 мл, 16,13 ммоль) и реакционную смесь перемешивали при температуре 50°C. Через 3 часа в смесь добавляли 2н водный раствор NaOH (1,5 мл, 3,0 ммоль) и реакционную смесь перемешивали при температуре 50°C еще в течение 3 часов. Растворитель удаляли при пониженном давлении досуха и полученный твердый продукт растворяли в 20 мл дистиллированной воды. Полученный раствор доводили до pH=5 с помощью 2н водного раствора HCl при охлаждении льдом. Полученное твердое вещество фильтровали, и полученный твердый продукт промывали три раза водой с получением соединения 30 (3,35 г, 93%) в виде твердого вещества белого цвета.
Соединение 30;1H-ЯМР (ДМСО-d6) δ: 1,51 (с, 6H), 8,97 (с, 2H), 12,45 (с, 1H).
В суспензию соединения 30 (2 г, 8,16 ммоль) в толуоле (20 мл) добавляли DIPEA (3,14 мл, 17,95 ммоль) и DPPA (1,93 мл, 8,98 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 50 минут и затем нагревали до 70°C и перемешивали еще в течение 90 минут. Реакционной смеси давали охладиться до комнатной температуры, и затем в смесь добавляли 2-триметилсилилэтанол (11,7 мл, 82 ммоль) и реакционную смесь нагревали до температуры 110°C и перемешивали в течение 40 часов. Растворитель удаляли при пониженном давлении и концентрированный остаток очищали путем хроматографии на колонке с силикагелем (гексан:этилацетат = 5:1×2) с получением соединения 31 (1,95 г, 66%) в виде бесцветного масла.
Соединение 31;1H-ЯМР (CDCl3) δ: 0,03 (с, 9H), 0,97 (т, J=8,62 Гц, 2H), 1,73 (с, 6H), 4,11 (т, J=8,62 Гц, 2H), 6,06 (с, 1H), 8,75 (с, 2H).
К раствору соединения 31 (800 мг, 2,22 ммоль) в DCM (4 мл) добавляли ТФУ (4 мл, 51,9 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение одного часа. ТФУ удаляли путем азеотропной отгонки с толуолом и остаток затем разбавляли дистиллированной водой и нейтрализовали насыщенной бикарбонатом натрия водой. Смесь экстрагировали три раза хлороформом, затем высушивали над сульфатом натрия. Растворитель удаляли при пониженном давлении. Концентрированный остаток растворяли в ТГФ (4 мл) и при охлаждении льдом в смесь последовательно добавляли DIPEA (0,437 мл, 2,51 ммоль) и AcCl (0,125 мл, 1,75 ммоль). Реакционную смесь перемешивали при температуре 0°C в течение одного часа. Реакционный раствор экстрагировали дистиллированной водой и этилацетатом, затем промывали насыщенным солевым раствором и сушили над сульфатом натрия. Растворитель удаляли при пониженном давлении. Концентрированный остаток очищали путем хроматографии на колонке с силикагелем (хлороформ/метанол = 10:1) с получением соединения 32 (488 мг, 85%) в виде твердого вещества белого цвета.
Соединение 32;1H-ЯМР (CDCl3) δ: 1,76 (с, 6H), 2,03 (с, 3H), 6,91 (с, 1H), 8,75 (с, 2H).
К раствору соединения 32 (450 мг, 1,74 ммоль) в толуоле (7,5 мл) добавляли йодид меди(I) (33,2 мг, 0,17 ммоль), карбонат цезия (852 мг, 2,62 ммоль), бензиловый спирт (0,90 мл, 8,72 ммоль) и 1,10-фенантролин (63 мг, 0,35 ммоль) и реакционную смесь перемешивали при воздействии микроволнового излучения при температуре 130°C в течение 2,5 часов. В реакционный раствор добавляли дистиллированную воду, и водный слой экстрагировали этилацетатом, затем промывали насыщенным солевым раствором и сушили над сульфатом натрия. Растворитель удаляли при пониженном давлении. Концентрированный остаток очищали путем хроматографии на колонке с силикагелем (гексан:этилацетат = 1:10, и второй раз хлороформ:метанол = 10:1) с получением соединения 33 в виде смеси приблизительно 10% соединения 32 (448 мг, 81%).
Соединение 33;1H-ЯМР (CDCl3) δ: 1,76 (с, 6H), 2,03 (с, 3H), 5,15 (с, 2H), 7,35-7,47 (м, 5H), 8,43 (с, 2H).
К раствору соединения 33 (440 мг, 1,54 ммоль) в метаноле (5 мл) добавляли 10% Pd/C (50% влажн.) (328 мг, 0,154 ммоль) и реакционную смесь перемешивали в атмосфере водорода при комнатной температуре в течение 3 часов. Реакционную смесь фильтровали через целит, и растворитель затем удаляли при пониженном давлении с получением сырого кристаллического вещества 34. Кристаллический продукт использовали в следующей реакции без дополнительной очистки.
Пример 12

К раствору соединения 10 (100 мг, 0,175 ммоль) в ДМФ (1 мл) добавляли соединение 34 (51 мг, 0,210 ммоль (из расчета приблизительно 80%-й по массе)) и карбонат цезия (74,2 мг, 0,228 ммоль) и реакционную смесь перемешивали при воздействии микроволнового излучения при температуре 130°C в течение 30 минут. В смесь добавляли соединение 34 (51 мг, 0,210 ммоль (из расчета приблизительно 80%-й по массе)) и реакционную смесь перемешивали при воздействии микроволнового излучения при температуре 130°C дополнительно в течение 20 минут. В реакционный раствор добавляли дистиллированную воду, затем экстрагировали этилацетатом, промывая три раза дистиллированной водой и один раз насыщенной бикарбонатом натрия водой, и сушили над сульфатом натрия. Растворитель удаляли при пониженном давлении. Концентрированный остаток очищали путем хроматографии на колонке с силикагелем (хлороформ:метанол = 10:1) с получением соединения 35 (75 мг, 67%) в виде аморфного вещества желтого цвета.
Соединение 35;1H-ЯМР (CDCl3) δ: -0,03 (с, 9H), 0,98 (т, J=8,36 Гц, 2H), 1,83 (с, 6H), 2,06 (с, 3H), 3,26 (т, J=4,82 Гц, 4H), 3,79 (т, J=8,36 Гц, 2H), 3,89 (т, J=4,82 Гц, 4H), 5,68 (с, 2H), 6,99 (д, J=8,62 Гц, 2H), 7,20 (с, 1H), 7,72 (д, J=8,62 Гц, 2H), 7,87 (с, 1H), 8,94 (с, 2H).
К раствору соединения 35 (70 мг, 0,110 ммоль) в DCM (0,5 мл) добавляли ТФУ (0,5 мл, 6,49 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение одного часа. После этого в смесь добавляли метанол (0,5 мл) и реакционную смесь перемешивали еще в течение одного часа. ТФУ удаляли путем азеотропной отгонки с толуолом. Полученный остаток нейтрализовали насыщенной бикарбонатом натрия водой, затем экстрагировали три раза хлороформом, промывая насыщенным солевым раствором и сушили над сульфатом натрия. Растворитель удаляли при пониженном давлении. Концентрированный остаток очищали путем хроматографии на колонке с силикагелем (хлороформ:метанол = 10:1) и кристаллизовали из смеси хлороформ/гексан с получением соединения D-2 (39 мг, 70%) в виде твердого вещества белого цвета.
Соединение D-2;1H-ЯМР (ДМСО-d6) δ: 1,61 (с, 6H), 1,80 (с, 3H), 3,20 (т, J=4,82 Гц, 4H), 3,76 (т, J=4,82 Гц, 4H), 7,02 (д, J=8,62 Гц, 2H), 7,57 (д, J=8,62 Гц, 2H), 8,00 (с, 1H), 8,26 (с, 1H), 8,94 (с, 2H), 13,42 (с, 1H).
Пример 13


В раствор 2-хлор-5-фтор-3-нитропиридина 36 (1,378 г, 7,81 ммоль) в ТГФ (10 мл) последовательно добавляли DIPEA (4,09 мл, 23,42 ммоль) и бензиламин (1,71 мл, 15,61 ммоль) и реакционную смесь перемешивали при кипячении с обратным холодильником в течение 7 часов. Реакционной смеси давали охладиться до комнатной температуры, и в смесь добавляли 20 мл дистиллированной воды, затем экстрагировали три раза 20 мл этилацетата и сушили над сульфатом натрия. Растворитель удаляли при пониженном давлении. Концентрированный остаток очищали путем хроматографии на колонке с силикагелем (гексан/EtOAc = 10:1) с получением соединения 37 в виде смеси с бензиламином.
Концентрированный остаток после очистки растворяли в смешанном растворителе из метанола (10 мл) и ТГФ (10 мл) и в смесь добавляли оксид платины (177 мг, 0,781 ммоль) и реакционную смесь перемешивали в атмосфере водорода в течение одного часа. Реакционный раствор фильтровали через целит и растворитель удаляли при пониженном давлении, затем очищали путем хроматографии на колонке с силикагелем (гексан/этилацетат = 3:1) с получением соединения 38 (1,52 г, 90%) в виде твердого вещества коричневого цвета.
Соединение 37;1H-ЯМР (ДМСО-d6) δ: 4,78 (д, J=6,08 Гц, 2H), 7,20-7,35 (м, 5H), 8,41 (дд, J=8,36, 2,79 Гц, 1H), 8,58 (д, J=2,79 Гц, 1H), 8,90 (т, J=6,08 Гц, 1H).
Соединение 38;1H-ЯМР (ДМСО-d6) δ: 4,51 (д, J=5,58 Гц, 2H), 5,18 (с, 2H), 6,02 (т, J=5,58 Гц, 1H), 6,60 (дд, J=10,65, 2,53 Гц, 1H), 7,19-7,34 (м, 6H).
В смешанный раствор MeOH (10 мл) и ТГФ (10 мл), содержащий соединение 38 (1,46 г, 6,72 ммоль), добавляли 5% Pd/C (715 мг, 0,336 ммоль) и реакционную смесь перемешивали в атмосфере водорода в течение 2 часов. Реакционной смеси давали охладиться до комнатной температуры, и затем в смесь добавляли 2-триметилсилилэтанол (8,75 мл, 61 ммоль) и реакционную смесь перемешивали при температуре 110°C в течение 10 часов. Реакционный раствор фильтровали через целит, и растворитель удаляли при пониженном давлении. Полученный остаток суспендировали в хлороформе и суспензию фильтровали с получением соединения 39 (800 мг, 94%) в виде твердого вещества белого цвета.
Соединение 39;1H-ЯМР (ДМСО-d6) δ: 5,04 (с, 2H), 5,29 (с, 2H), 6,57 (дд, J=10,65, 2,53 Гц, 1H), 7,15 (д, J=2,53 Гц, 1H).
К раствору соединения 39 (795 мг, 6,25 ммоль) в MeCN (70 мл) добавляли CDI (1,52 г, 9,38 ммоль) и реакционную смесь перемешивали при температуре 80°C в течение 6 часов. Реакционной смеси давали охладиться до комнатной температуры и растворитель удаляли при пониженном давлении, затем добавляли 50 мл хлороформа. Смесь перемешивали в течение 30 минут, и твердый продукт фильтровали с получением соединения 40 (738 мг, 77%) в виде твердого вещества белого цвета.
Соединение 40;1H-ЯМР (ДМСО-d6) δ: 7,24 (дд, J=8,62, 2,53 Гц, 1,0H), 7,84 (т, J=2,28 Гц, 1,0H), 11,04 (ушир.с, 1,0H), 11,40 (ушир.с, 1,0H).
К раствору соединения 40 (730 мг, 4,77 ммоль) в уксусной кислоте (20 мл) добавляли ацетат натрия (782 мг, 9,54 ммоль) и бром (990 мг, 6,20 ммоль) и реакционную смесь перемешивали при температуре 90°C в течение одного часа. Реакционной смеси давали охладиться до комнатной температуры, и затем в смесь добавляли 20 мл дистиллированной воды. Смесь перемешивали в течение одного часа, и полученное твердое вещество фильтровали с получением соединения 41 (810 мг, 73%) в виде твердого вещества коричневого цвета.
Соединение 41;1H-ЯМР (ДМСО-d6) δ: 7,43 (д, J=8,62 Гц, 1H), 11,23 (с, 1H), 11,65 (с, 1H).
К раствору соединения 41 (400 мг, 1,72 ммоль) в этаноле (3 мл) добавляли 1-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пирролидин (565 мг, 2,07 ммоль), PdCl2(PPh3)2 (85 мг, 0,121 ммоль) и 2 M водн. K2CO3 (2,15 мл, 4,31 ммоль) и реакционную смесь перемешивали при воздействии микроволнового излучения при температуре 130°C в течение 30 минут. Реакционный раствор разбавляли этилацетатом (300 мл) и смесь затем перемешивали при температуре 40°C в течение одного часа. Не растворившееся вещество фильтровали через целит, затем промывали насыщенным солевым раствором и сушили над сульфатом натрия. Растворитель удаляли при пониженном давлении. Концентрированный остаток перемешивали в смешанном растворителе из этилацетата (10 мл) и хлороформа (10 мл) в течение 30 минут, и затем фильтровали с получением соединения 42 (225 мг, 44%) в виде твердого вещества коричневого цвета.
Соединение 42;1H-ЯМР (ДМСО-d6) δ: 1,97 (т, J=6,34 Гц, 4H), 3,28 (т, J=6,34 Гц, 4H), 6,61 (д, J=9,12 Гц, 2H), 7,24 (д, J=11,66 Гц, 1H), 7,68 (д, J=7,60 Гц, 2H), 10,94 (с, 1H), 11,33 (с, 1H).
Суспензию соединения 42 (130 мг, 0,436 ммоль) в оксихлориде фосфора (2,5 мл, 26,9 ммоль) перемешивали при температуре 100°C в течение 3 часов. Суспензии давали охладиться до комнатной температуры, и затем добавляли тетраметилхлорид аммония (47,8 мг, 0,436 ммоль) и оксихлорид фосфора (1 мл, 10,76 ммоль) и реакционную смесь перемешивали при температуре 100°C в течение 7 часов. Реакцию гасили метанолом при охлаждении льдом. Смесь разбавляли дистиллированной водой и нейтрализовали 2н водным раствором NaOH, затем экстрагировали три раза хлороформом. Органический слой сушили над сульфатом натрия, и растворитель удаляли при пониженном давлении. Концентрированный остаток очищали путем хроматографии на колонке с силикагелем (гексан:этилацетат = 2:1) с получением соединения 43 (42 мг, 30%) в виде твердого вещества коричневого цвета.
Соединение 43;1H-ЯМР (ДМСО-d6) δ: 1,96-2,01 (м, 4H), 3,28-3,33 (м, 4H), 6,65 (д, J=9,12 Гц, 2H), 7,79 (д, J=9,12 Гц, 2H), 7,96 (ушир.с, 1H), 13,96 (с, 1H).
К раствору соединения 43 (40 мг, 0,126 ммоль) в ДМФ (0,4 мл) при охлаждении льдом добавляли DIPEA (28,7 мкл, 0,164 ммоль) и SEMCl (24 мкл, 0,133 ммоль) и реакционную смесь перемешивали при температуре 0°C в течение 40 минут. Реакционную смесь разбавляли 1 мл дистиллированной воды, затем экстрагировали этилацетатом, промывая насыщенным солевым раствором и сушили над сульфатом натрия. Растворитель удаляли при пониженном давлении. Концентрированный остаток очищали путем хроматографии на колонке с силикагелем (гексан:этилацетат = от 5:1 до 2:1) с получением соединения 44a (31,2 мг, 55%) и 44b (9,2 мг, 16%) в виде масла желтого цвета и твердого вещества желтого цвета, соответственно.
Соединение 44a;1H-ЯМР (ДМСО-d6) δ: -0,12 (с, 9H), 0,90 (т, J=7,86 Гц, 2H), 1,99 (т, J=6,59 Гц, 4H), 3,27-3,33 (м, 4H), 3,68 (т, J=7,86 Гц, 2H), 5,66 (с, 2H), 6,65 (д, J=9,12 Гц, 2H), 7,88 (дд, J=9,12, 1,52 Гц, 2H), 8,08 (д, J=12,17 Гц, 1H).
Соединение 44b;1H-ЯМР (ДМСО-d6) δ: -0,07 (с, 9H), 0,86 (т, J=8,11 Гц, 2H), 1,99 (т, J=6,59 Гц, 4H), 3,29-3,33 (м, 4H), 3,60 (т, J=8,11 Гц, 2H), 5,65 (с, 2H), 6,66 (д, J=9,12 Гц, 2H), 7,80 (д, J=9,12 Гц, 2H), 8,23 (д, J=11,15 Гц, 1H).
Пример 14


К раствору соединения 44a (30 мг, 0,067 ммоль) в ДМФ (600 мкл) добавляли карбонат цезия (33 мг, 0,101 ммоль) и трет-бутил 2-(4-гидроксифенил)-2-метилпропаноат (21 мг, 0,087 ммоль) и реакционную смесь перемешивали при температуре 70°C в течение одного часа. Реакционную смесь разбавляли 1 мл дистиллированной водой, затем экстрагировали этилацетатом, промывая насыщенным солевым раствором и сушили над сульфатом натрия. Растворитель удаляли при пониженном давлении. Концентрированный остаток очищали путем хроматографии на колонке с силикагелем (гексан:этилацетат = 5:1) с получением соединения 45 (36 мг, 82%) в виде твердого вещества белого цвета.
Соединение 45;1H-ЯМР (ДМСО-d6) δ: -0,10 (с, 9H), 0,93 (т, J=8,11 Гц, 2H), 1,37 (с, 9H), 1,49 (с, 6H), 1,99 (т, J=6,34 Гц, 4H), 3,28-3,33 (м, 4H), 3,76 (т, J=8,11 Гц, 2H), 5,62 (с, 2H), 6,65 (д, J=8,62 Гц, 2H), 7,37-7,46 (м, 4H), 7,79-7,86 (м, 3H).
К раствору соединения 45 (34 мг, 0,053 ммоль) в DCM (600 мкл) добавляли ТФУ (600 мкл, 7,79 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 4 часов. Растворитель удаляли при пониженном давлении, и полученный остаток разбавляли дистиллированной водой (1 мл). Смесь доводили до pH=5 с помощью 2н водного раствора NaOH, затем экстрагировали три раза этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Растворитель удаляли при пониженном давлении. К концентрированному остатку добавляли 15 мл этилацетата и полученный твердый остаток фильтровали с получением соединения C-39 (18 мг, 74%) в виде твердого вещества желтого цвета.
Соединение C-39;1H-ЯМР (ДМСО-d6) δ: 1,51 (с, 6H), 1,98 (т, J=4,39 Гц, 4H), 3,29 (т, J=4,39 Гц, 4H), 6,63 (д, J=9,12 Гц, 2H), 7,37 (д, J=8,62 Гц, 2H), 7,44 (д, J=8,62 Гц, 2H), 7,71 (д, J=12,17 Гц, 1H), 7,76 (д, J=9,12 Гц, 2H), 12,43 (с, 1H), 13,09 (с, 1H).
Соединения, показанные далее, были синтезированы тем же способом. Представлены результаты данных анализа ЯМР или LC/MS для каждого соединения.

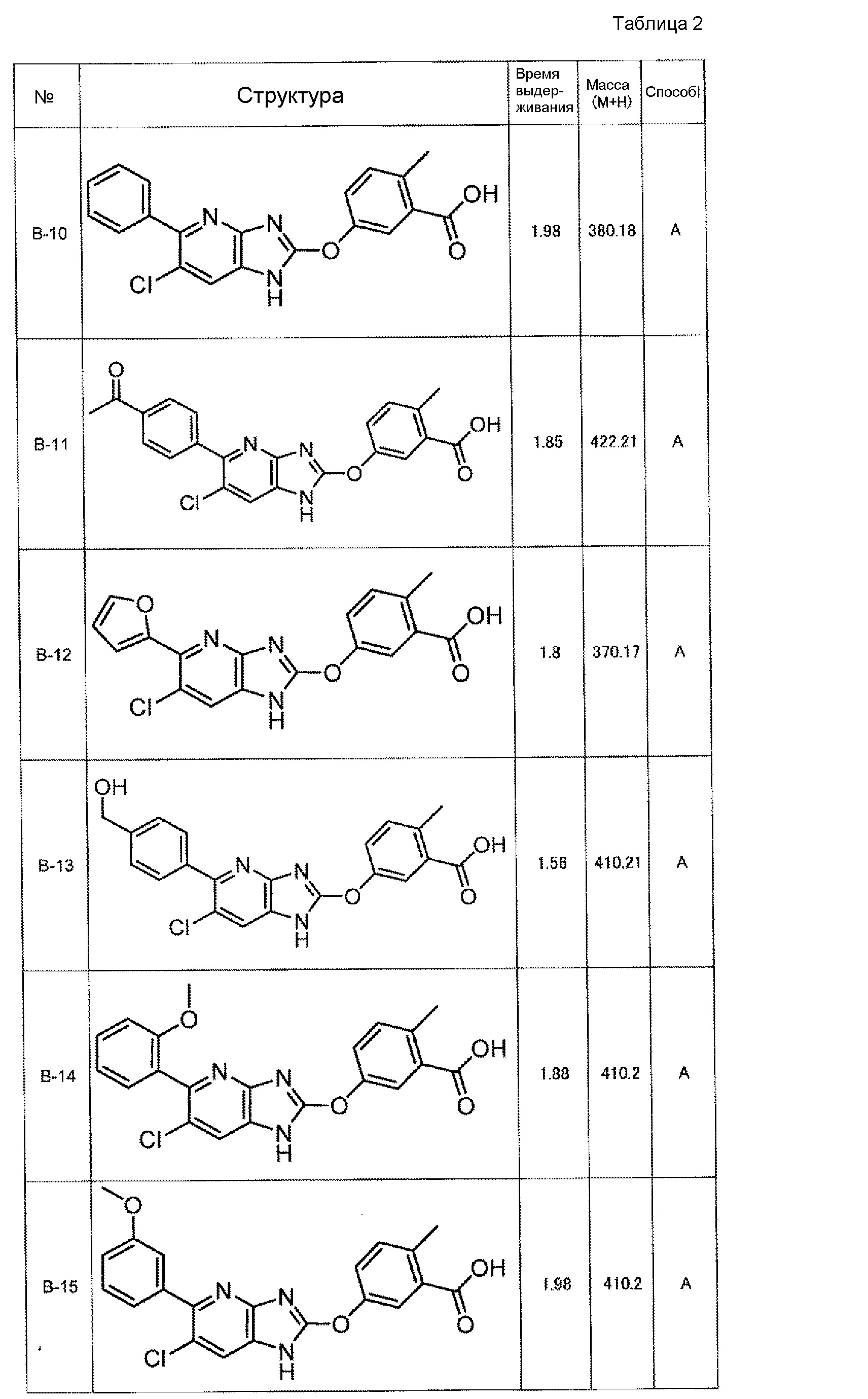







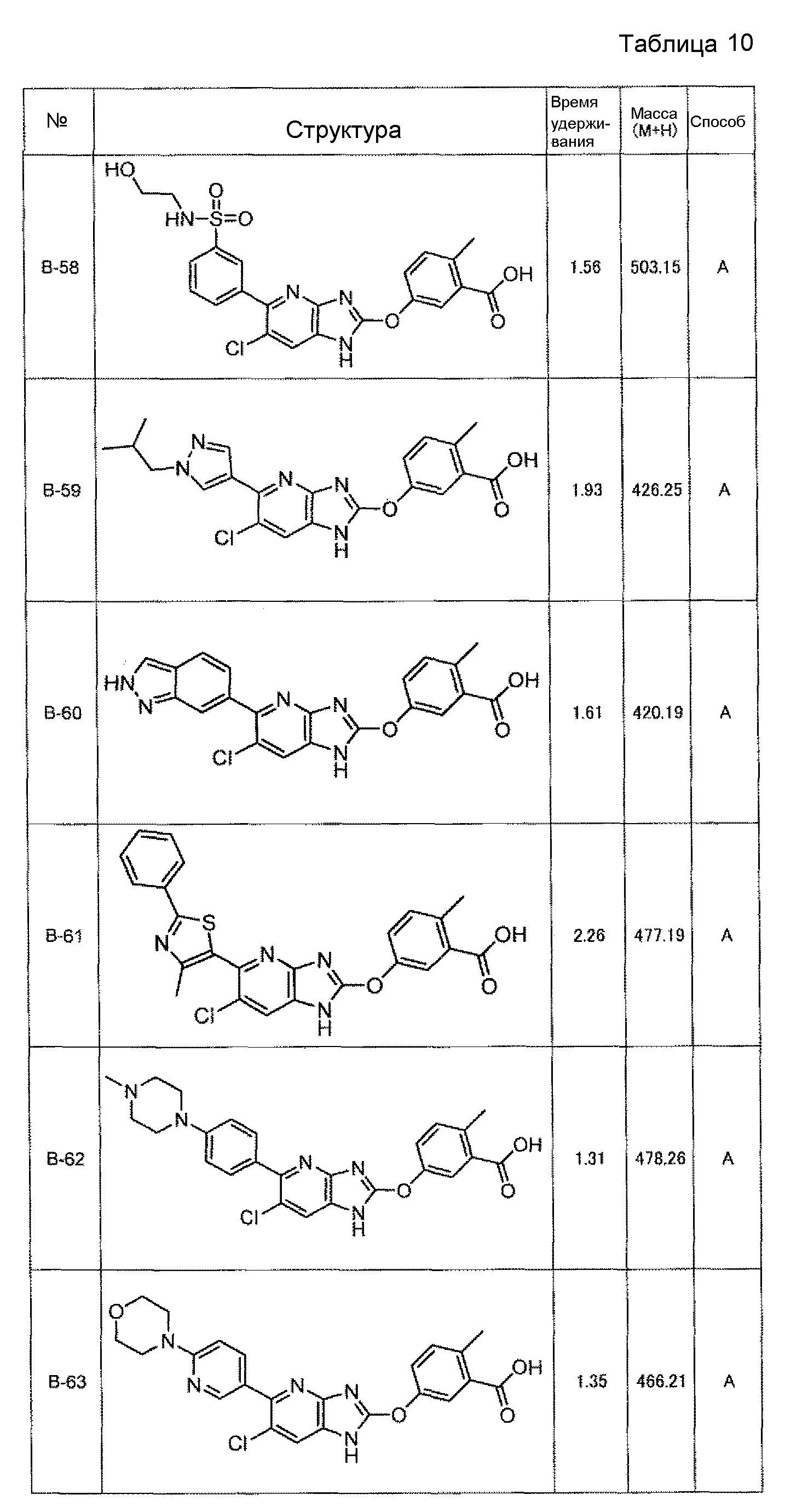
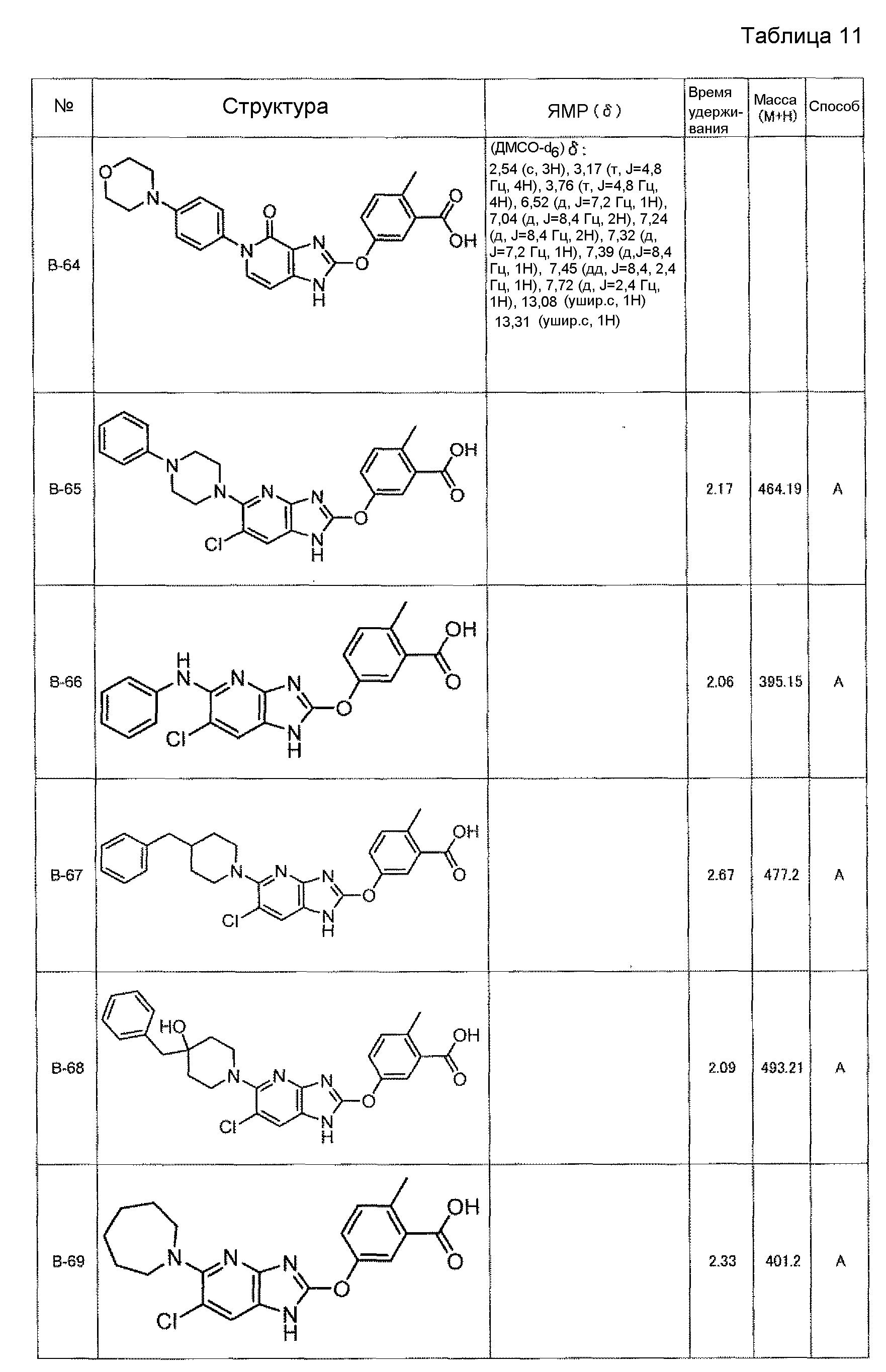









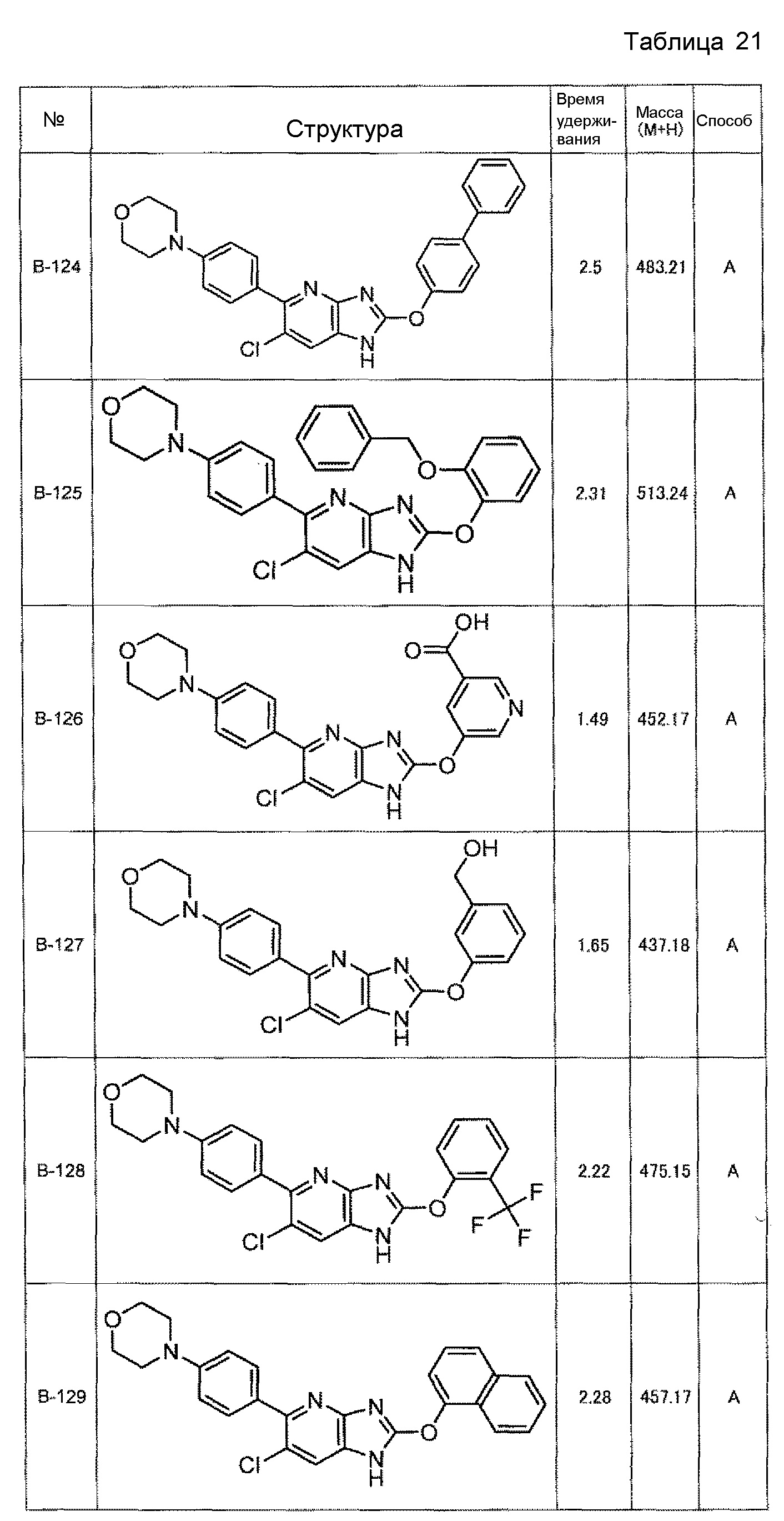




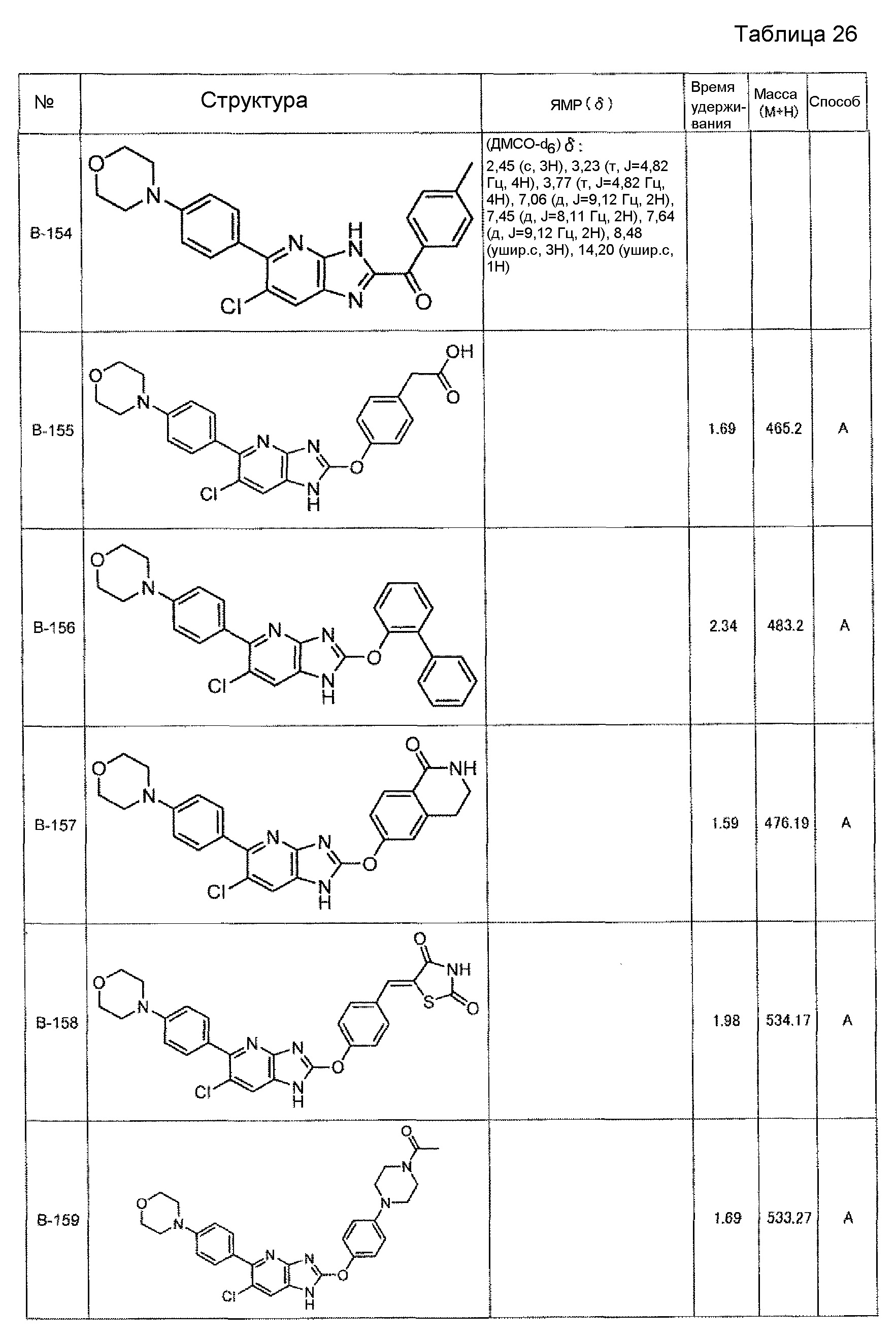

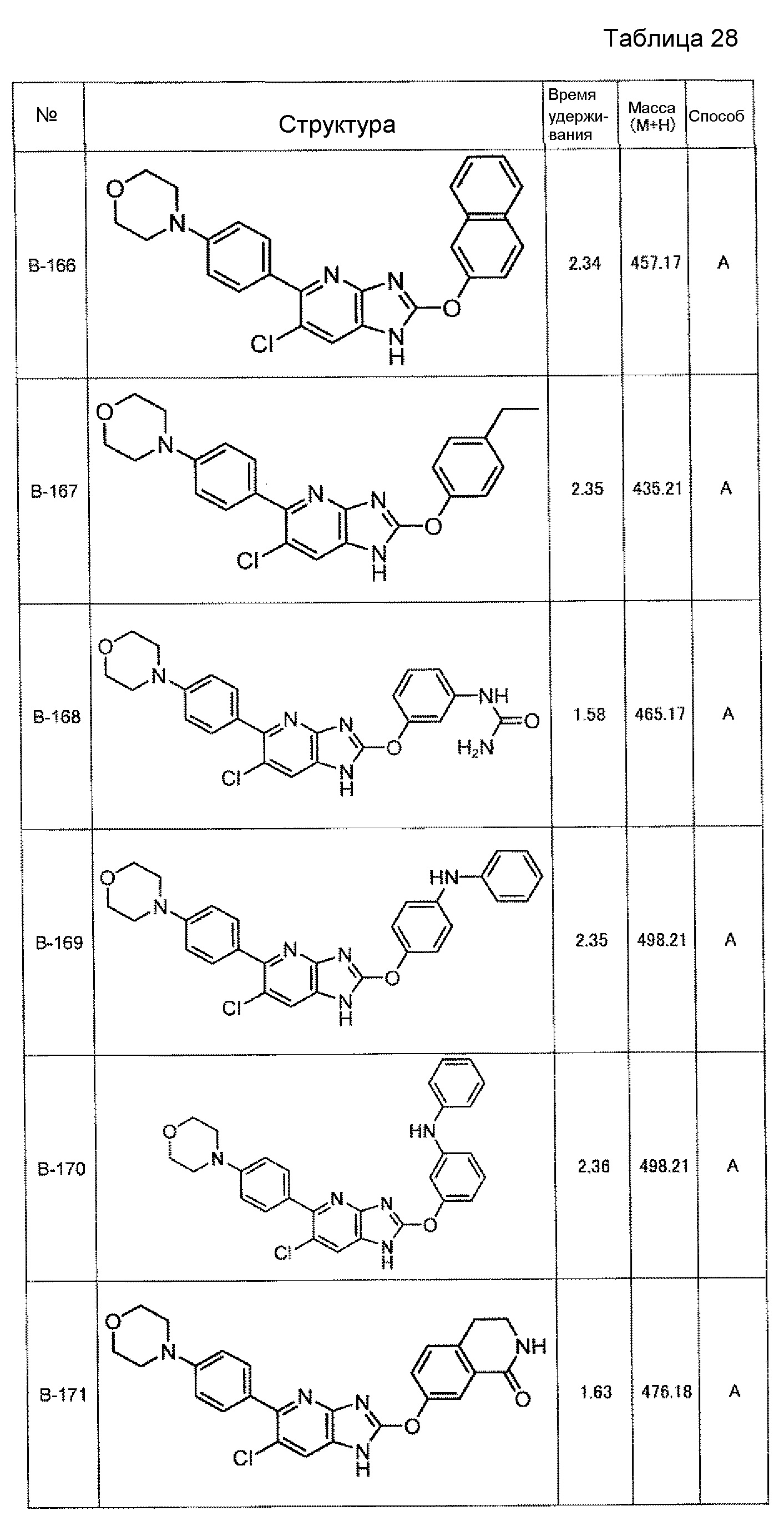














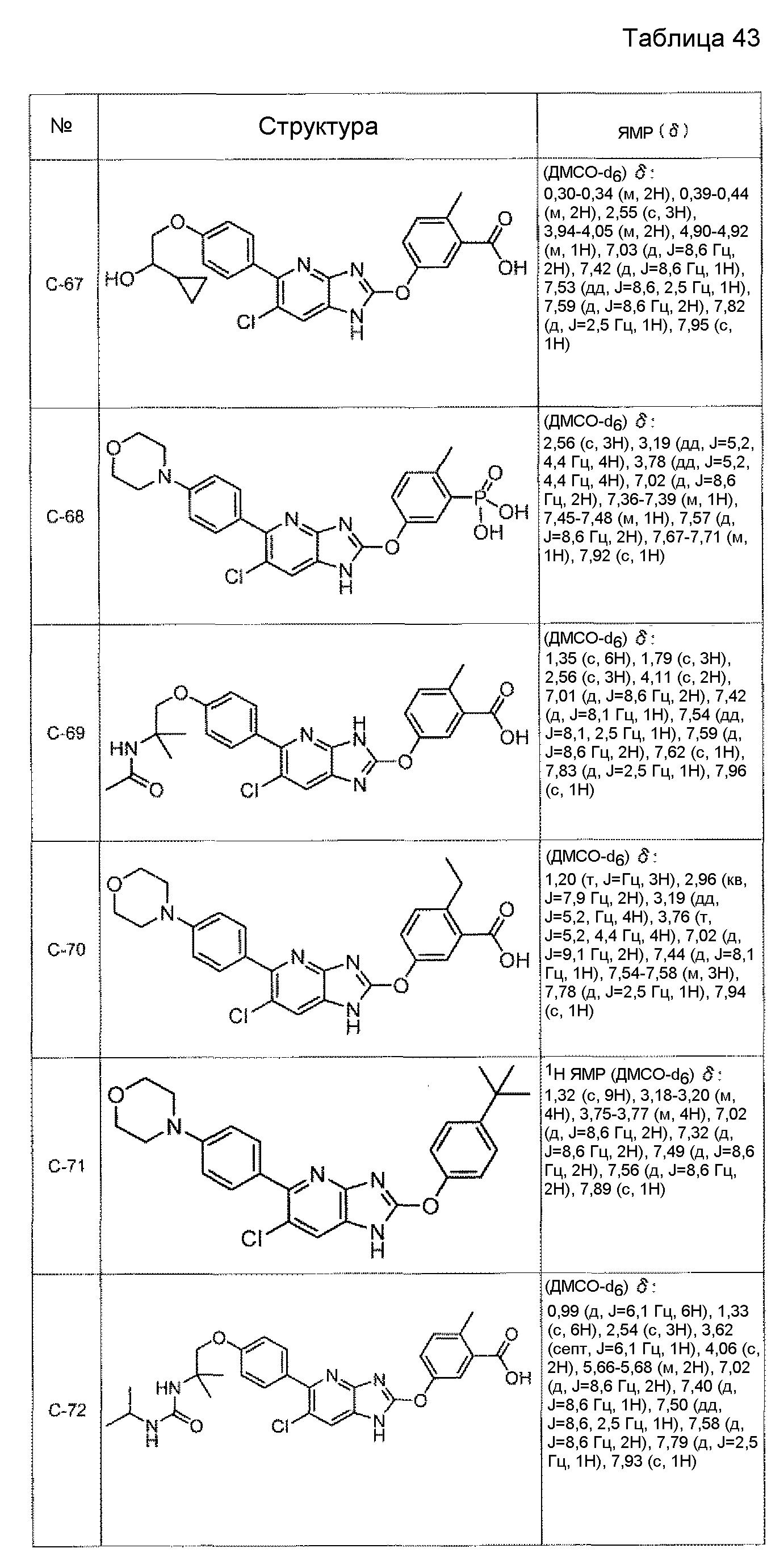



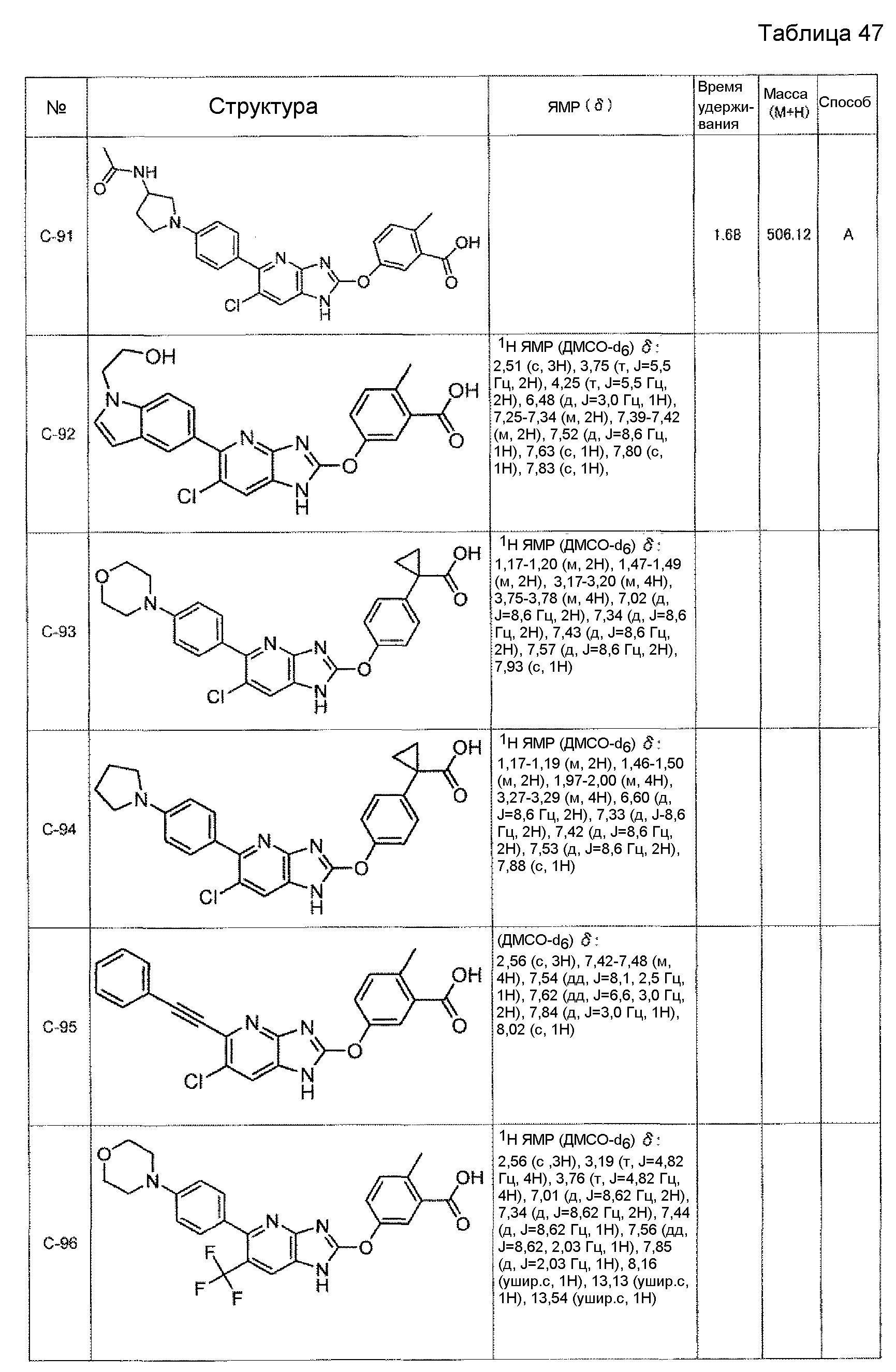
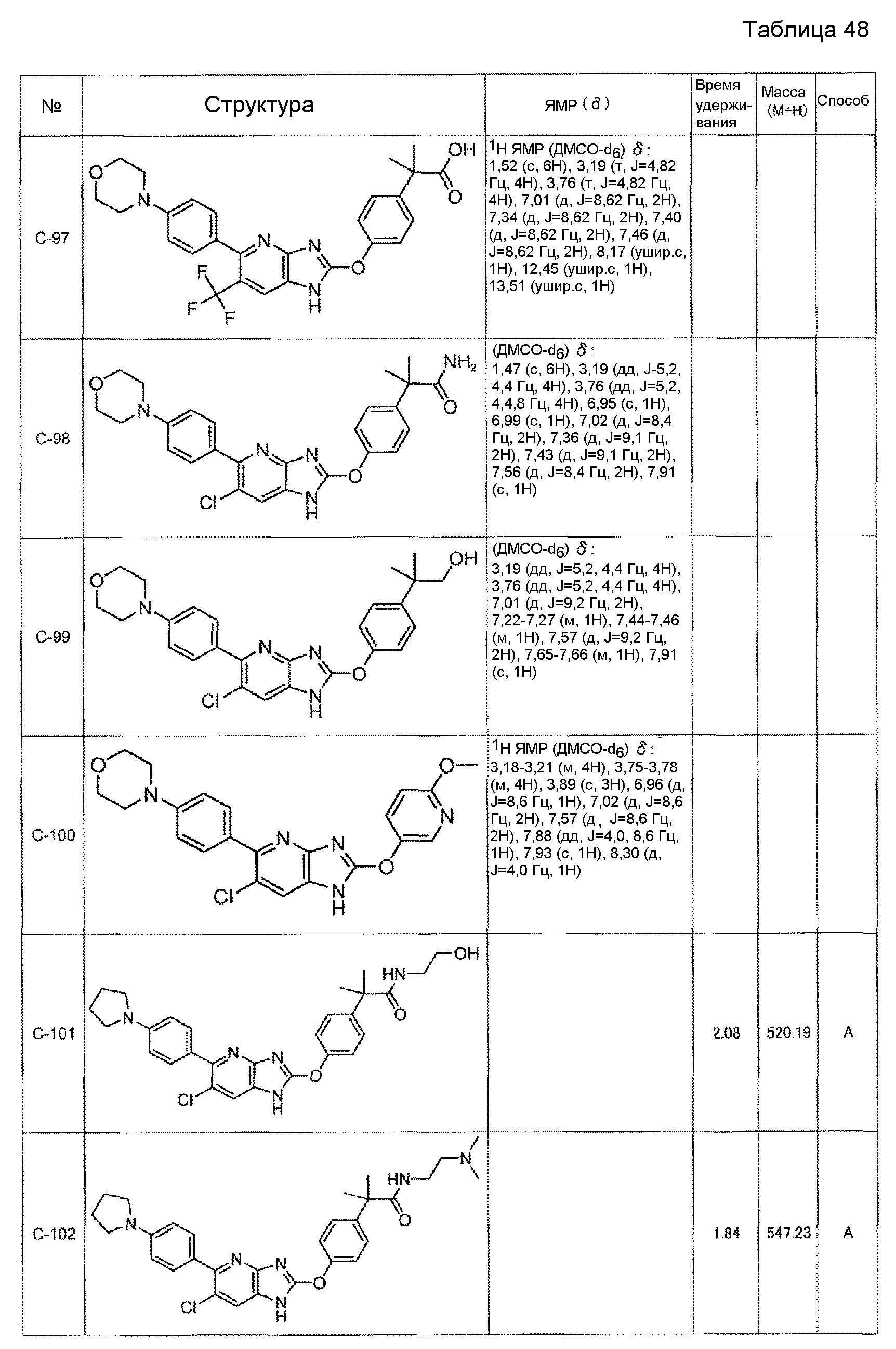
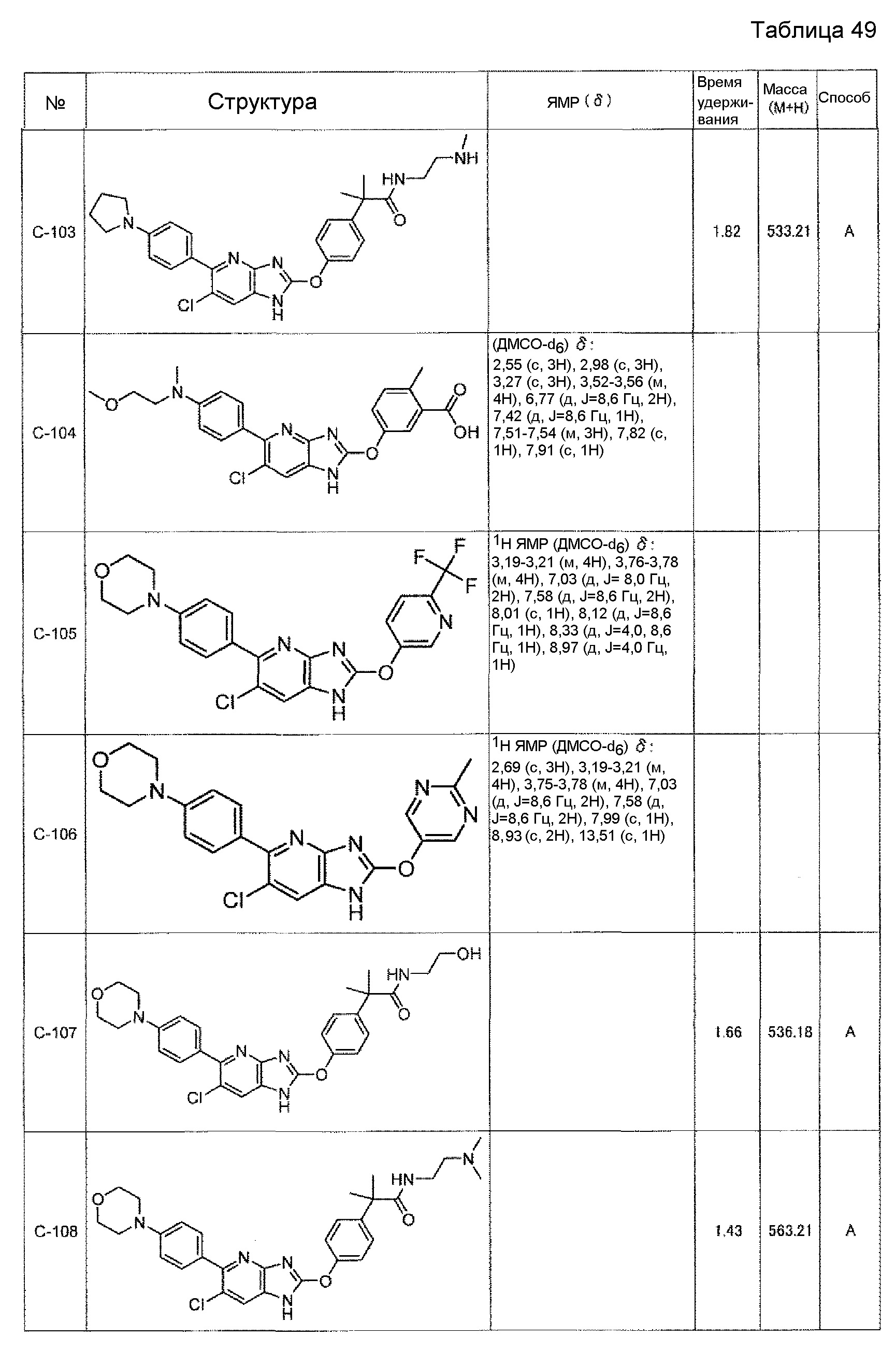






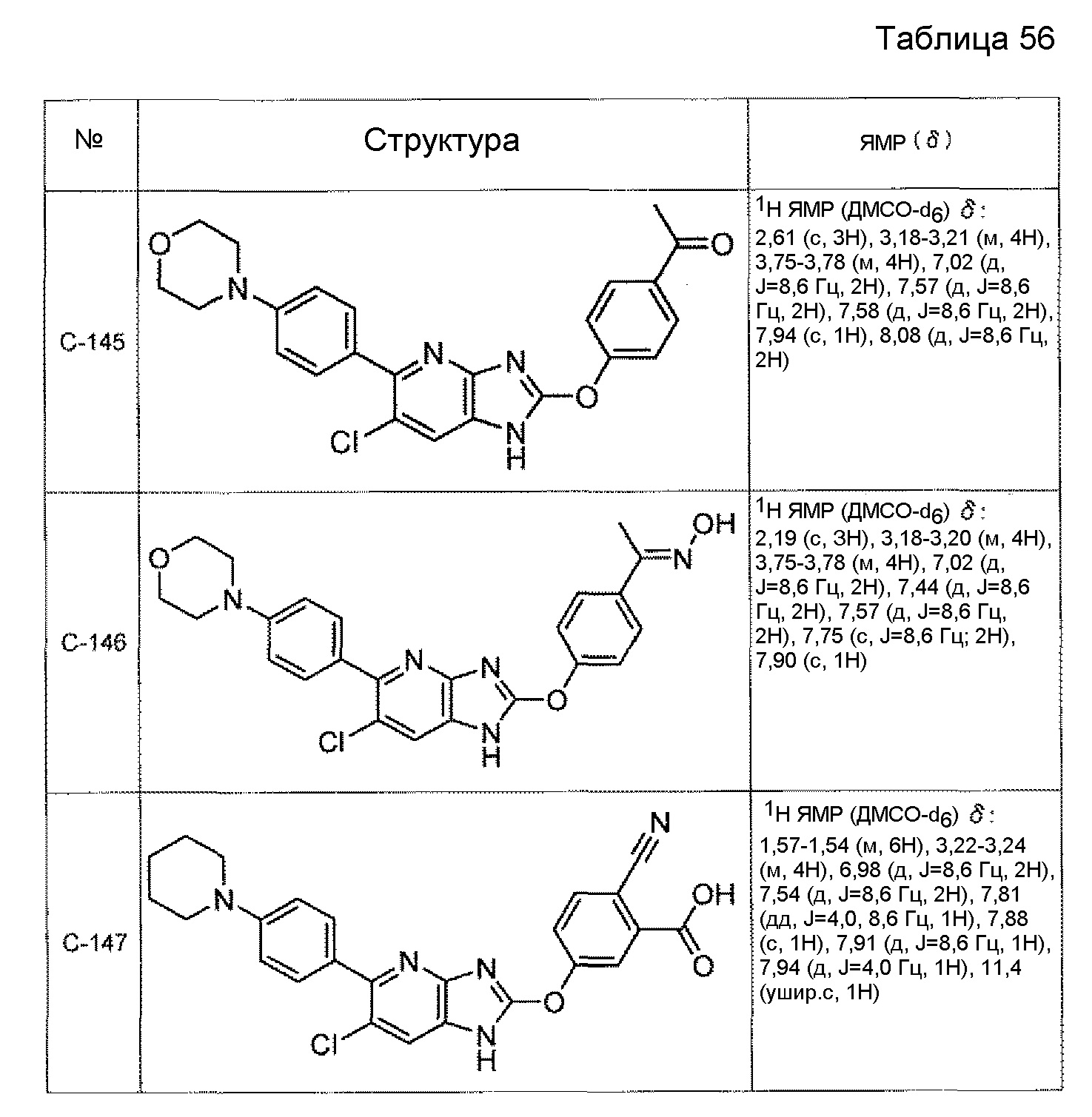

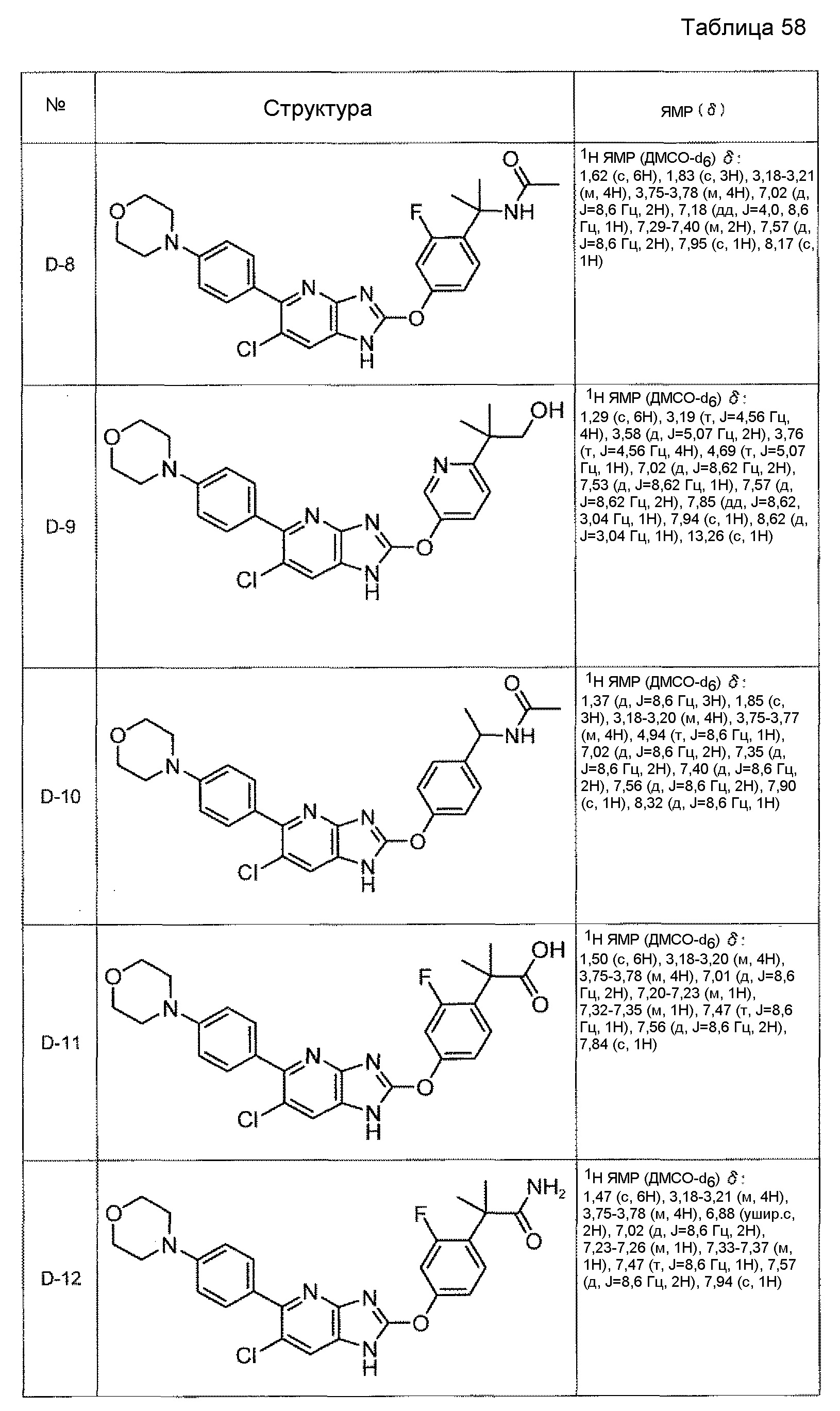

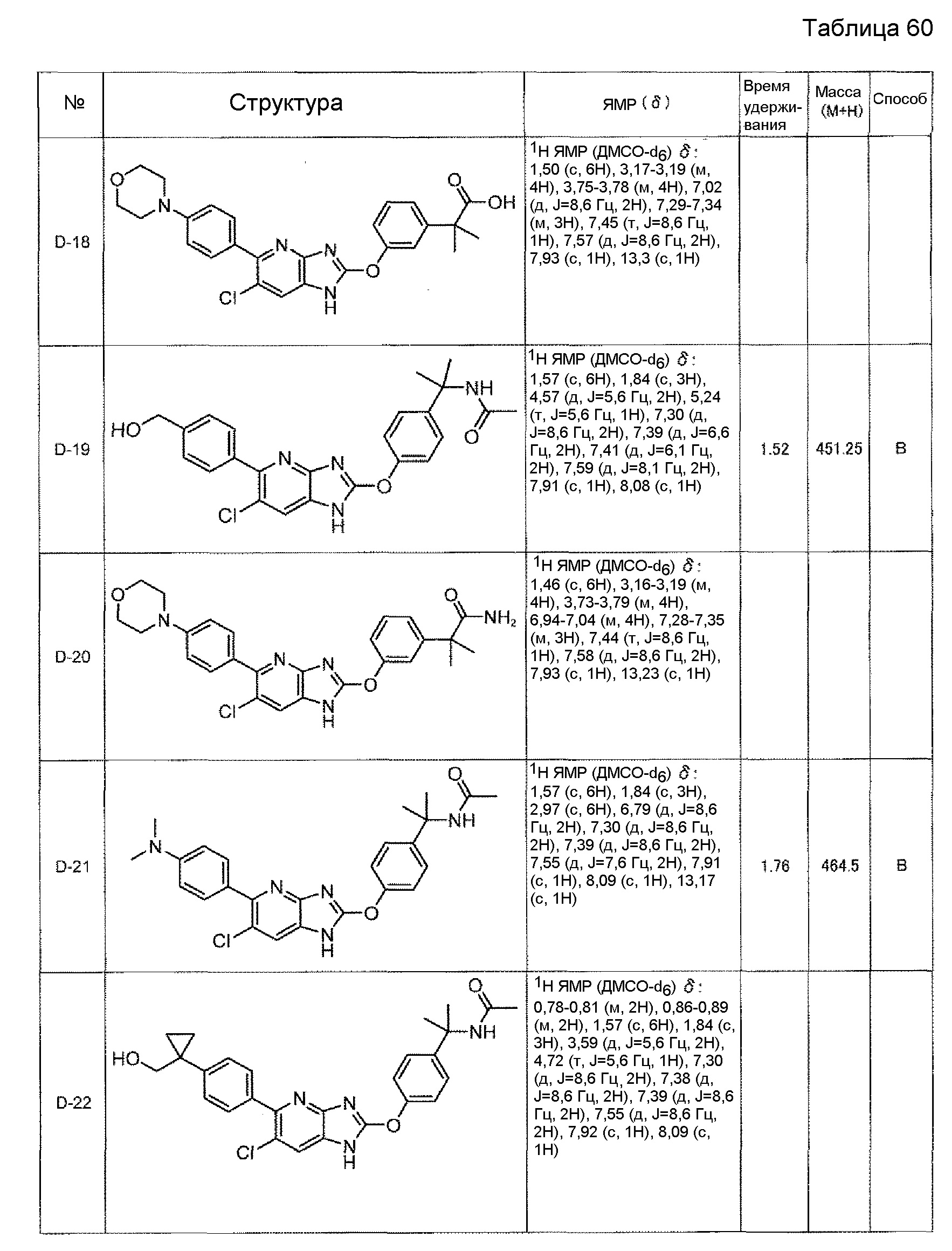
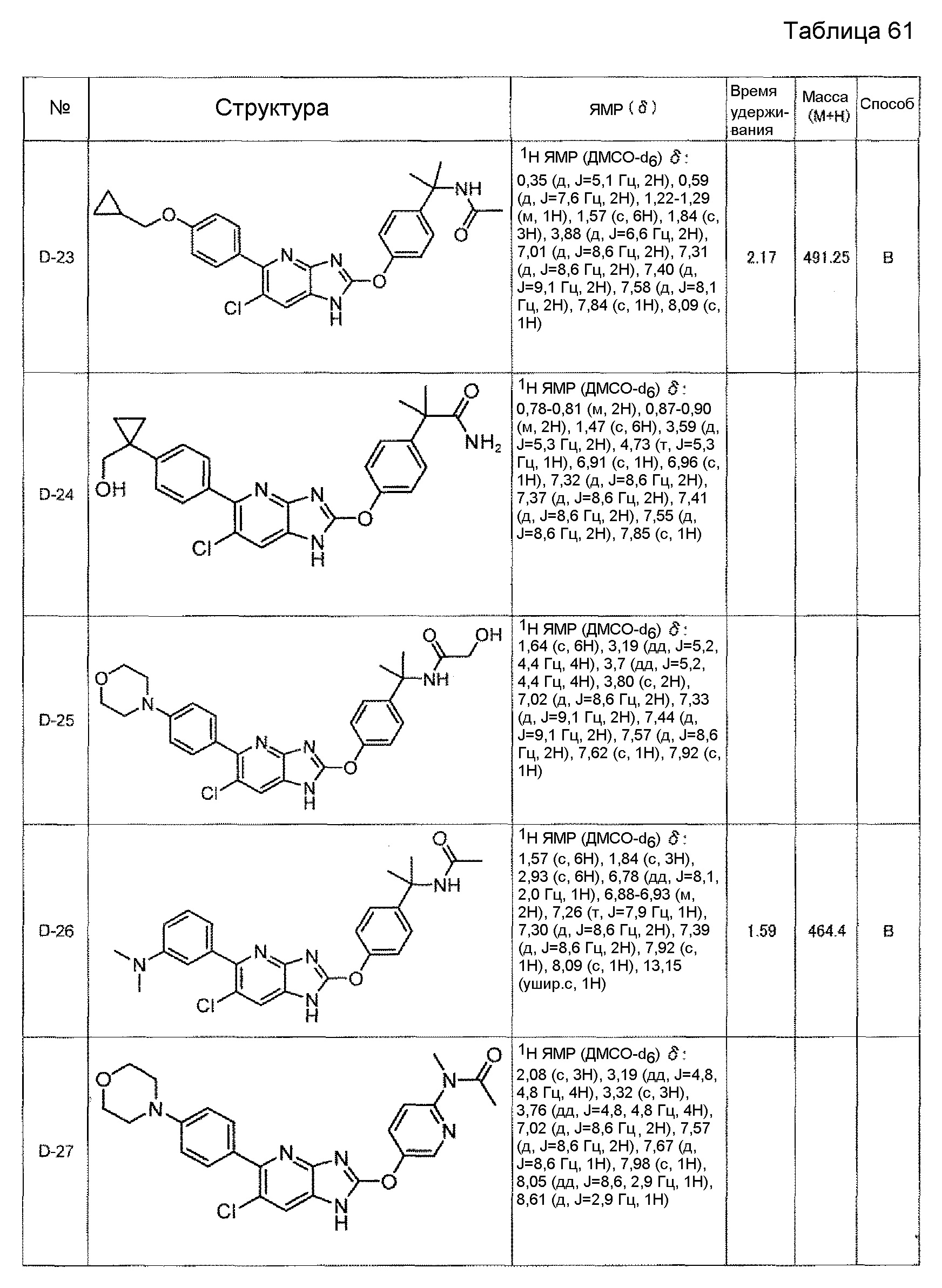


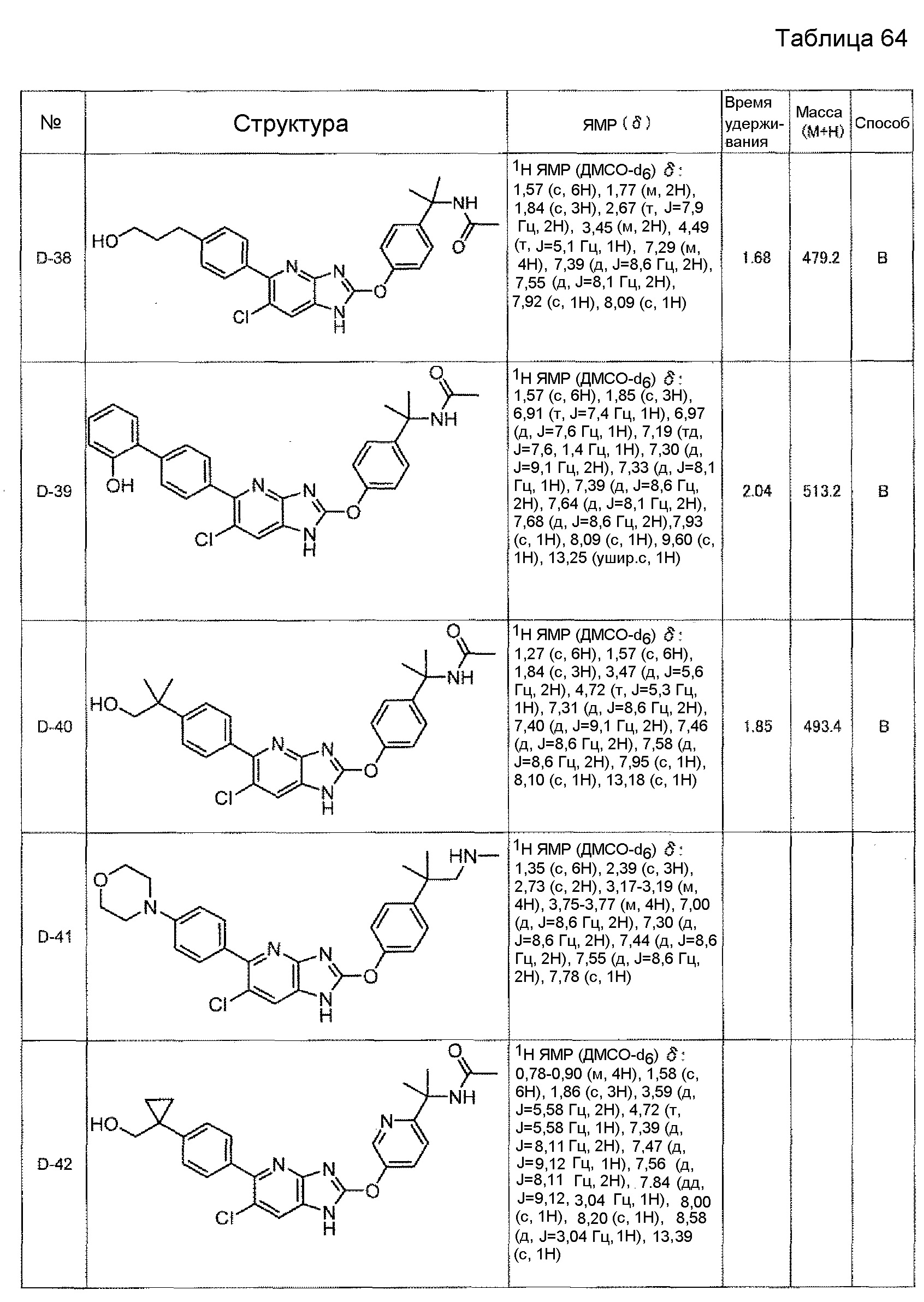
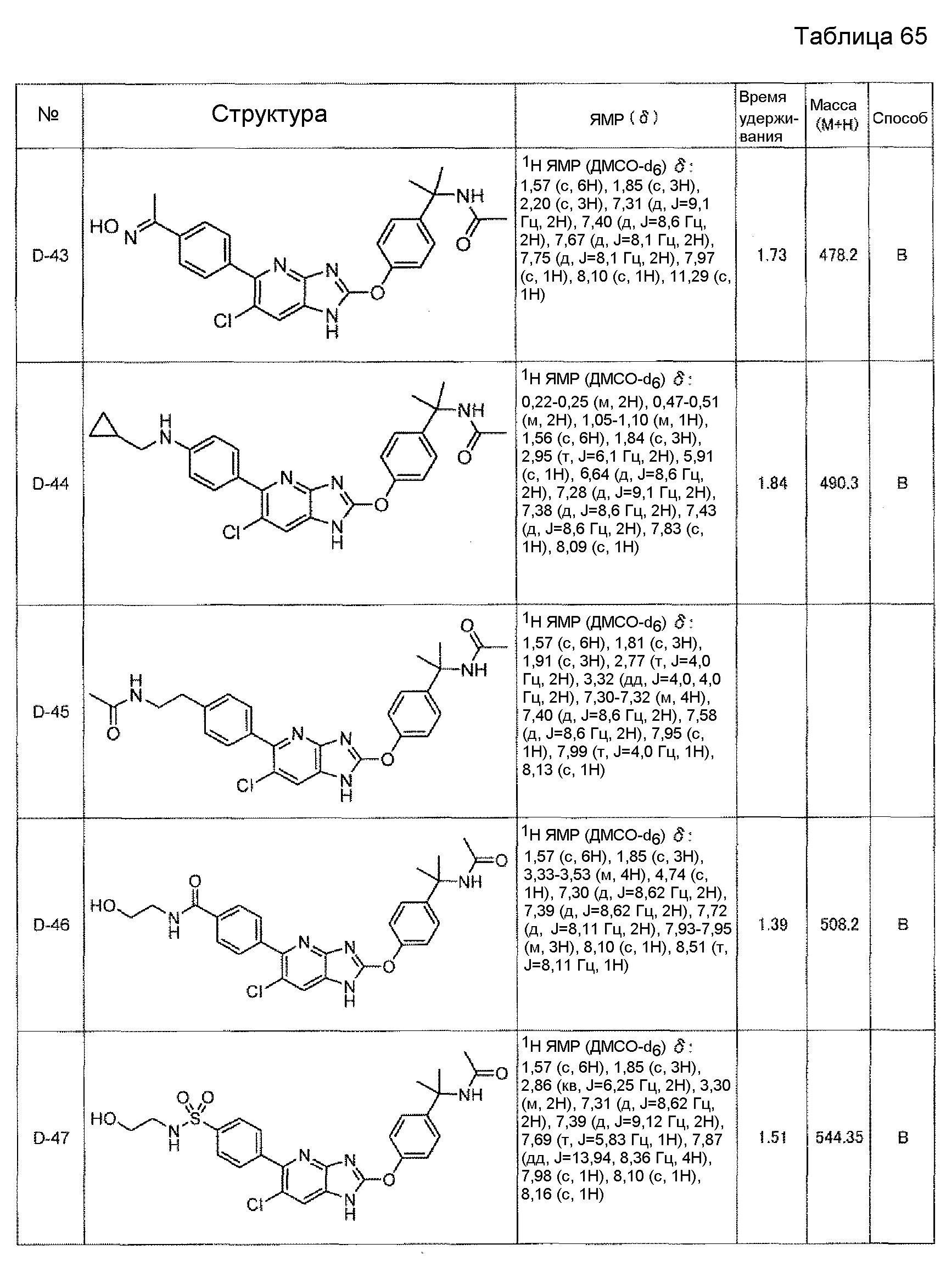



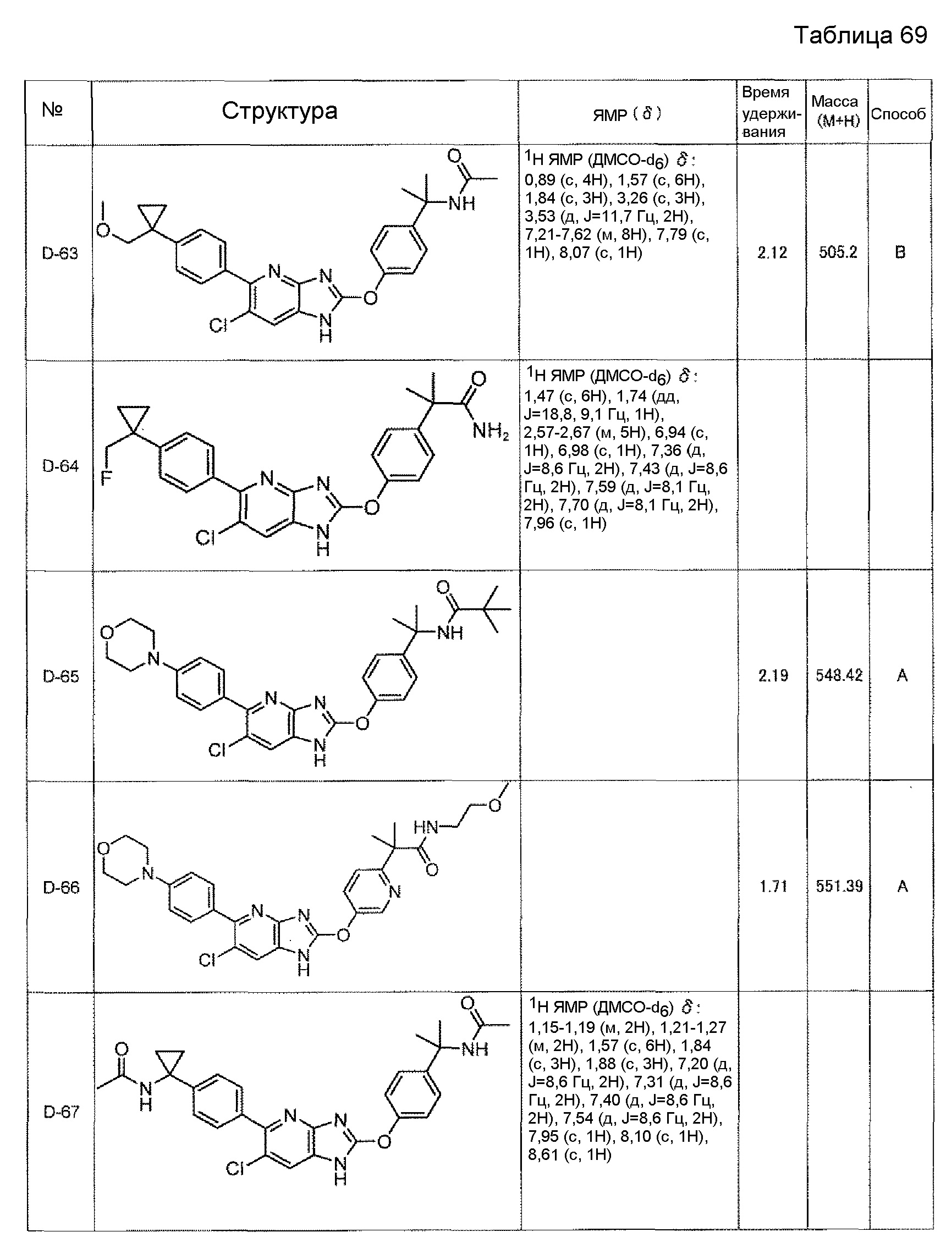
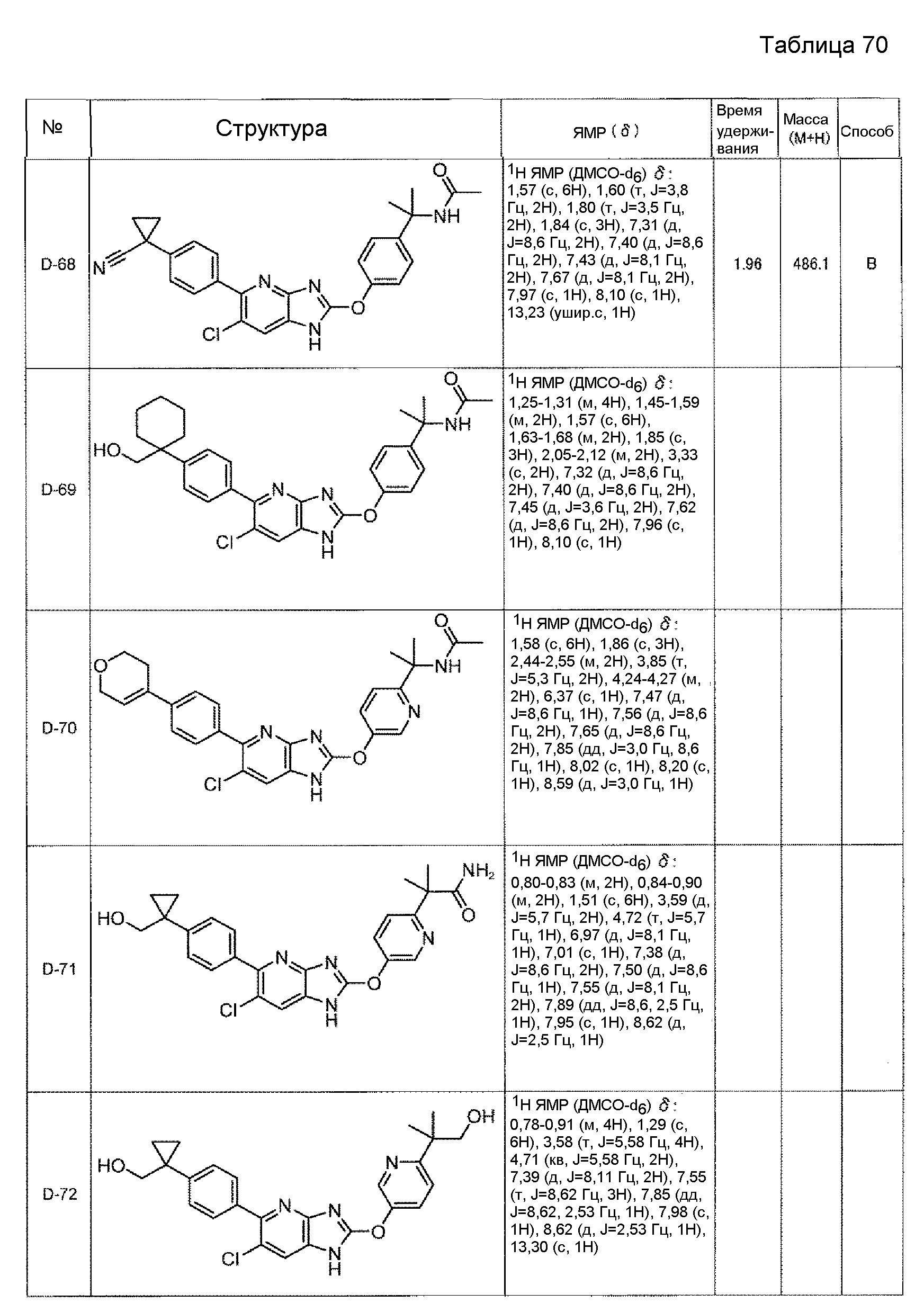







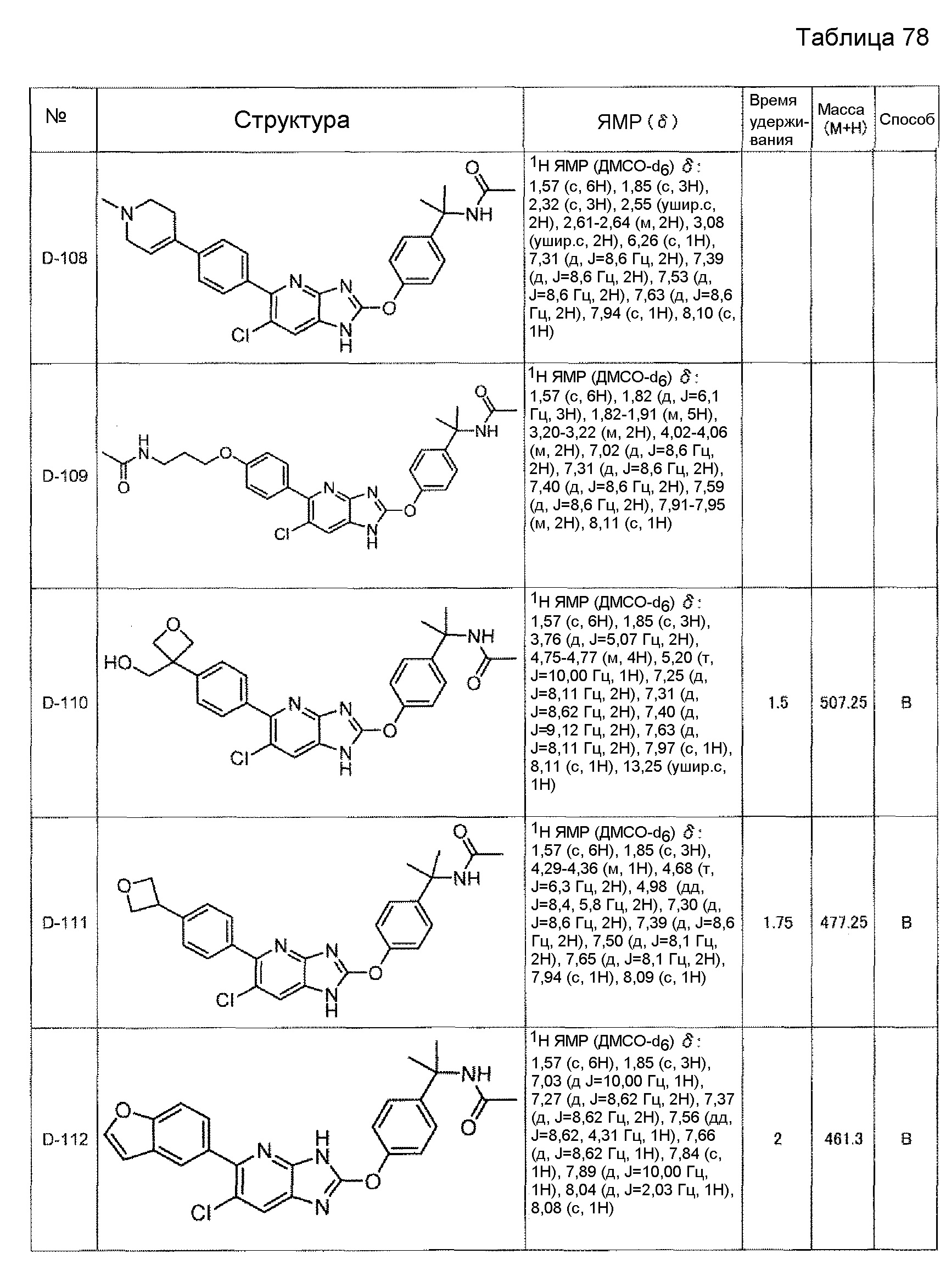
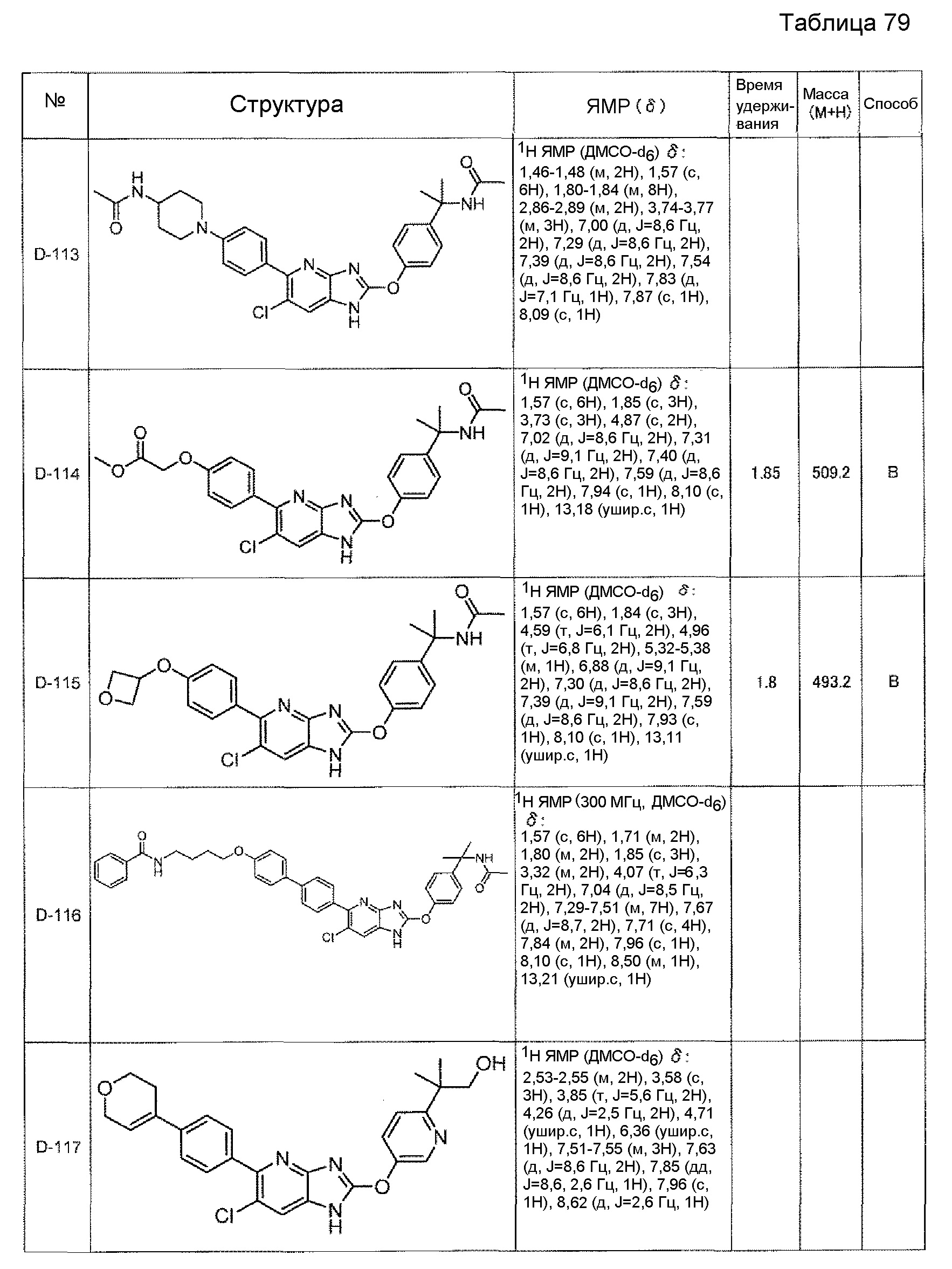




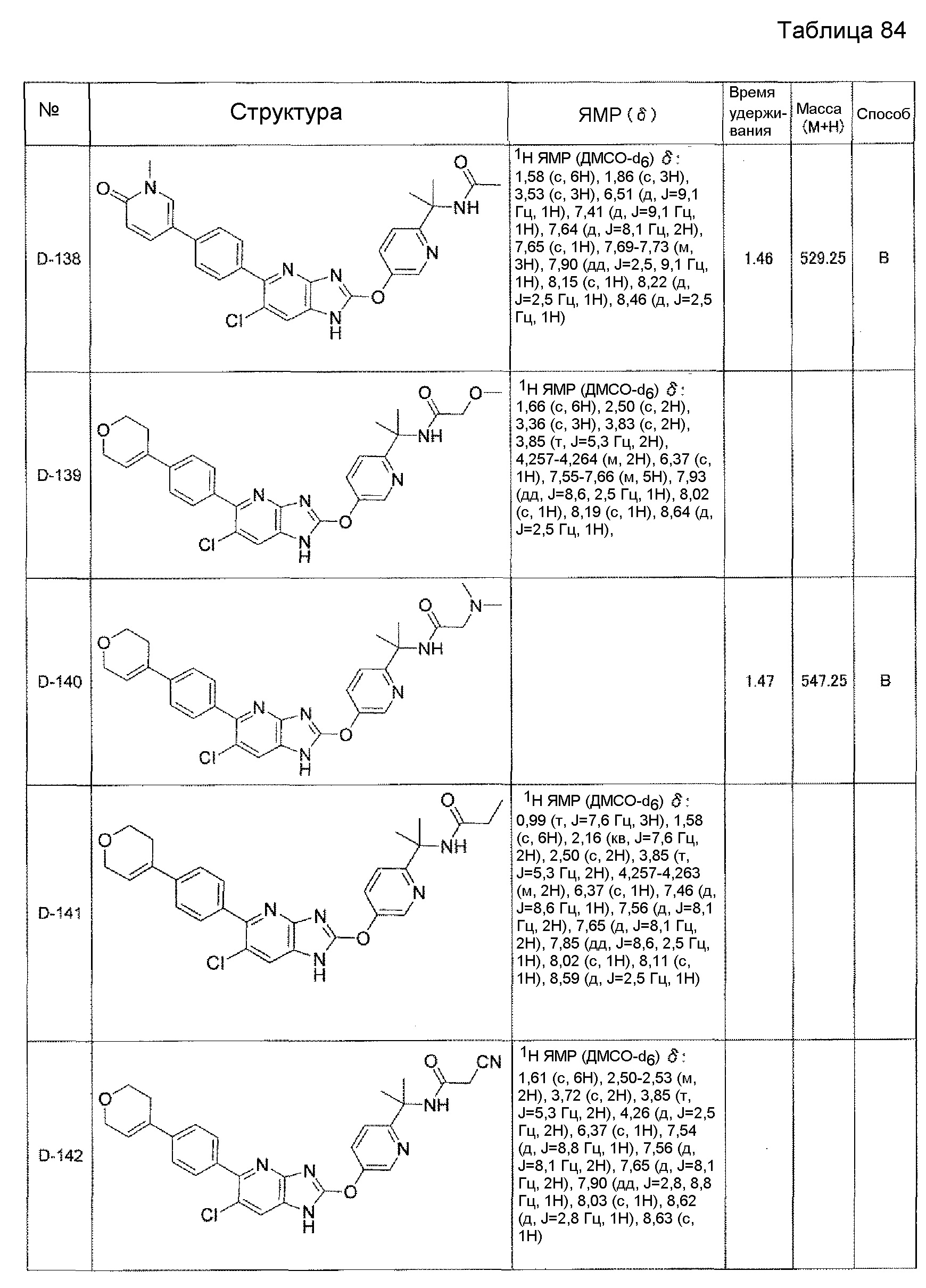



Соединения, показанные далее, также могут быть синтезированы согласно вышеприведенным примерам в качестве соединений по настоящему изобретению.



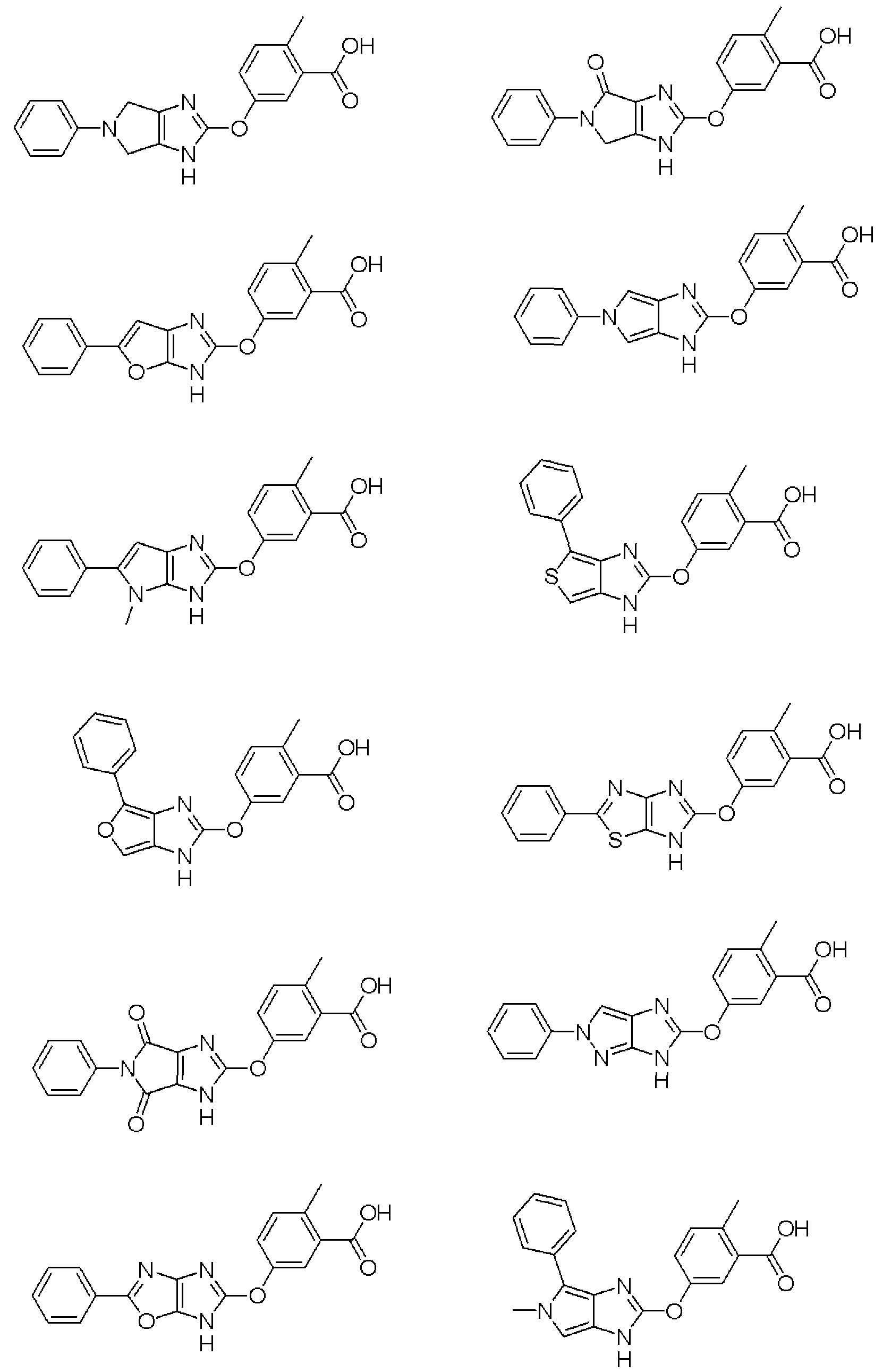
Далее, соединение, показанное далее, также может быть синтезировано в качестве соединения по настоящему изобретению.

Где X представляет собой -O- или -S-.
Где R1 включает заместители, показанные далее.




Где R1* представляет собой F или Cl.
Где Y включает заместители, показанные далее.





В частности, соединения, показанные далее, являются предпочтительными.

где R1 включает заместители, показанные в вышеприведенных примерах.

где Y включает заместители, показанные в вышеприведенных примерах.

где Y включает заместители, показанные в вышеприведенных примерах.
Способ оценки активатора для AMP-активированной протеинкиназы (AMPK)
Пример исследования 1
В буферный раствор, состоящий из 50 мМ буферного раствора HEPES-NaOH (рН 7,0), 100 мМ NaCl, 10 мМ хлорида магния, 0,1% бычьего сывороточного альбумина, 0,2 мМ ортованадата(V) натрия, 1 мМ этиленгликоль-бис (2-аминоэтил эфир)-N,N,N’,N’-тетрауксусной кислоты (EGTA), 5 мМ β-глицерофосфата динатрия и 2 мМ дитиотреитола, добавляли фермент человеческой AMPK α1β1γ1 (производство Carna Biosciences, Inc.) в таком количестве, чтобы получить скорость преобразования приблизительно 10% при взаимодействии в течение 2 часов и в смесь добавляли соединение, растворенное в ДМСО, так, чтобы иметь 1% концентрацию ДМСО. Полученную жидкость оставляли стоять в течение 10 минут.
К жидкости в равном количестве (10 мкл всего) добавляли раствор субстрата, состоящий из 50 мМ буферного раствора HEPES-NaOH (рН 7,0), 100 мМ NaCl, 10 мМ хлорида магния, 0,1% бычьего сывороточного альбумина, 0,2 мМ ортованадата(V) натрия, 1 мМ этиленгликоль-бис(2-аминоэтиловый эфир)-N,N,N’,N’-тетрауксусную кислоту (EGTA), 5 мМ β-глицерофосфата динатрия, 2 мМ дитиотреитола, 0,4 мМ ATP и 3 мкМ FL-Peptide 7 (производство Calier Life Sciences, Inc.). Полученной жидкости давали взаимодействовать при температуре 25°C в течение 2 часов, и затем в смесь добавляли 10 мкл 20 мМ EDTA для остановки реакции.
Для определения фосфорилированных флуоресцентных субстратов реакционную жидкость наносили на измеряющее устройство, LabChip EZ Reader II, производства Caliper Life Science, Inc., для определения флуоресценции, используя различия в подвижности из-за различий в заряде. Заданными условиями для устройства было давление, -1,5 PSI; восходящее напряжение, -2250 V; нисходящее напряжение, -400 V; задержка времени образца буфера sip, 40 секунд; финальное время задержки, 120 секунд; и порядок пика, Product First.
Скорость преобразования рассчитывали по высоте пиков полученного субстрата и продукта. Скорость преобразования, когда в качестве контроля использовали контроль, не содержащий соединение, и кривая зависимости от концентрации была получена путем нанесения скорости снижения активности по отношению к контролю для каждой концентрации соединения. Концентрация соединения, показывающая 150% по отношению к контролю (100%), была использована в качестве значения EC 150, и максимальная скорость увеличения активности в пределах диапазона измерений была использована в качестве Emax.
Результаты примера исследования 1 показаны далее
Соединение A-1: EC150=4,5 нМ, Emax=383%
Соединение A-2: EC150=7 нМ, Emax=408%
Соединение B-2: EC150=3,6 нМ, Emax=399%
Соединение B-3: EC150=23 нМ, Emax=313%
Соединение B-5: EC150=4700 нМ, Emax=176%
Соединение B-7: EC150=5100 нМ, Emax=246%
Соединение B-10: EC150=280 нМ, Emax=290%
Соединение B-13: EC150=76 нМ, Emax=311%
Соединение B-22: EC150=13 нМ, Emax=339%
Соединение B-32: EC150=70 нМ, Emax=301%
Соединение B-40: EC150=110 нМ, Emax=297%
Соединение B-63: EC150=100 нМ, Emax=321%
Соединение B-81: EC150=25 нМ, Emax=283%
Соединение B-101: EC150=120 нМ, Emax=269%
Соединение B-104: EC150=190 нМ, Emax=267%
Соединение B-107: EC150=250 нМ, Emax=249%
Соединение B-108: EC150=27 нМ, Emax=340%
Соединение B-109: EC150=140 нМ, Emax=315%
Соединение B-110: EC150=160 нМ, Emax=288%
Соединение B-113: EC150=13 нМ, Emax=316%
Соединение B-117: EC150=370 нМ, Emax=243%
Соединение B-119: EC150=220 нМ, Emax=265%
Соединение B-121: EC150=97 нМ, Emax=278%
Соединение B-126: EC150=180 нМ, Emax=262%
Соединение B-131: EC150=44 нМ, Emax=298%
Соединение B-133: EC150=360 нМ, Emax=234%
Соединение B-136: EC150=27 нМ, Emax=333%
Соединение B-137: EC150=25 нМ, Emax=301%
Соединение B-141: EC150=61 нМ, Emax=319%
Соединение C-1: EC150=66 нМ, Emax=295%
Соединение C-4: EC150=0,42 нМ, Emax=355%
Соединение C-9: EC150=33 нМ, Emax=322%
Соединение C-11: EC150=7,4 нМ, Emax=356%
Соединение C-12: EC150=140 нМ, Emax=256%
Соединение C-21: EC150=36 нМ, Emax=338%
Соединение C-24: EC150=17 нМ, Emax=237%
Соединение C-29: EC150=8,3 нМ, Emax=349%
Соединение C-32: EC150=68 нМ, Emax=253%
Соединение C-33: EC150=52 нМ, Emax=329%
Соединение C-37: EC150=1,3 нМ, Emax=349%
Соединение C-39: EC150=35 нМ, Emax=279%
Соединение C-63: EC150=16 нМ, Emax=331%
Соединение C-70: EC150=4,2 нМ, Emax=335%
Соединение C-88: EC150=120 нМ, Emax=298%
Соединение C-89: EC150=470 нМ, Emax=242%
Соединение C-94: EC150=12 нМ, Emax=352%
Соединение C-95: EC150=17 нМ, Emax=309%
Соединение C-96: EC150=99 нМ, Emax=326%
Соединение C-98: EC150=1700 нМ, Emax=165%
Соединение C-99: EC150=170 нМ, Emax=205%
Соединение C-100: EC150=590 нМ, Emax=212%
Соединение C-106: EC150=690 нМ, Emax=278%
Соединение C-107: EC150=300 нМ, Emax=232%
Соединение C-118: EC150=2,1 нМ, Emax=334%
Соединение C-119: EC150=130 нМ, Emax=237%
Соединение D-1: EC150=430 нМ, Emax=182%
Соединение D-2: EC150=220 нМ, Emax=255%
Соединение D-3: EC150=220 нМ, Emax=192%
Соединение D-4: EC150=70 нМ, Emax=207%
Соединение D-7: EC150=1600 нМ, Emax=285%
Соединение D-8: EC150=39 нМ, Emax=244%
Соединение D-9: EC150=380 нМ, Emax=186%
Соединение D-12: EC150=69 нМ, Emax=226%
Соединение D-16: EC150=8,5 нМ, Emax=280%
Соединение D-17: EC150=11 нМ, Emax=282%
Соединение D-18: EC150=21 нМ, Emax=325%
Соединение D-21: EC150=41 нМ, Emax=351%
Соединение D-24: EC150=140 нМ, Emax=198%
Соединение D-25: EC150=31 нМ, Emax=225%
Соединение D-26: EC150=82 нМ, Emax=282%
Соединение D-31: EC150=19 нМ, Emax=314%
Соединение D-33: EC150=52 нМ, Emax=220%
Соединение D-39: EC150=0,6 нМ, Emax=310%
Соединение D-41: EC150=8300 нМ, Emax=159%
Соединение D-42: EC150=260 нМ, Emax=187%
Соединение D-43: EC150=8,4 нМ, Emax=270%
Соединение D-49: EC150=3,5 нМ, Emax=263%
Соединение D-50: EC150=11 нМ, Emax=225%
Соединение D-52: EC150=2800 нМ, Emax=169%
Соединение D-54: EC150=110 нМ, Emax=252%
Соединение D-55: EC150=2700 нМ, Emax=177%
Соединение D-56: EC150=68 нМ, Emax=211%
Соединение D-58: EC150=66 нМ, Emax=224%
Соединение D-62: EC150=80 нМ, Emax=267%
Соединение D-65: EC150=42 нМ, Emax=252%
Соединение D-70: EC150=180 нМ, Emax=214%
Соединение D-71: EC150=860 нМ, Emax=174%
Соединение D-72: EC150=220 нМ, Emax=192%
Соединение D-73: EC150=17 нМ, Emax=254%
Соединение D-102: EC150=4300 нМ, Emax=172%
Соединение D-103: EC150=110 нМ, Emax=238%
Соединение D-107: EC150=26 нМ, Emax=249%
Соединение D-108: EC150=3,3 нМ, Emax=301%
Соединение D-109: EC150=18 нМ, Emax=270%
Соединение D-110: EC150=270 нМ, Emax=220%
Соединение D-111: EC150=150 нМ, Emax=238%
Способ получения человеческой AMPK α2β2γ1
Полноразмерные кДНК человеческой AMPK β2 (NM_005399.3) и человеческой AMPK α2 (NM_006252.3) встраивали в MCS1 и MCS2 вектора pETDuet-1 для получения человеческой AMPK β2 и человеческой AMPK α2 (6x His tag на 5’ конце), экспрессирующих плазмид. Плазмид контрансфектировали с плазмидом экспрессии, в котором полноразмерная кДНК человеческой AMPK γ1 (NM_002733.3) была встроена в pET28b(+), в BL21 CodonPlus (DE3)-RIL, чтобы получить экспрессирующий штамм. Экспрессирующий штамм культивировали в среде TB, затем индуцировали с 0,5 мМ IPTG, и культивировали при 25°C в течение 3 часов и затем харвестировали. После ультразвуковой обработки супернатант собирали и наносили на колонку Histrap (GE) и 6 мл колонку RESOUECE Q (GE) для получения 12,5 мг очищенного образца, содержащего три вида подъединиц из 1,8 л питательной среды.
Способ получения человеческой CaMKK2, используемой для придания активности AMPK
Вектор экспрессии, в котором кДНК полноразмерной человеческой CAMKK β (NM_172226.1) был встроен в pGEX-6P-3, трансфицировали в BL21 Star (DE3). Экспрессирующий штамм культивировали в среде ТБ, а затем индуцировали с 0,5 мМ IPTG, и культивировали при 25°C в течение 3 часов и затем харвестировали. После ультразвуковой обработки супернатант собирали и помещали на колонку GSTrap FF (GE) для получения 14 мг GST-конденсированной CAMKK β из 720 мл питательной среды.
Способ оценки активатора для AMP-активированной протеинкиназы (AMPK)
Пример исследования 2
Человеческая AMPK α2β2γ1, полученная в Escherichia coli не была фосфорилирована и не проявляла активности. Поэтому осуществляли фосфорилирование в качестве предварительной обработки.
Человеческую AMPK α2β2γ1 в таком количестве, чтобы получить скорость преобразования приблизительно 10% путем реакции в течение 2 часов, и CaMKK2 в количестве, способном придать достаточную активность AMPK в течение одного часа, смешивали в буферном растворе, состоящем из буферного раствора 50 мМ HEPES-NaOH (pH 7,0), 100 мМ NaCl, 5 мМ хлорида магния, 0,1% сывороточного альбумина, 0,2 мМ ортованадата(V) натрия, 1 мМ этиленгликоль-бис(2-аминоэтиловый эфир)-N,N,N’,N’-тетрауксусной кислоты (EGTA), 5 мМ β-глицерофосфата динатрия, 1 мМ дитиотреитола и 0,2 мМ ATP, и полученную жидкость оставляли стоять при температуре 25°C в течение от 1 до 1,5 часа для фосфорилирования AMPK в достаточной степени.
После этого в ферментную жидкость, которая была подвергнута фосфорилированию, добавляли соединение, растворенное в ДМСО, чтобы получить 1%-ю концентрацию ДМСО. Полученную жидкость оставляли стоять в течение 10 минут.
В эту жидкость добавляли в равном количестве (10 мкл всего) раствор субстрата, состоящего из буферного раствора 50 мМ HEPES-NaOH (рН 7,0), 100 мМ NaCl, 10 мМ хлорида магния, 0,1% бычьего сывороточного альбумина, 0,2 мМ ортованадата(V) натрия, 1 мМ этиленгликоль-бис(2-аминоэтиловый эфир)-N,N,N’,N’-тетрауксусной кислоты (EGTA), 5 мМ β-глицерофосфата динатрия, 2 мМ дитиотреитола, 0,4 мМ ATP и 3 мкМ FL-Peptide 7 (производство Caliper Life Sciences, Inc.). Полученной жидкости давали реагировать при температуре 25°C в течение 2 часов, и затем в смесь добавляли 10 мкл 20 мМ EDTA для остановки реакции.
Для определения фосфорилированных флуоресцентных субстратов реакционную жидкость наносили на измеряющее устройство, LabChip EZ Reader II, производства Caliper Life Science, Inc., для определения флуоресценции, используя различия в подвижности из-за различий в заряде. Заданными условиями для устройства было давление, -1,5 PSI; восходящее напряжение, -2250 V; нисходящее напряжение, -400 V; задержка времени образца буфера sip, 40 секунд; финальное время задержки, 120 секунд; и порядок пика, Product First.
Скорость преобразования рассчитывали по высоте пиков полученного субстрата и продукта. Скорость преобразования при использовании контроля без соединения и кривая зависимости от концентрации были получены путем нанесения скорости снижения активности по отношению к контролю для каждой концентрации соединения. Концентрация соединения, показывающая 150% по отношению к контролю (100%), была использована в качестве значения EC 150, и максимальная скорость увеличения активности в пределах диапазона измерений была использована в качестве Emax.
Результаты примера исследования 2 показаны далее
Соединение A-1: EC150=130 нМ, Emax=394%
Соединение A-2: EC150=74 нМ, Emax=406%
Соединение B-101: EC150=1300 нМ, Emax=212%
Соединение B-108: EC150=410 нМ, Emax=341%
Соединение B-119: EC150=240 нМ, Emax=242%
Соединение C-4: EC150=4,3 нМ, Emax=292%
Соединение C-12: EC150=130 нМ, Emax=293%
Соединение C-94: EC150=59 нМ, Emax=325%
Соединение C-106: EC150=580 нМ, Emax=290%
Соединение D-49: EC150=54 нМ, Emax=420%
Как видно из вышеуказанных примеров исследования, соединения по настоящему изобретению обладают превосходным активирующим действием как на тример AMPK α1, так и на тример AMPK α2.
Полезность в качестве лекарственного может быть изучена в следующих испытаниях и т.д.
MBI флуоресцентное исследование CYP3A4
MBI флуоресцентное исследование CYP3A4 представляет собой исследование по изучению усиления ингибирования CYP3A4 соединением путем реакции метаболизма, и исследование было проведено с использованием в качестве фермента CYP3A4, экспрессируемого в Escherichia coli, и использованием в качестве индекса реакции, в которой 7-бензилокситрифторметилкумарин (7-BFC) дебензилируют с помощью фермента CYP3A4, с получением метаболита, 7-гидрокситрифторметилкумарина (HFC), излучающего флуоресцентный свет.
Условия реакции были следующими: субстрат, 5,6 ммоль/л 7-BFC; время предварительной реакции, 0 или 30 минут; время реакции, 15 минут; температура реакции, 25ºC (комнатная температура); содержание CYP3A4 (фермент, экспрессированный в Escherichia coli), при предварительной реакции 62,5 пмоль/мл, при реакции 6,25 пмоль/мл (при 10-кратном разведении); концентрация исследуемого лекарственного средства, 0,625, 1,25, 2,5, 5, 10, 20 ммоль/л (шесть точек).
Фермент в буфере K-Pi buffer (pH 7,4) и раствор исследуемого лекарственного средства в виде предварительного реакционного раствора помещали на 96-луночный планшет в составе предварительной реакционной смеси, часть переносили на другой 96-луночный планшет так, чтобы он был разведен 1/10 субстратом и буфером K-Pi, добавляли NADPH в качестве кофактора для инициации реакции в качестве индекса (без предварительной инкубации) и по истечении заданного времени реакции добавляли смесь ацетонитрил/0,5 моль/л Трис (трисгидроксиаминометан) = 4/1 для остановки реакции. Кроме этого, добавляли NADPH к оставшемуся предварительно инкубированному раствору для инициации предварительного инкубирования (с предварительным инкубированием) и по истечении заданного времени предварительной инкубации часть переносили на другой планшет так, чтобы он был разведен 1/10 субстратом и буфером K-Pi для инициации реакции в качестве индекса. По истечении заданного времени реакции добавляли смесь ацетонитрил/0,5 моль/л Трис (трисгидроксиаминометан) = 4/1 для остановки реакции. Для планшета, на котором осуществляли каждый индекс реакции, с помощью флуоресцентного ридера измеряли значение флуоресценции 7-HFC, который является метаболитом. (Ex=420 нМ, Em=535 нм).
Добавление только ДМСО, который является растворителем, растворяющим лекарственное средство в реакционной системе, было принято в качестве контроля (100%), оставшуюся активность (%) рассчитывали при каждой концентрации добавленного в виде раствора исследуемого лекарственного средства, и IC50 рассчитывали как обратную вероятность с помощью логистической модели, используя концентрацию и скорость ингибирования. Когда разница между значениями IC50 составляет 5 мкМ или больше, это определяют как (+), и когда разница составляет 3 мкМ или меньше, это определяют как (-).
Исследование ингибирования CYP
Используя коммерчески доступные объединенные микросомы человеческой печени и применяя в качестве маркеров 7-этоксирезофурин O-деэтилирование (CYP1A2), толбутамид метил-гидроксилирование (CYP2C9), мефенитоин 4’-гидроксилирование (CYP2C19), декстрометорфан O-деметилирование (CYP2D6) и терфенедин гидроксилирование (CYP3A4) в качестве типичных реакций метаболизма субстрата пяти форм человеческого фермента CYP (CYP1A2, 2C9, 2C19, 2D6, 3A4), оценивали степень ингибирования количества продукции каждого метаболита исследуемым соединением.
Условия реакции были следующими: субстрат, 0,5 мкмоль/л этоксирезофурина (CYP1A2), 100 мкмоль/л толбутамида (CYP2C9), 50 мкмоль/л S-мефенитоина (CYP2C19), 5 мкмоль/л декстрометорфана (CYP2D6), 1 мкмоль/л терфенедина (CYP3A4); время реакции, 15 минут; температура реакции, 37ºC; фермент, объединенные микросомы человеческой печени 0,2 мг белок/мл; концентрация исследуемого лекарственного средства, 1, 5, 10, 20 ммоль/л (четыре точки).
Каждые пять видов субстратов, микросомы печени человека или исследуемое лекарственное средство в буфере 50 мМ Hepes в качестве реакционного раствора помещали на 96-луночный планшет в составе, как описано выше, в качестве кофактора добавляли NADPH, для инициирования реакций метаболизма в качестве маркеров, и после инкубирования при температуре 37ºC в течение 15 минут добавляли раствор метанол/ацетонитрил = 1/1 (об./об.) для остановки реакции. После центрифугирования при 3000 оборотах в минуту в течение 15 минут определяли количество резоруфина (метаболит CYP1A2) в супернатанте с помощью флуоресцентного счетчика multilabel и определяли количество гидроксида трибутамида (метаболит CYP2C9), гидроксида мефенитоина 4’ (CYP2C19 метаболит), декстрометорфана (метаболит CYP2D6) и терфенадинового спирта (метаболит CYP3A4) с помощью LC/MS/MS.
Добавление только ДМСО, являющегося растворителем лекарственного средства, в реакционную систему принималось в качестве контроля (100%), остаточную активность (%) рассчитывали для каждой концентрации исследуемого лекарственного средства, добавленного в виде раствора, и IC50 рассчитывали как обратную вероятность с помощью логистической модели, используя концентрацию и скорость ингибирования.
Исследование FAT
Каждые 20 мкл замороженной Salmonella typhimurium (штамм TA98 и TA100) инокулировали в 10 мл жидкой питательной среды (2,5% оксоидный питательный бульон № 2), и культуры инкубировали при температуре 37ºC при встряхивании в течение 10 часов. 9 мл культуры TA98 центрифугировали (2000×g, 10 минут) для удаления среды, и бактерии суспендировали в 9 мл буфера Micro F (K2HPO4: 3,5 г/л, KH2PO4: 1 г/л, (NH4)2SO4: 1 г/л, дигидрат цитрата тринатрия: 0,25 г/л, MgSO4·7H2O: 0,1 г/л), и суспензию добавляли в 110 мл воздействующей среды (буфер Micro F, содержащий биотин: 8 мкг/мл, гистидин: 0,2 мкг/мл, глюкозу: 8 мкг/мл). 3,16 мл культуры TA100 добавляли в 120 мл воздействующей среды для получения исследуемого бактериального раствора. 588 мкл исследуемого бактериального раствора (или смешанного раствора из 498 мкл исследуемого бактериального раствора и 90 мкл смеси S9 в случае метаболической активирующей системы) смешивали с каждыми 12 мкл следующего раствора: раствор в ДМСО исследуемой субстанции (восемь уровней доз от максимальной дозы 50 мг/мл при 2-кратном соотношении); ДМСО в качестве отрицательного контроля; раствор в ДМСО 50 мкг/мл 4-нитрохинолин-1-оксида в качестве положительного контроля для TA98 без метаболической активирующей системы; раствор в ДМСО 0,25 мкг/мл 2-(2-фурил)-3-(5-нитро-2-фурил)акриламида в качестве положительного контроля для TA100 без метаболической активирующей системы; раствор в ДМСО 40 мкг/мл 2-аминоантрацена в качестве положительного контроля для TA98 без метаболической активирующей системы; или раствор в ДМСО 20 мкг/мл 2-аминоантрацена ДМСО в качестве положительного контроля для TA100 без метаболической активирующей системы. 12 мкл раствора и 588 мкл исследуемого бактериального раствора (смешанный раствор 498 мкл исследуемого бактериального раствора и 90 мкл смеси S9 в условиях метаболической активации) смешивали и инкубировали при температуре 37ºC при встряхивании в течение 90 минут. 460 мкл бактериальной жидкости, подвергшейся воздействию исследуемой субстанцией, смешивали с 2300 мкл индикаторной среды (буфер Micro F, содержащий биотин: 8 мкг/мл, гистидин: 0,2 мкг/мл, глюкоза: 8 мг/мл и бромкрезоловый пурпурный: 37,5 мкг/мл), и каждые 50 мкл распределяли в 48 лунок на дозу микролуночного планшета, и подвергали статическому культивированию при температуре 37°C в течение 3 дней. Лунка, содержащая бактерии, которые приобрели способность к пролиферации путем мутации кодирующей ген аминокислоты (гистидина) синтетазы, изменяла фиолетовый цвет на желтый, ввиду изменения рН. Считали число лунок желтого цвета из общего количества 48 лунок на дозу и оценивали мутагенность в сравнении с отрицательной контрольной группой.
Исследование растворимости
Растворимость соединений определяли в условиях, при которых добавляли 1% ДМСО. 10 мМ раствора соединения получали с использованием ДМСО и затем добавляли 6 мкл раствора соединения в 594 мкл искусственного кишечного сока при pH 6,8 (в 250 мл раствора 0,2 моль/л дигидрофосфата калия раствора реагента добавляли 118 мл раствора 0,2 моль/л реагента NaOH и воду с получением конечного объема 1000 мл). После отстаивания при 25ºС в течение 16 часов смешанный раствор фильтровали с отсасыванием. Фильтрат дважды разбавляли смесью метанол/вода (1/1) и затем измеряли концентрацию в фильтрате с помощью HPLC или LC/MS/MS способом абсолютной калибровки.
Исследование метаболической стабильности
При использовании коммерчески доступных объединенных микросом печени человека исследуемое соединение подвергали взаимодействию в течение постоянного времени, оставшуюся скорость рассчитывали путем сравнения прореагировавшего образца и непрореагировавшего образца, тем самым оценивали степень метаболизма в печени.
Реакцию осуществляли (окислительная реакция) при температуре 37ºС в течение 0 минут или 30 минут в присутствии 1 ммоль/л NADPH в 0,2 мл буфера (50 ммоль/л Трис-HCl рН 7,4, 150 ммоль/л хлорида калия, 10 ммоль/л хлорида магния), содержащего 0,5 мг белка/мл в микросомах печени человека. После реакции добавляли 50 мкл реакционного раствора в 100 мкл смеси метанол/ацетонитрил = 1/1 (об./об.), перемешивали и центрифугировали при 3000 оборотов в минуту в течение 15 минут. Исследуемое соединение в супернатанте определяли количественно с помощью LC/MS/MS, и оставшееся количество исследуемого соединения после того, как реакцию обсчитывали, давало количество соединения при 0-минутном времени реакции равное 100%. Реакцию гидролиза осуществляли в отсутствие NADPH и реакцию глюкуронизации осуществляли в присутствии 5 мМ UDP-глюкуроновой кислоты вместо NADPH, после подобных операций.
Исследование hERG
С целью оценки риска удлинения интервала QT электрокардиограммы с помощью клеток HEK293, экспрессирующих канал человеческого эфир-go-go родственного гена (hERG), было исследовано воздействие на задерживание выпрямления К+ тока (IKr), который играет важную роль в процессе реполяризации желудочков.
После того как клетка оставалась при потенциале мембраны -80 мВ с помощью способа фиксации потенциала клетки, используя автоматизированную систему фиксации потенциала (PatchXpress 7000A, Axon Instruments Inc.), регистрировали IKr, индуцированный деполяризационной импульсной стимуляцией при +40 мВ в течение 2 секунд и, далее, реполяризационной импульсной стимуляцией при -50 мВ в течение 2 секунд. После стабилизации генерируемого тока внеклеточный раствор (NaCl: 135 ммоль/л, KCl: 5,4 ммоль/л, NaH2PO4: 0,3 ммоль/л, CaCl2·2H2O: 1,8 ммоль/л, MgCl2·6H2O: 1 ммоль/л, глюкоза: 10 ммоль/л, HEPES (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота): 10 ммоль/л, рН=7,4), в котором была растворено исследуемое соединение, при реальной концентрации применяли к клетке в условиях комнатной температуры в течение 10 минут. Из зарегистрированных данных IKr определяли абсолютную величину хвостовой амплитуды тока, базируясь на текущем значении при потенциале находящейся в покое мембраны с использованием программного обеспечения для анализа (DataXpress ver.1, Molecular Devices Corporation). Далее рассчитывали % ингибирования относительно хвостовой амплитуды тока перед применением исследуемого вещества и сравнивали с группой, в которой использовали растворитель (0,1% раствор диметилсульфоксида), чтобы оценить влияние исследуемого вещества на IKr.
Исследование растворимости порошка
Соответствующие количества исследуемых веществ были помещены в соответствующие контейнеры. В соответствующие контейнеры добавляли 200 мкл жидкости JP-1 (хлорид натрия 2,0 г, хлористоводородная кислота 7,0 мл и вода до достижения 1000 мл), 200 мкл жидкости JP-2 (фосфатный буфер (рН 6,8) 500 мл и вода 500 мл) и 200 мкл смеси 20 ммоль/л TCA (таурохолат натрия)/жидкость JP-2 (TCA 1,08 г и вода до 100 мл). В случае, когда исследуемое соединение растворяли после добавления исследуемой жидкости, добавляли сыпучий порошок по мере необходимости. Контейнеры закрывали и встряхивали в течение 1 часа при 37°C. Смеси фильтровали и добавляли 100 мкл метанола к каждому фильтрату (100 мкл), таким образом фильтрат был разбавлен два раза. Коэффициент разбавления изменяли в случае необходимости. После подтверждения отсутствия выделения пузырьков и осадка контейнеры опечатывали и встряхивали. Количественную оценку выполняли с помощью ВЭЖХ методом абсолютной калибровки.
Исследование BA
Материалы и способы для изучения перорального поглощения
(1) Животные: мыши или крысы
(2) Содержание животных:
Мыши и крысы имели свободный доступ к твердой пище и стерилизованной водопроводной воде в бутылках.
(3) Установка дозы и составы групп:
перорально или внутривенно введенные в заданной дозе; составы групп были, как, показаны далее (доза зависит от соединения)
Перорально: 1 до 30 мг/кг (n=2-3)
Внутривенно: от 0,5 до 10 мг/кг (n=2-3)
(4) Подготовка для дозирования препарата:
для перорального введения в виде раствора или суспензии; для внутривенного введения в растворенном состоянии
(5) Способ дозирования:
При исследовании с пероральным введением исследуемую суспензию вводили в желудок крыс с помощью трубки желудочного зонда. При исследовании с внутривенным введением исследуемый раствор вводили крысам через хвостовую вену с использованием шприца с иглой.
(6) Объект оценки:
Кровь собирали в каждой точке времени и концентрацию исследуемого вещества в плазме крови определяли с помощью системы LC/MS/MS.
(7) Данные анализа:
Что касается транзиции концентрации в плазме, площадь под кривой концентрация в плазме-время (AUC) рассчитывали с помощью программы WinNonlin®, соответственно. Биодоступность (BA) рассчитывали с помощью значения AUC в исследованиях при пероральном введении и при внутривенном введении.
Флуктуационный тест Эймса
В 10 мл питательной жидкой среды (2,5% оксоидный питательный бульон № 2) высевали 20 мкл замороженной Salmonella typhimurium (штамм TA 98, штамм TA 100) и среду предварительно культивировали при встряхивании при температуре 37°C в течение 10 часов. Для штамма TA 98 9 мл бактериальной жидкости центрифугировали (2000×g, 10 мин) для удаления питательного бульона. Бактерии суспендировали в 9 мл буферного раствора Micro F (K2HPO4: 3,5 г/л, KH2PO4: 1 г/л, (NH4)2SO4: 1 г/л, дигидрат цитрата тринатрия: 0,25 г/л, MgSO4⋅7H2O: 0,1 г/л) и суспензию добавляли к 110 мл воздействующей среды (буферный раствор Micro F, содержащий биотин: 8 мкг/мл, гистидин: 0,2 мкг/мл и глюкозу: 8 мг/мл). Для штамма TA 100 3,16 мл бактериальной жидкости добавляли в 120 мл воздействующей среды для приготовления исследуемой бактериальной жидкости. Каждые 12 мкл раствора соединения по настоящему изобретению в ДМСО (несколько стадий разведения от максимальной дозы в 50 мг/мл при общем соотношении 2 или 3), ДМСО в качестве отрицательного контроля, 50 мкг/мл раствора 4-нитрохинолин-1-оксида в ДМСО для штамма TA 98 и 0,25 мкг/мл раствора 2-(2-фурил)-3-(5-нитро-2-фурил)акриламида в ДМСО для штамма TA 100 в условиях неметаболического активирования, 40 мкг/мл раствора 2-аминоантрацена в ДМСО для штамма TA 98 и 20 мкг/мл раствора 2-аминоантрацена в ДМСО для штамма TA 100 в условиях метаболического активирования в качестве положительных контролей, смешивали с 588 мкл исследуемой биологической жидкости (смешанная жидкость из 498 мкл исследуемой биологической жидкости и 90 мкл смеси S9 в условиях метаболического активирования), и полученную жидкость культивировали при встряхивании при температуре 37°C в течение 90 минут. Бактериальную жидкость, подвергшуюся воздействию соединением по настоящему изобретению, 460 мкл, смешивали с 2300 мкл индикаторной среды (буферный раствор Micro F, содержащий биотин: 8 мкг/мл, гистидин: 0,2 мкг/мл, глюкозу: 8 мг/мл и бромкрезоловый пурпурный: 37,5 мкг/мл), и 50 мкл каждой полученной жидкости распределяли на микропланшете 48 лунок/доза. Планшет статистически культивировали при температуре 37°C в течение 3 дней. Лунка, которая содержала бактерии с приобретенной способностью к пролиферации путем мутации аминокислоты (гистидина)-синтеза гена фермента, изменяла фиолетовый цвет на желтый ввиду изменения рН. Таким образом, число лунок с пролиферировавшими бактериями, цвет которых изменялся на желтый, подсчитывали из 48 лунок на дозу и сравнивали с отрицательной контрольной группой для оценки. Отрицательная мутагенность показана как (-), и положительная показана как (+).
Пример препарата 1
Твердую желатиновую капсулу получали с использованием следующих ингредиентов.
Пример препарата 2
Таблетку получали с использованием следующих ингредиентов.
Ингредиенты смешивали и прессовали с получением таблеток, каждая из которых имела массу 665 мг.
Пример препарата 3
Получали аэрозольный раствор, содержащий следующие ингредиенты.
Активный ингредиент и этанол смешивали и в смесь добавляли часть пропеллента 22. Полученную смесь охлаждали до -30°C и переносили в упаковочную машину. После этого в контейнер из нержавеющей стали помещали требуемое количество и разбавляли оставшимся пропеллентом. К контейнеру присоединяли клапан для выброса газов.
Пример препарата 4
Таблетку, содержащую 60 мг активного ингредиента, получали следующим образом.
Активный ингредиент, крахмал и целлюлозу пропускали через сито 45 меш U.S. и затем хорошо смешивали. Водный раствор, содержащий поливинилпирролидон, перемешивали с полученным порошком и смесь затем пропускали через сито 14 меш U.S. Полученные таким образом гранулы сушили при 50°C и пропускали через сито 18 меш U.S. Натрий карбоксиметил крахмал, стеарат магния и тальк, пропущенные предварительно через сито 60 меш U.S., добавляли к гранулам, и полученную смесь перемешивали и затем прессовали с помощью таблетировочной машины с получением таблеток, каждая из которых имеет массу 150 мг.
Пример препарата 5
Капсулу, содержащую 80 мг активного ингредиента, получали следующим образом.
Активный ингредиент, крахмал, целлюлозу и стеарат магния смешивали и пропускали через сито 45 меш U.S., и твердые желатиновые капсулы, каждую, заполняли смесью по 200 мг.
Пример препарата 6
Суппозиторий, содержащий 225 мг активного ингредиента, получали следующим образом.
Активный ингредиент пропускали через сито 60 меш U.S. и суспендировали в глицериде насыщенной жирной кислоты, который был предварительно расплавлен при минимальном нагревании. После этого полученную смесь условной массы в 2 г помещали в пресс-форму и охлаждали.
Пример препарата 7
Суспензию, содержащую 50 мг активного ингредиента, получали следующим образом.
Активный ингредиент пропускали через сито 45 меш U.S. и смешивали с карбоксиметилцеллюлозой и сиропом с получением мягкой пасты. Добавляли раствор бензойной кислоты и ароматизатор, разбавленный частью воды, и перемешивали. Затем добавляли достаточное количество воды для получения требуемого количества.
Пример препарата 8
Препарат для внутривенного введения получали следующим образом.
Раствор вышеописанных ингредиентов внутривенно вводят пациенту обычно со скоростью 1 мл за 1 мин.
Промышленная применимость
Как ясно из вышеуказанных примеров исследования, соединения по настоящему изобретению показывают активирующее AMPK действие. Таким образом, соединения по настоящему изобретению являются весьма полезными в качестве терапевтического агента при лечении диабета II типа, гипергликемии, метаболического синдрома, ожирения, гиперхолестеринемии и гипертензии.
Реферат
Изобретение относится к области органической химии, а именно к гетероциклическому соединению формулы (I) или к его фармацевтически приемлемой соли, где группа, представленная формулой:является группой, представленной формулой:; R, в каждом случае независимо, представляет собой галоген, незамещенный алкил, замещенный алкенил, замещенный алкинил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный гетероциклил, или замещенный амино; где указанные значения радикала раскрыты в формуле изобретения; m равно целому числу от 2 или 3; Rпредставляет собой водород; X представляет собой -О-; и Y представляет собой замещенный или незамещенный арил, или замещенный или незамещенный гетероарил; где указанные значения радикала раскрыты в формуле изобретения. Также изобретение относится к фармацевтической композиции на основе соединения формулы (I) и способу предупреждения или лечения диабета, основанного на использовании соединения формулы (I). Технический результат: получены новые соединения, обладающие активирующим действием на аденозинмонофосфат-активированную протеинкиназу. 4 н. и 14 з.п. ф-лы, 87 табл., 24 пр.
Формула






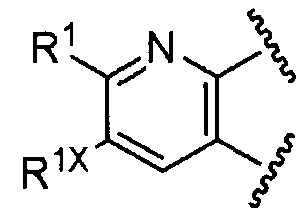




Комментарии