Мутации braf, обеспечивающие резистентность к ингибиторам braf - RU2571930C2
Код документа: RU2571930C2
Чертежи







Описание
РОДСТВЕННЫЕ ЗАЯВКИ
Для настоящей заявки испрашивается преимущество приоритета по заявке USSN 61/308275, поданной 25 февраля 2010 года. Содержание данной заявки включено в настоящий документ в качестве ссылки.
ПОДДЕРЖКА ПРАВИТЕЛЬСТВА
Данное изобретение выполнено при поддержке правительства на основе Гранта № K08 CA115927, предоставленного Национальными институтами здравоохранения. Правительство обладает определенными правами на изобретение.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Лечение злокачественных опухолей представляет собой одну из самых сложных задач современной медицины. Хотя химиотерапевтические средства, как правило, представляют собой эффективные средства лечения или облегчения симптомов, ассоциированных со злокачественной опухолью, в некоторых случаях во время лечения появляется резистентность к одному или нескольким химиотерапевтическим средствам. В результате конкретное химиотерапевтическое средство может становиться неэффективным для определенных индивидуумов. Молекулярные механизмы, отвечающие за развитие резистентности различных типов злокачественной опухоли, изучены недостаточно. Выяснение механизмов, обуславливающих резистентность к определенным средствам, необходимо для обнаружения способов лечения, которые помогают эффективно решать проблему резистентности к лекарственным средствам.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к обусловленной мутациями резистентности к химиотерапевтическому лечению злокачественных опухолей. В конкретных вариантах осуществления настоящее изобретение относится к мутациям, обнаруженным в полипептидах RAF (например, полипептиды BRAF), и к молекулам нуклеиновой кислоты, кодирующим полипептиды RAF. Эти мутации обеспечивают резистентность к ингибиторам RAF, применяемым в терапевтических целях. Обнаружение этих мутаций позволяет разрабатывать ингибиторы RAF второго поколения, которые проявляют активность против полипептидов RAF, содержащих одну или несколько мутаций, таких как мутации, описываемые в настоящем документе. Такие ингибиторы RAF второго поколения используют во многих клинических и терапевтических областях применения, включая лечение злокачественных опухолей.
Таким образом, в первом аспекте изобретение раскрывает изолированную молекулу нуклеиновой кислоты, кодирующую мутантный полипептид BRAF, проявляющий активность BRAF, где указанный мутантный полипептид BRAF содержит аминокислотную последовательность, содержащую, по меньшей мере, одну аминокислотную замену по сравнению с полипептидом BRAF дикого типа (SEQ ID NO: 2) или полипептидом BRAF V600E (SEQ ID NO:4), где, по меньшей мере, одна аминокислотная замена обеспечивает резистентность к одному или нескольким ингибиторам BRAF мутантного полипептида BRAF. В определенных вариантах осуществления данного аспекта, по меньшей мере, одна аминокислотная замена расположена в одной или нескольких следующих аминокислотных позициях: A29, H72, S113, S124, P162, C194, L227, P231, C251, V291, Q329, K483, L485, T521, V528, D587, P655, S657, S683, P686, C696, L697, P722, F738 и C748. В иллюстративных вариантах осуществления, по меньшей мере, одна аминокислотная замена представляет собой одну или несколько из следующих: A29V, H72N, S113I, S124F, P162H, C194*, L227F, P231T, C251F, V291F, Q329K, K483E, L485F, T521K, V528F, D587E, P655T, S657*, S683R, P686Q, P686T, C696*, L697I, P722T, F738L и C748F.
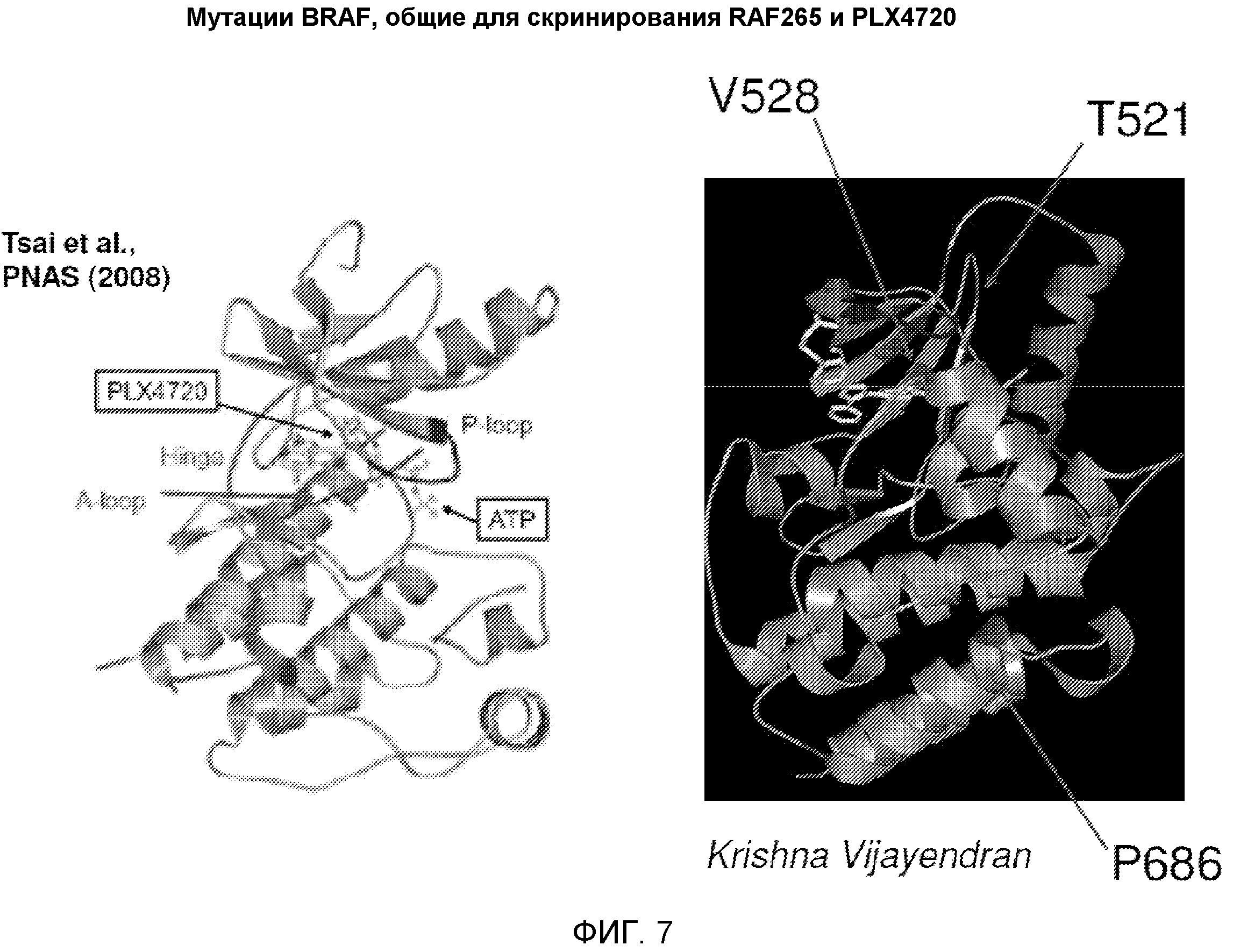
В одном из вариантов осуществления приведенного выше аспекта мутантный полипептид BRAF содержит от одной до пяти аминокислотных замен по сравнению с полипептидом BRAF дикого типа или полипептидом BRAF V600E. В иллюстративных вариантах осуществления мутантный полипептид BRAF содержит одну аминокислотную замену. В другом варианте осуществления мутантный полипептид BRAF представляет собой BRAF, содержащий замену в одной или нескольких следующих аминокислотных позициях SEQ ID NO: 2 или SEQ ID NO: 4: V528, T521, и/или P686. В некоторых вариантах осуществления приведенного выше аспекта ингибитор BRAF представляет собой RAF-265.
Изолированные молекулы нуклеиновой кислоты, кодирующие мутантные полипептиды RAF, можно встраивать в экспрессирующий вектор и экспрессировать в клетке-хозяине. Таким образом, в другом аспекте изобретение раскрывает экспрессирующий вектор, содержащий молекулу нуклеиновой кислоты, предоставленную в настоящем документе. В другом аспекте изобретение раскрывает клетку-хозяин, содержащую предоставленный экспрессирующий вектор. В другом аспекте изобретение раскрывает способ получения мутантного полипептида BRAF, содержащий культивирование клетки-хозяина, содержащей экспрессирующий вектор, кодирующий мутантный полипептид BRAF, где, таким образом, клетка производит мутантный полипептид BRAF.
В других вариантах осуществления изобретение раскрывает изолированные мутантные полипептиды BRAF, где мутантные полипептиды BRAF содержат аминокислотную последовательность, содержащую, по меньшей мере, одну аминокислотную замену по сравнению с полипептидом BRAF дикого типа (SEQ ID NO: 2) или полипептидом BRAF V600E (SEQ ID NO: 4), где, по меньшей мере, одна аминокислотная замена обеспечивает резистентность к одному или нескольким ингибиторам BRAF мутантного полипептида BRAF. В предпочтительных вариантах осуществления изолированные мутантные полипептиды BRAF проявляют активность полипептида BRAF дикого типа. В одном из вариантов осуществления приведенного выше аспекта, по меньшей мере, одна аминокислотная замена находится в одной или нескольких аминокислотных позициях, выбранных из следующих: A29, H72, S113, S124, P162, C194, L227, P231, C251, V291, Q329, K483, L485, T521, V528, D587, P655, S657, S683, P686, C696, L697, P722, F738 и C748. В иллюстративных вариантах осуществления, по меньшей мере, одна аминокислотная замена выбрана из следующих: A29V, H72N, S113I, S124F, P162H, С194*, L227F, Р231Т, C251F, V291F, Q329K, K483E, L485F, Т521К, V528F, D587E, P655T, S657*, S683R, P686Q, P686T, С696*, L697I, P722T, F738L и C748F. В некоторых вариантах осуществления мутантный полипептид BRAF содержит от одной до пяти аминокислотных замен по сравнению с полипептидом BRAF дикого типа или полипептидом BRAF V600E. В иллюстративных вариантах осуществления мутантный полипептид BRAF содержит одну аминокислотную замену по сравнению с полипептидом BRAF дикого типа. В других иллюстративных вариантах осуществления приведенного выше аспекта ингибитор BRAF представляет собой RAF-265.
В другом аспекте изобретение раскрывает способ обнаружения соединения, эффективного для лечения злокачественной опухоли, который включает предоставление анализируемой композиции, содержащей мутантный полипептид BRAF и субстрат BRAF, контактирование анализируемой композиции с тестируемым соединением в условиях, обеспечивающих фосфорилирование субстрата BRAF в отсутствие тестируемого соединения, и определение воздействия соединения на фосфорилирование субстрата BRAF, где снижение уровня фосфорилирования субстрата BRAF по сравнению с подходящим контролем указывает на то, что соединение представляет собой соединение, эффективное для лечения злокачественной опухоли. В некоторых вариантах осуществления анализируемая композиция представляет собой клеточный экстракт.
В другом аспекте изобретение раскрывает способ обнаружения соединения, представляющего собой ингибитор BRAF второго поколения, который включает предоставление анализируемой композиции, содержащей мутантный полипептид BRAF и субстрат BRAF, контактирование анализируемой композиции с тестируемым соединением в условиях, обеспечивающих фосфорилирование субстрата BRAF в отсутствие тестируемого соединения, и определение воздействия соединения на фосфорилирование субстрата BRAF, где снижение уровня фосфорилирования субстрата BRAF по сравнению с подходящим контролем указывает на то, что соединение представляет собой ингибитор BRAF второго поколения. В некоторых вариантах осуществления анализируемая композиция представляет собой клеточный экстракт.
В другом аспекте изобретение раскрывает способ обнаружения соединения, эффективного для лечения злокачественной опухоли, который включает предоставление клетки, содержащей мутантный полипептид BRAF, контактирование клетки с тестируемым соединением и определение воздействия соединения на фосфорилирование субстрата BRAF, где снижение уровня фосфорилирования субстрата BRAF по сравнению с подходящим контролем указывает на то, что соединение представляет собой соединение, эффективное для лечения злокачественной опухоли.
В другом аспекте изобретение раскрывает способ обнаружения соединения, которое представляет собой ингибитор BRAF второго поколения, включающий предоставление клетки, содержащей мутантный полипептид BRAF, контактирование клетки с тестируемым соединением и определение воздействия соединения на фосфорилирование субстрата BRAF, где снижение уровня фосфорилирования субстрата BRAF по сравнению с подходящим контролем указывает на то, что соединение представляет собой ингибитор BRAF второго поколения.
В одном из вариантов осуществления приведенных выше аспектов субстрат BRAF представляет собой MEK1 или MEK2. В иллюстративном варианте осуществления фосфорилирование MEK1 или MEK2 определяют с применением фосфоспецифических антител MEK. В другом иллюстративном варианте осуществления фосфорилирование MEK1 или MEK2 определяют посредством измерения фосфорилирования основного миелинового белка (MBP). В другом иллюстративном варианте осуществления фосфорилирование MEK1 или MEK2 определяют посредством измерения фосфорилирования ERK1 или ERK2.
В другом аспекте изобретение раскрывает способ определения соединения, эффективного для лечения злокачественной опухоли, который включает предоставление клетки, содержащей мутантный полипептид BRAF, контактирование клетки с тестируемым соединением и определение воздействия соединения на клеточную пролиферацию, где уменьшение клеточной пролиферации по сравнению с подходящим контролем указывает на то, что соединение эффективно для лечения злокачественной опухоли.
В другом аспекте изобретение раскрывает способ определения соединения, которое представляет собой ингибитор BRAF второго поколения, включающий предоставление клетки, содержащей мутантный полипептид BRAF, контактирование клетки с тестируемым соединением и определение воздействия соединения на клеточную пролиферацию, где уменьшение клеточной пролиферации по сравнению с подходящим контролем указывает на то, что соединение представляет собой ингибитор BRAF второго поколения.
В другом аспекте изобретение раскрывает клеточное тестирование для определения тестируемого соединения в качестве ингибитора BRAF второго поколения, где способ включает контактирование клетки-хозяина, содержащей мутантный полипептид BRAF, с тестируемым соединением, где чувствительность клетки-хозяина к тестируемому соединению по сравнению с подходящим контролем указывает на то, является ли соединение ингибитором BRAF второго поколения. В одном из вариантов осуществления чувствительность клетки-хозяина к тестируемому соединению измеряют с применением анализа, выбранного из группы, состоящей из анализа клеточной пролиферации, анализа жизнеспособности клеток и анализа фосфорилирования MEK, где уменьшение клеточной пролиферации, жизнеспособности клеток или фосфорилирования MEK в присутствии тестируемого соединения указывает на то, что соединение представляет собой ингибитор BRAF второго поколения.
В другом аспекте изобретение относится к способу определения ингибитора BRAF второго поколения, который включает выбор предполагаемого лекарственного средства с применением компьютерного моделирования с трехмерной кристаллической или растворенной формой мутантного полипептида BRAF, где указанный мутантный полипептид BRAF содержит аминокислотную последовательность, содержащую, по меньшей мере, одну аминокислотную замену по сравнению с полипептидом BRAF дикого типа или полипептидом BRAF V600E, где, по меньшей мере, одна аминокислотная замена обеспечивает резистентность к одному или нескольким ингибиторам BRAF мутантного полипептида BRAF; контактирование указанного предполагаемого лекарственного средства с мутантным полипептидом BRAF; и определение контактирования указанного предполагаемого лекарственного средства с мутантным полипептидом BRAF; где соединение, способное к контактированию с мутантным полипептидом BRAF, определяют как ингибитор BRAF второго поколения. В одном из вариантов осуществления тестируемое соединение входит в библиотеку соединений.
В другом аспекте изобретение раскрывает изолированное соединение, которое представляет собой ингибитор BRAF второго поколения, или соединение, эффективное для лечения злокачественной опухоли, где соединение определяют как ингибитор BRAF второго поколения или соединение, эффективное для лечения злокачественной опухоли согласно способам, описываемым в настоящем документе.
В другом аспекте изобретение раскрывает способ ингибирования активности мутантного полипептида BRAF, который включает контактирование мутантного полипептида BRAF с соединением, которое представляет собой ингибитор BRAF второго поколения. В предпочтительных вариантах осуществления представленного выше аспекта соединение далее ингибирует активность полипептида BRAF дикого типа и/или полипептида BRAF V600E. В некоторых вариантах осуществления контактирование мутантного полипептида BRAF с ингибитором BRAF второго поколения происходит in vitro. В других вариантах осуществления контактирование происходит in vivo. В иллюстративных вариантах осуществления контактирование происходит у субъекта, например, у субъекта со злокачественной опухолью. В некоторых вариантах осуществления субъект представляет собой субъект с рецидивом после лечения RAF-265. В иллюстративных вариантах осуществления злокачественная опухоль представляет собой меланому.
В другом аспекте изобретение раскрывает способ лечения злокачественной опухоли у субъекта, включающий введение субъекту соединения, которое представляет собой ингибитор BRAF второго поколения. В иллюстративных вариантах осуществления злокачественная опухоль содержит одну или несколько мутаций BRAF, где одна или несколько мутаций обеспечивают резистентность к RAF-265 полипептида BRAF. В предпочтительных вариантах осуществления приведенного выше аспекта соединение далее ингибирует активность полипептида BRAF дикого типа и/или полипептида BRAF V600E. В некоторых вариантах осуществления субъект представляет собой субъект с рецидивом после лечения RAF-265. В иллюстративных вариантах осуществления злокачественная опухоль представляет собой меланому.
В другом аспекте изобретение раскрывает способ проверки субъекта со злокачественной опухолью на наличие мутаций BRAF, обеспечивающих резистентность к лечению ингибитором RAF, который включает получение субъекта образца, содержащего злокачественную клетку, и выявление в образце молекулы нуклеиновой кислоты, кодирующей полипептид BRAF, содержащий одну или несколько мутаций по сравнению с молекулой нуклеиновой кислоты, кодирующей полипептид BRAF дикого типа (SEQ ID NO: 1) или полипептид BRAF V600E (SEQ ID NO: 3), где мутации наблюдаются в позициях, кодирующих одну или несколько аминокислот полипептида BRAF и выбранных из группы, состоящей из A29, H72, S113, S124, P162, C194, L227, P231, C251, V291, Q329, K483, L485, T521, V528, D587, P655, S657, S683, P686, C696, L697, P722, F738 и C748, где присутствие молекулы нуклеиновой кислоты в образце, содержащем злокачественную клетку, указывает на то, что субъект является резистентным к лечению ингибитором RAF. В иллюстративных вариантах осуществления молекула нуклеиновой кислоты кодирует полипептид BRAF, содержащий одну или несколько аминокислотных замен по сравнению с полипептидом BRAF дикого типа (SEQ ID NO: 2) или полипептидом BRAF V600E (SEQ ID NO: 4), выбранных из группы, состоящей из A29V, H72N, S113I, S124F, P162H, C194*, L227F, P231T, C251F, V291F, Q329K, K483E, L485F, T521K, V528F, D587E, P655T, S657*, S683R, P686Q, P686T, C696*, L697I, P722T, F738L и C748F. В некоторых вариантах осуществления присутствие молекулы нуклеиновой кислоты в образце, содержащем злокачественную клетку, указывает на то, что субъект характеризуется относительно высоким риском рецидива при лечении ингибитором BRAF первого поколения. В других вариантах осуществления присутствие молекулы нуклеиновой кислоты в образце, содержащем злокачественную клетку, указывает на то, что субъект не отвечает на лечение ингибитором BRAF первого поколения. В иллюстративных вариантах осуществления ингибитор BRAF первого поколения представляет собой RAF-265. В некоторых вариантах осуществления присутствие молекулы нуклеиновой кислоты в образце, содержащем злокачественную клетку, указывает на то, что субъекту необходимо лечение ингибитором BRAF второго поколения. В иллюстративных вариантах осуществления присутствие молекулы нуклеиновой кислоты в образце, содержащем злокачественную клетку, определяют способом, который включает определение последовательности молекулы нуклеиновой кислоты, кодирующей полипептид BRAF. В других вариантах осуществления присутствие молекулы нуклеиновой кислоты в образце, содержащем злокачественную клетку, определяют посредством выявления полипептида, кодируемого молекулой нуклеиновой кислоты, с применением антитела, которое специфически распознает полипептид BRAF, содержащий мутацию в позиции, выбранной из группы, состоящей из A29, H72, S113, S124, P162, C194, L227, P231, C251, V291, Q329, K483, L485, T521, V528, D587, P655, S657, S683, P686, C696, L697, P722, F738 и C748. В иллюстративном варианте осуществления способы, описанные в представленных выше аспектах, дополнительно содержат введение ингибитора BRAF второго поколения субъекту, у которого обнаружили присутствие одной или нескольких мутаций BRAF.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1 показана нуклеотидная последовательность BRAF дикого типа человека (SEQ ID NO: 1) (NCBI Reference Sequence No.: NM_004333,4; gi 187608632).
На фиг. 2 показана последовательность полипептида BRAF дикого типа человека (SEQ ID NO: 2) (NCBI Reference Sequence No.: NP_004324.2; gi 33188459).
На фиг. 3 показана нуклеотидная последовательность BRAF V600E человека (SEQ ID NO: 3). Замена тимидина на аденозин, которая обуславливает аминокислотную замену V600E по сравнению с последовательностью BRAF дикого типа, подчеркнута.
На фиг. 4 показана последовательность полипептида BRAF V600E человека (SEQ ID NO: 4). Замена V600E по сравнению с последовательностью BRAF дикого типа подчеркнута.
На фиг. 5 показана мутационная картина BRAF после отбора RAF265. Показаны аминокислотные замены, возникшие вследствие мутаций высокой частоты.
На фиг. 6 показана мутационная картина BRAF после отбора PLX4720. Показаны аминокислотные замены, возникшие вследствие мутаций высокой частоты.
На фиг. 7 показано структурное положение трех аминокислотных замен, характерных для RAF265 и PLX4720.
На фиг. 8 показаны результаты иммуноблоттинга уровней BRAF, p-MEK1/2 и p-ERK1/2 после лечения увеличивающимися концентрациями PLX4720 для клеток, содержащих BRAF дикого типа, BRAF-V600E, BRAF-V600E-T521K, BRAF-V600E-V528F или BRAF-V600E-P686Q.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. Биологическая активность BRAF
Семейство белков RAF включает три члена: BRAF, ARAF и CRAF (также известный как RAF-1). Каждый из белков RAF содержит аминоконцевой регуляторный домен, активационную петлю и C-концевой киназный домен. Регуляция RAF включает фосфорилирование регуляторного и каталитического доменов. После активации молекулы RAF функционируют как серин/треонин киназы, способные активировать сигнальные молекулы посредством фосфорилирования.
RAF вовлечен в активацию клеточной пролиферации посредством контактирования с сигнальным путем митогенактивируемой протеинкиназы (MAPK). В частности, белки RAF представляют собой основные эффекторы сигнального пути Ras. Активированный Ras напрямую взаимодействует с RAF и переносит RAF к клеточной мембране из цитоплазмы. После переноса к клеточной мембране связанный с Ras RAF подвергает серии последовательных фосфорилирований и изменений конформации, нужной для активации серин/треонин киназной активности RAF. RAF может также активироваться посредством Ras-зависимых путей, включающих интерферон бета, протеинкиназу C (PKC) альфа, антиапоптические белки, такие как Bcl-2, различные поддерживающие белки, ультрафиолетовое излучение, ионизирующее излучение, ретиноиды, эритропоэтин и димеризацию изоформ RAF.
После активации RAF модулирует участки нижележащего сигнального пути посредством фосфорилирования киназ MEK1 и MEK2, которые содержат богатую пролином последовательность, которая обеспечивает узнавание RAF. BRAF представляет собой гораздо более сильный активатор MEK1 и MEK2, чем ARAF или RAF-1. MEK1 и MEK2, в свою очередь, фосфорилируют и активируют ERK1 и ERK2, которые затем перемещаются в ядро. Ядерные ERK1 и ERK2 активируют факторы транскрипции, такие как Elk-1, Fos, Jun, AP-1 и Myc, в итоге индуцируя транскрипцию генов, вовлеченных в клеточную пролиферацию, дедифференциацию и выживание, включая, например, циклин D1, циклин E и активатор фосфатазу cdc25.
Положительная регуляция сигнального пути RAF, возникающая вследствие присутствия активирующих мутаций в RAF или аберрантного сигнального пути Ras, стимулирует онкогенез посредством активирования упомянутого выше сигнального пути, что приводит к повышенной клеточной пролиферации и выживанию. Активирующие мутации в полипептидах RAF, особенно в BRAF, связывают с высокой частотой возникновения рака у человека. Одна их таких мутаций BRAF представляет собой единичную замену тимидина на аденозин, которая обуславливает замену валина в аминокислотной позиции 600 на глутамат. Приблизительно две трети случаев меланомы связаны с этой онкогенной мутацией BRAF V600E, которая способствует изменению меланоцитов посредством активации сигнального пути MAPK. Многие другие виды злокачественной опухоли, включая в качестве неограничивающих примеров рак прямой кишки, яичника и рак щитовидной железы, также связаны с мутацией BRAF V600E. Таким образом, выбор RAF и, в частности, BRAF V600E, в качестве мишени для воздействия, представляет собой перспективный подход в лечении злокачественной опухоли. BRAF представляет собой хорошую мишень для лечения вследствие высокой степени специфичности, показанной для его субстратов MEK1 и MEK2. Несколько ингибиторов BRAF в настоящее время проходят клинические испытания. Один такой ингибитор представляет собой соединение RAF-265, который является эффективным против всех трех изоформ RAF, а также против BRAF V600E. Показано, что RAF-265 является перспективным для клинического применения, что указывает на то, что выбор RAF в качестве цели воздействия представляет собой многообещающий способ лечения злокачественной опухоли.
Как взаимозаменяемо используют в настоящем документе, термины "активность RAF", "биологическая активность RAF" и "функциональная активность RAF" включают активность, которую проявляет белок RAF, например, BRAF, по отношению к отвечающей на воздействие RAF клетке или ткани, например, злокачественной клетке или злокачественной опухоли, или по отношению к молекуле-мишени RAF, что определяют in vivo или in vitro с применением стандартных способов. Активность RAF может представлять собой прямую активность, такую как контактирование с молекулой-мишенью RAF, например, MEK1 или MEK2, или фосфорилирование субстрата RAF, например, MEK1 или MEK2. Альтернативно, активность RAF может представлять собой непрямую активность, такую как модулирование нижележащего участка сигнального пути посредством контактирования белка RAF с молекулой-мишенью RAF, например, MEK1 или MEK2. Поскольку RAF вовлечен в сигнальный путь, включающий MEK1 и MEK2, такие нижележащие участки сигнального пути включают в качестве неограничивающих примеров, например, фосфорилирование MBP, фосфорилирование ERK1 или ERK2, изменения регуляции генов-мишеней ERK1 или ERK2 и изменения клеточной пролиферации или жизнеспособности.
II. Мутации BRAF, обеспечивающие резистентность
Хотя лечение злокачественной опухоли ингибиторами RAF, например, ингибиторами BRAF, представляет собой перспективный терапевтический подход, пациенты, получающие такое лечение, могут демонстрировать рецидивы или не отвечать на лечение, вследствие чего заболевание пациента прогрессирует. Как описано в настоящем документе, настоящее изобретение относится к раскрытию мутаций BRAF, обеспечивающих резистентность к ингибиторам RAF, которые в настоящее время проходят клинические исследования. При наличии таких мутаций в злокачественных клетках пациенты становятся резистентными к лечению определенными ингибиторами RAF. В иллюстративных вариантах осуществления изобретение относится к развитию резистентности к ингибитору RAF RAF-265.
(A) Определение мутаций BRAF, обеспечивающих резистентность к ингибиторам RAF
В различных вариантах осуществления настоящее изобретение относится к способам определения мутаций в полипептиде BRAF или мутаций в молекуле нуклеиновой кислоты, кодирующей полипептид BRAF, которые обеспечивают резистентность полипептида BRAF к лекарственным средствам, ингибирующим активность RAF. "Мутантный полипептид BRAF," как применяют в настоящем документе, включает полипептид BRAF, содержащий одну или несколько мутаций, обеспечивающих резистентность к одному или нескольким известным ингибиторам BRAF. В дополнение к одной или нескольким мутациям, обеспечивающим резистентность к ингибитору BRAF, мутантный полипептид BRAF может содержать замены V600E. Полипептид BRAF, содержащий только замену V600E в отсутствие других мутаций по сравнению с последовательностью полипептида BRAF дикого типа, не рассматривают как "мутантный полипептид BRAF", как определено в настоящем документе. "Мутантная молекула нуклеиновой кислоты BRAF", как применяют в настоящем документе, включает молекулу нуклеиновой кислоты, которая кодирует мутантный полипептид BRAF. Молекулы нуклеиновой кислоты, кодирующие полипептиды BRAF и содержащие одну или несколько мутаций, можно получать с применением любого подходящего известного в данной области способа, включая, например, случайный мутагенез или сайт-специфический мутагенез последовательности нуклеиновой кислоты BRAF дикого типа или последовательности нуклеиновой кислоты BRAF V600E, что можно осуществлять с применением E. coli. В иллюстративных вариантах осуществления последовательность нуклеиновой кислоты BRAF дикого типа представляет последовательность нуклеиновой кислоты BRAF человека (SEQ ID NO: 1), и последовательность нуклеиновой кислоты BRAF V600E представляет собой последовательность нуклеиновой кислоты BRAF V600E человека (SEQ ID NO:3). Мутантные молекулы нуклеиновой кислоты BRAF можно затем обнаруживать в клетках, в отсутствие таких молекул отвечающих на лечение ингибитором BRAF, для определения нуклеиновой кислоты, кодирующей мутантный полипептид BRAF, резистентный к воздействию ингибитора RAF.
Для изучения мутантных нуклеиновых кислот BRAF и мутантных полипептидов BRAF на предмет резистентности к воздействию ингибитором RAF, например, RAF-265, можно применять ряд подходящих способов. Во всех случаях мутантный полипептид BRAF, резистентный к воздействию ингибитором RAF, проявляет более высокую активность BRAF в присутствии ингибитора RAF, чем полипептид BRAF дикого типа или полипептид BRAF V600E в присутствии ингибитора RAF. В одном иллюстративном способе молекулу нуклеиновой кислоты, кодирующую мутантный полипептид BRAF, можно экспрессировать в клетках, в отсутствие таких молекул отвечающую на воздействие ингибитора RAF. Клеточная линия, применяемая для таких целей, представляет собой, например, клеточную линии меланомы A375. После экспрессии мутантного полипептида BRAF клетки можно обрабатывать ингибитором RAF. Затем можно измерять активность мутантного полипептида BRAF и сравнивать ее с активностью полипептида BRAF дикого типа (или полипептида BRAF V600E), таким же способом экспрессированных и обработанных ингибитором RAF.
Активность полипептида BRAF можно определять, например, посредством измерения пролиферации или жизнеспособности клеток после обработки ингибитором BRAF, где пролиферация или жизнеспособность положительно коррелируют с активностью BRAF. Рост клеток, пролиферацию или жизнеспособность можно оценивать с применением любого подходящего известного в данной области способа. В одном из вариантов осуществления рост клеток можно определять с применением анализов клеточной пролиферации/жизнеспособности, таких как MTS или Cell Titer GLo, в которых рост клеток в присутствии ингибитора RAF выражают в виде процента от того значения, которое наблюдается у необработанных клеток, культивированных в отсутствие ингибитора RAF. В определенных вариантах осуществления резистентность определяют как изменение значения GI50, по меньшей мере, в 2 раза, более предпочтительно - по меньшей мере, в 3 раза, наиболее предпочтительно - по меньшей мере, в 4-5 раз, в отношении подходящего контроля. В других вариантах осуществления резистентность определяют как значение GI50, составляющее ~1 мкМ. Активность полипептида BRAF также можно измерять посредством, например, определения относительного количества фосфорилированного MEK1/2 или ERK1/2, присутствующего в клетке после обработки ингибитором BRAF. Активность полипептида BRAF дикого типа или мутантного полипептида BRAF можно также определять посредством анализа фосфорилирования in vitro, в котором активность BRAF определяют посредством измерения соотношения фосфорилированного MEK1/2 или ERK1/2 в анализе после обработки ингибитором BRAF. Как указано выше, MEK1/2 представляет собой субстрат BRAF, в то время как ERK1/2 представляет собой субстрат MEK1/2, и служит индикатором активности BRAF нижележащего участка сигнального пути. Мутантный полипептид BRAF, проявляющий более высокую активность, чем полипептид BRAF дикого типа или полипептид BRAF V600E после обработки ингибитором RAF, определяют как содержащий мутацию, обеспечивающую резистентность к ингибитору RAF. Мутацию, обеспечивающую резистентность к ингибитору RAF, можно обнаруживать посредством секвенирования нуклеиновой кислоты, кодирующей мутантный полипептид BRAF, или непосредственного секвенирования мутантного полипептида BRAF.
(B) Мутации BRAF, обеспечивающие резистентность к RAF-265
Посредством приведенного выше способа идентифицировали несколько аминокислотных остатков полипептида BRAF человека, которые при мутировании обеспечивают резистентность к ингибитору RAF RAF-265. Эти аминокислотные остатки включают один или несколько из следующих: A29, H72, S113, S124, P162, C194, L227, P231, C251, V291, Q329, K483, L485, T521, V528, D587, P655, S657, S683, P686, C696, L697, P722, F738 и C748. В определенных вариантах осуществления мутантные полипептиды BRAF содержат мутацию по сравнению с последовательностью полипептида BRAF человека дикого типа (или последовательностью полипептида BRAF V600E) в одном или нескольких из этих аминокислотных остатков. В связанных вариантах осуществления мутантные молекулы нуклеиновой кислоты BRAF содержат мутацию по сравнению с последовательностью нуклеиновой кислоты BRAF человека дикого типа (или последовательностью полипептида BRAF V600E) в одном или нескольких нуклеотидах, кодирующих один или несколько из этих аминокислотных остатков. В иллюстративных вариантах осуществления мутантные полипептиды BRAF, описанные в настоящем
документе, содержат одну или несколько из следующих обеспечивающих резистентность мутаций: A29V, H72N, S113I, S124F, P162H, C194*, L227F, P231T, C251F, V291F, Q329K, K483E, L485F, T521K, V528F, D587E, P655T, S657*, S683R, P686Q, P686T, C696*, L697I, P722T, F738L и C748F. В других иллюстративных вариантах осуществления мутантные молекулы нуклеиновой кислоты BRAF, описанные в настоящем документе и кодирующие мутантный полипептид BRAF, содержат одну или несколько следующих обеспечивающих резистентность мутаций: A29V, H72N, S113I, S124F, P162H, C194*, L227F, P231T, C251F, V291F, Q329K, K483E, L485F, T521K, V528F, D587E, P655T, S657*, S683R, P686Q, P686T, C696*, L697I, P722T, F738L и C748F.
Мутантные молекулы нуклеиновой кислоты BRAF и мутантные полипептиды BRAF по изобретению могут содержать другие мутации в дополнение к описанным в настоящем документе. Например, мутантный полипептид BRAF по изобретению может содержать мутации других аминокислотных остатков в дополнение к одной или нескольким мутациям аминокислотных остатков A29, H72, S113, S124, P162, C194, L227, P231, C251, V291, Q329, K483, L485, T521, V528, D587, P655, S657, S683, P686, C696, L697, P722, F738 и C748. Во всех случаях мутантные полипептиды BRAF по изобретению обладают активность BRAF, и мутантные молекулы нуклеиновой кислоты BRAF по изобретению кодируют полипептиды, обладающие активностью BRAF. В иллюстративном варианте осуществления мутантная молекула BRAF по изобретению содержит мутацию аминокислотного остатка V600 в дополнение к одной или нескольким мутациям аминокислотных остатков A29, H72, S113,
S124, P162, C194, L227, P231, C251, V291, Q329, K483, L485, T521, V528, D587, P655, S657, S683, P686, C696, L697, P722, F738 и C748. В одном из вариантов осуществления мутация V600 представляет собой активирующую мутацию, например, мутацию V600E. Показано, что ингибитор RAF RAF-265 эффективно ингибирует активность BRAF, содержащего активирующую мутацию V600E. Эта мутация наблюдается в большом количестве опухолей, включая приблизительно две трети меланом. Мутации BRAF, обеспечивающие резистентность, описываемые в настоящем документе, обеспечивают резистентность к ингибиторам RAF, таким как RAF-265, аллеля BRAF-V600E. Таким образом, пациенты с опухолью, содержащей BRAF-V600E, характеризуются риском рецидива при лечении ингибитором BRAF первого поколения, таким как RAF-265, вследствие наличия второй мутации BRAF в любой из следующих позиций: A29, H72, S113, S124, P162, C194, L227, P231, C251, V291, Q329, K483, L485, T521, V528, D587, P655, S657, S683, P686, C696, L697, P722, F738 и C748.
Как описано в настоящем документе, обнаружение мутаций BRAF, обеспечивающих резистентность к ингибиторам BRAF, позволяет разрабатывать и искать "ингибиторы RAF второго поколения", которые эффективно ингибируют белок BRAF, содержащий одну или несколько обеспечивающих резистентность мутаций. Такие ингибиторы RAF второго поколения используют во многих клинических и терапевтических областях применения, например, при лечении злокачественной опухоли. Обнаружение обеспечивающих резистентность мутаций в полипептиде BRAF также позволяет обследовать пациентов со злокачественной опухолью для определения наличия или отсутствия одной или нескольких обеспечивающих резистентность мутаций BRAF в злокачественной опухоли. Определение наличия или отсутствия одной или нескольких обеспечивающих резистентность мутаций BRAF в злокачественной опухоли позволяет изменять стратегию лечения пациента со злокачественной опухолью. Например, обнаружение одной или нескольких обеспечивающих резистентность мутаций BRAF, описываемых в настоящем документе, в образце, содержащем злокачественную клетку, который берут у пациента со злокачественной опухолью, можно использовать для назначения пациенту лечения ингибитором RAF второго поколения. Таким же образом, обнаружение одной или нескольких обеспечивающих резистентность мутаций BRAF, описываемых в настоящем документе, в образце, содержащем злокачественную клетку, который берут у пациента со злокачественной опухолью, можно использовать для назначения пациенту лечения ингибитором MEK. Обнаружение обеспечивающих резистентность мутаций BRAF также позволяет обследовать и обнаруживать пациентов с высоким риском рецидива или отсутствием ответа на лечение определенными ингибиторами RAF.
III. Способы определения ингибиторов BRAF второго поколения
Определение обеспечивающих резистентность мутаций BRAF позволяет разрабатывать и/или определять "ингибиторы RAF второго поколения". Как применяют в настоящем документе, ингибитор RAF второго поколения представляет собой средство, которое эффективно ингибирует активность полипептида RAF, например, полипептида BRAF, содержащих одну или несколько мутаций, описываемых в настоящем документе. Ингибитор RAF второго поколения необязательно может ингибировать активность полипептида RAF дикого типа в дополнение к мутантному полипептиду RAF. В предпочтительном варианте осуществления ингибитор RAF второго поколения ингибирует активность полипептида BRAF V600E (SEQ ID NO: 4), а также полипептида BRAF V600E, дополнительно содержащего одну или несколько обеспечивающих резистентность мутаций, описываемых в настоящем документе. В иллюстративном варианте осуществления ингибитор RAF второго поколения ингибирует активность полипептида BRAF, содержащего мутации одного или нескольких следующих аминокислотных остатков: A29, H72, S113, S124, P162, C194, L227, P231, C251, V291, Q329, K483, L485, T521, V528, D587, P655, S657, S683, P686, C696, L697, P722, F738 и C748.
Таким образом, настоящее изобретение относится к способам определения тестируемого соединения как ингибитор RAF второго поколения. В одном из вариантов осуществления соединение можно определять как ингибитор RAF второго поколения посредством определения относительной активности RAF мутантного полипептида BRAF в присутствие или отсутствие соединения по сравнению с немутантным полипептидом BRAF (например, полипептидом BRAF дикого типа или полипептидом BRAF V600E). В присутствии соединения, которое представляет собой ингибитор RAF второго поколения, мутантный полипептид BRAF проявляет более низкую активность RAF, чем в отсутствие соединения. В присутствии соединения, которое не представляет собой ингибитор RAF второго поколения, мутантный полипептид BRAF проявляет такую же или более высокую активность RAF, чем в отсутствие соединения. В конкретных вариантах осуществления активность RAF можно измерять посредством анализа in vitro анализ с применением рекомбинантных полипептидов BRAF. В других вариантах осуществления активность RAF можно измерять посредством анализа in vivo с применением культивированных клеток или экспериментальных животных, экспрессирующих полипептиды BRAF.
Любой индикатор активности BRAF является подходящим для определения того, является ли соединение ингибитором RAF второго поколения. В иллюстративном варианте осуществления активность BRAF определяют посредством измерения фосфорилирования субстрата RAF MEK1/2, где снижение фосфорилирования MEK1/2 указывает на снижение активности RAF. В одном из вариантов осуществления фосфорилирование MEK1/2 измеряют в клетке или клеточном экстракте. В альтернативном варианте осуществления фосфорилирование MEK1/2 измеряют в анализе фосфорилирования in vitro с применением очищенных или рекомбинантных белки. Способы определения фосфорилирования MEK1/2, известные в данной области, являются подходящими для измерения фосфорилирования MEK1/2 в качестве индикатора активности полипептида BRAF или мутантного полипептида BRAF. Такие способы включают в качестве неограничивающих примеров Вестерн-блоттинг и масс-спектроскопию. В определенных вариантах осуществления анализ фосфорилирования MEK1/2 можно проводить in vitro с применением рекомбинантных белков. В других вариантах осуществления анализ фосфорилирования MEK1/2 можно проводить in vivo с применением культивированных клеток или экспериментальных животных.
В другом иллюстративном варианте осуществления активность BRAF определяют посредством измерения фосфорилирования субстрата MEK ERK1/2, где снижение фосфорилирования ERK1/2 указывает на снижение активности BRAF. В одном из вариантов осуществления фосфорилирование ERK1/2 измеряют в клетке или клеточном экстракте. В альтернативном варианте осуществления фосфорилирование ERK1/2 измеряют в анализе фосфорилирования in vitro с применением очищенных или рекомбинантных белков. Способы определения фосфорилирования ERK1/2, известные в данной области, являются подходящими для измерения фосфорилирования ERK1/2 в качестве индикатора активности полипептида BRAF или мутантного полипептида BRAF. Такие способы включают в качестве неограничивающих примеров Вестерн-блоттинг и масс-спектроскопию. В определенных вариантах осуществления анализ фосфорилирования ERK1/2 можно проводить in vitro с применением рекомбинантных белков. В других вариантах осуществления анализ фосфорилирования ERK1/2 можно проводить in vivo с применением культивированных клеток или экспериментальных животных.
В одном из вариантов осуществления для определения ингибитора RAF второго поколения применяют клетку-хозяин, экспрессирующую мутантный полипептид BRAF, где чувствительность клетки-хозяина к тестируемому соединению указывает на то, что тестируемое соединение является ингибитором RAF второго поколения. Как применяют в настоящем документе, термин "чувствительность клетки-хозяина к тестируемому соединению" означает, что тестируемое соединение оказывает измеримое воздействие на один или несколько параметров, включая клеточный рост, клеточную пролиферацию, клеточную жизнеспособность и/или внутриклеточную передачу сигнала (например, передачу сигнала, опосредованную BRAF, как показано, например, фосфорилированием одного или нескольких субстратов BRAF, таких как MEK1/2, или одной или несколько сигнальных молекул нижележащего участка сигнального пути, таких как ERK1/2).
Соединение можно определять как ингибитор RAF второго поколения посредством определения жизнеспособности или скорости пролиферации клеток, экспрессирующих мутантный полипептид BRAF, в присутствие или отсутствие соединения. Клеточная линия, применяемая в таком анализе, должна быть чувствительной к ингибитору RAF, если клеточная линия экспрессирует полипептид BRAF дикого типа, и должна быть резистентной к ингибитору RAF (т.е. ингибитору RAF первого поколения), если клеточная линия экспрессирует мутантный полипептид BRAF. Иллюстративная клеточная линия, применяемая для определения ингибитора RAF второго поколения, представляет собой клеточную линию меланомы A375. Клетки A375 являются чувствительными к ингибитору RAF RAF-265 при экспрессии полипептида BRAF дикого типа, но являются резистентными к RAF-265 при экспрессии мутантного полипептида BRAF, например, полипептида BRAF, содержащего одну или несколько следующих обеспечивающих резистентность мутаций: A29V, H72N, S113I, S124F, P162H, C194*, L227F, P231T, C251F, V291F, Q329K, K483E, L485F, T521K, V528F, D587E, Р655Т, S657*, S683R, P686Q, P686T, С696*, L697I, P722T, F738L и C748F.
В присутствии соединения, которое представляет собой ингибитор RAF второго поколения, клеточная линия, экспрессирующая мутантный полипептид BRAF, демонстрирует более низкую жизнеспособность или скорость пролиферации, чем в отсутствие соединения. В присутствии соединения, которое не представляет собой ингибитор RAF второго поколения, клеточная линия, экспрессирующая мутантный полипептид BRAF, демонстрирует такую же или более высокую жизнеспособность или скорость пролиферации, чем в отсутствие соединения. Способы измерения клеточной жизнеспособности и/или скорости пролиферации, известные в данной области, являются подходящим для определения чувствительности клеточной линии, экспрессирующей полипептид BRAF или мутантный полипептид BRAF, к тестируемому соединению. Такие способы включают в качестве неограничивающих примеров измерение исключения трипановым синим, метаболизма соединений тетразолия, включения меченого тритием тимидина, включения BrdU, захвата глюкозы, концентрации АТФ и уровня апоптоза. В одном из вариантов осуществления клеточную пролиферацию можно определять с применением анализов клеточной пролиферации/жизнеспособности, таких как MTS или Cell Titer GLo. В определенных вариантах осуществления чувствительность определяют как изменение уровня GI50, по меньшей мере, в 2 раза, более предпочтительно - по меньшей мере, в 3 раза, наиболее предпочтительно, по меньшей, в 4-5 раз, по сравнению с подходящим контролем.
Таким образом, в одном из вариантов осуществления изобретение относится к способу определения соединения, которое представляет собой ингибитор RAF второго поколения, включающему предоставление тестируемой композиции, содержащей субстрат BRAF и полипептид BRAF, содержащий одну или несколько мутаций по сравнению с полипептидом BRAF дикого типа (или по сравнению с полипептидом BRAF V600E), контактирование тестируемой композиции с тестируемым соединением в условиях, допускающим фосфорилирование субстрата BRAF в отсутствие тестируемого соединения, и определение воздействия соединения на фосфорилирование субстрата BRAF, где снижение уровня фосфорилирования субстрата BRAF по сравнению с подходящим контролем указывает на то, что соединение представляет собой ингибитор RAF второго поколения. Соединение, определенное таким образом, представляет собой соединение, эффективное для лечения злокачественной опухоли, например, злокачественной опухоли, в которой был обнаружен мутантный полипептид RAF. Полипептид BRAF, применяемый в приведенных выше способах, представляет собой полипептид BRAF, содержащий одну один или несколько мутаций, обеспечивающих резистентность к ингибитору RAF RAF-265, например, полипептид BRAF, содержащий одну или несколько мутаций, описываемых в настоящем документе. Субстрат BRAF, применяемый в приведенных выше способах, представляет собой, например, MEK1/2. Снижение или уменьшение уровня фосфорилирования MEK1/2 указывает на то, что соединение представляет собой ингибитор RAF. Таким же образом, сигнальная молекула нижележащего участка сигнального пути, применяемая в приведенных выше способах, представляет собой, например, ERK1/2. Снижение или уменьшение фосфорилирования ERK1/2 указывает на то, что соединение представляет собой ингибитор RAF. Приведенные выше способы можно применять in vitro, где полипептиды BRAF и субстраты BRAF представляют собой изолированные или очищенные белки. Приведенные выше способы можно также применять in vitro, где полипептиды BRAF и субстраты BRAF представляют собой компоненты клеточного экстракта. В этом варианте осуществления тестируемая композиция представляет собой клеточный экстракт. Подходящий контроль представляет собой любой контроль, известный специалисту, применяющему способ, и включает, например, сходную или идентичную тестируемую композицию, не обработанную тестируемым соединением или обработанную контрольным соединением, или аналогичную тестируемую композицию или клеточный экстракт, содержащий полипептид BRAF "дикого типа" или полипептид BRAF V600E.
В другом варианте осуществления изобретение относится к способу определения соединения, которое представляет собой ингибитор RAF второго поколения, включающий предоставление клетки, содержащей мутантный полипептид BRAF, контактирование клетки с тестируемым соединением и определение воздействия соединения на фосфорилирование MEK1/2, фосфорилирование ERK1/2 или клеточную пролиферацию, где уменьшение или снижение уровня фосфорилирования MEK1/2, фосфорилирования ERK1/2 или клеточной пролиферации по сравнению с подходящим контролем указывает на то, что соединение представляет собой ингибитор RAF второго поколения. Соединение, определенное таким образом, представляет собой соединение, эффективное для лечения злокачественной опухоли, например, злокачественной опухоли, в которой обнаружили мутантный полипептид BRAF. Подходящий контроль представляет собой любой контроль, известный специалисту, применяющему способ, и включает, например, сходную или идентичную клетку, не обработанную тестируемым соединением или обработанную контрольным соединением, или аналогичную клетку или клеточный экстракт, в котором экспрессируется рекомбинантный BRAF "дикого типа" или полипептид BRAF V600E.
В одном из вариантов осуществления тестируемое соединение, применяемое в приведенных выше способах, представляет собой ингибитор RAF, который ингибирует биологическую активность полипептида RAF дикого типа, например, полипептида BRAF. Кроме того или альтернативно, тестируемое соединение, применяемое в приведенных выше способах, представляет собой ингибитор RAF, который ингибирует активность полипептида BRAF V600E. В одном из вариантов осуществления ингибиторы RAF, которые можно использовать в качестве тестируемых соединений для определения того, являются ли они ингибиторами RAF второго поколения, включают PLX4032, PLX5568, XL281 и производные имидазол-2-карбоксамида, описанные в US2008/0108615, в полном объеме включенном в настоящий документ в качестве ссылки.
В другом варианте осуществления тестируемое соединение включено в библиотеку тестируемых соединений. "Библиотека тестируемых соединений" относится к списку, включающему множество тестируемых соединений. Описан способ создания молекулярных библиотек небольших органических молекул (Carell et al. (1994). Angew. Chem. Int. Ed. Engl. 33:2059; Carell et al. (1994) Angew. Chem. Int. Ed. Engl. 33:2061). Соединения по настоящему изобретению можно получать с применением многочисленных способов из комбинаторной библиотеки, известных в данной области, включая: биологические библиотеки; пространственно адресуемые параллельные библиотеки твердой фазы или жидкой фазы, способ синтетических библиотек, требующих деконволюции, способ библиотек OBOC (one-bead one-compound) и способы синтетических библиотек c применением отбора посредством аффинной хроматографии. Способ биологических библиотек ограничен белковыми библиотеками, в то время как другие четыре способа можно применять к библиотекам пептидов, непептидных олигомеров или низкомолекулярных соединений (Lam, K.S. (1997) Anticancer Drug Des. 12: 145). Другие иллюстративные способы получения молекулярных библиотек можно найти в данной области, например в: Erb et al. (1994). Proc. Natl. Acad. Sci. USA 91: 11422; Horwell et al. (1996) Immunopharmacology 33:68-; и в Gallop et al. (1994); J. Med. Chem. 37: 1233-. Библиотеки соединений могут быть представлены в растворах (например, Houghten (1992) Biotechniques 13:412-421), или в гранулах (Lam (1991) Nature 354:82-84), крошках (Fodor (1993) Nature 364:555-556), бактериях (Ladner USP 5223409), спорах (Ladner USP '409), плазмидах (Cull et al. (1992) Proc Natl Acad Sci USA 89: 1865-1869) или бактериофагах (Scott и Smith (1990) Science 249:386-390); (Devlin (1990) Science 249:404-406); (Cwirla et al. (1990) Proc. Natl. Acad. Sci. 87:6378-6382); (Felici (1991) J. Mol. Biol. 222:301-310). В другом варианте осуществления комбинаторные полипептиды получают из библиотеки кДНК. Иллюстративные соединения, которые можно изучать на предмет активности, включают в качестве неограничивающих примеров библиотеки пептидов, нуклеиновых кислот, углеводов, небольших органических молекул и натуральных экстрактов.
Ингибиторы RAF второго поколения также можно рационально получать на основе структуры аллелей BRAF, содержащих одну или несколько обеспечивающих резистентность мутаций, описываемых в настоящем документе. Как описано в настоящем документе, остатки BRAF, обеспечивающие резистентность к ингибиторам RAF, расположены в одном участке BRAF, который связывается ингибитором RAF первого поколения RAF-265. Определение мутантных аллелей BRAF, обеспечивающих резистентность к ингибиторам RAF, позволяет сравнивать структуры мутантных аллелей BRAF и BRAF дикого типа, или BRAF V600E. Знание изменений структуры, обеспечивающих резистентность к ингибиторам RAF первого поколения, позволяет рационально конструировать и получать лиганды, включая ингибиторы, которые связываются и ингибируют мутантные аллели. Такие ингибиторы можно конструировать с тем, чтобы они связывали мутантные аллели BRAF, BRAF V600E, не содержащие вторичных мутаций, описываемых в настоящем документе, и BRAF дикого типа. Ингибиторы, сконструированные с тем, чтобы они связывали аллель BRAF, содержащий одну или более мутаций, описываемых в настоящем документе, представляют собой ингибиторы RAF второго поколения. Способность таких рационально конструированных ингибиторов ингибировать биологическую активность мутантного полипептида BRAF можно подтверждать с применением анализов in vitro и/или in vivo, описываемых в настоящем документе.
Структуру полипептида BRAF, содержащего одну или несколько обеспечивающих резистентность мутаций, описываемых в настоящем документе, можно определять посредством компьютерного моделирования или посредством определения кристаллической структуры или структуры в растворе мутантного полипептида BRAF. Для определения структуры мутантного полипептида BRAF можно использовать любой подходящий известный в данной области способ.
Иллюстративные способы компьютерного моделирования включают применение программного обеспечения, такого как PYMOL, CAVITY (описанные в J. Comp. Aided. Mol. Des. (1990) 4:337-354 (включены в настоящий документ в качестве ссылки)) и Discovery Studio® (Accelrys, San Diego, CA). Дополнительные способы, применяемые для компьютерного молекулярного моделирования, описаны в J BUON. (2007) 12 Suppl 1:S101-18 (включено в настоящий документ в качестве ссылки). Компьютерный анализ белка с известной структурой также можно использовать для определения молекулы, которая связывается с белком. Такие способы разделяют молекулы на основе их формы, комплементарной рецептору. Например, с применением базы данных 3-D можно использовать программу, такую как DOCK, для определения молекулы, которая связывается с XBP-1, IRE-1 альфа и/или EDEM. См. DesJarlias et al. (1988) J. Med. Chem. 31:722; Meng et al. (1992) J. Computer Chem. 13:505; Meng et al. (1993) Белки 17:266; Shoichet et al. (1993) Science 259: 1445. Кроме того, для определения молекул, которые связываются с мишенью, можно также анализировать комплементарность молекулы по отношению к белку-мишени, основанную на электрических свойствах молекул. Ее можно определять, например, с применением силового поля молекулярной механики, как описано в Meng et al. (1992) J. Computer Chem. 13:505 и Meng et al. (1993) Proteins 17:266. Другие программы, которые можно использовать, включают CLIX, которая применяет силовое поле GRID для отбора предполагаемых лигандов (см., например, Lawrence et al. (1992) Proteins 12:31; Goodford et al. (1985) J. Med. Chem. 28:849; и Boobbyer et al. (1989) J. Med. Chem. 32: 1083, включенные в полном объеме посредством ссылки).
Кристаллизацию можно проводить посредством любого способа кристаллизации, включая в качестве неограничивающих примеров диффузию периодического действия, диализ и диффузию паров (например, способы сидячей капли и висячей капли). Микро-, макро- затравливание кристалла и/или затравливание кристалла с применением пластинки также можно проводить для облегчения кристаллизации. Кристаллы, содержащие мутантные аллели BRAF, можно получать посредством ряда различных известных в данной области способов. Например, кристаллизацию можно проводить посредством диффузии периодического действия, диализа и диффузии паров (способы сидячей капли и висячей капли). Подробное описание основных способов кристаллизации белка можно найти в McRee, D., Practical Protein Crystallography, 2nd Ed. (1999), Academic Press Inc. Дальнейшие описания проведения экспериментов по кристаллизации предоставлены в Stevens et al. (2000) Curr. Opin. Struct. Biol: 10(5):558-63 и патентах США №№ 6296673; 5419278; и 5096676, включенных в настоящий документ в качестве ссылки в полном объеме. Такие кристаллы можно использовать для проведения рентгеноструктурного или нейтронографического анализа для определения трехмерной структуры мутантных аллелей BRAF. Структуру в растворе полипептида BRAF или мутантного полипептида BRAF можно определять посредством ядерной магнитно-резонансной спектроскопии с применением известных в данной области способов. Подходящие способы для определения структуры полипептида посредством рентгеноструктурной кристаллографии или ЯМР спектроскопии описаны в Brunger et al., (1998) "Crystallography & NMR system (CNS): A new Software system for macromolecular structure determination", Acta Crystallogr D54, 905-921; Brunger et al. (1987) "Solution of a Protein Crystal Structure With a Model Obtained From NMR Interproton Distance Restraints", 235 Science 1049-1053; Drenth, "Principles of Protein X-ray Crystallography", (1994), Springer-Verlag. pp. 1-19; и Narula et al. (1995) "Solution structure of the C-terminal SH2 domain of human tyrosine kinase Syk complexed with phosphotyrosine pentapeptide", Structure 3, 1061-1073, включенные в настоящий документ в качестве ссылки в полном объеме. После определения кристаллической структуры или структуры в растворе мутантого полипептида RAF ингибиторы мутантного полипептида BRAF можно определять с применением способов компьютерного моделирования, описанных выше.
Ингибиторы RAF второго поколения, определенные посредством приведенных выше способов, эффективны для лечения заболевания или состояния, ассоциированного с экспрессией полипептида RAF дикого типа и/или мутантного полипептида RAF. Например, ингибиторы RAF второго поколения эффективны для лечения злокачественной опухоли у субъекта, особенно злокачественной опухоли, в которой обнаружен мутантный полипептид BRAF. В иллюстративном варианте осуществления ингибиторы RAF второго поколения эффективны для лечения злокачественной опухоли, содержащей полипептид BRAF с мутацией одного или нескольких следующих аминокислотных остатков: A29, H72, S113, S124, P162, C194, L227, P231, C251, V291, Q329, K483, L485, T521, V528, D587, P655, S657, S683, P686, C696, L697, P722, F738 и С748. В связанном варианте осуществления ингибиторы RAF второго поколения применяют для лечения злокачественной опухоли, содержащей полипептид BRAF, содержащий одну или несколько следующих мутаций: A29V, H72N, S113I, S124F, P162H, C194*, L227F, P231T, C251F, V291F, Q329K, K483E, L485F, T521K, V528F, D587E, P655T, S657*, S683R, P686Q, P686T, C696*, L697I, P722T, F738L и C748F.
IV. Изолированные молекулы нуклеиновой кислоты
Настоящее изобретение относится к полинуклеотидам или молекулам нуклеиновой кислоты, относящимся к гену BRAF и соответствующим продуктам гена. Эти полинуклеотиды или молекулы нуклеиновой кислоты можно изолировать и очищать из клеток млекопитающих. В конкретных аспектах изобретения изолированные молекулы нуклеиновой кислоты BRAF, описываемые в настоящем документе, содержат одну или несколько мутаций, обеспечивающих резистентность к ингибитору BRAF. "Мутантная молекула нуклеиновой кислоты BRAF", как применяют в настоящем документе, включает молекулу нуклеиновой кислоты BRAF, которая кодирует мутантный полипептид BRAF, т.е. полипептид BRAF, содержащий одну или несколько мутаций, обеспечивающий резистентность к одному или нескольким известным ингибиторам BRAF.
Предполагают, что изолированная и очищенная молекула нуклеиновой кислоты BRAF, например, мутантная молекула нуклеиновой кислоты BRAF, может быть в форме РНК или ДНК. Как применяют в настоящем документе, термин "транскрипт РНК" относится к молекуле РНК, которая представляет собой продукт транскрипции молекулы нуклеиновой кислоты ДНК. Такой транскрипт может кодировать один или несколько полипептидов.
Как применяют в настоящей заявке, термин "полинуклеотид" относится к молекуле нуклеиновой кислоты, РНК или ДНК, которая была изолирована, а именно очищена от тотальной геномной нуклеиновой кислоты. Таким образом, "полинуклеотид, кодирующий BRAF" относится к участку нуклеиновой кислоты, который содержит кодирующие BRAF последовательности и изолирован от, или очищен от тотальной геномной ДНК и белков. Если настоящее изобретение относится к функциям или активности кодирующего BRAF полинуклеотида или нуклеиновой кислоты, это означает, что полинуклеотид кодирует молекулу, способную проявлять активность полипептида BRAF дикого типа, например, фосфорилирование субстратов MEK1 или MEK2.
Термин "кДНК" предназначен для обозначения ДНК, полученной посредством использования РНК в качестве матрицы. Преимущество применения кДНК вместо геномной ДНК или транскрипта РНК заключается в стабильности и возможности управлять последовательностью с применением технологии рекомбинантных ДНК (См. Sambrook, 1989; Ausubel, 1996). В некоторых случаях предпочтительно применение полной или частичной геномной последовательности. Альтернативно, предпочтительным может быть применение кДНК, поскольку она предоставляет кодирующие области полипептида и исключает интроны и другие регуляторные области.
Также предполагают, что рассматриваемая кодирующая BRAF нуклеиновая кислота или ген BRAF из данной клетки могут быть представлены природными вариантами или штаммами, которые характеризуются в немного различающимися последовательностями нуклеиновой кислоты, но при этом кодируют активный полипептид BRAF. В предпочтительном варианте осуществления активный полипептид BRAF представляет собой активный полипептид BRAF человека. В особенно предпочтительных вариантах осуществления активный полипептид BRAF представляет собой мутантный полипептид BRAF, который проявляет активность полипептида BRAF дикого типа, но является резистентным к одному или нескольким известным ингибиторам BRAF. Таким образом, определенные аспекты по настоящему изобретению охватывают производные BRAF с минимальными изменениями аминокислот, которые при этом выполняют те же биологические функции.
Термин "ген" применяют для удобства и относят к функциональному белку, полипептиду или кодирующему пептид участку. Специалистам в данной области ясно, что этот функциональный термин включает геномные последовательности, последовательности кДНК и небольшие сконструированные сегменты генов, которые экспрессируют или могут быть приспособлены для экспрессии белков, полипептидов, доменов, слитых белков и мутантных белков. Молекула нуклеиновой кислоты, кодирующая BRAF, может содержать смежную последовательность нуклеиновой кислоты, длина которой может составлять: по меньшей мере, приблизительно 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 441, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720, 730, 740, 750, 760, 770, 780, 790, 800, 810, 820, 830, 840, 850, 860, 870, 880, 890, 900, 910, 920, 930, 940, 950, 960, 970, 980, 990, 1000, 1010, 1020, 1030, 1040, 1050, 1060, 1070, 1080, 1090, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900, 3000, 3100, 3200, 3300, 3400, 3500, 3600, 3700, 3800, 3900, 4000, 4100, 4200, 4300, 4400, 4500, 4600, 4700, 4800, 4900, 5000, 5100, 5200, 5300, 5400, 5500, 5600, 5700, 5800, 5900, 6000, 6100, 6200, 6300, 6400, 6500, 6600, 6700, 6800, 6900, 7000, 7100, 7200, 7300, 7400, 7500, 7600, 7700, 7800, 7900, 8000, 8100, 8200, 8300, 8400, 8500, 8600, 8700, 8800, 8900, 9000, 9100, 9200, 9300, 9400, 9500, 9600, 9700, 9800, 9900, 10000, 10100, 10200, 10300, 10400, 10500, 10600, 10700, 10800, 10900, 11000, 11100, 11200, 11300, 11400, 11500, 11600, 11700, 11800, 11900, 12000 или более нуклеотидов, нуклеозидов или пар оснований. Такие последовательности могут быть идентичными или комплементарными, например, SEQ ID NO: 1 или ее фрагменту.
Различные варианты осуществления изобретения относятся к генетическим мутациям BRAF. Как применяют в настоящем документе, мутация относится к вставке, делеции или замене одного нуклеотида в молекуле нуклеиновой кислоты BRAF. В иллюстративном варианте осуществления мутантная молекула нуклеиновой кислоты BRAF содержит одну или несколько мутаций, обеспечивающих резистентность к определенным терапевтическим средствам, таким как ингибитор BRAF, например, RAF-265. В связанном варианте осуществления мутантная молекула нуклеиновой кислоты BRAF содержит одну или несколько мутации, так что мутантная молекула нуклеиновой кислоты BRAF кодирует мутантный полипептид BRAF, где мутантный полипептид BRAF содержит одну или несколько мутаций, обеспечивающих резистентность к определенным терапевтическим средствам, таким как a ингибитор BRAF, например, RAF-265. Таким образом, в конкретных аспектах изобретения изменения последовательности приводят к изменениям, которые затрагивают свойства полипептида, кодируемого последовательностью, так что в результате возникает, по меньшей мере, некоторая резистентность к терапии, такой как терапия ингибитором BRAF.
"В значительной степени изолированные от других кодирующих последовательностей" означает, что представляющий интерес ген образует часть кодирующей области участка нуклеиновой кислоты, и что фрагмент не содержит крупных сегментов природной кодирующей нуклеиновой кислоты, таких как крупные хромосомные фрагменты или другие функциональные гены или кодирующие области кДНК. Очевидно, что это относится к изначально изолированному фрагменту нуклеиновой кислоты и не исключает генов или кодирующих областей, позже искусственно добавленных человеком к фрагменту.
В конкретных вариантах осуществления изобретение относится к изолированным фрагментам нуклеиновой кислоты и рекомбинантным векторам, включающим последовательности ДНК, которые кодируют мутантные полипептиды BRAF или пептиды, в аминокислотную последовательность которых включена смежная аминокислотная последовательность соответствующая или в значительной степени соответствующая мутантным полипептидам BRAF. В иллюстративных вариантах осуществления изобретение относится к изолированным фрагментам ДНК и рекомбинантным векторам, включающим последовательности ДНК, которые кодируют белок BRAF, полипептид или пептид, в аминокислотную последовательность которых включена смежная аминокислотная последовательность полипептида BRAF, содержащего одну или несколько мутаций, обеспечивающих резистентность к ингибитору BRAF. В определенных вариантах осуществления одна или несколько мутаций наблюдаются в позициях A29, H72, S113, S124, P162, C194, L227, P231, C251, V291, Q329, K483, L485, T521, V528, D587, P655, S657, S683, P686, C696, L697, P722, F738 и C748. В других вариантах осуществления одна или несколько мутаций включают следующие: A29V, H72N, S113I, S124F, P162H, C194*, L227F, P231T, C251F, V291F, Q329K, K483E, L485F, T521K, V528F, D587E, P655T, S657*, S683R, P686Q, P686T, C696*, L697I, P722T, F738L и C748F.
Фрагменты нуклеиновой кислоты, применяемые в настоящем изобретении, независимо от их длины или самой кодирующей последовательности, можно комбинировать с другими последовательностями ДНК или РНК, такими как промоторы, сигналы полиаденилирования, дополнительные участки распознавания рестрикционных ферментов, участки множественного клонирования, другие кодирующие фрагменты и т.п., так что их общая длина может сильно варьировать. Предполагают, таким образом, что можно применять фрагмент нуклеиновой кислоты почти любой длины, где общая длина предпочтительно ограничена удобством получения и применения в предполагаемом протоколе применения рекомбинантной ДНК.
Предполагают, что конструкты нуклеиновой кислоты по настоящему изобретению кодируют полипептид BRAF или мутантный полипептид BRAF. "Гетерологичная" последовательность относится к последовательности, которая является неродственной или экзогенной по отношению к исходной последовательности. Гетерологичный ген относится к гену, который в природе не обнаруживают рядом с последовательностями, к которым он прилегает.
В неограничивающем примере можно получать один или несколько конструктов нуклеиновой кислоты, которые включают смежные цепочки нуклеотидов, идентичных или комплементарных всему или части гена BRAF. Конструкт нуклеиновой кислоты может содержать, по меньшей мере, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 11000, 12000, 13000, 14000, 15000, 20000, 30000, 50000, 100000, 250000, приблизительно от 500000, 750000, до приблизительно 1000000 нуклеотидов, а также может иметь большую длину, вплоть до размера хромосомы (включая все промежуточные длины и промежуточные размеры), учитывая появление конструктов нуклеиновых кислот, таких как искусственная дрожжевая хромосома, известная специалистам в данной области. Специалистам в данной области ясно, что "промежуточные длины" и "промежуточные диапазоны длины", как применяют в настоящем документе, означают любую длину и диапазон длины, включая указанные значения или промежуточные значения (т.е. все значения, включая значения, находящиеся между указанными). Неограничивающие примеры промежуточных длин включают приблизительно 11, приблизительно 12, приблизительно 13, приблизительно 16, приблизительно 17, приблизительно 18, приблизительно 19, и т.д.; приблизительно 21, приблизительно 22, приблизительно 23, и т.д.; приблизительно 31, приблизительно 32, и т.д.; приблизительно 51, приблизительно 52, приблизительно 53, и т.д.; приблизительно 101, приблизительно 102, приблизительно 103 и т.д.; приблизительно 151, приблизительно 152, приблизительно 153, приблизительно 97001, приблизительно 1001, приблизительно 1002, приблизительно 50001, приблизительно 50002, приблизительно 750001, приблизительно 750002, приблизительно 1000001, приблизительно 1000002 и т.д. Неограничивающие примеры промежуточных диапазонов длины включают приблизительно от 3 до приблизительно 32, приблизительно от 150 до приблизительно 500001, приблизительно от 3032 до приблизительно 7145, приблизительно от 5000 до приблизительно 15000, приблизительно от 20007 до приблизительно 1000003 и т.д.
Определенные варианты осуществления настоящего изобретения относятся к нуклеиновым кислотам, включая векторы, промоторы, терапевтические нуклеиновые кислоты и другие элементы нуклеиновой кислоты, вовлеченные в изменения и экспрессию в клетке. В определенных аспектах, нуклеиновая кислота содержит нуклеиновую кислоту дикого типа или мутантную нуклеиновую кислоту. В определенных аспектах нуклеиновая кислота кодирует или содержит транскрибированную нуклеиновую кислоту.
Термин "нуклеиновая кислота" хорошо известен в данной области. "Нуклеиновая кислота", как применяют в настоящем документе, как правило, относится к молекуле (т.е. цепочке) ДНК, РНК или их производных или аналогов, включающей нуклеиновое основание. Нуклеиновое основание включает, например, природный пурин или пиримидиновое основание, которое обнаруживают в ДНК (например, аденин "A," гуанин "G," тимин "T" или цитозин "C") или РНК (например, A, G, урацил "U" или C). Термин "нуклеиновая кислота" охватывает термины "олигонуклеотид" и "полинуклеотид", где каждый из этих терминов указывает на подрод термина "нуклеиновая кислота". Термин "олигонуклеотид" относится к молекуле, длина которой составляет приблизительно от 3 и приблизительно до 100 нуклеиновых оснований. Термин "полинуклеотид" относится к, по меньшей мере, одной молекуле, длина которой составляет более чем приблизительно 100 нуклеиновых оснований. "Ген" относится к последовательности, кодирующей продукт гена, а также интроны и промотор продукта гена. В дополнение к гену BRAF для применения согласно композициям и способам описываемого в заявке изобретения в качестве нуклеиновых кислот рассматривают и другие регуляторные области, такие как энхансеры для BRAF.
Эти определения, как правило, относятся к одноцепочечной молекуле, но в определенных вариантах осуществления также охватывают дополнительные цепочки, которые частично, по существу или полностью комплементарны одноцепочечной молекуле. Таким образом, нуклеиновая кислота может включать двухцепочечную молекулу или трехцепочечную молекулу, которая содержит одну или более комплементарную цепь (комплементарных цепей) или "комплемент (комплементов)" определенной последовательности, составляющих молекулу. Как применяют в настоящем документе, одноцепочечная нуклеиновая кислота может обозначаться префиксом "ss", двухцепочечная нуклеиновая кислота может обозначаться префиксом "ds", и трехцепочечная нуклеиновая кислота может обозначаться префиксом "ts".
Нуклеиновую кислоту можно получать любым способом, известным специалистам в данной области, например, посредством химического синтеза или ферментативного синтеза или биологического синтеза. Неограничивающие примеры искусственной нуклеиновой кислоты (например, искусственный праймер BRAF, который облегчает определение мутации, обеспечивающей резистентность к ингибитору BRAF), включают нуклеиновую кислоту, полученную посредством химического синтеза in vitro с применением фосфотриэфира, фосфита или фосфорамидита и твердофазных способов, таких как описанные в EP 266032, включенном в настоящий документ в качестве ссылки, или посредством применения дезоксинуклеозид H-фосфонатных промежуточных соединений, как описано в Froehler et ah, 1986 и патенте США № 5705629, включенных в настоящий документ в качестве ссылки. В способах по настоящему изобретению можно использовать один или несколько олигонуклеотидов. Различные способы получения олигонуклеотидов раскрыты, например, в патентах США №№ 4659774, 4816571, 5141813, 5264566, 4959463, 5428148, 5554744, 5574146, 5602244, содержание которых включено в настоящий документ в качестве ссылки.
Неограничивающие примеры полученной ферментативным способом нуклеиновой кислоты включают нуклеиновую кислоту, полученную с применением ферментов в реакциях амплификации, таких как ПЦР (см. например, патенты США №№ 4683202 и 4682195, включенные в настоящий документ в качестве ссылки), или нуклеиновую кислоту, полученную посредством синтеза олигонуклеотидов, как описано в патенте США № 5645897, включенном в настоящий документ в качестве ссылки. Неограничивающие примеры нуклеиновой кислоты, поученной биологическим способом, включают рекомбинантную нуклеиновую кислоту, полученную (т.е. реплицированную) в живой клетке, такую как рекомбинантный вектор ДНК, реплицированный в бактериях (см. например, Sambrook et al. 1989, включенный в настоящий документ в качестве ссылки).
Нуклеиновую кислоту можно очищать на полиакриламидных гелях, посредством центрифугирования в градиенте плотности хлорида цезия или с применением любых других способов, известных специалистам в данной области, для определения мутаций, обеспечивающих резистентность к BRAF (см. например, Sambrook et ah, 1989, включенный в настоящий документ в качестве ссылки). В предпочтительных аспектах нуклеиновая кислота представляет собой фармакологически приемлемую нуклеиновую кислоту. Фармакологически приемлемые композиции известны специалистам в данной области и описаны в настоящем документе.
В определенных аспектах настоящее изобретение относится к нуклеиновой кислоте, которая представляет собой изолированную нуклеиновую кислоту. Как применяют в настоящем документе, термин "изолированная нуклеиновая кислота" относится к молекуле нуклеиновой кислоты (например, молекуле РНК или ДНК), которая изолировали от, или освободили от тотальных геномных и транскрибированных нуклеиновых кислот одной или нескольких клеток. В определенных вариантах осуществления "изолированная нуклеиновая кислота" относится к нуклеиновой кислоте, которую изолировали от, или освободили от клеточных компонентов или компонентов реакций in vitro, включая, например, макромолекулы, такие как липиды или белки, небольшие биологические молекулы и т.п.
V. Экспрессирующие векторы и клетки-хозяева
Настоящее изобретение относится к композициям экспрессирующего вектора и применению таких векторов для кодирования полипептида BRAF, например, мутантного полипептида BRAF, а также к композициям клетки-хозяина, в которую вводят такие экспрессирующие векторы. Термин "вектор" относится к молекуле-носителю нуклеиновой кислоты, в которую можно вставлять последовательность нуклеиновой кислоты для ввода в клетку, где она может реплицироваться. Последовательность нуклеиновой кислоты может быть "экзогенной", что означает, что она чужеродная по отношению к клетке, в которую вставляют вектор, или что последовательность гомологична последовательности в клетке, но в той позиции, в которой она находится в нуклеиновой кислоте клетки-хозяина, как правило, не обнаруживается. Векторы включают плазмиды, космиды, вирусы (бактериофаг, вирусы животных и вирусы растений) и искусственные хромосомы (например, YACs). Специалисты в данной области легко могут получать векторы посредством стандартных способов рекомбинации, которые описаны в Sambrook et ah, 1989 и Ausubel et ah, 1996, включенных в настоящий документ в качестве ссылки.
Термин "экспрессирующий вектор" или "экспрессирующая конструкция" относится к вектору, содержащему последовательность нуклеиновой кислоты, кодирующую, по меньшей мере, участок продукта гена, поддающийся транскрибированию. В некоторых случаях молекулы РНК затем транслируют в белок, полипептид или пептид. В других случаях эти последовательности не транслируют, например, в случае антисмысловых молекул или рибозимов. Экспрессирующие векторы могут содержать ряд "контрольных последовательностей", которые относятся к последовательностям нуклеиновой кислоты, необходимым для транскрипции и возможной трансляции функционально связанной кодирующей последовательности в конкретном организме-хозяине. В дополнение к контрольной последовательности, управляющей транскрипцией и трансляцией, векторы и экспрессирующие векторы могут содержать последовательности нуклеиновой кислоты, выполняющие также другие функции, описанные ниже.
1. Промоторы и энхансеры
"Промотор" представляет собой контрольную последовательность, которая является участком последовательности нуклеиновой кислоты, в котором контролируется инициация и скорость транскрипции. Он может содержать генетические элементы, с которыми могут связываться регуляторные белки и молекулы, такие как РНК-полимераза и другие факторы транскрипции. Фразы "оперативно связанный", "функционально связанный", "под контролем" и "под транскрипционным контролем" означают, что промотор находится в правильном функциональном положении и/или ориентации по сравнению с последовательностью нуклеиновой кислоты для контроля инициации транскрипции и/или экспрессии этой последовательности. Промотор необязательно можно использовать в сочетании с "энхансером", который обозначает действующую в цис-положении регуляторную последовательность, вовлеченную в активацию транскрипции последовательности нуклеиновой кислоты.
Промотор может представлять собой промотор, естественным образом связанный с геном или последовательностью, и его можно получать посредством изолирования 5'-некодирующих последовательностей, расположенных в 5'-направлении кодирующего фрагмента и/или экзона. Такой промотор можно обозначать как "эндогенный". Так же, энхансер может представлять собой энхансер, естественным образом связанный с последовательностью нуклеиновой кислоты и расположенный либо в 5'-направлении, либо в 3'-направлении от такой последовательности. Альтернативно, определенные преимущества может предоставлять помещение кодирующего фрагмента нуклеиновой кислоты под контроль рекомбинантного или гетерологичного промотора, что обозначает промотор, который в природе не связан с последовательностью нуклеиновой кислоты. Рекомбинантный или гетерологичный энхансер относится также к энсхансеру, который в норме не связан с последовательностью нуклеиновой кислоты. Такие промоторы или энхансеры могут включать промоторы или энхансеры других генов и промоторы или энхансеры, изолированные из любых других прокариотических или эукариотических клеток или вирусов, и промоторы или энхансеры, которые не являются "природными", т.е. содержат различные элементы различных областей регуляции транскрипции и/или мутации, которые влияют на экспрессию.
Очевидно, что важно использовать промотор и/или энхансер, который эффективно управляет экспрессией фрагмента нуклеиновой кислоты в типе клеток, органелл и организмов, выбранном для экспрессии. Специалистам в данной области молекулярной биологии, как правило, известно применение комбинаций промоторов, энхансеров и типов клеток для экспрессии белка, например, см. Sambrook et al. (1989), включенный в настоящий документ в качестве ссылки. Применяемые промоторы могут быть конститутивными, тканеспецифическими, индуцируемыми и/или применяться в подходящих условиях для обеспечения высокого уровня экспрессии рассматриваемого фрагмента ДНК. Промотор может быть гетерологичным или экзогенным, например, промотор не для BRAF в отношении кодирующей последовательности BRAF. В некоторых примерах прокариотический промотор применяют для транскрипции in vitro желаемой последовательности.
Прокариотические промоторы для применения со многими коммерчески доступными системами включают T7, T3 и Sp6.
2. Сигналы инициации и внутренние участки связывания рибосомы
Специфический сигнал инициации может также быть необходим для эффективной трансляции кодирующих последовательностей. Эти сигналы включают кодон инициации ATG или прилежащие последовательности. Может требоваться предоставление экзогенных сигналов трансляционного контроля, включая кодон инициации ATG. Специалист в данной области сможет легко определить и предоставить необходимые сигналы. Хорошо известно, что кодон инициации должен находиться внутри рамки считывания необходимой кодирующей последовательности для обеспечения трансляции все вставки. Экзогенные сигналы трансляционного контроля могут быть природными и синтетическими. Эффективность экспрессии можно повышать посредством введения подходящих элементов-энхансеров транскрипции. В определенных вариантах осуществления внутренние участки связывания рибосом (IRES) применяют для получения мультигенных, или полицистронных механизмов.
3. Участки множественного клонирования
Векторы могут включать участок множественного клонирования (MCS), который представляет собой фрагмент нуклеиновой кислоты, содержащий многочисленные участки распознавания рестрикционных ферментов, любой из которых можно использовать в сочетании со стандартным способом рекомбинации расщепления вектора (см., например, Carbonelli et ah, 1999, Levenson et ah, 1998, и Cocea, 1997, включенный в настоящий документ в качестве ссылки). "Расщепление рестрикционными ферментами" относится к каталитическому расщеплению молекулы нуклеиновой кислоты посредством ферментов, который функционируют только в определенных сайтах молекулы нуклеиновой кислоты. Многие из этих рестрикционных ферментов коммерчески доступны. Применение таких ферментов широко известно специалистам в данной области. Часто вектор линеаризуют или фрагментируют с применением рестрикционного фермента, который делает разрезы внутри MCS, что обеспечивает лигирование экзогенных последовательностей с вектором. "Лигирование" относится к процессу образования фосфодиэфирных связей между двумя фрагментами нуклеиновой кислоты, которые необязательно являются смежными друг с другом. Способы, включающие рестрикционные ферменты и реакции лигирования, хорошо известны специалистам в области рекомбинантной технологии.
4. Участки сплайсинга
Большинство транскрибированных эукариотических молекул РНК далее претерпевают сплайсинг РНК, в результате которого из первичных транскриптов удаляются интроны. Для векторов, содержащих геномные эукариотические последовательности, могут требоваться донорные и/или акцепторные участки сплайсинга для обеспечения правильного процессинга транскрипта для белковой экспрессии (см., например, Chandler et ah, 1997, включенный в настоящий документ в качестве ссылки).
5. Сигналы терминации
Векторы или конструкты по настоящему изобретению, как правило, содержат, по меньшей мере, один сигнал терминации. "Сигнал терминации" или "терминатор" состоит из последовательности ДНК, участвующей в специфичной терминации транскрипта РНК посредством РНК-полимеразы. Таким образом, в определенных вариантах осуществления рассматривают сигналы терминации, которые терминируют образование транскрипта РНК in vivo для достижения желаемых уровней мРНК.
6. Сигналы полиаденилирования
Для экспрессии, особенно эукариотической экспрессии, как правило, включают сигнал полиаденилирования для обеспечения правильного полиаденилирования транскрипта. Полагают, что природа сигнала полиаденилирования несущественна для успешного осуществления изобретения и/или можно применять любую такую последовательность. Предпочтительные варианты осуществления включают сигнал полиаденилирования SV40 и/или бычий гормон роста, который является сигналом полиаденилирования, подходящий и/или известный как функционирующий в различных клетках-мишенях.
Полиаденилирование может повышать стабильность транскрипта или облегчать цитоплазатический транспорт.
7. Участки начала репликации
Для распространения вектора в клетке-хозяине он может содержать один или несколько участков начала репликации (обычно обозначаемых "ori"), которые представляют собой специфические последовательности нуклеиновой кислоты, с которых начинается репликация. Альтернативно, если клетка-хозяин представляет собой дрожжи, можно применять автономно реплицирующуюся последовательность (ARS).
8. Селективные и поддающиеся обнаружению маркеры
В определенных вариантах осуществления клетки, содержащие конструкты нуклеиновой кислоты по настоящему изобретению, можно определять in vitro или in vivo посредством включения маркера в экспрессирующий вектор. Такие маркеры обеспечивают различимое изменение клетки, позволяющее легко определять клетки, содержащие экспрессирующий вектор.
Как правило, селективный маркер представляет собой маркер, который обеспечивает свойства, позволяющие производить селекцию. Позитивный селективный маркер представляет собой маркер, для которого присутствие маркера позволяет произвести его селекцию, в то время как негативный селективный маркер представляет собой маркер, для которого присутствие маркера предотвращает его селекцию. Пример позитивного селективного маркера представляет собой маркер резистентности к лекарственному средству.
Как правило, включение селективного маркера лекарственного средства помогает в проведении клонирования и определении трансформантов, например, гены, которые обеспечивают резистентность к неомицину, пуромицину, гигромицину, DHFR, GPT, зеоцину и гистидинолу, представляют собой селективные маркеры. В дополнение к маркерам, обеспечивающим фенотип, который позволяет распознавать трансформанты на основе осуществления условий, применяют также другие типы маркеров, включая поддающиеся обнаружению, такие как GFP, которые основаны на калориметрическом анализе. Альтернативно, можно применять поддающиеся обнаружению ферменты, такие как тимидинкиназа (tk) вируса простого герпеса или хлорамфеникол ацетилтрансфераза (CAT). Специалистам в данной области также известно, как применять иммунологические маркеры, часто в сочетании с анализом FACS. Применяемый маркер, как полагают, неважен, при условии, что он может экспрессироваться одновременно с нуклеиновой кислотой, кодирующей продукт гена. Дальнейшие примеры селективных и поддающихся обнаружению маркеров хорошо известны специалисту в данной области.
9. Клетки-хозяева
Как применяют в настоящем документе, термины "клетка", "клеточная линия" и "клеточная культура" можно использовать взаимозаменяемо. Клетку, содержащую полинуклеотид BRAF, мутантный или дикого типа, можно применять по изобретению. Все эти термины также включают потомство этих клеток, к которому относят все последующие поколения. Следует понимать, что потомство может быть неидентичным вследствие произвольных или непроизвольных мутаций. В контексте экспрессии гетерологичной последовательности нуклеиновой кислоты "клетка-хозяин" относится к прокариотической или эукариотической клетке и включает любые преобразуемые организмы, способные реплицировать вектор и/или экспрессировать гетерологичный ген, кодируемый вектором. Клетку-хозяин можно применять в качестве реципиента векторов. Клетка-хозяин может быть "трансфектирована" или "трансформирована", что обозначает процесс, посредством которого экзогенную нуклеиновую кислоту переносят или встраивают в клетку-хозяина. Трансформированная клетка включает первичную клетку и ее потомство. "Рекомбинантная клетка-хозяин" относится к клетке-хозяину, которая несет рекомбинантную нуклеиновую кислоту, т.е. нуклеиновую кислота, которую обрабатывали in vitro или которая представляет собой реплицированную копию обработанной нуклеиновой кислоты.
Клетку-хозяина можно получать из прокариот или эукариот в зависимости от того, является ли желаемый результат репликацией вектора, экспрессией части или всей последовательности нуклеиновой кислоты, заключенной в векторе, или получение инфекционных вирусных частиц.
Различные клеточные линии и культуры доступны для применения в качестве клетки-хозяина, и их можно получать в Американской коллекции типовых культур (ATCC), которая представляет собой организацию, которая служит архивом для живых культур и генетических материалов. Подходящего хозяина может определить специалист в данной области на основе строения вектора и желаемого результата. Плазмиду или космиду, например, можно интродуцировать в прокариотическую клетку-хозяина для репликации многих векторов. Бактериальные клетки, применяемые в качестве клеток-хозяев для репликации и/или экспрессии вектора, включают DH5α, JM109, и KC8, а также ряд коммерчески доступных бактериальных хозяев, таких как SURE™ Competent Cells и Solopack™ Gold Cells (Strategene.RTM., La Jolla). Альтернативно, в качестве клеток-хозяев для бактериофагов можно применять бактериальные клетки, так как E. coli LE392.
Предпочтительная эукариотическая клетка-хозяин по изобретению представляет собой клеточную линию меланомы A375, где клетка трансформирована экспрессирующим вектором, кодирующим полипептид BRAF, например, мутантный полипептид BRAF по изобретению.
10. Экспрессирующие системы
Существуют различные экспрессирующие системы, которые содержат, по меньшей мере, часть или все композиции, указанные выше. Системы, основанные на прокариотах и/или эукариотах, можно применять по настоящему изобретению для получения последовательностей нуклеиновой кислоты BRAF или происходящих от них полипептидов, белков и пептидов. Многие такие системы являются коммерчески доступными и широко доступными.
Высокие уровни белковой экспрессии гетерологичного фрагмента нуклеиновой кислоты могут обеспечивать клетка насекомого/бакуловирусная система, которые описаны в патентах США №№ 5871986, 4879236, включенных в настоящий документ в качестве ссылки, и которые можно приобрести, например, под названием MaxBac™ 2,0 от Invitrogen™ и BacPack™ Baculovirus Expression System от Clontech™.
Другие примеры экспрессирующих систем включают Complete Control Inducible Mammalian Expression System от Stratagene, которая включает синтетический экдизон-индуцируемый рецептор, или Экспрессирующую систему pET, экспрессирующую систему на основе E. coli. Другой пример индуцируемой экспрессирующей системы доступен в Invitrogen, который выпускает Систему T-Rex™ (тетрациклин-регулируемая экспрессия), индуцируемую экспрессирующую систему млекопитающих, в которой используют полноразмерный промотор CMV. Системы Tet-On™ и Tet-Off™ от Clontech™ можно использовать для регуляции экспрессии у млекопитающего с применением тетрациклина или его производных. Применение этих систем описано в Gossen et al., 1992 и Gossen et al., 1995 и патенте США № 5650298, включенных в настоящий документ в качестве ссылки.
Invitrogen также предоставляет экспрессирующую систему на основе дрожжей под названием Экспрессирующая Система Pichia methanolica, которая создана для получения больших количеств рекомбинантных белков из метилотрофных дрожжей Pichia methanolica. Специалистам в данной области известны способы экспрессии вектора, такие как экспрессирующая конструкция, для получения последовательности нуклеиновой кислоты или происходящих от нее полипептида, белка или пептида.
VI. Изолированные молекулы полипептида
Другой аспект изобретения относится к изолированным и/или очищенным белкам BRAF и их биологически активным фрагментам. В определенных аспектах изобретения полипептиды BRAF, описываемые в настоящем документе, содержат одну или несколько мутаций, обеспечивающих резистентность к ингибитору BRAF. "Мутантный полипептид BRAF", как применяют в настоящем документе, включает полипептид BRAF, содержащий одну или несколько мутаций, которые обеспечивают резистентность к одному или нескольким известным ингибиторам BRAF.
"Изолированный" или "очищенный" белок или его биологически активный фрагмент являются в значительной степени свободными от клеточных компонентов при получении способами рекомбинантной ДНК или свободными от исходных химических веществ или других веществ при получении химическими способами. Фраза "в значительной степени свободны от клеточных компонентов" включает композиции белков BRAF, в которых белок отделен от клеточных компонентов клеток, из которых белок получают естественным или рекомбинантным способом. В одном из вариантов осуществления фраза "в значительной степени свободны от клеточных компонентов" включает композиции белка BRAF, содержащие менее чем приблизительно 30% (по сухой массе) белка, не являющегося BRAF (который в настоящем документе также называют "контаминирующий белок"), более предпочтительно менее чем приблизительно 20% белка, не являющегося BRAF, еще более предпочтительно менее чем приблизительно 10% белка, не являющегося BRAF, и наиболее предпочтительно менее чем приблизительно 5% белка, не являющегося BRAF. Если белок BRAF или его биологически активный фрагмент получают рекомбинантным способом, он также предпочтительно является в значительной степени свободным от среды для культивирования, т.е. среда для культивирования составляет менее чем приблизительно 20%, более предпочтительно менее чем приблизительно 10% и наиболее предпочтительно менее чем приблизительно 5% объема композиции белка. Фраза "в значительной степени свободны от исходных химических веществ или других химических веществ" включает композиции белка BRAF, в которых белок отделен от исходных химических веществ или других химических веществ, которые вовлечены в получение белка. В одном из вариантов осуществления фраза "в значительной степени свободны от исходных химических веществ или других химических веществ" включает композиции белка BRAF, содержащие менее чем приблизительно 30% (по сухой массе) исходных химических веществ или химических веществ, не являющихся BRAF, более предпочтительно менее чем приблизительно 20% исходных химических веществ или химических веществ, не являющихся BRAF, еще более предпочтительно менее чем приблизительно 10% исходных химических веществ или химических веществ, не являющихся BRAF, и наиболее предпочтительно менее чем приблизительно 5% исходных химических веществ или химических веществ, не являющихся BRAF.
Биологически активные фрагменты белка BRAF включают пептиды, содержащие аминокислотные последовательности, полученных от аминокислотной последовательности белка BRAF, например, аминокислотную последовательность, представленную в SEQ ID NO:2, или аминокислотную последовательность белка, гомологичного белку BRAF, которая содержит меньше аминокислот, чем полноразмерный белок BRAF или полноразмерный белок, гомологичный белку BRAF и проявляющий, по меньшей мере, одну активность белка BRAF. Как правило, биологически активные фрагменты (пептиды, например, пептиды длиной, например, 5, 10, 15, 20, 30, 35, 36, 37, 38, 39, 40, 50, 100, 200, 300, 400, 500, 600, 700 или более аминокислот) содержат домен или мотив, проявляющий, по меньшей мере, одну активность белка BRAF. Кроме того, другие биологически активные фрагменты, в которых удалены другие участки белка, можно получать рекомбинантными способами и оценивать на наличие одного или нескольких типов активности, описываемых в настоящем документе. Предпочтительно биологически активные фрагменты белка BRAF включают один или несколько выбранных доменов/мотивов или их участков, проявляющих биологическую активность. В предпочтительных вариантах осуществления биологически активные фрагменты белка содержат одну или несколько мутаций по сравнению с последовательностью BRAF дикого типа, где указанные одна или несколько мутаций при наличии их в полноразмерном мутантном полипептиде BRAF обеспечивают резистентность мутантного полипептида BRAF к известным ингибиторам BRAF. В иллюстративных вариантах осуществления мутации затрагивают аминокислоты, соответствующие одной или нескольким следующим позициям в белке BRAF дикого типа: A29, H72, S113, S124, P162, C194, L227, P231, C251, V291, Q329, K483, L485, T521, V528, D587, P655, S657, S683, P686, C696, L697, P722, F738 и C748. В связанном варианте осуществления мутации затрагивают один или несколько следующих остатков остатки BRAF: A29V, H72N, S113I, S124F, P162H, С194*,L227F, P231T, C251F, V291F, Q329K, K483E, L485F, T521K, V528F, D587E, P655T, S657*, S683R, P686Q, P686T, C696*, L697I, P722T, F738L и C748F.
Белки BRAF предпочтительно получают способами рекомбинантной ДНК. Например, молекулу нуклеиновой кислоты, кодирующую белок, клонируют в экспрессирующий вектор (как описано выше), экспрессирующий вектор помещают в клетку-хозяин (как описано выше), и белок BRAF экспрессируется в клетке-хозяине. Белок BRAF затем можно изолировать из клеток посредством подходящего способа очистки с применением стандартных способов очистки белка. В качестве альтернативы рекомбинантной экспрессии белок BRAF, полипептид или пептид можно синтезировать химически с применением стандартных способов пептидного синтеза. Кроме того, нативный белок BRAF и/или мутантный белок BRAF можно изолировать из клеток (например, злокачественных клеток), например, с применением анти-BRAF антител, которые можно получать стандартными способами с применением белка BRAF или его фрагмента по настоящему изобретению.
Изобретение также относится к химерным или слитым белкам BRAF. Как применяют в настоящем документе, "химерный белок" BRAF или "слитый белок" BRAF содержит полипептид BRAF, функционально связанный с полипептидом, не являющимся BRAF. "Полипептид BRAF" относится к полипептиду с аминокислотной последовательностью, соответствующей белку BRAF, в то время как "полипептид, не являющийся BRAF" относится к полипептиду с аминокислотной последовательностью, соответствующей белку, который не является в значительной степени гомологичной белку BRAF, например, белку, который в значительной степени отличается от белка BRAF, который не проявляет активности BRAF и получен из того же или другого организма. В отношении слитого белка термин "функционально связанный" обозначает, что полипептид BRAF и полипептид, не являющийся BRAF, связаны друг с другом с сохранением рамки считывания. Полипептид, не являющийся BRAF, можно сливать с N-концом или C-концом полипептида BRAF. Например, в одном из вариантов осуществления слитый белок представляет собой слитый белок GST-BRAF, в котором последовательность BRAF слита с C-концом последовательности GST. Такие слитые белки могут облегчать очистку рекомбинантных белков BRAF. В другом варианте осуществления слитый белок представляет собой белок BRAF, содержащий гетерологичную сигнальную последовательность на N-конце. В определенных клетках-хозяевах (например, клетках-хозяевах млекопитающих) экспрессию и/или секрецию белка BRAF можно усиливать посредством применения гетерологичной сигнальной последовательности.
Предпочтительно химерный или слитый белок BRAF по изобретению получают стандартными способами рекомбинантной ДНК. Например, фрагменты ДНК, кодирующие различные последовательности полипептида, лигируют с сохранением рамки считывания согласно общепринятым способам, например, посредством применения лигирования с липкими концами или лигирования способом ступенчатых разрывов, расщепления рестрикционными ферментами для предоставления подходящих концов, заполнения липких концов при необходимости, обработкой щелочной фосфатазой для предотвращения нежелательных соединений и ферментативного лигирования. В другом варианте осуществления гибридный ген можно получать посредством общепринятых способов, включая автоматизированные синтезирующие устройства ДНК. Альтернативно можно проводить ПЦР-амплификацию фрагментов генов с применением якорных праймеров, которые предоставляют комплементарные области перекрывания между двумя соседними фрагментами гена, которые затем можно отжигать и реамплифицировать с получением последовательности химерного гена (см., например, Current Protocols in Molecular Biologe, eds. Ausubel et al. John Wiley & Sons: 1992). Кроме того, коммерчески доступны многие экспрессирующие векторы, которые сразу кодируют гибридные молекулы (например, полипептид GST). BRAF-кодирующую нуклеиновую кислоту можно клонировать в такой экспрессирующий вектор, в результате чего гибридная молекула оказывается связанной с белком BRAF с сохранением рамки считывания.
В предпочтительном варианте осуществления изолированные полипептиды BRAF по изобретению содержат одну или несколько мутаций (например, замен или делеций) по сравнению с последовательностью полипептида BRAF дикого типа. В одном из вариантов осуществления мутантный полипептиды BRAF содержат одну или несколько мутаций по сравнению с последовательностью полипептида BRAF дикого типа человека (SEQ ID NO:2). В особенно предпочтительном варианте осуществления одна или несколько мутаций обеспечивают резистентность к ингибитору BRAF. В иллюстративном варианте осуществления ингибитор BRAF представляет собой RAF-265. Мутантный белок BRAF по изобретению проявляет биологическую активность, характерную для белка BRAF дикого типа. Такая биологическая активность может включать, например, фосфорилирование MEK1 или MEK2. Иллюстративные мутантные полипептиды BRAF по изобретению включают полипептиды BRAF, содержащие мутацию одного или нескольких следующих аминокислотных остатков по сравнению с полипептидом BRAF дикого типа человека: A29, H72, S113, S124, P162, C194, L227, P231, C251, V291, Q329, K483, L485, T521, V528, D587, P655, S657, S683, P686, C696, L697, P722, F738 или С748. Иллюстративные мутантные полипептид BRAF по изобретению также включают полипептиды BRAF, содержащие одну или несколько следующих аминокислотных замен по сравнению с белком BRAF дикого типа человека: A29V, H72N, S113I, S124F, P162H, C194*, L227F, P231T, C251F, V291F, Q329K, K483E, L485F, T521K, V528F, D587E, P655T, S657*, S683R, P686Q, P686T, C696*, L697I, P722T, F738L и C748F.
Мутантные белки BRAF можно получать посредством мутагенеза белка BRAF дикого типа или молекулы нуклеиновой кислоты, кодирующей белок BRAF дикого типа. Мутантные белки BRAF также можно определять посредством поиска в комбинаторных библиотеках мутантных BRAF мутантного белка BRAF с желаемой активностью, например, с резистентностью к ингибитору BRAF. В данной области известно несколько способов поиска в комбинаторных библиотеках продуктов генов, полученных посредством точечных мутаций или вырезания участков, и скринирования библиотек кДНК для поиска продуктов генов с выбранными свойствами. Такие способы можно настраивать для быстрого скринирования генных библиотек, полученных комбинаторным мутагенезом. Наиболее широко известные способы для скринирования обширных генных библиотек, позволяющие проводить анализ с высокой пропускной способностью, как правило,включают клонирование генной библиотеки в поддающиеся репликации экспрессирующие векторы, трансформирование подходящих клеток полученной библиотекой векторов и экспрессию комбинаторных генов в условиях, в которых обнаружение желаемой активности облегчает изоляцию вектора, кодирующего ген, продукт которого был обнаружен.
VIII. Обнаружение мутаций
В другом аспекте изобретение относится к способам обнаружения наличия мутантного белка BRAF в образце (например, в биологическом образце от пациента со злокачественной опухолью). Для обнаружения в образце, например, в образце нуклеиновой кислоты и/или полипептида, наличия мутантного белка BRAF по изобретению можно использовать ряд способов скринирования. В определенных вариантах осуществления образец содержит клетку или клеточный экстракт. В иллюстративных вариантах осуществления образец получают от субъекта, например, от субъекта со злокачественной опухолью.
Способы обнаружения наличия обеспечивающих резистентность мутаций в геномной ДНК, кДНК и РНК (т.е. мРНК), содержащей последовательность, кодирующую белок BRAF, или ее биологически активный фрагмент, можно использовать в объеме настоящего изобретения. Так же, способы обнаружения наличия обеспечивающих резистентность мутаций в полипептидах BRAF или их биологически активных фрагментах можно использовать в объеме настоящего изобретения. В конкретных вариантах осуществления способы включают в качестве неограничивающих примеров следующие способы, которые можно использовать для обнаружения наличия a полипептида BRAF или молекулы нуклеиновой кислоты, кодирующей полипептид BRAF, содержащей мутации одного или нескольких следующих аминокислотных остатков: A29, H72, S113, S124, P162, C194, L227, P231, C251, V291, Q329, K483, L485, T521, V528, D587, P655, S657, S683, P686, C696, L697, P722, F738 или C748. В иллюстративных вариантах осуществления способы включают в качестве неограничивающих примеров следующие способы, которые можно использовать для обнаружения наличия полипептида BRAF или молекулы нуклеиновой кислоты, кодирующей полипептид BRAF, содержащей мутации одного или нескольких следующих аминокислотных остатков: A29V, H72N, S113I, S124F, P162H, C194*, L227F, P231T, C251F, V291F, Q329K, K483E, L485F, T521K, V528F, D587E, P655T, S657*, S683R, P686Q, P686T, C696*, L697I, P722T, F738L и C748F.
Точечные мутации можно обнаруживать с применением способов, включающих электрофорез в градиенте денатурирующего геля ("DGGE"), анализ полиморфизма длины рестрикционных фрагментов ("RFLP"), способы химического или ферментативного расщепления, прямое секвенирование необходимых участков, амплифицированных посредством ПЦР (см. выше), анализ одноцепочечного конформационного полиморфизма ("SSCP"), полимеразную цепную реакцию, секвенирование, гибридизацию, способ "гибридной ловушки" с последующим пиросеквенированием или снеквенированием одиночных молекул и другие известные в данной области способы. Один способ поиска точечных мутаций основан на расщеплении РНКазой ошибочных пар оснований в гетеродуплексах РНК/ДНК или РНК/РНК. Как применяют в настоящем документе, термин "ошибочный" определяют как участок из одного или нескольких непарных или неверно спаренных нуклеотидов в двухцепочечной молекуле РНК/РНК, РНК/ДНК или ДНК/ДНК. Это определение, таким образом, включает ошибочные участки, возникшие в результате вставки/делеции, а также затрагивающих одну ин или несколько пар основания точечных мутаций. В патенте США № 4946773 описан анализ расщепления РНКазой А сайтов ошибочных нуклеотидов, который включает отжиг тестируемых одноцепочечных молекул ДНК или РНК с образцом РНК и последующую обработку дуплексов нуклеиновой кислоты РНКазой A. Для обнаружения сайтов ошибочных нуклеотидов одноцепочечные продукты обработки РНКазой A, разделенные по размеру посредством электрофореза, сравнивают с таким же способом обработанными контрольными дуплексами. Образцы, содержащие небольшие фрагменты (продукты расщепления), не обнаруженные для контрольных дуплексов, считают положительными.
Другие исследователи описывали применение РНКазы I в анализе сайтов ошибочных нуклеотидов. Например, Promega выпускает набор, содержащий РНКазу I, которая, как показано, расщепляет три из четырех сайтов ошибочных нуклеотидов. Другие исследователи описывали применение белка MutS или других ферментов репарации ДНК для обнаружения одиночных сайтов ошибочных нуклеотидов.
Альтернативные способы обнаружения делеций, вставок или замен, которые можно использовать в практическом осуществлении настоящего изобретения, раскрыты в патентах США №№ 5849483, 5851770, 5866337, 5925525 и 5928870, включенных в настоящий документ в качестве ссылки в полном объеме.
Способы скринирования можно применять для обследования индивидуума на наличие мутаций, указанных выше. Например, в одном из вариантов осуществления образец (такой как образец крови или другой биологической жидкости или образец клетки или ткани) берут у пациента для анализа генотипа. В иллюстративном варианте осуществления пациент представляет собой пациента со злокачественной опухолью. Наличие или отсутствие одной или нескольких мутаций, описываемых в настоящем документе, указывает на способность обследованных индивидуумов проявлять резистентность к лечению ингибитором BRAF первого поколения. Согласно способам, предоставленным по изобретению, эти результаты можно применять для установления и/или изменения дозы ингибитора BRAF первого поколения или для выбора курса лечения с применением ингибитора BRAF второго поколения. Эффективное лечение субъекта со злокачественной опухолью может включать уничтожение злокачественных клеток, подавление или уменьшение скорости роста злокачественной опухоли (такой как солидная опухоль) или облегчение, по меньшей мере, одного симптома злокачественной опухоли.
Обеспечивающие резистентность мутации полипептидов BRAF или молекул нуклеиновой кислоты, кодирующих полипептиды BRAF, можно обнаруживать с применением любых подходящих известных в данной области способов или их модификаций, включая способы, указанные ниже. Такие способы включают применение аллельспецифической полимеразной цепной реакции, прямого или непрямого секвенирования участка, применение рестрикционных ферментов, где соответствующие аллели участка создают или разрушают участок рестрикции, применение аллельспецифических зондов для гибридизации, применение антител, специфичных к мутантным полипептидам BRAF, или любые другие биохимические способы.
1. Секвенирование ДНК
Наиболее общеупотребительный способ обнаружения мутации представляет собой прямое секвенирование ДНК генетического локуса, который фланкирует и включает полиморфизм. Такой анализ можно проводить с применением "способа дидезокси-окончания цепи", также известного как способ "способ Сангера" (Sanger, F., et al, 1975) или "способа химической деградации", также известного как "способ Максама-Гилберта" (Maxam, A. M., et al, 1977). Секвенирование в сочетании со способами амплификации, специфичной для геномной последовательности, такими как полимеразная цепная реакция, можно применять для облегчения восстановления нужных генов (Mullis, K. et al, 1986; European Patent Appln. 50,424; European Patent Appln. 84,796, European Patent Appln. 258,017, European Patent Appln. 237,362; European Patent Appln. 201,184; патенты США №№ 4683202; 4582788; и 4683194), содержание которых включено в настоящий документ в качестве ссылки. Секвенирование объединенных образцов можно также проводить с применением секвенирования Solexa/Illumina (Illumina,® San Diego, CA), пиросеквенирования или других способов секвенирования одиночных молекул.
2. Резистентность к экзонуклеазе
Другие способы, которые можно применять для определения природы нуклеотида в сайте мутации, включают применение особых производных нуклеотидов, резистентных к экзонуклеазе (патент США № 4656127). Праймер, комплементарный аллельной последовательности, находящейся со стороны 3'-конца от полиморфного сайта, гибридизуют с исследуемой ДНК. Если полиморфный сайт ДНК содержит нуклеотид, комплементарный определенному производному нуклеотида, резистентному к экзонуклеазе, то производное нуклеотида встроится полимеразой в конец гибридизованного праймера. Такое встраивание делает праймер резистентным к расщеплению экзонуклеазой и тем самым позволяет его обнаруживать. Поскольку природа резистентного к экзонуклеазе производного известна, это позволяет определять конкретный нуклеотид в полиморфном сайте ДНК.
3. Способы микросеквенирования
Описано несколько других способов опосредованного праймерами включения нуклеотидов для анализа сайтов мутаций в ДНК (Komher, J. S. et ah, 1989; Sokolov, B. P., 1990; Syvanen 1990; Kuppuswamy et ah, 1991; Prezant et ah, 1992; Ugozzoll, L. et ah, 1992; Nyren et ah, 1993). Эти способы основаны на включении меченых дезоксинуклеотидов для различения пар оснований в сайте мутации. Поскольку сигнал пропорционален числу включенных дезоксинуклеотидов, мутации, возникающие при пробеге одного нуклеотида, дают сигнал, пропорциональный длине пробега (Syvanen et al, 1993).
4. Удлинение в растворе
В патенте Франции 2650840 и заявке PCT № W091/02087 описаны способы применения раствора для определения природы нуклеотида в сайте мутации. Согласно этим способам применяют праймер, комплементарный аллельным последовательностям, находящимся со стороны 3'-конца от полиморфного сайта. Природу нуклеотида в этом сайте определяют с применением с применением меченых производных дидезоксинуклеотидов, которые включаются в конец праймера в случае комплементарности нуклеотиду в полиморфном сайте.
5. Анализ Genetic BitTM или удлинение на твердой фазе
PCT Appln. No. 92/15712 описывает способ, который включает применение смесей меченых терминаторов и праймера, который комплементарен последовательности, находящейся со стороны 3'-конца от полиморфного сайта. Меченый терминатор комплементарен нуклеотиду в полиморфном сайте исследуемой молекулы, который оценивают и, таким образом, идентифицируют. В этом способе праймер или исследуемую молекулу иммобилизуют на твердой фазе.
6. Анализ лигирования олигонуклеотидов (OLA)
Анализ лигирования олигонуклеотидов представляет собой способ с применением твердой фазы, отличный от способа, описанного выше (Landegren et ah, 1988). Применяют два олигонуклеотида, способных гибридизоваться с прилежащими последовательностями одноцепочечной молекулы исследуемой ДНК. Один из этих олигонуклеотидов является биотинилированным, в то время как другой помечен выявляемой меткой. Если в исследуемой молекуле обнаружена полностью комплементарная последовательность, олигонуклеотиды гибридизуются таким образом, что их концы будут прилегать друг к другу, и образуют субстрат лигирования. Лигирование позволяет восстановить меченый олигонуклеотид с применением авидина.
Описаны также другие способы обнаружения нуклеиновой кислоты, основанные на этом способе, комбинированном с ПЦР (Nickerson et ah, 1990). В этом способе ПЦР применяют для получения экспоненциальной амплификации исследуемой ДНК, которую затем определяют посредством OLA.
7. Анализ генетической информации с применением лигазы/полимеразы
В патенте США № 5952174 описан способ, также включающий два праймера, способных к гибридизации с прилежащими последовательностями исследуемой молекулы. Продукт гибридизации образуется на твердой подложке, на которой иммобилизуют исследуемую молекулу. В этом способе гибридизация происходит таким образом, что праймеры отделяются друг от друга одним нуклеотидом. Инкубирование этого продукта гибридизации в присутствии полимеразы, лигазы и нуклеозид-трифосфатной смеси, содержащей, по меньшей мере, один дезоксинуклеозид трифосфат, позволяет проводить лигирование любой пары прилежащих друг к другу гибридизованных олигонуклеотидов. Добавление лигазы приводит к двум событиям, необходимым для получения сигнала, удлинению и лигированию. Этот способ обеспечивает более высокую специфичность и меньший уровень "фона", чем способы, в которых применяют только удлинение или только лигирование, и, в отличие от анализов с применением полимеразы, этот способ, благодаря объединению этого этапа со вторым этапом гибридизации и этапом лигирования, повышает специфичность полимеразного этапа в отношении сигнальной последовательности, присоединенной к твердой фазе.
8. Способы переноса нуклеиновой кислоты
Для некоторых способов по настоящему изобретению можно применять способы переноса нуклеиновой кислоты. Подходящие способы доставки нуклеиновой кислоты для воздействия на экспрессию композиций по настоящему изобретению, как полагают, включают в сущность любой способ, посредством которого нуклеиновую кислоту (например, ДНК, включая вирусные и невирусные векторы) можно внести в органеллу, клетку, ткань или организм, как описано в настоящем документе или как известно специалистам в данной области. Такие способы включают в качестве неограничивающих примеров прямую доставку ДНК, такую как доставка посредством инъекции (патенты США №№ 5994624, 5981274, 5945100, 5780448, 5736524, 5702932, 5656610, 5589466 и 5580859, включенные в настоящий документ в качестве ссылки), включая микроинъекцию (Harlan и Weintraub, 1985; патент США № 5789215, включенный в настоящий документ в качестве ссылки); посредством электропорации (патент США № 5384253, включенный в настоящий документ в качестве ссылки); посредством осаждения фосфатом кальция (Graham и Van Der Eb, 1973; Chen и Okayama, 1987; Rippe et al, 1990); посредством применения DEAE-декстрана и полиэтиленгликоля (Gopal, 1985); посредством обработки ультразвуком (Fechheimer et al, 1987); посредством трансфекции с применением липосомы (Nicolau и Sene, 1982; Fraley et al, 1979; Nicolau et al, 1987; Wong et al, 1980; Kaneda et al, 1989; Kato et al, 1991); посредством бомбардировки микрочастицами (Заявки PCT №№ WO 94/09699 и 95/06128; патенты США №№ 5610042; 5322783 5563055, 5550318, 5538877 и 5538880, включенные в настоящий документ в качестве ссылки); посредством перемешивания с волокнами карбида кремния (Kaeppler et al, 1990; патенты США №№ 5302523 и 5464765, включенные в настоящий документ в качестве ссылки); посредством трансформации с применением Agrobacterium (патенты США №№ 5591616 и 5563055, включенные в настоящий документ в качестве ссылки); посредством трансформации протопластов с применением PEG (Omirulleh et al, 1993; патенты США №№ 4684611 и 4952500, включенные в настоящий документ в качестве ссылки); или посредством захвата ДНК с применением высушивания/ингибирования (Potrykus et al, 1985). При применении способов, таких как эти, органеллу(ы), клетка(и), ткань(и) или организм(ы) можно изменять временно или стабильно.
9. Аллельспецифичные антитела
Полипептиды BRAF, содержащие одну или несколько обеспечивающих резистентность мутаций, описываемых в настоящем документе, можно определять с применением антител, которые специфично распознают мутантные полипептиды BRAF, но не распознают полипептиды BRAF дикого типа. Антитела можно индуцировать против одной или нескольких аллельных форм полипептидов BRAF, содержащих одну или несколько обеспечивающих резистентность мутаций. Хорошо известны способы применения специфичного белка или олигопептида в качестве антигена выявления антител, которые специфично распознают эпитопы на пептидах или белках. В одном из вариантов осуществления последовательность ДНК необходимой аллельной формы рассматриваемого гена можно клонировать посредством встраивания в подходящий экспрессирующий вектор и транслировать в белок в прокариотической или эукариотической клетке-хозяине. Белок можно восстанавливать и применять в качестве антигена для выявления выработки специфичных антител. В другом варианте осуществления ДНК необходимой аллельной формы рассматриваемого гена амплифицируют посредством ПЦР и затем транслируют in vitro в белок, который применяют в качестве антигена для выявления выработки специфических антител. Третий вариант осуществления включает применение последовательности ДНК альтернативных аллелей в качестве основы для получения синтетических пептидов, представляющих аминокислотную последовательность аллелей, для применения в качестве антигена для выявления выработки специфичных антител.
Антитела можно получать как стандартными способами получения моноклональных антител, так и с применением рекомбинантных экспрессирующих систем. См. Abbas, Lichtman and Pober, Cellular and Molecular Immunology, W. B. Saunders Co. (1991). Термин "антитела" включает интактные молекулы антител, а также фрагменты антител или их производные, такие как Fab и F(ab')2, которые способны к специфичному связыванию с антигеном. Антитела, полученные таким способом, предпочтительно связывают только мутантный белок, полученный в аллельной форме, которую использовали в качестве антигена при получении антитела. Способы получения аллель-специфичных антител также описаны в патенте США № 6200754 и патенте США № 6054273, в полном объеме включенных в настоящий документ в качестве ссылки.
Такие специфичные для мутантных полипептидов BRAF антитела можно использовать для обнаружения наличия полипептида BRAF, содержащего одну или несколько обеспечивающих резистентность мутаций, в образце, например, в образце для анализа, образце клетки, клеточном экстракте, биологическом образце или образце, полученном от пациента, с применением известных в данной области способов. Эти способы включают, например, Вестерн-блоттинг, иммуногистохимию, непрямую иммунофлуоресценцию и применение микрочипов с антителами. Антитела, специфически распознающие мутантные полипептиды BRAF, также могут представлять собой ингибиторы BRAF второго поколения. Способность антитела, специфически распознающего мутантный полипептид BRAF, ингибировать биологическую активность мутантного полипептида BRAF, можно определять с применением способов для определения ингибиторов BRAF второго поколения, описываемых в настоящем документе.
IX. Применение в диагностике и скринировании
Следующие способы можно использовать для определения наличия или отсутствия ранее указанных обеспечивающих резистентность мутаций в нуклеиновой кислоте BRAF или молекуле полипептида BRAF в образце, полученном от пациента. Обнаружение мутантной нуклеиновой кислоты BRAF или молекулы полипептида BRAF в образце, полученном от пациента, можно применять для получения характеристик заболевания или состояния пациента. Например, для пациента с заболеванием, ассоциированном с нарушениями экспрессии или активации BRAF (например, со злокачественной опухолью), обнаружение мутантной нуклеиновой кислоты BRAF или молекулы полипептида BRAF в образце (например, в образце, содержащем клетку злокачественной опухоли), полученном от пациента, указывает на то, что пациент характеризуется относительно высоким риском рецидива или отсутствия ответа на лечение ингибитором BRAF. В одном из вариантов осуществления обнаружение нуклеиновой кислоты BRAF или молекулы полипептида BRAF, содержащей одну или несколько мутаций, описываемых в настоящем документе, в содержащем клетку злокачественной опухоли образце, полученном от пациента, указывает на то, что пациент характеризуется относительно высоким риском рецидива или отсутствия ответа на лечение ингибитором BRAF первого поколения, например, RAF-265.
Пациента с обеспечивающей резистентность к BRAF мутацией, описываемой в настоящем документе, характеризуется более высоким риском рецидива при лечении ингибитором BRAF первого поколения, чем пациента, у которого обеспечивающая резистентность к BRAF мутация не обнаружена. Таким образом, как применяют в настоящем документе, термин "относительно высокий риск рецидива" рассматривают в сравнении с пациентом, у которого не обнаруживают мутантную молекулу нуклеиновой кислоты или полипептид BRAF. Таким образом, пациента, который характеризуется "относительно высоким риском рецидива", представляет собой пациента с более высоким риском рецидива по сравнению с пациентом, у которого не обнаруживают мутантную молекулу нуклеиновой кислоты или полипептида BRAF.
В определенных вариантах осуществления обнаружение полипептида BRAF или нуклеиновой кислоты, кодирующей полипептид BRAF, содержащих мутацию одного или нескольких следующих остатков, указывает на то, что пациент характеризуется относительно высоким риском рецидива или отсутствием ответа на лечение ингибитором BRAF первого поколения, например, RAF-265: A29, H72, S113, S124, P162, C194, L227, P231, C251, V291, Q329, K483, L485, T521, V528, D587, P655, S657, S683, P686, C696, L697, P722, F738 и C748. В иллюстративных вариантах осуществления обнаружение полипептида BRAF или нуклеиновой кислоты, кодирующей полипептид BRAF, содержащих одну или несколько следующих обеспечивающих резистентность мутаций, указывает на то, что пациент характеризуется относительно высоким риском рецидива или отсутствием ответа на лечение ингибитором BRAF, например, RAF-265: A29V, H72N, S113I, S124F, P162H, C194*, L227F, P231T, C251F, V291F, Q329K, K483E, L485F, T521K, V528F, D587E, P655T, S657*, S683R, P686Q, P686T, C696*, L697I, P722T, F738L или C748F.
Определение наличия или отсутствия мутантной молекулы нуклеиновой кислоты или полипептида BRAF в образце, полученном от пациента, также позволяет выбирать оптимальную схему лечения для пациента или определять пациента в определенную лечебную группу. В одном из вариантов осуществления схему лечения, включающую лечение ингибитором BRAF первого поколения, выбирают для пациента, у которого полученный от него образец, содержащий злокачественную клетку, не содержит мутантных молекул нуклеиновой кислоты или полипептида BRAF. Такому пациенту можно назначать схему лечения, включающую ингибитор BRAF первого поколения. Ингибитор BRAF можно доставлять такому пациенту в стандартной дозе со стандартными интервалами дозирования.
В другом варианте осуществления схему лечения, включающую лечение без ингибитора BRAF, выбирают для пациента, у которого полученный от него образец, содержащий злокачественную клетку, содержит мутантную молекулу нуклеиновой кислоты или полипептида BRAF, например, молекулу нуклеиновой кислоты или полипептида BRAF, содержащую одну или несколько мутаций, описываемых в настоящем документе. Такому пациенту можно назначать схему лечения, не включающую ингибитор BRAF.
В другом варианте осуществления схему лечения, включающую лечение увеличивающимися дозами ингибитора BRAF первого поколения, выбирают для пациента, у которого полученный от него образец, содержащий злокачественную клетку, содержит мутантную молекулу нуклеиновой кислоты или полипептида BRAF. Такому пациенту можно назначать схему лечения, включающую увеличивающиеся дозы ингибитора BRAF первого поколения. В иллюстративном аспекте представленных выше вариантов осуществления ингибитор BRAF первого поколения представляет собой RAF-265.
В альтернативном варианте осуществления обнаружение мутантной молекулы нуклеиновой кислоты или полипептида BRAF в полученном от пациента образце, содержащем клетку злокачественной опухоли, указывает на то, что пациент способен отвечать на лечение ингибитором BRAF второго поколения. Таким образом, в одном из вариантов осуществления схему лечения, включающую лечение ингибитором BRAF второго поколения, выбирают для пациента, у которого полученный от него образец, содержащий злокачественную клетку, содержит мутантную молекулу нуклеиновой кислоты или полипептида BRAF. Такому пациенту можно назначать схему лечения, содержащую ингибитор BRAF второго поколения.
В конкретных аспектах представленных выше вариантов осуществления мутантный полипептид BRAF содержит мутацию одного или нескольких следующих остатков: A29, H72, S113, S124, P162, C194, L227, P231, C251, V291, Q329, K483, L485, T521, V528, D587, P655, S657, S683, P686, C696, L697, P722, F738 и C748. В иллюстративных вариантах осуществления мутантный полипептид BRAF содержит одну или несколько следующих мутаций: A29V, H72N, S113I, S124F, P162H, C194*, L227F, P231T, C251F, V291F, Q329K, K483E, L485F, T521K, V528F, D587E, P655T, S657*, S683R, P686Q, P686T, С696*, L697I, P722T, F738L и C748F. В предпочтительном варианте осуществления мутантная молекула нуклеиновой кислоты BRAF кодирует мутантный полипептид BRAF, содержащий мутации одного или нескольких указанных выше аминокислотных остатков.
Таким образом, в одном из вариантов осуществления изобретение относится к способу оптимизации лечения субъекта со злокачественной опухолью, включающему выделение нуклеиновой кислоты из клеток злокачественной опухоли; и секвенирование молекулы нуклеиновой кислоты, кодирующей полипептид BRAF; где присутствие нуклеотидов, изменяющих природу аминокислотных остатков одной или нескольких аминокислот кодируемого полипептида BRAF относительно аминокислоты в одной или нескольких позициях, выбранных из группы, состоящей из A29, H72, S113, S124, P162, C194, L227, P231, C251, V291, Q329, K483, L485, T521, V528, D587, P655, S657, S683, P686, C696, L697, P722, F738 и С748 в SEQ ID NO: 2 или SEQ ID NO: 4, указывает на необходимость лечения субъекта ингибитором MEK или ингибитором RAF второго поколения.
В другом варианте осуществления изобретение относится к
способу оптимизации лечения субъекта со злокачественной опухолью, включающему выделение нуклеиновой кислоты из клеток злокачественной опухоли; и проведение ПЦР образца и определение нуклеотидной последовательности молекулы нуклеиновой кислоты, кодирующей полипептид BRAF; где присутствие нуклеотидов, изменяющих природу аминокислотных остатков одной или нескольких аминокислот кодируемого полипептида BRAF относительно аминокислоты в одной или нескольких позициях, выбранных из группы, состоящей из A29, H72, S113, S124, P162, C194, L227, P231, C251, V291, Q329, K483, L485, T521, V528, D587, P655, S657, S683, P686, C696, L697, P722, F738 и C748 в SEQ ID NO: 2 или SEQ ID NO: 4, указывает на необходимость лечения субъекта ингибитором MEK или ингибитором RAF второго поколения.
В другом варианте осуществления изобретение относится к способу лечения субъекта со злокачественной опухолью, включающему выделение нуклеиновой кислоты из клеток со злокачественной опухолью; секвенирование молекулы нуклеиновой кислоты, кодирующей полипептид BRAF; и введение ингибитора MEK или ингибитора BRAF второго поколения субъекту, если молекула нуклеиновой кислоты содержит нуклеотиды, которые изменяют природу аминокислотного остатка одной или нескольких аминокислот кодируемого полипептида BRAF относительно аминокислоты в одной или нескольких позициях, выбранных из группы, состоящей из A29, H72, S113, S124, P162, C194, L227, P231, C251, V291, Q329, K483, L485, T521, V528, D587, P655, S657, S683, P686, C696, L697, P722, F738 и C748 в SEQ ID NO: 2 или SEQ ID NO: 4.
В другом варианте осуществления изобретение относится к
способу лечения субъекта со злокачественной опухолью, включающему выделение нуклеиновой кислоты из клеток злокачественной опухоли; проведение ПЦР образца и определение нуклеотидной последовательности молекулы нуклеиновой кислоты, кодирующей полипептид BRAF; и введение ингибитора MEK или ингибитора RAF второго поколения субъекту, если молекула нуклеиновой кислоты содержит нуклеотиды, которые изменяют природу аминокислотного остатка одной или нескольких аминокислот кодируемого полипептида BRAF относительно аминокислоты в одной или нескольких позициях, выбранных из группы, состоящей из A29, H72, S113, S124, P162, C194, L227, P231, C251, V291, Q329, K483, L485, T521, V528, D587, P655, S657, S683, P686, C696, L697, P722, F738 и C748 в SEQ ID NO: 2 или SEQ ID NO: 4.
В другом варианте осуществления изобретение относится к способу определения субъекта со злокачественной опухолью, который способен отвечать на лечение ингибитором MEK или ингибитором RAF второго поколения, включающий анализ образца нуклеиновой кислоты, полученного из злокачественной опухоли, на наличие одной или нескольких мутаций в молекуле нуклеиновой кислоты, кодирующей полипептид BRAF, которые изменяют природу одного или нескольких аминокислотных остатков кодируемого полипептида BRAF относительно аминокислоты в одной или нескольких позициях, выбранных из группы, состоящей из A29, H72, S113, S124, P162, C194, L227, P231, C251, V291, Q329, K483, L485, T521, V528, D587, P655, S657, S683, P686, C696, L697, P722, F738 и C748 в SEQ ID NO: 2 или SEQ ID NO: 4; и соотнесение наличия одной или несколько мутаций в молекуле нуклеиновой
кислоты, кодирующей полипептид BRAF, с субъектом, который способен отвечать на лечение ингибитором MEK или ингибитором RAF второго поколения.
В другом варианте осуществления изобретение относится к способу определения субъекта со злокачественной опухолью, который способен отвечать на лечение ингибитором MEK или ингибитором RAF второго поколения, включающий анализ образца нуклеиновой кислоты, полученного из злокачественной опухоли, на наличие одной или нескольких мутаций в молекуле нуклеиновой кислоты, кодирующей полипептид BRAF, которые изменяют природу одного или нескольких аминокислотных остатков кодируемого полипептида BRAF относительно аминокислоты в одной или нескольких позициях, выбранных из группы, состоящей из A29, H72, S113, S124, P162, C194, L227, P231, C251, V291, Q329, K483, L485, T521, V528, D587, P655, S657, S683, P686, C696, L697, P722, F738 и C748 в SEQ ID NO: 2 или SEQ ID NO: 4; и соотнесение наличия одной или несколько мутаций в молекуле нуклеиновой кислоты, кодирующей полипептид BRAF, с субъектом, который способен отвечать на лечение ингибитором MEK или ингибитором RAF второго поколения.
В различных вариантах осуществления приведенных выше аспектов ингибитор MEK представляет собой СТ-1040, AZD6244, PD318088, PD98059, PD334581, RDEA119, 6-метокси-7-(3-морфолин-4-ил-пропокси)-4-(4-фенокси-фениламино)-хинолин-3-карбонитрил или 4-[3-хлор-4-(1-метил-1Н-имидазол-2-илсулфанил)-фениламино]-6-метокси-7-(3-морфолин-4-илпропокси)-хинолин-3-карбонитрил или их сочетания.
В другом варианте осуществления изобретение относится к способу определения субъекта со злокачественной опухолью как характеризующегося высоким риском рецидива при лечении ингибитором BRAF первого поколения, включающему выделение нуклеиновой кислоты из клеток злокачественной опухоли; и секвенирование молекулы нуклеиновой кислоты, кодирующей полипептид BRAF; где присутствие нуклеотидов, изменяющих природу аминокислотных остатков одной или нескольких аминокислот кодируемого полипептида BRAF относительно аминокислоты в одной или нескольких позициях, выбранных из группы, состоящей из A29, H72, S113, S124, P162, C194, L227, P231, C251, V291, Q329, K483, L485, T521, V528, D587, P655, S657, S683, P686, C696, L697, P722, F738 и C74 8 в SEQ ID NO: 2 или SEQ ID NO: 4, указывает на то, что субъект характеризуется высоким риском рецидива при лечении ингибитором BRAF первого поколения.
В другом варианте осуществления изобретение относится к способу определения субъекта со злокачественной опухолью как не отвечающего на лечение ингибитором BRAF первого поколения, включающему выделение нуклеиновой кислоты из клеток злокачественной опухоли; и секвенирование молекулы нуклеиновой кислоты, кодирующей полипептид BRAF; где присутствие нуклеотидов, изменяющих природу аминокислотных остатков одной или нескольких аминокислот кодируемого полипептида BRAF относительно аминокислоты в одной или нескольких позициях, выбранных из группы, состоящей из A29, H72, S113, S124, P162, C194, L227, P231, C251, V291, Q329, K483, L485, T521, V528, D587, P655, S657, S683, P686, C696, L697, P722, F738, и C748 в
SEQ ID NO: 2 или SEQ ID NO: 4, указывает на то, что субъект не отвечает на лечение ингибитором BRAF первого поколения.
В различных вариантах осуществления приведенных выше аспектов ингибитор RAF представляет собой RAF265 или PLX 4720. В некоторых вариантах осуществления приведенных выше аспектов злокачественная опухоль выбрана из группы, состоящей из лейкозов, лимфом, миелом, карцином, метастатических карцином, сарком, аденом, злокачественных опухолей нервной системы и злокачественных опухолей мочеполовой системы. В других вариантах осуществления злокачественная опухоль представляет собой меланому.
X. Способы лечения
В различных вариантах осуществления изобретение относится к способам лечения субъекта со злокачественной опухолью. В иллюстративных вариантах осуществления субъект страдает от злокачественной опухоли, содержащей полипептид BRAF с одной или несколькими мутациями, например, одной или несколькими обеспечивающими резистентность мутациями, описываемыми в настоящем документе. В связанных вариантах осуществления субъект страдает от злокачественной опухоли, содержащей молекулу нуклеиновой кислоты, которая кодирует полипептид BRAF и содержит одну или несколько мутаций, например, одну или несколько обеспечивающих резистентность мутаций, описываемых в настоящем документе. Термин "лечить" и "лечение" включает облегчение или смягчение, по меньшей мере, одного симптома, ассоциированного с состоянием, подлежащим лечению. Например, лечение может представлять собой облегчение одного или нескольких симптомов
нарушения или полное устранение нарушения, такого как злокачественная опухоль. Так же, терапевтически эффективное количество соединения представляет собой количество, достаточное для облегчения или смягчения, по меньшей мере, одного симптома, ассоциированного с состоянием, подлежащим лечению.
Таким образом, в некоторых вариантах осуществления изобретение относится к способам лечения субъекта со злокачественной опухолью, включающему введение субъекту ингибитора RAF второго поколения. В других вариантах осуществления изобретение относится к способам лечения субъекта со злокачественной опухолью, включающему введение субъекту ингибитора MEK. В иллюстративных вариантах осуществления приведенных выше аспектов в злокачественной опухоли обнаруживают одну или несколько мутаций полипептида BRAF или молекулы нуклеиновой кислоты, кодирующей полипептид BRAF, которые обеспечивают резистентность к одному или нескольким ингибиторам BRAF, как описано в настоящем документе. Например, изобретение относится к способу лечения злокачественной опухоли, содержащему замены аминокислот в одной или нескольких следующих позициях BRAF, необязательно в дополнение к мутации BRAF в V600E: A29, H72, S113, S124, P162, C194, L227, P231, C251, V291, Q329, K483, L485, T521, V528, D587, P655, S657, S683, P686, C696, L697, P722, F738 и C748 в SEQ ID NO: 2 или SEQ ID NO: 4, где указанный способ включает введение субъекту терапевтически эффективного количества ингибитора BRAF второго поколения. Изобретение дополнительно относится к способу лечения злокачественной опухоли, содержащей замены аминокислот в одной или нескольких
следующих позициях BRAF, необязательно в дополнение к мутации BRAF в V600E: A29, H72, S113, S124, P162, C194, L227, P231, C251, V291, Q329, K483, L485, T521, V528, D587, P655, S657, S683, P686, C696, L697, P722, F738 и C748 в SEQ ID NO: 2 или SEQ ID NO: 4, где указанный способ включает введение субъекту терапевтически эффективного количества ингибитора MEK. Поскольку MEK активируется в нижележащем участке сигнального пути по сравнению с RAF, ингибитор MEK может эффективно ингибировать сигнал RAF в клетках, содержащих одну или несколько обеспечивающих резистентность мутаций RAF, описываемых в настоящем документе.
Ингибиторы MEK, подходящие для применения по изобретению, включают в качестве неограничивающих примеров 1-1040, AZD6244, PD318088, PD98059, PD334581, RDEA119, 6-метокси-7-(3-морфолин-4-ил-пропокси)-4-(4-фенокси-фениламино)-хинолин-3-карбонитрил, 4-[3-хлор-4-(1-метил-1Н-имидазол-2-илсулфанил)-фениламино]-6-метокси-7-(3-морфолин-4-ил-пропокси)-хинолин-3-карбонитрил и соединение Roche RG7420.
Дополнительные ингибиторы MEK, подходящие для применения по изобретению, включают в качестве неограничивающих примеров соединения, описанные в WO 2008076415, US 20080166359, WO 2008067481, WO 2008055236, US 20080188453, US 20080058340, WO 2007014011, WO 2008024724, US 20080081821, WO 2008024725, US 20080085886, WO 2008021389, WO 2007123939, US 20070287709, WO 2007123936, US 20070287737, US 20070244164, WO 2007121481, US 20070238710, WO 2007121269, WO 2007096259, US 20070197617, WO 2007071951, EP 1966155, IN 2008MN01163, WO 2007044084, AU 2006299902, CA 2608201, EP 1922307, EP 1967516, MX 200714540, IN 2007DN09015, NO 2007006412, KR 2008019236, WO 2007044515, AU 2006302415, CA 2622755, EP 1934174, IN 2008DN02771, KR 2008050601, WO 2007025090, US 20070049591, WO 2007014011, AU 2006272837, CA 2618218, EP 1912636, US 20080058340, MX 200802114, KR 2008068637, US 20060194802, WO 2006133417, WO 2006058752, AU 2005311451, CA 2586796, EP 1828184, JP 2008521858, US 20070299103, NO 2007003393, WO 2006056427, AU 2005308956, CA 2587178, EP 1838675, JP 2008520615, NO 2007003259, US 20070293544, WO 2006045514, AU 2005298932, CA 2582247, EP 1802579, CN 101065358, JP 2008517024, IN 2007DN02762, MX 200704781, KR 2007067727, NO 2007002595, JP 2006083133, WO 2006029862, US 20060063814, US 7371869, AU 2005284293, CA 2579130, EP 1791837, CN 101023079, JP 2008513397, BR 2005015371, KR 2007043895, MX 200703166, IN 2007CN01145, WO 2006024034, AU 2005276974, CA 2578283, US 20060079526, EP 1799656, CN 101044125, JP 2008510839, MX 200702208, IN 2007DN02041, WO 2006018188, AU 2005274390, CA 2576599, EP 1781649, CN 101006085, JP 2008509950, BR 2005014515, AT 404556, US 20060041146, MX 200701846, IN 2007CN00695, KR 2007034635, WO 2006011466, AU 2005265769, CA 2575232, EP 1780197, BR 2005013750, JP 4090070, MX 200700736, CN 101124199, KR 2007041752, IN 2007DN01319, WO 2005121142, AU 2005252110, CA 2569850, US 20060014768, US 7378423, EP 1761528, CN 101006086, AT 383360, BR 2005011967, JP 2008501631, EP 1894932, ES 2297723,
MX 2006PA14478, NO 2007000155, IN 2007CN00102, KR 2007034581, HK 1107084, JP 2008201788, US 20050256123, US 20050250782, US 20070112038, US 20050187247, WO 2005082891, WO 2005051302, AU 2004293019, CA 2546353, US 20050130943, US 20050130976, US 20050153942, EP 1689233, JP 2007511615, WO 2005051301 AU 2004293018, CA 2545660, US 20050130943, US 20050130976, US 20050153942, EP 1682138, BR 2004016692, CN 1905873, JP 2007511614, MX 2006PA05657, IN 2006DN03183, NO 2006002692, KR 2007026343, WO 2005028426, EP 1674452, US 20070105859, US 20050054701, US 7230099, US 20050049419, US 7144907, AU 2004270699, CA 2537321, WO 2005023759, EP 1673339, BR 2004014111, CN 1874769, JP 2007504241, JP 4131741, US 20060030610, MX 2006PA02466, NO 2006001506, US 20050049419, US 7144907, US 20050054701, US 7230099, AU 2004270699, CA 2537321, WO 2005023759, EP 1673339, BR 2004014111, CN 1874769, JP 2007504241, JP 4131741 US 20060030610, MX 2006PA02466, IN 2006DN01661, NO 2006001506, US 20060189808, US 20060189649, US 7271178, US 20060189668, US 20050049276, WO 2005009975, CA 2532067, EP 1651214, BR 2004012851, JP 2006528621, US 20050026970, US 7160915, MX 2006PA00921, WO 2005007616, US 20050059710, WO 2005000818, US 20050026964, US 7273877, WO 2004056789, US 20050004186, CA 2509405, AU 2003286306, EP 1578736, BR 2003017254, JP 2006516967, MX 2005PA06803, WO 2004044219, AU 2003291268, WO 2004041811, AU 2003278369, EP 1575943, JP 2006508944, US 20050282856, US 7173136, US 20070191346, WO 2004041185, AU 2003287366, US 20060270643, WO 2004030620, AU 2003275282, US 20040092514, US 7232826, EP 1545529, US 20040039037, US 6989451, WO 2003077855, CA 2478534, AU 2003220202, US 20030216460, EP 1482944, CN 1652792, JP 2005526076, RU 2300528, BR 2003006016, MX 2004PA08894, US 20060106225, WO 2003062191, CA 2473545, EP 1467968, BR 2003007060, JP 2005515253, TW 592692, US 20040006245, US 6891066, MX 2004PA05527, US 20050137263, US 7078438, WO 2003062189, CA 2472367, EP 1467965, BR 2003007071, JP 2005515251, US 20030232889, US 6770778, MX 2004PA05528, WO 2003047585, AU 2002347360, WO 2003047583, AU 2002365665, WO 2003047523, CA 2466762, AU 2002365899, US 20030125359, US 7307071, JP 2005526008, EP 1578346, WO 2003035626, CA 2463101, AU 2002359291, EP 1438295, JP 2005508972, US 20050054706, US 7253199, US 20070293555, AU 2008202731, US 6506798, WO 9901421, WO 2000041994, US 6310060, WO 2002006213, CA 2416685, AU 2001073498, BR 2001012584, HU 2003002781, JP 2004504294, JP 3811775, EE 200300030, NZ 524120, AU 2001273498, IN 2003MN00028, NO 2003000249, KR 773621, MX 2003PA00591, HR 2003000083, BG 107564, ZA 2003000348, US 20040054172, US 6960614, HK 1055943, US 20050176820, US 7411001, WO 2000042029, JP 2000204077, CA 2355374, EP 1144394, BR 9916896, TR 200102029, HU 2001005092, JP 2002534515, EE 200100374, NZ 513432, AT 302761, ES 2249060, ZA 2001005219, MX 2001PA06659, IN 2001MN00785, NO 2001003451, HR 2001000525, BG 105801, US 6545030, HK 1042488, US 20030004193, WO 2000042022, JP 2000204079, CA 2355470, EP 1144385, BR 9916904, TR 200102030, HU 2001005113, EE 200100373, JP 2002534510, NZ 513433, AT 302193, ES 2247859, MX 2001PA06568, ZA 2001005224, IN 2001MN00786, US 6469004, NO 2001003452, HR 2001000524, BG 105800, WO 2000042003, JP 2000212157, CA 2349832, EP 1144371, BR 9916885, AT 309205, ES 2252996, MX 2001PA04332, US 6440966, US 20030092748, US 6750217, WO 2000042002, JP 2000204075, CA 2349467, EP 1144372, BR 9916894, JP 2002534497, AT 311363, ES 2251851, MX 2001PA04331, US 6455582, US 20030045521, US 6835749, WO 2000037141, CA 2352326, BR 9916839, EP 1140291, TR 200101871, HU 2001004844, JP 2002532570, EE 200100339, NZ 512859, AT 310567, ES2253928, ZA 2001004277, MX 2001PA05476, IN 2001MN00673, NO 2001003099, HR 2001000473, BG 105715, US 20040171632, GB 2323845, WO 9901426, CA 2290506, AU 9882627, AU 757046, EP 993439, BR 9810366, NZ 501276, HU 2000003731, JP 2002511092, AT 277895, IL 132840, PT 993439, ES 2229515, TW 396149, ZA 9805728, MX 9910649, NO 9906491, NO 315271, US 20030078428, US 6821963, US 20050049429, US 20060052608, US 7169816, WO 9901421, CA 2290509, AU 9882626, AU 756586, EP 993437, BR 9810385, JP 2002509536, NZ 501277, AT 344791, ES 2274572, TW 221831, ZA 9805726, MX 9910556, US 6310060, US 6506798, US 20020022647, US 6492363, US 20030149015, и US 7019033, содержание которых в полном объеме включено в настоящий документ в качестве ссылки.
Дозы, составы и способы введения приведенных выше соединений известны в данной области. Иллюстративные способы введения включают в качестве неограничивающих примеров пероральное, подкожное, внутривенное или парентеральное введение. Жидкие лекарственные формы для перорального введения могут включать в качестве неограничивающих примеров фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к активным соединениям жидкие лекарственные формы могут содержать инертные разбавители, общеупотребительные в данной области, так как, например, вода или другие растворители, солюбилизаторы и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, хлопковое, арахисовое, кукурузное масла, масло зародышей кукурузы, оливковое, касторовое и сезамовое масла), кремофор, глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные эфиры сорбитана и жирных кислот и их смеси. Помимо инертных разбавителей, пероральные композиции могут также включать вспомогательные средства, такие как увлажнители, эмульгирующие и суспендирующие средства, подсластители, вкусовые добавки и ароматизирующие добавки. Твердые лекарственные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых лекарственных формах активное соединение смешивают с, по меньшей мере, одним инертным фармацевтически приемлемым эксципиентом или носителем, таким как цитрат натрия или дифосфат кальция и/или a) наполнители или разбавители, такие как крахмалы, лактоза, сахароза, глюкоза, маннит и кремниевая кислота, b) связывающие средства, такие как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинил пирролидинон, сахароза и гуммиарабик, c) увлажнители, такие как глицерин, d) дезинтегрирующие средства, такие как агар-агар, карбонат кальция, картофельный или маниоковый крахмал, альгиновая кислота, некоторые силикаты и карбонат натрия, e) замедляющие растворение средства, такие как парафин, f) ускорители впитывания, такие как соединения четвертичного аммония, г) увлажнители, такие как, например, цетиловый спирт и глицерина моностеарат, h) абсорбенты, такие как каолиновая и бентонитовая глина, и i) смазочные средства, такие как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смеси, и (j) ускорители растворения, такие как полиэтиленгликоли с высокой молекулярной массой или поливинилпирролидон в смесях или в форме твердых дисперсий. В случае капсул, таблеток и пилюль лекарственная форма может также содержать буферные средства.
Поскольку мутации в BRAF значительно усиливают резистентность у ряда типов злокачественной опухоли, способы и ингибиторы BRAF второго поколения, описываемые в настоящем документе, применяют для лечения широкого спектра злокачественных опухолей, включая солидные опухоли и гематологические злокачественные новообразования. Примеры таких опухолей включают в качестве неограничивающих примеров лейкозы, лимфомы, миеломы, карциномы, метастатические карциномы, саркомы, аденомы, злокачественные опухоли нервной системы и злокачественные опухоли мочеполовой системы. В иллюстративных вариантах осуществления приведенные выше способы применяют в лечении взрослых и детей с острым лимфобластным лейкозом, острым миелолейкозом, адренокортикальной карциномой, злокачественными опухолями, ассоциированными со СПИДом, раком анального канала, злокачественной опухолью аппендикса, астроцитомой, базально-клеточной карциномой, злокачественной опухолью желчного протока, раком мочевого пузыря, злокачественной опухолью кости, остеосаркомой, фиброзной гистиоцитомой, злокачественной опухолью головного мозга, глиомой ствола мозга, мозжечковой астроцитомой, злокачественной глиомой, эпендиномой, медуллобластомой, супратенториальной примитивной нейроэктодермальной опухолью, гипоталамической глиомой, раком молочной железы, раком молочной железы у мужчин, бронхиальной аденомой, лимфомой Беркитта, карциноидной опухолью, карциномой неизвестного происхождения, лимфомой центральной нервной системы, мозжечковой астроцитомой злокачественной глиомой, раком шейки матки, детскими злокачественными опухолями, хроническим лимфоцитарным лейкозом, хроническим миелогенным лейкозом, хроническими миелопролиферативными нарушениями, колоректальным раком, T-клеточной лимфомой кожи, эндометриальной злокачественной опухолью, эпендиномой, злокачественной опухолью пищевода, семейными опухолями Юинга, экстракраниальной герминогенной опухолью, внегонадной герминогенной опухолью, злокачественной опухолью внепеченочных желчных протоков, внутриглазной меланомой, ретинобластомой, злокачественной опухолью желчного пузыря, раком желудка, желудочно-кишечной стромальной опухолью, экстракраниальной герминогенной опухолью, внегонадной герминогенной опухолью, овариальной герминогенной опухолью, гестационной трофобластической опухолью, глиомой, волосатоклеточным лейкозом, раком головы и шеи, печеночно-клеточной злокачественной опухолью, лимфомой Ходжкина, неходжкинской лимфомой, подглоточной злокачественной опухолью, глиомой гипоталамуса зрительных путей, инсулиномой, саркомой Капоши, раком почки, почечноклеточной злокачественной опухолью, ларингеальной злокачественной опухолью, злокачественной опухолью губы и ротовой полости, мелкоклеточным раком легких, немелкоклеточным раком легких, лимфомой первичной центральной нервной системы, макроглобулинемией Вальденстрема, фиброзной гистиоцитомой, медуллобластомой, меланомой, карциномой клеток Меркеля, злокачественной мезотелиомой, плоскоклеточной злокачественной опухолью шеи, множественными эндокринными неоплазиями, множественной миеломой, фунгоидным микозом, миелодисплазией, миелопролиферативными нарушениями, хроническими миелопролиферативными нарушениями, злокачественной опухолью носовой полости и околоносовых пазух, носоглоточной злокачественной опухолью, нейробластомой, орофарингеальной злокачественной опухолью, раком яичников, раком поджелудочной железы, раком паращитовидной железы, злокачественной опухолью полового члена, фарингеальной злокачественной опухолью, феохромоцитомой, пинеобластомой и супратенториальными примитивными нейроэктодермальными опухолями, злокачественной опухолью гипофиза, неоплазиями плазматических клеток, плевролегочной бластомой, раком предстательной железы, раком прямой кишки, рабдомиосаркомой, злокачественной опухолью слюнной железы, саркомой мягких тканей, саркомой матки, синдромом Сезари, непигментным раком кожи, злокачественной опухолью тонкого кишечника, плоскоклеточной карциномой, плоскоклеточной злокачественной опухолью шеи, супратенториальными примитивными нейроэктодермальными опухолями, раком яичка, злокачественной опухолью горла, тимомой и карциномой тимуса, раком щитовидной железы, переходно-клеточным раком, трофобластической болезнью, злокачественной опухолью мочеиспускательного канала, раком матки, саркомой матки, вагинальной злокачественной опухолью, влагалищной злокачественной опухолью и опухолью Вильмса.
XL. Наборы
Различные наборы можно собирать как часть настоящего изобретения. Набор может содержать компоненты для определения мутаций в BRAF для оценки у конкретного пациента риска развития резистентности к лечению с применением ингибитора BRAF и, таким образом, для определения необходимости назначения пациенту альтернативного способа лечения. Такие наборы могут содержать реагенты, позволяющие определять мутации, такие как наборы праймеров для оценки мутаций, коррелирующих со значимыми фенотипическими проявлениями в отношении резистентности к ингибитору BRAF (например, RAF-265). Полагают, что праймеры (или пары праймеров), которые являются комплементарными или идентичными всей или части последовательности SEQ ID NO: 1, например, могут быть частью набора. В предпочтительных вариантах осуществления праймеры можно использовать для специфичного определения или амплификации молекулы нуклеиновой кислоты, кодирующей мутантный полипептид BRAF, содержащий мутацию одного или нескольких следующих аминокислотных остатков: A29, H72, S113, S124, P162, C194, L227, P231, C251, V291, Q329, K483, L485, T521, V528, D587, P655, S657, S683, P686, C696, L697, P722, F738 и C748. В иллюстративных вариантах осуществления праймеры специфически определяют или амплифицируют молекулу нуклеиновой кислоты, кодирующую полипептид BRAF, содержащий одну или несколько следующих мутации: A29V, H72N, S113I, S124F, P162H, C194*, L227F, P231T, C251F, V291F, Q329K, K483E, L485F,
T521K, V528F, D587E, P655T, S657*, S683R, P686Q, P686T, C696*, L697I, P722T, F738L и C748F. В других вариантах осуществления наборы содержат инструкции по применению праймеров, комплементарных или идентичных всей или части последовательность SEQ ID NO: 1, для амплификации нуклеотидной последовательности, кодирующей полипептид BRAF.
В других вариантах осуществления наборы содержат композиции для определения мутации, содержащие полипептид BRAF, такие как антитело, которое специфически распознает мутантный полипептид BRAF, содержащий одну или несколько обеспечивающих резистентность мутаций. Иллюстративные полипептиды включают мутантный полипептид BRAF, содержащий мутацию одного или нескольких следующих аминокислотных остатков: A29, H72, S113, S124, P162, С194, L227, Р231, С251, V291, Q329, K483, L485, Т521, V528, D587, Р655, S657, S683, Р686, С696, L697, Р722, F738 и С748. В других вариантах осуществления мутантный полипептид BRAF содержит одну или несколько следующих мутаций: A29V, H72N, S113I, S124F, P162H, С194*, L227F, Р231Т, C251F, V291F, Q329K, K483E, L485F, T521K, V528F, D587E, Р655Т, S657*, S683R, P686Q, Р686Т, С696*, L697I, Р722Т, F738L и C748F.
Все необходимые материалы и реагенты, нужные для оценки мутаций BRAF данным способом и указанные выше, можно также объединять в набор. Если компоненты набора предоставляют в одном или нескольких жидких растворах, жидкий раствор предпочтительно представляет собой водный раствор, причем стерильный водный раствор является особенно предпочтительным.
Компоненты набора можно также предоставлять в сухих или лиофилизированных формах. Если реагенты или компоненты представляют в сухой форме, растворение, как правило, проводят посредством добавления подходящего растворителя. Полагают, что растворитель также можно предоставлять в другом контейнере.
Наборы по настоящему изобретению также, как правило, включают средства для наполнения сосудов для продаж, такие как, например, пластиковые контейнеры для инъекции или изготовленные с раздувом, в которые можно помещать необходимые сосуды. Независимо от числа или типа контейнеров, наборы по изобретению также могут включать, или быть упакованными с инструментом для взятия и анализа образца. Такой инструмент может представлять собой, например, ингалятор, шприц, пипетку, пинцет, мерную ложку, капельницу или любое другое одобренное с медицинской точки зрения средство доставки.
Наборы по изобретению могут также включать инструкцию, описывающую рекомендуемые альтернативные способы лечения для случаев обнаружения у пациента определенных мутаций. Например, инструкция, включенная в набор по изобретению, может включать рекомендацию, которая предписывает для пациента с нарушением, например, со злокачественной опухолью, в которой обнаружили мутантный полипептид BRAF, не продолжать лечение ингибитором BRAF первого поколения, наблюдать за возникновением рецидива при лечении ингибитором BRAF первого поколения, продолжать лечение ингибитором BRAF первого поколения в увеличенной дозе или начинать лечение ингибитором BRAF второго поколения. Инструкция, включенная в набор по изобретению, может также содержать рекомендацию, предписывающую для пациента с нарушением, в котором не обнаруживают мутантный полипептид BRAF, продолжать лечение ингибитором BRAF первого поколения в стандартной дозе. В иллюстративных вариантах осуществления ингибитор BRAF первого поколения представляет собой RAF-265.
Данное изобретение далее иллюстрировано следующими примерами, которые не следует рассматривать как ограничивающие. Содержание всех ссылок, патентов и опубликованных патентных заявок, процитированных на всем протяжении данной заявки, включено в настоящий документ в качестве ссылки.
ПРИМЕРЫ
Пример 1: Скринирование случайного мутагенеза BRAF-V600E (RAF265 и PLX4720)
Проводили создание библиотек мутаций с применением модификации опубликованных способов. В кратком изложении, мутагенез проводили репродуцирования экспрессирующей плазмиды BRAF(V600E) (pWZL-Blast-BRAF(V600E)) в E.coli, лишенной генов репарации ДНК MutS, MutD5 и MutT (XL1-Red; Stratagene). Плазмидную ДНК экстрагировали из этих бактерии и амплифицировали в XL1-Blue E.coli (Stratagene). Мутировавшую плазмиду BRAF(V600E) или немутировавший контроль использовали для встраивания в клетки меланомы A375. После отбора с применением бластицидина клетки высевали на 15-см планшеты и культивировали в присутствии ингибиторов RAF (RAF265 или PLX4720; 2 мкΜ или 1,5 мкΜ, соответственно) в течение 5 недель до появления резистентных клонов. Резистентные клоны секвенировали для определения мутаций, возникавших с высокой частотой. Результаты показаны на фиг. 5 (скринирование RAF265) и фиг. 6 (скринирование PLX4720). На фиг. 7 показано расположение трех мутаций BRAF, которые с высокой частотой возникали в обоих скринированиях.
Пример 2: Вестерн-блоттинг активации pMEK1/2 и pERK1/2 в клетках, содержащих мутантные BRAF
Клетки 293T трансфектировали 6 мкг pWZL(BLAST)-BRAF для каждого предполагаемого резистентного аллеля и затем обрабатывали различными концентрациями ингибитора BRAF(V600E) PLX4720 (0, 0,08, 0,4, 2, 5 и 10 мкΜ) в течение 16 часов. Анализ иммуноблота проводили с применением стандартных способов. В кратком изложении, обработанные клетки лизировали буфером TNN, содержащим ингибитор протеазы (Roche), NaF и NaVO3 (1 мМ каждый). Лизат количественно оценивали (анализ Бредфорда), денатурировали (95°C) и распределяли электрофорезом в геле с SDS. Белки переносили на нитроцеллюлозные мембраны и исследовали с применением первичных антител, распознающих BRAF (Santa Cruz; разведение 1:10000), р-ERK1/2, р-MEK1/2 (Ser-217/221) и α-тубулина (Cell Signaling Technology; разведение 1:1000). После инкубирования с подходящими вторичными антителами (IgG против кролика или против мыши, конъюгированные с HRP; разведение 1: 1000) (Cell Signaling Technology), белки обнаруживали с применением хемилюминесценции (Pierce). Результаты показаны на фиг. 8. Как показано, уровни фосфорилированных MEK1/2 и ERK1/2 были повышены в клетках, содержащих BRAF-V600E, BRAF-V600E-T521K и BRAF V600E-P686Q. Повышение уровней фосфорилированных MEK1/2 и ERK1/2 сохранялось в клетках BRAF-V600E-T521K и BRAF V600E-P686Q в присутствии увеличивающихся концентраций PLX4720.
Пример 3: Анализ киназной активности BRAF
Клетки 293T (70% конфлюэнтных) трансфектировали 15 мкг pc-DNA-DEST40, содержащим предполагаемые резистентные аллели BRAF(V600E), дефектные по киназе BRAF или аллели дикого типа. Через 48 часов получали лизаты стандартными способами. Осаждение с применением гранул кобальта проводили в течение 30 мин при 4°C с 1 мг всего клеточного экстракта. Связавшиеся с белком гранулы кобальта инкубировали с 20 мкл смеси АТФ/магний (20 мМ Mops pH 7,2, 25 мМ β-глицерофосфат, 5 мМ EGTA, 1 мМ Na3VO4, 1 мМ DTT, 75 мМ MgCl2 и 0,5 мМ АТФ), 20 мкл буфера для растворения (20 мМ Mops, pH 7,2, 25 мМ β-глицеринфосфат, 5 мМ EGTA, 1 мМ ортованданат натрия, 1 мМ DTT), и 1 мкг неактивного MEK1 (получен в Millipore) в течение 30 мин при 30°C. Фосфорилированный продукт MEK1 обнаруживали посредством иммуноокрашивания с применением антитела р-MEK1/2 (Cell Signaling Technology).
ЭКВИВАЛЕНТЫ
Изобретение описано в настоящем документе со ссылкой только на конкретные примеры и варианты осуществления. Не было сделано попытки исчерпывающе описать все возможные примеры и варианты осуществления изобретения. Специалисты в данной области должны понимать, что к описанным выше примерам и вариантам осуществления можно применять различные вставки, исключения, модификации и другие изменения без нарушения сущности и объема изобретения, изложенных в прилагаемой формуле изобретения. Следует понимать, что все такие вставки, исключения, модификации и другие изменения включены в объем прилагаемой формулы изобретения.
Реферат
Настоящее изобретение относится к биотехнологии и раскрывает изолированную молекулу нуклеиновой кислоты, кодирующую мутантный полипептид BRAF, в котором мутации обеспечивают резистентность к ингибиторам BRAF. Настоящее изобретение также раскрывает изолированный мутантный полипептид BRAF, кодируемый указанной молекулой нуклеиновой кислоты, экспрессирующий вектор, содержащий указанную молекулу нуклеиновой кислоты, клетку-хозяин для экспрессии указанного мутантного полипептида BRAF и способ получения указанного мутантного полипептида BRAF культивированием указанной клетки-хозяина. Используя варианты мутантного полипептида BRAF согласно настоящему изобретению, осуществляют способы определения соединения, представляющего собой ингибитор BRAF второго поколения по уровню фосфорилирования субстрата BRAF или клеточной пролиферации в клетке, содержащей субстрат BRAF. Настоящее изобретение раскрывает способ скринирования субъекта со злокачественной опухолью на наличие мутации BRAF, обеспечивающей резистентность к лечению ингибитором RAF. Настоящее изобретение позволяет обнаружить новые ингибиторы BRAF, которые могут быть использованы при лечении пациентов, имеющих резистентность к ингибиторам BRAF. 10 н. и 11 з.п. ф-лы, 8 ил., 3 пр.
Формула
где по меньшей мере одна аминокислотная замена или делеция находится в одной или нескольких аминокислотных позициях, выбранных из группы, состоящей из A29V, H72N, S113I, S124R, P162H, С194*, L227F, Р231Т, C251F, V291F, Q329K, K483E, L485F, T521K, V528F, D587E, Р655Т, S657*, S683R, P686Q, С696*, L697I, Р722Т, F738L и C748F.
где по меньшей мере одна аминокислотная замена или делеция находится в одной или нескольких аминокислотных позициях, выбранных из группы, состоящей из A29V, H72N, S113I, S124R, P162H, С194*, L227F, Р231Т, C251F, V291F, Q329K, K483E, L485F, T521K, V528F, D587E, Р655Т, S657*, S683R, P686Q, С696*, L697I, Р722Т, F738L и C748F.
где по меньшей мере одна аминокислотная замена или делеция находится в одной или нескольких аминокислотных позициях, выбранных из группы, состоящей из A29V, H72N, S113I, S124R, P162H, С194*, L227F, Р231Т, C251F, V291F, Q329K, K483E, L485F, T521K, V528F, D587E, Р655Т, S657*, S683R, P686Q, С696*, L697I, Р722Т, F738L и C748F.
где по меньшей мере одна аминокислотная замена или делеция находится в одной или нескольких аминокислотных позициях, выбранных из группы, состоящей из A29V, H72N, S113I, S124R, P162H, С194*, L227F, Р231Т, C251F, V291F, Q329K, K483E, L485F, T521K, V528F, D587E, Р655Т, S657*, S683R, P686Q, С696*, L697I, Р722Т, F738L и C748F.
(a) предоставление исследуемой композиции, содержащей мутантный полипептид BRAF, проявляющий активность BRAF, где указанный мутантный полипептид BRAF содержит аминокислотную последовательность, содержащую по меньшей мере одну аминокислотную замену или делецию по сравнению с полипептидом BRAF дикого типа (SEQ ID NO: 2) или полипептидом BRAF V600E (SEQ ID NO: 4), где по меньшей мере одна аминокислотная замена или делеция обеспечивает резистентность к одному или нескольким ингибиторам BRAF мутантного полипептида BRAF,
где по меньшей мере одна аминокислотная замена или делеция находится в одной или нескольких аминокислотных позициях, выбранных из группы, состоящей из A29V, H72N, S113I, S124R, P162H, С194*, L227F, Р231Т, C251F, V291F, Q329K, K483E, L485F, T521K, V528F, D587E, Р655Т, S657*, S683R, P686Q, С696*, L697I, Р722Т, F738L и C748F, и субстрат BRAF;
(b) контактирование исследуемой композиции с тестируемым соединением в условиях, обеспечивающих фосфорилирование субстрата BRAF в отсутствие тестируемого соединения;
(c) определение воздействия соединения на фосфорилирование субстрата BRAF; и
(d) идентификацию соединения, которое снижает уровень фосфорилирования субстрата BRAF по сравнению с подходящим контролем, где снижение фосфорилирования субстрата BRAF по сравнению с контролем указывает на то, что соединение представляет собой ингибитор BRAF второго поколения.
(а) предоставление клетки, содержащей мутантный полипептид BRAF, проявляющий активность BRAF, где указанный мутантный полипептид BRAF содержит аминокислотную последовательность, содержащую по меньшей мере одну аминокислотную замену или делецию по сравнению с полипептидом BRAF дикого типа (SEQ ID NO: 2) или полипептидом BRAF V600E (SEQ ID NO: 4), где по меньшей мере одна аминокислотная замена или делеция обеспечивает резистентность к одному или нескольким ингибиторам BRAF мутантного полипептида BRAF,
где по меньшей мере одна аминокислотная замена или делеция находится в одной или нескольких аминокислотных позициях, выбранных из группы, состоящей из A29V, H72N, S113I, S124R, P162H, С194*, L227F, Р231Т, C251F, V291F, Q329K, K483E, L485F, T521K, V528F, D587E, Р655Т, S657*, S683R, P686Q, С696*, L697I, Р722Т, F738L и C748F;
(b) контактирование клетки с тестируемым соединением;
(c) определение воздействия соединения на фосфорилирование субстрата BRAF или определение воздействия соединения на пролиферацию клеток; и
(d) идентификацию соединения, которое снижает уровень фосфорилирования субстрата BRAF или снижает клеточную пролиферацию по сравнению с подходящим контролем, где снижение фосфорилирования субстрата BRAF или снижение клеточной пролиферации по сравнению с подходящим контролем указывает на то, что соединение представляет собой ингибитор BRAF второго поколения.
где по меньшей мере одна аминокислотная замена или делеция находится в одной или нескольких аминокислотных позициях, выбранных из группы, состоящей из A29V, H72N, S113I, S124R, P162H, С194*, L227F, Р231Т, C251F, V291F, Q329K, K483E, L485F, T521K, V528F, D587E, Р655Т, S657*, S683R, P686Q, С696*, L697I, Р722Т, F738L и C748F с тестируемым соединением, и измерение чувствительности клетки-хозяина к тестируемому соединению измеряют посредством анализа, выбранного из группы, состоящей из анализа клеточной пролиферации, анализа клеточной жизнеспособности и анализа фосфорилирования MEK, где сокращение клеточной пролиферации, клеточной жизнеспособности или фосфорилирования MEK в присутствии тестируемого соединения указывает на то, что клетка-хозяин обладает чувствительностью к тестируемому соединению, и где чувствительность клетки-хозяина к тестируемому соединению указывает на то, что соединение представляет собой ингибитор BRAF второго поколения.
а) выбор потенциального лекарственного средства с применением компьютерного моделирования с трехмерной кристаллической структурой или структурой в растворе мутантного полипептида BRAF, где указанный мутантный полипептид BRAF содержит аминокислотную последовательность, содержащую по меньшей мере одну аминокислотную замену по сравнению с полипептидом BRAF дикого типа (SEQ ID NO: 2) или полипептидом BRAF V600E (SEQ ID NO: 4), где по меньшей мере одна аминокислотная замена обеспечивает резистентность к одному или нескольким ингибиторам BRAF мутантного полипептида BRAF, где по меньшей мере одна аминокислотная замена или делеция находится в одной или нескольких аминокислотных позициях, выбранных из группы, состоящей из A29V, H72N, S113I, S124R, P162H, С194*, L227F, Р231Т, C251F, V291F, Q329K, K483E, L485F, T521K, V528F, D587E, Р655Т, S657*, S683R, P686Q, С696*, L697I, Р722Т, F738L и C748F;
b) контактирование указанного потенциального лекарственного средства с указанным мутантным полипептидом BRAF; и
c) определение ингибирования указанного мутантного полипептида BRAF после взаимодействия указанного потенциального лекарственного средства с указанным мутантным полипептидом BRAF,
где указанное потенциальное лекарственное средство, способное к ингибированию мутантного полипептида BRAF, определяют как ингибитор BRAF второго поколения.
(a) получение от субъекта образца, содержащего злокачественную клетку; и
(b) определение в образце молекулы нуклеиновой кислоты, кодирующей полипептид BRAF, содержащий одну или несколько мутаций по сравнению с молекулой нуклеиновой кислоты, кодирующей полипептид BRAF дикого типа (SEQ ID NO: 2) или полипептид BRAF V600E (SEQ ID NO: 4), где мутации находятся в позициях, кодирующих одну или несколько аминокислот полипептида BRAF, выбранных из группы, состоящей из A29V, H72N, S113I, S124R, P162H, С194*, L227F, Р231Т, C251F, V291F, Q329K, K483E, L485F, T521K, V528F, D587E, Р655Т, S657*, S683R, P686Q, С696*, L697I, Р722Т, F738L и C748F, где присутствие молекулы нуклеиновой кислоты в образце, содержащем злокачественную клетку, указывает на то, что субъект обладает резистентностью к лечению ингибитором RAF.

Комментарии