Производные индолин-2-она или пирролопиридин/пиримидин-2-она - RU2666532C2
Код документа: RU2666532C2
Чертежи
Описание
Настоящее изобретение относится к производным индолин-2-она или пирролопиридин/пиримидин-2-она общей формулы

где
Ar представляет собой гетероарильную группу, содержащую один, два или три гетероатома, выбранных из N, S или О;
R1 представляет собой атом водорода, низший алкил, атом галогена, амино, диметиламино, циано, низший алкил, замещенный атомом галогена, низший алкил, замещенный гидрокси, CH(OH)CF3, (СН2)o-низший алкокси, циклоалкил, необязательно замещенный CF3, или гетероциклоалкил, необязательно замещенный низшим алкилом;
R2 представляет собой атом водорода, низший алкил, (СН2)o-циклоалкил, (СН2)o-O-циклоалкил, (СН2)o-низший алкокси, СН2)o-низший алкокси, замещенный атомом галогена, (СН2)o-гетероциклоалкил, необязательно замещенный низшим алкилом, (СН2)o-S(O)2-циклоалкил, низший алкил, замещенный одним или двумя гидрокси, низший алкил, замещенный одним или двумя низшими алкокси, (СН2)o-S(O)2-низший алкил, низший алкил, замещенный атомом галогена, или CH2CH(OH)CF3;
R3 представляет собой атом галогена или низший алкил;
X представляет собой СН или N;
X1 представляет собой СН или N;
n равно 1 или 2;
о равно 0, 1, 2 или 3;
m равно 0, 1 или 2;
и пунктирная линия представляет собой связь или ее отсутствие;
а также к их фармацевтически приемлемым солям, к их рацемический смеси или соответствующему энантиомеру и/или оптическому изомеру и/или стереоизомеру.
В WO 9106545 раскрыта очень близкая структура, содержащая фенил-замещенную имидазольную группировку для Ar, для предотвращения агрегации и эритроцитов, и тромбоцитов. В ЕР 2108641 и WO 2008046083 раскрыт очень широкий объем подобных соединений, являющихся ингибиторами активируемой азотом протеинкиназы р38, для лечения воспалительных заболеваний и доброкачественной гиперплазии предстательной железы соответственно.
Кроме того, в ссылках WO 2007/098214, WO 2012/143510 и WO 2012/152629 раскрыты соединения, отличающиеся от настоящего изобретения их остатком Ar, который в настоящем изобретении представляет собой 5- или 6-членный гетероарил вместо бициклического гетероарила в данных ссылках.
Теперь обнаружено, что соединения формулы I можно применять для лечения заболеваний ЦНС. Показано, что раскрытые соединения вызывают обратное развитие гиперлокомоции, индуцированной L-687414 ((3R,4R)-3-амино-1-гидрокси-4-метил-пирролидин-2-оном, являющимся антагонистом глицинового сайта N-метил-D-аспартата (NMDA)), представляющей собой поведенческую фармакодинамическую модель мыши для шизофрении, описанную D. Alberati et al. в статье Pharmacology, Biochemistry and Behavior, 97 (2010), 185-191. Авторы описали, что гиперлокомоция, индуцированная L-687414, была подвержена ингибированию серией известных антипсихотических лекарственных средств. Соединения формулы I демонстрируют значительную активность в этой модели. Эти результаты позволяют прогнозировать антипсихотическую активность для настоящих соединений, что обеспечивает их пользу для лечения позитивных (психоз) и негативных симптомов шизофрении, злоупотребления психоактивными веществами, привыкания к алкоголю и к лекарственным средствам, обсессивно-компульсивных расстройств, когнитивного нарушения, биполярных расстройств, расстройств настроения, большой депрессии, резистентной депрессии, тревожных расстройств, болезни Альцгеймера, аутизма, болезни Паркинсона, хронической боли, пограничного личностного расстройства, нарушений сна, синдрома хронической усталости, тугоподвижности, при противовоспалительных действиях при артрите и нарушениях равновесия.
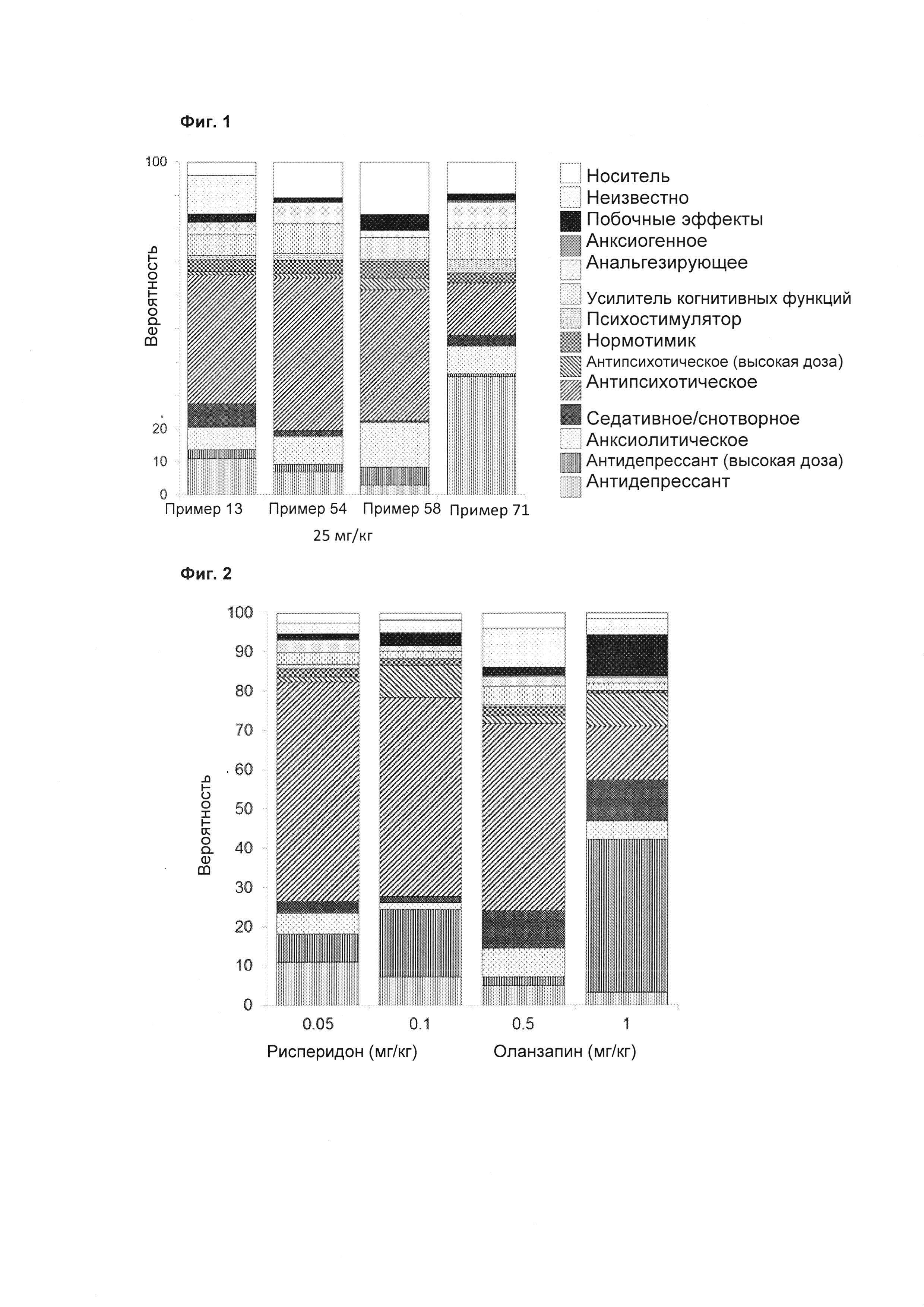
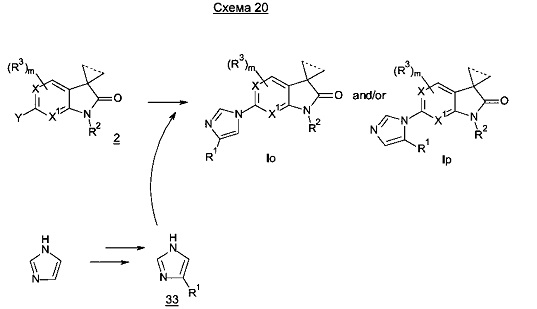
Результаты представлены в таблице 1. В дополнение к эксперименту по гиперлокомоции, индуцированной L-687414, как описано выше, некоторые соединения по настоящему изобретению протестированы в автоматизированной системе SmartCube®, в которой поведение мышей, обработанных соединениями, в ответ на множественные провокации, регистрируется цифровой видеокамерой и анализируется компьютерными алгоритмами (Roberds et al., Frontiers in Neuroscience, 2011, Vol. 5, Art. 103, 1-4). Таким образом, нейрофармакологические действия тестируемого соединения можно прогнозировать по аналогии с основными классами соединений, такими как антипсихотические средства, анксиолитики и антидепрессанты. В примерах 13, 54, 58, 71 показано сходство с атипичными антипсихотическими средствами. Результаты представлены в таблице 2.
Шизофрения представляет собой комплексное психическое расстройство, в характерном случае возникающее в позднем подростковом или раннем взрослом периоде при встречаемости у 1% взрослого населения во всем мире, обладающее огромным социальным и экономическим влиянием. Критерии Европейской психиатрической ассоциации (Международная классификация заболеваний, МКБ) и Американской психиатрической ассоциации (Диагностическое и статистическое руководство по психическим расстройствам, DSM (Diagnostic and Statistical Manual of Mental Disorders)) для диагностики шизофрении требуют наличия двух или более характеристических симптомов: бреда, галлюцинаций, дезорганизованной речи, значительно дезорганизованного или кататонического поведения (позитивные симптомы) или негативных симптомов (алогии, аффективной тупости, отсутствия мотивации, ангедонии). Как группа, люди с шизофренией имеют функциональные нарушения, которые могут начаться в детстве, продолжаться на протяжении взрослой жизни и привести к неспособности большинства пациентов к сохранению нормальной занятости или к обладанию иной нормальной социальной функцией. Они также могут иметь сокращенную продолжительность жизни по сравнению с общим населением, и до антипсихотического лечения страдать повышенной встречаемостью широкого ряда других нейропсихиатрических симптомов, включающих в себя злоупотребление психоактивными веществами, обсессивно-компульсивные симптомы и аномальные непроизвольные движения. Шизофрения также ассоциирована с широким рядом когнитивных нарушений, биполярными расстройствами, большой депрессией и тревожными расстройствами, тяжесть которых ограничивает функционирование пациентов даже в случаях, когда психотические симптомы хорошо контролируются. Первичным лечением шизофрении являются антипсихотические лекарственные средства. Антипсихотические средства, например, рисперидон, оланзапин, тем не менее, неспособны значительно улучшить негативные симптомы и когнитивную дисфункцию.
Антипсихотические лекарственные средства показали клиническую эффективность для лечения следующих заболеваний:
Фибромиалгии, которая представляет собой синдром, характеризующийся хронической генерализованной болью, ассоциированный с различными соматическими симптомами, такими как нарушения сна, усталость, тугоподвижность, нарушения равновесия, повышенная чувствительность к физическим и физиологическим стимулам окружающей среды, депрессия и тревога (CNS Drugs, 2012, 26(2): 135-53).
Шизоаффективных расстройств: включают психотические и аффективные симптомы, данное расстройство попадает в спектр между биполярными расстройствами (с депрессивными и маниакальными эпизодами, привыканием к алкоголю и лекарственным средствам, злоупотреблением психоактивными веществами) и шизофренией. J. Clin. Psychiatry, 2010, 71, Suppl. 2, 14-9, Pediatr. Drugs 2011, 13(5), 291-302.
Большой депрессии: BMC Psychiatry 2011, 11, 86.
Депрессии, резистентной к лечению: Journal of Psychopharmacology, 0(0) 1-16.
Тревоги: European Neuropsychopharmacology, 2011, 21, 429-449
Биполярных расстройств: Encephale, International J. of Neuropsychopharmacology, 2011, 14, 1029-104, International J. of Neuropsychopharmacology, 2012, pages 1-12, J. of Neuropsychopharmacology, 2011, 0(0), 1-15.
Расстройств настроения: J. Psychopharmacol. 2012, Jan 11, CNS Drugs, 2010, Feb. 24(2), 131-61.
Аутизма: Current opinion in pediatrics, 2011, 23:621-627; J. Clin. Psychiatry, 2011, 72(9), 1270-1276.
Болезни Альцгеймера: J. Clin. Psychiatry, 2012, 73(1), 121-128.
Болезни Паркинсона: Movement Disorders, Vol. 26, No. 6, 2011.
Синдрома хронической усталости: European Neuropsychopharmacology, 2011, 21, 282-286.
Пограничного личностного расстройства: J. Clin. Psychiatry, 2011, 72 (10), 1363-1365; J. Clin. Psychiatry, 2011, 72 (10), 1353-1362.
Противовоспалительных действий при артрите: European J. of Pharmacology, 678, 2012, 55-60.
Объектами настоящего изобретения являются новые соединения формулы I и применение соединений формулы I и их фармацевтически приемлемых солей для лечения заболеваний ЦНС, относящихся к позитивным (психоз) и негативным симптомам шизофрении, злоупотреблению веществами, привыканию к алкоголю и к лекарственным средствам, обсессивно-компульсивным расстройствам, когнитивному нарушению, биполярным расстройствам, расстройствам настроения, большой депрессии, резистентной депрессии, тревожным расстройствам, болезни Альцгеймера, аутизму, болезни Паркинсона, хронической боли, пограничному личностному расстройству, нарушениям сна, синдрому хронической усталости, тугоподвижности, противовоспалительным действиям при артрите и нарушениям равновесия. Следующими объектами настоящего изобретения являются лекарственные препараты, содержащие такие новые соединения, а также способы получения соединений формулы I, комбинация соединений формулы I с имеющимися в продаже антипсихотическими средствами, антидепрессантами, анксиолитиками или нормотимиками и способы лечения расстройств ЦНС, как упомянуто выше.
Распространенным антипсихотическим лекарственным средством для лечения шизофрении является оланзапин. Оланзапин (зипрекса) принадлежит к классу лекарственных средств, известных как атипичные антипсихотические средства. Другие члены этого класса включают, например, клозапин (клозарил), рисперидон (рисперидал), арипипразол (абилифай) и зипрасидон (геодон).
Оланзапин одобрен для лечения психотических расстройств, долгосрочного лечения биполярных расстройств и в комбинации с флуоксетином для лечения депрессивных эпизодов, обусловленных биполярными расстройствами, и для лечения резистентной депрессии.
Соединения по настоящему изобретению можно комбинировать с антипсихотическими лекарственными средствами, такими как оланзапин (зипрекса), клозапин (клозарил), рисперидон (рисперидал), арипипразол (абилифай), амисульприд (солиан), азенапин (сафрис), блонансерин (лонасен), клотиапин (энтумин), илоперидон (фанапт), луразидон (латуда), мосапрамин (кремин), палиперидон (инвега), пероспирон (луллан), кветиапин (сероквель), ремоксиприд (роксиам), сертиндол (сердолект), сульпирид (сульпирид, эглонил), зипразидон (геодон, зелдокс), зотепин (ниполепт), галоперидол (галдол, серенац), дроперидол (дролептан), хлорпромазин (торазин, ларгактил), флуфеназин (проликсин), перфеназин (трилафон), прохлорперазин (компазин), тиоридазин (мелларил, меллерил), трифлуоперазин (стелазин), трифлупромазин (весприн), левомепромазин (нозинан), прометазин (фенерган), пимозид (орап) и циамемазин (терциан).
Одно предпочтительное воплощение изобретения представляет собой комбинацию, где имеющееся в продаже антипсихотическое лекарственное средство представляет собой оланзапин (зипрекса), клозапин (клозарил), рисперидон (риспердал), арипипразол (абилифай) или зипрасидон.
Кроме того, соединения по настоящему изобретению можно комбинировать с антидепрессантами, такими как ингибиторы обратного захвата серотонина [циталопрам (селекса), эсциталопрам (лексапро, ципралекс), пароксетин (паксил, сероксат), флуоксетин (прозак), флувоксамин (лувокс), сертралин (золофт, лустрал)], ингибиторы обратного захвата серотонина-норэпинефрина [дулоксетин (симбалта), милнаципран (иксел, савелла), венлафаксин (эффексор), десвенлафаксин (пристик), трамадол (трамал, ультрам), сибутрамин (меридия, редуктил)], антагонист и ингибиторы обратного захвата серотонина [этоперидон (аксиомин, этонин), лубазодон (YM-992, YM-35,995), нефазодон (серзон, нефадар), тразодон (дезирел)], ингибиторы обратного захвата норэпинефрина [ребоксетин (эдронакс), вилоксазин (вивалан), атомоксетин (страттера)], ингибиторы обратного захвата норэпинефрина-дофамина [бупропион (веллбутрин, зибан), дексметилфенидат (фокалин), метилфенидат (риталин, концерта)], рилизинг-факторы норэпинефрина-дофамина [амфетамин (аддералл), декстроамфетамин (декседрин), декстрометамфетамин (дезоксин), лиздексамфетамин (виванс)], трициклические антидепрессанты [амитриптилин (элавил, эндеп), кломипрамин (анафранил), дезипрамин (норпрамин, пертофран), досулепин [дотиепин] (протиаден), доксепин (адалин, синекван), имипрамин (тофранил), лофепрамин (фепрапакс, гаманил, ломонт), нортриптилин (памелор), протриптилин (вивактил), тримипрамин (сурмонтил)], тетрациклические антидепрессанты [амоксапин (азендин), мапротилин (людиомил), миансерин (болвидон, норвал, толвон), миртазапин (ремерон)], ингибиторы моноаминоксидазы [изокарбоксазид (марплан), моклобемид (аурорикс, манерикс), фенелзин (нардил), селегилин [L-депренил] (элдеприл, зелапар, эмзам), транилципромин (парнат), пирлиндол (пиразидол)], агонисты рецептора 5-НТ1А [буспирон (буспар), тандоспирон (седиел), вилазодон (виибрид)], антагонисты рецептора 5-НТ2 [агомелатин (валдоксан), нефазодон (нефадар, серзон)], селективные усилители обратного захвата серотонина [тианептин].
Предпочтительное воплощение данного изобретения представляет собой комбинацию, где имеющееся в продаже антидепрессивное лекарственное средство представляет собой циталопрам (целекса), эсциталопрам (лексапро, ципралекс), пароксетин (паксил, сероксат), флуоксетин (прозак), сертралин (золофт, лустрал) дулоксетин (симбалта), милнаципран (иксел, савелла), венлафаксин (эффексор) или миртазапин (ремерон).
Соединения можно также комбинировать с анксиолитиками, такими как алпразолам (хелекс, ксанакс, ксанор, онакс, алпрокс, рестил, тафил, паксал), бретазенил, бромазепам (лектопам, лексотанил, лексотам, бромам), бротизолам (лендормин, дормекс, синтонал, ноктилан), хлордиазепоксид (либриум, рисолид, элениум), цинолазепам (геродорм), клоназепам (ривотрил, клонопин, икторивил, паксам), клоразепат (транксен, трансксилиум), клотиазепам (вератран, клозан, риз), клоксазолам (сепазон, олкадил), делоразепам (дадумир), диазепам (антенекс, апаурин, апзепам, апозепам, гексалид, паке, стесолид, стедон, валлиум, вивал, валаксона), эстазолам (ПроСом), этизолам (этилаам, пасаден, депас), флунитразепам (рогипнол, флусканд, флунипам, ронал, рогидорм), флуразепам (далмадорм, далман), флутопразепам (рестас), галазепам (паксипам), кетазолам (анксон), лопразолам (дормонокт), лоразепам (ативан, теместа, тавор, лорабенз), лорметазепам (лорамет, ноктамид, проноктан), медазепам (нобриум), мидазолам (дормикум, версед, гипновел, дормонид), ниметазепам (эримин), нитразепам (могадон, алодорм, пацисин, думолид, нитразадон), нордазепам (мадар, стилни), оксазепам (сереста, серакс, серенид, серепакс, собрил, оксабенз, оксапакс), феназепам (феназепам), пиназепам (домар), празепам (лизанксия, центракс), премазепам, квазепам (дорал), темазепам (ресторил, нормизон, эугипнос, темазе, тенокс), тетразепам (милостан), триазолам (хальцион, риламир), клобазам (фризиум, урбанол), эезопиклон (лунеста), залеплон (Sonata, Stamoc), золпидем (амбиен, нитамел, стилнокт, стилнокс, золдем, золнод), зопиклон (имован, рован, ксимован; зилез; зимоклон; зимован; зопитан; зорклон), прегабалин (лирика) и габапентин (фанатрекс, габарон, грализ, нейронтин, нупентин).
Одно предпочтительное воплощение данного изобретения представляет собой комбинацию, где имеющееся в продаже анксиолитическое лекарственное средство представляет собой алпразолам (хелекс, ксанакс, ксанор, онакс, алпрокс, рестил, тафил, паксал), хлордиазепоксид (либриум, рисолид, элениум), клоназепам (ривотрил, клонопин, икторивил, паксам), диазепам (антенекс, апаурин, апзепам, апозепам, гексалид, паке, стесолид, стедон, валлиум, вивал, валаксона), эстазолам (ПроСом), эезопиклон (лунеста), залеплон (Sonata, Starnoc), золпидем (амбиен, нитамел, стилнокт, стилнокс, золдем, золнод), прегабалин (лирика) или габапентин (фанатрекс, габарон, грализ, нейронтин, нупентин).
Следующим объектом изобретения является комбинация со нормотимиками, такими как карбамазепин (тегретол), ламотригин (ламиктал), литий (эскалит, литан, литобид) и вальпроевая кислота (депакот).
Соединения можно также комбинировать с прокогнитивными соединениями, такими как донепезил (арисепт), галантамин (разадин), ривастигмин (экселон) и мемантин (наменда).
Предпочтительными показаниями к применению соединений по настоящему изобретению являются психотические заболевания, такие как шизофрения.
При использовании в настоящем документе термин "низший алкил" означает насыщенную прямоцепочечную или разветвленную группу, содержащую от 1 до 7 атомов углерода, например, метил, этил, пропил, изопропил, н-бутил, изобутил, 2-бутил, трет-бутил и тому подобное. Предпочтительными алкильными группами являются группы с 1-4 атомами углерода.
При использовании в настоящем документе термин "низший алкокси" означает алкильную группу, как определено выше, связанную через атом О.
При использовании в настоящем документе термин "низший алкил, замещенный атомом галогена", означает группу, где алкильный остаток является таким, как определено выше, где по меньшей мере один атом водорода замещен атомом галогена.
При использовании в настоящем документе термин "низший алкокси, замещенный атомом галогена", означает группу, где остаток алкокси является таким, как определено выше, где по меньшей мере один атом водорода замещен атомом галогена.
При использовании в настоящем документе термин "низший алкил, замещенный гидрокси", означает группу, где алкильный остаток является таким, как определено выше, где по меньшей мере один атом водорода замещен гидроксигруппой.
Термин "циклоалкил" означает алкильное кольцо с 3-6 кольцевыми атомами углерода.
Термин "атом галогена" означает атом хлора, йода, фтора и брома.
Термин "гетероарил, содержащий один, два или три гетероатома, выбранных из N, S или О" означает 6-членную гетероарильную группу, содержащую один или два атома N, выбранную из групп пиридил, пиримидинил, пиридазинил, бициклическую кольцевую систему, содержащую от 1 до 3 гетероатомов, выбранную из групп циклопента[b]пиридинил, 2,3-дигидро-1Н-пиридо[2,3-b][1,4]оксазинил, 6,7-дигидро-5Н-пирроло[3,4-b]пиридинил, имидазол[1,2-а]пиридинил, или 5-членную гетероарильную группу, содержащую от 1 до 3 гетероатомов, выбранных из N, S или О, где такие группы представляют собой имидазолил, 1,2,4-оксадиазолил, 1,3,4-оксадиазолил, изоксазолил, оксазолил, 1,3,4-тиадиазолил или пиразолил.
Термин "гетероциклоалкил" означает насыщенное 4, 5 или 6-членное углеродное кольцо, где по меньшей мере один атом углерода замещен гетероатомом N или О, например пирролидинил, морфолинил, тиоморфолинил, пиперидинил, пиперазинил, тетрагидро-пиран-4-ил, тетрагидро-фуран-3-ил или оксетанил.
Термин "фармацевтически приемлемые соли присоединения кислоты" охватывает соли с неорганическими и органическими кислотами, такими как соляная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, пара-толуолсульфоновая кислота и тому подобное.
Одно воплощение изобретения представляет собой соединения формулы I, где Ar представляет собой 6-членную гетероарильную группу, содержащую один или два атома N, и R2 представляет собой атом водорода, а другие заместители являются такими, как описано выше, например, следующие соединения:
3,3-Диметил-6-(пиридин-3-ил)индолин-2-он
3,3-Диметил-6-(пиридин-4-ил)индолин-2-он
3,3-Диметил-6-(пиримидин-5-ил)индолин-2-он
6-(2-Аминопиримидин-5-ил)-3,3-диметилиндолин-2-он
3,3-Диметил-6-(пиридазин-4-ил)индолин-2-он
6-(6-Аминопиридин-3-ил)-3,3-диметилиндолин-2-он
3,3-Диметил-6-(2-метилпиридин-3-ил)индолин-2-он
3,3-Диметил-6-(3-метилпиридин-4-ил)индолин-2-он
3,3-Диметил-6-(2-метилпиримидин-5-ил)индолин-2-он
3,3-Диметил-6-(2-метилпиридин-4-ил)индолин-2-он
5-(3,3-Диметил-2-оксоиндолин-6-ил)никотинонитрил
6-(2,4-Диметил-пиридин-3-ил)-3,3-диметил-1,3-дигидро-индол-2-он
3,3-Диметил-6-(2-метилпиримидин-4-ил)индолин-2-он
6-(2-Циклопропилпиримидин-5-ил)-3,3-диметил-индолин-2-он
3,3-Диметил-6-(2-метилпиримидин-5-ил)-1Н-пирроло[3,2-с]пиридин-2-он
3,3-Диметил-6-(6-метилпиримидин-4-ил)индолин-2-он
3,3-Диметил-6-(3-метилпиридин-4-ил)-1Н-пирроло[3,2-с]пиридин-2(3Н)-он
3,3-Диметил-6-(6-метил-3-пиридил)-1Н-пирроло[3,2-с]пиридин-2-он
3,3-Диметил-6-(6-метилпиридин-3-ил)индолин-2-он
6-(4-Фторпиридин-3-ил)-3,3-диметилиндолин-2-он
3,3-Диметил-6-(5-метилпиразин-2-ил)индолин-2-он
6-(2,6-Диметилпиримидин-4-ил)-3,3-диметилиндолин-2-он или
3,3-Диметил-6-(6-метилпиридазин-3-ил)индолин-2-он.
Одно воплощение изобретения представляет собой дополнительные соединения формулы I, где Ar представляет собой шестичленную гетероарильную группу, содержащую один или два атома N, и R2 представляет собой низший алкил, а другие заместители являются такими, как описано выше, например, следующие соединения:
1,3,3-Триметил-6-(пиридин-4-ил)индолин-2-он
1,3,3-Триметил-6-(2-метилпиридин-4-ил)индолин-2-он
1,3,3-Триметил-6-(пиридин-3-ил)индолин-2-он
1,3,3-Триметил-6-(пиримидин-5-ил)индолин-2-он
1,3,3-Триметил-6-(пиридин-2-ил)индолин-2-он
1,3,3-Триметил-6-(2-(пирролидин-1-ил)пиримидин-5-ил)индолин-2-он
6-(2-Аминопиримидин-5-ил)-1,3,3-триметилиндолин-2-он
6-(2-(Диметиламино)пиримидин-5-ил)-1,3,3-триметилиндолин-2-он
1,3,3-Триметил-6-(2-метилпиримидин-5-ил)индолин-2-он
1,3,3-Триметил-6-(пиридазин-3-ил)индолин-2-он
6-(4-Этилпиримидин-5-ил)-1,3,3-триметилиндолин-2-он
6-(6-Аминопиридин-3-ил)-1,3,3-триметилиндолин-2-он
1,3,3-Триметил-6-(6-метилпиридазин-3-ил)индолин-2-он
6-(5-Аминопиридин-3-ил)-1,3,3-триметилиндолин-2-он
6-(3,5-Диметил-пиридин-4-ил)-1,3,3-триметил-1,3-дигидро-индол-2-он
6-(4,6-Диметил-пиримидин-5-ил)-1,3,3-триметил-1,3-дигидро-индол-2-он
6-(2,4-Диметил-пиридин-3-ил)-1,3,3-триметил-1,3-дигидро-индол-2-он
7-Фтор-1,3,3-триметил-6-(пиридин-3-ил)индолин-2-он
1,3,3,7-Тетраметил-6-(пиридин-3-ил)индолин-2-он
5-Фтор-1,3,3-триметил-6-(пиридин-3-ил)индолин-2-он
5-Фтор-1,3,3-триметил-6-(пиридин-4-ил)индолин-2-он
7-Фтор-1,3,3-триметил-6-пиридин-4-ил-1,3-дигидро-индол-2-он
5-Фтор-1,3,3-триметил-6-(2-метилпиридин-4-ил)индолин-2-он
1-Изопропил-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он
5,7-Дифтор-1,3,3-триметил-6-пиридин-3-ил-1,3-дигидро-индол-2-он
5,7-Дифтор-1,3,3-триметил-6-пиримидин-5-ил-1,3-дигидро-индол-2-он
1,3,3,5-Тетраметил-6-(2-метил-пиридин-4-ил)-1,3-дигидро-индол-2-он
5,7-Дифтор-1,3,3-триметил-6-(2-метил-пиримидин-5-ил)-1,3-дигидро-индол-2-он
6-(2-Циклопропилпиримидин-5-ил)-1,3,3-триметил-индолин-2-он
6-(6-Циклопропилпиридазин-3-ил)-1,3,3-триметил-индолин-2-он
1,3,3-Триметил-6-(2-метил-4-пиридил)пирроло[3,2-с]пиридин-2-он
3,3-Диметил-6-(2-метил-4-пиридил)-1Н-пирроло[3,2-с]пиридин-2-он
1,3,3-Триметил-6-(6-морфолинопиридин-3-ил)индолин-2-он
1,3,3-Триметил-6-(2-метилпиримидин-5-ил)пирроло[3,2-с]пиридин-2-он
1-Этил-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он
1,3,3-Триметил-6-(3-метил-4-пиридил)пирроло[3,2-с]пиридин-2-он
1,3,3-Триметил-6-(6-метил-3-пиридил)пирроло[3,2-с]пиридин-2-он
6-(2-Фтор-4-пиридил)-1,3,3-триметил-пирроло[3,2-с]пиридин-2-он
1'-Метил-6'-(2-метилпиридин-4-ил)спиро[циклопропан-1,3'-пирроло[3,2-с]пиридин]-2'(1'Н)-он
1'-Метил-6'-(пиридин-3-ил)спиро[циклопропан-1,3'-пирроло[3,2-с]пиридин]-2'(1'Н)-он или
1,3,3-Триметил-6-пиридазин-4-ил-пирроло[3,2-с]пиридин-2-он.
Одно воплощение изобретения представляет собой соединения формулы I, где Ar представляет собой 6-членную гетероарильную группу, содержащую один или два атома N, и R2 представляет собой R2 представляет собой (СН2)o-циклоалкил, (СН2)о-O-циклоалкил, (СН2)o-низший алкокси, СН2)o-низший алкокси, замещенный атомом галогена, (СН2)o-гетероциклоалкил, необязательно замещенный низшим алкилом, (СН2)o-S(O)2-циклоалкил, низший алкил, замещенный одной или двумя гидроксигруппами, низший алкил, замещенный одной или двумя низшими алкокси, (СН2)o-S(O)2-низший алкил, низший алкил, замещенный атомом галогена, или CH2CH(OH)CF3, а другие заместители являются такими, как описано выше, например, следующие соединения:
1-Циклопропил-5-фтор-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он
1-(Циклопропилметил)-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он
1-(Циклобутилметил)-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он
3,3-Диметил-6-(2-метил-пиримидин-5-ил)-1-оксетан-3-ил-1,3-дигидро-индол-2-он
1-(3-Циклопропоксипропил)-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он
3,3-Диметил-6-(2-метилпиридин-4-ил)-1-(оксетан-3-ил)индолин-2-он
3,3-Диметил-1-(оксетан-3-ил)-6-(пиридин-3-ил)индолин-2-он
3,3-Диметил-6-(6-метил-пиридазин-3-ил)-1-оксетан-3-ил-1,3-дигидро-индол-2-он
1-(3-(Циклопропилсульфонил)пропил)-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он
1-(2-Гидроксиэтил)-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он
1-(3-Гидроксипропил)-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он
3,3-Диметил-6-(2-метилпиримидин-5-ил)-1-(2-(метилсульфонил)этил)индолин-2-он
1-Циклопропил-6-(2-циклопропилпиримидин-5-ил)-3,3-диметил-индолин-2-он
1-Циклопропил-6-(6-циклопропилпиридазин-3-ил)-3,3-диметил-индолин-2-он
6-(6-Циклопропилпиридазин-3-ил)-3,3-диметил-1-(оксетан-3-ил)индолин-2-он
1-Циклопропил-3,3-диметил-6-(2-метил-4-пиридил)пирроло[3,2-с]пиридин-2-он
7-Циклопропил-5,5-диметил-2-(2-метилпиридин-4-ил)-5Н-пирроло[2,3-d]пиримидин-6(7Н)-он
1-Циклопропил-3,3-диметил-6-(6-метил-3-пиридил)пирроло[3,2-с]пиридин-2-он
1-Циклопропил-3,3-диметил-6-(3-метил-4-пиридил)пирроло[3,2-с]пиридин-2-он
1-Циклопропил-3,3-диметил-6-(2-метилпиримидин-5-ил)-1Н-пирроло[3,2-с]пиридин-2(3Н)-он
1-(2-Метоксиэтил)-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он
3,3-Диметил-6-(2-метилпиримидин-5-ил)-1-(2,2,2-трифторэтил)индолин-2-он
3,3-Диметил-6-(2-метилпиримидин-5-ил)-1-(2-(трифторметокси)этил)индолин-2-он
3,3-Диметил-6-(2-метилпиримидин-5-ил)-1-(оксетан-3-илметил)индолин-2-он
3,3-Диметил-6-(2-метилпиримидин-5-ил)-1-(3,3,3-трифтор-2-гидроксипропил)индолин-2-он
1-(3-Фторпропил)-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он
1-(2-Фторэтил)-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он
1'-Циклопропил-6'-(2-метилпиридин-4-ил)спиро[иклопропан-1,3'-пирроло[3,2-с]пиридин]-2'(1'Н)-он
1'-Циклопропил-6'-(пиридин-3-ил)спиро[циклопропан-1,3'-пирроло[3,2-с]пиридин]-2'(1'Н)-он
1-(2,3-Дигидроксипропил)-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он
1-((4S,5R)-4-Гидрокси-5-(гидроксиметил)тетрагидрофуран-2-ил)-3,3-диметил-6-(2-этилпиримидин-5-ил)индолин-2-он
1-(2,3-Диметоксипропил)-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он или
3,3-Диметил-6-(2-метилпиримидин-5-ил)-1-(тетрагидрофуран-3-ил)индолин-2-он.
Одно воплощение изобретения представляет собой соединения формулы I, где Ar представляет собой бициклическую кольцевую систему, содержащую от 1 до 3 гетероатомов, а другие заместители являются такими, как описано выше, например, следующие соединения:
6-(6,7-Дигидро-5Н-циклопента[b]пиридин-3-ил)-1,3,3-триметилиндолин-2-он
6-(2,3-Дигидро-1Н-пиридо[2,3-b][1,4]оксазин-7-ил)-1,3,3-триметилиндолин-2-он
6-(6,7-Дигидро-5Н-пирроло[3,4-b]пиридин-3-ил)-1,3,3-триметилиндолин-2-он
6-(Имидазо[1,2-а]пиридин-7-ил)-1,3,3-триметилиндолин-2-он или
6-(Имидазо[1,2-а]пиридин-6-ил)-1,3,3-триметилиндолин-2-он.
Одно воплощение изобретения представляет собой соединения формулы I, где R1 представляет собой 5-членную гетероарильную группу, содержащую от 1 до 3 гетероатомов, выбранных из N, S или О, и R2 представляет собой атом водорода, а другие заместители являются такими, как описано выше, например, следующие соединения:
6-Имидазол-1-ил-3,3-диметил-1,3-дигидро-индол-2-он
3,3-Диметил-6-(3-метил-1,2,4-оксадиазол-5-ил)индолин-2-он
3,3-Диметил-6-(4-метил-1Н-имидазол-1-ил)индолин-2-он
3,3-Диметил-6-(1-метил-1Н-пиразол-4-ил)индолин-2-он
6-(5-Циклопропил-1,3,4-оксадиазол-2-ил)-3,3-диметилиндолин-2-он
6-(4-Циклопропил-1Н-имидазол-1-ил)-3,3-диметилиндолин-2-он
3,3-Диметил-6-(5-метил-1,3,4-оксадиазол-2-ил)индолин-2-он
6-(1-Циклопропил-1Н-пиразол-4-ил)-3,3-диметилиндолин-2-он
6-(1-Циклопропил-1Н-имидазол-4-ил)-3,3-диметилиндолин-2-он
6-(4-Изопропил-1Н-имидазол-1-ил)-3,3-диметилиндолин-2-он
3,3-Диметил-6-[5-[1-(трифторметил)циклопропил]-1,3,4-оксадиазол-2-ил]индолин-2-он
6-(5-Этил-1,3,4-оксадиазол-2-ил)-3,3-диметил-индолин-2-он
3,3-Диметил-6-(1-метил-1Н-имидазол-4-ил)индолин-2-он
3,3-Диметил-6-[5-(оксетан-3-ил)-1,3,4-оксадиазол-2-ил]индолин-2-он
3,3-Диметил-6-(2-метилоксазол-5-ил)индолин-2-он
6-(4-Этилимидазол-1-ил)-3,3-диметил-индолин-2-он
6-(1,3-Диметил-1Н-пиразол-5-ил)-3,3-диметилиндолин-2-он
3,3-Диметил-6-(1-метил-1Н-пиразол-3-ил)индолин-2-он
6-(5-(Гидроксиметил)-1,3,4-оксадиазол-2-ил)-3,3-диметилиндолин-2-он
3,3-Диметил-6-[4-(трифторметил)имидазол-1-ил]индолин-2-он
3,3-Диметил-6-[4-(2,2,2-трифтор-1-гидрокси-этил)имидазол-1-ил]индолин-2-он или
6-[4-(1-Гидроксиэтил)имидазол-1-ил]-3,3-диметил-индолин-2-он.
Одно воплощение изобретения представляет собой соединения формулы I, где R1 представляет собой 5-членную гетероарильную группу, содержащую от 1 до 3 гетероатомов, выбранных из N, S или О, и R2 представляет собой низший алкил, а другие заместители являются такими, как описано выше, например, следующие соединения:
1,3,3-Триметил-6-(3-метил-1,2,4-оксадиазол-5-ил)индолин-2-он
6-(1Н-Имидазол-1-ил)-1,3,3-триметилиндолин-2-он
1,3,3-Триметил-6-(3-(трифторметил)-1,2,4-оксадиазол-5-ил)индолин-2-он
1,3,3-Триметил-6-(4-метил-1Н-имидазол-1-ил)индолин-2-он
1,3,3-Триметил-6-(5-метил-1Н-имидазол-1-ил)индолин-2-он
6-(1,5-Диметил-1Н-имидазол-2-ил)-1,3,3-триметилиндолин-2-он
1,3,3-Триметил-6-(2-метил-1Н-имидазол-5-ил)индолин-2-он
6-(1Н-Имидазол-4-ил)-1,3,3-триметилиндолин-2-он
1,3,3-Триметил-6-(оксазол-5-ил)индолин-2-он
1,3,3-Триметил-6-(оксазол-4-ил)индолин-2-он
1,3,3-Триметил-6-(2-метилоксазол-5-ил)индолин-2-он
1,3,3-Триметил-6-(5-метил-1,3,4-тиадиазол-2-ил)индолин-2-он
1,3,3-Триметил-6-(1,3,4-тиадиазол-2-ил)индолин-2-он
6-(2-Циклопропилоксазол-5-ил)-1,3,3-триметилиндолин-2-он
1,3,3-Триметил-6-(2-(4-метилпиперазин-1-ил)оксазол-5-ил)индолин-2-он
1,3,3-Триметил-6-(2-метилоксазол-4-ил)индолин-2-он
1,3,3-Триметил-6-(1-метил-1Н-пиразол-4-ил)индолин-2-он
1,3,3-Триметил-6-(5-метил-1,3,4-оксадиазол-2-ил)индолин-2-он
6-(5-Циклопропил-1,3,4-оксадиазол-2-ил)-1,3,3-триметилиндолин-2-он
6-(4-Циклопропил-1Н-имидазол-1-ил)-1,3,3-триметилиндолин-2-он
6-(5-Циклопропил-1Н-имидазол-1-ил)-1,3,3-триметилиндолин-2-он
6-(1-Циклопропил-1Н-пиразол-4-ил)-1,3,3-триметилиндолин-2-он
6-(1-Циклопропил-1Н-имидазол-4-ил)-1,3,3-триметилиндолин-2-он
1,3,3-Триметил-6-(1-метил-1Н-имидазол-4-ил)индолин-2-он
6-(4-Изопропил-1Н-имидазол-1-ил)-1,3,3-триметилиндолин-2-он
6-(1-Этил-1Н-имидазол-4-ил)-1,3,3-триметилиндолин-2-он
1,3,3-Триметил-6-(1-(2,2,2-трифторэтил)-1Н-имидазол-4-ил)индолин-2-он
6-(5-Этил-1,3,4-оксадиазол-2-ил)-1,3,3-триметил-индолин-2-он
6-(3-Циклопропилизоксазол-5-ил)-1,3,3-триметилиндолин-2-он
1,3,3-Триметил-6-(3-метилизоксазол-5-ил)индолин-2-он
6-(3-(Метоксиметил)изоксазол-5-ил)-1,3,3-триметилиндолин-2-он
1,3,3-Триметил-6-(2-(тетрагидро-2Н-пиран-4-ил)оксазол-5-ил)индолин-2-он
1,3,3-Триметил-6-[5-(оксетан-3-ил)-1,3,4-оксадиазол-2-ил]индолин-2-он
1,3,3-Триметил-6-[4-(трифторметил)имидазол-1-ил]индолин-2-он
6-(4-Этил-1Н-имидазол-1-ил)-1,3,3-триметилиндолин-2-он
6-(2-(Гидроксиметил)оксазол-5-ил)-1,3,3-триметилиндолин-2-он
6-[4-(1-Гидроксиэтил)имидазол-1-ил]-1,3,3-триметил-индолин-2-он
Одно воплощение изобретения представляет собой соединения формулы I, где R1 представляет собой 5-членную гетероарильную группу, содержащую от 1 до 3 гетероатомов, выбранных из N, S или О, и R2 представляет собой (СН2)o-циклоалкил, (СН2)o-O-циклоалкил, (СН2)o-низший алкокси, (СН2)o-низший алкокси, замещенный атомом галогена, (СН2)o-гетероциклоалкил, необязательно замещенный низшим алкилом, (СН2)o-S(O)2-циклоалкил, низший алкил, замещенный одной или двумя гидроксигруппами, низший алкил, замещенный одной или двумя низшими алкокси, (СН2)o-S(O)2-низший алкил, низший алкил, замещенный атомом галогена, или CH2CH(OH)CF3, а другие заместители являются такими, как описано выше, например, следующие соединения:
1-Циклопропил-3,3-диметил-6-(1-метил-1Н-пиразол-4-ил)индолин-2-он
1-Циклопропил-3,3-диметил-6-(4-метил-1Н-имидазол-1-ил)индолин-2-он
1-Циклопропил-3,3-диметил-6-(5-метил-1Н-имидазол-1-ил)индолин-2-он
1-Циклопропил-6-(4-циклопропил-1Н-имидазол-1-ил)-3,3-диметилиндолин-2-он
1-Циклопропил-6-(5-циклопропил-1Н-имидазол-1-ил)-3,3-диметилиндолин-2-он
1-Циклопропил-6-(5-циклопропил-1,3,4-оксадиазол-2-ил)-3,3-диметилиндолин-2-он
1-Циклопропил-3,3-диметил-6-(5-метил-1,3,4-оксадиазол-2-ил)индолин-2-он
1-Циклопропил-6-(1-циклопропил-1Н-пиразол-4-ил)-3,3-диметилиндолин-2-он
1-Циклопропил-3,3-диметил-6-(1-метил-1Н-имидазол-4-ил)индолин-2-он
1-Циклопропил-6-(1Н-имидазол-4-ил)-3,3-диметил-1Н-пирроло[3,2-с]пиридин-2(3Н)-он
1-Циклопропил-3,3-диметил-6-[5-(трифторметил)-1,3,4-оксадиазол-2-ил]индолин-2-он
1-Циклопропил-3,3-диметил-6-[4-(трифторметил)имидазол-1-ил]индолин-2-он
1-Циклопропил-3,3-диметил-6-[5-(оксетан-3-ил)-1,3,4-оксадиазол-2-ил]индолин-2-он
1-Циклопропил-6-[4-(1-гидроксиэтил)имидазол-1-ил]-3,3-диметил-индолин-2-он или
1-Циклопропил-3,3-диметил-6-[4-(2,2,2-трифтор-1-гидрокси-этил)имидазол-1-ил]индолин-2-он.
Еще одно воплощение изобретения представляет собой соединения формулы I, где X представляет собой N, и X1 представляет собой СН, а другие заместители являются такими, как описано выше, например, следующие соединения:
1,3,3-Триметил-6-(2-метил-4-пиридил)пирроло[3,2-с]пиридин-2-он
3,3-Диметил-6-(2-метил-4-пиридил)-1Н-пирроло[3,2-с]пиридин-2-он
1-Циклопропил-3,3-диметил-6-(2-метил-4-пиридил)пирроло[3,2-с]пиридин-2-он
3,3-Диметил-6-(2-метилпиримидин-5-ил)-1Н-пирроло[3,2-с]пиридин-2-он
1,3,3-Триметил-6-(2-метилпиримидин-5-ил)пирроло[3,2-с]пиридин-2-он
1-Циклопропил-6-(1Н-имидазол-4-ил)-3,3-диметил-1Н-пирроло[3,2-с]пиридин-2(3Н)-он
3,3-Диметил-6-(3-метилпиридин-4-ил)-1Н-пирроло[3,2-с]пиридин-2(3Н)-он
1-Циклопропил-3,3-диметил-6-(6-метил-3-пиридил)пирроло[3,2-с]пиридин-2-он
3,3-Диметил-6-(6-метил-3-пиридил)-1Н-пирроло[3,2-с]пиридин-2-он
1-Циклопропил-3,3-диметил-6-(3-метил-4-пиридил)пирроло[3,2-с]пиридин-2-он
1,3,3-Триметил-6-(3-метил-4-пиридил)пирроло[3,2-с]пиридин-2-он
1,3,3-Триметил-6-(6-метил-3-пиридил)пирроло[3,2-с]пиридин-2-он
1-Циклопропил-3,3-диметил-6-(2-метилпиримидин-5-ил)-1Н-пирроло[3,2-с]пиридин-2(3Н)-он
6-(2-Фтор-4-пиридил)-1,3,3-триметил-пирроло[3,2-с]пиридин-2-он
1'-Метил-6'-(2-метилпиридин-4-ил)спиро[циклопропан-1,3'-пирроло[3,2-с]пиридин]-2'(1'Н)-он
1'-Метил-6'-(пиридин-3-ил)спиро[циклопропан-1,3'-пирроло[3,2-c]пиридин]-2'(1'Н)-он
1'-Циклопропил-6,-(2-метилпиридин-4-ил)спиро[циклопропан-1,3'-пирроло[3,2-с]пиридин]-2'(1'Н)-он
1'-Циклопропил-6'-(пиридин-3-ил)спиро[циклопропан-1,3'-пирроло[3,2-с]пиридин]-2'(1'Н)-он или
1,3,3-Триметил-6-пиридазин-4-ил-пирроло[3,2-с]пиридин-2-он.
Еще одно воплощение изобретения представляет собой соединения формулы I, где X представляет собой N, и X1 представляет собой N, а другие заместители являются такими, как описано выше, например, следующее соединение:
7-Циклопропил-5,5-диметил-2-(2-метилпиридин-4-ил)-5Н-пирроло[2,3-d]пиримидин-6(7Н)-он.
Еще одно воплощение изобретения представляет собой соединения формулы I, где пунктирная линия представляет собой связь, а другие заместители являются такими, как описано выше, например, следующие соединения:
1'-Метил-6'-(2-метилпиридин-4-ил)спиро[циклопропан-1,3'-пирроло[3,2-с]пиридин]-2'(1'Н)-он
1'-Метил-6'-(пиридин-3-ил)спиро[циклопропан-1,3'-пирроло[3,2-с]пиридин]-2'(1'Н)-он
1'-Циклопропил-6'-(2-метилпиридин-4-ил)спиро[циклопропан-1,3'-пирроло[3,2-с]пиридин]-2'(1'Н)-он или
1'-Циклопропил-6'-(пиридин-3-ил)спиро[циклопропан-1,3'-пирроло[3,2-с]пиридин]-2'(1'Н)-он.
Настоящие соединения формулы I и их фармацевтически приемлемые соли могут быть получены способами, известными в данной области техники, например, способами, описанными ниже, включающими:
а) взаимодействие соединения формулы

с соединением формулы

с получением соединения формулы

где Y представляет собой атом галогена (такой как, например, атом брома или йода), R' представляет собой атом водорода или низший алкил (где -B(OR')2 представляет собой, например, бороновую кислоту или пинаколовый эфир бороновой кислоты), а дополнительные группы имеют значение, как описано выше, и
при желании преобразование полученных соединений в фармацевтически приемлемые соли присоединения кислоты;
или
b) преобразование подходящего предшественника формулы

путем применения стандартных последовательностей реакций для образования гетероарильного заместителя
с получением соединения формулы

где PC представляет собой -CO2R', -CO2H, -СНО, -СН2ОН или -(CO)R', где R' = низший алкил,
а дополнительные группы имеют такое же значение, как описано выше, и
при желании преобразование полученных соединений в фармацевтически приемлемые соли присоединения кислоты.
Получение соединений формулы I по настоящему изобретению может быть выполнено последовательными или конвергентными путями синтеза. Синтез соединений по изобретению представлен на приведенных ниже схемах. Специалисты в данной области техники обладают необходимыми навыками для проведения реакций и очистки полученных в результате продуктов. Заместители и индексы, используемые в последующем описании способов, имеют значение, приведенное в настоящем документе ниже, если не указано противоположное.
Более подробно соединения формулы I могут быть получены способами, приведенными ниже, способами, приведенными в примерах, или аналогичными способами. Соответствующие условия реакции для индивидуальных стадий реакции известны специалистам в данной области техники. Последовательность реакции не ограничена последовательностью, приведенной на схеме, тем не менее, в зависимости от исходных веществ и их соответствующей реакционной способности последовательность стадий реакции может быть свободно изменена. Исходные вещества либо имеются в продаже, либо могут быть получены способами, аналогичными приведенным ниже способам, способами, описанными в примерах, или способами, известными в данной области техники.


где Y представляет собой атом галогена (такой как, например, атом брома или йода), R' представляет собой атом водорода или низший алкил (где -B(OR')2 представляет собой, например, бороновую кислоту или пинаколовый эфир бороновой кислоты).
Настоящие соединения формулы I и их фармацевтически приемлемые соли могут быть получены путем сочетания Сузуки соответствующих гетероарилбороновых кислот или сложных эфиров 3 с галогенидами 2 или путем сочетания Сузуки соответствующих гетероарилбороновых кислот или сложных эфиров 6 с гетероарилгалогенидами 5 (см. схему 1). Гетероарилбороновые кислоты и сложные эфиры 3 либо имеются в продаже, либо могут быть получены из соответствующих галогенидов 5 общеизвестными методами, например, путем обработки галогенидов 5 бис(пинаколато)дибором в присутствии палладиевого катализатора. Бороновые кислоты и сложные эфиры 6 могут быть получены из соответствующих галогенидов 2 общеизвестными методами, например, путем обработки бис(пинаколато)дибором в присутствии палладиевого катализатора.
В случае R2 = Н это положение можно модифицировать с использованием, например, алкилгалогенидов или гетероциклоалкилгалогенидов в присутствии соответствующего основания. R2 может быть модифицирован путем соответствующих реакций, таких как дигидрокисление тетроксидом осмия в присутствии моногидрата N-оксида 4-метилморфолина и восстановительная обработка, и может быть дополнительно алкилирован с помощью алкилгалогенидов, таких как MeI, в присутствии соответствующего основания, такого как NaH. Либо, где R2 представляет собой защитную группу, такую как, например, 4-метоксибензил или 2-триметилсилилэтоксиметил, она может быть удалена общеизвестными методами, приводящими к R2, представляющему собой атом водорода.

где Y представляет собой атом галогена (такой как, например, атом брома или йода), R' представляет собой низший алкил (например, бутил).
Альтернативно соединения формулы I и их фармацевтически приемлемые соли могут быть получены путем катализируемого палладием сочетания Стилле гетероарилстаннанов 7 с галогенидами 2 (см. схему 2).


Соединение формулы Ia (см. схему 3), где R1 = пиримидил и замещен R'R''N (R' и R'' представляют собой независимо друг от друга атом водорода или низший алкил), может быть получен из соединений 8 (полученных согласно схеме 1) путем окисления метилтиоэфира, например, mCPBA, с последующим замещением метилсульфона аминами R'R''NH.

Альтернативно настоящие соединения формулы I и их фармацевтически приемлемые соли могут быть получены из подходящих предшественников 4 (PC представляет собой -CO2R', -CO2H, -СНО, -СН2ОН или -(CO)R', где R' = низший алкил) путем применения стандартной последовательности реакций для образования гетероарильного заместителя (см. схему 4), и как проиллюстрировано на приведенных ниже схемах. Альтернативно соединения формулы I могут быть получены путем реакции вытеснения атома галогена 2 (Y представляет собой атом галогена, такой как, например, атом брома или йода) гетероарильным соединением 10 (таким как, например 1Н-имидазолы), например, в каталитических условиях (таких как палладиевый или медный катализ).

1,2,4-Оксадиазолы формулы Ib могут быть получены путем конденсации кислот 11 с N-гидроксиамидинами R1C(=NOH)NH2, например, в присутствии CDI (см. схему 5).

Имидазолы формулы Ic могут быть получены путем конденсации глиоксаля, формальдегида и ацетата аммония с анилинами 12 (см. схему 6).

Имидазолы формулы Id могут быть получены, начиная с замещения галогенидов 2 цианидом, например, цианидом цинка, в присутствии палладиевого катализатора. В результате добавления LiHMDS к нитрилу с последующим кислотным гидролизом получают амидины 14, которые можно конденсировать с α-галогенметилкетонами R1'-C(=O)CH2Y (Y представляет собой атом галогена, такой как атом брома, хлора, и R1' представляет собой низший алкил, низший алкил, замещенный атомом галогена, циклоалкил или гетероциклоалкил) в присутствии основания с получением имидазолов Id (см. схему 7).

Имидазолы формулы Ie могут быть получены, начиная с карбоновых кислот 11. В результате преобразования в амиды Вайнреба 15 и взаимодействия с метильным реагентом Гриньяра получают метилкетоны 16, которые можно бромировать, например, трибромидом тетра-н-бутиламмония. В результате конденсации с амидинами R1C(=NH)NH2 получают имидазолы Ie (R1 представляет собой низший алкил, низший алкил, замещенный атомом галогена, циклоалкил или гетероциклоалкил), соединения 17 можно также конденсировать с амидами, такими как формамид, с получением имидазолов, где R1 представляет собой атом водорода или низший алкил. Ie можно дополнительно превращать в имидазолы формулы Im, где R1 представляет собой низший алкил, например, путем использования алкилгалогенидов в присутствии подходящего основания или бороновой кислоты и источника меди (II) в условиях Чана-Лама, см. схему 8.

Оксазолы формулы If могут быть получены путем замещения бромидов 17 азидом натрия с последующим взаимодействием с хлорангидридами R1C(=O)Cl в присутствии трифенилфосфина (R1 представляет собой низший алкил, низший алкил, замещенный атомом галогена, циклоалкил или гетероциклоалкил). В случаях, где R1 представляет собой низший алкил, замещенный ацетокси, его можно дополнительно модифицировать путем расщепления настоящего сложного эфира с использованием общеизвестных способов, приводящего к R1, представляющему собой низший алкил, замещенный гидрокси, см. схему 9.

Оксазолы формулы Ig могут быть получены путем преобразования карбоновых кислот 11 в альдегиды 20 с последовательности восстановления (например, комплексом борана с тетрагидрофураном) - окисления (например, диоксидом марганца). В результате взаимодействия альдегида с TOSMIC (тозилметилизоцианидом) получают оксазолы Ig. Эти соединения можно перевести в соединения формулы Ie, где R1 представляет собой атом водорода или низший алкил, путем взаимодействия с амидами, такими как формамид, а затем в соединения формулы Im, как уже описано на схеме 8, см. схему 10.

В результате взаимодействия метилкетонов 16 с ацетатом таллия и трифторметансульфоновой кислотой получают оксазолы формулы Ih (см. схему 11).

Соединения формулы Ik, где Ar = оксазолил, замещенный R'R''N (R' и R'' независимо друг от друга представляют собой атом водорода или низший алкил) могут быть получены путем галогенирования оксазолов Ig (Y = атом галогена), например, гексахлорэтаном, после удаления защиты основанием LiHMDS с последующим замещением амином R'R''NH при нагревании в традиционных условиях или в условиях микроволнового нагревания (см. схему 12).

Оксазолы формулы II могут быть получены путем конденсации α-бромкетонов 17 с амидами R1C(=O)NH2 (R1 представляет собой низший алкил, низший алкил, замещенный атомом галогена, циклоалкил или гетероциклоалкил), см. схему 13.

Соединения общей формулы 2, где R2 = метил, могут быть, например, получены путем триметилирования 6-галоген-оксиндолов 21. Me-LG, где LG представляет собой уходящую группу, такую как атом йода, атом брома, атом хлора, тозилат, в присутствии основания, такого как гидрид натрия (см. схему 14), и где Y представляет собой атом галогена.
Соединения общей формулы 2, где R2 ≠ метил, могут быть получены, например, путем диметилирования 6-галоген-оксиндолов 21, где Me-LG (где LG представляет собой уходящую группу, такую как атом йода, атом брома, атом хлора, тозилат) в присутствии основания, такого как трет-бутоксид калия, и в присутствии комплекса бромида меди (I) с диметилсульфидом. Затем диалкилированный продукт 2а можно преобразовывать в соединения 2 путем алкилирования R2-LG в присутствии основания, такого как гидрид натрия или карбонат цезия, или путем сочетания бороновых кислот R2-B(OH)2 или сложных эфиров R2-B(OR')2 (например, R2- 4,4,5,5-тетраметил-[1,3,2]диоксаборолана) в условиях металлического катализа (такого как, например, катализ палладием (0) или медью (II)) в присутствии основания, такого как, например, бис(триметилсилил)амид натрия или карбонат натрия.
Соединения общей формулы 2, где R2 = 3-(циклопропилтио)пропил, и LG = бромид, R2-LG могут быть получены путем взаимодействия 3-меркаптопропан-1-ола с бромциклопропаном в присутствии основания с последующим преобразованием спирта в бромид, например, с тетрабромметаном и трифенилфосфином.

Соединения общей формулы 2b, где Y = I, R3' = Н или F, и R3'' = F, могут быть получены, например, путем алкилирования оксиндола 22 по аналогии со схемой 14 с последующим орто-силилированием путем обработки LDA и триметилсилилхлоридом, а затем обмена силильной группы с монохлоридом йода (см. схему 15).

Соединения общей формулы 21 могут быть, например, получены путем восстановления производных изатина 25, например, гидразином, где Y представляет собой атом галогена (см. схему 16).

Альтернативно соединения общей формулы 21а, где Y = Br, могут быть получены, например, начиная с производных 4-бром-1-фтор-2-нитро-бензола 26, путем нуклеофильного замещения фторида сложным эфиром малонатом в присутствии основания, такого как гидрид натрия (см. схему 17). Гидролиз сложного эфира и декарбоксилирование может быть выполнено, например, путем нагревания в присутствии соляной кислоты с получением кислоты 28. После восстановления нитрогруппы, например, железом в уксусной кислоте, следует замыкание цикла с образованием лактама 21а.

Промежуточные гидразиды 29 могут быть получены из сложного эфира 30 либо посредством превращения в гидразиды 31 гидратом гидразина в метаноле, а затем в гидразиды 29 путем взаимодействия с R1-COOH способами, такими как сочетание TBTU, либо путем омыления соединения 30 с получением кислот 11, а затем путем взаимодействия с R1-гидразидами способами, такими как сочетание HOBt/EDCI, промежуточные соединения 29 впоследствии можно превращать в соединения формулы In путем взаимодействия, например, с пара-толуолсульфонилхлоридом в присутствии основания, такого как триэтиламин, см. схему 18.

Соединения формулы 21b можно превращать в спироциклические промежуточные соединения 31 путем взаимодействия с этилендибромидом в присутствии сильного основания. Эти соединения могут быть дополнительно модифицированы, как описано на схеме 14, с получением промежуточных соединений 32, которые можно использовать аналогично соединениям формулы 2, см. схему 19. Y представляет собой атом галогена, такой как атом брома или йода.
Соединения формулы Io и Ip, где R1 представляет собой низший алкил, галогеналкил, гидроксиалкил или их комбинацию, могут быть получены путем взаимодействия промежуточных соединений формулы 2 с имидазолами формулы 33 в условиях Ульмана, где защиту положения R1, например, защищенных TBMDS гидроксигрупп, можно впоследствии удалить с получением R1. Соединения формулы 33 либо имеются в продаже, либо могут быть получены из имидазола, например, путем взаимодействия с трифторацетальдегид-метил-полуацеталем и последующей защиты функциональной группы гидрокси TBDMS-Cl в присутствии основания, такого как триэтиламин, см. схему 20.

Соединения формулы Iq, где R1 = низший алкил или алкоксиалкил, могут быть получены путем взаимодействия кетонов 16 с R1-сложными эфирами в присутствии сильного основания, такого как гидрид натрия, с получением 1,3-дикетонов 34, которые можно впоследствии подвергать замыканию кольца с гидрохлоридом гидроксиламина, см. схему 21.

Соединения формулы Ig могут быть получены альтернативно схеме 10 путем взаимодействия галогенидов 2 с оксазолом в присутствии ацетата палладия (II), 2-ди-трет-бутилфосфино-3,4,5,6-тетраметил-2',4',6'-три-изо-пропилдифенил-пивалиновой кислоты и карбоната калия. Эти соединения можно далее превращать в соединения формулы Ir, где R1 представляет собой низший алкил, путем взаимодействия с алкилгалогенидами в присутствии комплекса борана с тетрагидрофураном и сильного основания, такого как н-бутиллитий, см. схему 22.

Соединения формулы Is могут быть получены, как описано ниже, путем взаимодействия этил-2-(2,4,6-трихлорпиримидин-5-ил)ацетата с R2-NH2 в присутствии основания, такого как диизопропилэтиламин, с получением промежуточных соединений структуры 35. Эти соединения можно диметилировать и подвергать замыканию цикла с получением соединений 36 путем взаимодействия с метилйодидом в присутствии основания, такого как карбонат цезия. Эти соединения можно далее функционализировать до соединений 37 способами, уже описанными на схеме 1. Наконец, соединения формулы Is получают путем гидрогенизации в присутствии палладия на угле, см. схему 23.
Экспериментальный раздел
Приведенные ниже примеры предложены для иллюстрации изобретения. Их не следует рассматривать как ограничивающие объем изобретения, но исключительно как репрезентативные.
Сокращения:
Brettphos, 2-(дициклогексилфосфино)-3,6-диметокси-2'-4'-6'-три-изопропил-1,1'-дифенил;
CBr4, тетрабромметан;
CDCl3, дейтериохлороформ;
CDI, 1,1'-карбонилдиимидазол;
CH2Cl2, дихлорметан;
СО, монооксид углерода;
Cs2CO3, карбонат цезия;
CuI, йод ид меди (I);
DIPEA, диизопропилэтиламин;
ДМА, N,N-диметилацетамид;
DMAP, 4-диметиламинопиридин;
ДМФ, N,N-диметилформамид;
ДМСО, диметилсульфоксид;
EDCI, гидрохлорид N1-((этилимино)метилен)-N3,N3-диметилпропан-1,3-диамина;
ИЭР, ионизация электрораспылением;
EtOAc, этилацетат;
H2O, вода;
HATU, O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат;
HCl, соляная кислота;
HOBt, 1Н-бензо[d][1,2,3]триазол-1-ол;
ВЭЖХ, высокоэффективная жидкостная хроматография;
KOH, гидроксид калия;
LiBH4, боргидрид лития;
LiHMDS, гексаметилдисилазид лития;
mCPBA, 3-хлорпербензойная кислота;
MeI, метилиодид;
МеОН, метанол;
МС, масс-спектр;
Na2CO3, карбонат натрия;
Na2SO4, сульфат натрия;
NaH, гидрид натрия;
NaHCO3, бикарбонат натрия;
NaOH, гидроксид натрия;
NaOtBu, трет-бутоксид натрия;
NH4Cl, хлорид аммония;
NMP, 1-метил-2-пирролидон;
ЯМР, спектр ядерного магнитного резонанса;
Pd(dppf)Cl2, [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II);
Pd(PPh3)4, тетракис(трифенилфосфин)палладий(0);
Pd2dba3.CHCl3, комплекс трис(дибензилиденацетон)дипалладия(0) и хлороформа;
СКФ, сверхкритическая флюидная хроматография;
TBAF, фторид тетрабутиламмония;
TBDMS-Cl, трет-бутилдиметилхлорсилан;
ТБМЭ, трет-бутилметиловый эфир;
TBTU, тетрафторборат 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония;
t-BuOH, трет-бутанол;
ТФУ, трифторуксусная кислота;
ТГФ, тетрагидрофуран;
ТРРО, оксид трифенилфосфина;
Ксантфос, 4,5-бис(дифенилфосфино)-9,9-диметилксантин.
Общие методы: Хроматографию на силикагеле проводили, используя либо предварительно набитые картриджи, такие как, например, SiliCycle® SiliaSep™ ОТ силикагель 40-63 мкм или SiliCycle® SiliaSep™ ОТ аминный силикагель 40-63 мкм, на системе, такой как Teledyne Isco CombiFlash® Rf 200, или автономные стеклянные колонки с силикагелем 60 40-63 мкм. МС измеряли на устройстве, таком как Waters ACQUITY-SQD. Спектры ЯМР измеряли на устройстве, таком как Bruker Avance I 300.
Пример 1
1,3,3-Триметил-6-(пиридин-4-ил)индолин-2-он

а) 6-Бром-1,3,3-триметилиндолин-2-он
В атмосфере аргона NaH (60% на минеральном масле, 7,32 г, 183 ммоль) суспендировали в безводном ТГФ (45 мл). Суспензию 6-броминдолин-2-она (10 г, 45,7 ммоль) в безводном ТГФ (108 мл) добавляли порциями в течение 10 минут, поддерживая при этом температуру ниже 27°С. Реакционную смесь подогревали до 25°С и добавляли по каплям MeI (11,4 мл, 183 ммоль) в течение 1 часа, при этом внутреннюю температуру осторожно поддерживали между 24 и 27°С. Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Осторожно добавляли насыщенный водный раствор NH4Cl (20 мл) при 10-15°С. Смесь разбавляли EtOAc, H2O и насыщенным водным раствором NaHCO3. Водную фазу экстрагировали EtOAc, органические слои промывали насыщенным водным раствором NaHCO3, объединяли и высушивали Na2SO4. Растворитель выпаривали, и остаток очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде светло-красного твердого вещества (7,0 г). Смешанные фракции снова очищали препаративной ВЭЖХ с получением еще 3,1 г соединения, указанного в заголовке.
МС ИЭР (m/z): 254,1, 256,2 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.19 (dd, J=1.5, 7.8 Гц, 1Н), 7.06 (d, J=7.9 Гц, 1Н), 6.99 (d, J=1.6 Гц, 1Н), 3.19 (s, 3Н), 1.35 (s, 6Н).
b) 1,3,3-Триметил-6-(пиридин-4-ил)индолин-2-он
К раствору 6-бром-1,3,3-триметилиндолин-2-она (250 мг, 984 мкмоль) и пиридин-4-бороновой кислоты (121 мг, 984 мкмоль) в диоксане (3,17 мл) добавляли 2 М водный раствор Na2CO3 (1,06 мл). Из реакционного сосуда откачивали воздух и продували его аргоном четыре раза, и добавляли [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (36,0 мг, 49,2 мкмоль). Затем реакционную смесь нагревали до образования флегмы в течение 24 часов. Реакционную смесь разбавляли водой, и водную фазу экстрагировали этилацетатом. Объединенные органические слои промывали 1 М водным раствором Na2CO3 и высушивали над Na2SO4. Растворитель выпаривали, и остаток очищали флэш-хроматографией на силикагеле, используя EtOAc/дихлорметан в качестве элюента. Соединение, указанное в заголовке, было получено в виде желтого твердого вещества (138 мг).
МС ИЭР (m/z): 253,2 [(М+Н)+].
1Н ЯМР (ДМСО-d6, 300 МГц) δ = 8.64 (d, J=6.1 Гц, 2Н), 7.75 (d, J=5.9 Гц, 2Н), 7.55-7.39 (m, 3Н), 3.22 (s, 3Н), 1.31 (s, 6Н).
Пример 2
1,3,3-Триметил-6-(2-метилпиридин-4-ил)индолин-2-он

Получили по аналогии с примером 1b из 6-бром-1,3,3-триметилиндолин-2-она (пример 1а) и 2-метилпиридин-4-бороновой кислоты. Соединение, указанное в заголовке, было получено в виде коричневого масла.
МС ИЭР (m/z): 267,2 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.56 (d, J=5.2 Гц, 1Н), 7.41-7.28 (m, 4Н), 7.05 (s, 1Н), 3.36-3.23 (m, 3Н), 2.64 (s, 3Н), 1.42 (s, 6Н).
Пример 3
1,3,3-Триметил-6-(пиридин-3-ил)индолин-2-он

Получили по аналогии с примером 1b из 6-бром-1,3,3-триметилиндолин-2-она (пример 1а) и пиридин-3-бороновой кислоты. Соединение, указанное в заголовке, было получено в виде светло-желтого твердого вещества.
МС ИЭР (m/z): 253,1 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.86 (d, J=2.2 Гц, 1Н), 8.62 (dd, J=1.4, 4.6 Гц, 1Н), 7.88 (td, J=1.9, 7.9 Гц, 1Н), 7.38 (dd, J=4.8, 7.9 Гц, 1Н), 7.31 (d, J=7.5 Гц, 1Н), 7.26 (dd, J=1.4, 7.5 Гц, 1Н), 7.02 (d, J=1.2 Гц, 1Н), 3.28 (s, 3Н), 1.42 (s, 6Н).
Пример 4
1,3,3-Триметил-6-(пиримидин-5-ил)индолин-2-он

Получили по аналогии с примером 1b из 6-бром-1,3,3-триметилиндолин-2-она (пример 1а) и пиримидин-5-илбороновой кислоты. Соединение, указанное в заголовке, было получено в виде светло-красного твердого вещества.
МС ИЭР (m/z): 254,2 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 9.23 (s, 1Н), 8.96 (в, 2Н), 7.35 (d, J=7.7 Гц, 1Н), 7.26 (dd, J=1.4, 7.5 Гц, 1Н), 7.00 (d, J=1.2 Гц, 1Н), 3.29 (s, 3Н), 1.43 (3, 6Н).
Пример 5
1,3,3-Триметил-6-(пиридин-2-ил)индолин-2-он

Из раствора 6-бром-1,3,3-триметилиндолин-2-она (пример 1а, 150 мг, 590 мкмоль) в ТГФ (3 мл) откачивали воздух 3 раза и продували аргоном. Добавляли 2-(трибутилстаннил)пиридин (266 мг, 231 мкл, 649 мкмоль), дихлорид бис(трифенилфосфин)палладия(II) (21,1 мг, 29,5 мкмоль) и йодид меди(I) (5,62 мг, 29,5 мкмоль), и смесь нагревали до образования флегмы. Через 3 часа снова добавляли 2-(трибутилстаннил)пиридин (266 мг, 231 мкл, 649 мкмоль), дихлорид бис(трифенилфосфин)палладия(II) (21,1 мг, 29,5 мкмоль) и йодид меди(I) (5,62 мг, 29,5 мкмоль), и смесь перемешивали в течение 60 с обратным холодильником. Смесь фильтровали через слой силикагеля, промывали EtOAc, и полученный раствор концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде светло-желтого твердого вещества (38 мг).
МС ИЭР (m/z): 253,1 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.70 (d, J=4.6 Гц, 1Н), 7.83-7.70 (m, 2Н), 7.62 (dd, J=1.4, 7.7 Гц, 1Н), 7.57 (s, 1Н), 7.32-7.22 (m, 2Н), 3.31 (s, 3Н), 1.41 (s, 6Н).
Пример 6
3,3-Диметил-6-(пиридин-3-ил)индолин-2-он

Получили по аналогии с примером 1b из 6-бром-3,3-диметил-индолин-2-она (пример 24а) и пиридин-3-бороновой кислоты. Соединение, указанное в заголовке, было получено в виде светло-коричневого твердого вещества.
МС ИЭР (m/z): 239,1 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.92 (br s, 1Н), 8.84 (d, J=2.2 Гц, 1Н), 8.61 (dd, J=1.4, 4.6 Гц, 1Н), 7.86 (td, J=1.9, 7.9 Гц, 1Н), 7.37 (dd, J=4.8, 7.9 Гц, 1Н), 7.30 (d, J=7.7 Гц, 1Н), 7.25 (dd, J=1.4, 8.1 Гц, 1Н), 7.16 (d, J=1.2 Гц, 1Н), 1.46 (s, 6Н).
Пример 7
3,3-Диметил-6-(пиридин-4-ил)индолин-2-он

Получили по аналогии с примером 1b из 6-бром-3,3-диметил-индолин-2-она (пример 24а) и пиридин-4-бороновой кислоты. Соединение, указанное в заголовке, было получено в виде светло-коричневого твердого вещества.
МС ИЭР (m/z): 239,1 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.72-8.63 (m, 2Н), 8.41 (br. s., 1Н), 7.53-7.44 (m, 2Н), 7.36-7.28 (m, 2Н), 7.18 (s, 1Н), 1.46 (s, 6Н).
Пример 8
3,3-Диметил-6-(пиримидин-5-ил)индолин-2-он

Получили по аналогии с примером 1b из 6-бром-3,3-диметил-индолин-2-она (пример 24а) и пиримидин-5-илбороновой кислоты. Соединение, указанное в заголовке, было получено в виде светло-коричневого твердого вещества.
МС ИЭР (m/z): 240,3 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 9.22 (s, 1Н), 8.94 (s, 2Н), 8.61 (br. s, 1Н), 7.35 (d, J=7.7 Гц, 1Н), 7.25 (dd, J=1.6, 7.7 Гц, 1Н), 7.14 (d, J=1.4 Гц, 1Н), 1.51-1.40 (s, 6Н).
Пример 9
1,3,3-Триметил-6-(2-(пирролидин-1-ил)пиримидин-5-ил)индолин-2-он

а) 1,3,3-Триметил-6-(2-(метилтио)пиримидин-5-ил)индолин-2-он
К суспензии 6-бром-1,3,3-триметилиндолин-2-она (пример 1а, 0,15 г, 590 мкмоль) и 2-(метилтио)пиримидин-5-бороновой кислоты (155 мг, 885 мкмоль) в диоксане (1,9 мл) добавляли 2 М водный раствор Na2CO3 (633 мкл). Из реакционного сосуда четыре раза откачивали воздух и продували аргоном. Добавляли [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (21,6 мг, 29,5 мкмоль), откачивание и продувание повторяли, и смесь нагревали до образования флегмы в течение 15 часов. Реакционную смесь разбавляли EtOAc и МеОН, добавляли две столовые ложки силикагеля, и суспензию концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Соединение, указанное в заголовке, выделили в виде светло-желтого твердого вещества (158 мг).
МС ИЭР (m/z): 300,4 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.80 (s, 2Н), 7.32 (d, J=7.7 Гц, 1Н), 7.21 (dd, J=1.6, 7.5 Гц, 1Н), 6.95 (d, J=1.4 Гц, 1Н), 3.28 (s, 3Н), 2.63 (s, 3Н), 1.41 (s, 6Н).
b) 1,3,3-Триметил-6-(2-(метилсульфонил)пиримидин-5-ил)индолин-2-он
К раствору 1,3,3-триметил-6-(2-(метилтио)пиримидин-5-ил)индолин-2-она (0,09 г, 301 мкмоль) в дихлорметане (3,01 мл) добавляли mCPBA (168 мг, 752 мкмоль), и реакционную смесь перемешивали в течение 4 часов при комнатной температуре. Смесь разбавляли CH2Cl2, H2O и 1 М водным раствором Na2CO3. Смесь экстрагировали CH2Cl2, и органический слой промывали 1 М водным раствором Na2CO3. Объединенные органические слои высушивали Na2SO4, фильтровали и концентрировали в вакууме. Соединение, указанное в заголовке, было получено в виде желтого твердого вещества (109 мг, чистота 92%) и использовано для следующей стадии без дополнительной очистки.
МС ИЭР (m/z): 332,1 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 9.11 (s, 2Н), 7.39 (d, J=7.7 Гц, 1Н), 7.32-7.27 (m, 1Н), 7.01 (d, J=1.0 Гц, 1Н), 3.42 (s, 3Н), 3.31 (s, 3Н), 1.43 (s, 6Н).
c) 1,3,3-Триметил-6-(2-(пирролидин-1-ил)пиримидин-5-ил)индолин-2-он
Суспензию 1,3,3-триметил-6-(2-(метилсульфонил)пиримидин-5-ил)индолин-2-она (0,107 г, 297 мкмоль, чистота 92%) в пирролидине (860 мг, 1 мл, 12,0 ммоль) нагревали до образования флегмы. Через 30 минут смесь разбавляли этилацетатом и водой. Водный слой экстрагировали EtOAc, и органические слои промывали 1 М водным раствором Na2CO3. Объединенные органические слои высушивали Na2SO4, фильтровали и концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде желтого твердого вещества (81 мг).
МС ИЭР (m/z): 323,3 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.56 (s, 2Н), 7.26 (d, J=7.5 Гц, 1Н), 7.15 (dd, J=1.5, 7.6 Гц, 1Н), 6.90 (d, J=1.4 Гц, 1Н), 3.69-3.58 (m, 4Н), 3.26 (s, 3Н), 2.09-1.98 (m, 4Н), 1.40 (s, 6Н).
Пример 10
6-(2-Аминопиримидин-5-ил)-1,3,3-триметилиндолин-2-он

Получили по аналогии с примером 9 с из 1,3,3-триметил-6-(2-(метилсульфонил)пиримидин-5-ил)индолин-2-она (пример 9b) и гидроксида аммония. Соединение, указанное в заголовке, было получено в виде белого твердого вещества.
МС ИЭР (m/z): 269,4 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.54 (s, 2Н), 7.28 (d, J=7.6 Гц, 1Н), 7.16 (dd, J=1.5, 7.6 Гц, 1Н), 6.91 (d, J=1.4Гц, 1Н), 5.12 (brs, 2Н), 3.27 (s, 3Н), 1.40 (s, 6Н).
Пример 11
6-(2-(Диметиламино)пиримидин-5-ил)-1,3,3-триметилиндолин-2-он

Получили по аналогии с примером 9 с из 1,3,3-триметил-6-(2-(метилсульфонил)пиримидин-5-ил)индолин-2-она (пример 9b) и диметиламина в этаноле. Соединение, указанное в заголовке, было получено в виде светло-желтого твердого вещества.
МС ИЭР (m/z): 297,4 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.56 (s, 2Н), 7.26 (d, J=7.5 Гц, 1Н), 7.15 (dd, J=1.4, 7.3 Гц, 1Н), 6.90 (d, J=1.2 Гц, 1Н), 3.28-3.22 (m, 9Н), 1.40 (s, 6Н).
Пример 12
1,3,3-Триметил-6-(2-метилпиримидин-5-ил)индолин-2-он

Суспензию 1,3,3-триметил-6-(2-(метилсульфонил)пиримидин-5-ил)индолин-2-она (пример 9b, 0,15 г, 430 мкмоль) в безводном тетрагидрофуране (2,2 мл) охлаждали до 0°С. Добавляли по каплям раствор хлорида метилмагния в ТГФ (3 М, 287 мкл, 860 мкмоль), охлаждающую баню удаляли, и реакционную смесь перемешивали в течение 15 часов при комнатной температуре. Смесь разбавляли CH2Cl2, H2O и 1 М водным раствором Na2CO3, и водный слой экстрагировали CH2Cl2. Объединенные органические слои промывали 1 М водным раствором Na2CO3, высушивали сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя дихлорметан/этилацетат в качестве элюента. Полученное вещество очищали препаративной ВЭЖХ на колонке Chiralpak AD, используя гептан/этанол в качестве элюента. Соединение, указанное в заголовке, было получено в виде светло-красного твердого вещества (52 мг).
МС ИЭР (m/z): 268,3 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.85 (s, 2Н), 7.33 (d, J=7.7 Гц, 1Н), 7.23 (dd, J=1.4, 7.5 Гц, 1Н), 6.98 (d, J=1.4 Гц, 1Н), 3.29 (s, 3Н), 2.81 (s, 3Н), 1.42 (s, 6Н).
Пример 13
1,3,3-Триметил-6-(пиридазин-3-ил)индолин-2-он

Из суспензии 1,3,3-триметил-6-(4)4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-2-она (пример 29а, 297 мг, 779 мкмоль), гидробромида 3-бром-пиридазина (286 мг, 1,17 ммоль) в диоксане (3,9 мл) и 2 М водном растворе Na2CO3 (1,3 мл) откачивали воздух три раза и продували аргоном. Затем добавляли [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (28,5 мг, 39,0 мкмоль), смесь нагревали до образования флегмы в течение 15 часов. Реакционную смесь разбавляли МеОН, добавляли силикагель, и смесь концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя дихлорметан/метанол в качестве элюента. Полученное вещество снова очищали препаративной ВЭЖХ на колонке Gemini NX 3u С18 110A, используя воду/муравьиную кислоту/метанол в качестве элюента. Соединение, указанное в заголовке, было получено в виде белого твердого вещества (136 мг).
МС ИЭР (m/z): 254,2 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 9.18 (d, J=3.8 Гц, 1Н), 7.89 (dd, J=1.4, 8.7 Гц, 1Н), 7.79 (d, J=1.0 Гц, 1Н), 7.63 (dd, J=1.3, 7.8 Гц, 1Н), 7.56 (dd, J=4.8, 8.5 Гц, 1Н), 7.34 (d, J=7.5 Гц, 1Н), 3.32 (s, 3Н), 1.43 (s, 6Н).
Пример 14
6-(4-Этилпиримидин-5-ил)-1,3,3-триметилиндолин-2-он

Получили по аналогии с примером 13 из 1,3,3-триметил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-2-она (пример 29а) и 5-бром-4-этилпиримидина. Соединение, указанное в заголовке, было получено в виде бесцветного масла.
МС ИЭР (m/z): 282,2 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 9.14 (s, 1Н), 8.54 (s, 1Н), 7.29 (d, J=7.5 Гц, 1Н), 6.99 (d, J=7.5 Гц, 1Н), 6.76 (s, 1Н), 3.24 (s, 3Н), 2.81 (q, J=7.5 Гц, 2Н), 1.43 (s, 6Н), 1.27 (t, J=7.5 Гц, 3Н).
Пример 15
6-(6-Аминопиридин-3-ил)-1,3,3-триметилиндолин-2-он

Получили по аналогии с примером 13 из 1,3,3-триметил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-2-она (пример 29а) и 2-амино-5-бромпиридина. Соединение, указанное в заголовке, было получено в виде светло-желтого твердого вещества.
МС ИЭР (m/z): 268,3 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.32 (d, J=2.4 Гц, 1Н), 7.68 (dd, J=2.3, 8.6 Гц, 1Н), 7.25 (d, J=7.4 Гц, 1Н), 7.18 (dd, J=1.4, 7.7 Гц, 1Н), 6.94 (d, J=1.4 Гц, 1Н), 6.60 (d, J=8.5 Гц, 1Н), 4.55 (brs, 2Н), 3.27 (s, 3Н), 1.40 (s, 6Н).
Пример 16
6-(2-Аминопиримидин-5-ил)-3,3-диметилиндолин-2-он

Получили по аналогии с примером 24b из 6-бром-3,3-диметил-индолин-2-она (пример 24а) и пинаколового эфира 2-аминопиримидин-5-бороновой кислоты. Соединение, указанное в заголовке, было получено в виде светло-коричневого твердого вещества.
МС ИЭР (m/z): 255,3 [(М+Н)+].
1Н ЯМР (ДМСО-d6, 300 МГц) δ = 10.40 (s, 1Н), 8.49 (s, 2Н), 7.33 (d, J=7.9 Гц, 1Н), 7.22-7.11 (m, 1Н), 6.98 (s, 1Н), 6.75 (s, 2Н), 1.26 (s, 6Н).
Пример 17
3,3-Диметил-6-(пиридазин-4-ил)индолин-2-он

a) 3,3-Диметил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-2-он
Получили по аналогии с примером 29а из 6-бром-3,3-диметил-индолин-2-она (пример 24а). Соединение, указанное в заголовке, было получено в виде светло-желтого твердого вещества.
МС ИЭР (m/z): 288,2 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.94 (br s, 1Н), 7.53 (d, J=7.5 Гц, 1Н), 7.35 (s, 1Н), 7.21 (d, J=7.3 Гц, 1Н), 1.40 (s, 6Н), 1.34 (s, 12Н)
b) 3,3-Диметил-6-(пиридазин-4-ил)индолин-2-он
Получили по аналогии с примером 29b из 3,3-диметил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-2-она и гидробромида 4-бромпиридазина. Соединение, указанное в заголовке, было получено в виде коричневого твердого вещества.
МС ИЭР (m/z): 240,2 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 9.46 (d, J=1.2 Гц, 1Н), 9.25 (d, J=5.4 Гц, 1Н), 8.52 (br s, 1Н), 7.64 (dd, J=2.4, 5.4 Гц, 1Н), 7.36 (s, 2Н), 7.23 (s, 1Н), 1.47 (s, 6Н)
Пример 18
6-(6-Аминопиридин-3-ил)-3,3-диметилиндолин-2-он

Получили по аналогии с примером 29b из 3,3-диметил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-2-она (пример 17а) и 2-амино-5-бромпиридина. Соединение, указанное в заголовке, было получено в виде светло-коричневого твердого вещества.
МС ИЭР (m/z): 254,2 [(М+Н)+].
1Н ЯМР (ДМСО-d6, 300 МГц) δ = 10.35 (s, 1Н), 8.16 (d, J=2.4 Гц, 1Н), 7.62 (dd, J=2.5, 8.6 Гц, 1Н), 7.30 (d, J=7.7 Гц, 1Н), 7.12 (dd, J=1.2, 7.7 Гц, 1Н), 6.94 (d, J=1.2 Гц, 1Н), 6.51 (d, J=8.5 Гц, 1Н), 6.05 (br. s, 2Н), 1.26 (s, 6Н)
Пример 19
3,3-Диметил-6-(2-метилпиридин-3-ил)индолин-2-он

Получили по аналогии с примером 24b из 6-бром-3,3-диметил-индолин-2-она (пример 24а) и 2-метилпиридин-3-илбороновой кислоты. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества.
МС ИЭР (m/z): 253,2 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.51 (dd, J=1.7, 4.7 Гц, 1Н), 7.94 (br s, 1Н), 7.51 (dd, J=1.7, 7.6 Гц, 1Н), 7.25 (d, J=7.6 Гц, 1Н), 7.19 (dd, J=4.8, 7.7 Гц, 1Н), 6.98 (dd, J=1.2, 7.7 Гц, 1Н), 6.86 (d, J=1.2 Гц, 1Н), 2.53 (s, 3Н), 1.46 (s, 6Н).
Пример 20
3,3-Диметил-6-(3-метилпиридин-4-ил)индолин-2-он

Получили по аналогии с примером 24b из 6-бром-3,3-диметил-индолин-2-она (пример 24а) и 3-метилпиридин-4-илбороновой кислоты. Соединение, указанное в заголовке, было получено в виде светло-коричневого твердого вещества.
МС ИЭР (m/z): 253,2 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.51 (s, 1Н), 8.47 (d, J=5.0 Гц, 1Н), 8.06 (br s, 1Н), 7.26 (d, J=7.5 Гц, 1Н), 7.14 (d, J=4.8 Гц, 1Н), 6.99 (dd, J=1.4, 7.7 Гц, 1Н), 6.86 (d, J=1.4 Гц, 1Н), 2.30 (s, 3Н), 1.46 (s, 6Н).
Пример 21
3,3-Диметил-6-(2-метилпиримидин-5-ил)индолин-2-он

Получили по аналогии с примером 24b из 6-бром-3,3-диметил-индолин-2-она (пример 24а) и 2-метилпиримидин-5-илбороновой кислоты. Соединение, указанное в заголовке, было получено в виде коричневого твердого вещества.
МС ИЭР (m/z): 254,2 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.83 (s, 2Н), 8.27 (br s, 1Н), 7.32 (d, J=8.1 Гц, 1Н), 7.23 (dd, J=1.4, 7.7 Гц, 1Н), 7.10 (d, J=1.2 Гц, 1Н), 2.80 (s, 3Н), 1.45 (s, 6Н).
Пример 22
1,3,3-Триметил-6-(6-метилпиридазин-3-ил)индолин-2-он

Получили по аналогии с примером 29b из 1,3,3-триметил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-2-она (пример 29а) и 3-бром-6-метилпиридазина. Соединение, указанное в заголовке, было получено в виде коричневого твердого вещества.
МС ИЭР (m/z): 268,2 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.82-7.74 (m, 2Н), 7.61 (dd, J=1.6, 7.9 Гц, 1Н), 7.41 (d, J=8.7 Гц, 1Н), 7.33 (d, J=7.7 Гц, 1Н), 3.31 (s, 3Н), 2.78 (s, 3Н), 1.42 (s, 6Н).
Пример 23
6-(6,7-Дигидро-5Н-циклопента[b]пиридин-3-ил)-1,3,3-триметилиндолин-2-он

Получили по аналогии с примером 29b из 1,3,3-триметил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-2-она (пример 29а) и 3-бром-6,7-дигидро-5Н-циклопента[b]пиридина. Соединение, указанное в заголовке, было получено в виде светло-красного твердого вещества.
МС ИЭР (m/z): 293,1 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.57 (s, 1Н), 7.69 (s, 1Н), 7.31-7.20 (m, 2Н), 6.99 (s, 1Н), 3.28 (s, 3Н), 3.13-2.96 (m, 4Н), 2.20 (quin, J=7.6 Гц, 2Н), 1.41 (s, 6Н).
Пример 24
3,3-Диметил-6-(2-метилпиридин-4-ил)индолин-2-он

a) 6-Бром-3,3-диметил-индолин-2-он
К суспензии трет-бутилата калия (12,8 г, 114 ммоль) в безводном ТГФ (80 мл) при 0°С в атмосфере аргона добавляли порциями 6-броминдолин-2-он (5,0 г, 22,9 ммоль) с последующим добавлением комплекса бромида меди(I) с диметилсульфидом (470 мг, 2,29 ммоль). Добавляли по каплям MeI (6,82 г, 3,00 мл, 48,0 ммоль) в течение 45 минут, поддерживая внутреннюю температуру ниже 8°С. Реакционную смесь подогревали до комнатной температуры и поддерживали при этой температуре в течение 16 часов. Реакционную смесь снова охлаждали до 0°С и осторожно добавляли насыщенный водный раствор хлорида аммония. Смесь разбавляли трет-бутилметиловым эфиром и водой. Водную фазу экстрагировали трет-бутилметиловым эфиром, объединенные органические фазы высушивали над сульфатом натрия, растворитель выпаривали, и остаток очищали хроматографией на силикагеле, используя этилацетат/гептан в качестве элюента. Соединение, указанное в заголовке, было получено в виде светло-желтого твердого вещества (5,17 г).
МС ИЭР (m/z): 240,0/242,1 [(М+Н)+].
1Н ЯМР (CDCl3, 400 МГц): δ (ppm) = 8.12 (m, 1Н), 7.20-7.16 (m, 1Н), 7.09-7.08 (m, 1Н), 7.06-7.04 (m, 1Н), 1.39 (s, 6Н).
b) 3,3-Диметил-6-(2-метилпиридин-4-ил)индолин-2-он
К суспензии 6-бром-3,3-диметилиндолин-2-она (120 мг, 500 мкмоль) и 2-метилпиридин-4-илбороновой кислоты (105 мг, 750 мкмоль) в диоксане (2 мл) и добавляли водный раствор карбоната натрия (2 М, 667 мкл) [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) (18,3 мг, 25,0 мкмоль) в атмосфере аргона. Реакционную смесь нагревали до образования флегмы и перемешивали при этой температуре в атмосфере аргона в течение 12 часов.
Смесь разбавляли этилацетатом и 2 М водным раствором карбоната натрия. Водную фазу экстрагировали этилацетатом, объединенные органические фазы промывали соляным раствором, высушивали над сульфатом натрия, растворитель выпаривали, и остаток очищали хроматографией на силикагеле, используя этилацетат/гептан в качестве элюента. Соединение, указанное в заголовке, было получено в виде беловатой пены (60 мг).
МС ИЭР (m/z): 253,1 [(М+Н)+].
1Н ЯМР (CDCl3, 400 МГц): δ (млн-1) = 8.55 (d, J=5.2 Гц, 1Н), 8.33 (br s, 1Н), 7.40-7.27 (m, 4Н), 7.20-7.13 (m, 1Н), 2.63 (s, 3Н), 1.45 (s, 6Н).
Пример 25
6-(2,3-Дигидро-1Н-пиридо[2,3-b][1,4]оксазин-7-ил)-1,3,3-триметилиндолин-2-он

Получили по аналогии с примером 29b из 1,3,3-триметил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-2-она (пример 29а) и 7-бром-2,3-дигидро-1Н-пиридо[2,3-b][1,4]оксазина. Соединение, указанное в заголовке, было получено в виде светло-желтого твердого вещества.
МС ИЭР (m/z): 310,2 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.84 (d, J=2.0 Гц, 1Н), 7.24 (d, J=8.1 Гц, 1Н), 7.18 (dd, J=1.2, 7.7 Гц, 1Н), 7.06 (d, J=2.2 Гц, 1Н), 6.97-6.91 (m, 1Н), 4.50-4.42 (m, 2Н), 3.96 (br s, 1Н), 3.52-3.42 (m, 2Н), 3.26 (s, 3Н), 1.40 (s, 6Н).
Пример 26
6-(6,7-Дигидро-5Н-пирроло[3,4-b]пиридин-3-ил)-1,3,3-триметилиндолин-2-он

Получили по аналогии с примером 29b из 1,3,3-триметил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-2-она (пример 29а) и 3-бром-6,7-дигидро-5Н-пирроло[3,4-b]пиридина. Соединение, указанное в заголовке, было получено в виде светло-коричневого твердого вещества.
МС ИЭР (m/z): 294,2 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.65 (s, 1Н), 7.73 (s, 1Н), 7.34-7.20 (m, 2Н), 7.00 (d, J=1.2 Гц, 1H), 4.44-4.30 (m, 4Н), 3.28 (s, 3Н), 2.56 (br s, 1H), 1.42 (s, 6H).
Пример 27
6-(5-Аминопиридин-3-ил)-1,3,3-триметилиндолин-2-он

Получили по аналогии с примером 29b из 1,3,3-триметил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-2-она (пример 29а) и 5-бромпиридин-3-амина. Соединение, указанное в заголовке, было получено в виде светло-желтого твердого вещества.
МС ИЭР (m/z): 268,2 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.26 (d, J=1.8 Гц, 1Н), 8.10 (d, J=2.6 Гц, 1Н), 7.28 (d, J=7.7 Гц, 1Н), 7.23 (dd, J=1.6, 7.7 Гц, 1Н), 7.17-7.13 (m, 1Н), 6.99 (d, J=1.2 Гц, 1Н), 3.79 (br s, 2Н), 3.27 (s, 3Н), 1.41 (s, 6Н).
Пример 28
6-(3,5-Диметил-пиридин-4-ил)-1,3,3-триметил-1.3-дигидро-индол-2-она формиат

Из раствора 4-бром-3,5-диметилпиридина (500 мг, 2,69 ммоль) в безводном ТГФ (20 мл) откачивали воздух и продували аргоном. Добавляли карбонат цезия (1051 мг, 3,22 ммоль) с последующим добавлением 1,3,3-триметил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-2-она (пример 29а, 972 мг, 3,22 ммоль). После 15 минут продувания аргоном добавляли тетракис(трифенилфосфин)палладий(0) (249 мг, 0,21 ммоль). Сосуд снова продували в течение 15 минут аргоном, и реакционную смесь нагревали до образования флегмы в течение 15 часов. Реакционную смесь разбавляли этилацетатом, фильтровали через слой целлита, промывали дополнительным количеством этилацетата, и полученный раствор концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле. Полученное вещество, наконец, очищали препаративной ВЭЖХ с получением соединения, указанного в заголовке, в виде беловатого твердого вещества (344 мг).
МС ИЭР (m/z): 281 [(М+Н)+].
Пример 29
6-(Имидазо[1,2-а]пиридин-7-ил)-1,3,3-триметилиндолин-2-он

а) 1,3,3-Триметил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-2-он
Через суспензию 6-бром-1,3,3-триметилиндолин-2-она (пример 1а, 500 мг, 1,97 ммоль), бис(пинаколато)дибора (757 мг, 2,95 ммоль) и ацетата калия (390 мг, 3,94 ммоль) в ДМСО (10 мл) барботировали аргон в течение 5 минут. [1,1'-Добавляли бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (72 мг, 98,4 мкмоль), и аргон снова барботировали в течение 5 минут. Реакционную смесь нагревали до 110°С в течение 5 часов. Добавляли воду, и водную фазу экстрагировали этилацетатом. Объединенные органические слои высушивали над сульфатом натрия, растворитель выпаривали, и остаток очищали хроматографией на силикагеле, используя этилацетат/гептан в качестве элюента. Соединение, указанное в заголовке, было получено в виде белого твердого вещества (607 мг).
МС ИЭР (m/z): 302,3 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.57 (dd, J=0.8, 7.3 Гц, 1Н), 7.27 (s, 1Н), 7.23 (d, J=7.3 Гц, 1Н), 3.24 (s, 3Н), 1.37 (s, 6Н), 1.36 (s, 12Н)
b) 6-(Имидазо[1,2-а]пиридин-7-ил)-1,3,3-триметилиндолин-2-он
Через суспензию 1,3,3-триметил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-2-она (300 мг, 896 мкмоль), 7-бромимидазо[1,2-а]пиридина (F.P.

МС ИЭР (m/z): 292,2 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.20 (dd, J=0.8, 7.1 Гц, 1Н), 7.87-7.80 (m, 1Н), 7.69 (d, J=1.2 Гц, 1Н), 7.62 (s, 1Н), 7.38-7.28 (m, 2Н), 7.14-7.04 (m, 2Н), 3.29 (s, 3Н), 1.42 (s, 6Н).
Пример 30
6-(Имидазо[1,2-а]пиридин-6-ил)-1,3,3-триметилиндолин-2-он
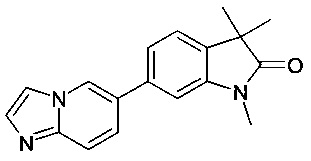
Получили по аналогии с примером 29 из 6-бромимидазо[1,2-а]пиридина (М. Yamanaka et al., Chem. Pharm. Bull. 1991, 39(6), 1556-1567). Соединение, указанное в заголовке, было получено в виде светло-красного твердого вещества.
МС ИЭР (m/z): 292,1 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.33 (dd, J=1.0, 1.8 Гц, 1Н), 7.74-7.62 (m, 3Н), 7.43 (dd, J=1.8, 9.5 Гц, 1Н), 7.33-7.28 (m, 1Н), 7.26-7.21 (m, 1Н), 7.00 (d, J=1.2 Гц, 1Н), 3.29 (S, 3Н), 1.42 (s, 6Н).
Пример 31
6-(4,6-Диметил-пиримидин-5-ил)-1,3,3-триметил-1,3-дигидро-индол-2-он

Получили по аналогии с примером 29b из 1,3,3-триметил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-2-она (пример 29а) и 5-бром-4,6-диметилпиримидина. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества.
МС ИЭР (m/z): 282 [(М+Н)+].
Пример 32
6-(2,4-Диметил-пиридин-3-ил)-1,3,3-триметил-1,3-дигидро-индол-2-он

Получили по аналогии с примером 29b из 1,3,3-триметил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-2-она (пример 29а) и 3-бром-2,4-диметилпиримидина. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества.
МС ИЭР (m/z): 281 [(М+Н)+].
Пример 33
5-(3,3-Диметил-2-охоиндолин-6-ил)никотинонитрил

Получили по аналогии с примером 29b из 3,3-диметил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-2-она (пример 17а) и 5-бромникотинонитрила. Соединение, указанное в заголовке, было получено в виде белого твердого вещества.
МС ИЭР (m/z): 264,1 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 9.02 (d, J=2.4 Гц, 1Н), 8.87 (d, J=1.8 Гц, 1Н), 8.53 (br. s, 1Н), 8.11 (t, J=2.1 Гц, 1Н), 7.35 (d, J=7.3 Гц, 1Н), 7.24 (dd, J=1.6, 7.7 Гц, 1Н), 7.13 (d, J=1.2 Гц, 1Н), 1.46 (s, 6Н).
Пример 34
7-Фтор-1,3,3-триметил-6-(пиридин-3-ил)индолин-2-он

а) 7-Фтор-1,3,3-триметилиндолин-2-он
К суспензии NaH (8,79 г, 220 ммоль) в тетрагидрофуране (100 мл) добавляли 7-фториндолин-2-он (8,30 г, 54,9 ммоль) порциями в течение 20 минут. Реакционную смесь перемешивали в течение 30 минут. Добавляли по каплям MeI (31,2 г, 13,7 мл, 220 ммоль) при 24-27°С в течение 1,5 часов. Реакционную смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь очень осторожно гасили 20 мл насыщенного водного раствора хлорида аммония при 10-15°С, затем разбавляли трет-бутилметиловым эфиром и водой. Водную фазу экстрагировали трет-бутилметиловым эфиром, объединенные органические фазы промывали соляным раствором и высушивали над сульфатом натрия. Растворитель выпаривали, и остаток очищали хроматографией на силикагеле, используя этилацетат/гептан в качестве элюента. Соединение, указанное в заголовке, было получено в виде оранжевых кристаллов (9,91 г).
МС ИЭР (m/z): 194,3 [(М+Н)+].
1Н ЯМР (CDCl3, 400 МГц): δ (млн-1) = 6.99-6.97 (m, 3Н), 3.43 (d, J=2.62 Гц, 3Н), 1.37 (s, 6Н).
b) 7-Фтор-1,3,3-триметил-6-(триметилсилил)индолин-2-он
Раствор диизопропиламина (5,4 г, 7,6 мл, 52,8 ммоль) в безводном тетрагидрофуране (23 мл) в атмосфере аргона охлаждали до -40°С и добавляли по каплям раствор n-BuLi (1,6 М в гексане, 31,6 мл, 50,5 ммоль). Смесь перемешивали при -40°С в течение 30 минут, а затем добавляли к раствору 7-фтор-1,3,3-триметилиндолин-2-она (8,875 г, 45,9 ммоль) и триметилсилилхлорида (5,49 г, 6,46 мл, 50,5 ммоль) в безводном тетрагидрофуране (69 мл) при -75°С. Реакционную смесь подогревали до комнатной температуры в течение 16 часов. Реакционную смесь осторожно гасили водой (2 мл) и разбавляли этилацетатом и водой. Водную фазу экстрагировали этилацетатом, объединенные органические слои промывали соляным раствором и высушивали над сульфатом натрия. Растворитель выпаривали в вакууме, и остаток очищали хроматографией на силикагеле, используя этилацетат/гептан в качестве элюента. Соединение, указанное в заголовке, было получено в виде светло-желтого масла (8,55 г).
МС ИЭР (m/z): 266,2 [(М+Н)+].
1Н ЯМР (CDCl3, 400 МГц): δ (млн-1) = 7.06-7.02 (m, 1Н), 6.99-6.96 (m, 1Н), 3.44 (d, J=3.03 Гц, 3Н), 1.36 (s, 6Н), 0.33 (s, 9Н).
c) 7-Фтор-6-йод-1,3,3-триметилиндолин-2-он
К раствору 7-фтор-1,3,3-триметил-6-(триметилсилил)индолин-2-она (9,9 г, 37,3 ммоль) в дихлорметане (500 мл) при 0°С добавляли монохлорид йода (1 M в CH2Cl2, 37,3 мл, 37,3 ммоль). Реакционную смесь подогревали до комнатной температуры и перемешивали в течение 16 часов. К реакционной смеси добавляли насыщенный водный раствор тиосульфата натрия, и водную фазу экстрагировали дихлорметаном. Объединенные органические слои высушивали над сульфатом натрия. Растворитель выпаривали, и остаток очищали хроматографией на силикагеле, используя этилацетат/гептан в качестве элюента. Соединение, указанное в заголовке, было получено в виде беловатых кристаллов (9,82 г).
МС ИЭР (m/z): 320,0 [(М+Н)+].
1Н ЯМР (CDCl3, 400 МГц): δ (млн-1) = 7.43-7.39 (m, 1Н), 6.77-6.75 (m, 1Н), 3.42 (d, J=3.23 Гц, 3Н), 1.36 (s, 6Н).
d) 7-Фтор-1,3,3-триметил-6-(пиридин-3-ил)индолин-2-он
Получили по аналогии с примером 1b из 7-фтор-6-йод-1,3,3-триметилиндолин-2-она и пиридин-3-илбороновой кислоты. Соединение, указанное в заголовке, было получено в виде желтого твердого вещества.
МС ИЭР (m/z): 271,2 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.81-8.74 (m, 1Н), 8.63 (dd, J=1.6, 4.8 Гц, 1Н), 7.85 (qd, J=2.0, 7.9 Гц, 1Н), 7.39 (ddd, J=0.9, 4.9, 7.9 Гц, 1Н), 7.12-7.03 (m, 2Н), 3.48 (d, J=3.2 Гц, 3Н), 1.42 (s, 6Н).
Пример 35
6-(2,4-Диметил-пиридин-3-ил)-3,3-диметил-1,3-дигидро-индол-2-он

Получили по аналогии с примером 29b из 3,3-диметил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-2-она (пример 17а) и 3-бром-2,4-диметилпиридина. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества.
МС ИЭР (m/z): 267 [(М+Н)+].
Пример 36
1,3,3,7-Тетраметил-6-(пиридин-3-ил)индолин-2-он

а) 6-Бром-7-метил-1,3-дигидро-индол-2-он
Смесь 6-бром-7-метилиндолин-2,3-диона (G.W. Rewcastle et al., J. Med. Chem. 1991, 34(1), 217-222; 7,65 г, 31,9 ммоль) и моногидрата гидразина (35,9 г, 35 мл, 718 ммоль) нагревали до 130°С в течение 3 часов, а затем охлаждали до 10°С. Медленно добавляли 37% HCl (72,2 г, 60,2 мл, 733 ммоль). Осадок фильтровали через спеченное стекло, промывали избытком воды, затем небольшим количеством гептана и высушивали в высоком вакууме. Соединение, указанное в заголовке, было получено в виде желтых кристаллов и использовано для следующей реакции без дополнительной очистки.
b) 6-Бром-1,3,3,7-тетраметилиндолин-2-он
Получили по аналогии с примером 1а из 6-бром-7-метил-1,3-дигидро-индол-2-она. Соединение, указанное в заголовке, было получено в виде светло-коричневого твердого вещества.
МС ИЭР (m/z): 268,1, 270,4 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.29 (d, J=7.9 Гц, 1Н), 6.89 (d, J=8.0 Гц, 1Н), 3.51 (s, 3Н), 2.67 (s, 3Н), 1.33 (s, 6Н).
с) 1,3,3,7-Тетраметил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-2-он
Получили по аналогии с примером 29а из 6-бром-1,3,3,7-тетраметилиндолин-2-она. Соединение, указанное в заголовке, было получено в виде белого твердого вещества.
МС ИЭР (m/z): 316,2 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.49 (d, J=7.5 Гц, 1Н), 7.04 (d, J=7.3 Гц, 1Н), 3.53 (s, 3Н), 2.78 (s, 3Н), 1.35 (s, 12Н), 1.33 (s, 6Н).
d) 1,3,3,7-Тетраметил-6-(пиридин-3-ил)индолин-2-он
Получили по аналогии с примером 29b из 1,3,3,7-тетраметил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-2-она и 3-бромпиридина. Соединение, указанное в заголовке, было получено в виде вязкого коричневого масла.
МС ИЭР (m/z): 267,2 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.61 (dd, J=1.6, 4.8 Гц, 1Н), 8.57 (d, J=1.6 Гц, 1Н), 7.66-7.59 (m, 1Н), 7.36 (ddd, J=0.9, 4.8, 7.8 Гц, 1Н), 7.11 (d, J=7.5 Гц, 1Н), 6.92 (d, J=7.5 Гц, 1Н), 3.56 (s, 3Н), 2.44 (s, 3Н), 1.40 (s, 6Н)
Пример 37
5-Фтор-1,3,3-триметил-6-(пиридин-3-ил)индолин-2-он

а) Диметиловый эфир 2-(4-бром-5-фтор-2-нитро-фенил)-малоновой кислоты/диметиловый эфир 2-(2-бром-5-фтор-4-нитро-фенил)-малоновой кислоты
Суспензию NaH (60% в минеральном масле, 20,2 г, 504 ммоль) в диоксане (233 мл) охлаждали до 11°С. Осторожно добавляли 1-бром-2,4-дифтор-5-нитробензол (50 г, 26,5 мл, 210 ммоль) и диметилмалонат (33,3 г, 28,9 мл, 242 ммоль) в диоксане (467 мл) при 11-14°С в течение 45 минут (выделение газа). После завершения добавления реакционную смесь держали при 12°С еще в течение часа, а затем подогревали до комнатной температуры. Через 16 часов реакционную смесь охлаждали до 10°С и добавляли 100 мл насыщенного водного раствора хлорида аммония. Реакционную смесь разбавляли трет-бутилметиловым эфиром, водой и насыщенным водным раствором хлорида аммония. Водную фазу экстрагировали трет-бутилметиловым эфиром, объединенные органические фазы промывали насыщенным водным раствором хлорида аммония и соляным раствором и высушивали над сульфатом натрия. Растворитель выпаривали, и остаток очищали хроматографией на силикагеле, используя этилацетат/гептан в качестве элюента. Соединения, указанные в заголовке, были получены в виде желтой жидкости (53,7 г) в виде смеси 2,6:1 и использованы для следующей реакции без дополнительной очистки.
МС ИЭР (m/z): 348,1/350,3 [(М-Н)-].
1Н ЯМР (CDCl3, 400 МГц) диметилового эфира 2-(4-бром-5-фтор-2-нитро-фенил)-малоновой кислоты: δ (млн-1) = 8.37-8.35 (m, 1Н), 7.36-7.33 (m, 1Н), 5.36 (s, 1Н), 3.82 (s, 6Н).
1Н ЯМР (CDCl3, 400 МГц) диметилового эфира 2-(2-бром-5-фтор-4-нитро-фенил)-малоновой кислоты: δ (млн-1) = 8.33-8.30 (m, 1Н), 7.60-7.56 (m, 1Н), 5.27 (s, 1Н), 3.76 (s, 6Н).
b) (4-Бром-5-фтор-2-нитрофенил)-уксусная кислота/(2-Бром-5-фтор-4-нитро-фенил)-уксусная кислота
Смесь диметилового эфира 2-(4-бром-5-фтор-2-нитро-фенил)-малоновой кислоты/диметилового эфира 2-(2-бром-5-фтор-4-нитро-фенил)-малоновой кислоты (смесь 2,6:1, 53,7 г, 153 ммоль) и 6 М водной соляной кислоты (767 мл) нагревали до образования флегмы в течение 7 часов, а затем охлаждали до 5°С. Осадок фильтровали, промывали водой и н-пентаном, а затем совместно выпаривали 3 раза толуолом с получением 25,9 г смеси соединений, указанных в заголовке, в виде белого твердого вещества. Маточный раствор экстрагировали этилацетатом, и объединенные органические фазы высушивали над сульфатом натрия. Растворитель выпаривали, и остаток растирали с н-пентаном, а затем совместно выпаривали толуолом с получением 11,42 г смеси соединений, указанных в заголовке, в виде беловатого твердого вещества. Это вещество объединяли с первой партией с получением в сумме 37,32 г соединений, указанных в заголовке, в виде смеси 2,6:1, которую использовали для следующей реакции без дополнительной очистки.
МС ИЭР (m/z): 232,0/233,9 [(М-CO2-Н)-].
1Н ЯМР (ДМСО-D6, 400 МГц) 2-(4-бром-5-фтор-2-нитрофенил)уксусной кислоты: δ (млн-1) = 8.50-8.47 (m, 1Н), 7.70-7.67 (m, 1Н), 4.00 (s, 2Н).
1Н ЯМР (ДМСО-D6, 400 МГц) (2-Бром-5-фтор-4-нитро-фенил)-уксусной кислоты: δ (млн-1) = 8.40-8.37 (m, 1Н), 7.78-7.74 (m, 1Н), 3.87 (s, 2Н).
c) 6-Бром-5-фториндолин-2-он
Суспензию (4-бром-5-фтор-2-нитрофенил)-уксусной кислоты/(2-бром-5-фтор-4-нитро-фенил)-уксусной кислоты (смесь 2,6:1, 37,3 г, 134 ммоль) и железа (30,0 г, 537 ммоль) в уксусной кислоте (671 мл) нагревали до 100°С в течение 7 часов, а затем охлаждали до комнатной температуры. Остаточное элементное железо удаляли магнитным стержнем. К реакционной смеси добавляли ледяную воду (900 мл). Осадок отфильтровывали, промывали четыре раза водой, а затем суспендировали в охлажденном во льду водном растворе 25% HCl (300 мл) и концентрированной HCl (50 мл). После перемешивания в течение 10 минут осадок отфильтровывали и промывали четыре раза водой.
Осадок суспендировали в смеси 1 М водного раствора Na2CO3 (400 мл) и 0.1 М NaOH (100 мл) и перемешивали в течение 40 минут. Осадок отфильтровывали и промывали четыре раза 0,1 М водным раствором NaOH, три раза водой и один раз диизопропиловым эфиром с получением соединения, указанного в заголовке, в виде светло-серого твердого вещества (20,5 г).
МС ИЭР (m/z): 228,0/230,0 [(М-Н)-].
1Н ЯМР (ДМСО-D6, 400 МГц): δ (млн-1) = 10.47 (bs, 1Н), 7.31-7.28 (m, 1Н), 7.01-6.99 (m, 1Н), 3.49 (s, 2Н).
d) 6-Бром-5-фтор-1,3,3-триметилиндолин-2-он
К суспензии NaH (5,04 г, 126 ммоль) в тетрагидрофуране (105 мл) добавляли порциями 6-бром-5-фториндолин-2-он (7,24 г, 31,5 ммоль) в атмосфере аргона. После того, как выделение газа прекратилось, добавляли по каплям метилиодид (17,9 г, 7,88 мл, 126 ммоль) в течение 50 минут с помощью шприцевого насоса (экзотермическая реакция), поддерживая температуру реакционной смеси между 24°С и 26°С. Реакционную смесь держали при комнатной температуре в течение 4 часов, а затем осторожно гасили водным раствором хлорида аммония.
Реакционную смесь разбавляли трет-бутилметиловым эфиром, водой и насыщенным водным раствором хлорида аммония. Водную фазу экстрагировали трет-бутилметиловым эфиром, объединенные органические фазы промывали насыщенным водным раствором хлорида аммония и высушивали над сульфатом натрия. Растворитель выпаривали, и остаток растирали с гептаном с получением соединения, указанного в заголовке, в виде светло-коричневого твердого вещества (7,87 г).
МС ИЭР (m/z): 272,1, 274,1 [(М+Н)+].
1Н ЯМР (CDCl3, 400 МГц): δ (млн-1) = 7.02-6.97 (m, 2Н), 3.19 (s, 3Н), 1.36 (s, 6Н).
е) 5-Фтор-1,3,3-триметил-6-(пиридин-3-ил)индолин-2-он
Получили по аналогии с примером 1b из 6-бром-5-фтор-1,3,3-триметилиндолин-2-она и пиридин-3-илбороновой кислоты. Соединение, указанное в заголовке, было получено в виде светло-коричневого твердого вещества.
МС ИЭР (m/z): 271,3 [(М+Н)+].
1Н ЯМР (CDCl3 300 МГц): δ = 8.80 (s, 1Н), 8.63 (d, J=3.6 Гц, 1Н), 7.88 (qd, J=1.8, 7.9 Гц, 1Н), 7.40 (dd, J=4.8, 7.9 Гц, 1Н), 7.08 (d, J=9.5 Гц, 1Н), 6.83 (d, J=5.9 Гц, 1Н), 3.25 (s, 3Н), 1.42 (s, 6Н).
Пример 38
5-Фтор-1,3,3-триметил-6-(пиридин-4-ил)индолин-2-он

Получили по аналогии с примером 1b из 6-бром-5-фтор-1,3,3-триметилиндолин-2-она (пример 37d) и пиридин-4-илбороновой кислоты. Соединение, указанное в заголовке, было получено в виде светло-коричневой пены.
МС ИЭР (m/z): 271,3 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.71 (d, J=5.0 Гц, 2Н), 7.49 (d, J=5.0 Гц, 2Н), 7.08 (d, J=9.7 Гц, 1Н), 6.85 (d, J=5.9 Гц, 1Н), 3.25 (s, 3Н), 1.42 (s, 6Н).
Пример 39
7-Фтор-1,3,3-триметил-6-пиридин-4-ил-1,3-дигидро-индол-2-он

Получили по аналогии с примером 1b из 7-фтор-6-йод-1,3,3-триметилиндолин-2-она (пример 34с) и пиридин-4-илбороновой кислоты. Соединение, указанное в заголовке, было получено в виде коричневого твердого вещества.
МС ИЭР (m/z): 271 [(М+Н)+].
Пример 40
5-Фтор-1,3,3-триметил-6-(2-метилпиридин-4-ил)индолин-2-он

Получили по аналогии с примером 1b из 6-бром-5-фтор-1,3,3-триметилиндолин-2-она (пример 37d) и 2-метилпиридин-4-илбороновой кислоты. Соединение, указанное в заголовке, было получено в виде желтого твердого вещества.
МС ИЭР (m/z): 285,1 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.58 (d, J=5.2 Гц, 1Н), 7.34 (s, 1Н), 7.31-7.27 (m, 1Н), 7.07 (d, J=9.5 Гц, 1Н), 6.84 (d, J=5.9 Гц, 1Н), 3.30-3.21 (m, 3Н), 2.64 (s, 3Н), 1.41 (s, 6Н).
Пример 41
1-Изопропил-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он

a) 6-Бром-1-изопропил-3,3-диметил-1,3-дигидро-индол-2-он
К суспензии 6-бром-3,3-диметилиндолин-2-она (пример 24а, 1,0 г, 4,16 ммоль) в ДМФ (18 мл) добавляли 2-бромпропан (1,28 г, 978 мкл, 10,4 ммоль) и карбонат цезия (2,99 г, 9,16 ммоль). Реакционную смесь нагревали до 80°С в течение 18 часов. Реакционную смесь обрабатывали 1 М водным раствором HCl, и водную фазу экстрагировали EtOAc. Объединенные органические слои высушивали над Na2SO4, и растворитель выпаривали. Остаток очищали хроматографией на силикагеле, используя этилацетат/гептан в качестве элюента. Соединение, указанное в заголовке, было получено в виде оранжевого твердого вещества (824 мг).
МС ИЭР (m/z): 281,1/282,9 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.20-7.11 (m, 2Н), 7.09-7.02 (m, 1Н), 4.60 (spt, J=7.1 Гц, 1Н), 1.47 (d, J=7.1 Гц, 6Н), 1.33 (s, 6Н)
b) 1-Изопропил-3,3-диметил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-2-он
Через суспензию 6-бром-1-изопропил-3,3-диметилиндолин-2-она (400 мг, 1,42 ммоль), бис(пинаколато)дибора (720 мг, 2,84 ммоль) и ацетата калия (348 мг, 3,54 ммоль) в ДМСО (6,5 мл) барботировали аргон в течение 5 минут. Добавляли комплекс [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) с дихлорметаном (1:1) (57,9 мг, 70,9 мкмоль) и снова барботировали аргон в течение 5 минут. Реакционную смесь нагревали до 110°С в течение 22 часов. Реакционную смесь обрабатывали водой, и водную фазу экстрагировали EtOAc. Органические слои объединяли, высушивали над Na2SO4, растворитель выпаривали, и остаток очищали хроматографией на силикагеле, используя EtOAc/гептан в качестве элюента. Соединение, указанное в заголовке, было получено в виде светло-желтого твердого вещества (660 мг, чистота 65%), которое использовали для следующей стадии без дополнительной очистки.
МС ИЭР (m/z): 330,2 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.53 (dd, J=0.8, 7.3 Гц, 1Н), 7.40 (s, 1Н), 7.23 (d, J=7.3 Гц, 1Н), 4.61 (spt, J=7.0 Гц, 1Н), 1.51 (d, J=7.1 Гц, 6Н), 1.35 (s, 12Н), 1.34 (s, 6Н).
с) 1-Изопропил-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он
Через суспензию 1-изопропил-3,3-диметил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-2-она (220 мг, 668 мкмоль), 5-бром-2-метилпиримидина (139 мг, 802 мкмоль) и 2 М водного раствора Na2CO3 (668 мкл, 1,34 ммоль) в диоксане (3,0 мл) барботировали аргон в течение 5 минут. Добавляли комплекс [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) с дихлорметаном (1:1) (27,3 мг, 33,4 мкмоль) и снова барботировали аргон в течение 5 минут. Реакционную смесь нагревали до 110°С в течение 20 часов. Растворитель выпаривали, и остаток очищали хроматографией на силикагеле, используя EtOAc/гептан в качестве элюента, с последующей хроматографией на амино-силикагеле, используя EtOAc/гептан в качестве элюента. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества (115 мг).
МС ИЭР (m/z): 296,3 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.83 (s, 2Н), 7.32 (d, J=7.7 Гц, 1Н), 7.23-7.15 (m, 1Н), 7.12 (d, J=1.4 Гц, 1Н), 4.69 (spt, J=7.1 Гц, 1Н), 2.81 (s, 3Н), 1.52 (d, J=7.1 Гц, 6Н), 1.39 (s, 6Н).
Пример 42
5,7-Дифтор-1,3,3-триметил-6-пиридин-3-ил-1,3-дигидро-индол-2-он

а) 5,7-Дифтор-6-йод-1,3,3-триметил-1,3-дигидро-индол-2-он
Получили по аналогии с примером 34а-с из 5,7-дифтор-1,3-дигидро-индол-2-она. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества.
МС ИЭР (m/z): 338 [(М+Н)+].
b) 5,7-Дифтор-1,3,3-триметил-6-пиридин-3-ил-1,3-дигидро-индол-2-он
Получили по аналогии с примером 1b из 5,7-дифтор-6-йод-1,3,3-триметил-1,3-дигидро-индол-2-она и пиридин-3-илбороновой кислоты. Соединение, указанное в заголовке, было получено в виде коричневого твердого вещества.
МС ИЭР (m/z): 289,2 [(М+Н)+].
Пример 43
5,7-Дифтор-1,3,3-триметил-6-пиримидин-5-ил-1,3-дигидро-индол-2-он

Получили по аналогии с примером 1b из 5,7-дифтор-6-йод-1,3,3-триметил-1,3-дигидро-индол-2-она (пример 42а) и пиримидин-5-илбороновой кислоты. Соединение, указанное в заголовке, было получено в виде коричневого твердого вещества.
МС ИЭР (m/z): 290,0 [(М+Н)+].
Пример 44
1,3,3,5-Тетраметил-6-(2-метил-пиридин-4-ил)-1,3-дигидро-индол-2-он

Получили по аналогии с примером 37а-е из 1-бром-4-фтор-2-метил-5-нитробензола и 2-метилпиридин-4-илбороновой кислоты. Соединение, указанное в заголовке, было получено в виде светло-желтого твердого вещества.
МС ИЭР (m/z): 289 [(М+Н)+].
Пример 45
1-Циклопропил-5-фтор-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он

a) 6-Бром-5-фтор-3,3-диметилиндолин-2-он
Получили по аналогии с примером 24а из 6-бром-5-фториндолин-2-она (пример 37с). Соединение, указанное в заголовке, было получено в виде коричневого твердого вещества.
МС ИЭР (m/z): 258,0, 259,9 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.52 (br s, 1Н), 7.11 (d, J=5.4 Гц, 1Н), 6.99 (d, J=7.7 Гц, 1Н), 1.40 (s, 6Н).
b) 6-Бром-1-циклопропил-5-фтор-3,3-диметилиндолин-2-он
К суспензии 6-бром-5-фтор-3,3-диметилиндолин-2-она (10,5 г, 40,7 ммоль), циклопропилбороновой кислоты (6,99 г, 81,4 ммоль), DMAP (14,9 г, 122 ммоль) и ацетата меди(II) (11,1 г, 61,0 ммоль) в тетрагидрофуране (810 мл) добавляли бис(триметилсилил)амид натрия (40% в ТГФ, 21,3 мл, 42,7 ммоль). При барботировании сухого воздуха через смесь реакционную смесь нагревали до 60°С в течение 15 часов. Реакционную смесь разбавляли ТБМЭ и водой, затем добавляли 400 мл 1 М водного раствора HCl. Водную фазу экстрагировали ТБМЭ. Объединенные органические фазы промывали 1 М водным раствором HCl и соляным раствором, высушивали сульфатом натрия, фильтровали, и полученный раствор концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента.
Соединение, указанное в заголовке, выделили в виде желтого твердого вещества (8,84 г).
МС ИЭР (m/z): 298,1, 300,0 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.23 (d, J=5.7 Гц, 1Н), 6.97 (d, J=7.7 Гц, 1Н), 2.67-2.57 (m, 1Н), 1.32 (s, 6Н), 1.13-1.02 (m, 2Н), 0.94-0.84 (m, 2Н).
c) 1-Циклопропил-5-фтор-3,3-диметил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-2-он
Получили по аналогии с примером 29а из 6-бром-1-циклопропил-5-фтор-3,3-диметилиндолин-2-она. Соединение, указанное в заголовке, было получено в виде светло-желтого твердого вещества.
1Н ЯМР (CDCl3, 300 МГц): δ = 7.34 (d, J=4.4 Гц, 1Н), 6.90 (d, J=8.3 Гц, 1Н), 2.72-2.61 (m, 1Н), 1.38 (s, 12Н), 1.32 (s, 6Н), 1.14-1.03 (m, 2Н), 0.96-0.86 (m, 2Н).
d) 1-Циклопропил-5-фтор-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он
Получили по аналогии с примером 29b из 1-циклопропил-5-фтор-3,3-диметил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-2-она и 5-бром-2-метилпиримидина. Соединение, указанное в заголовке, было получено в виде светло-желтого твердого вещества.
1Н ЯМР (CDCl3, 300 МГц): δ = 8.84 (d, J=1.4 Гц, 2Н), 7.07 (d, J=1.8 Гц, 1Н), 7.05 (d, J=1.0 Гц, 1Н), 2.82 (s, 3Н), 2.74-2.62 (m, 1Н), 1.38 (s, 6Н), 1.14-1.04 (m, 2Н), 0.96-0.87 (m, 2Н).
Пример 46
5,7-Дифтор-1,3,3-триметил-6-(2-метил-пиримидин-5-ил)-1,3-дигидро-индол-2-он

К раствору 5-бром-2-метил-пиримидина (247 мг, 1,42 ммоль) в безводном ДМСО (5 мл) добавляли бис(пинаколато)диборан (452 мг, 1,78 ммоль) и ацетат калия (233 мг, 2,37 ммоль). Затем реакционную смесь перемешивали в ультразвуковой бане при барботировании аргона через нее в течение 1 часа. Затем добавляли [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (44 мг, 0,059 ммоль), продували аргоном еще в течение 15 минут, а затем добавляли 5,7-дифтор-6-йод-1,3,3-триметил-1,3-дигидро-индол-2-он (пример 42а, 400 мг, 1,18 ммоль), и реакционную смесь перемешивали при 110°С в течение ночи. Смесь разбавляли этилацетатом, 0,1 М водным раствором соляной кислоты и водой, фильтровали через слой целлита и промывали EtOAc. Органический слой отделяли и промывали соляным раствором, высушивали над сульфатом натрия и концентрировали в вакууме. Полученное вещество очищали хроматографией на амино-силикагеле. Соединение, указанное в заголовке, было получено в виде желтого твердого вещества (72 мг).
МС ИЭР (m/z): 304,2 [(М+Н)+].
Пример 47
1-(Циклопропилметил)-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он

Получили по аналогии с примером 48, применяя (бромметил)циклопропан. Соединение, указанное в заголовке, было получено в виде белого твердого вещества.
МС ИЭР (m/z): 308,5 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.85 (s, 2Н), 7.33 (d, J=7.7 Гц, 1Н), 7.22 (dd, J=1.5, 7.7 Гц, 1Н), 7.06 (d, J=1.4 Гц, 1Н), 3.67 (d, J=6.9 Гц, 2Н), 2.81 (s, 3Н), 1.42 (s, 6Н), 1.23-1.07 (m, 1Н), 0.61-0.32 (m, 4Н).
Пример 48
1-(Циклобутилметил)-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он

a) 6-Бром-1-(циклобутилметил)-3,3-диметилиндолин-2-он
К раствору 6-бром-3,3-диметилиндолин-2-она (пример 24а, 500 мг, 2,08 ммоль) в ДМФ (17 мл) добавляли (бромметил)циклобутан (621 мг, 468 мкл, 4,16 ммоль) и карбонат цезия (1,36 г, 4,16 ммоль). Реакционную смесь нагревали до 80°С в течение 1 часа, а затем обрабатывали 1 М водным раствором HCl. Водную фазу экстрагировали EtOAc, объединенные органические слои высушивали над Na2SO4, растворитель выпаривали, и остаток очищали флэш-хроматографией на силикагеле, используя EtOAc/гептан в качестве элюента.
МС ИЭР (m/z): 308,4/310,4 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.16 (dd, J=1.6, 7.7 Гц, 1Н), 7.04 (d, J=7.7 Гц, 1Н), 6.98 (d, J=1.6 Гц, 1Н), 3.71 (d, J=7.3 Гц, 2Н), 2.74 (quin, J=7.7 Гц, 1Н), 2.10-1.71 (m, 6Н), 1.34 (s, 6Н).
b) 1-(Циклобутилметил)-3,3-диметил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-2-он
Через раствор 6-бром-1-(циклобутилметил)-3,3-диметилиндолин-2-она (145 мг, 470 мкмоль), бис(пинаколато)дибора (239 мг, 941 мкмоль) и ацетата калия (115 мг, 1,18 ммоль) в ДМСО (4 мл) барботировали аргон в течение 5 минут и добавляли комплекс [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) с дихлорметаном (19,2 мг, 23,5 мкмоль). Реакционную смесь нагревали до 120°С в течение 5 часов. Добавляли воду, водную фазу экстрагировали EtOAc, и объединенные органические слои высушивали над Na2SO4. Растворитель выпаривали, и остаток очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде светло-желтого твердого вещества (200 мг, чистота ~80%) и использовали для следующей реакции без дополнительной очистки.
МС ИЭР (m/z): 356,6 [(М+Н)+].
с) 1-(Циклобутилметил)-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он
Через смесь 1-(циклобутилметил)-3,3-диметил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-2-она (200 мг, 563 мкмоль), 5-бром-2-метилпиримидина (146 мг, 844 мкмоль), 2 М водного раствора Na2CO3 (563 мкл, 1,13 ммоль) и диоксана (5 мл) барботировали аргон в течение 5 минут и добавляли комплекс [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) с дихлорметаном (1:1) (25,5 мг, 28,1 мкмоль). Реакционную смесь нагревали до 120°С в течение 4 часов, а затем обрабатывали насыщенным водным раствором NaHCO3. Водную фазу экстрагировали EtOAc, объединенные органические слои высушивали над Na2SO4, и растворитель выпаривали. Остаток очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента, с последующей хроматографией на NH2-силикагеле, используя гептан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде светло-желтого твердого вещества (105 мг).
МС ИЭР (m/z): 322,5 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.83 (s, 2Н), 7.35-7.28 (m, 1Н), 7.23-7.15 (m, 1Н), 6.96 (d, J=1.4 Гц, 1Н), 3.81 (d, J=7.3 Гц, 2Н), 2.87-2.70 (m, 1Н), 2.80 (s, 3Н), 2.13-1.78 (m, 6Н), 1.40 (s, 6Н).
Пример 49
3,3-Диметил-6-(2-метил-пиримидин-5-ил)-1-оксетан-3-ил-1,3-дигидро-индол-2-он

а) 6-Бром-3,3-диметил-1-(оксетан-3-ил)индолин-2-он
К раствору 6-бром-3,3-диметилиндолин-2-она (пример 24а, 500 мг, 2,08 ммоль) в ДМФ (6,6 мл) в атмосфере аргона добавляли 3-бромоксетан (535 мг, 298 мкл, 3,75 ммоль) и карбонат цезия (1,36 г, 4,16 ммоль). Реакционную смесь нагревали до 60°С в течение 18 ч, а затем обрабатывали 1 М водным раствором хлорида аммония. Водную фазу экстрагировали EtOAc, объединенные органические слои высушивали над Na2SO4, и растворитель выпаривали. Остаток очищали хроматографией на силикагеле, используя EtOAc/гептан в качестве элюента. Соединение, указанное в заголовке, было получено в виде оранжевого масла (545 мг).
МС ИЭР (m/z): 296,5/298,5 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.71 (d, J=1.6 Гц, 1Н), 7.27 (dd, J=1.8, 7.9 Гц, 2Н), 7.12 (d, J=7.9 Гц, 1Н), 5.56 (tt, J=6.0, 7.8 Гц, 1Н), 5.12-5.03 (m, 4Н), 1.36 (s, 6Н).
b) 3,3-Диметил-6-(2-метил-пиримидин-5-ил)-1-оксетан-3-ил-1,3-дигидро-индол-2-он
Получили по аналогии с примером 48b-с из 6-бром-3,3-диметил-1-(оксетан-3-ил)индолин-2-она. Соединение, указанное в заголовке, было получено в виде белого твердого вещества.
МС ИЭР (m/z): 310,5 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.87 (s, 2Н), 7.75 (d, J=1.2 Гц, 1Н), 7.39 (d, J=7.6 Гц, 1Н), 7.30 (dd, J=1.4, 7.5 Гц, 1Н), 5.63 (tt, J=5.8, 7.9 Гц, 1Н), 5.20-5.03 (m, 4Н), 2.81 (s, 3Н), 1.42 (s, 6Н).
Пример 50
1-(3-Циклопропоксипропил)-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он

а) 6-Бром-1-(3-циклопропоксипропил)-3,3-диметилиндолин-2-он
К суспензии 6-бром-3,3-диметилиндолин-2-она (пример 24а, 1,34 г, 5,58 ммоль) и Cs2CO3 (3,64 г, 11,2 ммоль) в ДМФ (10 мл) добавляли раствор (3-бромпропокси)циклопропана (2,00 г, 11,2 ммоль) в ДМФ (2,5 мл). Реакционную смесь нагревали до 70°С и перемешивали при этой температуре в течение 15 часов. Реакционную смесь фильтровали, и полученный раствор концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде желтого масла (1,44 г).
МС ИЭР (m/z): 338,4, 340,4 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.17 (dd, J=1.8, 7.7 Гц, 1Н), 7.08-7.02 (m, 2Н), 3.75 (t, J=6.8 Гц, 2Н), 3.49 (t, J=6.0 Гц, 2Н), 3.29-3.20 (m, 1Н), 1.92 (quin, J=6.4 Гц, 2Н), 1.35 (s, 6Н), 0.61-0.40 (m, 4Н).
b) 1-(3-Циклопропоксипропил)-3,3-диметил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-2-он
Получили по аналогии с примером 29а из 6-бром-1-(3-циклопропоксипропил)-3,3-диметилиндолин-2-она. Соединение, указанное в заголовке, было получено в виде желтого вязкого масла.
МС ИЭР (m/z): 386,6 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.54 (dd, J=0.8, 7.3 Гц, 1Н), 7.31 (s, 1Н), 7.22 (d, J=7.3 Гц, 1Н), 3.81 (t, J=6.7 Гц, 2Н), 3.50 (t, J=6.2 Гц, 2Н), 3.30-3.22 (m, 1Н), 1.96 (quin, J=6.5 Гц, 2Н), 1.36 (s, 6Н), 1.35 (s, 12Н), 0.62-0.52 (m, 2Н), 0.47-0.37 (m, 2Н).
c) 1-(3-Циклопропоксипропил)-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он
Получили по аналогии с примером 29b из 1-(3-циклопропоксипропил)-3,3-диметил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-2-она и 5-бром-2-метилпиримидина. Соединение, указанное в заголовке, было получено в виде светло-желтого масла.
МС ИЭР (m/z): 352,5 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.85 (s, 2Н), 7.32 (d, J=7.5 Гц, 1Н), 7.22 (dd, J=1.6, 7.7 Гц, 1Н), 7.07 (d, J=1.2 Гц, 1Н), 3.85 (t, J=6.9 Гц, 2Н), 3.52 (t, J=6.0 Гц, 2Н), 3.26-3.16 (m, 1Н), 2.80 (s, 3Н), 1.96 (quin, J=6.4 Гц, 2Н), 1.41 (s, 6Н), 0.58-0.36 (m, 4Н).
Пример 51
3,3-Диметил-6-(2-метилпиридин-4-ил)-1-(оксетан-3-ил)индолин-2-он

Через суспензию 6-бром-3,3-диметил-1-(оксетан-3-ил)индолин-2-она (пример 49а, 130 мг, 439 мкмоль) и 2-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридина (118 мг, 527 мкмоль) в диоксане (3,8 мл) и 2 М водном растворе карбоната натрия (219 мкл, 439 мкмоль) барботировали аргон в течение 5 минут. Добавляли комплекс [1,1-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) с дихлорметаном (1:1) (17,9 мг, 21,9 мкмоль), и снова барботировали аргон в течение 5 минут. Реакционную смесь нагревали до 110°С в течение 2 часов. Растворитель выпаривали, и остаток очищали хроматографией на силикагеле, используя дихлорметан/метанол с 1% аммиаком в качестве элюента, с последующей препаративной ВЭЖХ. Соединение, указанное в заголовке, было получено в виде белого твердого вещества (75 мг).
МС ИЭР (m/z): 309,5 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.56 (d, J=5.0 Гц, 1Н), 7.83 (d, J=0.8 Гц, 1Н), 7.43-7.31 (m, 4Н), 5.65 (tt, J=5.9, 8.0 Гц, 1Н), 5.24-5.05 (m, 4Н), 2.64 (s, 3Н), 1.42 (s, 6Н).
Пример 52
3,3-Диметил-1-(оксетан-3-ил)-6-(пиридин-3-ил)индолин-2-он

Получили по аналогии с примером 51, используя 3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества.
МС ИЭР (m/z): 295,4 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.88 (d, J=2.0 Гц, 1Н), 8.63 (dd, J=1.4, 4.8 Гц, 1Н), 7.96-7.85 (m, 1Н), 7.81-7.73 (m, 1Н), 7.45-7.29 (m, 3Н), 5.64 (tt, J=5.8, 8.0 Гц, 1Н), 5.25-5.03 (m, 4Н), 1.43 (s, 6Н).
Пример 53
3,3-Диметил-6-(6-метил-пиридазин-3-ил)-1-оксетан-3-ил-1,3-дигидро-индол-2-он

Получили по аналогии с примером 49, используя 3-хлор-6-метилпиридазин. Соединение, указанное в заголовке, было получено в виде белого твердого вещества.
МС ИЭР (m/z): 310,5 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.16 (d, J=1.2 Гц, 1Н), 7.82 (dd, J=1.4, 7.7 Гц, 1Н), 7.78 (d, J=8.7 Гц, 1Н), 7.44-7.37 (m, 2Н), 5.60 (tt, J=6.1, 7.9 Гц, 1Н), 5.28-5.02 (m, 4Н), 2.78 (s, 3Н), 1.43 (s, 6Н).
Пример 54
1-(3-(Циклопропилсульфонил)пропил)-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он

a) 3-Циклопропилтио)пропан-1-ол
Раствор 3-меркаптопропан-1-ола (1,15 г, 1,08 мл, 12,5 ммоль), трет-бутоксида калия (1,4 г, 12,5 ммоль) и бромциклопропана (1,51 г, 1 мл, 12,5 ммоль) в ДМСО (30 мл) нагревали до 80°С в течение 15 часов. Реакционную смесь наливали в 75 мл насыщенного водного раствора NaHCO3 и экстрагировали диэтиловым эфиром и промывали водой. Объединенные органические слои высушивали сульфатом натрия, фильтровали, и полученный раствор концентрировали в вакууме. Соединение, указанное в заголовке, было получено в виде красной жидкости (1,24 г) и использовано без дополнительной очистки.
1Н ЯМР (CDCl3, 300 МГц): δ = 3.78 (q, J=5.9 Гц, 2Н), 2.70 (t, J=7.1 Гц, 2Н), 2.00-1.81 (m, 3Н), 0.95-0.75 (m, 2Н), 0.61-0.47 (m, 2Н).
b) (3-Бромпропил)(циклопропил)сульфан
К суспензии 3-(циклопропилтио)пропан-1-ола (1,68 г, 12,7 ммоль) и CBr4 (5,06 г, 15,2 ммоль) в пентане (13 мл) добавляли порциями трифенилфосфин (4,00 г, 15,2 ммоль) при охлаждении во льду. К очень густой суспензии добавляли дихлорметан (7 мл), и суспензию перемешивали 4 часов. Реакционную смесь фильтровали и промывали пентаном. Полученный раствор концентрировали в вакууме. Соединение, указанное в заголовке, было получено в виде смеси с ТРРО в виде коричневого полутвердого вещества (6,66 г). Это вещество использовали без дополнительной очистки.
c) 6-Бром-1-(3-(Циклопропилтио)пропил)-3,3-диметилиндолин-2-он
Получили по аналогии с примером 50а из 6-бром-3,3-диметилиндолин-2-она (пример 24а) и (3-бромпропил)(циклопропил)сульфана. Соединение, указанное в заголовке, было получено в виде желтого вязкого масла.
МС ИЭР (m/z): 354,4, 356,4 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.18 (dd, J=1.8, 7.9 Гц, 1Н), 7.10-7.01 (m, 2Н), 3.79 (t, J=7.2 Гц, 2Н), 2.61 (t, J=7.3 Гц, 2Н), 2.09-1.95 (m, 2Н), 1.95-1.83 (m, 1Н), 1.35 (s, 6Н), 0.93-0.78 (m, 2Н), 0.59-0.50 (m, 2Н).
d) 1-(3-(Циклопропилтио)пропил)-3,3-диметил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-2-он
Получили по аналогии с примером 29а из 6-бром-1-(3-(циклопропилтио)пропил)-3,3-диметилиндолин-2-она. Соединение, указанное в заголовке, было получено в виде светло-желтого вязкого масла.
МС ИЭР (m/z): 402,6 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.55 (dd, J=0.9, 7.4 Гц, 1Н), 7.30 (s, 1Н), 7.23 (d, J=7.7 Гц, 1Н), 3.85 (t, J=7.1 Гц, 2Н), 2.62 (t, J=7.5 Гц, 2Н), 2.05 (quin, J=7.3 Гц, 2Н), 1.90 (tt, J=4.4, 7.4 Гц, 1Н), 1.36 (s, 6Н), 1.35 (s, 12Н), 0.89-0.77 (m, 2Н), 0.59-0.51 (m, 2Н).
e) 1-(3-(Циклопропилтио)пропил)-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он
Получили по аналогии с примером 29b из 1-(3-(циклопропилтио)пропил)-3,3-диметил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-2-она и 5-бром-2-метилпиримидина. Соединение, указанное в заголовке, было получено в виде красного вязкого масла.
МС ИЭР (m/z): 368,6 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.85 (s, 2Н), 7.33 (d, J=7.5 Гц, 1Н), 7.23 (d, J=7.7 Гц, 1Н), 7.09 (s, 1Н), 3.90 (t, J=7.0 Гц, 2Н), 2.81 (s, 3Н), 2.63 (t, J=7.0 Гц, 2Н), 2.13-2.00 (m, 2Н), 1.95-1.81 (m, 1Н), 1.41 (s, 6Н), 0.91-0.75 (m, 2Н), 0.61-0.43 (m, 2Н).
f) 1-(3-Циклопропилсульфонил)пропил)-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он
К раствору 1-(3-(циклопропилтио)пропил)-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-она (147 мг, 340 мкмоль) в метаноле (1,5 мл) добавляли раствор оксона (314 мг, 510 мкмоль) в воде (1,5 мл), и смесь перемешивали в течение 2 часов. Реакционную смесь наливали в 20 мл 2 М водного раствора карбоната натрия и экстрагировали этилацетатом. Органические слои высушивали сульфатом натрия, фильтровали, и полученный раствор концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя этилацетат/метанол в качестве элюента. Соединение, указанное в заголовке, было получено в виде светло-желтого твердого вещества (35 мг).
МС ИЭР (m/z): 400,6 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.86 (s, 2Н), 7.34 (d, J=7.7 Гц, 1Н), 7.26-7.23 (m, 1Н), 7.11 (d, J=1.4 Гц, 1Н), 3.98 (t, J=7.0 Гц, 2Н), 3.18-3.07 (m, 2Н), 2.80 (s, 3Н), 2.46-2.25 (m, 3Н), 1.42 (s, 6Н), 1.29-1.22 (m, 2Н), 1.12-0.99 (m, 2Н).
Пример 55
1-(2-Гидроксиэтил)-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он

Получили по аналогии с примером 56, используя (2-бромэтокси)(трет-бутил)диметилсилан. Соединение, указанное в заголовке, было получено в виде белого твердого вещества.
МС ИЭР (m/z): 298,6 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.83 (s, 2Н), 7.33 (d, J=7.5 Гц, 1Н), 7.23 (dd, J=1.4, 7.7 Гц, 1Н), 7.11 (d, J=1.4 Гц, 1Н), 3.96 (s, 4Н), 2.79 (s, 3Н), 1.43 (s, 6Н).
Пример 56
1-(3-Гидроксипропил)-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он

a) 1-(3-(трет-Бутилдиметилсилилокси)пропил)-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он
К раствору 3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-она (пример 21, 140 мг, 553 мкмоль) в ДМФ (2,5 мл) в атмосфере аргона добавляли (3-бромпропокси)(трет-бутил)диметилсилана (280 мг, 256 мкл, 1,11 ммоль) и карбонат цезия (360 мг, 1,11 ммоль). Реакционную смесь нагревали до 80°С в течение 3 часов. Реакционную смесь наливали в воду, и водную фазу экстрагировали EtOAc. Объединенные органические слои высушивали над Na2SO4, и растворитель выпаривали. Остаток очищали флэш-хроматографией на силикагеле, используя EtOAc/гептан в качестве элюента. Соединение, указанное в заголовке, было получено в виде светло-коричневой жидкости (250 мг).
МС ИЭР (m/z): 426,6 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.82 (s, 2Н), 7.31 (d, J=7.5 Гц, 1Н), 7.19 (dd, J=1.6, 7.5 Гц, 1Н), 7.06 (d, J=1.4 Гц, 1Н), 3.87 (t, J=7.2 Гц, 2Н), 3.68 (t, J=5.9 Гц, 2Н), 2.80 (s, 3Н), 1.97-1.83 (m, 2Н), 1.40 (s, 6Н), 0.88 (s, 9Н), 0.04 (s, 6Н).
b) 1-(3-Гидроксипропил)-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он
Раствор 1-(3-(трет-бутилдиметилсилилокси)пропил)-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-она (250 мг, 587 мкмоль) в ТГФ (10 мл) охлаждали до 0°С и добавляли раствор TBAF в ТГФ (1 М, 587 мкл, 587 мкмоль). Реакционную смесь подогревали до комнатной температуры и перемешивали в течение 3 часов. Реакционную смесь обрабатывали водой, и водную фазу экстрагировали этилацетатом. Объединенные органические слои высушивали над сульфатом натрия, и растворитель выпаривали. Остаток очищали флэш-хроматографией на силикагеле, используя дихлорметан/метанол с 10% концентрированным водным раствором аммиака в качестве элюента. Соединение, указанное в заголовке, было получено в виде беловатого воскового твердого вещества (140 мг).
МС ИЭР (m/z): 312,5 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.84 (s, 2Н), 7.35 (d, J=7.7 Гц, 1Н), 7.26-7.23 (m, 1Н), 7.04 (d, J=1.2 Гц, 1Н), 4.00-3.90 (m, 2Н), 3.62-3.51 (m, 2Н), 3.02 (t, J=6.8 Гц, 1Н), 2.80 (s, 3Н), 1.96-1.85 (m, 2Н), 1.44 (s, 6Н).
Пример 57
3,3-Диметил-6-(2-метилпиримидин-5-ил)-1-(2-(метилсульфонил)этил)индолин-2-он

К раствору 3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-она (пример 21, 100 мг, 395 мкмоль) в ДМФ (2 мл) добавляли метилсульфонилэтен (50,3 мг, 44,9 мкл, 474 мкмоль) и карбонат цезия (154 мг, 474 мкмоль), и реакционную смесь перемешивали при комнатной температуре в течение 12 часов. Добавляли воду, и водную фазу экстрагировали этилацетатом. Объединенные органические слои высушивали над Na2SO4, и растворитель выпаривали. Остаток очищали флэш-хроматографией на силикагеле, используя дихлорметан/метанол с 10% аммиаком в качестве элюента. Соединение, указанное в заголовке, было получено в виде белого твердого вещества (126 мг).
МС ИЭР (m/z): 360,6 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.85 (s, 2Н), 7.34 (d, J=7.9 Гц, 1Н), 7.26 (dd, J=1.5, 7.6 Гц, 1Н), 7.14 (d, J=1.2 Гц, 1Н), 4.28 (t, J=6.8 Гц, 2Н), 3.44 (t, J=6.7 Гц, 2Н), 2.98 (s, 3Н), 2.80 (s, 3Н), 1.43 (s, 6Н).
Пример 58
6-Имидазол-1-ил-3,3-диметил-1,3-дигидро-индол-2-он

Получили по аналогии с примером 63, используя 1Н-имидазол. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества.
МС ИЭР (m/z): 228,2 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 8.46 (br s, 1Н), 7.86 (s, 1Н), 7.29-7.26 (m, 1Н), 7.22 (s, 1Н), 7.07 (dd, J=2.0, 7.9 Гц, 1Н), 6.97 (d, J=1.8 Гц, 1Н), 1.44 (s, 6Н).
Пример 59
1,3,3-Триметил-6-(3-метил-1,2,4-оксадиазол-5-ил)индолин-2-он

а) 1,3,3-Триметил-2-оксоиндолин-6-карбоновая кислота
К суспензии NaH (60% на минеральном масле, 12,6 г, 314 ммоль) в безводном ТГФ (260 мл) добавляли метил-2-оксоиндолин-6-карбоксилат (15 г, 78,5 ммоль) порциями в течение 30 минут. После прекращения выделения газа добавляли по каплям MeI (44,5 г, 19,6 мл, 314 ммоль) шприцевым насосом в течение 80 минут при осторожном поддержании температуры от 24°С до 28°С. Реакционную смесь перемешивали в течение 2 часов при комнатной температуре, а затем очень осторожно гасили добавлением воды (5,65 мл, 314 ммоль), а затем 32% водного раствора NaOH (19,6 г, 14,5 мл, 157 ммоль). Полученную в результате смесь наливали в 100 мл ТБМЭ, слои разделяли, и органический слой экстрагировали водой. Объединенные водные слои подкисляли 25% водным раствором HCl (20 мл). Полученную в результате суспензию фильтровали. Водный слой подвергали обратной экстракции дихлорметаном, объединенные органические слои высушивали сульфатом натрия и концентрировали в вакууме. Полученное твердое вещество объединяли с фильтрованным твердым веществом с получением соединения, указанного в заголовке, в виде светло-красного твердого вещества (17,7 г).
МС ИЭР (m/z): 220,2 [(М+Н)+].
1Н ЯМР (ДМСО-d6, 300 МГц) δ = 12.98 (br. s, 1Н), 7.69 (dd, J=1.0, 7.7 Гц, 1H), 7.55-7.41 (m, 2Н), 3.18 (s, 3Н), 1.29 (s, 6H).
b) 1,3,3-Триметил-6-(3-метил-1,2,4-оксадиазол-5-ил)индолин-2-он
Суспензию 1,3,3-триметил-2-оксоиндолин-6-карбоновой кислоты (200 мг, 912 мкмоль) и CDI (229 мг, 1,37 ммоль) в безводном ТГФ (9,03 мл) нагревали до образования флегмы в атмосфере аргона в течение 2 часов. Затем смесь охлаждали до комнатной температуры, добавляли (Z)-N'-гидроксиацетимидамид (67,6 мг, 912 мкмоль), и реакционную смесь перемешивали в течение 24 часов при комнатной температуре в атмосфере аргона. Смесь концентрировали в вакууме, и полученный остаток растворяли в уксусной кислоте (13,4 г, 12,7 мл, 223 ммоль). Затем реакционную смесь нагревали до образования флегмы в течение 3 часов. Смесь концентрировали в вакууме, и полученный в результате остаток растворяли в этилацетате и 1 М водном растворе карбоната натрия. Смесь экстрагировали этилацетатом и промывали 1 М водным раствором карбоната натрия. Объединенные органические слои высушивали над сульфатом натрия, фильтровали, и полученный раствор концентрировали в вакууме. Полученное вещество очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента.
МС ИЭР (m/z): 258,2 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.86 (dd, J=1.4, 7.7 Гц, 1Н), 7.55 (d, J=1.2 Гц, 1Н), 7.35 (d, J=7.7 Гц, 1Н), 3.29 (s, 3Н), 2.49 (s, 3Н), 1.42 (s, 6Н).
Пример 60
3,3-Диметил-6-(3-метил-1,2,4-оксадиазол-5-ил)индолин-2-он

а) Метил-3,3-диметил-2-охоиндолин-6-карбоксилат
К раствору MeI (7,42 г, 3,27 мл, 52,3 ммоль) в ДМФ (75,0 мл) добавляли метил-2-оксоиндолин-6-карбоксилат (5 г, 26,2 ммоль). Как только все растворилось, добавляли NaH (60% в минеральном масле, 1,05 г, 26,2 ммоль), и реакционную смесь перемешивали в течение 30 минут при комнатной температуре. Затем снова добавляли NaH (60% на минеральном масле, 523 мг, 13,1 ммоль), и перемешивание продолжали еще в течение часа. Снова добавляли NaH (60% на минеральном масле, 523 мг, 13,1 ммоль), и перемешивание продолжали в течение 15 часов. Реакционную смесь гасили 1 М водным раствором HCl, смесь экстрагировали этилацетатом, и органические слои промывали водой. Объединенные органические слои высушивали сульфатом натрия, фильтровали, и полученный раствор концентрировали в вакууме. Полученное в результате твердое вещество растирали с диизопропиловым эфиром, фильтровали, и собранное твердое вещество высушивали. Соединение, указанное в заголовке, было получено в виде красного твердого вещества (4,61 г)
МС ИЭР (m/z): 220,3 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.98 (br s, 1Н), 7.78 (dd, J=1.3, 7.8 Гц, 1Н), 7.58 (d, J=1.0 Гц, 1Н), 7.26 (d, J=7.7 Гц, 1Н), 3.92 (s, 3Н), 1.42 (s, 6Н).
b) 3,3-Диметил-2-оксоиндолин-6-карбоновая кислота
Суспензию метил-3,3-диметил-2-охоиндолин-6-карбоксилата (2 г, 9,12 ммоль) в 25% водном растворе HCl (55,1 мл, 423 ммоль) нагревали до 100°С в течение 18 часов. Смесь охлаждали до комнатной температуры и разбавляли водой. Полученную в результате суспензию фильтровали, промывали водой и гептаном, и собранное твердое вещество высушивали. Соединение, указанное в заголовке, было получено в виде красного твердого вещества (1,51 г).
МС ИЭР (m/z): 204,1 [(М-Н)+].
1Н ЯМР (ДМСО-d6, 300 МГц) δ = 12.90 (br s, 1Н), 10.49 (s, 1Н), 7.60 (dd, J=1.2, 7.7 Гц, 1Н), 7.47-7.32 (m, 2Н), 1.27 (s, 6Н).
c) 3,3-Диметил-6-(3-метил-1,2,4-оксадиазол-5-ил)индолин-2-он
Получили по аналогии с примером 59b, используя 3,3-диметил-2-оксоиндолин-6-карбоновую кислоту. Соединение, указанное в заголовке, было получено в виде пурпурного твердого вещества.
МС ИЭР (m/z): 244,3 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.85 (d, J=7.9 Гц, 1Н), 7.67-7.56 (m, 2Н), 7.34 (d, J=7.7 Гц, 1Н), 2.48 (s, 3Н), 1.45 (s, 6Н).
Пример 61
6-(1Н-Имидазол-1-ил)-1,3,3-триметилиндолин-2-он

К раствору глиоксаля (40% в воде, 458 мг, 360 мкл, 3,15 ммоль) и формальдегида (36% в воде, 658 мг, 603 мкл, 7,88 ммоль) в метаноле (1,58 мл) добавляли раствор 6-амино-1,3,3-триметил-2-оксоиндолина (300 мг, 1,58 ммоль) в метаноле (1,58 мл) и ацетат аммония (248 мг, 3,15 ммоль), и реакционную смесь нагревали до образования флегмы. Через 3 часа смесь гасили 10 мл насыщенного водного раствора NaHCO3. Смесь экстрагировали ТБМЭ, и органические слои промывали насыщенным водным раствором NaHCO3. Объединенные органические слои высушивали сульфатом натрия, фильтровали и концентрировали в вакууме. Полученное вещество очищали хроматографией на силикагеле, используя дихлорметан/метанол в качестве элюента. Полученное вещество дополнительно очищали препаративной ВЭЖХ с обращенной фазой, используя колонку Gemini С18 и метанол/воду/триэтиламин в качестве элюента. Соединение, указанное в заголовке, было получено в виде белого твердого вещества (169 мг).
МС ИЭР (m/z): 242,3 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.85 (s, 1Н), 7.33-7.20 (m, 3Н), 7.07 (dd, J=1.9, 7.8 Гц, 1Н), 6.84 (d, J=1.8 Гц, 1Н), 3.30-3.22 (m, 3Н), 1.41 (s, 6Н).
Пример 62
1,3,3-Триметил-6-(3-(трифторметил)-1,2,4-оксадиазол-5-ил)индолин-2-он

Получили по аналогии с примером 59b, используя 1,3,3-триметил-2-оксоиндолин-6-карбоновую кислоту (пример 59а) и 2,2,2-трифтор-N-гидрокси-ацетамидин. Соединение, указанное в заголовке, было получено в виде белого твердого вещества.
МС ИЭР (m/z): 311 [М+]
1Н ЯМР (CDCl3, 300 МГц): δ = 7.94 (dd, J=1.6, 7.7 Гц, 1Н), 7.60 (d, J=1.4 Гц, 1Н), 7.40 (d, J=7.7 Гц, 1Н), 3.31 (s, 3Н), 1.43 (s, 6Н).
Пример 63
3,3-Диметил-6-(4-метил-1Н-имидазол-1-ил)индолин-2-он

Через суспензию 6-бром-3,3-диметилиндолин-2-она (пример 24а, 200 мг, 833 мкмоль), 4-метил-1Н-имидазола (342 мг, 4,16 ммоль), карбоната калия (121 мг, 875 мкмоль) и 2-ацетилциклогексанона (29,2 мг, 27,1 мкл, 208 мкмоль) в NMP (1,6 мл) барботировали аргон в течение 5 минут, добавляли хлорид меди(I) (8,25 мг, 83,3 мкмоль) и снова барботировали аргон через суспензию в течение 5 минут. Реакционную смесь нагревали до 130°С в течение 16 часов. К реакционной смеси добавляли 4-метил-1Н-имидазол (342 мг, 4,16 ммоль), карбонат калия (121 мг, 875 мкмоль), 2-ацетилциклогексанон (29,2 мг, 27,1 мкл, 208 мкмоль) и хлорид меди(I) (8,25 мг, 83,3 мкмоль) и нагревали до 130°С еще в течение 24 часов. Смесь разбавляли EtOAc и насыщенным водным раствором NaHCO3. Водную фазу экстрагировали EtOAc, органические слои объединяли и высушивали Na2SO4. Растворитель выпаривали, и остаток очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента, с последующей препаративной ВЭЖХ и хроматографией на NH2-силикагеле, используя гептан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде белого твердого вещества (56 мг).
МС ИЭР (m/z): 242,3 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.72 (d, J=1.4 Гц, 1Н), 7.70 (bs, 1Н), 7.26-7.23 (m, 1Н), 7.03 (dd, J=1.9, 8.0 Гц, 1Н), 6.97 (t, J=1.2 Гц, 1Н), 6.90 (d, J=1.8 Гц, 1Н), 2.30 (s, 3Н), 1.43 (s, 6Н).
Пример 64
1,3,3-Триметил-6-(4-метил-1Н-имидазол-1-ил)индолин-2-он

Получили по аналогии с примером 63, используя 6-бром-1,3,3-триметилиндолин-2-он (пример 1а). Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества.
МС ИЭР (m/z): 256,3 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.75 (d, J=1.4 Гц, 1Н), 7.25-7.24 (m, 1Н), 7.04 (dd, J=2.0, 7.9 Гц, 1Н), 7.01 (t, J=1.2 Гц, 1Н), 6.81 (d, J=1.8 Гц, 1Н), 3.25 (s, 3Н), 2.31 (d, J=0.8 Гц, 3Н), 1.40 (s, 6Н).
Пример 65
1,3,3-Триметил-6-(5-метил-1Н-имидазол-1-ил)индолин-2-он

Образован как минорный изомер примера 64. Соединение, указанное в заголовке, было получено в виде оранжевого масла.
МС ИЭР (m/z): 256,3 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.59 (s, 1Н), 7.29 (d, J=7.9 Гц, 1Н), 6.96 (dd, J=1.9, 7.8 Гц, 1Н), 6.92 (s, 1Н), 6.75 (d, J=1.8 Гц, 1Н), 3.24 (s, 3Н), 2.20 (d, J=1.0 Гц, 3Н), 1.43 (s, 6Н).
Пример 66
6-(1,5-Диметил-1Н-имидазол-2-ил)-1,3,3-триметилиндолин-2-он

а) 1,3,3-Триметил-2-оксоиндолин-6-карбонитрил
Суспензию 6-бром-1,3,3-триметилиндолин-2-она (пример 1а, 500 мг, 1,97 ммоль), цианида цинка (277 мг, 2,36 ммоль) и тетракис(трифенилфосфин)палладия(0) (227 мг, 197 мкмоль) в ДМФ (13,0 мл) нагревали до 80°С в течение 17 часов в атмосфере аргона. Реакционную смесь обрабатывали водой, и водную фазу экстрагировали EtOAc. Объединенные органические слои высушивали над Na2SO4, и растворитель выпаривали. Неочищенное вещество очищали флэш-хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде белого твердого вещества (371 мг).
ИЭР (m/z): 201,2 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.40 (dd, J=1.4, 7.5 Гц, 1Н), 7.29 (d, J=8.1 Гц, 1Н), 7.07 (d, J=1.2 Гц, 1Н), 3.24 (s, 3Н), 1.39 (s, 6Н)
b) 1,3,3-Триметил-2-оксоиндолин-6-карбоксимидамид
К раствору бис(триметилсилил)амида лития (1 M в ТГФ) (3,21 мл, 3,21 ммоль) в безводном диэтиловом эфире (6 мл) при 0°С в атмосфере аргона добавляли 1,3,3-триметил-2-оксоиндолин-6-карбонитрил (314 мг, 1,57 ммоль) тремя порциями. Через 5 минут охлаждающую баню удаляли, и перемешивание продолжали при комнатной температуре в течение 12 часов. Реакционную смесь охлаждали до 0°С и медленно добавляли водный раствор HCl (6 М, 1,57 мл, 9,41 ммоль). Реакционную смесь перемешивали при 0°С в течение 1 часа, затем подогревали до комнатной температуры и перемешивали в течение 12 часов. Реакционную смесь разбавляли диэтиловым эфиром и водой и осторожно подщелачивали до рН 14 твердым NaOH. Водную фазу экстрагировали дихлорметаном. Объединенные органические слои высушивали над Na2SO4, и растворитель выпаривали. Соединение, указанное в заголовке, было получено в виде белого твердого вещества (325 мг).
ИЭР (m/z): 218,3 [(М+Н)+].
c) 1,3,3-Триметил-6-(5-метил-1Н-имидазол-2-ил)индолин-2-он
К раствору 1,3,3-триметил-2-оксоиндолин-6-карбоксимидамида (550 мг, 2,53 ммоль) в ТГФ (10 мл) добавляли водный раствор 1 М бикарбоната натрия (5,06 мл, 5,06 ммоль), а затем хлорацетон (234 мг, 202 мкл, 2,53 ммоль). Реакционную смесь нагревали до образования флегмы и перемешивали в течение 5 часов. Добавляли дополнительное количество хлорацетона (20 мкл) и водного раствора бикарбоната натрия (500 мкл), и перемешивание с обратным холодильником продолжали еще в течение 3 часов. Реакционную смесь экстрагировали этилацетатом и водой, объединенные органические слои высушивали над Na2SO4, и растворители выпаривали. Неочищенное вещество очищали хроматографией на силикагеле, используя дихлорметан/метанол (с 10% концентрированным раствором аммиака), с последующей препаративной ВЭЖХ. Соединение, указанное в заголовке, было получено в виде белого твердого вещества (200 мг).
ИЭР (m/z): 256,3 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.46 (d, J=1.2 Гц, 1Н), 7.39 (d, J=7-7 Гц, 1Н), 7.20 (d, J=7.5 Гц, 1Н), 6.86 (d, J=1.0 Гц, 1Н), 3.19 (s, 3Н), 2.33 (s, 3Н), 1.37 (s, 6Н).
d) 6-(1,5-Диметил-1Н-имидазол-2-ил)-1,3,3-триметилиндолин-2-он
К суспензии 1,3,3-триметил-6-(5-метил-1Н-имидазол-2-ил)индолин-2-она (195 мг, 764 мкмоль) и карбоната цезия (249 мг, 764 мкмоль) в безводном ДМФ (4 мл) медленно добавляли раствор йодметана (97,6 мг, 43,0 мкл, 687 мкмоль) в безводном ДМФ (4 мл) и перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь гасили водой, и водную фазу экстрагировали этилацетатом. Объединенные органические слои высушивали над Na2SO4, и растворители выпаривали. Неочищенное вещество очищали СФХ (сверхкритической флюидной хроматографией с CO2) с получением 60 мг 6-(1,4-диметил-1Н-имидазол-2-ил)-1,3,3-триметилиндолин-2-она в виде светло-желтого твердого вещества. Смешанные фракции снова очищали хроматографией на амино-силикагеле, используя дихлорметан/метанол (с 10% концентрированным водным раствором аммиака) в качестве элюента. Соединение, указанное в заголовке, было получено в виде светло-желтого твердого вещества (33 мг).
ИЭР (m/z): 270,5 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.24 (d, J=0.8 Гц, 1Н), 7.20 (d, J=1.4 Гц, 1Н), 7.19-7.16 (m, 1Н), 6.92-6.85 (m, J=1.0 Гц, 1Н), 3.63 (s, 3Н), 3.24 (s, 3Н), 2.28 (d, J=1.0 Гц, 3Н), 1.40 (s, 6Н).
Пример 67
1,3,3-Триметил-6-(2-метил-1Н-имидазол-5-ил)индолин-2-он
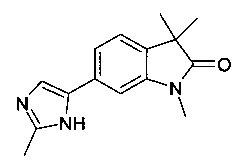
К суспензии гидрохлорида ацетимидамида (757 мг, 7,77 ммоль) в ТГФ (324 мл) добавляли 1 М водный раствор бикарбоната натрия (14,0 мл, 14,0 ммоль). Через 20 минут медленно добавляли раствор 6-(2-бромацетил)-1,3,3-триметилиндолин-2-она (пример 70с, 460 мг, 1,55 ммоль) в ТГФ (23 мл). Реакционную смесь нагревали до 80°С в течение 18 часов. Растворитель выпаривали и добавляли воду. Водную фазу экстрагировали EtOAc. Объединенные органические слои высушивали над Na2SO4, и растворитель выпаривали. Неочищенное вещество очищали флэш-хроматографией на NH2-силикагеле, используя дихлорметан/метанол (с 10% концентрированным водным раствором аммиака) в качестве элюента, с последующей препаративной ВЭЖХ с обращенной фазой. Соединение, указанное в заголовке, было получено в виде белой пены (143 мг).
ИЭР (m/z): 256,5 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.42-7.27 (m, 2Н), 7.21 (s, 1Н), 7.18 (d, J=7.7 Гц, 1Н), 3.26 (s, 3Н), 2.51 (s, 3Н), 1.73-1.48 (m, 1Н), 1.38 (s, 6Н).
Пример 68
6-(1Н-Имидазол-4-ил)-1,3,3-триметилиндолин-2-он

Раствор 1,3,3-триметил-6-(оксазол-5-ил)индолин-2-она (пример 69с, 300 мг, 1,24 ммоль) в формамиде (11 мл) нагревали до 180°С в запаянной трубке и перемешивали при этой температуре в течение 3 часов. Реакционную смесь наливали в воду и экстрагировали этилацетатом. Органические слои высушивали сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя дихлорметан/метанол в качестве элюента. Соединение, указанное в заголовке, выделили в виде коричневого вязкого масла (268 мг).
МС ИЭР (m/z): 242,5 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.73 (d, J=0.8 Гц, 1Н), 7.46-7.31 (m, 3Н), 7.20 (d, J=7.7 Гц, 1Н), 3.27 (s, 3Н), 1.39 (s, 6Н).
Пример 69
1,3,3-Триметил-6-(оксазол-5-ил)индолин-2-он

а) 6-(Гидроксиметил)-1.3.3-триметилиндолин-2-он
К суспензии 1,3,3-триметил-2-оксоиндолин-6-карбоновой кислоты (пример 59а, 150 мг, 684 мкмоль) в тетрагидрофуране (1 мл) добавляли по каплям комплекс борана с тетрагидрофураном (1 M в ТГФ, 1 мл, 1,00 ммоль) при 0°С. Охлаждающую баню удаляли, и реакционную смесь перемешивали в течение 2 часов при комнатной температуре. Смесь наливали в 10 мл насыщенного водного раствора бикарбоната натрия и экстрагировали этилацетатом. Органический слой высушивали сульфатом натрия, фильтровали и концентрировали в вакууме. Соединение, указанное в заголовке, было получено в виде светло-желтой пены (140 мг) и использовано без дополнительной очистки.
МС ИЭР (m/z): 206,5 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.18 (d, J=7.5 Гц, 1Н), 7.08-7.00 (m, 1Н), 6.91 (d, J=0.8 Гц, 1Н), 4.72 (s, 2Н), 3.23 (s, 3Н), 1.37 (s, 6Н).
b) 1,3,3-Триметил-2-оксоиндолин-6-карбальдегид
Суспензию 6-(гидроксиметил)-1,3,3-триметилиндолин-2-она (140 мг, 682 мкмоль) и диоксида марганца (296 мг, 3,41 ммоль) в дихлорметане (2 мл) перемешивали при 30°С в течение 15 часов. Снова добавляли диоксид марганца (296 мг, 3,41 ммоль), и реакционную смесь перемешивали в течение 2 часов с обратным холодильником. Реакционную смесь фильтровали через стекловолоконный фильтр, промывали дихлорметаном, и полученный раствор концентрировали в вакууме. Соединение, указанное в заголовке, было получено в виде светло-коричневого твердого вещества (110 мг) и использовано без дополнительной очистки.
МС ИЭР (m/z): 204,5 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 9.99 (s, 1Н), 7.63-7.55 (m, 1Н), 7.41-7.34 (m, 2Н), 3.31-3.24 (m, 3Н), 1.41 (s, 6Н).
c) 1,3,3-Триметил-6-(оксазол-5-ил)индолин-2-он
К суспензии 1,3,3-триметил-2-оксоиндолин-6-карбальдегида (110 мг, 541 мкмоль) и карбоната калия (97,2 мг, 704 мкмоль) в метаноле (2 мл) добавляли тозилметилизоцианид (106 мг, 541 мкмоль), и реакционную смесь нагревали до 80°С в течение 1,5 часов. Реакционную смесь наливали в воду и экстрагировали дихлорметаном. Органические слои высушивали сульфатом натрия, фильтровали и концентрировали в вакууме. Соединение, указанное в заголовке, было получено в виде коричневой пены (123 мг).
МС ИЭР (m/z): 243,6 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.93 (s, 1Н), 7.42-7.34 (m, 2Н), 7.26-7.23 (m, 1Н), 7.10 (d, J=1.4 Гц, 1Н), 3.27 (s, 3Н), 1.40 (s, 6Н)
Пример 70
1,3,3-Триметил-6-(оксазол-4-ил)индолин-2-он

a) N-Метокси-N,1,3,3-тетраметил-2-оксоиндолин-6-карбоксамид
К раствору 1,3,3-триметил-2-оксоиндолин-6-карбоновой кислоты (пример 59а, 0,2 г, 912 мкмоль) в безводном N,N-диметилформамиде (4,56 мл) добавляли DIPEA (650 мкл, 3,65 ммоль), и смесь перемешивали в течение 2 минут. Затем добавляли HATU (347 мг, 912 мкмоль), и перемешивание продолжали еще в течение 15 минут. Добавляли гидрохлорид N,O-диметилгидроксиламина (182 мг, 1,82 ммоль), и перемешивание продолжали еще в течение 15 часов. Реакционную смесь разбавляли этилацетатом, водой и 1 М водным раствором HCl. Смесь экстрагировали этилацетатом, и органические слои промывали 1 М водным раствором HCl и 1 М водным раствором карбоната натрия. Объединенные органические слои высушивали сульфатом натрия, фильтровали и концентрировали в вакууме. Полученное вещество очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде светло-коричневого вязкого масла (237 мг).
МС ИЭР (m/z): 263,1 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.40 (dd, J=1.4, 7.7 Гц, 1Н), 7.22 (d, J=7.7 Гц, 1Н), 7.16 (d, J=1.2 Гц, 1Н), 3.60 (s, 3Н), 3.38 (s, 3Н), 3.23 (s, 3Н), 1.38 (s, 6Н).
b) 6-Ацетил-1.3.3-триметилиндолин-2-он
Суспензию N-метокси-N,1,3,3-тетраметил-2-оксоиндолин-6-карбоксамида (5,8 г, 21,0 ммоль) в тетрагидрофуране (23,5 мл) охлаждали до 0°С. Добавляли по каплям бромид метилмагния (3,2 М в 2-метилтетрагидрофуране, 13,1 мл, 42,0 ммоль), поддерживая температуру ниже 8°С. Реакционную смесь перемешивали в течение 1 часа при 0°С. Реакционную смесь осторожно гасили 1,25 М этанольным раствором HCl (47 мл) и разбавляли этилацетатом и водой. Водную фазу экстрагировали этилацетатом, и органические слои промывали водой. Объединенные органические слои высушивали сульфатом натрия, фильтровали и концентрировали в вакууме. Полученное твердое вещество снова обрабатывали этилацетатом и 1 М водным раствором HCl, экстрагировали этилацетатом и промывали 1 М водным раствором HCl. Объединенные органические слои высушивали сульфатом натрия, фильтровали и концентрировали в вакууме. Соединение, указанное в заголовке, было получено в виде красного твердого вещества (2,85 г).
МС ИЭР (m/z): 218,5 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.69 (dd, J=1.4, 7.7 Гц, 1Н), 7.45 (d, J=1.2 Гц, 1Н), 7.29 (d, J=7.7 Гц, 1Н), 3.27 (s, 3Н), 2.63 (s, 3Н), 1.40 (s, 6Н).
c) 6-(2-Бромацетил)-1,3,3-триметилиндолин-2-он
К раствору 6-ацетил-1,3,3-триметилиндолин-2-она (1 г, 4,6 ммоль) в ТГФ (33,3 мл) и метаноле (22,2 мл) добавляли трибромид тетра-N-бутиламмония (2,26 г, 4,6 ммоль) в ТГФ (11,1 мл). Реакционную смесь нагревали до 50°С в течение 3 часов, а затем концентрировали в вакууме. Полученное вещество очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества (1,08 г).
МС ИЭР (m/z): 296,4, 298,4 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.71 (dd, J=1.4, 7.7 Гц, 1Н), 7.46 (d, J=1.4 Гц, 1Н), 7.31 (d, J=7.7 Гц, 1Н), 4.45 (s, 2Н), 3.27 (s, 3Н), 1.40 (s, 6Н).
d) 1,3,3-Триметил-6-(оксазол-4-ил)индолин-2-он
В трубке под давлением 6-(2-бромацетил)-1,3,3-триметилиндолин-2-он (1,05 г, 3,55 ммоль) обрабатывали формамидом (12,7 мл, 319 ммоль), трубку запаивали, и реакционную смесь нагревали до 110°С. Через 2 часа реакционную смесь разбавляли этилацетатом, водой и насыщенным водным раствором бикарбоната натрия. Смесь экстрагировали этилацетатом, и органические слои промывали насыщенным водным раствором бикарбоната натрия. Объединенные органические слои высушивали сульфатом натрия, фильтровали и концентрировали в вакууме. Полученное вещество очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента.
МС ИЭР (m/z): 243,6 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.97 (d, J=1.0 Гц, 1Н), 7.96 (d, J=0.8 Гц, 1Н), 7.42 (dd, J=1.4, 7.7 Гц, 1Н), 7.28 (d, J=1.2 Гц, 1Н), 7.23 (d, J=7.7 Гц, 1Н), 3.27 (s, 3Н), 1.39 (s, 6Н).
Пример 71
1,3,3-Триметил-6-(2-метилоксазол-5-ил)индолин-2-он

Раствор ацетата таллия (263 мг, 690 мкмоль) и трифторметансульфоновой кислоты (184 мкл, 2,07 ммоль) в ацетонитриле (2 мл) перемешивали в течение 10 минут. Затем добавляли 6-ацетил-1,3,3-триметилиндолин-2-он (пример 70b, 100 мг, 460 мкмоль), и реакционную смесь нагревали до 90°С в течение 4 часов. Снова добавляли ацетат таллия (2,63 мг, 690 мкмоль) и трифторметансульфоновую кислоту (184 мкл, 2,07 ммоль), и перемешивание при 90°С продолжали в течение 15 часов. Реакционную смесь наливали в 2 М водный раствор карбоната натрия и экстрагировали этилацетатом. Органические слои высушивали сульфатом натрия, фильтровали и концентрировали в вакууме. Полученное вещество очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде светло-коричневого твердого вещества (50 мг).
МС ИЭР (m/z): 257,6 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.32 (dd, J=1.6, 7.7 Гц, 1Н), 7.25-7.19 (m, 2Н), 7.05 (d, J=1.2 Гц, 1Н), 3.27 (s, 3Н), 2.55 (s, 3Н), 1.39 (s, 6Н).
Пример 72
1,3,3-Триметил-6-(5-метил-1,3,4-тиадиазол-2-ил)индолин-2-он

В трубке под давлением 1,3,3-триметил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-2-он (пример 29а, 0,1 г, 332 мкмоль) и 2-бром-5-метил-1,3,4-тиадиазол (71,3 мг, 398 мкмоль) суспендировали в диоксане (2,66 мл) и добавляли 2 М водный раствор карбоната натрия (664 мкл). Аргон барботировали через смесь в течение 5 минут, затем добавляли хлорид бис(трифенилфосфин)палладия(II) (23,8 мг, 33,2 мкмоль), трубку запаивали, и реакционную смесь нагревали до 115°С в течение 2,5 часов. Реакционную смесь разбавляли этилацетатом и метанолом, добавляли 2 столовые ложки силикагеля, и смесь концентрировали в вакууме. Вещество очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде светло-коричневого твердого вещества (87 мг).
МС ИЭР (m/z): 247,5 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.56 (d, J=1.4 Гц, 1Н), 7.50 (dd, J=1.6, 7.7 Гц, 1Н), 7.29-7.26 (m, 1Н), 3.29 (s, 3Н), 2.83 (s, 3Н), 1.41 (s, 6Н).
Пример 73
1,3,3-Триметил-6-(1,3,4-тиадиазол-2-ил)индолин-2-он

Получили по аналогии с примером 72, используя 2-бром-1,3,4-тиадиазол. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества.
МС ИЭР (m/z): 260,5 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 9.12 (s, 1Н), 7.65-7.56 (m, 2Н), 7.30 (d, J=7.5 Гц, 1Н), 3.30 (s, 3Н), 1.42 (s, 6Н).
Пример 74
6-(2-Циклопропилоксазол-5-ил)-1,3,3-триметилиндолин-2-он

а) 6-(2-Азидоацетил)-1,3,3-триметилиндолин-2-он
Суспензию 6-(2-бромацетил)-1,3,3-триметилиндолин-2-она (пример 70с, 200 мг, 675 мкмоль) и азида натрия (87,8 мг, 1,35 ммоль) в ацетоне (2 мл) перемешивали в течение 2 часов при комнатной температуре. Реакционную смесь наливали в 50 мл воды и экстрагировали дихлорметаном. Органические слои высушивали сульфатом натрия и концентрировали в вакууме. Соединение, указанное в заголовке, было получено в виде светло-коричневого твердого вещества (169 мг) и использовано без дополнительной очистки.
МС ИЭР (m/z): 259,5 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.58 (dd, J=1.6, 7.7 Гц, 1Н), 7.42 (d, J=1.2 Гц, 1Н), 7.30 (d, J=7.7 Гц, 1Н), 4.56 (s, 2Н), 3.27 (s, 3Н), 1.40 (s, 6Н).
b) 6-(2-Циклопропилоксазол-5-ил)-1,3,3-триметилиндолин-2-он
К суспензии 6-(2-азидоацетил)-1,3,3-триметилиндолин-2-она (165 мг, 639 мкмоль) и циклопропанкарбонилхлорида (58,0 мкл, 639 мкмоль)в толуоле (2 мл) добавляли трифенилфосфин (285 мг, 1,09 ммоль), и смесь перемешивали в течение 5 часов при комнатной температуре. Реакционную смесь фильтровали и промывали толуолом. Полученный раствор концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде светло-желтого твердого вещества (57 мг).
МС ИЭР (m/z): 283,5 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.29 (dd, J=1.6, 7.9 Гц, 1Н), 7.21 (d, J=7.7 Гц, 1Н), 7.18 (s, 1Н), 7.01 (d, J=1.2 Гц, 1Н), 3.27 (s, 3Н), 2.20-2.07 (m, 1Н), 1.38 (s, 6Н), 1.18-1.06 (m, 4Н).
Пример 75
1,3,3-Триметил-6-(2-(4-метилпиперазин-1-ил)оксазол-5-ил)индолин-2-он

а) 6-(2-Хлороксазол-5-ил)-1.3.3-триметилиндолин-2-он
К суспензии 1,3,3-триметил-6-(оксазол-5-ил)индолин-2-она (пример 69, 310 мг, 1,28 ммоль) в тетрагидрофуране (4,5 мл) при температуре от -70°С до -68°С добавляли по каплям LiHMDS (1,54 мл, 1,54 ммоль). После подогрева до 0°С в течение 10 минут реакционную смесь охлаждали до температуры от -70°С до -64°С и добавляли гексахлорэтан (321 мг, 1,34 ммоль). Реакционную смесь подогревали до комнатной температуры и держали при этой температуре в течение 5 часов. Реакционную смесь наливали в 50 мл насыщенного водного раствора NH4Cl. Водную фазу экстрагировали ТБМЭ. Объединенные органические слои промывали H2O и высушивали над Na2SO4. Растворитель выпаривали, и неочищенное вещество очищали флэш-хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде светло-желтых кристаллов (271 мг).
МС ИЭР (m/z): 277,4/ 279,4 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.32-7.23 (m, 3Н), 7.03 (d, J=1.2 Гц, 1Н), 3.27 (s, 3Н), 1.39 (s, 6Н).
b) 1,3,3-Триметил-6-(2-(4-метилпиперазин-1-ил)оксазол-5-ил)индолин-2-он
К раствору 6-(2-хлороксазол-5-ил)-1,3,3-триметилиндолин-2-она (0,062 г, 224 мкмоль) в ДМФ (2,2 мл) добавляли 1-метилпиперазин (24,9 мг, 27,6 мкл, 246 мкмоль) и DIPEA (57,9 мг, 78,3 мкл, 448 мкмоль). Реакционную смесь нагревали до 150°С в течение 30 минут при микроволновом облучении. Реакционную смесь концентрировали, а затем разбавляли EtOAc, H2O и 1 М водным раствором Na2CO3. Водную фазу экстрагировали EtOAc, объединенные органические слои промывали соляным раствором, высушивали Na2SO4, и растворитель выпаривали. Неочищенное вещество очищали хроматографией на силикагеле, используя дихлорметан/метанол в качестве элюента. Соединение, указанное в заголовке, было получено в виде беловатой пены (67 мг).
МС ИЭР (m/z): 341,5 [(М+Н)+].
1Н ЯМР (CDCl3, 300 МГц): δ = 7.21-7.15 (m, 2Н), 7.07 (s, 1Н), 6.90 (s, 1Н), 3.64-3.61 (m, 4Н), 3.25 (s, 3Н), 2.55-2.52 (m, 4Н), 2.36 (s, 3Н), 1.37 (s, 6Н).
Пример 76
1,3,3-Триметил-6-(2-метилоксазол-4-ил)индолин-2-он

Смесь 6-(2-бромацетил)-1,3,3-триметилиндолин-2-она (пример 70 с, 100 мг, 338 мкмоль) и ацетамида (300 мг, 259 мкл, 5,08 ммоль) нагревали до 174°С в запаянной трубке в течение 16 часов. Реакционную смесь наливали в 20 мл H2O, и водную фазу экстрагировали EtOAc. Объединенные органические слои промывали H2O, высушивали над Na2SO4, и растворитель выпаривали. Неочищенное вещество очищали флэш-хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде белых кристаллов (26 мг).
МС ИЭР (m/z): 257,1 [(М+Н)+].
1Н ЯМР (CDCl3, 600 МГц): δ = 7.83 (s, 1Н), 7.37 (dd, J=1.5, 7.6 Гц, 1Н), 7.24 (d, J=1.4 Гц, 1Н), 7.21 (d, J=7.6 Гц, 1Н), 3.26 (s, 3Н), 2.54 (s, 3Н), 1.38 (s, 6Н).
Пример 77
6-(2-циклопропилпиримидин-5-ил)-1,3,3-триметил-индолин-2-он

Получили по аналогии с примером 29b, используя 5-бром-2-циклопропилпиримидин и время реакции 4 часа. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества.
МС ИЭР (m/z): 294,2 [(М+Н)+].
Пример 78
1-Циклопропил-6-(2-циклопропилпиримидин-5-ил)-3,3-диметил-индолин-2-он

а) 6-Бром-1-циклопропил-3,3-диметил-индолин-2-он
К суспензии 6-бром-3,3-диметилиндолин-2-она (пример 24а, 10 г, 41,6 ммоль), циклопропилбороновой кислоты (7,16 г, 83,3 ммоль), DMAP (15,6 г, 125 ммоль) и ацетата меди(II) (7,94 г, 43,7 ммоль) в безводном толуоле (555 мл) добавляли 2 М бис(триметилсилил)амид натрия в ТГФ (21,9 мл, 43,7 ммоль). При барботировании сухого воздуха через реакционную смесь ее нагревали до 95°С в течение 15 часов. После охлаждения до комнатной температуры смесь разбавляли ТБМЭ, гасили водой и подкисляли 2 М водным раствором HCl (~150 мл). Смесь экстрагировали ТБМЭ, и органические слои промывали 1 М водным раствором HCl и соляным раствором. Объединенные органические слои высушивали сульфатом натрия, фильтровали, и полученный раствор концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде светло-коричневого твердого вещества (10,322 г).
МС ИЭР (m/z): 280,3, 282,3 [(М+Н)+].
1Н ЯМР (300 МГц, хлороформ-d) δ = 7.24 (d, J=1.8 Гц, 1Н), 7.19 (dd, J=1.6, 7.7 Гц, 1Н), 7.03 (d, J=7.9 Гц, 1Н), 2.67-2.57 (m, 1Н), 1.32 (s, 6Н), 1.13-0.98 (m, 2Н), 0.98-0.84 (m, 2Н)
b) 1-Циклопропил-3,3-диметил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-2-он
Получили по аналогии с примером 29а, используя 6-бром-1-циклопропил-3,3-диметил-индолин-2-он. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества.
МС ИЭР (m/z): 328,2 [(М+Н)+].
c) 1-Циклопропил-6-(2-циклопропилпиримидин-5-ил)-3,3-диметил-индолин-2-он
Получили по аналогии с примером 29b, используя 1-циклопропил-3,3-диметил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-2-он и 5-бром-2-циклопропил-пиримидин и время реакции 4 часа. Соединение, указанное в заголовке, было получено в виде бесцветного вязкого масла.
МС ИЭР (m/z): 320,3 [(М+Н)+].
Пример 79
6-(6-Циклопропилпиридазин-3-ил)-1,3,3-триметил-индолин-2-он

Получили по аналогии с примером 29b, используя 3-бром-6-циклопропилпиридазин и время реакции 4 часа. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества.
МС ИЭР (m/z): 294,0 [(М+Н)+].
Пример 80
1-Циклопропил-6-(6-циклопропилпиридазин-3-ил)-3,3-диметил-индолин-2-он

Получили по аналогии с примером 78с, используя 3-бром-6-циклопропилпиридазин и время реакции 4 часа. Соединение, указанное в заголовке, было получено в виде светло-розового твердого вещества.
МС ИЭР (m/z): 320,0 [(М+Н)+].
Пример 81
6-(6-Циклопропилпиридазин-3-ил)-3,3-диметил-1-(оксетан-3-ил)индолин-2-он
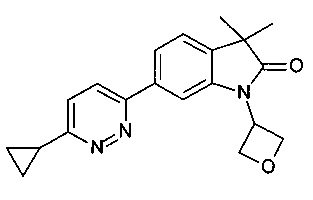
а) 6-Бром-3,3-диметил-1-(оксетан-3-ил)индолин-2-он
К раствору 6-бром-3,3-диметилиндолин-2-она (пример 24а, 1,5 г, 6,25 ммоль) в ДМФ (20,0 мл) в атмосфере аргона добавляли 3-бромоксетан (1,6 г, 895 мкл, 11,2 ммоль) и карбонат цезия (4,07 г, 12,5 ммоль), и реакционную смесь нагревали до 60°С в течение 17,5 часов. Снова добавляли 3-бромоксетан (250 мкл) и карбонат цезия (2 г), и перемешивание при 60°С продолжали в течение 3,5 часов. Реакционную смесь обрабатывали 50 мл 1 М водного раствора HCl и экстрагировали EtOAc. Объединенные органические слои высушивали над сульфатом натрия и концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде белого твердого вещества (1.49 г)
МС ИЭР (m/z): 296,3, 298,3 [(М+Н)+].
1Н ЯМР (300 МГц, хлороформ-d) δ = 7.71 (d, J=1.6 Гц, 1Н), 7.30-7.23 (m, 1Н), 7.12 (d, J=7.9 Гц, 1Н), 5.63-5.50 (m, 1Н), 5.16-4.98 (m, 4Н), 1.36 (s, 6Н)
b) 3,3-Диметил-1-(оксетан-3-ил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-2-он
Получили по аналогии с примером 29а, используя 6-бром-3,3-диметил-1-(оксетан-3-ил)индолин-2-он. Соединение, указанное в заголовке, было получено в виде белого твердого вещества.
МС ИЭР (m/z): 344,2 [(М+Н)+].
c) 6-(6-ииклопропилпиридазин-3-ил)-3,3-диметил-1-(оксетан-3-ил)индолин-2-он
Получили по аналогии с примером 29b, используя 3-бром-6-циклопропил-пиридазин и время реакции 4 часа. Соединение, указанное в заголовке, получили в виде беловатого твердого вещества.
МС ИЭР (m/z): 335,8 [(М+Н)+].
Пример 82
3,3-Диметил-6-(2-метилпиримидин-4-ил)индолин-2-он

Получили по аналогии с примером 29b, используя 3,3-диметил-6-(2-метилпиридин-4-ил)индолин-2-он (пример 24а) и время реакции 2,5 часа. Соединение, указанное в заголовке, было получено в виде белого твердого вещества.
МС ИЭР (m/z): 254,1 [(М+Н)+].
Пример 83
1,3,3-Триметил-6-(2-метил-4-пиридил)пирроло[3,2-с]пиридин-2-он

a) 6-Хлор-1,3,3-триметил-1,3-дигидро-пирроло[3,2-с]пиридин-2-он
К перемешанному раствору 6-хлор-1,3-дигидро-пирроло[3,2-с]пиридин-2-она (2,0 г, 11,86 ммоль) в ТГФ (15 мл) добавляли порциями NaH (60%, 1,9 г, 47,45 ммоль) при 0°С. Реакционную смесь перемешивали при этой температуре в течение 10 минут, затем при 25°С в течение 20 минут. Затем к реакционной смеси медленно добавляли MeI (3,0 мл, 47,45 ммоль) при 0°С, а затем перемешивали при 25°С в течение 2 часов. Реакционную смесь гасили добавлением насыщенного водного раствора хлорида аммония (10 мл) при 0°С. Смесь экстрагировали этилацетатом и промывали водой. Объединенные органические слои высушивали сульфатом натрия, фильтровали, и полученный раствор концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя гексан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде белого твердого вещества (1,5 г).
МС ИЭР (m/z): 210,9 [(М+Н)+].
b) 1,3,3-Триметил-6-(2-метил-4-пиридил)пирроло[3,2-с]пиридин-2-он
В трубке под давлением 6-хлор-1,3,3-триметил-1,3-дигидро-пирроло[3,2-с]пиридин-2-он (0,12 г, 0,57 ммоль) и 2-метилпиридин-4-бороновую кислоту (0,093 г, 0,68 ммоль) суспендировали в 2 М водном растворе карбоната натрия (0,5 мл) и диоксане (4 мл). Реакционную смесь продували аргоном в течение 15 минут. Затем добавляли Pd(dppf)Cl2 (0,042 г, 0,057 ммоль), и продувание продолжали в течение 15 минут. Трубку запаивали, и реакционную смесь нагревали до 110°С в течение 12 часов. Реакционную смесь разбавляли этилацетатом и водой. Реакционную смесь экстрагировали этилацетатом и промывали водой и соляным раствором. Объединенные органические слои высушивали сульфатом натрия, фильтровали, и полученный раствор концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя гексан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества (55 мг).
МС ИЭР (m/z): 267,8 [(М+Н)+].
Пример 84
3,3-Диметил-6-(2-метил-4-пиридил)-1Н-пирроло[3,2-с]пиридин-2-он

а) 6-Хлор-3,3-диметил-1,3-дигидро-пирроло[3,2-с]пиридин-2-он
Получили по аналогии с примером 24а из 6-хлор-1,3-дигидро-пирроло[3,2-с]пиридин-2-она. Соединение, указанное в заголовке, было получено в виде желтого твердого вещества.
МС ИЭР (m/z): 197,0 [(М+Н)+].
b) 3,3-Диметил-6-(2-метил-4-пиридил)-1Н-пирроло[3,2-с]пиридин-2-он
Данное соединение получили по аналогии с 83b из 6-хлор-3,3-диметил-1,3-дигидро-пирроло[3,2-с]пиридин-2-она. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества.
МС ИЭР (m/z): 253,8 [(М+Н)+].
Пример 85
1,3,3-Триметил-6-(1-метил-1Н-пиразол-4-ил)индолин-2-он

К раствору 6-бром-1,3,3-триметилиндолин-2-она (пример 1а, 75 мг, 295 мкмоль) и 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1Н-пиразола (95,0 мг, 443 мкмоль) в 1,2-диметоксиэтане (3,4 мл) в трубке под давлением добавляли 2 М водный раствор карбоната натрия (0,7 мл) и трифенилфосфин (18,6 мг, 70,8 мкмоль). Барботировали аргон через смесь в течение 5 минут. Затем добавляли ацетат палладия(II) (9,54 мг, 42,5 мкмоль) и снова барботировали аргон через реакционную смесь в течение 5 минут. Трубку запаивали, и реакционную смесь перемешивали в течение 16 часов при 90°С. Реакционную смесь концентрировали в вакууме. Остаток разбавляли дихлорметаном, добавляли силикагель, и смесь снова концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Полученное вещество снова очищали хроматографией на аминном силикагеле, используя гептан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде белого твердого вещества (43 мг)
МС ИЭР (m/z): 256,5 [(М+Н)+].
Пример 86
1-Циклопропил-3,3-диметил-6-(1-метил-1Н-пиразол-4-ил)индолин-2-он

Получили по аналогии с примером 85, используя 6-бром-1-циклопропил-3,3-диметил-индолин-2-он (пример 78а). Соединение, указанное в заголовке, было получено в виде светло-желтой пены.
МС ИЭР (m/z): 282,6 [(М+Н)+].
Пример 87
3,3-Диметил-6-(1-метил-1Н-пиразол-4-ил)индолин-2-он

Получили по аналогии с примером 85, используя 6-бром-3,3-диметил-1,3-дигидро-индол-2-он (пример 24а). Соединение, указанное в заголовке, было получено в виде белого твердого вещества.
МС ИЭР (m/z): 242,6 [(М+Н)+].
Пример 88
6-(2-Циклопропилпиримидин-5-ил)-3,3-диметил-индолин-2-он

Получили по аналогии с примером 24b, используя 5-бром-2-циклопропилпиримидин при времени реакции 4 часа. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества.
МС ИЭР (m/z): 280,3 [(М+Н)+].
Пример 89
1-Циклопропил-3,3-диметил-6-(2-метил-4-пиридил)пирроло[3,2-с]пиридин-2-он

a) 6-Хлор-1-циклопропил-3,3-диметил-1,3-дигидро-пирроло[3,2-с]пиридин-2-он
Получили по аналогии с примером 78а из 6-хлор-3,3-диметил-1,3-дигидро-пирроло[3,2-с]пиридин-2-она (пример 84а). Соединение, указанное в заголовке, было получено в виде белого твердого вещества.
МС ИЭР (m/z): 237,1 [(М+Н)+].
b) 1-Циклопропил-3,3-диметил-6-(2-метил-4-пиридил)пирроло[3,2-с]пиридин-2-он
Получили по аналогии с примером 83b из 6-хлор-1-циклопропил-3,3-диметил-1,3-дигидро-пирроло[3,2-с]пиридин-2-она. Соединение, указанное в заголовке, было получено в виде светло-коричневого твердого вещества.
МС ИЭР (m/z): 294,6 [(М+Н)+].
Пример 90
1-Циклопропил-3,3-диметил-6-(4-метил-1Н-имидазол-1-ил)индолин-2-он
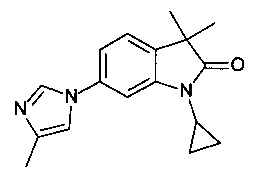
Получили по аналогии с примером 63 из 6-бром-1-циклопропил-3,3-диметил-индолин-2-она (пример 78а). Соединение, указанное в заголовке, было получено в виде беловатой пены.
МС ИЭР (m/z): 282,1 [(М+Н)+].
Пример 91
1-Циклопропил-3,3-диметил-6-(5-метил-1Н-имидазол-1-ил)индолин-2-он

Соединение, указанное в заголовке, выделили в виде беловатой пены при взаимодействии с примером 90.
МС ИЭР (m/z): 282,1 [(М+Н)+].
Пример 92
3,3-Диметил-6-(2-метилпиримидин-5-ил)-1Н-пирроло[3,2-с]пиридин-2-он

Получили по аналогии с примером 84b, используя 2-метил-пиримидин-5-бороновую кислоту и время реакции 6 часов. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества.
МС ИЭР (m/z): 255,0 [(М+Н)+].
Пример 93
1,3,3-Триметил-6-(5-метил-1,3,4-оксадиазол-2-ил)индолин-2-он

а) N'-Ацетил-1,3,3-триметил-2-оксоиндолин-6-карбогидразид
К раствору 1,3,3-триметил-2-оксоиндолин-6-карбоновой кислоты (пример 59а, 120 мг, 547 мкмоль) в дихлорметане (6 мл) в атмосфере аргона добавляли 1Н-бензо[d][1,2,3]триазол-1-ол (HOBt, 118 мг, 876 мкмоль), гидрохлорид N1-((этилимино)метилен)-N3,N3-диметилпропан-1,3-диамина (EDCI, 168 мг, 876 мкмоль), триэтиламин (138 мг, 191 мкл, 1,37 ммоль) и ДМФ (1 мл). Затем добавляли ацетогидразид (40,5 мг, 547 мкмоль). Реакционную смесь перемешивали в запаянной трубке при комнатной температуре в течение 16 часов. Затем реакционную смесь концентрировали в вакууме. Остаток разбавляли дихлорметаном, добавляли силикагель, и смесь концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя дихлорметан/метанол в качестве элюента. Соединение, указанное в заголовке, было получено в виде белой пены (135 мг), еще содержащей HOBt. Это вещество использовали без дополнительной очистки.
МС ИЭР (m/z): 276,1 [(М+Н)+].
b) 1,3,3-Триметил-6-(5-метил-1,3,4-оксадиазол-2-ил)индолин-2-он
К раствору N'-ацетил-1,3,3-триметил-2-оксоиндолин-6-карбогидразида (129,5 мг, 470 мкмоль) в ацетонитриле (6 мл) добавляли триэтиламин (143 мг, 197 мкл, 1,41 ммоль) и пара-толуолсульфонилхлорид (137 мг, 706 мкмоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь обрабатывали 15 мл насыщенного водного раствора бикарбоната натрия и экстрагировали этилацетатом. Органические слои высушивали сульфатом натрия, фильтровали, и полученный раствор концентрировали в вакууме. Остаток разбавляли дихлорметаном, добавляли силикагель, и смесь концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде светло-желтого твердого вещества (88 мг).
МС ИЭР (m/z): 258,2 [(М+Н)+].
Пример 94
6-(5-Циклопропил-1,3,4-оксадиазол-2-ил)-1,3,3-триметилиндолин-2-он

Получили по аналогии с примером 93, используя циклопропанкарбогидразид. Соединение, указанное в заголовке, было получено в виде светло-желтого твердого вещества.
МС ИЭР (m/z): 284,2 [(М+Н)+].
Пример 95
6-(5-Циклопропил-1,3,4-оксадиазол-2-ил)-3,3-диметилиндолин-2-он

Получили по аналогии с примером 93 из 3,3-диметил-2-оксоиндолин-6-карбоновой кислоты (пример 60b), используя циклопропанкарбогидразид. Соединение, указанное в заголовке, было получено в виде светло-красного твердого вещества.
МС ИЭР (m/z): 270,2 [(М+Н)+].
Пример 96
6-(4-Циклопропил-1Н-имидазол-1-ил)-1,3,3-триметилиндолин-2-он

Получили по аналогии с примером 63 из 6-бром-1,3,3-триметилиндолин-2-она (пример 1а), используя 4-циклопропил-1Н-имидазол. Соединение, указанное в заголовке, было получено в виде желтого масла.
МС ИЭР (m/z): 282,2 [(М+Н)+].
Пример 97
6-(5-Циклопропил-1Н-имидазол-1-ил)-1,3,3-триметилиндолин-2-он

Соединение, указанное в заголовке, было получено в виде белой пены при взаимодействии с примером 96.
МС ИЭР (m/z): 282,2 [(М+Н)+].
Пример 98
1-Циклопропил-6-(4-циклопропил-1Н-имидазол-1-ил)-3,3-диметилиндолин-2-он

Получили по аналогии с примером 96 из 6-бром-1-циклопропил-3,3-диметил-индолин-2-она (пример 78а). Соединение, указанное в заголовке, было получено в виде светло-желтого вязкого масла.
МС ИЭР (m/z): 308,3 [(М+Н)+].
Пример 99
1-Циклопропил-6-(5-циклопропил-1Н-имидазол-1-ил)-3,3-диметилиндолин-2-он

Соединение, указанное в заголовке, было получено в виде светло-желтого твердого вещества при взаимодействии с примером 98.
МС ИЭР (m/z): 308,3 [(М+Н)+].
Пример 100
6-(1-Циклопропил-1Н-пиразол-4-ил)-1,3,3-триметилиндолин-2-он

а) 1,3,3-Триметил-6-(1Н-пиразол-4-ил)индолин-2-он
Во флаконе для микроволнового реактора 6-бром-1,3,3-триметилиндолин-2-он (пример 1а, 200 мг, 787 мкмоль) и трет-бутил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1Н-пиразол-1-карбоксилат (232 мг, 787 мкмоль) объединяли с диоксаном (4,5 мл) и 2 М водным раствором карбоната натрия (787 мкл, 1,57 ммоль). Смесь барботировали аргоном в течение 5 минут. Затем добавляли [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (32,1 мг, 39,4 мкмоль), и барботирование аргоном продолжали еще в течение 5 минут. Затем флакон герметично закрывали и нагревали до 120°С в течение 30 минут при микроволновом облучении. Реакционную смесь разбавляли этилацетатом и насыщенного водным раствором бикарбоната натрия. Полученную в результате смесь экстрагировали этилацетатом, объединенные органические слои высушивали сульфатом натрия, фильтровали, и полученный раствор концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде коричневого вязкого масла (115 мг).
МС ИЭР (m/z): 242,5 [(М+Н)+].
b) 6-(1-Циклопропил-1Н-пиразол-4-ил)-1,3,3-триметилиндолин-2-он
Получили по аналогии с примером 104 из 1,3,3-триметил-6-(1Н-пиразол-4-ил)индолин-2-она. Соединение, указанное в заголовке, было получено в виде светло-желтого масла.
МС ИЭР (m/z): 282,2 [(М+Н)+].
Пример 101
6-(4-Циклопропил-1Н-имидазол-1-ил)-3,3-диметилиндолин-2-он

Получили по аналогии с примером 63, используя 4-циклопропил-1Н-имидазол. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества.
МС ИЭР (m/z): 268,1 [(М+Н)+].
Пример 102
1-Циклопропил-6-(5-циклопропил-1,3,4-оксадиазол-2-ил)-3,3-диметилиндолин-2-он

a) Метил-1-циклопропил-3,3-диметил-2-оксоиндолин-6-карбоксилат
В реактор помещали 6-бром-1-циклопропил-3,3-диметилиндолин-2-он (пример 78а, 4 г, 14,3 ммоль) и добавляли триэтиламин (4,00 мл, 28,6 ммоль), затем этилацетат (50 мл) и метанол (50 мл), и реактор помещали в атмосферу аргона. Затем добавляли аддукт дихлорида 1,1'-бис(дифенилфосфино)ферроцен-палладия(II) и дихлорметана (1,17 г, 1,43 ммоль), и реактор продували СО и давление доводили до 50 бар. Реакционную смесь нагревали до 100°С и перемешивали при этой температуре в атмосфере СО в течение 48 часов. Реакционную смесь охлаждали до комнатной температуры, разбавляли метанолом и концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества (3,6 г).
МС ИЭР (m/z): 260,5 [(М+Н)+].
1Н ЯМР (300 МГц, хлороформ-d) δ = 7.79 (dd, J=1.5, 7.8 Гц, 1Н), 7.73 (d, J=1.0 Гц, 1Н), 7.24 (d, J=7.7 Гц, 1Н), 3.94 (s, 3Н), 2.74-2.64 (m, 1Н), 1.35 (s, 6Н), 1.17-1.02 (m, 2Н), 1.00-0.88 (m, 2Н)
b) 1-Циклопропил-3,3-диметил-2-оксоиндолин-6-карбоновая кислота
К суспензии метил-1-циклопропил-3,3-диметил-2-оксоиндолин-6-карбоксилата (3,6 г, 13,9 ммоль) в метаноле (55,5 мл) добавляли 1 М водный раствор NaOH (55,5 мл, 55,5 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь разбавляли ТБМЭ и водой. Слои разделяли, и органический слой экстрагировали 0,1 М водным раствором NaOH, и водные слои промывали ТБМЭ. Объединенные водные слои подкисляли 25% водным раствором HCl. Смесь экстрагировали дихлорметаном, и органические слои промывали соляным раствором. Объединенные органические слои высушивали сульфатом натрия, фильтровали и концентрировали в вакууме. Соединение, указанное в заголовке, было получено в виде светло-желтого твердого вещества (3,33 г)
МС ИЭР (m/z): 246,5 [(М+Н)+].
1Н ЯМР (300 МГц, хлороформ-d) δ = 7.89 (dd, J=1.4, 7.7 Гц, 1Н), 7.81 (d, J=1.2 Гц, 1Н), 7.29 (d, J=7.7 Гц, 1Н), 2.78-2.62 (m, 1Н), 1.38 (s, 6Н), 1.19-1.03 (m, 2Н), 1.03-0.88 (m, 2Н)
с) 1-Циклопропил-6-(5-циклопропил-1,3,4-оксадиазол-2-ил)-3,3-диметилиндолин-2-он
Получили по аналогии с примером 93с 1-циклопропил-3,3-диметил-2-оксоиндолин-6-карбоновой кислотой, используя циклопропанкарбогидразид. Соединение, указанное в заголовке, было получено в виде светло-желтого твердого вещества.
МС ИЭР (m/z): 310,1 [(М+Н)+].
Пример 103
1,3,3-Триметил-6-(6-морфолинопиридин-3-ил)индолин-2-он

Получили по аналогии с примером 1, используя 6-морфолинопиридин-3-илбороновую кислоту и время реакции 3 часа. Соединение, указанное в заголовке, было получено в виде светло-коричневого твердого вещества.
МС ИЭР (m/z): 338,2 [(М+Н)+]
1Н ЯМР (300 МГц, хлороформ-d) δ = 8.46 (d, J=2.6 Гц, 1Н), 7.74 (dd, J=2.5, 8.8 Гц, 1Н), 7.25-7.17 (m, 2Н), 6.95 (s, 1Н), 6.96 (s, 1Н), 6.72 (d, J=8.7 Гц, 1Н), 3.92-3.79 (m, 4Н), 3.63-3.49 (m, 4Н), 3.26 (s, 3Н), 1.40 (s, 6Н)
Пример 104
6-(1-Циклопропил-1Н-имидазол-4-ил)-1,3,3-триметилиндолин-2-он

К суспензии 6-(1Н-имидазол-4-ил)-1,3,3-триметилиндолин-2-она (пример 68, 120 мг, 497 мкмоль), циклопропилбороновой кислоты (107 мг, 1,24 ммоль) и карбоната натрия (132 мг, 1,24 ммоль) в 1,2-дихлорэтане (6 мл) добавляли по каплям раствор ацетата меди(II) (111 мг, 597 мкмоль) и 2,2-дипиридила (94,2 мг, 597 мкмоль) в 1,2-дихлорэтане (9 мл) (который был получен при 70°С) в течение 4 минут. Реакционную смесь перемешивали в течение 2,5 часов при 70°С, затем в течение 16 часов при комнатной температуре. Реакционную смесь разбавляли дихлорметаном и промывали насыщенным водным раствором хлорида аммония и соляным раствором. Органический слой высушивали сульфатом натрия, фильтровали, и полученный раствор концентрировали в вакууме. Остаток разбавляли дихлорметаном, добавляли аминный силикагель, и смесь концентрировали в вакууме. Неочищенное вещество очищали хроматографией на аминном силикагеле, используя гептан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде белой пены (97 мг).
МС ИЭР (m/z): 282,2 [(М+Н)+].
Пример 105
1-Циклопропил-3,3-диметил-6-(5-метил-1,3,4-оксадиазол-2-ил)индолин-2-он

Получили по аналогии с примером 93 из 1-циклопропил-3,3-диметил-2-оксоиндолин-6-карбоновой кислоты (пример 102b). Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества.
МС ИЭР (m/z): 284,1 [(М+Н)+].
Пример 106
3,3-Диметил-6-(5-метил-1,3,4-оксадиазол-2-ил)индолин-2-он

Получили по аналогии с примером 93 из 3,3-диметил-2-оксоиндолин-6-карбоновой кислоты (пример 60b). Соединение, указанное в заголовке, было получено в виде светло-красной пены.
МС ИЭР (m/z): 262,1 [(М+Н)+].
Пример 107
1-Циклопропил-6-(1-циклопропил-1Н-пиразол-4-ил)-3,3-диметилиндолин-2-он

Получили по аналогии с примером 100 из 6-бром-1-циклопропил-3,3-диметил-индолин-2-она (пример 78а). Соединение, указанное в заголовке, было получено в виде белого твердого вещества.
МС ИЭР (m/z): 308,6 [(М+Н)+].
Пример 108
1,3,3-Триметил-6-(2-метилпиримидин-5-ил)пирроло[3,2-с]пиридин-2-он

Смесь 6-хлор-1,3,3-триметил-1,3-дигидро-пирроло[3,2-с]пиридин-2-она (пример 83а) (0,1 г, 0,475 ммоль), 2-метилпиримидин-5-бороновой кислоты (0,078 г, 0,57 ммоль) и NaOtBu (0,068 г, 0,712 ммоль) в диоксане (2,0 мл) в сосуде для микроволнового реактора барботировали аргоном в течение 15 минут. Затем к реакционной смеси добавляли Brettphos (0,019, 0,024 ммоль), и барботирование продолжали в течение 15 минут. Флакон герметично закрывали, и реакционную смесь облучали до 110°С в течение 1 часа. Реакционную смесь фильтровали через целлит, и фильтрат концентрировали в вакууме. Неочищенное вещество очищали препаративной ВЭЖХ с обращенной фазой на колонке X Terra Prep RPC18 250 х 19 мм, 10 мкм, используя ацетонитрил/5 мМ водный раствор ацетата аммония в качестве элюента. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества (30 мг).
МС ИЭР (m/z): 268,8 [(М+Н)+].
Пример 109
1-Циклопропил-3,3-диметил-6-(1-метил-1Н-имидазол-4-ил)индолин-2-он

a) 1-Циклопропил-3,3-диметил-6-(оксазол-5-ил)индолин-2-он
Получили по аналогии с примером 69 из 1-циклопропил-3,3-диметил-2-оксоиндолин-6-карбоновой кислоты (пример 102b). Соединение, указанное в заголовке, было получено в виде коричневого вязкого масла.
МС ИЭР (m/z): 269,5 [(М+Н)+].
b) 1-Циклопропил-6-(1Н-имидазол-4-ил)-3,3-диметилиндолин-2-он
Получили по аналогии с примером 68 из 1-циклопропил-3,3-диметил-6-(оксазол-5-ил)индолин-2-она и за время реакции 15 часов. Соединение, указанное в заголовке, было получено в виде светло-коричневой пены.
МС ИЭР (m/z): 268,5 [(М+Н)+].
c) 1-Циклопропил-3,3-диметил-6-(1-метил-1Н-имидазол-4-ил)индолин-2-он
Получили по аналогии с примером 110 из 1-циклопропил-6-(1Н-имидазол-4-ил)-3,3-диметилиндолин-2-она. Соединение, указанное в заголовке, было получено в виде белого твердого вещества.
МС ИЭР (m/z): 282,16 [(М+Н)+].
Пример 110
1,3,3-Триметил-6-(1-метил-1Н-имидазол-4-ил)индолин-2-он

К раствору 6-(1Н-имидазол-4-ил)-1,3,3-триметилиндолин-2-она (пример 68, 100 мг, 414 мкмоль) в ДМФ (5 мл) при 0°С добавляли NaH (60% на минеральном масле, 67,8 мг, 1,7 ммоль). После перемешивания в течение 15 минут добавляли йодметан (88,2 мг, 38,7 мкл, 622 мкмоль) при 0°С. Реакционную смесь перемешивали в течение 2 часов при 0°С. При 0°С добавляли по каплям воду, затем смесь разбавляли соляным раствором и экстрагировали этилацетатом. Органические слои объединяли и высушивали сульфатом натрия, фильтровали, и полученный раствор концентрировали в вакууме. Полученное вещество очищали препаративной сверхкритической флюидной хроматографией на колонке AD-H 20 × 250 мм 5 мкм, используя диоксид углерода/метанол/диэтиламин в качестве элюента. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества (47 мг)
МС ИЭР (m/z): 256,2 [(М+Н)+].
Пример 111
1-Циклопропил-6-(1Н-имидазол-4-ил)-3,3-диметил-1Н-пирроло[3,2-с]пиридин-2(3Н)-он
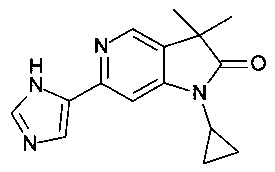
Получили по аналогии со статьей J. Med. Chem. 2008, vol 51, no 20, pp 6571-6580, подтверждающая информация с. S24/25, из 6-хлор-1-циклопропил-3,3-диметил-1,3-дигидро-пирроло[3,2-с]пиридин-2-она (пример 89а), используя N,N-диметил-4-(трибутилстаннил)-1Н-имидазол-1-сульфонамид. Соединение, указанное в заголовке, было получено в виде белой пены.
МС ИЭР (m/z): 269,2 [(М+Н)+].
Пример 112
6-(1-Циклопропил-1Н-пиразол-4-ил)-3,3-диметилиндолин-2-он

a) 6-Бром-1-(4-метоксибензил)-3,3-диметилиндолин-2-он
Раствор 6-бром-3,3-диметилиндолин-2-она (пример 24а, 250 мг, 1,04 ммоль) в ДМФ (8 мл) в трубке под давлением барботировали аргоном в течение 5 минут. Затем добавляли 1-(бромметил)-4-метоксибензол (209 мг, 1,04 ммоль) и карбонат цезия (679 мг, 2,08 ммоль), и барботирование аргоном продолжали в течение 5 минут. Флакон герметично закрывали, и реакционную смесь нагревали до 80°С. Через 1 час реакционную смесь обрабатывали водой и экстрагировали этилацетатом. Органические слои объединяли, высушивали сульфатом натрия, фильтровали, и полученный раствор концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде красной жидкости (340 мг).
МС ИЭР (m/z): 360,5, 362,5 [(М+Н)+].
1Н ЯМР (300 МГц, хлороформ-d) δ = 7.23-7.17 (m, 2Н), 7.15 (dd, J=1.6, 7.9 Гц, 1Н), 7.05 (d, J=7.9 Гц, 1Н), 6.89-6.82 (m, 3Н), 4.81 (s, 2Н), 3.78 (s, 3Н), 1.40 (s, 6Н)
b) 1-(4-Метоксибензил)-3,3-диметил-6-(1Н-пиразол-4-ил)индолин-2-он
К смеси 6-бром-1-(4-метоксибензил)-3,3-диметилиндолин-2-она (750 мг, 2,08 ммоль) и трет-бутил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1Н-пиразол-1-карбоксилата (947 мг, 3,12 ммоль) в 1,2-диметоксиэтане (20 мл) и 2 М водного раствора карбоната натрия (4 мл) в трубке под давлением добавляли трифенилфосфин (135 мг, 500 мкмоль). Смесь барботировали аргоном в течение 5 минут, затем добавляли ацетат палладия(II) (67,3 мг, 300 мкмоль), и барботирование аргоном продолжали еще в течение 5 минут. Флакон герметично закрывали, и реакционную смесь нагревали до 100°С в течение 16 часов. К реакционной смеси добавляли силикагель, и смесь концентрировали в вакууме.
Неочищенное вещество очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде светло-желтой пены (573 мг)
МС ИЭР (m/z): 348,2 [(М+Н)+].
c) 6-(1-Циклопропил-1Н-пиразол-4-ил)-1-(4-метоксибензил)-3,3-диметилиндолин-2-он
Получили по аналогии с примером 104 из 1-(4-метоксибензил)-3,3-диметил-6-(1Н-пиразол-4-ил)индолин-2-она. Соединение, указанное в заголовке, было получено в виде светло-желтого вязкого масла.
МС ИЭР (m/z): 388,3 [(М+Н)+].
d) 6-(1-Циклопропил-1Н-пиразол-4-ил)-3,3-диметилиндолин-2-он
Раствор 6-(1-циклопропил-1Н-пиразол-4-ил)-1-(4-метоксибензил)-3,3-диметилиндолин-2-она (117 мг, 302 мкмоль) в ТФУ (2 мл) в герметично закрытой пробирке перемешивали в течение 17 часов при 110°С. Снова добавляли ТФУ (0,5 мл), и реакционную смесь перемешивали еще в течение 22 часов при 110°С. Реакционную смесь наливали в 2 М водный раствор карбоната натрия и экстрагировали этилацетатом. Объединенные органические слои высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток разбавляли дихлорметаном, добавляли аминный силикагель, и смесь концентрировали в вакууме. Неочищенное вещество очищали препаративной хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде светло-желтой пены (75 мг).
МС ИЭР (m/z): 268,2 [(М+Н)+].
Пример 113
6-(1-Циклопропил-1Н-имидазол-4-ил)-3,3-диметилиндолин-2-он

a) Метил-1-(4-метоксибензил)-3,3-диметил-2-оксоиндолин-6-карбоксилат
Получили по аналогии с примером 102а, используя 6-бром-1-(4-метоксибензил)-3,3-диметилиндолин-2-он (пример 112а). Соединение, указанное в заголовке, было получено в виде желтого вязкого масла.
МС ИЭР (m/z): 340,5 [(М+Н)+].
b) 1-(4-Метоксибензил)-3.3-диметил-2-оксоиндолин-6-карбоновая кислота
Получили по аналогии с примером 102b, используя метил-1-(4-метоксибензил)-3,3-диметил-2-оксоиндолин-6-карбоксилат при 50°С в течение 16 часов. Соединение, указанное в заголовке, было получено в виде белого твердого вещества.
МС ИЭР (m/z): 326,6 [(М+Н)+].
c) N-Метокси-1-(4-метоксибензил)-N,3,3-триметил-2-оксоиндолин-6-карбоксамид
Получили по аналогии с примером 70а, используя 1-(4-метоксибензил)-3,3-диметил-2-оксоиндолин-6-карбоновую кислоту. Соединение, указанное в заголовке, было получено в виде светло-желтого твердого вещества.
МС ИЭР (m/z): 369,5 [(М+Н)+].
d) 6-Ацетил-1-(4-метоксибензил)-3,3-диметилиндолин-2-он
Получили по аналогии с примером 70b, используя N-метокси-1-(4-метоксибензил)-N,3,3-триметил-2-оксоиндолин-6-карбоксамид. Соединение, указанное в заголовке, было получено в виде оранжевого твердого вещества.
МС ИЭР (m/z): 324,5 [(М+Н)+].
e) 6-(2-Бромацетил)-1-(4-метоксибензил)-3,3-диметилиндолин-2-он
Получили по аналогии с примером 70с, используя 6-ацетил-1-(4-метоксибензил)-3,3-диметилиндолин-2-он. Соединение, указанное в заголовке, было получено в виде светло-желтой пены.
МС ИЭР (m/z): 402,2, 404,2 [(М+Н)+].
f) 6-(1Н-Имидазол-4-ил)-1-(4-метоксибензил)-3,3-диметилиндолин-2-он
Суспензию 6-(2-бромацетил)-1-(4-метоксибензил)-3,3-диметилиндолин-2-она (718 мг, 1,78 ммоль) в формамиде (15 мл) в запаянной трубке под давлением нагревали до 180°С в течение 3,5 часов. Нагревание удаляли, и реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Затем реакционную смесь концентрировали в вакууме. Остаток разбавляли дихлорметаном, добавляли аминный силикагель, и смесь концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде коричневого вязкого масла (613 мг), еще содержащего формамид. Это вещество использовали без дополнительной очистки.
МС ИЭР (m/z): 348,2 [(М+Н)+].
g) 6-(1-Циклопропил-1Н-имидазол-4-ил)-1-(4-метоксибензил)-3,3-диметилиндолин-2-он
Получили по аналогии с примером 104, используя 6-(1Н-имидазол-4-ил)-1-(4-метоксибензил)-3,3-диметилиндолин-2-он и время реакции 4,5 часа. Соединение, указанное в заголовке, было получено в виде светло-красной пены.
МС ИЭР (m/z): 388,3 [(М+Н)+].
h) 6-(1-Циклопропил-1Н-имидазол-4-ил)-3,3-диметилиндолин-2-он
Получили по аналогии с примером 112d, используя 6-(1-циклопропил-1Н-имидазол-4-ил)-1-(4-метоксибензил)-3,3-диметилиндолин-2-он. Соединение, указанное в заголовке, было получено в виде оранжевого твердого вещества.
МС ИЭР (m/z): 268,2 [(М+Н)+].
Пример 114
7-Циклопропил-5,5-диметил-2-(2-метилпиридин-4-ил)-5Н-пирроло[2,3-d]пиримидин-6(7Н)-он

a) Этил-2-(2,4-дихлор-6-(циклопропиламино)пиримидин-5-ил)ацетат
В трубке под давлением этил-2-(2,4,6-трихлорпиримидин-5-ил)ацетат (1,6 г, 5,94 ммоль) растворяли в N,N-диметилформамиде (39,6 мл). Затем добавляли циклопропиламин (380 мг, 462 мкл, 6,53 ммоль) и DIPEA (921 мг, 1,24 мл, 7,12 ммоль), трубку запаивали, и смесь нагревали до 50°С в течение 1,5 часов. Реакционную смесь разбавляли этилацетатом, водой и соляным раствором. Смесь экстрагировали этилацетатом, и органические слои промывали соляным раствором, 1 М водным раствором HCl и соляным раствором. Объединенные органические слои высушивали сульфатом натрия, фильтровали, и полученный раствор концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде светло-коричневого твердого вещества (1,363 г).
МС ИЭР (m/z): 290,0, 292,0, 294,0 [(М+Н)+].
1Н ЯМР (300 МГц, хлороформ-d) δ = 6.14 (br. s., 1Н), 4.18 (q, J=7.2 Гц, 2Н), 3.58 (s, 2Н), 3.01-2.88 (m, 1Н), 1.27 (t, J=7.1 Гц, 3Н), 0.97-0.83 (m, 2Н), 0.62-0.50 (m, 2Н)
b) 2,4-Дихлор-7-циклопропил-5,5-диметил-5Н-пирроло[2,3-d]пиримидин-6(7Н)-он
В трубке под давлением MeI (1,24 г, 548 мкл, 8,76 ммоль) добавляли к суспензии этил-2-(2,4-дихлор-6-(циклопропиламино)пиримидин-5-ил)ацетата (1,24 г, 4,27 ммоль) и карбоната цезия (6,96 г, 21,4 ммоль) в безводном ДМФ (42,7 мл). Трубку запаивали, и реакционную смесь нагревали до 60°С в течение 2 часов. Снова добавляли MeI (121 мг, 53,4 мкл, 855 мкмоль), и перемешивание при 60°С продолжали еще в течение 1,5 часов. Реакционную смесь разбавляли этилацетатом, насыщенным водным раствором бикарбоната натрия и соляным раствором. Смесь экстрагировали этилацетатом, и органические слои промывали насыщенным водным раствором бикарбоната натрия и соляным раствором. Объединенные органические слои высушивали сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде белого твердого вещества (725 мг).
МС ИЭР (m/z): 272,1, 274,1, 276,1 [(М+Н)+]
1Н ЯМР (300 МГц, хлороформ-d) δ = 2.90-2.77 (m, 1Н), 1.48 (s, 6Н), 1.13-1.02 (m, 4Н)
c) 4-Хлор-7-циклопропил-5,5-диметил-2-(2-метилпиридин-4-ил)-5Н-пирроло[2,3-d]пиримидин-6(7Н)-он
Получили по аналогии с примером 1b из 2,4-дихлор-7-циклопропил-5,5-диметил-5Н-пирроло[2,3-d]пиримидин-6(7Н)-она, используя 2-метилпиридин-4-бороновую кислоту и время реакции 2,5 часа. Соединение, указанное в заголовке, было получено в виде белого твердого вещества.
МС ИЭР (m/z): 329,2, 331,2 [(M+H)+]
1Н ЯМР (300 МГц, хлороформ-d) δ = 8.66 (d, J=5.2 Гц, 1Н), 8.12 (s, 1Н), 8.07 (dd, J=1.1, 5.1 Гц, 1Н), 3.03-2.91 (m, 1Н), 2.68 (s, 3Н), 1.53 (s, 6Н), 1.21-1.10 (m, 4Н)
d) 7-Циклопропил-5,5-диметил-2-(2-метилпиридин-4-ил)-5Н-пирроло[2,3-d]пиримидин-6(7H)-OH
Из колбы, содержащей суспензию 4-хлор-7-циклопропил-5,5-диметил-2-(2-метилпиридин-4-ил)-5Н-пирроло[2,3-d]пиримидин-6(7Н)-она (0,073 г, 222 мкмоль) в метаноле (2,22 мл), откачивали воздух 4 раза (вспенивание) и продували аргоном. Затем добавляли 10% Pd/C (23,6 мг, 22,2 мкмоль), и дегазирование повторяли. Затем из аппарата снова 4 раза откачивали воздух (вспенивание) и продували водородом. Реакционную смесь перемешивали при комнатной температуре в атмосфере водорода в течение 2 часов. Снова добавляли метанол (2,22 мл) и 10% Pd/C (23,6 мг, 22,2 мкмоль), дегазирование и продувание водородом повторяли, и реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь разбавляли этилацетатом, водой и насыщенным водным раствором бикарбоната натрия. Смесь фильтровали через дикалит и промывали водой и этилацетатом. Полученную смесь экстрагировали этилацетатом, и органические слои промывали соляным раствором. Объединенные органические слои высушивали сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде белого твердого вещества (41 мг).
МС ИЭР (m/z): 295,2 [(М+Н)+]
1Н ЯМР (300 МГц, хлороформ-d) δ = 8.66 (dd, J=0.6, 5.2 Гц, 1Н), 8.37 (s, 1Н), 8.13 (s, 1Н), 8.08 (dd, J=1.1, 5.1 Гц, 1Н), 3.02-2.92 (m, 1Н), 2.68 (s, 3Н), 1.45 (s, 6Н), 1.23-1.11 (m, 4Н)
Пример 115
3,3-Диметил-6-(6-метилпиримидин-4-ил)индолин-2-он

Получили по аналогии с примером 17, используя 4-бром-6-метилпиримидин. Соединение, указанное в заголовке, было получено в виде коричневого твердого вещества.
МС ИЭР (m/z): 254,2 [(М+Н)+]
Пример 116
3,3-Диметил-6-(3-метилпиридин-4-ил)-1Н-пирроло[3,2-c]пиридин-2(3Н)-он
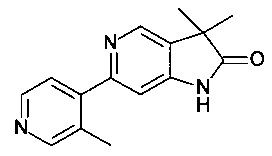
Получили по аналогии с примером 83b из 6-хлор-3,3-диметил-1,3-дигидро-пирроло[3,2-с]пиридин-2-она (пример 84а), используя 2-метил-пиридин-4-бороновую кислоту. Соединение, указанное в заголовке, было получено в виде бесцветного масла.
МС ИЭР (m/z): 254,2 [(М+Н)+]
1Н ЯМР (300 МГц, хлороформ-d) δ = 8.55 (s, 1Н), 8.53 (d, J=5.0 Гц, 1Н), 8.44 (s, 1Н), 7.60 (d, J=5.7 Гц, 1Н), 7.29 (d, J=5.0 Гц, 1Н), 6.97 (s, 1Н), 2.39 (s, 3Н), 1.52 (s, 6Н)
Пример 117
1-Циклопропил-3,3-диметил-6-(6-метил-3-пиридил)пирроло[3,2-с]пиридин-2-он

В трубке под давлением суспензию 6-хлор-1-циклопропил-3,3-диметил-1,3-дигидро-пирроло[3,2-с]пиридин-2-она (пример 89а, 0,20 г, 0,845 ммоль) и 2-метилпиридин-5-бороновой кислоты (0,139 г, 1,014 ммоль) и карбоната цезия (0,55 г, 1,69 ммоль) в диоксане (4 мл) продували аргоном в течение 15 минут. Затем добавляли Pd2(dba)3.CHCl3 (0,085 г, 0,084 ммоль) и Xantphos (0,098 г, 0,17 ммоль), и продувание продолжали в течение 15 минут. Трубку запаивали, и реакционную смесь нагревали до 110°С в течение 12 часов. Реакционную смесь разбавляли этилацетатом и водой. Смесь экстрагировали этилацетатом, и органические слои промывали водой, а затем соляным раствором. Объединенные органические слои высушивали сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя гексан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде желтого твердого вещества (40 мг).
МС ИЭР (m/z): 294,0 [(М+Н)+]
Пример 118
3,3-Диметил-6-(6-метил-3-пиридил)-1Н-пирроло[3,2-с]пиридин-2-он

Получили по аналогии с примером 117 из 6-хлор-3,3-диметил-1,3-дигидро-пирроло[3,2-с]пиридин-2-она (пример 84а). Соединение, указанное в заголовке, было получено в виде белого твердого вещества.
МС ИЭР (m/z): 253,8 [(М+Н)+]
Пример 119
6-(4-Изопропил-1Н-имидазол-1-ил)-3,3-диметилиндолин-2-он

Получили по аналогии с примером 63, используя 4-изопропил-1Н-имидазол. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества.
МС ИЭР (m/z): 270,3 [(М+Н)+]
Пример 120
6-(4-Изопропил-1Н-имидазол-1-ил)-1,3,3-триметилиндолин-2-он

Получили по аналогии с примером 63 из 6-бром-1,3,3-триметилиндолин-2-она (пример 1а), используя 4-изопропил-1Н-имидазол. Соединение, указанное в заголовке, было получено в виде светло-коричневого масла.
МС ИЭР (m/z): 284,2 [(М+Н)+]
Пример 121
1-Этил-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он
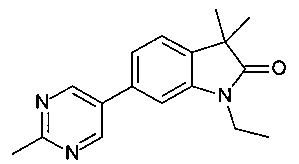
Суспензию 3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-она (пример 21, 100 мг, 395 мкмоль) и карбоната цезия (257 мг, 790 мкмоль) в ДМФ (1,5 мл) обрабатывали бромэтаном (64,5 мг, 592 мкмоль), и суспензию нагревали при 60°С в течение 20 минут. Реакционную смесь разбавляли водой и этилацетатом. Смесь экстрагировали этилацетатом, и органические слои промывали водой. Объединенные органические слои высушивали сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток кристаллизовали из смеси этилацетат/гептан 1:5 при -20°С. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества (88 мг).
МС ИЭР (m/z): 282,2 [(М+Н)+].
Пример 122
1-Циклопропил-3,3-диметил-6-(3-метил-4-пиридил)пирроло[3,2-с]пиридин-2-он

Получили по аналогии с примером 83b из 6-хлор-1-циклопропил-3,3-диметил-1,3-дигидро-пирроло[3,2-с]пиридин-2-она (пример 89а), используя 3-метилпиридин-4-бороновую кислоту. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества.
МС ИЭР (m/z): 294,0 [(М+Н)+]
Пример 123
1,3,3-Триметил-6-(3-метил-4-пиридил)пирроло[3,2-с]пиридин-2-он
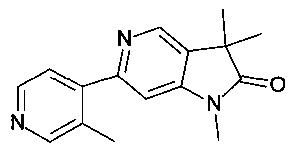
Получили по аналогии с примером 83, используя 3-метилпиридин-4-бороновую кислоту. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества.
МС ИЭР (m/z): 267,8 [(М+Н)+]
Пример 124
1,3,3-Триметил-6-(6-метил-3-пиридил)пирроло[3,2-с]пиридин-2-он

Получили по аналогии с примером 83, используя 2-метилпиридин-5-бороновую кислоту. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества.
МС ИЭР (m/z): 267,8 [(М+Н)+]
Пример 125
1-Циклопропил-3,3-диметил-6-(2-метилпиримидин-5-ил)-1Н-пирроло[3,2-с]пиридин-2(3Н)-он

а) 2-Метил-5-(триметилстаннил)пиримидин
В трубке под давлением 5-бром-2-метилпиримидин (500 мг, 2,89 ммоль) и гексаметилдиолово (2,9 г, 1,85 мл, 8,67 ммоль) объединяли с диоксаном (24 мл). Смесь барботировали аргоном в течение 2 минут, затем добавляли дихлорид бис(трифенилфосфин)палладия(II) (203 мг, 289 мкмоль), и трубку запаивали. Реакционную смесь нагревали до 90°С в течение 5 часов. Реакционную смесь наливали в 1 М водный раствор фторида калия и экстрагировали этилацетатом. Органические слои промывали 1 М водным раствором фторида калия, объединяли, высушивали сульфатом натрия и концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде желтого вязкого масла (590 мг).
МС ИЭР (m/z): 259,0 [(М+Н)+] (основной пик, Sn-специфичная изотопный спектр).
b) 1-Циклопропил-3,3-диметил-6-(2-метилпиримидин-5-ил)-1Н-пирроло[3,2-с]пиридин-2(3Н)-он
В трубке под давлением 6-хлор-1-циклопропил-3,3-диметил-1Н-пирроло[3,2-с]пиридин-2(3Н)-он (пример 89а, 100 мг, 422 мкмоль) и 2-метил-5-(триметилстаннил)пиримидин (130 мг, 507 мкмоль) объединяли с безводным ДМФ (2 мл). Смесь барботировали аргоном в течение 5 минут. Затем добавляли тетракис(трифенилфосфин)палладий(0) (48,8 мг, 42,2 мкмоль), трубку запаивали, и реакционную смесь нагревали до 80°С в течение 16 часов. Реакционную смесь разбавляли этилацетатом, водой и насыщенным водным раствором бикарбоната натрия. Смесь экстрагировали этилацетатом, и органические слои промывали насыщенным водным раствором бикарбоната натрия. Объединенные органические слои высушивали сульфатом натрия, фильтровали и концентрйровали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя дихлорметан/метанол в качестве элюента. Полученное вещество растирали с диизопропиловым эфиром. Соединение, указанное в заголовке, было получено в виде желтого твердого вещества (75 мг).
МС ИЭР (m/z): 295,2 [(М+Н)+]
Пример 126
1-(2-Метоксиэтил)-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он

К раствору 3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-она (пример 21, 100 мг, 395 мкмоль) в ДМФ (3 мл) добавляли гидрид натрия (55% на минеральном масле, 20,7 мг, 474 мкмоль) при 0°С. Реакционную смесь перемешивали при 0°С в течение 5 минут, а затем при комнатной температуре. Через 30 минут при комнатной температуре добавляли по каплям 1-бром-2-метоксиэтан (71,3 мг, 48,2 мкл, 513 мкмоль), и реакционную смесь перемешивали при комнатной температуре в течение следующих 3 часов. Смесь распределяли между водой и этилацетатом. Смесь экстрагировали этилацетатом, объединенные органические слои высушивали сульфатом натрия, фильтровали, и полученный раствор концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Полученное вещество кристаллизовали из смеси диэтиловый эфир/гептан 1:2 при -20°С). Соединение, указанное в заголовке, было получено в виде белого твердого вещества (58 мг).
МС ИЭР (m/z): 312,2 [(М+Н)+].
Пример 127
3,3-Диметил-6-(2-метилпиримидин-5-ил)-1-(2,2,2-трифторэтил)индолин-2-он

Получили по аналогии с примером 121, используя 2-бром-1,1,1-трифторэтан и время реакции 4 часа. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества.
МС ИЭР (m/z): 336,2 [(М+Н)+].
Пример 128
3,3-Диметил-6-(2-метилпиримидин-5-ил)-1-(2-(трифторметокси)этил)индолин-2-он

Получили по аналогии с примером 121, используя 1-бром-2-(трифторметокси)этан при времени реакции 3 часа при комнатной температуре. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества.
МС ИЭР (m/z): 366,2 [(М+Н)+].
Пример 129
3,3-Диметил-6-(2-метилпиримидин-5-ил)-1-(оксетан-3-илметил)индолин-2-он

Получили по аналогии с примером 126, используя 3-(бромметил)оксетан. Соединение, указанное в заголовке, было получено в виде белого твердого вещества.
МС ИЭР (m/z): 324,3 [(М+Н)+].
Пример 130
3,3-Диметил-6-(2-метилпиримидин-5-ил)-1-(3,3,3-трифтор-2-гидроксипропил)индолин-2-он

Получили по аналогии с примером 121, используя 3-бром-1,1,1-трифторпропан-2-ол при времени реакции 2 часа при 100°С. Соединение, указанное в заголовке, было получено в виде белого твердого вещества.
МС ИЭР (m/z): 366,2 [(М+Н)+].
Пример 131
1-(3-Фторпропил)-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он

Получили по аналогии с примером 126, используя 1-бром-3-фторпропан. Соединение, указанное в заголовке, было получено в виде белого твердого вещества.
МС ИЭР (m/z): 314,2 [(М+Н)+].
Пример 132
1-(2-Фторэтил)-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он
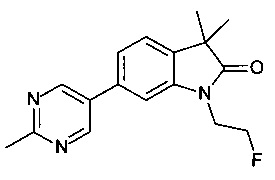
Получили по аналогии с примером 126, используя 1-бром-2-фторэтан. Соединение, указанное в заголовке, было получено в виде белого твердого вещества.
МС ИЭР (m/z): 300,2 [(М+Н)+].
Пример 133
6-(1-Этил-1Н-имидазол-4-ил)-1,3,3-триметилиндолин-2-он

Получили по аналогии с примером 126 из 6-(1Н-имидазол-4-ил)-1,3,3-триметилиндолин-2-она (пример 68), используя этилбромид и время реакции 20 часов. Соединение, указанное в заголовке, было получено в виде светло-коричневого масла.
МС ИЭР (m/z): 270,2 [(М+Н)+].
Пример 134
1,3,3-Триметил-6-(1-(2,2,2-трифторэтил)-1Н-имидазол-4-ил)индолин-2-он

Получили по аналогии с примером 126 из 6-(1Н-имидазол-4-ил)-1,3,3-триметилиндолин-2-она (пример 68), используя 2,2,2-трифторэтилтрифторметансульфонат. Соединение, указанное в заголовке, было получено в виде светло-коричневой пены.
МС ИЭР (m/z): 324,2 [(М+Н)+].
Пример 135
6-(2-Фтор-4-пиридил)-1,3,3-триметил-пирроло[3,2-с]пиридин-2-он

К раствору 6-хлор-1,3,3-триметил-1,3-дигидро-пирроло[3,2-с]пиридин-2-она (пример 83а, 200 мг, 0,950 ммоль) в диоксане (10 мл) и воде (2,5 мл) добавляли карбонат натрия (179,6 мг, 1,695 ммоль) и 2-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-пиридин (318 мг, 1,429 ммоль). Из аппарата 3 раза откачивали воздух и продували азотом. Смесь барботировали азотом в течение 10 минут, затем добавляли Pd(PPh3)4 (11,1 мг, 0,01 ммоль), и продувание азотом продолжали в течение 10 минут. Реакционную смесь нагревали до 110°С в течение 16 часов при энергичном перемешивании. Реакционную смесь разбавляли ледяной водой и экстрагировали этилацетатом, и органические слои промывали соляным раствором. Объединенные органические слои высушивали сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества (50 мг).
МС ИЭР (m/z): 271,7 [(М+Н)+].
Пример 136
1'-Метил-6'-(2-метилпиридин-4-ил)спиро[циклопропан-1,3'-пирроло[3,2-с]пиридин]-2'(1'Н)-он

а) 6-Хлорспиро[1Н-пирроло[3,2-с]пиридине-3,1'-циклопропан]-2-он
К перемешанному раствору 6-хлор-1,3-дигидро-пирроло[3,2-с]пиридин-2-она (2,0 г, 11,905 ммоль) и диизопропиламина (3,553 мл, 25,0 ммоль) в ТГФ (60,0 мл) добавляли n-BuLi (2,1 M в толуоле, 22,7 мл, 47,619 ммоль) при -30°С в атмосфере аргона. Затем реакционную смесь перемешивали в течение 30 минут, при этом температура достигала 0°С. При этой температуре добавляли этилендибромид (3,092 мл, 35,714) в ТГФ (5,0 мл). После добавления охлаждающую баню удаляли, и реакционную смесь перемешивали при 25°С в течение 16 часов. Реакционную смесь гасили 30 мл насыщенного водного раствора хлорида аммония и экстрагировали этилацетатом. Органические слои высушивали сульфатом натрия, фильтровали, и полученный раствор концентрировали в вакууме. Неочищенное вещество растирали с гексаном, фильтровали и высушивали. Соединение, указанное в заголовке, было получено в виде коричневого твердого вещества (1,7 г) и использовали без дополнительной очистки.
МС ИЭР (m/z): 195,6 [(М+Н)+].
b) 6'-Хлор-1'-метил-спиро[циклопропан-1,3'-пирроло[3,2-с]пиридине]-2'-он
К перемешанному раствору 6-хлорспиро[1Н-пирроло[3,2-с]пиридин-3,1'-циклопропан]-2-она (3,8 г, 19,522 ммоль) в безводном ТГФ (120 мл) добавляли порциями NaH (60%, 0,936 г, 23,427 ммоль) при 0°С в атмосфере аргона. Затем реакционную смесь перемешивали при 0°С в течение 10 минут, затем температуру повышали до 25°С в течение 20 минут. Затем к реакционной смеси медленно добавляли MeI (1,465 мл, 23,427 ммоль) при 0°С, и перемешивание продолжали еще в течение 4 часов при 25°С. Затем реакционную смесь гасили насыщенным водным раствором хлорида аммония при 0°С, экстрагировали этилацетатом, и органические слои промывали водой. Объединенные органические слои высушивали сульфатом натрия, фильтровали, и полученный раствор концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя гексан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде светло-желтого твердого вещества (1,85 г).
МС ИЭР (m/z): 209,6 [(М+Н)+].
с) 1'-Метил-6'-(2-метилпиридин-4-ил)спиро[циклопропан-1,3'-пирроло[3,2-с]пиридин]-2'(1'Н)-он
Получили по аналогии с примером 1b из 6'-хлор-1'-метил-спиро[циклопропан-1,3'-пирроло[3,2-с]пиридин]-2'-она, используя 2-метилпиридин-4-бороновую кислоту. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества.
МС ИЭР (m/z): 266,2 [(М+Н)+].
Пример 137
6-(5-Этил-1,3,4-оксадиазол-2-ил)-1,3,3-триметил-индолин-2-он

Получили по аналогии с примером 93, используя пропангидразин. Соединение, указанное в заголовке, было получено в виде белого твердого вещества.
МС ИЭР (m/z): 272,1 [(М+Н)+].
Пример 138
1'-Метил-6'-(пиридин-3-ил)спиро[циклопропан-1,3'-пирроло[3,2-с]пиридин]-2'(1'Н)-он

Получили по аналогии с примером 1b из 6'-хлор-1'-метил-спиро[циклопропан-1,3'-пирроло[3,2-с]пиридин]-2'-она (пример 136b), используя пиридин-3-бороновую кислоту. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества.
МС ИЭР (m/z): 252,1 [(М+Н)+].
Пример 139
1'-Циклопропил-6'-(2-метилпиридин-4-ил)спиро[циклопропан-1,3'-пирроло[3,2-с]пиридин]-2'(1'Н)-он

а) 6'-Хлор-1'-циклопропил-спиро[циклопропан-1,3'-пирроло[3,2-с]пиридин]-2'-он
Получили по аналогии с примером 78а из 6-хлорспиро[1Н-пирроло[3,2-с]пиридин-3,1'-циклопропан]-2-она (пример 136а). Соединение, указанное в заголовке, было получено в виде бледно-желтого твердого вещества.
МС ИЭР (m/z): 234,7 [(М+Н)+].
р) 1'-Циклопропил-6'-(2-метилпиридин-4-ил)спиро[циклопропан-1,3'-пирроло[3,2-с]пиридин]-2'(1'Н)-он
Получили по аналогии с примером 1b из 6'-хлор-1'-циклопропил-спиро[циклопропан-1,3'-пирроло[3,2-с]пиридин]-2'-она, используя 2-метилпиридин-4-бороновую кислоту. Соединение, указанное в заголовке, было получено в виде белого твердого вещества.
МС ИЭР (m/z): 292,1 [(М+Н)+].
Пример 140
1'-Циклопропил-6'-(пиридин-3-ил)спиро[циклопропан-1,3'-пирроло[3,2-с]пиридин]-2'(1'Н)-он
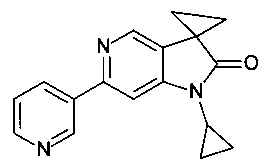
Получили по аналогии с примером 1b из 6'-хлор-1'-циклопропил-спиро[циклопропан-1,3'-пирроло[3,2-с]пиридин]-2'-она (пример 139а), используя пиридин-3-бороновую кислоту. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества.
МС ИЭР (m/z): 278,1 [(М+Н)+].
Пример 141
3,3-Диметил-6-[5-[1-(трифторметил)циклопропил]-1,3,4-оксадиазол-2-ил]индолин-2-он

а) Метил-3.3-диметил-2-оксо-2,3-дигидро-1Н-индол-6-карбоксилат
Раствор соединения 6-бром-3,3-диметил-1,3-дигидро-индол-2-она (пример 24а, 4 г, 16,66 ммоль) в МеОН (40 мл) и ДМФ (4 мл) барботировали аргоном в течение 10 минут. Затем добавляли DIPEA (29,5 мл, 166,6 ммоль) и Pd(dppf)Cl2 (1,36 г, 1,67 ммоль), и барботирование продолжали еще в течение 15 минут. Затем реакционную смесь перемешивали при 100°С при 10,3 бар в течение 16 часов в атмосфере газа СО. Реакционную смесь охлаждали до 25°С и концентрировали в вакууме. Остаток растворяли в этилацетате, и органическую фазу промывали водой, а затем соляным раствором. Органический слой высушивали сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя гексан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде желтого твердого вещества (2,8 г).
МС ИЭР (m/z): 220,2 [(М+Н)+].
b) 3,3-Диметил-2-оксо-2,3-дигидро-1Н-индол-6-карбогидразид
К перемешанному раствору метил-3,3-диметил-2-оксо-2,3-дигидро-1Н-индол-6-карбоксилата (0,5 г, 2,28 ммоль) в метаноле (7 мл) добавляли гидрат гидразина (1,1 мл, 22,8 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Затем смесь концентрировали в вакууме. Три раза добавляли толуол, и смесь концентрировали в вакууме. Соединение, указанное в заголовке, было получено в виде коричневого твердого вещества (0,48 г) и использовано без дополнительной очистки.
МС ИЭР (m/z): 220,2 [(М+Н)+].
c) N'-[(3,3-Диметил-2-оксо-2,3-дигидро-1Н-индол-6-ил)карбонил]-1-(трифторметил)циклопропан-1-карбогидразид
К перемешанному раствору 1-(трифторметил)циклопропан-1-карбоновой кислоты (0,07 г, 0,45 ммоль) в ДМФ (2 мл) добавляли TBTU (0,22 г, 0,68 ммоль), а затем N-метилморфолин (0,15 мл, 1,3 ммоль), и реакционную смесь перемешивали при 25°С в течение 15 минут. Затем добавляли 3,3-диметил-2-оксо-2,3-дигидро-1Н-индол-6-карбогидразид (0,1 г, 0,73 ммоль), и реакционную смесь перемешивали при 25°С в течение 16 часов. Реакционную смесь концентрировали в вакууме. Остаток разбавляли дихлорметаном и промывали насыщенным водным раствором бикарбоната натрия, а затем водой. Органический слой высушивали сульфатом натрия и концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества (90 мг) и использовано без дополнительной очистки.
МС ИЭР (m/z): 356,2 [(М+Н)+].
d) 3,3-Диметил-6-[5-[1-(трифторметил)циклопропил]-1,3,4-оксадиазол-2-ил]индолин-2-он
Получили по аналогии с примером 93b из N'-[(3,3-диметил-2-оксо-2,3-дигидро-1Н-индол-6-ил)карбонил]-1-(трифторметил)циклопропан-1-карбогидразида. Соединение, указанное в заголовке, было получено в виде бледно-желтого твердого вещества.
МС ИЭР (m/z): 337,8 [(М+Н)+].
Пример 142
6-(3-ииклопропилизоксазол-5-ил)-1,3,3-триметилиндолин-2-он

а) 1-Циклопропил-3-(1,3,3-триметил-2-оксоиндолин-6-ил)пропан-1,3-дион
К раствору 6-ацетил-1,3,3-триметилиндолин-2-она (пример 70b, 326 мг, 1,5 ммоль) и метилциклопропанкарбоксилата (150 мг, 153 мкл, 1,5 ммоль) в ТГФ (8 мл) при 22°С в инертной атмосфере добавляли гидрид натрия (55% на минеральном масле, 137 мг, 3,15 ммоль) одной порцией. Суспензию перемешивали при 22°С в течение 39 часов. Смесь распределяли между 1 М водным раствором HCl и этилацетатом, и водный слой экстрагировали этилацетатом. Объединенные органические слои высушивали сульфатом натрия, фильтровали, и полученный раствор концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде бесцветного твердого вещества (243 мг).
МС ИЭР (m/z): 286,1 [(М+Н)+]
b) 6-(3-Циклопропилизоксазол-5-ил)-1,3,3-триметилиндолин-2-он
К раствору 1-циклопропил-3-(1,3,3-триметил-2-оксоиндолин-6-ил)пропан-1,3-диона (220 мг, 771 мкмоль) в этаноле (4,6 мл) в трубке под давлением добавляли при 22°С в атмосфере аргона гидрохлорид гидроксиламина (53,6 мг, 771 мкмоль). Трубку запаивали, и реакционную смесь нагревали при 85°С в течение 15 часов. Смесь разбавляли насыщенным водным раствором бикарбоната натрия и этилацетатом. Смесь экстрагировали этилацетатом, объединенные органические слои высушивали сульфатом натрия, фильтровали, и полученный раствор концентрировали в вакууме. Неочищенное вещество очищали препаративной сверхкритической флюидной хроматографией на колонке AD-H 20 х 250 мм, 5 мкм, используя диоксид углерода/метанол в качестве элюента. Соединение, указанное в заголовке, было получено в виде светло-красного масла (65 мг).
МС ИЭР (m/z): 283,1 [(М+Н)+]
Пример 143
1,3,3-Триметил-6-(3-метилизоксазол-5-ил)индолин-2-он

Получили по аналогии с примером 142, используя метилацетат. Соединение, указанное в заголовке, было получено в виде светло-желтого твердого вещества.
МС ИЭР (m/z): 257,1 [(М+Н)+]
Пример 144
6-(3-(Метоксиметил)изоксазол-5-ил)-1,3,3-триметилиндолин-2-он

Получили по аналогии с примером 142, используя метил-2-метоксиацетат. Соединение, указанное в заголовке, было получено в виде бесцветного масла.
МС ИЭР (m/z): 290,1 [(М+Н)+]
Пример 145
1,3,3-Триметил-6-(2-(тетрагидро-2Н-пиран-4-ил)оксазол-5-ил)индолин-2-он

а) 6-(2-Азидоацетил)-1,3,3-триметилиндолин-2-он
К раствору 6-(2-бромацетил)-1,3,3-триметилиндолин-2-она (пример 70с, 1,75 г, 5,9 ммоль) в ацетоне (17,5 мл) добавляли при 22°С в инертной атмосфере азид натрия (767 мг, 11,8 ммоль) и перемешивали при 22°С в течение 6 часов. Реакционную смесь наливали в воду и экстрагировали дихлорметаном, объединенные органические слои высушивали сульфатом натрия, фильтровали, и полученный раствор концентрировали в вакууме. Соединение, указанное в заголовке, было получено в виде светло-желтого твердого вещества (1,51 г).
МС ИЭР (m/z): 259,1 [(М+Н)+]
b) 1,3,3-Триметил-6-(2-(тетрагидро-2Н-пиран-4-ил)оксазол-5-ил)индолин-2-он
К бесцветному раствору трифенилфосфина (345 мг, 1,32 ммоль) в толуоле (2,5 мл) при 22°С в инертной атмосфере 6-(2-азидоацетил)-1,3,3-триметилиндолин-2-он (200 мг, 774 мкмоль), а затем через 2 минуты тетрагидро-2Н-пиран-4-карбонилхлорид (115 мг, 774 мкмоль). Реакционную смесь перемешивали при 22°С в течение 18 часов. Затем реакционную смесь концентрировали в вакууме, и остаток очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Полученное вещество снова очищали препаративной ВЭЖХ с обращенной фазой на колонке YMC Actus Triart С18 100 х 30 мм, 5 мкм, 12 нм, используя воду/ацетонитрил/муравьиную кислоту в качестве элюента. Соединение, указанное в заголовке, было получено в виде бесцветного масла (45 мг).
МС ИЭР (m/z): 327,2 [(М+Н)+]
Пример 146
1,3,3-Триметил-6-пиридазин-4-ил-пирроло[3,2-с]пиридин-2-он

К раствору 6-хлор-1,3,3-триметил-1,3-дигидро-пирроло[3,2-с]пиридин-2-она (пример 83а, 250 мг, 1,19 ммоль) в диоксане (12,5 мл) и воде (3,1 мл) добавляли карбонат калия (329 мг, 2,381 ммоль) и 4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-пиридазин (367 мг, 1,786 ммоль). Из аппарата откачивали воздух и снова наполняли азотом три раза. Затем смесь барботировали азотом в течение 10 минут. Затем добавляли Pd(dppf)Cl2, и смесь снова барботировали азотом в течение 10 минут. Реакционную смесь нагревали до 110°С в течение 16 часов при энергичном перемешивании. Реакционную смесь разбавляли ледяной водой, экстрагировали этилацетатом, и органические слои промывали соляным раствором. Объединенные органические слои высушивали сульфатом натрия, фильтровали, и полученный раствор концентрировали в вакууме. Сырое вещество очищали хроматографией на силикагеле, используя этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества (30 мг).
МС ИЭР (m/z): 254,8 [(М+Н)+]
Пример 147
1-Циклопропил-3,3-диметил-6-[5-(трифторметил)-1,3,4-оксадиазол-2-ил]индолин-2-он

а) 1-Циклопропил-3,3-диметил-2-оксо-2,3-дигидро-1Н-индоле-6-карбогидразид
Получили по аналогии с примером 141а-b из 6-бром-1-циклопропил-3,3-диметил-индолин-2-она (пример 78а). Соединение, указанное в заголовке, было получено в виде белого твердого вещества.
МС ИЭР (m/z): 260,2 [(М+Н)+]
b) 1-Циклопропил-3,3-диметил-2-оксо-N'-(трифторацетил)-2,3-дигидро-1Н-индоле-6-карбогидразид
К перемешанному раствору 1-циклопропил-3,3-диметил-2-оксо-2,3-дигидро-1Н-индол-6-карбогидразида (0,2 г, 0,77 ммоль) в ТГФ (5 мл) добавляли трифторуксусный ангидрид (0,33 мл, 2,31 ммоль) при 0°С. Затем реакционную смесь перемешивали при 25°С в течение 2 часов. Реакционную смесь концентрировали в вакууме. Соединение, указанное в заголовке, было получено в виде белой пены (0,22 г), которую использовали без дополнительной очистки. ЖХ-МС: 356,2 (М+Н).
МС ИЭР (m/z): 356,2 [(М+Н)+]
с) 1-Циклопропил-3,3-диметил-6-[5-(трифторметил)-1,3,4-оксадиазол-2-ил]индолин-2-он
Получили по аналогии с примером 93b из 1-циклопропил-3,3-диметил-2-оксо-N'-(трифторацетил)-2,3-дигидро-1Н-индол-6-карбогидразида. Соединение, указанное в заголовке, было получено в виде белого твердого вещества.
МС ИЭР (m/z): 338,3 [(М+Н)+]
Пример 148
3,3-Диметил-6-(6-метилпиридин-3-ил)индолин-2-он

Получили по аналогии с примером 1b из 6-бром-3,3-диметил-1,3-дигидро-индол-2-она (пример 24а), используя 6-метилпиридин-3-бороновую кислоту. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества.
МС ИЭР (m/z): 253,3 [(М+Н)+]
Пример 149
6-(4-Фторпиридин-3-ил)-3,3-диметилиндолин-2-он

Получили по аналогии с примером 1b из 6-бром-3,3-диметил-1,3-дигидро-индол-2-она (пример 24а), используя 4-фторпиридин-3-пинаколовый эфир бороновой кислоты. Соединение, указанное в заголовке, было получено в виде светло-коричневого твердого вещества.
МС ИЭР (m/z): 257,2 [(М+Н)+]
Пример 150
6-(5-Этил-1,3,4-оксадиазол-2-ил)-3,3-диметил-индолин-2-он

а) N'-[(3,3-Диметил-2-оксо-2,3-дигидро-1Н-индол-6-ил)карбонил]пропангидразид
К перемешанному раствору 3,3-диметил-2-оксо-2,3-дигидро-1Н-индол-6-карбогидразида (пример 141b, 0,3 г, 1,37 ммоль) в смеси ДМФ/дихлорметан 1:3 (4 мл) добавляли триэтиламин (0,47 мл, 3,42 ммоль), а затем пропионилхлорид (0,15 мл, 1,64 ммоль). Реакционную смесь перемешивали при 25°С в течение 2 часов. Затем реакционную смесь концентрировали в вакууме. Остаток растворяли в этилацетате, и органический слой промывали насыщенным водным раствором бикарбоната натрия, а затем водой. Органический слой высушивали сульфатом натрия, фильтровали, и полученный раствор концентрировали в вакууме. Соединение, указанное в заголовке, было получено в виде светло-коричневого твердого вещества (195 мг) и использовано без дополнительной очистки.
МС ИЭР (m/z): 276,2 [(М+Н)+]
b) 6-(5-Этил-1,3,4-оксадиазол-2-ил)-3,3-диметил-индолин-2-он
Получили по аналогии с примером 93b, используя ацетонитрил/ДМФ 4:1 в качестве растворителя. Соединение, указанное в заголовке, было получено в виде белого твердого вещества.
МС ИЭР (m/z): 258,2 [(М+Н)+]
Пример 151
3,3-Диметил-6-(1-метил-1Н-имидазол-4-ил)индолин-2-он

Получили по аналогии с примером 17, используя 4-бром-1-метил-1Н-имидазол. Соединение, указанное в заголовке, было получено в виде светло-коричневого твердого вещества.
МС ИЭР (m/z): 242,2 [(М+Н)+]
Пример 152
1,3,3-Триметил-6-[5-(оксетан-3-ил)-1,3,4-оксадиазол-2-ил]индолин-2-он

а) Метил-1,3,3-триметил-2-оксоиндолин-6-карбоксилат
Получили по аналогии с примером 141а из 6-бром-1,3,3-триметилиндолин-2-она (пример 1а). Соединение, указанное в заголовке, было получено в виде желтого твердого вещества.
МС ИЭР (m/z): 234,1 [(М+Н)+]
b) 1,3,3-Триметил-6-[5-(оксетан-3-ил)-1,3,4-оксадиазол-2-ил]индолин-2-он
Получили по аналогии с примером 141 из метил-1,3,3-триметил-2-оксоиндолин-6-карбоксилата, используя оксетан-3-карбоновую кислоту. Соединение, указанное в заголовке, было получено в виде белого твердого вещества.
МС ИЭР (m/z): 300,2 [(М+Н)+]
Пример 153
1,3,3-Триметил-6-[4-(трифторметил)имидазол-1-ил]индолин-2-он

Суспензию 6-бром-1,3,3-триметилиндолин-2-она (пример 1а, 25,0 мг, 0,098 ммоль), 4-(трифторметил)-1Н-имидазола (20,094 мг, 0,148 ммоль) и карбоната калия (40,8 мг, 0,295 ммоль) в ацетонитриле (2,0 мл) в пробирке для микроволнового реактора барботировали аргоном в течение 5 минут. Затем добавляли CuI (3,749 мг, 0,02 ммоль) и N,N'-диметилэтан-1,2-диамин (0,0040 мл, 0,034 ммоль), и дегазирование повторяли. Пробирку герметично закрывали, и реакционную смесь нагревали до 90°С при микроволновом облучении. Реакционную смесь концентрировали в вакууме. Остаток разбавляли этилацетатом и промывали 1 М водным раствором HCl. Органический слой высушивали сульфатом натрия, фильтровали, и полученный раствор концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя гексан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества (10 мг).
МС ИЭР (m/z): 310,2 [(М+Н)+]
Пример 154
1-Циклопропил-3,3-диметил-6-[4-(трифторметил)имидазол-1-ил]индолин-2-он

Получили по аналогии с примером 153 из 6-бром-1-циклопропил-3,3-диметил-индолин-2-она (пример 78а). Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества.
МС ИЭР (m/z): 336,0 [(М+Н)+]
Пример 155
3,3-Диметил-6-(5-метилпиразин-2-ил)индолин-2-он

Получили по аналогии с примером 17, используя 2-бром-5-метилпиразин. Соединение, указанное в заголовке, было получено в виде светло-желтого твердого вещества.
МС ИЭР (m/z): 254,1 [(М+Н)+]
Пример 156
6-(2,6-Диметилпиримидин-4-ил)-3,3-диметилиндолин-2-он

Получили по аналогии с примером 17, используя 4-бром-2,6-диметилпиримидин. Соединение, указанное в заголовке, было получено в виде светло-желтого твердого вещества.
МС ИЭР (m/z): 268,2 [(М+Н)+]
Пример 157
3,3-Диметил-6-(6-метилпиридазин-3-ил)индолин-2-он

Получили по аналогии с примером 17, используя 3-бром-6-метилпиридазин. Соединение, указанное в заголовке, было получено в виде светло-желтого твердого вещества.
МС ИЭР (m/z): 254,1 [(М+Н)+]
Пример 158
1-Циклопропил-3,3-диметил-6-[5-(оксетан-3-ил)-1,3,4-оксадиазол-2-ил]индолин-2-он

Получили по аналогии с примером 141 из 1-циклопропил-3,3-диметил-2-оксо-2,3-дигидро-1Н-индоле-6-карбогидразида (пример 147а), используя оксетан-3-карбоновую кислоту. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества.
МС ИЭР (m/z): 326,3 [(М+Н)+]
Пример 159
6-(4-Этил-1Н-имидазол-1-ил)-1,3,3-триметилиндолин-2-он

Получили по аналогии с примером 63 из 6-бром-1,3,3-триметилиндолин-2-она (пример 1а), используя 4-этил-1Н-имидазол. Соединение, указанное в заголовке, было получено в виде бесцветного масла.
МС ИЭР (m/z): 270,1 [(М+Н)+]
Пример 160
3,3-Диметил-6-[5-(оксетан-3-ил)-1,3,4-оксадиазол-2-ил]индолин-2-он

Получили по аналогии с примером 141, используя оксетан-3-карбоновую кислоту. Соединение, указанное в заголовке, было получено в виде белого твердого вещества.
МС ИЭР (m/z): 286,2 [(М+Н)+]
Пример 161
3,3-Диметил-6-(2-метилоксазол-5-ил)индолин-2-он

а) 1-(4-Метоксибензил)-3,3-диметил-6-(оксазол-5-ил)индолин-2-он
В реакционную трубку помещали 6-бром-1-(4-метоксибензил)-3,3-диметилиндолин-2-он (пример 112а, 144 мг, 400 мкмоль), ацетат палладия(II) (4,49 мг, 20,0 мкмоль), 2-ди-трет-бутилфосфино-3,4,5,6-тетраметил-2',4',6'-три-изопропилдифенил (19,2 мг, 40,0 мкмоль), пивалиновую кислоту (16,3 мг, 18,6 мкл, 160 мкмоль) и карбонат калия (166 мг, 1,2 ммоль). Флакон закрывали крышкой, откачивали воздух и снова заполняли азотом три раза. Добавляли безводный диметилацетамид (ДМА) (1,5 мл) с помощью шприца, а затем оксазол (55,2 мг, 800 мкмоль), и реакционную смесь нагревали до 110°С в течение 24 часов. После охлаждения до комнатной температуры реакционную смесь непосредственно очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Полученное вещество растворяли в дихлорметане и промывали водой. Органические слои высушивали сульфатом натрия, фильтровали, и полученный раствор концентрировали в вакууме. Соединение, указанное в заголовке, было получено в виде светло-желтого масла (57 мг).
МС ИЭР (m/z): 349,2 [(М+Н)+]
b) 1-(4-Метоксибензил)-3,3-диметил-6-(2-метилоксазол-5-ил)индолин-2-он
К раствору 1-(4-метоксибензил)-3,3-диметил-6-(оксазол-5-ил)индолин-2-она (200 мг, 574 мкмоль) в ТГФ (4 мл) добавляли при 22°С 1 М комплекс борана с тетрагидрофураном в ТГФ (689 мкл, 689 мкмоль), при этом отмечали некоторое выделение газа. Через 30 минут раствор охлаждали до -78°С с последующим добавлением 1,6 М н-бутиллития в гексане (431 мкл, 689 мкмоль). После 15 минут при -78°С добавляли йодметан (97,8 мг, 43,0 мкл, 689 мкмоль) с помощью шприца, и смеси давали возможность подогреться до -20°С и перемешивали при этой температуре в течение 4 часов. Смесь гасили в 5% уксусной кислоте в этаноле (об/об) (10,3 г, 9,86 мл, 8,61 ммоль) и перемешивали при 22°С в течение 16 часов. Смесь наливали в насыщенный водный раствор бикарбоната натрия и экстрагировали эфиром. Органические слои промывали соляным раствором, объединяли, высушивали сульфатом натрия, фильтровали, и полученный раствор концентрировали в вакууме. Остаток очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде светло-желтого масла (36 мг).
МС ИЭР (m/z): 363,2 [(М+Н)+]
с) 3,3-Диметил-6-(2-метилоксазол-5-ил)индолин-2-он
В пробирке растворяли 1-(4-метоксибензил)-3,3-диметил-6-(2-метилоксазол-5-ил)индолин-2-он (35 мг, 96,6 мкмоль) в трифторуксусной кислоте (661 мг, 446 мкл, 5,79 ммоль). Пробирку помещали в атмосферу аргона, герметично закрывали, и реакционную смесь нагревали до 140°С в течение 1 часа при микроволновом облучении. Смесь концентрировали в вакууме. Остаток очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде светло-коричневого твердого вещества (15,9 мг).
МС ИЭР (m/z): 243,1 [(М+Н)+]
Пример 162
6-(4-Этилимидазол-1-ил)-3,3-диметил-индолин-2-он

а) 6-Бром-3,3-диметил-1-(2-триметилсилилэтоксиметил)индолин-2-он
К суспензии NaH (60%, 0,18 г, 4,58 ммоль) в ТГФ (5 мл) добавляли раствор 6-бром-3,3-диметил-2,3-дигидро-1Н-индол-2-она (пример 24а, 1,0 г, 4,16 ммоль) в ТГФ (5 мл) при 0°С, и реакционную смесь перемешивали при этой температуре в течение 30 минут. Затем к этой смеси добавляли [2-(хлорметокси)этил]триметилсилан (0,82 мл, 4,58 ммоль), и перемешивание продолжали при 25°С в течение 16 часов. Реакционную смесь концентрировали в вакууме. Остаток растворяли в этилацетате (50 мл), и органический слой промывали водой. Отделенный органический слой высушивали сульфатом натрия, фильтровали, и полученный раствор концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя гексан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде красной жидкости (1,3 г).
МС ИЭР (m/z): 370,2 [(М+Н)+]
b) 6-(4-Этилимидазол-1-ил)-3,3-диметил-1-(2-триметилсилилэтоксиметил)индолин-2-он
Получили по аналогии с примером 63 из 6-бром-3,3-диметил-1-(2-триметилсилилэтоксиметил)индолин-2-она, используя 4-этил-1Н-имидазол. Соединение, указанное в заголовке, было получено в виде желтой смолы.
МС ИЭР (m/z): 385,9 [(М+Н)+]
c) 6-(4-Этилимидазол-1-ил)-3,3-диметил-индолин-2-он
К перемешанному раствору 6-(4-этил-1Н-имидазол-1-ил)-3,3-диметил-1-{[2-(триметилсилил)этокси]метил}-2,3-дигидро-1Н-индол-2-она (0,16 г, 0,42 ммоль) в дихлорметане (5 мл) добавляли ТФУ (2,8 мл, 37,34 ммоль) при 0°С, и реакционную смесь перемешивали при 25°С в течение 4 часов. Реакционную смесь концентрировали в вакууме, и остаток растворяли в смеси дихлорметан/метанол 4:1 (5 мл). Затем к смеси добавляли этилендиамин (2,8 мл, 41,49 ммоль) и перемешивали ее при 25°С в течение 16 часов. Реакционную смесь концентрировали в вакууме, и остаток растворяли в этилацетате. Органический слой промывали водой, отделяли, высушивали сульфатом натрия, фильтровали, и полученный раствор концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя гексан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде желтого липкого твердого вещества (30 мг).
МС ИЭР (m/z): 256,0 [(М+Н)+]
Пример 163
6-(1,3-Диметил-1Н-пиразол-5-ил)-3,3-диметилиндолин-2-он

a) 1-(1-(4-Метоксибензил)-3,3-диметил-2-оксоиндолин-6-ил)бутан-1,3-дион
Получили по аналогии с примером 142а из 6-ацетил-1-(4-метоксибензил)-3,3-диметилиндолин-2-она (пример 113d), используя метилацетат. Соединение, указанное в заголовке, было получено в виде желтого масла.
МС ИЭР (m/z): 366,2 [(М+Н)+]
b) 6-(1,3-Диметил-1Н-пиразол-5-ил)-1-(4-метоксибензил)-3,3-диметилиндолин-2-он
В реакционной трубке к раствору 1-(1-(4-метоксибензил)-3,3-диметил-2-оксоиндолин-6-ил)бутан-1,3-диона (135 мг, 369 мкмоль) в ТГФ (1,4 мл) добавляли при 22°С метилгидразин (85,1 мг, 97,3 мкл, 1,85 ммоль) и моногидрат пара-толуолсульфоновой кислоты (3,51 мг, 18,5 мкмоль). Трубку продували аргоном, запаивали, и реакционную смесь перемешивали при 80°С в течение 2 часов. Смесь адсорбировали на силикагеле, выпаривали и очищали хроматографией на силикагеле, используя дихлорметан/метанол в качестве элюента. Полученное вещество дополнительно очищали препаративной ВЭЖХ с нормальной фазой, используя колонку Reprosil Chiral-NR и гептан/этанол 60:40 в качестве элюента. Соединение, указанное в заголовке, было получено в виде бесцветного масла (73 мг).
МС ИЭР (m/z): 376,2 [(М+Н)+]
c) 6-(1,3-Диметил-1Н-пиразол-5-ил)-3,3-диметилиндолин-2-он
Получили по аналогии с примером 161с из 6-(1,3-диметил-1Н-пиразол-5-ил)-1-(4-метоксибензил)-3,3-диметилиндолин-2-она. Соединение, указанное в заголовке, было получено в виде бесцветного твердого вещества.
МС ИЭР (m/z): 256,1 [(М+Н)+]
Пример 164
3,3-Диметил-6-(1-метил-1Н-пиразол-3-ил)индолин-2-он

Получили по аналогии с примером 17, используя 3-йод-1-метил-1Н-пиразол. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества.
МС ИЭР (m/z): 242,1 [(М+Н)+]
Пример 165
6-(2-(Гидроксиметил)оксазол-5-ил)-1,3,3-триметилиндолин-2-он

а) (5-(1,3,3-Триметил-2-оксоиндолин-6-ил)оксазол-2-ил)метилацетат
Получили по аналогии с примером 145, используя 2-хлор-2-оксоэтилацетат. Соединение, указанное в заголовке, было получено в виде желтого масла.
МС ИЭР (m/z): 315,2 [(М+Н)+]
b) 6-(2-(Гидроксиметил)оксазол-5-ил)-1,3,3-триметилиндолин-2-он
К раствору (5-(1,3,3-триметил-2-оксоиндолин-6-ил)оксазол-2-ил)метилацетата (34 мг, 108 мкмоль) в МеОН (0,7 мл) добавляли карбонат калия (17,9 мг, 130 мкмоль), и смесь перемешивали при 22°С в течение 2 часов. Реакционную смесь концентрировали в вакууме, и остаток очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Полученное вещество дополнительно очищали препаративной обращенно-фазовой ВЭЖХ на колонке YMC Actus Triart С18 100 × 30 мм, 5 мкм, 12 нм, используя смесь вода/ацетонитрил/муравьиная кислота в качестве элюента. Соединение, указанное в заголовке, было получено в виде бесцветного масла (12 мг).
МС ИЭР (m/z): 273,1 [(М+Н)+]
Пример 166
6-(5-(Гидроксиметил)-1,3,4-оксадиазол-2-ил)-3,3-диметилиндолин-2-он

a) Этил-2-[2-(3,3-диметил-2-оксо-индолине-6-карбонил)гидразино]-2-оксо-ацетат
К перемешанному раствору 3,3-диметил-2-оксо-2,3-дигидро-1Н-индол-6-карбогидразида (пример 141b, 0,2 г, 0,91 ммоль) в смеси ДМФ : дихлорметан 1:3 (4 мл) добавляли триэтиламин (0,32 мл, 2,28 ммоль), а затем этилоксалилхлорид (0,12 мл, 1,09 ммоль). Реакционную смесь перемешивали при 25°С в течение 12 часов. После завершения смесь концентрировали в вакууме, и остаток растворяли в EtOAc. Органический слой промывали насыщенным водным раствором бикарбоната натрия, а затем водой, высушивали сульфатом натрия, фильтровали, и полученный раствор концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя гексан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде белого твердого вещества (70 мг).
МС ИЭР (m/z): 318,2 [(М+Н)+]
b) Этил-5-(3,3-диметил-2-оксо-индолин-6-ил)-1,3,4-оксадиазол-2-карбоксилат
Получили по аналогии с примером 93b из этил-2-[2-(3,3-диметил-2-оксо-индолин-6-карбонил)гидразино]-2-оксо-ацетата, используя смесь ацетонитрил/ДМФ 4:1 в качестве растворителя. Соединение, указанное в заголовке, было получено в виде белого твердого вещества.
МС ИЭР (m/z): 302,0 [(М+Н)+]
с) 6-(5-(Гидроксиметил)-1,3,4-оксадиазол-2-ил)-3,3-диметилиндолин-2-он
К перемешанному раствору этил-5-(3,3-диметил-2-оксо-индолин-6-ил)-1,3,4-оксадиазол-2-карбоксилата (0,35 г, 1,16 ммоль) в ТГФ (5 мл) добавляли LiBH4 (0,127 г, 5,81 ммоль) при 25°С, и реакционную смесь перемешивали при этой температуре в течение 30 минут. Реакционную смесь гасили 20% водным раствором KOH, и остаток отфильтровывали и промывали смесью дихлорметан/метанол 9:1. Фильтрат концентрировали в вакууме, и неочищенное вещество очищали хроматографией на силикагеле, используя гексан/этилацетат в качестве элюента. Полученное вещество дополнительно очищали препаративной обращенно-фазовой ВЭЖХ, используя колонку Synergi 4 мкм Мах-RP 80А° и смесь ацетонитрил/вода/муравьиная кислота в качестве элюента. Соединение, указанное в заголовке, было получено в виде бесцветного твердого вещества (29 мг).
МС ИЭР (m/z): 260,1 [(М+Н)+]
Пример 167
3,3-Диметил-6-[4-(трифторметил)имидазол-1-ил]индолин-2-он

а) 1-[(4-Метоксифенил)метил]-3,3-диметил-6-[4-(трифторметил)имидазол-1-ил]индолин-2-он
Получили по аналогии с примером 153 из 6-бром-1-(4-метоксибензил)-3,3-диметилиндолин-2-она (пример 112а), используя 4-трифторметил-1Н-имидазол. Соединение, указанное в заголовке, было получено в виде белого твердого вещества.
МС ИЭР (m/z): 416,3 [(М+Н)+]
b) 3,3-Диметил-6-[4-(трифторметил)имидазол-1-ил]индолин-2-он
В запаянной трубке смесь 1-[(4-метоксифенил)метил]-3,3-диметил-6-[4-(трифторметил)имидазол-1-ил]индолин-2-она (0,15 г, 0,36 ммоль) и ТФУ (5 мл) нагревали до 120°С в течение 72 часов. Реакционную смесь концентрировали в вакууме, и остаток растворяли в EtOAc. Смесь промывали насыщенным водным раствором бикарбоната натрия, органический слой высушивали сульфатом натрия, фильтровали, и полученный раствор концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя гексан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде коричневого твердого вещества (77 мг).
МС ИЭР (m/z): 296,0 [(М+Н)+]
Пример 168
3,3-Диметил-6-[4-(2,2,2-трифтор-1-гидрокси-этил)имидазол-1-ил]индолин-2-он

a) 2,2,2-Трифтор-1-(1Н-имидазол-5-ил)этанол
Смесь имидазола (4,0 г, 58,75 ммоль) и трифторацетальдегидметилполуацеталь (3,82 г, 29,37 ммоль) нагревали до образования флегмы в атмосфере аргона в течение 2 часов при 150°С, смесь становилась однородной, и образовавшийся метанол кипятили с обратным холодильником. Реакционную смесь концентрировали в вакууме. Неочищенное вещество очищали колоночной хроматографией на силикагеле, используя гексан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде белого полутвердого вещества (1,5 г).
МС ИЭР (m/z): 166,8 [(М+Н)+]
b) трет-Бутил-диметил-[2,2,2-трифтор-1-(1Н-имидазол-5-ил)этокси]силан
К раствору 2,2,2-трифтор-1-(1Н-имидазол-5-ил)этанола (300,0 мг, 1,807 ммоль) в дихлорметане (6 мл) добавляли по каплям триэтиламин (2,507 мл, 18,072 ммоль) при 0°С. Реакционную смесь перемешивали при 0°С в течение 15 минут, затем добавляли TBDMS-C (817,048 мг, 5,422 ммоль), и перемешивание продолжали в течение 16 часов. Реакционную смесь разбавляли водой, и смесь экстрагировали дихлорметаном. Объединенные органические слои высушивали сульфатом натрия, фильтровали, и полученный раствор концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя гексан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде белого полутвердого вещества (150,0 мг).
МС ИЭР (m/z): 280,8 [(М+Н)+]
c) 6-[4-[1-[трет-Бутил(диметил)силил]окси-2,2,2-трифтор-этил]имидазол-1-ил]-1-[(4-метоксифенил)метил]-3,3-диметил-индолин-2-он
Получили по аналогии с примером 153 из 6-бром-1-(4-метоксибензил)-3,3-диметилиндолин-2-она (пример 112а) и трет-бутил-диметил-[2,2,2-трифтор-1-(1Н-имидазол-5-ил)этокси]силана. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества.
МС ИЭР (m/z): 559,6 [(М+Н)+]
d) 3,3-Диметил-6-[4-(2,2,2-трифтор-1-гидрокси-этил)имидазол-1-ил]индолин-2-он
Получили по аналогии с примером 167b из 6-[4-[1-[трет-бутил(диметил)силил]окси-2,2,2-трифтор-этил]имидазол-1-ил]-1-[(4-метоксифенил)метил]-3,3-диметил-индолин-2-она. Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества.
МС ИЭР (m/z): 326,1 [(М+Н)+]
Пример 169
1-Циклопропил-6-[4-(1-гидроксиэтил)имидазол-1-ил]-3,3-диметил-индолин-2-он

a) трет-Бутил-[1-(1Н-имидазол-5-ил)этокси]-диметил-силан
Получили по аналогии с примером 168b, используя 1-(3Н-имидазол-4-ил)-этанол. Соединение, указанное в заголовке, было получено в виде бесцветной жидкости.
МС ИЭР (m/z): 227,0 [(М+Н)+]
b) 6-[4-[1-[трет-Бутил(диметил)силил]оксиэтил]имидазол-1-ил]-1-циклопропил-3,3-диметил-индолин-2-он
Получили по аналогии с примером 153 из 6-бром-1-циклопропил-3,3-диметил-индолин-2-она (пример 78а) и трет-бутил-[1-(1Н-имидазол-5-ил)этокси]-диметил-силана. Соединение, указанное в заголовке, было получено в виде светло-коричневого полутвердого вещества.
МС ИЭР (m/z): 426,6 [(М+Н)+]
c) 1-Циклопропил-6-[4-(1-гидроксиэтил)имидазол-1-ил]-3,3-диметил-индолин-2-он
К раствору 6-[4-[1-[трет-бутил(диметил)силил]оксиэтил]имидазол-1-ил]-1-циклопропил-3,3-диметил-индолин-2-она (0,09 г, 0,212 ммоль) в метаноле (8 мл) добавляли 12 М водный раствор HCl (0,5 мл) при 0°С, и смесь перемешивали при 25°С в течение 24 часов. Реакционную смесь концентрировали в вакууме. Остаток разбавляли дихлорметаном и промывали 10% водным раствором бикарбоната натрия. Органические слои высушивали сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя гексан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде беловатого полутвердого вещества (40 мг).
МС ИЭР (m/z): 312,2 [(М+Н)+]
Пример 170
1-Циклопропил-3,3-диметил-6-[4-(2,2,2-трифтор-1-гидрокси-этил)имидазол-1-ил]индолин-2-он

Получили по аналогии с примером 169b-с, используя трет-бутил-диметил-[2,2,2-трифтор-1-(1Н-имидазол-5-ил)этокси]силан (пример 168b). Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества.
МС ИЭР (m/z): 366,0 [(М+Н)+]
Пример 171
6-[4-(1-Гидроксиэтил)имидазол-1-ил]-1,3,3-триметил-индолин-2-он

Получили по аналогии с примером 169 из 6-бром-1,3,3-триметилиндолин-2-она (пример 1а). Соединение, указанное в заголовке, было получено в виде беловатого твердого вещества.
МС ИЭР (m/z): 286,2 [(М+Н)+]
Пример 172
6-[4-(1-Гидроксиэтил)имидазол-1-ил]-3,3-диметил-индолин-2-он

a) 6-[4-[1-[трет-Бутил(диметил)силил]оксиэтил]имидазол-1-ил]-3,3-диметил-1-(2-триметилсилилэтоксиметил)индолин-2-он
Получили по аналогии с примером 153 из 6-бром-3,3-диметил-1-(2-триметилсилилэтоксиметил)индолин-2-она (пример 162а) и трет-бутил-[1-(1Н-имидазол-5-ил)этокси]-диметил-силана (пример 169а). Соединение, указанное в заголовке, было получено в виде желтого липкого твердого вещества.
МС ИЭР (m/z): 516,1 [(М+Н)+]
b) 6-[4-(1-Гидроксиэтил)имидазол-1-ил]-3,3-диметил-индолин-2-он Получили по аналогии с примером 162с из 6-[4-[1-[трет-бутил(диметил)силил]оксиэтил]имидазол-1-ил]-3,3-диметил-1-(2-триметилсилилэтоксиметил)индолин-2-она. Соединение, указанное в заголовке, было получено в виде светло-желтого твердого вещества.
МС ИЭР (m/z): 272,0 [(М+Н)+]
Пример 173
1-(2,3-Дигидроксипропил)-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он

а) 1-Аллил-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он
Получили по аналогии с примером 126 из 3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-она (пример 21), используя аллилбромид. Соединение, указанное в заголовке, было получено в виде бесцветного вязкого масла.
МС ИЭР (m/z): 294,1 [(М+Н)+]
b) 1-(2,3-Дигидроксипропил)-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он
В трубке под давлением 1-аллил-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он (110 мг, 375 мкмоль), моногидрат н-оксида 4-метилморфолина (76,0 мг, 562 мкмоль) и тетроксид осмия (596 мг, 596 мкл, 93,7 мкмоль) объединяли с ТГФ (2 мл) и t-BuOH (200 мкл). Трубку запаивали, и реакционную смесь перемешивали при 60°С в течение 6 часов. Реакционную смесь наливали в насыщенный водный раствор сульфита натрия и экстрагировали этилацетатом. Органические слои промывали насыщенным водным раствором сульфита натрия, высушивали сульфатом натрия, фильтровали, и полученный раствор концентрировали в вакууме. Неочищенное вещество очищали хроматографией на аминном силикагеле, используя дихлорметан/метанол в качестве элюента. Соединение, указанное в заголовке, было получено в виде белой пены (94 мг).
МС ИЭР (m/z): 328,2 [(М+Н)+]
Пример 174
1-((4S,5R)-4-Гидрокси-5-(гидроксиметил)тетрагидрофуран-2-ил)-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он

а) (2R,3S)-5-(3,3-Диметил-6-(2-метилпиримидин-5-ил)-2-оксоиндолин-1-ил)-2-((4-метилбензоилокси)метил)тетрагидрофуран-3-ил-4-метилбензоат
К суспензии 3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-она (пример 21, 0,1 г, 395 мкмоль) в ацетонитриле (10,5 мл) в атмосфере аргона добавляли NaH на минеральном масле (60%, 19,7 мг, 493 мкмоль), и реакционную смесь перемешивали в течение 1 часа при комнатной температуре. Затем добавляли суспензию 3,5-ди-орто-(пара-толуил)-2-деокси-d-рибофуранозилхлорида (256 мг, 592 мкмоль) в безводном ТГФ (2,63 мл), и перемешивание при комнатной температуре продолжали в течение 16 часов. Затем к реакционной смеси добавляли 2 столовые ложки силикагеля, и суспензию концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Соединение, указанное в заголовке, было получено в виде желтого аморфного твердого вещества (132 мг).
МС ИЭР (m/z): 606,3 [(М+Н)+]
b) 1-((4S,5R)-4-Гидрокси-5-(гидроксиметил)тетрагидрофуран-2-ил)-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он
К (2R,3S)-5-(3,3-диметил-6-(2-метилпиримидин-5-ил)-2-оксоиндолин-1-ил)-2-((4-метилбензоилокси)метил)тетрагидрофуран-3-ил-4-метилбензоату (0,13 г, 215 мкмоль) добавляли 7 М аммиак в метаноле (1,3 мл, 9,1 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 19 часов. Снова добавляли 7 М аммиак в метаноле (1,3 мл, 9,1 ммоль), и перемешивание при комнатной температуре продолжали еще в течение 22 часов. Затем реакционную смесь нагревали до 40°С в течение 3 часов, а затем до 50°С в течение 3 часов. Затем нагревание удаляли, и реакционную смесь перемешивали при комнатной температуре в течение 72 часов. Реакционную смесь концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя дихлорметан/метанол в качестве элюента. Соединение, указанное в заголовке, было получено в виде белой пены, представляющей собой смесь α- и β-формы 2:1.
МС ИЭР (m/z): 370,2 [(М+Н)+]
Пример 175
1-(2,3-Диметоксипропил)-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-он

К смеси 1-(2,3-дигидроксипропил)-3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-она (пример 173, 72 мг, 220 мкмоль) в ДМФ (2,5 мл) добавляли NaH (60% на минеральном масле, 19,4 мг, 484 мкмоль), и смесь перемешивали в течение 15 минут при комнатной температуре. Затем добавляли MeI (78,0 мг, 34,4 мкл, 550 мкмоль), и перемешивание при комнатной температуре продолжали в течение 16 часов. Затем снова добавляли NaH (60% на минеральном масле, 19,4 мг, 484 мкмоль) и MeI (78,0 мг, 34,4 мкл, 550 мкмоль), и перемешивание продолжали в течение 1,5 часов. Реакционную смесь гасили водой, экстрагировали этилацетатом, и органические слои промывали водой. Объединенные органические слои высушивали сульфатом натрия, фильтровали, и полученный раствор концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле, используя дихлорметан/метанол в качестве элюента. Соединение, указанное в заголовке, было получено в виде светло-желтого вязкого масла (52 мг).
МС ИЭР (m/z): 356,2 [(М+Н)+]
Пример 176
3,3-Диметил-6-(2-метилпиримидин-5-ил)-1-(тетрагидрофуран-3-ил)индолин-2-он

Суспензию 3,3-диметил-6-(2-метилпиримидин-5-ил)индолин-2-она (пример 21, 50 мг, 197 мкмоль), 3-хлортетрагидрофурана (42,1 мг, 37,1 мкл, 395 мкмоль) и карбоната цезия (129 мг, 395 мкмоль) в ДМФ (800 мкл) перемешивали при комнатной температуре в течение 64 часов. Затем реакционную смесь охлаждали до 0°С и добавляли NaH (60% на минеральном масле, 9,47 мг, 237 мкмоль), охлаждающую баню удаляли и перемешивали в течение 10 минут. Затем при комнатной температуре снова добавляли 3-хлортетрагидрофуран (42,1 мг, 37,1 мкл, 395 мкмоль), и перемешивание продолжали в течение 2 часов. Затем реакционную смесь нагревали до 85°С и перемешивали при этой температуре в течение 16 часов. Снова добавляли NaH (60% на минеральном масле, 9,47 мг, 237 мкмоль) и 3-хлортетрагидрофуран (42,1 мг, 37,1 мкл, 395 мкмоль), и перемешивание при 85°С продолжали в течение 24 часов. Снова добавляли NaH (60% на минеральном масле, 9,47 мг, 237 мкмоль) и 3-хлортетрагидрофуран (42,1 мг, 37,1 мкл, 395 мкмоль), и перемешивание продолжали в течение 24 часов. Реакционную смесь непосредственно очищали хроматографией на силикагеле, используя гептан/этилацетат в качестве элюента. Полученное вещество дополнительно очищали препаративной обращенно-фазовой ВЭЖХ на колонке Phenomenex Gemini NX 5 мкл С18 110A, используя смесь ацетонитрил/вода/муравьиная кислота в качестве элюента. Соединение, указанное в заголовке, было получено в виде белого твердого вещества (22 мг).
МС ИЭР (m/z): 324,2 [(М+Н)+]
Биологические анализы и данные
Теперь обнаружено, что соединения формулы I можно применять для лечения заболеваний ЦНС.
Описанные соединения формулы I уменьшают гиперлокомоцию, индуцированную L-687414. Эту гиперлокомоцию оценивали путем использования компьютеризированной системы мониторинга активности животных Digiscan 16 (Omnitech Electronics, г. Колумбус, штат Огайо) для количественного определения локомоторной активности. Животных держали при 12-часовом цикле света/темноты, и эксперименты проводили в течение светлого периода. Каждая камера мониторинга активности состояла из плексигласового ящика (41×41×28 см; ширина × длина × высота) с подстилкой из древесных опилок на полу, окруженного невидимыми горизонтальными и вертикальными датчиками инфракрасных лучей. Испытательные ящики были разделены плексигласовой перегородкой, предоставляющей каждой мыши пространство для перемещения 20×20 см. Клетки соединяли с анализатором Digiscan, соединенным с компьютером, который непрерывно собирал информацию о положении лучей. Регистрацию прерываний лучей фотоэлементом для индивидуальных животных проводили каждые 5 минут на протяжении всего экспериментального сеанса, и суммирование первых 6 периодов использовали в качестве конечного параметра. Соединения вводили либо перорально (р.о.) за 15 минут до подкожной (s.c.) инъекции 50 мг/kg L-687414, либо интраперитонеально (i.p.) одновременно с s.c. инъекцией 50 мг/kg L-687414. Затем мышей переносили из их домашней клетки в регистрирующие камеры в течение 15-минутной фазы привыкания, давая возможность свободного обследования нового окружения. Затем горизонтальную активность регистрировали в течение 30-минутного периода времени. % Ингибирования гиперлокомоции, индуцированной L-687414, вычисляли согласно уравнению:
((Горизонтальная активность носитель+L-687414 - горизонтальная активность лекарственное средство+L-687414)/Горизонтальная активность носитель+L-687414) х 100
Значения ID50, определенные как дозы каждого соединения, приводящие к 50% ингибированию гиперлокомоции, индуцированной L-687414, вычисляли с помощью анализа линейной регрессии данных доза-ответ, используя компьютерную программу, совместимую с Excel.
Поскольку данные не были предрасположены к нормальному распределению, группы, обработанные тестируемыми соединениями, статистически сравнивали с контрольной (обработанной носителем) группой, используя односторонние U-критерии Манна-Уитни. В статистике U-критерий Манна-Уитни (также называемый критерием Манна-Уитни-Уилкоксона (MWW) или критерием суммы рангов Уилкоксона) представляет собой непараметрический критерий статистической гипотезы для оценки, склонен ли один из двух образцов независимых наблюдений иметь большие значения, чем другой. Этот критерий является одним из самых широко известных непараметрических критериев значимости. Значение р дает вероятность, что две группы статистически достоверно отличаются друг от друга, и значение менее 0,05 является общепринятым в качестве критерия, он подразумевает, что существует более 95% вероятности, что две группы действительно отличаются друг от друга. Значения р, приведенные в таблице 1, являются односторонними, поскольку ожидаются и проверяются только уменьшения локомоции (Mann, Н. В., Whitney, D. R. (1947), "On a Test of Whether one of Two Random Variables is Stochastically Larger than the Other", Annals of Mathematical Statistics, 18 (1), 50-60).



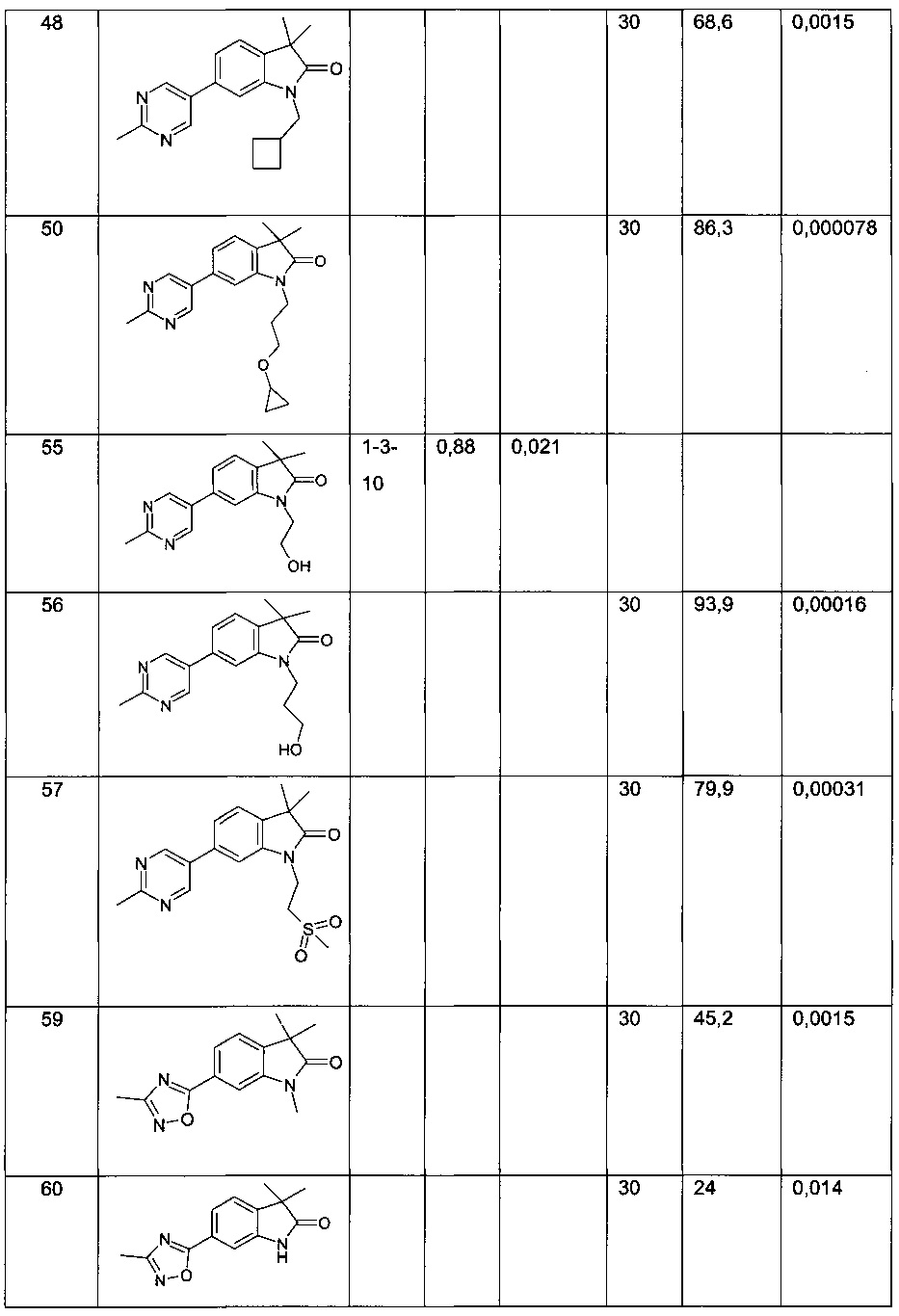




Как упомянуто выше, некоторые соединения протестированы в SmartCube®, аналитической системе, разработанной компанией PsychoGenics Inc.
SmartCube® использовали для сравнения бихевиориальной сигнатуры тестируемого соединения с базой данных бихевиориальных сигнатур, полученных для большой серии клинически одобренных референсных лекарственных средств, сгруппированных по показаниям. Таким образом, нейрофармакологические действия тестируемого соединения можно прогнозировать на основании подобия основным классам соединений, таким как антипсихотические средства, анксиолитические средства и антидепрессанты. Данный метод идеально подходит для скрининга коллекций существующих лекарственных средств или лекарственных средств-кандидатов с ранее неизвестной нейрофармакологией, которые могли бы ускорить разработку новых и неожиданных видов терапии психиатрических расстройств.
Некоторые соединения по настоящему изобретению инъецировали i.p. в различных дозах за 15 минут до теста. По меньшей мере 8 мышей использовали в каждой группе обработки. Цифровые видеосъемки субъектов обрабатывали с помощью алгоритмов компьютерного анализа визуальных изображений с извлечением более 2000 независимых измерений, включающих частоту и продолжительность многих различных бихевиориальных статусов. Результаты этих классификаций представлены в виде столбчатых диаграмм для каждого соединения и каждой дозы (мг/кг), где на оси Y указаны относительные вероятности того, что тестируемое соединение проявит эффективность при конкретном показании ЦНС.
Столбчатые диаграммы примеров соединений 13, 54, 58 и 71 при дозе 25 мг/кг показаны на фиг. 1. На фиг. 2 для сравнения приведены бихевиориальные сигнатуры атипичных антипсихотических средств оланзапина и рисперидона. Соединения по настоящему изобретению проявляют сигнатуры, подобные большинству атипичных антипсихотических средств. Независимый анализ проводили на неклассифицированных данных для определения подобия соединений примеров активным дозам известных атипичных антипсихотических средств. Для этого анализа авторы изобретения используют коэффициент дискриминации как меру различимости между двумя лекарственными средствами, то есть "отличимость" одного лекарственного средства от другого. Коэффициент, равный 50% (или 0,5), соответствует нулевой различимости. Эмпирические данные показали, что пороговый коэффициент для надежного разделения находится выше 70%, то есть два лекарственных средства, показывающие коэффициент дискриминации 70% или ниже, считают подобными, тогда как коэффициент дискриминации выше 70% указывает на то, что два лекарственных средства не являются подобными. В приведенной ниже таблице представлен анализ подобия выбранных соединений по настоящему изобретению нескольким атипичным антипсихотическим средствам. В большинстве случаев соединения примеров проявляют подобие рисперидону, клозапину и оланзапину с коэффициентом дискриминации не более 0,70.

Таким образом, можно считать, что соединения обладают эффективностями, подобными известным атипичным антипсихотическим средствам.
Фиг. 1: Сигнатуры SmartCube® соединений 13, 54, 58 и 71 (при 25 мг/kg) - подобны сигнатурам атипичных антипсихотических средств.
Фиг. 2: Сигнатуры SmartCube® атипичных антипсихотических средств оланзапина и рисперидона (каждый при двух дозах).
Соединения формулы (I) и их фармацевтически приемлемые соли можно применять в качестве лекарственных средств, например, в форме фармацевтических препаратов. Фармацевтические препараты можно вводить перорально, например, в форме таблеток, таблеток с покрытием, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Тем не менее введение можно также выполнять ректально, например, в форме суппозиториев, или парентерально, например, в форме инъекционных растворов.
Соединения формулы (I) и их фармацевтически приемлемые соли можно обрабатывать с фармацевтически инертными, неорганическими или органическими носителями, предназначенными для получения фармацевтических препаратов. Лактозу, кукурузный крахмал или его производные, тальк, стеариновую кислоту или их соли и тому подобное можно использовать, например, в качестве таких носителей для таблеток, таблеток с покрытием, драже и твердых желатиновых капсул. Подходящими носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и тому подобное; в зависимости от природы активного вещества в случае мягких желатиновых капсул, тем не менее, носители обычно не требуются. Подходящими носителями для получения растворов и сиропов являются, например, вода, полиолы, сахароза, инвертный сахар, глюкоза и тому подобное. Адъюванты, такие как спирты, полиолы, глицерин, растительные масла и тому подобное, можно использовать для водных инъекционных растворов водорастворимых солей соединений формулы (I), но, как правило, в этом нет необходимости. Подходящими носителями для суппозиториев являются, например, натуральные или отвержденные масла, воски, жиры, полужидкие или жидкие полиолы и тому подобное.
Дополнительно фармацевтические препараты могут содержать консерванты, солюбилизаторы, стабилизаторы, увлажняющие агенты, эмульгаторы, подсластители, красящие вещества, корригенты, соли для изменения осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они могут также содержать другие терапевтически ценные вещества.
Как упомянуто выше, лекарственные средства, содержащие соединение формулы (I) или его фармацевтически приемлемые соли и терапевтически инертный эксципиент, также являются объектом настоящего изобретения, а также способ получения таких лекарственных средств, включающий приведение одного или более соединений формулы I или их фармацевтически приемлемых солей и, если желательно, одного или более других терапевтически ценных веществ в дозируемую форму галенова препарата вместе с одним или более терапевтически инертных носителей. Активные соединения можно также применять в форме их пролекарств.
Как дополнительно упомянуто выше, применение соединений формулы (I) для получения лекарственных средств, полезных при профилактике и/или лечении перечисленных выше заболеваний, также является объектом настоящего изобретения.
Дозировка может изменяться в широких пределах, и, конечно, ее следует регулировать по индивидуальным потребностям в каждом конкретном случае. Как правило, эффективная доза для перорального или парентерального введения составляет от 0,01 до 20 мг/кг/сутки, при этом доза 0,1-10 мг/кг/сутки предпочтительна для всех описанных показаний. Суточная доза для взрослого человека, весящего 70 кг, соответственно, находится в диапазоне от 0,7 до 1400 мг в сутки, предпочтительно от 7 до 700 мг в сутки.
Получение фармацевтических композиций, содержащих соединения по изобретению:
Таблетки следующей композиции готовят обычным способом:

Метод получения
1. Смешивают ингредиенты 1, 2, 3 и 4 и гранулируют с дистиллированной водой.
2. Высушивают гранулы при 50°С.
3. Пропускают гранулы через подходящее оборудование для измельчения.
4. Добавляют ингредиент 5 и смешивают в течение трех минут; прессуют на подходящем прессе.
Готовят капсулы следующей композиции:


Метод получения
1. Смешивают ингредиенты 1, 2 и 3 в подходящем смесителе в течение 30 минут.
2. Добавляют ингредиенты 4 и 5 и смешивают в течение 3 минут.
3. Заполняют в подходящую капсулу.
Соединение формулы I, лактозу и кукурузный крахмал сначала смешивают в смесителе, а затем в измельчающем аппарате. Смесь возвращают в смеситель; добавляют к ней тальк и тщательно смешивают. Смесь заполняют с помощью капсульной машины в подходящие капсулы, например, в твердые желатиновые капсулы.
Готовят инъекционные растворы следующей композиции:

Метод получения
Соединение формулы I растворяют в смеси полиэтиленгликоля 400 и воды для инъекций (части). Доводят рН до 5,0 уксусной кислотой. Объем доводят до 1,0 мл добавлением остального количества воды. Раствор фильтруют, заполняют во флаконы, используя подходящий допустимый избыток, и стерилизуют.
Реферат
Изобретение относится к 2-оксо-2,3-дигидроиндолам общей формулы (I), где Ar представляет собой 6-членную гетероарильную группу, содержащую один или два атома N, которая представляет собой группы пиридинил, пиримидинил, пиридазинил или пиразинил, или 5-членную гетероарильную группу, содержащую от 1 до 3 гетероатомов, выбранных из N, S или О, которая представляет собой имидазолил, 1,2,4-оксадиазолил, 1,3,4-оксадиазолил, изоксазолил, оксазолил, 1,3,4-тиадиазолил или пиразолил; Rпредставляет собой атом водорода, C-алкил, атом галогена, амино, диметиламино, циано, C-алкил, замещенный атомом галогена, C-алкил, замещенный гидрокси, CH(OH)CF, (СН)-C-алкокси, C-циклоалкил, необязательно замещенный CF, или гетероциклоалкил, выбранный из пирролидинила, морфолинила, пиперазинила, тетрагидропиран-4-ила и оксетанила, необязательно замещенный C-алкилом; Rпредставляет собой атом водорода, C-алкил, (СН)-C-циклоалкил, (СН)-O-C-циклоалкил, (СН)-C-алкокси, (СН)-C-алкокси, замещенный атомом галогена, (СН)-гетероциклоалкил, выбранный из тетрагидрофуран-3-ила, оксетанила, необязательно замещенного C-алкилом, и тетрагидрофуран-2-ила, замещенного гидроксигруппой и гидрокси-C-алкилом, (CH)-S(O)-C-циклоалкил, C-алкил, замещенный одной или двумя гидроксигруппами, C-алкил, замещенный одной или двумя C-алкокси, (СН)-S(О)-C-алкил, C-алкил, замещенный атомом галогена, или CHCH(OH)CF; Rпредставляет собой атом галогена или C-алкил; X представляет собой СН или N; Xпредставляет собой СН или N; n равно 1 или 2; о равно 0, 1, 2 или 3; m равно 0, 1 или 2; и пунктирная линия представляет собой связь или ее отсутствие; а также его фармацевтически приемлемые соли, стереоизомеры, энантиомеры или их рацемическая смесь. Соединения можно применять для лечения определенных расстройств центральной нервной системы, представляющих собой позитивные (психоз) и негативные симптомы шизофрении, злоупотребление психоактивными веществами, привыкание к алкоголю и к лекарственным средствам, обсессивно-компульсивные расстройства, когнитивное нарушение, биполярные расстройства, расстройства настроения, большую депрессию, депрессию, резистентную к лечению, тревожные расстройства, болезнь Альцгеймера, аутизм, болезнь Паркинсона, хроническую боль, пограничное личностное расстройство, нарушения сна, синдром хронической усталости, тугоподвижность, при противовоспалительных действиях при артрите и нарушениях равновесия. 4 н. и 19 з.п. ф-лы, 2 ил., 5 табл., 176 пр.
Формула


Документы, цитированные в отчёте о поиске
Агонисты мускариновых рецепторов, композиции, способы лечения ими и способы их изготовления

Комментарии