Ангиотензин в лечении состояний головного мозга - RU2661109C2
Код документа: RU2661109C2
Чертежи





















Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ПАТЕНТНЫЕ ЗАЯВКИ
[001] Настоящая заявка испрашивает приоритет согласно предварительной заявке на патент США №61/708793, поданной 2 октября 2012, предварительной заявке на патент США №61/720299, поданной 30 октября 2012, содержание которых полостью включено в настоящую заявку посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
[002] Правильное функционирование центральной нервной системы имеет ключевое значение для любого животного. Повреждение головного мозга, в частности, такое как при ишемическом или геморрагическом инсульте, может иметь критические и, возможно, смертельные последствия. Одним из препятствий для лечения или профилактики повреждений головного мозга является гематоэнцефалический барьер, который представляет собой совокупность плотных контактов между соседними эндотелиальными клетками капилляров головного мозга. Такие контакты предотвращают транспорт большинства веществ через гематоэнцефалический барьер, за исключением случаев, когда они являются очень липофильными или транспортируются специфичным образом. Вследствие этого чрезвычайно сложно вводить лекарственные средства с помощью обычно предпочтительных путей, таких как внутривенное или подкожное введение, и наблюдать терапевтический эффект в головном мозге.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[003] В настоящем изобретении предложены, помимо прочего, способы и композиции для лечения состояний головного мозга, включая, но не ограничиваясь ими: инсульт, сосудистую деменцию и черепно-мозговую травму. Как описано в разделе «Примеры» ниже, настоящее изобретение, в частности, основано на неожиданном обнаружении того факта, что системное введение, такое как подкожное введение, пептида ангиотензина (1-7) (например, PanCyte), приводит к улучшению неврологической и моторной функции в модели ишемического инсульта на крысах. До того как было сделано настоящее изобретение, считалось, что ангиотензин (1-7) не может пересекать гематоэнцефалический барьер и, следовательно, его необходимо вводить интрацеребровентрикулярным путем (ICV) или с использованием сложных методов, таких как инфицирование гемопоэтических стволовых клеток, которые способны пересекать гематоэнцефалический барьер, лентивирусом, который вызывает гиперэкспрессию Анг-(1-7). Месса et al., Cerebroprotection by Angiotensin-(1-7) in Endothelin-1-Induced Ischaemic Stroke, (2011) Exp Physiol. 2011 96(10):1084-1096. Никто не показал, что введение пептида ангиотензина (1-7) или непептидного агониста ангиотензина (1-7) с использованием системного (например, подкожного или внутривенного) пути введения может привести к получению терапевтических уровней, которые достигают головного мозга, и, в частности, поврежденной ткани головного мозга.
[004] Согласно некоторым вариантам реализации настоящего изобретения предложены способы лечения состояния головного мозга, включающие введение субъекту, который страдает или восприимчив к такому состоянию головного мозга, пептида ангиотензина (1-7) путем системного введения. В некоторых вариантах реализации настоящего изобретения указанное системное введение, пригодное для настоящего изобретения, представляет собой внутривенное введение. В некоторых вариантах реализации настоящего изобретения указанное системное введение, пригодное для настоящего изобретения, представляет собой подкожное введение. В некоторых вариантах реализации настоящего изобретения указанное системное введение, пригодное для настоящего изобретения, представляет собой пероральное введение. В некоторых вариантах реализации настоящего изобретения указанное системное введение, пригодное для настоящего изобретения, не включает интрацеребровентрикулярное введение. Согласно некоторым вариантам реализации настоящего изобретения состояние головного мозга выбрано из инсульта, сосудистой деменции и травматического повреждения мозга. Согласно некоторым вариантам реализации настоящего изобретения указанный инсульт представляет собой ишемический инсульт. Согласно некоторым вариантам реализации настоящего изобретения указанный инсульт представляет собой геморрагический инсульт.
[005] Согласно некоторым вариантам реализации настоящего изобретения пептид ангиотензина (1-7) вводят посредством непрерывной инфузии. Согласно некоторым вариантам реализации настоящего изобретения пептид ангиотензина (1-7) вводят с каким-либо интервалом введения. Например, пептид ангиотензина (1-7) может быть введен три раза в сутки, два раза в сутки, один раз в сутки, два раза в неделю, один раз в неделю, три раза в месяц, два раза в месяц, один раз в две недели, один раз в три недели, один раз в четыре недели, один раз в месяц, один раз в два месяца, один раз в три месяца, один раз в четыре месяца, один раз в пять месяцев, один раз в шесть месяцев, с нерегулярным интервалом.
[006] Согласно настоящему изобретению подразумевается, что в различных вариантах реализации изобретения могут быть использованы различные количества пептида ангиотензина (1-7). Согласно некоторым вариантам реализации настоящего изобретения пептид ангиотензина (1-7) вводят в эффективной дозе, находящейся в пределах от приблизительно 1 до 1000 мкг/кг/сутки (например, находящейся в диапазоне приблизительно 1-900 мкг/кг/сутки, 1-800 мкг/кг/сутки, 1-700 мкг/кг/сутки, 1-600 мкг/кг/сутки, 1-500 мкг/кг/сутки, 1-400 мкг/кг/сутки, 1-300 мкг/кг/сутки, 1-200 мкг/кг/сутки, 1-100 мкг/кг/сутки, 1-90 мкг/кг/сутки, 1-80 мкг/кг/сутки, 1-70 мкг/кг/сутки, 1-60 мкг/кг/сутки, 1-50 мкг/кг/сутки, 1-40 мкг/кг/сутки, 1-30 мкг/кг/сутки, 1-20 мкг/кг/сутки, 1-10 мкг/кг/сутки). Согласно некоторым вариантам реализации настоящего изобретения пептид ангиотензина (1-7) вводят в эффективной дозе, находящейся в пределах от приблизительно 1 до 500 мкг/кг/сутки. Согласно некоторым вариантам реализации настоящего изобретения пептид ангиотензина (1-7) вводят в эффективной дозе, находящейся в пределах от приблизительно 1 до 100 мкг/кг/сутки. Согласно некоторым вариантам реализации настоящего изобретения пептид ангиотензина (1-7) вводят в эффективной дозе, находящейся в пределах от приблизительно 1 до 60 мкг/кг/сутки. Согласно некоторым вариантам реализации настоящего изобретения пептид ангиотензина (1-7) вводят в эффективной дозе, выбранной из приблизительно 1, 2, 4, 6, 8, 10, 15, 20, 25, 30, 35, 40, 45, 50, 75, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950 или 1000 мкг/кг/сутки.
[007] Также предусмотрено, что в различных вариантах реализации могут применяться различные пептиды ангиотензина (1-7). Согласно некоторым вариантам реализации настоящего изобретения пептид ангиотензина (1-7) содержит природную аминокислотную последовательность ангиотензина (1-7): Aspl-Arg2-Val3-Tyr4-Ile5-His6-Pro7 (SEQ ID NO: 1).
[008] Согласно некоторым вариантам реализации пептид ангиотензина (1-7) представляет собой функциональный эквивалент SEQ ID NO: 1. Согласно некоторым вариантам реализации указанный функциональный эквивалент представляет собой линейный пептид. Согласно некоторым вариантам реализации указанный линейный пептид содержит последовательность, которая содержит по меньшей мере четыре, по меньшей мере пять, или по меньшей мере шесть аминокислот из семи аминокислот, которые присутствуют в природном ангиотензине (1-7), причем по меньшей мере четыре, пять или шесть аминокислот сохраняют свои относительные положения, в которых они присутствуют в природном ангиотензине (1-7). Согласно некоторым вариантам реализации линейный пептид содержит 4-25 аминокислот. Согласно некоторым вариантам реализации линейный пептид представляет собой фрагмент природного ангиотензина (1-7). Согласно некоторым вариантам реализации линейный пептид содержит аминокислотные замены, удаления и/или вставки в последовательности природного ангиотензина (1-7). Согласно некоторым вариантам реализации линейный пептид имеет аминокислотную последовательность Asp1-Arg2-Val3-Ser4-Ile5-His6-Cys7 (SEQ ID NO: 6).
[009] Согласно некоторым вариантам реализации функциональный эквивалент представляет собой циклический пептид. Согласно некоторым вариантам реализации циклический пептид содержит связи между аминокислотами. Согласно некоторым вариантам реализации связи расположены в остатках, соответствующих положениям Tyr4 и Pro7 в природном ангиотензине (1-7). Согласно некоторым вариантам реализации связь представляет собой тиоэфирный мостик. Согласно некоторым вариантам реализации циклический пептид содержит аминокислотную последовательность, которая в остальном идентична природной аминокислотной последовательности ангиотензина (1-7): Asp1-Arg2-Val3-Tyr4-Ile5-His6-Pro7 (SEQ ID NO: 1). Согласно некоторым вариантам реализации циклический пептид содержит норлейцин (Nle), замещающий положение Val3 в природном ангиотензине (1-7). Согласно некоторым вариантам реализации циклический пептид представляет собой 4,7-циклизованный ангиотензин (1-7), имеющий следующую формулу Asp1-Arg2-Val3-Ser4-Ile5-His6-Cys7 (SEQ ID NO: 22). Согласно некоторым вариантам реализации циклический пептид представляет собой 4,7-циклизованный ангиотензин (1-7), имеющий следующую формулу:

[0010] Согласно некоторым вариантам реализации пептид ангиотензина (1-7) содержит одну или более химических модификаций для повышения устойчивости к действию протеаз, стабильности в сыворотке крови и/или биодоступности. Согласно некоторым вариантам реализации одна или более химических модификаций включают пегилирование.
[0011] Согласно некоторым вариантам реализации в настоящем изобретении предложены способы лечения состояний головного мозга, включая, но не ограничиваясь ими, инсульт, сосудистую деменцию и черепно-мозговую травму, включающие введение субъекту, который страдает или восприимчив к одному или большему числу состояний головного мозга, агониста рецептора ангиотензина (1-7). Согласно некоторым вариантам реализации агонист рецептора ангиотензина (1-7) представляет собой непептидный агонист. Согласно некоторым вариантам реализации непептидный агонист представляет собой соединение со следующей структурой:

[0012] или его фармацевтически приемлемую соль.
[0013] В настоящей заявке термины «примерно» и «приблизительно» используются как эквивалентные. Любые числа, используемые в настоящей заявке с или без примерно/приблизительно, подразумевают включение любых нормальных колебаний, определенных специалистом в данной области техники.
[0014] Другие признаки, задачи и преимущества настоящего изобретения очевидны на основании подробного описания, приведенного ниже. Следует понимать, однако, что подробное описание, несмотря на то, что в нем описаны варианты реализации настоящего изобретения, приведено только в качестве иллюстрации и не ограничивает объем настоящего изобретения. Различные изменения и модификации в пределах объема настоящего изобретения будут очевидны для специалистов в данной области техники на основании подробного описания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0015] На ФИГ. 1 показан пример столбчатой диаграммы сравнения результатов шагового теста у крыс с кратковременной окклюзией средней мозговой артерии, которые также получали некоторое количество PanCyte в течение 14 или 49 дней.
[0016] На ФИГ. 2 показан пример столбчатой диаграммы сравнения результатов испытания реакции передних конечностей на стимуляцию у крыс с кратковременной окклюзией средней мозговой артерии, которые также получали некоторое количество PanCyte в течение 14 или 49 дней.
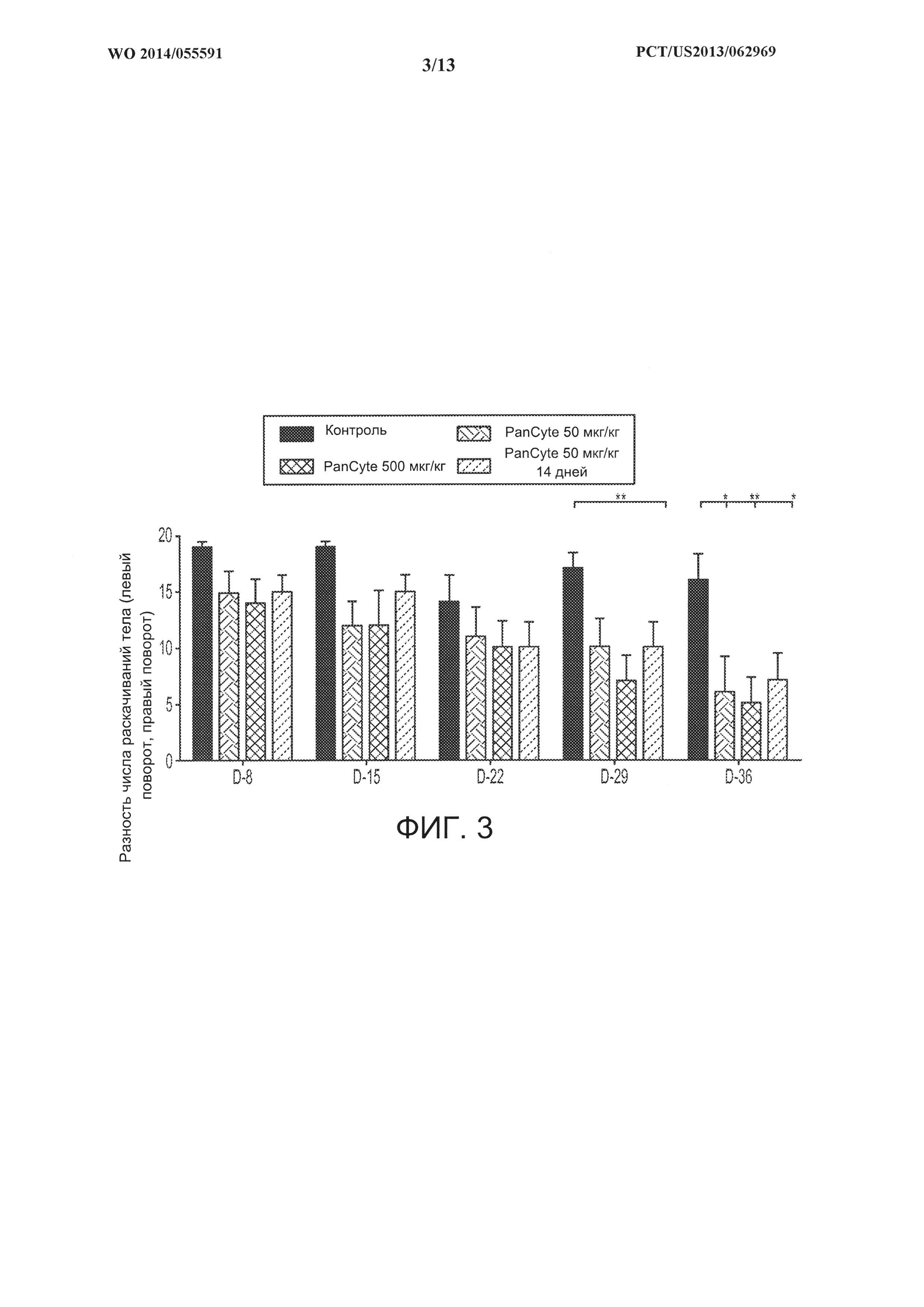
[0017] На ФИГ. 3 показан пример столбчатой диаграммы сравнения результатов испытания с раскачиванием тела у крыс с кратковременной окклюзией средней мозговой артерии, которые также получали некоторое количество PanCyte в течение 14 или 49 дней.
[0018] На ФИГ. 4 показан пример столбчатой диаграммы сравнения результатов неврологического исследования (модифицированная оценочная шкала Neuroscore) у крыс с кратковременной окклюзией средней мозговой артерии, которые также получали некоторое количество PanCyte в течение 14 или 49 дней.
[0019] На ФИГ. 5 показан пример столбчатой диаграммы сравнения результатов шагового теста у крыс с кратковременной окклюзией средней мозговой артерии и которые также получали ТХА127, PanCyte или линейный PanCyte подкожно в течение 28 дней.
[0020] На ФИГ. 6 показан пример столбчатой диаграммы сравнения результатов испытания реакции передних конечностей на стимуляцию у крыс с кратковременной окклюзией средней мозговой артерии, которые также получали ТХА127, PanCyte или линейный PanCyte подкожно в течение 28 дней.
[0021] На ФИГ. 7 показан пример столбчатой диаграммы сравнения результатов испытания с раскачиванием тела у крыс с кратковременной окклюзией средней мозговой артерии, которые также получали ТХА127, PanCyte или линейный PanCyte подкожно в течение 28 дней.
[0022] На ФИГ. 8 показан пример столбчатой диаграммы сравнения результатов неврологического исследования (модифицированная оценочная шкала Neuroscore) у крыс с кратковременной окклюзией средней мозговой артерии, которые также получали ТХА127, PanCyte или линейный PanCyte подкожно в течение 28 дней.
[0023] На ФИГ. 9 показан пример столбчатой диаграммы, в котором приведены результаты сравнения показателей перфузии крови между ипсилатеральной и контралатеральной сторонами, а также диаметра кровеносных сосудов у животных, которым вводили ТХА127, PanCyte или линейный PanCyte путем подкожных инъекций в течение 28 дней.
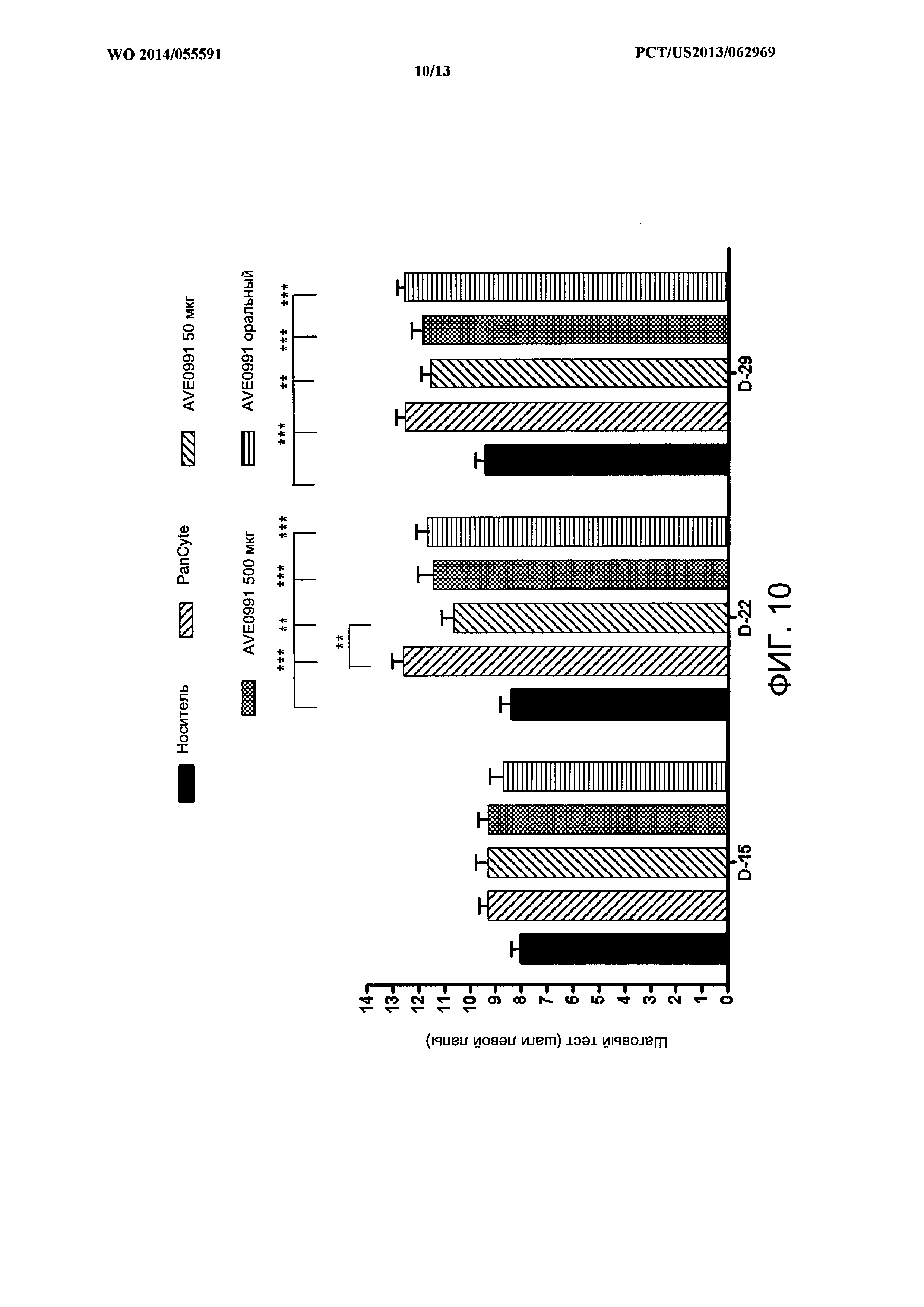
[0024] На ФИГ. 10 показан пример столбчатой диаграммы сравнения результатов шагового теста у крыс с кратковременной окклюзией средней мозговой артерии, которые также получали PanCyte или AVE0991 подкожно в течение 28 дней.
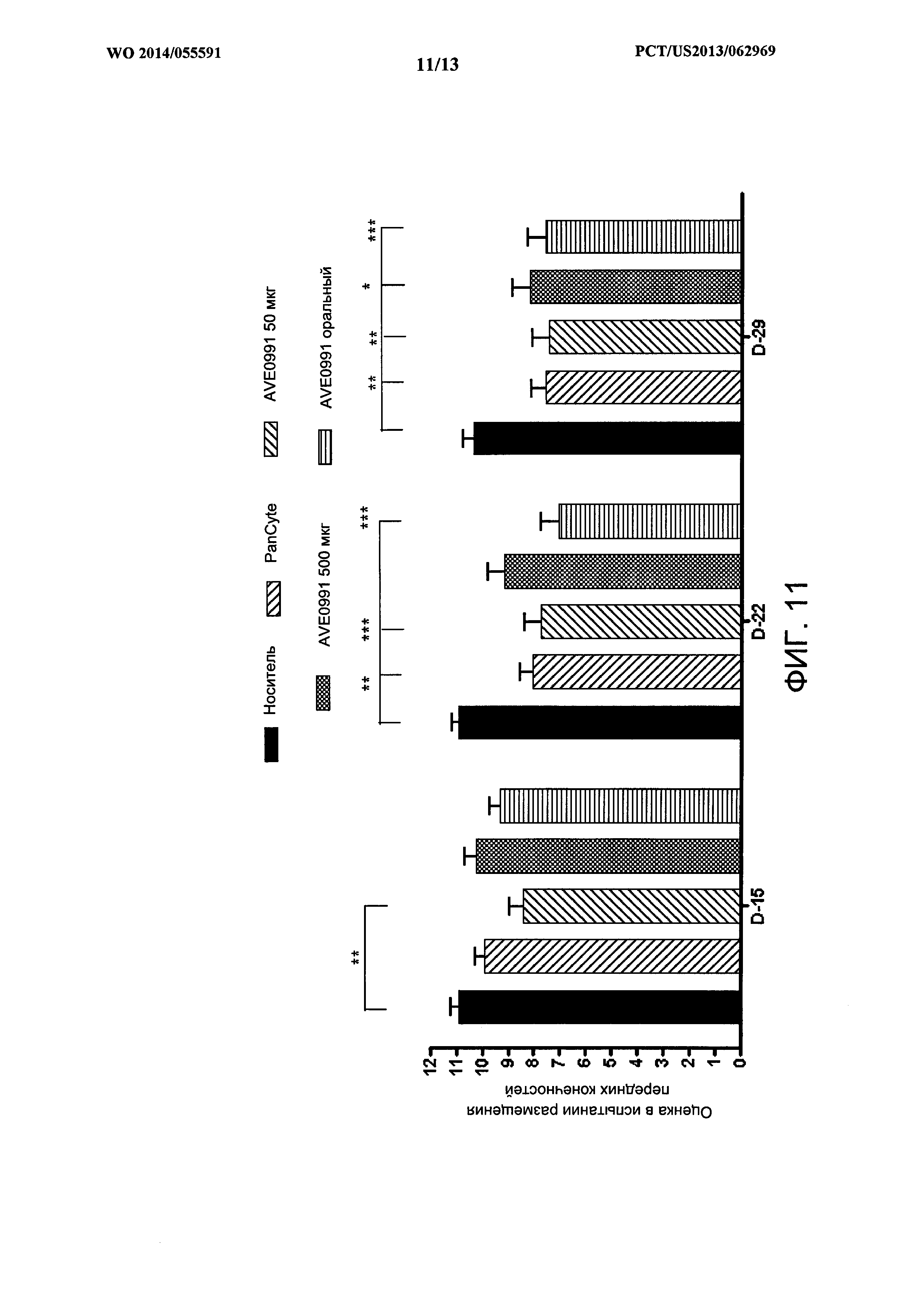
[0025] На ФИГ. 11 показан пример столбчатой диаграммы сравнения результатов испытания реакции передних конечностей на стимуляцию у крыс с кратковременной окклюзией средней мозговой артерии, которые также получали PanCyte или AVE0991 подкожно в течение 28 дней.
[0026] На ФИГ. 12 показан пример столбчатой диаграммы сравнения результатов испытания с раскачиванием тела у крыс с кратковременной окклюзией средней мозговой артерии, которые также получали PanCyte или AVE0991 подкожно в течение 28 дней.
[0027] На ФИГ. 13 показан пример столбчатой диаграммы сравнения результатов неврологического исследования (модифицированная оценочная шкала Neuroscore) у крыс с кратковременной окклюзией средней мозговой артерии, которые также получали PanCyte или AVE0991 подкожно в течение 28 дней.
ОПРЕДЕЛЕНИЯ
[0028] Для более ясного понимания настоящего изобретения некоторые термины сначала будут определены ниже. Дополнительные определения для нижеследующих терминов и других терминов приведены по тексту настоящего описания.
[0029] Животные: В настоящей заявке термин «животное» относится к любому члену царства животных. Согласно некоторым вариантам реализации «животное» относится к человеку, на любой стадии развития. Согласно некоторым вариантам реализации «животное» относится к животным, не относящимся к человеку, на любой стадии развития. Согласно некоторым вариантам реализации животное, не относящееся к человеку, является млекопитающим (например, грызун, мышь, крыса, кролик, обезьяна, собака, кошка, овца, крупный рогатый скот, примат и/или свинья). Согласно некоторым вариантам реализации животные включают, но не ограничиваются следующими: млекопитающих, птиц, рептилий, амфибий, рыб, насекомых и/или червей. Согласно некоторым вариантам реализации животное может быть трансгенным животным, модифицированным животным и/или клоном.
[0030] Приблизительно или примерно: В настоящей заявке термин «примерно» или «приблизительно», применительно к одному или большему числу значений, представляющих интерес, относится к значению, которое аналогично приведенному ориентировочному значению. Согласно некоторым вариантам реализации термин «примерно» или «приблизительно» относится к диапазону значений, которые находятся в пределах 25%, 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1% или менее в любом направлении (более чем или менее чем) относительно приведенного ориентировочного значения, если не указано иное или иное не очевидно из контекста (кроме случаев, когда такое число превышало 100% от возможного значения).
[0031] Биологически активный: В настоящей заявке выражение «биологически активный» относится к характеристике любого агента, который обладает активностью в биологической системе, и, в частности, в организме. Например, агент, который, при введении в организм, оказывает биологическое воздействие на организм, рассматривается как биологически активный. В конкретных вариантах реализации, в том случае, если пептид является биологически активным, часть этого пептида, которая также обладает по меньшей мере одним видом биологической активности указанного пептида, как правило, называется «биологически активной» частью. Согласно некоторым вариантам реализации пептид, который не имеет природной биологической активности, но который ингибирует действие одного или более природных соединений ангиотензина, считается биологически активным.
[0032] Состояние головного мозга - в настоящей заявке «состояние головного мозга» представляет собой любое состояние, расстройство или явление, которое приводит к повреждению и/или дисфункции по меньшей мере части головного мозга субъекта. Неограничивающие примеры состояний головного мозга включают: инсульт (оба типа, ишемический и геморрагический), сосудистую деменцию и черепно-мозговую травму.
[0033] Носитель или разбавитель: В настоящей заявке термины «носитель» и «разбавитель» относятся к фармацевтически приемлемому (например, безопасному и нетоксичному для введения человеку) носителю или разбавляющему веществу, пригодному для получения фармацевтического состава. Примеры разбавителей включают стерильную воду, бактериостатическую воду для инъекций (BWFI), раствор с фиксированным значением рН (например, забуференный фосфатом физиологический раствор), стерильный физиологический раствор, раствор Рингера или раствор декстрозы.
[0034] Лекарственная форма: В настоящей заявке термины «лекарственная форма» и «стандартная лекарственная форма» относятся к физически дискретной единице терапевтического агента для пациента, подлежащего лечению. Каждая единица содержит заранее определенное количество активного материала, рассчитанное для получения желаемого терапевтического эффекта. Следует понимать, однако, что общая доза композиции будет определяться лечащим врачом на основании обоснованного медицинского заключения.
[0035] Схема дозирования: в настоящей заявке «схема дозирования» (или «терапевтическая схема») представляет собой множество отдельных доз (обычно более одной), которые вводят по отдельности субъекту, обычно, с некоторыми временными интервалами между введениями. Согласно некоторым вариантам реализации данный терапевтический агент имеет рекомендованную схему дозирования, которая может включать одну или более доз. Согласно некоторым вариантам реализации схема дозирования включает множество доз, введение каждой из которых разделено одинаковым периодом времени; согласно некоторым вариантам реализации схема дозирования включает множество доз и по меньшей мере два разных периода времени, разделяющих введение отдельных доз. Согласно некоторым вариантам реализации терапевтический агент вводят непрерывно в течение заранее определенного периода времени. Согласно некоторым вариантам реализации терапевтический агент вводят один раз в сутки (QD) или два раза в сутки (BID).
[0036] Функциональный эквивалент или производное: В настоящей заявке термин «функциональный эквивалент» или «функциональное производное» обозначает, применительно к функциональному производному аминокислотной последовательности, молекулу, сохраняющую биологическую активность (функциональную или структурную), которая по существу аналогична активности для исходной последовательности. Функциональное производное или эквивалент может представлять собой природное производное или может быть получено синтетическим способом. Примеры функциональных производных включают аминокислотные последовательности, имеющие замены, удаления или добавления одного или более аминокислотных остатков при условии, что биологическая активность белка сохраняется. Замещающие аминокислоты предпочтительно имеют физико-химические свойства, которые аналогичны свойствам замещенной аминокислоты. В предпочтительном варианте аналогичные физико-химические свойства включают близость по величине заряда, объему молекулы, гидрофобности, гидрофильное™ и тому подобное.
[0037] Улучшать, увеличивать или снижать: в настоящей заявке термины «улучшать», «увеличивать» или «снижать», или их грамматические эквиваленты, указывают значения, которые являются относительными по сравнению с исходным уровнем, таким как значение, измеренное у того же индивидуума перед началом лечения, описанного в настоящей заявке, или значение, измеренное у контрольного субъекта (или нескольких контрольных субъектов) в отсутствие лечения, описанного в настоящей заявке. «Контрольный субъект» представляет собой субъекта, пораженного той же формой заболевания, что и субъект, которого лечат, который имеет приблизительно тот же возраст, что и субъект, подлежащий лечению.
[0038] Условия in vitro: в настоящей заявке термин «in vitro» обозначает события, которые происходят в искусственном микроокружении, например, в пробирке или реакционном сосуде, в клеточной культуре и т.д., а не в многоклеточном организме.
[0039] Условия in vivo: в настоящей заявке термин «w vivo» обозначает события, которые происходят в многоклеточном организме, таком как человек и животное, не являющегося человеком. Применительно к клеточным системам термин может быть использован для обозначения событий, которые происходят в живой клетке (в отличие от, например, систем in vitro).
[0040] Выделенный: в настоящей заявке термин «выделенный» относится к веществу и/или фрагменту, который был (1) отделен по меньшей мере от некоторых из компонентов, с которыми он был связан при первоначальном образовании (независимо от того, происходило это в природных и/или экспериментальных условиях), и/или (2), полученному, приготовленному и/или изготовленному вручную. Выделенные вещества и/или фрагменты могут быть отделены по меньшей мере от приблизительно 10%, приблизительно 20%, приблизительно 30%», приблизительно 40%, приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 80%, приблизительно 90%, приблизительно 95%, приблизительно 98%, приблизительно 99%, по существу 100% или 100% других компонентов, с которыми они были первоначально связаны. Согласно некоторым вариантам реализации выделенные агенты являются чистыми более чем приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 91%, приблизительно на 92%, приблизительно на 93%, приблизительно на 94%, приблизительно на 95%, приблизительно на 96%, приблизительно на 97%, приблизительно на 98%, приблизительно на 99%, по существу на 100% или на 100%. В настоящей заявке вещество является «чистым», если оно по существу не содержит других компонентов. В настоящей заявке термин «выделенная клетка» относится к клетке, которая не содержится в многоклеточном организме.
[0041] Предотвращать: в настоящей заявке термин «предотвращать» или «предотвращение» применительно к возникновению заболевания, нарушения и/или состояния, относится к снижению риска развития заболевания, расстройства и/или состояния. См. определение термина «риск».
[0042] Полипептид: в настоящей заявке термин «полипептид» относится к последовательной цепи аминокислот, соединенных между собой пептидными связями. Термин используется для обозначения аминокислотной цепи любой длины, однако специалист в данной области поймет, что этот термин не ограничен очень длинными цепями и может относиться к минимальной цепи, содержащей две аминокислоты, связанные друг с другом пептидной связью. Как известно специалистам в данной области техники, полипептиды могут подвергаться протеолитическому расщеплению и/или модификации.
[0043] Белок: в настоящей заявке термин «белок» относится к одному или большему числу полипептидов, которые функционируют в качестве отдельной единицы. Если отдельный полипептид представляет собой отдельную функционирующую единицу и не требует постоянной или временной физической связи с другими полипептидами для образования отдельной функциональной единицы, то термины «полипептид» и «белок» могут быть использоваться взаимозаменяемо. Если отдельная функциональная единица содержит более одного полипептида, которые физически связаны друг с другом, то термин «белок» относится к нескольким полипептидам, которые физически соединены и функционируют совместно в качестве отдельной единицы.
[0044] Риск: как будет понятно из контекста, «риск» заболевания, нарушения и/или состояния включает вероятность того, что у конкретного индивидуума разовьется заболевание, нарушение и/или состояние (например, инсульт). Согласно некоторым вариантам реализации величину риска выражают в процентах. Согласно некоторым вариантам реализации величина риска составляет от 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90 до 100%. Согласно некоторым вариантам реализации величину риска выражают как величину риска по отношению к таковой для риска, связанного с референсным образцом или группой референсных образцов. В некоторых вариантах реализации референсный образец или группа референсных образцов имеет известный риск развития состояния, расстройства, состояния и/или явления (например, инсульта). Согласно некоторым вариантам реализации референсный образец или группа референсных образцов получены от индивидуумов, показатели которых сопоставимы с таковыми у конкретного индивидуума. Согласно некоторым вариантам реализации относительный риск составляет 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более.
[0045] Стабильность: в настоящей заявке термин «стабильный» относится к способности терапевтического агента поддерживать свою терапевтическую эффективность (например, все или большую часть видов его предполагаемой биологической активности и/или физико-химическую целостность) в течение длительных периодов времени. Стабильность терапевтического агента и способность фармацевтической композиции поддерживать стабильность такого терапевтического агента можно оценивать в течение длительных периодов времени (например, по меньшей мере 1, 3, 6, 12, 18, 24, 30, 36 месяцев и более). Согласно некоторым вариантам реализации фармацевтические композиции, описанные в настоящей заявке, приготовлены таким образом, что они способны обеспечивать стабилизацию, или другим способом замедлять или предотвращать разрушение одного или более терапевтических агентов, которые входят в состав указанных композиций. Применительно к составу, стабильный состав представляет собой состав, в котором терапевтический агент, содержащийся в нем, по существу сохраняет свою физическую и/или химическую целостность и биологическую активность при хранении и в ходе ряда процессов (например, замораживания/оттаивания, механического перемешивания и лиофилизации).
[0046] Субъект: в настоящей заявке термин «субъект» относится к человеку или любому животному, не относящемуся к человеку (например, мыши, крысе, кролику, собаке, кошке, крупному рогатому скоту, свинье, овце, лошади или примату). Человек включает пре- и постнатальные формы. Согласно многим вариантам реализации субъектом является человек. Субъект может быть пациентом, что обозначает человека, поступившего в медицинское учреждение для диагностики или лечения состояния. В настоящей заявке термин «субъект» используется взаимозаменяемо с терминами «индивидуум» или «пациент». Субъект может быть поражен заболеванием или нарушением или восприимчив к ним, при этом симптомы этого заболевания или нарушения у него могут проявляться или отсутствовать.
[0047] По существу: в настоящей заявке термин «по существу» относится к качественному условию, относящемуся к проявлению конечной или почти конечной величины или степени признака или свойства, представляющего интерес. Для специалиста в области биологии будет понятно, что биологические и химические явления редко, почти никогда, протекают до завершения и/или продолжаются до достижения завершенности, или достигают, или исключают какой-либо абсолютный результат. Соответственно, в настоящей заявке термин «по существу» используется для того чтобы учесть потенциальное отсутствие завершенности, присущее многим биологическим и химическим явлениям.
[0048] Страдающий от: индивидуум, «страдающий от» заболевания, нарушения и/или состояния, представляет собой индивидуума, у которого было диагностировано заболевание, нарушение и/или состояние или который проявляет один или более симптомов заболевания, нарушения и/или состояния.
[0049] Восприимчивый к: индивидуум, «восприимчивый к» состоянию, расстройству и/или состоянию, представляет собой индивидуума, у которого не было диагностировано состояние, расстройство и/или состояние. В некоторых вариантах реализации индивидуум, который восприимчив к заболеванию, нарушению и/или состоянию, может не проявлять симптомов заболевания, нарушения и/или состояния. Согласно некоторым вариантам реализации индивидуум, который является восприимчивым к заболеванию, нарушению, состоянию или событию (например, ишемическому инсульту), может быть охарактеризован с использованием одного или более из следующих признаков: (1) генетическая мутация, связанная с развитием заболевания, нарушения и/или состояния; (2) генетический полиморфизм, связанный с развитием заболевания, нарушения и/или состояния; (3) увеличение и/или снижение экспрессии и/или активности белка, связанного с заболеванием, нарушением и/или состоянием; (4) привычки и/или образ жизни, связанные с развитием заболевания, нарушения, состояния и/или события; (5) перенесенная или планируемая трансплантация либо потребность в трансплантате. Согласно некоторым вариантам реализации у индивидуума, который восприимчив к заболеванию, нарушению и/или состоянию, разовьется состояние, расстройство и/или состояние. Согласно некоторым вариантам реализации у индивидуума, который восприимчив к состоянию, расстройству и/или состоянию, не разовьется состояние, расстройство и/или состояние.
[0050] Терапевтически эффективное количество: в настоящей заявке термин «терапевтически эффективное количество» терапевтического агента означает количество, которое является достаточным, при введении субъекту, страдающему или восприимчивому к заболеванию, нарушению и/или состоянию, для лечения, диагностики, предотвращения и/или задержки начала развития симптома(ов) заболевания, нарушения и/или состояния. Для специалистов в данной области техники будет понятно, что терапевтически эффективное количество обычно вводят с использованием схемы дозирования, включающей по меньшей мере одну стандартную дозу.
[0051] Лечение: в настоящей заявке термин «лечить», «лечение» или «процесс лечения» относится к любому способу, используемому для того чтобы частично или полностью снять, ослабить, облегчить, ингибировать, предотвратить, задержать начало развития, уменьшить степень тяжести и/или уменьшить частоту одного или более симптомов или признаков конкретного заболевания, нарушения и/или состояния. Лечение можно применять к субъекту, который не проявляет признаков состояния и/или проявляет только ранние признаки состояния, для снижения риска развития патологии, связанной с состоянием.
ПОДРОБНОЕ ОПИСАНИЕ НЕКОТОРЫХ ВАРИАНТОВ РЕАЛИЗАЦИИ
[0052] В настоящем изобретении предложены, помимо прочего, улучшенные композиции и способы лечения или снижения риска развития состояний головного мозга, вызванных повреждением или нарушением тканей головного мозга.
[0053] Различные аспекты настоящего изобретения будут подробно описаны в следующих разделах. Использование разделов не предназначено для ограничения настоящего изобретения. Каждый раздел может относиться к любому аспекту настоящего изобретения. В настоящей заявке использование «или» означает «и/или», если не указано иное.
Состояния головного мозга
Инсульт
[0054] Головной мозг чрезвычайно чувствителен к нарушению поступления в него кислорода. Аноксия и ишемия продолжительностью всего в несколько секунд, могут вызвать симптомы и, если такое состояние сохраняется в течение минут, они могут вызвать необратимое повреждение нейронов. Соответственно, инсульт является одной из основных причин тяжелой, долгосрочной инвалидности и ведущей причиной смерти в Соединенных Штатах Америки. Инсульт также налагает ощутимое бремя на медицинскую отрасль, при этом общие расходы на здравоохранение по инвалидности в результате инсульта, согласно оценкам, составляют приблизительно 53 млрд. долларов США в год.
[0055] Существует два типа инсультов: ишемический и геморрагический инсульты. Ишемический инсульт включает закупорку одного или более сосудов, которые снабжают кровью ткани головного мозга, например, окклюзию, вызванную атеросклеротическими тромбами, или эмболию. Ишемический инсульт (церебральная ишемия) составляет приблизительно 88% от всех инсультов, что делает ишемический инсульт одним из наиболее распространенных типов цереброваскулярных повреждений. Ишемические состояния в головном мозге незамедлительно ведут к гибели нейронов, что часто приводит к хроническим сенсомоторным поражениям. В настоящей заявке геморрагический инсульт определяется как накопление крови в любом месте под сводом черепа. Геморрагические инсульты могут быть следствием многих причин, включая травму в результате расширяющейся гематомы, которая может разрушить или деформировать ткань.
[0056] Основным препятствием в лечении как ишемического, так и геморрагического инсультов является доставка лекарственного средства, которое достигнет пораженной ткани. Вследствие эффективности гематоэнцефалического барьера очень немногие соединения способны проникать в ткань мозга и оказывать на нее влияние. Ранее доставка соединений, таких как ангиотензин (1-7), должна была осуществляться с использованием интрацеребровентрикулярного (ICV) введения. Неожиданно было обнаружено, что варианты реализации настоящего изобретения, включая типичные пептиды ангиотензина (1-7), описанные ниже, способны пересекать гематоэнцефалический барьер без сложных систем доставки, таких как модифицированные стволовые клетки и тому подобное. Действительно, согласно некоторым вариантам реализации пептиды ангиотензина (1-7) могут быть доставлены с использованием внутривенных или подкожных путей введения. Сосудистая деменция
[0057] Сосудистая деменция является второй по распространенности формой деменции после болезни Альцгеймера. Сосудистая деменция может быть следствием проблем с кровоснабжением головного мозга, таких как проблемы, вызванные ишемическим или геморрагическим инсультом или другими причинами, которые приводят к развитию поражений головного мозга. Другие причины сосудистой деменции включают церебральную амилоидную ангиопатию, гиперхолестеринемию, сахарный диабет или сердечнососудистые заболевания. Деменция, вызванная одним или более инсультами, также известна как «одноинфарктная деменция» или «мультиинфарктная деменция», в зависимости от первопричины.
[0058] Лечение сосудистой деменции сосредоточено преимущественно на предотвращении дальнейших цереброваскулярных поражений за счет использования антитромбоцитарных лекарственных препаратов и изменения образа жизни (изменение диеты, отказ от курения и т.д.). Также было исследовано применение ингибиторов холинэстеразы, таких как галантамин, при этом клиническом сценарии, однако этот тип лечения связан с поддержанием функции ацетилхолина в головном мозге, а не восстановлением или формированием улучшенного и устойчивого кровоснабжения. Таким образом, варианты реализации настоящего изобретения представляют новый вид внутривенной и подкожной терапии, направленной на улучшение основополагающих причин заболевания, в отличие от контроля симптомов или максимизации оставшихся ресурсов тканей. Травматическое повреждение мозга
[0059] Травматическое повреждение мозга (ТПМ), форма приобретенного повреждения головного мозга, возникает в том случае, когда неожиданная травма приводит к повреждению мозга. ТПМ может возникнуть в случае, когда голова внезапно и сильно ударяется о предмет (или наоборот), или когда предмет пробивает череп и входит в ткань головного мозга. Симптомы ТПМ могут быть легкой, средней или тяжелой степени тяжести, в зависимости от степени повреждения головного мозга. Человек с ТПМ легкой степени тяжести может остаться в сознании или может потерять сознание на несколько секунд или минут. Другие симптомы ТПМ легкой степени тяжести включают головную боль, спутанность сознания, предобморочное состояние, головокружение, расфокусированное зрение или утомленность глаз, звон в ушах, плохой привкус во рту, усталость или вялость, изменение режима сна, изменение поведения или настроения и проблемы с памятью, концентрацией, вниманием или мышлением. Человек с умеренной или тяжелой ТПМ может иметь эти же симптомы, однако может также иметь головную боль, которая ухудшается или не проходит, многократную рвоту или тошноту, судороги или приступы, неспособность пробудиться ото сна, расширение одного или обоих зрачков глаз, невнятную речь, онемение или слабость в конечностях, потерю координации и повышенную спутанность сознания, беспокойство или возбуждение.
[0060] Лечение ТПМ сосредоточено преимущественно на предотвращении дальнейшего повреждения или осложнений. Основные проблемы в лечении ТПМ включают обеспечение надлежащего кровоснабжения головного мозга и остальных частей тела, поддержание надлежащего кровотока и контроль артериального давления. Обычно начальное лечение, которое получает субъект, страдающий ТПМ, после стабилизации, представляет собой реабилитацию, которая включает индивидуально подобранные программы лечения в области физиотерапии, реабилитационной терапии, речевой/логопедической терапии, психологии/психиатрии и социальной поддержки. Варианты реализации настоящего изобретения обеспечивают новый вид лечения таких пациентов.
Пептиды ангиотензина (1-7)
[0061] В настоящей заявке термин «пептид ангиотензина (1-7)» относится как к природному ангиотензину (1-7), так и любому функциональному эквиваленту, аналогу или производному природного ангиотензина (1-7). В настоящей заявке термин «пептид» и «полипептид» являются взаимозаменяемыми терминами и относятся к двум или более аминокислотам, связанным между собой пептидной связью. В настоящей заявке термины «пептид» и «полипептид» включают как линейный, так и циклический пептид. Термины «ангиотензин-(1-7)», «Ангиотензин-(1-7)» и «Анг-(1-7)» используются взаимозаменяемо.
Природный ангиотензин (1-7)
[0062] Природный ангиотензин (1-7) (также называемый Анг-(1-7)) представляет собой содержащий семь аминокислот пептид, который приведен ниже:

Этот пептид является частью ренин-ангиотензиновой системы и образуется из предшественника, также известного как ангиотензиноген, представляющего собой α-2-глобулин, который вырабатывается конститутивно и высвобождается в кровоток, главным образом, печенью. Ангиотензиноген является членом семейства серпинов и также известен как субстрат ренина. Ангиотензиноген человека имеет 452 аминокислоты в длину, но другие виды имеют молекулы ангиотензиногена различных размеров. Как правило, первые 12 аминокислот являются наиболее важными для активности ангиотензина:

[0063] Могут образовываться под действием различных ферментов могут образовываться различные типы ангиотензина. Например, ангиотензин (1-7) вырабатывается под действием ангиотензин-превращающего фермента 2 (АПФ-2).
[0064] Анг-(1-7) является эндогенным лигандом для рецепторов Mas. Рецепторы Mas представляют собой сопряженные с G-белком рецепторы, содержащие семь трансмембранных участков. В настоящей заявке термин «рецептор ангиотензина (1-7)» включает сопряженные с G-белком рецепторы Mas.
[0065] В настоящей заявке термин «природный ангиотензин (1-7)» включает любой пептид ангиотензина (1-7), выделенный из природных источников, а также любые рекомбинантные или химически синтезированные пептиды, имеющие аминокислотную последовательность, которая идентична последовательности природного ангиотензина (1-7).
Функциональные эквиваленты, аналоги или производные Анг-(1-7)
[0066] В некоторых вариантах реализации настоящего изобретения пептид ангиотензина (1-7), пригодный для настоящего изобретения, представляет собой функциональный эквивалент природного Анг-(1-7). В настоящей заявке функциональный эквивалент природного Анг-(1-7) относится к любому пептиду, аминокислотная последовательность которого идентична последовательности природного Анг-(1-7), и который сохраняет активность по существу близкую или аналогичную активности природного Анг-(1-7). Например, согласно некоторым вариантам реализации функциональный эквивалент природного Анг-(1-7), описанный в настоящей заявке, имеет проангиогенную активность, согласно результатам определения с помощью методов, описанных в настоящей заявке или известных в данной области техники, или активность, такую как высвобождение оксида азота, вазодилатация, улучшение функции эндотелия, антидиуретическое действие или одно из других свойств, описанных в настоящей заявке, которое положительно влияет на ангиогенез. Согласно некоторым вариантам реализации функциональный эквивалент природного Анг-(1-7), описанный в настоящей заявке, может связываться или активировать рецептор ангиотензина (1-7) (например, сопряженный с G-белком рецептор Mas), согласно результатам анализа различными количественными методами, описанными в настоящей заявке или известными в данной области техники. Согласно некоторым вариантам реализации функциональный эквивалент Анг-(1-7) также называется аналогом или производным ангиотензина (1-7) или его функциональным производным.
[0067] Обычно аминокислотная последовательность функционального эквивалента ангиотензина (1-7) сходна с последовательностью природного Анг-(1-7). Согласно некоторым вариантам реализации функциональный эквивалент Анг-(1-7) в соответствии с настоящим изобретением содержит последовательность, которая содержит по меньшей мере 3 (например, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7) аминокислоты из семи аминокислот, которые присутствуют в природном Анг-(1-7), причем по меньшей мере 3 (например, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6 или по меньшей мере 7) аминокислоты сохраняют свое относительное положение и/или расстояние по отношению к соответствующим аминокислотам, в случае их присутствия в природном Анг-(1-7).
[0068] Согласно некоторым вариантам реализации функциональный эквивалент Анг-(1-7) также включает любой пептид, содержащий последовательность, которая по меньшей мере на 50% (например, по меньшей мере на 60%, 70%, 80% или 90%) идентична аминокислотной последовательности природного Анг-(1-7). Процент идентичности аминокислотных последовательностей может быть определен путем выравнивания аминокислотных последовательностей. Выравнивание аминокислотных последовательностей может быть достигнуто различными способами, которые известны специалистам в данной области техники, например, с использованием общедоступного программного обеспечения, такого как BLAST, ALIGN, или программного обеспечения Megalign (DNASTAR). Специалисты в данной области техники могут определить соответствующие параметры для оценки выравнивания, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Предпочтительно для определения идентичности аминокислотных последовательностей используется программное обеспечение WU-BLAST-2 (Altschul et al., Methods in Enzymology 266, 460-480 (1996); http://blast.wustl/edu/blast/README.html). WU-BLAST-2 использует несколько параметров поиска, большинство из которых установлены как значения по умолчанию. Регулируемые параметры устанавливаются со следующими значениями: длина перекрывания = 1, доля перекрывания = 0,125, пороговая длина слова (Т)=11. Оценка HSP (S) и параметры HSP S2 представляют собой динамические значения и устанавливаются самой программой, в зависимости от состава конкретной последовательности, однако минимальные значения могут быть скорректированы и установлены, как указано выше.
[0069] Согласно некоторым вариантам реализации функциональный эквивалент, аналог или производное Анг-(1-7) представляет собой фрагмент природного Анг-(1-7). Согласно некоторым вариантам реализации функциональный эквивалент, аналог или производное Анг-(1-7) содержит аминокислотные замены, удаления и/или вставки в последовательности природного Анг-(1-7). Функциональные эквиваленты, аналоги или производные Анг-(1-7) могут быть получены путем изменения аминокислотных последовательностей с помощью замен, добавлений и/или удалений. Например, один или более аминокислотных остатков в пределах последовательности природного Анг-(1-7) (SEQ ID NO: 1) могут быть замещены другой аминокислотой с аналогичной полярностью, которая действует в качестве функционального эквивалента, что приводит к получению молчащей замены. Замена аминокислоты в пределах последовательности может быть выбрана среди других членов класса, к которому принадлежит данная аминокислота. Например, положительно заряженные (основные) аминокислоты включают аргинин, лизин и гистидин. Неполярные (гидрофобные) аминокислоты включают лейцин, изолейцин, аланин, фенилаланин, валин, пролин, триптофан и метионин. Незаряженные полярные аминокислоты включают серии, треонин, цистеин, тирозин, аспарагин и глутамин. Отрицательно заряженные (кислые) аминокислоты включают глутаминовую кислоту и аспарагиновую кислоту. Аминокислота глицин может быть включена либо в семейство неполярных аминокислот, либо в семейство незаряженных (нейтральных) полярных аминокислот. Замены, сделанные в пределах семейства аминокислот, как правило, рассматриваются как консервативные замены. Например, аминокислотная последовательность ингибитора пептида может быть модифицированной или замещенной.
[0070] Примеры функциональных эквивалентов, аналогов и производных Анг-(1-7) описаны в разделе, озаглавленном «Типичные пептиды ангиотензина (1-7)», ниже.
[0071] Пептид ангиотензина (1-7) может иметь любую длину. В некоторых вариантах реализации настоящего изобретения пептид ангиотензина (1-7) согласно настоящему изобретению может содержать, например, от 4 до 25 аминокислот (например, 4-20, 4-15, 4-14, 4-13, 4-12, 4-11, 4-10, 4-9, 4-8, 4-7 аминокислот). Согласно некоторым вариантам реализации линейный пептид содержит 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 аминокислот.
[0072] Согласно некоторым вариантам реализации пептид ангиотензина (1-7) содержит одну или более модификаций для увеличения устойчивости к действию протеаз, стабильности в сыворотке крови и/или биодоступности. Согласно некоторым вариантам реализации пригодные модификации выбраны из пегилирования, ацетилирования, гликозилирования, биотинилирования, замещения D-аминокислотой и/или неприродной аминокислотой, и/или циклизации пептида.
[0073] В настоящей заявке термин «аминокислота», в самом широком смысле, относится к любому соединению и/или веществу, которое может быть включено в полипептидную цепь. Согласно некоторым вариантам реализации аминокислота имеет общую структуру H2N-C(H)(R)-COOH. Согласно некоторым вариантам реализации аминокислота представляет собой природную аминокислоту. Согласно некоторым вариантам реализации аминокислота представляет собой синтетическую или неприродную аминокислоту (например, α,α-дизамещенные аминокислоты, N-алкиламинокислоты); согласно некоторым вариантам реализации аминокислота представляет собой D-аминокислоту; согласно некоторым вариантам реализации аминокислота представляет собой L-аминокислоту. Термин «стандартная аминокислота» относится к любой из двадцати стандартных аминокислот, обычно обнаруживаемых в природных пептидах, включая L- и D- аминокислоты, оба типа которых включены в пептиды в природе. Термин «нестандартная» или «необычная аминокислота» относится к любой аминокислоте, отличной от стандартных аминокислот, независимо от того, приготовлена она синтетическим способом или получена из природного источника. В настоящей заявке термин «синтетическая или неприродная аминокислота» включает химически модифицированные аминокислоты, включая, но не ограничиваясь ими, соли, производные аминокислот (например, амиды) и/или замены. Аминокислоты, включая карбокси- и/или амино-концевые аминокислоты в пептидах, могут быть модифицированы путем метилирования, амидирования, ацетилирования и/или замещения другими химическими группами, которые могут изменить период полувыведения пептида из кровотока, не оказывая нежелательного влияния на его активность. Примеры необычных или неприродных аминокислот включают, но не ограничиваются следующими: цитруллин, орнитин, норлейцин, норвалин, 4-(Е)-бутенил-4(R)-метил-N-метилтреонин (MeBmt), N-метиллейцин (MeLeu), аминоизомасляную кислоту, статин и N-метилаланин (MeAla). Аминокислоты могут участвовать в образовании дисульфидной связи. Термин «аминокислота» используется взаимозаменяемо с термином «аминокислотный остаток» и может относиться к свободной аминокислоте и/или аминокислотному остатку пептида. Исходя из контекста, в котором используется термин, будет понятно, относится ли он к свободной аминокислоте или остатку пептида.
[0074] Согласно некоторым вариантам реализации пептид ангиотензина (1-7) содержат одну или более L-аминокислот, D-аминокислот и/или неприродных аминокислот.
[0075] Помимо пептидов, содержащих только природные аминокислоты, в объем настоящего изобретения также включены пептидомиметики или аналоги пептидов. Аналоги пептидов широко используются в фармацевтической промышленности в качестве непептидных лекарственных препаратов, обладающих свойствами, которые аналогичны таковым для пептида-матрицы. Непептидные соединения называются «миметики пептидов» или пептидомиметики (Fauchere et al., Infect. Immun. 54: 283-287 (1986); Evans et al., J. Med. Chem. 30: 1229-1239 (1987)). Миметики пептидов по своей структуре являются родственными пептидам, пригодным для терапевтического применения, и могут быть использованы для получения эквивалентного или повышенного терапевтического или профилактического эффекта. Обычно пептидомиметики структурно сходны с эталонным полипептидом (например, полипептидом, который обладает биологической или фармакологической активностью), например, с природными полипептидами, связывающимися с рецепторами, но в которых одна или более пептидных связей могут быть замещены такими связями как -CH2NH-, -CH2S- -СН2-СН2-, -СН=СН- (цис- и транс), -CH2SO-, -СН(ОН)СН2-, -СОСН2- и т.д., методами, которые хорошо известны в данной области техники (Spatola, Peptide Backbone Modifications, Vega Data, 1(3): 267 (1983); Spatola et al. Life Sci. 38: 1243-1249 (1986); Hudson et al. Int. J. Pept. Res. 14: 177-185 (1979); и Weinstein. В., 1983, Chemistry and Biochemistry, of Amino Acids, Peptides and Proteins, Weinstein eds, Marcel Dekker, New-York). Такие миметики пептидов могут иметь значительные преимущества по сравнению с природными полипептидами, включая экономически более выгодное производство, большую химическую устойчивость, улучшенные фармакологические свойства (например, период полувыведения, всасывание, активность, эффективность и т.д.), пониженную антигенность и другие.
[0076] Пептиды Анг-(1-7) также включают другие типы пептидных производных, содержащих дополнительные химические фрагменты, которые в обычных условиях не являются частью пептида, при условии, что производное сохраняет желательную функциональную активность пептида. Примеры таких производных включают (1) N-ацильные производные концевой аминогруппы или другой свободной аминогруппы, при этом ацильная группа может представлять собой алканоильную группу (например, ацетил, гексаноил, октаноил), ароильную группу (например, бензоил) или блокирующую группу, такую как F-moc (фторенилметил-О-СО-); (2) сложные эфиры карбокси-концевой или другой свободной карбоксильной или гидроксильной группы; (3) амид карбокси-концевой группы или другой свободной карбоксильной группы, полученный в результате реакции с аммиаком или с соответствующим амином; (4) фосфорилированные производные; (5) производные, конъюгированные с антителом или другим биологическим лигандом и другие виды производных; и (6) производные, конъюгированные с цепью полиэтиленгликоля (ПЭГ).
[0077] Пептиды Анг-(1-7) могут быть получены с использованием любого метода синтеза пептидов, известного специалистам в данной области техники, включая синтетические (например, полный твердофазный синтез, частичный твердофазный синтез, конденсацию фрагментов, классический синтез в растворе, нативное химическое лигирование) и рекомбинантные методики. Например, пептиды или производные пептидов могут быть получены путем твердофазного пептидного синтеза, который, в общих чертах, представляет собой конъюгацию карбоксильной группы С-концевой аминокислоты со смолой (например, бензгидриламиновой смолой, хлорметилированной смолой, гидроксиметильной смолой) и последовательное присоединение N-альфа-защищенных аминокислот. Защитные группы могут представлять собой любые группы, известные в данной области техники. Перед присоединением каждой новой аминокислоты к растущей цепи, защитная группа предыдущей аминокислоты, добавленной к цепи, удаляется. Такой твердофазный синтез раскрыт, например, в Merrifield, J. Am. Chem. Soc. 85: 2149 (1964); Vale et al., Science 213: 1394-1397 (1981), в патентах США №№4305872 и 4316891, Bodonsky et al. Chem. Ind. (London), 38: 1597 (1966); и Pietta and Marshall, Chem. Comm. 650 (1970), с помощью методик, рассмотренных в Lubell et al. "Peptides" Science of Synthesis 21.11, Chemistry of Amides. Thieme, Stuttgart, 713-809 (2005). Конъюгация аминокислот с соответствующими смолами также хорошо известна в данной области техники и была раскрыта в патенте США №4244946. (Рассматривается в Houver-Weyl, Methods of Organic Chemistry. Vol E22a. Synthesis of Peptides and Peptidomimetics, Murray Goodman, Editor-in-Chief, Thieme. Stuttgart. New York 2002).
[0078] Если не указано иное, научные и технические термины и номенклатура, используемые в настоящей заявке, имеют значение, аналогичное тому, которое обычно подразумевает средний специалист в области, к которой относится настоящее изобретение. В целом, процедуры клеточных культур, инфекции, методы молекулярной биологии и т.п. являются обычными методами, используемыми в данной области техники. Такие стандартные методики могут быть найдены в справочных руководствах, таких как, например, Ausubel et al., Current Protocols in Molecular Biology, Wiley Interscience, New York, 2001; и Sambrook et al., Molecular Cloning: A Laboratory Manual, 3rd edition, Cold Spring Harbor Laboratory Press, N.Y., 2001.
[0079] В ходе любого процесса получения пептида Анг-(1-7) может быть желательной защита чувствительных реакционноспособных групп в любой из рассматриваемых молекул. Это может быть достигнуто с помощью обычных защитных групп, таких как те, которые описаны в Protective Groups In Organic Synthesis авторами T.W. Greene & P.G.M. Wuts, 1991, John Wiley and Sons, New-York; и Peptides: chemistry and Biology авторами Sewald and Jakubke, 2002, Wiley-VCH, Wheinheim p. 142. Например, альфа-аминозащитные группы включают защитные группы ацильного типа (например, трифторацетил, формил, ацетил), алифатические уретановые защитные группы (например, трет-бутилоксикарбонил (ВОС), циклогексилоксикарбонил), ароматические уретановые защитные группы (например, фторенил-9-метоксикарбонил (Fmoc), бензилоксикарбонил (Cbz), производные Cbz) и защитные группы алкильного типа (например, трифенилметил, бензил). Защитные группы для боковой цепи аминокислот включают бензил (для Thr и Ser), Cbz (Tyr, Thr, Ser, Arg, Lys), метилэтил, циклогексил (Asp, His), Boc (Arg, His, Cys) и т.д. Защитные группы могут быть удалены на подходящей последующей стадии с использованием способов, известных в данной области техники.
[0080] Также пептиды Анг-(1-7) могут быть синтезированы в соответствии с протоколом FMOC в органической фазе с использованием защитных групп. Желательной может быть очистка пептидов с выходом 70%, используя жидкостную хроматографию высокого давления (ВЭЖХ) на хроматографической колонке С18 и элюирование в 10-60% градиенте ацетонитрила. Молекулярная масса пептида может быть подтверждена с помощью масс-спектрометрии (рассматривается в Fields, G.B. "Solid-Phase Peptide Synthesis" Methods in Enzymology. Vol. 289, Academic Press, 1997).
[0081] Кроме того, пептиды Анг-(1-7) могут быть получены в рекомбинантных системах с использованием, например, полинуклеотидных последовательностей, кодирующих полипептиды. Следует понимать, что полипептид может содержать более одной из вышеописанных модификаций в пределах одного и того же полипептида.
[0082] Несмотря на то, что пептиды могут эффективно вызывать биологическую активность в условиях in vitro, их эффективность в условиях in vivo может снижаться вследствие присутствия протеаз. Сывороточные протеазы имеют специфические требования в отношении субстратов. Субстрат должен содержать L-аминокислоты и пептидные связи, подходящие для расщепления. Кроме того, экзопептидазы, которые представляют наиболее важный компонент протеазной активности в сыворотке крови, обычно действуют на первую пептидную связь пептида и нуждаются в наличии свободного N-конца (Powell et al., Pharm. Res. 10: 1268-1273 (1993)). В виду этого использование модифицированных версий пептидов часто является предпочтительным. Модифицированные пептиды сохраняют структурные характеристики исходных L-аминокислотных пептидов, которые придают желаемую биологическую активность Анг-(1-7), но предпочтительно не всегда восприимчивы к расщеплению протеазой и/или экзопептидазами.
[0083] Системная замена одной или более аминокислот в консенсусной последовательности D-аминокислотой аналогичного типа (например, D-лизин вместо L-лизина) может использоваться для получения более стабильных пептидов. Следовательно, производное пептида или пептидомиметик согласно настоящему изобретению может представлять собой пептид, состоящий только из L, только из D или из смеси D-, L-аминокислот, в прямом или обратном порядке. Наличие N-концевой или С-концевой D-аминокислоты увеличивает стабильность пептида в условиях in vivo, поскольку пептидазы не могут использовать D-аминокислоту в качестве субстрата (Powell et al., Pharm. Res. 10: 1268-1273 (1993)). Обратные D-пептиды представляют собой пептиды, содержащие D-аминокислоты, расположенные в обратной последовательности по отношению к пептиду, содержащему L-аминокислоты. Следовательно, С-концевой остаток L-аминокислотного пептида становится N-концом для D-аминокислотного пептида и так далее. Обратные D-пептиды сохраняют ту же вторичную конформацию и, следовательно, аналогичную активность, что и L-аминокислотные пептиды, но являются более устойчивыми к ферментативному расщеплению в условиях in vitro и условиях in vivo, и, следовательно, могут иметь большую терапевтическую эффективность, чем исходный пептид (Brady and Dodson, Nature 368: 692-693 (1994); Jameson et al., Nature 368: 744-746 (1994)). Аналогичным образом, обратный L-пептид может быть получен с использованием стандартных методов, когда С-конец исходного пептида становится N-концом обратного L-пептида. Предполагается, что обратные L-пептиды из L-аминокислотных пептидов, которые не имеют значимой вторичной структуры, (например, короткие пептиды), сохраняют те же расстояния и конформацию боковых цепей, что и в L-аминокислотном пептиде, и, следовательно, часто имеют активность, аналогичную активности исходного L-аминокислотного пептида. Кроме того, обратный пептид может содержать комбинацию L- и D-аминокислот. Расстояние между аминокислотами и конформация боковых цепей могут сохраняться, что приводит к активности, близкой к активности исходного L-аминокислотного пептида.
[0084] Другой эффективный подход для придания устойчивости к действию пептидаз, действующих на N-концевые или С-концевые остатки пептида, заключается в добавлении химических групп к концам пептида, так, что модифицированный пептид больше не является субстратом для пептидазы. Одной из таких химических модификаций является гликозилирование пептидов на одном или обоих концах. Было показано, что некоторые химические модификации, в частности N-концевое гликозилирование, повышают стабильность пептидов в сыворотке крови человека (Powell et al., Pharm. Res. 10: 1268-1273 (1993)). Другие химические модификации, которые повышают стабильность в сыворотке крови, включают, но не ограничиваются следующими: добавление N-концевой алкильной группы, состоящей из низшего алкила, содержащего от одного до двадцати атомов углерода, такой как ацетильная группа, и/или добавление С-концевого амида или замещенной амидной группы. В частности, настоящее изобретение включает модифицированные пептиды, состоящие из пептидов, несущих N-концевую ацетильную группу и/или С-концевую амидную группу.
[0085] Замещение неприродных аминокислот природными аминокислотами в подпоследовательности пептидов также может придавать устойчивость к протеолизу. Такое замещение может, например, придавать устойчивость к протеолизу под действием экзопептидаз, действующих на N-конец, не влияя на биологическую активность. Примеры неприродных аминокислот включают α,α-дизамещенные аминокислоты, N-алкиламинокислоты, С-α-метиламинокислоты, β-аминокислоты и β-метиламинокислоты. Аналоги аминокислот, пригодные для настоящего изобретения, могут включать, но не ограничиваются следующими: β-аланин, норвалин, норлейцин, 4-аминомасляную кислоту, орнитин, гидроксипролин, саркозин, цитруллин, цистеиновую кислоту, циклогексилаланин, 2-аминоизомасляную кислоту, 6-аминокапроновую кислоту, трет-бутилглицин, фенилглицин, О-фосфосерин, N-ацетилсерин, N-формилметионин, 3-метил гистидин и другие необычные аминокислоты. Кроме того, синтез пептидов, содержащих неприродные аминокислоты, является обычным в данной области техники.
[0086] Помимо этого пептиды с ограниченной конформационной свободой, содержащие консенсусную последовательность или по существу идентичный вариант консенсусной последовательности, могут быть получены способами, хорошо известными в данной области техники (Rizo and Gierasch, Ann. Rev. Biochem. 61: 387-418 (1992)). Например, пептиды с ограниченной конформационной свободой могут быть получены путем добавления остатков цистеина, способных образовывать дисульфидные мостики, что приводит получению циклического пептида. Циклические пептиды могут быть сконструированы таким образом, что они не будут содержать свободных N- или С-концов. Соответственно, такие пептиды не чувствительны к протеолизу под действием экзопептидаз, несмотря на то, что они могут быть чувствительны к действию эндопептидаз, которые не расщепляют связи на концах пептида. Аминокислотные последовательности пептидов с N-концевыми или С-концевыми D-аминокислотами и циклических пептидов обычно идентичны последовательностям пептидов, которым они соответствуют, за исключением присутствия N-концевого или С-концевого остатка D-аминокислоты, или их циклической структуры, соответственно. Циклические пептиды
[0087] Согласно некоторым вариантам реализации функциональный эквивалент, аналог или производное природного Анг-(1-7) представляет собой циклический пептид. В настоящей заявке циклический пептид содержит внутримолекулярную ковалентную связь между двумя несоседними остатками. Внутримолекулярная связь может представлять собой связь между двумя главными цепями, боковой цепью и главной цепью или между двумя боковыми цепями (т.е., концевые функциональные группы линейного пептида и/или функциональные группы боковой цепи концевого остатка или внутреннего остатка могут быть связаны для достижения циклизации). Типичные внутримолекулярные связи включают дисульфидные, амидные и тиоэфирные связи. Разные способы циклизации полипептидов хорошо известны в данной области техники, как и многие другие модификации, которые могут быть внесены в такие пептиды. Общее обсуждение приведено в международных публикациях патентных заявок WO 01/53331 и WO 98/02452, содержание которых включено в настоящую заявку посредством ссылки. Такие циклические связи и другие модификации могут быть применены к циклическим пептидам и производным соединениям согласно настоящему изобретению.
[0088] Циклические пептиды, описанные в настоящей заявке, могут содержать остатки L-аминокислот, D-аминокислот или любую их комбинацию. Аминокислоты могут быть из природных или неприродных источников, при условии, что в молекуле присутствует по меньшей мере одна аминогруппа и по меньшей мере одна карбоксильная группа; в целом, предпочтительными являются α- и β-аминокислоты. Циклические пептиды также могут содержать одну или более редких аминокислот (например, 4-гидроксипролин или гидроксилизин), органических кислот или амидов и/или производных обычных аминокислот, таких как аминокислоты с этерифицированным С-концевым карбоксилатом (например, сложный бензиловый, метиловый или этиловый эфир), или амидированной и/или модифицированной N-концевой аминогруппой (например, ацетилирование или алкоксикарбонилирование), с или без любой из широкого спектра модификаций и/или замен боковых цепей (например, метилирование, бензилирование, трет-бутилирование, тозилирование, алкоксикарбонилирование и тому подобное). Подходящие производные включают аминокислоты, имеющие N-концевую ацетильную группу (так что аминогруппа, которая представляет собой N-конец линейного пептида до циклизации, является ацетилированной) и/или С-концевую амидную группу (например, карбокси-конец линейного пептида до циклизации является амидированным). Остатки, помимо распространенных аминокислот, которые могут присутствовать в циклическом пептиде, включают, но не ограничиваются следующими: пеницилламин, β,β-тетраметиленцистеин, β,β-пентаметиленцистеин, β-меркаптопропионовую кислоту, β,β-пентаметилен-β-меркаптопропионовую кислоту, 2-меркаптобензен, 2-меркаптоанилин, 2-меркаптопролин, орнитин, диаминомасляную кислоту, α-аминоадипиновую кислоту, м-аминометилбензойную кислоту и α,β-диаминопропионовую кислоту.
[0089] После синтеза линейного пептида, содержащего или не содержащего N-концевые ацетильные группы и/или С-концевые амидные группы, циклизация может быть достигнута с помощью любой из разнообразных методик, хорошо известных в данной области техники. В одном варианте реализации настоящего изобретения связь может быть образована между реакционноспособными боковыми аминокислотными цепями. Например, дисульфидный мостик может быть образован из линейного пептида, содержащего два тиолсодержащих остатка, путем окисления пептида с использованием любого из множества способов. Согласно одному из таких способов окисление тиолов кислородом воздуха может привести к образованию дисульфидных мостиков в течение периода в несколько дней при использовании основной или нейтральной водной среды. Пептид используется в высокой степени разбавления, чтобы минимизировать агрегацию и межмолекулярные побочные реакции. В другом варианте для образования дисульфидных связей могут использоваться сильные окислители, такие как I2 и K3Fe(CN)6. Специалистам в данной области техники будет понятно, что необходимо принять меры, чтобы не допустить окисления чувствительных боковых цепей Met, Tyr, Trp или His. В других вариантах реализации циклизация может быть достигнута путем образования амидной связи. Например, пептидная связь может быть образована между концевыми функциональными группами (например, амино- и карбокси-концы линейного пептида до циклизации). В другом таком варианте реализации линейный пептид содержит D-аминокислоты. В другом варианте циклизация может быть осуществлена путем связывания одного конца и боковой цепи остатка или с использованием двух боковых цепей, с или без N-концевой ацетильной группы и/или С-концевой амидной группы. Остатки, способные образовывать лактамную связь, включают лизин, орнитин (Orn), α-аминоадипиновую кислоту, м-аминометилбензойную кислоту, α,β-диаминопропионовую кислоту, глутамат или аспартат. Способы образования амидных связей, в целом, хорошо известны в данной области техники. Согласно одному из таких способов образование лактама, опосредованное карбодиимидом, может быть осуществлено путем взаимодействия карбоновой кислоты с DCC, DIC, ED АС или DCCI, что приводит к образованию О-ацилмочевины, которая может немедленно вступать в реакцию со свободной аминогруппой для завершения циклизации. Помимо этого циклизация может быть выполнена с использованием азидного метода, в котором реакционноспособное азидное промежуточное соединение образуется из алкилового эфира через стадию гидразида. Также циклизация может быть осуществлена с использованием активированных сложных эфиров. Наличие электроноакцепторных заместителей на углеродном атоме алкоксигруипы сложных эфиров повышает их чувствительность к аминолизу. Высокая реакционная способность сложных эфиров п-нитрофенола, N-гидрокси соединений и полигалогенированных фенолов обеспечила возможность применения таких «активных сложных эфиров» в синтезе амидных связей. В другом варианте реализации настоящего изобретения тиоэфирная связь может быть образована между боковой цепью тиолсодержащего остатка и соответствующим производным α-аминокислоты. В качестве примера боковая цепь лизина может быть соединена с бромуксусной кислотой с использованием карбодиимидного метода связывания (DCC, EDAC), а затем подвергнута реакции с боковой цепью любого из тиолсодержащих остатков, указанных выше, с образованием тиоэфирной связи. Для образования дитиоэфиров две любые тиолсодержащие боковые цепи могут быть подвергнуты реакции с дибромэтаном и диизопропиламином в ДМФ. Примеры пептидов ангиотензина (1-7)
[0090] Согласно некоторым аспектам в настоящем изобретении предложены линейные пептиды ангиотензина (1-7). Как обсуждалось выше, природный Анг-(1-7) имеет следующую структуру:

[0091] Пептиды и аналоги пептидов согласно настоящему изобретению могут быть в общем случае представлены следующей последовательностью:

или ее фармацевтически приемлемой солью.
[0092] Хаа1 обозначает любую аминокислоту или дикарбоновую кислоту. Согласно некоторым вариантам реализации Хаа1 представляет собой Asp, Glu, Asn, Асрс (1-аминоциклопентанкарбоновую кислоту), Ala, Me2Gly (N,N-диметилглицин), Pro, Bet (бетаин, гидроксид 1-карбокси-N,N,N-триметилметанаммония), Glu, Gly, Asp, Sar (саркозин) или Sue (янтарную кислоту). В некоторых указанных вариантах реализации Хаа1 является отрицательно заряженной аминокислотой, такой как Asp или Glu, обычно, Asp.
[0093] Хаа2 представляет собой Arg, Lys, Ala, Cit (цитруллин), Orn (орнитин), ацетилированный Ser, Sar, D-Arg и D-Lys. Согласно некоторым вариантам реализации Хаа2 является положительно заряженной аминокислотой, такой как Arg или Lys, обычно, Arg.
[0094] Хаа3 представляет собой Val, Ala, Leu, Nle (норлейцин), Ile, Gly, Lys, Pro, HydroxyPro (гидроксипролин), Aib (2-аминоизомасляную кислоту), Асрс или Tyr. Согласно некоторым вариантам реализации Хаа3 представляет собой алифатическую аминокислоту, такую как Val, Leu, Не или Nle, обычно, Val или Nle.
[0095] Хаа4 представляет собой Tyr, Tyr(РО3), Thr, Ser, homoSer (гомосерин), azaTyr (аза-α1-гомо-Е-тирозин) или Ala. Согласно некоторым вариантам реализации Хаа4представляет собой гидроксилзамещенную аминокислоту, такую как Tyr, Ser или Thr, обычно, Tyr.
[0096] Хаа5 представляет собой Ile, Ala, Leu, norLeu. Val или Gly. Согласно некоторым вариантам реализации Хаа5 является алифатической аминокислотой, такой как Val, Leu, Не или Nle, обычно, Не.
[0097] Хаа6 представляет собой His, Arg или 6-NH2-Phe (6-аминофенилаланин). Согласно некоторым вариантам реализации Хаа6 является полностью или частично положительно заряженной аминокислотой, такой как Arg или His.
[0098] Хаа7 представляет собой Cys, Pro или Ala.
[0099] Согласно некоторым вариантам реализации одна или более из Хаа1-Хаа7идентичны соответствующей аминокислоте в природном Анг-(1-7). В некоторых таких вариантах реализации все, за исключением одной или двух из Хаа1-Хаа7, идентичны соответствующей аминокислоте в природном Анг-(1-7). В других вариантах реализации все из Хаа1-Хаа7 идентичны соответствующей аминокислоте в природном Анг-(1-7).
[00100] Согласно некоторым вариантам реализации Хаа3 представляет собой Nle. В том случае, если Хаа3 представляет собой Nle, одна или более из Хаа1-Хаа2 и Хаа4-7необязательно являются идентичными соответствующей аминокислоте в природном Анг-(1-7). В некоторых таких вариантах реализации все, за исключением одной или двух из Хаа1-Хаа2 и Хаа4-7, идентичны соответствующей аминокислоте в природном Анг-(1-7). В других вариантах реализации все из Хаа1-Хаа2 и Хаа4-7 идентичны соответствующей аминокислоте в природном Анг-(1-7), что приводит в результате к получению аминокислотной последовательности: Asp1-Arg2-Nle3-Tyr4-Ile5-His6-Pro7(SEQ ID NO: 5).
[00101] Согласно некоторым вариантам реализации такой пептид имеет аминокислотную последовательность Asp1-Arg2-Val3-Ser4-Ile5-His6-Cys7 (SEQ ID NO: 6) или Asp1-Arg2-Val3-Ser4-Ile5-His6-Cys7 (SEQ ID NO: 2).
[00102] Согласно некоторым вариантам реализации линейный пептид ангиотензина (1-7), описанный в настоящей заявке, представляет собой пептид, имеющий последовательность Asp1-Arg2-Val3-Tyr4-Ile5-His6-Pro7-Phe8-His9 (SEQ ID NO: 22), которая идентична последовательности Анг-(1-9). Согласно некоторым вариантам реализации пептид ангиотензина (1-7) является производным Анг-(1-9). Типичные пептиды Анг-(1-9), включая производные Анг-(1-9), описаны в публикации патентной заявки США №2012/0172301, сущность изобретения которой включена в настоящую заявку посредством ссылки.
[00103] Согласно некоторым вариантам реализации линейный пептид ангиотензина (1-7) представляет собой пептид, имеющий аминокислотную последовательность Ala1-Arg2-Val3-Tyr4-Ile5-His6-Pro7 (SEQ ID NO: 23). Дополнительные последовательности, полученные из SEQ ID NO: 23, приведены в европейской патентной заявке №2264048, сущность изобретения которой включена в настоящую заявку посредством ссылки. Примеры циклических пептидов ангиотензина (1-7)
[00104] Согласно некоторым аспектам в настоящем изобретении предложен циклический аналог пептида ангиотензина (1-7) (Анг-(1-7)), содержащий связь, например, между боковыми цепями аминокислот, соответствующих положениям Tyr4 и Pro7 в Анг. Такие аналоги пептидов, обычно, содержат 7 аминокислотных остатков, а также могут содержать отщепляемую последовательность. Как описано более подробно ниже, настоящее изобретение включает фрагменты и аналоги, в которых одна или более аминокислот замещены другой аминокислотой (включая фрагменты). Одним из примеров такого аналога является пептид Asp1-Arg2-Val3-Ser4-Ile5-His6-Cys7(SEQ ID NO: 6), в котором связь образована между Ser4 и Cys7.
[00105] Несмотря на то, что в разделе ниже аспекты настоящего изобретения описаны применительно к тиоэфирной связи, соединяющей ос татки в положениях 4 и 7, следует понимать, что другие связи (описанные выше) могут присутствовать вместо тиоэфирного мостика и что другие остатки могут быть циклизованы. Тиоэфирный мостик также называется моносульфидный мостик, или, в случае Ala-S-Ala, лантиониновый мостик. Пептиды, содержащие тиоэфирный мостик, могут быть образованы двумя аминокислотами, имеющими одну из следующих формул:


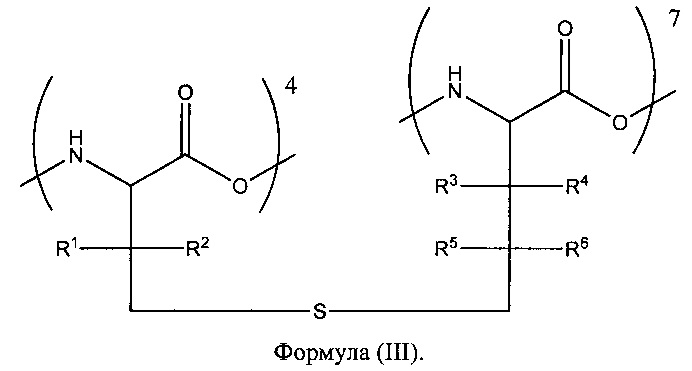
[00106] В данных формулах R1, R2, R3, R4, R5 и R6 независимо представляют собой -Н, алкил (например, C1-С6-алкил, С1-С4алкил) или аралкильную группу, причем алкильные и аралкильные группы возможно являются замещенными одной или более из галоген, -ОН или -NRR' групп (где R и R' независимо представляют собой -Н или С1-С4 алкил). Согласно некоторым вариантам реализации каждый из R1, R2, R3, R4, R5 и R6 независимо представляет собой -Н или -СН3, например, когда все заместители представляют собой -Н.
[00107] Согласно некоторым вариантам реализации в настоящем изобретении предложен аналог или производное Анг, содержащее тиоэфирный мостик в соответствии с формулой (I). Обычно R1, R2, R3 и R4 независимо выбраны из -Н и -СН3. Пептиды, содержащие тиоэфирный мостик в соответствии с формулой (I), могут быть получены, например, с помощью ферментов-лантибиотиков или удаления атома серы из дисульфида. В одном примере дисульфид, из которого экструдируют атом серы, может быть образован D-цистеином в положении 4 и L-цистеином в положении 7 или D-цистеином в положении 4 и L-пеницилламином в положении 7 (см., например, Galande, Trent and Spatola (2003) Biopolymers 71, 534-551).
[00108] Согласно другим вариантам реализации настоящего изобретения связь двух аминокислот может представлять собой мостики, приведенные в формуле (II) или формуле (III). Пептиды, содержащие тиоэфирный мостик в соответствии с формулой (II), могут быть получены, например, путем удаления атома серы из дисульфида, образованного D-гомоцистеином в положении 4 и L-цистеином в положении 7. Аналогичным образом, пептиды, содержащие тиоэфирный мостик в соответствии с формулой (III), могут быть получены, например, путем удаления атома серы из дисульфида, образованного D-цистеином в положении 4 и L-гомоцистеином в положении 7.
[00109] Как описано выше, аналоги и производные Анг согласно настоящему изобретению имеют различную длину и аминокислотный состав. Аналоги и производные Анг согласно настоящему изобретению предпочтительно обладают биологической активностью или являются неактивными молекулами-предшественниками, которые могут быть активированы в результате протеолиза (например, аналогично тому, как ангиотензин (I), содержащий 10 аминокислот, превращается в активные фрагменты при отщеплении 2-х аминокислот). Размер аналога или производного Анг может варьироваться, но обычно составляет от приблизительно 5 до 10 аминокислот, при условии, что сохраняется «центральный» пентамерный сегмент, содержащий 3-7 Nle-тиоэфирную кольцевую структуру. Аминокислотная последовательность аналога или производного согласно настоящему изобретению может изменяться, обычно, при условии, что он является биологически активным или может быть активирован в результате протеолиза. Биологическая активность аналога или производного может быть определена с использованием методов, известных в данной области техники, включая исследования связывания радиолиганда, количественные исследования активации клеток в условиях in vitro и эксперименты в условиях in vivo. См., например, Godeny and Sayeski, (2006) Am. J. Physiol. Cell. Physiol. 291: C1297-1307; Sarr et al., Cardiovasc. Res. (2006) 71: 794-802; и Koziarz et al., (1933) Gen. Pharmacol. 24: 705-713.
[00110] Аналоги и производные Анг, различающиеся только длиной пептида, включают следующие:
[00111] 4,7-циклизованный аналог, обозначенный [Cyc4-7]Анг-(1-7), являющийся производным природного Анг-(1-7) (Asp1-Arg2-Val3-Cyc4-Ile5-His6-Cyc7, SEQ ID NO: 7). 4,7-циклизованный аналог, обозначенный [Nle3, Cyc4-7]Анг-(1-10), являющийся производным природного ангиотензина I (Анг-(1-10)) (Asp1-Arg2-Nle3-Cyc4-Ile5-His6-Cyc7-Phe8-His9-Leu10, SEQ ID NO: 8);
4,7-циклизованный аналог, обозначенный [Nle3, Cyc4-7] Анг (1-8), являющийся производным природного ангиотензина II (Анг-(1-8)) (Asp1-Arg2-Nle3-Cyc4-Ile5-His6-Cyc7-Phe8, SEQ ID NO: 9);
4,7-циклизованный аналог, обозначенный [Nle3, Cyc4-7]Анг-(2-8), являющийся производным природного ангиотензина III (Анг-(2-8)) (Arg2-Nle3-Cyc4-Ile5-His6-Cyc7-Phe8, SEQ ID NO: 10);
4,7-циклизованный аналог, обозначенный [Nle3, Cyc4-7]Анг-(3-8), являющийся производным природного ангиотензина IV (Анг-(3-8)) (Nle3-Cyc4-Ile5-His6-Cyc7-Phe8, SEQ ID NO: 11);
4,7-циклизованный аналог, обозначенный [Nle3, Cyc4-7]-Анг-(1-7), являющийся производным природного Анг-(1-7) (Asp1-Arg2-Nle3-Cyc4-Ile5-His6-Cyc7, SEQ ID NO: 12); и
4,7-циклизованный аналог, обозначенный [Nle3, Cyc4-7] Анг (1-9), являющийся производным природного Анг-(1-9) (Asp1-Arg2-Nle3-Cyc4-Ile5-His6-Cyc7-Phe8-His9, SEQ ID NO: 13).
Указанные аналоги могут иметь один из тиоэфирных мостиков, показанных в формулах (I)-(III), в виде фрагмента Cyc4-7, например, где Cyc4 и Cyc7 представлены формулой (I), например, в которой каждый из R*-R4 представляет собой -Н или -СН3, обычно, -Н.
[00112] По сравнению с аминокислотной последовательностью природного пептида ангиотензина, аминокислоты в положениях 4 и 7 аналога Cyc4-7модифицированы, таким образом чтобы обеспечить введение тиоэфирных кольцевых структур, показанных выше. Помимо длины аналогов Анг, аминокислоты в положениях, отличных от 3, 4 и 7, могут быть такими же или отличаться от таковых в природном пептиде, обычно, при условии, что аналог сохраняет биологическую функцию. Для аналогов неактивных предшественников, таких как [Cyc4-7]Анг-(1-10), биологическая функция относится к одной или обеим из чувствительности аналога к ангиотензин-превращающим ферментам, которые могут расщеплять его с образованием биологически активного фрагмента (например Анг-(1-8) или Анг-(1-7)), или к биологической активности самого фрагмента. В некоторых вариантах реализации настоящего изобретения аналог или производное Анг согласно настоящему изобретению не имеет собственной функции, но ингибирует действие одного или более природных соединений ангиотензина.
[00113] В некоторых вариантах реализации настоящего изобретения аналог Анг согласно настоящему изобретению представлен формулой (IV):
[00114] Хаа1-Хаа2-Хаа3-Cyc4-Хаа5-Хаа6-Cyc7 (IV, SEQ ID NO: 14)
[00115] Хаа1 представляет собой любую аминокислоту, но, обычно, отрицательно заряженную аминокислоту, такую как Glu или Asp, наиболее часто Asp.
[00116] Хаа2 представляет собой положительно заряженную аминокислоту, такую как Arg или Lys, обычно, Arg.
[00117] Хаа3 представляет собой алифатическую аминокислоту, такую как Leu, Не или Val, обычно, Val.
[00118] Cyc4 образует тиоэфирный мостик с Cyc7. Cyc4 может представлять собой D-стереоизомер и/или L-стереоизомер, обычно, D-стереоизомер. Примеры Cyc4(взятого с Сус7) приведены в формулах (I), (II) и (III). Обычно группы R в формулах (I), (II) и (III) представляют собой -Н или -СНз, в частности, -Н.
[00119] Хаа5 представляет собой алифатическую аминокислоту, такую как Leu, Ile или Val, обычно, Ile.
[00120] Хаа6 представляет собой His.
[00121] Cyc7 образует тиоэфирный мостик с Cyc4, например, как в формуле (I), (II) или (III). Cyc7 может представлять собой D-стереоизомер и/или L-стереоизомер, обычно, L-стереоизомер. Примеры Cyc7 (взятого с Cyc4) приведены в формулах (I), (II), (III) и (IV). Как правило, группы R в формулах (I), (II),) и (III) и (IV) представляют собой -Н или -СНз, в частности, -Н.
[00122] Согласно некоторым вариантам реализации одна или более из Хаа1-Хаа6(исключая Cyc4 и Cyc7) идентичны соответствующим аминокислотам в природном Анг-(1-7). В некоторых таких вариантах реализации все, за исключением одной или двух Хаа1-Хаа6, идентичны соответствующей аминокислоте в природном Анг-(1-7). В других вариантах реализации все из Хаа1-Хаа6 идентичны соответствующей аминокислоте в природном Анг-(1-7).
[00123] Согласно некоторым вариантам реализации Cyc4 и Cyc7 независимо выбраны из Abu (2-аминомасляной кислоты) и Ala (аланина), причем Ala присутствует по меньшей мере в одном положении. Соответственно, циклические аналоги могут содержать тиоэфирную связь, образованную -Ala4-S-Ala7- (формула (I), где каждый из R1-R4 представляет собой -Н); -Ala4-S-Abu7- (формула (I), где R1-R3 представляют собой -Н и R4 представляет собой СН3) или -Abu4-S-Ala7- (формула (I), где R1, R3 и R4представляют собой -Н и R2 представляет собой -СН3). Конкретные примеры циклических аналогов включают связи -Abu4-S-Ala7- или -Ala4-S-Ala7-.
[00124] Согласно некоторым вариантам реализации в настоящем изобретении предложен аналог Анг-(1-7), содержащий тиоэфирный мостик между положением 4 и положением 7, который имеет аминокислотную последовательность Asp1-Arg2-Val3-Abu4-Ile5-His6-Ala7 (SEQ ID NO: 15) или аминокислотную последовательность Asp1-Arg2-Val3-Ala4-Ile5-His6-Ala7 (SEQ ID NO: 16), которые представлены следующими структурными схемами:


[00125] В некоторых вариантах реализации настоящего изобретения аналог или производное Анг согласно настоящему изобретению представлены формулой (V):
Xaa1-Xaa2-Nle3-Cyc4-Xaa5-Xaa6-Cyc7-Xaa8-Xaa9-Xaa10 (V, SEQ ID NO: 17)
Как обсуждалось выше, одна или более из Хаа1, Хаа2, Хаа8, Хаа9 и Хаа10 отсутствуют в некоторых вариантах реализации настоящего изобретения. Например, (1) Хаа10отсутствует, (2) Хаа9 и Хаа10 отсутствуют, (3) Хаа8, Хаа9 и Хаа10 отсутствуют, (4) Хаа1отсутствует, (5) Хаа1 и Хаа10 отсутствуют, (6) Хаа1, Хаа9 и Хаа10 отсутствуют, (7) Хаа1, Хаа8, Хаа9 и Хаа10 отсутствуют, (8) Хаа1 и Хаа2 отсутствуют, (9) Хаа1, Хаа2 и Хаа10отсутствуют, (10) Хаа1, Хаа2, Хаа9 и Хаа10 отсутствуют, или (11) Хаа1, Хаа2, Хаа8, Хаа9и Хаа10 отсутствуют. Для каждого из этих вариантов реализации остальные аминокислоты имеют характеристики, описанные ниже.
[00126] Хаа1, в случае когда она присутствует, представляет собой любую аминокислоту, но, обычно, отрицательно заряженную аминокислоту, такую как Glu или Asp, наиболее часто Asp.
[00127] Хаа2, в случае когда она присутствует, представляет собой положительно заряженную аминокислоту, такую как Arg или Lys, обычно, Arg.
[00128] Nle3 представляет собой норлейцин.
[00129] Cyc4 образует тиоэфирный мостик с Cyc7. Cyc4 может представлять собой D-стереоизомер и/или L-стереоизомер, обычно, D-стереоизомер. Примеры Cyc4 (взятого с Cyc7) приведены в формулах (I), (II) и (III). Как правило, группы R в формулах (I), (II) и (III) представляют собой -Н или -СН3, в частности, -Н.
[00130] Хаа5 представляет собой алифатическую аминокислоту, такую как Leu, Nle, Ile или Val, обычно, Ile.
[00131] Хаа6 представляет собой His.
[00132] Cyc7 образует тиоэфирный мостик с Cyc4, например, как в формуле (I), (II) или (III). Cyc7 может представлять собой D-стереоизомер и/или L-стереоизомер, обычно, L-стереоизомер. Примеры Cyc7 (взятого с Cyc4) приведены в формулах (I), (II) и (III). Как правило, группы R в формулах (I), (II) и (III) представляют собой -Н или -СН3, в частности, -Н.
[00133] Хаа8, в случае когда она присутствует, представляет собой аминокислоту, отличную от Pro, обычно, Phe или Ile. Согласно некоторым вариантам реализации Ile приводит к получению ингибитора Анг-(1-8). Согласно некоторым вариантам реализации Phe сохраняет биологическую активность Анг-(1-8) или Анг-(1-10).
[00134] Хаа9, в случае когда она присутствует, представляет собой His.
[00135] Хаа10, в случае когда она присутствует, представляет собой алифатический остаток, например, Ile, Val или Leu, обычно, Leu.
[00136] Согласно некоторым вариантам реализации одна или более из Хаа1-Хаа10(исключая Nle3, Cyc4 и Cyc7) идентична соответствующей аминокислоте в природном Анг (включая Анг-(1-7), Анг-(1-8), Анг-(1-9), Анг-(1-10), Анг-(2-7), Анг-(2-8), Анг-(2-9), Анг-(2-10), Анг-(3-8), Анг-(3-9) и Анг-(3-Ю). В некоторых таких вариантах реализации все, за исключением одной или двух из Хаа1-Хаа10 (для тех, которые присутствуют), идентичны соответствующей аминокислоте в природном Анг. В других вариантах реализации все из Хаа1-Хаа10 (для тех, которые присутствуют) идентичны соответствующей аминокислоте в природном Анг.
[00137] Согласно некоторым вариантам реализации Cyc4 и Cyc7 независимо выбраны из Abu (2-аминомасляной кислоты) и Ala (аланина), причем Ala присутствует по меньшей мере в одном положении. Соответственно, настоящее изобретение включает циклические аналоги, содержащие тиоэфирную связь, образованную -Ala4-S-Ala7- (формула (I), где каждый из R1-R4 представляет собой -Н); -Ala4-S-Abu7- (формула (I), где R1-R3 представляют собой -Н и R4 представляет собой -CH3) или -Ala4-S-Abu7-(формула (I), где R1, R3 и R4 представляют собой -Н и R2 представляет собой -СН3). Конкретные циклические аналоги содержат связь -Ala4-S-Abu7- или -Ala4-S-Abu7-.
[00138] В частности, в настоящем изобретении предложен аналог или производное Анг-(1-7), содержащее тиоэфирный мостик между положением 4 и положением 7, имеющее аминокислотную последовательность Asp1-Arg2-Nle3-Abu4-Ile5-His6-Ala7 (SEQ ID NO: 18) или аминокислотную последовательность Asp1-Arg2-Nle3-Ala4-Ile5-His6-Ala7 (SEQ ID NO: 19).
[00139] Согласно другому аспекту в настоящем изобретении предложен аналог или производное Анг-(1-8), содержащее тиоэфирный мостик между положением 4 и положением 7, имеющее антагонистическую активность в отношении Анг-(1-8), в частности, аналог или производное Анг-(1-8), имеющее аминокислотную последовательность Asp1-Arg2-Nle3-Abu4-Ile5-His6-Ala7-Ile8 (SEQ ID NO: 20) или аминокислотную последовательность Asp1-Arg2-Nle3-Ala4-Ile5-His6-Ala7-Ile8 (SEQ ID NO: 21).
[00140] Алкильная группа представляет собой полностью насыщенный, неразветвленный или разветвленный неароматический углеводород. Обычно неразветвленная или разветвленная алкильная группа содержит от 1 до приблизительно 20 атомов углерода, предпочтительно от 1 до приблизительно 10 атомов углерода. Примеры неразветвленных и разветвленных алкильных групп включают метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил, пентил, гексил, пентил и октил. С1-С4 неразветвленная или разветвленная алкильная группа также называется «низший алкил».
[00141] Аралкильная группа представляет собой алкильную группу, замещенную арильной группой. Ароматические (арильные) группы включают карбоциклические ароматические группы, такие как фенил, нафтил и антрацил, и гетероарильные группы, такие как имидазолил, тиенил, фурил, пиридил, пиримидил, пиранил, пиразолил, пирролил, пиразинил, тиазолил, оксазолил и тетразолил. Ароматические группы также включают конденсированные полициклические ароматические кольцевые системы, в которых карбоциклическое ароматическое кольцо или гетероарильное кольцо конденсировано с одним или большим числом других гетероарильных колец. Примеры включают бензотиенил, бензофурил, индолил, хинолинил, бензотиазол, бензоксазол, бензимидазол, хинолинил, изохинолинил и изоиндолил.
Агонисты рецептора Анг-(1 -7)
[00142] Согласно некоторым вариантам реализации в настоящем изобретении предложены способы лечения состояний головного мозга, включающие введение субъекту, который страдает или восприимчив к одному или большему числу из состояний головного мозга, агониста рецептора ангиотензина (1-7). В настоящей заявке термин «агонист рецептора ангиотензина (1-7)» включает любую молекулу, которая оказывает положительное влияние на функцию рецептора ангиотензина (1-7), в частности, связанного с G-белком рецептора Mas. Согласно некоторым вариантам реализации агонист рецептора ангиотензина (1-7) непосредственно или косвенно повышает, усиливает, активирует и/или увеличивает активность рецептора ангиотензина (1-7) (т.е. рецептора Mas). Согласно некоторым вариантам реализации агонист рецептора ангиотензина (1-7) непосредственно взаимодействует с рецептором ангиотензина (1-7) (т.е. рецептором Mas). Такие агонисты могут быть пептидными или непептидными, включая, например, белки, химические соединения, небольшие молекулы, нуклеиновые кислоты, антитела, лекарственные препараты, лиганды или другие агенты. Согласно некоторым вариантам реализации агонист рецептора ангиотензина (1-7) является непептидным агонистом.
[00143] Типичным классом агонистов рецептора ангиотензина (1-7) являются 1-(п-тиенилбензил)имидазолы. Примеры таких непептидных агонистов рецепторов ангиотензина (1-7) представлены структурной формулой (VI):

или ее фармацевтически приемлемыми солями, где:
R1 представляет собой галоген, гидроксил, (С1-С4)-алкокси, (С1-С8)-алкокси, в котором от 1 до 6 атомов углерода замещены гетероатомами О, S или NH (предпочтительно О), (С1-С4)-алкокси, замещенный насыщенным циклическим эфиром, таким как тетрагидропиран и тетрагидрофуран, O-(С1-С4)-алкенил, O-(С1-С4)-алкиларил или арилокси, который не имеет заместителей или замещен заместителем, выбранным из галогена, (С1-С3)-алкила, (С1-С3)-алкокси и трифторметила;
R2 представляет собой СНО, СООН или (3) СО-O-(С1-С4)-алкил;
R3 представляет собой (С1-С4)-алкил или арил;
R4 представляет собой водород, галоген (хлор, бром, фтор) или (С1-С4)-алкил;
X представляет собой кислород или серу;
Y представляет собой кислород или -NH-;
R5 представляет собой водород, (С1-С6)-алкил; или (С1-C4)-алкиларил, где R5представляет собой водород, в том случае, когда Y представляет NH-; и
R6 представляет собой (С1-С5)-алкил.
[00144] Согласно некоторым вариантам реализации R1 не является галогеном, в том случае, если R2 представляет собой СООН или СО-O-(С1-С4)-алкил.
[00145] Согласно некоторым вариантам реализации агонист рецептора ангиотензина (1-7) представляет собой AVE 0991, 5-формил-4-метокси-2-фенил-1[[4-[2-(этиламинокарбонилсульфонамидо)-5-изобутил-3-тиенил]-фенил]-метил]-имидазол, который представлен следующей структурой:
[00146] Другим примеров классов агонистов рецептора ангиотензина (1-7) являются п-тиенилбензиламиды. Примеры таких непептидных агонистов рецептора ангиотензина (1-7) представлены структурной формулой (VII):

или ее фармацевтически приемлемой солью, где:
R1 представляет собой (С1-С5)-алкил, который не имеет заместителей или замещен радикалом, выбранным из NH2, галогена, O-(С1-С3)-алкила, СО-O-(С1-С3)-алкила и CO2H, (С3-С8)-циклоалкил, (С1-С3)-алкил-(С3-С8)-циклоалкил, (С6-С10)-арил, который не имеет заместителей или замещен радикалом, выбранным из галогена и O-(С1-С3)-алкила, (С1-С3)-алкил-(С6-С10)-арил, в котором арильный радикал является незамещенным или замещенным радикалом, выбранным из галогена и O-(С1-С3)-алкила, (С1-С3)-гетероарил или (С1-С3)-алкил-(С1-С5)-гетероарил;
R2 представляет собой водород, (С1-С6)-алкил, который не имеет заместителей или замещен радикалом, выбранным из галогена и O-(С1-С3)-алкила, (С3-С8)-циклоалкил, (С1-С3)-алкил-(С3-С8)-циклоалкил, (С6-С10)-арил, который не имеет заместителей или замещен радикалом, выбранным из галогена, O-(С1-С3)-алкила и СО-O-(С1-С3)-алкила, или (С1-С3)-алкил-(С6-С10)-арил, который не имеет заместителей или замещен радикалом, выбранным из галогена и O-(С1-С3)-алкила;
R3 представляет собой водород, СООН или СОО-(С1-С4)-алкил;
R4 представляет собой водород, галоген; или (С1-С4)-алкил;
R5 представляет собой водород или (С1-С6)-алкил;
R6 представляет собой водород, (С1-С6)-алкил, (С1-С3)-алкил-(С3-С8)-циклоалкил или (С2-С6)-алкенил; и
X представляет собой кислород или NH.
[00147] Дополнительные примеры агонистов рецептора ангиотензина (1-7) описаны в патенте США №6235766, содержание которого включено в настоящую заявку посредством ссылки.
[00148] Различные агонисты рецептора ангиотензина (1-7), описанные выше, могут присутствовать в виде фармацевтически приемлемых солей. В настоящей заявке термин «фармацевтически приемлемая соль» относится к солям, которые сохраняют желаемую активность пептида или эквивалентного соединения, но предпочтительно не оказывают отрицательного влияния на активность пептида или другого компонента системы, в которой используется пептид. Примеры таких солей включают соли присоединения кислот, образованные с неорганическими кислотами, например, хлористоводородной кислотой, бромистоводородной кислотой, серной кислотой, фосфорной кислотой, азотной кислотой и т.п. Соли также могут быть образованы с органическими кислотами, такими как, например, уксусная кислота, щавелевая кислота, винная кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, глюконовая кислота, лимонная кислота, яблочная кислота, аскорбиновая кислота, бензойная кислота, дубильная кислота, памовая кислота, альгиновая кислота, полиглутаминовая кислота и т.п. Соли, образованные из катионного материала, могут использовать конъюгированное основание этих неорганических и органических кислот. Соли также могут быть образованы с катионами поливалентных металлов, таких как цинк, кальций, висмут, барий, магний, алюминий, медь, кобальт, никель и тому подобное, или с органическим катионом, образованным из N,N'-дибензилэтилендиамина или этилендиамина, или их комбинациями (например, таннат цинка). Предпочтительными являются нетоксичные, физиологически приемлемые соли.
[00149] Соли могут быть получены обычными средствами, например, путем взаимодействия продукта в форме свободной кислоты или свободного основания с одним или более эквивалентами соответствующей кислоты или основания в растворителе или среде, в которой соль нерастворима, или в растворителе, таком как вода, который затем удаляют в вакууме или путем сублимационной сушки, или путем обмена катионов существующей соли на другой катион на подходящей ионообменной смоле.
[00150] Алкильная группа представляет собой полностью насыщенный, неразветвленный или разветвленный неароматический углеводород. Обычно неразветвленная или разветвленная алкильная группа содержит от 1 до приблизительно 20 атомов углерода, предпочтительно от 1 до приблизительно 10 атомов углерода. Примеры неразветвленных и разветвленных алкильных групп включают метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил, пентил, гексил, пентил и октил. С1-С4 неразветвленная или разветвленная алкильная группа также называется «низший алкил».
[00151] Алкенильная группа представляет собой неразветвленный или разветвленный неароматический углеводород, который содержит одну или более двойных связей. Как правило, неразветвленная или разветвленная алкенильная группа содержит от 2 до приблизительно 20 атомов углерода, предпочтительно от 2 до 10 атомов углерода. Примеры неразветвленных и разветвленных алкенильных групп включают этенил, н-пропенил и н-бутенил.
[00152] Ароматические (арильные) группы включают карбоциклические ароматические группы, такие как фенил, нафтил и антрацил, и гетероарильные группы, такие как имидазолил, тиенил, фурил, пиридил, пиримидил, пиранил, пиразолил, пирролил, пиразинил, тиазолил, оксазолил и тетразолил. Ароматические группы также включают конденсированные полициклические ароматические кольцевые системы, в которых карбоциклическое ароматическое кольцо или гетероарильное кольцо конденсировано с одним или более другими гетероарильными кольцами. Примеры включают бензотиенил, бензофурил, индолил, хинолинил, бензотиазол, бензоксазол, бензимидазол, хинолинил, изохинолинил и изоиндолил.
[00153] Аралкильная группа представляет собой алкильную группу, замещенную арильной группой.
Составы
[00154] В соответствии со способами согласно настоящему изобретению пептид Анг (1-7) или агонист рецептора ангиотензина (1-7), описанные в настоящем изобретении, могут быть введены субъекту по отдельности (например, в виде очищенного пептида или соединения) или в качестве компонента композиции или лекарственного средства (например, при изготовлении лекарственного средства для лечения состояния), как описано в настоящей заявке. Композиции могут быть приготовлены с физиологически приемлемым носителем или вспомогательным веществом для получения фармацевтической композиции. Носитель и композиция могут быть стерильными. Состав должен соответствовать способу введения, например, внутривенному или подкожному способу введения. Способы приготовления композиций известны в данной области техники (см., например, Remington's Pharmaceuticals Sciences, 17th Edition, Mack Publishing Co., (Alfonso R. Gennaro, editor) (1989)).
[00155] Пригодные фармацевтически приемлемые носители включают, но не ограничиваются следующими: воду, солевые растворы (например, NaCl), физиологический раствор, забуференный физиологический раствор, спирты, глицерин, этанол, гуммиарабик, растительные масла, бензиловые спирты, полиэтиленгликоли, желатин, углеводы, такие как лактоза, амилоза или крахмал, сахара, такие как маннит, сахароза или другие, декстрозу, стеарат магния, тальк, кремниевую кислоту, вязкий парафин, парфюмерное масло, сложные эфиры жирных кислот, гидроксиметилцеллюлозу, поливинилпирролидон и т.п., а также их комбинации. Фармацевтические препараты можно, если это необходимо, смешивать со вспомогательными веществами (например, смазывающими веществами, консервантами, стабилизаторами, смачивающими агентами, эмульгаторами, солями для влияния на осмотическое давление, буферами, красителями и/или ароматическими веществами и т.п.), которые не взаимодействуют отрицательным образом с активными соединениями или не ухудшают их активность. В предпочтительном варианте реализации используют водорастворимый носитель, пригодный для внутривенного введения.
[00156] Композиция или лекарственное средство, если это необходимо, может также содержать незначительные количества смачивающих или эмульгирующих агентов или рН-буферные агенты. Композиция может представлять собой жидкий раствор, суспензию, эмульсию, состав с пролонгированным высвобождением или порошок. Композиция также может быть приготовлена в виде суппозитория со стандартными связывающими веществами и носителями, такими как триглицериды.
[00157] Композиция или лекарственное средство могут быть приготовлены в соответствии со стандартными процедурами в виде фармацевтической композиции, адаптированной для введения человеку. Например, в предпочтительном варианте реализации, композиция для внутривенного введения, обычно, представляет собой раствор в стерильном изотоническом водном буфере. В тех случаях, когда это необходимо, композиция может также содержать солюбилизирующий агент и местный анестетик для облегчения боли в месте инъекции. В целом, ингредиенты доставляются по отдельности либо в смеси в составе стандартной лекарственной формы, например, в виде сухого лиофилизированного порошка или безводного концентрата в герметично закрытом контейнере, таком как ампула или саше, с указанием количества активного агента. В том случае, когда композиция предназначена для введения путем инфузии, она может распределяться с инфузионным флаконом, содержащим стерильную воду фармацевтической чистоты, физиологический раствор или декстрозу/воду. В том случае, когда композицию вводят путем инъекции, может быть обеспечена ампула со стерильной водой для инъекций или физиологическим раствором, что обеспечивает возможность смешивания ингредиентов перед введением.
[00158] Пептид Анг-(1-7) или агонист рецептора ангиотензина (1-7), описанные в настоящей заявке, могут быть изготовлены в нейтральных или солевых формах. Фармацевтически приемлемые соли включают соли, образованные со свободными аминогруппами, такие как соли, которые получены при реакции с хлористоводородной, фосфорной, уксусной, щавелевой, винной кислотами и т.д., и соли, образованные со свободными карбоксильными группами, такие как соли, полученные при реакции с гидроксидами натрия, калия, аммония, кальция, железа, а также изопропиламином, триэтиламином, 2-этиламиноэтанолом, гистидином, прокаином и т.н.
[00159] Пептид Анг-(1-7) или агонист рецептора ангиотензина (1-7), описанные в настоящей заявке (композицию или лекарственное средство, содержащее пептид Анг-(1-7) или агонист рецептора ангиотензина (1-7), описанные в настоящей заявке), вводят любым подходящим путем. Согласно некоторым вариантам реализации пептид Анг-(1-7) или агонист рецептора ангиотензина (1-7), описанные в настоящей заявке, вводят подкожно. В настоящей заявке термин «подкожная ткань» определяется как слой рыхлой, нерегулярной соединительной ткани, расположенный непосредственно под кожей. Например, подкожное введение может быть выполнено путем инъекции композиции в различные области, включая, но не ограничиваясь ими, область бедра, брюшную полость, область ягодиц или область лопатки. Согласно некоторым вариантам реализации пептид Анг-(1-7) или агонист рецептора ангиотензина (1-7), описанные в настоящей заявке, вводят внутривенно. В другом варианте пептид Анг-(1-7) или агонист рецептора ангиотензина (1-7), описанные в настоящей заявке (композицию или лекарственное средство, содержащее пептид Анг-(1-7) или агонист рецептора ангиотензина (1-7), описанные в настоящей заявке), можно вводить путем ингаляции, парентерально, интрадермально, трансдермально, ректально или через слизистую. Одновременно можно использовать более одного способа ведения, если это необходимо.
[0160] Согласно некоторым вариантам реализации композицию вводят в терапевтически эффективном количестве и/или в соответствии со схемой дозирования, которая согласуется с конкретным желаемым результатом (например, лечением или снижением риска ишемического инсульта).
[0161] Конкретные дозы или количества, предназначенные для введения в соответствии с настоящим изобретением, могут изменяться, например, в зависимости от характера и/или степени желаемого результата, от особенностей способа и/или времени введения, и/или от одной или более характеристик (например, вес, возраст, анамнез, генетические характеристики, параметры образа жизни, степень тяжести нарушения функции сердца и/или уровень риска нарушения функции сердца и т.п., или их комбинации). Такие дозы или количества могут быть определены специалистом. Согласно некоторым вариантам реализации соответствующая доза или количество определяется в соответствии со стандартными клиническими методиками. Например, согласно некоторым вариантам реализации соответствующая доза или количество представляет собой дозу или количество, достаточное для снижения оценки по индексу для определения степени тяжести состояния на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100% или более. Например, согласно некоторым вариантам реализации соответствующая доза или количество представляет собой дозу или количество, достаточное для снижения оценки по индексу для определения степени тяжести состояния на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100%. В качестве альтернативы или дополнения согласно некоторым вариантам реализации, соответствующая доза или количество определяется с помощью одного или более методов количественных исследований в условиях in vitro или in vivo, чтобы облегчить определение величины желательных или оптимальных диапазонов дозировки или количеств для введения.
[00162] В различных вариантах реализации пептид Анг-(1-7) или агонист рецептора ангиотензина (1-7) вводят в терапевтически эффективном количестве. В настоящей заявке термин «терапевтически эффективное количество» в значительной степени определяется на основании общего количества терапевтического агента, содержащегося в фармацевтических композициях согласно настоящему изобретению. Обычно терапевтически эффективное количество является достаточным для достижения значимой пользы для субъекта (например, лечение, модуляция, излечение, профилактика и/или облегчение основного состояния или состояния). В некоторых конкретных вариантах реализации соответствующие дозы или количества для введения, могут быть экстраполированы по кривым доза-ответ, полученных в системах исследования в условиях in vitro и на животных моделях.
[00163] Терапевтически эффективные дозы пептидов ангиотензина (1-7) или агонистов рецепторов ангиотензина (1-7), включая производные, аналоги и/или соли, могут присутствовать в различных количествах в различных вариантах реализации. Например, в некоторых вариантах реализации, терапевтически эффективное количество пептида ангиотензина (1-7) может представлять собой количество, варьирующееся от приблизительно 10 до 1000 мг (например, приблизительно 20 мг-1000 мг, 30 мг-1000 мг, 40 мг-1000 мг, 50 мг-1000 мг, 60 мг-1000 мг, 70 мг-1000 мг, 80 мг-1000 мг, 90 мг-1000 мг, приблизительно 10-900 мг, 10-800 мг, 10-700 мг, 10-600 мг, 10-500 мг, 100-1000 мг, 100-900 мг, 100-800 мг, 100-700 мг, 100-600 мг, 100-500 мг, 100-400 мг, 100-300 мг, 200-1000 мг, 200-900 мг, 200-800 мг, 200-700 мг, 200-600 мг, 200-500 мг, 200-400 мг, 300-1000 мг, 300-900 мг, 300-800 мг, 300-700 мг, 300-600 мг, 300-500 мг, 400 мг-1000 мг, 500 мг-1000 мг, 100 мг-900 мг, 200 мг-800 мг, 300 мг-700 мг, 400 мг-700 мг и 500 мг-600 мг). Согласно некоторым вариантам реализации пептид ангиотензина (1-7) или агонист рецептора ангиотензина (1-7) присутствует в количестве равном или превышающем приблизительно 10 мг, 50 мг, 100 мг, 150 мг, 200 мг, 250 мг, 300 мг, 350 мг, 400 мг, 450 мг, 500 мг, 550 мг, 600 мг, 650 мг, 700 мг, 750 мг, 800 мг. Согласно некоторым вариантам реализации пептид ангиотензина (1-7) или агонист рецептора ангиотензина (1-7) присутствует в количестве равном или менее приблизительно 1000 мг, 950 мг, 900 мг, 850 мг, 800 мг, 750 мг, 700 мг, 650 мг, 600 мг, 550 мг, 500 мг, 450 мг, 400 мг, 350 мг, 300 мг, 250 мг, 200 мг, 150 мг или 100 мг. Согласно некоторым вариантам реализации терапевтически эффективное количество, описанное в настоящей заявке, обеспечивается в виде однократной дозы. Согласно некоторым вариантам реализации терапевтически эффективное количество, описанное в настоящей заявке, обеспечивается для введения в течение одних суток.
[00164] В других вариантах реализации терапевтически эффективная величина дозы может составлять, например, приблизительно от 0,001 мг/кг массы тела до 500 мг/кг массы тела, например, от приблизительно 0,001 мг/кг массы тела до 400 мг/кг массы тела, от приблизительно 0,001 мг/кг массы тела до 300 мг/кг массы тела, от приблизительно 0,001 мг/кг массы тела до 200 мг/кг массы тела, от приблизительно 0,001 мг/кг массы тела до 100 мг/кг массы тела, от приблизительно 0,001 мг/кг массы тела до 90 мг/кг массы тела, от приблизительно 0,001 мг/кг массы тела до 80 мг/кг массы тела, от приблизительно 0,001 мг/кг массы тела до 70 мг/кг массы тела, от приблизительно 0,001 мг/кг массы тела до 60 мг/кг массы тела, от приблизительно 0,001 мг/кг массы до 50 мг/кг массы тела, от приблизительно 0,001 мг/кг массы тела до 40 мг/кг массы тела, от приблизительно 0,001 мг/кг массы тела до 30 мг/кг массы тела, от приблизительно 0,001 мг/кг массы тела до 25 мг/кг массы, от приблизительно 0,001 мг/кг массы тела до 20 мг/кг массы тела, от приблизительно 0,001 мг/кг массы тела до 15 мг/кг массы тела, от приблизительно 0,001 мг/кг массы тела до 10 мг/кг массы тела. Согласно некоторым вариантам реализации терапевтически эффективное количество, описанное в настоящей заявке, обеспечивается в виде однократной дозы. Согласно некоторым вариантам реализации терапевтически эффективное количество, описанное в настоящей заявке, обеспечивается для введения в течение одних суток.
[00165] В других вариантах реализации терапевтически эффективная величина дозы может составлять, например, от приблизительно 0,001 мг/кг массы тела до приблизительно 1 мг/кг массы тела, например, от приблизительно 0,001 мг/кг массы тела до приблизительно 0,9 мг/кг массы тела, от приблизительно 0,001 мг/кг массы тела до приблизительно 0,8 мг/кг массы тела, от приблизительно 0,001 мг/кг массы до приблизительно 0,7 мг/кг массы тела, от приблизительно 0,001 мг/кг массы тела до приблизительно 0,6 мг/кг массы тела, от приблизительно 0,001 мг/кг массы тела до приблизительно 0,5 мг/кг массы тела, от приблизительно 0,01 мг/кг массы тела до приблизительно 1 мг/кг массы тела, от приблизительно 0,01 мг/кг массы тела до приблизительно 0,9 мг/кг массы тела, от приблизительно 0,01 мг/кг массы тела до приблизительно 0,8 мг/кг массы тела, от приблизительно 0,01 мг/кг массы тела до приблизительно 0,7 мг/кг массы тела, от приблизительно 0,01 мг/кг массы тела до приблизительно 0,6 мг/кг массы тела, от приблизительно 0,01 мг/кг массы тела до приблизительно 0,5 мг/кг массы тела, от приблизительно 0,02 мг/кг массы тела до приблизительно 1 мг/кг массы тела, от приблизительно 0,02 мг/кг массы до приблизительно 0,9 мг/кг массы тела, от приблизительно 0,02 мг/кг массы тела до приблизительно 0,8 мг/кг массы тела, от приблизительно 0,02 мг/кг массы тела до приблизительно 0,7 мг/кг массы тела, от приблизительно 0,02 мг/кг массы тела до приблизительно 0,6 мг/кг массы тела, от приблизительно 0,02 мг/кг массы тела до приблизительно 0,5 мг/кг массы тела, от приблизительно 0,03 мг/кг массы тела до приблизительно 1 мг/кг массы тела, от приблизительно 0,03 мг/кг массы тела до приблизительно 0,9 мг/кг массы тела, от приблизительно 0,03 мг/кг массы тела до приблизительно 0,8 мг/кг массы тела, от приблизительно 0,03 мг/кг массы тела до приблизительно 0,7 мг/кг массы тела, от приблизительно 0,03 мг/кг массы тела до приблизительно 0,6 мг/кг массы тела, от приблизительно 0,03 мг/кг массы до приблизительно 0,5 мг/кг массы тела, от приблизительно 0,04 мг/кг массы тела до приблизительно 1 мг/кг массы тела, от приблизительно 0,04 мг/кг массы тела до приблизительно 0,9 мг/кг массы тела, от приблизительно 0,04 мг/кг массы тела до приблизительно 0,8 мг/кг массы тела, от приблизительно 0,04 мг/кг массы тела до приблизительно 0,7 мг/кг массы тела, от приблизительно 0,04 мг/кг массы тела до приблизительно 0,6 мг/кг массы тела, от приблизительно 0,04 мг/кг массы тела до приблизительно 0,5 мг/кг массы тела, от приблизительно 0,05 мг/кг массы тела до приблизительно 1 мг/кг массы тела, от приблизительно 0,05 мг/кг массы тела до приблизительно 0,9 мг/кг массы тела, от приблизительно 0,05 мг/кг массы тела до приблизительно 0,8 мг/кг массы, от приблизительно 0,05 мг/кг массы до приблизительно 0,7 мг/кг массы, от приблизительно 0,05 мг/кг массы тела до приблизительно 0,6 мг/кг массы тела, от приблизительно 0,05 мг/кг массы тела до приблизительно 0,5 мг/кг массы тела. Согласно некоторым вариантам реализации терапевтически эффективное количество, описанное в настоящей заявке, вводят в одной дозе. Согласно некоторым вариантам реализации терапевтически эффективное количество, описанное в настоящей заявке, вводят за один день.
[00166] В других вариантах терапевтически эффективная величина дозы может составлять, например, от приблизительно 0,0001 мг/кг массы тела до 0,1 мг/кг массы тела, например, от приблизительно 0,0001 мг/кг массы тела до 0,09 мг/кг массы, от приблизительно 0,0001 мг/кг массы тела до 0,08 мг/кг массы, от приблизительно 0,0001 мг/кг массы тела до 0,07 мг/кг массы, от приблизительно 0,0001 мг/кг массы тела до 0,06 мг/кг массы тела, от приблизительно 0,0001 мг/кг массы тела до 0,05 мг/кг массы тела, от приблизительно 0,0001 мг/кг массы тела до приблизительно 0,04 мг/кг массы тела, от приблизительно 0,0001 мг/кг массы тела до 0,03 мг/кг массы тела, от приблизительно 0,0001 мг/кг массы тела до 0,02 мг/кг массы тела, от приблизительно 0,0001 мг/кг массы тела до 0,019 мг/кг массы тела, от приблизительно 0,0001 мг/кг массы тела до 0,018 мг/кг массы тела, от приблизительно 0,0001 мг/кг массы тела до 0,017 мг/кг массы тела, от приблизительно 0,0001 мг/кг массы тела до 0,016 мг/кг массы тела, от приблизительно 0,0001 мг/кг массы тела до 0,015 мг/кг массы тела, от приблизительно 0,0001 мг/кг массы тела до 0,014 мг/кг массы тела, от приблизительно 0,0001 мг/кг массы тела до 0,013 мг/кг массы тела, от приблизительно 0,0001 мг/кг массы тела до 0,012 мг/кг массы тела, от приблизительно 0,0001 мг/кг массы тела до 0,011 мг/кг массы тела, от приблизительно 0,0001 мг/кг массы тела до 0,01 мг/кг массы тела, от приблизительно 0,0001 мг/кг массы тела до 0,009 мг/кг массы тела, от приблизительно 0,0001 мг/кг массы тела до 0,008 мг/кг массы тела, от приблизительно 0,0001 мг/кг массы тела до 0,007 мг/кг массы тела, от приблизительно 0,0001 мг/кг массы до 0,006 мг/кг массы, от приблизительно 0,0001 мг/кг массы тела до 0,005 мг/кг массы тела, от приблизительно 0,0001 мг/кг массы тела до 0,004 мг/кг массы тела, от приблизительно 0,0001 мг/кг массы тела до 0,003 мг/кг массы тела, от приблизительно 0,0001 мг/кг массы тела до 0,002 мг/кг массы тела. Согласно некоторым вариантам реализации терапевтически эффективная доза может составлять 0,0001 мг/кг массы тела, 0,0002 мг/кг массы тела, 0,0003 мг/кг массы тела, 0,0004 мг/кг массы тела, 0,0005 мг/кг массы тела, 0,0006 мг/кг массы тела, 0,0007 мг/кг массы тела, 0,0008 мг/кг массы тела, 0,0009 мг/кг массы тела, 0,001 мг/кг массы тела, 0,002 мг/кг массы тела, 0,003 мг/кг массы тела, 0,004 мг/кг массы тела, 0,005 мг/кг массы тела, 0,006 мг/кг массы тела, 0,007 мг/кг массы тела, 0,008 мг/кг массы тела, 0,009 мг/кг массы тела, 0,01 мг/кг массы тела, 0,02 мг/кг массы тела, 0,03 мг/кг массы тела, 0,04 мг/кг массы тела, 0,05 мг/кг массы тела, 0,06 мг/кг массы тела, 0,07 мг/кг массы тела, 0,08 мг/кг массы тела, 0,09 мг/кг массы тела или 0,1 мг/кг массы тела. Эффективная доза для конкретного индивидуума может варьировать (например, увеличиваться или уменьшаться) с течением времени, в зависимости от потребностей индивидуума.
[00167] Согласно некоторым вариантам реализации пептид ангиотензина (1-7) вводят в эффективной дозе, варьирующей от приблизительно 1 до 1000 мкг/кг/сутки (например, находящейся в пределах приблизительно 1-900 мкг/кг/сутки, 1-800 мкг/кг/сутки, 1-700 мкг/кг/сутки, 1-600 мкг/кг/сутки, 1-500 мкг/кг/сутки, 1-400 мкг/кг/сутки, 1-300 мкг/кг/сутки, 1-200 мкг/кг/сутки, 1-100 мкг/кг/сутки, 1-90 мкг/кг/сутки, 1-80 мкг/кг/сутки, 1-70 мкг/кг/сутки, 1-60 мкг/кг/сутки, 1-50 мкг/кг/сутки, 1-40 мкг/кг/сутки, 1-30 мкг/кг/сутки, 1-20 мкг/кг/сутки, 1-10 мкг/кг/сутки). Согласно некоторым вариантам реализации пептид ангиотензина (1-7) вводят в эффективной дозе, находящейся в диапазоне от приблизительно 1 до 500 мкг/кг/сутки. Согласно некоторым вариантам реализации пептид ангиотензина (1-7) вводят в эффективной дозе, находящейся в диапазоне от приблизительно 1 до 100 мкг/кг/сутки. Согласно некоторым вариантам реализации пептид ангиотензина (1-7) вводят в эффективной дозе, находящейся в диапазоне от приблизительно 1 до 60 мкг/кг/сутки. Согласно некоторым вариантам реализации пептид ангиотензина (1-7) вводят в эффективной дозе, выбранной из приблизительно 1, 2, 4, 6, 8, 10, 15, 20, 25, 30, 35, 40, 45, 50, 75, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950 или 1000 мкг/кг/сутки.
Схемы дозирования
[00168] Различные варианты реализации настоящего изобретения могут включать различающиеся схемы дозирования. Согласно некоторым вариантам реализации пептид ангиотензина (1-7) или агонист рецептора ангиотензина (1-7) вводят посредством непрерывной инфузии. Согласно некоторым вариантам реализации непрерывная инфузия является внутривенной. В других вариантах реализации настоящего изобретения непрерывная инфузия является подкожной. В качестве альтернативы или дополнительно согласно некоторым вариантам реализации, пептид ангиотензина (1-7) или агонист рецептора ангиотензина (1-7) вводят раз в два месяца, один раз в месяц, два раза в месяц, один раз в три недели, один раз в две недели, один раз в неделю, два раза в неделю, три раза в неделю, один раз в сутки, два раза в сутки или в соответствии с другой схемой дозирования, желаемой с клинической точки зрения. Схема дозирования для одного субъекта не обязательно должна иметь фиксированный интервал, и может быть изменена с течением времени, в зависимости от потребностей субъекта.
Комбинированные методы лечения
[00169] Согласно некоторым вариантам реализации пептид Анг-(1-7) или агонист рецептора ангиотензина (1-7) будет применяться в качестве части комбинированной терапии. Предполагается, что любой известный лекарственный препарат или средство лечения одного или более состояний головного мозга может применяться с одним или большим числом пептидов Анг-(1-7) или агонистов рецептора ангиотензина (1-7), раскрытых в настоящей заявке. Примеры соединений, которые могут использоваться с одним или более пептидов Анг-(1-7) или агонистов рецептора ангиотензина (1-7) в виде комбинированной терапии, включают, но не ограничиваются следующими: тромболитические соединения, антиоксиданты или другие агенты, реагирующие на активные формы кислорода, интерферон бета-1а (например, авонекс, ребиф, циновекс, рециген), интерферон бета-1b (бетасерон), ацетат глатирамера (копаксон), митоксантрон (новантрон), натализумаб (тизабри), финголимод (гилениа), первый доступный оральный лекарственный препарат, и терифлуномид (обаджио), или их комбинации.
Наборы
[00170] Согласно некоторым вариантам реализации в настоящем изобретении дополнительно предложены наборы или другие изделия, которые содержат пептид Анг-(1-7), агонист рецептора ангиотензина (1-7) или состав, содержащий их, и предложены инструкции для их восстановления (для лиофилизированной формы) и/или использования. Наборы или другие изделия могут включать контейнер, шприц, флакон и любые другие изделия, устройства или оборудование, пригодные для введения (например, подкожно, путем ингаляции). Подходящие контейнеры включают, например, бутылки, флаконы, шприцы (например, предварительно заполненные шприцы), ампулы, картриджи, резервуары или шприцы Lyo-Ject®. Контейнер может быть выполнен из различных материалов, таких как стекло или пластик. Согласно некоторым вариантам реализации контейнер представляет собой предварительно заполненный шприц. Подходящие предварительно заполненные шприцы включают, но не ограничиваются следующими: шприцы из боросиликатного стекла с обожженным силиконовым покрытием, шприцы из боросиликатного стекла с напыленным силиконовым покрытием или пластиковые шприцы из смол без силикона.
[00171] Как правило, контейнер может содержать составы и этикетку на контейнере, или связанную с ним, на которой могут быть указаны инструкции для восстановления и/или использования. Например, на этикете может быть указано, что состав восстанавливают до концентраций, описанных выше. На этикете может быть дополнительно указано, что состав пригоден или предназначен, например, для подкожного введения. Согласно некоторым вариантам реализации контейнер может содержать однократную дозу стабильного состава, содержащего пептид Анг-(1-7) или агонист рецептора ангиотензина (1-7). В различных вариантах реализации настоящего изобретения однократная доза стабильного состава присутствует в объеме менее приблизительно 15 мл, 10 мл, 5,0 мл, 4,0 мл, 3,5 мл, 3,0 мл, 2,5 мл, 2,0 мл, 1,5 мл, 1,0 мл или 0,5 мл. В другом варианте контейнер, содержащий состав, может представлять собой многофункциональный флакон, который позволяет осуществлять многократные введения (например, от 2 до 6 введений) состава. Наборы или другие готовые изделия могут дополнительно включать второй контейнер, содержащий подходящий растворитель (например, BWFI, физиологический раствор, забуференный физиологический раствор). После перемешивания разбавителя и состава конечная концентрация белка в восстановленном составе обычно будет составлять по меньшей мере 1 мг/мл (например, по меньшей мере 5 мг/мл, по меньшей мере 10 мг/мл, по меньшей мере 20 мг/мл, по меньшей мере 30 мг/мл, по меньшей мере 40 мг/мл, по меньшей мере 50 мг/мл, по меньшей мере 75 мг/мл, по меньшей мере 100 мг/мл). Наборы или другие готовые изделия могут дополнительно включать другие материалы, желательные с коммерческой и потребительской точки зрения, включая другие буферы, разбавители, фильтры, иглы, шприцы и листки-вкладыши с инструкциями по применению. Согласно некоторым вариантам реализации наборы или другие готовые изделия могут включать инструкции для самостоятельного введения.
ПРИМЕРЫ
Пример 1. Непрерывное введение PanCyte
[00172] Для исследования церебральной ишемии, чтобы понять ее патофизиологию и определить терапевтические стратегии для снижения до минимального уровня тяжести ишемического повреждения используется несколько животных моделей. Фокальная ишемия приводит к локализованному инфаркту мозга и может быть индуцирована окклюзией средней мозговой артерии (МСАО). Модель на крысах МСАО признана в качестве модели инфаркта полушарий у человека. После МСАО в сосудистой области, снабжаемой кровью средней мозговой артерией, происходит инфаркт коры и полосатого тела, который усугубляется со временем и распространяется в пространстве.
[00173] В течение последних нескольких лет было собрано достаточное количество доказательств, касающихся оценок поведения в исследованиях инсульта у животных, включая модель на крысах МСАО-индуцированного ишемического инсульта. Улучшение поведения, как полагают, является надежным параметром для исследований эффективности биотехнологических кандидатных лекарственных средств.
[00174] Желательным методом лечения сосудистых осложнений инсульта будет неинвазивный метод, способствующий образованию новых сосудов в ишемических тканях. Варианты реализации настоящего изобретения обеспечивают такое терапевтическое лечение. Связывание пептида ангиотензина (1-7) на поверхности эндотелиальных клеток может спасать такие клетки от апоптоза, индуцировать их пролиферацию, миграцию и образование мелких кровеносных сосудов в условиях in vitro.
[00175] В данном примере модель на крысах МСАО использовали для оценки зависимости эффективности пептидов ангиотензина (1-7), например, PanCyte, от дозы в улучшении функции головного мозга после окклюзии, согласно результатам измерения с помощью нескольких принятых поведенческих тестов.
[00176] С животными обращались в соответствии с рекомендациями Национального института здоровья (NIH) и Ассоциации по оценке и аккредитации условий содержания лабораторных животных (AAALAC). Животных помещали в полиэтиленовые клетки (5/клетку) размером 35×30×15 см с верхней решеткой из нержавеющей стали, которая облегчает доступ к гранулированному корму и питьевой воде в пластиковой бутылке; использовали чистую подстилку из рисовой шелухи, стерилизованной паром (Harlan, Sani-chip, каталожный номер: 2018SC+F), и подстилку заменяли вместе с клеткой по меньшей мере два раза в неделю. В данном примере использовали в общей сложности 60 крыс, и в начале исследования каждая крыса весила приблизительно 300 граммов.
[00177] Животные получали без ограничений корм для грызунов, доступный для приобретения (Teklad Certified Global, 18% белковый корм, номер по каталогу: 106S8216). Животные имели свободный доступ к подкисленной питьевой воде (рН от 2,5 до 3,5), полученной от муниципального поставщика в соответствии с СОН PharmaSeed №214 (Water System). Животных содержали в стандартных лабораторных условиях, с кондиционируемым и фильтруемым воздухом (НЕРА F6/6) и достаточным поступлением свежего воздуха (минимально 15 замен воздуха/час). Животных содержали в условиях контроля окружающей среды. Животных содержали при температуре в диапазоне приблизительно 20-24°С, относительной влажности 30-70% и при 12-часовом цикле дня и ночи. Животных проверяли по прибытии и ежедневно проверяли на наличие признаков заболеваемости или угрозе жизни. Животных, обнаруженных в состоянии агонии, и животных, демонстрирующих сильную боль и стойкие признаки тяжелых страданий (например, одышка, лежачее положение на боку, судороги, плегия или невозможность достать корм или воду), усыпляли с соблюдением этических правил.
[00178] Для целей данного примера день проведения процедуры кратковременной окклюзии средней мозговой артерии (tMCAO) определяется как «Сутки 1» в данном исследовании. В день операции анестезию индуцировали путем введения 4% изофлурана в смеси 70% N2O и 30% O2 и поддерживали с использованием 1,5-2% изофлурана.
[00179] Процедуры tMCAO выполняли в соответствии с методом, описанным R. Schmid-Elsaesser et al. В общих чертах, правую ОСА (общую сонную артерию) обнажали с помощью срединного разреза шеи и осторожно освобождали от окружающих нервов и фасций, начиная от ее бифуркации до основания черепа. Затем выделяли ветви затылочной артерии НСА (наружная сонная артерия), эти ветви высвобождали и коагулировали. НСА высвобождали далее дистально и коагулировали вместе с концевыми ветвями язычной и верхнечелюстной артерий, которые затем разделяли. Выделяли ВСА (внутренняя сонная артерия) и тщательно отделяли от соседнего блуждающего нерва, затем крылонебную артерию лигировали недалеко от ее начала с использованием нейлоновой хирургической нити 5-0 (SMI, Бельгия). Далее, шелковую хирургическую нить 4-0 свободно завязывали вокруг мобилизованной культи НСА, и отрезок нейлоновой хирургической мононити 4-0 длиной 4 см (кончик нити закругляли с помощью пламени, и хирургическую нить покрывали полилизином до введения) вставляли через проксимальную НСА в ВСА, а оттуда в круг Уиллиса, обеспечивая тем самым эффективную окклюзию СМА. Хирургическую рану закрывали, и животных возвращали в их клетки для восстановления от анестезии. Через полтора часа после окклюзии крыс повторно анестезировали, мононить удаляли, чтобы обеспечить восстановление перфузии, хирургическую рану закрывали, и крыс возвращали в их клетки.
[00180] Состояние животных оценивали по модифицированной шкале для определения неврологического статуса (mNRS) через 24 ч после реперфузии. В данное исследование включали только животных с общей оценкой ≥10. Животных распределяли в экспериментальные группы в соответствии с результатами mNRS на 2-е сутки, чтобы иметь одинаковое распределение крыс по двигательной активности между группами. Начиная со 2-х суток, через 24 часа после операции, каждому животному имплантировали подкожно осмотический насос Alzet и лечили путем непрерывного введения PanCyte (2,5 мг/мл или 25 мг/мл в фосфатно-солевом буфере (ФСБ); SEQ ID NO: 6). Данные о распределении по группам приведены в таблице 1:


Шаговый тест (оценка на 8-е сутки, 15-е сутки, 22-е сутки, 29-е сутки и 36-е сутки)
[00181] Животных исследовали для выявления акинезии передних конечностей с помощью шагового теста. Исследователь фиксировал одной рукой задние конечности животного, а второй рукой - переднюю конечность, которая не подвергалась оценке, в то время как необездвиженная передняя лапа касалась стола. Число корректировочных шагов подсчитывали, в то время как животное перемещалось вбок вдоль поверхности стола (85 см в течение приблизительно пяти секунд), в прямом и обратном направлении для обеих передних конечностей. На ФИГ. 1 показаны результаты шагового теста на 8, 15, 22, 29 и 36 сутки. В этом тесте исследовали четыре группы: контрольную группу (получавшую только ФСБ в течение 49 дней), группу, получавшую 50 мкг/кг PanCyte в течение 49 дней, группу, получавшую 500 мкг/кг PanCyte в течение 49 дней, и группу, получавшую 50 мкг/кг PanCyte в течение 14 дней. Данные показывают, что каждая группа крыс, которым вводили PanCyte, обладала повышенной двигательной активностью к 22-ым суткам по сравнению с контрольными животными, и что этот эффект поддерживался до 36-х суток с увеличением статистической значимости. Кроме того, двигательная активность в группе, которая подверглась воздействию дозы 50 мкг/кг PanCyte в течение 49 дней, также значительно улучшилась, по сравнению с контрольными животными, на 15-ые сутки, в то время как группы, подвергнутые воздействию 500 мкг/кг PanCyte в течение 49 дней или 50 мкг/кг Pancyte в течение 14 дней, несмотря на тенденцию к улучшению, не достигали в данном эксперименте статистически значимых уровней в этой временной точке.
Испытание реакции передних конечностей на стимуляцию (оценка на 8-е сутки, 15-е сутки, 22-е сутки, 29-е сутки и 36-е сутки)
[00182] Испытание реакции конечностей на стимуляцию разделяли на испытания передних конечностей и задних конечностей. Для проведения испытания реакции передних конечностей на стимуляцию эксперт удерживал крысу близко к поверхности стола и оценивал способность крысы помещать переднюю конечность на поверхность стола в ответ на стимуляцию усов, визуальную, тактильную или проприоцептивную стимуляцию. Аналогичным образом, для испытания реакции задних конечностей на стимуляцию эксперт оценивал способность крысы помещать заднюю конечность на поверхность стола в ответ на тактильную и проприоцептивную стимуляцию. Отдельные дополнительные оценки получали для каждого режима сенсорного ввода и суммировали, получая в результате общую оценку (для испытания реакции передних конечностей на стимуляцию: 0 = нормальный, 12 = максимально нарушенный; для испытания реакции задних конечностей на стимуляцию: 0 = нормальный; 6 = максимально нарушенный). Оценки представляли с шагом в пол балла следующим образом: испытание реакции передних конечностей на стимуляцию: размещение лапы при стимуляции усов (0-2), размещение лапы при визуальной стимуляции -вперед (0-2), -в сторону (0-2); размещение лапы при тактильной стимуляции -дорзально (0-2), -латерально (0-2); размещение лапы при проприоцептивной стимуляции (0-2); в общей сложности 0-12. На ФИГ. 2 показаны результаты испытания реакции передних конечностей на стимуляцию на 8, 15, 22, 29 и 36 сутки. В данном испытании исследовали четыре группы: контрольную группу (получавшую только ФСБ в течение 49 дней), группу, получавшую 50 мкг/кг PanCyte в течение 49 дней, группу, получавшую 500 мкг/кг PanCyte в течение 49 дней, и группу, получавшую 50 мкг/кг PanCyte в течение 14 дней. Данные показывают, что в этом испытании в каждой группе крыс, которым вводили PanCyte, двигательная активность увеличивалась к 29-м суткам по сравнению с контрольными животными, и что это влияние сохранялось до 36-х суток. Также двигательная активность в группе, которая подверглась воздействию 50 мкг/кг PanCyte в течение 14 дней, значительно улучшалась, по сравнению с контрольными животными, начиная с 15-х суток, тогда как другие группы лечения, несмотря на аналогичную тенденцию, не достигали в этом эксперименте статистической значимости до 29-х суток.
Испытание с раскачиванием тела (оценка на 8-е сутки, 15-е сутки, 22-е сутки, 29-е сутки и 36-е сутки)
[00183] Крысу удерживали на расстоянии приблизительно одного дюйма от основания хвоста. Затем крысу поднимали на один дюйм над поверхностью стола. Крысу удерживали в вертикальном положении, которое определяли как отклонение не более 10° влево или вправо. Раскачивание регистрировали в любой момент, когда крыса смещала положение головы относительно вертикальной оси в любую сторону. Перед тем как приступить к регистрации следующего эпизода раскачивания, крыса должна была вернуться в вертикальное положение для подсчета количества следующих эпизодов раскачивания. Подсчитывали в общей сложности двадцать (20) раскачиваний. Нормальная крыса обычно имеет равное число раскачиваний в обе стороны. После фокальной ишемии крысы обычно раскачиваются в контралатеральную сторону (левая сторона в данном примере). Оценки в испытании с раскачиванием тела выражают в процентах раскачиваний вправо по отношению к общему количеству раскачиваний. На ФИГ. 3 показаны результаты испытания с раскачиванием тела на 8, 15, 22, 29 и 36 сутки. В данном испытании исследовали четыре группы: контрольную группу (получавшую только ФСБ в течение 49 дней), группу, получавшую 50 мкг/кг в PanCyte течение 49 дней, группу, получавшую 500 мкг/кг PanCyte в течение 49 дней, и группу, получавшую 50 мкг/кг PanCyte в течение 14 дней. Данные показывают, что каждая группа, которой вводили PanCyte, имела улучшенную двигательную активность в испытании к 36-м суткам по сравнению с контрольной группой, при этом в данном эксперименте группа, получавшая 50 мкг/кг PanCyte в течение 14 дней, имела статистически значимые результаты, начиная с 29 суток, по сравнению с контрольными животными. Все группы лечения демонстрировали тенденцию к улучшению оценок, начиная с 8-х суток, по сравнению с контрольной группой.
Оценка mNRS (оценка на 1-е сутки, 8-е сутки, 15-е сутки, 22-е сутки, 29-е сутки и 36-е сутки)
[00184] Модифицированная шкала для определения неврологического статуса (mNRS) применялась человеком, который не был осведомлен о вводимых препаратах/дозе (слепой метод). Применение mNRS позволяет осуществлять оценку неврологического статуса по шкале от 0 до 18 возможных баллов. Животные с более высокими оценками проявляли более тяжелые симптомы и инвалидность, чем крысы с более низкими оценками. На ФИГ. 4 показаны результаты оценки mNRS на 1, 8, 15, 22, 29 и 36 сутки. В данном испытании исследовали четыре группы: контрольную группу (получавшую только ФСБ в течение 49 дней), группу, получавшую 50 мкг/кг в PanCyte течение 49 дней, группу, получавшую 500 мкг/кг PanCyte в течение 49 дней, и группу, получавшую 50 мкг/кг PanCyte в течение 14 дней. Данные показывают, что каждая группа, которой вводили PanCyte, имела улучшенную двигательную активность в испытании к 29-м суткам по сравнению с контрольной группой. Помимо ответа на лечение к 29 суткам и 36 суткам, в данном эксперименте группа, получавшая 50 мкг/кг PanCyte в течение 49 дней, показала достоверно улучшенную двигательную активность на 8-е и 15-е сутки, и группа, получавшая 500 мкг/кг PanCyte в течение 49 дней, показала достоверно улучшенную двигательную активность на 22-е сутки.
Пример 2. Сравнение результатов введения ТХА127, PanCyte или линейного PanCyte
[00185] Животная модель, хирургические процедуры, процедуры по уходу за животными и условия соответствовали тем, которые описаны выше в примере 1, если не указано иное. В данном примере использовали в общей сложности 105 животных, и в таблице 2 показано распределение по группам для данного исследования:

[00186] Состояние животных оценивали с использованием модифицированной шкалы для определения неврологического статуса (mNRS) через 24 ч после реперфузии. В данное исследование включали только животных с общей оценкой ≥10. Животных распределяли в экспериментальные группы в соответствии с результатами mNRS на 2-е сутки, чтобы иметь одинаковое распределение крыс по двигательной активности между группами. Начиная со 2-х суток, через 24 часа после операции, животным в группах 4, 5 и 7 подкожно имплантировали осмотический насос Alzet и вводили 500 мкг/кг ТХА127 (SEQ ID NO: 1), 500 мкг/кг PanCyte (циклизованный, SEQ ID NO: 6) или 50 мкг/кг линейного PanCyte (SEQ ID NO: 6). Животные в группах 2, 3 и 6 получали 500 мкг/кг или 1000 мкг/кг ТХА127, или 500 мкг/кг PanCyte, которые вводили подкожно с помощью ежедневных инъекций. Животные в группе 1 получали ежедневную подкожную инъекцию ФСБ (носитель).
Шаговый тест (оценка перед проведением операции, на 14-е сутки, 21-е сутки, 28-е сутки и 35-е сутки, 42-е сутки и 49-е сутки)
[00187] Животных исследовали для выявления акинезии передних конечностей с помощью шагового теста. Исследователь фиксировал одной рукой задние конечности животного, а второй рукой - переднюю конечность, которая не подвергалась оценке, в то время как необездвиженная передняя лапа касается стола. Подсчитывали число корректировочных шагов во время перемещения животного вбок вдоль поверхности стола (85 см в течение приблизительно пяти секунд), в прямом и обратном направлении для обеих передних конечностей. На ФИГ. 5 показано, что лечение с использованием ТХА127, PanCyte или линейного PanCyte значительно улучшало двигательную активность крыс, получивших лечение, во всех экспериментальных условиях к 21-ым суткам после операции, по сравнению с контрольными животными, получавшими носитель. Тенденция к улучшению наблюдалась уже на 14-е сутки после операции. Следует отметить, что, несмотря на введение только 50 мкг/кг линейного PanCyte, результаты по существу эквивалентны десятикратному увеличению показателей по сравнению с таковыми для ТХА127 или PanCyte.
Испытание реакции передних конечностей на стимуляцию (оценка перед проведением операции, на 14-е сутки, 21-е сутки, 28-е сутки, 35-е сутки, 42-е сутки и 49-е сутки)
[00188] Для испытания реакции передних конечностей на стимуляцию крысу удерживали близко к поверхности стола, и оценивали способность крысы помещать переднюю конечность на поверхности стола в ответ на стимуляцию усов, визуальную, тактильную или проприоцептивную стимуляцию (0 = нормальный, 12 = максимально нарушенный). Оценки приведены с шагом в пол балла (см. ниже). Обычно наблюдают медленное и устойчивое восстановление поведения, направленного на точное размещение конечностей, в течение первого месяца после инсульта. На ФИГ. 6 показано, что значительное улучшение двигательной активности наблюдали для всех условий лечения по сравнению с контрольными животными, получавшими носитель, начиная с 14-х суток и на всем протяжении исследования. Оказалось, что группа, получавшая линейный PanCyte, вновь имела наилучшую двигательную активность, в частности, начиная с 35-х суток и далее, несмотря на то, что эта группа подверглась воздействию значительно меньшей дозы агента, чем другие экспериментальные группы.
Испытание с раскачиванием тела (оценка перед проведением операции, на 14-е сутки, 21-е сутки, 28-е сутки, 35-е сутки, 42-е сутки и 49-е сутки)
[00189] Крысу удерживали на расстоянии приблизительно одного дюйма от основания хвоста. Затем поднимали на один дюйм над поверхностью стола. Крысу удерживали в вертикальном положении, которое определяли как отклонение не более 10° влево или вправо. Раскачивание регистрировали в любой момент, когда крыса смещала положение головы относительно вертикальной оси в любую сторону. Перед тем как приступить к регистрации следующего эпизода раскачивания, крыса должна была вернуться в вертикальное положение для подсчета количества следующих эпизодов раскачивания. В общей сложности двадцать (20) раскачиваний было подсчитано. Нормальная крыса обычно имеет равное число раскачиваний в обе стороны. После фокальной ишемии крысы, обычно, раскачиваются в контралатеральную сторону (левая сторона в данном примере). Оценки в испытании с раскачиванием тела выражают в процентах раскачиваний вправо по отношению к общему количеству раскачиваний. Обычно имеет место частичное спонтанное восстановление (до 50%) оценок в испытаниях с раскачиванием тела в течение первого месяца после инсульта. На ФИГ. 7 показано, что все группы, получавшие 1000 мкг/кг ТХА127, ТХА Alzet, PanCyte Alzet, 500 мкг/кг PanCyte и линейного PanCyte, имели достоверное улучшение двигательной активности к 28-м суткам по сравнению с контрольными животными, получавшими носитель. Группа, получавшая 500 мкг/кг ТХА127, не показала достоверных результатов до 35-х суток. Все группы, получавшие 1000 мкг/кг ТХА 127, ТХА Alzet, PanCyte Alzet и линейный PanCyte, имели улучшение к 21-м суткам, при этом все экспериментальные группы показали тенденцию к улучшению к 14-м суткам. На 49-е сутки двигательная активность во всех группах, получавших ТХА 1000 г/кг, ТХА ALZET и линейный PanCyte, по-видимому, была почти на нормальном (ненарушенном) уровне.
Оценка mNRS (оценка перед проведением операции, на 1-е сутки, 14-е сутки, 21-е сутки, 28-е сутки, 35-е сутки, 42-е сутки и 49-е сутки)
[00190] Модифицированная шкала для определения неврологического статуса (mNRS) применялась человеком, который не был осведомлен о вводимых препаратах/дозе (слепой метод). Применение mNRS позволяет осуществлять оценку неврологического статуса по шкале от 0 до 18 возможных баллов. Животные с более высокими оценками проявляли более тяжелые симптомы и инвалидность, чем крысы с более низкими оценками. На ФИГ. 8 показано, что каждая экспериментальная группа показала значительное улучшение двигательной активности к 14-м суткам по сравнению с контрольными животными, получавшими носитель. Наблюдаемое увеличение двигательной активности сохранялось на протяжении всего исследования.
[00191] Эти результаты показывают, что все из ТХА 127, PanCyte и линейного PanCyte являются сильными терапевтическими кандидатами, которые способны значительно улучшить двигательную активность животных после инсульта. В дополнение к преимуществам в улучшении двигательной активности, рассмотренным выше, в каждой из групп, в которых не использовали насос Alzet, на 50-е сутки измеряли кровоток и диаметр кровеносных сосудов с помощью лазерной допплеровской флоуметрии в соответствии с известными протоколами. Результаты приведены на ФИГ. 9 и показывают, что животные во всех группах лечения, которые подвергались оценке, имели значительно увеличенный диаметр кровеносных сосудов и кровоток по сравнению с контрольными животными к 50-м суткам. В частности, линейный PanCyte, по-видимому, значительно улучшил терапевтический потенциал, даже более, чем другие эффективные методы лечения, испытанные в этом примере. Эти результаты являются особенно удивительными, поскольку единственное различие между PanCyte и линейным PanCyte, по-видимому, заключается в том, что PanCyte циклизован, тогда как линейный PanCyte - нет. Полагают, что циклизация пептида, обычно, обеспечивает большую эффективность пептида в условиях in vivo, делая его более устойчивым к расщеплению под действием протеаз. Однако в данном примере линейный PanCyte почти столь же эффективен в более низкой дозе 50 мкг/кг (по сравнению с 500 мкг/кг PanCyte).
Пример 3. Сравнение результатов введения PanCyte и AVE0991
[00192] Животная модель, хирургические процедуры, процедуры по уходу за животным и условия соответствовали тем, которые описаны выше в примере 1, если не указано иное. В этом примере использовали в общей сложности 75 животных, и в таблице 3 показано распределение по группам для этого исследования:

[00193] Животных подвергали оценке с использованием модифицированной шкалы для определения неврологического статуса (mNRS) через 24 ч после реперфузии. В данное исследование включали только животных с общей оценкой ≥10. Животных распределяли в экспериментальные группы в соответствии с результатами mNRS на 2-е сутки, чтобы иметь одинаковое распределение крыс по двигательной активности между группами. Начиная со 2-х суток, через 24 часа после операции, животные в группах 2, 3 и 4 получали PanCyte или AVE0991 подкожно путем ежедневных инъекций. Животные в группе 5 получали AVE0991, который вводили с помощью желудочного зонда дважды в сутки, и животные в группе 1 (контрольные животные, получавшие носитель) получали носитель, который вводили подкожно путем ежедневных инъекций.
Шаговый тест (оценка перед проведением операции, на 15-е сутки, 22-е сутки и 29-е сутки)
[00194] Животных исследовали для выявления акинезии передних конечностей с помощью шагового теста (ST). Исследователь фиксировал одной рукой задние конечности животного, а второй рукой - переднюю конечность, которая не подвергалась оценке, в то время как необездвиженная передняя лапа касается стола. Число корректировочных шагов подсчитывали, в то время как животное перемещалось вбок вдоль поверхности стола (85 см в течение приблизительно пяти секунд), в прямом и обратном направлении для обеих передних конечностей. На ФИГ. 10 показано, что лечение PanCyte и AVE0991 привело к значительному улучшению к 22-м суткам, которое поддерживалось до 29-х суток, при этом тенденция к улучшению становилась очевидной к 15-м суткам по сравнению с контрольными животными, получавшими носитель.
Испытание реакции передних конечностей на стимуляцию (оценка перед проведением операции, на 15-е сутки, 22-е сутки и 29-е сутки)
[00195] Для испытания реакции передних конечностей на стимуляцию крысу удерживали близко к поверхности стола и оценивали способность крысы помещать переднюю конечность на поверхность стола в ответ на стимуляцию усов, визуальную, тактильную или проприоцептивную стимуляцию (0 = нормальный, 12 = максимально нарушенный). Оценки приведены с шагом в пол балла (см. ниже). Как правило, наблюдают медленное и устойчивое восстановление поведения, направленного на точное размещение конечности, в течение первого месяца после инсульта. На ФИГ. 11 показано, что лечение с использованием PanCyte и AVE0991 привело к значительному улучшению двигательной активности к 22-м суткам и поддерживалось до 29-х суток по сравнению с контрольными животными, получавшими носитель. Следует отметить, что животные, получавшие 50 мкг AVE0991, имели статистически значимое улучшение двигательной активности к 15-м суткам, в то время как другие группы, включая те, которые получали десятикратно превышающую дозу AVE0991 (500 мкг), показали только тенденцию к улучшению.
Испытание с раскачиванием тела (оценка перед проведением операции, на 15-е сутки, 22-е сутки и 29-е сутки)
[00196] Крысу удерживали на расстоянии приблизительно одного дюйма от основания хвоста. Затем поднимали на один дюйм над поверхностью стола. Крысу удерживали в вертикальном положении, которое определяли как отклонение не более 10° влево или вправо. Раскачивание регистрировали в любой момент, когда крыса смещала положение головы относительно вертикальной оси в любую сторону. Перед тем как приступить к регистрации следующего эпизода раскачивания, крыса должна была вернуться в вертикальное положение для подсчета количества следующих эпизодов раскачивания. В общей сложности двадцать (20) раскачиваний было подсчитано. Нормальная крыса обычно имеет равное число раскачиваний в обе стороны. После фокальной ишемии крысы обычно раскачиваются в контралатеральную сторону (левая сторона в данном примере). Оценки в испытании с раскачиванием тела выражают в процентах раскачиваний вправо по отношению к общему количеству раскачиваний. На ФИГ. 12 показано, что лечение PanCyte или AVE0991 (через желудочный зонд) привело к значительному улучшению к 22-м суткам по сравнению с контрольными животными, получавшими носитель. При введении AVE0991 подкожно наблюдали тенденцию к улучшению к 22-м суткам.
Оценка mNRS (оценка перед проведением операции, на 2-е сутки, 15-е сутки, 22-е сутки и 29-е сутки)
[00197] Модифицированная шкала для определения неврологического статуса (mNRS) применялась человеком, который не был осведомлен о вводимых препаратах/дозе (слепой метод). Применение mNRS позволяет осуществлять оценку неврологического статуса по шкале от 0 до 18 возможных баллов. Животные с более высокими оценками проявляли более тяжелые симптомы и инвалидность, чем крысы с более низкими оценками. На ФИГ. 13 показано, что введение PanCyte и AVE0991 (через желудочный зонд) привело к значительному улучшению двигательной активности к 22-м суткам, в то время как при введении AVE0991 подкожно наблюдали тенденцию к улучшению по сравнению с контрольными животными, получавшими носитель. К 29-м суткам все группы лечения проявляли значительно улучшенную двигательную активность по сравнению с контрольными животными, получавшими носитель. Все группы лечения показали тенденцию к улучшению уже к 15-м суткам. [00198] Данный пример показывает, что AVE0991 также является мощным терапевтическим кандидатом для лечения инсульта, обеспечивая существенную пользу для выздоравливающих субъектов в течение 2-3 недель лечения.
ЭКВИВАЛЕНТЫ И ОБЪЕМ
[00199] Специалисты в данной области техники поймут или будут способны установить, используя не более чем стандартные эксперименты, многие эквиваленты конкретных вариантов реализации настоящего изобретения, описанных в настоящей заявке. Объем настоящего изобретения не ограничивается приведенным выше описанием, а скорее изложен в нижеследующей формуле изобретения.
Реферат
Изобретение относится к области биотехнологии, конкретно к способу лечения инсульта или травматического повреждения головного мозга, и может быть использовано в медицине. Изобретение предполагает предоставление пациенту, страдающему инсультом, линейной или 4,7-циклизованной формы пептида ангиотензина (1-7) в эффективной дозе с помощью внутривенного или подкожного пути введения. В отличие от известных аналогов предоставляемый в соответствии с настоящим изобретением препарат способен преодолевать гематоэнцефалический барьер без использования ICV и иных более сложных в реализации методов. 21 з.п. ф-лы, 13 ил., 3 табл., 3 пр.
Формула


Комментарии