Модулирование экспрессии рецептора андрогенов - RU2670486C9
Код документа: RU2670486C9
Чертежи


























































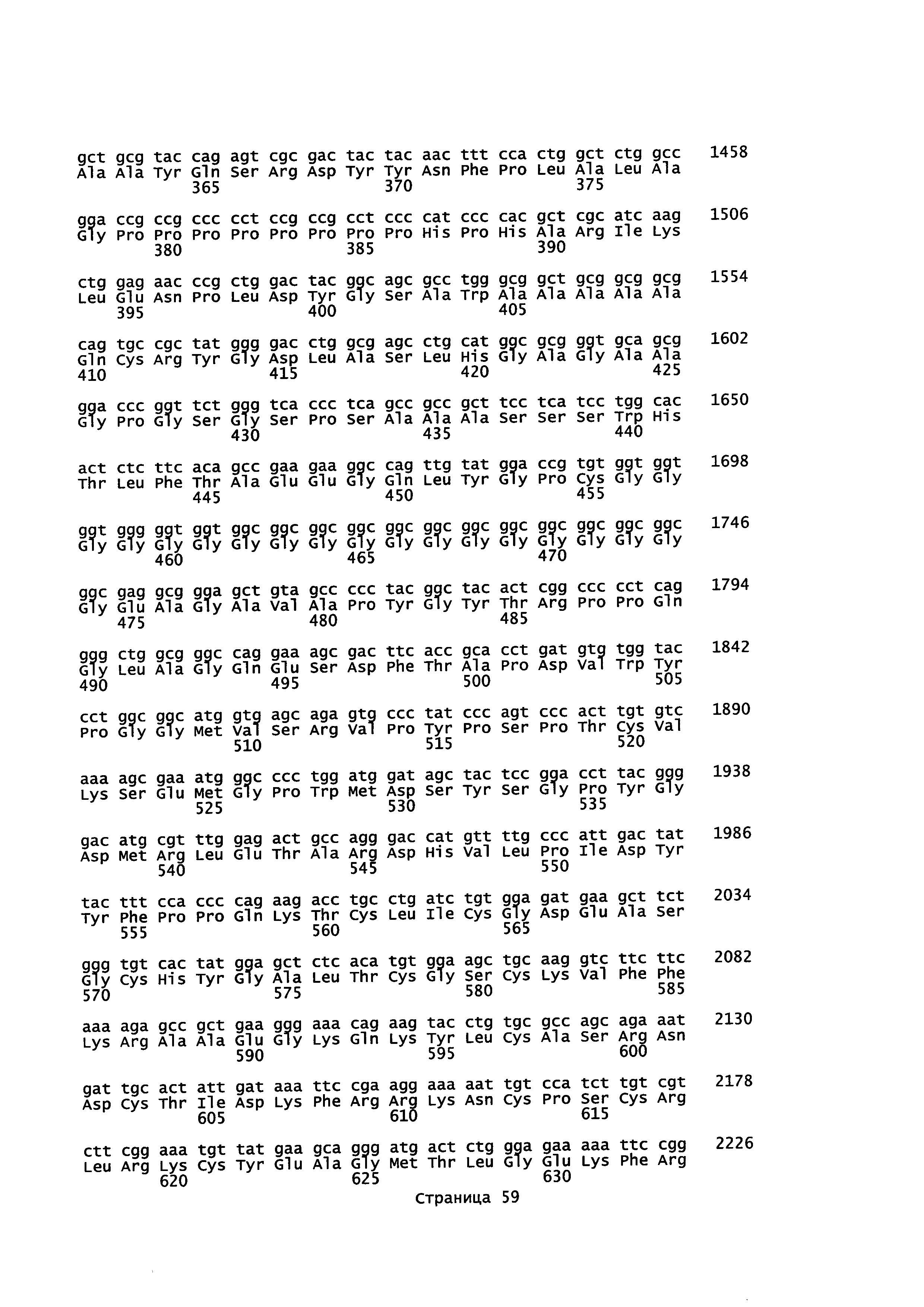

























































































Описание
Перечень последовательностей
Настоящая заявка подана вместе с Перечнем последовательностей в электронном формате. Перечень последовательностей представлен в виде файла под названием 200157WOSEQ.txt, который создан 1 октября 2013 года и который имеет размер приблизительно 556 KB. Информация в электронном формате перечня последовательностей во всей ее полноте включена в данный документ посредством ссылки.
Область изобретения
Некоторые воплощения относятся к соединениям и композициям, направленно воздействующим на рецептор андрогенов (AR) человека для ингибирования уровней рецептора андрогенов в клетке, которые могут быть полезны для способов лечения рака и ингибирования роста или пролиферации раковых клеток.
Предшествующий уровень техники
Рецептор андрогенов (AR) является членом надсемейства ядерных рецепторов и активируется в результате связывания с его лигандами-гормонами: андрогеном, тестостероном или DHT (дигидротестостерон). После связывания лиганда-гормона в цитоплазме рецептор андрогенов транслоцируется в ядро, где он связывает ДНК и функционирует в качестве фактора транскрипции для регуляции целого ряда генов-мишеней, таких как простатический специфический антиген (PSA) и TMPRSS2. Knudsen et al. (Trends Endocrinol Metab 21: 315-24, 2010) Bennett et al. (Int J Biochem Cell Biol. 42: 813-827, 201).
Передача сигнала через рецептор андрогенов (AR) является необходимым путем выживания для раковых клеток предстательной железы, и андроген-депривационная терапия (ADT), также известная как "химическая кастрация", является первоочередной стратегией лечения гормон-чувствительного, андроген-зависимого рака предстательной железы, обеспечивающей снижение уровней циркулирующих в крови андрогенов и, благодаря этому, ингибирование активности AR. Хотя большинство пациентов вначале реагируют на ADT, почти у каждого, в конечном счете, развивается резистентность к кастрации, при которой заболевание прогрессирует, несмотря на кастрированные уровни тестостерона. Этот тип рака известен как резистентный к кастрации рак предстательной железы (CRPC). Существует целый ряд механизмов, лежащих в основе развития резистентности к кастрации, в том числе увеличение экспрессии белка AR, который может сенситизировать клетки к низким уровням андрогена, мутации AR, которые могут изменять трансактивацию или сенситизацию AR к альтернативным лигандам, и появление альтернативно сплайсированных форм AR, не имеющих лиганд-связывающего домена, но все же способных действовать, промотируя рост опухоли в отсутствие стимуляции лиганда. Дополнительно, опухоли предстательной железы могут также синтезировать их собственные андрогены, увеличивая тем самым локальные внутриопухолевые уровни тестостерона, доступные для активации AR.
Передача сигнала через рецептор андрогенов (AR) является необходимым путем выживания для клеток рака предстательной железы, и андроген-депривационная терапия (ADT) остается основным видом лечения пациентов с локально прогрессирующим и метастатическим заболеванием. Хотя большинство пациентов вначале реагируют на ADT, почти у каждого, в конечном счете, развивается резистентность к кастрации, при которой заболевание прогрессирует, несмотря на кастрированные уровни тестостерона. Этот тип рака известен как резистентный к кастрации рак предстательной железы (CRPC) (Karantos et al., Oncogene advance online: 1-13, 2013). Существует целый ряд механизмов, лежащих в основе развития резистентности к кастрации, в том числе увеличение экспрессии белка AR, который может сенситизировать клетки к низким уровням андрогена (Gregory et al., Cancer Res 61: 2892-2898, 2001; Linja et al., Cancer Res 61: 3550-3555, 2001), мутации AR, которые могут изменять трансактивацию или сенситизацию AR к альтернативным лигандам (Scher et al., J Clin Oncol 23: 8253-8261, 2005), и появление альтернативно сплайсированных форм AR, не имеющих лиганд-связывающего домена, но тем не менее способных действовать, промотируя рост опухоли в отсутствие стимуляции лиганда (Yingming et al., Cancer Res 73: 483-489, 2013). Дополнительно, опухоли предстательной железы могут также синтезировать их собственные андрогены, увеличивая тем самым локальные внутриопухолевые уровни тестостерона, доступные для активации AR (Attard et al., Cancer Cell 16: 458-462, 2009).
Тот факт, что рецептор андрогенов остается активным при резистентном к кастрации раке предстательной железы, привел к разработке новых агентов, которые ингибируют продуцирование лигандов к андрогенам или блокируют действия этих лигандов на AR. Эти новые агенты включают абиратерона ацетат, который ингибирует активность 17-а-гидроксилазы/17,20-лиазы (CYP17), вызывая снижение уровня остаточных андрогенов, синтезированных надпочечниками, и сокращение самой опухоли предстательной железы (deBono et al., N EngI J Med 364: 1995-2006, 2011), и энзалутамид, который препятствует связыванию лиганда к андрогену с AR, транслокации в ядра и связыванию с ДНК (Scher et al., N EngI J Med 367: 1187-1197, 2012). Целый ряд других ингибиторов синтеза андрогенов или блокаторов рецептора андрогенов находятся в разработке, либо доклинической, либо клинической, и включают, например, ARN509, ODM201, TOK001, VT464.
Хотя активность агентов, таких как энзалутамид и абиратерон, при CRPC является очень обнадеживающей, ни один из них не действует у всех пациентов, и оба ассоциированы с развитием дополнительной резистентности в результате реактивации AR по механизмам, описанным выше (Yingming et al., Cancer Res 73: 483-489, 2013). Таким образом, продолжает существовать необходимость в идентификации альтернативных терапий для лечения CRPC, и в частности тех, которые могут устранять и/или ингибировать активность всех форм AR, включая, например, формы дикого типа, мутантные формы и сплайсированные варианты AR.
Согласно настоящему изобретению предложены антисмысловые олигонуклеотиды, которые благодаря их строению и механизму действия (спариваются с мишенью, РНК AR, и опосредуют ее деструкцию РНазой Н, ферментом, который разрушает РНК в дуплексе ДНК/РНК) способствуют ингибированию основных форм AR. Направленно воздействуя на соответствующую область мРНК AR, антисмысловой олигонуклеотид будет вызывать ингибирование основных форм (полноразмерных, сплайс-вариантов и мутантных форм) белков рецептора андрогенов и, следовательно, будет подходящим для лечения пациентов с CRPC.
Помимо рака предстательной железы, AR также вовлечен в качестве фактора в прогрессирование других опухолей, таких как рак молочной железы. При раке молочной железы AR экспрессируется в 70-80% опухолей, которые также являются ER-позитивными, и которые в 12% случаев известны как тройственно негативные (отсутствие экспрессии ER, PR и HER2) (Hickey et al., Molecular Endocrinology 26: 1252-1267, 2012). В доклинических исследованиях антагонист рецептора андрогенов бикалутамид индуцирует антипролиферативные ответные реакции in vitro в клетках рака молочной железы, и это действие усиливается добавлением ингибитора Pi3K/mTOR (Mi et al., Cancer Cell 20: 119-131, 2011). Антиандроген 2-го поколения, энзалутамид, ингибирует дигидротестостерон (DHT)-опосредованную пролиферацию в ER+/AR+клетках рака молочной железы и является настолько же эффективным, как и тамоксифен, при ингибировании эстроген-стимулируемого роста раковой опухоли молочной железы в доклинических моделях in vivo (Cochrane et al., Cancer Res 72 (24 Supplement): P2-14-02, 2012). Энзалутамид также ингибирует пролиферацию HER2+ и тройственно негативных клеток рака молочной железы. Представляется, что в ситуациях, когда действие эстрогенов снижается (например, долговременная депривация эстрогенов или отсутствие ER), уровни AR повышаются и могут стать онкогенными. Это означает, что антагонисты AR могут быть позиционированы лучше всего в условиях тройственно негативного или гормонорезистентного рака молочной железы (Hickey et al., Molecular Endocrinology 26: 1252-1267, 2012). AR-направленные терапии в настоящее исследуются в клинических испытаниях в отношении рака молочной железы (NCT00468715, NCT01597193, NCT01381874, NCT00755886).
AR также экспрессируется во множестве других опухолей, включая, без ограничения, опухоли мочевого пузыря, яичника, желудка, легкого и печени. Доклинические данные подтверждают ту же роль, как при раке молочной железы, в содействии пролиферативному выживанию опухолевых клеток, поэтому блокирование AR в этих опухолях может иметь клиническую терапевтическую пользу (Chang et al., Oncogene advance online: 1-10, 2013).
Краткое изложение сущности изобретения
В нескольких предложенных в данном документе воплощениях изобретение относится соединениям и композициям для ингибирования уровней рецептора андрогенов в клетке, которые могут быть полезными для способов лечения рака и ингибирования пролиферации или роста раковых клеток, таких как рак или раковые клетки предстательной железы, яичника, желудка или мочевого пузыря.
Подробное описание изобретения
Следует иметь в виду, что приведенное выше общее описание и следующее далее подробное описание являются только иллюстративными и разъяснительными и не ограничивают изобретение в том виде, как оно заявлено. В данном документе использование форм единственного числа включает множественное число, если конкретно не указанно иное. В данном документе "или" означает "и/или", если не указано иное. Кроме того, использование термина "включающий", а также других форм, таких как "включает" и "включен", не является ограничительным. Также такие термины, как "элемент" или "компонент", охватывают как элементы и компоненты, содержащие одну единицу, так и элементы и компоненты, которые содержат более чем одну субъединицу, если конкретно не указано иное.
Заголовки разделов использованы в данном описании только в организационных целях и не должны рассматриваться как ограничивающие описанный предмет изобретения. Все документы или части документов, процитированные в данной заявке, включая, без ограничения, патенты, патентные заявки, статьи, книги и научные труды, в прямой форме включены в данный документ посредством ссылки на части обсуждаемого документа, а также на документы во всей их полноте.
Определения
Если не даны конкретные определения, номенклатура, использованная в связи с ними, и методики и методы, аналитическая химия, синтетическая органическая химия и медицинская и фармацевтическая химия, описанные в данном документе, общеизвестны и обычно используются в данной области. Для химического синтеза и химического анализа могут быть использованы стандартные методы. Где это допустимо, все патенты, заявки, опубликованные заявки и другие публикации, номера доступа в базе данных GENBANK и ассоциированная информация о последовательностях, получаемая через базы данных, такие как National Center for Biotechnology Information (Национальный центр биотехнологической информации (NCBI)), и другие данные, упомянутые в описании изобретения, включены посредством ссылки для частей документа, обсуждаемого в данном описании, а также во всей их полноте.
Если не указано иное, указанные ниже термины имеют следующие значения:
"2'-O-метоксиэтил" (также 2'-МОЕ и 2'-O(СН2)2-ОСН3) относится к O-метоксиэтильной модификации в положении 2' сахарного кольца, например фуранозного кольца. 2'-O-метоксиэтил-модифицированный сахар представляет собой модифицированный сахар.
"2'-МОЕ-нуклеозид" (также 2'-O-метоксиэтил-нуклеозид) означает нуклеозид, содержащий 2'-МОЕ-модифицированную сахарную группировку.
"2'-замещенный нуклеозид" означает нуклеозид, содержащий заместитель в положении 2' фуранозильного кольца, иной, чем Н или ОН. В некоторых воплощениях 2'-замещенные нуклеозиды включают нуклеозиды с модификациями бициклического сахара.
"3'-сайт-мишень" относится к нуклеотиду нуклеиновой кислоты-мишени, которая комплементарна нуклеотиду с самого 3'-конца конкретного антисмыслового соединения.
"5'-сайт-мишень" относится к нуклеотиду нуклеиновой кислоты-мишени, которая комплементарна нуклеотиду с самого 5'-конца конкретного антисмыслового соединения.
"5-метилцитозин" означает цитозин, модифицированный метильной группой, присоединенной в положении 5'. 5-Метилцитозин представляет собой модифицированное нуклеооснование.
"Примерно" означает в пределах ±7% от значения. Например, если указано, что "соединения осуществляли по меньшей мере примерно 70%-ное ингибирование рецептора андрогенов", то подразумевается, что уровни рецептора андрогенов ингибируются в диапазоне от 63% до 77%.
"Введение" или "осуществление введения" относится к путям введения предложенного в данной заявке антисмыслового соединения субъекту для осуществления его намеченной функции. Примером пути введения, который может быть использован, является, без ограничения, парентеральное введение, такое как подкожная, внутривенная или внутримышечная инъекция или инфузия.
"Рецептор андрогенов-позитивный" применительно к раку молочной железы или клетке рака молочной железы относится к раку молочной железы или клетке рака молочной железы, которая экспрессирует рецептор андрогенов.
"Животное" относится к человеку или животному, не являющемуся человеком, включая, без ограничения, мышей, крыс, кроликов, собак, кошек, свиней и приматов, не являющихся людьми, включая, без ограничения, обезьян и шимпанзе.
"Антиандрогенный агент" относится к терапевтическому соединению или лекарственному средству, которое является ингибитором синтеза андрогенов или блокатором рецептора андрогенов.
"Антисмысловая активность" означает любую детектируемую или измеримую активность, обусловленную гибридизацией антисмыслового соединения с его нуклеиновой кислотой-мишенью. В некоторых воплощениях антисмысловая активность представляет собой снижение количества или экспрессии нуклеиновой кислоты-мишени или белка, кодируемого такой нуклеиновой кислотой-мишенью.
"Антисмысловое соединение" означает олигомерное соединение, которое способно подвергаться гибридизации с нуклеиновой кислотой-мишенью посредством водородной связи. Примеры антисмысловых соединений включают одноцепочечные и двухцепочечные соединения, такие как антисмысловые олигонуклеотиды, киРНК (короткие интерферирующие РНК), кшРНК (короткие шпилечные РНК), оцРНК (одноцепочечные РНК) и соединения на основе занятости.
"Антисмысловое ингибирование" означает снижение уровней нуклеиновой кислоты-мишени в присутствии антисмыслового соединения, комплементарного нуклеиновой кислоте-мишени, по сравнению с уровнями нуклеиновой кислоты-мишени в отсутствие антисмыслового соединения.
"Антисмысловыми механизмами" являются все те механизмы, в которые вовлечена гибридизация соединения с нуклеиновой кислотой-мишенью, где результат или эффект гибридизации заключается в разрушении мишени или занятии мишени с одновременным прекращением вовлечения клеточного аппарата, например транскрипции или сплайсинга.
"Антисмысловой олигонуклеотид" означает одноцепочечный олигонуклеотид, имеющий последовательность нуклеооснований, которая допускает гибридизацию с соответствующей областью или соответствующим сегментом нуклеиновой кислоты-мишени.
"Комплементарность оснований" относится к способности к точному спариванию нуклеооснований антисмыслового олигонуклеотида с соответствующими нуклеооснованиями в нуклеиновой кислоте-мишени (т.е. к гибридизации) посредством образования водородной связи по Уотсону-Крику (Watson-Crick), по Хугстину (Hoogsteen) или с образованием обратных хугстиновских пар между соответствующими нуклеооснованиями.
"Бициклическая сахарная группировка" означает модифицированную сахарную группировку, содержащую 4-7-членное кольцо (включая, без ограничения, фуранозил), содержащую связанные мостиком два атома 4-7-членного кольца с образованием второго кольца и, в результате, бициклической структуры. В некоторых воплощениях 4-7-членное кольцо представляет собой сахарное кольцо. В некоторых воплощениях 4-7-членное кольцо представляет собой фуранозил. В некоторых таких воплощениях мостик соединяет 2'-углерод и 4'-углерод фуранозила.
Согласно изобретению в определение LNA ("закрытая" нуклеиновая кислота) также входят LNA, в которых 2'-гидроксильная группа рибозильного сахарного кольца связана с 4'-атомом углерода сахарного кольца, образуя метиленокси (4'-СН2-O-2') мостик с образованием бициклической сахарной группировки. Мостик может представлять собой также метиленовую (-СН2-) группу, соединяющую 2'-атом кислорода и 4'-атом углерода, и для этого используется термин метиленокси (4'-СН2-O-2') LNA. Кроме того, в случае бициклической сахарной группировки, имеющей этиленовую мостиковую группу в этом положении, используется термин этиленокси (4'-СН2СН2-O-2') LNA. α-L-метиленокси (4'-СН2-O-2'), изомер метиленокси (4'-СН2-O-2') LNA, также охвачен определением LNA, используемым в данном документе.
"Кэп-структура" или "концевая кэп-группировка" означает химические модификации, которые были введены по любому концу антисмыслового соединения.
"Кастрат-резистентный рак предстательной железы" или "резистентный к кастрации рак предстательной железы" и "резистентные к кастрации клетки рака предстательной железы" относятся к снижению чувствительности рака предстательной железы и клеток рака предстательной железы к андроген-депривационной терапии или к антиандрогенному агенту.
"cEt" или "связанный этил" означает бициклическую сахарную группировку, содержащую мостик, соединяющий 4'-углерод и 2'-углерод, где мостик имеет формулу: 4'-СН(CH3)-O-2'.
"Связанный этил-нуклеозид" (также cEt-нуклеозид) означает нуклеозид, содержащий бициклическую сахарную группировку, содержащую мостик 4'-СН(CH3)-O-2'.
"Химически отличающаяся область" относится к области антисмыслового соединения, которая некоторым образом химически отличается от другой области того же антисмыслового соединения. Например, область, имеющая 2'-O-метоксиэтил-нуклеотиды, химически отличается от области, имеющей нуклеотиды без 2'-O-метоксиэтильных модификаций.
"Химерные антисмысловые соединения" означает антисмысловые соединения, которые имеют по меньшей мере 2 химически отличающиеся области, причем каждое положение имеет множество субъединиц.
"Комплементарность" означает способность к спариванию между нуклеооснованиями первой нуклеиновой кислоты и второй нуклеиновой кислоты.
Должно быть понятно, что "содержат", "содержит" и "содержащий" подразумевают включение указанной стадии или указанного элемента или группы стадий или элементов, но не исключение какой-либо другой стадии или какого-либо другого элемента или группы стадий или элементов.
"Смежные нуклеооснования" означает нуклеооснования, непосредственно граничащие друг с другом.
"Дезоксирибонуклеотид" означает нуклеотид, имеющий водород в положении 2' сахарного участка нуклеотида. Дезоксирибонуклеотиды могут быть модифицированы различными заместителями.
"Конструирование" или "сконструированный для" относятся к способу конструирования олигомерного соединения, которое специфически гибридизируется с выбранной молекулой нуклеиновой кислоты.
"Ниже" относится к относительному направлению в сторону 3'-конца или С-конца нуклеиновой кислоты.
"Эффективность" означает способность вызывать желаемый эффект.
"Рецептор эстрогенов (ЕР)-позитивный" в отношении рака молочной железы или клетки рака молочной железы относится к раку молочной железы или клетке рака молочной железы, который(ая) экспрессирует рецептор эстрогенов (ER).
"Рецептор эстрогенов (ЕК)-негативный" в отношении рака молочной железы или клетки рака молочной железы относится к раку молочной железы или клетке рака молочной железы, который(ая) не экспрессирует рецептор эстрогенов (ER).
"Экспрессия" охватывает все функции, посредством которых кодируемая геном информация конвертируется в структуры, присутствующие и действующие в клетке. Такие структуры включают, без ограничения, продукты транскрипции и трансляции.
"Полностью комплементарный" или "на 100% комплементарный" означает, что каждое нуклеооснование первой нуклеиновой кислоты имеет комплементарное нуклеооснование во второй нуклеиновой кислоте. В некоторых воплощениях первая нуклеиновая кислота представляет собой антисмысловое соединение, а второй нуклеиновой кислотой является нуклеиновая кислота-мишень.
"Гэпмер" означает химерное антисмысловое соединение, в котором внутренняя область, имеющая множество нуклеозидов, которые поддерживают расщепление РНазой Н (рибонуклеаза Н), расположена между внешними областями, имеющими один или более нуклеозидов, где нуклеозиды, составляющие внутреннюю область, химически отличаются от нуклеозида или нуклеозидов, составляющих внешние области. Внутренняя область может упоминаться как "гэп", а внешние обрасти могут упоминаться как "крылья".
"Her2/neu-негативный" в отношении рака молочной железы или клетки рака молочной железы относится к раку молочной железы или клетке рака молочной железы, который(ая) не экспрессирует Her2/neu.
"Гибридизация" означает отжиг молекул комплементарных нуклеиновых кислот. В некоторых воплощениях молекулы комплементарных нуклеиновых кислот включают, без ограничения, антисмысловое соединение и нуклеиновую кислоту-мишень. В некоторых воплощениях молекулы комплементарных нуклеиновых кислот включают, без ограничения, антисмысловой олигонуклеотид и нуклеиновую кислоту-мишень.
"Непосредственно граничащие" означает отсутствие промежуточных элементов между непосредственно граничащими элементами.
"Индивидуум" означает человек или животное, не являющееся человеком, выбранный(ое) для лечения или терапии.
"Индуцируют", "ингибируют", "потенцируют", "повышают", "увеличивают", "снижают", "осуществляют повышающую регуляцию", "осуществляют понижающую регуляцию" или т.п. обычно означают количественные различия между двумя состояниями.
"Ингибирование экспрессии или активности" относится к снижению, блокированию экспрессии или активности и не обязательно указывает на тотальное устранение экспрессии или активности.
"Межнуклеозидная связь" относится к химической связи между нуклеозидами.
"Удлиненными" антисмысловыми олигонуклеотидами являются те антисмысловые олигонуклеотиды, которые имеют один или более дополнительных нуклеозидов по сравнению с антисмысловым олигонуклеотидом, раскрытым в данном документе.
"Связанный дезоксинуклеозид" означает основание нуклеиновой кислоты (A, G, С, Т, U), замещенное дезоксирибозой, связанной посредством фосфатного сложного эфира с образование нуклеотида.
"Связанные нуклеозиды" означает непосредственно граничащие друг с другом нуклеозиды, связанные вместе посредством межнуклеозидной связи.
"Ошибочное спаривание оснований" или "некомплементарное нуклеооснование" относится к случаю, когда нуклеооснование первой нуклеиновой кислоты не способно спариваться с соответствующим нуклеооснованием второй нуклеиновой кислоты или нуклеиновой кислоты-мишени.
"Модифицированная межнуклеозидная связь" относится к замещению или любому изменению по сравнению с встречающейся в природе межнуклеозидной связью (т.е. фосфодиэфирной межнуклеозидной связью).
"Модифицированное нуклеооснование" означает любое нуклеооснование, иное, чем аденин, цитозин, гуанин, тимидин или урацил. "Немодифицированное нуклеооснование" означает пуриновые основания аденин (А) и гуанин (г) и пиримидиновые основания тимин (Т), цитозин (С) и урацил (U).
"Модифицированный нуклеозид" означает нуклеозид, имеющий, независимо, модифицированную сахарную группировку и/или модифицированное нуклеооснование.
"Модифицированный нуклеотид" означает нуклеотид, имеющий, независимо, модифицированную сахарную группировку, модифицированную межнуклеозидную связь или модифицированное нуклеооснование.
"Модифицированный олигонуклеотид" означает олигонуклеотид, содержащий по меньшей мере одну модифицированную межнуклеозидную связь, модифицированный сахар и/или модифицированное нуклеооснование.
"Модифицированный сахар" означает замещение и/или любое изменение по сравнению с природной сахарной группировкой.
"Мономер" относится к одиночному звену олигомера. Мономеры включают, без ограничения, нуклеозиды и нуклеотиды, встречающиеся в природе или модифицированные.
"Мотив" означает паттерн немодифицированных и модифицированных нуклеозидов в антисмысловом соединении.
"Природная сахарная группировка" означает сахарную группировку, встречающуюся в ДНК (2'-Н) или РНК (2'-ОН).
"Встречающаяся в природе межнуклеозидная связь" означает 3'-5'-фосфодиэфирную связь.
"Некомплементарное нуклеооснование" относится к паре нуклеооснований, которые не образуют водородные связи друг с другом или иным способом не поддерживают гибридизацию.
"Нуклеиновая кислота" относится к молекулам, состоящим из мономерных нуклеотидов. Нуклеиновая кислота включает, без ограничения, рибонуклеиновые кислоты (РНК), дезоксирибонуклеиновые кислоты (ДНК), одноцепочечные нуклеиновые кислоты и двухцепочечные нуклеиновые кислоты.
"Нуклеооснование" означает гетероциклическую группировку, способную спариваться с основанием другой нуклеиновой кислоты.
"Комплементарность нуклеооснований" относится к нуклеооснованию, которое способно спариваться с другим нуклеооснованием. Например, в ДНК аденин (А) комплементарен тимину (Т). Например, в РНК аденин (А) комплементарен урацилу (U). В некоторых воплощениях комплементарное нуклеооснование относится к нуклеооснованию антисмыслового соединения, которое способно спариваться с нуклеооснованием его нуклеиновой кислоты-мишени. Например, если нуклеооснование в некотором положении антисмыслового соединения способно образовывать водородную связь с нуклеооснованием в некотором положении нуклеиновой кислоты-мишени, то положение водородной связи между олигонуклеотидом и нуклеиновой кислотой-мишенью считается комплементарным по этой паре нуклеооснований.
"Последовательность нуклеооснований" означает порядок расположения смежных нуклеооснований независимо от сахара, связи и/или модификации нуклеооснований.
"Нуклеозид" означает нуклеооснование, связанное с сахаром.
"Миметик нуклеозида" включает те структуры, которые используют для замены сахара или сахара и основания и необязательно связи по одному или более положениям олигомерного соединения, такие как, например, миметики нуклеозидов, имеющие морфолино, циклогексенил, цикпогексил, тетрагидропиранил, бицикло или трицикло сахарные миметики, например нефуранозные сахарные единицы. Миметик нуклеотида включает те структуры, которые используют для замены нуклеозида и связи по одному или более положениям олигомерного соединения, такие как, например, пептидные нуклеиновые кислоты или морфолино (морфолино, связанные посредством -N(H)-C(=O)-O- или другой нефосфодиэфирной связи). "Сахар-суррогат" перекрывается с немного более широким термином "миметик нуклеозида", но означает замену только сахарной единицы (фуранозного кольца). Тетрагидропиранильные кольца, приведенные в данном описании, являются иллюстративным примером сахара-суррогата, где фуранозная сахарная группа заменена тетрагидропиранильной кольцевой системой. "Миметик" относится к группам, которые замещают сахар, нуклеооснование и/или межнуклеозидную связь. Как правило, миметик используют вместо сахара или комбинации сахар-межнуклеозидная связь, а нуклеооснование сохраняют для гибридизации с выбранной мишенью.
"Нуклеотид" означает нуклеозид, имеющий фосфатную группу, ковалентно связанную с сахарным участком нуклеозида.
"Олигомерное соединение" означает полимер из связанных мономерных субъединиц, которые способны гибридизироваться с по меньшей мере областью молекулы нуклеиновой кислоты.
"Олигонуклеозид" означает олигонуклеотид, в котором межнуклеозидные связи не содержат атом фосфора.
"Олигонуклеотид" означает полимер из связанных нуклеозидов, каждый из которых может быть модифицированным или немодифицированным независимо друг от друга.
"Фосфоротиоатная связь" означает связь между нуклеозидами, где фосфодиэфирная связь модифицирована путем замены одного немостикового атома кислорода атомом серы. Фосфоротиоатная связь представляет собой модифицированную межнуклеозидную связь.
"Участок" означает определенное количество смежных (т.е. связанных) нуклеооснований нуклеиновой кислоты. В некоторых воплощениях участок представляет собой определенное количество смежных нуклеооснований нуклеиновой кислоты-мишени. В некоторых воплощениях участок представляет собой определенное количество смежных нуклеооснований антисмыслового соединения.
"Рецептор прогестерона (РК)-негативный" по отношению к раку молочной железы или клетке рака молочной железы относится к раку молочной железы или клетке рака молочной железы, который(ая) не экспрессирует рецептор прогестерона (PR).
"Область" определена как участок нуклеиновой кислоты-мишени, имеющий по меньшей мере одну поддающуюся распознаванию структуру, функцию или характеристику.
"Рибонуклеотид" означает нуклеотид, имеющий гидроксигруппу в положении 2' сахарного участка нуклеотида. Рибонуклеотиды могут быть модифицированы любыми из множества различных заместителей.
"Сегменты" определены как меньшие или суб-участки областей в нуклеиновой кислоте-мишени.
"Сайты" в данном документе определены как уникальные положения нуклеооснований в нуклеиновой кислоте-мишени.
"Специфически гибиридизируемый" относится к антисмысловому соединению, имеющему значительную степень комплементарности между антисмысловым олигонуклеотидом и нуклеиновой кислотой-мишенью для индуцирования желаемого эффекта, и в то же время демонстрирующему минимальные воздействия или отсутствие воздействий на нуклеиновые кислоты, не являющиеся мишенью, в условиях, в которых требуется специфическое связывание, т.е. в физиологических условиях в случае анализов in vivo и в случае терапевтического лечения. "Строгие условия гибиридизации" или "строгие условия" относятся к условиям, при которых олигомерное соединение будет гибридизироваться с его последовательностью-мишенью, но с минимальным количеством других последовательностей.
"Субъект" означает человек или животное, не являющееся человеком, выбранный(ое) для лечения или терапии.
"Синергизм" или "оказывать синергетический эффект" относится к эффекту комбинации, который больше, чем сумма эффектов каждого компонента, взятого отдельно.
"Мишень" относится к белку, модулирование которого является желательным.
"Ген-мишень" относится к гену, кодирующему мишень.
"Направленное воздействие" означает способ конструирования и выбора антисмыслового соединения, которое будет специфически гибридизироваться с нуклеиновой кислотой-мишенью и индуцировать желаемый эффект.
"Нуклеиновая кислота-мишень", "РНК-мишень", "являющийся мишенью транскрипт РНК" и "нуклеиновая кислота-мишень" все означают нуклеиновую кислоту, способную быть мишенью направленного воздействия антисмысловых соединений.
"Область-мишень" означает участок нуклеиновой кислоты-мишени, на который одно или более антисмысловых соединений оказывают направленное воздействие.
"Сегмент-мишень" означает последовательность нуклеотидов нуклеиновой кислоты-мишени, на которую антисмысловое соединение оказывает направленное воздействие. "5'-сайт-мишень" относится к нуклеотиду с самого 5'-конца сегмента-мишени. "3'-сайт-мишень" относится к нуклеотиду с самого 3'-конца сегмента-мишени.
"Лечение рака" относится к осуществлению действий, которые приводят к ослаблению рака или сопровождающих его симптомов. Комбинация указанных действий охвачена термином "лечение". Ослабление рака включает, без ограничения, сокращение количества раковых клеток у субъекта или снижение количества раковых клеток у субъекта. Указанное лечение в данном документе также включает полное восстановление здоровья в отношении рака. Следует иметь в виду, что лечение в соответствии с воплощениями, представленными в данном документе, может быть эффективным не у всех субъектов, которых лечат. Однако популяцию субъектов, страдающих раком, упоминаемым в данном документе, можно успешно лечить. В некоторых воплощениях "лечение рака" может быть описано целым рядом разных параметров, включая, без ограничения, сокращение размера опухоли у субъекта, имеющего рак, снижение роста или пролиферации опухоли у субъекта, имеющего рак, предупреждение метастазирования или снижение степени метастазирования и/или продление жизни субъекта, имеющего рак, по сравнению с контролем. Рак, который упоминается в этом определении, может представлять собой любой вид рака, включая рак, выбранный из рака предстательной железы, рака молочной железы, рака яичника, рака желудка и рака мочевого пузыря.
"Немодифицированные" нуклеооснования означают пуриновые основания аденин (А) и гуанин (г) и пиримидиновые основания тимин (Т), цитозин (С) и урацил (U).
"Немодифицированный нуклеотид" означает нуклеотид, состоящий из встречающихся в природе нуклеооснований, сахарных группировок и межнуклеозидных связей. В некоторых воплощениях немодифицированным нуклеотидом является РНК нуклеотид (т.е. β-D-рибонуклеозиды) или ДНК нуклеотид (т.е. β-D-дезоксирибонуклеозид).
"Выше" относится к относительному направлению в сторону 5'-конца или М-конца нуклеиновой кислоты.
Некоторые воплощения
В некоторых воплощениях предусмотрены способы, соединения и композиции, ингибирующие экспрессию мРНК рецептора андрогенов (AR).
В некоторых воплощениях предусмотрены антисмысловые соединения или композиции, направленно воздействующие на нуклеиновую кислоту рецептора андрогенов. В некоторых воплощениях нуклеиновой кислотой рецептора андрогенов является совокупность последовательностей, изложенных в базе данных GENBANK, номер доступа NT_011669.17_TRUNC_5079000_5270000 (включена в данный документ как SEQ ID NO: 1), GENBANK, номер доступа НМ_000044.3 (включена в данный документ как SEQ ID NO: 2), GENBANK, номер доступа НМ_001011645.2 (включена в данный документ как SEQ ID NO: 3), GENBANK, номер доступа FJ235916.1 (включена в данный документ как SEQ ID NO: 4), GENBANK, номер доступа FJ235917.1 (включена в данный документ как SEQ ID NO: 5), GENBANK, номер доступа FJ235918.1 (включена в данный документ как SEQ ID N0: 6), GENBANK, номер доступа FJ235919.1 (включена в данный документ как SEQ ID NO: 7), или GENBANK, номер доступа FJ235920.1 (включена в данный документ как SEQ ID NO: 8).
В некоторых воплощениях соединения или композиции содержат модифицированный олигонуклеотид длиной 10-30 связанных нуклеозидов, направленно воздействующий на AR. AR-мишень может иметь последовательность, изложенную в любой из SEQ ID NO: 1-8, или ее участок или ее вариант. В некоторых воплощениях AR-мишень может иметь последовательность известных вариантов сплайсинга AR, включая, без ограничения, AR-V1, AR-V2, AR-V3, AR-V4, AR-V5, AR-V6 и AR-W (также упоминаемого как AR3), которые содержат экзоны 1-3, но не имеют экзонов 4-8. AR-V1, AR-V2, AR-V3, AR-V4, AR-V5, AR-V6, AR-V7 и дополнительные варианты сплайсинга, которые могут быть мишенью направленного воздействия предложенных в данном документе соединений, описаны в Ни et al., Cancer Res 2009; 69: 16-22, и в публикации патентной заявки США №US 2010/0068802, каждая из которых во всей полноте включена в данное описание посредством ссылки.
В некоторых воплощениях соединения или композиции содержат модифицированный олигонуклеотид, состоящий из 10-30 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую по меньшей мере 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных нуклеооснований любой из SEQ ID NO: 12-179. В некоторых воплощениях один или более модифицированных нуклеозидов в сегменте "крыло" имеют модифицированный сахар. В некоторых воплощениях модифицированный сахар представляет собой бициклический сахар. В некоторых воплощениях модифицированный нуклеозид представляет собой LNA нуклеозид. В некоторых воплощениях модифицированный нуклеозид представляет собой 2'-замещенный нуклеозид. В некоторых воплощениях 2'-замещенные нуклеозиды включают нуклеозиды с модификациями бициклического сахара. В некоторых воплощениях модифицированный нуклеозид представляет собой 2'-МОЕ-нуклеозид. В некоторых воплощениях модифицированный нуклеозид представляет собой связанный этил (сЕ1)-нуклеозид.
В некоторых воплощениях соединения или композиции содержат модифицированный олигонуклеотид, состоящий из 10-30 связанных нуклеозидов и имеющий последовательность нуклеооснований, состоящую из последовательности нуклеооснований, любой из SEQ ID NO: 12-179. В некоторых воплощениях один или более модифицированных нуклеозидов в сегменте "крыло" имеют модифицированный сахар. В некоторых воплощениях модифицированный сахар представляет собой бициклический сахар. В некоторых воплощениях модифицированный нуклеозид представляет собой LNA нуклеозид. В некоторых воплощениях модифицированный нуклеозид представляет собой 2'-замещенный нуклеозид. В некоторых воплощениях 2'-замещенные нуклеозиды включают нуклеозиды с модификациями бициклического сахара. В некоторых воплощениях модифицированный нуклеозид представляет собой 2'-МОЕ-нуклеозид. В некоторых воплощениях модифицированный нуклеозид представляет собой связанный этил (cEt)-нуклеозид.
В некоторых воплощениях соединения или композиции, направленно воздействующие на рецептор андрогенов, содержат одноцепочечный модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов, имеющих последовательность нуклеооснований, состоящую из последовательности SEQ ID NO: 35, 39, 43, 124, 150, 155, 169 или 175, или его фармацевтически приемлемую соль. В некоторых воплощениях антисмысловым соединением, направленно воздействующим на AR человека, является ISIS 560131, ISIS 569213, ISIS 569216, ISIS 569221, ISIS 569236, ISIS 579671, ISIS 586124, ISIS 583918, ISIS 584149, ISIS 584163, ISIS 584269 или ISIS 584468.
В некоторых воплощениях модифицированный олигонуклеотид содержит: а) гэп-сегмент, состоящий из связанных дезоксинуклеозидов; б) 5'-сегмент-"крыло", состоящий из связанных нуклеозидов; и в) 3'-сегмент-"крыло", состоящий из связанных нуклеозидов. Гэп-сегмент расположен между 5'-сегментом-"крылом" и 3'-сегментом-"крылом", и каждый нуклеозид каждого сегмента-"крыла" содержит модифицированный сахар.
В некоторых воплощениях модифицированный олигонуклеотид состоит из 20 связанных нуклеозидов, гэп-сегмента, состоящего из 10 связанных дезоксинуклеозидов, 5'-сегмента-"крыла", состоящего из пяти связанных нуклеозидов, 3'-сегмента-"крыла", состоящего из пяти связанных нуклеозидов, каждый нуклеозид каждого сегмента-"крыла" содержит 2'-O-метоксиэтил-сахар, каждая межнуклеозидная связь представляет собой фосфоротиоатную связь, и каждый цитозин представляет собой 5-метилцитозин.
В некоторых воплощениях модифицированный олигонуклеотид состоит из 16 связанных нуклеозидов, гэп-сегмента, состоящего из 10 связанных дезоксинуклеозидов, 5'-сегмента-"крыла", состоящего из трех связанных нуклеозидов, 3'-сегмента-"крыла", состоящего из трех связанных нуклеозидов, каждый нуклеозид каждого сегмента-"крыла" содержит связанный этил (cEt)-сахар, каждая межнуклеозидная связь представляет собой фосфоротиоатную связь, и каждый цитозин представляет собой 5-метилцитозин.
В некоторых воплощениях модифицированный олигонуклеотид состоит из 16 связанных нуклеозидов, гэп-сегмента, состоящего из 9 связанных дезоксинуклеозидов, 5'-сегмента-"крыла", состоящего из трех связанных нуклеозидов, 3'-сегмента-"крыла", состоящего из четырех связанных нуклеозидов; каждый из трех связанных нуклеозидов 5'-сегмента-"крыла" содержит связанный этил (cEt)-caxap; четыре связанных нуклеозида 3'-сегмента-"крыла" содержат связанный этил (cEt)-caxap, связанный этил (cEt)-caxap, связанный этил (cEt)-caxap и 2'-O-метоксиэтил-сахар в направлении от 5' к 3'; каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и каждый цитозин представляет собой 5-метилцитозин.
В некоторых воплощениях модифицированный олигонуклеотид состоит из 16 связанных нуклеозидов, гэп-сегмента, состоящего из 8 связанных дезоксинуклеозидов, 5'-сегмента-"крыла", состоящего из пяти связанных нуклеозидов, 3'-сегмента-"крыла", состоящего из трех связанных нуклеозидов; каждый из пяти связанных нуклеозидов 5'-сегмента-"крыла" содержит связанный этил (cEt)-caxap; каждый из трех связанных нуклеозидов 3'-сегмента-"крыла" содержит связанный этил (cEt)-caxap; каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и каждый цитозин представляет собой 5-метилцитозин.
В некоторых воплощениях модифицированный олигонуклеотид состоит из 16 связанных нуклеозидов, гэп-сегмента, состоящего из 8 связанных дезоксинуклеозидов, 5'-сегмента-"крыла", состоящего из четырех связанных нуклеозидов, 3'-сегмента-"крыла", состоящего из четырех связанных нуклеозидов; четыре связанных нуклеозида 5'-сегмента-"крыла" содержат 2'-O-метоксиэтил-сахар, связанный этил (cEt)-caxap, связанный этил (cEt)-caxap и связанный этил (cEt)-caxap в направлении от 5' к 3'; четыре связанных нуклеозида 3'-сегмента-"крыла" содержат связанный этил (cEt)-caxap, связанный этил (cEt)-caxap, связанный этил (cEt)-caxap и 2'-O-метоксиэтил-сахар в направлении от 5' к 3'; каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и каждый цитозин представляет собой 5-метилцитозин.
В некоторых воплощениях модифицированный олигонуклеотид состоит из 16 связанных нуклеозидов, гэп-сегмента, состоящего из 8 связанных дезоксинуклеозидов, 5'-сегмента-"крыла", состоящего из пяти связанных нуклеозидов, 3'-сегмента-"крыла", состоящего из трех связанных нуклеозидов; пять связанных нуклеозидов 5'-сегмента-"крыла" содержат 2'-O-метоксиэтил-сахар, 2'-O-метоксиэтил-сахар, связанный этил (cEt)-caxap, связанный этил (cEt)-caxap и связанный этил (cEt)-caxap в направлении от 5' к 3'; каждый из трех связанных нуклеозидов 3'-сегмента-"крыла" содержат связанный этил (cEt)-caxap; каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и каждый цитозин представляет собой 5-метилцитозин.
В некоторых воплощениях модифицированный олигонуклеотид состоит из 16 связанных нуклеозидов, гэп-сегмента, состоящего из 7 связанных дезоксинуклеозидов, 5'-сегмента-"крыла", состоящего из семи связанных нуклеозидов, 3'-сегмента-"крыла", состоящего из двух связанных нуклеозидов; семь связанных нуклеозидов 5'-сегмента-"крыла" содержат 2'-O-метоксиэтил-сахар, связанный этил (cEt)-caxap, связанный этил (cEt)-caxap, 2'-O-метоксиэтил-сахар, 2'-O-метоксиэтил-сахар, связанный этил (cEt)-caxap и связанный этил (cEt)-caxap в направлении от 5' к 3'; каждый из двух связанных нуклеозидов 3'-сегмента-"крыла" содержит связанный этил (cEt)-сахар; каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и каждый цитозин представляет собой 5-метилцитозин.
В некоторых воплощениях модифицированный олигонуклеотид состоит из 16 связанных нуклеозидов, гэп-сегмента, состоящего из 7 связанных дезоксинуклеозидов, 5'-сегмента-"крыла", состоящего из шести связанных нуклеозидов, 3'-сегмента-"крыла", состоящего из трех связанных нуклеозидов; шесть связанных нуклеозидов 5'-сегмента-"крыла"содержат 2'-O-метоксиэтил-сахар, связанный этил (cEt)-caxap, связанный этил (cEt)-caxap, 2'-O-метоксиэтил-сахар, связанный этил (cEt)-caxap и связанный этил (cEt)-caxap в направлении от 5' к 3'; каждый из трех связанных нуклеозидов 3'-сегмента-"крыла" содержит связанный этил (cEt)-caxap; каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и каждый цитозин представляет собой 5-метилцитозин.
В некоторых воплощениях модифицированный олигонуклеотид состоит из 16 связанных нуклеозидов, гэп-сегмента, состоящего из 7 связанных дезоксинуклеозидов, 5'-сегмента-"крыла", состоящего из пяти связанных нуклеозидов, 3'-сегмента-"крыла", состоящего из четырех связанных нуклеозидов; пять связанных нуклеозидов 5'-сегмента-"крыла" содержат 2'-O-метоксиэтил-сахар, 2'-O-метоксиэтил-сахар, связанный этил (cEt)-сахар, связанный этил (cEt)-caxap и связанный этил (cEt)-caxap в направлении от 5' к 3'; четыре связанных нуклеозида 3'-сегмента-"крыла" содержат связанный этил (cEt)-caxap, связанный этил (cEt)-caxap, связанный этил (cEt)-caxap и 2'-O-метоксиэтил-сахар в направлении от 5' к 3'; каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и каждый цитозин представляет собой 5-метилцитозин.
В некоторых воплощениях модифицированный олигонуклеотид состоит из 16 связанных нуклеозидов, гэп-сегмента, состоящего из 7 связанных дезоксинуклеозидов, 5'-сегмента-"крыла", состоящего из четырех связанных нуклеозидов, 3'-сегмента-"крыла", состоящего из пяти связанных нуклеозидов; четыре связанных нуклеозида 5'-сегмента-"крыла" содержат 2'-O-метоксиэтил-сахар, связанный этил (cEt)-caxap, связанный этил (cEt)-caxap и связанный этил (cEt)-caxap в направлении от 5' к 3'; пять связанных нуклеозидов 3'-сегмента-"крыла" содержат связанный этил (cEt)-сахар, связанный этил (cEt)-caxap, связанный этил (cEt)-caxap, 2'-O-метоксиэтил-сахар и 2'-O-метоксиэтил-сахар в направлении от 5' к 3'; каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и каждый цитозин представляет собой 5-метилцитозин.
В некоторых воплощениях соединения или композиции, направленно воздействующие на рецептор андрогенов, содержат одноцепочечный модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов, имеющий последовательность нуклеооснований, состоящую из последовательности SEQ ID NO: 35, 39, 43, 124, 150, 155, 169 или 175, или его фармацевтически приемлемую соль, где модифицированный олигонуклеотид содержит гэп-сегмент, состоящий из дезоксинуклеозидов; 5'-сегмент-"крыло"; и 3'-сегмент-"крыло", где гэп-сегмент расположен между 5'-сегментом-"крылом" и 3'-сегментом-"крылом", и каждый нуклеозид каждого сегмента-"крыла" содержит модифицированный сахар. В некоторых воплощениях каждая межнуклеозидная связь модифицированного олигонуклеотида представляет собой фосфоротиоатную связь. В некоторых воплощениях каждый цитозин модифицированного олигонуклеотида представляет собой 5'-метилцитозин.
В некоторых воплощениях соединение, направленно воздействующее на рецептор андрогенов, содержит одноцепочечный модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов, имеющий последовательность нуклеооснований, состоящую из последовательности SEQ ID NO: 35, или его фармацевтически приемлемую соль, где модифицированный олигонуклеотид содержит:
гэп-сегмент, состоящий из 9 связанных дезоксинуклеозидов;
5'-сегмент-"крыло", состоящий из трех связанных нуклеозидов; и
3'-сегмент-"крыло", состоящий из четырех связанных нуклеозидов;
где гэп-сегмент расположен между 5'-сегментом-"крылом" и 3'-сегментом-"крылом"; каждый из трех связанных нуклеозидов 5'-сегмента-"крыла" содержит связанный этил (cEt)-caxap; четыре связанных нуклеозида 3'-сегмента-"крыла" содержат связанный этил (cEt)-caxap, связанный этил (cEt)-caxap, связанный этил (cEt)-caxap и 2'-O-метоксиэтил-сахар в направлении от 5' к 3'; каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и каждый цитозин представляет собой 5-метилцитозин.
В некоторых воплощениях соединение, направленно воздействующее на рецептор андрогенов, содержит одноцепочечный модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов, имеющий последовательность нуклеооснований, состоящую из последовательности SEQ ID NO: 39, или его фармацевтически приемлемую соль, где модифицированный олигонуклеотид содержит:
гэп-сегмент, состоящий из 9 связанных дезоксинуклеозидов;
5'-сегмент-"крыло", состоящий из трех связанных нуклеозидов; и
3'-сегмент-"крыло", состоящий из четырех связанных нуклеозидов;
где гэп-сегмент расположен между 5'-сегментом-"крылом" и 3'-сегментом-"крылом"; каждый из трех связанных нуклеозидов 5'-сегмента-"крыла" содержит связанный этил (cEt)-caxap; четыре связанных нуклеозида 3'-сегмента-"крыла" содержат связанный этил (cEt)-caxap, связанный этил (cEt)-caxap, связанный этил (cEt)-caxap и 2'-O-метоксиэтил-сахар в направлении от 5' к 3'; каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и каждый цитозин представляет собой 5-метилцитозин.
В некоторых воплощениях соединение, направленно воздействующее на рецептор андрогенов, содержит одноцепочечный модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов, имеющий последовательность нуклеооснований, состоящую из последовательности SEQ ID NO: 39, или его фармацевтически приемлемую соль, где модифицированный олигонуклеотид содержит:
гэп-сегмент, состоящий из 8 связанных дезоксинуклеозидов;
5'-сегмент-"крыло", состоящий из четырех связанных нуклеозидов; и
3'-сегмент-"крыло", состоящий из четырех связанных нуклеозидов;
где гэп-сегмент расположен между 5'-сегментом-"крылом" и 3'-сегментом-"крылом"; четыре связанных нуклеозида 5'-сегмента-"крыла" содержат 2'-O-метоксиэтил-сахар, связанный этил (cEt)-caxap, связанный этил (cEt)-caxap и связанный этил (cEt)-caxap в направлении от 5' к 3'; четыре связанных нуклеозида 3'-сегмента-"крыла" содержат связанный этил (cEt)-caxap, связанный этил (cEt)-caxap, связанный этил (cEt)-caxap и 2'-O-метоксиэтил-сахар в направлении от 5' к 3'; каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и каждый цитозин представляет собой 5-метилцитозин.
В некоторых воплощениях соединение, направленно воздействующее на рецептор андрогенов, содержит одноцепочечный модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов, имеющий последовательность нуклеооснований, состоящую из последовательности SEQ ID NO: 39, или его фармацевтически приемлемую соль, где модифицированный олигонуклеотид содержит:
гэп-сегмент, состоящий из 8 связанный дезоксинуклеозидов;
5'-сегмент-"крыло", состоящий из пяти связанных нуклеозидов; и
3'-сегмент-"крыло", состоящий из трех связанных нуклеозидов;
где гэп-сегмент расположен между 5'-сегментом-"крылом" и 3'-сегментом-"крылом"; пять связанных нуклеозидов 5'-сегмента-"крыла" содержат 2'-O-метоксиэтил-сахар, 2'-O-метоксиэтил-сахар, связанный этил (cEt)-caxap, связанный этил (cEt)-caxap и связанный этил (cEt)-caxap в направлении от 5' к 3'; каждый из трех связанных нуклеозидов 3'-сегмента-"крыла" содержит связанный этил (cEt)-caxap; каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и каждый цитозин представляет собой 5-метилцитозин.
В некоторых воплощениях соединение, направленно воздействующее на рецептор андрогенов, содержит одноцепочечный модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов, имеющий последовательность нуклеооснований, состоящую из последовательности SEQ ID NO: 39, или его фармацевтически приемлемую соль, где модифицированный олигонуклеотид содержит:
гэп-сегмент, состоящий из 7 связанных дезоксинуклеозидов;
5'-сегмент-"крыло", состоящий из четырех связанных нуклеозидов; и
3'-сегмент-"крыло", состоящий из пяти связанных нуклеозидов;
где гэп-сегмент расположен между 5'-сегментом-"крылом" и 3'-сегментом-"крылом"; четыре связанных нуклеозида 5'-сегмента-"крыла" содержат 2'-O-метоксиэтил-сахар, связанный этил (cEt)-caxap, связанный этил (cEt)-caxap и связанный этил (cEt)-caxap в направлении от 5' к 3'; пять связанных нуклеозидов 3'-сегмента-"крыла" содержат связанный этил (cEt)-caxap, связанный этил (cEt)-caxap, связанный этил (cEt)-caxap, 2'-O-метоксиэтил-сахар и 2'-O-метоксиэтил-сахар в направлении от 5' к 3'; каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и каждый цитозин представляет собой 5-метилцитозин.
В некоторых воплощениях соединение, направленно воздействующее на рецептор андрогенов, содержит одноцепочечный модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов, имеющий последовательность нуклеооснований, состоящую из последовательности SEQ ID NO: 35, или его фармацевтически приемлемую соль, где модифицированный олигонуклеотид содержит:
гэп-сегмент, состоящий из 7 связанных дезоксинуклеозидов;
5'-сегмент-"крыло", состоящий из шести связанных нуклеозидов; и
3'-сегмент-"крыло", состоящий из трех связанных нуклеозидов;
где гэп-сегмент расположен между 5'-сегментом-"крылом" и 3'-сегментом-"крылом"; шесть связанных нуклеозидов 5'-сегмента-"крыла" содержат 2'-O-метоксиэтил-сахар, связанный этил (cEt)-caxap, связанный этил (cEt)-caxap, 2'-O-метоксиэтил-сахар, связанный этил (cEt)-caxap и связанный этил (cEt)-caxap в направлении от 5' к 3'; каждый из трех связанных нуклеозидов 3'-сегмента-"крыла" содержит связанный этил (cEt)-сахар; каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и каждый цитозин представляет собой 5-метилцитозин.
В некоторых воплощениях соединение, направленно воздействующее на рецептор андрогенов, содержит одноцепочечный модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов, имеющих последовательность нуклеооснований, состоящую из последовательности SEQ ID NO: 43, или его фармацевтически приемлемую соль, где модифицированный олигонуклеотид содержит:
гэп-сегмент, состоящий из 10 связанных дезоксинуклеозидов;
5'-сегмент-"крыло", состоящий из трех связанных нуклеозидов; и
3'-сегмент-"крыло", состоящий из трех связанных нуклеозидов;
где гэп-сегмент расположен между 5'-сегментом-"крылом" и 3'-сегментом-"крылом"; каждый нуклеозид каждого сегмента-"крыла" содержит связанный этил (cEt)-caxap; каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и каждый цитозин представляет собой 5-метилцитозин.
В некоторых воплощениях соединение, направленно воздействующее на рецептор андрогенов, содержит одноцепочечный модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов, имеющих последовательность нуклеооснований, состоящую из последовательности SEQ ID NO: 124, или его фармацевтически приемлемую соль, где модифицированный олигонуклеотид содержит:
гэп-сегмент, состоящий из 10 связанных дезоксинуклеозидов;
5'-сегмент-"крыло", состоящий из трех связанных нуклеозидов; и
3'-сегмент-"крыло", состоящий из трех связанных нуклеозидов;
где гэп-сегмент расположен между 5'-сегментом-"крылом" и 3'-сегментом-"крылом"; каждый нуклеозид каждого сегмента-"крыла" содержит связанный этил (cEt)-caxap; каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и каждый цитозин представляет собой 5-метилцитозин.
В некоторых воплощениях, соединение, направленно воздействующее на рецептор андрогенов, содержит одноцепочечный модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов, имеющих последовательность нуклеооснований, состоящую из последовательности SEQ ID NO: 150, или его фармацевтически приемлемую соль, где модифицированный олигонуклеотид содержит:
гэп-сегмент, состоящий 10 связанных дезоксинуклеозидов;
5'-сегмент-"крыло", состоящий из трех связанных нуклеозидов; и
3'-сегмент-"крыло", состоящий из трех связанных нуклеозидов;
где гэп-сегмент расположен между 5'-сегментом-"крылом" и 3'-сегментом-"крылом"; каждый нуклеозид каждого сегмента-"крыла" содержит связанный этил (cEt)-caxap; каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и каждый цитозин представляет собой 5-метилцитозин.
В некоторых воплощениях соединение, направленно воздействующее на рецептор андрогенов, содержит одноцепочечный модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов, имеющих последовательность нуклеооснований, состоящую из последовательности SEQ ID NO: 155, или его фармацевтически приемлемую соль, где модифицированный олигонуклеотид содержит:
гэп-сегмент, состоящий из 10 связанных дезоксинуклеозидов;
5'-сегмент-"крыло", состоящий из трех связанных нуклеозидов; и
3'-сегмент-"крыло", состоящий из трех связанных нуклеозидов;
где гэп-сегмент расположен между 5'-сегментом-"крылом" и 3'-сегментом-"крылом"; каждый нуклеозид каждого сегмента-"крыла" содержит связанный этил (cEt)-caxap; каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и каждый цитозин представляет собой 5-метилцитозин.
В некоторых воплощениях соединение, направленно воздействующее на рецептор андрогенов, содержит одноцепочечный модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов, имеющих последовательность нуклеооснований, состоящую из последовательности SEQ ID NO: 169, или его фармацевтически приемлемую соль, где модифицированный олигонуклеотид содержит:
гэп-сегмент, состоящий из 10 связанных дезоксинуклеозидов;
5'-сегмент-"крыло", состоящий из трех связанных нуклеозидов; и
3'-сегмент-"крыло", состоящий из трех связанных нуклеозидов;
где гэп-сегмент расположен между 5'-сегментом-"крылом" и 3'-сегментом-"крылом"; каждый нуклеозид каждого сегмента-"крыла" содержит связанный этил (cEt)-caxap; каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и каждый цитозин представляет собой 5-метилцитозин.
В некоторых воплощениях соединение, направленно воздействующее на рецептор андрогенов, содержит одноцепочечный модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов, имеющих последовательность нуклеооснований, состоящую из последовательности SEQ ID NO: 175, или его фармацевтически приемлемую соль, где модифицированный олигонуклеотид содержит:
гэп-сегмент, состоящий из 10 связанных дезоксинуклеозидов;
5'-сегмент-"крыло", состоящий из трех связанных нуклеозидов; и
3'-сегмент-"крыло", состоящий из трех связанных нуклеозидов;
где гэп-сегмент расположен между 5'-сегментом-"крылом" и 3'-сегментом-"крылом"; каждый нуклеозид каждого сегмента-"крыла" содержит связанный этил (cEt)-caxap; каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и каждый цитозин представляет собой 5-метилцитозин.
В некоторых воплощениях антисмысловое соединение или антисмысловой олигонуклеотид, направленно воздействующее(ий) на нуклеиновую кислоту рецептора андрогенов, является комплементарным в пределах следующих нуклеотидных областей SEQ ID NO: 1: 2957-2972, 3079-3094, 3099-3114, 3109-3124, 3113-3128, 3120-3135, 3133-3148, 3224-3239, 3226-3241, 3351-3366, 3353-3368, 3361-3376, 3388-3403, 3513-3528, 3517-3532, 3519-3534, 3641-3656, 3735-3750, 3764-3779, 3768-3783, 3798-3813, 3799-3814, 3851-3866, 3870-3885, 3874-3889, 3876-3891, 3878-3893, 3884-3899, 3886-3901, 3888-3903, 3901-3916, 3956-3971, 3962-3977, 3964-3979, 3967-3982, 4019-4034, 4038-4053, 4049-4064, 4056-4071, 4059-4074, 4062-4077, 4066-4081, 4070-4085, 4101-4116, 4103-4118, 4105-4120, 4109-4124, 4305-4320, 4405-4420, 4532-4547, 4534-4549, 4537-4552, 4539-4554, 4555-4570, 4571-4586, 4573-4588, 4578-4593, 4597-4612, 4632-4647, 4655-4670, 4656-4671, 4662-4677, 4699-4714, 4747-4762, 4750-4765, 4752-4767, 4754-4769, 4755-4770, 4769-4784, 4798-4813, 4804-4819, 4807-4822, 4833-4848, 4837-4852, 4839-4854, 4865-4880, 4868-4883, 4872-4887, 4874-4889, 4876-4891, 4887-4902, 4889-4904, 4916-4931, 4918-4933, 4938-4953, 4942-4957, 4944-4959, 4951-4966, 5050-5065, 5052-5067, 5054-5069, 5056-5071, 5060-5075, 5061-5076, 5062-5077, 5133-5148, 5141-5156, 5155-5170, 5265-5280, 5293-5308, 5308-5323, 5392-5407, 5448-5463, 5469-5484, 5481-5496, 5483-5498, 5486-5501, 5488-5503, 5494-5509, 5521-5536, 5666-5681, 6222-6237, 6701-6716, 7543-7558, 8471-8486, 8638-8653, 9464-9479, 10217-10232, 10250-10265, 10865-10880, 11197-11212, 11855-11870, 13189-13204, 13321-13336, 13346-13361, 16555-16570, 16793-16808, 16968-16983, 17206-17221, 18865-18880, 29329-29344, 32290-32305, 33315-33330, 39055-39070, 40615-40630, 42017-42032, 56050-56065, 58719-58734, 58720-58739, 58720-58735, 58721-58736, 58722-58737, 58723-58738, 58724-58739, 58724-58739, 58725-58740, 58725-58740, 58725-58740, 58750-58769, 58750-58765, 58751-58766, 58752-58767, 58753-58768, 58754-58769, 58755-58770, 60902-60917, 67454-67469, 102156-102171, 114874-114889, 115272-115287, 115365-115380, 134971-134986, 139682-139697, 139762-139777, 139782-139797, 144856-144871, 144938-144953, 148406-148421, 148443-148458, 148520-148535, 181695-181710, 182958-182973 или 183049-183064.
В некоторых воплощениях антисмысловое соединение или антисмысловой олигонуклеотид, направленно воздействующее(ий) на нуклеиновую кислоту-мишень рецептора андрогенов, направленно воздействует на следующие нуклеотидные области SEQ ID NO: 1: 2957-2972, 3079-3094, 3099-3114, 3109-3124, 3113-3128, 3120-3135, 3133-3148, 3224-3239, 3226-3241, 3351-3366, 3353-3368, 3361-3376, 3388-3403, 3513-3528, 3517-3532, 3519-3534, 3641-3656, 3735-3750, 3764-3779, 3768-3783, 3798-3813, 3799-3814, 3851-3866, 3870-3885, 3874-3889, 3876-3891, 3878-3893, 3884-3899, 3886-3901, 3888-3903, 3901-3916, 3956-3971, 3962-3977, 3964-3979, 3967-3982, 4019-4034, 4038-4053, 4049-4064, 4056-4071, 4059-4074, 4062-4077, 4066-4081, 4070-4085, 4101-4116, 4103-4118, 4105-4120, 4109-4124, 4305-4320, 4405-4420, 4532-4547, 4534-4549, 4537-4552, 4539-4554, 4555-4570, 4571-4586, 4573-4588, 4578-4593, 4597-4612, 4632-4647, 4655-4670, 4656-4671, 4662-4677, 4699-4714, 4747-4762, 4750-4765, 4752-4767, 4754-4769, 4755-4770, 4769-4784, 4798-4813, 4804-4819, 4807-4822, 4833-4848, 4837-4852, 4839-4854, 4865-4880, 4868-4883, 4872-4887, 4874-4889, 4876-4891, 4887-4902, 4889-4904, 4916-4931, 4918-4933, 4938-4953, 4942-4957, 4944-4959, 4951-4966, 5050-5065, 5052-5067, 5054-5069, 5056-5071, 5060-5075, 5061-5076, 5062-5077, 5133-5148, 5141-5156, 5155-5170, 5265-5280, 5293-5308, 5308-5323, 5392-5407, 5448-5463, 5469-5484, 5481-5496, 5483-5498, 5486-5501, 5488-5503, 5494-5509, 5521-5536, 5666-5681, 6222-6237, 6701-6716, 7543-7558, 8471-8486, 8638-8653, 9464-9479, 10217-10232, 10250-10265, 10865-10880, 11197-11212, 11855-11870, 13189-13204, 13321-13336, 13346-13361, 16555-16570, 16793-16808, 16968-16983, 17206-17221, 18865-18880, 29329-29344, 32290-32305, 33315-33330, 39055-39070, 40615-40630, 42017-42032, 56050-56065, 58719-58734, 58720-58739, 58720-58735, 58721-58736, 58722-58737, 58723-58738, 58724-58739, 58724-58739, 58725-58740, 58725-58740, 58725-58740, 58750-58769, 58750-58765, 58751-58766, 58752-58767, 58753-58768, 58754-58769, 58755-58770, 60902-60917, 67454-67469, 102156-102171, 114874-114889, 115272-115287, 115365-115380, 134971-134986, 139682-139697, 139762-139777, 139782-139797, 144856-144871, 144938-144953, 148406-148421, 148443-148458, 148520-148535, 181695-181710, 182958-182973 или 183049-183064.
В некоторых воплощениях антисмысловые соединения или антисмысловые олигонуклеотиды направленно воздействуют на область нуклеиновой кислоты рецептора андрогенов. В некоторых воплощениях такие соединения или олигонуклеотиды, направленно воздействующие на область нуклеиновой кислоты рецептора андрогенов, имеют смежный участок нуклеооснований, который является комплементарным участку нуклеооснований равной длины данной области. Например, участок может представлять собой по меньшей мере участок из 8, 9, 10, 11, 12, 13, 14, 15 или 16 смежных нуклеооснований, комплементарный участку равной длины области, изложенной в данном документе. В некоторых воплощениях такие соединения или олигонуклеотиды направленно воздействуют на следующие нуклеотидные области SEQ ID NO: 1: 2957-2972, 3079-3094, 3099-3114, 3109-3124, 3113-3128, 3120-3135, 3133-3148, 3224-3239, 3226-3241, 3351-3366, 3353-3368, 3361-3376, 3388-3403, 3513-3528, 3517-3532, 3519-3534, 3641-3656, 3735-3750, 3764-3779, 3768-3783, 3798-3813, 3799-3814, 3851-3866, 3870-3885, 3874-3889, 3876-3891, 3878-3893, 3884-3899, 3886-3901, 3888-3903, 3901-3916, 3956-3971, 3962-3977, 3964-3979, 3967-3982, 4019-4034, 4038-4053, 4049-4064, 4056-4071, 4059-4074, 4062-4077, 4066-4081, 4070-4085, 4101-4116, 4103-4118, 4105-4120, 4109-4124, 4305-4320, 4405-4420, 4532-4547, 4534-4549, 4537-4552, 4539-4554, 4555-4570, 4571-4586, 4573-4588, 4578-4593, 4597-4612, 4632-4647, 4655-4670, 4656-4671, 4662-4677, 4699-4714, 4747-4762, 4750-4765, 4752-4767, 4754-4769, 4755-4770, 4769-4784, 4798-4813, 4804-4819, 4807-4822, 4833-4848, 4837-4852, 4839-4854, 4865-4880, 4868-4883, 4872-4887, 4874-4889, 4876-4891, 4887-4902, 4889-4904, 4916-4931, 4918-4933, 4938-4953, 4942-4957, 4944-4959, 4951-4966, 5050-5065, 5052-5067, 5054-5069, 5056-5071, 5060-5075, 5061-5076, 5062-5077, 5133-5148, 5141-5156, 5155-5170, 5265-5280, 5293-5308, 5308-5323, 5392-5407, 5448-5463, 5469-5484, 5481-5496, 5483-5498, 5486-5501, 5488-5503, 5494-5509, 5521-5536, 5666-5681, 6222-6237, 6701-6716, 7543-7558, 8471-8486, 8638-8653, 9464-9479, 10217-10232, 10250-10265, 10865-10880, 11197-11212, 11855-11870, 13189-13204, 13321-13336, 13346-13361, 16555-16570, 16793-16808, 16968-16983, 17206-17221, 18865-18880, 29329-29344, 32290-32305, 33315-33330, 39055-39070, 40615-40630, 42017-42032, 56050-56065, 58719-58734, 58720-58739, 58720-58735, 58721-58736, 58722-58737, 58723-58738, 58724-58739, 58724-58739, 58725-58740, 58725-58740, 58725-58740, 58750-58769, 58750-58765, 58751-58766, 58752-58767, 58753-58768, 58754-58769, 58755-58770, 60902-60917, 67454-67469, 102156-102171, 114874-114889, 115272-115287, 115365-115380, 134971-134986, 139682-139697, 139762-139777, 139782-139797, 144856-144871, 144938-144953, 148406-148421, 148443-148458, 148520-148535, 181695-181710, 182958-182973 или 183049-183064.
В некоторых воплощениях предложенное(ый) антисмысловое соединение или антисмысловой олигонуклеотид направленно воздействует на AR в пределах экзона 1, например в пределах нуклеотидных областей 2863-5593 (экзон 1) или 27672-27853 (экзон 1В) SEQ ID NO: 1. В некоторых воплощениях предложенное антисмысловое соединение, направленно воздействующее на экзон 1 AR, является комплементарным в пределах любой из следующих нуклеотидных областей SEQ ID NO: 1: 2957-2972, 3079-3094, 3099-3114, 3109-3124, 3113-3128, 3120-3135, 3133-3148, 3224-3239, 3226-3241, 3351-3366, 3353-3368, 3361-3376, 3388-3403, 3513-3528, 3517-3532, 3519-3534, 3641-3656, 3735-3750, 3764-3779, 3768-3783, 3798-3813, 3799-3814, 3851-3866, 3870-3885, 3874-3889, 3876-3891, 3878-3893, 3884-3899, 3886-3901, 3888-3903, 3901-3916, 3956-3971, 3962-3977, 3964-3979, 3967-3982, 4019-4034, 4038-4053, 4047-4062, 4049-4064, 4056-4071, 4059-4074, 4062-4077, 4066-4081, 4070-4085, 4101-4116, 4103-4118, 4105-4120, 4109-4124, 4305-4320, 4405-4420, 4532-4547, 4534-4549, 4537-4552, 4539-4554, 4555-4570, 4571-4586, 4573-4588, 4578-4593, 4597-4612, 4632-4647, 4655-4670, 4656-4671, 4662-4677, 4699-4714, 4747-4762, 4750-4765, 4752-4767, 4754-4769, 4755-4770, 4769-4784, 4798-4813, 4804-4819, 4807-4822, 4833-4848, 4837-4852, 4839-4854, 4865-4880, 4868-4883, 4872-4887, 4874-4889, 4876-4891, 4887-4902, 4889-4904, 4916-4931, 4918-4933, 4938-4953, 4942-4957, 4944-4959, 4951-4966, 5050-5065, 5052-5067, 5054-5069, 5056-5071, 5060-5075, 5061-5076, 5062-5077, 5133-5148, 5141-5156, 5155-5170, 5265-5280, 5293-5308, 5308-5323, 5392-5407, 5448-5463, 5469-5484, 5481-5496, 5483-5498, 5486-5501, 5488-5503, 5494-5509 или 5521-5536.
В некоторых воплощениях предложенное(ый)антисмысловое соединение или антисмысловой олигонуклеотид направленно воздействует на AR в пределах экзона 2, например в пределах нуклеотидных областей 102087-102238 (экзон 2) или 139551-139834 (экзон 2с) SEQ ID NO: 1. В некоторых воплощениях предложенное антисмысловое соединение, направленно воздействующее на экзон 2 AR, является комплементарным в пределах любой из следующих нуклеотидных областей SEQ ID NO: 1: 102155-102170, 102156-102171, 139682-139697, 139762-139777 или 139782-139797.
В некоторых воплощениях предложенное(ый) антисмысловое соединение или антисмысловой олигонуклеотид направленно воздействует на AR в пределах экзона 3, например в пределах нуклеотидных областей 144841-144957 (экзон 3), 148380-148594 (экзон 3b) или 153504-154908 (экзон 3d) SEQ ID NO: 1. В некоторых воплощениях предложенное антисмысловое соединение, направленно воздействующее на экзон 3 AR, является комплементарным в пределах любой из следующих нуклеотидных областей SEQ ID NO: 1: 144856-144871, 144938-144953, 148406-148421, 148443-148458 или 148520-148535.
В некоторых воплощениях предложенное(ый) антисмысловое соединение или антисмысловой олигонуклеотид направленно воздействует на AR в пределах экзона 7, например в пределах нуклеотидной области 181658-181815 SEQ ID NO: 1. В некоторых воплощениях предложенное антисмысловое соединение, направленно воздействующее на экзон 7 AR, является комплементарным в пределах нуклеотидной области 181695-181710 SEQ ID NO: 1.
В некоторых воплощениях предложенное(ый) антисмысловое соединение или антисмысловой олигонуклеотид направленно воздействует на AR в пределах экзона 8, например в пределах нуклеотидной области 182517-189455 SEQ ID NO: 1. В некоторых воплощениях предложенное антисмысловое соединение, направленно воздействующее на экзон 8 AR, является комплементарным в пределах нуклеотидных областей 182958-182973 или 183049-183064 SEQ ID NO: 1.
В некоторых воплощениях предложенное(ый) антисмысловое соединение или антисмысловой олигонуклеотид направленно воздействует на AR в пределах интрона 1, например в пределах нуклеотидных областей 5594-27671 или 27854-102086 SEQ ID NO: 1. В некоторых воплощениях предложенное антисмысловое соединение, направленно воздействующее на интрон 1 AR, является комплементарным в пределах любой из следующих нуклеотидных областей SEQ ID NO: 1: 5666-5681, 6222-6237, 6701-6716, 7543-7558, 8471-8486, 8638-8653, 9464-9479, 10217-10232, 10250-10265, 10865-10880, 11197-11212, 11855-11870, 13189-13204, 13321-13336, 13346-13361, 16555-16570, 16793-16808, 16968-16983, 17206-17221, 18865-18880, 29329-29344, 32290-32305, 33315-33330, 39055-39070, 40615-40630, 42017-42032, 56050-56065, 58719-58734, 58720-58739, 58720-58735, 58721-58736, 58722-58737, 58723-58738, 58724-58739, 58724-58739, 58725-58740, 58725-58740, 58725-58740, 58750-58769, 58750-58765, 58751-58766, 58752-58767, 58753-58768, 58754-58769, 58755-58770, 60902-60917 или 67454-67469.
В некоторых воплощениях предложенное(ый) антисмысловое соединение или антисмысловой олигонуклеотид направленно воздействует на AR в пределах интрона 2, например в пределах нуклеотидных областей 102239-139550 или 139835-144840 SEQ ID NO: 1. В некоторых воплощениях предложенное антисмысловое соединение, направленно воздействующее на интрон 2 AR, является комплементарным в пределах любой из следующих нуклеотидных областей SEQ ID NO: 1: 114874-114889, 115272-115287, 115365-115380 или 134971-134986.
В некоторых воплощениях следующие нуклеотидные области SEQ ID NO: 1 при направленном воздействии на них антисмысловых соединений или антисмысловых олигонуклеотидов, демонстрируют по меньшей мере 50%-ное ингибирование: 3099-3114, 3120-3135, 3351-3366, 3353-3368, 3361-3376, 3513-3528, 3519-3534, 3768-3783, 3799-3814, 3851-3866, 3888-3903, 4059-4074, 4534-4549, 4555-4570, 4571-4586, 4578-4593, 4655-4670, 4699-4714, 4750-4765, 4755-4770, 4865-4880, 5054-5069, 5060-5075, 5061-5076, 5062-5077, 5155-5170, 5265-5280, 5392-5407, 5448-5463, 5483-5498, 7543-7558, 8471-8486, 8638-8653, 9464-9479, 10217-10232, 10250-10265, 10865-10880, 11197-11212, 11855-11870, 13189-13204, 13321-13336, 13346-13361, 16555-16570, 16793-16808, 16968-16983, 17206-17221, 18865-18880, 29329-29344, 32290-32305, 33315-33330, 39055-39070, 40615-40630, 42017-42032, 56050-56065, 58719-58734, 58720-58735, 58720-58739, 58721-58736, 58722-58737, 58723-58738, 58724-58739, 58725-58740, 58750-58765, 58750-58769, 58751-58766, 58752-58767, 58753-58768, 58754-58769, 58755-58770, 60902-60917, 67454-67469, 102156-102171, 114874-114889, 114874-114889, 115272-115287, 115365-115380, 134971-134986, 144856-144871, 181695-181710, 182958-182973 и 183049-183064.
В некоторых воплощениях следующие нуклеотидные области SEQ ID NO: 1 при направленном воздействии на них антисмысловых соединений или антисмысловых олигонуклеотидов, демонстрируют по меньшей мере 60%-ное ингибирование: 3799-3814, 3851-3866, 3888-3903, 4059-4074, 4534-4549, 4555-4570, 4571-4586, 4578-4593, 4655-4670, 4699-4714, 4755-4770, 4865-4880, 5060-5075, 5061-5076, 5062-5077, 5155-5170, 5265-5280, 5392-5407, 5448-5463, 5483-5498, 7543-7558, 8471-8486, 8638-8653, 9464-9479, 10217-10232, 10250-10265, 10865-10880, 11197-11212, 11855-11870, 13189-13204, 13321-13336, 13346-13361, 16555-16570, 16793-16808, 16968-16983, 17206-17221, 18865-18880, 29329-29344, 32290-32305, 33315-33330, 42017-42032, 56050-56065, 58719-58734, 58720-58735, 58720-58739, 58721-58736, 58722-58737, 58723-58738, 58724-58739, 58725-58740, 58750-58765, 58750-58769, 58751-58766, 58752-58767, 58753-58768, 58754-58769, 58755-58770, 67454-67469, 102156-102171, 115272-115287, 115365-115380, 144856-144871, 181695-181710, 182958-182973 и 183049-183064.
В некоторых воплощениях следующие нуклеотидные области SEQ ID NO: 1 при направленном воздействии на них антисмысловых соединений или антисмысловых олигонуклеотидов, демонстрируют по меньшей мере 70%-ное ингибирование: 3799-3814, 3851-3866, 3888-3903, 4059-4074, 4534-4549, 4655-4670, 4699-4714, 4755-4770, 4865-4880, 5060-5075, 5062-5077, 5155-5170, 5265-5280, 5392-5407, 5448-5463, 5483-5498, 7543-7558, 8471-8486, 8638-8653, 9464-9479. 10865-10880, 11197-11212, 11855-11870, 13189-13204, 13321-13336, 13346-13361, 16555-16570, 16793-16808, 16968-16983, 17206-17221, 18865-18880, 33315-33330, 42017-42032, 58719-58734, 58720-58739, 58720-58735, 58721-58736, 58722-58737, 58723-58738, 58724-58739, 58725-58740, 58750-58769, 58750-58765, 58751-58766, 58752-58767, 58753-58768, 58754-58769, 58755-58770, 102156-102171, 115365-115380, 144856-144871, 181695-181710, 182958-182973 и 183049-183064.
В некоторых воплощениях следующие нуклеотидные области SEQ ID NO: 1 при направленном воздействии на них антисмысловых соединений или антисмысловых олигонуклеотидов, демонстрируют по меньшей мере 80%-ное ингибирование: 3799-3814, 3851-3866, 3888-3903, 4059-4074, 4534-4549, 4655-4670, 4699-4714, 4755-4770, 4865-4880, 5060-5075, 5062-5077, 5155-5170, 5265-5280, 5392-5407, 5448-5463, 5483-5498, 8471-8486, 8638-8653, 9464-9479, 10865-10880, 11197-11212, 13189-13204, 16793-16808, 58719-58734, 58720-58735, 58721-58736, 58722-58737, 58723-58738, 58724-58739, 58725-58740, 58750-58765, 58751-58766, 58752-58767, 58753-58768, 58754-58769, 58755-58770, 102156-102171, 144856-144871, 181695-181710, 182958-182973 и 183049-183064.
В некоторых воплощениях следующие нуклеотидные области SEQ ID NO: 1 при направленном воздействии на них антисмысловых соединений или антисмысловых олигонуклеотидов, демонстрируют по меньшей мере 90%-ное ингибирование: 4534-4549, 5060-5075, 5062-5077, 5155-5170, 5265-5280, 5448-5463, 58720-58735, 58721-58736, 58722-58737, 58723-58738, 58724-58739, 58725-58740, 58750-58765, 58751-58766, 58752-58767, 58753-58768, 58754-58769, 58755-58770, 182958-182973 и 183049-183064.
В некоторых воплощениях следующие антисмысловые соединения или антисмысловые олигонуклеотиды направленно воздействуют на область нуклеиновой кислоты рецептора андрогенов и осуществляют по меньшей мере 50%-ное ингибирование мРНК рецептора андрогенов, ISIS ID: 549332, 549334, 549338, 549347, 549358, 549360, 549361, 549362, 549366, 549371, 549372, 549374, 549377, 549379, 549380, 549381, 549387, 549390, 549414, 549432, 549434, 549457, 549458, 549459, 560071, 560098, 560099, 560100, 560131, 560132, 560133, 560137, 569213, 569215, 569216, 569220, 569222, 569223, 569227, 569228, 569229, 569236, 569238, 583559, 583567, 583608, 583609, 583613, 583635, 583638, 583662, 583795, 583796, 583799, 583834, 583919, 584145, 584148, 584149, 584152, 584157, 584158, 584162, 584163, 584165, 584166, 584167, 584168, 584179, 584180, 584183, 584184, 584192, 584233, 584242, 584245, 584263, 584269, 584274, 584312, 584329, 584361, 584465, 584465, 584468, 584469, 584469, 584495, 584495, 585233, 585259, 585262, 585263, 585264, 585265, 585268, 585269, 585271, 585274, 586124, 586224, 586224, 586225, 586225, 586227 и 586227.
В некоторых воплощениях следующие антисмысловые соединения или антисмысловые олигонуклеотиды направленно воздействуют на область нуклеиновой кислоты рецептора андрогенов и осуществляют по меньшей мере 50%-ное ингибирование мРНК рецептора андрогенов, SEQ ID NO: 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 29, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 46, 49, 53, 54, 55, 57, 59, 63, 92, 93, 95, 101, 125, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176 и 177.
В некоторых воплощениях следующие антисмысловые соединения или антисмысловые олигонуклеотиды направленно воздействуют на область нуклеиновой кислоты рецептора андрогенов и осуществляют по меньшей мере 60%-ное ингибирование мРНК рецептора андрогенов, ISIS ID: 549332, 549334, 549338, 549347, 549358, 549360, 549361, 549362, 549366, 549371, 549372, 549374, 549377, 549379, 549380, 549381, 549387, 549390, 549414, 549432, 549434, 549457, 549458, 549459, 560071, 560098, 560099, 560100, 560131, 560137, 569213, 569216, 569222, 569228, 569236, 583795, 583796, 583799, 584145, 584148, 584149, 584152, 584157, 584158, 584162, 584163, 584165, 584166, 584167, 584168, 584179, 584180, 584183, 584184, 584192, 584233, 584242, 584245, 584274, 584312, 584361, 584468, 584469, 585233, 585259, 585262, 585263, 585264, 585265, 585268, 585269, 585274, 586124, 586224, 586225 и 586227.
В некоторых воплощениях следующие антисмысловые соединения или антисмысловые олигонуклеотиды направленно воздействуют на область нуклеиновой кислоты рецептора андрогенов и осуществляют по меньшей мере 60%-ное ингибирование мРНК рецептора андрогенов, SEQ ID NO: 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 29, 31, 32, 33, 34, 35, 36, 37, 38, 38, 39, 40, 41, 42, 43, 92, 93, 95, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 170, 171, 173, 175 и 176.
В некоторых воплощениях следующие антисмысловые соединения или антисмысловые олигонуклеотиды направленно воздействуют на область нуклеиновой кислоты рецептора андрогенов и осуществляют по меньшей мере 70%-ное ингибирование мРНК рецептора андрогенов, ISIS IDs: 549332, 549334, 549338, 549347, 549358, 549360, 549361, 549362, 549366, 549371, 549372, 549374, 549377, 549379, 549380, 549381, 549387, 549390, 549414, 549432, 549434, 549457, 549458, 549459, 560071, 560098, 560099, 560100, 560131, 560137, 569222, 584145, 584148, 584149, 584152, 584162, 584163, 584165, 584166, 584167, 584168, 584179, 584180. 584183, 584184, 584192, 584245, 584274, 584469, 585259, 585262, 585268, 585269, 586124, 586224, 586225 и 586227.
В некоторых воплощениях следующие антисмысловые соединения или антисмысловые олигонуклеотиды направленно воздействуют на область нуклеиновой кислоты рецептора андрогенов и осуществляют по меньшей мере 70%-ное ингибирование мРНК рецептора андрогенов, SEQ ID NO: 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 29, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 43, 148, 149, 150, 151, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 167, 170 и 176.
В некоторых воплощениях следующие антисмысловые соединения или антисмысловые олигонуклеотиды направленно воздействуют на область нуклеиновой кислоты рецептора андрогенов и осуществляют по меньшей мере 80%-ное ингибирование мРНК рецептора андрогенов, ISIS IDs: 549332, 549334, 549338, 549347, 549358, 549360, 549361, 549362, 549366, 549371, 549372, 549374, 549377, 549379, 549380, 549381, 549387, 549390, 549414, 549432, 549434, 549457, 549458, 549459, 560098, 560099, 560100, 560137, 584148, 584149, 584152, 584162, 584163, 584166, 584180, 586124, 586224, 586225 и 586227.
В некоторых воплощениях следующие антисмысловые соединения или антисмысловые олигонуклеотиды направленно воздействуют на область нуклеиновой кислоты рецептора андрогенов и осуществляют по меньшей мере 80%-ное ингибирование мРНК рецептора андрогенов, SEQ ID NO: 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 29, 31, 32, 33, 34, 35, 36, 37, 39, 40, 41, 43, 149, 150, 151, 154, 155, 157 и 161.
В некоторых воплощениях следующие антисмысловые соединения или антисмысловые олигонуклеотиды направленно воздействуют на область нуклеиновой кислоты рецептора андрогенов и осуществляют по меньшей мере 90%-ное ингибирование мРНК рецептора андрогенов, ISIS IDs: 549358, 549371, 549372, 549374, 549377, 549380, 549432, 549434, 549457, 549458, 549459, 560098, 560099, 560100, 560137 и 586224.
В некоторых воплощениях следующие антисмысловые соединения или антисмысловые олигонуклеотиды направленно воздействуют на область нуклеиновой кислоты рецептора андрогенов и осуществляют по меньшей мере 90%-ное ингибирование мРНК рецептора андрогенов, SEQ ID NO: 16, 21, 22, 23, 24, 26, 33, 34, 35, 36, 37, 39, 40 и 41.
Процент ингибирования мРНК рецептора андрогенов может быть определен с использованием стандартных методов, известных специалистам в данной области, таких как методы, описанные в Примере 1.
Понятно, что последовательность, изложенная в каждой SEQ ID NO в примерах, приведенных в данном описании, не зависит от модификации сахарной группировки, межнуклеозидной связи или нуклеооснования. Как таковые, антисмысловые соединения, определенные SEQ ID NO, могут содержать, независимо, одну или более модификаций сахарной группировки, межнуклеозидной связи или нуклеооснования. Антисмысловые соединения, описанные номером ISIS (ISIS #), указывают комбинацию последовательности нуклеооснований, химической модификации и мотива.
В некоторых воплощениях соединения или композиции, описанные в данном документе, эффективны благодаря тому, что они имеют in vitro no меньшей мере одно значение IC50 менее 250 нМ, менее 200 нМ, менее 150 нМ, менее 100 нМ, менее 90 нМ, менее 80 нМ, менее 70 нМ, менее 65 нМ, менее 60 нМ, менее 55 нМ, менее 50 нМ, менее 45 нМ, менее 40 нМ, менее 35 нМ, менее 30 нМ, менее 25 нМ или менее 20 нМ при доставке в клетки HuVEC. В некоторых воплощениях ингибирование измеряют с использованием комплекта праймеров и зондов RTS3559, как описано в данном документе.
В некоторых воплощениях соединения или композиции, которые описаны в данном документе, являются очень хорошо переносимыми, что продемонстрировано тем, что имело место по меньшей мере одно из следующего: не более чем 4-кратное, 3-кратное или 2-кратное увеличение уровней ALT или AST по сравнению с животными, которым вводили физиологический раствор, или увеличение массы печени, селезенки или почки не более чем на 30%, 20%, 15%, 12%, 10%, 5% или 2%. В некоторых воплощениях соединения или композиции, которые описаны в данном документе, являются очень хорошо переносимыми, что продемонстрировано отсутствием повышенных уровней ALT или AST по сравнению с животными, которым вводили физиологический раствор. В некоторых воплощениях соединения или композиции, которые описаны в данном документе, являются очень хорошо переносимыми, что продемонстрировано отсутствием увеличения массы печени, селезенки или почки по сравнению с животными, которым вводили физиологический раствор.
В некоторых воплощениях предложенное антисмысловое соединение направленно воздействует на вариант сплайсинга AR, который содержит экзон 1, кодирующий N-концевой домен, и экзоны 2 и 3, кодирующие ДНК-связывающий домен, но не содержит по меньшей мере участок экзона 4, кодирующего короткую шарнирную область, или по меньшей мере участок экзонов 4-8, кодирующих лиганд-связывающий домен. Примером такого варианта сплайсинга AR является, без ограничения, AR-W, который содержит экзоны 1-3, но не имеет экзонов 4-8. Дополнительные примеры таких вариантов сплайсинга AR включают, например, AR3, AR4, AR4b, AR5 и AR6 (SEQ ID NO: 4-8 соответственно). В некоторых воплощениях антисмысловое соединение, направленно воздействующее на AR выше 3'-конца экзона 3 и/или выше лиганд-связывающего домена, способно ингибировать уровни рецептора андрогенов в большей степени, чем антисмысловое соединение, направленно воздействующее на лиганд-связывающий домен, такое EZN-4176, которое направленно воздействует на экзон 4 и соответствует SEQ ID NO: 58, описанной в US 7737125.
В некоторых воплощениях антисмысловое соединение направленно воздействует вариант сплайсинга AR, который имеет функциональный ДНК-связывающий домен, но не функциональный лиганд-связывающий домен. Должно быть понятно, что в некоторых воплощениях антисмысловое соединение может направленно воздействовать на вариант сплайсинга AR, который содержит полный или по меньшей мере функциональный участок экзона 1, кодирующего N-концевой домен, и полный или по меньшей мере функциональный участок экзонов 2 и 3, кодирующих ДНК-связывающий домен, но не содержит по меньшей мере функциональный участок экзона 4, кодирующего короткую шарнирную область, или по меньшей мере функциональный участок экзонов 4-8, кодирующих лиганд-связывающий домен. Предполагается, что некоторые варианты сплайсинга AR, являющиеся мишенью направленного воздействия предложенных антисмысловых соединений, по существу состоящие из экзонов 1-3, могут также содержать нефункциональный участок последовательности нуклеиновой кислоты из геномной области или экзоны 4-8. Предполагается, что процесс сплайсинга может возбуждать такие варианты сплайсинга AR, которые сохраняют ДНК-связывающую функцию, но не лиганд-связывающую функцию. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на вариант сплайсинга AR, который имеет функциональный ДНК-связывающий домен, но не функциональный лиганд-связывающий домен, способен ингибировать рост или клеточную пролиферацию рака предстательной железы, которые являются резистентными к кастрации. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на вариант сплайсинга AR, который имеет функциональный ДНК-связывающий домен, но не функциональный лиганд-связывающий домен, способно ингибировать рост или пролиферацию клетки рака предстательной железы, резистентной к диарилгидантоиновому ингибитору AR формулы XI в большей степени, чем антисмысловое соединение, направленно воздействующее на лиганд-связывающий домен, такое как EZN-4176, которое направленно воздействует на экзон 4 и соответствует SEQ ID NO: 58, описанной в US 7737125. В некоторых воплощениях предложенное антисмысловое соединение направленно воздействует на AR в пределах экзона 1, который находится выше 3'-конца экзона 3 и/или выше лиганд-связывающего домена. В некоторых воплощениях предложенное антисмысловое соединение направленно воздействует на AR в пределах экзона 2, который находится выше 3'-конца экзона 3 и/или выше лиганд-связывающего домена. В некоторых воплощениях предложенное антисмысловое соединение направленно воздействует на AR в пределах интрона 1, который находится выше 3'-конца экзона 3 и/или выше лиганд-связывающего домена.
В некоторых воплощениях предложенное антисмысловое соединение способно снижать экспрессию как полноразмерного AR, так и варианта сплайсинга AR, который содержит экзон 1, кодирующий N-концевой домен, и экзоны 2 и 3, кодирующие ДНК связывающий домен, но не содержит по меньшей мере участок экзона 4, кодирующего короткую шарнирную область, или по меньшей мере участок любого из экзонов 4-8, кодирующих лиганд-связывающий домен. В некоторых воплощениях такое антисмысловое соединение направленно воздействует на рецептор андрогенов человека выше лиганд-связывающего домена. В некоторых воплощениях такие антисмысловые соединения направленно воздействуют на рецептор андрогенов человека выше 3'-конца экзона 3. В некоторых воплощениях предложенное антисмысловое соединение направленно воздействует на AR в пределах экзона 1, который находится выше 3'-конца экзона 3 и/или выше лиганд-связывающего домена. В некоторых воплощениях предложенное антисмысловое соединение направленно воздействует на AR в пределах экзона 2, который находится выше 3'-конца экзона 3 и/или выше лиганд-связывающего домена. В некоторых воплощениях предложенное антисмысловое соединение направленно воздействует на AR в пределах интрона 1, который находится выше 3'-конца экзона 3 и/или выше лиганд-связывающего домена.
В некоторых воплощениях предложенное антисмысловое соединение направленно воздействует на вариант сплайсинга AR, который содержит экзон 1, кодирующий N-концевой домен, и экзоны 2 и 3, кодирующие ДНК-связывающий домен, но не включает по меньшей мере участок экзона 4, кодирующего короткую шарнирную область, или по меньшей мере участок экзонов 4-8, кодирующих лиганд-связывающий домен. Примером такого варианта сплайсинга AR является, без ограничения, AR-W, который содержит экзоны 1-3, но не имеет экзонов 4-8.
Некоторые воплощения относятся к антисмысловому соединению, направленно воздействующему на рецептор андрогенов (AR) человека выше лиганд-связывающего домена, которое способно ингибировать рост или пролиферацию клетки резистентного рака предстательной железы в большей степени, чем антисмысловое соединение, направленно воздействующее на лиганд-связывающий домен, такое как EZN-4176, которое направленно воздействует на экзон 4 и соответствует SEQ ID NO: 58, описанной в US 7737125. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов (AR) человека выше лиганд-связывающего домена, направленно воздействует на область AR выше 3'-конца экзона 3. В некоторых воплощениях предложенное антисмысловое соединение направленно воздействует на AR в пределах экзона 1, который находится выше 3'-конца экзона 3 и/или выше лиганд-связывающего домена. В некоторых воплощениях предложенное антисмысловое соединение направленно воздействует на AR в пределах экзона 2, который находится выше 3'-конца экзона 3 и/или выше лиганд-связывающего домена. В некоторых воплощениях предложенное антисмысловое соединение направленно воздействует на AR в пределах интрона 1, который находится выше 3'-конца экзона 3 и/или выше лиганд-связывающего домена.
В некоторых воплощениях последовательность нуклеооснований предложенного модифицированного олигонуклеотида является по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95% или на 100% комплементарной любой из SEQ ID NO: 1-8 при измерении по всему модифицированному олигонуклеотиду.
В некоторых воплощениях антисмысловое соединение представляет собой модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов и имеющий последовательность нуклеооснований, по меньшей мере на 90% комплементарную любой из SEQ ID NO: 1-8 при измерении по всему указанному модифицированному олигонуклеотиду.
В некоторых воплощениях антисмысловое соединение представляет собой модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов и имеющий последовательность нуклеооснований, по меньшей мере на 100% комплементарную любой из SEQ ID NO: 1-8 при измерении по всему указанному модифицированному олигонуклеотиду. В некоторых воплощениях соединение или модифицированный олигонуклеотид, предложенные в данном документе, является одноцепочечным.
В некоторых воплощениях модифицированный олигонуклеотид, предложенный в данном документе, состоит из 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 связанных нуклеозидов. В некоторых воплощениях модифицированный олигонуклеотид состоит из 20 связанных нуклеозидов. В некоторых воплощениях модифицированный олигонуклеотид состоит из 16 связанных нуклеозидов.
В некоторых воплощениях по меньшей мере одна межнуклеозидная связь модифицированного олигонуклеотида, предложенного в данном документе, представляет собой модифицированную межнуклеозидную связь. В некоторых воплощениях каждая межнуклеозидная связь представляет собой фосфоротиоатную межнуклеозидную связь.
В некоторых воплощениях по меньшей мере один нуклеозид модифицированного олигонуклеотида содержит модифицированный сахар. В некоторых воплощениях по меньшей мере один модифицированный сахар содержит 2'-O-метоксиэтильную группу (2'-O(СН2)2-OCH3). В некоторых воплощениях модифицированный сахар содержит группу 2'-O-CH3.
В некоторых воплощениях по меньшей мере один модифицированный сахар представляет собой бициклический сахар. В некоторых воплощениях бициклический сахар содержит мостик 4'-(СН2)n-O-2', где n равно 1 или 2. В некоторых воплощениях бициклический сахар содержит мостик 4'-СН2-O-2'. В некоторых воплощениях бициклический сахар содержит мостик 4'-СН(CH3)-O-2'.
В некоторых воплощениях по меньшей мере один нуклеозид модифицированного олигонуклеотида, предложенного в данном документе, содержит модифицированное нуклеооснование. В некоторых воплощениях модифицированное нуклеооснование представляет собой 5-метилцитозин.
В некоторых воплощениях модифицированный олигонуклеотид, предложенный в данном документе, состоит из одноцепочечного модифицированного олигонуклеотида.
В некоторых воплощениях соединения или композиции, предложенные в данном документе, содержат соль модифицированного олигонуклеотида.
Композиции и способы изготовления фармацевтических композиций
Антисмысловые олигонуклеотиды могут быть смешаны с фармацевтически приемлемыми активными или инертными веществами для изготовления фармацевтических композиций или лекарственных форм. Композиции и способы изготовления фармацевтических композиций зависят от целого ряда критериев, включая, без ограничения, путь введения, степень заболевания или доза, которую нужно вводить.
Антисмысловое соединение, направленно воздействующее на нуклеиновую кислоту рецептора андрогенов, можно использовать в фармацевтических композициях путем объединения антисмыслового соединения с подходящим фармацевтически приемлемым разбавителем или носителем. В некоторых воплощениях фармацевтически приемлемым разбавителем является вода, например стерильная вода, пригодная для инъекций. Соответственно, в одном воплощении в способах, описанных в данном документе, используют фармацевтическую композицию, содержащую антисмысловое соединение, направленно воздействующее на нуклеиновую кислоту рецептора андрогенов, и фармацевтически приемлемый разбавитель. В некоторых воплощениях фармацевтически приемлемым разбавителем является вода. В некоторых воплощениях антисмысловое соединение представляет собой антисмысловой олигонуклеотид, предложенный в данном документе.
Фармацевтические композиции, содержащие антисмысловые соединения, охватывают любые фармацевтически приемлемые соли, сложные эфиры, или соли таких сложных эфиров, или любой другой олигонуклеотид, которые при введении животному, включая человека, способны обеспечивать (напрямую или опосредованно) образование биологически активного метаболита или его остатка. Соответственно, например, изобретение также относится к фармацевтически приемлемым солям антисмысловых соединений, пролекарствам, фармацевтически приемлемым солям таких пролекарств и другим биологическим эквивалентам. Подходящие фармацевтически приемлемые соли включают, без ограничения, натриевые и калиевые соли.
Пролекарство может включать встраивание дополнительных нуклеозидов в один или оба конца антисмыслового соединения, которые отщепляются эндогенными нуклеазами в организме с образованием активного антисмыслового соединения.
В некоторых воплощениях соединения или композиции дополнительно содержат фармацевтически приемлемый носитель или разбавитель.
Некоторые показания
Некоторые аспекты изобретения относятся к способам лечения рака, включающим введение антисмыслового соединения, направленно воздействующего на рецептор андрогенов, как предусмотрено в данном документе. В некоторых воплощениях рак является AR-позитивным. В некоторых воплощениях рак представляет собой рак предстательной железы, рак молочной железы, рак яичника, рак мочевого пузыря или рак желудка. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, содержит модифицированный олигонуклеотид, состоящий из 10-30 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую по меньшей мере 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных нуклеооснований любой из SEQ ID NO: 12-179. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, содержит модифицированный олигонуклеотид, состоящий из 10-30 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую любую из SEQ ID NO: 12-179. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, содержит модифицированный олигонуклеотид, состоящий из последовательности нуклеооснований любой из SEQ ID NO: 12-179. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, содержит модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов и имеющий последовательность нуклеооснований, состоящую из SEQ ID NO: 35, 39, 43, 124, 150, 155, 169 или 175. В некоторых воплощениях антисмысловое соединение является одноцепочечным. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, представляет собой ISIS 560131, ISIS 569213, ISIS 569216, ISIS 569221, ISIS 569236, ISIS 579671, ISIS 586124, ISIS 583918, ISIS 584149, ISIS 584163, ISIS 584269 или ISIS 584468.
Некоторые аспекты относятся к предложенному антисмысловому соединению, направленно воздействующему на рецептор андрогенов, для применения в лечении рака. В некоторых воплощениях рак является AR-позитивным. В некоторых воплощениях рак представляет собой рак предстательной железы, рак молочной железы, рак яичника, рак мочевого пузыря или рак желудка. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, содержит модифицированный олигонуклеотид, состоящий из 10-30 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую по меньшей мере 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных нуклеооснований любой из SEQ ID NO: 12-179. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, содержит модифицированный олигонуклеотид, состоящий из 10-30 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую любую из SEQ ID NO: 12-179. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, содержит модифицированный олигонуклеотид, состоящий из последовательности нуклеооснований любой из SEQ ID NO: 12-179. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, содержит модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов и имеющий последовательность нуклеооснований, состоящую из SEQ ID NO: 35, 39, 43, 124, 150, 155, 169 или 175. В некоторых воплощениях антисмысловое соединение является одноцепочечным. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, представляет собой ISIS 560131, ISIS 569213, ISIS 569216, ISIS 569221, ISIS 569236, ISIS 579671, ISIS 586124, ISIS 583918, ISIS 584149, ISIS 584163, ISIS 584269 или ISIS 584468.
Некоторые аспекты изобретения относятся к применению предложенного антисмыслового соединения, направленно воздействующего на рецептор андрогенов, для изготовления лекарственного средства для лечения рака. В некоторых воплощениях рак является AR-позитивным. В некоторых воплощениях рак представляет собой рак предстательной железы, рак молочной железы, рак яичника, рак мочевого пузыря или рак желудка. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, содержит модифицированный олигонуклеотид, состоящий из 10-30 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую по меньшей мере 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных нуклеооснований любой из SEQ ID NO: 12-179. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, содержит модифицированный олигонуклеотид, состоящий из 10-30 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую любую из SEQ ID NO: 12-179. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, содержит модифицированный олигонуклеотид, состоящий из последовательности нуклеооснований любой из SEQ ID NO: 12-179. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, содержит модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов и имеющий последовательность нуклеооснований, состоящую из SEQ ID NO: 35, 39, 43, 124, 150, 155, 169 или 175. В некоторых воплощениях антисмысловое соединение является одноцепочечным. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, представляет собой ISIS 560131, ISIS 569213, ISIS 569216, ISIS 569221, ISIS 569236, ISIS 579671, ISIS 586124, ISIS 583918, ISIS 584149, ISIS 584163, ISIS 584269 или ISIS 584468.
Некоторые аспекты изобретения относятся к применению антисмыслового соединения, направленно воздействующего на рецептор андрогенов (AR) человека, как описано в данном документе, для лечения ракового пациента, чей рак стал резистентным к лечению антиандрогенным агентом (например соединением или лекарственным средством). В некоторых воплощениях указанный рак представляет собой рак предстательной железы. В некоторых воплощениях указанным пациентом является пациент с развившейся резистентностью, или имеющий рак с развившейся резистентностью к лечению агентом, выбранным из MDV3100, ARN-059, ODM-201, абиратерона ацетата, TOK001, TAK700 и VT464. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, содержит модифицированный олигонуклеотид, состоящий из 10-30 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую по меньшей мере 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных нуклеооснований любой из SEQ ID NO: 12-179. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, содержит модифицированный олигонуклеотид, состоящий из 10-30 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую любую из SEQ ID NO: 12-179. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, содержит модифицированный олигонуклеотид, состоящий из последовательности нуклеооснований любой из SEQ ID NO: 12-179. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, содержит модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов и имеющий последовательность нуклеооснований, состоящую из SEQ ID NO: 35, 39, 43, 124, 150, 155, 169 или 175. В некоторых воплощениях антисмысловое соединение направленно воздействует на AR в пределах экзона 1, например в пределах нуклеотидных областей 2863-5593 (экзон 1) или 27672-27853 (экзон 1 В) SEQ ID NO: 1. В некоторых воплощениях предложенное антисмысловое соединение, направленно воздействующее на экзон 1 AR, является комплементарным в пределах любой из следующих нуклеотидных областей SEQ ID NO: 1: 2957-2972, 3079-3094, 3099-3114, 3109-3124, 3113-3128, 3120-3135, 3133-3148, 3224-3239, 3226-3241, 3351-3366, 3353-3368, 3361-3376, 3388-3403, 3513-3528, 3517-3532, 3519-3534, 3641-3656, 3735-3750, 3764-3779, 3768-3783, 3798-3813, 3799-3814, 3851-3866, 3870-3885, 3874-3889, 3876-3891, 3878-3893, 3884-3899, 3886-3901, 3888-3903, 3901-3916, 3956-3971, 3962-3977, 3964-3979, 3967-3982, 4019-4034, 4038-4053, 4049-4064, 4056-4071, 4059-4074, 4062-4077, 4066-4081, 4070-4085, 4101-4116, 4103-4118, 4105-4120, 4109-4124, 4305-4320, 4405-4420, 4532-4547, 4534-4549, 4537-4552, 4539-4554, 4555-4570, 4571-4586, 4573-4588, 4578-4593, 4597-4612, 4632-4647, 4655-4670, 4656-4671, 4662-4677, 4699-4714, 4747-4762, 4750-4765, 4752-4767, 4754-4769, 4755-4770, 4769-4784, 4798-4813, 4804-4819, 4807-4822, 4833-4848, 4837-4852, 4839-4854, 4865-4880, 4868-4883, 4872-4887, 4874-4889, 4876-4891, 4887-4902, 4889-4904, 4916-4931, 4918-4933, 4938-4953, 4942-4957, 4944-4959, 4951-4966, 5050-5065, 5052-5067, 5054-5069, 5056-5071, 5060-5075, 5061-5076, 5062-5077, 5133-5148, 5141-5156, 5155-5170, 5265-5280, 5293-5308, 5308-5323, 5392-5407, 5448-5463, 5469-5484, 5481-5496, 5483-5498, 5486-5501, 5488-5503, 5494-5509 или 5521-5536. В некоторых воплощениях предложенное антисмысловое соединение направленно воздействует на AR в пределах экзона 2, например в пределах нуклеотидных областей 102087-102238 (экзон 2) или 139551-139834 (экзон 2с) SEQ ID NO: 1. В некоторых воплощениях предложенное антисмысловое соединение, направленно воздействующее на экзон 2 AR, является комплементарным в пределах любой из следующих нуклеотидных областей SEQ ID NO: 1: 102155-102170, 102156-102171, 139682-139697, 139762-139777 или 139782-139797. В некоторых воплощениях предложенное антисмысловое соединение направленно воздействует на AR в пределах экзона 3, например в пределах нуклеотидных областей 144841-144957 (экзон 3), 148380-148594 (экзон 3b) или 153504-154908 (экзон 3d) SEQ ID NO: 1. В некоторых воплощениях предложенное антисмысловое соединение, направленно воздействующее на экзон 3 AR, является комплементарным в пределах любой из следующих нуклеотидных областей SEQ ID NO: 1: 144856-144871, 144938-144953, 148406-148421, 148443-148458 или 148520-148535. В некоторых воплощениях предложенное антисмысловое соединение направленно воздействует на AR в пределах интрона 1, например в пределах нуклеотидных областей 5594-27671 или 27854-102086 SEQ ID NO: 1. В некоторых воплощениях предложенное антисмысловое соединение, направленно воздействующее на интрон 1 AR, является комплементарным в пределах любой из следующих нуклеотидных областей SEQ ID NO: 1: 5666-5681, 6222-6237, 6701-6716, 7543-7558, 8471-8486, 8638-8653, 9464-9479, 10217-10232, 10250-10265, 10865-10880, 11197-11212, 11855-11870, 13189-13204, 13321-13336, 13346-13361, 16555-16570, 16793-16808, 16968-16983, 17206-17221, 18865-18880, 29329-29344, 32290-32305, 33315-33330, 39055-39070, 40615-40630, 42017-42032, 56050-56065, 58719-58734, 58720-58739, 58720-58735, 58721-58736, 58722-58737, 58723-58738, 58724-58739, 58724-58739, 58725-58740, 58725-58740, 58725-58740, 58750-58769, 58750-58765, 58751-58766, 58752-58767, 58753-58768, 58754-58769, 58755-58770, 60902-60917 или 67454-67469. В некоторых воплощениях предложенное антисмысловое соединение направленно воздействует на AR в пределах интрона 2, например в пределах нуклеотидных областей 102239-139550 или 139835-144840 of SEQ ID NO: 1. В некоторых воплощениях предложенное антисмысловое соединение, направленно воздействующее на интрон 2 AR, является комплементарным в пределах любой из следующих нуклеотидных областей SEQ ID NO: 1: 114874-114889, 115272-115287, 115365-115380 или 134971-134986. В некоторых воплощениях антисмысловое соединение является одноцепочечным. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, представляет собой ISIS 560131, ISIS 569213, ISIS 569216, ISIS 569221, ISIS 569236, ISIS 579671, ISIS 586124, ISIS 583918, ISIS 584149, ISIS 584163, ISIS 584269 или ISIS 584468.
Под резистентным к лечению конкретным агентом (например соединением или лекарственным средством) подразумевается, что агент является менее эффективным или стал неэффективным в остановке роста или распространения рака, и поэтому пациент, или его рак, со временем стал менее реагирующим или чувствительным к нему. Обычно такого пациента можно отнести к категории резистентного к указанному агенту, и его больше не нужно лечить таким агентом. Субъектом, имеющим рак предстательной железы, резистентный к агенту, выбранному из MDV3100, ARN-059, ODM-201, абиратерона ацетата, TOK001, TAK700 и VT464, может быть, например, пациент, который раньше принимал указанный агент, но его рак предстательной железы стал менее чувствительным к агенту или менее реагирующим на агент. Например, рак предстательной железы, резистентный к антиандрогенному агенту, выбранному из MDV3100, ARN-059, ODM-201, абиратерона ацетата, TOK001, TAK700 и VT464, может включать рак предстательной железы, при котором имеет место увеличение объема опухоли, метастазирование или прогрессирование, несмотря на лечение данным агентом. В некоторых воплощениях рак предстательной железы, резистентный к антиандрогенному агенту, выбранному из MDV3100, ARN-059, ODM-201, абиратерона ацетата, TOK001, TAK700 и VT464, может включать рак предстательной железы, который не поддается лечению агентом, и при котором не происходит уменьшение объема опухоли, метастазирования или прогрессирования, несмотря на лечение. Несколько воплощений относятся к способу лечения рака предстательной железы, резистентного к антиандрогенному агенту, выбранному из MDV3100, ARN-059, ODM-201, абиратерона ацетата, TOK001, TAK700 и VT464, у субъекта, включающему идентификацию субъекта как имеющего рак предстательной железы, резистентный к указанному агенту, и введение субъекту антисмыслового соединения, направленно воздействующего на рецептор андрогенов (AR) человека выше 3'-конца экзона 3 и/или выше лиганд-связывающего домена, как описано в данном документе. Несколько воплощений относятся к способу лечения рака предстательной железы, резистентного к антиандрогенному агенту, выбранному из MDV3100, ARN-059, ODM-201, абиратерона ацетата, TOK001, TAK700 и VT464, у субъекта, включающему введение субъекту, идентифицированному или диагностированному как имеющему рак предстательной железы, резистентный к указанному антиандрогенному агенту, антисмыслового соединения, направленно воздействующего на рецептор андрогенов (AR) человека выше 3'-конца экзона 3 и/или выше лиганд-связывающего домена, как описано в данном документе. В некоторых воплощениях клетки рака предстательной железы, резистентного к антиандрогенному агенту, выбранному из MDV3100, ARN-059, ODM-201, абиратерона ацетата, TOK001, TAK700 и VT464, преимущественно экспрессируют вариант сплайсинга AR по всей длине AR.
Некоторые аспекты изобретения относятся к способу лечения пациента, страдающего раком предстательной железы, где у пациента, или его рака, развилась или возникла резистентность к лечению антиандрогенным агентом (соединением или лекарственным средством), включающему введение указанному пациенту антисмыслового соединения, направленно воздействующего на рецептор андрогенов (AR) человека, как описано в данном документе. В некоторых воплощениях указанным пациентом является пациент, у которого развилась резистентность к лечению агентом, выбранным из MDV3100, ARN-059, ODM-201, абиратерона ацетата, TOK001, TAK700 и VT464. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, содержит модифицированный олигонуклеотид, состоящий из 10-30 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую по меньшей мере 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных нуклеооснований любой из SEQ ID NO: 12-179. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, содержит модифицированный олигонуклеотид, состоящий из 10-30 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую любую из SEQ ID NO: 12-179. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, содержит модифицированный олигонуклеотид, состоящий из последовательности нуклеооснований любой из SEQ ID NO: 12-179. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, содержит модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов и имеющий последовательность нуклеооснований, состоящую из SEQ ID NO: 35, 39, 43, 124, 150, 155, 169 или 175. В некоторых воплощениях антисмысловое соединение является одноцепочечным. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, представляет собой ISIS 560131, ISIS 569213, ISIS 569216, ISIS 569221, ISIS 569236, ISIS 579671, ISIS 586124, ISIS 583918, ISIS 584149, ISIS 584163, ISIS 584269 или ISIS 584468.
Рак предстательной железы, который развился или стал резистентным к лечению антиандрогенным агентом, называется устойчивым к кастрации раком предстательной железы (CRPC). Так, в нескольких воплощениях клетка рака предстательной железы, резистентная к антиандрогенному агенту, такому как MDV3100, ранее подвергалась воздействию этого ингибитора и со временем стала менее реагирующей или чувствительной к нему. Например, MDV3100 может вначале ингибировать рост или клеточную пролиферацию рака предстательной железы у пациента, но со временем такой ингибирующий эффект может убывать, когда клетки становятся резистентными к этому ингибитору.
Некоторые аспекты изобретения относятся к применению предложенного в данном документе антисмыслового соединения, направленно воздействующего на рецептор андрогенов, для изготовления лекарственного средства для лечение рака у пациента, чей рак стал резистентным к лечению антиандрогенным агентом (соединением или лекарственным средством). В некоторых воплощениях рак представляет собой рак предстательной железы. В некоторых воплощениях указанным пациентом является пациент, который имеет, или чей рак имеет, развившуюся резистентность к лечению агентом, выбранным из MDV3100, ARN-059, ODM-201, абиратерона ацетата, TOK001, TAK700 и VT464. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, содержит модифицированный олигонуклеотид, состоящий из 10-30 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую по меньшей мере 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных нуклеооснований любой из SEQ ID NO: 12-179. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, содержит модифицированный олигонуклеотид, состоящий из 10-30 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую любую из SEQ ID NO: 12-179. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, содержит модифицированный олигонуклеотид, состоящий из последовательности нуклеооснований любой из SEQ ID NO: 12-179. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, содержит модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов и имеющий последовательность нуклеооснований, состоящую из SEQ ID NO: 35, 39, 43, 124, 150, 155, 169 или 175. В некоторых воплощениях антисмысловое соединение является одноцепочечным. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, представляет собой ISIS 560131, ISIS 569213, ISIS 569216, ISIS 569221, ISIS 569236, ISIS 579671, ISIS 586124, ISIS 583918, ISIS 584149, ISIS 584163, ISIS 584269 или ISIS 584468.
Энзалутамид:
MDV3100, также известный как энзалутамид (Xtandi™) и имеющий название согласно номенклатуре IUPAC 4-(3-(4-циано-3-(трифторметил)фенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил)-2-фтор-N-метилбензамид, является ингибитором связывания лиганда с рецептором андрогенов, принадлежащим диарилгидантоиновому классу ингибиторов рецептора андрогенов, имеющих формулу XI. MDV3100 имеет следующую химическую формулу:
MDV3100 и дополнительные диарилгидантоиновые ингибиторы рецептора андрогенов, подходящие для использования в некоторых воплощениях, предложенных в данном документе, описаны в патенте США №7709517, в публикации заявки на патент США № US 20100172975 и в публикации заявки на патент США № US 20100210665, полное содержание которых включено в данное описание посредством ссылки.
ARN-509:

Соединение формулы XII, также известное как ARN-509 и имеющее название согласно номенклатуре IUPAC 4-(7-(6-циано-5-(трифторметил)пиридин-3-ил)-6,8-диоксо-5,7-диазаспиро[3.4]октан-5-ил)-2-фтор-N-метилбензамид, является ингибитором связывания лиганда с рецептором андрогенов. ARN-509 и дополнительные ингибиторы рецептора андрогенов, подходящие для использования в некоторых воплощениях, предложенных в данном документе, описаны в WO 2007126765, в WO 2008119015 и в публикации заявки на патент США №2013/0116258, полное содержание которых включено в данное описание посредством ссылки.
Абиратерона ацетат
Соединение формулы XIII, которое также известно как абиратерона ацетат и ZYTIGA® и имеющее название согласно номенклатуре IUPAC [(3S,8R,9S,10R,13S,14S)-10,13-диметил-17-(3-пиридил)-2,3,4,7,8,9,11,12,14,15-декагидро-1Н-циклопента[а]фенантрен-3-ил]-ацетат, является ингибитором биосинтеза андрогенов и имеет следующую химическую формулу:

Структура и синтез абиратерона ацетата описаны в Potter et al., Journal of Medicinal Chemistry (38(13), 2463-71, 1995, полное содержание которого включено в данное описание посредством ссылки.
Галетерон:
Соединение формулы XIV, которое также известно как TOK-001 и галетерон и имеет название согласно номенклатуре IUPAC (3S,10R,13S)-17-(1Н-бензо[а]имидазол-1-ил)-10,13-диметил-2,3,4,7,8,9,10,11,12,13,14,15-додекагидро-1Н-циклопента[а]фенантрен-3-ол, имеет следующую химическую формулу:

Структура и синтез TOK-001 описаны в Handratta et al., Journal of Medicinal Chemistry (2005), 48(8), 2972-84, 2005, полное содержание которого включено в данное описание посредством ссылки:
Ортеронел:
Соединение формулы XV, которое также известно как ТАК-700 и ортеронел и имеющее название согласно номенклатуре IUPAC 6-[7(S)-гидрокси-6,7-дигидро-5Н-пирроло[1,2-с]имидазол-7-ил]-М-метилпнафталин-2-карбоксамид, является ингибитором биосинтеза андрогенов и имеет следующую химическую формулу:

Структура и синтез ТАК-700 описаны в Kaku et al., Bioorganic and Medicinal Chemistry, 19(21), 6383-99, 2011.
В Yin et al., Int. J. Mol. Sci., 14(7): 13958-13978, 2013, обсуждается недавний прогресс в связи с использованием различных фармацевтических терапевтических средств, включая ODM-21, VT464, ARN509, TAK700 и TOK-001, для лечения резистентного к кастрации рака предстательной железы.
Некоторые комбинации и комбинированные терапии
В некоторых воплощениях первый агент, содержащий соединение, описанное в данном документе, вводят совместно с одним или более дополнительными агентами. В некоторых воплощениях такие дополнительные агенты предназначены для лечения того же заболевания, расстройства или состояния, как и первый агент, описанный в данном документе. В некоторых воплощениях такие дополнительные агенты предназначены для лечения другого заболевания, расстройства или состояния, чем первый агент, описанный в данном документе. В некоторых воплощениях первый агент предназначен для лечения нежелательного побочного эффекта дополнительного агента. В некоторых воплощениях дополнительные агенты вводят совместно с первым агентом для лечения нежелательного эффекта первого агента. В некоторых воплощениях такие дополнительные агенты предназначены для лечения нежелательного побочного эффекта одной или более фармацевтических композиций, которые описаны в данном документе. В некоторых воплощениях дополнительные агенты вводят совместно с первым агентом для продуцирования комбинационного эффекта. В некоторых воплощениях дополнительные агенты вводят совместно с первым агентом для продуцирования синергетического эффекта. В некоторых воплощениях совместное введение первого и дополнительных агентов дает возможность использовать меньшие дозировки, чем те, которые потребовались бы для достижения терапевтического или профилактического эффекта, если бы агенты вводили в качестве независимой терапии.
В некоторых воплощениях одно или более соединений или одну или более композиций, предложенных в данном документе, вводят совместно с одним или более антиандрогенными агентами. В некоторых воплощениях одно или более соединений или одну или более композиций, предложенных в данном документе, и один или более антиандрогенных агентов вводят в разное время. В некоторых воплощениях одно или более соединений или одна или более композиций, предложенных в данном документе, и один или более антиандрогенных агентов приготовлены вместе в единой композиции. В некоторых воплощениях одно или более соединений или одна или более композиций, предложенных в данном документе, и один или более антиандрогенных агентов приготовлены по отдельности. В некоторых воплощениях антиандрогенный агент выбран из MDV3100, ARN-059, ODM-201, абиратерона, TOK001, TAK700 и VT464.
Некоторые аспекты изобретения относятся к применению антисмыслового соединения, направленно воздействующего на рецептор андрогенов (AR) человека, как описано в данном документе, в комбинации с антиандрогенным агентом. В конкретных воплощениях такое применение имеет место в способе лечения пациента, страдающего раком, или в изготовлении лекарственного средства для лечения рака. В некоторых воплощениях рак выбран из рака предстательной железы, рака молочной железы, рака яичника, рака мочевого пузыря или рака желудка. Конкретными классами антиандрогенных агентов являются противогормональные агенты второго поколения, такие как энзалутамид (MDV3100), ARN-059, ODM-201, абиратерона ацетат, галетерон (TOK001), ортеронел (TAK700) и VT464 (смотри Yin et al. выше).
Некоторые аспекты относятся к комбинации антисмыслового соединения, направленно воздействующего на рецептор андрогенов (AR) человека, как описано в данном документе, и антиандрогенного агента, такого как противогормональный агент второго поколения, выбранный из MDV3100, ARN-059, ODM-201, абиратерона, TOK001, TAK700 и VT464.
В некоторых воплощениях такая комбинация антисмыслового соединения, направленно воздействующего на рецептор андрогенов (AR), как описано в данном документе, и антиандрогенного агента, такого как противогормональный агент второго поколения, выбранный из MDV3100, ARN-059, ODM-201, абиратерона, TOK001, TAK700 и VT464, полезна для ингибирования роста или пролиферации раковых клеток и/или лечения рака. В некоторых воплощениях рак выбран из рака предстательной железы, рака молочной железы, рака яичника, рака мочевого пузыря или рака желудка. В некоторых воплощениях рак представляет собой рак предстательной железы. В некоторых воплощениях рак представляет собой рак молочной железы. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на AR, как описано в данном документе, и антиандрогенный агент, такой как противогормональный агент второго поколения, выбранный из MDV3100, ARN-059, ODM-201, абиратерона, TOK001, TAK700 и VT464, в комбинации оказывают синергетическое действие в отношении ингибирования роста или пролиферации раковой клетки. В некоторых воплощениях раковая клетка представляет собой клетку рака предстательной железы, которая является или стала резистентной к кастрации. В различных воплощениях раковая клетка представляет собой клетку рака предстательной железы, которая является или стала резистентной к противогормональному агенту второго поколения, выбранному из MDV3100, ARN-059, ODM-201, абиратерона, TOK001, TAK700 и VT464. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, содержит модифицированный олигонуклеотид, состоящий из 10-30 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую по меньшей мере 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных нуклеооснований любой из SEQ ID NO: 12-179. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, содержит модифицированный олигонуклеотид, состоящий из 10-30 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую любую из SEQ ID NO: 12-179. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, содержит модифицированный олигонуклеотид, состоящий из последовательности нуклеооснований любой из SEQ ID NO: 12-179. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, содержит модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов и имеющий последовательность нуклеооснований, состоящую из SEQ ID NO: 35, 39, 43, 124, 150, 155, 169 или 175. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на рецептор андрогенов, представляет собой ISIS 560131, ISIS 569213, ISIS 569216, ISIS 569221, ISIS 569236, ISIS 579671, ISIS 586124, ISIS 583918, ISIS 584149, ISIS 584163, ISIS 584269 или ISIS 584468.
Несколько воплощений относятся к комбинации антисмыслового соединения, направленно воздействующего на рецептор андрогенов (AR) человека, и диарилгидантоинового ингибитора AR формулы XI, такого как MDV3100. В некоторых воплощениях диарилгидантоиновый ингибитор рецептора андрогенов (AR) представляет собой соединение формулы XVI:

где Х выбран из группы, состоящей из трифторметила и йода, где W выбран из группы, состоящей из О и NR5, где R5 выбран из группы, состоящей из Н, метила и

где D представляет собой S или О, а Е представляет собой N или О, и G представляет собой алкил, арил, замещенный алкил или замещенный арил; или D представляет собой S или О, a E-G вместе представляют собой С1-С4 низший алкил,
где R1 и R2 вместе содержат восемь или меньше атомов углерода и выбраны из группы, состоящей из алкила, замещенного алкила, включая галогеноалкил, и вместе с атомом углерода, с которым они связаны, образуют циклоалкильную или замещенную циклоалкильную группу,
где R3 выбран из группы, состоящей из водорода, галогена, метила, С1-С4 алкокси, формила, галогенацетокси, трифторметила, циано, нитро, гидроксила, фенила, амино, метилкарбамоила, метоксикарбонила, ацетамидо, метансульфонамино, метансульфонила, 4-метансульфонил-1-пиперизинила, пиперизинила и С1-С6 алкила или алкенила, возможно замещенного гидроксилом, метоксикарбонилом, циано, амино, амидо, нитро, карбамоилом или замещенным карбамоилом, включая метилкарбамоил, диметилкарбамоил и гидроксиэтилкарбамоил,
где R4 выбран из группы, состоящей из водорода, галогена, алкила и галогеноалкила, и
где R3 не является метиламинометилом или диметиламинометилом;
R5 может представлять собой
В некоторых воплощениях такая комбинация антисмыслового соединения, направленно воздействующего на рецептор андрогенов (AR), и диарилгидантоинового ингибитора AR формулы XVI, такого как MDV3100, полезна для ингибирования роста или клеточной пролиферации рака предстательной железы и/или лечения рака предстательной железы. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на AR, и диарилгидантоиновый ингибитор AR формулы XVI, такой как MDV3100, в комбинации оказывают синергетическое действие в отношении ингибирования роста или пролиферации клетки рака предстательной железы. В некоторых воплощениях клетка рака предстательной железы является резистентной к кастрации. В различных воплощениях клетка рака предстательной железы является резистентной к диарилгидантоиновому ингибитору AR формулы XVI, такому как MDV3100. В некоторых воплощениях клетка рака предстательной железы или клетка резистентного к кастрации рака предстательной железы экспрессирует преимущественно вариант сплайсинга AR по сравнению с полноразмерным AR. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на AR, которое описано в данном документе, и другой антиандрогенный агент используют в комбинированном лечении путем введения двух агентов одновременно, отдельно или последовательно. В некоторых воплощениях два агента приготовлены в виде комбинированного продукта фиксированной дозы. В других воплощениях два агента предоставляют пациенту в виде отдельных единиц, которые затем можно принимать либо одновременно, либо периодически (последовательно).
В некоторых воплощениях антисмысловые соединения, полезные для ингибирования роста или клеточной пролиферации рака предстательной железы и/или клеток резистентного к кастрации рака предстательной железы, в комбинации с другим антиандрогенным агентом, таким как противогормональный агент второго поколения, выбранный из MDV3100, ARM-059, ODM-201, абиратерона, TOK001, TAK700 и VT464, направленно воздействуют на рецептор андрогенов человека выше 3'-конца экзона 3 и/или выше лиганд-связывающего домена. В некоторых воплощениях предложенное антисмысловое соединение, направленно воздействует на AR в пределах экзона 1, экзона 2, экзона 3, интрона 1 или интрона 2, как описано в данном документе.
В некоторых воплощениях предложенное антисмысловое соединение, направленно воздействует на вариант сплайсинга AR, который содержит экзон 1, кодирующий N-концевой домен, и экзоны 2 и 3, кодирующие ДНК-связывающий домен, но не содержит по меньшей мере участок экзона 4, кодирующего короткую шарнирную область, или по меньшей мере участок экзонов 4-8, кодирующих лиганд-связывающий домен. Примером такого варианта сплайсинга AR является, без ограничения, AR-W, который содержит экзоны 1-3, но лишен экзонов 4-8. Дополнительные примеры таких вариантов сплайсинга AR включают, например, AR3, AR4, AR4b, AR5 и AR6 (SEQ ID NO: 4-8 соответственно). В некоторых воплощениях клетка рака предстательной железы, которая может быть резистентной к кастрации, экспрессирует преимущественно вариант сплайсинга AR по сравнению с полноразмерным AR. В конкретных воплощениях клетка рака предстательной железы является кастрат-резистентной к антиандрогенному агенту, выбранному из MDV3100, ARN-059, ODM-201, абиратерона, TOK001, TAK700 и VT464. В некоторых воплощениях антисмысловое соединение, направленно воздействующее на AR выше 3'-конца экзона 3 и/или выше лиганд-связывающего домена, способно ингибировать рост или пролиферацию клетки рака предстательной железы, включая клетку резистентного к кастрации рака предстательной железы, в комбинации с антиандрогенным агентом, выбранным из MDV3100, ARN-059, ODM-201, абиратерона, TOK001, TAK700 и VT464, в большей степени, чем антисмысловое соединение, направленно воздействующее на лиганд-связывающий домен, такое как EZN-4176, которое направленно воздействует на экзон 4 и соответствует SEQ ID NO: 58, описанной в US 7737125, в комбинации с таким же антиандрогенным агентом, выбранным из MDV3100, ARN-059, ODM-201, абиратерона, TOK001, TAK700 и VT464. В некоторых воплощениях комбинация антисмыслового соединения, которое описано в данном документе, и антиандрогенного агента, выбранного из MDV3100, ARN-059, ODM-201, абиратерона, TOK001, TAK700 и VT464, обеспечивает синергетический (например более чем аддитивный) эффект в ингибировании роста или пролиферации клетки рака предстательной железы, такой как клетка резистентного к кастрации рака предстательной железы, по сравнению с только антисмысловым соединением или только антиандрогенным агентом, выбранным из MDV3100, ARN-059, ODM-201, абиратерона, TOK001, TAK700 и VT464. Соответственно, в некоторых воплощениях количества каждого или обоих антисмыслового соединения и/или антиандрогенного агента, выбранного из MDV3100, ARN-059, ODM-201, абиратерона, TOK001, TAK700 и VT464, при использовании в комбинации могут быть меньше соответствующего количества либо только антисмыслового соединения, либо только антиандрогенного агента, выбранного из MDV3100, ARN-059, ODM-201, абиратерона, TOK001, TAK700 и VT464, необходимого для достижения эквивалентного уровня ингибирования роста или клеточной пролиферации рака предстательной железы.
В некоторых воплощениях предложенное антисмысловое соединение, полезное для ингибирования роста или клеточной пролиферации рака предстательной железы и/или резистентного к кастрации рака предстательной железы, в комбинации с антиандрогенным агентом, выбранным из MDV3100, ARN-059, ODM-201, абиратерона, TOK001, TAK700 и VT464, направленно воздействует на вариант сплайсинга AR, который имеет функциональный ДНК-связывающий домен, но не имеет функционального лиганд-связывающего домена. Должно быть понятно, что в некоторых воплощениях антисмысловое соединение может направленно воздействовать на вариант сплайсинга AR, который содержит полный или по меньшей мере функциональный участок экзона 1, кодирующего N-концевой домен, и полный или по меньшей мере функциональный участок экзонов 2 и 3, кодирующих ДНК-связывающий домен, но не содержит по меньшей мере функциональный участок экзона 4, кодирующего короткую шарнирную область, или по меньшей мере функциональный участок экзонов 4-8, кодирующих лиганд-связывающий домен. Предполагается, что некоторые варианты сплайсинга AR, являющиеся мишенью направленного воздействия антисмысловых соединений, предложенных в данном документе, по существу состоящие из экзонов 1-3, могут также содержать нефункциональный участок последовательности нуклеиновой кислоты из геномной области или экзонов 4-8. Предполагается, что процесс сплайсинга может давать в результате такие варианты сплайсинга AR, которые сохраняют ДНК-связывающую функцию, но не лиганд-связывающую функцию. В некоторых воплощениях клетка рака предстательной железы, которая может быть резистентной к кастрации, экспрессирует преимущественно вариант сплайсинга AR по сравнению с полноразмерным AR. В некоторых воплощениях клетка рака предстательной железы является кастрат-резистентной к антиандрогенному агенту, выбранному из MDV3100, ARN-059, ODM-201, абиратерона, TOK001, TAK700 и VT464. В некоторых воплощениях предложенное антисмысловое соединение направленно воздействует на AR в пределах экзона 1, который находится выше 3'-конца экзона 3 и/или выше лиганд-связывающего домена. В некоторых воплощениях предложенное антисмысловое соединение направленно воздействует на AR в пределах экзона 1, экзона 2, экзона 3, интрона 1 или интрона 2, как описано в данном документе.
В некоторых воплощениях антисмысловое соединение, направленно воздействующее на вариант сплайсинга AR, который имеет функциональный ДНК-связывающий домен, но не функциональный лиганд-связывающий домен, способно ингибировать рост или пролиферацию клетки рака предстательной железы, включая клетку резистентного к кастрации рака предстательной железы, в комбинации с антиандрогенным агентом, выбранным из MDV3100, ARN-059, ODM-201, абиратерона, TOK001, TAK700 и VT464, в большей степени, чем антисмысловое соединение, направленно воздействующее на лиганд-связывающий домен, такое как EZN-4176, которое направленно воздействует на экзон 4 и соответствует SEQ ID NO: 58, описанной в US 7737125, в комбинации с таким же антиандрогенным агентом, выбранным из MDV3100, ARN-059, ODM-201, абиратерона, TOK001, TAK700 и VT464. В некоторых воплощениях комбинация антисмыслового соединения и антиандрогенного агента, выбранного из MDV3100, ARN-059, ODM-201, абиратерона, TOK001, TAK700 и VT464, обеспечивает синергетический (например более чем аддитивный) эффект в ингибировании роста или пролиферации клетки рака предстательной железы, такой как клетка резистентного к кастрации рака предстательной железы, по сравнению с только антисмысловым соединением или только антиандрогенным агентом. Соответственно, в некоторых воплощениях количества каждого или обоих антисмыслового соединения и/или антиандрогенного агента, выбранного из MDV3100, ARN-059, ODM-201, абиратерона, TOK001, TAK700 и VT464, при использовании в комбинации может быть меньше соответствующего количества либо только антисмыслового соединения, либо только антиандрогенного агента, необходимого для достижения эквивалентного уровня ингибирования роста или клеточной пролиферации рака предстательной железы.
В некоторых воплощениях предложенное антисмысловое соединение, полезное для ингибирования роста или клеточной пролиферации рака предстательной железы и/или клеток резистентного к кастрации рака предстательной железы, в комбинации с антиандрогенным агентом, выбранным из MDV3100, ARN-059, ODM-201, абиратерона, TOK001, TAK700 и VT464, способно снижать экспрессию как полноразмерного AR, так и варианта сплайсинга AR, который содержит экзон 1, кодирующий N-концевой домен, и экзоны 2 и 3, кодирующие ДНК-связывающий домен, но не содержит по меньшей мере участок экзона 4, кодирующего короткую шарнирную область, или по меньшей мере участок любого из экзонов 4-8, кодирующих лиганд-связывающий домен. В некоторых воплощениях такое антисмысловое соединение направленно воздействует на рецептор андрогенов человека выше лиганд-связывающего домена. В некоторых воплощениях такие антисмысловые соединения направленно воздействуют на рецептор андрогенов человека выше 3'-конца экзона 3. В некоторых воплощениях предложенное антисмысловое соединение направленно воздействует на AR в пределах экзона 1, который находится выше 3'-конца экзона 3 и/или выше лиганд-связывающего домена.
В некоторых воплощениях предложена комбинация антисмыслового соединения, направленно воздействующего на рецептор андрогенов (AR) человека, которое описано в данном документе, и антиандрогенного агента, выбранного из MDV3100, ARN-059, ODM-201, абиратерона, TOK001, TAK700 и VT464, где антисмысловое соединение содержит модифицированный олигонуклеотид, состоящий из 10-30 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую по меньшей мере 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных нуклеооснований любой из SEQ ID NO: 12-179. В некоторых воплощениях предложена комбинация антисмыслового соединения, направленно воздействующего на рецептор андрогенов (AR) человека, и антиандрогенного агента, выбранного из MDV3100, ARN-059, ODM-201, абиратерона, TOK001, TAK700 и VT464, где антисмысловое соединение содержит модифицированный олигонуклеотид, состоящий из 10-30 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую любую из SEQ ID NO: 12-179. В некоторых воплощениях предложена комбинация антисмыслового соединения, направленно воздействующего на рецептор андрогенов (AR) человека, и антиандрогенного агента, выбранного из MDV3100, ARN-059, ODM-201, абиратерона, TOK001, TAK700 и VT464, где антисмысловое соединение содержит модифицированный олигонуклеотид, состоящий из последовательности нуклеооснований любой из SEQ ID NO: 12-179. В некоторых воплощениях предложена комбинация антисмыслового соединения, направленно воздействующего на рецептор андрогенов (AR) человека, и диарилгидантоинового ингибитора AR формулы XI, такого как MDV3100, где антисмысловое соединение содержит модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов и имеющий последовательность нуклеооснований, состоящую из SEQ ID NO: 35, 39, 43, 124, 150, 155, 169 или 175. В некоторых воплощениях предложена комбинация антисмыслового соединения, направленно воздействующего на рецептор андрогенов (AR) человека, и диарилгидантоинового ингибитора AR формулы XI, такого как MDV3100, где антисмысловое соединение, направленно воздействующее на рецептор андрогенов, представляет собой ISIS 560131, ISIS 569213, ISIS 569216, ISIS 569221, ISIS 569236, ISIS 579671, ISIS 586124, ISIS 583918, ISIS 584149, ISIS 584163, ISIS 584269 или ISIS 584468.
Несколько воплощений относятся к способу ингибирования роста или клеточной пролиферации рака предстательной железы, включающему приведение клетки рака предстательной железы в контакт с антисмысловым соединением, направленно воздействующим на рецептор андрогенов (AR) человека, и антиандрогенным агентом, выбранным из MDV3100, ARN-059, ODM-201, абиратерона, TOK001, TAK700 и VT464. В некоторых воплощениях антисмысловое соединение и антиандрогенный агент, выбранный из MDV3100, ARN-059, ODM-201, абиратерона, TOK001, TAK700 и VT464, в комбинации оказывают синергетическое действие в ингибировании роста или пролиферации клетки рака предстательной железы. В некоторых воплощениях клетка рака предстательной железы является резистентной к кастрации. В различных воплощениях клетка рака предстательной железы является резистентной к кастрации, будучи резистентной к антиандрогенному агенту, выбранному из MDV3100, ARN-059, ODM-201, абиратерона, TOK001, TAK700 и VT464. В некоторых воплощениях клетка рака предстательной железы или клетка резистентного к кастрации рака предстательной железы экспрессирует преимущественно вариант сплайсинга AR по сравнению с полноразмерным AR.
В некоторых аспектах любого из приведенных выше воплощений антисмысловые соединения, полезные для ингибирования роста или клеточной пролиферации рака предстательной железы, в комбинации с диарилгидантоиновым ингибитором AR формулы XVI, таким как MDV3100, могут направленно воздействовать на (1) рецептор андрогенов человека выше 3'-конца экзона 3 и/или выше лиганд-связывающего домена или (2) вариант сплайсинга AR, который имеет функциональный ДНК-связывающий домен, но не имеет функционального лиганд-связывающего домена; и/или способен (1) снижать экспрессию как полноразмерного AR, так и варианта сплайсинга AR, который содержит экзон 1, кодирующий N-концевой домен, и экзоны 2 и 3, кодирующие ДНК-связывающий домен, но не содержит по меньшей мере участок экзона 4, кодирующего короткую шарнирную область, или по меньшей мере участок любого из экзонов 4-8, кодирующих лиганд-связывающий домен;
при условии, что антисмысловые соединения не имеют последовательность нуклеооснований, состоящую из любой из SEQ ID NO: 194-215, указанных в Таблице А ниже.

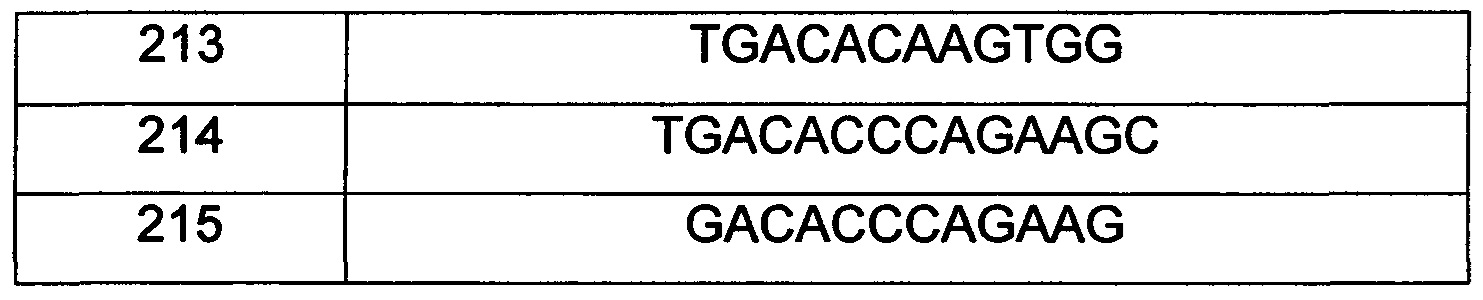
В некоторых аспектах любого из приведенных выше воплощений антисмысловые соединения, полезные для ингибирования роста или пролиферации клетки рака предстательной железы, резистентного к антиандрогенному агенту, выбранному из MDV3100, ARN-059, ODM-201, абиратерона, TOK001, TAK700 и VT464, могут направленно воздействовать на (1) рецептор андрогенов человека выше 3'-конца экзона 3 и/или выше лиганд-связывающего домена или (2) вариант сплайсинга AR, который имеет функциональный ДНК-связывающий домен, но не имеет функционального лиганд-связывающего домена; и/или способен (1) снижать экспрессию как полноразмерного AR, так и варианта сплайсинга AR, который содержит экзон 1, кодирующий N-концевой домен, и экзоны 2 и 3, кодирующие ДНК-связывающий домен, но не содержит по меньшей мере участок экзона 4, кодирующего короткую шарнирную область, или по меньшей мере участок любого из экзонов 4-8, кодирующих лиганд-связывающий домен; или (2) ингибировать рост или пролиферацию резистентной клетки рака предстательной железы в большей степени, чем антисмысловое соединение, направленно воздействующее на лиганд-связывающий домен, такое как EZN-4176; при условии, что антисмысловые соединения не имеют последовательность нуклеооснований, состоящую из любой из SEQ ID NO: 194-215, описанных в US 7737125 как SEQ ID NO: 2-9, 49-50, 52-53, 55-56 и 86-93 (включены в данное описание посредством ссылки) и указаны в Таблице А.
Некоторые аспекты относятся к способам лечения рака молочной железы и способам ингибирования роста или пролиферации клетки рака молочной железы антисмысловым олигонуклеотидом, направленно воздействующим на рецептор андрогенов (AR) человека, который описан в данном документе. В некоторых воплощениях рак молочной железы имеет одну или более следующих характеристик: рецептор андрогенов-позитивный, зависимый от андрогена для роста, рецептор эстрогенов (ER)-негативный, независимый от эстрогена для роста, рецептор прогестерона (PR)-негативный, независимый от прогестерона для роста, или Her2/neu-негативный. В некоторых воплощениях рак молочной железы или клетка рака молочной железы является апокринным(ой).
Некоторые воплощения относятся к способу лечения рака молочной железы у субъекта, включающему введение субъекту антисмыслового соединения, направленно воздействующего на рецептор андрогенов (AR) человека. Некоторые воплощения относятся к способу лечения рака молочной железы у субъекта, включающему идентификацию субъекта, имеющего рак молочной железы, и введение субъекту антисмыслового соединения, направленно воздействующего на рецептор андрогенов (AR) человека, осуществляя тем самым лечение рака молочной железы у субъекта. Некоторые воплощения относятся к способу ингибирования роста или пролиферации клетки рака молочной железы, включающему приведение клетки рака молочной железы в контакт с антисмысловым соединением, направленно воздействующим на рецептор андрогенов (AR) человека. Некоторые воплощения относятся к способу ингибирования экспрессии AR у субъекта, имеющего рак молочной железы или имеющего риск возникновения рака молочной железы, включающему идентификацию рака молочной железы у субъекта и введение субъекту антисмыслового соединения, направленно воздействующего на человек AR, при котором антисмысловое соединение ингибирует экспрессию AR у субъекта.
В некоторых воплощениях рак молочной железы или клетка рака молочной железы имеет одну или более следующих характеристик: рецептор андрогенов-позитивный, зависимый от андрогена для роста, рецептор эстрогенов (ER)-негативный, независимый от эстрогена для роста, рецептор прогестерона (PR)-негативный, независимый от прогестерона для роста, или Her2/neu-негативный. В некоторых воплощениях рак молочной железы или клетка рака молочной железы является тройственно ER-, PR- и HER2-негативным(ой) и AR-позитивным(ой) (ER-, PR-, HER2-, AR+). В некоторых воплощениях рак молочной железы или клетка рака молочной железы является ER-негативным(ой) и AR-позитивным(ой) (ER-, AR+). В некоторых воплощениях рак молочной железы или клетка рака молочной железы является ER-позитивным(ой) и AR-позитивным(ой) (ER+, AR+).
В некоторых воплощениях рак молочной железы или клетка рака молочной железы является апокринным(ой). Апокринные виды рака молочной железы часто являются "тройственно негативными", что означает, что клетки не экспрессируют рецепторы ER, PR или HER2, и обычно, но не обязательно, являются AR-позитивными. В некоторых воплощениях апокринный рак молочной железы или апокринная клетка рака молочной железы является тройственно ER-, PR- и HER2-негативным(ой) и AR-позитивным(ой) (ER-, PR-, HER2-, AR+). В некоторых воплощениях апокринный рак молочной железы или апокринная клетка рака молочной железы является ER-негативным(ой) и AR-позитивным(ой) (ER-, AR+). В некоторых воплощениях апокринный рак молочной железы или апокринная клетка рака молочной железы имеет происхождение из потовой железы молочной железы. В некоторых воплощениях апокринный рак молочной железы или апокринная клетка рака молочной железы представляет собой рак протока или раковую клетку молочной железы. В некоторых воплощениях апокринный рак молочной железы может иметь один или более следующих признаков: большое количество эозинофильной гранулярной цитоплазмы, четкие границы, большие везикулярные ядра, отношение нуклеарных к цитоплазматическим примерно 1:2 и/или накопления секреторных гранул в апикальной цитоплазме, известные как апикальные выступы.
В некоторых воплощениях рак молочной железы или клетка рака молочной железы является ER-негативным(ой) и AR-позитивным(ой) (ER-, AR+) молекулярным апокринным раком молочной железы или молекулярной клеткой рака молочной железы. В некоторых аспектах ER-негативный(ая) и AR-позитивный(ая) (ER-, AR+) молекулярный(ая) апокринный(ая) рак молочной железы или клетка рака молочной железы может быть дополнительно PR-позитивным(ой), PR-негативным(ой), НЕР2-негативным(ой) или HER2-позитивным(ой).
Рак молочной железы может быть идентифицирован как позитивный или негативный в отношении рецепторов гормонов, таких как ER, PR или HER2, стандартными гистологическими методами. Например, гистологические образцы рака молочной железы можно классифицировать как "тройственно негативные" (ER-, PR-, HER2-), когда менее 1% клеток демонстрируют ядерное окрашивание для рецепторов эстрогенов и прогестерона, и иммуногистохимическое окрашивание для HER2 показывает 0, 1-кратный или 2-кратный позитивный показатель и FISH (флуоресцентная гибридизация in situ) отношение (сигналов гена HER2 к сигналам хромосомы 17) менее 1,8 согласно релевантным руководствам ASCO (Американское общество клинической онкологии) и CAP (Коллегия американских патологоанатомов) (Meyer, P. et al., PLoS ONE 7(5): e38361 (2012)).
В некоторых воплощениях предложенное антисмысловое соединение, полезное для лечения рака молочной железы или ингибирования роста или пролиферации клетки рака молочной железы, направленно воздействует на AR в пределах экзона 1, который находится выше 3'-конца экзона 3 и/или выше лиганд-связывающего домена. В некоторых воплощениях предложенное антисмысловое соединение направленно воздействует на AR в пределах экзона 1, например в пределах нуклеотидных областей 2863-5593 (экзон 1) или 27672-27853 (экзон 1 В) SEQ ID NO: 1. В некоторых воплощениях предложенное антисмысловое соединение, направленно воздействующее на экзон 1 AR, является комплементарным в пределах любой из следующих нуклеотидных областей SEQ ID NO: 1: 3353-3368, 3361-3376, 3519-3534, 3735-3750, 3768-3783, 3798-3813, 3799-3814, 3851-3866, 3870-3885, 3874-3889, 3888-3903, 4047-4062, 4062-4077, 4109-4124, 4534-4549, 4537-4552, 4555-4570, 4571-4586, 4573-4588, 4578-4593, 4655-4670, 4750-4765, 4752-4767, 4833-4848, 4837-4852, 4839-4854, 4865-4880, 4872-4887, 4874-4889, 4876-4891, 4916-4931, 4918-4933, 5052-5067, 5054-5069, 5060-5075, 5061-5076, 5061-5076, 5062-5077, 5155-5170, 5265-5280, 5293-5308, 5392-5407, 5448-5463, 5483-5498, 5486-5501 или 5494-5509.
В некоторых воплощениях предложенное антисмысловое соединение направленно воздействует на AR в пределах экзона 2, который находится выше 3'-конца экзона 3 и/или выше лиганд-связывающего домена. В некоторых воплощениях предложенное в данном документе антисмысловое соединение, полезное для лечения рака молочной железы или ингибирования роста или пролиферации клетки рака молочной железы, направленно воздействует на AR в пределах экзона 2, например в пределах нуклеотидных областей 102087-102238 (экзон 2) или 139551-139834 (экзон 2 с) SEQ ID NO: 1. В некоторых воплощениях предложенное антисмысловое соединение, направленно воздействующее на экзон 2 AR, является комплементарным в пределах любой из следующих нуклеотидных областей SEQ ID NO: 1: 102155-102170 или 102156-107171.
В некоторых аспектах предложенное в данном документе антисмысловое соединение, полезное для лечения рака молочной железы или ингибирования роста или пролиферации клетки рака молочной железы, направленно воздействует на AR в пределах интрона 1, который находится выше 3'-конца экзона 3 и/или выше лиганд-связывающего домена. В некоторых воплощениях предложенное антисмысловое соединение направленно воздействует на AR в пределах интрона 1, например в пределах нуклеотидных областей 5594-27671 или 27854-102086 SEQ ID NO: 1. В некоторых аспектах предложенное антисмысловое соединение, направленно воздействующее на интрон 1 AR, является комплементарным в пределах любой из следующих нуклеотидных областей SEQ ID NO: 1: 5666-5681, 6701-6716, 7543-7558, 8471-8486, 8638-8653, 9464-9479, 10865-10880, 11197-11212, 11855-11870, 13189-13204, 13321-13336, 13346-13361, 16793-16808, 16968-16983, 17206-17221, 18865-18880, 32290-32305, 33315-33330, 39055-39070, 40615-40630, 42017-42032, 56050-56065, 58719-58734, 58720-58735, 58721-58736, 58722-58737, 58723-58738, 58725-58740, 58750-58765, 58751-58766, 58752-58767, 58753-58768, 58754-58769 или 58755-58770.
В некоторых аспектах любого из приведенных выше воплощений антисмысловые соединения, полезные для лечения рака молочной железы или ингибирования роста или пролиферации клетки рака молочной железы, направленно воздействуют на рецептор андрогенов человека выше 3'-конца экзона 3 и/или выше лиганд-связывающего домена. В некоторых воплощениях антисмысловые соединения, предложенные в данном документе, включая, без ограничения, те, которые направленно воздействуют на рецептор андрогенов человека выше 3'-конца экзона 3 и/или выше лиганд-связывающего домена, могут лечить рак молочной железы или ингибировать рост или пролиферацию клетки рака молочной железы в большей степени, чем антисмысловое соединение, направленно воздействующее на лиганд-связывающий домен, такое как EZN-4176; при условии, что антисмысловые соединения не имеют последовательность нуклеооснований, состоящую из любой из SEQ ID NO: 194-215, описанных в US 7737125 как SEQ ID NO: 2-9, 49-50, 52-53, 55-56 и 86-93 (включены в данное описание посредством ссылки), и указанную в Таблице А.
Антисмысловые соединения
Олигомерные соединения включают, без ограничения, олигонуклеотиды, олигонуклеозиды, аналоги олигонуклеотидов, миметики олигонуклеотидов, антисмысловые соединения, антисмысловые олигонуклеотиды и киРНК. Олигомерное соединение может быть "антисмысловым" по отношению к нулеиновой кислоте-мишени, то есть способным подвергаться гибридизации с нуклеиновой кислотой-мишенью посредством водородной связи.
В некоторых воплощениях антисмысловое соединение имеет последовательность нуклеооснований, которая, когда написана в направлении от 5' к 3', содержит обратный комплемент сегмента-мишени нуклеиновой кислоты-мишени, на которую оно направленно воздействует. В некоторых таких воплощениях антисмысловой олигонуклеотид имеет последовательность нуклеооснований, которая, когда написана в направлении от 5' к 3', содержит обратный комплемент сегмента-мишени нуклеиновой кислоты-мишени, на которую он направленно воздействует.
В некоторых воплощениях антисмысловое соединение имеет длину 10-30 субъединиц. В некоторых воплощениях антисмысловое соединение имеет длину 12-30 субъединиц. В некоторых воплощениях антисмысловое соединение имеет длину 12-22 субъединицы. В некоторых воплощениях антисмысловое соединение имеет длину 14-30 субъединиц. В некоторых воплощениях антисмысловое соединение имеет длину 14-20 субъединиц. В некоторых воплощениях антисмысловое соединение имеет длину 15-30 субъединиц. В некоторых воплощениях антисмысловое соединение имеет длину 15-20 субъединиц. В некоторых воплощениях антисмысловое соединение имеет длину 16-30 субъединиц. В некоторых воплощениях антисмысловое соединение имеет длину 16-20 субъединиц. В некоторых воплощениях антисмысловое соединение имеет длину 17-30 субъединиц. В некоторых воплощениях антисмысловое соединение имеет длину 17-20 субъединиц. В некоторых воплощениях антисмысловое соединение имеет длину 18-30 субъединиц. В некоторых воплощениях антисмысловое соединение имеет длину 18-21 субъединиц. В некоторых воплощениях антисмысловое соединение имеет длину 18-20 субъединиц. В некоторых воплощениях антисмысловое соединение имеет длину 20-30 субъединиц. Другими словами, такие антисмысловые соединения имеют длину от 12-30 связанных субъединиц, от 14 до 30 связанных субъединиц, от 14 до 20 субъединиц, от 15 до 30 субъединиц, от 15 до 20 субъединиц, от 16 до 30 субъединиц, от 16 до 20 субъединиц, от 17 до 30 субъединиц, от 17 до 20 субъединиц, от 18 до 30 субъединиц, от 18 до 20 субъединиц, от 18 до 21 субъединиц, от 20 до 30 субъединиц или от 12 до 22 связанных субъединиц соответственно. В некоторых воплощениях антисмысловое соединение имеет длину 14 субъединиц. В некоторых воплощениях антисмысловое соединение имеет длину 16 субъединиц. В некоторых воплощениях антисмысловое соединение имеет длину 17 субъединиц. В некоторых воплощениях антисмысловое соединение имеет длину 18 субъединиц. В некоторых воплощениях антисмысловое соединение имеет длину 20 субъединиц. В других воплощениях антисмысловое соединение представляет собой антисмысловое соединение длиной от 8 до 80, от 12 до 50, от 13 до 30, от 13 до 50, от 14 до 30, от 14 до 50, от 15 до 30, от 15 до 50, от 16 до 30, от 16 до 50, от 17 до 30, от 17 до 50, от 18 до 22, от 18 до 24, от 18 до 30, от 18 до 50, от 19 до 22, от 19 до 30, от 19 до 50 или от 20 до 30 связанных субъединиц. В некоторых таких воплощениях антисмысловые соединения представляют собой антисмысловые соединения длиной 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79 или 80 связанных субъединиц или в диапазоне, определенном любыми двумя вышеуказанными значениями. В некоторых воплощениях антисмысловое соединение представляет собой антисмысловой олигонуклеотид, и связанные субъединицы представляют собой нуклеотиды.
В некоторых воплощениях антисмысловые олигонуклеотиды могут быть укороченными или усеченными. Например, одна единственная субъединица может быть удалена из 5'-конца (5'-усечение) или, альтернативно, из 3'-конца (3'-усечение). Укороченное или усеченное антисмысловое соединение, направленно воздействующее на нуклеиновую кислоту рецептора андрогенов, может иметь две субъединицы, удаленные из 5'-конца или, альтернативно, может иметь две субъединицы, удаленные из 3'-конца антисмыслового соединения. Альтернативно, удаленные нуклеозиды могут быть рассредоточены по всему антисмысловому соединению, например, в антисмысловом соединении, имеющем один нуклеозид, удаленный из 5'-конца, и один нуклеозид, удаленный из 3'-конца.
Когда в удлиненном антисмысловом соединении присутствует единственная дополнительная субъединица, тогда эта дополнительная субъединица может быть расположена на 5'- или 3'-конце антисмыслового соединения. Когда присутствуют две или более дополнительных субъединиц, эти добавленные субъединицы могут быть граничащими друг с другом, например в антисмысловом соединении, имеющем две субъединицы, добавленные к 5'-концу (5'-добавление) или, альтернативно, к 3'-концу (3'-добавление) антисмыслового соединения. Альтернативно, добавленные субъединицы могут быть рассредоточены по всему антисмысловому соединению, например в антисмысловом соединении, имеющем одну субъединицу, добавленную к 5'-концу, и одну субъединицу, добавленную к 3'-концу.
Можно увеличивать или уменьшать длину антисмыслового соединения, такого как антисмысловой олигонуклеотид, и/или индуцировать ошибочное спаривание оснований, не лишая активности. Например, в Woolf et al., Proc. Natl. Acad. Sci. USA 89: 7305-7309, 1992, серию антисмысловых олигонуклеотидов длиной 13-25 нуклеооснований тестировали в отношении их способности индуцировать расщепление РНК-мишени в модели с инъецированием ооцитов. Антисмысловые олигонуклеотиды длиной 25 нуклеооснований с 8 или 11 ошибочными спариваниями оснований вблизи концов антисмысловых олигонуклеотидов обеспечивали прямое специфическое расщепление мРНК-мишени, хотя и в меньшей степени, чем антисмысловые олигонуклеотиды, которые не имели ошибочных спариваний. Аналогично, специфическое расщепление мишени достигалось с использованием антисмысловых олигонуклеотидов длиной 13 нуклеооснований, включая антисмысловые олигонуклеотиды с 1 или 3 ошибочными спариваниями оснований.
В Gautschi et al., J. Natl. Cancer Inst. 93: 463-471, March 2001, продемонстрирована способность олигонуклеотида, имеющего 100%-ную комплементарность по отношению к мРНК bcl-2 и имеющего 3 ошибочных спаривания оснований по отношению к мРНК bcl-xL, снижать экспрессию как bcl-2, так и bcl-xL in vitro и in vivo. Кроме того, этот олигонуклеотид продемонстрировал мощную противоопухолевую активность in vivo.
Maher и Dolnick (Nuc. Acid. Res. 16:3341-3358, 1988) тестировали серию тандемных антисмысловых олигонуклеотидов из 14 нуклеооснований и антисмысловых олигонуклеотидов из 28 и 42 нуклеооснований, состоящих из последовательности двух или трех тандемных антисмысловых олигонуклеотидов соответственно, в отношении их способности останавливать трансляцию DHFR (дигидрофолатредуктаза) человека в анализе кроличьих ретикулоцитов. Каждый из трех антисмысловых олигонуклеотидов, состоящих из 14 нуклеооснований, по отдельности был способен ингибировать трансляцию, хотя и на более умеренном уровне, чем антисмысловые олигонуклеотиды из 28 или 42 нуклеооснований.
Некоторые мотивы и механизмы антисмысловых соединений
В некоторых воплощениях антисмысловые соединения имеют химически модифицированные субъединицы, расположенные в паттернх, или мотивах, для придания антисмысловым соединениям таких свойств, как усиленная ингибирующая активность, повышенная аффинность связывания с нуклеиновой кислотой-мишенью или устойчивость к расщеплению нуклеазами in vivo.
Химерные антисмысловые соединения обычно содержат по меньшей мере одну область, модифицированную с целью повышения устойчивости к расщеплению нуклеазами, повышения клеточного захвата, повышения аффинности связывания с нуклеиновой кислотой-мишенью и/или повышения ингибирующей активности. Вторая область химерного антисмыслового соединения может обеспечивать наличие другого желаемого свойства, например может служить в качестве субстрата для клеточной эндонуклеазы РНзы Н, которая расщепляет цепь РНК дуплекса РНК : ДНК.
Антисмысловая активность может быть результатом любого механизма, в который вовлечена гибридизация антисмыслового соединения (например олигонуклеотида) с нуклеиновой кислотой-мишенью, где гибридизация в конечном счете приводит к биологическому эффекту. В некоторых воплощениях количество и/или активность нуклеиновой кислоты-мишени модулируется. В некоторых воплощениях количество и/или активность нуклеиновой кислоты-мишени снижается. В некоторых воплощениях гибридизация антисмыслового соединения с нуклеиновой кислотой-мишенью в конечном счете приводит к расщеплению нуклеиновой кислоты-мишени. В некоторых воплощениях гибридизация антисмыслового соединения с нуклеиновой кислотой-мишенью не приводит к расщеплению нуклеиновой кислоты-мишени. В некоторых таких воплощениях присутствие антисмыслового соединения, гибридизированного с нуклеиновой кислотой-мишенью (занятость), приводит к модулированию антисмысловой активности. В некоторых воплощениях антисмысловые соединения, имеющие конкретный химический мотив или паттерн химических модификаций, особенно подходят для использования одного или более механизмов. В некоторых воплощениях антисмысловые соединения функционируют по более чем одному механизму и/или по механизмам, которые еще не выяснены. Соответственно, антисмысловые соединения, описанные в данном документе, не ограничены конкретным механизмом.
Антисмысловые механизмы включают, без ограничения, РНза Н-опосредованный антисмысловой механизм; механизмы РНК-интерференции, которые используют RISC (РНК-индуцированный комплекс сайлесинга) путь и включают, без ограничения, киРНК-, оцРНК- и микроРНК-механизмы; и механизмы на основе занятости. Некоторые антисмысловые соединения могут действовать по более чем одному такому механизму и/или по дополнительным механизмам.
РНза Н-опосредованный антисмысловой механизм
В некоторых воплощениях антисмысловая активность является, по меньшей мере частично, результатом расщепления РНК-мишени РНзой Н. РНза Н является клеточной эндонуклеазой, которая расщепляет цепь РНК дуплекса РНК : ДНК. В данной области известно, что одноцепочечные антисмысловые соединения, которые являются "ДНК-подобными", вызывают активность РНазы Н в клетках млекопитающих. Соответственно, антисмысловые соединения, содержащие по меньшей мере участок ДНК или ДНК-подобные нуклеозиды, могут активировать РНКазу Н, вызывая расщепление нуклеиновой кислоты-мишени. В некоторых воплощениях антисмысловые соединения, которые используют РНазу Н, содержат один или более модифицированных нуклеозидов. В некоторых воплощениях такие антисмысловые соединения содержат по меньшей мере один блок из 1-8 модифицированных нуклеозидов. В некоторых таких воплощениях модифицированные нуклеозиды не поддерживают активность РНазы Н. В некоторых воплощениях такие антисмысловые соединения являются гэпмерами, которые описаны в данном документе. В некоторых таких воплощениях гэп гэпмера содержит ДНК нуклеозиды. В некоторых таких воплощениях гэп гэпмера содержит ДНК-подобные нуклеозиды. В некоторых таких воплощениях гэп гэпмера содержит ДНК нуклеозиды и ДНК-подобные нуклеозиды.
Некоторые антисмысловые соединения, имеющие гэпмерный мотив, считаются химерными антисмысловыми соединениями. В гэпмере внутренняя область, имеющая множество нуклеотидов, которая поддерживает расщепление РНазой Н, расположена между внешними областями, имеющими множество нуклеотидов, которые химически отличаются от нуклеозидов внутренней области. В случае антисмыслового олигонуклеотида, имеющего гэпмерный мотив, гэп-сегмент обычно служит в качестве субстрата для расщепления эндонуклеазой, тогда как сегменты-"крылья" содержат модифицированные нуклеозиды. В некоторых воплощениях области гэпмера дифференцированы по типам сахарных группировок, составляющих каждую отличающуюся область. Типы сахарных группировок, которые используют для дифференциации областей гэпмера, могут в некоторых воплощениях включать β-D-рибонуклеозиды, β-D-дезоксирибонуклеозиды, 2'-модифицированные нуклеозиды (такие 2'-модифицированные нуклеозиды могут содержать 2'-МОЕ и 2'-O-CH3, помимо прочих) и бициклический сахар-модифицированные нуклеозиды (такие бициклический сахар-модифицированные нуклеозиды могут включать те, которые имеют связанный этил). В некоторых воплощениях нуклеозиды в "крыльях" могут содержать несколько модифицированных сахарных группировок, включая, например, 2'-МОЕ, и бициклических сахарных группировок, таких как связанный этил или LNA. В некоторых воплощениях "крылья" могут содержать несколько модифицированных и немодифицированных сахарных группировок. В некоторых воплощениях "крылья" могут содержать различные комбинации 2'-МОЕ-нуклеозидов, бициклических сахарных группировок, таких как связанный этил-нуклеозиды или LNA нуклеозиды и 2'-дезоксинуклеозиды.
Каждая отличающаяся область может содержать однотипные сахарные группировки, варианты или чередующиеся сахарные группировки. Мотив "крыло"-гэп-"крыло" часто описывают как "X-Y-Z", где "X" означает длину 5'-"крыла", "Y" означает длину гэпа, и "Z" означает длину 3'-"крыла". "X" и "Z" могут содержать однотипные, вариантные или чередующиеся сахарные группировки. В некоторых воплощениях "X" и "Y" могут содержать один или более 2'-дезоксинуклеозидов. "Y" может содержать 2'-дезоксинуклеозиды. В данном документе гэпмер, описанный как "X-Y-Z", имеет такую конфигурацию, что гэп расположен в позиции, непосредственно граничащей с каждым из 5'-"крыла" и 3'-"крыла". Таким образом, никаких промежуточных нуклеотидов нет между 5'-"крылом" и гэпом или гэпом и 3'-"крылом". Любые антисмысловые соединения, описанные в данном документе, могут иметь гэпмерный мотив. В некоторых воплощениях "X" и "Z" одинаковые; в других воплощениях они разные. В некоторых воплощениях "Y" состоит из 8 до 15 нуклеозидов. X, Y или Z могут состоять из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30 или более нуклеозидов.
В некоторых воплощениях антисмысловое соединение, направленно воздействующее на нуклеиновую кислоту рецептора андрогенов, имеет гэпмерный мотив, в котором гэп состоит из 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или 16 связанных нуклеозидов.
В некоторых воплощениях антисмысловой олигонуклеотид имеет сахарный мотив, описанный формулой A: (J)m-(B)n-(J)p-(B)r-(A)t-(D)g-(A)v-(B)w-(J)x-(B)y-(J)z,
где:
каждый А независимо представляет собой 2'-замещенный нуклеозид;
каждый В независимо представляет собой бициклический нуклеозид;
каждый J независимо представляет собой либо 2'-замещенный нуклеозид, либо 2'-дезоксинуклеозид;
каждый D представляет собой 2'-дезоксинуклеозид;
m равно 0-4; n равно 0-2; р равно 0-2; r равно 0-2; t равно 0-2; v равно 0-2;
w равно 0-4; х равно 0-2; y равно 0-2; z равно 0-4; g равно 6-14;
при условии, что
по меньшей мере один из m, n и r не равен 0;
по меньшей мере один из w и y не равен 0;
сумма m, n, р, r и t равна от 2 до 5; и
сумма v, w, х, y и z равна от 2 до 5.
РНКи соединения
В некоторых воплощениях антисмысловые соединения являются интерферирующими РНК соединениями (РНКи), которые включают двухцепочечные РНК соединения (также упоминаемые как короткие интерферирующие РНК или киРНК) и одноцепочечные РНКи соединения (или оцРНК). Такие соединения действуют, по меньшей мере частично, через RISC путь, расщепляя и/или секвестируя нуклеиновую кислоту-мишень (таким образом, включают микроРНК/микроРНК-имитирующие соединения). В некоторых воплощениях антисмысловые соединения содержат модификации, которые делают их особенно подходящими для таких механизмов.
1. оцРНК соединения
В некоторых воплощениях антисмысловые соединения, включая те, которые, в частности, подходят для использования в качестве одноцепочечных РНКи соединений (оцРНК), содержат модифицированную 5'-концевую область. В некоторых таких воплощениях 5'-концевая область содержит модифицированную фосфатную группировку. В некоторых воплощениях такой модифицированный фосфат является стабилизированным (например, устойчивым к разрушению/расщеплению по сравнению с немодифицированным 5'-фосфатом). В некоторых воплощениях такие 5'-концевые нуклеозиды стабилизируют 5'-фосфористую группировку. Некоторые модифицированные 5'-концевые нуклеозиды можно найти в данной области, например в WO/2011/139702.
В некоторых воплощениях 5'-нуклеозид оцРНК соединения имеет формулу Не:
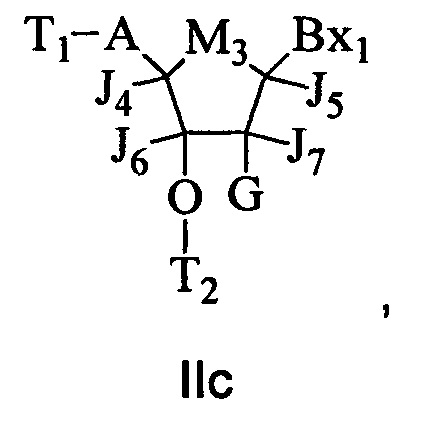
где:
T1 представляет собой возможно защищенную фосфорную группировку;
Т2 представляет собой группу межнуклеозидной связи, связывающую соединение формулы IIc с олигомерным соединением;
А имеет одну из формул:

каждый из Q1 и Q2 независимо представляет собой Н, галоген, С1-С6алкил, замещенный C1-С6алкил, С1-С6алкокси, замещенный C1-С6алкокси, С2-С6алкенил, замещенный С2-С6алкенил, С2-С6алкинил, замещенный C2-С6алкинил или N(R3)(R4);
Q3 представляет собой О, S, N(R5) или С(R6)(R7);
каждый R3, R4 R5, R6 и R7 независимо представляет собой Н, C1-С6алкил, замещенный C1-С6алкил или C1-С6алкокси;
М3 представляет собой О, S, NR14, C(R15)(R16), C(R15)(R16)C(R17)(R18), C(R15)=C(R17), OC(R15)(R16) или OC(R15)(Bx2);
R14 представляет собой Н, C1-С6алкил, замещенный C1-С6алкил, C1-С6алкокси, замещенный C1-С6алкокси, С2-С6алкенил, замещенный С2-С6алкенил, С2-С6алкинил или замещенный С2-С6алкинил;
каждый из R15, R16, R17 и R18 независимо представляет собой Н, галоген, C1-С6алкил, замещенный C1-С6алкил, C1-С6алкокси, замещенный C1-С6алкокси, С2-С6алкенил, замещенный С2-С6алкенил, С2-С6алкинил или замещенный С2-С6алкинил;
Bx1 представляет собой группировку гетероциклического основания;
или, если Вх2 присутствует, то Вх2 представляет собой группировку гетероциклического основания, а Bx1 представляет собой Н, галоген, C1-С6алкил, замещенный C1-С6алкил, C1-С6алкокси, замещенный C1-С6алкокси, С2-С6алкенил, замещенный С2-С6алкенил, С2-С6алкинил или замещенный С2-С6алкинил;
каждый из J4, J5, J6 и J7 каждый независимо представляет собой Н, галоген, C1-С6алкил, замещенный C1-С6алкил, C1-С6алкокси, замещенный C1-С6алкокси, С2-С6алкенил, замещенный С2-С6алкенил, С2-С6алкинил или замещенный С2-С6алкинил;
или J4 образует мостик с одним из J5 или J7, где указанный мостик содержит от 1 до 3 связанных бирадикальных групп, выбранных из О, S, NR19, C(R20)(R21), C(R20)=C(R21), C[=C(R20)(R21)] и С(=O), а другие два из J5, J6 и J7, каждый независимо, представляют собой Н, галоген, C1-С6алкил, замещенный C1-С6алкил, C1-С6алкокси, замещенный C1-С6алкокси, С2-С6алкенил, замещенный С2-С6алкенил, С2-С6алкинил или замещенный С2-С6алкинил;
каждый из R19, R20 и R21 независимо представляет собой Н, C1-С6алкил, замещенный C1-С6алкил, C1-С6алкокси, замещенный C1-С6алкокси, С2-С6алкенил, замещенный С2-С6алкенил, С2-С6алкинил или замещенный С2-С6алкинил;
G представляет собой Н, ОН, галоген или O-[C(R8)(R9)]n-[(C=O)m-X1]j-Z;
каждый из R8 и R9 независимо представляет собой Н, галоген, C1-С6алкил или замещенный C1-С6алкил;
X1 представляет собой О, S или N(E1);
Z представляет собой Н, галоген, C1-С6алкил, замещенный C1-С6алкил, С2-С6алкенил, замещенный C2-С6алкенил, C2-С6алкинил, замещенный С2-С6алкинил или N(Е2)(Е3);
каждый из E1, E2 и Е3 независимо представляет собой Н, C1-С6алкил или замещенный C1-С6алкил;
n означает число от 1 до примерно 6;
m означает 0 или 1;
j означает 0 или 1;
каждая замещенная группа содержит одну или более возможно защищенных групп-заместителей, независимо выбранных из галогена, OJ1, N(J1)(J2), =NJ1, SJ1, N3, CN, OC(=X2)J1, OC(=X2)N(J1)(J2) и C(=X2)N(J1)(J2);
X2 представляет собой О, S или NJ3;
каждый из J1, J2 и J3 независимо представляет собой Н или C1-С6алкил;
когда j равно 1, тогда Z является иным, чем галоген или N(Е2)(Е3); и
где указанное олигомерное соединение содержит от 8 до 40 мономерных субъединиц и гибридизируется с по меньшей мере участком нуклеиновой кислоты-мишени.
В некоторых воплощениях М3 представляет собой О, СН=СН, ОСН2 или ОС(Н)(Вх2). В некоторых воплощениях М3 представляет собой О.
В некоторых воплощениях каждый из J4, J5, J6 и J7 представляет собой Н. В некоторых воплощениях J4 образует мостик с одним из J5 или J7.
В некоторых воплощениях А имеет одну из формул:
где:
каждый из Q1 и Q2 независимо представляет собой Н, галоген, C1-С6алкил, замещенный C1-С6алкил, C1-С6алкокси или замещенный C1-С6алкокси. В некоторых воплощениях каждый из Q1 и Q2 представляет собой Н. В некоторых воплощениях каждый из Q1 и Q2 независимо представляет собой Н или галоген. В некоторых воплощениях один из Q1 и Q2 представляет собой Н, а другой из Q1 и Q2 представляет собой F, CH3 или OCH3.
В некоторых воплощениях T1 имеет формулу:

где:
каждый из Ra и Rc независимо представляет собой защищенный гидроксил, защищенный тиол, C1-С6алкил, замещенный C1-С6алкил, C1-С6алкокси, замещенный C1-С6алкокси, защищенную аминогруппу или замещенную аминогруппу; и
Rb представляет собой О или S. В некоторых воплощениях Rb представляет собой О, и каждый из Ra и Rc независимо представляет собой OCH3, OCH2CH3 или СН(CH3)2.
В некоторых воплощениях G представляет собой галоген, OCH3, OCH2F, OCHF2, OCF3, OCH2CH3, O(СН2)2F, OCH2CHF2, OCH2CF3, ОСН2-СН=СН2, O(СН2)2-OCH3, O(СН2)2-SCH3, O(СН2)2-OCF3, O(СН2)3-N(R10)(R11), O(СН2)2-ON(R10)(R11), O(СН2)2-O(СН2)2-N(R10)(R11), OCH2C(=O)-N(R10)(R11), ОСН2С(=O)-N(R12)-(СН2)2-N(R10)(R11) или O(СН2)2-N(R12)-C(=NR13)[N(R10)(R11)], где каждый из R10, R11, R12 и R13 независимо представляет собой Н или С1-С6алкил. В некоторых воплощениях G представляет собой галоген, OCH3, OCF3, OCH2CH3, OCH2CF3, ОСН2-СН=СН2, O(СН2)2-OCH3, O(СН2)2-O(СН2)2-N(CH3)2, ОСН2С(=O)-N(Н)CH3, ОСН2С(=O)-N(Н)-(СН2)2-N(CH3)2 или OCH2-N(H)-C(=NH)NH2. В некоторых воплощениях G представляет собой F, OCH3 или O(СН2)2-OCH3. В некоторых воплощениях G представляет собой O(СН2)2-OCH3.
В некоторых воплощениях 5'-концевой нуклеозид имеет формулу IIe:

В некоторых воплощениях антисмысловые соединения, включая те, которые, в частности, подходят для оцРНК, содержат модифицированные сахарные группировки одного или более чем одного типа и/или существующие в природе сахарные группировки, расположенные по олигонуклеотиду или его области в определенном паттерне или мотиве с модификацией сахара. Такие мотивы могут содержать любую из модификаций сахара, обсуждаемых в данном описании, и/или иные известные модификации сахара.
В некоторых воплощениях олигонуклеотиды содержат или состоят из области, имеющей однотипные модификации сахара. В некоторых таких воплощениях каждый нуклеозид области содержит одинаковую РНК-подобную модификацию сахара. В некоторых воплощениях каждый нуклеозид области представляет собой 2'-F-нуклеозид. В некоторых воплощениях каждый нуклеозид области представляет собой 2'-ОМе-нуклеозид. В некоторых воплощениях каждый нуклеозид области представляет собой 2'-МОЕ-нуклеозид. В некоторых воплощениях каждый нуклеозид области представляет собой cEt-нуклеозид. В некоторых воплощениях каждый нуклеозид области представляет собой LNA-нуклеозид. В некоторых воплощениях однотипная область составляет весь или по существу весь олигонуклеотид. В некоторых воплощениях область составляет весь олигонуклеотид, за исключением 1-4 концевых нуклеозидов.
В некоторых воплощениях олигонуклеотиды содержат одну или более областей чередующихся модификаций сахара, где нуклеозиды чередуются между нуклеотидами, имеющими модификацию сахара первого типа, и нуклеотидами, имеющими модификацию сахара второго типа. В некоторых воплощениях нуклеозиды обоих типов являются РНК-подобными нуклеозидами. В некоторых воплощениях чередующиеся нуклеозиды выбраны из 2'-ОМе, 2'-F, 2'-MOE, LNA и cEt. В некоторых воплощениях чередующиеся модификации представляют собой 2'-F и 2'-ОМе. Такие области могут быть смежными или могут прерываться иным образом модифицированными нуклеозидами или конъюгированными нуклеозидами.
В некоторых воплощениях каждая область чередования чередующихся модификаций состоит из единственного нуклеозида (т.е. паттерн представляет собой (АВ)xAy, где А представляет собой нуклеозид, имеющий модификацию сахара первого типа, а В представляет собой нуклеозид, имеющий модификацию сахара второго типа; х равно 1-20, и y равно 0 или 1). В некоторых воплощениях одна или более областей чередования в чередующемся мотиве содержит более, чем единственный нуклеозид некоторого типа. Например, олигонуклеотиды могут содержать одну или более областей любого из следующих мотивов нуклеозидов:
ААВВАА;
АВВАВВ;
ААВААВ;
АВВАВААВВ;
АВАВАА;
ААВАВАВ;
АВАВАА;
АВВААВВАВАВАА;
ВАВВААВВАВАВАА; или
АВАВВААВВАВАВАА;
где А представляет собой нуклеозид первого типа, а В представляет собой нуклеозид второго типа. В некоторых воплощениях каждый из А и В выбран из 2'-F, 2'-OMe, BNA и МОЕ.
В некоторых воплощениях олигонуклеотиды, имеющие такой чередующийся мотив, также содержат модифицированный 5'-концевой нуклеозид, такой как нуклеозиды формулы IIc или IIe.
В некоторых воплощениях олигонуклеотиды содержат область, имеющую мотив 2-2-3. Такие области содержат следующий мотив:
-(А)2-(В)х-(А)2-(С)y-(А)3-,
где А представляет собой модифицированный нуклеозид первого типа;
В и С являются нуклеозидами, которые модифицированы иначе, чем А, однако В и С могут иметь одинаковые модификации или модификации, отличающиеся друг от друга;
х и y означают число от 1 до 15.
В некоторых воплощениях А представляет собой 2'-ОМе-модифицированный нуклеозид. В некоторых воплощениях В и С оба представляют собой 2'-F-модифицированные нуклеозиды. В некоторых воплощениях А представляет собой 2'-ОМе-модифицированный нуклеозид, а В и С оба представляют собой 2'-F-модифицированные нуклеозиды.
В некоторых воплощениях олигонуклеозиды имеют следующий сахарный мотив:
5'-(Q)-(AB)xAy-(D)z,
где:
Q представляет собой нуклеозид, содержащий стабилизированную фосфатную группировку; в некоторых воплощениях Q представляет собой нуклеозид, имеющий формулу IIc или IIe;
А представляет собой модифицированный нуклеозид первого типа;
В представляет собой модифицированный нуклеозид второго типа;
D представляет собой модифицированный нуклеозид, содержащий модификацию, отличающуюся от нуклеозида, граничащего с ним; так, если у равно 0, то D должен быть модифицирован иначе, чем В, а если у равно 1, то D должен быть модифицирован иначе, чем А; в некоторых воплощениях D отличается как от А, так и от В;
Х равно 5-15;
Y равно 0 или 1;
Z равно 0-4.
В некоторых воплощениях олигонуклеозиды имеют следующий сахарный мотив:
5'-(Q)-(A)x-(D)z,
где:
Q представляет собой нуклеозид, содержащий стабилизированную фосфатную группировку; в некоторых воплощениях Q представляет собой нуклеозид, имеющий формулу IIc или IIe;
А представляет собой модифицированный нуклеозид первого типа;
D представляет собой модифицированный нуклеозид, содержащий модификацию, отличающуюся от А.
Х равно 11-30;
Z равно 0-4.
В некоторых воплощениях А, В, С и D в вышеуказанных мотивах выбраны из 2'-ОМе, 2'-F, 2'-MOE, LNA и cEt. В некоторых воплощениях D представляет собой концевые нуклеозиды. В некоторых воплощениях такие концевые нуклеозиды не предназначены для гибридизации с нуклеиновой кислотой-мишенью (хотя один или более могут гибридизироваться случайно). В некоторых воплощениях нуклеооснование каждого нуклеозида D представляет собой аденин, независимо от идентичности нуклеооснования в соответствующем положении нуклеиновой кислоты-мишени. В некоторых воплощениях нуклеооснование каждого нуклеозида D представляет собой тимин.
В некоторых воплощениях антисмысловые соединения, включая те, которые, в частности, пригодны для использования в качестве оцРНК, содержат модифицированные межнуклеозидные связи, расположенные по олигонуклеотиду или его области в определенном паттерне или мотиве модифицированных межнуклеозидных связей. В некоторых воплощениях олигонуклеотиды содержат область, имеющую мотив чередующихся межнуклеозидных связей. В некоторых воплощениях олигонуклеотиды содержат область однотипно модифицированных межнуклеозидных связей. В некоторых таких воплощениях олигонуклеотид содержит область, которая связана однотипными фосфоротиоатными межнуклеозидными связями. В некоторых воплощениях олигонуклеотид связан однотипными фосфоротиоатными межнуклеозидными связями. В некоторых воплощениях каждая межнуклеозидная связь олигонуклеотида выбрана из фосфодиэфирной связи и фосфоротиоатной связи. В некоторых воплощениях каждая межнуклеозидная связь олигонуклеотида выбрана из фосфодиэфирной связи и фосфоротиоатной связи, и по меньшей мере одна межнуклеозидная связь является фосфоротиоатной.
В некоторых воплощениях олигонуклеотид содержит по меньшей мере 6 фосфоротиоатных межнуклеозидных связей. В некоторых воплощениях олигонуклеотид содержит по меньшей мере 8 фосфоротиоатных межнуклеозидных связей. В некоторых воплощениях олигонуклеотид содержит по меньшей мере 10 фосфоротиоатных межнуклеозидных связей. В некоторых воплощениях олигонуклеотид содержит по меньшей мере один блок из по меньшей мере 6 последовательных фосфоротиоатных межнуклеозидных связей. В некоторых воплощениях олигонуклеотид содержит по меньшей мере один блок из по меньшей мере 8 последовательных фосфоротиоатных межнуклеозидных связей. В некоторых воплощениях олигонуклеотид содержит по меньшей мере один блок из по меньшей мере 10 последовательных фосфоротиоатных межнуклеозидных связей. В некоторых воплощениях олигонуклеотид содержит по меньшей мере один блок из по меньшей мере 12 последовательных фосфоротиоатных межнуклеозидных связей. В некоторых таких воплощениях по меньшей мере один такой блок расположен на 3'-конце олигонуклеотида. В некоторых таких воплощениях по меньшей мере один такой блок расположен в пределах 3 нуклеозидов 3'-конца олигонуклеотида.
Олигонуклеотиды, имеющие любой из различных сахарных мотивов, описанных в данном документе, может иметь любой мотив связей. Например, олигонуклеотиды, включая, без ограничения, те, которые описаны выше, могут иметь мотив связей, выбранный из приведенной ниже таблицы, не являющейся ограничивающей:
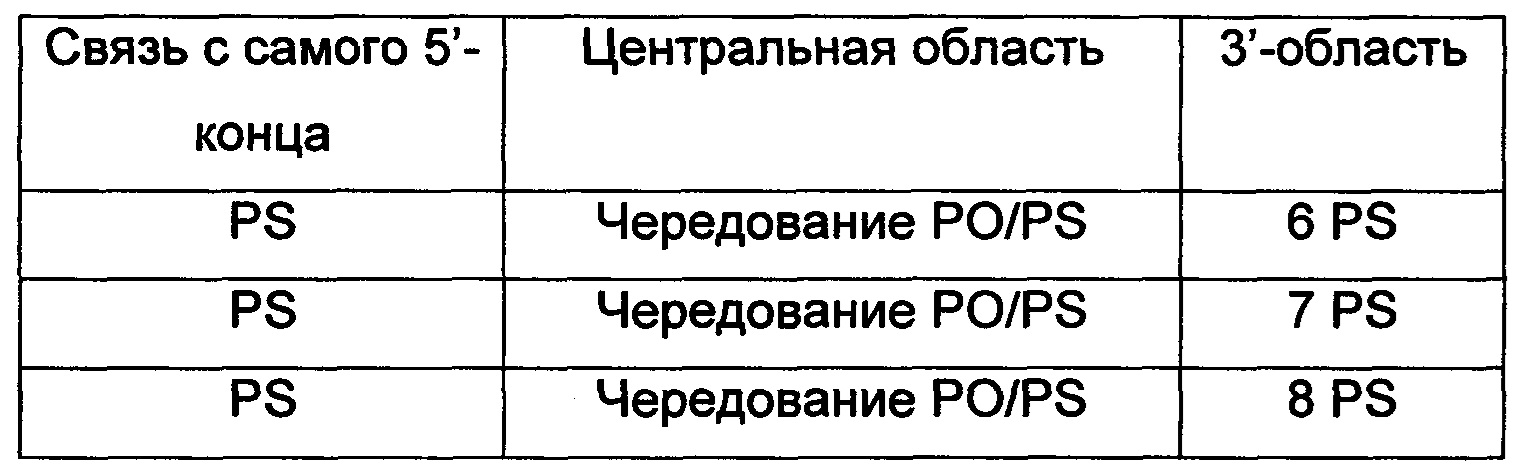
2. киРНК соединения
В некоторых воплощениях антисмысловые соединения являются двухцепочечными РНКи соединениями (киРНК). В таких воплощениях одна или обе цепи могут содержать любой мотив модификаций, описанный выше для оцРНК. В некоторых воплощениях оцРНК соединения могут представлять собой немодифицированную РНК. В некоторых воплощениях киРНК соединения могут содержать немодифицированные РНК нуклеозиды, но модифицированные межнуклеозидные связи.
Несколько воплощений относятся к двухцепочечным соединениям, где каждая цепь содержит мотив, определенный местоположением одного или более модифицированных или немодифицированных нуклеозидов. В некоторых воплощениях предложены соединения, содержащие первое и второе олигомерные соединения, которые полностью или по меньшей мере частично гибридизированы с образованием дуплексной области, и дополнительно содержащие область, которая является комплементарной нуклеиновой кислоте-мишени и гибридизируется с ней. Удобно, что такое соединение содержит первое олигомерное соединение, которое представляет собой антисмысловую цепь, имеющую полную или частичную комплементарность нуклеиновой кислоте-мишени, и второе олигомерное соединение, которое является смысловой цепью, имеющей одну или более областей комплементарности и образующей по меньшей мере одну дуплексную область с первым олигомерным соединением.
Соединения нескольких воплощений модулируют экспрессию генов посредством гибридизации с нуклеиновой кислотой-мишенью, лишая ее нормальной функции. В некоторых воплощениях нуклеиновая кислота-мишень является рецептором андрогенов. В некоторых воплощениях расщеплению являющегося мишенью рецептора андрогенов способствует активированный RISC комплекс, который образуется со структурами по изобретению.
Несколько воплощений относятся к двухцепочечным соединениям, где одна из цепей полезна, например, тем, что она влияет на преимущественный ввод противоположной цепи в RISC (или расщепление) комплекс. Соединения полезны для направленного воздействия на выбранные молекулы нуклеиновых кислот и модулирования экспрессии одного или более генов. В некоторых воплощениях соединения по настоящему изобретению гибридизируются с участком РНК-мишени, приводя к потере нормальной функции РНК-мишени.
Некоторые воплощения относятся к двухцепочечным соединениям, где обе цепи содержат гемимерный мотив, полностью модифицированный мотив, позиционно модифицированный мотив или мотив чередований. Каждая цепь соединений по настоящему изобретению может быть модифицирована с целью выполнения конкретной роли, например, в киРНК пути. Использование разного мотива в каждой цепи или одинакового мотива с разными химическими модификациями в каждой цепи дает возможность направленно воздействовать на антисмысловую цепь для RISC комплекса, одновременно ингибируя включение смысловой цепи. В этой модели каждая цепь может быть независимо модифицирована так, чтобы усилить ее конкретную роль. Антисмысловая цепь может быть модифицирована по 5'-концу для усиления ее роли в одной области RISC, а 3'-конец может быть модифицирован дифференцированно для усиления ее роли в другой области RISC.
Молекулы двухцепочечного олигонуклеотида могут представлять собой молекулу двухцепочечного полинуклеотида, содержащую самокомплементарные смысловую и антисмысловую области, где антисмысловая область содержит нуклеотидную последовательность, которая комплементарна нуклеотидной последовательности в молекуле нуклеиновой кислоты-мишени или ее участку, а смысловая область имеет нуклеотидную последовательность, соответствующую последовательности нуклеиновой кислоты-мишени или ее участку. Двухцепочечные молекулы олигонуклеотидов могут быть собраны из двух отдельных олигонуклеотидов, где одна цепь является смысловой цепью, а другая является антисмысловой цепью, где антисмысловая и смысловая цепи являются самокомплементарными (т.е. каждая цепь содержит нуклеотидную последовательность, которая комплементарна нуклеотидной последовательности в другой цепи; например где антисмысловая цепь и смысловая цепь образуют дуплекс или двухцепочечную структуру, например где двухцепочечная область представляет собой от примерно 15 до примерно 30, например примерно 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 пар оснований;
антисмысловая цепь содержит нуклеотидную последовательность, которая комплементарна нуклеотидной последовательности в молекуле нуклеиновой кислоты-мишени или ее участку, а смысловая цепь содержит нуклеотидную последовательность, соответствующую последовательности нуклеиновой кислоты-мишени или ее участку (например, от примерно 15 до примерно 25 или более нуклеотидов молекулы двухцепочечного олигонуклеотида комплементарны нуклеиновой кислоте-мишени или ее участку). Альтернативно, двухцепочечный олигонуклеотид собран из единственного олигонуклеотида, где самокомплементарные смысловая и антисмысловая области киРНК связаны посредством линкера(ов) на основе нуклеиновых кислот или не на основе нуклеиновых кислот.
Двухцепочечный олигонуклеотид может представлять собой полинуклеотид с дуплексом, асимметрическим дуплексом, шпилечной или асимметрической шпилечной вторичной структурой, имеющий самокомплементарные смысловую и антисмысловую области, где антисмысловая область содержит нуклеотидную последовательность, которая комплементарна нуклеотидной последовательности в отдельной молекуле нуклеиновой кислоты-мишени или ее участку, а смысловая область имеет нуклеотидную последовательность, соответствующую последовательности нуклеиновой кислоты-мишени или ее участку. Двухцепочечный олигонуклеотид может представлять собой кольцевой одноцепочечный полинуклеотид, имеющий две или более петлевых структур и "стебель", содержащий самокомплементарные смысловую и антисмысловую области, где антисмысловая область содержит нуклеотидную последовательность, которая комплементарна нуклеотидной последовательности в молекуле нуклеиновой кислоты-мишени или ее участку, а смысловая область имеет нуклеотидную последовательность, соответствующую последовательности нуклеиновой кислоты-мишени или ее участку, и где кольцевой полинуклеотид может быть подвергнут процессингу in vivo или in vitro для создания активной молекулы киРНК, способной опосредовать РНКи.
В некоторых воплощениях двухцепочечный олигонуклеотид содержит отдельные смысловую и антисмысловую последовательности или области, где смысловая и антисмысловая области ковалентно связаны молекулами нуклеотидных или ненуклеотидных линкеров, как известно в данной области, или поочередно нековалентно связаны ионными взаимодействиями, водородной связью, ванн-дер-ваальсовыми взаимодействиями, гидрофобными взаимодействиями и/или стэкинг-взаимодействиями. В некоторых воплощениях двухцепочечный олигонуклеотид содержит нуклеотидную последовательность, которая комплементарна нуклеотидной последовательности гена-мишени. В другом воплощении двухцепочечный олигонуклеотид взаимодействует с нуклеотидной последовательностью гена-мишени способом, который вызывает ингибирование экспрессии гена-мишени.
В данном документе термин "двухцепочечные олигонуклеотиды" не ограничен молекулами, содержащими только РНК, а охватывает также химически модифицированные нуклеотиды и ненуклеотиды. В некоторых воплощениях в молекулах коротких интерферирующих нуклеиновых кислот отсутствуют 2'-гидрокси (2'-ОН)-содержащие нуклеотиды. В некоторых воплощениях короткие интерферирующие нуклеиновые кислоты возможно не содержат какие-либо рибонуклеотиды (например, нуклеотиды, имеющие группу 2'-ОН). Такие двухцепочечные олигонуклеотиды, которые не требуют присутствия рибонуклеотидов в молекуле для поддержания РНКи, могут, однако, иметь присоединенный линкер или линкеры или другие присоединенные или ассоциированные группы, группировки или цепи, содержащие один или более нуклеотидов с группами 2'-ОН. Возможно, двухцепочечные олигонуклеотиды могут содержать рибонуклеотиды примерно в 5, 10, 20, 30, 40 или 50% положений нуклеотидов. Подразумевается, что используемый в данном документе термин "киРНК" является эквивалентным другим терминам, использованным для описания молекул нуклеиновых кислот, которые способны опосредовать последовательность-специфическую РНКи, например короткая интерферирующая РНК (киРНК), двухцепочечная РНК (дцРНК), микро-РНК (миРНК), короткая шпилечная РНК (кшРНК), короткий интерферирующий олигонуклеотид, короткая интерферирующая нуклеиновая кислота, короткий интерферирующий модифицированный олигонуклеотид, химически модифицированная киРНК, РНК посттранскрипционного сайлесинга гена (птсгРНК) и другие. Кроме того, используемый в данном документе термин "РНКи" является эквивалентным другим терминам, используемым для описания последовательность-специфической РНК-интерференции, таким как посттранскрипционный сайлесинг генов, трансляционное ингибирование или эпигенетика. Например, двухцепочечные олигонуклеотиды могут быть использованы для эпигенетического сайлесинга гена как на посттранскрипционном уровне, так и на предтранскрипционном уровне. В качестве не ограничивающего примера, эпигенетическая регуляция экспрессии генов молекулами киРНК по изобретению может происходить в результате киРНК-опосредованной модификации структуры хроматина или паттерна метилирования для изменения экспрессии генов (смотри, например, Verdel et al., 2004, Science, 303, 672-676; Pal-Bhadra et al., 2004, Science, 303, 669-672; Allshire, 2002, Science, 297, 1818-1819; Voipe et al., 2002, Science, 297, 1833-1837; Jenuwein, 2002, Science, 297, 2215-2218; и Hall et al., 2002, Science, 297, 2232-2237).
Предполагается, что соединения и композиции нескольких воплощений предложенных в данном документе, могут направленно воздействовать на рецептор андрогенов посредством дцРНК-опосредованного сайлесинга гена или РНКи-механизма, включая, например, двухцепочечные РНК эффекторные молекулы типа "шпилька" или "петля-на-стебле", в которых одиночная РНК цепь с самокомплементарными последовательностями способна принимать двухцепочечную конформацию, или дуплексные дцРНК эффекторные молекулы, содержащие две отдельные цепи РНК. В различных воплощениях дцРНК состоит полностью из рибонуклеотидов или состоит из смеси рибонуклеотидов и дезоксинуклеотидов, такой как гибриды РНК/ДНК, раскрытые, например, в WO 00/63364, поданной 19 апреля 2000 года, или в заявке на патент США серийный №60/130,377, поданной 21 апреля 1999 года. дцРНК или дцРНК эффекторная молекула может представлять собой одиночную молекулу с областью самокомплементарности, чтобы нуклеотиды в одном сегменте молекулы спаривались с нуклеотидами в другом сегменте молекулы. В различных воплощениях дцРНК, которая состоит из одной молекулы, состоит полностью из рибонуклеотидов или содержит область рибонуклеотидов, которая является комплементарной области дезоксирибонуклеотидов. Альтернативно, дцРНК может содержать две разные цепи, которые имеют область комплементарности друг другу.
В различных воплощениях обе цепи состоят полностью из рибонуклеотидов, одна цепь состоит полностью из рибонуклеотидов, и одна цепь состоит полностью из дезоксирибонуклеотидов, или одна или обе цепи содержат смесь рибонуклеотидов и дезоксирибонуклеотидов. В некоторых воплощениях области комплементарности по меньшей мере на 70, 80, 90, 95, 98 или на 100% комплементарны друг другу и последовательности нуклеиновой кислоты-мишени. В некоторых воплощениях область дцРНК, которая присутствует в двухцепочечной конформации, содержит по меньшей мере 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 50, 75,100, 200, 500, 1000, 2000 или 5000 нуклеотидов или содержит все нуклеотиды кДНК или другой последовательности нуклеиновой кислоты-мишени, которые представлены в дцРНК. В некоторых воплощениях дцРНК не содержит никаких одноцепочечных областей, таких как одноцепочечные концы, или дцРНК представляет собой "шпильку". В других воплощениях дцРНК имеет одну или более одноцепочечных областей или "тупых" концов. В некоторых воплощениях гибриды РНК/ДНК содержат цепь или область ДНК, которая является антисмысловой цепью или областью (например имеет по меньшей мере 70, 80, 90, 95, 98 или 100%-ную комплементарность нуклеиновой кислоте-мишени), и цепь или область РНК, которая является смысловой цепью или областью (например имеет по меньшей мере 70, 80, 90, 95, 98 или 100%-ную идентичность нуклеиновой кислоте-мишени), и наоборот.
В различных воплощениях гибрид РНК/ДНК получен in vitro с использованием ферментативных или химических методов синтеза, таких как методы, описанные в данном документе, или методы, описанные в WO 00/63364, поданной 19 апреля 2000 года, или в заявке на патент США серийный №60/130,377, поданной 21 апреля 1999 года. В других воплощениях цепь ДНК, синтезированная in vitro, получена в виде комплекса с цепью РНК, полученной in vivo или in vitro до, после или параллельно с трансформацией цепи ДНК в клетку. В еще одном другом воплощении дцРНК представляет собой однокольцевую нуклеиновую кислоту, содержащую смысловую и антисмысловую область, или дцРНК содержит кольцевую нуклеиновую кислоту и вторую либо кольцевую нуклеиновую кислоту, либо линейную нуклеиновую кислоту (смотри, например, WO 00/63364, поданную 19 апреля 2000 года, или заявку на патент США серийный №60/130,377, поданную 21 апреля 1999 года). Примерами кольцевых нуклеиновых кислот являются структуры типа "лассо", в которых свободная 5'-фосфорильная группа нуклеотида становится связанной с 2'-гидроксильной группой другого нуклеотида по типу обратной петли.
В других воплощениях дцРНК содержит один или более модифицированных нуклеотидов, в которых положение 2' в сахаре содержит галоген (например фтор-группу) или содержит алкоксигруппу (например метоксигруппу), которая увеличивает период полужизни дцРНК in vitro или in vivo по сравнению с соответствующей дцРНК, в которой соответствующее положение 2' содержит водород или гидроксильную группу. В еще одном другом воплощении дцРНК содержит одну или более связей между соседними нуклеотидами, иных, чем встречающаяся в природе фосфодиэфирная связь. Примеры таких связей включают фосфорамидные, фосфоротиоатные и фосфородитиоатные связи. дцРНК могут также представлять собой молекулы химически модифицированной нуклеиновой кислоты, как указано в патенте США №6673661. В других воплощениях дцРНК содержит одну или две копированные цепи, как раскрыто, например, в WO 00/63364, поданной 19 апреля 2000 года, или в заявке на патент США №60/130,377, поданной 21 апреля 1999 года.
В других воплощениях дцРНК может представлять собой любую из по меньшей мере частично раскрытых в WO 00/63364 дцРНК молекул, а также любую из дцРНК молекул, описанных в предварительной заявке США 60/399,998, в предварительной заявке США 60/419,532 и в заявке PCT/US2003/033466, каждая из которых включена в данное описание посредством ссылки. Любая дцРНК может быть экспрессирована in vitro или in vivo с использованием методов, описанных в данном документе, или стандартных методов, таких как те, которые описаны в WO 00/63364.
Занятость
В некоторых воплощениях не предполагается, что антисмысловые соединения приводят к расщеплению нуклеиновой кислоты-мишени РНазой Н или приводят к расщеплению или секвестрации через RISC путь. В некоторых таких воплощениях антисмысловая активность может быть результатом занятости, где присутствие гибридизированного антисмыслового соединения нарушает активность нуклеиновой кислоты-мишени. В некоторых таких воплощениях антисмысловое соединение может быть однотипно модифицированным или может содержать смесь модификаций и/или модифицированные и немодифицированные нуклеозиды.
Нуклеиновые кислоты-мишени, области-мишени и нуклеотидные последовательности
Нуклеотидные последовательности, которые кодируют рецептор андрогенов человека, включают, без ограничения, следующие: GENBANK, номер доступа NT_011669.17_TRUNC_5079000_5270000 (включена в данный документ как SEQ ID NO: 1), GENBANK, номер доступа НМ_000044.3 (включена в данный документ как SEQ ID NO: 2), GENBANK, номер доступа НМ_001011645.2 (включена в данный документ как SEQ ID NO: 3), GENBANK, номер доступа FJ235916.1 (включена в данный документ как SEQ ID NO: 4), GENBANK, номер доступа FJ235917.1 (включена в данный документ как SEQ ID NO: 5), GENBANK, номер доступа FJ235918.1 (включена в данный документ как SEQ ID NO: 6), GENBANK, номер доступа FJ235919.1 (включена в данный документ как SEQ ID NO: 7) и GENBANK, номер доступа FJ235920.1 (включена данный документ как SEQ ID NO: 8).
мРНК рецептора андрогенов кодирует несколько функциональных доменов. В некоторых воплощениях мРНК полноразмерного рецептора андрогенов содержит экзон 1, кодирующий N-концевой домен, экзоны 2 и 3, кодирующие ДНК-связывающий домен, экзон 4, кодирующий короткую шарнирную область, и экзоны 4-8, кодирующие лиганд-связывающий домен.
В некоторых воплощениях варианты сплайсинга рецептора андрогенов, на которые способны направленно воздействовать антисмысловые соединения, предложенные в данном документе, содержат экзон 1, кодирующий N-концевой домен, и экзоны 2 и 3, кодирующие ДНК-связывающий домен или его функциональные участки, но не содержат по меньшей мере участок экзона 4, кодирующего короткую шарнирную область, или по меньшей мере участок экзонов 4-8, кодирующих лиганд-связывающий домен. Примеры таких вариантов сплайсинга AR включают, без ограничения, AR-V1, AR-V2, AR-V3, AR-V4, AR-V5, AR-V6 и AR-W (также именуемый AR3), которые содержат экзоны 1-3, но не имеют экзонов 4-8. AR-V1, AR-V2, AR-V3, AR-V4, AR-V5, AR-V6, AR-V7 и дополнительные варианты сплайсинга, являющиеся мишенью антисмысловых соединений, предложенных в данном документе, описаны в Ни et al., Cancer Res 2009; 69: 16-22, и в публикации заявки на патент США №US 2010/0068802, полное содержание которых включено в данное описание посредством ссылки. Дополнительные примеры таких вариантов сплайсинга AR, являющихся мишенью антисмысловых соединений, предложенных в данном документе, включают, без ограничения, AR3, AR4, AR4b, AR5 и AR6 (SEQ ID NO: 4-8 соответственно), как описано в Guo et al., Cancer Res. 2009; 69: 2305-13, полное содержание которого включено в данное описание посредством ссылки.
Гибридизация
В некоторых воплощениях гибридизация происходит между антисмысловым соединением, раскрытым в данном документе, и рецептором андрогенов. Самый распространенный механизм гибридизации включает в себя связывание посредством водородной связи (например, связывание посредством водородной связи по Уотсону-Крику, по Хугстину или с образованием обратных хугстиновских пар оснований) между комплементарными нуклеооснованиями молекул нуклеиновых кислот.
Гибридизация может происходить в различных условиях. Жесткие условия зависят от последовательностей и определяются природой и составом молекул нуклеиновых кислот, которые подвергаются гибридизации.
Методы определения, является ли последовательность специфически гибиридизируемой с нуклеиновой кислотой-мишенью, известны в данной области. В некоторых воплощениях антисмысловые соединения, предложенные в данном документе, способны специфически гибиридизироваться с рецептором андрогенов.
Комплементарность
Антисмысловое соединение и нуклеиновая кислота-мишень комплементарны друг другу, когда достаточное количество нуклеооснований антисмыслового соединения может связываться посредством водородной связи с соответствующими нуклеооснованиями нуклеиновой кислоты-мишени, чтобы имел место желаемый эффект (например антисмысловое ингибирование нуклеиновой кислоты-мишени, такой как нуклеиновая кислота рецептора андрогенов).
Некомплементарные нуклеооснования между антисмысловым соединением и нуклеиновой кислотой рецептора андрогенов допускаются при условии, что антисмысловое соединение остается способным специфически гибридизироваться с нуклеиновой кислотой-мишенью. Более того, антисмысловое соединение может гибридизироваться по одному или более сегментам нуклеиновой кислоты рецептора андрогенов, чтобы промежуточные или непосредственно граничащие сегменты не вовлекались в событие гибридизации (например, петлевая структура, ошибочное спаривание оснований или шпилечная структура).
В некоторых воплощениях антисмысловые соединения, предложенные в данном документе, или их конкретно указанный участок, являются или являются по меньшей мере на 70%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% комплементарными нуклеиновой кислоте рецептора андрогенов, области-мишени, сегменту-мишени или конкретно указанному их участку. Процент комплементарности антисмыслового соединения с нуклеиновой кислотой-мишенью может быть определен рутинными методами.
Например, антисмысловое соединение, в котором 18 из 20 нуклеооснований антисмыслового соединения комплементарны области-мишени и, следовательно, могут специфически гибридизироваться, будет иметь 90-процентную комплементарность. В этом примере остальные некомплементарные нуклеооснования могут быть сгруппированы или рассредоточены с комплементарными нуклеооснованиями и необязательно будут смежными друг с другом или с комплементарными нуклеооснованиями. Как таковое, антисмысловое соединение длиной 18 нуклеооснований, имеющее четыре некомплементарных нуклеооснования, которые фланкированы двумя областями полной комплементарности нуклеиновой кислоте-мишени, будет иметь 77,8%-ную общую комплементарность нуклеиновой кислоте-мишени и поэтому входит в объем настоящего изобретения. Процент комплементарности антисмыслового соединения области нуклеиновой кислоты-мишени может быть определен рутинно с использованием программных продуктов BLAST (средства поиска основного локального выравнивания) и программного пакета PowerBLAST, известного в данной области (Altschul et al., J. Mol. Biol., 1990, 215, 403 410; Zhang and Madden, Genome Res., 1997, 7, 649 656). Процент гомологии, идентичность или комплементарность последовательностей могут быть определены, например, с помощью программы Gap (Wisconsin Sequence Analysis Package, Version 8 for Unix, Genetics Computer Group, University Research Park, Madison Wis.), используя установки по умолчанию, в которых используется алгоритм Смита (Smith) и Уотермана (Waterman) (Adv. Appl. Math., 1981, 2, 482489).
В некоторых воплощениях антисмысловые соединения, предложенные в данном документе, или их конкретные участки, полностью комплементарны (т.е. на 100% комплементарны) нуклеиновой кислоте-мишени или ее конкретному участку. Например, антисмысловое соединение может быть полностью комплементарным нуклеиновой кислоте рецептора андрогенов или ее области-мишени, или сегменту-мишени, или последовательности-мишени. В данном документе "полностью комплементарный" означает, что каждое нуклеооснование антисмыслового соединения способно к точному спариванию с соответствующими нуклеооснованиями нуклеиновой кислоты-мишени. Например, антисмысловое соединение из 20 нуклеооснований полностью комплементарно последовательности-мишени длиной в 400 нуклеооснований, поскольку имеется соответствующий участок нуклеиновой кислоты-мишени из 20 нуклеооснований, который является полностью комплементарным антисмысловому соединению. Термин "полностью комплементарный" может быть также использован при упоминании конкретного участка первой и/или второй нуклеиновой кислоты. Например, участок из 20 нуклеооснований антисмыслового соединения, состоящего из 30 нуклеооснований, может быть "полностью комплементарным" последовательности-мишени, длина которой составляет 400 нуклеооснований. Участок из 20 нуклеооснований олигонуклеотида, состоящего из 30 нуклеооснований, может быть полностью комплементарным последовательности-мишени, если последовательность-мишень имеет соответствующий участок из 20 нуклеооснований, где каждое нуклеооснование комплементарно участку из 20 нуклеооснований антисмыслового соединения. В то же время, полное антисмысловое соединение из 30 нуклеооснований может быть или не быть полностью комплементарным последовательности-мишени в зависимости от того, комплементарны ли также остальные 10 нуклеотидных оснований антисмыслового соединения последовательности-мишени.
Местоположением некомплементарного нуклеооснования может быть 5'-конец или 3'-конец антисмыслового соединения. Альтернативно, некомплементарное(ые) нуклеооснование или нуклеооснования могут находиться во внутреннем положении антисмыслового соединения. Когда присутствуют два или более некомплементарных нуклеооснований, тогда они могут быть смежными (т.е. связанными) или несмежными. В одном воплощении некомплементарное нуклеооснование расположено в сегменте-"крыле" гэпмерного антисмыслового олигонуклеотида.
В некоторых воплощениях антисмысловые соединения длиной вплоть до 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 нуклеооснований содержат не более 4, не более 3, не более 2 или не более 1 некомплементарного(ых) нуклеооснования(й) по отношению к нуклеиновой кислоте-мишени, такой как нуклеиновая кислота рецептора андрогенов, или ее конкретно указанного участка.
В некоторых воплощениях антисмысловые соединения длиной вплоть до 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 нуклеооснований, содержат не более 6, не более 5, не более 4, не более 3, не более 2 или не более 1 некомплементарного(ых) нуклеооснования(й) по отношению к нуклеиновой кислоте-мишени, такой как нуклеиновая кислота рецептора андрогенов, или ее конкретно указанному участку.
Предложенные антисмысловые соединения также включают те антисмысловые соединения, которые комплементарны участку нуклеиновой кислоты-мишени. В данном документе "участок" относится к определенному количеству смежных (т.е. связанных) нуклеооснований в области или сегменте нуклеиновой кислоты-мишени. "Участок" может также относиться к определенному количеству смежных нуклеооснований антисмыслового соединения. В некоторых воплощениях антисмысловые соединения комплементарны участку сегмента-мишени по меньшей мере из 8 нуклеооснований. В некоторых воплощениях антисмысловые соединения комплементарны участку сегмента-мишени по меньшей мере из 9 нуклеооснований. В некоторых воплощениях антисмысловые соединения комплементарны участку сегмента-мишени по меньшей мере из 10 нуклеооснований. В некоторых воплощениях антисмысловые соединения комплементарны участку сегмента-мишени по меньшей мере из 11 нуклеооснований. В некоторых воплощениях антисмысловые соединения комплементарны участку сегмента-мишени по меньшей мере из 12 нуклеооснований. В некоторых воплощениях антисмысловые соединения комплементарны участку сегмента-мишени по меньшей мере из 13 нуклеооснований. В некоторых воплощениях антисмысловые соединения комплементарны участку сегмента-мишени по меньшей мере из 14 нуклеооснований. В некоторых воплощениях антисмысловые соединения комплементарны участку сегмента-мишени по меньшей мере из 15 нуклеооснований. Предусмотрены также антисмысловые соединения, которые комплементарны участку сегмента-мишени по меньшей мере из 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более нуклеооснований или в диапазоне любых двух из этих значений.
Идентичность
Антисмысловые соединения, предложенные в данном документе, могут также иметь определенный процент идентичности с конкретной нуклеотидной последовательностью, SEQ ID NO, или с соединением, обозначенным конкретным ISIS номером, или ее(его) участком. В данном документе антисмысловое соединение является идентичным последовательности, раскрытой в данном документе, если оно имеет такую же способность к спариванию нуклеооснований. Например, РНК, которая содержит урацил вместо тимидина в раскрытой последовательности ДНК, будет считаться идентичной последовательности ДНК, поскольку оба урацил и тимидин спариваются с аденином. Укороченные и удлиненные версии антисмысловых соединений, описанных в данном документе, а также соединения, имеющие неидентичные основания относительно антисмысловых соединений, предложенных в данном документе, также предусмотрены. Неидентичные основания могут быть граничащими друг с другом или могут быть рассредоточены по антисмысловому соединению. Процент идентичности антисмыслового соединения вычисляют по количеству оснований, которые имеют идентичное спаривание оснований относительно последовательности, с которой его сравнивают.
В некоторых воплощениях антисмысловые соединения или их участки по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичны одному или более антисмысловым соединениям или SEQ ID NO или их участкам, раскрытым в данном документе.
В некоторых воплощениях участок антисмыслового соединения сравнивают с участком равной длины нуклеиновой кислоты-мишени. В некоторых воплощениях участок из 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 нуклеооснований сравнивают с участком равной длины нуклеиновой кислоты-мишени.
В некоторых воплощениях участок антисмыслового олигонуклеотида сравнивают с участком равной длины нуклеиновой кислоты-мишени. В некоторых воплощениях участок из 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 нуклеооснований сравнивают с участком равной длины нуклеиновой кислоты-мишени.
Модификации
Нуклеозид представляет собой комбинацию основание-сахар. Нуклеооснование (также известное как основание) как участок нуклеозида в норме представляет собой группировку гетероциклического основания. Нуклеотиды являются нуклеозидами, которые дополнительно содержат фосфатную группу, ковалентно связанную с сахарным участком нуклеозида. Для тех нуклеозидов, которые содержат пентофуранозильный сахар, фосфатная группа может быть связана с 2'-, 3'- или 5'-гидроксильной группой сахара. Олигонуклеотиды образуются посредством ковалентной связи граничащих друг с другом нуклеозидов с образованием линейного полимерного олигонуклеотида. В структуре олигонуклеотида фосфатные группы обычно называют образующими межнуклеозидные связи олигонуклеотида.
Модификации антисмысловых соединений охватывают замещения или замены межнуклеозидных связей, сахарных группировок или нуклеооснований. Модифицированные антисмысловые соединения часто являются предпочтительными по сравнению с нативными формами благодаря желаемым свойствам, таким как, например, усиленный клеточный захват, повышенная аффинность к нуклеиновой кислоте-мишени, повышенная устойчивость в присутствии нуклеаз или повышенная ингибирующая активность.
Химически модифицированные нуклеозиды можно также использовать для увеличения аффинности связывания укороченного или усеченного антисмыслового олигонуклеотида с являющейся его мишенью нуклеиновой кислотой. Следовательно, сравнимые результаты часто могут достигаться с более короткими антисмысловыми соединениями, которые имеют такие химически модифицированные нуклеозиды.
Модифицированные межнуклеозидные связи
Встречающейся в природе межнуклеозидной связью РНК и ДНК является 3'-5' фосфодиэфирная связь. Антисмысловые соединения, имеющие одну или более модифицированных, т.е. не встречающихся в природе, межнуклеозидных связей, чаще выбирают по сравнению с антисмысловыми соединениями, имеющими встречающиеся в природе межнуклеозидные связи, благодаря желаемым свойствам, таким как, например, усиленный клеточный захват, повышенная аффинность к нуклеиновой кислоте-мишени, повышенная устойчивость в присутствии нуклеаз.
Олигонуклеотиды, имеющие модифицированные межнуклеозидные связи, содержат межнуклеозидные связи, которые сохраняют атом фосфора, а также межнуклеозидные связи, которые не имеют атома фосфора. Репрезентативные фосфорсодержащие межнуклеозидные связи включают, без ограничения, фосфодиэфиры, фосфотриэфиры, метилфосфонаты, фосфорамидаты и фосфоротиоаты. Способы получения фосфорсодержащих и не содержащих фосфор связей общеизвестны.
В некоторых воплощениях антисмысловые соединения, направленно воздействующие на нуклеиновую кислоту рецептора андрогенов, содержат одну или более модифицированных межнуклеозидных связей. В некоторых воплощениях модифицированные межнуклеозидные связи являются фосфоротиоатными связями. В некоторых воплощениях каждая межнуклеозидная связь антисмыслового соединения представляет собой фосфоротиоатную межнуклеозидную связь.
Модифицированные сахарные группировки
Антисмысловые соединения возможно могут содержать один или более нуклеозидов с модифицированной сахарной группой. Такие нуклеозиды с модифицированным сахаром могут наделять антисмысловое соединение повышенной устойчивостью к нуклеазам, повышенной аффинностью связывния или каким-либо другим полезным биологическим свойством. В некоторых воплощениях нуклеозиды содержат химически модифицированные рибофуранозные кольцевые группировки. Примеры химических модификаций рибофуранозных колец включают, без ограничения, присоединение групп-заместителей (включая 5'- и 2'-заместители, образующие мостик негеминальных кольцевых атомов с образованием бициклических нуклеиновых кислот (BNA), замена рибозильного кольцевого атома кислорода атомом S, N(R) или C(R1)(R2) (каждый из R, R1 и R2 независимо представляет собой Н, C1-С12алкил или защитную группу) и их комбинации. Примеры химически модифицированных Сахаров включают 2'-F-5'-метил-замещенный нуклеозид (смотри РСТ Международную заявку WO 2008/101157, опубликованную 8/21/08, в отношении других раскрытых 5',2'-бис-замещенных нуклеозидов), или замену атома кислорода рибозильного кольца атомом S с дополнительным замещением в положении 2" (смотри опубликованную заявку на патент США US2005-0130923, опубликованную 16 июня 2005) или, альтернативно, 5'-замещением BNA (смотри РСТ Междунароную заявку WO 2007/134181, опубликованную 11/22/07, где группировка 4'-(СН2)-O-2' (LNA) замещена, например, 5'-метильной или 5'-винильной группой).
Примеры нуклеозидов, имеющих модифицированные сахарные группировки, включают, без ограничения, нуклеозиды, содержащие группы-заместители 5'-винил, 5'-метил (R или S), 4'-S, 2'-F, 2'-OCH3, 2'-OCH2CH3, 2'-OCH2CH2F и 2'-O(СН2)2OCH3. Заместитель в положении 2' может быть также выбран из аллила, амино, азидо, тио, O-аллила, O-C1-С10алкила, OCF3, OCH2F, O(СН2)2SCH3, O(СН2)2-O-N(Rm)(Rn), O-СН2-C(=O)-N(Rm)(Rn) и O-СН2-C(=O)-N(Rl)-(СН2)2-N(Rm)(Rn), где каждый из Rl, Rm и Rn независимо представляет собой Н или замещенный или незамещенный C1-С10алкил.
В данном документе "бициклические нуклеозиды" относятся к модифицированным нуклеозидам, содержащим бициклическую сахарную группировку. Примеры бициклических нуклеозидов включают, без ограничения, нуклеозиды, содержащие мостик 4'- и 2'-атомами рибозильного кольца. В некоторых воплощениях антисмысловые соединения, предложенные в данном документе, включают один или более бициклических нуклеозидов, содержащих мостик 4'-2'. Примеры таких 4'-2'-мостиков бициклических нуклеозидов включают, без ограничения, мостики одной из формул: 4'-(СН2)-O-2' (LNA); 4'-(СН2)-S-2'; 4'-(СН2)2-O-2' (ENA); 4'-СН(CH3)-O-2' (также упоминаемый как связанный этил или cEt) и 4'-СН(CH2OCH3)-O-2' (и его аналоги; смотри патент США 7399845, выданный 15 июля 2008 года); 4'-С(CH3)(CH3)-O-2' (и его аналоги; смотри публикацию Международной заявки WO/2009/006478, дата публикации 8 января 2009 года); 4'-СН2-N(OCH3)-2' (и его аналоги; смотри публикацию Международной заявки WO/2008/150729, дата публикации 11 декабря 2008 года); 4'-СН2-O-N(CH3)-2' (смотри публикацию заявки на патент США US2004-0171570, дата публикации 2 сентября 2004 года); 4'-СН2-N(R)-O-2', где R представляет собой Н, С1-С12алкил или защитную группу (смотри патент США 7427672, выданный 23 сентября 2008 года); 4'-СН2-С(Н)(CH3)-2' (смотри Chattopadhyaya et al., J. Org. Chem., 2009, 74, 118-134); и 4'-СН2-С(=СН2)-2' (и его аналоги; смотри публикацию Международной заявки WO 2008/154401, дата публикации 8 декабря 2008 года).
Дополнительные сообщения, относящиеся к бициклическим нуклеозидам, также можно найти в опубликованной литературе (смотри, например, Singh et al., Chem. Commun., 1998, 4, 455-456; Koshkin et al., Tetrahedron, 1998, 54, 3607-3630; Wahlestedt et al., Proc. Natl. Acad. Sci. U.S.A., 2000, 97, 5633-5638; Kumar et al., Bioorg. Med. Chem. Lett., 1998, 8, 2219-2222; Singh et al., J. Org. Chem., 1998, 63, 10035-10039; Srivastava et al., J. Am. Chem. Soc., 2007, 129(26) 8362-8379; Elayadi et al., Curr. Opinion Invest. Drugs, 2001, 2, 558-561; Braasch et al., Chem. Biol., 2001, 8, 1-7; и Orum et al., Curr. Opinion Mol. Ther., 2001, 3, 239-243; патенты США №№6268490, 6525191. 6670461, 6770748, 6794499, 7034133, 7053207, 7399845, 7547684 и 7,696,345; патентные публикации США №№ US2008-0039618, US2009-0012281; заявки на патент США серийные №№60/989,574; 61/026,995; 61/026,998; 61/056,564; 61/086,231; 61/097,787; и 61/099,844; публикации РСТ Международных заявок WO 1994/014226; WO 2004/106356; WO 2005/021570; WO 2007/134181; WO 2008/150729; WO 2008/154401; и WO 2009/006478. Каждый из вышеуказанных бициклических нуклеозидов может быть получен с одной или более стереохимическими конфигурациями сахара, включая, например, α-L-рибофуранозу и β-D-рибофуранозу (смотри РСТ Международную заявку PCT/DK98/00393, опубликованную 25 марта 1999 года как WO 99/14226).
В некоторых воплощениях бициклические сахарные группировки BNA нуклеозидов включают, без ограничения, соединения, имеющие по меньшей мере один мостик между положением 4' и положением 2' пентофуранозильной сахарной группировки, где такой мостик независимо содержит 1 или от 2 до 4 связанных групп, независимо выбранных из -[C(Ra)(Rb)]n-, -C(Ra)=C(Rb), -C(Ra)=N-, -C(=O)-, -C(=NRa)-, -C(=S)-, -O-, -Si(Ra)2-, -S(=O)x- и -N(Ra)-;
где:
x равно О, 1 или 2;
n равно 1, 2, 3 или 4;
каждый из Ra и Rb независимо представляет собой Н, защитную группу, гидроксил, C1-C12алкил, замещенный C1-C12алкил, C2-C12алкенил, замещенный C2-C12алкенил, C2-C12алкинил, замещенный C2-C12алкинил, С5-С20арил, замещенный С5-С20арил, гетероциклический радикал, замещенный гетероциклический радикал, гетероарил, замещенный гетероарил, C5-C7 алициклический радикал, замещенный C5-C7 алициклический радикал, галоген, OJ1, NJ1J2, SJ1, N3, COOJ1, ацил (С(=O)-Н), замещенный ацил, CN, сульфонил (S(=O)2-J1), или сульфоксил (S(=O)-J1); и
каждый из J1 и J2 независимо представляет собой Н, C1-C12алкил, замещенный C1-C12алкил, C2-C12алкенил, замещенный C2-C12алкенил, C2-C12алкинил, замещенный C2-C12алкинил, С5-С20арил, замещенный С5-С20арил, ацил (С(=O)-Н), замещенный ацил, гетероциклический радикал, замещенный гетероциклический радикал, C1-C12аминоалкил, замещенный C1-C12аминоалкил или защитную группу.
В некоторых воплощениях мостик бициклической сахарной группировки представляет собой -[C(Ra)(Rb)]n-, -[C(Ra)(Rb)]n-O-, -C(RaRb)-N(R)-O- или -C(RaRb)-O-N(R)-. В некоторых воплощениях мостик представляет собой 4'-СН2-2',4'-(СН2)2-2', 4'-(СН2)3-2', 4'-СН2-O-2', 4'-(СН2)2-O-2', 4'-СН2-O-N(R)-2' и 4'-СН2-N(R)-O-2'-, где каждый R независимо представляет собой Н, защитную группу или С1-С12алкил.
В некоторых воплощениях бициклические нуклеозиды дополнительно определены изомерной конфигурацией. Например, нуклеозид, содержащий мостик 4'-2' метилен-окси, может быть в α-L-конфигурации или в β-D-конфигурации. Ранее α-L-метиленокси (4'-СН2-O-2') BNA были введены в антисмысловые олигонуклеотиды, которые показали антисмысловую активность (Frieden et al., Nucleic Acids Research, 2003, 21, 6365-6372).
В некоторых воплощениях бициклические нуклеозиды включают, без ограничения, (А) α-L-метиленокси (4'-СН2-O-2') BNA, (В) β-D-метиленокси (4'-СН2-O-2') BNA, (С) этиленокси (4'-(СН2)2-O-2') BNA, (D) аминоокси (4'-СН2-O-N(R)-2') BNA, (E) оксиамино (4'-СН2-N(R)-O-2') BNA, (F) метил(метиленокси) (4'-СН(CH3)-O-2') BNA, (G) метилен-тио (4'-СН2-S-2') BNA, (H) метилен-амино (4'-СН2-N(R)-2') BNA, (I) метил-карбоцикпическая (4'-СН2-СН(CH3)-2') BNA, (J) пропилен-карбоциклическая (4'-(СН2)3-2') BNA и (K) винил BNA, которые изображены ниже:
где Вх представляет собой группировку основания, и R независимо представляет собой H, защитную группу, C1-C12алкил или C1-C12алкокси.
В некоторых воплощениях предложены бициклические нуклеозиды, имеющие формулу I:
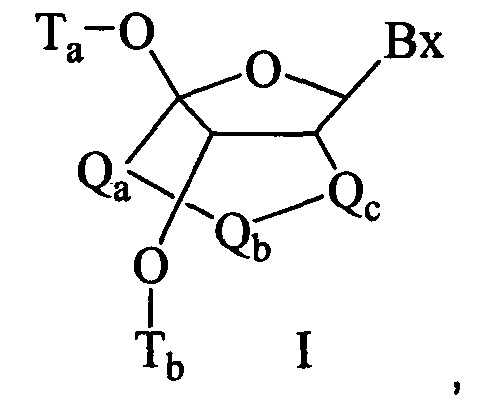
где:
Вх представляет собой группировку гетероциклического основания;
-Qa-Qb-Qc- представляет собой -СН2-N(Rc)-СН2-, -C(=O)-N(Rc)-СН2-, -СН2-O-N(Rc)-, -CH2-N(Rc)-O- или -N(Rc)-O-СН2;
Rc представляет собой C1-C12алкил или защитную группу аминогруппы; и
каждый из Та и Tb независимо представляет собой Н, защитную группу гидроксила, конъюгированную группу, реакционноспособную фосфорную группу, фосфорную группировку или ковалентное присоединение к среде-носителю.
В некоторых воплощениях предложены бициклические нуклеозиды, имеющие формулу II:
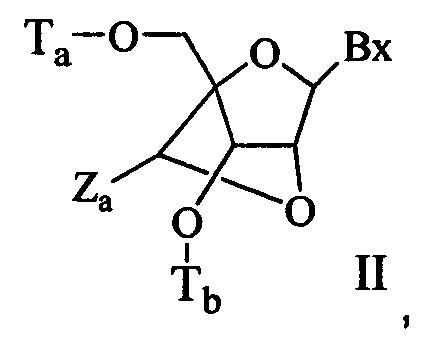
где:
Вх представляет собой группировку гетероциклического основания;
каждый из Та и Tb независимо представляет собой Н, защитную группу гидроксила, конъюгированную группу, реакционноспособную фосфорную группу, фосфорную группировку или ковалентное присоединение к среде-носителю;
Za представляет собой C1-C6алкил, С2-С6алкенил, С2-С6алкинил, замещенный C1-C6алкил, замещенный С2-С6алкенил, замещенный С2-С6алкинил, ацил, замещенный ацил, замещенный амид, тиол или замещенный тио.
В одном воплощении каждая замещенная группа независимо является моно- или полизамещенной группами-заместителями, независимо выбранными из галогена, оксо, гидроксила, OJc, NJcJd, SJc, N3, OC(=X)Jc и NJeC(=X)NJcJd, где каждый из Jc, Jd и Je независимо представляет собой Н, C1-C6алкил или замещенный C1-C6алкил, и Х представляет собой О или NJc.
В некоторых воплощениях предложены бициклические нуклеозиды, имеющие формулу III:

где:
Вх представляет собой группировку гетероциклического основания;
каждый из Та и Tb независимо представляет собой Н, защитную группу гидроксила, конъюгированную группу, реакционноспособную фосфорную группу, фосфорную группировку или ковалентное присоединение к среде-носителю;
Zb представляет собой C1-C6алкил, С2-С6алкенил, С2-С6алкинил, замещенный C1-C6алкил, замещенный С2-С6алкенил, замещенный C2-C6алкинил или замещенный ацил (С(=O)-).
В некоторых воплощениях предложены бициклические нуклеозиды, имеющие формулу IV:

где:
Вх представляет собой группировку гетероциклического основания;
каждый из Та и Tb независимо представляет собой Н, защитную группу гидроксила, конъюгированную группу, реакционноспособную фосфорную группу, фосфорную группировку или ковалентное присоединение к среде-носителю;
Rd представляет собой C1-C6алкил, замещенный C1-C6алкил, C2-С6алкенил, замещенный C2-С6алкенил, С2-С6алкинил или замещенный C2-С6алкинил;
каждый qa, qb, qc и qd независимо представляет собой Н, галоген, C1-C6алкил, замещенный C1-C6алкил, С2-С6алкенил, замещенный С2-С6алкенил, С2-С6алкинил или замещенный С2-С6алкинил, C1-C6алкоксил, замещенный C1-C6алкоксил, ацил, замещенный ацил, C1-C6аминоалкил или замещенный C1-C6аминоалкил;
В некоторых воплощениях предложены бициклические нуклеозиды, имеющие формулу V:

где:
Вх представляет собой группировку гетероциклического основания;
каждый из Та и Tb независимо представляет собой Н, защитную группу гидроксила, конъюгированную группу, реакционноспособную фосфорную группу, фосфорную группировку или ковалентное присоединение к среде-носителю;
каждый из qa, qb, qe и qf независимо представляет собой водород, галоген, C1-C12алкил, замещенный C1-C12алкил, C2-C12алкенил, замещенный C2-C12алкенил, C2-C12алкинил, замещенный C2-C12алкинил, C1-C12алкокси, замещенный C1-C12алкокси, OJj, SJj, SOJj, SO2Jj, NJjJk, N3, CN, C(=O)OJj, C(=O)NJjJk, C(=O)Jj, O-C(=O)NJjJk, N(H)C(=NH)NJjJk, N(H)C(=O)NJjJk или N(H)C(=S)NJjJk;
или qe и qf вместе представляют собой =C(qg)(qh);
каждый из qg и qh независимо представляет собой Н, галоген, C1-C12алкил или замещенный C1-C12алкил.
Синтез и получение метиленокси (4'-СН2-O-2') BNA мономеров аденина, цитозина, гуанина, 5-метил-цитозина, тимина и урацила наряду с их олигомеризацией и свойства узнавания нуклеиновых кислот описаны в Koshkin et al., Tetrahedron, 1998, 54, 3607-3630. Бициклические нуклеиновые кислоты (BNA) и их получение описаны также в WO 98/39352 и WO 99/14226.
Аналоги метиленокси (4'-СН2-O-2') BNA и 2'-тио-BNA также были получены (Kumar et al., Bioorg. Med. Chem. Lett., 1998, 8, 2219-2222). Получение "закрытых" нуклеозидных аналогов, содержащих олигодезоксирибонуклеотидные дуплексы, в качестве субстратов для полимераз нуклеиновых кислот также были описаны (Wengel et al., WO 99/14226). Кроме того, синтез 2'-амино-BNA, нового конформационно ограниченного высокоаффинного олигонуклеотидного аналога был описан в данной области (Singh et al., J. Org. Chem., 1998, 63, 10035-10039). Помимо этого, были получены 2'-амино- и 2'-метиламино-BNA, и о термостабильности их дуплексов с комплементарными цепями РНК и ДНК ранее сообщалось.
В некоторых воплощениях предложены бициклические нуклеозиды, имеющие формулу VI:
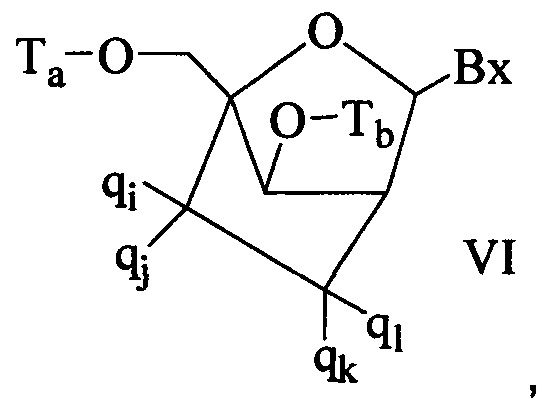
где:
Вх представляет собой группировку гетероциклического основания;
каждый из Та и Tb независимо представляет собой Н, защитную группу гидроксила, конъюгированную группу, реакционноспособную фосфорную группу, фосфорную группировку или ковалентное присоединение к среде-носителю;
каждый из qi, qj, qk и ql независимо представляет собой Н, галоген, C1-C12алкил, замещенный C1-C12алкил, C2-C12алкенил, замещенный C2-C12алкенил, C2-C12алкинил, замещенный C2-C12алкинил, C1-C12алкоксил, замещенный C1-C12алкоксил, OJj, SJj, SOJj, SO2Jj, NJjJk, N3, CN, C(=O)OJj, C(=O)NJjJk, C(=O)Jj, O-C(=O)NJjJk, N(H)C(=NH)NJjJk, N(H)C(=O)NJjJk или N(H)C(=S)NJjJk; и
qi и qj или qi и qk вместе представляют собой =C(qg)(qh), где каждый из qg и qn независимо представляет собой Н, галоген, C1-C12алкил или замещенный С1-С12алкил.
Один карбоциклический бициклический нуклеозид, имеющий мостик 4'-(СН2)3-2' и алкенильный мостик-аналог 4'-СН=СН-СН2-2', был описан в Freier et al., Nucleic Acids Research, 1997, 25(22), 4429-4443, и Albaek etal., J. Org. Chem., 2006, 71, 7731-7740. Синтез и получение карбоциклических бициклических нуклеозидов наряду с их олигомеризацией и биохимическими исследованиями также были описаны (Srivastava et al., J. Am. Chem. Soc., 2007, 129(26), 8362-8379).
В данном документе "4'-2' бициклический нуклеозид" или "от 4' к 2' бициклический нуклеозид" относится к бициклическому нуклеозиду, содержащему фуранозное кольцо, содержащее мостик, соединяющий два атома углерода фуранозного кольца, 2'-атом углерода и 4'-атом углерода сахарного кольца.
В данном документе "моноциклические нуклеозиды" относятся к содержащим модифицированные сахарные группировки нуклеозидам, которые не являются бициклическими сахарными группировками. В некоторых воплощениях сахарная группировка или аналог сахарной группировки нуклеозида могут быть модифицированы или замещены в любом положении.
В данном документе '2'-модифицированный сахар" означает фуранозильный сахар, модифицированный в положении 2'. В некоторых воплощениях такие модификации включают заместители, выбранные из заместителей, включающих, без ограничения, галогенид, замещенный и незамещенный алкокси, замещенный и незамещенный тиоалкил, замещенный и незамещенный аминоалкил, замещенный и незамещенный алкил, замещенный и незамещенный аллил и замещенный и незамещенный алкинил. В некоторых воплощениях 2'-модификации выбраны из заместителей, включающих, без ограничения, O[(СН2)nO]mCH3, O(СН2)nNH2, O(СН2)nCH3, O(СН2)nF, O(СН2)nONH2, ОСН2С(=O)N(Н)CH3 и O(СН2)nON[(СН2)nCH3]2, где n и m означают число от 1 до примерно 10. Другие 2'-заместители могут быть также выбраны из С1-С12алкила, замещенного алкила, алкенила, алкинила, алкарила, аралкила, O-алкарила или O-аралкила, SH, SCH3, OCN, Cl, Br, CN, F, CF3, OCF3, SOCH3, SO2CH3, ONO2, NO2, N3, NH2, гетероциклоалкила, гетероциклоалкарила, аминоалкиламино, полиалкиламино, замещенного силила, РНК-расщепляющей группы, репортерной группы, интеркалятора, группы для улучшения фармакокинетических свойств или группы для улучшения фармакодинамических свойств антисмыслового соединения и других заместителей, имеющих подобные свойства. В некоторых воплощениях модифицированные нуклеозиды содержат 2'-МОЕ боковую цепь (Baker et al; J. Biol. Chem., 1997, 272, 11944-12000). Такое 2'-МОЕ замещение было описано как обеспечивающее улучшенную аффинность связывания по сравнению с немодифицированными нуклеозидами и другими модифицированными нуклеозидами, такими как 2'-O-метильные, -O-пропильные и -O-аминопропильные. Было показано также, что олигонуклеотиды, имеющие 2'-МОЕ заместитель, являются антисмысловыми ингибиторами экспрессии генов с многообещающими характеристиками для использования in vivo (Martin, Helv. Chim. Acta, 1995, 78, 486-504; Altmann et al., Chimia, 1996, 50, 168-176; Altmann et al., Biochem. Soc. Trans., 1996, 24, 630-637; и Altmann et al., Nucleisides Nucleotides, 1997, 16, 917-926).
В данном документе "модифицированный тетрагидропирановый нуклеозид" или "модифицированный ТНР нуклеозид" означает нуклеозид, имеющий шестичленный тетрагидропирановый "сахар", заменяющий пентофуранозильный остаток в нормальных нуклеозидах (суррогат сахара). Модифицированные ТНР нуклеозиды включают, без ограничения, те, которые упоминаются в данной области как гекситоловая нуклеиновая кислота (HNA), анитоловая нуклеиновая кислота (ANA), маннитоловая нуклеиновая кислота (MNA) (смотри Leumann, Bioorg. Med. Chem., 2002, 10, 841-854) или фтор-HNA (F-HNA), имеющие тетрагидропирановую кольцевую систему, как проиллюстрировано ниже:
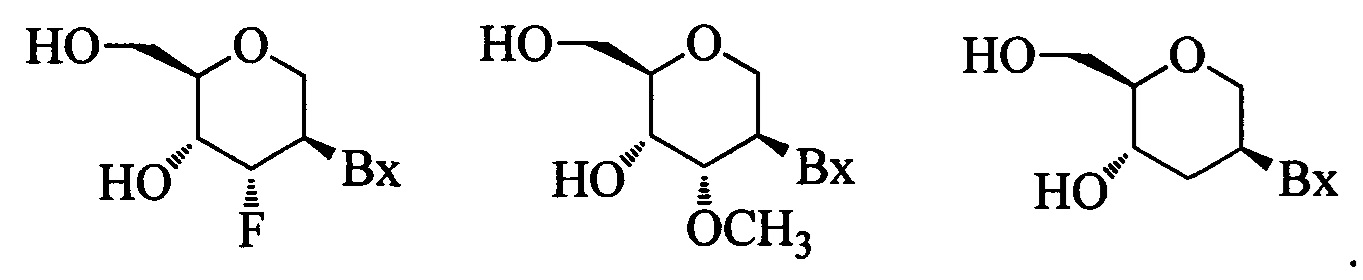
В некоторых воплощениях выбирают суррогаты сахара, имеющие формулу VII:

где независимо для каждого указанного по меньшей мере одного тетрагидропиранового аналога нуклеозида формулы VII:
Вх представляет собой группировку гетероциклического основания;
каждый из Та и Tb независимо представляет собой группу межнуклеозидной связи, связывающую тетрагидропирановый аналог нуклеозида с антисмысловым соединением, или один из Та и Tb представляет собой группу межнуклеозидной связи, связывающую тетрагидропирановый аналог нуклеозида с антисмысловым соединением, а другой из Та и Tb представляет собой Н, защитную группу гидроксила, связанную конъюгированную группу или 5' или 3'-концевую группу;
каждый из q1, q2, q3, q4, q5, q6 и q7 независимо представляет собой Н, C1-С6алкил, замещенный C1-C6алкил, С2-С6алкенил, замещенный С2-С6алкенил, С2-С6алкинил или замещенный С2-С6алкинил; и каждый из R1 и R2 выбран из водорода, гидроксила, галогена, замещенного или незамещенного алкокси, NJ1J2, SJ1, N3, OC(=X)J1, OC(=X)NJ1J2, NJ3C(=X)NJ1J2 и CN, где Х представляет собой О, S или NJ1, и каждый из J1, J2 и J3 независимо представляет собой Н или C1-C6алкил.
В некоторых воплощениях предложены модифицированные ТНР нуклеозиды формулы VII, где каждый из q1, q2, q3, q4, q5, q6 и q7 представляет собой Н. В некоторых воплощениях по меньшей мере один из q1, q2, q3, q4, q5, q6 и q7 является иным, чем Н. В некоторых воплощениях по меньшей мере один из q1, q2, q3, q4, q5, q6 и q7 представляет собой метил. В некоторых воплощениях предложены ТНР нуклеозиды формулы VII, где один из R1 и R2 представляет собой фтор. В некоторых воплощениях R1 представляет собой фтор, а R2 представляет собой Н; R1 представляет собой метокси, а R2 представляет собой Н; и R1 представляет собой метоксиэтокси, а R2 представляет собой Н.
В некоторых воплощениях суррогаты сахара содержат кольца, имеющие более 5 атомов и более одного гетероатома. Например, сообщалось о нуклеозидах, содержащих группировки морфолинового сахара, и об их использовании в олигомерных соединениях (смотри, например, Braasch et al., Biochemistry, 2002, 41, 4503-4510; и патенты США 5698685, 5166315, 5185444 и 5034506). В данном документе термин "морфолино" означает суррогат сахара, имеющий следующую формулу:
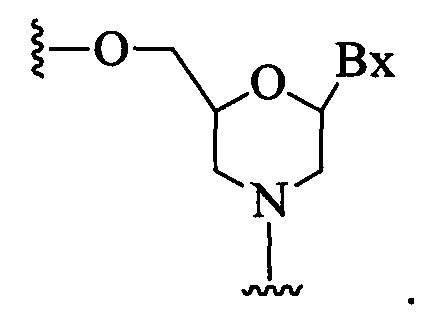
В некоторых воплощениях морфолино могут быть модифицированы, например путем присоединения или изменения различных групп-заместителей вышеуказанной морфолиновой структуры. Такие суррогаты сахара упоминаются в данном документе как "модифицированные морфолино".
Предложены также комбинации модификаций, такие как, без ограничения, 2'-F-5'-метил-замещенные нуклеозиды (смотри РСТ Международную заявку WO 2008/101157, опубликованную 8/21/08, в отношении других раскрытых 5'-, 2'-бис замещенных нуклеозидов) и замену атома кислорода рибозильного кольца атомом S и дополнительное замещение в положении 2' (смотри публикацию заявки на патент США US2005-0130923, опубликованной 16 июня 2005 года) или, альтернативно, 5'-замещение бициклической нуклеиновой кислоты (смотри РСТ Международную заявку WO 2007/134181, опубликованную 11/22/07, где 4'-СН2-O-2' бициклический нуклеозид дополнительно замещен в положении 5' 5'-метильной или 5'-винильной группой). Синтез и получение карбоциклических бициклических нуклеозидов наряду с их олигомеризацией и биохимическими исследованиями также были описаны (Srivastava et al., J. Am. Chem. Soc., 2007, 129(26), 8362-8379).
В некоторых воплощениях антисмысловые соединения содержат один или более модифицированных циклогексенильных нуклеозидов, которые являются нуклеозидом, имеющим шестичленный циклогексенил вместо пентофуранозильного остатка в существующих в природе нуклеозидах. Модифицированные циклогексенильные нуклеозиды включают, без ограничения, те, которые описаны в данной области (смотри, например, публикацию РСТ заявки WO 2010/036696, опубликованной 10 апреля 2010 года, поданной заявителем настоящей заявки и одновременно находящейся на рассмотрении; Robeyns et al., J. Am. Chem. Soc., 2008, 130(6), 1979-1984; Horvath et al., Tetrahedron Letters, 2007, 48, 3621-3623; Nauwelaerts et al., J. Am. Chem. Soc., 2007, 129(30), 9340-9348; Gu et al., Nucleosides, Nucleotides & Nucleic Acids, 2005, 24(5-7), 993-998; Nauwelaerts et al., Nucleic Acids Research, 2005, 33(8), 2452-2463; Robeyns et al., Acta Crystallographica, Section F: Structural Biology and Crystallization Communications, 2005, F61(6), 585-586; Gu et al., Tetrahedron, 2004, 60(9), 2111-2123; Gu et al., Oligonucleotides, 2003, 13(6), 479-489; Wang et al., J. Org. Chem., 2003, 66, 4499-4505; Verbeure et al.. Nucleic Acids Research, 2001, 29(24), 4941-4947; Wang et al., J. Org. Chem., 2001, 66, 8478-82; Wang et al., Nucleosides, Nucleotides & Nucleic Acids, 2001, 20(4-7), 785-788; Wang et al., J. Am. Chem., 2000, 122, 8595-8602; публикацию РСТ заявки WO 06/047842; и публикацию РСТ заявки WO 01/049687; полный текст каждого из указанных источников информации включен в данное описание посредством ссылки).
Некоторые модифицированные циклогексенильные нуклеозиды имеют формулу X.

где независимо для каждого указанного по меньшей мере одного циклогексенильного аналога нуклеозида формулы X:
Вх представляет собой группировку гетероциклического основания;
каждый из Т3 и Т4 независимо, представляет собой группу межнуклеозидной связи, связывающую тетрагидропирановый аналог нуклеозида с антисмысловым соединением, или один из Т3 и Т4 представляет собой группу межнуклеозидной связи, связывающую тетрагидропирановый аналог нуклеозида с антисмысловым соединением, а другой из Т3 и Т4 представляет собой Н, защитную группу гидроксила, связанную конъюгированную группу или 5' или 3'-концевую группу; и
каждый из q1, q2, q3, q4, q5, q6 и q7 независимо представляет собой Н, C1-С6алкил, замещенный C1-С6алкил, С2-С6алкенил, замещенный С2-С6алкенил, С2-С6алкинил или замещенный С2-С6алкинил или другую группу-заместитель сахара.
В данном документе '2'-модифицированный" или "2'-замещенный" относится к нуклеозиду, содержащему сахар, содержащий заместитель в положении 2', иной чем Н или ОН. 2'-Модифицированные нуклеозиды включают, без ограничения, бициклические нуклеозиды, где мостик, соединяющий два атома углерода сахарного кольца, соединяет 2'-углерод и другой углерод сахарного кольца; и нуклеозиды с немостиковыми 2'-заместителями, такими как аллил, амино, азидо, тио, O-аллил, O-C1-С10алкил, -OCF3, O-(СН2)2-O-CH3, 2'-O(СН2)2SCH3, O-(СН2)2-O-N(Rm)(Rn) или O-СН2-С(=O)-N(Rm)(Rn), где каждый из Rm и Rn независимо представляет собой Н или замещенный или незамещенный С1-С10алкил. 2'-Модифицированные нуклеозиды дополнительно могут содержать другие модификации, например в положениях сахара и/или нуклеооснования.
В данном документе "2'-F" относится к нуклеозиду, содержащему сахар, содержащий фтор в положении 2' сахарного кольца.
В данном документе каждый из "2'-ОМе", или "2'-OCH3", или "2'-O-метил" относится к нуклеозиду, содержащему сахар, содержащий группу -OCH3 в положении 2' сахарного кольца.
В данном документе "олигонуклеотид" относится к соединению, содержащему множество связанных нуклеозидов. В некоторых воплощениях один или более из множества нуклеозидов является модифицированным. В некоторых воплощениях олигонуклеотид содержит один или более рибонуклеозидов (РНК) и/или дезоксирибонуклеозидов (ДНК).
В данной области также известны многие другие бициклические и трициклические суррогатные сахарные кольцевые системы, которые могут быть использованы для модификации нуклеозидов для введения в антисмысловые соединения (смотри, например, обзорную статью Leumann, Bioorg. Med. Chem., 2002, 10, 841-854). Такие кольцевые системы могут подвергаться различным дополнительным замещениям для усиления активности.
Способы получения модифицированных Сахаров общеизвестны специалистам в данной области. Некоторые репрезентативные патенты США, в которых описано получение таких модифицированных Сахаров, включают, без ограничения, патенты США 4981957, 5118800, 5319080, 5359044, 5393878, 5446137, 5466786, 5514785, 5519134, 5567811, 5576427, 5591722, 5597909, 5610300, 5627053, 5639873, 5646265, 5670633, 5700920, 5792847 и 6600032 и Международную заявку PCT/US2005/019219, поданную 2 июня 2005 года и опубликованную как WO 2005/121371 22 декабря 2005 года; полное содержание этих источников информации включено в данное описание посредством ссылки.
В нуклеотидах, имеющих модифицированные сахарные группировки, группировки нуклеооснований (природных, модифицированных или их комбинаций) поддерживаются для гибридизации с соответствующей нуклеиновой кислотой-мишенью.
В некоторых воплощениях антисмысловые соединения содержат один или более нуклеозидов, имеющих модифицированные сахарные группировки. В некоторых воплощениях модифицированной сахарной группировкой является 2'-МОЕ. В некоторых воплощениях 2'-МОЕ-модифицированные нуклеозиды расположены в гэпмерном мотиве. В некоторых воплощениях модифицированной сахарной группировкой является бициклический нуклеозид, имеющий мостиковую группу (4'-СН(CH3)-O-2'). В некоторых воплощениях (4'-СН(CH3)-O-2')-модифицированные нуклеозиды расположены в "крыльях" гэпмерного мотива.
Модифицированные нуклеооснования
Модифицированные или замещенные нуклеооснования (или основания) структурно отличаются от существующих в природе или синтетических немодифицированных нуклеооснований, но все же функционально взаимозаменяемых с ними. Как природные, так и модифицированные нуклеооснования способны участвовать в образовании водородных связей. Такие модифицированные нуклеооснования могут придавать антисмысловым соединениям устойчивость к нуклеазам, аффинность связывания или некоторые другие полезные биологические свойства. Модифицированные нуклеооснования включают синтетические и природные нуклеооснования, такие как, например, 5-метилцитозин (5-Ме-С). Некоторые замещения нуклеооснований, включая 5-метилцитозиновое замещение, особенно полезны для увеличения аффинности связывания антисмыслового соединения с нуклеиновой кислотой-мишенью. Например, было показано, что 5-метилцитозиновые замещения увеличивают стабильность дуплекса нуклеиновых кислоту на 0,6-1,2°С (Sanghvi, Y.S., Crooke, S.T. and Lebleu, В., eds., Antisense Research and Applications, CRC Press, Boca Raton, 1993, pp. 276-278).
Дополнительные модифицированные нуклеооснования включают 5-гидроксиметил-цитозин, ксантин, гипоксантин, 2-аминоаденин, 6-метильные и другие алкильные производные аденина и гуанина, 2-пропильные и другие алкильные производные аденина и гуанина, 2-тиоурацил, 2-тиотимин и 2-тиоцитозин, 5-галоген-урацил и -цитозин, 5-пропинил (-С≡С-CH3)-урацил и -цитозин и другие алкинильные производные пиримидиновых оснований, 6-азо-урацил, -цитозин и -тимин, 5-урацил- (псевдоурацил-), 4-тиоурацил-, 8-галоген", 8-амино-, 8-тиол-, 8-тиоалкил-, 8-гидроксил-замещенные и другие 8-замещенные аденины и гуанины, 5-галоген-, в частности 5-бром-, 5-трифторметил-замещенные и другие 5-замещенные урацилы и цитозины, 7-метилгуанин и 7-метиладенин, 2-F-аденин, 2-амино-аденин, 8-азагуанин и 8-азааденин, 7-деазагуанин и 7-деазааденин и 3-деазагуанин и 3-деазааденин.
Группировки гетероциклических оснований могут также включать те группировки, в которых пуриновое или пиримидиновое основание заменено другими гетероциклами, например 7-деаза-аденин, 7-деазагуанозин, 2-аминопиридин и 2-пиридон. Нуклеооснования, которые особенно полезны для увеличения аффинности связывания антисмысловых соединений, включают 5-замещенные пиримидины, 6-азапиримидины и N-2-, N-6- и O-6-замещенные пурины, включая 2-аминопропиладенин, 5-пропинилурацил и 5-пропинилцитозин.
В некоторых воплощениях антисмысловые соединения, направленно воздействующие на нуклеиновую кислоту рецептора андрогенов, содержат одно или более модифицированных нуклеооснований. В некоторых воплощениях укороченные или гэп-расширенные антисмысловые олигонуклеотиды, направленно воздействующие на нуклеиновую кислоту рецептора андрогенов, содержат одно или более модифицированных нуклеооснований. В некоторых воплощениях модифицированным нуклеооснованием является 5-метилцитозин. В некоторых воплощениях каждый цитозин представляет собой 5-метилцитозин.
Конъюгированные антисмысловые соединения
Антисмысловые соединения могут быть ковалентно связаны с одной(им) или более группировками или конъюгатами, которые усиливают активность, клеточное распределение или клеточный захват полученных антисмысловых олигонуклеотидов. Типичные конъюгированные группы включают холестериновые группировки и липидные группировки. Дополнительные конъюгированные группы включают углеводы, фосфолипиды, биотин, феназин, фолат, фенантридин, антрахинон, акридин, флуоресцеины, родамины, кумарины и красители.
Антисмысловые соединения могут быть модифицированы также, чтобы иметь одну или более стабилизирующих групп, которые обычно присоединены к одному или обоим концам антисмысловых соединений для усиления свойств, таких как, например, устойчивость к нуклеазам. В число стабилизирующих групп входят кэп-структуры. Эти концевые модификации защищают антисмысловое соединение, имеющее концевую нуклеиновую кислоту, от расщепления эндонуклеазами и могут улучшать доставку в клетку и/или локализацию в клетке. Кэп может присутствовать на 5'-конце (5'-кэп) или на 3'-конце (3'-кэп) или может присутствовать на обоих концах. Кэп-структуры общеизвестны в данной области и включают, например, инвертированные лишенные азотистых оснований дезокси кэпы. Дополнительно, 3'- и 5'-стабилизирующие группы, которые могут быть использованы для копирования одного или обоих концов антисмыслового соединения с целью придания устойчивости к нуклеазам, включают группы, которые раскрыты в WO 03/004602, опубликованной 16 января 2003 года.
В некоторых воплощениях антисмысловые соединения, включая, без ограничения, соединения, которые, в частности, пригодны для использования в качестве оцРНК, модифицированы путем присоединения одной или более конъюгированных групп. Как правило, конъюгированные группы модифицируют одно или более свойств присоединенного олигонуклеотида, включая, без ограничения, фармакодинамику, фармакокинетику, стабильность, связывание, всасывание, клеточное распределение, клеточный захват, нагрузку и клиренс. Конъюгированные группы рутинно используют в химических областях и связывают с родительским соединением, таким как олигонуклеотид, напрямую или через возможную конъюгированную связывающую группировку или конъюгированную связывающую группу. Конъюгированные группы включают, без ограничения, интеркаляторы, репортерные молекулы, полиамины, полиамиды, полиэтиленгликоли, тиоэфиры, полиэфиры, холестерины, тиохолестерины, группировки холевой кислоты, фолат, липиды, фосфолипиды, биотин, феназин, фенантридин, антрахинон, адамантан, акридин, флуоресцеины, родамины, кумарины и красители. Ранее были описаны некоторые конъюгированные группы, например холестериновая группировка (Letsinger et al., Proc. Natl. Acad. Sci. USA, 1989, 86, 6553-6556), холевая кислота (Manoharan et al., Bioorg. Med. Chem. Let, 1994, 4, 1053-1060), тиоэфир, например гексил-S-тритилтиол (Manoharan et al., Ann. N.Y. Acad. Sci., 1992, 660, 306-309; Manoharan et al., Bioorg. Med. Chem. Let., 1993, 3, 2765-2770), тиохолестерин (Oberhauser et al., Nucl. Acids Res., 1992, 20, 533-538), алифатическая цепь, например додекандиольные или ундецильные остатки (Saison-Behmoaras et al., EMBO J., 1991, 10, 1111-1118; Kabanov et al., FEBS Lett., 1990, 259, 327-330; Svinarchuk et al., Biochimie, 1993, 75, 49-54), фосфолипид, например ди-гексадецил-гас-глицерин или триэтил-аммония 1,2-ди-O-гексадецил-гас-глицеро-3-Н-фосфонат (Manoharan et al., Tetrahedron Lett., 1995, 36, 3651-3654; Shea et al., Nucl. Acids Res., 1990, 18, 3777-3783), полиаминная или полиэтиленгликолевая цепь (Manoharan et al., Nucleosides & Nucleotides, 1995, 14, 969-973) или адамантан-уксусная кислота (Manoharan et al., Tetrahedron Lett., 1995, 36, 3651-3654), пальмитильная группировка (Mishra et al., Biochim. Biophys. Acta, 1995, 1264, 229-237), или октадециламин, или гексиламино-карбонил-оксихолестериновая группировка (Crooke et al., J. Pharmacol. Exp. Ther., 1996, 277, 923-937).
Относительно дополнительных конъюгатов, включая те из них, которые полезны для оцРНК, и их расположения в антисмысловых соединениях, смотри, например, РСТ публикацию № WO2013/033230.
Композиции и способы изготовления фармацевтических композиций
Антисмысловые олигонуклеотиды могут быть смешаны с фармацевтически приемлемыми активными или инертными веществами с получением фармацевтических композиций или препаратов. Композиции и способы изготовления фармацевтических композиций зависят от целого ряда критериев, включая, без ограничения, путь введения, степень заболевания или доза, которая предназначена для введения.
Антисмысловое соединение, направленно воздействующее на нуклеиновую кислоту рецептора андрогенов, можно использовать в фармацевтических композициях, объединяя антисмысловое соединения с подходящим фармацевтически приемлемым разбавителем или носителем. В некоторых воплощениях фармацевтически приемлемым разбавителем является вода, такая как стерильная вода, пригодная для инъекций. Соответственно, в одном воплощении в способах, описанных в данном документе, используют фармацевтическую композицию, содержащую антисмысловое соединение, направленно воздействующее на нуклеиновую кислоту рецептора андрогенов, и фармацевтически приемлемый разбавитель. В некоторых воплощениях фармацевтически приемлемым разбавителем является вода. В некоторых воплощениях антисмысловое соединение представляет собой антисмысловой олигонуклеотид, предложенный в данном документе.
Фармацевтические композиции, содержащие антисмысловые соединения, охватывают любые фармацевтически приемлемые соли, сложные эфиры или соли таких сложных эфиров или любой другой олигонуклеотид, который после введения животному, включая человека, способен образовывать (прямо или опосредованно) биологически активный метаболит или его остаток. Соответственно, например, изобретение также относится к фармацевтически приемлемым солям антисмысловых соединений, пролекарствам, фармацевтически приемлемым солям таких пролекарств и другим биологическим эквивалентам. Подходящие фармацевтически приемлемые соли включают, без ограничения, натриевые и калиевые соли.
Пролекарство может включать антисмысловые соединения с введенными по одному или обоим концам дополнительными нуклеозидами, которые отщепляются эндогенными нуклеазами в организме с образованием активного антисмыслового соединения.
Тестирование антисмысловых олигонуклеотидов in vitro
В данном документе описаны способы обработки клеток антисмысловыми олигонуклеотидами, которые могут быть модифицированы соответствующим образом для лечения другими антисмысловыми соединениями.
Клетки можно обрабатывать антисмысловыми олигонуклеотидами, когда клетки достигают приблизительно 60-80%-ной конфлюэнтности в культуре.
Один реагент, обычно используемый для введения антисмысловых олигонуклеотидов в культивированные клетки, представляет собой катионный липидный реагент для трансфекции LIPOFECTIN (Invitrogen, Carlsbad, CA). Антисмысловые олигонуклеотиды можно смешивать с LIPOFECTIN в OPTI-МЕМ 1 (Invitrogen, Carlsbad, CA) до достижения желаемой конечной концентрации антисмыслового олигонуклеотида и концентрации LIPOFECTIN, которая может находиться в диапазоне от 2 до 12 мкг/мл на 100 нМ антисмыслового олигонуклеотида.
Другой реагент, используемый для введения антисмысловых олигонуклеотидов в культивированные клетки, представляет собой LIPOFECTAMINE (Invitrogen, Carlsbad, CA). Антисмысловой олигонуклеотид смешивают с LIPOFECTAMINE в среде OPTI-МЕМ 1 с пониженным содержанием сыворотки (Invitrogen, Carlsbad, CA) до достижения желаемой концентрации антисмыслового олигонуклеотида и концентрации LIPOFECTAMINE, которая может находиться в диапазоне от 2 до 12 мкг/мл на 100 нМ антисмыслового олигонуклеотида.
Другой метод, используемый для введения антисмысловых олигонуклеотидов в культивированные клетки, включает электропорацию.
Еще один метод, используемый для введения антисмысловых олигонуклеотидов в культивированные клетки, включает свободный захват олигонуклеотидов клетками.
Клетки обрабатывают антисмысловыми олигонуклеотидами рутинными методами. Клетки могут быть харвестированы через 16-24 часов после обработки антисмысловым олигонуклеотидом, и в этот момент уровни РНК или белка нуклеиновых кислот-мишеней измеряют методами, известными в данной области и описанным в данном документе. Как правило, при выполнении обработок в многократных повторах данные представляют в виде среднего значения повторных обработок.
Используемая концентрация антисмыслового олигонуклеотида варьирует от линии клеток к линии клеток. Методы определения оптимальной концентрации антисмыслового олигонуклеотида для конкретной линии клеток общеизвестны в данной области. Антисмысловые олигонуклеотиды обычно используют в концентрациях в пределах от 1 нМ до 300 нМ при трансфекции с использованием LIPOFECTAMINE. Антисмысловые олигонуклеотиды используют в более высоких концентрациях в пределах от 625 до 20000 нМ при трансфекции с использованием электропорации.
Выделение РНК
Анализ РНК может быть осуществлен по общей клеточной РНК или поли(А)+ мРНК. Методы выделения РНК общеизвестны в данной области. РНК получают способами, известными в данной области, например используя реагент TRIZOL (Invitrogen, Carlsbad, СА) согласно рекоммендованным протоколам производителя.
Воплощения:
Е1. Соединение, содержащее модифицированный олигонуклеотид, состоящий из 10-30 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую по меньшей мере 8 смежных нуклеооснований любой из последовательностей нуклеооснований SEQ ID NO: 12-179.
Е2. Соединение, содержащее модифицированный олигонуклеотид, состоящий из 16-30 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую последовательность нуклеооснований любой из SEQ ID NO: 12-179.
Е3. Соединение, содержащее модифицированный олигонуклеотид, состоящий из последовательности нуклеооснований любой из SEQ ID NO: 12-179.
Е4. Соединение, содержащее модифицированный олигонуклеотид, состоящий из 10-30 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую по меньшей мере 8 смежных нуклеооснований любой из последовательностей нуклеооснований SEQ ID NO: 35, 39, 43, 124, 150, 155, 169 или 175.
Е5. Соединение, содержащее модифицированный олигонуклеотид, состоящий из 16-30 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую последовательность нуклеооснований SEQ ID NO: 35, 39, 43, 124, 150, 155, 169 или 175.
Е6. Соединение, содержащее модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов и имеющий последовательность нуклеооснований, состоящую из последовательности нуклеооснований SEQ ID NO: 35, 39, 43, 124, 150, 155, 169 или 175.
Е7. Соединение, содержащее модифицированный олигонуклеотид, состоящий из 10-30 связанных нуклеозидов, комплементарных в пределах нуклеотидов 2957-2972, 3079-3094, 3099-3114, 3109-3124, 3113-3128, 3120-3135, 3133-3148, 3224-3239, 3226-3241, 3351-3366, 3353-3368, 3361-3376, 3388-3403, 3513-3528, 3517-3532, 3519-3534, 3641-3656, 3735-3750, 3764-3779, 3768-3783, 3798-3813, 3799-3814, 3851-3866, 3870-3885, 3874-3889, 3876-3891, 3878-3893, 3884-3899, 3886-3901, 3888-3903, 3901-3916, 3956-3971, 3962-3977, 3964-3979, 3967-3982, 4019-4034, 4038-4053, 4049-4064, 4056-4071, 4059-4074, 4062-4077, 4066-4081, 4070-4085, 4101-4116, 4103-4118, 4105-4120, 4109-4124, 4305-4320, 4405-4420, 4532-4547, 4534-4549, 4537-4552, 4539-4554, 4555-4570, 4571-4586, 4573-4588, 4578-4593, 4597-4612, 4632-4647, 4655-4670, 4656-4671, 4662-4677, 4699-4714, 4747-4762, 4750-4765, 4752-4767, 4754-4769, 4755-4770, 4769-4784, 4798-4813, 4804-4819, 4807-4822, 4833-4848, 4837-4852, 4839-4854, 4865-4880, 4868-4883, 4872-4887, 4874-4889, 4876-4891, 4887-4902, 4889-4904, 4916-4931, 4918-4933, 4938-4953, 4942-4957, 4944-4959, 4951-4966, 5050-5065, 5052-5067, 5054-5069, 5056-5071, 5060-5075, 5061-5076, 5062-5077, 5133-5148, 5141-5156, 5155-5170, 5265-5280, 5293-5308, 5308-5323, 5392-5407, 5448-5463, 5469-5484, 5481-5496, 5483-5498, 5486-5501, 5488-5503, 5494-5509, 5521-5536, 5666-5681, 6222-6237, 6701-6716, 7543-7558, 8471-8486, 8638-8653, 9464-9479, 10217-10232, 10250-10265, 10865-10880. 11197-11212, 11855-11870, 13189-13204, 13321-13336, 13346-13361, 16555-16570, 16793-16808, 16968-16983, 17206-17221, 18865-18880, 29329-29344, 32290-32305, 33315-33330, 39055-39070, 40615-40630, 42017-42032, 56050-56065, 58719-58734, 58720-58739, 58721-58736, 58722-58737, 58723-58738, 58724-58739, 58725-58740, 58750-58769, 58751-58766, 58752-58767, 58753-58768, 58754-58769, 58755-58770, 60902-60917, 67454-67469, 114874-114889, 115272-115287, 115365-115380, 134971-134986, 102156-102171, 139682-139697, 139762-139777, 139782-139797, 144856-144871, 144938-144953, 148406-148421, 148443-148458, 148520-148535, 181695-181710, 182958-182973 или 183049-183064 из SEQ ID NO: 1, где указанный модифицированный олигонуклеотид является по меньшей мере на 90% комплементарным SEQ ID NO: 1.
Е8. Соединение, содержащее модифицированный олигонуклеотид, состоящий из 10-30 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую участок из по меньшей мере 8 смежных нуклеооснований, на 100% комплементарный участку равной длины нуклеооснований 2957-2972, 3079-3094, 3099-3114, 3109-3124, 3113-3128, 3120-3135, 3133-3148, 3224-3239, 3226-3241, 3351-3366, 3353-3368, 3361-3376, 3388-3403, 3513-3528, 3517-3532, 3519-3534, 3641-3656, 3735-3750, 3764-3779, 3768-3783, 3798-3813, 3799-3814, 3851-3866, 3870-3885, 3874-3889, 3876-3891, 3878-3893, 3884-3899, 3886-3901, 3888-3903, 3901-3916, 3956-3971, 3962-3977, 3964-3979, 3967-3982, 4019-4034, 4038-4053, 4049-4064, 4056-4071, 4059-4074, 4062-4077, 4066-4081, 4070-4085, 4101-4116, 4103-4118, 4105-4120, 4109-4124, 4305-4320, 4405-4420, 4532-4547, 4534-4549, 4537-4552, 4539-4554, 4555-4570, 4571-4586, 4573-4588, 4578-4593, 4597-4612, 4632-4647, 4655-4670, 4656-4671, 4662-4677, 4699-4714, 4747-4762, 4750-4765, 4752-4767, 4754-4769, 4755-4770, 4769-4784, 4798-4813, 4804-4819, 4807-4822, 4833-4848, 4837-4852, 4839-4854, 4865-4880, 4868-4883, 4872-4887, 4874-4889, 4876-4891, 4887-4902, 4889-4904, 4916-4931, 4918-4933, 4938-4953, 4942-4957, 4944-4959, 4951-4966, 5050-5065, 5052-5067, 5054-5069, 5056-5071, 5060-5075, 5061-5076, 5062-5077, 5733-5148, 5141-5156, 5155-5170, 5265-5280, 5293-5308, 5308-5323, 5392-5407, 5448-5463, 5469-5484, 5481-5496, 5483-5498, 5486-5501, 5488-5503, 5494-5509, 5521-5536, 5666-5681, 6222-6237, 6701-6716, 7543-7558, 8471-8486, 8638-8653, 9464-9479, 10217-10232, 10250-10265, 10865-10880, 11197-11212, 11855-11870, 13189-13204, 13321-13336, 13346-13361, 16555-16570, 16793-16808, 16968-16983, 17206-17221, 18865-18880, 29329-29344, 32290-32305, 33315-33330, 39055-39070, 40615-40630, 42017-42032, 56050-56065, 58719-58734, 58720-58739, 58721-58736, 58722-58737, 58723-58738, 58724-58739, 58725-58740, 58750-58769, 58751-58766, 58752-58767, 58753-58768, 58754-58769, 58755-58770, 60902-60917, 67454-67469, 114874-114889, 115272-115287, 115365-115380, 134971-134986, 102156-102171, 139682-139697, 139762-139777, 139782-139797, 144856-144871, 144938-144953, 148406-148421, 148443-148458, 148520-148535, 181695-181710, 182958-182973 или 183049-183064 SEQ ID NO: 1, где последовательность нуклеооснований модифицированного олигонуклеотида комплементарна SEQ ID NO: 1.
Е9. Соединение по любому из Е1, Е7 или Е8, содержащее модифицированный олигонуклеотид, состоящий 10-30 связанных нуклеозидов, комплементарных в пределах экзона 1 нуклеотидов 2957-2972, 3079-3094, 3099-3114, 3109-3124, 3113-3128, 3120-3135, 3133-3148, 3224-3239, 3226-3241, 3351-3366, 3353-3368, 3361-3376, 3388-3403, 3513-3528, 3517-3532, 3519-3534, 3641-3656, 3735-3750, 3764-3779, 3768-3783, 3798-3813, 3799-3814, 3851-3866, 3870-3885, 3874-3889, 3876-3891, 3878-3893, 3884-3899, 3886-3901, 3888-3903, 3901-3916, 3956-3971, 3962-3977, 3964-3979, 3967-3982, 4019-4034, 4038-4053, 4049-4064, 4056-4071, 4059-4074, 4062-4077, 4066-4081, 4070-4085, 4101-4116, 4103-4118, 4105-4120, 4109-4124, 4305-4320, 4405-4420, 4532-4547, 4534-4549, 4537-4552, 4539-4554, 4555-4570, 4571-4586, 4573-4588, 4578-4593, 4597-4612, 4632-4647, 4655-4670, 4656-4671, 4662-4677, 4699-4714, 4747-4762, 4750-4765, 4752-4767, 4754-4769, 4755-4770, 4769-4784, 4798-4813, 4804-4819, 4807-4822, 4833-4848, 4837-4852, 4839-4854, 4865-4880, 4868-4883, 4872-4887, 4874-4889, 4876-4891, 4887-4902, 4889-4904, 4916-4931, 4918-4933, 4938-4953, 4942-4957, 4944-4959, 4951-4966, 5050-5065, 5052-5067, 5054-5069, 5056-5071, 5060-5075, 5061-5076, 5062-5077, 5133-5148, 5141-5156, 5155-5170, 5265-5280, 5293-5308, 5308-5323, 5392-5407, 5448-5463, 5469-5484, 5481-5496, 5483-5498, 5486-5501, 5488-5503, 5494-5509 или 5521-5536 SEQ ID NO: 1.
Е10. Соединение по Е9, содержащее модифицированный олигонуклеотид, состоящий 10-30 связанных нуклеозидов, комплементарных в пределах экзона 1 нуклеотидов 5052-5067 SEQ ID NO: 1.
Е11. Соединение по любому из Е1, Е7 или Е8, содержащее модифицированный олигонуклеотид, состоящий 10-30 связанных нуклеозидов, комплементарных в пределах интрона 1 нуклеотидов 5666-5681, 6222-6237, 6701-6716, 7543-7558, 8471-8486, 8638-8653, 9464-9479, 10217-10232, 10250-10265, 10865-10880, 11197-11212, 11855-11870, 13189-13204, 13321-13336, 13346-13361, 16555-16570, 16793-16808, 16968-16983, 17206-17221, 18865-18880, 29329-29344, 32290-32305, 33315-33330, 39055-39070, 40615-40630, 42017-42032, 56050-56065, 58719-58734, 58720-58739, 58721-58736, 58722-58737, 58723-58738, 58724-58739, 58725-58740, 58750-58769, 58751-58766, 58752-58767, 58753-58768, 58754-58769, 58755-58770, 60902-60917, 67454-67469, 114874-114889, 115272-115287, 115365-115380 или 134971-134986 SEQ ID NO: 1.
E12. Соединение по Е11, содержащее модифицированный олигонуклеотид, состоящий 10-30 связанных нуклеозидов, комплементарных в пределах интрона 1 нуклеотидов 8638-8653, 11197-11212, 40615-40630, 58719-58734, 58720-58735 или 58721-58736 SEQ ID NO: 1.
E13. Соединение по любому из Е1-12, где модифицированный олигонуклеотид содержит по меньшей мере один модифицированный сахар.
Е14. Соединение по E13, где по меньшей мере один модифицированный сахар содержит 2'-O-метоксиэтильную группу.
Е15. Соединение по E13, где по меньшей мере один модифицированный сахар представляет собой бициклический сахар.
Е16. Соединение по Е15, где бициклический сахар содержит группу 4'-СН(CH3)-O-2'.
Е17. Соединение по Е15, где бициклический сахар содержит группу 4'-СН2-O-2' или 4'-(СН2)2-O-2'.
Е18. Соединение по любому из Е1-17, где модифицированный олигонуклеотид содержит по меньшей мере одну модифицированную межнуклеозидную связь.
Е19. Соединение по Е18, где каждая межнуклеозидная связь антисмыслового олигонуклеотида представляет собой фосфоротиоатную межнуклеозидную связь.
Е20. Соединение по любому из Е1-19, где модифицированный олигонуклеотид содержит по меньшей мере одно модифицированное нуклеооснование.
Е21. Соединение по Е20, где модифицированное нуклеооснование представляет собой 5-метилцитозин.
Е22. Соединение по любому из Е1-21, где модифицированный оли гону клеотид содержит:
гэп-сегмент, состоящий из связанных дезоксинуклеозидов;
5'-сегмент-"крыло", состоящий из связанных нуклеозидов; и
3'-сегмент-"крыло", состоящий из связанных нуклеозидов;
где гэп-сегмент расположен между 5'-сегментом-"крылом" и 3'-сегментом-"крылом", и где каждый нуклеозид каждого сегмента-"крыла" содержит модифицированный сахар.
Е23. Соединение по Е22, где модифицированный олигонуклеотид содержит:
гэп-сегмент, состоящий из десяти связанных дезоксинуклеозидов;
5'-сегмент-"крыло", состоящий из 3 связанных нуклеозидов; и
3'-сегмент-"крыло" состоящий из 3 связанных нуклеозидов;
где гэп-сегмент расположен между 5'-сегментом-"крылом" и 3'-сегментом-"крылом", где каждый нуклеозид каждого сегмента-"крыла" содержит 2'-O-метоксиэтил-сахар или связанный этил-сахар; и где каждая межнуклеозидная связь представляет собой фосфоротиоатную связь.
Е24. Соединение, содержащее одноцепочечный модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов, имеющих последовательность нуклеооснований, состоящую из последовательности SEQ ID NO: 35, или его фармацевтически приемлемая соль, где модифицированный олигонуклеотид содержит:
гэп-сегмент, состоящий из 9 связанных дезоксинуклеозидов;
5'-сегмент-"крыло", состоящий из трех связанных нуклеозидов; и
3'-сегмент-"крыло", состоящий из четырех связанных нуклеозидов;
где гэп-сегмент расположен между 5'-сегментом-"крылом" и 3'-сегментом-"крылом"; каждый из трех связанных нуклеозидов 5'-сегмента-"крыла" содержит связанный этил (cEt)-caxap; четыре связанных нуклеозида 3'-сегмента-"крыла" содержат связанный этил (cEt)-caxap, связанный этил (cEt)-caxap, связанный этил (cEt)-caxap и 2'-O-метоксиэтил-сахар в направлении от 5' к 3'; каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и каждый цитозин представляет собой 5-метилцитозин.
Е25. Соединение, содержащее одноцепочечный модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов, имеющих последовательность нуклеооснований, состоящую из последовательности SEQ ID NO: 39, или его фармацевтически приемлемая соль, где модифицированный олигонуклеотид содержит:
гэп-сегмент, состоящий из 9 связанных дезоксинуклеозидов;
5'-сегмент-"крыло", состоящий из трех связанных нуклеозидов; и
3'-сегмент-"крыло", состоящий из четырех связанных нуклеозидов;
где гэп-сегмент расположен между 5'-сегментом-"крылом" и 3'-сегментом-"крылом"; каждый из трех связанных нуклеозидов 5'-сегмента-"крыла" содержит связанный этил (cEt)-caxap; четыре связанных нуклеозида 3'-сегмента-"крыла" содержат связанный этил (cEt)-caxap, связанный этил (cEt)-caxap, связанный этил (cEt)-caxap и 2'-O-метоксиэтил-сахар в направлении от 5' к 3'; каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и каждый цитозин представляет собой 5-метилцитозин.
Е26. Соединение, содержащее одноцепочечный модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов, имеющих последовательность нуклеооснований, состоящую из последовательности SEQ ID NO: 39, или его фармацевтически приемлемая соль, где модифицированный олигонуклеотид содержит:
гэп-сегмент, состоящий из 8 связанных дезоксинуклеозидов;
5'-сегмент-"крыло", состоящий из четырех связанных нуклеозидов; и
3'-сегмент-"крыло", состоящий из четырех связанных нуклеозидов;
где гэп-сегмент расположен между 5'-сегментом-"крылом" и 3'-сегментом-"крылом"; четыре связанных нуклеозида 5'-сегмента-"крыла" содержат 2'-O-метоксиэтил-сахар, связанный этил (cEt)-caxap, связанный этил (cEt)-caxap и связанный этил (cEt)-caxap в направлении от 5' к 3'; четыре связанных нуклеозида 3'-сегмента-"крыла" содержат связанный этил (cEt)-caxap, связанный этил (cEt)-caxap, связанный этил (cEt)-caxap и 2'-O-метоксиэтил-сахар в направлении от 5' к 3'; каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и каждый цитозин представляет собой 5-метилцитозин.
Е27. Соединение, содержащее одноцепочечный модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов, имеющих последовательность нуклеооснований, состоящую из последовательности SEQ ID NO: 39, или его фармацевтически приемлемая соль, где модифицированный олигонуклеотид содержит:
гэп-сегмент, состоящий из 8 связанных дезоксинуклеозидов;
5'-сегмент-"крыло", состоящий из пяти связанных нуклеозидов; и
3'-сегмент-"крыло", состоящий из трех связанных нуклеозидов;
где гэп-сегмент расположен между 5'-сегментом-"крылом" и 3'-сегментом-"крылом"; пять связанных нуклеозидов 5'-сегмента-"крыла" содержат 2'-O-метоксиэтил-сахар, 2'-O-метоксиэтил-сахар, связанный этил (cEt)-caxap, связанный этил (cEt)-caxap и связанный этил (cEt)-caxap в направлении от 5' к 3'; каждый из трех связанных нуклеозидов 3'-сегмента-"крыла" содержит связанный этил (cEt)-caxap; каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и каждый цитозин представляет собой 5-метилцитозин.
Е28. Соединение, содержащее одноцепочечный модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов, имеющих последовательность нуклеооснований, состоящую из последовательности SEQ ID NO: 39, или его фармацевтически приемлемая соль, где модифицированный олигонуклеотид содержит:
гэп-сегмент, состоящий из 7 связанных дезоксинуклеозидов;
5'-сегмент-"крыло", состоящий из четырех связанных нуклеозидов; и
3'-сегмент-"крыло", состоящий из пяти связанных нуклеозидов;
где гэп-сегмент расположен между 5'-сегментом-"крылом" и 3'-сегментом-"крылом"; четыре связанных нуклеозида 5'-сегмента-"крыла" содержат 2'-O-метоксиэтил-сахар, связанный этил (cEt)-caxap, связанный этил (cEt)-caxap и связанный этил (cEt)-caxap в направлении от 5' к 3'; пять связанных нуклеозидов 3'-сегмента-"крыла" содержат связанный этил (cEt)-caxap, связанный этил (cEt)-caxap, связанный этил (cEt)-caxap, 2'-O-метоксиэтил-сахар и 2'-O-метоксиэтил-сахар в направлении от 5' к 3'; каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и каждый цитозин представляет собой 5-метилцитозин.
Е29. Соединение, содержащее одноцепочечный модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов, имеющих последовательность нуклеооснований, состоящую из последовательности SEQ ID NO: 35, или его фармацевтически приемлемая соль, где модифицированный олигонуклеотид содержит:
гэп-сегмент, состоящий из 7 связанных дезоксинуклеозидов;
5'-сегмент-"крыло", состоящий из шести связанных нуклеозидов; и
3'-сегмент-"крыло", состоящий из трех связанных нуклеозидов;
где гэп-сегмент расположен между 5'-сегментом-"крылом" и 3'-сегментом-"крылом"; шесть связанных нуклеозидов 5'-сегмента-"крыла" содержат 2'-O-метоксиэтил-сахар, связанный этил (cEt)-caxap, связанный этил (cEt)-caxap, 2'-O-метоксиэтил-сахар, связанный этил (cEt)-caxap и связанный этил (cEt)-caxap в направлении от 5' к 3'; каждый из трех связанных нуклеозидов 3'-сегмента-"крыла" содержит связанный этил (cEt)-сахар; каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и каждый цитозин представляет собой 5-метилцитозин.
Е30. Соединение, содержащее одноцепочечный модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов, имеющих последовательность нуклеооснований, состоящую из последовательности SEQ ID NO: 43, или его фармацевтически приемлемая соль, где модифицированный олигонуклеотид содержит:
гэп-сегмент, состоящий из 10 связанных дезоксинуклеозидов;
5'-сегмент-"крыло", состоящий из трех связанных нуклеозидов; и
3'-сегмент-"крыло", состоящий из трех связанных нуклеозидов;
где гэп-сегмент расположен между 5'-сегментом-"крылом" и 3'-сегментом-"крылом"; каждый нуклеозид каждого сегмента-"крыла" содержит связанный этил (cEt)-caxap; каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и каждый цитозин представляет собой 5-метилцитозин.
Е31. Соединение, содержащее одноцепочечный модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов, имеющих последовательность нуклеооснований, состоящую из последовательности SEQ ID NO: 124, или его фармацевтически приемлемая соль, где модифицированный олигонуклеотид содержит:
гэп-сегмент, состоящий из 10 связанных дезоксинуклеозидов;
5'-сегмент-"крыло", состоящий из трех связанных нуклеозидов; и
3'-сегмент-"крыло", состоящий из трех связанных нуклеозидов;
где гэп-сегмент расположен между 5'-сегментом-"крылом" и 3'-сегментом-"крылом"; каждый нуклеозид каждого сегмента-"крыла" содержит связанный этил (cEt)-caxap; каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и каждый цитозин представляет собой 5-метилцитозин.
Е32. Соединение, содержащее одноцепочечный модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов, имеющих последовательность нуклеооснований, состоящую из последовательности SEQ ID NO: 150, или его фармацевтически приемлемая соль, где модифицированный олигонуклеотид содержит:
гэп-сегмент, состоящий из 10 связанных дезоксинуклеозидов;
5'-сегмент-"крыло", состоящий из трех связанных нуклеозидов; и
3'-сегмент-"крыло", состоящий из трех связанных нуклеозидов;
где гэп-сегмент расположен между 5'-сегментом-"крылом" и 3'-сегментом-"крылом"; каждый нуклеозид каждого сегмента-"крыла" содержит связанный этил (cEt)-caxap; каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и каждый цитозин представляет собой 5-метил цитозин.
Е33. Соединение, содержащее одноцепочечный модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов, имеющих последовательность нуклеооснований, состоящую из последовательности SEQ ID NO: 155, или его фармацевтически приемлемая соль, где модифицированный олигонуклеотид содержит:
гэп-сегмент, состоящий из 10 связанных дезоксинуклеозидов;
5'-сегмент-"крыло", состоящий из трех связанных нуклеозидов; и
3'-сегмент-"крыло", состоящий из трех связанных нуклеозидов;
где гэп-сегмент расположен между 5'-сегментом-"крылом" и 3'-сегментом-"крылом"; каждый нуклеозид каждого сегмента-"крыла" содержит связанный этил (cEt)-caxap; каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и каждый цитозин представляет собой 5-метилцитозин.
Е34. Соединение, содержащее одноцепочечный модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов, имеющих последовательность нуклеооснований, состоящую из последовательности SEQ ID NO: 169, или его фармацевтически приемлемая соль, где модифицированный олигонуклеотид содержит:
гэп-сегмент, состоящий из 10 связанных дезоксинуклеозидов;
5'-сегмент-"крыло", состоящий из трех связанных нуклеозидов; и
3'-сегмент-"крыло", состоящий из трех связанных нуклеозидов;
где гэп-сегмент расположен между 5'-сегментом-"крылом" и 3'-сегментом-"крылом"; каждый нуклеозид каждого сегмента-"крыла" содержит связанный этил (cEt)-caxap; каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и каждый цитозин представляет собой 5-метилцитозин.
Е35. Соединение, содержащее одноцепочечный модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов, имеющих последовательность нуклеооснований, состоящую из последовательности SEQ ID NO: 175, или его фармацевтически приемлемая соль, где модифицированный олигонуклеотид содержит:
гэп-сегмент, состоящий из 10 связанных дезоксинуклеозидов;
5'-сегмент-"крыло", состоящий из трех связанных нуклеозидов; и
3'-сегмент-"крыло", состоящий из трех связанных нуклеозидов;
где гэп-сегмент расположен между 5'-сегментом-"крылом" и 3'-сегментом-"крылом"; каждый нуклеозид каждого сегмента-"крыла" содержит связанный этил (cEt)-caxap; каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и каждый цитозин представляет собой 5-метилцитозин.
Е36. Соединение по любому из Е1-35, где модифицированный олигонуклеотид является по меньшей мере на 90% комплементарным нуклеиновой кислоте, кодирующей рецептор андрогенов.
Е37. Соединение по любому из Е1-36, где антисмысловой олигонуклеотид является на 100% комплементарным нуклеиновой кислоте, кодирующей рецептор андрогенов.
Е38. Соединение по Е37, где нуклеиновая кислота, кодирующая рецептор андрогенов, содержит нуклеотидную последовательность любой из SEQ ID NO: 1-8.
E39. Композиция, содержащая соединение по любому из Е1-38 или его фармацевтически приемлемую соль и фармацевтически приемлемый разбавитель или носитель.
Е40. Композиция, содержащая соединение по любому из Е1-38 и диарилгидантоиновый ингибитор рецептора андрогенов (AR) формулы XVI:

где Х выбран из группы, состоящей из трифторметила и йода, где W выбран из группы, состоящей из О и NR5, где R5 выбран из группы, состоящей из Н, метила и
где D представляет собой S или О, и Е представляет собой N или О, и G представляет собой алкил, арил, замещенный алкил или замещенный арил; или D представляет собой S или О, и E-G вместе представляют собой С1-С4 низший алкил,
где R1 и R2 вместе содержат восемь или меньше атомов углерода и выбраны из группы, состоящей из алкила, замещенного алкила, включая галогеноалкил, и вместе с атомом углерода, с которым они связаны, образуют циклоалкильную или замещенную циклоалкильную группу,
где R3 выбран из группы, состоящей из водорода, галогена, метила, С1-С4алкокси, формила, галогенацетокси, трифторметила, циано, нитро, гидроксила, фенила, амино, метилкарбамоила, метоксикарбонила, ацетамидо, метансульфонамино, метансульфонила, 4-метансульфонил-1 -пиперизинила, пиперизинила и С1-С6алкила или алкенила, возможно замещенного гидроксилом, метокси карбон илом, циано, амино, амидо, нитро, карбамоилом или замещенным карбамоилом, включая метилкарбамоил, диметилкарбамоил и гидроксиэтилкарбамоил,
где R4 выбран из группы, состоящей из водорода, галогена, алкила и галогеноалкила, и
где R3 не является метиламинометилом или диметиламинометилом.
R5 может представлять собой

Е41. Композиция по Е40, где диарилгидантоиновым ингибитором рецептора андрогенов (AR) является MDV3100.
Е42. Композиция, содержащая соединение по любому из Е1-38 и антиандрогенный агент, выбранный из MDV3100, ARN-059, ODM-201, абиратерона, TOK001, TAK700 и VT464.
Е43. Способ лечения рака, включающий введение субъекту, имеющему рак, соединения по любому из Е1-38 или композиции по любому из Е39-42, осуществляя тем самым лечение рака у субъекта.
Е44. Антисмысловое соединение по любому из Е1-38 или композиция по любому из Е39-42 для применения в лечении рака.
Е45. Соединение или композиция по Е44, где рак представляет собой рак предстательной железы, рак молочной железы, рак яичника, рак желудка или рак мочевого пузыря.
Е46. Соединение или композиция по Е45, где рак представляет собой резистентный к кастрации рак предстательной железы.
Е47. Соединение или композиция по Е46, где резистентный к кастрации рак предстательной железы является резистентным к антиандрогенному агенту, выбранному из MDV3100, ARN-059, ODM-201, абиратерона, TOK001, TAK700 и VT464.
Е48. Способ по Е43, где рак представляет собой рак предстательной железы, рак молочной железы, рак яичника, рак желудка или рак мочевого пузыря.
Е49. Способ по Е48, где рак представляет собой резистентный к кастрации рак предстательной железы.
Е50. Способ по Е49, где резистентный к кастрации рак предстательной железы является резистентным к антиандрогенному агенту, выбранному из MDV3100, ARN-059, ODM-201, абиратерона, TOK001, TAK700 и VT464.
Е51. Соединение по Е44-47 или способ по Е49 или Е50, где антисмысловое соединение направленно воздействует на вариант сплайсинга AR.
Е52. Соединение или способ по Е51, где вариант сплайсинга AR не имеет функционального лиганд-связывающего домена.
Е53. Соединение по Е44-47 или способ по любому из Е49-52, где антисмысловое соединение способно снижать экспрессию полноразмерного AR и варианта сплайсинга AR, не имеющего любого одного из экзонов 4-8.
Е54. Соединение или способ по Е51, где вариант сплайсинга AR состоит из экзонов 1-3.
Е55. Соединение по Е44-47 или способ по любому из Е49-52, где антисмысловое соединение направленно воздействует на AR выше 3'-конца экзона 3 и способно ингибировать рост или пролиферацию клетки рака предстательной железы в большей степени, чем антисмысловое соединение, направленно воздействующее на область AR ниже 3'-конца экзона 3.
Е56. Соединение или способ по Е55, где антисмысловое соединение, направленно воздействующее на область AR ниже 3'-конца экзона 3, способно снижать уровни полноразмерного AR, но не вариант сплайсинга AR, состоящий из экзонов 1-3.
Е57. Соединение или способ по Е56, где область ниже 3'-конца экзона 3 содержит экзон 4.
Е58. Соединение по Е44-47 или способ по любому из Е49-52, где клетка рака предстательной железы экспрессирует преимущественно вариант сплайсинга AR по сравнению с полноразмерным AR.
Е59. Соединение или способ по Е58, где вариант сплайсинга AR не имеет функционального лиганд-связывающего домена.
Е60. Способ лечения рака предстательной железы, резистентного к антиандрогенному агенту, выбранному из MDV3100, ARN-059, ODM-201, абиратерона, TOK001, TAK700 и VT464, у субъекта, включающий введение субъекту антисмыслового соединения, направленно воздействующего на рецептор андрогенов (AR) человека выше 3'-конца экзона 3, тем самым осуществляя лечение рака предстательной железы.
Е61. Способ по Е60, где у субъекта диагностирован рак предстательной железы, резистентный к антиандрогенному агенту, выбранному из MDV3100, ARN-059, ODM-201, абиратерона, TOK001, TAK700 и VT464.
Е62. Способ по Е60 или Е61, где антисмысловое соединение направленно воздействует на вариант сплайсинга AR.
Е63. Способ по Е62, где вариант сплайсинга AR не имеет функционального лиганд-связывающего домена.
Е64. Способ по любому из Е60-63, где антисмысловое соединение способно снижать экспрессию полноразмерного AR и варианта сплайсинга AR, не имеющего любого одного из экзонов 4-8.
Е65. Способ по Е64, где вариант сплайсинга AR состоит из экзонов 1-3.
Е66. Способ по любому из Е60-65, где антисмысловое соединение направленно воздействует на AR выше 3'-конца экзона 3 и способно ингибировать рост или пролиферацию клетки рака предстательной железы, резистентного к диарилгидантоиновому ингибитору рецептора андрогенов (AR), в большей степени, чем антисмысловое соединение, направленно воздействующее на область AR ниже 3'-конца экзона 3.
Е67. Способ по Е66, где антисмысловое соединение, направленно воздействующее на область AR ниже 3'-конца экзона 3, способно снижать уровни полноразмерного AR, но не варианта сплайсинга AR, не имеющего любого одного из экзонов 4-8.
Е68. Способ по Е67, где вариант сплайсинга AR состоит из экзонов 1-3.
Е69. Способ по Е68, где область ниже 3'-конца экзона 3 содержит экзон 4.
Е70. Способ по любому из Е60-69, где рак предстательной железы является резистентным к кастрации.
Е71. Способ по любому из Е60-70, где рак предстательной железы содержит клетки, которые экспрессируют преимущественно вариант сплайсинга AR по сравнению с полноразмерным AR.
Е72. Способ по Е71, где вариант сплайсинга AR не имеет любого одного из экзонов 4-8.
Е73. Способ по Е72, где вариант сплайсинга AR состоит из экзонов 1-3.
Е74. Способ по Е72, где вариант сплайсинга AR не имеет функционального лиганд-связывающего домена.
Е75. Способ ингибирования роста или пролиферации клетки рака предстательной железы, включающий приведение клетки рака предстательной железы в контакт с антисмысловым соединением, направленно воздействующим на рецептор андрогенов (AR) человека, и антиандрогенным агентом, выбранным из MDV3100, ARN-059, ODM-201, абиратерона, TOK001, TAK700 и VT464, где антисмысловое соединение и антиандрогенный агент в комбинации оказывают синергетическое действие в отношении ингибирования роста или пролиферации клетки рака предстательной железы.
Е76. Способ по Е75, где антисмысловое соединение направленно воздействует на AR выше 3'-конца экзона 3.
Е77. Способ по Е75 или Е76, где клетку рака предстательной железы приводят в контакт с некоторым количеством антисмыслового соединения и некоторым количеством антиандрогенного агента, которые, каждое или оба, в комбинации меньше, чем количество либо только антисмыслового соединения, либо только антиандрогенного агента, эффективным в ингибировании роста или пролиферации указанной клетки рака предстательной железы.
Е78. Способ по любому из Е75-77, где антисмысловое соединение и антиандрогенный агент обеспечивают более чем аддитивный эффект по сравнению с только антисмысловым соединением или только антиандрогенным агентом в ингибировании роста или пролиферации указанной клетки рака предстательной железы.
Е79. Способ по любому из Е75-78, где антисмысловое соединение направленно воздействует на вариант сплайсинга AR.
Е80. Способ по Е79, где вариант сплайсинга AR не имеет функционального лиганд-связывающего домена.
Е81. Способ по любому из Е75-80, где антисмысловое соединение способно снижать экспрессию полноразмерного AR и варианта сплайсинга AR, состоящего из экзонов 1-3.
Е82. Способ ингибирования роста или пролиферации рецептор андрогенов (АР)-позитивной клетки рака молочной железы, включающий приведение клетки рака молочной железы в контакт с антисмысловым соединением, направленно воздействующим на рецептор андрогенов (AR) человека, при котором ингибируется рост или пролиферация клетки рака молочной железы.
Е83. Способ ингибирования экспрессии AR у субъекта, имеющего AR-позитивный рак молочной железы или имеющего риск возникновения рецептор андрогенов (АК)-позитивного рака молочной железы, включающий:
идентификацию субъекта, имеющего AR-позитивный рак молочной железы или имеющего риск возникновения AR-позитивного рака молочной железы, и
введение субъекту антисмыслового соединения, направленно воздействующего на AR человека,
где антисмысловое соединение ингибирует экспрессию AR у субъекта.
Е84. Способ лечения AR-позитивного рака молочной железы у субъекта, включающий введение субъекту антисмыслового соединения, направленно воздействующего на рецептор андрогенов (AR) человека, тем самым осуществляя лечение рака молочной железы у субъекта.
Е85. Способ по любому из Е82-84, где AR-позитивный рак молочной железы или клетка рака молочной железы зависит от экспрессии андрогенов для роста.
Е86. Способ по любому из Е82-85, где рак молочной железы или клетка рака молочной железы является рецептор эстрогенов (ЕР)-негативным(ой), рецептор прогестерона (PR)-негативным(ой) или Her2/neu-негативным(ой).
Е87. Способ по любому из Е82-85, где рак молочной железы или клетка рака молочной железы является ER-позитивным(ой) и AR-позитивным(ой).
Е88. Способ по любому из Е82-85, где рак молочной железы или клетка рака молочной железы является ER-негативным(ой) и AR-позитивным(ой).
Е89. Способ по любому из Е82-88, где рак молочной железы или клетка рака молочной железы является апокринным раком молочной железы или клеткой апокринного рака молочной железы.
Е90. Способ по любому из Е60-88, где антисмысловое соединение представляет собой соединение по любому из Е1-38 или его фармацевтически приемлемую соль.
Е91. Способ по любому из Е60-88, где антисмысловое соединение представляет собой соединение по любому из Е24-35 или его фармацевтически приемлемую соль.
ПРИМЕРЫ
Не являющееся ограничительным раскрытие предмета изобретения и включение посредством ссылки
Хотя некоторые соединения, композиции и способы, описанные в данном документе с конкретностью согласно некоторым воплощениям, приведенные ниже примеры служат только для иллюстрации соединений, описанных в данном документе, и не предназначены для ограничения таковых. Каждый из источников информации, процитированный в настоящей заявке, во всей полноте включен в нее посредством ссылки.
Пример 1: Антисмысловое ингибирование AR человека в клетках HuVEC
Антисмысловые олигонуклеотиды были сконструированы для направленного воздействия на нуклеиновую кислоту AR и были протестированы в отношении их эффектов на мРНК AR in vitro. Антисмысловые олигонуклеотиды тестировали в серии экспериментов в сходных культуральных условиях. Результаты для каждого эксперимента представлены в отдельных таблицах, приведенных ниже. Культивированные клетки HuVEC при плотности 20000 клеток на лунку трансфицировали методом электропорации с использованием 500 нМ антисмыслового олигонуклеотида. После обработки в течение приблизительно 24 часов РНК выделяли из клеток, и уровни мРНК AR измеряли методом количественной ПЦР (полимеразная цепная реакция) в реальном времени. Для измерения уровней мРНК использовали комплект праймеров и зондов для человека RTS3559 (прямая последовательность TCCTTCACCAATGTCAACTCC, обозначенная в данном документе как SEQ ID N0: 9; обратная последовательность GAGCCATCCAAACTCTTGAGA, обозначенная как SEQ ID NO: 10; последовательность зонда AGTACCGCATGCACAAGTCCCG, обозначенная в данном документе как SEQ ID NO: 11). Уровни мРНК AR корректировали в соответствии с общим содержанием РНК, которое измеряли с использованием RIBOGREEN®. Результаты представлены в виде процента ингибирования AR относительно необработанных контрольных клеток. Всего было протестировано 155 олигонуклеотидов. В Таблицах 1 и 2 показаны только те олигонуклеотиды, которые были отобраны для дальнейшего исследования.
Впервые сконструированные химерные антисмысловые олигонуклеотиды в Таблицах 1 и 2 были сконструированы как гэпмеры 3-10-3 (S)-cET. Гэпмеры представляют собой гэпмеры длиной 16 нуклеозидов, где центральный гэп-сегмент содержит десять 2'-дезоксинуклеозидов и фланкирован содержащими три нуклеозида сегментами-крыльями" как по 5'-направлению, так и по 3'-направлению. Каждый нуклеозид в 5'-сегменте-"крыле" и каждый нуклеозид в 3'-сегменте-"крыле" имеет (S)-cEt модификацию. Межнуклеозидные связи по всей длине каждого гэпмера являются фосфоротиоатными связями. Все цитозиновые остатки по всей длине каждого гэпмера являются 5-метилцитозиновыми остатками. "Сайт инициации" означает нуклеозид с самого 5'-конца, на который гэпмер нацелен в последовательности гена человека. "Стоп-сайт" означает нуклеозид с самого 3'-конца, на который гэпмер нацелен в последовательности гена человека. Каждый гэпмер, указанный в Таблицах 1 и 2, направленно воздействует либо на геномную последовательность AR человека, обозначенную как SEQ ID NO: 1 (GENBANK, номер доступа NT_011669.17, с усечением нуклеотидов от 5079000 до 5270000), либо на последовательность мРНК AR человека, обозначенную как SEQ ID NO: 2 (GENBANK, номер доступа НМ_000044.3), либо на обе. "n/а" ("нет данных") означает, что олигонуклеотид не оказывает направленного воздействия на данную последовательность гена.


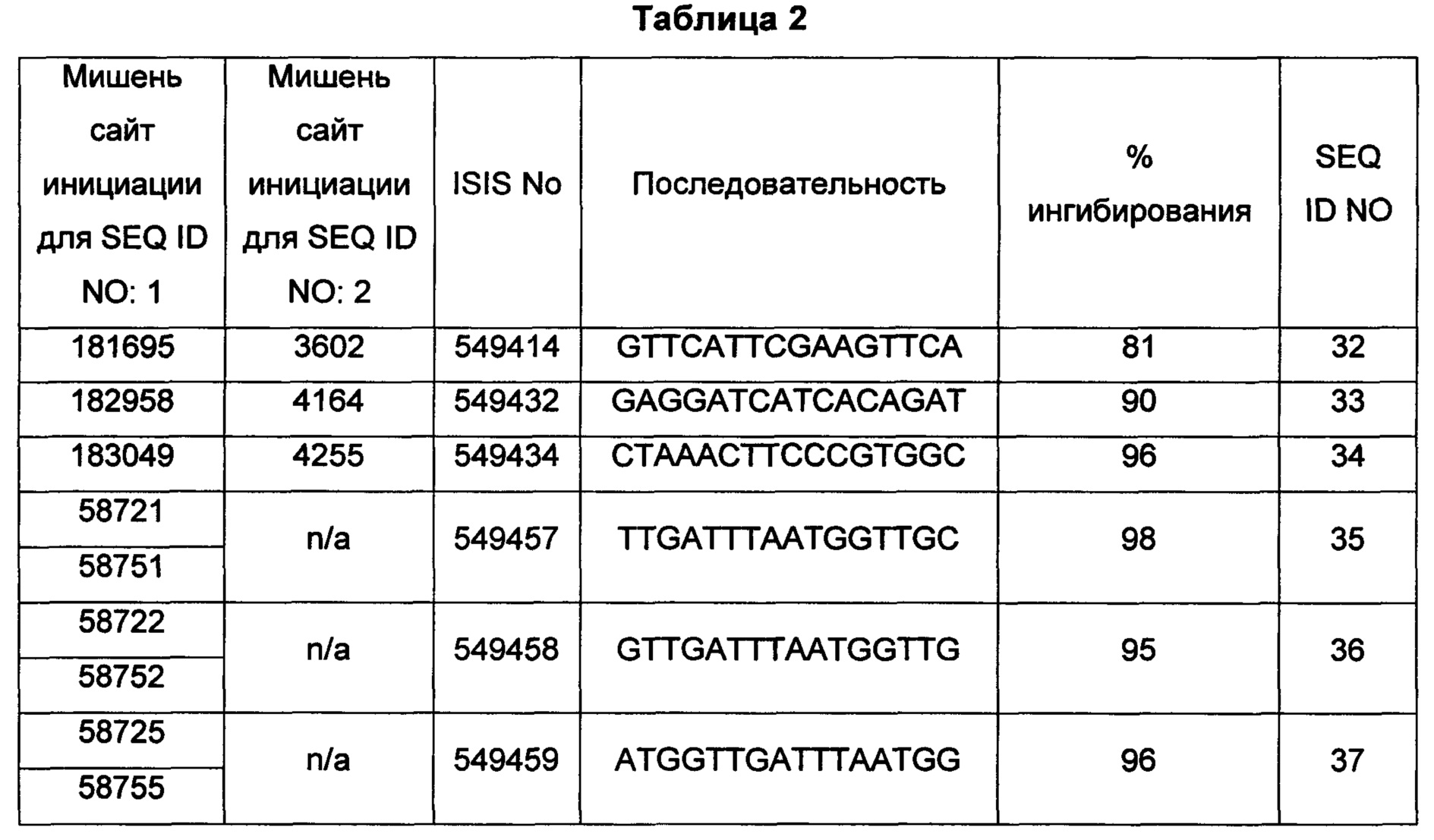
Пример 2: Зависимое от дозы антисмысловое ингибирование AR человека в клетках HuVEC
Гэпмеры из описанного выше исследования, демонстрирующие значительное ингибирование мРНК AR in vitro, были отобраны и протестированы в различных дозах в клетках HuVEC. Клетки высевали при плотности 20000 клеток на лунку и трансфицировали методом элекгропорации антисмысловым олигонуклеотидом в концентрациях 18,5 нМ, 55,6 нМ, 166,7 нМ, 500,0 нМ и 1500,0 нМ, как конкретно указано в Таблицах 3 и 4. После обработки в течение приблизительно 16 часов РНК выделяли из клеток, и уровни мРНК AR измеряли количественной ПЦР в реальном времени. Для измерения уровней мРНК использовали комплект праймеров и зондов для AR человека RTS3559. Уровни мРНК AR корректировали в соответствии с общим содержанием РНК, который измеряли с помощью RIBOGREEN®. Результаты представлены в виде процента ингибирования AR относительно необработанных контрольных клеток. Антисмысловые олигонуклеотиды тестировали в серии экспериментов в сходных условиях. Результаты для каждого эксперимента представлены в отдельных таблицах, приведенных ниже.
Полумаксимальная ингибирующая концентрация (IC50) каждого олигонуклеотида также представлена в Таблицах 3 и 4. Как проиллюстрировано, уровни мРНК AR в обработанных антисмысловыми олигонуклеотидами клетках снижались в зависимости от дозы.

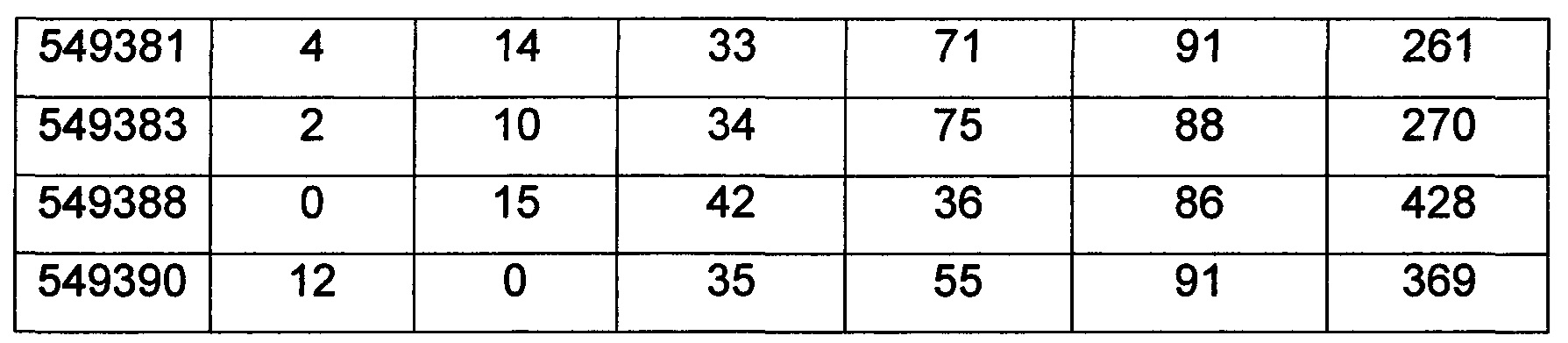

Пример 3: Антисмысловое ингибирование AR человека в клетках HuVEC
Дополнительные антисмысловые олигонуклеотиды были сконструированы для направленного воздействия на нуклеиновую кислоту AR и были протестированы в отношении их воздействия на мРНК AR in vitro. Культивированные клетки HuVEC при плотности 20000 клеток на лунку трансфицировали методом электропорации 500 нМ антисмысловым олигонуклеотидом. После обработки в течение приблизительно 24 часов РНК выделяли из клеток, и уровни мРНК AR измеряли количественной ПЦР в реальном времени. Для измерения уровней мРНК использовали комплект праймеров и зондов для человека RTS3559. Уровни мРНК AR корректировали в соответствии с общим содержанием РНК, который измеряли с помощью RIBOGREEN®. Результаты представлены в виде процента ингибирования AR относительно необработанных контрольных клеток. Всего было протестировано 82 олигонуклеотида. Только те олигонуклеотиды, которые были отобраны для дальнейшего исследования, показаны в Таблице 5.
Впервые сконструированные новые химерные антисмысловые олигонуклеотиды, указанные в Таблице 5, были сконструированы в виде 3-10-3 (S)-сЕТ-гэпмеров или 5-10-5 МОЕ-гэпмеров. 3-10-3 (S)-cEt-гэпмеры представляют собой гэпмеры длиной 16 нуклеозидов, где центральный гэп-сегмент содержит десять 2'-дезоксинуклеозидов и фланкирован содержащими три нуклеозида сегментами-крыльями" как по 5'-направлению, так и по 3'-направлению. Каждый нуклеозид в 5'-сегменте-"крыле" и каждый нуклеозид в 3'-сегменте-"крыле" имеет (S)-cEt модификацию. 5-10-5 МОЕ-гэпмер представляет собой гэпмер длиной 20 нуклеозидов, в котором центральный гэп-сегмент содержит десять 2'-дезоксинуклеозидов и фланкирован содержащими по пять нуклеозидов сегментами-Крыльями" как по 5'-направлению, так и по 3'-направлению. Каждый нуклеозид в 5'-сегменте-"крыле" и каждый нуклеозид в 3'-сегменте-"крыле" имеет 2'-МОЕ модификацию. Межнуклеозидные связи по всей длине каждого гэпмера являются фосфоротиоатными связями. Все цитозининовые остатки по всей длине каждого гэпмера являются 5-метилцитозинами. "Сайт инициации" означает нуклеозид с самого 5'-конца, на который гэпмер нацелен в последовательности гена человека. "Стоп-сайт" означает нуклеозид с самого 3'-конца, на который гэпмер нацелен в последовательности гена человека. Каждый гэпмер, указанный в Таблице 5, направленно воздействует на геномную последовательность AR человека, обозначенную в данном документе как SEQ ID NO: 1 (GENBANK, номер доступа NT_011669.17, с усечением нуклеотидов 5079000-5270000).
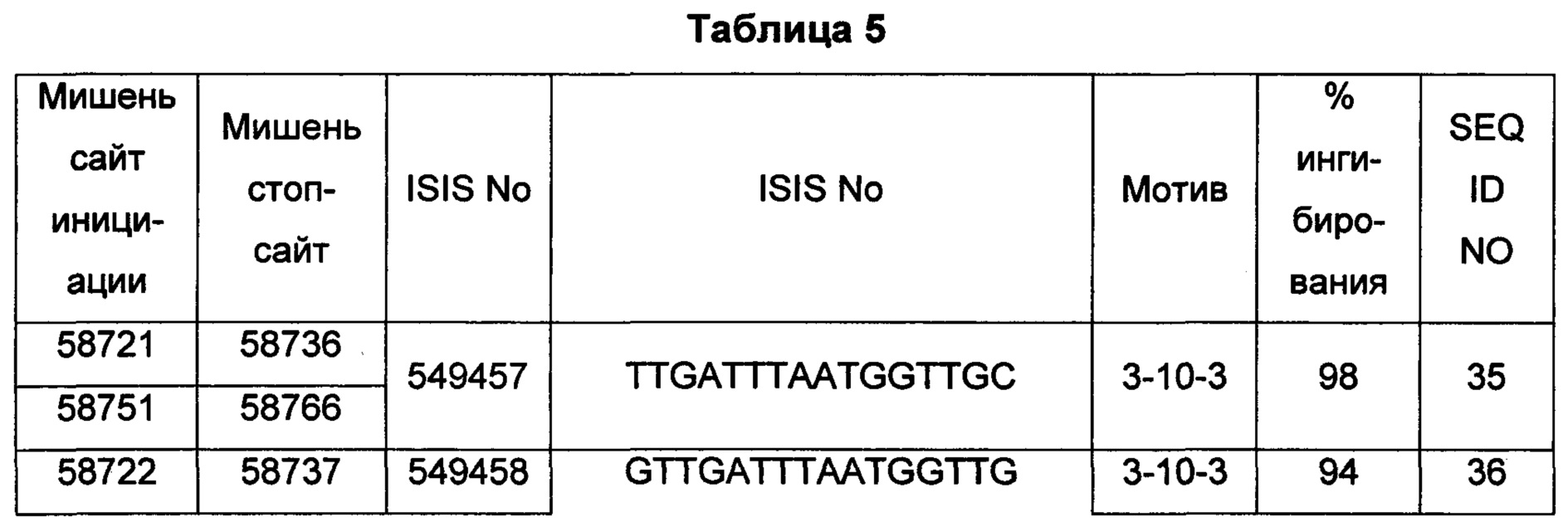

Пример 4: Зависимое от дозы антисмысловое ингибирование AR человека в клетках HuVEC
Гэпмеры из описанных выше исследований, демонстрирующие значительное ингибирование AR мРНК in vitro, были отобраны и протестированы в различных дозах в клетках HuVEC. Клетки высевали при плотности 20000 клеток на лунку и трансфицировали методом электропорации антисмысловым олигонуклеотидом в концентрациях 31,3 нМ, 62,5 нМ, 125,0 нМ, 250,0 нМ, 500,0 нМ и 1000,0 нМ, как конкретно указано в Таблице 6. После обработки в течение приблизительно 16 часов РНК выделяли из клеток, и уровни мРНК AR измеряли количественной ПЦР в реальном времени. Для измерения уровней мРНК использовали комплект праймеров и зондов для AR человека RTS3559. Уровни мРНК AR корректировали в соответствии с общим содержанием РНК, которое измеряли с помощью RIBOGREEN®. Результаты представлены в виде процента ингибирования AR относительно необработанных контрольных клеток. Антисмысловые олигонуклеотиды тестировали в серии экспериментов в сходных условиях. Результаты для каждого эксперимента представлены в отдельных таблицах, приведенных ниже.
Полумаксимальная ингибирующая концентрация (IC50) каждого олигонуклеотида также указана в Таблице 6. Как проиллюстрировано, уровни мРНК AR в клетках, обработанных антисмысловыми олигонуклеотидами, снижались в зависимости от дозы.

Пример 5: Антисмысловое ингибирование AR человека в клетках HuVEC
Дополнительные антисмысловые олигонуклеотиды были сконструированы для направленного воздействия на нуклеиновую кислоту AR и были протестированы в отношении их воздействия на мРНК AR in vitro. Культивированные клетки HuVEC при плотности 20000 клеток на лунку трансфицировали методом электропорации 250 нМ антисмысловым олигонуклеотидом. После обработки в течение приблизительно 24 часов РНК выделяли из клеток, и уровни мРНК AR измеряли количественной ПЦР в реальном времени. Для измерения уровней мРНК использовали комплект праймеров и зондов для человека RTS3559. Уровни мРНК AR корректировали в соответствии с общим содержанием РНК, которое измеряли с помощью RIBOGREEN®. Результаты представлены в виде процента ингибирования AR относительно необработанных контрольных клеток. Всего было протестировано 40 олигонуклеотидов. Только те олигонуклеотиды, которые были отобраны для дальнейшего исследования, показаны в Таблице 7.
Впервые сконструированные химерные антисмысловые олигонуклеотиды, указанные в Таблице 7, были сконструированы в виде 3-10-3 (S)-cET гэпмеров или дезокси, МОЕ и (S)-cEt олигонуклеотидов. 3-10-3 (S)-cEt гэпмеры представляют собой гэпмеры длиной 16 нуклеозидов, где центральный гэп-сегмент содержит десять 2'-дезоксинуклеозидов и фланкирован содержащими по нуклеозида сегментами-крыльями" как по 5'-направлению, так и по 3'-направлению. Каждый нуклеозид в 5'-сегменте-"крыле" и каждый нуклеозид в 3'-сегменте-"крыле" имеет (S)-cEt модификацию. Дезокси, МОЕ и (S)-cEt олигонуклеотиды представляют собой олигонуклеотиды длиной 16 нуклеозидов, где нуклеозид имеет МОЕ модификацию сахара, (S)-cEt модификацию сахара или дезокси модификацию. В графе "Химия" указаны модификации Сахаров каждого олигонуклеотида. "k" означает (S)-cEt модификацию сахара; число означает количество дезоксинуклеозидов; и "е" означает МОЕ модификацию. Межнуклеозидные связи по всей длине каждого гэпмера являются фосфоротиоатными связями. Все цитозининовые остатки по всей длине каждого гэпмера являются 5-метилцитозинами. SEQ ID NO, указанные в таблице, относятся к олигонуклеотидной последовательности. "Сайт инициации" означает нуклеозид с самого 5'-конца, на который гэпмер нацелен в последовательности гена человека. "Стоп-сайт" означает нуклеозид с самого 3'-конца, на который гэпмер нацелен в последовательности гена человека. Каждый гэпмер, указанный в Таблице 7, направленно воздействует на геномную последовательность AR человека, обозначенную как SEQ ID NO: 1 (GENBANK, номер доступа NT_011669.17, с усечением нуклеотидов 5079000-5270000).


Пример 6: Зависимое от дозы антисмысловое ингибирование AR человека в клетках HuVEC
Гэпмеры из описанных выше исследований, демонстрирующие значительное ингибирование мРНК AR in vitro, были отобраны и протестированы в различных дозах в клетках HuVEC. Клетки высевали при плотности 20000 клеток на лунку и трансфицировали методом электропорации антисмысловым олигонуклеотидом в концентрациях 31,3 нМ, 62,5 нМ, 125,0 нМ, 250,0 нМ, 500,0 нМ и 1000,0 нМ, как указано в Таблице 8. После обработки в течение приблизительно 16 часов РНК выделяли из клеток, и уровни мРНК AR измеряли количественной ПЦР в реальном времени. Для измерения уровней мРНК использовали комплект праймеров и зондов для AR человека RTS3559. Уровни мРНК AR корректировали в соответствии с общим содержанием РНК, которое измеряли с помощью RIBOGREEN®. Результаты представлены в виде процента ингибирования AR относительно необработанных контрольных клеток. Антисмысловые олигонуклеотиды тестировали в серии экспериментов в сходных условиях. Результаты для каждого эксперимента представлены в отдельных таблицах, приведенных ниже.
Полу максимальная ингибирующая концентрация (IC50) каждого олигонуклеотида также представлена в Таблице 8. Как проиллюстрировано, уровни мРНК AR в клетках, обработанных антисмысловыми олигонуклеотидами, снижались в зависимости от дозы.

Пример 7: Зависимое от дозы антисмысловое ингибирование AR человека в клетках HuVEC
Дополнительные антисмысловые олигонуклеотиды были сконструированы в виде дезокси, МОЕ и (S)-cEt олигонуклеотидов, направленно воздействующих на последовательность гена AR и были протестированы в различных дозах в клетках HuVEC. Олигонуклеотиды представляют собой олигонуклеотиды длиной 16 нуклеозидов, в которых нуклеозид имеет МОЕ модификацию сахара, (S)-cEt модификацию сахара или дезокси модификацию. В графе "Химия" указаны модификации сахара каждого олигонуклеотида. "k" означает (S)-cEt модификация сахара; число означает количество дезоксинуклеозидов; или же "d" означает дезоксирибозу; и "е" означает МОЕ модификацию. Межнуклеозидные связи по всей длине каждого гэпмера являются фосфоротиоатными связями. Все цитозининовые остатки по всей длине каждого гэпмера являются 5-метилцитозинами. SEQ ID NO, указанная в таблице, относится к олигонуклеотидной последовательности. "Сайт инициации" означает нуклеозид с самого 5'-конца, на который гэпмер нацелен в последовательности гена человека. "Стоп-сайт" означает нуклеозид с самого 3'-конца, на который гэпмер нацелен в последовательности гена человека. Каждый гэпмер, указанный в Таблице 9, направленно воздействует на геномную последовательность AR человека, обозначенную в данном документе как SEQ ID NO: 1 (GENBANK, номер доступа NT_011669.17, с усечением нуклеотидов 5079000-5270000).
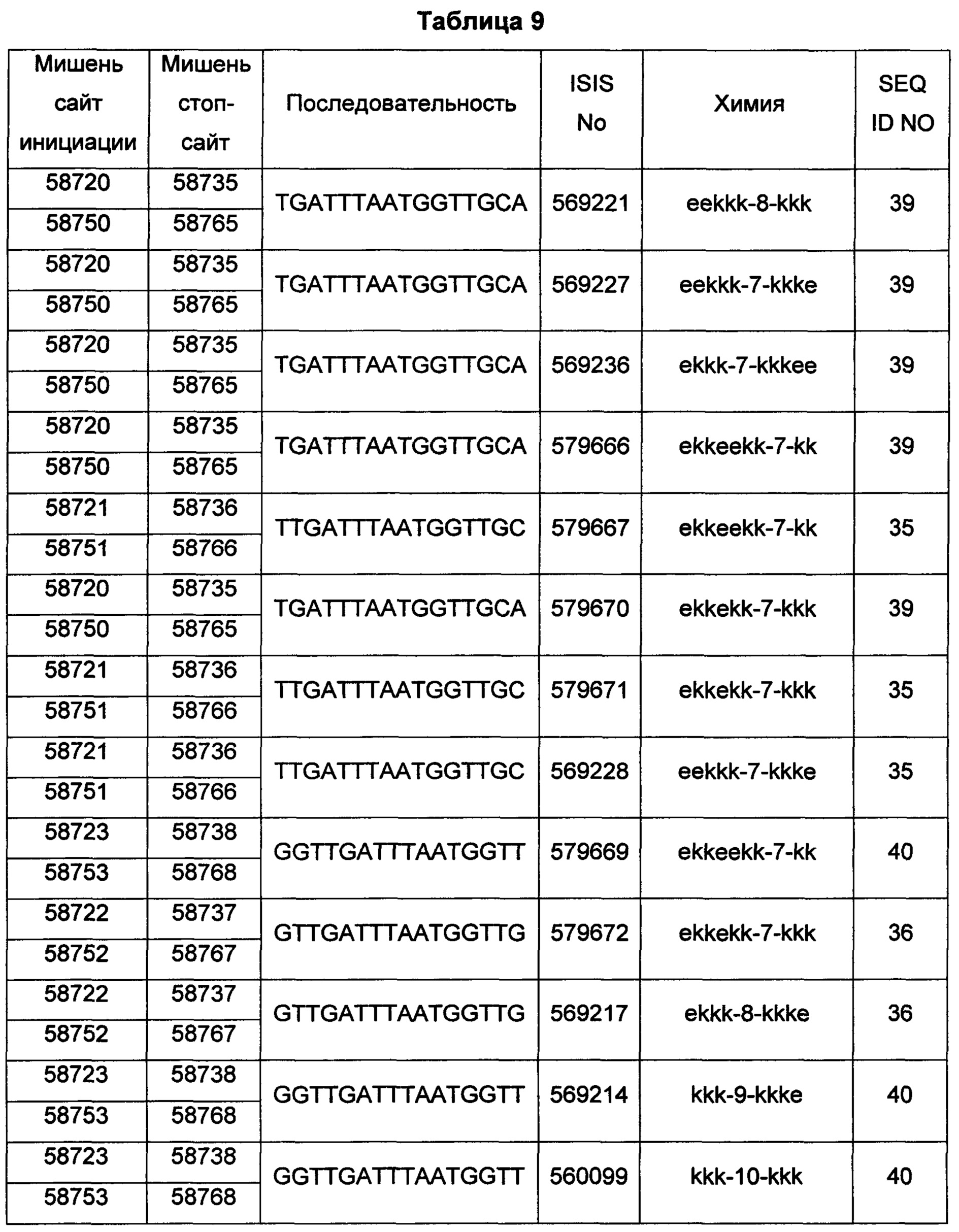
Клетки высевали при плотности 20000 клеток на лунку и трансфицировали методом электропорации антисмысловым олигонуклеотидом в концентрациях 62,5 нМ, 125,0 нМ, 250,0 нМ, 500,0 нМ и 1000,0 нМ, как указано в Таблицах 10-12. После обработки в течение приблизительно 16 часов РНК выделяли из клеток, и уровни мРНК AR измеряли количественной ПЦР в реальном времени. Для измерения уровней мРНК использовали комплект праймеров и зондов для AR человека RTS3559. Уровни мРНК AR корректировали в соответствии с общим содержанием РНК, которое измеряли с помощью RIBOGREEN®. Результаты представлены в виде процента ингибирования AR относительно необработанных контрольных клеток. Антисмысловые олигонуклеотиды тестировали в серии экспериментов в сходных условиях. Результаты для каждого эксперимента представлены в отдельных таблицах, приведенных ниже.
Полумаксимальная ингибирующая концентрация (IC50) каждого олигонуклеотида также представлена в Таблицах 10-12. Как проиллюстрировано, в клетках, обработанных некоторыми антисмысловыми олигонуклеотидами, уровни мРНК AR снижались в зависимости от дозы.




Пример 8: Антисмысловое ингибирование AR человека в клетках HuVEC
Дополнительные антисмысловые олигонуклеотиды были сконструированы для направленного воздействия на нуклеиновую кислоту AR и были протестированы в отношении их воздействия на мРНК AR in vitro. Культивированные клетки HuVEC при плотности 20000 клеток на лунку трансфицировали методом электропорации 1000 нМ антисмысловым олигонуклеотидом. После обработки в течение приблизительно 24 часов РНК выделяли из клеток, и уровни мРНК AR измеряли количественной ПЦР в реальном времени. Для измерения уровней мРНК использовали комплект праймеров и зондов для человека RTS3559. Уровни мРНК AR корректировали в соответствии с общим содержанием РНК, которое измеряли с помощью RIBOGREEN®. Результаты представлены в виде процента ингибирования AR относительно необработанных контрольных клеток. Всего было протестировано 75 олигонуклеотидов. Только те олигонуклеотиды, которые были отобраны для дальнейшего исследования, показаны в Таблице 13.
Впервые сконструированные химерные антисмысловые олигонуклеотиды, указанные в Таблице 13, были сконструированы в виде 3-10-3 (S)-cET гэпмеров, 3-9-4 (S)-cEt гэпмеров, 4-8-4 (S)-cEt гэпмеров, 4-9-3 (S)-cEt гэпмеров, 5-7-4 (S)-cEt гэпмеров, 5-8-3 (S)-cEt гэпмеров, 6-7-3 (S)-cEt гэпмеров или дезокси, МОЕ и (S)-cEt олигонуклеотидов. 3-10-3 (S)-cEt гэпмеры представляют собой гэпмеры длиной 16 нуклеозидов, где центральный гэп-сегмент содержит десять 2'-дезоксинуклеозидов и фланкирован содержащими по три нуклеозида сегментами-"крыльями" как по 5'-направлению, так и по 3'-направлению. 3-9-4 (S)-cEt гэпмеры представляют собой гэпмеры длиной 16 нуклеозидов, где центральный гэп-сегмент состоит из девяти 2'-дезоксинуклеозидов и фланкирован содержащим три нуклеотида сегментом-"крылом" по 5'-направлению и содержащим четыре нуклеозида сегментом-крылом" по 3'-направлению. 4-8-4 (S)-cEt гэпмеры представляют собой гэпмеры длиной 16 нуклеозидов, где центральный гэп-сегмент содержит восемь 2'-дезоксинуклеозидов и фланкирован содержащими по четыре нуклеозида сегментами-Крыльями" как по 5'-направлению, так и по 3'-направлению. 4-9-3 (S)-cEt гэпмеры представляют собой гэпмеры длиной 16 нуклеозидов, где центральный гэп-сегмент содержит девять 2'-дезоксинуклеозидов и фланкирован содержащим четыре нуклеотида сегментом-Крылом" по 5'-направлению и содержащим три нуклеозида сегментом-Крылом" по 3'-направлению. 5-7-4 (S)-cEt гэпмеры представляют собой гэпмеры длиной 16 нуклеозидов, где центральный гэп-сегмент содержит семь 2'-дезоксинуклеозидов и фланкирован содержащим пять нуклеотидов сегментом-Крылом" по 5'-направлению и содержащим четыре нуклеотида сегментом-Крылом" по 3'-направлению. 5-8-3 (S)-cEt гэпмеры представляют собой гэпмеры длиной 16 нуклеозидов, где центральный гэп-сегмент содержит восемь 2'-дезоксинуклеозидов и фланкирован содержащим пять нуклеотидов сегментом-Крылом" по 5'-направлению и содержащим три нуклеозида сегментом-Крылом" по 3'-направлению. 6-7-3 (S)-cEt гэпмеры представляют собой гэпмеры длиной 16 нуклеозидов, где центральный гэп-сегмент содержит семь 2'-дезоксинуклеозидов и фланкирован содержащим шесть нуклеотидов сегментом-Крылом" по 5'-направлению и содержащим три нуклеозида сегментом-Крылом" по 3'-направлению. Каждый нуклеозид в 5'-сегменте-"крыле" и каждый нуклеозид в 3'-сегменте-"крыле" имеет (S)-cEt модификацию. Дезокси, МОЕ и (S)-cEt олигонуклеотиды представляют собой олигонуклеотиды длиной 16 нуклеозидов, где нуклеозид имеет МОЕ модификацию сахара, (S)-cEt модификацию сахара или дезокси модификацию. В графе "Химия" указаны модификации сахара каждого олигонуклеотида. "k" означает (S)-cEt модификацию сахара; число означает количество дезоксинуклеозидов; или же "d" означает дезоксирибозу; и "е" означает МОЕ модификацию. Межнуклеозидные связи по всей длине каждого гэпмера являются фосфоротиоатными связями. Все цитозининовые остатки по всей длине каждого гэпмера являются 5-метилцитозинами.
SEQ ID NO, указанная в таблице, относится к олигонуклеотидной последовательности. "Сайт инициации" означает нуклеозид с самого 5'-конца, на который гэпмер нацелен в последовательности гена человека. "Стоп-сайт" означает нуклеозид с самого 3'-конца, на который гэпмер нацелен в последовательности гена человека. Каждый гэпмер, указанный в Таблице 13, направленно воздействует на геномную последовательность AR человека, обозначенную в данном документе как SEQ ID NO: 1 (GENBANK, номер доступа NT_011669.17, с усечением нуклеотидов 5079000-5270000).
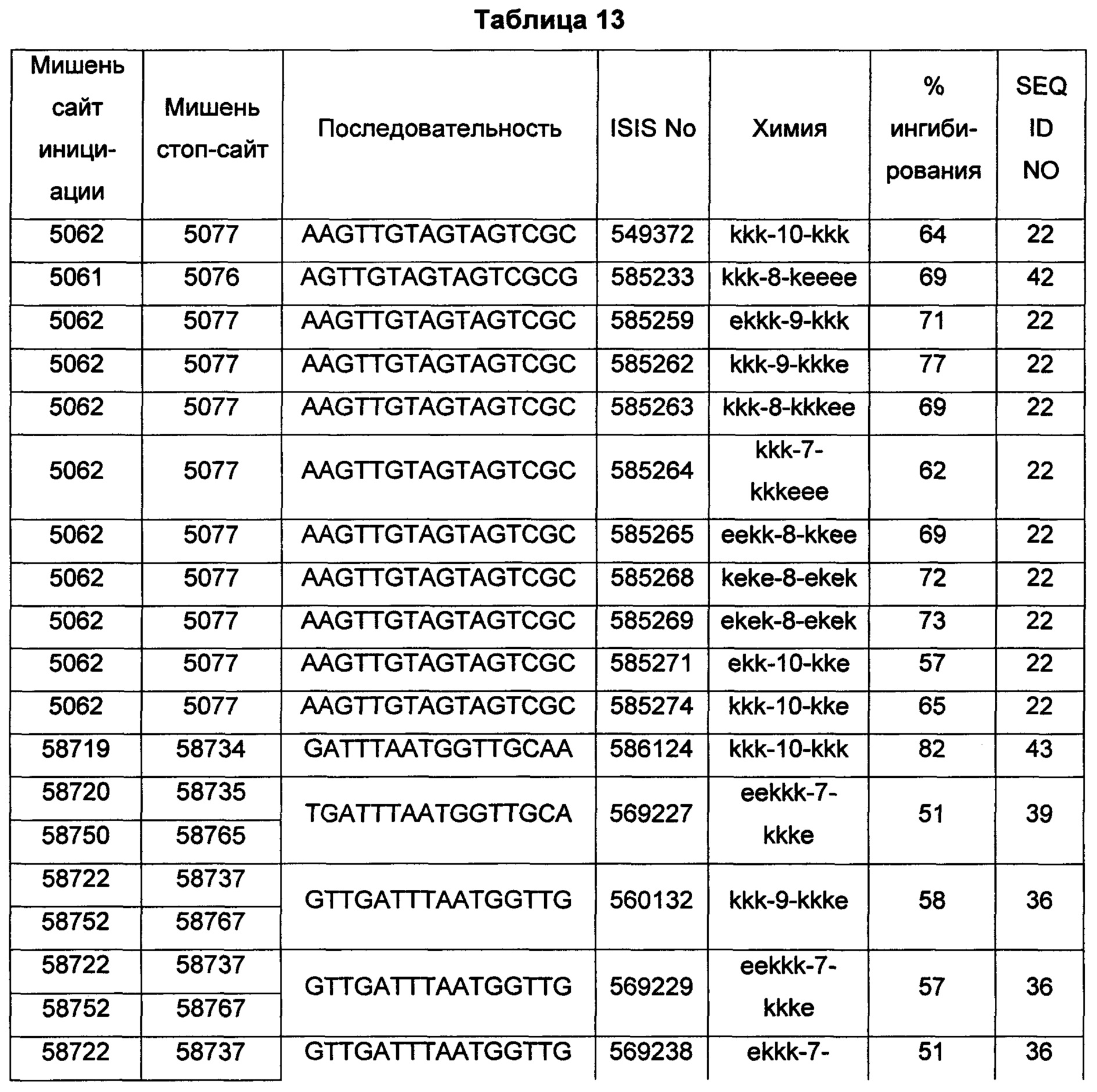

Пример 9: Зависимое от дозы антисмысловое ингибирование AR человека в клетках HuVEC
Антисмысловые олигонуклеотиды из описанных выше исследований, демонстрирующие значительное ингибирование мРНК AR in vitro, были отобраны и протестированы в различных дозах в клетках HuVEC. Клетки высевали при плотности 20000 клеток на лунку и трансфицировали методом электропорации антисмысловым олигонуклеотидом в концентрациях 31,25 нМ, 62,5 нМ, 125,0 нМ, 250,0 нМ, 500,0 нМ и 1000,0 нМ, как указано в Таблице 14. После обработки в течение приблизительно 16 часов РНК выделяли из клеток, и уровни мРНК AR измеряли количественной ПЦР в реальном времени. Для измерения уровней мРНК использовали комплект праймеров и зондов для AR человека RTS3559 мРНК. Уровни мРНК AR корректировали в соответствии с общим содержанием РНК, который измеряли с помощью RIBOGREEN®. Результаты представлены в виде процента ингибирования AR относительно необработанных контрольных клеток. Антисмысловые олигонуклеотиды тестировали в серии экспериментов в сходных условиях. Результаты для каждого эксперимента представлены в отдельных таблицах, приведенных ниже.
Полумаксимальная ингибирующая концентрация (IC50) каждого олигонуклеотида также представлена в Таблице 14. Как проиллюстрировано, уровни мРНК AR в клетках, обработанных антисмысловыми олигонуклеотидами, снижались в зависимости от дозы.

Пример 10: Зависимое от дозы антисмысловое ингибирование AR человека в клетках HuVEC
Гэпмеры из Примера 8, демонстрирующие значительное ингибирование мРНК AR in vitro, были отобраны и протестированы в различных дозах в клетках HuVEC. Клетки высевали при плотности 20000 клеток на лунку и трансфицировали методом электропорации антисмысловым олигонуклеотидом в концентрациях 46,9 нМ, 187,5 нМ, 750,0 нМ и 3000,0 нМ, как указано в Таблице 15. После обработки в течение приблизительно 16 часов РНК выделяли из клеток, и уровни мРНК AR измеряли количественной ПЦР в реальном времени. Для измерения уровней мРНК использовали комплект праймеров и зондов для AR человека RTS3559. Уровни мРНК AR корректировали в соответствии с общим содержанием РНК, который измеряли с помощью RIBOGREEN®. Результаты представлены в виде процента ингибирования AR относительно необработанных контрольных клеток.
Полумаксимальная ингибирующая концентрация (IC50) каждого олигонуклеотида также представлена в Таблице 15. Как проиллюстрировано, уровни мРНК AR в клетках, обработанных антисмысловыми олигонуклеотидами, снижались в зависимости от дозы.

Пример 11: Антисмысловое ингибирование AR человека в клетках HuVEC
Дополнительные антисмысловые олигонуклеотиды были сконструированы для направленного воздействия на нуклеиновую кислоту AR и были протестированы в отношении их воздействия на мРНК AR in vitro. Культивированные клетки HuVEC при плотности 20000 клеток на лунку трансфицировали методом электропорации 500 нМ антисмысловым олигонуклеотидом. После обработки в течение приблизительно 24 часов РНК выделяли из клеток, и уровни мРНК AR измеряли количественной ПЦР в реальном времени. Для измерения уровней мРНК использовали комплект праймеров и зондов для человека RTS3559. Уровни мРНК AR корректировали в соответствии с общим содержанием РНК, который измеряли с помощью RIBOGREEN®. Результаты представлены в виде процента ингибирования AR относительно необработанных контрольных клеток. Всего было протестировано 616 олигонуклеотидов. Только те олигонуклеотиды, которые были отобраны для дальнейшего исследования, показаны в Таблицах 16-23.
Впервые сконструированные химерные антисмысловые олигонуклеотиды, указанные в Таблицах 16-23, были сконструированы в виде 3-10-3 (S)-cET гэпмеров. Гэпмеры представляют собой гэпмеры длиной 16 нуклеозидов, где центральный гэп-сегмент содержит десять 2'-дезоксинуклеозидов и фланкирован содержащими по три нуклеозида сегментами-крыльями" как по 5'-направлению, так и по 3'-направлению. Каждый нуклеозид в 5'-сегменте-"крыле" и каждый нуклеозид в 3'-сегменте-"крыле" имеет (S)-cEt модификацию. Межнуклеозидные связи по всей длине каждого гэпмера являются фосфоротиоатными связями. Все цитозининовые остатки по всей длине каждого гэпмера являются 5-метилцитозинами.
SEQ ID NO, указанная в таблице, относится к олигонуклеотидной последовательности. "Сайт инициации" означает нуклеозид с самого 5'-конца, на который гэпмер нацелен в последовательности гена человека. "Стоп-сайт" означает нуклеозид с самого 3'-конца, на который гэпмер нацелен в последовательности гена человека. Каждый гэпмер, указанный в Таблицах 16-23, направленно воздействует на геномную последовательность AR человека, обозначенную в данном документе как SEQ ID NO: 1 (GENBANK, номер доступа NT_011669.17, с усечением нуклеотидов 5079000-5270000), или на последовательность мРНК AR человека, обозначенную в данном документе как SEQ ID NO: 2 (GENBANK, номер доступа НМ_000044.3), или на обе. "n/а" означает, что олигонуклеотид не оказывает направленного воздействия на данную последовательность гена.


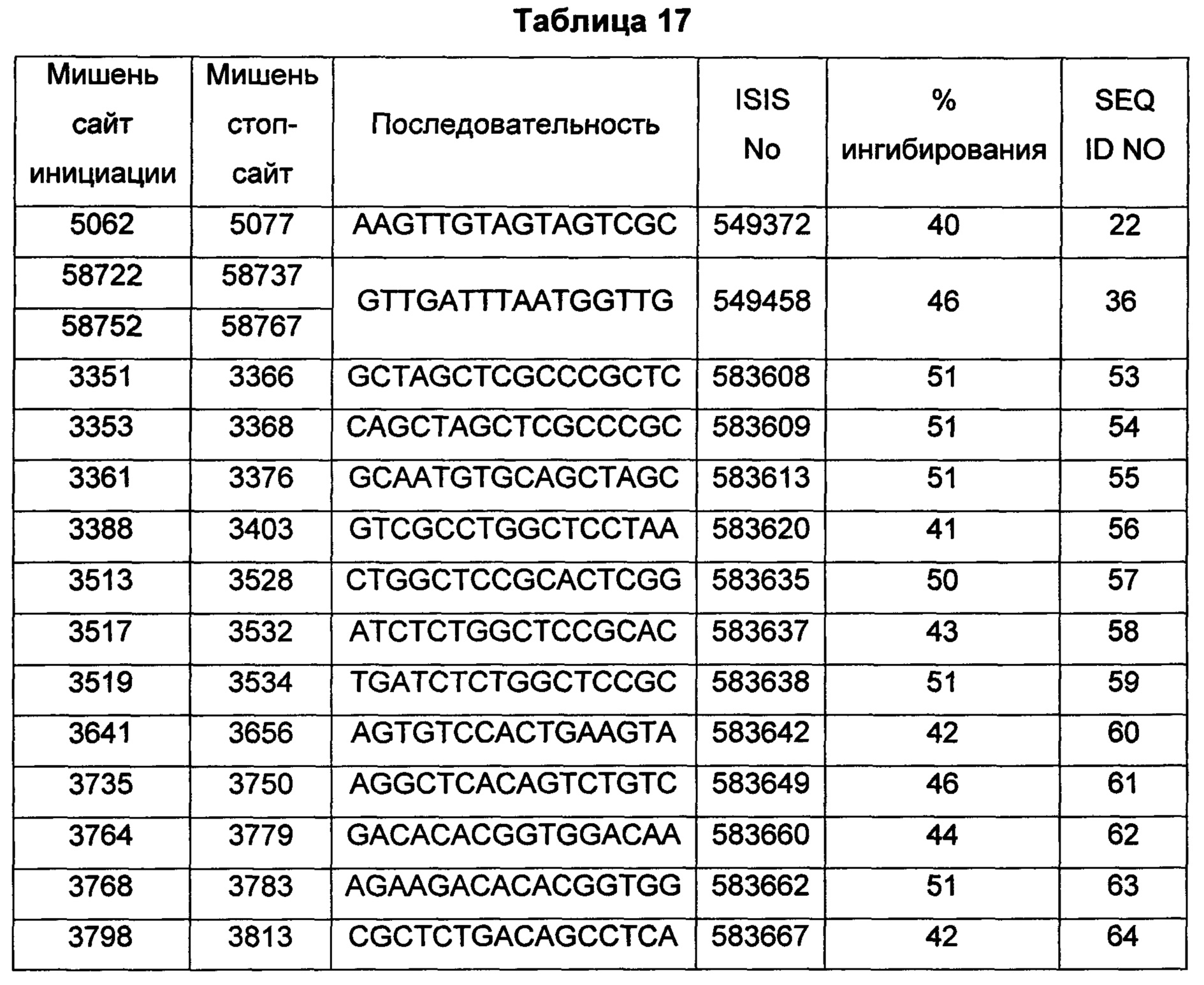
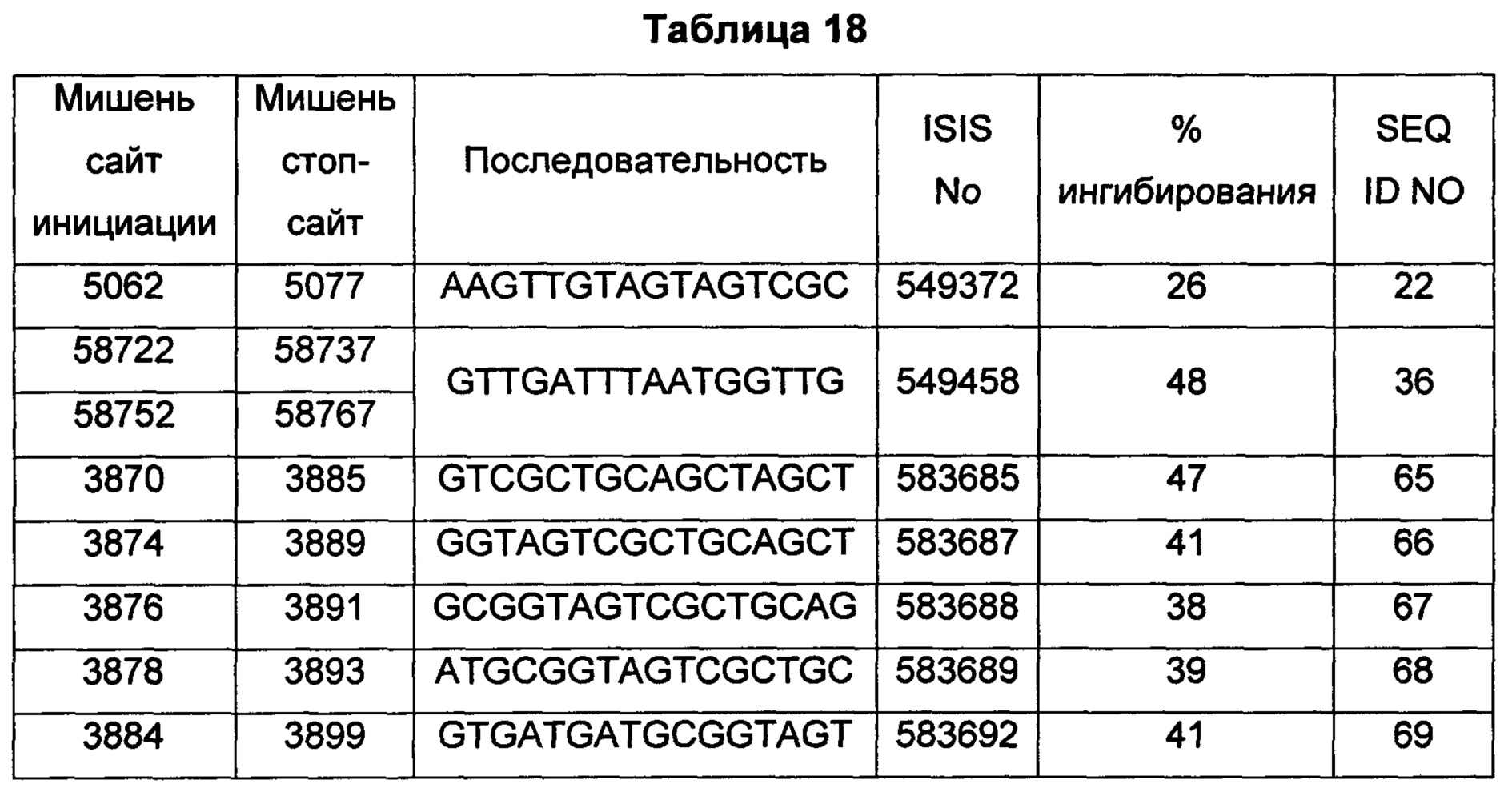
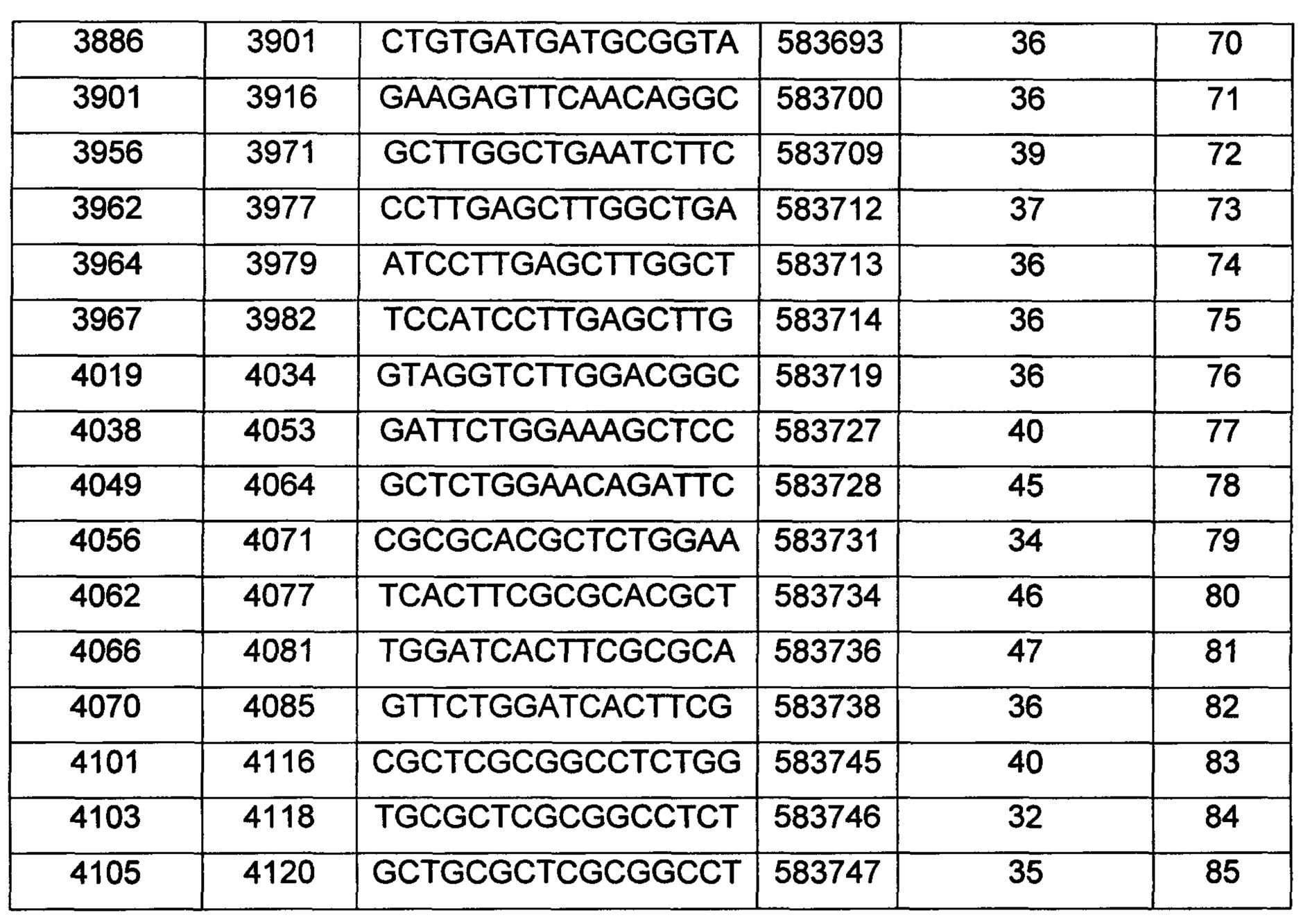
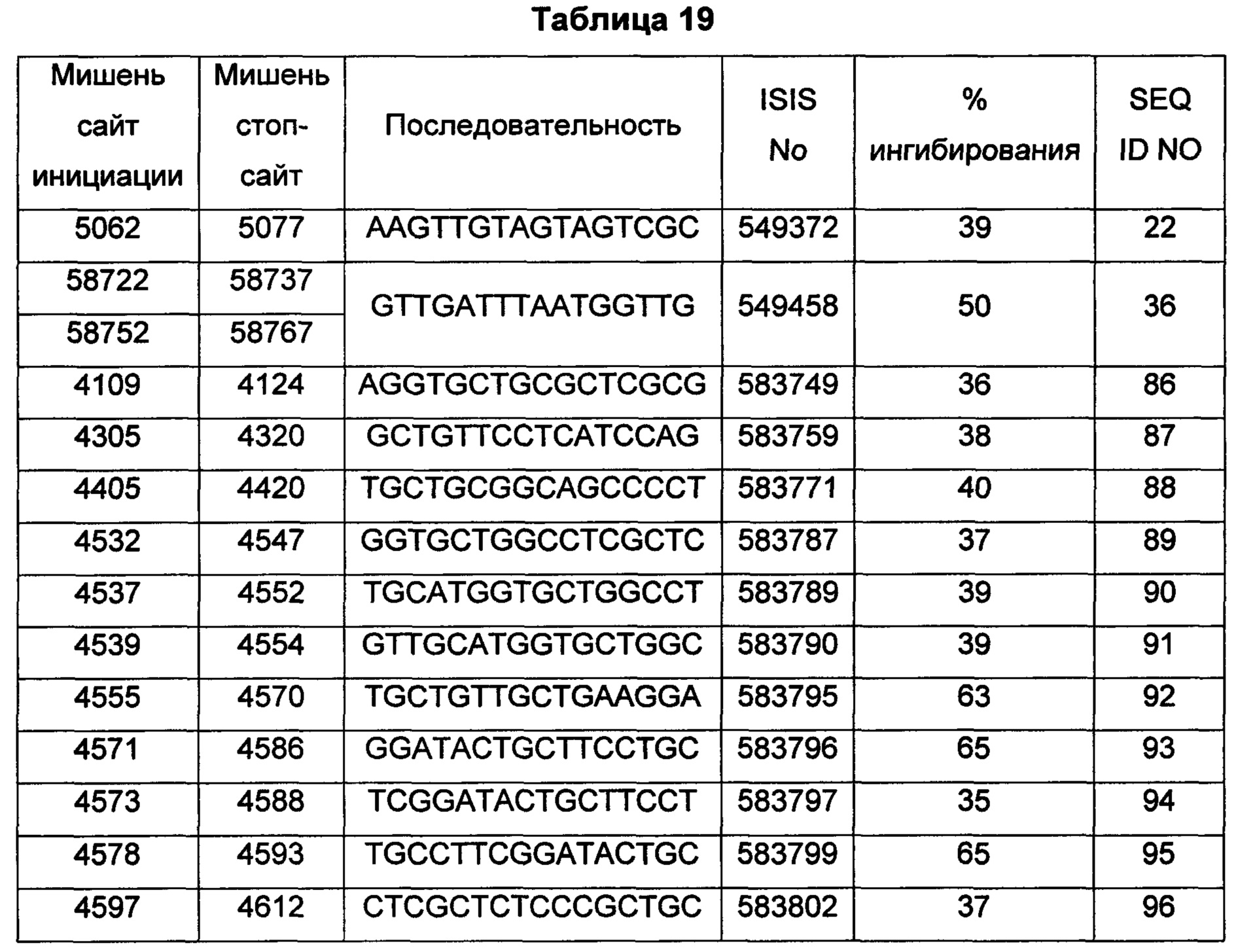
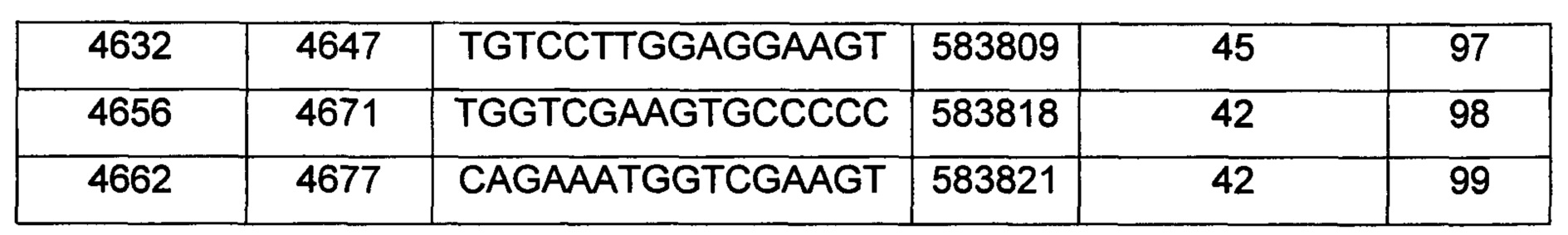
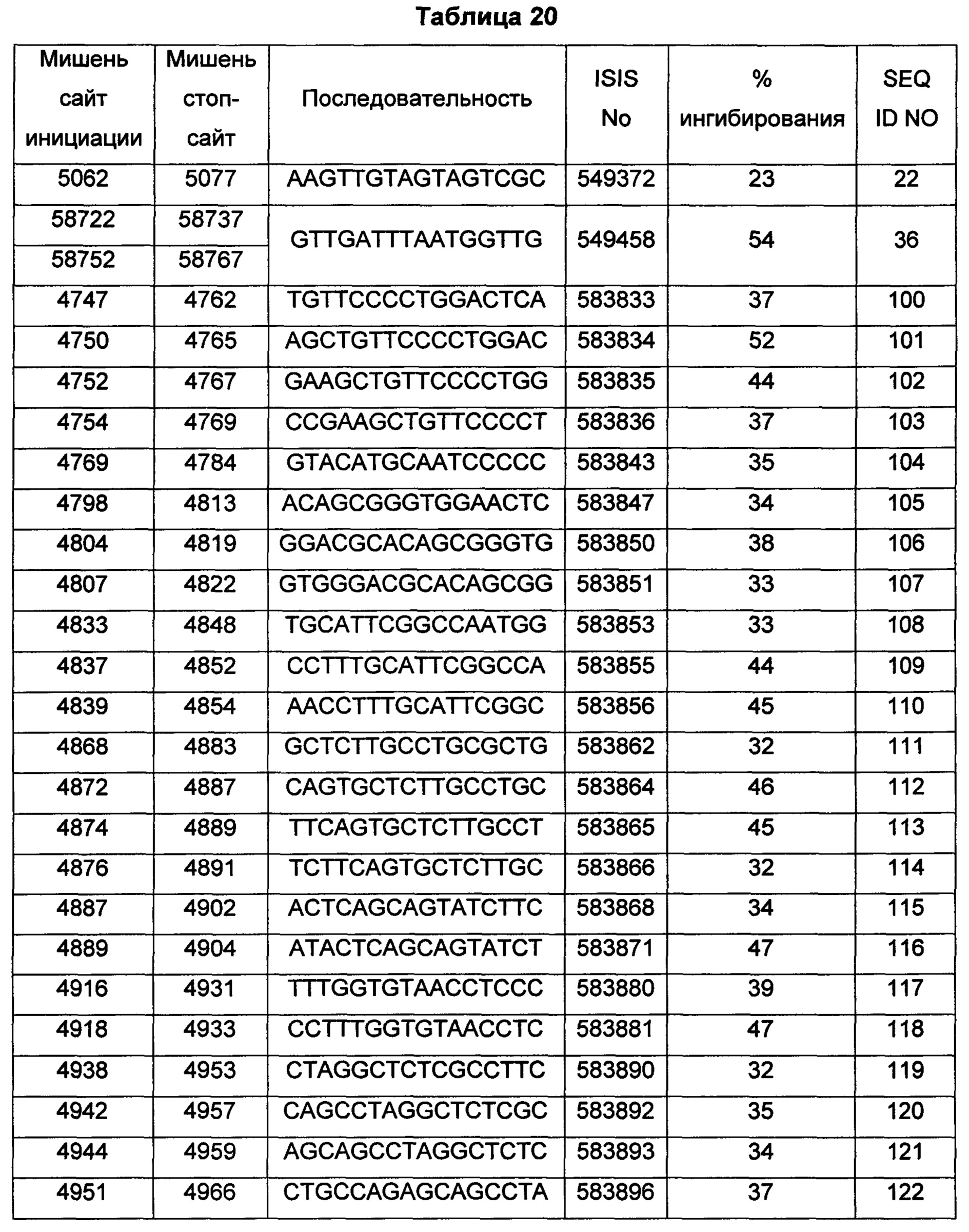

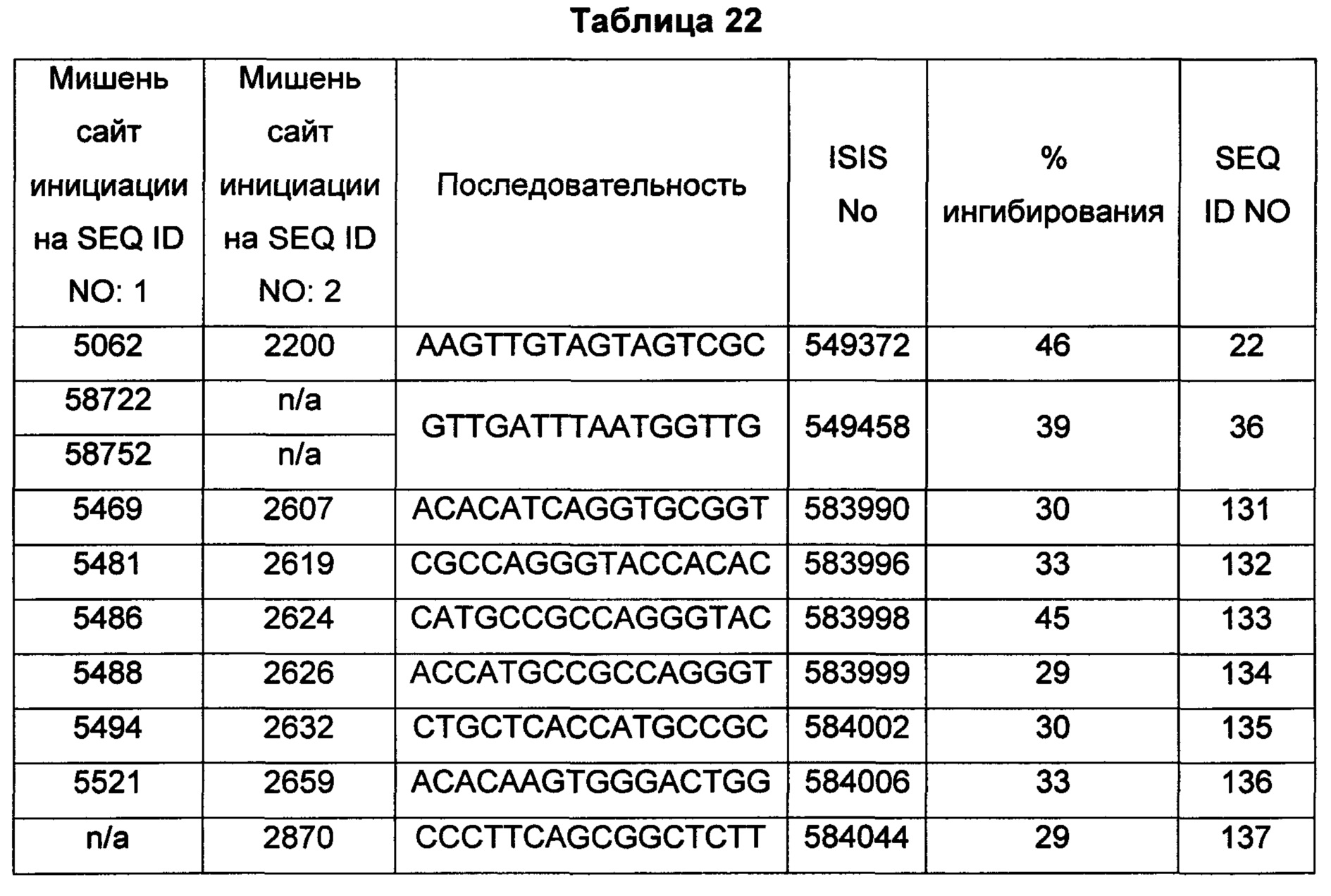

Пример 12: Антисмысловое ингибирование AR человека в клетках HuVEC
Дополнительные антисмысловые олигонуклеотиды были сконструированы для направленного воздействия на нуклеиновую кислоту AR и были протестированы в отношении их воздействия на мРНК AR in vitro. Культивированные клетки HuVEC при плотности 20000 клеток на лунку трансфицировали методом электропорации 1000 нМ антисмысловым олигонуклеотидом. После обработки в течение приблизительно 24 часов РНК выделяли из клеток, и уровни мРНК AR измеряли количественной ПЦР в реальном времени. Для измерения уровней мРНК использовали комплект праймеров и зондов для человека RTS3559. Уровни мРНК AR корректировали в соответствии с общим содержанием РНК, который измеряли с помощью RIBOGREEN®. Результаты представлены в виде процента ингибирования AR относительно необработанных контрольных клеток. Всего было протестировано 385 олигонуклеотидов. Только те олигонуклеотиды, которые были отобраны для дальнейшего исследования, показаны в Таблицах 24-28.
Впервые сконструированные химерные антисмысловые олигонуклеотиды в Таблицах 24-28 были сконструированы в виде 3-10-3 (S)-cET гэпмеров. Гэпмеры представляют собой гэпмеры длиной 16 нуклеозидов, где центральный гэп-сегмент содержит десять 2'-дезоксинуклеозидов и фланкирован содержащими по три нуклеозида сегментами-крыльями" как по 5'-направлению, так и по 3'-направлению. Каждый нуклеозид в 5'-сегменте-"крыле" и каждый нуклеозид в 3'-сегменте-"крыле" имеет (S)-cEt модификацию. Межнуклеозидные связи по всей длине каждого гэпмера являются фосфоротиоатными связями. Все цитозининовые остатки по всей длине каждого гэпмера являются 5-метилцитозинами.
SEQ ID NO, указанная в таблице, относится к олигонуклеотидной последовательности. "Сайт инициации" означает нуклеозид с самого 5'-конца, на который гэпмер нацелен в последовательности гена человека. "Стоп-сайт" означает нуклеозид с самого 3'-конца, на который гэпмер нацелен в последовательности гена человека. Каждый гэпмер, указанный в Таблицах 24-28, направленно воздействует на геномную последовательность AR человека, обозначенную в данном документе как SEQ ID NO: 1 (GENBANK, номер доступа NT_011669.17, с усечением нуклеотидов 5079000-5270000)
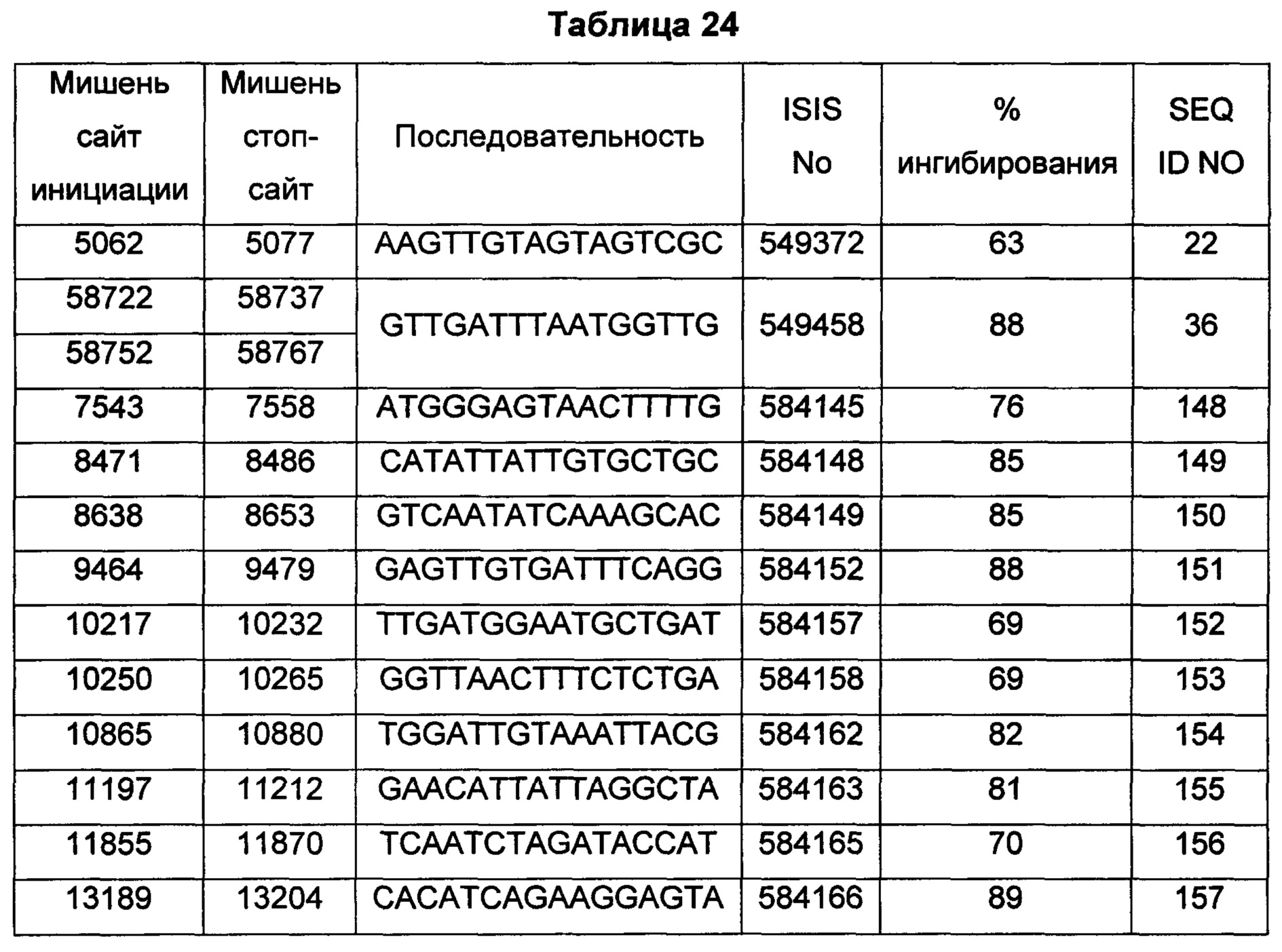




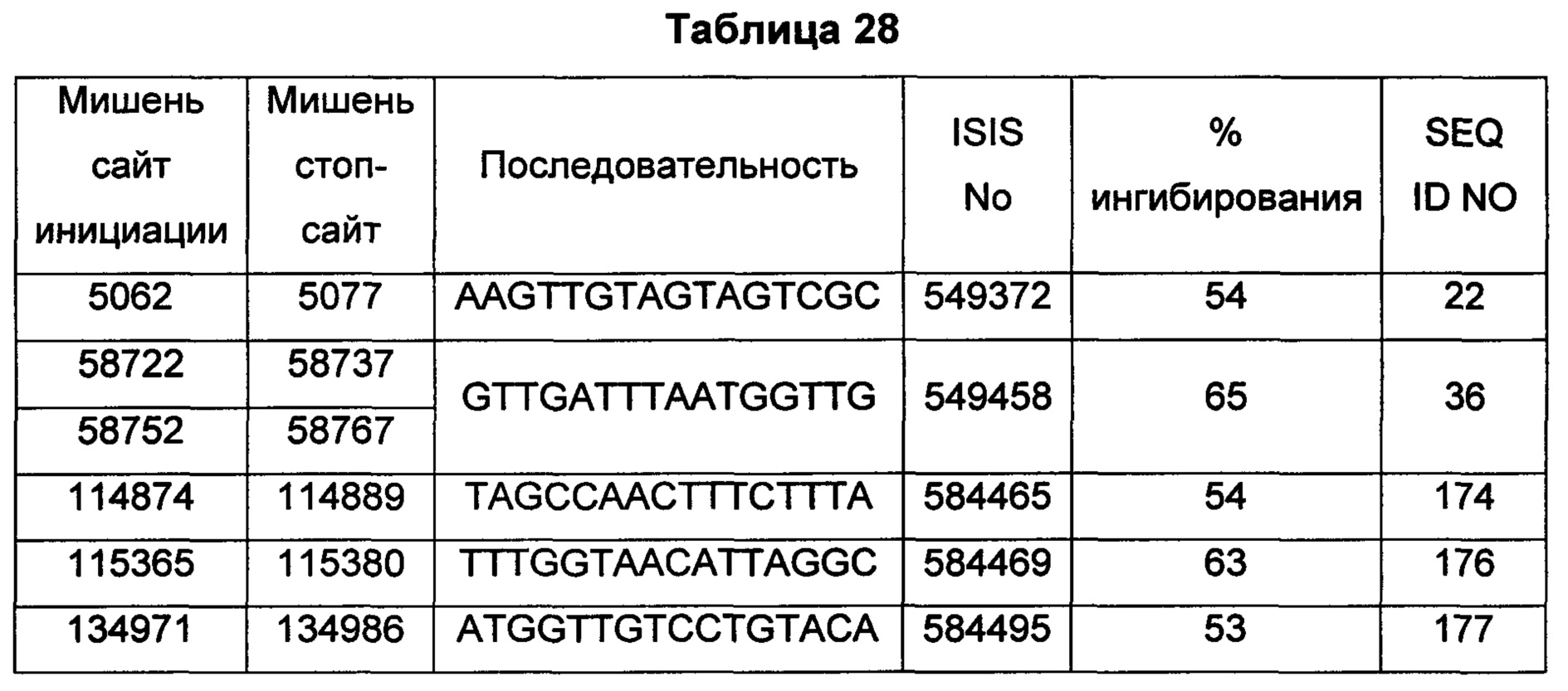
Пример 13: Зависимое от дозы антисмысловое ингибирование AR человека в клетках HuVEC
Гэпмеры из описанных выше исследований, демонстрирующие значительное ингибирование мРНК AR in vitro, были отобраны и протестированы в различных дозах в клетках HuVEC. Клетки высевали при плотности 20,000 клеток на лунку и трансфицировали методом электропорации антисмысловым олигонуклеотидом в концентрациях 46,9 нМ, 187,5 нМ, 750,0 нМ и 3000,0 нМ, как указано в Таблицах 29-37. После обработки в течение приблизительно 16 часов РНК выделяли из клеток, и уровни мРНК AR измеряли количественной ПЦР в реальном времени. Для измерения уровней мРНК использовали комплект праймеров и зондов для AR человека RTS3559. Уровни мРНК AR корректировали в соответствии с общим содержанием РНК, который измеряли с помощью RIBOGREEN®. Результаты представлены в виде процента ингибирования AR относительно необработанных контрольных клеток.
Полумаксимальная ингибирующая концентрация (1С50) каждого олигонуклеотида также представлена в Таблицах 29-37. Как проиллюстрировано, уровни мРНК AR в клетках, обработанных некоторыми антисмысловыми олигонуклеотидами, снижались в зависимости от дозы.
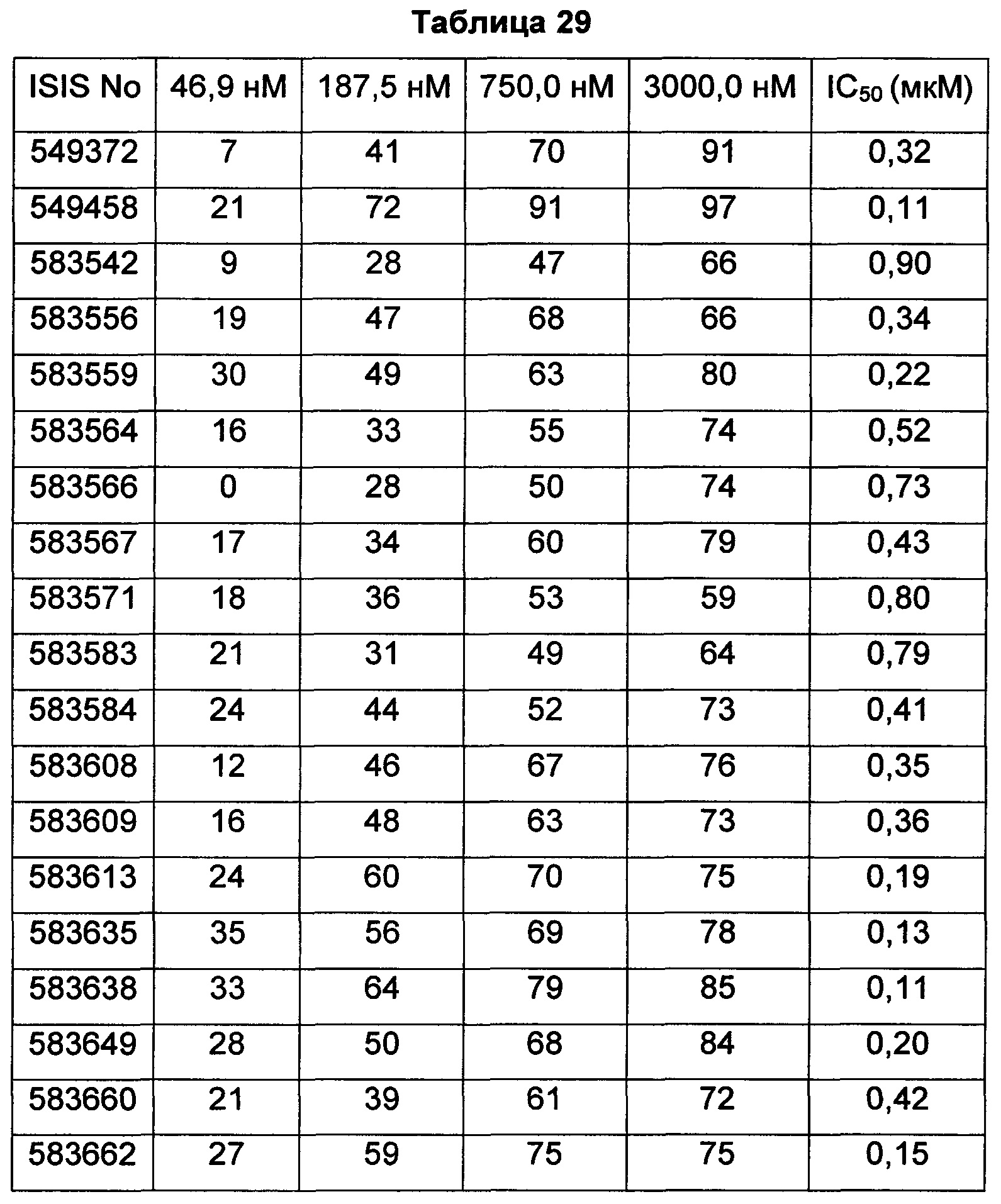








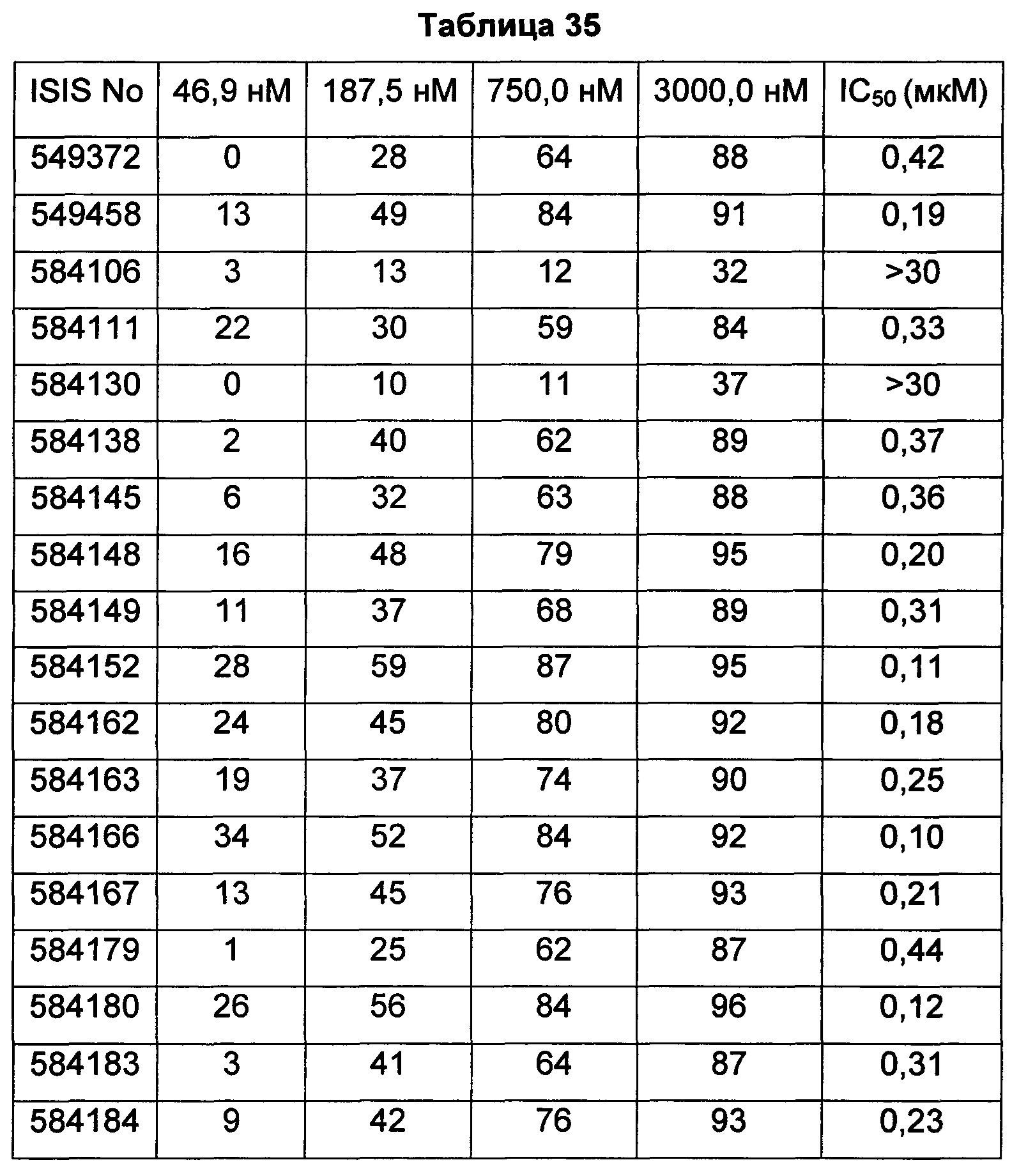


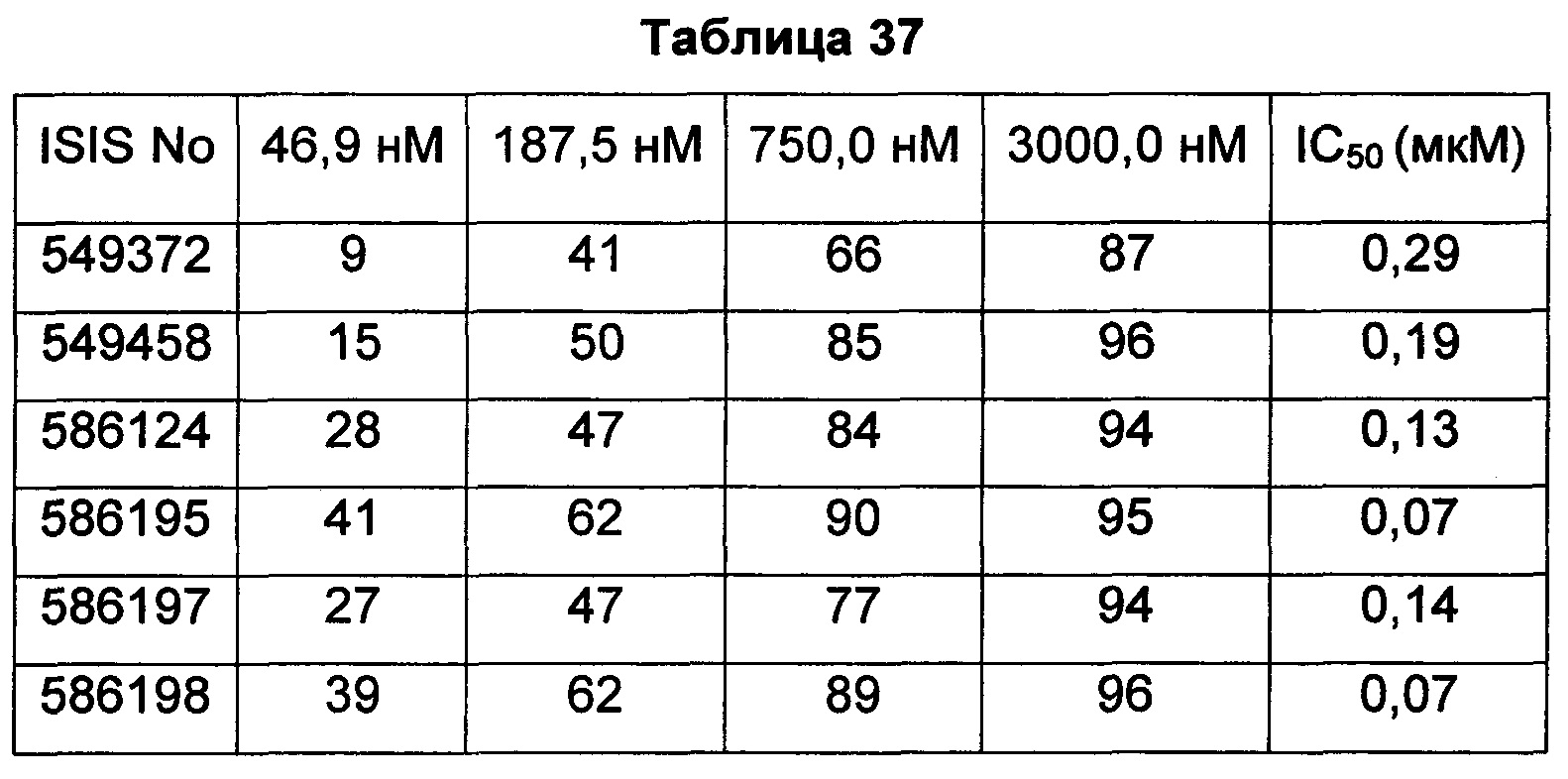

Пример 14: Отбор антисмысловых олигонуклеотидов, направленно воздействующих на мРНК рецептора андрогенов (AR) человека, для анализов с использованием линий клеток рака предстательной железы
Антисмысловые олигонуклеотиды из тех, которые представлены в исследованиях выше, и которые направленно воздействуют на разные области геномной последовательности AR человека, были отобраны для дальнейших исследований на линиях клеток рака предстательной железы. AR-V7 и AR-V567 являются основными вариантами сплайсинга AR, обнаруживаемыми у раковых пациентов, как описано в Hornberg, E. et al., PLoS One 2011. Vol. 6.
Для дальнейших исследований были отобраны следующие ISIS олигонуклеотиды: ISIS 549372, который направленно воздействует на геномную последовательность AR человека на экзоне 1; ISIS 549434, который направленно воздействует на геномную последовательность AR человека на 3'-конце экзона 8 выше стоп-кодона AR; ISIS 560131, который направленно воздействует на геномную последовательность AR человека на интроне 1; и ISIS 569236, который направленно воздействует на геномную последовательность AR человека на интроне 1. Еще один антисмысловой олигонуклеотид, ISIS 554221 (ACCAAGTTTCTTCAGC, обозначенная в данном документе как SEQ ID NO: 178), был сконструирован как 3-10-3 LNA гэпмер с фосфоротиоатным каркасом, направленно воздействующий на экзон 4 (т.е. лиганд-связывающий домен) AR, идентичный антисмысловому олигонуклеотиду, обозначенному как SEQ ID NO: 58 в US 7737125, для использования в качестве контроля.
Пример 15: Воздействие антисмыслового ингибирования мРНК рецептора андрогенов (AR) человека на уровни белка рецептора андрогенов в MDV3100-резистентных С4-2В клетках
Клетки С4-2В являются клетками андроген-независимой аденокарциномы предстательной железы человека, которые обычно используют в области онкологии и которые, как было установлено, являются клинически релевантными культивируемыми клетками (Thalmann, G.N. et al., Cancer Res. 1994. 54: 2577). MDV3100, или энзалутамид, представляет собой экспериментальное лекарственное средство, являющееся антагонистом рецептора андрогенов, разработанное Medivation для лечения резистентного к кастрации рака предстательной железы. ISIS 549372, ISIS 554221 и ISIS 549434 были протестированы на MDV3100-резистентных (MR) клетках С4-2В.
Клетки культивировали в присутствии MDV3100 в концентрации 5 мкМ в течение 2 месяцев для индуцирования резистентности к MDV3100. Каждый из ISIS 549372, ISIS 549434 и ISIS 554221 в концентрации 1 мкМ антисмыслового олигонуклеотида добавляли в культуральную среду в концентрации 1 мкМ для свободного захвата клетками. После обработки в течение 2 суток клетки харвестировали в RIPA-буфере (буфер для анализа радиоиммунопреципитации), содержащем ингибиторы протеаз. Присутствие полос для полноразмерного AR, а также вариантной формы, AR-W, детектировали методом вестерн-блот с использованием AR антитела (N-20, Santa Cruz). Обработка клеток ISIS 549372 снижала уровни полноразмерного AR и AR-W в большей степени, чем обработка либо ISIS 554221, либо ISIS 549434.
Пример 16: Воздействие антисмыслового ингибирования мРНК рецептора андрогенов (AR) человека на гены AR-мишени в MDV3100-резистентных С4-2В клетках
Анализировали воздействие антисмыслового ингибирования AR на гены AR-мишени. ISIS 549372, ISIS 549458, ISIS 554221 и ISIS 549434 тестировали в MR клетках С4-2В.
Клетки высевали при плотности 40000 клеток на лунку в 96-луночные планшеты и культивировали в среде RPMI1640 с 10% сыворотки плода коровы. Клетки культивировали в присутствии MDV3100 в 5 мкМ концентрации на протяжении 2 месяцев для индуцирования резистентности к MDV3100. Каждый из ISIS 549372, ISIS 549458, ISIS 549434 и ISIS 554221 добавляли в концентрациях антисмыслового олигонуклеотида 0,04 мкМ, 0,20 мкМ, 1,00 мкМ и 5,00 мкМ в культуральные среды для свободного захвата клетками. Контрольный олигонуклеотид, ISIS 347526 (последовательность TCTTATGTTTCCGAACCGTT (SEQ ID NO: 179) 5-10-5 МОЕ гэпмер) с неизвестной областью-мишенью в последовательностях генов человека, был включен в качестве негативного контроля. После обработки в течение 24 часа общие уровни мРНК AR измеряли количественной ПЦР в реальном времени, используя комплект праймеров и зондов RTS3559. Для измерения уровней мРНК AR-W использовали комплект праймеров и зондов для AR человека hAR_LTS00943 (прямая последовательность GCCCCTGGATGGATAGCTACT, обозначенная в данном документе как SEQ ID NO: 180; обратная последовательность CCACAGATCAGGCAGGTCTTC, обозначенная в данном документе как SEQ ID NO: 181; последовательность зонда ACTGCCAGGGACCATGTTTTGCCC, обозначенная в данном документе как SEQ ID NO: 182). Уровни мРНК AR корректировали в соответствии с уровнями мРНК актина человека. Результаты представлены в Таблице 38 в виде процента ингибирования общего AR относительно необработанных контрольных клеток. Обработка клеток олигонуклеотидами ISIS 549372, ISIS 549458 и ISIS 549434 снижала общие уровни транскриптов AR в зависимости от дозы в большей степени, чем обработка одигонуклеотидом ISIS 554221.
Вестерн-блот-анализ полноразмерного AR, а также варианта AR-V7, также проводили подобно анализу, описанному выше. Анализ продемонстрировал, что обработка олигонуклеотидами ISIS 549372 и ISSI 549458 снижала уровни полноразмерного AR и AR-V7. Обработка олигонуклеотидом ISIS 549434 снижала уровни полноразмерного AR, но не варианта AR-V7. Обработка олигонуклеотидом ISIS 554221 снижала уровни полноразмерного AR менее сильно по сравнению с ISIS 549372 и не снижала уровни AR-W. Контрольный олигонуклеотид ISIS 347526 не снижал уровни белка, как ожидалось.
Уровень мРНК гена AR-мишени KLK2 измеряли с использованием комплекта праймеров и зондов hKLK2_LTS00963 (прямая последовательность CTTGCGCCCCAGGAGTCT, обозначенная в данном документе как SEQ ID NO: 183; обратная последовательность CTCAGAGTAAGCTCTAGCACACATGTC, обозначенная в данном документе как SEQ ID NO: 184; последовательность зонда AGTGTGTGAGCCTCCATCTCCTGTCCAA, обозначенная в данном документе как SEQ ID NO: 185). Уровень мРНК гена AR-мишени KLK3 измеряли с использованием комплекта праймеров и зондов RTS1072 (прямая последовательность GCCAAGGAGGGAGGGTCTT, обозначенная в данном документе как SEQ ID NO: 186; обратная последовательность CCCCCCATAGTGAATCAGCTT, обозначенная в данном документе как SEQ ID N0: 187; последовательность зонда ATGAAGTAAGGAGAGGGACTGGACCCCC, обозначенная в данном документе как SEQ ID NO: 188). Как представлено в Таблицах 39 и 40, обработка олигонуклеотидами ISIS 549372, ISIS 549458 и ISIS 549434 снижала уровни гена-мишени в зависимости от дозы в большей степени, чем обработка олигонуклеотидом ISIS 554221.

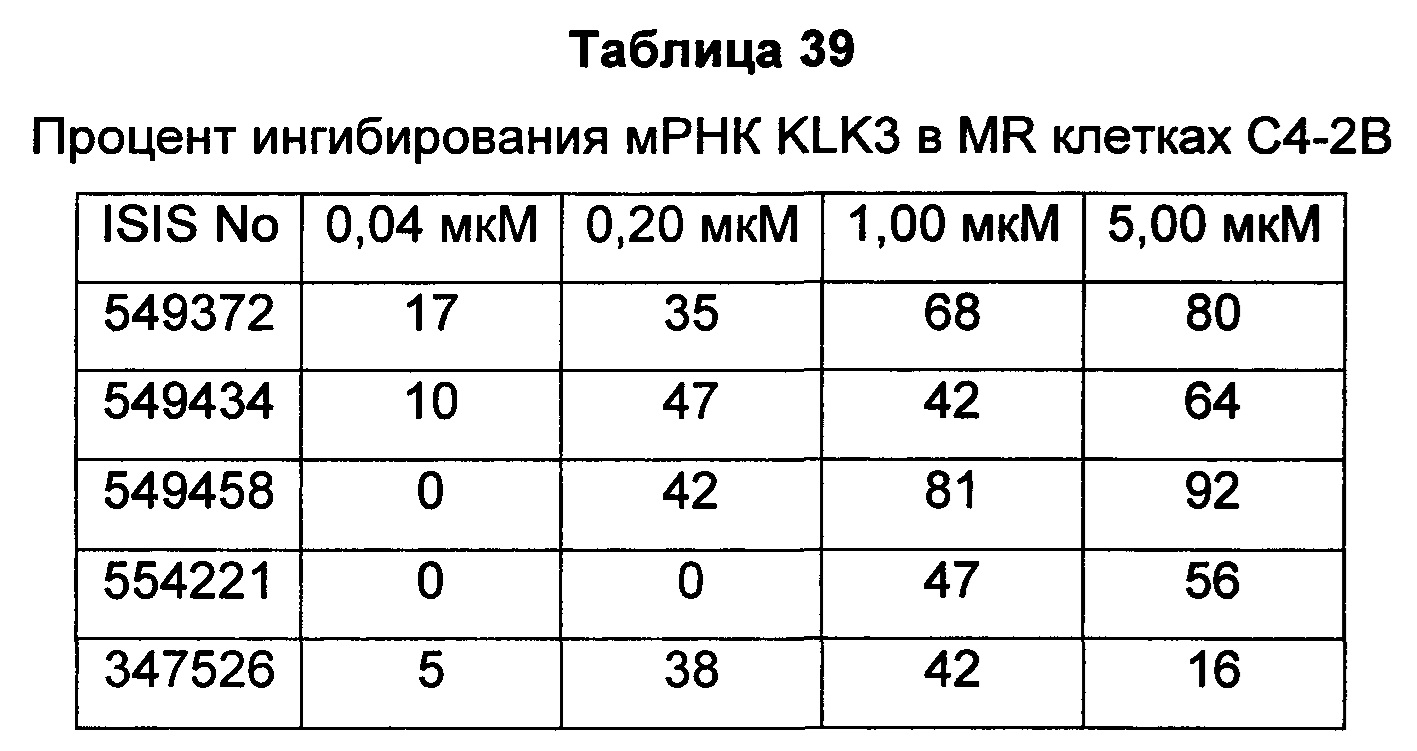
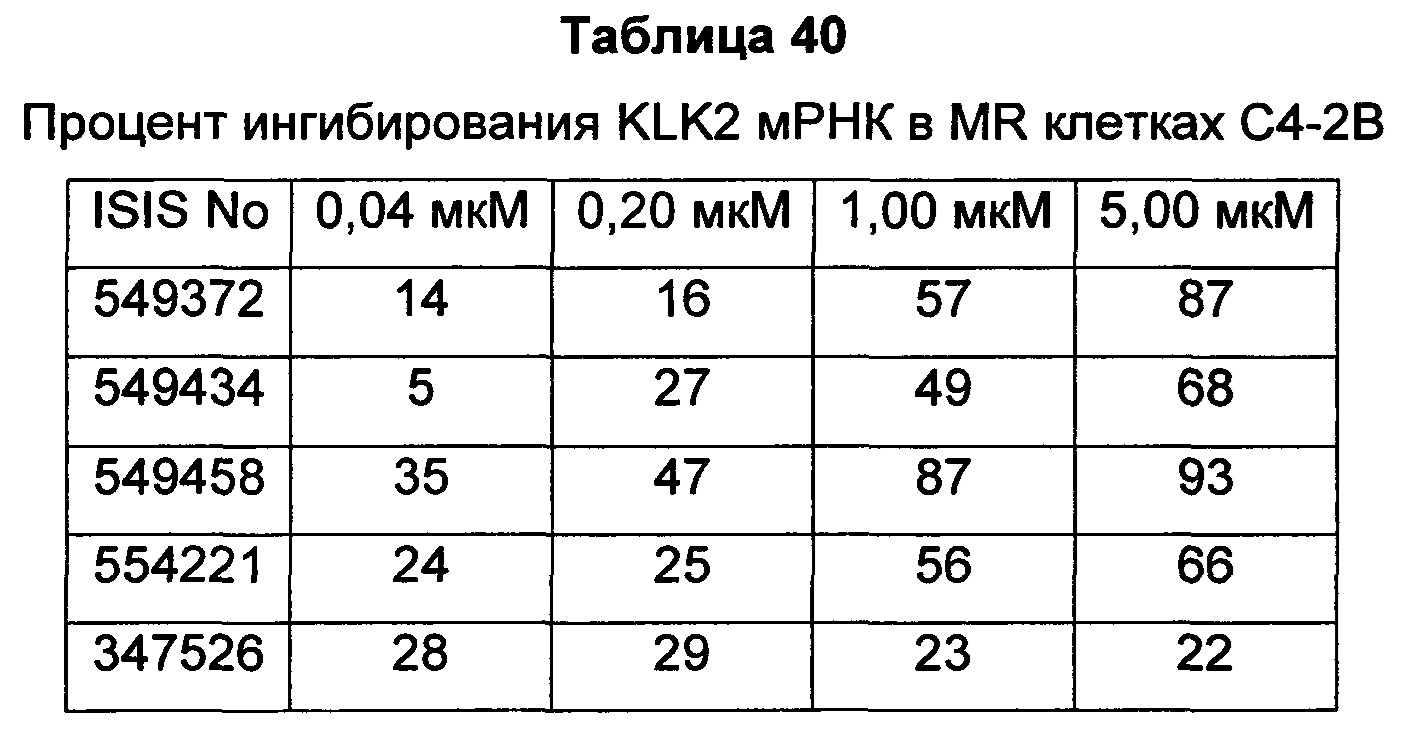
Пример 17: Воздействие антисмыслового ингибирования мРНК рецептора андрогенов (AR) человека на пролиферативную способность MDV3100-резистентных клеток С4-2В
Анализировали воздействие антисмыслового ингибирования AR на пролиферативную способность раковых клеток. ISIS 549372, ISIS 549458, ISIS 554221 и ISIS 549434 тестировали в MR клетках С4-2В.
Каждый из ISIS 549372, ISIS 549434, ISIS 549458 и ISIS 554221 добавляли в культуральные среды в концентрации антисмыслового олигонуклеотида 0,04 мкМ, 0,20 мкМ, 1,00 мкМ и 5,00 мкМ. ISIS 347526 был включен в качестве негативного контроля. После обработки в течение 6 суток пролиферативную способность раковых клеток измеряли с использованием набора для определения клеточной пролиферации CellTiter 96® AQueous One Solution Cell Prolifiration (Promega), следуя инструкциям производителя. Результаты представлены в Таблице 41 в виде процента ингибирования пролиферации относительно необработанных клеток. Обработка клеток олигонуклеотидами ISIS 549372, ISIS 549434 и ISIS 549458 снижала клеточную пролиферацию в зависимости от дозы в большей степени, чем обработка олигонуклеотидом ISIS 554221.

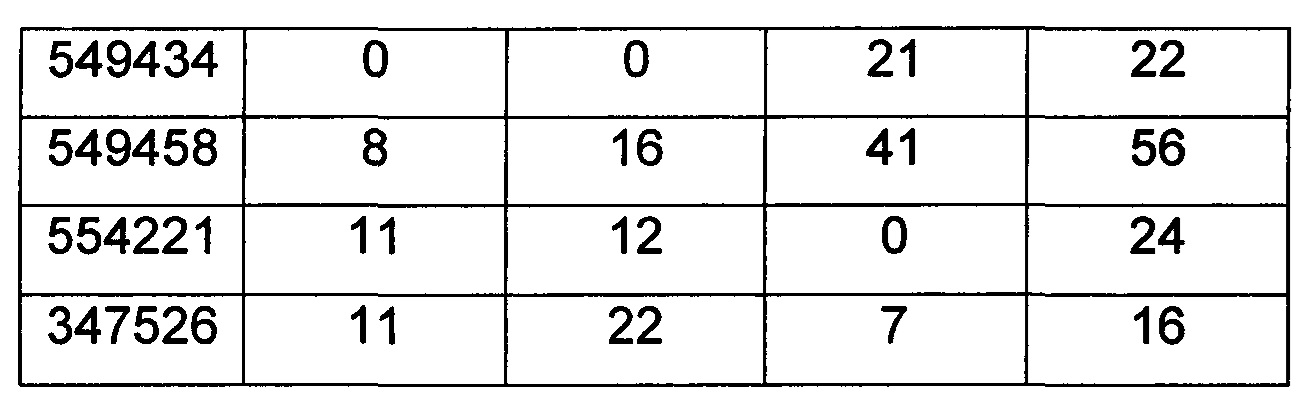
Пример 18: Воздействие антисмыслового ингибирования мРНК рецептора андрогенов (AR) человека на MDV3100-резистентные клетки LMR20
Была создана MDV3100-резистентная линия клеток, обозначенная LMR20. Анализировали воздействие антисмыслового ингибирования AR на пролиферативную способность и уровни мРНК AR клеток LMR20. Тестировали ISIS 560131, ISIS 549458 и ISIS 569236 вместе с LNA гэпмером, ISIS 554221.
Клетки LnCaP инкубировали с MDV3100 в возрастающих концентрациях в течение приблизительно 6 месяцев. После экстенсивного культивирования в присутствии 20 мкМ MDV3100 отбирали единственный клон. Этот клон, LMR20, сохранял способность обеспечивать свободный захват антисмысловых олигонуклеотидов без липид-опосредованной трансфекции, демонстрируя при этом приблизительно десятикратное увеличение IC50 при обработке MDV3100, по сравнению с родительскими клетками LnCaP.
Исследование 1
Клетки LMR20 высевали при плотности 1500 клеток на лунку в не содержащую фенолового красного среду с очищенной на активированном угле сывороткой плода коровы (CSS) для удаления любых андрогенов из среды (Life Technologies). ISIS 560131, ISIS 549458, ISIS 569236 и ISIS 554221 по отдельности добавляли в культуральную среду в концентрации 0,04 мкМ, 0,2 мкМ, 1,0 мкМ или 5,0 мкМ. ISIS 549148, который имеет неизвестную человеческую последовательность-мишень, был включен в качестве контроля. Синтетический агонист андрогенов, R1881 (Takeda, A.N. et al., Mol. Pharmacol. 2007. 71: 473-82), добавляли в день 1 в дозе 1 нМ к группе клеток, также обработанных каждым антисмысловым олигонуклеотидом. DHT добавляли в день 1 в дозе 10 нМ к другой группе клеток, также обработанных каждым антисмысловым олигонуклеотидом. MDV3100 добавляли в день 1 в дозе 10 нМ к еще одной группе клеток, не обработанных антисмысловым олигонуклеотидом, которая служила контролем. После обработки в течение 5 суток пролиферативную способность раковых клеток измеряли стандартным анализом МТТ (микрокультивирование с тетразолиевым соединением 3-(4,5-диметитиазол-2-ил)-2,5-дифенилтетразолия бромид). Результаты представлены в Таблице 42 в виде процента ингибирования пролиферации относительно необработанных клеток.
Как представлено в Таблице 42, в присутствии агонистов андрогенов R1881 или DHT олигонуклеотиды ISIS 560131, ISIS 549458 и ISIS 569236 значительно ингибировали пролиферацию MDV3100-резистентных клеток рака предстательной железы в зависимости от дозы в большей степени, чем ISIS 554221. Ингибирование пролиферации антисмысловыми олигонуклеотидами также было либо сравнимым, либо более сильным, чем при обработке MDV3100.
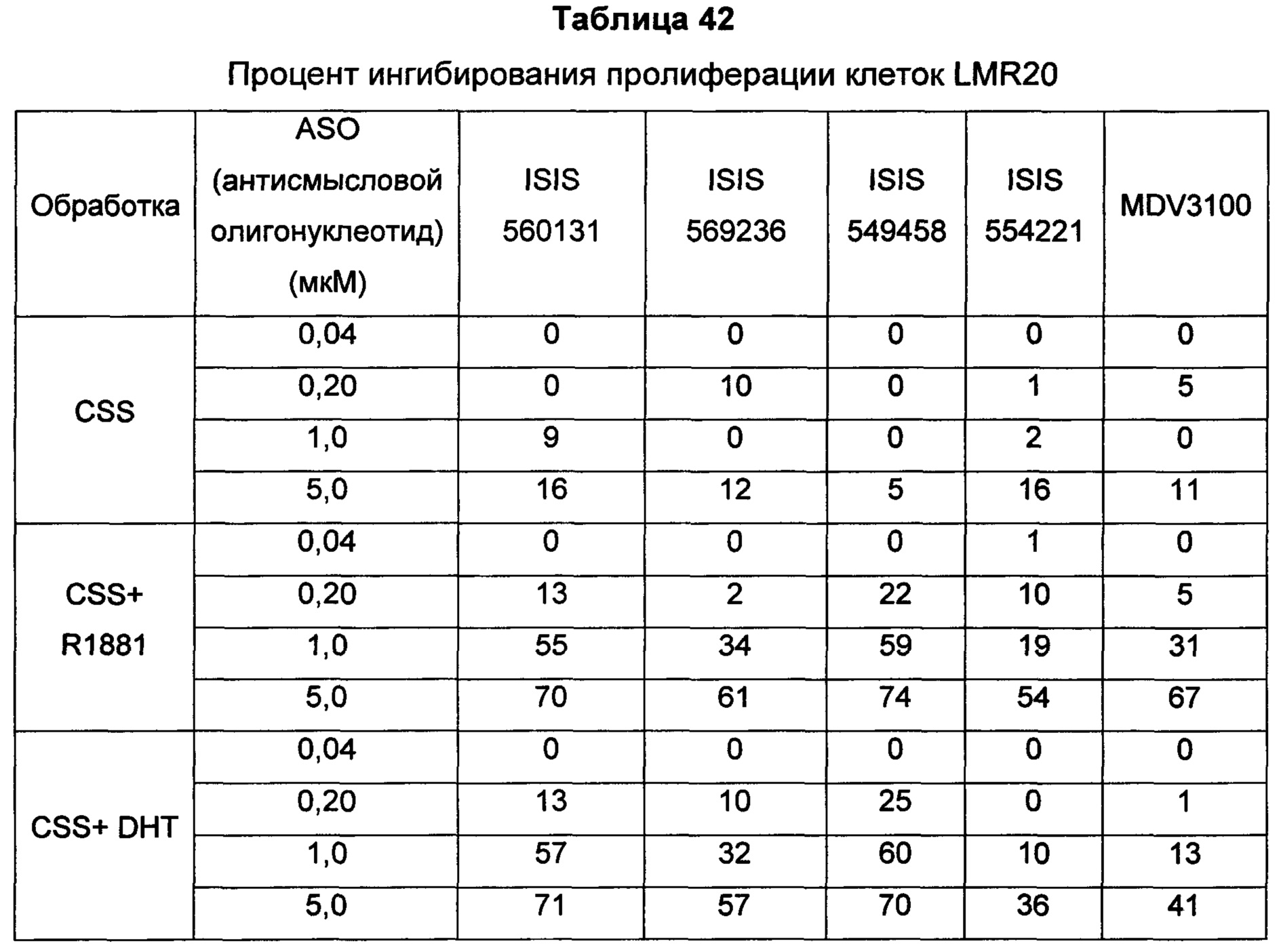
Исследование 2
Клетки LMR20 высевали при плотности 1500 клеток на лунку в не содержащей фенолового красного среде с CSS. ISIS 560131, ISIS 549458, ISIS 569236 и LNA гэпмер ISIS 554221 по отдельности добавляли в культуральную среду в концентрации 0,04 мкМ, 0,2 мкМ, 1,0 мкМ или 5,0 мкМ. ISIS 549148, который имеет неизвестную человеческую последовательность-мишень, был включен в качестве контроля. MDV3100 добавляли в день 1 в дозе 10 нМ к группе клеток, и он служил в качестве контроля. DHT добавляли в день 1 в дозе 10 нМ в течение 72 часов к одной группе клеток, также обработанных каждым из антисмысловых олигонуклеотидов или MDV3100. R1881 добавляли в день 1 в дозе 10 нМ в течение 72 часов к другой группе клеток, также обработанных каждым из антисмысловых олигонуклеотидов или MDV3100. Измеряли уровни мРНК AR, простатического специфического антигена (PSA) и TMPRSS2, андроген-регулируемого гена (Lin, В., et al., Cancer Res. 1999. 59: 4180). Результаты представлены в Таблицах 43-45 в виде уровней мРНК, выраженных процентах от исходных значений. Уровни мРНК могут понижаться или повышаться после обработки.
Как представлено в Таблицах 43-45, ISIS 560131, ISIS 549458 и ISIS 569236 снижали уровни мРНК AR в клетках LMR20, обработанных или не обработанных агонистом AR, в зависимости от дозы относительно исходного уровня. Обработка LNA гэпмером ISIS 554221 не изменяла уровни мРНК AR. ISIS 560131, ISIS 549458 и ISIS 569236 снижали уровни PSA и TMPRSS2 в большей степени, чем LNA гэпмер ISIS 554221 или MDV3100. Обработка MDV3100 повышала уровни мРНК AR в клетках, обработанных агонистом AR, и не снижала уровни ни PSA, ни мРНК TMPRSS2.

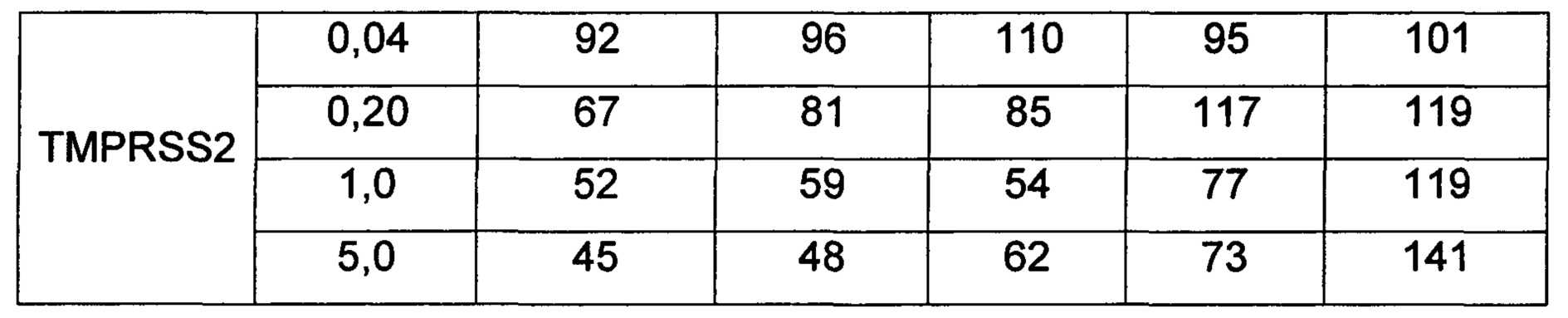
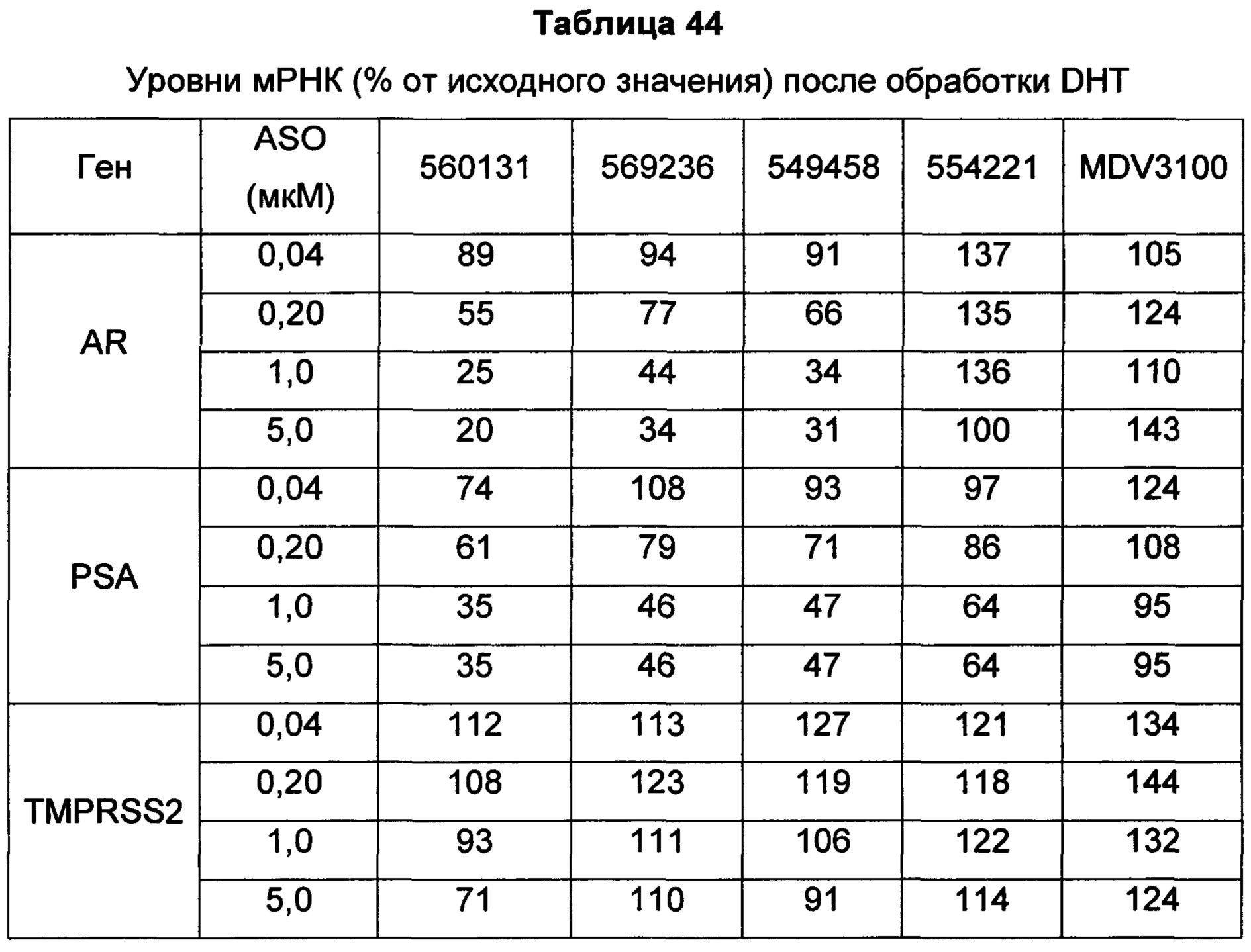
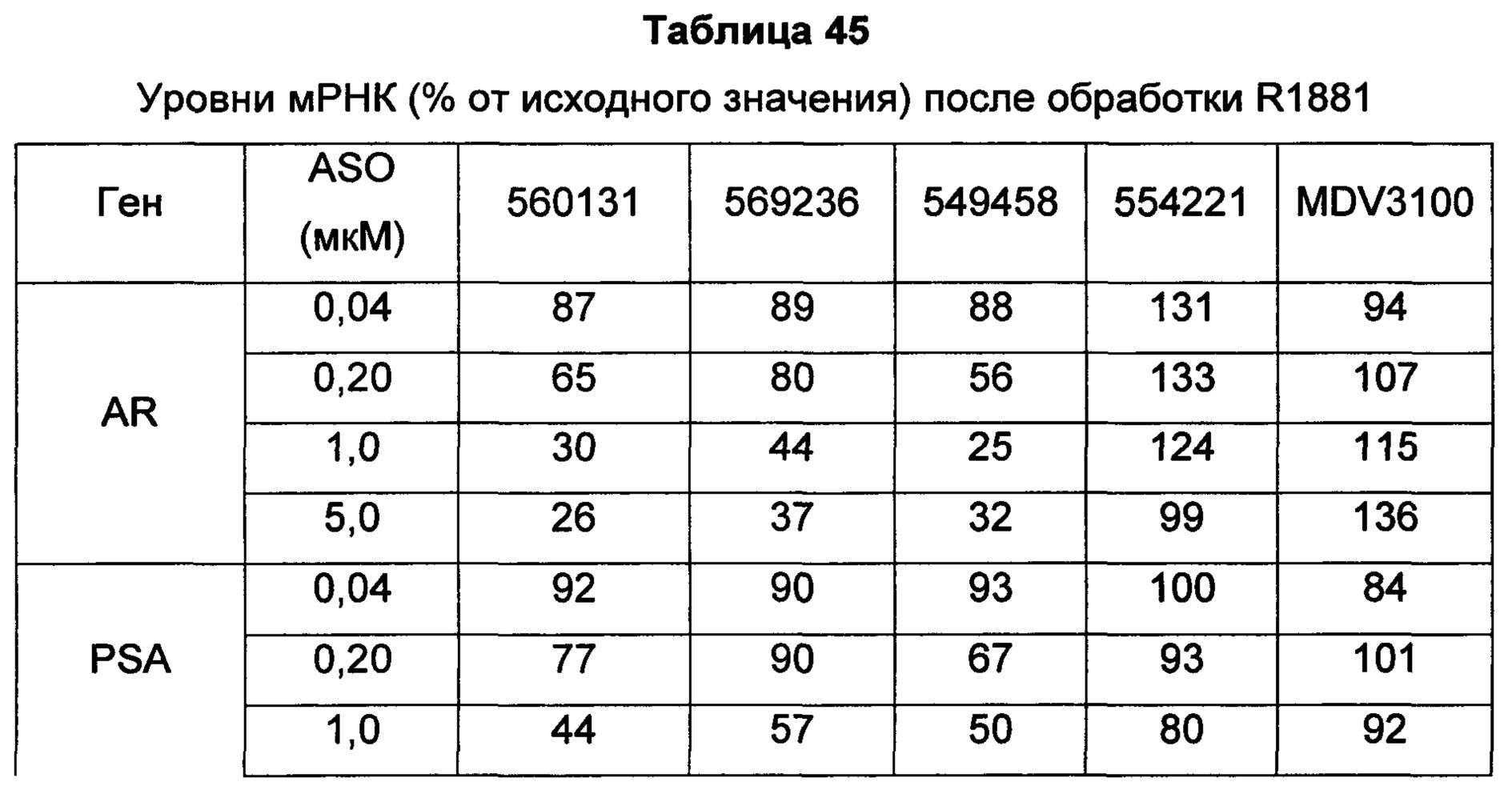
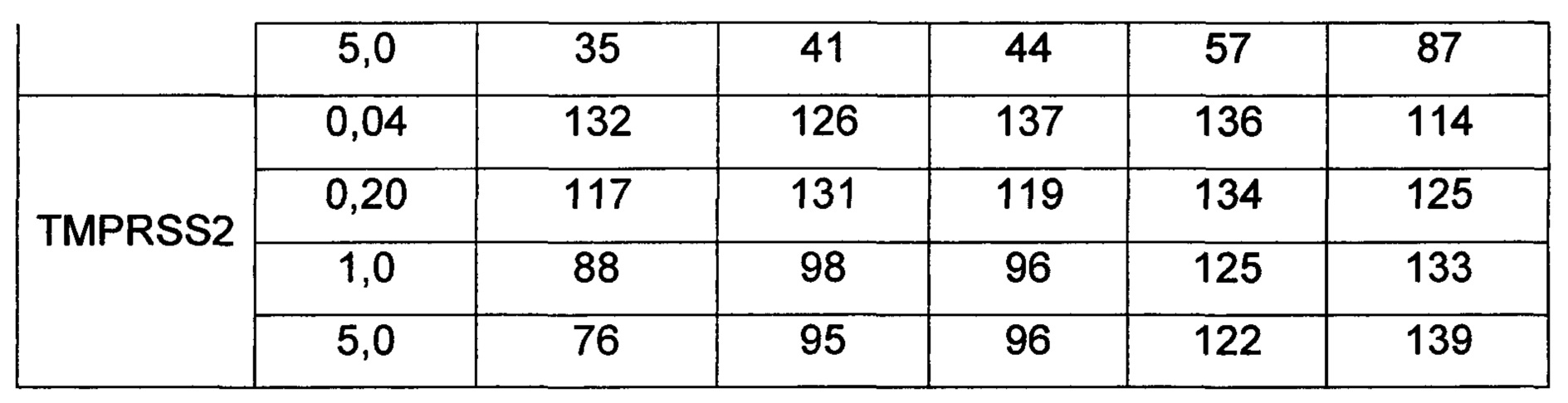
Пример 19: Воздействие антисмыслового ингибирования мРНК рецептора андрогенов (AR) человека в комбинации с MDV3100 на пролиферативную способность клеток С4-2В
Анализировали воздействие антисмыслового ингибирования AR в комбинации с разными дозами MDV3100 на пролиферативную способность раковых клеток. ISIS 549372, ISIS 549434, ISIS 549458 и ISIS 554221 тестировали в клетках С4-2В.
Клетки С4-2В высевали при плотности 1500 клеток на лунку. ISIS 549372, ISIS 549434, ISIS 549458 или ISIS 554221 по отдельности добавляли в культуральную среду в концентрации 0,1 мкМ. ISIS 347526 был включен в качестве негативного контроля. MDV3100 также добавляли в день 1 в дозах 0,25 мкМ или 1,00 мкМ. После обработки в течение 6 суток пролиферативную способность раковых клеток измеряли с использованием набора для определения клеточной пролиферации CellTiter 96® AQueous One Solution Cell Prolifiration (Promega), следуя инструкциям производителя. Результаты представлены в Таблице 46 в виде процента ингибирования пролиферации относительно необработанных клеток. Обработка клеток олигонуклеотидами ISIS 549372 или ISIS 549458 снижала клеточную пролиферацию в большей степени, чем обработка ISIS 554221. Например, как представлено в Таблице 46, обработка одним ISIS 549372 снижала клеточную пролиферацию на 59%, а обработка олигонуклеотидом ISIS 549458 снижала клеточную пролиферацию на 74% по сравнению с одним ISIS 554221, который снижал клеточную пролиферацию на 23%.
Как представлено в Таблицах 46 и 47, ISIS 549372 или ISIS 549458 в комбинации с MDV3100 ингибировали клеточную пролиферацию рака предстательной железы в большей степени, чем равная молярная концентрация ISIS 554221 в комбинации с MDV3100.
Чтобы выяснить, была ли обработка клеток олигонуклеотидами ISIS 549372 или ISIS 549458 с MDV3100 синергетической, анализ повторяли при 0,1 мкМ ASO (антисмысловой олигонуклеотид). Как представлено в Таблице 46, обработка олигонуклеотидом ISIS 549372 или ISIS 549458 с MDV3100 оказывала синергетическое действие. Например, один MDV3100 в концентрации 0,25 мкМ ингибировал пролиферацию на 4%; один ISIS 549372 в концентрации 0,1 мкМ ингибировал клеточную пролиферацию на 23%; в комбинации достигалось ингибирование клеточной пролиферации на 66%. Аналогично, один ISIS 549458 в концентрации 0,1 мкМ ингибировал клеточную пролиферацию на 39%; в комбинации достигалось ингибирование клеточной пролиферации на 75%. Следовательно, комбинация ISIS 549372 или ISIS 549458 и MDV3100 оказывала синергетическое действие (т.е. больше, чем аддитивное) на основе данных по ингибированию клеточной пролиферации рака предстательной железы.



Пример 20: Воздействие антисмыслового ингибирования мРНК рецептора андрогенов (AR) человека в комбинации с MDV3100 на пролиферативную способность клеток LNCaP
Анализировали воздействие антисмыслового ингибирования AR в комбинации с разными дозами MDV3100 на пролиферативную способность раковых клеток. ISIS 560131 и ISIS 569236 тестировали в клетках LNCaP.
Клетки LNCaP высевали при плотности 1000 клеток на лунку. ISIS 560131 или ISIS 569236 по отдельности добавляли в культуральную среду в концентрации 0,08 мкМ, 0,04 мкМ, 0,2 мкМ или 1,0 мкМ. ISIS 549148 был включен в качестве негативного контроля. MDV3100 добавляли к ISIS обработанным олигонуклеотидом клеткам в день 2 в дозах 0,016 мкМ, 0,08 мкМ, 0,4 мкМ или 2,0 мкМ. После обработки в течение 5 суток пролиферативную способность раковых клеток измеряли с использованием набора для определения клеточной пролиферации CellTiter 96® AQueous One или CellTiter-Glo® Solution (Promega), следуя инструкциям производителя. Результаты представлены в Таблицах 48-52 в виде процента ингибирования пролиферации относительно необработанных клеток.
Как представлено в Таблицах, обработка олигонуклеотидом ISIS 560131 или ISIS 569236 с MDV3100 оказывала синергетическое действие. Например, MDV3100 с контрольным олигонуклеотидом, ISIS 549148, в концентрации 0,08 мкМ ингибировал пролиферацию в среднем на 7%; один ISIS 560131 в концентрации 0,04 мкМ ингибировал клеточную пролиферацию на 24%; в комбинации достигалось ингибирование клеточной пролиферации на 41%. Аналогично, один ISIS 569236 в концентрации 0,04 мкМ ингибировал клеточную пролиферацию на 9%; в комбинации достигалось ингибирование клеточной пролиферации на 26%. Следовательно, комбинация ISIS 560131 или ISIS 569236 и MDV3100 оказывала синергетическое действие (т.е. больше, чем аддитивное) на основе данных по ингибирования клеточной пролиферации рака предстательной железы.
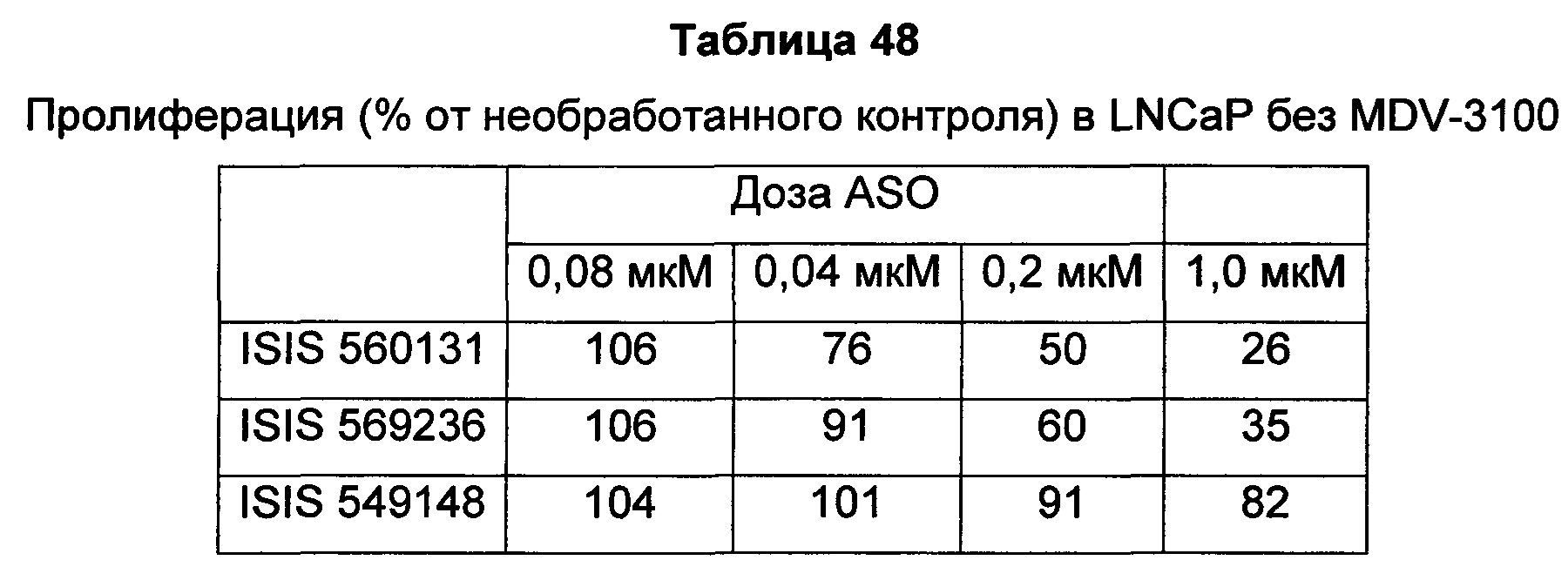
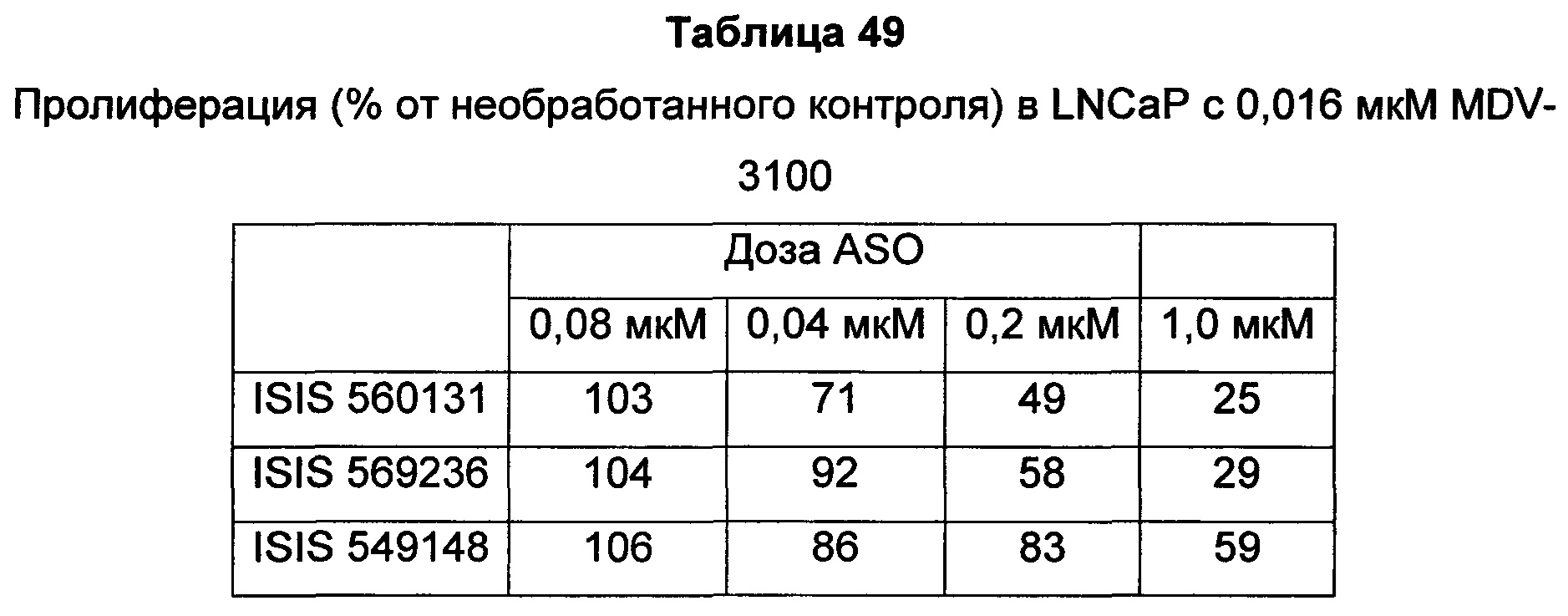



Пример 21: Воздействие антисмыслового ингибирования мРНК рецептора андрогенов (AR) человека в комбинации с MDV3100 на пролиферативную способность клеток С4-2В
Анализировали воздействие антисмыслового ингибирования AR в комбинации с разными дозами MDV3100 на пролиферативную способность раковых клеток. ISIS 560131 и ISIS 569236 тестировали в клетках С4-2В.
Клетки С4-2В высевали при плотности 1000 клеток на лунку. ISIS 560131 или ISIS 569236 по отдельности добавляли в культуральную среду в концентрации 0,08 мкМ, 0,04 мкМ, 0,2 мкМ или 1,0 мкМ. ISIS 549148 был включен в качестве негативного контроля. MDV3100 добавляли к обработанным ISIS олигонуклеотидом клеткам в день 2 в дозах 0,016 мкМ, 0,08 мкМ, 0,4 мкМ или 2,0 мкМ. После обработки в течение 5 суток пролиферативную способность раковых клеток измеряли с использованием набора для определения клеточной пролиферации CellTiter 96® AQueous One Solution (Promega), следуя инструкциям производителя. Результаты представлены в Таблицах 53-57 в виде процента ингибирования пролиферации относительно необработанных клеток.
Как представлено в Таблицах, обработка олигонуклеотидом ISIS 560131 или ISIS 569236 с MDV3100 оказывала синергетическое действие. Например, MDV3100 с контрольным олигонуклеотидом, ISIS 549148, в концентрации 0,4 мкМ ингибировал пролиферацию в среднем на 6%; один ISIS 560131 в концентрации 0,08 мкМ ингибировал клеточную пролиферацию на 16%; в комбинации достигалось ингибирование клеточной пролиферации на 31%. Аналогично, MDV3100 с контрольным олигонуклеотидом, ISIS 549148, в концентрации 0,08 мкМ не ингибировал пролиферацию (0%); один ISIS 569236 в концентрации 0,2 мкМ ингибировал клеточную пролиферацию на 37%; в комбинации достигалось ингибирование клеточной пролиферации на 52%. Следовательно, комбинация ISIS 560131 или ISIS 569236 и MDV3100 оказывала синергетическое действие (т.е. больше, чем аддитивное) на основе данных по ингибирования клеток рака предстательной железы пролиферацию.

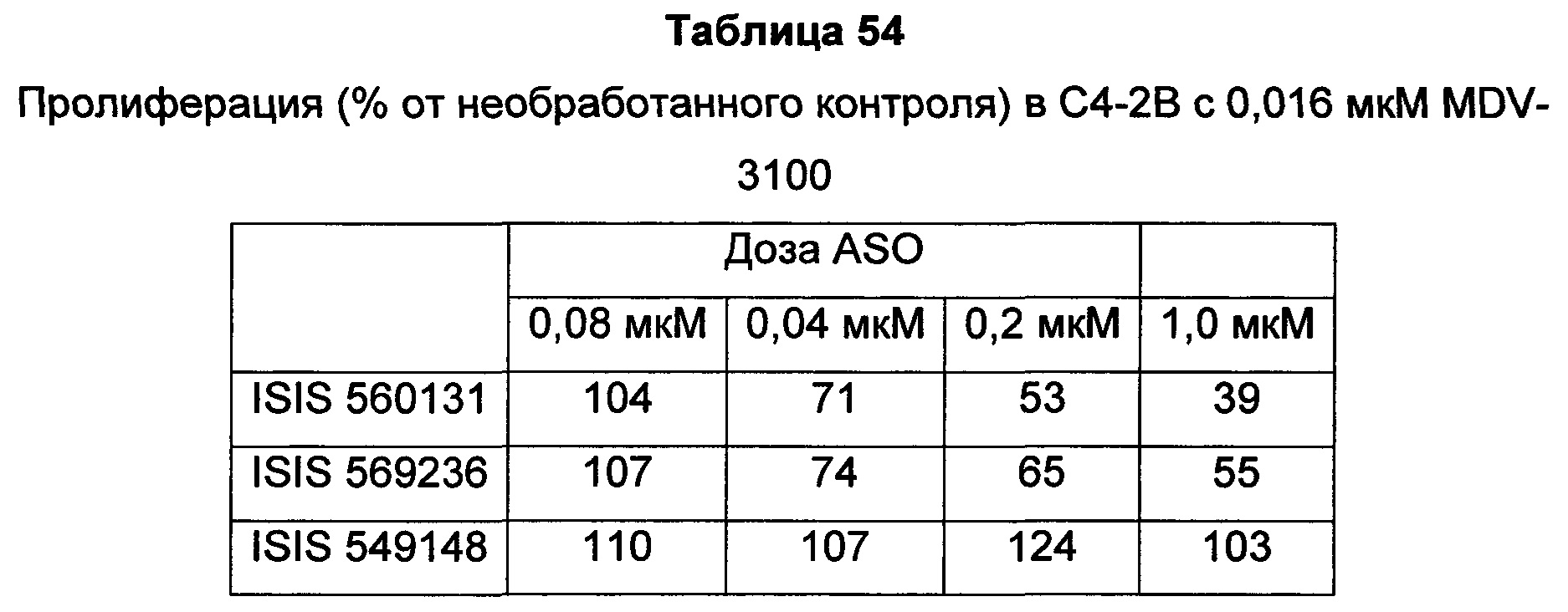


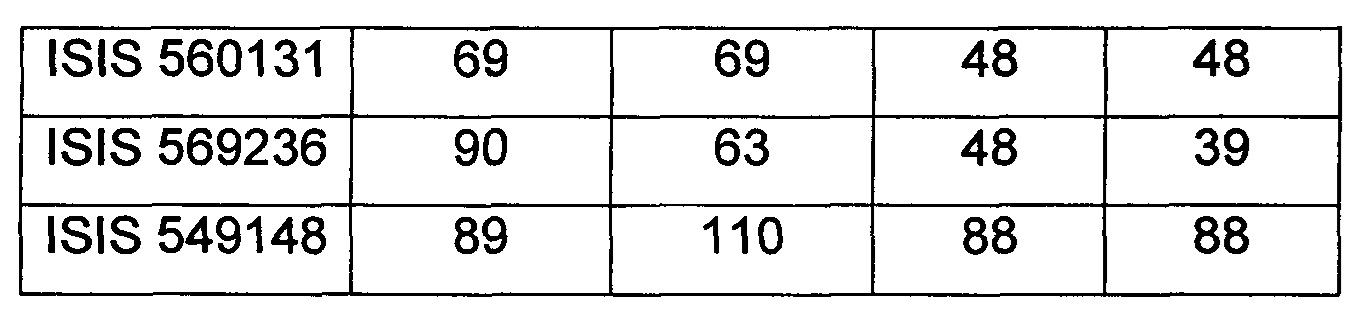

Пример 22: Воздействие антисмыслового ингибирования мРНК рецептора андрогенов (AR) человека в комбинации с MDV3100 на пролиферативную способность клеток 22RV1
Анализировали воздействие антисмыслового ингибирования AR в комбинации с разными дозами MDV3100 на пролиферативную способность раковых клеток. ISIS 560131 и ISIS 569236 тестировали в клетках 22RV1.
Клетки 22RV1 высевали при плотности 2000 клеток на лунку в среде с 5% CSS в течение 48 часов. Клетки трансфицировали с использованием реагента RNAiMAX с ISIS 560131 или ISIS 569236 в концентрациях 0,4 нМ, 1,34 нМ, 4 нМ или 13,4 нМ. ISIS 549148 был включен в качестве негативного контроля. DHT в концентрации 1 нМ и/или MDV3100 в дозах 0,04 мкМ, 0,2 мкМ, 1,0 мкМ или 5,0 мкМ добавляли через 4 часа. После обработки в течение 3 суток пролиферативную способность раковых клеток измеряли с использованием набора для определения клеточной пролиферации CellTiter 96® AQueous One Solution (Promega), следуя инструкциям производителя. Результаты представлены в Таблицах 58-62 в виде процента ингибирования пролиферации относительно необработанных клеток.
Как представлено в Таблицах, обработка олигонуклеотидом ISIS 560131 или ISIS 569236 с MDV3100 оказывала синергетическое действие. Например, MDV3100 с контрольным олигонуклеотидом, ISIS 549148, в концентрации 1,0 мкМ ингибировал пролиферацию в среднем на 5%; один ISIS 560131 в концентрации 1,34 нМ ингибировал клеточную пролиферацию на 3%; в комбинации достигалось ингибирование клеточной пролиферации на 23%. Аналогично, MDV3100 с контрольным олигонуклеотидом, ISIS 549148, в концентрации 1,0 мкМ ингибировал пролиферацию на 5%; один ISIS 569236 в концентрации 1,0 мкМ ингибировал клеточную пролиферацию на 17%; в комбинации достигалось ингибирование клеточной пролиферации на 30%. Следовательно, комбинация ISIS 560131 или ISIS 569236 и MDV3100 оказывала синергетическое действие (т.е. больше, чем аддитивное) на основе данных по ингибирования пролиферации клеток рака предстательной железы.
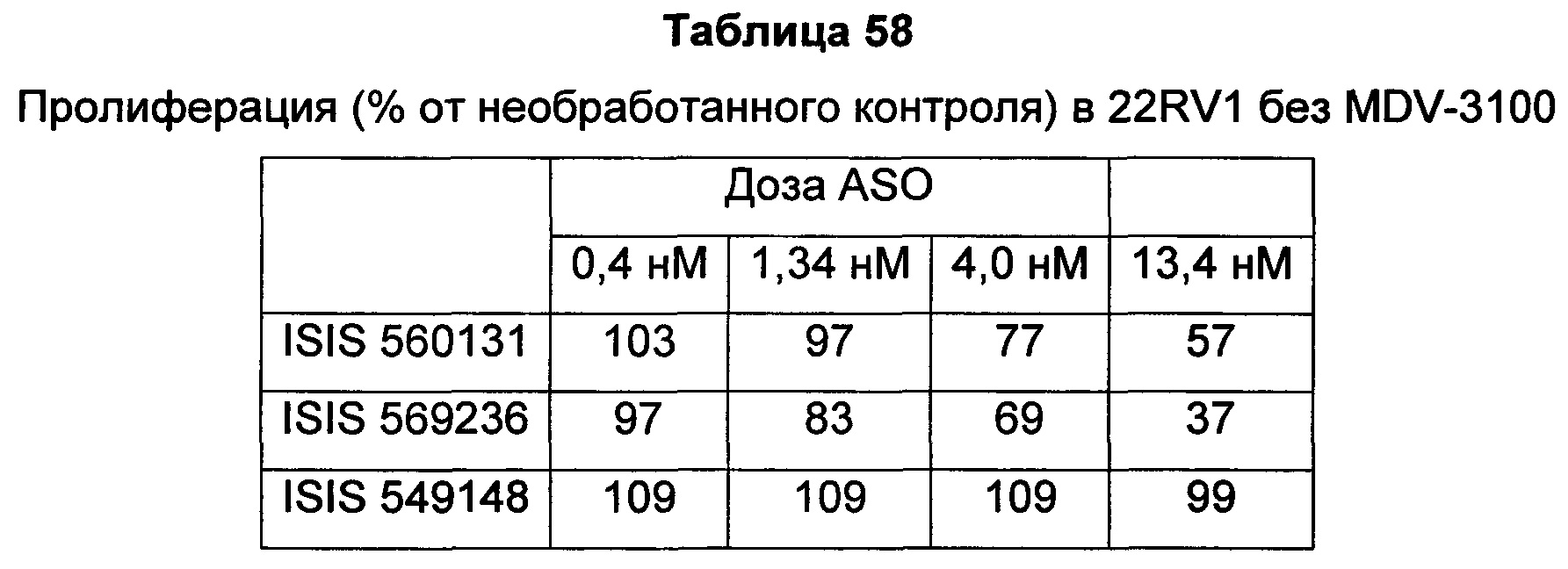

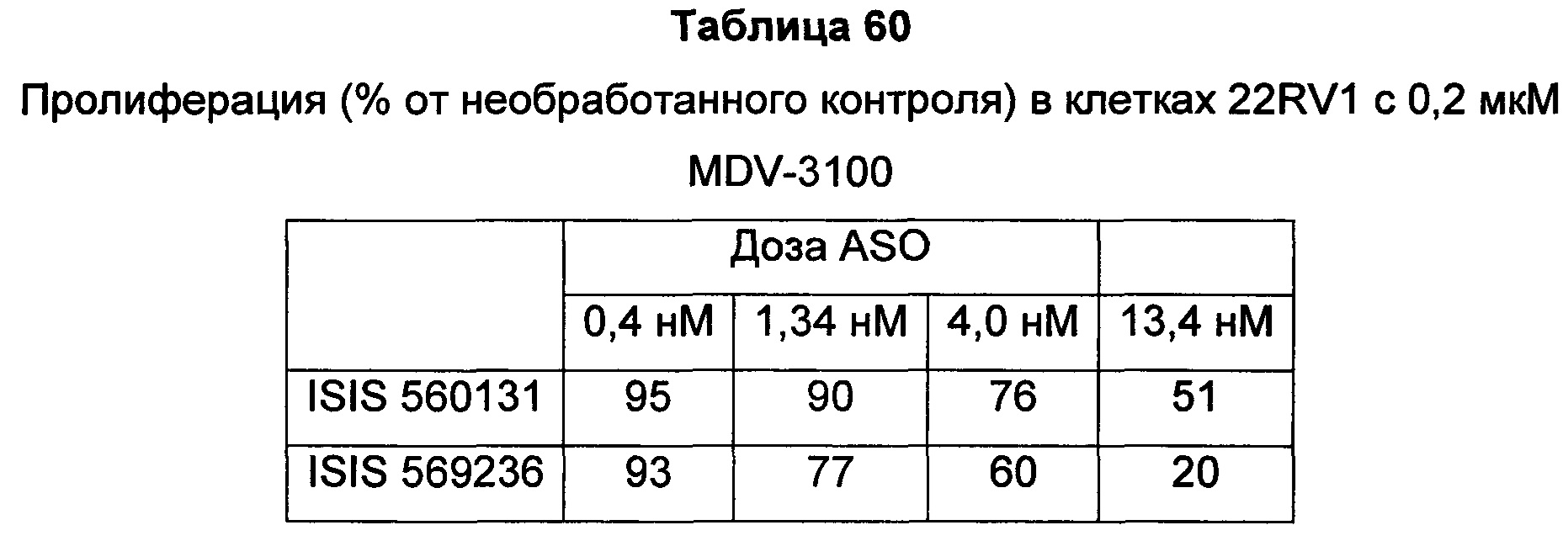



Пример 23: Воздействие антисмыслового ингибирования мРНК рецептора андрогенов (AR) человека на клетки CWR22-RV1
Анализировали воздействие антисмыслового ингибирования AR на пролиферативную способность раковых клеток. ISIS 549372, ISIS 549434, ISIS 549458 и ISIS 554221 тестировали в клетках CWR22-RV1.
Клетки CWR22-RV1 высевали и трансфицировали с использованием реагента RNAiMax (Life Technologies) ISIS олигонуклеотидами в концентрациях 1,7 нМ, 5,0 нМ, 16,7 нМ или 50 нМ. ISIS 347526 был включен в качестве негативного контроля. После обработки в течение 6 суток измеряли снижение уровня мишени и пролиферативную способность раковых клеток.
Антисмысловое ингибирование мРНК полноразмерного AR измеряли с использованием комплекта праймеров и зондов RTS3559. Результаты представлены в Таблице 63 в виде процента ингибирования относительно необработанных клеток. Снижение уровня мРНК варианта сплайсинга W AR также измеряли методом ОТ-ПЦР (обратная транскрипция-ПЦР), используя окрашивание зеленым красителем SYBR Green (Ни, R. et al., Cancer Res. 2009. 69: 16-22). Результаты представлены в Таблице 64 в виде процента сокращения относительно необработанных клеток. Клеточную пролиферацию измеряли с использованием набора для определения клеточной пролиферации CellTiter 96® AQueous One Solution (Promega), следуя инструкциям производителя. Результаты представлены в Таблице 65 в виде процента ингибирования пролиферации относительно необработанных клеток.

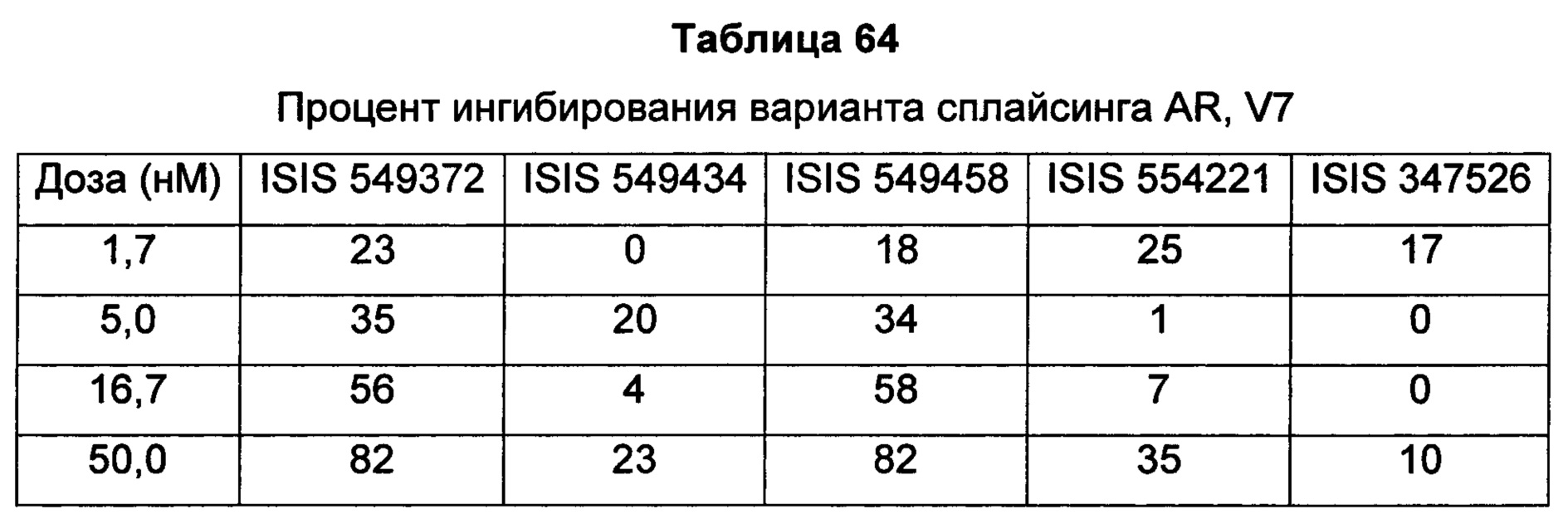
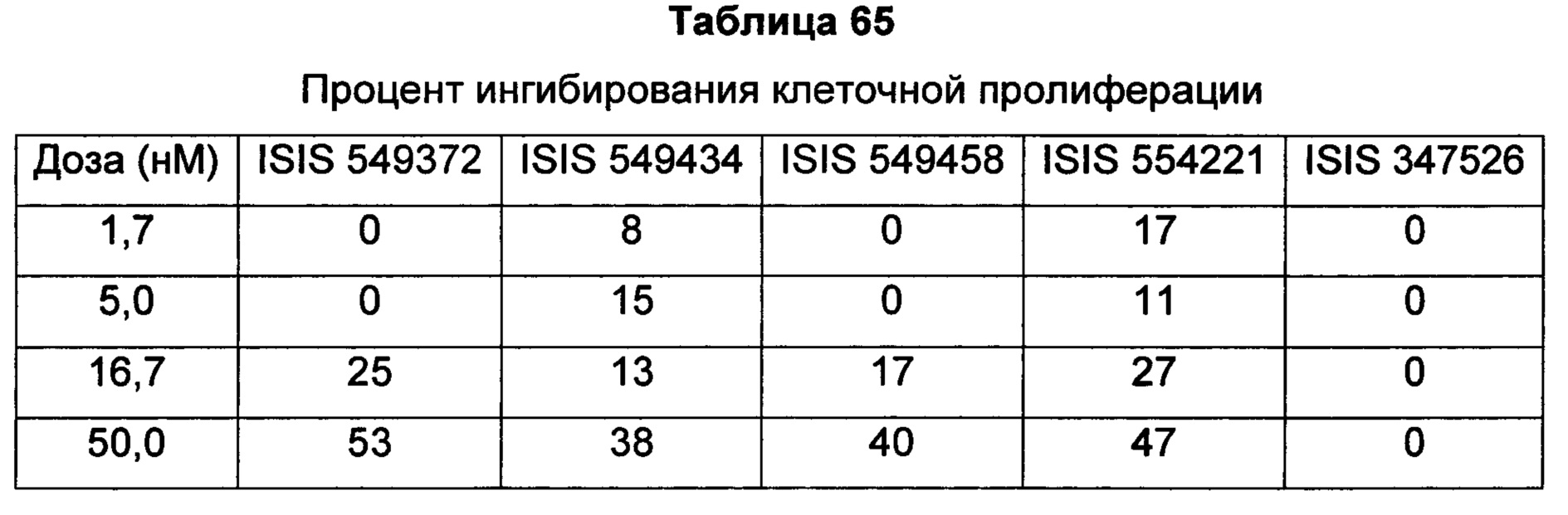
Пример 24: Воздействие антисмыслового ингибирования мРНК рецептора андрогенов (AR) человека при свободном захвате антисмыслового олигонуклеотида клетками С4-2В
Исследовали воздействие свободного захвата антисмысловых олигонуклеотидов на уровни мРНК AR. Тестировали ISIS 549372, ISIS 549434, ISIS 549458 и ISIS 554221.
Клетки высевали в концентрации 1000 клеток на лунку в 96-луночные планшеты для измерения клеточной пролиферации и в концентрации 4000 клеток на лунку для измерения снижения уровня мишени. ISIS 549458, ISIS 549372, ISIS 549434 и ISIS 554221 добавляли по отдельности в концентрации 0,04 мкМ, 0,20 мкМ, 1,00 мкМ или 5,00 мкМ. После инкубирования в течение 24 часов измеряли уровни мРНК, используя hAR_LTS00943. Данные представлены в Таблице 66. Результаты показывают, что ISIS 549458, ISIS 549372 и ISIS 549434 ингибировали экспрессию мРНК AR более мощно, чем ISIS 554221.
В день 6 клетки, засеянные для измерения пролиферации, инкубировали с реагентом МТТ до проявления окраски. Интенсивность окраски измеряли, используя спектрофотометр, при 490 нМ. Данные представлены в Таблице 67.


Пример 25: Воздействие антисмыслового ингибирования мРНК рецептора андрогенов (AR) человека при свободном захвате антисмыслового олигонуклеотида клетками LnCaP
Исследовали воздействие свободного захвата антисмысловых олигонуклеотидов на уровни mphkar.
Клетки высевали в концентрации 4000 клеток на лунку в 96-луночные планшеты. ISIS олигонуклеотиды, указанные в Таблице 68, добавляли по отдельности в концентрации 0,02 мкМ, 0,10 мкМ, 0,50 мкМ, 2,50 мкМ или 10,00 мкМ. После инкубирования в течение 24 часов уровни мРНК измеряли с использованием комплекта праймеров и зондов hAR_LTS00943. Данные представлены в Таблице 68. Результаты показывают, что большинство ISIS олигонуклеотидов ингибировали экспрессию мРНК AR более мощно, чем ISIS 554221, при каждой концентрации.
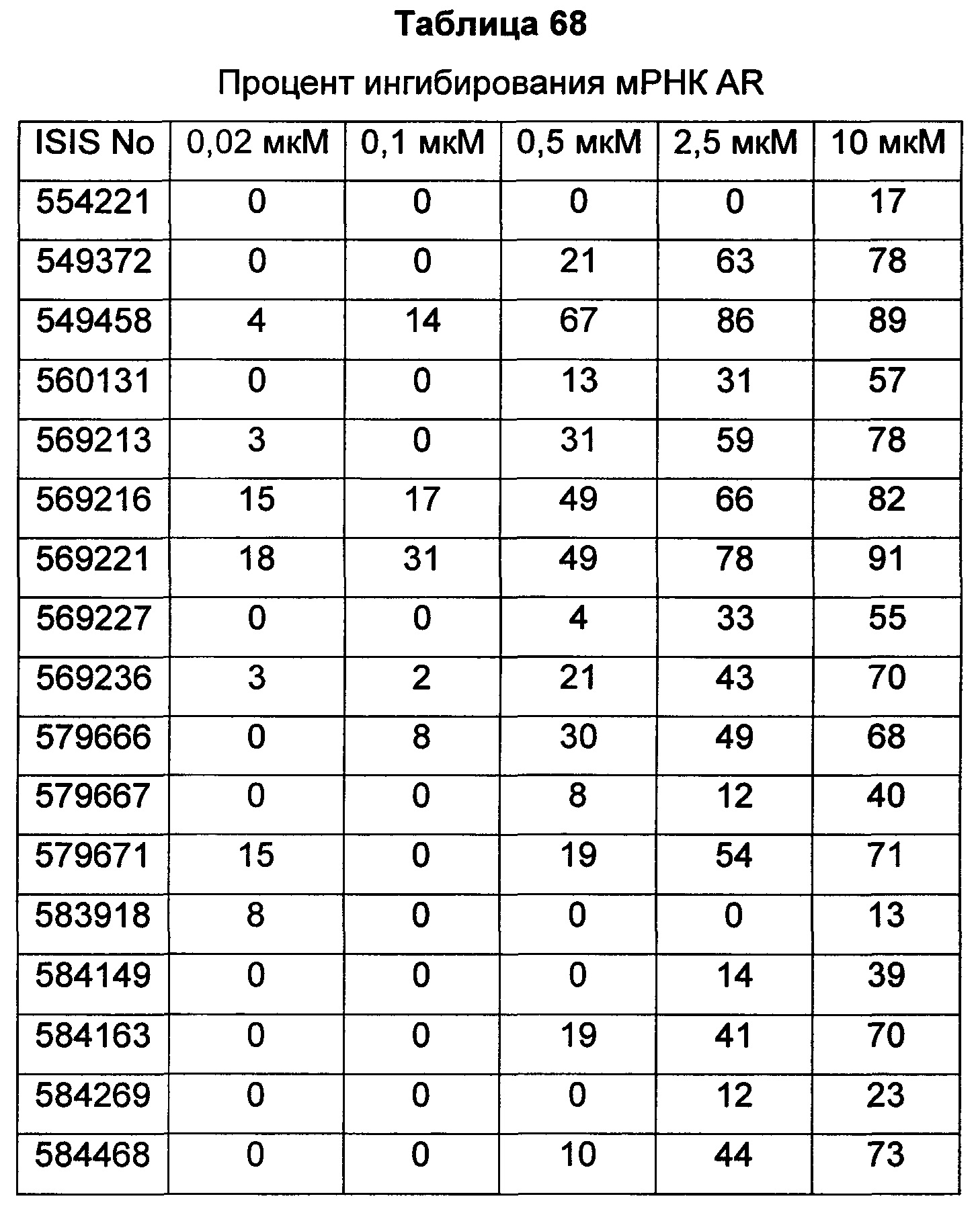

Пример 26: Воздействие антисмыслового ингибирования мРНК рецептора андрогенов (AR) человека в присутствии DHT на пролиферативную способность клеток 22RV1
Дигидротестостерон (DHT) является андрогенным гормоном и активатором AR. Анализировали эффект антисмыслового ингибирования AR на пролиферативную способность раковых клеток, обработанных DHT. ISIS 560131 и ISIS 569236 тестировали в линии клеток карциномы предстательной железы человека, 22RV1.
Клетки 22RV1 высевали при плотности 1500 клеток на лунку. ISIS 560131 и ISIS 569236 по отдельности трансфицировали в клетки, используя реагент RNAiMAX™ (Life Technologies) в концентрации 1,34 нМ, 4,00 нМ, 13,4 нМ или 40,0 нМ. ISIS 549148, который имеет неизвестную последовательность-мишень человека, был включен в качестве контроля. Отдельные группы клеток, обработанные также каждым из антисмысловых олигонуклеотидов, обрабатывали DHT, добавляя его в день 1 в конечной концентрации 1 нМ. После обработки в течение 5 суток пролиферативную способность раковых клеток измеряли, используя стандартный МТТ-анализ. Результаты представлены в Таблице 69 в виде процента ингибирования пролиферации относительно необработанных клеток.
Как представлено в Таблице 69, ISIS 560131 и ISIS 569236 оба значительно ингибировали клеточную пролиферацию рака предстательной железы даже в присутствии активатора AR, DHT, по сравнению с контролем. Контрольный олигонуклеотид не показал никакого влияния на пролиферацию, как ожидалось.


Пример 27: Исследование по определению зависимости от времени обработки клеток С4-2В ISIS олигонуклеотидами, направленно воздействующими на AR
Анализировали воздействие антисмыслового ингибирования раковых клеток С4-2В на экспрессию генов. Тестировали ISIS 560131 и ISIS 569236.
Анализ мРНКАР
Клетки С4-2В высевали при плотности 1000 клеток на лунку в полной среде. ISIS 560131 или ISIS 569236 по отдельности добавляли в культуральную среду до конечных концентраций 0,04 мкМ, 0,2 мкМ, 1,0 мкМ или 5,0 мкМ, не используя реагент для трансфекции. ISIS 549148 был включен в качестве негативного контроля. MDV3100 добавляли в дозе 0,04 мкМ, 0,2 мкМ, 1,0 мкМ или 5,0 мкМ к отдельной группе клеток. После обработки в течение 8 часов, 24 часов и 48 часов измеряли экспрессию AR с использованием комплекта праймеров и зондов hAR-LTS00943. Результаты представлены в Таблицах 70-72 в виде процента экспрессии AR относительно необработанных клеток. Обработка клеток олигонуклеотидами ISIS 560131 или ISIS 569236 снижала экспрессию AR в клетках по сравнению с контрольной группой. Обработка MDV3100 увеличивала экспрессию AR в точке времени 48 часов.
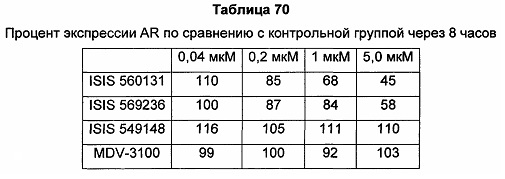


Анализ белка AR
Уровни белка в клетках также анализировали. Клетки харвестировали в буфере RIPA, содержащем ингибиторы протеаз. Присутствие полос для полноразмерного AR детектировали вестерн-блоттингом с использованием AR антитела (N-20, SC-816, Santa Cruz Biotechnology). Уровни полноразмерного AR, нормализованные к уровням гена "домашнего хозяйства", GAPDH, значительно снижались в клетках, обработанных ISIS 560131 или ISIS 569236 в течение 24 часов и 48 часов.
Анализ экспрессии мРНК ниже генов
Анализ экспрессии простатического специфического антигена (PSA) и TMPRSS2 также анализировали. Результаты представлены в Таблицах 73-75 в виде процента ингибирования экспрессии PSA и в Таблицах 76-78 в виде процента ингибирования экспрессии TMPRSS2 относительно необработанных клеток. Обработка клеток олигонуклеотидами ISIS 560131 или ISIS 569236 снижала экспрессию PSA и TMPRSS2 в клетках по сравнению с контрольной группой в точки времени 24 ч и 48 ч. Обработка MDV-3100 также снижала экспрессию ниже генов, но не настолько сильно, как ISIS олигонуклеотиды.

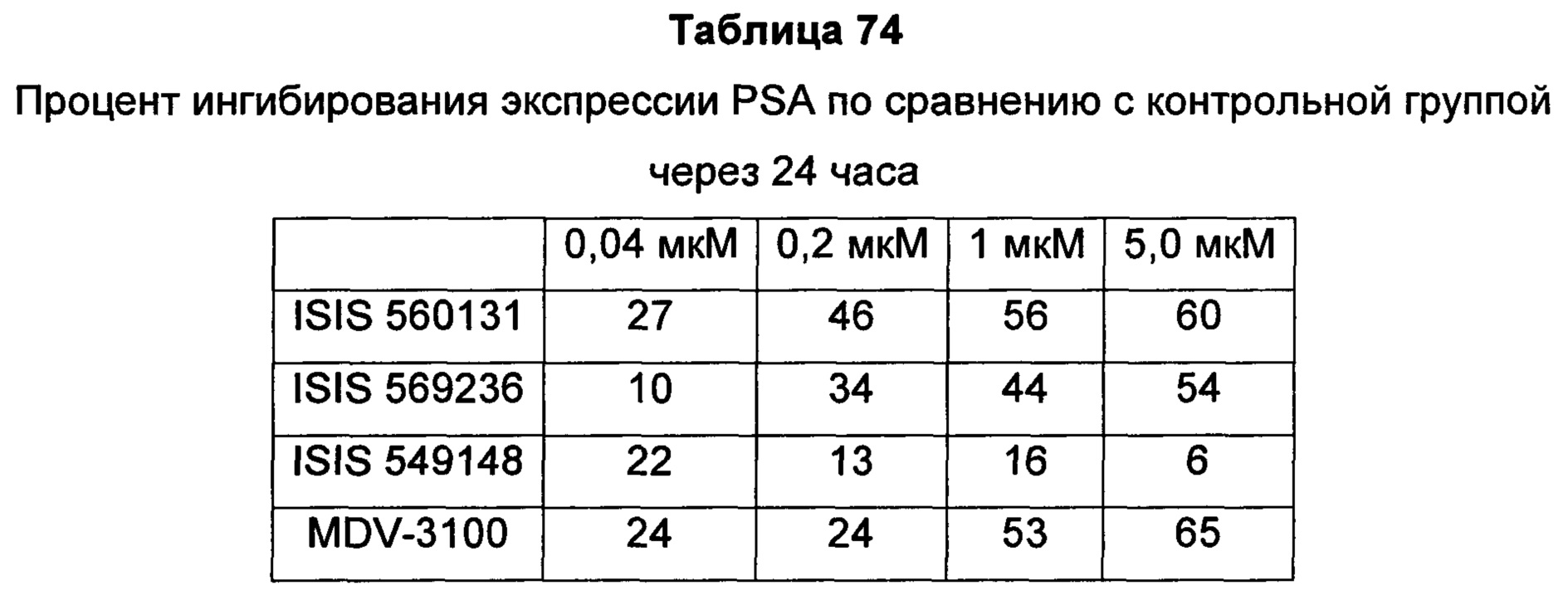
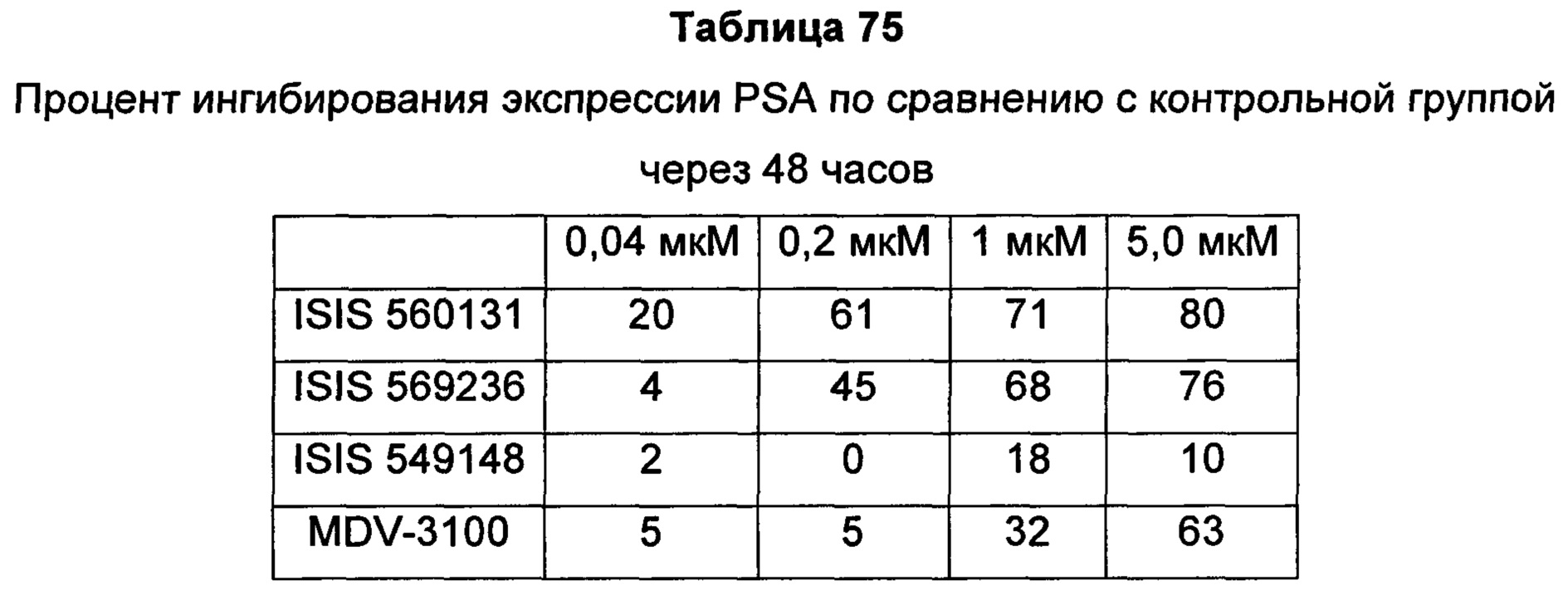
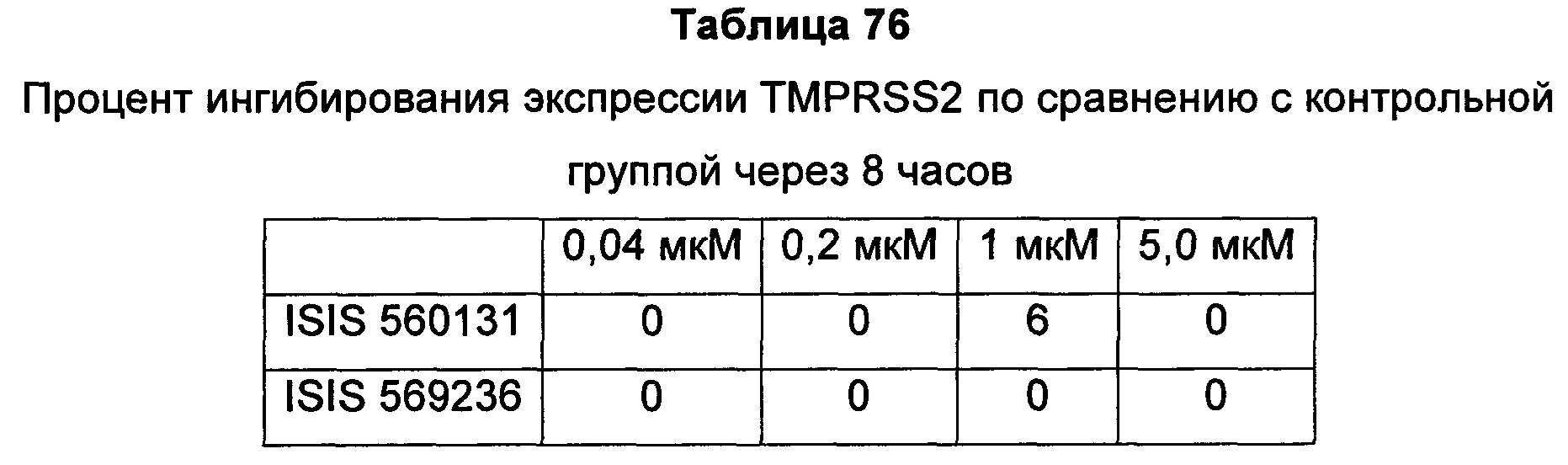

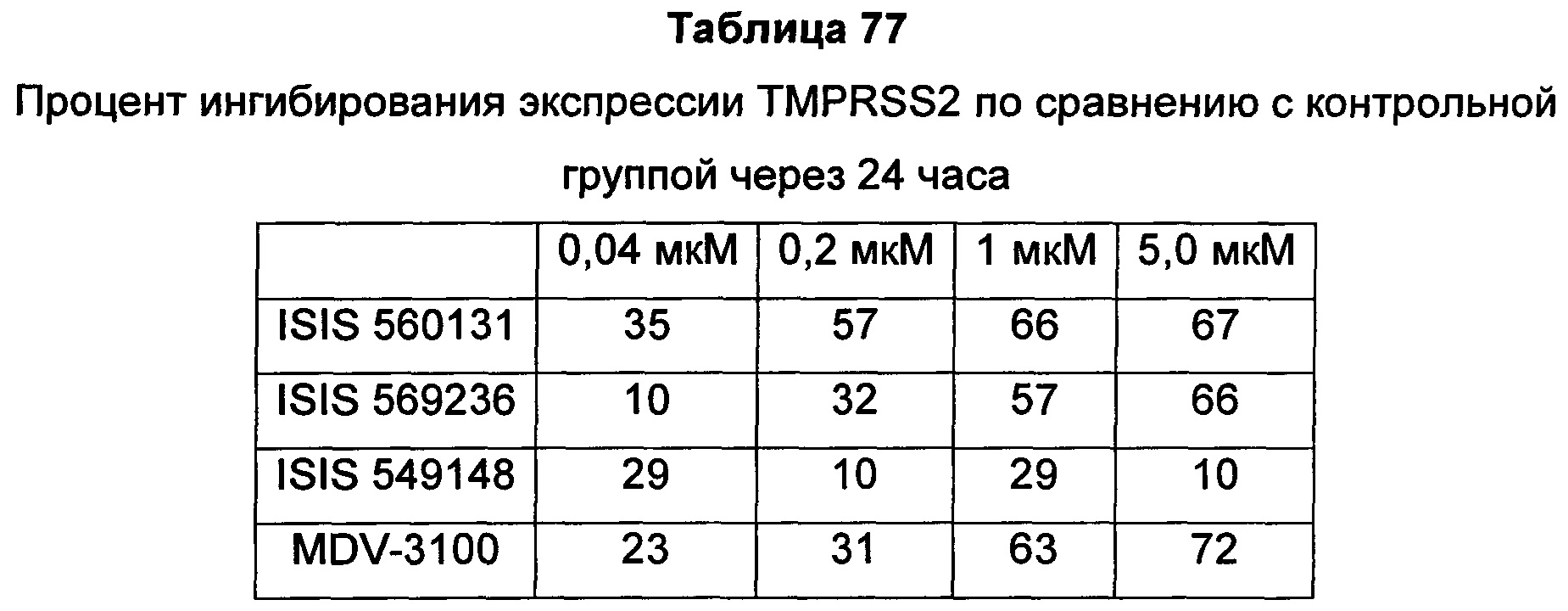

Пример 28: Антисмысловое ингибирование мРНК AR в клетках LNCaP, культивированных в полной среде и CSS средах
Исследовали эффект антисмыслового ингибирования AR в клетках LNCaP, культивированных в полной среде, а также в CSS среде с DHT.
Экспрессия генов в полной среде
Клетки высевали при плотности 1000 клеток на лунку. ISIS 560131 или ISIS 569236 добавляли по отдельности в концентрации 0,04 мкМ, 0,2 мкМ, 1,0 мкМ или 5,0 мкМ. ISIS 549148 был включен в качестве негативного контроля. MDV3100 добавляли в дозе 0,04 мкМ, 0,2 мкМ, 1,0 мкМ или 5,0 мкМ к отдельной группе клеток. После инкубирования в течение 48 часов измеряли уровни РНК AR, PSA и TMPRSS2. Данные представлены в Таблицах 79-81.
Анализ белка полноразмерного AR также продемонстрировал зависимое от дозы снижение экспрессии, нормализованное к уровням гена "домашнего хозяйства", GAPDH.



Экспрессия генов в среде CSS и средах CSS+DHT
Клетки высевали при плотности 2000 клеток на лунку и культивировали в не содержащей фенолового красного среде RPMI, дополненной средой, представляющей собой очищенную на активированном угле 5% сыворотку (Gibco) в течение 16 часов. ISIS 560131 или ISIS 569236 добавляли по отдельности в концентрации 0,04 мкМ, 0,2 мкМ, 1,0 мкМ или 5,0 мкМ к каждой группе клеток. ISIS 549148 был включен в качестве негативного контроля. MDV3100 добавляли в концентрации 0,04 мкМ, 0,2 мкМ, 1,0 мкМ или 5,0 мкМ к отдельной группе клеток. После инкубирования в течение 4 часов в среду добавляли DHT до конечной концентрации 1 нМ, как указано. РНК собирали спустя 48 часов, и измеряли уровни AR, PSA и TMPRSS2. Данные представлены в Таблицах 82-85. В отсутствие DHT экспрессия AR в клетках LNCaP составляла 95%, экспрессия PSA составляла 7%, и экспрессия TMPRSS2 составляла 24% относительно необработанного контроля.
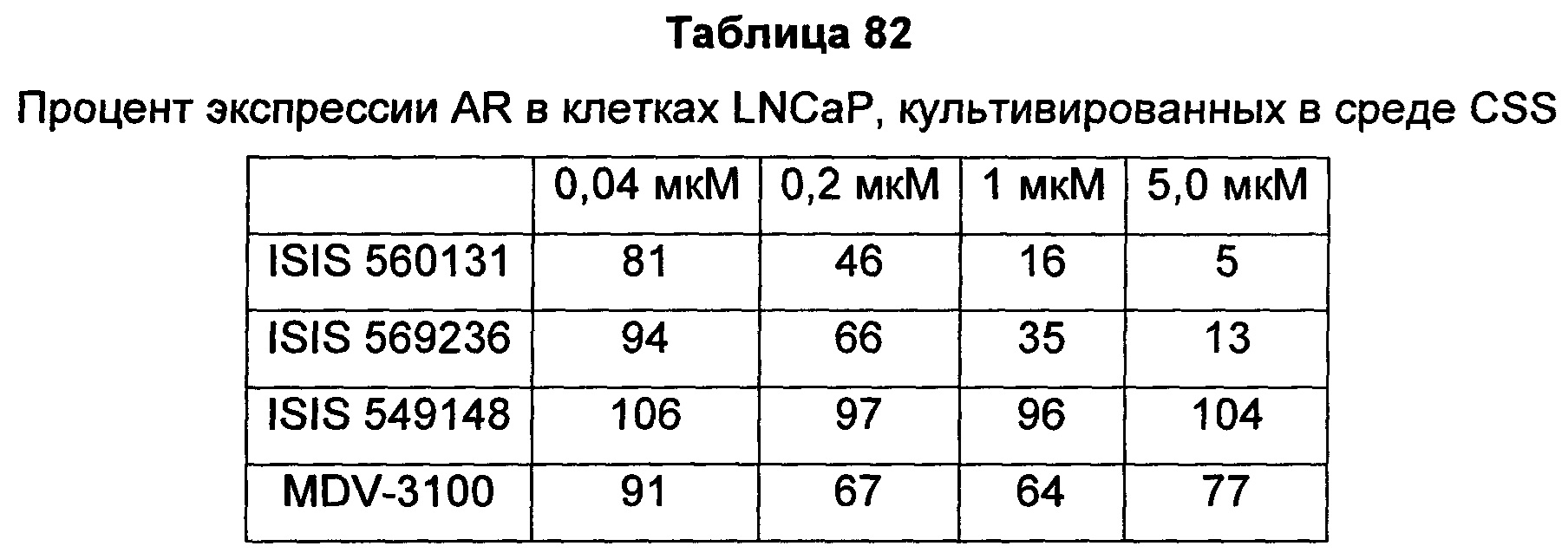

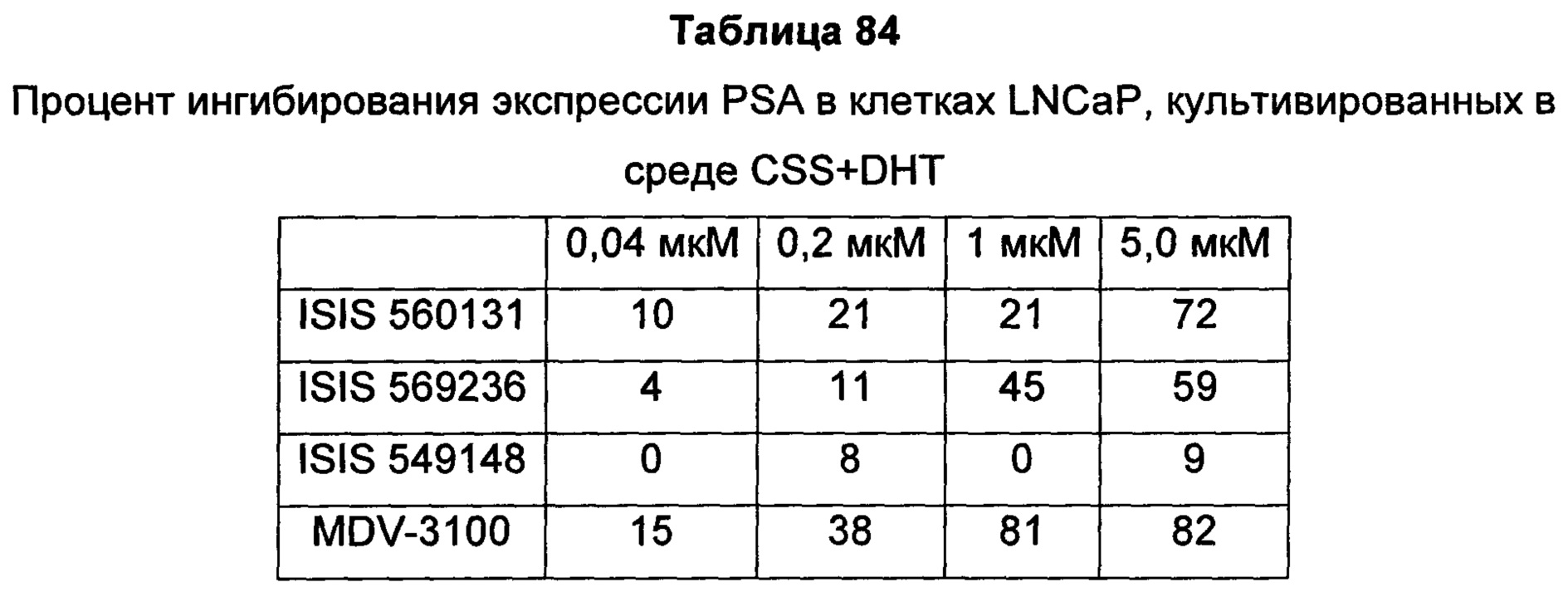

Влияние на пролиферацию в среде CSS и средах CSS+DHT
После обработки в течение 5 суток в полной среде или в среде CSS+1 нМ DHT пролиферативную способность раковых клеток измеряли с использованием набора для определения клеточной пролиферации CellTiter 96® AQueous One Solution или CellTiter-Glo® solution (Promega), следуя инструкциям производителя. Результаты представлены в Таблицах 86 и 87 в виде процента ингибирования пролиферации относительно необработанных клеток. Обработка клеток олигонуклеотидами ISIS 560131, ISIS 569236 и MDV-3100 снижала клеточную пролиферацию в зависимости от дозы по сравнению с контролем. Обработка олигонуклеотидами ISIS в среде CSS+DHT снижала пролиферативную способность в большей степени, чем обработка MVD-3100. Пролиферативная способность клеток, культивированных в среде CSS без DHT, составляет 17% от необработанных контрольных уровней.
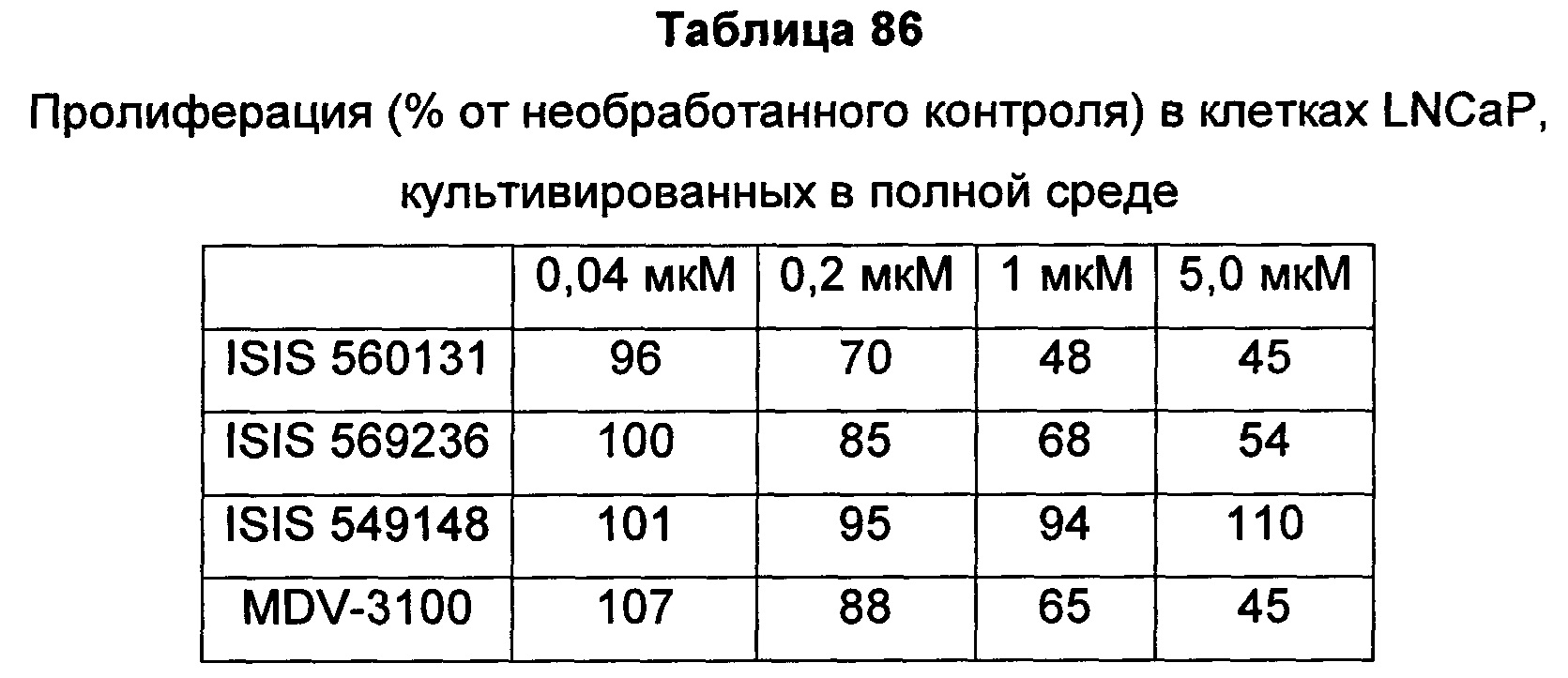

Пример 29: Антисмысловое ингибирование мРНК AR в клетках С4-2, культивированных в полной среде и в среде CSS
Исследовали эффект антисмыслового ингибирования уровней мРНК AR в клетках С4-2, культивированных в полной среде, а также в среде CSS с DHT.
Экспрессия генов в полной среде
Клетки высевали при 1000 клеток на лунку. ISIS 560131 или ISIS 569236 добавляли по отдельности в концентрации 0,04 мкМ, 0,2 мкМ, 1,0 мкМ или 5,0 мкМ. ISIS 549148 был включен в качестве негативного контроля. MDV3100 добавляли в концентрации 0,04 мкМ, 0,2 мкМ, 1,0 мкМ или 5,0 мкМ к отдельной группе клеток. После инкубирования в течение 48 часов измеряли уровни РНК AR, PSA и TMPRSS2. Данные представлены в Таблицах 88-90. Обработка олигонуклеотидом ISIS ингибировала экспрессию AR, тогда как обработка MDV3100 увеличивала экспрессию AR в клетках.
Анализ белка полноразмерного AR и PSA также продемонстрировала зависимое от дозы снижение экспрессии, нормализованное к уровням гена "домашнего хозяйства", GAPDH.
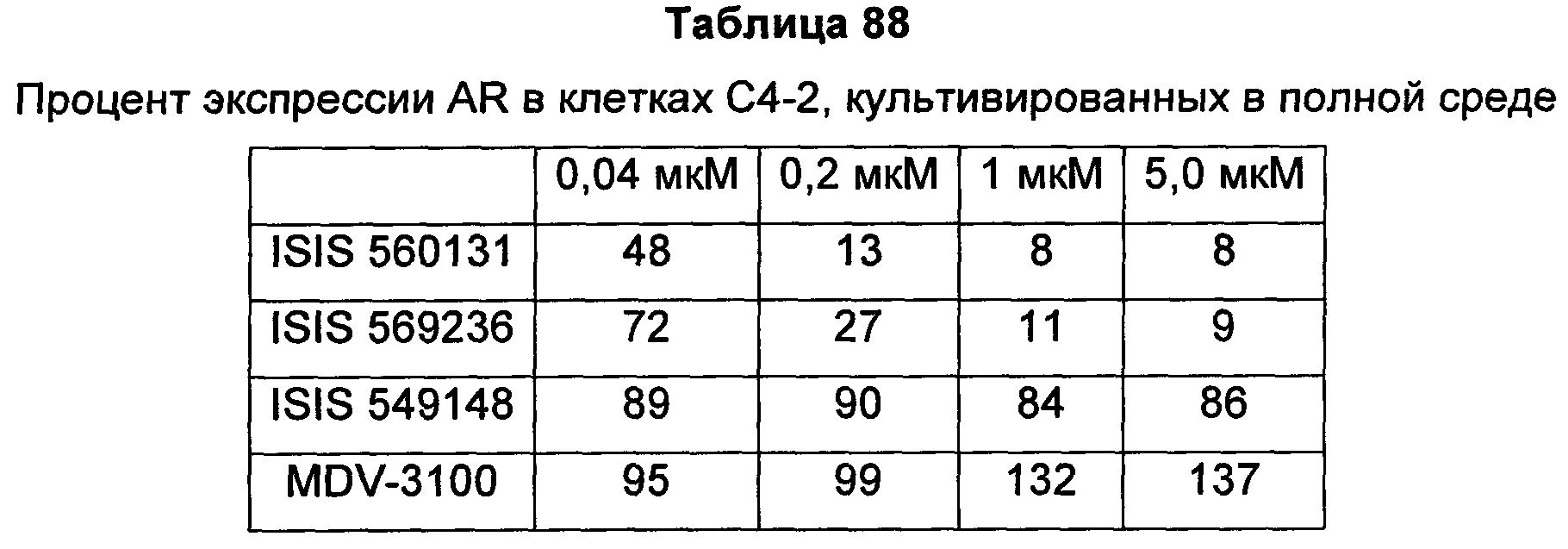
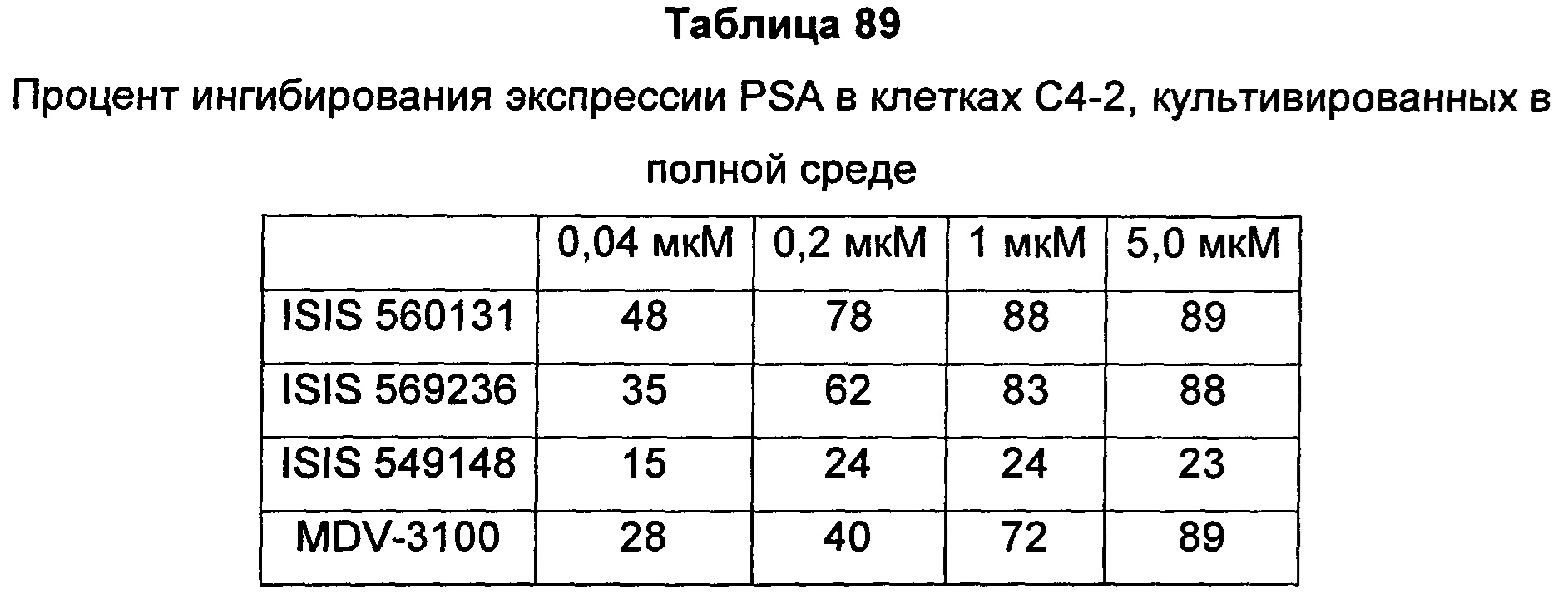

Экспрессия генов в среде CSS+DHT
Клетки высевали при 2000 клеток на лунку и культивировали в среде CSS с 1 нМ DHT. ISIS 560131 или ISIS 569236 добавляли по отдельности в концентрации 0,04 мкМ, 0,2 мкМ, 1,0 мкМ или 5,0 мкМ к каждой группе клеток. ISIS 549148 был включен в качестве негативного контроля. MDV3100 добавляли в концентрации 0,04 мкМ, 0,2 мкМ, 1,0 мкМ или 5,0 мкМ к отдельной группе клеток. После инкубирования в течение 48 часов измеряли уровни РНК AR, PSA и TMPRSS2. Данные представлены в Таблице 91-93. В отсутствие DHT экспрессия AR в клетках С4-2 составляла 153%, экспрессия PSA составляла 42% и экспрессия TMPRSS2 составляла 23% по сравнению с необработанным контролем. Обработка олигонуклеотидом ISIS ингибировала экспрессию AR, тогда как обработка MDV-3100 увеличивала экспрессию AR в клетках.

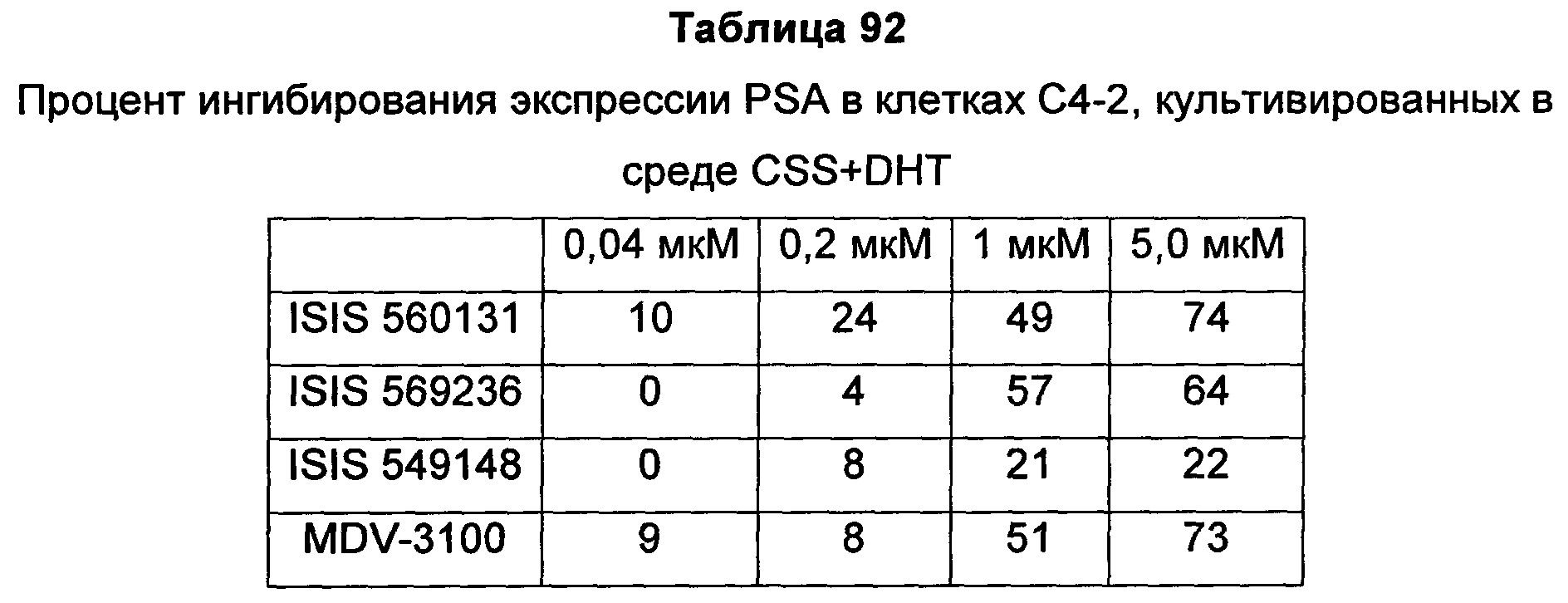
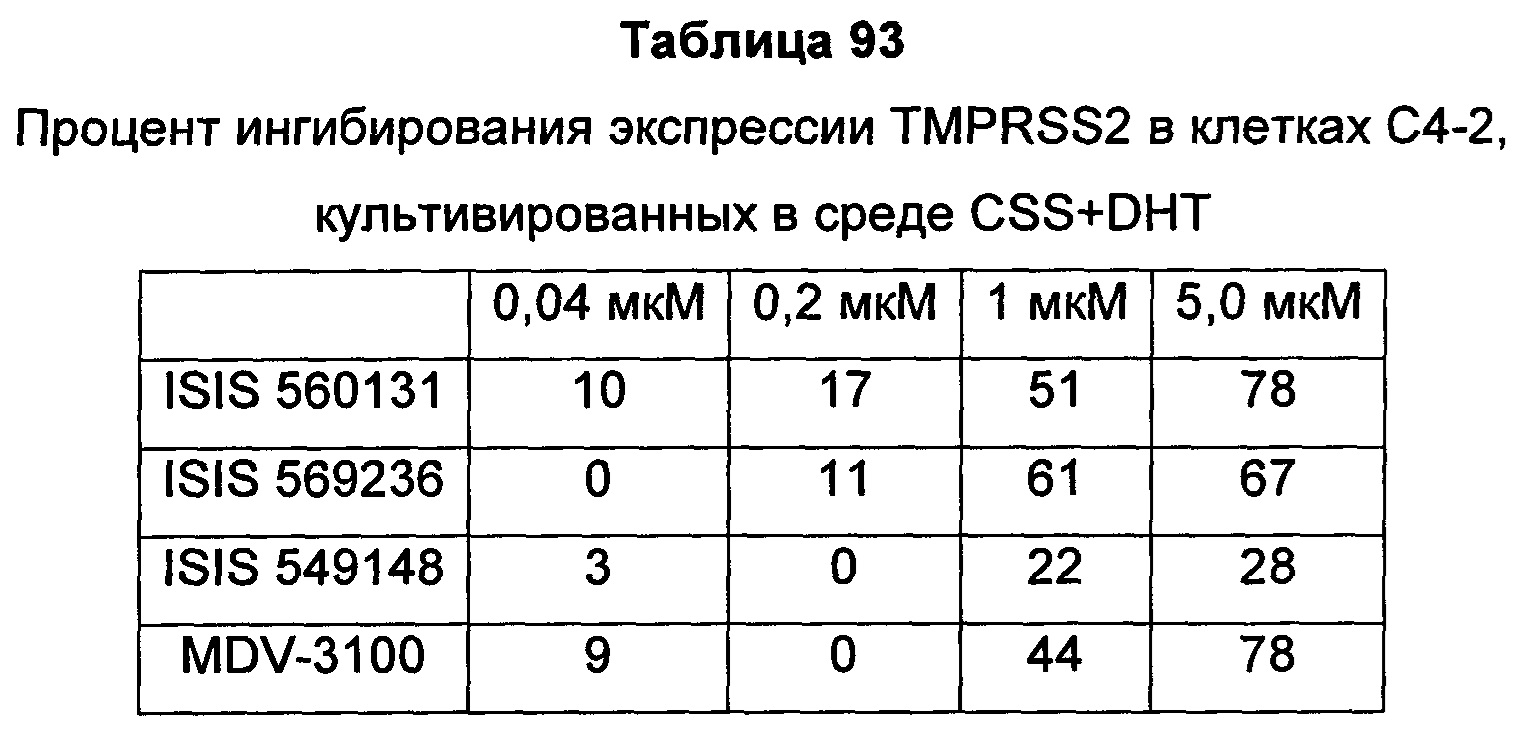
Влияние на пролиферацию в среде CSS и среде CSS+DHT После обработки в течение 5 суток в полной среде или среде CSS+1 нМ DHT пролиферативную способность раковых клеток измеряли с использованием набора для определения клеточной пролиферации CellTiter 96® AQueous One Solution или CellTiter-Glo® (Promega), следуя инструкциям производителя. Результаты представлены в Таблицах 94 и 95 в виде процента ингибирования пролиферации относительно необработанных клеток. Обработка клеток олигонуклеотидами ISIS 560131, ISIS 569236 и MDV-3100 снижала клеточную пролиферацию в зависимости от дозы по сравнению с контролем. Пролиферативная способность клеток, культивированных в CSS среде без DHT, составляет 17% от необработанных контрольных уровней.
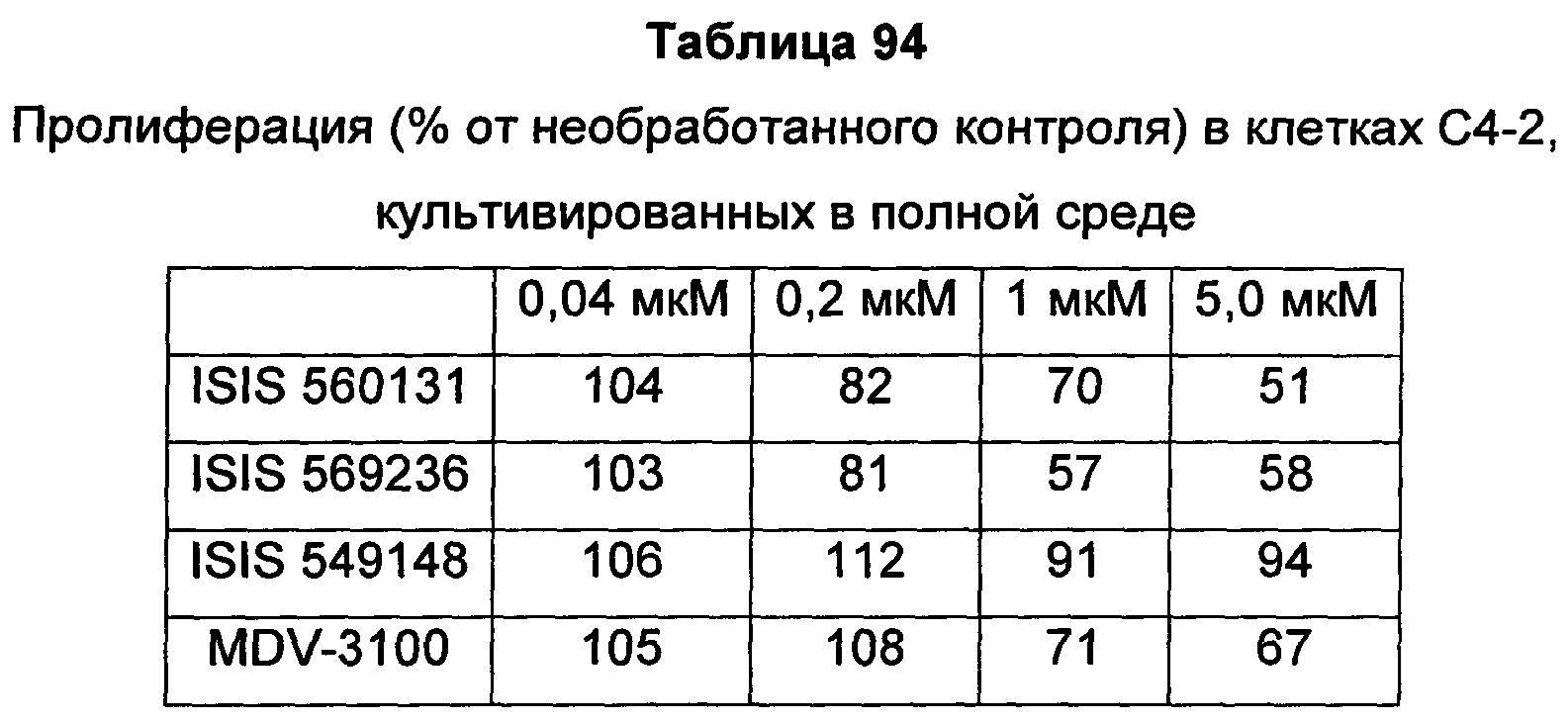

Пример 30: Антисмысловое ингибирование мРНК AR в клетках С4-2В, культивированных в полной среде и в среде CSS
Исследовали эффект антисмыслового ингибирования уровней мРНК AR в клетках С4-2В, культивированных в полной среде, а также в среде CSS с DHT.
Экспрессия генов в полной среде
Клетки высевали при 1000 клеток на лунку. ISIS 560131 или ISIS 569236 добавляли по отдельности в концентрации 0,04 мкМ, 0,2 мкМ, 1,0 мкМ или 5,0 мкМ. ISIS 549148 был включен в качестве негативного контроля. MDV3100 добавляли в концентрации 0,04 мкМ, 0,2 мкМ, 1,0 мкМ или 5,0 мкМ к отдельной группе клеток. После инкубирования в течение 48 часов измеряли уровни РНК AR, PSA и TMPRSS2. Данные представлены в Таблицах 96-98. Обработка олигонуклеотидом ISIS ингибировала экспрессию AR, тогда как обработка MDV-3100 увеличивала экспрессию AR в клетках.
Анализ белка полноразмерного AR также продемонстрировал зависимое от дозы снижение экспрессии, нормализованное к уровням гена "домашнего хозяйства", GAPDH.
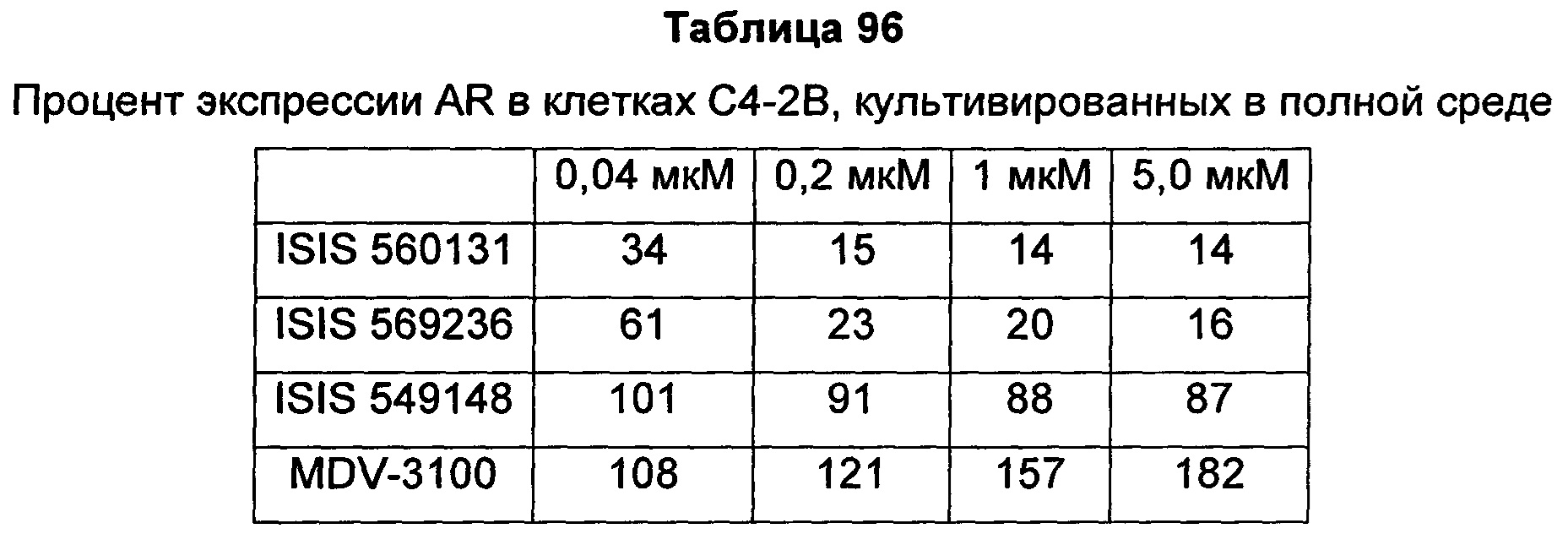
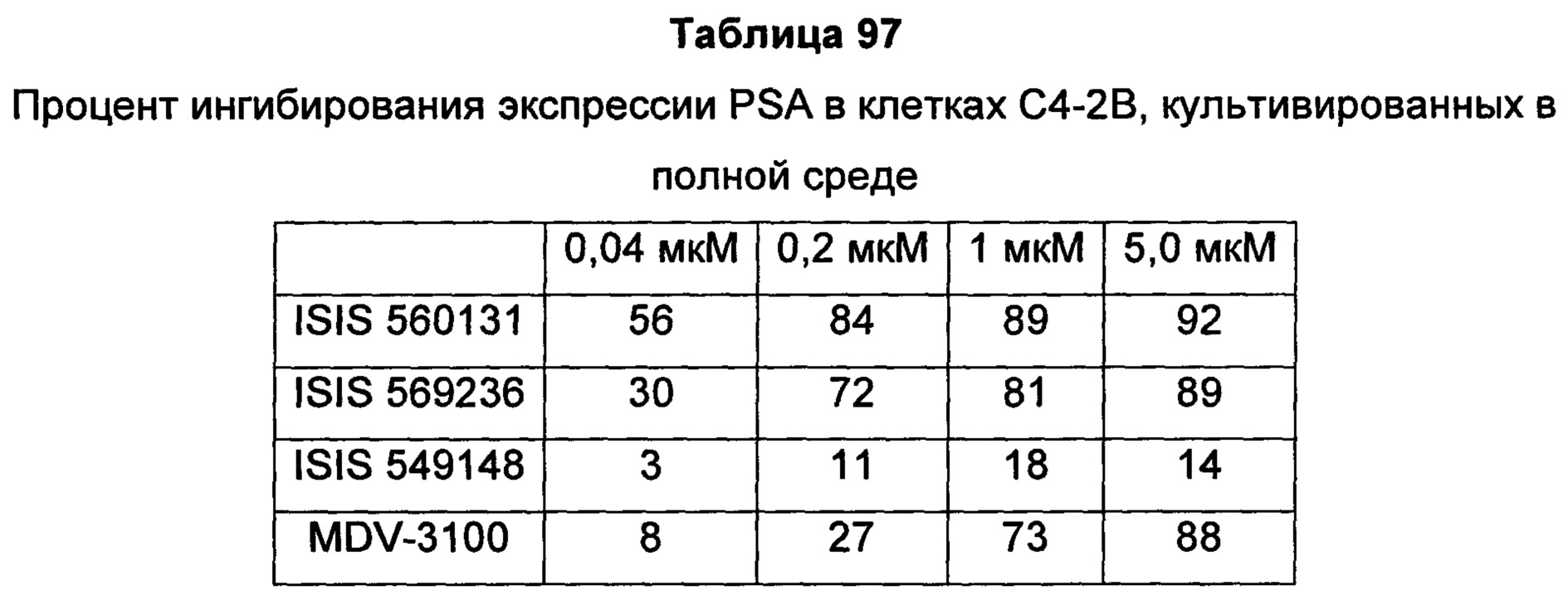
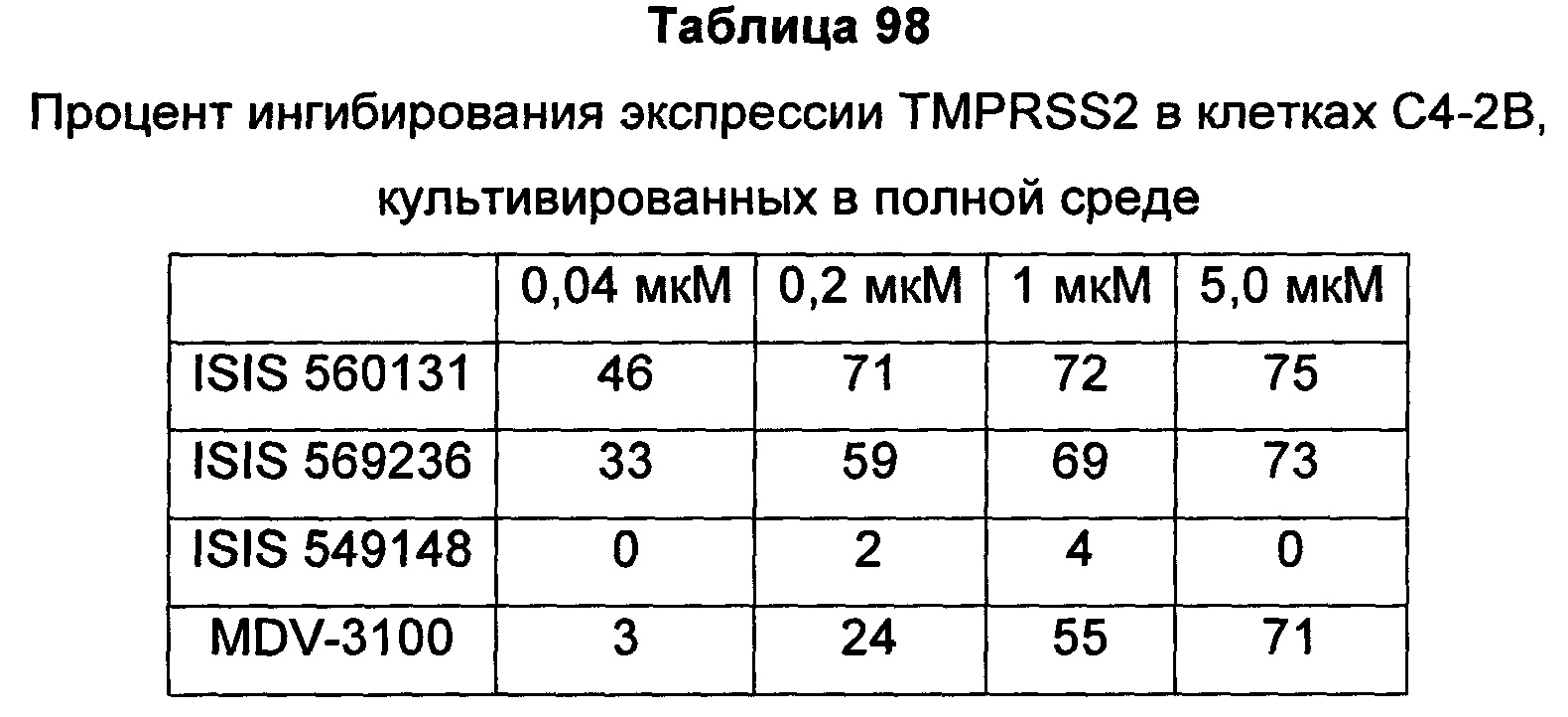
Экспрессия генов в среде CSS+DHT
Клетки высевали при 2000 клеток на лунку и культивировали в среде CSS с 1 нМ DHT. ISIS 560131 или ISIS 569236 добавляли по отдельности в концентрации 0,04 мкМ, 0,2 мкМ, 1,0 мкМ или 5,0 мкМ к каждой группе клеток. ISIS 549148 был включен в качестве негативного контроля. MDV3100 добавляли в концентрации 0,04 мкМ, 0,2 мкМ, 1,0 мкМ или 5,0 мкМ к отдельной группе клеток. После инкубирования в течение 48 часов измеряли уровни РНК AR, PSA и TMPRSS2. Данные представлены в Таблицах 99-101. В отсутствие DHT экспрессия AR в клетках С4-2 составляла 188%, экспрессия PSA составляла 43%, и экспрессия TMPRSS2 составляла 27% по сравнению с необработанным контролем. Обработка олигонуклеотидом ISIS ингибировала экспрессию AR, тогда как обработка MDV-3100 увеличивала экспрессию AR в клетках.
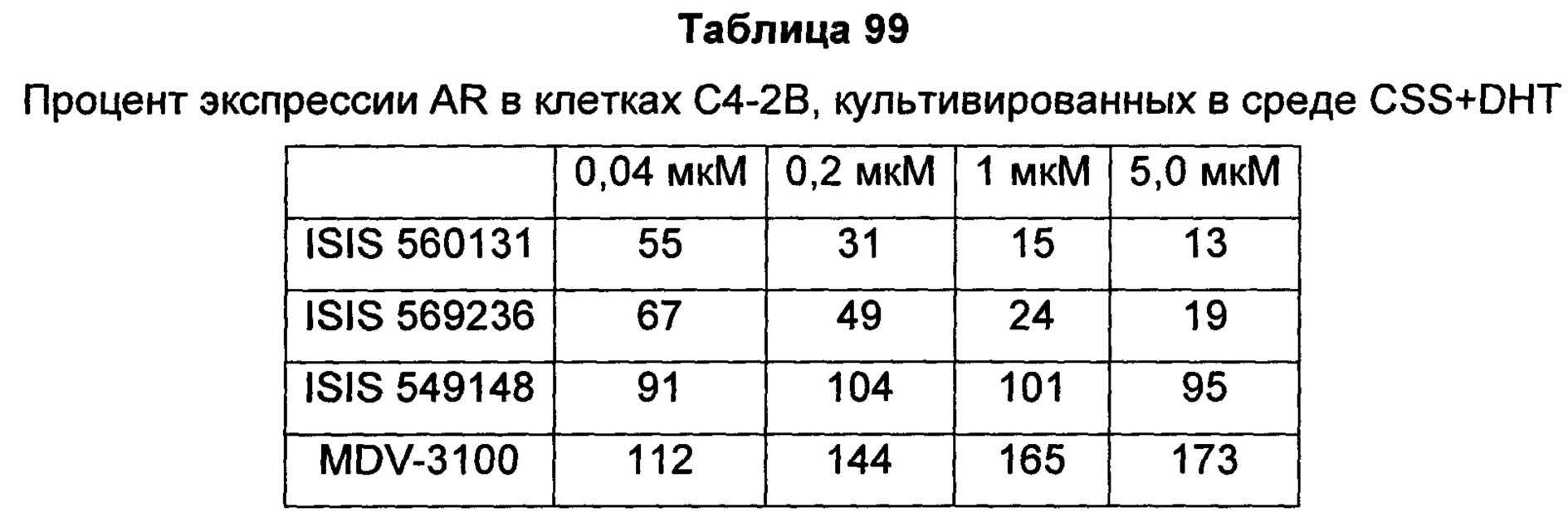
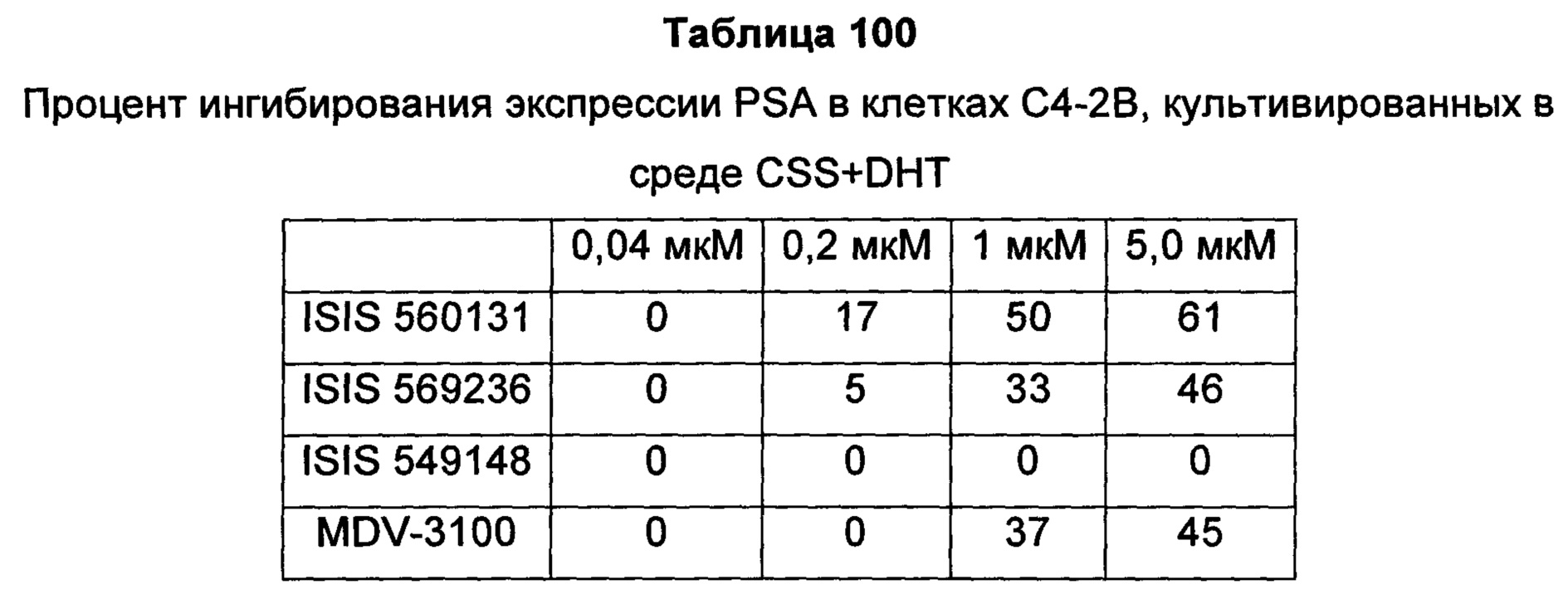

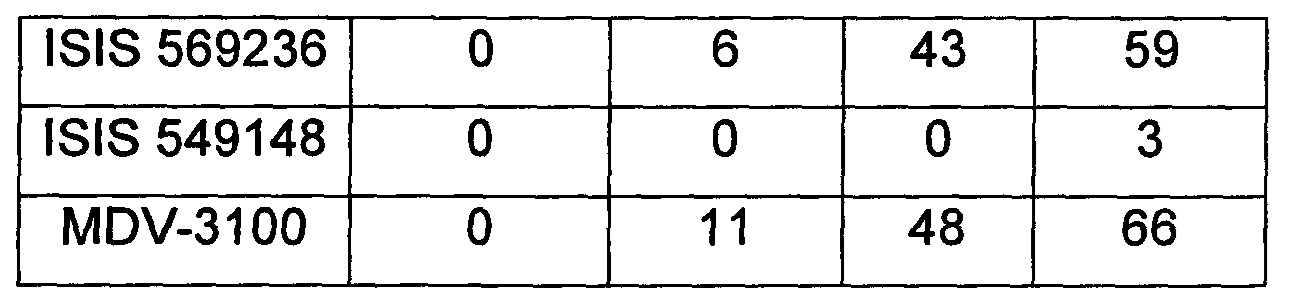
Влияние на пролиферацию в среде CSS и среде CSS+DHT После обработки в течение 5 суток в полной среде или в среде CSS+1 нМ DHT измеряли пролиферативную способность раковых клеток с использованием набора для определения клеточной пролиферации CellTiter 96® AQueous One или CellTiter-Glo® Solution (Promega), следуя инструкциям производителя. Результаты представлены в Таблицах 102 и 103 в виде процента ингибирования пролиферации относительно необработанных клеток. Обработка клеток олигонуклеотидами ISIS 560131, ISIS 569236 и MDV-3100 снижала клеточную пролиферацию в зависимости от дозы по сравнению с контролем. Обработка олигонуклеотидами ISIS в среде CSS+DHT снижала пролиферативную способность в большей степени, чем обработка MVD-3100. Пролиферативная способность клеток, культивированных в CSS среде без DHT, составляет 12% от необработанных контрольных уровней.



Пример 31: Антисмысловое ингибирование мРНК AR в клетках VCaP, культивированных в полной среде и в среде CSS
Исследовали воздействие антисмыслового ингибирования AR в клетках VCaP рака предстательной железы (Korenchuk, S. et al., In Vivo. 2001. 15: 163-168), культивированных в полной среде, а также в среде CSS с DHT. Клетки VCaP экспрессируют полноразмерный AR, а также W вариант.
Экспрессия генов в полной среде
Клетки высевали при 10000 клеток на лунку. ISIS 560131 или ISIS 569236 добавляли по отдельности в концентрации 1,34 нМ, 4 нМ, 13,4 нМ или 40 нМ с использованием реагента для трансфекции RNAiMax. ISIS 549148 был включен в качестве негативного контроля. После инкубирования в течение 48 часов измеряли уровни РНК полноразмерного AR, W варианта, PSA и TMPRSS2. Данные представлены в Таблицах 104-107.
Анализ белка полноразмерного AR и варианта W также продемонстрировал зависимое от дозы снижение экспрессии и того, и другого по сравнению с уровнями гена "домашнего хозяйства", GAPDH.
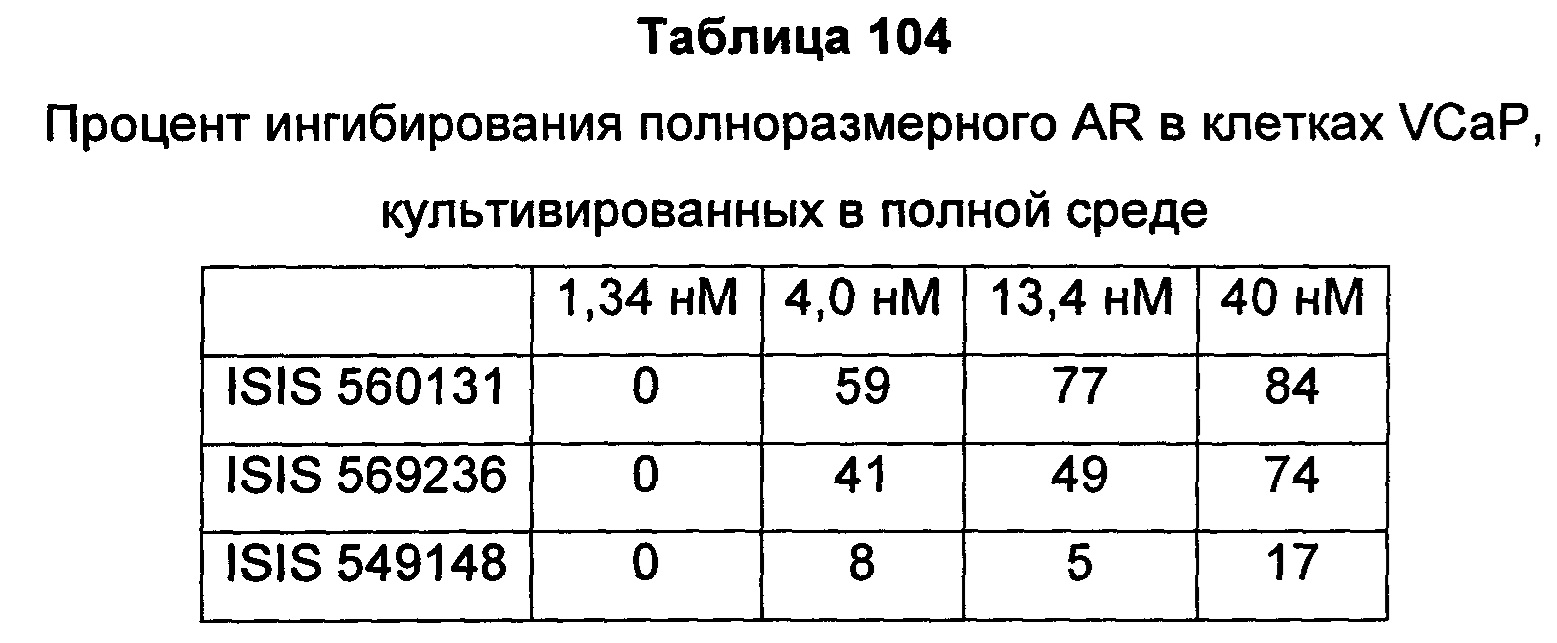


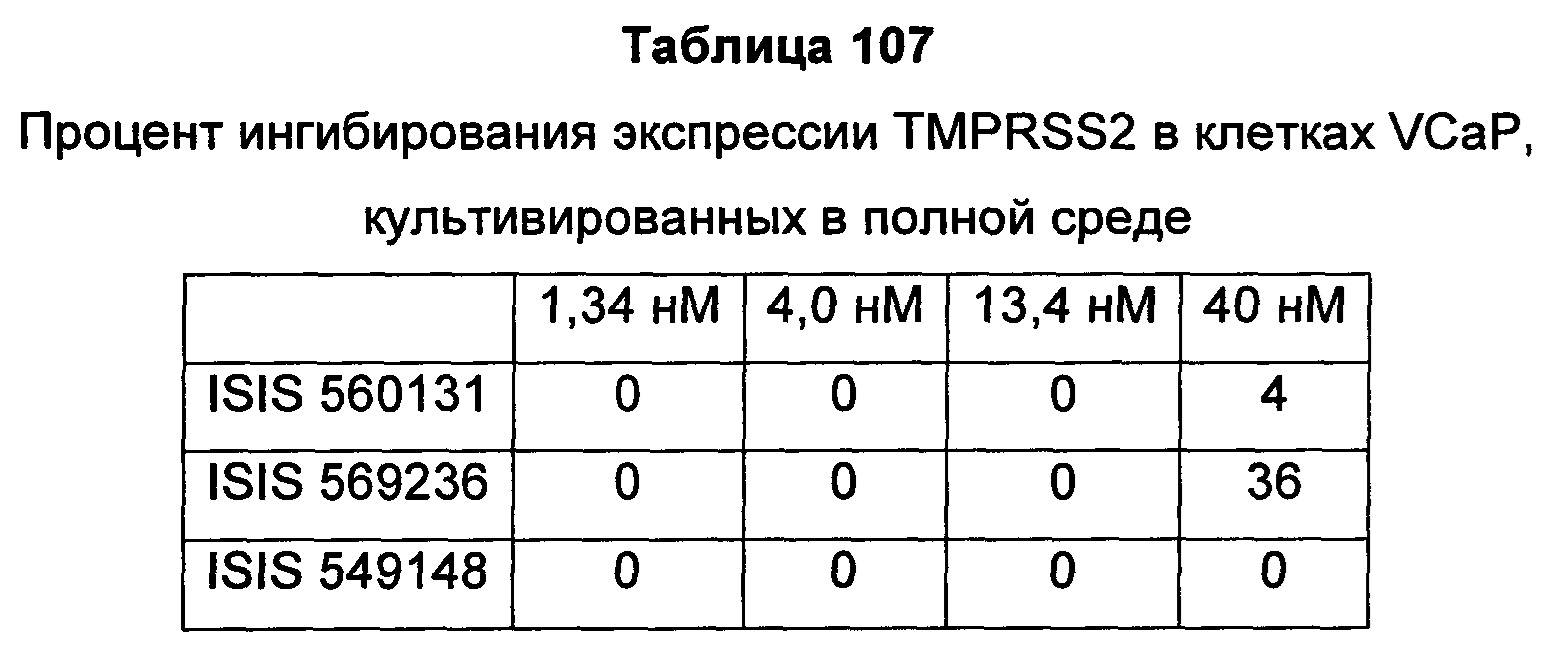
Отдельную группу клеток обрабатывали MDV-3100 в концентрации 0,04 мкМ, 0,2 мкМ, 1,0 мкМ или 5,0 мкМ. После инкубирования в течение 48 часов измеряли уровни РНК полноразмерного AR, варианта W, PSA и TMPRSS2. в Таблице 108 представлены данные, выраженные в виде процента экспрессии гена по сравнению с необработанным контролем.

Экспрессия генов в среде CSS+DHT
Клетки высевали при плотности 15000 клеток на лунку и культивировали в среде CSS в течение 16 часов. Клетки затем трансфицировали с использованием реагента RNAiMax с ISIS 560131 или ISIS 569236 в концентрации 1,34 нМ, 4 нМ, 13,4 нМ или 40 нМ для каждой группы клеток. ISIS 549148 был включен в качестве негативного контроля. Через 4 часа добавляли 1 нМ DHT. MDV3100 добавляли в отдельную группу клеток в дозах 0,04 мкМ, 0,2 мкМ, 1,0 мкМ или 5,0 мкМ. После инкубирования в течение 48 часов измеряли уровни РНК AR, PSA и TMPRSS2. Данные представлены в Таблицах 109-113. В отсутствие DHT экспрессия AR в клетках VCaP составляла 555%, экспрессия варианта W составляла 656%, экспрессия PSA составляла 11%, и экспрессия TMPRSS2 составляла 22% по сравнению с необработанным контролем.

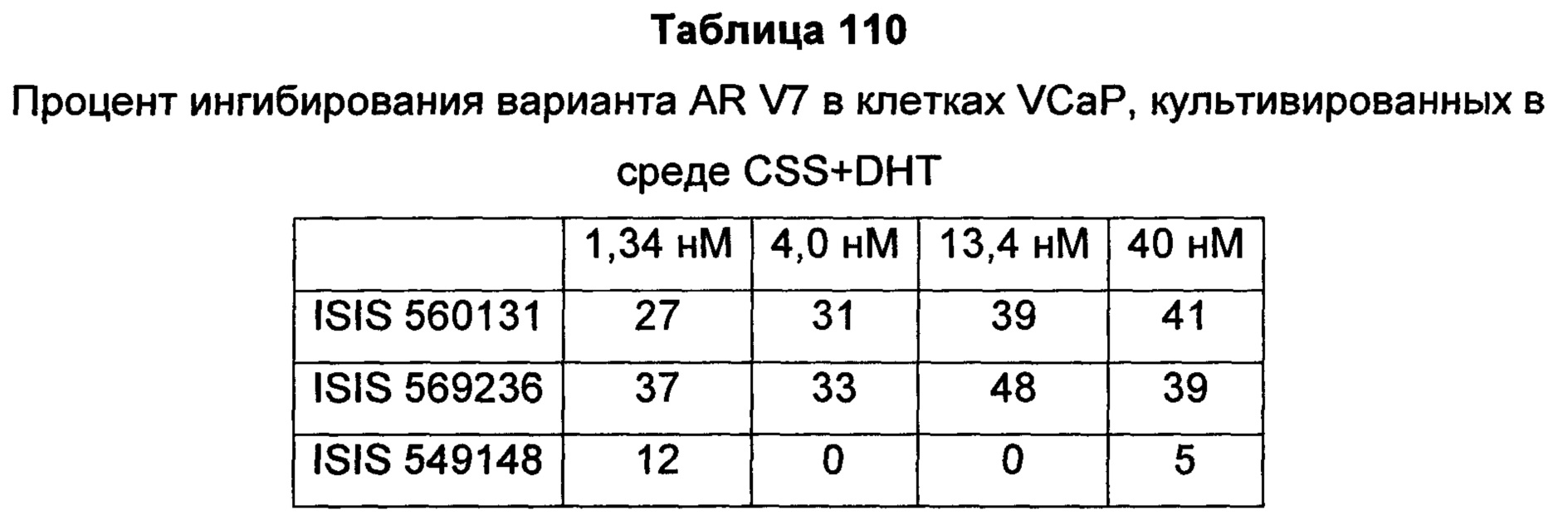

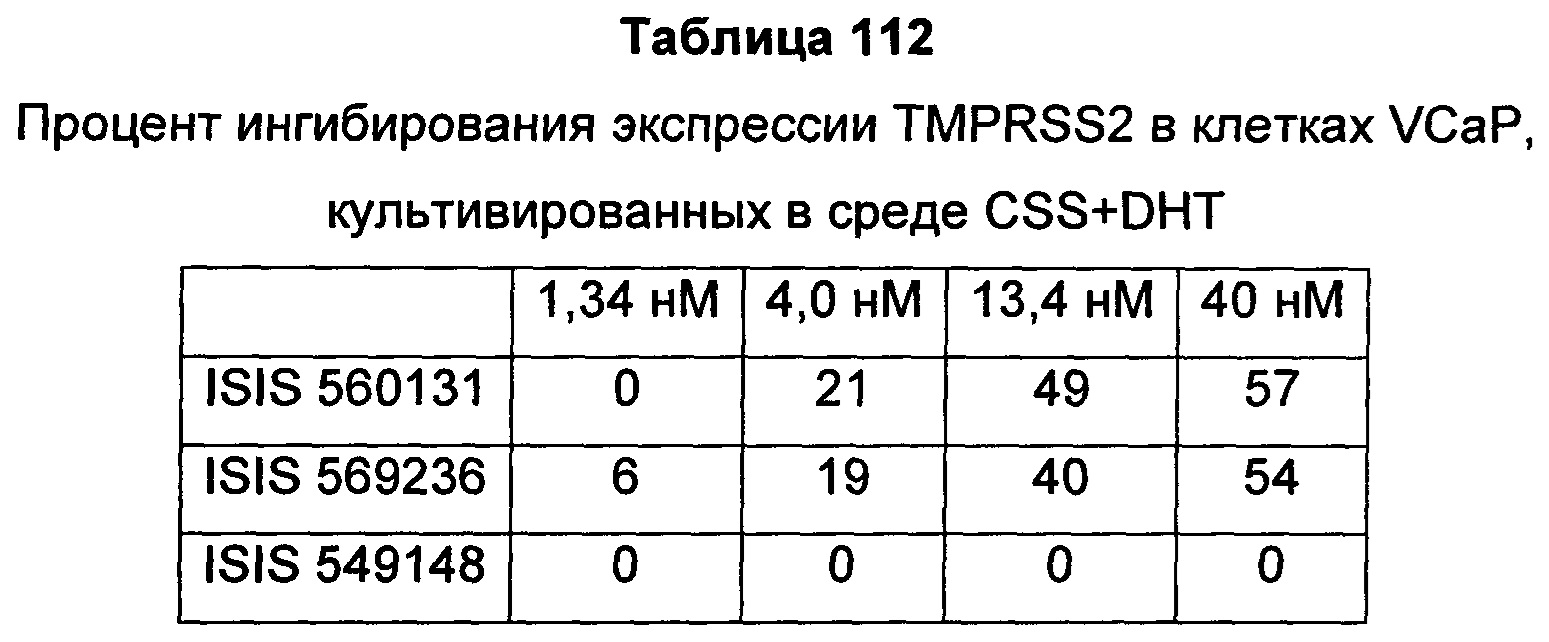

Влияние на пролиферацию
После обработки в течение 5 суток в полной среде или в среде CSS+1 нМ DHT измеряли пролиферативную способность раковых клеток с использованием набора для определения клеточной пролиферации CellTiter 96® AQueous One или CellTiter-Glo® Solution (Promega), следуя инструкциям производителя. Результаты представлены в Таблицах 114-116 в виде процента ингибирования пролиферации относительно необработанных клеток. Обработка клеток олигонуклеотидами ISIS 560131, ISIS 569236 и MDV-3100 снижала клеточную пролиферацию в зависимости от дозы по сравнению с контролем. Обработка олигонуклеотидами ISIS в среде CSS+DHT снижала пролиферативную способность в большей степени, чем обработка MVD-3100. Пролиферативная способность клеток, культивированных в среде CSS без DHT, составляет 12% от необработанных контрольных уровней.



Влияние на апоптоз
После обработки в течение 72 часов в полной среде измеряли апоптоз раковых клеток анализом Caspase-Glo 3/7 (Promega). Результаты представлены в Таблицах 117 и 118 в виде процента апоптоза клеток относительно необработанных клеток. Обработка клеток олигонуклеотидами ISIS 560131, ISIS 569236 и MDV-3100 увеличивала апоптоз клеток в зависимости от дозы по сравнению с контролем.
Апоптоз также измеряли вестерн-блот-анализом уровней расщепленного PARP, которые, как было показано, увеличивались в зависимости от дозы в клетках, обработанных ISIS 560131, ISIS 569236 и MDV-3100.
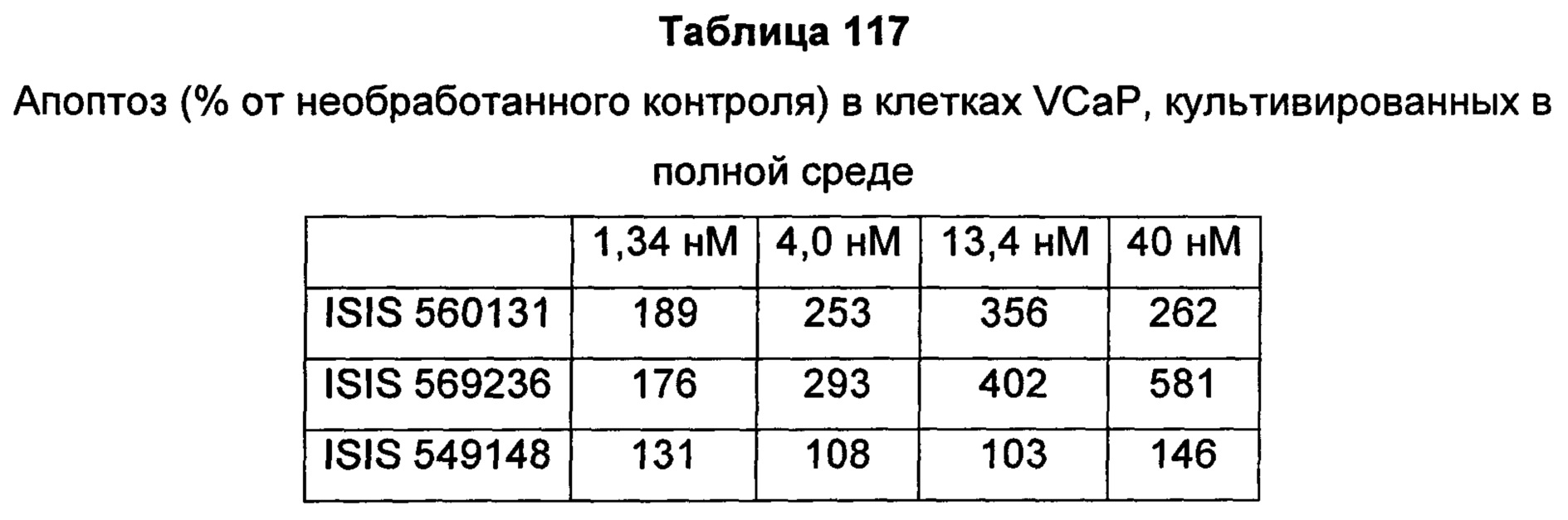

Пример 32: Антисмысловое ингибирование мРНК AR в клетках 22RV1, культивированных в полной среде и в среде CSS
Исследовали эффект антисмыслового ингибирования AR в клетках 22RV1, культивированных в полной среде, а также в среде CSS с DHT.
Экспрессия генов в полной среде
Клетки высевали при 1000 клеток на лунку. ISIS 560131 или ISIS 569236 добавляли по отдельности в концентрациях 1,34 нМ, 4 нМ, 13,4 нМ или 40 нМ с использованием реагента для трансфекции RNAiMax. ISIS 549148 был включен в качестве негативного контроля. После инкубирования в течение 48 часов измеряли уровни РНК полноразмерного AR, варианта W, PSA и TMPRSS2. Данные представлены в Таблицах 119-122.
Анализ белка полноразмерного AR и варианта W также продемонстрировал зависимое от дозы снижение экспрессии по сравнению с уровнями гена "домашнего хозяйства", GAPDH.
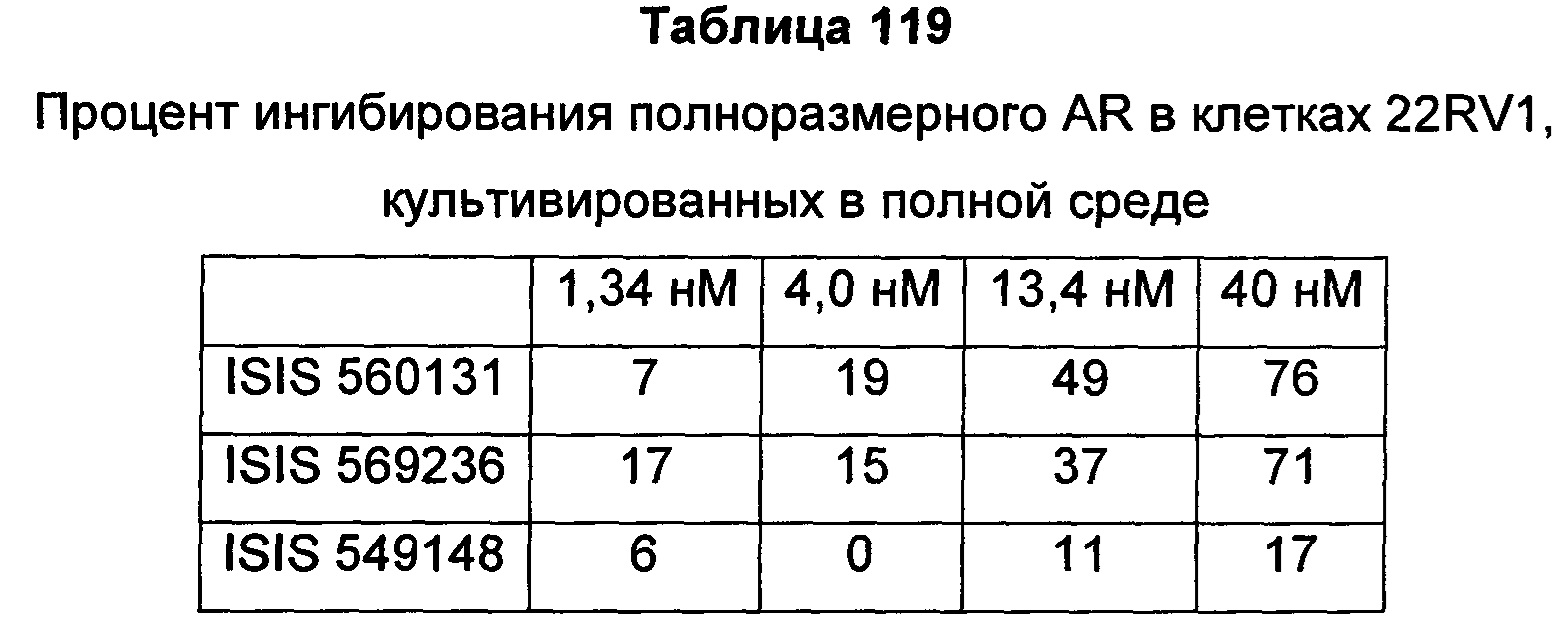
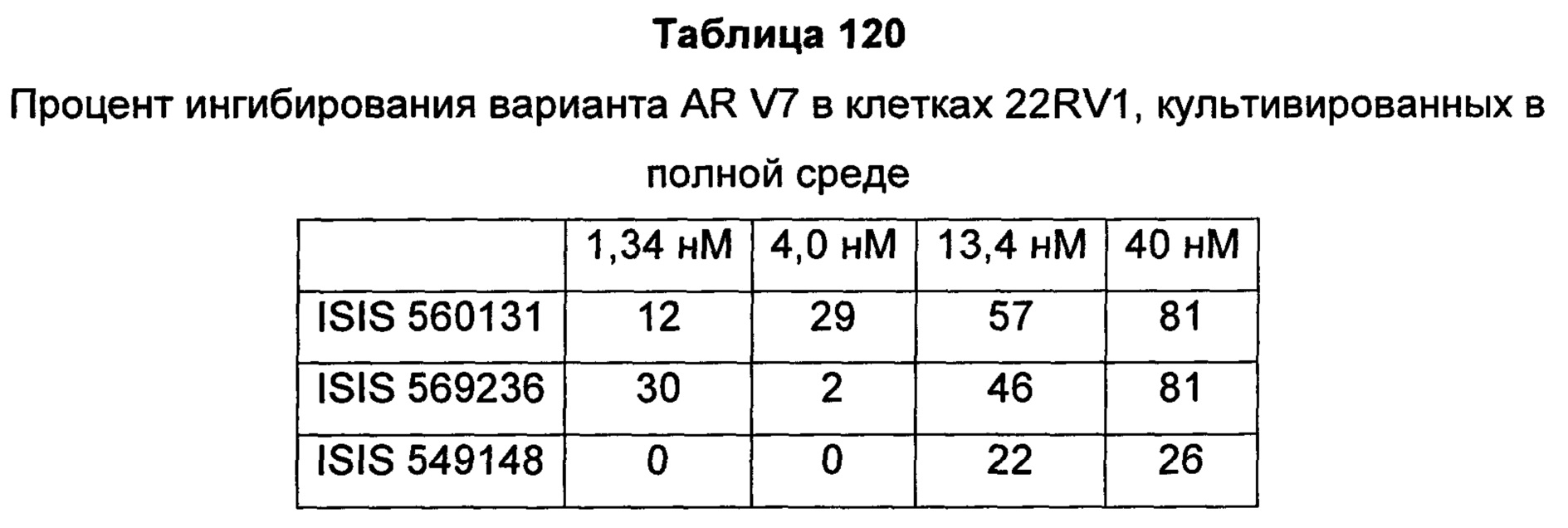
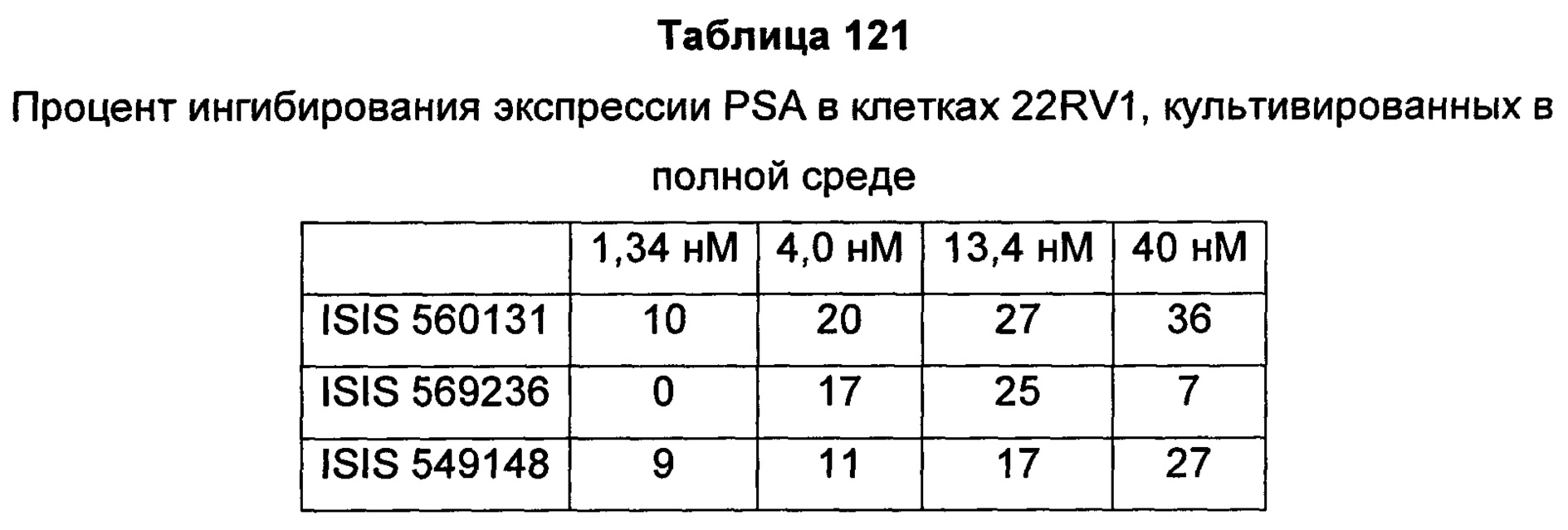
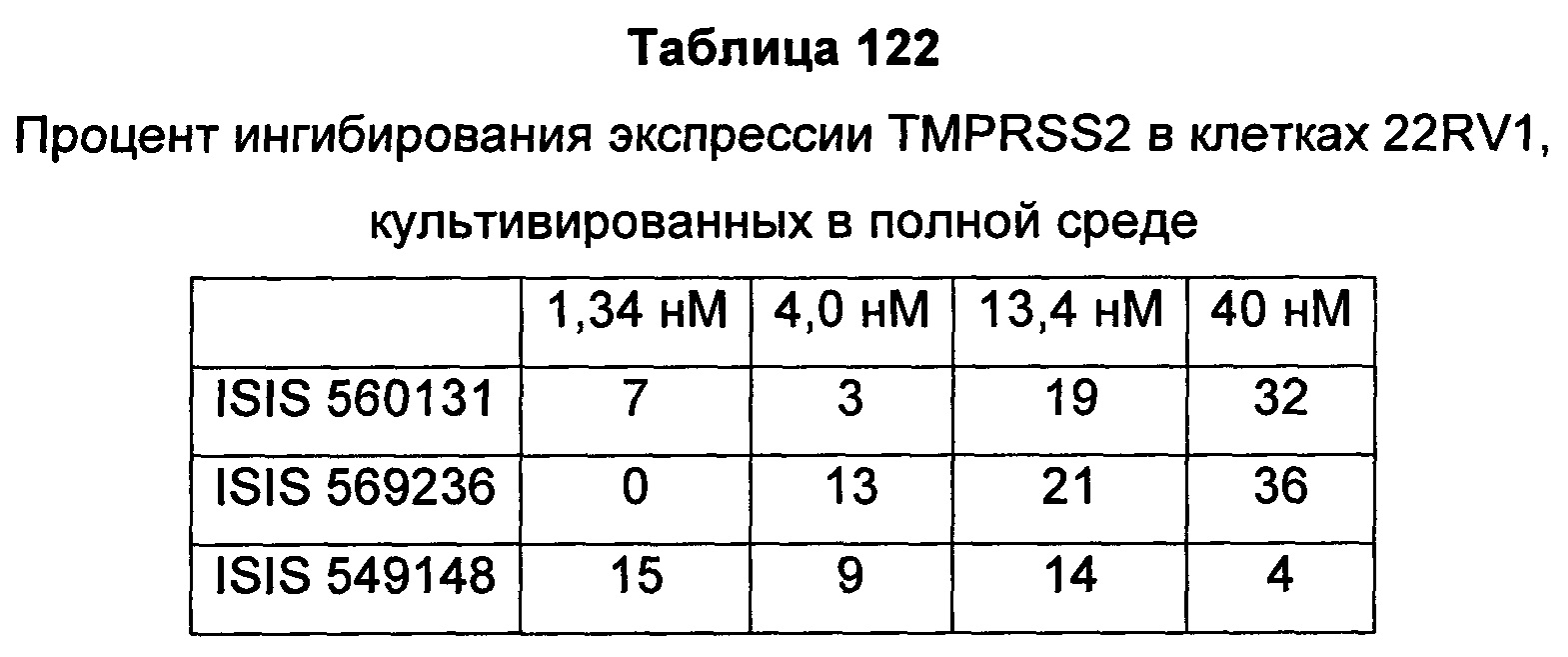
Отдельную группу клеток обрабатывали MDV-3100 в концентрации 0,04 мкМ, 0,2 мкМ, 1,0 мкМ или 5,0 мкМ. После инкубирования в течение 48 часов измеряли уровни РНК полноразмерного AR, варианта W, PSA и TMPRSS2. В Таблице 123 представлены данные, выраженные в виде процента экспрессии уровней гена по сравнению с необработанным контролем.
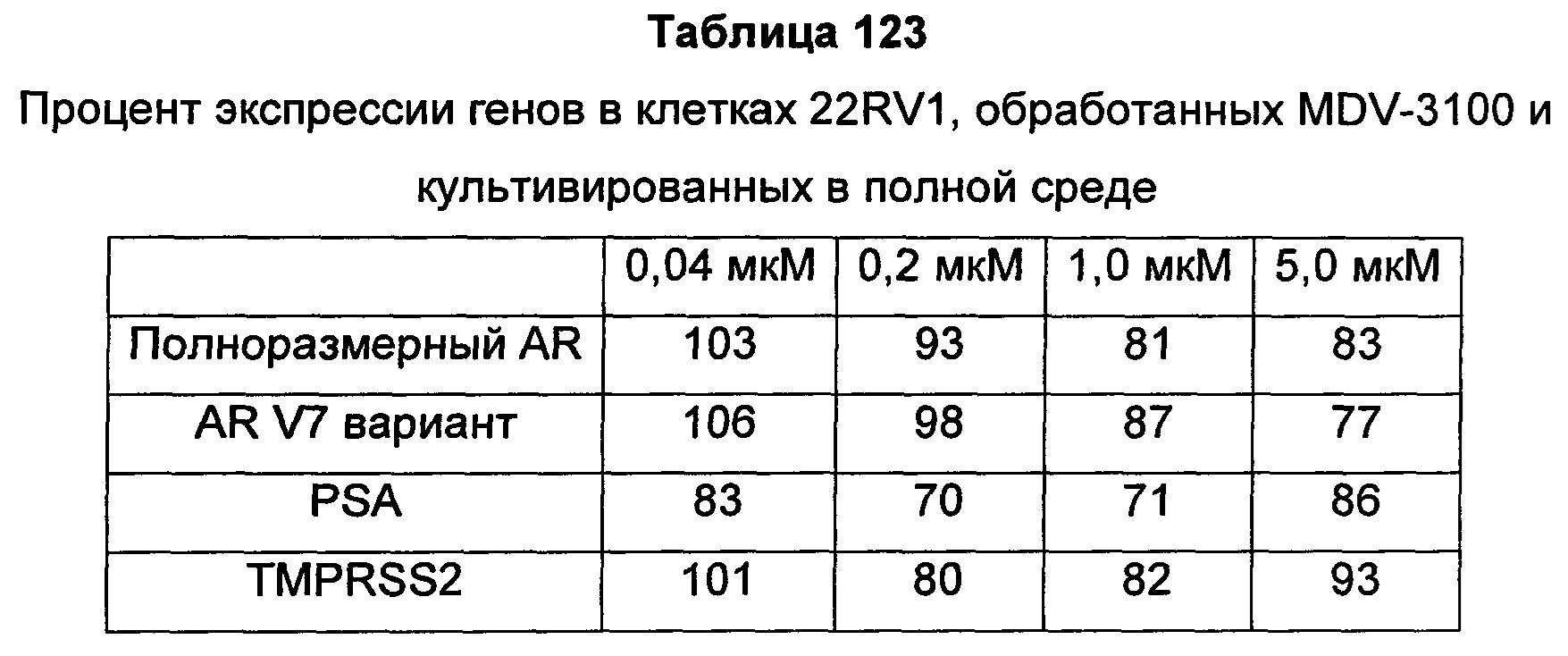
Экспрессия генов в среде CSS+DHT
Клетки высевали при 2000 клеток на лунку и культивировали в среде CSS в течение 16 часов. Клетки затем трансфицировали с использованием реагента RNAiMax с ISIS 560131 или ISIS 569236 в концентрации 1,34 нМ, 4 нМ или 13,4 нМ для каждой группы клеток. ISIS 549148 был включен в качестве негативного контроля. Через 4 часа добавляли 1 нМ DHT. MDV3100 добавляли в отдельную группу клеток в дозах 0,04 мкМ, 0,2 мкМ, 1,0 мкМ или 5,0 мкМ. После инкубирования в течение 48 часов измеряли уровни РНК AR, варианта AR V7, PSA и TMPRSS2. Данные представлены в Таблицах 124-128. В отсутствие DHT экспрессия AR в клетках VCaP составляла 555%, экспрессия варианта V7 составляла 656%, экспрессия PSA составляла 11%, и экспрессия TMPRSS2 составляла 22% по сравнению с необработанным контролем.
Обработка олигонуклеотидами ISIS привела к значительному ингибированию полноразмерного AR и варианта W, а также ниже по ходу экспрессии генов. Обработка олигонуклеотидами ISIS привела к ингибированию экспрессии генов в большей степени, чем обработка MVD-3100.
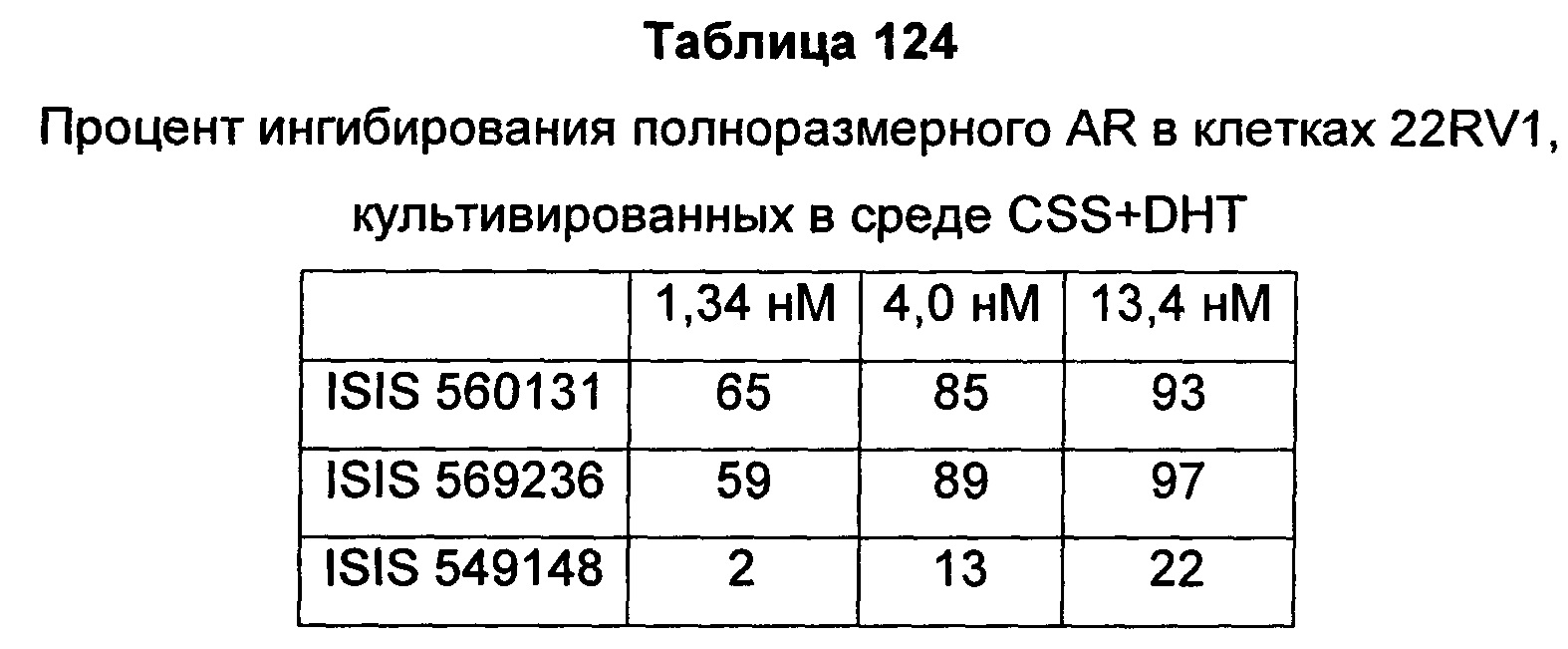

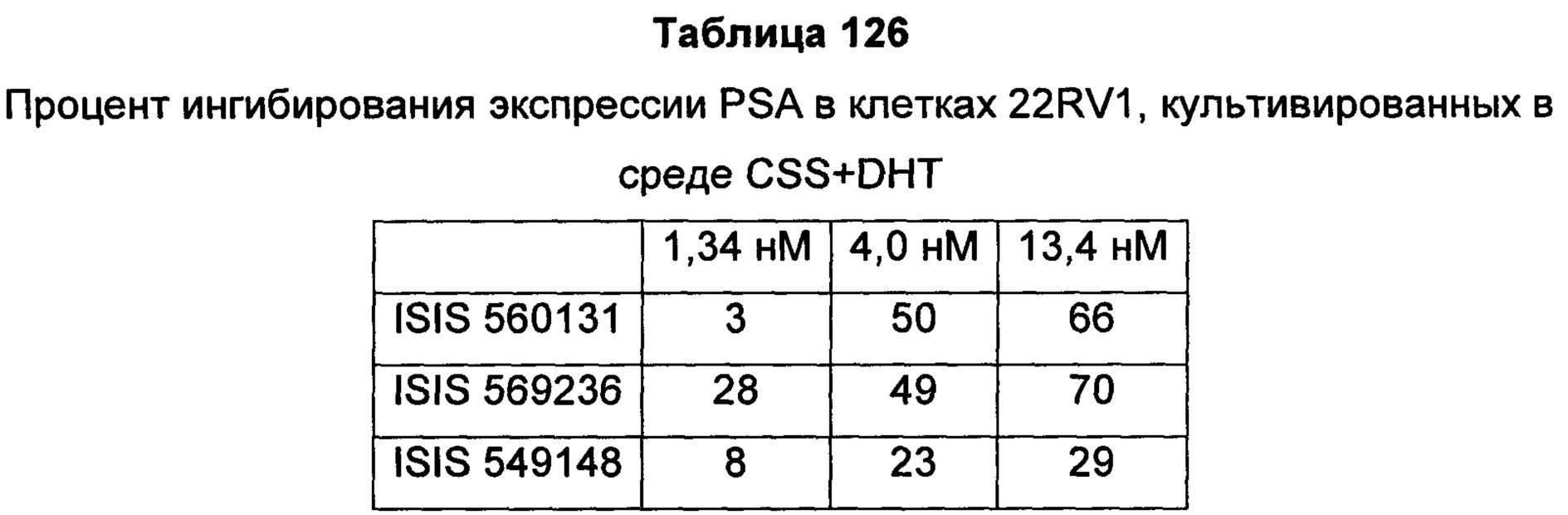


Влияние на пролиферацию
После обработки в течение 5 суток в полной среде измеряли пролиферативную способность раковых клеток с использованием набора для определения клеточной пролиферации CellTiter 96® AQueous One или CellTiter-Glo® Solution (Promega), следуя инструкциям производителя. Результаты представлены в Таблицах 129 и 130 в виде процента ингибирования пролиферации относительно необработанных клеток. Обработка клеток олигонуклеотидами ISIS 560131, ISIS 569236 и MDV-3100 снижала клеточную пролиферацию в зависимости от дозы по сравнению с контролем. Обработка олигонуклеотидами ISIS в среде CSS+DHT снижала пролиферативную способность в большей степени, чем обработка MVD-3100. Пролиферативная способность клеток, культивированных в CSS среде без DHT, составляет 12% от необработанных контрольных уровней.
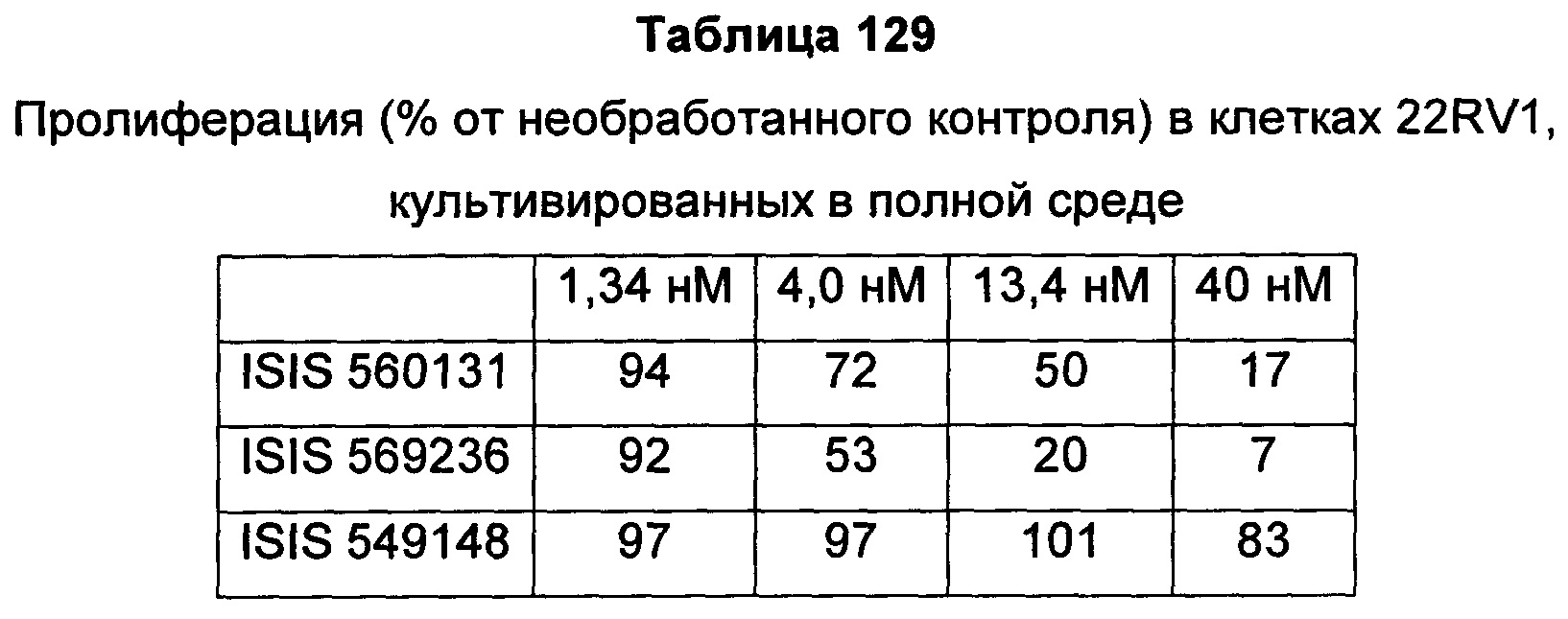

Влияние на апоптоз
После обработки в течение 72 часов в полной среде или в среде CSS+DHT измеряли апоптоз раковых клеток с использованием набора для анализа Caspase-glo 3/7 (Promega). Результаты представлены в Таблицах 131 и 132 в виде процента апоптоза клеток относительно необработанных клеток. Обработка клеток олигонуклеотидами ISIS 560131 и ISIS 569236 увеличивала апоптоз клеток в зависимости от дозы по сравнению с контролем.

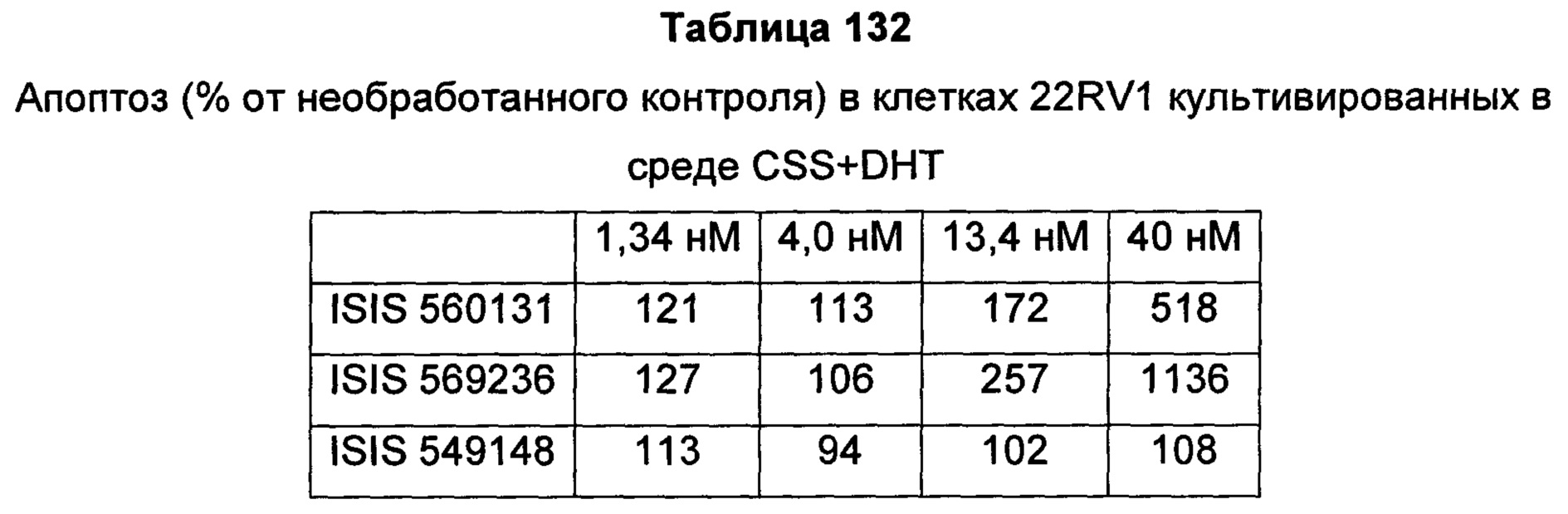
Пример 33: Эффект ISIS антисмысловых олигонуклеотидов, направленное воздействующих на рецептор андрогенов человека, у обезьян вида яванский макак
Яванским макакам вводили антисмысловые олигонуклеотиды ISIS, отобранные из исследований, описанных выше. Оценивали эффективность и переносимость антисмысловых олигонуклеотидов. Протестированные антисмысловые олигонуклеотиды для человека являются перекрестнореагирующими с резус геномной последовательностью (GENBANK, номер доступа NW_001218131.1, с усечением нуклеотидов 134001-308000, и обозначенная в данном документе как SEQ ID NO: 189). Являющийся мишенью сайт инициации и область-мишень каждого олигонуклеотида SEQ ID NO: 189, а также подробности их химии и последовательность представлены в Таблице 133.

Введение
Перед исследованием обезьян держали в карантине в течение периода времени 30 суток, и в это время животных ежесуточно осматривали в отношении общего здоровья. Обезьяны были в возрасте 2-4 года и весили от 2 до 4 кг.Каждой из тринадцати групп по четыре самца яванских макак в каждой, распределенные случайным образом, инъецировали подкожно олигонуклеотид ISIS или PBS (забуференный фосфатами физиологический раствор). Раствор PBS или олигонуклеотиды ISIS в дозе 40 мг/кг вводили в нагрузочном режиме, состоящем из четырех доз в первую неделю исследования (дни 1, 3, 5 и 7), а затем поддерживали режим, состоящий из введения один раз в неделю, начиная в День 14 (недели 2-6). Подкожные инъекции выполняли поочередно по часовой стрелке в 4 места на спине, одно место на дозу. Места инъекций были намечены татуировкой под воздействием седативного средства кетамин, и между ними было минимум 3 см.
В ходе исследования обезьян обследовали минимум один раз в сутки в отношении признаков заболевания или расстройства. Протоколы, описанные в Примере, были одобрены Институциональным комитетом по содержанию и использованию животных (IACUC).
Снижение уровней мишени
Анализ РНК
РНК экстрагировали из тканей печени, сердца, скелетной мышцы, почки и предстательной железы для анализа AR методом ПЦР в реальном времени с использованием комплекта праймеров и зондов RTS3559. Результаты нормализовали к RIBOGREEN®. Результаты представлены в виде процента ингибирования мРНК AR относительно PBS-контроля. Как показано в Таблице 134, введение антисмысловых олигонуклеотидов ISIS приводило к значительному снижению мРНК AR относительно PBS-контроля. "n/а" означает, что уровни мРНК в данном органе не измеряли.


Анализ белка
Сывороточные уровни белка тестостерона измеряли в плазме крови с использованием набора для ELISA (Enzo Life Sciences), следуя инструкциям производителя. Результаты, выраженные в нг/мл, представлены в Таблице 135. Результаты свидетельствуют о том, что некоторые олигонуклеотиды ISIS снижают уровни белка тестостерона.

Исследования переносимости
Измерения массы тела и органов
Чтобы оценить влияние олигонуклеотидов ISIS на общее состояние здоровья животных, измеряли массы тел и органов. Массы тел измеряли в день 42, и они представлены в Таблице 136. Массы органов измеряли после эвтаназии, и данные также представлены в Таблице 136. Конкретно, введение олигонуклеотида ISIS 560131 хорошо переносилось на основе данных по массам тел и органов обезьян.
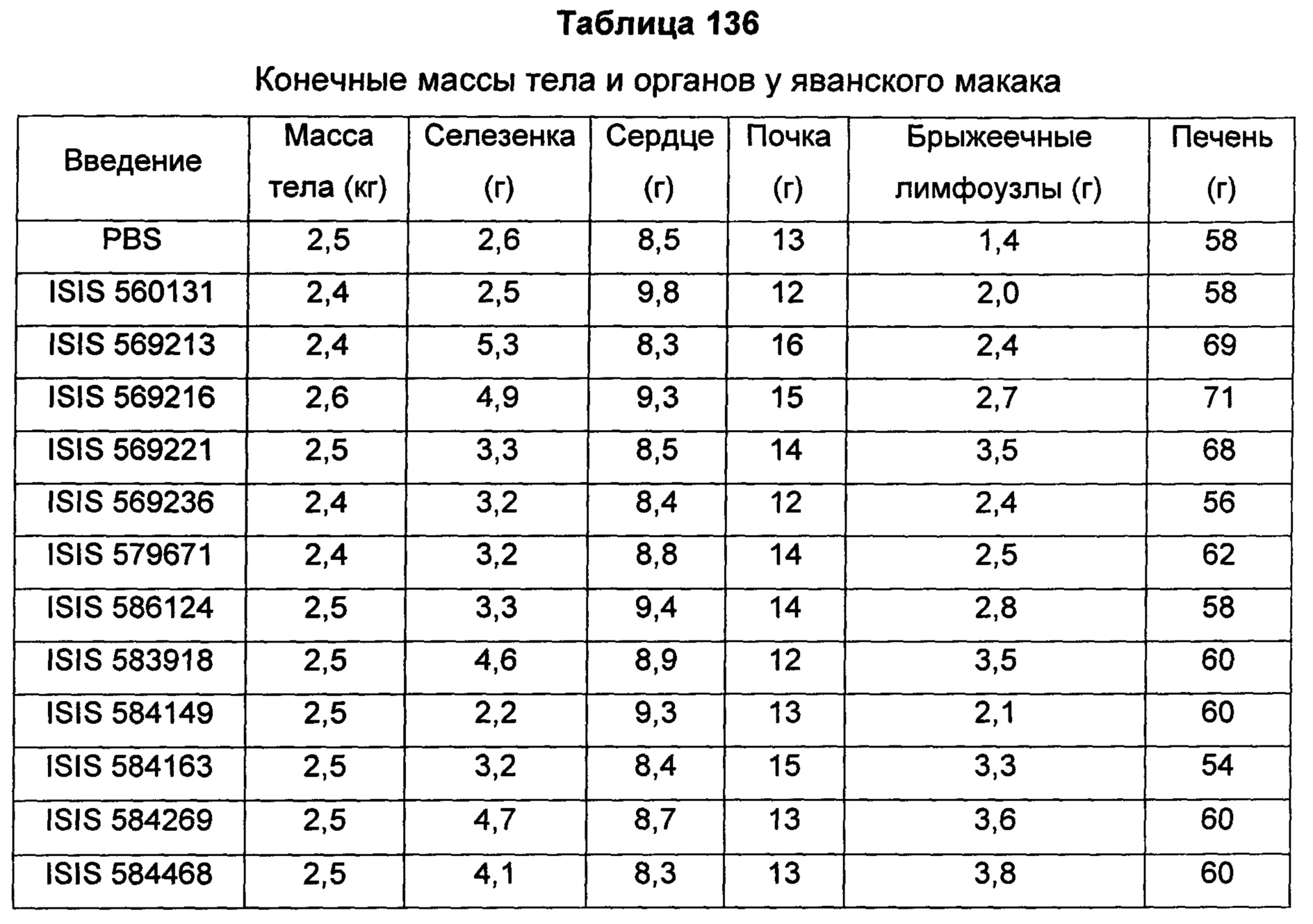
Функция печени
Чтобы оценить влияние олигонуклеотидов ISIS на печеночную функцию, обезьян не кормили в течение ночи. Образцы крови приблизительно 1,5 мл собирали в день 44 у всех исследуемых групп. Кровь собирали в пробирки без антикоагулянта для отделения сыворотки. Пробирки хранили при комнатной температуре в течение минимум 90 минут и затем центрифугировали при 3000 об/мин в течение 10 минут. Уровни различных маркеров функции печени измеряли, используя химический анализатор Toshiba 120FR NEO (Toshiba Co., Japan). Результаты представлены в Таблице 137. Конкретно, введение олигонуклеотида ISIS 560131 хорошо переносилось на основе данных по маркерам функции печени.


Гематология
Для оценки влияния олигонуклеотидов ISIS у яванских макак на гематологические параметры собирали образцы крови в объеме приблизительно 0,5 мл в день 44 у каждого участвующего в исследованиях животного в пробирки, содержащие K2-EDTA. Образцы анализировали для определения количества красных кровяных телец (RBC), количества белых кровяных телец (WBC), количества тромбоцитов, содержание гемоглобина и гематокрита, используя гематологический анализатор ADVIA2120i (SIEMENS, USA). Данные представлены в Таблице 138.
Данные показывают, что введение большинства олигонуклеотидов не вызывает никаких изменений гематологических параметров, выходящих за пределы ожидаемого диапазона для антисмысловых олигонуклеотидов в этой дозе. Конкретно, введение олигонуклеотида ISIS 560131 хорошо переносилось на основе данных по гематологоии обезьян.

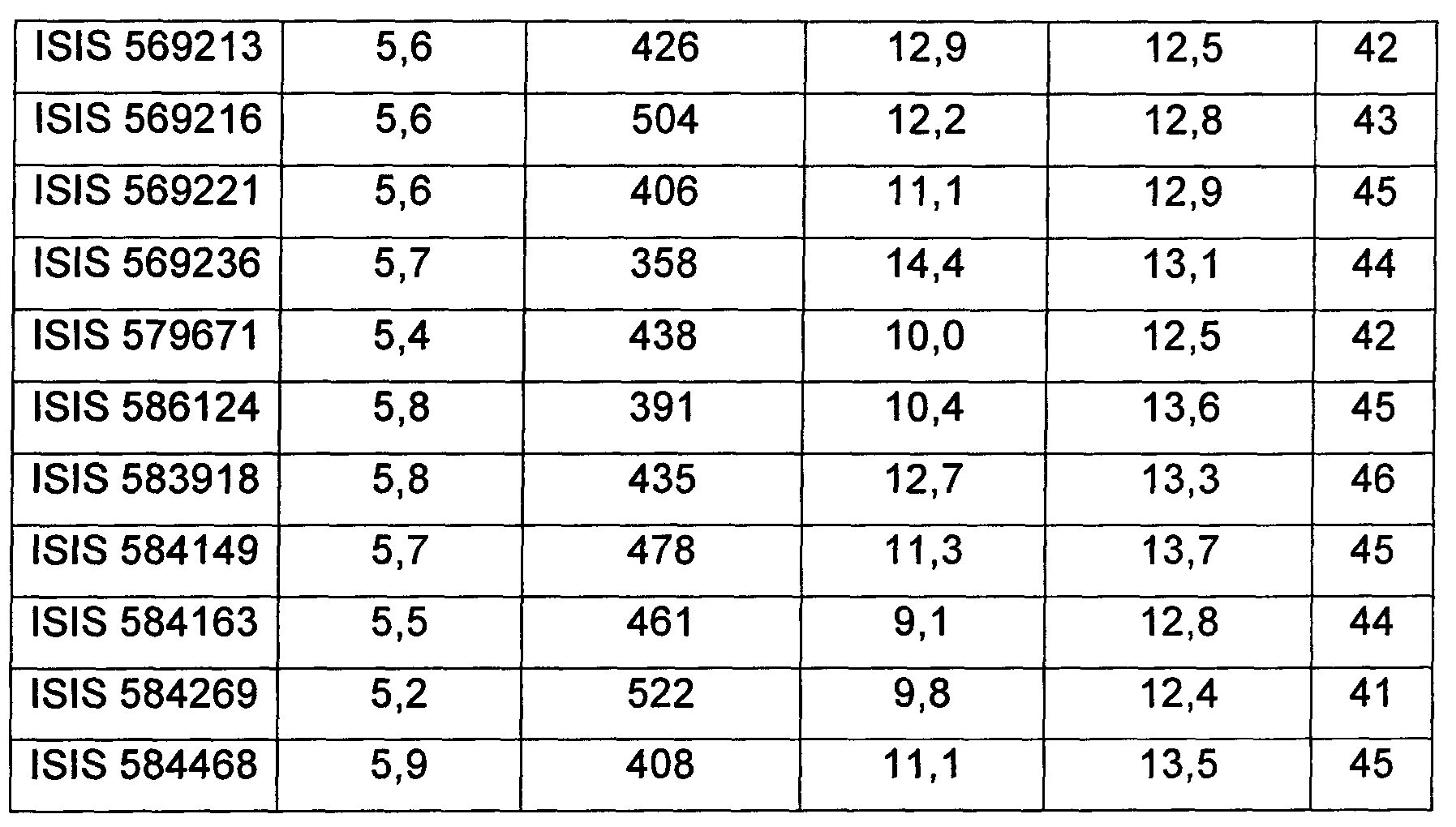
Функция почек
Чтобы оценить влияние олигонуклеотидов ISIS на функцию почек, обезьян не кормили в течение ночи. Собирали образцы крови в объеме приблизительно 1,5 мл у всех участвующих в исследовании групп в день 44. Кровь собирали в пробирки без коагулянта для отделения сыворотки. Пробирки хранили при комнатной температуре в течение минимум 90 минут и затем центрифугировали при 3000 об/мин в течение 10 минут. Уровни BUN (азот мочевины крови) и креатинина измеряли, используя химический анализатор Toshiba 120FR NEO (Toshiba Co., Japan). Результаты, выраженные в мг/дл, представлены в Таблице 139. Данные по химическому составу плазмы крови показывают, что большинство олигонуклеотидов ISIS не оказывают никакого влияния на функцию почек за пределами ожидаемого диапазона для антисмысловых олигонуклеотидов. Конкретно, на основе данных по функции почек обезьян введение олигонуклеотида ISIS 560131 хорошо переносилось.
Функцию почек также оценивали по результатам анализа мочи. Свежую мочу у всех животных собирали в день 44, используя чистый поддон из клеток на мокром льду. Корм не давали в течение ночи перед днем сбора свежей мочи, но водой обеспечивали. Уровни общего белка и креатинина измеряли, используя автоматизированный химический анализатор Toshiba 120FR NEO (Toshiba Co., Japan), и рассчитывали соотношение белка к креатинину. Результаты представлены в Таблице 140.


Анализ уровней С-реактивного белка
Чтобы оценить воспалительный эффект олигонуклеотидов ISIS у яванских макак, обезьян не кормили в течение ночи. Собирали образцы крови в объеме приблизительно 1,5 мл у всех участвующих в исследовании групп в день 44. Кровь собирали в пробирки без коагулянта для отделения сыворотки. Пробирки хранили при комнатной температуре в течение минимум 90 минут и затем центрифугировали при 3000 об/мин в течение 10 минут. С-реактивный белок (CRP), который синтезируется в печени и который служит маркером воспаления, измеряли в день 43, используя химический анализатор Toshiba 120FR NEO (Toshiba Co., Japan). Комплемент С3 также измеряли аналогично, и данные представлены в виде процента от исходных значений. Результаты представлены в Таблице 141, и они показывают, что большинство олигонуклеотидов ISIS не вызывают никакого воспаления у обезьян.

Фармакокинетические исследования
Измеряли концентрации полноразмерного олигонуклеотида в почке и печени выбранных групп лечения. Использовали метод, представляющий собой модификацию ранее опубликованных методов (Leeds et al., 1996; Geary et al., 1999), которая состоит из фенол-хлороформной (жидкость-жидкость) экстракции с последующей твердофазной экстракцией. Перед экстракцией добавляли внутренний стандарт (ISIS 355868, 27-мер 2'-O-метоксиэтил-модифицированный фосфоротиоатный олигонуклеотид, GCGTTTGCTCTTCTTCTTGCGTTTTTT, обозначенный в данном документе как SEQ ID NO: 190). Концентрации в образцах тканей вычисляли, используя калибровочную кривую, с нижним пределом количественного анализа (LLOQ) приблизительно 1,14 мкг/г.
Результаты, выраженные в мкг/г ткани, представлены в Таблице 142. Соотношение почка/печень также вычисляли, и результаты представлены в Таблице 142.
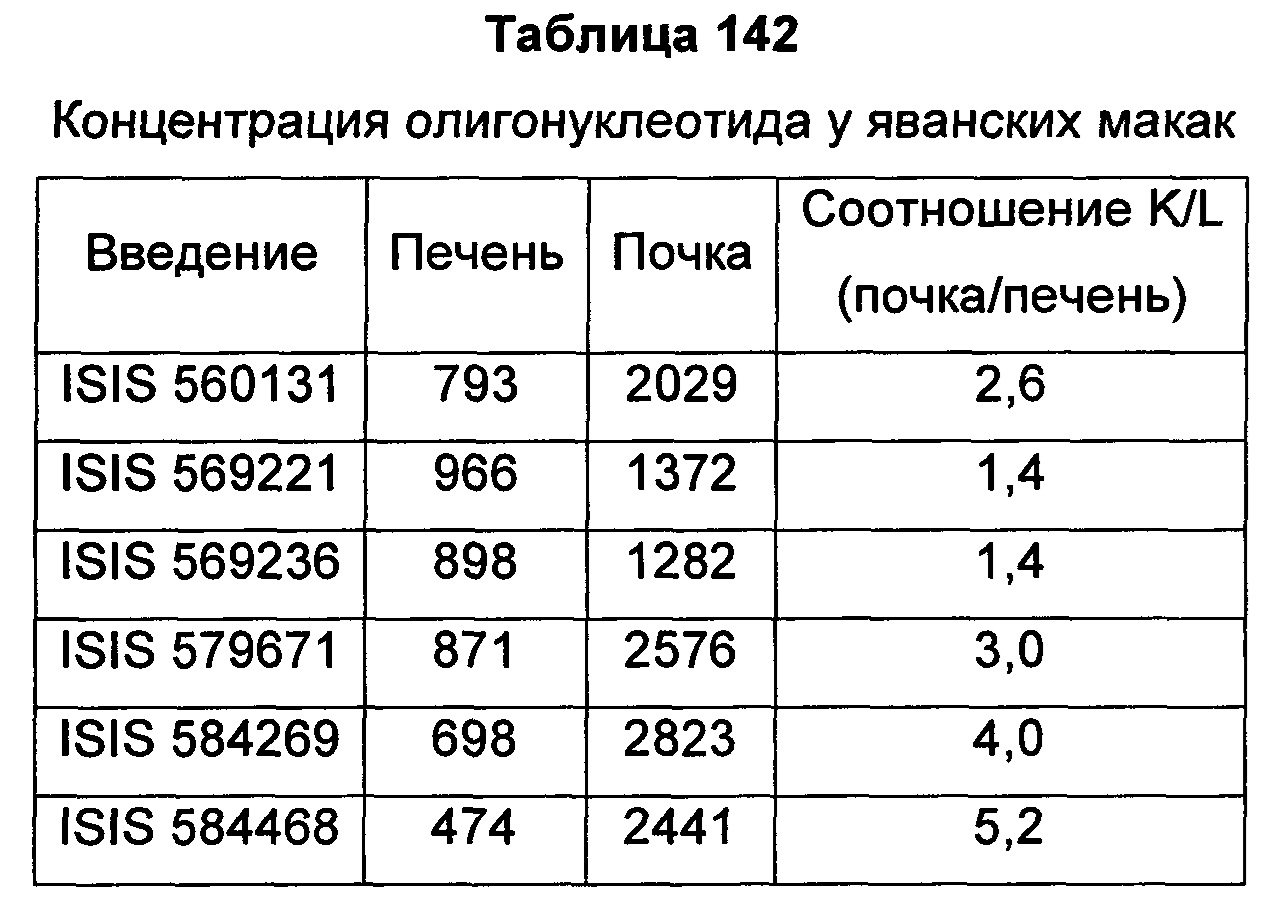
Пример 34: Эффект антисмыслового ингибирования рецептора андрогенов (AR) в ортотопической модели рецептор андрогенов-зависимого рака молочной железы
Клетки MDA-MB-453 экспрессируют AR в отсутствие рецепторов эстрогенов и рецептора прогестерона (Hall, R.E. et al., Eur. J. Cancer 1994. 30: 484-490). Эффект ингибирования экспрессии мРНК AR антисмысловыми олигонуклеотидами исследовали у имеющих опухоль мышей MDA-MB-453.
Исследование 1
ISIS 569216 (TGATTTAATGGTTGCA; SEQ ID NO: 39), который является антисмысловым олигонуклеотидом, протестированным в анализе, был сконструирован как дезокси, МОЕ и (S)cEt олигонуклеотид длиной 16 нуклеозидов. Химический состав этого олигонуклеотида: 5'-Те Gk Ak Tk Td Td Ad Ad Td Gd Gd Td Tk Gk Ck А, где "е" означает 2'-O-метоксиэтилрибозу; "k" означает (S)-cEt; "d" означает 2'-дезоксирибозу. Межнуклеозидные связи по всему олигонуклеотиду являются фосфоротиоатными (P=S) связями. Все цитозиновые остатки по всему олигонуклеотиду представляли собой 5-метилцитозины. ISIS 569216 имеет два сайта инициации-мишени, 58720 и 58750, на геномной последовательности AR человека (GENBANK, номер доступа NT_011669.17, с усечением нуклеозидов 5079000-5270000, SEQ ID NO: 1).
Лечение
Клетки карциномы молочной железы MDA-MB-453 (5×106), смешанные с 50% Matrigel, инъецировали в жировое тело молочной железы 10 самок мышей NSG. В это же время подкожно имплантировали гранулы дигидротестостерона (DHT), активной формы основного циркулирующего андрогена, тестостерона. Как только опухоль достигала размера 100 мм3, мышей рандомизированно разделяли на две группы лечения. Первой группе лечения делали подкожные инъекции ISIS 569216 в дозе 50 мг/кг пять раз в неделю в течение 4 недель. Второй группе лечения инъецировали только носитель, который вводили подкожной инъекцией пять раз в неделю в течение 4 недель, и эта группа служила в качестве контрольной группы. Мониторинг роста опухоли выполняли один раз в неделю, и мышей умерщвляли в день 32 после лечения. Образцы опухолевой ткани и ТВ-области контакта собирали для дальнейшего анализа.
Анализ РНК
Опухоли вырезали, и ткань обрабатывали для экстракции РНК и количественных ПЦР-анализов. Экспрессию мРНК AR оценивали в ТВ-области контакта и нормализовали к экспрессии мРНК актина. Экспрессия мРНК AR у мышей, которым вводили ISIS 569216, была ингибирована на 48% по сравнению с контрольной группой.
Измерение объема опухоли
Объемы опухолей измеряли на регулярной основе на всем протяжении периода исследования, используя штангенциркули. Как показано в Таблице 143, объемы опухолей были значительно сокращены у мышей, которым вводили ISIS 569216, по сравнению с контрольной группой.

Исследование 2
Лечение
Клетки MDA-MB-453, полученные из АТСС (Американская коллекция типовых культур), поддерживали в среде Лейбовица L-15 с 10% FBS. Самкам мышей NSG (Jackson Laboratories) имплантировали в жировое тело молочной железы 5×106 опухолевых клеток в матригеле с пониженным содержанием факторов роста (1:1). Одновременно гранулы DHT также имплантировали мышам между плечевыми лопатами.
Через 20 суток мышей рандомизированно разделяли на группы лечения. Группам мышей инъецировали 50 мг/кг ISIS 569236 или ISIS 560131, которые вводили подкожно 5 дней в неделю в течение 2 недель. Группу мышей аналогично лечили контрольным олигонуклеотидом, ISIS 549148 (3-10-3 (S)-cEt гэпмер с последовательностью GGCTACTACGCCGTCA, обозначенной в данном документе как SEQ ID NO: 193, с неизвестной человеческой последовательностью). Другую контрольную группу мышей аналогично лечили PBS.
Измерение роста опухоли
Объемы опухолей измеряли на регулярной основе на всем протяжении периода исследования, используя штангенциркули. Как показано в Таблице 144, объемы опухолей были сокращены у мышей, которых лечили антисмысловыми олигонуклеотидами, направленно воздействующими на AR, по сравнению с контрольной группой.

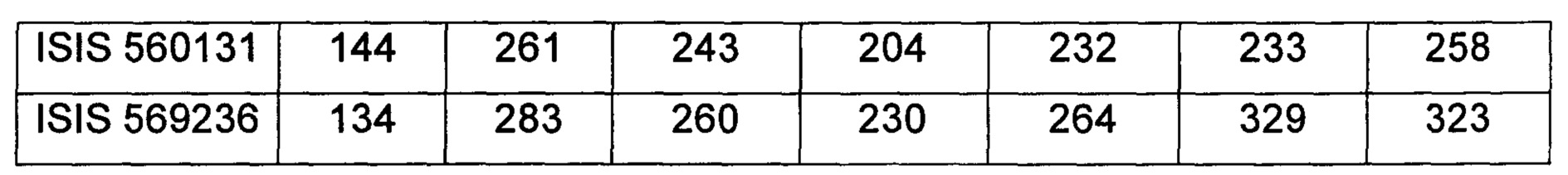
Анализ РНК
Экстракцию РНК осуществляли с использованием набора для экстракции РНК от Qiagen. Экспрессию РНК AR измеряли с использованием комплекта праймеров и зондов LTS00943 и нормализовали к экспрессии мРНК актина человека.
Экспрессию РНК AR человека оценивали в ткани опухоли. У мышей, которым вводили ISIS 560131, достигалось ингибирование экспрессии РНК AR на 35%, а у мышей, которым вводили ISIS 569236, достигалось ингибирование экспрессии AR на 19% по сравнению с контрольной группой.
12
Реферат
Изобретение относится к области биотехнологии, конкретно к модифицированному олигонуклеотиду, направленно воздействующему на рецептор андрогенов (AR) человека для ингибирования уровней рецептора андрогенов в клетке, и может быть использовано в медицине. Полученный модифицированный олигонуклеотид и его фармацевтически приемлемую соль используют в составе композиции для ингибирования уровней рецептора андрогенов в клетке, а также для ингибирования пролиферации или роста раковых клеток, таких как клетки рака предстательной железы, рака молочной железы, рака яичника, рака желудка или рака мочевого пузыря. Благодаря своему строению и механизму действия олигонуклеотид позволяет направленно воздействовать на мРНК рецептора андрогенов и индуцировать антипролиферативные ответные реакции в клетке. 4 н. и 16 з.п. ф-лы, 146 табл., 34 пр.

Комментарии