Снижение системного уровня регуляторных т-клеток или их активности для лечения заболеваний и трамв цнс - RU2741366C2
Код документа: RU2741366C2
Чертежи









Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится в целом к способам и препаратам для лечения болезней, расстройств, патологических состояний или травм центральной нервной системы (ЦНС) путем временного снижения уровня системной иммуносупрессии в кровотоке.
УРОВЕНЬ ТЕХНИКИ
Большинство патологий центральной нервной системы (ЦНС) объединяет общий нейровоспалительный компонент, являющийся частью развития заболевания и способствующий его обострению. К таким патологиям относится болезнь Альцгеймера (БА), связанное с возрастом нейродегенеративное заболевание, характеризующееся прогрессирующей потерей памяти и когнитивных функций, при котором, как считается, накопление бета-амилоидных (Aβ) пептидных бляшек играет ключевую роль в каскадном развитии воспаления ЦНС, что в конечном счете ведет к разрушению нейронов и повреждению тканей (Akiyama et al, 2000; Hardy & Selkoe, 2002; Vom Berg et al, 2012). Несмотря на хронический нейровоспалительный ответ в нейродегенеративных заболеваниях, за последнее десятилетие клинические и доклинические исследования, направленные на изучение терапии нейродегенеративных заболеваний на основе иммуносупрессии, подняли вопрос о неэффективности противовоспалительных препаратов (Breitner et al, 2009; Group et al, 2007; Wyss-Coray & Rogers, 2012). Мы предоставляем новаторское решение, которое преодолевает недостатки существующих методов лечения БА, а также аналогичных заболеваний и травм ЦНС; этот метод основан на нашем особенном понимании роли различных компонентов системной и центральной иммунной системы в поддержании функционирования и восстановлении ЦНС.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном аспекте, настоящее изобретение предлагает лекарственный препарат, включающий в себя активный агент, который вызывает снижение уровня системной иммуносупрессии у пациента снятием ограничения, наложенного на иммунную систему одной или несколькими иммунными контрольными точками, что может использоваться при лечении болезней, расстройств, патологических состояний или травм ЦНС, кроме аутоиммунных нейровоспалительных заболеваний, рецидивирующе-ремиттирующего рассеянного склероза (РРРС), при этом упомянутая фармацевтическая композиция вводится в режиме дозирования, состоящем по меньшей мере из двух курсов терапии, каждый из которых включает в себя сеанс лечения, после которого следует перерыв; при этом упомянутая иммунная контрольная точка (или несколько точек) выбирается из группы, состоящей из ICOS-B7RP1, иммуноглобулиноподобного V-доменного супрессора активации Т-клеток (VISTA), В7-СD28-подобной молекулы, CD40L-CD40, CD28-CD80, CD28-CD86, В7Н3, В7Н4, В7Н7, BTLA-HVEM, CD137-CD137L, OX40L, CD27-CD70, стимулятора генов интерферона (STING), ингибиторного мотива домена иммуноглобулина и иммунорецептора Т-клеток на основе тирозина (TIGIT), а также A2aR-аденозина и индоламин-2,3-диоксигеназы (IDO)-L-триптофана.
В другом аспекте, настоящее изобретение предлагает методику лечения болезней, расстройств, патологических состояний или травм центральной нервной системы (ЦНС), кроме аутоиммунных нейровоспалительных заболеваний, рецидивирующе-ремиттирующего рассеянного склероза (РРРС), при этом упомянутая методика предполагает введение пациенту лекарственного препарата, включающего в себя активный агент, который вызывает снижение уровня системной иммуносупрессии снятием ограничения, наложенного на иммунную систему одной или несколькими иммунными контрольными точками в соответствии с настоящим изобретением, при этом упомянутый лекарственный препарат вводится в режиме дозирования, состоящем по меньшей мере из двух курсов терапии, каждый из которых включает в себя сеанс лечения, после которого следует перерыв; при этом упомянутая иммунная контрольная точка (или несколько точек) выбирается из группы, состоящей из ICOS-B7RP1, иммуноглобулиноподобного V-доменного супрессора активации Т-клеток (VISTA), В7-СD28-подобной молекулы, CD40L-CD40, CD28-CD80, CD28-CD86, В7Н3, В7Н4, В7Н7, BTLA-HVEM, CD137-CD137L, OX40L, CD27-CD70, стимулятора генов интерферона (STING), ингибиторного мотива домена иммуноглобулина и иммунорецептора Т-клеток на основе тирозина (TIGIT), а также A2aR-аденозина и индоламин-2,3-диоксигеназы (IDO)-L-триптофана.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1А-В изображена активность сосудистого сплетения (СС) в течение прогрессирования заболевания на трансгенных мышах 5XFAD с моделью БА (AD-Tg). (А) уровни экспрессии мРНК генов icam1, vcam1, cxcl10 и ccl2, измеренные методом количественной ПЦР в реальном времени (RT-qPCR), в СС, отобранных у AD-Tg мышей 1, 2, 4 и 8-месячного возраста, показанные как кратное изменение по сравнению с контрольными образцами дикого типа (WT) соответственно возрасту (n=6-8 на группу; т-критерий Стьюдента по каждой временной точке). (В) Репрезентативные микроскопические изображения СС 8-месячных AD-Tg мышей и контрольных особей дикого типа соответственно возрасту, с иммуноокрашиванием для эпителиальных молекул с плотным контактом Клаудин-1, ядерный краситель Хехст и Интегрин лиганд, ICAM-1 (масштабная полоска, 50 мкм). На всех панелях величина ошибки представляет собой среднее ± стандартная ошибка среднего; *, Р<0,05; **, Р<0,01; ***, Р<0,001.
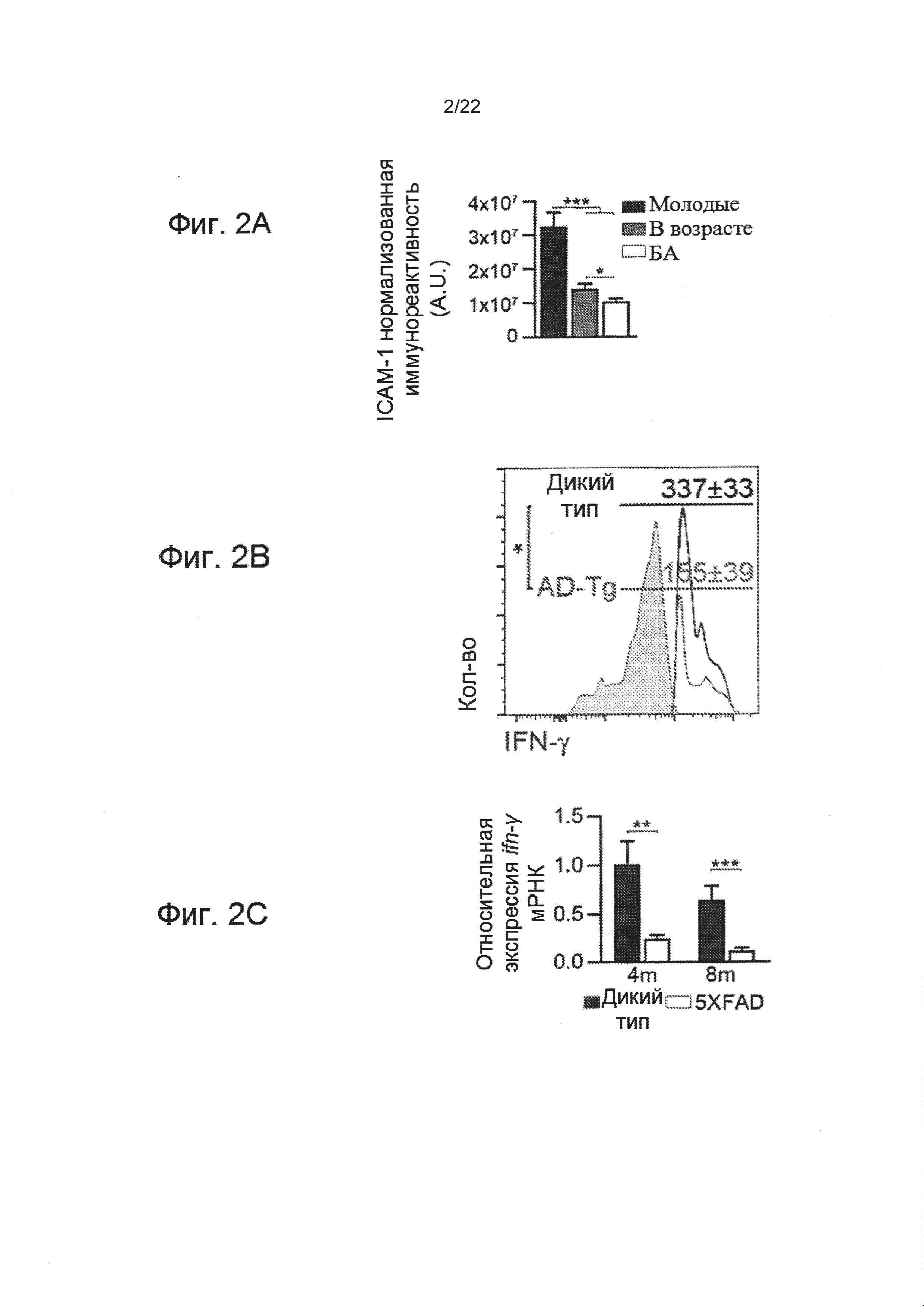
На фиг. 2А-С показаны: (А) Количественная оценка ICAM-1 иммунореактивности в СС человека (посмертно) у молодых и пожилых больных без расстройств ЦНС и страдающих БА (n=5 на группу; односторонний дисперсионный анализ ANOVA, затем ретроспективный анализ Ньюмана-Кейлса); (В) анализ методом проточной цитометрии для иммунных клеток, экспрессирующих IFN-γ (внутриклеточно окрашенных и заранее настроенных на CD45) в СС 8-месячных AD-Tg мышей и у контрольных особей дикого типа соответственно возрасту. Заштрихованная гистограмма отображает контроль изотипов (n=4-6 на группу; т-критерий Стьюдента); а также (С) уровни экспрессии мРНК генов IFN-γ (ИФН-γ), измеренные методом количественной ПЦР в реальном времени (RT-qPCR), в СС, отобранных у AD-Tg мышей 4- и 8-месячного возраста, в сравнении с контрольными образцами дикого типа (WT) соответственно возрасту (n=5-8 на группу; т-критерий Стьюдента по каждой временной точке). На всех панелях величина ошибки представляет собой среднее ± стандартная ошибка среднего; *, Р<0,05; **, Р<0,01; ***, Р<0,001.
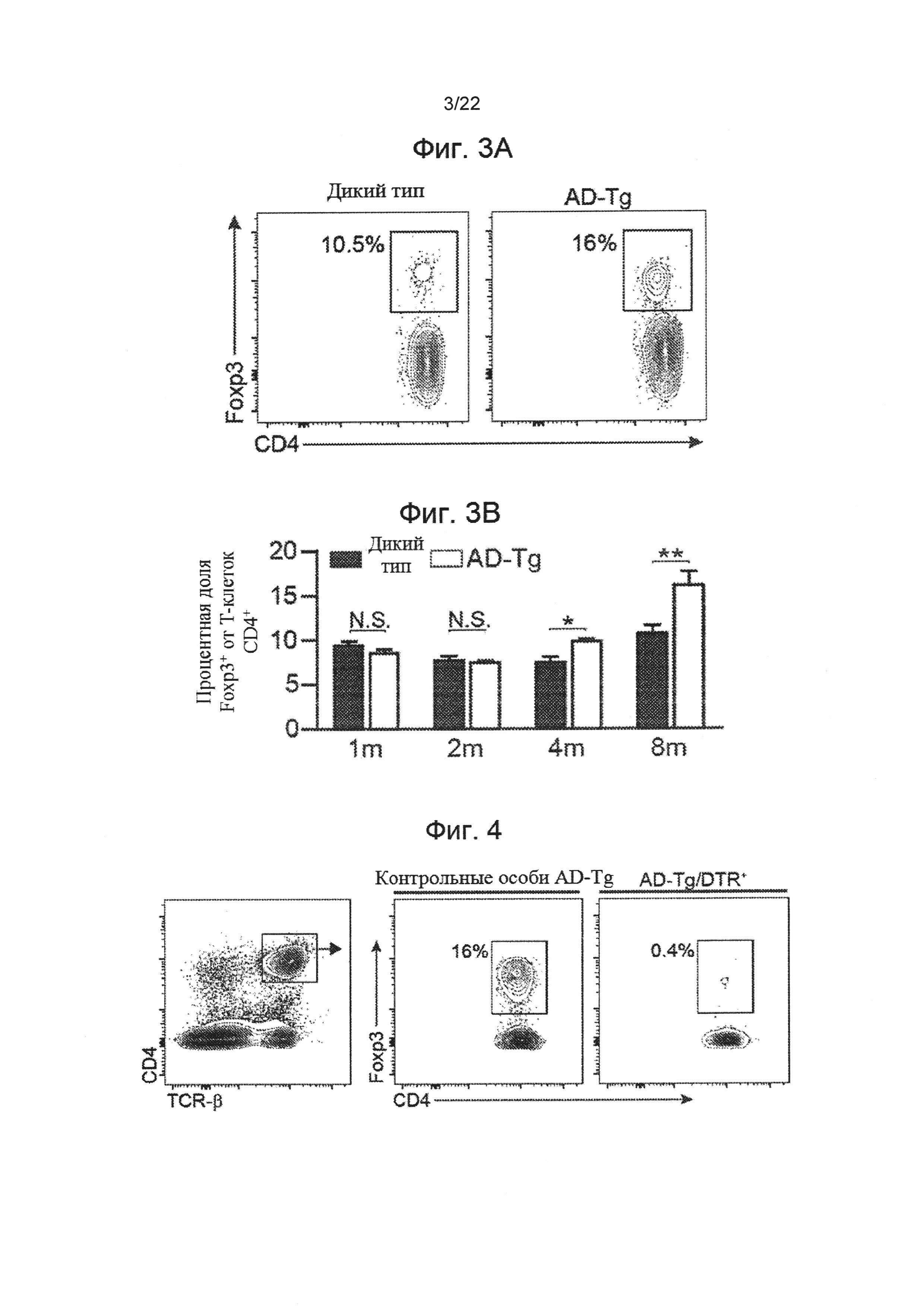
На фиг. 3А-В представлены: (А) репрезентативные участки поточной цитометрии частотности спленоцитов CD4+Foxp3+ (предварительно настроенные на TCRβ) у 8-месячных AD-Tg мышей и контрольных особей дикого типа; а также (В) количественный анализ спленоцитов от 1-, 2-, 4- и 8-месячных AD-Tg мышей и контрольных особей дикого типа (n=6-8 на группу; т-критерий Стьюдента по каждой временной точке). На всех панелях величина ошибки представляет собой среднее ± стандартная ошибка среднего; *, Р<0,05; **, Р<0,01; ***, Р<0,001.
На фиг. 4 показана стратегия настройки и репрезентативные участки поточной цитометрии спленоцитов от AD-Tg/Foxp3-DTR+/- мышей, через 1 день после последней инъекции DTx. DTx вводили интраперитонеально в течение 4 дней подряд, достигнуто истощение клеток Foxp3+ на ~99%.
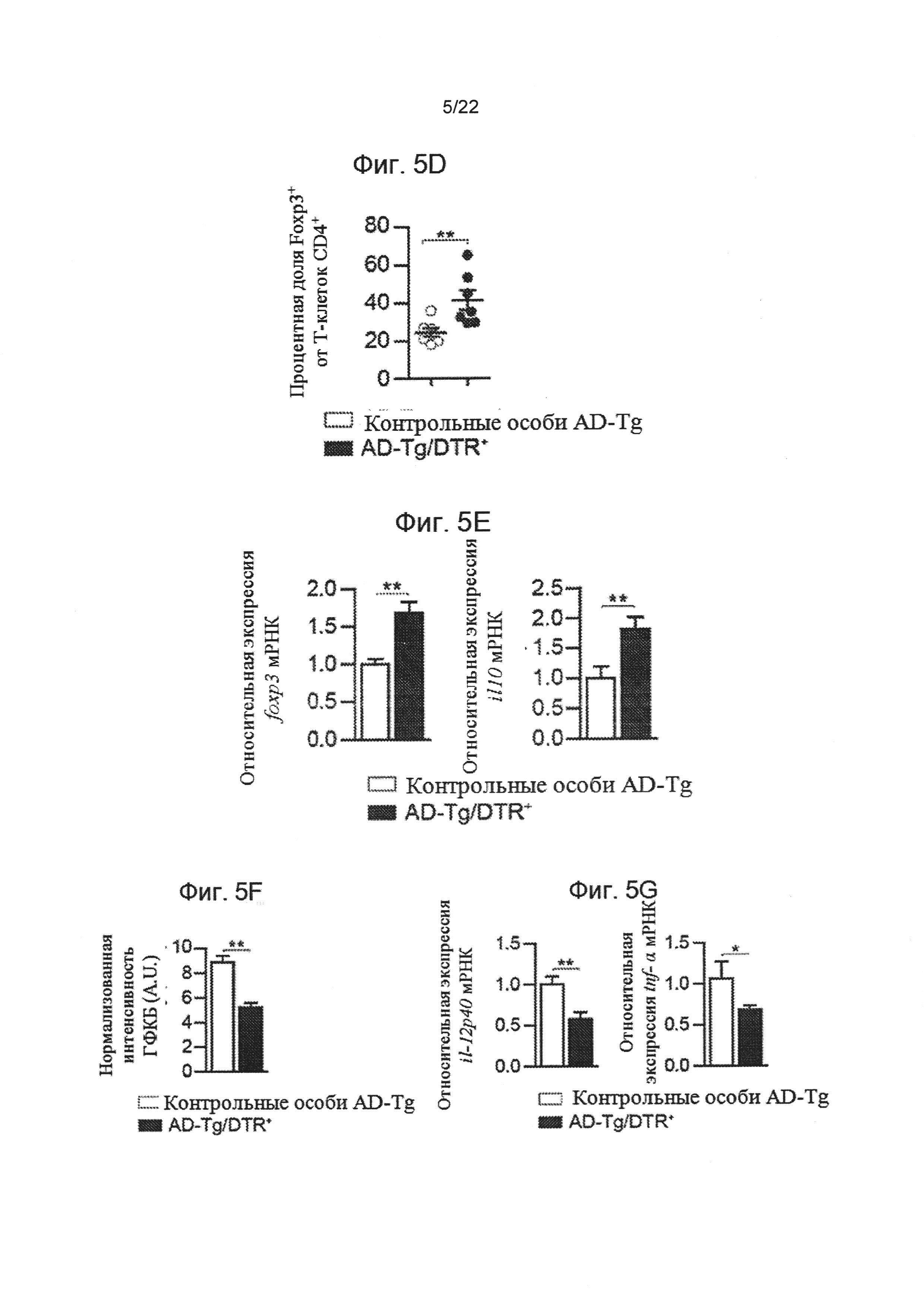
На фиг. 5A-G показаны последствия переходного истощения Treg клеток у AD-Tg мышей. (A) AD-Tg/Foxp3-DTR+ (экспрессирующие трансген DTR) и не экспрессирующий DTR однопометник AD-Tg (AD-Tg/Foxp3-DTR-) контрольной группы получали DTx в течение 4 дней подряд. Уровни экспрессии мРНК генов icam1, cxcl10 и ccl2, методом количественной ПЦР в реальном времени (RT-qPCR), в СС у 6-месячных AD-Tg мышей, получавших DTx, через 1 день после последней инъекции DTx (n=6-8 на группу; т-критерий Стьюдента). (B-D) Анализ паренхимы мозга методом проточной цитометрии (за исключением сосудистого сплетения, отсеченного отдельно) у 6-месячных AD-Tg мышей и контрольных особей, получавших DTx, в течение 3 недель после последней инъекции DTx. Количественный анализ методом проточной цитометрии, показывающий увеличение числа D11bhigh/CD45high mo-МФ и CD4+ Т-клеток (В), а также репрезентативные участки проточной цитометрии (С) и количественный анализ (D) частотности Treg клеток CD4+Foxp3+, в паренхиме мозга у AD-Tg/Foxp3-DTR+ мышей и AD-Tg/Foxp3-DTR контрольных особей, получавших DTx (n=3-7 на каждую группу; т-критерий Стьюдента). (Е) уровни экспрессии мРНК foxp3 и il10 в паренхиме мозга получавших DTx 6-месячных AD-Tg AD-Tg/Foxp3-DTR+ мышей и AD-Tg/Foxp3-DTR- контрольных особей, 3 недели после последней инъекции DTx (n=6-8 на группу; т-критерий Стьюдента). (F) количественный анализ ГФКБ с иммуноокрашиванием, с демонстрацией сокращения астроглиоза в разделах гиппокампа у получающих DTx 6-месячных AD-Tg/Foxp3-DTR+ и AD-Tg/Foxp3-DTR- контрольных мышей, 3 недели после последней инъекции DTx (масштабная полоска, 50 мкм; n=3-5 на группу; т-критерий Стьюдента). (G) уровни экспрессии мРНК il-12р40 и tnf-α в паренхиме мозга, 3 недели после последней инъекции DTx (n=6-8 на группу; т-критерий Стьюдента). На всех панелях величина ошибки представляет собой среднее ± стандартная ошибка среднего; *, Р<0,05; **, Р<0,01; ***, Р<0,001.
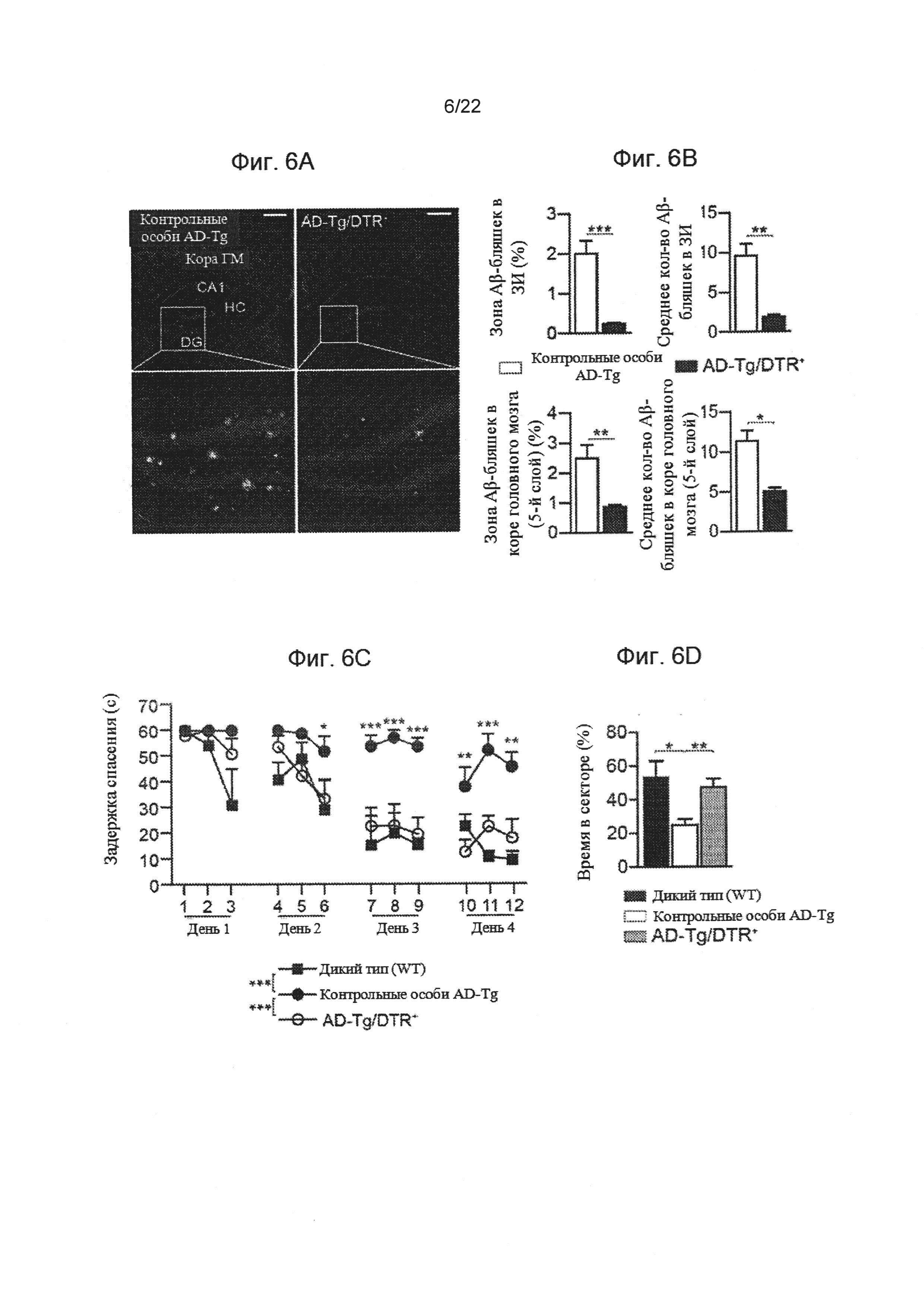
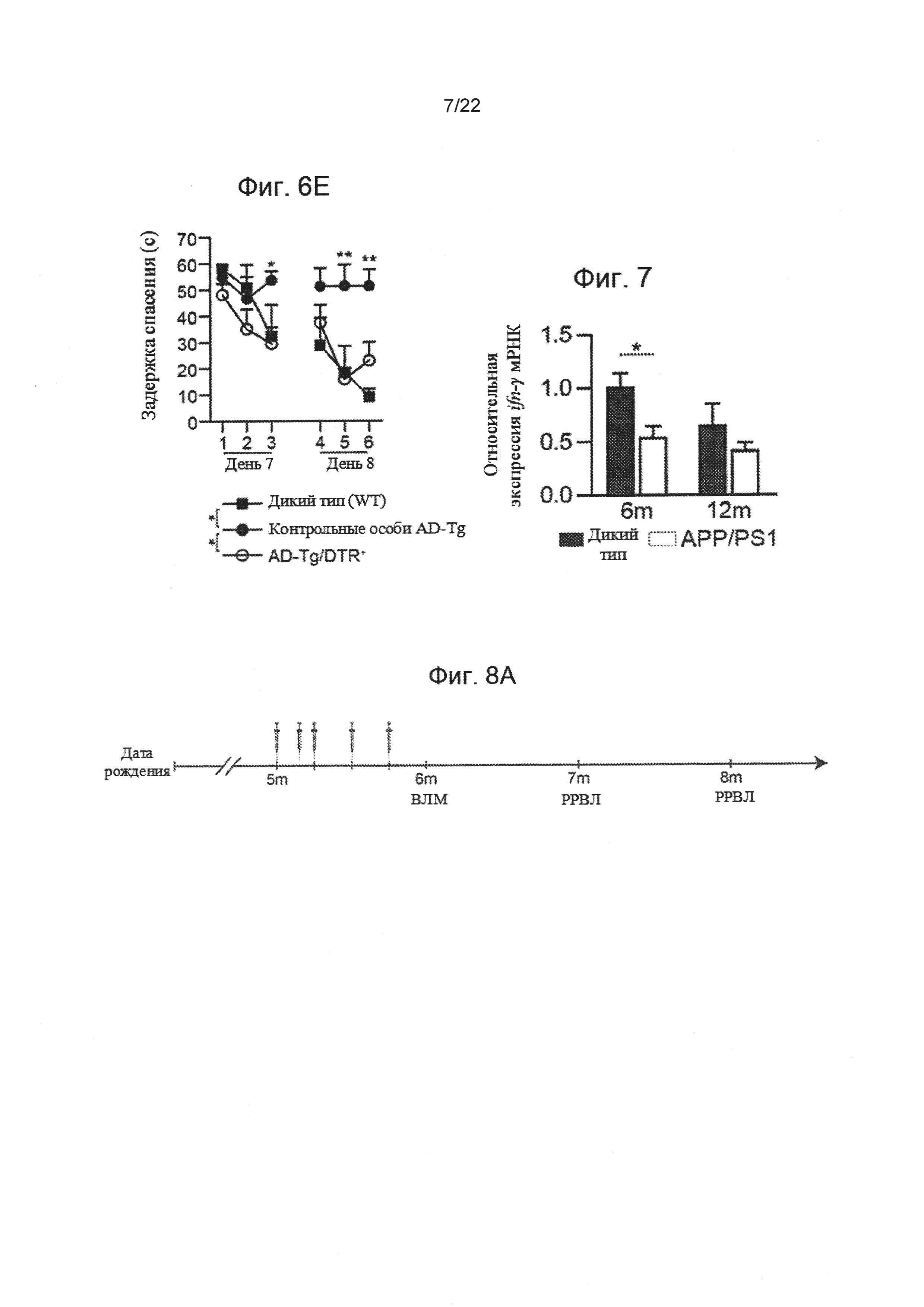
На фиг. 6А-Е показаны последствия переходного истощения Treg клеток на функции обучения и запоминания Аβ-бляшек. (А) Репрезентативные микроскопические изображения и (В) количественный анализ мозга получающих DTx 5-месячных AD-Tg/Foxp3-DTR+ и AD-Tg/Foxp3-DTR- контрольных мышей, 3 недели после последней инъекции DTx, иммуноокрашивание на Аβ-бляшки и ядерное окрашивание Хехст (масштабная линейка, 250 мкм). Были вычислены средние площадь и количество Аβ-бляшек в зубчатой извилине гиппокампа (ЗИ) и на 5-ом слое коры головного мозга (в 6 мкм срезе мозга; n=5-6 на группу; т-критерий Стьюдента). На фиг. 6С-Е изображены результаты испытаний в водном лабиринте Морриса (ВЛМ) получавших DTx 6-месячных AD-Tg/Foxp3-DTR+ мышей и контрольных особей, 3 недели после последней инъекции DTx. После переходного истощения Treg клеток, AD-Tg мыши показали лучшие результаты пространственного обучения и памяти на фазах (С) узнавания, (D) зондирования и (Е) разворота ВЛМ, по сравнению с контрольными особями AD-Tg (n=7-9 на группу; двусторонний повторный дисперсионный анализ ANOVA, затем ретроспективный анализ Бонферрони для сравнения отдельных пар; *, Р<0,05 в совокупности для узнавания, зондирования и разворота). На всех панелях величина ошибки представляет собой среднее ± стандартная ошибка среднего; *, Р<0,05; **, Р<0,01; ***, Р<0,001.
На фиг. 7 показаны уровни экспрессии мРНК ifn-γ, измеренные методом количественной ПЦР в реальном времени (RT-qPCR), в СС, вырезанных у 6- и 12-месячных APP/PS1 AD-Tg мышей (модель мыши для болезни Альцгеймера (см. материалы и методы)), по сравнению с контрольными особями дикого типа соответствующего возраста (n=5-8 на группу; т-критерий Стьюдента). Величина ошибки представляет собой среднее ± стандартная ошибка среднего; *, Р<0,05.
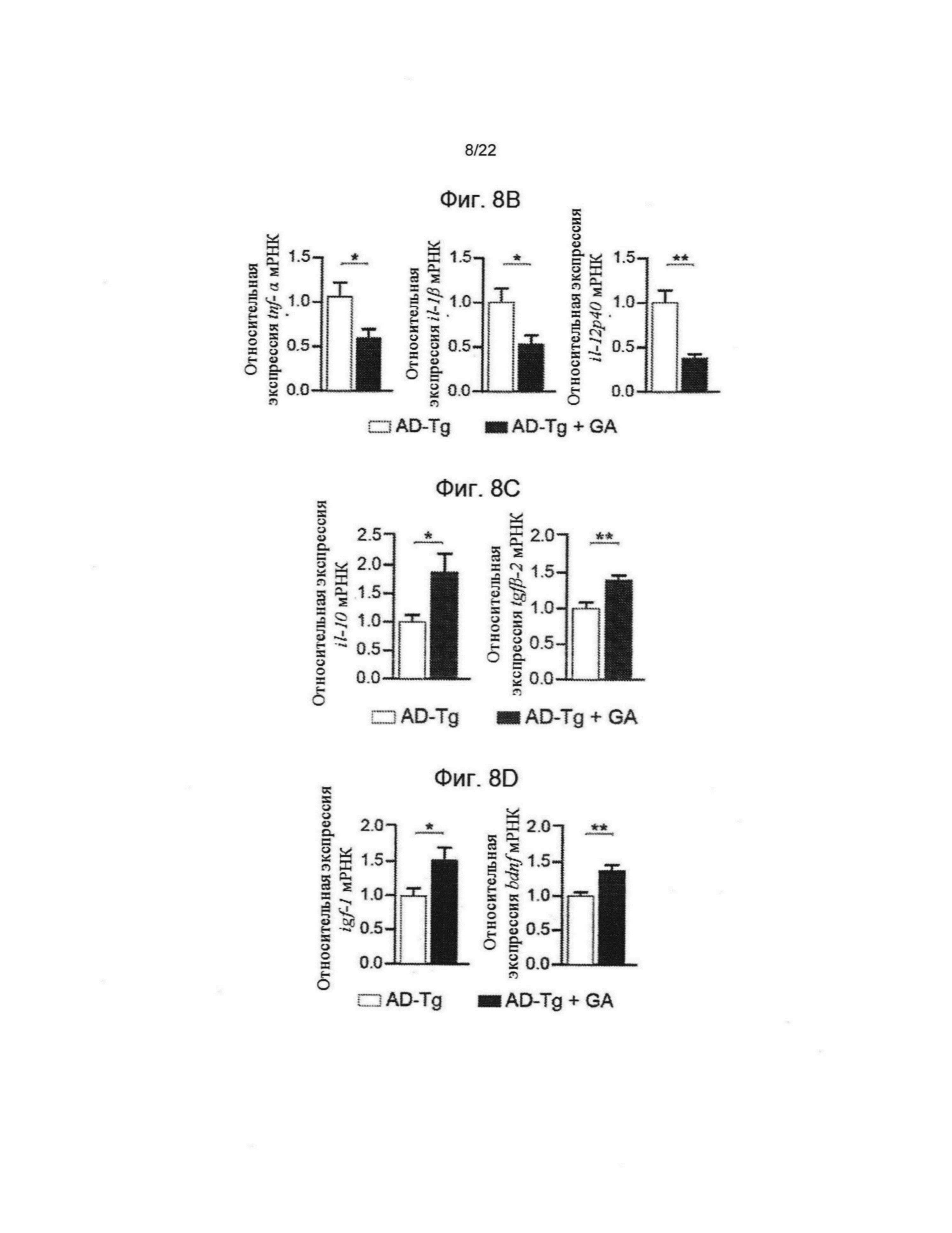
На фиг. 8A-I показан терапевтический эффект еженедельного ввода глатирамера ацетата (ГА) мышам AD-Tg. (А) Схематическое представление режима лечения еженедельным вводом ГА. Мышам (5-месячным) подкожно вводили ГА (100 мкг), дважды в течение первой недели (день 1 и 4), а после этого раз в неделю, общей продолжительностью 4 недели. Мышей исследовали в плане когнитивных функций, через 1 неделю (ВЛМ), 1 месяц (РРВЛ) и 2 месяца (РРВЛ, с использованием различных экспериментальных пространственных параметров) после последней инъекции, а также на предмет воспаления гиппокампа. На фиг. 8B-D показаны уровни экспрессии мРНК генов в гиппокампе не подвергавшихся лечению AD-Tg мышей, и AD-Tg мышей, получавших еженедельно ГА, в возрасте 6 месяцев, показано (В) сокращение экспрессии провоспалительных цитокинов, таких как TNF-α (ФНО-альфа), IL-1β и IL-12р40, (С) повышение противовоспалительных цитокинов IL-10 и TGF-β, а также (D) нейротропные факторы, IGF-1 (ИФР-1) и BDNF (нейротрофический фактор головного мозга), у мышей, еженедельно получавших ГА (n=6-8 на группу; т-критерий Стьюдента). На фиг. 8E-G AD-Tg мыши (5 месяцев) еженедельно получали либо ГА, либо проводник (PBS), по сравнению с однопометниками дикого типа соответственно возрасту в решении ВЛМ, в возрасте 6 месяцев. Получавшие лечение AD-Tg мыши показали лучшие результаты пространственного обучения и памяти на фазах узнавания (Е), зондирования (F) и разворота (G) ВЛМ, по сравнению с контрольными особями (n=6-9 на группу; двусторонний повторный дисперсионный анализ ANOVA, затем ретроспективный анализ Бонферрони для сравнения отдельных пар; мыши дикого типа, черные круги; контрольные особи AD-Tg, белые круги; получавшие лечение AD-Tg, серые круги). На фиг. 8H-I показана когнитивная деятельность тех же мышей в решении РРВЛ через 1 месяц (Н) или 2 месяца (I) после последней инъекции ГА (n=6-9 на группу; двусторонний повторный дисперсионный анализ ANOVA, затем ретроспективный анализ Бонферрони для сравнения отдельных пар). Данные представляют по меньшей мере три независимых эксперимента. На всех панелях величина ошибки представляет собой среднее ± стандартная ошибка среднего; *, Р<0,05; **, Р<0,01; ***, Р<0,001.
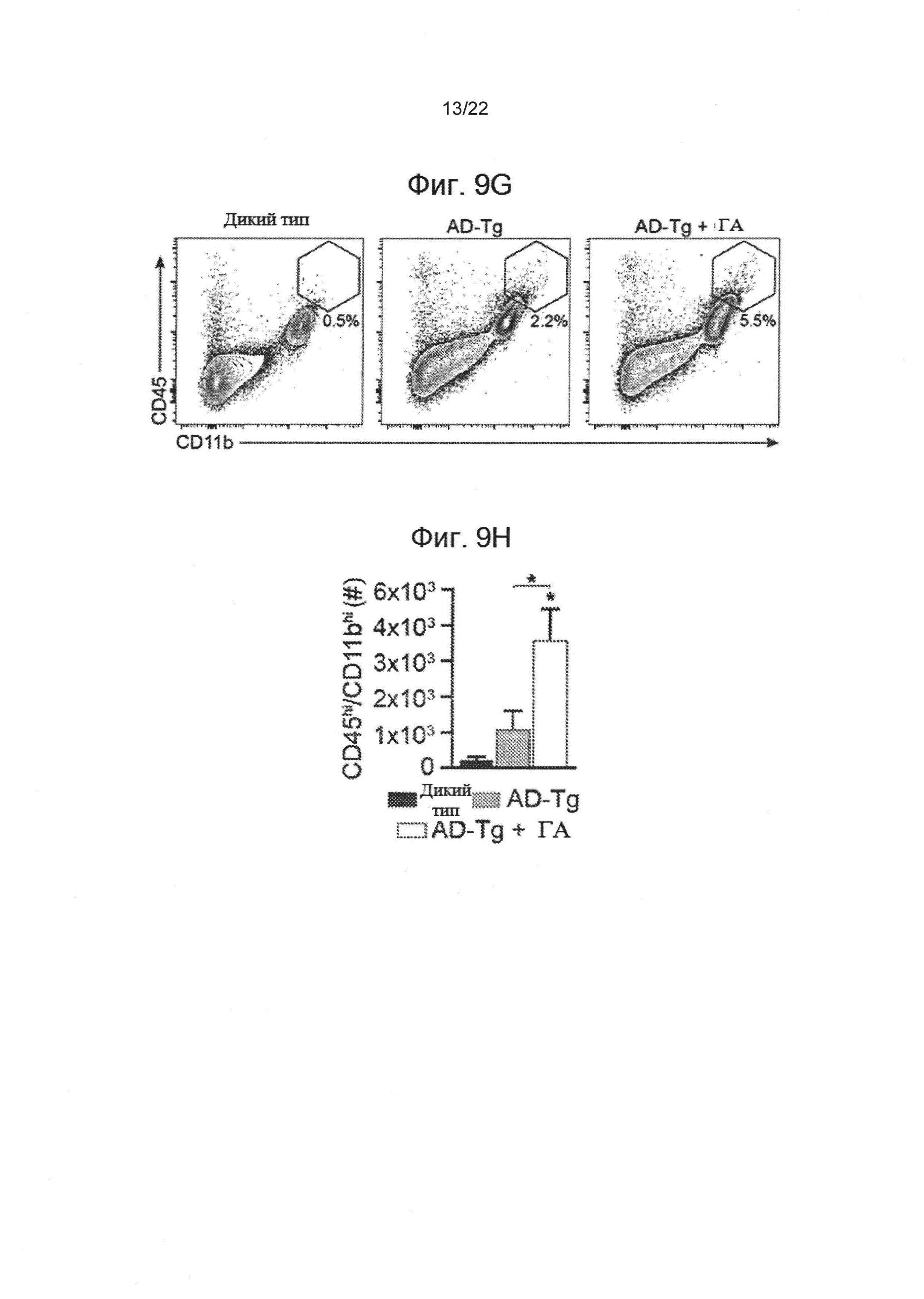
На фиг. 9А-Н показаны дальнейшие терапевтические последствия еженедельного ввода ГА мышам AD-Tg. А-В демонстрируют 5XFAD AD-Tg мышей, которые еженедельно получали ГА или проводник (PBS) и были исследованы в конце первой недели режима ввода (итого после двух инъекций ГА). Анализ методом проточной цитометрии на частотность спленоцитов CD4+Foxp3+(А) и иммуноклеток СС, экспрессирующих IFN-γ (В; внутриклеточно окрашенных и предварительно настроенных на CD45), у получавших лечение 6-месячных AD-Tg мышей, по сравнению с контрольными особями соответствующего возраста (n=4-6 на группу; односторонний дисперсионный анализ ANOVA, затем ретроспективный анализ Ньюмана-Кейлса). (С) уровни экспрессии мРНК генов icam1, cxcl10 и ccl2, измеренные методом количественной ПЦР в реальном времени, в СС 4-месячных AD-Tg мышей, получавших еженедельно либо ГА, либо проводник, и исследованных в конце либо 1-ой, либо 4-ой недели режима еженедельного ввода ГА (n=6-8 на группу; односторонний дисперсионный анализ ANOVA, затем ретроспективный анализ Ньюмана-Кейлса). На фиг. 9D-E показаны репрезентативные изображения срезов мозга 6-месячных AD-Tg/CX3CR1GFP/+ костномозговых химер после недельного ввода ГА. Клетки CX3CR1GFP были локализованы в СС третьего желудочка (3V; i), в прилегающем к желудочкам пространстве (ii) и в СС боковых желудочков (LV; iii) у AD-Tg мышей, еженедельно получавших ГА (D; масштабная линейка, 25 мкм). Репрезентативные прямоугольные проекции софокусных пучков оси Z, показывающие колокализацию клеток GFP+ с миелоидным маркером, CD68, в СС 7-месячных мышей AD-Tg/CX3CR1GFP/+, еженедельно получавших ГА, но не у контрольных мышей AD-Tg/CX3CR1GFP/+, получавших PBS (Е, масштабная линейка, 25 мкм). (F) Клетки CX3CR1GFP локализуются совместно с миелоидным маркером IBA-1 в мозгах получавших ГА мышей AD-Tg/CX3CR1GFP/+ рядом с Аβ-бляшками, совместно экспрессируя миелоидный маркер, IBA-1 (масштабная линейка, 25 мкм). На фиг. 9G-H показаны репрезентативные участки проточной цитометрии клеток, изолированных от гиппокампа 4-месячных особей дикого типа, не получавших лечение AD-Tg мышей, а также AD-Tg мышей на второй неделе еженедельного ввода ГА. CD11bhigh/CD45high mo-МФ были настроены (G) и определены количественно (Н; n=4-5 на группу; односторонний дисперсионный анализ ANOVA, затем ретроспективный анализ Ньюмана-Кейлса). На всех панелях величина ошибки представляет собой среднее ± стандартная ошибка среднего; *, Р<0,05; **, Р<0,01; ***, Р<0,001.
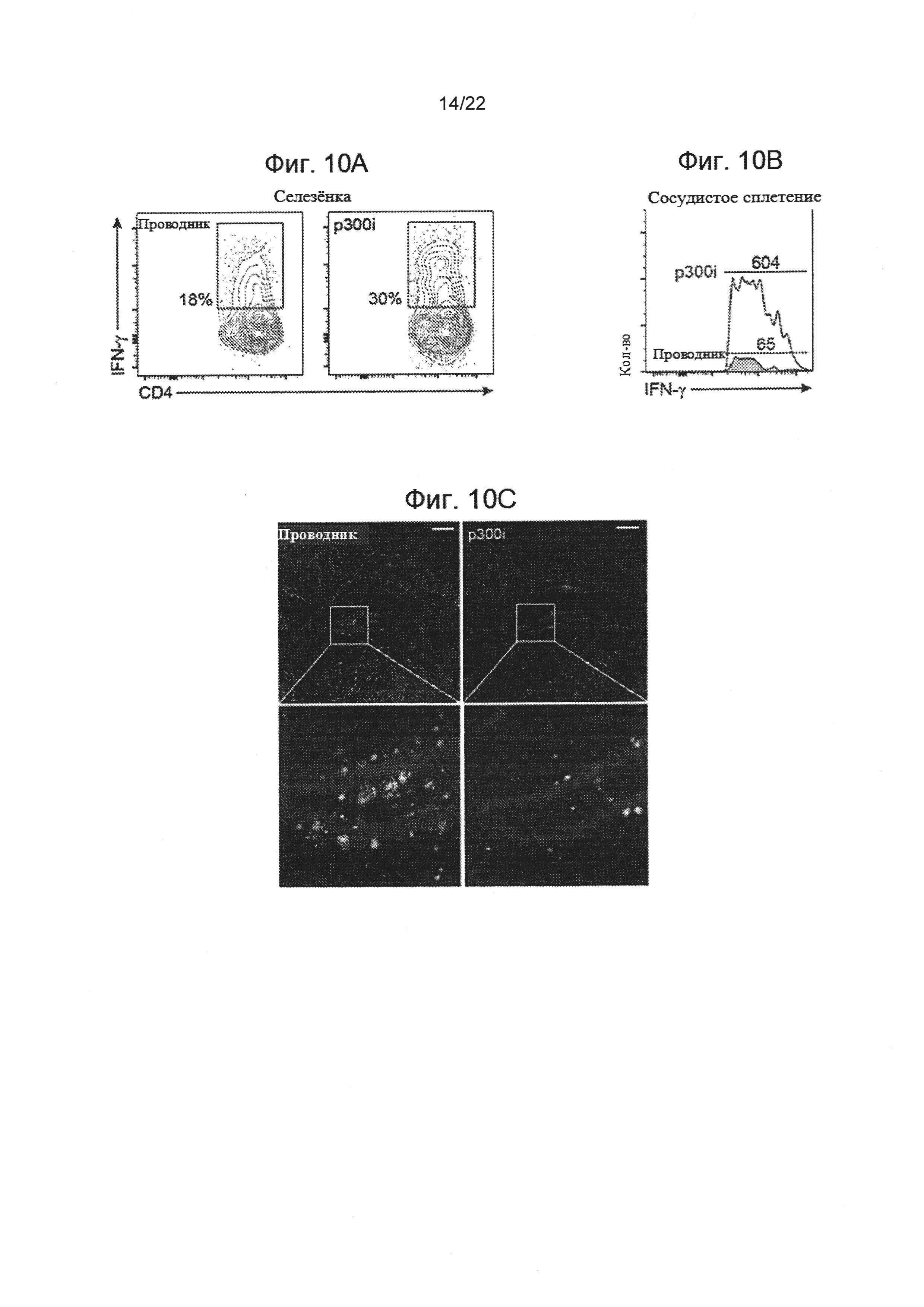
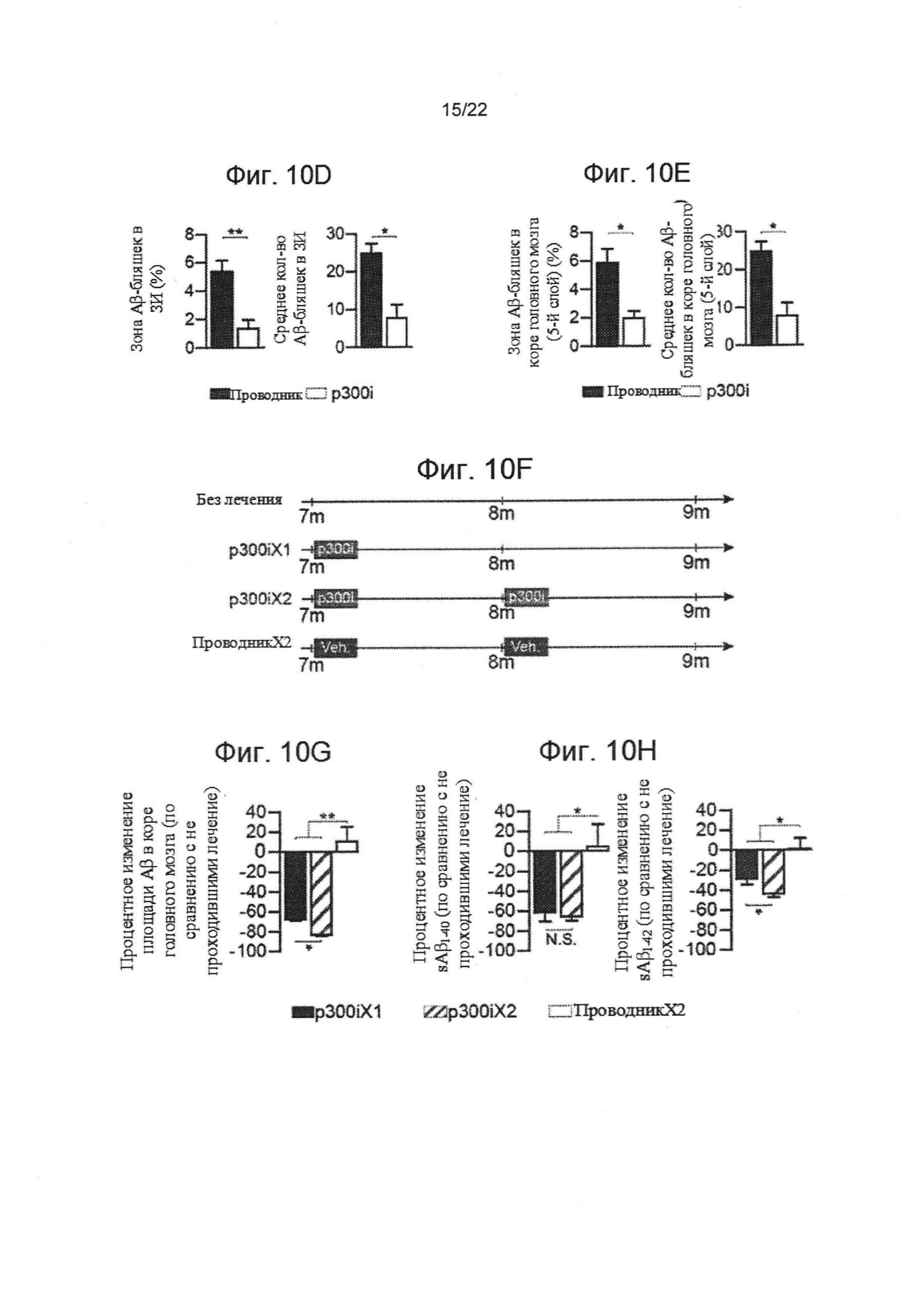
На фиг. 10А-Н изображен терапевтический эффект ввода p300 ингибитора (С646) мышам AD-Tg. На фиг. 10А-В взрослые мыши (18 месяцев) получали либо p300i, либо проводник (ДМСО) в течение 1 недели и исследовались на следующий день после прекращения лечения. Репрезентативные участки проточной цитометрии показывают повышение частоты CD4+ Т-клеток, экспрессирующих IFN-γ, в селезенке (А), и количества клеток, экспрессирующих IFN-γ, в СС (В), после курса p300i. На Фигурах 10С-Е показаны репрезентативные микроскопические изображения (С) и количественный анализ нагрузки Аβ-бляшек в мозгах 10-месячных AD-Tg мышей, которые получали p300i или проводник (ДМСО) в течение 1 недели и затем были исследованы спустя еще 3 недели. Мозги были подвергнуты иммуноокрашиванию на Аβ-бляшки и ядерному окрашиванию Хехст (n=5 на группу; масштабная линейка, 250 мкм). Были вычислены средние площадь и количество Аβ-бляшек в зубчатой извилине гиппокампа (ЗИ) (D) и на 5-ом слое коры головного мозга (Е) (в 6 мкм срезе мозга; n=5-6 на группу; т-критерий Стьюдента). (F) схематическое представление режима ввода p300i (или DMSO в качестве проводника) различным группам AD-Tg мышей в возрасте 7 месяцев, в течение 1 или 2 сессий. Фиг. 10G-H показывает изменение среднего значения процентного охвата коры головного мозга Аβ-бляшками (5-й слой) (G) и изменение в средних уровнях растворимого в мозгу Aβ1-40 и Aβ1-42 протеина (Н), по отношению к группе AD-Tg, не получавших лечение (средний уровень Aβ1-40 и Аβ1-42 в не проходившей лечение группе, 90,5±11,2 и 63,8±6,8 пг/мг общего количества, соответственно; n=5-6 на группу; односторонний дисперсионный анализ ANOVA, затем ретроспективный анализ Ньюмана-Кейлса). На всех панелях величина ошибки представляет собой среднее ± стандартная ошибка среднего; *, Р<0,05; **, Р<0,01; ***, Р<0,001.
На фиг. 11A-D показано, что блокада PD-1 увеличивает IFN-γ-зависимую деятельность сосудистого сплетения у AD-Tg мышей. 10-месячным AD-Tg мышам вводили интраперитонеально на 1 день и 4 день 250 мкг анти-PD-1 или контрольного IgG, затем исследовали на 7-10-й дни на предмет воздействия на системный иммунный ответ и деятельность CC (А-В) Репрезентативные участки проточной цитометрии (А) и количественный анализ (В) частотности спленоцитов CD4+IFN-γ+ (внутриклеточно окрашенных и настроенных на CD45 и TCR-β), у AD-Tg мышей, получавших αPD-1 или IgG, а также не получавших лечение AD-Tg мышей и контрольных особей дикого типа (n=4-6 на группу; односторонний дисперсионный анализ ANOVA, затем ретроспективный анализ Ньюмана-Кейлса; **, Р<0,01 между группами, проходившими лечение; величина ошибки представляет среднее значение ± стандартная ошибка среднего). (С) уровни экспрессии мРНК ifn-g, измеренные методом количественной ПЦР в реальном времени в СС мышей AD-Tg, получавших анти-PD-1, в сравнении с получавшими IgG и с не проходившими лечение контрольными особями AD-Tg(D) Термины генной онтологии, расширенные в последовательности РНК в СС тех же мышей (n=3-5 на группу; односторонний дисперсионный анализ ANOVA, затем ретроспективный анализ Ньюмана-Кейлса; *, Р<0,05) (серая шкала соответствует отрицательному базовому протоколу 10 значения Р).
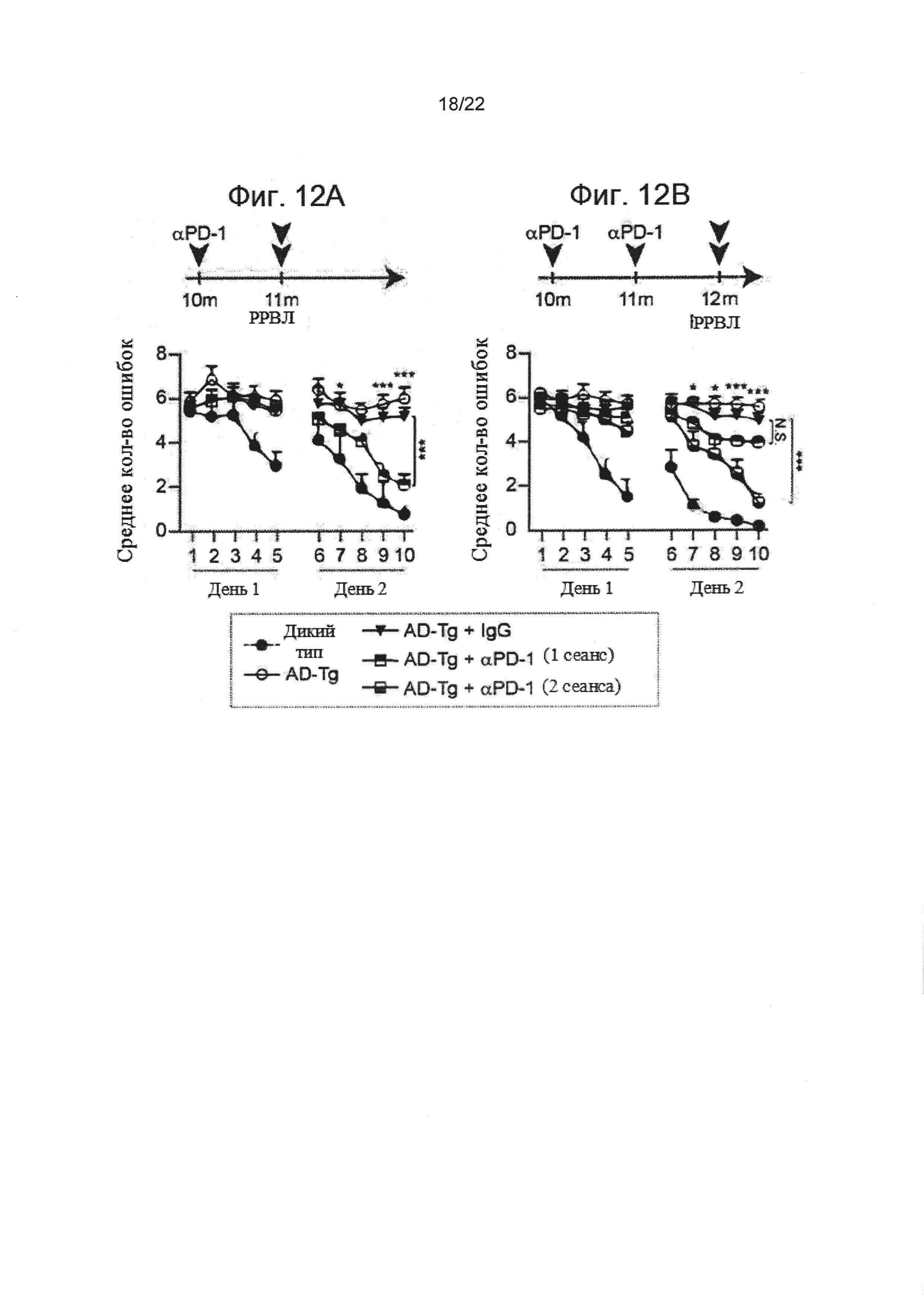
На Фиг 12А-В показано, что блокада PD-1 уменьшает когнитивный спад у AD-Tg мышей. 10-месячным AD-Tg мышам вводили интраперитонеально на 1 день и 4 день 250 мкг анти-PD-1 или контрольного IgG, затем исследовали через 1 или 2 месяца на предмет воздействия на патологию. (А-В) Схема эксперимента. Одинарные стрелки указывают временные точки лечения, двойные стрелки указывают временные точки когнитивного тестирования. Когнитивная деятельность мышей, прошедших лечение анти-PD-1 и IgG, по сравнению с диким типом соответствующего возраста и AD-Tg мышей, не проходивших лечение, оцененные по среднему количеству ошибок в день при выполнении задач обучения и запоминания в РРВЛ (n=6-8 на группу; двусторонний повторный дисперсионный анализ ANOVA, затем ретроспективный анализ Бонферрони для сравнения отдельных пар). (А) Результаты AD-Tg мышей в РРВЛ после 1 сеанса лечения с контролем анти-PD-1 или IgG. (В) Воздействие одного сеанса лечения анти-PD-1 или 2 сеансов с интервалом в 1 месяц на производительность.
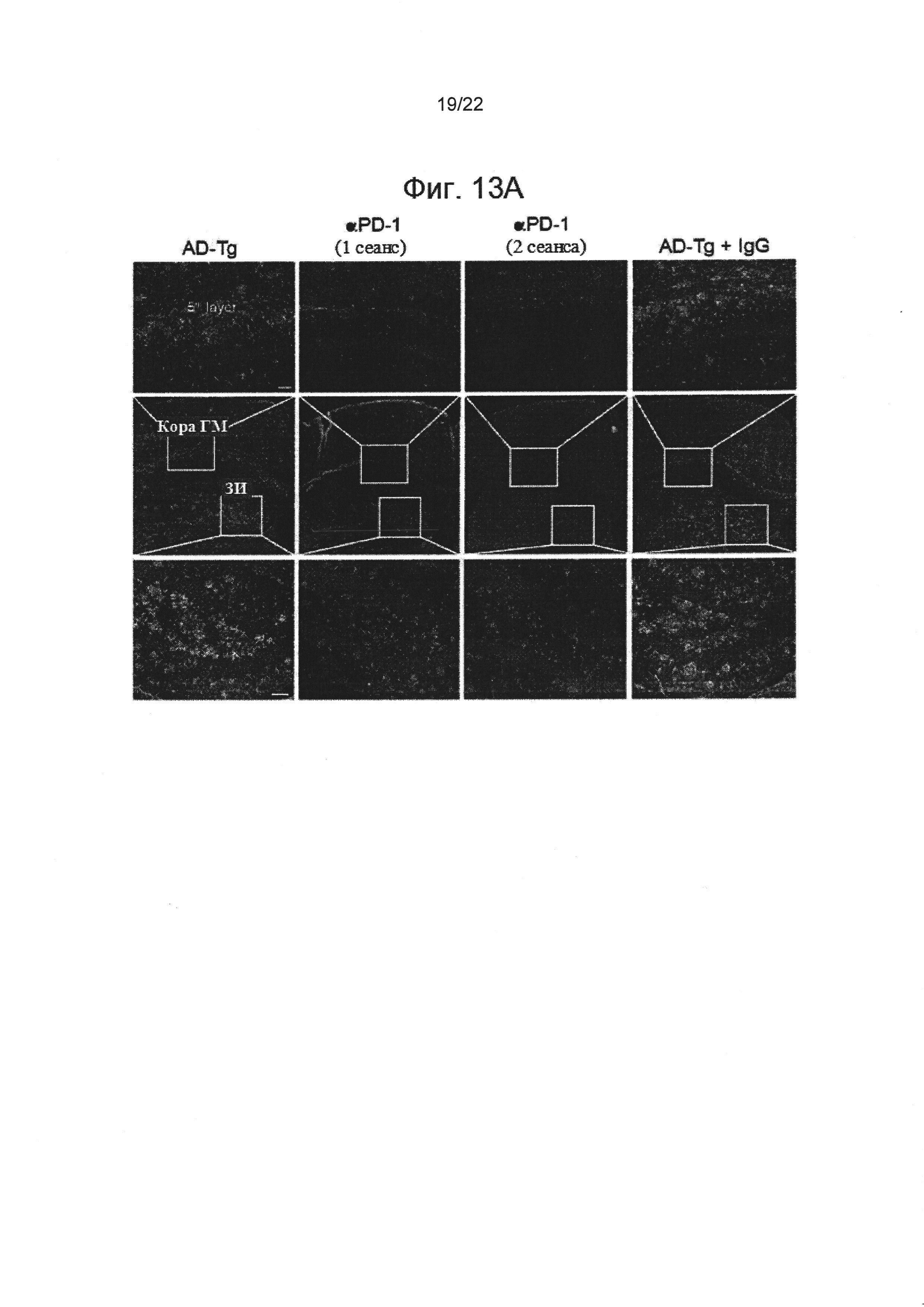
Фигуры 13A-D содержат репрезентативные микроскопические изображения, показывающие, что блокада PD-1 уменьшает патологию БА (А), и количественный анализ (В, С, D), нагрузки Аβ-бляшек и астроглиоза в мозгах AD-Tg мышей, которые лечились в возрасте 10 месяцев с контролем либо анти-PD-1 (1 или 2 сеанса, согласно фиг. 12А-b), либо IgG, и впоследствии были исследованы в возрасте 12 месяцев. Мозги были подвергнуты иммуноокрашиванию на Аβ-бляшки (выделено красным), ГФКБ (отмечен астроглиоз, зеленым) и ядерному окрашиванию Хехст (n=4-5 на группу; масштабная линейка, 50 мкм). Были вычислены средние площадь и количество Аβ-бляшек в зубчатой извилине гиппокампа (ЗИ) и на 5-ом слое коры головного мозга, а также была измерена иммуноактивность ГФКБ в гиппокампе (на 6 мкм срезе мозга; n=5-6 на группу; т-критерий Стьюдента). На всех панелях величина ошибки представляет собой среднее ± стандартная ошибка среднего; *, Р<0,05; **, Р<0,01; ***, Р<0,001.
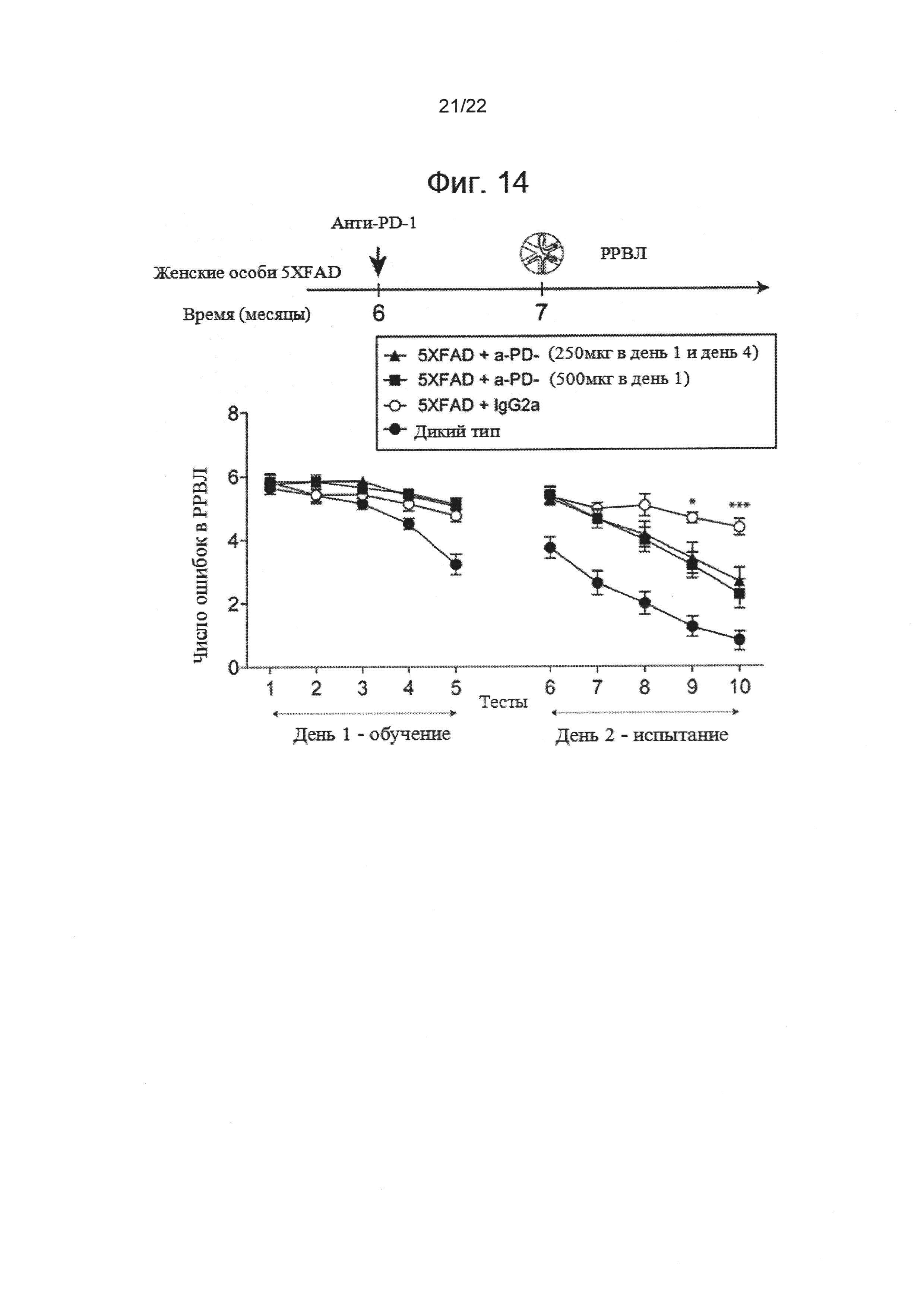
На фиг. 14 показано влияние разных дозировок и частоты ввода антител анти-PD-1 на когнитивный спад у АД-Tg мышей.. Женским особям 5XFAD AD трансгенных мышей (средний возраст группы 6 месяцев) вводили либо анти-PD-1-специфические антитела (lgG2a анти-мышь с контролем PD-1 либо IgG (крыса lgG2a). Мыши, проходившие лечение анти-PD-1, получали либо 1 инъекцию 500 мкг антител в день 1 эксперимента, либо 2 инъекции 250 мкг с 3-дневным интервалом между инъекциями. Мыши дикого типа соответствующего возраста были использованы в качестве дополнительной контрольной группы. Влияние на пространственное обучение и память оценивалось нами с помощью радиального рукавного водного лабиринта (РРВЛ). Схема эксперимента представлена. Черные стрелки указывают временные точки лечения, иллюстрации показывают временные точки когнитивного тестирования. Результаты в РРВЛ у 5XFAD мышей, проходивших лечение анти-PD-1 одной инъекцией (n=7) или двумя инъекциями (n=11), 5XFAD мышей, проходивших лечение lgG2a (n=10) и контрольных особей дикого типа (n=14); двусторонний повторный дисперсионный анализ ANOVA и послеэкспериментальный тест Даннетта). Величина ошибки представляет собой среднее ± стандартная ошибка среднего; *Р<0,05, **Р<0,01, ***Р<0,001, проходившие лечение анти-PD-1 (1 инъекция) в сравнении с контрольными особями, проходившими лечение IgG.
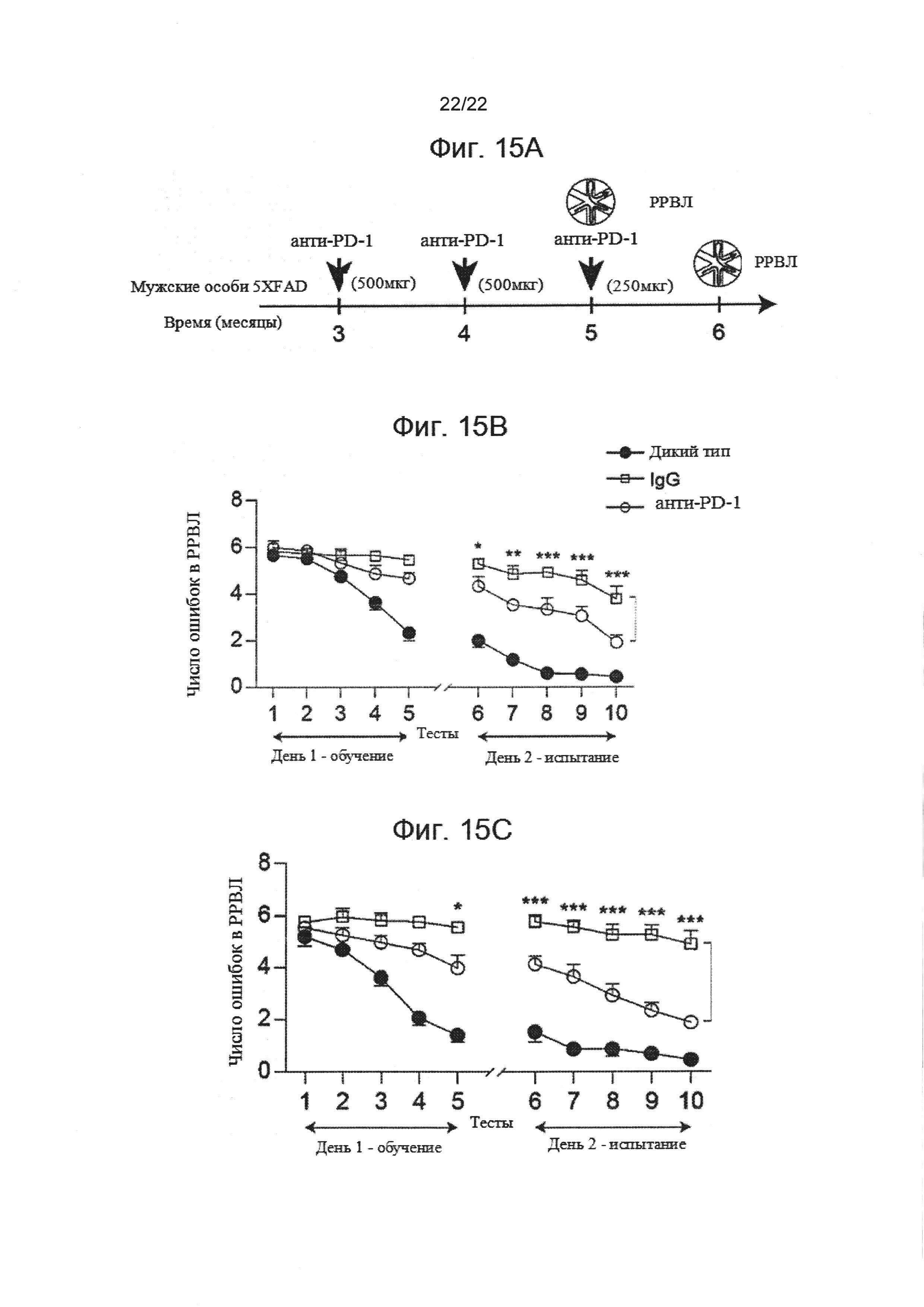
На фиг. 15А-С показано влияние повторного ввода антител анти-PD-1 на когнитивный спад у АД-Tg мышей. Мужских особей 5XFAD AD трансгенных мышей лечили повторными сеансами, один раз в месяц, либо анти-PD-1- специфическими антителами (lgG2a анти-мышь PD-1), либо с контролем IgG (крыса lgG2a). Первая инъекция проводилась в возрасте 3 месяцев, вторая в возрасте 4 месяцев, третья в возрасте 5 месяцев. Дозировка указана в схеме эксперимента (А). Мыши дикого типа соответствующего возраста были использованы в качестве дополнительной контрольной группы. Влияние на пространственное обучение и память оценивалось нами с помощью радиального рукавного водного лабиринта (РРВЛ), в две различные временные точки - 5-месячный возраст (В) и возраст 6 месяцев (С). Схема эксперимента представлена. Черные стрелки указывают временные точки лечения, иллюстрации показывают временные точки когнитивного тестирования. Результаты в РРВЛ у 5XFAD мышей, проходивших лечение анти-PD-1 одной инъекцией (n=7) или двумя инъекциями (n=9), 5XFAD мышей, проходивших лечение lgG2a (n=8) и контрольных особей дикого типа (n=14); двусторонний повторный дисперсионный анализ ANOVA и послеэкспериментальный тест Даннетта). Величина ошибки представляет собой среднее ± стандартная ошибка среднего; *Р<0,05, **Р<0,01, ***Р<0,001, проходившие лечение анти-PD-1 в сравнении с контрольными особями, проходившими лечение IgG..
ПОДРОБНОЕ ОПИСАНИЕ
Иммунные механизмы контрольных точек, к которым относится свойственная клеткам отрицательная регуляция отзывчивости и эффекторных функций активированных Т-клеток при помощи рецепторов-ингибиторов, поддерживают системный иммунный гомеостаз и аутоиммунную терпимость (Joller et al, 2012; Pardoll, 2012). В последние годы блокада этих иммунных контрольных точек, например, способ запрограммированной смерти-1 (PD-1) (Francisco et al, 2010), продемонстрировала заметную противоопухолевую эффективность, подчеркнув потенциал использования возможностей иммунной системы в борьбе с различными злокачественными образованиями. Недавно было показано (WO 2015/136541; Baruch et al., 2016), что ввод антител анти-PD-1 в животную модель болезни Альцгеймера приводит к очистке Aβ, устранению когнитивного спада, и связан с решением нейровоспалительной реакции.
Таким образом, системная иммуносупрессия препятствует способности бороться с патологией БА, и путем снятия ограничений системной иммунной системы патологии БА могут быть смягчены.
Настоящее изобретение предлагает методику лечения болезней, расстройств, патологических состояний или травм центральной нервной системы (ЦНС), кроме аутоиммунных нейровоспалительных заболеваний, рецидивирующе-ремиттирующего рассеянного склероза (РРРС), при этом упомянутая методика предполагает введение пациенту активного агента, который вызывает снижение уровня системной иммуносупрессии снятием ограничения, наложенного на иммунную систему одной или несколькими иммунными контрольными точками, причем упомянутый активный агент вводится в режиме дозирования, состоящем по меньшей мере из двух курсов терапии, каждый из которых включает в себя сеанс лечения, после которого следует перерыв; при этом упомянутая иммунная контрольная точка (или несколько точек) выбирается из группы, состоящей из ICOS-B7RP1, иммуноглобулиноподобного V-доменного супрессора активации Т-клеток (VISTA), В7-CD28-подобной молекулы, CD40L-CD40, CD28-CD80, CD28-CD86, В7Н3, В7Н4, В7Н7, BTLA-HVEM, CD137-CD137L, OX40L, CD27-CD70, стимулятора генов интерферона (STING), ингибиторного мотива домена иммуноглобулина и иммунорецептора Т-клеток на основе тирозина (TIGIT), а также A2aR-аденозина и индоламин-2,3-диоксигеназы (IDO)-L-триптофана.
С другой стороны, настоящее изобретение направлено на активный агент, который вызывает снижение уровня системной иммуносупрессии у пациента снятием ограничения, наложенного на иммунную систему одной или несколькими иммунными контрольными точками, или лекарственный препарат, содержащий активный агент, что может использоваться при лечении болезней, расстройств, патологических состояний или травм ЦНС, кроме аутоиммунных нейровоспалительных заболеваний, рецидивирующе-ремиттирующего рассеянного склероза (РРРС), при этом упомянутая фармацевтическая композиция вводится в режиме дозирования, состоящем по меньшей мере из двух курсов терапии, каждый из которых включает в себя сеанс лечения, после которого следует перерыв; при этом упомянутая иммунная контрольная точка (или несколько точек) выбирается из группы, состоящей из ICOS-B7RP1, VISTA, В7-CD28-подобной молекулы, CD40L-CD40, CD28-CD80, CD28-CD86, В7Н3, В7Н4, В7Н7, BTLA-HVEM, CD137-CD137L, OX40L, CD27-CD70, STING, ингибиторного мотива домена иммуноглобулина и иммунорецептора Т-клеток на основе тирозина (TIGIT), а также A2aR-аденозина и индоламин-2,3-диоксигеназы (IDO)-L-триптофана.
В определенных вариантах осуществления режим дозирования откалиброван таким образом, чтобы уровень системной иммуносупрессии временно снижался.
Термин «лечение», используемый здесь, относится к средствам получения желаемого физиологического эффекта. Эффект может быть терапевтическим с точки зрения частичного или полного излечения болезни и/или симптомом, относимых на счет болезни. Термин относится к ингибированию заболевания, т.е. остановке или замедлению ее развития; или смягчению заболевания, т.е. достижению регрессии заболевания.
Термин «период отсутствия лечения» и термин «перерыв в лечении» здесь взаимозаменяемы и относятся к периоду, во время которого пациенту (особи) не вводится активного агента.
Термин «системное присутствие» регуляторных или эффекторных Т-клеток используется здесь по отношению к присутствию регуляторных или эффекторных Т-клеток (судя по уровню их активности) в циркулирующей иммунной системе, то есть в крови, селезенке и лимфатических узлах. В области иммунологии прекрасно известно, что профиль клеточной популяции в селезенке отражается в профиле клеточной популяции в крови (Zhao et al, 2007).
Настоящее лечение применяется как к пациентам, демонстрирующим повышение системной иммуносупрессии, так и к пациентам, у которых нет такого повышения. Иногда пациент, нуждающийся в лечении в соответствии с настоящим изобретением, характеризуется определенным уровнем периферийной иммуносупрессии, которая отражается повышенной частотностью или числом Treg клеток в циркуляции, и (или) их расширенной функциональной деятельностью, и (или) снижением числа лейкоцитов, продуцирующих IFNγ, и (или) снижением распространения лейкоцитов в ответ на стимуляцию. Повышение частоты или количества Treg клеток может выражаться в общих количествах или в процентах от общего числа CD4 клеток. Например, было установлено в соответствии с настоящим изобретением, что животная модель болезни Альцгеймера имеет более высокую частотность Foxp3 из клеток CD4 по сравнению с мышами дикого типа. Однако, даже если уровень системных Treg клеток не поднимается, их функциональная активность не повышается, уровень лейкоцитов, продуцирующих IFNγ, не снижается, или распространение лейкоцитов в ответ на стимуляцию не уменьшилось у упомянутого пациента, методика настоящего изобретения, снижающая уровень или активность системной иммуносупрессии, является эффективной в лечении болезней, расстройств, патологических состояний или травм ЦНС, кроме аутоиммунного нейровоспалительного заболевания рецидивирующе-ремиттирующего рассеянного склероза (РРРС). Необходимо отметить, что упомянутая системная иммуносупрессия может также включать дополнительные типы иммунных клеток, кроме Treg, такие как супрессорные клетки миелоидного происхождения (MDSC) (Gabrilovich & Nagaraj, 2009).
Уровень системной иммуносупрессии может быть обнаружен различными методами, которые хорошо известны в соответствующей сфере. Например, уровень Treg клеток может быть измерен методом поточной цитометрии мононуклеарных клеток или Т-лимфоцитов периферической крови, подвергнутых иммуноокрашиванию на клеточные поверхностные маркеры или ядерные внутриклеточные маркеры Treg (Chen & Oppenheim, 2011), CD45, TCR-β, или CD4 маркеры лимфоцитов, путем измерения количества антител, конкретно привязанных к клеткам. Функциональная активность Treg клеток может быть измерена различными способами; например, широко используется анализ включения тимидина, в котором подавление распространения Т-клеток CD4+CD25- (обычные Т-клетки), стимулируемое анти-CD3 mAb, измеряется по включению [3Н] тимидина или с помощью CFSE (5-(и 6)- карбоксифлуоресцеин диацетат сукцинимидил эфира, который способен проникать в клетки; деление клеток измеряется как последовательные сокращения интенсивности флуоресценции CFSE наполовину). Количество лейкоцитов, продуцирующих IFNγ, их деятельность или потенциал распространения могут легко быть оценены квалифицированными специалистами с использованием распространенных методов; например, уровень лейкоцитов, продуцирующих IFNγ, может быть измерен анализом поточной цитометрии мононуклеаров периферической крови, после короткой ex-vivo стимуляции, использования GolgiStop и иммуноокрашивания IFNγ внутриклеточным красителем (например, с помощью комплекта для фиксации/пермеабилизации BD Biosciences Cytofix/cytoperm™), путем сбора условной среды этих клеток и подсчета уровня выделенных цитокинов, с помощью ИФА или сравнением соотношения различных цитокинов в условной среде, например IL2/IL10, IL2/IL4, INFγ/TGFβ, и т.д. Уровни MDSC в периферической крови человека легко могут оцениваться квалифицированными специалистами, например, с помощью анализа методом проточной цитометрии частоты DR-/LIN-/CD11b+, DR-/LIN-/CD15+, DR-/LIN-/CD33+ и DR(-/низкий)/CD14+ клеток, согласно описанию (Kotsakis et al, 2012).
В организме человека периферическая/системная иммуносупрессия может считаться повышенной, когда общее количество Treg клеток в циркуляции превышает 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100%, или выше, чем в здоровой контрольной популяции, доля Treg клеток от общего количества CD4+ клеток повышена на 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100%, или выше, чем в здоровой контрольной популяции, или же функциональная активность Treg клеток повышена на 10, 20, 30, 40, 50, 60, 70, 80, 90, или 100%, или выше, чем в здоровой контрольной популяции. Помимо этого, периферическая/системная иммуносупрессия может считаться повышенной, когда уровень лимфоцитов, продуцирующих IFNγ, или их активность меньше, чем в здоровой контрольной популяции, на 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100%; или распространение лейкоцитов в ответ на стимуляцию снижено по сравнению со здоровой контрольной популяцией на 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100%.
Агент может считаться агентом, вызывающим снижение уровня системной иммуносупрессии, когда при введении агента пациенту общее число Treg клеток в циркуляции у данного пациента снижается на 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100% по сравнению с уровнем до введения агента, доля Treg клеток в общем числе CD4+ клеток падает на 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100% по сравнению со здоровой контрольной популяцией, или функциональная активность Treg клеток снижается на 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100% по сравнению с уровнем до введения агента. Кроме того, агент может считаться агентом, вызывающим снижение уровня системной иммуносупрессии, когда при введении агента пациенту общее число лейкоцитов, продуцирующих IFNγ, или их активность увеличивается на 10, 20, 30, 40, 50, 60, 70, 80, 90, 100% или больше; или распространение лейкоцитов в ответ на стимуляцию возрастает по сравнению со здоровой контрольной популяцией на 10, 20, 30, 40, 50, 60, 70, 80, 90, 100% или более.
В определенных вариантах осуществления активный агент снижает уровень системной иммуносупрессии путем снятия ограничений, наложенных на иммунную систему одной или несколькими иммунными контрольными точками, например, путем блокады одной или нескольких иммунных контрольных точек.
В определенных вариантах осуществления снижение уровня системной иммуносупрессии связывается с увеличением системного присутствия или активности лейкоцитов, продуцирующих IFNγ.
В определенных вариантах осущесьвления активный агент приводит к снижению уровня системной иммуносупрессии и, тем самым, к увеличению системного присутствия или активности эффекторных Т-клеток.
Контрольные точки, манипуляция которыми может производиться для снятия системной иммуносупрессии, указываются здесь как пара, состоящая из рецептора иммунной контрольной точки и его родного лиганда, или любой из них. Например PD1, у которого известно два лиганда, здесь именуется «PD1-PDL1» или «PD1-PDL2», в то время как В7Н3, лиганд которого еще не определен, называется просто «В7Н3».
В определенных вариантах осуществления активный агент, который может использоваться согласно настоящему изобретению, может быть выбран из группы, состоящей из (i) антитела, такого как гуманизированное антитело; человеческого антитела; функционального фрагмента антитела; однодоменного антитела, такого как нанотело; рекомбинантного антитела; и одноцепочечного вариабельного фрагмента (ScFv) (ii) имитатора антител, такого как молекула аффибного антитела; аффилина; аффимера; аффитина; альфатела; антикалина; авимера; дарпина; финомера; пептида домена Куниц; и монотела; (iii) аптамера; и (iv) низкомолекулярного ингибитора.
Примеры имитаторов антител представлены в таблице 1 (список не является исчерпывающим):

Аптамеры являются олигонуклеотидными или пептидными молекулами, привязанными к конкретной целевой молекуле.
В определенных вариантах осуществления активный агент, который может использоваться согласно настоящему изобретению, может быть выбран из группы, состоящей из:
(i) антитела, выбранного из группы, состоящей из: (а) анти-ICOS; (b) анти-B7RP1; (с) анти-VISTA; (d) анти-CD40; (е) анти-CD40L; (f) анти-CD80; g) анти-CD86; (h) анти-В7-H3; (i) анти-В7-Н4; (j) В7-Н7; (k) анти-BTLA; (l) анти-HVEM; (m) анти-CD137; (n) анти-CD137L; (о) анти-OX40L; (p) анти-CD-27; (q) анти-CD70; (r) анти-STING; (s) анти-TIGIT; и (t) любой комбинации (а)-(s);
(ii) любой комбинации (а)-(s) в сочетании с адъювантом;
(iii) малой молекулы, выбранной из группы, состоящей из: (а) антагониста рецепторов аденозина А1; (b) рецептора аденозина А2а; и (с) антагониста рецепторов A3;
(iv) любой комбинации (iii) (а-с) и (i) (a-s); а также
(v) любой комбинации (i)-(iv).
В определенных вариантах осуществления, антитела, описанные выше могут вводиться человеку в дозировке, например, около 0,1 мг/кг - 20 мг/кг, 0,1 мг/кг - 15 мг/кг, 0,1 мг/кг - 10 мг/кг, 0,1 мг/кг - 5 мг/кг, 0,2 мг/кг - 20 мг/кг, 0,2 мг/кг - 15 мг/кг, 0,2 мг/кг - 10 мг/кг, 0,2 мг/кг - 6 мг/кг, 0,2 мг/кг - 5 мг/кг, 0,3 мг/кг - 20 мг/кг, 0,3 мг/кг - 15 мг/кг, 0,3 мг/кг - 10 мг/кг, 0,3 мг/кг - 5 мг/кг, 1 мг/кг - 20 мг/кг, 1 мг/кг - 15 мг/кг, 1 мг/кг - 10 мг/кг, 1 мг/кг - 5 мг/кг, 1,5 мг/кг - 20 мг/кг, 1,5 мг/кг - 15 мг/кг, 1,5 мг/кг - 10 мг/кг,1,5 мг/кг - 6 мг/кг или 1,5 мг/кг - 5 мг/кг.
В определенных вариантах осуществления антагонист аденозинового рецептора А1 может представлять собой PSB 36 (1-Бутил-8-(гексагидро-2,5-метанопантенан-3а(1Н)-ил)-3,7-дигидро-3- (3-гидроксипропил)-1Н-пурин-2,6-дион); антагонистом рецептора аденозина А2а может быть SCH58261 (5-Амино-7-(2-фенилэтил)-2-(2-фурил)-пиразоло(4,3-е)-1,2,4-триазоло(1,5-ц)пиримидин), SYN115 (4-гидрокси-N-[4-метокси-7-(4-морфолинил)-2-бензотиазолил]-4-метил-1-пиперидинкарбоксамид), FSPTP (также называемый SCH58261 (5-амино-7-[2-(4-фторсульфонил)фенилэтил]-2-(2-фурил)-пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин), SCH442416 (2-(2-фуранил)-7-[3-(4-метоксифенил)пропил]-7Н-пиразоло [4,3-е][1,2,4]триазоло[1,5-ц]пиримидин-5-амин) или ZM241385 (также называемый тозаденантом (4-гидрокси-N-(4-метокси-7-морфолинобензо[д]тиазол-2-ил)-4-метилпиперидин-1-карбоксамид); и антагонистом рецептора A3 может быть MRS3777 (2-фенокси-6- (циклогексиламино)пурин-гемиоксалат).
Как указывалось выше, активный агент вводится в режиме дозирования, состоящем по крайней мере из двух курсов терапии, каждый курс терапии включает в себя сеанс лечения, за которым следует перерыв без лечения. Режим дозирования может быть определен несколькими способами. Например, уровень иммуносупрессии может быть откалиброван до желаемого уровня для каждого пациента, проходящего лечение (персонализированная медицина), путем мониторинга уровня или активности лейкоцитов, продуцирующих IFN-γ, или скорости распространения лейкоцитов в ответ на стимуляцию индивидуально, и корректировки сеанса лечения, частоты введения и перерыва эмпирическим путем и индивидуально, как определено по результатам мониторинга.
Таким образом, сеанс лечения может включать введение активного агента или лекарственного препарата пациенту, и сеанс лечения продолжается по меньшей мере до тех пор, пока системное присутствие или уровень лейкоцитов, продуцирующих IFN-γ, или скорость распространения лейкоцитов в ответ на стимуляцию поднимется выше контрольного значения, затем введение приостанавливается на время перерыва, и перерыв продолжается до тех пор, пока уровень выше контрольного значения, при этом контрольное значение выбирается из (а) уровня системного присутствия или активности лейкоцитов, продуцирующих IFN-γ, или скорости распространения лейкоцитов в ответ на стимуляцию, измеренной в последнем образце крови, полученном от пациента перед упомянутым введением; или (b) уровня системного присутствия или активности лейкоцитов, продуцирующих IFN-γ, или скорости распространения лейкоцитов в ответ на стимуляцию, характерной для группы лиц, страдающих от заболевания, расстройства, патологического состояния или травмы ЦНС.
Продолжительность сеансов лечения и перерывов может определяться врачами в клинических испытаниях, направленных на определенные группы пациентов, и затем последовательно применяются к этой группе пациентов, без необходимости индивидуального контроля за уровнем иммуносупрессии.
В определенных вариантах осуществления сеанс лечения включает в себя введение активного агента пациенты, и продолжается по меньшей мере до тех пор, пока системное присутствие активного агента не достигнет терапевтического уровня, введение приостанавливается на время перерыва, а перерыв продолжается до тех пор, пока уровень остается выше 95%, 90%, 80%, 70%, 60% или 50% от упомянутого терапевтического уровня. Термин «терапевтический уровень» используется здесь по отношению к общепринятому системному уровню препаратов, используемых для блокировки иммунных контрольных точек в известных методах лечения, таких как терапия рака (см. выше).
В определенных вариантах осуществления сеанс лечения может представлять собой однократное введение или включать в себя несколько введений в течение периода от 1 дня до четырех недель, например 1 день, 2 дня или 3 дня, или от одной до четырех недель. Например, сеанс лечения может состоять из двух введений, оба в течение одной недели, например, если второе введение происходит на 1, 2, 3, 4, 5 или 6-й день после первого. В качестве другого примера, сеанс лечения может включать три введения, все в течение одной недели, например, через 1, 2 или 3 дня после предшествующего введения. В качестве другого примера, сеанс лечения может включать три введения, все в течение двух недель, например, через 1, 2, 3, 4 или 5 дней после предшествующего введения. В качестве другого примера, сеанс лечения может включать четыре введения, все в течение двух недель, например, через 1, 2, 3, 4 или 5 дней после предшествующего введения. В качестве другого примера, сеанс лечения может включать четыре введения, все в течение трех недель, например, через 1, 2, 3, 4, 5 или 6 дней после предшествующего введения. В качестве другого примера, сеанс лечения может включать пять введений, все в течение трех недель, например, через 1, 2, 3, 4 или 5 дней после предшествующего введения.
В определенных вариантах осуществления перерыв, когда лечение не проводится, может составлять от одной недели до шести месяцев, например, от двух до четырех недель, от трех до четырех недель, от двух недель до шести месяцев, от 3 недель до шести месяцев и, в частности, 2, 3 или 4 недели. В определенных вариантах осуществления перерыв, когда лечение не проводится, может составлять от 1 до 2 месяцев, от 1 до 3 месяцев или от 2 до 3 месяцев.
Во время сеанса лечения введение активного агента или лекарственного препарата может представлять собой однократное введение или повторяющееся введение, например, активное вещество или лекарственный препарат можно вводить только один раз, а затем немедленно следует перерыв, или его можно вводить ежедневно или по одному разу каждые два, три, четыре, пять или шесть дней, раз в неделю, раз в две недели, раз в три недели или раз в четыре недели. Эта периодичность применима к любому активному агенту, может быть основана на общепринятых практиках в данной области и может окончательно определяться врачами в клинических испытаниях. Кроме того, периодичность повторных введений во время сеанса лечения может изменяться в зависимости от характера активного агента, при этом, например, малые молекулы могут вводиться ежедневно, а антитела могут вводиться раз в 3 дня. Следует понимать, что при введении агента во время сеанса лечения с относительно малой периодичностью, например, один раз в неделю при сеансе лечения в течение одного месяца, или один раз в месяц при сеансе лечения в течение шести месяцев, за этим сеансом лечения следует перерыв, продолжительность которого больше, чем интервал между повторными введениями во время сеанса лечения (т.е. в этом примере - соответственно более одной недели или одного месяца). Период продолжительностью одна неделя или один месяц между введениями во время сеанса лечения в этом примере не считается перерывом в лечении.
Продолжительность сеанса лечения и перерыва может корректироваться по частоте введения, так что, например, частота введения активного агента один раз каждые 3 дня может привести к продолжительности сеанса лечения 6 или 9 дней, и соответствующему перерыву.
Если сеанс лечения состоит из одного введения, режим дозирования определяется длиной перерыва, чтобы за одним введением следовал перерыв продолжительностью 7, 8, 9, 10, 14, 18, 21, 24 или 28 дней или дольше до следующего сеанса лечения с однократным введением. В частности, режим дозирования состоит из отдельных введений, чередующихся с перерывами без лечения продолжительностью 2, 3 или 4 недели. Кроме того, режим дозирования может состоять из отдельных введений, чередующихся с интервалами без лечения от 2 до 4 недель, от 2 до 3 недель или от 3 до 4 недель.
Если сеанс лечения состоит из нескольких введений, режим дозирования определяется продолжительностью перерыва, так чтобы за несколькими введениями в течение одной недели следовал перерыв 7, 10, 14, 18, 21, 24 или 28 дней или дольше до следующего сеанса лечения с несколькими введениями. В частности, режим дозирования может состоять из нескольких введений в течение одной недели, чередующихся с перерывами без лечения продолжительностью 2, 3 или 4 недели. Кроме того, режим дозирования может состоять из нескольких введений в течение одной недели, чередующихся с перерывами без лечения от 2 до 4 недель, от 2 до 3 недель или от 3 до 4 недель.
В качестве другого примера, режим дозирования может включать несколько введений в течение двух недель, с последующим перерывом в 2 недели, 3 недели или 1, 2, 3 или 4 месяца или дольше, до следующего сеанса лечения с несколькими введениями. В частности, режим дозирования может состоять из нескольких введений в течение двух недель, чередующихся с перерывами без лечения продолжительностью 1, 2, 3 или 4 месяца. Кроме того, режим дозирования может состоять из нескольких введений в течение двух недель с перерывами без лечения от 1 до 2 месяцев, от 1 до 3 месяцев, от 1 до 4 месяцев, от 2 до 3 месяцев, от 2 до 4 месяцев или от 3 до 4 месяцев.
В качестве другого примера, режим дозирования может включать несколько введений в течение трех недель, с последующим перерывом в 1, 2, 3, 4, 5 или 6 месяцев или дольше, до следующего сеанса лечения с несколькими введениями. В частности, режим дозирования может состоять из нескольких введений в течение трех недель, чередующихся с перерывами без лечения продолжительностью 1, 2, 3, 4, 5 или 6 месяцев. Кроме того, режим дозирования может состоять из нескольких введений в течение трех недель с перерывами без лечения от 1 до 2 месяцев, от 1 до 3 месяцев, от 1 до 4 месяцев, от 1 до 5 месяцев, от 1 до 6 месяцев, от 2 до 3 месяцев, от 2 до 4 месяцев, от 2 до 5 месяцев, от 2 до 6 месяцев, от 3 до 4 месяцев, от 3 до 5 месяцев, от 3 до 6 месяцев, от 4 до 5 месяцев, от 4 до 6 месяцев, или от 5 до 6 месяцев.
Разумеется, предусмотрен гибкий режим дозирования, который начинается с определенного режима и меняется на другой. Например, сеансы лечения, каждый из которых включает в себя 2 отдельных введения с интервалом в 3 дня, с перерывом, например, 1 неделя между сеансами лечения, может быть заменен, если это будет сочтено целесообразным, режимом дозирования, включающим сеансы лечения с однократными введениями, разделенными перерывами продолжительностью, например, 2, 3 или 4 недели. В качестве другого примера, сеансы лечения, каждый из которых включает в себя 2 отдельных введения с интервалом в 7 дней, с перерывом, например, 2 недели между сеансами лечения, может быть заменен, если это будет сочтено целесообразным, режимом дозирования, включающим сеансы лечения с однократными введениями, разделенными перерывами продолжительностью, например, 2, 3, 4, 5 или 6 недель. В качестве другого примера, сеансы лечения, каждый из которых включает в себя 3 отдельных введения с интервалом в 3 дня, с перерывом, например, 2 недели между сеансами лечения, может быть заменен, если это будет сочтено целесообразным, режимом дозирования, включающим сеансы лечения с однократными введениями, разделенными перерывами продолжительностью, например, 2, 3, 4, 5 или 6 недель.
В любом случае, режим дозирования, то есть продолжительность сеанса лечения и перерыва, подбирается таким образом, чтобы снижение уровня иммуносупрессии, например, согласно измерениям снижения уровня системного присутствия или активности регуляторных Т-клеток, или увеличения у пациента уровня системного присутствия или активности лейкоцитов, продуцирующих IFN-γ, являлось кратковременным.
Методика, активный агент или лекарственный препарат в соответствии с настоящим изобретением могут быть предназначены для лечения заболеваний, расстройств или патологических состояний ЦНС, к которым относятся нейродегенеративные заболевания, расстройства или патологические состояния, включающие в себя болезнь Альцгеймера, амиотрофический боковой склероз, болезнь Паркинсона, болезнь Хантингтона, первичный прогрессирующий рассеянный склероз; вторичный прогрессирующий рассеянный склероз, кортикобазальную дегенерацию, синдром Ретта, дегенерацию сетчатки, выбранную из группы, куда входит возрастная макулярная дегенерация и пигментная дегенерация сетчатки; переднюю ишемическую оптическую невропатию; глаукому; увеит; депрессию; связанный с травмой стресс или посттравматическое стрессовое расстройство, лобно-временную деменцию, болезнь диффузных телец Леви, умеренные когнитивные нарушения, атрофию задней коры головного мозга, первичную прогрессирующую афазию или прогрессирующий надъядерный паралич. В определенных вариантах осуществления патологическим состоянием ЦНС является возрастная деменция.
В определенных вариантах осуществления к патологическим состояниям ЦНС относятся болезнь Альцгеймера, боковой амиотрофический склероз, болезнь Паркинсона, болезнь Хантингтона.
В определенных вариантах осуществления, каждый из вышеописанных активных агентов, блокирующий одну из иммунных контрольных точек, в том числе ICOS-B7RP1, lg V-доменный супрессор активации Т-клеток (VISTA), В7-CD28-подобная молекула, CD40L-CD40, CD28-CD80, CD28-CD86, В7Н3, В7Н4, В7Н7, BTLA-HVEM, CD137-CD137L, OX40L, CD27-CD70, STING, TIGIT и A2aR-аденозин, а также индоламин-2,3-диоксигеназа (IDO)-L-триптофан, такой как антитело, против одного из двух компонентов иммунной контрольной точки, предназначен для лечения нейродегенеративных заболеваний, расстройств или патологических состояний, включающих в себя болезнь Альцгеймера, амиотрофический боковой склероз, болезнь Паркинсона, болезнь Хантингтона, первичный прогрессирующий рассеянный склероз; вторичный прогрессирующий рассеянный склероз, кортикобазальную дегенерацию, синдром Ретта, дегенерацию сетчатки, выбранную из группы, куда входит возрастная макулярная дегенерация и пигментная дегенерация сетчатки; переднюю ишемическую оптическую невропатию; глаукому; увеит; депрессию; связанный с травмой стресс или посттравматическое стрессовое расстройство, лобно-временную деменцию, болезнь диффузных телец Леви, умеренные когнитивные нарушения, атрофию задней коры головного мозга, первичную прогрессирующую афазию или прогрессирующий надъядерный паралич. Лечение любого из этих заболеваний с использованием любого из этих активных агентов может осуществляться согласно режиму, описанному выше.
Методика, активный агент и лекарственный препарат в соответствии с настоящим изобретением могут дополнительно использоваться при лечении повреждений ЦНС, в том числе травмы спинного мозга, закрытой травмы головы, тупой травмы, проникающей травмы, геморрагического инсульта, ишемического инсульта, церебральной ишемии, травмы зрительного нерва, инфаркта миокарда, отравления органофосфатом и травм, вызванных удалением опухоли.
В определенных вариантах осуществления, каждый из описанных выше активных агентов блокирует одну из иммунных контрольных точек, в том числе ICOS-B7RP1, lg V-доменный супрессор активации Т-клеток (VISTA), В7-CD28-подобная молекула, CD40L-CD40, CD28-CD80, CD28-CD86, В7Н3, В7Н4, В7Н7, BTLA-HVEM, CD137-CD137L, OX40L, CD27-CD70, STING, TIGIT и A2aR-аденозин, а также индоламин-2,3-диоксигеназа (IDO)-L-триптофан, такой как антитело против одного из двух компонентов иммунной контрольной точки, предназначен для лечения травм ЦНС, в том числе травмы спинного мозга, закрытой травмы головы, тупой травмы, проникающей травмы, геморрагического инсульта, ишемического инсульта, церебральной ишемии, повреждения зрительного нерва, инфаркта миокарда, отравления органофосфатом и травм, вызванных удалением опухоли. Лечение любой из этих травм с использованием любого из этих активных агентов может осуществляться согласно режиму, описанному выше.
Как указывалось выше, изобретатели пришли к выводу, что настоящее изобретение улучшает когнитивные функции у мышей с эмуляцией болезни Альцгеймера. Таким образом, данная методика, активный агент и лекарственный препарат могут использоваться для улучшения моторной и/или когнитивной функции ЦНС, например, для уменьшения возрастной потери когнитивной функции, которая может возникать у людей, не страдающих диагностированными заболеваниями, а также у людей, страдающих нейродегенеративными заболеваниями. Кроме того, данная методика, активный агент и лекарственный препарат могут быть использованы для уменьшения потери когнитивной функции в результате острого стресса или травматического происшествия. К указанным выше когнитивным функциям может относиться обучение, память или то и другое.
Следует подчеркнуть, что улучшение когнитивных функций у мышей с эмуляцией болезни Альцгеймера (5XFAD AD-Tg мыши) наблюдалось и описывалось изобретателями в различных стадиях проявления болезни; как на ранних, так и на поздних стадиях развития болезни патологии можно уменьшить путем лечения. 5XFAD AD-Tg мыши начинают демонстрировать патологию церебральных бляшек в возрасте 2,5 месяцев, а когнитивную недостаточность в возрасте 5 месяцев (Oakley et al, 2006). Следует отметить, что, в то время как в приведенном ниже Примере 2 изобретатели описывают терапевтический эффект у 5XFAD мышей в возрасте 6 месяцев, в Примере 5 они характеризуют терапевтический эффект у 5XFAD мышей в возрасте 11 и 12 месяцев - чрезвычайно прогрессивный этап осаждения бета-амилоидных бляшек и когнитивной недостаточности в данной модели. Поэтому предполагается, что предложенное изобретение будет относиться к пациентам на разных этапах прогрессирования заболевания, таких как Этап 1 - легкий/ранний (длится 2-4 года); Этап 2 - умеренный/средний (длится 2-10 лет); и Этап 3 - тяжелый/поздний (длится 1-3 года и дольше).
Используемый здесь термин «функция ЦНС» относится, среди прочего, к получению и обработке сенсорной информации, мышлению, обучению, запоминанию, восприятию, производству и пониманию языка, управлению двигательной функцией, слуховым и визуальным ответом, поддержанию баланса и равновесия, координации движения, передаче сенсорной информации и контролю таких вегетативных функций, как дыхание, сердечный ритм и пищеварение.
Используемые здесь термины «познание», «когнитивная функция» и «когнитивная деятельность» взаимозаменяемы и обозначают любой психический процесс или состояние, к которым относятся, помимо всего прочего, обучение, память, создание изображений, мышление, понимание, рассуждение, пространственная ориентация, речь и язык, приобретение языковых знаний и потенциал произвольного внимания. Познание формируется в нескольких областях головного мозга, таких как гиппокамп, кора и другие структуры головного мозга. Однако предполагается, что долговременные воспоминания хранятся, по меньшей мере, частично, в коре, а также известно, что сенсорная информация приобретается, объединяется и извлекается определенной кортикальной структурой, вкусовой корой, которая находится внутри островковой коры.
У людей когнитивную функцию можно измерить при помощи любого известного способа, например, без ограничения, шкалы общего клинического впечатления (шкалы CIBIC-плюс); мини-экзамена по психическому состоянию (MMSE); нейропсихиатрического опросника (NPI); клинической рейтинговой шкалы деменции (CDR); Кембриджской нейропсихологической автоматизированной батареи тестов (CANTAB) или гериатрической шкалы клинической оценки Сандоз (SCAG). Когнитивная функция также может быть измерена косвенно с использованием методов визуализации, таких как позитронная эмиссионная томография (PET), функциональная магнитно-резонансная томография (fMRI), однофотонная эмиссионная компьютерная томография (SPECT) или любая другая техника визуализации, позволяющая измерить мозговую деятельность.
Улучшение одного или нескольких процессов, влияющих на познание у пациента, будет означать улучшение когнитивной функции у упомянутого пациента, поэтому в определенных вариантах осуществления совершенствование познания включает в себя улучшение обучения, пластичности и/или долговременной памяти. Термины «совершенствование» и «повышение» могут использоваться как взаимозаменяемые.
Термин «обучение» касается приобретения новых или изменения и закрепления имеющихся знаний, образцов поведения, навыков, ценностей или предпочтений.
Термин «пластика» относится к синаптической пластичности, пластичности мозга или нейропластичности, связанным со способностью мозга изменяться посредством обучения и изменять уже приобретенную память. Один из поддающихся измерению параметров, отражающих пластичность, это отмирание памяти.
Термин «память» относится к процессу, при котором информация кодируется, хранится и извлекается. Память имеет три различных категории: сенсорная память, кратковременная память и долговременная память.
Термин «долговременная память» означает способность хранить информацию в течение длительного или неограниченного периода времени. Долговременная память состоит из двух основных отделов: эксплицитная память (декларативная память) и имплицитная память (скрытая память). Долговременная память достигается путем консолидации памяти, которая представляет собой категорию процессов, стабилизирующих след в памяти после первоначального приобретения. Консолидация делится на два конкретных процесса: синаптическая консолидация, которая происходит в течение первых нескольких часов после обучения, и системная консолидация, при которой зависимые от гиппокампа воспоминания становятся независимыми от гиппокампа в течение периода от нескольких недель до нескольких лет.
Вышеизложенные варианты осуществления, описывающие различные особенности лекарственного препарата согласно настоящему изобретению, также актуальны для методики по изобретению, поскольку в этой методике используется тот же самый лекарственный препарат.
В еще одном аспекте, настоящее изобретение предлагает методику снижения нагрузки Аβ-бляшек у пациента с диагнозом болезни Альцгеймера, включающую в себя введение упомянутому пациенту активного агента или лекарственного препарата, как указано выше, что приводит к снижению уровня системной иммуносупрессии путем снятия ограничения, налагаемого на иммунную систему одной или несколькими иммунными контрольными точками.
В еще одном аспекте, настоящее изобретение предлагает методику снижения гиппокампального глиоза у пациента с диагнозом болезни Альцгеймера, включающую в себя введение упомянутому пациенту активного агента или лекарственного препарата, как указано выше, что приводит к снижению уровня системной иммуносупрессии путем снятия ограничения, налагаемого на иммунную систему одной или несколькими иммунными контрольными точками.
Лекарственные препараты для использования в соответствии с настоящим изобретением могут быть приготовлены обычным способом с использованием одного или нескольких физиологически приемлемых носителей или вспомогательных средств. Носитель (носители) должен быть «приемлемым» в смысле совместимости с другими ингредиентами препарата и не должен быть вредным для реципиента.
Следующие примеры носителей, способов введения, лекарственных форм и т.д. перечислены как известные возможности, из которых можно выбрать носители, способы введения, лекарственные формы и т.д. для использования с настоящим изобретением. Специалистам в данной области, тем не менее, должно быть ясно, что каждую выбранную лекарственную форму и способ введения необходимо сначала испытать, чтобы определить, достигаются ли желаемые результаты.
К способам введения относятся, помимо прочего, парентеральный (например внутривенный, интраперитонеальный (внутрибрюшинный), внутримышечный, подкожный), слизистый (например, пероральный, интраназальный, трансбуккальный, вагинальный, ректальный, внутриглазной), подоболочечный, местный и внутрикожный пути. Введение может быть системным или местным.
Термин «носитель» обозначает разбавитель, адъювант, наполнитель или проводник, с помощью которого осуществляется введение активного агента. Носители в лекарственном препарате могут содержать связующее, такое как микрокристаллическая целлюлоза, поливинилпирролидон (поливидон или повидон), трагакантовая камедь, желатин, крахмал, лактоза или моногидрат лактозы; дезинтегрирующий агент, такой как альгиновая кислота, кукурузный крахмал и т.п.; смазывающее вещество или поверхностно-активное вещество, такое как стеарат магния или лаурилсульфат натрия; а также глидант, такой как коллоидный диоксид кремния.
Для перорального введения лекарственный препарат может быть в жидкой форме, например растворах, сиропах или суспензиях, или может быть представлен в виде лекарственного средства для разведения водой или другой подходящей основой перед использованием. Такие жидкие препараты могут быть получены обычными способами с фармацевтически приемлемыми добавками, такими как суспендирующие агенты (например, сироп сорбита, производные целлюлозы или гидрированные пищевые жиры); эмульгаторы (например, лецитин или аравийская камедь); неводные носители (например, миндальное масло, масляные сложные эфиры или фракционированные растительные масла); а также консерванты (например, метил, пропил-п-гидроксибензоаты или сорбиновая кислота). Лекарственные препараты могут принимать форму, например, таблеток или капсул, полученных обычными способами, с фармацевтически приемлемыми вспомогательными средствами, такими как связывающие агенты (например, предварительно желатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или гидрофосфат кальция); смазывающие вещества (например, стеарат магния, тальк или диоксид кремния); разрыхлители (например, картофельный крахмал или натрия гликолят крахмала); или смачивающие агенты (например, лаурилсульфат натрия). Таблетки могут быть покрыты способами, хорошо известными в уровне техники.
Формулу препаратов для перорального введения можно соответствующим образом подобрать для получения контролируемого высвобождения активного компонента.
Для трансбуккального (щечного) введения препарат может принимать форму таблетки или леденца, с обычной формулой состава.
Препараты могут быть разработаны для парентерального введения путем инъекции, например, путем болюсной инъекции или непрерывной инфузии. Составы для инъекций могут быть представлены в стандартной дозированной форме, например, в ампулах или в контейнерах с множественными дозами, с добавлением консерванта. Препараты могут принимать такие формы, как суспензии, растворы или эмульсии в масляных или водных основах, и могут содержать формообразующие агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Кроме этого, активный ингредиент может быть в виде порошка для соединения с подходящим носителем, например, стерильной апирогенной водой, перед использованием.
Препараты также могут производиться в форме ректальных составов, таких как суппозитории или удерживающие клизмы, например, с содержанием обычных основ для суппозиториев, таких как масло какао или других глицеридов.
Для введения путем ингаляции препараты для использования в соответствии с настоящим изобретением доставляются в удобной форме в виде аэрозоля в упаковках под давлением или распылителя с использованием подходящего пропеллента, например дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа. В случае аэрозоля под давлением дозировочная единица может определяться путем установки клапана для введения отмеренного количества. Капсулы и картриджи, например, желатин для использования в ингаляторе или инсуффляторе, могут быть составлены с использованием порошковой смеси препарата и подходящей порошкообразной основы, такой как лактоза или крахмал.
Определение доз активного ингредиента, используемого при лечении людей, основано на общепринятых практиках в данной области и будет окончательно определено врачами в клинических испытаниях. Ожидаемая приблизительная эквивалентная доза для введения человеку может быть рассчитана на основании экспериментальных данных in vivo, приведенных ниже, с использованием известных формул (например, Reagan-Show et al. (2007) Dose translation from animal to human studies revisited. The FASEB Journal 22: 659-661). Согласно этой парадигме взрослая эквивалентная человеческая доза (мг/кг массы тела) равна дозе, рассчитанной для мыши (мг/кг массы тела), умноженной на 0,081.
Далее изобретение будет проиллюстрировано следующими примерами, не налагающими никаких ограничений.
ПРИМЕРЫ
Материалы и методы
Животные. 5XFAD трансгенные мыши (Tg6799) со сверхэкспрессией семейных мутантных форм БА человеческого АРР (шведская мутация, K670N/M671L; флоридская мутация, I716V; и лондонская мутация, V717I), PS1 (M146L/L286V) трансгены при транскрипционном контроле специфического для нейрона катализатора для мышей Thy-1 (Oakley et al, 2006) и двойные трансгенные мыши с БА B6.Cg-Tg (APPswe, PSEN1dE9) 85Dbo/J (Borchelt et al, 1997) были приобретены в Лаборатории Джексона. Генотипирование проведено методом ПЦР-анализа хвостовой ДНК, как описано выше (Oakley et al, 2006). Гетерозиготные мутанты мышей cx3cr1GFP/+ (Jung et al, 2000) (B6.129P-cx3cr1tm1Litt/J, где одна из CX3CR1 аллелей хемокинового рецептора заменена геном GFP) были использованы в качестве доноров костномозговых химер. Мыши Foxp3.LuciDTR (Suffner et al, 2010) были выведены из 5XFAD мышей для активации условного истощения Foxp3+ Treg клеток. Животные были выведены и содержались Центром по разведению животных Института Вейцмана. Все эксперименты, описанные в настоящем документе, проведены с соблюдением правил, сформулированных Комитетом по уходу за животными и их использованию в учреждениях (IACUC) Института Вейцмана.
Очистка РНК, синтез cDNA и количественный анализ ПЦР в реальном времени. Общая РНК зубчатой извилины гиппокампа (ЗИ) была экстрагирована TRI Reagent (Молекулярный исследовательский центр) и очищена от лизатов с использованием комплекта RNeasy (Qiagen). Общая РНК сосудистого сплетения получена с помощью комплекта MicroPrep РНК (Zymo Research). мРНК (1 мкг) преобразована в кДНК, с использованием высокопроизводительного комплекта для обратной транскриптазы кДНК (Applied Biosystems). Экспрессия специфических мРНК анализировалась с использованием флуоресцентной количественной ПЦР в реальном времени (RT-qPCR). Реакции RT-qPCR проводили с использованием смеси Fast-SYBR PCM Master Mix (Applied Biosystems). Реакции количественной оценки проводили в трех повторах для каждого образца с использованием метода стандартной кривой. В качестве контрольного (домашнего) гена была выбрана пептидил-пролил-изомераза А (ppia). Циклы усиления составляли 95°С в течение 5 с, 60°С в течение 20 с и 72°С в течение 15 с. В конце анализа была построена кривая плавления для оценки специфичности реакции. Для анализа генов ifn-γ и ppia кДНК была предварительно усилена за 14 циклов ПЦР с неслучайными праймерами ПЦР, тем самым была увеличена чувствительность последующего анализа ПЦР в реальном времени, согласно протоколу производителя (PreAmp Master Mix Kit; Applied Biosystems). Экспрессию мРНК определяли с помощью TaqMan RT-qPCR, согласно инструкциям производителя (Applied Biosystems). Все реакции RT-qPCR были проведены и проанализированы с помощью программного обеспечения StepOne V2.2.2 (Applied Biosystems). Были использованы следующие зонды TaqMan Assays-on-Demand™: Mm02342430_g1 (ppia) и Mm01168134_m1 (ifn-γ).
Для всех других исследованных генов использовались следующие праймеры:
ppia прямой 5'-AGCATACAGGTCCTGGCATCTTGT-3' (Идентиф. номер: 33) и обратный 5'-CAAAGACCACATGCTTGCCATCCA-3' (Идентиф. номер: 34);
icam1 прямой 5'-AGATCACATTCACGGTGCTGGCTA-3' (Идентиф. номер: 35) и обратный 5'-AGCTTTGGGATGGTAGCTGGAAGA-3' (Идентиф. номер: 36);
vcam1 прямой 5'-TGTGAAGGGATTAACGAGGCTGGA-3' (Идентиф. номер: 37) и обратный 5'-CCATGTTTCGGGCACATTTCCACA-3' (Идентиф. номер: 38);
cxcl10 прямой 5'-AACTGCATCCATATCGATGAC-3' (Идентиф. номер: 39) и обратный 5'-GTGGCAATGATCTCAACAC-3' (Идентиф. номер: 40);
ccl2 прямой 5'-CATCCACGTGTTGGCTCA-3' (Идентиф. номер: 41) и обратный 5'-GATCATCTTGCTGGTGAATGAGT-3' (Идентиф. номер: 42);
tnf-γ прямой 5'-GCCTCTTCTCATTCCTGCTT-3' (Идентиф. номер: 43) обратный CTCCTCCACTTGGTGGTTTG-3' (Идентиф. номер: 44);
il-1β прямой 5'-CCAAAAGATGAAGGGCTGCTT-3' (Идентиф. номер: 45) и обратный 5'-TGCTGCTGCGAGATTTGAAG-3' (Идентиф. номер: 46);
il-12р40 прямой 5'-GAAGTTCAACATCAAGAGCA-3' (Идентиф. номер: 47) и обратный 5'-CATAGTCCCTTTGGTCCAG-3' (Идентиф. номер: 48);
il-10 прямой 5'-TGAATTCCCTGGGTGAGAAGCTGA-3' (Идентиф. номер: 49) и обратный 5'-TGGCCTTGTAGACACCTTGGTCTT-3' (Идентиф. номер: 50);
tgfβ2 прямой 5'-AATTGCTGCCTTCGCCCTCTTTAC-3' (Идентиф. номер: 51) и обратный 5'-TGTACAGGCTGAGGACTTTGGTGT-3' (Идентиф. номер: 52);
igf-1 прямой 5'-CCGGACCAGAGACCCTTTG (Идентиф. номер: 53) и обратный 5'-CCTGTGGGCTTGTTGAAGTAAAA-3' (Идентиф. номер: 54);
bdnf прямой 5'-GATGCTCAGCAGTCAAGTGCCTTT-3' (Идентиф. номер: 55) и обратный 5'-GACATGTTTGCGGCATCCAGGTAA-3' (Идентиф. номер: 56);
Иммуногистохимия. Обработка тканей и иммуногистохимия были выполнены на парафиновом срезе мозга мыши (толщиной 6 мкм) и человека (толщиной 10 мкм). Для окрашивания человеческого ICAM-1 использовали первичное антитело против ICAM мышей (1:20 Abcam, ab2213). Слайды инкубировали в течение 10 мин в 3% H2O2, и использовали вторичное биотин-конъюгированное антимышиное антитело с последующей амплификацией биотином/авидином с помощью набора Vectastain ABC (Vector Laboratories). Затем применяли 3,3'-диаминобензидин (субстрат ДАБ) (набор Zytomed); слайды дегидратировались и устанавливались с помощью крепежного раствора на основе ксилола. Для окрашивания тканей мыши были увлажнены транскардиально при помощи PBS до вырезания ткани и фиксации. Ткани СС были отделены под препаровальной лупой (Stemi DV4; Zeiss) от боковых, третьего и четвертого желудочка головного мозга. При окрашивании цельного соединения СС ткани фиксировали 2,5% параформальдегидом (ПФА) в течение 1 часа при 4°С, а затем переносили в PBS, содержащий 0,05% азида натрия. Перед окрашиванием рассеченные ткани промывали PBS и блокировали (20% лошадиной сыворотки, 0,3% Triton Х-100 и PBS) в течение 1 часа при комнатной температуре. В течение 1 часа при комнатной температуре проводили окрашивание с полным первичным антителом (в PBS, содержащим 2% лошадиной сыворотки и 0,3% Triton Х-100), или с вторичными антителами. После каждого шага следовало три промывания в PBS. Ткани были нанесены на слайды, смонтированы с помощью Immu-mount (9990402, Thermo Scientific) и запечатаны с помощью обложки. Для окрашивания срезов мозга были применены два различных протокола подготовки тканей (внедренный парафин или микротомные свободные срезы), как описано ранее (Baruch et al, 2013; Kunis et al, 2013). Были использованы следующие первичные антитела: мышь анти-Аβ (1:300, Covance, #SIG-39320); кролик анти-GFP (1:100, MBL, #598); крыса анти-CD68 (1:300, eBioscience, #14-0681); крыса анти-ICAM-1 (1:200, Abcam, #АВ2213); коза анти-GFP (1:100, Abcam, #ab6658); кролик анти-IBA-1 (1:300, Wako, #019-19741); коза анти-IL-10 (1:20, R&D systems, #AF519); крыса анти-Foxp3 (1:20, eBioscience, #13-5773-80); кролик анти-CD3 (1:500, Dako, #IS503); мышь анти-ZO-1, мышь анти-Е-Cahedrin и кролик анти-Клаудин-1 (все 1:100, Invitrogen, #33-9100, #33-4000, #51-9000); кролик анти-ГФКБ (1:200, Dako, #Z0334). Вторичные антитела включали в себя: Cy2/Cy3/Cy5-конъюгированные антитела осла против мыши/козла/кролика/крысы (1:200, все от Jackson Immunoresearch). Слайды были подвергнуты ядерному окрашиванию Хехст (1:4000; Invitrogen Probes) в течение 1 мин. В процедурах иммуноокрашивания регулярно применяли два отрицательных контроля, проводилось окрашивание антителом контрольного изотипа с последующим вторичным антителом, или окрашивание только вторичным антителом. Для внутриклеточного окрашивания Foxp3 извлечение антигена из парафиновых слайдов выполняли с использованием набора Retreivagen Kit (№550524, №550527, BD Pharmingen™). Микроскопический анализ проводили с использованием флуоресцентного микроскопа (Е800, Nikon) или лазерного сканирующего конфокального микроскопа (Carl Zeiss, Inc.). Флуоресцентный микроскоп был оснащен цифровой камерой (DXM 1200F, Nikon) и объективом 20× NA 0,50 или 40× NA 0,75 (Plan Fluor, Nikon). Конфокальный микроскоп был оснащен устройством лазерного сканирования LSM 510 (три лазера: Ar 488, HeNe 543 и HeNe 633). Записи были сделаны на вторично фиксированных тканях с использованием программного обеспечения для захвата (NIS-Elements, F3 [Nikon] или LSM [Carl Zeiss, Inc.]). Для количественной оценки интенсивности окрашивания, общее окрашивание клеток и фона измеряли с использованием программного обеспечения ImageJ (NIH), а интенсивность специфического окрашивания рассчитывали, как описано ранее (Burgess et al, 2010). Изображения были обрезаны, объединены и оптимизированы с помощью Photoshop CS6 13.0 (Adobe), и организованы с помощью Illustrator CS5 15.1 (Adobe).
Парафиновые срезы СС человека. Посмертные срезы головного мозга молодых и пожилых пациентов, скончавшихся не от заболеваний ЦНС, а также пациентов с БА были получены из Оксфордского мозгового банка (ранее известного как Оксфордская коллекция головного мозга имени Томаса Уиллиса (TWOBC)) с соответствующего согласия и одобрения Комитета по этике (TW220). Эксперименты с применением этих срезов были одобрены Комитетом по биоэтике Института Вейцмана.
Проточная цитометрия, подготовка и анализ проб. Мышей транскардиально увлажнили при помощи PBS, и ткани были обработаны, как описано выше (Baruch et al, 2013). Мозги были рассечены, различные участки мозга были удалены под препаровальной лупой (Stemi DV4; Zeiss) в PBS, ткани были отделены с помощью диссоциатора gentleMACS™ (Miltenyi Biotec). Ткани сосудистого сплетения выделялись из боковых, третьего и четвертого желудочков головного мозга, инкубировались при 37°С в течение 45 минут в PBS (с Ca2+/Mg2+), содержащем 400 ед/мл коллагеназы типа IV (Worthington Biochemical Corporation), а затем вручную гомогенизировались путем пипетирования. Селезенки раздавливались плунжером шприца и обрабатывались лизинговым буфером ACK (аммоний-хлорид-калий) для удаления эритроцитов. Во всех случаях пробы окрашивались согласно протоколам производителей. Все образцы фильтровали через нейлоновую сетку размером 70 мкм и блокировали при помощи анти-Fc CD16/32 (1:100; BD Biosciences). Для внутриклеточного окрашивания IFN-γ клетки инкубировали с параметоксиамфетамином (10 нг/мл, Sigma-Aldrich) и иономицином (250 нг/мл, Sigma-Aldrich) в течение 6 ч, на последние 4 часа добавлялся Брефельдин-А (10 мкг/мл, Sigma-Aldrich). Внутриклеточную маркировку цитокинов проводили с помощью набора BD Cytofix/Cytoperm™ Plus для фиксации/пермеализации (кат. №555028). Для окрашивания Treg клеток использовался набор для окрашивания буфера eBioscience FoxP3 (кат. №00-5523-00). Следующие моноклональные антитела, маркированные флуорохромом, были приобретены у BD Pharmingen, BioLegend, R&D Systems или eBiosciences, и использованы в соответствии с протоколами производителей: РЕ или Alexa Fluor 450-конъюгированное анти-CD4; РЕ-конъюгированное анти-CD25; PerCP-Cy5.5-конъюгированное анти-CD45; FITC-конъюгированное анти-TCRβ; АРС-конъюгированное анти-IFN-γ; АРС-конъюгированное анти-FoxP3; ярко-фиолетовое конъюгированное анти-CD45. Клетки анализировались на цитометре LSRII (BD Biosciences) с использованием программного обеспечения FlowJo. В каждом эксперименте использовались соответствующие отрицательные контрольные группы, положительные контрольные образцы и одиночные окрашенные образцы по каждой ткани для идентификации популяций, представляющих интерес, и для исключения других популяций.
Подготовка костномозговых химер. Костномозговые химеры были подготовлены как описано выше (Shechter et al, 2009; Shechter et al, 2013). Вкратце, мыши-реципиенты с учетом пола были подвергнуты летальному облучению всего тела (950 рад) при защите головы (Shechter et al, 2009). Мышам затем ввели внутривенно 5×106 костномозговых клеток от доноров CX3CR1GFP/+. Мышей оставляли на 8-10 недель после трансплантации костномозговых клеток, чтобы обеспечить восстановление гематопоэтической линии до их использования в экспериментах. Процент химеризма определяли с помощью FACS-анализа образцов крови согласно процентной доле клеток, экспрессирующих GFP, из числа циркулирующих моноцитов (CD11b+). В этой модели с защитой головного мозга было достигнуто в среднем 60% химеризма, и CNS-инфильтрирующие GFP+ миелоидные клетки были подтверждены как CD45high/CD11bhigh, представляющие собой макрофаги, полученные из моноцитов, а не микроглии (Shechter et al, 2013).
Водный лабиринт Морриса. Мышам проводилось по три испытания в день в течение 4 дней подряд, чтобы они научились находить скрытую платформу, расположенную на 1,5 см ниже поверхности воды в бассейне (1,1 м в диаметре). Температура воды поддерживалась на уровне 21-22°С. Вода была сделана непрозрачной при помощи молочного порошка. В помещении для испытаний у мышей для помощи в поиске погруженной платформы были только отдаленная визуальная форма и объекты-подсказки. Задержка спасения, т.е. время, необходимое для поиска платформы и подъема на нее, регистрировалась до 60 с. Каждой мыши разрешалось остаться на платформе в течение 15 с, затем ее забирали из лабиринта и возвращали в клетку. Если мышь не находила платформы в течение 60 с, ее вручную сажали на платформу и через 15 с возвращали в клетку. Интервал между испытаниями для каждой мыши составлял 10 мин. На 5-й день платформа убиралась, и мышам проводилось одно испытание продолжительностью 60 с без возможности найти выход. В дни 6 и 7 платформа помещалась в секторе напротив первоначального сектора обучения, и мышь переобучали по три сессии каждый день. Данные записывались с помощью автоматизированной системы слежения EthoVision V7.1 (Noldus Information Technology). Статистический анализ проводился с помощью дисперсионного анализа (ANOVA) и ретроспективного анализа Бонферрони. Все испытания в ВЛМ проводились с 10 утра до 5 вечера во время фазы выключенного освещения.
Радиальный рукавный водный лабиринт. Для тестирования пространственного обучения и памяти, как было подробно описано ранее, использовался радиальный рукавный водный лабиринт (РРВЛ) (Alamed et al, 2006). Вкратце, шесть вставок из нержавеющей стали помещались в резервуар, образуя шесть плавающих рукавов, выходящих из открытой центральной зоны. Платформа для выхода была расположена в конце одного из рукавов (целевой рукав), на 1,5 см ниже поверхности воды в бассейне диаметром 1,1 м. Температура воды поддерживалась на уровне 21-22°С. Вода была сделана непрозрачной при помощи молочного порошка. В помещении для испытаний у мышей для помощи в поиске погруженной платформы были только отдаленная визуальная форма и объекты-подсказки. Местоположение целевого рукава оставалось неизменным для данной мыши. На 1 день с мышами проводилось 15 испытаний (в течение 3 часов), с чередованием видимой и скрытой платформы, и последние 4 испытания только со скрытыми платформами. На 2 день мышей обучали посредством 15 испытаний со скрытой платформой. Вход в неверный рукав или неспособность выбрать рукав в течение 15 с записывались как ошибка. Пространственное обучение и память измерялись путем подсчета количества ошибок входа в рукав или задержки спасения мышей в каждом испытании. Данные обучения анализировались как средние ошибки или задержки спасения по блокам из трех последовательных испытаний.
Введение ГА. Каждой мыши подкожно вводили ГА общей дозой 100 мкг (партия №Р53640, Teva Pharmaceutical Industries, Петах-Тиква, Израиль), растворенный в 200 мкл PBS. Мышам делали инъекции в соответствии с режимом либо еженедельного введения ГА (Butovsky et al, 2006), либо ежедневного введения ГА (Фиг. 8 и Фиг. 16). Мышей умерщвляли через 1 неделю после последней инъекции ГА или спустя 1 месяц после лечения, как указано по каждому эксперименту.
Условная абляция Treg клеток. Дифтерийный токсин (DTx, 8 нг/г массы тела, Sigma) вводили интраперитонеально ежедневно в течение 4 дней подряд мышам Foxp3.LuciDTR (Suffner et al, 2010). Эффективность DTx была подтверждена проточным цитометрическим анализом иммунных клеток в крови и селезенке, было достигнуто почти полное (>99%) истощение GFP-экспрессирующих FoxP3+CD4+ Treg клеток (Фиг. 4).
Ингибирование Р300. Ингибирование р300 у мышей проводили аналогично ранее описанному (Liu et al, 2013). При этом p300i (С646; Tocris Bioscience) растворяли в ДМСО и ежедневно вводили интраперитонеально (8,9 мг кг-1 д-1, интраперитонеально) в течение 1 недели. Аналогичным образом, мышам, проходившим лечение проводником, вводили ДМСО.
Лечение ПТРК. Политрансретиноевая кислота (ПТРК) вводилась мышам аналогично ранее описанной процедуре (Walsh et al, 2014). ПТРК (Sigma) растворялась в ДМСО и вводилась интраперитонеально. (8 мг кг-1 д-1) через день в течение 1 недели. Аналогичным образом, мышам, проходившим лечение проводником, вводили ДМСО.
Изоляция и количественная оценка растворимого белка Аβ (sAβ). Гомогенизация ткани и экстракция белка sAβ проводились, как описано ранее (Schmidt et al, 2005) ENREF 54 ENREF 53. Вкратце, паренхиму мозга головного мозга отделяли, замораживали и выдерживали при -80°С вплоть до гомогенизации. Белки последовательно экстрагировали из образцов для получения отдельных фракций, содержащих белки с различной растворимостью. Образцы гомогенизировали в 10 объемах ледяного буфера гомогенизации ткани, содержащего 250 ммолей сахарозы, 20 ммолей основания Триса, 1 ммоль этилендиаминтетрауксусной кислоты (ЭДТК) и 1 ммоль этиленгликолевой тетрауксусной кислоты (рН 7,4) с использованием пестика из шлифованного стекла в гомогенизаторе Даунса. После шести ударов гомогенат смешивали 1:1 с 0,4% диэтиламина (DEA) в растворе 100 ммолей NaCl перед еще шестью ударами, и затем обрабатывали центрифугой на 135,000 g при 4°С в течение 45 минут. Супернатант (DEA-растворимая фракция, содержащая внеклеточные и цитозольные белки) собирали и нейтрализовали 10% раствором 0,5 М трис-HCl (рН 6,8). Аβ1-40 и Аβ1-42 индивидуально измеряли с помощью иммуноферментного анализа (ELISA) из растворимой фракции с использованием коммерчески доступных наборов (Biolegend; #SIG-38954 и #SIG-38956 соответственно) в соответствии с инструкциями производителя.
Подсчет Аβ-бляшек. Из каждого мозга взяты 6 мкм коронарные срезы, и по восемь срезов на мышь, с четырех различных заранее определенных глубин по всей изучаемой области (зубчатая извилина или кора головного мозга), были подвергнуты иммуноокрашиванию. Сегментация положительно окрашенных пикселей на основе гистограммы была выполнена с использованием программного обеспечения Image-Pro Plus (Media Cybernetics, Бетесда, Мэриленд, США). Алгоритм сегментации был вручную применен к каждому изображению, в области зубчатой извилины или в 5-ом кортикальном слое, и была определена процентная доля площади, занимаемой полным иммуноокрашиванием Аβ. Количество бляшек было подсчитано на тех же 6 мкм корональных срезах мозга и представлено как среднее число бляшек на область мозга. До количественной оценки срезы были закодированы, чтобы скрыть идентификаторы экспериментальных групп, и нагрузка бляшек подсчитывалась наблюдателем, не способным идентифицировать группы.
Статистический анализ. Конкретные тесты, используемые для анализа каждой серии экспериментов, указаны в условных обозначениях к фигурам. Данные были проанализированы с использованием двухстороннего т-критерия Стьюдента для сравнения между двумя группами, одностороннего дисперсионного анализа ANOVA для сравнения нескольких групп, затем ретроспективного анализа Ньюмана-Кейлса для парного сравнения групп после отклонения нулевой гипотезы (Р<0,05). Данные поведенческих тестов анализировались с использованием двухсторонних повторных анализов ANOVA, а ретроспективный анализ Бонферрони использовался для последующего парного сравнения. Размеры проб выбирались с достаточной статистической мощностью, основанной на литературе и прошлом опыте, мышей выделяли в экспериментальные группы в зависимости от возраста, пола и генотипа. Исследователи во время экспериментов и при оценке результатов не могли идентифицировать группы («слепой метод»). Все критерии включения и исключения были предварительно установлены в соответствии с руководящими принципами IACUC. Результаты представлены как среднее ± стандартная ошибка среднего. На графиках ось у погрешностей представляет стандартную ошибку среднего. Статистические вычисления выполнялись с использованием программного обеспечения GraphPad Prism (GraphPad Software, Сан-Диего, Калифорния).
Пример 1. Шлюзовая деятельность сосудистых сплетений (СС) при прогрессировании болезни в мышиной модели БА.
Сначала нами была исследована деятельность СС при прогрессировании заболевания в модели БА у трансгенных мышей 5XFAD (AD-Tg); эти мыши совместно экспрессируют пять мутаций, связанных с семейной БА, и у них развивается церебральная Аβ-патология и глиоз уже в возрасте 2 месяцев (Oakley et al, 2006). Мы обнаружили, что на прогрессирующих стадиях патологии болезни СС мышей AD-Tg по сравнению с контрольными особями дикого типа (WT) соответствующего возраста экспрессировали значительно более низкие уровни детерминантов самонаведения и трафика лейкоцитов, включая icam1, vcam1, cxcl10 и ccl2 (фиг. 1А), демонстрируя повышающее регулирования со стороны СС в ответ на острое поражение ЦНС, и нуждались в трансэпителиальной миграции лейкоцитов (Kunis et al, 2013; Shechter et al, 2013). Иммуногистохимическое окрашивание лиганда интегрина, ICAM-1, подтвердило его пониженную экспрессию эпителием СС мышей AD-Tg (фиг. 1b). Кроме того, окрашивание на ICAM-1 в мозгах человека после смерти показало его возрастное снижение в эпителии СС в соответствии с нашими предыдущими наблюдениями (Baruch et al, 2014), а количественная оценка этого эффекта выявила дальнейшее снижение у пациентов с БА по сравнению с пожилыми людьми без заболеваний ЦНС (фиг. 2А). Поскольку индукция детерминантов трафика лейкоцитов со стороны СС зависит от (IFN)-γ сигналов эпителиального интерферона (Kunis et al, 2013), мы затем проверили, отражают ли наблюдаемые эффекты потерю доступности IFN-γ в СС. Изучение СС мышей 5XFAD AD-Tg с использованием внутриклеточного окрашивания проточной цитометрии выявило значительно меньшее количество клеток, продуцирующих IFN-γ, в этом отделении (фиг. 2В), а количественный анализ ПЦР в реальном времени (RT-qPCR) подтвердил более низкий уровень экспрессии мРНК ifn-γ в СС мышей AD-Tg по сравнению с контрольными особями дикого типа соответствующего возраста (фиг. 2С).
Пример 2. Функциональные связи между Treg-опосредованной системной иммуносупрессией, шлюзовой активностью СС и патологией БА.
Регуляторные Т-клетки (Treg) играют ключевую роль в подавлении системных эффекторных иммунных реакций (Sakaguchi et al, 2008). Мы предположили, что Treg-опосредованная системная иммуносупрессия влияет на доступность IFN-γ в СС и, соответственно, сфокусировались на вовлечении Treg клеток в патологию БА. В соответствии с предыдущими сообщениями о повышенных уровнях Treg и супрессии у пациентов с БА (Rosenkranz et al, 2007; Saresella et al, 2010; Torres et al, 2013), оценка частотности Foxp3+ Treg в спленоцитах мышей 5XFAD AD-Tg по сравнению с их сопоставимыми по возрасту однопометниками дикого типа показала повышенные уровни при прогрессировании заболевания (фиг. 3А, В). Для изучения функциональных связей между Treg-опосредованной системной иммуносупрессией, шлюзовой активностью СС и БА-патологией мы скрестили 5XFAD AD-Tg мышей с мышами Foxp3-дифтерийного рецептора токсина (DTR+), что обеспечило временное условное in vivo истощение Foxp3+ Treg клеток у AD-Tg/DTR+ мышей путем введения дифтерийного токсина (DTx) ENREF 33 (фиг. 4А). Переходное истощение Treg клеток привело к повышенной экспрессии мРНК молекул трафика лейкоцитов со стороны СС AD-Tg/DTR+ мышей в сравнении с их AD-Tg/DTR однопометниками, получавшими DTx (фиг. 5А). Анализ долгосрочного эффекта временного истощения Treg клеток на паренхиму головного мозга (3 недели спустя) выявил накопление иммунных клеток в мозгу, включая повышенное количество CD45high/CD11high миелоидных клеток, представляющих собой проникающие mo-МФ (Shechter et al, 2013) и CD4+ Т-клетки (фиг. 5В). Кроме того, кратковременное истощение Treg клеток привело к заметному обогащению Foxp3+ Treg клеток среди CD4+ Т-клеток, которые накопились в мозгу, согласно оценке по проточной цитометрии (фиг. 5С, D). Исследование гиппокампа методом количественной ПЦР в реальном времени (RT-qPCR) показало повышенную экспрессию мРНК foxp3 и il10 (фиг. 5Е).
Затем мы изучили, приводит ли краткосрочное истощение Treg клеток, после которого иммунорегуляторные клетки накапливаются в зонах патологии головного мозга, к долгосрочному воздействию на мозговую деятельность. Мы наблюдали снижение глиоза гиппокампа (фиг. 5F) и снижение уровня экспрессии мРНК провоспалительных цитокинов, таких как il-12р40 и tnf-α (фиг. 5G). Кроме того, нагрузка церебральных Аβ-бляшек в зубчатой извилине гиппокампа, а также в коре головного мозга (5-й слой), двух областях мозга, демонстрирующих устойчивую патологию Аβ-бляшек у 5XFAD AD-Tg мышей (Oakley et al, 2006), была снижена (фиг. 6А, В). Оценка влияния на когнитивную функцию с использованием водного лабиринта Морриса (ВЛМ) показала значительное улучшение пространственного обучения и памяти у мышей AD-Tg/DTR+ после истощения Treg клеток по сравнению с AD-Tg/DTR мышами, получавшими DTx, достигая производительности, аналогичной таковой у мышей дикого типа (фиг. 6С-Е). В совокупности эти данные продемонстрировали, что кратковременное нарушение Treg-опосредованной системной иммуносупрессии у мышей AD-Tg привело к накоплению снимающих воспаление клеток, включая mo-МФ и Treg, в мозгу, после чего последовало разрешение нейровоспалительной реакции, очистка Аβ и устранение когнитивного спада.
Пример 3. Еженедельное введение сополимера-1 снижает Treg-опосредованную системную иммуносупрессию, повышает шлюзовую активность СС и смягчает патологию БА.
Для дальнейшего обоснования причинно-следственной природы обратной зависимости между системной иммуносупрессией, деятельностью СС и патологией БА нами затем использовалось иммуномодулирующее соединение, глатирамер ацетат (ГА, также известный как сополимер-1 или Copaxone®), которое по результатам еженедельного введения продемонстрировало терапевтический эффект в мышиной модели БА APP/PS1 (Butovsky et al, 2006); ENREF 22 этот эффект был функционально связан с рекрутингом mo-МФ в участки мозга, пораженные заболеванием (Butovsky et al, 2007). В этом случае мы сначала исследовали, характеризуются ли СС у мышей AD-Tg APP/PS1, аналогично нашему наблюдению у мышей 5XFAD AD-Tg, недостаточностью в плане уровня экспрессии IFN-γ. Мы обнаружили, что у мышей AD-Tg APP/PS1 уровни IFN-γ d СС были снижены по сравнению с контрольными особями дикого типа соответствующего возраста (фиг. 7А). Эти результаты побудили нас проверить, можно ли воспроизвести терапевтический эффект еженедельного введения ГА мышам APP/PS1 (Butovsky et al, 2006) у мышей 5XFAD AD-Tg, и если да, то повлияет ли это на системные Treg клетки и активацию СС для трафика mo-МФ. Поэтому мы применили к 5XFAD AD-Tg мышам еженедельный режим введения ГА в течение 4 недель (далее «еженедельный ГА»; схематически изображен на фиг. 8А). Мы обнаружили, что мыши 5XFAD AD-Tg, получавшие еженедельный ГА, продемонстрировали снижение нейровоспаления (фиг. 8B-D) и улучшенные когнитивные способности, что продолжалось до 2 месяцев после лечения (фиг. 8E-I). Изучая методом проточной цитометрии воздействие еженедельного ГА на системный иммунитет и на СС, мы обнаружили снижение уровней Foxp3+ Treg спленоцитов (фиг. 9А) и увеличение клеток, продуцирующих IFN-γ, в СС проходивших лечение мышей 5XFAD AD-Tg, с достижением уровней, аналогичных наблюдаемым у контрольных особей дикого типа (фиг. 9В). Повышенный уровень IFN-γ-экспрессирующих клеток в СС у мышей, получавших еженедельный ГА, сопровождался повышающим регулированием эпителиальной экспрессии молекул трафика лейкоцитов (фиг. 9С).
Чтобы обнаружить попадание проникающих mo-МФ в ЦНС, мы использовали мышей 5XFAD AD-Tg/CX3CR1GFP/+ с костномозговыми химерами (подготовлены с использованием защиты головы), что позволило визуализировать циркулирующие (с маркировкой зеленым флуоресцентным белком (ЗФБ/GFP)+) миелоидные клетки (Shechter et al, 2009; Shechter et al, 2013). Мы обнаружили увеличение самонаведения GFP+ mo-МФ в СС и в соседние желудочковые пространства после терапии с еженедельным введением ГА, по сравнению с контрольными особями AD-Tg/CX3CR1GFP/+, получавшими проводник (фиг. 9D-E). Иммуногистохимия паренхимы мозга показала наличие GFP+ mo-МФ скоплений на участках формирования мозговых бляшек (фиг. 9F), а количественная оценка проникающих миелоидных клеток путем анализа гиппокампа методом проточной цитометрии у не-химерных мышей AD-Tg показала увеличение числа CD11bhighCD45high-экспрессирующих клеток (фиг. 9G, Н). Вместе эти результаты подтверждают функциональную связь между рекрутингом mo-МФ в участках патологии БА, снижением системного уровня Treg и IFN-γ-зависимой активации СС.
Пример 4. Вмешательство в деятельность Treg с использованием низкомолекулярного ингибитора гистоновой ацетилтрансферазы.
Вышеприведенные данные, предполагающие, что Treg-опосредованная системная иммуносупрессия препятствует способности бороться с патологией БА, напоминают о функции, приписываемой Treg клеткам при иммунотерапии рака, в которой эти клетки препятствуют способности иммунной системы обеспечивать эффективную анти-опухолевую реакцию (Bos & Rudensky, 2012; Nishikawa & Sakaguchi, 2010). Поэтому мы сделали вывод, что лечение, которое непосредственно препятствует активности клеток Foxp3+ Treg, может быть эффективным при БА. Мы испытали p300i (С646 (Bowers et al, 2010)), непептидный ингибитор р300, гистоновую ацетилтрансферазу, регулирующую функцию Treg (Liu et al, 2013); было продемонстрировано, что этот ингибитор влияет на подавляющую деятельность Treg, оставляя защитные ответы Т-эффекторных клеток без изменений (Liu et al, 2013). Мы обнаружили, что мыши, проходившие лечение p300i, по сравнению с мышами, получавшими проводник (ДМСО), демонстрировали повышенный уровень системных IFN-γ-экспрессирующих клеток в селезенке (фиг. 10А), а также в СС (фиг. 10В). Затем мы лечили AD-Tg мышей либо p300i, либо проводником в течение 1 недели, и исследовали их через 3 недели касательно нагрузки церебральных Аβ-бляшек. Иммуногистохимический анализ показал значительное снижение нагрузки церебральных Аβ-бляшек у мышей, получавших p300i, по сравнению с AD-Tg мышами (фиг. 10С-Е). Мы также протестировали, будет ли воздействие на патологию бляшек после одного курса лечения продолжаться дольше, чем 3 недели, и если да, внесут ли дополнительные курсы лечения свой вклад в длительное воздействие. По этой причине мы сравнили мышей AD-Tg, которые прошли один курс лечения p300i и были обследованы 2 месяца спустя, с группой, сопоставимой по возрасту, которая в течение этого периода прошла два курса лечения с интервалом в 1 месяц между ними (схематично изображена на фиг. 10F). Мы обнаружили, что снижение нагрузки церебральных бляшек было очевидно даже через два месяца после одного курса лечения, но было интенсивнее у мышей, которые прошли два курса лечения с интервалом в 1 месяц между ними (фиг. 10G). Поскольку нарушенная синаптическая пластичность и память при БА связаны с повышенным уровнем растворимого Aβ1-40/Aβ1-42 (sAβ) в мозгу (Shankar et al, 2008), мы также измерили уровень sAβ после одного или нескольких циклов лечения p300i. И снова мы обнаружили, что как один, так и два курса (с интервалом в 1 месяц между ними) эффективны в снижении церебрального sAβ, однако этот эффект был сильнее после нескольких курсов в плане воздействия на sAβ1-42 (фиг. 10Н). Эти результаты показали, что, несмотря на эффективность одного краткосрочного курса лечения, серия курсов лечения способствовала бы поддержанию долговременного терапевтического эффекта, аналогичного нашим наблюдениям после еженедельного лечения ГА.
Пример 5. Терапевтический потенциал PD-1 блокады иммунной контрольной точки при болезни Альцгеймера.
Сперва мы проверили, может ли наводка на ингибирующий путь PD-1 повлиять на IFN-γ-ассоциированный системный иммунитет у трансгенных (AD-Tg) мышей 5XFAD с БА, которые совместно выражают пять мутаций, связанных с семейной БА (Oakley et al, 2006). Мышам AD-Tg в возрасте 10 месяцев, когда развивается церебральная патология, вводили две интраперитонеальные инъекции либо блокирующих антител, направленных на контрольные антитела PD-1 (анти-PD-1), либо IgG, в дни 1 и 4, а затем на 7-й день. Анализ методом проточной цитометрии показал, что блокада пути PD-1 приводит к повышенным частотам спленоцитов CD4+ Т, продуцирующих IFN-γ (фиг. 11А, В).

Затем нами было изучено, влияет ли этот системный иммунный ответ на деятельность СС. Геномное РНК-секвенирование СС (не приведено, полный анализ будет раскрыт в отчете авторов изобретения под названием Примера 5, и может быть получен от изобретателей по запросу) показало профиль экспрессии, связанный с реакцией на IFN-γ (Фиг. 11D и Таблица 2), и анализ методом количественной ПЦР в реальном времени (RT-qPCR) подтвердил повышенный уровень мРНК IFN-γ в СС, по сравнению с контрольными AD-Tg особями, получавшими IgG или не проходившими лечение (фиг. 11С). Эти выводы подтвердили системную и специфичную для тканей СС IFN-γ иммунную реакцию после блокады PD-1, и побудило нас после этого проверить воздействие на патологию заболевания.
Для изучения функциональных последствий блокады PD-1 на патологию БА мы лечили 10-месячных AD-Tg мышей анти-PD-1 или контрольными антителами IgG и оценивали влияние на пространственное обучение и память с помощью радиального рукавного водного лабиринта (РРВЛ).
Через месяц после лечения (две интраперинетонеальных инъекции с 3-дневным интервалом) у мышей AD-Tg, получивших анти-PD1, наблюдалось значительное улучшение когнитивной функции по сравнению с контрольными особями соответствующего возраста, получавшими IgG или не проходившими лечение, с достижением когнитивных уровней, аналогичных уровням у мышей дикого типа соответствующего возраста (фиг. 12А). Далее мы исследовали, продлится ли эффект блокады PD-1 на когнитивные функции у AD-Tg мышей дольше 1 месяца, и будут ли эффективны дополнительные терапевтические сеансы. Мы лечили AD-Tg-мышей в возрасте 10 месяцев анти-PD-1 («1 сеанс») или в возрасте 10 и 11 месяцев («2 сеанса»), и изучали результаты когнитивной деятельности в возрасте 12 месяцев (схематически изображено на фиг. 12В). В контрольные группы входили мыши дикого типа, не проходившие лечение AD-Tg мыши и AD-Tg мыши, которые прошли два сеанса лечения IgG. Мы обнаружили, что в то время как один сеанс анти-PD-1-адъюванта оказал благотворное влияние на пространственное обучение и память через 1 месяц после лечения (фиг. 12А), никакого существенного эффекта нельзя было обнаружить у мышей, которые прошли один сеанс лечения и были исследованы через 2 месяца (фиг. 12В). Напротив, мыши AD-Tg, которые прошли два сеанса лечения анти-PD-1, с интервалом в 1 месяц, демонстрировали когнитивную деятельность, аналогичную деятельности мышей дикого типа, в конце 2-месячного периода (фиг. 12В).
Мы изучили, повлияла ли блокада PD-1 на патологию БА, проявляющуюся при нагрузке церебральных Аβ-бляшек и глиозе. Мозги AD-Tg мышей, которые получали анти PD-1 или IgG в течение одного или двух сеансов, были исследованы методом иммуногистохимии на Аβ и глиальный фибриллярный кислый белок (ГФКБ). Мы обнаружили, что нагрузка церебральных Аβ-бляшек была снижена в зубчатой извилине гиппокампа (фиг. 13А, В), а также в коре головного мозга (5-й слой) (фиг. 13А, С), двух областях мозга, демонстрирующих устойчивую патологию Аβ-бляшек у 5XFAD мышей (Oakley et al, 2006). Воздействие на очистку Аβ проявилось после одного сеанса введения анти-PD-1 и стало более устойчивым после двух сеансов. Количественный анализ иммуноокрашивания на ГФКБ показал уменьшение астроглиоза гиппокампа как у AD-Tg мышей, прошедших 1 сеанс, так и у тех, что прошли 2 сеанса блокады PD-1, по сравнению с контрольными особями, проходившими лечение IgG (фиг. 13А, D).
Чтобы исследовать воздействие дозировки и частотности введения, женским особям 5XFAD AD трансгенных мышей (средний возраст группы 6 месяцев) вводили либо анти-PD-1-специфические антитела (lgG2a анти-мышь с контролем PD-1 или IgG (крыса lgG2a). Мыши, проходившие лечение анти-PD-1, получали либо 1 инъекцию 500 мкг антител в день 1 эксперимента, либо 2 инъекции 250 мкг с 3-дневным интервалом между инъекциями. Мыши дикого типа соответствующего возраста были использованы в качестве дополнительной контрольной группы. Влияние на пространственное обучение и память оценивалось нами с помощью радиального рукавного водного лабиринта (РРВЛ).
Через месяц после лечения (две интраперинетонеальных инъекции с 3-дневным интервалом) у мышей AD-Tg, получивших анти-PD1, наблюдалось значительное улучшение когнитивной функции по сравнению с контрольными особями соответствующего возраста, получавшими IgG или не проходившими лечение, с достижением когнитивных уровней, аналогичных уровням у мышей дикого типа соответствующего возраста (фиг. 14).
Наконец, мужских особей 5XFAD AD трансгенных мышей лечили повторными сеансами, один раз в месяц, либо анти-PD-1- специфическими антителами (lgG2a анти-мышь PD-1), либо с контролем IgG (крыса lgG2a). Первая инъекция проводилась в возрасте 3 месяцев, вторая в возрасте 4 месяцев, третья в возрасте 5 месяцев. Дозировка указана в схеме эксперимента (фиг. 15А). Мыши дикого типа соответствующего возраста были использованы в качестве дополнительной контрольной группы. Влияние на пространственное обучение и память оценивалось нами с помощью радиального рукавного водного лабиринта (РРВЛ), в две различные временные точки - 5-месячный возраст (фиг. 15В) и возраст 6 месяцев (фиг. 15С). Схема эксперимента представлена. Черные стрелки указывают временные точки лечения, иллюстрации показывают временные точки когнитивного тестирования. Результаты в РРВЛ у 5XFAD мышей, проходивших лечение анти-PD-1 (n=7), 5XFAD мышей, проходивших лечение lgG2a (n=9) и контрольных особей дикого типа (n=8); двусторонний повторный дисперсионный анализ ANOVA и послеэкспериментальный тест Даннетта). Величина ошибки представляет собой среднее ± стандартная ошибка среднего; *Р<0,05, **Р<0,01, ***Р<0,001, проходившие лечение анти-PD-1 в сравнении с контрольными особями, проходившими лечение IgG. Эти данные свидетельствуют о том, что повторные сеансы лечения с блокадой PD-1 могут не только обратить вспять развитие заболевания при введении мышам 5XFAD на поздних стадиях заболевания, но и задержать начало заболевания, если лечение начинается в раннем возрасте, до когнитивного спада (фиг. 15В-С).
Пример 6. Терапевтический потенциал блокады иммунной контрольной точки при болезни Альцгеймера.
Чтобы проверить, может ли блокада иммунных контрольных точек ослабить патологию БА, мышей AD-Tg лечат в возрасте от 6 до 10 месяцев одним из следующих антител, действующих против контрольной точки: анти-ICOS, анти-B7RP1, анти-VISTA, анти-CD40, анти-CD40L анти-CD80, анти-CD86, анти-В7-Н3, анти-В7-Н4, В7-Н7, анти-BTLA, анти-HVEM, анти-CD137, анти-CD137L, анти- -OX40L, анти-CD-27, анти-CD70, анти-STING или анти-TIGIT. Некоторых мышей лечат антителом против PD-1 в качестве положительного контроля, IgG в качестве отрицательного контроля или комбинацией анти-PD1 и одного из других антител против контрольной точки, упомянутых выше. Эффект лечения на пространственное обучение и память измеряется через месяц после лечения, с помощью радиального рукавного водного лабиринта (РРВЛ), нагрузки Аβ-бляшек с помощью иммуногистохимии на Аβ и астроглиоз гиппокампа путем иммуногистохимии на глиальный фибриллярный кислый белок (ГФКБ).
Ожидается, что мыши, получавшие антитела, будут демонстрировать значительное улучшение познавательной способности по сравнению с получавшими IgG и не проходившими лечение мышами AD-Tg, а также значительное снижение нагрузки церебральных бляшек.
Пример 7. Терапевтический потенциал блокады иммунной контрольной точки при патологии ПТСР.
Особо стрессовые условия или хронический стресс могут привести к депрессии и посттравматическому стрессовому расстройству (ПТСР). Мы приняли ПТСР-подобную физиологическое животную модель, в которой мыши демонстрируют бессонницу, нарушение внимания, повышенный учет риска и плохой сон (Lebow et al, 2012). В этой экспериментальной модели индукции ПТСР мышей приучают за 10 дней к обратному дневному/ночному циклу, подвергают двум ударам электрическим током (травма и триггер), под названием «ПТСР индукция», и оценивают в разные временные точки после травмы. После травматического события мышам вводят упомянутый препарат, который блокирует иммунные контрольные точки. Мышей лечат по одной из следующих схем:
Мышей лечат одним из следующих антител против контрольных точек: анти-ICOS, анти-B7RP1, анти-VISTA, анти-CD40, анти-CD40L, анти-CD80, анти-CD86, анти-В7-Н3, анти-В7-Н4, В7-Н7, анти-BTLA, HVEM, анти-CD137, анти-CD137L, анти-OX40L, анти-CD-27, анти-CD70, анти-STING или анти-TIGIT по отдельности или в сочетании с антителом анти-CTLA-4. Некоторых мышей лечат антителом против PD-1 в качестве положительного контроля, IgG в качестве отрицательного контроля или комбинацией анти-PD1 и одного из других антител против контрольной точки, упомянутых выше.
Некоторые мыши проходят дополнительный сеанс лечения после соответствующего интервала.
Ожидается, что мыши, получающие лечение, не проявляют тревожного поведения, связанного с ПТСР, в этой экспериментальной модели, что оценивается по времени, проведенному в исследовании и оценке риска в темном/светлом лабиринте или при выполнении других поведенческих задач, описанных в (Lebow et al, 2012).
Пример 8. Терапевтический потенциал метода блокады иммунной контрольной точки при патологии болезни Паркинсона.
В этом эксперименте используются трансгенные мыши (Tg) с болезнью Паркинсона (PD) или мышиные модели БП, индуцированные МФТФ. Мышей лечат на прогрессивных стадиях заболевания по одной из следующих схем:
Мышей PD-Tg лечат одним из следующих антител против контрольных точек: анти-ICOS, анти-B7RP1, анти-VISTA, анти-CD40, анти-CD40L, анти-CD80, анти-CD86, анти-В7-Н3, анти-В7-Н4, В7-Н7, анти-BTLA, анти-HVEM, анти-CD137, анти-CD137L анти-OX40L, анти-CD-27, анти-CD70, анти-STING или анти-TIGIT, по отдельности или в комбинации с антителом анти-CTLA-4. Некоторых мышей лечат антителом против PD-1 в качестве положительного контроля, IgG в качестве отрицательного контроля или комбинацией анти-PD1 и одного из других антител против контрольной точки, упомянутых выше.
Моторные неврологические функции оцениваются, например, с помощью теста «ротарод», который оценивает способность мышей удерживаться на вращающемся барабане.
Ожидается, что мыши PD-Tg, прошедшие один сеанс лечения, будут проявлять значительно улучшенную двигательную активность по сравнению с контрольной группой, получавшей IgG или проводник, или группой, не проходившей лечение. У мышей PD-Tg, которые пройдут два сеанса лечения и которые будут исследованы после соответствующего перерыва, как ожидается, проявится долговременный терапевтический эффект. Чтобы сохранить терапевтический эффект, мышей подвергают активному сеансу лечения с соответствующим перерывом без лечения после каждого сеанса лечения.
Пример 9. Терапевтический потенциал блокады иммунной контрольной точки при патологии болезни Хантингтона.
Модель, используемая в этих экспериментах, может быть тестовой системой болезни Хантингтона (HD) у R6/2 трансгенных мышей (Tg). R6/2 трансгенные мыши сверхэкспрессируют мутировавший человеческий гентингтин, что подразумевает введение множественных CAG-повторов у мышей на прогрессирующих стадиях заболевания. У этих мышей наблюдается прогрессирующая поведенческо-моторная недостаточность, начинающаяся уже в возрасте 5-6 недель и приводящая к преждевременной смерти через 10-13 недель. Симптомы включают в себя низкий вес тела, сокращение мышц, тремор и судороги.
Мышей лечат по одной из следующих схем в возрасте 45 дней:
Мышей лечат одним из следующих антител против контрольных точек: анти-ICOS, анти-B7RP1, анти-VISTA, анти-CD40, анти-CD40L, анти-CD80, анти-CD86, анти-В7-Н3, анти-В7-Н4, В7-Н7, анти-BTLA, HVEM, анти-CD137, анти-CD137L анти-OX40L анти-CD-27, анти-CD70, анти-STING или анти-TIGIT по отдельности или в сочетании с антителом анти-CTLA-4. Некоторых мышей лечат антителом против PD-1 в качестве положительного контроля, IgG в качестве отрицательного контроля или комбинацией анти-PD1 и одного из других антител против контрольной точки, упомянутых выше.
Моторные неврологические функции оцениваются, например, с помощью теста «ротарод», который оценивает способность мышей удерживаться на вращающемся барабане.
Ожидается, что мыши HD-Tg, прошедшие один сеанс лечения, будут проявлять значительно улучшенную двигательную активность по сравнению с контрольной группой, получавшей IgG или проводник, или группой, не проходившей лечение. У мышей HD-Tg, которые пройдут два сеанса лечения и которые будут исследованы после соответствующего перерыва, как ожидается, проявится долговременный терапевтический эффект. Чтобы сохранить терапевтический эффект, мышей подвергают активному сеансу лечения с соответствующим перерывом без лечения после каждого сеанса лечения.
Пример 10. Терапевтический потенциал метода блокады иммунной контрольной точки при патологии бокового амиотрофического склероза.
Модель, используемая в этом эксперименте, может представлять трансгенных мышей, сверхэкспрессирующих дефектный человеческий мутантный аллель SOD1, содержащий ген Gly93→Ala (G93A) (B6SJL-TgN (SOD1-G93A)1Gur (далее «мыши ALS»). В этой модели развивается болезнь моторных нейронов, таким образом, она является приемлемой моделью для тестирования ALS.
Мышей лечат по одной из следующих схем в возрасте 75 дней:
Мышей лечат одним из следующих антител против контрольных точек: анти-ICOS, анти-B7RP1, анти-VISTA, анти-CD40, анти-CD40L, анти-CD80, анти-CD86, анти-В7-Н3, анти-В7-Н4, В7-Н7, анти-BTLA, HVEM, анти-CD137, анти-CD137L, анти-OX40L, анти-CD-27, анти-CD70, анти-STING или анти-TIGIT по отдельности или в сочетании с антителом анти-CTLA-4. Некоторых мышей лечат антителом против PD-1 в качестве положительного контроля, IgG в качестве отрицательного контроля или комбинацией анти-PD1 и одного из других антител против контрольной точки, упомянутых выше.
Двигательные неврологические функции оценивают, например, с использованием теста «ротарод», при котором оценивается способность мышей оставаться на вращающемся барабане, или при этом мышам разрешается хвататься и держаться за вертикальный провод (диаметром 2 мм) с небольшой петлей на нижнем конце. Вертикальный провод позволяет мыши использовать как передние, так и нижние конечности для захвата. Провод в вертикальном положении совершает круговые движения (радиус окружности 10 см) со скоростью 24 об/мин. Время, в течение которого мышь может висеть на проводе, отсчитывается таймером.
Ожидается, что мыши ALS, прошедшие один сеанс лечения, будут проявлять значительно улучшенную двигательную активность по сравнению с контрольной группой, получавшей IgG или проводник, или группой, не проходившей лечение. У мышей ALS, которые пройдут два сеанса лечения и которые будут исследованы после соответствующего перерыва, как ожидается, проявится долговременный терапевтический эффект. Чтобы сохранить терапевтический эффект, мышей подвергают активному сеансу лечения с соответствующим перерывом без лечения после каждого сеанса лечения.
СПРАВОЧНАЯ ДОКУМЕНТАЦИЯ
Akiyama Н, Barger S, Barnum S, Bradt B, Bauer J, Cole GM, Cooper NR, Eikelenboom P, Emmerling M, Fiebich BL, Finch CE, Frautschy S, Griffin WS, Hampel H, Hull M, Landreth G, Lue L, Mrak R, Mackenzie IR, McGeer PL, O'Banion MK, Pachter J, Pasinetti G, Plata-Salaman C, Rogers J, Rydel R, Shen Y, Streit W, Strohmeyer R, Tooyoma I, Van Muiswinkel FL, Veerhuis R, Walker D, Webster S, Wegrzyniak B, Wenk G, Wyss-Coray T (2000) Inflammation and Alzheimer's disease. Neurobiology of aging 21: 383-421
Alamed J, Wilcock DM, Diamond DM, Gordon MN, Morgan D (2006) Two-day radial-arm water maze learning and memory task; robust resolution of amyloid-related memory deficits in transgenic mice. Nature protocols 1: 1671-1679
Bai A, Lu N, Guo Y, Liu Z, Chen J, Peng Z (2009) All-trans retinoic acid down-regulates inflammatory responses by shifting the Treg/Th17 profile in human ulcerative and murine colitis. Journal of leukocyte biology 86: 959-969
Baruch K, Aleksandra Deczkowska, Neta Rosenzweig, Afroditi Tsitsou-Kampeli, Alaa Mohammad Sharif, Orit Matcovitch-Natan, Alexander Kertser, Eyal David, Ido Amit & Michal Schwartz (2016). PD-1 immune checkpoint blockade reduces pathology and improves memory in mouse models of Alzheimer's disease. Nature Medicine 22, 135-137.
Baruch K, Deczkowska A, David E, Castellano JM, Miller O, Kertser A, Berkutzki T, Barnett-Itzhaki Z, Bezalel D, Wyss-Coray T, Amit I, Schwartz M (2014) Aging. Aging-induced type I interferon response at the choroid plexus negatively affects brain function. Science 346: 89-93
Baruch K, Kertser A, Porat Z, Schwartz M (2015) Cerebral nitric oxide represses choroid plexus NFkappaB-dependent gateway activity for leukocyte trafficking. The EMBO journal
Baruch K, Ron-Harel N, Gal H, Deczkowska A, Shifrut E, Ndifon W, Mirlas-Neisberg N, Cardon M, Vaknin I, Cahalon L, Berkutzki T, Mattson MP, Gomez-Pinilla F, Friedman N, Schwartz M (2013) CNS-specific immunity at the choroid plexus shifts toward destructive Th2 inflammation in brain aging. Proceedings of the National Academy of Sciences of the United States of America 110: 2264-2269
Borchelt DR, Ratovitski T, van Lare J, Lee MK, Gonzales V, Jenkins NA, Copeland NG, Price DL, Sisodia SS (1997) Accelerated amyloid deposition in the brains of transgenic mice coexpressing mutant presenilin 1 and amyloid precursor proteins. Neuron 19: 939-945
Bos PD, Rudensky AY (2012) Treg cells in cancer: a case of multiple personality disorder. Science translational medicine 4: 164fs144
Bowers EM, Yan G, Mukherjee C, Orry A, Wang L, Holbert MA, Crump NT, Hazzalin CA, Liszczak G, Yuan H, Larocca C, Saldanha SA, Abagyan R, Sun Y, Meyers DJ, Marmorstein R, Mahadevan LC, Alani RM, Cole PA (2010) Virtual ligand screening of the р300/CBP histone acetyltransferase: identification of a selective small molecule inhibitor. Chemistry & biology 17: 471-482
Breitner JC, Haneuse SJ, Walker R, Dublin S, Crane PK, Gray SL, Larson EB (2009) Risk of dementia and AD with prior exposure to NSAIDs in an elderly community-based cohort. Neurology 72: 1899-1905
Brestoff JR, Artis D (2013) Commensal bacteria at the interface of host metabolism and the immune system. Nature immunology 14: 676-684
Burgess A, Vigneron S, Brioudes E, Labbe JC, Lorca T, Castro A (2010) Loss of human Greatwall results in G2 arrest and multiple mitotic defects due to deregulation of the cyclin B-Cdc2/PP2A balance. Proceedings of the National Academy of Sciences of the United States of America 107: 12564-12569
Butovsky O, Koronyo-Hamaoui M, Kunis G, Ophir E, Landa G, Cohen H, Schwartz M (2006) Glatiramer acetate fights against Alzheimer's disease by inducing dendritic-like microglia expressing insulin-like growth factor 1. Proceedings of the National Academy of Sciences of the United States of America 103: 11784-11789
Butovsky O, Kunis G, Koronyo-Hamaoui M, Schwartz M (2007) Selective ablation of bone marrow-derived dendritic cells increases amyloid plaques in a mouse Alzheimer's disease model. The European journal of neuroscience 26: 413-416
Chen X, Oppenheim JJ (2011) Resolving the identity myth: key markers of functional CD4+FoxP3+ regulatory T cells. International immunopharmacology 11: 1489-1496
Colombo MP, Piconese S (2007) Regulatory-T-cell inhibition versus depletion: the right choice in cancer immunotherapy. Nature reviews Cancer 7: 880-887
Coyne GO, Gulley JL (2014) Adding fuel to the fire: Immunogenic intensification. Human vaccines & immunotherapeutics 10: 3306-3312
Dalotto-Moreno T, Croci DO, Cerliani JP, Martinez-Allo VC, Dergan-Dylon S, Mendez-Huergo SP, Stupirski JC, Mazal D, Osinaga E, Toscano MA, Sundblad V, Rabinovich GA, Salatino M (2013) Targeting galectin-1 overcomes breast cancer-associated immunosuppression and prevents metastatic disease. Cancer research 73: 1107-1117
Desmet, J.; Verstraete, K.; Bloch, Y.; Lorent, E.; Wen, Y.; Devreese, В.; Vandenbroucke, K.; Loverix, S.; Hettmann, Т.; Deroo, S.; Somers, K.; Henderikx, P.; Lasters, I.; Savvides, S.N. (5 Feb 2014). "Structural basis of IL-23 antagonism by an Alphabody protein scaffold". Nature Communications 5: 5237. doi: 10.1038/ncomms6237.
Duraiswamy J, Freeman GJ, Coukos G (2014) Dual blockade of PD-1 and CTLA-4 combined with tumor vaccine effectively restores T-cell rejection function in tumors-response. Cancer research 74: 633-634; discussion 635
Ebersbach H, Fiedler E, Scheuermann T, et al. (September 2007). "Affilin-novel binding molecules based on human gamma-B-crystallin, an all beta-sheet protein". J. Mol. Biol. 372 (1): 172-85. doi: 10.1016/j.jmb.2007.06.045. PMID 17628592.
Francisco LM, Sage PT, Sharpe AH (2010) The PD-1 pathway in tolerance and autoimmunity. Immunological reviews 236: 219-242
Gabrilovich DI, Nagaraj S (2009) Myeloid-derived suppressor cells as regulators of the immune system. Nature reviews Immunology 9: 162-174
Galvin KC, Dyck L, Marshall NA, Stefanska AM, Walsh KP, Moran B, Higgins SC, Dungan LS, Mills KH (2013) Blocking retinoic acid receptor-alpha enhances the efficacy of a dendritic cell vaccine against tumours by suppressing the induction of regulatory T cells. Cancer immunology, immunotherapy: CII 62: 1273-1282
Ghiringhelli F, Bruchard M, Chalmin F, Rebe С (2012) Production of adenosine by ectonucleotidases: a key factor in tumor immunoescape. Journal of biomedicine & biotechnology 2012: 473712
Grabulovski D; Kaspar, M; Neri, D (2007). "A novel, non-immunogenic Fyn SH3-derived binding protein with tumor vascular targeting properties". J Biol Chem 282 (5): 3196-3204. doi: 10.1074/jbc.M609211200. PMID 17130124.
Group AR, Lyketsos CG, Breitner JC, Green RC, Martin BK, Meinert C, Piantadosi S, Sabbagh M (2007) Naproxen and celecoxib do not prevent AD in early results from a randomized controlled trial. Neurology 68: 1800-1808
Hardy J, Selkoe DJ (2002) The amyloid hypothesis of Alzheimer's disease: progress and problems on the road to therapeutics. Science 297: 353-356
He F, Balling R (2013) The role of regulatory T cells in neurodegenerative diseases. Wiley interdisciplinary reviews Systems biology and medicine 5: 153-180
Hirayama M, Nishikawa H, Nagata Y, Tsuji T, Kato T, Kageyama S, Ueda S, Sugiyama D, Hori S, Sakaguchi S, Ritter G, Old LJ, Gnjatic S, Shiku H (2013) Overcoming regulatory T-cell suppression by a lyophilized preparation of Streptococcus pyogenes. European journal of immunology 43: 989-1000
Hong J, Li N, Zhang X, Zheng B, Zhang JZ (2005) Induction of CD4+CD25+ regulatory T cells by copolymer-l through activation of transcription factor Foxp3. Proceedings of the National Academy of Sciences of the United States of America 102: 6449-6454
Johnson A, Song Q, Ko Ferrigno P, Bueno PR, Davis JJ (Aug 7, 2012). "Sensitive Affimer and antibody based impedimetric label-free assays for C-reactive protein". Anal. Chem. 7; 84(15): 6553-60. doi: 10.1021/ac300835b. PMID 22789061.
Joller N, Peters A, Anderson AC, Kuchroo VK (2012) Immune checkpoints in central nervous system autoimmunity. Immunological reviews 248: 122-139
Ju Y, Shang X, Liu Z, Zhang J, Li Y, Shen Y, Liu Y, Liu C, Liu B, Xu L, Wang Y, Zhang B, Zou J (2014) The Tim-3/galectin-9 pathway involves in the homeostasis of hepatic Tregs in a mouse model of concanavalin A-induced hepatitis. Molecular immunology 58: 85-91
Jung S, Aliberti J, Graemmel P, Sunshine MJ, Kreutzberg GW, Sher A, Littman DR (2000) Analysis of fractalkine receptor CX(3)CR1 function by targeted deletion and green fluorescent protein reporter gene insertion. Molecular and cellular biology 20: 4106-4114
Kim JM, Rasmussen JP, Rudensky AY (2007) Regulatory T cells prevent catastrophic autoimmunity throughout the lifespan of mice. Nature immunology 8: 191-197
Kim PS, Jochems C, Grenga I, Donahue RN, Tsang KY, Gulley JL, Schlom J, Farsaci В (2014) Pan-Bcl-2 inhibitor, GX15-070 (obatoclax), decreases human T regulatory lymphocytes while preserving effector T lymphocytes: a rationale for its use in combination immunotherapy. Journal of immunology 192: 2622-2633
Koide A, Koide S (2007). "Monobodies: antibody mimics based on the scaffold of the fibronectin type III domain". Methods Mol. Biol. 352: 95-109. doi: 10.1385/1-59745-187-8:95. PMID 17041261.
Kotsakis A, Harasymczuk M, Schilling B, Georgoulias V, Argiris A, Whiteside TL (2012) Myeloid-derived suppressor cell measurements in fresh and cryopreserved blood samples. Journal of immunological methods 381: 14-22
Krehenbrink M, Chami M, Guilvout I, Alzari PM,

Kunis G, Baruch K, Miller O, Schwartz M (2015) Immunization with a Myelin-Derived Antigen Activates the Brain's Choroid Plexus for Recruitment of Immunoregulatory Cells to the CNS and Attenuates Disease Progression in a Mouse Model of ALS. The Journal of neuroscience: the official journal of the Society for Neuroscience 35: 6381-6393
Kunis G, Baruch K, Rosenzweig N, Kertser A, Miller O, Berkutzki T, Schwartz M (2013) IFN-gamma-dependent activation of the brain's choroid plexus for CNS immune surveillance and repair. Brain: a journal of neurology 136: 3427-3440
Lebow M, Neufeld-Cohen A, Kuperman Y, Tsoory M, Gil S, Chen A (2012) Susceptibility to PTSD-like behavior is mediated by corticotropin-releasing factor receptor type 2 levels in the bed nucleus of the stria terminalis. J Neurosci 32: 6906-6916
Lesokhin AM, Callahan MK, Postow MA, Wolchok JD (2015) On being less tolerant: enhanced cancer immunosurveillance enabled by targeting checkpoints and agonists of T cell activation. Science translational medicine 7: 280sr281
Liu Y, Wang L, Predina J, Han R, Beier UH, Wang LC, Kapoor V, Bhatti TR, Akimova T, Singhal S, Brindle PK, Cole PA, Albelda SM, Hancock WW (2013) Inhibition of p300 impairs Foxp3(+) T regulatory cell function and promotes antitumor immunity. Nature medicine 19: 1173-1177
Marabelle A, Kohrt H, Sagiv-Barfi I, Ajami B, Axtell RC, Zhou G, Rajapaksa R, Green MR, Torchia J, Brody J, Luong R, Rosenblum MD, Steinman L, Levitsky HI, Tse V, Levy R (2013) Depleting tumor-specific Tregs at a single site eradicates disseminated tumors. The Journal of clinical investigation 123: 2447-2463
Mellman I, Coukos G, Dranoff G (2011) Cancer immunotherapy comes of age. Nature 480: 480-489
Michaud JP, Bellavance MA, Prefontaine P, Rivest S (2013) Real-time in vivo imaging reveals the ability of monocytes to clear vascular amyloid beta. Cell reports 5: 646-653
Nishikawa H, Sakaguchi S (2010) Regulatory T cells in tumor immunity. International journal of cancer Journal international du cancer 127: 759-767
Nixon AE, Wood CR (March 2006). "Engineered protein inhibitors of proteases". Curr Opin Drug Discov Devel 9(2): 261-8. PMID 16566296.
Nygren PA (June 2008). "Alternative binding proteins: affibody binding proteins developed from a small three-helix bundle scaffold". FEBS J. 275 (11): 2668-76.
Oakley H, Cole SL, Logan S, Maus E, Shao P, Craft J, Guillozet-Bongaarts A, Ohno M, Disterhoft J, Van Eldik L, Berry R, Vassar R (2006) Intraneuronal beta-amyloid aggregates, neurodegeneration, and neuron loss in transgenic mice with five familial Alzheimer's disease mutations: potential factors in amyloid plaque formation. The Journal of neuroscience: the official journal of the Society for Neuroscience 26: 10129-10140
Ohaegbulam KC, Assal A, Lazar-Molnar E, Yao Y, Zang X (2015) Human cancer immunotherapy with antibodies to the PD-1 and PD-L1 pathway. Trends in molecular medicine 21: 24-33
Pardoll DM (2012) The blockade of immune checkpoints in cancer immunotherapy. Nature reviews Cancer 12: 252-264
Peng W, Liu C, Xu C, Lou Y, Chen J, Yang Y, Yagita H, Overwijk WW, Lizee G, Radvanyi L, Hwu P (2012) PD-1 blockade enhances T-cell migration to tumors by elevating IFN-gamma inducible chemokines. Cancer research 72: 5209-5218
Pere H, Montier Y, Bayry J, Quintin-Colonna F, Merillon N, Dransart E, Badoual C, Gey A, Ravel P, Marcheteau E, Batteux F, Sandoval F, Adotevi O, Chiu C, Garcia S, Tanchot C, Lone YC, Ferreira LC, Nelson BH, Hanahan D, Fridman WH, Johannes L, Tartour E (2011) A CCR4 antagonist combined with vaccines induces antigen-specific CD8+ T cells and tumor immunity against self antigens. Blood 118: 4853-4862
Postow MA, Callahan MK, Wolchok JD (2015) Immune Checkpoint Blockade in Cancer Therapy. Journal of clinical oncology: official journal of the American Society of Clinical Oncology
Qin A, Wen Z, Zhou Y, Li Y, Li Y, Luo J, Ren T, Xu L (2013) MicroRNA-126 regulates the induction and function of CD4(+) Foxp3(+) regulatory T cells through PI3K/AKT pathway. Journal of cellular and molecular medicine 17: 252-264
Rosenkranz D, Weyer S, Tolosa E, Gaenslen A, Berg D, Leyhe T, Gasser T, Stoltze L (2007) Higher frequency of regulatory T cells in the elderly and increased suppressive activity in neurodegeneration. Journal of neuroimmunology 188: 117-127
Roy S, Barik S, Banerjee S, Bhuniya A, Pal S, Basu P, Biswas J, Goswami S, Chakraborty T, Bose A, Baral R (2013) Neem leaf glycoprotein overcomes indoleamine 2,3 dioxygenase mediated tolerance in dendritic cells by attenuating hyperactive regulatory T cells in cervical cancer stage IIIB patients. Human immunology 7A: 1015-1023
Sakaguchi S, Yamaguchi T, Nomura T, Ono M (2008) Regulatory T cells and immune tolerance. Cell 133: 775-787
Saresella M, Calabrese E, Marventano I, Piancone F, Gatti A, Calvo MG, Nemni R, Clerici M (2010) PD1 negative and PD1 positive CD4+ T regulatory cells in mild cognitive impairment and Alzheimer's disease. Journal of Alzheimer's disease: JAD 21: 927-938
Schmidt SD, Nixon RA, Mathews PM (2005) ELISA method for measurement of amyloid-beta levels. Methods in molecular biology 299: 279-297
Schreiber RD, Old LJ, Smyth MJ (2011) Cancer immunoediting: integrating immunity's roles in cancer suppression and promotion. Science 331: 1565-1570
Schwartz M, Baruch K (2014a) Breaking peripheral immune tolerance to CNS antigens in neurodegenerative diseases: boosting autoimmunity to fight-off chronic neuroinflammation. Journal of autoimmunity 54: 8-14
Schwartz M, Baruch K (2014b) The resolution of neuroinflammation in neurodegeneration: leukocyte recruitment via the choroid plexus. The EMBO journal 33: 7-22
Shankar GM, Li S, Mehta TH, Garcia-Munoz A, Shepardson NE, Smith I, Brett FM, Farrell MA, Rowan MJ, Lemere CA, Regan CM, Walsh DM, Sabatini BL, Selkoe DJ (2008) Amyloid-beta protein dimers isolated directly from Alzheimer's brains impair synaptic plasticity and memory. Nature medicine 14: 837-842
Shechter R, London A, Varol C, Raposo C, Cusimano M, Yovel G, Rolls A, Mack M, Pluchino S, Martino G, Jung S, Schwartz M (2009) Infiltrating blood-derived macrophages are vital cells playing an anti-inflammatory role in recovery from spinal cord injury in mice. PLoS medicine 6: e1000113
Shechter R, Miller O, Yovel G, Rosenzweig N, London A, Ruckh J, Kim KW, Klein E, Kalchenko V, Bendel P, Lira SA, Jung S, Schwartz M (2013) Recruitment of beneficial M2 macrophages to injured spinal cord is orchestrated by remote brain choroid plexus. Immunity 38: 555-569
Shevchenko I, Karakhanova S, Soltek S, Link J, Bayry J, Werner J, Umansky V, Bazhin AV (2013) Low-dose gemcitabine depletes regulatory T cells and improves survival in the orthotopic Panc02 model of pancreatic cancer. International journal of cancer Journal international du cancer 133: 98-107
Silverman J, Liu Q, Lu Q, et al. (December 2005). "Multivalent avimer proteins evolved by exon shuffling of a family of human receptor domains". Nat. Biotechnol. 23(12): 1556-61. doi: 10.1038/nbt1166. PMID 16299519.
Simpson TR, Li F, Montalvo-Ortiz W, Sepulveda MA, Bergerhoff K, Arce F, Roddie C, Henry JY, Yagita H, Wolchok JD, Peggs KS, Ravetch JV, Allison JP, Quezada SA (2013) Fc-dependent depletion of tumor-infiltrating regulatory T cells co-defines the efficacy of anti-CTLA-4 therapy against melanoma. The Journal of experimental medicine 210: 1695-1710
Skerra A (June 2008). "Alternative binding proteins: anticalins - harnessing the structural plasticity of the lipocalin ligand pocket to engineer novel binding activities". FEBS J. 275(11): 2677-83. doi: 10.1111/j.1742-4658.2008.06439.x. PMID 18435758.
Smith PM, Howitt MR, Panikov N, Michaud M, Gallini CA, Bohlooly YM, Glickman JN, Garrett WS (2013) The microbial metabolites, short-chain fatty acids, regulate colonic Treg cell homeostasis. Science 341: 569-573
Stumpp MT, Binz HK, Amstutz P (August 2008). "DARPins: a new generation of protein therapeutics". Drug Discov. Today 13 (15-16): 695-701. doi: 10.1016/j.drudis.2008.04.013. PMID 18621567.
Suffner J, Hochweller K, Kuhnle MC, Li X, Kroczek RA, Garbi N, Hammerling GJ (2010) Dendritic cells support homeostatic expansion of Foxp3+ regulatory T cells in Foxp3.LuciDTR mice. Journal of immunology 184: 1810-1820
Terme M, Colussi O, Marcheteau E, Tanchot C, Tartour E, Taieb J (2012) Modulation of immunity by antiangiogenic molecules in cancer. Clinical & developmental immunology 2012: 492920
Thomas-Schoemann A, Batteux F, Mongaret C, Nicco C, Chereau C, Annereau M, Dauphin A, Goldwasser F, Weill B, Lemare F, Alexandre J (2012) Arsenic trioxide exerts antitumor activity through regulatory T cell depletion mediated by oxidative stress in a murine model of colon cancer. Journal of immunology 189: 5171-5177
Torres KC, Araujo Pereira P, Lima GS, Bozzi IC, Rezende VB, Bicalho MA, Moraes EN, Miranda DM, Romano-Silva MA (2013) Increased frequency of T cells expressing IL-10 in Alzheimer disease but not in late-onset depression patients. Progress in neuro-psychopharmacology & biological psychiatry 47: 40-45
Vom Berg J, Prokop S, Miller KR, Obst J, Kalin RE, Lopategui-Cabezas I, Wegner A, Mair F, Schipke CG, Peters O, Winter Y, Becher B, Heppner FL (2012) Inhibition of IL-12/IL-23 signaling reduces Alzheimer's disease-like pathology and cognitive decline. Nature medicine 18: 1812-1819
Voo KS, Bover L, Harline ML, Vien LT, Facchinetti V, Arima K, Kwak LW, Liu YJ (2013) Antibodies targeting human OX40 expand effector T cells and block inducible and natural regulatory T cell function. Journal of immunology 191: 3641-3650
Walsh JT, Zheng J, Smirnov I, Lorenz U, Tung K, Kipnis J (2014) Regulatory T cells in central nervous system injury: a double-edged sword. Journal of immunology 193: 5013-5022
Ward FJ, Dahal LN, Wijesekera SK, Abdul-Jawad SK, Kaewarpai T, Xu H, Vickers MA, Barker RN (2013) The soluble isoform of CTLA-4 as a regulator of T-cell responses. European journal of immunology 43: 1274-1285
Weber JS, Kudchadkar RR, Yu B, Gallenstein D, Horak CE, Inzunza HD, Zhao X, Martinez AJ, Wang W, Gibney G, Kroeger J, Eysmans C, Sarnaik AA, Chen YA (2013) Safety, efficacy, and biomarkers of nivolumab with vaccine in ipilimumab-refractory or -naive melanoma. Journal of clinical oncology: official journal of the American Society of Clinical Oncology 31: 4311-4318
Weber MS, Hohlfeld R, Zamvil SS (2007) Mechanism of action of glatiramer acetate in treatment of multiple sclerosis. Neurotherapeutics: the journal of the American Society for Experimental NeuroTherapeutics 4: 647-653
Weiskopf K, Ring AM, Schnorr PJ, Volkmer JP, Volkmer AK, Weissman IL, Garcia KC (2013) Improving macrophage responses to therapeutic antibodies by molecular engineering of SIRPalpha variants. Oncoimmunology 2: e25773
Wyss-Coray T, Rogers J (2012) Inflammation in Alzheimer disease-a brief review of the basic science and clinical literature. Cold Spring Harbor perspectives in medicine 2: a006346
Zeng J, See AP, Phallen J, Jackson CM, Belcaid Z, Ruzevick J, Durham N, Meyer C, Harris TJ, Albesiano E, Pradilla G, Ford E, Wong J, Hammers HJ, Mathios D, Tyler B, Brem H, Tran PT, Pardoll D, Drake CG, Lim M (2013) Anti-PD-1 blockade and stereotactic radiation produce long-term survival in mice with intracranial gliomas. International journal of radiation oncology, biology, physics 86: 343-349
Zhao L, Sun L, Wang H, Ma H, Liu G, Zhao Y (2007) Changes of CD4+CD25+Foxp3+ regulatory T cells in aged Balb/c mice. Journal of leukocyte biology 81: 1386-1394
Zheng H, Fridkin M, Youdim M (2015) New approaches to treating Alzheimer's disease. Perspectives in medicinal chemistry 7: 1-8
Реферат
Предложенная группа изобретений относится к области медицины. Предложен способ лечения заболеваний центральной нервной системы, выбранных из болезни Альцгеймера и бокового амиотрофического склероза, включающий введение пациенту, нуждающегося в этом, фармацевтической композиции, содержащей анти-ОХ40 антитело или анти-ОХ40L-антитело. Предложено применение анти-ОХ40 антитела или анти-ОХ40L-антитела для производства фармацевтической композиции для лечения заболеваний центральной нервной системы, выбранных из болезни Альцгеймера и бокового амиотрофического склероза, где лечение включает введение пациенту, нуждающегося в этом, фармацевтической композиции, содержащей анти-ОХ40 антитело или анти-ОХ40L-антитело. Предложенная группа изобретений обеспечивает эффективное лечение болезни Альцгеймера и бокового амиотрофического склероза. 2 н. и 12 з.п. ф-лы, 15 ил., 2 табл., 10 пр.

Комментарии