Карбоксамидные соединения и их применение в качестве ингибиторов кальпаина - RU2567392C2
Код документа: RU2567392C2
Описание
Настоящее изобретение относится к новым карбоксамидным соединениям и их применению для получения лекарственного средства. Карбоксамидные соединения являются ингибиторами кальпаина (кальций-зависимых цистеиновых протеиназ). Соответственно, изобретение также относится к применению этих карбоксамидных соединений для лечения расстройства, связанного с повышенной активностью кальпаина.
Кальпаины являются внутриклеточными протеолитическими ферментами из группы цистеиновых протез, и они присутствуют во многих клетках. Фермент кальпаин активируется при повышенной концентрации кальция, при этом различают кальпаин I или μ-кальпаин, который активируется при микромолярных концентрациях ионов кальция, и кальпаин II или м-кальпаин, который активируется при миллимолярных концентрациях ионов кальция. В настоящее время, также высказываются предположения о существовании дополнительных кальпаиновых изоферментов (M.E. Saez et al; Drug Discovery Today 2006, 11 (19/20), pp. 917-923; K. Suzuki et al, Biol. Chem. Hoppe-Seyler, 1995, 376 (9), pp.523-9).
Кальпаины играют важную роль в различных физиологических процессах. Эти процессы включают расщепление различных регуляторных белков, таких как протеинкиназа C, белков цитоскелета, таких как MAP 2 и спектрин, и мышечных белков, разрушение белка при ревматоидном артрите, белков при активации тромбоцитов, нейропептидном метаболизме, белков при митотическом делении, и другие процессы, которые приведены в публикации M.J.Barrett et al, Life Sci. 1991, 48, pp.1659-69; K. Wang et al, Trends in Pharmacol.Sci. 1994, 15, pp. 412-419.
Повышенные уровни кальпаина обнаружены при различных патофизиологических процессах, например: сердечных ишемиях (например, инфаркте миокарда), ишемиях почек, легких, печени или центральной нервной системы (например, инсульте), воспалениях, мышечных дистрофиях, катарактах глаз, диабете, ВИЧ расстройствах, повреждениях центральной нервной системы (например, травме головного мозга), болезни Альцгеймера, болезни Хантингтона, болезни Паркинсона, рассеянном склерозе и других заболеваниях (см. K.K. Wang, выше) и инфекционных заболеваниях, таких как малярия (IM Medana et al, Neuropath and Appl. Neurobiol. 2007, 33, pp.179-192). Предполагают, что существует связь между этими заболеваниям и обычно или постоянно повышенными внутриклеточными уровнями кальция. Это приводит к тому, что кальций-зависимые процессы становятся сверхактивными и больше не подвергаются нормальному физиологическому контролю. Соответствующая сверхактивация кальпаинов может также запускать патофизиологические процессы.
По этой причине, было сделано предположение, что ингибиторы кальпаина могли бы применяться для лечения этих заболеваний. Это предположение было подтверждено рядом исследований. Так, в публикации Seung-Chyul Hong et al, Stroke 1994, 25 (3), pp. 663-669, and R. T. Bartus et al, Neurological Res. 1995, 17, pp. 249-258, было показано, что ингибиторы кальпаина обладают нейропротективным действием при острых нейродегенеративных повреждениях или ишемиях, таких как возникающие после мозгового инсульта. В публикации K.E. Saatman et al, Proc. Natl. Acad. Sci. USA, 1996, 93, pp. 3428-3433 сообщается, что после экспериментальной травмы головного мозга, ингибиторы кальпаина также улучшают восстановление нарушений характеристик памяти и нейромоторных нарушений. В публикации C.L. Edelstein et al, Proc. Natl. Acad. Sci. USA, 1995, 92, pp. 7662-6, было показано, что ингибиторы кальпаина обладают защитным действием в случае пораженных гипоксией почках. В публикации Yoshida, Ken Ischi et al, Jap. Circ. J. 1995, 59 (1), pp. 40-48 было отмечено, что ингибиторы кальпаина оказывают положительное действие после кардиологического повреждения, вызванного ишемией или реперфузией. Ингибитор кальпаина BDA-410 задерживал развитие заражения малярией на экспериментальной модели патогенеза малярии на мышах, как показано в публикации X. Li et al., Mol. Biochem. Parasitol. 2007, 155 (1), pp 26-32.
Более поздние исследования кальпастатина на генетически измененных животных показали, что экспрессия природного ингибитора кальпаина значительно уменьшает патофизиологическое действие активированного кальпаина при экспериментальном гломерулонефрите (J. Peltier et al., J A, Soc Nephrol. 2006, 17, pp. 3415-3423), при сердечно-сосудистом ремоделировании в случае гипертензии, вызванной ангиотензином II, при нарушенной синаптической передаче в случае врожденного миастенического синдрома медленных каналов (Groshong JS et al, J. Clin. Invest. 2007, 117 (10), pp 2903-2912), при эксайтотоксичной фрагментации ДНК через митохондриальные сигнальные пути (J Takano et al, J. Biol. Chem. 2005, 280 (16) pp. 16175-16184), и при некротических процессах в дистрофичных мышцах (M.J. Spencer et al, Hum Mol Gen, 2002, 11(21), pp 2645-2655).
В последние годы было показано, что как функция, так и метаболизм ряда важных белков, принимающих участие в развитии болезни Альцгеймера, модулируются с помощью кальпаина. Различные внешние воздействия, такие как, например, эксайтотоксины, окислительный стресс или же воздействие амилоидного белка, приводят к сверхактивности кальпаина в нервной клетке, вызывающей, в виде каскада, дисрегуляцию ЦНС-специфической киназы cdk5 и затем гиперфосфорилирование так называемого тау-белка. В то время как основная задача тау-белка заключается в стабилизации микротрубочек и, следовательно, цитоскелета, фосфорилированный тау-белок уже больше не способен выполнять эту функцию; цитоскелет разрушается, аксональный транспорт вещества нарушается, и следовательно, в конечном счете, дегенерируется нервная клетка (G. Patrick et al, Nature 1999, 402, pp. 615-622; E. A. Monaco et al; Curr. Alzheimer Res. 2004, 1 (1), pp. 33-38). Накопление фосфорилированного тау-белка дополнительно приводит к образованию так называемых нейрофибриллярных клубков (NFT), которые вместе с хорошо известными амилоидными бляшками представляют собой патологический признак болезни Альцгеймера. Аналогичные изменения в тау-белке, обычно относимые к важной особенности таупатий, также наблюдаются при других (нейро)дегенеративных расстройствах, таких как, например, последствия инсульта, воспаления мозга, паркинсонизм, при нормотензивной гидроцефалии и болезни Крейтцфельда-Якоба.
Участие кальпаина в нейродегенеративных процессах было показано на трансгенных мышах с помощью кальпастатина, специфического и природного ингибитора кальпаинов (Higuchi et al; J. Biol. Chem. 2005, 280 (15), pp. 15229-15237). С помощью ингибитора кальпаина удавалось значительно снижать клинические признаки острого аутоиммунного энцефаломиелита на экспериментальной модели рассеяного склероза на мышах (F. Mokhtarian et al; J. Neuroimmunology 2006, Vol. 180, pp. 135-146). Кроме того, было показано, что, с одной стороны, ингибиторы кальпаина блокируют Αβ-индуцируемую дегенерацию нейронов (Park et al; J. Neurosci. 2005, 25, pp. 5365-5375), и, помимо этого, уменьшают высвобождение β-амилоидного предшественника белка (β APP) (J. Higaki et al, Neuron, 1995, 14, pp. 651-659). Исходя из этого, ингибиторы кальпаина, обладающие достаточной ЦНС доступностью, представляют собой новый терапевтический подход к лечению нейродегенеративных расстройств в целом, а также, в частности, болезни Альцгеймера.
Ингибиторы кальпаина также ингибируют высвобождение интерлейкина-1α (N. Watanabe et al, Cytokine 1994, 6(6), pp. 597-601). Кроме того, было обнаружено, что ингибиторы кальпаина проявляют цитотоксическое действие в отношении опухолевых клеток (E. Shiba et al. 20th Meeting Int. Ass. Breast Cancer Res., Sendai Jp, 1994, 25.-28.Sept., Int. J. Oncol. S(SuppL), 1994, 381).
Только недавно было показано участие кальпаина в ВИЧ расстройствах. Так, было продемонстрировано, что ВИЧ-индуцированная нейротоксичность опосредуется кальпаином (O'Donnell et al; J. Neurosci. 2006, 26 (3), pp. 981-990). Было также показано участие кальпаина в репликации вируса ВИЧ (Teranishi et al; Biochem. Biophys. Res. Comm. 2003, 303 (3), pp. 940-946).
Последние исследования указывают, что кальпаин играет некоторую роль в так называемой ноцицепции, в восприятии боли. Ингибиторы кальпаина продемонстрировали явный положительный эффект на различных соответствующих доклинических моделях боли, например, при термически индуцируемой гипералгезии у крыс (Kunz et al; Pain 2004, 110, pp.409-418), при индуцируемой таксолом нейропатии (Wang et al; Brain 2004, 127, pp.671-679) и при острых и хронических воспалительных процессах (Cuzzocrea et al; American Journal of Pathololgy 2000, 157 (6), pp. 2065-2079).
Недавно было также показано участие кальпаина в развитии заболеваний почек, таких как хронические заболевания почек, например, диабетическая нейропатия. Так, на экспериментальных моделях на животных было продемонстрировано (Y. Shi et al.), что происходит подавление природного ингибитора кальпаина, кальпастатина, во время ишемии/реперфузии почек (Am. J. Physiol. Renal Physiol. 2000, 279, pp. 509-517). Кроме того, было показано на модели острой почечной недостаточности (A. Dnyanmote et al, Toxicology and Applied Pharmacology 2006, 215, pp.146-157), что ингибирование кальпаина посредством сверхэкспрессии кальпастатина снижает развитие повреждение почек, индуцируемое нефротоксическим веществом DCVC (S-(1,2-дихлорвинил)-L-цистеином). Кроме того, было продемонстрировано (Peltier et al.), что активация и секреция кальпаина способствует гломерулярному повреждению на экспериментальной модели гломерулонефрита (J. Am. Soc. Nephrol. 2006, 17, pp. 3415-3423). Было также показано, что ингибиторы кальпаина снижают почечную дисфункцию и повреждение, вызываемое ишемией/реперфузией почек, и, следовательно, они могут применяться для повышения устойчивости почек к их повреждению, связанному с сосудистым хирургическим вмешательством на аорте или с пересадкой почки (P. Chatterjee et al., Biochem. Pharmacol. 2005, 7, pp. 1121-1131).
Кальпаин был также идентифицирован в качестве центрального медиатора, важного для паразитической активности.
Паразиты, такие как малярийный плазмодий Plasmodium falciparum и возбудитель токсоплазмоза Toxoplasma gondii, используют кальпаины клетки-хозяина для облегчения высвобождения из внутриклеточной паразитофорной вакуоли и/или плазматической мембраны хозяина. Ингибирование кальпаина-1 в гипотонически лизированных и вторично уплотненных эритроцитах предотвращало высвобождение паразитов P. falciparum, которое восстанавливали путем добавления очищенного кальпаина-1. Аналогично, эффективный выход T. gondii из фибробластов млекопитающих блокировали либо путем небольшого вмешательства в РНК-опосредованное подавление, либо путем генетического стирания активности кальпаина, и могли восстанавливать путем генетической комплементации (D. Greenbaum et al, Science 324, 794 (2009). Тот факт, что паразиты, которые не могут высвобождаться из клеток-хозяев, не способны к пролиферации, позволяет предложить стратегию для антипаразитарной терапии. Было показано, что фармакологическое ингибирование кальпаина оказывает противомалярийную активность, и, вследствие этого, представляет собой новой подход в антипаразитарной стратегии при лечении заболеваний, вызываемых такими инфекциями, как малярия или токсоплазмоз (Li et al., Mol Biochem Parasitol. 2007; 155(1): 26-32; Jung et al. Archives of Pharmacal Research (2009), 32(6), 899-906, Chandramohanadas et al. Science (2009), 324, 794).
Кроме того, возможные применения ингибиторов кальпаина подробно рассмотрены в публикациях: M.Pietsch et al. Current Topics in Medicinal Chemistry, 2010, 10, 270-293; M.E. Saez et al; Drug Discovery Today 2006, 11 (19/20), pp. 917-923; N. O. Carragher, Curr. Pharm. Design 2006, 12, pp. 615-638; K. K. Wang et al; Drugs of the Future 1998, 23 (7), pp. 741-749; and Trends in Pharmacol.Sci. 1994, 15, pp. 412-419.
Описанные к настоящему времени ингибиторы кальпаина в целом подразделяют на необратимые и обратимые ингибиторы, и на пептидные и непептидные ингибиторы.
Необратимыми ингибиторами обычно являются алкилирующие вещества. Их недостатком является то, что, во-первых, они реагируют неселективно, и/или они не стабильны в организме. Следовательно, соответствующие ингибиторы часто проявляют нежелательные побочные эффекты, такие как токсичность, и поэтому их применение существенно ограничено. Необратимые ингибиторы включают, например, эпоксиды, такие как E64, α-галогенкетоны и дисульфиды.
К большому числу известных обратимых ингибиторов кальпаина относятся пептидные альдегиды, которые получают, в частности, из ди- или трипептидов, таких как, например, Z-Val-Phe-H (MDL 28170). Также описаны производные и пролекарства, структурно получаемые из альдегидов, в частности, соответствующие ацетали и гемиацетали (например, гидрокситетрагидрофураны, гидроксиоксазолиндины, гидроксиморфолины и другие подобные соединения), а также имины или гидразоны. Однако, при физиологических условиях, пептидные альдегиды и родственные соединения обычно имеют недостаток, заключающийся в том, что вследствие их реакционной способности, они часто являются нестабильными, быстро метаболизируются и склонны к неспецифическим реакциям, которые могут также вызывать токсическое действие (J.A. Fehrentz and B.Castro, Synthesis 1983, pp. 676-78).
В последние годы был описан ряд непептидных карбоксамидов, имеющих β-кетофункцию в аминном фрагменте и ингибирующих кальпаин. Так, в WO 98/16512 описаны производные 3-амино-2-оксокарбоновой кислоты, в которых аминогруппу амидируют с помощью соединения 4-пиперидинкарбоновой кислоты. В WO 99/17775 описаны аналогичные соединения, которые амидируют с помощью хинолинкарбоновой кислоты. В WO 98/25883, WO 98/25899 и WO 99/54294 описаны производные 3-амино-2-оксокарбоновой кислоты, аминогруппу которой амидируют с помощью замещенной бензойной кислоты. В WO 99/61423 описаны производные 3-амино-2-оксокарбоновой кислоты, аминогруппу которой амидируют с помощью ароматической карбоновой кислоты, несущей остаток тетрагидрохинолина/изохинолина и 2,3-дигидроиндола/изоиндола. Аналогичные соединения, в которых остаток ароматической карбоновой кислоты несет гетероциклоалкильный радикал или (гетеро)арильный радикал, который необязательно соединен через мостик, описаны в WO 99/54320, WO 99/54310, WO 99/54304 и WO 99/54305. Или же, в WO 08/080969 описаны никотинамиды производных 3-амино-2-оксокарбоновой кислоты, которые в положении 2 пиридинового кольца связаны с замещенным пиразолом через атом азота. В WO 03/080182 описано применение упомянутых выше амидов для лечения легочных заболеваний. Упоминаемые в описании изобретения непептидные ингибиторы кальпаина также имеют ряд недостатков, в частности низкую селективность или ее отсутствие в отношении родственных цистеиновых протеаз, таких как различные катепсины, что также может приводить к нежелательным побочным эффектам.
В WO 07/016589 и WO 08/106130 описаны производные 2-оксокарбоновой кислоты, несущие N-ацилированную 2-пирролидинкарбоксиламидную группу в 3-положении. Кроме того, раскрыто их применение при лечении вирусных инфекций гепатита C.
Было показано, что карбоксамиды, включающие α-кетоамидный фрагмент в аминном компоненте, в частности карбоксамиды, описанные в WO 08/080969, являются высокоэффективными и селективными ингибиторами кальпаина. Однако, как было обнаружено авторами настоящего изобретения, в ряде случаев они имели ограниченную цитозольную стабильность, в частности, у людей, что может приводить к их преждевременному выведению из цитозоля. Вследствие этого, может быть неудовлетворительной фармакокинетика этих соединений.
Считают, что цитозольное разложение указанных карбоксамидных соединений, имеющих α-кетоамидный фрагмент, вызывается в основном метаболическим восстановлением карбонильной функции в α-положении. Восстановление карбонила является важной стадией в фазе I метаболизма карбонилсодержащих лекарственных средств путем превращения альдегидных, кетоновых хиноновых фрагментов в спирты для облегчения выделения с помощью конъюгации или непосредственного выведения фазы II (M.J.C. Rosemond and J.S. Walsh: "Human carbonyl reduction pathways and a strategy for their study in vitro", Drug Metabolism Reviews, 2004, 36, 335-361). Активность по восстановлению карбонила в организме человека проявляется повсеместно, обнаруживается во многих тканях, включая печень, легкие, головной мозг, сердце, почки, и кровь. Было охарактеризовано множество ферментов человека, восстанавливающих карбонил, включая среднецепочечные (MDR) и короткоцепочечные (SDR) дегидрогеназы/редуктазы, альдокеторедуктазы (AKR) и хинонредуктазы (QR), большинство из которых присутствуют в цитозолях печени, кроме некоторого семейства короткоцепочечных ферментов, присутствующих в микросомах печени и митохондриях, описанных в публикации F. Hoffmann and E. Maser: "Carbonyl reductases and pluripotent гидроксиsteroid dehydrogenases of the shortchain dehydrogenases/reductases superfamily", Drug Metabolism Reviews 2007, 39, 87-144.
Следовательно, задачей настоящего изобретения является разработка соединений, которые ингибируют кальпаин с высокой аффинностью и селективностью. Кроме того, предполагается, что соединения должны проявлять повышенную цитозольную стабильность в клетках человека, таких как гепатоциты, и, вследствие этого, улучшенную фармакокинетику.
Решение этой задачи и дополнительных задач достигается за счет применения описанных ниже карбоксамидных соединений общей формулы I, их фармацевтически приемлемых солей, пролекарств, гидратов и таутомеров:
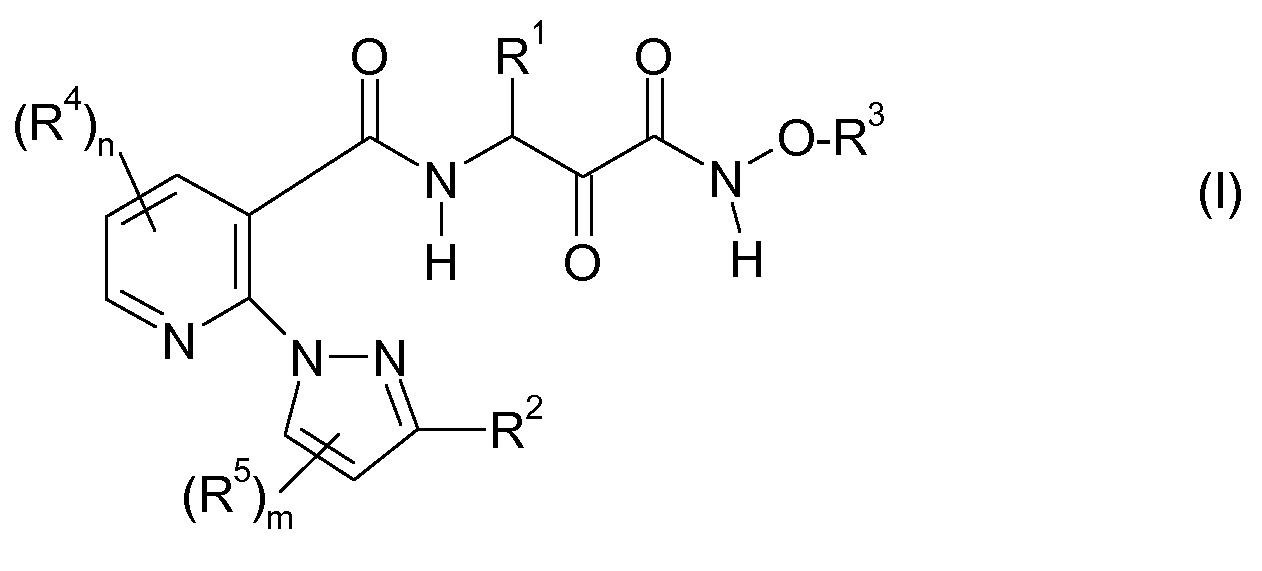
где
R1является C1-C10-алкилом, C2-C10-алкенилом, C2-C10-алкинилом, где последние 3 упомянутые радикалы могут быть частично или полностью галогенированы и/или иметь 1, 2 или 3 заместителя R1a,
C3-C7-циклоалкилом, C3-C7-циклоалкил-C1-C4-алкилом, где CH2 группа в циклоалкильном фрагменте последних двух упомянутых радикалов может быть заменена на O, NH или S, или два смежных атома С могут образовывать двойную связь, где циклоалкильный фрагмент может дополнительно иметь 1, 2, 3 или 4 радикала R1b,
арилом, гетероарилом, арил-C1-C6-алкилом, арил-C2-C6-алкенилом, гетероарил-C1-C4-алкилом или гетероарил-C2-C6-алкенилом, где арил и гетероарил в последних 6 упомянутых радикалах могут быть незамещенными или иметь 1, 2, 3 или 4 одинаковых или различных радикала R1c; где
R1aвыбирают независимо из OH, SH, COOH, CN, OCH2COOH, C1-C6-алкокси, C1-C6-галогеналкокси, C3-C7-циклоалкилокси, C1-C6-алкилтио, C1-C6-галогеналкилтио, COORa1, CONRa2Ra3, SO2NRa2Ra3, -NRa2-SO2-Ra4, NRa2-CO-Ra5, SO2-Ra4 и NRa6Ra7,
R1bвыбирают независимо из OH, SH, COOH, CN, OCH2COOH, галогена, фенила, который необязательно имеет 1, 2 или 3 заместителя R1d,
C1-C6-алкила, C1-C6-алкокси, C1-C6-алкилтио, где алкильные фрагменты в 3 последних упомянутых заместителях могут быть частично или полностью галогенированы и/или иметь 1, 2 или 3 заместителя R1a,
COORb1, CONRb2Rb3, SO2NRb2Rb3, NRb2-SO2-Rb4, NRb2-CO-Rb5, SO2-Rb4 и NRb6Rb7,
кроме того, два R1b радикала могут вместе образовывать C1-C4-алкиленовую группу, или 2 R1b радикала, соединенных со смежными атомами С циклоалкила, могут образовывать вместе с углеродными атомами, к которым они присоединены, также бензольное кольцо.
R1c выбирают независимо из OH, SH, галогена, NO2, NH2, CN, COOH, OCH2COOH, C1-C6-алкила, C1-C6-алкокси, C1-C6-алкокси-C1-C4-алкила, C1-C6-алкилтио, где алкильные фрагменты в последних 4 упомянутых заместителях могут быть частично или полностью галогенированы и/или иметь 1, 2 или 3 заместителя R1a,
C3-C7-циклоалкила, C3-C7-циклоалкил-C1-C4-алкила, C3-C7-циклоалкилокси, где циклоалкильный фрагмент последних трех упомянутых радикалов может иметь 1, 2, 3 или 4 радикала R1b,
арила, гетероарила, O-арила, O-CH2-арила, где последние три упомянутых радикала являются незамещенными в арильном фрагменте или могут иметь 1, 2, 3 или 4 радикала R1d, COORc1, CONRc2Rc3, SO2NRc2Rc3, NRc2-SO2-Rc4, NRc2-CO-Rc5, SO2-Rc4,
-(CH2)p-NRc6Rc7 при p=0, 1, 2, 3, 4, 5 или 6, и
O-(CH2)q-NRc6Rc7 при q=2, 3, 4, 5 или 6; где
Ra1, Rb1 и Rc1 являются независимо H, C1-C6-алкилом, C1-C6-галогеналкилом, C1-C6-алкилом, который имеет 1, 2 или 3 заместителя R1a, или C2-C6-алкенилом, C2-C6-алкинилом, C3-C7-циклоалкилом, C3-C7-циклоалкил-C1-C4-алкилом, C3-C7-гетероциклоалкил-C1-C4-алкилом, C1-C6-алкокси-C1-C4-алкилом, арилом, арил-C1-C4-алкилом, гетероарилом или гетероарил-C1-C4-алкилом, где арил или гетероарил в последних 4 упомянутых радикалах являются незамещенными или имеют 1, 2 или 3 заместителя R1d,
Ra2, Rb2 и Rc2 являются независимо H, C1-C6-алкилом, C1-C6-галогеналкилом, C1-C6-алкилом, который имеет 1, 2 или 3 заместителя R1a, или C2-C6-алкенилом, C2-C6-алкинилом, C3-C7-циклоалкилом, C3-C7-циклоалкил-C1-C4-алкилом, C3-C7-гетероциклоалкил-C1-C4-алкилом, C1-C6-алкокси-C1-C4-алкилом, арилом, арил-C1-C4-алкилом, гетероарилом или гетероарил-C1-C4-алкилом, где арил или гетероарил в последних 4 упомянутых радикалах являются незамещенными или имеют 1, 2 или 3 заместителя R1d, и
Ra3, Rb3 и Rc3 являются независимо H, C1-C6-алкилом, C1-C6-галогеналкилом, C1-C6-алкилом, который имеет 1, 2 или 3 заместителя R1a, или C2-C6-алкенилом, C2-C6-алкинилом, C3-C7-циклоалкилом, C3-C7-циклоалкил-C1-C4-алкилом, C3-C7-гетероциклоалкил-C1-C4-алкилом, C1-C6-алкокси-C1-C4-алкилом, арилом, арил-C1-C4-алкилом, гетероарилом или гетероарил-C1-C4-алкилом, где арил или гетероарил в последних 4 упомянутых радикалах являются незамещенными или имеют 1, 2 или 3 заместителя R1d, или
два радикала Ra2 и Ra3, или Rb2 и Rb3, или Rc2 и Rc3 образуют вместе с атомом N необязательно замещенный азотсодержащий 3-7-членный гетероцикл, который может необязательно иметь 1, 2 или 3 дополнительных различных или одинаковых гетероатома из группы O, N, S в качестве членов кольца,
Ra4, Rb4 и Rc4 являются независимо C1-C6-алкилом, C1-C6-галогеналкилом, C1-C6-алкилом, который имеет 1, 2 или 3 заместителя R1a, или C2-C6-алкенилом, C2-C6-алкинилом, C3-C7-циклоалкилом, C3-C7-циклоалкил-C1-C4-алкилом, C3-C7-гетероциклоалкил-C1-C4-алкилом, C1-C6-алкокси-C1-C4-алкилом, арилом, арил-C1-C4-алкилом, гетероарилом или гетероарил-C1-C4-алкилом, где арил или гетероарил в последних 4 упомянутых радикалах являются незамещенными или имеют 1, 2 или 3 заместителя R1d, и
Ra5, Rb5 и Rc5 имеют независимо одно из значений, упомянутых для Ra1, Rb1 и Rc1;
Ra6, Rb6 и Rc6 являются независимо H, C1-C6-алкилом, C1-C6-алкокси, C1-C6-галогеналкилом, C1-C6-алкилом, который имеет 1, 2 или 3 заместителя R1a, или C2-C6-алкенилом, C2-C6-алкинилом, C3-C7-циклоалкилом, C3-C7-циклоалкил-C1-C4-алкилом, C3-C7-гетероциклоалкил-C1-C4-алкилом, C1-C6-алкокси-C1-C4-алкилом, CO-C1-C6-алкилом, CO-O-C1-C6-алкилом, SO2-C1-C6-алкилом, арилом, гетероарилом, O-арилом, OCH2-арилом, арил-C1-C4-алкилом, гетероарил-C1-C4-алкилом, CO-арилом, CO-гетероарилом, CO-(арил-C1-C4-алкил), CO-(гетероарил-C1-C4-алкил), CO-O-арилом, CO-O-гетероарилом, CO-O-(арил-C1-C4-алкил), CO-O-(гетероарил-C1-C4-алкил), SO2-арилом, SO2-гетероарилом, SO2-(арил-C1-C4-алкил) или SO2-(гетероарил-C1-C4-алкил), где арил или гетероарил в последних 18 упомянутых радикалах являются незамещенными или имеют 1, 2 или 3 заместителя R1d, и
Ra7, Rb7 и Rc7 являются независимо H, C1-C6-алкилом, C1-C6-галогеналкилом, C1-C6-алкилом, который имеет 1, 2 или 3 заместителя R1a, или C2-C6-алкенилом, C2-C6-алкинилом, C3-C7-циклоалкилом, C3-C7-циклоалкил-C1-C4-алкилом, C3-C7-гетероциклоалкил-C1-C4-алкилом, C1-C6-алкокси-C1-C4-алкилом, арилом, арил-C1-C4-алкилом, гетероарилом или гетероарил-C1-C4-алкилом, где арил или гетероарил в последних 4 упомянутых радикалах являются незамещенными или имеют 1, 2 или 3 заместителя R1d, или
два радикала Ra6и Ra7, или Rb6 и Rb7, или Rc6 и Rc7 образуют вместе с атомом N необязательно замещенный азотсодержащий 3-7-членный гетероцикл, который может необязательно иметь 1, 2 или 3 дополнительных различных или одинаковых гетероатома из группы O, N, S в качестве членов кольца,
или два радикала R1b, или два радикала R1c, соединенных со смежными атомами С, образуют вместе с атомами С, с которыми они соединены, 4, 5, 6 или 7-членный необязательно замещенный карбоцикл или необязательно замещенный гетероцикл, который имеет 1, 2 или 3 различных или одинаковых гетероатома из группы O, N и S в качестве членов кольца;
R1d выбирают из галогена, OH, SH, NO2, COOH, C(O)NH2, CHO, CN, NH2, OCH2COOH, C1-C6-алкила, C1-C6-галогеналкила, C1-C6-алкокси, C1-C6-галогеналкокси, C1-C6-алкилтио, C1-C6-галогеналкилтио, CO-C1-C6-алкила, CO-O-C1-C6-алкила, NH-C1-C6-алкила, NHCHO, NH-C(O)C1-C6-алкила и SO2-C1-C6-алкила;
R2 является C3-C7-циклоалкилом, C3-C7-циклоалкил-C1-C4-алкилом, где CH2 группа в циклоалкильном фрагменте последних двух упомянутых радикалов может быть заменена на O, NH или S, или два смежных атома С могут образовывать двойную связь, где циклоалкильный фрагмент может дополнительно иметь 1, 2, 3 или 4 радикала R2b;
арилом, O-арилом, O-CH2-арилом, гетероарилом, арил-C1-C6-алкилом, арил-C2-C6-алкенилом, гетероарил-C1-C4-алкилом или гетероарил-C2-C6-алкенилом, где арил или гетероарил в последних 8 упомянутых радикалах могут быть незамещенными или иметь 1, 2, 3 или 4 одинаковых или различных радикала R2c; где
R2b имеет одно из значений, указанных для R1b, и
R2c имеет одно из значений, указанных для R1c;
R3 является C1-C4-галогеналкилом или C1-C6-алкилом, C3-C6-алкенилом, C3-C6-алкинилом, C3-C6-циклоалкилом, C3-C6-циклоалкил-C1-C2-алкилом, C3-C6-гетероциклоалкил-C1-C2-алкилом, C1-C4-алкокси-C1-C2-алкилом, где алкил, алкенил, алкокси, алкинил, циклоалкил, гетероциклоалкил в последних 7 упомянутых радикалах являются незамещенными или имеют 1, 2 или 3 заместителя Rxa,
арилом, арил-C1-C4-алкилом, гетероарилом или гетероарил-C1-C4-алкилом, где арил или гетероарил в последних 4 упомянутых радикалах являются незамещенными или имеют 1, 2 или 3 заместителя Rxd,
где Rxa имеет одно из значений, указанных для R1a, и Rxd имеет одно из значений, указанных для R1d;
R4 и R5 выбирают независимо из галогена, NH2, CN, CF3, CHF2, CH2F, O-CF3, O-CHF2, O-CH2F, COOH, OCH2COOH, C1-C2-алкила, C1-C2-алкокси, C1-C2-алкокси-C1-C2-алкила, C1-C2-алкилтио, CH2NRR', где
R и R' выбирают независимо из водорода и C1-C4-алкила;
m является 0, 1 или 2; и
n является 0, 1 или 2.
Следовательно, настоящее изобретение, относится к карбоксамидным соединениям общей формулы I, их таутомерам, гидратам, фармацевтически приемлемым солям карбоксамидных соединений общей формулы I, пролекарствам карбоксамидных соединений общей формулы I и фармацевтически приемлемым солям пролекарств, таутомеров или гидратов карбоксамидных соединений общей формулы I.
Карбоксамидные соединения изобретения формулы I, их соли, их пролекарства, их гидраты и их таутомеры эффективно ингибируют кальпаин даже при низких концентрациях. Кроме того, они отличаются высокой селективностью в отношении ингибирования кальпаина по сравнению с другими цистеиновыми протеазами, такими как катепсин B, катепсин K, катепсин L и катепсин S, и их повышенной устойчивостью к цитозольному разложению.
Поэтому, карбоксамидные соединения изобретения формулы I, их соли, их пролекарства, их гидраты и их таутомеры особенно подходят для лечения расстройств и состояний у животных, в частности у людей, которые связаны с повышенной активностью кальпаина.
Следовательно, изобретение также относится к применению карбоксамидных соединений формулы I, их таутомеров, их гидратов и их фармацевтически приемлемых солей для получения лекарственного средства, в частности лекарственного средства, которое применяют для лечения расстройства или состояния, которое связано с повышенной активностью кальпаина.
Кроме того, изобретение относится к лекарственному средству, в частности лекарственному средству, которое применяют для лечения расстройства или состояния, которое связано с повышенной активностью кальпаина. Лекарственное средство включает, по меньшей мере, одно описанное в изобретении карбоксамидное соединение формулы I, таутомер, гидрат или пролекарство соединения формулы I, или фармацевтически приемлемую соль соединения формулы I или таутомера, гидрата или пролекарства соединения формулы I.
Настоящее изобретение также относится к карбоксамидным соединениям, которые выбирают из группы, состоящей из
1-бензил-N-(4-(этоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамида, его стереоизомеров (2R)-1-бензил-N-(4-(этоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамида и (2S)-1-бензил-N-(4-(этоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамида, а также смесей этих стереоизомеров,
1-бензил-N-(4-(изопропоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамида, его стереоизомеров (2R)-1-бензил-N-(4-(изопропоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамида и (2S)-1-бензил-N-(4-(изопропоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамида, а также смесей этих стереоизомеров,
1-бензил-N-(4-(циклопропилметоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамида, его стереоизомеров (2R)-1-бензил-N-(4-(циклопропилметоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамида и (2S)-1-бензил-N-(4-(циклопропилметоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамида, а также смесей этих стереоизомеров,
1-(2-фторбензил)-N-(4-(метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамида, его стереоизомеров (2R)-1-(2-фторбензил)-N-(4-(метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамида и (2-S)-1-(2-фтор-бензил)-N-(4-(метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамида, а также смесей этих стереоизомеров,
1-(2-хлорбензил)-N-(4-(метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамида, его стереоизомеров (2R)-1-(2-хлорбензил)-N-(4-(метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамида и (2S)-1-(2-хлорбензил)-N-(4-(метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамида, а также смесей этих стереоизомеров, и их таутомеров, их гидратов, их пролекарств и их фармацевтически приемлемых солей.
Эти карбоксамидные соединения, их соли, их пролекарства, их гидраты и их таутомеры, подобные соединениям формулы I, эффективно ингибируют кальпаин даже при низких концентрациях. Кроме того, они отличаются высокой селективностью в отношении ингибирования кальпаина по сравнению с другими цистеиновыми протеазами, такими как катепсин B, катепсин K, катепсин L и катепсин S, и их повышенной устойчивостью к цитозольному разложению. Поэтому, эти карбоксамидные соединения особенно подходят для лечения расстройств и состояний у животных, в частности у людей, которые связаны с повышенной активностью кальпаина. Следовательно, изобретение также относится к применению этих карбоксамидных соединений, их таутомеров, их гидратов и их фармацевтически приемлемых солей для получения лекарственного средства, в частности лекарственного средства, которое применяют для лечения расстройства или состояния, которое связано с повышенной активностью кальпаина, описанных в изобретении для соединений формулы I. Что касается таутомеров, гидратов, фармацевтически приемлемых солей или пролекарств, то они относятся к соединениям формулы I.
Карбоксамидные соединения формулы I могут присутствовать в форме α-кетоамида, показанного в формуле I. В качестве варианта, они могут также присутствовать в форме гидрата, то есть, кетогруппу в α-положении относительно амидного фрагмента в аминном компоненте трансформируют в две присоединенных к одному и тому же атому гидроксильных группы, как показано в формуле I-H ниже. R1, R2, R3, R4, R5, m и n в формуле I-H имеют упомянутые выше значения.

В присутствии воды, особенно при физиологических условиях, обычно обе и α-кетоамидная форма, и гидратная форма присутствуют в смеси.
Когда в следующих далее формулах и описаниях указывается только α-кетоамидная форма, предполагается, что она включает также гидрат и его смеси с α-кетоамидной формой, если не указано иное. Гидраты и α-кетоамидные формы в равной степени подходят в качестве ингибиторов кальпаина.
Карбоксамидные соединения изобретения формулы I также способны образовывать таутомеры, которые в равной степени подходят в качестве ингибиторов кальпаина. Конкретными примерами таутомеров, которые могут быть упомянуты, являются соединения формулы I-T:

R1, R2, R3, R4, R5, m и n в формуле I-T имеют упомянутые выше значения.
Карбоксамидные соединения изобретения формулы I могут также образовывать гемиацетали, гемикетали, ацетали или кетали с алканолами. Эти соединения в равной степени подходят в качестве ингибиторов кальпаина, так как они являются пролекарствами соединений формулы I. Соответственно, соединения, в которых одна или обе геминальных гидроксильных группы, показанные в формуле I-H, являются радикалом, полученным из алканола, и, в частности, C1-C6-алкокси, могут также быть использованы согласно изобретению.
Используемый в описании и пунктах формулы изобретения термин "пролекарство" относится к соединению, которое трансформируется в условиях метаболизма в соединение формулы I. Помимо упомянутых выше гемиацеталей, гемикеталей, ацеталей и кеталей, пролекарства соединений формулы I включают соединения формулы I, в которых атом кислорода кетогруппы в α-положении к амидному фрагменту заменяют группой O-Alk-O, S-Alk-O или S-Alk-S, где Alk является линейным C2-C5-алкандиилом, который может быть незамещенным или замещенным с помощью 1, 2, 3 или 4 радикалов, выбранных из C1-C4-алкила или галогена, и примеры таких групп включают O(CH2)2O, O(CH2)5O, O(CH2)4O, S(CH2)2O, S(CH2)5O, S(CH2)4O и другие группы. Кроме того, пролекарства соединений формулы I включают соединения формулы I, в которых кетогруппа в α-положении к амидному фрагменту заменена на группу C=NR6, где R6 выбирают из H, C1-C6-алкила, C1-C6-алкокси, C2-C6-алкенила, C3-C6-циклоалкила, C3-C6-циклоалкил-C1-C4-алкила, C2-C6-алкенилокси, C3-C6-циклоалкилокси, C3-C6-циклоалкил-C1-C4-алкилокси. В условиях метаболизма, упомянутые выше пролекарства трансформируются в соответствующие α-кетоамидные соединения формулы I или в соответствующие гидраты формулы I-H. Следовательно, указанные пролекарства и их фармацевтически приемлемые соли являются также частью изобретения.
В равной степени возможно использование фармацевтически приемлемых солей карбоксамидных соединений формулы I, их таутомеров, их гидратов или их пролекарств, особенно, солей присоединения кислоты с физиологически приемлемыми органическими или неорганическими кислотами. Примерами подходящих физиологически приемлемых органических и неорганических кислот являются хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота, азотная кислота, серная кислота, органические сульфоновые кислоты, имеющие от 1 до 12 углеродных атомов, например, C1-C4-алкилсульфоновые кислоты, такие как метансульфоновая кислота, циклоалифатические сульфоновые кислоты, такие как S-(+)-10-камфорсульфоновые кислоты, и ароматические сульфоновые кислоты, такие как бензолсульфоновая кислота и толуолсульфоновая кислота, ди- и трикарбоновые кислоты и гидроксикарбоновые кислоты, имеющие от 2 до 10 углеродных атомов, такие как щавелевая кислота, малоновая кислота, малеиновая кислота, фумаровая кислота, слизевая кислота, молочная кислота, винная кислота, лимонная кислота, гликолевая кислота и адипиновая кислота, а также цис- и транс-коричная кислота, фуран-2-карбоновая кислота и бензойная кислота. Другие подходящие кислоты описаны в публикации Fortschritte der Arzneimittelforschung, Volume 10, pages 224 et seq., Birkhauser Verlag, Basel and Stuttgart, 1966. Физиологически приемлемые соли соединений формулы I могут находиться в форме моно-, ди-, три- или тетрасолей, подразумевая, что они могут включать 1, 2, 3 или 4 молекулы упомянутой выше кислоты на молекулу соединения формулы I. Молекулы кислоты могут присутствовать в кислотной форме или в виде аниона.
Соединения изобретения могут находиться в форме смеси диастереомеров, или смеси диастереомеров, которая обогащена одним из двух диастереомеров, или по существу диастереомерно чистых соединений (диастереомерный избыток de >90%). Предпочтительно, чтобы соединения находились в форме по существу диастереомерно чистых соединений (диастереомерный избыток de >90%). Кроме того, соединения формулы I изобретения могут находиться в форме смеси энантиомеров (например, в виде рацемата), смеси энантиомеров, которая обогащена одним из двух энантиомеров, или по существу энантиомерно чистых соединений (энантиомерный избыток ee >90%). Однако, соединения изобретения часто склонны к рацемизации относительно стереохимии углеродного атома, который несет радикал R1, так что часто получают смеси относительно этого углеродного атома, или соединения, которые характеризуются одной и той же стереохимией относительно этого атома C, образуют смеси при физиологических условиях. Однако, относительно других стереоцентров и связанного с ними наличия энантиомеров и диастереомеров, предпочтительно использовать энантиомерно чистые или диастереомерно чистые соединения.
В контексте настоящего описания, если не указано иное, то термины "алкил", "алкокси", "алкилтио", "галогеналкил", "галогеналкокси", "галогеналкилтио", "алкенил", "алкинил", "алкилен" и радикалы, полученные из них, всегда включают как неразветвленный, так и разветвленный "алкил", "алкокси", "алкилтио", "галогеналкил", "галогеналкокси", "галогеналкилтио", "алкенил", "алкинил" и "алкилен", соответственно.
Префикс Cn-Cm- указывает на соответствующее число углеродов в углеводородном звене. Если не указано иное, то предпочтительно, чтобы галогенированные заместители имели от одного до пяти одинаковых или различных атомов галогена, в частности атомов фтора или атомов хлора. C0-Алкилен или (CH2)0, или аналогичные выражения в контексте описания, обозначают одинарную химическую связь, если не указано иначе.
Термин "галоген" в каждом случае обозначает фтор, бром, хлор или йод, в частности фтор, хлор или бром.
Примерами других значений являются:
Алкил и алкильные фрагменты, например, в алкокси, алкилтио, арилалкиле, гетероарилалкиле, циклоалкилалкиле или алкоксиалкиле: насыщенные линейные или разветвленные углеводородные радикалы, имеющие один или более атомов C, например, от 1 до 4, от 1 до 6, или от 1 до 10 углеродных атомов, например, C1-C6-алкил, такой как метил, этил, пропил, 1-метилэтил, бутил, 1-метилпропил, 2-метилпропил, 1,1-диметилэтил, пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 2,2-диметилпропил, 1-этилпропил, гексил, 1,1-диметилпропил, 1,2-диметилпропил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 1,1-ди-метилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,2-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1-этил-1-метилпропил, 1-этил-2-метилпропил. В одном варианте осуществления изобретения, алкил представляет небольшие алкильные группы, такие как C1-C4-алкил. В другом варианте осуществления изобретения, алкил представляет более крупные алкильные группы, такие как C5-C10-алкил.
Галогеналкил: упомянутый выше алкильный радикал, имеющий обычно от 1 до 6, или от 1 до 4 атомов C, в котором атомы водорода частично или полностью заменены на атомы галогена, такие как фтор, хлор, бром и/или йод, например, хлорметил, дихлорметил, трихлорметил, фторметил, дифторметил, трифторметил, хлорфторметил, дихлорфторметил, хлордифторметил, 2-фторэтил, 2-хлорэтил, 2-бромэтил, 2-йодэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, 2-хлор-2-фторэтил, 2-хлор-2,2-дифторэтил, 2,2-дихлор-2-фторэтил, 2,2,2-трихлорэтил, пентафторэтил, 2-фторпропил, 3-фторпропил, 2,2-дифторпропил, 2,3-дифторпропил, 2-хлорпропил, 3-хлорпропил, 2,3-дихлорпропил, 2-бромпропил, 3-бромпропил, 3,3,3-трифторпропил, 3,3,3-трихлорпропил, 2,2,3,3,3-пентафторпропил, гептафторпропил, 1-(фторметил)-2-фторэтил, 1-(хлорметил)-2-хлорэтил, 1-(бромметил)-2-бромэтил, 4-фторбутил, 4-хлорбутил, 4-бромбутил и нонафторбутил.
Циклоалкил и циклоалкильные фрагменты, например, в циклоалкокси или циклоалкил-C1-C6-алкиле: моноциклические насыщенные углеводородные группы, имеющие три или более атомов C, например 3, 4, 5, 6 или 7 углеродных членов кольца, такие как циклопропил, циклобутил, циклопентил, циклогексил.
Алкенил и алкенильные фрагменты, например, в арил-(C2-C6)-алкениле: мононенасыщенные линейные или разветвленные углеводородные радикалы, имеющие два или более атомов C, например, от 2 до 4, от 2 до 6 или от 2 до 10 углеродных атомов, и одну двойную связь в любом положении, например, C2-C6-алкенил, такой как этенил, 1-пропенил, 2-пропенил, 1-метилэтенил, 1-бутенил, 2-бутенил, 3-бутенил, 1-метил-1-пропенил, 2-метил-1-пропенил, 1-метил-2-пропенил, 2-метил-2-пропенил, 1-пентенил, 2-пентенил, 3-пентенил, 4-пентенил, 1-метил-1-бутенил, 2-метил-1-бутенил, 3-метил-1-бутенил, 1-метил-2-бутенил, 2-метил-2-бутенил, 3-метил-2-бутенил, 1-метил-3-бутенил, 2-метил-3-бутенил, 3-метил-3-бутенил, 1,1-диметил-2-пропенил, 1,2-диметил-1-пропенил, 1,2-диметил-2-пропенил, 1-этил-1-пропенил, 1-этил-2-пропенил, 1-гексенил, 2-гексенил, 3-гексенил, 4-гексенил, 5-гексенил, 1-метил-1-пентенил, 2-метил-1-пентенил, 3-метил-1-пентенил, 4-метил-1-пентенил, 1-метил-2-пентенил, 2-метил-2-пентенил, 3-метил-2-пентенил, 4-метил-2-пентенил, 1-метил-3-пентенил, 2-метил-3-пентенил, 3-метил-3-пентенил, 4-метил-3-пентенил, 1-метил-4-пентенил, 2-метил-4-пентенил, 3-метил-4-пентенил, 4-метил-4-пентенил, 1,1-диметил-2-бутенил, 1,1-диметил-3-бутенил, 1,2-диметил-1-бутенил, 1,2-диметил-2-бутенил, 1,2-диметил-3-бутенил, 1,3-диметил-1-бутенил, 1,3-диметил-2-бутенил, 1,3-диметил-3-бутенил, 2,2-диметил-3-бутенил, 2,3-диметил-1-бутенил, 2,3-диметил-2-бутенил, 2,3-диметил-3-бутенил, 3,3-диметил-1-бутенил, 3,3-диметил-2-бутенил, 1-этил-1-бутенил, 1-этил-2-бутенил, 1-этил-3-бутенил, 2-этил-1-бутенил, 2-этил-2-бутенил, 2-этил-3-бутенил, 1,1,2-триметил-2-пропенил, 1-этил-1-метил-2-пропенил, 1-этил-2-метил-1-пропенил, 1-этил-2-метил-2-пропенил.
Алкинил: линейные или разветвленные углеводородные группы, имеющие два или более атомов C, например, от 2 до 4, от 2 до 6 или от 2 до 10 углеродных атомов, и одну или две тройных связей в любом положении, но не смежных, например, C2-C6-алкинил, такой как этенил, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил, 3-бутинил, 1-метил-2-пропинил, 1-пентинил, 2-пентинил, 3-пентинил, 4-пентинил, 1-метил-2-бутинил, 1-метил-3-бутинил, 2-метил-3-бутинил, 3-метил-1-бутинил, 1,1-диметил-2-пропинил, 1-этил-2-пропинил, 1-гексинил, 2-гексинил, 3-гексинил, 4-гексинил, 5-гексинил, 1-метил-2-пентинил, 1-метил-3-пентинил, 1-метил-4-пентинил, 2-метил-3-пентинил, 2-метил-4-пентинил, 3-метил-1-пентинил, 3-метил-4-пентинил, 4-метил-1-пентинил, 4-метил-2-пентинил, 1,1-диметил-2-бутинил, 1,1-диметил-3-бутинил, 1,2-диметил-3-бутинил, 2,2-диметил-3-бутинил, 3,3-диметил-1-бутинил, 1-этил-2-бутинил, 1-этил-3-бутинил, 2-этил-3-бутинил, 1-этил-1-метил-2-пропинил.
Алкокси или алкоксильные фрагменты, например, в алкоксиалкиле:
Определенный выше алкил, имеющий, предпочтительно, от 1 до 6, или от 1 до 4 атомов C, который присоединен через атом O: например, метокси, этокси, н-пропокси, 1-метилэтокси, бутокси, 1-метилпропокси, 2-метилпропокси или 1,1-диметилэтокси, пентокси, 1-метилбутокси, 2-метилбутокси, 3-метилбутокси, 1,1-диметилпропокси, 1,2-диметилпропокси, 2,2-диметилпропокси, 1-этилпропокси, гексокси, 1-метилпентокси, 2-метилпентокси, 3-метилпентокси, 4-метилпентокси, 1,1-диметилбутокси, 1,2-диметилбутокси, 1,3-диметилбутокси, 2,2-диметилбутокси, 2,3-диметилбутокси, 3,3-диметилбутокси, 1-этилбутокси, 2-этилбутокси, 1,1,2-триметилпропокси, 1,2,2-триметилпропокси, 1-этил-1-метилпропокси или 1-этил-2-метилпропокси.
Галогеналкокси: описанный выше алкокси, в котором атомы водорода этих групп частично или полностью заменены на атомы галогена, то есть, например, C1-C6-галогеналкокси, такой как хлорметокси, дихлорметокси, трихлорметокси, фторметокси, дифторметокси, трифторметокси, хлорфторметокси, дихлорфторметокси, хлордифторметокси, 2-фторэтокси, 2-хлорэтокси, 2-бромэтокси, 2-йодэтокси, 2,2-дифторэтокси, 2,2,2-трифторэтокси, 2-хлор-2-фторэтокси, 2-хлор-2,2-дифторэтокси, 2,2-дихлор-2-фторэтокси, 2,2,2-трихлорэтокси, пентафторэтокси, 2-фторпропокси, 3-фторпропокси, 2,2-дифторпропокси, 2,3-дифторпропокси, 2-хлорпропокси, 3-хлорпропокси, 2,3-дихлорпропокси, 2-бромпропокси, 3-бромпропокси, 3,3,3-трифторпропокси, 3,3,3-трихлорпропокси, 2,2,3,3,3-пентафторпропокси, гептафторпропокси, 1-(фторметил)-2-фторэтокси, 1-(хлорметил)-2-хлорэтокси, 1-(бромметил)-2-бромэтокси, 4-фторбутокси, 4-хлорбутокси, 4-бромбутокси, нонафторбутокси, 5-фтор-1-пентокси, 5-хлор-1-пентокси, 5-бром-1-пентокси, 5-йод-1-пентокси, 5,5,5-трихлор-1-пентокси, ундекафторпентокси, 6-фтор-1-гексокси, 6-хлор-1-гексокси, 6-бром-1-гексокси, 6-йод-1-гексокси, 6,6,6-трихлор-1-гексокси или додекафторгексокси, в частности хлорметокси, фторметокси, дифторметокси, трифторметокси, 2-фторэтокси, 2-хлорэтокси или 2,2,2-трифторэтокси.
Алкоксиалкил: алкильный радикал, обычно имеющий от 1 до 4 атомов C, в котором один атом водорода заменен на алкоксильный радикал, обычно имеющий от 1 до 6, или от 1 до 4 атомов C. Его примерами являются CH2-OCH3, CH2-OC2H5, н-пропоксиметил, CH2-OCH(CH3)2, н-бутоксиметил, (1-метилпропокси)метил, (2-метилпропокси)метил, CH2-OC(CH3)3, 2-(метокси)этил, 2-(этокси)этил, 2-(н-пропокси)этил, 2-(1-метилэтокси)этил, 2-(н-бутокси)этил, 2-(1-метилпропокси)этил, 2-(2-метилпропокси)этил, 2-(1,1-диметилэтокси)этил, 2-(метокси)пропил, 2-(этокси)пропил, 2-(н-пропокси)пропил, 2-(1-метилэтокси)пропил, 2-(н-бутокси)пропил, 2-(1-метилпропокси)пропил, 2-(2-метилпропокси)пропил, 2-(1,1-диметилэтокси)пропил, 3-(метокси)пропил, 3-(этокси)пропил, 3-(н-пропокси)пропил, 3-(1-метилэтокси)пропил, 3-(н-бутокси)пропил, 3-(1-метилпропокси)пропил, 3-(2-метилпропокси)пропил, 3-(1,1-диметилэтокси)пропил, 2-(метокси)бутил, 2-(этокси)бутил, 2-(н-пропокси)бутил, 2-(1-метилэтокси)бутил, 2-(н-бутокси)бутил, 2-(1-метилпропокси)бутил, 2-(2-метилпропокси)бутил, 2-(1,1-диметилэтокси)бутил, 3-(метокси)бутил, 3-(этокси)бутил, 3-(н-пропокси)бутил, 3-(1-метилэтокси)бутил, 3-(н-бутокси)бутил, 3-(1-метилпропокси)бутил, 3-(2-метилпропокси)бутил, 3-(1,1-диметилэтокси)бутил, 4-(метокси)бутил, 4-(этокси)бутил, 4-(н-пропокси)бутил, 4-(1-метилэтокси)бутил, 4-(н-бутокси)бутил, 4-(1-метилпропокси)бутил, 4-(2-метилпропокси)бутил, 4-(1,1-диметилэтокси)бутил и другие.
Алкилтио: определенный выше алкил, предпочтительно имеющий от 1 до 6, или от 1 до 4 атомов C, который присоединен через атом S, например, метилтио, этилтио, н-пропилтио и тому подобные.
Галогеналкилтио: определенный выше галогеналкил, предпочтительно имеющий от 1 до 6, или от 1 до 4 атомов C, который присоединен через атом S, например, фторметилтио, дифторметилтио, трифторметилтио, 2-фторэтилтио, 2,2-дифторэтилтио, 2,2,2-трифторэтилтио, пентафторэтилтио, 2-фторпропилтио, 3-фторпропилтио, 2,2-дифторпропилтио, 2,3-дифторпропилтио и гептафторпропилтио.
Арил: моно-, би- или трициклический ароматический углеводородный радикал, такой как фенил или нафтил, особенно фенил.
Гетероциклил: гетероциклический радикал, который может быть насыщенным или частично ненасыщенным или ароматическим, и который обычно имеет 3, 4, 5, 6, 7 или 8 атомов кольца, где обычно 1, 2, 3 или 4, в частности 1, 2 или 3, из атомов кольца являются гетероатомами, такими как N, S или O, помимо углеродных атомов в качестве членов кольца.
Примерами насыщенных гетероциклов являются, в частности:
Гетероциклоалкил: то есть, насыщенный гетероциклический радикал, который обычно имеет 3, 4, 5, 6 или 7 атомов кольца, где обычно 1, 2 или 3 из атомов кольца являются гетероатомами, такими как N, S или O, помимо углеродных атомов в качестве членов кольца. Они включают, например:
Соединенные с атомом С 3-4-членные насыщенные кольца, такие как
2-оксиранил, 2-оксетанил, 3-оксетанил, 2-азиридинил, 3-тиетанил, 1-азетидинил, 2-азетидинил.
Соединенные с атомом С 5-членные насыщенные кольца, такие как
тетрагидрофуран-2-ил, тетрагидрофуран-3-ил, тетрагидротиен-2-ил, тетрагидротиен-3-ил, тетрагидропиррол-2-ил, тетрагидропиррол-3-ил, тетрагидропиразол-3-ил, тетрагидропиразол-4-ил, тетрагидроизоксазол-3-ил, тетрагидроизоксазол-4-ил, тетрагидро-изоксазол-5-ил, 1,2-оксатиолан-3-ил, 1,2-оксатиолан-4-ил, 1,2-оксатиолан-5-ил, тетрагидроизотиазол-3-ил, тетрагидроизотиазол-4-ил, тетрагидроизотиазол-5-ил, 1,2-дитиолан-3-ил, 1,2-дитиолан-4-ил, тетрагидроимидазол-2-ил, тетрагидроимидазол-4-ил, тетрагидрооксазол-2-ил, тетрагидрооксазол-4-ил, тетрагидрооксазол-5-ил, тетрагидротиазол-2-ил, тетрагидротиазол-4-ил, тетрагидротиазол-5-ил, 1,3-диоксолан-2-ил, 1,3-диоксолан-4-ил, 1,3-оксатиолан-2-ил, 1,3-оксатиолан-4-ил, 1,3-оксатиолан-5-ил, 1,3-дитиолан-2-ил, 1,3-дитиолан-4-ил, 1,3,2-диоксатиолан-4-ил.
Соединенные с атомом С 6-членные насыщенные кольца, такие как:
тетрагидропиран-2-ил, тетрагидропиран-3-ил, тетрагидропиран-4-ил, пиперидин-2-ил, пиперидин-3-ил, пиперидин-4-ил, тетрагидротиопиран-2-ил, тетрагидротиопиран-3-ил, тетрагидротиопиран-4-ил, 1,3-диоксан-2-ил, 1,3-диоксан-4-ил, 1,3-диоксан-5-ил, 1,4-диоксан-2-ил, 1,3-дитиан-2-ил, 1,3-дитиан-4-ил, 1,3-дитиан-5-ил, 1,4-дитиан-2-ил, 1,3-оксатиан-2-ил, 1,3-оксатиан-4-ил, 1,3-оксатиан-5-ил, 1,3-оксатиан-6-ил, 1,4-оксатиан-2-ил, 1,4-оксатиан-3-ил, 1,2-дитиан-3-ил, 1,2-дитиан-4-ил, гексагидропиримидин-2-ил, гексагидропиримидин-4-ил, гексагидропиримидин-5-ил, гексагидропиразин-2-ил, гексагидропиридазин-3-ил, гексагидропиридазин-4-ил, тетрагидро-1,3-оксазин-2-ил, тетрагидро-1,3-оксазин-4-ил, тетрагидро-1,3-оксазин-5-ил, тетрагидро-1,3-оксазин-6-ил, тетрагидро-1,3-тиазин-2-ил, тетрагидро-1,3-тиазин-4-ил, тетрагидро-1,3-тиазин-5-ил, тетрагидро-1,3-тиазин-6-ил, тетрагидро-1,4-тиазин-2-ил, тетрагидро-1,4-тиазин-3-ил, тетрагидро-1,4-оксазин-2-ил, тетрагидро-1,4-оксазин-3-ил, тетрагидро-1,2-оксазин-3-ил, тетрагидро-1,2-оксазин-4-ил, тетрагидро-1,2-оксазин-5-ил, тетрагидро-1,2-оксазин-6-ил.
Соединенные с атомом N 5-членные насыщенные кольца, такие как:
тетрагидропиррол-1-ил, тетрагидропиразол-1-ил, тетрагидроизоксазол-2-ил, тетрагидроизотиазол-2-ил, тетрагидроимидазол-1-ил, тетрагидрооксазол-3-ил, тетрагидротиазол-3 -ил.
Соединенные с атомом N 6-членные насыщенные кольца, такие как:
пиперидин-1-ил, гексагидропиримидин-1-ил, гексагидропиразин-1-ил, гексагидропиридазин-1-ил, тетрагидро-1,3-оксазин-3-ил, тетрагидро-1,3-тиазин-3-ил, тетрагидро-1,4-тиазин-4-ил, тетрагидро-1,4-оксазин-4-ил, тетрагидро-1,2-оксазин-2-ил.
Ненасыщенные гетероциклические радикалы, которые обычно имеют 4, 5, 6 или 7 атомов кольца, где обычно 1, 2 или 3 из атомов кольца являются гетероатомами, такими как N, S или O, помимо углеродных атомов в качестве членов кольца. Они включают, например:
Соединенные с атомом С 5-членные частично ненасыщенные кольца, такие как:
2,3-дигидрофуран-2-ил, 2,3-дигидрофуран-3-ил, 2,5-дигидрофуран-2-ил, 2,5-дигидрофуран-3-ил, 4,5-дигидрофуран-2-ил, 4,5-дигидрофуран-3-ил, 2,3-дигидротиен-2-ил, 2,3-дигидротиен-3-ил, 2,5-дигидротиен-2-ил, 2,5-дигидротиен-3-ил, 4,5-дигидротиен-2-ил, 4,5-дигидротиен-3-ил, 2,3-дигидро-1H-пиррол-2-ил, 2,3-дигидро-1H-пиррол-3-ил, 2,5-дигидро-1H-пиррол-2-ил, 2,5-дигидро-1H-пиррол-3-ил, 4,5-дигидро-1H-пиррол-2-ил, 4,5-дигидро-1H-пиррол-3-ил, 3,4-дигидро-2H-пиррол-2-ил, 3,4-дигидро-2H-пиррол-3-ил, 3,4-дигидро-5H-пиррол-2-ил, 3,4-дигидро-5H-пиррол-3-ил, 4,5-дигидро-1H-пиразол-3-ил, 4,5-дигидро-1H-пиразол-4-ил, 4,5-дигидро-1H-пиразол-5-ил, 2,5-дигидро-1H-пиразол-3-ил, 2,5-дигидро-1H-пиразол-4-ил, 2,5-дигидро-1H-пиразол-5-ил, 4,5-дигидроизоксазол-3-ил, 4,5-дигидроизоксазол-4-ил, 4,5-дигидроизоксазол-5-ил, 2,5-дигидроизоксазол-3-ил, 2,5-дигидроизоксазол-4-ил, 2,5-дигидроизоксазол-5-ил, 2,3-дигидроизоксазол-3-ил, 2,3-дигидроизоксазол-4-ил, 2,3-дигидроизоксазол-5-ил, 4,5-дигидроизотиазол-3-ил, 4,5-дигидроизотиазол-4-ил, 4,5-дигидроизотиазол-5-ил, 2,5-дигидроизотиазол-3-ил, 2,5-дигидроизотиазол-4-ил, 2,5-дигидроизотиазол-5-ил, 2,3-дигидроизотиазол-3-ил, 2,3-дигидроизотиазол-4-ил, 2,3-дигидроизотиазол-5-ил, 4,5-дигидро-1H-имидазол-2-ил, 4,5-дигидро-1H-имидазол-4-ил, 4,5-дигидро-1H-имидазол-5-ил, 2,5-дигидро-1H-имидазол-2-ил, 2,5-дигидро-1H-имидазол-4-ил, 2,5-дигидро-1H-имидазол-5-ил, 2,3-дигидро-1H-имидазол-2-ил, 2,3-дигидро-1H-имидазол-4-ил, 4,5-дигидрооксазол-2-ил, 4,5-дигидрооксазол-4-ил, 4,5-дигидрооксазол-5-ил, 2,5-дигидрооксазол-2-ил, 2,5-дигидрооксазол-4-ил, 2,5-дигидрооксазол-5-ил, 2,3-дигидрооксазол-2-ил, 2,3-дигидрооксазол-4-ил, 2,3-дигидрооксазол-5-ил, 4,5-дигидротиазол-2-ил, 4,5-дигидротиазол-4-ил, 4,5-дигидротиазол-5-ил, 2,5-дигидротиазол-2-ил, 2,5-дигидротиазол-4-ил, 2,5-дигидротиазол-5-ил, 2,3-дигидротиазол-2-ил, 2,3-дигидротиазол-4-ил, 2,3-дигидротиазол-5-ил, 1,3-диоксол-2-ил, 1,3-диоксол-4-ил, 1,3-дитиол-2-ил, 1,3-дитиол-4-ил, 1,3-оксатиол-2-ил, 1,3-оксатиол-4-ил, 1,3-оксатиол-5-ил.
Соединенные с атомом С 6-членные частично ненасыщенные кольца, такие как:
2H-3,4-дигидропиран-6-ил, 2H-3,4-дигидропиран-5-ил, 2H-3,4-дигидропиран-4-ил, 2H-3,4-дигидропиран-3-ил, 2H-3,4-дигидропиран-2-ил, 2H-3,4-дигидротиопиран-6-ил, 2H-3,4-дигидротиопиран-5-ил, 2H-3,4-дигидротиопиран-4-ил, 2H-3,4-дигидротиопиран-3-ил, 2H-3,4-дигидротиопиран-2-ил, 1,2,3,4-тетрагидропиридин-6-ил, 1,2,3,4-тетрагидропиридин-5-ил, 1,2,3,4-тетрагидропиридин-4-ил, 1,2,3,4-тетрагидропиридин-3-ил, 1,2,3,4-тетрагидропиридин-2-ил, 2H-5,6-дигидропиран-2-ил, 2H-5,6-дигидропиран-3-ил, 2H-5,6-дигидропиран-4-ил, 2H-5,6-дигидропиран-5-ил, 2H-5,6-дигидропиран-6-ил, 2H-5,6-дигидротиопиран-2-ил, 2H-5,6-дигидротиопиран-3-ил, 2H-5,6-дигидротиопиран-4-ил, 2H-5,6-дигидротиопиран-5-ил, 2H-5,6-дигидротиопиран-6-ил, 1,2,5,6-тетрагидропиридин-2-ил, 1,2,5,6-тетрагидропиридин-3-ил, 1,2,5,6-тетрагидропиридин-4-ил, 1,2,5,6-тетрагидропиридин-5-ил, 1,2,5,6-тетрагидропиридин-6-ил, 2,3,4,5-тетрагидропиридин-2-ил, 2,3,4,5-тетрагидропиридин-3-ил, 2,3,4,5-тетрагидропиридин-4-ил, 2,3,4,5-тетрагидропиридин-5-ил, 2,3,4,5-тетрагидропиридин-6-ил, 4H-пиран-2-ил, 4H-пиран-3-ил, 4H-пиран-4-ил, 4H-тиопиран-2-ил, 4H-тиопиран-3-ил, 4H-тиопиран-4-ил, 1,4-дигидропиридин-2-ил, 1,4-дигидропиридин-3-ил, 1,4-дигидропиридин-4-ил, 2H-пиран-2-ил, 2H-пиран-3-ил, 2H-пиран-4-ил, 2H-пиран-5-ил, 2H-пиран-6-ил, 2H-тиопиран-2-ил, 2H-тиопиран-3-ил, 2H-тиопиран-4-ил, 2H-тиопиран-5-ил, 2H-тиопиран-6-ил, 1,2-дигидропиридин-2-ил, 1,2-дигидропиридин-3-ил, 1,2-дигидропиридин-4-ил, 1,2-дигидропиридин-5-ил, 1,2-дигидропиридин-6-ил, 3,4-дигидропиридин-2-ил, 3,4-дигидропиридин-3-ил, 3,4-дигидропиридин-4-ил, 3,4-дигидропиридин-5-ил, 3,4-дигидропиридин-6-ил, 2,5-дигидропиридин-2-ил, 2,5-дигидропиридин-3-ил, 2,5-дигидропиридин-4-ил, 2,5-дигидропиридин-5-ил, 2,5-дигидропиридин-6-ил, 2,3-дигидропиридин-2-ил, 2,3-дигидропиридин-3-ил, 2,3-дигидропиридин-4-ил, 2,3-дигидропиридин-5-ил, 2,3-дигидропиридин-6-ил, 2H-5,6-дигидро-1,2-оксазин-3-ил, 2H-5,6-дигидро-1,2-оксазин-4-ил, 2H-5,6-дигидро-1,2-оксазин-5-ил, 2H-5,6-дигидро-1,2-оксазин-6-ил, 2H-5,6-дигидро-1,2-тиазин-3-ил, 2H-5,6-дигидро-1,2-тиазин-4-ил, 2H-5,6-дигидро-1,2-тиазин-5-ил, 2H-5,6-дигидро-1,2-тиазин-6-ил, 4H-5,6-дигидро-1,2-оксазин-3-ил, 4H-5,6-дигидро-1,2-оксазин-4-ил, 4H-5,6-дигидро-1,2-оксазин-5-ил, 4H-5,6-дигидро-1,2-оксазин-6-ил, 4H-5,6-дигидро-1,2-тиазин-3-ил, 4H-5,6-дигидро-1,2-тиазин-4-ил, 4H-5,6-дигидро-1,2-тиазин-5-ил, 4H-5,6-дигидро-1,2-тиазин-6-ил, 2H-3,6-дигидро-1,2-оксазин-3-ил, 2H-3,6-дигидро-1,2-оксазин-4-ил, 2H-3,6-дигидро-1,2-оксазин-5-ил, 2H-3,6-дигидро-1,2-оксазин-6-ил, 2H-3,6-дигидро-1,2-тиазин-3-ил, 2H-3,6-дигидро-1,2-тиазин-4-ил, 2H-3,6-дигидро-1,2-тиазин-5-ил, 2H-3,6-дигидро-1,2-тиазин-6-ил, 2H-3,4-дигидро-1,2-оксазин-3-ил, 2H-3,4-дигидро-1,2-оксазин-4-ил, 2H-3,4-дигидро-1,2-оксазин-5-ил, 2H-3,4-дигидро-1,2-оксазин-6-ил, 2H-3,4-дигидро-1,2-тиазин-3-ил, 2H-3,4-дигидро-1,2-тиазин-4-ил, 2H-3,4-дигидро-1,2-тиазин-5-ил, 2H-3,4-дигидро-1,2-тиазин-6-ил, 2,3,4,5-тетрагидропиридазин-3-ил, 2,3,4,5-тетрагидропиридазин-4-ил, 2,3,4,5-тетрагидропиридазин-5-ил, 2,3,4,5-тетрагидропиридазин-6-ил, 3,4,5,6-тетрагидропиридазин-3-ил, 3,4,5,6-тетрагидропиридазин-4-ил, 1,2,5,6-тетрагидропиридазин-3-ил, 1,2,5,6-тетрагидропиридазин-4-ил, 1,2,5,6-тетрагидропиридазин-5-ил, 1,2,5,6-тетрагидропиридазин-6-ил, 1,2,3,6-тетрагидропиридазин-3-ил, 1,2,3,6-тетрагидропиридазин-4-ил, 4H-5,6-дигидро-1,3-оксазин-2-ил, 4H-5,6-дигидро-1,3-оксазин-4-ил, 4H-5,6-дигидро-1,3-оксазин-5-ил, 4H-5,6-дигидро-1,3-оксазин-6-ил, 4H-5,6-дигидро-1,3-тиазин-2-ил, 4H-5,6-дигидро-1,3-тиазин-4-ил, 4H-5,6-дигидро-1,3-тиазин-5-ил, 4H-5,6-дигидро-1,3-тиазин-6-ил, 3,4,5-6-тетрагидропиримидин-2-ил, 3,4,5,6-тетрагидропиримидин-4-ил, 3,4,5,6-тетрагидропиримидин-5-ил, 3,4,5,6-тетрагидропиримидин-6-ил, 1,2,3,4-тетрагидропиразин-2-ил, 1,2,3,4-тетрагидропиразин-5-ил, 1,2,3,4-тетрагидропиримидин-2-ил, 1,2,3,4-тетрагидропиримидин-4-ил, 1,2,3,4-тетрагидропиримидин-5-ил, 1,2,3,4-тетрагидропиримидин-6-ил, 2,3-дигидро-1,4-тиазин-2-ил, 2,3-дигидро-1,4-тиазин-3-ил, 2,3-дигидро-1,4-тиазин-5-ил, 2,3-дигидро-1,4-тиазин-6-ил, 2H-1,3-оксазин-2-ил, 2H-1,3-оксазин-4-ил, 2H-1,3-оксазин-5-ил, 2H-1,3-оксазин-6-ил, 2H-1,3-тиазин-2-ил, 2H-1,3-тиазин-4-ил, 2H-1,3-тиазин-5-ил, 2H-1,3-тиазин-6-ил, 4H-1,3-оксазин-2-ил, 4H-1,3-оксазин-4-ил, 4H-1,3-оксазин-5-ил, 4H-1,3-оксазин-6-ил, 4H-1,3-тиазин-2-ил, 4H-1,3-тиазин-4-ил, 4H-1,3-тиазин-5-ил, 4H-1,3-тиазин-6-ил, 6H-1,3-оксазин-2-ил, 6H-1,3-оксазин-4-ил, 6H-1,3-оксазин-5-ил, 6H-1,3-оксазин-6-ил, 6H-1,3-тиазин-2-ил, 6H-1,3-оксазин-4-ил, 6H-1,3-оксазин-5-ил, 6H-1,3-тиазин-6-ил, 2H-1,4-оксазин-2-ил, 2H-1,4-оксазин-3-ил, 2H-1,4-оксазин-5-ил, 2H-1,4-оксазин-6-ил, 2H-1,4-тиазин-2-ил, 2H-1,4-тиазин-3-ил, 2H-1,4-тиазин-5-ил, 2H-1,4-тиазин-6-ил, 4H-1,4-оксазин-2-ил, 4H-1,4-оксазин-3-ил, 4H-1,4-тиазин-2-ил, 4H-1,4-тиазин-3-ил, 1,4-дигидропиридазин-3-ил, 1,4-дигидропиридазин-4-ил, 1,4-дигидропиридазин-5-ил, 1,4-дигидропиридазин-6-ил, 1,4-дигидропиразин-2-ил, 1,2-дигидропиразин-2-ил, 1,2-дигидропиразин-3-ил, 1,2-дигидропиразин-5-ил, 1,2-дигидропиразин-6-ил, 1,4-дигидропиримидин-2-ил, 1,4-дигидропиримидин-4-ил, 1,4-дигидропиримидин-5-ил, 1,4-дигидропиримидин-6-ил, 3,4-дигидропиримидин-2-ил, 3,4-дигидропиримидин-4-ил, 3,4-дигидропиримидин-5-ил или 3,4-дигидропиримидин-6-ил.
Соединенные с атомом N 5-членные частично ненасыщенные кольца, такие как:
2,3-дигидро-1H-пиррол-1-ил, 2,5-дигидро-1H-пиррол-1-ил, 4,5-дигидро-1H-пиразол-1-ил, 2,5-дигидро-1H-пиразол-1-ил, 2,3-дигидро-1H-пиразол-1-ил, 2,5-дигидроизоксазол-2-ил, 2,3-дигидроизоксазол-2-ил, 2,5-дигидроизотиазол-2-ил, 2,3-дигидроизоксазол-2-ил, 4,5-дигидро-1H-имидазол-1-ил, 2,5-дигидро-1H-имидазол-1-ил, 2,3-дигидро-1H-имидазол-1-ил, 2,3-дигидрооксазол-3-ил, 2,3-дигидротиазол-3-ил.
Соединенные с атомом N 6-шестичленные частично ненасыщенные кольца, такие как:
1,2,3,4-тетрагидропиридин-1-ил, 1,2,5,6-тетрагидропиридин-1-ил, 1,4-дигидропиридин-1-ил, 1,2-дигидропиридин-1-ил, 2H-5,6-дигидро-1,2-оксазин-2-ил, 2H-5,6-дигидро-1,2-тиазин-2-ил, 2H-3,6-дигидро-1,2-оксазин-2-ил, 2H-3,6-дигидро-1,2-тиазин-2-ил, 2H-3,4-дигидро-1,2-оксазин-2-ил, 2H-3,4-дигидро-1,2-тиазин-2-ил, 2,3,4,5-тетрагидропиридазин-2-ил, 1,2,5,6-тетрагидропиридазин-1-ил, 1,2,5,6-тетрагидропиридазин-2-ил, 1,2,3,6-тетрагидропиридазин-1-ил, 3,4,5,6-тетрагидропиримидин-3-ил, 1,2,3,4-тетрагидропиразин-1-ил, 1,2,3,4-тетрагидропиримидин-1-ил, 1,2,3,4-тетрагидропиримидин-3-ил, 2,3-дигидро-1,4-тиазин-4-ил, 2H-1,2-оксазин-2-ил, 2H-1,2-тиазин-2-ил, 4H-1,4-оксазин-4-ил, 4H-1,4-тиазин-4-ил, 1,4-дигидропиридазин-1-ил, 1,4-дигидропиразин-1-ил, 1,2-дигидропиразин-1-ил, 1,4-дигидропиримидин-1-ил или 3,4-дигидропиримидин-3-ил.
Гетероарил: 5- или 6-членный ароматический гетероциклический радикал, который обычно имеет 1, 2, 3 или 4 атомов азота или гетероатом, выбранный из кислорода и серы, и, в соответствующем случае, 1, 2 или 3 атомов азота в качестве членов кольца помимо углеродных атомов в качестве членов кольца: например
Соединенные с атомом С 5-членные гетероароматические радикалы, имеющие 1, 2, 3 или 4 атомов азота или гетероатом, выбранный из кислорода и серы, и, в соответствующем случае, имеющие 1, 2 или 3 атомов азота в качестве членов кольца, такие как:
2-фурил, 3-фурил, 2-тиенил, 3-тиенил, пиррол-2-ил, пиррол-3-ил, пиразол-3-ил, пиразол-4-ил, изоксазол-3-ил, изоксазол-4-ил, изоксазол-5-ил, изотиазол-3-ил, изотиазол-4-ил, изотиазол-5-ил, имидазол-2-ил, имидазол-4-ил, оксазол-2-ил, оксазол-4-ил, оксазол-5-ил, тиазол-2-ил, тиазол-4-ил, тиазол-5-ил, 1,2,3-оксадиазол-4-ил, 1,2,3-оксадиазол-5-ил, 1,2,4-оксадиазол-3-ил, 1,2,4,-оксадиазол-5-ил, 1,3,4-оксадиазол-2-ил, 1,2,3-тиадиазол-4-ил, 1,2,3-тиадиазол-5-ил, 1,2,4-тиадиазол-3-ил, 1,2,4-тиадиазол-5-ил, 1,3,4-тиадиазолил-2-ил, 1,2,3-триазол-4-ил, 1,2,4-триазол-3-ил, тетразол-5-ил.
Соединенные с атомом С 6-членные гетероароматические радикалы, имеющие 1, 2, 3 или 4 атомов азота в качестве членов кольца, такие как:
пиридин-2-ил, пиридин-3-ил, пиридин-4-ил, пиридазин-3-ил, пиридазин-4-ил, пиримидин-2-ил, пиримидин-4-ил, пиримидин-5-ил, пиразин-2-ил, 1,3,5-триазин-2-ил, 1,2,4-триазин-3-ил, 1,2,4-триазин-5-ил, 1,2,4-триазин-6-ил, 1,2,4,5-тетразин-3-ил.
Соединенные с атомом N 5-членные гетероароматические радикалы, имеющие 1, 2, 3 или 4 атомов азота в качестве членов кольца, такие как:
пиррол-1-ил, пиразол-1-ил, имидазол-1-ил, 1,2,3-триазол-1-ил, 1,2,4-триазол-1-ил, тетразол-1-ил.
Гетероциклил также включает бициклические гетероциклилы, которые имеют одно из упомянутых выше 5- или 6-членных гетероциклических колец и дополнительно насыщенный, ненасыщенный или ароматический карбоцикл, конденсированный с ним, например, бензольное, циклогексановое, циклогексеновое или циклогексадиеновое кольцо, или дополнительно 5- или 6-членное гетероциклическое кольцо, конденсированное с ним, где последнее может также являться насыщенным, ненасыщенным или ароматическим. Эти бициклические гетероциклы включают, например, хинолинил, изохинолинил, индолил, индолизинил, изоиндолил, индазолил, бензофурил, бензотиенил, бензо[b]тиазолил, бензоксазолил, бензтиазолил и бензимидазолил. Примеры 5-6-членных неароматических гетероциклических радикалов, включающих конденсированное бензольное кольцо, включают дигидроиндолил, дигидроиндолизинил, дигидроизоиндолил, дигидрохинолинил, дигидроизохинолинил, хроменил и хроманил.
Арилалкил: определенный выше арильный радикал, который присоединен через алкиленовую группу, в частности через метиленовую, 1,1-этиленовую или 1,2-этиленовую группу, например, бензил, 1-фенилэтил и 2-фенилэтил (= фенетил).
Арилалкенил: определенный выше арильный радикал, который присоединен через алкениленовую группу, в частности через 1,1-этенильную, 1,2-этенильную или 1,3-пропенильную группу, например, 2-фенилэтен-1-ил и 1-фенилэтен-1-ил.
Циклоалкокси: определенный выше циклоалкильный радикал, который присоединен через атом кислорода, например, циклопропилокси, циклобутилокси, циклопентилокси или циклогексилокси.
Циклоалкилалкил: определенный выше циклоалкильный радикал, который присоединен через алкиленовую группу, в частности через метиленовую, 1,1-этиленовую или 1,2-этиленовую группу, например, циклопропилметил, циклобутилметил, циклопентилметил или циклогексилметил.
Гетероциклилалкил и гетероарилалкил: определенный выше гетероциклильный или гетероарильный радикал, который присоединен через алкиленовую группу, в частности через метиленовую, 1,1-этиленовую или 1,2-этиленовую группу.
Выражение "необязательно замещенный" означает в контексте настоящего изобретения, что соответствующий фрагмент является замещенным или имеет 1, 2 или 3, в частности 1, заместитель, которые выбирают из галогена, C1-C4-алкила, C1-C4-галогеналкила, OH, SH, CN, CF3, O-CF3, COOH, O-CH2-COOH, C1-C6-алкокси, C1-C4-галогеналкокси, C1-C6-алкилтио, C3-C7-циклоалкила, COO-C1-C6-алкила, CONH2, CONH-C1-C6-алкила, SO2NH-C1-C6-алкила, CON-(C1-C6-алкил)2, SO2N-(C1-C6-алкил)2, NH-SO2-C1-C6-алкила, NH-CO-C1-C6-алкила, SO2-C1-C6-алкила, O-фенила, O-CH2-фенила, CONH-фенила, SO2NH-фенила, CONH-гетероарила, SO2NH-гетероарила, SO2-фенила, NH-SO2-фенила, NH-CO-фенила, NH-SO2-гетероарила и NH-CO-гетероарила, где фенил и гетероарил в последних 11 упомянутых радикалах являются незамещенными или могут иметь 1, 2 и 3 заместителя, которые выбирают из галогена, C1-C4-алкила, C1-C4-галогеналкила, C1-C4-алкокси и C1-C4-галогеналкокси.
Что касается применения соединений формулы I в качестве ингибиторов кальпаина, то, предпочтительно, чтобы переменные R1, R2, R3, R4, R5, m и n имели приведенные далее значения, где эти значения представляют, рассматриваемые как их собственные, так и в комбинации, по меньшей мере, с одним другим значением или со всеми значениями, конкретные конфигурации соединений формулы I:
R1 является C1-C10-алкилом, предпочтительно, C3-C6-алкилом, который может быть частично или полностью галогенирован и/или иметь 1, 2 или 3 заместителя R1a, в частности, незамещенным C1-C10-алкилом, в частности незамещенным C3-C6-алкилом,
C3-C7-циклоалкил-C1-C4-алкилом, в частности C3-C7-циклоалкилметилом, 1-(C3-C7-циклоалкил)этилом или 2-(C3-C7-циклоалкил)этилом, где циклоалкильный фрагмент может иметь 1, 2, 3 или 4 радикала R1b, наиболее предпочтительно, циклогексилметилом,
фенил-C1-C4-алкилом или гетероарил-C1-C4-алкилом, в частности бензилом, 1-фенилэтилом, 2-фенилэтилом, гетероарилметилом, 1-гетероарилэтилом, 2-гетероарилэтилом, таким как тиенилметил, пиридинилметил, где фенил и гетероарил в последних упомянутых радикалах могут являться незамещенными или иметь 1, 2, 3 или 4 одинаковых или различных радикала R1c.
Более предпочтительно, чтобы R1 являлся фенил-C1-C2-алкилом или гетероарил-C1-C2-алкилом, где фенил и гетероарил могут являться незамещенными или иметь 1 или 2 одинаковых или различных определенных в настоящем описании радикала R1c, где R1c, в частности, выбирают из галогена, особенно фтора и хлора, C1-C2-алкила и C1-C4-алкокси. В частности, R1 является бензилом, где фенильная группа бензила может являться незамещенной или иметь 1 или 2 одинаковых или различных определенных в настоящем описании радикала R1c, где R1c, в частности, выбирают из фтора, хлора, метила и метокси.
В этой связи, R1a, R1b и R1c, когда они присутствуют, имеют упомянутые выше значения. В частности:
R1a является C1-C4-алкокси или C1-C4-галогеналкокси;
R1b является галогеном, C1-C4-алкилом, C1-C4-галогеналкилом, C1-C4-алкокси или C1-C4-галогеналкокси; и
R1c является галогеном, C1-C4-алкилом, OH, SH, CN, C1-C4-галогеналкилом, C1-C4-галогеналкокси, COOH, O-CH2-COOH, C1-C6-алкокси, C1-C6-алкилтио, C3-C7-циклоалкилом, COO-C1-C6-алкилом, CONH2, CONH-C1-C6-алкилом, SO2NH-C1-C6-алкилом, CON-(C1-C6-алкил)2, SO2N-(C1-C6-алкил)2, NH-SO2-C1-C6-алкилом, NH-CO-C1-C6-алкилом, SO2-C1-C6-алкилом,
O-фенилом, O-CH2-фенилом, CONH-фенилом, SO2NH-фенилом, CONH-гетероарилом, SO2NH-гетероарилом, SO2-фенилом, NH-SO2-фенилом, NH-CO-фенилом, NH-SO2-гетероарилом, NH-CO-гетероарилом, где фенил и гетероарил в последних 11 упомянутых радикалах являются незамещенными или могут иметь 1, 2 или 3 заместителя, которые выбирают из галогена, C1-C4-алкила, C1-C4-галогеналкила, C1-C4-алкокси и C1-C4-галогеналкокси,
-(CH2)p-NRc6Rc7 при p=0, 1, 2, 3, 4, 5 или 6, в частности 0, и
-O-(CH2)q-NRc6Rc7 при q=2, 3, 4, 5 or 6, в частности 2, где
Rc6, Rc7 являются независимо водородом или C1-C6-алкилом, или вместе с атомом азота, к которому они присоединены, являются морфолиновым, пиперидиновым, пирролидиновым, азетидиновым или пиперазиновым остатком, где последние 5 упомянутых радикалов являются незамещенными или могут иметь 1, 2, 3 или 4 радикала, выбранных из C1-C4-алкила, C1-C4-галогеналкила, C1-C4-алкокси или C1-C4-галогеналкокси.
R1c выбирают, в частности, из галогена, C1-C4-алкила, C1-C4-алкокси, CF3, CHF2, CH2F, O-CHF2, O-CH2FOCF3 и -(CH2)p-NRc6Rc7 при p=0, 1 или 2, где
Rc6 выбирают из группы, состоящей из H и C1-C4-алкила, и
Rc7 выбирают из группы, состоящей из H и C1-C4-алкила, или два радикала Rc6 и Rc7 образуют вместе с атомом N 5, 6 или 7-членный насыщенный азотсодержащий гетероцикл, который может необязательно иметь дополнительный отличающийся или одинаковый гетероатом из группы O, N и S в качестве члена кольца, и где азотсодержащий гетероцикл является незамещенным или имеет 1, 2 или 3 заместителя, выбранных из C1-C4-алкила.
R1c является, в частности, галогеном, C1-C4-алкилом, CF3, CHF2, CH2F, C1-C4-алкокси, O-CF3, O-CHF2 или O-CH2F.
R2 является C3-C7-циклоалкил-C1-C4-алкилом, в частности C3-C7-циклоалкилметилом, 1-(C3-C7-циклоалкил)этилом или 2-(C3-C7-циклоалкил)этилом, где циклоалкильный фрагмент может иметь 1, 2, 3 или 4 радикала R2b,
арилом или гетероарилом, где арил и гетероарил в последних двух упомянутых 2 радикалах могут являться незамещенными или иметь 1, 2, 3 или 4 одинаковых или различных радикала R2c,
арил-C1-C6-алкилом, арил-C2-C6-алкенилом или гетероарил-C1-C4-алкилом, где арил и гетероарил в последних 3 упомянутых радикалах могут являться незамещенными или иметь 1, 2, 3 или 4 одинаковых или различных радикала R2c.
Более предпочтительно, чтобы R2 являлся арилом, гетероарилом, арил-C1-C6-алкилом, арил-C2-C6-алкенилом или гетероарил-C1-C4-алкилом, в частности арилом или гетероарилом, и особенно фенилом, тиенилом или пиридилом, где арил и гетероарил (или фенил, тиенил и пиридил) могут являться незамещенными или иметь 1, 2, 3 или 4, в частности 1 или 2, одинаковых или различных радикала R2c.
В частности, R2 является фенилом, который может являться незамещенным или иметь 1 или 2 определенных в настоящем описании радикала R2c, при особом предпочтении к соединениям, в которых
R2c выбирают из группы, состоящей из галогена, C1-C4-алкила, C1-C4-алкокси, CF3, OCF3 и -(CH2)p-NRc6Rc7 при p=0, 1 или 2, где
Rc6 выбирают из группы, состоящей из H и C1-C4-алкила, и
Rc7 выбирают из группы, состоящей из H и C1-C4-алкила, или два радикала Rc6 и Rc7 образуют вместе с атомом N 5, 6 или 7-членный насыщенный азотсодержащий гетероцикл, который может необязательно иметь дополнительный отличающийся или одинаковый гетероатом из группы O, N и S в качестве члена кольца, и где азотсодержащий гетероцикл является незамещенным или имеет 1, 2 или 3 заместителя, выбранных из C1-C4-алкила.
Более предпочтительно, чтобы R2 являлся фенилом, который может являться незамещенным или иметь 1 или 2 одинаковых или различных радикала, выбранных из галогена, C1-C2-алкила, C1-C2-алкокси и -(CH2)p-NRc6Rc7 при p=0, 1 или 2, где
Rc6 выбирают из группы, состоящей из H и C1-C4-алкила, и
Rc7 выбирают из группы, состоящей из H и C1-C4-алкила, или два радикала Rc6 и Rc7 образуют вместе с атомом N 5, 6 или 7-членный насыщенный азотсодержащий гетероцикл, который может необязательно иметь дополнительный отличающийся или одинаковый гетероатом из группы O, N и S в качестве члена кольца, и где азотсодержащий гетероцикл является незамещенным или имеет 1, 2 или 3 заместителя, выбранных из C1-C4-алкила.
В конкретном варианте осуществления, R2 является фенилом, который может являться незамещенными или иметь 1 радикал, выбранный из фтора, хлора, метила и метокси.
В этой связи, R2b и R2c, в случае их присутствия, имеют упомянутые выше значения. В частности:
R2b является галогеном, C1-C4-алкилом, OH, CN, CF3, O-CF3, COOH, O-CH2-COOH, C1-C6-алкокси, C1-C6-алкилтио, COO-C1-C6-алкилом, CONH2, CONH-C1-C6-алкилом, SO2NH-C1-C6-алкилом, CONH-фенилом, SO2NH-фенилом, CONH-гетероарилом, SO2NH-гетероарилом, CON-(C1-C6-алкил)2, SO2N-(C1-C6-алкил)2, NH-SO2-C1-C6-алкилом, NH-CO-C1-C6-алкилом, SO2-C1-C6-алкилом, SO2-фенилом, NH-SO2-фенилом, NH-CO-фенилом, NH-SO2-гетероарилом, NH-CO-гетероарилом или NRb6Rb7, где Rb6, Rb7 являются независимо водородом или C1-C6-алкилом, или вместе с атомом азота, к которому они присоединены, являются морфолиновым, пиперидиновым, пирролидиновым, азетидиновым или пиперазиновым остатком, где последние 5 упомянутых радикала являются незамещенными или могут иметь 1, 2, 3 или 4 радикала, выбранных из C1-C4-алкила, C1-C4-галогеналкила, C1-C4-алкокси или C1-C4-галогеналкокси; и
R2c является галогеном, C1-C4-алкилом, OH, SH, CN, CF3, O-CF3, COOH, O-CH2-COOH, C1-C6-алкокси, C1-C6-алкилтио, C3-C7-циклоалкилом, COO-C1-C6-алкилом, CONH2, CONH-C1-C6-алкилом, SO2NH-C1-C6-алкилом, CON-(C1-C6-алкил)2, SO2N-(C1-C6-алкил)2, NH-SO2-C1-C6-алкилом, NH-CO-C1-C6-алкилом, SO2-C1-C6-алкилом,
O-фенилом, O-CH2-фенилом, CONH-фенилом, SO2NH-фенилом, CONH-гетероарилом, SO2NH-гетероарилом, SO2-фенилом, NH-SO2-фенилом, NH-CO-фенилом, NH-SO2-гетероарилом, NH-CO-гетероарилом, где фенил и гетероарил в последних 11 упомянутых радикалах являются незамещенными или могут иметь 1, 2 или 3 заместителя, которые выбирают из галогена, C1-C4-алкила, C1-C4-галогеналкила, C1-C4-алкокси и C1-C4-галогеналкокси,
-(CH2)p-NRc6Rc7 при p=0, 1, 2, 3, 4, 5 или 6, в частности 0, и
-O-(CH2)q-NRc6Rc7 при q=2, 3, 4, 5 или 6, в частности 2, где
Rc6, Rc7 являются независимо водородом или C1-C6-алкилом, или вместе с атомом азота, к которому они присоединены, являются морфолиновым, пиперидиновым, пирролидиновым, азетидиновым или пиперазиновым остатком, где последние 5 упомянутых радикала являются незамещенными или могут иметь 1, 2, 3 или 4 радикала, выбранных из C1-C4-алкила, C1-C4-галогеналкила, C1-C4-алкокси или C1-C4-галогеналкокси,
R2c выбирают, в частности, из галогена, C1-C4-алкила, C1-C4-алкокси, CF3, OCF3 и -(CH2)p-NRc6Rc7 при p=0, 1 или 2, где
Rc6 выбирают из группы, состоящей из H и C1-C4-алкила, и
Rc7 выбирают из группы, состоящей из H и C1-C4-алкила, или
два радикала Rc6 и Rc7 образуют вместе с атомом N 5, 6 или 7-членный насыщенный азотсодержащий гетероцикл, который может необязательно иметь дополнительный отличающийся или одинаковый гетероатом из группы O, N и S в качестве члена кольца, и где азотсодержащий гетероцикл является незамещенным или имеет 1, 2 или 3 заместителя, выбранных из C1-C4-алкила;
R3 выбирают из группы, состоящей из C1-C6-алкила, C1-C3-галогеналкила, C3-C5-алкенила, C3-C5-алкинила, C3-C6-циклоалкила, C3-C6-циклоалкил-C1-C2-алкила, C3-C6-гетероциклоалкил-C1-C2-алкила, C1-C2-алкокси-C1-C2-алкила, в частности, где алкил, алкенил, алкокси, циклоалкил, гетероциклоалкил в последних 6 упомянутых радикалах являются незамещенными или имеют 1, 2 или 3 заместителя Rxa,
арила, арил-C1-C4-алкила, гетероарила и гетероарил-C1-C4-алкила, где арил и гетероарил в последних 4 упомянутых радикалах являются незамещенными или имеют 1, 2 или 3 заместителя Rxd, где Rxa и Rxd имеют упомянутые выше значения, и в частности:
Rxa является CN, C1-C2-алкокси или C1-C2-галогеналкокси; и
Rxd является CN, NO2, галогеном, C1-C4-алкилом, C1-C4-галогеналкилом, C1-C4-алкокси или C1-C4-галогеналкокси.
R3 выбирают, в частности, из группы, состоящей из C1-C4-алкила, C1-C3-галогеналкила, C3-C5-алкенила, C3-C5-алкинила, C3-C6-циклоалкила, C3-C6-циклоалкил-C1-C2-алкила, C3-C6-гетероциклоалкил-C1-C2-алкила и C1-C2-алкокси-C1-C2-алкила.
Более предпочтительно, чтобы R3 являлся C1-C3-алкилом, в особенности, метилом, этилом, н-пропилом или изопропилом, C1-C3-галогеналкилом, C2-C4-алкенилом, в особенности, проп-2-ен-1-илом (= аллилом), бут-2-енилом или бут-3-енилом, C3-C6-циклоалкилом, в особенности, циклопропилом или циклобутилом или циклопентилом, C3-C6-циклоалкил-C1-C2-алкилом, в частности циклопропилметилом, C3-C6-гетероциклоалкил-C1-C2-алкилом, в особенности, 2-(4-морфолинил)этилом или фенил-C1-C3-алкилом, в частности бензилом или 2-фенилэтилом.
R4 и R5 являются независимо галогеном, CF3, CHF2, CH2F, C1-C2-алкилом или C1-C2-алкокси.
Более предпочтительно, чтобы R4 и R5 являлись независимо фтором, хлором, метилом, этилом или метокси, и в особенности, фтором, хлором или метилом.
m и n являются независимо 0 или 1, и в особенности, 0.
Или же, если не указано иначе, предпочтительно, чтобы радикалы R1d, Ra1, Rb1, Rc1, Ra2, Rb2, Rc2, Ra3, Rb3, Rc3, Ra4, Rb4, Rc4, Ra5, Rb5, Rc5, Ra6, Rb6, Rc6, Ra7, Rb7, Rc7, R и R' имели независимо одно из следующих значений:
R1d: галоген, C1-C4-алкил, C1-C4-галогеналкил, C1-C4-алкокси и C1-C4-галогеналкокси.
Ra1, Rb1, Rc1 независимо: водород, C1-C6-алкил, C1-C6-галогеналкил, фенил, бензил, гетероарил и гетероарилметил, где фенил и гетероарил в последних 4 упомянутых радикалах являются незамещенными или имеют 1, 2 или 3 заместителя, которые выбирают из галогена, C1-C4-алкила, C1-C4-галогеналкила, C1-C4-алкокси и C1-C4-галогеналкокси.
Ra2, Rb2, Rc2 независимо: водород, C1-C6-алкил, фенил, бензил, гетероарил и гетероарилметил, где фенил и гетероарил в последних 4 упомянутых радикалах являются незамещенными или имеют 1, 2 или 3 заместителя, которые выбирают из галогена, C1-C4-алкила, C1-C4-галогеналкила, C1-C4-алкокси и C1-C4-галогеналкокси.
Ra3, Rb3, Rc3 независимо: водород или C1-C6-алкил,
или Ra2 с Ra3 (и или же Rb2с Rb3, и Rc2 с Rc3) вместе с атомом азота, к которому они присоединены, являются морфолиновым, пиперидиновым, пирролидиновым, азетидиновым или пиперазиновым остатком, где последние 5 упомянутых радикалов являются незамещенными или могут иметь 1, 2, 3 или 4 радикала, выбранных из C1-C4-алкила, C1-C4-галогеналкила, C1-C4-алкокси или C1-C4-галогеналкокси.
Ra4, Rb4, Rc4 независимо: C1-C6-алкил, фенил, бензил, гетероарил и гетероарилметил, где фенил и гетероарил в последних 4 упомянутых радикалах являются незамещенными или имеют 1, 2 или 3 заместителя, которые выбирают из галогена, C1-C4-алкила, C1-C4-галогеналкила, C1-C4-алкокси и C1-C4-галогеналкокси.
Ra5, Rb5, Rc5 независимо: водород, C1-C6-алкил, фенил, бензил, гетероарил и гетероарилметил, где фенил и гетероарил в последних 4 упомянутых радикалах являются незамещенными или имеют 1, 2 или 3 заместителя, которые выбирают из галогена, C1-C4-алкила, C1-C4-галогеналкила, C1-C4-алкокси и C1-C4-галогеналкокси.
Ra6, Rb6, Rc6 независимо: водород, C1-C6-алкил, фенил, бензил, гетероарил и гетероарилметил, где фенил и гетероарил в последних 4 упомянутых радикалах являются незамещенными или имеют 1, 2 или 3 заместителя, которые выбирают из галогена, C1-C4-алкила, C1-C4-галогеналкила, C1-C4-алкокси и C1-C4-галогеналкокси.
Ra7, Rb7, Rc7 независимо: водород или C1-C6-алкил,
или Ra6 с Ra7 (и или же Rb6 с Rb7, и Rc6 с Rc7) вместе с атомом азота, к которому они присоединены, являются морфолиновым, пиперидиновым, пирролидиновым, азетидиновым или пиперазиновым остатком, где последние 5 упомянутых радикала являются незамещенными или могут иметь 1, 2, 3 или 4 радикала, выбранных из C1-C4-алкила, C1-C4-галогеналкила, C1-C4-алкокси или C1-C4-галогеналкокси.
R и R', независимо: водород, метил или этил.
Согласно предпочтительному варианту изобретения, соединения формулы I преобладающе имеют S-конфигурации при углеродном атоме, несущем радикал R1, и согласно особенно предпочтительному варианту осуществления, соединения формулы I полностью имеют S-конфигурацию в указанном положении.
Согласно одному аспекту изобретения, атом водорода, соединенный с атомом углерода, несущим радикал R1 соединения формулы I, заменяют на атом дейтерия, как это показано в формуле I-D ниже. R1, R2, R3, R4, R5, m и n в формуле I-H имеют упомянутые выше значения.

Степень дейтерирования в указанном положении обычно превышает 80%, предпочтительно превышает 90%>, и в частности, превышает 95%. Дейтерированные диастереомеры формулы I-D часто характеризуются заметно более высокой устойчивостью к рацемизации, чем их недейтерированные аналоги формулы I, возможно вследствие кинетического изотопного эффекта (см. публикацию F. Maltais et al. J. Med. Chem, DOI 10.1021/jm901023f). Следовательно, обычно можно стабилизировать S-конфигурацию при углеродном атоме, несущем радикал R1, соединения I согласно упомянутым выше предпочтительным вариантам осуществления изобретения, путем введения дейтерия на этом углеродном атоме.
Соединения общих формул I и I-H, которые приведены в таблицах 1-35 ниже, и их таутомеры, пролекарства и фармацевтически приемлемые соли, представляют собой perse предпочтительные варианты осуществления настоящего изобретения. Значения для R2, R3, m и R5, приведенные в таблице A ниже, представляют собой варианты осуществления изобретения, которые являются также предпочтительными как независимо, так и особенно в комбинации.
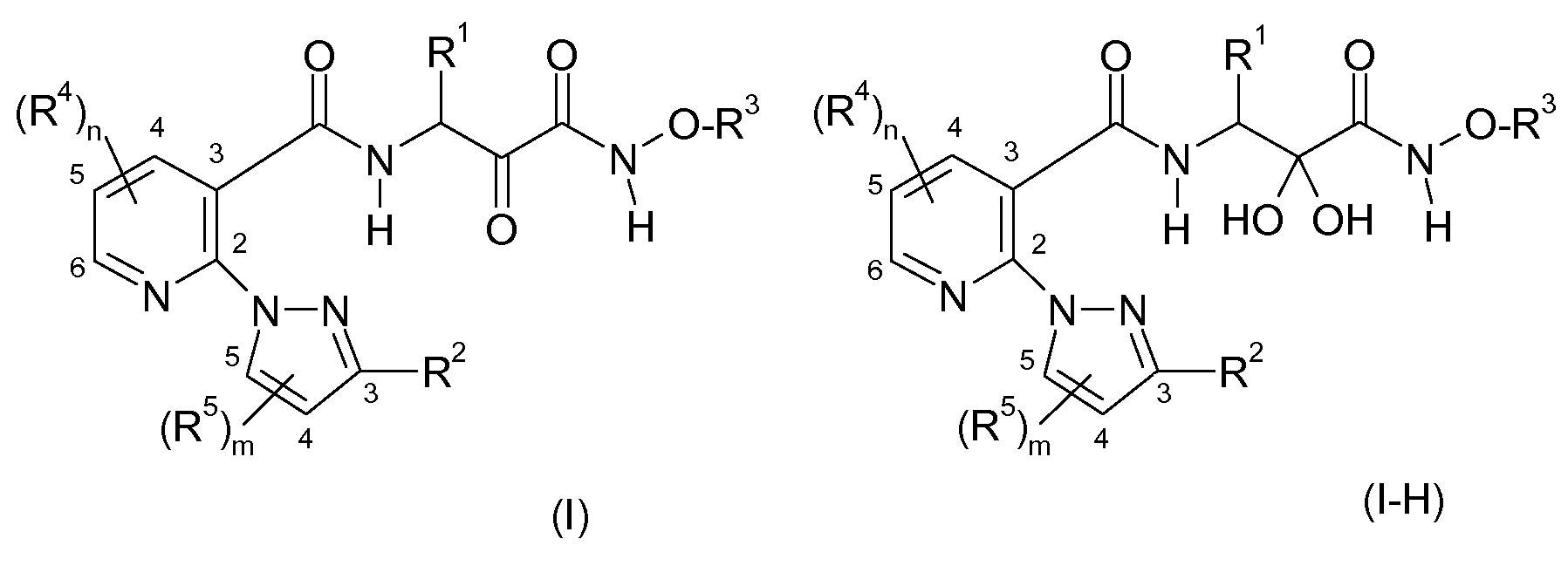
Таблица 1
Соединения формул I и I-H, в которых R1 является бензилом, n=0, то есть, (R4)n отсутствует, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 2
Соединения формул I и I-H, в которых R1 является 3-фторбензилом, n=0, то есть, (R4)n отсутствует, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 3
Соединения формул I и I-H, в которых R1 является 4-фторбензилом, n=0, то есть (R4)n отсутствует, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 4
Соединения формул I и I-H, в которых R1 является 3-хлорбензилом, n=0, то есть, (R4)n отсутствует, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 5
Соединения формул I и I-H, в которых R1 является 4-хлорбензилом, n=0, то есть, (R4)n отсутствует, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 6
Соединения формул I и I-H, в которых R1 является 4-метоксибензилом, n=0, то есть, (R4)n отсутствует, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 7
Соединения формул I и I-H, в которых R1 является бензил, (R4)n является 4-F, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 8
Соединения формул I и I-H, в которых R1 является 3-фторбензилом, (R4)n является 4-F, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 9
Соединения формул I и I-H, в которых R1 является 4-фторбензилом, (R4)n является 4-F, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 10
Соединения формул I и I-H, в которых R1 является 3-хлорбензилом, (R4)n является 4-F, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 11
Соединения формул I и I-H, в которых R1 является 4-хлорбензилом, (R4)n является 4-F, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 12
Соединения формул I и I-H, в которых R1 является 4-метоксибензилом, (R4)n является 4-F, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 13
Соединения формул I и I-H, в которых R1 является бензилом, (R4)n является 5-F, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 14
Соединения формул I и I-H, в которых R1 является 3-фторбензилом, (R4)n является 5-F, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 15
Соединения формул I и I-H, в которых R1 является 4-фторбензилом, (R4)n является 5-F, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 16
Соединения формул I и I-H, в которых R1 является 3-хлорбензилом, (R4)n является 5-F, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 17
Соединения формул I и I-H, в которых R1 является 4-хлорбензилом, (R4)n является 5-F, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 18
Соединения формул I и I-H, в которых R1 является 4-метоксибензилом, (R4)n является 5-F, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 19
Соединения формул I и I-H, в которых R1 является бензилом, (R4)n является 6-F, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 20
Соединения формул I и I-H, в которых R1 является 3-фторбензилом, (R4)n является 6-F, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 21
Соединения формул I и I-H, в которых R1 является 4-фторбензилом, (R4)n является 6-F, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 22
Соединения формул I и I-H, в которых R1 является 3-хлорбензилом, (R4)n является 6-F, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 23
Соединения формул I и I-H, в которых R1 является 4-хлорбензилом, (R4)n является 6-F, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 24
Соединения формул I и I-H, в которых R1 является 4-метоксибензилом, (R4)n является 6-F, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 25
Соединения формул I и I-H, в которых R1 является бензилом, (R4)n является 4-Cl, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 26
Соединения формул I и I-H, в которых R1 является 3-фторбензилом, (R4)n является 4-Cl, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 27
Соединения формул I и I-H, в которых R1 является 4-фторбензилом, (R4)n является 4-Cl, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 28
Соединения формул I и I-H, в которых R1 является 3-хлорбензилом, (R4)n является 4-Cl, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 29
Соединения формул I и I-H, в которых R1 является 4-хлорбензилом, (R4)n является 4-Cl, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 30
Соединения формул I и I-H, в которых R1 является 4-метоксибензилом, (R4)n является 4-Cl, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 31
Соединения формул I и I-H, в которых R1 является бензилом, (R4)n является 5-Cl, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 32
Соединения формул I и I-H, в которых R1 является 3-фторбензилом, (R4)n является 5-Cl, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 33
Соединения формул I и I-H, в которых R1 является 4-фторбензилом, (R4)n является 5-Cl, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 34
Соединения формул I и I-H, в которых R1 является 3-хлорбензилом, (R4)n является 5-Cl, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 35
Соединения формул I и I-H, в которых R1 является 4-хлорбензилом, (R4)n является 5-Cl, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 36
Соединения формул I и I-H, в которых R1 является 4-метоксибензилом, (R4)n является 5-Cl, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 37
Соединения формул I и I-H, в которых R1 является бензилом, (R4)n является 6-Cl, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 38
Соединения формул I и I-H, в которых R1 является 3-фторбензилом, (R4)n является 6-Cl, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 39
Соединения формул I и I-H, в которых R1 является 4-фторбензилом, (R4)n является 6-Cl, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 40
Соединения формул I и I-H, в которых R1 является 3-хлорбензилом, (R4)n является 6-Cl, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 41
Соединения формул I и I-H, в которых R1 является 4-хлорбензилом, (R4)n является 6-Cl, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Таблица 42
Соединения формул I и I-H, в которых R1 является 4-метоксибензилом, (R4)n является 6-Cl, и комбинация R2, R3, m и R5 для соединения в каждом случае соответствует одной строке в таблице A.
Изобретение, в частности, относится к соединениям формулы I, которые выбирают из группы, состоящей из
2-[3-(4-Фторфенил)-1H-пиразол-1-ил]-N-[4-(метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил]пиридин-3-карбоксамида,
(2R)-2-[3-(4-Фторфенил)-1H-пиразол-1-ил]-N-[4-(метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил]пиридин-3-карбоксамида,
(2S)-2-[3-(4-Фторфенил)-1H-пиразол-1-ил]-N-[4-(метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил]пиридин-3-карбоксамида,
N-(4-(Метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
(2R)-N-(4-(Метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
(2S)-N-(4-(Метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
2-(4-Фтор-3-фенил-1H-пиразол-1-ил)-N-(4-(метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)никотинамида,
(2R)-2-(4-Фтор-3-фенил-1H-пиразол-1-ил)-N-(4-(метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)никотинамида,
(2S)-2-(4-Фтор-3-фенил-1H-пиразол-1-ил)-N-(4-(метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)никотинамида,
N-[4-(Метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил]-2-(4-метил-3-фенил-1H-пиразол-1-ил)пиридин-3-карбоксамида,
(2R)-N-[4-(Метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил]-2-(4-метил-3-фенил-1H-пиразол-1-ил)пиридин-3-карбоксамида,
(2S)-N-[4-(Метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил]-2-(4-метил-3-фенил-1H-пиразол-1-ил)пиридин-3-карбоксамида,
N-(1-(4-Фторфенил)-4-(метоксиамино)-3,4-диоксобутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
(2R)-N-(1-(4-Фторфенил)-4-(метоксиамино)-3,4-диоксобутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
(2S)-N-(1-(4-Фторфенил)-4-(метоксиамино)-3,4-диоксобутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
N-(1-(3-Фторфенил)-4-(метоксиамино)-3,4-диоксобутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
(2R)-N-(1-(3-Фторфенил)-4-(метоксиамино)-3,4-диоксобутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
(2S)-N-(1-(3-Фторфенил)-4-(метоксиамино)-3,4-диоксобутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
N-(4-(Этоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
(2R)-N-(4-(Этоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
(2S)-N-(4-(Этоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
N-(4-(Аллилоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
(2R)-N-(4-(Аллилоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
(2S)-N-(4-(Аллилоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
N-(4-(Метоксиамино)-1-(4-метоксифенил)-3,4-диоксобутан-2-ил)-2-(3-фенил-1-пиразол-1-ил)никотинамида,
(2R)-N-(4-(Метоксиамино)-1-(4-метоксифенил)-3,4-диоксобутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
(2S)-N-(4-(Метоксиамино)-1-(4-метоксифенил)-3,4-диоксобутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
2-(4-Хлор-3-фенил-1H-пиразол-1-ил)-N-(4-(метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)никотинамида,
(2R)-2-(4-Хлор-3-фенил-1H-пиразол-1-ил)-N-(4-(метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)никотинамида,
(2S)-2-(4-Хлор-3-фенил-1H-пиразол-1-ил)-N-(4-(метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)никотинамида,
N-[4-(Изопропоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
(2R)-N-[4-(Изопропоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
(2S)-N-[4-(Изопропоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
N-[3,4-диоксо-1-фенил-4-(пропоксиамино)-2-бутанил]-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
(2R)-N-[3,4-диоксо-1-фенил-4-(пропоксиамино)-2-бутанил]-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
(2S)-N-[3,4-диоксо-1-фенил-4-(пропоксиамино)-2-бутанил]-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
N-[4-(Метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-{3-[4-(4-морфолинил)фенил]-1H-пиразол-1-ил}никотинамида,
(2R)-N-[4-(Метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-{3-[4-(4-морфолинил)фенил]-1H-пиразол-1-ил}никотинамида,
(2S)-N-[4-(Метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-{3-[4-(4-морфолинил)фенил]-1H-пиразол-1-ил}никотинамида,
N-[4-(Метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-{3-[4-(4-морфолинилметил)фенил]-1H-пиразол-1-ил}никотинамида,
(2R)-N-[4-(Метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-{3-[4-(4-морфолинилметил)фенил]-1H-пиразол-1-ил}никотинамида,
(2S)-N-[4-(Метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-{3-[4-(4-морфолинилметил)фенил]-1H-пиразол-1-ил}никотинамида,
2-(3-{4-[(Диэтиламино)метил]фенил}-1H-пиразол-1-ил)-N-[4-(метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]никотинамида,
(2R)-2-(3-{4-[(Диэтиламино)метил]фенил}-1H-пиразол-1-ил)-N-[4-(метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]никотинамида,
(2S)-2-(3-{4-[(Диэтиламино)метил]фенил}-1H-пиразол-1-ил)-N-[4-(метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]никотинамида,
N-(4-{[(2-Метил-2-пропанил)окси]амино}-3,4-диоксо-1-фенил-2-бутанил)-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
(2R)-N-(4-{[(2-Метил-2-пропанил)окси]амино}-3,4-диоксо-1-фенил-2-бутанил)-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
(2S)-N-(4-{[(2-Метил-2-пропанил)окси]амино}-3,4-диоксо-1-фенил-2-бутанил)-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
N-{4-[(Циклопентилокси)амино]-3,4-диоксо-1-фенил-2-бутанил}-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
(2R)-N-{4-[(Циклопентилокси)амино]-3,4-диоксо-1-фенил-2-бутанил}-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
(2S)-N-{4-[(Циклопентилокси)амино]-3,4-диоксо-1-фенил-2-бутанил}-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
N-[4-(Этоксиамино)-1-(4-фторфенил)-3,4-диоксо-2-бутанил]-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
(2R)-N-[4-(Этоксиамино)-1-(4-фторфенил)-3,4-диоксо-2-бутанил]-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
(2S)-N-[4-(Этоксиамино)-1-(4-фторфенил)-3,4-диоксо-2-бутанил]-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
N-[4-(Этоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-(4-фтор-3-фенил-1H-пиразол-1-ил)никотинамида,
(2R)-N-[4-(Этоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-(4-фтор-3-фенил-1H-пиразол-1-ил)никотинамида,
(2S)-N-[4-(Этоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-(4-фтор-3-фенил-1H-пиразол-1-ил)никотинамида,
N-{4-[(Циклобутилокси)амино]-3,4-диоксо-1-фенил-2-бутанил}-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
(2R)-N-{4-[(Циклобутилокси)амино]-3,4-диоксо-1-фенил-2-бутанил}-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
(2S)-N-{4-[(Циклобутилокси)амино]-3,4-диоксо-1-фенил-2-бутанил}-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
N-{4-[(2,2-Диметилпропокси)амино]-3,4-диоксо-1-фенил-2-бутанил}-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
(2R)-N-{4-[(2,2-Диметилпропокси)амино]-3,4-диоксо-1-фенил-2-бутанил}-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
(2S)-N-{4-[(2,2-Диметилпропокси)амино]-3,4-диоксо-1-фенил-2-бутанил}-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
N-(4-{[2-(4-Морфолинил)этокси]амино}-3,4-диоксо-1-фенил-2-бутанил)-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
(2R)-N-(4-{[2-(4-Морфолинил)этокси]амино}-3,4-диоксо-1-фенил-2-бутанил)-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
(2S)-N-(4-{[2-(4-Морфолинил)этокси]амино}-3,4-диоксо-1-фенил-2-бутанил)-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
N-{4-[(Циклопропилметокси)амино]-3,4-диоксо-1-фенил-2-бутанил}-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
(2R)-N-{4-[(Циклопропилметокси)амино]-3,4-диоксо-1-фенил-2-бутанил}-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
(2S)-N-{4-[(Циклопропилметокси)амино]-3,4-диоксо-1-фенил-2-бутанил}-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
N-[4-(Этоксиамино)-1-(4-метоксифенил)-3,4-диоксо-2-бутанил]-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
(2R)-N-[4-(Этоксиамино)-1-(4-метоксифенил)-3,4-диоксо-2-бутанил]-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
(2S)-N-[4-(Этоксиамино)-1-(4-метоксифенил)-3,4-диоксо-2-бутанил]-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
2-[3-(2-Фторфенил)-1H-пиразол-1-ил]-N-[4-(метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]никотинамида,
(2R)-2-[3-(2-Фторфенил)-1H-пиразол-1-ил]-N-[4-(метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]никотинамида,
(2S)-2-[3-(2-Фторфенил)-1H-пиразол-1-ил]-N-[4-(метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]никотинамида,
N-[4-(Метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-{3-[3-(трифторметил)фенил]-1H-пиразол-1-ил}никотинамида,
(2R)-N-[4-(Метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-{3-[3-(трифторметил)фенил]-1H-пиразол-1-ил}никотинамида,
(2S)-N-[4-(Метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-{3-[3-(трифторметил)фенил]-1H-пиразол-1-ил}никотинамида,
N-[4-(Метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-[3-(2-пиридинил)-1H-пиразол-1-ил]никотинамида,
(2R)-N-[4-(Метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-[3-(2-пиридинил)-1H-пиразол-1-ил]никотинамида,
(2S)-N-[4-(Метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-[3-(2-пиридинил)-1H-пиразол-1-ил]никотинамида,
N-(3,4-диоксо-1-фенил-4-(тиазол-2-иламино)бутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
(2R)-N-(3,4-диоксо-1-фенил-4-(тиазол-2-иламино)бутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
(2S)-N-(3,4-диоксо-1-фенил-4-(тиазол-2-иламино)бутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамида,
их таутомерам, их гидратам, их пролекарствам и их фармацевтически приемлемым солям.
Соединения по изобретению общей формулы I и исходные реагенты, используемые для их получения, могут быть синтезированы по аналогии с известными методами органической химии, описанными в традиционных пособиях по органической химии, например, в Houben-Weyl, "Methoden der Organischen Chemie", Thieme-Verlag, Stuttgart, Jerry March "Advanced Organic Chemistry", 5th edition, Wiley & Sons и в цитируемой в них литературе, и R. Larock, "Comprehensive Organic Transformations", 2nd edition, Weinheim, 1999 и цитируемой в ней литературе. Карбоксамидные соединения по изобретению общей формулы I предпочтительно получать с помощью методов, описанных ниже и/или в экспериментальном разделе.
Соединения формулы I могут быть получены по аналогии со схемами и методами, описанными в WO 99/54305, pp. 6-10 и в WO 2008/080969, pp. 65-70. Важный метод синтеза соединений формулы I приведен на схеме 1.
Схема 1:

На схеме 1, R1, R2, R3, R4, R5, m и n имеют упомянутые выше значения, и переменная PG обозначает защитную группу, которая может являться любой известной в области техники защитной группой, применяемой для защиты групп карбоновой кислоты и предпочтительно выбранной из C1-C6-алкилов, в частности метила и этила.
На первой стадии i), карбоновую кислоту II превращают путем реакции с аминогидроксиэфиром III в соответствующий гидроксиамидоэфир IV. При этом, обычно используют традиционные методы сочетания пептидов, описанные, например, в R. C. Larock, Comprehensive Organic Transformations, VCH Publisher, 1989, pages 972-976, или в Houben-Weyl, Methoden der organischen Chemie, 4th edition, E5, Chap. V. Сначала может быть предпочтительным активирование карбоновой кислоты II. Для этой цели, например, карбоновую кислоту II подвергают взаимодействию с реагентом реакции сочетания, например, карбодиимидом, таким как дициклогексилкарбодиимид (DCC), CDI (карбонилдиимидазол), карбонилдипиразол, DCI (диизопропилкарбодиимид) или 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC), предпочтительно, в присутствии гидроксибензотриазола (HOBt), нитрофенола, пентафторфенола, 2,4,5-трихлорфенола или N-гидроксисукцинимида, с получением активированного эфира IIa. Кроме того, может быть предпочтительным получение активированного эфира IIa в присутствии основания, например, третичного амина. Кроме того, подходящими реагентами реакции сочетания для стадии I являются реагенты, упоминаемые ниже для стадии iii), такие как производные бензотриазола, производные пиридинтриазола и фосфониевые активаторы. Активированный эфир IIa затем подвергают взаимодействию с аминогидроксиэфиром формулы III или его гидрогалогенидной солью с получением гидроксиамидного эфира IV. Реакция обычно проводят в безводных инертных растворителях, таких как хлорированные углеводороды, например, дихлорметан или дихлорэтан, эфиры, например, тетрагидрофуран или 1,4-диоксан, или карбоксамиды, например, N,N-диметилформамид, Ν,Ν-диметилацетамид или N-метилпирролидон. Стадию i) обычно проводят при температурах в интервале от -20°C до +25°C.
На следующей стадии ii) защитную группу PG удаляют с помощью традиционных методов. В случае, когда PG является алкильной группой, реакцию предпочтительно проводить путем обработки соединения IV с помощью основания в водной среде, например, гидроксида лития в смеси тетрагидрофуран (THF)/вода. Полученную карбоновую кислоту подвергают реакции сочетания на следующей стадии iii) с гидроксиламином V с получением гидроксидиамида VI, используя метод сочетания, аналогичный методу, описанному выше для стадии i). Подходящие реагенты реакции сочетания (активаторы) известны специалистам в данной области и их выбирают, например, из карбодиимидов, таких как DCC, EDC, CDI (карбонилдиимидазол), карбонилдипиразол и DCI (диизопропилкарбодиимид), производные бензотриазола, такие как 1-гидроксибензотриазол, HBTU ((O-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат) и HCTU (1-[бис(диметиламино)-метилен]-5-хлор-1H-бензотриазония тетрафторборат), производные пиридинтриазола, такие как HATU (2-(7-аза-1H-бензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат), и фосфониевые активаторы, такие как BOP ((бензотриазол-1-илокси)трис(диметиламино)фосфония гексафторфосфат), Py-BOP ((бензотриазол-1-илокси)трипирролидинфосфония гексафторфосфат) и Py-BrOP (бромтрипирролидинфосфония гексафторфосфат). Обычно, активатор используют в избытке. Бензотриазольные и фосфониевые реагенты реакции сочетания обычно применяют в щелочной среде, например, в присутствии амина, отличающегося от амина V, предпочтительно, ненуклеофильного амина, такого как третичные алифатические амины, в частности диизопропилэтиламин, и алициклические амины. Условия реакции обычно соответствуют условиям, приведенным выше для стадии i).
На следующей стадии iv), гидроксидиамидное соединение VI окисляют до карбоксамидного соединения формулы I по изобретению. Для этого используют различные традиционные реакции окисления (см. R. C. Larock, Comprehensive Organic Transformations, VCH Publisher, 1989, page 604 et seq.) такие как, например, окисление по Сверну и аналогичные методы окисления (T.T. Tidwell, Synthesis 1990, pp. 857-870), или окисление Пфицнера-Моффатта. Подходящими окислителями являются диметилсульфоксид (ДМСО) в комбинации с дициклогексил-карбодиимидом или 1-этил-3-(3-диметиламинопропил)карбодиимидом, диметилсульфоксид в комбинации с комплексом пиридин-SO3, или диметилсульфоксид в комбинации с оксалилхлоридом, гипохлорид натрия/TEMPO (S. L. Harbenson et al, J. Med. Chem. 1994, 37, 2918-2929) или соединения гипервалентного йода (периодинан), такие как 2-йодоксибензойная кислота (IBX) (J. Org. Chem. 1995, 60, 7272) или периодинан Десс-Мартина (J. Org. Chem. 1983, 48, 4155). В зависимости от используемого окислителя, окисление гидроксидиамидного соединения VI проводят при температурах от -50 до +35°C.
Гидроксиламины V и аминогидроксиэфиры III либо являются коммерчески доступными, либо могут быть синтезированы в соответствии с известными методами.
Дейтерированные производные I-D соединений I, которые имеют S-конфигурацию при углеродном атоме, несущем как дейтерий, так и радикал R1, могут быть получены с помощью метода, приведенного на схеме 1, исходя из соответствующих дейтерированных промежуточных соединений III'. Соединения III' могут быть синтезированы с помощью очевидного варианта 9-стадийного метода, описанного в F. Maltais et al, J. Med. Chem. 2009, 52 (24), 7993-8001 (DOI 10.1021/jm901023f), как показано ниже. В качестве исходного реагента в этом методе используют алкинол VII, и он включает хиральное разделение получаемой промежуточной рацемической смеси путем амидирования с помощью деоксихолевой кислоты.

Карбоновая кислота II может быть получена путем гидролиза карбонового эфира VIII с помощью кислот или оснований обычно при традиционных условиях. Предпочтительно проводить гидролиз с помощью оснований, таких как гидроксиды щелочных или щелочноземельных металлов, например, гидроксид лития, гидроксид натрия или гидроксид калия, в водной среде, такой как смесь воды и органических растворителей, например, спиртов, таких как метанол или этанол, эфиров, таких как тетрагидрофуран или диоксан, при комнатной температуре или повышенной температуре, такой как 25-100°C.
В формулах II и VIII, R2, R4, R5, m и n имеют упомянутые выше значения. В формуле VIII, R7 является алкилом, предпочтительно C1-C6-алкилом.
Карбоновый эфир формулы VIII может быть предпочтительно получен путем реакции карбонового эфира общей формулы IX с соединением пиразола X, как показано на схеме 3.
Схема 3:

На схеме 3, LG представляет нуклеофильно замещаемую уходящую группу. Примерами подходящих нуклеофильно замещаемых уходящих групп являются галоген, например, хлор или бром, или тозилат. R7 является алкилом, предпочтительно C1-C6-алкилом. R2, R4, R5, m и n имеют упомянутые выше значения.
Как показано на схеме 3, эфир IX реагирует с соответствующим пиразольным соединением формулы X. Реакцию обычно проводят при традиционных условиях в присутствии основания в инертном растворителе при повышенной температуре. Может быть предпочтительным, когда это целесообразно, проводить реакцию в присутствии каталитически активных количеств переходного металла, в частности металла группы 10 или 11 Периодической таблицы.
Реакцию предпочтительно проводить при повышенной температуре без разбавителя или в инертном растворителе, таком как эфир, например тетрагидрофуран или диоксан, карбоксамиды, такие как N,N-диметилформамид, Ν,Ν-диметилацетамид или N-метилпирролидон, или ароматический углеводород, такой как бензол, толуол или o-, м- или п-ксилол. Реакция проводят в присутствии неорганических или органических оснований и краун-эфира. Подходящими неорганическими основаниями являются амиды щелочных или щелочноземельных металлов, такие как амид натрия, карбонаты щелочных или щелочноземельных металлов, такие как карбонат калия или карбонат цезия, или гидриды щелочных металлов, такие как гидрид натрия. Подходящими органическими основаниями являются третичные амины, такие как, например, триметиламин или триэтиламин. Подходящим краун-эфиром является 18-краун-6. В качестве катализатора, когда это целесообразно, добавляют соль Cu(I), такую как, например, CuI, CuCN, Cu2O (см., например, US 4826835 и WO 88/00468).
Пиразольные соединения X могут быть приобретены или могут быть синтезированы традиционными методами, которые кратко изложены ниже, из соединений-предшественников, которые могут быть приобретены у их производителей.
Общие методы получения пиразолов общей формулы X описаны, например, у R. Fusco в "The Chemistry of Heterocyclic Compounds: Pyrazoles, Pyrazolines, Pyrazolidines, Indazoles and Condensed Rings", Wiley, R. H., editor; Wiley: New York, 1967; Vol. 22, pages 1-174; или у J. Elguero, "Comprehensive Heterocyclic Chemistry"; Potts, K. T., Ed.; Pergamon: Oxford 1984; Vol. 5, pages 291-298. Одним из наиболее широко используемых методов является циклоконденсация 1,3-дикарбонильных соединений или соответствующих реакционноспособных аналогов с гидразином или производными замещенного гидразина.
3-Арил- или 3-гетероарилзамещенные пиразолы X особенно предпочтительно получать путем реакции соединений 1-арил- или 1-гетероарил-3-диметиламино-2-пропена с гадразином по аналогии с методами, описанными, например, в M.A. Halcrow et al; J. Chem. Soc. Dalton Trans. 1997, pages 4025-4035. 1-Арил- и 1-гетероарил-3-диметиламино-2-пропены, необходимые в качестве исходного реагента, могут быть легко получены путем конденсации аналогичных ароматических ацетильных соединений с Ν,Ν-диметилформамиддиметилацеталем (или аналогично используя соответствующий диэтилацеталь). Реакцию обычно проводят без разбавителя или в инертном растворителе, таком как, например, диметилформамид или толуол, при повышенной температуре. Особенно предпочтительно также подводить энергию активации, необходимую для реакции, в реакционную смесь путем воздействия микроволнового излучения, и проводить реакцию при повышенном давлении, как это описано в A.K. Pleier, Synthesis 2001, 1, 55-62.
Еще одной общей возможностью для получения замещенных пиразолов формулы X является реакция сочетания Сузуки соответствующих пиразолбороновых кислот или пиразолбороновых эфиров, описанная, например в: N. Zhe et al; J. Med. Chem. 2005, 48 (5), 1569-1609; Young et al; J. Med. Chem. 2004, 47 (6), 1547-1552; C. Slee et al; Bioorg. Med. Chem. Lett. 2001, 9, 3243-3253. Соответствующим альтернативным вариантом является также реакция сочетания Стилле галогенированных производных пиразола с соответствующими органилами олова, описанная, например, в J. Eluguero et al; Synthesis 1997, 5, 563-566.
Реакционную смесь выделяют традиционным способом, например, путем смешивания с водой, разделения фаз и, когда это целесообразно, очистки неочищенных продуктов с помощью хроматографии. Промежуточные соединения и конечные продукты в некоторых случаях получают в форме бесцветных или бледно-коричневатых вязких масел, которые освобождают от легколетучих компонентов или очищают при пониженном давлении и умеренно повышенной температуре. Если промежуточные соединения и конечные продукты получают в виде твердых веществ, то очистка может быть также осуществлена путем перекристаллизации или выщелачивания.
Если индивидуальные соединения I нельзя получить с помощью описанных выше схем, они могут быть получены путем дериватизации других соединений I.
Соединения по изобретению характеризуются исключительно низкими значениями Ki при ингибировании кальпаина и, следовательно, позволяют эффективно ингибировать кальпаин, особенно кальпаин I, при низких уровнях в сыворотке. При ингибировании кальпаина in vitro соединения по изобретению обычно характеризуются значениями Ki<1200 нМ, предпочтительно <600 нМ, в частности <300 нМ, и в особенности ≤200 нМ. Поэтому, соединения изобретения особенно подходят для лечения расстройств, связанных с повышенной активностью кальпаина.
Кроме того, соединения по изобретению являются селективными ингибиторами кальпаина, то есть ингибирование других цистеиновых протеаз, таких как катепсин B, катепсин K, катепсин L или катепсин S, происходит только при концентрациях, которые являются значительно более высокими, чем концентрации, необходимые для ингибирования кальпаина. Соответственно, соединения по изобретению должны характеризоваться значительно меньшими побочными эффектами, чем соединения известного уровня техники, которые являются относительно неселективными при ингибировании кальпаина и также ингибируют другие цистеиновые протеазы.
Предпочтительные соединения согласно изобретению соответственно имеют селективность при ингибировании катепсина B, выраженную в форме отношения величины Ki для ингибирования катепсина B к величине Ki для ингибирования кальпаина, ≥2, в частности ≥4, и в особенности ≥10.
Предпочтительные соединения согласно изобретению соответственно имеют селективность при ингибировании катепсина K, выраженную в форме отношения величины Ki для ингибирования катепсина К к величине Ki для ингибирования кальпаина, ≥2, в частности ≥4, и в особенности ≥10.
Предпочтительные соединения согласно изобретению соответственно имеют селективность при ингибировании катепсина L, выраженную в форме отношения величины Ki для ингибирования катепсина L к величине Ki для ингибирования кальпаина, ≥5, в частности ≥10, и в особенности ≥50.
Предпочтительные соединения согласно изобретению соответственно имеют селективность при ингибировании катепсина S, выраженную в форме отношения величины Ki для ингибирования катепсина S к величине Ki для ингибирования кальпаина, ≥5, в частности ≥10, и в особенности ≥50.
Кроме того, соединения по настоящему изобретению характеризуются повышенной стабильностью в цитозоле человеческих клеток, что заметно способствует их высокой общей метаболической стабильности. Цитозольную стабильность можно измерить, например, путем инкубирования раствора соединения по изобретению с цитозолем печени конкретных особей (например, крысы, собаки, обезьяны или человека) и определения времени полуразложения соединения при этих условиях. Большие значения времен полуразложения позволяют сделать вывод об улучшенной метаболической стабильности соединения. Стабильность в присутствии цитозоля печени человека является особенно важным показателем, так как этот показатель позволяет предсказывать метаболическое разложение соединения в печени человека. Поэтому, соединения с повышенной цитозольной стабильностью, по-видимому, будут разлагаться с меньшими скоростями в печени. Более медленное метаболическое разложение в печени, в свою очередь, может приводить к более высоким и/или более продолжительным во времени концентрациям (эффективным уровням) соединения в организме, в результате чего увеличивается полупериод выведения соединений изобретения. Более высокие и/или более продолжительные во времени эффективные уровни могут приводить к более высокой эффективности соединения при лечении или профилактике различных кальпаин-зависимых заболеваний. Кроме того, улучшенная метаболическая стабильность может приводить к повышенной биодоступности при пероральном введении, так как соединение подвергается, после всасывания в кишечнике, меньшему метаболическому разложению в печени (называемому эффектом первого прохождения). Повышенная пероральная биодоступность, поскольку концентрация (эффективный уровень) соединения является повышенной, может приводить к более высокой эффективности соединения при пероральном введении.
Соответственно, соединения по изобретению, вследствие их улучшенной цитозольной стабильности, остаются в цитозоле в течение продолжительных периодов времени, то есть, имеют пониженный цитозольный клиренс, и поэтому должны характеризоваться улучшенной фармакокинетикой при применении у человека.
Предпочтительные соединения согласно изобретению соответственно имеют значение цитозольного клиренса в цитозоле печени человека ≤30 мкл/мин/мг, в частности ≤15 мкл/мин/мг, и в особенности ≤5 мкл/мин/мг.
Улучшенная цитозольная стабильность соединений согласно настоящему изобретению, вероятно, является следствием в первую очередь пониженной подверженности воздействию альдо-кето редуктаз (AKR), которые опосредуют метаболическое разложение соединений, имеющих карбонильную группу, в цитозоле печени людей и обезьян. Таким образом, AKR-катализируемое восстановление кетоамидов формулы I должно быть менее выражено, чем в случае менее стабильных кетоамидов. Следовательно, отношение концентрации исходного соединения, то есть, кетамида формулы I, к концентрации метаболита, то есть, возникающей гидроксиамидной формы кетоамида, является мерой стабильности соединений по изобретению.
Предпочтительные соединения согласно изобретению соответственно имеют, после инкубирования в гепатоцитах человека в течение 4 часов, отношение концентрации гидроксиамидного метаболита к концентрациям их соответствующего исходного соединения формулы I, ≤2, в частности ≤1, и в особенности ≤0,1.
Благодаря ингибиторному воздействию на кальпаин, селективности в отношении кальпаина по сравнению с другими цистеиновыми протеазами и цитозольной стабильности, соединения изобретения подходят, в частности, для лечения расстройства или состояния, которое связано с повышенной активностью кальпаина, описанного, например, в начале заявки при описании известного уровня техники.
Расстройствами, связанными с повышенной активностью кальпаина, являются, в частности, нейродегенеративные расстройства, особенно те нейродегенеративные расстройства, которые возникают в результате хронического нарушения кровоснабжения головного мозга, ишемии (инсульта) или травмы, такой как травма головного мозга, и нейродегенеративные расстройства болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз и болезнь Хантингтона, а также рассеянный склероз и связанное с ним повреждение нервной системы, в частности повреждение зрительного нерва (неврит зрительного нерва) и нервов, которые контролируют движение глаз. Соответственно, предпочтительные варианты осуществления изобретения относятся к лечению нейродегенеративных расстройств, в частности упомянутых выше нейродегенеративных расстройств у людей, и к применению соединений по изобретению формулы I, их таутомеров и их фармацевтически приемлемых солей для получения лекарственного средства для лечения этих расстройств.
Расстройства, связанные с повышенной активностью кальпаина, также включают эпилепсию. Соответственно, предпочтительные варианты осуществления изобретения относятся к лечению эпилепсии у людей, и к применению соединений по изобретению для получения лекарственного средства для лечения эпилепсии.
Расстройства или состояния, связанные с повышенной активностью кальпаина, также включают боль и болезненные состояния. Соответственно, предпочтительные варианты осуществления изобретения относятся к лечению боли и болезненных состояний у млекопитающих, в частности у людей, и к применению соединений по изобретению для получения лекарственного средства для лечения боли и болезненных состояний.
Расстройства или состояния, связанные с повышенной активностью кальпаина, также включают повреждение сердца после сердечных ишемий, повреждение почек после почечных ишемий, повреждение скелетной мышцы, мышечные дистрофии, повреждение, возникающее в результате пролиферации гладкомышечных клеток, спазмы коронарных сосудов, спазмы мозговых сосудов, дегенерацию желтого пятна, катаракты глаз или рестеноз кровеносных сосудов после ангиопластики. Соответственно, предпочтительные варианты осуществления изобретения относятся к лечению заболеваний или состояний, связанных с повреждением сердца после сердечных ишемий, повреждением почек после почечных ишемий, повреждением скелетной мышцы, мышечными дистрофиями, повреждением, возникающим в результате пролиферации гладкомышечных клеток, коронарных вазоспазмами, церебральными вазоспазмами, дегенерацией желтого пятна, катарактами глаз или рестенозом кровеносных сосудов после ангиопластики у млекопитающих, в частности у людей, и к применению соединений изобретения для получения лекарственного средства для лечения этих расстройств.
Кроме того, было обнаружено, что ингибирование кальпаина приводит к цитотоксическим эффектам на опухолевых клетках. Соответственно, соединения изобретения подходят для химиотерапии опухолей и их метастазирования. Поэтому, предпочтительные варианты осуществления изобретения относятся к применению соединений изобретения при терапии опухолей и метастаз, и к их применению для получения лекарственного средства для терапии опухолей и метастаз.
Кроме того, было обнаружено, что различные повреждения, связанные с ВИЧ расстройством, в частности повреждением нерва (ВИЧ-индуцированная нейротоксичность), опосредуются кальпаином и поэтому ингибирование кальпаина позволяет лечить или облегчать такие повреждения. Соответственно, соединения по изобретению подходят для лечения ВИЧ пациентов. Поэтому, предпочтительные варианты осуществления по изобретению относятся к применению соединений по изобретению для лечения ВИЧ-инфицированных пациентов, в частности, лечениях тех нарушений, которые вызываются ВИЧ-индуцированной нейротоксичностью, и к их применению для получения лекарственного средства для лечения ВИЧ пациентов.
Кроме того, было обнаружено, что может быть понижено или полностью ингибировано высвобождение интерлейкина-I, фактора некроза опухолей (TNF) или бета-амилоидных пептидов (Αβ или Αβ-пептидов) с помощью ингибиторов кальпаина. Соответственно, в результате применения соединений по изобретению формулы I, их таутомеров и их фармацевтически приемлемых солей можно лечить повреждения или расстройства, связанные с повышенным уровнем интерлейкина-I, фактора некроза опухолей (TNF) или бета-амилоидных пептидов (Αβ). Поэтому, предпочтительные варианты осуществления изобретения относятся к применению соединений по изобретению для лечения повреждений или расстройств, связанных с повышенным уровнем интерлейкина-I, фактора некроза опухолей (TNF) или бета-амилоидных пептидов (Αβ), таких как ревматизм, ревматоидный артрит, и их применению для получения лекарственного средства для лечения таких повреждений или расстройств.
Кроме того, было обнаружено, что ингибирование кальпаина применимо для лечения протозойной инфекции (инфекции одноклеточными организмами), такой как малярия или токсоплазмоз (Li et al, Mol Biochem Parasitol. 2007; 155(1): 26-32; Jung et al. Archives of Pharmacal Research (2009), 32(6), 899-906). Следовательно, соединения по настоящему изобретению особенно подходят для лечения протозойных инфекций, таких как малярия или токсоплазмоз, и их применения для получения лекарственного средства для лечения таких повреждений или расстройств.
Помимо повышенной цитозольной стабильности, соединения по настоящему изобретению также отличаются высокой устойчивостью к разложению в микросомах печени. Микросомальная стабильность соединения может быть измерена, например, путем инкубирования раствора этого соединения с микросомами печени конкретных особей (например, крысы, собаки или человека) и определения периода полуразложения соединения при этих условиях (RS Obach, Curr Opin Drug Discov Devel. 2001, 4, 36-44). Высокая микросомальная стабильность способствует повышенной общей метаболической стабильности соединений по изобретению.
Кроме того, соединения по настоящему изобретению отличаются повышенной фармакологической активностью, по сравнению с раскрытыми в прототипе карбоксамидными соединениями, у пациентов или в соответствующих экспериментальных моделях на животных, позволяющих прогнозировать возможность применения соединений для лечения.
Настоящее изобретение также относится к фармацевтическим композициям (то есть, лекарственным средствам), которые включают по меньшей мере одно соединение по изобретению, и, когда это целесообразно, один или более подходящих носителей.
Эти носители выбирают в соответствии с фармацевтической формой и требуемым способом введения.
Соединения по изобретению могут быть использованы для получения фармацевтических композиций для перорального, сублингвального, подкожного, внутримышечного, внутривенного, местного, интратрахеального, интраназального, трансдермального или ректального введения, и они могут быть введены животным или людям в стандартной лекарственной форме, смешанной с традиционными фармацевтическими носителями, для профилактики или лечения указанных выше повреждений или заболеваний.
Подходящие стандартные лекарственные формы включают формы для перорального введения, такие как таблетки, желатиновые капсулы, порошки, гранулы и растворы или суспензии для перорального введения, формы для сублингвального, буккального, интратрахеального или интраназального введения, аэрозоли, импланты, формы для подкожного, внутримышечного или внутривенного введения и формы для ректального введения.
Соединения по изобретению могут быть использованы в кремах, мазях или лосьонов для местного введения.
Для достижения требуемого профилактического или терапевтического эффекта, доза основного активного ингредиента может изменяться от 0,01 до 50 мг на килограмм массы тела в сутки.
Каждая единичная доза может включать от 0,05 до 5000 мг, предпочтительно, от 1 до 1000 мг, активного ингредиента в комбинации с фармацевтическим носителем. Эта единичная доза может быть введена от 1 до 5 раз в сутки, в результате чего вводится суточная доза от 0,5 до 25000 мг, предпочтительно, от 1 до 5000 мг.
Если твердую композицию приготавливают в форме таблеток, основной ингредиент смешивают с фармацевтическим носителем, таким как желатин, крахмал, лактоза, стеарат магния, тальк, диоксид кремния и другие подобные вещества.
На таблетки может быть нанесено покрытие из сахарозы, производного целлюлозы или другого подходящего вещества, или таблетки могут быть подвергнуты обработке другим путем, для того чтобы они проявляли пролонгированное или отсроченное действие, и для того чтобы непрерывно высвобождать заданное количество основного активного ингредиента.
Препарат в форме желатиновых капсул получают путем смешивания активного ингредиента с наполнителем и заполнения полученной смесью мягких или твердых желатиновых капсул.
Препарат в форме сиропа или эликсира или для введения в форме капель может включать активные ингредиенты вместе с подсластителем, который предпочтительно не содержал бы калорий, метилпарабеном или пропилпарабеном в качестве антисептика, ароматизатором и подходящим окрашивающим веществом.
Диспергируемые в воде порошки или гранулы могут включать активные ингредиенты, смешанные с диспергирующими веществами, смачивающими веществами или суспендирующими средствами, такими как поливинилпирролидоны, и подсластителями или веществами, корригирующими вкус и запах.
Ректальное введение достигается за счет использования суппозиториев, которые приготавливают со связующими, которые расплавляются при ректальной температуре, например, маслом какао или полиэтиленгликолями. Парентеральное введение осуществляется путем использования водных суспензий, изотонических солевых растворов или стерильных и инъецируемых растворов, которые включают фармакологически подходящие диспергирующие вещества и/или смачивающие вещества, например, пропиленгликоль или полиэтиленгликоль.
Основной активный ингредиент может также быть приготовлен в виде микрокапсул или липосом/центросом, если это целесообразно, с одним или более носителями или добавками.
Помимо соединений общей формулы I, их таутомеров, их гидратов или их фармацевтически приемлемых солей, композиции изобретения могут включать дополнительные основные активные ингредиенты, которые могут обеспечивать положительный эффект при лечении указанных выше повреждений или заболеваний.
Следовательно, настоящее изобретение, кроме того, относится к фармацевтическим композициям, в которых вместе присутствует множество основных активных ингредиентов, где по меньшей мере один из них является соединением по изобретению.
Следующие примеры иллюстрируют изобретение без его ограничения. В зависимости от способа осуществления реакции и метода выделения, соединения по изобретению присутствуют в виде смесей соединений формулы I и соответствующих гидратов формулы I-H. Превращение в чистые карбонильные соединения обычно осуществляют путем обработки веществ с помощью HCl в инертном растворителе.
Примеры синтезов
Используемые промежуточные соединения либо приобретали у их производителей, либо синтезировали в соответствии с методиками, описанными в WO 2008/080969.
Пример 1
2-[3-(4-Фторфенил)-1H-пиразол-1-ил]-N-[4-(метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил]пиридин-3-карбоксамид
1.1 Этил 3-(2-(3-(4-фторфенил)-1H-пиразол-1-ил)никотинамидо)-2-гидрокси-4-фенилбутаноат
N-(3-Диметиламинопропил)-N'-этилкарбодиимида гидрохлорид (EDC) (4,47 г, 23,3 ммоль), 1-гидроксибензотриазола гидрат (HOBt) (3,57 г, 23,3 ммоль) и триэтиламин (Et3N) (4,5 мл, 32,3 ммоль) последовательно добавляли к раствору 2-(3-(4-фторфенил)-1H-пиразол-1-ил)никотиновой кислоты (6,0 г, 21,8 ммоль) и 4-этокси-3-гидрокси-4-оксо-1-фенилбутан-2-аминия хлорида (6,60 г, 25,4 ммоль) в дихлорметане (300 мл) при 5°C, и смесь перемешивали при 5°C в течение приблизительно 5 минут. Доводили значение pH до 10 путем добавления 6 мл Et3N, смесь перемешивали в течение 1 часа при 5°C, и затем в течение ночи при комнатной температуре. Смесь затем концентрировали при пониженном давлении, выливали в 1000 мл воды, образовавшийся осадок отфильтровывали при разрежении и сушили под вакуумом с получением 7,8 г, которые обрабатывали с помощью 100 мл метил-трет-бутилового эфира с получением 7,39 г требуемого продукта. ESI-MS [M+H]+: 489,2.
1.2 3-(2-(3-(4-Фторфенил)-1H-пиразол-1-ил)никотинамидо)-2-гидрокси-4-фенилбутановая кислота
К суспензии этил 3-(2-(3-(4-фторфенил)-1H-пиразол-1-ил)никотинамидо)-2-гидрокси-4-фенилбутаноата (4500 мг, 9,21 ммоль) в тетрагидрофуране (THF) (500 мл) добавляли гидроксид лития (LiOH) (441 мг, 18,42 ммоль) в воде (100 мл), и смесь перемешивали в течение 2 часов при комнатной температуре. После завершения реакции (ТСХ: CH2Cl2+10% (об./об.) метанол), смесь концентрировали при пониженном давлении, и после добавления воды (300 мл) подкисляли с помощью 2 N HCl. Образовавшийся осадок отфильтровывали и сушили с получением 4,13 г белого аморфного твердого вещества.
1H-ЯМР (400 МГц ДМСО) δ [м.д.]: 12,78 (широкий, 1H), 8,65 (м, 1H), 8,42 (м, 1H), 8,30 (м, 1H), 7,90 (м, 2H), 7,75 (м, 1H), 7,50 (м, 1H), 7,18 (м, 6H), 7,0 (м, 1H), 5,26 (широкий, 1H), 4,44 (м, 1H), 3,86 (с, 1H), 2,82 и 2,67 (каждый м, 1H).
1.3 2-(3-(4-Фторфенил)-1H-пиразол-1-ил)-N-(3-гидрокси-4-(метоксиамино)-4-оксо-1-фенилбутан-2-ил)никотинамид
N,N-Диизопропилэтиламин (2 мл, 11,56 ммоль) добавляли к суспензии 3-(2-(3-(4-фторфенил)-1H-пиразол-1-ил)никотинамидо)-2-гидрокси-4-фенилбутановой кислоты (700 мг, 1,520 ммоль) и O-метилгидроксиламина гидрохлорида (0,577 мл, 7,60 ммоль) в дихлорметане (60 мл) при 5°C при перемешивании. Через приблизительно 5 минут добавляли 2-(1H-7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат (HATU) (665 мг, 1,748 ммоль), величину pH доводили до 10 путем добавления дополнительного количества диизопропилэтиламина, и смесь затем перемешивали в течение 1 часа при 5°C, и затем в течение ночи при комнатной температуре. Реакционную смесь затем концентрировали, добавляли 100 мл воды, образовавшийся осадок отфильтровывали при разрежении и сушили. Полученный неочищенный продукт обрабатывали с помощью 20 мл метил-трет-бутилового эфира, отфильтровывали и сушили с получением 318 мг белого аморфного твердого вещества. Экстракция маточного раствора дихлорметаном и испарение давали 384 мг желтоватого твердого вещества. Обе фракции объединяли и обрабатывали с помощью 6 мл смеси пентан/дихлорметан 1:1 с получением 126 мг требуемого продукта в виде белого твердого вещества. ESI-MS [M+H]+: 490,2.
1.4 2-[3-(4-Фторфенил)-1H-пиразол-1-ил]-N-[4-(метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил]пиридин-3-карбоксамид
При 5°C пиридин (350 мкл, 4,3 ммоль) и 5 мл раствора периодинан Десс-Мартина (0,3 М в дихлорметане) добавляли к раствору 2-(3-(4-фторфенил)-1H-пиразол-1-ил)-N-(3-гидрокси-4-(метоксиамино)-4-оксо-1-фенилбутан-2-ил)никотинамида (400 мг, 0,17 ммоль) в DMF (3 мл) и дихлорметане (50 мл). Смесь перемешивали в течение 1 часа при 5°C, затем в течение еще 30 минут при комнатной температуре. Затем добавляли 50 мл насыщенного раствора NaHCO3, органический слой промывали дважды водой, сушили, фильтровали и концентрировали с получением 423 мг желтого масла, которое обрабатывали с помощью 6 мл смеси н-пентан/CH2Cl2 (1:1 (об./об.)) с получением 123 мг белого аморфного твердого вещества. ESI-MS [M+H]+: 488,2.
1Н-ЯМР (400 МГц ДМСО) δ [м.д.]: 12,11 (широкий, 1H), 9,01 (дд, 1H), 8,56 (дд, 1H), 8,49 (дд, 1H), 7,78 (м, 2H), 7,65 (м, 1H), 7,47 (м, 1H), 7,16 (м, (H), 7,01 (д, 1H), 5,50 (м, 1H), 3,69 (с, 3H), 3,11 и 2,81 (каждый дд, 1H).
Пример 2
N-(4-(Метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
2.1 Этил 2-гидрокси-4-фенил-3-(2-(3-фенил-1H-пиразол-1-ил)никотинамидо)бутаноат
Реакцию проводили по аналогии с реакционной стадией 1.1, исходя из 2-(3-фенил-1H-пиразол-1-ил)никотиновой кислоты и 4-этокси-3-гидрокси-4-оксо-1-фенилбутан-2-аминия хлорида. ESI-MS [M+H]+=471,2.
2.2 2-Гидрокси-4-фенил-3-(2-(3-фенил-1H-пиразол-1-ил)-никотинамидо)бутановая кислота
Этил 2-гидрокси-4-фенил-3-(2-(3-фенил-1H-пиразол-1-ил)-никотинамидо)бутаноат подвергали омылению по аналогии с реакционной стадией 1.2. ESI-MS [M+H]+: 443,2.
1H-ЯМР (400 МГц ДМСО) δ [м.д.]: 8,54 (дд, 1H), 8,42 (д, 1H), 8,26 (д, 1H), 7,90 (д, 2H), 7,75 (дд, 1H), 7,47 (м, 1H), 7,35 (м, 2H), 7,27 (м, 2H), 7,17 (м, 4H), 6,99 (д, 1H), 4,42 (м, 1H), 3,78 (д, 1H), 2,80 и 2,67 (каждый м, 1H).
2.3 N-(3-Гидрокси-4-(метоксиамино)-4-оксо-1-фенилбутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
Реакцию проводили по аналогии с реакционной стадией 1.3 путем реакции 2-гидрокси-4-фенил-3-(2-(3-фенил-1H-пиразол-1-ил)никотинамидо)бутановой кислоты и O-метилгидроксиламина гидрохлорида. ESI-MS [M+H]+: 472,2.
2.4 N-(4-(Метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
К раствору N-(3-гидрокси-4-(метоксиамино)-4-оксо-1-фенилбутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамида (2000 мг, 4,24 ммоль) в ДМСО (25 мл) при 20°C добавляли 2-йодоксибензойную кислоту (IBX) (3959 мг, 6,36 ммоль). Добавляли еще 2 раза IBX (400 мг, 0,643 ммоль) в течение 2 часов, смесь перемешивали в течение ночи, добавляли еще 500 мг IBX и продолжали перемешивание. После завершения реакции (ТСХ: CH2Cl2 + 5% (об./об.) метанол), добавляли по каплям 100 мл насыщенного раствора NaHCO3, затем добавляли 200 мл воды и 200 мл дихлорметана, и осадок отфильтровывали при разрежении. Дихлорметановый слой сушили, фильтровали и концентрировали с получением 1,9 г желтоватого аморфного твердого вещества, которое кристаллизовали из этилацетата и сушили под вакуумом с получением 1,1 г названного соединения. ESI-MS [M+H]+: 470,2.
1H-ЯМР (400 МГц ДМСО) δ [м.д.]: 12,08 (широкий, 1H), 8,96 (широкий, 1H), 8,55 (дд, 1H), 8,47 (дд, 1H), 7,73 (м, 3H), 7,38-7,30 (м, 5H), 7,16 (м, 6H), 6,99 (д, 1H), 5,47 (м, 1H), 3,63 (с, 3H), 3,09 и 2,80 (каждый дд, 1H).
Пример 3
2-(4-Фтор-3-фенил-1H-пиразол-1-ил)-N-(4-(метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)никотинамид
3.1 Этил 2-(4-фтор-3-фенил-1H-пиразол-1-ил)никотинат
К раствору фтор-3-фенил-1H-пиразола (полученного в соответствии с T. Hanamoto et al; Tetrahedron 2007, 63 (23), 5062-5070) (0,95 г, 5,86 ммоль) и этил 2-хлор-никотината (2,3 г, 12,39 ммоль) в DMF (35 мл), добавляли K2CO3 (2,2 г, 15,92 ммоль), 18-краун-6 (0,15 г, 0,568 ммоль) и KI (0,10 г, 0,602 ммоль), и смесь нагревали до 135°C в течение 2 часов. После завершения реакции, смесь концентрировали при пониженном давлении. Остаток растворяли в дихлорметане (210 мл), промывали водой, солевым раствором, сушили, отфильтровывали и концентрировали с получением 3,0 г желтого масла, которое дополнительно очищали с помощью хроматографии на силикагеле (элюент: CH2Cl2+ 0-4% (об./об.) метанол). После испарения объединенных фракций продукта, получали 1,49 г указанного в заголовке соединения в виде масла. ESI-MS [M+H]+: 312,1.
3.2 2-(4-Фтор-3-фенил-1H-пиразол-1-ил)никотиновая кислота
К этил 2-(4-фтор-3-фенил-1H-пиразол-1-ил)никотинату (1,49 г, 4,79 ммоль) в метаноле (40 мл) добавляли по каплям 8,5 мл 2 М водного раствора NaOH (17 ммоль) при 10°C, и смесь перемешивали в течение 2 часов при комнатной температуре, и затем в течение 3 часов при 65°C. После завершения реакции, смесь концентрировали при пониженном давлении, растворяли в воде и подкисляли с помощью 2 N HCl. Образовавшийся осадок отфильтровывали, промывали водой и сушили с получением 1,23 г белого аморфного твердого вещества. ESI-MS [M+H]+: 284,1.
3.3 Этил 3-(2-(4-фтор-3-фенил-1H-пиразол-1-ил)никотинамидо)-2-гидрокси-4-фенилбутаноат
Реакцию проводили по аналогии с реакционной стадией 1.1 путем реакции 2-(4-фтор-3-фенил-1H-пиразол-1-ил)никотиновой кислоты и 4-этокси-3-гидрокси-4-оксо-1-фенилбутан-2-аминия хлорида. ESI-MS [M+H]+: 489,2.
3.4 3-(2-(4-Фтор-3-фенил-1H-пиразол-1-ил)никотинамидо)-2-гидрокси-4-фенилбутановая кислота
Этил 3-(2-(4-фтор-3-фенил-1H-пиразол-1-ил)никотинамидо)-2-гидрокси-4-фенилбутаноат подвергали омылению по аналогии с реакционной стадией 1.2. ESI-MS [M+H]+: 461,2.
3.5 2-(4-Фтор-3-фенил-1H-пиразол-1-ил)-N-(3-гидрокси-4-(метоксиамино)-4-оксо-1-фенилбутан-2-ил)никотинамид
Реакцию проводили по аналогии с реакционной стадией 1.3 путем реакции 3-(2-(4-фтор-3-фенил-1H-пиразол-1-ил)никотинамидо)-2-гидрокси-4-фенилбутановой кислоты с O-метилгидроксиламина гидрохлоридом. ESI-MS [M+H]+: 490,2.
3.6 2-(4-Фтор-3-фенил-1H-пиразол-1-ил)-N-(4-(метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)никотинамид
2-(4-Фтор-3-фенил-1H-пиразол-1-ил)-N-(3-гидрокси-4-(метоксиамино)-4-оксо-1-фенилбутан-2-ил)никотинамид окисляли по аналогии с реакционной стадией 2.4. ESI-MS [M+H]+: 488,2.
1H-ЯМР (400 МГц ДМСО) δ [м.д.]: 8,77 (м, 2H), 8,52 (д, 1H), 7,50 (м, 1H), 7,65 (м, 2H), 7,44 (м, 3H), 7,31 (м, 1H), 7,08 (м, 5H), 5,60 (м, 1H), 3,59 (с, 3H), 3,30 (перекрываемый водой), 2,69 (м, 1H).
Пример 4
N-[4-(Метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил]-2-(4-метил-3-фенил-1H-пиразол-1-ил)пиридине-3-карбоксамид
4.1 Этил 2-гидрокси-3-(2-(4-метил-3-фенил-1H-пиразол-1-ил)никотинамидо)-4-фенилбутаноат
Реакцию проводили по аналогии с реакционной стадией 1.1 путем реакции 2-(4-метил-3-фенил-1H-пиразол-1-ил)никотиновой кислоты и 4-этокси-3-гидрокси-4-оксо-1-фенилбутан-2-аминия хлорида. ESI-MS [M+H]+: 485,3.
4.2 3-(2-(4-Метил-3-фенил-1H-пиразол-1-ил)никотинамидо)-2-гидрокси-4-фенилбутановая кислота
Этил 2-гидрокси-3-(2-(4-метил-3-фенил-1H-пиразол-1-ил)-никотинамидо)-4-фенилбутаноат подвергали омылению по аналогии с реакционной стадией 1.2. ESI-MS [M+H]+: 457,2.
4.3 N-(3-Гидрокси-4-(метоксиамино)-4-оксо-1-фенилбутан-2-ил)-2-(4-метил-3-фенил-1H-пиразол-1-ил)никотинамид
Реакцию проводили по аналогии с реакционной стадией 1.3 путем реакции 3-(2-(4-метил-3-фенил-1H-пиразол-1-ил)никотинамидо)-2-гидрокси-4-фенилбутановой кислоты с O-метилгидроксиламина гидрохлоридом. ESI-MS [M+H]+: 486,2.
4.4 N-[4-(Метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил]-2-(4-метил-3-фенил-1H-пиразол-1-ил)пиридин-3-карбоксамид
К нанесенной на полимер IBX (Novabiochem, 1,1 ммоль/г; 300 мг, 0,330 ммоль) добавляли дихлорметан (5 мл), и смесь выдерживали в течение 10 минут. Затем добавляли N-(3-гидрокси-4-(метоксиамино)-4-оксо-1-фенилбутан-2-ил)-2-(4-метил-3-фенил-1H-пиразол-1-ил)никотинамид (77 мг, 0,159 ммоль) в 10 мл дихлорметана, и смесь встряхивали в течение 1 дня при комнатной температуре. Через 2 дня и 3 дня добавляли дополнительные порции нанесенной на полимер IBX (120 мг, 0,132 ммоль и 100 мг, 0,110 ммоль). Через 4 дня смесь отфильтровывали, испаряли при пониженном давлении, и неочищенный продукт очищали с помощью хроматографии на силикагеле (элюент: CH2Cl2 + 2-4% (об./об.) метанол). После испарения объединенных фракций продукта, получали 45 мг аморфного твердого вещества. ESI-MS [M+H]+: 484,2.
Пример 5
N-(1-(4-Фторфенил)-4-(метоксиамино)-3,4-диоксобутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
3-(2-(3-Фенил-1H-пиразол-1-ил)никотинамидо)-2-гидрокси-4-(4-фторфенил)бутановую кислоту получали с использованием методов, аналогичных стадиям 1.1 и 1.2.
5.1 N-(1-(4-Фторфенил)-3-гидрокси-4-(метоксиамино)-4-оксобутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
Реакцию проводили по аналогии с реакционной стадией 1.3 путем реакции 3-(2-(3-фенил-1H-пиразол-1-ил)никотинамидо)-2-гидрокси-4-(4-фторфенил)бутановой кислоты с O-метилгидроксиламина гидрохлоридом. ESI-MS [M+H]+: 490,1
5.2 N-(1-(4-Фторфенил)-4-(метоксиамино)-3,4-диоксобутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
N-(1-(4-Фторфенил)-3-гидрокси-4-(метоксиамино)-4-оксобутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид окисляли по аналогии с реакционной стадией 2.4. ESI-MS [M+H]+: 488,2.
1H-ЯМР (400 МГц ДМСО) δ [м.д.]: 12,14 (широкий, 1H), 9,01 (м, 1H), 8,57 (м, 1H), 8,50 (м, 1H), 7,71 (м, 3Н), 7,50 (м, 1H), 7,38 (м, 3H), 7,16 (м, 2H), 7,01 (м, 3H), 5,44 (м, 1H), 3,69 (с широкий, 3Н), 3,12 и 2,76 (каждый м, 1H).
Пример 6
N-(1-(3-Фторфенил)-4-(метоксиамино)-3,4-диоксобутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
3-(2-(3-Фенил-1H-пиразол-1-ил)никотинамидо)-2-гидрокси-4-(3-фторфенил)бутановую кислоту получали с использованием методов, аналогичных стадиям 1.1 и 1.2.
6.1 N-(1-(3-Фторфенил)-3-гидрокси-4-(метоксиамино)-4-оксобутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
Реакцию проводили по аналогии с реакционной стадией 1.3 путем реакции 3-(2-(3-фенил-1H-пиразол-1-ил)никотинамидо)-2-гидрокси-4-(3-фторфенил)бутановой кислоты с O-метилгидроксиламина гидрохлоридом. ESI-MS [M+H]+: 490,2.
6.2 N-(1-(3-Фторфенил)-4-(метоксиамино)-3,4-диоксобутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
N-(1-(3-Фторфенил)-3-гидрокси-4-(метоксиамино)-4-оксобутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид окисляли по аналогии с реакционной стадией 2.4. ESI-MS [M+H]+: 488,2.
1H-ЯМР (400 МГц ДМСО) δ [м.д.]: 9,08 (м, 1H), 8,60 (м, 1H), 8,47 (м, 1H), 7,73 (м, 3H), 7,49 (м, 1H), 7,33 (м, 3H), 7,12 (м, 1H), 6,94 (м, 4H), 5,52 (м, 1H), 3,70 (с, 3H), 3,13 и 2,81 (каждый м, 1H).
Пример 7
N-(4-(Этоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
7.1 N-(4-(Этоксиамино)-3-гидрокси-4-оксо-1-фенилбутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
Реакцию проводили по аналогии с реакционной стадией 1.3 путем реакции 2-гидрокси-4-фенил-3-(2-(3-фенил-1H-пиразол-1-ил)никотинамидо)бутановой кислоты и O-этилгидроксиламина гидрохлоридом. ESI-MS [M+H]+: 486,2.
7.2 N-(4-(Этоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
N-(4-(Этоксиамино)-3-гидрокси-4-оксо-1-фенилбутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид окисляли по аналогии с реакционной стадией 2.4. ESI-MS [M+H]+: 484,2.
1H-ЯМР (400 МГц ДМСО) δ [м.д.]: 11,82 (широкий, 1H), 8,88 (м, 1H), 8,54 (м, 1H), 8,36 (м, 1H), 7,71 (м, 3H), 7,44 (м, 1H), 7,35 (м, 3H), 7,17 (м, 5H), 6,94 (м, 1H), 5,50 (м, 1H), 3,89 (м, 2H), 3,12 и 2,84 (каждый м, 1H), 1,16 (м, 3H).
Пример 8
N-(4-(Аллилоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
8.1 N-(4-(Аллилоксиамино)-3-гидрокси-4-оксо-1-фенилбутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
Реакцию проводили по аналогии с реакционной стадией 1.3 путем реакции 2-гидрокси-4-фенил-3-(2-(3-фенил-1H-пиразол-1-ил)никотинамидо)бутановой кислоты с O-аллилгидроксиламина гидрохлоридом. ESI-MS [M+H]+: 498,2.
8.2 N-(4-(Аллилоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
N-(4-(Аллилоксиамино)-3-гидрокси-4-оксо-1-фенилбутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид окисляли по аналогии с реакционной стадией 2.4. ESI-MS [M+H]+: 496,2.
1H-ЯМР (400 МГц ДМСО) δ [м.д.]: 12,1 (широкий, 1H), 9,01 (м, 1H), 8,71 (м, 1H), 8,28 (м, 1H), 7,72 (м, 3H), 7,466 (м, 1H), 7,36 (м, 2H), 7,18 (м, 5H), 7,01 (м, 1H), 5,95 (м, 1H), 5,51 (м, 1H), 5,36 (м, 1H), 5,24 (м, 1H), 4,35 (м, 3H), 3,08 (м, 2H), 2,78 (м, 1H).
Пример 9
N-(4-(Метоксиамино)-1-(4-метоксифенил)-3,4-диоксобутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
3-(2-(3-Фенил-1H-пиразол-1-ил)никотинамидо)-2-гидрокси-4-(4-метоксифенил)бутановую кислоту получали с использованием методов, аналогичных стадиям 1.1 и 1.2.
9.1 N-(3-Гидрокси-4-(метоксиамино)-4-оксо-1-(4-метоксифенил)бутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
Реакцию проводили по аналогии с реакционной стадией 1.3 путем реакции 2-гидрокси-4-(4-метоксифенил)-3-(2-(3-фенил-1H-пиразол-1-ил)никотинамидо)бутановой кислоты с O-метилгидроксиламина гидрохлоридом. ESI-MS [M+H]+: 502,2.
9.2 N-(4-(Метоксиамино)-1-(4-метоксифенил)-3,4-диоксобутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
N-(3-Гидрокси-4-(метоксиамино)-4-оксо-1-(4-метоксифенил)-бутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид окисляли по аналогии с реакционной стадией 2.4. ESI-MS [M+H]+: 500,2.
1H-ЯМР (400 МГц ДМСО) δ [м.д.]: 12,17 (с, 1H), 8,88 (м, 1H), 8,55 (м, 1H), 8,47 (м, 1H), 7,74 (м, 4H), 7,48 (м, 1H), 7,40 (м, 3H), 6,99 (м, 2H), 6,90 (м, 1H), 6,71 (м, 2H), 5,55 (м, 1H), 3,54 (с, 6H), 3,13 и 2,67 (каждый м, 1H).
Пример 10
2-(4-Хлор-3-фенил-1H-пиразол-1-ил)-N-(4-(метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)никотинамид
10.1 4-Хлор-3-фенил-1H-пиразол
К раствору 3-фенил-1H-пиразола (3 г, 20,81 ммоль) в дихлорэтане (60 мл) добавляли N-хлорсукцинимид (2,92 г, 21,85 ммоль), и смесь перемешивали в течение ночи при комнатной температуре. Смесь затем концентрировали при пониженном давлении, и остаток очищали с помощью хроматографии на силикагеле (элюент: циклогексан/этилацетат 0-30% (об./об.)). Концентрирование объединенных фракций давало 3,54 г слегка желтого аморфного твердого вещества; ESI-MS [M+H]+: 179,0.
10.2 Этил 2-(4-хлор-3-фенил-1H-пиразол-1-ил)никотинат
Реакцию проводили по аналогии с реакционной стадией 3.1 путем реакции 4-хлор-3-фенил-1H-пиразола и этил 2-хлорникотината. ESI-MS [M+H]+: 328,1.
10.3 2-(4-Хлор-3-фенил-1H-пиразол-1-ил)никотиновая кислота
Этил 2-(4-хлор-3-фенил-1H-пиразол-1-ил)никотинат подвергали омылению по аналогии с реакционной стадией 3.2. ESI-MS [M+H]+: 300,2.
10.4 Этил 3-(2-(4-хлор-3-фенил-1H-пиразол-1-ил)-никотинамидо)-2-гидрокси-4-фенилбутаноат
Реакцию проводили по аналогии с реакционной стадией 1.1 путем реакции 2-(4-хлор-3-фенил-1H-пиразол-1-ил)никотиновой кислоты и 4-этокси-3-гидрокси-4-оксо-1-фенилбутан-2-аминия хлорида. ESI-MS [M+H]+: 505,15.
10.5 3-(2-(4-Хлор-3-фенил-1H-пиразол-1-ил)никотинамидо)-2-гидрокси-4-фенилбутановая кислота
Этил 3-(2-(4-хлор-3-фенил-1H-пиразол-1-ил)никотинамидо)-2-гидрокси-4-фенилбутаноат подвергали омылению по аналогии с реакционной стадией 1.2. ESI-MS [M+H]+: 477,1.
10.6 2-(4-Хлор-3-фенил-1H-пиразол-1-ил)-N-(3-гидрокси-4-(метоксиамино)-4-оксо-1-фенилбутан-2-ил)никотинамид
Реакцию проводили по аналогии с реакционной стадией 1.3 путем реакции 3-(2-(4-Хлор-3-фенил-1H-пиразол-1-ил)никотинамидо)-2-гидрокси-4-фенилбутановой кислоты с O-метилгидроксиламина гидрохлоридом. ESI-MS [M+H]+: 506,2.
10.7 2-(4-Хлор-3-фенил-1H-пиразол-1-ил)-N-(4-(метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)никотинамид
2-(4-Хлор-3-фенил-1H-пиразол-1-ил)-N-(3-гидрокси-4-(метоксиамино)-4-оксо-1-фенилбутан-2-ил)никотинамид окисляли по аналогии с реакционной стадией 2.4. ESI-MS [M+H]+: 504,15.
1Н-ЯМР (400 МГц ДМСО) δ [м.д.]: 12,05 (с широкий, 1H), 9,06 (м, 1H), 8,75 (с, 1H), 8,60 (м, 1H), 7,80 (м, 3H), 7,55 (м, 1H), 7,44 (м, 3H), 7,17 (м, 6H), 5,48 (м, 1H), 3,70 (с, ЗН), 3,13 и 2,78 (каждый м, 1H).
Пример 11
N-[4-(Изопропоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-(3-фенил-1H-пиразол-1-ил)никотинамид
11.1 N-(3-Гидрокси-4-(изопропоксиамино)-4-оксо-1-фенилбутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
ESI-MS [M+H+]: 500,2.
11.2 N-[4-(Изопропоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-(3-фенил-1H-пиразол-1-ил)никотинамид
ESI-MS [M+H+]: 498,2.
Пример 12
N-[3,4-Диоксо-1-фенил-4-(пропоксиамино)-2-бутанил]-2-(3-фенил-1H-пиразол-1-ил)никотинамид
12.1 N-(3-Гидрокси-4-оксо-1-фенил-4-(пропоксиамино)бутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
ESI-MS [M+H+]: 500,2.
12.2 N-[3,4-Диоксо-1-фенил-4-(пропоксиамино)-2-бутанил]-2-(3-фенил-1H-пиразол-1-ил)никотинамид
ESI-MS [M+H+]: 498,2.
1Н-ЯМР (400 МГц ДМСО), δ [м.д.] (конформеры, основной/побочный): 12,05/11,25 (с широкий, 1H), 9,05/8,95 (широкий, 1H), 8,55 (м, 2H), 7,97-7,70 (м, 3H), 7,48-7,37 (м, 4H), 7,19 (м, 5H), 7,02 (с, 1H), 5,51/5,65 (широкий, 1H), 3,77/4,06 (широкий, 2H), 3,14 и 2,84 (каждый широкий, 2H), 1,70-1,57 (м, 3H), 0,92 (м, 4H).
Пример 13
N-[4-(Метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-{3-[4-(4-морфолинил)фенил]-1H-пиразол-1-ил}никотинамид
13.1 N-(3-Гидрокси-4-(метоксиамино)-4-оксо-1-фенилбутан-2-ил)-2-(3-(4-морфолинофенил)-1H-пиразол-1-ил)никотинамид
ESI-MS [M+H+]: 557,2.
13.2 N-[4-(Метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-{3-[4-(4-морфолинил)фенил]-1H-пиразол-1-ил}никотинамид
ESI-MS [M+H+]: 555,2.
1H-ЯМР (400 МГц ДМСО), δ [м.д.]: 12,12 (с широкий, 1H), 8,98 (широкий, 1H), 8,53 (с, 1H), 8,44 (с, 1H), 7,70 (м, 1H), 7,63 (м, 2H), 7,44 (м, 1H), 7,19 (м, 5H), 6,93 (м, 3H), 5,48 (м, 1H), 3,78 (м, 4H), 3,63 (с широкий, 3H), 3,17 (м, 5H), 2,83 (м, 1H).
Пример 14
N-[4-(Метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-{3-[4-(4-морфолинилметил)фенил]-1H-пиразол-1-ил}никотинамид
14.1 N-(3-Гидрокси-4-(метоксиамино)-4-оксо-1-фенилбутан-2-ил)-2-(3-(4-(морфолинометил)фенил)-1H-пиразол-1-ил)никотинамид
ESI-MS [M+H+]: 571,2.
14.2 N-[4-(Метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-{3-[4-(4-морфолинилметил)фенил]-1H-пиразол-1-ил}никотинамид
ESI-MS [M+H+]: 569,2.
1H-ЯМР (400 МГц ДМСО), δ [м.д.]: 12,10 (широкий, 1H), 8,99 (с, 1H), 8,55 (д, 1H), 8,49 (с, 1H), 7,72 (м, 3Н), 7,47 (м, 1H), 7,33 (м, 2H), 7,17 (м, 5H), 6,98 (с, 1H), 5,50 (м, 1H), 3,69 (с широкий, 3H), 3,59-3,44 (перекрываемый водой), 3,13 и 2,82 (каждый дд, 1H), 2,37 (м, 4H).
Пример 15
2-(3-{4-[(Диэтиламино)метил]фенил}-1H-пиразол-1-ил)-N-[4-(метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]никотинамид
15.1 2-(3-(4-((Диэтиламино)метил)фенил)-1H-пиразол-1-ил)-N-(3-гидрокси-4-(метоксиамино)-4-оксо-1-фенилбутан-2-ил)-никотинамид
ESI-MS [M+H+]: 557,2.
15.2 2-(3-{4-[(Диэтиламино)метил]фенил}-1H-пиразол-1-ил)-N-[4-(метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]никотинамид
ESI-MS [M+H+]: 555,2.
1H-ЯМР (400 МГц ДМСО), δ [м.д.]: 8,97 (д, 1Н), 8,55 (с, 1H), 8,48 (с, 1H), 7,72 (м, 3H), 7,46 (м, 1H), 7,35 (д, 2H), 7,18 (м, 5H), 6,98 (с, 1H), 5,50 (м, 1H), 3,69 (с, 2H), 3,48 (перекрываемый водой, 4H), 3,11 и 2,82 (каждый дд, 1Н), 2,49 (м, 4H).
Пример 16
N-(4-{[(2-Метил-2-пропанил)окси]амино}-3,4-диоксо-1-фенил-2-бутанил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
16.1 N-(4-(трет-Бутоксиамино)-3-гидрокси-4-оксо-1-фенилбутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
ESI-MS [M+H+]: 514,2.
16.2 N-(4-{[(2-Метил-2-пропанил)окси]амино}-3,4-диоксо-1-фенил-2-бутанил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
ESI-MS [M+H+]: 512,2.
1H-ЯМР (400 МГц ДМСО), (конформеры, основной/побочный) δ [м.д.]: 11,4/10,95 (с широкий, 1H), 9,00/8,90 (м, 1H), 8,55-8,48 (м, 2H), 7,75 (м, 3H), 7,46 (м, 1H), 7,35 (м, 3H), 7,18 (м, 5H), 6,99 (м, 1H), 5,71/5,44 (м, 1H), 3,13 и 2,81 (каждый м, 1H), 1,18/1,33 (с, 9H).
Пример 17
N-{4-[(Циклопентилокси)амино]-3,4-диоксо-1-фенил-2-бутанил}-2-(3-фенил-1H-пиразол-1-ил)никотинамид
17.1 N-(4-(Циклопентилоксиамино)-3-гидрокси-4-оксо-1-фенилбутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
ESI-MS [M+H+]: 526,2.
17.2 N-{4-[(Циклопентилокси)амино]-3,4-диоксо-1-фенил-2-бутанил}-2-(3-фенил-1H-пиразол-1-ил)никотинамид
ESI-MS [M+H+]: 524,2.
1H-ЯМР (400 МГц ДМСО) δ [м.д.]: 11,8 (с широкий, 1H), 8,98 (с, 1H), 8,55 (с, 1H), 8,48 (с, 1H), 7,73 (3Н), 7,46 (м, 1H), 7,38 (м, 3Н), 7,17 (м, 5Н), 7,00 (с, 1H), 5,50 (м, 1H), 4,49 (м, 1H), 3,12 и 2,81 (каждый м, 1H), 1,74-1,50 (м, 8H).
Пример 18
N-[4-(Этоксиамино)-1-(4-фторфенил)-3,4-диоксо-2-бутанил]-2-(3-фенил-1H-пиразол-1-ил)никотинамид
18.1 N-(4-(Этоксиамино)-1-(4-фторфенил)-3-гидрокси-4-оксобутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
ESI-MS [M+H+]: 504,2.
18.2 N-[4-(Этоксиамино)-1-(4-фторфенил)-3,4-диоксо-2-бутанил]-2-(3-фенил-1H-пиразол-1-ил)никотинамид
ESI-MS [M+H+]: 502,2.
1H-ЯМР (400 МГц ДМСО) δ [м.д.]: 11,8 (широкий, 1H), 8,97 (с, 1H), 8,57 (с, 1H), 8,50 (с, 1H), 7,74 (м, 2H), 7,49 (м, 1H), 7,38 (м, 3H), 7,35 (м, 2H), 7,15 (м, 4H), 5,43 (м, 1H), 3,91 (м, 2H), 3,09 и 2,79 (каждый м, 1H), 1,20 (м, 3H).
Пример 19
N-[4-(Этоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-(4-фтор-3-фенил-1H-пиразол-1-ил)никотинамид
19.1 N-(4-(Этоксиамино)-3-гидрокси-4-оксо-1-фенилбутан-2-ил)-2-(4-фтор-3-фенил-1H-пиразол-1-ил)никотинамид
ESI-MS [M+H+]: 504,2.
19.2 N-[4-(Этоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-(4-фтор-3-фенил-1H-пиразол-1-ил)никотинамид
ESI-MS [M+H+]: 502,2.
1H-ЯМР (400 МГц ДМСО) δ [м.д.]: 11,90 (широкий, 1H), 9,00 (широкий, 1H), 8,65 (д, 1H), 8,57 (д, 1H), 7,76 (м, 1H), 7,70 (м, 2H), 7,51 (м, 1H), 7,44 (м, 3H), 7,16 (м, 5H), 5,49 (м, 1H), 3,92 (м широкий, 2H), 3,12 и 2,79 (каждый дд, 1H), 1,19 (м, 3H).
Пример 20
N-{4-[(Циклобутилокси)амино]-3,4-диоксо-1-фенил-2-бутанил}-2-(3-фенил-1H-пиразол-1-ил)никотинамид
20.1 N-(4-(Циклобутоксиамино)-3-гидрокси-4-оксо-1-фенилбутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
ESI-MS [M+H+]: 512,2.
20.2 N-{4-[(Циклобутилокси)амино]-3,4-диоксо-1-фенил-2-бутанил}-2-(3-фенил-1H-пиразол-1-ил)никотинамид
ESI-MS [M+H+]: 502,2.
1H-ЯМР (400 МГц ДМСО) δ [м.д.]: 11,94 (с широкий, 1H), 8,95 (широкий, 1H), 8,55 (д, 1H), 8,47 (д, 1H), 7,76 (м, 3H), 7,48 (м, 1H), 7,36 (м, 3H), 7,15 (м, 5H), 6,99 (д, 1H), 5,48 (м, 1H), 4,39 (м, 1H), 3,10 и 2,82 (каждый м, 1H), 2,10 (м, 4H), 1,50 и 0,50 (каждый м, 1H).
Пример 21
N-{4-[(2,2-Диметилпропокси)амино]-3,4-диоксо-1-фенил-2-бутанил}-2-(3-фенил-1H-пиразол-1-ил)никотинамид
21.1 N-(3-Гидрокси-4-(неопентилоксиамино)-4-оксо-1-фенилбутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
ESI-MS [M+H+]: 528,2.
21.2 N-{4-[(2,2-Диметилпропокси)амино]-3,4-диоксо-1-фенил-2-бутанил}-2-(3-фенил-1H-пиразол-1-ил)никотинамид
ESI-MS [M+H+]: 526,2.
1Н-ЯМР (400 МГц ДМСО) δ [м.д.]: 12,03 (широкий, 1H), 8,94 (широкий, 1H), 8,55 (д, 1H), 8,46 (д, 1H), 7,75 (м, 3H), 7,47 (м, 1H), 7,40 (м, 3H), 7,17 (м, 5H), 6,99 (с, 1H), 5,49 (м, 1H), 3,48 (широкий, 2H), 3,08 и 2,81 (каждый дд, 1H), 0,90 (с, 9H).
Пример 22
N-(4-{[2-(4-Морфолинил)этокси]амино}-3,4-диоксо-1-фенил-2-бутанил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
22.1 N-(3-Гидрокси-4-(2-морфолиноэтоксиамино)-4-оксо-1-фенилбутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
ESI-MS [M+H+]: 571,2.
22.2 N-(4-{[2-(4-Морфолинил)этокси]амино}-3,4-диоксо-1-фенил-2-бутанил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
ESI-MS [M+H+]: 569,2.
Пример 23:
N-{4-[(Циклопропилметокси)амино]-3,4-диоксо-1-фенил-2-бутанил}-2-(3-фенил-1H-пиразол-1-ил)никотинамид
23.1 N-(4-(Циклопропилметоксиамино)-3-гидрокси-4-оксо-1-фенилбутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
ESI-MS [M+H+]: 512,2.
23.2 N-{4-[(Циклопропилметокси)амино]-3,4-диоксо-1-фенил-2-бутанил}-2-(3-фенил-1H-пиразол-1-ил)никотинамид
ESI-MS [M+H+]: 510,2.
1H-ЯМР (400 МГц ДМСО) δ [м.д.]: 11,97 (широкий, 1H), 8,93 (широкий, 1H), 8,55 (д, 1H), 8,46 (д, 1H), 7,75-7,50 (м, 3H), 7,46 (м, 1H), 7,38 (м, 3H), 7,18 (м, 5H), 6,99 (д, 1H), 5,49 (м, 1H), 3,61 (широкий, 2H), 3,10 и 2,82 (каждый дд, 1H), 1,05 (м, 1H), 0,51 и 0,24 (каждый м, 2H).
Пример 24
N-[4-(Этоксиамино)-1-(4-метоксифенил)-3,4-диоксо-2-бутанил]-2-(3-фенил-1H-пиразол-1-ил)никотинамид
24.1 N-(4-(Этоксиамино)-3-гидрокси-1-(4-метоксифенил)-4-оксобутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
ESI-MS [M+H+]: 514,2.
24.2 N-[4-(Этоксиамино)-1-(4-метоксифенил)-3,4-диоксо-2-бутанил]-2-(3-фенил-1H-пиразол-1-ил)никотинамид
ESI-MS [M+H+]: 514,2.
1H-ЯМР (400 МГц ДМСО) δ [м.д.]: 11,94 (широкий, 1H), 8,89 (широкий, 1H), 8,55 (д, 1H), 8,47 (д, 1H), 7,74 (м, 3H), 7,49 (м, 1H), 7,38 (м, 1H), 7,35 (м, 3H), 7,06 (м, 2H), 6,99 (м, 1H), 6,73 (м, 2H), 5,43 (м, 1H), 3,84 (широкий, 2H), 3,71 (с, 3H), 3,03 и 2,74 (каждый м, 1H), 1,16 (м, 3H).
Пример 25
2-[3-(2-Фторфенил)-1H-пиразол-1-ил]-N-[4-(метоксиамино)-3,4-диоксо-1-фенил-2-бутанил] никотинамид
25.1 2-(3-(2-Фторфенил)-1H-пиразол-1-ил)-N-(3-гидрокси-4-(метоксиамино)-4-оксо-1-фенилбутан-2-ил)никотинамид
ESI-MS [M+H+]: 490,2.
25.2 2-[3-(2-Фторфенил)-1H-пиразол-1-ил]-N-[4-(метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]никотинамид
ESI-MS [M+H+]: 488,2.
1Н-ЯМР (400 МГц ДМСО) δ [м.д.]: 12,08 (широкий, 1H), 9,00 (широкий, 1H), 8,59 (д, 1H), 8,54 (с, 1H), 7,76 (м, 2H), 7,52 (м, 1H), 7,49 (м, 1H), 7,32 (м, 1H), 7,19 (м, 6H), 6,87 (с, 1H), 5,49 (м, 1H), 3,69 (м, 3H), 3,11 и 2,79 (каждый дд, 1H).
Пример 26
N-[4-(Метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-{3-[3-(трифторметил)фенил]-1H-пиразол-1-ил}никотинамид
26.1 N-(3-Гидрокси-4-(метоксиамино)-4-оксо-1-фенилбутан-2-ил)-2-(3-(3-(трифторметил)фенил)-1H-пиразол-1-ил)никотинамид
ESI-MS [M+H+]: 538,2.
26.2 N-[4-(Метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-{3-[3-(трифторметил)фенил]-1H-пиразол-1-ил}никотинамид
ESI-MS [M+H+]: 540,2.
1H-ЯМР (400 МГц ДМСО) 5 [м.д.]: 12,01 (широкий, 1H), 8,97 (широкий, 1H), 8,58 (д, 1H), 8,52 (с, 1H), 8,09 (с, 1H), 8,02 (м, 1H), 7,77 (м, 1H), 7,69 (м, 1H), 7,62 (м, 1H), 7,51 (м, 1H), 7,17 (с, 1H), 7,08 (м, 5H), 5,39 (м, 1H), 3,67 (м, 3H), 3,10 и 2,76 (каждый дд, 1H).
Пример 27
N-[4-(Метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-[3-(2-пиридинил)-1H-пиразол-1-ил]никотинамид
27.1 N-(3-Гидрокси-4-(метоксиамино)-4-оксо-1-фенилбутан-2-ил)-2-(3-(пиридин-2-ил)-1H-пиразол-1-ил)никотинамид
ESI-MS [M+H+]: 473,2.
27.2 N-[4-(Метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-[3-(2-пиридинил)-1H-пиразол-1-ил]никотинамид
ESI-MS [M+H+]: 471,1.
1Н-ЯМР (400 МГц ДМСО) δ [м.д.]: 12,11 (широкий, 1H), 8,99 (широкий, 1H), 8,58 (м, 2H), 8,49 (д, 1H), 7,74 (м, 3H), 7,50, (дд, 1H), 7,34 (дд, 1H), 7,20 (м, 5H), 7,03 (д, 1H), 5,48 (м, 1H), 3,64 (широкий, 3Н), 3,10 и 2,76 (каждый дд, 1H).
Пример 28 (сравнительный)
N-(3-Амино-1-бензил-2,3-диоксопропил)-2-[3-(4-фторфенил)-1H-пиразол-1-ил]никотинамид
Указанное в заголовке соединение является идентичным соединению Примера 38 WO 08/080969, и оно было получено так, как это описано в этом документе.
Пример 29
(2R)-1-Бензил-N-(4-(этоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамид
Исходный реагент (R)-1-бензил-5-оксо-пирролидин-2-карбоновая кислота, которую использовали в следующем примере, является коммерчески доступной.
29.1 Этил 3-((R)-1-бензил-5-оксопирролидин-2-карбоксамидо)-2-гидрокси-4-фенилбутаноат
Реакцию проводили по аналогии с реакционной стадией 1.1 путем реакции (R)-1-бензил-5-оксопирролидин-2-карбоновой кислоты и 4-этокси-3-гидрокси-4-оксо-1-фенилбутан-2-аминия хлорида. ESI-MS [M+H]+=425,2.
29.2 3-((R)-1-Бензил-5-оксопирролидин-2-карбоксамидо)-2-гидрокси-4-фенилбутановая кислота
Этил 3-((R)-1-бензил-5-оксопирролидин-2-карбоксамидо)-2-гидрокси-4-фенилбутаноат подвергали омылению по аналогии с реакционной стадией 1.2. ESI-MS [M+H]+=397,2.
29.3 (2R)-1-Бензил-N-(4-(этоксиамино)-3-гидрокси-4-оксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамид
Реакцию проводили по аналогии с реакционной стадией 1.3 путем реакции 3-((R)-1-бензил-5-оксопирролидин-2-карбоксамидо)-2-гидрокси-4-фенилбутановой кислоты с O-этилгидроксиламина гидрохлоридом с использованием HATU (1,2 эквивалентов) в качестве реагента реакции сочетания и DIPEA (6,8 эквивалентов) в качестве основания. ESI-MS [M+H]+=440,2.
29.4 (2R)-1-Бензил-N-(4-(этоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамид
IBX (2-йодоксибензойную кислоту 432 мг, 0,694 ммоль) добавляли к раствору (2R)-1-бензил-N-(4-(этоксиамино)-3-гидрокси-4-оксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамида (218 мг, 0,496 ммоль) в ДМСО (2 мл). После перемешивания в течение 2 часов при комнатной температуре добавляли еще IBX (123 мг, 0,198 ммоль), и перемешивание продолжали в течение ночи. Добавляли насыщенный водный раствор NaHCO3, и реакционную смесь разбавляли водой и дихлорметаном. Образовавшийся осадок отфильтровывали, органический слой отделяли, и водный слой экстрагировали дихлорметаном. Объединенные органические слои промывали водой и сушили (MgSO4). Растворитель удаляли под вакуумом, полученный остаток повторно растворяли в небольшом количестве дихлорметана, и добавляли диэтиловый эфир. Образовавшийся белый осадок фильтровали, промывали диэтиловым эфиром и сушили под вакуумом. Неочищенный продукт растворяли в дихлорметане и обрабатывали тремя каплями водной HCl (4M в диоксане). Удаление растворителя давало указанное в заголовке соединение (8,2 мг, 0,015 ммоль, выход 3,02%). ESI-MS [M+H]+=438,2.
Пример 30
(2R)-1-Бензил-N-(4-(изопропоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамид
Исходный реагент (R)-1-бензил-5-оксопирролидин-2-карбоновая кислота, которую использовали в следующем примере, является коммерчески доступной.
30.1 Этил 3-((R)-1-бензил-5-оксопирролидин-2-карбоксамидо)-2-гидрокси-4-фенилбутаноат
Реакцию проводили по аналогии с реакционной стадией 1.1 путем реакции (R)-1-бензил-5-оксопирролидин-2-карбоновой кислоты и 4-этокси-3-гидрокси-4-оксо-1-фенилбутан-2-аминия хлорида. ESI-MS [M+H]+=425,2.
30.2 3-((R)-1-Бензил-5-оксопирролидин-2-карбоксамидо)-2-гидрокси-4-фенилбутановая кислота
Этил 3-((R)-1-бензил-5-оксопирролидин-2-карбоксамидо)-2-гидрокси-4-фенилбутаноат подвергали омылению по аналогии с реакционной стадией 1.2. ESI-MS [M+H]+=397,2.
30.3 (2R)-1-Бензил-N-(3-гидрокси-4-(изопропоксиамино)-4-оксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамид
Реакция может быть проведена по аналогии с реакционной стадией 1.3 путем реакции 3-((R)-1-бензил-5-оксопирролидин-2-карбоксамидо)-2-гидрокси-4-фенилбутановой кислоты с O-изопропилгидроксиламином.
30.4 (2R)-1-Бензил-N-(4-(изопропоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамид
(2R)-1-Бензил-N-(3-гидрокси-4-(изопропоксиамино)-4-оксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамид может быть окислен по аналогии с реакционной стадией 2.4.
Пример 31
(2R)-1-Бензил-N-(4-(циклопропилметоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамид
Исходный реагент (R)-1-бензил-5-оксо-пирролидин-2-карбоновая кислота является коммерчески доступной.
31.1 Этил 3-((R)-1-бензил-5-оксопирролидин-2-карбоксамидо)-2-гидрокси-4-фенилбутаноат
Реакцию проводили по аналогии с реакционной стадией 1.1 путем реакции (R)-1-бензил-5-оксопирролидин-2-карбоновой кислоты и 4-этокси-3-гидрокси-4-оксо-1-фенилбутан-2-аминия хлорида. ESI-MS [M+H]+=425,2.
31.2 3-((R)-1-Бензил-5-оксопирролидин-2-карбоксамидо)-2-гидрокси-4-фенилбутановая кислота
Этил 3-((R)-1-бензил-5-оксопирролидин-2-карбоксамидо)-2-гидрокси-4-фенилбутаноат подвергали омылению по аналогии с реакционной стадией 1.2. ESI-MS [M+H]+=397,2.
31.3 (2R)-1-Бензил-N-(4-(циклопропилметоксиамино)-3-гидрокси-4-оксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамид
Реакция может быть проведена по аналогии с реакционной стадией 1.3 путем реакции 3-((R)-1-бензил-5-оксопирролидин-2-карбоксамидо)-2-гидрокси-4-фенилбутановой кислоты с O-(циклопропилметил)гидроксиламином.
31.4 (2R)-1-Бензил-N-(4-(циклопропилметоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамид
(2R)-1-бензил-N-(4-(циклопропилметоксиамино)-3-гидрокси-4-оксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамид может быть окислен по аналогии с реакционной стадией 2.4.
Пример 32
(2R)-1-(2-Фторбензил)-N-(4-(метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамид
Исходный реагент (R)-1-(2-фторбензил)-5-оксопирролидин-2-карбоновую кислоту получали по аналогии с методикой, опубликованной в S. Marchalin et al, Synthetic Communications 28(19), 3619 (1998).
32.1 Этил 3-((R)-1-(2-фторбензил)-5-оксопирролидин-2-карбоксамидо)-2-гидрокси-4-фенилбутаноат
Реакцию проводили по аналогии с реакционной стадией 1.1 путем реакции (R)-1-(2-фторбензил)-5-оксопирролидин-2-карбоновой кислоты и 4-этокси-3-гидрокси-4-оксо-1-фенилбутан-2-аминия хлорида. ESI-MS [M+H]+=443,2.
32.2 3-((R)-1-(2-Фторбензил)-5-оксопирролидин-2-карбоксамидо)-2-гидрокси-4-фенилбутановая кислота
Этил 3-((R)-1-(2-фторбензил)-5-оксопирролидин-2-карбоксамидо)-2-гидрокси-4-фенилбутаноат подвергали омылению по аналогии с реакционной стадией 1.2. ESI-MS [M+H]+=415,2.
32.3 (2R)-1-(2-Фторбензил)-N-(3-гидрокси-4-(метоксиамино)-4-оксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамид
Реакция может быть проведена по аналогии с реакционной стадией 1.3 путем реакции 3-((R)-1-(2-фторбензил)-5-оксопирролидин-2-карбоксамидо)-2-гидрокси-4-фенилбутановой кислоты с O-метилгидроксиламином.
32.4 (2R)-1-(2-Фторбензил)-N-(4-(метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамид
(2R)-1-(2-Фторбензил)-N-(3-гидрокси-4-(метоксиамино)-4-оксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамид может быть окислен по аналогии с реакционной стадией 2.4.
Пример 33
(2R)-1-(2-Хлорбензил)-N-(4-(метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамид
Исходный реагент (R)-1-(2-хлорбензил)-5-оксопирролидин-2-карбоновую кислоту получали по аналогии с методикой, опубликованной в S. Marchalin et al, Synthetic Communications 28(19), 3619 (1998).
33.1 Этил 3-((R)-1-(2-хлорбензил)-5-оксопирролидин-2-карбоксамидо)-2-гидрокси-4-фенилбутаноат
Реакцию проводили по аналогии с реакционной стадией 1.1 путем реакции (R)-1-(2-хлорбензил)-5-оксопирролидин-2-карбоновой кислоты и 4-этокси-3-гидрокси-4-оксо-1-фенилбутан-2-аминия хлорида. ESI-MS [M+H]+=459,2.
33.2 3-((R)-1-(2-Хлорбензил)-5-оксопирролидин-2-карбоксамидо)-2-гидрокси-4-фенилбутановая кислота
Этил 3-((R)-1-(2-хлорбензил)-5-оксопирролидин-2-карбоксамидо)-2-гидрокси-4-фенилбутаноат подвергали омылению по аналогии с реакционной стадией 1.2. ESI-MS [M+H]+=431,1.
33.3 (2R)-1-(2-Хлорбензил)-N-(3-гидрокси-4-(метоксиамино)-4-оксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамид
Реакция может быть проведена по аналогии с реакционной стадией 1.3 путем реакции 3-((R)-1-(2-хлорбензил)-5-оксопирролидин-2-карбоксамидо)-2-гидрокси-4-фенилбутановой кислоты с O-метилгидроксиламином.
33.4 (2R)-1-(2-Хлорбензил)-N-(4-(метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамид
(2R)-1-(2-Хлорбензил)-N-(3-гидрокси-4-(метоксиамино)-4-оксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамид может быть окислен по аналогии с реакционной стадией 2.4.
Пример 34
N-(3,4-Диоксо-1-фенил-4-(тиазол-2-иламино)бутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
34.1 N-(3-Гидрокси-4-оксо-1-фенил-4-(тиазол-2-иламино)бутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
ESI-MS [M+H]+=525,2.
34.2 N-(3,4-диоксо-1-фенил-4-(тиазол-2-иламино)бутан-2-ил)-2-(3-фенил-1H-пиразол-1-ил)никотинамид
ESI-MS [M+H+]: 523,15.
1Н-ЯМР (400 МГц ДМСО), δ [м.д.]: 12,76 (широкий, 1H), 9,12 (широкий, 1H), 8,55 (д, 1H), 8,48 (д, 1H), 7,78 (м, 2H), 7,74 (м, 1H), 7,58 (м, 1H), 7,47 (м, 3H), 7,35 (м, 1H), 7,15 (м, 5H), 6,99 (д, 1H), 5,51 (м, 1H), 3,16 и 2,88 (каждый дд, 1H).
Биологическое исследование ингибирования кальпаина и катепсинов
I. Ингибирование фермента in vitro:
Исследование ингибирования активности соответствующих ферментов проводили с помощью кинетического флуоресцентного анализа (длина волны возбуждения 390 нм, длина волны излучения 460 нм).
Кажущиеся значения Ki рассчитывали из полученных экспериментально значений IC50 с помощью уравнения Ченга-Прусоффа, полагая обратимое конкурентное ингибирование фермента. Значения Km субстратов, использовавшихся при указанных выше условиях анализа, составляли: 90 мкΜ (Z-Phe-Arg-AMC, катепсин B), 10 мкΜ (Z-Gly-Pro-Arg-AMC, катепсин K), 2 мкΜ (Z-Phe-Arg-AMC, катепсин L) и 30 мкΜ (Z-Val-Val-Arg-AMC, катепсин S).
Указанные значения Ki являются средними значениями констант ингибирования, рассчитанных на основе от 2 до 4 независимых кривых доза-эффект.
Использовали следующие анализы:
1. Кальпаин I:
20 нМ кальпаин-I, выделенный из эритроцитов человека (Calbiochem #208713), 100 мкΜ Suc-Leu-Tyr-AMC (Bachem #1-1355) в качестве субстрата в буфере с 62 мМ имидазола, 0,3 мМ CaCl2, 0,10% CHAPS, 0,05% BSA, 1 мМ DTT при pH 7,3 и комнатной температуре.
2. Катепсин B:
0,25 нМ катепсин B, выделенный из печени человека (Calbiochem #219362), 100 мкΜ Z-Phe-Arg-AMC (Bachem #1-1160) в качестве субстрата в 50 мМ MES, 2 мМ EDTA, 0,05% Brij 35 (полиоксиэтиленовых эфиров), 2,5 мМ L-цистеин, pH 6,0, комнатная температура.
3. Катепсин K:
3 нМ катепсин K, активированный из рекомбинантного человеческого прокатепсина K из E. coli (Calbiochem #342001), 10 мкΜ Z-Gly-Pro-Arg-AMC (Biomol #P-142) в качестве субстрата в 50 мМ MES, 2 мМ EDTA, 0,05% Brij 35, 2,5 мМ L-цистеин, pH 6,0, комнатная температура.
4. Катепсин L:
1 нМ катепсин L, выделенный из печени человека (Calbiochem #219402), 2 мкΜ Z-Phe-Arg-AMC (Bachem #1-1160) в качестве субстрата в 50 мМ MES, 2 мМ EDTA, 0,05% Brij 35, 2,5 мМ L-цистеин, pH 6,0, комнатная температура.
5. Катепсин S:
0,5 нМ рекомбинантный человеческий катепсин S из E. coli (Calbiochem #219343), 20 мкΜ Z-Val-Val-Arg-AMC (Bachem #1-1540) в качестве субстрата в 50 мМ MES, 2 мМ EDTA, 0,05% Brij 35, 2,5 мМ L-цистеин, pH 6,0, комнатная температура.
Результаты определения in vitro приведены в таблице 1. В таблице 1 используются следующие условные обозначения:
В колонке "Активность кальпаина", +++ обозначает значение Ki для кальпаина (Ki(кальпаин))<200 нМ, ++ обозначает 200 нМ ≤Ki(кальпаин)≤300 нМ, и + обозначает 300 нМ В колонке "Селективность по катепсину B" приводится отношение Ki(катепсин B)/Ki(кальпаин). При этом, +++ обозначает отношение Ki(катепсин B)/Ki(кальпаин)>10, ++ обозначает 4 В колонке "Селективность по катепсину K" приводится отношение Ki(катепсин K)/Ki(кальпаин). При этом, +++ обозначает отношение Ki(катепсин K)/Ki(кальпаин)>10, ++ обозначает 4 В колонке "Селективность по катепсину L" приводится отношение Ki(катепсин L)/Ki(кальпаин). При этом, +++ обозначает отношение Ki(катепсин L)/Ki(кальпаин)>50, ++ обозначает 10 В колонке "Селективность по катепсину S" приводится отношение Ki(катепсин S)/Ki(кальпаин). При этом, +++ обозначает отношение Ki(катепсин S)/Ki(кальпаин)>50, ++ обозначает 10 II. Анализ спектрина в клетках molt-4 для определения ингибирования кальпаина в клетках: Использовали следующие растворы и буферы: - HBS (для 40 мл): 800 мкл 1M HEPES; 2,16 мл l00 мМ KCl; 4,8 мл 1M NaCl; 3,59 мл 5% глюкоза; 60 мкл 1M MgSO4; 400 мкл 100 мМ Na пируват, 28,19 мл вода; pH 7,2-7,5. - лизисный буфер (для 20 мл): 400 мкл 1M Tris pH 8,2; 2,74 мл 1M NaCl; 520 мкл 0,5M EDTA; 2 мл 10% Triton X-100; 0,8 мл (=1:25) CompletePlus (1 таблетка/2 мл H2O); 200 мкл 100 мМ Pefabloc; 13,34 мл вода, pH 8,2. - TBST (10×) (для 1 литра): 100 мМ Tris (12,1 г); 1,5M NaCl (87 г); 1% Tween 20 (10 г), доведенный до pH 8. Осуществление и методика анализа были описаны в Chatterjee; BMC 1998, 6, pp. 509-522; значения EC50 рассчитывали из процента разложения спектрина в зависимости от дозы. Условия культивирования клеток: клетки molt-4 выдерживают в среде RPMI 1640 + Glutamax™ I (Gibco) с 10% FCS и 50 мкг/мл гентамицина при 37°C, 5% CO2 и разбавляют 1:15 дважды в неделю. Приготовление клеток molt-4: клетки промывают, подсчитывают и создают концентрацию 2×107 клеток/мл в HBS буфере. Разбавление ингибирующих веществ: все ингибиторы растворяют при концентрации 10-2 M в ДМСО. Исходный раствор затем разбавляют 1:15 в ДМСО (=6,67×10-4 M). После этого, разбавленный 1:15 исходный раствор разбавляют 1:4 в ДМСО в два этапа (=1,67×10-4 M и 4,17×10-5 M). Затем эти три раствора дополнительно разбавляют 1:50 в HBS буфере с получением растворов, имеющих концентрацию 1,33×10-5 M, 3,36×10-6 M и 8,34×10-7 M. Испытуемая смесь: для каждой смеси, 106 клеток (см. выше) вводят в пробирку Эппендорфа объемом 1,5 мл. К ним добавляют в каждом случае 150 мкл разбавленных веществ (с конечной концентрацией 10-5 M; 2,5×10-6 M и 6,25×10-7 M) и тщательно перемешивают. В качестве контроля используют отрицательную контрольную пробу и положительную контрольную пробу. В этом случае, сначала на клетки из пипетки вводят только 150 мкл HBS буфера. Все смеси инкубируют при 37°C, 5% CO2 в инкубаторе в течение 10 минут. Затем, за исключением отрицательной контрольной пробы, в каждом случае добавляют CaCl2 (до конечной концентрации 5 мМ) и иономицин (до конечной концентрации 5 мкΜ), тщательно перемешивают и инкубируют при 37°C, 5% CO2 в инкубаторе в течение 30 минут. Затем центрифугируют при 700 g в течение 5 минут. Надосадочные жидкости отбрасывают, а осадки помещают в 20 мкл лизисного буфера. Смеси затем помещают на лед в течение 30-60 минут и затем центрифугируют при 15000 g в течение 15 минут. Надосадочные жидкости отбирают и помещают в новые пробирки Эппендорфа. Затем проводят определение белка, например, с помощью анализа MicroBCA (Pierce). Электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия: 10 мкг общего белка из каждой смеси помещают в новую пробирку Эппендорфа, и после добавления из пипетки в таком же объеме додецилсульфата натрия в 2× Tris-glycine буфере (Invitrogen) и 1/10 объема 1M DTT (дитиотреитола), тщательно смешивают и нагревают при 95°C в течение 15 минут. Растворы в течение непродолжительного времени центрифугируют и загружают на гель с 6% додецилсульфата натрия (Invitrogen). Электрофорез проводят при 100 вольтах с буфером 1× Tris-glycine laemmli (Biomol) до тех пор, пока нижняя полоска маркера не достигнет основания геля. Вестерн-блоттинг: гель извлекают из прибора и блотируют на нитроцеллюлозе в буфере для блоттинга 1× Tris-glycine (Invitrogen) + 20% метанол при 1,5 A/см2 в камере FastBlot (Biometra) в течение 30 минут. Нитроцеллюлозный фильтр извлекают, недолго промывают в TBST буфере и блокируют в TBST/5% сухое молоко в течение 1 часа при комнатной температуре. Блокированную нитроцеллюлозу затем инкубируют с антиспектрином Ab (Chemicon) (1:10000 в TBST/5% сухое молоко) при комнатной температуре в течение 3 часов или при 4°C в течение ночи. Нитроцеллюлозу промывают 3 раза в TBST буфере. Затем ее инкубируют с антимышиными антителами IgG (POD) (Sigma) (1:10000 в TBST/5% сухое молоко) при комнатной температуре в течение 1 часа. Нитроцеллюлозу затем промывают 5 раз в TBST буфере. На следующей стадии, 5 мл приготовленного раствора хемилюминесцентного субстрата SuperSignal® West Pico (Pierce) помещают на фильтр и инкубируют в течение 5 минут. Нитроцеллюлозу затем извлекают из раствора, слегка встряхивают и вставляют в папку с проявляющей пленкой (Tropix). Систему анализа цифровых изображение (VersaDoc, Biorad) используют для регистрации и количественного определения электрогенерированной хемилюминесценции (ECL) (QuantityOne), и из полученных данных рассчитывают процент разложения спектрина. Программу Graph-pad prism используют для аппроксимации процента разложения спектрина в зависимости от дозы для сигмоидальной графической зависимости доза-эффект (верхняя точка фиксируется при 100%, а нижняя точка при 0%), и рассчитывают EC 50%. III. Определение цитозольного клиренса соединений формулы I: Для сравнения, данные, полученные для цитозоля печени человека, сравнивали с данными, полученные для цитозоля печени яванского макака. 0,5 мкΜ испытуемого соединения инкубировали с 1 мг/мл цитозоля печени человека, а также с цитозолем печени яванского макака, при 37°C в 0,5 M фосфатном буфере при pH 7,5 при встряхивании (цитозоль печени самки яванского макака приобретали у фирмы Tebu bio, цитозоль печени человека у фирмы BDgentest). В каждом случае отбирали аликвоты 65 мкл через 0, 5, 10 и 15 минут и переносили их в лунки планшета, которые быстро заполняли 130 мкл этанола для прерывания реакции. До анализа LC/MS/MS (Applied Biosystems SCIEX 4000), образцы хранили в замороженном виде. Считываемыми параметрами являлись убыль исходных соединений, на основании которых рассчитывали периоды полуразложения (T1/2). По этим данным рассчитывали показатели цитозольного клиренса (cytCL), приведенного клиренса (CLs) и прогнозируемого клиренса (CLp) с использованием следующих уравнений: 1) cytCL=(ln 2/T1/2)×[цитозольный белок]×1000 2) CLs=cytCL×[цитозольный выход]/1000000×60 3) CLp=(CLs + ток плазмы в печени)/ток плазмы в печени/CLs Для оценки стабильности испытуемых соединений, интервалы клиренса приводили в соответствие с током плазмы в печени различных особей, согласно следующей схеме: стабильный = от 0 до приблизительно 1/3 тока плазмы в печени; относительно стабильный = от приблизительно 1/3 до приблизительно 2/3 тока плазмы в печени; нестабильный = более чем 2/3 тока плазмы в печени. На основе этого соответствия были определены следующие классификаторы для оценки цитозольной стабильности испытуемых соединений Данные по цитозольному клиренсу (cytCL), полученные таким способом для соединений примеров 1-18, приведены в таблице 1 выше. Как видно из таблицы 1, соединения формулы I согласно изобретению характеризуются улучшенной стабильностью по сравнению с родственным соединением из WO 08/080969, имеющего незамещенный карбоксамидный фрагмент (сравнительный пример 18). IV. In-vitro исследование с целью определения разложения соединений I в соответствующие гидроксиамидные метаболиты в гепатоцитах: Каждое испытуемое соединение (10 мкл) инкубировали в гепатоцитах обезьяны и гепатоцитах человека для определения отношения концентрации гидроксиамидного метаболита к концентрации соединения формулы I как исходного соединения. Инкубирования проводили при 37°C в течение от 0 до 4 часов в 24-луночном планшете, при этом каждая лунка содержала 0,5 мл среды гепатоцитов с приблизительно 500000 клеток/мл. В конце каждого момента времени, в каждую лунку добавляли 1 мл смеси ацетонитрил/этанол (1/1 по объему) для прерывания реакции. Растворы встряхивали и тщательно перемешивали. Аликвоту подвергали анализу с помощью LC-UV-MS/MS при длине волны УФ 254 нм. Идентификацию испытуемых соединений I и их соответствующих гидроксиамидных метаболитов проводили с помощью MS/MS и путем сравнения с синтетическими стандартами. УФ площади для каждого испытуемого соединения и его гидроксиамидного метаболита интегрировали. Отношение концентраций гидроксиамидных метаболитов к концентрациям исходных соединений (отношения M/P) определяли как отношения УФ площадей метаболитов к площадям соединений I, полагая при этом, что коэффициенты экстинкции εP и εM являются приблизительно одинаковыми. Полученные таким образом отношения M/P для инкубирований, прерванных через 4 часа, приведены в таблице 2. Как видно из таблицы 2, восстановительное разложение соединения примера 2 согласно изобретению происходит значительно медленнее, как в случае гепатоцитов человека, так и гепатоцитов cyno, по сравнению с родственным соединением из WO 08/080969 (сравнительный пример 11). V. In-vivo определение отношения гидроксиамидного метаболита к исходному соединению I в плазме яванского макака Испытуемые соединения готовили в виде раствора, либо для внутривенного, либо для перорального введения, в группах самок яванского макака. Для внутривенного дозирования, соединения готовили в среде 10% ДМСО/PEG-400 при концентрации 2 мг/мл. Для перорального дозирования, соединения готовили в среде на основе липида при концентрации 3 мг/мл. Группы из трех обезьян получали либо 1 мг/кг (0,5 мл/кг) внутривенной дозы, либо 3 мг/кг (1 мл/кг) пероральной дозы. Внутривенную дозу вводили в виде болюса с медленной скоростью в подкожную вену ноги; пероральную дозу вводили через зонд в желудок и затем вводили ~5 мл воды. От каждого животного получали ряд последовательных образцов крови в выбранные моменты времени вплоть до 24 часов после введения лекарственного средства. Плазму отделяли от крови центрифугированием и хранили замороженной (<-15°C) до тех пор, пока не проводили анализ. Исходные соединения I и выбранные метаболиты выделяли из плазмы путем осаждения белка смесью метанола, ацетонитрила и воды. Надосадочную жидкость испаряли досуха в токе сухого азота. Образцы растворяли в аликвоте подвижной фазы, затем проводили их количественное определение с помощью HPLC-MS/MS. Стандартные кривые, как для исходных соединений, так и для выбранных метаболитов, получали из аутентичных стандартов в контрольной плазме обезьян; стандарты анализировали одновременно с образцами. Концентрацию в плазме каждого образца рассчитывали с помощью метода наименьших квадратов из пикового отношения площадей (исходного или метаболита/внутреннего стандарта) вводимых стандартов в плазме в зависимости от концентрации. Пиковые концентрации в плазме (Cmax) и время до достижения пиковой концентрации в плазме (Tmax) регистрировали непосредственно из данных по концентрации в плазме для каждой обезьяны. Данные по концентрации в плазме, как для исходных соединений, так и для метаболитов, аппроксимировали мультиэкспоненциальной кривой с помощью программы WinNonlin. Площадь под кривой "концентрация в плазме-время" от 0 до t часов (время последнего измерения концентрации в плазме) после дозирования (AUC0-4) рассчитывали с использованием правила трапеции для кривых "концентрация в плазме-время". Оставшуюся площадь, экстраполируемую до бесконечности, определяемую как последняя измеренная концентрация в плазме (Ct), деленная на конечную константу скорости элиминации (β), добавляли к AUC0-4 для получения суммарной площади под кривой (AUC0-inf). Кажущийся суммарный плазменный клиренс (CLP) рассчитывали путем деления вводимой дозы на AUC0-inf. Начальный объем распределения (Vc) рассчитывали как дозу, деленную на экстраполированную концентрацию при времени =0 (C0). Объем распределения при стационарном состоянии, Vss, оценивали как произведение плазменного клиренса (CLP) и среднего времени пребывания (MRT); объем распределения в терминальной фазе (Vβ) получали из величины плазменного клиренса (CLP), деленной на константу скорости элиминации (β). Биодоступность рассчитывали как нормализованную по дозе суммарную площадь под кривой AUC0-infиз пероральной дозы, деленной на соответствующее значение, полученное из внутривенной дозы. Отношения метаболитов к исходным соединениям рассчитывали как Cmax (метаболит)/Cmax (исходное соединение) или AUC(метаболит)/AUC(исходное соединение) для пиковых концентраций и площади под кривой, соответственно. Полученные результаты представлены в таблице 3. Как видно из таблицы 3, при сравнении с соединением, раскрытым в WO 08/080969 (Пример 11), соединение по изобретению из примера 2 проявляет значительно более высокую устойчивость к AKR-опосредованному восстановлению и, кроме того, имеет почти в 300 раз более высокую пероральную биодоступность.
Реферат
Изобретение относится к области органической химии, а именно к новым карбоксамидным соединениям формулы (I) и к их фармацевтически приемлемым солям, где Rявляется фенил-С-С-алкилом, где фенил может быть незамещенным или замещенным 1 радикалом R; где Rвыбирают независимо из галогена, С-С-алкила, C-C-алкокси, где С-Салкильные группы могут быть частично или полностью галогенированы или могут иметь 1, 2 или 3 заместителя R, и -(CH)-NRR, где р=0, 1, где Rвыбирают независимо из NRR, Rпредставляет собой С-С-алкил, Rпредставляет собой С-С-алкил, или два радикала Rи R, или Rи Rобразуют вместе с атомом N азотсодержащий 6-членный насыщенный гетероцикл, который может необязательно иметь 1 дополнительный гетероатом О в качестве члена кольца, Rпредставляет собой фенил, пиридил, где фенил может быть незамещенным или может иметь 1 заместитель R; где Rимеет одно из значений, указанных для R; Rпредставляет собой С-С-алкил, С-С-алкенил, С-С-циклоалкил, С-С-циклоалкил-С-С-алкил, где С-Салкил, является незамещенным или имеет 1 заместитель R, где Rимеет одно из значений, указанных для R; Rпредставляет собой галоген или С-С-алкил, где m является 0 или 1; n является 0. Также изобретение относится к конкретным соединениям, фармацевтической композиции на основе соединения формулы (I). Технический результат: получены новые карбоксамидные соединения, полезные в качестве ингибиторов кальпаина (кальций-зависимых цистеиновых протеаз). 3 н. и 24 з.п. ф-лы, 4 табл., 34 пр.
Формула
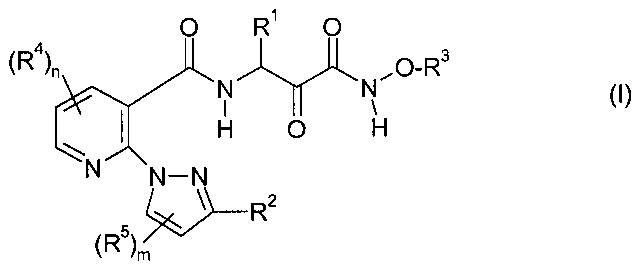
в котором
R1 является фенил-С1-С6-алкилом, где фенил может быть незамещенным или замещенным 1 радикалом R1c; где
R1c выбирают независимо из галогена, С1-С6-алкила, C1-C6-алкокси, где С1-С6алкильные группы могут быть частично или полностью галогенированы или могут иметь 1, 2 или 3 заместителя R1a, и -(CH2)p-NRc6Rc7, где р=0, 1, где
R1a выбирают независимо из NRa6Ra7,
Ra6 представляет собой С1-С6-алкил,
Ra7 представляет собой С1-С6-алкил,
или два радикала Ra6 и Ra7 или Rc6 и Rc7 образуют вместе с атомом N азотсодержащий 6-членный насыщенный гетероцикл, который может необязательно иметь 1 дополнительный гетероатом О в качестве члена кольца,
R2 представляет собой фенил, пиридил, где фенил может быть незамещенным или может иметь 1 заместитель R2c; где
R2c имеет одно из значений, указанных для R1c;
R3 представляет собой С1-С6-алкил, С3-С6-алкенил, С3-С6-циклоалкил, С3-С6-циклоалкил-С1-С2-алкил, где С1-С6алкил, является незамещенным или имеет 1 заместитель Rxa,
где Rxa имеет одно из значений, указанных для R1a;
R5 представляет собой галоген или С1-С2-алкил, где
m является 0 или 1;
n является 0; и
его фармацевтически приемлемые соли.
-(СН2)P-NRc6Rc7 при р=0 или 1, где
два радикала Rc6 и Rc7 образуют вместе с атомом N 6-членный насыщенный азотсодержащий гетероцикл, который может необязательно иметь дополнительный гетероатом О в качестве члена кольца.
2-[3-(4-Фторфенил)-1Н-пиразол-1-ил]-N-[4-(метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил]пиридин-3-карбоксамида,
N-(4-(Метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-2-(3-фенил-1Н-пиразол-1-ил)никотинамида,
2-(4-Фтор-3-фенил-1Н-пиразол-1-ил)-N-(4-(метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)никотинамида,
N-[4-(Метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил]-2-(4-метил-3-фенил-1Н-пиразол-1-ил)пиридин-3-карбоксамида,
N-(1-(4-Фторфенил)-4-(метоксиамино)-3,4-диоксобутан-2-ил)-2-(3-фенил-1Н-пиразол-1-ил)никотинамида,
N-(1-(3-Фторфенил)-4-(метоксиамино)-3,4-диоксобутан-2-ил)-2-(3-фенил-1Н-пиразол-1-ил)никотинамида,
N-(4-(Этоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-2-(3-фенил-1Н-пиразол-1-ил)никотинамида,
N-(4-(Аллилоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-2-(3-фенил-1Н-пиразол-1-ил)никотинамида,
N-(4-(Метоксиамино)-1-(4-метоксифенил)-3,4-диоксобутан-2-ил)-2-(3-фенил-1Н-пиразол-1-ил)никотинамида,
2-(4-Хлор-3-фенил-1Н-пиразол-1-ил)-N-(4-(метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)никотинамида,
N-[4-(Изопропоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-(3-фенил-1Н-пиразол-1-ил)никотинамида,
N-[3,4-диоксо-1-фенил-4-(пропоксиамино)-2-бутанил]-2-(3-фенил-1Н-пиразол-1-ил)никотинамида,
N-[4-(Метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-{3-[4-(4-морфолинил)фенил]-1Н-пиразол-1-ил}никотинамида,
N-[4-(Метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-{3-[4-(4-морфолинилметил)фенил]-1Н-пиразол-1-ил}никотинамида,
2-(3-{4-[(Диэтиламино)метил]фенил}-1Н-пиразол-1-ил)-N-[4-(метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]никотинамида,
N-(4-{[(2-Метил-2-пропанил)окси]амино}-3,4-диоксо-1-фенил-2бутанил)-2-(3-фенил-1Н-пиразол-1-ил)никотинамида,
N-{4-[(Циклопентилокси)амино]-3,4-диоксо-1-фенил-2-бутанил}2-(3-фенил-1Н-пиразол-1-ил)никотинамида,
N-[4-(Этоксиамино)-1-(4-фторфенил)-3,4-диоксо-2-бутанил]-2-(3-фенил-1Н-пиразол-1-ил)никотинамида,
N-[4-(Этоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-(4-фтор-3-фенил-1Н-пиразол-1-ил)никотинамида,
N-{4-[(Циклобутилокси)амино]-3,4-диоксо-1-фенил-2-бутанил}-2-(3-фенил-1Н-пиразол-1-ил)никотинамида,
N-{4-[(2,2-Диметилпропокси)амино]-3,4-диоксо-1-фенил-2-бутанил}-2-(3-фенил-1Н-пиразол-1-ил)никотинамида,
N-(4-{[2-(4-Морфолинил)этокси]амино}-3,4-диоксо-1-фенил-2-бутанил)-2-(3-фенил-1Н-пиразол-1-ил)никотинамида,
N-{4-[(Циклопропилметокси)амино]-3,4-диоксо-1-фенил-2-бутанил}-2-(3-фенил-1Н-пиразол-1-ил)никотинамида,
N-[4-(Этоксиамино)-1-(4-метоксифенил)-3,4-диоксо-2-бутанил]-2-(3-фенил-1Н-пиразол-1-ил)никотинамида,
2-[3-(2-Фторфенил)-1Н-пиразол-1-ил]-N-[4-(метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]никотинамида,
N-[4-(Метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-{3-[3-(трифторметил)фенил]-1Н-пиразол-1-ил}никотинамида,
N-[4-(Метоксиамино)-3,4-диоксо-1-фенил-2-бутанил]-2-[3-(2-пиридинил)-1Н-пиразол-1-ил]никотинамида,
и его фармацевтически приемлемые соли.

Комментарии