Замещенные пиразолы, фармацевтическая композиция на их основе, применение фармацевтической композиции и способ ингибирования активности катепсина s - RU2317988C2
Код документа: RU2317988C2
Описание
Данное изобретение относится к ряду замещенных пиразолов, фармацевтическим композициям, содержащим эти соединения, промежуточным продуктам, используемым при получении, и способам применения описанных соединений.
Катепсин S (ЕС 3.4.22.27) представляет собой цистеинпротеазу семейства папаина, обнаруживаемую, главным образом, в лизосомах (Bromme, D.; McGrath, M.E. High Level Expression and Crystallization of Recombinant Human Cathepsin S. Protein Science, 1996, 5, 7890791).
Роль катепсина S в иммунном ответе определяется его распределением в тканях: катепсин S обнаружен, главным образом, в лимфатических тканях, лимфатических узлах, селезенке, в лимфоцитах и макрофагах (Kirschke, H. Chapter 211. Cathepsin S. In Handbook of Proteolytic Enzymes. Barrett, A.J.; Rawlings, N.D.; Woessner, J.F., Eds. San Diego: Academic Press, 1998, pp. 621-624). Показано, что ингибиторы катепсина S в животных моделях модулируют представление антигена и эффективны при применении на животных моделях астмы (Riese, R.J.; Mitchell, R.N.; Villadangos, J.A.; Shi, G.-P.; Palmer, J.T.; Karp, E.R.; De Sanctis, G.T.; Ploegh, H.L.; Chapman, H.A. Cathepsin S Activity Regulates Presentation and Immunity. J. Clin. Invesr. 1998, 101, 2351-2363; Shi, G.-P.; Villadangos, J.A.; Dranoff, G.; Small, C.; Gu, L.; Haley, K.J.; Riese, R.; Ploegh, H.L.; Chapman H.A. Cathepsin S required for Normal MHC Class II Peptide Loading and Germinal Center Development. Immunity1999, 10, 197-206).
Мыши, в организме которых ген-кодирующий катепсин S был заблокирован, менее чувствительны к коллаген-индуцированному артриту, и способность их иммунной системы реагировать на антигены ослаблена (Nakahawa, T.Y.; Brissette, W.H.; Lira, P.D.; Griffiths, R.J.; Petrushova, N.; Stock, J.; McNeish, J.D.; Eastman, S.E.; Howard, E.D.; Clarke, S.R.M.; Rosloniec, E.F.; Elliott, E.A.; Rudensky, A.Y. Impaired Invariant Chain Degradation and Antigen Presentation and Diminished Collagen-Induced Arthritis in Cathepsin S Null Mice. Immunity,1999, 10, 207-217).
Эти данные показывают, что соединения, которые ингибируют протеолитическую активность катепсина S человека, должны находить применение в лечении хронических аутоиммунных заболеваний, включая, но без ограничения приведенным перечнем, волчанку, ревматоидный артрит и астму, и потенциально полезны в моделировании иммунного ответа при трансплантации тканей.
Ряд ингибиторов катепсина S описан в литературе. Наиболее важные патенты перечислены ниже.
Некоторые дипептидилнитрилы запатентованы фирмой Norvatis в качестве ингибиторов катепсина S в публикации WO 99/24460 (Altmann et al.).
Дипептидилвинилсульфоны заявлены фирмой Arris (в настоящее время Axys) в качестве ингибиторов цистеинпротеазы (включая катепсин S) в публикации US-5976858 (Palmer et al.).
Некоторые пептидилсульфонамиды запатентованы фирмой Arris/Axys в качестве ингибиторов цистеинпротеазы (включая катепсин S) в публикациях US-5776718 (Palmer et al.) (фирма Arris, в настоящее время Axys) и US-6030946 (Klaus et al.) (Axys).
Соединения, в некоторой степени аналогичные соединениям данного изобретения, описаны в приведенных ниже публикациях.
В публикациях Winters, G.; Sala, A.; Barone, D; Baldoli, E. J. Med. Chem., 1985, 28, 934-940; Singh, P.; Sharma, R.C. Quant. Struct.-Act. Relat., 1990, 9, 29-32; Winters, G.; Sala, A.; Barone, D.; US-4500525 (1985) описаны бициклические пиразолы, структура которых представлена ниже. R не содержит гетероциклического кольца, и для этих молекул ингибиторная активность не описана; соединения описаны в качестве модуляторов α1-адренергических рецепторов.

Запатентованы также бициклические пиразолы, представленные ниже. В данной системе пиридиновое кольцо является ароматическим (Shutske, G.M.; Kapples, K.J.; Tomer, J.D. US-5264576 (1993)). Хотя в описании указывается, что R является мостиком, присоединенным к гетероциклу, в формуле изобретения заявлено только, что R - водород. Соединения описаны как ингибиторы повторного поглощения серотонина.

Соединение - 2-[4-[4-(3-метил-5-фенил-1Н-пиразол-1-ил)бутил]-1-пиперазинил]пиримидин - известно из публикации ЕР-382637, где описываются пиримидины, обладающие анксиолитическими свойствами. Данное соединение и его аналоги описаны также в ЕР-502786 в качестве лекарственных сердечно-сосудистых средств и лекарственных средств для лечения заболеваний центральной нервной системы. Фармацевтические препараты таких соединений описаны в ЕР-655248 для применения при лечении желудочной секреции и в качестве противоязвенного средства. В публикации WO 9721439 описываются лекарственные средства с такими соединениями для лечения обсессивно-компульсивных расстройств, приступов апноэ во сне, половых дисфункций, рвоты и болезни движения.
Соединения - 5-метил-3-фенил-1-[4-(4-фенил-1-пиперазинил)бутил]-1Н-индазол и 5-бром-3-(2-хлорфенил)-1-[4-(4-фенил-1-пиперазинил)бутил]-1H-индазол, в частности их гидрохлоридные соли, впервые описаны в публикациях WO 9853940 и СА 122:314528, где данные соединения и их аналоги представлены в качестве ингибиторов киназы (в первой ссылке) и как соединения, обладающие сродством к бензодиазепиновым рецепторам (во второй ссылке).
Краткое описание изобретения
Данное изобретение относится к соединениям, которые могут быть представлены формулой (I)

где Ar2 представляет собой моноциклическую или бициклическую кольцевую систему, ненасыщенную, насыщенную или ароматическую, необязательно конденсированную, необязательно содержащую кольцевые фрагменты, включающие от 1 до 5 гетероатомов, независимо выбранных из О, S, N, и группы SO2 и C=О; указанная кольцевая система Ar2является необязательно замещенной 1-4 заместителями;
R5 и R6 независимо выбраны из водорода и C1-5 алкила;
R7 и R8 независимо представляют собой водород, C1-5 алкил, С2-5 алкенил, C1-5 алкоксигруппу, C1-5 алкилтиогруппу, галоген или 4-7-членный карбоциклил или гетероциклил;
альтернативно R7 и R8 вместе могут образовывать необязательно замещенное 5-7-членное карбоциклическое или гетероциклическое кольцо, которое может быть ненасыщенным или ароматическим и может быть необязательно замещенным одним - тремя заместителями, независимо выбранными из галогена, цианогруппы, аминогруппы, гидроксильной группы, нитрогруппы, R4, R4O-, R4S-, R4O(C1-5 алкилен)-, R4О(C=O)-, R4(C=O)-, R4(C=S)-, R4(C=O)O-, R4O(C=O)(C=O)-, R4SO2, NHR44(C=NH)-, NHR44SO2- и NHR44(C=O)-;
R4 представляет собой H, C1-5алкил, C2-5 алкенил, C1-5 гетероциклил, (C1-5 гетероциклил)C1-6алкилен, фенил, бензил, фенэтил, NH2, моно- или ди(C1-6 алкил)N-, (C1-6алкокси)карбонил- или R42OR43-, где R42 представляет собой H, C1-5 алкил, C2-5 алкенил, фенил, бензил, фенэтил, C1-5 гетероциклил или (C1-5 гетероциклил)C1-6алкилен и R43 представляет собой C1-5 алкилен, фенилен или двухвалентный C1-5гетероциклил;
R44 в дополнение к значениям R4может представлять собой Н;
n равно 0, 1 или 2;
G представляет собой C3-6 алкендиил или C3-6 алкандиил, необязательно замещенный гидроксильной группой, галогеном, C1-5алкоксигруппой, C1-5 алкилом, оксогруппой, гидроксиминогруппой, CO2Rk, RkRlN, RkRlNCO2, (L)-C1-4 алкиленом-, (L)-C1-5 алкоксигруппой, N3 или [(L)-C1-5алкилен]аминогруппой;
каждый из Rk и Rl независимо представляет собой водород, C1-5 алкил, C3-5 алкенил, фенил, бензил, фенэтил или C1-5 гетероциклил; альтернативно Rk и Rl вместе могут образовывать необязательно замещенное 4-7-членное гетероциклическое кольцо, которое может быть насыщенным, ненасыщенным или ароматическим;
L представляет собой аминогруппу, моно- или ди-C1-5алкиламиногруппу, пирролидинил, морфолинил, пиперидинил, гомопиперидинил или пиперазинил, где доступные кольцевые атомы азота могут быть необязательно замещенными C1-5 алкилом, бензилом, C2-5ацилом, C1-5 алкилсульфонилом или C1-5 алкоксикарбонилом;
Ar представляет собой моноциклическое или бициклическое арильное или гетероарильное кольцо, необязательно замещенное 1-3 заместителями, независимо выбранными из галогена, C1-5 алкоксигруппы, C1-5 алкила, C2-5 алкенила, цианогруппы, азидогруппы, нитрогруппы, R22R23N, R24SO2, R24S, R24SO, R24OC=O, R22R23NC=O, C1-5 галогеналкила, C1-5галогеналкоксигруппы, C1-5галогеналкилтиогруппы и C1-5 алкилтиогруппы;
R22 представляет собой водород, C1-5алкил, C3-5 алкенил, фенил, фенэтил, бензил или C1-5гетероциклил, C2-8 ацил, ароил, R38OC=O, R25R26NC=O, R38SO, R38SO2, R38S или R25R26NSO2;
R23 представляет собой водород, C1-5 алкил, C3-5алкенил, фенил, бензил или C1-5 гетероциклил; альтернативно R22 и R23 вместе могут образовывать необязательно замещенное 4-7-членное гетероциклическое кольцо, которое может быть насыщенным, ненасыщенным или ароматическим;
каждый из R24 представляет собой C1-5 алкил, C3-5 алкенил, фенил, бензил или C1-5гетероциклил;
R25 и R26 независимо представляют собой водород, C1-5 алкил, C3-5 алкенил, фенил, бензил или C1-5 гетероциклил; альтернативно R25 и R26 вместе могут образовывать необязательно замещенное 4-7-членное гетероциклическое кольцо, которое может быть насыщенным, ненасыщенным или ароматическим;
W представляет собой О, S, NR27, C=O, (C=О)NH, NH(C=O), CHR28 или ковалентную связь;
Rz представляет собой H или OH, и пунктирная линия в этом случае отсутствует или Rz отсутствует, и тогда пунктирная линия представляет собой sp2связь;
R27 представляет собой водород, C1-5алкил, C3-5 алкенил, фенил, нафтил, бензил, фенэтил, C1-5 гетероциклил, C2-8 ацил, ароил, R29OC=O, R30R31NC=O, R29SO, R29S, R29SO2 или R30R31NSO2; альтернативно R27 и часть Ar2 вместе могут образовывать необязательно замещенное 5- или 6-членное гетероциклическое кольцо, необязательно содержащее 1-3 дополнительных фрагмента, включающих гетероатомы и выбранных из О, NR9, NR10, N, SO2, C=O и S; указанное кольцо может быть насыщенным, ненасыщенным или ароматическим; R9иR10 независимо выбраны из H, C1-3 алкила и -CH2CO2(C1-4 алкил);
R28 представляет собой водород, C1-5алкил, C3-5 алкенил, гидроксильную группу, фенил, бензил, C1-5 гетероциклил, R29O, R30R31NC=O, R29S, R29SO, R29SO2 или R30R31NSO2;
R29 представляет собой C1-5 алкил, C3-5 алкенил, фенил, бензил или C1-5 гетероциклил;
R30и R31 независимо выбраны из водорода, C1-5алкила, C3-5 алкенила, фенила, бензила, фенэтила, нафтила и C1-5 гетероарила; альтернативно R30 и R31 вместе могут образовывать необязательно замещенное 4-7-членное карбоциклическое или гетероциклическое кольцо, которое может быть насыщенным, ненасыщенным или ароматическим;
причем, если не указано другое условие, каждая из описанных выше углеводородных групп или гетероуглеводородных групп, помимо любых перечисленных заместителей необязательно и независимо содержит независимо 1-3 заместителя, выбранных из метила, галогенметила, гидроксиметила, галогена, гидроксильной группы, аминогруппы, нитрогруппы, цианогруппы, C1-5 алкила, C1-5 алкоксигруппы, -COOH, C2-6 ацила, [ди(C1-4 алкил)амино]C2-5 алкилена, [ди(C1-4алкил)амино]C2-5-алкил-NH-CO- и C1-5 галогенал-коксигруппы;
или их фармацевтически приемлемая соль, амид или сложный эфир, или их стереизомерная форма.
Одно воплощение данного изобретения представляет собой соединение формулы (I), где Ar2 выбран из 5-7-членных моноциклических колец и [5,6], [6,6], [6,5] и [5,5] конденсированных бициклических кольцевых систем, причем указанное кольцо или кольцевая система является карбоциклическим/ой или гетероциклическим/ой, насыщенным/ой, ненасыщенным/ой или ароматическим/ой, необязательно замещенным/ой галогеном, C1-4 алкилом, C1-4 галогеналкилом, C1-4 гидроксиалкилом, нитрогруппой, гидроксильной группой, аминогруппой, моно- или ди-(C1-6 алкил)аминогруппой, C1-4 алкоксигруппой, C2-4 алкоксикарбонилом, C2-6 ацилом, C2-6ацилоксигруппой, C1-5 алкилсульфонилом, C1-5 алкоксикарбонил-C1-4алкоксигруппой, цианогруппой и моно- или ди(C1-6 алкил)карбамоилом.
Другое воплощение данного изобретения представляет собой соединение формулы (I), где Ar2 выбран из 2,5-ди(C1-6 алкил)аминопирролила и фрагментов 6 приведенных далее формул:


где каждая пунктирная линия может представлять собой sp2-связь или отсутствовать;
Xc представляет собой О, S или N и Xd представляет собой О или S;
R1 представляет собой водород, галоген, C1-5алкоксигруппу, гидроксильную группу, C1-5алкил, C2-5 алкенил, цианогруппу, нитрогруппу, RaRbN, C2-8 ацил, C1-5 гетероциклил, (C1-5 гетероциклил)C1-5 алкилен, R11S, R11SO, R11SO2, RcOC=O, RcRdNC=O или RcRdNSO2 или R1 вместе с R27 может образовывать группы, описанные ниже;
R2 представляет собой водород, галоген, C1-5алкоксигруппу, гидроксильную группу, C1-5алкил, C2-5 алкенил, цианогруппу, нитрогруппу, ReRfN, C1-5 гетероциклил или C2-8 ацил;
R3 представляет собой водород, галоген, C1-5 алкоксигруппу, гидроксильную группу, C1-5 алкил, C2-5 алкенил, цианогруппу, нитрогруппу, RgRhN, C2-8 ацил, C1-5 гетероциклил, RhOC=O, RgRhNC=O или RgRhNSO2;
Ra выбран из водорода, C1-5 алкила, C3-5 алкенила, фенила, бензила, фенэтила, C1-5 гетероциклила, C2-8 ацила, ароила, RjOC=O, RiRjNC=O, R12SO, R12SO2, R12S и RiRjNSO2;
Reвыбран из водорода, C1-5алкила, C3-5 алкенила, фенила, бензила, фенэтила, C1-5 гетероциклила, C2-8 ацила, ароила, R32OC=O, R32R33NC=O, R13SO, R13SO2, R13S и R32R33NSO2;
Rm выбран из водорода, C1-5алкила, C3-5 алкенила, фенила, бензила, фенэтила, C1-5 гетероциклила, C2-8 ацила, ароила, R34OC=O, R34R35NC=O, R15SO, R15SO2, R15S и R34 R35NSO2;
Ro выбран из водорода, C1-5алкила, C3-5 алкенила, фенила, бензила, фенэтила, C1-5 гетероциклила, C2-8 ацила, ароила, R36OC=O, R36R37NC=O, R19SO, R19SO2, R19S и R36R37NSO2;
каждый из Rb, Rf, Rn, Rp, R32, R33, R34, R35, R36, R37, R39 и R40 независимо выбран из водорода, C1-5алкила, C3-5 алкенила, фенила, бензила, фенэтила и C1-5 гетероарила;
альтернативно Ra и Rb, Re и Rf, Rm и Rn, Ro и Rp независимо вместе могут образовывать необязательно замещенное 4-7-членное гетероциклическое кольцо, которое может быть насыщенным, ненасыщенным или ароматическим;
каждый из R11, R12, R13, R14, R15, R16, R19, R38 и R41 независимо представляет собой C1-5 алкил, C3-5 алкенил, фенил, бензил, фенэтил или C1-5 гетероциклил;
каждый из Rc и Rd, Ri и Rj независимо представляет собой водород, C1-5 алкил, C3-5 алкенил, фенил, бензил, фенэтил или C1-5 гетероарил; альтернативно Rc и Rd, Ri и Rj независимо вместе могут образовывать необязательно замещенное 4-7-членное гетероциклическое кольцо, которое может быть насыщенным, ненасыщенным или ароматическим;
Rg представляет собой водород, C1-5алкил, C3-5 алкенил, фенил, бензил, фенэтил, C1-5 гетероциклил, C2-8ацил, ароил, R17OC=O, R17R18NC=O, R16S, R16SO, R16SO2 или R17R18NSO2;
Rh представляет собой водород, C1-5алкил, C3-5 алкенил, фенил, бензил, фенэтил или C1-5 гетероциклил; альтернативно Rg и Rh вместе могут образовывать необязательно замещенное 4-7-членное гетероциклическое кольцо, которое может быть насыщенным, ненасыщенным или ароматическим;
R17 и R18 независимо представляют собой водород, C1-5алкил, C3-5 алкенил, фенил, бензил или C1-5 гетероциклил;
альтернативно R17 и R18 вместе могут образовывать необязательно замещенное 4-7-членное гетероциклическое кольцо, которое может быть насыщенным, ненасыщенным или ароматическим;
Ye представляет собой атом азота или R20C;
Ze представляет собой атом азота или R21C;
R20 представляет собой водород, галоген, C1-5 алкоксигруппу, C1-5алкил, C2-5 алкенил, цианогруппу, нитрогруппу, RmRnN, C2-8 ацил, RmOC=O, R14S, R14SO или R14SO2;
R21 представляет собой водород, галоген, C1-5 алкоксигруппу, C1-5алкил, C2-5 алкенил, цианогруппу, нитрогруппу, RoRpN, C2-8 ацил, R16OC=O, R11S, R11SO или R11SO2;
альтернативно R3 и R20 или R3 и R21 вместе могут образовывать необязательно замещенное 5- или 6-членное карбоциклическое или гетероциклическое кольцо, которое может быть насыщенным, ненасыщенным или ароматическим, где указанное кольцо может быть необязательно замещенным галогеном, ди(C1-5 алкил)аминогруппой, C2-5 ацилом и C1-5 алкоксигруппой;
R27 представляет собой водород, C1-5алкил, C3-5 алкенил, фенил, нафтил, бензил, фенэтил, C1-5 гетероциклил, C2-8 ацил, ароил, R29OC=O, R30R31NC=O, R29SO, R29S, R29SO2 или R30R31NSO2;
или альтернативно R27 и R1 вместе могут образовывать необязательно замещенное 5- или 6-членное гетероциклическое кольцо необязательно с 1-3 дополнительными фрагментами, содержащими гетероатомы и выбранными из О, NR9, NR10, N, SO2, C=O и S; указанное кольцо может быть насыщенным, ненасыщенным или ароматическим и R9 иR10 независимо выбраны из H, C1-3 алкила и -CH2CO2(C1-4 алкила);
Xf представляет собой CHR1f, =N-, NH, C=O, SO2, CHSR1f, где в формуле (f) R1f представляет собой водород, галоген, C1-5алкоксигруппу, гидроксильную группу, C1-5 алкил, C3-5 алкенил, цианогруппу, нитрогруппу, R39R40N, C2-8 ацил, C1-5 гетероциклил, (C1-5 гетероциклил)C1-5 алкилен, R41S, R41SO, R41SO2, R39OC=O, R39R40NC=O, R39R40NSO2, R41SO3- или R39(C=O)O-;
Yf представляет собой CH2, CHR2f, =CR2f, O или NR2f, где R2f представляет собой H, C1-7 алкил, C3-5 алкенил, C2-8 ацил, C1-5 гетероциклил, (C1-5гетероциклил)-C1-5 алкилен, фенил, (фенил)-C1-5 алкилен, (C3-7 циклоалкил)-C1-5 алкилен, (H2NCO)-C1-5алкилен, C1-5-галогеналкил, C1-5 цианоалкил, (C1-5 алкоксикарбонил)C1-5алкилен и (фенилкарбонил)NH-;
m равно 0 или 1;
p равно 0 или 1;
где, если не указано другого условия, каждая из описанных выше углеводородных групп или углеводородных групп, включающих гетероатомы, помимо любых указанных заместителей необязательно и независимо является замещенной 1-3 заместителями, выбранными из метила, галогенметила, гидроксиметила, галогена, гидроксильной группы, аминогруппы, нитрогруппы, цианогруппы, C1-5алкила, C1-5 алкоксигруппы, -COOH, C2-6 ацила, [ди(C1-4 алкил)амино]C2-5 алкилена, [ди(C1-4алкил)амино]C2-5 алкил-NH-CO- и C1-5 галогеналкоксигруппы.
Раскрытые в данном изобретении соединения являются ингибиторами с высоким сродством к протеолитической активности катепсина S человека. Для применения в медицине может быть желательно получение фармацевтически приемлемых солей соединений формулы (I).
Некоторые соединения данного изобретения могут содержать стереогенный атом и могут существовать в виде двух энантиомеров. Некоторые соединения данного изобретения могут содержать два или несколько стереогенных атома и могут существовать также в виде диастереомеров. Квалифицированному в данной области техники специалисту понятно, что все такие стереоизомеры и их смеси в любом соотношении включены в объем данного изобретения.
В соответствии с другим аспектом данное изобретение относится к фармацевтическим композициям, включающим соединение формулы (I) и фармацевтически приемлемый носитель. Еще одно воплощение данного изобретения представляет собой способ получения фармацевтической композиции, включающий смешение описанного соединения, определенного выше, с подходящим фармацевтически приемлемым носителем.
Изобретение также охватывает фармацевтические композиции, включающие несколько соединений формулы (I), и композиции, включающие соединение формулы (I) и другое фармацевтически активное средство.
Изобретение относится к способу лечения расстройств или состояний, опосредованных ферментом - катепсином S, у субъекта, нуждающегося в таком лечении, способ включает введение данному субъекту терапевтически эффективного количества любого соединения или любой фармацевтической композиции, которые описаны выше. Если вводится несколько активных лекарственных средств, терапевтически эффективное количество может быть общим эффективным количеством. Соединения, описанные в данном изобретении, ингибируют протеазную активность катепсина S человека - фермента, который вовлечен в иммунную реакцию. В предпочтительных воплощениях изобретения ингибирование катепсина S является селективным. Сами по себе описанные соединения и композиции полезны для профилактики, подавления или лечения аутоиммунных заболеваний, таких как волчанка, ревматоидный артрит и астма, а также для профилактики, ингибирования или лечения отторжения трансплантированных тканей.
Дополнительные отличительные признаки и преимущества данного изобретения станут понятными из подробного описания, приведенного ниже, которое включает примеры и прилагаемую формулу изобретения.
Подробное описание данного изобретения
Изобретение относится к пиразолам формулы (I), способам их получения, композициям, включающим данные соединения, и способам их применения для лечения заболеваний и болезненных состояний, включая заболевания и состояния, опосредованные катепсином S.
A. Термины
Ниже определены некоторые термины, а также их применение в данном описании.
Термин «алкил» относится к необязательно замещенным углеводородам с прямой и разветвленной цепью, в которых удален, по меньшей мере, один атом водорода с образованием радикальной группы. Алкильные группы включают метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, 1-метилпропил, пентил, изопентил, втор-пентил, гексил, гептил, октил и т.д. Термин «алкил» включает циклоалкилы, такие как циклопропил, циклобутил, циклопентил и циклогексил.
Термин «алкенил» включает необязательно замещенные углеводородные радикалы с прямой и разветвленной цепью, которые определены выше, содержащие, по меньшей мере, одну двойную углерод-углеродную связь (sp2). Алкенилы включают этенил (или винил), проп-1-енил, проп-2-енил (или аллил), изопропенил (или 1-метилвинил), бут-1-енил, бут-2-енил, бутадиенилы, пентенилы, гекса-2,4-диенил и т.д. Углеводородные радикалы, содержащие как двойные, так и тройные связи, такие как 2-пентен-4-инил, в данном описании относятся к группе алкинилов. Термин «алкенил» включает также циклоалкенилы. Цис- и транс- или (E) и (Z) формы также включены в область данного изобретения.
Термин «алкинил» относится к необязательно замещенным углеводородным радикалам с прямой и разветвленной цепью, которые определены выше, содержащим, по меньшей мере, одну тройную углерод-углеродную связь (sp). Алкинилы включают этинил, пропинилы, бутинилы и пентинилы. Углеводородные радикалы, содержащие как двойные, так и тройные связи, такие как 2-пентен-4-инил, в данном описании включены в группу алкинилов. Термин «алкинил» не включает циклоалкинилы.
Термин «алкоксигруппа» относится к необязательно замещенной алкильной группе с прямой и разветвленной цепью, содержащей концевой атомом кислорода, который связывает эту алкильную группу с остатком молекулы. Термин «алкоксигруппа» включает метокси-, этокси-, пропокси-, изопропокси-, бутокси-, трет-бутокси-, пентоксигруппу и т.д. Термины "аминоалкил", "тиоалкил" и "сульфонилалкил" означают группы, аналогичные группам, определенным термином «алкоксигруппы», в которых атом кислорода заменен соответственно группами NH (или NR), S и SO2. Термин «гетероалкил» включает алкоксигруппы, аминоалкилы, тиоалкилы и т.д.
Термин «арил» включает фенил, нафтил, бифенил, тетрагидронафтил и т.д., каждый из которых может быть необязательно замещенным. Термин «арил» также включает арилалкильные группы, такие как бензил, фенэтил и фенилпропил. Термин «арил» относится также к кольцевой системе, содержащей необязательно замещенное 6-членное карбоциклическое ароматическое кольцо, причем указанная система может быть бициклической, мостиковой и/или конденсированной. Система может включать кольца, которые являются ароматическими или частично или полностью насыщенными. Примеры кольцевых систем включают инденил, пенталенил, 1,4-дигидронафтил, инданил, бензимидазолил, бензтиофенил, индолил, бензофуранил, изохинолинил и т.д.
Термин "гетероциклил" включает необязательно замещенные ароматические и неароматическиес кольца, содержащие в кольце атомы углерода и, по меньшей мере, один гетероатом (О, S, N) или фрагмент, включающий гетероатом (SO2, CO, CONH, COO). Если не указано иначе, гетероциклический радикал может иметь валентность, соединяющую его с остатком молекулы через атом углерода, например, 3-фурил или 2-имидазолил, или через гетероатом, например, N-пиперидил или 1-пиразолил. Предпочтительно моноциклический гетероциклил содержит от 4 до 7 кольцевых атомов или от 5 до 6 кольцевых атомов; кольцо может включать от 1 до 5 гетероатомов или фрагменты, содержащие от 1 до 5 гетероатомов, предпочтительно от 1 до 3 гетероатомов. Гетероциклил может быть насыщенным, ненасыщенным, ароматическим (например, гетероарил), неароматическим или конденсированным.
Термин «гетероциклил» включает также конденсированные, например, бициклические кольца, в частности кольца, необязательно конденсированные с необязательно замещенным карбоциклическим или гетероциклическим пяти- или шестичленным ароматическим кольцом. Например, термин «гетероарил» означает необязательно замещенное шестичленное гетероароматическое кольцо, содержащее 1, 2 или 3 атома азота и конденсированное с необязательно замещенным пяти- или шестичленным карбоциклическим или гетероциклическим ароматическим кольцом. Указанное гетероциклическое пяти- или шестичленное ароматическое кольцо, конденсированное с указанным пяти- или шестичленным ароматическим кольцом, может содержать 1, 2 или 3 атома азота и представлять собой шестичленное кольцо или может содержать 1, 2 или 3 гетероатома, выбранных из атомов кислорода, азота и серы, и представлять собой пятичленное кольцо.
Примерами гетероциклилов являются тиазолил, фурил, пиранил, изобензофуранил, пирролил, имидазолил, пиразолил, изотиазолил, изоксазолил, пиридил, пиразинил, пиримидинил, пиридазинил, индолизинил, изоиндолил, индолил, индазолил, пуринил, хинолил, фуразанил, пирролидинил, пирролинил, имидазолидинил, имидазолинил, пиразолидинил, пиразолинил, пиперидил, пиперазинил, индолинил и морфолинил. Например, предпочтительными гетероциклилами или гетероциклическими радикалами являются морфолинил, пиперазинил, пирролидинил, пиридил, циклогексилимино, циклогептилимино, более предпочтительно пиперидил.
Примерами, иллюстрирующими термин «гетероарил», являются тиенил, фуранил, пирролил, имидазолил, оксазолил, тиазолил, бензотиенил, бензофуранил, бензимидазолил, бензоксазолил, бензотиазолил.
Термин "ацил" относится к карбонильному фрагменту, соединенному либо с атомом водорода (например, формильная группа), либо с необязательно замещенной алкильной или алкенильной цепью, либо с гетероциклилом.
Термин "гало" или "галоген" включает фтор, хлор, бром и йод, предпочтительно хлор или бром, в качестве заместителя.
Термин "алкандиил" или "алкилен" относится к необязательно замещенным двухвалентным алкановым радикалам с прямой или разветвленной цепью, таким как, например, метилен, этилен, пропилен, бутилен, пентилен или гексилен.
Термин "алкендиил" относится, аналогично описанному выше термину, к необязательно замещенным двухвалентным алкеновым радикалам с прямой или разветвленной цепью, таким как, например, пропенилен, бутенилен, пентенилен или гексенилен. В таких радикалах атом углерода, к которому присоединяется атом азота, предпочтительно должен быть ненасыщенным.
Термин «ароил» относится к карбонильному фрагменту, соединенному с необязательно замещенной арильной или гетероарильной группой, где арил и гетероарил определены выше. В частности, бензоил представляет собой фенилкарбонил.
Как определено в данном описании, два радикала вместе с атомом(ами), к которому(ым) они присоединены, могут образовывать необязательно замещенное 4-7-, 5-7- или 5-6-членное карбоциклическое или гетероциклическое кольцо, которое может быть насыщенным, ненасыщенным или ароматическим. Указанные кольца могут представлять собой кольца, определенные в разделе «Краткое описание данного изобретения». Конкретные примеры таких колец приведены в следующем разделе.
Выражение «фармацевтически приемлемые соли, сложные эфиры и амиды» включают карбоксилатные соли (например, C1-8алкил-, циклоалкил-, арил-, гетероарил- или неароматический гетероциклил), аминокислотно-аддитивные соли, сложные эфиры и амиды, свойства которых находятся в пределах допустимого соотношения «полезное действие/риск» и которые фармацевтически эффективны и подходят для контакта с тканями пациентов без избыточной токсичности, раздражения или аллергической реакции. Примеры солей включают гидробромид, гидрохлорид, сульфат, бисульфат, нитрат, ацетат, оксалат, валерат, олеат, пальмитат, стеарат, лаурат, борат, бензоат, лактат, фосфат, тозилат, цитрат, малеат, фумарат, сукцинат, тартрат, нафтилат, мезилат, глюкогептонат, лактобионат и лаурилсульфонат. Они могут включать катионы щелочных и щелочно-земельных металлов, таких как натрий, калий, кальций и магний, а также нетоксичный катион аммония, четвертичного аммония и аминные катионы, такие как тетраметиламмоний, метиламин, триметиламин и этиламин (см., например, публикацию S.M. Berge et al., "Pharmaceutical Salts," J. Pharm. Sci., 1977, 66: 1-19, которая включена в описание в качестве ссылки). Примеры фармацевтически приемлемых амидов данного изобретения включают амиды, полученные из аммиака, первичных C1-8алкиламинов и вторичных ди(C1-6 алкил)аминов. Вторичные амины включают 5- или 6-членные гетероциклические или гетероароматические кольцевые фрагменты, содержащие, по меньшей мере, один атом азота и необязательно 1-2 дополнительных гетероатома. Предпочтительные амиды являются производными аммиака, первичных C1-3алкиламинов и ди(C1-2алкил)аминов. Типичные фармацевтически приемлемые сложные эфиры данного изобретения включают C1-7алкильные, C5-7циклоалкильные, фенильные и фенил (C1-6)алкильные сложные эфиры. Предпочтительные сложные эфиры включают сложные метиловые эфиры.
Термин "пациент" или "субъект" включает млекопитающих, таких как человек и животные (собаки, кошки, лошади, крысы, кролики, мыши, нечеловекообразные обезьяны), при необходимости обследования, эксперимента, лечения или профилактики, связанных с релевантным заболеванием или состоянием. Предпочтительно пациент или субьект является человеком.
Термин "композиция" относится к готовой лекарственной форме, включающей указанные ингредиенты в указанных количествах, а также к любому препарату, который является прямым или опосредованным результатом соединения указанных ингредиентов в указанных количествах.
Термин "терапевтически эффективное количество" или "эффективное количество" означает количество активных соединений или фармацевтического средства, вызывающее в тканях животного или человека ответную биологическую реакцию или реакцию на лекарственное средство, данный ответ является целью деятельности исследователя, врача или другого клинициста и включает облегчение симптомов заболевания или расстройства, подлежащего лечению.
Что касается различных радикалов, встречающихся в данном описании и формуле изобретения, то следует обратить внимание на три общих замечаниях. Первое относится к валентности. При описании всех углеводородных радикалов: насыщенных, ненасыщенных или ароматических, циклических, с прямой или разветвленной цепью, а также всех гетероциклических радикалов - каждый радикал включает замещенные радикалы данного типа и одновалентные, двухвалентные и поливалентные радикалы, как указано в контексте формулы изобретения. Из контекста будет видно, когда заместитель представляет собой алкилен или углеводородный радикал, в котором удалены, по меньшей мере, два атома водорода (двухвалентный) или несколько атомов водорода (поливалентный). Примером двухвалентного радикала, связывающего две части молекулы, является G в формуле (I), который связывает два кольца.
Второе замечание относится к радикалам и структурным фрагментам, которые определены в данном описании, и следует представлять, что они включают замещенные радикалы и структурные фрагменты. Углеводороды включают одновалентные радикалы, содержащие углерод и водород, такие как алкил, алкенил, алкинил, циклоалкил и циклоалкенил (ароматический или ненасыщенный), а также соответствующие двухвалентные радикалы, такие как алкилен, алкенилен, фенилен и т.д. Гетероуглеводороды включают моновалентные и двухвалентные радикалы, содержащие углерод, водород и, по меньшей мере, один гетероатом. Примеры одновалентных гетероуглеводородов включают ацил, ацилокси, алкоксиацил, гетероциклил, гетероарил, ароил, бензоил, диалкиламино-, гидроксиалкил и т.д.
Например, при использовании термина «алкил» следует представлять, что он включает замещенный алкил, содержащий один или несколько заместителей, в частности от 1 до 5 заместителей, от 1 до 3 или от 2 до 4 заместителей. Заместители могут быть одинаковыми (дигидрокси, диметил), подобными (хлорфтор) или разными (хлорбензил- или аминометил-замещенный). Примерами замещенного алкила являются галогеналкил (фторметил, хлорметил, дифторметил, перхлорметил, 2-бромэтил, перфторметил, и 3-йодциклопентил), гидроксиалкил (гидроксиметил, гидроксиэтил, 2-гидроксипропил), аминоалкил (аминометил, 2-аминоэтил, 3-аминопропил и 2-аминопропил), нитроалкил, алкилалкил и т.д. Ди(C1-6алкил)аминогруппа включает независимо выбранные алкильные группы с образованием, например, метилпропиламиногруппы и изопропилметиламиногруппы, а также диалкиламиногруппы, содержащей две одинаковые алкильные группы, такие как диметиламино- или диэтиламиногруппа.
Третье замечание относится к тому, что в описании рассматриваются только стабильные соединения. Например, когда имеет место группа NR'R" и R может представлять собой алкенильную группу, двойная связь имет место в том случае, когда, по меньшей мере, один атом углерода удален от атома азота для предотвращения образования енамина. Аналогично, если пунктирная линия представляет необязательную sp2связь, то когда она отсутствует, добавляется соответствующее количество атомов водорода.
Предпочтительные заместители для Ar или Ar1 включают метил, метоксигруппу, фторметил, дифторметил, перфторметил (трифторметил), 1-фторэтил, 2-фторэтил, этоксигруппу, фтор, хлор и бром, особенно предпочтительны метил, бром, хлор, перфторметил, перфторметокси, метоксигруппа и фтор. Предпочтительными примерами замещенных Ar или Ar1 являются 4-замещенный или 3,4-дизамещенный фенил.
Соединения данного изобретения более подробно описаны в следующем разделе.
B. Соединения
Изобретение предоставляет соединения формулы (I), определенные выше.
Предпочтительные соединения включают соединения, в которых
(a) Ar2 выбран из групп формулы (e);
(b) Ar2 выбран из групп формулы (f);
(c) Ar2 выбран из групп формул (a)-(d);
(d) R1 представляет собой галоген, C1-5алкоксигруппу, гидроксильную группу, C1-5алкил, цианогруппу, нитрогруппу, RaRbN или вместе с R27образует группу;
(e) R1 вместе с R27образует группу;
(f) R1 и R27 вместе образуют группу, выбранную из
(1) -CH2NR9-(C=O)-
(2) -OCH2(C=O)-
(3) -CH2CH2(C=O)-
(4) -CH2-O(C=O)-
(5) -CH2S(C=O)-
(6) -О(C=О)-
(7) -CH2(C=O)-
(8) -NR9(C=O)-
(9) -NR9(SO2)-
(10) -CH2NR9SO2-
(11) -NR9CH2(C=O)- и -SCH2(C=O)-
(g) R1 и R27 вместе образуют группу, выбранную из
a) -CH2-(C=O)-
b) -O(C=O)-
c) -CH2CH2-
d) -S(C=O)-
e) -N=N-
f) -NR9SO2-
g) -N=CR9-
h) -NR9(C=O)- и
i)-CH=CH-;
(h) R2представляет собой водород, галоген, C1-5 алкоксигруппу, C1-5алкил, цианогруппу или ReRfN, где Re и Rf представляют собой H или C1-5 алкил или вместе образуют 5-7-членное гетероциклическое кольцо;
(i) R3 представляет собой водород, галоген, C1-5 алкоксигруппу, C1-5алкил, цианогруппу, нитрогруппу или RgRhN, где Rg и Rh представляют собой H или C1-5 алкил или вместе образуют 5-7-членное гетероциклическое кольцо;
(j) R5 и R6 независимо выбраны из водорода и C1-3алкила;
(k) один из R5 и R6 представляет собой H;
(l) R5 и R6 каждый представляет собой H;
(m) один из R7 и R8 представляет собой H, а другой представляет собой 5-7-членный карбоциклил или гетероциклил;
(n) R7 и R8 вместе образуют необязательно замещенное 5-7-членное карбоциклическое или гетероциклическое кольцо;
(o) R7 и R8 вместе образуют шестичленный гетероциклил;
(p) R7 и R8 вместе образуют пиридинил, пиримидинил или пиперазинил, необязательно N-замещенный группами -(C=О)R4, -SO2R4 или -(C=О)NHR44;
(q) каждый из Rа, Rе, Rm и Ro независимо выбран из водорода, C1-5алкила, C2-8 ацила и соответствующих групп ROC=O, RRNC=O, RSO, RSO2и RRNSO2;
(r) каждый из Ra, Re, Rm, Ro, Rb, Rf, Rn и Rp независимо выбран из водорода и C1-5 алкила или независимо Rа и Rb, Re и Rf, Rm и Rn, R° и Rp вместе образуют необязательно замещенное 4-7-членное карбоциклическое или гетероциклическое кольцо;
(s) (1) Raи Rb вместе независимо представляют собой морфолинил, пиперидинил или пирролидинил; (2) Re и Rfвместе представляют собой морфолинил, пиперидинил или пирролидинил или (3) одновременно выполняются условия пунктов (1) и (2);
(t) каждый из Rcи Rd, Riи Rj, Rk и Rl независимо представляет собой водород или C1-5алкил или альтернативно Rc и Rd, Ri и Rj, Rk и Rl независимо могут вместе образовывать необязательно замещенное 4-7-членное гетероциклическое кольцо, которое может быть насыщенным, ненасыщенным или ароматическим;
(u) Rc и Rd, Ri и Rj, Rk и Rl независимо вместе образуют необязательно замещенное 4-7-членное гетероциклическое кольцо, которое может быть насыщенным, ненасыщенным или ароматическим;
(v) каждый из Rb, Rf, Rn, Rp, R32, R33, R34, R35, R36, R37, R39 и R40 независимо представляет собой H или C1-5алкил;
(w) каждый из R11, R12, R13, R14, R15, R16, R19, R38 и R41 независимо представляет собой H или C1-5 алкил;
(x) Rg представляет собой C1-5 алкил, C2-8 ацил, R17OC=O, R17R18NC=O, R16S, R16SO, R16SO2или R17R18NSO2 и Rh представляет собой водород или C1-5алкил; альтернативно Rg и Rh могут вместе образовывать необязательно замещенное 4-7-членное гетероциклическое кольцо;
(y) R17 и R18 независимо представляют собой водород или C1-5алкил;
(z) n равно 1;
(aa) n равно 0;
(bb) G представляет собой C3-4 алкандиил, необязательно замещенный гидроксильной группой, галогеном, (L)-C1-5алкилоксигруппой или [(L)-C1-5 алкилен]аминогруппой;
(cc) G представляет собой C3-алкандиил, необязательно замещенный гидроксильной группой, (L)-C1-5 алкилоксигруппой или [(L)-C1-5 алкилен]аминогруппой;
(dd) каждый из R20 и R21 независимо выбран из водорода, галогена, C1-5алкоксигруппы, C1-5алкила, цианогруппы, нитрогруппы и Rm RnN или RoRpN соответственно;
(ee) каждый из R20 и R21 независимо выбран из водорода, галогена, C1-3 алкила и RmRnN или RoRpN соответственно;
(ff) Ar представляет собой моноциклическое кольцо, необязательно замещенное 1-2 заместителями, выбранными из галогена, C1-5 алкила, цианогруппы, азидогруппы, нитрогруппы, R22R23N, галогенметила и галогенметоксигруппы;
(gg) Ar представляет собой шестичленное кольцо, замещенное 1-2 заместителями, независимо выбранными из метила, галогена, CF3 и OCF3, и указанный заместитель или заместители находятся в положении 4 или в положениях 3 и 4 соответственно;
(hh) каждый из R22, R23 и R24 представляет собой водород или C1-5 алкил;
(ii) R25 и R26 независимо представляют собой водород или C1-5 алкил или альтернативно R25 и R26 вместе могут образовывать необязательно замещенное 4-7-членное гетероциклическое кольцо;
(jj) каждый из R25 и R26 независимо представляет собой водород или C1-5 алкил;
(kk) W представляет собой NR27;
(ll) W представляет собой CHR28 и R28представляет собойводород или C1-5алкил;
(mm) R29 представляет собойC1-5 алкил или R30иR31 независимо выбраны из водорода и C1-5 алкила, или R30 и R31 вместе образуют 5-6-членное гетероциклическое кольцо;
(nn) Ar2 представляет собой группу формулы (e) и R1 представляет собой галоген, C1-5алкоксигруппу, гидроксильную группу, C1-5 алкил, цианогруппу, нитрогруппу и RaRbN или R1 вместе с R27 может образовывать группу, описанную ниже; R2 представляет собой водород, галоген, C1-5 алкоксигруппу, C1-5 алкил или ReRfN; R3 представляет собой водород, галоген, C1-5 алкоксигруппу, гидроксильную группу, C1-5 алкил, цианогруппу, RgRhN; R5иR6независимо выбраны из водорода и C1-3 алкила;
(oo) R7 и R8 вместе независимо образуют необязательно замещенное 5-7-членное карбоциклическое или гетероциклическое кольцо, которое может быть насыщенным, ненасыщенным или ароматическим;
(pp) каждый из Ra,Re, Rm и Ro независимо выбран из водорода, C1-5 алкила, C2-8 ацила и соответствующих групп ROC=O, RRNC=O, RS, RSO, RSO2 и RRNSO2;
(qq) каждый из Rb, Rf, Rn и Rp независимо выбран из водорода и C1-5 алкила; каждый из R11, R12, R13, R14, R15, R16, R19 и R38 независимо представляет собой C1-5 алкил; каждый из Rc и Rd, Ri и Rj, Rk и Rl, R32 и R33, R34 и R35, R36 и R37 независимо представляет водород или C1-5 алкил или вместе они образуют необязательно замещенное 4-7-членное гетероциклическое кольцо;
(rr) Rgпредставляет собой водород, C1-5 алкил, C2-8 ацил, R17OC=O, R17R18NC=O, R16S, R16 SO, R16SO2 или R17R18NSO2; Rhпредставляет собойводород или C1-5алкил; альтернативно Rg и Rh вместе могут образовывать необязательно замещенное 4-7-членное гетероциклическое кольцо; R17 и R18 независимо представляют собой водород или C1-5 алкил; n равно 0 или 1;
(ss) G представляет собой C3-4 алкендиил или C3-4алкандиил, необязательно замещенный гидроксильной группой, галогеном, C1-5 алкилоксигруппой, (L)-C1-5 алкоксигруппой или [(L)-C1-5 алкилен]аминогруппой; L представляет собой аминогруппу, моно- или ди-C1-5алкиламиногруппу, пирролидинил, морфолинил, пиперидинил, гомопиперидинил или пиперазинил, где доступные кольцевые атомы азота могут быть необязательно замещены C1-5 алкилом, бензилом, C1-5алкилкарбонилом или C1-5алкилоксикарбонилом;
(tt) Ye представляет собой атом азота или R20C; Ze представляет собой атом азота или R21C;
(uu) R20 и R21 независимо выбраны из водорода, галогена, C1-5алкоксигруппы, C1-5 алкила, цианогруппы, нитрогруппы и RmRnN или RоRpN соответственно; альтернативно R3 и R20 или R3 и R21 вместе могут образовывать необязательно замещенное 5- или 6-членное карбоциклическое или гетероциклическое кольцо;
(vv) Ar представляет собой моноциклическое или бициклическое арильное или гетероарильное кольцо, необязательно замещенное 1-3 заместителями, независимо выбранными из галогена, C1-5алкоксигруппы, C1-5 алкила, цианогруппы, азидогруппы, нитрогруппы, R22R23N, R24SO2, R24OC=O, R25R26NC=O, CF3, OCF3, CF3S и C1-5 алкилтиогруппы; R22 представляет собой водород, C1-5 алкил, фенил, бензил, фенэтил, C1-5гетероциклил, C2-8ацил, ароил, R24OC=O, R25R26NC=O, R24SO, R24SO2 или R25R26NSO2; R23 представляет собой водород или C1-5алкил;
(ww) альтернативно R22 и R23 вместе могут образовывать необязательно замещенное 4-7-членное гетероциклическое кольцо; R24 представляет собой водород или C1-5алкил; R25 и R26 независимо представляют собой водород или C1-5 алкил или альтернативно R25 и R26 вместе могут образовывать необязательно замещенное 4-7-членное гетероциклическое кольцо; W представляет собой NR27или CHR28; R27представляет собойводород, C1-5 алкил, R29OC=O, R30R31NC=O, R29SO, R29 SO2 или R30R31NSO2 или альтернативно R27иR1 вместе могут образовывать необязательно замещенное 5- или 6-членное гетероциклическое кольцо, которое может быть насыщенным, ненасыщенным или ароматическим; R28 представляет собой водород, гидроксильную группу, C1-5гетероциклил, фенил или C1-5 алкил; R29представляет собойC1-5 алкил; R30иR31 независимо выбраны из водорода, C1-5алкила; альтернативно R30 и R31 вместе могут образовывать необязательно замещенное 4-7-членное гетероциклическое кольцо;
(xx) один из R5 и R6 представляет собой H; R7 и R8 вместе образуют необязательно замещенное 6-членное карбоциклическое или гетероциклическое кольцо и Ar представляет собой моноциклическое кольцо, необязательно замещенное 1-2 заместителями, выбранными из галогена, C1-5 алкила, цианогруппы, азидогруппы, нитрогруппы, R22R23N, CF3 и OCF3;
(yy) R5 и R6 каждый представляет собой H, Ar представляет собой шестичленное кольцо, замещенное 1-2 заместителями, независимо выбранными из галогена, метила, CF3 и OCF3 , и указанный заместитель или заместители находятся в положении 4 или в положениях 3 и 4;
(zz) R7 и R8 вместе образуют тетрагидропиридинил, необязательно N-замещенный группами -(C=O)R4, -SO2R4 или -(C=O)NHR44;
(aaa) Xfпредставляет собойC=O, SO2 или CHR1f и Yf представляет собой O или NR2f, где R2f представляет собой H, C1-5 алкил, C2-5 гетероциклил, C1-5 цианоалкил или (C1-5 алкоксикарбонил)C1-5алкилен;
(bbb) R2f представляет собой H, C1-3 алкил или C2-5 гетероциклил;
(ccc) Xf представляет собой C=O и Yf представляет собой O, CHR2f или NR2f, где R2f представляет собой H, C1-5 алкил, C2-5гетероциклил, C1-5 цианоалкил или (C1-5 алкоксикарбонил)C1-5алкилен;
(ddd) Xf представляет собой C=O и Yfпредставляет собойO;
(eee) m равно 0 и p равно 0; m равно 0 и p равно 1 или m равно 1 и p равно 0;
(fff) p равно 0;
(ggg) Rzпредставляет собойH;
(hhh) Rzпредставляет собойOH;
(iii) Rz отсутствует;
(jjj) R20 и R3 вместе представляют собой шестичленное карбоциклическое или гетероциклическое кольцо, необязательно замещенное 1-3 заместителями, независимо выбранными из галогена, C1-3 алкоксигруппы, ди(C1-3 алкил)аминогруппы и C2-5 ацила;
(kkk) каждый из R20 и R3 представляет собой H и
(lll) сочетания указанных выше радикалов и групп.
Конкретные предпочтительные соединения включают соединения, описанные в примерах, например:
1-(1-{2-гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6, 7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-он; 1-(1-{3-[3-(3,4-дихлорфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-он; амид 3-(3,4-дихлорфенил)-1-{3-[4-(2-оксо-2,3-дигидробензимидазол-1-ил)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4, 3-c]пиридин-5-карбоновой кислоты; 6-хлор-1-(1-{3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-он; амид 3-(3, 4-дихлорфенил)-1-{3-[4-(3-метил-2-оксо-2,3-дигидробензимидазол-1-ил)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты; [3-(1-{2-гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-2-оксо-2,3-дигидробензимидазол-1-ил]ацетонитрил; этиловый эфир [3-(1-{2-гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-2-оксо-2,3-дигидробензимидазол-1-ил]уксусной кислоты; 5-хлор-3-(1-{2-гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1-метил-1,3-дигидробензимидазол-2-он; амид 1-{3-[4-(6-хлор-3-метил-2-оксо-2,3-дигидробензимидазол-1-ил)пиперидин-1-ил]пропил}-3-(3,4-дихлорфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты; 3-(1-{2-гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1,5-диметил-1,3-дигидробензимидазол-2-он; 3-(1-{2-гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1,3-дигидроимидазо[4,5-b]пиридин-2-он; 3-(1-{3-[3-(4-бромфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-5-метокси-1,3-дигидроимидазо[4,5-b]пиридин-2-он; амид 3-(4-бромфенил)-1-{2-гидрокси-3-[4-(5-метокси-2-оксо-1,2-дигидроимидазо[4,5-b]пиридин-3-ил)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты; 3-(1-{2-гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-5-метокси-1-метил-1,3-дигидроимидазо[4,5-b]пиридин-2-он; 5-диметиламино-3-(1-{2-гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1,3-дигидроимидазо[4,5-b]пиридин-2-он; 6-хлор-1-(1-{3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1,3-дигидроиндол-2-он; 1-(1-{2-гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-3,4-дигидро-1Н-хинолин-2-он; 4-(1-{3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-4H-бензо[1,4]оксазин-3-он; 4-(1-{2-гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-4H-бензо[1,4]оксазин-3-он и 1-(1-{3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-3,4-дигидро-1H-хиназолин-2-он.
Кроме того, предпочтительные соединения включают соединения, в которых Ar или Ar1 выбран из 4-трифторметилфенила, 4-бромфенила, 4-хлорфенила, 4-хлор-3-метилфенила и 3,4-дихлорфенила.
Более предпочтительные соединения включают соединения примеров 37 и 50.
Родственные соединения
Изобретение относится к соединениям, раскрытым выше, и ближайшим аналогам (родственные соединения), фармацевтически приемлемым формам заявленных соединений, например их солям, сложным эфирам, амидам, кислотам, гидратам или сольватированным формам; замаскированным формам или защищенным формам и рацемическим смесям или энантиомерно или оптически чистым формам. Родственные соединения также включают соединения данного изобретения, модифицированные для возможного обнаружения, например соединения, меченные изотопом18F для применения в качестве зонда в позитронной эмиссионной томографии (positron emission tomography - PET) или в компьютерной эмиссионной томографии одиночных фотонов (single-photon emission computed tomography - SPECT).
Изобретение также включает раскрытые соединения, содержащие одну или несколько функциональных групп (например, гидроксильную, аминогруппу или карбоксильную группу), защищенную защитной группой (см. монографию Greene and Wuts, Protective Groups in Organic Synthesis, 3rd ed. (1999), John Wiley & Sons, NY). Некоторые из таких замаскированных или защищенных соединений являются фармацевтически приемлемыми; другие будут полезны в качестве промежуточных продуктов. Синтетические промежуточные продукты и способы, описанные в данном изобретении, а также их незначительные модификации также входят в объем данного изобретения.
ЗАЩИТНЫЕ ГРУППЫ ГИДРОКСИЛЬНОЙ ГРУППЫ
Защита гидроксильной группы включает образование простых эфиров - метиловых эфиров, замещенных метиловых эфиров, замещенных этиловых эфиров, замещенных бензиловых эфиров и силиловых эфиров.
Замещенные простые метиловые эфиры
Примеры защитных групп замещенных простых метиловых эфиров включают метоксиметил, метилтиометил, трет-бутилтиометил, (фенилдиметилсилил)метоксиметил, бензилоксиметил, п-метоксибензилоксиметил, (4-метоксифенокси)метил, гваяколметил, трет-бутоксиметил, 4-пентенилоксиметил, силоксиметил, 2-метоксиэтоксиметил, 2,2,2-трихлорэтоксиметил, бис(2-хлорэтокси)метил, 2-(триметилсилил)этоксиметил, тетрагидропиранил, 3-бромтетрагидропиранил, тетрагидротиопиранил, 1-метоксициклогексил, 4-метокситетрагидропиранил, 4-метокситетрагидротиопиранил, 4-метокситетрагидротиопиранил S,S-диоксидо, 1-[(2-хлор-4-метил)фенил]-4-метоксипиперидин-4-ил, 1, 4-диоксан-2-ил, тетрагидрофуранил, тетрагидротиофуранил и 2,3,3a,4,5,6,7,7a-октагидро-7,8,8-триметил-4,7-метанбензофуран-2-ил.
Замещенные простые этиловые эфиры
Примеры защитных групп замещенных простых этиловых эфиров включают 1-этоксиэтил, 1-(2-хлорэтокси)этил, 1-метил-1-метоксиэтил, 1-метил-1-бензилоксиэтил, 1-метил-1-бензилокси-2-фторэтил, 2,2,2-трихлорэтил, 2-триметилсилилэтил, 2-(фенилселенил)этил, трет-бутил, аллил, п-хлорфенил, п-метоксифенил, 2,4-динитрофенил и бензил.
Замещенные простые бензиловые эфиры
Примеры защитных групп замещенных простых бензиловых эфиров включают п-метоксибензил, 3,4-диметоксибензил, o-нитробензил, п-нитробензил, п-галогенбензил, 2,6-дихлорбензил, п-цианобензил, п-фенилбензил, 2- и 4-пиколил, 3-метил-2-пиколил-N-оксидо, дифенилметил, п,п'-динитробензгидрил, 5-дибензосуберил, трифенилметил, α-нафтилдифенилметил, п-метоксифенилдифенилметил, ди(п-метоксифенил)фенилметил, три(п-метоксифенил)метил, 4-(4'-бромфенацилокси)фенилдифенилметил, 4,4',4"-трис-(4,5-дихлорфталимидофенил)метил, 4,4',4"-трис(левулиноилоксифенил)метил, 4,4',4"-трис(бензоилоксифенил)метил, 3-(имидазол-1-илметил)-бис(4',4"-диметоксифенил)метил, 1,1-бис(4-метоксифенил)-1'-пиренилметил, 9-антрил, 9-(9-фенил)ксантенил, 9-(9-фенил-10-оксо)антрил, 1,3-бензодитиолан-2-ил и бензизотиазолил-S, S-диоксидо.
Простые силиловые эфиры
Примеры защитных групп простых силиловых эфиров включают триметилсилил, триэтилсилил, триизопропилсилил, диметилизопропилсилил, диэтилизопропилсилил, диметилгексилсилил, трет-бутилдиметилсилил, трет-бутилдифенилсилил, трибензилсилил, три-п-ксилилсилил, трифенилсилил, дифенилметилсилил и трет-бутилметоксифенилсилил.
Сложные эфиры
Помимо простых эфиров гидроксильная группа может защищаться посредством получения сложного эфира. Примеры таких сложных эфиров включают формиат, бензоилформиат, ацетат, хлорацетат, дихлорацетат, трихлорацетат, трифторацетат, метоксиацетат, трифенилметоксиацетат, феноксиацетат, п-хлорфеноксиацетат, п-P-фенилацетат, 3-фенилпропионат, 4-оксопентаноат (левулинат), 4,4-(этилендитио)пентаноат, пивалоат, адамантоат, кротонат, 4-метоксикротонат, бензоат, п-фенилбензоат, 2,4,6-триметилбензоат (мезитоат).
Карбонаты
Примеры защитных групп карбонатов включают метил, 9-флуоренилметил, этил, 2,2,2-трихлорэтил, 2-(триметилсилил)этил, 2-(фенилсульфонил)этил, 2-(трифенилфосфонио)этил, изобутил, винил, аллил, п-нитрофенил, бензил, п-метоксибензил, 3,4-диметоксибензил, o-нитробензил, п-нитробензил, S-бензилтиокарбонат, 4-этокси-1-нафтил и метилдитиокарбонат.
Вспомогательное отщепление (assisted cleavage)
Примеры соединений, требующих вспомогательного отщепления, включают 2-йодбензоат, 4-азидобутират, 4-нитро-4-метилпентаноат, o-(дибромметил)бензоат, 2-формилбензолсульфонат, 2-(метилтиометокси)этилкарбонат, 4-(метилтиометокси)бутират и 2-(метилтиометоксиметил)бензоат.
Смешанные сложные эфиры
Примеры смешанных сложных эфиров включают 2, 6-дихлор-4-метилфеноксиацетат, 2,6-дихлор-4-(1,1,3,3-тетраметилбутил)феноксиацетат, 2,4-бис(1,1-диметилпропил)феноксиацетат, хлордифенилацетат, изобутират, моносукциноат, (E)-2-метил-2-бутеноат (тиглоат), o-(метоксикарбонил)бензоат, п-P-бензоат, α-нафтоат, нитрат, алкил N,N,N',N'-тетраметилфосфородиамидат, N-фенилкарбамат, борат, диметилфосфинотиоил и 2,4-динитрофенилсульфенат.
Сульфонаты
Примеры защитных сульфонатов включают сульфат, метансульфонат (мезилат), бензилсульфонат и тозилат.
ЗАЩИТНЫЕ ГРУППЫ АМИНОГРУППЫ
Защита аминогруппы включает получение карбаматов, амидов и использование особых групп для защиты -NH-группы.
Примеры карбаматов включают метил- и этилкарбаматы, замещенные этилкарбаматы, карбаматы вспомогательного отщепления, карбаматы фотолитического отщепления, производные мочевинного типа и смешанные сложные карбаматы.
Карбаматы
Примеры защитных групп метил- и этилкарбаматов включают метил и этил, 9-флуоренилметил, 9-(2-сульфо)флуоренилметил, 9-(2,7-дибром)флуоренилметил, 2,7-ди-трет-бутил-[9-(10, 10-диоксо-10,10,10,10-тетрагидротиоксантил)]метил- и 4-метоксифенацил.
Замещенные этилкарбаматы
Примеры защитных групп замещенных этилкарбаматов включают 2,2, 2-трихлорэтил, 2-триметилсилилэтил, 2-фенилэтил, 1-(1-адамантил)-1-метилэтил, 1,1-диметил-2-галогенэтил, 1,1-диметил-2,2-дибромэтил, 1,1-диметил-2,2,2-трихлорэтил, 1-метил-1-(4-бифенил)этил, 1-(3, 5-ди-трет-бутилфенил)-1-метилэтил, 2-(2'- и 4'-пиридил)этил, 2-(N,N-дициклогексилкарбоксамидо)этил, трет-бутил, 1-адамантил, винил, аллил, 1-изопропилаллил, циннамил, 4-нитроциннамил, 8-хинолил, N-гидроксипиперидинил, алкилдитио, бензил, п-метоксибензил, п-нитробензил, п-бромбензил, п-хлорбензил, 2,4-дихлорбензил, 4-метилсульфинилбензил, 9-антрилметил и дифенилметил.
Вспомогательное отщепление
Примеры групп, требующих вспомогательного отщепления, включают 2-метилтиоэтил, 2-метилсульфонилэтил, 2-(п-толуолсульфонил)этил, [2-(1,3-дитианил)]метил-, 4-метилтиофенил, 2,4-диметилтиофенил, 2-фосфониоэтил, 2-трифенилфосфониоизопропил, 1,1-диметил-2-цианоэтил, м-хлор-п-ацилоксибензил, п-(дигидроксиборил)бензил, 5-бензизоксазолилметил и 2-(трифторметил)-6-хромонилметил.
Фотолитическое отщепление
Примеры групп фотолитического отщепления включают м-нитрофенил, 3,5-диметоксибензил, o-нитробензил, 3, 4-диметокси-6-нитробензил и фенил(o-нитрофенил)метил.
Производные мочевины
Примеры производных мочевины включают фенотиазинил-(10)-карбонилпроизводное, N'-п-толуолсульфониламинокарбонил- и N'-фениламинотиокарбонилпроизводное.
Смешанные карбаматы
Примеры защитных групп смешанных карбаматов включают трет-амил, S-бензилтиокарбамат, п-цианобензил, циклобутил, циклогексил, циклопентил, циклопропилметил, п-децилоксибензил, диизопропилметил, 2,2-диметоксикарбонилвинил, o-(N,N-диметилкарбокарбоксамидо)бензил, 1, 1-диметил-3-(N,N-диметилкарбоксамидо)пропил, 1,1-диметилпропинил, ди(2-пиридил)метил, 2-фуранилметил, 2-йодэтил, изоборнил, изобутил, изоникотинил, п-(п'-метоксифенилазо)бензил, 1-метилциклобутил, 1-метилциклогексил, 1-метил-1-циклопропилметил, 1-метил-1-(3,5-диметоксифенил)этил, 1-метил-1-(п-фенилазофенил)этил, 1-метил-1-фенилэтил, 1-метил-1-(4-пиридил)этил, фенил, п-(фенилазо)бензил, 2,4,6-три-трет-бутилфенил, 4-(триметиламмоний)бензил и 2,4,6-триметилбензил.
Амиды, используемые для защиты -NH группы, включают следующие:
N-формил-, N-ацетил-, N-хлорацетил-, N-трихлорацетил-, N-трифторацетил-, N-фенилацетил-, N-3-фенилпропионил-, N-пиколиноиламиды, N-3-пиридилкарбоксамид, N-бензоилфенилаланил-амидпроизводное, N-бензоил-, N-п-фенилбензоиламиды.
Вспомогательное отщепление
Группами, требующими вспомогательного отщепления, являются N-o-нитрофенилацетил, N-o-нитрофеноксиацетил, N-ацетоацетил, (N'-дитиобензилоксикарбониламино)ацетил, N-3-(п-гидроксифенил)пропионил, N-3-(o-нитрофенил)пропионил, N-2-метил-2-(o-нитрофенокси)пропионил, N-2-метил-2-(o-фенилазофенокси)пропионил, N-4-хлорбутирил, N-3-метил-3-нитробутирил, N-o-нитроциннамоил, N-ацетилметионинпроизводное, N-o-нитробензоил, N-o-(бензоилоксиметил)бензоил и 4,5-дифенил-3-оксазолин-2-он.
Циклические производные имида
Циклическими производными имида, используемыми для защиты NH-группы, являются N-фталимид, N-дитиасукциноил, N-2,3-дифенилмалеоил, N-2,5-диметилпирролил, N-1,1,4, 4-тетраметилдисилилазациклопентановый аддукт, 5-замещенный 1,3-диметил-1,3,5-триазациклогексан-2-он, 5-замещенный 1,3-дибензил-1,3,5-триазациклогексан-2-он и 1-замещенный 3,5-динитро-4-пиридонил.
СПЕЦИАЛЬНЫЕ ГРУППЫ ДЛЯ ЗАЩИТЫ NH-
Примеры специальных защитных групп для NH-группы включают следующие.
N-Алкил- и N-ариламины:
N-метил-, N-аллил-, N-[2-(триметилсилил)этокси]метил, N-3-ацетоксипропил, N-(1-изопропил-4-нитро-2-оксо-3-пирролин-3-ил), четвертичные аммониевые соли, N-бензил, N-ди(4-метоксифенил)метил, N-5-дибензосуберил, N-трифенилметил, N-(4-метоксифенил)дифенилметил, N-9-фенилфлуоренил, N-2,7-дихлор-9-флуоренилметилен, N-ферроценилметил и N-2-пиколиламин N'-оксид.
Производные имина:
N-1,1-диметилтиометилен, N-бензилиден, N-п-метоксибензилиден, N-дифенилметилен, N-[(2-пиридил)мезитил]метилен и N-(N',N'-диметиламинометилен).
ЗАЩИТА КАРБОНИЛЬНОЙ ГРУППЫ
Ациклические ацетали и кетали
Примеры ациклических ацеталей и кеталей, используемых для защиты карбонильной группы, включают диметил-, бис(2,2,2-трихлорэтил)-, дибензил-, бис(2-нитробензил)- и диацетилацетали и -кетали.
Циклические ацетали и кетали
Примеры циклических ацеталей и кеталей, используемых для защиты карбонильной группы, включают 1,3-диоксаны, 5-метилен-1,3-диоксан, 5,5-дибром-1,3-диоксан, 5-(2-пиридил)-1,3-диоксан, 1,3-диоксоланы, 4-бромметил-1,3-диоксолан, 4-(3-бутенил)-1,3-диоксолан, 4-фенил-1,3-диоксолан, 4-(2-нитрофенил)-1,3-диоксолан, 4,5-диметоксиметил-1,3-диоксолан, O,O'-фенилендиокси- и 1,5-дигидро-3H-2,4-бензодиоксепин.
Ациклические дитиоацетали и -кетали
Примеры защитных групп ациклических дитиоацеталей и -кеталей, используемых для защиты карбонильной группы, включают S,S'-диметил, S,S'-диэтил, S,S'-дипропил, S,S'-дибутил, S,S'-дипентил, S,S'-дифенил, S,S'-дибензил и S,S'-диацетил.
Циклические дитиоацетали и -кетали
Примеры циклических дитиоацеталей и -кеталей включают 1, 3-дитиан, 1,3-дитиолан и 1,5-дигидро-3H-2,4-бензодитиепин.
Ациклические монотиоацетали и -кетали
Примеры защитных групп ациклических монотиоацеталей и -кеталей включают О-триметилсилил-S-алкил, O-метил-S-алкил или -S-фенил и O-метил-S-2-(метилтио)этил.
Циклические монотиоацетали и -кетали
Примеры защитных циклических монотиоацеталей и -кеталей включают 1,3-оксатиоланы.
СМЕШАННЫЕ ПРОИЗВОДНЫЕ
O-замещенные цианогидрины
Примеры защитных групп O-замещенных цианогидринов включают O-ацетил, О-триметилсилил, O-1-этоксиэтил и O-тетрагидропиранил.
Замещенные гидразоны
Примеры защитных групп замещенных гидразонов включают N, N-диметил и 2,4-динитрофенил.
Оксимпроизводные
Примеры оксимпроизводных включают O-метил-, O-бензил- и O-фенилтиометил-оксимпроизводные.
Имины
Замещенные метиленпроизводные, циклические производные
Примеры замещенных метилен- и циклических производных включают оксазолидины, 1-метил-2-(1'-гидроксиалкил)имидазолы, N, N'-диметилимидазолидины, 2,3-дигидро-1,3-бензотиазолы, диэтиламинные аддукты и комплекс метилалюминий-бис(2,6-ди-трет-бутил-4-метилфеноксид) (MAD).
ЗАЩИТА КАРБОКСИЛЬНОЙ ГРУППЫ
Эфиры
Замещенные сложные метиловые эфиры
Примеры защитных групп замещенных сложных метиловых эфиров, используемых для защиты карбоксильной группы, включают 9-флуоренилметил, метоксиметил, метилтиометил, тетрагидропиранил, тетрагидрофуранил, метоксиэтоксиметил, 2-(триметилсилил)этоксиметил, бензилоксиметил, фенацил, п-бромфенацил, α-метилфенацил, п-метоксифенацил, карбоксамидометил и N-фталимидометил.
2-Замещенные сложные этиловые эфиры
Примеры защитных групп 2-замещенных сложных этиловых эфиров включают 2,2,2-трихлорэтил, 2-галогенэтил, ω-хлоралкил, 2-(триметилсилил)этил, 2-метилтиоэтил, 1,3-дитианил-2-метил, 2-(п-нитрофенилсульфенил)этил, 2-(п-толуолсульфонил)этил, 2-(2'-пиридил)этил, 2-(дифенилфосфино)этил, 1-метил-1-фенилэтил, трет-бутил, циклопентил, циклогексил, аллил, 3-бутен-1-ил, 4-(триметилсилил)-2-бутен-1-ил, циннамил, α -метилциннамил, фенил, п-(метилмеркапто)фенил и бензил.
Замещенные сложные бензиловые эфиры
Примеры защитных групп замещенных сложных бензиловых эфиров включают трифенилметил, дифенилметил, бис(o-нитрофенил)метил, 9-антрилметил, 2-(9,10-диоксо)антрилметил, 5-дибензосуберил, 1-пиренилметил, 2-(трифторметил)-6-хромилметил, 2,4,6-триметилбензил, п-бромбензил, o-нитробензил, п-нитробензил, п-метоксибензил, 2,6-диметоксибензил, 4-(метилсульфинил)бензил, 4-сульфобензил, пиперонил, 4-пиколил и п-P-бензил.
Сложные силиловые эфиры
Примеры сложных силиловых эфиров включают триметилсилил, триэтилсилил, трет-бутилдиметилсилил, изопропилдиметилсилил, фенилдиметилсилил и ди-трет-бутилметилсилил.
Активированные сложные эфиры
Примеры активированных сложных эфиров включают тиолы.
Смешанные производные
Примеры смешанных производных включают оксазолы, 2-алкил-1, 3-оксазолины, 4-алкил-5-оксо-1,3-оксазолидины, 5-алкил-4-оксо-1,3-диоксоланы, сложные орто-эфиры, фенильную группу и комплекс пентаминокобальта (III).
Сложные станниловые эфиры
Примеры сложных станниловых эфиров включают триэтилстаннил и три-н-бутилстаннил.
АМИДЫ и ГИДРАЗИДЫ
Амиды
Примеры амидов включают N,N-диметил, пирролидинил-, пиперидинил-, 5,6-дигидрофенантридинил-, o-нитроанилиды, N-7-нитроиндолил-, N-8-нитро-1,2,3,4-тетрагидрохинолил- и п-P-бензолсульфонамиды.
Гидразиды
Примеры гидразидов включают N-фенил- и N,N'-диизопропилгидразиды.
С. Синтез
Соединения данного изобретения могут быть получены традиционными способами синтеза органической химии и по образцу или комбинированием способов, представленных ниже на схемах 1-10 и в примерах 1-31. Квалифицированный в данной области техники специалист сможет модифицировать и адаптировать основные принципы, приведенные в данном описании, для получения заявленных соединений.











D. Препараты и способы введения
Соединения данного изобретения ингибируют протеолитическую активность катепсина S человека и, следовательно, полезны в качестве лекарственного средства, в частности, для применения в способах лечения пациентов, страдающих расстройствами или состояниями, которые модулируются и регулируются ингибированием активности катепсина S.
Изобретение относится к способу лечения состояния, опосредованного катепсином S, и указанный способ включает введение субъекту терапевтически эффективного количества фармацевтической композиции, включающей соединение данного изобретения. Изобретение также относится к способу ингибирования активности катепсина S, причем способ включает введение субъекту терапевтически эффективного количества фармацевтической композиции, включающей соединение данного изобретения. Изобретение относится также к способу лечения аутоиммунного заболевания или способу ингибирования прогрессирования аутоиммунного заболевания у субъекта, причем указанный способ включает введение субъекту терапевтически эффективного количества фармацевтической композиции, включающей соединения данного изобретения. Аутоиммунное заболевание может представлять собой, например, волчанку, ревматоидный артрит или предпочтительно астму. Изобретение также относится к способу лечения или ингибирования прогрессирования отторжения тканевого трансплантата у субъекта, причем способ включает введение субъекту терапевтически эффективного количества фармацевтической композиции, включающей соединение данного изобретения. Введение может осуществляться до, во время и/или после трансплантации ткани.
Соединения данного изобретения оказывают ингибиторное воздействие на протеолитическую активность катепсина S человека, поэтому они могут вводиться в фармацевтические препараты, подходящие для различных способов применения. Для приготовления таких фармацевтических композиций эффективное количество конкретного соединения в форме основно- или кислотно-аддитивной соли в качестве активного ингредиента тщательно смешивается с фармацевтически приемлемым носителем.
Носитель может иметь самые разные формы, в зависимости от формы препарата для желаемого введения. Такие фармацевтические композиции представляют собой желательно лекарственную форму унифицированной дозы предпочтительно для перорального введения или парентеральной инъекции. Например, при приготовлении композиции в дозированной лекарственной форме для перорального введения может использоваться любая полезная фармацевтическая среда. Такая среда включает воду, гликоли, масла, спирты и т.п. в случае жидких препаратов для перорального введения, например, суспензий, сиропов, эликсиров и растворов, или твердые носители, например крахмалы, сахара, каолин, смазки, связующие вещества, дезинтеграторы и т.п., в случае порошков, пилюль, капсул и таблеток. Благодаря легкости введения таблетки и капсулы представляют собой наиболее предпочтительную лекарственную форму стандартной дозы, в которой обычно используются твердые фармацевтические носители. В композициях для парентерального введения носитель обычно включает стерильную воду, по меньшей мере, в большей части, хотя могут включаться и другие ингредиенты, например, для повышения растворимости. Могут приготавливаться растворы для инъекций, например растворы, в которых носитель включает раствор соли, раствор глюкозы или смесь раствора соли и раствора глюкозы. Могут также приготавливаться суспензии для инъекций, в которых могут применяться подходящие жидкие носители, суспендирующие агенты и т.п. В композициях, подходящих для чрескожного введения, носитель необязательно включает средство для повышения пенетрации и/или подходящий смачивающий агент необязательно в сочетании с небольшими количествами подходящих добавок любой природы, которые не оказывают значительного неблагоприятного воздействия на кожу. Такие добавки могут облегчать нанесение на кожу и/или способствовать получению желаемых композиций. Эти композиции могут вводиться различными способами, например в виде чрескожного пластыря, в виде бляшки, в виде мази. Кислотно-аддитивные соли соединений формулы I, благодаря их большей растворимости в воде по сравнению с соответствующей основной формой, более подходят для приготовления водных композиций.
Особенно преимущественно приготовление описанных выше фармацевтических композиций в виде лекарственной формы стандартной дозы для простоты введения и равномерной дозировки. Термин «лекарственная форма стандартной дозы», используемый в данном описании, относится к физически дискретным единичным дозам, подходящим для унифицированного дозирования, причем каждая единичная доза содержит предопределенное количество активного ингредиента, рассчитанного для получения желаемого терапевтического эффекта, в сочетании с необходимым фармацевтическим носителем. Примерами таких лекарственных форм стандартной дозы являются таблетки (включая таблетки без оболочек или покрытые оболочкой), капсулы, пилюли, расфасованные порошки, пластины, растворы или суспензии для инъекций, ложечки объема чайной ложки или столовой ложки и т.п., и их различные сочетания.
Фармацевтически приемлемые кислотно-аддитивные соли включают терапевтически активные нетоксичные кислотно-аддитивные солевые формы, которые могут образовывать соединения данного изобретения. Последние могут быть стандартно получены обработкой основной формы подходящей кислотой. Подходящие кислоты включают, например, неорганические кислоты, такие как галогенводородные кислоты, например соляная или бромистоводородная кислота; серная; азотная; фосфорная и т.п. кислоты, или органические кислоты, такие как, например, уксусная, пропановая, гидроксиуксусная, молочная, пировиноградная, щавелевая, малоновая, янтарная, малеиновая, фумаровая, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламиновая, салициловая, п-аминосалициловая, пальмоиновая (palmoic) и т.п. кислоты. Термин «аддитивная соль» включает также сольваты, которые также как и соли могут образовывать соединения данного изобретения. Примерами таких сольватов являются гидраты, алкоголяты и т.п. Обычно солевая форма может легко превращаться в форму свободного основания обработкой щелочью.
Стереоизомерная форма определяет все возможные изомерные формы, которыми могут обладать соединения формулы (I). Если не указано иначе, химическая структура соединений представляет смеси всех возможных стереохимически изомерных форм, причем указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры, то есть стереогенные центры могут иметь (R)- или (S)-конфигурацию; заместители на двухвалентных циклических насыщенных радикалах могут иметь цис- или транс-конфигурацию. Изобретение включает все стереохимические изомеры заявляемых соединений, включая диастереоизомеры, а также их смеси в любом соотношении. Заявляемые соединения могут также существовать в таутомерных формах. Подразумевается, что такие формы, хотя и явно не показаны на формулах, приведенных выше и приведенных далее, входят в область данного изобретения.
Квалифицированный специалист в области лечения заболеваний или состояний, проводимых ферментом катепсина S, легко сможет определить эффективное суточное количество из результатов испытаний, представленных ниже, и другой информации. Обычно предполагается, что терапевтически эффективная доза должна составлять от 0,001 мг/кг массы тела до 5 мг/кг массы тела, более предпочтительно от 0,01 мг/кг массы тела до 0,5 мг/кг массы тела. Можно делить терапевтически эффективную дозу на два, три, четыре или более приемов через соответствующие интервалы в течение дня. Указанные субдозы могут приготавливаться в виде стандартных дозированных форм, например, содержащих от 0,05 до 250 мг, в частности от 0,5 до 50 мг активного ингредиента в лекарственной форме стандартной дозы. Примеры включают стандартные лекарственные формы массой 2 мг, 4 мг, 7 мг, 10 мг, 15 мг, 25 мг и 35 мг. Соединения данного изобретения могут также приготавливаться в виде препаратов с высвобождением действующего вещества во времени, препаратов для подкожного введения или чрескожных пластырей. Соединения данного изобретения могут также вводиться в препарат в виде спрея или другие препараты для местного применения или для применения в виде ингаляций.
Квалифицированному специалисту хорошо известно, что точная доза и частота введения зависит от применяемого соединения формулы (I), состояния, подлежащего лечению, тяжести состояния, подлежащего лечению, возраста, массы тела и общего физического состояния данного пациента, а также другой лекарственной терапии, которую может принимать пациент. Кроме того, доказано, что указанное эффективное суточное количество может быть снижено или увеличено в зависимости от ответа пациента, подлежащего лечению, и/или в зависимости от оценки лечащим врачом описанных выше соединений данного изобретения. Таким образом, интервалы суточных эффективных количеств, укзанные в данном описании, являются только общими или примерными интервалами.
В следующем разделе представлена подробная информация, относящаяся к получению, идентификации и применению описанных соединений.
E. Примеры
ПРИМЕР 1

2-(1-{3-[5-Ацетил-3-(4-хлорфенил)-4,5,6, 7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-иламино)бензонитрил.
A. 1-[3-(4-Хлорфенил)-1,4,6,7-тетрагидропиразоло[4, 3-c]пиридин-5-ил]этанон
К раствору 50 г (0,35 моль) N-ацетил-4-пиперидона и 31 г (0,35 моль) морфолина в бензоле (350 мл) при перемешивании добавляют каталитическое количество (˜0,25 г) п-толуолсульфоновой кислоты. Смесь кипятят с обратным холодильником в течение 10 часов, используя ловушку Дина-Старка. Растворитель удаляют под пониженным давлением с получением коричневого масла. Сырой продукт разбавляют CH2Cl2 (175 мл) и добавляют 50,0 мл (0,35 моль) Et3N. Смесь охлаждают до 0°C и медленно в течение 1 часа с помощью капельной воронки добавляют раствор 45,0 мл (0,35 моль) хлорбензоилхлорида в CH2Cl2 (50 мл). Смеси дают нагреться до комнатной температуры и перемешивают ее в течение ночи. После этого реакционную смесь разбавляют 1 N HCl (150 мл) и энергично перемешивают в течение 3 часов. Водный слой экстрагируют CH2Cl2 (3×250 мл), объединенные экстракты сушат над Na2SO4 и растворитель удаляют под пониженным давлением. Неочищенное масло разбавляют EtOH (350 мл) и охлаждают до 0°C. К полученному раствору медленно добавляют 33,0 мл (1,06 моль) гидразина, смеси дают нагреться до комнатной температуры и перемешивают в течение ночи, в процессе чего образуется белый осадок. Объем реакционной смеси снижают до ˜150 мл и к полученному раствору добавляют EtOAc (750 мл). Суспензию энергично перемешивают в течение 2 часов, фильтруют, затем промывают EtOAc (2×200 мл) и сушат в вакууме с получением 41,4 г (42% после 3 стадий) твердого вещества бледно-желтого цвета. ТСХ (диоксид кремния, 5% MeOH/CH2Cl2): Rf=0,3. МС (электрораспыление), m/z: вычислено для C14H14 ClN3O [M+H] 276,08, найдено 276,0.1H ЯМР (400 МГц, CDCl3, смесь амидных ротамеров): 7,65 (д, J=8,4 Гц, 2H), 7,64 (д, J=9,3 Гц, 2H), 7,58 (д, J=10,5 Гц, 2H), 7,55 (д, J=8,5 Гц, 2H), 4,94 (с, 2H), 4,78 (с, 2H), 4,08 (т, J=5,9 Гц, 2H), 3,90 (т, J=5,8 Гц, 2H), 3,02 (т, J=5,8 Гц, 2H), 2,96 (т, J=5,9 Гц, 2H), 2,36 (с, 3H), 2,31 (с, 3H).
B. 1-[3-(4-Хлорфенил)-1-оксиранилметил-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон
К раствору 1,00 г (3,63 ммоль) 1-[3-(4-хлорфенил)-1,4,6,7-тетрагидропиразоло[4, 3-c]пиридин-5-ил]этанона и 2,85 мл (36,3 ммоль) эпихлоргидрина при перемешивании добавляют 1,30 г (3,99 ммоль) твердого Cs2CO3. Реакционную смесь перемешивают в течение 48 часов и растворитель удаляют под пониженным давлением. Затем остаток разбавляют H2O (50 мл) и EtOAc (50 мл). Слои разделяют, органический слой промывают H2O (25 мл) и насыщенным раствором соли (25 мл), сушат над Na2SO4 и растворитель удаляют под пониженным давлением. Очистка флэш-хроматографией (диоксид кремния, 0-15% ацетон/CH2Cl2) приводит к получению 0,72 г (60%) твердого белого вещества. ТСХ (диоксид кремния, 5% MeOH/CH2Cl2) : Rf=0,5. МС (электрораспыление); m/z: вычислено для C17H18ClN3O2 [M+H]+, 332,11; найдено 332,0.1H ЯМР (400 МГц, CDCl3, смесь амидных ротамеров): 7,60 (д, J=8,6 Гц, 2H), 7,54 (д, J=8,4 Гц, 2H), 7,40 (д, J=8,6 Гц, 2H), 7,36 (д, J=8,4 Гц, 2H), 4,80 и 4,73 (A и В из AB квартета, Jab=15,8 Гц, 2H), 4,60 (с, 2H), 4,47 (дд, J=15,3, 2,5 Гц, 1H), 4,42 (дд, J=15,0, 2,7 Гц, 1H), 4,11 (дд, J=5,3, 2,5 Гц, 1 H), 4,08 (дд, J=5,1, 3,3 Гц, 1 H), 3,99-3,85 (м, 2H), 3,73 (дт, J=5,9, 1,8 Гц, 2H), 3,37 (м, 2H), 2,87-2,80 (м, 3H), 2,80-2,69 (м, 3H), 2,53 (дд, J=4,7, 2,5 Гц, 1H), 2, 48 (дд, J=4,6, 2,6, 1H), 2,19 (с, 3H), 2,15 (с, 3H).
C. 1-{3-(4-Хлорфенил)-1-[3-(1,4-диокса-8-азаспиро[4,5]дец-8-ил)-2-гидроксипропил]-1,4,6,7-тетрагидропиразоло[4, 3-c]пиридин-5-ил}этанон
К раствору 3,20 г (9,64 ммоль) 1-[3-(4-хлорфенил)-1-оксиранилметил-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанона и 2,07 г (14,5 ммоль) 1, 4-диокса-8-азаспиро[4,5]декана в CH2Cl2 (65 мл) при перемешивании добавляют 1,79 г (2,89 ммоль) Yb(OTf)3˙H2O. Реакционную смесь перемешивают в течение ночи и сразу очищают флэш-хроматографией (диоксид кремния, 0-5% MeOH/CH2Cl2) с получением 3,70 г (81 %) указанного в заголовке соединения. ТСХ (диоксид кремния, 5% MeOH/CH2Cl2): Rf=0,35. МС (электрораспыление); m/z: вычислено для C24H81ClN4O4[M++H] 475,20, найдено 475,1.
D. 1-{3-[5-Ацетил-3-(4-хлорфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-он
Суспензию 0,50 г (0,96 ммоль) 1-{3-(4-хлорфенил)-1-[3-(1,4-диокса-8-азаспиро[4,5]дец-8-ил)-2-гидроксипропил]-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил}этанона в 1 N HCl (2,0 мл) нагревают до 65°C и выдерживают при этой температуре в герметично закрытой емкости в течение 48 часов. Реакционной смеси дают охладиться до комнатной температуры и разбавляют CHCl3 (20 мл) и насыщенным раствором NaHCO3 (20 мл). Водную фазу экстрагируют CHCl3 (2×10 мл), объединенные органические экстракты сушат над Na2SO4 и растворитель удаляют под пониженным давлением. После этого неочищенный остаток разбавляют Ac2O (3,0 мл) и перемешивают в течение 48 часов. Растворитель удаляют под пониженным давлением и неочищенный остаток выдерживают под пониженным давлением в течение ночи. Полученное твердое вещество растворяют в MeOH (5,0 мл), к смеси добавляют каталитическое количество (0,05 г) K2CO3 и перемешивание продолжают в течение ночи. После этого реакционную смесь разбавляют H2O (20 мл) и CH2Cl2 (20 мл) и слои разделяют. Водную фазу экстрагируют CH2Cl2 (2×10 мл), объединенные органические экстракты сушат над Na2SO4 и растворитель удаляют под пониженным давлением. Очистка флэш-хроматографией (диоксид кремния, 0-10% MeOH/CH2 Cl2 приводит к получению 0,29 г (65% после 3 стадий) твердого белого вещества. ТСХ (диоксид кремния, 5% MeOH/CH2Cl2): Rf=0,35. МС (электрораспыление); m/z: вычислено для C22H27ClN4O5 [M+H]+ 431,18; найдено 431,1.1H ЯМР (400 МГц, CDCl3, смесь амидных ротамеров): 7,59 (д, J=8,3 Гц, 1H), 7,53 (д, J=8,6 Гц, 1H), 7,41 (д, J=8,5 Гц, 1H), 7,37 (д, J=8,5 Гц, 1H), 4,85 и 4,73 (A и В из AB квартета, Jab=15,8 Гц, 1H), 4,62 (с, 1H), 4,26-4,12 (м, 2H), 4,09-3,68 (м, 4H), 3,49 (с, 1,5H), 3,28 (с, 1,5H).
E. 2-(1-{3-[5-Ацетил-3-(4-хлорфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-иламино)бензонитрил
К раствору 50,0 мг (116,0 мкмоль) 5-1-{3-[5-ацетил-3-(4-хлорфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-она и 9,6 мг (82,5 мкмоль) 2-аминобензонитрила в AcOH (0,5 мл) при перемешивании добавляют 130,0 мг (917,0 мкмоль) Na2SO4 и реакционную смесь перемешивают в течение 1 часа. К полученной смеси добавляют 58,0 мг (275,0 мкмоль) NaBH(OAc)3иреакционную смесь перемешивают в течение 48 часов. Смесь разбавляют CH2Cl2 (20 мл) и насыщенным раствором NaHCO3 (20 мл). Водную фазу экстрагируют CH2Cl2 (2×10 мл), объединенные органические экстракты сушат над Na2SO4ирастворитель удаляют под пониженным давлением. Очистка флэш-хроматографией (диоксид кремния, 0-5% MeOH/CH2Cl2) приводит к получению 9,0 мг (20%) твердого белого вещества. ТСХ (диоксид кремния, 5% MeOH/CH2Cl2): Rf=0,2. МС (электрораспыление); m/z: вычислено для C29 H33ClN6O2 [M+H]+ 533,24; найдено 533,3.1Н ЯМР (400 МГц, CDCl3, смесь амидных ротамеров): 7,58 (д, J=8,6 Гц, 1H), 7,52 (д, J=8,4 Гц, 1H), 7,43-7,34 (м, 4H), 6,69 (дт, J=7,6, 4,0 Гц, 1H), 6,64 (д, J=8,6 Гц, 1H), 4,83 и 4,73 (A и В из AB квартета, Jab=15,7 Гц, 1H), 4,61 (с, 1H), 4,44 (д, J=7,3 Гц, 1H), 4,33-4,14 (м, 2Н), 4, 11-3,84 (м, 2Н), 3,83-3,67 (м, 1H), 3,55-3,43 (м, 1Н), 3,17-2,94 (м, 1Н), 2,93-2,75 (м, 2Н), 2,74-2,54 (м, 2H), 2,21 (с, 1,5H), 2,16 (с, 1,5H), 2,23-1,53 (м, 9Н).
ПРИМЕР 2

1-(1-{3-[5-Ацетил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-он.
A. 1-[3-(4-Трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон
Раствор N-ацетил-4-пиперидона (2,82 г, 20 ммоль), морфолина (1,93 мл, 22 ммоль) и п-толуолсульфоновой кислоты (5 мг) в бензоле (8,5 мл) кипятят в аппарате Дина-Старка с обратным холодильником в течение 8 часов. Растворитель удаляют и остаток растворяют в CH2Cl2 (20 мл). Добавляют триэтиламин (3,1 мл) и к полученному раствору по каплям при 0оС добавляют п-трифторметилбензоилхлорид (3,27 мл, 22 ммоль) в CH2Cl2 (4 мл). Реакционную смесь перемешивают при 25°C в течение 24 часов и разбавляют водной HCl (5%, 25 мл). После перемешивания в течение дополнительных 30 минут органический слой отделяют, промывают H2O (20 мл), сушат (Na2SO4) и концентрируют. Остаток растворяют в EtOH (95%, 18 мл) и обрабатывают при 0°C гидразином (2,9 мл, 60 ммоль). Смесь перемешивают при 25°C в течение 3 часов и добавляют H2O (4 мл). Большую часть летучих веществ удаляют и остаток экстрагируют CH2Cl2 (50 мл). Органический слой отделяют, промывают H2O (20 мл), сушат над Na2SO4 и концентрируют. Колоночная хроматография (диоксид кремния, 5% MeOH/CH2Cl2) приводит к получению 5,1 г (83%) продукта в виде белого порошка. ТСХ (диоксид кремния, 10% MeOH/CH2Cl2): Rf=0,30. МС (электрораспыление); m/z:вычислено для C15H14F3N3O [M+Na]+ 309,1; найдено 332,0.1H ЯМР (CDCl3 , 400 МГц, смесь двух ротамеров): 7,73-7,67 (м, 4H), 4,85 (с, 1,2H), 4,68 (с, 0,8H), 3,96 (т, J=4,5 Гц, 0,8H), 3,78 (т, J=4,5 Гц, 1,2H), 2,89 (т, J=4,5 Гц, 1,2H), 2,83 (т, J=4,5 Гц, 0,8H), 2,23 (с, 1, 8H), 2,18 (с, 1,2H).
B. 1-[1-Оксиранилметил-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон
Раствор 1-[3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанона (2,4 г, 7,77 ммоль) в ДМФА (15 мл) обрабатывают карбонатом цезия (5,05 г, 15,5 ммоль) и эпихлоргидрином (6,1 мл, 77,7 ммоль) при 25°C и перемешивают в течение 24 часов, затем разбавляют его EtOAc (100 мл) и H2O (50 мл). Органический слой отделяют, промывают H2O (2×50 мл), насыщенным раствором соли (50 мл), сушат над Na2SO4 и концентрируют. Колоночная хроматография (диоксид кремния, 10% ацетон/CH2Cl2) приводит к получению 2,30 г (81%) продукта в виде белого порошка. ТСХ (диоксид кремния, 10% MeOH/CH2Cl2): Rf=0,35. МС (электрораспыление); m/z: вычислено для C18H18 F3N3O3[M+Na]+ 365,1; найдено 388,0.1H ЯМР (CDCl3, 400 МГц, смесь двух ротамеров): 7,77 и 7,63 (AB-система, Jab=8,2 Гц, 2H), 7,71 и 7,67 (AB-система, Jab=8,4 Гц, 2H), 4,82 и 4,76 (AB-система, Jab=15,5 Гц, 1,2H), 4,58 (с, 0,8H), 4,45-4,35 (м, 1H), 4,08-4,02 (м, 1H), 3,92-3,80 (м, 1H), 3,70-3,63 (м, 1H), 3,30 (м, 1H), 2,80-2,67 (м, 3H), 2,48-2,42 (м, 1H), 2,13 (с, 1,3H), 2,08 (с, 1,7H).
C. 1-(1-{3-[5-Ацетил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин)-1,3-дигидробензимидазол-2-он
Раствор 1-[1-оксиранилметил-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанона (1,17 г, 3,2 ммоль) в ДМФА (10 мл) обрабатывают трифлатом иттербия (III) (0,4 г, 0,64 ммоль) и 4-(2-кето-1-бензимидазолинил)пиперидином (1,04 г, 4,8 ммоль) при 25°C и перемешивают в течение 48 часов, затем разбавляют CH2Cl2 (100 мл) и H2O (50 мл). Органический слой отделяют, промывают H2O (2×50 мл), сушат над Na2SO4 и концентрируют. Колоночная флэш-хроматография (диоксид кремния, 5% MeOH/CH2Cl2)приводит к получению 1,71 г (92%) продукта в виде белого порошка. ТСХ (диоксид кремния, 10% MeOH/CH2Cl2): Rf=0,25. МС (электрораспыление); m/z: вычислено для C30H33F3N6O3 [M+H]+582,3; найдено 583,5.1H ЯМР (CDCl3, 400 МГц, смесь двух ротамеров): 9,30 (уш.с, 0,5H), 9,25 (уш.с, 0,5H), 7,82 и 7,68 (AB-система, Jab=8,2 Гц, 2H), 7,76 и 7,72 (AB-система, Jab=8,4 Гц, 2H), 7,25-7,05 (м, 4H), 4,92 и 4,80 (AB-система, Jab=15,6 Гц, 1,1H), 4,70 (с, 0,9H), 4,40-3,70 (м, 7H), 3,20-2,82 (м, 4H), 2,60-2,45 (м, 4H), 2,35-2,25 (м, 1H), 2,25 (с, 1,5H), 2,20 (с, 1,5H), 1,90-1,87 (м, 2H).
ПРИМЕР 3

3-(1-{3-[5-Ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-3H-бензоксазол-2-он.
A. 1-[3-(4-Бромфенил)-1,4,6, 7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон
В колбу, снабженную ловушкой Дина-Старка, загружают N-ацетил-4-пиперидон (100,1 г, 709 ммоль), пиперидин (68 мл, 779 ммоль), п-TsOH (3,7 г) и бензол (500 мл). Смесь нагревают до 125°C и выдерживают при этой температуре в течение 17 часов. Смеси дают охладиться и делят ее на две части. К раствору енамина (˜355 ммоль) в CH2Cl2 (320 мл), охлажденному до 0оС, по каплям в течение 15 часов добавляют раствор п-бромбензоилхлорида (70,0 г, 319 ммоль) в CH2Cl2(400 мл). После этого смеси дают нагреться до 23°C и перемешивают ее в течение дополнительных 5 часов. Раствор обрабатывают 1 N HCl (500 мл) и энергично перемешивают в течение 1,5 часов. Слои разделяют и водный слой экстрагируют CH2Cl2 (2×300 мл). Объединенные экстракты промывают насыщенным водным раствором NaHCO3 (300 мл), H2O (300 мл), насыщенным раствором соли (300 мл), сушат над Na2SO4 и концентрируют. Остаток растворяют в MeOH (300 мл) и обрабатывают NH2NH2 (50,0 мл, 1,59 моль). Смесь перемешивают в течение 17 часов, образующийся осадок собирают фильтрованием и сушат на воздухе с получением 52 г (50%) указанного в заголовке соединения, которое используют без дополнительной очистки. ТСХ (диоксид кремния, 5% MeOH/CH2Cl2): Rf=0,3. МС (электрораспыление); m/z: вычислено для C14H1579BrN3O [M+H]+, 320,04, найдено 320.1H ЯМР (CD3OD/CDCl3, 400 МГц, смесь амидных ротамеров): 7,53 и 7,35 (A и В из AA'BB', J=8,5 Гц, 2H), 7,51 и 7,39 (A и В из AA'BB', J=8,6 Гц, 2H), 4,72 (с, 2H), 4,58 (с, 2H), 3,85 (т, J=5,9 Гц, 2H), 3,71 (т, J=5,8 Гц, 2H), 2,81, (т, J=5,8 Гц, 2H), 2,74, (т, J=5,8 Гц, 2H), 2,16 (с, 3H), 2,11 (с, 3H).
B. 1-[3-(4-Бромфенил)-1-оксиранилметил-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон
К раствору 1-[3-(4-бромфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанона (7,59 г, 23,7 ммоль) и эпихлоргидрина (20 мл, 234 ммоль) в ДМФА (100 мл) добавляют Cs2CO3 (11,58 г, 35,5 ммоль). Смесь перемешивают в течение 18 часов, затем разбавляют EtOAc (800 мл) и промывают насыщенным раствором водным раствором NaHCO3 (2×100 мл), H2O (2×100 мл) и насыщенным раствором соли (100 мл). Слой раствора NaHCO3 экстрагируют EtOAc (2×150 мл). Объединенные водные фракции экстрагируют EtOAc (2×100 мл). Объединенные экстракты сушат над Na2SO4 и концентрируют. Колоночная хроматография (диоксид кремния, 10-20% ацетон/CH2Cl2) приводит к получению 4,98 г (56%) указанного в заголовке соединения. ВЭЖХ, tR=4,90 мин (условия хроматографии с обращенной фазой: HP 1100 LCMS, колонка Phenomenex luna 2,1×150 мм, элюирование: от 60% MeOH/H2O(0,5% AcOH) до 90%MeOH/H2O(0,5% AcOH), поддерживают начальные условия в течение 2 минут, затем в течение 5 минут переходят к конечным условиям). МС (электрораспыление); m/z: вычислено для C17H1979BrN3O2, [M+H]+ 376,07, найдено 376,0.1H ЯМР (CDCl3, 400 МГц, смесь амидных ротамеров): 7,47 (d с тонким расщеплением, J=8,5 Гц, 2H), 7,44 (м, 4H), 7,38 (d с тонким расщеплением, J=8,5 Гц, 2H), 4,71 и 4,64 (A и В из AB квартета, Jab=15,7 Гц, 2H), 4,51 (с, 2H), 4,39 (дд, J=15,1, 2,5 Гц, 1H), 4,34 (дд, J=15,0, 2,9 Гц, 1H), 4,02 (дд, J=5,2, 3,9 Гц, 1H), 3,98 (дд, J=5,3, 3,7 Гц, 1H), 3,83 (м, 2H), 3,64 (м, 2H), 3,25 (уш. м, 2H), 2,80-2,60 (м, 6H), 2,46 (дд, J=4,6, 2,6 Гц, 1H), 2,38 (дд, J=4,6, 2,6 Гц, 1H), 2,10 (с, 3H), 2,06 (с, 3H).
C. трет-Бутиловый эфир 4-(2-оксобензоксазол-3-ил)пиперидин-1-карбоновой кислоты
К раствору 1,00 г (5,01 ммоль) трет-бутил-4-оксо-1-пиперидинкарбоксилата и 0,55 г (5,01 ммоль) 2-аминофенола в CH2Cl2 (15 мл) под атмосферой азота при комнатной температуре с перемешиванием добавляют одной порцией 1,62 г (7,52 ммоль) NaBH(OAc)3 и смесь перемешивают в течение 14 часов. Смесь разбавляют CH2Cl2 (50 мл) и насыщенным раствором NaHCO3 (75 мл) и слои разделяют. Водный слой экстрагируют CH2Cl2 (2×25 мл) и объединенные органические фракции промывают насыщенным раствором соли, сушат над Na2SO4 и растворитель удаляют под пониженным давлением. Неочищенный твердый продукт разбавляют CH2Cl2(15 мл), одной порцией добавляют 0,89 г (5,51 ммоль) карбонилдиимидазола и смесь перемешивают в течение 16 часов. Смесь разбавляют CH2 Cl2 (50 мл) и 1 N HCl (50 мл) и слои разделяют. Водный слой экстрагируют CH2Cl2 (2×25 мл) и объединенные органические фракции промывают насыщенным раствором соли, сушат над Na2SO4 и растворитель удаляют под пониженным давлением. Очистка остатка флэш-хроматографией (диоксид кремния, 0-5% ацетон/CH2Cl2) приводит к получению 1,59 г (99%) продукта в виде твердого белого вещества. ТСХ (диоксид кремния, 5% ацетон/CH2C2): Rf=0,6. МС (электрораспыление); m/z: вычислено для C17H22N2O4, [M+Na]+ 341,1, найдено 341,1.
D. 3-Пиперидин-4-ил-3H-бензоксазол-2-он
К раствору 1,00 г (2,87 ммоль) трет-бутилового эфира 4-(2-оксобензоксазол-3-ил)пиперидин-1-карбоновой кислоты в CH2Cl2(6,0 мл) при перемешивании добавляют ТФУК (6,0 мл) и смесь перемешивают в течение 12 часов. Растворители удаляют под пониженным давлением и неочищенный твердый продукт растворяют в MeOH (10 мл), к полученной смеси добавляют насыщенный раствор NaHCO3 (15 мл) и перемешивание продолжают в течение 10 минут. Раствор разбавляют CH2Cl2 (30 мл) и слои разделяют. Водную фазу экстрагируют CH2Cl2 (2×20 мл). Органические фракции объединяют, сушат над Na2SO4 и растворитель удаляют под пониженным давлением с получением 1,02 г (88%) продукта в виде твердого вещества бледно-желтого цвета. ТСХ (диоксид кремния, 10% MeOH/CH2Cl2): Rf=0,1. МС (электрораспыление); m/z: вычислено для C12H14N2O2, [M+H] 219,11, найдено 219,1.
E. 3-(1-{3-[5-Ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-3H-бензоксазол-2-он
К 0,025 г (0,066 ммоль) 3-пиперидин-4-ил-3H-бензоксазол-2-она и 0,015 г (0,066 ммоль) 1-[3-(4-бромфенил)-1-оксиранилметил-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанона в EtOH (0,5 мл) добавляют 0,01 мл (0,066 ммоль) Et3N. Смесь нагревают до 80°C в герметично закрытой емкости и выдерживают в этих условиях в течение 16 часов. Реакционную смесь охлаждают и растворитель удаляют под пониженным давлением. Очистка остатка флэш-хроматографией (диоксид кремния, 0-5% MeOH/CH2Cl2)приводит к получению 0,030 г (79%) продукта в виде белой пены. ТСХ (диоксид кремния, 5% MeOH/CH2Cl2): Rf=0,4. МС (электрораспыление); m/z: вычислено для C29H32BrN5O4 [M+H]+ 594,16; найдено 594,2.1H ЯМР (400 МГц, CDCl3, смесь амидных ротамеров): 7,60-7,43 (м, 4H), 7,23-7,06 (м, 4H), 4,83 и 4,73 (A и В из AB квартета, Jab =15,4 Гц, 1H), 4,61 (с, 1H), 4,38-3,66 (м, 7H), 3,37-3,02 (м, 2H), 2,99-2,28 (м, 6H), 2,21 (с, 1,5H), 2,16 (с, 1,5H), 1,99-1,83 (м, 3H).
ПРИМЕР 4
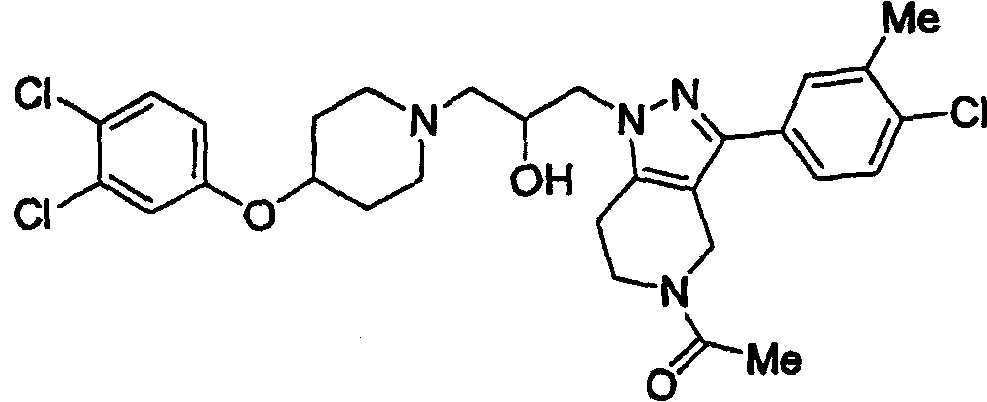
1-(3-(4-Хлор-3-метилфенил)-1-{3-[4-(3,4-дихлорфенокси)пиперидин-1-ил]пропил}-1,4,6, 7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон.
A. 1-[3-(4-Хлор-3-метилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон
К раствору 1-ацетил-4-пиперидона (3 г, 0,021 моль) и морфолина (1,86 г, 0,21 моль) в бензоле (21 мл) при перемешивании добавляют каталитическое количество (˜0,015 г) п-толуолсульфоновой кислоты. Смесь кипятят с обратным холодильником в течение 10 часов с использованием ловушки Дина-Старка. Растворитель удаляют под пониженным давлением с получением коричневого масла. Сырой продукт разбавляют CH2Cl2 (10,5 мл) и добавляют Et3N (3,0 мл, 0,021 моль). Смесь охлаждают до 0°C и медленно в течение часа с помощью капельной воронки добавляют раствор 3-метил-4-хлорбензоилхлорида (2,7 мл, 0,021 моль) в CH2Cl2 (3,0 мл). Смеси дают нагреться до комнатной температуры и перемешивают в течение ночи. После этого реакционную смесь разбавляют 1 N HCl (9,0 мл) и энергично перемешивают в течение 3 часов. Водный слой экстрагируют CH2Cl2 (3×15 мл). Объединенные экстракты сушат над Na2SO4 и растворитель удаляют под пониженным давлением. Неочищенное масло разбавляют EtOH (21 мл) и смесь охлаждают до 0°C. К полученному раствору медленно добавляют гидразин (2,0 мл, 0,064 моль), смеси дают нагреться до комнатной температуры и перемешивают в течение ночи, в процессе чего образуется белый осадок. Объем реакционной смеси уменьшают до ˜9 мл и добавляют EtOAc (45 мл). Суспензию энергично перемешивают в течение 2 часов, затем фильтруют, промывают EtOAc (2×12 мл) и сушат в вакууме с получением 4,93 г (81% после 3 стадий) продукта в виде твердого вещества бледно-желтого цвета. ТСХ (диоксид кремния, 10% ацетон/CH2Cl2): Rf=0,2. МС (электрораспыление); вычислено: точное значение массы для C15H16ClN3O 289,10; найдено 290,1 [M++H].
B. 1-[3-(4-Хлор-3-метилфенил)-1-оксиранилметил-1,4,6,7-тетрагидропиразоло[4, 3-c]пиридин-5-ил]этанон
К раствору 1-[3-(4-хлор-3-метилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанона (4,9 г, 16,9 ммоль) в ДМФА (49 мл) добавляют Cs2 CO3 (11 г, 33,8 ммоль) и полученную смесь перемешивают в течение 15 минут. Добавляют эпихлоргидрин (13,2 мл, 169 ммоль) и смесь перемешивают под атмосферой N2 при комнатной температуре в течение 16 часов. К реакционной смеси добавляют EtOAc (250 мл) и полученную смесь перемешивают в течение 5 минут. Полученный раствор промывают водой (2×50 мл) и насыщенным раствором соли (1×50 мл). Органические экстракты сушат над Na2SO4 и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния, 10-20% ацетон/CH2 Cl2) с получением 3,8 г (65%) продукта в виде твердого белого вещества. ТСХ (диоксид кремния, 10% ацетон/CH2Cl2): Rf=0,3. МС (электрораспыление); вычислено: точное значение массы для C18H20ClN3O2345,12; найдено: 346,1 [M++H], 368,0 [M++Na].
C. Трифторацетат 4-(3,4-дихлорфенокси)пиперидиния
Суспензию 0,69 г (20,0 ммоль) трифенилфосфина (на полимерной основе, 3 ммоль P/г) в CH2Cl2 (4,0 мл) перемешивают в течение 15 минут до разбухания смолы. К полученной суспензии добавляют 0,20 г (1,00 ммоль) 1-трет-бутоксикарбонил-4-пиперидинола, 0,16 г (1,00 ммоль) 3,4-дихлорфенола и 0,35 г (1,50 ммоль) ди-трет-бутилазодикарбоксилата. Реакционную смесь перемешивают в течение 4 часов, фильтруют и смолу промывают 5% MeOH/CH2Cl2 (2×20 мл) и Et2O (20 мл). Органические фракции объединяют и растворитель удаляют. Неочищенное масло разбавляют CH2Cl2 (2,0 мл) и ТФУК (2,0 мл) и смесь перемешивают в течение ночи. Растворитель удаляют под пониженным давлением с получением неочищенной ТФУ-соли, которую используют без дополнительной очистки. ТСХ (диоксид кремния, 10% MeOH/CH2Cl2): Rf=0,1. МС (электрораспыление); m/z: вычислено для C11H13Cl2NO [M+H]+, 246,04, найдено 246,1.
D. 1-(3-(4-Хлор-3-метилфенил)-1-{3-[4-(3,4-дихлорфенокси)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон
К раствору 25,0 мг (0,066 ммоль) 1-[3-(4-хлор-3-метилфенил)-1-оксиранилметил-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанона и 25,0 мг (0,10 ммоль) трифторацетата 4-(3,4-дихлорфенокси)пиперидиния в EtOH (0,5 мл) при перемешивании добавляют 0,019 мл (0,014 ммоль) Et3N. Смесь нагревают до 80°C в герметично закрытом сосуде и выдерживают в этих условиях в течение 16 часов. Реакционную смесь охлаждают и растворитель удаляют под пониженным давлением. Очистка остатка флэш-хроматографией (0-5% MeOH/CH2Cl2) приводит к получению 28 мг (74%) продукта в виде пены бледно-желтого цвета. ТСХ (диоксид кремния, 5% MeOH/CH2Cl2): Rf=0,5. МС (электрораспыление); m/z: вычислено для C29H33Cl3N4 O3 [M+H]+591,16; найдено 591,2.1 H ЯМР (400 МГц, CDCl3, смесь амидных ротамеров): 7,51 (д, J=6,9 Гц, 1H), 7,41-7,29 (м, 3H), 6,99 (д, J=2,9 Гц, 1H), 6,74 (дд, J=9,0, 3,1 Гц, 1H), 4,82 и 4,73 (A и В из AB квартет, J=15,7 Гц, 1H), 4,60 (с, 1H), 4,46-3,93 (м, 4H), 3,92-3,83 (м, 1H), 3,82-3,68 (м, 1H), 3,08-2,51 (м, 6H), 2,43 (с, 1,5H), 2,41 (с, 1,5H), 2, 21 (с, 1,5H), 2,15 (с, 1,5H) 2,00-1,83 (м, 3H), 1,75-1,39 (м, 4H).
ПРИМЕР 5

1-(3-(4-Хлор-3-метилфенил)-1-{3-[4-(2,3-дигидроиндол-1-ил)пиперидин-1-ил]-2-гидроксипропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон.
A. 1-Пиперидин-4-ил-2,3-дигидро-1H-индол
Индолин (11,0 г, 92 ммоль) и N-BOC-4-пиперидон (18,4 г, 92 ммоль) при перемешивании при комнатной температуре добавляют в 300 мл CH2 Cl2 под атмосферой азота. Затем добавляют уксусную кислоту (5,5 мл, 96 ммоль). Спустя 1,5 часа добавляют триацетоксиборогидрид натрия (27,4 г, 129 ммоль) и смесь перемешивают в течение 4 дней. Реакционную смесь гасят медленным добавлением насыщенного раствора NaHCO3. Органическую часть отделяют, сушат (MgSO4) и растворитель удаляют под пониженным давлением с получением 28 г (100%) прозрачной темно-зеленой жидкости. Неочищенный продукт переносят в смесь 1:1 ТФУК/CH2Cl2(100 мл) и перемешивают при комнатной температуре. Спустя 45 минут растворитель удаляют под пониженным давлением, масло переносят в EtOAc и охлаждают на ледяной бане с получением бежевого осадка. Осадок фильтруют, промывают Et2O и сушат на воздухе с получением 22,5 г (57%) твердого белого вещества в форме ТФУ-соли. МС (электрораспыление); вычислено: точное значение массы для C13H18N2 202,15; найдено m/z 203,2.1H ЯМР (400 МГц, ДМСО-d6): 8,74 (уш.с, 1H), 8,46 (уш.с, 1H), 7,07 (м, 2H), 6,63 (м, 2H), 3,81 (уш.с, 1H), 3,46 (м, 2H), 3,37 (м, 2H), 3,12 (м, 2H), 2,95 (м, 2H), 1,86 (м, 4H).
B. 1-(3-(4-Хлор-3-метилфенил-1-{3-[4-(2,3-дигидроиндол-1-ил)пиперидин-1-ил]-2-гидроксипропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон
1-Пиперидин-4-ил-2,3-дигидро-1H-индол (ТФУ соль) (506 мг, 1,18 ммоль) и 1-[3-(4-хлор-3-метилфенил)-1-оксиранилметил-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон (261 мг, 0,75 ммоль) при перемешивании добавляют в 20 мл EtOH, нагревают до 80°C и выдерживают при этой температуре в течение 20 часов. Смесь охлаждают, упаривают, переносят в EtOAc и промывают насыщенным раствором NaHCO3. Органическую часть сушат (MgSO4) и выпаривают с получением прозрачного масла золотистого цвета. Очистка флэш-хроматографией (диоксид кремния, 100% ацетон) приводит к получению 260 мг (63%) продукта в виде твердого белого вещества. ТСХ (диоксид кремния, 100% ацетон): Rf=0,10. МС (электрораспыление); вычислено: точное значение массы для C31 H28ClN5O2 547,27; найдено m/z 548,3.1H ЯМР (400 МГц, CDCl3): 7,64 (м, 1H), 7,43 (м, 2H), 7,16 (м, 2H), 6,72 (с, 1H), 6,50 (м, 1H), 4,88 (м, 1H), 4,73 (с, 1H), 4,28 (м, 2H), 4,13 (м, 2H), 3,92 (м, 2H), 3,47 (м, 3H), 30,9 (м, 6H), 2,55 (м, 6H), 2,27 (м, 3H), 1,84 (м, 4H).
ПРИМЕР 6

(S)-1-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-6-хлор-1,3-дигидробензимидазол-2-он
А. (R)-1-[3-(4-Хлор-3-метилфенил)-1-(2,3-дигидроксипропил)-1,4,6, 7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон
Раствор KHMDS (0,5 M, 8,4 мл, 4,1 ммоль) добавляют к раствору 1-[3-(4-хлор-3-метилфенил)-1,4,6,7-тетрагидропиразоло[4, 3-c]пиридин-5-ил]этанона (1,01 г, 3,49 ммоль) в ДМФА (8,5 мл). Смесь перемешивают в течение 1 часа, затем добавляют (2R)-1-трет-бутилдиметилсилилглицидол (1,97 г, 10,5 ммоль). Смесь перемешивают в течение 17 часов, затем распределяют между EtOAc (500 мл) и насыщенным водным раствором NaHCO3 (100 мл). Этилацетатный слой промывают H2O (3×100 мл) и насыщенным раствором соли (100 мл). Объединенные водные фракции экстрагируют EtOAc (2×100 мл). Объединенные экстракты сушат над Na2SO4 и концентрируют. Остаток растворяют в MeOH (50 мл) и обрабатывают CSA (171 мг). Полученную смесь перемешивают в течение 24 часов, затем выпаривают досуха. Остаток разбавляют EtOAc (300 мл), промывают NaHCO3 (100 мл), сушат над Na2 SO4 и концентрируют. Очистка остатка флэш-хроматографией (диоксид кремния, 5-10% MeOH/CH2Cl2) приводит к получению 652 мг (50%) нерацемического диола. ТСХ (диоксид кремния, 10% MeOH/CH2Cl2): Rf=0,2. МС (электрораспыление); m/z: вычислено для C18H2335ClN3O3 ([M+H]+ 364,14; найдено 364,1).
B. (R)-1-[3-(4-Хлор-3-метилфенил)-1-оксиранилметил-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон
( R)-1-[3-(4-Хлор-3-метилфенил)-1-(2,3-дигидроксипропил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон (452 мг, 1,24 ммоль) и п-толуолсульфонат пиридиния (85 мг) объединяют в MeC(OMe)3 (50 мл) и обрабатывают ультразвуком. Смесь перемешивают в течение 17 часов, концентрируют и остаток растворяют в CH2Cl2 (8 мл). Раствор охлаждают до 0° C и обрабатывают AcBr (0,15 мл, 2,0 ммоль). Спустя 5 часов смесь распределяют между EtOAc (300 мл) и насыщенным водным раствором NaHCO3(75 мл). Этилацетатный слой промывают H2O (75 мл) и насыщенным раствором соли (75 мл), сушат над Na2SO4 и концентрируют. Остаток объединяют с K2CO3 (243 мг, 1,84 ммоль) в MeOH (50 мл) и перемешивают в течение 3 часов, затем снова обрабатывают, как описано выше. Очистка колоночной хроматографией (диоксид кремния, 10-40% ацетон/CH2Cl2) приводит к получению 159 мг (37%) указанного в заголовке соединения. Анализ хиральной ВЭЖХ (Daicel OD, 0,5% Et2NH/MeOH) показывает оптическую чистоту >95%. ВЭЖХ (с обращенной фазой): tR=4,97 мин. МС (электрораспыление): точное значение массы вычислено для C18H20ClN3O2 [M++Na] 368,11; найдено 368,05.1H ЯМР (CDCl3, 400 МГц, смесь амидных ротамеров): 7,54 (уш.д, J=6,3 Гц, 2H), 7,41-7,35 (м, 3H), 7,29 (дд, J=8,2, 1,9 Гц, 1H), 4,81 и 4,74 (A и В из AB квартета, J=15,7 Гц, 2H), 4,60 (с, 2H), 4,48 (дд, J=15,2, 2,4 Гц, 1H), 4,42 (дд, J=15,4, 2,8 Гц, 1H), 4,13 (т, J=4,7 Гц, 1H), 4,09 (дд, J=4,6 Гц, 1H), 3,93 (м, 2H), 3,74 (т, J=5,8 Гц, 1H), 3,73 (т, J=5,8 Гц, 1H), 3,34 (м, 2H), 2,85-2,75 (м, 6H), 2,53 (дд, J=4,6, 2,5 Гц, 1H), 2,48 (дд, J=4,6, 2,6 Гц, 1H), 2,43 (с, 3H), 2,41 (с, 3H), 2,20 (с, 3H), 2,15 (с, 3H).
C. Этиловый эфир 4-(5-хлор-2-нитрофениламино)пиперидин-1-карбоновой кислоты
К раствору 2,03 г (11,6 ммоль) 4-хлор-2-фторнитробензола в ДМФА (12,0 мл) при комнатной температуре добавляют 2,00 г (11,6 ммоль) этил-4-амино-1-пиперидинкарбоксилата. В течение 30 минут образуется желтый осадок, реакционную смесь дополнительно разбавляют ДМФА (12,0 мл) и CH2Cl2 (5,0 мл), помещают в вибрационный аппарат со скоростью вращения 300 об/мин и выдерживают в течение ночи. Растворитель удаляют под пониженным давлением и полученное твердое вещество сушат в вакууме. Неочищенный продукт очищают флэш-хроматографией (диоксид кремния, 0-5% МеОН/СН2Cl2) с получением 2,83 г (81%) указанного в заголовке соединения. ТСХ (диоксид кремния, 5% MeOH/CH2Cl2): Rf=0,4. МС (электрораспыление); m/z: вычислено для C14H18ClN3O4 [M++H] 350,09, найдено 350,0.1H ЯМР (400 МГц, CDCl3): 8,13 (видимый д, J=9,1 Гц, 2H), 6,84 (д, J=2,0 Гц, 1H), 6,62 (дд, J=9,4, 2,3 Гц, 1H), 4,15 (кв, J=14,9, 7,3 Гц, 2H), 4,08 (уш.д, J=12,4 Гц, 2H), 3,70-3,58 (м, 1H), 3,17-3,05 (м, 2H), 2,07 (уш.дд, J=13,1, 3,1 Гц, 2H), 1,63-1,50 (м, 2H), 1, 28 (т, J=7,0 Гц, 3H).
D. Этиловый эфир 4-(6-хлор-2-оксо-2,3-дигидробензимидазол-1-ил)пиперидин-1-карбоновой кислоты
К раствору 0,50 г (1,52 ммоль) этилового эфира 4-(5-хлор-2-нитрофениламино)пиперидин-1-карбоновой кислоты в EtOH (15,0 мл) при перемешивании добавляют концентрированную HCl (3,0 мл) и затем 0,99 г (15,2 ммоль) порошкообразного цинка. Спустя 1 час добавляют дополнительное количество концентрированной HCl (1,5 мл) и 0,99 г (15,2 ммоль) порошкообразного цинка и реакционную смесь перемешивают в течение 1,5 часа. Смесь фильтруют через целит и промывают 5% MeOH/CH2Cl2. Смесь разбавляют насыщенным раствором NaHCO3с образованием осадка. Слои разделяют и водную фазу экстрагируют (3×5% MeOH/CH2Cl2). Объединенные органические фракции сушат над Na2SO4 и растворитель удаляют под пониженным давлением с получением коричневого масла. К неочищенному маслу добавляют CH2Cl2 (15,0 мл) и 0,64 мл (4,56 ммоль) Et3N, затем 0,45 г (1,52 ммоль) трифосгена. Реакционную смесь перемешивают в течение ночи, затем разбавляют 1 N NaOH (20 мл) и дополнительно перемешивают в течение 1 часа. Слои разделяют и водную фазу экстрагируют CH2Cl2 (3×20 мл). Объединенные органические экстракты сушат над Na2SO4, растворитель удаляют под пониженным давлением. Очистка флэш-хроматографией (диоксид кремния, 0-5% MeOH/CH2Cl2) приводит к получению 0,33 г (67% после двух стадий) указанного в заголовке соединения. ТСХ (диоксид кремния, 5%MeOH/CH2Cl2): Rf=0,5. МС (электрораспыление); m/z: вычислено для C15H18ClN3O3 [M++Na] 346,10; найдено 346,0.1H ЯМР (400 МГц, CDCl3): 9,41 (с, 1H), 7,11 (д, J=2,0 Гц, 1H), 7,04 (д, J=1,8 Гц, 1H), 7,02 (с, 1H), 4,48-4,33 (м, 3H), 4,20 (кв, J=7,1 Гц, 2H), 2,92 (т, J=12,5 Гц, 2H), 2,30 (дкв, J=12,9, 4,6 Гц, 2H), 2,10 (д, J=12,6 Гц, 2H), 1,31 (т, J=7,1 Гц, 3H).
E. 6-Хлор-1-пиперидин-4-ил-1,3-дигидробензимидазол-2-он
Суспензию 0,20 г (0,62 ммоль) этилового эфира 4-(6-хлор-2-оксо-2,3-дигидробензимидазол-1-ил)пиперидин-1-карбоновой кислоты в 10% NaOH (0,62 мл) нагревают до 105°C в течение 6 часов и затем охлаждают. Значение рН раствора доводят до 1 (концентрированной HCl) и затем снова до 10 (NaOH). После этого смесь разбавляют 5% MeOH/CH2Cl2(˜30 мл) до тех пор, пока оба слоя не станут прозрачными. Слои разделяют и водную фазу экстрагируют 5% MeOH/CH2Cl2(2×30 мл). Объединенные органические фазы сушат над Na2SO4 и растворитель удаляют под пониженным давлением с получением 0,12 г (76%) продукта в виде твердого вещества светло-коричневого цвета. ТСХ (диоксид кремния, 10%MeOH/CH2Cl2): Rf=0,1. МС (электрораспыление); m/z: вычислено для C12H14ClN3O [M++H] 252,08; найдено 252,1.1H ЯМР (400 МГц, CDCl3): 7,27 (д, J=1,6 Гц, 2H), 7,02 (д, J=1,6 Гц, 1H), 7,01 (с, 1H), 4,38 (м, 1H), 3,30 (уш.д, J=11,9 Гц, 2H), 2,82 (дт, J=12,3, 2,0 Гц, 2H ), 2, 35 (дкв, J=12,3, 3,5 Гц, 2H), 1,85 (уш.дд, J=12,1, 2,1 Гц, 2H).
F.(S)-1-(1-(3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропилпиперидин-4-ил)-6-хлор-1,3-дигидробензимидазол-2-он
(R)-1-[3-(4-Хлор-3-метилфенил)-1-оксиранилметил-1,4,6,7-тетрагидропиразоло[4, 3-c]пиридин-5-ил]этанон (31 мг, 0,10 ммоль) и 6-хлор-1-пиперидин-4-ил-1,3-дигидробензимидазол-2-он (36 мг, 0,17 ммоль) при перемешивании добавляют в EtOH (0,3 мл), нагревают до 70°C и выдерживают при этой температуре в течение 18 часов. Смеси дают охладиться, разбавляют CH2Cl2и очищают препаративной ТСХ (диоксид кремния, 8% MeOH/CH2Cl2) с получением 7 мг (12%) указанного в заголовке соединения. ВЭЖХ (с обращенной фазой): tR=3,49 мин. МС (электрораспыление); m/z: вычислено для C30H3535Cl2N6O3[M++H] 597,22, найдено 597,20.1H ЯМР (CDCl3, 400 МГц, смесь амидных ротамеров): 9,16 (уш.д, J=10,1 Гц, 1H), 7,55 (уш.м, 1H), 7,40-7,28 (м, 2H), 7,18 (уш.с, 1H), 7,03 и 6,98 (A и В из ABX (с тонким расщеплением), Jab=8,4 Гц, 2H), 4,85 и 4,74 (A и В из ABX (с тонким расщеплением), Jab=15,7 Гц, 1H), 4,62 (с, 1H), 4,29-4,18 (м, 4H), 4,09-4,00 (м, 2H), 3,91-3,71 (м, 2H), 3,16-2,78 (м, 4H), 2,55-2,50 (м, 4H), 2,43 (с, 1,5H), 2,41 (с, 1,5H), 2,23 (м, 1H), 2,21 (с, 1,5H), 2,16 (с, 1,5H), 1,84 (уш.с, 2H).
ПРИМЕР 7

1-(1-{3-[5-Ацетил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-3-(2-морфолин-4-илэтил)-1,3-дигидробензимидазол-2-он
Раствор 1-(1-{3-[5-ацетил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-она (130 мг, 0,22 ммоль) в ДМФА (1 мл) обрабатывают карбонатом цезия (146 мг, 0,45 ммоль) и 4-(2-хлорэтил)морфолином гидрохлоридом (329 мг, 2,2 ммоль) при 25°C и перемешивают в течение 24 часов, затем раствор разбавляют EtOAc (10 мл) и H2O (5 мл). Органический слой отделяют, промывают H2O (2×5 мл), сушат над Na2SO4 и концентрируют. Очистка колоночной хроматографией (диоксид кремния, 5% MeOH/CH2Cl2) приводит к получению 124 мг (81%) белого порошка. ТСХ (10% MeOH/CH2Cl2): Rf=0,31. МС (электрораспыление); m/z: вычислено для C36H44F3N7O4[M+H]+695,3; найдено 696,3.1H ЯМР (CDCl3, 400 МГц, смесь двух ротамеров): 7,82 и 7,65 (AB-система, Jab=8,2 Гц, 2H), 7,74 и 7,68 (AB-система, Jab=8,4 Гц, 2H), 7,23-7,05 (м, 4Н), 4,92 и 4,80 (AB-система, Jab=15,6 Гц, 1,2H), 4,69 (с, 0,8H), 4,38-4,00 (м, 5H), 4,02 (т, J=7,0 Гц, 2H), 3,92-3,70 (м, 2H), 3,70 (т, J=4,5 Гц, 4H), 3,15-2,80 (м, 4Н), 2,70 (т, J=7,1 Гц, 2H), 2,60-2,20 (м, 9H), 2,24 (с, 1,6H), 2,18 (с, 1,4H), 1,85-1,75 (м, 2Н).
ПРИМЕР 8

1-(1-{3-[3-(4-Бромфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-6-хлор-1,3-дигидробензимидазол-2-он
A. трет-Бутиловый эфир 3-(4-бромфенил)-1,4,6,7-тетрагидропиразоло[4, 3-c]пиридин-5-карбоновой кислоты
К раствору 500,0 г (2,51 моль) 1-трет-бутоксикарбонил-4-пиперидона и 87,1 г (2,76 моль) морфолина в бензоле (1,25 л) при перемешивании добавляют каталитическое количество (˜0,25 г) п-TsOH. Смесь кипятят с обратным холодильником в течение 36 часов с использовании ловушки Дина-Старка. Растворитель удаляют под пониженным давлением с получением коричневого масла, которое затвердевает. Неочищенный продукт разделяют и 335,0 г (1,25 моль) енамина разбавляют CH2Cl2 (1,25 л) и добавляют 175,0 мл (1,25 моль) Et3N. Смесь охлаждают до 0°C и медленно в течение часа с помощью капельной воронки добавляют раствор 275,0 г (1,25 моль) 4-бромбензоилхлорида в CH2Cl2 (150 мл), смеси дают нагреться до комнатной температуры и перемешивают в течение ночи. После этого реакционную смесь разбавляют 1 N HCl (450 мл) и энергично перемешивают в течение 3 часов. Водный слой экстрагируют CH2Cl2 (3×500 мл), объединенные экстракты сушат над Na2SO4 и растворитель удаляют под пониженным давлением. Неочищенное масло разбавляют EtOH (850 мл) и охлаждают до 0°C. К полученному раствору медленно добавляют 120,0 г (3,75 моль) гидразина, смеси дают нагреться до комнатной температуры и перемешивают в течение ночи, в процессе чего образуется белый осадок. Объем реакционной смеси снижают до ˜350 мл и к смеси добавляют EtOAc (1,50 л). Суспензию энергично перемешивают в течение 2 часов и фильтруют, затем промывают EtOAc (2×500 мл) и сушат в вакууме с получением 309,0 г (62% после 3 стадий) продукта в виде твердого белого вещества. ТСХ (диоксид кремния, 5% MeOH/CH2Cl2): Rf=0,3. МС (электрораспыление); m/z: вычислено для C17H20BrN3O2 [M++H] 378,07, найдено 378,0.1H ЯМР (400 МГц, CDCl3): 7,65-7,26 (м, 4H), 4,64 (уш.с, 2H), 3,84-3,68 (уш.м, 2H), 2,87-2,74 (уш.м, 2H), 1,48 (уш.с, 9H).
B. Трифторацетат 3-(4-бромфенил)-4,5,6,7-тетрагидро-1H-пиразоло[4,3-c]пиридиния
К раствору 10,0 г (26,4 ммоль) трет-бутилового эфира 3-(4-бромфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты в CH2Cl2(26,0 мл) при перемешивании добавляют 26,0 мл ТФУК. Полученную смесь перемешивают в течение ночи. Растворитель удаляют под пониженным давлением и твердый продукт сушат в вакууме. Высушенный твердый продукт суспендируют в Et2O, энергично перемешивают в течение 2 часов, затем фильтруют и сушат в вакууме с получением 10,1 г продукта в виде твердого белого вещества, которое используют без дополнительной очистки. ТСХ (диоксид кремния, 10% MeOH/CH2Cl2): Rf=0,05. МС (электрораспыление); m/z: вычислено для C12H12BrN3[M++H] 278,02; найдено 278,0.
C. 3-(4-Бромфенил)-5-метансульфонил-4,5,6,7-тетрагидро-1-H пиразоло[4,3-c]пиридин
К раствору 3,11 г (11,1 ммоль) трифторацетата 3-(4-бромфенил)-4,5,6,7-тетрагидро-1H-пиразоло[4,3-c]пиридиния и 4,71 мл (33,5 ммоль) E3N в ДМФА (55 мл) при перемешивании медленно добавляют 1,21 мл (15,6 ммоль) метансульфонилхлорида. Спустя 2,5 часа растворитель удаляют под пониженным давлением и остаток разбавляют CH2Cl2 (100 мл) и насыщенным раствором NaHCO3 (100 мл). Слои разделяют и водную фазу экстрагируют CH2Cl2 (2×30 мл). Объединенные органические фракции сушат над Na2SO4 и растворитель удаляют под пониженным давлением. Очистка колоночной хроматографией (диоксид кремния, 0-5% MeOH/CH2Cl2) приводит к получению 2,01 г (50%) указанного в заголовке соединения. ТСХ (диоксид кремния, 5% MeOH/CH2Cl2): Rf=0,3. МС (электрораспыление); m/z: вычислено для C13H14BrN3O3S [M++H] 356,00; найдено 356,0.
D. 3-(4-Бромфенил)-5-метансульфонил-1-оксиранилметил-4,5,6,7-тетрагидро-1H-пиразоло[4,3-c]пиридин
К раствору 2,50 г (7,00 ммоль) 3-(4-бромфенил)-5-метансульфонил-4,5,6,7-тетрагидро-1H-пиразоло[4,3-c]пиридина и 5,52 мл (70,0 ммоль) эпихлоргидрина при перемешивании добавляют 2,50 г (7,72 ммоль) твердого Cs2CO3.Реакционную смесь перемешивают в течение 48 часов и растворитель удаляют под пониженным давлением. Затем остаток разбавляют H2O (150 мл) и EtOAc (150 мл). Слои разделяют, органический слой промывают H2O (50 мл) и насыщенным раствором соли (50 мл), сушат над Na2SO4 и растворитель удаляют под пониженным давлением. Очистка флэш-хроматографией (диоксид кремния, 0-20% ацетон/CH2Cl2) приводит к получению 1,52 г (53%) продукта в виде твердого белого вещества. ТСХ (диоксид кремния, 5% MeOH/CH2 Cl2): Rf=0,5. МС (электрораспыление); m/z: вычислено для C16H18BrN3O3S [M++H] 412,03, найдено 412,0.1H ЯМР (400 МГц, CDCl3): 7,54 и 7,47 (A и В из AA'BB', J=8,6 Гц, 4H), 4,56-4,45 (м, 3H), 4,10 (дд, J=15,1, 5,4 Гц, 1H), 3,73-3,58 (м, 2H), 3,38-3,32 (м, 1H), 2,96-2,87 (м, 2H), 2,86 (с, 3H), 2,83 (дд, J=4,4, 4,2 Гц, 1H), 2,48 (дд, J=4,6, 2,6 Гц, 1H).
E. 1-(1-{3-[3-(4-Бромфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-6-хлор-1,3-дигидробензимидазол-2-он
Раствор 25,0 мг (0,061 ммоль) 3-(4-бромфенил)-5-метансульфонил-1-оксиранилметил-4,5,6, 7-тетрагидро-1H-пиразоло[4,3-c]пиридина и 19,0 мг (0,073 ммоль) 6-хлор-1-пиперидин-4-ил-1,3-дигидробензимидазол-2-она в EtOH (0,5 мл) нагревают до 80°C в герметично закрытой емкости и выдерживают в этих условиях в течение 16 часов. Реакционную смесь охлаждают и растворитель удаляют под пониженным давлением. Неочищенный продукт очищают колоночной хроматографией (диоксид кремния, 0-5% MeOH/CH2Cl2) с получением 0,025 г (63%) указанного в заголовке соединения. ТСХ (диоксид кремния, 5% MeOH/CH2Cl2): Rf=0,4. МС (электрораспыление); m/z: вычислено для C28H32BrClN6O4S (M+H] 663,11; найдено 663,0.1H ЯМР (400 МГц, CDCl3): 10,2 (с, 1H), 7,52 и 7, 46 (A и В из AA'BB', J=8,6 Гц, 4H), 7,15 (уш.д, J=1,5 Гц, 1H), 7,04-6,95 (м, 2H), 4,52 и 4,49 (A и В из AB квартета, Jab=14,5 Гц, 2H), 4,33-4,14 (м, 3H), 4,07-3,97 (м, 1H), 3,74-3,58 (м, 2H), 3,17-2,89 (м, 4H), 2,86 (с, 3H), 2,57-2,30 (м, 5H), 2,20 (т, J=11,1 Гц, 1H), 1,87-1,73 (м, 2H).
ПРИМЕР 9

[3-(1-{3-[5-Метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-2-оксо-2, 3-дигидробензимидазол-1-ил]ацетонитрил
A. трет-Бутиловый эфир 3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
К раствору 500 г (2,51 моль) 1-трет-бутоксикарбонил-4-пиперидона и 87,1 г (2,76 моль) морфолина в бензоле (1,25 л) при перемешивании добавляют каталитическое количество (˜0,25 г) п-TsOH. Смесь кипятят с обратным холодильником в течение 36 часов с использованием ловушки Дина-Старка. Половину растворителя удаляют под пониженным давлением и полученный раствор охлаждают и фильтруют. Фильтрат концентрируют с получением 630 г (94%) оранжево-красного масла. 320 г енамина (1,19 моль) разбавляют CH2Cl2 (1,0 л) и добавляют 165,0 мл (1,19 моль) Et3N. Смесь охлаждают до 0°C и медленно в течение часа с помощью капельной воронки добавляют раствор 225 г (1,08 моль) 4-трифторметилбензоилхлорида в CH2Cl2 (0,5 л). Смеси дают нагреться до комнатной температуры и перемешивают в течение ночи. После этого реакционную смесь разбавляют 1 N HCl (450 мл) и энергично перемешивают в течение 3 часов. Водный слой экстрагируют CH2Cl2 (3×500 мл), объединенные экстракты сушат над Na2SO4 и растворитель удаляют под пониженным давлением. Неочищенное масло разбавляют EtOH (1 л) и охлаждают до 0°C. К полученному раствору медленно добавляют 115 г (3,57 моль) гидразина, смеси дают нагреться до комнатной температуры и перемешивают, в процессе чего образуется белый осадок. Объем реакционной смеси снижают до ˜500 мл и смесь охлаждают. Осадок собирают с получением 285 г (72% из расчета на енамин) продукта в виде твердого белого вещества.1H ЯМР (400 МГц, CDCl3): 7,63-7,55 (м, 4H), 4,58 (уш.с, 2H), 3,69-3,62 (уш.м, 2H), 2,74-2,68 (уш.м, 2H), 1,47 (с, 9H).
B. трет-Бутиловый эфир 1-(2-метоксикарбонилэтил)-3-(4-трифторметилфенил-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
трет-Бутиловый эфир 3-(4-трифторметилфенил)-1,4,6, 7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты (1,85 г, 5,04 ммоль) и метилакрилат (0,50 мл, 5,6 ммоль) объединяют в толуоле (30 мл) и нагревают до 75°C. Полученную смесь обрабатывают t-BuONa (100 мг) и продолжают нагревание в течение 48 часов. Смеси дают охладиться и распределяют ее между EtOAc (300 мл) и NaHCO3 (75 мл). Водный слой экстрагируют EtOAc (3×75 мл). Объединенные экстракты сушат над Na2SO4 и концентрируют. Очистка колоночной хроматографией (диоксид кремния, 30-60% EtOAc/гексаны) приводит к получению 343 мг (15%) указанного в заголовке соединения. ТСХ (диоксид кремния, 50% EtOAc/гексаны): Rf=0,4. МС (электрораспыление); m/z: вычислено для C22H27F3N3O4 [M++H] 454,20, найдено 454,1. 1H ЯМР (CDCl3, 400 МГц): 7,75 (уш.д, J=8,1 Гц, 2H), 7,64 (уш.с, 2H), 4,63 (уш.с, 2H), 4,30 (т, J=6,6 Гц, 2H), 3,75 (уш.с, 2H), 3,68 (с, 3H), 2,98 (т, J=6,6 Гц, 2H), 2,79 (уш.т, J=5,6 Гц, 2H), 1,48 (с, 9H).
C. трет-Бутиловый эфир 1-(3-гидроксипропил)-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4, 3-c]пиридин-5-карбоновой кислоты
Раствор LiBH4 (26 мг, 1,2 ммоль) в ТГФ (0,5 мл) добавляют к раствору трет-бутилового эфира 1-(2-метоксикарбонилэтил)-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты (317 мг, 0,70 ммоль) в ТГФ (4,0 мл), охлажденному до 0оС. Смесь перемешивают в течение 5 минут, затем добавляют дополнительное количество LiBH4 (15 мг) и перемешивание продолжают в течение 17 часов. Смесь распределяют между EtOAc (80 мл) и насыщенным водным раствором NaHCO3 (20 мл). Водный слой экстрагируют EtOAc (2×20 мл). Объединенные экстракты сушат над Na2SO4 и концентрируют. Очистка колоночной хроматографией (диоксид кремния, 0-8% MeOH/CH2Cl2) приводит к получению 268 мг (95%) указанного в заголовке соединения. ВЭЖХ (с обращенной фазой): tR=6,82 мин. МС (электрораспыление); m/z: вычислено для C21H26F3N3O3 [M++Na] 448,18, найдено 448,10.1H ЯМР (CDCl3, 400 МГц): 7,73 (уш.д, J=8,2 Гц, 2H), 7,65 (уш.с, 2H), 4,64 (уш.с, 2H), 4,21 (т, J=6,4 Гц, 2H), 3,76 (уш.с, 2H), 3,66 (т, J=5,7 Гц, 2H), 2,73 (уш.т, J=5,4 Гц, 2H), 2,04 (кв, J=6,1, 2H), 1,48 (с, 9H).
D. трет-Бутиловый эфир 4-(2-оксо-2,3-дигидробензимидазол-1-ил)пиперидин-1-карбоновой кислоты
1-Пиперидин-4-ил-1,3-дигидробензимидазол-2-он (7,24 г, 34,1 ммоль) и ди-трет-бутилкарбонат (9,12 г, 41,0 ммоль) объединяют в ДМФА (80 мл), смесь нагревают до 40°C под атмосферой N2 и выдерживают в этих условиях в течение 17 часов. Смеси дают охладиться, разбавляют ее EtOAc (800 мл), промывают насыщенным водным раствором NaHCO3 (150 мл), H2O (3×150 мл) и насыщенным раствором соли (150 мл). Объединенные водные фазы экстрагируют EtOAc (2×150 мл). Объединенные экстракты сушат над Na2SO4 и концентрируют с получением 12,4 г указанного в заголовке соединения. ТСХ (диоксид кремния, 50% EtOAc/гексаны): Rf=0,3. МС (электрораспыление); m/z: вычислено для C17H23N3O3[M++Na] 340,16; найдено 340,1.1H ЯМР (CDCl3, 400 МГц): 10,59 (с, 1H), 7,15-7,11 (м, 2H), 7,08-7,02 (м, 2H), 4,49 (тт, J=8,4, 4,0 Гц, 1H), 4,32 (уш.с, 2H), 2,89 (уш.т, J=11,6, 2H), 2,34 (дкв, J=12,6, 4,4 Гц, 2H), 1,83 (уш.д, J=10,5 Гц, 2H), 1,36 (с, 9H).
E. (2-Оксо-3-пиперидин-4-ил-2,3-дигидробензимидазол-1-ил)ацетонитрил
Раствор трет-бутилового эфира 4-(2-оксо-2, 3-дигидробензимидазол-1-ил)пиперидин-1-карбоновой кислоты (2,91 г, 9,16 ммоль) в ТГФ (10 мл) по каплям добавляют к раствору KHMDS (2,19 г, 11,0 ммоль) в ТГФ (20 мл). Смесь перемешивают в течение 10 минут, затем добавляют бромацетонитрил (3,2 мл, 46 ммоль). Полученную смесь перемешивают в течение 4 часов, затем распределяют между EtOAc (750 мл) и насыщенным водным раствором NaHCO3 (200 мл). Слой EtOAc промывают H2O (3×200 мл) и насыщенным раствором соли (200 мл). Объединенные водные фазы экстрагируют EtOAc (2×150 мл). Объединенные экстракты сушат над Na2SO4 и концентрируют. Очистка колоночной хроматографией (диоксид кремния, 20-60% EtOAc/гексаны) приводит к получению 2,20 г (67%) трет-бутилового эфира 4-(3-цианометил-2-оксо-2, 3-дигидробензимидазол-1-ил)пиперидин-1-карбоновой кислоты. Очищенный продукт растворяют в CH2Cl2 (40 мл) и разбавляют ТФУК (25 мл). Полученную смесь перемешивают в течение 1 часа, затем разбавляют CH2Cl2 (250 мл) и промывают 1 N NaOH (100 мл). Водный слой экстрагируют CH2Cl2 (2×100 мл). Объединенные экстракты сушат над Na2SO4 и концентрируют с получением 1,59 г (95%) указанного в заголовке соединения, которое может использоваться далее без дополнительной очистки. ТСХ (диоксид кремния, 5% MeOH/CH2Cl2): Rf=0,1. МС (электрораспыление); m/z: вычислено для C14H17N4O [M++H] 257,14, найдено 257,1.1H ЯМР (CDCl3, 400 Гц): 7,33-7,29 (м, 1H), 7,17-7,02 (м, 3H), 4,75 (с, 2H), 4,41 (тт, J=12,2, 4,4 Гц, 1H), 3,28 (уш.д, J=9,8 Гц, 2H), 3,11 (уш.с, 1H), 2,80 (т, J=10,0 Гц, 2H), 2,37 (дкв, J=12,5, 4,2 Гц, 2H), 1,83 (уш.д, J=11,8 Гц, 2H).
F. [3-(1-{3-[5-Метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-2-оксо-2, 3-дигидробензоимидазол-1-ил]ацетонитрил
трет-Бутиловый эфир 1-(3-гидроксипропил)-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты (268 мг, 0, 63 ммоль) растворяют в CH2Cl2 (10 мл) и ТФУК (10 мл). Смесь перемешивают в течение 1 часа и выпаривают досуха. Остаток растворяют в CH2Cl2 (4,0 мл), охлаждают до 0°C и обрабатывают изо-Pr2NEt (0,36 мл, 2,1 ммоль), затем метансульфонилхлоридом (0,16 мл, 2,1 ммоль). Реакционную смесь перемешивают в течение 4 часов, затем разбавляют EtOAc (200 мл) и промывают насыщенным водным раствором NaHCO3 (2×25 мл). Водные фазы экстрагируют EtOAc (2×25 мл). Объединенные экстракты сушат над Na2SO4 и концентрируют. Часть неочищенного мезилата (197 мг, ˜0,41 ммоль) объединяют с (2-оксо-3-пиперидин-4-ил-2,3-дигидробензимидазол-1-ил)ацетонитрилом (321 мг, 1,25 ммоль) в CH2Cl2 (2,0 мл) и ДМФА (0,5 мл). Полученную смесь обрабатывают изо-Pr2NEt (0,22 мл, 1,3 ммоль) и перемешивают в течение 60 часов. Реакционную смесь распределяют между EtOAc (150 мл) и насыщенным водным раствором NaHCO3 (75 мл). Этилацетатный слой промывают H2O (2×75 мл) и насыщенным раствором соли (75 мл). Объединенные водные фазы экстрагируют EtOAc (3×50 мл). Объединенные экстракты сушат над Na2SO4 и концентрируют. Очистка остатка препаративной ТСХ (диоксид кремния, 1% MeOH/CH2Cl2, затем 25% ацетон/CH2Cl2) приводит к получению 37 мг (14%) указанного в заголовке соединения. ВЭЖХ (с обращенной фазой): tR=2,94 мин. МС (электрораспыление); m/z: вычислено для C31H35F3N7O3S [M++H] 642,25, найдено 642,25.1H ЯМР (CDCl3, 400 МГц): 7,73 и 7,76 (A и В из AA'BB', Jab=8,2 Гц, 4H), 7,26-7,05 (м, 4H), 4,81 (с, 2H), 4,56 (с, 2H), 4,26 (м, 1H), 4,15 (т, J=6,8 Гц, 2H), 3,70 (т, J=5,8 Гц, 2H), 3,03 (уш.д, J=11,1 Гц, 2H), 2,95 (т, J=5,7 Гц, 2H), 2,91 (с, 3H), 2,43 (м, 4H), 2,12 (м, 4H), 1,82 (уш.д, J=9,9 Гц, 2H).
ПРИМЕР 10
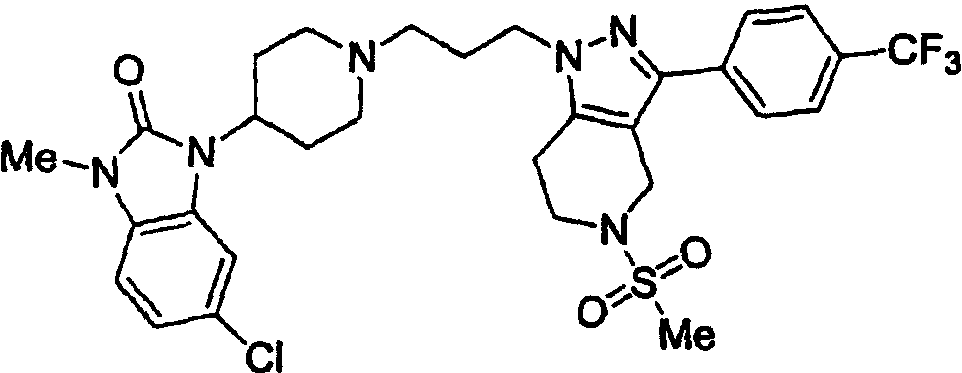
5-Хлор-3-(1-{3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1-метил-1,3-дигидробензимидазол-2-он
A. 1-Метансульфонилпиперидин-4-он
К раствору 4-пиперидона моногидрата гидрохлорида (90 г, 586 ммоль) в хлороформе (300 мл) и воде (300 мл) добавляют карбонат калия (324 г, 2340 ммоль). Суспензию охлаждают до 0°C и обрабатывают метилсульфонилхлоридом (136 мл, 1760 ммоль), добавляя его по каплям в течение 1 часа. Реакционную смесь обрабатывают на вибраторе в течение 72 часов и распределяют между CH2Cl2(500 мл) и насыщенным водным раствором NaHCO3 (500 мл). Водный слой экстрагируют CH2Cl2 (3× 200 мл). Органический слой промывают 1% KHSO4 (250 мл), сушат (Na2SO4) и концентрируют с получением 90,5 г (87%) продукта в виде твердого белого вещества. ВЭЖХ (с обращенной фазой): tR=2,19 мин. МС (электрораспыление); вычислено: точное значение массы для C6H11NO3S 177,1; m/z найдено 178,1 [M+H]+.1H ЯМР (400 МГц, CDCl3): 3,60 (т, J=6,5 Гц, 4H), 2,89 (с, 3H), 2,59 (т, J=6,3 Гц, 4H).
B. 5-Метансульфонил-3-(4-трифторметилфенил)-4,5,6, 7-тетрагидро-1H-пиразоло[4,3-c]пиридин
К раствору 1-метансульфонилпиперидин-4-она (50,0 г, 282 ммоль) в бензоле (282 мл) добавляют п-толуолсульфоновую кислоту (1,34 г, 7,0 ммоль) и морфолин (25,83 мл, 296 ммоль). Реакционную смесь кипятят с обратным холодильником с использованием ловушки Дина-Старка в течение 15 часов. Реакционную смесь охлаждают и концентрируют в вакууме с получением енамина, который используют без дополнительной очистки. Енамин растворяют в CH2Cl2 (200 мл) и охлаждают до 0°C. К полученному раствору добавляют триэтиламин (47, 2 мл, 339 ммоль), затем по каплям 4-трифторметилбензоилхлорид (42,3 мл, 285 ммоль) в CH2Cl2 (82 мл). Реакционной смеси дают нагреться до комнатной температуры и перемешивают в течение 20 часов. Реакционную смесь промывают 1 N HCl (250 мл), слой CH2Cl2 отделяют, сушат (Na2SO4) и концентрируют. Полученное масло переносят в этанол (300 мл) и обрабатывают гидразином (44,3 мл, 1,41 моль) при 0°C. Реакционной смеси дают нагреться до комнатной температуры и перемешивают в течение 24 часов. Смесь концентрируют и полученное твердое вещество фильтруют, промывают этанолом и сушат в вакууме с получением 70 г (72%) 5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидро-1H-пиразоло[4,3-c]пиридина в виде твердого белого вещества. ВЭЖХ (с обращенной фазой): tR=6,33 мин. МС (электрораспыление); вычислено: точное значение массы для C14H14F3N3O2S 345,0; m/z найдено 346,0 [M+H]+.1H ЯМР (400 МГц, CDCl3): 7,72 (с, 4H), 4,58 (с, 2H), 3,69 (т, J=5,7 Гц, 2H), 2,99 (т, J=5,7 Гц, 2H), 2,92 (с, 3H).
C. 3-[5-Метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропан-1-ол
К раствору 5-метансульфонил-3-(4-трифторметилфенил)-4,5,6, 7-тетрагидро-1H-пиразоло[4,3-c]пиридина (29,8 г, 86,3 ммоль) в безводном ДМФА (70 мл) добавляют Cs2CO3 (33,74 г, 103,5 ммоль) и перемешивают полученную смесь в течение 25 минут. Добавляют 3-бром-1-пропанол (8,6 мл, 13,2 г, 94,9 ммоль) и смесь перемешивают под атмосферой N2 при комнатной температуре в течение 18 часов. Добавляют воду (500 мл) и перемешивают в течение 5 минут. Образующийся осадок отфильтровывают, промывают водой (4×100 мл) и сушат вымораживанием. Неочищенный продукт (31,0 г) переносят в безводный ДМФА (65 мл), добавляют Cs2 CO3 (33,74 г, 103,5 ммоль) и перемешивают в течение 10 минут. Добавляют 3-бром-1-пропанол (8,6 мл, 13,2 г, 94,9 ммоль) и MeOH (6,0 мл, 4,75 г, 148 ммоль) и перемешивание продолжают под атмосферой N2 при комнатной температуре в течение 15 часов. К реакционной смеси добавляют воду (500 мл) и перемешивают в течение 10 минут. Образующийся осадок фильтруют и промывают водой (3×100 мл). Осадок на фильтре растворяют в CH2Cl2 (200 мл), промывают насыщенным раствором соли (50 мл), сушат (Na2SO4) и концентрируют. Твердый остаток растирают с Et2O (200 мл), фильтруют, затем промывают Et2O и сушат с получением 16,0 г желаемого соединения. Маточную жидкость очищают хроматографией (диоксид кремния, 0-10% ацетон/EtOAc) с получением допонительно 3,0 г указанного в заголовке соединения. Общий выход продукта 54,6%. МС (электрораспыление); вычислено: точное значение массы для C17H20F3N3O3S 403,12; m/z найдено: 404,0 [M+H]+, 426,0 [M+Na]+.1H ЯМР (400 МГц, CDCl3): 7,71 (д, J=8,2 Гц, 2H), 7, 66 (д, J=8,5 Гц, 2H), 4,55 (с, 2H), 4,23 (т, J=6,5 Гц, 2H), 3,70-3,63 (м, 4H), 2,90 (с, 3H), 2,90 (т, J=5,1 Гц, 2H), 2,62 (т, J=5,9 Гц, 1H), 2,06 (кв, J=6,1 Гц, 2H).
D. 5-Хлор-1-метил-3-пиперидин-4-ил-1,3-дигидробензимидазол-2-он
К суспензии 0,97 г (2,99 ммоль) этилового эфира 4-(6-хлор-2-оксо-2,3-дигидробензимидазол-1-ил)пиперидин-1-карбоновой кислоты в ТГФ (30 мл) добавляют 0,5 M KHMDS в толуоле. Полученную смесь перемешивают в течение 1 часа и одной порцией добавляют 0,25 мл (3,89 ммоль) MeI. Спустя 1,5 часа реакционную смесь разбавляют 1 N HCl (75 мл) и EtOAc (75 мл). Слои разделяют, органический слой промывают H2O (50 мл) и насыщенным раствором соли (50 мл), сушат над Na2SO4 и растворитель удаляют под пониженным давлением. Очистка флэш-хроматографией (диоксид кремния, 0-5% MeOH/CH2Cl2) приводит к получению 0,92 г (91%) твердого белого вещества. Суспензию 0,92 г (2,72 ммоль) этилкарбамата в смеси 1:1 EtOH (7,0 мл) и 10% NaOH (7,0 мл) нагревают до 110°C и выдерживают при этой температуре 36 часов, затем охлаждают. Смесь разбавляют EtOAc (30 мл) и H2O. Слои разделяют и водную фазу экстрагируют EtOAc (2×30 мл). Объединенные органические фракции сушат над Na2SO4 и растворитель удаляют под пониженным давлением с получением 0,56 г (78%) продукта в виде твердого вещества бледно-желтого цвета. ТСХ (диоксид кремния, 10% MeOH/CH2Cl2): Rt=0,1. МС (электрораспыление); m/z: вычислено для C13H16ClN3O [M++H] 266,10; найдено 266,0.1H ЯМР (400 МГц, CDCl3): 7,28 (д, J=1,8 Гц, 2H), 7,05 (дд, J=8,3, 2,0 Гц, 1H), 6,87 (д, J=8,3 Гц, 1H), 4,41 (тт, J=12,5, 4,3 Гц, 1H), 3,39 (с, 3H), 3,30 (уш.д, J=11,9 Гц, 2H), 2,82 (дт, J=12,4, 2,0 Гц, 2H ), 2,30 (дкв, J=12,3, 4,3 Гц, 2H), 1,81 (уш.дд, J=12,1, 2,3 Гц, 2H).
E. 5-Хлор-3-(1-{3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1-метил-1,3-дигидробензимидазол-2-он
К раствору 0,33 мл (3,72 ммоль) оксалилхлорида в CH2Cl2 (10 мл) под атмосферой N2 при -78°C с перемешиванием добавляют 0,36 мл (4,96 ммоль) ДМСО и реакционную смесь перемешивают в течение 15 минут. К полученному раствору в течение 10 минут добавляют раствор 1,0 г (2,48 ммоль) 3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]пропан-1-ола в 10 мл и перемешивание продолжают еще 25 минут. К полученному раствору добавляют 1,40 мл (9,92 ммоль) Et3N и реакционную смесь перемешивают в течение 10 минут при -78°C, затем дают ей нагреться до комнатной температуры и перемешивают еще 1 час. Смесь разбавляют EtOAc (75 мл) и насыщенным раствором NaHCO3 (75 мл) и слои разделяют. Объединенные органические фракции сушат над Na2SO4 и растворитель удаляют под пониженным давлением. Полученное твердое вещество сушат в вакууме, суспендируют в Et2O (20 мл) и энергично перемешивают в течение 1 часа. Твердый осадок фильтруют и промывают Et2O (2×10 мл) с получением неочищенного альдегида, который используют без дополнительной очистки. Неочищенный альдегид, 5-хлор-1-метил-3-пиперидин-4-ил-1,3-дигидробензимидазол-2-он (0,60 г, 2,3 ммоль) и 0,20 мл (3,72 ммоль) AcOH растворяют в CH2Cl2 (15 мл), затем добавляют 0,69 г (3,25 ммоль) NaBH(OAc)3 и реакционную смесь перемешивают в течение ночи. Смесь разбавляют CH2Cl2(75 мл) и насыщенным раствором NaHCO3(75 мл) и слои разделяют. Объединенные органические фракции сушат над Na2SO4 и растворитель удаляют под пониженным давлением. Очистка флэш-хроматографией (диоксид кремния, 0-4% MeOH/CH2Cl2) приводит к получению 1,28 г (79% после двух стадий) продукта в виде твердого белого вещества. ТСХ (диоксид кремния, 5% MeOH/CH2Cl2): Rf=0,5. МС (электрораспыление); m/z: вычислено для C30H34ClF3N6O3S [M++H] 651,21; найдено 651,2.1H ЯМР (400 МГц, CDCl3): 7,71 и 7,63 (A и В из AA'BB", Jab=8,17 Гц, 4H), 7,16 (д, J=1,8 Гц, 1H), 7,04 (д, J=8,3, 1,8 Гц, 1Н), 6,86 (д, J=8,3 Гц, 1H), 4,55 (с, 2H), 4,23 (тт, J=12,4, 4,3 Гц, 1H), 4,13 (т, J=6,7 Гц, 2H), 3,69 (т, J=5,7 Гц, 2H), 3,36 (с, 3H), 3,0 (д, J=11,6 Гц, 2H), 2,95 (т, J=5,7 Гц, 2H), 2,90 (с, 3H), 2,45-2,32 (м, 4H), 2,16-2,04 (м, 4H), 1,76 (дд, J=11,0, 2,0 Гц, 2H).13C ЯМР (100 МГц, CDCl3): 171,0, 153,7, 144,7, 137,1, 136,8, 129,3, 129,0, 128,7, 126,4, 125,5 (кв, J=3,8 Гц), 122,7, 120,7, 109,8, 109,2, 108,0, 60,3, 54,7, 53,0, 51,3, 46,8, 43,1, 42,4, 36,8, 29,0, 27,2, 27,0, 22,3, 21,0, 14,1.
ПРИМЕР 11

1-(1-{3-[5-Метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1,3-дигидроиндол-2-он
A. Метил-2-нитрофенилацетат
2-Нитрофенилуксусную кислоту (60 г, 0,3 моль) при перемешивании добавляют в 250 мл метанола. Добавляют серную кислоту (0,5 мл) и смесь кипятят с обратным холодильником в течение 20 часов. Смесь охлаждают и выпаривают под пониженным давлением с получением прозрачного желтого масла. Масло переносят в EtOAc и промывают насыщенным раствором NaHCO3. Органическую часть сушат (MgSO4) и выпаривают c получением 63 г (98%) сложного эфира в виде прозрачной жидкости оранжевого цвета. ТСХ (диоксид кремния, 25% EtOAc/гексаны): Rf=0,36.1H ЯМР (400 МГц, CDCl3): 8,24 (м, 1H), 7,16 (м, 1H), 7,60 (м, 1H), 7,47 (м, 1H), 4,15 (с, 2H), 3,83 (с, 3H).
B. Метил-2-аминофенилацетат
Метил-2-нитрофенилацетат (10,1 г, 51,2 ммоль) в 125 мл метанола, содержащего 221 мг 10% Pd/C, помещают в гидрогенизатор Парра при 40 фунтах/кв. дюйм. Спустя 5 часов смесь фильтруют через целит и выпаривают под пониженным давлением с получением прозрачного масла красного цвета. Растворитель удаляют под пониженным давлением с получением 8,5 г (100%) метил-2-аминофенилацетата в виде прозрачного красного масла. ТСХ (диоксид кремния, EtOAc/гексаны): Rf=0,24.1H ЯМР (400 МГц, CDCl3): 7,21 (м, 2H), 6,86 (м, 2H), 3,81 (с, 3H), 3,70 (с, 2H).
C. трет-Бутиловый эфир 4-(2-оксо-2,3-дигидроиндол-1-ил)пиперидин-1-карбоновой кислоты
Метил-2-аминофенилацетат (3,0 г, 18,2 ммоль) и 1-трет-бутоксикарбонил-4-пиперидон (4,5 г, 22,6 ммоль) растворяют при перемешивании в 50 мл CH2Cl2 под атмосферой азота. Добавляют триацетоксиборогидрид натрия (5,4 г, 25,5 ммоль), затем 1 мл уксусной кислоты и оставляют на 20 часов при комнатной температуре. После этого реакцию гасят медленным добавлением насыщенного водного раствора NaHCO3. Полученную смесь перемешивают 30 минут, затем органическую часть отделяют, сушат (MgSO4) и выпаривают с получением 7,5 г масла ярко-красного цвета. Очистка колоночной хроматографией (диоксид кремния, 10-50% EtOAc/гексаны) приводит к получению 3,9 г (62%) указанного в заголовке соединения. ТСХ (диоксид кремния, 25% EtOAc/гексаны): Rf=0,15.1H ЯМР (400 МГц, CDCl3): 7,25 (м, 2H), 7,01 (м, 2H), 4,40 (м, 1H), 3,53 (с, 2H), 2,83 (м, 2H), 2,32 (м, 2H), 1,70 (м, 2H), 1,51 (с, 9H).
D. 1-Пиперидин-4-ил-1,3-дигидроиндол-2-он
трет-Бутиловый эфир 4-(2-оксо-2,3-дигидроиндол-1-ил)пиперидин-1-карбоновой кислоты (3,9 г, 12,3 ммоль) при перемешивании добавляют в смесь ТФУК/CH2Cl2(1:1). Спустя 45 минут растворитель удаляют под пониженным давлением с получением прозрачного красного масла. Масло переносят в диэтиловый эфир и охлаждают на ледяной бане, в результате в смеси образуется осадок. Осадок фильтруют, промывают эфиром и сушат на воздухе с получением 4,0 г (100%) указанного в заголовке соединения в виде ТФУ-соли.1H ЯМР (400 МГц, ДМСО-d6): 8,6 (уш.с, 1 H), 7,27 (м, 3H), 7,03 (м, 1H), 4,45 (м, 1H), 3,56 (с, 2H), 3,42 (м, 2H), 3,09 (м, 2H), 2,53 (м, 2H), 1,78 (м, 2H).
E. 1-(1-{3-[5-Метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1,3-дигидроиндол-2-он
3-[5-Метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропан-1-ол (304 мг, 0,754 ммоль) при перемешивании добавляют в 5 мл CH2Cl2 при комнатной температуре под атмосферой азота. К полученной смеси одной порцией добавляют реагент Десса-Мартина (394 мг, 0,929 ммоль) и реакционную смесь перемешивают 1,5 часа. Полученную смесь при перемешивании добавляют к раствору тиосульфата (10 экв.) в 20 мл воды и 5 мл насыщенного раствора NaHCO3. Спустя 2 часа органический слой отделяют, сушат (MgSO4) и выпаривают с получением альдегида в виде твердого вещества светло-желтого цвета. Полученный альдегид (303 мг, 0,754 ммоль) и 1-пиперидин-4-ил-1,3-дигидроиндол-2-он при перемешивании добавляют в 15 мл CH2 Cl2,содержащего Et3N (0,15 мл, 1,1 ммоль). С помощью пипетки по каплям в течение 10 минут добавляют раствор Na(AcO)3BH в 5 мл CH2Cl2 и смесь перемешивают в течение ночи. Смесь гасят насыщенным раствором NaHCO3 и органическую фазу отделяют. Органическую фазу сушат (MgSO4) и выпаривают до прозрачного масла пурпурного цвета. Очистка колоночной хроматографией (диоксид кремния, 50-100% ацетон/CH2Cl2) приводит к получению 240 мг (53%) твердого продукта светло-розового цвета. ТСХ (диоксид кремния, 50% ацетон/CH2Cl2): Rf=0,17.1H ЯМР (400 МГц, ДМСО-d6): 7,82 (м, 4H), 7,24 (м, 2H), 7,11 (м, 1H), 6,98 (м, 1H), 4,49 (с, 2H), 4,12 (м, 3H), 3,54 (в, 2Н), 3,32 (с, 4H), 2,95 (м, 7H), 2,32 (м, 4H), 1,99 (м, 4H), 1,55 (м, 2H).
ПРИМЕР 12

1-[3-(4-Хлор-3-метилфенил)-1-(3-{4-[3-(4-хлорфенил)-[1,2,4]оксадиазол-5-ил]-пиперидин-1-ил}-2-гидроксипропил)-1,4,6,7-тетрагидропиразоло[4, 3-c]пиридин-5-ил]этанон
1-[3-(4-Хлор-3-метилфенил)-1-оксиранилметил-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон (0,069 г, 0,20 ммоль) растворяют в CH2Cl2 (1 мл) и к полученному раствору добавляют 4-[3-(4-хлорфенил)-1,2,4-оксадиазол-5-ил]пиперидин (0,105 г, 0,4 ммоль) и затем Yb(OTf)3 (0,031 г, 0,22 ммоль). Смесь перемешивают при комнатной температуре в течение 16 часов. Очистка препаративной ТСХ (диоксид кремния, 7,5% MeOH/CH2Cl2) приводит к получению 84 мг (69%) указанного в заголовке соединения. МС (электрораспыление); вычислено: точное значение массы для C31H34Cl2N6O3 608,21; m/z: найдено 609,2 [M++H].1H ЯМР (400 МГц, CDCl3, 1:1 смесь ротамеров): 8,00 (д, J=8,4 Гц, 2H), 7,56-7,53 (м, 1H), 7,48-7,42 (д, J=8,6 Гц, 2H), 7,41-7,30 (м, 2H), 4,84 и 4,73 (A и В из AB квартета, J=15,6 Гц, 1H), 4,62 (уш.с, 1H), 4, 25-4,13 (м, 2H), 4,10-3,98 (м, 2H), 3,90-3,70 (м, 2H), 3,04-2,71 (м, 5H), 2,51-2,40 (м, 6H), 2,30-2,15 (м, 6H), 2,10-1,90 (м, 2H).
ПРИМЕР 13

1-[1-{2-Гидрокси-3-[4-(5-трифторметилбензотиазол-2-ил)пиперидин-1-ил]пропил}-3-(4-трифторметилфенил)-1,4,6, 7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон.
A. 2-Пиперидин-4-ил-5-трифторметилбензотиазол
К раствору 5 г (29,2 ммоль) 1-ацетилпиперидин-4-карбоновой кислоты в толуоле (100 мл) и каталитического количества ДМФА (1 мл) при перемешивании по каплям добавляют 2,4 мл оксалилхлорида (33,3 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем аликвоту 20 мл (6 ммоль) полученного раствора переносят в отдельную колбу и обрабатывают раствором 1,4 г (6,10 ммоль) 2-амино-4-(трифторметил)тиофена гидрохлорида в триэтиламине (4 мл). Реакционную смесь нагревают до 80°C, выдерживают при этой температуре 30 минут, затем распределяют между этилацетатом (50 мл) и водой (20 мл) и фазы разделяют. Водную фазу дополнительно экстрагируют EtOAc (2×30 мл). Объединенные органические фракции промывают водой (25 мл), насыщенным раствором соли, сушат над Na2SO4 и растворитель удаляют под пониженным давлением. Остаток переносят в 1 N раствор HCl/MeOH, нагревают до 60о С и перемешивают при этой температуре в течение ночи. Реакционную смесь охлаждают и выпаривают досуха. Остаток переносят в 35 мл MeOH и перемешивают над бикарбонатом натрия (1 г) в течение 1 часа, затем фильтруют и растирают с получением 1,05 г (60%) желаемого продукта, который используют без дополнительной очистки. МС (электрораспыление); вычислено: точное значение массы для C13H13F3N2S 286,08; m/z: найдено 287,1 [M+H]+.1H ЯМР (CDCl3, 400 МГц): 8,25 (с, 1H), 7,98 (д, J=8,41 Гц, 1H), 7,65 (д, J=8,41 Гц, 1H), 3,38 (тт, J=11,35, 4,11 Гц, 1H), 3,28 (ддд, J=13,69, 11, 74, 2,74 Гц, 1H), 3,16 (ддд, J=13,89, 11,15, 2,74 Гц, 1H), 2,85 (м, 1H), 2,25 (уш.м, 2H), 1,97 (уш.м, 2H).
B. 1-[1-{2-Гидрокси-3-[4-(5-трифторметилбензотиазол-2-ил)пиперидин-1-ил]пропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон
Раствор 63 мг (0,22 ммоль) 2-пиперидин-4-ил-5-трифторметилбензотиазола растворяют в 4 мл EtOH и обрабатывают 40 мг (0,11 ммоль) 1-[1-оксиранилметил-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанона. Раствор нагревают до 60°C и выдерживают при этой температуре в течение ночи. Затем растворитель удаляют с помощью роторного испарителя и полученный неочищенный продукт очищают колоночной хроматографией (диоксид кремния, 0-10% MeOH/EtOAc) с получением 57 мг (80%) продукта в виде твердого белого вещества. МС (электрораспыление); вычислено: точное значение массы для C31H31F6N5O2S 651,21; найдено m/z: 652,2[M+H]+.1H ЯМР (CDCl3, 400 МГц, смесь амидных ротамеров): 8,24 (с, 1H), 7,97 (д, J=8,41 Гц, 1H), 7,78 (д, J=8,41 Гц, 1H), 7,70 (м, 2H), 7,65 (д, J=8,41 Гц, 1H), 7,60 (дд, J=8,41, 1,37 Гц, 1H), 4,88 и 4,76 (A и В из AB квартета, J=15,85 Гц, 1H), 4,66 (уш.с, 1H), 4,25-4,15 (м, 2H), 4,08-3,99 (м, 1,5H), 3,91-3,83 (м, 0,5H), 3,82-3,68 (м, 1H), 3,16 (тт, J=11,35, 3,52 Гц, 1H), 3,12-3,06 (м, 1H), 3,02-2,97 (м, 1H), 2,9-2,87 (м, 1,4H), 2,87-2,75 (м, 0,6H), 2,55-2,43 (м, 3H), 2,27-2,17 (м, 3H), 2,21 (с, 1,5H), 2,17 (с, 1,5H), 2,04-1,87 (м, 2H).
ПРИМЕР 14

1-[1-{3-[4-(Бензо[d]изоксазол-3-илокси)пиперидин-1-ил]-2-гидроксипропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон.
A. трет-Бутиловый эфир 4-(бензо[d]изоксазол-3-илокси)пиперидин-1-карбоновой кислоты
К раствору 263 мг трет-бутил-4-гидрокси-1-пиперидинкарбоксилата (1,3 ммоль) в 5 мл сухого ДМФА при перемешивании добавляют 52 мг 60% NaH в минеральном масле (1,3 ммоль) и полученный раствор перемешивают при комнатной температуре в течение 10 минут. К раствору добавляют 100 мг (0,65 ммоль) 3-хлор-1, 2-бензизоксазола в ДМФА (1 мл). Смесь перемешивают при 40°C в течение ночи, затем распределяют между EtOAc (50 мл) и водой (20 мл) и фазы разделяют. Водную фазу дополнительно экстрагируют EtOAc (2x30 мл). Объединенные органические фракции промывают водой (25 мл), насыщенным раствором соли, сушат над Na2SO4 и растворитель удаляют под пониженным давлением с получением неочищенного продукта. Очистка хроматографией (диоксид кремния, градиентное элюирование: от 40% смеси гексаны/CH2Cl2 до 100% CH2Cl2) приводит к получению 176 мг (85%) продукта в виде твердого вещества светло-желтого цвета. МС (электрораспыление); вычислено: точное значение массы для C17H22N2O4 318,16; m/z найдено: 341,1 [M+Na]+.1H ЯМР (CDCl3 400 МГц): 7,64 (дт, J=8,02, 1,17 Гц, 1H), 7,53 (ддд, J=8,41, 7,04, 1,17 Гц, 1H), 7,43 (дт, J=8,41, 0,78 Гц, 1H), 7,27 (ддд, J=8, 02, 7,04, 0,78 Гц, 1H), 5,07 (м, 1H), 3,87-3,77 (уш.м, 2H), 3,30 (м, 2H), 2,17-2,10 (уш.м, 2H), 1,93-1,84 (уш.м, 2H),1,48(с, 9H).
B. 1-[1-{3-[4-(Бензо[d]изоксазол-3-илокси)пиперидин-1-ил]-2-гидроксипропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон
Раствор 176 мг (0,55 ммоль) трет-бутилового эфира 4-(бензо[d]изоксазол-3-илокси)пиперидин-1-карбоновой кислоты в CH2Cl2(2 мл) обрабатывают трифторуксусной кислотой (0,5 мл) при комнатной температуре в течение ночи. Затем растворитель удаляют, неочищенный продукт растворяют в метаноле и перемешивают над 100 мг бикарбоната натрия в течение 1 часа, твердый продукт отфильтровывают и фильтрат концентрируют. Неочищенный пиперидин растворяют в 4 мл EtOH и обрабатывают 202 мг (0,55 ммоль) 1-[1-оксиранилметил-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанона. Раствор нагревают до 60°C и выдерживают при этой температуре в течение ночи. Затем растворитель удаляют с помощью роторного испарителя и неочищенный продукт очищают колоночной хроматографией (диоксид кремния, 0-10% MeOH/EtOAc) с получением 220 мг (68%) твердого белого вещества. МС (электрораспыление); вычислено: точное значение массы для C30H32F3N5O4583,24; m/z найдено: 584,2 [M+H]+.1H ЯМР (CDCl3, 400 МГц, смесь амидных ротамеров): 7,77 (д, J=8,22 Гц, 1H), 7,69 (м, 2H), 7,66-7,61 (м, 2H), 7, 54-7,49 (м, 1H), 7,41 (д, J=8,41 Гц, 1H), 7,28-7,23 (м, 1H), 4,93 (уш.м, 1H), 4,88 и 4,75 (A и В из AB квартета, J=15,65 Гц, 1H), 4,65 (уш.с, 1H), 4,24-4,18 (м, 0,75H), 4,18-4,09 (м, 1,25H), 4,07-3,98 (м, 1,5H), 3,91-3,79 (м, 0,5H), 3,79-3,67 (м, 1H), 3,02-2,85 (м, 2,4H), 2,85-2,70 (м, 1,6H), 2,61-2,52 (м, 1H), 2,51-2,40 (м, 2H), 2,39-2,30 (м, 1H), 2,24-2,12 (уш.м, 2H), 2,20 (с, 1,5H), 2,16 (с, 1, 5H), 2,02-1,86 (м, 2H).
ПРИМЕР 15

1-[1-{3-[4-(5-Хлорбензоксазол-2-ил)пиперидин-1-ил]-2-гидроксипропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон
A. 5-Хлор-2-пиперидин-4-илбензоксазол
В колбу загружают 1,35 мл (10 ммоль) метилизонипикотата, добавляют 1,43 г (10 ммоль) 2-амино-4-хлорфенола и 5 г полифосфорной кислоты. Колбу нагревают до 180°C и выдерживают при этой температуре в течение 5 часов. После этого реакционную смесь выливают в воду, сохраняя нагревание, и обрабатывают 50% раствором KOH до получения значения pH, равного 12. Раствор экстрагируют CH2Cl2 (3×50 мл), затем промывают водой (25 мл), насыщенным раствором соли, сушат над Na2SO4и растворитель удаляют под пониженным давлением с получением 1,53 г (57%) неочищенного продукта, который используют без дополнительной очистки. МС (электрораспыление); вычислено: точное значение массы для C12H13ClN2O 236,07; m/z найдено: 237,1 [M+H]+.
B. 1-[1-{3-[4-(5-Хлорбензоксазол-2-ил)пиперидин-1-ил]-2-гидроксипропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил}этанон
Раствор 130 мг (0,55 ммоль) 5-хлор-2-пиперидин-4-илбензоксазола в 4 мл EtOH обрабатывают 100 мг (0,27 ммоль) 1-[1-оксиранилметил-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанона. Раствор нагревают до 60°C и выдерживают при этой температуре в течение ночи. Затем растворитель удаляют с помощью роторного испарителя и неочищенный продукт очищают колоночной хроматографией (диоксид кремния, 0-10% MeOH/EtOAc) с получением 156 мг (95%) продукта в виде твердого белого вещества. МС (электрораспыление); вычислено: точное значение массы для C30H31ClF3N5 O3601,21; m/z найдено: 602,2 [M+H]+.1H ЯМР (CDCl3, 400 МГц, смесь амидных ротамеров): 7,76 (д, J=8,41 Гц, 1H), 7,71 и 7,67 (A и В из AB квартета, J=8,41 Гц, 2H), 7,65-7,61 (м, 2H), 7,38 (д, J=8,61 Гц, 1H), 7,26 (дд, J=8,61, 1,96, 1H), 4,86 и 4,74 (A и В из AB квартета, J=15,65 Гц, 1H), 4,64 (уш.с, 1H), 4,24-4,10 (м, 2,3H), 4,07-3,97 (м, 1,7H), 3,89-3, 67 (м, 2H), 3,06-3,00 (м, 1H), 3,00-2,90 (м, 2H), 2,90-2,74 (м, 2H), 2,51-2,38 (м, 3H), 2,25-2,10 (м, 2,3H), 2,20 (с, 1,5H), 2,15 (с, 1,5H), 2,06-1,83 (м, 2,7H).
ПРИМЕР 16

1-[1-{3-[4-(Бензотиазол-2-иламино)пиперидин-1-ил]-2-гидроксипропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон
A. трет-Бутиловый эфир 4-(бензотиазол-2-иламино)пиперидин-1-карбоновой кислоты
К раствору 300 мг (1,77 ммоль) 2-хлорбензотиазола в сухом ДМФА (3,5 мл) при перемешивании добавляют 2,9 г карбоната цезия (8,8 ммоль) и 535 мг трет-бутил-4-гидрокси-1-пиперидинкарбоксилата (2,66 ммоль). Смесь перемешивают при комнатной температуре в течение 4 часов, затем распределяют между EtOAc (70 мл) и водой (30 мл) и фазы разделяют. Водную фазу снова экстрагируют EtOAc (2×50 мл). Объединенные органические фракции промывают водой (25 мл), насыщенным раствором соли, сушат над Na2SO4 и растворитель удаляют под пониженным давлением. Очистка флэш-хроматографией (диоксид кремния, 0-15% EtOAc/гексаны) приводит к получению 220 мг (37%) желаемого продукта в виде твердого вещества белого цвета. МС (электрораспыление); вычислено: точное значение массы для C17H23N3O2S 333,15; m/z найдено: 334,2 [M+H]+.1H ЯМР (CDCl3, 400 МГц): 7,65 (т, J=7,63 2H), 7,36 (ддд, J=8,41, 7,43, 1,37 Гц, 1H), 7,22 (дт, J=7,63, 1,17 Гц, 1H), 5,36 (м, 1H), 3,79-3,70 (уш.м, 2H), 3,36 (м, 2H), 2,12-2,04 (уш.м, 2H), 1, 92-1,82 (уш.м, 2H), 1,48 (с, 9H).
B. 1-[1-{3-[4-(Бензотиазол-2-иламино)пиперидин-1-ил]-2-гидроксипропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4, 3-c]пиридин-5-ил]этанон
Раствор 220 мг (0,66 ммоль) трет-бутилового эфира 4-(бензотиазол-2-иламино)пиперидин-1-карбоновой кислоты в дихлорметане (2 мл) обрабатывают трифторуксусной кислотой (0,5 мл) при комнатной температуре в течение ночи. Затем растворитель удаляют и неочищенный продукт растворяют в MeOH и перемешивают над 100 мг бикарбоната натрия в течение 1 часа. Твердый осадок отфильтровывают и фильтрат концентрируют. Неочищенный пиперидин растворяют в 4 мл EtOH и обрабатывают 220 мг (0,60 ммоль) 1-[1-оксиранилметил-3-(4-трифторметилфенил)-1,4,6, 7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанона. Раствор нагревают до 60°C и выдерживают при этой температуре в течение ночи. Затем растворитель удаляют с помощью роторного испарителя и неочищенный остаток очищают колоночной хроматографией (диоксид кремния, 0-10% MeOH/EtOAc) с получением 240 мг (66%) твердого белого вещества. МС (электрораспыление); вычислено: точное значение массы для C30H33F3N6O2S 598,23; m/z найдено: 599,3 [M+H]+.1H ЯМР (CDCl3, 400 МГц, смесь амидных ротамеров): 7,78 (д, J=8,22 Гц, 1H), 7,72 и 7,68 (A и В из AB квартета, J=8,41 Гц, 2H), 7,64 (д, J=8,22 Гц, 1H), 7,56 (уш.д, J=8,02 Гц, 1H), 7,51 (уш.д, J=8,02 Гц, 1H), 7,29 (уш.д, J=7,63 Гц, 1H), 7,08 (уш.т, J=7,63 Гц, 1H), 5,29 (уш.с, 1H), 4,88 и 4,75 (A и В из AB квартета, J=15,65 Гц, 1H), 4,65 (уш.с, 1H), 4,23-4,16 (м, 1H), 4,16-4,08 (м, 1H), 4,06-3,98 (м, 2H), 3,92-3,65 (м, 3H), 3,03-2,70 (м, 4H), 2,52-2,41 (м, 3H), 2,26-2,18 (м, 1H), 2,21 (с, 1,5H), 2,16 (с, 1,5H), 2,16-2,08 (м, 2H), 1,66-1,44 (м, 2H).
ПРИМЕР 17

1-[1-{3-[4-(3,5-Дихлорпиридин-4-илокси)пиперидин-1-ил]-2-гидроксипропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон.
A. трет-Бутиловый эфир 4-(3,5-дихлорпиридин-4-илокси)пиперидин-1-карбоновой кислоты
К раствору 828 мг (4,12 ммоль) трет-бутил-4-гидрокси-1-пиперидинкарбоксилата в 10 мл сухого ДМФА при перемешивании добавляют 165 мг 60% NaH в минеральном масле (4,12 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 10 минут, после этого добавляют 500 мг (2,74 ммоль) 3,4,5-трихлорпиридина. Смесь перемешивают при 80°C в течение ночи, затем распределяют между EtOAc (50 мл) и водой (20 мл) и фазы разделяют. Водную фазу дополнительно экстрагируют EtOAc (2×30 мл). Объединенные органические фракции промывают водой (25 мл), насыщенным раствором соли, сушат над Na2SO4 и растворитель удаляют под пониженным давлением. Очистка колоночной хроматографией (диоксид кремния, 60-100% CH2Cl2/гексаны) приводит к получению 265 мг (28%) желаемого продукта. МС (электрораспыление); вычислено: точное значение массы для C15H20Cl2N2O3, 346,09; m/z найдено: 369,1 [M+Na]+.1H ЯМР (CDCl3, 400 МГц): 8,45 (с, 2H), 4,66 (м, 1H), 3,90-3,80 (уш.м, 2H), 3,26 (м, 2H), 1,96-1,83 (уш.м, 4H), 1,47 (с, 9H).
B. 1-[1-{3-[4-(3, 5-Дихлорпиридин-4-илокси)пиперидин-1-ил]-2-гидроксипропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон
Раствор 103 мг (0,30 ммоль) трет-бутилового эфира 4-(3,5-дихлорпиридин-4-илокси)пиперидин-1-карбоновой кислоты в CH2Cl2 (2 мл) обрабатывают трифторуксусной кислотой (0,5 мл) при комнатной температуре в течение ночи. Затем растворитель удаляют и неочищенный продукт растворяют в MeOH и перемешивают над 100 мг бикарбоната натрия 1 час. Твердый осадок отфильтровывают и фильтрат концентрируют. Неочищенный пиперидин растворяют в 4 мл EtOH и обрабатывают 100 мг (0,27 ммоль) 1-[1-оксиранилметил-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанона. Раствор нагревают до 60°C и выдерживают при этой температуре в течение ночи. Затем растворитель удаляют с помощью роторного испарителя и неочищенный остаток очищают колоночной хроматографией (диоксид кремния, 0-10% MeOH/EtOAc) с получением 90 мг (54%) продукта в виде твердого белого вещества. МС (электрораспыление); вычислено: точное значение массы для C28H30Cl2F3N5O3 611,17; m/z найдено: 612,2 [M+H]+.1H ЯМР (CDCl3, 400 МГц, смесь амидных ротамеров): 8,44 (с, 2H), 7,77 (д, J=8,41 Гц, 1H), 7,72 и 7,68 (A и В из AB квартета, J=8,41 Гц, 2H), 7,65 (д, J=8,41 Гц, 1H), 4,88 и 4,76 (A и В из AB квартета, J=15,65 Гц, 1H), 4,66 (уш.с, 1H), 4,55 (уш.с, 1H), 4,26-4,08 (м, 2H), 4,08-3,98 (м, 2H), 3,91-3,69 (м, 2H), 3,03-2,92 (м, 1, 6H), 2,91-2,85 (м, 0,8H), 2,85-2,75 (м, 1,6H), 2,52-2,40 (м, 3H), 2,35-2,24 (уш.м, 1H), 2,22 (с, 1,5H), 2,17 (с, 1,5H), 2,03-1,90 (м, 4H).
ПРИМЕР 18
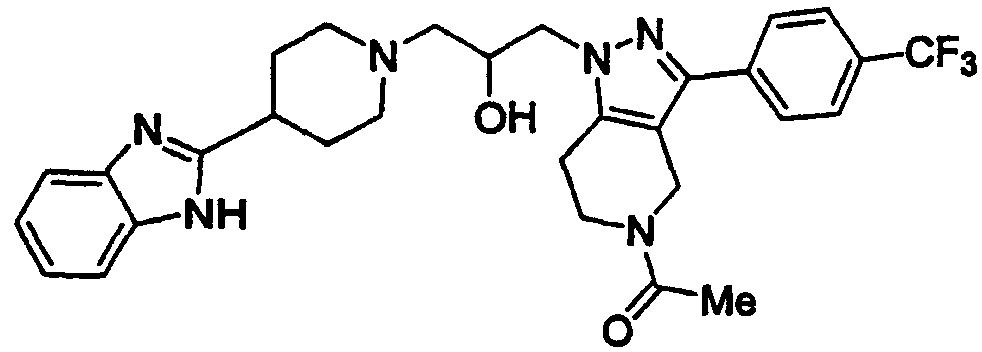
1-[1-{3-[4-(1H-Бензимидазол-2-ил)пиперидин-1-ил]-2-гидроксипропил}-3-(4-трифторметилфенил)-1,4,6, 7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон
A. 2-Пиперидин-4-ил-1H-бензимидазол
В колбу загружают 1,35 мл (10 ммоль) метилизонипикотата, 1,0 г (10 ммоль) 1,2-фенилендиамина и 5 г полифосфорной кислоты. Смесь нагревают до 180°C и выдерживают при этой температуре в течение 5 часов. Теплую реакционную смесь выливают в воду и обрабатывают 50% раствором KOH до pH 12. Раствор экстрагируют CH2Cl2 (3x50 мл), промывают водой (25 мл), насыщенным раствором соли, сушат над Na2SO4 и растворитель удаляют под пониженным давлением с получением 530 мг (27%) неочищенного продукта, который используют без дополнительной очистки. МС (электрораспыление); вычислено: точное значение массы для C12H15N3 201,13; m/z найдено 202,1 [M+H]+.1H ЯМР (400 МГц, ДМСО-d6): 12,1 (уш.с, 1H), 7,49 (уш.м, 1H), 7,38 (уш.м, 1H), 7,09 (уш.м, 2H), 3, 00 (дт, J=12,13, 3,33 Гц, 2H), 2,88 (тт, J=11,54, 3,74 Гц, 1H), 2,57 (дт, J=12,13, 2,35 Гц, 2H), 1,90 (м, 2H), 1,66 (м, 2H).
B. 1-[1-{3-[4-(1H-Бензимидазол-2-ил)пиперидин-1-ил]-2-гидроксипропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон
Раствор 83 мг (0,41 ммоль) 2-пиперидин-4-ил-1H-бензимидазола растворяют в 4 мл EtOH и обрабатывают 100 мг (0,27 ммоль) 1-[1-оксиранилметил-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанона. Раствор нагревают до 60°C и выдерживают при этой температуре в течение ночи. Затем растворитель удаляют с помощью роторного испарителя и неочищенный продукт очищают колоночной хроматографией (диоксид кремния, 0-10% MeOH/EtOAc) с получением 55 мг (36%) твердого белого вещества. МС (электрораспыление); вычислено: точное значение массы для C30H33F3N6O2 566,26; m/z найдено 567,3 [M+H]+.1H ЯМР (CDCl3, 400 МГц, смесь амидных ротамеров): 10,66 (уш.с, 0,5H), 10,57 (уш.с, 0,5H), 7,73 (уш.д, J=8,41 Гц, 1H), 7,72-7, 63 (м, 3H), 7,60 (уш.д, J=8,41 Гц, 1H), 7,39-7,32 (м, 1H), 7,23-7,13 (м, 2H), 7,02 (уш.с, 1Н), 4,86 и 4,75 (A и В из AB квартета, J=15,85 Гц, 1,25H), 4,64 (уш.с, 1H), 4,21-4,06 (м, 2H), 4,06-3,81 (м, 2H), 3,80-3,63 (м, 1H), 3,80-3,69 (м, 1H), 3,00-2,68 (м, 5H), 2,44-2,36 (м, 2H), 2,39-2,23 (м, 2H), 2,19 (с, 1,6H), 2,15 (с, 1,4H), 2,13-2,00 (м, 4H), 2,00-1,80 (м, 2H).
ПРИМЕР 19

6-Хлор-4-(1-{2-гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6, 7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-4H-бензо[1,4]оксазин-3-он
A. 5-Метансульфонил-1-оксиранилметил-3-(4-трифторметилфенил)-4,5,6, 7-тетрагидро-1H-пиразоло[4,3-c]пиридин
5-Метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидро-1H-пиразоло[4,3-c]пиридин (10,0 г, 29,0 ммоль) и эпихлоргидрин (24 мл, 307 ммоль) при перемешивании добавляют в ДМФА (150 мл), содержащий Cs2CO3 (10,4 г, 31,9 ммоль) и полученный раствор перемешивают при комнатной температуре в течение 4 дней. Смесь выпаривают, переносят в EtOAc и промывают водой. Органическую часть сушат (MgSO4) и выпаривают с получением твердого остатка светло-желтого цвета. Очистка остатка колоночной хроматографией (диоксид кремния, 5% ацетон/CH2Cl2) приводит к получению 4,1 г (35%) продукта в виде твердого белого вещества. ТСХ (диоксид кремния, 5% ацетон/CH2Cl2): Rf =0,28. МС (электрораспыление); вычислено: точное значение массы для C17H18F3N3O3S 401,10; m/z найдено: 402,1 [M+H]+.1H ЯМР (400 МГц, CDCl3); 7,84 (д, J=8,3 Гц, 2H), 7,79 (д, J=8,3 Гц, 2H), 4,70-4,62 (м, 3H), 4,25 (д, J=5,4 Гц, 1H), 3,90-3,70 (м, 2H), 3,47 (м, 1H), 3,10-2,9 (м, 6H), 2,65-2,60 (м, 1H).
B. трет-Бутиловый эфир 4-(5-хлор-2-гидроксифениламино)пиперидин-1-карбоновой кислоты
2-Амино-4-хлорфенол (30,0 г, 209 ммоль) и трет-бутиловый эфир 4-оксопиперидин-1-карбоновой кислоты (46,0 г, 231 ммоль) при перемешивании добавляют в дихлорметан (600 мл). К полученной смеси небольшими порциями в течение 10 минут добавляют триацетоксиборогидрид натрия (58,0 г, 274 ммоль). Добавляют уксусную кислоту (12 мл, 210 ммоль) и смесь перемешивают в течение 18 часов. К полученной смеси добавляют насыщенный раствор NaHCO3 и органическую фазу отделяют. Органическую фазу сушат (Mg2SO4) и выпаривают с получением 56 г (82%) твердого вещества светло-бежевого цвета. ТСХ (диоксид кремния, 50% EtOAc/гексаны): Rf=0, 66. МС (электрораспыление); вычислено: точное значение массы для C16H23ClN2O3 326,14; m/z найдено: 349,1 [M+Na]+.1H ЯМР (400 МГц, ДМСО-d6): 6,70 (д, J=8,3 Гц, 1H), 6,63 (с, 1H), 6,47 (д, J=8,2 Гц, 1H), 3,97 (д, J=12,2 Гц, 2H), 3,55-3,50 (м, 1H), 2,93 (уш.с, 2H), 1,93 (д, J=11,1 Гц, 2H), 1,48 (с, 9H), 1,35 (д, J=11,2 Гц, 2H).
C. трет-Бутиловый эфир 4-[(5-хлор-2-гидроксифенил)этоксикарбонилметиламино]пиперидин-1-карбоновой кислоты
трет-Бутиловый эфир 4-(5-хлор-2-гидроксифениламино)пиперидин-1-карбоновой кислоты (15,6 г, 47,7 ммоль) при перемешивании добавляют в ТГФ (200 мл) и охлаждают до 5°C. Небольшими порциями в течение 10 минут добавляют гидрид натрия (1,37 г, 54,2 ммоль) и смесь перемешивают в течение 1 часа. Добавляют этилбромацетат (5,8 мл, 52,3 ммоль) и ледяную баню удаляют. Смесь перемешивают 20 часов, затем выпаривают, остаток переносят в EtOAc и промывают водой. Органические части сушат (MgSO4) и выпаривают с получением 22,5 г масла насыщенного красного цвета. Масло очищают (диоксид кремния, 5% ацетон/CH2Cl2) с получением 12,9 г (65%) прозрачной жидкости оранжевого цвета. ТСХ (диоксид кремния, 5% ацетон/CH2Cl2): Rf=0,43. МС (электрораспыление); вычислено: точное значение массы для C20H29ClN2O3 412,18; m/z найдено: 413,2 [M+H]+.1H ЯМР (400 МГц, CDCl3): 6,75-6,62 (м, 3H), 4,71 (с, 1H), 4,37 (кв, J=7,2 Гц, 2H), 4,14 (уш.с, 2H), 3,55-3,50 (м, 1H), 3,08 (уш.т, 2H), 2,14 (м, 2H), 1,65-1,45 (м, 12H), 1,41 (т, J=7,2 Гц, 3H).
D. трет-Бутиловый эфир 4-(6-хлор-3-оксо-2,3-дигидробензо[1,4]оксазин-4-ил)пиперидин-1-карбоновой кислоты
трет-Бутиловый эфир 4-[(5-хлор-2-гидроксифенил)этоксикарбонилметиламино]пиперидин-1-карбоновой кислоты (12,9 г, 31,2 ммоль) при перемешивании добавляют в MeOH (100 мл). К полученному раствору добавляют раствор NaOH (2,5 г, 62,5 ммоль) в воде (100 мл) и смесь перемешивают при комнатной температуре в течение 3 часов. Смесь подкисляют до pH 2 и MeOH выпаривают. Водную фазу дважды экстрагируют EtOAc. Органические фракции объединяют, сушат (MgSO4) и выпаривают с получением 11 г прозрачного масла оранжевого цвета. Масло при перемешивании переносят в CH2Cl2 (150 мл) и добавляют EDC (8,2 г, 42,8 ммоль). Спустя 1 час органическую часть промывают 1 NHCl (100 мл), водой (100 мл) и сушат (MgSO4). Растворитель удаляют с получением 7,2 г (63%) продукта в виде твердого вещества оранжевого цвета. ТСХ (диоксид кремния, 5% ацетон/CH2Cl2): Rf=0,53. МС (электрораспыление); вычислено: точное значение массы для C18H23 ClN2O4366,13; m/z найдено: 389,1 [M+Na]+.1H ЯМР (400 МГц, CDCl3): 7,19 (с, 1H), 7,11-7,00 (м, 2H), 4,60 (с, 2H), 4,50-4,30 (м, 3H), 3,00-2,80 (м, 2H), 2,70-2,60 (м, 2H), 1,86 (д, J=11,4 Гц, 2H), 1,60 (с, 9H).
E. 6-Хлор-4-пиперидин-4-ил-4H-бензо[1,4]оксазин-3-он
трет-Бутиловый эфир 4-(6-хлор-3-оксо-2,3-дигидробензо[1,4]оксазин-4-ил)пиперидин-1-карбоновой кислоты (7,2 г, 19,6 ммоль) при перемешивании добавляют в смесь растворителей ТФУК/CH2Cl2(1:1). Спустя 1 час смесь выпаривают под пониженным давлением и оставшееся красное масло переносят в Et2O. Образущийся осадок отфильтровывают и сушат на воздухе с получением 7,2 г (96%) продукта в виде твердого вещества светло-бежевого цвета. МС (электрораспыление); вычислено: точное значение массы для C13H15ClN2O2 266,08; найдено 267,1 [M+H]+.1H ЯМР (400 МГц, CD3OD): 7,52 (c, 1H), 7,20-7,00 (м, 2H), 4,60 (с, 2H), 4,50-4,40 (м, 1H), 3,65-3,55 (м, 2H), 3,28 (т, J=13,1 Гц, 2H), 3,10-3,00 (м, 2H), 2,15 (д, J=13,9 Гц, 2H).
F. 6-Хлор-4-(1-{2-гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-4H-бензо[1, 4]оксазин-3-он
6-Хлор-4-пиперидин-4-ил-4H-бензо[1,4]оксазин-3-он (252 мг, 0,66 ммоль) и 5-метансульфонил-1-оксиранилметил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидро-1H-пиразоло[4, 3-c]пиридин (209 мг, 0,52 ммоль) при перемешивании добавляют в EtOH (10 мл), содержащий E3N (115 мкл, 0,83 ммоль) при 70°C. Спустя 2 дня смесь охлаждают, выпаривают, переносят в EtOAc и промывают насыщенным раствором NaHCO3. Органическую часть сушат (MgSO4) и выпаривают с получением прозрачного золотистого масла. Масло очищают (диоксид кремния, 50% ацетон/CH2Cl2) с получением 191 мг (55%) твердого белого вещества. ТСХ (диоксид кремния, 50% ацетон/CH2Cl2): Rf=0,38. МС (электрораспыление); вычислено: точное значение массы для C30H33ClF3N5O5S 667,18; m/z найдено: 668,2 [M+H]+.1Н ЯМР (400 МГц, CDCl3): 7,83 (д, J=8,3 Гц, 2H), 7,77 (д, J=8,3 Гц, 2H), 7,21 (с, 1H), 7,10-7,00 (м, 2H), 4,68 (д, J=5,1 Гц, 2H), 4,58 (с, 2H), 4,40-4,10 (м, 4H), 3,90-3,70 (с, 2H), 3,30-3,0 (м, 4H), 3,00 (с, 3H), 2,90-2,70 (м, 2H), 2,65-2,50 (м, 3H), 2,35-2,20 (м, 2H), 1,88 (д, J=11,3 Гц, 2H).
ПРИМЕР 20

6-Хлор-1-(1-{2-гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-3,4-дигидро-1Н-хинолин-2-он
A. Этиловый эфир 3-(2-амино-5-хлорфенил)акриловой кислоты
2-Амино-5-хлорбензальдегид (7,58 г, 48,7 ммоль) и 36 г (103 ммоль) (карбэтоксиметилен)трифенилфосфорана добавляют в бензол (300 мл) и полученную смесь кипятят с обратным холодильником в течение 20 часов. Реакционную смесь охлаждают и концентрируют с получением оранжевого масла. Масло переносят в Et2O, образуется осадок. Осадок отфильтровывают и промывают Et2O. Органическую часть выпаривают с получением прозрачного оранжевого масла. Масло очищают колоночной хроматографией (диоксид кремния, 10-40% EtOAc/гексаны) с получением 10,4 г (95%) продукта в виде твердого вещества желтого цвета. МС (электрораспыление); вычислено: точное значение массы для C11H12ClNO2 225,06; m/z найдено: 226,1 [M++H].1H ЯМР (400 МГц, CDCl3): 7,69 (д, J=15,85 Гц, 1H), 7,30 (д, J=2,54 Гц, 1H), 7,07 (дд, J=6,26 Гц, 2,35 Гц, 1H), 6,60 (д, J=8,61 Гц, 1H), 6,30 (д, J=15,85 Гц, 1H), 4,22 (дд, J=7,24 Гц, 7,24 Гц, 2H), 3,98 (уш.с, 2H), 1,30 (т, J=7,04 Гц, 3H).
B. трет-Бутиловый эфир 4-[4-хлор-2-(2-этоксикарбонилвинил)фениламино]пиперидин-1-карбоновой кислоты
Этиловый эфир 3-(2-амино-5-хлорфенил)акриловой кислоты (10,4 г, 46 ммоль) и трет-бутиловый эфир 4-оксопиперидин-1-карбоновой кислоты (13,8 г, 69 ммоль) при перемешивании добавляют в CH2Cl2 (230 мл). К полученной смеси небольшими порциями в течение 10 минут добавляют триацетоксиборогидрид натрия (14,6 г, 69 ммоль). После этого добавляют уксусную кислоту (1,3 мл, 25 ммоль) и смесь перемешивают в течение 18 часов. Добавляют насыщенный раствор NaHCO3 и органическую часть отделяют. Органическую фракцию сушат над Na2SO4 и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния, 20-50% EtOAc/гексаны) с получением 12,4 г (66%) продукта в виде твердого вещества насыщенного светло-бежевого цвета. ТСХ (диоксид кремния, 25% EtOAc/гексаны): Rf=0,5. МС (электрораспыление); вычислено: точное значение массы для C21H29ClN2O4 408,18; m/z найдено: 409,1 [M++H].1H ЯМР (400 МГц, CDCl3): 7,64 (д, J=15, 65 Гц, 1H), 7,29 (д, J=2,35 Гц, 1H), 7,14 (дд, J=6,26 Гц, 2,54 Гц, 1H), 6,59 (д, J=9,00 Гц, 1H), 6,28 (д, J=15,65 Гц, 1H), 4,23 (дд, J=7,04 Гц, 7,04 Гц, 2H), 4,11-3,98 (м, 2H), 3,81 (уш.с, 1H), 3,46-3, 36 (м, 1H), 2,89 (т, J=11,74 Гц, 2H), 2,04-1,95 (м, 2H), 1,44 (с, 9H), 1,42-1,33 (м, 2H), 1,30 (т, J=7,24 Гц, 3H).
C. трет-Бутиловый эфир 4-[4-хлор-2-(2-этоксикарбонилэтил)фениламино]пиперидин-1-карбоновой кислоты
трет-Бутиловый эфир 4-[4-хлор-2-(2-этоксикарбонилвинил)фениламино]пиперидин-1-карбоновой кислоты (12,4 г, 30,4 ммоль) в EtOAc (150 мл), содержащем PtO2 (1 г), помещают в гидрогенезатор Парра с давлением Н2, равным 60 фунтов/кв.дюйм. Через 18 часов смесь фильтруют через целит и выпаривают с получением прозрачной жидкости коричневого цвета. Жидкость очищают колоночной хроматографией (диоксид кремния, 20-50% EtOAc/гексаны) с получением 5,7 г (46%) указанного в заголовке соединения. ТСХ (диоксид кремния, 25% EtOAc/гексаны): Rf=0,5. МС (электрораспыление); вычислено: точное значение массы для C21H31ClN2O4 410,2; m/z найдено: 411,2 [M++H].1H ЯМР (400 МГц, CDCl3): 7,05 (дд, J=6,06 Гц, 2,54 Гц, 1H), 6,99 (д, J=2,35 Гц, 1H), 6,55 (д, J=8,61 Гц, 1H), 4,13 (дд, J=7,04 Гц, 3,13 Гц, 2H), 4,11-3,98 (м, 2H), 3,81 (уш.с, 1H), 3,72 (т, J=6,26 Гц, 2H), 3,46-3,36 (м, 1H), 2,75 (т, J=7,43 Гц, 2H), 2,60 (т, J=7,04, 2H), 2,04-1,95 (м, 2H), 1,46 (с, 9H), 1,42-1,33 (м, 2H), 1,26 (т, J=7,24 Гц, 3H).
D. трет-Бутиловый эфир 4-[2-(2-карбоксиэтил)-4-хлорфениламино]пиперидин-1-карбоновой кислоты
трет-Бутиловый эфир 4-(4-хлор-2-(2-этоксикарбонилэтил)фениламино)пиперидин-1-карбоновой кислоты (5,7 г, 13,9 ммоль) при перемешивании добавляют в MeOH (40 мл). Добавляют раствор NaOH (1,4 г, 34,7 ммоль) в воде (10 мл) и смесь перемешивают при комнатной температуре. Спустя 3 часа смесь подкисляют до pH 7 и MeOH выпаривают. Водный слой экстрагируют CH2Cl2 (3×100 мл). Органические фракции объединяют, сушат над Na2SO4 и концентрируют с получением 3,9 г (73%) желаемого продукта. ТСХ (диоксид кремния, 50% EtOAc/гексаны): Rf=0,4. МС (электрораспыление); вычислено: точное значение массы для C19H27ClN2O4 382,17; m/z найдено: 381,1 [M--H].
E. трет-Бутиловый эфир 4-(6-хлор-2-оксо-3,4-дигидро-2H-хинолин-1-ил)пиперидин-1-карбоновой кислоты
трет-Бутиловый эфир 4-[2-(2-карбоксиэтил)-4-хлорфениламино]пиперидин-1-карбоновой кислоты (3,9 г, 10,1 ммоль) и EDC (2,9 г, 15,3 ммоль) добавляют в CH2Cl2 (50 мл) и перемешивают в течение 2 часов. Реакционную смесь растворяют в CH2Cl2 (150 мл), промывают водой (2×50 мл) и насыщенным раствором соли (1×50 мл). Органическую фазу сушат над Na2SO4 и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния, 30-50% EtOAc/гексаны) с получением 1,9 г (52%) желаемого продукта. ТСХ (диоксид кремния, 50% EtOAc/гексаны): Rf=0,67. МС (электрораспыление); вычислено: точное значение массы для C19H25ClN2O3 364,16; m/z найдено: 365,1 [M++H].1H ЯМР (400 МГц, CDCl3): 7,14-7,08 (м, 2H), 6,98 (д, J=8,61 Гц, 1H), 4,33-3, 98 (м, 3H), 2,75 (т, J=7,83 Гц, 4H), 2,55-2,36 (м, 4H), 1,70-1,65 (м, 2H), 1,44 (с, 9H).
F. 6-Хлор-1-пиперидин-4-ил-3,4-дигидро-1Н-хинолин-2-он
трет-Бутиловый эфир 4-(6-хлор-2-оксо-3,4-дигидро-2H-хинолин-1-ил)пиперидин-1-карбоновой кислоты (1,2 г, 3,28 ммоль) добавляют при перемешивании в смесь ТФУК/CH2Cl2(1:1). Спустя 45 минут смесь выпаривают и полученное масло золотистого цвета переносят в Et2O. Образованный твердый осадок отфильтровывают, промывают Et2O и сушат на воздухе с получением 1,3 г (93%) твердого белого вещества. МС (электрораспыление); вычислено: точное значение массы для C13H17ClN2O 264,10; m/z найдено: 265,1 [M++H].
G. 6-Хлор-1-(1-{2-гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-3,4-дигидро-1Н-хинолин-2-он
6-Хлор-1-пиперидин-4-ил-3,4-дигидро-1Н-хинолин-2-он (270 мг, 0,62 ммоль) и 5-метансульфонил-1-оксиранилметил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидро-1H-пиразоло[4,3-c]пиридин (165 мг, 0, 41 ммоль) при перемешивании добавляют в EtOH (10 мл), содержащий Et3N (97 мкл, 0,70 ммоль), при 80°C и перемешивают при этой температуре в течение 16 часов. После этого смесь охлаждают, выпаривают, остаток переносят в дихлорметан и промывают водой. Органическую фракцию сушат над Na2SO4 и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния, 5-10% MeOH/CH2Cl2) с получением 205 мг (75%) твердого белого вещества. ТСХ (диоксид кремния, 10% MeOH/CH2Cl2): Rf=0,75. МС (электрораспыление); вычислено: точное значение массы для C31H35ClF3N5O4S 665,21; m/z найдено: 666,2 [M++H].1H ЯМР (CDCl3, 400 МГц): 7,69 (д, J=8,41 Гц, 2H), 7,62 (д, J=8,41 Гц, 2H), 7,16-7,08 (м, 2H), 7,00 (д, J=9,00 Гц, 1H), 4,52 (дд, J=14,28 Гц, 5,48 Гц, 2H), 4,18 (дд, J=10,56 Гц, 3,13 Гц, 1H), 4, 14-4,04 (м, 2H), 4,03-3,96 (м, 1H), 3,72-3,56 (м, 2H), 3,10-2,96 (м, 2H), 2,95-2,86 (м, 2H), 2,85 (с, 3H), 2,75 (т, J=6,26 Гц, 2H), 2,69-2,54 (м, 2H), 2,53-2,47 (м, 2H), 2,44-2,31 (м, 3H), 2,15-2,05 (м, 1H), 1,71-1,62 (м, 2H).
ПРИМЕР 21

6-Хлор-1-(1-{2-гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-3,4-дигидро-1H-хиназолин-2-он.
A. трет-Бутиловый эфир спиро[пиперидин-4,2'(1'H)-6'-хлор-3',4'-дигидро-4'-оксо-хиназолин]-1-карбоновой кислоты
К раствору 2-амино-5-хлорбензамида (5,67 г, 33,2 ммоль) и трет-бутилового эфира 4-оксопиперидин-1-карбоновой кислоты (6,62 г, 33,2 ммоль) в бензоле (70 мл) при перемешивании добавляют каталитическое количество (˜0,3 г) п-толуолсульфоновой кислоты. Смесь кипятят с обратным холодильником с использованием ловушки Дина-Старка. Полученную суспензию концентрируют. Добавляют насыщенный раствор NaHCO3 (68 мл). Смесь экстрагируют EtOAc и кристаллический осадок в водном слое собирают фильтрованием. Осадок промывают водой и сушат с получением 11,22 г (96%) желаемого продукта. МС (электрораспыление); вычислено: точное значение массы для C17H22ClN3O3 351,13; m/z найдено: 352,1 [M++H].1H ЯМР (CD3OD, 400 МГц): 7,50 (д, J=2,54 Гц, 1H), 7,13 (дд, J=6, 06 Гц, 2,54 Гц, 1H), 6,65 (д, J=8,61 Гц, 1H), 3,56-3,47 (м, 2H), 3,36-3,25 (м, 2H), 1,79-1,66 (м, 4H), 1,32 (с, 9H).
B. трет-Бутиловый эфир 4-(2-аминометил-4-хлорфениламино)пиперидин-1-карбоновой кислоты
трет-Бутиловый эфир спиро[пиперидин-4,2'(1'H)-6'-хлор-3',4'-дигидро-4'-оксохиназолин]-1-карбоновой кислоты (1 г, 2,8 ммоль) и борантетрагидрофурановый комплекс (1,0 M, 9,9 мл, 9,9 ммоль) добавляют в ТГФ (10 мл) и кипятят с обратным холодильником в течение 6 часов. Реакционную смесь охлаждают и выливают в ледяную воду. Полученную суспензию экстрагируют CH2Cl2 (2×100 мл). Органические фракции сушат и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния, 5-10% MeOH/CH2Cl2) с получением 795 мг (79%) продукта. МС (электрораспыление); вычислено: точное значение массы для C17H26ClN3O2339,17; m/z найдено: 362,1 [M++Na].1H ЯМР (CDCl3, 400 МГц): 7,07 (дд, J=6,06 Гц, 2,54 Гц, 1H), 6,97 (д, J=2,54 Гц, 1H), 6,54 (д, J=8,61 Гц, 1H), 3,94-3,70 (м, 4H), 3,48-3,38 (м, 1H), 3,05 (т, J=11,15 Гц, 2H), 2,68-2,55 (м, 1H), 2,02-1,90 (м, 4H), 1,46 (с, 9H).
C. трет-Бутиловый эфир 4-(6-хлор-2-оксо-3, 4-дигидро-2H-хиназолин-1-ил)пиперидин-1-карбоновой кислоты
К раствору трет-бутилового эфира 4-(2-аминометил-4-хлорфениламино)пиперидин-1-карбоновой кислоты (0,79 г, 2,25 ммоль) в CH3CN (10 мл) добавляют 1,1'-карбонилдиимидазол (0,51 г, 3,15 ммоль) и полученный раствор перемешивают в течение 3 часов при 50°C. После этого реакционную смесь охлаждают до комнатной температуры и перемешивают в течение дополнительных 2 часов. Реакционную смесь растворяют в CH2Cl2 (100 мл), промывают водой (2×10 мл), насыщенным раствором соли (1x10 мл). Органическую фазу сушат над Na2SO4и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния, 30-50% EtOAc/гексаны) с получением 0,46 г (63%) желаемого продукта. ТСХ (диоксид кремния, 50% EtOAc/гексаны): Rf=0,5. МС (электрораспыление); вычислено: точное значение массы для C18H24ClN3O3 365,15; m/z найдено: 388,1 [M++Na].1H ЯМР (CDCl3, 400 МГц): 7,18 (дд, J=6,26 Гц, 2,54 Гц, 1H), 7,05 (д, J=2,15 Гц, 1H), 6,94 (д, J=9,00 Гц, 1H), 6,29 (с, 1H), 4,32-4, 18 (м, 4H), 4,13-4,02 (м, 1H), 2,88-2,71 (м, 2H), 2,64-2,50 (м, 2H), 1,82-1,73 (м, 2H), 1,49 (с, 9H).
D. 6-Хлор-1-пиперидин-4-ил-3,4-дигидро-1H-хиназолин-2-он
трет-Бутиловый эфир 4-(6-хлор-2-оксо-3,4-дигидро-2H-хиназолин-1-ил)пиперидин-1-карбоновой кислоты (0,52 г, 1,42 ммоль) при перемешивании добавляют к смеси ТФУК/CH2Cl2(1:1). Перемешивают в течение 45 минут. После этого смесь выпаривают и полученное масло золотистого цвета переносят в Et2O. Образующийся твердый осадок фильтруют, промывают Et2O и сушат на воздухе с получением 0,52 г (97%) продукта в виде твердого не совсем белого вещества. МС (электрораспыление); вычислено: точное значение массы для C13H16 ClN3O 265,10; m/z найдено: 266,1 [M++H].
E. 6-Хлор-1-(1-{2-гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-3,4-дигидро-1H-хиназолин-2-он
6-Хлор-1-пиперидин-4-ил-3,4-дигидро-1H-хиназолин-2-он (183 мг, 0,42 ммоль) и 5-метансульфонил-1-оксиранилметил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидро-1H-пиразоло[4,3-c]пиридин (112 мг, 0,28 ммоль) при перемешивании добавляют в EtOH (10 мл), содержащий Et3N (66 мкл, 0,47 ммоль) и перемешивают при 80°C в течение 16 часов. После этого смесь охлаждают, выпаривают, переносят в CH2Cl2 и промывают водой. Органическую фракцию сушат над Na2SO4 и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния, 5-10% MeOH/CH2Cl2) с получением 141 мг (76%) твердого белого вещества. ТСХ (диоксид кремния, 10% MeOH/CH2Cl2): Rf=0,6. МС (электрораспыление); вычислено: точное значение массы для C30H34ClF3N6 O4S 666,20; m/z найдено: 667,2 [M++H].1H ЯМР (CDCl3, 400 МГц): 7,70 (д, J=7,83 Гц, 2H), 7,63 (д, J=8,02 Гц, 2H), 7,12 (дд, J=6,65 Гц, 2,35 Гц, 1H), 7,01 (уш.с, 1H), 6,92 (д, J=9,00 Гц, 1H), 5,44 (уш.с, 1H), 4,54 (дд, J=14,67 Гц, 6,46 Гц, 2H), 4,23-4,08 (м, 4H), 4,05-3,97 (м, 1H), 3,92-3,80 (м, 1H), 3,74-3,57 (м, 2H), 3,14-2,99 (м, 2H), 2,97-2,87 (м, 2H), 2,86 (с, 3H), 2,78-2,57 (м, 2H), 2,48-2,32 (м, 3H), 2,10 (т, J=11,50 Гц, 1H), 1,80-1,70 (м, 2H).
ПРИМЕР 22

1-[4-(6-Хлор-2,2-диоксо-3,4-дигидро-2H-2λ6-бензо[1,2, 6]тиадиазин-1-ил)пиперидин-1-ил]-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропан-2-ол
A. трет-Бутиловый эфир 4-(6-хлор-2,2-диоксо-3,4-дигидро-2H-2λ6-бензо[1,2,6]тиадиазин-1-ил)пиперидин-1-карбоновой кислоты
Раствор трет-бутилового эфира 4-(2-аминометил-4-хлорфениламино)пиперидин-1-карбоновой кислоты (678 мг, 2 ммоль) и сульфамида (596 мг, 6,2 ммоль) в пиридине (12 мл) кипятят с обратным холодильником в течение 6 часов. После этого реакционную смесь охлаждают до комнатной температуры и выливают в ледяную воду (50 мл). Раствор экстрагируют CH2Cl2 (4×100 мл). Органические экстракты сушат над Na2SO4 и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния, 30-50% EtOAc/гексаны) с получением 767 мг (96%) желаемого продукта. ТСХ (диоксид кремния, 50% EtOAc/гексаны): Rf=0,75. МС (электрораспыление; вычислено: точное значение массы для C17H24ClN3O4S 401,12; m/z найдено 400 [M-H].1H ЯМР (CDCl3, 400 МГц): 7,13 (дд, J=6,46 Гц, 2,15 Гц, 1H), 7,00 (д, J=1,96 Гц, 1H), 6,92 (д, J=8,60 Гц, 1H), 5,54 (уш.с, 1H), 4,35 (с, 2H), 4,11-3,81 (м, 3H), 2,62 (уш.с, 2H), 1, 90-1,66 (м, 4H), 1,34 (с, 9H).
B. 6-Хлор-1-пиперидин-4-ил-3,4-дигидро-1H-бензо[1,2,6]тиадиазин 2,2-диоксид
трет-Бутиловый эфир 4-(6-хлор-2,2-диоксо-3, 4-дигидро-2H-2λ6-бензо[1,2,6]тиадиазин-1-ил)пиперидин-1-карбоновой кислоты (767 мг, 1,91 ммоль) при перемешивании добавляют в смесь ТФУК/CH2Cl2(1:1) и перемешивают в течение 45 минут. После этого смесь выпаривают и полученное масло золотистого цвета переносят в Et2O. Образующийся твердый осадок фильтруют, промывают Et2O и сушат на воздухе с получением 730 мг (91%) продукта в виде не совсем белого твердого вещества. МС (электрораспыление); вычислено: точное значение массы для C12H16ClN3O2S 301,07; m/z найдено 302,0 [M++H].
C. 1-[4-(6-Хлор-2,2-диоксо-3,4-дигидро-2H-2λ6-бензо[1,2, 6]тиадиазин-1-ил)пиперидин-1-ил]-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-пропан-2-ол
6-Хлор-1-пиперидин-4-ил-3, 4-дигидро-1H-бензо[1,2,6]тиадиазина 2,2-диоксид (440 мг, 1,03 ммоль) и 5-метансульфонил-1-оксиранилметил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидро-1H-пиразоло[4,3-c]пиридин (415 мг, 1,03 ммоль) при перемешивании добавляют в EtOH (20 мл), содержащий Et3N (215 мкл, 1,54 ммоль), и перемешивают при 80°C в течение 16 часов. После этого смесь охлаждают, выпаривают, переносят в CH2Cl2 и промывают водой. Органическую фракцию сушат над Na2SO4 и концентрируют. Остаток очищают колоночной хроматографией (диоксид кремния, 0-5% MeOH/CH2Cl2) с получением 229 мг (32%) твердого белого вещества. ТСХ (диоксид кремния, 5% MeOH/CH2Cl2): Rf=0,8. МС (электрораспыление); вычислено: точное значение массы для C29H34ClF3N6O5S2 702,7; найдено 703,2 [M++H].1H ЯМР (CDCl3, 400 МГц, смесь двух ротамеров): 7,66 (д, J=8,61 Гц, 2H), 7,60 (д, J=8,61 Гц, 2H), 7,16 (дд, J=6,85 Гц, 1,96 Гц, 1H), 6,98 (с, 1H), 6,95 (д, J=9,00 Гц, 1H), 4,47 (с, 2H), 4,33 (с, 2H), 4,16-3,99 (м, 2H), 3,98-3,90 (м, 1H), 3,89-3,78 (м, 1H), 3,62-3,52 (м, 2H), 3,05-2,95 (м, 1H), 2,93-2,84 (м, 2H), 2,82 (с, 3H), 2,81-2,76 (м, 1H), 2,33 (д, J=6,46 Гц, 2H), 2,25 (т, J=11,24 Гц, 1H), 2,09-1,90 (м, 3H), 1,90-1,78 (м, 2H).
ПРИМЕР 23

4-(1-{2-Гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-4H-пиридо[3,2-b][1,4]оксазин-3-он.
A. трет-Бутиловый эфир 4-(3-гидроксипиридин-2-иламино)пиперидин-1-карбоновой кислоты
К раствору 4,7 г (0,042 моль) 2-амино-3-гидроксипиридина и 12,75 г (0,064 моль) трет-бутилового эфира 4-оксопиперидин-1-карбоновой кислоты в смеси CH2Cl2/AcOH (150 мл/60 мл) добавляют 10 г (0,070 моль) Na2SO4. Спустя 3,5 часа в виде трех порций добавляют 9,9 г (0,047 моль) триацетоксиборогидрида натрия и смесь перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь гасят NaHCO3 (150 мл), экстрагируют CH2Cl2(500 мл), промывают NaHCO3(2×100 мл) и объединенные водные фракции экстрагируют EtOAc (150 мл). Объединенные органические фракции сушат над Na2 SO4, концентрируют и очищают флэш-хроматографией (диоксид кремния, 3-10% MeOH/CH2Cl2) с получением 5,9 г (48%) продукта в виде порошка бежевого цвета. МС (электрораспыление); вычислено: точное значение массы для C15H23N3O3 293,17; m/z найдено: 294,2 [M+H]+.1H ЯМР (400 МГц, CDCl3): 7,52 (дд, J=5,3 Гц, 1,3 Гц, 1H), 6,79 (дд, J=7,6 Гц, 1,3 Гц, 1H), 6,40 (дд, J=7,6 Гц, 5,3 Гц, 1H), 4,06-3,94 (м, 3H), 3,02-2,86 (м, 2H), 2,72 (уш.с, 1H), 2,06-1,97 (м, 2H), 1,42 (с, 9H), 1, 46-1,28 (м, 2H).
B. трет-Бутиловый эфир 4-(3-этоксикарбонилметоксипиридин-2-иламино)пиперидин-1-карбоновой кислоты
Раствор 1,4 г (0,0048 моль) трет-бутилового эфира 4-(3-гидроксипиридин-2-иламино)пиперидин-1-карбоновой кислоты в ТГФ (24 мл) при перемешивании охлаждают до 0°C и к полученному раствору добавляют 0,13 г (0,0052 моль) NaH. Спустя 30 минут добавляют 0,8 г (0,0052 моль) этилбромацетата, реакционной смеси дают возможность нагреться до комнатной температуры и перемешивают в течение ночи. Добавляют насыщенный раствор NaHCO3 (20 мл) и реакционную смесь распределяют между EtOAc (200 мл) и насыщенным раствором NaHCO3 (75 мл). Органический слой промывают водой (50 мл) и NaCl (50 мл), сушат над Na2SO4 и концентрируют с получением 0,9 г (49%) продукта в виде белого порошка. МС (электрораспыление); вычислено: точное значение массы для C19H29N3O5, 379,21; m/z найдено: 380,2 [M+H]+. 1H ЯМР (400 МГц, CDCl3): 7,74 (д, J=5,3 Гц, 1H), 6,76 (д, J=7,8 Гц, 1H), 6,46 (дд, J=7,8 Гц, 5,3 Гц, 1H), 5,05 (д, J=7,33 Гц, 1H), 4,59 (с, 2H), 4,26 (кв, J=7,3 Гц, 2H), 4,18-3,92 (м, 3H), 2,97 (т, J=11,6 Гц, 2H), 2,06 (д, J=12,1 Гц, 2H), 1,46 (с, 9H), 1,46-1,34 (м, 2H) 1,29 (т, J=7,3 Гц, 3H).
C. трет-Бутиловый эфир 4-(3-оксо-2,3-дигидропиридо[3,2-b][1,4]оксазин-4-ил)пиперидин-1-карбоновой кислоты
К раствору 0,9 г (0,0023 моль) трет-бутилового эфира 4-(3-этоксикарбонилметоксипиридин-2-иламино)пиперидин-1-карбоновой кислоты в смеси H2O/MeOH (1 мл/11 мл) при перемешивании добавляют 0,05 г (0,0023 моль) LiOH и полученную смесь перемешивают в течение 6 часов. После этого растворитель удаляют под пониженным давлением. Остаток растворяют в ДМФА (12 мл) и при перемешивании к раствору добавляют 1,82 г (0,0048 моль) HATU. Спустя 3 часа реакционную смесь распределяют между EtOAc (250 мл) и насыщенным раствором NaHCO3(100 мл) и промывают водой (3x100 мл). Объединенные водные фракции экстрагируют EtOAc (100 мл). Объединенные органические фракции промывают насыщенным раствором соли (100 мл), сушат над Na2SO4 и концентрируют с получением 0,37 г (46%) продукта в виде твердого белого вещества. МС (электрораспыление); вычислено: точное значение массы для C17H23N3O4, 333,17; m/z найдено: 356,1 [M+Na]+.1H ЯМР (400 МГц, CDCl3): 7,97 (дд, J=4,8 Гц, 1,5 Гц, 1H), 7,25 (дд, J=8,1 Гц, 1,5 Гц, 1H), 6,96 (дд, J=8,1 Гц, 4,8 Гц, 1H), 5,03 (тт, J=11,9 Гц, 4,0 Гц, 1H), 4,55 (с, 2H), 4,13 (д, J=10,9 Гц, 2H), 2,82-2, 69 (м, 2H), 2,68 (квд, J=12,4 Гц, 4,0 Гц, 2H), 1,65 (д, J=12,1 Гц, 2H), 1,46 (с, 9H).
D. 4-Пиперидин-4-ил-4H-пиридо[3,2-b][1,4]оксазин-3-он
К раствору 0,37 г (0,0011 моль) трет-бутилового эфира 4-(3-оксо-2,3-дигидропиридо[3,2-b][1,4]оксазин-4-ил)пиперидин-1-карбоновой кислоты в CH2Cl2 (2,5 мл) добавляют 2,5 мл ТФУК. Спустя 2,5 часа растворитель удаляют. Остаток распределяют между EtOAc (200 мл) и 1 N NaOH (150 мл). Водный слой экстрагируют EtOAc (3×100 мл), объединенные органические фракции сушат над Na2SO4 и концентрируют с получением 0,24 г (94%) продукта в виде твердого вещества бело-розового цвета.1H ЯМР (400 МГц, CDCl3): 7,87 (дд, J=4,8 Гц, 1,5 Гц, 1H), 7,25 (дд, J=7,8 Гц, 1,8 Гц, 1H), 6,84 (дд, J=7,8 Гц, 4,8 Гц, 1H), 4,98-4,83 (м, 1H), 4,45 (с, 2H), 3,90 (с, 1H), 3,06 (д, J=8,3 Гц, 2H), 2,65-2,53 (м, 4H), 1,65-1,53 (м, 2H).
E. 4-(1-{2-Гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-4H-пиридо[3,2-b][1,4]оксазин-3-он
К раствору 0,24 г (0,001 моль) 4-пиперидин-4-ил-4H-пиридо[3,2-b][1,4]оксазин-3-она в смеси EtOH/дихлорэтан (2 мл/2 мл) при перемешивании добавляют 0,27 г (0,0007 моль) 5-метансульфонил-1-оксиранилметил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидро-1H-пиразоло[4,3-c]пиридина. Реакционную смесь нагревают до 80°C и перемешивают в течение 16 часов. Затем растворитель удаляют под пониженным давлением и неочищенный продукт очищают с помощью флэш-хроматографии (30% ацетон/CH2Cl2), получая 0,42 г (96%) продукта в виде твердого белого вещества. МС (электрораспыление); вычислено: точное значение массы для C29H33F3N6O5S 634,22; m/z найдено: 635,3 [M+H]+.1 H-ЯМР (400 МГц, CDCl3): 8,00 (дд, J=4,8 Гц, 1,5 Гц, 1H), 7,71 и 7,67 (A и В из АА'ВВ' квартета, Jab=8,4 Гц, 4H), 7,22 (дд, J=7,9 Гц, 1,5 Гц, 1H), 6,94 (дд, J=7,9 Гц, 4,8 Гц, 1H), 4,94 (тт, J=12,1 Гц, 4,0 Гц, 1H) 4,57 и 4,55 (A и В из AB квартета, Jab=14,5 Гц, 2H), 4,57 (с, 2H), 4,25-4,02 (м, 3H), 3,78-3,61 (м, 2H), 3,16-2,90 (м, 4H), 2,90 (с, 3H), 2,89-2,76 (м, 1H), 2,56-2,43 (м, 3H) 2,23 (т, J=11,2 Гц, 1H), 1,67 (д, J=11,3 Гц, 2H).
ПРИМЕР 24

5-Хлор-1-(1-{2-гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1,3-дигидроиндол-2-он
A. Диэтиловый эфир 2-(5-хлор-2-нитрофенил)малоновой кислоты
Гидрид натрия (2,94 г, 123 ммоль) при перемешивании добавляют в ДМСО (100 мл) и полученную смесь нагревают 100°C. Добавляют диэтилмалонат (17,5 мл, 115 ммоль) в ДМСО (30 мл) и спустя 10 минут получают прозрачный раствор красного цвета. Добавляют 2,4-дихлорнитробензола в ДМСО (50 мл). Спустя 1,5 часа смесь охлаждают и выливают в воду (1000 мл). Продукт экстрагируют эфиром. Органическую фракцию сушат (MgSO4) и выпаривают с получением прозрачного масла желтого цвета (10 г, 59 %). ТСХ (диоксид кремния, 20% EtOAc/гексаны): Rf=0,36. МС (электрораспыление); вычислено: точное значение массы для C13H14ClNO6 315,05; m/z найдено: 338, 0 [M+Na]+.1H ЯМР (400 МГц, CDCl3): 8,05 (д, J=8,7 Гц, 1H), 7,55-7,40 (м, 2H), 5,30 (с, 1H), 4,30 (кв, J=7,1 Гц, 4H), 1,31 (т, J=7,1 Гц, 6H).
B. Этиловый эфир (5-хлор-2-нитрофенил)уксусной кислоты
Диэтиловый эфир 2-(5-хлор-2-нитрофенил)малоновой кислоты (10,3 г, 32,6 ммоль) при перемешивании добавляют в ДМСО (200 мл), содержащий LiCl (2,9 г, 68,4 ммоль) и воду (0,6 мл, 33,3 ммоль), нагревают до 100°C и премешивают в течение 5 часов. После этого смесь охлаждают до комнатной температуры и выливают в воду (750 мл). Продукт экстрагируют двумя порциями EtOAc. Органические фракции объединяют, промывают водой, сушат (MgSO4) и выпаривают с получением 5,9 г (75%) продукта в виде прозрачного масла желтого цвета. ТСХ (диоксид кремния, 25% EtOAc /гексаны): Rf=0,50.1H ЯМР (400 МГц, CDCl3): 8,21 (д, J=8,8 Гц, 1H), 7,56 (дд, J=8,8, 2,3 Гц, 2H), 7, 47 (д, J=2,3 Гц, 1H), 4,30 (кв, J=7,2 Гц, 2H), 4,12 (с, 2H), 1,38 (т, J=7,1 Гц, 3H).
C. Этиловый эфир (2-амино-5-хлорфенил)уксусной кислоты
Этиловый эфир (5-хлор-2-нитрофенил)уксусной кислоты (5,9 г, 24,2 ммоль) в бензоле (125 мл), содержащем PtO2 (500 мг), помещают в гидрогенизатор Парра с давлением H240 футов/кв.дюйм. Спустя 18 часов смесь фильтруют через целит и выпаривают с получением прозрачной жидкости коричневого цвета. Жидкость очищают (диоксид кремния, 25% EtOAc/гексаны), получая 3,3 г (64%) очищенного продукта в виде прозрачной жидкости золотистого цвета. ТСХ (диоксид кремния, 25% EtOAc/гексаны): Rf=0,30. МС (электрораспыление); вычислено: точное значение массы для C10H12ClNO2 213,06; m/z найдено: 214,1 [M+H]+.1H ЯМР (400 МГц, CDCl3): 7,20-7,10 (м, 2H), 6,78 (д, J=8,3 Гц, 1H), 4,26 (кв, J=7,2, 2H), 1, 18 (т, J=7,1 Гц, 3H).
D. трет-Бутиловый эфир 4-(5-хлор-2-оксо-2,3-дигидроиндол-1-ил)пиперидин-1-карбоновой кислоты
В CH2Cl2 (50 мл) при перемешивании добавляют этиловый эфир (2-амино-5-хлорфенил)уксусной кислоты (3,3 г, 15,4 ммоль), трет-бутиловый эфир 4-оксопиперидин-1-карбоновой кислоты (4,6 г, 23 ммоль), триацетоксиборогидрид натрия (4,9 г, 23,1 ммоль), затем уксусную кислоту (3 мл) и полученную смесь перемешивают в течение 5 дней. После этого к смеси добавляют насыщенный раствор NaHCO3 и органическую часть отделяют. Органическую фракцию сушат (MgSO4) и выпаривают с получением 7,5 г продукта в виде прозрачного масла золотистого цвета. Масло очищают (диоксид кремния, 50% EtOAc/гексаны) с получением 3,4 г (63%) продукта в виде твердого белого вещества. ТСХ (диоксид кремния, 25% EtOAc/гексаны): Rf=0,18. МС (электрораспыление); вычислено: точное значение массы для C18H23ClN2O3 350,14; m/z найдено: 373,1 [M+Na]+.1H ЯМР (400 МГц, CDCl3): 7,40-7,30 (м, 2H), 7,00 (д, J=8,4 Гц, 1H), 4, 55-4,45 (м, 1H), 4,40 (м, 2H), 3,63 (с, 2H), 2,94 (м, 2H), 2,45-2,30 (м, 2H), 1,82 (м, 2H), 1,62 (с, 9H).
E. 5-Хлор-1-пиперидин-4-ил-1,3-дигидроиндол-2-он
трет-Бутиловый эфир 4-(5-хлор-2-оксо-2,3-дигидроиндол-1-ил)пиперидин-1-карбоновой кислоты (3,4 г, 9,7 ммоль) при перемешивании добавляют в смесь ТФУК/CH2Cl2 (1:1) и перемешивают в течение 45 минут. После этого смесь выпаривают и полученное масло золотистого цвета переносят в Et2O. Образующийся твердый осадок фильтруют, промывают Et2O и сушат на воздухе с получением 3,4 г (97%) продукта в виде твердого белого вещества. МС (электрораспыление); вычислено: точное значение массы для C12H15ClN2O 250,09; m/z найдено: 251,1 [M+H]+.1H ЯМР (400 МГц, ДМСО-d6); 7,45 (с, 2H), 7,31 (д, J=8,1 Гц, 1H), 4,55-4,45 (м, 1H), 3,68 (с, 2H), 3,50 (д, J=12,3, 2H), 3,14 (м, 2H), 2,70-2,55 (м, 2H), 1,87 (д, J=13,1 Гц, 2H).
F. 5-Хлор-1-(1-{2-гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]пропил}пиридин-4-ил)-1,3-дигидроиндол-2-он
5-Хлор-1-пиперидин-4-ил-1,3-дигидроиндол-2-он (256 мг, 0,70 ммоль) и 5-метансульфонил-1-оксиранилметил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидро-1H-пиразоло[4,3-c]пиридин (255 мг, 0,64 ммоль) с перемешиванием при 80°C добавляют в EtOH (15 мл), содержащий Et3N (107 мл, 0,77 ммоль), и перемешивают в течение 20 часов. После этого смесь охлаждают, выпаривают, переносят в CH2Cl2 и промывают водой. Органическую фракцию сушат (MgSO4) и выпаривают с получением прозрачного масла золотистого цвета. Масло очищают (диоксид кремния, 50% ацетон/CH2Cl2) с получением 225 мг (54%) продукта в виде твердого белого вещества. ТСХ (диоксид кремния, 50% ацетон/CH2Cl2): Rf=0,32. МС (электрораспыление); вычислено: точное значение массы для C30H33 ClF3N5O4S 651,19; m/z найдено: 652,2 [M+H]+.1H ЯМР (400 МГц, CDCl3): 7,82 (д, J=8,1 Гц, 2H), 7,76 (д, J=8,1 Гц, 2H), 7,40-7,25 (м, 2H), 7,04 (д, J=8,1 Гц, 2H), 4,66 (д, J=4,0 Гц, 2H), 4,40-4,10 (м, 4H), 4,05-3,70 (м, 3H), 3,59 (с, 2H), 3,30-3,0 (м, 4H), 2,99 (с, 3H), 2,70-2,40 (м, 5H), 2,28 (м, 2H).
ПРИМЕР 25

1-[4-(6-Хлориндол-1-ил)пиперидин-1-ил]-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропан-2-ол.
A. 5-Хлор-2-(2, 2-диметоксиэтил)фениламин
К раствору 10,3 г (60 ммоль) 4-хлор-2-нитротолуола в сухом ДМФА (120 мл) при перемешивании добавляют 16,45 г N,N-диметилформамиддиметилацеталя (138 ммоль). Смесь нагревают до 140°C и выдерживают при этой температуре в течение 18 часов, затем растворитель удаляют под пониженным давлением и остаток разбавляют 150 мл MeOH и 15,2 мл хлортриметилсилана (120 ммоль). Реакционную смесь нагревают 60°C и выдерживают при этой температуре в течение ночи. После этого метанол удаляют под пониженным давлением, остаток переносят в EtOH и помещают в бутыль Парра. Добавляют 100 мг 10% платины на углероде, реакционную смесь помещают на вибрационный аппарат Парра с давлением водорода 2 атмосферы и выдерживают в этих условиях в течение 8 часов. Когда реакция завершается, катализат удаляют фильтрованием и фильтрат концентрируют под пониженным давлением. Неочищенный анилин используют без дополнительной очистки. ТСХ (диоксид кремния, 35% EtOAc/гексаны): Rf=0,4. МС (электрораспыление); вычислено: точное значение массы для C10H14ClNO2 215,07; m/z найдено: 216,1 [M+H]+ .
B. трет-Бутиловый эфир 4-[5-хлор-2-(2,2-диметоксиэтил)фениламино]пиперидин-1-карбоновой кислоты
К раствору 2 г 5-хлор-2-(2, 2-диметоксиэтил)фениламина (9,27 ммоль) в 50 мл уксусной кислоты при перемешивании добавляют 3,7 г трет-бутилового эфира 4-оксопиперидин-1-карбоновой кислоты (18,5 ммоль). Реакционную смесь перемешивают в течение 1 часа при комнатной температуре, затем одной порцией добавляют 5,9 г триацетоксиборогидрида натрия (27,9 ммоль). Реакционную смесь перемешивают в течение дополнительных 5 часов, затем растворитель удаляют под пониженным давлением. Неочищенный продукт распределяют между CH2Cl2 (250 мл) и водой. Водный слой снова экстрагируют CH2Cl2 (2×75 мл). Объединенные органические фракции промывают 1 N NaOH (2×50 мл), насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Очистка хроматографией (диоксид кремния, 10-25% EtOAc/гексаны) приводит к получению 1,5 г (71%) желаемого продукта. ТСХ (диоксид кремния, 35% EtOAc/гексаны): Rf=0,49. МС (электрораспыление); вычислено: точное значение массы для C20H31ClN2O4 398,20; m/z найдено: 399,2 [M+H]+.1H ЯМР (CDCl3, 400 МГц): 6,94 (д, J=7,83 Гц, 1H), 6,61 (дд, J=7,83, 2,02 Гц, 1H), 6,57 (д, J=2,02 Гц, 1H), 4,87 (уш.с, 1H), 4,40 (т, J=5,31 Гц, 1H), 3,97 (уш.м, 2H), 3,36 (с, 6H), 3,02 (м, 2H), 2,78 (д, J=5,05 Гц, 2H), 2,00 (м, 2H), 1,47 (с, 9H), 1,37 (м, 2H).
C. 6-Хлор-1-пиперидин-4-ил-1Н-индол
К раствору 1,03 г (2,59 ммоль) трет-бутилового эфира 4-[5-хлор-2-(2, 2-диметоксиэтил)фениламино]пиперидин-1-карбоновой кислоты в 15 мл толуола при перемешивании добавляют 1,0 г (5,2 ммоль) п-толуолсульфоновой кислоты. Реакционную смесь нагревают до 60°C и выдерживают при этой температуре в течение 20 минут, затем дают ей охладиться до комнатной температуры и гасят 100 мл насыщенного водного раствора NaHCO3, затем экстрагируют EtOAc (3× 75 мл). Объединенные органические фракции промывают насыщенным раствором соли, сушат над Na2SO4и концентрируют с получением 590 мг (98%) желаемого продукта в виде масла розового цвета. МС (электрораспыление); вычислено: точное значение массы для C13H15ClN2 234,09; m/z найдено: 235,1 [M+H]+.1H ЯМР (CDCl3,400 МГц, смесь амидных ротамеров): 7,52 (д, J=8,34 Гц, 1H), 7,38 (уш.с, 1H), 7,21 (д, J=3,28 Гц, 1H), 7,06 (дд, J=8,34, 1,77 Гц, 1H), 6,49 (д, J=3,28 Гц, 1H), 4,24 (м, 1H), 3,30 (м, 2H), 2,85 (дт, J=12,38, 2,53 Гц, 2H), 2,08 (м, 2H), 1,94 (м, 2H).
D. 1-[4-(6-Хлориндол-1-ил)пиперидин-1-ил]-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]пропан-2-ол
К раствору 86 мг (0,21 ммоль) 5-метансульфонил-1-оксиранилметил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидро-1H-пиразоло[4,3-c]пиридина в 4 мл EtOH при перемешивании добавляют 50 мг (0,39 ммоль) 6-хлор-1-пиперидин-4-ил-1Н-индола. Раствор нагревают до 60°C и выдерживают при этой температуре в течение ночи. Затем растворитель удаляют с помощью роторного испарителя и неочищенный продукт очищают колоночной хроматографией (диоксид кремния, элюирование с градиентом: 0-5% 2 NNH3/MeOH в CH2Cl2) с получением 64 мг (48%) продукта в виде твердого белого вещества. МС (электрораспыление); вычислено: точное значение массы для C30H33ClF3N5O3S 635,19; m/z найдено: 636,2 [M+H]+. ВЭЖХ (с обращенной фазой: 10-90%). tR=4,88 минут.1H ЯМР (CDCl3 400 МГц): 7,72 и 7,67 (A и В из AB квартета, J=8,80 Гц, 4H), 7,52 (д, J=8,41, 1H), 7,34 (с, 1H), 7,18 (д, J=3,33 Гц, 1H), 7,07 (дд, J=8,41, 1,76 Гц, 1H), 6,50 (д, J=3,33 Гц, 1H), 4,59 и 4,54 (A и В из AB квартета, J=14,48 Гц, 2H), 4,24 (дд, J=13,69, 2,39 Гц, 1H), 4,21-4, 14 (м, 2H), 4,05 (дд, J=13,69, 6,46 Гц, 1H), 3,69 (м, 2H), 3,15 (уш.д, J=11,54 Гц, 1H), 3,11-2,91 (м, 3H), 2,60-2,48 (м, 3H), 2,28 (дт, J=11,74, 2,15 Гц, 1H), 2,13-1,93 (м, 4H).
ПРИМЕР 26

1-(1-{3-[5-Метансульфонил-3-(4-трифторметилфенил)-4,5,6, 7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1Н-бензотриазол
К раствору 3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]пропиональдегида (0,084 г, 0,21 ммоль) в CH2Cl2 (0,5 мл) при перемешивании последовательно добавляют 1-пиперидин-4-ил-1H-бензотриазол гидрохлорид (Maybridge Chemicals, 0,050 г, 0,21 ммоль), E3N (0,1 мл) и ледяную AcOH (12 мл, 0,21 ммоль) и перемешивают в течение 20 минут. К полученной смеси добавляют NaBH(OAc)3 (0,058 г, 0,27 ммоль) и смесь перемешивают под атмосферой азота в течение ночи. К смеси добавляют насыщенный раствор NaHCO3 (1 мл) и перемешивают в течение 30 минут. Слои разделяют и водный слой экстрагируют CH2Cl2 (3 мл). Объединенные органические экстракты промывают насыщенным раствором соли (3 мл), сушат над Na2SO4 и выпаривают под пониженным давлением. MPLC неочищенного продукта приводит к получению желаемого соединения в виде твердого вещества белого цвета (0,098 г, 80 %). ТСХ (диоксид кремния, 12% MeOH/CH2Cl2): Rf=0,44. МС (электрораспыление); вычислено: точное значение массы для C28H32F3N7O2S 587,23; m/z найдено: 588,2 [M+H]+.1H ЯМР (400 МГц, CDCl3): 8,00 (д, J=8,4 Гц, 1H), 7,66 (д, J=8,2 Гц, 2H), 7,59 (д, J=8,2 Гц, 2H), 7,50 (д, J=8,4 Гц, 1H), 7,41 (дт, J=0,9, 7,6 Гц, 1H), 7,30 (дт, J=0,9, 7,6 Гц, 1H), 4,59 (уш.т, J=11,2 Гц, 1H), 4,50 (с, 2H), 4,10 (т, J=6,7 Гц, 2H), 3,63 (т, J=5,8 Гц, 2H), 3,00 (уш.д, J=12,0 Гц, 2H), 2,89 (т, J=5,8 Гц, 2H), 2,86 (с, 3H), 2,38-2,27 (м, 4H), 2,17-1,99 (м, 6H).
ПРИМЕР 27

Амид 1-{3-[4-(3-метил-2-оксо-2, 3-дигидробензимидазол-1-ил)пиперидин-1-ил]пропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-сульфоновой кислоты
A. трет-Бутиловый эфир 1-(3-оксопропил)-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
К раствору трет-бутилового эфира 1-(3-гидроксипропил)-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты (1,30 г, 3,05 ммоль) в CH2Cl2 (15 мл) при 0°C под атмосферой N2при перемешивании одной порцией добавляют периодинан Дэсса-Мартина (1,43 г, 3,36 ммоль). После этого реакционную смесь перемешивают при 0°C в течение 15 минут, дают ей нагреться до комнатной температуры и перемешивают при комнатной температуре в течение 1,5 часов. После этого реакционную смесь разбавляют Et2O (50 мл) и медленно добавляют (Осторожно! Выделение газа) насыщенный раствор NaHCO3 (15 мл). Затем добавляют Na2S2O3˙H2O (5,31 г, 21,4 ммоль) и перемешивают в течение 30 минут. Слои разделяют и водный слой экстрагируют Et2O (2×30 мл). Объединенные экстракты промывают насыщенным раствором соли, сушат (Na2SO4) и концентрируют. MPLC (1-10% MeOH/CH2Cl2) приводит к получению альдегида с выходом 79% (1,02 г). ТСХ (диоксид кремния, 10% MeOH/CH2Cl2): Rf=0,67. МС (электрораспыление) вычислено для C21H24F3N3O3424,2 ([M+H]+), m/z найдено 424,2.1H ЯМР (400 МГц, CDCl3): 9,82 (с, 1H), 7,65 (уш.д, J=8,0 Гц, 2H), 7,54 (уш.с, 2H), 4,53 (с, 2H), 4,21 (т, J=6,2 Гц, 2H), 3,68 (уш.с, 2H), 3,04 (т, J=6,2 Гц, 2H), 2,70 (т, J=5,6 Гц, 2H), 1,39 (с, 9H).
B. трет-Бутиловый эфир 1-{3-[4-(3-метил-2-оксо-2,3-дигидробензимидазол-1-ил)пиперидин-1-ил]пропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
К раствору трет-бутилового эфира 1-(3-оксопропил)-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты (0,99 г, 23,6 ммоль) в CH2Cl2 (20 мл) при перемешивании последовательно добавляют 1-метил-3-пиперидин-4-ил-1,3-дигидробензимидазол-2-он (0,60 г, 25,9 ммоль) и ледяную AcOH (0,13 мл, 23,6 ммоль) и полученную смесь перемешивают в течение 20 минут. Добавляют NaBH(OAc)3 (0,65 г, 30,6 ммоль) и перемешивают под атмосферой азота в течение 2 часов. Добавляют насыщенный раствор NaHCO3 (20 мл), перемешивают в течение 30 минут и слои разделяют. Органический экстракт промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют под пониженным давлением. MPLC неочищенного продукта приводит к получению желаемого соединения в виде твердого белого вещества (1,27 г, 85%). ТСХ (диоксид кремния, 7% MeOH/CH2Cl2): Rf=0,35. МС (электрораспыление); вычислено: точное значение массы для C34H41F3N6O3 638,32; m/z найдено: 639,3 [M+H]+, 661,2 [M+Na]+.1H ЯМР (400 МГц, CDCl3): 7,81 (уш.д, J=8,0 Гц, 2H), 7,68 (уш.с, 2H), 7,25 (дд, J=1,6, 7,5 Гц, 1H), 7,15-7,07 (м, 2H), 7,02 (дд, J=1,6, 7,9 Гц, 1H), 4,70 (уш.с, 2H), 4,38 (тт, J=4,2, 12,4 Гц, 1H), 4,18 (т, J=6,8 Гц, 2H), 3,82 (с, 2H), 3,45 (с, 3H), 3,07 (д, J=11,6 Гц, 2H), 2,84 (т, J=5,5 Гц, 2H), 2,53-2,42 (м, 2H), 2,44 (т, J=6,7 Гц, 2H), 2,21-2,03 (м, 4H), 1,84 (д, J=12,0 Гц, 2H), 1,52 (с, 9H).
C. 1-Метил-3-(1-{3-[3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-он
трет-Бутиловый эфир 1-{3-[4-(3-метил-2-оксо-2,3-дигидробензимидазол-1-ил)пиперидин-1-ил]пропил} -3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты (1,19 г, 1,86 ммоль) растворяют в трифторуксусной кислоте (5 мл) и CH2Cl2(5 мл) и перемешивают при комнатной температуре в течение 2 часов. Реакционную смесь концентрируют, разбавляют CH2Cl2 и промывают насыщенным раствором NaHCO2. Органическую фазу сушат над Na2SO4 и концентрируют с получением 1-метил-3-(1-{3-[3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-она (0,955 г, 96%) в виде белой пены. ТСХ (диоксид кремния, 10% MeOH/CH2Cl2): Rf=0,19. МС (электрораспыление): вычислено для C29H35F3N6O 539,3 ([M+H]+, m/z найдено: 539,3.
D. (N-трет-Бутоксикарбонил)амид 1-{3-[4-[3-метил-2-оксо-2,3-дигидробензимидазол-1-ил)пиперидин-1-ил]пропил)-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4, 3-c]пиридин-5-сульфоновой кислоты
К раствору хлорсульфонилизоцианата (0,018 мл, 0,209 ммоль) в CH2Cl2(0,150 мл) добавляют 2-метил-2-пропанол (0,020 мл, 0,209 ммоль) и раствор перемешивают при комнатной температуре в течение 15 минут. Полученный раствор по каплям добавляют к раствору 1-метил-3-(1-{3-[3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-она (75 мг, 0,139 ммоль) и триэтиламина (0,039 мл, 0,279 ммоль) в CH2Cl2 (0,4 мл). Дополнительные 0,15 мл CH2Cl2 используют для переноса всего вещества в реакционную смесь. Реакционную смесь перемешивают в течение ночи. Очистка колоночной хроматографией (диоксид кремния, 2-10% MeOH/CH2Cl2) приводит к получению 93 мг (93%) указанного в заголовке соединения. ТСХ (диоксид кремния, 5% MeOH/CH2Cl2): Rf=0,24. МС (электрораспыление): вычислено для C34H42F3N7O5S 718,3 ([M+H]+); m/z найдено: 718,3.
E. Амид 1-{3-[4-(3-метил-2-оксо-2, 3-дигидробензимидазол-1-ил)пиперидин-1-ил]пропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-сульфоновой кислоты
(N-трет-Бутоксикарбонил)амид 1-{3-[4-(3-метил-2-оксо-2,3-дигидробензимидазол-1-ил)пиперидин-1-ил]пропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-сульфоновой кислоты (75 мг, 0,105 ммоль) растворяют в трифторуксусной кислоте (0,75 мл) и CH2Cl2 (0,75 мл). Реакционную смесь перемешивают в течение 2 часов, концентрируют, разбавляют CH2Cl2 (25 мл) и промывают насыщенным раствором NaHCO3. Органическую фазу сушат над Na2SO4, концентрируют и очищают гель-хроматографией на силикагеле (5-10% MeOH/CH2Cl2) с получением амида 1-{3-[4-(3-метил-2-оксо-2,3-дигидробензимидазол-1-ил)пиперидин-1-ил]пропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-сульфоновой кислоты (15 мг, 23%). МС (электрораспыление): вычислено для C29H34F3N7O3S 618,2 ([M+H]+); m/z найдено: 618,2. 1H ЯМР (400 МГц, CDCl3): 7,72 (д, J=8,2 Гц, 2H), 7,63 (д, J=8,2 Гц, 2H), 7,22 (уш.с, 1H), 7,04-7,11 (м, 2H), 6,95-7,00 (м, 1H), 5,02 (уш.с, 1H), 4,53 (с, 1H), 4,08-4,36 (м, 3H), 3,68 (уш.т, J=5,9 Гц, 2H), 3,38 (с, 3H), 2,95-3,01 (м, 2H), 2,41-2,70 (м, 4H), 2,11-2,34 (м, 4H), 1,52-1,94 (м, 6H).
ПРИМЕР 28

5-Хлор-3-(1-{2-гидрокси-3-[4-пиридин-4-ил-3-(4-трифторметилфенил)пиразол-1-ил]пропил}пиперидин-4-ил)-1-метил-1,3-дигидробензимидазол-2-он
A. 4-[1-Оксиранилметил-3-(4-трифторметилфенил)-1Н-пиразол-4-ил]пиридин
К раствору 4-[3-(4-трифторметилфенил)-1H-пиразол-4-ил]пиридина (0,5 г, 1,73 ммоль) и эпихлоргидрина (1,35 мл, 17,3 ммоль) в ДМФА (2 мл) добавляют карбонат цезия (0,676 г, 2,07 ммоль). Реакционную смесь перемешивают в течение 24 часов, разбавляют EtOAc и последовательно промывают насыщенным раствором NaHCO3, водой и насыщенным раствором соли. Органическую фазу сушат над Na2SO4, концентрируют и частично очищают, пропуская через силикагель (5% ацетон/CH2Cl2) с получением 4-[1-оксиранилметил-3-(4-трифторметилфенил)-1H-пиразол-4-ил]-пиридина (0,198 г, 33%) в виде нестабильного масла. ТСХ (диоксид кремния, 20% ацетон/CH2Cl2): Rf=0,39. МС (электрораспыление); найдено: точное значение массы для C18H14F3N3O 346,1 [M+H]+, m/z найдено: 346,1.
B. 5-Хлор-3-(1-{2-гидрокси-3-[4-пиридин-4-ил-3-(4-трифторметилфенил)пиразол-1-ил]пропил}пиперидин-4-ил)-1-метил-1,3-дигидробензоимидазол-2-он
К раствору 4-[1-оксиранилметил-3-(4-трифторметилфенил)-1H-пиразол-4-ил]пиридина (68 мг, 0,197 ммоль) и 5-хлор-1-метил-3-пиперидин-4-ил-1,3-дигидробензимидазол-2-она (0,055 г, 0,207 ммоль) в EtOH (1 мл) добавляют триэтиламин (0,027 мл, 0,197 ммоль). Реакционную смесь нагревают до 80°C, выдерживают при этой температуре в течение ночи, концентрируют и очищают колоночной хроматографией (диоксид кремния, 2-10% MeOH/CH2Cl2) с получением указанного в заголовке соединения (0,026 г, 22%). МС (электрораспыление); вычислено: точное значение массы для C31H30ClF3N6O2 611,2 [M+H]+, m/zнайдено: 611,2.1H ЯМР (400 МГц, CDCl3): 8,59 (уш.с, 2H), 8,20 (с, 1H), 7, 67 (д, J=8,2 Гц, 2H), 7,61 (д, J=5,9 Гц, 2H), 7,55 (д, J=8,2 Гц, 2H), 7,35 (уш.с, 1H), 7,09 (дд, J=8,2, 1,8 Гц, 1H), 6,89 (д, J=8,2 Гц, 1H), 4,55-4,60 (м, 2H), 4,39 (д, J=14,2, 4,1 Гц, 1H), 4,31 (д, J=14,2, 6,1 Гц, 1H), 3,80-3,90 (м, 2H), 3,37 (с, 3H), 3,18-3,33 (м, 2H), 3,02-3,17 (м, 2H), 2,77-2,95 (м, 2H), 1,99 (т, J=12,4 Гц, 2H).
ПРИМЕР 29

4-(1-{2-Гидрокси-3-[4-пиразин-2-ил-3-(4-трифторметилфенил)пиразол-1-ил]пропил}пиперидин-4-ил)-4H-бензо[1,4]оксазин-3-он
A. трет-Бутиловый эфир 4-(2-гидроксифениламино)пиперидин-1-карбоновой кислоты
2-Аминофенол (15,0 г, 137 ммоль) и трет-бутиловый эфир 4-оксопиперидин-1-карбоновой кислоты (27,4 г, 138 ммоль) при перемешивании при комнатной температуре добавляют в CH2Cl2 (200 мл). Небольшими частями в течение 10 минут добавляют триацетоксиборогидрид натрия (40,8 г, 193 ммоль) и затем уксусную кислоту (7,8 мл, 136 ммоль). По истечении 18 часов добавляют насыщенный раствор NaHCO3, органическую часть отделяют, сушат (MgSO4) и выпаривают с получением 36,4 г (91%) продукта в виде твердого вещества бежевого цвета. ТСХ (диоксид кремния, 50% EtOAc/гексаны): Rf=0,56. МС (электрораспыление); вычислено: точное значение массы для C16H24 N2O3, 292,18; m/z найдено: 315,1 [M+Na]+.1H ЯМР (400 МГц, CDCl3): 9,20 (с, 1H), 6,80-6,50 (м, 3H), 6,40 (т, J=6,1 Гц, 1H), 4,30 (д, J=8,7 Гц, 1H), 3,88 (д, J=12,6 Гц, 2H), 3,45-3,35 (м, 1H), 3,00-2,75 (уш.с, 2H), 1,88 (д, J=10,5 Гц, 2H), 1,40 (с, 9H), 1,30-1,20 (м, 2H).
B. трет-Бутиловый эфир 4-(2-этоксикарбонилметоксифениламино)пиперидин-1-карбоновой кислоты
Смесь NaH (1,56 г, 65 ммоль) в ТГФ (100 мл) при перемешивании охлаждают до 5°C. К полученной смеси по каплям в течение 30 минут добавляют трет-бутиловый эфир 4-(2-гидроксифениламино)пиперидин-1-карбоновой кислоты (17,5 г, 60 ммоль) в ТГФ (100 мл). По истечении 2 часов добавляют этилбромацетат (7,3 мл, 66 ммоль) и полученную смесь перемешивают при комнатной температуре в течение 24 часов. После этого добавляют насыщенный раствор NH4Cl (100 мл) и органическую часть выпаривают. Водный слой экстрагируют EtOAc (2×150 мл). Органические фракции объединяют, сушат (MgSO4) и выпаривают с получением 24 г продукта в виде прозрачной красной жидкости. Жидкость очищают (диоксид кремния, 5% ацетон/CH2Cl2) с получением 21,4 г (94%) прозрачной оранжевой жидкости. ТСХ (диоксид кремния, 5% ацетон/CH2Cl2): Rf=0,48. МС (электрораспыление); вычислено: точное значение массы для C20H30N2O5 378,22; m/zнайдено: 379,2 [M+H]+.1H ЯМР (400 МГц, ДМСО): 7,02 (м, 1H), 6,90-6,70 (м, 3H), 4,74 (с, 2H), 4,37 (кв, J=7,1 Гц, 2H), 4,13 (уш.с, 2H), 3,60-3,50 (м, 1H), 3,08 (м, 2H), 2,16 (м, 2H), 1,60-1,50 (м, 2H), 1,58 (с, 9H), 1,41 (т, J=7,1 Гц, 3H).
C. трет-Бутиловый эфир 4-(2-карбоксиметоксифениламино)пиперидин-1-карбоновой кислоты
трет-Бутиловый эфир 4-(2-этоксикарбонилметоксифениламино)пиперидин-1-карбоновой кислоты (21,4 г, 56,5 ммоль) при перемешивании добавляют к MeOH (150 мл). К полученной смеси добавляют раствор NaOH (4,5 г, 112,5 ммоль) в воде (150 мл). По истечении 3 часов смесь подкисляют до pH 4 добавлением 6 N HCl. MeOH удаляют под пониженным давлением, водный слой экстрагируют EtOAc (2×150 мл). Органические фракции объединяют, сушат (MgSO4) и выпаривают с получением 20 г (100%) продукта в виде твердого вещества коричневого цвета. МС (электрораспыление); вычислено: точное значение массы для C18H26N2O5350,18; m/z найдено: 351,2 [M+H]+.
D. трет-Бутиловый эфир 4-(3-оксо-2,3-дигидробензо[1, 4]оксазин-4-ил)пиперидин-1-карбоновой кислоты
трет-Бутиловый эфир 4-(2-карбоксиметоксифениламино)пиперидин-1-карбоновой кислоты (22 г, 63 ммоль) при перемешивании добавляют к CH2Cl2 (200 мл). К полученной смеси одной порцией добавляют EDC (13 г, 68 ммоль). Спустя 30 минут добавляют 1 N HCl. Органическую фракцию отделяют, сушат (MgSO4) и выпаривают с получением 17 г (81%) продукта в виде прозрачного коричневого масла. ТСХ (диоксид кремния, 5% ацетон/CH2Cl2): Rf=0,45. МС (электрораспыление); вычислено: точное значение массы для C18H24N2O4 332,17; m/z найдено: 259,1 [M-BOC+H]+.1H ЯМР (400 МГц, CDCl3): 7,30-7,20 (м, 1H), 7, 15-7,10 (м, 3H), 4,61 (с, 2H), 4,60-4,45 (м, 1H), 4,45-4,30 (уш.с, 2H), 2,88 (т, J=12,5 Гц, 2H), 2,65 (дд, J=12,6, 4,5 Гц, 2H), 1,87 (д, J=12,4 Гц, 2H), 1,60 (с, 9H).
E. 4-Пиперидин-4-ил-4H-бензо[1,4]оксазин-3-он
трет-Бутиловый эфир 4-(3-оксо-2,3-дигидробензо[1,4]оксазин-4-ил)пиперидин-1-карбоновой кислоты (17 г, 51 ммоль) и смесь ТФУК/CH2Cl2 (1:1) (40 мл) объединяют и перемешивают в течение 45 минут. После этого смесь выпаривают с получением прозрачного коричневого масла. Масло при перемешивании добавляют к Et2O (300 мл). Образующийся осадок отфильтровывают, промывают Et2O и сушат на воздухе с получением 16 г продукта (90%) в виде твердого светло-бежевого вещества. МС (электрораспыление); вычислено: точное значение массы для C13H16N2O2 232,12; m/z найдено: 233,1 [M+H]+.1H ЯМР (400 МГц, CD3OD): 7,44 (дд, J=6,5, 1,4 Гц, 1H), 7,20-7,10 (м, 3H), 4,58 (с, 2H), 4,55-4,45 (м, 1H), 4,65-4,55 (м, 2H), 3,27 (дт, J=13,0, 2,3 Гц, 2H), 3,05 (дд, J=12,3, 4,1 Гц, 2H), 2,15 (д, J=13,8 Гц, 2H).
F. 2-[1-Оксиранилметил-3-(4-трифторметилфенил)-1Н-пиразол-4-ил]пиразин.
К раствору 2-[3-(4-трифторметилфенил)-1Н-пиразол-4-ил]пиразина (200 мг, 0,69 ммоль) и эпихлоргидрина (0,540 мл, 6,9 ммоль) в ДМФА (2 мл) добавляют карбонат цезия (450 мг, 1,38 ммоль). Реакционную смесь перемешивают в течение 24 часов, разбавляют EtOAc и промывают насыщенным раствором NaHCO3, водой и насыщенным раствором соли. Органическую фазу сушат над Na2SO4, концентрируют и очищают колоночной хроматографией (диоксид кремния, 5% ацетон/CH2Cl2) с получением 2-[1-оксиранилметил-3-(4-трифторметилфенил)-1H-пиразол-4-ил]пиразина (141 мг, 59%). ТСХ (диоксид кремния, 20% ацетон/CH2Cl2): Rf=0, 38. МС (электрораспыление); m/z: вычислено для C17H13F3N4O, M++H 347,1; найдено 347,1.1H ЯМР (400 МГц, CDCl3): 8,51 (дд, J=2,8, 1,8 Гц, 1H), 8,45 (д, J=1,5 Гц, 1H), 8,38 (д, J=12,8 Гц, 1H), 8,01 (с, 1H), 7,66 (д, J=8,6 Гц, 1H), 7,62 (д, J=8,6 Гц, 1H), 4,57 (дд, J=14,7, 3,1 Гц, 1H), 4,21 (дд, J=14,7, 6,1 Гц, 1H), 3,44 (м, 1H), 2,91 (т, J=4,5 Гц, 1H), 2,62 (дд, J=4,0, 2,5 Гц, 1H).
G. 4-(1-{2-Гидрокси-3-[4-пиразин-2-ил-3-(4-трифторметилфенил)пиразол-1-ил]пропил}пиперидин-4-ил)-4H-бензо[1,4]оксазин-3-он
К раствору 2-[1-оксиранилметил-3-(4-трифторметилфенил)-1H-пиразол-4-ил]пиразина (76 мг, 0,220 ммоль) и 4-пиперидин-4-ил-4H-бензо[1,4]оксазин-3-она (61 мг, 0,231 ммоль) в EtOH (1,1 мл) добавляют триэтиламин (0, 031 мл, 0,220 ммоль). Реакционную смесь нагревают до 80°C и выдерживают при этой температуре в течение ночи, затем концентрируют и очищают колоночной хроматографией (диоксид кремния, 5-10% MeOH/CH2Cl2) с получением 4-(1-{2-гидрокси-3-[4-пиразин-2-ил-3-(4-трифторметилфенил)пиразол-1-ил]пропил}пиперидин-4-ил)-4H-бензо[1,4]оксазин-3-она (27 мг, 21%). ТСХ (диоксид кремния, 5% MeOH/CH2Cl2): Rf=0,09. МС (электрораспыление); m/z: вычислено для C30H29F3N6O3, M++H 579, 2; найдено: 579,2.1H ЯМР (400 МГц, CDCl3): 8,53 (с, 1H), 8,48 (с, 1H), 8,40 (с, 1H), 8,11 (с, 1H), 7,73 (д, J=8,2 Гц, 2H), 7,63 (д, J=8,2 Гц, 2H), 7,16 (д, J=5,4 Гц, 1H), 7,00-7, 03 (м, 3H), 4,49 (с, 2H), 4,39 (д, J=10,8 Гц, 1H), 3,13 (д, J=11,9 Гц, 1H), 2,96 (д, J=11,9 Гц, 1H), 2,59-2,80 (м, 2H), 2,40-2,55 (м, 3H), 2,17 (т, J=11,9 Гц, 1H), 1,77 (д, J=11,9 Гц, 2H).
ПРИМЕР 30

(S)-1-(1-{2-Гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-3-метил-1,3-дигидробензимидазол-2-он
A. трет-Бутиловый эфир 4-(2-оксо-2,3-дигидробензимидазол-1-ил)пиперидин-1-карбоновой кислоты
1-Пиперидин-4-ил-1,3-дигидробензимидазол-2-он (7,24 г, 34,1 ммоль) и ди-трет-бутилдикарбонат (9,12 г, 41,0 ммоль) объединяют в ДМФА (80 мл), смесь нагревают 40°C под атмосферой N2 и выдерживают в этих условиях в течение 17 часов. Смеси дают охладиться, разбавляют EtOAc (800 мл) и промывают насыщенным раствором NaHCO3 (150 мл), H2O (3×150 мл) и насыщенным раствором соли (150 мл). Объединенные водные фазы экстрагируют EtOAc (2×150 мл). Объединенные экстракты сушат над Na2SO4 и концентрируют с получением трет-бутилового эфира 4-(2-оксо-2,3-дигидробензимидазол-1-ил)пиперидин-1-карбоновой кислоты (12,36 г, 94%). ТСХ (диоксид кремния, 50% EtOAc/гексаны): Rf=0,3. МС (электрораспыление); вычислено: точное значение массы для C17H23N3O3 340,16; m/z найдено: 340,1 [M+Na]+.1H ЯМР (CDCl3, 400 МГц): 10,59 (с, 1H), 7,15-7,11 (м, 2H), 7,08-7,02 (м, 2H), 4,49 (тт, J=8,4, 4,0 Гц, 1H), 4,32 (уш.с, 2H), 2,89 (уш.т, J=11,6, 2H), 2,34 (дкв, J=12,6, 4,4 Гц, 2H), 1,83 (уш.д, J=10,5 Гц, 2H) 1,36 (с, 9H).
B. 1-Метил-3-пиперидин-4-ил-1,3-дигидробензимидазол-2-он
К раствору трет-бутилового эфира 4-(2-оксо-2,3-дигидробензимидазол-1-ил)пиперидин-1-карбоновой кислоты (6,64 г, 20,2 ммоль) в ТГФ (20 мл) с помощью канюли добавляют раствор KHMDS (5,07 г, 25, 4 ммоль) в ТГФ (40 мл плюс 10 мл для смыва). Смесь перемешивают в течение 25 минут, после этого добавляют йодметан (5,2 мл, 84 ммоль). Полученную смесь перемешивают в течение 45 минут, затем разбавляют EtOAc (700 мл). Этилацетатный слой промывают H2O (3×200 мл), насыщенным раствором NaHCO3 (150 мл) и насыщенным раствором соли (150 мл). Объединенные водные фракции экстрагируют EtOAc (2×150 мл). Объединенные экстракты сушат над Na2SO4 и концентрируют. Неочищенную реакционную смесь очищают колоночной хроматографией (диоксид кремния, 15-60% EtOAc/гексаны) с получением метилированного аддукта (5,21 г, 78%). Очищенный продукт растворяют в смеси CH2Cl2 (40 мл) и ТФУК (35 мл). Смесь перемешивают в течение 4 часов, затем концентрируют в вакууме. Остаток растворяют в CH2Cl2 (300 мл) и промывают насыщенным раствором NaHCO3 (100 мл). Водный слой экстрагируют 5% MeOH/CH2Cl2 (4×150 мл). Объединенные экстракты сушат над Na2SO4 и концентрируют с получением указанного в заголовке соединения (3,85 г, содержащие неорганические соли), которое пригодно для дальнейшего использования. ТСХ (диоксид кремния, 5% MeOH/CH2Cl2) Rf=0,1. МС (электрораспыление); вычислено: точное значение массы для C13H18N3O 232,14; m/z найдено: 232,1 [M+H]+.1H ЯМР (CDCl3, 400 Гц): 7,27-7,29 (м, 1H), 7,05-7,12 (м, 2H), 6,99 (дд, J=6,1, 2,1 Гц, 1H), 4,45 (тт, J=12,5, 4,2 Гц, 1H), 3,42 (с, 3H), 3,27 (дд, J=10,2, 2,1 Гц, 2H), 2,81 (дт, J=2,4, 12,4 Гц, 2H), 2,35 (дкв, J=12,5, 4,2 Гц, 2H), 2,26 (уш.с, 1H), 1,83 (дд, J=12,1, 2,1 Гц, 2H).
C. (R)-трет-Бутилдиметилоксиранилметоксисилан
трет-Бутилхлордиметилсилан (12,9 г, 85,5 ммоль) и затем Et3N (19 мл, 136 ммоль) добавляют к раствору (S)-(+)глицидола (5,0 г, 67 ммоль) в CH2Cl2 (200 мл), охлажденному до 0°C. Полученной смеси дают нагреться до 23°C и перемешивают в течение 17 часов. Полученный раствор розового цвета разбавляют Et2O (800 мл) и перемешивают еще 30 минут. Слой Et2O промывают насыщенным водным раствором NaHCO3 (200 мл), H2O (2×100 мл), насыщенным раствором соли (100 мл), сушат над Na2SO4 и концентрируют. Очистка колоночной хроматографией (диоксид кремния, 5-10% Et2 O/гексаны) приводит к получению (R)-трет-бутилдиметилоксиранилметоксисилана (10,01 г, 79%). ТСХ (диоксид кремния, 10% Et2O/гексаны): Rf=0,5.1H ЯМР (CDCl3, 400 МГц): 3,85 (дд, J=11,9, 3,2 Гц, 1H), 3,66 (дд, J=11,9, 4,8 Гц, 1H), 3,09 (м, 1H), 2,77 (дд, J=5,0, 4,2 Гц, 1H), 2,64 (дд, J=5,2, 2,7 Гц, 1H), 0,90 (с, 9H), 0,08 (с, 3H), 0,07 (с, 3H).
D. (R)-3-[5-Метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропан-1,2-диол
К раствору (R)-трет-бутилдиметилоксиранилметоксисилана (2,72 г, 14,4 ммоль) и 5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидро-1Н-пиразоло[4,3-c]пиридина (1,70 г, 4,81 ммоль) в ДМФА (13 мл) добавляют Cs2CO3 (1,88 г, 5,77 ммоль). Смесь перемешивают при комнатной температуре в течение 5 дней, затем распределяют между EtOAc (400 мл) и насыщенным раствором NaHCO3 (100 мл). Слой EtOAc промывают H2O (3x75 мл) и насыщенным раствором соли (100 мл), сушат над Na2SO4 и концентрируют. Остаток растворяют в MeOH (125 мл) и обрабатывают CSA (800 мг). Смесь перемешивают в течение 20 часов, затем концентрируют. Остаток снова растворяют в EtOAc (200 мл), промывают насыщенным раствором NaHCO3 (100 мл), сушат над Na2 SO4 и концентрируют. Очистка колоночной хроматографией (диоксид кремния, 20-60% ацетон/CH2C2) приводит к получению соответствующего диола (0,78 г, 40%). ТСХ (25% ацетон/CH2Cl2): Rf=0,2. МС (электрораспыление); вычислено: точное значение массы для C17H21F3N3O4S420,11; m/z найдено: 420,1 [M+H]+.1H ЯМР (CD3OD/CDCl3, 400 МГц): 7,74 и 7,67 (A и В из AA'BB', Jab=8,3 Гц, 4H), 4,52 (с, 2H), 4,23 (дд, J=13,0, 3,0 Гц, 1H), 4,04-4,11 (м, 2H), 3,64 (т, J=5,9 Гц, 2H), 3,52 и 3,57 (A и В из ABX, Jab=11,4, Jax=4,8, Jbx=4,9 Гц, 2H), 2,98 (м, 2H), 2,91 (с, 3H).
E. (R)-5-Метансульфонил-1-оксиранилметил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидро-1Н-пиразоло[4,3-c]пиридин
PpTs (271 мг, 1,1 ммоль) и (R)-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропан-1,2-диол (317 мг, 0,756 ммоль) добавляют в триметилортоацетат (30 мл). Смесь перемешивают в течение 18 часов, затем разбавляют EtOAc (125 мл), промывают насыщенным раствором NaHCO3 (2×50 мл), насыщенным раствором соли (50 мл), сушат над Na2SO4 и концентрируют. Очистка хроматографией (диоксид кремния, 100% EtOAc) приводит к получению соответствующего ортоацетата (313 мг, 0,678 ммоль). Очищенный ортоацетат растворяют в CH2Cl2 (2,25 мл), охлаждают до 0°C и обрабатывают MeOH (25 мкл) и AcBr (110 мкл, 1,48 ммоль). Смеси дают нагреться в течение 3 часов, затем распределяют между EtOAc (50 мл) и насыщенным раствором NaHCO3(20 мл). Слой EtOAc промывают насыщенным раствором NaHCO3(2×20 мл). Объединенные водные фракции экстрагируют EtOAc (3×20 мл). Объединенные экстракты сушат над Na2SO4 и концентрируют. Остаток растворяют в EtOH (40 мл) и обрабатывают KOEt (1,0 мл, 40 мас.%) раствор в EtOH). Спустя 1 час смесь концентрируют до объема ˜20 мл и снова обрабатывают, как описано выше. Очистка колоночной хроматографией (диоксид кремния, 100% EtOAc) приводит к получению эпоксида (189 мг, 62%). ТСХ (100% EtOAc): Rf=0,35. МС (электрораспыление); вычислено: точное значение массы для C17H19F3N3O3S 402,10; m/z найдено: 402,1 [M+H]+.1H ЯМР (CDCl3, 400 МГц): 7,72 и 7,67 (A и В из AA'BB', Jab=8,3 Гц, 4H), 4,57 и 4,53 (A и В из AB, Jab=12,9 Гц, 2H), 4,52 (дд, J=15,2, 2,7 Гц, 1H), 4,12 (дд, J=15,2, 5,4 Гц, 1H), 3,67 (м, 2H), 3,36 (м, 1H), 2,92 (м, 2H), 2,88 (с, 3H), 2,85 (дд, J=4,4, 4,3 Гц, 1H), 2,49 (дд, J=4,6, 2,6 Гц, 1H).
F. (S)-1-(1-{2-Гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-3-метил-1,3-дигидробензимидазол-2-он
Раствор (R)-5-метансульфонил-1-оксиранилметил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидро-1H-пиразоло[4,3-c]пиридина (134 мг, 0,334 ммоль) и 1-метил-3-пиперидин-4-ил-1,3-дигидробензимидазол-2-она (110 мг, 0, 476 ммоль) в EtOH (0,8 мл) и дихлорэтане (0,8 мл) нагревают до 80°C и выдерживают при этой температуре в течение 18 часов. Затем смесь концентрируют и остаток очищают колоночной хроматографией (диоксид кремния, 0-50% ацетон/CH2Cl2) с получением указанного в заголовке соединения (134 мг, 86%). ТСХ (20% ацетон/CH2Cl2): Rf=0,3. МС (электрораспыление): вычислено для C30H36F3N6O4S [M+H]+ 633,24; m/z найдено: 633,3.1H ЯМР (CDCl3, 400 МГц): 7, 72 и 7,66 (A и В из AA'BB', Jab=8,3 Гц, 4H), 7,15 (дд, J=7,0, 1,7 Гц, 1H), 7,08 (м, 2H), 6,98 (дд, J=6,6, 1,8 Гц, 1H), 4,60 и 4,55 (A и В из AB, Jab=14,5 Гц, 2H), 4,34 (м, 1H), 4, 23 (дд, J=13,8, 2,8 Гц, 1H), 4,15 (м, 1H), 4,23 (дд, J=13,8, 6,6 Гц, 1H), 3,71 (м, 2H), 3,40 (с, 3H), 3,08 (м, 2H), 2,96 (м, 2H), 2,89 (с, 3H), 2,56-2,36 (м, 4H), 2,23 (д, J=11,6 Гц, 1H), 1,81 (м, 2H).
ПРИМЕР 31

(S)-5-Диметиламино-3-(1-{2-гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1-метил-1,3-дигидроимидазо[4,5-b]пиридин-2-он
A. трет-Бутиловый эфир 4-(6-хлор-3-нитропиридин-2-иламино)пиперидин-1-карбоновой кислоты
Раствор 20 г (0,10 моль) 2,6-дихлор-3-нитропиридина в ДМФА (245 мл) при перемешивании охлаждают до 0°C. Спустя 5 минут добавляют 9,87 г (0,05 моль) трет-бутиловый эфир 4-аминопиперидин-1-карбоновой кислоты и 6,8 г (0,05 моль) K2CO3 с получением суспензии. Смесь перемешивают в течение 5 часов при 0°C. После этого смесь распределяют между водой (300 мл) и EtOAc (400 мл). Затем водный слой экстрагируют EtOAc (5×400 мл). Органическую фазу сушат над безводным Na2SO4 и концентрируют с получением продукта в виде масла коричневого цвета. Продукт очищают с помощью хроматографии на силикагеле (диоксид кремния, 100% CH2Cl2, затем 10% EtOAc/гексаны) с получением 8,99 г (51%) желаемого продукта в виде твердого вещества ярко-желтого цвета. МС (электрораспыление); вычислено: точное значение массы для C15H21ClN4O4 356,13; m/z найдено: 379,1 [M+Na]+.1H ЯМР (400 МГц, CDCl3): 8,36 (д, J=8,4 Гц, 1H), 8,27 (д, J=7,3 Гц, 1H), 6,62 (д, J=8,4 Гц, 1H), 4,38-4,26 (м, 1H), 4,14-3,96 (м, 2H), 3,01 (т, J=11,6 Гц, 2H), 2,05 (дд, J=12,4 Гц, 3,03 Гц, 2H), 1,58-1,44 (м, 2H), 1,47 (с, 9H).
B. трет-Бутиловый эфир 4-(6-диметиламино-3-нитропиридин-2-иламино)пиперидин-1-карбоновой кислоты
К раствору 6 г (0,016 моль) трет-бутилового эфира 4-(6-хлор-3-нитропиридин-2-иламино)пиперидин-1-карбоновой кислоты в MeOH/CH2Cl2 (84 мл/15 мл) добавляют 2,2 г (0,05 моль) диметиламина в ТГФ (25 мл). Реакционную смесь перемешивают при комнатной температуре в течение 16 часов и затем концентрируют. Неочищенный продукт растворяют в CH2Cl2 (400 мл) и промывают насыщенным раствором NaHCO3(2×200 мл). Водные фазы объединяют и экстрагируют EtOAc (100 мл). Объединенные органические фракции сушат над Na2SO4и концентрируют с получением 6,1 г (99%) желаемого продукта в виде твердого вещества ярко-желтого цвета. МС (электрораспыление); вычислено: точное значение массы для C17H27N5O4 365,21; m/z найдено: 388,19 [M+Na]+.1H ЯМР (400 МГц, CDCl3): 8,74 (д, J=7,07 Гц, 1H), 8,18 (д, J=9,4 Гц, 1H), 5,97 (д, J=7,3 Гц, 1H), 4,28-4,16 (м, 1H), 4,07-3,93 (м, 2H), 3,17 (с, 6H), 3, 01 (т, J=11,9 Гц, 2H), 2,05 (дд, J=12,4 Гц и 3,03 Гц, 2H), 1,60-1,50 (м, 2H), 1,47 (с, 9H).
C. трет-Бутиловый эфир 4-(5-диметиламино-1-метил-2-оксо-1, 2-дигидроимидазо[4,5-b]пиридин-3-ил)пиперидин-1-карбоновой кислоты
Раствор 5,3 г (0,014 моль) трет-бутилового эфира 4-(6-диметиламино-3-нитропиридин-2-иламино)пиперидин-1-карбоновой кислоты в смеси метанол/EtOAc (73 мл/15 мл) при перемешивании дегазируют. К раствору добавляют 10% Pd/C (1,17 г, 0,5 ммоль) добавляют в виде суспензии в EtOH (5 мл) и затем формиат аммония (4,5 г, 0,073 моль). Смесь перемешивают при комнатной температуре в течение 3 часов. После этого реакционную смесь фильтруют через целит и фильтрат концентрируют, получая масло пурпурного цвета. Остаток растворяют в ТГФ (73 мл), к полученному раствору добавляют 11,7 г (0,073 моль) CDI, реакционную смесь нагревают до 98°C и перемешивают в течение 16 часов. Затем смесь охлаждают и концентрируют. Неочищенный продукт распределяют между EtOAc (800 мл) и NaHCO3 (100 мл), органический слой промывают водой (5× 100 мл) и NaCl (100 мл). Объединенные водные фракции снова экстрагируют EtOAc (150 мл). Органические фракции объединяют, сушат над Na2SO4 и концентрируют. Остаток (2,4 г) растворяют в ТГФ (73 мл). К полученному раствору добавляют KHMDS (3,46 г, 0,017 моль) и йодметан (10,3 г, 0,072 моль) и смесь перемешивают в течение 20 минут. После этого растворитель выпаривают и неочищенный продукт распределяют между EtOAc (600 мл) и NaHCO3(200 мл). Органический слой промывают NaHCO3(150 мл), сушат над Na2SO4 и концентрируют. Очистка флэш-хроматографией (диоксид кремния, 80% EtOAc/гексаны) приводит к получению 2,4 г (67% выход после трех стадий, из расчета на использование 2/3 материала на стадии метилирования) желаемого продукта в виде твердого белого вещества. МС (электрораспыление); вычислено: точное значение массы для C19H29N5O3 375,23; m/z найдено: 276,17 [M+H-100]+.1H ЯМР (400 МГц, CDCl3): 7,02 (д, J=8,6 Гц, 1H), 6,15 (д, J=8,6 Гц, 1H), 4,46 (тт, J=12,0 Гц и 4,0 Гц, 1H), 4,38-4,11(м, 2H), 3,33 (с, 3H), 3,01 (с, 6H), 2,95-2,73 (м, 2H), 2,73-2,55 (м, 2H), 1,77-1,61 (м, 2H), 1,47 (с, 9H).
D. 5-Диметиламино-1-метил-3-пиперидин-4-ил-1,3-дигидроимидазо[4,5-b]пиридин-2-он
К раствору 1,7 г (0,0028 моль) трет-бутилового эфира 4-(5-диметиламино-1-метил-2-оксо-1,2-дигидроимидазо[4,5-b]пиридин-3-ил)пиперидин-1-карбоновой кислоты в CH2Cl2 (7 мл) добавляют 7 мл ТФУК. Спустя 35 минут растворитель удаляют. Остаток распределяют между EtOAc (200 мл) и 1 NNaOH (150 мл). Водный слой экстрагируют EtOAc (3×100 мл), объединенные органические фракции сушат над Na2SO4 и концентрируют с получением 0,74 г (96%) 5-диметиламино-1-метил-3-пиперидин-4-ил-1,3-дигидроимидазо[4,5-b]пиридин-2-она в виде твердого вещества бело-розового цвета.1H ЯМР (400 МГц, CDCl3): 6,95 (д, J=8,3 Гц, 1H), 6,08 (д, J=8,3 Гц, 1H), 4,35 (тт, J=12,1 Гц, 4,0 Гц, 1H), 3,25 (с, 3H), 3,14 (д, J=12,4 Гц, 2H) 2,97 (с, 6H), 2,66 (тд, J=12,9 Гц, 1,3 Гц, 2H), 2,53 (квд, J=12,4 Гц, 4,0 Гц, 2H), 1,69 (д, J=11,9 Гц, 2H).
E. (S)-5-Диметиламино-3-(1-{2-гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)метил-1,3-дигидроимидазо[4,5-b]пиридин-2-он
К раствору 0,24 г (0,0009 моль) 5-диметиламино-1-метил-3-пиперидин-4-ил-1,3-дигидроимидазо[4,5-b]пиридин-2-она в смеси EtOH/дихлорэтан (1,5 мл/1,5 мл) при перемешивании добавляют 0,23 г (0,0005 моль) (R)-5-метансульфонил-1-оксиранилметил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидро-1H-пиразоло[4,3-c]пиридина. Реакционную смесь нагревают до 80°C, перемешивают при этой температуре в течение 16 часов и затем концентрируют. Неочищенный продукт растворяют в CH2Cl2 (40 мл) и очищают флэш-хроматографией (0-6% MeOH/CH2Cl2) с получением 0,38 г (97%) желаемого продукта в виде твердого белого вещества. МС (электрораспыление), вычислено: точное значение массы для C31H39F3N8O4S, 676,28; m/z найдено: 677,28 [M+H]+.1H ЯМР (400 МГц, CDCl3): 7,71 и 7,67 (A и В из AA'BB' квартета, Jab=8,3 Гц, 4H), 7,03 (д, J=8,6 Гц, 1H), 6,16 (д, J=8,6 Гц, 1H), 4,58 и 4,56 (A и В из AB квартета, Jab=14,5 Гц, 2H), 4,36 (тт, J=12,1 Гц, 4,04 Гц, 1H), 4,25-4,01 (м, 4H), 3,77-3,60 (м, 2H), 3,33 (с, 3H), 3,16-3,04 (м, 2H), 3,03 (с, 6H), 2,99-2,90 (м, 2H), 2,88 (с, 3H), 2,77 (квд, J=12,1 Гц, 3,54 Гц, 2H), 2,56-2,42 (м, 3H), 2,21 (т, J=11,6 Гц, 1H), 1,75 (д, J=11,6 Гц, 2H).
ПРИМЕР 32

1-(1-{2-Гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 33

1-(1-{3-[3-(3,4-Дихлорфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 34

Амид 3-(3,4-дихлорфенил)-1-{3-[4-(2-оксо-2, 3-дигидробензимидазол-1-ил)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 35

6-Хлор-1-(1-{3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1, 3-дигидробензимидазол-2-он
ПРИМЕР 36
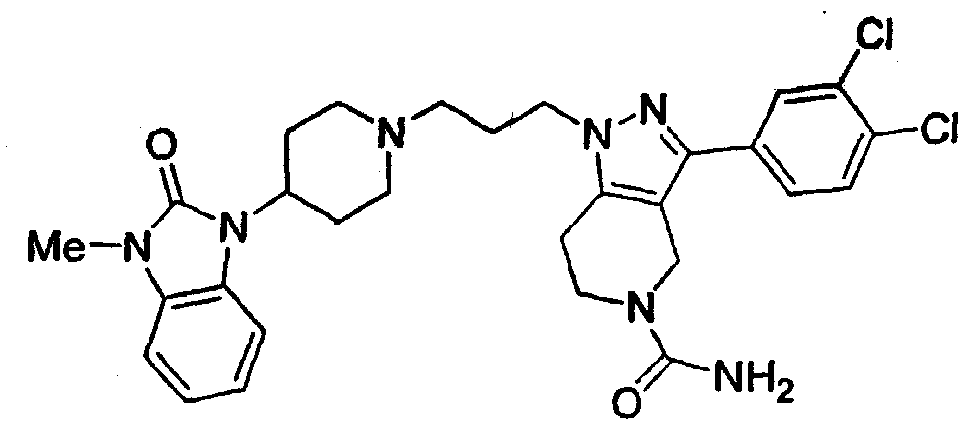
Амид 3-(3, 4-дихлорфенил)-1-{3-[4-(3-метил-2-оксо-2,3-дигидробензимидазол-1-ил)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 37

[3-(1-{2-Гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-2-оксо-2,3-дигидробензимидазол-1-ил)ацетонитрил
ПРИМЕР 38

Этиловый эфир [3-(1-{2-гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-2-оксо-2,3-дигидробензимидазол-1-ил)уксусной кислоты
ПРИМЕР 39

5-Хлор-3-(1-{2-гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1-метил-1, 3-дигидробензимидазол-2-он
ПРИМЕР 40

Амид 1-{3-[4-(6-хлор-3-метил-2-оксо-2,3-дигидробензимидазол-1-ил)пиперидин-1-ил]пропил}-3-(3,4-дихлорфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 41

3-(1-{2-Гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6, 7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1,5-диметил-1,3-дигидробензимидазол-2-он
ПРИМЕР 42

3-(1-{2-Гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-с]пиридин-1-ил]пропил}пиперидин-4-ил)-1, 3-дигидроимидазо[4,5-b]пиридин-2-он
ПРИМЕР 43

3-(1-{3-[3-(4-Бромфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-5-метокси-1,3-дигидроимидазо[4,5-b]пиридин-2-он
ПРИМЕР 44

Амид 3-(4-бромфенил)-1-{2-гидрокси-3-[4-(5-метокси-2-оксо-1,2-дигидроимидазо[4, 5-b]пиридин-3-ил)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 45

3-(1-{2-Гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-5-метокси-1-метил-1,3-дигидроимидазо[4,5-b]пиридин-2-он
ПРИМЕР 46
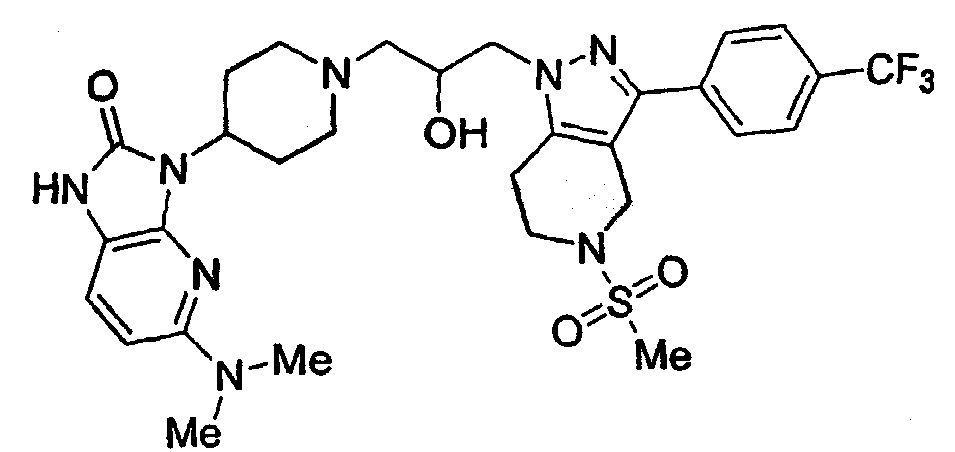
5-Диметиламино-3-(1-{2-гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1, 3-дигидроимидазо[4,5-b]пиридин-2-он
ПРИМЕР 47

6-Хлор-1-(1-{3-[5-Метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1,3-дигидроиндол-2-он
ПРИМЕР 48

1-(1-{2-Гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-3,4-дигидро-1Н-хинолин-2-он
ПРИМЕР 49

4-(1-{3-[5-Метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-4H-бензо[1,4]оксазин-3-он
ПРИМЕР 50

4-(1-{2-Гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6, 7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-4H-бензо[1,4]оксазин-3-он
ПРИМЕР 51

1-(1-{3-[5-Метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-3,4-дигидро-1Н-хиназолин-2-он
ПРИМЕР 52
Биологическое испытание ингибирования катепсина S
Рекомбинантный катепсин S (CatS) человека экспрессируют в бакуловирусной системе и очищают в одну стадию на колонке с тиопропилсефарозой. Из 10 л получают ˜700 мг CatS и концевой N подтверждает его идентичность. Испытание проводят в 100 мМ растворе ацетата натрия с pH 5,0, содержащем 1 мМ DTT и 100 мМ NaCl. Субстрат для испытания представляет собой (Aedens) EKARVLAEAA (Dabcyl) K-амид
Km субстрата равна приблизительно 5 мкМ, но наличие субстратного ингибирования затрудняет кинетический анализ. При использовании 20 мкМ субстрата скорость опыта является линейной при содержании CatS в интервале 1-8 нг в 100 мкл реакционной смеси. При использовании 2 нг/ячейка CatS образование продукта является линейным и дает ˜7-кратный сигнал после 20 минут с потерей лишь 20% субстрата. Первичные испытания проводят гашением реакции по истечении 20 минут с помощью 0,1% SDS с последующим измерением флуоресценции. В других опытах изменения осуществляют каждую минуту в течение 20 минут. Скорость вычисляют из углового коэффициента возрастания содержания продукта и, исходя из нее, вычисляют процент ингибирования (см. таблицы 1, 2 и 3, представленные ниже).
ПРИМЕР 101
1-(1-{3-[5-Метансульфонил-3-(4-трифторметилфенил)-4,5,6, 7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)октагидробензимидазол-2-он
ПРИМЕР 102
1-(1-{3-[5-Ацетил-3-(3,4-дихлорфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)октагидробензимидазол-2-он
ПРИМЕР 103
1-(1-{3-[5-Ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1Н-бензимидазол-2-иловый эфир уксусной кислоты
ПРИМЕР 104
1-(1-{3-[3-(4-Бромфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1H-бензимидазол-2-иловый эфир метансульфоновой кислоты
ПРИМЕР 105
1-(1-{3-[5-Ацетил-3-(3,4-дихлорфенил)-4,5,6, 7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-5-хлор-1,3-дигидроиндол-2-он
ПРИМЕР 106
Амид 1-{3-[4-(5-хлор-2-оксо-2, 3-дигидроиндол-1-ил)пиперидин-1-ил]пропил}-3-(3,4-дихлорфенил)-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-карбоновой кислоты
ПРИМЕР 107
Метиламид 1-{3-[4-(5-хлор-2-оксо-2,3-дигидроиндол-1-ил)пиперидин-1-ил]пропил}-3-(3,4-дихлорфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 108
1-(1-{3-[5-Ацетил-3-(3,4-дихлорфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил)пиперидин-4-ил)-1Н-бензимидазол-2-иловый эфир уксусной кислоты
ПРИМЕР 109
1-(1-{3-[3-(3,4-Дихлорфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1H-бензимидазол-2-иловый эфир метансульфоновой кислоты
ПРИМЕР 110
1-[1-{3-[4-(3,5-Дихлорпиридин-4-иламино)пиперидин-1-ил]-2-гидроксипропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон
ПРИМЕР 111
1-[1-{3-[4-(Бензоксазол-2-илокси)пиперидин-1-ил]-2-гидроксипропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон
ПРИМЕР 112
1-[1-{3-[4-(Бензоксазол-2-иламино)пиперидин-1-ил]-2-гидроксипропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон
ПРИМЕР 113
1-(4-Бензоксазол-2-илпиперидин-1-ил)-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропан-2-ол
ПРИМЕР 114
1-(4-Бензотиазол-2-илпиперидин-1-ил)-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропан-2-ол
ПРИМЕР 115
Амид 1-{3-[4-(5-метил-3-оксо-2,3-дигидробензо[1,4]оксазин-4-ил)пиперидин-1-ил]пропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 116
N-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-N-(3-хлорфенил)бензамид
ПРИМЕР 117
4-(1-{3-[5-Ацетил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-5-метил-4H-бензо[1,4]оксазин-3-он
ПРИМЕР 118
4-(1-{3-[5-Метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-5-метил-4H-бензо[1,4]оксазин-3-он
ПРИМЕР 119
Амид 3-(4-бромфенил)-1-{3-[4-(5-метил-3-оксо-2,3-дигидробензо[1,4]оксазин-4-ил)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 120
4-(1-{3-[5-Ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-5-метил-4H-бензо[1,4]оксазин-3-он
ПРИМЕР 121
4-(1-{3-[3-(4-Бромфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-5-метил-4H-бензо[1,4]оксазин-3-он
ПРИМЕР 122
Амид 3-(4-бромфенил)-1-{3-[4-(6-этансульфонил-3-оксо-2,3-дигидробензо[1,4]оксазин-4-ил)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 123
4-(1-{3-[5-Ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-6-этансульфонил-4H-бензо[1,4]оксазин-3-он
ПРИМЕР 124
4-(1-{3-[3-(4-Бромфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-6-этансульфонил-4H-бензо[1,4]оксазин-3-он
ПРИМЕР 125
1-[1-[3-(4-Бензотиазол-2-илпиперидин-1-ил)-2-гидроксипропил]-3-(4-хлор-3-метилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон
ПРИМЕР 126
1-[1-[3-(4-Бензотиазол-2-илпиперидин-1-ил)-2-гидроксипропил-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон
ПРИМЕР 127
1-(1-{3-[3-(4-Бромфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-6-хлор-3,4-дигидро-1H-хинолин-2-он
ПРИМЕР 128
1-(1-{3-[5-Ацетил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-6-хлор-3,4-дигидро-1H-хинолин-2-он
ПРИМЕР 129
1-(1-{3-[5-Ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-6-хлор-3,4-дигидро-1H-хинолин-2-он
ПРИМЕР 130
1-(1-{3-[3-(4-Бромфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-6-хлор-3,4-дигидро-1H-хиназолин-2-он
ПРИМЕР 131
1-(1-{3-[5-Ацетил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-6-хлор-3,4-дигидро-1H-хиназолин-2-он
ПРИМЕР 132
1-[3-(4-Бромфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-3-[4-(6-хлор-2,2-диоксо-3,4-дигидро-2H-2λ6-2,1, 3-бензотиадиазин-1-ил)пиперидин-1-ил]пропан-2-ол
ПРИМЕР 133
1-[4-(6-Хлор-2,2-диоксо-2,3-дигидро-2λ6-2,1, 3-бензотиадиазол-1-ил)пиперидин-1-ил]-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропан-2-ол
ПРИМЕР 134
1-[1-{3-[4-(6-Хлор-2,2-диоксо-2,3-дигидро-2λ6-2,1,3-бензотиадиазол-1-ил)пиперидин-1-ил]-2-гидроксипропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4, 3-c]пиридин-5-ил]этанон
ПРИМЕР 135
4-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-4Н-1, 4-бензоксазин-3-он
ПРИМЕР 136
1-(1-{3-[5-Метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-3, 4-дигидро-1H-хинолин-2-он
ПРИМЕР 137
1-(1-{3-[3-(4-Бромфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-3, 4-дигидро-1H-хинолин-2-он
ПРИМЕР 138
4-(1-{3-[3-(4-Бромфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-4H-1, 4-бензоксазин-3-он
ПРИМЕР 139
4-(1-{3-[5-Ацетил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-4H-1, 4-бензоксазин-3-он
ПРИМЕР 140
1-(1-{3-[5-Ацетил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-3, 4-дигидро-1Н-хинолин-2-он
ПРИМЕР 141
трет-Бутиловый эфир 1-{2-гидрокси-3-[4-(2-оксо-3,4-дигидро-2H-хинолин-1-ил)пиперидин-1-ил]пропил}-3-(4-трифторметилфенил)-1,4,6, 7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 142
трет-Бутиловый эфир 1-{2-гидрокси-3-[4-(3-оксо-2,3-дигидро-1, 4-бензоксазин-4-ил)пиперидин-1-ил]пропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 143
4-(1-{3-[3-(4-Бромфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-6-хлор-4H-1,4-бензоксазин-3-он
ПРИМЕР 144
4-(1-{3-[3-(4-Бромфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-4H-1,4-бензоксазин-3-он
ПРИМЕР 145
1-(1-{3-[3-(4-Бромфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-3,4-дигидро-1H-хинолин-2-он
ПРИМЕР 146
трет-Бутиловый эфир 1-{3-[4-(2-оксо-3,4-дигидро-2H-хинолин-1-ил)пиперидин-1-ил]пропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 147
трет-Бутиловый эфир 1-{3-[4-(3-оксо-2,3-дигидро-1,4-бензоксазин-4-ил)пиперидин-1-ил]пропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 148
6-Хлор-4-(1-{3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-4H-1,4-бензоксазин-3-он
ПРИМЕР 149
4-(1-{3-[3-(4-Бромфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-6-хлор-4H-1,4-бензоксазин-3-он
ПРИМЕР 150
4-(1-{3-[5-Ацетил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-4H-1,4-бензоксазин-3-он
ПРИМЕР 151
1-(1-{3-[5-Ацетил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-3,4-дигидро-1Н-хинолин-2-он
ПРИМЕР 152
4-(1-{3-[5-Ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-4H-1,4-бензоксазин-3-он
ПРИМЕР 153
1-(1-{3-[5-Ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-3,4-дигидро-1Н-хинолин-2-он
ПРИМЕР 154
1-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-1,3-дигидроиндол-2-он
ПРИМЕР 155
1-(1-{3-[5-Метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1,3-дигидроиндол-2-он
ПРИМЕР 156
1-(1-{3-[5-Ацетил-3-(3-хлор-4-метилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-1,3-дигидроиндол-2-он
ПРИМЕР 157
1-(1-{3-[3-(4-Хлор-3-метилфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-1,3-дигидроиндол-2-он
ПРИМЕР 158
1-(1-{3-[5-Ацетил-3-(4-трифторметилфенил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-1,3-дигидроиндол-2-он
ПРИМЕР 159
1-(1-{3-[5-Ацетил-3-(4-нитрофенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил]пиперидин-4-ил)-1,3-дигидроиндол-2-он
ПРИМЕР 160
1-(1-{3-[5-Ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-1,3-дигидроиндол-2-он
ПРИМЕР 161
1-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-6-хлор-1,3-дигидроиндол-2-он
ПРИМЕР 162
6-Хлор-1-(1-{2-гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1,3-дигидроиндол-2-он
ПРИМЕР 163
1-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-5-хлор-1,3-дигидроиндол-2-он
ПРИМЕР 164
5-Хлор-1-(1-{3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1,3-дигидроиндол-2-он
ПРИМЕР 165
1-(1-{3-[5-Ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-5-хлор-1,3-дигидроиндол-2-он
ПРИМЕР 166
1-(1-{3-[3-(4-Бромфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-5-хлор-1,3-дигидроиндол-2-он
ПРИМЕР 167
4-(1-{3-[3-(4-Бромфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-4H-пиридо[3,2-b]-1,4-оксазин-3-он
ПРИМЕР 168
1-(1-[2-Гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1,5-дигидро-4,1-бензоксазепин-2-он
ПРИМЕР 169
1-(1-{2-Гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1,4-дигидро-3,1-бензоксазин-2-он
ПРИМЕР 170
1-(1-{3-[3-(4-Бромфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-1,4-дигидро-3,1-бензоксазин-2-он
ПРИМЕР 171
1-(1-{2-Гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1,5-дигидро-4,1-бензоксазепин-2-он
ПРИМЕР 172
1-(1-{2-Гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1,4-дигидро-3,1-бензоксазин-2-он
ПРИМЕР 173
1-(1-{3-[3-(4-Бромфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-1,4-дигидро-3,1-бензоксазин-2-он
ПРИМЕР 174
1-(3-(4-Хлор-3-метилфенил)-1-{2-гидрокси-3-[4-(5-нитро-2,3-дигидроиндол-1-ил)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон
ПРИМЕР 175
1-(3-(4-Хлор-3-метилфенил)-1-{2-гидрокси-3-[4-(6-нитро-2,3-дигидроиндол-1-ил)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон
ПРИМЕР 176
1-(3-(4-Хлор-3-метилфенил)-1-{2-гидрокси-3-[4-(2-метил-2,3-дигидроиндол-1-ил)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон
ПРИМЕР 177
1-(1-{2-Гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-3,4-дигидро-1Н-хиназолин-2-он
ПРИМЕР 178
1-(1-{3-[3-(4-Бромфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил)пиперидин-4-ил)-3,4-дигидро-1H-хиназолин-2-он
ПРИМЕР 179
1-(1-{3-[5-Ацетил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил}-3,4-дигидро-1Н-хиназолин-2-он
ПРИМЕР 180
1-(1-{3-[3-(4-Бромфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-3,4-дигидро-1H-хиназолин-2-он
ПРИМЕР 181
1-(1-{3-[5-Ацетил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-3,4-дигидро-1Н-хиназолин-2-он
ПРИМЕР 182
1-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-1-(3-хлорфенил)-3-метилмочевина
ПРИМЕР 183
трет-Бутиловый эфир 1-[3-(4-бензотриазол-1-илпиперидин-1-ил)-2-гидроксипропил]-3-(3,4-дихлорфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 184
трет-Бутиловый эфир 1-{3-[4-(5-хлор-2-оксо-2,3-дигидроиндол-1-ил)пиперидин-1-ил]пропил}-3-(3,4-дихлорфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 185
5-Хлор-1-(1-{3-[3-(3,4-дихлорфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1,3-дигидроиндол-2-он
ПРИМЕР 186
трет-Бутиловый эфир 1-{3-[4-(5-метил-3-оксо-2,3-дигидробензо[1,4]оксазин-4-ил)пиперидин-1-ил]пропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 187
трет-Бутиловый эфир 3-(4-бромфенил)-1-{3-[4-(5-метил-3-оксо-2,3-дигидробензо[1,4]оксазин-4-ил)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4, 3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 188
трет-Бутиловый эфир 3-(4-бромфенил)-1-{3-[4-(6-этансульфонил-3-оксо-2,3-дигидробензо[1, 4]оксазин-4-ил)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 189
1-(5-Метансульфонил-3-(4-трифторметилфенил)-4,5,6, 7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-3-[4-(5-трифторметилбензотиазол-2-ил)пиперидин-1-ил]пропан-2-ол
ПРИМЕР 190
5-Метил-4-(1-{3-[3-(4-трифторметилфенил)-4,5,6, 7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-4H-бензо[1,4]оксазин-3-он
ПРИМЕР 191
4-(1-{3-[3-(4-Бромфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-5-метил-4H-бензо[1,4]оксазин-3-он
ПРИМЕР 192
4-(1-{3-[3-(4-Бромфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-6-этансульфонил-4H-бензо[1,4]оксазин-3-он
ПРИМЕР 193
1-{3-[4-(6-Хлориндол-1-ил)пиперидин-1-ил]пропил)-5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидро-1H-пиразоло[4,3-c]пиридин
ПРИМЕР 194
трет-Бутиловый эфир 3-(4-бромфенил)-1-{3-[4-(2-оксо-3,4-дигидро-2H-хинолин-1-ил)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 195
трет-Бутиловый эфир 3-(4-бромфенил)-1-{2-гидрокси-3-[4-(2-оксо-3,4-дигидро-2H-хинолин-1-ил)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 196
трет-Бутиловый эфир 3-(4-бромфенил)-1-{2-гидрокси-3-[4-(3-оксо-2,3-дигидро-1,4-бензоксазин-4-ил)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 197
1-(1-{3-[3-(4-Трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-3,4-дигидро-1Н-хинолин-2-он
ПРИМЕР 198
трет-Бутиловый эфир 3-(4-бромфенил)-1-{3-[4-(3-оксо-2,3-дигидро-1,4-бензоксазин-4-ил)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 199
1-(1-{2-Гидрокси-3-[3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-3,4-дигидро-1Н-хинолин-2-он
ПРИМЕР 200
4-(1-{3-[3-(4-Трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-4H-1,4-бензоксазин-3-он
ПРИМЕР 201
1-(1-{3-[3-(4-Бромфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-3,4-дигидро-1H-хинолин-2-он
ПРИМЕР 202
4-(1-{3-[3-(4-Бромфенил)-4,5,6, 7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-4H-1,4-бензоксазин-3-он
ПРИМЕР 203
1-(1-{3-[3-(4-Бромфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-3,4-дигидро-1H-хинолин-2-он
ПРИМЕР 204
4-(1-{3-[3-(4-Бромфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-4H-1,4-бензоксазин-3-он
ПРИМЕР 205
4-(1-{2-Гидрокси-3-[3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-4H-1,4-бензоксазин-3-он
ПРИМЕР 206
1-(3-(3,4-Дифторфенил)-1-{3-[4-(2,3-дигидроиндол-1-ил}пиперидин-1-ил]-2-гидроксипропил}-1,4,6, 7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон
ПРИМЕР 207
1-[1-{3-[4-(5-Бром-2,3-дигидроиндол-1-ил)пиперидин-1-ил]-2-гидроксипропил}-3-(4-хлор-3-метилфенил)-1,4,6, 7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон
ПРИМЕР 208
1-(1-{3-[5-Ацетил-3-(3,4-дифторфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-1,3-дигидроиндол-2-он
ПРИМЕР 209
1-[1-{3-[4-(5-Бром-2,3-дигидроиндол-1-ил)пиперидин-1-ил]-2-гидроксипропил}-3-(3, 4-дифторфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон
ПРИМЕР 210
1-(1-{3-[3-(4-Бромфенил-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-3,4-дигидро-1H-хиназолин-2-он
ПРИМЕР 211
1-(1-{3-[3-(4-Трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-3,4-дигидро-1Н-хиназолин-2-он
ПРИМЕР 212
1-(1-{3-[3-(4-Бромфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-3,4-дигидро-1H-хиназолин-2-он
ПРИМЕР 213
1-(3-(4-Хлорфенил)-1-{3-[4-(3-хлорфениламино)пиперидин-1-ил]-2-гидроксипропил}-1,4,6, 7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон
ПРИМЕР 214
N-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-N-(3-хлорфенил)ацетамид
ПРИМЕР 215
1-(4-Бензимидазол-1-илпиперидин-1-ил)-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропан-2-ол
ПРИМЕР 216
1-(3-(4-Хлорфенил)-1-{2-гидрокси-3-[4-(2-метоксифениламино)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон
ПРИМЕР 217
1-{3-(4-Хлорфенил)-1-{3-[4-(2-фторфениламино)пиперидин-1-ил]-2-гидроксипропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил}этанон
ПРИМЕР 218
1-{3-(4-Хлорфенил)-1-[2-гидрокси-3-(4-фениламинопиперидин-1-ил)пропил]-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил}этанон
ПРИМЕР 219
1-(3-(4-Хлорфенил)-1-{3-[4-(4-хлорфениламино)пиперидин-1-ил]-2-гидроксипропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон
ПРИМЕР 220
1-[1-{3-[4-(4-Бромфениламино)пиперидин-1-ил]-2-гидроксипропил}-3-(4-хлорфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон
ПРИМЕР 221
4-(1-{3-[5-Ацетил-3-(4-хлорфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-иламино)бензонитрил
ПРИМЕР 222
1-{3-(4-Хлорфенил)-1-[2-гидрокси-3-(4-п-толиламинопиперидин-1-ил)пропил]-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил}этанон
ПРИМЕР 223
1-(3-(4-Хлорфенил)-1-{2-гидрокси-3-[4-(4-метоксифениламино)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон
ПРИМЕР 224
1-(3-(4-Хлорфенил)-1-{2-гидрокси-3-[4-(3-метоксифениламино)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон
ПРИМЕР 225
1-(3-(4-Хлорфенил)-1-{3-[4-(3,5-диметоксифениламино)пиперидин-1-ил]-2-гидроксипропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон
ПРИМЕР 226
1-[1-{3-[4-(5-Хлор-2-метилфениламино)пиперидин-1-ил]-2-гидроксипропил}-3-(4-хлорфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон
ПРИМЕР 227
1-(3-(4-Хлорфенил)-1-{3-[4-(3-хлорфениламино)пиперидин-1-ил]-2-гидроксипропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон
ПРИМЕР 228
Метиловый эфир [2-(1-{3-[3-(4-бромфенил)-5-карбамоил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-иламино)-4-этансульфонилфенокси]уксусной кислоты
ПРИМЕР 229
Метиловый эфир [2-(1-{3-[5-ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-иламино)-4-этансульфонилфенокси]уксусной кислоты
ПРИМЕР 230
Метиловый эфир [2-(1-{3-[3-(4-бромфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-иламино)-4-этансульфонилфенокси]уксусной кислоты
ПРИМЕР 231
трет-Бутиловый эфир 3-(4-бромфенил)-1-{3-[4-(5-этансульфонил-2-метоксикарбонилметоксифениламино)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 232
Метиловый эфир [2-(1-{3-[3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-иламино)-4-этансульфонилфенокси]уксусной кислоты
ПРИМЕР 233
1-(3-(4-Бромфенил)-1-{2-гидрокси-3-(4-o-толилоксипиперидин-1-ил)пропил]-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил}этанон
ПРИМЕР 234
1-{3-(4-Бромфенил)-1-[2-гидрокси-3-(4-феноксипиперидин-1-ил)пропил]-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил}этанон
ПРИМЕР 235
1-{3-(4-Бромфенил)-1-[2-гидрокси-3-(4-п-толилоксипиперидин-1-ил)пропил]-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил}этанон
ПРИМЕР 236
1-(3-(4-Бромфенил)-1-{2-гидрокси-3-[4-(4-метоксифенокси)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон
ПРИМЕР 237
1-(3-(4-Бромфенил)-1-{3-[4-(4-хлорфенокси)пиперидин-1-ил]-2-гидроксипропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон
ПРИМЕР 238
1-(3-(4-Бромфенил)-1-{3-[4-(3-хлорфенокси)пиперидин-1-ил]-2-гидроксипропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон
ПРИМЕР 239
1-(3-(4-Бромфенил)-1-{3-[4-(3,4-дихлорфенокси)пиперидин-1-ил]-2-гидроксипропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон
ПРИМЕР 240
1-{3-(4-Хлор-3-метилфенил)-1-[2-гидрокси-3-(4-феноксипиперидин-1-ил)пропил]-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил}этанон
ПРИМЕР 241
1-{3-(4-Хлор-3-метилфенил)-1-[2-гидрокси-3-(4-п-толилоксипиперидин-1-ил)пропил]-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил}этанон
ПРИМЕР 242
1-(3-(4-Хлор-3-метилфенил)-1-{2-гидрокси-3-[4-(4-метоксифенокси)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон
ПРИМЕР 243
1-(3-(4-Хлор-3-метилфенил)-1-{3-[4-(4-хлорфенокси)пиперидин-1-ил]-2-гидроксипропил}-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил)этанон
ПРИМЕР 244
1-(3-(4-Хлор-3-метилфенил)-1-{3-[4-(3-хлорфенокси)пиперидин-1-ил]-2-гидроксипропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон
ПРИМЕР 245
1-{3-(4-Хлор-3-метилфенил)-1-[2-гидрокси-3-(4-о-толилоксипиперидин-1-ил)пропил]-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил}этанон
ПРИМЕР 245
1-{3-(4-Хлор-3-метилфенил)-1-{3-[4-(3,4-дихлорфенокси)пиперидин-1-ил]-2-гидроксипропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон
ПРИМЕР 246
2-(1-{3-[3-(4-Бромфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-илокси)бензонитрил
ПРИМЕР 247
2-(1-{3-[5-Ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-илокси)бензонитрил
ПРИМЕР 248
1-[3-(4-Бромфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-3-[4-(4-хлорфенокси)пиперидин-1-ил]пропан-2-ол
ПРИМЕР 249
1-[1-{3-[4-(4-Хлорфенокси)пиперидин-1-ил]-2-гидроксипропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон
ПРИМЕР 250
1-(1-{3-[5-Ацетил-3-(4-хлорфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 251
1-{1-[3-(5-Ацетил-3-фенил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил)-2-гидроксипропил]пиперидин-4-ил}-1,3-дигидробензимидазол-2-он
ПРИМЕР 252
1-(1-{3-[5-Ацетил-3-(4-трифторметоксифенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 253
1-(1-{3-[5-Ацетил-3-(4-йодфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 254
1-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 255
1-(1-{3-[5-Ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 256
1-(1-{3-[5-Ацетил-3-(4-хлор-3-нитрофенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 257
1-(1-{3-[5-Ацетил-3-(4-трифторметилсульфанилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 258
1-(1-{3-[5-Ацетил-3-(4-метансульфонилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 259
1-(1-{3-[5-Ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-6-хлор-1,3-дигидробензимидазол-2-он
ПРИМЕР 260
1-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-3-метил-1,3-дигидробензимидазол-2-он
ПРИМЕР 261
1-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-3-этил-1,3-дигидробензимидазол-2-он
ПРИМЕР 262
1-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-3-изопропил-1,3-дигидробензимидазол-2-он
ПРИМЕР 263
1-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-3-бутил-1,3-дигидробензимидазол-2-он
ПРИМЕР 264
1-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-3-бензил-1, 3-дигидробензимидазол-2-он
ПРИМЕР 265
1-(1-{3-[5-Ацетил-3-(4-йодфенил)-4,5,6,7-тетрагидропиразоло[4,3-c|пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-5-фтор-1, 3-дигидробензимидазол-2-он
ПРИМЕР 266
3-(1-{3-[5-Ацетил-3-(4-йодфенил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-7-фтор-2-оксо-2, 3-дигидро-1H-бензимидазол-4-карбонитрил
ПРИМЕР 267
1-(1-{3-[5-Ацетил-3-(4-йодфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-6-фтор-1,3-дигидробензимидазол-2-он
ПРИМЕР 268
3-(1-{3-[5-Ацетил-3-(4-йодфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-2-оксо-2,3-дигидро-1H-бензимидазол-5-карбонитрил
ПРИМЕР 269
Амид 1-{2-гидрокси-3-[4-(2-оксо-2, 3-дигидробензимидазол-1-ил)пиперидин-1-ил]пропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 270
1-(1-{3-[3-(4-Хлор-3-метилфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 271
Метиламид 3-(4-хлор-3-метилфенил)-1-{2-гидрокси-3-[4-(2-оксо-2,3-дигидробензимидазол-1-ил)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 272
Этиламид 3-(4-хлор-3-метилфенил)-1-{2-гидрокси-3-[4-(2-оксо-2,3-дигидробензимидазол-1-ил)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4, 3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 273
1-(1-{3-[5-Ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-5-метил-1,3-дигидробензимидазол-2-он
ПРИМЕР 274
1-(1-{3-[5-Ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-6-метил-1,3-дигидробензимидазол-2-он
ПРИМЕР 275
1-(1-{3-[5-Ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-5,6-дихлор-1,3-дигидробензимидазол-2-он
ПРИМЕР 276
1-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6, 7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-5-метил-1,3-дигидробензимидазол-2-он
ПРИМЕР 277
1-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4, 5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-6-метил-1,3-дигидробензимидазол-2-он
ПРИМЕР 278
1-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-5,6-дихлор-1,3-дигидробензимидазол-2-он
ПРИМЕР 279
1-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-6-хлор-1,3-дигидробензимидазол-2-он
ПРИМЕР 280
1-(1-{3-[5-Ацетил-3-(4-хлор-3-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-с]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 281
1-(1-{3-[3-(4-Хлор-3-метилфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4,3-с]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-3-(2-морфолин-4-илэтил)-1, 3-дигидробензимидазол-2-он
ПРИМЕР 282
1-(1-{3-[5-Ацетил-3-(3-фтор-4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 283
1-(1-{3-[5-Ацетил-3-(4-бром-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 284
(R)-1-(1-{3-[5-Ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 285
1-(1-{3-[5-Ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-5-метокси-1,3-дигидробензимидазол-2-он
ПРИМЕР 286
1-(1-{3-[5-Ацетил-3-(4-бромфенил-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-7-хлор-1,3-дигидробензимидазол-2-он
ПРИМЕР 287
3-(1-{3-[5-Ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-1,3-дигидроимидазо[4,5-b]пиридин-2-он
ПРИМЕР 288
1-(1-{3-[5-Ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-7-метил-1,3-дигидробензимидазол-2-он
ПРИМЕР 289
(R)-1-(1-{3-[5-Ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-6-хлор-1,3-дигидробензимидазол-2-он
ПРИМЕР 290
1-(1-{3-[5-Ацетил-3-(3,4-дихлорфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 291
1-(1-{3-[5-Ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 292
1-(1-{3-[5-Ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-6-хлор-1,3-дигидробензимидазол-2-он
ПРИМЕР 293
(S)-1-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6, 7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-6-хлор-1,3-дигидробензимидазол-2-он
ПРИМЕР 294
(R)-1-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 295
(R)-1-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-6-хлор-1,3-дигидробензимидазол-2-он
ПРИМЕР 296
2-{2-[3-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-2-оксо-2,3-дигидробензимидазол-1-ил]этил}изоиндол-1,3-дион
ПРИМЕР 297
1-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-3-(2-аминоэтил)-1, 3-дигидробензимидазол-2-он
ПРИМЕР 298
1-(1-{3-[5-Ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-3-метил-1, 3-дигидробензимидазол-2-он
ПРИМЕР 299
1-(1-{3-[5-Ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-3-этил-1, 3-дигидробензимидазол-2-он
ПРИМЕР 300
1-(1-{3-[5-Ацетил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-3-метил-1,3-дигидробензимидазол-2-он
ПРИМЕР 301
1-(1-{3-[5-Ацетил-3-(4-трифторметилфенил)-4,5,6, 7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-3-этил-1,3-дигидробензимидазол-2-он
ПРИМЕР 302
6-Хлор-1-(1-{3-[3-(4-хлор-3-метилфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 303
1-(1-{3-[5-Ацетил-3-(3-хлор-4-метилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 304
3-(1-{3-[3-(4-Бромфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-5-хлор-1-(2-морфолин-4-илэтил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 305
Этиловый эфир [3-(1-{3-[5-ацетил-3-(4-хлор-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-2-оксо-2, 3-дигидробензимидазол-1-ил]уксусной кислоты
ПРИМЕР 306
1-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-3-(2,2,2-трифторэтил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 307
[3-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6, 7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-2-оксо-2,3-дигидробензимидазол-1-ил]ацетонитрил
ПРИМЕР 308
1-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-3-(2-гидроксиэтил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 309
1-(1-{3-[5-Ацетил-3-(3-хлор-4-метилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-6-хлор-1,3-дигидробензимидазол-2-он
ПРИМЕР 310
1-(1-{3-[5-Ацетил-3-(3-хлор-4-метилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-3-метил-1,3-дигидробензимидазол-2-он
ПРИМЕР 311
1-Этил-3-(1-{2-гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 312
1-(1-{2-Гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-3-метил-1, 3-дигидробензимидазол-2-он
ПРИМЕР 313
1-(1-{3-[5-Ацетил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-3-(2-гидроксиэтил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 314
3-(1-{3-[5-Ацетил-3-(4-трифторметилфенил)-4,5,6, 7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-1,3-дигидроимидазо[4,5-b]пиридин-2-он
ПРИМЕР 315
[3-(1-{3-[5-Ацетил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-2-оксо-2,3-дигидробензимидазол-1-ил]ацетонитрил
ПРИМЕР 316
2-[3-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-2-оксо-2,3-дигидробензимидазол-1-ил]ацетамид
ПРИМЕР 317
1-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-3-(2-оксотетрагидрофуран-3-ил)-1, 3-дигидробензимидазол-2-он
ПРИМЕР 318
1-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-3-(2-метоксиэтил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 319
1-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6, 7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-3-(2-оксобутил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 320
1-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-3-(2-диэтиламиноэтил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 321
1-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-3-циклопропилметил-1,3-дигидробензимидазол-2-он
ПРИМЕР 322
1-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-3-(2-метилаллил)-1, 3-дигидробензимидазол-2-он
ПРИМЕР 323
1-(1-{3-[5-Ацетил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-5-метил-1,3-дигидробензимидазол-2-он
ПРИМЕР 324
5-Хлор-3-(1-{2-гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1-метил-1,3-дигидробензимидазол-2-он
ПРИМЕР 325
6-Хлор-1-(1-{2-гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 326
N-[4-(5-Ацетил-1-{2-гидрокси-3-[4-(2-оксо-2,3-дигидробензимидазол-1-ил)пиперидин-1-ил]пропил}-4,5,6,7-тетрагидро-1Н-пиразоло[4,3-c]пиридин-3-ил)фенил]ацетамид
ПРИМЕР 327
[3-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-2-оксо-2, 3-дигидробензимидазол-1-ил]уксусная кислота
ПРИМЕР 328
1-(1-{3-[5-Ацетил-3-(3-бром-4-хлорфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 329
3-(1-{3-[5-Метансульфонил-3-(4-трифторметилфенил)-4,5,6, 7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1-метил-1,3-дигидроимидазо[4,5-b]пиридин-2-он
ПРИМЕР 330
3-(1-{2-Гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1-метил-1,3-дигидроимидазо[4,5-b]пиридин-2-он
ПРИМЕР 331
1-(1-{3-[5-(1Н-Имидазол-4-карбонил)-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-3-метил-1,3-дигидробензимидазол-2-он
ПРИМЕР 332
Амид 1-{3-(4-(3-метил-2-оксо-2,3-дигидробензимидазол-1-ил)пиперидин-1-ил]пропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 333
Этиламид 1-{3-[4-(3-метил-2-оксо-2,3-дигидробензимидазол-1-ил)пиперидин-1-ил]пропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4, 3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 334
1-(1-{3-[5-(Изоксазол-5-карбонил)-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-3-метил-1,3-дигидробензимидазол-2-он
ПРИМЕР 335
(N-трет-Бутоксикарбонил)амид 1-{3-[4-(3-метил-2-оксо-2, 3-дигидробензимидазол-1-ил)пиперидин-1-ил]пропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-сульфоновой кислоты
ПРИМЕР 336
1-Метил-3-(1-{3-[5-(5-метилизоксазол-3-карбонил)-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 337
3-(1-{3-[5-Метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-5-метокси-1-метил-1,3-дигидроимидазо[4,5-b]пиридин-2-он
ПРИМЕР 338
3-(1-{3-[3-(4-Бромфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-5-метокси-1-метил-1,3-дигидроимидазо[4, 5-b]пиридин-2-он
ПРИМЕР 339
5-Диметиламино-3-(1-{3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1-метил-1,3-дигидроимидазо[4,5-b]пиридин-2-он
ПРИМЕР 340
3-(1-{3-[3-(4-Бромфенил)-5-метансульфонил-4,5,6, 7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1-этил-5-метокси-1,3-дигидроимидазо[4,5-b]пиридин-2-он
ПРИМЕР 341
1-(1-{3-[5-Ацетил-3-(4-нитрофенил)-4, 5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 342
1-(1-{3-[5-Ацетил-3-(4-нитрофенил)-4,5,6, 7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-3-метил-1,3-дигидробензимидазол-2-он
ПРИМЕР 343
3-(1-{3-[5-Ацетил-3-(4-бромфенил)-4,5,6, 7-тетрагидропиразоло[4,3-c]пиридин-1-ил)пропил}пиперидин-4-ил)-1-этил-5-метокси-1,3-дигидроимидазо[4,5-b]пиридин-2-он
ПРИМЕР 344
3-(1-{3-[5-Ацетил-3-(4-бромфенил)-4,5, 6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-5-метокси-1-метил-1,3-дигидроимидазо[4,5-b]пиридин-2-он
ПРИМЕР 345
Бензиловый эфир 1-{3-[4-(3-метил-2-оксо-2,3-дигидробензимидазол-1-ил)пиперидин-1-ил]пропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 346
5-Диметиламино-3-(1-{2-гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1-метил-1,3-дигидроимидазо[4, 5-b]пиридин-2-он
ПРИМЕР 347
Метиламид 1-{3-[4-(3-метил-2-оксо-2,3-дигидробензимидазол-1-ил)пиперидин-1-ил]пропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4, 3-c]пиридин-5-карботиокислоты
ПРИМЕР 348
Фениламид 3-(4-бромфенил)-1-{3-[4-(3-метил-2-оксо-2,3-дигидробензимидазол-1-ил)пиперидин-1-ил]пропил}-1,4,6, 7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 349
1-(1-{3-[5-Бензоил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4, 3-с]пиридин-1-ил]пропил}пиперидин-4-ил)-3-метил-1,3-дигидробензимидазол-2-он
ПРИМЕР 350
1-(1-{3-[3-(4-Бромфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-3-метил-1,3-дигидробензимидазол-2-он
ПРИМЕР 351
1-(1-{3-[5-Метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 352
3-(1-{3-[5-Ацетил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-5-хлор-1-метил-1,3-дигидробензимидазол-2-он
ПРИМЕР 353
Амид 1-{3-[4-(6-хлор-3-метил-2-оксо-2, 3-дигидробензимидазол-1-ил)пиперидин-1-ил]пропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 354
1-(1-{3-[3-(4-Бромфенил)-5-фенилметансульфонил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-3-метил-1,3-дигидробензимидазол-2-он
ПРИМЕР 355
1-(1-{3-[5-Ацетил-3-(3,4-дихлорфенил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-3-метил-1,3-дигидробензимидазол-2-он
ПРИМЕР 356
Амид 3-(4-бромфенил)-1-{3-[4-(3-метил-2-оксо-2,3-дигидробензимидазол-1-ил)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 357
3-(1-{3-[5-Ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-5-хлор-1-метил-1,3-дигидробензимидазол-2-он
ПРИМЕР 358
3-(1-{3-[3-(4-Бромфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-5-хлор-1-метил-1,3-дигидробензимидазол-2-он
ПРИМЕР 359
Амид 3-(4-бромфенил)-1-{3-[4-(6-хлор-3-метил-2-оксо-2,3-дигидробензимидазол-1-ил)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 360
3-(1-{3-[5-Метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1,5-диметил-1,3-дигидробензимидазол-2-он
ПРИМЕР 361
1-(1-{3-[5-Ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-3-метил-1,3-дигидробензимидазол-2-он
ПРИМЕР 362
трет-Бутоксикарбониламид 3-(4-бромфенил)-1-{3-[4-(3-метил-2-оксо-2,3-дигидробензимидазол-1-ил)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-сульфоновой кислоты
ПРИМЕР 363
1-(1-{3-[3-(4-Бромфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 364
1-(1-{3-[5-Ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1,3-дигидробензимидазол-2-он
ПРИМЕР 365
трет-Бутоксикарбониламид 3-(4-бромфенил)-1-{3-[4-(2-оксо-2,3-дигидробензимидазол-1-ил)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-сульфоновой кислоты
ПРИМЕР 366
Амид 3-(4-бромфенил)-1-{3-[4-(2-оксо-2,3-дигидробензимидазол-1-ил)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 367
(R)-5-Хлор-3-(1-{2-гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1-метил-1, 3-дигидробензимидазол-2-он
ПРИМЕР 368
1-(1-{3-[5-Ацетил-3-(3,4-дихлорфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-3-метил-1, 3-дигидробензимидазол-2-он
ПРИМЕР 369
1-(1-{3-[3-(3,4-Дихлорфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-3-метил-1, 3-дигидробензимидазол-2-он
ПРИМЕР 370
1-(1-{3-[5-Ацетил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-6-метокси-1,3-дигидробензимидазол-2-он
ПРИМЕР 371
3-(1-{3-[3-(4-Бромфенил)-5-метансульфонил-4,5,6, 7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-1,3-дигидроимидазо[4,5-b]пиридин-2-он
ПРИМЕР 372
3-(1-{3-[3-(4-Бромфенил)-5-метансульфонил-4, 5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-5-метокси-1,3-дигидроимидазо[4,5-b]пиридин-2-он
ПРИМЕР 373
Амид 1-{2-гидрокси-3-[4-(2-оксо-1,2-дигидроимидазо[4,5-b]пиридин-3-ил)пиперидин-1-ил]пропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 374
Амид 3-(4-бромфенил)-1-{2-гидрокси-3-[4-(2-оксо-1,2-дигидроимидазо[4,5-b]пиридин-3-ил)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 375
[3-(1-{2-Гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-2-оксо-2,3-дигидроимидазо[4, 5-b]пиридин-1-ил]ацетонитрил
ПРИМЕР 376
Метиламид 3-(3,4-дихлорфенил)-1-{3-[4-(2-оксо-2,3-дигидробензимидазол-1-ил)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4, 3-c]пиридин-5-карбоновой кислоты
ПРИМЕР 377
3-(1-{3-[5-Ацетил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1, 3-дигидроимидазо[4,5-b]пиридин-2-он
ПРИМЕР 378
3-(1-{3-[5-Ацетил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-5-метокси-1,3-дигидроимидазо[4,5-b]пиридин-2-он
ПРИМЕР 379
Этиловый эфир [3-(1-{3-[3-(4-бромфенил)-5-метансульфонил-4,5,6, 7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-2-оксо-2,3-дигидробензимидазол-1-ил]уксусной кислоты
ПРИМЕР 380
Этиловый эфир [3-(1-{3-[5-ацетил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-2-оксо-2,3-дигидробензимидазол-1-ил]уксусной кислоты
ПРИМЕР 381
Этиловый эфир [3-(1-{3-[5-ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-2-оксо-2,3-дигидробензимидазол-1-ил]уксусной кислоты
ПРИМЕР 382
5-Хлор-3-(1-{3-[3-(3,4-дихлорфенил)-5-метансульфонил-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1-метил-1, 3-дигидробензимидазол-2-он
ПРИМЕР 383
(R)-1-(1-{2-Гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-3-метил-1,3-дигидробензимидазол-2-он
ПРИМЕР 384
1-(1-{2-Гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6, 7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-3-пиридин-4-илметил-1,3-дигидробензимидазол-2-он
ПРИМЕР 385
(R)-5-Диметиламино-3-(1-{2-гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-1-метил-1,3-дигидроимидазо[4,5-b]пиридин-2-он
ПРИМЕР 386
3-(1-{3-[5-Ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-5-хлор-3H-бензоксазол-2-он
ПРИМЕР 387
3-(1-{3-[5-Ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-4-метил-3H-бензоксазол-2-он
ПРИМЕР 388
Этиловый эфир 3-(1-{3-[5-ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-2-оксо-2,3-дигидробензоксазол-6-карбоновой кислоты
ПРИМЕР 389
3-(1-{3-[5-Ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-6-этансульфонил-3H-бензоксазол-2-он
ПРИМЕР 390
3-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-4-метил-3H-бензоксазол-2-он
ПРИМЕР 391
Этиловый эфир 3-(1-{3-[5-ацетил-3-(4-хлор-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-2-оксо-2, 3-дигидробензоксазол-6-карбоновой кислоты
ПРИМЕР 392
3-(1-{3-[5-Ацетил-3-(4-бромфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-6-метокси-3H-бензоксазол-2-он
ПРИМЕР 393
3-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6,7-тетрагидропиразоло[4, 3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-6-этансульфонил-3H-бензоксазол-2-он
ПРИМЕР 394
3-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6, 7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-6-метокси-3H-бензоксазол-2-он
ПРИМЕР 395
3-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6, 7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-3H-бензоксазол-2-он
ПРИМЕР 396
3-(1-{3-[5-Ацетил-3-(4-хлор-3-метилфенил)-4,5,6, 7-тетрагидропиразоло[4,3-c]пиридин-1-ил]-2-гидроксипропил}пиперидин-4-ил)-5-хлор-3H-бензоксазол-2-он
ПРИМЕР 397
3-(1-{2-Гидрокси-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропил}пиперидин-4-ил)-3H-оксазоло[4,5-b]пиридин-2-он
ПРИМЕР 398
1-[1-[3-(4-Бензоксазол-2-илпиперидин-1-ил)-2-гидроксипропил]-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон
ПРИМЕР 399
1-[1-{2-Гидрокси-3-[4-(6-метилбензоксазол-2-ил)пиперидин-1-ил]пропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон
ПРИМЕР 400
1-[1-{3-[4-(Бензотиазол-2-илокси)пиперидин-1-ил]-2-гидроксипропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон
ПРИМЕР 401
1-[1-{2-Гидрокси-3-[4-(5-метилбензоксазол-2-ил)пиперидин-1-ил]пропил}-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон
ПРИМЕР 402
1-(3-(4-Хлорфенил)-1-{2-гидрокси-3-[4-(2-метоксифенил)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон
ПРИМЕР 403
3-(4-Хлорфенил)-1-{2-гидрокси-3-[4-(2-метоксифенил)пиперидин-1-ил]пропил}-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбальдегид
ПРИМЕР 404
1-[1-[3-(4-Бензо[b]тиофен-2-илпиперидин-1-ил)-2-гидроксипропил]-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон
ПРИМЕР 405
1-[4-(6-Хлориндол-1-ил)пиперидин-1-ил]-3-[5-метансульфонил-3-(4-трифторметилфенил)-4,5,6,7-тетрагидропиразоло[4,3-c]пиридин-1-ил]пропан-2-ол
F. Другие воплощения
Отличительные черты и преимущества данного изобретения для квалифицированного специалиста в данной области техники очевидны. Исходя из данного описания, включая краткое описание, подробное описание, предпосылки изобретения, примеры и формулу изобретения, квалифицированный специалист может внести изменения и адаптировать данное изобретение к различным условиям и областям применения. Эти другие воплощения также входят в область данного изобретения.
Реферат
Описываются новые замещенные пиразолы общей формулы

(значения радикалов Ar, Ar2, W, G, R5-R8, Rz и n приведены в формуле изобретения), фармацевтическая композиция на их основе, применение последней для производства лекарственного средства, предназначенного для лечения астмы, и способ ингибирования активности катепсина S; указанные соединения могут найти применение в медицине. 4 н. и 23 з.п. ф-лы, 3 табл.
Формула


Документы, цитированные в отчёте о поиске
Бициклические тетрагидропиразолпиридины или их фармацевтически приемлемые соли, фармацевтическая композиция, способ ингибирования фосфодиэстеразы, способ лечения

Комментарии