Ингибиторы неприлизина - RU2605557C2
Код документа: RU2605557C2
Описание
ОБЛАСТЬ ТЕХНИКИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ НАСТОЯЩЕЕ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к новым соединениям, обладающим ингибирующей неприлизин активностью. Настоящее изобретение также относится к фармацевтическим композициям, содержащим данные соединения, способам и промежуточным соединениям для получения данных соединений и способам применения данных соединений для лечения заболеваний, таких как гипертензия, сердечная недостаточность, легочная гипертензия и заболевание почек.
СУЩЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Неприлизин (нейтральная эндопептидаза, EC 3.4.24.11) (NEP), представляет собой эндотелиальную мембраносвязанную Zn2+металлопептидазу, обнаруживаемую во многих органах и тканях, включая мозг, почки, легкие, желудочно-кишечный тракт, сердце и периферическую сосудистую систему. NEP разрушает и дезактивирует ряд эндогенных пептидов, таких как энкефалины, циркулирующий брадикинин, пептиды ангиотензина и натрийуретических пептидов, последние из которых обладают несколькими эффектами, включая, например, вазодилатацию и натрийурез/диурез, а также ингибирование гипертрофии сердца и вентрикулярный фиброз. Таким образом, NEP играет важную роль в гомеостазе кровяного давления и здоровье сердечно-сосудистой системы.
NEP ингибиторы, такие как тиорфан, кандоксатрил и кандоксатрилат, исследуются в качестве потенциальных терапевтических средств. Соединения, которые ингибируют и NEP, и ангиотензин-I конвертирующий фермент (ACE), также являются известными и включают омапатрилат, гемпатрилат и сампатрилат. Называемые вазопептидазными ингибиторами, данный последний класс соединений описан в Robl et al. (1999) Exp. Opin. Ther. Patents 9(12): 1665-1677.
СУЩНОСТЬ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым соединениям, для которых обнаружено, что они обладают активностью, ингибирующий фермент, неприлизин (NEP). Соответственно, ожидают, что соединения настоящего изобретения будут пригодными и полезными в качестве терапевтических агентов для лечения заболеваний, таких как гипертензия и сердечная недостаточность.
Один аспект настоящего изобретения относится к соединению формулы I:

где
R1 выбран из -OR7 и -NR8R9;
R2 представляет собой H или -P(O)(OH)2, или R2 берут вместе с R7, получая -CR18R19- или берут вместе с R8, получая -C(O)-;
X представляет собой -C1-9гетероарил;
R3 отсутствует или выбран из H; галогена; -C0-5алкилен-OH; -NH2; -C1-6алкила; -CF3; -C3-7циклоалкила; -C0-2алкилен-O-C1-6алкила; -C(O)R20; -C0-1алкилен-COOR21; -C(O)NR22R23; -NHC(O)R24; =O; -NO2; -C(CH3)=N(OH); фенила, необязательно замещенного одной или двумя группами, независимо выбранными из галогена, -OH, -CF3, -OCH3, -NHC(O)CH3 и фенила; нафталенила; пиридинила; пиразинила; пиразолила, необязательно замещенного метилом; тиофенила, необязательно замещенного метилом или галогеном; фуранила; и -CH2-морфолинила; и R3, когда он присутствует, соединен с атомом углерода;
R4 отсутствует или выбран из H; -OH; -C1-6алкила; -C1-2алкилен-COOR35; -CH2OC(O)CH(R36)NH2; -OCH2OC(O)CH(R36)NH2; -OCH2OC(O)CH3; -CH2OP(O)(OH)2; -CH2CH(OH)CH2OH; -CH[CH(CH3)2]-NHC(O)O-C1-6алкила; пиридинила; и фенила или бензила, необязательно замещенного одной или более группами, выбранными из галогена, -COOR35, -OCH3, -OCF3 и -SCF3; и R4, когда он присутствует, соединен с атомом углерода или атомом азота;
или R3 и R4 берут вместе, получая -фенилен-O-(CH2)1-3- или -фенилен-O-CH2-CHOH-CH2-;
a равен 0 или 1; R5 выбран из галогена, -CH3, -CF3 и -CN;
b равен 0 или целому числу от 1 до 3; каждый R6 независимо выбран из галогена, -OH, -CH3, -OCH3 и -CF3;
R7 выбран из H, -C1-8алкила, -C1-3алкилен-C6-10арила, -C1-3алкилен-C1-9гетероарила, -C3-7циклоалкила, -[(CH2)2O]1-3CH3, -C1-6алкилен-OC(O)R10, -C1-6алкилен-NR12R13, -C1-6алкилен-C(O)R31, -C0-6алкиленморфолинила; -C1-6алкилен-SO2-C1-6алкила;
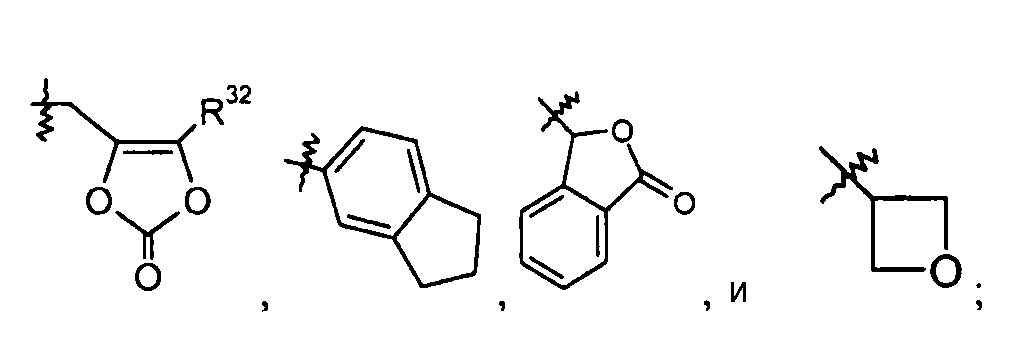
R10выбран из -C1-6алкила, -O-C1-6алкила, -C3-7циклоалкила, -O-C3-7циклоалкила, фенила, -O-фенила, -NR12R13, -CH[CH(CH3)2]-NH2, -CH[CH(CH3)2]-NHC(O)O-C1-6алкила и -CH(NH2)CH2COOCH3; и R12 и R13 независимо выбраны из H, -C1-6алкила и бензила; или R12 и R13 берут вместе как -(CH2)3-6-, -C(O)-(CH2)3- или -(CH2)2O(CH2)2-; и R31 выбран из -O-C1-6алкила, -O-бензила и -NR12R13; R32 представляет собой -C1-6алкил или -C0-6алкилен-C6-10арил;
R8 выбран из H, -OH, -OC(O)R14, -CH2COOH, -O-бензила, пиридила и -OC(S)NR15R16; R14 выбран из H, -C1-6алкила, -C6-10арила, -OCH2-C6-10арила, -CH2O-C6-10арила и -NR15R16; и R15 и R16 независимо выбраны из H и -C1-4алкила;
R9 выбран из H, -C1-6алкила и -C(O)R17; и R17 выбран из H, -C1-6алкила, -C3-7циклоалкила, -C6-10арила и -C1-9гетероарила;
R18 и R19 независимо выбраны из H, -C1-6алкила и -O-C3-7циклоалкила, или R18и R19берут вместе, получая =O;
R20 выбран из H и -C1-6алкила;
R21 и R35 независимо выбраны из H, -C1-6алкила, -C1-3алкилен-C6-10арила, -C1-3алкилен-C1-9гетероарила, -C3-7циклоалкила, -[(CH2)2O]1-3CH3, -C1-6алкилен-OC(O)R25; -C1-6алкилен-NR27R28, -C1-6алкилен-C(O)R33, -C0-6алкиленморфолинила, -C1-6алкилен-SO2-C1-6алкила,

R25 выбран из -C1-6алкила, -O-C1-6алкила, -C3-7циклоалкила, -O-C3-7циклоалкила, фенила, -O-фенила, -NR27R28, -CH[CH(CH3)2]-NH2, -CH[CH(CH3)2]-NHC(O)O-C1-6алкила и -CH(NH2)CH2COOCH3; R27 и R28 независимо выбраны из H, -C1-6алкила и бензила; или R27 и R28 берут вместе в виде -(CH2)3-6-, -C(O)-(CH2)3- или -(CH2)2O(CH2)2-;R33 выбран из -O-C1-6алкила, -O-бензила и -NR27R28; и R34 представляет собой -C1-6алкил или -C0-6алкилен-C6-10арил;
R22 и R23независимо выбраны из H, -C1-6алкила, -CH2COOH, -(CH2)2OH; -(CH2)2OCH3, -(CH2)2SO2NH2, -(CH2)2N(CH3)2, -C0-1алкилен-C3-7циклоалкила и -(CH2)2-имидазолила; или R22 и R23 берут вместе, получая насыщенный или частично ненасыщенный -C3-5гетероцикл, необязательно замещенный галогеном, -OH, -COOH или -CONH2; и необязательно содержащий атом кислорода в кольце;
R24 выбран из -C1-6алкила; -C0-1алкилен-O-C1-6алкила; фенила, необязательно замещенного галогеном или -OCH3; и -C1-9гетероарила; и
R36 выбран из H, -CH(CH3)2, фенила и бензила;
где каждая алкильная группа в R1, R3 и R4 необязательно замещена 1-8 атомами фтора; и
где метиленовый линкер в бифениле необязательно замещен одной или двумя -C1-6алкильными группами или циклопропилом;
или его фармацевтически приемлемой соли.
Другой аспект настоящего изобретения относится к фармацевтическим композициям, содержащим фармацевтически приемлемый носитель и соединение настоящего изобретения. Данные композиции могут необязательно содержать другие терапевтические агенты. Соответственно, в еще другом аспекте настоящего изобретения фармацевтическая композиция содержит соединение настоящего изобретения в качестве первого терапевтического агента, один или более вторых терапевтических агентов и фармацевтически приемлемый носитель. Другой аспект настоящего изобретения относится к комбинации активных агентов, содержащей соединение настоящего изобретения и второй терапевтический агент. Соединение настоящего изобретения можно формулировать вместе или отдельно от дополнительного агента (агентов). При формулировании отдельно, фармацевтически приемлемый носитель можно включать вместе с дополнительным агентом (агентами). Таким образом, еще другой аспект настоящего изобретения относится к комбинации фармацевтических композиций, причем комбинация содержит первую фармацевтическую композицию, содержащую соединение настоящего изобретения и первый фармацевтически приемлемый носитель; и вторую фармацевтическую композицию, содержащую второй терапевтический агент и второй фармацевтически приемлемый носитель. В другом аспекте настоящее изобретение относится к набору, содержащему данные фармацевтические композиции, например, когда первая и вторая фармацевтические композиции представляют собой отдельные фармацевтические композиции.
Соединения настоящего изобретения обладают ингибирующей NEP фермент активностью, и, следовательно, ожидают, что они будут пригодны в качестве терапевтических агентов для лечения пациентов, страдающих от заболевания или расстройства, которые лечатся ингибированием NEP фермента или повышением концентрации его пептидных субстратов. Таким образом, один аспект настоящего изобретения относится к способу лечения пациентов, страдающих от заболевания или расстройства, которые лечатся ингибированием NEP фермента, включающему введение пациенту терапевтически эффективного количества соединения настоящего изобретения. Другой аспект настоящего изобретения относится к способу лечения гипертензии, сердечной недостаточности или заболевания почек, включающему введение пациенту терапевтически эффективного количества соединения настоящего изобретения. Еще другой аспект настоящего изобретения относится к способу ингибирования NEP фермента у млекопитающего, включающему введение млекопитающему, ингибирующего NEP фермент количества соединения настоящего изобретения.
Поскольку соединения настоящего изобретения обладают NEP ингибирующей активностью, они также являются пригодными в качестве исследовательских инструментов. Соответственно, один аспект настоящего изобретения относится к способу применения соединения настоящего изобретения в качестве исследовательского инструмента, причем способ включает проведение биологического анализа, применяя соединение настоящего изобретения. Соединения настоящего изобретения можно также применять для оценки новых химических соединений. Таким образом, другой аспект настоящего изобретения относится к способу оценки испытуемого соединения в биологическом анализе, включающему (a) проведение биологического анализа с испытуемым соединением, получая первый результат анализа; (b) проведение биологического анализа с соединением настоящего изобретения, получая второй результат анализа; где стадию (a) проводят или перед, после или одновременно со стадией (b); и (c) сравнение первого результата анализа стадии (a) со вторым результатом анализа из стадии (b). Примеры биологических исследований включают анализ ингибирования NEP фермента. Еще другой аспект настоящего изобретения относится к способу изучения биологической системы или образца, содержащего NEP фермент, причем способ включает (a) контакт биологической системы или образца с соединением настоящего изобретения; и (b) определение эффектов, вызванных соединением на биологическую систему или образец.
Еще другой аспект настоящего изобретения относится к способам и промежуточным соединениям, пригодным для получения соединений настоящего изобретения. Соответственно, другой аспект настоящего изобретения относится к способу получения соединений формулы I, включающему стадию конденсации соединения формулы 1 с соединением формулы 2:
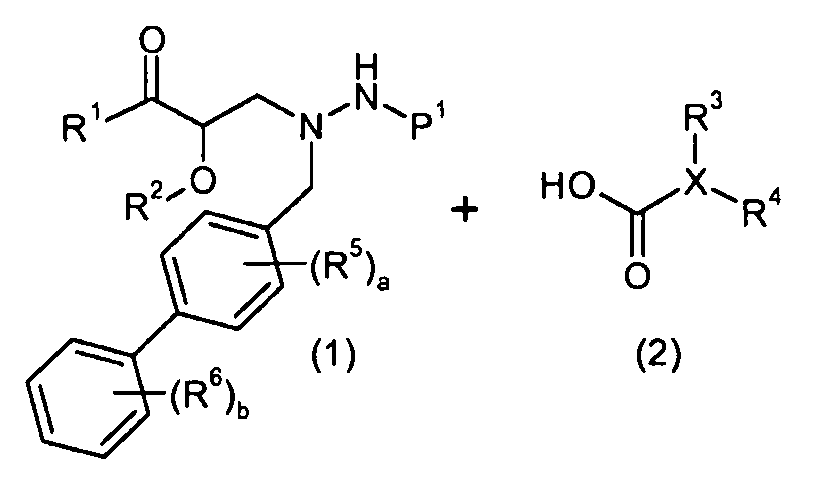
получая соединение формулы I; где P1 представляет собой H или амино-защитную группу, выбранную из трет-бутоксикарбонила, тритила, бензилоксикарбонила, 9-флуоренилметоксикарбонила, формила, триметилсилила и трет-бутилдиметилсилила; и где способ дополнительно включает снятие защитной группы соединения формулы 1, когда P1 представляют собой амино-защитную группу; и где R1-R6, a, b и X представляют собой, как определено для формулы I. Другой аспект настоящего изобретения относится к способу получения фармацевтически приемлемой соли соединения формулы I, включающему контакт соединения формулы I в свободной кислотной или основной форме с фармацевтически приемлемым основанием или кислотой. В других аспектах настоящее изобретение относится к продуктам, полученным любым из способов, описанных в настоящем изобретении, а также новым промежуточным соединениям, применяемым в данном способе. В одном аспекте настоящего изобретения новые промежуточные соединения имеют формулы 1, 6, 7, 8, 9 или их соли, как определено в настоящем изобретении.
Еще другой аспект настоящего изобретения относится к применению соединения формулы I или его фармацевтически приемлемой соли, для получения лекарственного средства, особенно для получения медикамента, пригодного для лечения гипертензии, сердечной недостаточности или заболевания почек. Другой аспект настоящего изобретения относится к применению соединения настоящего изобретения для ингибирования NEP фермента у млекопитающего. Еще другой аспект настоящего изобретения относится к применению соединения настоящего изобретения в качестве исследовательского инструмента. Другие аспекты и варианты осуществления настоящего изобретения описаны в настоящем изобретении.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
ОПРЕДЕЛЕНИЯ
При описании соединений, композиций, способов и процессов настоящего изобретения, следующие термины имеют следующие значения, если не указано иначе. Кроме того, как применяют в настоящем изобретении, единичные формы включают соответствующие множественные формы, если контекст применения ясно не диктует иначе. Предполагается, что термины "содержащий", "включающий" и "имеющий" являются включающими и обозначают то, что могут присутствовать дополнительные элементы, отличные от перечисленных элементов. Все числовые величины, выражающие количества ингредиентов, свойства, такие как молекулярный вес, условия реакции и так далее, применяемые в настоящем изобретении, следует понимать как модифицированные во всех случаях термином "приблизительно", если не указано иначе. Соответственно, числовые величины, приведенные в настоящем изобретении, являются приблизительными величинами, которые могут изменяться в зависимости от требуемых свойств, которые стремятся получить настоящим изобретением. По меньшей мере, и не как попытка ограничить применение теории эквивалентов до объема формулы изобретения, каждую числовую величину следует, по меньшей мере, интерпретировать с учетом сообщенных значащих цифр и применяя стандартные способы округления.
Термин "алкил" обозначает моновалентную насыщенную углеводородную группу, которая может быть линейной или разветвленной. Если не указано иначе, данные алкильные группы обычно содержат от 1 до 10 атомов углерода и включают, например, -C1-4алкил, -C1-5алкил, -C2-5алкил, -C1-6алкил, -C1-8алкил и -C1-10алкил. Примеры алкильных групп включают, например, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил, н-гексил, н-гептил, н-октил, н-нонил, н-децил и подобные.
Когда конкретное количество атомов углерода предполагается для конкретного термина, применяемого в настоящем изобретении, количество атомов углерода показано предшествующим термином в виде нижнего индекса. Например, термин "-C1-6алкил" обозначает алкильную группу, содержащую от 1 до 6 атомов углерода, и термин "-C3-7циклоалкил" обозначает циклоалкильную группу, содержащую от 3 до 7 атомов углерода, соответственно, где атомы углерода имеют любую приемлемую конфигурацию.
Термин "алкилен" обозначает двухвалентную насыщенную углеводородную группу, которая может быть линейной или разветвленной. Если не указано иначе, данные алкиленовые группы обычно содержат от 0 до 10 атомов углерода и включают, например, -C0-1алкилен-, -C0-6алкилен-, -C1-3алкилен- и -C1-6алкилен-. Примеры алкиленовых групп включают, например, метилен, этан-1,2-диил ("этилен"), пропан-1,2-диил, пропан-1,3-диил, бутан-1,4-диил, пентан-1,5-диил и подобные. Ясно, что когда алкиленовый термин содержит ноль атомов углерода, такой как -C0-1алкилен-, предполагается, что данные термины включают отсутствие атомов углерода, т.е. алкиленовая группа отсутствует, за исключением ковалентной связи, соединяющей группы, разделенные алкиленовым термином.
Термин "арил" обозначает моновалентной ароматический углеводород, содержащий одно кольцо (т.е. фенил) или одно или более конденсированных колец. Конденсированные кольцевые системы включают системы, которые являются полностью насыщенными (например, нафталин), а также системы, которые являются частично ненасыщенными (например, 1,2,3,4-тетрагидронафталин). Если не указано иначе, данные арильные группы обычно содержат от 6 до 10 кольцевых атомов углерода и включают, например, -C6-10арил. Примеры арильных групп включают, например, фенил и нафталин-1-ил, нафталин-2-ил и подобные.
Термин "циклоалкил" обозначает моновалентную насыщенную карбоциклическую углеводородную группу. Если не указано иначе, данные циклоалкильные группы обычно содержат от 3 до 10 атомов углерода и включают, например, -C3-5циклоалкил, -C3-6циклоалкил и -C3-7циклоалкил. Примеры циклоалкильных групп включают, например, циклопропил, циклобутил, циклопентил, циклогексил и подобные.
Термин "галоген" обозначает фтор, хлор, бром и йод.
Предполагается, что термин "гетероцикл" включает моновалентные ненасыщенные (ароматические) гетероциклы, содержащие одно кольцо или два конденсированных кольца, а также моновалентные насыщенные и частично ненасыщенные группы, содержащие одно кольцо или несколько конденсированных колец. Гетероциклильное кольцо может содержать в сумме от 3 до 15 кольцевых атомов, из которых 1-14 являются кольцевыми атомами углерода, и 1-4 являются кольцевыми гетероатомами, выбранными из азота, кислорода или серы. Обычно, однако, гетероциклильная группа содержит в сумме от 3 до 10 кольцевых атомов, из которых 1-9 являются кольцевыми атомами углерода, и 1-4 являются кольцевыми гетероатомами. Место присоединения может находиться при любом доступном кольцевом атоме углерода или атоме азота. Примеры гетероциклов включают, например, -C1-7гетероцикл, -C3-5гетероцикл, -C2-6гетероцикл, -C3-12гетероцикл, -C5-9гетероцикл, -C1-9гетероцикл, -C1-11гетероцикл и -C1-14гетероцикл.
Моновалентные ненасыщенные гетероциклы также обычно называют "гетероарильными" группами. Если не указано иначе, гетероарильные группы обычно содержат в сумме от 5 до 10 кольцевых атомов, из которых 1-9 являются кольцевыми атомами углерода, и 1-4 являются кольцевыми гетероатомами, и включают, например, -C1-9гетероарил и -C5-9гетероарил. Примеры гетероарильных групп включают, например, пиррол (например, 3-пирролил и 2H-пиррол-3-ил), имидазол (например, 2-имидазолил), фуран (например, 2-фурил и 3-фурил), тиофен (например, 2-тиенил), триазол (например, 1,2,3-триазолил и 1,2,4-триазолил), пиразол (например, 1H-пиразол-3-ил), оксазол (например, 2-оксазолил), изоксазол (например, 3-изоксазолил), тиазол (например, 2-тиазолил и 4-тиазолил) и изотиазол (например, 3-изотиазолил), пиридин (например, 2-пиридил, 3-пиридил и 4-пиридил), пиридилимидазол, пиридилтриазол, пиразин, пиридазин (например, 3-пиридазинил), пиримидин (например, 2-пиримидинил), тетразол, триазин (например, 1,3,5-триазинил), индолил (например, 1H-индол-2-ил, 1H-индол-4-ил и 1H-индол-5-ил), бензофуран (например, бензофуран-5-ил), бензотиофен (например, бензо[b]тиен-2-ил и бензо[b]тиен-5-ил), бензимидазол, бензоксазол, бензотиазол, бензотриазол, хинолин (например, 2-хинолил), изохинолин, хиназолин, хиноксалин и подобные.
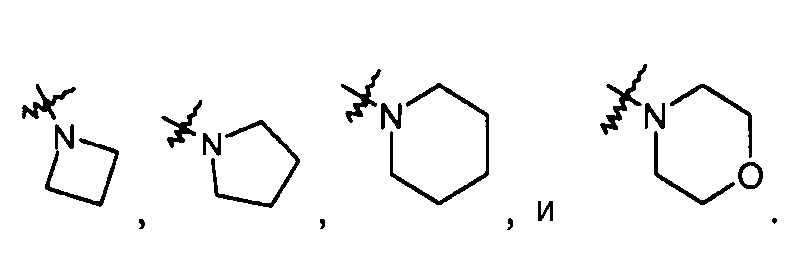
Моновалентные насыщенные гетероциклы обычно содержат в сумме от 3 до 10 кольцевых атомов, из которых 2-9 являются кольцевыми атомами углерода, и 1-4 являются кольцевыми гетероатомами, и включают, например, -C3-5гетероцикл. Примеры моновалентных насыщенных гетероциклов включают, например, моновалентные группы пирролидина, имидазолидина, пиразолидина, пиперидина, 1,4-диоксана, морфолина, тиоморфолина, пиперазина, 3-пирролина и подобные. В некоторых случаях группы можно описывать как взятые вместе, образуя -C3-5гетероцикл, необязательно содержащий атом кислорода в кольце. Данные группы включают:
Моновалентные частично ненасыщенные гетероциклы обычно содержат в сумме от 3 до 10 кольцевых атомов, из которых 2-11 являются кольцевыми атомами углерода, и 1-3 являются кольцевыми гетероатомами, и включают, например, -C3-5гетероцикл и -C2-12гетероцикл. Примеры моновалентных частично ненасыщенных гетероциклов включают, например, пиран, бензопиран, бензодиоксол (например, бензо[1,3]диоксол-5-ил), тетрагидропиридазин, 2,5-дигидро-1H-пиррол, дигидроимидазол, дигидротриазол, дигидрооксазол, дигидроизоксазол, дигидротиазол, дигидроизотиазол, дигидрооксадиазол, дигидротиадиазол, тетрагидропиридазин, гексагидропирролохиноксалин и дигидрооксадиазабензо[e]азулен. В некоторых случаях группы могут быть описаны как взятые вместе, образуя частично ненасыщенный -C3-5гетероцикл. Данные группы включают:
Термин "необязательно замещенный" обозначает то, что рассматриваемая группа может быть незамещенной или она может быть замещена один или несколько раз, например, 1-3 раза, или 1-5 раз или 1-8 раз. Например, фенильная группа, которая является "необязательно замещенной" атомами галогена, может быть незамещенной, или она может содержать 1, 2, 3, 4 или 5 атомов галогена; и алкильная группа, которая является "необязательно замещенной" атомами фтора, может быть незамещенной, или она может содержать 1, 2, 3, 4, 5, 6, 7 или 8 атомов фтора. Аналогично, группа, которая является "необязательно замещенной" одной или двумя -C1-6алкильными группами, может быть незамещенной, или она может содержать одну или две -C1-6алкильные группы.
Как применяют в настоящем изобретении, не предполагается, что фраза "имеющее формулу" или "имеющее структуру" является ограничивающей и ее применяют тем же способом, как обычно применяют термин "включающее". Например, если изображена одна структура, ясно, что все стереоизомерные и таутомерные формы включены, если не указано иначе.
Термин "фармацевтически приемлемая" относится к веществу, которое не является биологически или иначе неприемлемым при применении в настоящем изобретении. Например, термин "фармацевтически приемлемый носитель" относится к веществу, которое вводят в композицию и вводят пациенту, не вызывающему неприемлемых биологических эффектов или не взаимодействующему неприемлемым способом с другими компонентами композиции. Данные фармацевтически приемлемые вещества обычно удовлетворяют требуемым стандартам токсикологического и производственного испытания, и включают материалы, определенные как подходящие неактивные ингредиенты администрацией США по пищевым продуктам и лекарственным веществам.
Термин "фармацевтически приемлемая соль" обозначает соль, полученную из основания или кислоты, которая является приемлемой для введения пациенту, такому как млекопитающее (например, соли, имеющие приемлемую безопасность для млекопитающего для указанного режима дозирования). Однако, ясно, что не требуется, чтобы соли, включенные в настоящее изобретение, были фармацевтически приемлемыми солями, такими как соли промежуточных соединений, которые не предполагаются для введения пациенту. Фармацевтически приемлемые соли можно получить из фармацевтически приемлемых неорганических или органических оснований и из фармацевтически приемлемых неорганических или органических кислот. Кроме того, когда соединение формулы I содержит и основную группу, такую как амин, пиридин или имидазол, и кислотную группу, такую как карбоксильная группа или тетразол, могут образовываться цвиттерионы, и они включены в термин "соль", как применяют в настоящем изобретении. Соли, полученные из фармацевтически приемлемых неорганических оснований, включают соли аммония, кальция, меди, железа (II), железа (III), лития, магния, марганца (III), марганца (II), калия, натрия и цинка, и подобные. Соли, полученные из фармацевтически приемлемых органических оснований, включают соли первичных, вторичных и третичных аминов, включая замещенные амины, циклические амины, встречающиеся в природе амины и подобные, такие как аргинин, бетаин, кофеин, холин, N,N'-дибензилэтилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперадин, полиаминовые смолы, прокаин, пурины, теобромин, триэтиламин, триметиламин, трипропиламин, трометамин и подобные. Соли, полученные из фармацевтически приемлемых неорганических кислот, включают соли борной, угольной, галогенводородных (бромистоводородной, хлористоводородной, фтористоводородной или иодистоводородной), азотной, фосфорной, сульфаминовой и серной кислот. Соли, полученные из фармацевтически приемлемых органических кислот, включают соли алифатических гидроксикислот (например, лимонной, глюконовой, гликолевой, молочной, лактобионовой, яблочной и винной кислот), алифатических монокарбоновых кислот (например, уксусной, масляной, муравьиной, пропионовой и трифторуксусной кислот), аминокислот (например, аспарагиновой и глютаминовой кислот), ароматических карбоновых кислот (например, бензойной, п-хлорбензойной, дифенилуксусной, гентизиновой, гиппуровой и трифенилуксусной кислот), ароматических гидроксикислот (например, o-гидроксибензойной, п-гидроксибензойной, 1-гидроксинафталин-2-карбоновой и 3-гидроксинафталин-2-карбоновой кислот), аскорбиновой кислоты, дикарбоновых кислот (например, фумаровой, малеиновой, щавелевой и янтарной кислот), глюкуроновой, миндальной, муциновой, никотиновой, оротовой, памовой, пантотеновой кислот, сульфокислот (например, бензолсульфоновой, камфосульфоновой, эдизиловой, этансульфоновой, изетионовой, метансульфоновой, нафталинсульфоновой, нафталин-1,5-дисульфоновой, нафталин-2,6-дисульфоновой и п-толуолсульфоновой кислот), ксинафоевой кислоты и подобных.
Как применяют в настоящем изобретении, предполагается, что термин "пролекарство" обозначает неактивный (или значительно менее активный) предшественник лекарственного средства, который превращается в его активную форму в теле в физиологических условиях, например, нормальными биологическими процессами. Данные соединения могут не обладать фармакологической активностью относительно NEP, но их можно вводить перорально или парентерально и после этого они подвергаются метаболизму в теле, образуя соединения, которые являются фармакологически активными относительно NEP. Примеры пролекарств включают эфиры, такие как C1-6алкиловые эфиры и арил-C1-6алкиловые эфиры. В одном варианте осуществления активное соединение содержит свободную карбоксильную группу, и пролекарство представляет собой его эфирное производное, т.е. пролекарство представляет собой эфир, такой как -C(O)OCH2CH3. Затем данные эфирные пролекарства превращаются сольволизом или в физиологических условиях в соединение со свободной карбоксильной группой. Также предполагается, что термин включает определенные защищенные производные соединений формулы I, которые можно получить перед конечной стадии снятия защитной группы. Таким образом, все защищенные производные и пролекарства соединений формулы I включены в объем настоящего изобретения.
Термин "терапевтически эффективное количество" обозначает количество, достаточное для осуществления лечения при введении нуждающемуся в лечении пациенту, т.е. количество лекарственного средства, необходимое для получения требуемого терапевтического эффекта. Например, терапевтически эффективное количество для лечения гипертензии представляет собой количество соединения, требуемое, например, для ослабления, подавления, устранения или предотвращения симптомов гипертензии, или для лечения лежащей в основе причины гипертензии. В одном варианте осуществления терапевтически эффективное количество представляет собой количество лекарственного средства, требуемое для снижения кровяного давления, или количество лекарственного средства, требуемое для поддержания нормального кровяного давления. С другой стороны, термин "эффективное количество" обозначает количество, достаточное для получения требуемого результата, который может быть необязательно терапевтическим результатом. Например, при исследовании системы, содержащей NEP фермент, "эффективное количество" может представлять собой количество, требуемое для ингибирования фермента.
Термин "лечить" или "лечение", как применяют в настоящем изобретении, обозначает лечение заболевания или медицинского состояния (такого как гипертензия) у пациента, такого как млекопитающее (в частности человека), которое включает одно или более из следующих: (a) предотвращение возникновения заболевания или медицинского показания, т.е. предотвращение повторения заболевания или медицинского показания или профилатическое лечение пациента, который является предрасположенным к заболеванию или медицинскому показанию; (b) улучшение заболевания или медицинского показания, т.е. устранение или вызывание регрессии заболевания или медицинского показания у пациента; (c) подавление заболевания или медицинского показания, т.е. замедление или остановку развития заболевания или медицинского показания у пациента; или (d) облегчение симптомов заболевания или медицинского показания у пациента. Например, термин "лечение гипертензии" будет включать предотвращение возникновения гипертензии, улучшение гипертензии, подавление гипертензии и облегчение симптомов гипертензии (например, снижение кровяного давления). Предполагается, что термин "пациент" включает млекопитающих, таких как люди, которые нуждаются в лечении или предотвращении заболевания или которые в настоящий момент подвергаются лечению для предотвращения или лечения конкретного заболевания или медицинского показания, а также субъектов для испытаний, в которых соединения настоящего изобретения оценивают или применяют в анализе, например, животная модель.
Предполагается, что все другие термины, применяемые в настоящем изобретении, имеют их стандартное значение, которое известно специалисту в данной области техники, к которой они принадлежат.
В одном аспекте настоящее изобретение относится к соединениям формулы I:

или его фармацевтически приемлемой соли.
Как применяют в настоящем изобретении, термин "соединение настоящего изобретения" включает все соединения, включенные формулой I, такие как варианты, осуществленные в формулах 1a и 1b, а также соединения, включенные формулами II и III, и их варианты. Кроме того, соединения настоящего изобретения могут также содержать несколько основных или кислых групп (например, амино или карбоксильные группы) и, следовательно, данные соединения могут существовать в виде свободного основания, свободной кислоты или в различных солевых формах. Все данные солевые формы включены в объем настоящего изобретения. Кроме того, соединения настоящего изобретения могут также существовать в виде пролекарств. Соответственно, специалисту в данной области техники ясно, что ссылка на соединение в настоящем изобретении, например, ссылка на "соединение настоящего изобретения" или "соединение формулы I" включает соединение формулы I, а также фармацевтически приемлемые соли и пролекарства данного соединения, если не указано иначе. Кроме того, предполагается, что термин "или его фармацевтически приемлемая соль и/или пролекарство" включает все комбинации солей и пролекарств, такие как фармацевтически приемлемая соль пролекарства. Кроме того, сольваты соединений формулы I включены в объем настоящего изобретения.
Соединения формулы I могут содержать один или более хиральных центров и, следовательно, данные соединения можно получить и применять в различных стереоизомерных формах. Соответственно, настоящее изобретение также относится к рацемическим смесям, чистым стереоизомерам (например, энантиомерам и диастереомерам), обогащенным стереоизомером смесям и подобным, если не указано иначе. Когда химическая структура показана в настоящем изобретении без любой стереохимии, ясно, что все возможные стереоизомеры включены данной структурой. Таким образом, предполагается, например, что термины "соединение формулы I", "соединения формулы II" и так далее включают все возможные стереоизомеры соединения. Аналогично, когда показан или назван конкретный стереоизомер в настоящем изобретении, специалисту в данной области техники ясно, что небольшие количества других стереоизомеров могут присутствовать в композиции настоящего изобретения, если не указано иначе, при условии, что полезность композиции как целого не устраняется наличием данных других изомеров. Отдельные стереоизомеры можно получить многочисленными способами, которые являются хорошо известными в данной области техники, включая хиральную хроматографию, применяя подходящую хиральную стационарную фазу или подложку, или химическим превращением их в диастереоизомеры, разделением диастереоизомеров общепринятыми способами, такими как хроматография или перекристаллизация, затем регенерированием исходного стереоизомера.
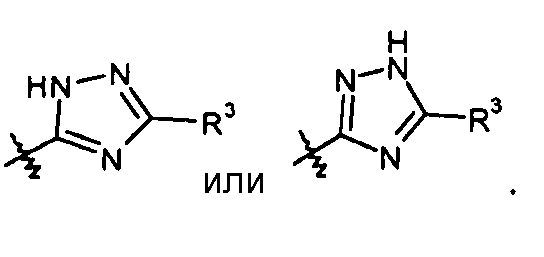
Кроме того, где применимо, все цис-транс или E/Z изомеры (геометрические изомеры), таутомерные формы и топоизомерные формы соединений настоящего изобретения включены в объем настоящего изобретения, если не указано иначе. Например, если X показан как (R4 является водородом):
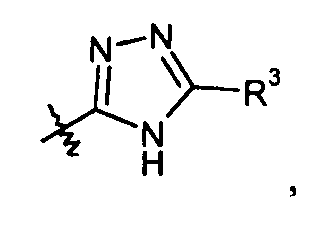
ясно, что соединение может также существовать в таутомерной форме, такой как:
Более конкретно, соединения формулы I могут содержать по меньшей мере один хиральный центр, показанный символом * в следующей формуле:

В одном варианте осуществления настоящего изобретения атом углерода, показанный символом *, имеет (R) конфигурацию. Данный вариант осуществления настоящего изобретения показан в формуле 1a:

В данном варианте осуществления соединения имеют (R) конфигурацию при * атоме углерода или обогащены стереоизомерной формой, имеющей (R) конфигурацию при данном атоме углерода.
В другом варианте осуществления атом углерода, показанный символом *, имеет (S) конфигурацию. Данный вариант осуществления настоящего изобретения показан в формуле 1b:

В данном варианте осуществления соединения имеют (S) конфигурацию при * атоме углерода или обогащены стереоизомерной формой, имеющей (S) конфигурацию при данном атоме углерода.
В некоторых вариантах осуществления для того, чтобы оптимизировать терапевтическую активность соединений настоящего изобретения, например, для лечения гипертензии, может быть желательно, чтобы атом углерода, показанный * символом, имел конкретную (R) или (S) конфигурацию или был обогащен стереоизомерной формой, имеющей данную конфигурацию. Например, в одном варианте осуществления соединения настоящего изобретения имеют (R) конфигурацию формулы 1a или обогащены стереоизомерной формой, имеющей (R) конфигурацию, и в другом варианте осуществления соединения настоящего изобретения имеют (S) конфигурацию формулы 1b или обогащены стереоизомерной формой, имеющей (S) конфигурацию. В других вариантах осуществления соединения настоящего изобретения присутствуют в виде рацемической смеси, например, в виде смеси энантиомеров формулы 1a и 1b.
Соединения настоящего изобретения, а также соединения, применяемые при их получении, могут также включать изотопно-меченные соединения, т.е. когда один или более атомов обогащены атомами, имеющими атомную массу, отличную от атомной массы, преимущественно обнаруживаемой в природе. Примеры изотопов, которые можно вводить в соединения формулы I, например, включают, но не ограничиваются ими,2H,3H,13C,14C,15N,18O,17O,35S,36Cl и18F. Особый интерес представляют соединения формулы I, обогащенные тритием или углеродом-14, которые можно применять, например, в исследованиях распределения в тканях; соединения формулы I, обогащенные дейтерием, особенно в месте метаболизма, приводя в результате, например, к соединениям, имеющим большую метаболическую стабильность; и соединения формулы I, обогащенные позитронно-активным изотопом, таким как11C,18F,15O и13N, которые можно применять, например, в исследованиях с помощью позитронно-эмиссионной томографии (PET).
Номенклатура, применяемая в настоящем изобретении для обозначения соединений настоящего изобретения, показана в примерах настоящего изобретения. Данная номенклатура получена, применяя имеющееся в продаже AutoNom программное обеспечение (MDL, San Leandro, California).
РЕПРЕЗЕНТАТИВНЫЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
Предполагается, что следующие заместители и величины обеспечивают репрезентативные примеры различных аспектов и вариантов осуществления настоящего изобретения. Предполагается, что данные репрезентативные величины дополнительно определяют и иллюстрируют данные аспекты и варианты осуществления и не предполагается, что они исключают другие варианты осуществления или ограничивают объем настоящего изобретения. В этой связи, не предполагается, что утверждение, что конкретная величина или заместитель является предпочтительной, исключает любым способом другие величины или заместители из настоящего изобретения, если специально не указано.
В одном аспекте настоящее изобретение относится к соединениям формулы I:

R1 выбран из -OR7 и -NR8R9. R7 группа выбрана из
H;
-C1-8алкила, например, -CH3, -CH2CH3, -(CH2)2CH3, -CH(CH3)2, -CH2CH(CH3)2, -(CH2)3CH3, -(CH2)4CH3, -(CH2)2CH(CH3)2, -(CH2)5CH3 и -(CH2)6CH3;
-C1-3алкилен-C6-10арила, например, бензила;
-C1-3алкилен-C1-9гетероарила, например, -CH2-пиридинила и -(CH2)2-пиридинила;
-C3-7циклоалкила, например, циклопентила;
-[(CH2)2O]1-3CH3, например, -(CH2)2OCH3 и -[(CH2)2O]2CH3;
-C1-6алкилен-OC(O)R10, например, -CH2OC(O)CH3, -CH2OC(O)CH2CH3, -CH2OC(O)(CH2)2CH3, -CH2CH(CH3)OC(O)CH2CH3, -CH2OC(O)OCH3, -CH2OC(O)OCH2CH3, -CH(CH3)OC(O)OCH2CH3, -CH(CH3)OC(O)O-CH(CH3)2, -CH2CH(CH3)OC(O)-циклопентила, -CH2OC(O)O-циклопропила, -CH(CH3)-OC(O)-O-циклогексила, -CH2OC(O)O-циклопентила, -CH2CH(CH3)OC(O)фенила, -CH2OC(O)O-фенила, -CH2OC(O)-CH[CH(CH3)2]-NH2, -CH2OC(O)-CH[CH(CH3)2]-NHC(O)OCH3 и -CH(CH3)OC(O)-CH(NH2)CH2COOCH3;
-C1-6алкилен-NR12R13, например, -(CH2)2-N(CH3)2,

-C1-6алкилен-C(O)R31, например, -CH2C(O)OCH3, -CH2C(O)O-бензила, -CH2C(O)-N(CH3)2 и

-C0-6алкиленморфолинила, например, -(CH2)2-морфолинила и -(CH2)3-морфолинила:

-С1-6алкилен-SO2-C1-6алкила, например, -(CH2)2SO2CH3;



R10 группа выбрана из
-C1-6алкила, например, -CH3 и -CH2CH3;
-O-C1-6алкила, например, -OCH3, -O-CH2CH3 и -O-CH(CH3)2;
-C3-7циклоалкила, например, циклопентила;
-O-C3-7циклоалкила, например, -O-циклопропила, -O-циклогексила и -O-циклопентила;
фенила;
-O-фенила;
-NR12R13;
-CH[CH(CH3)2]-NH2;
-CH[CH(CH3)2]-NHC(O)O-C1-6алкила, например, -CH[CH(CH3)2]-NHC(O)OCH3; и
-CH(NH2)CH2COOCH3.
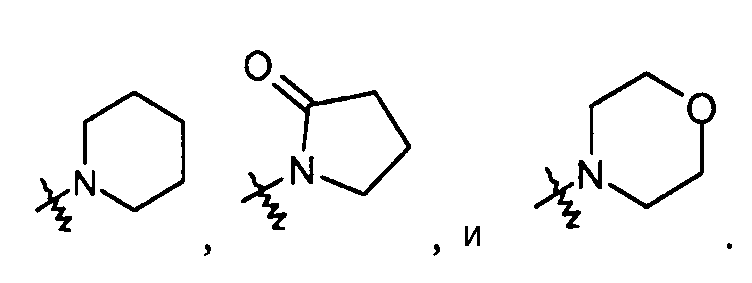
R12 и R13 группы независимо выбраны из H, -C1-6алкила (например, CH3) и бензила. Альтернативно, R12 и R13 группы можно брать вместе в виде -(CH2)3-6-, -C(O)-(CH2)3- или -(CH2)2O(CH2)2-, например, образуя группу, такую как:
R31 группа выбрана из -O-C1-6алкила, например, -OCH3, -O-бензила и -NR12R13, например, -N(CH3)2 и

R32 группа представляет собой -С1-6алкил (например, -CH3 и -C(CH3)3) или -C0-6алкилен-C6-10арил.
R8 группа выбрана из
H;
-OH;
-OC(O)R14, например, -OC(O)CH3, -OC(O)фенила, -OC(O)-OCH2-фенила, -OC(O)-CH2O-фенила, -OC(O)(NH2) и -OC(O)[N(CH3)2];
-CH2COOH;
-O-бензила;
пиридила; и
-OC(S)NR15R16, например, -OC(S)NH2 и -OC(S)N(CH3)2.
R14 группа выбрана из
H;
-C1-6алкила, например, -CH3;
-C6-10арила, например, фенила;
-OCH2-C6-10арила, например, -OCH2-фенила;
-CH2O-C6-10арила, например, -CH2O-фенила; и
-NR15R16, например, -NH2 и N(CH3)2.
R15 и R16 группы независимо выбраны из H и -C1-4алкила.
R9 группа выбрана из H, -C1-6алкила (например, -CH3) и -C(O)R17(например, -C(O)H). R17 группа выбрана из H, -C1-6алкила (например, -CH2CH3), -C3-7циклоалкила (например, циклопропила), -C6-10арила (например, фенила) и -C1-9гетероарила (например, пиридина).
Кроме того, каждая алкильная группа в R1 необязательно замещена 1-8 атомами фтора. Например, когда R1 представляет собой -OR7, и R7 представляет собой -C1-8алкил, R1 может также представлять собой группу, такую как -OCH(CH3)CF3, -OCH2CF2CF3, -OCH(CF3)2, -O(CH2)2CF3, -OCH(CH2F)2, -OC(CF3)2CH3 и -OCH(CH3)CF2CF3.
В одном варианте осуществления R1 представляет собой -OR7, и R7 выбран из H, -C1-8алкила, -C1-3алкилен-C6-10арила, -C0-6алкиленморфолинила и

где R32 представляет собой -C1-6алкил; и где каждая алкильная группа необязательно замещена 1-8 атомами фтора. В других вариантах осуществления данные соединения имеют формулу III.
В одном варианте осуществления R1 выбран из -OR7 и -NR8R9, где R7 представляет собой H, R8 представляет собой H или -OH, и R9 представляет собой H. В других вариантах осуществления данные соединения имеют формулу III.
В другом варианте осуществления R1 представляет собой -OR7, где R7 выбран из -C1-8алкила, -C1-3алкилен-C6-10арила, -C1-3алкилен-C1-9гетероарила, -C3-7циклоалкила, -[(CH2)2O]1-3CH3, -C1-6алкилен-OC(O)R10, -C1-6алкилен-NR12R13, -C1-6алкилен-C(O)R31, -C0-6алкиленморфолинила; -C1-6алкилен-SO2-C1-6алкила;
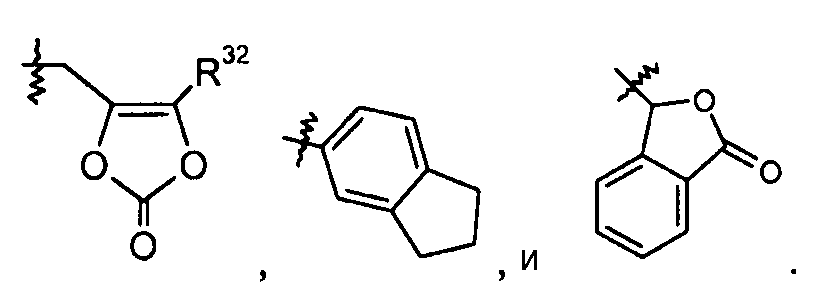
В еще другом варианте осуществления R1 представляет собой -NR8R9; где R8 выбран из -OC(O)R14, -CH2COOH, -O-бензила, пиридила и -OC(S)NR15R16; и R9 представляет собой H. В еще другом варианте осуществления R1 представляет собой -NR8R9, где R8 представляет собой H или -OH; и R9 представляет собой -C1-6алкил или -C(O)R17. В еще другом варианте осуществления R1 представляет собой -NR8R9, где R8 выбран из -OC(O)R14, -CH2COOH, -O-бензила, пиридила и -OC(S)NR15R16; и R9 представляет собой -C1-6алкил или -C(O)R17. В другом варианте осуществления данные соединения имеют формулу III. В одном аспекте настоящего изобретения данные соединения могут быть особенно полезны в качестве пролекарств или в качестве промежуточных соединений в способах получения, описанных в настоящем изобретении. Например, в одном варианте осуществления R1 представляет собой -OR7, и R7 представляет собой -C1-6алкилен-OC(O)R10, такой как -O-CH(CH3)OC(O)-O-циклогексил:
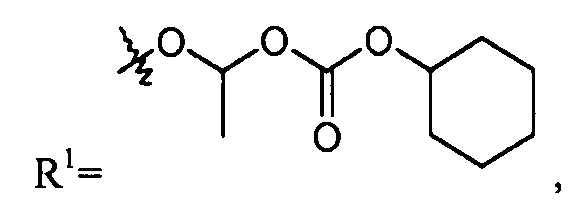
делая соединение цилексетиловым эфиром; или R1 представляет собой -OR7, и R7 представляет собой -C0-6алкиленморфолинил, такой как -O-(CH2)2-морфолинил:
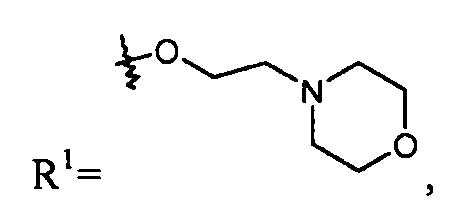
делая соединение 2-морфолиноэтиловым или мофетиловым эфиром; или R1 представляет собой -OR7, и R7 представляет собой

такой как -O-CH2-5-метил-[1,3]диоксол-2-он:

делая соединение медоксомиловым эфиром.
R2 представляет собой H или -P(O)(OH)2. R2 можно также брать вместе с R7, получая -CR18R19- или брать вместе с R8, получая -C(O)-. R18 и R19 независимо выбраны из H, -C1-6алкила и -O-C3-7циклоалкила, или R18 и R19 можно брать вместе, получая =O. В одном варианте осуществления R2 представляет собой H. В другом варианте осуществления данное соединение имеет формулу III.
Когда R2 берут вместе с R7, получая -CR18R19-, данный вариант осуществления может быть показан как:

и когда R18 и R19 берут вместе, получая =O, данный вариант осуществления может быть показан как:

Когда R2 берут вместе с R8, получая -C(O)-, данный вариант осуществления может быть показан как:

В одном аспекте настоящего изобретения данные соединения могут быть особенно полезны в качестве пролекарств или в качестве промежуточных соединений в способах получения, описанных в настоящем изобретении. В другом варианте осуществления данные соединения имеют формулу III. Соединения, когда R2 представляет собой -P(O)(OH)2, могут также быть полезны в качестве пролекарств.
"X" группа представляет собой -C1-9гетероарил, и место присоединения находится при любом доступном кольцевом атоме углерода или азота. Следует отметить, что в некоторых вариантах осуществления R3 и/или R4 могут отсутствовать. Когда он присутствует, R3 может быть при любом доступном атоме углерода. Когда он присутствует, R4 может быть при любом доступном атоме углерода или азота. Примеры -C1-9гетероарильных колец включают, в качестве иллюстрации и не ограничения:
пиразольные кольца, такие как:
конкретные примеры которых включают:
имидазольные кольца, такие как:

конкретные примеры которых включают:
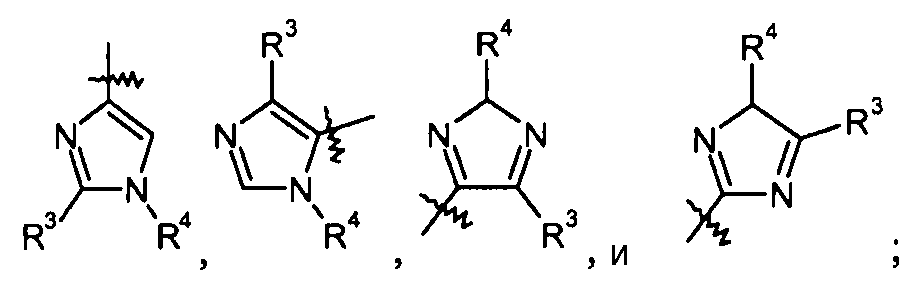
триазольные кольца, включая 1,2,3-триазол, такие как:

а также 1,2,4-триазол, такой как:

бензотриазольные кольца, такие как:
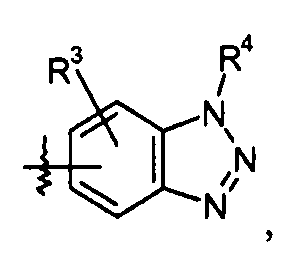
конкретные примеры которых включают:

фурановые кольца:

конкретные примеры которых включают:

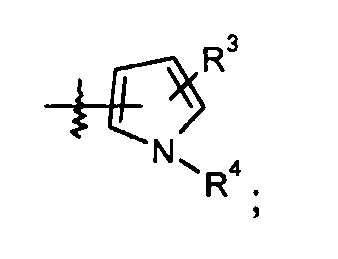
пиррольные кольца:

конкретные примеры которых включают:
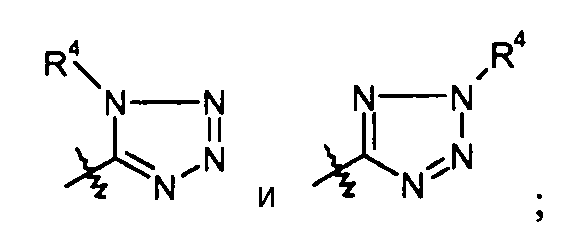
тетразольные кольца, такие как:
пиразиновые кольца:
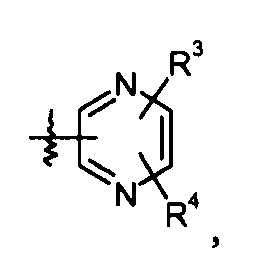
конкретные примеры которых включают:

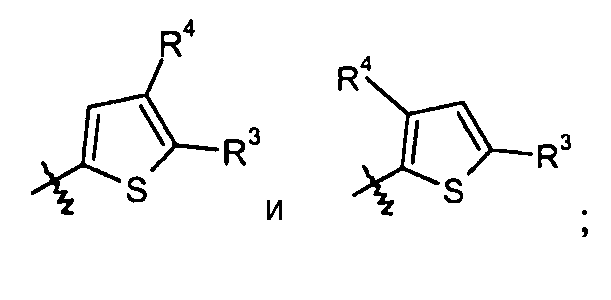
тиофеновые кольца:

конкретные примеры которых включают:
оксазольные кольца:
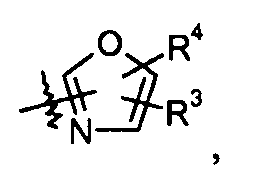
конкретные примеры которых включают:

изоксазольные кольца:
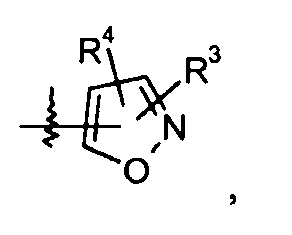
конкретные примеры которых включают:
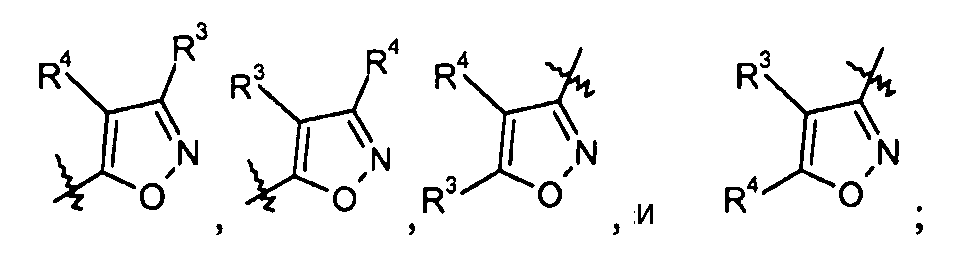
тиазольные кольца:

конкретные примеры которых включают:
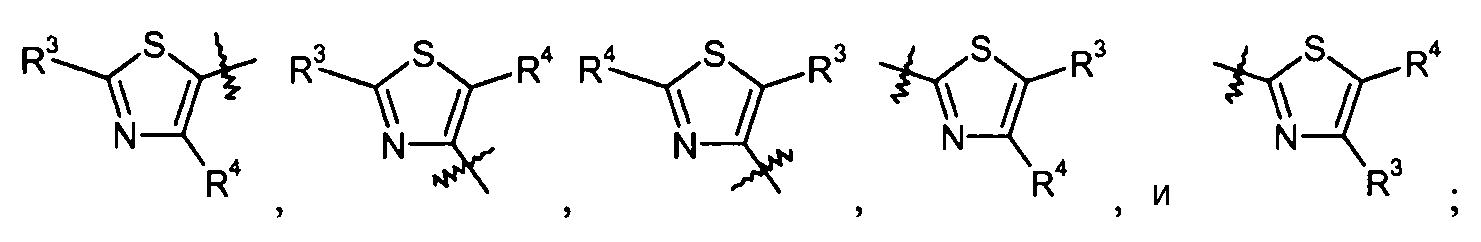
изотиазольные кольца:
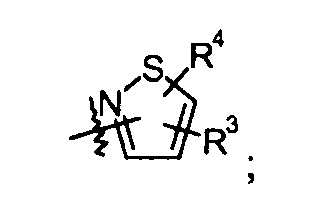
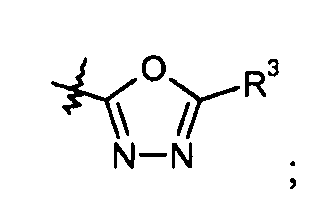
оксадиазольные кольца, включая [1,2,4]оксадиазол, такие как:
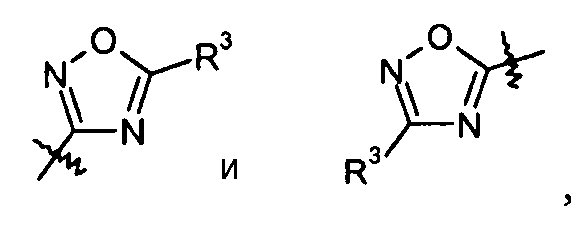
а также [1,2,3]оксадиазол, такой как
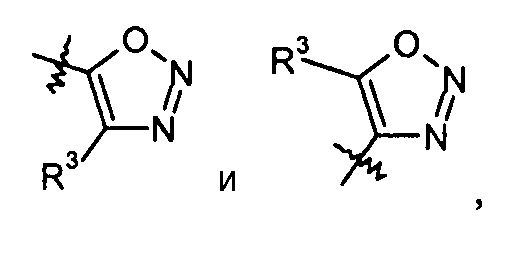
и [1,3,4]оксадиазол:
тиадиазольные кольца, включая [1,2,4]тиадиазол, такие как:

а также [1,2,3]тиадиазол, такой как:

и [1,3,4]тиадиазол:

пиридазиновые кольца:
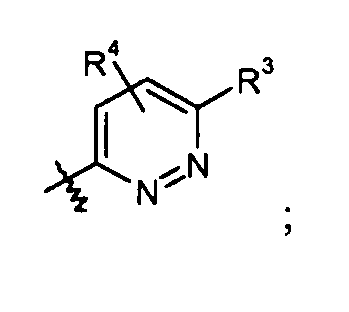
пиридиновые кольца:

конкретные примеры которых включают:
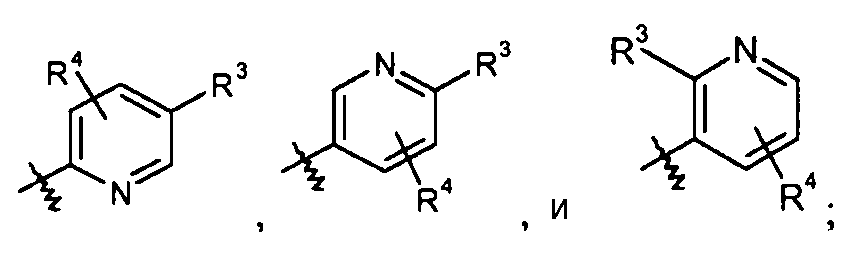
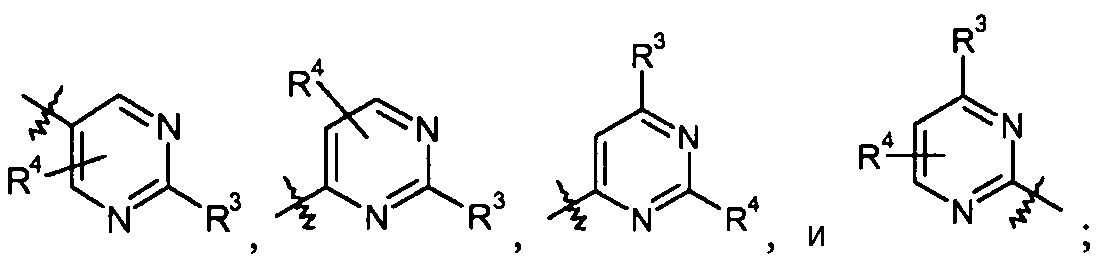
пиримидиновые кольца:
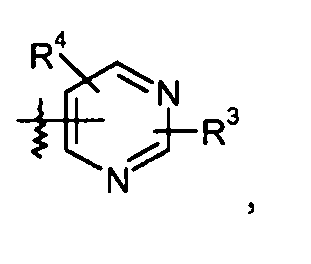
конкретные примеры которых включают:
пирановые кольца, такие как:

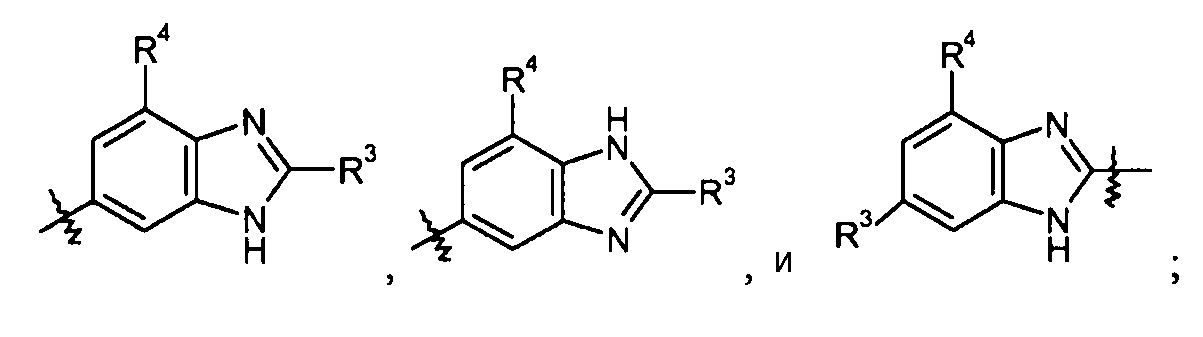
бензимидазольные кольца, такие как:

конкретные примеры которых включают:
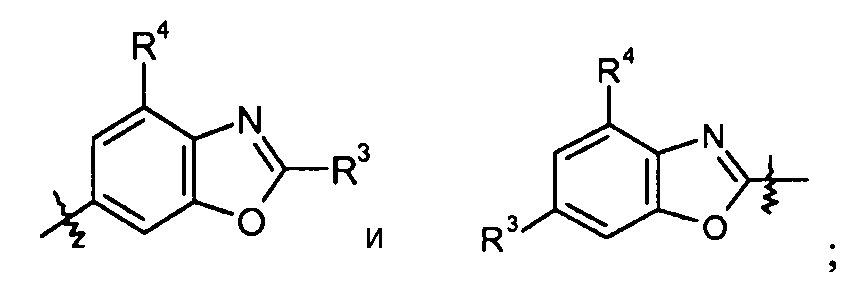
бензоксазольные кольца, такие как:

конкретные примеры которых включают:
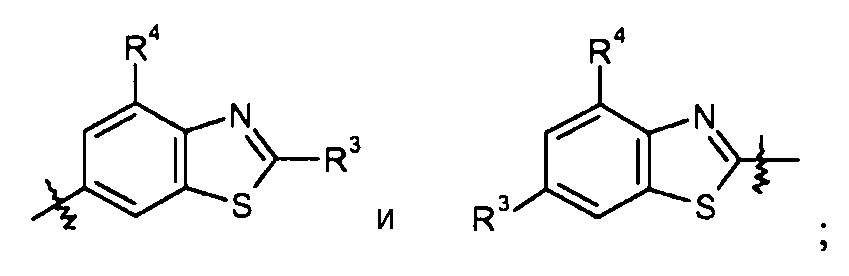
бензотиазольные кольца, такие как:
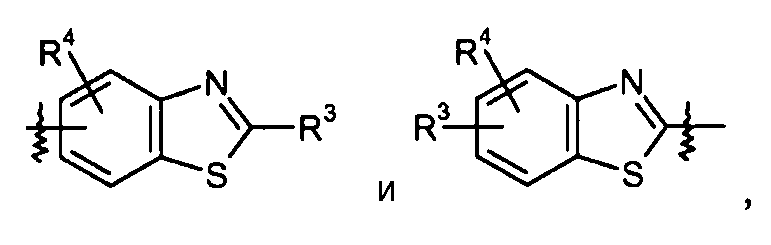
конкретные примеры которых включают:
пиридилимидазольные кольца, такие как:
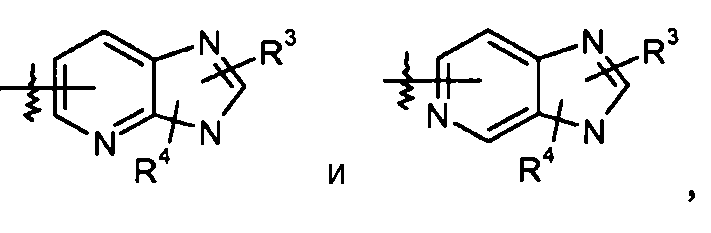
конкретные примеры которых включают:
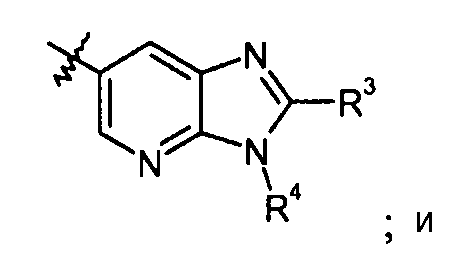
пиридилтриазольные кольца, такие как:

конкретные примеры которых включают:

В одном конкретном варианте осуществления X выбран из пиразола, имидазола, триазола, бензотриазола, фурана, пиррола, тетразола, пиразина, тиофена, оксазола, изоксазола, тиазола, изотиазола, оксадиазола, тиадиазола, пиридазина, пиридина, пиримидина, пирана, бензимидазола, бензоксазола, бензотиазола, пиридилимидазола и пиридилтриазола.
Ясно, что некоторые -C1-9гетероарильные кольца могут существовать в таутомерной форме, и что данные таутомерные формы являются частью настоящего изобретения и включены термином "гетероарил". Следовательно, если соединение показано как -C1-9гетероарильное кольцо, ясно, что соединение может также существовать в таутомерной форме и обратно, и что обе формы включены в настоящее изобретение.

В одном конкретном варианте осуществления X выбран из пиразола, триазола, бензотриазола, тетразола, оксазола, изоксазола, тиазола, пиридазина, пиримидина и пиридилтриазола. В еще другом варианте осуществления X представляет собой изоксазол и в одном конкретном варианте осуществления имеет формулу III:
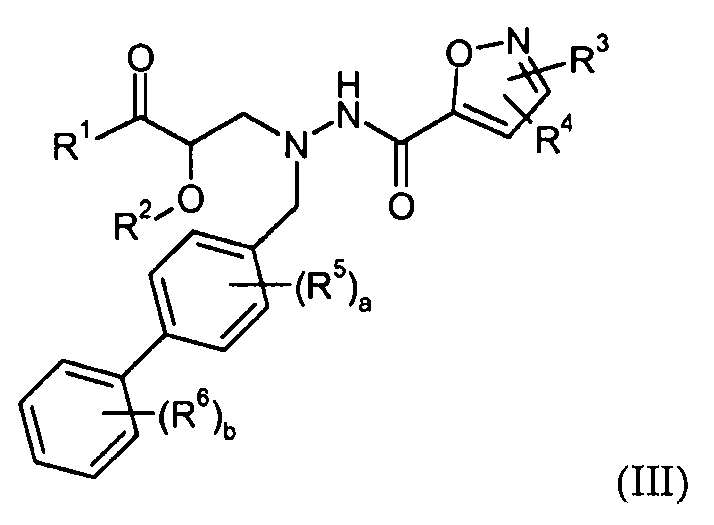
где R1-R6, a и b представляют собой, как определено для формулы I. В еще другом варианте осуществления соединения настоящего изобретения имеют формулу IIIa:
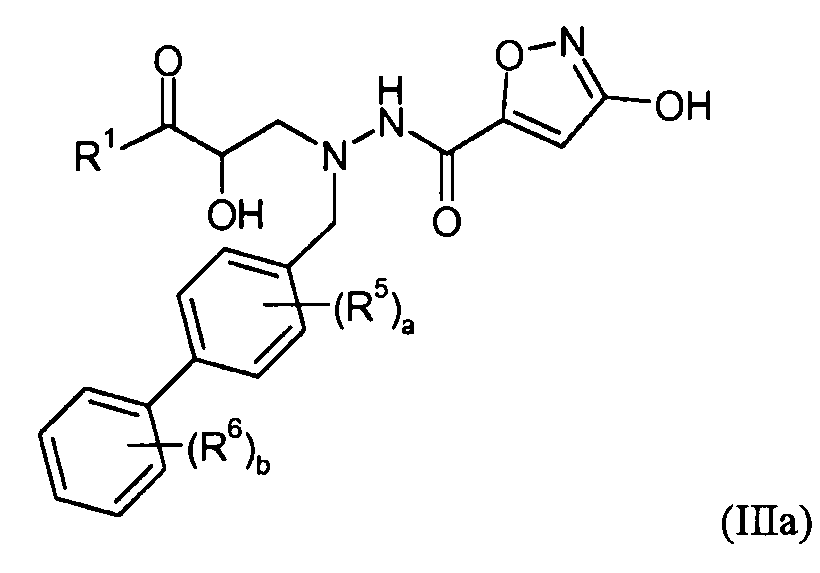
где R1, R5, R6, a и b представляют собой, как определено для формулы I. В еще другом варианте осуществления соединения настоящего изобретения имеют формулу IIIb:
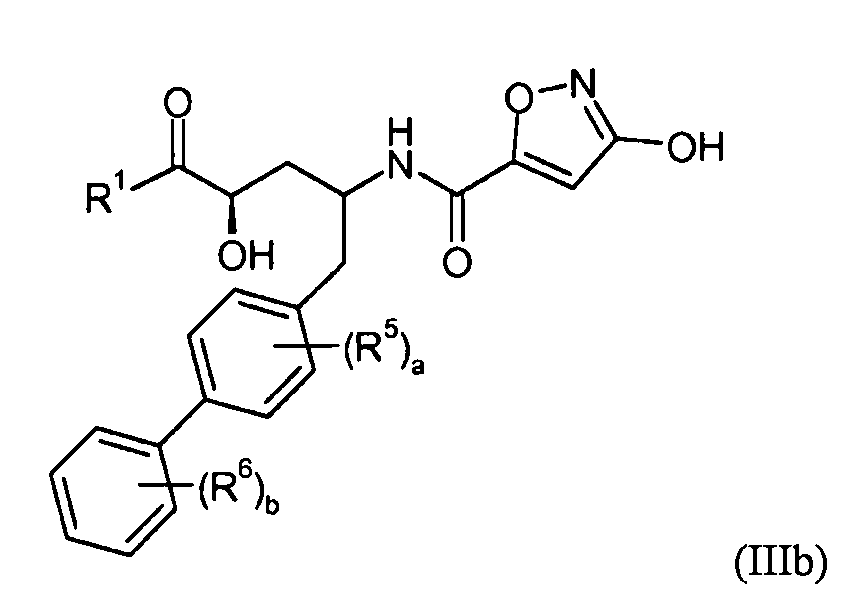
где R1, R5, R6, a и b представляют собой, как определено для формулы I.
R3 группа может отсутствовать. Когда она присутствует, R3 соединена с атомом углерода в "X" группе, и выбрана из
H;
галогена, например, хлора и фтора;
-C0-5алкилен-OH, например, -OH, -CH2OH, -CH(OH)CH3 и -C(CH3)2-OH;
-NH2;
-C1-6алкила, например, -CH3, -(CH2)2CH3, -CH(CH3)2 и -(CH2)3-CH3;
-CF3;
-C3-7циклоалкила, например, циклопропила и циклогексила;
-C0-2алкилен-O-C1-6алкила, например, -OCH3, -OCH2CH3, -CH2-OCH3 и -(CH2)2-OCH3;
-C(O)R20, например, -C(O)H и -C(O)CH3;
-C0-1алкилен-COOR21, например, -COOH, -CH2-COOH, -C(O)O-CH2CH3, -C(O)O-(CH2)2OCH3, -C(O)O-CH2OC(O)CH3, -CH2-C(O)O-CH2OC(O)CH3, -C(O)O-CH2OC(O)O-CH3, -CH2-C(O)O-CH2OC(O)O-CH3, -C(O)O-CH(CH3)OC(O)O-CH2CH3, -C(O)O-CH(CH3)OC(O)O-CH(CH3)2, -C(O)O-CH2CH(CH3)OC(O)-циклопентила, -C(O)O-CH2OC(O)O-циклопропила, -C(O)O-CH(CH3)-OC(O)-O-циклогексила, -C(O)O-CH2OC(O)O-циклопентила, -C(O)O-CH2CH(CH3)OC(O)фенила, -C(O)O-CH2OC(O)O-фенила, -C(O)O-CH2-пиридина, -C(O)O-CH2-пирролидина, -C(O)O-(CH2)2-морфолинила, -C(O)O-(CH2)3-морфолинила и -C(O)O-(CH2)2-SO2-CH3;
-C(O)NR22R23, например, -C(O)NH2, -C(O)NHCH3, -C(O)N(CH3)2, -C(O)NH-(CH2)2CH3, -C(O)NH-CH2COOH, -C(O)NH-(CH2)2-OH, -C(O)NH-(CH2)2-N(CH3)2, -C(O)NH-циклопропила, -C(O)NH-(CH2)2-имидазолила, -C(O)N(CH3)-CH2CH(CH3)2 и -C(O)N(CH3)[(CH2)2OCH3];
-NHC(O)R24, например, -NHC(O)-CH2CH3, -NHC(O)-(CH2)3CH3, -NHC(O)O-CH2CH3, -NHC(O)-CH2-OCH3, -NHC(O)-2-метоксифенила, -NHC(O)-2-хлорфенила и -NHC(O)-2-пиридина;
=O;
-NO2;
-C(CH3)=N(OH);
фенила, необязательно замещенного одной или двумя группами, независимо выбранными из галогена, -OH, -CF3, -OCH3, -NHC(O)CH3 и фенила (например, фенил, 2-хлорфенил, 2-фторфенил, 2-гидроксифенил, 2-трифторметилфенил, 2-метоксифенил, 3-хлорфенил, 3-фторфенил, 3-метоксифенил, 3-NHC(O)CH3-фенил, 4-хлорфенил, 4-фторфенил, 4-метоксифенил, 4-бифенил, 2,5-дифторфенил, 2,5-диметоксифенил, 2,4-дихлорфенил, 2-метокси, 5 -фторфенил и 3,4-дифторфенил);
нафталенила;
пиридинила;
пиразинила;
пиразолила, необязательно замещенного метилом;
тиофенила, необязательно замещенного метилом или галогеном (например, хлором);
фуранила; и
-CH2-морфолинила.
R20 группа выбрана из H и -C1-6алкила (например, -CH3). R21 группа выбрана из
H;
-C1-6алкила, например, -CH3 и -CH2CH3;
-C1-3алкилен-C6-10арила;
-C1-3алкилен-C1-9гетероарила, например, -CH2-пиридина;
-C3-7циклоалкила;
-[(CH2)2O]1-3CH3, например, -(CH2)2OCH3;
-C1-6алкилен-OC(O)R25, например, -CH2OC(O)CH3, -CH2OC(O)O-CH3, -CH2OC(O)O-CH3, -CH(CH3)OC(O)O-CH2CH3, -CH(CH3)OC(O)O-CH(CH3)2, -CH2CH(CH3)OC(O)-циклопентила, -CH2OC(O)O-циклопропила, -CH(CH3)-OC(O)-O-циклогексила, -CH2OC(O)O-циклопентила, -CH2CH(CH3)OC(O)фенила и -CH2OC(O)O-фенила;
-C1-6алкилен-NR27R28, например, -CH2-пирролидина;
-C1-6алкилен-C(O)R33;
-C0-6алкиленморфолинила, например, -(CH2)2-морфолинила и -(CH2)3-морфолинила:
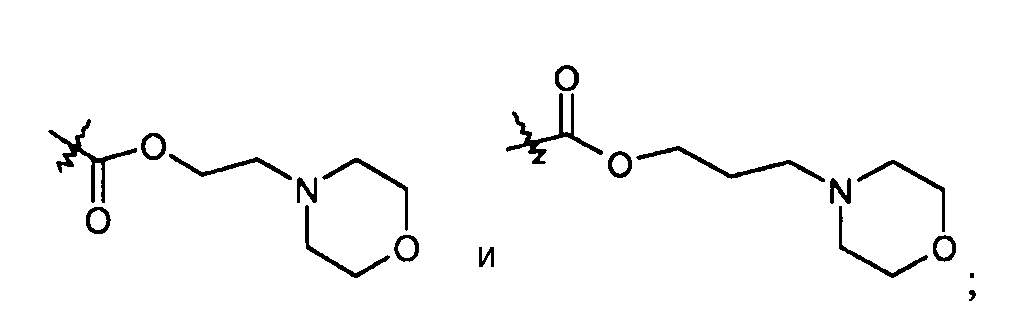
-С1-6алкилен-SO2-C1-6алкила, например, -(CH2)2-SO2-CH3;

R22 и R23 группы независимо выбраны из
H;
-C1-6алкила, например, -CH3 и -(CH2)2CH3;
-CH2COOH;
-(CH2)2OH;
-(CH2)2OCH3;
-(CH2)2SO2NH2;
-(CH2)2N(CH3)2;
-C0-1алкилен-C3-7циклоалкила, например, циклопропила и -CH2-циклопропила; и
-(CH2)2-имидазолила.
R22и R23 можно также брать вместе, получая насыщенный или частично ненасыщенный -C3-5гетероцикл, необязательно замещенный галогеном, -OH, -COOH или -CONH2, и необязательно содержащий атом кислорода в кольце. Насыщенные -C3-5гетероциклы включают азетидин, пирролидин, пиперидин и морфолин, так что примеры R3 групп включают:
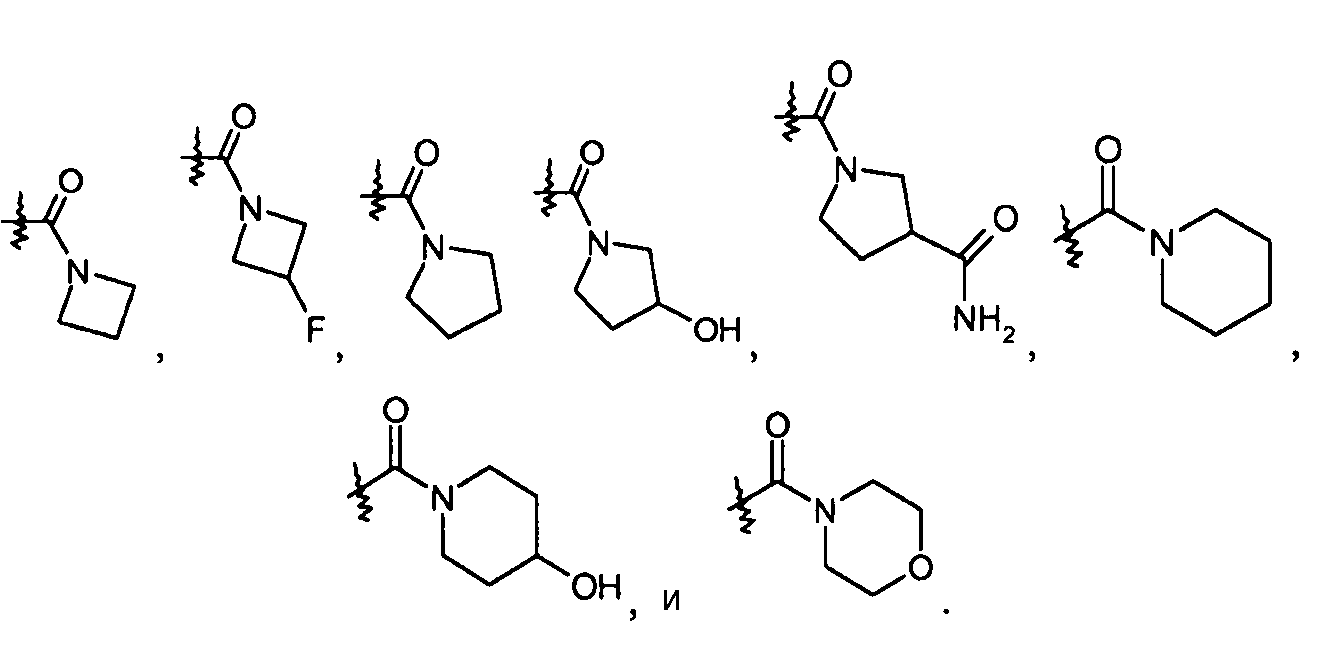
Частично ненасыщенные -C3-5гетероциклы включают 2,5-дигидро-1H-пиррол, так что примеры R3 групп включают:
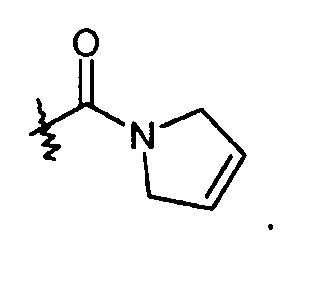
R24 группа выбрана из
-C1-6алкила, например, -CH2CH3 и -(CH2)3CH3;
-C0-1алкилен-O-C1-6алкила, например, -O-CH2CH3 и -CH2-OCH3;
фенила, необязательно замещенного галогеном или -OCH3, например, -2-хлорфенила или -2-метоксифенила; и
-C1-9гетероарила, например, 2-пиридина.
R25 выбран из
-C1-6алкила, например, -CH3, -CH2CH3 и -(CH2)3CH3;
-O-C1-6алкила, например, -OCH3, -OCH2CH3 и -OCH(CH3)2;
-C3-7циклоалкила, например, циклопентила;
-O-C3-7циклоалкила, например, -O-циклопропила, -O-циклопентила и -O-циклогексила;
фенила;
-O-фенила;
-NR27R28;
-CH[CH(CH3)2]-NH2;
-CH[CH(CH3)2]-NHC(O)O-C1-6алкила, например, -CH[CH(CH3)2]-NHC(O)OCH3; и
-CH(NH2)CH2COOCH3.
R27 и R28 независимо выбраны из H, -C1-6алкила и бензила, или R27 и R28 берут вместе в виде -(CH2)3-6-, -C(O)-(CH2)3- или -(CH2)2O(CH2)2-; R33 выбран из -O-C1-6алкила, -O-бензила и -NR27R28; и R34 представляет собой -C1-6алкил (например, -CH3 и -C(CH3)3) или -C0-6алкилен-C6-10арил.
Кроме того, каждая алкильная группа в R3 необязательно замещена 1-8 атомами фтора. Например, когда R3 представляет собой -C0-1алкилен-COOR21, и R21 представляет собой -C1-6алкил, R3 может также представлять собой группу, такую как -COOCH(CH3)CF3, -COOCH2CF2CF3, -COOCH(CF3)2, -COO(CH2)2CF3, -COOCH(CH2F)2, -COOC(CF3)2CH3 и -COOCH(CH3)CF2CF3.
В одном варианте осуществления R3 отсутствует или выбран из H; галогена; -C0-5алкилен-OH; -C1-6алкила; -C3-7циклоалкила; -C0-2алкилен-O-C1-6алкила; -C(O)R20; -C0-1алкилен-COOR21; -C(O)NR22R23; -NHC(O)R24; =O; фенила, необязательно замещенного одной или двумя группами, независимо выбранными из галогена, -OH и -OCH3; пиридинила; и пиразинила; R20 представляет собой -C1-6алкил; R21 представляет собой H; R22 представляет собой H или -C1-6алкил; R23 выбран из -C1-6алкила, -(CH2)2OH, -(CH2)2OCH3, -(CH2)2SO2NH2 и -C0-1алкилен-C3-7циклоалкила; или R22 и R23 берут вместе, получая насыщенный или частично ненасыщенный -C3-5гетероцикл, необязательно замещенный галогеном или -OH, и необязательно содержащий атом кислорода в кольце; и R24 представляет собой фенил, замещенный -OCH3. В других вариантах осуществления данные соединения имеют формулу III.
В одном варианте осуществления R3 отсутствует или выбран из H; галогена; -C0-5алкилен-OH; -NH2; -C1-6алкила; -CF3; -C3-7циклоалкила; -C0-2алкилен-O-C1-6алкила; -C(O)R20; -C0-1алкилен-COOR21; -C(O)NR22R23; -NHC(O)R24; =O; -NO2; -C(CH3)=N(OH); фенила, необязательно замещенного одной или двумя группами, независимо выбранными из галогена, -OH, -CF3, -OCH3, -NHC(O)CH3 и фенила; нафталенила; пиридинила; пиразинила; пиразолила, необязательно замещенного метилом; тиофенила, необязательно замещенного метилом или галогеном; фуранила; и -CH2-морфолинила; и R21 представляет собой H. В других вариантах осуществления данные соединения имеют формулу III.
В другом варианте осуществления R3 представляет собой -C0-1алкилен-COOR21, и R21 выбран из -C1-6алкила, -C1-3алкилен-C6-10арила, -C1-3алкилен-C1-9гетероарила, -C3-7циклоалкила, -[(CH2)2O]1-3CH3, -C1-6алкилен-OC(O)R25; -C1-6алкилен-NR27R28, -C1-6алкилен-C(O)R33, -C0-6алкиленморфолинила, -C1-6алкилен-SO2-C1-6алкила,
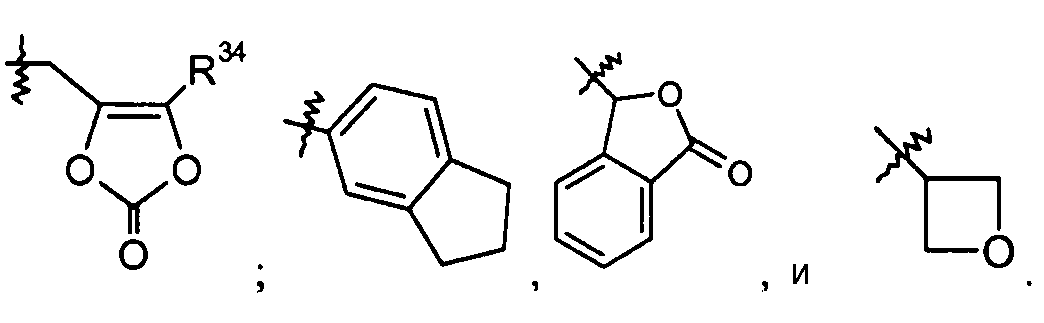
В одном аспекте настоящего изобретения данные соединения могут быть особенно полезны в качестве пролекарств или в качестве промежуточных соединений в способах получения, описанных в настоящем изобретении. В других вариантах осуществления данные соединения имеют формулу III.
R4 группа может отсутствовать. Когда она присутствует, R4 соединена с атомом углерода или азота в "X" группе и выбрана из
H;
-OH;
-C1-6алкила, например, -CH3;
-C1-2алкилен-COOR35, например, -CH2COOH и -(CH2)2-COOH;
-CH2OC(O)CH(R36)NH2, например, -CH2OC(O)CH[CH(CH3)2]NH2;
-OCH2OC(O)CH(R36)NH2, например, -OCH2OC(O)CH[CH(CH3)2]NH2;
-OCH2OC(O)CH3;
-CH2OP(O)(OH)2;
-CH2CH(OH)CH2OH;
-CH[CH(CH3)2]-NHC(O)O-C1-6алкила;
пиридинила; и
фенила или бензила, необязательно замещенного одной или более группами, выбранными из галогена, -COOR35, -OCH3, -OCF3 и -SCF3 (например, 4-хлорфенил, 3-метоксифенил, 2,4-дихлорфенил, 3,4-дихлорфенил, 2-хлор, 5-фторфенил, 3-трифторметокси, 4-хлорфенил, 3-трифторметилсульфанил, 4-хлорфенил, 2,6-дифтор, 4-хлорфенил, 2-хлорбензил, 3-хлорбензил, 4-хлорбензил, 3-карбоксибензил, 4-карбоксибензил, 3-метоксибензил, 2-хлор, 5-фторбензил, 3-хлор, 5-фторбензил, 2-фтор, 4-хлорбензил, 3-хлор, 4-фторбензил, 3-OCF3, 4-хлорбензил, 3-SCF3, 4-хлорбензил, 2,6-дифтор, 3-хлорбензил, 2,6-дифтор, 4-хлорбензил, и 2,3,5,6-тетрафтор, 4-метоксибензил).
R35 группа выбрана из
H;
-C1-6алкила, например, -CH3 и -CH2CH3;
-C1-3алкилен-C6-10арила;
-C1-3алкилен-C1-9гетероарила, например, -CH2-пиридина;
-C3-7циклоалкила;
-[(CH2)2O]1-3CH3, например, -(CH2)2OCH3;
-C1-6алкилен-OC(O)R25, например, -CH2OC(O)CH3, -CH2OC(O)O-CH3, -CH2OC(O)O-CH3, -CH(CH3)OC(O)O-CH2CH3, -CH(CH3)OC(O)O-CH(CH3)2, -CH2CH(CH3)OC(O)-циклопентила, -CH2OC(O)O-циклопропила, -CH(CH3)-OC(O)-O-циклогексила, -CH2OC(O)O-циклопентила, -CH2CH(CH3)OC(O)фенила и -CH2OC(O)O-фенила;
-C1-6алкилен-NR27R28, например, -CH2-пирролидина;
-C1-6алкилен-C(O)R33;
-C0-6алкиленморфолинила, например, -(CH2)2-морфолинила и -(CH2)3-морфолинила:

-C1-6алкилен-SO2-C1-6алкила, например, -(CH2)2-SO2-CH3;
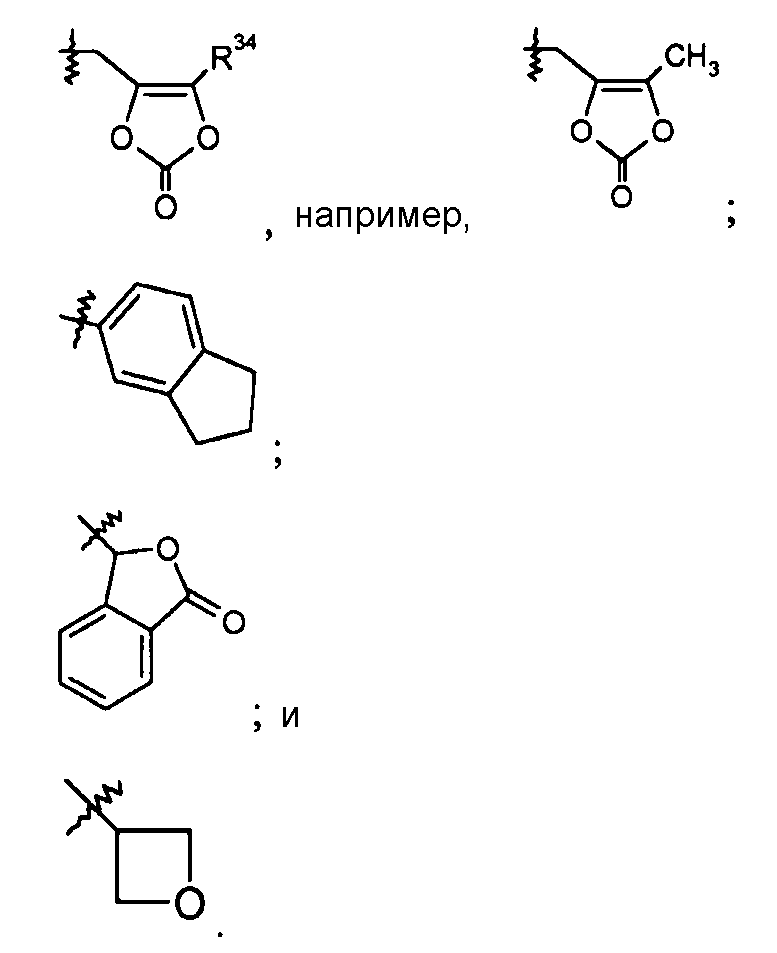
R25, R27, R28, R33 и R34 группы определяют выше. R36 группа выбрана из H, -CH(CH3)2, фенила и бензила.
Кроме того, каждая алкильная группа в R4 необязательно замещена 1-8 атомами фтора. Например, когда R4 представляет собой -C1-2алкилен-COOR35, и R35 представляет собой -C1-6алкил, R4 может также представлять собой группу, такую как -COOCH(CH3)CF3, -COOCH2CF2CF3, -COOCH(CF3)2, -COO(CH2)2CF3, -COOCH(CH2F)2, -COOC(CF3)2CH3 и -COOCH(CH3)CF2CF3.
R4 группу можно также брать вместе с R3, получая -фенилен-O-(CH2)1-3- или -фенилен-O-CH2-CHOH-CH2-. С целью только иллюстрации, данные варианты осуществления показаны ниже с X, являющимся пиразолом. Ясно, что можно также применять другие X группы.
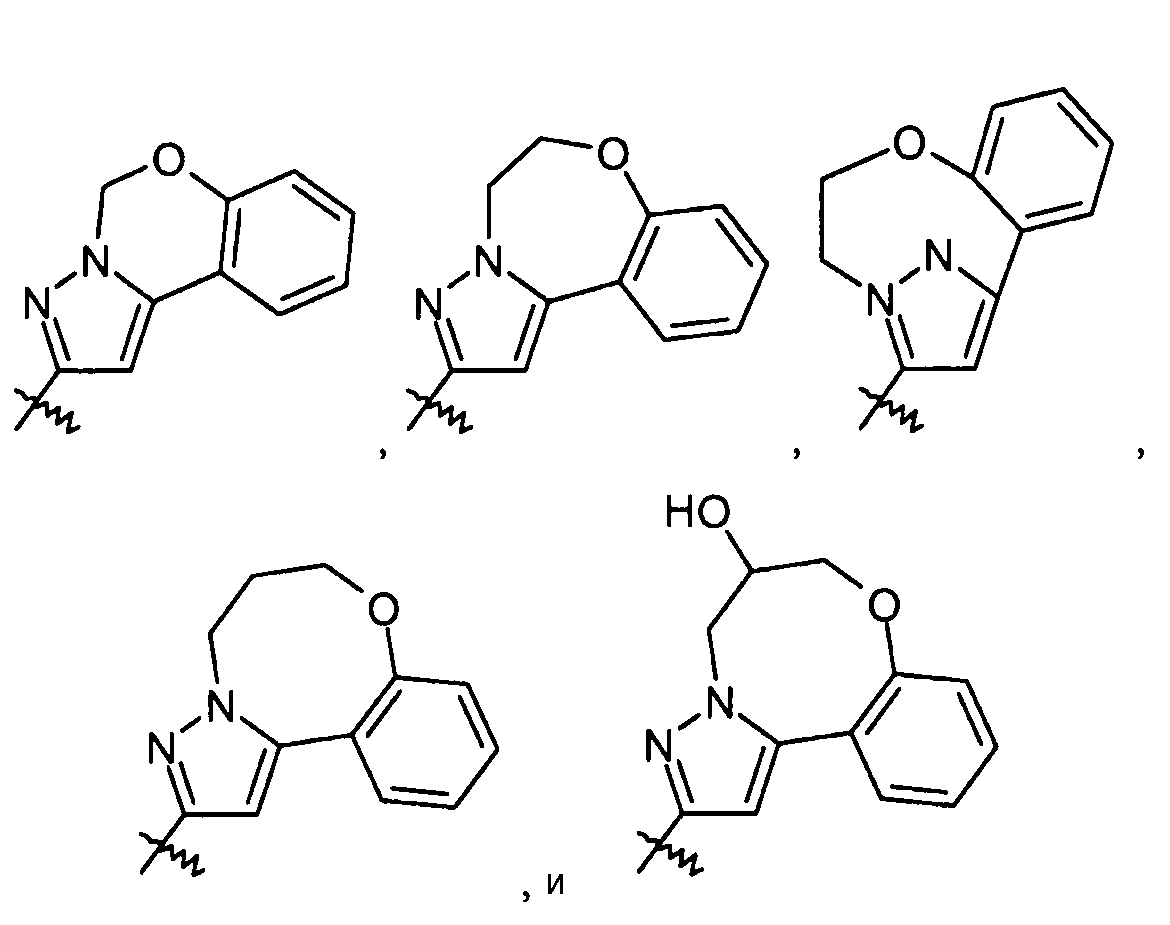
В другом конкретном варианте осуществления R4 выбран из H; -OH; -C1-2алкилен-COOR35; пиридинила; и фенила или бензила, необязательно замещенного одной или более группами, выбранными из галогена и -OCH3; и R35 представляет собой H. В других вариантах осуществления данные соединения имеют формулу III.
В одном варианте осуществления R4 отсутствует или выбран из H; -OH; -C1-6алкила; -C1-2алкилен-COOR35; -CH2OC(O)CH(R36)NH2, -CH2CH(OH)CH2OH; пиридинила; и фенила или бензила, необязательно замещенного одной или более группами, выбранными из галогена, -COOR35, -OCH3, -OCF3 и -SCF3; и R35 представляет собой H. В других вариантах осуществления данные соединения имеют формулу III.
В другом варианте осуществления R4 выбран из -OCH2OC(O)CH3; -CH2OP(O)(OH)2; -C1-2алкилен-COOR35; и фенила или бензила, замещенного по меньшей мере одной -COOR35 группой; где R35 выбран из -C1-6алкила, -C1-3алкилен-C6-10арила, -C1-3алкилен-C1-9гетероарила, -C3-7циклоалкила, -[(CH2)2O]1-3CH3, -C1-6алкилен-OC(O)R25; -C1-6алкилен-NR27R28, -C1-6алкилен-C(О)R33, -C0-6алкиленморфолинила, -C1-6алкилен-SO2-C1-6алкила,

В одном аспекте настоящего изобретения данные соединения могут быть особенно полезны в качестве пролекарств или в качестве промежуточных соединений в способах получения, описанных в настоящем изобретении. В других вариантах осуществления данные соединения имеют формулу III.
Нумерация для R5 и R6 групп является следующей:
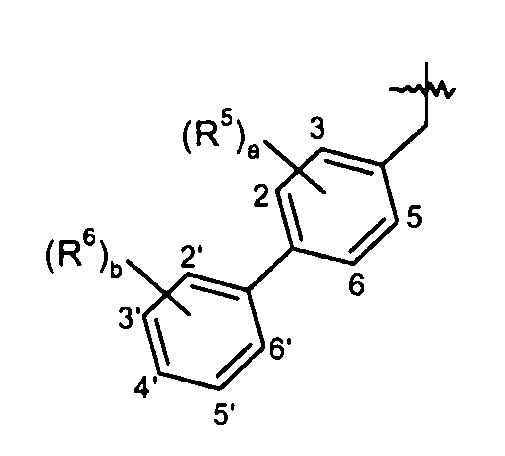
Целое "a" равно 0 или 1. R5 группа, когда она присутствует, выбрана из галогена, -CH3, -CF3 и -CN. В одном варианте осуществления a равно 0. В другом варианте осуществления a равно 1, и R5 выбран из галогена и -CN, такой как 2-хлор, 2-фтор, 3-циано, 3-хлор или 3-фтор. Целое "b" равно 0 или целому от 1 до 3. R6 группа, когда она присутствует, независимо выбрана из галогена, -OH, -CH3, -OCH3 и -CF3. В одном варианте осуществления b равно 0. В другом варианте осуществления b равно 1, и R6 выбран из Cl, F, -OH, -CH3, -OCH3 и -CF3, такой как 2'-хлор, 3'-хлор, 2'-фтор, 3'-фтор, 2'-гидрокси, 3'-гидрокси, 3'-метил, 2'-метокси или 3'-трифторметил. В одном варианте осуществления b равно 2, и R6 представляет собой 2'-фтор-5'-хлор, 2',5'-дихлор, 2',5'-дифтор, 2'-метил-5'-хлор, 3'-фтор-5'-хлор, 3'-гидрокси-5'-хлор, 3',5'-дихлор, 3',5'-дифтор, 2'-метокси-5'-хлор, 2'-метокси-5'-фтор, 2'-гидрокси-5'-фтор, 2'-фтор-3'-хлор, 2'-гидрокси-5'-хлор, или 2'-гидрокси-3'-хлор; и в другом варианте осуществления b равно 2, и каждый R6 независимо представляет собой галоген, -OH, -CH3 или -OCH3, например, 2'-фтор-5'-хлор, 2',5'-дихлор, 2'-метил-5'-хлор, 3'-гидрокси-5'-хлор, 3',5'-дихлор, 3',5'-дифтор, 2'-метокси-5'-хлор, 2'-метокси-5'-фтор, 3'-фтор-5'-хлор, 2'-гидрокси-5'-фтор, 2'-фтор-3'-хлор, 2'-гидрокси-5'-хлор или 2'-гидрокси-3'-хлор. В другом варианте осуществления b равно 3, и каждый R6 независимо представляет собой галоген или -CH3, такой как 2'-метил-3',5'-дифтор или 2'-фтор-3'-метил-5'-хлор. В еще другом варианте осуществления a равно 1, и b равно 1, и R5 и R6 независимо представляют собой галоген, например, 3-хлор и 3'-хлор. В других вариантах осуществления данные соединения имеют формулу III. Особенно интересными являются соединения формул:
Метиленовый линкер в бифениле необязательно замещен одной или двумя -C1-6алкильными группами или циклопропилом. Например, в одном варианте осуществления метиленовый линкер в бифениле является незамещенным; в другом варианте осуществления метиленовый линкер в бифениле замещен одной -C1-6алкильной группой (например, -CH3); и в еще другом варианте осуществления метиленовый линкер в бифениле замещен двумя -C1-6алкильными группами (например, двумя -CH3 группами); в другом варианте осуществления метиленовый линкер в бифениле замещен циклопропильной группой. Данные варианты осуществления показаны, соответственно, как:

В другом варианте осуществления R1 представляет собой OR7; R2 представляет собой H; X выбран из пиразола, триазола, бензотриазола, тетразола, оксазола, изоксазола, тиазола, пиридазина, пиримидина и пиридилтриазола; R3 отсутствует или выбран из H; галогена; -C0-5алкилен-OH; -C1-6алкила; -C3-7циклоалкила; -C0-2алкилен-O-C1-6алкила; -C(O)R20; -C0-1алкилен-COOR21; -C(O)NR22R23; -NHC(O)R24; =O; фенила, необязательно замещенного одной или двумя группами, независимо выбранными из галогена, -OH и -OCH3; пиридинила; и пиразинила; R4 выбран из H; -OH; -C1-2алкилен-COOR35; пиридинила; и фенила или бензила, необязательно замещенного одной или более группами, выбранными из галогена и -OCH3; a равно 0; или a равно 1, и R5 выбран из галогена и -CN; b равно 0; или b равно 1, и R6 выбран из Cl, F, -OH, -CH3, -OCH3 и -CF3; или b равно 2, и каждый R6 независимо представляет собой галоген, -OH, -CH3 или -OCH3; или b равно 3, и каждый R6 независимо представляет собой галоген или -CH3; R7 выбран из H, -C1-8алкила, -C1-3алкилен-C6-10арила, -C0-6алкиленморфолинила и
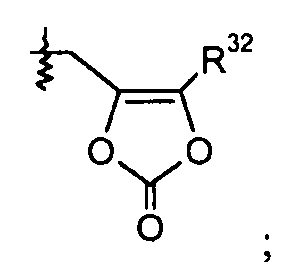
R32 представляет собой -C1-6алкил; R20 представляет собой -C1-6алкил; R21 представляет собой H; R22 представляет собой H или -C1-6алкил; R23 выбран из -C1-6алкила, -(CH2)2OH, -(CH2)2OCH3, -(CH2)2SO2NH2 и -C0-1алкилен-C3-7циклоалкила; или R22 и R23 берут вместе, получая насыщенный или частично ненасыщенный -C3-5гетероцикл, необязательно замещенный галогеном или -OH, и необязательно содержащий атом кислорода в кольце; R24 представляет собой фенил, замещенный -OCH3; и R35 представляет собой H; и где каждая алкильная группа в R1 необязательно замещена 1-8 атомами фтора.
В еще другом варианте осуществления R1 представляет собой OR7; R2 представляет собой H; X выбран из пиразола, триазола, бензотриазола, тетразола, оксазола, изоксазола, тиазола, пиридазина и пиримидина; R3 отсутствует или выбран из H; галогена; -C0-5алкилен-OH; -C1-6алкила; -C3-7циклоалкила; -C0-2алкилен-O-C1-6алкила; -C(O)R20; -C0-1алкилен-COOR21; -C(O)NR22R23; -NHC(O)R24; =O; фенила, замещенного одной или двумя группами, независимо выбранными из галогена, -OH и -OCH3; пиридинила; и пиразинила; R4 выбран из H, -OH и фенила, необязательно замещенного галогеновой группой; a равно 0; или a равно 1, и R5 представляет собой галоген; b равно 0; или b равно 1, и R6 представляет собой галоген или -CH3; или b равно 2, и каждый R6 независимо представляет собой галоген, -OH, -CH3 или -OCH3; R20 представляет собой -C1-6алкил; R21представляет собой H; R22 представляет собой -C1-6алкил; R23 представляет собой -C1-6алкил или -C0-1алкилен-C3-7циклоалкил; или R22 и R23 берут вместе, получая насыщенный -C3-5гетероцикл, необязательно замещенный галогеном или -OH; R24 представляет собой фенил, замещенный -OCH3; и R7 представляет собой, как определено для формулы I.
Конкретной группой соединений формулы I являются соединения, описанные в предварительной заявке США № 61/423175, поданной 15 декабря 2010 г. Данная группа включает соединения формулы II:
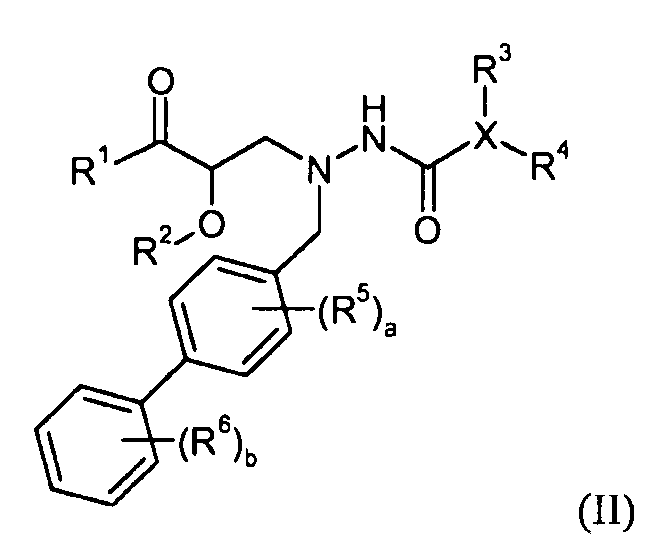
где R1 выбран из -OR7 и -NR8R9; R7 выбран из H; -C1-6алкила; -C1-3алкилен-C6-10арила; -C1-3алкилен-C1-9гетероарила; -C3-7циклоалкила; -(CH2)2OCH3; -C1-6алкилен-OC(O)R10; -CH2-пиридина; -CH2-пирролидина; -C0-6алкиленморфолина; -C1-6алкилен-SO2-C1-6алкила;
где R10 выбран из -C1-6алкила, -O-C1-6алкила, -C3-7циклоалкила, -O-C3-7циклоалкила, фенила, -O-фенила, -NR12R13 и -CH(NH2)CH2COOCH3; и R12 и R13 независимо выбраны из H, -C1-6алкила и бензила, или R12 и R13 берут вместе как -(CH2)3-6-; R8 выбран из H; -OH; -OC(O)R14; -CH2COOH; -O-бензила; пиридила; и -OC(S)NR15R16; где R14 выбран из H, -C1-6алкила, -C6-10арила, -OCH2-C6-10арила, -CH2O-C6-10арила и -NR15R16; и R15 и R16 независимо выбраны из H и -C1-4алкила; R9 выбран из H; -C1-6алкила; и -C(O)R17; где R17 выбран из H; -C1-6алкила; -C3-7циклоалкила; -C6-10арила; и -C1-9гетероарила; R2 представляет собой H или его берут вместе с R1, получая -OCHR18R19- или -NHC(O)-; где R18 и R19 независимо выбраны из H, -C1-6алкила и -O-C3-7циклоалкила, или R18 и R19 берут вместе, получая =O; X представляет собой -C1-9гетероарил или частично ненасыщенный -C3-5гетероцикл; R3 отсутствует или выбран из H; галогена; -C0-5алкилен-OH; -NH2; -C1-6алкила; -C3-7циклоалкила; -C0-1алкилен-O-C1-6алкила; -C(O)R20; -C0-1алкилен-C(O)OR21; -C(O)NR22R23; -NHC(O)R24; фенила, необязательно замещенного одной группой, выбранной из галогена, -CF3, -OCH3, -NHC(O)CH3 и фенила; нафтила; пиридина; пиразина; пиразола, необязательно замещенного метилом; тиофена, необязательно замещенного метилом; и фурана; и R3, когда он присутствует, соединен с атомом углерода; R20 выбран из H и -C1-6алкила; R21 выбран из H; -C1-6алкила; -C1-3алкилен-C6-10арила; -C1-3алкилен-C1-9гетероарила; -C3-7циклоалкила; -(CH2)2OCH3; -C1-6алкилен-OC(O)R25; -CH2-пиридина; -CH2-пирролидина; -C0-6алкиленморфолина; -C1-6алкилен-SO2-C1-6алкила;

где R25 выбран из -C1-6алкила, -O-C1-6алкила, -C3-7циклоалкила, -O-C3-7циклоалкила, фенила, -O-фенила, -NR27R28 и -CH(NH2)CH2COOCH3; и R27 и R28 независимо выбраны из H, -C1-6алкила и бензила, или R27 и R28 берут вместе как -(CH2)3-6-; R22 и R23 независимо выбраны из H; -C1-6алкила; -CH2COOH; -(CH2)2OH; -(CH2)2OCH3; -(CH2)2SO2NH2; -(CH2)2N(CH3)2; -C3-7циклоалкила; и -(CH2)2-имидазола; или R22и R23 берут вместе, получая насыщенный или частично ненасыщенный -C3-5гетероцикл, необязательно замещенный -OH, -COOH или -CONH2; и необязательно содержащий атом кислорода в кольце; R24 выбран из -C1-6алкила; -O-C1-6алкила; -CH2-O-C1-6алкила; фенила, замещенного -OCH3; и пиридина; R4 выбран из H; -C1-6алкила; фенила или бензила, замещенного одной или более группами, выбранными из галогена, -COOH, -OCH3, -OCF3 и -SCF3; и R4 соединен с атомом углерода или азота; a равно 0 или 1; R5 представляет собой галоген или -CF3; и b равно 0 или 1; R6 представляет собой галоген; или их фармацевтически приемлемая соль.
Кроме того, конкретные соединения формулы I, которые представляют интерес, включают соединения, описанные в примерах ниже, а также их фармацевтически приемлемые соли.
ОБЩИЕ СПОСОБЫ ПОЛУЧЕНИЯ
Соединения настоящего изобретения можно получить из легкодоступных исходных веществ, применяя следующие общие способы, методики, приведенные в примерах, или применяя другие способы, реагенты и исходные вещества, которые являются известными специалисту в данной области техники. Хотя следующие способы могут иллюстрировать конкретный вариант осуществления настоящего изобретения, ясно, что другие варианты осуществления настоящего изобретения можно аналогично получить, применяя те же или аналогичные способы, или применяя другие способы, реагенты и исходные вещества, известные специалисту в данной области техники. Также ясно, что когда приведены стандартные или предпочтительные условия способов (например, температура, продолжительность реакции, мольное соотношение реагентов, растворители, давления и т.д.), другие условия способа можно также применять, если не указано особо. В некоторых случаях реакции проводят при комнатной температуре и не проводят измерения реальной температуры. Ясно, что комнатную температуру можно брать для обозначения температуры в диапазоне, обычно связанном с температурой окружающей среды в лабораторном окружении, и она обычно будет в диапазоне от приблизительно 18°C до приблизительно 30°C. В других случаях реакции проводят при комнатной температуре, и температуру будут в действительности измерять и записывать. Тогда как оптимальные условия реакции будут обычно изменяться в зависимости от различных параметров реакции, таких как конкретные применяемые реагенты, растворители и количества, специалист в данной области техники может легко определить подходящие условия реакции, применяя стандартные способы оптимизации.
Кроме того, как ясно специалисту в данной области техники, общепринятые защитные группы могут быть необходимы или желательны для предотвращения нежелательных реакций некоторых функциональных групп. Выбор подходящей защитной группы для конкретной функциональной группы, а также подходящие условия и реагенты для защиты и снятия защитной группы данной функциональной группы являются хорошо известными в данной области техники. Можно применять защитные группы, отличные от групп, показанных в способах, описанных в настоящем изобретении, при желании. Например, многочисленные защитные группы и их введение и удаление описывают в T. W. Greene и G. M. Wuts, Protecting Groups in Organic Synthesis, Fourth Edition, Wiley, New York, 2006, и ссылках, приводимых в настоящем изобретении.
Карбокси-защитные группы являются подходящими для предотвращения нежелательных реакций по карбоксигруппе, и примеры включают, но не ограничиваются ими, метил, этил, трет-бутил, бензил (Bn), п-метоксибензил (PMB), 9-флуоренилметил (Fm), триметилсилил (TMS), трет-бутилдиметилсилил (TBDMS), дифенилметил (бензгидрил, DPM) и подобные. Амино-защитные группы являются подходящими для предотвращения нежелательных реакций по аминогруппе, и примеры включают, но не ограничиваются ими, трет-бутоксикарбонил (BOC), тритил (Tr), бензилоксикарбонил (Cbz), 9-флуоренилметоксикарбонил (Fmoc), формил, триметилсилил (TMS), трет-бутилдиметилсилил (TBDMS) и подобные. Гидроксил-защитные группы являются подходящими для предотвращения нежелательных реакций по гидроксильной группе, и примеры включают, но не ограничиваются ими, C1-6алкилы, силильные группы, включая триС1-6алкилсилильные группы, такие как триметилсилил (TMS), триэтилсилил (TES) и трет-бутилдиметилсилил (TBDMS); эфиры (ацильные группы), включая C1-6алканоильные группы, такие как формил, ацетил и пивалоил, и ароматические ацильные группы, такие как бензоил; арилметильные группы, такие как бензил (Bn), п-метоксибензил (PMB), 9-флуоренилметил (Fm) и дифенилметил (бензгидрил, DPM); и подобные.
Стандартные способы и реагенты для снятия защитной группы применяют для удаления защитных групп, и они могут изменяться в зависимости от применяемой группы. Например, гидроксид натрия или лития обычно применяют, когда карбокси-защитная группа представляет собой метил, кислоту, такую как TFA или HCl, обычно применяют, когда карбокси-защитная группа представляет собой этил или трет-бутил, и H2/Pd/C можно применять, когда карбокси-защитная группа представляет собой бензил. BOC амино-защитную группу можно удалить, применяя кислый реагент, такой как TFA в DCM или HCl в 1,4-диоксане, тогда как Cbz амино-защитную группу можно удалить применением условий каталитического гидрирования, таких как H2 (1 атм) и 10% Pd/C в спиртовом растворителе ("H2/Pd/C"). H2/Pd/C обычно применяют, когда гидроксил-защитная группа представляет собой бензил, тогда как NaOH обычно применяют, когда гидроксил-защитная группа представляет собой ацильную группу.
Подходящие основания для применения в данных схемах включают, в качестве иллюстрации и не ограничения, карбонат калия, карбонат кальция, карбонат натрия, триэтиламин, пиридин, 1,8-диазабицикло-[5.4.0]ундец-7-ен (DBU), N,N-диизопропилэтиламин (DIPEA), 4-метилморфолин, гидроксид натрия, гидроксид калия, трет-бутоксид калия и гидриды металлов.
Подходящие инертные разбавители или растворители для применения в данных схемах включают, в качестве иллюстрации и не ограничения, тетрагидрофуран (THF), ацетонитрил (MeCN), N,N-диметилформамид (DMF), N,N-диметилацетамид (DMA), диметилсульфоксид (DMSO), толуол, дифторметан (DCM), хлороформ (CHCl3), тетрахлорид углерода (CCl4), 1,4-диоксан, метанол, этанол, воду и подобные.
Подходящие реагенты для конденсации карбоновой кислоты с амином включают гексафторфосфат бензотриазол-1-илокситрис(диметиламино)фосфония (BOP), гексафторфосфат бензотриазол-1-илокситрипирролидинофосфония (PyBOP), гексафторфосфат N,N,N',N'-тетраметил-O-(7-азабензотриазол-1-ил)урония (HATU), 1,3-дициклогексилкарбодиимид (DCC), N-(3-диметиламинопропил)-N'-этилкарбодиимид (EDCI), карбонилдиимидазол (CDI), 1-гидроксибензотриазол (HOBt) и подобные. Реакции конденсации проводят в инертном разбавителе в присутствии основания, такого как DIPEA, и проводят в общепринятых условиях образования амидной связи.
Все реакции обычно проводят при температуре в диапазоне приблизительно -78-100°C, например, при комнатной температуре. Реакции можно контролировать, применяя тонкослойную хроматографию (TLC), высокоэффективную жидкостную хроматографию (HPLC) и/или LCMS перед завершением. Реакции могут завершаться в течение минут или могут занимать часы, обычно 1-2 часа и вплоть до 48 часов. После завершения полученную в результате смесь или продукт реакции можно дополнительно обработать для того, чтобы получить требуемый продукт. Например, полученную в результате смесь или продукт реакции можно подвергать одному или более из следующих способов: концентрирование или распределение (например, между EtOAc и водой или между 5% THF в EtOAc и 1M фосфорной кислотой); экстракция (например, EtOAc, CHCl3, DCM, хлороформ); промывка (например, насыщенным водным NaCl, насыщенным водным NaHCO3, Na2CO3 (5%), CHCl3 или 1M NaOH); сушка (например, над MgSO4, над Na2SO4или в вакууме); фильтрация; кристаллизация (например, из EtOAc и гексана); концентрирование (например, в вакууме); и/или очистка (например, хроматография на силикагеле, флэш-хроматография, препаративная ВЭЖХ, обращенно-фазовая ВЭЖХ или кристаллизация).
В качестве иллюстрации, соединения формулы I, а также их соли, можно получить, как показано на схеме I:
Схема I
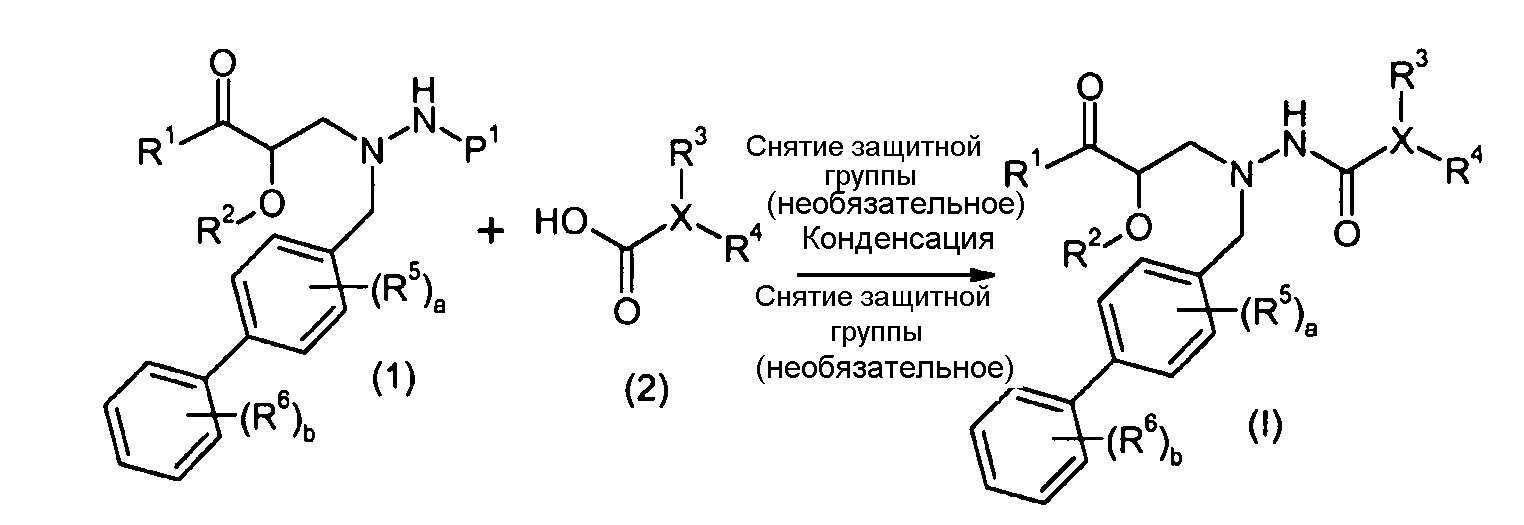
Способ включает стадию конденсации соединение 1 с соединением 2, где R1-R6, X, a и b представляют собой, как определено для формулы I, и P1 представляет собой H или подходящую амино-защитную группу, примеры которой включают трет-бутоксикарбонил, тритил, бензилоксикарбонил, 9-флуоренилметоксикарбонил, формил, триметилсилил и трет-бутилдиметилсилил. Когда P1 представляет собой амино-защитную группу, способ дополнительно включает снятие защитной группы соединения формулы 1 перед или in situ со стадией конденсации.
В случаях, когда R1 представляет собой группу, такую как -OCH3 или -OCH2CH3, за стадией конденсации может следовать стадия снятия защитной группы, давая соединение формулы I, где R1 представляет собой группу, такую как -OH. Таким образом, один способ получения соединений настоящего изобретения включает конденсацию соединений 1 и 2, с необязательной стадией снятия защитной группы, получая соединение формулы I или его фармацевтически приемлемую соль.
Способы получения соединение 1 показаны в примерах. Соединение 2 является обычно имеющимся в продаже, или его можно получить, применяя способы, которые являются известными в данной области техники.
Соединения формулы I, а также их соли, можно также получить, как показано на схеме II:
Схема II

На первой стадии соединение 1 конденсируют с соединением 3, и соединение 3 конденсируют с соединением 4, где Y и Z реагируют in situ, давая R3 группу. Например, когда R3 представляет собой -C(O)NR22R23, Y представляет собой -COOH, и Z представляет собой HNR22R23. Альтернативно, соединение 3 вначале конденсируют с соединением 4, и полученное в результате соединение затем конденсируют с соединением 1. Как на схеме I, в случаях, когда R1 представляет собой группу, такую как -OCH3 или -OCH2CH3, за стадией конденсации может следовать стадия снятия защитной группы, давая соединение формулы I, где R1 представляет собой группу, такую как -OH. Таким образом, один способ получения соединения настоящего изобретения включает конденсацию соединений 1, 2 и 3, с необязательной стадией снятия защитной группы, давая соединение формулы I или его фармацевтически приемлемую соль.
Соединения 3 и 4 являются обычно имеющимися в продаже, или их можно получить, применяя способы, которые являются известными в данной области техники.
Соединения формулы I, а также их соли, можно также получить, как показано на схеме III:
Схема III

Снова, как на схемах I и II, она представляет собой стандартную реакцию конденсации между соединением формулы I, где R1 представляет собой -OH, и соединением 5, давая соединение формулы I, где R1 представляет собой -NR8R9.
Считают, что определенные промежуточные соединения, описанные в настоящем изобретении, являются новыми и, соответственно, данные соединения обеспечивают как дополнительные аспекты настоящего изобретения, включая, например, соединения формулы 1 или их соль:

где P1 представляет собой H или амино-защитную группу, выбранную из трет-бутоксикарбонила, тритила, бензилоксикарбонила, 9-флуоренилметоксикарбонила, формила, триметилсилила и трет-бутилдиметилсилила; и R1, R2, R5, R6, a и b представляют собой, как определено для формулы I. Другое промежуточное соединение настоящего изобретения имеет формулу 6 или его соль:

где R1P выбран из -O-P3, -NHP2 и -NH(O-P4); где P2 представляет собой амино-защитную группу, выбранную из трет-бутоксикарбонила, тритила, бензилоксикарбонила, 9-флуоренилметоксикарбонила, формила, триметилсилила и трет-бутилдиметилсилила; P3 представляет собой карбокси-защитную группу, выбранную из метила, этила, трет-бутила, бензила, п-метоксибензила, 9-флуоренилметила, триметилсилила, трет-бутилдиметилсилила и дифенилметила; P4 представляет собой гидроксил-защитную группу, выбранную из -C1-6алкила, триС1-6алкилсилила, -C1-6алканоила, бензоила, бензила, п-метоксибензила, 9-флуоренилметила и дифенилметила; и R2, R3, R4, R5, R6, a, b и X представляют собой, как определено для формулы I. Другое промежуточное соединение настоящего изобретения имеет формулу 7 или его соль:
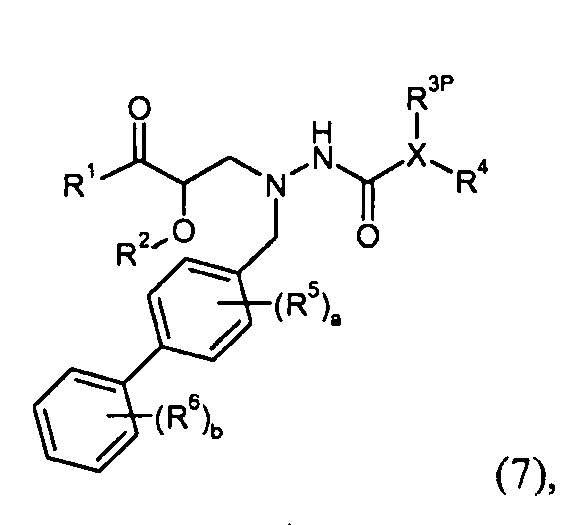
где R3P выбран из -C0-5алкилен-O-P4, -C0-1алкилен-COO-P3 и фенила, замещенного -O-P4; P3 представляет собой карбокси-защитную группу, выбранную из метила, этила, трет-бутила, бензила, п-метоксибензила, 9-флуоренилметила, триметилсилила, трет-бутилдиметилсилила и дифенилметила; P4 представляет собой гидроксил-защитную группу, выбранную из -C1-6алкила, триС1-6алкилсилила, -C1-6алканоила, бензоила, бензила, п-метоксибензила, 9-флуоренилметила и дифенилметила; и R1, R2, R4, R5, R6, a, b и X представляют собой, как определено для формулы I. Еще другое промежуточное соединение настоящего изобретения имеет формулу 8 или его соль:
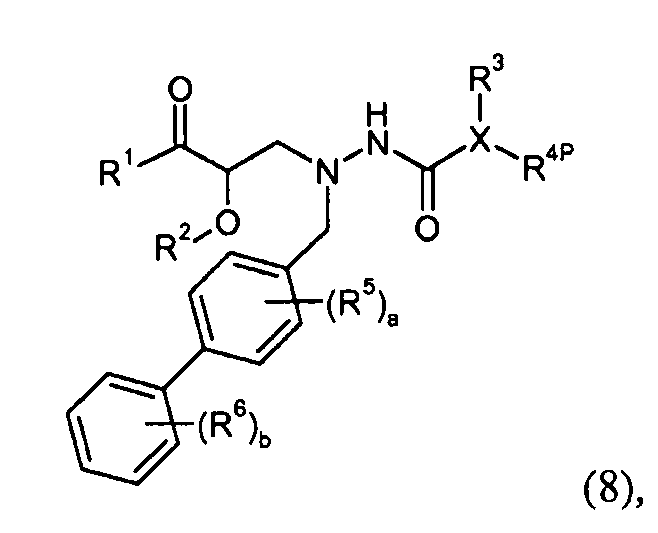
где R4P выбран из -O-P4; -C1-2алкилен-COO-P3; и фенила или бензила, замещенного -COO-P3; P3 представляет собой карбокси-защитную группу, выбранную из метила, этила, трет-бутила, бензила, п-метоксибензила, 9 -флуоренилметила, триметилсилила, трет-бутилдиметилсилила и дифенилметила; P4 представляет собой гидроксил-защитную группу, выбранную из -C1-6алкила, триС1-6алкилсилила, -C1-6алканоила, бензоила, бензила, п-метоксибензила, 9-флуоренилметила и дифенилметила; и R1, R2, R3, R5, R6, a, b и X представляют собой, как определено для формулы I. Еще другое промежуточное соединение настоящего изобретения имеет формулу 9 или его соль:
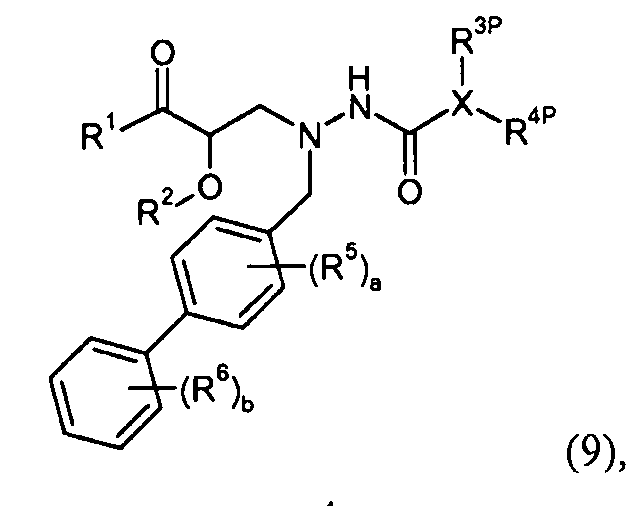
где R3P выбран из -C0-5алкилен-O-P4, -C0-1алкилен-COO-P3 и фенила, замещенного -O-P4; R4P выбран из -O-P4; -C1-2алкилен-COO-P3; и фенила или бензила, замещенного -COO-P3; P3 представляет собой карбокси-защитную группу, выбранную из метила, этила, трет-бутила, бензила, п-метоксибензила, 9-флуоренилметила, триметилсилила, трет-бутилдиметилсилила и дифенилметила; P4 представляет собой гидроксил-защитную группу, выбранную из -C1-6алкила, триС1-6алкилсилила, -C1-6алканоила, бензоила, бензила, п-метоксибензила, 9-флуоренилметила и дифенилметила; и R1, R2, R5, R6, a, b и X представляют собой, как определено для формулы I. Таким образом, другой способ получения соединения настоящего изобретения включает снятие защитной группы соединения формулы 1, 6, 7, 8, 9, или его соли.
Дополнительные детали, касающиеся конкретных условий реакций и другие способы получения репрезентативных соединений настоящего изобретения или их промежуточных соединений описывают в примерах, приведенных ниже.
ПРИМЕНЕНИЕ
Соединения настоящего изобретения обладают ингибирующей неприлизин (NEP) активностью, т.е. соединения способны ингибировать фермент-каталитическую активность. В другом варианте осуществления соединения не обладают значительной ингибирующей активностью ангиотензин-превращающего фермента. Соединения формулы I могут представлять собой активные лекарственные средства, а также пролекарства. Таким образом, при обсуждении активности соединений настоящего изобретения, ясно, что любое из данных пролекарств обладает ожидаемой активностью после метаболизма.
Одной количественной оценкой способности соединения ингибировать NEP активность является константа ингибирования (pKi). pKi величина представляет собой отрицательный логарифм с основанием 10 константы диссоциации (Ki), которую обычно приводят в молях. Соединениями настоящего изобретения, представляющими особый интерес, являются соединения с pKi относительно NEP большей чем или равной 6,0, в частности соединения, имеющие pKi большую чем или равную 7,0, и даже более предпочтительно соединения, имеющие pKi большую чем или равную 8,0. В одном варианте осуществления соединения, представляющие интерес, имеют pKi в диапазоне 6,0-6,9; в другом варианте осуществления соединения, представляющие интерес, имеют pKi в диапазоне 7,0-7,9; в еще другом варианте осуществления соединения, представляющие интерес, имеют pKi в диапазоне 8,0-8,9; и в еще другом варианте осуществления соединения, представляющие интерес, имеют pKi в диапазоне больше чем или равной 9,0. Данные величины можно определить способами, которые являются хорошо известными в данной области техники, а также анализами, описанными в настоящем изобретении.
Другой количественной оценкой способности соединения ингибировать NEP активность является кажущаяся константа ингибирования (IC50), которая представляет собой молярную концентрацию соединения, которая приводит в результате к полумаксимальному ингибированию превращения субстрата NEP ферментом. pIC50 величина представляет собой отрицательный логарифм с основанием 10 IC50. Соединения настоящего изобретения, которые представляют особый интерес, включают соединения, которые обладают pIC50 относительно NEP большей чем или равной приблизительно 5,0. Соединения, представляющие интерес, также включают соединения, имеющие pIC50 относительно NEP ≥ приблизительно 6,0 или pIC50 относительно NEP ≥ приблизительно 7,0. В другом варианте осуществления соединения, представляющие интерес, имеют pIC50 относительно NEP в диапазоне приблизительно 7,0-11,0; и в другом варианте осуществления в диапазоне приблизительно 8,0-11,0, таком как в диапазоне приблизительно 8,0-10,0.
Следует отметить, что в некоторых случаях соединения настоящего изобретения могут обладать слабой NEP ингибирующей активностью. В данных случаях специалисту в данной области техники ясно, что данные соединения могут еще быть полезны в качестве исследовательских инструментов.
Примеры анализов для определения свойств соединений настоящего изобретения, таких как NEP ингибирующая активность, описаны в примерах и включают, в качестве иллюстрации и не ограничения, анализы, которые измеряют NEP ингибирование (описаны в анализе 1). Пригодные вторичные анализы включают анализы, измеряющие ACE ингибирование (также описано в анализе 1) и ингибирование аминопептидазы P (APP) (описано в Sulpizio et al. (2005) JPET 315: 1306-1313). Фармакодинамический анализ для оценки in vivo ингибирующей активности относительно ACE и NEP на анестезированных крысах описан в анализе 2 (см. также Seymour et al. (1985) Hypertension 7(Suppl I):I-35-1-42 и Wigle et al. (1992) Can. J. Physiol. Pharmacol. 70: 1525-1528), где ACE ингибирование измеряют как ингибирование в процентах ангиотензин I прессорной реакции, и NEP ингибирование измеряют как повышенное содержание в моче циклического гуанозин 3',5'-монофосфата (цГМФ).
Существует большое количество in vivo анализов, которые можно применять для установления дополнительных вариантов применения соединений настоящего изобретения. Модель крыс со спонтанной гипертензией (SHR), находящихся в сознании, представляет собой модель ренин-зависимой гипертензии и описана в анализе 3. См. также Intengan et al. (1999) Circulation 100(22):2267-2275 и Badyal et al. (2003) Indian Journal of Pharmacology 35:349-362. Модель крыс, которым водят ацетатную соль дезоксикортикостерона (DOCA-соль) и которые находятся в сознании, представляет собой модель зависящей от объема гипертензии, которая является пригодной для измерения NEP активности и описана в анализе 4. См. также Trapani et al. (1989) J. Cardiovasc. Pharmacol. 14:419-424, Intengan et al. (1999) Hypertension 34(4):907-913, и Badyal et al. (2003) выше). DOCA-солевая модель является, в частности, пригодной для оценки способности испытуемого соединения снижать кровяное давление, а также для измерения способности испытуемого соединения предотвращать или замедлять повышение кровяного давления. Модель крыс линии Dahl (DSS), чувствительных к развитию гипертензии при употреблении солевой диеты, представляет собой модель гипертензии, которая является чувствительной к пищевой соли (NaCl), и она описана в анализе 5. См. также Rapp (1982) Hypertension 4:753-763. Крысиная монокроталиновая модель легочной артериальной гипертензии, описанная, например, в Kato et al. (2008) J. Cardiovasc. Pharmacol. 51(1): 18-23, представляет собой надежную предсказывающую модель клинической эффективности для лечения легочной артериальной гипертензии. Животные модели сердечной недостаточности включают DSS крысиную модель сердечной недостаточности и модель аортокавальной фистулы (AV анастомоз), последняя из которых описана, например, в Norling et al. (1996) J. Amer. Soc. Nephrol. 7: 1038-1044. Другие животные модели, такие как испытание с горячей плиткой, с подергиванием хвостом и формалиновый тест, можно применять для измерения анальгезирующих свойств соединений настоящего изобретения, а также модель с лигатурой спинального нерва (SNL) нейропатической боли. См., например, Malmberg et al. (1999) Current Protocols in Neuroscience 8.9.1-8.9.15.
Ожидают, что соединения настоящего изобретения ингибируют NEP фермент в любом из анализов, приведенных выше, или аналогичных анализов. Таким образом, приведенные выше анализы являются пригодными для определения терапевтической полезности соединений настоящего изобретения, например, их полезности в качестве антигипертензивных агентов или противодиарейных агентов. Другие свойства и применения соединений настоящего изобретения можно продемонстрировать, применяя другие in vitro и in vivo анализы, хорошо известные специалисту в данной области техники. Соединения формулы I могут представлять собой активные лекарственные средства, а также пролекарства. Таким образом, при обсуждении активности соединений настоящего изобретения, ясно, что любое из данных пролекарств может не обладать ожидаемой активностью в анализе, но ожидают, что оно будет проявлять требуемую активность после метаболизма.
Ожидают, что соединения настоящего изобретения являются пригодными для лечения и/или предотвращения медицинских показаний, чувствительных к NEP ингибированию. Таким образом, ожидают, что данных пациентов, страдающих от заболевания или расстройства, которое лечится ингибированием NEP фермента или повышением концентрации его пептидных субстратов, можно лечить введением терапевтически эффективного количества соединения настоящего изобретения. Например, ожидают, что ингибированием NEP соединения усиливают биологические эффекты эндогенных пептидов, которые метаболизируются NEP, таких как натрийуретические пептиды, бомбезин, брадикинины, кальцитонин, эндотелины, энкефалины, нейротензин, субстанция P и вазоактивный пептид кишечника. Таким образом, ожидают, что данные соединения будут обладать другими физиологическими действиями, например, на почки, центральную нервную, репродуктивную систему и желудочно-кишечный тракт.
В одном варианте осуществления настоящего изобретения пациентов, страдающих от заболевания или расстройства, которое лечится ингибированием NEP фермента, лечат введением соединения настоящего изобретения, которое находится в неактивной форме, т.е. соединения формулы I, где R1 выбран из -OR7 и -NR8R9, R7 представляет собой H, R8 представляет собой H или -OH, R9представляет собой H, и R2-R6, a, b и X представляют собой, как определено для формулы I.
В другом варианте осуществления пациентов лечат введением соединения, которое подвергается метаболизму in vitro, образуя соединение формулы I, где R1 выбран из -OR7 и -NR8R9, R7 представляет собой H, R8 представляет собой H или -OH, R9 представляет собой H, и R2-R6, a, b и X представляют собой, как определено для формулы I.
В другом варианте осуществления пациентов лечат введением соединения настоящего изобретения, которое находится в его пролекарственной форме при R1 группе, т.е. соединения формулы I где:
R1 представляет собой -OR7; и R7 выбран из -C1-8алкила, -C1-3алкилен-C6-10арила, -C1-3алкилен-C1-9гетероарила, -C3-7циклоалкила, -[(CH2)2O]1-3CH3, -C1-6алкилен-OC(O)R10, -C1-6алкилен-NR12R13, -C1-6алкилен-C(O)R31, -C0-6алкиленморфолинила, -C1-6алкилен-SO2-C1-6алкила,

R1 представляет собой -NR8R9; R8 выбран из -OC(O)R14, -CH2COOH, -O-бензила, пиридила и -OC(S)NR15R16; и R9 представляет собой H; или
R1 представляет собой -NR8R9; R8 выбран из -OC(O)R14, -CH2COOH, -O-бензила, пиридила и -OC(S)NR15R16; и R9 представляет собой -C1-6алкил или -C(O)R17;
R1 представляет собой -NR8R9; R8 выбран из H или -OH; и R9 выбран из -C1-6алкила и -C(O)R17;
R1 представляет собой -OR7, и R2 берут вместе с R7, получая -CR18R19-; или
R1 представляет собой -NR8R9, и R2 берут вместе с R8, получая -C(O)-;
и R10, R12-R17, R31, R32, R3-R6, a, b и X представляют собой, как определено для формулы I.
Сердечно-сосудистые заболевания
Усилением эффектов вазоактивных пептидов, подобных натрийуретическим пептидам и брадикинину, ожидают, что соединения настоящего изобретения будут пригодны для лечения и/или предотвращения медицинских показаний, таких как сердечно-сосудистые заболевания. См., например, Roques et al. (1993) Pharmacol Rev. 45:87-146 и Dempsey et al. (2009) Amer. J. of Pathology 174(3):782-796. Сердечно-сосудистые заболевания, представляющие особый интерес, включают гипертензию и сердечную недостаточность. Гипертензия включает, в качестве иллюстрации и не ограничения, первичную гипертензию, которая также известна как эссенциальная гипертензия или идиопатическая гипертензия; вторичную гипертензию; гипертензию, сопровождающуюся заболеванием почек; тяжелую гипертензию, сопровождающуюся или не сопровождающуюся заболеванием почек; легочную гипертензию, включая легочную артериальную гипертензию; и устойчивую гипертензию. Сердечная недостаточность включает, в качестве иллюстрации и не ограничения, застойную сердечную недостаточность; острую сердечную недостаточность; хроническую сердечную недостаточность, например, с пониженной фракцией выброса левого желудочка (также называемую цистолической сердечной недостаточностью) или с сохранившейся фракцией выброса левого желудочка (также называемую диастолической сердечной недостаточностью); и острую и хроническую декомпенсированную сердечную недостаточность, сопровождающуюся или не сопровождающуюся заболеванием почек. Таким образом, один вариант осуществления настоящего изобретения относится к способу лечения гипертензии, в частности первичной гипертензии или легочной артериальной гипертензии, включающему введение пациенту терапевтически эффективного количества соединения настоящего изобретения.
Для лечения первичной гипертензии терапевтически эффективное количество обычно представляет собой количество, которое является достаточным для снижения кровяного давления у пациента. Она может включать от легкой до умеренной гипертензии и тяжелую гипертензию. При применении для лечения гипертензии, соединение можно вводить в комбинации с другими терапевтическими агентами, такими как антагонисты альдостерона, ингибиторы ангиотензин-превращающего фермента и ингибиторы ангиотензин-превращающего фермента/неприлизина двойного действия, активаторы и стимуляторы ангиотензин-превращающего фермента 2 (ACE2), вакцины ангиотензина-II, антидиабетические агенты, антилипидные агенты, противотромботические агенты, антагонисты AT1 рецептора и антагонист AT1 рецептора/ингибитор неприлизина двойного действия, антагонисты β1-адренергического рецептора, антагонист β-адренергического рецептора/антагонист α1-рецептора двойного действия, блокаторы кальциевых каналов, диуретики, антагонисты рецепторов эндотелина, ингибиторы эндотелин-превращающего фермента, ингибиторы неприлизина, натрийуретические пептиды и их аналоги, антагонисты очищающего рецептора натрийуретического пептида, доноры оксида азота, нестероидные противовоспалительные агенты, ингибиторы фосфодиэстеразы (особенно PDE-V ингибиторы), агонисты простагландинового рецептора, ингибиторы ренина, стимуляторы и активаторы растворимой гуанилатциклазы и их комбинации. В одном конкретном варианте осуществления настоящего изобретения соединение настоящего изобретения объединено с антагонистом AT1 рецептора, диуретиком, блокатором кальциевых каналов, или их комбинацией, и его применяют для лечения первичной гипертензии. В другом конкретном варианте осуществления настоящего изобретения соединение настоящего изобретения объединено с антагонистом AT1 рецептора, и его применяют для лечения гипертензии, сопровождающейся заболеванием почек.
Для лечения легочной артериальной гипертензии терапевтически эффективное количество обычно представляет собой количество, которое является достаточным для снижения легочного сосудистого сопротивления. Другие цели терапии заключаются в улучшении способности пациента переносить физическую нагрузку. Например, в клинических условиях терапевтически эффективное количество может представлять собой количество, которое улучшает способность пациента спокойно ходить в течение 6 минут (покрывая расстояние приблизительно 20-40 метров). При применении для лечения легочной артериальной гипертензии соединение можно вводить в комбинации с другими терапевтическими агентами, такими как α-адренергические антагонисты, антагонисты β1-адренергического рецептора, агонисты β2-адренергического рецептора, ингибиторы ангиотензин-превращающего фермента, антикоагулянты, блокаторы кальциевых каналов, диуретики, антагонисты эндотелинового рецептора, PDE-V ингибиторы, простагландиновые аналоги, селективные ингибиторы обратного захвата серотонина и их комбинации. В одном конкретном варианте осуществления настоящего изобретения соединение настоящего изобретения объединено с PDE-V ингибитором или селективным ингибитором обратного захвата серотонина, и его применяют для лечения легочной артериальной гипертензии.
Другой вариант осуществления настоящего изобретения относится к способу лечения сердечной недостаточности, в частности застойной сердечной недостаточности (включая и систолическую, и диастолическую застойную сердечную недостаточность), включающему введение пациенту терапевтически эффективного количества соединения настоящего изобретения. Обычно терапевтически эффективное количество представляет собой количество, которое является достаточным для снижения кровяного давления и/или улучшения почечных функций. В клинических условиях терапевтически эффективное количество может представлять собой количество, которое является достаточным для улучшения гемодинамических параметров сердца, подобных, например, снижению заклиненного давления, давления в правом предсердии, давления наполнения и сосудистого сопротивления. В одном варианте осуществления соединение вводят в виде внутривенной лекарственной формы. При применении для лечения сердечной недостаточности, соединение можно вводить в комбинации с другими терапевтическими агентами, такими как антагонисты аденозинового рецептора, агенты, разрушающие конечный продукт усиленного гликозилирования, антагонисты альдостерона, антагонисты AT1 рецептора, антагонисты β1-адренергического рецептора, антагонист β-адренергического рецептора/антагонист α1-рецептора с двойным действием, ингибиторы химазы, дигоксин, диуретики, ингибиторы эндотелин-превращающего фермента (ECE), антагонисты эндотелинового рецептора, натрийуретические пептиды и их аналоги, антагонисты очищающего рецептора натрийуретического пептида, доноры оксида азота, простагландиновые аналоги, PDE-V ингибиторы, активаторы и стимуляторы растворимой гуанилатциклазы и антагонисты вазопрессинового рецептора. В одном конкретном варианте осуществления настоящего изобретения соединение настоящего изобретения объединено с антагонистом альдостерона, антагонистом β1-адренергического рецептора, антагонистом AT1 рецептора или диуретиком, и его применяют для лечения застойной сердечной недостаточности.
Диарея
В качестве NEP ингибиторов ожидают, что соединения настоящего изобретения будут ингибировать разложение эндогенных энкефалинов и, таким образом, данные соединения можно также применять для лечения диареи, включая инфекционную и секреторную/водянистую диарея. См., например, Baumer et al. (1992) Gut 33:753-758; Farthing (2006) Digestive Diseases 24:47-58; и Marcais-Collado (1987) Eur. J. Pharmacol. 144(2): 125-132. При применении для лечения диареи соединения настоящего изобретения можно объединять с одной или более дополнительными противодиарейными терапиями.
Заболевания почек
Усилением эффектов вазоактивных пептидов, подобных натрийуретическим пептидам и брадикинину, ожидают, что соединения настоящего изобретения будут улучшать почечную функцию (см. Chen et al. (1999) Circulation 100:2443-2448; Lipkin et al. (1997) Kidney Int. 52:792-801; и Dussaule et al. (1993) Clin. Sci. 84:31-39) и найдут применение в лечении и/или предотвращении заболеваний почек. Заболевания почек, представляющие особый интерес, включают диабетическую нефропатию, хроническую болезнь почек, протеинурию и особенно острое повреждение почек или острую почечную недостаточность (см. Sharkovska et al. (2011) Clin. Lab. 57:507-515 и Newaz et al. (2010) Renal Failure 32:384-390). При применении для лечения заболевания почек, соединение можно вводить в комбинации с другими терапевтическими агентами, такими как ингибиторы ангиотензин-превращающего фермента, антагонисты AT1 рецептора и диуретики.
Превентативная терапия
За счет усиления действия натрийуретических пептидов также ожидают, что соединения настоящего изобретения будут пригодны в превентативной терапии, благодаря антигипертрофическому и противофиброзному действиям натрийуретических пептидов (см. Potter et al. (2009) Handbook of Experimental Pharmacology 191:341-366), например, для предотвращения развития сердечной недостаточности после инфаркта миокарда, предотвращения артериального рестеноза после ангиопластики, предотвращения утолщения стенок кровеносных сосудов после операций на сосудах, предотвращения атеросклероза и предотвращения диабетической ангиопатии.
Глаукома
Усилением действия натрийуретических пептидов ожидают, что соединения настоящего изобретения будут пригодны для лечения глаукомы. См., например, Diestelhorst et al. (1989) International Ophthalmology 12:99-101. При применении для лечения глаукомы, соединения настоящего изобретения можно объединять с одним или более дополнительными агентами против глаукомы.
Облегчение боли
В качестве NEP ингибиторов ожидают, что соединения настоящего изобретения будут ингибировать разрушение эндогенных энкефалинов и, таким образом, данные соединения могут также найти применение в качестве анальгетиков. См., например, Roques et al. (1980) Nature 288:286-288 и Thanawala et al. (2008) Current Drug Targets 9:887-894. При применении для лечения боли, соединения настоящего изобретения можно объединять с одним или более дополнительными антиноцицептивными лекарственными средствами, такими как ингибиторы аминопептидазы N или дипептидилпептидазы III, нестероидные противовоспалительные агенты, ингибиторы обратного захвата моноаминов, мышечные релаксанты, антагонисты NMDA рецептора, агонисты опиодиных рецепторов, агонисты 5-HT1D серотонинового рецептора и трициклические антидепрессанты.
Другие варианты применения
Благодаря их NEP ингибирующим свойствам также ожидают, что соединения настоящего изобретения будут пригодны в качестве противокашлевых агентов, а также найдут применение в лечении портальной гипертензии, связанной с циррозом печени (см. Sansoe et al. (2005) J. Hepatol. 43:791-798), рака (см. Vesely (2005) J. Investigative Med. 53:360-365), депрессии (см. Noble et al. (2007) Exp. Opin. Ther. Targets 11: 145-159), нарушений менструального цикла, преждевременных родов, преэклампсии, эндометриоза, нарушений репродуктивной функции (например, мужского и женского бесплодия, синдрома поликистозных яичников, неудачной имплантации) и сексуальных дисфункций у мужчин и женщин, включая нарушение эрекции у мужчин и расстройство полового возбуждения у женщин. Более конкретно, ожидают, что соединения настоящего изобретения будут пригодны для лечения женской сексуальной дисфункции (см. Pryde et al. (2006) J. Med. Chem. 49:4409-4424), которую часто определяют как сложность или невозможность у пациента женского пола найти удовлетворение в сексуальных проявлениях. Она включает ряд различных сексуальных расстройств у женщин, включая, в качестве иллюстрации и не ограничения, сниженное сексуальное влечение, расстройство полового возбуждения, нарушение, связанное с оргазмом, и сексуальное болевое расстройство. При применении для лечения данных расстройств, особенно женской сексуальной дисфункции, соединения настоящего изобретения можно объединять с одним или более из следующих вторичных агентов: PDE-V ингибиторы, агонисты допамина, агонисты и/или антагонисты рецептора эстрогена, андрогены и эстрогены. Благодаря их NEP ингибирующим свойствам, также ожидают, что соединения настоящего изобретения будут обладать противовоспалительными свойствами, и ожидают, что они будут применимы, в частности при применении в комбинации со статинами.
Недавние исследования показывают, что NEP играет роль в регуляции нервной функции при инсулин-дефицитном диабете и алиментарном ожирении. Coppey et al. (2011) Neuropharmacology 60:259-266. Следовательно, благодаря их NEP ингибирующим свойствам, также ожидают, что соединения настоящего изобретения будут пригодны в обеспечении защиты от повреждения нервов, вызванного диабетом или алиментарным ожирением.
Количество соединения настоящего изобретения, вводимое в одной дозе, или суммарное количество, вводимое в день, можно предварительно определить или его можно определить для отдельного пациента, принимая во внимание многочисленные факторы, включая характер и тяжесть заболевания у пациента, заболевание, которое подвергают лечению, возраст, вес и общее состояние здоровья пациента, устойчивость пациента к активному агенту, путь введения, фармакологические факторы, такие как активность, эффективность, фармакокинетические параметры и токсикологические профили соединения и любые вторичные агенты, которые будут вводить, и подобные. Лечение пациента, страдающего от заболевания или медицинского показания (такого как гипертензия) можно начинать с предварительно определенного дозирования или дозирования, определенного лечащим врачом, и оно будет продолжаться в течение периода времени, необходимого для предотвращения, улучшения, подавления или облегчения симптомов заболевания или медицинского показания. Пациентов, подвергающихся лечению, будут обычно контролировать на постоянной основе для определения эффективности терапии. Например, при лечении гипертензии измерения кровяного давления можно применять для определения эффективности лечения. Аналогичные индикаторы для других заболеваний и состояний, описанных в настоящем изобретении, являются хорошо известными и являются легко доступными для лечащего врача. Непрерывный контроль врача будет гарантировать, что будут вводить оптимальное количество соединения настоящего изобретения в любой указанный момент времени, а также облегчать определение продолжительности лечения. Это является особенно ценным, когда также вводят дополнительные агенты, поскольку их выбор, дозирование и продолжительность лечения может также требовать регулирования. Таким образом, режим лечения и график дозирования можно регулировать в процессе терапии так, чтобы вводить наименьшее количество активного агента, которое проявляет требуемую эффективность и, кроме того, чтобы введение продолжалось только до тех пор, пока оно необходимо для успешного лечения заболевания или медицинского показания.
Исследовательские инструменты
Поскольку соединения настоящего изобретения обладают ингибирующей NEP фермент активностью, данные соединения также являются пригодными в качестве исследовательских инструментов для исследования или изучения биологических систем или образцов, содержащих NEP фермент, например, для изучения заболеваний, при которых играют роль NEP фермент или его пептидные субстраты. Любую подходящую биологическую систему или образец, содержащий NEP фермент, можно применять в данных исследованиях, которые можно проводить или in vitro, или in vivo. Примеры биологических систем или образцов, пригодных для данных исследований, включают, но не ограничиваются ими, клетки, клеточные экстракты, клеточные мембраны, образцы тканей, выделенные органы, животных (таких как мыши, крысы, морские свинки, кролики, собаки, свиньи, люди и так далее) и подобные, причем млекопитающие представляют особый интерес. В одном конкретном варианте осуществления настоящего изобретения NEP ферментную активность у млекопитающего ингибируют введением NEP-ингибирующего количества соединения настоящего изобретения. Соединения настоящего изобретения можно также применять в качестве исследовательских инструментов, проводя биологические анализы, применяя данные соединения.
При применении в качестве исследовательского инструмента, биологическая система или образец, содержащий NEP фермент, обычно контактирует с NEP фермент-ингибирующим количеством соединения настоящего изобретения. После воздействия на биологическую систему или образец соединением, эффекты ингибирования NEP фермента определяют, применяя общепринятые способы и оборудование, такие как измерение рецепторного связывания в анализе на связывание или измерение опосредованных лигандом изменений в функциональном анализе. Воздействие включает контакт клеток или ткани с соединением, введение соединения млекопитающему, например, интраперитонеальным, пероральным, внутривенным, подкожным или ингаляционным введением и так далее. Данная стадия определения может включать измерение ответа (количественный анализ) или может включать осуществление наблюдений (качественный анализ). Измерение ответа включает, например, определение эффектов соединения на биологическую система или образец, применяя общепринятые способы и оборудование, такие как анализы ферментативной активности и измерение изменений, опосредованных субстратом или продуктом фермента, в функциональном анализе. Результаты анализа можно применять для определения степени активности, а также количества соединения, необходимого для достижения требуемого результата, т.е. NEP фермент-ингибирующего количества. Обычно стадия определения будет включать определение эффектов ингибирования NEP фермента.
Кроме того, соединения настоящего изобретения можно применять в качестве исследовательских инструментов для оценки других химических соединений и, таким образом, они также являются пригодными для скрининговых анализов для обнаружения, например, новых соединений, обладающих NEP-ингибирующей активностью. Таким образом, соединение настоящего изобретения применяют в качестве стандарта в анализе, позволяя сравнивать результаты, полученные для испытуемого соединения и соединений настоящего изобретения, для обнаружения испытуемых соединений, которые обладают приблизительно равной или большей активностью, если вообще обладают. Например, pKi данные для испытуемого соединения или группы испытуемых соединений сравнивают с pKi данными для соединения настоящего изобретения, определяя испытуемые соединения, которые обладают требуемыми свойствами, например, испытуемые соединения, обладающие pKi величиной, приблизительно равной или большей, чем у соединения настоящего изобретения, если она вообще присутствует. Данный аспект настоящего изобретения включает, в качестве отдельного варианта осуществления, и получение сравнительных данных (применяя подходящие анализы), и анализ данных испытания для обнаружения испытуемых соединений, представляющих интерес. Таким образом, испытуемое соединение можно оценивать в биологическом анализе способом, включающим стадии: (a) проведения биологического анализа с испытуемым соединением, получая первую величину анализа; (b) проведения биологического анализа с соединением настоящего изобретения, получая вторую величину анализа; где стадию (a) проводят или перед, после или одновременно со стадией (b); и (c) сравнение первой величины анализа из стадии (a) со второй величиной анализа из стадии (b). Примеры биологических анализов включают анализ на ингибирование NEP фермента.
ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СОСТАВЫ
Соединения настоящего изобретения обычно вводят пациенту в виде фармацевтической композиции или состава. Данные фармацевтические композиции можно вводить пациенту любым подходящим путем введения, включая, но не ограничиваясь, пероральный, ректальный, вагинальный, назальный, ингаляцией, местный (включая трансдермальный), глазной и парентеральный пути введения. Кроме того, соединения настоящего изобретения можно вводить, например, перорально, в виде нескольких доз в день (например, два, три или четыре раза в день), в виде единичной дневной дозы или единичной недельной дозы. Ясно, что любую форму соединений настоящего изобретения (т.е. свободное основание, свободная кислота, фармацевтически приемлемая соль, сольват и т.д.), которая является пригодной для конкретного пути введения, можно применять в фармацевтических композициях, обсуждаемых в настоящем изобретении.
Соответственно, в одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и соединение настоящего изобретения. Композиции могут содержать другие терапевтические агенты и/или агенты для формулирования, при желании. При обсуждении композиций, "соединение настоящего изобретения" могут также называть в настоящем изобретении "активным агентом" для того, чтобы отличить его от других компонентов состава, таких как носитель. Таким образом, ясно, что термин "активный агент" включает соединения формулы I, а также фармацевтически приемлемые соли, сольваты и пролекарства данного соединения.
Фармацевтические композиции настоящего изобретения обычно содержат терапевтически эффективное количество соединения настоящего изобретения. Однако специалисту в данной области техники ясно, что фармацевтическая композиция может содержать больше, чем терапевтически эффективное количество, такое как в сыпучих композициях, или меньше, чем терапевтически эффективное количество, т.е. отдельные однократные дозы, разработанные для нескольких введений, образующих в результате терапевтически эффективное количество. Обычно композиция будет содержать приблизительно 0,01-95% по весу активного агента, включая, приблизительно 0,01-30% по весу, такую как от приблизительно 0,01-10% по весу, с реальным количеством, зависящим от самого состава, пути введения, частоты дозирования и т.д. В одном варианте осуществления композиция, подходящая для пероральной лекарственной формы, например, может содержать приблизительно 5-70% по весу, или приблизительно 10-60% по весу активного агента.
Любой общепринятый носитель или вспомогательное вещество можно применять в фармацевтических композициях настоящего изобретения. Выбор конкретного носителя или вспомогательного вещества или комбинаций носителей или вспомогательных веществ будет зависеть от пути введения, который применяют для лечения конкретного пациента, или типа медицинского показания или болезненного состояния. В связи с этим, способ получения подходящей композиции для конкретного пути введения является известным специалисту в фармацевтической области техники. Кроме того, носители или вспомогательные вещества, применяемые в данных композициях, являются имеющимися в продаже. В качестве дополнительной иллюстрации, общепринятые способы формулирования описаны в Remington: The Science and Practice of Pharmacy, 20th Edition, Lippincott Williams & White, Baltimore, Maryland (2000); и H. C. Ansel et al., Pharmaceutical Dosage Forms and Drug Delivery Systems, 7th Edition, Lippincott Williams & White, Baltimore, Maryland (1999).
Типичные примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, включают, но не ограничиваются ими, следующие: сахара, такие как, лактоза, глюкоза и сахароза; крахмал, такой как кукурузный крахмал и картофельный крахмал; целлюлозу, такую как микрокристаллическая целлюлоза и ее производные, такие как карбоксиметилцеллюлоза натрия, этилцеллюлоза и ацетат целлюлозы; порошкообразный трагакант; солод; желатин; тальк; вспомогательные вещества, такие как масло какао и воски для суппозиториев; масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль; полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; эфиры, такие как этилолеат и этиллаурат; агар; буферные агенты, такие как гидроксид магния и гидроксид алюминия; альгиновую кислоту; апирогенную воду; изотонический солевой раствор; раствор Рингера; этиловый спирт; фосфатно-буферные растворы; сжатые пропелленты, такие как хлорфторуглероды и гидрофторуглероды; и другие нетоксичные совместимые вещества, применяемые в фармацевтических композициях.
Фармацевтические композиции обычно получают тщательным и равномерным смешением или замесом активного агента с фармацевтически приемлемым носителем и одним или более необязательными ингредиентами. Затем полученную в результате однородно перемешанную смесь формуют или загружают в таблетки, капсулы, пилюли, контейнеры, картриджы, дозаторы и подобные, применяя общепринятые способы и оборудование.
В одном варианте осуществления фармацевтические композиции являются пригодными для перорального введения. Подходящие композиции для перорального введения могут быть в виде капсул, таблеток, пилюль, пастилок, крахмальных капсул, драже, порошков, гранул; растворов или суспензий в водной или неводной жидкости; жидких эмульсий масло в воде или вода в масле; эликсиров или сиропов; и подобных; причем каждый содержит предварительно определенное количество активного агента.
Когда предполагается пероральное введение в твердой лекарственной форме (капсулы, таблетки, пилюли и подобные), композиция будет обычно содержать активный агент и один или более фармацевтически приемлемых носителей, таких как цитрат натрия или фосфат дикальция. Твердые лекарственные формы могут также содержать наполнители или разбавители, такие как крахмалы, микрокристаллическая целлюлоза, лактоза, сахароза, глюкоза, маннит и/или кремниевая кислота; связующие, такие как карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и/или аравийская камедь; увлажнители, такие как глицерин; разрыхлители, такие как агар-агар, карбонат кальция, картофельный крахмал или крахмал тапиоки, альгиновую кислоту, некоторые силикаты и/или карбонат натрия; замедляющие растворение агенты, такие как парафин; ускорители абсорбции, такие как четвертичные аммониевые соединения; смачивающие агенты, такие как цетиловый спирт и/или моностеарат глицерина; абсорбенты, такие как каолин и/или бентонит; смазывающие вещества, такие как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и/или их смеси; красители; и буферные агенты.
Агенты, регулирующие высвобождение, смачивающие агенты, покрывающие агенты, подсластители, вкусовые добавки и ароматизаторы, консерванты и антиоксиданты могут также присутствовать в фармацевтических композициях. Примеры покрывающих агентов для таблеток, капсул, пилюль и подобных включают покрывающие агенты, применяемые для энтеросолюбильного покрытия таблеток, такие как ацетатфталат целлюлозы, поливинилацетатфталат, фталат гидроксипропилметилцеллюлозы, эфирные сополимеры метакриловая кислота-метакриловая кислота, ацетаттримеллитат целлюлозы, карбоксиметилэтилцеллюлоза, ацетатсукцинат гидроксипропилметилцеллюлозы и подобные. Примеры фармацевтически приемлемых антиоксидантов включают растворимые в воде антиоксиданты, такие как аскорбиновая кислота, гидрохлорид цистеина, бисульфат натрия, метабисульфат натрия, сульфит натрия и подобные; растворимые в масле антиоксиданты, такие как аскорбилпальмитат, бутилированный гидроксианизол, бутилированный гидрокситолуол, лецитин, пропилгаллат, альфа-токоферол и подобные; и металл-хелатирующие агенты, такие как лимонная кислота, этилендиаминтетрауксусная кислота, сорбит, винная кислота, фосфорная кислота и подобные.
Композиции можно также формулировать, получая медленное или контролируемое высвобождение активного агента, применяя, например, гидроксипропилметилцеллюлозу в различных пропорциях или другие полимерные матриксы, липосомы и/или микросферы. Кроме того, фармацевтические композиции настоящего изобретения могут содержать затемняющие агенты, и их можно формулировать так, чтобы они высвобождали только или предпочтительно активный агент, в определенной части желудочно-кишечного тракта, необязательно, замедленным способом. Примеры заливочных композиций, которые можно применять, включают полимерные вещества и воски. Активный агент может также быть в микроинкапсулированной форме, необязательно с одним или более из описанных выше вспомогательных веществ.
Подходящие жидкие лекарственные формы для перорального введения включают, в качестве иллюстрации, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Жидкие лекарственные формы обычно содержат активный агент и инертный разбавитель, такой как, например, вода или другие растворители, агенты, способствующие растворению и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, масла (например, хлопковое, арахисовое, кукурузное, зародышевое, оливковое, касторовое и кунжутное масло), глицерин, тетрагидрофуриловый спирт, полиэтиленгликоли и эфиры сорбитана и жирных кислот и их смеси. Суспензии могут содержать суспендирующие агенты, такие как, например, этоксилированные изостеариловые спирты, полиоксиэтиленсорбит и эфиры сорбитана, микрокристаллическую целлюлозу, метагидроксид алюминия, бентонит, агар-агар и трагакант, и их смеси.
Когда предполагается пероральное введение, фармацевтические композиции настоящего изобретения можно упаковывать в единичные лекарственные формы. Термин "единичная лекарственная форма" относится к физиологически дискретной единице, подходящей для введения дозы пациенту, т.е. каждая единица содержит предварительно определенное количество активного агента, рассчитанное для оказания требуемого терапевтического эффекта или отдельно, или в комбинации с одной или более дополнительными единицами. Например, данные единичные лекарственные формы могут представлять собой капсулы, таблетки, пилюли и подобные.
В другом варианте осуществления композиции настоящего изобретения являются пригодными для ингаляционного введения и обычно будут в виде аэрозоля или порошка. Данные композиции обычно вводят, применяя хорошо известные устройства для доставки, такие как распылитель, ингалятор сухого порошка или дозирующий ингалятор. Распылительные устройства генерируют высокоскоростной поток воздуха, который вызывает распыление композиции в виде аэрозоля, который попадает в дыхательные пути пациента. Пример распылительного состава содержит активный агент, растворенный в носителе, образуя раствор, или мелкоизмельченный и объединенный с носителем, образуя суспензию тонкоизмельченных частиц пригодного для дыхания размера. Ингаляторы сухого порошка вводят активный агент в виде свободно текущего порошка, который диспергируется в потоке воздуха пациента при вдохе. Пример состава в виде сухого порошка включает активный агент, смешанный в сухом виде со вспомогательным веществом, таким как лактоза, крахмал, маннит, декстроза, полимолочная кислота, полилактид-со-гликолид и их комбинации. Дозирующие ингаляторы высвобождают отмеренное количество активного агента, применяя сжатый газ, являющийся пропеллентом. Пример дозированного состава включает раствор или суспензию активного агента в сжиженном пропелленте, таком как хлорфторуглерод или гидрофторалкан. Необязательные компоненты данных составов включают сорастворители, такие как этанол или пентан, и поверхностно-активные вещества, такие как триолеат сорбитана, олеиновая кислота, лецитин, глицерин и лаурилсульфат натрия. Данные композиции обычно получают добавлением охлажденного или сжатого гидрофторалкана в подходящий контейнер, содержащий активный агент, этанол (если он присутствует) и поверхностно-активное вещество (если оно присутствует). Для получения суспензии, активный агент тонко измельчают и затем объединяют с пропеллентом. Альтернативно, состав в виде суспензии можно получить сушкой распылением покрытия поверхностно-активного вещества на тонко измельченных частицах активного агента. Затем состав загружают в аэрозольную емкость, которая образует часть ингалятора.
Соединения настоящего изобретения можно также вводить парентерально (например, подкожной, внутривенной, внутримышечной или интраперитонеальной инъекцией). Для данного введения активный агент обеспечивают в стерильном растворе, суспензии или эмульсии. Примеры растворителей для получения данных составов включают воду, соляной раствор, низкомолекулярные спирты, такие как пропиленгликоль, полиэтиленгликоль, масла, желатин, эфиры жирных кислот, такие как этилолеат, и подобные. Парентеральные составы могут также содержать один или более антиоксидантов, солюбилизаторов, стабилизаторов, консервантов, смачивающих агентов, эмульгаторов и диспергаторов. Поверхностно-активные вещества, дополнительные стабилизирующие агенты или pH-регулирующие агенты (кислоты, основания или буферы) и антиоксиданты являются, в частности, пригодными для придания стабильности составу, например, для снижения до минимума или предотвращения гидролиза эфирной и амидной связей или димеризации тиолов, которые могут присутствовать в соединении. Данные составы можно делать стерильными, применяя стерильные инъецируемые среды, стерилизующий агент, фильтрацию, облучение или нагревание. В одном конкретном варианте осуществления парентеральный состав содержит водный циклодекстриновый раствор в качестве фармацевтически приемлемого носителя. Подходящие циклодекстрины включают циклические молекулы, содержащие шесть или более α-D-глюкопиранозных фрагментов, соединенных в 1,4-положениях связями как в амилазе, β-циклодекстрине или циклогептаамилозе. Примеры циклодекстринов включают циклодекстриновые производные, такие как гидроксипропиловый и сульфобутиловый эфир циклодекстринов, такие как гидроксипропил-β-циклодекстрин и сульфобутиловый эфир β-циклодекстрина. Примеры буферов для данных составов включают буферы на основе карбоновых кислот, такие как цитратные, лактатные и малеатные буферные растворы.
Соединения настоящего изобретения можно также вводить трансдермально, применяя известные трансдермальные системы доставки и вспомогательные вещества. Например, соединение можно смешивать с агентами, улучшающими проникновение, такими как пропиленгликоль, монолаурат полиэтиленгликоля, азациклоалкан-2-оны и подобными, и вводить в пластырь или аналогичную систему доставки. Можно применять дополнительные вспомогательные вещества, включая желатинизирующие агенты, эмульгаторы и буферы, в данных трансдермальных композициях, при желании.
Вспомогательные агенты
Соединения настоящего изобретения могут быть пригодны в качестве монотерапии заболевания или их можно объединять с одним или более другими терапевтическими агентами для того, чтобы получить требуемый терапевтический эффект. Таким образом, в одном варианте осуществления фармацевтические композиции настоящего изобретения содержат другие лекарственные средства, которые вводят совместно с соединением настоящего изобретения. Например, композиция может дополнительно содержать одно или более лекарственных средств (также называемых "вспомогательный агент (агенты)"). Данные терапевтические агенты являются хорошо известными в данной области техники, и они включают антагонисты аденозинового рецептора, антагонисты α-адренергического рецептора, антагонисты β1-адренергического рецептора, агонисты β2-адренергического рецептора, антагонист β-адренергического рецептора/α1-рецепторный антагонист, агенты, разрушающие конечный продукт усиленного гликозилирования, антагонисты альдостерона, ингибиторы альдостеронсинтазы, ингибиторы аминопептидазы N, андрогены, ингибиторы ангиотензин-превращающего фермента и ингибиторы ангиотензин-превращающего фермента/неприлизина двойного действия, активаторы и стимуляторы ангиотензин-превращающего фермента 2, ангиотензин-II вакцины, антикоагулянты, противодиабетические агенты, противодиарейные агенты, агенты против глаукомы, антилипидные агенты, антиноцицептивные агенты, противотромботические агенты, антагонисты AT1 рецептора и антагонист AT1 рецептора/ингибитор неприлизина двойного действия и блокаторы многофункционального ангиотензинового рецептора, антагонисты рецептора брадикинина, блокаторы кальциевых каналов, ингибиторы химазы, дигоксин, диуретики, агонисты допамина, ингибиторы эндотелин-превращающего фермента, антагонисты эндотелинового рецептора, ингибиторы HMG-CoA редуктазы, эстрогены, агонисты и/или антагонисты эстрогенового рецептора, ингибиторы обратного захвата моноаминов, мышечные релаксанты, натрийуретические пептиды и их аналоги, антагонисты очищающего рецептора натрийуретического пептида, ингибиторы неприлизина, доноры оксида азота, нестероидные противовоспалительные агенты, антагонисты рецептора N-метил d-аспартата, агонисты опиоидных рецепторов, ингибиторы фосфодиэстеразы, простагландиновые аналоги, агонисты простагландинового рецептора, ингибиторы ренина, селективные ингибиторы обратного захвата серотонина, блокатор натриевых каналов, стимуляторы и активаторы растворимой гуанилатциклазы, трициклические антидепрессанты, антагонисты вазопрессинового рецептора и их комбинации. Конкретные примеры данных агентов приводятся подробно в настоящем изобретении.
Соответственно, в еще другом аспекте настоящего изобретения фармацевтическая композиция содержит соединение настоящего изобретения, второй активный агент и фармацевтически приемлемый носитель. Третий, четвертый и т.д. активные агенты можно также включать в композицию. В комбинационной терапии количество соединения настоящего изобретения, которое вводят, а также количество вспомогательных агентов может быть меньшим, чем количество, обычно вводимое при монотерапии.
Соединения настоящего изобретения можно физически смешивать со вторым активным агентом, получая композицию, содержащую оба агента; или каждый агент может присутствовать в отдельных и отличных композициях, которые вводят пациенту одновременно или в разные моменты времени. Например, соединение настоящего изобретения можно объединять со вторым активным агентом, применяя общепринятые способы и оборудование, получая комбинацию активных агентов, содержащую соединение настоящего изобретения и второй активный агент. Кроме того, активные агенты можно объединять с фармацевтически приемлемым носителем, получая фармацевтическую композицию, содержащую соединение настоящего изобретения, второй активный агент и фармацевтически приемлемый носитель. В данном варианте осуществления компоненты композиции обычно смешивают или замешивают, получая физическую смесь. Затем физическую смесь вводят в терапевтически эффективном количестве, применяя любой из путей, описанных в настоящем изобретении.
Альтернативно, активные агенты могут оставлять разделенными и индивидуальными перед введением пациенту. В данном варианте осуществления агенты не смешивают вместе физически перед введением, но вводят одновременно или в различные моменты времени в отдельных композициях. Данные композиции можно упаковывать отдельно или можно упаковывать вместе в наборе. При введении в различные моменты времени вспомогательный агент будут обычно вводить меньше чем через 24 часа после введения соединения настоящего изобретения, в диапазоне от любого промежутка времени от введения соединения настоящего изобретения до приблизительно 24 часов после дозирования. Это также называют последовательным введением. Таким образом, соединение настоящего изобретения можно вводить перорально одновременно или последовательно с другим активным агентом, применяя две таблетки, по одной таблетки для каждого активного агента, где последовательно может обозначать введение немедленно после введения соединения настоящего изобретения или через некоторый заранее определенный промежуток времени (например, через час или три часа). Также предполагается, что вспомогательный агент можно вводить более чем через 24 часа после введения соединения настоящего изобретения. Альтернативно, комбинацию можно вводить различными путями введения, т.е. одну перорально и другую ингаляцией.
В одном варианте осуществления набор содержит первую лекарственную форму, содержащую соединение настоящего изобретения и по меньшей мере одну дополнительную лекарственную форму, содержащую один или более из вспомогательных агентов, описанных в настоящем изобретении, в количествах, достаточных для осуществления способов настоящего изобретения. Первая лекарственная форма и вторая (или третья и т.д.) лекарственная форма вместе содержат терапевтически эффективное количество активных агентов для лечения или предотвращения заболевания или медицинского показания у пациента.
Вспомогательный агент (агенты), при их включении, присутствуют в терапевтически эффективном количестве так, что их обычно вводят в количестве, которое дает терапевтически благоприятный эффект при совместном введении с соединением настоящего изобретения. Вспомогательный агент может быть в форме фармацевтически приемлемой соли, сольвата, необязательно чистого стереоизомера и так далее. Вспомогательный агент может быть также в форме пролекарства, например, соединения, содержащего карбоксильную группу, которая этерифицирована. Таким образом, предполагается, что вспомогательные агенты, перечисленные в настоящем изобретении, включают все данные формы, и являются имеющимися в продаже, или их можно получить, применяя общепринятые способы и реагенты.
В одном варианте осуществления соединения настоящего изобретения вводят в комбинации с антагонистом аденозинового рецептора, типичные примеры которого включают, но не ограничиваются ими, наксифиллин, ролофиллин, SLV-320, теофиллин и тонапофиллин.
В одном варианте осуществления соединения настоящего изобретения вводят в комбинации с антагонистом α-адренергического рецептора, типичные примеры которых включают, но не ограничиваются ими, доксазозин, празозин, тамсулозин и теразозин.
Соединения настоящего изобретения можно также вводить в комбинации с антагонистом β1-адренергического рецептора ("β1-блокатор"). Типичные β1-блокаторы включают, но не ограничиваются ими, ацебутолол, альпренолол, амосулалол, аротинолол, атенолол, бефунолол, бетаксолол, бевантолол, бисопролол, бопиндолол, буциндолол, букумолол, буфетолол, буфуралол, бунитролол, бупранолол, бубридин, бутофилолол, каразолол, картеолол, карведилол, целипролол, кетамолол, клоранолол, дилевалол, эпанолол, эсмолол, инденолол, лабетолол, левобунолол, мепиндолол, метипранолол, метопролол, такой как сукцинат метопролола и тартрат метопролола, мопролол, надолол, надоксолол, небивалол, нипрадилол, окспренолол, пенбутолол, пербутолол, пиндолол, практолол, пронеталол, пропранолол, соталол, суфиналол, талиндол, тертатолол, тилизолол, тимолол, толипролол, ксибенолол, и их комбинации. В одном конкретном варианте осуществления β1-антагонист выбран из атенолола, бисопролола, метопролола, пропранолола, соталола и их комбинации. Обычно β1-блокатор будут вводить в количестве, достаточном для обеспечения приблизительно 2-900 мг на дозу.
В одном варианте осуществления соединения настоящего изобретения вводят в комбинации с агонистом β2-адренергического рецептора, типичные примеры которого включают, но не ограничиваются ими, альбутерол, битолтерол, фенотерол, формотерол, индакатерол, изоэтарин, левалбутерол, метапротеренол, пирбутерол, сальбутамол, салмефамол, сальметерол, тербуталин, вилантерол и подобные. Обычно агонист β2-адренергического рецептора будут вводить в количестве, достаточном для обеспечения приблизительно 0,05-500 мкг на дозу.
В одном варианте осуществления соединения настоящего изобретения вводят в комбинации с агентом, разрушающим конечный продукт усиленного гликозилирования (AGE), примеры которого включают, в качестве иллюстрации и не ограничения, алагебриум (или ALT-711) и TRC4149.
В другом варианте осуществления соединения настоящего изобретения вводят в комбинации с антагонистом альдостерона, типичные примеры которого включают, но не ограничиваются ими, эплеренон, спиронолактон и их комбинации. Обычно антагонист альдостерона будут вводить в количестве, достаточном для обеспечения приблизительно 5-300 мг в день.
В одном варианте осуществления соединения настоящего изобретения вводят в комбинации с ингибитором аминопептидазы N или дипептидилпептидазы III, примеры которых включают, в качестве иллюстрации и не ограничения, бестатин и PC 18 (2-амино-4-метилсульфонилбутантиол, метионинтиол).
Соединения настоящего изобретения можно также вводить в комбинации с ингибитором ангиотензин-превращающего фермента (АСЕ). Типичные АСЕ ингибиторы включают, но не ограничиваются ими, аккуприл, алацеприл, беназеприл, беназеприлат, каптоприл, церанаприл, цилазаприл, делаприл, эналаприл, эналаприлат, фозиноприл, фозиноприлат, имидаприл, лизиноприл, моэксиприл, моноприл, мовелтиприл, пентоприл, периндоприл, хинаприл, хинаприлат, рамиприл, рамиприлат, ацетат саралазина, спираприл, темокаприл, трандолаприл, зофеноприл и их комбинации. В конкретном варианте осуществления АСЕ ингибитор выбран из беназеприла, каптоприла, эналаприла, лизиноприла, рамиприла и их комбинаций. Обычно АСЕ ингибитор будут вводить в количестве, достаточном для обеспечения приблизительно 1-150 мг в день.
В одном варианте осуществления соединения настоящего изобретения вводят в комбинации с агентом двойного действия, таким как ингибитор ангиотензин-превращающего фермента/неприлизина (ACE/NEP), примеры которого включают, но не ограничиваются ими, AVE-0848 ((4S,7S,12bR)-7-[3-метил-2(S)-сульфанилбутирамидо]-6-оксо-1,2,3,4,6,7,8,12b-октагидропиридо[2,1-а][2]бензазепин-4-карбоновая кислота); AVE-7688 (илепатрил) и его исходное соединение; BMS-182657 (2-[2-оксо-3(S)-[3-фенил-2(S)-сульфанилпропионамидо]-2,3,4,5-тетрагидро-1Н-1-бензазепин-1-ил]уксусная кислота); CGS-26303 ([N-[2-(бифенил-4-ил)-1(S)-(1H-тетразол-5-ил)этил]амино]метилфосфоновая кислота); CGS-35601 (N-[1-[4-метил-2(S)-сульфанилпентанамидо]циклопентилкарбонил]-L-триптофан); фазидотрил; фазидотрилат; эналаприлат; ER-32935 ((3R,6S,9aR)-6-[3(S]-метил-2(S)-сульфанилпентанамидо]-5-оксопергидротиазоло[3,2-a]азепин-3-карбоновая кислота); гемпатрилат; MDL-101264 ((4S,7S,12bR)-7-[2(S)-(2-морфолиноацетилтио)-3-фенилпропионамидо]-6-оксо-1,2,3,4,6,7,8,12b-октагидропиридо[2,1-a][2]бензазепин-4-карбоновая кислота); MDL-101287 ([4S-[4a,7a(R*),12bβ]]-7-[2-(карбоксиметил)-3-фенилпропионамидо]-6-оксо-1,2,3,4,6,7,8,12b-октагидропиридо[2,1-a][2]бензазепин-4-карбоновая кислота); омапатрилат; RB-105 (N-2(S)-(меркаптометил)-3(R)-фенилбутил]-L-аланин); сампатрилат; SA-898 ((2R,4R)-N-[2-(2-гидроксифенил)-3-(3-меркаптопропионил)тиазолидин-4-илкарбонил]-L-фенилаланин); Sch-50690 (N-[1(S)-карбокси-2-[N2-(метансульфонил)-L-лизиламино]этил]-L-валил-L-тирозин); и их комбинации, можно также включать. В одном конкретном варианте осуществления ACE/NEP ингибитор выбран из AVE-7688, эналаприлата, фазидотрила, фазидотрилата, омапатрилата, сампатрилата и их комбинаций.
В одном варианте осуществления соединения настоящего изобретения вводят в комбинации с активатором или стимулятором ангиотензин-превращающего фермента 2 (ACE2).
В одном варианте осуществления соединения настоящего изобретения вводят в комбинации с ангиотензин-II вакциной, примеры которой включают, но не ограничиваются ими, ATR12181 и CYT006-AngQb.
В одном варианте осуществления соединения настоящего изобретения вводят в комбинации с антикоагулянтом, типичные примеры которого включают, но не ограничиваются ими, кумарины, такие как варфарин; гепарин; и прямые ингибиторы тромбина, такие как аргатробан, бивалирубин, дабигатран и лепирудин.
В еще другом варианте осуществления соединения настоящего изобретения вводят в комбинации с антидиабетическим агентом. Типичные антидиабетические агенты включают инъецируемые лекарственные средства, а также перорально эффективные лекарственные средства, и их комбинации. Примеры инъецируемых лекарственных средств включают, но не ограничиваются ими, инсулин и производные инсулина. Примеры перорально эффективных лекарственных средств включают, но не ограничиваются ими, бигуаниды, такие как метформин; антагонисты глюкагона; ингибиторы α-глюкозидазы, такие как акарбоза и миглитол; ингибиторы дипептидилпептидазы IV (DPP-IV ингибиторы), такие как алоглиптин, денаглиптин, линаглиптин, саксаглиптин, ситаглиптин и вилдаглиптин; меглитиниды, такие как репаглинид; оксадиазолидиндионы; сульфонилмочевины, такие как хлорпропамид, глимепирид, глипизид, глибурид и толазамид; тиазолидиндионы, такие как пиоглитазон и розиглитазон; и их комбинации.
В другом варианте осуществления соединения настоящего изобретения вводят в комбинации с антидиарейными терапиями. Типичные варианты терапии включают, но не ограничиваются ими, раствор для пероральной регидратации (ORS), лоперамид, дифеноксилат и субсалицил висмута.
В еще другом варианте осуществления соединение настоящего изобретения вводят в комбинации с противоглаукомным агентом. Типичные противоглаукомные агенты включают, но не ограничиваются ими, α-адренергические агонисты, такие как бримонидин; антагонисты β1-адренергического рецептора; местные β1-блокаторы, такие как бетаксолол, левобунолол и тимолол; ингибиторы карбоангидразы, такие как ацетазоламид, бринзоламид или дорзоламид; холинергические агонисты, такие как цевимелин и DMXB-анабазеин; эпинефриновые соединения; миотики, такие как пилокарпин; и простагландиновые аналоги.
В еще другом варианте осуществления соединения настоящего изобретения вводят в комбинации с антилипидным агентом. Типичные антилипидные агенты включают, но не ограничиваются ими, ингибиторы транспортного белка холестериновых эфиров (CETP), такие как анацетрапиб, далцетрапиб и торцетрапиб; статины, такие как аторвастатин, флувастатин, ловастатин, правастатин, розувастатин и симвастатин; и их комбинации.
В одном варианте осуществления соединения настоящего изобретения вводят в комбинации с противотромботическим агентом. Типичные противотромботические агенты включают, но не ограничиваются ими, аспирин; антитромбоцитные агенты, такие как клопидогрел, празугрел и тиклоридин; гепарин, и их комбинации.
В одном варианте осуществления соединения настоящего изобретения вводят в комбинации с антагонистом ΑΤ1 рецептора, также известного как блокатор рецептора ангиотензина II 1 типа (ARB). Типичные ARB включают, но не ограничиваются ими, абитесартан, азилсартан (например, азилсартанмедоксомил), бензиллосартан, кандесартан, кандесартанцилексетил, элисартан, эмбусартан, энолтазосартан, эпросартан, ЕХР3174, фонсартан, форасартан, глициллосартан, ирбесартан, изотеолин, лосартан, медоксимил, милфасартан, олмесартан (например, олмесартанмедоксомил), опомисартан, пратосартан, риписартан, саприсартан, саралазин, сармезин, TAK-591, тазосартан, телмисартан, валсартан, золасартан и их комбинации. В конкретном варианте осуществления ARB выбран из азилсартанмедоксимила, кандесартанцилексетила, эпросартана, лосартана, олмесартанамедоксимила, ирбесартана, саприсартана, тазосартана, телмисартана, валсартана, и их комбинаций. Примеры солей и/или пролекарств включают кандесартанцилексетил, эпросартанмезилат, калиевую соль лосартана и олмесартанмедоксомил. Обычно ARB будут вводить в количестве, достаточном для обеспечения приблизительно 4-600 мг на дозу, с примерным дневным дозированием в диапазоне 20-320 мг в день.
Соединения настоящего изобретения можно также вводить в комбинации с агентом двойного действия, таким как антагонист АТ1 рецептора/ингибитор неприлизина (ARB/NEP), примеры которого включают, но не ограничиваются ими, соединения, описанные в публикациях США №2008/0269305 и 2009/0023228, обе Allegretti et al., поданные 23 апреля 2008 г., такие как соединение, 4′-{2-этокси-4-этил-5-[((S)-2-меркапто-4-метилпентаноиламино]метил]имидазол-1-илметил}-3′-фторбифенил-2-карбоновая кислота.
Соединения настоящего изобретения можно также вводить в комбинации с блокаторами многофункционального рецептора ангиотензина, как описано в Kurtz & Klein (2009) Hypertension Research 32:826-834.
В одном варианте осуществления соединения настоящего изобретения вводят в комбинации с антагонистом рецептора брадикинина, например, икатибантом (HOE-140). Ожидают, что данная комбинационная терапия может способствовать предотвращению ангиоэдемы или других нежелательных последствий повышенных концентраций брадикинина.
В одном варианте осуществления соединения настоящего изобретения вводят в комбинации с блокатором кальциевых каналов. Типичные блокаторы кальциевых каналов включают, но не ограничиваются ими, амлодипин, анипамил, аранипин, барнидипин, бенциклан, бенидипин, бепридил, клентиазем, цилнидипин, циннаризин, дилтиазем, эфонидипин, элгодипин, этафенон, фелодипин, фендилин, флунаризин, галлопамил, исрадипин, лацидипин, лерканидипин, лидофлазин, ломеризин, манидипин, мибефрадил, никардипин, нифедипин, нигулдипин, нилудипин, нилвадипин, нимодипин, низолдипин, нитрендипин, нивалдипин, пергексилин, прениламин, риозидин, семотиадил, теродилин, тиапамил, верапамил и их комбинации. В конкретном варианте осуществления блокатор кальциевых каналов выбран из амлодипина, бепридила, дилтиазема, фелодипина, исрадипина, лацидипина, никардипина, нифедипина, нигулдипина, нилудипина, нимодипина, низолдипина, риозидина, верапамила и их комбинаций. Обычно блокатор кальциевых каналов будут вводить в количестве, достаточном для обеспечения приблизительно 2-500 мг на дозу.
В одном варианте осуществления соединения настоящего изобретения вводят в комбинации с ингибитором химазы, таким как ТРС-806 и 2-(5-формиламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-[{3,4-диоксо-1-фенил-7-(2-пиридилокси)}-2-гептил]ацетамид (NK3201).
В одном варианте осуществления соединения настоящего изобретения вводят в комбинации с диуретиком. Типичные диуретики включают, но не ограничиваются ими, ингибиторы карбоангидразы, такие как ацетазоламид и дихлорфенамид; петлевые диуретики, которые включают сульфонамидные производные, такие как ацетазоламид, амбузид, азосермид, буметанид, бутазоламид, хлораминофенамид, клофенамид, клопамид, клорексолон, дисульфамид, этоксзоламид, фуросемид, мефрузид, метазоламид, пиретанид, торземид, трипамид и ксипамид, а также несульфонамидные диуретики, такие как этакриновая кислота и другие соединения, являющиеся производными феноксиуксусной кислоты, такие как тиениловая кислота, индакринон и квинкарбат; осмотические диуретики, такие как маннит; калийсберегающие диуретики, которые включают антагонисты альдостерона, такие как спиронолактон, и ингибиторы Na+ каналов, такие как амилорид и триамтерен; тиазидные и тиазидоподобные диуретики, такие как алтиазид, бендрофлуметиазид, бензилгидрохлортиазид, бензтиазид, бутиазид, хлорталидон, хлортиазид, циклопентиазид, циклотиазид, эпитиазид, этиазид, фенквизон, флуметиазид, гидрохлортиазид, гидрофлуметиазид, индапамид, метилклотиазид, метикран, метолазон, парафлутизид, политиазид, квинетазон, теклотиазид и трихлорметиазид и их комбинации. В конкретном варианте осуществления диуретик выбран из амилорида, буметанида, хлортиазида, хлорталидона, дихлорфенамида, этакриновой кислоты, фуросемида, гидрохлортиазида, гидрофлуметиазида, индапамида, метилклотиазида, метолазона, торземида, триамтерена и их комбинаций. Диуретик будут вводить в количестве, достаточном для обеспечения приблизительно 5-50 мг в день, более обычно 6-25 мг в день, причем обычное дозирование составляет 6,25 мг, 12,5 мг или 25 мг в день.
Соединения настоящего изобретения можно также вводить в комбинации с ингибитором эндотелин-превращающего фермента (ECE), примеры которого включают, но не ограничиваются ими, фосфорамидон, CGS 26303 и их комбинации.
В конкретном варианте осуществления соединения настоящего изобретения вводят в комбинации с антагонистом эндотелинового рецептора. Типичные антагонисты эндотелинового рецептора включают, но не ограничиваются ими, селективные антагонисты эндотелинового рецептора, которые воздействуют на рецепторы эндотелина A, такие как авозентан, амбризентан, атразентан, BQ-123, клазозентан, дарузентан, ситаксентан и зиботентан; и двойные антагонисты эндотелиновых рецепторов, которые воздействуют на рецепторы и эндотелина A, и эндотелина B, такие как бозентан, мацитентан, тезозентан.
В еще другом варианте осуществления соединение настоящего изобретения вводят в комбинации с одним или более ингибиторами HMG-CoA редуктазы, которые также известны как статины. Типичные статины включают, но не ограничиваются ими, аторвастатин, флувастатин, ловастатин, питавастатин, правастатин, розувастатин и симвастатин.
В одном варианте осуществления соединения настоящего изобретения вводят в комбинации с ингибитором обратного захвата моноаминов, примеры которого включают, в качестве иллюстрации и не ограничения, ингибиторы обратного захвата норэпинефрина, такие как атомоксетин, бупроприон и гидроксибупроприон, являющийся бупроприоновым метаболитом, мапротилин, ребоксетин и вилоксазин; селективные ингибиторы обратного захвата серотонина (SSRI), такие как циталопрам и дезметилциталопрам, являющийся циталопрамовым метаболитом, дапоксетин, эсциталопрам (например, оксалат эскиталопрама), флуоксетин и норфлуоксетин, являющийся деметилированным метаболитом флуоксетина, флувоксамин (например, малеат флувоксамина), пароксетин, сертралин и дезметилсертралин, являющийся сертралиновым метаболитом; двойные ингибиторы обратного захвата серотонина и норэпинефрина (SNRI), такие как бицифадин, дулоксетин, милнаципран, нефазодон и венлафаксин; и их комбинации.
В другом варианте осуществления соединения настоящего изобретения вводят в комбинации с мышечным релаксантом, примеры которого включают, но не ограничиваются ими, карисопродол, хлорзоксазон, циклобензаприн, дифлунизал, метаксалон, метокарбамол и их комбинации.
В одном варианте осуществления соединения настоящего изобретения вводят в комбинации с натрийуретическим пептидом или аналогом, примеры которого включают, но не ограничиваются ими, карперитид, CD-NP (Nile Therapeutics), CU-NP, незиритид, PL-3994 (Palatin Technologies, Inc.), уларитид, цендеритид и соединения, описанные в Ogawa et al (2004) J.Biol.Chem. 279:28625-31. Данные соединения также называют агонистами рецептора-A натрийуретических пептидов (NPR-A). В другом варианте осуществления соединения настоящего изобретения вводят в комбинации с антагонистом очищающего рецептора натрийуретического пептида (NPR-C), таким как SC-46542, cANF (4-23) и AP-811 (Veale (2000) Bioorg Med Chem Lett 10: 1949-52). Например, AP-811 проявляет синергию при объединении с NEP ингибитором, тиорфаном (Wegner (1995) Clin.Exper.Hypert. 17:861-876).
В другом варианте осуществления соединения настоящего изобретения вводят в комбинации с ингибитором неприлизина (NEP). Типичные NEP ингибиторы включают, но не ограничиваются ими, AHU-377; кандоксатрил; кандоксатрилат; дексекадотрил, бензиловый эфир ((+)-N-[2(R)-(ацетилтиометил)-3-фенилпропионил]глицина); CGS-24128 (3-[3-(бифенил-4-ил)-2-(фосфонометиламино)пропионамидо]пропионовая кислота); CGS-24592 ((S)-3-[3-(бифенил-4-ил)-2-(фосфонометиламино)пропионамидо]пропионовая кислота); CGS-25155 бензиловый эфир (N-[9(R)-(ацетилтиометил)-10-оксо-1-азациклодекан-2(S)-илкарбонил]-4(R)гидрокси-L-пролина); производные 3-(1-карбамоилциклогексил)пропионовой кислоты, описанные в WO 2006/027680 Hepworth et al. (Pfizer Inc.); JMV-390-1 (2(R)-бензил-3-(N-гидроксикарбамоил)пропионил-L-изолейцин-L-лейцин); экадотрил; фосфорамидон; ретротиорфан; RU-42827 (2-(меркаптометил)-N-(4-пиридинил)бензолпропионамид); RU-44004 (N-(4-морфолинил)-3-фенил-2-(сульфанилметил)пропионамид); SCH-32615 ((S)-N-[N-(1-карбокси-2-фенилэтил)-L-фенилаланил]-β-аланин) и его пролекарство SCH-34826 ((S)-N-[N-[1-[[(2,2-диметил-1,3-диоксолан-4-ил)метокси]карбонил]-2-фенилэтил]-L-фенилаланил]-β-аланин); сиалорфин; SCH-42495 этиловый эфир (N-[2(S)-(ацетилсульфанилметил)-3-(2-метилфенил)пропионил]-L-метионина); спинорфин; SQ-28132 (N-[2-(меркаптометил)-1-оксо-3-фенилпропил]лейцин); SQ-28603 (N-[2-(меркаптометил)-1-оксо-3-фенилпропил]-β-аланин); SQ-29072 (7-[[2-(меркаптометил)-1-оксо-3-фенилпропил]амино]гептановая кислота); тиорфан и его пролекарство, рацекадотрил; UK-69578 (цис-4-[[[1-[2-карбокси-3-(2-метоксиэтокси)пропил]циклопентил]карбонил]амино]-циклогексанкарбоновая кислота); UK-447841 (2-{1-[3-(4-хлорфенил)пропилкарбамоил]циклопентилметил}-4-метоксимасляная кислота); UK-505749 ((R)-2-метил-3-{1-[3-(2-метилбензотиазол-6-ил)пропилкарбамоил]циклопентил}пропионовая кислота); 5-бифенил-4-ил-4-(3-карбоксипропиониламино)-2-метилпентановая кислота и этиловый эфир 5-бифенил-4-ил-4-(3-карбоксипропиониламино)-2-метилпентановой кислоты (WO 2007/056546); даглутрил [(3S,2'R)-3-{1-[2'-(этоксикарбонил)-4'-фенилбутил]-циклопентан-1-карбониламино}-2,3,4,5-тетрагидро-2-оксо-1H-1-бензазепин-1-уксусная кислота], описанный в WO 2007/106708 Khder et al. (Novartis AG); и их комбинации. В конкретном варианте осуществления NEP ингибитор выбран из AHU-377, кандоксатрила, кандоксатрилата, CGS-24128, фосфорамидона, SCH-32615, SCH-34826, SQ-28603, тиорфана и их комбинаций. В конкретном варианте осуществления NEP ингибитор представляет собой соединение, такое как даглутрил, которое также обладает активностью и ингибитора эндотелин-превращающего фермента (ECE), и NEP. Можно также применять ECE/NEP соединения двойного действия. NEP ингибитор будут вводить в количестве, достаточном для обеспечения приблизительно 20-800 мг в день, причем обычная дневная доза будет находится в диапазоне 50-700 мг в день, более обычно 100-600 или 100-300 мг в день.
В одном варианте осуществления соединения настоящего изобретения вводят в комбинации с донором оксида азота, примеры которого включают, но не ограничиваются ими, никорандил; органические нитраты, такие как тетранитрат пентаэритритола; и сиднонимины, такие как линсидомин и молсидомин.
В еще другом варианте осуществления соединения настоящего изобретения вводят в комбинации с нестероидным противовоспалительным агентом (NSAID). Типичные NSAID включают, но не ограничиваются ими, ацеметацин, ацетилсалициловую кислоту, алклофенак, алминопрофен, амфенак, амиприлоз, алоксиприн, аниролак, апазон, азапропазон, бенорилат, беноксапрофен, безпиперилон, броперамол, буклоксовую кислоту, карпрофен, клиданак, диклофенак, дифлунизал, дифталон, эноликам, этодолак, эторикоксиб, фенбуфен, фенклофенак, фенклозовую кислоту, фенопрофен, фентиазак, фепразон, флуфенамовую кислоту, флуфенизал, флупрофен, флурбипрофен, фурофенак, ибуфенак, ибупрофен, индометацин, индопрофен, изоксепак, изоксикам, кетопрофен, кеторолак, лофемизол, лорноксикам, меклофенамат, меклофенамовую кислоту, мефенамовую кислоту, мелоксикам, месаламин, миропрофен, мофебутазон, набуметон, напроксен, нифлумовую кислоту, оксапрозин, окспинак, оксифенбутазон, фенилбутазон, пироксикам, пирпрофен, пранопрофен, салсалат, судоксикам, сульфасалазин, сулиндак, супрофен, теноксикам тиопинак, тиапрофеновую кислоту, тиоксапрофен, толфенамовую кислоту, толметин, трифлумидат, зидометацин, зомепирак и их комбинации. В конкретном варианте осуществления NSAID выбран из этодолака, флурбипрофена, ибупрофена, индометацина, кетопрофена, кеторолака, мелоксикама, напроксена, оксапрозина, пироксикама и их комбинаций.
В одном варианте осуществления соединения настоящего изобретения вводят в комбинации с антагонистом рецептора N-метил d-аспартата (NMDA), примеры которого включают, в качестве иллюстрации и не ограничения, амантадин, декстрометорфан, декстропропоксифен, кетамин, кетобемидон, мемантин, метадон и так далее.
В еще другом варианте осуществления соединения настоящего изобретения вводят в комбинации с агонистом опиоидных рецепторов (также называемым опиоидным анальгетиком). Типичные агонисты опиоидного рецептора включают, но не ограничиваются ими, бупренорфин, буторфанол, кодеин, дигидрокодеин, фентанил, гидрокодон, гидроморфон, леваллорфан, леворфанол, меперидин, метадон, морфин, нальбуфин, налмефен, налорфин, налоксон, налтрексон, налорфин, оксикодон, оксиморфон, пентазоцин, пропоксифен, трамадол и их комбинации. В определенных вариантах осуществления агонист опиоидных рецепторов выбран из кодеина, дигидрокодеина, гидрокодона, гидроморфона, морфина, оксикодона, оксиморфона, трамадола и их комбинаций.
В конкретном варианте осуществления соединения настоящего изобретения вводят в комбинации с ингибитором фосфодиэстеразы (PDE), в частности PDE-V ингибитором. Типичные PDE-V ингибиторы включают, но не ограничиваются ими, аванафил, лоденафил, мироденафил, силденафил (Revatio®), тадалафил (Adcirca®), варденафил (Levitra®) и уденафил.
В другом варианте осуществления соединения настоящего изобретения вводят в комбинации с простагландиновым аналогом (также называемым простаноидами или простациклиновыми аналогами). Типичные простагландиновые аналоги включают, но не ограничиваются ими, берапрост натрия, биматопрост, эпопростенол, илопрост, латанопрост, тафлупрост, травопрост и трепростинил, причем биматопрост, латанопрост и тафлупрост представляют особый интерес.
В еще другом варианте осуществления соединения настоящего изобретения вводят в комбинации с агонистом простагландинового рецептора, примеры которого включают, но не ограничиваются ими, биматопрост, латанопрост, травопрост и так далее.
Соединения настоящего изобретения можно также вводить в комбинации с ингибитором ренина, примеры которого включают, но не ограничиваются ими, алискирен, еналкирен, ремикирен и их комбинации.
В другом варианте осуществления соединения настоящего изобретения вводят в комбинации с селективным ингибитором обратного захвата серотонина (SSRI). Типичные SSRI включают, но не ограничиваются ими, циталопрам и дезметилциталопрам, являющийся метаболитом циталопрама, дапоксетин, эсциталопрам (например, оксалат эсциталопрама), флуоксетин и норфлуоксетин, являющийся дезметилилированным метаболитом флуоксетина, флувоксамин (например, малеат флувоксамина), пароксетин, сертралин и деметилсертралин, являющийся метаболитом сертралина, и их комбинации.
В одном варианте осуществления соединения настоящего изобретения вводят в комбинации с агонистом 5-HT1D серотонинового рецептора, примеры которого включают, в качестве иллюстрации и не ограничения, триптаны, такие как алмотриптан, авитриптан, элетриптан, фроватриптан, наратриптан, ризатриптан, суматриптан, и золмитриптан.
В одном варианте осуществления соединения настоящего изобретения вводят в комбинации с блокатором натриевых каналов, примеры которого включают, в качестве иллюстрации и не ограничения, карбамазепин, фосфенитоин, ламотриджин, лидокаин, мексилетин, оксакарбазепин, фенитоин и их комбинации.
В одном варианте осуществления соединения настоящего изобретения вводят в комбинации со стимулятором или активатором растворимой гуанилатциклазы, примеры которых включают, но не ограничиваются ими, атацигуат, риоцигуат и их комбинации.
В одном варианте осуществления соединения настоящего изобретения вводят в комбинации с трициклическими антидепрессантами (ТСА), примеры которых включают, в качестве иллюстрации и не ограничения, амитриптилин, амитриптилиноксид, бутриптилин, кломипрамин, демексиптилин, десипрамин, дибензепин, диметакрин, досулепин, доксепин, имипрамин, имипраминоксид, лофепрамин, мелитрацен, метапрамин, нитроксазепин, нортриптилин, ноксиптилин, пипофезин, пропизепин, протриптилин, квинупрамин и их комбинации.
В одном варианте осуществления соединения настоящего изобретения вводят в комбинации с антагонистом вазопрессинового рецептора, примеры которого включают, в качестве иллюстрации и не ограничения, кониваптан и толваптан.
Объединенные вспомогательные терапевтические агенты могут также быть полезны в дополнительной комбинационной терапии с соединениями настоящего изобретения. Например, соединения настоящего изобретения можно объединять с диуретиком и ARB, или блокатором кальциевых каналов и ARB, или диуретиком и ACE ингибитором, или блокатором кальциевых каналов и статином. Конкретные примеры включают комбинацию ACE ингибитора, эналаприла (в форме малеатной соли) и диуретика, гидрохлортиазида, который продается под торговым названием Vaseretic®, или комбинацию блокатора кальциевого канала, амлодипина (в виде безилатной соли) и ARB, олмесартана (в форме медоксомильного пролекарства), или комбинацию блокатора кальциевых каналов и статина, все из которых можно также применять с соединениями настоящего изобретения. Другие терапевтические агенты, такие как агонисты α2-адренергического рецептора и антагонисты вазопрессинового рецептора, могут также быть пригодны в комбинационной терапии. Примеры агонистов α2-адренергического рецептора включают клонидин, дексмедетомидин и гуанфацин.
Следующие составы иллюстрируют типичные фармацевтические композиции настоящего изобретения.
Пример твердых желатиновых капсул для перорального введения
Соединение настоящего изобретения (50 г), 440 г высушенной распылением лактозы и 10 г стеарата магния тщательно смешивали. Затем полученную в результате композицию загружали в твердые желатиновые капсулы (500 мг композиции на капсулу). Альтернативно, соединение настоящего изобретения (20 мг) тщательно смешивали с крахмалом (89 мг), микрокристаллической целлюлозой (89 мг) и стеаратом магния (2 мг). Затем смесь пропускали через U.S. сита No.45 меш и загружали в твердые желатиновые капсулы (200 мг композиции на капсулу).
Альтернативно, соединение настоящего изобретения (30 г), вспомогательный агент (20 г), 440 г высушенной распылением лактозы и 10 г стеарата магния тщательно смешивали и обрабатывали, как описано выше.
Пример состава желатиновых капсул для перорального введения
Соединение настоящего изобретения (100 мг) тщательно смешивали с моноолеатом полиоксиэтиленасорбитана (50 мг) и порошкообразным крахмалом (250 мг). Затем смесь загружали в желатиновые капсулы (400 мг композиции на капсулу). Альтернативно, соединение настоящего изобретения (70 мг) и вспомогательный агент (30 мг) тщательно смешивали с моноолеатом полиоксиэтиленсорбитана (50 мг) и порошкообразным крахмалом (250 мг), и полученную в результате смесь загружали в желатиновую капсулу (400 мг композиции на капсулу).
Альтернативно, соединение настоящего изобретения (40 мг) тщательно смешивали с микрокристаллической целлюлозой (Avicel PH 103; 259,2 мг) и стеаратом магния (0,8 мг). Затем смесь загружали в желатиновую капсулу (размер #1, белая, непрозрачная) (300 мг композиции на капсулу).
Пример состава таблетки для перорального введения
Соединение настоящего изобретения (10 мг), крахмал (45 мг) и микрокристаллическую целлюлозу (35 мг) пропускали через U.S. сита No. 20 меш и тщательно смешивали. Полученные таким образом гранулы сушили при 50-60°C и пропускали через U.S. сита No. 16 меш. Раствор поливинилпирролидона (4 мг в виде 10% раствора в стерильной воде) смешивали с карбоксиметилкрахмалом натрия (4,5 мг), стеаратом магния (0,5 мг) и тальком (1 мг), и затем данную смесь пропускали через U.S. сита No. 16 меш. Затем карбоксиметилкрахмал натрия, стеарат магния и тальк добавляли к гранулам. После смешения смесь прессовали на таблетировочной машине, получая таблетку, весящую 100 мг.
Альтернативно, соединение настоящего изобретения (250 мг) тщательно смешивали с микрокристаллической целлюлозой (400 мг), высокодисперсным диоксидом кремния (10 мг) и стеариновой кислотой (5 мг). Затем смесь прессовали, получая таблетки (665 мг композиции на таблетку).
Альтернативно, соединение настоящего изобретения (400 мг) тщательно смешивали с кукурузным крахмалом (50 мг), кроскармелозой натрия (25 мг), лактозой (120 мг) и стеаратом магния (5 мг). Затем смесь прессовали, получая таблетку с одной риской (600 мг композиции на таблетку).
Альтернативно, соединение настоящего изобретения (100 мг) тщательно смешивали с кукурузным крахмалом (100 мг), водным раствором желатина (20 мг). Смесь сушили и измельчали до тонкодисперсного порошка. Затем микрокристаллическую целлюлозу (50 мг) и стеарат магния (5 мг) смешивали с желатиновым составом, гранулировали, и полученную в результате смесь прессовали, получая таблетки (100 мг соединения настоящего изобретения на таблетку).
Пример состава суспензии для перорального введения
Следующие ингредиенты смешивали, получая суспензию, содержащую 100 мг соединения настоящего изобретения на 10 мл суспензии:
Пример жидкого состава для перорального введения
Подходящий жидкий состав представляет собой состав с буфером на основе карбоновой кислоты, таким как цитратный, лактатный и малеатный буферные растворы. Например, соединение настоящего изобретения (которое может быть предварительно смешано с DMSO) смешивали с 100 мМ аммонийцитратным буфером, и pH доводили до pH 5, или смешивали с 100 мМ раствором лимонной кислоты, и pH доводили до pH 2. Данные растворы также могут содержать вспомогательное вещество, повышающее растворимость, такое как циклодекстрин, например, раствор может содержать 10% по весу гидроксипропил-β-циклодекстрина.
Другие подходящие составы содержат 5% NaHCO3 раствор, с или без циклодекстрина.
Пример инъецируемого состава для введения инъекцией
Соединение настоящего изобретения (0,2 г) смешивали с 0,4 M натрийацетатным буферным раствором (2,0 мл). pH полученного в результате раствора доводили до pH 4, применяя 0,5н водную хлористоводородную кислоту или 0,5н водный гидроксид натрия, при необходимости, и затем добавляли достаточное количество воды для инъекции, получая суммарный объем 20 мл. Затем смесь фильтровали через стерильный фильтр (0,22 микрон), получая стерильный раствор, пригодный для введения инъекцией.
Пример композиций для введения ингаляцией
Соединение настоящего изобретения (0,2 мг) тонко измельчали и затем смешивали с лактозой (25 мг). Затем данную смешанную смесь загружали в желатиновый картридж для ингаляции. Содержимое картриджа вводили, применяя, например, ингалятор сухого порошка.
Альтернативно, тонко измельченное соединение настоящего изобретения (10 г) диспергировали в растворе, полученном растворением лецитина (0,2 г) в деминерализованной воде (200 мл). Полученную в результате суспензию сушили распылением и затем тонко измельчали, получая тонко измельченную композицию, содержащую частицы, имеющие средний диаметр, меньший чем приблизительно 1,5 мкм. Затем тонко измельченную композицию загружали в картриджи для дозирующего ингалятора, содержащие сжатый 1,1,1,2-тетрафторэтан в количестве, достаточном для обеспечения от приблизительно 10 мкг до приблизительно 500 мкг соединения настоящего изобретения на дозу при введении ингалятором.
Альтернативно, соединение настоящего изобретения (25 мг) растворяли в забуференном цитратом (pH 5) изотоническом соляном растворе (125 мл). Смесь перемешивали и обрабатывали ультразвуком до растворения соединения. pH раствора проверяли и доводили, при необходимости, до pH 5 медленным добавлением водного 1н NaOH. Раствор вводили, применяя распылительное устройство, которое обеспечивало от приблизительно 10 мкг до приблизительно 500 мкг соединения настоящего изобретения на дозу.
ПРИМЕРЫ
Следующие способы получения и примеры приводят для иллюстрации конкретных вариантов осуществления настоящего изобретения. Однако не предполагается, что данные конкретные варианты осуществления ограничивают объем настоящего изобретения любым способом, если не указано особо.
Следующие сокращения имеют следующие значения, если не указано иначе, и любые другие сокращения, применяемые в настоящем изобретении и неопределенные, имеют их стандартное, общепринятое значение:
Если не указано иначе, все вещества, такие как реагенты, исходные вещества и растворители, получали из коммерческих источников (таких как Sigma-Aldrich, Fluka Riedel-de Haën, и подобные) и применяли без дополнительной очистки.
Реакции проводили в атмосфере азота, если не указано иначе. Протекание реакции контролировали тонкослойной хроматографией (TLC), аналитической высокоэффективной жидкостной хроматографией (аналитическая ВЭЖХ) и масс-спектрометрией, подробности которых приведены в конкретных примерах. Растворители, применяемые в аналитической ВЭЖХ, были следующими: растворитель A представлял собой 98% H2O/2% MeCN /1,0 мл/л TFA; растворитель B представлял собой 90% MeCN/10% H2O/1,0 мл/л TFA.
Реакционные смеси обрабатывали, как конкретно описано в каждом примере получения; обычно реакционные смеси очищали экстракцией и другими способами очистки, такими как зависящая от температуры и растворителя кристаллизация и осаждение. Кроме того, реакционные смеси стандартно очищали препаративной ВЭЖХ, обычно применяя Microsorb C18 и Microsorb BDS упакованные колонки и общепринятые элюенты. Протекание реакции обычно контролировали жидкостной хроматографией-масс-спеткрометрией (LCMS). Получение характеристик изомеров получали спектроскопией ядерного эффекта Оверхаузера (NOE). Получение характеристик продуктов реакции стандартно проводили масс и1H-ЯМР спектрометрией. Что касается ЯМР измерений, образцы растворяли в дейтерированном растворителе (CD3OD, CDCl3 или DMSO-d6), и1H-ЯМР спектры регистрировали Varian Gemini 2000 прибором (400 МГц) в стандартных условиях наблюдения. Масс-спектрометрическую идентификацию соединений обычно проводили, применяя способ электро-спрей ионизации (ESMS) на Applied Biosystems (Foster City, CA) модель API 150 EX приборе или Agilent (Palo Alto, CA) модель 1200 LC/MSD приборе.
Пример получения 1
Метиловый эфир (R)-3-(N-бифенил-4-илметил-N'-трет-бутоксикарбонилгидразино)-2-гидроксипропионовой кислоты (2A) и метиловый эфир (S)-3-(N-бифенил-4-илметил-N'-трет-бутоксикарбонилгидразино)-2-гидроксипропионовой кислоты (2B)
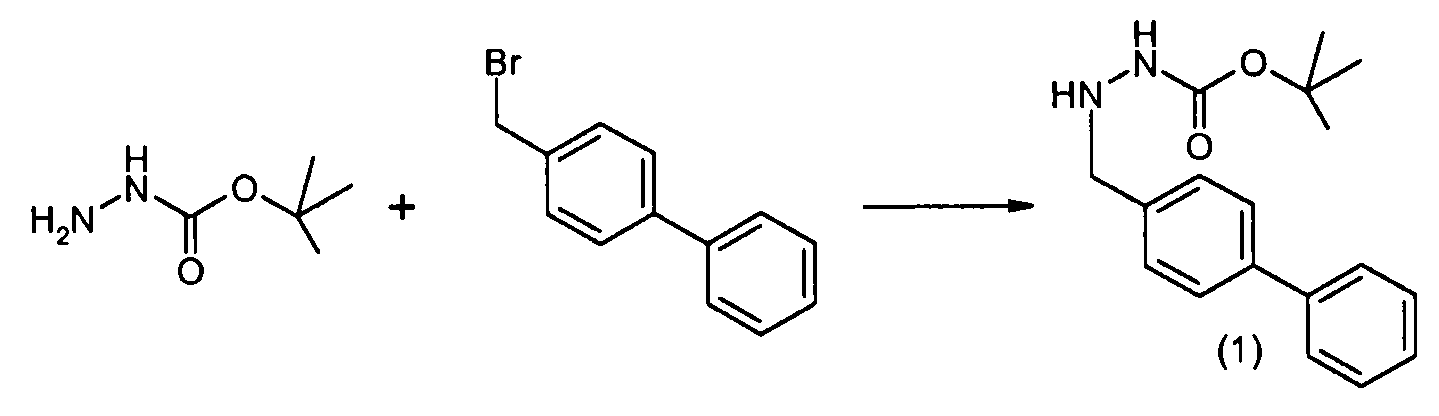
4-(Брометил)бифенил (2,0 г, 8,1 ммоль, 1,0 экв.) и DIPEA (1,4 мл, 1,0 экв.) растворяли в DMF (40,0 мл). Добавляли трет-бутилкарбазат (2,1 г, 16,2 ммоль, 2,0 экв.), и смесь перемешивали при комнатной температуре в течение ночи. Смесь частично концентрировали, и остаток распределяли между EtOAc и насыщенным водным NaHCO3 раствором. Затем EtOAc слой сушили над Na2SO4 и концентрировали. Неочищенный продукт очищали флэш-хроматографией (0-60% EtOAc/гексан с 0,5% DIPEA), получая соединение 1, трет-бутиловый эфир N'-бифенил-4-илметил-гидразинкарбоновой кислоты (1,7 г).

Соединение 1 (830 мг, 2,8 ммоль, 1,0 экв.) растворяли в изопропиловом спирте (20,0 мл). Добавляли метил (2R)-глицидат (365 мкл, 4,2 ммоль, 1,5 экв.), и смесь грели при 85°C. Смесь перемешивали в течение ночи и затем распределяли между EtOAc и насыщенным водным NaHCO3 раствором. EtOAc слой сушили над Na2SO4 и концентрировали, получая соединение 2A (803 мг), которое применяли без дополнительной очистки. Способ повторяли, применяя метил (2S)-глицидат (365 мкл, 4,2 ммоль, 1,5 экв.), получая соединение 2B (717 мг), которое применяли без дополнительной очистки.
Способ получения 2
Метиловый эфир (R)-3-(N-Бифенил-4-илметилгидразино)-2-гидроксипропионовой кислоты

Метиловый эфир (R)-3-(N-бифенил-4-илметил-N'-трет-бутоксикарбонилгидразино)-2-гидроксипропионовой кислоты (300 мг, 749 мкмоль, 1,0 экв.) растворяли в DCM (3,0 мл). Добавляли TFA (3,0 мл), и смесь перемешивали при комнатной температуре до завершения реакции (приблизительно 1 час). Смесь концентрировали, получая заявленное в заголовке соединение, которое применяли без дополнительной очистки.
ПРИМЕР 1
5-[N'-Бифенил-4-илметил-N'-((R)-2-карбокси-2-гидроксиэтил)гидразинокарбонил]-1H-пиразол-3-карбоновая кислота

1H-пиразол-3,5-дикарбоновую кислоту (58,4 мг, 374 мкмоль, 1,2 экв.) растворяли в DMF (2 мл). Добавляли DIPEA (163 мкл, 3,0 экв.), с последующим добавлением HATU (142 мг, 374 мкмоль, 1,2 экв.), и полученный в результате раствор перемешивали в течение 30 минут. Затем добавляли метиловый эфир (R)-3-(N-бифенил-4-илметилгидразино)-2-гидроксипропионовой кислоты (93,7 мг, 312 мкмоль, 1,0 экв.) в DMF (2 мл), и смесь перемешивали при комнатной температуре в течение ночи. Смесь концентрировали, и неочищенное промежуточное соединение применяли на следующей стадии без дополнительной очистки.
Неочищенное промежуточное соединение растворяли в THF (2,0 мл) и добавляли моногидрат гидроксида лития (131 мг, 3,1 ммоль) в воде (2,0 мл). Смесь перемешивали при комнатной температуре в течение приблизительно 2,5 часов. Реакцию гасили добавлением AcOH (10 экв.), и смесь концентрировали. Неочищенный продукт очищали препаративной ВЭЖХ (10-70% MeCN/H2O), получая заявленное в заголовке соединение в виде TFA соли (31,2 мг; чистота 100%). MS m/z [M+H]+ рассчитанная для C21H20N4O6, 425,14; найденная 425,2.
ПРИМЕР 2
Следуя способам, описанным в примерах в настоящем изобретении и заменяя на подходящие исходные вещества и реагенты, соединения, имеющие следующую формулу, получали в виде TFA солей:
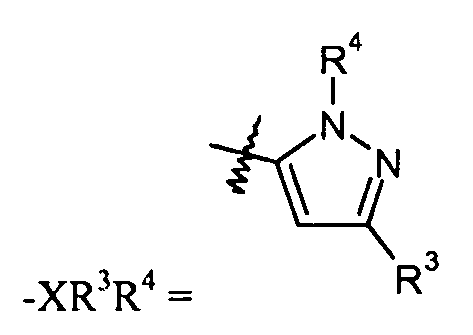

1. 5-[N'-Бифенил-4-илметил-N'-((S)-2-карбокси-2-гидроксиэтил)гидразинокарбонил]-1H-пиразол-3-карбоновая кислота
2. (R)-3-{N-Бифенил-4-илметил-N'-[5-(2-гидроксиэтилкарбамоил)-2H-пиразол-3-карбонил]гидразино}-2-гидроксипропионовая кислота
3. (R)-3-{N-Бифенил-4-илметил-N'-[5-(2-сульфамоилэтилкарбамоил)-2H-пиразол-3-карбонил]гидразино}-2-гидроксипропионовая кислота
4. (R)-3-[N-Бифенил-4-илметил-N'-(5-циклопропилкарбамоил-2H-пиразол-3-карбонил)гидразино]-2-гидроксипропионовая кислота
5. (R)-3-(N-Бифенил-4-илметил-N'-{5-[(2-метоксиэтил)метилкарбамоил]-2H-пиразол-3-карбонил}гидразино)-2-гидроксипропионовая кислота
6. (R)-3-[N-Бифенил-4-илметил-N'-(5-диметилкарбамоил-2H-пиразол-3-карбонил)гидразино]-2-гидроксипропионовая кислота
7. (R)-3-{N-Бифенил-4-илметил-N'-[5-(изобутилметилкарбамоил)-2H-пиразол-3-карбонил]гидразино}-2-гидроксипропионовая кислота
8. (R)-3-{N'-[5-(Азетидин-1-карбонил)-2H-пиразол-3-карбонил]-N-бифенил-4-илметилгидразино}-2-гидроксипропионовая кислота
9. (R)-3-{N-Бифенил-4-илметил-N'-[5-(пирролидин-1-карбонил)-2H-пиразол-3-карбонил]гидразино}-2-гидроксипропионовая кислота
10. (R)-3-{N-Бифенил-4-илметил-N'-[5-(3-гидроксипирролидин-1-карбонил)-2H-пиразол-3-карбонил]гидразино}-2-гидроксипропионовая кислота
11. (R)-3-{N-Бифенил-4-илметил-N'-[5-((R)-3-гидроксипирролидин-1-карбонил)-2H-пиразол-3-карбонил]гидразино}-2-гидроксипропионовая кислота
12. (R)-3-{N-Бифенил-4-илметил-N'-[5-((S)-3-гидроксипирролидин-1-карбонил)-2H-пиразол-3-карбонил]гидразино}-2-гидроксипропионовая кислота
13. (R)-3-{N-Бифенил-4-илметил-N'-[5-(2,5-дигидропиррол-1-карбонил)-2H-пиразол-3-карбонил]гидразино}-2-гидроксипропионовая кислота
14. (R)-3-{N-Бифенил-4-илметил-N'-[5-(пиперидин-1-карбонил)-2H-пиразол-3-карбонил]гидразино}-2-гидроксипропионовая кислота
15. (R)-3-{N-Бифенил-4-илметил-N'-[5-(морфолин-4-карбонил)-2H-пиразол-3-карбонил]гидразино}-2-гидроксипропионовая кислота
16. (R)-3-[N-Бифенил-4-илметил-N'-(5-фенил-2H-пиразол-3-карбонил)гидразино]-2-гидроксипропионовая кислота
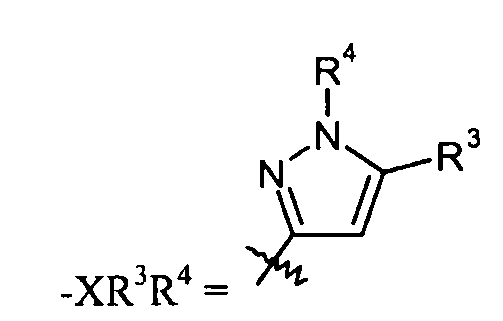
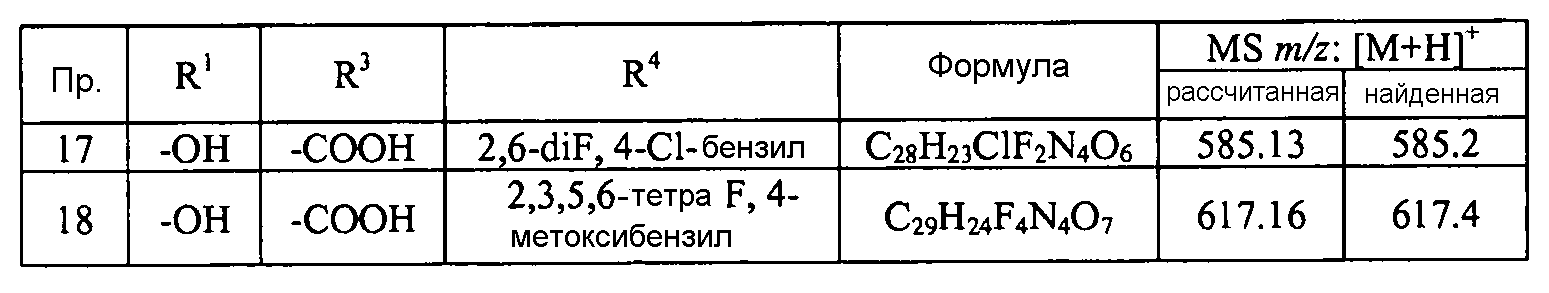
17. 5-[N'-Бифенил-4-илметил-N'-((R)-2-карбокси-2-гидроксиэтил)гидразинокарбонил]-2-(4-хлор-2,6-дифторбензил)-2H-пиразол-3-карбоновая кислота
18. 5-[N'-Бифенил-4-илметил-N'-((R)-2-карбокси-2-гидроксиэтил)гидразинокарбонил]-2-(2,3,5,6-тетрафтор-4-метоксибензил)-2H-пиразол-3-карбоновая кислота


19. (R)-3-[N-Бифенил-4-илметил-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота

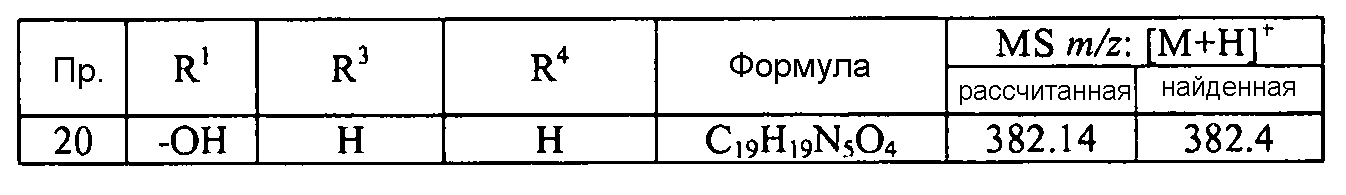
20. (S)-3-[N-Бифенил-4-илметил-N'-(4H-[1,2,4]триазол-3-карбонил)гидроксипропионовая кислота

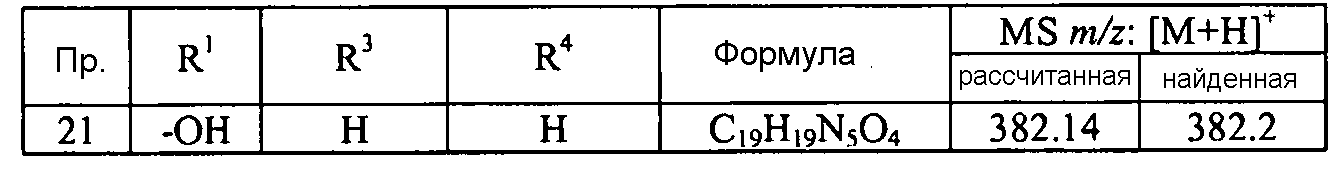
21. (R)-3-[N-Бифенил-4-илметил-N'-(3H-[1,2,3]триазол-4-карбонил)гидразино]-2-гидроксипропионовая кислота
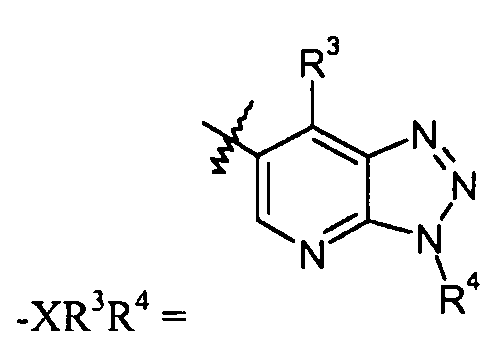

22. (S)-3-[N-Бифенил-4-илметил-N'-(3H-[1,2,3]триазоло[4,5-b]пиридин-6-карбонил)гидразино]-2-гидроксипропионовая кислота
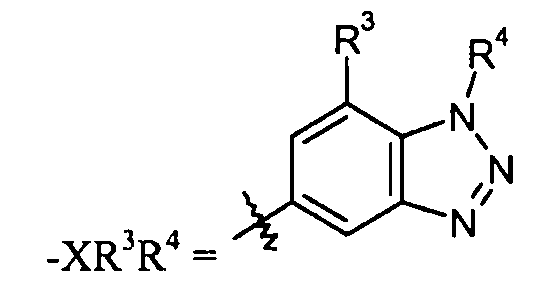
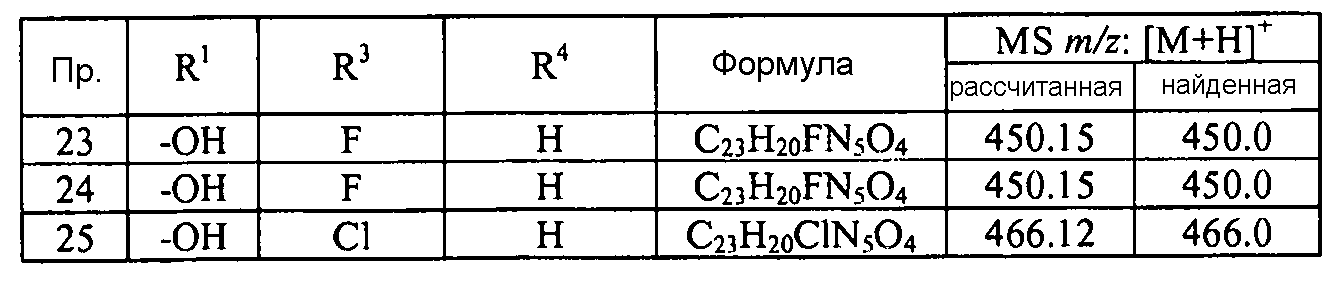
23. (R)-3-[N-Бифенил-4-илметил-N'-(7-фтор-1H-бензотриазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
24. (S)-3-[N-Бифенил-4-илметил-N'-(7-фтор-1H-бензотриазол-5-карбонил)гидразин)]-2-гидроксипропионовая кислота
25. (S)-3-[N-Бифенил-4-илметил-N'-(7-хлор-1H-бензотриазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
Способ получения 3
Метиловый эфир (R)-3-[N-(4-бромбензил)-N'-трет-бутоксикарбонилгидразино]-2-гидроксипропионовой кислоты (соединение 2) и этиловый эфир (R)-3-[N-(3'-Хлорбифенил-4-илметилгидразино]-2-гидроксипропионовой кислоты (соединение 3)

4-Бромбензилбромид (5,0 г, 20 ммоль) и DIPEA (3,48 мл, 20,0 ммоль) растворяли в DMF (20 мл). Добавляли трет-бутилкарбазат (7,9 г, 60,0 ммоль), и смесь перемешивали при комнатной температуре до завершения реакции. Смесь частично концентрировали, затем остаток распределяли между EtOAc и насыщенным водным NaHCO3 раствором. Затем EtOAc слой сушили над Na2SO4 и концентрировали. Неочищенный продукт очищали флэш-хроматографией, получая соединение 1 (3,8 г).

Соединение 1 (1,9 г, 6,3 ммоль) растворяли в изопропиловом спирте (26,4 мл). Добавляли метил (2R)-глицидат (1,1 мл, 12,6 ммоль), и смесь грели при 90°C до завершения реакции (~4 дня). Смесь охлаждали до комнатной температуры и концентрировали, получая соединение 2 (2,5 г) в виде твердого вещества белого цвета.

Соединение 2 (600 мг, 1 ммоль), 3-хлорфенилбороновую кислоту (419 мг, 2,7 ммоль) и K2CO3 (617 мг, 4,5 ммоль) объединяли в EtOH (5 мл) и воде (1 мл), с последующим добавлением SilicaCat®Pd(0) (0,09 ммоль/г загрузка, 1160 мг, 104 мкмоль). Смесь грели при 120°C до завершения реакции (~30 минут). Смесь фильтровали и концентрировали. Остаток растворяли в MeN/AcOH и очищали обращенно-фазовой хроматографией (55 г колонка; градиент 30-95% MeCN в воде с 0,1%TFA). Чистые фракции собирали, концентрировали и затем растворяли в 4M HCl в диоксане (6 мл) и EtOH (6 мл). Смесь перемешивали при комнатной температуре в течение ночи, затем концентрировали до соединения 3 (250 мг), которое применяли без дополнительной очистки.
Способ получения 4
(R)-3-[N'-трет-Бутоксикарбонил-N-(3'-хлорбифенил-4-илметил)гидразино]-2-гидроксипропионовая кислота

Метиловый эфир (R)-3-[N-(4-бромбензил)-N'-трет-бутоксикарбонил-гидразино]-2-гидроксипропионовой кислоты (1,0 г, 2,5 ммоль), 3-хлорфенилбороновую кислоту (776 мг, 5,0 ммоль) и K2CO3 (857 мг, 6,2 ммоль) растворяли в смеси THF (18 мл) и воды (18 мл). Затем реакционную колбу продували азотом и добавляли тетракис(трифенилфосфин)палладий (0) (286 мг, 248 мкмоль). Смесь перемешивали при 90°C в течение ночи (~18 часов). Смесь разбавляли насыщенным водным хлоридом аммония и экстрагировали EtOAc. Органический слой собирали, сушили и концентрировали. Продукт очищали (Interchim колонка для обращенно-фазовой хроматографии, 10-80% MeCN в воде), получая заявленное в заголовке соединение.
Способ получения 5
Изопропиловый эфир (S)-3-[N-(3'-хлорбифенил-4-илметил)гидразино]-2-гидроксипропионовой кислоты
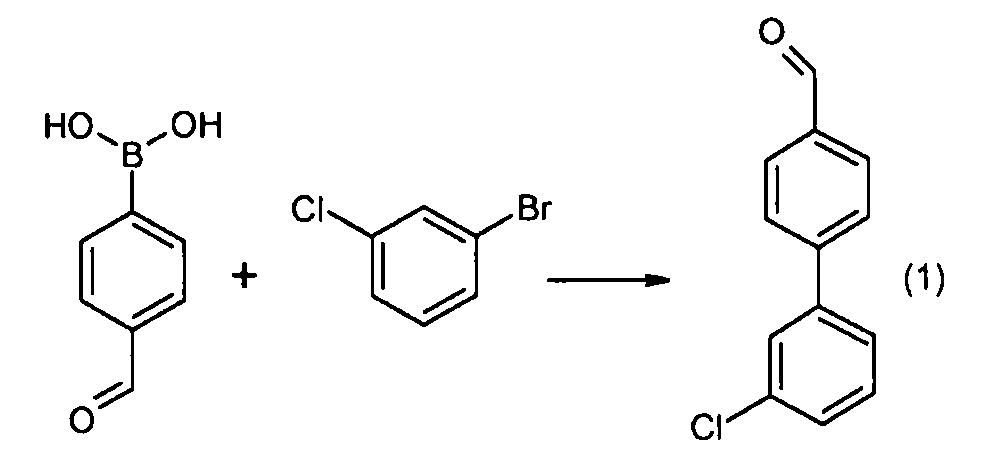
4-Формилфенилбороновую кислоту (18 г, 120 ммоль) объединяли с MeTHF (300 мл), 3-хлорбромбензолом (14,1 мл, 120 ммоль) и 1 M водным Na2CO3 (120 мл). Смесь продували азотом три раза и добавляли дихлорид 1,1'-бис(ди-трет-бутилфосфино)ферроценпалладия (540 мг, 840 мкмоль). Смесь снова продували азотом три раза, затем перемешивали в течение 30 минут при повышении температуры до 30°C. Затем смесь грели при 50°C до завершения реакции (~2 часа). Смесь охлаждали до комнатной температуры, добавляли 1 М водный Na2CO3 (120 мл), и смесь перемешивали в течение ночи при комнатной температуре. Слои разделяли, и органический слой (темно-коричневого цвета) собирали и сушили над Na2SO4 и фильтровали. Его частично концентрировали (до 150 мл объема). К раствору добавляли Si-SH (модифицированный меркаптаном силикагель, ~2 г). Смесь перемешивали при комнатной температуре в течение 2 часов, затем фильтровали через целит®. Остаток на фильтре промывали MeTHF (100 мл), получая соединение 1 (25 г), которое применяли без дополнительной очистки.

Соединение 1 (25,0 г, 115,4 ммоль) объединяли с MeTHF (150 мл) и трет-бутилкарбазатом (15,6 г, 118,0 ммоль) и перемешивали при комнатной температуре в течение одного часа. Добавляли АсОН (5 мл), и полученную в результате смесь перемешивали в течение одного часа, получая соединение 2, которое выдерживали в течение ночи.
Смесь соединения 2 в MeTHF (250 мл) и АсОН (20,0 мл) продували азотом и охлаждали баней со льдом до 0°С. После перемешивания в течение 30 минут, добавляли цианоборгидрид натрия (8,7 г, 138 ммоль) в течение 5 минут. Полученную в результате смесь перемешивали при 0°С в течение одного часа,медленно нагревали до комнатной температуры и перемешивали до завершения (~20 часов). Смесь охлаждали баней со льдом и добавляли 1 M водный NaOH (346,2 мл, 346,2 ммоль). Затем добавляли MeTHF (100 мл, 1,0 моль), и смесь нагревали до комнатной температуры. Слои разделяли, и органический слой промывали 1 M водным NaOH (150 мл, 150 ммоль). Слои разделяли, и органический слой сушили над Na2SO4, фильтровали и концентрировали, получая масло, которое растворяли в эфире (250 мл, 2,4 моль) и перемешивали в течение ночи. Смесь концентрировали, получая соединение 3 (35 г), которое применяли без дополнительной очистки.

Соединение 3 (20,0 г, 60,1 ммоль) и метил (2S)-глицидат (5,8 мл, 66,1 ммоль) объединяли в изопропиловом спирте (170 мл), и смесь грели при 90°C и контролировали до завершения реакции (~ несколько дней), добавляя дополнительные аликвоты метил (2S)-глицидата (1,8 мл и 2 мл) по мере протекания реакции. Смесь охлаждали до комнатной температуры и выдерживали в течение ночи. Твердые вещества отфильтровывали, промывали изопропиловым спиртом и сушили (16 г в сумме; 20% соединения 4 и 80% соединения 5).

Изопропиловый спирт (200 мл, 2 моль) охлаждали в бане со льдом в течение 15 минут. Добавляли ацетилхлорид (10 мл, 200 ммоль), с последующим добавлением соединения 5 (12,6 г, 27,2 ммоль). Полученную в результате смесь перемешивали при комнатной температуре в течение ~48 часов. Осадок из неочищенной реакционной смеси фильтровали, сушили в вакууме, затем промывали MeCN (40 мл) и сушили в вакууме, получая заявленное в заголовке соединение (6,8 г; 98% чистота).
ПРИМЕР 3
A. Этиловый эфир (R)-3-[N-(3'-хлорбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты
B. (R)-3-[N-(3'-Хлорбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
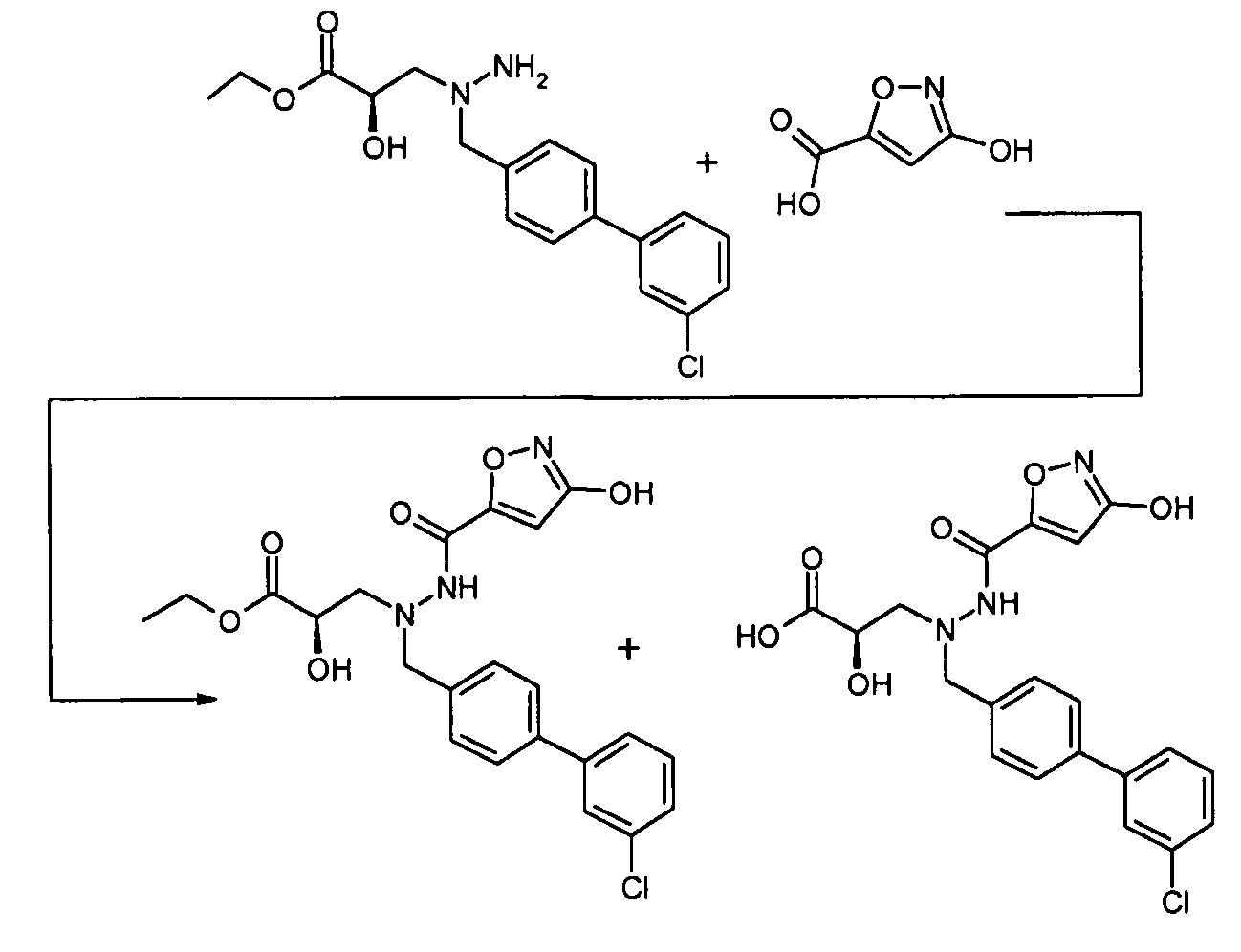
3-Гидроксиизоксазол-5-карбоновую кислоту (888 мг, 6,9 ммоль), HATU (2,6 г, 6,9 ммоль) и DMF объединяли, и полученную в результате смесь перемешивали в течение 5 минут при комнатной температуре. Добавляли DIPEA (2,3 мл, 13,2 ммоль) и этиловый эфир (R)-3-[N-(3'-хлорбифенил-4-илметил)гидразино]-2-гидроксипропионовой кислоты (2,0 г, 5,7 ммоль), и полученную в результате смесь перемешивали до завершения реакции (20 минут). Реакцию гасили водой, смесь разбавляли EtOAc, затем промывали водой и насыщенным водным NaCl. Органический слой сушили, концентрировали и очищали флэш-хроматографией (50-90% EtOAc в гексане с 0,1% Et3N). Чистые фракции собирали и концентрировали. Органический слой растворяли в DCM, и осадок фильтровали и промывали DCM, получая эфирное соединение A в виде TFA соли (1,3 г; чистота 96%). MS m/z [M+H]+ рассчитанная для C22H22ClN3O6, 460,12; найденная 460,4.
Часть эфирного соединения A (350 мг) растворяли в 1M LiOH (4 мл) и EtOH (10 мл). Полученную в результате смесь перемешивали при комнатной температуре до завершения реакции (1 час). Смесь концентрировали, растворяли в AcOH и очищали (C18 обращенно-фазовая колонка). Чистые фракции собирали и лиофилизировали, получая кислотное соединение B в виде TFA соли (280 мг; чистота 99%). MS m/z [M+H]+ рассчитанная для C20H18ClN3O6, 432,09; найденная 432,4.
C. Изопропиловый эфир (R)-3-[N-(3'-Хлорбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты
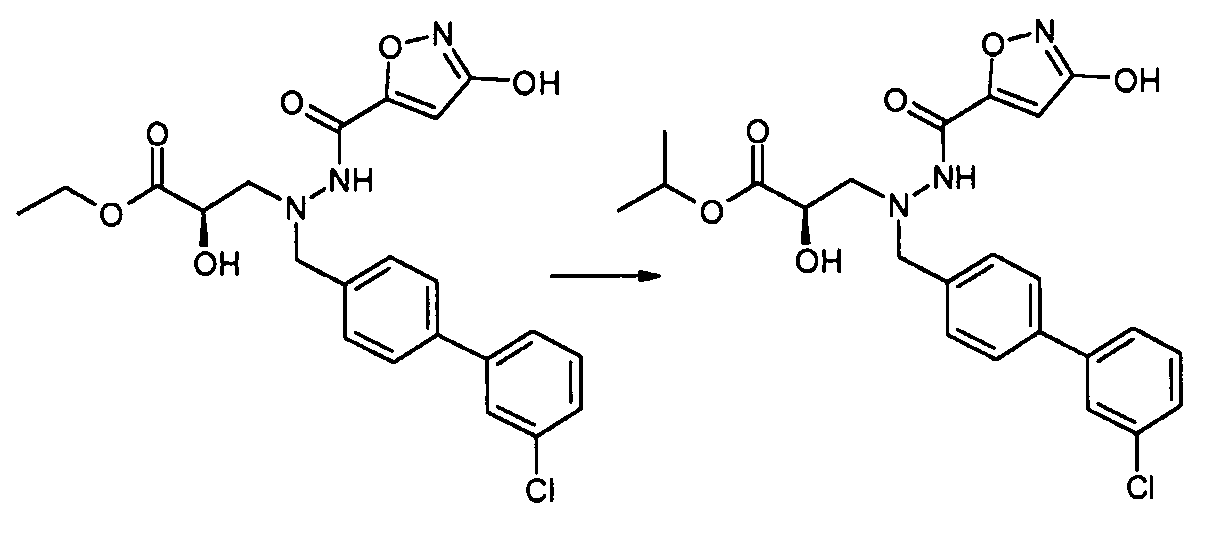
Этиловый эфир (R)-3-[N-(3'-Хлорбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты (1,4 г, 3,0 ммоль) растворяли в изопропиловом спирте (20 мл, 0,2 моль) и добавляли 4 M HCl в диоксане (9 мл, 40 ммоль). Смесь перемешивали при комнатной температуре в течение ночи (18 часов). Смесь грели при 60°C в течение 1 часа, затем охлаждали до комнатной температуры и перемешивали в течение 2 часов. Смесь концентрировали и очищали (Interchim C18 колонка для обращенно-фазовой хроматографии, 30-90% MeCN в воде в течение 22 минут). Чистые фракции объединяли и лиофилизировали, получая заявленное в заголовке соединение (110 мг; чистота 98%). MS m/z [M+H]+ рассчитанная для C23H24ClN3O6, 474,14; найденная 474,2.
D. Бутиловый эфир (R)-3-[N-(3'-Хлорбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты
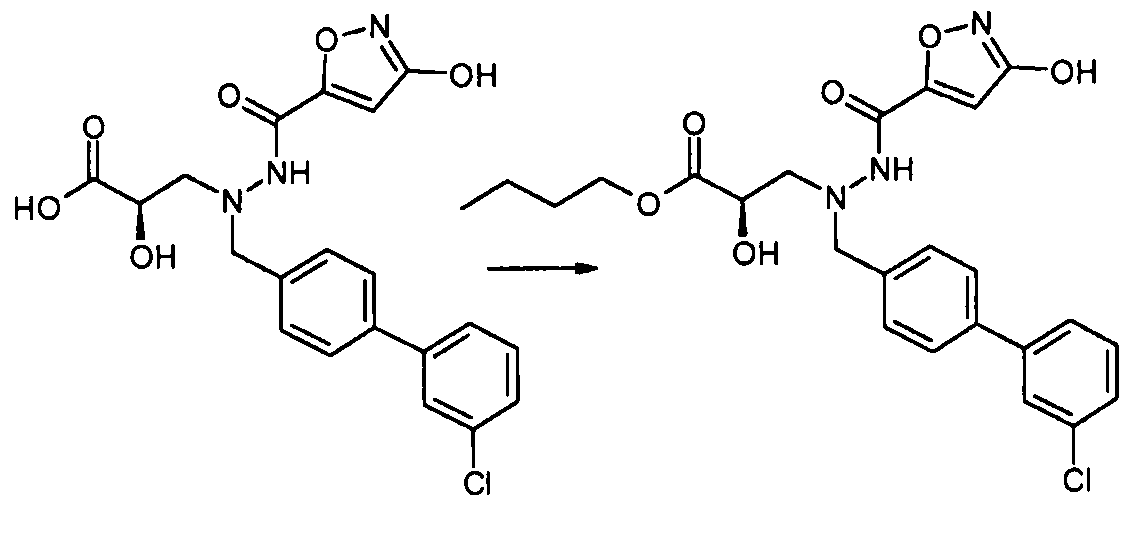
(R)-3-[N-(3'-Хлорбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовую кислоту (60 мг, 0,1 ммоль) растворяли в 1-пропаноле (4 мл, 50 ммоль) и добавляли 4 M HCl в диоксане (700 мл, 3 ммоль). Смесь перемешивали при комнатной температуре до завершения реакции (~3 часа), затем упаривали при пониженном давлении и очищали (Interchim колонка для обращенно-фазовой хроматографии, 30-95% MeCN в воде с 5% TFA). Чистые фракции объединяли и лиофилизировали, затем очищали препаративной ВЭЖХ, получая заявленное в заголовке соединение (43 мг, чистота 95%). MS m/z [M+H]+ рассчитанная для C24H26ClN3O6, 488,15; найденная 488,4.
E. Изобутиловый эфир (R)-3-[N-(3'-Хлорбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты
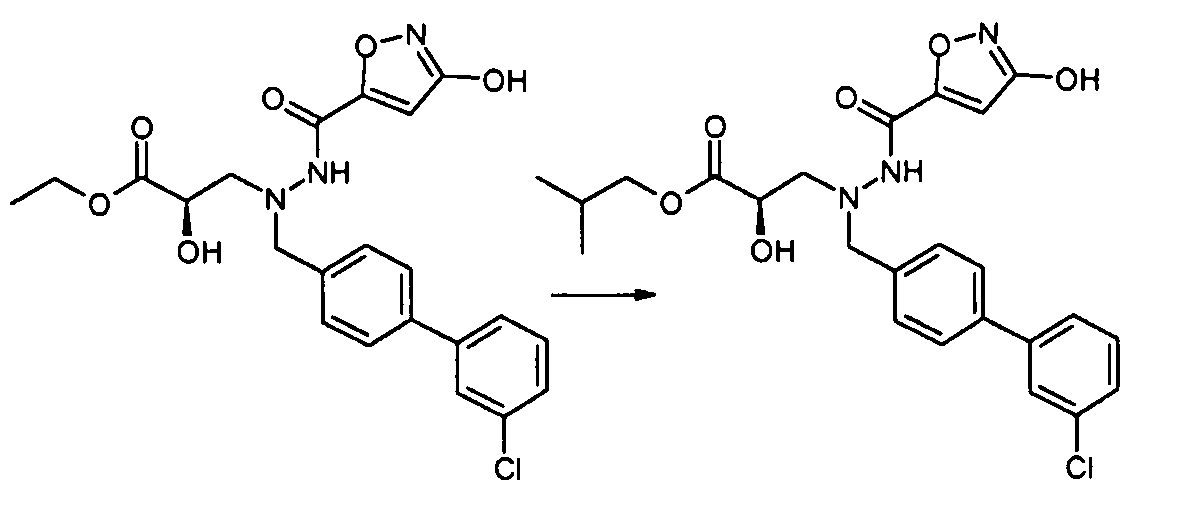
Этиловый эфир (R)-3-[N-(3'-хлорбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты (1,5 г, 3,3 ммоль) растворяли в изобутиловом спирте (20 мл, 200 ммоль) и добавляли 4 M HCl в диоксане (10 мл, 40 ммоль). Смесь перемешивали при комнатной температуре в течение 6 часов. Смесь концентрировали, растворяли в смеси вода/MeCN/MeOH, и очищали (Interchim C18 колонка для обращенно-фазовой хроматографии, 25-75% MeCN в воде в течение 22 минут). Чистые фракции объединяли и лиофилизировали, получая заявленное в заголовке соединение (948 мг; чистота 99%). MS m/z [M+H]+ рассчитанная для C24H26ClN3O6, 488,15; найденная 488,4.
F. Бензиловый эфир (R)-3-[N-(3'-Хлорбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты

Этиловый эфир (R)-3-[N-(3'-хлорбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты (1,5 г, 3,3 ммоль) растворяли в бензиловом спирте (20 мл, 100 ммоль) и добавляли 4 M HCl в диоксане (10 мл, 40 ммоль). Смесь перемешивали при комнатной температуре в течение 6 часов. Смесь упаривали при пониженном давлении и очищали (Interchim C18 колонка для обращенно-фазовой хроматографии, 30-95% MeCN в воде с 0,05% TFA). Чистые фракции объединяли, лиофилизировали и очищали, получая заявленное в заголовке соединение (688 мг; чистота 98%). MS m/z [M+H]+ рассчитанная для C27H24ClN3O6, 522,14; найденная 522,2.
G. 5-метил-2-оксо[1,3]диоксол-4-илметиловый эфир (R)-3-[N-(3'-хлорбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты
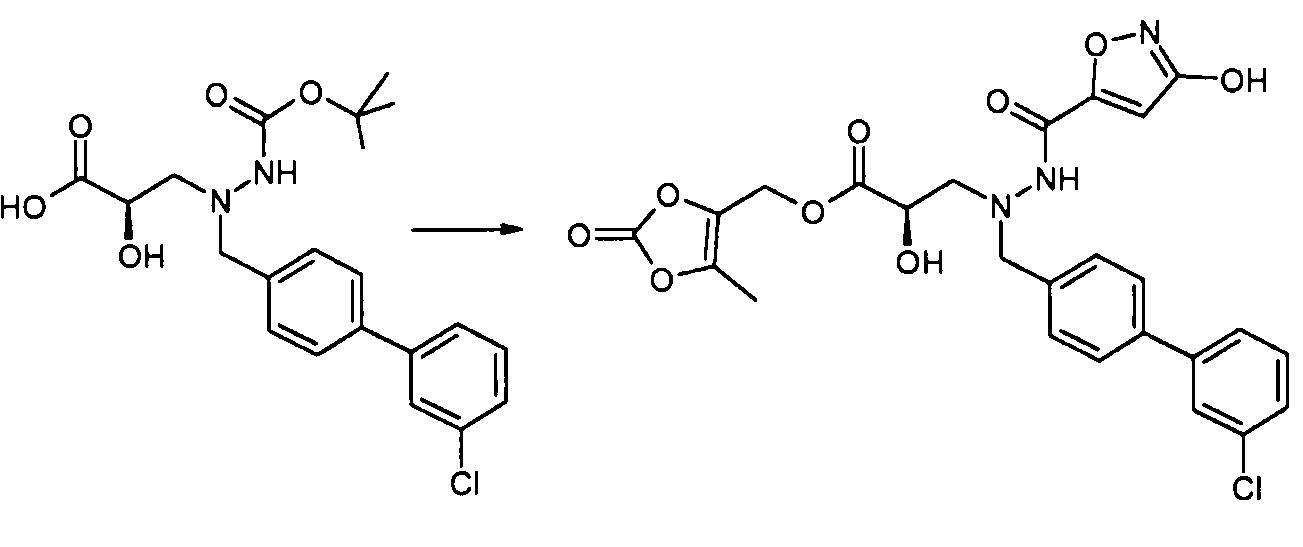
(R)-3-[N'-трет-Бутоксикарбонил-N-(3'-хлорбифенил-4-илметил)гидразино]-2-гидроксипропионовую кислоту (150 мг, 356 мкмоль), HOBt (140 мг, 1,1 ммоль), EDC (0,19 мл, 1,1 ммоль) растворяли в DCM. Смесь перемешивали в течение 10 минут, затем добавляли 4-гидроксиметил-5-метил-[1,3]диоксол-2-он (370 мг, 2,8 ммоль) и 4-метилморфолин (160 мкл, 1,4 ммоль). Смесь перемешивали при комнатной температуре в течение 2 часов. Смесь концентрировали и очищали (combiflash. 10-95% EtOAc в гексане с 0,01% Et3N). Чистые фракции объединяли и концентрировали. Добавляли MeCN (10 мл, 200 ммоль) и 4 M HCl в диоксане (3 мл, 10 ммоль), и смесь перемешивали при комнатной температуре в течение 3 часов. Растворитель удаляли, получая промежуточную HCl соль. 3-Гидроксиизоксазол-5-карбоновую кислоту (55 мг, 430 мкмоль) и HATU (160 мг, 430 мкмоль) объединяли в DMF (5 мл, 60 ммоль). Полученную в результате смесь перемешивали в течение 5 минут, с последующим добавлением DIPEA (120 мкл, 710 мкмоль) и промежуточной HCl соли. Смесь перемешивали в течение 30 минут, затем упаривали при пониженном давлении и очищали препаративной ВЭЖХ, получая заявленное в заголовке соединение в виде TFA соли (37 мг; чистота 95%). MS m/z [M+H]+ рассчитанная для C25H22ClN3O9, 544,10; найденная 544,4.
H. Гексиловый эфир (R)-3-[N-(3'-хлорбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты

Этиловый эфир (R)-3-[N-(3'-хлорбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты (50 мг, 0,1 ммоль) растворяли в 1-гексаноле (4 мл, 30 ммоль) и добавляли 4 M HCl в диоксане (500 мкл, 2 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. Смесь упаривали при пониженном давлении и очищали препаративной ВЭЖХ, получая заявленное в заголовке соединение в виде TFA соли (21 мг; чистота 95%). MS m/z [M+H]+ рассчитанная для C26H30ClN3O6, 516,18; найденная 516,6.
I. Гептиловый эфир (R)-3-[N-(3'-Хлорбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты
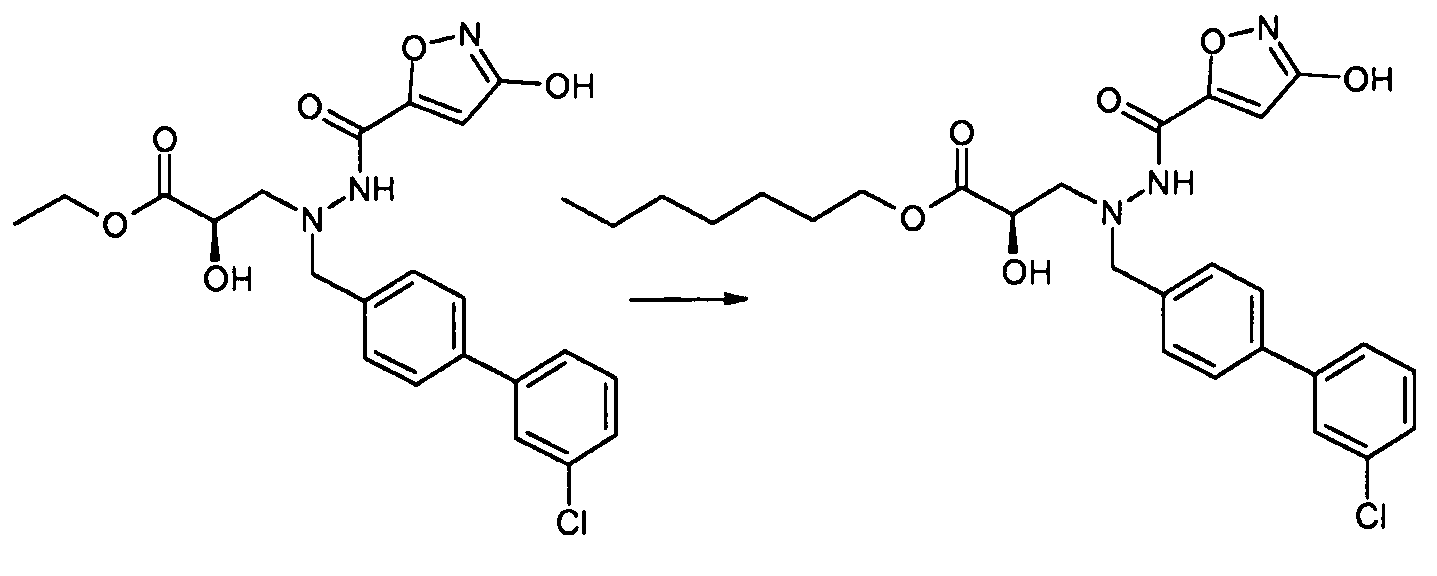
Этиловый эфир (R)-3-[N-(3'-Хлорбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты (50 мг, 0,1 ммоль) растворяли в 1-гептаноле (4 мл, 30 ммоль) и добавляли 4 M HCl в диоксане (500 мкл, 2 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. Смесь упаривали при пониженном давлении и очищали препаративной ВЭЖХ, получая заявленное в заголовке соединение в виде TFA соли (39 мг; чистота 95%). MS m/z [M+H]+ рассчитанная для C27H32ClN3O6, 530,20; найденная 530,2.
J. Изопропиловый эфир (S)-3-[N-(3'-хлорбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты
K. (S)-3-[N-(3'-хлорбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота

3-Гидроксиизоксазол-5-карбоновую кислоту (1,6 г, 12,1 ммоль), HATU (4,6 г, 12,1 ммоль) и DMF (31,2 мл) объединяли, и полученную в результате смесь перемешивали в течение 5 минут при комнатной температуре. Добавляли DIPEA (4,0 мл, 23,1 ммоль) и изопропиловый эфир (S)-3-[N-(3'-хлорбифенил-4-илметил)гидразино]-2-гидроксипропионовой кислоты (3,7 г, 10,0 ммоль), и полученную в результате смесь перемешивали до завершения реакции (20 минут). Реакцию гасили водой, смесь разбавляли EtOAc, затем промывали водой и насыщенным водным NaCl. Органический слой сушили, концентрировали и очищали флэш-хроматографией (50-90% EtOAc в гексане). Чистые фракции собирали и концентрировали. После упаривания, эфирное соединение J собирали в виде желтой твердой TFA соли (3,5 г). MS m/z [M+H]+ рассчитанная для C23H24ClN3O6, 474,14; найденная 474,1.
Несколько граммов эфирного соединения J (350 мг) растворяли в EtOH (17,6 мл, 302 ммоль) и добавляли 10,0 M водный NaOH (20,1 мл, 201 ммоль). Твердые вещества фильтровали и фильтрат подкисляли до pH=2 и экстрагировали дважды DCM. Раствор сушили над MgSO4, фильтровали и концентрировали, получая желтую смолу. Неочищенный остаток очищали (C18 обращенно-фазовая колонка). Фракции собирали (1,4 г) и дополнительно очищали, получая кислое соединение K в виде TFA соли (чистота 100%). MS m/z [M+H]+ рассчитанная для C20H18ClN3O6, 432,09; найденная 432,1.
L. 2-Фтор-1-фторметилэтиловый эфир (R)-3-[N-(3'-Хлорбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты
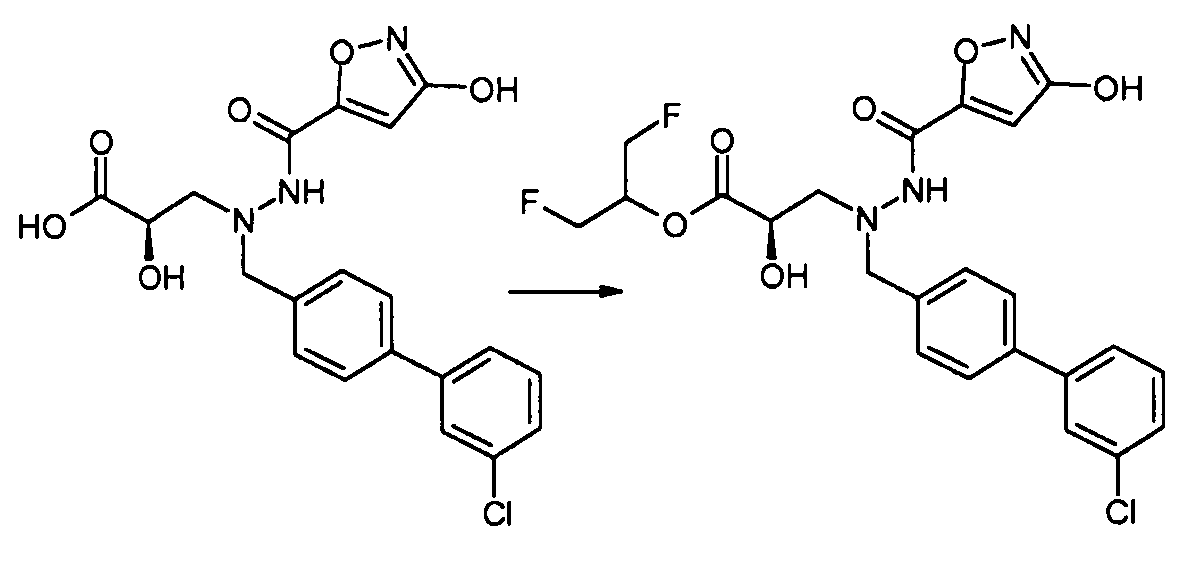
(R)-3-[N-(3'-Хлорбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовую кислоту (8 мг, 20 мкмоль) растворяли в 1,3-дифтор-2-пропаноле (144 мкл, 1,9 ммоль) и обрабатывали ультразвуком. Добавляли раствор 4 M HCl в диоксане (232 мкл, 0,9 ммоль), и полученную в результате смесь перемешивали при комнатной температуре в течение 2 часов и при 50°C в течение 1 часа и контролировали на завершенность. Затем смесь перемешивали в течение ночи до завершения реакции, затем упаривали при пониженном давлении и очищали препаративной ВЭЖХ, получая заявленное в заголовке соединение в виде TFA соли (6,3 мг; чистота 95%). MS m/z [M+H]+ рассчитанная для C23H22ClF2N3O6, 510,12; найденная 510,1.
M. 2,2,3,3,3-Пентафторпропиловый эфир (R)-3-[N-(3'-хлорбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты

(R)-3-[N-(3'-Хлорбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовую кислоту (8 мг, 20 мкмоль) растворяли в 2,2,3,3,3-пентафтор-1-пропаноле (0,2 мл, 1,9 ммоль) и обрабатывали ультразвуком. Добавляли раствор 4 M HCl в диоксане (232 мкл, 0,9 ммоль), и полученную в результате смесь перемешивали до завершения реакции (~48 часов), затем упаривали при пониженном давлении и очищали препаративной ВЭЖХ, получая заявленное в заголовке соединение в виде TFA соли (1,9 мг). MS m/z [M+H]+ рассчитанная для C23H19ClF5N3O6, 564,09; найденная 564,2.
ПРИМЕР 4
Следуя способам, описанным в примерах в настоящем изобретении, и заменяя на подходящие исходные вещества и реагенты, получали соединения, имеющие следующую формулу, в виде TFA солей:
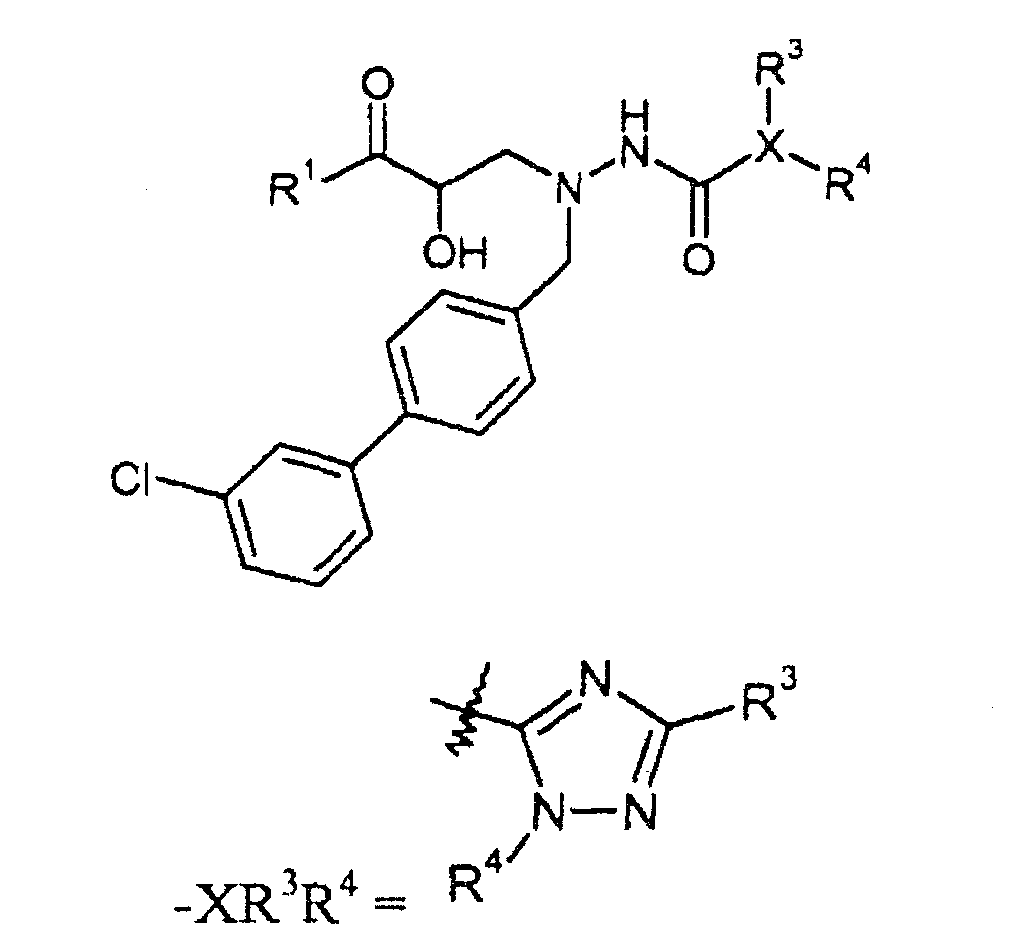

1. (R)-3-[N-(3'-Хлорбифенил-4-илметил)-N'-(5-хлор-2H-[1,2,4]триазол-3-карбонил)гидразино]-2-гидроксипропионовая кислота
2. (R)-3-[N-(3'-Хлорбифенил-4-илметил)-N'-(5-гидрокси-2H-[1,2,4]триазол-3-карбонил)гидразино]-2-гидроксипропионовая кислота

3. (R)-3-[N-(3'-Хлорбифенил-4-илметил)-N'-(3H-[1,2,3]триазол-4-карбонил)гидразино]-2-гидроксипропионовая кислота

4. (R)-3-[N-(3'-Хлорбифенил-4-илметил)-N'-(1-гидрокси-1H-[1,2,3]триазол-4-карбонил)гидразино]-2-гидроксипропионовая кислота

5. (R)-3-[N-(3'-Хлорбифенил-4-илметил)-N'-(1H-тетразол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
6. Изобутиловый эфир (R)-3-[N-(3'-хлорбифенил-4-илметил)-N'-(1H-тетразол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты
7. Изопропиловый эфир (R)-3-[N-(3'-хлорбифенил-4-илметил)-N'-(1H-тетразол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты
8. Этиловый эфир (R)-3-[N-(3'-хлорбифенил-4-илметил)-N'-(1H-тетразол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты

9. (R)-3-[N-(3'-Хлорбифенил-4-илметил)-N'-(5-пиридин-3-ил-1H-пиразол-3-карбонил)гидразино]-2-гидроксипропионовая кислота (ди-TFA соль)
10. (R)-3-[N-(3'-Хлорбифенил-4-илметил)-N'-(5-циклопропил-1H-пиразол-3-карбонил)гидразино]-2-гидроксипропионовая кислота
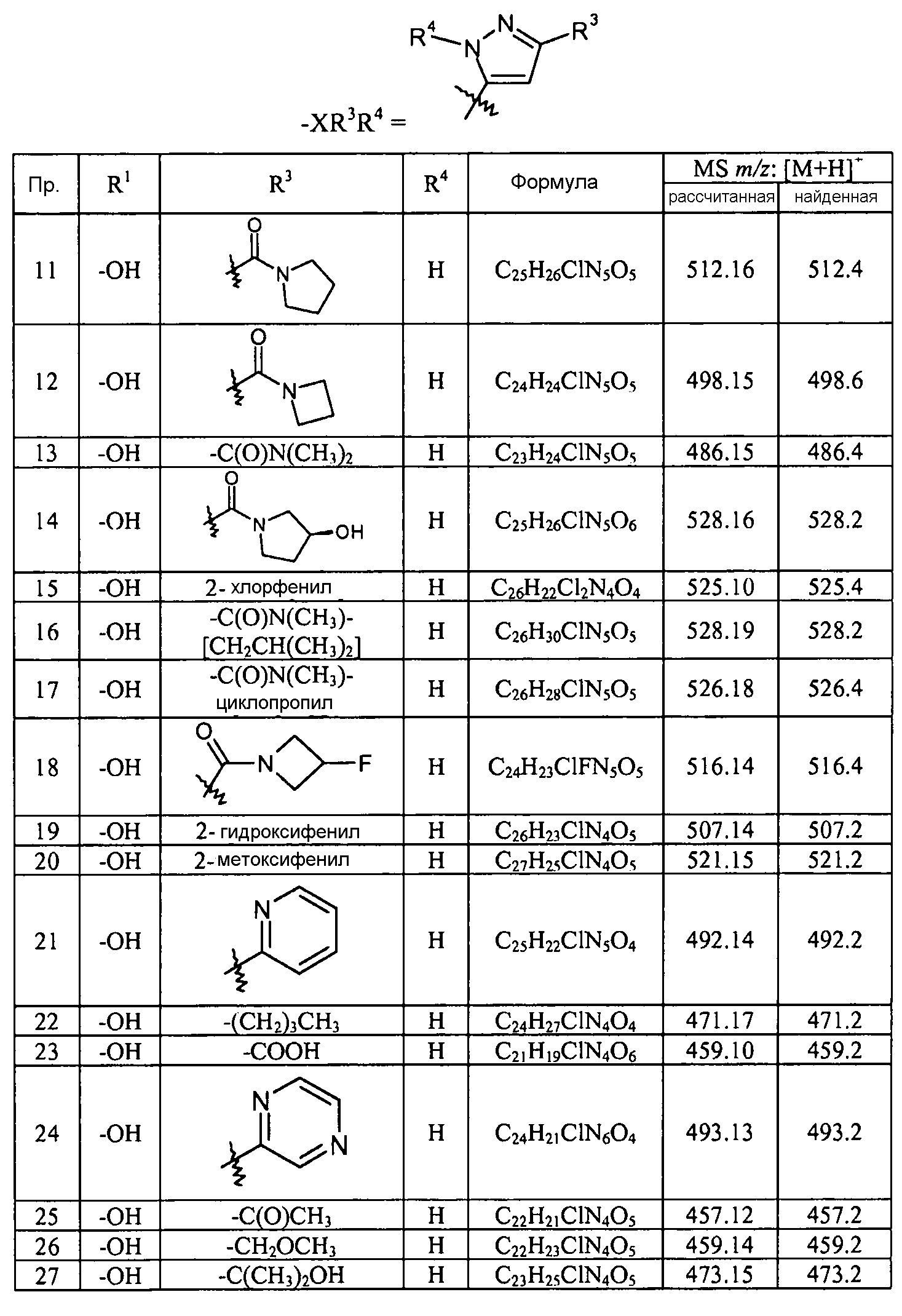
11. (R)-3-{N-(3'-Хлорбифенил-4-илметил)-N'-[5-(пирролидин-1-карбонил)-2H-пиразол-3-карбонил]гидразино}-2-гидроксипропионовая кислота
12. (R)-3-[Ν'-[5-(Азетидин-1-карбонил)-2H-пиразол-3-карбонил]-N-(3'-хлорбифенил-4-илметил)гидразино]-2-гидроксипропионовая кислота
13. (R)-3-[N-(3'-Хлорбифенил-4-илметил)-N'-(5-диметилкарбамоил-2H-пиразол-3-карбонил)гидразино]-2-гидроксипропионовая кислота
14. (R)-3-{N-(3'-Хлорбифенил-4-илметил)-N'-[5-((R)-3-гидроксипирролидин-1-карбонил)-2H-пиразол-3-карбонил]гидразино}-2-гидроксипропионовая кислота
15. (R)-3-{N-(3'-Хлорбифенил-4-илметил)-N'-[5-(2-хлорфенил)-2H-пиразол-3-карбонил]гидразино}-2-гидроксипропионовая кислота
16. (R)-3-{N-(3'-Хлорбифенил-4-илметил)-N'-[5-(изобутилметилкарбамоил)-2H-пиразол-3-карбонил]гидразино}-2-гидроксипропионовая кислота
17. (R)-3-{N-(3'-Хлорбифенил-4-илметил)-N'-[5-(циклопропилметилметилкарбамоил)-2H-пиразол-3-карбонил]гидразино}-2-гидроксипропионовая кислота
18. (R)-3-{N-(3'-Хлорбифенил-4-илметил)-N'-[5-(3-фторазетидин-1-карбонил)-2H-пиразол-3-карбонил]гидразино}-2-гидроксипропионовая кислота
19. (R)-3-{N-(3'-Хлорбифенил-4-илметил)-N'-[5-(2-гидроксифенил)-2H-пиразол-3-карбонил]гидразино}-2-гидроксипропионовая кислота
20. (R)-3-{N-(3'-Хлорбифенил-4-илметил)-N'-[5-(2-метоксифенил)-2H-пиразол-3-карбонил]гидразино}-2-гидроксипропионовая кислота
21. (R)-3-[N-(3'-Хлорбифенил-4-илметил)-N'-(5-пиридин-2-ил-2H-пиразол-3-карбонил)гидразино]-2-гидроксипропионовая кислота (ди-TFA соль)
22. (R)-3-[N'-(5-Бутил-2H-пиразол-3-карбонил)-N-(3'-хлорбифенил-4-илметил)гидразино]-2-гидроксипропионовая кислота
23. 5-[N'-((R)-2-Карбокси-2-гидроксиэтил)-N'-(3'-хлорбифенил-4-илметил)гидразинокарбонил]-1H-пиразол-3-карбоновая кислота
24. (R)-3-[N-(3'-Хлорбифенил-4-илметил)-N'-(5-пиразин-2-ил-2H-пиразол-3-карбонил)гидразино]-2-гидроксипропионовая кислота (ди-TFA соль)
25. (R)-3-[N'-(5-Ацетил-2H-пиразол-3-карбонил)-N-(3'-хлорбифенил-4-илметил)гидразино]-2-гидроксипропионовая кислота
26. (R)-3-[N-(3'-Хлорбифенил-4-илметил)-N'-(5-метоксиметил-2H-пиразол-3-карбонил)гидразино]-2-гидроксипропионовая кислота
27. (R)-3-{N-(3'-Хлорбифенил-4-илметил)-N'-[5-(1-гидрокси-1-метилэтил)-2H-пиразол-3-карбонил]гидразино}-2-гидроксипропионовая кислота

28. (R)-3-[N-(3'-Хлорбифенил-4-илметил)-N'-(2-фенилоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
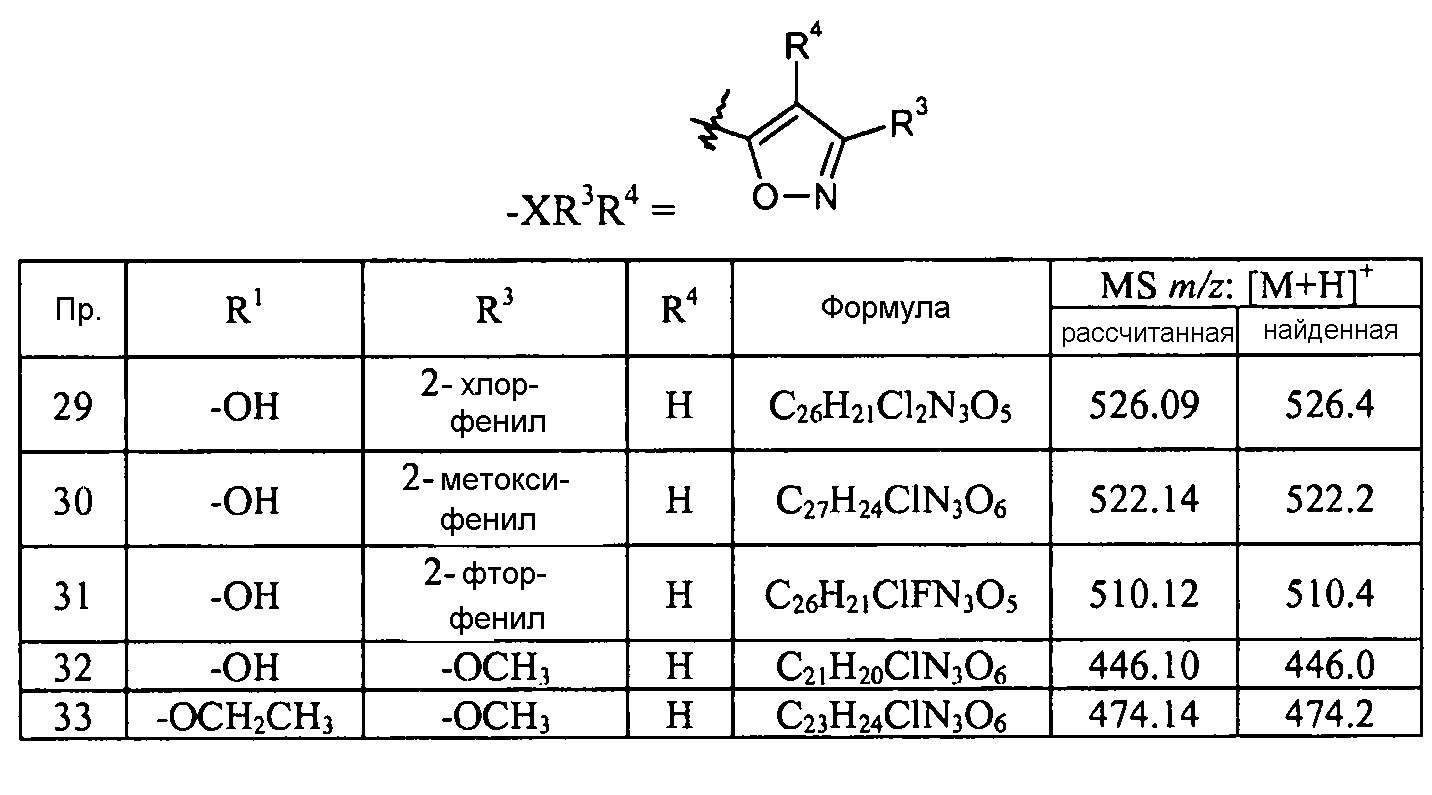
29. (R)-3-{N-(3'-Хлорбифенил-4-илметил)-N'-[3-(2-хлорфенил)изоксазол-5-карбонил]гидразино}-2-гидроксипропионовая кислота
30. (R)-3-{N-(3'-Хлорбифенил-4-илметил)-N'-[3-(2-метоксифенил)изоксазол-5-карбонил]гидразино}-2-гидроксипропионовая кислота
31. (R)-3-{N-(3'-Хлорбифенил-4-илметил)-N'-[3-(2-фторфенил)изоксазол-5-карбонил]гидразино}-2-гидроксипропионовая кислота
32. (R)-3-[N-(3'-Хлорбифенил-4-илметил)-N'-(3-метоксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
33. этиловый эфир (R)-3-[N-(3'-хлорбифенил-4-илметил)-N'-(3-метоксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты

34. (R)-3-[N-(3'-Хлорбифенил-4-илметил)-N'-(2-гидроксипиримидин-5-карбонил)гидразино]-2-гидроксипропионовая кислота
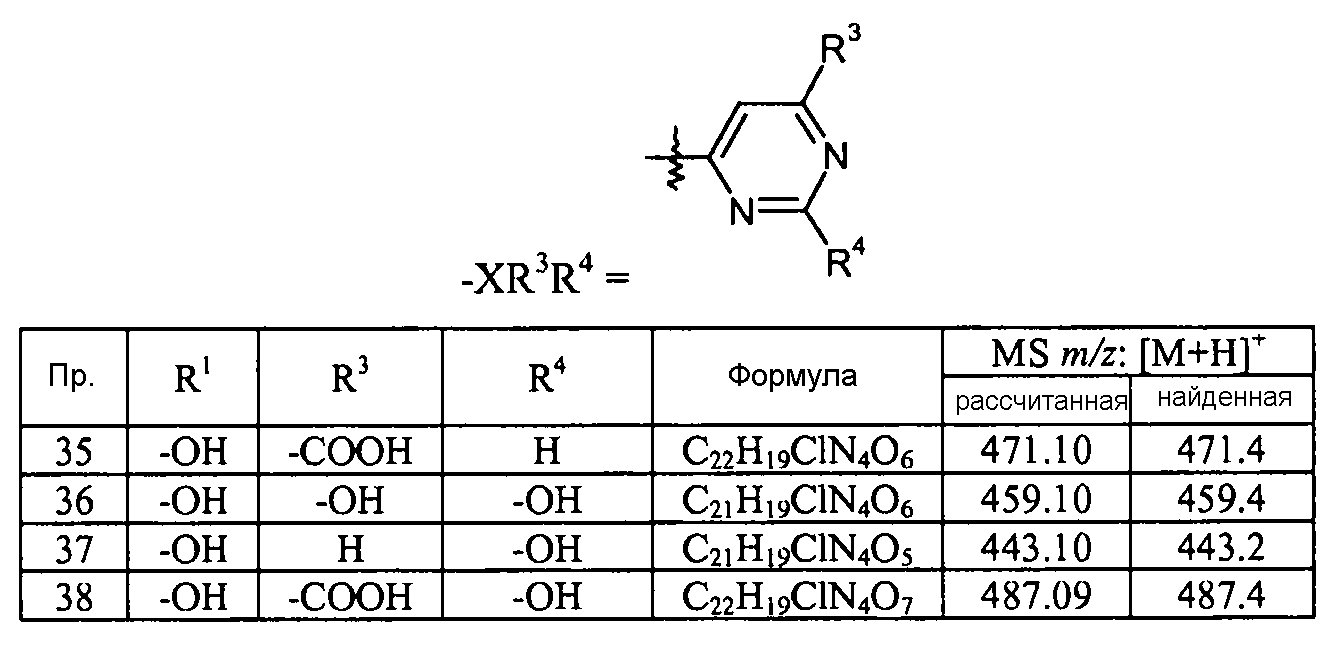
35. 6-[N'-((R)-2-Карбокси-2-гидроксиэтил)-N'-(3'-хлорбифенил-4-илметил)гидразинокарбонил]пиримидин-4-карбоновая кислота
36. (R)-3-[N-(3'-Хлорбифенил-4-илметил)-N'-(2,6-дигидроксипиримидин-4-карбонил)гидразино]-2-гидроксипропионовая кислота
37. (R)-3-[N-(3'-Хлорбифенил-4-илметил)-N'-(2-гидроксипиримидин-4-карбонил)гидразино]-2-гидроксипропионовая кислота
38. 6-[N'-((R)-2-Карбокси-2-гидроксиэтил)-N'-(3'-хлорбифенил-4-илметил)гидразинокарбонил]-2-гидроксипиримидин-4-карбоновая кислота

39. (R)-3-[N-(3'-Хлорбифенил-4-илметил)-N'-(2-оксо-2,3-дигидрооксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
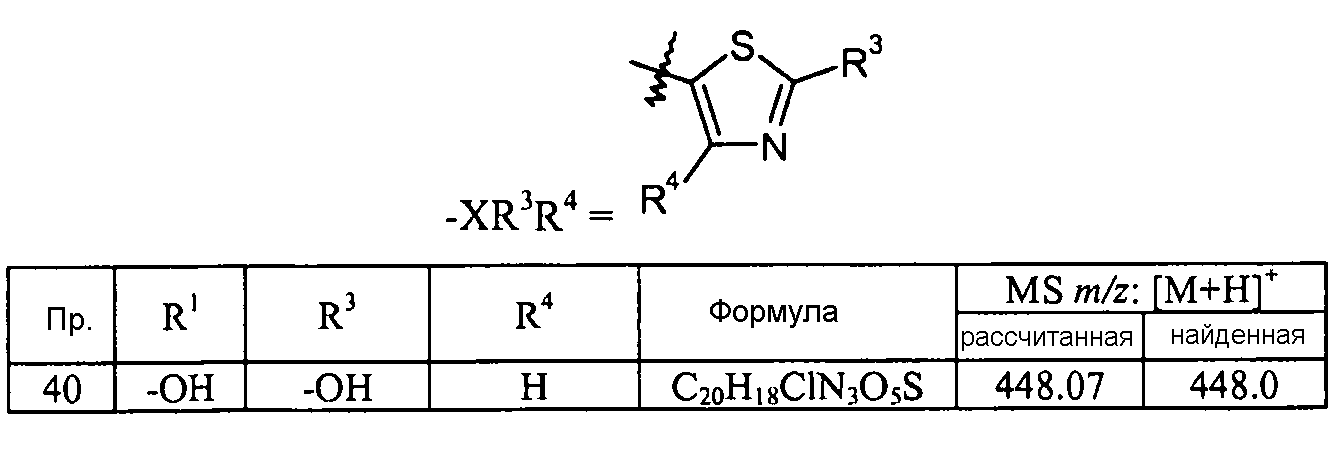
40. (R)-3-[N-(3'-Хлорбифенил-4-илметил)-N'-(2-гидрокситиазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота

41. (R)-3-[N-(3'-Хлорбифенил-4-илметил)-N'-(1-гидрокси-1H-бензотриазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
42. (R)-3-[N-(3'-Хлорбифенил-4-илметил)-N'-(4-фтор-1H-бензотриазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
ПРИМЕР 5
Следуя способам, описанным в примерах в настоящем изобретении, и заменяя на подходящие исходные вещества и реагенты, получали соединения, имеющие следующую формулу, в виде TFA солей:
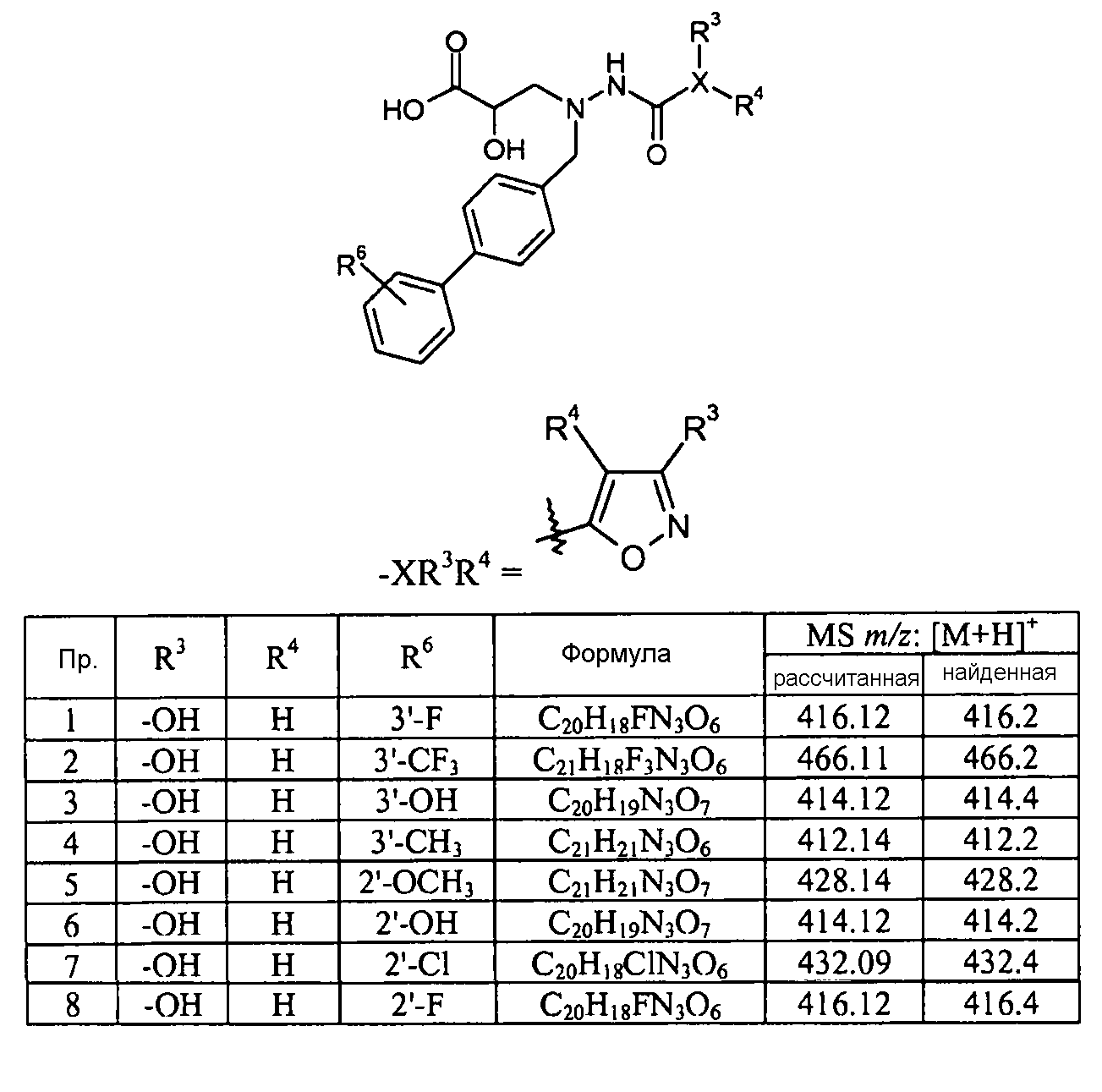
1. (R)-3-[N-(3'-Фторбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
2. (R)-2-Гидрокси-3-[N'-(3-гидроксиизоксазол-5-карбонил)-N-(3'-трифторметилбифенил-4-илметил)гидразино]пропионовая кислота
3. (S)-2-Гидрокси-3-[N-(3'-гидроксибифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]пропионовая кислота
4. (S)-2-Гидрокси-3-[N'-(3-гидроксиизоксазол-5-карбонил)-N-(3'-метилбифенил-4-илметил)гидразино]пропионовая кислота
5. (R)-2-Гидрокси-3-[N'-(3-гидроксиизоксазол-5-карбонил)-N-(2'-метоксибифенил-4-илметил)гидразино]пропионовая кислота
6. (R)-2-Гидрокси-3-[N-(2'-гидроксибифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]пропионовая кислота
7. (R)-3-[N-(2'-Хлорбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
8. (R)-3-[N-(2'-Фторбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
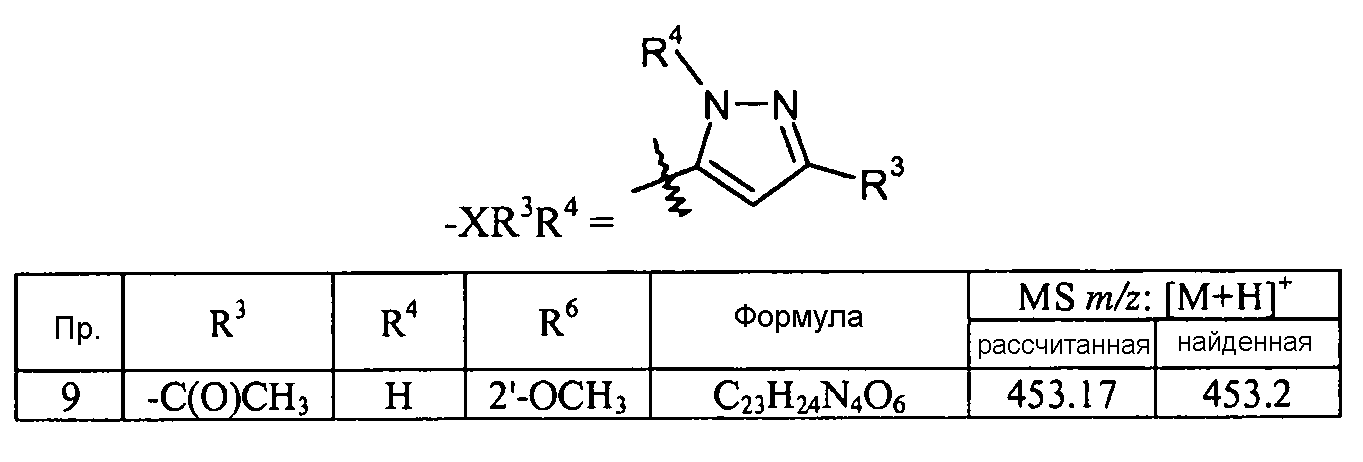
9. (S)-3-[N'-(5-Ацетил-2H-пиразол-3-карбонил)-N-(2'-метоксибифенил-4-илметил)гидразино]-2-гидроксипропионовая кислота
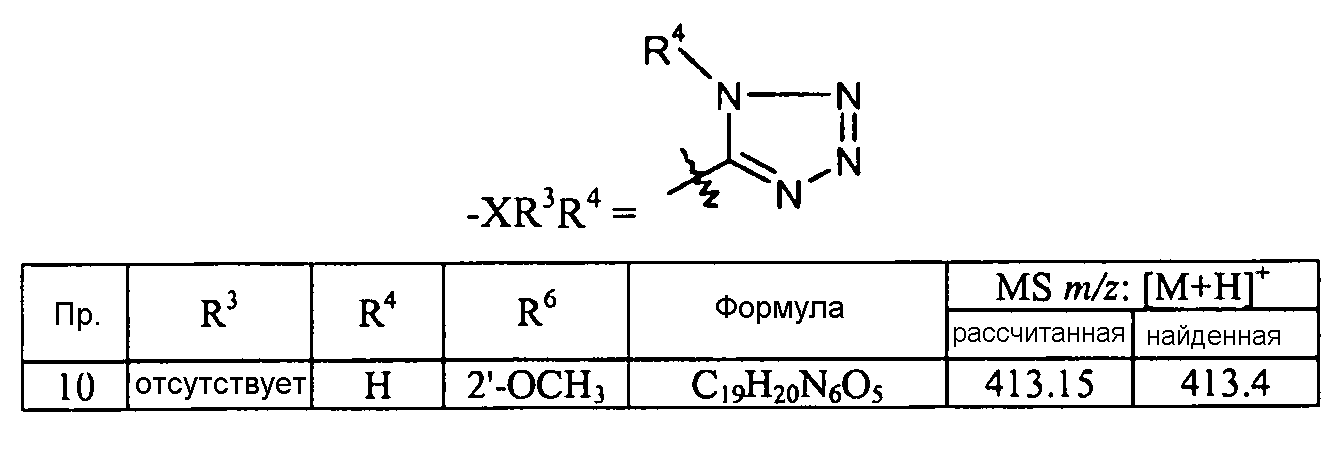
10. (R)-2-Гидрокси-3-[N-(2'-метоксибифенил-4-илметил)-N'-(1H-тетразол-5-карбонил)гидразино]пропионовая кислота
Способ получения 6
1H-тетразол-5-карбоксилат дикалия

Раствор гидроксида калия (1,3 г, 23,2 ммоль) в воде (4,2 мл, 230 ммоль) добавляли к раствору этил тетразол-5-карбоксилата (1,1 г, 7,7 ммоль) в EtOH (24 мл, 410 ммоль). Немедленно образовывался твердый продукт, и его собирали и промывали холодным EtOH, получая заявленное в заголовке соединение (1,5 г).
Способ получения 7
Метиловый эфир (R)-3-[N-(4-Бромбензил)гидразино]-2-гидроксипропионовой кислоты
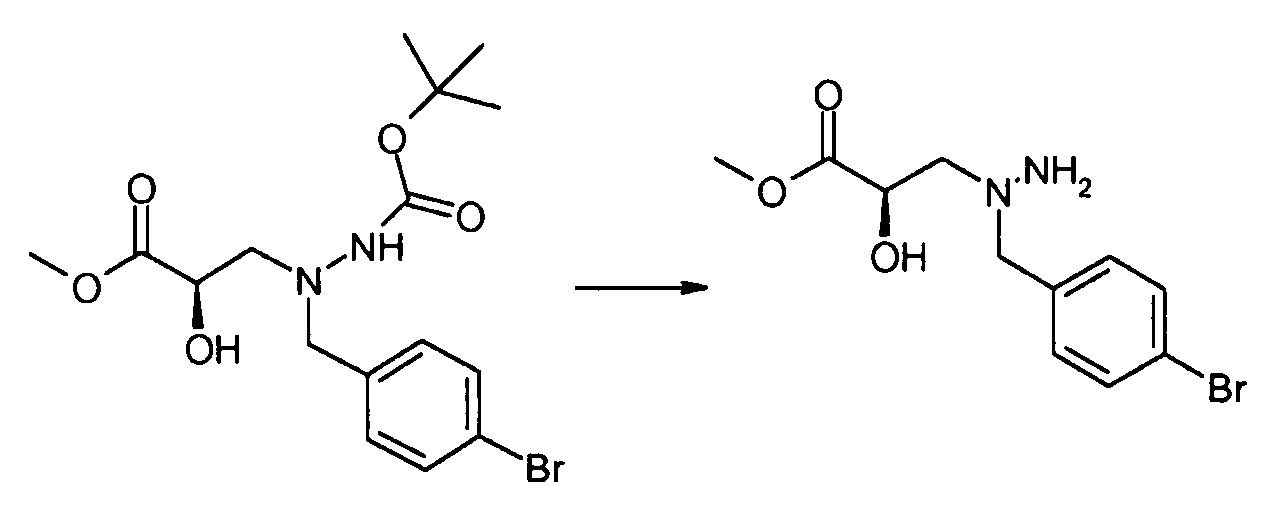
Метиловый эфир (R)-3-[N-(4-Бромбензил)-N'-трет-бутоксикарбонилгидразино]-2-гидроксипропионовой кислоты (1,1 г, 2,8 ммоль) растворяли в MeCN (10 мл) и 4н HCl в диоксане (6 мл, 20 ммоль). Смесь перемешивали при комнатной температуре до завершения снятия защитной группы (1 час). Осадок фильтровали и сушили, получая заявленное в заголовке соединение (840 мг) в виде HCl соли.
Способ получения 8
Метиловый эфир (R)-3-[N-(4-бромбензил)-N'-(1H-тетразол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты

К перемешиваемому раствору DMF (711 мкл, 9,2 ммоль) в MeCN (2 мл, 40 ммоль) при 0°C медленно добавляли раствор оксалилхлорида (249 мкл, 2,94 ммоль) в MeCN (500 мкл, 9 ммоль). Через 10 минут добавляли 1H-тетразол-5-карбоксилат дикалия (241 мг, 1,3 ммоль) и после перемешивания в течение дополнительных 15 минут добавляли к раствору соединение 1 (240 мг, 0,8 ммоль) в пиридине (9,6 мл, 120 ммоль). Перемешиваемую реакционную смесь медленно нагревали до комнатной температуры и перемешивали в течение 20 минут. Смесь упаривали при пониженном давлении, получая заявленное в заголовке соединение.
Способ получения 9
Этиловый эфир (R)-3-[N-(5'-Хлор-2'-фторбифенил-4-илметил)гидразино]-2-гидроксипропионовой кислоты
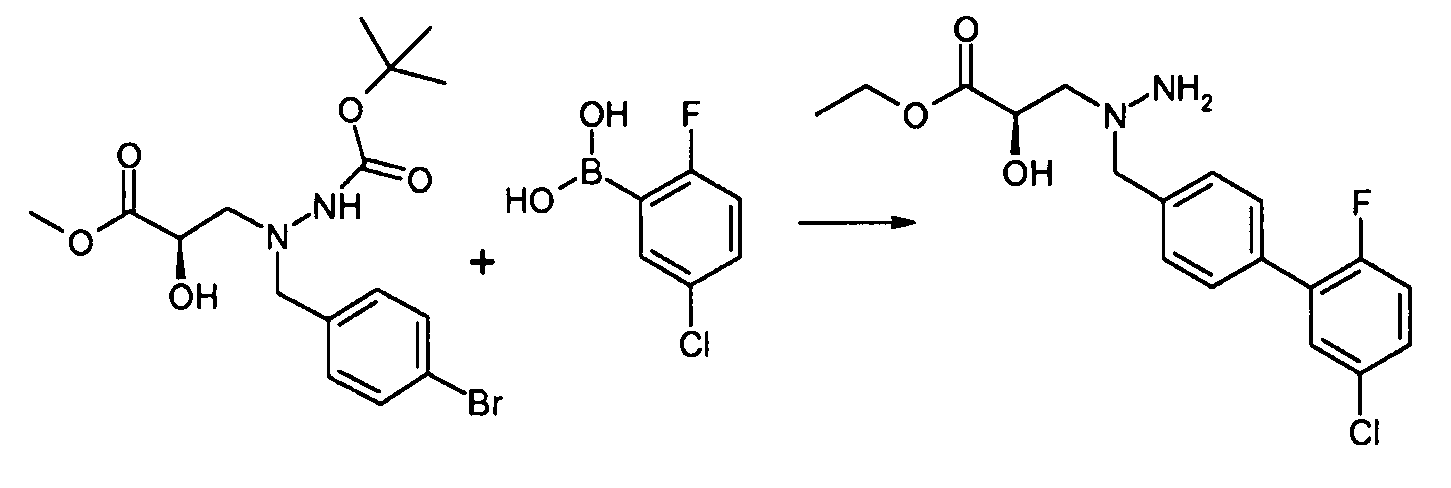
Метиловый эфир (R)-3-[N-(4-бромбензил)-N'-трет-бутоксикарбонил-гидразино]-2-гидроксипропионовой кислоты (1,0 г, 2,5 ммоль), 5-хлор-2-фторфенилбороновую кислоту (865 мг, 4,96 ммоль) и K2CO3 (857 мг, 6,2 ммоль) объединяли в EtOH (30 мл, 500 ммоль) и воде (8 мл, 400 ммоль), с последующим добавлением SilicaCat®DPP-Pd (0,28 ммоль/г загрузка; 886 мг, 248 мкмоль). Смесь грели при 90°C до завершения реакции (2 часов). Осадок отфильтровывали, и фильтрат концентрировали и очищали (Interchim колонка для обращенно-фазовой хроматографии; 30-95% MeCN в воде с 0,5% TFA). Чистые фракции собирали, лиофилизировали и объединяли с 4 M HCl в диоксане (8 мл, 30 ммоль) и EtOH (10 мл, 200 ммоль). Полученную в результате смесь перемешивали при комнатной температуре до завершения реакции (7 часов). Смесь концентрировали, получая масло, которое перемешивали в эфире с несколькими каплями EtOH в течение ночи. Осадок отфильтровывали и промывали эфиром, получая заявленное в заголовке соединение (140 мг).
ПРИМЕР 6
A. (R)-3-[N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-(1H-тетразол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
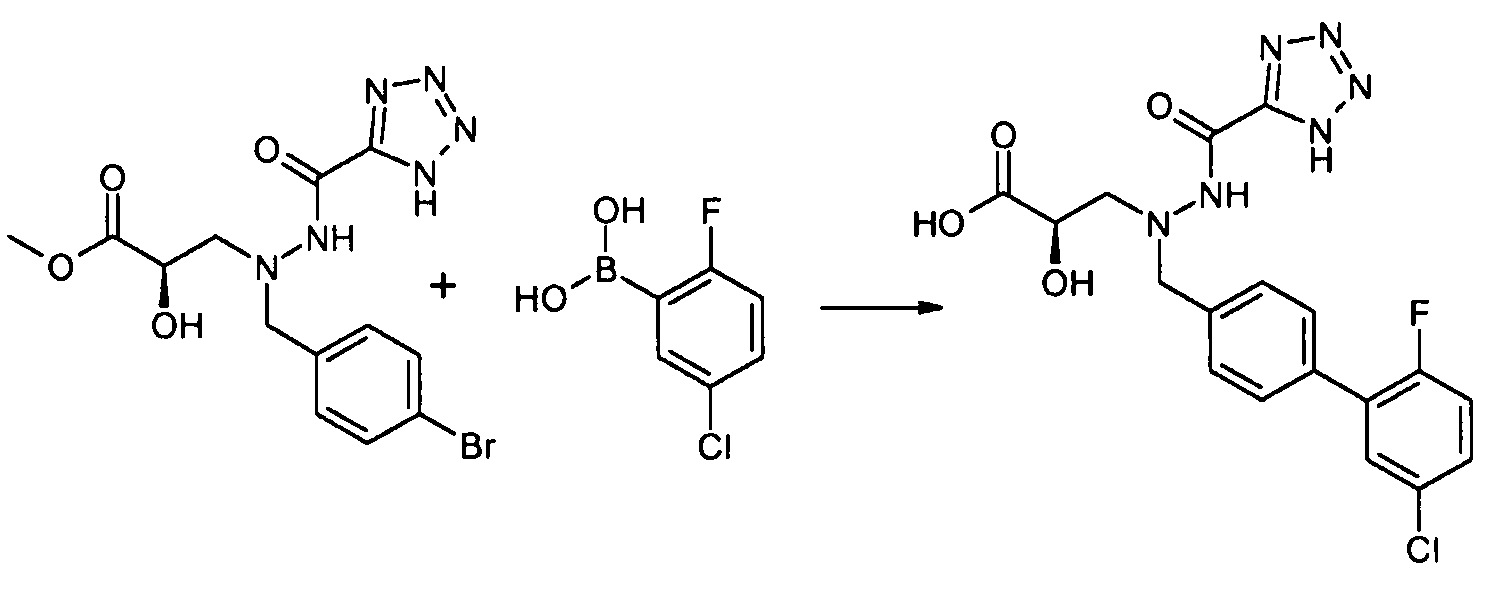
Метиловый эфир (R)-3-[N-(4-Бромбензил)-N'-(1H-тетразол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты (60 мг, 0,2 ммоль), 5-хлор-2-фторфенилбороновую кислоту (52,4 мг, 301 мкмоль) и K2CO3 (62,3 мг, 451 мкмоль) объединяли в EtOH (0,8 мл) и воде (0,2 мл), с последующим добавлением SilicaCat®DPP-Pd (0,28 ммоль/г загрузка; 53,7 мг, 15 мкмоль). Смесь грели при 120°C до завершения реакции (30 минут). Осадок отфильтровывали, и добавляли к фильтрату 1 M водный LiOH (1,2 мл, 1,2 ммоль) и перемешивали в течение 1 часа. Смесь упаривали при пониженном давлении и очищали препаративной ВЭЖХ, получая заявленное в заголовке соединение в виде TFA соли (20 мг; чистота 95%). MS m/z [M+H]+ рассчитанная для C18H16ClFN6O4, 435,09; найденная 435,4.
B. Этиловый эфир (R)-3-[N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-(1H-тетразол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты
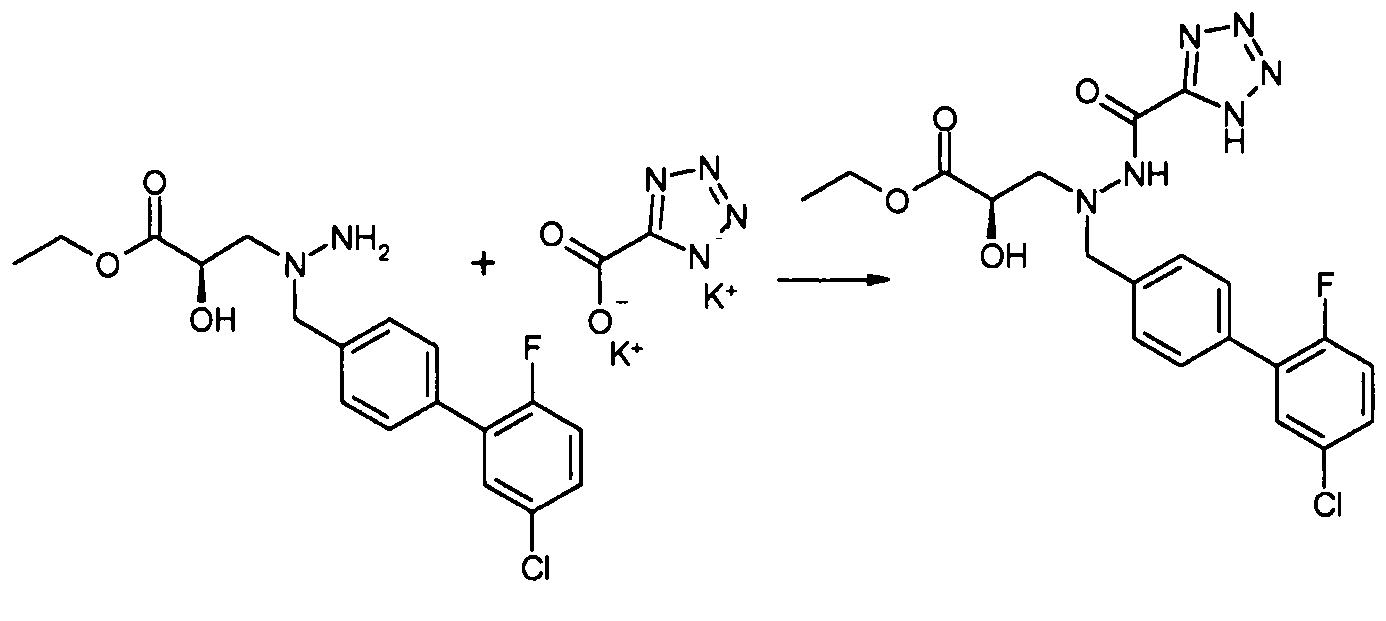
1H-Тетразол-5-карбоксилат дикалия получали следующим образом: Раствор гидроксида калия (1,3 г, 23,2 ммоль) в воде (4,2 мл, 230 ммоль) добавляли к раствору этил тетразол-5-карбоксилата (1,1 г, 7,7 ммоль) в EtOH (24 мл, 410 ммоль). Твердый продукт, который тут же образовывался, собирали и промывали холодным EtOH, получая 1H-тетразол-5-карбоксилат дикалия (1,5 г).
К перемешиваемому раствору DMF (734 мкл, 9,5 ммоль) в MeCN (2 мл, 50 ммоль) при 0°C медленно добавляли раствор оксалилхлорида (257 мкл, 3,0 ммоль) в MeCN (500 мкл, 9 ммоль). Через 10 минут добавляли 1H-тетразол-5-карбоксилат дикалия (249 мг, 1,3 ммоль) и после перемешивания в течение дополнительных 15 минут добавляли к раствору этиловый эфир (R)-3-[N-(5'-хлор-2'-фторбифенил-4-илметил)гидразино]-2-гидроксипропионовой кислоты (300 мг, 0,8 ммоль) в MeCN (2 мл, 40 ммоль) и пиридин (661 мкл, 8,2 ммоль). Смесь перемешивали при 0°C в течение 10 минут, затем упаривали при пониженном давлении и очищали (Interchim колонка для обращенно-фазовой хроматографии; элюировали 55-75%, оба пика элюировались вместе), получая заявленное в заголовке соединение (280 мг). Часть (80 мг) дополнительно очищали препаративной ВЭЖХ, получая заявленное в заголовке соединение в виде TFA соли (33 мг; чистота 98%). MS m/z [M+H]+ рассчитанная для C20H20ClFN6O4, 463,12; найденная 463,4.
C. Изопропиловый эфир (R)-3-[N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-(1H-тетразол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты
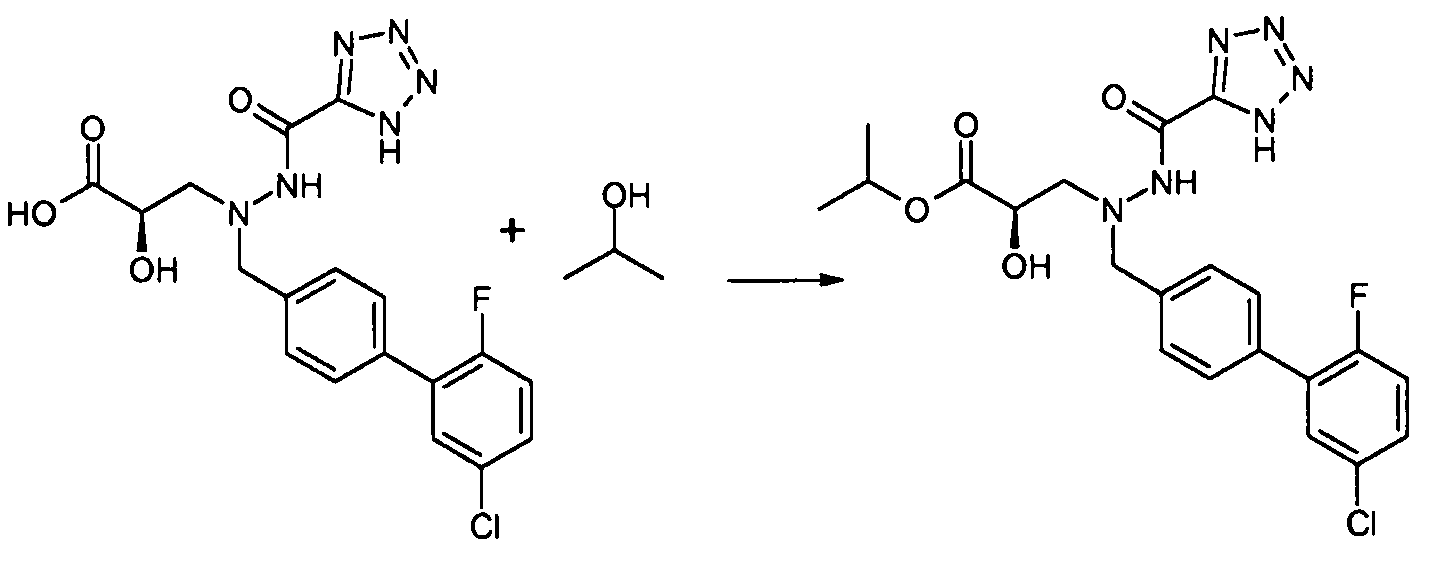
(R)-3-[N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-(1H-тетразол-5-карбонил)гидразино]-2-гидроксипропионовую кислоту (50 мг, 0,1 ммоль) растворяли в изопропиловом спирте (2 мл, 30 ммоль), затем добавляли 4 M HCl в диоксане (0,8 мл, 3 ммоль). Полученную в результате смесь перемешивали при комнатной температуре до завершения реакции (~17 часов). Смесь упаривали при пониженном давлении и очищали (Interchim C18 обращенно-фазовая колонка; 30-95% MeCN в воде с 0,05% TFA). Чистые фракции объединяли и лиофилизировали, получая заявленное в заголовке соединение в виде TFA соли (43 мг; чистота 98%). MS m/z [M+H]+ рассчитанная для C21H22ClFN6O4, 477,14; найденная 477,2.
D. Изобутиловый эфир (R)-3-[N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-(1H-тетразол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты
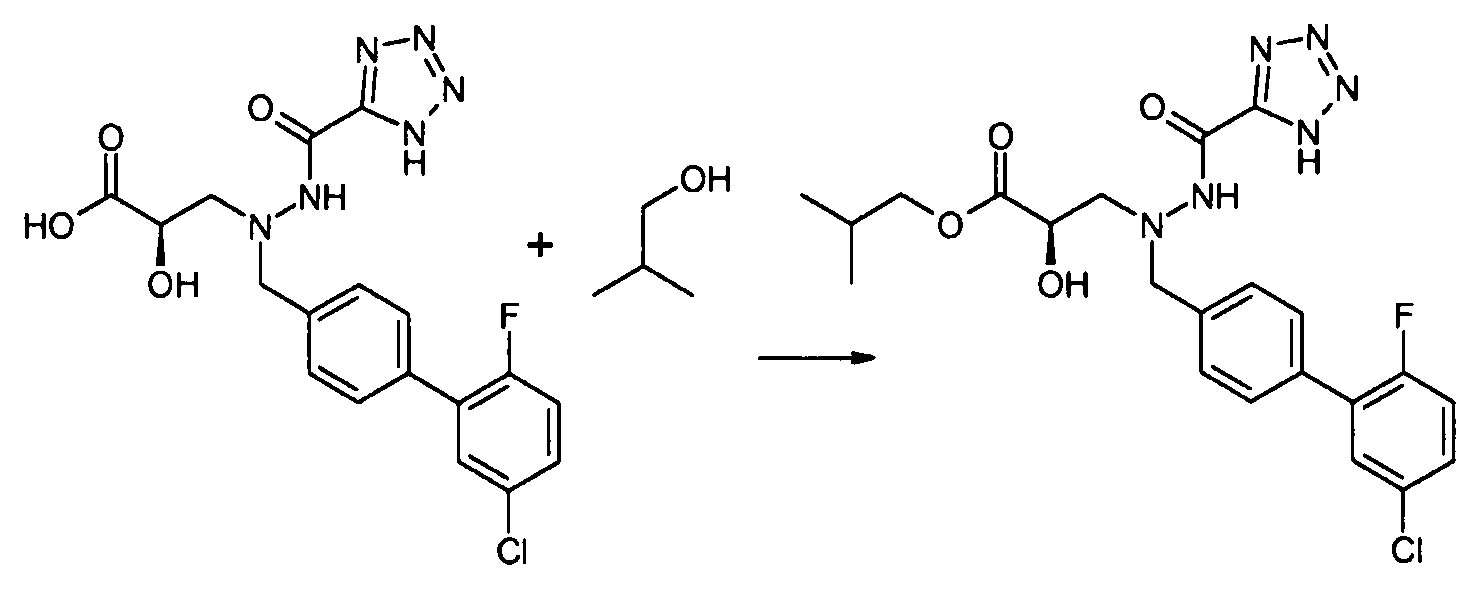
(R)-3-[N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-(1H-тетразол-5-карбонил)гидразино]-2-гидроксипропионовую кислоту (50 мг, 0,1 ммоль) растворяли в изобутиловом спирте (2 мл, 30 ммоль), затем добавляли 4 M HCl в диоксане (0,8 мл, 3 ммоль). Полученную в результате смесь перемешивали при комнатной температуре до завершения реакции (~3 часа). Смесь упаривали при пониженном давлении и очищали (Interchim C18 обращенно-фазовая колонка; 30-95% MeCN в воде с 0,05% TFA). Чистые фракции объединяли и лиофилизировали, получая заявленное в заголовке соединение в виде TFA соли (34 мг; чистота 98%). MS m/z [M+H]+ рассчитанная для C22H24ClFN6O4, 491,15; найденная 491,4.
Альтернативный способ
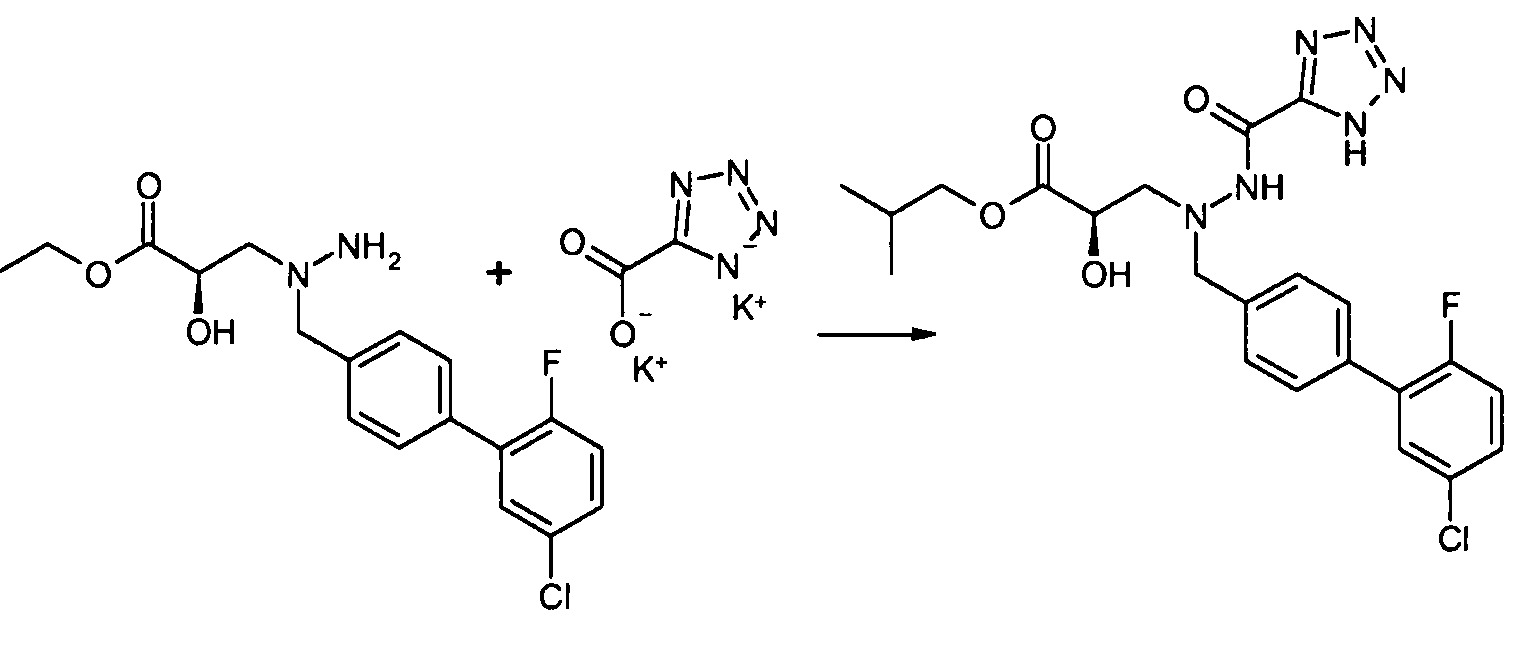
К перемешиваемому раствору DMF (2,8 мл, 36,6 ммоль) в MeCN (10 мл, 200 ммоль) при 0°C медленно добавляли раствор оксалилхлорида (267 мкл, 3,2 ммоль) в MeCN (1,7 мл, 31,5 ммоль). Через 10 минут добавляли 1H-тетразол-5-карбоксилат дикалия (600 мг, 3 ммоль) и после перемешивания в течение дополнительных 15 минут добавляли к раствору этиловый эфир (R)-3-[N-(5'-хлор-2'-фторбифенил-4-илметил)гидразино]-2-гидроксипропионовой кислоты (1000 мг, 3 ммоль в пиридине (5,1 мл, 63,1 ммоль). Смесь перемешивали при 0°C в течение 10 минут, затем упаривали при пониженном давлении. Затем высушенный материал растворяли в EtOH (7,4 мл, 126 ммоль). Затем добавляли раствор 1 M водного LiOH (15,8 мл, 15,8 ммоль), и полученную в результате смесь перемешивали при комнатной температуре в течение 30 минут. Затем раствор упаривали при пониженном давлении и очищали (Interchim обращенно-фазовая колонка; 10-90% MeCN в воде). Очищенный продукт растворяли в изобутиловом спирте (29,1 мл, 315 ммоль). Добавляли раствор 4,0 M HCl в 1,4-диоксане (7,9 мл, 31,5 ммоль), и полученную в результате смесь перемешивали при комнатной температуре в течение 1 часа, затем при 30°C в течение 1 часа. Раствор упаривали при пониженном давлении и очищали препаративной ВЭЖХ, получая заявленное в заголовке соединение в виде TFA соли (186,6 мг).
ПРИМЕР 7
A. (R)-3-[N-(2',5'-Дихлорбифенил-4-илметил)-N'-(1-гидрокси-1H-[1,2,3]триазол-4-карбонил)гидразино]-2-гидроксипропионовая кислота
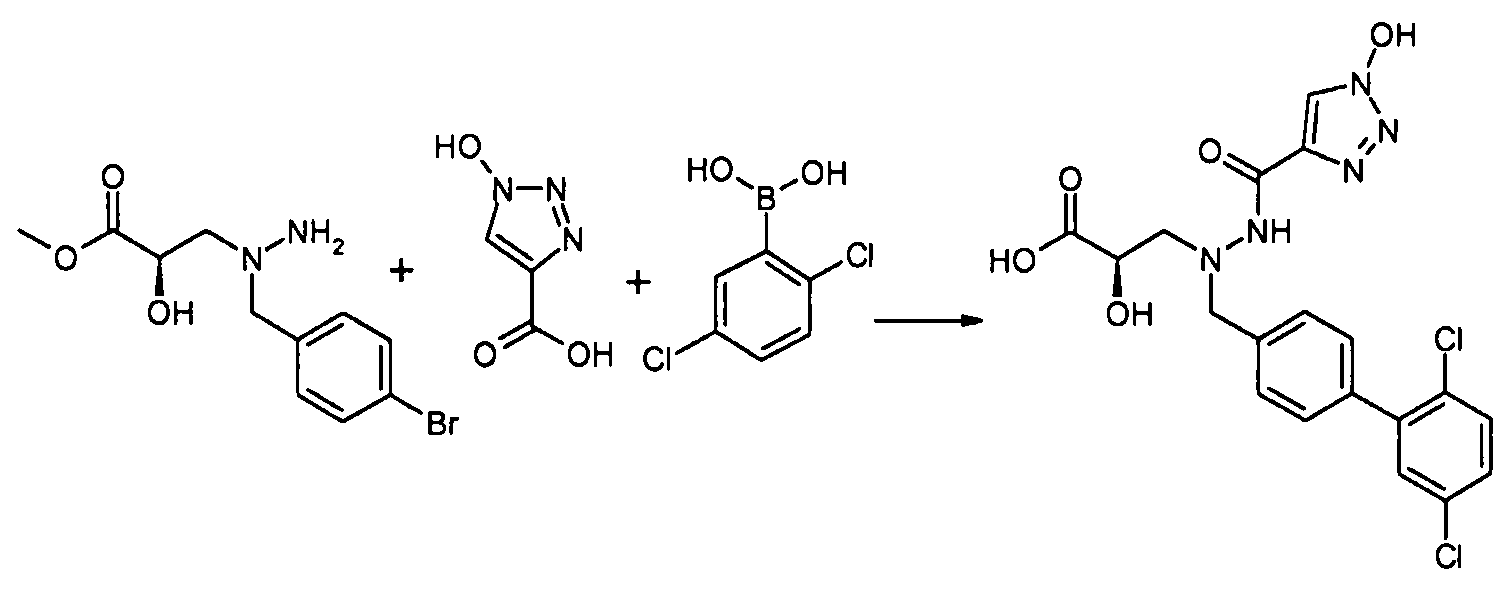
1-Гидрокси-1H-1,2,3-триазол-4-карбоновую кислоту (42,6 мг, 330 мкмоль) и HATU (125 мг, 330 мкмоль) объединяли в DMF (2 мл) и перемешивали в течение 5 минут при комнатной температуре. Добавляли DIPEA (86 мкл, 495 мкмоль) и метиловый эфир (R)-3-[N-(4-бромбензил)гидразино]-2-гидроксипропионовой кислоты (50 мг, 0,2 ммоль), и полученную в результате смесь перемешивали в течение 30 минут. Смесь упаривали при пониженном давлении и продукт растворяли в EtOH (0,8 мл, 10 ммоль) и воде (0,2 мл, 10 ммоль). Добавляли 2,5-дихлорфенилбороновую кислоту (57 мг, 297 мкмоль), K2CO3 (68 мг, 495 мкмоль) и SilicaCat®DPP-Pd (0,28 ммоль/г загрузка; 58,9 мг, 16,5 мкмоль), и полученную в результате смесь грели при 120°C в течение 10 минут. Смесь фильтровали и добавляли к фильтрату 1 M водный LiOH (1,2 мл, 1,2 ммоль). Смесь перемешивали до завершения реакции (1 час), затем упаривали досуха и очищали препаративной ВЭЖХ, получая заявленное в заголовке соединение в виде TFA соли (14 мг; чистота 95%). MS m/z [M+H]+ рассчитанная для C19H17Cl2N5O5, 466,06; найденная 466,2.
B. Гептиловый эфир (R)-3-[N-(2',5'-дихлорбифенил-4-илметил)-N'-(1-гидрокси-1H-[1,2,3]триазол-4-карбонил)гидразино]-2-гидроксипропионовой кислоты
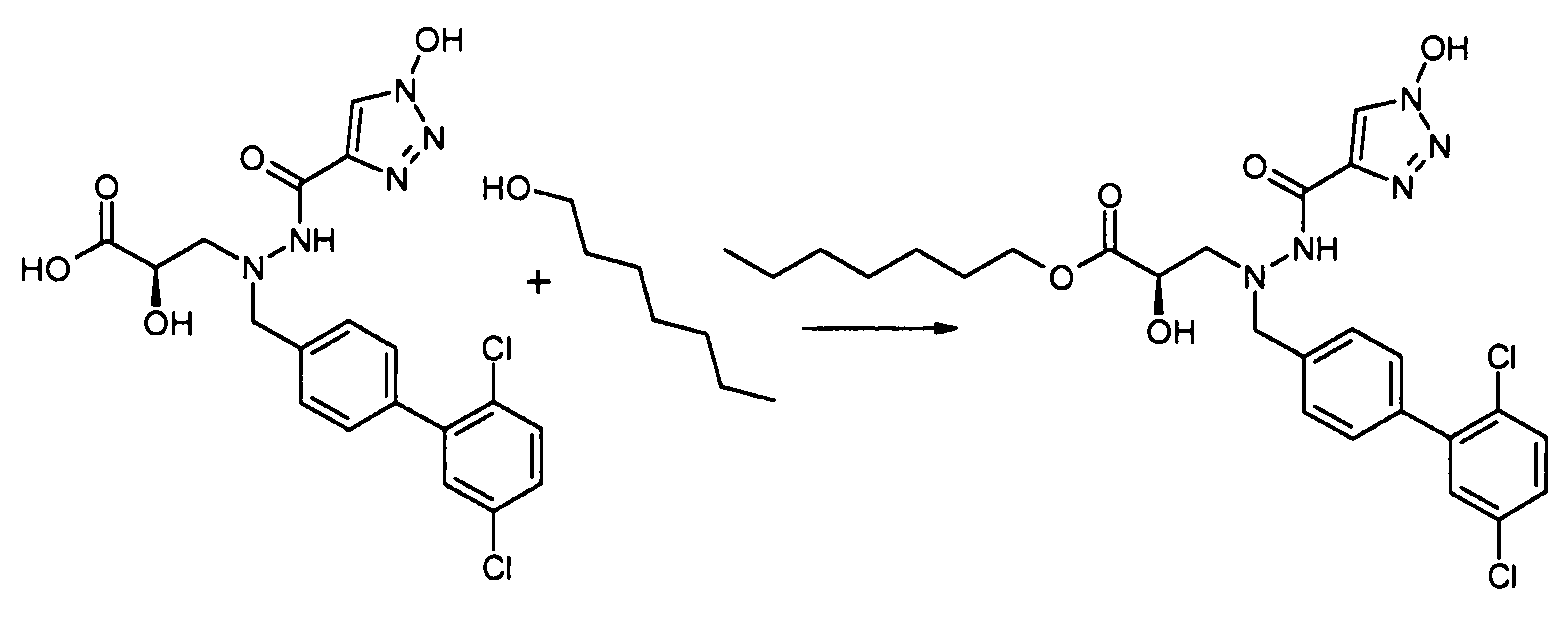
(R)-3-[N-(2',5'-Дихлорбифенил-4-илметил)-N'-(1-гидрокси-1H-1,2,3-триазол-4-карбонил)гидразино]-2-гидроксипропионовую кислоту (150 мг, 320 мкмоль) растворяли в 1-гептаноле (9,1 мл, 64,3 ммоль). Добавляли 4 M HCl в диоксане (3,2 мл, 12,9 ммоль), и полученную в результате смесь перемешивали при комнатной температуре в течение ночи. Смесь упаривали при пониженном давлении и очищали препаративной ВЭЖХ, получая заявленное в заголовке соединение в виде TFA соли (12 мг; чистота 100%). MS m/z [M+H]+ рассчитанная для C26H31Cl2N5O5, 564,17; найденная 564,2.
C. Изобутиловый эфир (R)-3-[N-(2',5'-дихлорбифенил-4-илметил)-N'-(1-гидрокси-1H-[1,2,3]триазол-4-карбонил)гидразино]-2-гидроксипропионовой кислоты

(R)-3-[N-(2',5'-Дихлорбифенил-4-илметил)-N'-(1-гидрокси-1H-1,2,3-триазол-4-карбонил)гидразино]-2-гидроксипропионовую кислоту (150 мг, 320 мкмоль) растворяли в изобутиловом спирте (8,9 мл, 96,5 ммоль). Добавляли 4 M HCl в диоксане (3,2 мл, 12,9 ммоль), и полученную в результате смесь перемешивали при комнатной температуре в течение ночи. Смесь упаривали при пониженном давлении и очищали препаративной ВЭЖХ, получая заявленное в заголовке соединение в виде TFA соли (28,5 мг; чистота 100%). MS m/z [M+H]+ рассчитанная для C23H25Cl2N5O5, 522,12; найденная 522,2.
D. Изопропиловый эфир (R)-3-[N-(2',5'-дихлорбифенил-4-илметил)-N'-(1-гидрокси-1H-[1,2,3]триазол-4-карбонил)гидразино]-2-гидроксипропионовой кислоты
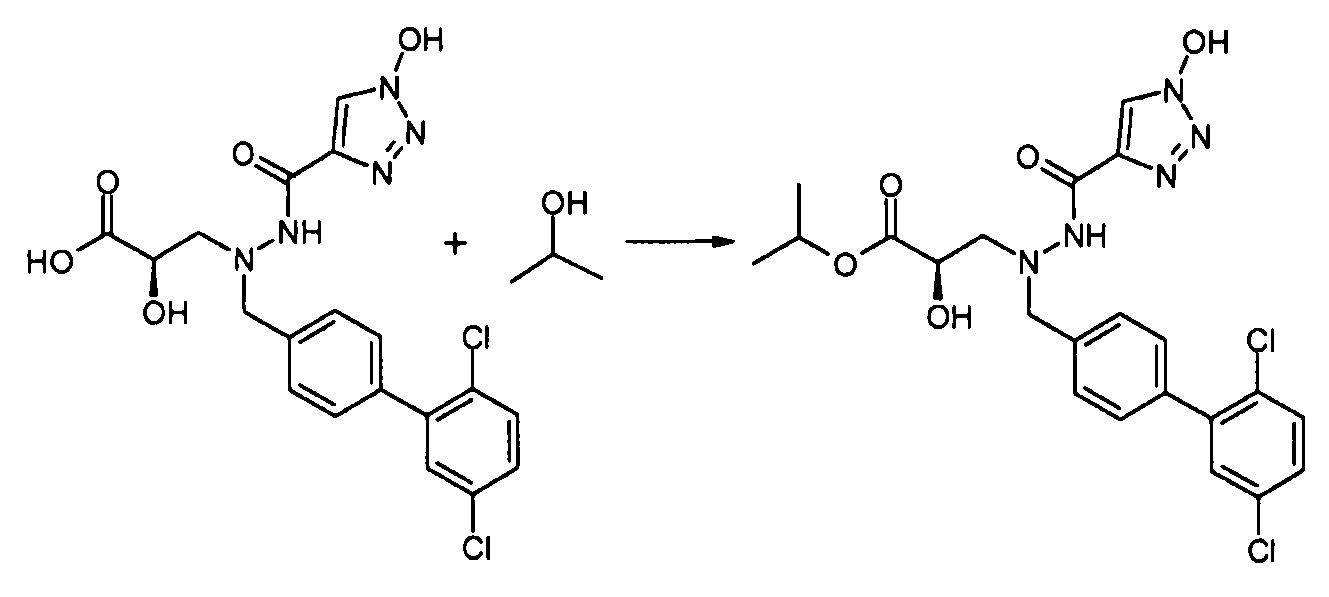
(R)-3-[N-(2',5'-Дихлорбифенил-4-илметил)-N'-(1-гидрокси-1H-1,2,3-триазол-4-карбонил)гидразино]-2-гидроксипропионовую кислоту (150 мг, 320 мкмоль) растворяли в изопропиловом спирте (4,9 мл, 64,3 ммоль). Добавляли 4 M HCl в диоксане (3,2 мл, 12,9 ммоль), и полученную в результате смесь перемешивали при комнатной температуре в течение ночи. Смесь упаривали при пониженном давлении и очищали препаративной ВЭЖХ, получая заявленное в заголовке соединение в виде TFA соли (4,7 мг; чистота 100%). MS m/z [M+H]+ рассчитанная для C22H23Cl2N5O5, 508,11; найденная 508,2.
ПРИМЕР 8
Следуя способам, описанным в примерах в настоящем изобретении, и заменяя на подходящие исходные вещества и реагенты, получали соединения, имеющие следующую формулу, в виде TFA солей:
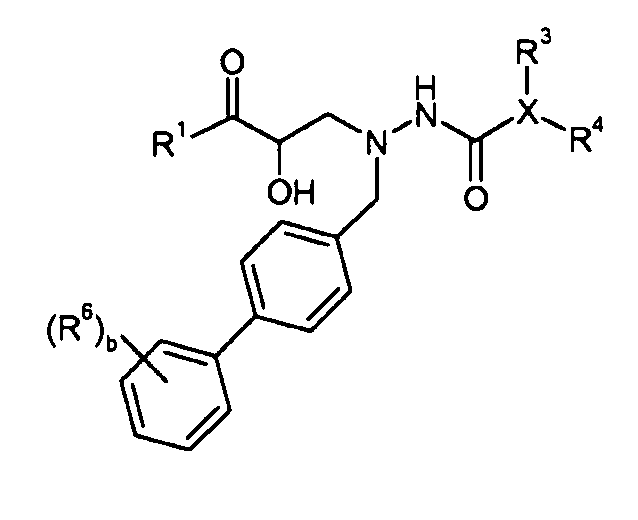

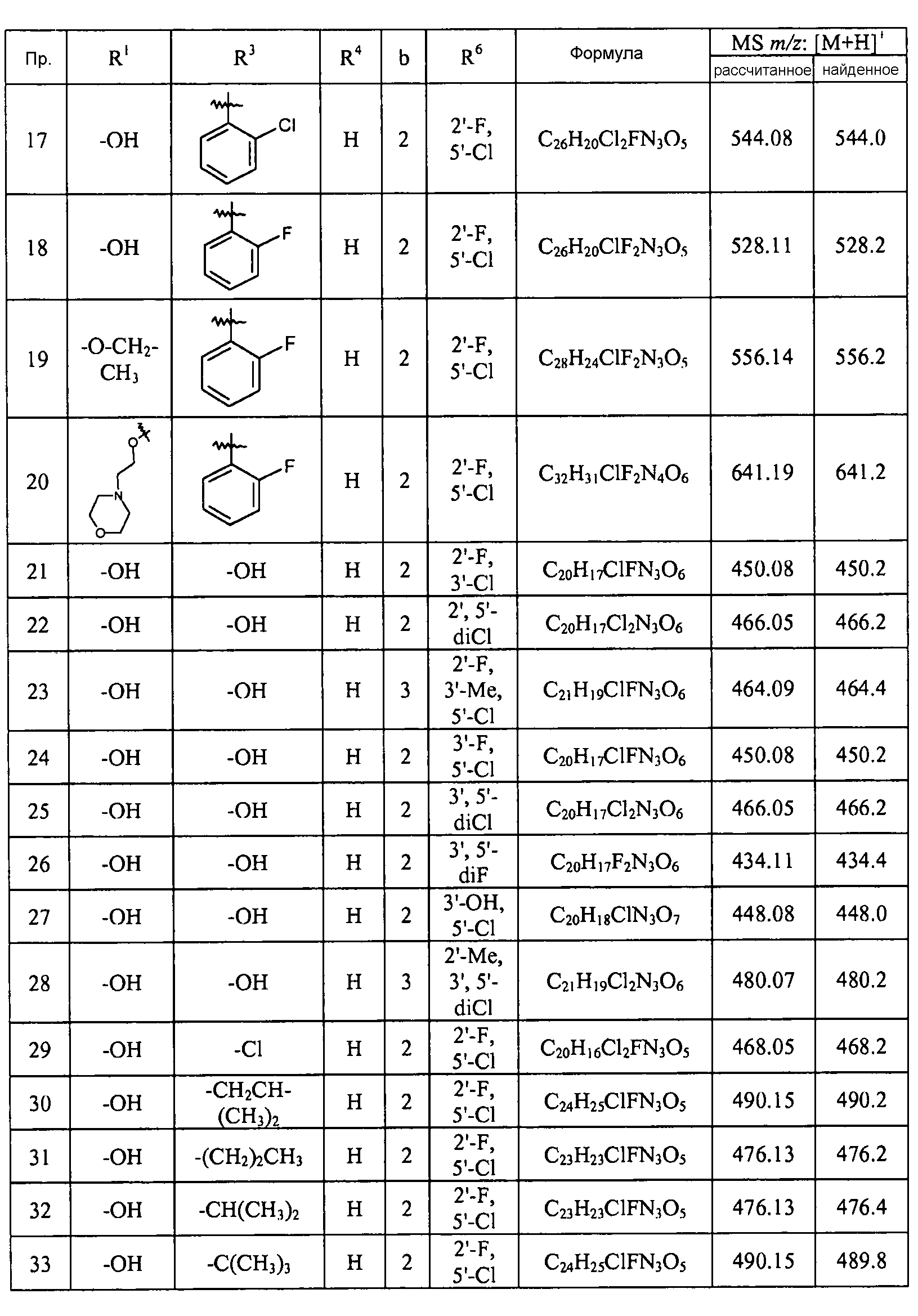
1. (R)-3-[N-(5'-Хлор-2'-метилбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
2. (R)-3-[N-(5'-Хлор-2'-метоксибифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
3. этиловый эфир (R)-3-[N-(5'-Хлор-2'-метоксибифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты
4. (R)-3-[N-(5'-Фтор-2'-метоксибифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
5. (S)-3-[N-(5'-Фтор-2'-гидроксибифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
6. (S)-3-[N-(5'-Хлор-2'-гидроксибифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
7. (R)-3-[N-(3'-Хлор-2'-гидроксибифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
8. (R)-3-[N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
9. (R)-3-[N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-(3-метоксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
10. этиловый эфир (R)-3-[N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-(3-метоксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты
11. изопропиловый эфир (R)-3-[N-(5'-хлор-2'-фторбифенил-4-илметил)-N'-(3-метоксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты
12. изобутиловый эфир (R)-3-[N-(5'-хлор-2'-фторбифенил-4-илметил)-N'-(3-метоксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты
13. (R)-3-{N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-[3-(3-фторфенил)изоксазол-5-карбонил]гидразино}-2-гидроксипропионовая кислота
14. (R)-3-[N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-(3-этилизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
15. (R)-3-{N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-[3-(2-метоксифенил)изоксазол-5-карбонил]гидразино}-2-гидроксипропионовая кислота
16. (R)-3-{N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-[3-(3-хлорфенил)изоксазол-5-карбонил]гидразино}-2-гидроксипропионовая кислота
17. (R)-3-{N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-[3-(2-хлорфенил)изоксазол-5-карбонил]гидразино}-2-гидроксипропионовая кислота
18. (R)-3-{N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-[3-(2-фторфенил)изоксазол-5-карбонил]гидразино}-2-гидроксипропионовая кислота
19. этиловый эфир (R)-3-{N-(5'-хлор-2'-фторбифенил-4-илметил)-N'-[3-(2-фторфенил)изоксазол-5-карбонил]гидразино}-2-гидроксипропионовой кислоты
20. 2-морфолин-4-илэтиловый эфир (R)-3-{N-(5'-хлор-2'-фторбифенил-4-илметил)-N'-[3-(2-фторфенил)изоксазол-5-карбонил]гидразино}-2-гидроксипропионовой кислоты
21. (R)-3-[N-(3'-Хлор-2'-фторбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
22. (S)-3-[N-(2',5'-Дихлорбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
23. (S)-3-[N-(5'-Хлор-2'-фтор-3'-метилбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
24. (S)-3-[N-(5'-Хлор-3'-фторбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
25. (R)-3-[N-(3',5'-Дихлорбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
26. (S)-3-[N-(3',5'-Дифторбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
27. (S)-3-[N-(5'-Хлор-3'-гидроксибифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
28. (S)-3-[N-(3',5'-Дихлор-2'-метилбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
29. (R)-3-[N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-(3-хлор-изоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
30. (R)-3-[N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-(3-изобутилизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
31. (R)-3-[N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-(3-пропилизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
32. (R)-3-[N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-(3-изопропилизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
33. (R)-3-[N'-(3-трет-бутилизоксазол-5-карбонил)-N-(5'-хлор-2'-фторбифенил-4-илметил)гидразино]-2-гидроксипропионовая кислота

34. (R)-3-[N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-(5-пиридин-3-илизоксазол-3-карбонил)гидразино]-2-гидроксипропионовая кислота

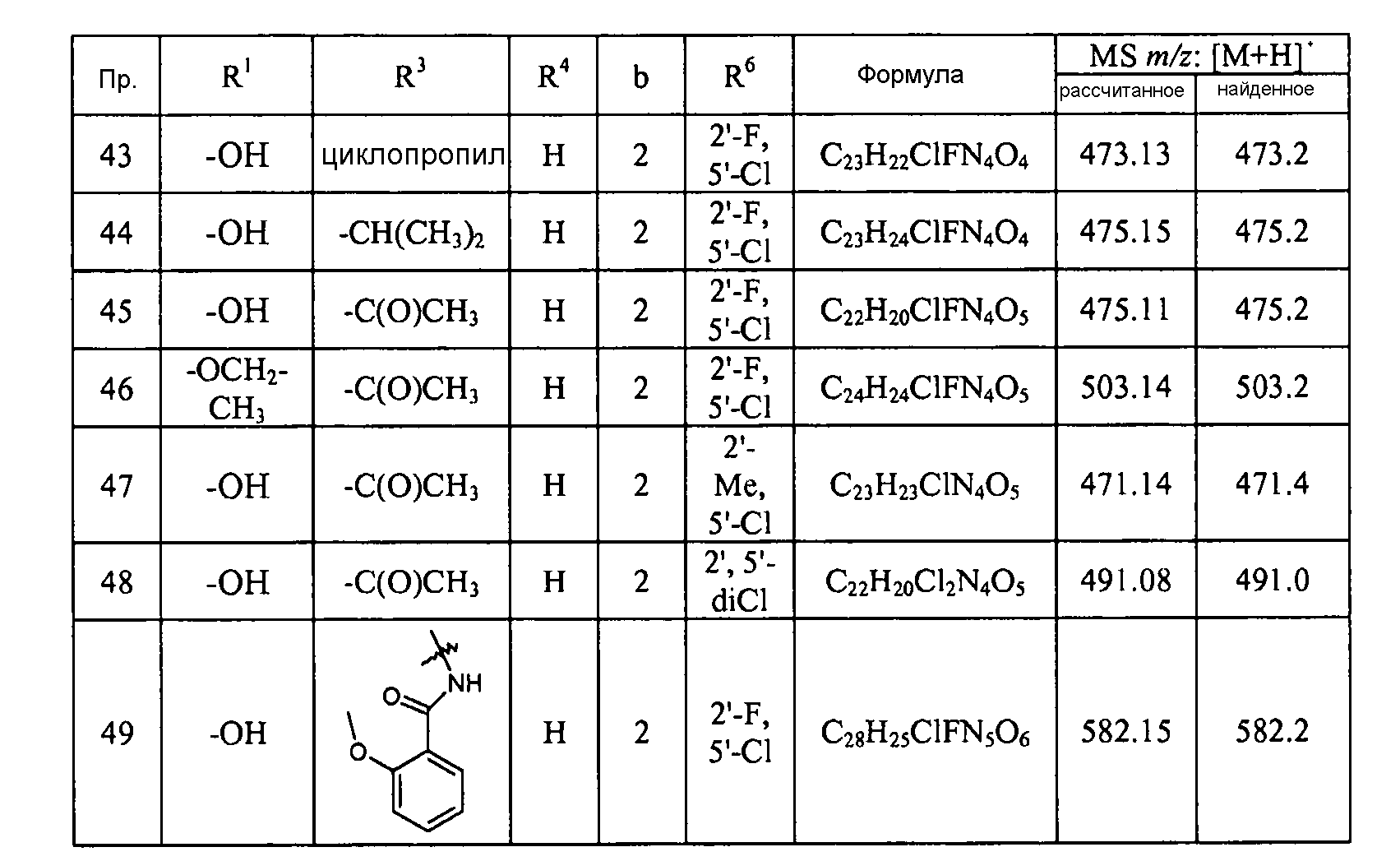
35. (R)-3-[N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-(5-диметилкарбамоил-2H-пиразол-3-карбонил)гидразино]-2-гидроксипропионовая кислота
36. (R)-3-[N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-(5-пиридин-2-ил-2H-пиразол-3-карбонил)гидразино]-2-гидроксипропионовая кислота
37. этиловый эфир (R)-3-[N-(5'-хлор-2'-фторбифенил-4-илметил)-N'-(5-пиридин-2-ил-2H-пиразол-3-карбонил)гидразино]-2-гидроксипропионовой кислоты
38. (R)-3-{N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-[5-(2-гидроксифенил)-2H-пиразол-3-карбонил]гидразино}-2-гидроксипропионовая кислота
39. (R)-3-{N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-[5-(2-метоксифенил)-2H-пиразол-3-карбонил]гидразино}-2-гидроксипропионовая кислота
40. (R)-3-{N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-[5-(1-гидрокси-1-метилэтил)-2H-пиразол-3-карбонил]гидразино}-2-гидроксипропионовая кислота
41. (R)-3-{N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-[5-(2,5-дифторфенил)-2H-пиразол-3-карбонил]гидразино}-2-гидроксипропионовая кислота
42. (R)-3-[N'-(5-Бутил-2H-пиразол-3-карбонил)-N-(5'-хлор-2'-фторбифенил-4-илметил)гидразино]-2-гидроксипропионовая кислота
43. (R)-3-[N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-(5-циклопропил-2H-пиразол-3-карбонил)гидразино]-2-гидроксипропионовая кислота
44. (R-3-[N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-(5-изопропил-2H-пиразол-3-карбонил)гидразино]-2-гидроксипропионовая кислота
45. (S)-3-[N'-(5-Ацетил-2H-пиразол-3-карбонил)-N-(5'-хлор-2'-фторбифенил-4-илметил)гидразино]-2-гидроксипропионовая кислота
46. этиловый эфир (S)-3-[N'-(5-ацетил-2H-пиразол-3-карбонил)-N-(5'-хлор-2'-фторбифенил-4-илметил)гидразино]-2-гидроксипропионовой кислоты
47. (S)-3-[N'-(5-Ацетил-2H-пиразол-3-карбонил)-N-(5'-хлор-2'-метилбифенил-4-илметил)гидразино]-2-гидроксипропионовая кислота
48. (S)-3-[N'-(5-Ацетил-2H-пиразол-3-карбонил)-N-(2',5'-дифторбифенил-4-илметил)гидразино]-2-гидроксипропионовая кислота
49. (R)-3-{N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-[5-(2-метоксибензоиламино)-2H-пиразол-3-карбонил]гидразино}-2-гидроксипропионовая кислота

50. (R)-3-[N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-(5-пиразин-2-ил-1H-пиразол-3-карбонил)гидразино]-2-гидроксипропионовая кислота
51. (R)-3-[N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-(5-гидрокси-1-пиридин-2-ил-1H-пиразол-3-карбонил)гидразино]-2-гидроксипропионовая кислота
52. (R)-3-{N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-[1-(2-фторфенил)-5-гидрокси-1H-пиразол-3-карбонил]гидразино}-2-гидроксипропионовая кислота
53. (R)-3-[N'-(1-Карбоксиметил-5-циклопропил-1H-пиразол-3-карбонил)-N-(5'-хлор-2'-фторбифенил-4-илметил)гидразино]-2-гидроксипропионовая кислота
54. (R)-3-[N'-(1-Карбоксиметил-5-изопропил-1H-пиразол-3-карбонил)-N-(5'-хлор-2'-фторбифенил-4-илметил)гидразино]-2-гидроксипропионовая кислота
55. (R)-3-[N'-(5-Бутил-1-карбоксиметил-1H-пиразол-3-карбонил)-N-(5'-хлор-2'-фторбифенил-4-илметил)гидразино]-2-гидроксипропионовая кислота
56. (R)-3-[N'-[1-Карбоксиметил-5-(1-гидрокси-1-метилэтил)-1H-пиразол-3-карбонил]-N-(5'-хлор-2'-фторбифенил-4-илметил)гидразино]-2-гидроксипропионовая кислота
57. (R)-3-[N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-(5-этокси-1H-пиразол-3-карбонил)гидразино]-2-гидроксипропионовая кислота
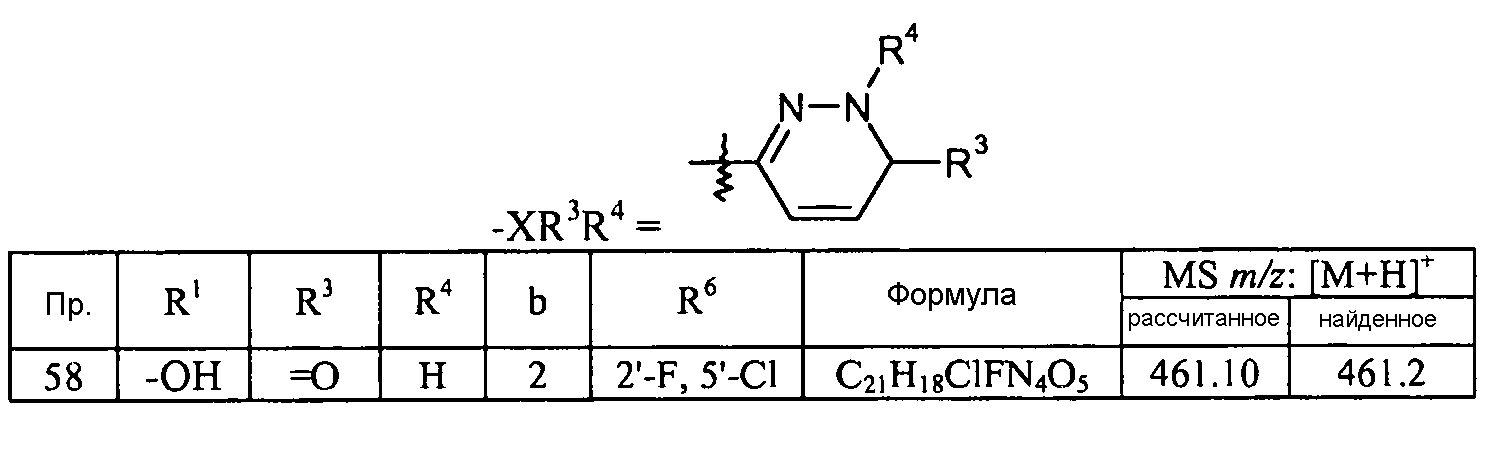
58. (R)-3-[N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-(6-оксо-1,6-дигидропиридазин-3-карбонил)гидразино-2-гидроксипропионовая кислота

59. (R)-3-[N-(5'-Хлор-2'-метилбифенил-4-илметил)-N'-(1H-тетразол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
60. (R)-3-[N-(2',5'-Дихлорбифенил-4-илметил)-N'-(1H-тетразол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
61. изобутиловый эфир (R)-3-[N-(2',5'-дихлорбифенил-4-илметил)-N'-(1H-тетразол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты
62. изопропиловый эфир (R)-3-[N-(2',5'-дихлорбифенил-4-илметил)-N'-(1H-тетразол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты
63. этиловый эфир (R)-3-[N-(2',5'-Дихлорбифенил-4-илметил)-N'-(1H-тетразол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты
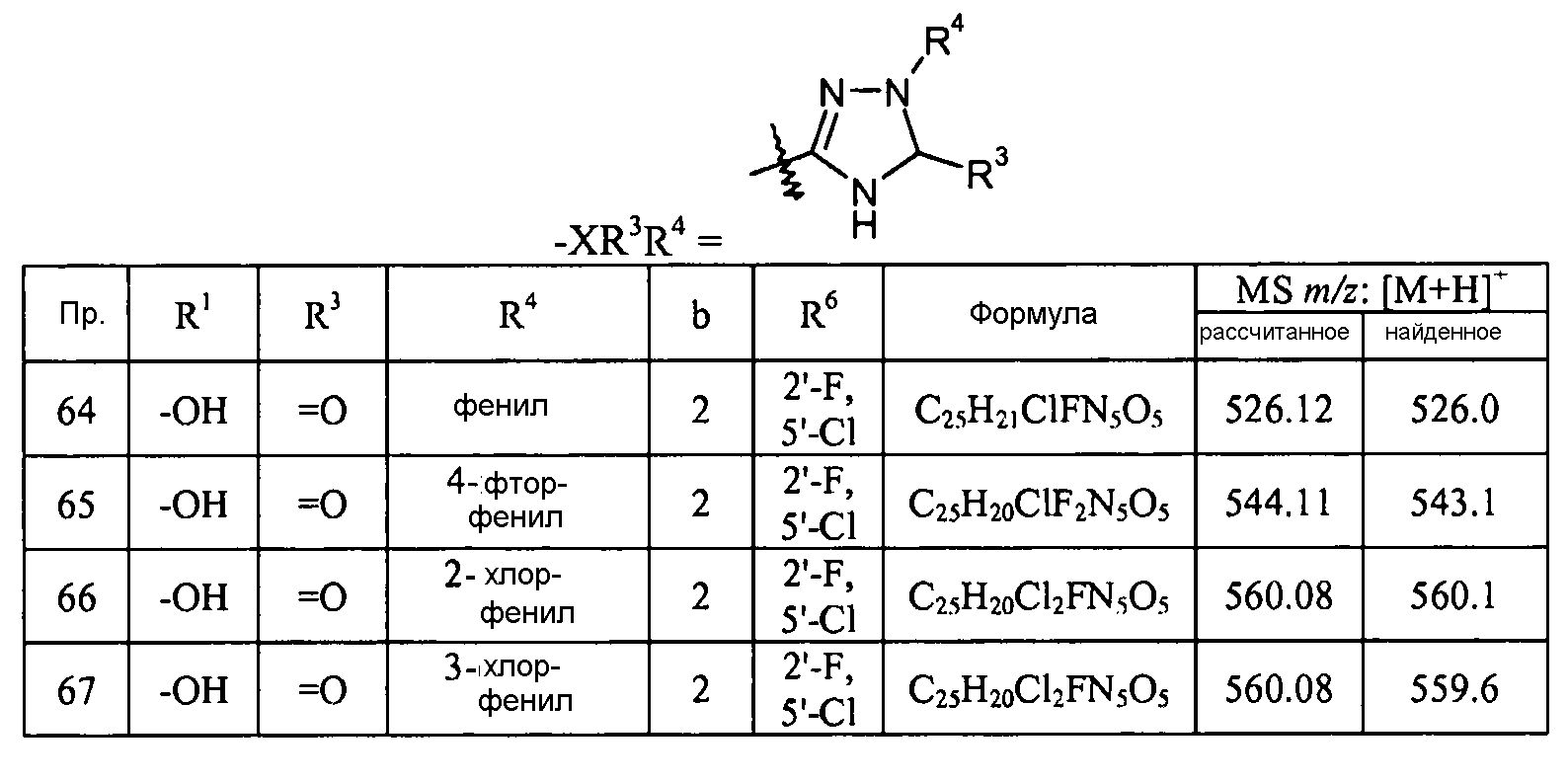
64. (R)-3-[N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-(5-оксо-1-фенил-4,5-дигидро-1H-[1,2,4]триазол-3-карбонил)гидразино]-2-гидроксипропионовая кислота
65. (R)-3-{N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-[1-(4-фторфенил)-5-оксо-4,5-дигидро-1H-[1,2,4]триазол-3-карбонил]гидразино}-2-гидроксипропионовая кислота
66. (R)-3-{N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-[1-(2-хлорфенил)-5-оксо-4,5-дигидро-1H-[1,2,4]триазол-3-карбонил]гидразино}-2-гидроксипропионовая кислота
67. (R)-3-{N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-[1-(3-хлорфенил)-5-оксо-4,5-дигидро-1H-[1,2,4]триазол-3-карбонил]гидразино}-2-гидроксипропионовая кислота

68. (R)-3-[N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-(7-метил-3H-бензотриазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
69. (R)-3-[N'-(7-Хлор-3H-бензотриазол-5-карбонил)-N-(5'-хлор-2'-фторбифенил-4-илметил)гидразино]-2-гидроксипропионовая кислота
70. этиловый эфир (R)-3-[N'-(7-Хлор-3H-бензотриазол-5-карбонил)-N-(5'-хлор-2'-фторбифенил-4-илметил)гидразино]-2-гидроксипропионовой кислоты
71. изопропиловый эфир (R)-3-[N'-(7-Хлор-3H-бензотриазол-5-карбонил)-N-(5'-хлор-2'-фторбифенил-4-илметил)гидразино]-2-гидроксипропионовой кислоты
72. изобутиловый эфир (R)-3-[N'-(7-Хлор-3H-бензотриазол-5-карбонил)-N-(5'-хлор-2'-фторбифенил-4-илметил)гидразино]-2-гидроксипропионовой кислоты
73. (R)-3-[N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-(7-фтор-3H-бензотриазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
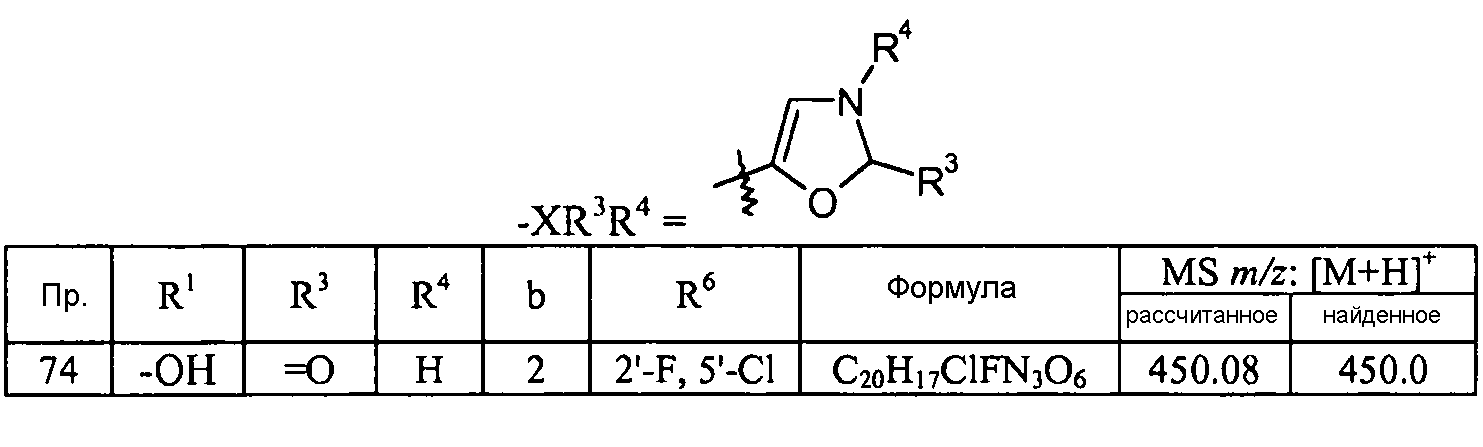
74. (R)-3-[N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-(2-оксо-2,3-дигидрооксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота

75. (R)-3-[N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-(3H-[1,2,3]триазол-4-карбонил)гидразино]-2-гидроксипропионовая кислота
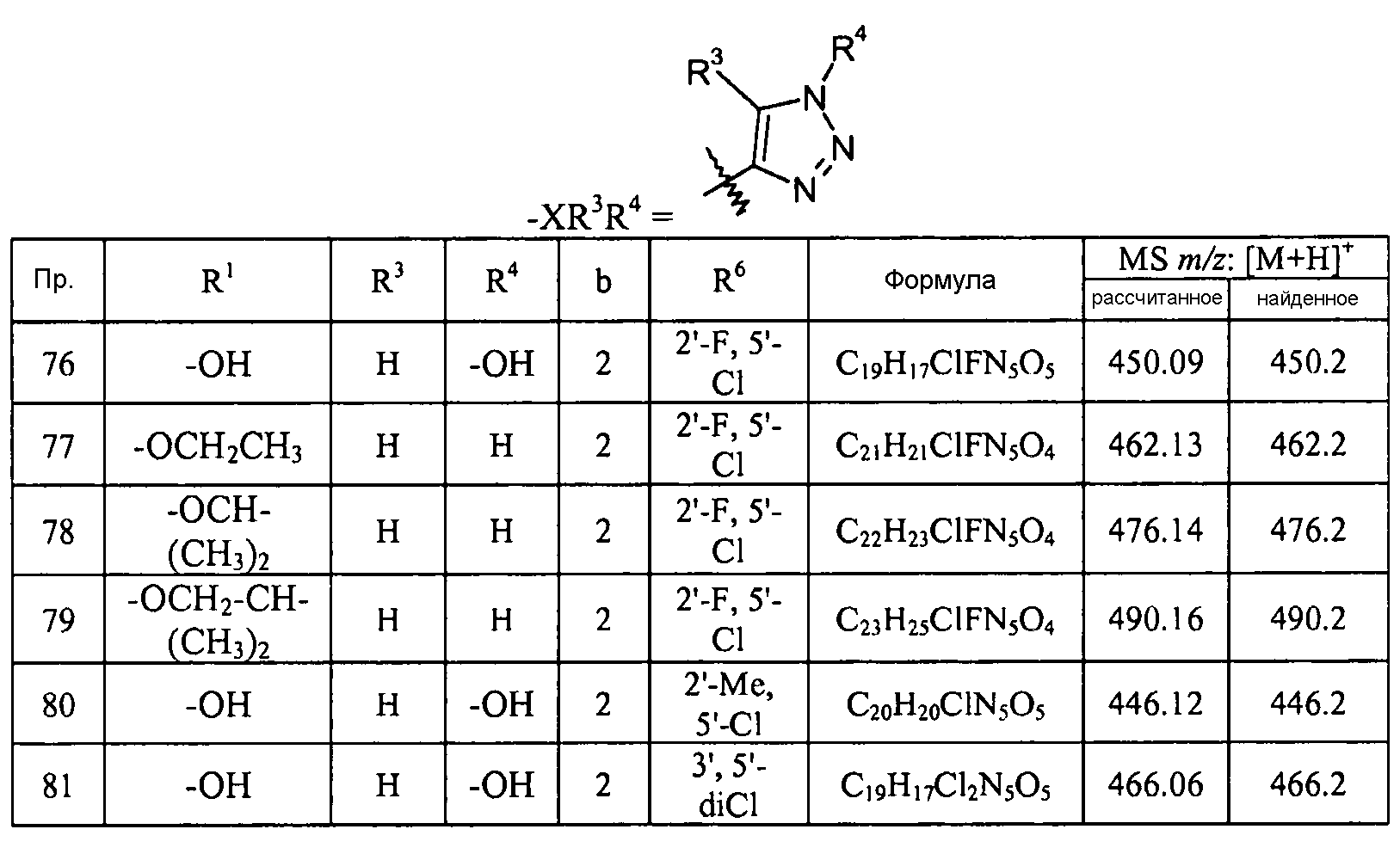
76. (R)-3-[N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-(1-гидрокси-1H-[1,2,3]триазол-4-карбонил)гидразино]-2-гидроксипропионовая кислота
77. этиловый эфир (R)-3-[N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-(1H-[1,2,3]триазол-4-карбонил)гидразино]-2-гидроксипропионовой кислоты
78. изопропиловый эфир (R)-3-[N-(5'-хлор-2'-фторбифенил-4-илметил)-N'-(1H-[1,2,3]триазол-4-карбонил)гидразино]-2-гидроксипропионовой кислоты
79. изобутиловый эфир (R)-3-[N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-(1H-[1,2,3]триазол-4-карбонил)гидразино]-2-гидроксипропионовой кислоты
80. (R)-3-[N-(5'-Хлор-2'-метилбифенил-4-илметил)-N'-(1-гидрокси-1H-[1,2,3]триазол-4-карбонил)гидразино]-2-гидроксипропионовая кислота
81. (R)-3-[N-(3',5'-Дихлорбифенил-4-илметил)-N'-(1-гидрокси-1H-[1,2,3]триазол-4-карбонил)гидразино]-2-гидроксипропионовая кислота

82. (R)-3-[N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-(5-хлор-1H-[1,2,4]триазол-3-карбонил)гидразино-2-гидроксипропионовая кислота
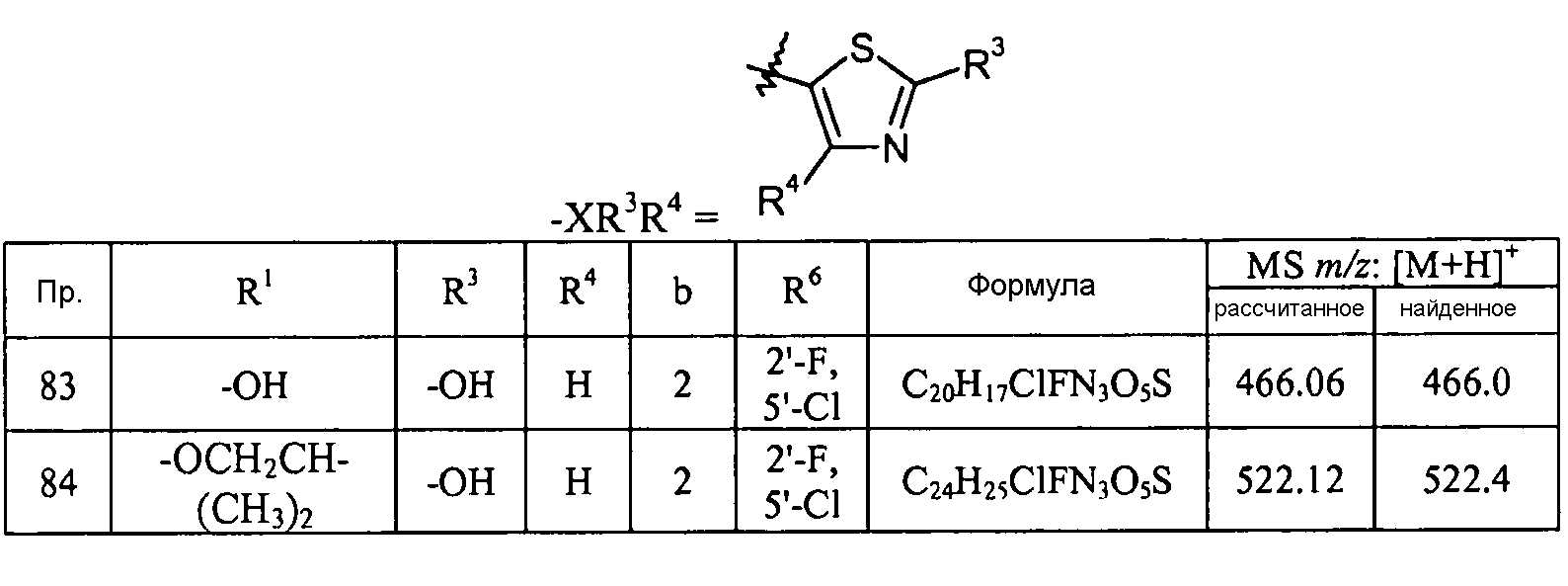
83. (R)-3-[N-(5'-Хлор-2'-фторбифенил-4-илметил)-N'-(2-гидрокситиазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
84. изобутиловый эфир (R)-3-[N-(5'-хлор-2'-фторбифенил-4-илметил)-N'-(2-гидрокситиазол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты
Способ получения 10
Метиловый эфир (R)-3-[N-('4-бром-2-фторбензил)гидразино]-2-гидроксипропионовой кислоты
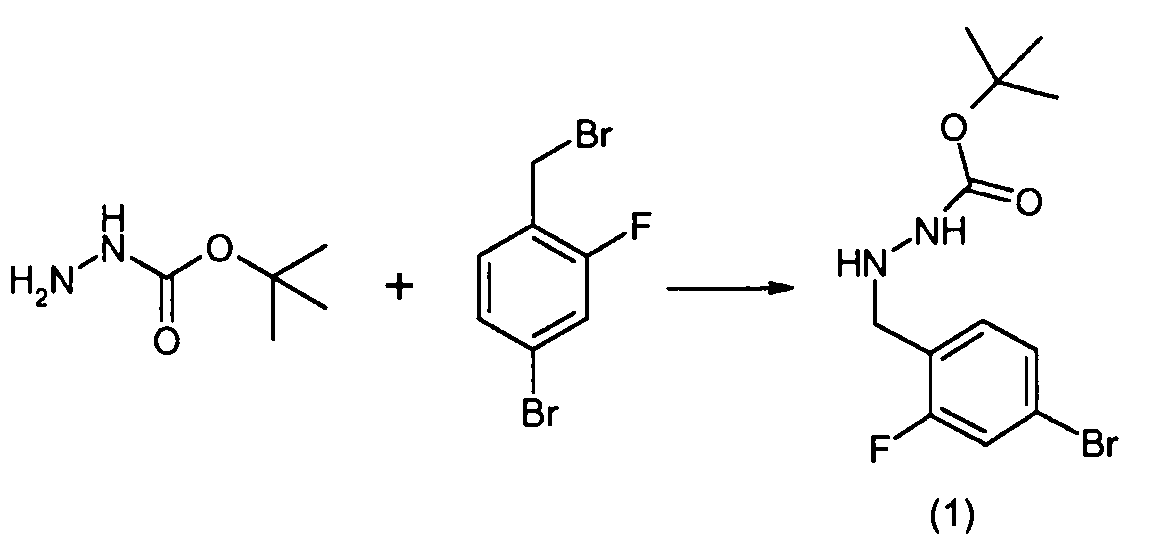
4-Бром-2-фторбензилбромид (5,0 г, 19 ммоль) и DIPEA (3,3 мл, 18,7 ммоль) растворяли в DMF (20 мл). Добавляли трет-бутилкарбазат (7,4 г, 56,0 ммоль), и смесь перемешивали при комнатной температуре до завершения реакции. Смесь частично концентрировали, затем остаток распределяли между EtOAc и насыщенным водным NaHCO3 раствором. Затем EtOAc слой сушили над Na2SO4 и концентрировали. Неочищенный продукт очищали флэш-хроматографией, получая соединение 1 (4,7 г).
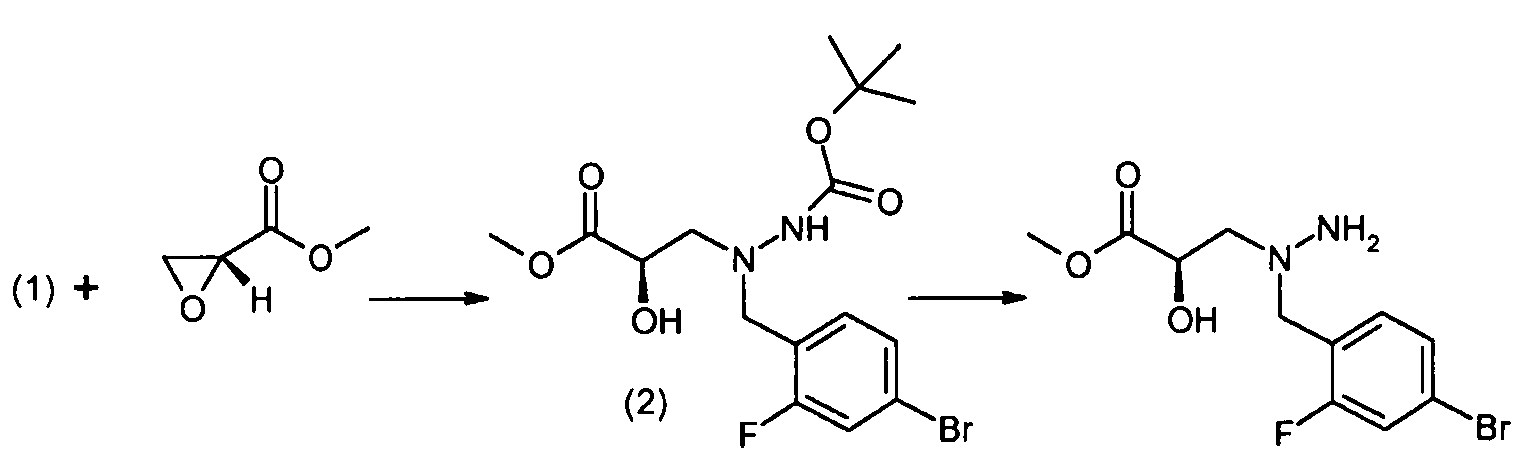
Соединение 1 (1,9 г, 6,3 ммоль) растворяли в изопропиловом спирте (30 мл). Добавляли метил (2R)-глицидат (3,3 мл, 37,3 ммоль), и смесь кипятили с обратным холодильником при 90°C до завершения реакции (~2 дня). Смесь концентрировали, получая соединение 2 (4,7 г).
Соединение 2 растворяли в 1:1 EtOH и 4н HCl в диоксане и перемешивали в течение ночи. Затем смесь концентрировали, получая заявленное в заголовке соединение (330 мг).
ПРИМЕР 9
A. (R)-3-[N-(3'-Хлор-3-фторбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
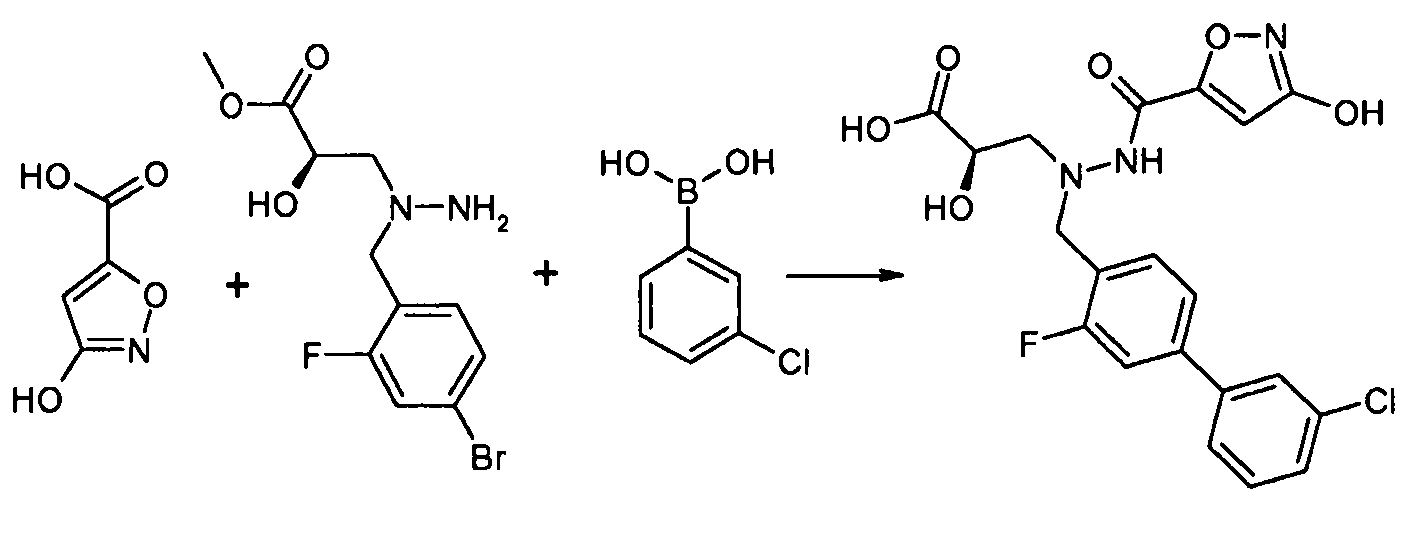
3-Гидроксиизоксазол-5-карбоновую кислоту (24,1 мг, 186 мкмоль) объединяли с HATU (70,9 мг, 186 мкмоль) в DMF (2 мл) и перемешивали в течение 5 минут при комнатной температуре. Добавляли DIPEA (54 мкл, 311 мкмоль) и метиловый эфир (R)-3-[N-(4-бром-2-фторбензил)гидразино]-2-гидроксипропионовой кислоты (50 мг, 0,2 ммоль), и полученную в результате смесь перемешивали в течение 10 минут. Смесь упаривали при пониженном давлении, и остаток разбавляли EtOAc, и промывали водой и насыщенным водным NaCl. Органический слой отделяли и концентрировали. Добавляли 3-хлорфенилбороновую кислоту (43,8 мг, 280 мкмоль), K2CO3 (65 мг, 467 мкмоль), EtOH (0,8 мл) и воду (0,2 мл), с последующим добавлением SilicaCat®Pd(0) (0,09 ммоль/г загрузка; 121 мг, 11 мкмоль). Смесь грели при 120°C до завершения реакции (10 минут). Смесь фильтровали, концентрировали и очищали препаративной ВЭЖХ, получая заявленное в заголовке соединение в виде TFA соли (9,7 мг; чистота 95%). MS m/z [M+H]+ рассчитанная для C20H17ClFN3O6, 450,08; найденная 450,2.
B. Изобутиловый эфир (R)-3-[N-(3'-хлор-3-фторбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты

(R)-3-[N-(3'-Хлор-3-фторбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовую кислоту (75 мг, 0,2 ммоль) растворяли в изобутиловом спирте (3 мл, 30 ммоль) и добавляли 4 M HCl в диоксане (1 мл, 4 ммоль). Смесь перемешивали при комнатной температуре до завершения реакции (~3 часа), затем упаривали при пониженном давлении и очищали препаративной ВЭЖХ, получая заявленное в заголовке соединение в виде TFA соли (26 мг; чистота 95%). MS m/z [M+H]+ рассчитанная для C24H25ClFN3O6, 506,14; найденная 506.
C. Изопропиловый эфир (R)-3-[N-(3'-хлор-3-фторбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовой кислоты
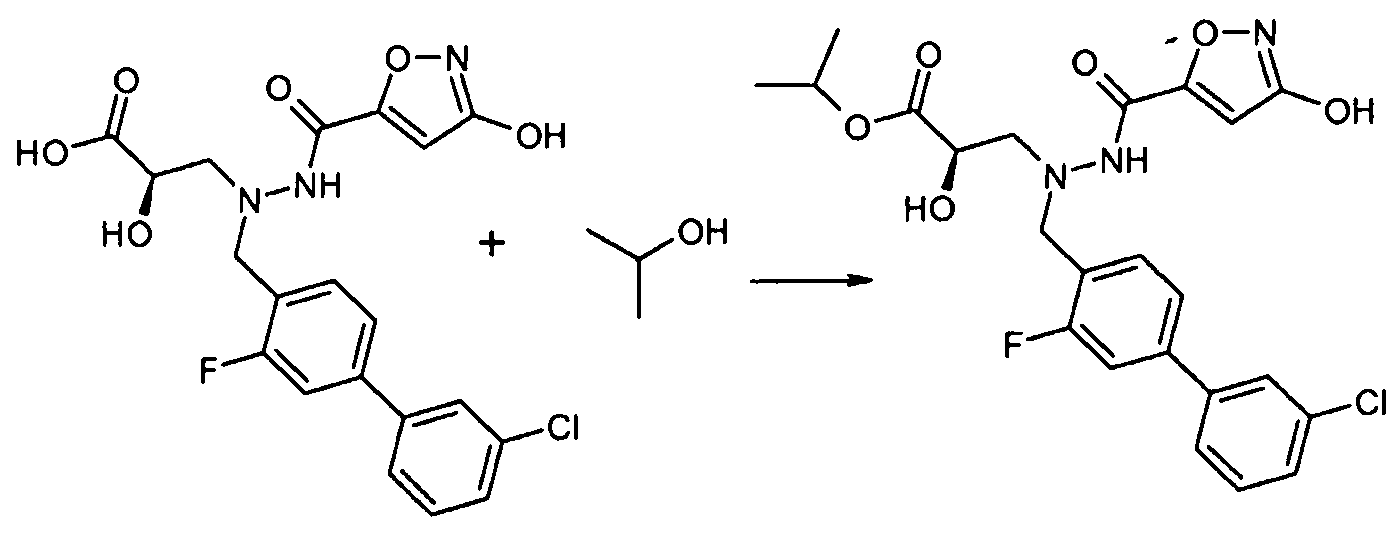
(R)-3-[N-(3'-Хлор-3-фторбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовую кислоту (75 мг, 0,2 ммоль) растворяли в изопропиловом спирте (2 мл, 20 ммоль) и добавляли 4 M HCl в диоксане (1 мл, 4 ммоль). Смесь перемешивали при комнатной температуре до завершения реакции (~3 часа), затем упаривали при пониженном давлении и очищали препаративной ВЭЖХ, получая заявленное в заголовке соединение в виде TFA соли (20 мг; чистота 95%). MS m/z [M+H]+ рассчитанная для C23H23ClFN3O6, 492,13; найденная 492,2.
ПРИМЕР 10
Следуя способам, описанным в примерах в настоящем изобретении, и заменяя на подходящие исходные вещества и реагенты, получали соединения, имеющие следующую формулу, или в виде исходного соединения или в виде TFA соли:
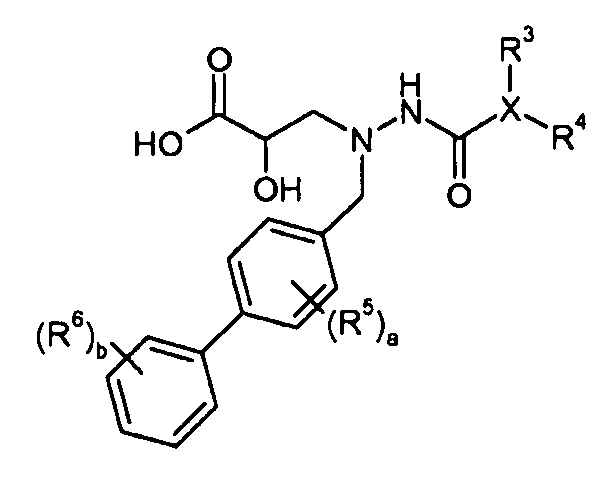
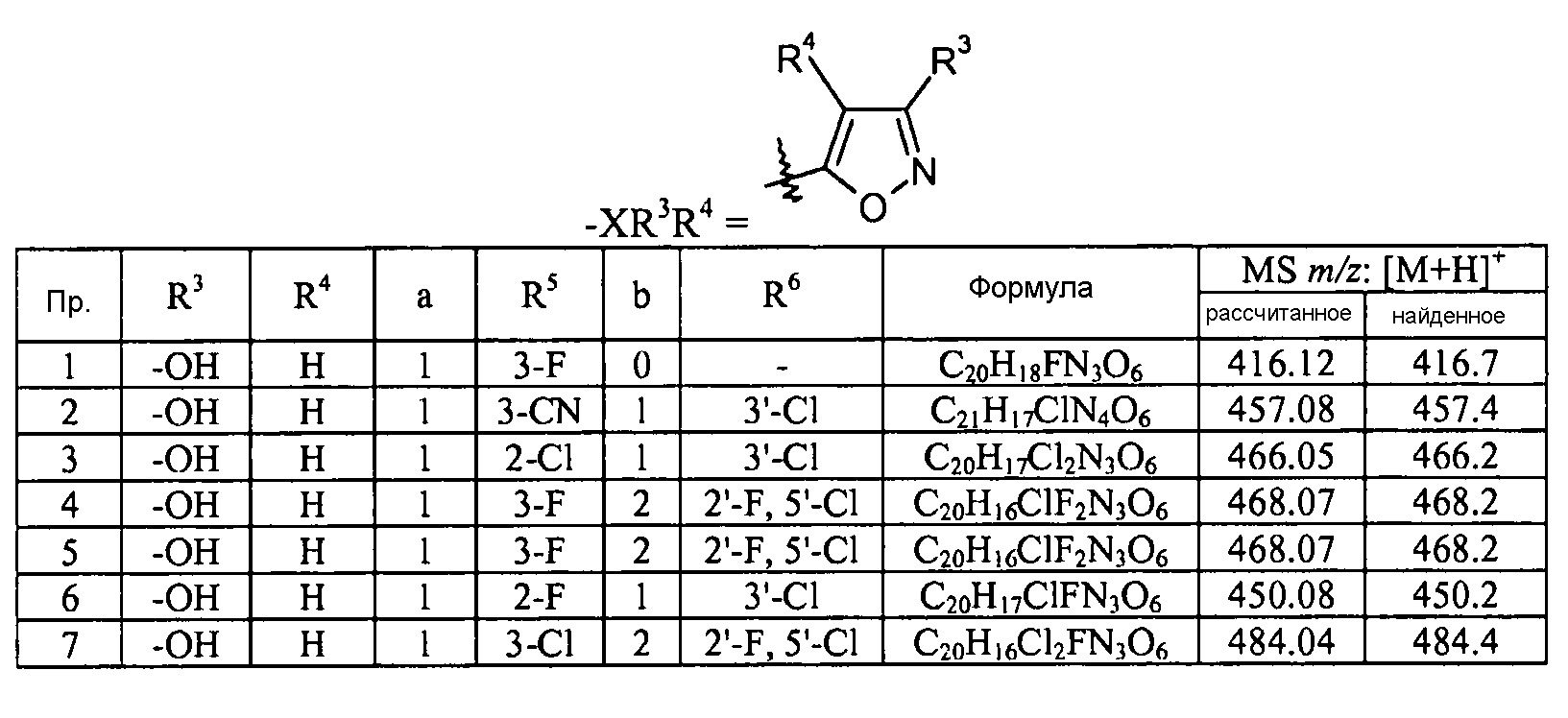
1. (R)-3-[N-(3-Фторбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
2. (R)-3-[N-(3'-Хлор-3-цианобифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
3. (R)-3-[N-(2,3'-Дихлорбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
4. (R)-3-[N-(5'-Хлор-3,2'-дифторбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
5. (R)-3-[N-(5'-Хлор-3,2'-дифторбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
6. (R)-3-[N-(3'-Хлор-2-фторбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота
7. (R)-3-[N-(3,5'-Дихлор-2'-фторбифенил-4-илметил)-N'-(3-гидроксиизоксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота

8. (R)-3-[N-(3'-Хлор-3-фторбифенил-4-илметил)-N'-(1H-тетразол-5-карбонил)гидразино]-2-гидроксипропионовая кислота

9. (R)-3-[N-(3'-Хлор-3-фторбифенил-4-илметил)-N'-(1-гидрокси-1H-[1,2,3]триазол-4-карбонил)гидразино]-2-гидроксипропионовая кислота
10. (R)-3-[N-(3,5'-Дихлор-2'-фторбифенил-4-илметил)-N'-(1H-[1,2,3]триазол-4-карбонил)гидразино]-2-гидроксипропионовая кислота
11. (R)-3-[N-(3,3'-Дихлорбифенил-4-илметил)-N'-(1H-[1,2,3]триазол-4-карбонил)гидразино]-2-гидроксипропионовая кислота
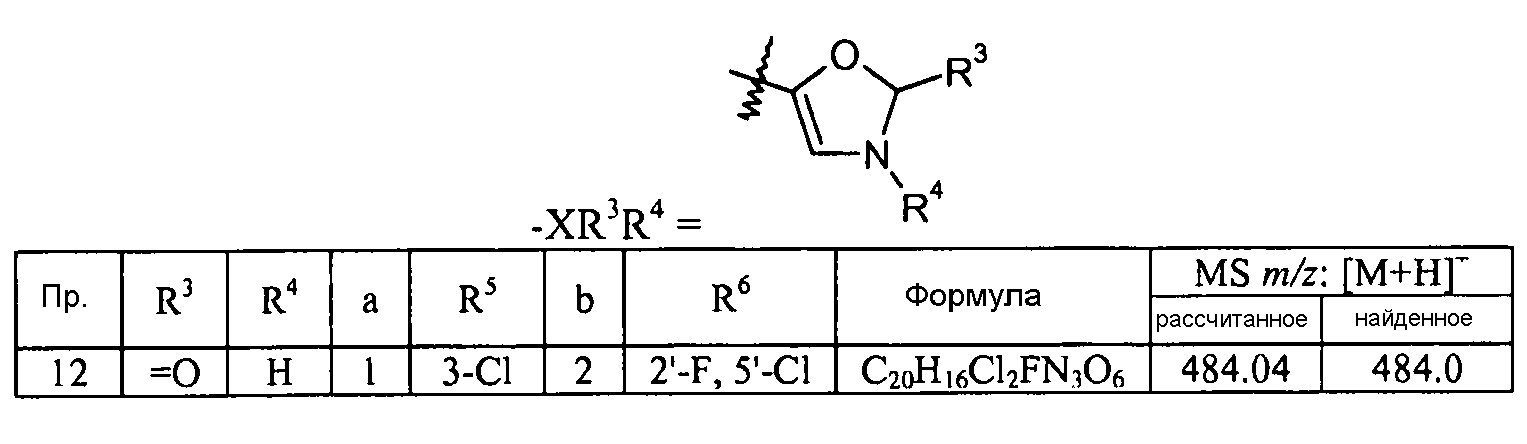
12. (R)-3-[N-(3,5'-Дихлор-2'-фторбифенил-4-илметил)-N'-(2-оксо-2,3-дигидрооксазол-5-карбонил)гидразино]-2-гидроксипропионовая кислота (исходное)
АНАЛИЗ 1
In vitro анализы для количественного определения эффективности ингибитора (IC50) относительно человеческого и крысиного NEP и человеческого ACE
Ингибирующие активности соединений относительно человеческого и крысиного неприлизина (EC 3.4.24.11; NEP) и человеческого ангиотензин-превращающего фермента (ACE) определяли, применяя in vitro анализы, как описано ниже.
Экстракция NEP активности из крысиных почек
Крысиный NEP получали из почек взрослых крыс линии Sprague Dawley Доули. Цельные почки промывали охлажденным фосфатно-буферным соляным раствором (PBS) и помещали в охлажденный на льду буфер для лизиса (1% Triton X-114, 150 мМ NaCl, 50 мМ трис(гидроксиметил)аминометан (Tris) pH 7,5; Bordier (1981) J. Biol. Chem. 256: 1604-1607) с соотношением 5 мл буфера для каждого грамма почек. Образцы гомогенизировали на льду, применяя polytron ручной гомогенизатор ткани. Гомогенаты центрифугировали при 1000×g в бакет-роторе в течение 5 минут при 3°C. Осадок в пробирке после центрифугирования повторно суспендировали в 20 мл охлажденного на льду буфера для лизиса и выдерживали на льду в течение 30 минут. Затем образцы (15-20 мл) наслаивали на 25 мл охлажденную на льду подушку-буфер (6% масс./об. сахароза, 50 мМ pH 7,5 Tris, 150 мМ NaCl, 0,06%, Triton X-114), грели при 37°C в течение 3-5 минут и центрифугировали при 1000×g в бакет-роторе при комнатной температуре в течение 3 минут. Два верхних слоя отсасывали, оставляя вязкий маслянистый осадок, содержащий обогащенную мембранную фракцию. Добавляли глицерин до концентрации 50%, и образцы хранили при -20°C. Концентрации белка количество определяли, применяя BCA систему детекции с бычьим сывороточным альбумином (BSA) в качестве стандарта.
Анализы на ингибирование фермента
Рекомбинантный человеческий NEP и рекомбинантный человеческий ACE получали у производителя (R&D Systems, Minneapolis, MN, номера в каталоге 1182-ZN и 929-ZN, соответственно). Флуорогенный пептидный субстрат Mca-D-Arg-Arg-Leu-Dap-(Dnp)-OH (Medeiros et al. (1997) Braz. J. Med. Biol. Res. 30: 1157-62; Anaspec, San Jose, CA) и Abz-Phe-Arg-Lys(Dnp)-Pro-OH (Araujo et al. (2000) Biochemistry 39:8519-8525; Bachem, Torrance, CA) применяли в NEP и ACE анализах, соответственно.
Анализы проводили в 384-луночных белых непрозрачных планшетах при 37°C, применяя флуорогенные пептидные субстраты при концентрации 10 мкМ в буфере для анализа (NEP: 50 мМ HEPES, pH 7,5, 100 мМ NaCl, 0,01% монолаурат полиэтиленгликольсорбитана (Tween-20), 10 мкМ ZnSO4; ACE: 50 мМ HEPES, pH 7,5, 100 мМ NaCl, 0,01% Tween-20, 1 мкМ ZnSO4). Соответствующие ферменты применяли при концентрациях, которые приводили в результате к количественному протеолизу 1 мкМ субстрата через 20 минут при 37°C.
Испытуемые соединения анализировали в диапазоне концентраций от 10 мкМ до 20 пМ. Испытуемые соединения добавляли к ферментам и выдерживали в течение 30 минут при 37°C перед началом реакции добавлением субстрата. Реакции прекращали после 20-минутного выдерживания при 37°C добавлением ледяной уксусной кислоты до конечной концентрации 3,6% (об./об.).
Планшеты считывали на флуориметре с длинами волн возбуждения и испускания, установленными на 320 нм и 405 нм, соответственно. Константы ингибирования получали нелинейной регрессией данных, применяя уравнение (GraphPad Software, Inc., San Diego, CA):
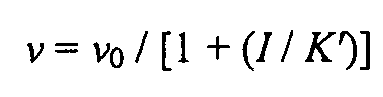
где ν представляет собой скорость реакции, ν0 представляет собой неингибированную скорость реакции, I представляет собой концентрацию ингибитора и K' представляет собой кажущуюся константу ингибирования.
Соединения настоящего изобретения испытывали в данном анализе и обнаружили, что они имеют следующие pKi величины относительно NEP. В общем, или пролекарственные соединения не ингибировали фермент в данном in vitro анализе, или пролекарства не испытывали (n.d.), поскольку не ожидали их активности.

АНАЛИЗ 2
Фармакодинамический (PD) анализ относительно ACE и NEP активности на анестезированных крысах
Мужских особей нормотензивных крыс линии Sprague Dawley анестезировали 120 мг/кг (интраперитонеально) инактина. После анестезирования катетеры яремной вены, сонной артерии (PE 50 трубка) и мочевого пузыря (PE 50 трубка с расширением на конце) канюлировали, и проводили трахеотомию (Teflon игла, калибр иглы 14) для облегчения самостоятельного дыхания. Животным позволяли восстановиться в течение 60 минут и поддерживали постоянное вливание 5 мл/кг/ч соляного раствора (0,9%) за весь период времени, не давая животным стать обезвоженными и обеспечивая продукцию мочи. Температуру тела поддерживали в течение всего эксперимента применением нагревательной подушки. В конце 60-минутного периода стабилизации животным вводили внутривенно (i.v.) две дозы AngI (1,0 мкг/кг, для ACE ингибирующей активности) через 15 минут. Через 15 минут после введения второй дозы AngI животных обрабатывали средой или испытуемым соединением. Через пять минут животных дополнительно обрабатывали болюсной внутривенной инъекцией атриального натрийуретического пептида (ANP; 30 мкг/кг). Сбор мочи (в предварительно взвешенные пробирки eppendorf) начинали непосредственно после ANP обработки и продолжали в течение 60 минут. Через 30 и 60 минут после начала сбора мочи животным повторно вводили AngI. Измерение кровяного давления осуществляли, применяя Notocord систему (Kalamazoo, MI). Образцы мочи замораживали при -20°C до применения для цГМФ анализа. Концентрации цАМФ в моче определяли Enzyme Immuno анализом, применяя имеющийся в продаже набор (Assay Designs, Ann Arbor, Michigan, Cat. No. 901-013). Объем мочи определяли гравиметрически. Продукция цГМФ в моче рассчитывали как произведение продукции в моче и концентрации цАМФ в моче. ACE ингибирование оценивали количественным определением % ингибирования прессорной реакции на AngI. NEP ингибирование оценивали количественным определением усиления ANP-вызванного повышения продукции цАМФ в моче.
АНАЛИЗ 3
In Vivo оценка антигипертензивных эффектов в сознательной SHR модели гипертензии
Крысам со спонтанной гипертензией (SHR, 14-20 недельный возраст) позволяли акклиматизироваться в течение минимум 48 часов перед помещением в место испытания со свободным доступом к воде и пище. Что касается записи показаний кровяного давления, данным животным хирургически имплантировали небольшой радиопередатчик для грызунов (телеметрическая установка; DSI модели TA11PA-C40 или C50-PXT, Data Science Inc., USA). Конец катетера, соединенного с передатчиком, вставляли в нисходящую аорту выше подвздошного разветвления и закрепляли на месте тканевых клеем. Передатчик держали интраперитонеально и закрепляли на абдоминальной стенке, закрывая разрез брюшной стенки нерассасывающимся швом. Внешний слой кожи закрывали нитью и хирургическими скобками. Животным позволяли восстановиться, обеспечивая подходящий послеоперационный уход. В день эксперимента животных в их клетках помещали наверх блоков телеметрического приемника для акклиматизации к окружающей среде при испытании и получении исходных показаний. Через по меньшей мере 2 часа после осуществления исходных измерений животным дозировали среду или испытуемое соединение и осуществляли измерение кровяного давления через 24 часа после введения дозы. Данные регистрировали непрерывно в течение исследования, применяя Notocord программное обеспечение (Kalamazoo, MI) и хранили в виде электронных цифровых сигналов. Измеренными параметрами были кровяное давление (систолическое, диастолическое и среднее артериальное давление) и частота ударов сердца.
АНАЛИЗ 4
In Vivo оценка антигипертензивных эффектов в сознательной DOCA-солевой крысиной модели гипертензии
CD крысам (мужские особи, взрослые, 200-300 грамм, Charles River Laboratory, USA) позволяли акклиматизироваться в течение минимум 48 часов перед помещением в место испытания с режимом питания с высоким содержанием соли. Через одну неделю после начала режима питания с высоким содержанием соли (8% в пище или 1% NaCl в питьевой воде) гранулы дезоксикортикостеронацетата (DOCA) (100 мг, время высвобождения 90 дней, Innovative Research of America, Sarasota, FL) имплантировали подкожно и проводили одностороннюю нефректомию. На данном этапе животным также хирургически имплантировали небольшой радиопередатчик для грызунов для измерения кровяного давления (см. подробности в анализе 3). Животным позволяли восстановиться, обеспечивая подходящий послеоперационный уход. Дизайн исследования, регистрацию данных и измерение параметров осуществляли аналогично тому, как описано в анализе 3.
АНАЛИЗ 5
In Vivo оценка антигипертензивных эффектов в сознательной Dahl/SS крысиной модели гипертензии
Мужским особям крыс линии Dahl, чувствительных к развитию гипертензии при употреблении солевой диеты (Dahl/SS, 6-7 недельный возраст от Charles River Laboratory, USA) позволяли акклиматизироваться в течение минимум 48 часов перед помещением в место испытания с режимом питания с высоким содержанием соли 8% NaCl (TD.92012, Harlan, USA), затем им хирургически имплантировали небольшой радиопередатчик для грызунов для измерения кровяного давления (см. подробности в анализе 3). Животным позволяли восстановиться, обеспечивая подходящий послеоперационный уход. Через приблизительно 4-5 недель после начала режима питания с высоким содержанием соли ожидают, что у данных животных разовьется гипертензия. После подтверждения степени гипертензии, данных животных применяли для исследования, сохраняя режим питания с высоким содержанием соли, сохраняя их степень гипертензии. Дизайн исследования, регистрацию данных и измерение параметров осуществляли аналогично тому, как описано в анализе 3.
Тогда как настоящее изобретение описано со ссылкой на его конкретные аспекты или варианты осуществления, специалисту в данной области техники ясно, что различные изменения можно осуществлять или можно заменять эквивалентами, не выходя за пределы реальной сущности и объема настоящего изобретения. Кроме того, в тех случаях, когда позволено применяемым патентным законодательством и инструкциями, все публикации, патенты и патентные заявки, приводимые в настоящем изобретении, включены в настоящее изобретение с помощью ссылки во всей своей полноте в той же степени, как если каждый документ отдельно включен в настоящее изобретение с помощью ссылки.
Реферат
Изобретение относится к соединению формулы I, где Rпредставляет собой -OR; Rпредставляет собой Н; X выбран из пиразола, триазола, бензотриазола, тетразола, оксазола, изоксазола, тиазола, пиридазина, пиримидина и пиридилтриазола; Rотсутствует или выбран из Н; галогена; -Салкилен-ОН; -Салкила; -Сциклоалкила; -Салкилен-О-Салкила; -C(O)R; -Салкилен-COOR; -С(О)NRR; -NHC(O)R; =O; фенила, необязательно замещенного одной или двумя группами, независимо выбранными из галогена, -ОСН, -NHC(O)CHи фенила; нафталенила; пиридинила; пиразинила; и R, когда он присутствует, соединен с атомом углерода; Rвыбран из Н; -ОН; -Cалкилен-COOR; -пиридинила; и фенила или бензила, необязательно замещенного одной или более группами, выбранными из галогена и -ОСН; и R, когда он присутствует, соединен с атомом углерода или атомом азота; а равен 0; или а равен 1; и Rвыбран из галогена и -CN; b равен 0; или b равен 1, и Rвыбран из Cl, F, -ОН, -СН, -ОСНи -CF; или b равен 2, и Rкаждый независимо выбран из галогена, -ОН, -СН, или -ОСН, или b равен 3, и Rкаждый независимо выбран из галогена или -СН; Rвыбран из Н, -Салкила, -Салкилен-Сарила, -Салкиленморфолинила или диоксол-2-онметила, формулы (а); или его фармацевтически приемлемой соли. Соединения формулы (I) получают путем конденсации соединения формулы 1 с соединением формулы 2, где Рпредставляет собой Н или трет-бутоксикарбонил; и при этом способ дополнительно включает снятие защитной группы соединения формулы 1, когда Рпредставляет собой трет-бутоксикарбонил. Также соединения формулы (I) получают путем снятия защитной группы соединения формулы (6) или его соли; где Rпредставляет собой -O-Р, где Рпредставляет собой метил. Изобретение также относится к промежуточным соединениям, представленным формулами (1) и (6). Соединения формулы (I) предназначены для ингибирования активности неприлизина. Технический результат - соединения, обладающие ингибирующей неприлизин активностью. 7 н. и 12 з.п. ф-лы, 9 пр.,(а),,
Формула
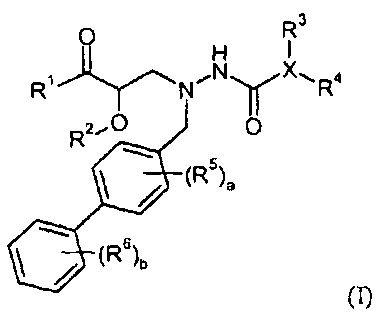
где
R1 представляет собой -OR7;
R2 представляет собой Н;
X выбран из пиразола, триазола, бензотриазола, тетразола, оксазола, изоксазола, тиазола, пиридазина, пиримидина и пиридилтриазола;
R3 отсутствует или выбран из Н; галогена; -С0-5алкилен-ОН; -С1-6алкила; -С3-7циклоалкила; -С0-2алкилен-О-С1-6алкила; -C(O)R20; -С0-1алкилен-COOR21; -С(О)NR22R23; -NHC(O)R24; =O; фенила, необязательно замещенного одной или двумя группами, независимо выбранными из галогена, -ОСН3, -NHC(O)CH3 и фенила; нафталенила; пиридинила; пиразинила; и R3, когда он присутствует, соединен с атомом углерода;
R4 выбран из Н; -ОН; -C1-2алкилен-COOR35; -пиридинила; и фенила или бензила, необязательно замещенного одной или более группами, выбранными из галогена и -ОСН3; и R4, когда он присутствует, соединен с атомом углерода или атомом азота;
а равен 0; или а равен 1, и R5 выбран из галогена и -CN;
b равен 0; или b равен 1, и R6 выбран из Cl, F, -ОН, -СН3, -ОСН3 и -CF3; или
b равен 2, и R6 каждый независимо выбран из галогена, -ОН, -СН3, или -ОСН3, или
b равен 3, и R6 каждый независимо выбран из галогена или -СН3;
R7 выбран из Н, -С1-8алкила, -С1-3алкилен-С6-10арила, -С0-6алкиленморфолинила и
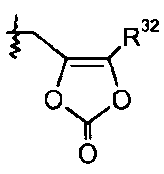
R32 представляет собой -С1-6алкил;
R20 представляет собой -С1-6алкил;
R21 и R35 независимо представляют собой Н,
R22 представляет собой Н или С1-6алкил, и R23 выбран из -C1-6алкила, -(СН2)2ОН, -(СН2)2ОСН3, - (СН2)2SO2NH2 и -С0-1алкилен-С3-7циклоалкила; или R22 и R23 берут вместе, получая насыщенный или частично ненасыщенный -С3-5гетероцикл, необязательно замещенный галогеном или -ОН; и необязательно содержащий атом кислорода в кольце, выбранный из азетидина, пирролидина, 2,5-дигидропиррола и морфолина;
R24 представляет собой фенил, замещенный -ОСН3; и
где каждая алкильная группа в R1 необязательно замещена 1-8 атомами фтора;
или его фармацевтически приемлемая соль.
R7 выбран из -С1-8алкила, -С1-3алкилен-С6-10арила, -С0-6алкиленморфолинила и

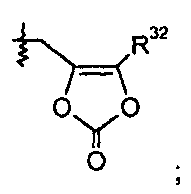
где R32 представляет собой -С1-6алкил; и где каждая алкильная группа необязательно замещена 1-8 атомами фтора.
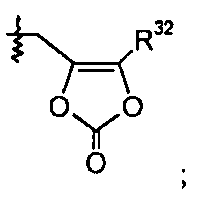
R32 представляет собой -С1-6алкил; R20 представляет собой -С1-6алкил; R21 представляет собой Н; R22 представляет собой Н или -C1-6алкил; R23 выбран из -С1-6алкила, -(СН2)2ОН, -(СН2)2ОСН3, (CH2)2SO2NH2 и -С0-1алкилен-С3-7циклоалкила; или R22 и R23 берут вместе, получая насыщенный или частично ненасыщенный -С3-5гетероцикл, необязательно замещенный галогеном или -ОН, и необязательно содержащий атом кислорода в кольце; R24 представляет собой фенил, замещенный -ОСН3; и R35 представляет собой Н; и где каждая алкильная группа в R1 необязательно замещена 1-8 атомами фтора.
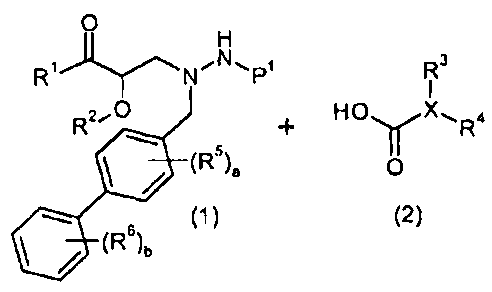
получая соединение формулы I; где Р1 представляет собой Н или трет-бутоксикарбонил; и где способ дополнительно включает снятие защитной группы соединения формулы 1, когда Р1 представляет собой трет-бутоксикарбонил.

где Р1 представляет собой Н или трет-бутоксикарбонил; или его соль.

или его соли; где R1P представляет собой -O-Р3, где Р3 представляет собой метил.
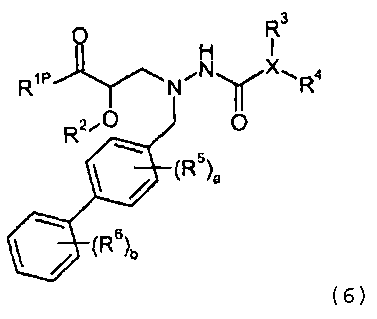
или его соль; где R1P представляет собой -O-Р3, где Р3 представляет собой метил.

Комментарии