Трансгенные растения - RU2515927C2
Код документа: RU2515927C2
Чертежи








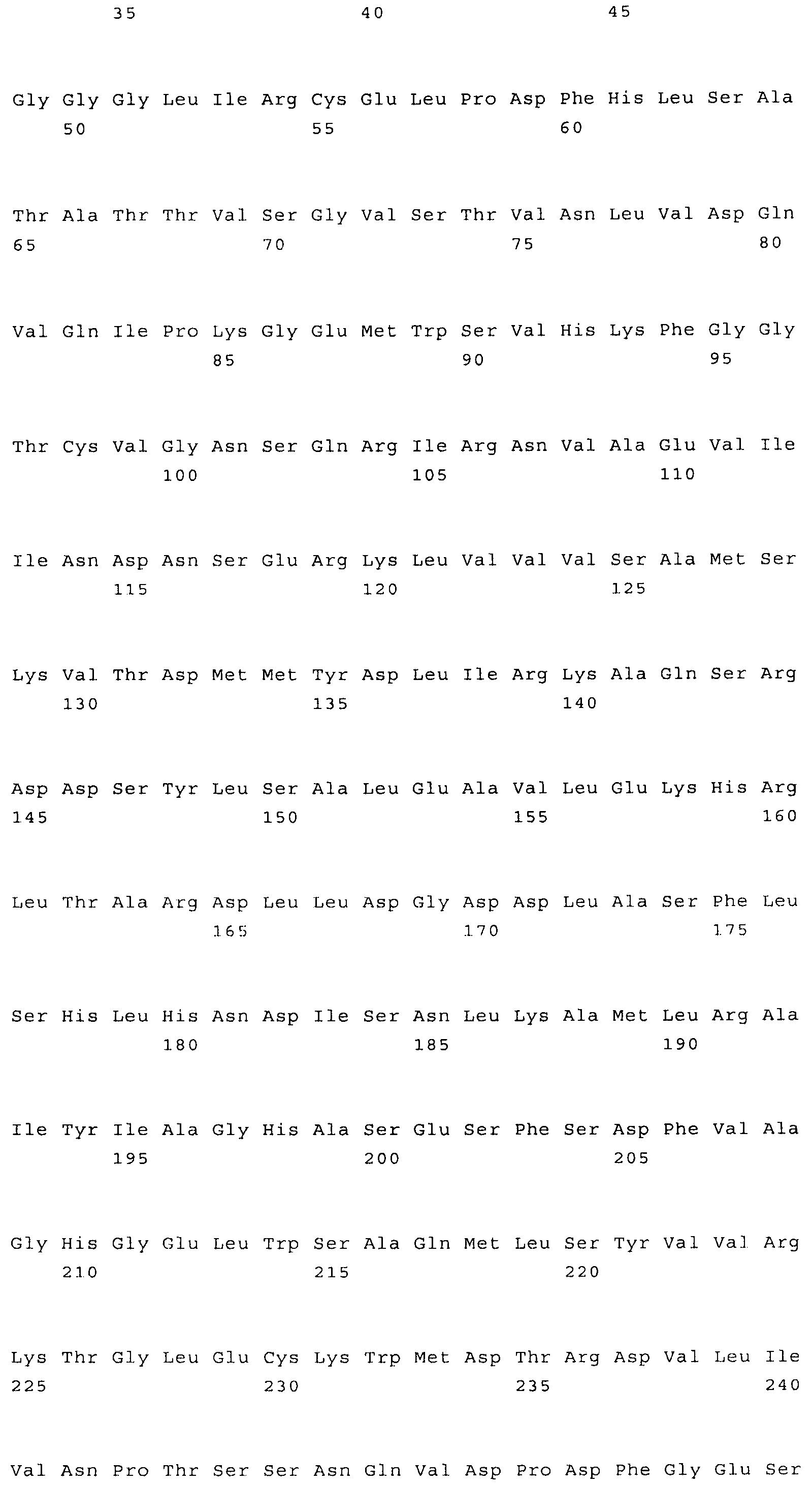
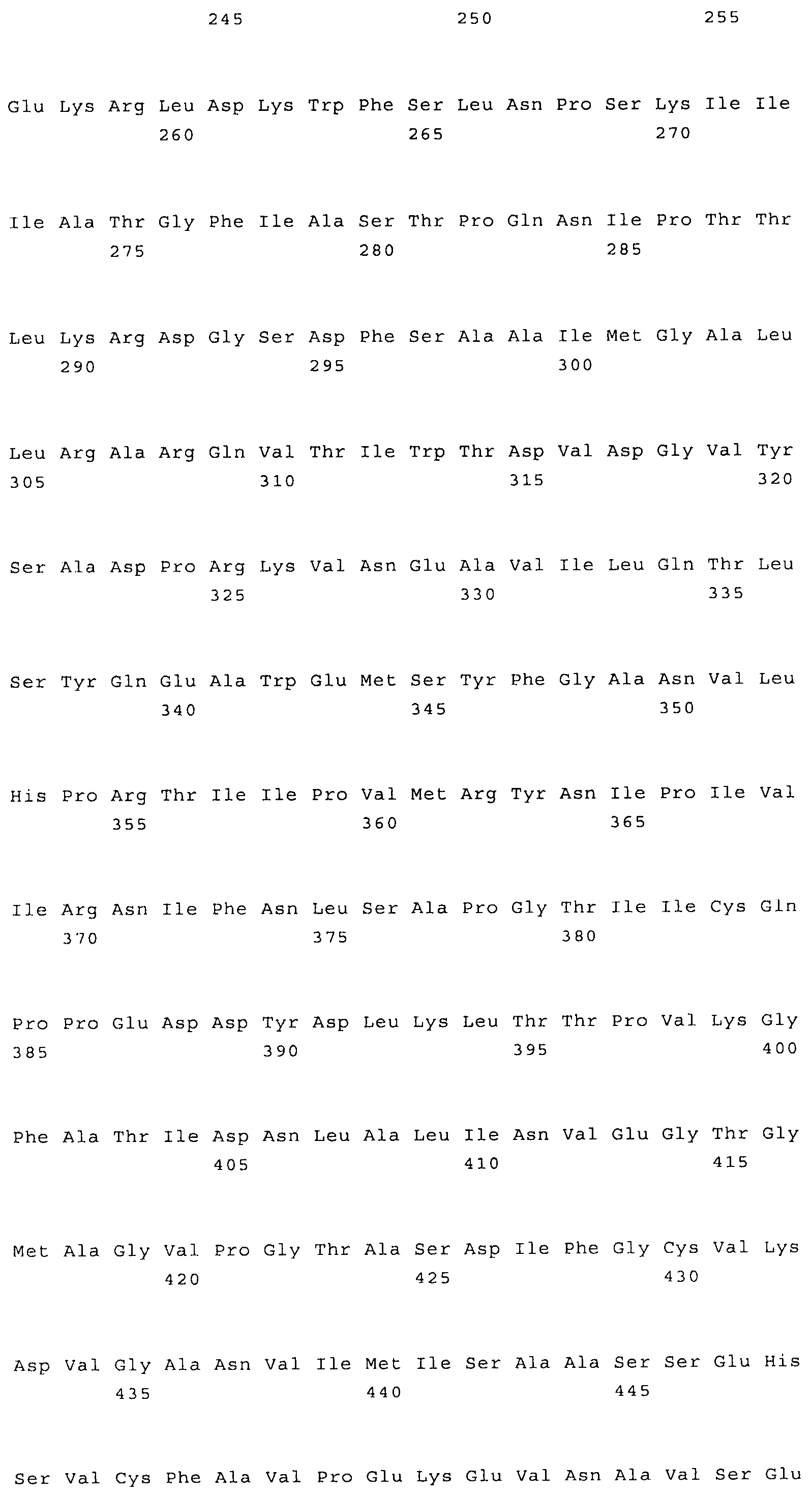
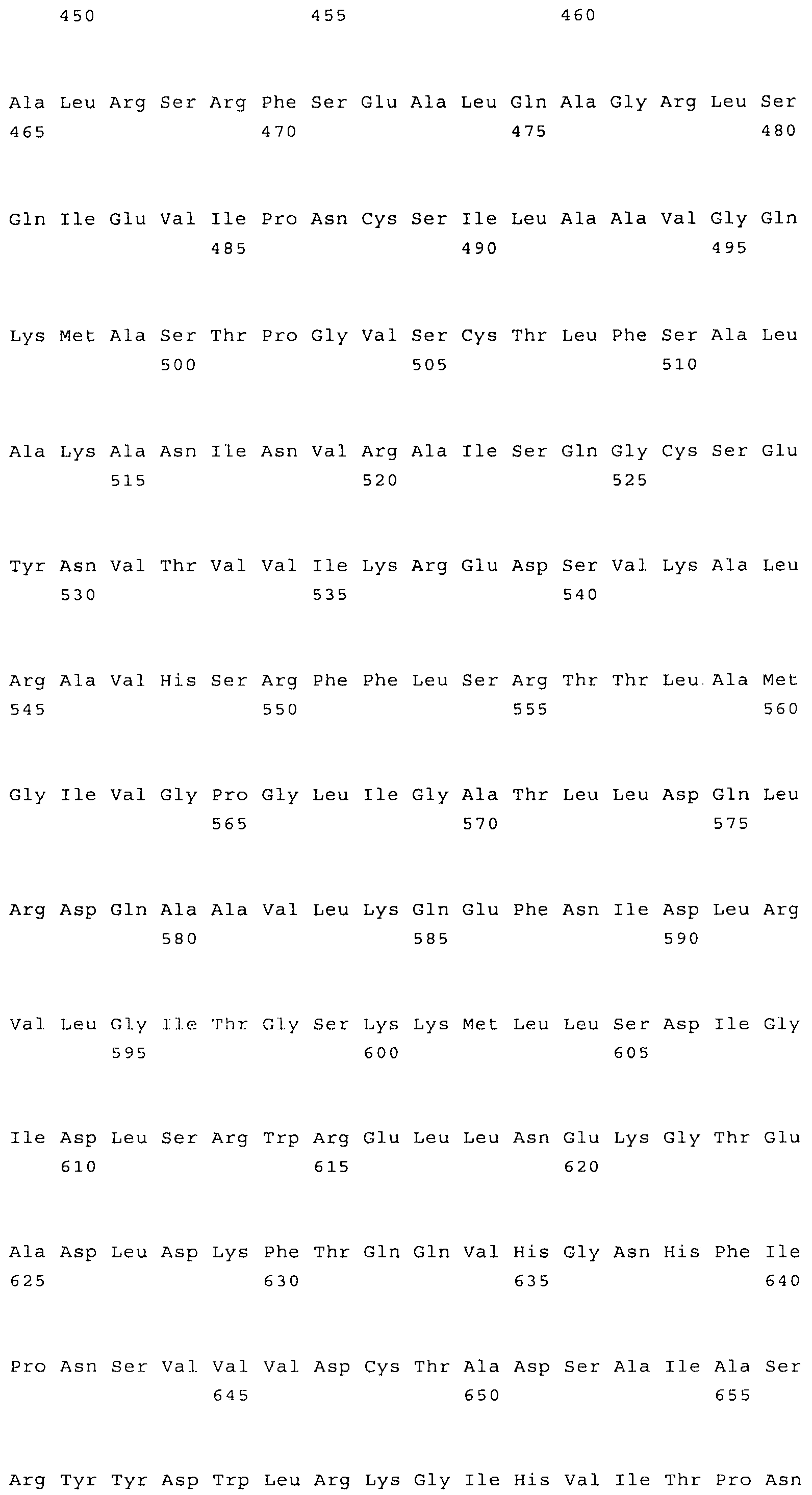
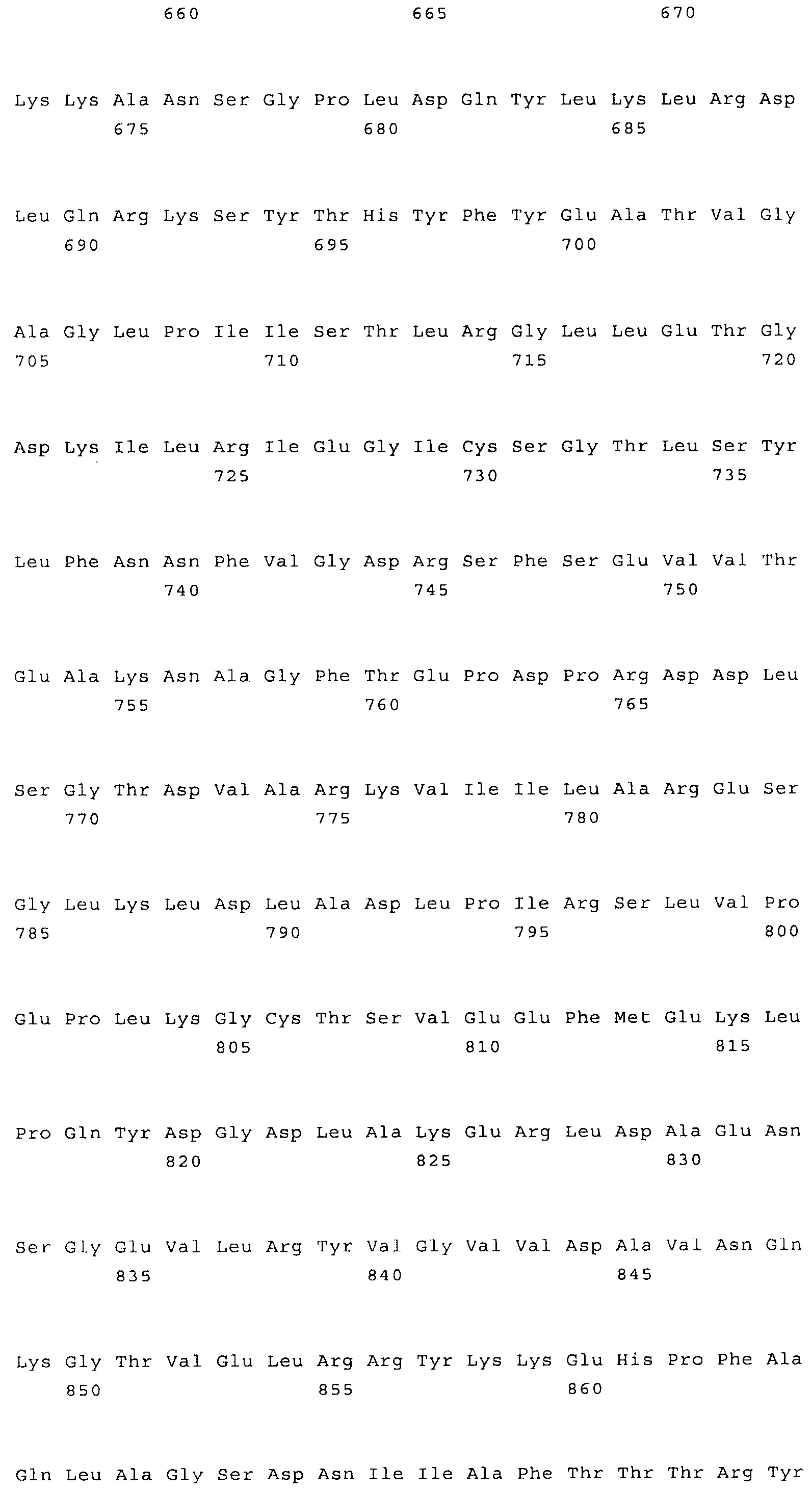




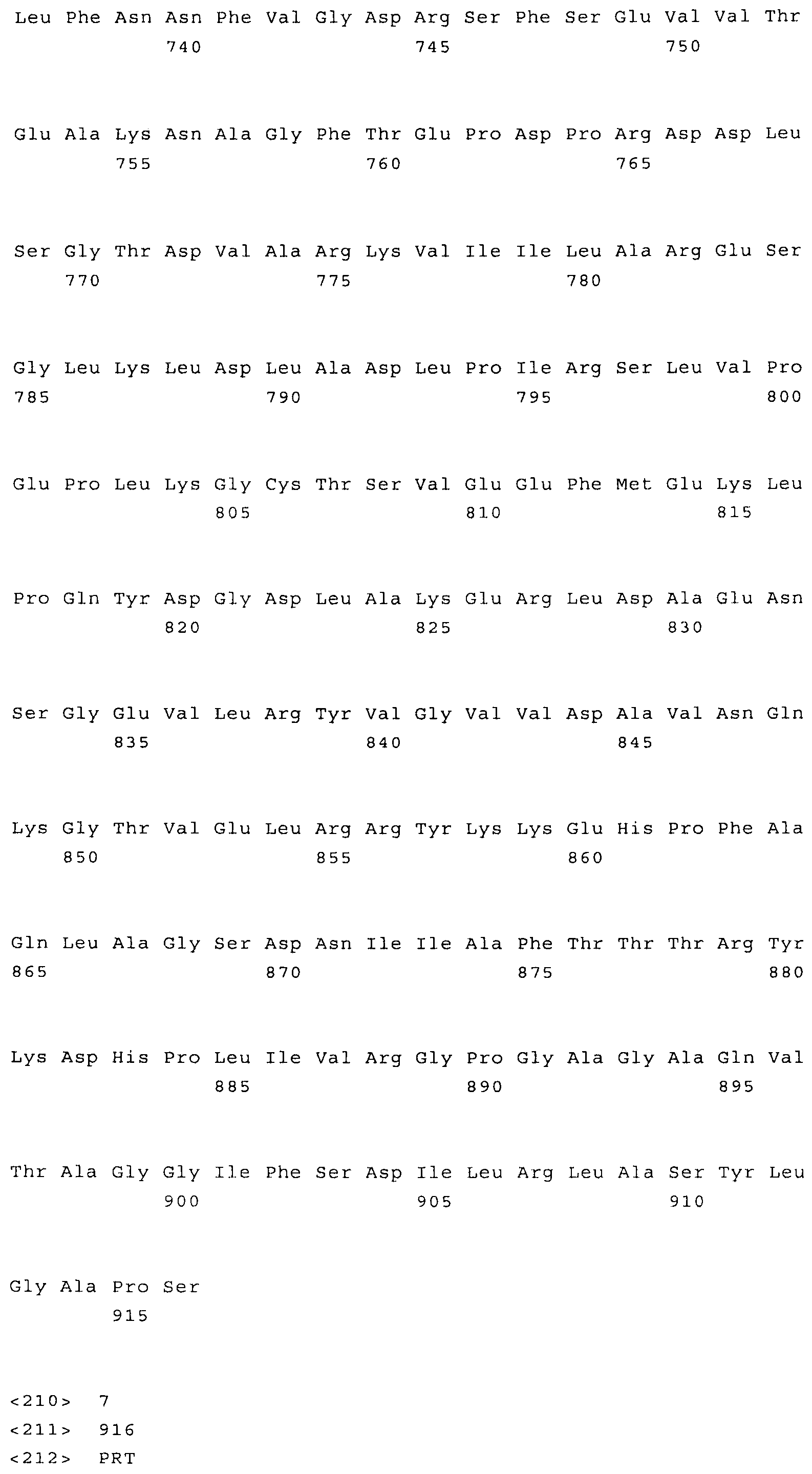

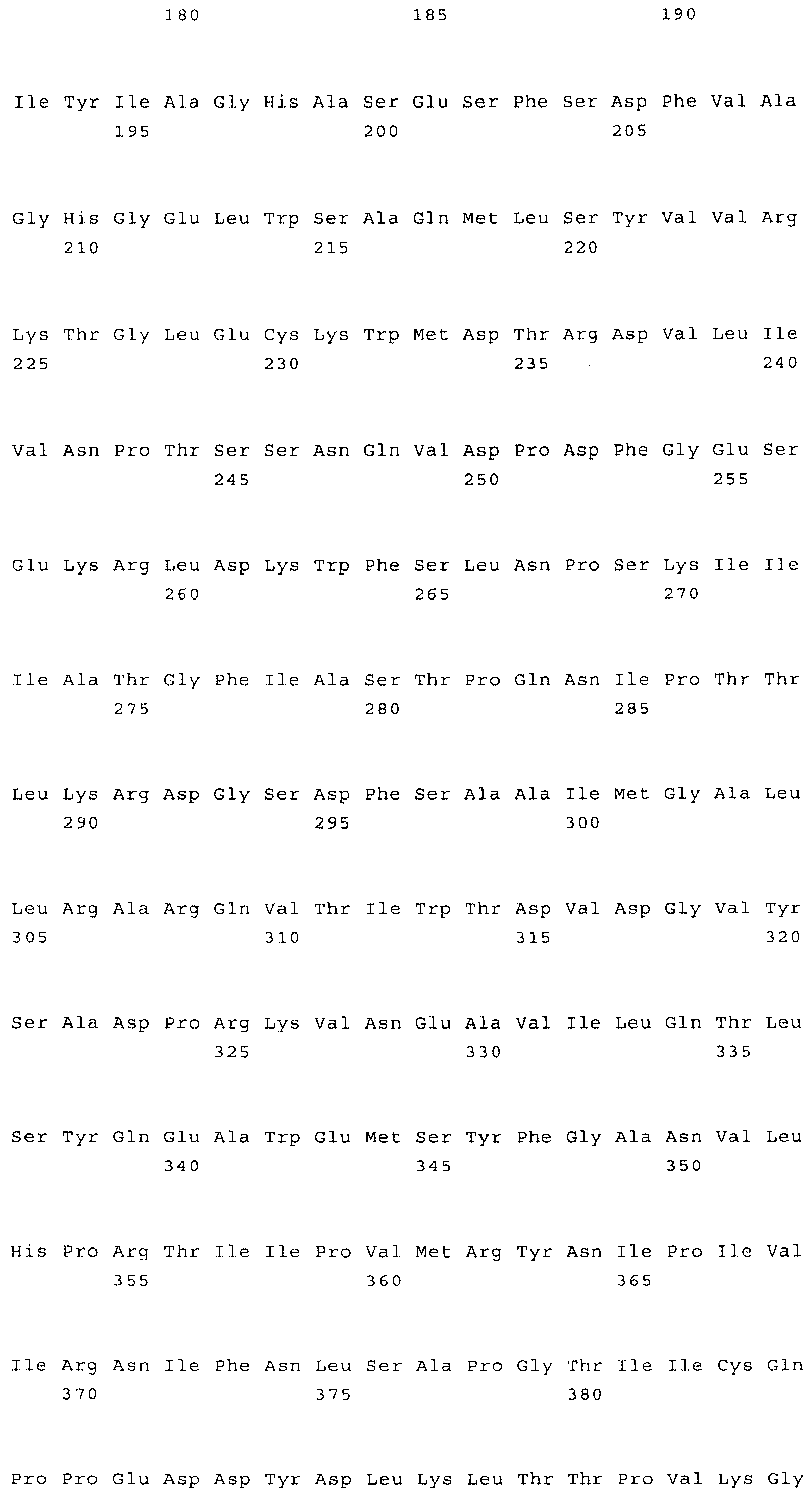

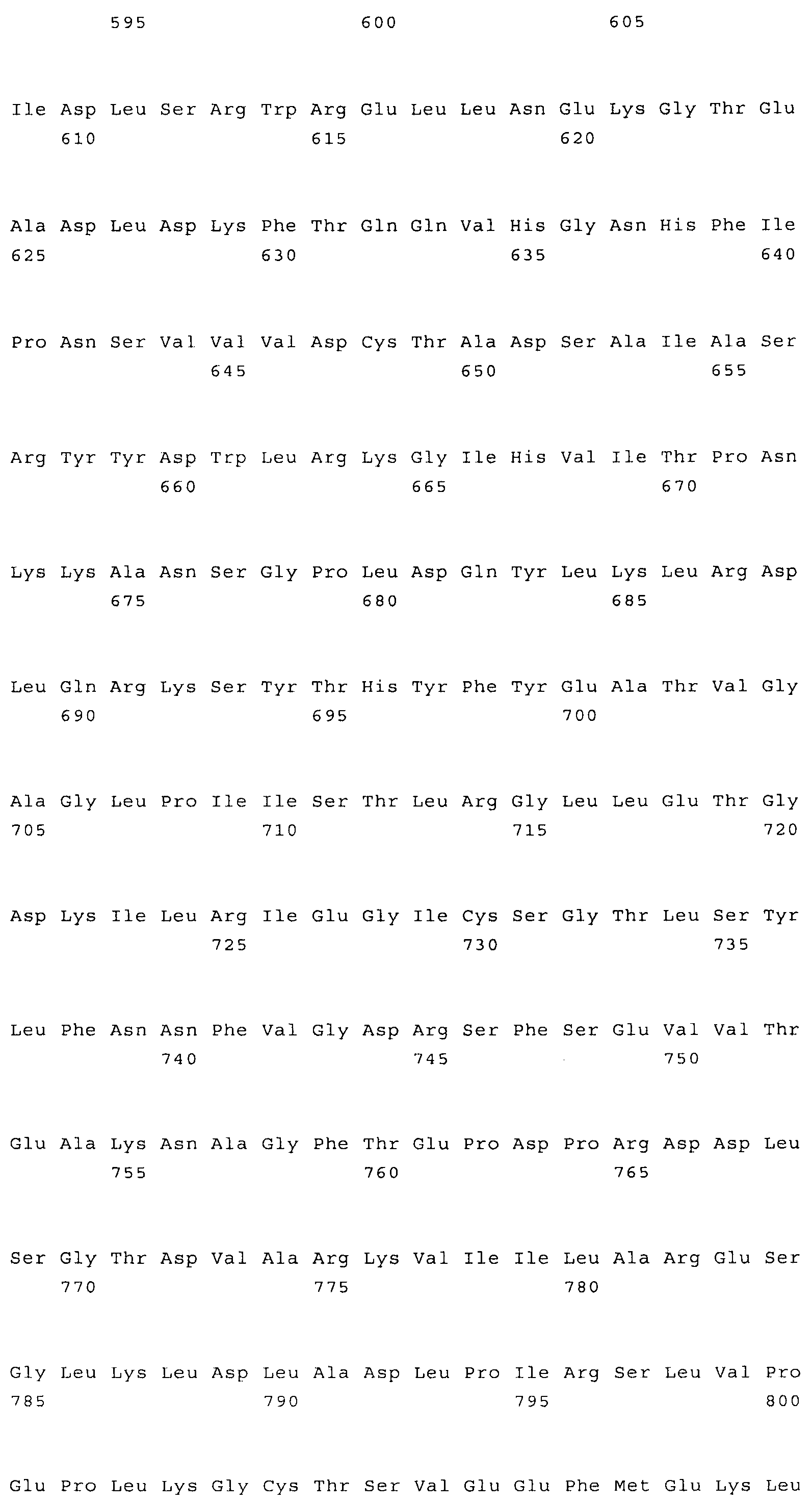






Описание
Настоящее изобретение относится к генетическим конструкциям, применяемым для создания трансгенных растений. Конструкции могут придавать растениям способность к накоплению треонина в их листьях, прежде всего в процессе старения листьев. Изобретение относится к растительным клеткам, трансформированным указанными конструкциями, и к самим трансгенным растениям. Изобретение относится также к способам получения трансгенных растений и к способам повышения концентрации треонина в стареющих растениях. Изобретение относится также к собранным листьям растений, например к листьям табака, которые были трансформированы генетическими конструкциями, и к предназначенным для курения продуктам, содержащим такие собранные листья растений.
С точки зрения усиления запаха табака обработанного трубоогневой сушкой, основная цель заключается в обеспечении производства в растении аминокислоты треонина. Накопление в листьях мутантных растений табака треонина в высоких концентрациях дает значительные преимущества с точки зрения запаха и аромата. Однако в норме производство треонина, а также производство других аминокислот семейства аспартатов, а именно метионина, лизина и изолейцина, строго регулируется. Следовательно, для достижения указанных преимуществ касательно запаха и аромата необходимо модифицировать путь биосинтеза треонина.
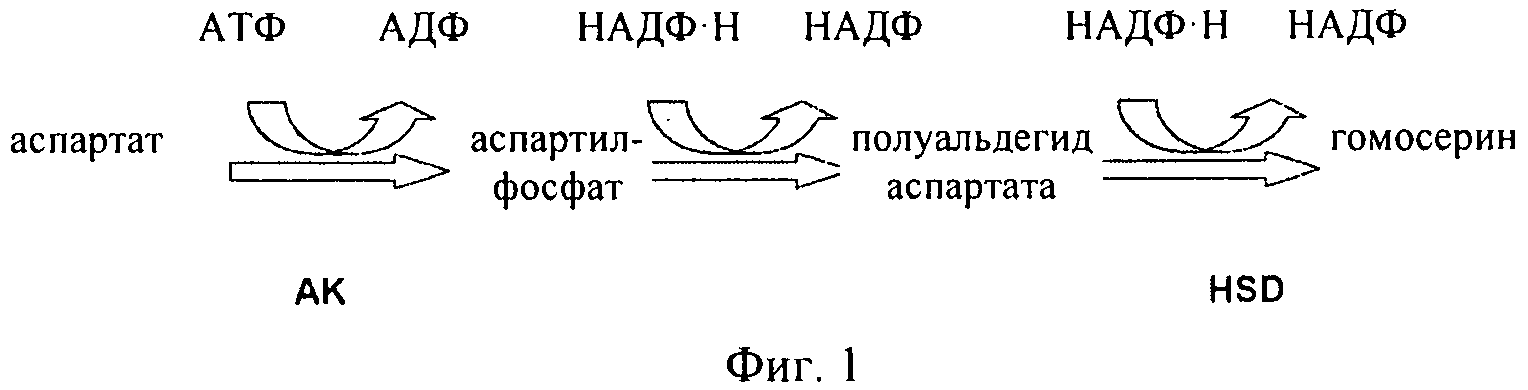
Как проиллюстрировано на фиг.1 и фиг.2, аспартаткиназа (AK) представляет собой первый фермент в пути биосинтеза в растениях, в котором происходит превращение аспартата в аминокислоты, в том числе в треонин. Производство эндогенной аспартаткиназы регулируется путем ингибирования по типу обратной связи как лизином, так треонином. Следовательно, для достижения указанной цели необходима аспартаткиназа, которая не подвержена ингибированию по типу обратной связи. Однако указанной цели необходимо достигать, не вызывая при этом снижения содержания метионина или истощения уровней аспартата до такой степени, чтобы это приводило к ограничению других зависящих от него путей.
В проведенных ранее исследованиях было установлено, что трансгенные растения, которые содержат нечувствительную к действию по типу обратной связи аспартаткиназу и которые обладают способностью сверхпродуцировать треонин по сравнению с растениями дикого типа, характеризуются плохим ростом и очень высокой «ценой за приспособленность», если указанные растения являются гомозиготными по такой мутации. Понятия «плохой рост» и «цена за приспособленность» относятся к любому неблагоприятному изменению характеристик роста растений, которые замечает фермер. Очевидно, что любое такое изменение является нежелательным.
Поэтому в основу настоящего изобретения была положена задача создать трансгенное растение, обладающее способностью накапливать треонин в листьях в результате преодоления указанного выше ингибирования, обусловленного петлей (контуром) обратной связи, но в идеале не требующее никаких затрат, обусловленных ценой за его приспособленность. С учетом этого при создании изобретения был разработан целый ряд генетических конструкций, в которых ген, кодирующий нечувствительный к треонину фермент аспартаткиназу (AK), находился под контролем промотора, для которых проводили оценку воздействия (если оно имеет место), которое оказывает сверхэкспрессия указанного гена на уровни треонина в стареющих листьях.
Старение листьев представляет собой фазу развития растения, на которой клетки подвергаются выраженным метаболическим и структурным изменениям, предшествующим гибели клетки. Физиологические и генетические исследования продемонстрировали, что старение представляет собой строго регулируемый процесс. Развитие листа на фазе старения характеризуется видимой невооруженным глазом потерей хлорофилла и последующим пожелтением, что обусловлено разрушением хлоропластов. Снижение уровня хлорофилла в листьях, характерное для этой стадии развития, можно оценивать, например, с помощью экстракции растворителем и спектрофотометрических измерений или с использованием измерителя уровня хлорофилла. Снижение уровня хлорофилла в листьях по сравнению с уровнем хлорофилла в листьях в более ранний момент времени, выявленное для того же самого растения, которое предпочтительно выращивают в постоянных условиях, свидетельствует о старении.
Результаты исследований на молекулярном уровне указывают на то, что старение ассоциировано с изменениями генной экспрессии. В процессе старения происходит снижение уровней мРНК, кодирующих белки, участвующие в фотосинтезе, при этом происходит повышение уровней мРНК генов, кодирующих белки, которые, по-видимому, участвуют в ускорении старения. Старение представляет собой высокоорганизованный процесс, регулируемый генами, которые в целом обозначают как ассоциированные со старением гены (Senescence Associated Genes (SAG)). При старении листьев происходит расщепление белков, нуклеиновых кислот и мембран, и имеет место последующий транспорт питательных веществ, образующихся в результате этого расщепления, в другие части растения, такие как развивающиеся семена, листья или запасающие органы. Одна из проблем, связанных со старением растения, заключается в том, что большое количество минералов и питательных веществ, присутствующих в стареющих листьях, остаются в листьях, и, следовательно, фактически теряются после гибели листьев. Например, треонин, а также многие другие аминокислоты, присутствующие в стареющих листьях, могут попадать в отходы, если их не выделяют из погибших листьев.
Как описано в примере 2, при создании изобретения были проведены эксперименты, которые осуществляли с генетическими конструкциями, экспрессирующими нечувствительную к треонину AK, которые были локализованы в определенных областях в растении, а именно применяли специфичный для листа промотор гена пластоцианина из гороха. Однако было установлено, что листья таких трансгенных растений были бледными, утолщенными, хрупкими и похожими на полоски (т.е. длинными и узкими). Междоузлия были укороченными и по мере созревания становились побуревшими, почки либо не развивались, либо были деформированными. Таким образом, указанные трансгенные растения оказались неспособными преодолеть цену за приспособленность.
Поэтому при создании изобретения были разработаны серии генетических конструкций, в которых активность нечувствительной к воздействию по типу обратной связи аспартаткиназы (AK) проявлялась только после того, как растение вступало в фазу старения (под контролем промотора SAG12), и таким образом, оно имело возможность нормально развиваться. При создании изобретения неожиданно было установлено, что разработанные таким путем конструкции, которые дают возможность трансгенным растениям, трансформированным указанными конструкциями, нормально расти до созревания (т.е. до фазы старения), пока не происходит «включение» нечувствительной к воздействию по типу обратной связи аспартаткиназы (AK), способны преодолеть цену за приспособленность.
Таким образом, первым объектом изобретения является генетическая конструкция, содержащая специфический для фазы старения промотор, функционально связанный с кодирующей последовательностью, которая кодирует полипептид, обладающий активностью нечувствительной к треонину аспартаткиназы.
Согласно изобретению специфический для фазы старения промотор, связанный с кодирующей последовательностью, которая кодирует полипептид, обладающий активностью нечувствительной к треонину аспартаткиназы, применяют для создания конструкции, являющейся первым объектом изобретения, которую затем применяют для трансформации растения. В результате проведенных при создании изобретения исследований неожиданно было установлено, что конструкция, предлагаемая в изобретении, обеспечивает получение более высоких уровней треонина в стареющих листьях. Кроме того, указанное временное ограничение экспрессии трансгена, контролируемого специфическим для фазы старения промотором, позволяет преодолевать негативное воздействие цены за приспособленность, с которым ранее сталкивались в первых попытках создать способное к накоплению треонина растение. Как продемонстрировано в примерах, полученное таким путем трансгенное растение продуцирует треонин в большем количестве, чем растение дикого типа в период старения листьев. Было продемонстрировано, что накопление треонина происходит в листьях и что такие повышенные уровни оказывают положительное влияние на запах табачных листьев, содержащих указанную конструкцию, и, следовательно, продуктов для курения, изготовленных из таких листьев.
Промотор в генетической конструкции, являющейся первым объектом изобретения, может обладать способностью индуцировать РНК-полимеразу к связыванию (и к инициации транскрипции) с кодирующей последовательностью, которая кодирует полипептид, обладающий активностью нечувствительной к треонину аспартаткиназы.
«Специфический для фазы старения промотор» (SAG) может представлять собой любой промотор, обеспечивающий контроль экспрессии ассоциированного со старением гена. Таким образом, промотор может ограничивать экспрессию кодирующей последовательности (т.е. гена), с которой он функционально связан, таким образом, чтобы она происходила практически только в стареющей ткани. Следовательно, специфический для фазы старения промотор может представлять собой промотор, обладающий способностью стимулировать генную экспрессию в растительной ткани преимущественно в зависимости от стадии развития таким образом, чтобы экспрессия кодирующей белок 3'-области происходила практически только тогда, когда растительная ткань находится на фазе старения. Следует иметь в виду, что старение имеет тенденцию происходить в более старых частях растения, таких как более старые листья, а не в более молодых частях растений, таких как семена.
Одним из примеров растения, в отношении которого известно, что в нем происходит экспрессия многочисленных ассоциированных со старением генов, является Arabidopsis. Следовательно, промотор, присутствующий в конструкции, являющейся первым объектом изобретения, можно выделять из ассоциированного со старением гена из Arabidopsis. Gepstein с соавторами (The Plant Journal, 36, 2003, cc.629-642) провели подробное изучение семейства SAG и промоторов, входящих в это семейство, используя в качестве модели Arabidopsis. Так, генетическая конструкция может содержать промотор из числа любых SAG, описанных в данной публикации. Например, пригодный промотор можно выбирать из группы, включающей SAG12, SAG13, SAG101, SAG21 и SAG18 и их функциональные варианты или функциональные фрагменты.
Предпочтительными промоторами являются промоторы SAG12 и SAG13. В одном из вариантов осуществления изобретения промотор представляет собой промотор SAG12, известный специалисту в данной области, или его функциональный вариант или фрагмент (Gan и Amasino, Plant Physiology, 113, 1997, cc.313-319). Последовательность ДНК, кодирующая промотор SAG12, представлена на фиг.6, она обозначена в настоящем описании как SEQ ID NO:1 и представлена ниже:
SEQ ID NO:1

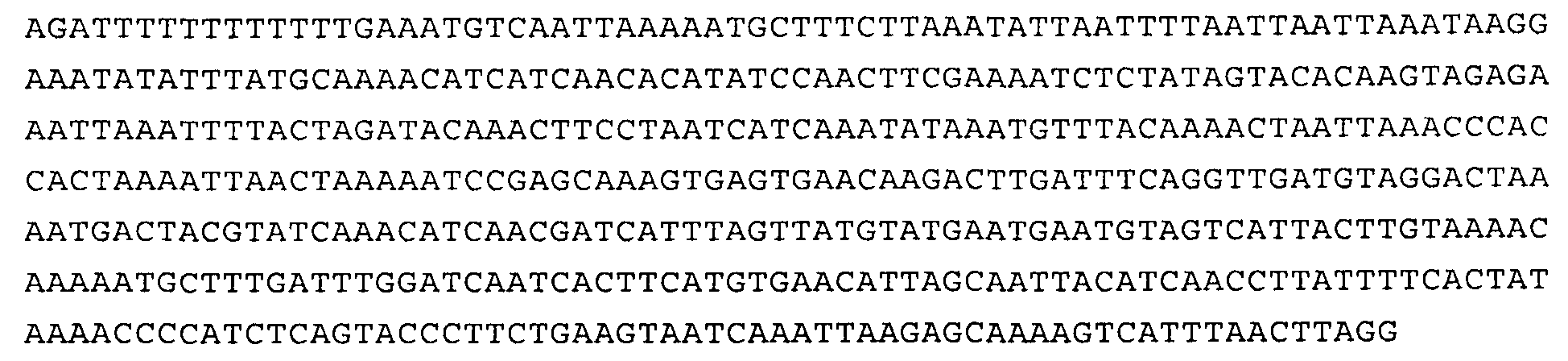
Таким образом, промотор, который применяют в конструкции, предлагаемой в изобретении, может иметь нуклеотидную последовательность, которая практически совпадает с последовательностью, представленной в SEQ ID NO:1, или представляет собой ее функциональный вариант или функциональный фрагмент. Последовательность промотора SAG12 можно получать из Arabidopsis thaliana согласно методу, описанному в US 5689042. Следует иметь в виду, что в тех вариантах осуществления изобретения, в которых промотор представляет собой SAG12, промотор может содержать все основания 1-2093 SEQ ID NO:1. Однако в генетических конструкциях, предлагаемых в изобретении, можно применять также функциональные варианты или функциональные фрагменты промотора.
«Функциональный вариант или функциональный фрагмент промотора» может представлять собой производное или часть промотора, которая обладает функциональной активностью, достаточной для инициации экспрессии любой кодирующей области, которая функционально связана с ней. Например, специалисту в данной области должно быть очевидно, что в тех вариантах осуществления изобретения, в которых основой промотора является SAG12, последовательность, представленную в SEQ ID NO:1, можно модифицировать, или что могут требоваться только части промотора SAG12, лишь бы все еще можно было инициировать в конструкции экспрессию гена полипептида, обладающего активностью нечувствительной к треонину аспартаткиназы. Можно осуществлять аналогичные модификации нуклеотидных последовательностей любых других известных промоторов семейства SAG, таких как SAG13, SAG101, SAG21 и SAG18.
Функциональные варианты и функциональные фрагменты промотора можно легко идентифицировать путем оценки того, может или не может транскриптаза связываться с предполагаемой промоторной областью и затем приводить к транскрипции кодирующей последовательности с получением полипептида, обладающего активностью нечувствительной к треонину аспартаткиназы. В альтернативном варианте такие функциональные варианты и фрагменты можно анализировать путем осуществления мутагенеза промотора, ассоциированного с кодирующей областью, и определения того, может ли иметь место экспрессия гена.
Генетическая конструкция, представляющая собой первый объект изобретения, может обладать способностью вызывать в процессе старения экспрессию полипептида, обладающего активностью нечувствительной к треонину аспартаткиназы. Промотор может индуцировать экспрессию кодирующей последовательности, которая кодирует полипептид, обладающий активностью нечувствительной к треонину аспартаткиназы. Следовательно, генетическая конструкция может содержать по меньшей мере одну кодирующую последовательность, которая кодирует нечувствительную к треонину аспартаткиназу (AK) или ее функциональный вариант или фрагмент. Таким образом, в первом варианте осуществления изобретения генетическая конструкция может содержать специфический для фазы старения промотор и кодирующую последовательность, которая кодирует нечувствительную к треонину аспартаткиназу (AK), или ее функциональный вариант, или фрагмент.
Как описано в примерах 3-4, при создании изобретения было установлено, что экспрессия нечувствительной к треонину аспартаткиназы в клетке-хозяине, в случае растения, трансформированного конструкцией, предлагаемой в изобретении, приводит к существенному повышению уровней треонина. Кроме того, было установлен тот благоприятный факт, что конструкция не оказывает негативного воздействия на приспособленность трансформированного растения.
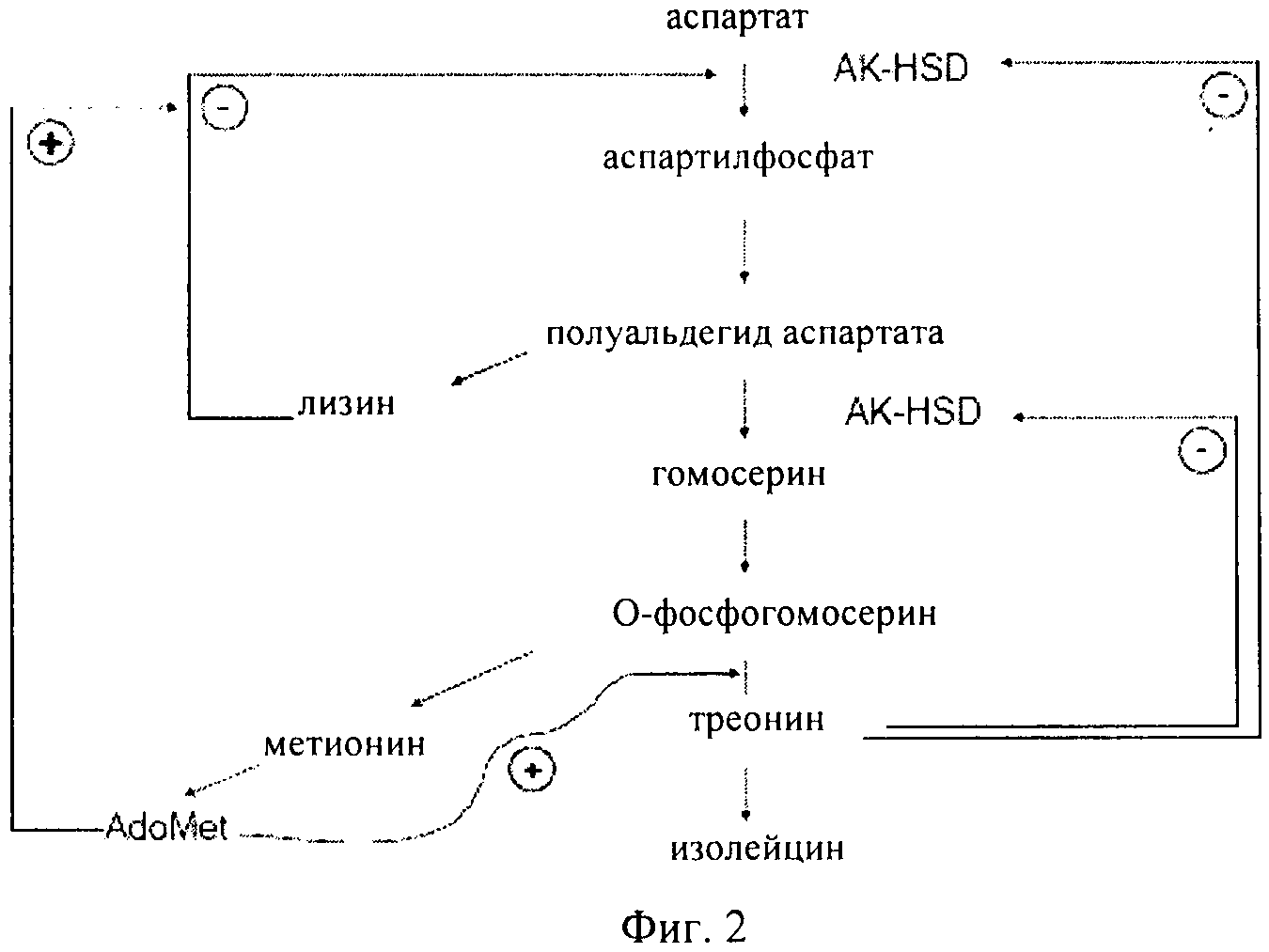
Как проиллюстрировано на фиг.1 и фиг.2, в растениях аминокислоты лизин, треонин, метионин и изолейцин синтезируются из аспартата. Было установлено, что в этом пути присутствуют несколько петель ингибирования по типу обратной связи. Первый фермент в пути, аспартаткиназа (AK) (КФ 2.7.2.4), катализирует фосфорилирование аспартата с образованием 3-аспартилфосфата, что сопровождается гидролизом АТФ. По-видимому, для высших растений, как правило, характерно присутствие по меньшей мере двух или трех изозимов AK. Активность AK подвергается воздействию конечных продуктов, представляющих собой аминокислоты лизин и треонин по типу отрицательной обратной связи. По меньшей мере один изозим AK ингибируется по типу обратной связи треонином, а другой лизином и S-аденозилметионином. Для ячменя в спектре активности AK можно выделить три пика, соответствующие изозимам, один из которых ингибируется треонином, а два другие лизином. Дополнительные петли обратной связи имеют место для других ферментов в пути биосинтеза, таких как дигидропиколинатсинтаза (DHPS) и гомосериндесатураза (HSD).
Как проиллюстрировано на фиг.1 и фиг.2, гомосериндесатураза (HSD) (КФ 1.1.1.3), также известная как гомосериндегидрогеназа (HSDH), катализирует первую реакцию, которая ассоциирована только с биосинтезом треонина, метионина и изолейцина, а именно с реакцией превращения полуальдегида 3-аспартамовой кислоты в гомосерин. Высшие растения, как правило, обладают по меньшей мере двумя формами HSDH: чувствительной к треонину формой и нечувствительной к треонину формой. Характеризация очищенной HSDH и клонов кДНК подтвердила, что изозимы HSDH связаны с AK, образуя единые белковые конструкции, и поэтому их обозначают как «AK:HSDH».
Повышение содержания треонина (Thr) в листьях зависит от возможности преодоления осуществляемого по типу отрицательной обратной связи контроля пути синтеза. Например, были созданы трансгенные растения табака, в которых имела место экспрессия нечувствительной к лизину AK из E.coli, обладающие фенотипом накопления треонина. В этих трансформантах экспрессия бактериальной AK происходила под контролем промотора 35S либо в цитоплазме, либо в хлоропласте растения табака. Эндогенная активность AK все еще оставалась полностью чувствительной к ингибированию как лизином, так и к треонином. Присутствовавший в хлоропласте трансген обусловливал более высокую активность AK. Более высокие уровни треонина были выявлены в растениях, в которых происходила экспрессия формы, интродуцированной в хлоропласт. Однако был выявлен слабый рост растений, и было установлено, что гомозиготные растения утрачивали приспособленность, что выражалось в морщинистых верхних листьях, замедлении цветения и частичной стерильности.
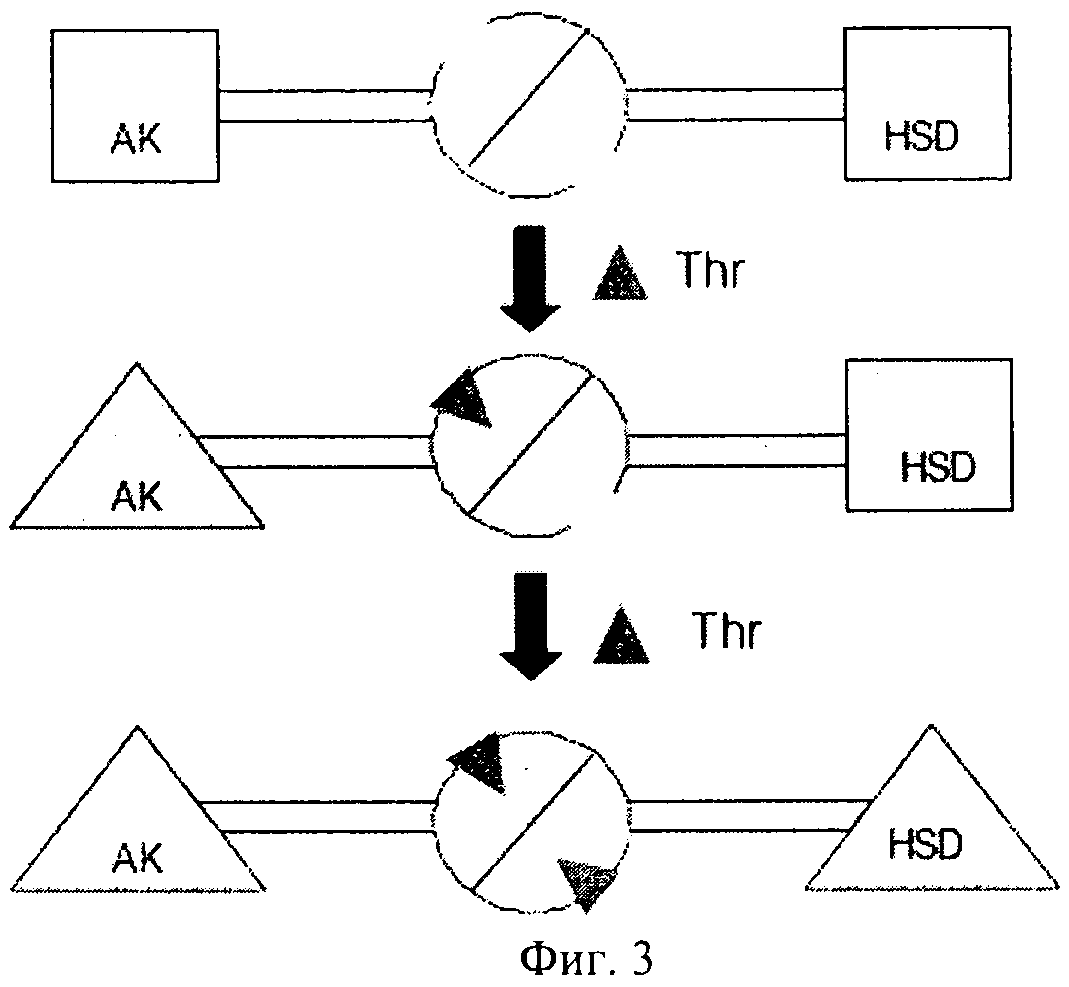
Исследование, проведенное на Arabidopsis (Paris и др., The Journal of Biological Chemistry, том 278, №7, 2003, cc.5361-5366), продемонстрировало, что регуляторный домен фермента AK:HSDH содержит два гомологичных субдомена, которые характеризуются общим мотивом типа: петля-α спираль-петля-β цепь-петля-β цепь. Для выявления сайтов связывания треонина применяли сайт-направленный мутагенез. Было установлено, что каждый регуляторный домен мономеров аспартаткиназа-гомосериндегидрогеназа имеет два неэквивалентных сайта связывания треонина, включающих, в частности, остатки Gln443 и Gln524. Связывание треонина с Gln443 приводит к ингибированию активности AK и облегчает также связывание второго треонина с Gln524, что приводит к ингибированию HSDH.
На фиг.3 предложена модель механизма ингибирования AK-HSDH треонином, на чертеже активные каталитические домены AK и HSDH обозначены квадратами, а ингибируемые каталитические домены обозначены треугольниками. Связывание треонина (Thr) с первым субдоменом приводит как к (I) конформационным модификациям другого субдомена, так и к (II) конформационным модификациям каталитического домена AK, что вызывает ингибирование AK.
Конформационная модификация второго субдомена должна индуцировать связывание второго остатка треонина, что приводит к конформационным модификациям каталитического домена HSDH и ингибированию HSDH.
Мутация, приводящая к замене этих глутаминовых остатков на аланин, приводит к тому, что ингибирование фермента треонином становится неэффективным. Мутации не оказывают воздействия на кинетические характеристики активности HSDH, они оказывают воздействие только на чувствительность фермента к треонину; они лишь слегка модифицируют кинетические характеристики AK. Однако, к сожалению, оказалось, что в случае трансгенных растений, в которые была интродуцирована нечувствительная к действию по типу обратной связи конструкция AK:HSDH из Arabidopsis и в которых происходила ее экспрессия, также имела место цена за приспособленность.
В отличие от этого, генетическая конструкция, предлагаемая в настоящем изобретении, вызывает экспрессию полипептида, обладающего активностью нечувствительной к треонину аспартаткиназы в период старения, и не оказывает никакого неблагоприятного воздействия на адаптацию трансгенного растения. Так, генетическая конструкция, представляющая собой первый объект изобретения, может кодировать нечувствительную к треонину аспартаткиназу (AK), или нечувствительный к треонину фермент бифункциональному аспартаткиназу-гомосериндегидрогеназу (AK-HSDH), или их функциональные варианты или функциональные фрагменты.
Нечувствительная к треонину AK или нечувствительный к треонину бифункциональный фермент AK-HSDH, или их функциональные варианты, или фрагменты, можно получать из любого пригодного источника, такого как растение. Кодирующую последовательность, которая кодирует полипептид, обладающий активностью нечувствительной к треонину аспартаткиназы, можно получать из Arabidopsis spp., Zea spp., Flaveria spp. или Cleome spp. Кодирующую последовательность, которая кодирует полипептид, обладающий активностью нечувствительной к треонину аспартаткиназы, можно получать из Arabidopsis thaliana, Zea mays, Flaveria trinervia, Flaveria bidentis, Flaveria brownie или Cleome gynandra. Предпочтительно кодирующую последовательность фермента можно получать из Arabidopsis spp., например, из Arabidopsis thaliana.
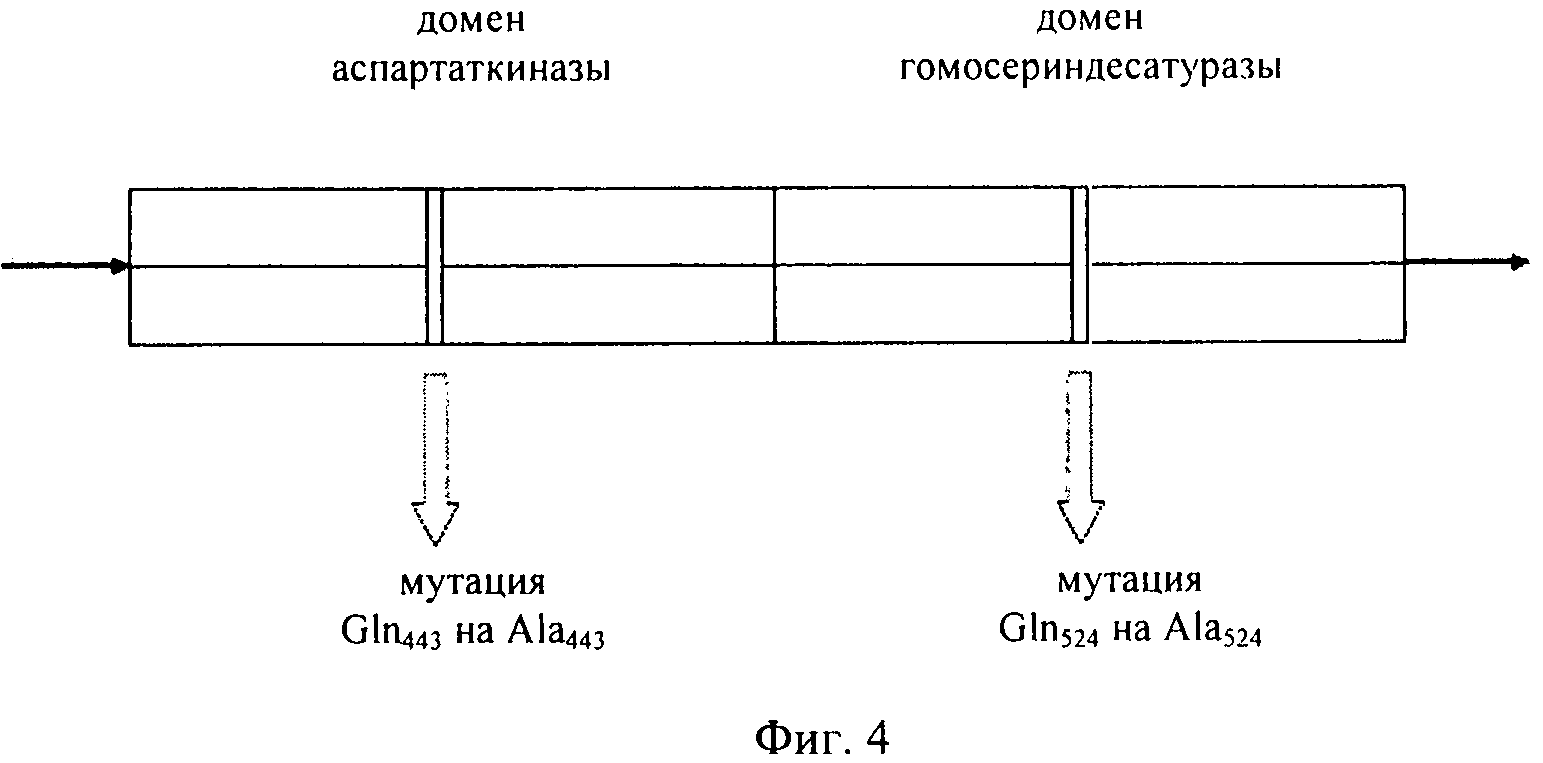
Наиболее предпочтительным нечувствительным к треонину ферментом является мутантная AK-HSDH, в которой изменен по меньшей мере один сайт связывания треонина. Предпочтительно мутации подвергают один или оба сайта связывания треонина, включающих, в частности Gln443 и Gln524. Например, AK-HSDH из Arabidopsis можно подвергать мутации на остатке Gln443 и/или Gln524. Предпочтительно, AK-HSDH из Arabidopsis подвергают мутации на Gln443 и Gln524. Мутантный ген AK:HSDH, применяемый согласно настоящему изобретению, представлен на фиг.7, где подвергнутые мутации основания подчеркнуты.
В соответствии с этим ниже представлена последовательность ДНК, кодирующая один из вариантов (т.е. вариант с одной мутацией Gln443Ala) нечувствительной к треонину аспартаткиназы из Arabidopsis, в виде SEQ ID NO:2.
SEQ ID NO:2:
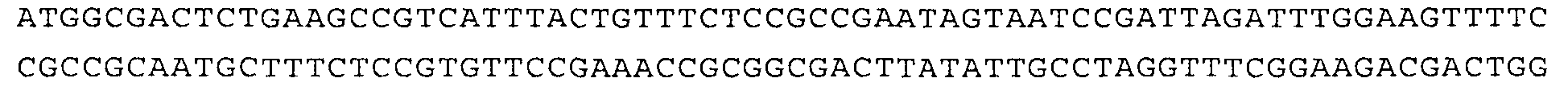

В SEQ ID NO:2 (т.е. Q443A) выделенный GCT соответствует мутантному Gln443, кодирующему аланин, а выделенный CAR соответствует Gln524 в последовательности дикого типа, где R может представлять собой либо G, либо А.
Последовательность ДНК, кодирующая другой вариант (т.е. вариант с одной мутацией Gln524Ala) нечувствительной к треонину аспартаткиназы из Arabidopsis, представлена ниже в виде SEQ ID NO:3.
SEQ ID NO:3:

В SEQ ID NO:3 (т.е. Q524A) выделенный GCT соответствует мутантному Gln524, кодирующему аланин, а выделенный CAR соответствует Gln443 в последовательности дикого типа, где R может представлять собой либо G, либо А.
Последовательность ДНК, кодирующая другой вариант (т.е. вариант с двойной мутацией Gln443Ala; Gln524Ala) нечувствительной к треонину аспартаткиназы из Arabidopsis, представлена ниже в виде SEQ ID NO:4.
SEQ ID NO:4:

В SEQ ID NO:4 (т.е. Q443A; Q524A) выделенные GCT соответствуют мутантным Gln443 и Gln524, которые оба кодируют аланин.
Таким образом, кодирующая последовательность, которая кодирует полипептид, обладающий активностью нечувствительной к треонину аспартаткиназы, может содержать нуклеотидную последовательность, практически совпадающую с одной из последовательностей, представленных в любой из SEQ ID NO:2, 3 или 4, или ее функциональный вариант или фрагмент.
Полипептидная последовательность одного из вариантов (а именно варианта с одной мутацией Gln443Ala) нечувствительной к треонину аспартаткиназы представлена ниже в виде SEQ ID NO:5.
SEO ID NO:5:
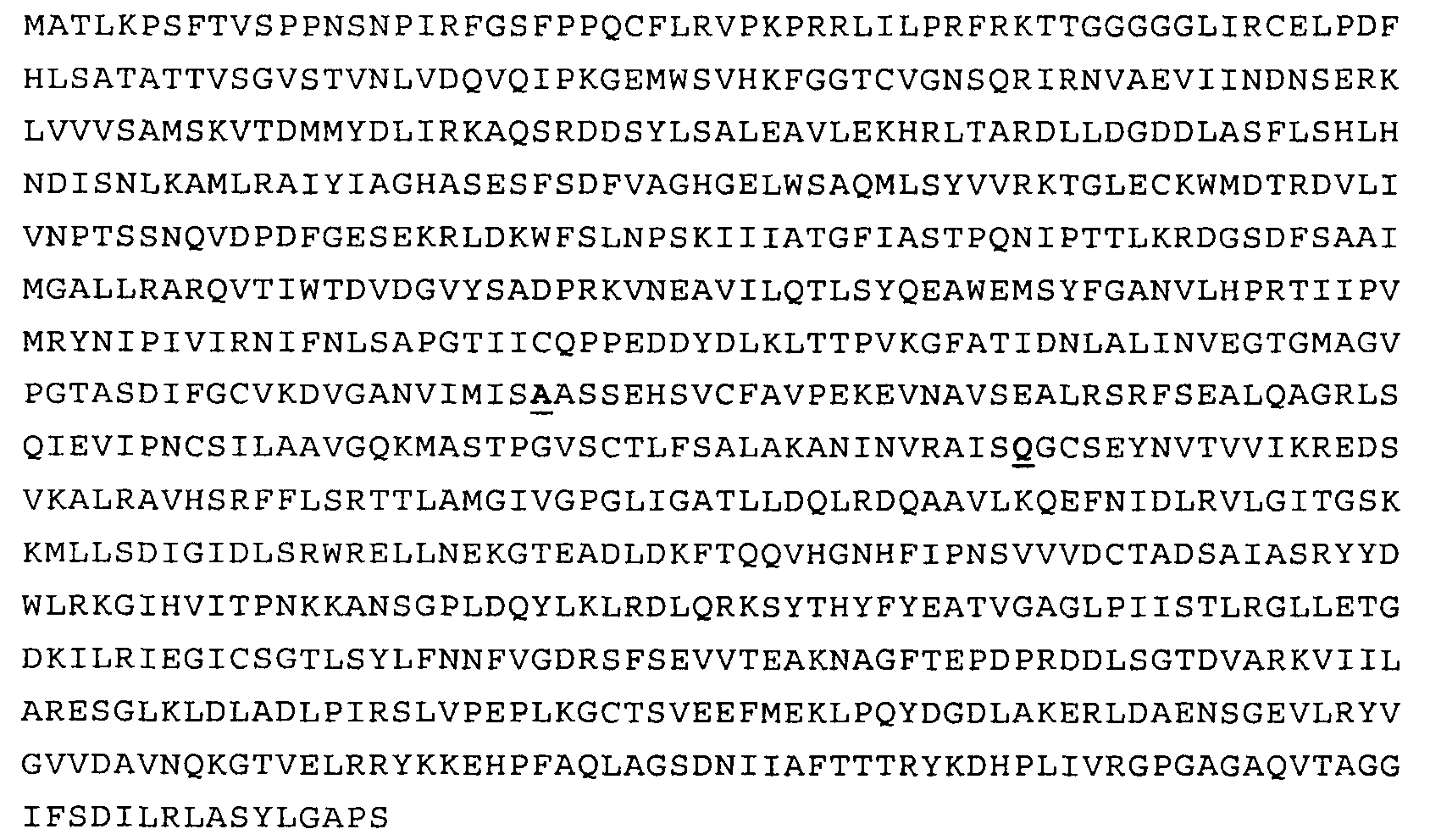
В SEQ ID NO:5 выделены мутантный аланин (А) в положении 443 и присутствующий в последовательности дикого типа глутамин (Q) в положении 524.
Полипептидная последовательность другого варианта (а именно варианта с одной мутацией Gln524Ala) нечувствительной к треонину аспартаткиназы представлена ниже в виде SEQ ID NO:6.
SEQ ID NO:6:

В SEQ ID NO:6 выделены мутантный аланин (А) в положении 524 и присутствующий в последовательности дикого типа глутамин (Q) в положении 443.
Полипептидная последовательность другого варианта (а именно варианта с двойной мутацией Gln443Ala; Gln524Ala) нечувствительной к треонину аспартаткиназы представлена ниже в виде SEQ ID NO:7.
SEQ ID NO:7:
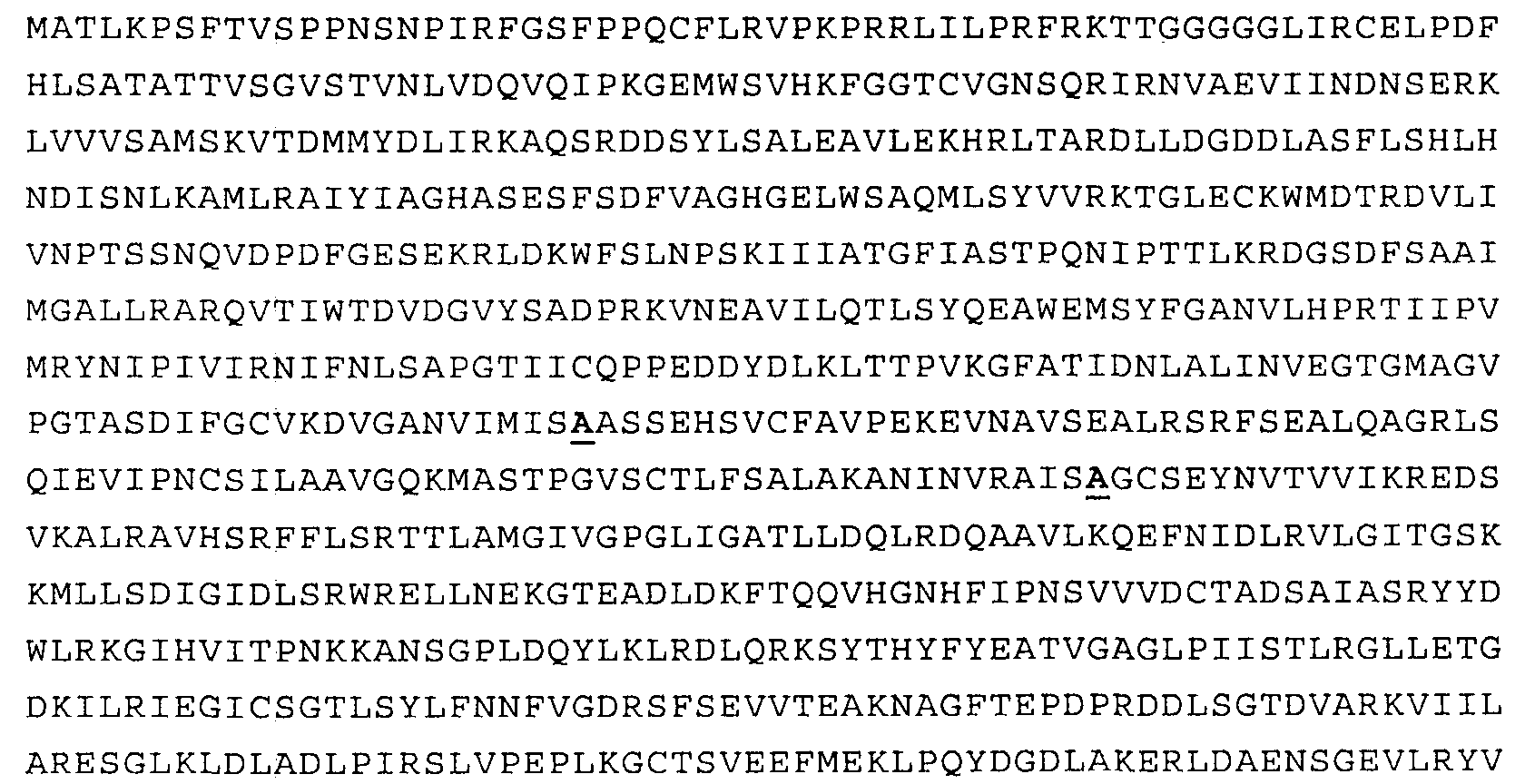
В SEQ ID NO:7 выделены мутантные остатки аланина (А) в положениях 443 и 524.
Таким образом, полипептидная последовательность, обладающая активностью нечувствительной к треонину аспартаткиназы, может содержать аминокислотную последовательность, практически совпадающую с одной из последовательностей, представленных в любой из SEQ ID NO:5, 6 или 7, или ее функциональный вариант, или фрагмент.
Генетические конструкции, предлагаемые в изобретении, могут находиться в форме кассет экспрессии, которые можно применять для обеспечения экспрессии кодирующей последовательности в клетке-хозяине. Генетическую конструкцию, предлагаемую в изобретении, можно интродуцировать в клетку-хозяина, не включая ее в вектор. Например, генетическую конструкцию, которая может представлять собой молекулу нуклеиновой кислоты, можно встраивать в липосому или вирусную частицу. В альтернативном варианте очищенную молекулу нуклеиновой кислоты (например, не содержащую гистоны ДНК или «оголенную» ДНК) можно встраивать непосредственно в клетку-хозяина с помощью пригодных средств, например, путем прямого эндоцитозного поглощения. Генетическую конструкцию можно интродуцировать непосредственно в клетки организма-хозяина (например, растения) путем трансфекции, инфекции, микроинъекции, клеточного слияния, слияния протопластов или путем бомбардировки микроснарядами. В альтернативном варианте генетические конструкции, предлагаемые в изобретении, можно интродуцировать непосредственно в клетку-хозяина с помощью «генной пушки» (пушки для обстрела несущими генетические конструкции микрочастицами). В альтернативном варианте генетическую конструкцию можно включать в рекомбинантный вектор для осуществления экспрессии в пригодной клетке-хозяине.
Таким образом, вторым объектом изобретения является рекомбинантный вектор, содержащий генетическую конструкцию, представляющую собой первый объект изобретения.
Рекомбинантный вектор может представлять собой плазмиду, космиду или фаг. Такие рекомбинантные вектора чрезвычайно удобно применять для трансформации клеток-хозяев генетической конструкцией, представляющей собой первый объект изобретения, и для обеспечения репликации в них кассеты экспрессии. Специалисту в данной области должно быть очевидно, что генетические конструкции, предлагаемые в изобретении, можно объединять с многими типами каркасных векторов для целей обеспечения экспрессии. Каркасный вектор может представлять собой бинарный вектор, например, вектор, который может реплицироваться и в E.coli, и в Agrobacterium tumefaciens. Например, пригодным вектором может служить плазмида типа pBIN, такая как pBIN19. Однако предпочтительный каркасный вектор представляет собой BNP 1380000001, основой которого является pBINPLUS (F. A. van Engelen и др., Transgenic Research, 4, 1995, cc.288-290), и который несет промотор SAG12. Вариант этого вектора представлен на фиг.16.
Рекомбинантные векторы могут включать различные другие функциональные элементы помимо промотора (например, ассоциированного с фазой старения промотора), и по меньшей мере одну кодирующую последовательность (кодирующую мутантную AK-HSDH). Например, можно создавать рекомбинантный вектор таким образом, чтобы он автономно реплицировался в цитозоле клетки-хозяина. В этом случае может оказаться необходимым включать в рекомбинантный вектор элементы, которые индуцируют или регулируют репликацию ДНК. В альтернативном варианте можно создавать рекомбинантный вектор таким образом, чтобы он интегрировался в геном клетки-хозяина. В этом случае следует предусматривать включение последовательностей ДНК, которые способствуют направленной интеграции (например, путем гомологичной рекомбинации).
Рекомбинантный вектор может содержать также ДНК, кодирующую ген, который можно использовать в качестве селектируемого маркера в процессе клонирования, т.е. позволяющий отбирать трансфектированные или трансформированные клетки и позволяющий отбирать клетки, которые несут векторы, содержащие гетерологичную ДНК. В альтернативном варианте селектируемый маркерный ген может присутствовать в другом векторе, предназначенном для применения одновременно с вектором, несущим представляющий интерес ген. Вектор может содержать также ДНК, участвующую в регуляции экспрессии кодирующей последовательности, или предназначенную для направленного переноса экспрессированного полипептида в определенную часть клетки-хозяина, например, в хлоропласт. Так, вектор, представляющий собой второй объект изобретения, может содержать по меньшей мере один дополнительный элемент, выбранный из группы, включающей: селектируемый маркерный ген (например, ген, обусловливающий устойчивость к антибиотику); сигнал терминации трансляции полипептида; и последовательность, обеспечивающую направленный перенос белка (например, хлоропластный транзитный пептид).
Примерами пригодных маркерных генов, могут служить гены, обусловливающие устойчивость к антибиотикам, такие как гены, обусловливающие устойчивость к канамицину, генетицину (G418) и гигромицину (npt-II, hyg-B); гены, обусловливающие устойчивость к гербицидам, такие как гены, обусловливающие устойчивость к фосфинотрицину и гербицидам на основе сульфонамида (bar и suI соответственно; ЕР-А-242246, ЕР-А-0249637); и применяемые для скрининга маркеры, такие как бета-глюкуронидаза (GB2197653), люцифераза и зеленый флуоресцентныйо белок (GFP).
Маркерный ген может находиться под контролем второго промотора (который может представлять собой ассоциированный с фазой старения промотор, но может и не быть им), позволяющего осуществлять экспрессию в клетках, которые могут присутствовать в семенах или могут не присутствовать в них, что дает возможность осуществлять отбор клеток или тканей, которые содержат маркер, на любой стадии развития растения. Пригодными для применения в качестве второго промотора являются промотор гена нопалинсинтазы из Agrobaclerium и промотор, выведенный из гена, кодирующего транскрипт 35S вируса мозаики цветной капусты (CaMV). Однако можно применять любые другие промоторы, пригодные в качестве второго промотора.
Различные варианты генетических конструкций, предлагаемых в изобретении, можно создавать с использованием пригодной процедуры клонирования, которая описана в примере 2, и которую можно обобщить следующим образом. Ген, кодирующий AK-HSDH дикого типа, можно амплифицировать, применяя в качестве матрицы либо геномную, либо кДНК, с помощью ПЦР с использованием пригодных праймеров. Пригодные праймеры для амплификации гена AK-HSDH дикого типа могут иметь последовательности, представленные в SEQ ID NO:8 и/или SEQ ID NO:9. ПЦР-продукты можно анализировать с помощью электрофореза на агарозном геле. Затем можно осуществлять сайт-направленный мутагенез с использованием пригодной пары праймеров для того, чтобы осуществить мутацию кодонов дикого типа в положениях 443 и/или 524 с получением вариантов, имеющих одну мутацию Gln443Ala и Gln524Ala, или две мутации (двойной мутант). Например, пригодные праймеры для изменения кодона Gln443 могут иметь последовательности, представленные в SEQ ID NO:10 и/или SEQ ID NO:11. Пригодные праймеры для изменения кодона Gln524 могут иметь последовательности, представленные в SEQ ID NO:12 и/или SEQ ID NO:13.
После этого ПЦР-продукты, кодирующие либо две конструкции, имеющие одну мутацию, либо один двойной мутант, можно встраивать путем лигирования в пригодный для целей клонирования вектор, например, в вектор, который поступает в продажу под товарным знаком pCR4 Blunt-TOPO от фирмы Invitrogen. Затем векторы, несущие ПЦР-продукты, можно выращивать в пригодном хозяине, таком как Е.coli. После этого колонии Е.coli можно подвергать скринингу с помощью ПЦР с использованием пригодных праймеров, и вставки в плазмидах, для которых выявлена правильная схема расщепления рестриктазами, можно секвенировать с использованием пригодных праймеров.
Колонии Е.coli, несущие кДНК ТОРО (AK-HSDH), можно культивировать до получения соответствующего количества плазмид, которые можно затем подвергать очистке. После этого плазмиду можно расщеплять с высвобождением ДНК-фрагмента, кодирующего мутантную AK-HSDH, который затем можно клонировать в векторе, несущем пригодный промотор, например, промотор SAG-семейства (предпочтительно SAG 12), в таком как плазмида pBNP. Образовавшуюся плазмиду обозначили как pBNP138-0453-001. Вариант вектора, представляющий собой второй объект изобретения, может являться практически таким же вектором, который изображен на фиг.15.
Третий объект изобретения представляет собой способ получения трансгенного растения, в листьях которого происходит накопление треонина в больших количествах, чем в соответствующем растении дикого типа, культивируемом в таких же условиях, заключающийся в том, что:
(I) трансформируют клетку растения генетической конструкцией, представляющей собой первый объект изобретения, или вектором, представляющим собой второй объект изобретения; и
(II) регенерируют растение из трансформированной клетки.
Методы определения уровня треонина в листьях растения и скорости роста растения описаны в примере 1. Способ, представляющий собой третий объект изобретения, может предусматривать трансформацию клетки опытного растения генетической конструкцией, представляющей собой первый объект изобретения, или вектором, представляющим собой второй объект изобретения. Генетические конструкции или вектор можно интродуцировать в клетку-хозяина любыми пригодными путями.
Четвертым объектом изобретения является клетка, содержащая генетическую конструкцию, представляющую собой первый объект изобретения, или рекомбинантный вектор, представляющий собой второй объект изобретения.
Клетка может представлять собой клетку растения. При создании изобретения неожиданно было установлено, что экспрессия нечувствительной к треонину аспартаткиназы под контролем специфического для фазы старения промотора в клетке-хозяине является эффективной с точки зрения повышения концентрации треонина в стареющих листьях и не сопровождается ухудшением приспособленности, при этом клетка, представляющая собой четвертый объект изобретения, может содержать одну или несколько конструкций, представляющих собой первый объект изобретения, или один или несколько векторов, представляющих собой второй объект изоберетния.
Клетку можно трансформировать генетической конструкцией или вектором, предлагаемой/предлагаемым в изобретении, с помощью известных методов. Пригодные методы интродукции генетической конструкции в клетку-хозяина могут предусматривать применение «обезоруженного» (лишенного онкогенов) Ti-плазмидного вектора, встроенного в Agrobacterium с помощью процедур, известных в данной области, которые описаны, например, в ЕР-А-0116718 и ЕР-А-0270822. Другим методом может служить трансформация протопласта растения, в котором сначала удаляют клеточную мембрану и интродуцируют нуклеиновую кислоту, а затем восстанавливают клеточную мембрану. После этого из трансформированной клетки можно выращивать растение.
Пятым объектом изобретения является трансгенное растение, содержащее генетическую конструкцию, представляющую собой первый объект изобретения, или вектор, представляющий собой второй объект изобретения.
Трансгенное растение, представляющее собой пятый объект изобретения, может относиться к семейству Brassicaceae, например, к Brassica spp. Растение может представлять собой Brassica napus (масличный pane).
Другими примерами трансгенных растений, представляющих собой пятый объект изобретения, могут служить растения, относящиеся к семейству Poales, например, к Triliceae spp. Растение может представлять собой Trilicum spp. (пшеница). Повышение содержания белков в зерне пшеницы может обеспечивать увеличение объема пищевых продуктов, изготовленных из такой пшеницы, например, хлеба.
Следующими примерами пригодных трансгенных растений, представляющих собой пятый объект изобретения, могут служить растения семейства Solanaceae, к которым относятся, например, дурман вонючий, баклажан, мандрагора, красавка (беладонна), перец стручковый красный (паприка, перец стручковый жгучий), картофель и табак. Одним из примеров пригодных родов семейства Solanaceae является род Nicotiana. Пригодные виды растений рода Nicotiana можно обозначать как растения табака или просто табак. Известны различные методы, пригодные для трансформации растений генетической конструкцией, представляющей собой первый объект изобретения, или вектором, представляющим собой второй объект изобретения, и их можно применять при осуществлении настоящего изобретения.
Например, табак можно трансформировать следующим образом. Растение Nicotiana tabacum трансформируют с помощью метода совместного культивирования листовых дисков, практически следуя процедуре, описанной у Horsch и др., Science 227, 1985, cc.1229-1231. Берут по два самых молодых раскрывшихся листа с 7-недельных растений табака, стерилизуют их поверхность в 8%-ном Domestos™ в течение 10 мин и отмывают 6 раз стерильной дистиллированной водой. Листовые диски вырезают с помощью сверла для пробок размера 6 и помещают в суспензию Agrobacterium, несущих соответствующие бинарные векторы (предлагаемые в изобретении), примерно на две минуты. Диски осторожно промокают, помещая их между двумя листами стерильной фильтровальной бумаги. Десять дисков помещают на планшеты, содержащие среду LS + 3% сахарозы + 2 мкМ БАП (бензиламинопурин) + 0,2 мкМ НУК (нафтилуксусная кислота), которые затем инкубируют в течение 2 дней в фитотроне.
Диски переносят на планшеты, содержащие среду LS + 3% сахарозы + 2 мкМ БАП + 0,2 мкМ НУК, дополненную 500 г/л клафорана и 100 г/л канамицина. Через 2 недели диски переносят на новые планшеты с описанной выше средой. Еще через 2 недели листовые диски переносят на планшеты, содержащие среду LS + 3% сахарозы + 0,5 мкМ БАП, дополненную 500 мг/л клафорана и 100 мг/л канамицина. Диски переносят на свежую среду через каждые две недели. После появления проростков их вырезают и переносят в банки со средой LS + 3% сахарозы, дополненной 500 мг/л клафорана. Примерно через 4 недели проростки в банках переносят на среду LS + 3% сахарозы + 250 мг/л клафорана. Еще через 3-4 недели растения переносят на среду LS + 3% сахарозы (без антибиотиков) и укореняют. После укоренения растений их высаживают в почву и переносят в теплицу.
Шестым объектом изобретения является материал для размножения растений, полученный из трансгенного растения, представляющего собой пятый объект изобретения.
«Материал для размножения растений» может представлять собой любой растительный материал, взятый из растения, из которого затем можно получать растение. Пригодным материалом для размножения растений может являться семя.
Под объем настоящего изобретения подпадают также листья, собранные с трансгенного растения, предлагаемого в настоящем изобретении, где собранные листья содержат треонин в большем количестве, чем листья, собранные с соответствующего растения дикого типа, выращенного в тех же самых условиях.
Таким образом, седьмым объектом изобретения является собранный лист, содержащий треонин в большем количестве, чем листья, собранные с соответствующего растения дикого типа, выращенного в тех же самых условиях, где лист представляет собой лист, собранный с трансгенного растения, представляющего собой пятый объект изобретения, или растения, полученного способом, представляющим собой третий объект изобретения.
Восьмым объектом изобретения является предназначенный для курения продукт, содержащий обогащенный треонином табак, полученный из мутантного растения табака, где мутант обладает способностью сверхпродуцировать треонин в стареющих листьях.
Для достижения преимущества и предпочтительно мутантное растение табака должно быть трансформировано генетической конструкцией или вектором, предлагаемой/предлагаемым в изобретении. Предназначенный для курения продукт может представлять собой сигарету, сигару, сигареллу или свернутый табак, или т.п.
Обогащенный треонином табак может представлять собой табак, в котором концентрация треонина превышает соответствующую концентрацию в растении дикого типа, выращенном в тех же условиях. Такой предназначенный для курения продукт может содержать табак, полученный из мутантного растения табака, которое было трансформировано генетической конструкцией, представляющей собой первый объект изобретения, или вектором, представляющим собой второй объект изобретения. Обогащенный треонином табак характеризуется улучшенным запахом и ароматом.
Следует иметь в виду, что в настоящем изобретении предложен способ повышения уровня треонина в листьях растения по сравнению с уровнем в соответствующем растении дикого типа, не вызывающий ухудшение приспособленности растения, который предусматривает изменение метаболизма растения с целью обеспечения повышенного производства треонина после начала старения листа.
Таким образом, девятый объект изобретения представляет собой способ повышения уровня треонина в листьях растения по сравнению с уровнем в соответствующем растении дикого типа, не вызывающий ухудшение приспособленности растения, который предусматривает изменение метаболизма растения с целью обеспечения повышенного производства треонина после начала старения листа.
Предпочтительно и преимущественно способы, предлагаемые в изобретении, не ухудшают здоровье или адаптацию созданного растения. Предпочтительно способы предусматривают трансформацию опытного растения и предпочтительно его листьев генетической конструкцией, представляющей собой первый объект изобретения, или вектором, представляющим собой второй объект изобретения.
Как описано в примере 4, помимо измерения уровней треонина в трансформированных растениях, предлагаемых в изобретении, и демонстрации того, что концентрации треонина в стареющих листьях повышаются, при создании изобретения проводили также измерения концентраций других аминокислот в трансгенном растении, включая глутамин, глутаминовую кислоту, аспарагиновую кислоту и гистидин. Как продемонстрировано на фиг.10-14, концентрации каждой из указанных аминокислот оказались сопоставимыми или даже превышали соответствующие концентрации в контролях, что убедительно свидетельствует о том, что приспособленность трансгенного растения не ухудшилась. Таким образом, в целом конструкцию, предлагаемую в изобретении, можно применять для повышения уровня треонина в стареющих листьях, не оказывая при этом негативного воздействия на приспособленность трансгенного растения.
Следует иметь в виду, что под объем изобретения подпадают любая/любой нуклеиновая кислота или пептид, или ее/его вариант, производное или аналог, которые имеют практически такие же аминокислотные или нуклеотидные последовательности, которые представлены в любой из последовательностей, приведенных в настоящем описании, включая их функциональные варианты или функциональные фагменты. Понятия «практически такая же аминокислотная/полинуклеотидная/полипептидная последовательность», «функциональный вариант» и «функциональный фрагмент» относятся к последовательности, которая идентична по меньшей мере на 40% любой из аминокислотных/полинуклеотидных/полипептидных последовательностей, представленных в настоящем описании, например, идентична на 40% последовательности промотора, представленной в SEQ ID NO:1 (т.е. последовательности промотора SAG12), или гена, представленной в SEQ ID NO:2, 3 или 4 (который кодирует различные варианты фермента AK-HSDH), или идентична на 40% последовательности полипептида, представленной в SEQ ID NO:5, 6 или 7 (т.е. последовательностям различных вариантов мутантного фермента AK-HSDH), и т.д.
Можно рассматривать также
аминокислотные/полинуклеотидные/полипептидные последовательности, которые идентичны более чем на 65%, более предпочтительно более чем на 70%, еще более предпочтительно более чем на 75%, и еще более предпочтительно более чем на 80% любой из представленных в настоящем описании последовательностей. Предпочтительно аминокислотные/полинуклеотидные/полипептидные последовательности идентичны по меньшей мере на 85% любой из представленных в настоящем описании последовательности, более предпочтительно по меньшей мере на 90%,еще более предпочтительно по меньшей мере на 92%, еще более предпочтительно по меньшей мере на 95%, еще более предпочтительно по меньшей мере на 97%, еще более предпочтительно по меньшей мере на 98% и наиболее предпочтительно по меньшей мере на 99% любой из представленных в настоящем описании последовательности.
Специалисту в данной области должно быть известно, как рассчитывать процент идентичности между двумя аминокислотными/полинуклеотидными/полипептидными последовательностями. Для расчета процента идентичности между двумя аминокислотными/полинуклеотидными/полипептидными последовательностями сначала необходимо осуществить выравнивание двух последовательностей, а затем расчет степени идентичности. Процент идентичности двух последовательностей может быть выражен в виде различных величин в зависимости от: (I) метода, применяемого для выравнивания последовательностей, такого, например, как ClustalW, BLAST, FASTA, Smith-Waterman (реализованного в виде раличных программ), или структурного выравнивания на основе сравнения 3D-структур; и (II) параметров, используемых в методе выравнивания, например, зависящих от того, проводят локальное или глобальное выравнивание, применяемой матрицы для парных сравнений (наример, BLOSUM62, РАМ250, Gonnet и т.д.), и штрафа за брешь, например, в зависимости от того, применяют его в функциональной форме или в виде констант.
После осуществления выравнивания можно применять многочисленные различные подходы для расчета процента идентичности между двумя последовательностями. Например, можно делить количество идентичных положений на: (I) длину наиболее короткой последовательности; (II) длину участка, на котором произведено выравнивание; (III) среднюю длину последовательности; (IV) количество положений, в которые не вводили бреши; или (V) количество эквивалентных положений за исключением выступающих концов. Кроме того, очевидно, что процент идентичности сильно зависит также от длины. Следовательно, можно ожидать, что чем короче пара последовательностей, тем более высокой является степень идентичности.
Таким образом, очевидно, что точное выравнивание белковых последовательностей или последовательностей ДНК является сложным процессом. Получившая широкое распространение программа множественных выравниваний ClustalW (Thompson и др., Nucleic Acids Research, 22, 1994, cc.4673-4680; Thompson и др., Nucleic Acids Research, 24, 1997, cc.4876-4882) представляет собой предпочтительный подход для осуществления множественных выравниваний белковых последовательностей или последовательностей ДНК, предлагаемых в изобретении. Пригодными параметрами для ClustalW могут являться следующие параметры: для выравнивания ДНК: штраф за введение бреши = 15,0, штраф за удлинение бреши = 6,66, и категория матрицы (Matrix) = идентичность (Identity). Для выравнивания белков: штраф за введение бреши = 10,0, штраф за удлинение бреши = 0,2, и категория матрицы (Matrix) = Gonnet. Для выравнивания ДНК и белков: ENDGAP = -1, и GAPDIST = 4. Специалистам в данной области должно быть известно, что при необходимости можно изменять эти и другие параметры для осуществления оптимального выравнивания последовательностей.
Предпочтительно после такого выравнивания можно расчитывать процент идентичности между двумя аминокислотными/полинуклеотидным и/полипептидным и последовательностями в виде (N/T×100, где N представляет собой количество положений, в которых последовательностях находятся идентичные остатки, и Т представляет собой общее количество сравниваемых положений, включая бреши, но исключая выступающие концы. Таким образом, наиболее предпочтительный метод расчета процента идентичности между двумя последовательностями заключается в том, что (I) осуществляют выравнивание последовательностей с помощью программы ClustalW с использованием пригодного набора параметров, например, указанного выше; и (II) подставляют величины N и Т в следующую формулу:-процент идентичности = (N/T)×100.
Специалистам в данной области должны быть известны и другие методы идентификации сходных последовательностей. Например, практически сходная нуклеотидная последовательность должна представлять собой последовательность, которая гибридизуется в строгих условиях с последовательностями, представленными в SEQ ID NO:1, 2, 3 или 4, или их комплементами. В контексте настоящего описания гибридизация в строгих условиях означает гибридизацию нуклеотида со связанной с фильтром ДНК или РНК в 3-кратном хлориде натрия/цитрате натрия (SSC) при температуре примерно 45°C с последующей по меньшей мере однократной отмывкой в 0,2×SSC/0,1% ДСН при температуре примерно 20-65°С. В альтернативном варианте практически сходный полипептид может отличаться по меньшей мере на 1, но меньше чем на 5, 10, 20, 50 или 100 аминокислот от последовательностей, представленных в SEQ ID NO:5, 6 или 7,
Очевидно, что вследствие вырожденности генетического кода любую нуклеотидную последовательность из числа представленных в настоящем описании можно варьировать или изменять, не оказывая при этом существенного влияния на последовательность кодируемого ей белка, что приводит к появлению ее функциональных вариантов. Пригодными нуклеотидными вариантами являются варианты, последовательности которых изменены в результате замены различных кодонов, кодирующих одну и ту же аминокислоту в последовательности, в результате чего возникают «молчащие» изменения. Другими пригодными вариантами могут являться варианты, которые имеют гомологичные нуклеотидные последовательности, но содержат полностью или частично последовательности, измененные путем замены различных кодонов, которые кодируют аминокислоту с боковой цепью, обладающей биофизическими свойствами, сходными со свойствами аминокислоты, на которую ее заменяют, в результате чего возникает консервативное изменение. Например, в группу малых неполярных гидрофобных аминокислот входят глицин, аланин, лейцин, изолейцин, валин, пролин и метионин. К крупным неполярным гидрофобным аминокислотам относятся фенилаланин, триптофан и тирозин. К полярным нейтральным аминокислотам относятся серин, треонин, цистеин, аспарагин и глутамин. К положительно заряженным (основным) аминокислотам относятся лизин, аргинин и гистидин. К отрицательно зараженным (кислотным) аминокислотам относятся аспарагиновая кислота и глутаминовая кислота. Таким образом, является очевидным, какие аминокислоты можно заменять на аминокислоты, имеющие сходные биофизические свойства, и специалисту в данной области должны быть известны нуклеотидные последовательности, кодирующие указанные аминокислоты.
Все отличительные признаки, представленные в настоящем описании (включая все пункты прилагаемой формулы изобретения, реферат и чертежи), и/или все стадии описанного способа или процесса можно объединять с любым из вышеуказанных объектов изобретения в любой комбинации, за исключением комбинаций, в которых по меньшей мере некоторые из отличительных признаков и/или стадий являются взаимоисключающими.
Для более ясного понимания изобретения и для пояснения путей реализации вариантов осуществления рассматриваемого изобретения ниже представлены в качестве примера чертежи, на которых показано:на фиг.1 - часть пути биосинтеза в растении, в котором аспартат превращается в другие аминокислоты. Участвующие в этом процессе ферменты представляют собой аспартаткиназу (AK) и гомосериндесатуразу (HSDH);
на фиг.2 - путь биосинтеза в растении, в котором аспартат превращается в другие аминокислоты, включая треонин. Первым активным ферментом в этом пути является аспартаткиназа (AK). Растения могут продуцировать бифункциональный фермент аспартаткиназу:гомосериндегидрогеназу (АК-HSDH). Путь биосинтеза строго регулируется по типу положительной и отрицательной обратной связи конечными продуктами;
на фиг.3 - модель аллостерического контроля аспартаткиназы-гомосериндегидрогеназы треонином в Arabidopsis (согласно Paris и др. (2003));
на фиг.4 - схематическое изображение мутантного бифункционального фермента аспартаткиназы-гомосериндесатуразы;
на фиг.5 - уровни треонина, выявленные в листовых дисках согласно методу, описанному в примере 2;
на фиг.6 - последовательность промотора SAG12;
на фиг.7 - последовательность мутантного фермента аспартаткиназы-гомосериндесатуразы. Мутантные основания, необходимые для преодоления ингибирования по типу обратной связи треонином, выделены жирным шрифтом и подчеркнуты;
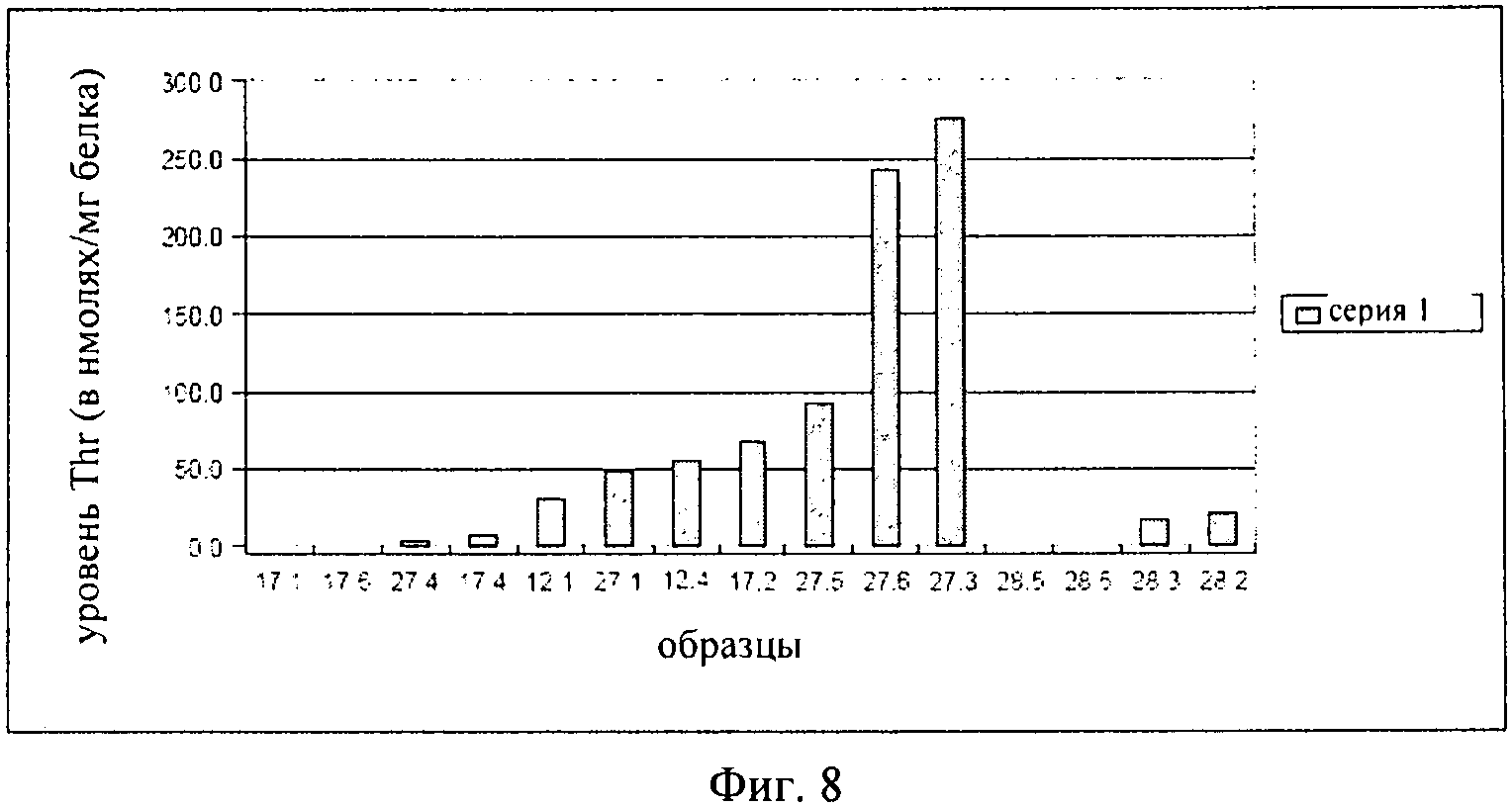
на фиг.8 - уровень треонина в листовых дисках, взятых с трансгенных растений, в которых нечувствительная к треонину AK-HSDH находится под контролем специфического для фазы старения промотора, что описано в примере примере 3;
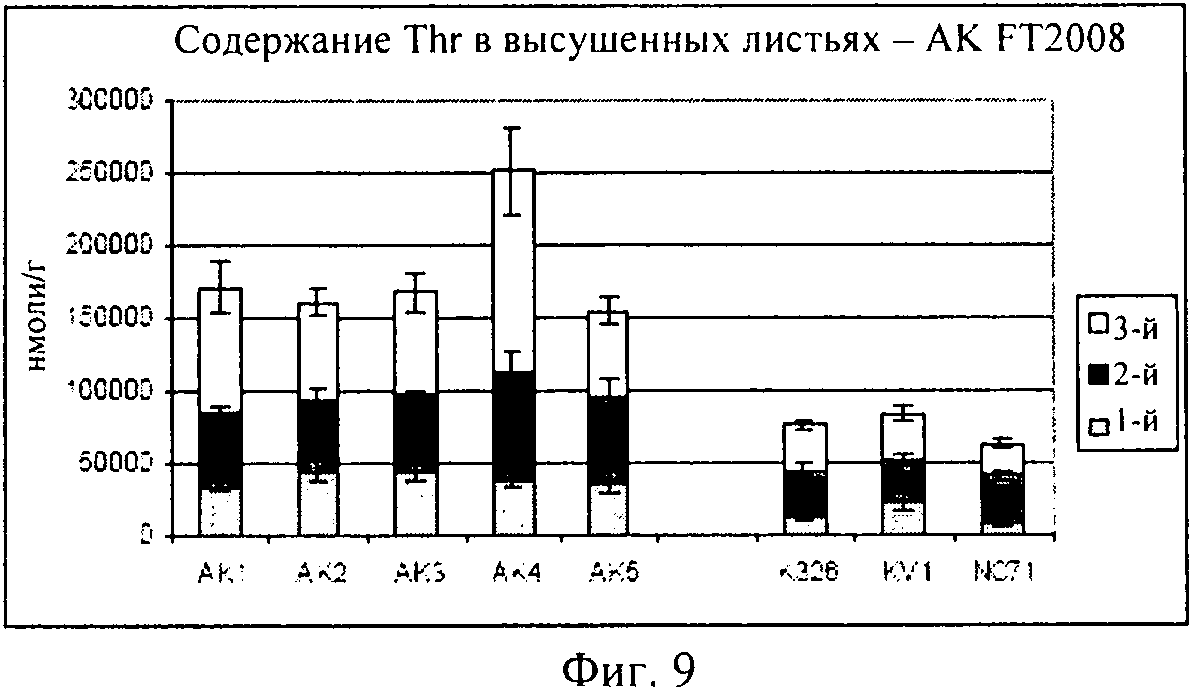
на фиг.9 - столбиковая диаграмма, на которой представлено содержание треонина в высушенных листьях, которые были выращены в полевом опыте;
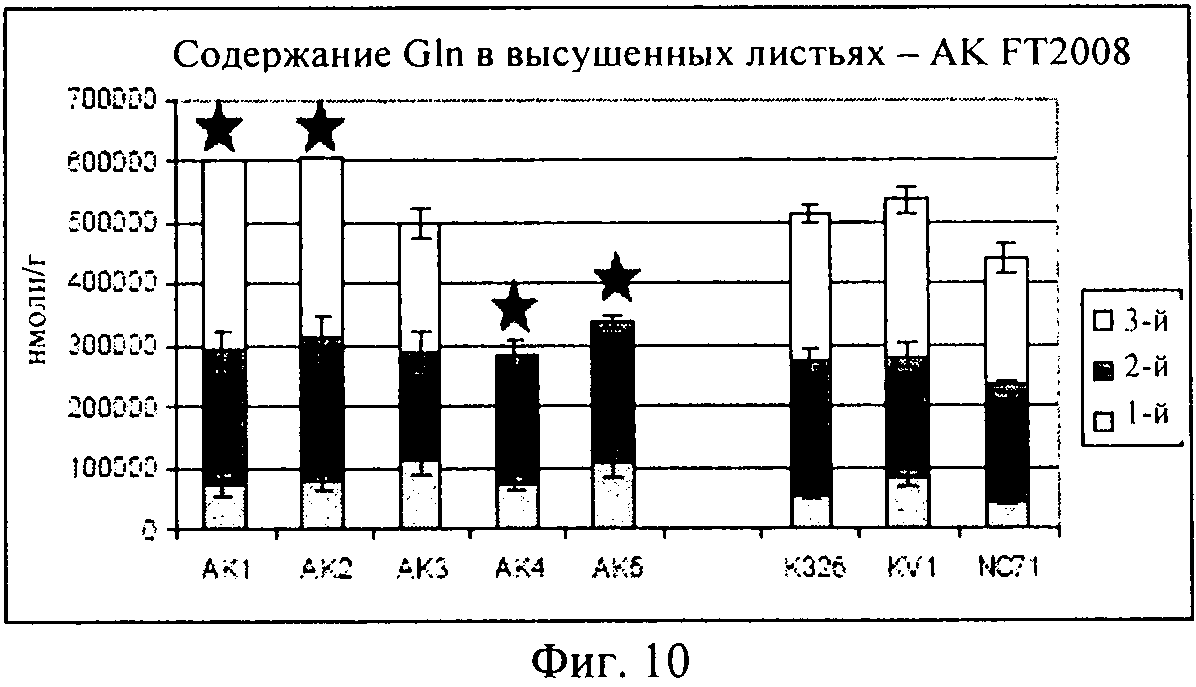
на фиг.10 - столбиковая диаграмма, на которой представлено содержание глутамина в высушенных листьях, которые были выращены в полевом опыте;
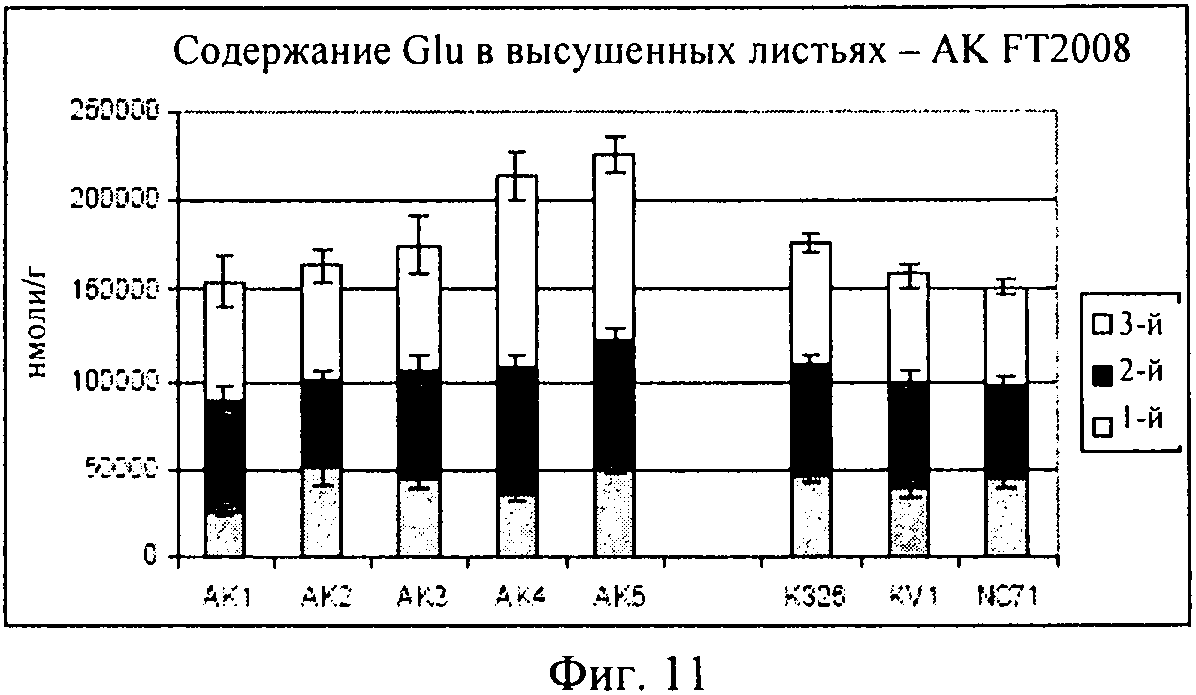
на фиг.11 - столбиковая диаграмма, на которой представлено содержание глутаминовой кислоты в высушенных листьях, которые были выращены в полевом опыте;
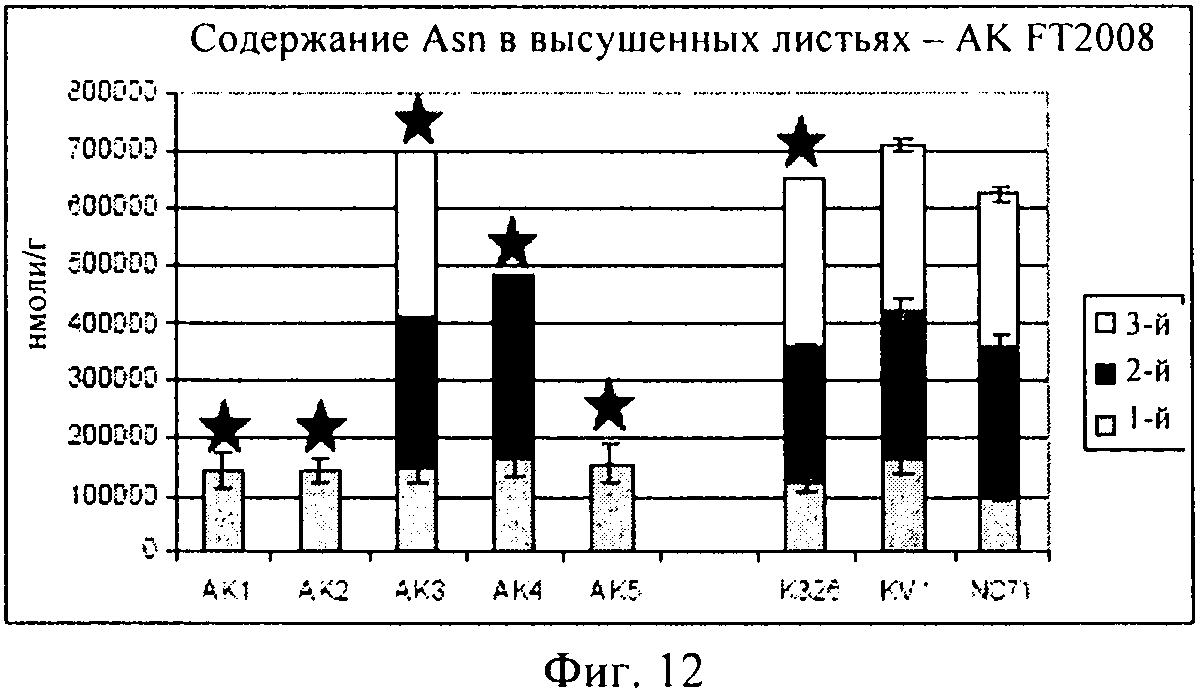
на фиг.12 - столбиковая диаграмма, на которой представлено содержание аспарагина в высушенных листьях, которые были выращены в полевом опыте;
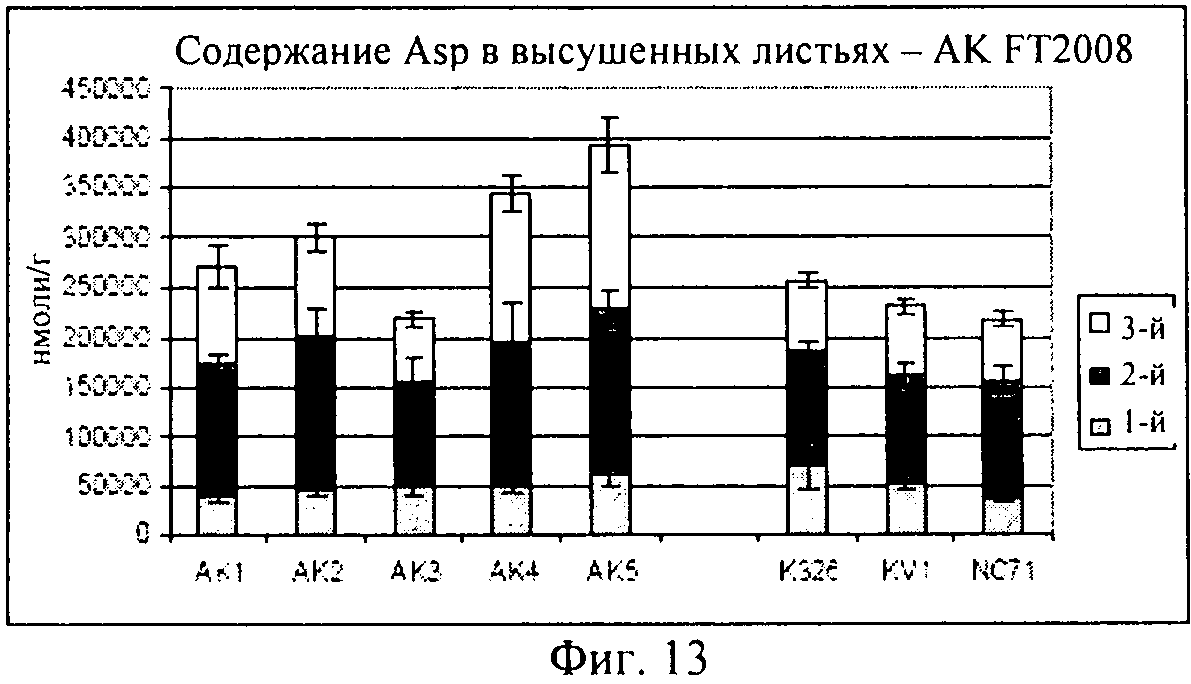
на фиг.13 - столбиковая диаграмма, на которой представлено содержание аспарагиновой кислоты в высушенных листьях, которые были выращены в полевом опыте;
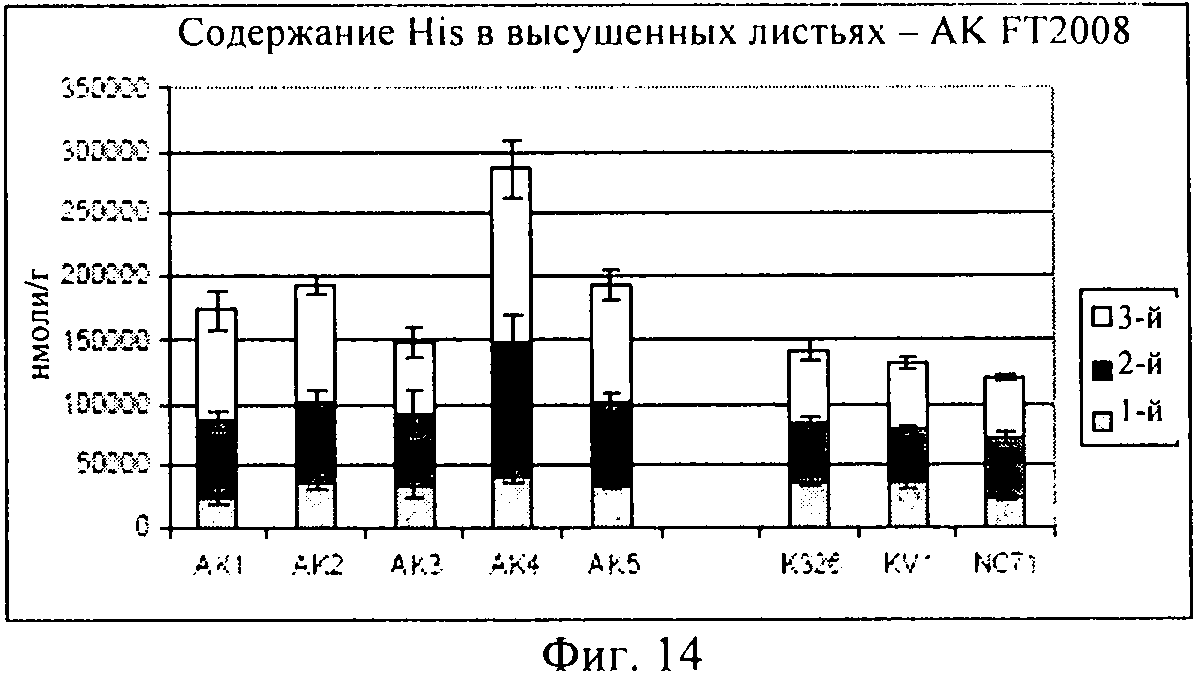
на фиг.14 - столбиковая диаграмма, на которой представлено содержание гистидина в высушенных листьях, которые были выращены в полевом опыте;
на фиг.15 - плазмидная карта одного из вариантов вектора, предлагаемого в изобретении; и
на фиг.16 - плазмидная карта каркасного вектора, применяемого согласно изобретению.
Примеры
Как описано в примере 2, при создании изобретения были созданы трансгенные растения, в которых экспрессия модифицированной нечувствительной к действию по типу обратной связи аспартаткиназы (AK:HSDH) происходила под контролем специфического для листа промотора. Однако было установлено, что локализация экспрессии модифицированной AK:HSDH в листьях приводила к возникновению цены за приспособленность для трансгенного растения. Поэтому, как описано в примерах 3-4, затем при создании изобретения применяли специфическаий для фазы старения промотор (SAG12), связанный с кодирующей последовательностью, которая кодирует полипептид, обладающий активностью нечувствительной к треонину аспартаткиназы (AK:HSDH). Созданное таким путем трансгенное растение продуцировало треонин в количестве, которое превышало уровень, достигаемый в растениях дикого типа в период старения листьев, не ухудшая при этом приспособленность растения.
Пример 1 - Оценка уровней треонина в листьях
Определение уровней треонина осуществляли для зеленых и пожелтевших листьях. Брали и применяли для анализа листовые диски, так что измерения заключались в определении количества треонина на листовой диск (т.е. количества thr/площадь листа) или в определении количества белка в супернатанте (т.е. количества thr/мг белка). Пульпу листового диска смешивали взятой в определенном объеме водой и центрифугировали для осаждения нерастворимого листового дебриса. Затем супернатант, полученный с помощью такого процесса, обрабатывали с использованием набора Phenomenex EZfaast. Этот набор представляет собой запатентованный набор, который применяют для дериватизации аминокислот в экстракте для того, чтобы можно было осуществлять их количественную оценку с помощью стандартного устройства для ЖХ/МС.
Калибровку осуществляли с помощью внешнего стандарта для каждой подлежащей количественной оценке аминокислоты и выход после стадий дериватизации стандартизовали для образцов, используя при осуществлении процесса внутренние стандарты. Хроматограммы анализировали путем измерения площади пиков, которые соотносили с концентрацией, с использованием алгоритмов интегрирования, включенных в программное обеспечение для ЖХ/МС. Если пик нельзя было достоверно идентифицировать с помощью программного обеспечения или визуально специалистом, то принимали решение о том, что он находится «ниже пределов обнаружения». Было установлено, что это имело место для некоторых используемых в качестве контролей пустых векторов и для некоторых последующих поколений «растений-нулевых сегрегантов».
Пример 2 - Трансгенные растения с нечувствительной к воздействию по типу обратной связи AK:HSDH, функционально связанной со специфическим для листа промотором
При создании изобретения осуществляли сайт-направленный мутагенез последовательности бифункциональной AK:HSDH дикого типа из Arabidopsis thaliana (At4g19710). Для этого сначала выделяли последовательность дикого типа из специфической для листа библиотеки кДНК из Arabidopsis thaliana с помощью ПЦР с использованием следующих праймеров:
At4g19710 For. ATGGCGACTCTGAAGCCGTCATTTAC (SEQ ID NO:8);
At4g19710 Rev. TTAAGACGGTGCACCGAGATAAGATGC (SEQ ID NO:9).
Последовательность дикого типа модифицировали одним из трех методов: (I) подвергали мутации только домен AK, (II) подвергали мутации домен HSDH, или (III) подвергали мутации оба домена с целью нарушения регуляции, обусловленной связыванием с Thr. Специфические мутации осуществляли на остатках Gln443 и Gln524, которые оба находятся в регуляторных доменах фермента, при этом в обоих случаях мутации осуществляли путем замены на аланин с помощью сайт-направленного мутагенеза (Paris и др., «Mechanism of control of Arabidopsis thaliana aspartate kinase-homoserine dehydrogenase by threonine», J.Biol.Chem 278, 2003, cc.5361-5366, и Frankard и др., «Two feedback-insensitive enzymes of the aspartate pathway in Nicotiana sylvestris», Plant Physiol 99, 1992, cc.1285-1293.
Для осуществления указанной процедуры применяли набор для сайт-направленного мутагенеза Stratagene® QuikChange® (каталожный номер 200518). Для изменения кодона, кодирующего Glu443, при осуществлении реакций сайт-направленного мутагенеза применяли следующие праймеры:
Gln443 For. GTGATTATGATATCAGCTGCTAGCAGTGAGCATTCTG (SEQ ID NO:10); и
Gln443 Rev. CAGAATGCTCACTGCTAGCAGCTGATATCATAATTCAC (SEQ ID NO:11).
Для Gln524 применяли следующую пару праймеров:
Gln524 For. GTCCGAGCTATATCTGCTGGTTGTTCTGAGTACAATG;
(SEQ ID NO:12); и
Gln524 Rev. CATTGATCTCAGAACAACCAGCAGATATAGCTCGGAC
(SEQ ID NO:13).
Эти три мутантные последовательности использовали индивидуально для трансформации растений Nicotiana tabacum, а также последовательностью дикого типа AK:HSDH Arabidopsis. Во всех случаях экспрессия представляющего интерес гена осуществлялась под контролем специфического для листа промотора гена пластоцианина из гороха. Растения из всех популяций создавали путем опосредуемой Agrobacterium трансформации и выращивали в условиях теплицы в Кэмбридже, Великобритания. Для осуществления экстракции и дериватизации свободных аминокислот в каждом образце использовали набор для аминокислот EZfaast (Phenomenex®). Количественную оценку осуществляли с помощью ЖХ/МС.
Результаты представлены на фиг.5 и в таблице 1. На фиг, 5 серии растений, в которых подвергнут мутации только домен AK, имеют названия, начинающиеся на AK, серии растений, в которых подвергнут мутации только домен HSDH, имеют названия, начинающиеся на HSDH, серии растений, в которых подвергнуты мутации оба домена АК и HSDH, имеют названия, начинающиеся на AK/HSDH, растения дикого типа имеют названия, начинающиеся на WT, а трансгенные растения, несущие пустые контрольные векторы, имеют названия, начинающиеся на EV.
При создании изобретения было достигнуто повышение уровней треонина в листьях во всех популяциях растений, трансформированных последовательностью из Arabidopsis, в том числе в растениях, трансформированных не подвергнутой мутации последовательностью из Arabidopsis. Популяции, трансформированные последовательностями, которые были подвергнуты мутации в домене AK, характеризовались наиболее высокими уровнями Thr в листьях. В этой группе имела место наибольшая пропорция популяций, характеризующихся серьезным ухудшением приспособленности. Хотя при создании изобретения применяли специфический для листьев промотор с целью снижения влияния модификации на фертильность, тем не менее воздействия оказались достаточными для того, чтобы метаболические последствия дерегуляции оказываемого ферментом контроля по типу обратной связи затрагивали все растение.
При этом для всех растений, характеризующихся повышенным уровнем треонина, была выявлена корреляция с измененными особенностями роста. Листья были бледными, утолщенными, хрупкими и похожими на послоки. Междоузлия были укороченными и по мере созревания становились побуревшими, почки либо не развивались, либо были деформированными. Таким образом, можно сделать вывод о том, что сайт-направленный мутагенез позволил добиться повышения уровня треонина в листьях. Однако для того, чтобы с помощью такого подхода можно было создать жизнеспособное с агрономической точки зрения растение, еще оказывается необходимым преодолеть цену за приспособленность после нарушения осуществляемого по типу обратной связи контроля аспартаткиназы.
Пример 3 - Трансгенные растения, содержащие нечувствительную к треонину AK:HSDH, функционально связанную со специфическим для фазы старения промотором
Растения Nicotiana tabacum, культивар K326, использовали для получения листовых дисков, которые совместно культивировали с Agrobacterium tumefasciens, предварительно подвергнутой трансформации (путем электропорации) бинарным вектором, несущим представляющий интерес ген (а именно ген мутантной AK:HSDH, последовательность которого представлена на фиг.7, т.е. SEQ ID NO:2, 3 или 4), находящийся под контролем специфического для фазы старения промотора, т.е. SAG 12 (последовательность которого представлена на фиг.6, т.е. SEQ ID NO:1). Одновременно создавали контрольную популяцию, в которой бинарный вектор содержал промотор, но не содержал ген AK:HSDH. Затем листовые диски обрабатывали согласно протоколам культивирования тканей с получением проростков (Horsch и др., Science 227, 1985, cc.1229-1231). Каждый проросток давал одно трансформированное растение, в котором содержалась ДНК, перенесенная из бактерии и интегрированная в геномную ДНК растения. Указанные растения переносили в теплицу и выращивали до созревания. Зрелые листья отделяли от растений и помещали в полиэтиленовые мешки и хранили в темноте при 35°С в течениег 72 ч. По истечении этого времени из листа получали листовые диски, которые анализировали с целью определения содержания треонина согласно методу, описанному выше в примере 1.
Результаты представлены на фиг.8, где продемонстрировано, что в некоторых растениях были выявлены высокие уровни треонина. Преимуществом этих растений было то, что они характеризовались нормальным ростом. Таким образом, для указанных трансгенных растений не была обнаружена потеря приспособленности, которая наблюдалась для растений, описанных в примере 2.
Пример 4 - Полевые опыты с трансгенными растениями, содежащими нечувствительную к треонину AK:HSDH, связанную с промотором SAG12
Линии растительных клеток, выбранные из экспериментальной популяции SAG12:аспартаткиназа (pBNP 138-0253-001), выращивали в полевых условиях в 2008 г. в шт. Северная Каролина. Листья подвергали трубоогневой сушке и анализировали в отношении присутствия конкретных свободных аминокислот. Анализ осуществляли с помощь. ЖХ/МС, валидацию проводили путем калибровки с использованием внутренних и внешних стандартов. В том случае, когда аналит выпадал из диапазона, применяемого для калибровки, его отмечали символом «>S» в таблице 2, а на чертежах - звездочкой над соответствующим столбиком.
Перечень образцов подразделяли на следующие группы: линии, полученные из исходной линии K326, которую модифицировали генетической конструкцией, предлагаемой в изобретении, обозначены символом «AK» с соответствующими номерами, и три репрезентативные контрольные линии, а именно немодифицированная K326, немодифицированная KV1, немодифицированная NC71, которые все выращивали и сушили в одно и то же время в одинаковых условиях.
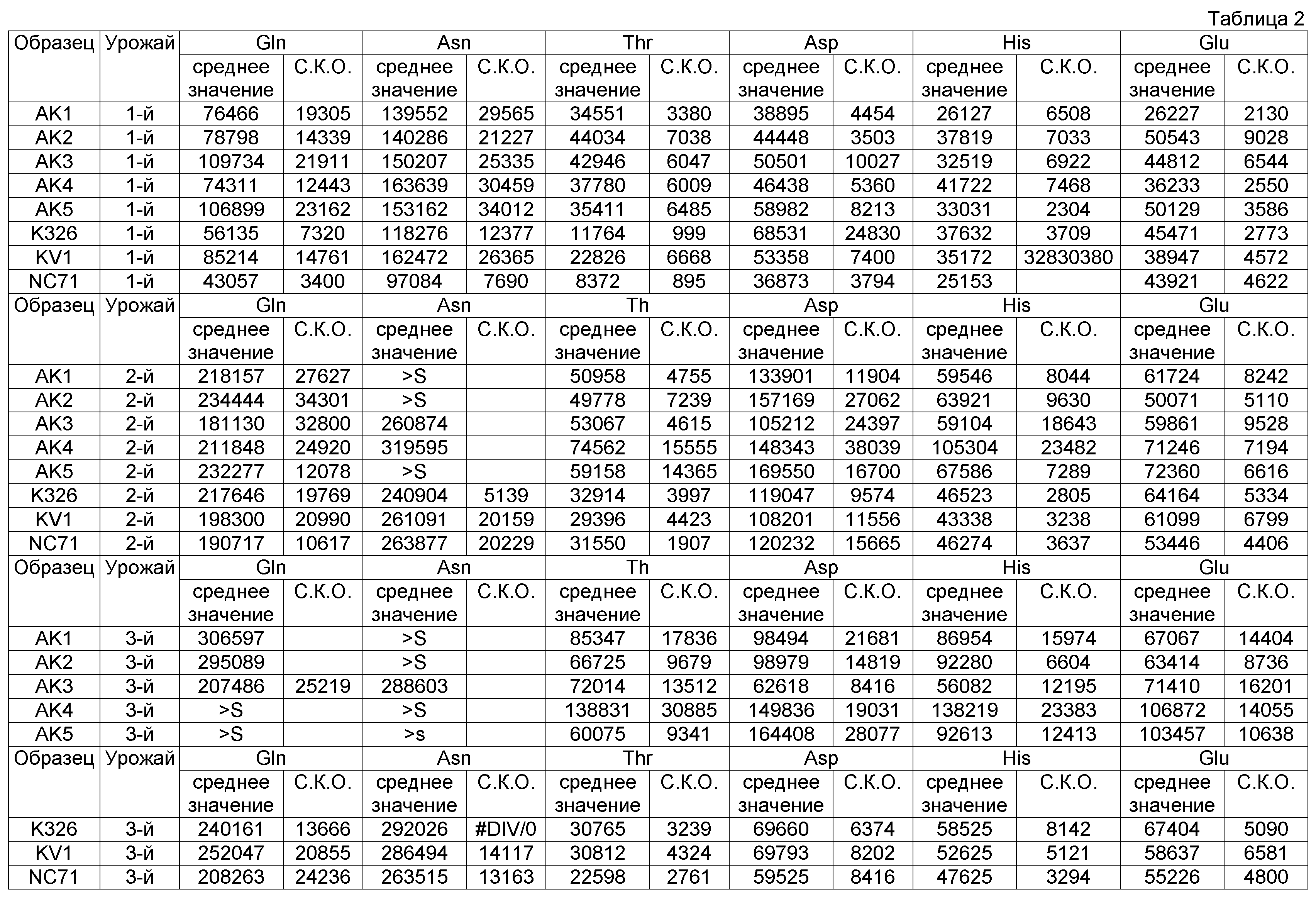
На фиг.9 представлена столбиковая диаграмма, на которой приведены концентрации треонина, полученные в пяти опытных растениях (AK1-AK5), в сравнении с тремя контролями (K326, KV1 и NC7). Данные свидетельствуют о том, что все пять опытных растений продуцировали треонин в существенно большем количестве, чем любой из контролей. Кроме того, ни для одного из пяти опытных растений не требовалась никакая цена за приспособленность позиций роста. Эти данные убедительно демонстрируют, что опытные растения, трансформированные конструкцией, предлагаемой в изобретении, дают листья с повышенным (по меньшей мере в два-три раза) содержанием свободного треонина при их выращивании в полевых условиях, соответствующих условиям промышленного производства, и что это содержание сохраняется в процессе сушки. Кроме того, опытные растения представляли собой несегрегированные линии, которые не характеризовались потерей урожайности в указанных полевых условиях.
При создании изобретения проводили также оценку концентрации нескольких других аминокислот (GLN: глутамин; GLU: глутаминовая кислота; ASN: аспарагин; ASP: аспарагиновая кислота; HIS: гистидин) в высушенных листьях, собранных с выращенных в полевом опыте растений, данные представлены на фиг.10-14.
Как продемонстрировано на фиг.10, для клеточной линии AK3 концентрация глутамина оказалась сопоставимой с концентрациями в растениях трех контрольных линий. Как продемонстрировано на фиг.11, AK1-3 характеризовалась таким же уровнем глутаминовой кислоты, который был обнаружен в контролях, в то время как для линий AK4-5 были выявлены несколько более высокие концентрации. На фиг.12 представлены соответствующие концентрации аспарагина.
На фиг.13 продемонстрировано, что концентрации аспарагиновой кислоты являлись примерно одинаковыми в опытных растениях клеточных линий AK1-AK3 и в контролях, хотя для AK4-5 концентрации, по-видимому, были выше. И, наконец, как продемонстрировано на фиг.14, концентрация гистидина была примерно одинаковой, за исключением того, что для опытных растений клеточной линии AK4 эти концентрации были более высокими.
В целом, результаты, представленные на фиг.10-14, убедительно свидетельствуют о том, что концентрации каждой из указанных аминокислот были сопоставимыми с концентрациями в контролях, или даже превышали их, это является четким доказательством того, что приспособленность трансгенного растения не была ухудшена.
Реферат
Изобретение относится к области биохимии, в частности к генетической конструкции для экспрессии нечувствительной к треонину аспартаткиназы в растении, где конструкция содержит специфический для фазы старения промотор, функционально связанный с кодирующей последовательностью, которая кодирует полипептид, обладающий активностью нечувствительной к треонину аспартаткиназы, и в которой специфический к старению промотор выбран из группы, состоящей из SAG12, SAG13, SAG101, SAG21 и SAG18, или их функциональных вариантов, или фрагментов. Раскрыты вектор, растительная клетка, трансгенное растение, материал для размножения растения, собранный лист, курительный табак, содержащие вышеуказанную генетическую конструкцию. Также раскрыт способ получения трансгенного растения, которое обладает способностью накапливать треонин в увядающих листьях в большем количестве, чем в листьях соответствующего растения дикого типа, и способ повышения уровня треонина в листьях стареющего растения до уровней треонина, превышающих содержание треонина в листьях растения дикого типа без ухудшения приспособленности растения с использованием вышеуказанной генетической конструкции. Изобретение позволяет получать трансгенное растение, которое обладает способностью накапливать треонин в увядающих листьях в большем количестве, чем в листьях растения дикого типа. 9 н. и 13 з.п. ф-лы, 16 ил., 2 табл., 4 пр.
Формула
I) трансформируют клетку растения генетической конструкцией по п.1; и
II) регенерируют растение из трансформированной клетки.

Комментарии