Способ лечения или предупреждения связанных с инфекцией иммунных состояний с использованием композиции, содержащей igm - RU2733377C2
Код документа: RU2733377C2
Чертежи




Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к лечению или предупреждению иммунных симптомов или состояний путем введения композиций, содержащих IgM (иммуноглобулин М).
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Микробные виды могут стать крайне опасными для инфицированного пациента, если этот индивидуум не может избавиться от инфекции. Инфекции могут стать также септическими, распространяясь из инфицированного органа в кровоток. Эти септические инфекции имеют плохой прогноз для пациентов.
Хорошо изучено, что полученный из плазмы крови IgM (иммуноглобулин М) может связываться с эндотоксинами и предупреждать опосредованную эндотоксинами токсичность по отношению к пациенту. Это обусловлено свойственной способностью или предпочтением IgM связывать гликаны, тем самым препятствуя их эффектам. Эти токсические эффекты эндотоксинов обычно являются ответом на гибель или лизис бактерий, индуцированный антибиотиками или иммунной системой пациента.
Кроме того, использование композиций IgM или обогащенных композиций IgM предложено для лечения аутоиммунных заболеваний или атеросклероза, основанного на взаимодействии IgM со специфическими маркерами указанных заболеваний, например аутоантителами (Hurez, V. et. al. "Pooled Normal Human Polyspecific IgM Contains Neutralizing Anti-ldioitypes to IgG Autoantibodies of Autoimmune Patients and Protects from Experimental Autoimmune Disease", Blood, 1997, Vol. 90, No. 10, 4004-4013; и Cesena, HY. "Immune-modulation by polyclonal IgM treatment reduces atherosclerosis in hypercholesterolemic apoE -/- mice", Atherosclerosis, 2012, Vol. 220, 59-65).
Септические состояния и другие осложнения микробных инфекций часто связаны с избыточным стимулированием иммунной системы, и часто их невозможно контролировать из-за их чрезмерной величины и быстрого развития. Следовательно, остается потребность в эффективных режимах лечения для снижения, ингибирования или предупреждения избыточного стимулирования иммунной системы.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В одном воплощении настоящего изобретения предложена композиция, содержащая, по существу состоящая из или состоящая из IgM, полученного из плазмы крови, и возможно одного или более эксципиентов в фармацевтическом носителе.
В еще одном воплощении настоящего изобретения предложена композиция, содержащая IgM, для применения в лечении сепсиса.
В еще одном воплощении настоящего изобретения предложена композиция, содержащая IgM, для применения в лечении иммунных осложнений, вызванных инфекцией.
В еще одном воплощении настоящего изобретения предложен способ лечения иммунных осложнений, вызванных инфекцией, у нуждающихся в этом пациентов, отличающийся тем, что он включает введение композиции, содержащей IgM.
В еще одном воплощении настоящего изобретения предложен также способ иммуномодулирования инфекции у нуждающегося в этом пациента, отличающийся тем, что он включает введение композиции, содержащей IgM.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Для лучшего понимания настоящее изобретение описано ниже более подробно со ссылкой на прилагаемые графические материалы, которые представлены в качестве примера, и со ссылкой на иллюстративные примеры, которые не ограничивают настоящее изобретение.
На Фиг. 1 представлены результаты, полученные для оценки эффекта IgM на активацию NF-кB (ядерный фактор каппа-В), индуцированную LPS (липополисахаридом) Escherichia coli, в клетках ТНР-1, несущих стабильную репортерную плазмиду для NF-кB. На Фиг. 1А и Фиг. 1В по оси у показано кратное увеличение активности NF-кB, измеренное с помощью SEAP (секретируемая щелочная фосфатаза) в качестве репортера для NF-кB, и указанное увеличение пропорционально индуцированию активности NF-кB. Также на обеих диаграммах (Фиг. 1А и Фиг. 1В) по оси x показаны группы лечения. Стандартная ошибка указана на каждом столбике.
На Фиг. 2 представлены результаты, полученные для индуцирования NF-кB Анатоксином А или Анатоксином В Clostridium difficile в клетках ТНР-1, несущих стабильную NF-кB репортерную плазмиду. Кратное увеличение активности NF-кB, измеренное с помощью репортера SEAP для NF-кB, указано по оси y и является пропорциональным индуцированию активности NF-кВ. Концентрация Анатоксина А или Анатоксина В в мкг/мл показана по оси х.
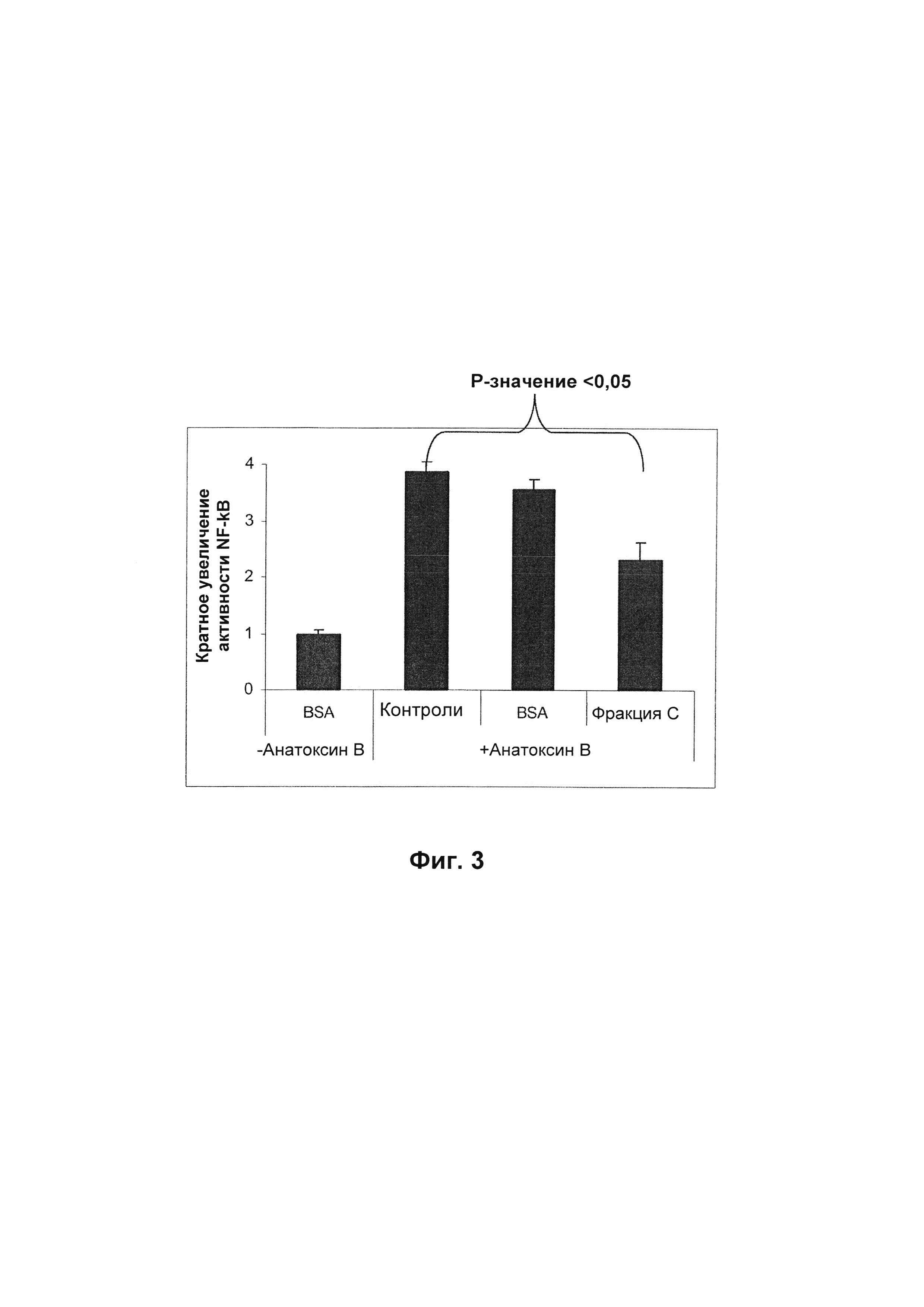
На Фиг. 3 представлены результаты, полученные по ингибированию индуцированной Анатоксином В Clostridium difficile активации NF-кB в клетках ТНР-1, несущих стабильную NF-кB репортерную плазмиду. Кратное увеличение активности NF-кB, измеренное с помощью репортера SEAP для NF-кB, указано по оси y и является пропорциональным индуцированию активности NF-кB. Различные группы лечения показаны по оси x. Стандартная ошибка указана на каждом столбике.
На Фиг. 4 представлены результаты по ингибированию активации NF-кB, индуцированной Klebsiella pneumoniae и Pseudomonas aeruginosa, и секреции IL-8 в клетках ТНР-1, несущих стабильную NF-кB репортерную плазмиду. На Фиг. 4А по оси y показано кратное увеличение активности NF-кB, измеренное с помощью репортера SEAP для NF-кB, и оно пропорционально индуцированию активности NF-кB. По оси x показаны различные группы лечения. На Фиг. 4В по оси у показана концентрация IL-8, секретированного в культуральную надосадочную жидкость, и по оси x показаны различные группы обработки. На Фиг. 4В "UD" означает, что IL-8 не обнаруживался у контрольной группы, не подвергнутой обработке. На обеих диаграммах стандартная ошибка указана на каждом столбике.
На Фиг. 5 представлены результаты, полученные в эксперименте, относящемся к IgM-опосредованной блокировке индуцированной форбол-12-миристат-13-ацетатом (РМА)/иономицином клеточной пролиферации мононуклеарных клеток периферической крови (РВМС), в частности Т-клеток. Кратное увеличение относительной пролиферации относительно контрольной группы указано по оси y по результатам измерения в анализе Cell Titer Glow, и является пропорциональным индуцированию клеточной пролиферации. Различные группы лечения показаны по оси х. Стандартная ошибка указана на каждом столбике.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения после всестороннего и интенсивного экспериментирования и исследования обнаружили, что композиции IgM проявляют иммуномодулирующую активность (например, уменьшая индуцирование активности NF-кB и/или снижая пролиферацию мононуклеарных клеток периферической крови), что делает указанные композиции подходящими для лечения состояний, связанных с избыточной стимуляцией иммунной системы, например избыточной стимуляцией иммунной системы, ассоциированной с септическими состояниями.
В одном из воплощений настоящего изобретения предложена композиция, содержащая, по существу состоящая из или состоящая из IgM, полученного из плазмы крови, и возможно одного или более эксципиентов в фармацевтическом носителе. Согласно конкретным воплощениям один или более эксципиентов и/или фармацевтический носитель являются синтетическими, т.е. не встречающимися в природе.
Используемый в данном документе термин "фармацевтически приемлемый носитель" относится к разбавителю, вспомогательному веществу, эксципиенту или носителю, с которым вводят полученный из плазмы крови IgM по настоящему изобретению. Такие носители могут представлять собой стерильные жидкости, такие как вода и масла, включая масла нефтяного, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и т.п., полипропиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители. Физиологические растворы и водные растворы декстрозы и глицерина также могут быть использованы в качестве жидких носителей, в частности для инъецируемых растворов. Согласно конкретным воплощениям фармацевтически приемлемый носитель является синтетическим (т.е. носителем, не встречающимся в природе).
Не ограничительные примеры подходящих эксципиентов включают крахмал, глюкозу, лактозу, сахарозу, желатин, силикагель, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, глицерин, пропиленгликоль, воду, этанол и т.п. Эксципиенты могут также включать увлажняющие или эмульгирующие агенты, или pH буферные агенты, такие как ацетаты, цитраты или фосфаты; антибактериальные агенты, такие как бензиловый спирт или метилпарабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие агенты, такие как этилендиаминтетрауксусная кислота; и агенты для регулирования тоничности, такие как хлорид натрия или декстроза. Согласно конкретным воплощениям один или более эксципиентов являются синтетическими (т.е. эксципиентами, не встречающимися в природе).
Воплощения настоящего изобретения также относятся к способам иммуномодулирования ответных реакций на микробные инфекции, не зависящих от опосредованного эндотоксинами иммунного ответа.
Таким образом, в первом воплощении настоящего изобретения предложена композиция, содержащая IgM, для применения в лечении сепсиса.
Во втором воплощении настоящего изобретения предложена композиция, содержащая IgM, для применения в лечении иммунных осложнений, вызванных инфекцией.
В еще одном воплощении настоящего изобретения предложен способ лечения иммунных осложнений, вызванных инфекцией, у нуждающихся в этом пациентов, отличающийся тем, что он включает введение композиции, содержащей IgM.
Более того, согласно настоящему изобретению предложен также способ иммуномодулирования инфекции у нуждающегося в этом пациента, отличающийся тем, что он включает введение композиции, содержащей IgM.
В данном документе "гиперцитокинемия" и ее множественное число означают иммунное осложнение, характеризующееся избыточным продуцированием провоспалительных цитокинов в результате положительной петли обратной связи между цитокинами и белыми кровяными тельцами, включая Т-клетки и макрофаги.
В данном документе "гиперкоагулопатия" и ее множественное число означают иммунное осложнение, вызванное чрезмерной активацией некоторых компонентов клеток крови, таких как тромбоциты, факторов коагуляции крови внешних и внутренних путей микробами и их продуктами.
В одном из воплощений настоящего изобретения предложена композиция, содержащая IgM, для применения в лечении сепсиса. Согласно конкретным воплощениям композиция содержит, по существу состоит из или состоит из IgM, полученного из плазмы крови, и возможно одного или более эксципиентов в фармацевтическом носителе.
Сепсис может быть вызван одной или более бактериями (грамположительными или грамотрицательными), одним или более грибами (например, Aspergillus flavus), одним или более вирусами или их комбинациями. В предпочтительном воплощении сепсис вызван одной или более бактериями, более предпочтительно сепсис вызван Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus, Klebsiella pneumoniae, Streptococcus pneumoniae, Clostridium difficile, Clostridium botulinum или их комбинациями.
Лечение сепсиса или септического состояния осуществляют посредством лечения иммунных осложнений, таких как провоспалительные ответные реакции или гиперактивация иммунной системы, которое, в свою очередь, осуществляют посредством иммуномодулирования. Указанное иммуномодулирование предпочтительно не зависит от опосредованного эндотоксинами иммунного ответа и может быть приведено в действие различными способами. В предпочтительном воплощении иммуномодулирование осуществляют посредством ингибирования индуцирования NF-кB. В другом воплощении иммуномодулирование осуществляют посредством ингибирования пролиферации мононуклеарных клеток периферической крови, предпочтительно Т-клеток. В наиболее предпочтительном воплощении иммуномодулирование осуществляют обоими способами, упомянутыми выше.
Предпочтительно, композиция имеет чистоту по меньшей мере 90% (масс./об.) IgM, более предпочтительно по меньшей мере чистоту 95% IgM. В наиболее предпочтительном воплощении композиция имеет чистоту 95% (масс./об.) IgM.
Доза композиции, которую будут вводить, составляет предпочтительно от 75 мг IgM/кг массы тела пациента до 1 г IgM/кг массы тела пациента, более предпочтительно от 75 мг IgM/кг массы тела пациента до 600 мг IgM/кг массы тела пациента и наиболее предпочтительно от 75 мг IgM/кг массы тела пациента до 300 мг IgM/кг массы тела пациента. Кроме того, композицию предпочтительно предоставляют или вводят по меньшей мере один раз в неделю или через день или три раза в неделю или ежедневно.
Кроме того, указанный IgM может быть рекомбинантным, полученным из плазмы крови, полученным из культуры клеток, трансгенным или химически синтезированным.
Если IgM является рекомбинантным, то он может быть получен любым методом, известным в области экспрессии, продуцирования и очистки белков. Например, последовательность нуклеиновых кислот IgM может быть вставлена в любой вектор, подходящий для экспрессии в выбранной клетке-хозяине, например в клетках бактерий (Escherichia coli, Bacilus subtilis, Salmonella typhimurium, Pseudomonas, Streptomyces и Staphylococcus), дрожжей (Saccharomyces, Pichia или Kluyveromyces genus), клетках насекомых (Bombyx mori, Mamestra brassicae, Spodoptera frugiperda, Trichoplusia ni или Drosophila melanogaster) или клетках млекопитающих (клетках HeLa, клетках почки новорожденного хомячка (ВНК), клетках почки обезьяны (COS-1), клетках гепатоцеллюлярной карциномы человека (например Hep G2), трансформированных аденовирусом клетках человека 293, мышиных клетках L-929, линиях клеток хомячка HaK, мышиных клетках 3Т3, полученных от мышей Swiss, Balb-c или NIH, линии клеток CV-1, клеточных штаммах, полученных in vitro из культуры первичной ткани или первичных эксплантатов.
Полученный из культуры клеток IgM может быть продуцирован любым методом или способом, известным в данной области, например гибридомным методом.
Трансгенный и химически синтезированный IgM может быть получен любым методом или способом, известным в данной области.
В предпочтительном воплощении IgM представляет собой полученный из плазмы крови IgM, выделенный из подходящей фракции плазмы крови, например в результате осуществления процедур промывки двух колонок ANX после сбора IgG, как описано в патенте США №6307028, или дополнительной очистки указанной фракции методом аффинной хроматографии с негативным отбором или методом эксклюзионной хроматографии.
Что касается указанного полученного из плазмы крови IgM, он возможно может быть выделен или очищен для увеличения относительных количеств специфических антител к данному экзотоксину, секретированному белку, микробным видам или их комбинациям.
Согласно конкретным воплощениям предполагается, что вводят только композицию, содержащую IgM.
В другом воплощении композицию, содержащую IgM, вводят вместе с одной или более другими композициями или молекулами. Указанные другие композиции или молекулы предпочтительно выбраны из противовоспалительных молекул, антибиотиков (например, антибиотиков, имеющих небольшую молекулу, молекул, которые являются противомикробными по своей природе, природных или синтетических пептидных противомикробных средств и/или белков с противомикробными свойствами), других иммуномодуляторов или их комбинаций. В предпочтительном воплощении указанные другие композиции или молекулы представляют собой ванкомицин, меропенем, лактоферрин или их комбинации. Введение композиции, содержащей IgM, вместе с одной или более другими композициями или молекулами, которые упомянуты выше, включают одновременное введение всех композиций или молекул или введение композиций или молекул, которые предусмотрены, одной после другой.
Композиция, содержащая IgM, может быть использована как для лечения сепсиса, как упомянуто выше, так и для предупреждения указанного заболевания.
В еще одном воплощении настоящего изобретения раскрыта композиция, содержащая IgM, для применения в лечении иммунных осложнений, вызванных инфекцией.
Инфекция может быть вызвана одной или более бактериями (грамположительными или грамотрицательными), одним или более грибами (например, Aspergillus flavus), одним или более вирусами или их комбинациями. В предпочтительном воплощении инфекция вызвана одной или более бактериями, более предпочтительно инфекция вызвана Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus, Klebsiella pneumoniae, Streptococcus pneumoniae, Clostridium difficile, Clostridium botulinum или их комбинациями.
Лечение иммунных осложнений, таких как провоспалительные ответные реакции или гиперактивация иммунной системы, осуществляют посредством иммуномодулирования. Указанное иммуномодулирование предпочтительно не зависит от опосредованного эндотоксинами иммунного ответа и может быть осуществлено различными способами. В предпочтительном воплощении иммуномодулирование осуществляют посредством ингибирования индуцирования NF-кB. В другом воплощении иммуномодулирование осуществляют посредством ингибирования пролиферации мононуклеарных клеток периферической крови, предпочтительно Т-клеток. В наиболее предпочтительном воплощении иммуномодулирование осуществляют посредством обоих вышеупомянутых способов.
Композиция предпочтительно имеет чистоту по меньшей мере 90% (масс./об.) IgM, более предпочтительно по меньшей мере чистоту 95% (масс./об.) IgM. В наиболее предпочтительном воплощении используемая композиция содержит 95% (масс/об.) IgM.
Доза композиции, которую будут вводить, предпочтительно составляет от 75 мг IgM/кг массы тела пациента до 1 г IgM/кг массы тела пациента, более предпочтительно от 75 мг IgM/кг массы тела пациента до 600 мг IgM/кг массы тела пациента и наиболее предпочтительно от 75 мг IgM/кг массы тела пациента до 300 мг IgM/кг массы тела пациента. Кроме того, композицию предпочтительно предоставляют или вводят по меньшей мере один раз в неделю или через день или три раза в неделю или ежедневно.
Кроме того, указанный IgM может быть рекомбинантным, полученным из плазмы крови, полученным из культуры клеток, трансгенным или химически синтезированным.
Если IgM является рекомбинантным, то он может быть получен любым методом, известным в области экспрессии, продуцирования и очистки белков. Например, последовательность нуклеиновых кислот IgM может быть вставлена в любой вектор, подходящий для экспрессии в выбранной клетке-хозяине, например в клетках бактерий (Escherichia coli, Bacilus subtilis, Salmonella typhimurium, Pseudomonas, Streptomyces и Staphylococcus), дрожжей (Saccharomyces, Pichia или Kluyveromyces genus), клетках насекомых (Bombyx mori, Mamestra brassicae, Spodoptera frugiperda, Trichoplusia ni или Drosophila melanogaster) или клетках млекопитающих (клетках HeLa, клетках почки новорожденного хомячка (ВНК), клетках почки обезьяны (COS-1), клетках гепатоцеллюлярной карциномы человека (например Hep G2), трансформированных аденовирусом клетках человека 293, мышиных клетках L-929, линии клеток хомячка HaK, мышиных клетках 3Т3, полученных от мышей Swiss, Balb-c или NIH, линии клеток CV-1, клеточных штаммах, полученных in vitro из культуры первичной ткани или первичных эксплантатов.
Полученный из культуры клеток IgM, может быть продуцирован любым методом или способом, известным в данной области, например гибридомным методом.
Трансгенный и химически синтезированный IgM может быть получен любым методом или способом, известным в данной области.
В предпочтительном воплощении IgM представляет собой полученный из плазмы крови IgM, выделенный из подходящей фракции плазмы крови, например посредством осуществления процедур промывки двух колонок ANX после сбора IgG, как описано в патенте США №6307028, или дополнительной очистки указанной фракции аффинной хроматографией с негативным отбором или эксклюзионной хроматографией.
В другом предпочтительном воплощении иммунное осложнение, вызванное инфекцией, представляет собой гиперцитокинемию, гиперкоагулопатию или органную недостаточность.
Что касается указанного полученного из плазмы крови IgM, он возможно может быть выделен или очищен для увеличения относительных количеств специфических антител к данному экзотоксину, секретированному белку, микробным видам или их комбинациям.
Согласно конкретным воплощениям предполагается, что вводят только композицию, содержащую IgM.
В другом воплощении композицию, содержащую IgM, вводят вместе с одной или более другими композициями или молекулами. Указанные другие композиции или молекулы предпочтительно выбраны из противовоспалительных молекул, антибиотиков (например, антибиотиков, имеющих небольшую молекулу, молекул, которые являются противомикробными по своей природе, природных или синтетических пептидных противомикробных средств и/или белков с противомикробными свойствами), других иммуномодуляторов или их комбинаций. В предпочтительном воплощении указанные другие композиции или молекулы представляют собой ванкомицин, меропенем, лактоферрин или их комбинации. Введение композиции, содержащей IgM, вместе с одной или более другими композициями или молекулами, как упомянуто выше, включают одновременное введение всех композиций или молекул или введение композиций или молекул, которые предусмотрены, одной после другой.
Композиция, содержащая IgM, может быть использована как для лечения сепсиса, как упомянуто выше, так и для предупреждения указанных иммунных осложнений.
В дополнительном воплощении настоящее изобретение относится к способу лечения иммунных осложнений, вызванных инфекцией, у нуждающихся в этом пациентов, отличающемуся тем, что он включает введение композиции, содержащей IgM.
Инфекция может быть вызвана одной или более бактериями (грамположительными или грамотрицательными), одним или более грибами (например, Aspergillus flavus), одним или более вирусами или их комбинациями. В предпочтительном воплощении инфекция вызвана одной или более бактериями, более предпочтительно инфекция вызвана Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus, Klebsiella pneumoniae, Streptococcus pneumoniae, Clostridium difficile, Clostridium botulinum или их комбинациями.
Лечение иммунных осложнений, таких как провоспалительные ответные реакции или гиперактивация иммунной системы, осуществляют посредством иммуномодулирования. Указанное иммуномодулирование предпочтительно не зависит от опосредованного эндотоксинами иммунного ответа и может быть осуществлено различными способами. В предпочтительном воплощении иммуномодулирование осуществляют посредством ингибирования индуцирования NF-кB. В другом воплощении иммуномодулирование осуществляют посредством ингибирования пролиферации мононуклеарных клеток периферической крови, предпочтительно Т-клеток. В наиболее предпочтительном воплощении иммуномодулирование осуществляют посредством обоих вышеупомянутых способов.
Композиция предпочтительно имеет чистоту по меньшей мере 90% (масс./об.) IgM, более предпочтительно чистоту по меньшей мере 95% (масс./об.) IgM. В наиболее предпочтительном воплощении используемая композиция содержит 95% (масс./об.) IgM.
Доза композиции, которую будут вводить, предпочтительно составляет от 75 мг IgM/кг массы тела пациента до 1 г IgM/кг массы тела пациента, более предпочтительно от 75 мг IgM/кг массы тела пациента до 600 мг IgM/кг массы тела пациента и наиболее предпочтительно от 75 мг IgM/кг массы тела пациента до 300 мг IgM/кг массы тела пациента. Кроме того, композицию предпочтительно предоставляют или вводят по меньшей мере один раз в неделю или через день или три раза в неделю или ежедневно.
Кроме того, указанный IgM может быть рекомбинантным, полученным из плазмы крови, полученным из культуры клеток, трансгенным или химически синтезированным.
Если IgM является рекомбинантным, то он может быть получен любым методом, известным в области экспрессии, продуцирования и очистки белков. Например, последовательность нуклеиновых кислот IgM может быть вставлена в любой вектор, подходящий для экспрессии в выбранной клетке-хозяине, например в клетках бактерий (Escherichia coli, Bacilus subtilis, Salmonella typhimurium, Pseudomonas, Streptomyces и Staphylococcus), дрожжей (Saccharomyces, Pichia или Kluyveromyces genus), клетках насекомых (Bombyx mori, Mamestra brassicae, Spodoptera frugiperda, Trichoplusia ni или Drosophila melanogaster) или клетках млекопитающих (клетках HeLa, клетках почки новорожденного хомячка (ВНК), клетках почки обезьяны (COS-1), клетках гепатоцеллюлярной карциномы человека (например Hep G2), трансформированных аденовирусом клетках человека 293, мышиных клетках L-929, линии клеток хомячка НаК, мышиных клетках 3Т3, полученных от мышей Swiss, Balb-c или NIH, линии клеток CV-1, клеточных штаммах, полученных in vitro из культуры первичной ткани или первичных эксплантатов.
Полученный из культуры клеток IgM, может быть продуцирован любым методом или способом, известным в данной области, например гибридомным методом.
Трансгенный и химически синтезированный IgM может быть получен любым методом или способом, известным в данной области.
В предпочтительном воплощении IgM представляет собой полученный из плазмы крови IgM, выделенный из подходящей фракции плазмы крови, например посредством осуществления процедур промывки двух колонок ANX после сбора IgG, как описано в патенте США №6307028, или дополнительной очистки указанной фракции аффинной хроматографией с негативным отбором или эксклюзионной хроматографией.
Что касается указанного полученного из плазмы крови IgM, он возможно может быть выделен или очищен для увеличения относительных количеств специфических антител к данному экзотоксину, секретированному белку, микробным видам или их комбинациям.
Согласно конкретным воплощениям предполагается, что вводят только композицию, содержащую IgM.
В другом воплощении композицию, содержащую IgM, вводят вместе с одной или более другими композициями или молекулами. Указанные другие композиции или молекулы предпочтительно выбраны из противовоспалительных молекул, антибиотиков (например, антибиотиков, имеющих небольшую молекулу, молекул, которые являются противомикробными по своей природе, природных или синтетических пептидных противомикробных средств и/или белков с противомикробными свойствами), других иммуномодуляторов или их комбинаций. В предпочтительном воплощении указанные другие композиции или молекулы представляют собой ванкомицин, меропенем, лактоферрин или их комбинации. Введение композиции, содержащей IgM, вместе с одной или более другими композициями или молекулами, как упомянуто выше, включают одновременное введение всех композиций или молекул или введение композиций или молекул, которые предусмотрены, одной после другой.
Способ по настоящему изобретению может быть использован как для лечения иммунных осложнений, вызванных инфекцией, как упомянуто выше, так и для предупреждения указанных иммунных осложнений.
Наконец, согласно настоящему изобретению раскрыт способ иммуномодулирования инфекции у нуждающегося в этом пациента, отличающийся тем, что он включает введение композиции, содержащей IgM.
Указанное иммуномодулирование может быть использовано для лечения или предупреждения инфекций или связанных с инфекцией симптомов или состояний.
Инфекция может быть вызвана одной или более бактериями (грамположительными или грамотрицательными), одним или более грибами (например, Aspergillus flavus), одним или более вирусами или их комбинациями. В предпочтительном воплощении инфекция вызвана одной или более бактериями, более предпочтительно инфекция вызвана Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus, Klebsiella pneumoniae, Streptococcus pneumoniae, Clostridium difficile, Clostridium botulinum или их комбинациями.
Указанное иммуномодулирование дает возможность лечить иммунные осложнения, такие как провоспалительные ответные реакции или гиперактивация иммунной системы, и, предпочтительно, не зависит от опосредованного эндотоксинами иммунного ответа и может быть осуществлено различными способами. В предпочтительном воплощении, иммуномодулирование осуществляют посредством ингибирования индуцирования NF-кB. В другом воплощении иммуномодулирование осуществляют посредством ингибирования пролиферации мононуклеарных клеток периферической крови, предпочтительно Т-клеток. В наиболее предпочтительном воплощении иммуномодулирование осуществляют обоими способам, упомянутыми выше.
Композиция предпочтительно имеет чистоту по меньшей мере 90% (масс./об.) IgM, более предпочтительно чистоту по меньшей мере 95% (масс./об.) IgM. В наиболее предпочтительном воплощении используемая композиция содержит 95% (масс./об.) IgM.
Доза композиции, которую будут вводить, предпочтительно составляет от 75 мг IgM/кг массы тела пациента до 1 г IgM/кг массы тела пациента, более предпочтительно от 75 мг IgM/кг массы тела пациента до 600 мг IgM/кг массы тела пациента и наиболее предпочтительно от 75 мг IgM/кг массы тела пациента до 300 мг IgM/кг массы тела пациента. Кроме того, композицию предпочтительно предоставляют или вводят по меньшей мере один раз в неделю или через день или три раза в неделю или ежедневно.
Кроме того, указанный IgM может быть рекомбинантным, полученным из плазмы крови, полученным из культуры клеток, трансгенным или химически синтезированным.
Если IgM является рекомбинантным, то он может быть получен любым методом, известным в области экспрессии, продуцирования и очистки белков. Например, последовательность нуклеиновых кислот IgM может быть вставлена в любой вектор, подходящий для экспрессии в выбранной клетке-хозяине, например в клетках бактерий (Escherichia coli, Bacilus subtilis, Salmonella typhimurium, Pseudomonas, Streptomyces и Staphylococcus), дрожжей (Saccharomyces, Pichia или Kluyveromyces genus), клетках насекомых (Bombyx mori, Mamestra brassicae, Spodoptera frugiperda, Trichoplusia ni или Drosophila melanogaster) или клетках млекопитающих (клетках HeLa, клетках почки новорожденного хомячка (ВНК), клетках почки обезьяны (COS-1), клетках гепатоцеллюлярной карциномы человека (например Hep G2), трансформированных аденовирусом клетках человека 293, мышиных клетках L-929, линии клеток хомячка НаK, мышиных клетках 3Т3, полученных от мышей Swiss, Balb-c или NIH, линии клеток CV-1, клеточных штаммах, полученных in vitro из культуры первичной ткани или первичных эксплантатов.
Полученный из культуры клеток IgM, может быть продуцирован любым методом или способом, известным в данной области, например гибридомным методом.
Трансгенный и химически синтезированный IgM может быть получен любым методом или способом, известным в данной области.
В предпочтительном воплощении IgM представляет собой полученный из плазмы крови IgM, выделенный из подходящей фракции плазмы крови, например посредством осуществления процедур промывки двух колонок ANX после сбора IgG, как описано в патенте США №6307028, или дополнительной очистки указанной фракции аффинной хроматографией с негативным отбором или эксклюзионной хроматографией.
Что касается указанного полученного из плазмы крови IgM, он возможно может быть выделен или очищен для увеличения относительных количеств специфических антител к данному экзотоксину, секретированному белку, микробным видам или их комбинациям.
Согласно конкретным воплощениям предполагается, что вводят только композицию, содержащую IgM.
В другом воплощении композицию, содержащую IgM, вводят вместе с одной или более другими композициями или молекулами. Указанные другие композиции или молекулы предпочтительно выбраны из противовоспалительных молекул, антибиотиков (например, антибиотиков, имеющих небольшую молекулу, молекул, которые являются противомикробными по своей природе, природных или синтетических пептидных противомикробных средств и/или белков с противомикробными свойствами), других иммуномодуляторов или их комбинаций. В предпочтительном воплощении указанные другие композиции или молекулы представляют собой ванкомицин, меропенем, лактоферрин или их комбинации. Введение композиции, содержащей IgM, вместе с одной или более другими композициями или молекулами, как упомянуто выше, включают одновременное введение всех композиций или молекул или введение композиций или молекул, которые предусмотрены, одной после другой.
Воплощения, описанные в данном документе, являются иллюстрацией изобретения и не ограничивают его. Для специалиста в данной области очевидно, что могут быть произведены модификации воплощений и примеров, приведенных в настоящем описании изобретения, не выходя за рамки объема настоящего изобретения.
Воплощения изобретения описаны выше с использованием термина "содержащая" и его вариантов. Однако согласно замыслу авторов изобретения термин "содержащая" может быть заменен в любом из воплощений, описанных в данном документе, терминами "состоящая из" и "по существу состоящая из" без отклонения от объема изобретения. Если конкретно не указано иное, все числовые значения, приведенные в данном документе, включают вплоть до и включая указанные исходные точки и конечные точки.
Приведенные ниже примеры дополнительно иллюстрируют воплощения изобретения и должны рассматриваться как иллюстративные, а не как ограничивающие изобретение.
ПРИМЕРЫ
Пример 1. Анализ влияния IgM на индуцирование активности NF-кB эндотоксином, липополисахаридом (LPS) Escherichia coli.
Для проведения этого эксперимента использовали клеточную линию моноцитов ТНР-1 человека, несущую стабильную плазмиду с NF-кB-зависимым промотором, стимулирующим репортер, секретируемую щелочную фосфатазу (SEAP) (Invivogen, San Diego, CA USA), в качестве средства мониторинга активации сигнального пути NF-кB.
Клетки культивировали в среде для пролиферации согласно рекомендациям производителя.
Эксперимент проводили с использованием LPS, выделенного из штамма Escherichia coli O111:В4, и LPS, выделенного из штамма Escherichia coli К12. Клетки ТНР-1, упомянутые выше, обрабатывали 100 нг/мл LPS Escherichia coli, выделенного из штамма O111:В4 (смотри Фиг. 1А), или 1 нг/мл LPS Escherichia coli, выделенного из штамма К12 (смотри Фиг. 1В), в течение 24 часов.
Когда использовали IgM, LPS предварительно инкубировали с очищенным IgM (чистота 95% (масс./об.) или выше) перед обработкой клеток.
Для анализов активности NF-кB 1×105 клеток засевали в каждую лунку 96-луночного планшета. Культуральная среда для анализа была такой же, как среда для пролиферации, за исключением того, что она содержала сыворотку для сведения к минимуму неспецифических эффектов белков сыворотки плода коровы (FBS). Клетки обрабатывали так, как описано выше, используя конечную концентрацию 2,5 мг/мл IgM (чистота по меньшей мере 95% (масс./об.) IgM).
Активность NF-кB определяли, оценивая уровни секретированной щелочной фосфатазы (SEAP) в надосадочной жидкости по результатам измерений в анализе Quanti-Blue (Invivogen, San Diego, CA USA) согласно инструкциям производителя. Относительное количество клеток во время анализа NF-кB определяли анализом Cell Titer Glow (Promega Corp. Madison, WI, USA), который осуществляли согласно инструкциям производителя. Относительную активность NF-кB, показанную на Фиг. 1, вычисляли путем приведения значений, полученных в результате анализа NF-кB, к относительному количеству клеток, которое определено анализом Cell Titer Glow, с последующим нормированием экспериментальных контролей к значению 1.
Неожиданно было установлено, что очищенный IgM не оказывает никакого значительного эффекта на LPS-опосредованную активацию сигнального пути NF-кB во всех случаях, протестированных и упомянутых выше (смотри Фиг. 1А и Фиг. 1В).
Пример 2. Анализ влияния IgM на индуцирование активности NF-кB Анатоксином В Clostridium difficile.
Известно, что токсины Clostridium difficile индуцируют секрецию цитокинов, в том числе IL-8 и TNF-α, в моноцитах (Linevsky, JK., et. al., "IL-8 release and neutrophil activation by Clostridium difficile toxin-exposed human monocytes", Am J Physiol Gastrointest Liver Physiol, 1997, 273, G1333-G1340; и Sun, X., et. al. "Essential role of the glucosyltransferase activity in Clostridium difficile toxin-induced secretion of TNF-α by macrophages", Microbial Pathogenesis, 2009, 16, 298-305). Известно также, что каждый из этих цитокинов индуцируется при активации NF-кB.
Поэтому были проведены тесты с целью определения, может ли Анатоксин В Clostridium difficile индуцировать сигнальный путь NF-кB NF-кB в клетках ТНР-1 человека, несущих стабильно интегрированную NF-кB репортерную плазмиду (Invivogen, San Diego, CA USA), как указано выше. Клетки культивировали в среде для пролиферации согласно рекомендациям производителя.
Поскольку токсины сами являются цитотоксическими, во избежание сложной интерпретации результатов использовали инактивированные анатоксины. Для анализов активности NF-кB 2×105 клеток засевали в каждую лунку 96-луночного планшета за 24 часа до обработок. Клетки затем обрабатывали несколькими концентрациями Анатоксина А С.difficile (List Biological Labs, Inc, Campbell, CA USA) или Анатоксина В (List Biological Labs, Inc. Campbell, CA USA). Активность NF-кB определяли, оценивая уровни секретированной щелочной фосфатазы (SEAP) в надосадочной жидкости по результатам измерений анализом Quanti-Blue (Invivogen, San Diego, CA USA) согласно инструкциям производителя. Относительное количество клеток во время анализа NF-кB определяли анализом Cell Titer Glow (Promega Corp. Madison, WI, USA) согласно инструкциям производителя. Относительную активность NF-кB, показанную на Фиг. 2, вычисляли путем приведения значений, полученных в результате анализа NF-кB, к относительному количеству клеток, определенному с использованием анализа Cell Titer Glow, с последующим нормированием экспериментальных контролей к значению 1.
Хотя Анатоксин А не индуцировал сигнальный путь NF-кB NF-кB в этих клетках, Анатоксин В продемонстрировал индуцирование репортера для NF-кB в этих клетках (смотри Фиг. 2).
Способность раствора IgM (чистота 90-95% IgM) ингибировать активацию NF-кB оценивали по сравнению с BSA (бычий сывороточный альбумин) в качестве контроля.
Клетки обрабатывали 9,25 мкг/мл Анатоксина В Clostridium difficile в течение 24 часов. В случае обработки также BSA или композицией IgM перед обработкой клеток Анатоксин В предварительно инкубировали с указанным BSA или с раствором IgM (чистота 90-95% (масс./об.) IgM).
Культуральная среда для анализа была такой же, как среда для пролиферации, за исключением того, что она содержала 0,025 мкм витамина D3. Для анализа активности NF-кB 2×105 клеток засевали в каждую лунку 96-луночного планшета за 24 часа до обработок. Клетки затем обрабатывали так, как описано выше, используя конечную концентрацию 3 мг/мл IgM (чистота 90-95% (масс./об.) IgM) или BSA. Активность NF-кB определяли, оценивая уровни секретированной щелочной фосфатазы (SEAP) в надосадочной жидкости по результатам измерений посредством анализа Quanti-Blue (Invivogen, San Diego, CA USA) согласно инструкциям производителя. Относительное количество клеток во время анализа NF-кB определяли посредством анализа Cell Titer Glow (Promega Corp. Madison, WI, USA) согласно инструкциям производителя. Относительную активность NF-кB, показанную на Фиг. 3, вычисляли путем приведения значений, полученных в результате анализа NF-кB, к относительному количеству клеток, которое определяли посредством анализа Cell Titer Glow, с последующим нормированием экспериментальных контролей к значению 1.
BSA не оказывал влияния на активацию NF-кB Анатоксином В, тогда как раствор IgM, указанный выше, ослаблял эффект Анатоксина В (смотри Фиг. 3).
Пример 3. Анализ влияния IgM на индуцирование активности NF-кB и секрецию IL-8 бактериями Klebsiella pneumoniae и Pseudomonas aeruginosa.
Поскольку IgM был неспособен ослаблять сигнальный путь NF-кB, опосредованный эндотоксином LPS клеточной стенки Е coli. (смотри Пример 1), оценивали эффект очищенного IgM на интактные цельные бактерии (имеющие компоненты клеточной стенки, подобные LPS).
Обработка живой культурой микробов могла обгонять и задерживать получение результатов системы анализов клеточной культуры млекопитающих. Поэтому цельные бактерии (Klebsiella pneumoniae и Pseudomonas aeruginosa) фиксировали формальдегидом, чтобы убить указанные бактерии, сохраняя при этом клетки интактными.
Клетки ТНР-1, несущие стабильную NF-кB репортерную плазмиду, как указано выше, обрабатывали убитыми формальдегидом Klebsiella pneumoniae и Pseudomonas aeruginosa в течение 24 часов.
Когда использовали IgM, тогда вышеуказанные микробы совместно обрабатывали очищенным IgM во время обработки.
Для анализа активности NF-кB 2×105 клеток засевали в каждую лунку 96-луночного планшета. Культуральная среда для анализа была такой же, как среда для пролиферации, за исключением того, что она содержала редуцированную сыворотку для снижения до минимума неспецифических эффектов белков FBS. Клетки затем обрабатывали так, как указано в надписях на диаграмме, используя конечную концентрацию 2,5 мг/мл IgM (чистота по меньшей мере 95% (масс./об.) IgM) или BSA. Активность NF-кB определяли, оценивая уровни секретированной щелочной фосфатазы (SEAP) в надосадочной жидкости по результатам измерений анализом Quanti-Blue (Invivogen, San Diego, CA USA) согласно инструкциям производителя. Относительное количество клеток во время анализа NF-кВ определяли анализом Cell Titer Glow (Promega Corp. Madison, WI, USA) согласно инструкциям производителя. Показанную относительную активность NF-кB вычисляли путем приведения значений, полученных в результате анализа NF-кB, к относительному количеству клеток, которое определяли посредством анализа Cell Titer Glow, с последующим нормированием экспериментальных контролей к значению 1.
Оба вида обработанных формальдегидом бактерий были способны эффективно индуцировать сигнальный путь NF-кB в клеточной системе или модели, использованной в Примерах 1 и 2 (т.е. в клетках ТНР-1 человека, несущих стабильно интегрированную NF-кB репортерную плазмиду) (смотри Фиг. 4А).
Неожиданно совместная обработка фиксированными формальдегидом Klebsiella pneumoniae или Pseudomonas aeruginosa и очищенным IgM показала снижение NF-кB передачи сигнала.
Из предшествующем уровня техники известно, что активация сигнального пути NF-кB индуцирует секрецию провоспалительных цитокинов. IL-8 также является хорошо изученным, чувствительным к NF-кB провоспалительным цитокином у людей. Поэтому секрецию IL-8 оценивали в культуральных надосадочных жидкостях вышеуказанных клеточных культур, чтобы увидеть, чувствительна ли секреция IL-8 также к бактериям (Klebsiella pneumoniae или Pseudomonas aeruginosa) и IgM (смотри Фиг. 4В). Цитокин IL-8, секретированный в надосадочную жидкость, измеряли методом AlphaLISA, используя набор для иммунологического анализа IL-8 AlphaLISA, согласно протоколу производителя (Perkin-Elmer, Waltham, MA USA).
Подобно активации NF-кB, фиксированные формальдегидом бактерии сами по себе индуцировали секрецию IL-8, тогда как совместная обработка указанными бактериями и IgM продемонстрировала пониженную секрецию IL-8 по сравнению с культурами, обработанными отдельно (смотри Фиг. 4В).
Пример 4. Анализ влияния IgM на пролиферацию мононуклеарных клеток периферической крови
Поскольку IgM продемонстрировал четкие эффекты на провоспалительный путь NF-кB, оценивали также, оказывает ли очищенный IgM более общий эффект на иммунные функции. Пролиферация лимфоцитов крови, в частности Т-клеток, стимулированная антигеном, является одним из самых главных провоспалительных иммунных ответов.
Форбол-12-миристат-13-ацетат (РМА) и иономицин, очень широко распространенный стимулятор пролиферации, использовали для индуцирования пролиферации мононуклеарных клеток периферической крови, более точно Т-лимфоцитов, или Т-клеток.
Мононуклеарные клетки периферической крови человека культивировали в RPMI с 10% инактивированной нагреванием сыворотки человека. Для анализов пролиферации 3×105 клеток засевали в каждую лунку 96-луночного планшета, используя культуральную среду.
Т-клетки обрабатывали 10 нг/мл РМА и 0,5 мкМ иономицина в течение 3 суток. В случае использования IgM клетки обрабатывали или совместно обрабатывали очищенным IgM (в конечной концентрации приблизительно 5 мг/мл и с чистотой по меньшей мере 95%) во время обработки, в зависимости от случая.
Титр клеток для разных групп измеряли анализом Cell Titer Glow (Promega Corp. Madison, WI, USA) согласно инструкциям производителя и на основе измерения индуцирования клеточной пролиферации как функции содержания АТР (аденозинтрифосфат).
После 3 суток стимулирования РМА/иономицином наблюдалось значительное увеличение пролиферации мононуклеарных клеток периферической крови (смотри Фиг. 5). Обработка клеток IgM либо в присутствии, либо в отсутствие РМА/иономицина снижала пролиферацию мононуклеарных клеток периферической крови относительно необработанных контрольных клеток и относительно обработки клеток РМА/иономицином. Это наблюдение было очень неожиданным, поскольку РМА/иономицин является очень мощным, очень неспецифическим митогеном. Это свидетельствует о том, что IgM оказывает модулирующий эффект на сам иммунный ответ.
Реферат
Группа изобретений относится к области медицины, а именно к иммунологии и инфекционным болезням, и предназначена для лечения иммунных осложнений, вызванных инфекциямиили их комбинациями. Для лечения указанных осложнений нуждающемуся в этом пациенту вводят композицию, содержащую иммуноглобулин М (IgM), где чистота IgM составляет по меньшей мере 90% (масс./об.). Указанную композицию также применяют для лечения гиперактивации иммунной системы, вызванной инфекциями, вызванными,,или их комбинациями. Использование группы изобретений обеспечивает эффективное подавление иммунных осложнений, в частности гиперактивацию иммунной системы, вызванных инфекциями,или их комбинациями. 2 н. и 16 з.п. ф-лы, 5 ил., 4 пр.

Комментарии