Способ получения модуляторов регулятора трансмембранной проводимости кистозного фиброза - RU2553989C2
Код документа: RU2553989C2
Чертежи


















Описание
Перекрестная ссылка на родственные заявки
[0001] Настоящая заявка заявляет приоритет относительно временной заявки США, серийный № 61/254634, поданной 23 октября 2009 года, содержание которой включено в настоящую заявку посредством ссылки во всей ее полноте.
Область техники, к которой относится настоящее изобретение
[0001] Настоящее изобретение относится к способу получения модуляторов регулятора трансмембранной проводимости кистозного фиброза ("CFTR").
Предпосылки создания изобретения
[0002] Кистозный фиброз (CF) представляет собой рецессивное генетическое заболевание, которое поражает приблизительно 30000 детей и взрослых в США и приблизительно 30000 детей и взрослых в Европе. Несмотря на прогресс в лечении CF метод его лечения отсутствует.
[0003] CF вызывается мутациями в гене регулятора трансмембранной проводимости кистозного фиброза (CFTR), который кодирует эпителиальный хлорный ионный канал, отвечающий за помощь в регуляции солевой и водной абсорбции и секреции в различных тканях. Лекарственные средства на основе малых молекул, известные как потенцирующие средства, которые повышают вероятность открытия CFTR канала, представляют собой одну потенциальную терапевтическую стратегию для лечения CF.
[0004] В частности, CFTR представляет собой cAMP/ATP-опосредованный анионный канал, который экспрессируется в различных типах клеток, включая абсорбтивные и секреторные эпителиальные клетки, где он регулирует приток анионов через мембрану, а также активность других ионных каналов и белков. В эпителиальных клетках нормальное функционирование CFTR является критическим для поддержания транспорта электролитов в организме, включая респираторную и пищеварительную ткани. CFTR состоит приблизительно из 1480 аминокислот, которые кодируют белок, состоящий из тандемного повтора трансмембранных доменов, каждый из которых содержит шесть трансмембранных двойных спиралей и нуклеотид-связывающий домен. Эти два трансмембранных домена связаны между собой большим полярным регуляторным (R)-доменом с множественными сайтами фосфорилирования, которые регулируют активность канала и клеточный трафик.
[0005] Ген, кодирующий CFTR, был идентифицирован и секвенирован (см. Gregory, R. J. et al. (1990) Nature 347:382-386; Rich, D. P. et al. (1990) Nature 347:358-362), (Riordan, J. R. et al. (1989) Science 245:1066-1073). Дефект в этом гене вызывает мутации в CFTR, приводящие к кистозному фиброзу ("CF"), наиболее распространенному фатальному генетическому заболеванию у людей. Кистозный фиброз поражает приблизительно одного из каждых 2500 детей раннего возраста в США. Из населения США в целом до 10 миллионов людей имеют одну копию дефектного гена без явно выраженных эффектов заболевания. В отличие от этого субъекты с двумя копиями CF-ассоциированного гена страдают от изнурительных и фатальных эффектов CF, включая хроническое легочное заболевание.
[0006] У пациентов с CF мутации в CFTR, эндогенно экспрессируемые в респираторном эпителии, приводят к уменьшенной апикальной анионной секреции, вызывая дисбаланс в транспорте ионов и жидкостей. Полученное в результате снижение анионного транспорта способствует повышенной аккумуляции слизи в легких с сопутствующими микробными инфекциями, которые в конечном счете приводят к смерти CF пациентов. Помимо респираторного заболевания CF пациенты типично страдают от желудочно-кишечных проблем и недостаточной функции поджелудочной железы, что, если это не лечить, приводит к смерти. Кроме того, большинство мужчин с кистозным фиброзом являются бесплодными, и фертильность снижена у женщин с кистозным фиброзом. В отличие от тяжелых эффектов двух копий CF-ассоциированного гена субъекты с одной копией CF-ассоциированного гена демонстрируют повышенную резистентность к холере и к обезвоживанию в результате диареи, возможно, объясняющую относительно высокую распространенность CF гена среди населения.
[0007] Анализ последовательности CFTR гена CF хромосом выявил ряд различных заболеваний, вызывающих мутации (Cutting, G. R. et al. (1990) Nature 346:366-369; Dean, M. et al. (1990) Cell 61:863:870; and Kerem, B-S. et al. (1989) Science 245:1073-1080; Kerem, B-S. et al. (1990) Proc. Natl. Acad. Sci. USA 87:8447-8451). В настоящее время идентифицировано более чем 1000 заболеваний, вызывающих мутации в CF гене (http://www.genet.sickkids.on.ca/cftr/app). Наиболее распространенной мутацией является делеция фенилаланина в положении 508 аминокислотной последовательности CFTR, и ее обычно указывают как ΔF508-CFTR. Эта мутация возникает приблизительно в 70% случаев кистозного фиброза, и она ассоциируется с тяжелым заболеванием.
[0008] Делеция остатка 508 в ΔF508-CFTR препятствует правильной укладке зарождающегося белка. Это приводит к неспособности мутантного белка выходить из ER и перемещаться к плазменной мембране. В результате количество каналов, присутствующих в мембране, намного меньше, чем наблюдается в клетках, экспрессирующих CFTR дикого типа. Помимо нарушенного трафика такая мутация приводит к дефекту воротного механизма канала. Все вместе, уменьшенное количество каналов в мембране и дефект воротного механизма, приводят к снижению анионного транспорта через эпителий, приводя к нарушенному транспорту ионов и жидкостей. (Quinton, P. M. (1990), FASEB J. 4:2709-2727). Исследования, однако, показали, что уменьшенные количества ΔF508-CFTR в мембране являются функциональными, хотя меньше, чем CFTR дикого типа. (Dalemans et al. (1991), Nature Lond. 354:526-528; Denning et al., выше; Pasyk and Foskett (1995), J. Cell. Biochem. 270:12347-50). Помимо ΔF508-CFTR другие вызывающие заболевания мутации в CFTR, которые приводят к нарушению трафика, синтеза и/или воротного механизма канала, можно было бы регулировать либо путем активации, либо даун-регуляции для изменения анионной секреции и модификации прогрессирования и/или тяжести заболевания.
[0009] Хотя CFTR транспортирует различные молекулы помимо анионов, ясно, что эта роль (транспорт анионов) представляет собой один элемент в важном механизме транспорта ионов и воды через эпителий. Другие элементы включают эпителиальный Na+ канал, ENaC, Na+/2C1-/K+ ко-транспортер, Na+-K+-ATPазный насос и базолатеральные мембранные K+ каналы, которые отвечают за поглощение хлора в клетке.
[0010] Эти элементы работают вместе для достижения направленного транспорта через эпителий через их селективную экспрессию и локализацию в клетке. Абсорбция хлора происходит в результате скоординированной активности ENaC и CFTR, присутствующих на апикальной мембране, и Na+-K+-ATPазного насоса и Cl ионных каналов, экспрессируемых на базолатеральной поверхности клетки. Вторичный активный транспорт хлора с люминальной стороны приводит к аккумуляции внутриклеточного хлора, который затем пассивно покидает клетку через Cl-каналы, приводя к векторному транспорту. Расположение Na+/2C1-/K+ ко-транспортера, Na+-K+-ATPазного насоса и базолатеральных мембранных K+ каналов на базолатеральной поверхности и CFTR на люминальной стороне координирует секрецию хлора через CFTR на люминальной стороне. Поскольку вода, вероятно, никогда сама активно не транспортируется, ее протекание через эпителий зависит от очень малых трансэпителиальных осмотических градиентов, создаваемых объемным потоком натрия и хлора.
[0011] Как обсуждалось выше, считается, что делеция остатка 508 в ΔF508-CFTR препятствует правильной укладке зарождающегося белка, что приводит к неспособности мутантного белка выходить из ER и перемещаться к плазменной мембране. В результате на плазменной мембране присутствуют недостаточные количества зрелого белка и транспорт хлора в эпителиальных тканях существенно снижен. Действительно, было показано, что этот клеточный феномен дефектного ER процессинга ABC транспортеров при помощи ER механизма лежит в основе не только CF заболевания, но также широкого ряда других отдельных и наследственных заболеваний.
[0012] Соответственно, существует потребность в сильных и селективных модуляторах дикого типа и мутантных форм человеческого CFTR. Эти мутантные формы CFTR включают, но не ограничиваются этим, ΔF508del, G551D, R117H, 2789+5G→A.
[0013] Также существует потребность в модуляторах CFTR активности и их композициях, которые можно использовать для модулирования CFTR активности в клеточной мембране млекопитающего.
[0014] Существует потребность в способах лечения заболеваний, вызванных мутацией в CFTR, с использованием таких модуляторов CFTR активности.
[0015] Существует также потребность в способах модулирования CFTR активности в ex vivo клеточной мембране млекопитающего.
[0016] Кроме того, существует потребность в стабильных твердых формах указанного соединения, которые можно легко использовать в фармацевтических композициях, подходящих для применения в качестве терапевтических средств.
Краткое описание изобретения
[0017] Настоящее изобретение относится к способам синтеза соединений, полезных в качестве модуляторов CFTR.
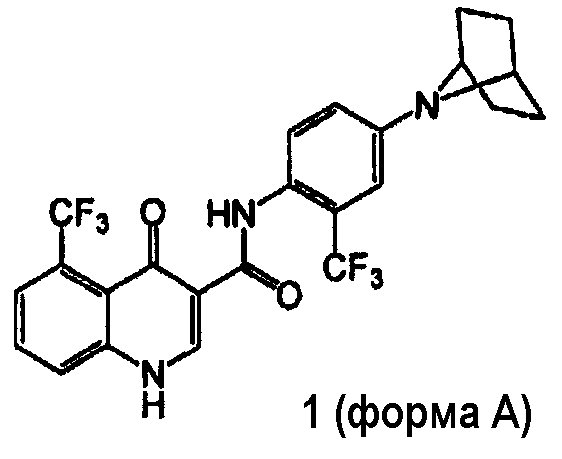
[0018] В одном аспекте изобретение обеспечивает способ получения кристаллической формы соединения 1:

включающий
(а) взаимодействие соединения 2 с соединением 3 в присутствии связующего вещества:

где связующее вещество выбрано из группы, включающей тетрафторборат 2-хлор-1,3-диметил-2-имидазолия, HBTU, HCTU, 2-хлор-4,6-диметокси-1,3,5-триазин, HATU, HOBT/EDC, и T3P®.
[0019] Соединения формулы I и их фармацевтически приемлемые композиции являются полезными для лечения или ослабления тяжести ряда заболеваний, расстройств или состояний, включающих, но не ограничивающихся этим, кистозный фиброз, астму, вызванное курением COPD (хроническое обструктивное легочное заболевание), хронический бронхит, риносинусит, запор, панкреатит, недостаточность функции поджелудочной железы, мужское бесплодие, вызванное врожденным двусторонним отсутствием семявыносящих протоков (CBAVD), неосложненную форму легочного заболевания, идиопатический панкреатит, аллергический бронхолегочный аспергиллез (ABPA), заболевание печени, наследственную эмфизему, наследственный гемохроматоз, коагуляционно-фибринолизные недостаточности, такие как дефицит белка С, наследственный ангионевротический отек типа 1, нарушения липидного процессинга, такие как семейная гиперхолестеринемия, хиломикронемия типа 1, абеталипопротеинемия, лизосомальные болезни накопления, такие как болезнь клеточных включений/болезнь Дери, мукополисахаридоз, Sandhof/Tay-Sachs, болезнь Криглера-Найяра типа II, полиэндокринопатию/гиперинсулемию, сахарный диабет, карликовость Ларона, миелопероксидазную недостаточность, первичный гипопаратиреоз, меланому, гликаноз CDG типа 1, врожденный тиреотоксикоз, несовершенный остеогенез, наследственную гипофибриногенемию, недостаточное активированное время свертывания крови (АСТ), несахарный диабет (НД), несахарный нейрофизарный диабет, нефрогенный несахарный диабет, мышечную атрофию Шарко-Мари-Тута, болезнь Перлизауса-Мерцбахера, нейродегенеративные заболевания, такие как болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз, прогрессирующий супрануклеарный паралич, атрофия Пика, некоторые полиглутаминовые неврологические расстройства, такие как болезнь Гентингтона, спинально-церебеллярную атаксию типа I, спинальную и бульбарную мышечную атрофию, dentatorubal pallidoluysian и миотоническую дистрофию, а также губчатые энцефалопатии, такие как наследственная болезнь Крейтцфельдта-Якоба (из-за дефекта процессинга прионного белка), болезнь Фабри, синдром Штросслера-Шейнкера, COPD, синдром сухих глаз или болезнь Шегрена, остеопороз, остеопению, заживление костей и рост костей (включая восстановление кости, регенерацию костной ткани, снижение резорбции костной ткани и увеличение костных отложений), синдром Горема, хлоридные каналопатии, такие как врожденная миотония (формы Томсона и Бекера), синдром Барттера типа III, болезнь Дента, гиперэкплексию, эпилепсию, гиперэкплексию, лизосомную болезнь накопления, синдром Ангельмана и первичную цилиарную дискинезию (PCD), термин для наследственных нарушений структуры и/или функции реснитчатых структур, включая PCD с транспозицией внутренних органов (также известный как синдром Картагенера), PCD без транспозиции внутренних органов и цилиарную аплазию.
[0020] В одном аспекте соединение 1 присутствует в кристаллической форме, которая указана как форма A.
[0021] В другом аспекте соединение 1 присутствует в кристаллической форме, которая указана как форма B.
[0022] В следующем аспекте соединение 1 присутствует в кристаллической форме, которая указана как форма A-HCl.
[0023] В дополнительном аспекте соединение 1 присутствует в кристаллической форме, которая указана как форма B-HCl.
[0024] Способы, описанные в настоящей заявке, можно использовать для получения композиций по настоящему изобретению, включающих форму A, форму A-HCl, форму B, форму B-HCl или любое сочетание этих форм.
Краткое описание фигур
[0025] Фиг.1 представляет рентгеновскую порошковую дифрактограмму репрезентативного образца соединения 1 формы A.
[0026] Фиг.2 представляет FTBR спектр репрезентативного образца соединения 1 формы A.
[0027] Фиг.3 иллюстрирует конформационную структуру соединения 1 формы А на основании одного рентгеновского анализа.
[0028] Фиг.4 представляет рентгеновскую порошковую дифрактограмму иллюстративного образца соединения 1 формы A-HCl.
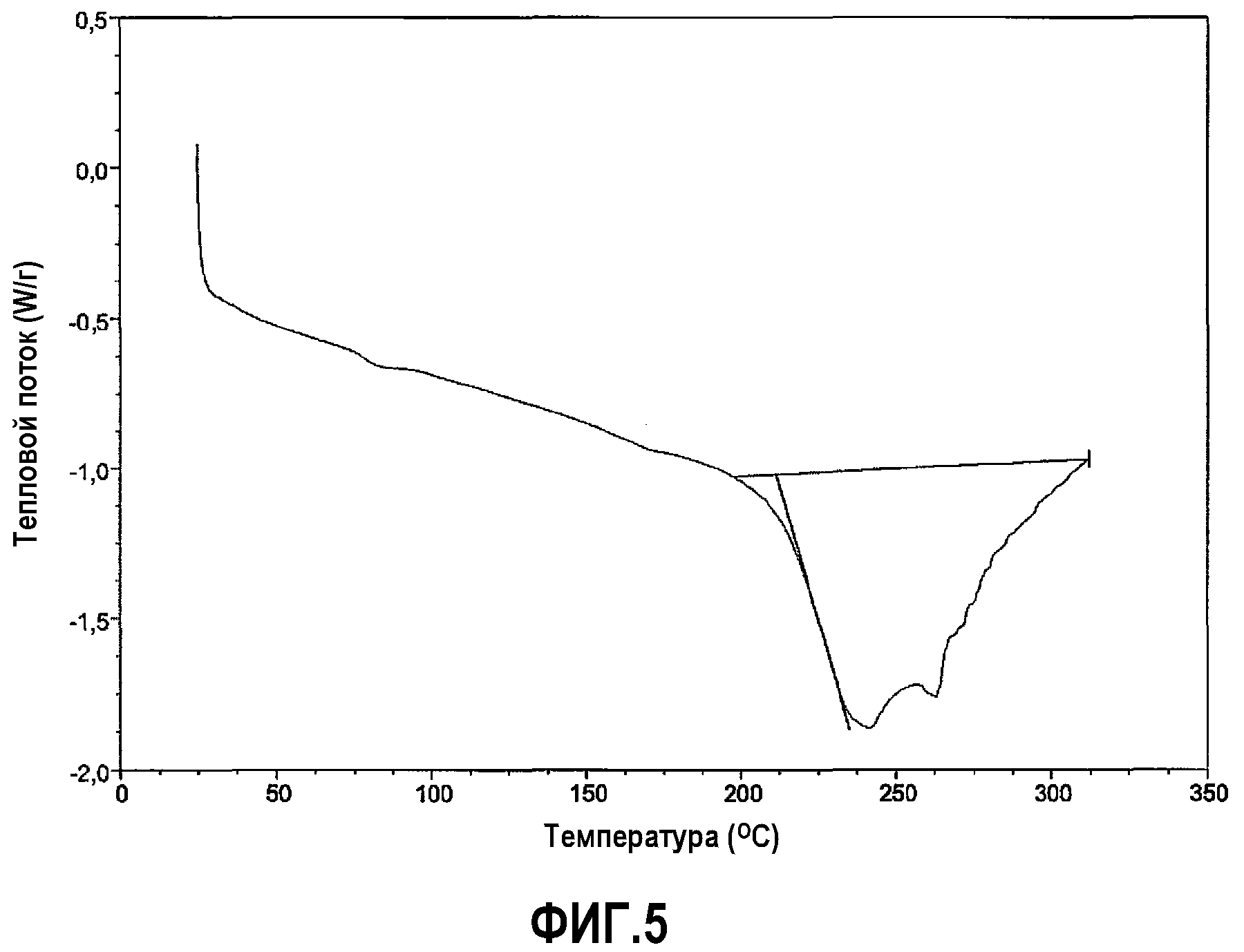
[0029] Фиг.5 представляет DSC кривую для репрезентативного образца соединения 1 формы A-HCl.
[0030] Фиг.6 представляет кривую, полученную при помощи термогравиметрического анализа репрезентативного образца соединения 1 формы A-HCl, которая представляет массу образца как функцию температуры.
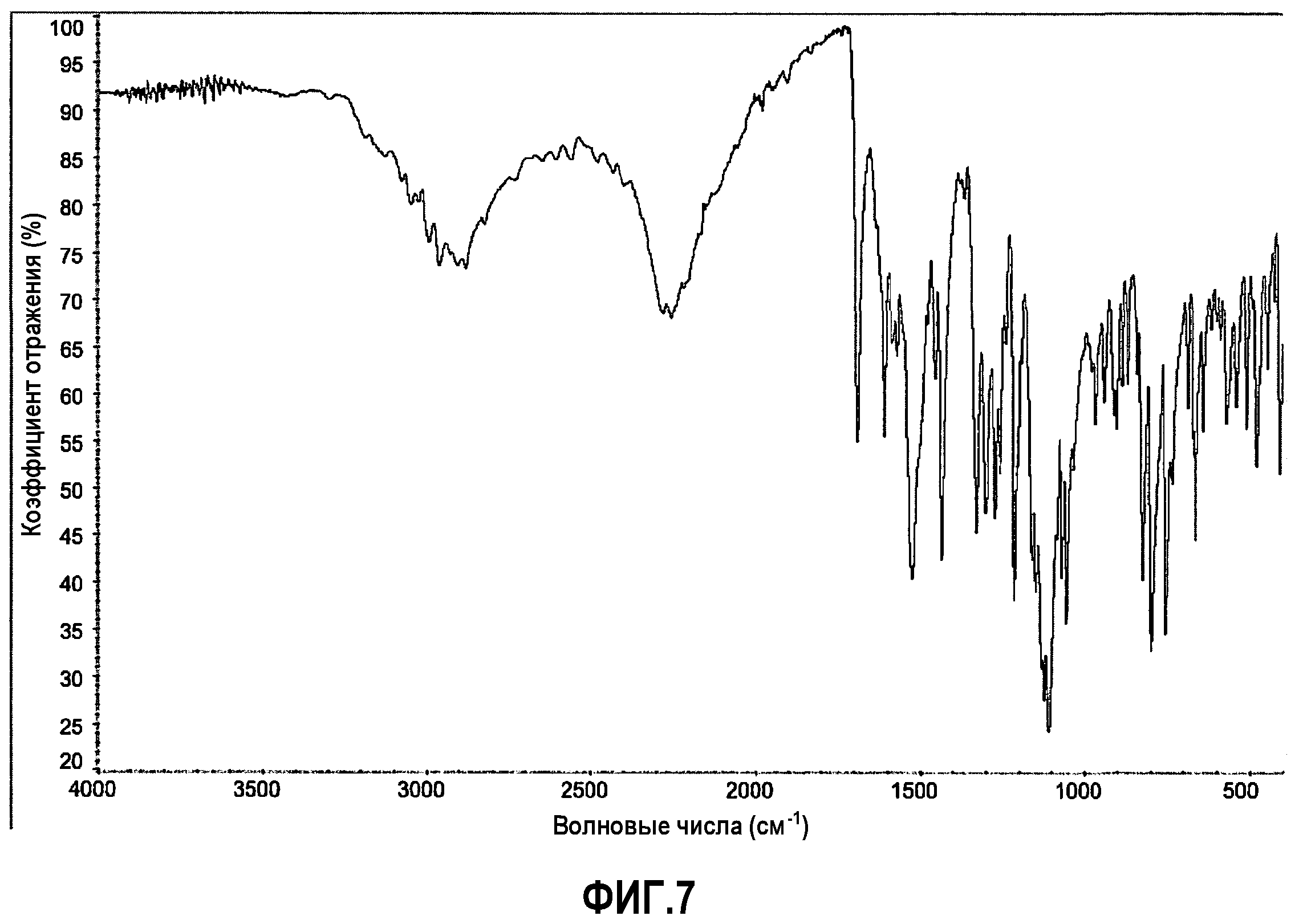
[0031] Фиг.7 представляет FTIR спектр репрезентативного образца соединения 1 формы A-HCl.
[0032] Фиг.8 представляет твердофазный13C ЯМР спектр репрезентативного образца соединения 1 формы A-HCl.
[0033] Фиг.9 представляет твердофазный19F ЯМР спектр репрезентативного образца соединения 1 формы A-HCl.
[0034] Фиг.10A представляет рентгеновскую порошковую дифрактограмму для репрезентативного образца соединения 1 формы B, полученную при помощи инструмента 1.
[0035] Фиг.10B представляет рентгеновскую порошковую дифрактограмму для репрезентативного образца соединения 1 формы B, полученную при помощи инструмента 2.
[0036] Фиг.11 представляет DSC кривую для репрезентативного образца соединения 1 формы B.
[0037] Фиг.12 представляет кривую, полученную при помощи термогравиметрического анализа репрезентативного образца соединения 1 формы B, которая представляет массу образца как функцию температуры.
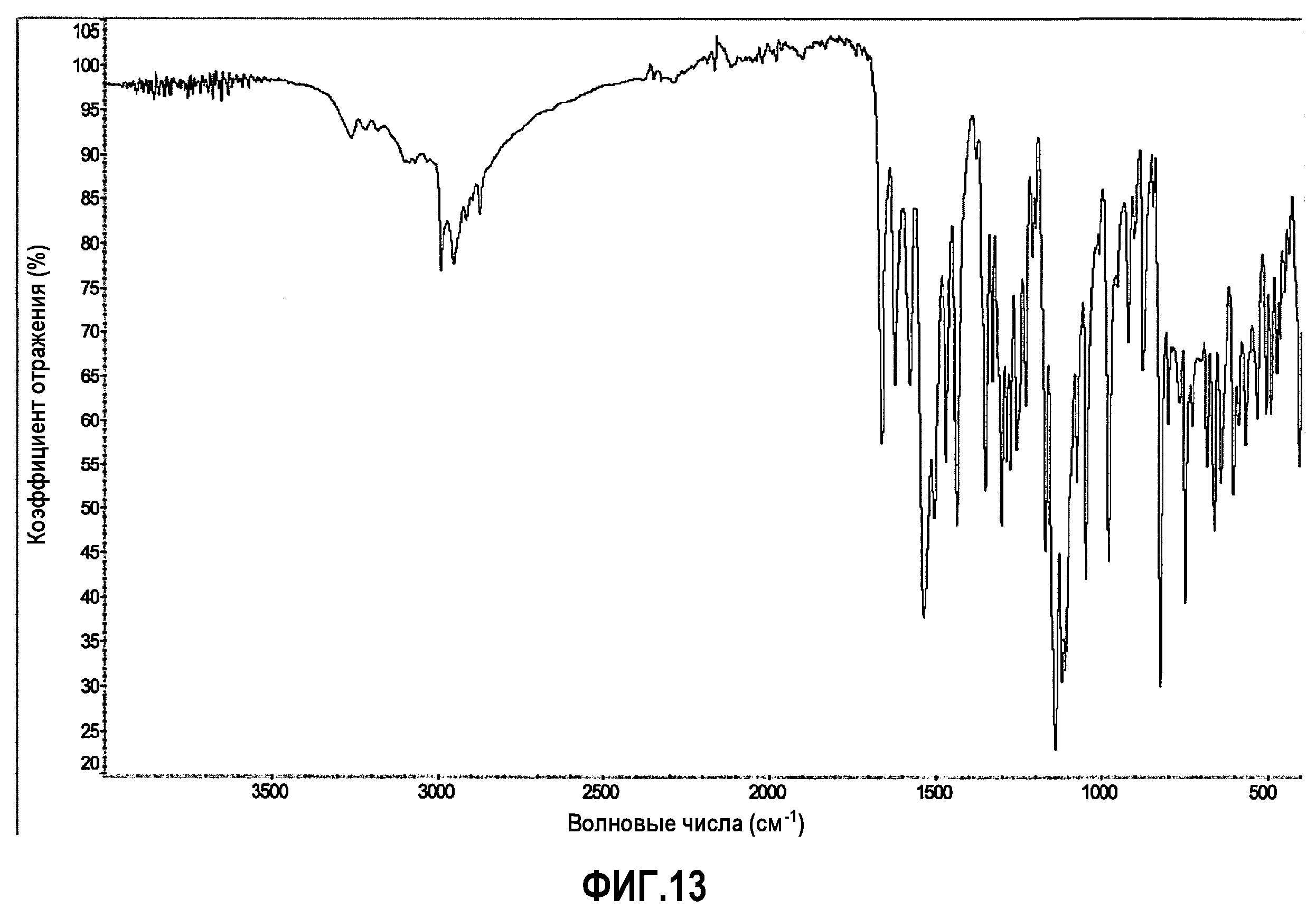
[0038] Фиг.13 представляет FTIR спектр репрезентативного образца соединения 1 формы B.
[0039] Фиг.14 представляет твердофазныйl3C ЯМР спектр репрезентативного образца соединения 1 формы B.
[0040] Фиг.15 представляет твердофазныйl9F ЯМР спектр репрезентативного образца соединения 1 формы B.
[0041] Фиг.16 представляет рентгеновскую порошковую дифрактограмму соединения 1 формы B-HCl.
[0042] Фиг.17 представляет DSC кривую для репрезентативного образца соединения 1 формы B-HCl.
[0043] Фиг.18 представляет кривую, полученную при помощи термогравиметрического анализа репрезентативного образца соединения 1 формы B-HCl, которая представляет массу образца как функцию температуры.
[0044] Фиг.19 представляет FTIR спектр репрезентативного образца соединения 1 формы B-HCl.
[0045] Фиг.20 представляет твердофазный13C ЯМР спектр репрезентативного образца соединения 1 формы B-HCl.
[0046] Фиг.21 представляет твердофазный19F ЯМР спектр репрезентативного образца соединения 1 формы B-HCl.
Подробное описание изобретения
Определения
[0047] Как это используется в настоящей заявке, следующие определения являются применимыми, если не указано иное.
[0048] Термин "ABC-транспортер", как он используется в настоящей заявке, означает ABC-транспортерный белок или его фрагмент, содержащий по меньшей мере один связывающий домен, где указанный белок или его фрагмент присутствует in vivo или in vitro. Термин "связывающий домен", как он используется в настоящей заявке, означает домен на ABC-транспортере, который может связываться с модулятором. См., например, Hwang, T. C. et al., J. Gen. Physiol. (1998): 111(3), 477-90.
[0049] Термин "CFTR", как он используется в настоящей заявке, означает регулятор трансмембранной проводимости кистозного фиброза или его мутацию, обладающую способностью регулятора активности, включая, но не ограничиваясь этим, ΔF508 CFTR, R117H CFTR и G551D CFTR (см., например, http://www.genet.sickkids.on.ca/cftr/, для CFTR мутаций).
[0050] Термин "модулирующий", как он используется в настоящей заявке, означает увеличение или уменьшение на количество, которое можно измерить.
[0051] Термин "нормальный CFTR" или "нормальная CFTR функция", как он используется в настоящей заявке, означает CFTR, подобный дикому типу, без какого-либо повреждения из-за влияния факторов окружающей среды, таких как курение, загрязнение или что-либо, вызывающее воспаление в легких.
[0052] Термин "уменьшенный CFTR" или "пониженная функция CFTR", как он используется в настоящей заявке, означает меньше, чем нормальный CFTR или меньше, чем нормальная функция CFTR.
[0053] Термин "кристаллический" относится к соединениям или композициям, где структурные единицы расположены так, что образуют постоянные геометрические структуры или решетки, таким образом, кристаллические твердые вещества имеют жесткий дальний порядок структуры. Структурные единицы, которые образуют кристаллическую структуру, могут представлять собой атомы, молекулы или ионы. Кристаллические твердые вещества показывают определенные точки плавления.
[0054] Термин "по существу кристаллический" относится к твердому веществу, которое преимущественно имеет структуру в виде постоянных геометрических форм или решеток, которые имеют жесткий дальний порядок. Например, по существу кристаллические вещества имеют более чем около 85% кристалличности (например, более чем около 90% кристалличности, более чем около 95% кристалличности или более чем около 99% кристалличности). Также следует отметить, что термин «по существу кристаллический» включает ключевое слово 'кристаллический', которое определено в предыдущем абзаце.
[0055] Для целей настоящего изобретения химические элементы обозначаются в соответствии с Периодической таблицей элементов, CAS version, Handbook of Chemistry and Physics, 75th Ed. Кроме того, общие принципы органической химии описаны в "Organic Chemistry", Thomas Sorrell, University Science Books, Sausalito: 1999, и в "March's Advanced Organic Chemistry", 5th Ed., Ed.: Smith, M. B. and March, J., John Wiley & Sons, New York: 2001, полное содержание которых включено в настоящую заявку посредством ссылки.
[0056] Термин "стабильный", как он используется в настоящей заявке, относится к соединениям, которые, по существу, не изменяются, будучи подверженными условиям, которые делают возможным их получение, детекцию и, предпочтительно, их выделение, очистку и использование по одному или нескольким назначениям, раскрытым в настоящей заявке. В некоторых вариантах воплощения стабильное соединение или химически достижимое соединение представляет собой такое, которое, по существу, не изменяется при выдерживании при температуре 40°C или ниже в отсутствие влаги или в других химически реакционных условиях в течение по меньшей мере недели.
[0057] Примеры подходящих растворителей, которые можно использовать в настоящем изобретении, включают, но не ограничиваются этим, воду, метанол, дихлорметан (ДСМ, DCM), ацетонитрил, диметилформамид (ДМФ, DMF), метилацетат (MeOAc), этилацетат (EtOAc), изопропилацетат (IPAc), трет-бутилацетат (t-BuOAc), изопропиловый спирт (IPA), тетрагидрофуран (ТГФ), метилэтилкетон (MEK), трет-бутанол, диэтиловый эфир (Et2O), метил-трет-бутиловый эфир (МТБЭ, MTBE), 1,4-диоксан и N-метилпирролидон (NMP).
[0058] Примеры подходящих связующих веществ, которые можно использовать в настоящем изобретении, включают, но не ограничиваются этим, гидрохлорид 1-(3-(диметиламино)пропил)-3-этилкарбодиимида (EDCI), гексафторфосфат 2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилурония (HBTU), 1-гидроксибензотриазол (HOBT), гексафторфосфат 2-(1H-7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония (HATU), тетрафторборат 2-хлор-1,3-диметил-2-имидазолия, 1-H-бензотриазолий-1-[бис(диметиламино)метилен]-5-хлоргексафторфосфат (HCTU), 2-хлор-4,6-диметокси-1,3,5-триазин и 2-пропанфосфоновый ангидрид (T3P®).
[0059] Примеры подходящих оснований, которые можно использовать в настоящем изобретении, включают, но не ограничиваются этим, карбонат калия (K2CO3), N-метилморфолин (NMM), триэтиламин (Et3N; TEA), диизопропилэтиламин (i-Pr2EtN; DIEA), пиридин, гидроксид калия (KOH), гидроксид натрия (NaOH) и метоксид натрия (NaOMe; NaOCH3).
[0060] Кроме того, также подразумевается, если не указано иное, что структуры, представленные в настоящей заявке, включают соединения, которые отличаются только присутствием одного или нескольких изотопно-обогащенных атомов. Например, соединения, имеющие представленные структуры за исключением замены водорода дейтерием или тритием или замены углерода углеродом13C или14C, включены в объем настоящего изобретения. Такие соединения являются полезными, например, в качестве аналитических инструментов, зондов в биологических анализах.
Способы по настоящему изобретению
[0061] В основном, изобретение обеспечивает способы синтеза соединений, полезных в качестве модуляторов CFTR.
Получение соединения 1
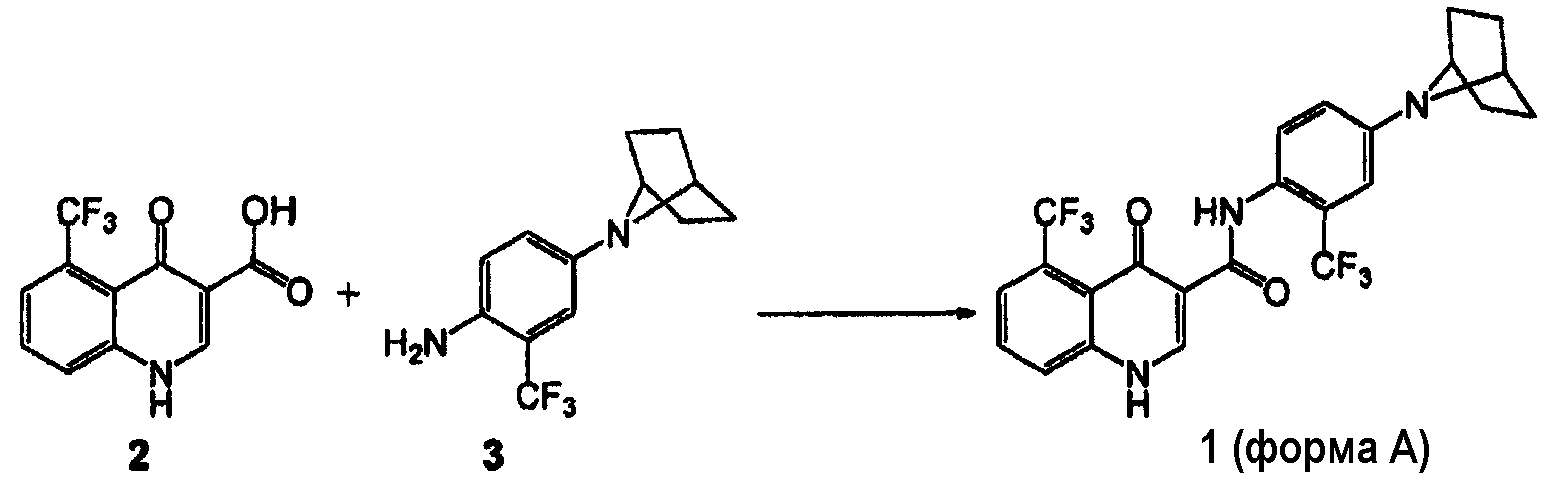
[0062] В некоторых вариантах воплощения изобретение обеспечивает способ получения кристаллической формы соединения 1:

включающий
(а) взаимодействие соединения 2 с соединением 3 в присутствии связующего вещества
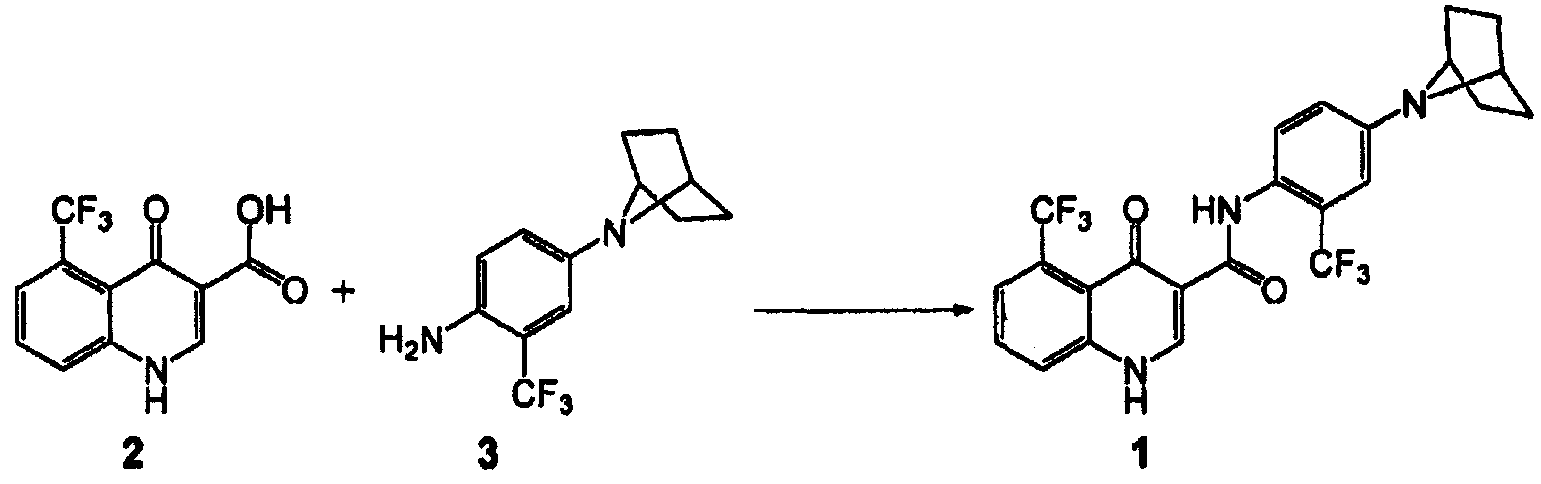
где связующее вещество выбрано из группы, включающей тетрафторборат 2-хлор-1,3-диметил-2-имидазолия, HBTU, HCTU, 2-хлор-4,6-диметокси-1,3,5-триазин, HATU, HOBT/EDC и T3P®.
[0063] В другом аспекте этого варианта воплощения соединение 3 может представлять собой соль HCl.
[0064] В одном аспекте этого варианта воплощения связывание соединения 2 и соединения 3 осуществляют в присутствии основания, такого как K2CO3, Et3N, N-метилморфолин (NMM), пиридин или диизопропилэтиламин (DIEA).
[0065] В другом аспекте этого варианта воплощения связывание соединения 2 и соединения 3 осуществляют в присутствии пиридина или DIEA.
[0066] В другом аспекте этого варианта воплощения связывание соединения 2 и соединения 3 осуществляют в присутствии пиридина.
[0067] В другом аспекте этого варианта воплощения связывание соединения 2 и соединения 3 осуществляют в присутствии растворителя. В одном аспекте растворитель представляет собой полярный апротонный растворитель. Например, растворитель выбран из группы, включающей этилацетат, изопропилацетат, тетрагидрофуран, метилэтилкетон, N-метил-2-пирролидон, ацетонитрил, Ν,Ν-диметилформамид или 2-метилтетрагидрофуран. Более конкретно, растворитель представляет собой 2-метилтетрагидрофуран.
[0068] В другом аспекте этого варианта воплощения связывание соединения 2 и соединения 3 осуществляют при температуре реакции, которую поддерживают в пределах от 30°C до 80°C. В следующих аспектах связывание соединения 2 и анилина формулы 3 осуществляют при температуре реакции, которую поддерживают в пределах от 30°C до 80°C (например, в пределах приблизительно от 40°C до 78°C, в пределах приблизительно от 45°C до 75°C, в пределах приблизительно от 50°C до 70°C, в пределах приблизительно от 62°C до 68°C или около 65°C). Например, связывание соединения 2 и соединения 3 осуществляют при температуре реакции, которую поддерживают при около 65°C.
[0069] В другом аспекте этого варианта воплощения соединение 1 представляет собой твердую форму A.
[0070] В другом варианте воплощения изобретение обеспечивает соединение 1, полученное способом, описанным в предыдущих параграфах.

Получение соединения 1 формы A
[0078] В другом варианте воплощения изобретение обеспечивает способ получения соединения 1, имеющего твердую форму A,
включающий взаимодействие соединения 2 с соединением 3 в присутствии связующего вещества
где связующее вещество выбрано из группы, включающей тетрафторборат 2-хлор-1,3-диметил-2-имидазолия, HBTU, HCTU, 2-хлор-4,6-диметокси-1,3,5-триазин, HATU, HOBT/EDC и T3P®.
[0079] В некоторых других аспектах этого варианта воплощения соединение 3 может представлять собой соль HCl.
[0080] В одном аспекте этого варианта воплощения связывание соединения 2 и соединения 3 осуществляют в присутствии основания, такого как K2CO3, Et3N, N-метилморфолин (NMM), пиридин или диизопропилэтиламин (DIEA).
[0081] В другом аспекте этого варианта воплощения связывание соединения 2 и соединения 3 осуществляют в присутствии пиридина или DIEA.
[0082] В другом аспекте этого варианта воплощения связывание соединения 2 и соединения 3 осуществляют в присутствии пиридина.
[0083] В другом аспекте этого варианта воплощения связывание соединения 2 и соединения 3 осуществляют в присутствии полярного апротонного растворителя. Например, полярный апротонный растворитель выбран из группы, включающей этилацетат, изопропилацетат, тетрагидрофуран, метилэтилкетон, N-метил-2-пирролидон, ацетонитрил, Ν,Ν-диметилформамид или 2-метилтетрагидрофуран. Более конкретно, связывание соединения 2 и соединения 3 осуществляют в присутствии 2-метилтетрагидрофурана.
[0084] В другом аспекте этого варианта воплощения связывание соединения 2 и соединения 3 осуществляют при температуре реакции, которую поддерживают в пределах от 30°C до 80°C. В следующих аспектах связывание соединения 2 и анилина формулы 3 осуществляют при температуре реакции, которую поддерживают в пределах от 30°C до 80°C (например, в пределах приблизительно от 40°C до 78°C, в пределах приблизительно от 45°C до 75°C, в пределах приблизительно от 50°C до 70°C, в пределах приблизительно от 62°C до 68°C или около 65°C). Например, связывание соединения 2 и соединения 3 осуществляют при температуре реакции, которую поддерживают при около 65°C.
[0085] В другом варианте воплощения изобретение обеспечивает соединение 1 формы A, полученное способом, описанным в предыдущих параграфах.

[0086] В одном варианте воплощения изобретение обеспечивает способ получения соединения 1 формы A, включающий взаимодействие соединения 2 с соединением 3 в присутствии T3P® и пиридина, при температуре около 65°C, в течение около 10 часов, в растворителе 2-MeTГФ.

Получение соединения 1 формы B
[0087] В другом варианте воплощения изобретение обеспечивает способ получения соединения 1, имеющего твердую форму B:

включающий
(a) взаимодействие соединения 2 с гидрохлоридной солью соединения 3 (3-HCl) в присутствии связующего вещества, выбранного из группы, включающей тетрафторборат 2-хлор-1,3-диметил-2-имидазолия, HBTU, HCTU, 2-хлор-4,6-диметокси-1,3,5-триазин, HATU, HOBT/EDC и T3P®.

[0088] В одном аспекте этого варианта воплощения связывание соединения 2 и гидрохлоридной соли 3-HCl осуществляют в присутствии основания, такого как K2CO3, Et3N, N-метилморфолин (NMM), пиридин или DIEA.
[0089] В некоторых других аспектах этого варианта воплощения гидрохлоридная соль 3-HCl может представлять собой соединение 3.
[0090] В другом аспекте этого варианта воплощения связывание соединения 2 и гидрохлоридной соли 3-HCl осуществляют в присутствии пиридина или DIEA.
[0091] В другом аспекте этого варианта воплощения связывание соединения 2 и гидрохлоридной соли 3-HCl осуществляют в присутствии пиридина.
[0092] В другом аспекте этого варианта воплощения связывание соединения 2 и гидрохлоридной соли 3-HCl осуществляют в присутствии растворителя, такого как EtOAc, IPAc, ТГФ, MEK, NMP, ацетонитрил, DMF или 2-метилтетрагидрофуран. Более конкретно, связывание соединения 2 и гидрохлоридной соли 3-HCl осуществляют в присутствии 2-метилтетрагидрофурана.
[0093] В другом аспекте этого варианта воплощения связывание соединения 2 и гидрохлоридной соли 3-HCl осуществляют при температуре реакции, которую поддерживают в пределах от 15°C до 70°C. В следующих аспектах связывание соединения 2 и гидрохлоридной соли 3-HCl осуществляют при температуре реакции, которую поддерживают в пределах от 15°C до 70°C (например, в пределах приблизительно от 20°C до 65°C, в пределах приблизительно от 25°C до 60°C, в пределах приблизительно от 30°C до 55°C, в пределах приблизительно от 35°C до 50°C или около 45°C). В предпочтительном аспекте этого варианта воплощения связывание соединения 2 и HCl соли соединения 3 осуществляют при температуре реакции, которую поддерживают при около 45°C.
[0094] В другом аспекте реакцию связывания осуществляют при перемешивании в течение времени от около 1,5 часов до около 10 часов. В следующих аспектах реакцию связывания осуществляют при перемешивании в течение времени от около 1,5 часов до около 10 часов (например, от около 2 часов до около 7 часов, от около 3 часов до около 6 часов, от около 4 часов до около 5,5 часов или около 5 часов).
[0095] В другом варианте воплощения изобретение обеспечивает соединение 1 формы B, полученное способом, описанным в предыдущих параграфах.

[0096] В одном варианте воплощения изобретение обеспечивает способ получения соединения 1 формы B, включающий взаимодействие соединения 2 с соединением 3-HCl в присутствии T3P® и пиридина, при температуре около 45°C, в течение около 5-6 часов, в растворителе 2-MeTГФ.

Получение соединения 1 формы A-HCl
[0097] В другом варианте воплощения изобретение обеспечивает способ получения гидрохлоридной соли соединения 1, имеющего твердую форму A-HCl:

включающий
(a) взаимодействие соединения 2 с гидрохлоридной солью соединения 3 (3-HCl) в присутствии связующего вещества, выбранного из группы, включающей тетрафторборат 2-хлор-1,3-диметил-2-имидазолия, HBTU, HCTU, 2-хлор-4,6-диметокси-1,3,5-триазин, HATU, HOBT/EDC и T3P®.

(b) обработку смесей продукта стадии (a) при помощи HCl.
[0098] В одном аспекте этого варианта воплощения стадию (a) осуществляют в присутствии основания, такого как K2CO3, Et3N, N-метилморфолин (NMM), пиридин или диизопропилэтиламин (DIEA).
[0099] В другом аспекте этого варианта воплощения стадию (a) осуществляют в присутствии пиридина или DIEA.
[00100] В другом аспекте этого варианта воплощения стадию (a) осуществляют в присутствии пиридина.
[00101] В другом аспекте этого варианта воплощения стадию (a) осуществляют в присутствии полярного апротонного растворителя. Например, полярный апротонный растворитель выбран из группы, включающей этилацетат, изопропилацетат, тетрагидрофуран, метилэтил кетон, N-метил-2-пирролидон, ацетонитрил, Ν,Ν-диметилформамид или 2-метилтетрагидрофуран. Более конкретно, связывание соединения 2 и 3-HCl осуществляют в присутствии 2-метилтетрагидрофурана.
[00102] В другом аспекте этого варианта воплощения стадию (a) осуществляют при температуре реакции, которую поддерживают в пределах от 10°C до 80°C. В другом аспекте этого варианта воплощения стадию (a) осуществляют при температуре реакции, которую поддерживают в пределах от 15°C до 70°C. В следующих аспектах связывание соединения 2 и HCl соли соединения 3 осуществляют при температуре реакции, которую поддерживают в пределах от 15°C до 70°C (например, в пределах приблизительно от 20°C до 65°C, в пределах приблизительно от 25°C до 60°C, в пределах приблизительно от 30°C до 55°C, в пределах приблизительно от 35°C до 50°C или около 45°C). Например, связывание соединения 2 и 3-HCl осуществляют при температуре реакции, которую поддерживают при около 45°C.
[00103] В другом аспекте этого варианта воплощения время стадии (a) составляет от около 1,5 часов до около 72 часов. В следующих аспектах реакцию связывания осуществляют при перемешивании в течение времени от около 1,5 часов до около 72 часов или больше (например, от около 2 часов до около 48 часов, от около 3 часов до около 24 часов, от около 5 часов до около 20 часов или от около 12 часов до около 15 часов).
[00104] В следующем аспекте этого варианта воплощения продукт связывания стадии (a) обрабатывают хлористым водородом (HCl) на стадии (b). Например, газообразный HCl барботируют в смесь, включающую продукт реакции связывания стадии (a) и неполярный апротонный растворитель, такой как 2-метилтетрагидрофуран.
[00105] Типично по меньшей мере около 1 эквивалента газообразного HCl и вплоть до около 50 эквивалентов газообразного HCl барботируют в смесь. Более типично от около 2 эквивалентов (экв.) до около 20 эквивалентов (от около 5 экв. до около 15 экв., от около 8 экв. до около 12 экв. или около 10 экв.) газообразного HCl барботируют в реакционную смесь, включающую продукт связывания стадии (a).
[00106] Типично газообразный HCl барботируют в смесь продукта стадии (a) и растворителя, такого как апротонный растворитель, в течение времени от около 0,5 часа до около 5 часов и более типично в течение времени от около 0,5 часа до около 5 часов (например, от около 0,75 часа до около 3 часов или около 2 часов).
[00107] В другом варианте воплощения изобретение обеспечивает соединение 1 формы A-HCl, полученное способом, описанным в предыдущих параграфах.
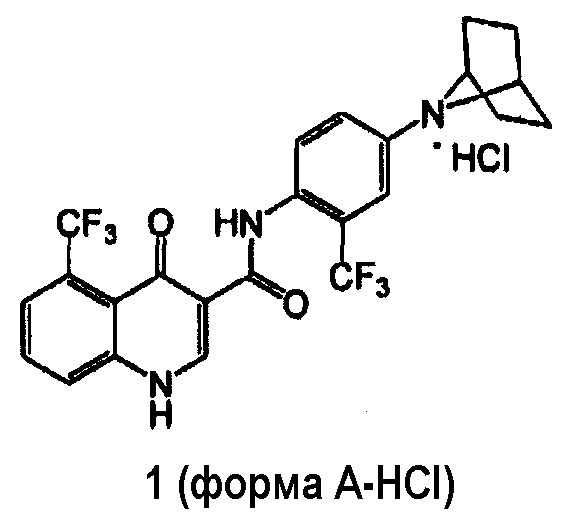
[00108] В одном варианте воплощения изобретение обеспечивает способ получения соединения 1 формы A-HCl, включающий взаимодействие соединения 2 с соединением 3-HCl в присутствии T3P® и пиридина, при температуре около 45°C в течение около 12-15 часов, в растворителе 2-MeTГФ, с последующей обработкой газообразным HCl.

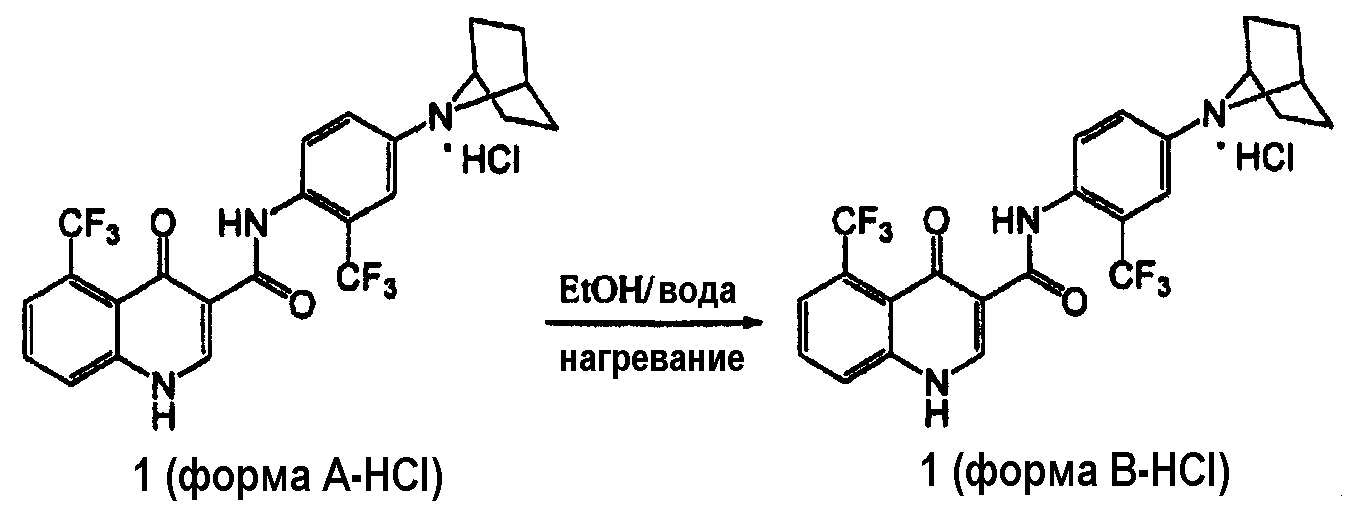
Получение соединения 1 формы B-HCl
[00109] В другом аспекте изобретение обеспечивает способ получения гидрохлоридной соли соединения 1, имеющего твердую форму - форму B-HCl:

включающий
(a) смешивание гидрохлоридной соли соединения 1 формы A-HCl, описанной в настоящей заявке, с органическим растворителем и водой с образованием смеси:

и
(b) нагревание смеси.
[00110] В одном аспекте этого варианта воплощения органический растворитель включает диметилсульфоксид, диметилформамид, диоксан, гексаметилфосфортриамид, тетрагидрофуран, EtOAc, IPAc, ТГФ, MEK, NMP, ацетонитрил, DMF, EtOH, MeOH, изопропиловый спирт или 2-метилтетрагидрофуран. Более конкретно, апротонный растворитель включает 2-метилтетрагидрофуран.
[00111] В другом аспекте смешивание на стадии (a) продолжают на стадии (b), поддерживая смесь при температуре от около 30°C до около 80°C (например, от около 40°C до около 70°C, от около 50°C до около 65°C или около 60°C). Способ по пункту 20, где смесь поддерживают при температуре от 30°C до около 80°C в течение времени от около 12 часов до около 72 часов.
[00112] В другом аспекте после нагревания на стадии (b) смесь фильтруют с образованием фильтровальной лепешки.
[00113] В другом аспекте после фильтрования осуществляют промывку фильтровальной лепешки апротонным растворителем, таким как 2-метилтетрагидрофуран.
[00114] В другом варианте воплощения изобретение обеспечивает соединение 1 формы B-HCl, полученное способом, описанным в предыдущих параграфах.

[00115] В одном варианте воплощения изобретение обеспечивает способ получения соединения 1 формы B-HCl, включающий нагревание соединения 1 формы A-HCl в смеси 2-MeTГФ и воды при температуре 60°C в течение 48 часов; охлаждение до комнатной температуры и фильтрование осажденного продукта и сушку продукта в вакууме при температуре 60°C.

[00116] В другом варианте воплощения изобретение обеспечивает способ получения соединения 1 формы B-HCl, включающий нагревание соединения 1 формы A-HCl в смеси EtOH и воды до температуры кипения с обратным холодильником; охлаждение до 20°C и перемешивание в течение 3 часов; фильтрование осажденного продукта; и сушку продукта в вакууме при температуре 45°C.
Получение соединений 2, 3 и 3-HCl
[00117] В другом варианте воплощения изобретение обеспечивает способ получения соединения 2:

включающий
(a) взаимодействие соединения 4 с диэтил 2-(этоксиметилен)малонат 5 с образованием сложного эфира 6A
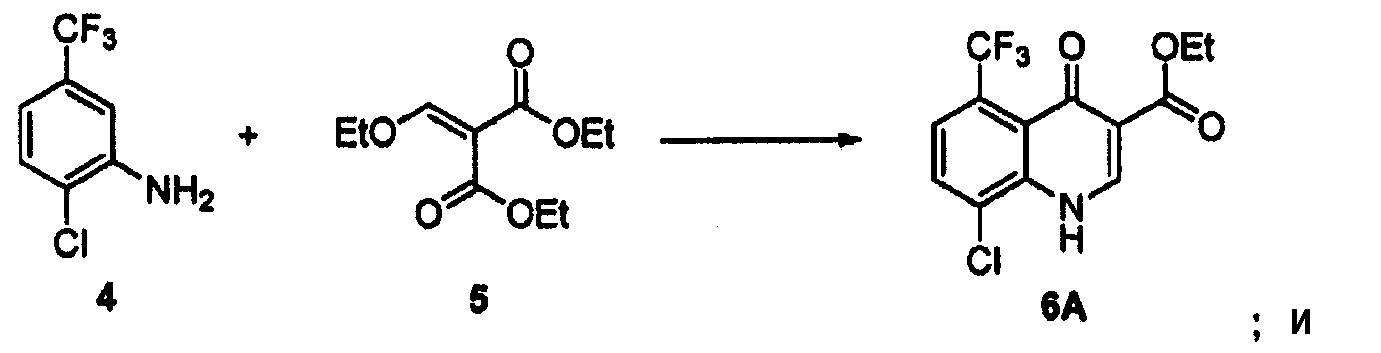
(b) обработку сложного эфира 6A источником атомарного водорода, таким как газообразный водород или формиат, в присутствии катализатора и основания на отдельных стадиях с образованием соединения 2

[00118] В одном аспекте соединение 6A обрабатывают источником атомарного водорода, таким как газообразный водород или формиат, в присутствии катализатора с получением соединения 6C

которое затем обрабатывают основанием с получением соединения 2.
[00119] В другом аспекте соединение 6A обрабатывают основанием с получением соединения 6D

которое затем обрабатывают источником атомарного водорода, таким как газообразный водород или формиат, в присутствии катализатора с получением соединения 2.
[00120] В некоторых аспектах источник водорода представляет собой газообразный водород. В других аспектах источник водорода представляет собой формиат.
[00121] В некоторых аспектах катализатор представляет собой палладиевый катализатор.
[00122] В некоторых аспектах основание представляет собой водный раствор гидроксида натрия или водный раствор гидроксида калия. Например, основание представляет собой водный раствор гидроксида натрия.
[00123] В одном варианте воплощения изобретение обеспечивает способ получения соединения 2, включающий следующие стадии:
a) взаимодействие соединения 4 с соединением 5 в толуоле при температуре кипения с обратным холодильником в аппарате Дина-Старка с получением соединения 6B;
b) нагревание соединения 6B в Dowtherm при температуре около 260°C с получением циклизованного продукта, соединения 6A;
c) гидрирование соединения 6A в EtOH с использованием Pd/C в качестве катализатора в присутствии газообразного водорода и триэтиламина с получением соединения 6C; и
d) гидролиз соединения 6C с использованием 5 M NaOH с получением соединения 2

[00124] В одном варианте воплощения изобретение обеспечивает способ получения соединения 2, включающий следующие стадии:
a) взаимодействие соединения 4 с соединением 5 в толуоле при температуре кипения с обратным холодильником в аппарате Дина-Старка с получением соединения 6B;
b) нагревание соединения 6B в Dowtherm при температуре около 260°C с получением циклизованного продукта, соединения 6A;
c) гидролиз соединения 6A с использованием NaOH в смеси изопропанола и воды с получением соединения 6D; и
d) гидрирование соединения 6D в EtOH с использованием Pd/C в качестве катализатора в присутствии формиата, метоксида натрия и метанола; и
е) окисление раствора при помощи уксусной кислоты с получением соединения 2

[00125] В другом варианте воплощения изобретение обеспечивает способ получения соединения 3

включающий
(a) взаимодействие соединения 7, где Hal представляет собой F, Cl, Br или I, с 7-азабицикло[2.2.1]гептаном 8 или его солью с образованием соединения 9

(b) восстановление нитрогруппы в соединении 9 с получением анилина 3.

[00126] В одном аспекте этого варианта воплощения стадию (a) осуществляют в присутствии основания в полярном апротонном растворителе. Например, основание представляет собой третичный амин, такой как триэтиламин или диизопропилэтиламин или подобные, и растворитель представляет собой такой, как ацетонитрил.
[00127] В другом аспекте этого варианта воплощения стадию (b) осуществляют с использованием газообразного водорода в и катализатора на основе переходного металла в спиртовом растворителе. Например, катализатор включает катализатор на основе переходного металла группы 9 или группы 10, полученный из Pt, Pd или Ni. Более конкретно, катализатор включает Pd. Спиртовой растворитель включает спирт, такой как изопропанол, этанол, метанол или подобные. Например, растворитель включает этанол.
[00128] В другом варианте воплощения изобретение обеспечивает способ получения соединения 3:
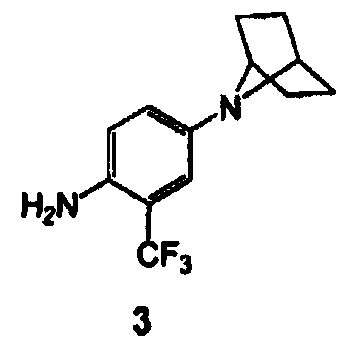
включающий
(a) взаимодействие соединения 7, где Hal представляет собой F, Cl, Br или I, с гидрохлоридной солью 7-азабицикло[2.2.1]гептана (8-HCl) с образованием соединения 9

(b) восстановление нитрогруппы в соединении 9 с получением соединения 3.

[00129] В одном аспекте этого варианта воплощения стадию (a) осуществляют в присутствии неорганического карбонатного основания, такого как карбонат натрия, и полярного апротонного растворителя, такого как DMSO.
[00130] В другом аспекте этого варианта воплощения стадию (b) осуществляют с использованием газообразного водорода и катализатора на основе переходного металла в спиртовом растворителе. Например, катализатор включает катализатор на основе переходного металла группы 9 или группы 10, образованный из Pt, Pd или Ni. Более конкретно, катализатор включает Pd. Спиртовой растворитель включает спирт, такой как изопропанол, этанол, метанол или подобные. Например, растворитель включает этанол.
[00131] В другом варианте воплощения изобретение обеспечивает способ получения гидрохлоридной соли 3-HCl:

включающий
(а) взаимодействие соединения 7, где Hal представляет собой F, Cl, Br или I, с гидрохлоридом 7-азабицикло[2.2.1]гептана солью 8-HCl с образованием соединения 9

(b) восстановление нитрогруппы в соединении 9 с получением анилина 3;

(c) обработку продукта стадии (c) газообразным HCl с получением 3-HCl.
[00132] В одном аспекте этого варианта воплощения стадию (a) осуществляют в присутствии неорганического карбонатного основания, такого как карбонат натрия, и полярного апротонного растворителя, такого как DMSO.
[00133] В другом аспекте этого варианта воплощения стадию (b) осуществляют с использованием газообразного водорода и катализатора на основе переходного металла в спиртовом растворителе. Например, катализатор включает катализатор на основе переходного металла группы 9 или группы 10, образованный из Pt, Pd или Ni. Более конкретно, катализатор включает Pd. Спиртовой растворитель включает спирт, такой как изопропанол, этанол, метанол или подобные. Например, растворитель включает этанол.
[00134] В другом варианте воплощения изобретение включает способ получения соединения 8,

или фармацевтически приемлемой соли, включающий контактирование транс-4-аминоциклогексанола с Boc ангидридом с получением соединения формулы A

контактирование соединения формулы A с метансульфоновой кислотой с получением соединения формулы B

контактирование соединения формулы B с трифторуксусной кислотой с получением соединения формулы C

и
контактирование соединения формулы C с гидроксидом с получением соединения формулы 8.
[00135] В другом варианте воплощения изобретение включает способ получения соединения формулы 8-HCl,

включающий контактирование соединения формулы 8 с хлористоводородной кислотой.
[00136] В одном варианте воплощения изобретение обеспечивает способ получения соединения 3, включающий следующие стадии:
a) взаимодействие соединения 7 с соединением 8-HCl в ацетонитриле в присутствии триэтиламина при около 80°C в течение около 16 часов с получением соединения 9; и
b) гидрирование соединения 9 в этаноле, с использованием Pd/C в качестве катализаторов в присутствии газообразного водорода

[00137] В одном варианте воплощения изобретение обеспечивает способ получения соединения 3, включающий следующие стадии:
a) взаимодействие соединения 7 с соединением 8-HCl в DMSO в присутствии карбоната натрия при около 55°C с получением соединения 9; и
b) гидрирование соединения 9 в этаноле с использованием Pd/C в качестве катализаторов в присутствии газообразного водорода

[00138] В одном варианте воплощения изобретение обеспечивает способ получения соединения 3, включающий следующие стадии:
a) взаимодействие соединения 7 с соединением 8-HCl в дихлорметане в присутствии гидроксида натрия и тетрабутиламмонийбромида с получением соединения 9; и
b) гидрирование соединения 9 в этаноле с использованием Pd/C в качестве катализаторов в присутствии газообразного водорода

[00139] В одном варианте воплощения изобретение обеспечивает способ получения соединения 3-HCl, включающий гидрирование гидрохлоридной соли соединения 9 в 2-MeTГФ в присутствии газообразного водорода с использованием Pd/C в качестве катализатора.

Другие аспекты настоящего изобретения
[00140] В одном аспекте изобретение представляет фармацевтическую композицию, включающую соединение 1 форму A, соединение 1 форму A-HCl, соединение 1 форму B, соединение 1 форму B-HCl или любое их сочетание и фармацевтически приемлемый адъювант или носитель.
[00141] В одном аспекте настоящее изобретение представляет способ лечения CFTR-опосредованного заболевания у человека, включающий введение человеку эффективного количества соединения 1 формы A, соединения 1 формы A-HCl, соединения 1 формы B, соединения 1 формы B-HCl или любого их сочетания.
[00142] В некоторых вариантах воплощения способ включает введение дополнительного терапевтического средства.
[00143] В некоторых вариантах воплощения настоящее изобретение обеспечивает способ лечения заболеваний, связанных с пониженной функцией CFTR из-за мутаций в гене, кодирующем CFTR, или факторов окружающей среды (например, курение). Эти заболевания включают кистозный фиброз, астму, вызванное курением COPD, хронический бронхит, риносинусит, запор, панкреатит, недостаточность функции поджелудочной железы, мужское бесплодие, вызванное врожденным двусторонним отсутствием семявыносящих протоков (CBAVD), неосложненную форму легочного заболевания, идиопатический панкреатит, аллергический бронхолегочный аспергиллез (ABPA), заболевание печени, наследственную эмфизему, наследственный гемохроматоз, коагуляционно-фибринолизные недостаточности, такие как дефицит белка С, наследственный ангионевротический отек типа 1, нарушения липидного процессинга, такие как семейная гиперхолестеринемия, хиломикронемия типа 1, абеталипопротеинемия, лизосомальные болезни накопления, такие как болезнь клеточных включений/болезнь Дери, мукополисахаридоз, Sandhof/Tay-Sachs, болезнь Криглера-Найяра типа II, полиэндокринопатию/гиперинсулемию, сахарный диабет, карликовость Ларона, миелопероксидазную недостаточность, первичный гипопаратиреоз, меланому, гликаноз CDG (врожденные заболевания гликозилирования) типа 1, врожденный тиреотоксикоз, несовершенный остеогенез, наследственную гипофибриногенемию, недостаточное активированное время свертывания крови(АСТ), несахарный диабет (НД), несахарный нейрофизарный диабет, нефрогенный несахарный диабет, мышечную атрофию Шарко-Мари-Тута, болезнь Перлизауса-Мерцбахера, нейродегенеративные заболевания, такие как болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз, прогрессирующий супрануклеарный паралич, атрофия Пика, некоторые полиглутаминовые неврологические расстройства, такие как болезнь Гентингтона, спинально-церебеллярную атаксию типа I, спинальную и бульбарную мышечную атрофию, dentatorubal pallidoluysian и миотоническую дистрофию, а также губчатые энцефалопатии, такие как наследственная болезнь Крейтцфельдта-Якоба (из-за дефекта процессинга прионного белка), болезнь Фабри, синдром Штросслера-Шейнкера, COPD, синдром сухих глаз или болезнь Шегрена, остеопороз, остеопению, заживление костей и рост костей (включая восстановление кости, регенерацию костной ткани, снижение резорбции костной ткани и увеличение костных отложений), синдром Горема, хлоридные каналопатии, такие как врожденная миотония (формы Томсона и Бекера), синдром Барттера типа III, болезнь Дента, гиперэкплексию, эпилепсию, гиперэкплексию, лизосомную болезнь накопления, синдром Ангельмана и первичную цилиарную дискинезию (PCD), термин для наследственных нарушений структуры и/или функции реснитчатых структур, включающий PCD с транспозицией внутренних органов (также известный как синдром Картагенера), PCD без транспозиции внутренних органов и цилиарную аплазию.
[00144] В некоторых вариантах воплощения способ включает лечение или ослабление тяжести кистозного фиброза у пациента, включающий введение указанному пациенту одной из композиций, определенных в настоящей заявке. В некоторых вариантах воплощения у пациента имеются мутантные формы человеческого CFTR. В других вариантах воплощения у пациента имеется одна или несколько из следующих мутаций ΔF508, R117H и G551D человеческого CFTR. В одном варианте воплощения способ включает лечение или ослабление тяжести кистозного фиброза у пациента, имеющего ΔF508 мутацию человеческого CFTR, включающий введение указанному пациенту одной из композиций, определенных в настоящей заявке. В одном варианте воплощения способ включает лечение или ослабление тяжести кистозного фиброза у пациента, имеющего G551D мутацию человеческого CFTR, включающий введение указанному пациенту одной из композиций, определенных в настоящей заявке. В одном варианте воплощения способ включает лечение или ослабление тяжести кистозного фиброза у пациента, имеющего ΔF508 мутацию человеческого CFTR на по меньшей мере одном аллеле, включающий введение указанному пациенту одной из композиций, определенных в настоящей заявке. В одном варианте воплощения способ включает лечение или ослабление тяжести кистозного фиброза у пациента, имеющего ΔF508 мутацию человеческого CFTR на обоих аллелях, включающий введение указанному пациенту одной из композиций, определенных в настоящей заявке. В одном варианте воплощения способ включает лечение или ослабление тяжести кистозного фиброза у пациента, имеющего G551D мутацию человеческого CFTR на по меньшей мере одном аллеле, включающий введение указанному пациенту одной из композиций, определенных в настоящей заявке. В одном варианте воплощения способ включает лечение или ослабление тяжести кистозного фиброза у пациента, имеющего G551D мутацию человеческого CFTR на обоих аллелях, включающий введение указанному пациенту одной из композиций, определенных в настоящей заявке.
[00145] В некоторых вариантах воплощения способ включает ослабление тяжести кистозного фиброза у пациента, включающий введение указанному пациенту одной из композиций, определенных в настоящей заявке. В некоторых вариантах воплощения у пациента имеются мутантные формы человеческого CFTR. В других вариантах воплощения у пациента имеется одна или несколько из следующих мутаций ΔF508, R117H и G551D человеческого CFTR. В одном варианте воплощения способ включает ослабление тяжести кистозного фиброза у пациента, имеющего ΔF508 мутацию человеческого CFTR, включающий введение указанному пациенту одной из композиций, определенных в настоящей заявке. В одном варианте воплощения способ включает ослабление тяжести кистозного фиброза у пациента, имеющего G551D мутацию человеческого CFTR, включающий введение указанному пациенту одной из композиций, определенных в настоящей заявке. В одном варианте воплощения способ включает ослабление тяжести кистозного фиброза у пациента, имеющего ΔF508 мутацию человеческого CFTR на по меньшей мере одном аллеле, включающий введение указанному пациенту одной из композиций, определенных в настоящей заявке. В одном варианте воплощения способ включает ослабление тяжести кистозного фиброза у пациента, имеющего ΔF508 мутацию человеческого CFTR на обоих аллелях, включающий введение указанному пациенту одной из композиций, определенных в настоящей заявке. В одном варианте воплощения способ включает ослабление тяжести кистозного фиброза у пациента, имеющего G551D мутацию человеческого CFTR на по меньшей мере одном аллеле, включающий введение указанному пациенту одной из композиций, определенных в настоящей заявке. В одном варианте воплощения способ включает ослабление тяжести кистозного фиброза у пациента, имеющего G551D мутацию человеческого CFTR на обоих аллелях, включающий введение указанному пациенту одной из композиций, определенных в настоящей заявке.
[00146] В некоторых аспектах изобретение обеспечивает способ лечения или ослабления тяжести остеопороза у пациента, включающий введение указанному пациенту соединения 1, описанного в настоящей заявке.
[00147] В некоторых вариантах воплощения способ лечения или ослабления тяжести остеопороза у пациента включает введение указанному пациенту фармацевтической композиции, описанной в настоящей заявке.
[00148] В некоторых аспектах изобретение обеспечивает способ лечения или ослабления тяжести остеопении у пациента, включающий введение указанному пациенту соединения 1, описанного в настоящей заявке.
[00149] В некоторых вариантах воплощения способ лечения или ослабления тяжести остеопении у пациента включает введение указанному пациенту фармацевтической композиции, описанной в настоящей заявке.
[00150] В некоторых аспектах изобретение обеспечивает способ заживления кости и/или восстановления кости у пациента, включающий введение указанному пациенту соединения 1, описанного в настоящей заявке.
[00151] В некоторых вариантах воплощения способ заживления кости и/или восстановления кости у пациента включает введение указанному пациенту фармацевтической композиции, описанной в настоящей заявке.
[00152] В некоторых аспектах изобретение обеспечивает способ снижения резорбции костной ткани у пациента, включающий введение указанному пациенту соединения 1, описанного в настоящей заявке.
[00153] В некоторых аспектах изобретение обеспечивает способ снижения резорбции костной ткани у пациента, включающий введение указанному пациенту фармацевтической композиции, описанной в настоящей заявке.
[00154] В некоторых аспектах изобретение обеспечивает способ увеличения костных отложений у пациента, включающий введение указанному пациенту соединения 1, описанного в настоящей заявке.
[00155] В некоторых вариантах воплощения способ увеличения костных отложений у пациента включает введение указанному пациенту фармацевтической композиции, описанной в настоящей заявке.
[00156] В некоторых аспектах изобретение обеспечивает способ лечения или ослабления тяжести COPD у пациента, включающий введение указанному пациенту соединения 1, описанного в настоящей заявке.
[00157] В некоторых вариантах воплощения способ лечения или ослабления тяжести COPD у пациента включает введение указанному пациенту фармацевтической композиции, описанной в настоящей заявке.
[00158] В некоторых аспектах изобретение обеспечивает способ лечения или ослабления тяжести вызванного курением COPD у пациента, включающий введение указанному пациенту соединения 1, описанного в настоящей заявке.
[00159] В некоторых вариантах воплощения способ лечения или ослабления тяжести вызванного курением COPD у пациента включает введение указанному пациенту фармацевтической композиции, описанной в настоящей заявке.
[00160] В некоторых аспектах изобретение обеспечивает способ лечения или ослабления тяжести хронического бронхита у пациента, включающий введение указанному пациенту соединения 1, описанного в настоящей заявке.
[00161] В некоторых вариантах воплощения способ лечения или ослабления тяжести хронического бронхита у пациента включает введение указанному пациенту фармацевтической композиции, описанной в настоящей заявке.
[00162] В одном варианте воплощения настоящее изобретение обеспечивает способ лечения кистозного фиброза у человека, включающий введение указанному человеку эффективного количества соединения 1 формы A, формы A-HCl, формы B, формы B-HCl или любого их сочетания.
[00163] В одном аспекте настоящее изобретение представляет фармацевтическую упаковку или набор, включающие соединение 1 форму A, форму A-HCl, форму B, форму B-HCl или любое сочетание этих форм и фармацевтически приемлемый носитель.
[00164] В одном аспекте изобретение представляет кристаллическую форму N-(4-(7-азабицикло[2.2.1]гептан-7-ил)-2-(трифторметил)фенил)-4-оксо-5-(трифторметил)-1,4-дигидрохинолин-3-карбоксамида, имеющую тригональную кристаллическую систему, R-3 пространственную группу и следующие размеры элементарной ячейки: a=19,1670(4) Ǻ, b=19,1670(4) Ǻ, c=33,6572(12) Ǻ, α=90°, β=90° и γ=120°.
[00165] В одном варианте воплощения настоящее изобретение обеспечивает кристалл N-(4-(7-азабицикло[2.2.1]гептан-7-ил)-2-(трифторметил)фенил)-4-оксо-5-(трифторметил)-1,4-дигидрохинолин-3-карбоксамида в форме B, имеющий моносимметричную кристаллическую систему, P21/c пространственную группу и следующие размеры элементарной ячейки: a=13,5429(4) Ǻ, b=13,4557(4) Ǻ, c=12,0592(4) Ǻ, a=90°, β=101,193° и γ=90°.
Применения, формулирование и введение
[00166] В одном аспекте настоящего изобретения обеспечиваются фармацевтически приемлемые композиции, которые включают форму A, описанную в настоящей заявке, и, необязательно, включают фармацевтически приемлемый носитель, адъювант или наполнитель. В некоторых вариантах воплощения эти композиции, необязательно, дополнительно включают одно или несколько дополнительных терапевтических средств.
[00167] Как описано выше, фармацевтически приемлемые композиции по настоящему изобретению дополнительно включают фармацевтически приемлемый носитель, адъювант или наполнитель, который, как это используется в настоящей заявке, включает любой и все растворители, разбавители или другие жидкие носители, вещества, способствующие диспергированию или суспендированию, поверхностно-активные вещества, изотонические агенты, загустители или эмульгаторы, консерванты, твердые связующие, смазывающие вещества и подобные, как это является подходящим для конкретной лекарственной формы, которая является желательной. Remington's Pharmaceutical Sciences, Sixteenth Edition, E. W. Martin (Mack Publishing Co., Easton, Pa., 1980) раскрывает различные носители, используемые для формулирования фармацевтически приемлемых композиций, и известные способы их получения. За исключением только тех случаев, когда какая-либо традиционная среда, используемая в качестве носителя, несовместима с соединениями по настоящему изобретению, например вызывает какой-либо нежелательный биологический эффект или иначе взаимодействует неблагоприятным образом с любым другим компонентом(ами) фармацевтически приемлемой композиции, ее использование предусматривается как охватываемое объемом настоящего изобретения. Некоторые примеры веществ, которые могут служить в качестве фармацевтически приемлемых носителей, включают, но не ограничиваются этим, ионообменники, оксид алюминия, стеарат алюминия, лецитин, белки сыворотки, такие как человеческий сывороточный альбумин, буферные вещества, такие как фосфаты, глицин, сорбиновая кислота или сорбат калия, смеси неполных глицеридов насыщенных растительных жирных кислот, воду, соли или электролиты, такие как протаминсульфат, вторичный кислый фосфат натрия, гидрофосфат калия, хлорид натрия, соли цинка, коллоидный диоксид кремния, трисиликат магния, поливинилпирролидон, полиакрилаты, воски, полиэтилен-полиоксипропиленовые блок-полимеры, ланолин, сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу и ее производные, такие как натрий-карбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; порошкообразный трагакант; солод; желатин; тальк; эксципиенты, такие как масло какао и воски для суппозиториев; масла, такие как арахисовое масло, масло семян хлопчатника; саффлоровое масло; кунжутное масло; оливковое масло; кукурузное масло и соевое масло; гликоли; такие пропиленгликоль или полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; буферные вещества, такие как гидроксид магния и гидроксид алюминия; альгиновую кислоту; апирогенную воду; изотонический солевой раствор; раствор Рингера; этиловый спирт и фосфатно-буферные растворы, а также другие нетоксичные совместимые смазывающие вещества, такие как лаурилсульфат натрия и стеарат магния, а также красители, вещества, способствующие высвобождению из формы, вещества покрытий, подсластители, отдушки и ароматизаторы, консерванты и антиоксиданты также могут присутствовать в композиции, в соответствии с тем, как это сочтет нужным специалист, занимающийся формулированием композиции.
[00168]Применения соединений и фармацевтически приемлемых композиций
[00169] Еще в одном аспекте настоящее изобретение обеспечивает способ лечения или ослабления тяжести состояния, заболевания или расстройства, связанного с CFTR мутацией. В некоторых вариантах воплощения настоящее изобретение обеспечивает способ лечения состояния, заболевания или расстройства, связанного с дефицитом CFTR активности, включающий введение композиции, включающей соединение 1 форму A, форму A-HCl, форму B, форму B-HCl или любое сочетание этих форм, субъекту, предпочтительно млекопитающему, нуждающемуся в этом.
[00170] В некоторых вариантах воплощения настоящее изобретение обеспечивает способ лечения заболеваний, связанных с пониженной функцией CFTR из-за мутаций в гене, кодирующем CFTR или факторов окружающей среды (например, курения). Эти заболевания включают кистозный фиброз, хронический бронхит, возвратный бронхит, острый бронхит, мужское бесплодие, вызванное врожденным двусторонним отсутствием семявыносящих протоков (CBAVD), женское бесплодие, вызванное врожденным отсутствием матки и вагины (CAUV), идиопатический хронический панкреатит (ICP), идиопатический возвратный панкреатит, идиопатический острый панкреатит, хронический риносинусит, первичный склерозирующий холангит, аллергический бронхолегочный аспергиллез, диабет, синдром сухих глаз, запор, аллергический бронхолегочный аспергиллез (АВРА), заболевание костей (например, остеопороз) и астму.
[00171] В некоторых вариантах воплощения настоящее изобретение обеспечивает способ лечения заболеваний, связанных с нормальной функцией CFTR. Эти заболевания включают хроническое обструктивное легочное заболевание (COPD), хронический бронхит, возвратный бронхит, острый бронхит, риносинусит, запор, панкреатит, включая хронический панкреатит, возвратный панкреатит и острый панкреатит, недостаточность функции поджелудочной железы, мужское бесплодие, вызванное врожденным двусторонним отсутствием семявыносящих протоков (CBAVD), неосложненную форму легочного заболевания, идиопатический панкреатит, заболевание печени, наследственную эмфизему, камни в желчном пузыре, гастро-эзофагеальный рефлюкс, желудочно-кишечные злокачественные заболевания, воспалительное заболевание кишечника, запор, диабет, артрит, остеопороз и остеопению.
[00172] В некоторых вариантах воплощения настоящее изобретение обеспечивает способ лечения заболеваний, связанных с нормальной функцией CFTR, включающих наследственный гемохроматоз, коагуляционно-фибринолизные недостаточности, такие как дефицит белка С, наследственный ангионевротический отек типа 1, нарушения липидного процессинга, такие как семейная гиперхолестеринемия, хиломикронемия типа 1, абеталипопротеинемия, лизосомальные болезни накопления, такие как болезнь клеточных включений/болезнь Дери, мукополисахаридоз, Sandhof/Tay-Sachs, болезнь Криглера-Найяра типа II, полиэндокринопатию/гиперинсулемию, сахарный диабет, карликовость Ларона, миелопероксидазную недостаточность, первичный гипопаратиреоз, меланому, гликаноз CDG типа 1, врожденный тиреотоксикоз, несовершенный остеогенез, наследственную гипофибриногенемию, недостаточное активированное время свертывания крови(АСТ), несахарный диабет (НД), несахарный нейрофизарный диабет, нефрогенный несахарный диабет, мышечную атрофию Шарко-Мари-Тута, болезнь Перлизауса-Мерцбахера, нейродегенеративные заболевания, такие как болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз, прогрессирующий супрануклеарный паралич, атрофия Пика, некоторые полиглутаминовые неврологические расстройства, такие как болезнь Гентингтона, спинально-церебеллярную атаксию типа I, спинальную и бульбарную мышечную атрофию, dentatorubal pallidoluysian и миотоническую дистрофию, а также губчатые энцефалопатии, такие как наследственная болезнь Крейтцфельдта-Якоба (из-за дефекта процессинга прионного белка), болезнь Фабри, синдром Штросслера-Шейнкера, синдром Горема, хлоридные каналопатии, такие как врожденная миотония (формы Томсона и Бекера), синдром Барттера типа III, болезнь Дента, гиперэкплексию, эпилепсию, гиперэкплексию, лизосомную болезнь накопления, синдром Ангельмана и первичную цилиарную дискинезию (PCD), включая PCD с транспозицией внутренних органов (также известный как синдром Картагенера), PCD без транспозиции внутренних органов и цилиарную аплазию, или болезнь Шегрена, включающий стадию введения указанному млекопитающему эффективного количества композиции, включающей соединение 1 форму A, соединение 1 форму A-HCl, соединение 1 форму B, соединение 1 форму B-HCl или любое сочетание этих форм, описанных в настоящей заявке.
[00173] В соответствии с альтернативным предпочтительным вариантом воплощения настоящее изобретение обеспечивает способ лечения кистозного фиброза, включающий стадию введения указанному млекопитающему эффективного количества композиции, включающей соединение 1 форму A, соединение 1 форму A-HCl, соединение 1 форму B, соединение 1 форму B-HCl или любое сочетание этих форм, описанных в настоящей заявке.
[00174] В соответствии с настоящим изобретением "эффективное количество" соединения 1 формы A, соединения 1 формы A-HCl, соединения 1 формы B, соединения 1 формы B-HCl, любого сочетания этих форм или их фармацевтически приемлемой композиции представляет собой такое количество, которое является эффективным для лечения или ослабления тяжести одного или нескольких из заболеваний, расстройств или состояний, перечисленных выше.
[00175] Соединение 1 форму A, соединение 1 форму A-HCl, соединение 1 форму B, соединение 1 форму B-HCl или любое сочетание этих форм или их фармацевтически приемлемую композицию можно вводить с использованием любого количества и любого пути введения, эффективного для лечения или ослабления тяжести одного или нескольких из заболеваний, расстройств или состояний, перечисленных выше.
[00176] В некоторых вариантах воплощения соединение 1 форма A, соединение 1 форма A-HCl, соединение 1 форма B, соединение 1 форма B-HCl, любое сочетание этих форм или их фармацевтически приемлемая композиция являются полезными для лечения или ослабления тяжести кистозного фиброза у пациентов, которые демонстрируют остаточную CFTR активность в апикальной мембране ткани респираторного и нереспираторного эпителия. Присутствие остаточной CFTR активности на поверхности эпителия можно легко определить при помощи способов, известных из уровня техники, например стандартными электрофизиологическими, биохимическими или гистохимическими методами. Такими способами определяют CFTR активность с использованием in vivo или ex vivo электрофизиологических методов, измерения Cl- концентраций в выделениях потовых или слюнных желез или с использованием ex vivo биохимических или гистохимических методов для контроля плотности клеточной поверхности. С использованием таких способов можно легко определить остаточную CFTR активность у пациентов гетерозиготных или гомозиготных для различных мутаций, включая пациентов гомозиготных или гетерозиготных для наиболее распространенной мутации ΔF508.
[00177] В другом варианте воплощения соединение 1 форма A, соединение 1 форма A-HCl, соединение 1 форма B, соединение 1 форма B-HCl, любое сочетание этих форм или их фармацевтически приемлемая композиция являются полезными для лечения или ослабления тяжести кистозного фиброза у пациентов, которые имеют остаточную CFTR активность, индуцируемую или усиливаемую с использованием фармакологических способов или генной терапии. Такие способы повышают количество CFTR, присутствующего на клеточной поверхности, индуцируя таким образом отсутствующую до этого CFTR активность у пациента или повышая существующий уровень остаточной CFTR активности у пациента.
[00178] В одном варианте воплощения соединение 1 форма A, соединение 1 форма A-HCl, соединение 1 форма B, соединение 1 форма B-HCl, любое сочетание этих форм, описанных в настоящей заявке, или их фармацевтически приемлемая композиция являются полезными для лечения или ослабления тяжести кистозного фиброза у пациентов в рамках определенных генотипов, демонстрирующих остаточную CFTR активность, например, мутации класса III (нарушение регуляции или воротного механизма), мутации класса IV (изменение проводимости) или мутации класса V (уменьшение синтеза) (Lee R. Choo-Kang, Pamela L., Zeitlin, Type I, II, III, IV and V cystic fibrosis Transmembrane Conductance Regulator Defects and Opportunities of Therapy; Current Opinion in Pulmonary Medicine 6:521-529, 2000). Другие генотипы пациентов, которые демонстрируют остаточную CFTR активность, включают пациентов, гомозиготных для одного из этих классов или гетерозиготных с любым другим классом мутаций, включая мутации класса I, мутации класса II или мутации, которые не классифицированы.
[00179] В одном варианте воплощения соединение 1 форма A, соединение 1 форма A-HCl, соединение 1 форма B, соединение 1 форма B-HCl, любое сочетание этих форм или их фармацевтически приемлемая композиция являются полезными для лечения или ослабления тяжести кистозного фиброза у пациентов в пределах определенных клинических фенотипов, например от средней тяжести до легкой формы клинического фенотипа, который типично соотносится с количеством остаточной CFTR активности в апикальной мембране эпителиальных тканей. Такие фенотипы включают пациентов, демонстрирующих недостаточность функции поджелудочной железы, или пациентов, у которых диагностирован идиопатический панкреатит и врожденное двустороннее отсутствие семявыносящих протоков или легкая форма легочного заболевания.
[00180] Точное количество, которое необходимо, будет разным для разных субъектов в зависимости от конкретного вида, возраста и общего состояния субъекта, тяжести инфекции, конкретного средства, способа его введения и т.п. Соединения по настоящему изобретению предпочтительно формулируют в лекарственную форму, содержащую стандартные единицы дозирования, для простоты введения и равномерного дозирования. Выражение "стандартные единицы дозирования", используемое в настоящей заявке, относится к физически дискретной единице средства, подходящего для пациента, подлежащего лечению. Однако должно быть понятно, что общий суточный прием соединений и композиций по настоящему изобретению определяет лечащий врач в соответствии со взвешенной медицинской оценкой. Конкретный уровень эффективной дозы для любого конкретного пациента или организма будет зависеть от различных факторов, включая расстройство, подлежащее лечению, и тяжесть этого расстройства; активность конкретного используемого соединения; конкретную используемую композицию; возраст, массу тела, общее состояние здоровья, пол и режим питания пациента; время введения, пути введения и скорость выведения из организма конкретного используемого соединения; продолжительность лечения; лекарственные средства, используемые в сочетании или случайно с конкретным используемым соединением и подобные факторы, хорошо известные в медицине. Термин "пациент", как он используется в настоящей заявке, означает животное, предпочтительно - млекопитающее, и наиболее предпочтительно - человека.
[00181] Фармацевтически приемлемые композиции по настоящему изобретению можно вводить человеку и другим животным перорально, ректально, парентерально, интрацистернально, интравагинально, интраперитонеально, местным путем (например, в виде порошков, мазей, капель или пластыря), буккально, в виде перорального или назального спрея или т.п. в зависимости от тяжести инфекции, подлежащей лечению. В некоторых вариантах воплощения соединения по настоящему изобретению можно вводить перорально или парентерально при дозах на уровне от около 0,01 мг/кг до около 50 мг/кг и предпочтительно от около 0,5 мг/кг до около 25 мг/кг массы тела субъекта в день, один или несколько раз в день для получения желаемого терапевтического эффекта.
[00182] Жидкие лекарственные формы для перорального введения включают, но не ограничиваются этим, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Помимо активного соединения жидкие лекарственные формы могут содержать инертные разбавители, традиционно используемые в данной области, такие как, например, вода или другие растворители, солюбилизирующие вещества и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, масло семян хлопчатника, арахисовое масло, кукурузное масло, масло из проростков семян, оливковое масло, касторовое масло и кунжутное масло), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот сорбитана и их смеси. Помимо инертных разбавителей пероральные композиции также могут включать адъюванты, такие как смачивающие вещества, эмульгаторы и суспендирующие вещества, подсластители, отдушки и ароматизаторы.
[00183] Препараты для инъекций, например стерильные водные растворы или масляные суспензии для инъекций, можно сформулировать в соответствии с известными из уровня техники способами с использованием подходящих диспергирующих или смачивающих веществ и суспендирующих веществ. Стерильный препарат для инъекций также может представлять собой стерильный раствор, суспензию или эмульсию для инъекций в нетоксичном парентерально приемлемом разбавителе или растворителе, например в виде раствора в 1,3-бутандиоле. Из приемлемых наполнителей и растворителей, которые можно использовать, можно указать воду, раствор Рингера U.S.P. и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла традиционно используют в качестве растворителя или среды для суспендирования. Для этих целей можно использовать любое светлое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, в препаратах для инъекций используют жирные кислоты, такие как олеиновая кислота.
[00184] Композиции для инъекций можно стерилизовать, например, путем фильтрования через удерживающий бактерии фильтр или путем включения стерилизующих веществ в форме стерильных твердых композиций, которые можно растворить или диспергировать в стерильной воде или другой стерильной среде для инъекций перед использованием.
[00185] Для пролонгирования эффекта соединения по настоящему изобретению часто желательно замедлить абсорбцию соединения из подкожной или интрамышечной инъекции. Это можно осуществить с использованием жидкой суспензии кристаллического или аморфного вещества с плохой водорастворимостью. Скорость абсорбции соединения в этом случае зависит от скорости его растворения, которая, в свою очередь, может зависеть от размера кристалла и кристаллической формы. Альтернативно, замедленную абсорбцию парентерально вводимой формы соединения получают путем растворения или суспендирования соединения в масляном наполнителе. Депо формы для инъекций получают путем образования матриц для микроинкапсулирования соединения в биоразлагаемых полимерах, таких как полилактид-полигликолид. В зависимости от соотношения соединения с полимером и природы конкретного используемого полимера можно контролировать скорость высвобождения соединения. Примеры других биоразлагаемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Композиции депо препаратов для инъекций также получают путем заключения соединения в липосомы или микроэмульсии, которые совместимы с тканями организма.
[00186] Композиции для ректального или вагинального введения предпочтительно представляют собой суппозитории, которые можно получить путем смешивания соединения по настоящему изобретению с подходящими нераздражающими эксципиентами или носителями, такими как масло какао, полиэтиленгликоль или воск для суппозиториев, которые являются твердыми при температуре окружающей среды, но являются жидкими при температуре тела и поэтому плавятся в прямой кишке или вагинальной полости и высвобождают активное соединение.
[00187] Твердые лекарственные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых лекарственных формах активное соединение смешано с по меньшей мере одним инертным, фармацевтически приемлемым эксципиентом или носителем, таким как цитрат натрия или вторичный кислый фосфат кальция и/или a) наполнителями или объемными веществами, такими как крахмалы, лактоза, сахароза, глюкоза, маннит и кремневая кислота, b) связующими, такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидинон, сахароза и аравийская камедь, c) увлажнителями, такими как глицерин, d) разрыхлителями, такими как агар-агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновая кислота, некоторые силикаты и карбонат натрия, e) замедляющими растворение веществами, такими как парафин, f) ускорителями абсорбции, такими как четвертичные аммониевые соединения, g) смачивающими веществами, такими как, например, цетиловый спирт и глицеринмоностеарат, h) абсорбентами, такими как каолиновая и бентонитовая глина, и i) смазывающими веществами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия, и смесями таких веществ. В случае капсул, таблеток и пилюль лекарственная форма также может включать буферные вещества.
[00188] Твердые композиции подобного типа также можно использовать в качестве наполнителей в мягких и твердых желатиновых капсулах с использованием таких эксципиентов, как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и подобные. Твердые лекарственные формы в виде таблеток, драже, капсул, пилюль и гранул могут быть получены с покрытиями и оболочками, такими как энтеросолюбильные покрытия и другие покрытия, хорошо известные в области фармацевтического формулирования. Они необязательно содержат светонепроницаемые агенты и также могут иметь такую композицию, которая делает возможным высвобождение активного ингредиента(ов), только или, предпочтительно, в определенной части пищеварительного тракта, необязательно замедленным образом. Примеры композиций инкапсулирующих веществ, которые можно использовать, включают полимерные вещества и воски. Твердые композиции подобного типа также можно использовать в качестве наполнителей, заключенных в мягкие и твердые желатиновые капсулы, с использованием таких эксципиентов, как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и подобные.
[00189] Активные соединения также могут быть в микроинкапсулированной форме с одним или несколькими эксципиентами, как указано выше. Твердые лекарственные формы, такие как таблетки, драже, капсулы, пилюли и гранулы, могут быть получены с покрытиями и оболочками, такими как энтеросолюбильные покрытия, контролирующие высвобождение покрытия и другие покрытия, хорошо известные в области фармацевтического формулирования. В таких твердых лекарственных формах активное соединение может быть смешано с по меньшей мере одним инертным разбавителем, таким как сахароза, лактоза или крахмал. Такие лекарственные формы также могут включать, как это имеет место в обычной практике, дополнительные вещества, отличные от инертных разбавителей, например смазывающие вещества для таблетирования и другие вспомогательные вещества для таблетирования, такие как стеарат магния и микрокристаллическая целлюлоза. В случае капсул, таблеток и пилюль такие лекарственные формы также могут включать буферные вещества. Они необязательно содержат светонепроницаемые агенты и также могут иметь такую композицию, которая делает возможным высвобождение активного ингредиента(ов), только или, предпочтительно, в определенной части пищеварительного тракта, необязательно замедленным образом. Примеры композиций инкапсулирующих веществ, которые можно использовать, включают полимерные вещества и воски.
[00190] Лекарственные формы для введения местным или чрескожным путем соединения по настоящему изобретению включают мази, пасты, кремы, лосьоны, гели, порошки, растворы, спреи, препараты для ингаляций или пластыри. Активный компонент смешивают в стерильных условиях с фармацевтически приемлемым носителем и любыми необходимыми консервантами или буферами, которые могут для этого потребоваться. Глазные препараты, ушные капли и глазные капли также предусматриваются как охватываемые объемом настоящего изобретения. Кроме того, настоящее изобретение предусматривает использование чрескожных пластырей, которые имеют дополнительное преимущество, обеспечивая контролируемую доставку соединения в организм. Такие лекарственные формы получают путем растворения или диспергирования соединения в подходящей среде. Также можно использовать усилители абсорбции, используемые для усиления проникновения соединения через кожу. Скорость можно контролировать либо путем обеспечения контролирующей скорость мембраны, либо путем диспергирования соединения в полимерной матрице или геле.
[00191] Также должно быть понятно, что форму A, форму A-HCl, форму B, форму B-HCl или любое их сочетание, описанное в настоящей заявке, или их фармацевтически приемлемую композицию можно использовать в комбинированной терапии, то есть форму A, форму A-HCl, форму B, форму B-HCl или любое их сочетание, описанное в настоящей заявке, или их фармацевтически приемлемую композицию можно вводить одновременно с введением, до или после введения одного или нескольких других желательных терапевтических средств или медицинских процедур. Конкретные комбинированные терапии (терапевтические средства или процедуры) для использования в комбинированной схеме лечения должны учитывать совместимость желаемых терапевтических средств и/или процедур и желаемого терапевтического эффекта, достижение которого необходимо. Также должно быть понятно, что используемые терапии могут достигать желаемого эффекта для одного и того же расстройства (например, соединение по настоящему изобретению можно вводить одновременно с другим средством, используемым для лечения этого же расстройства), или они могут быть предназначены для достижения разных эффектов (например, контроль любых побочных эффектов). Как это используется в настоящей заявке, дополнительные терапевтические средства, которые обычно вводят для лечения или предупреждения определенного заболевания или состояния, известны как "подходящие для заболевания или состояния, подлежащего лечению".
[00192] В одном варианте воплощения дополнительное средство выбрано из муколитического средства, бронходилататора, антибиотика, противоинфекционного средства, противовоспалительного средства, модулятора CFTR, отличного от соединения по настоящему изобретению, или питательного вещества.
[00193] В одном варианте воплощения дополнительное средство представляет собой антибиотик. Примеры антибиотиков, полезных в настоящем изобретении, включают тобрамицин, включая тобрамицин в виде порошка для ингаляции (TIP), азитромицин, азтреонам, включая аэрозольную форму азтреонама, амикацин, включая его липосомальную композицию, ципрофлоксацин, включая его композицию, подходящую для введения путем ингаляции, левофлаксацин, включая его аэрозольную композицию, и сочетания двух антибиотиков, например фосфомицина и тобрамицина.
[00194] Еще в одном варианте воплощения дополнительное средство представляет собой муколитическое средство. Примеры муколитических средств, полезных в настоящем изобретении, включают Pulmozyme®.
[00195] Еще в одном варианте воплощения дополнительное средство представляет собой бронходилататор. Примеры бронходилататоров включают албутерол, метапротенерол сульфат, пирбутерол ацетат, салметерол или тетрабулин сульфат.
[00196] Еще в одном варианте воплощения дополнительное средство является эффективным для восстановления поверхностной жидкости в дыхательных путях в легких. Такие средства улучшают перемещение соли в клетки и из клеток, делая слизь в дыхательных путях в легких более гидратированной, поэтому они более легко выводятся. Примеры таких средств включают гипертонический солевой раствор, денуфозол тетранатрий ([[(3S,5R)-5-(4-амино-2-оксопиримидин-1-ил)-3-гидроксиоксолан-2-ил]метоксигидроксифосфорил][[[(2R,3S,4R,5R)-5-(2,4-диоксопиримидин-1-ил)-3,4-дигидроксиоксолан-2-ил]метоксигидроксифосфорил]окси-гидроксифосфорил]гидрофосфат) или бронхитол (препарат для ингаляций на основе маннита).
[00197] Еще в одном варианте воплощения дополнительное средство представляет собой противовоспалительное средство, т.е. средство, которое может уменьшать воспаление в легких. Примеры таких средств, полезных в настоящем изобретении, включают ибупрофен, докозагексановую кислоту (DHA), силденафил, глутатион для ингаляций, пиоглитазон, гидроксихлорохин или симавастатин.
[00198] В другом варианте воплощения дополнительное средство снижает активность блокатора эпителиального натриевого канала (ENaC) либо непосредственно путем блокирования канала, либо опосредованно путем модуляции протеаз, которые приводят к повышению ENaC активности (например, серинпротеаз, канал-активирующих протеаз). Примеры таких средств включают камостат (трипсин-подобный ингибитор протеазы), QAU145, 552-02, GS-9411, INO-4995, Aerolytic и амилорид. Дополнительные средства, которые снижают активность блокатора эпителиального натриевого канала (ENaC), можно найти, например, в публикации PCT № WO2009/074575, полное содержание которой включено в настоящую заявку во всей полноте.
[00199] Среди других заболеваний, описанных в настоящей заявке, сочетания CFTR модуляторов, таких как описанные в настоящей заявке, и средств, которые снижают активность ENaC, используют для лечения синдрома Лиддла, воспалительного или аллергического состояния, включающего кистозный фиброз, первичную цилиарную дискинезию, хронический бронхит, хроническое обструктивное легочное заболевание, астму, инфекции дыхательных путей, карциному легкого, ксеростомию и кератоконъюнктивит, инфекции дыхательных путей (острые и хронические; вирусные и бактериальные) и карциному легкого.
[00200] Сочетания CFTR модуляторов, таких как описанные в настоящей заявке, и средств, которые снижают активность ENaC, также являются полезными для лечения заболеваний, опосредованных блокадой эпителиальных натриевых каналов, также включающих заболевания, отличные от респираторных заболеваний, которые ассоциируются с анормальным регулированием жидкости через эпителий, возможно, включающие аномальную физиологию защитных поверхностных жидкостей на их поверхности, например ксеростомию (сухость во рту) или кератоконъюнктивит (синдром сухих глаз). Кроме того, блокаду эпителиальных натриевых каналов в почке можно использовать для поддержания диуреза, индуцируя, таким образом, гипотензивный эффект.
[00201] Астма включает как наследственную бронхиальную (неаллергическую) астму, так и приобретенную бронхиальную (аллергическую) астму, слабую форму астмы, умеренную форму астмы, тяжелую форму астмы, бронхитную астму, индуцированную физическими нагрузками астму, профессиональную астму и астму, индуцированную бактериальной инфекцией. Лечение астмы также следует понимать как охватывающее лечение субъектов, например, возраста меньше чем 4 или 5 лет, у которых имеются симптомы одышки и которым поставлен диагноз или можно поставить диагноз "страдающий одышкой ребенок", которые представляют установленную категорию пациентов, которая прежде всего вызывает озабоченность у медиков и которую в настоящее время часто идентифицируют как “ранние астматики” или “астматики ранней фазы”. (Для удобства это конкретное астматическое состояние называют "синдромом одышки у детей".) Доказательством профилактической эффективности в лечении астмы является снижение частоты или тяжести симптоматических приступов, например острого приступа астмы или бронхоконстрикции, улучшение функции легких или улучшенная гиперреактивность дыхательных путей. Дополнительным доказательством может быть снижение необходимости в другом симптоматическом лечении, т.е. лечения, направленного на или предназначенного для ограничение или прекращение симптоматического приступа, когда он возникает, например противовоспалительного (например, кортикостероиды) или бронхорасширяющего. Профилактическая польза при астме может, в частности, быть очевидной у субъектов, склонных к "утренним приступам". "Утренний приступ" представляет собой признанный астматический синдром, типичный для существенного процента астматиков, и характеризуется приступом астмы, например, в промежутке времени примерно 4-6 часов утра, т.е. обычно проходит существенное время после симптоматического лечения астмы.
[00202] Хроническое обструктивное легочное заболевание включает хронический бронхит или связанную с ним одышку, эмфизему, а также обострение гиперреактивности дыхательных путей вследствие другой лекарственной терапии, в частности другой лекарственной терапии, вводимой путем ингаляции. В некоторых вариантах воплощения сочетания CFTR модуляторов, таких как описанные в настоящей заявке, и средств, которые снижают активность ENaC, являются полезными для лечения бронхита любого типа или происхождения, включая, например, острый, arachidic катарального, крупозного, хронического или гнойного туберкулезного бронхита.
[00203] В другом варианте воплощения дополнительное средство представляет собой модулятор CFTR, отличный от формы A, формы B, формы B-HCl и формы A-HCl, т.е. средство, которое обладает эффектом модуляции CFTR активности. Примеры таких средств включают аталурен ("PTC 124®"; 3-[5-(2-фторфенил)-1,2,4-оксадиазол-3-ил]бензойная кислота), синапултит, ланковутид, депелестат (человеческий рекомбинантный ингибитор эластазы нейтрофилов), кобипростон (7-{(2R,4aR,5R,7aR)-2-[(3S)-1,1-дифтор-3-метилпентил]-2-гидрокси-6-оксооктагидроциклопента[b]пиран-5-ил}гептановая кислота) или (3-(6-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-3-метилпиридин-2-ил)бензойную кислоту. Еще в одном варианте воплощения дополнительное средство представляет собой (3-(6-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-3-метилпиридин-2-ил)бензойную кислоту.
[00204] Еще в одном варианте воплощения дополнительное средство представляет собой питательное вещество. Примеры таких веществ включают панкрелипазу (заместитель панкреатических ферментов), включая Pancrease®, Pancreacarb®, Ultrase® или Creon®, Liprotomase® (прежнее название Trizytek®), Aquadeks®, или глутатион для ингаляций. В одном варианте воплощения дополнительное питательное вещество представляет собой панкрелипазу.
[00205] В одном варианте воплощения дополнительное средство представляет собой модулятор CFTR, отличный от соединения по настоящему изобретению.
[00206] Количество дополнительного терапевтического средства, присутствующего в композиции по настоящему изобретению, не должно превышать количество, являющееся нормально возможным для введения в композиции, включающей такое терапевтическое средство в качестве единственного активного вещества. Предпочтительно количество дополнительного терапевтического средства в композициях, раскрытых в настоящем изобретении, должно находиться в пределах от около 50% до 100% от количества, являющегося нормально возможным для введения в композиции, включающей такое терапевтическое средство в качестве единственного активного вещества.
[00207] Соединение 1 форма A, форма A-HCl, форма B, форма B-HCl или любое их сочетание, описанные в настоящей заявке, или их фармацевтически приемлемая композиция также могут быть включены в композиции для покрытия имплантируемых медицинских устройств, таких как протезы, искусственные клапаны, сосудистые трансплантаты, стенты и катетеры. Соответственно, настоящее изобретение еще в одном аспекте включает композицию для покрытия имплантируемого устройства, включающую соединение по настоящему изобретению, описанное в целом выше и в классах и подклассах, описанных в настоящей заявке, и носитель, подходящий для покрытия указанного имплантируемого устройства. Еще в одном аспекте настоящее изобретение включает имплантируемое устройство с покрытием, имеющим композицию, включающую соединение по настоящему изобретению, описанное в целом выше и в классах и подклассах, описанных в настоящей заявке, и носитель, подходящий для покрытия указанного имплантируемого устройства. Подходящие покрытия и общее описание получения имеющих покрытия имплантируемых устройств можно найти в патентах США № 6099562; 5886026 и 5304121. Покрытия типично представляют собой биосовместимые полимерные вещества, такие как полимерные гидрогели, полиметилдисилоксан, поликапролактон, полиэтиленгликоль, полимолочная кислота, этиленвинилацетат и их смеси. Покрытия, необязательно, могут быть дополнительно покрыты подходящим верхним слоем из фторсиликона, полисахаридов, полиэтиленгликоля, фосфолипидов или их сочетаний для придания композиции характеристик контролируемого высвобождения.
[00208] Другой аспект настоящего изобретения относится к модулированию активности CFTR в биологическом образце или у пациента (например, in vitro или in vivo), при этом способ включает введение пациенту или контактирование указанного биологического образца с соединением 20 в форме А, форме A-HCl, форме B, форме B-HCl или любого их сочетания, описанного в настоящей заявке, и их фармацевтически приемлемой композиции. Термин "биологический образец", используемый в настоящей заявке, включает, без ограничения, клеточные культуры или их экстракты; материал биопсии, полученный от млекопитающего, или его экстракты; и кровь, слюну, мочу, кал, семенную жидкость, слезы или другие жидкости организма или их экстракты.
[00209] Модуляция CFTR в биологическом образце является полезной для различных целей, которые известны специалистам в данной области. Примеры таких целей включают, но не ограничиваются этим, исследование CFTR в биологических и патологических явлениях и сравнительную оценку новых модуляторов CFTR.
[00210] В следующем варианте воплощения обеспечивается способ модулирования активности анионного канала in vitro или in vivo, включающий стадию контактирования указанного канала с соединением 20 в форме A, форме A-HCl, форме B, форме B-HCl или их сочетаниями, описанными в настоящей заявке, или их фармацевтически приемлемой композицией. В предпочтительных вариантах воплощения анионный канал представляет собой хлоридный канал или бикарбонатный канал. В других предпочтительных вариантах воплощения анионный канал представляет собой хлоридный канал.
[00211] В соответствии с альтернативным вариантом воплощения настоящее изобретение обеспечивает способ увеличения количества функционального CFTR в мембране клетки, включающий стадию контактирования указанной клетки с соединением 20 в форме A, форме A-HCl, форме B, форме B-HCl или их сочетаниями, описанными в настоящей заявке, или их фармацевтически приемлемой композицией.
[00212] В соответствии с другим предпочтительным вариантом воплощения активность CFTR определяют путем измерения трансмембранного потенциала. Средства для измерения потенциала через мембрану в биологическом образце могут включать любой из способов, известных из уровня техники, такой как оптический анализ мембранного потенциала или другие электрофизиологические методы.
[00213] Оптический анализ мембранного потенциала включает использование потенциал-чувствительных FRET сенсоров, описанных Gonzalez и Tsien (см. Gonzalez, J.E. and R.Y. Tsien (1995) "Voltage sensing by fluorescence resonance energy transfer in single cells." Biophys. J. 69(4): 1272-80; и Gonzalez, J.E. and R.Y. Tsien (1997); "Improved indicators of cell membrane potential that use fluorescence resonance energy transfer" Chem. Biol. 4(4): 269-77), в сочетании со средствами измерения изменений флуоресценции, такими как Voltage/Ion Probe Reader (VIPR) (см. Gonzalez, J.E., K. Oades, et al. (1999) "Cell-based assays and instrumentation for screening ion-channel targets" Drug Discov Today 4(9): 431-439).
[00214] Эти потенциал-чувствительные анализы основаны на изменении передачи резонансной энергии флуоресценции (FRET) между мембрано-растворимым потенциал-чувствительным красителем, DiSBAC2(3) и флуоресцентным фосфолипидом, CC2-DMPE, который присоединен к внешней створке плазменной мембраны и действует в качестве FRET донора. Изменения мембранного потенциала (Vm) вызывают редистрибуцию отрицательно заряженного DiSBAC2(3) через плазменную мембрану, и количество передаваемой энергии от CC2-DMPE соответственно изменяется. Изменения эмиссии флуоресценции можно отслеживать с использованием VIPR™ II, который представляет собой интегрированное устройство подачи жидкости и детектор флуоресценции, предназначенное для осуществления клеточных скрининговых анализов в 96- или 384-луночных микротитровальных планшетах.
[00215] В другом аспекте изобретение обеспечивает набор для использования в измерении активности CFTR или его фрагмента в биологическом образце in vitro или in vivo, включающий (i) композицию, включающую соединение 20 форму A, форму A-HCl, форму B, форму B-HCl или их сочетание или любой из описанных выше вариантов воплощения; и (ii) инструкции для a) контактирования композиции с биологическим образцом и b) измерения активности указанного CFTR или его фрагмента. В одном варианте воплощения набор также содержит инструкции для а) контактирования дополнительного соединения с биологическим образцом; b) измерения активности указанного CFTR или его фрагмента в присутствии указанного дополнительного соединения и с) сравнения активности CFTR в присутствии дополнительного соединения с плотностью CFTR в присутствии формы A, формы A-HCl, формы B, формы B-HCl или их сочетания, описанных в настоящей заявке. В предпочтительных вариантах воплощения набор используют для измерения плотности CFTR.
[00216] Для более полного раскрытия изобретения, описанного в настоящей заявке, далее представлены следующие примеры. Должно быть понятно, что эти примеры предназначены только для иллюстративных целей и не должны рассматриваться как ограничивающие каким-либо образом настоящее изобретение.
ПРИМЕРЫ
Методы и материалы
[00217]XRPD (Рентгеновская порошковая дифракция)
[00218] Инструмент 1
[00219] Данные рентгеновской порошковой дифракции (XRPD) регистрировали при комнатной температуре с использованием рентгеновского порошкового дифрактометра Rigaku/MSC MiniFlex Desktop (Rigaku, The Woodlands, TX). Рентгеновские лучи генерировали с использованием Cu трубки, работающей при 30 кВ и 15 мА с KB заграждающим фильтром. Щель расхождения луча менялась в зависимости от рассеяния, и принимающие щели устанавливали при 4,2 градуса и щели 0,3 мм соответственно. Режим сканирования включал фиксированное время (FT) с шириной шага 0,02 градуса и временем счета 2,0 секунды. Рентгеновский порошковый дифрактометр был откалиброван с использованием стандартного образца: 75% Содалита (Na3Al4Si4O12Cl) и 25% кремния (Rigaku, Cat# 2100/ALS). Стадию анализа шести образцов осуществляли с использованием нулевого фона для держателей образцов (SH-LBSI511-RNDB). Порошкообразный образец помещали на ячеистой поверхности и выравнивали предметным стеклом.
[00220] Инструмент 2
[00221] Альтернативно, измерения методом рентгеновской порошковой дифракции осуществляли с использованием дифрактометра PANalytical's X-pert Pro при комнатной температуре с облучением, генерируемым медным источником (1,54060 A). Оптическое устройство с падающим лучом включало щель с регулированием расхождением луча для обеспечения постоянной длины освещения на образце и на стороне дифрагированного луча. Использовали быстрый линейный твердотельный детектор с активной длиной 2,12 градуса 2 тета, измеренной в режиме сканирования. Порошкообразный образец был упакован на ячеистой поверхности кремниевого держателя образца с нулевым фоном и осуществляли центрифугирование для получения лучшей статистики. Симметричный скан измеряли от 4-40 градусов 2 тета с размером шага 0,017 градуса и временем шага сканирования 15,5 сек.
[00222] Инструмент 3
[00223] Альтернативно, данные высокого разрешения собирали при комнатной температуре на линии луча ID31 (European Synchrotron Radiation Facility in Grenoble, France) Рентгеновские лучи генерировали с использование трех 11-мм-gap ex-вакуумных ондуляторов. Монохроматический пучок получали при помощи криогенного охлажденного двухкристалльного монохроматора (Si(111) кристаллы). Охлаждаемые водой щели определяли размер падающего луча на монохроматоре монохроматического пучка, посылаемого на образец в диапазоне 0,5-2,5 мм (горизонтальный) на 0,1-1,5 мм (вертикальный). Длина волны, которую использовали для эксперимента, составляла 1,29984 (3) Ǻ. Дифрактометр включал блок из девяти детекторов для вертикального сканирования для измерения дифрагированной интенсивности как функции 2θ. Каждому детектору предшествовал Si(111) кристаллический анализатор, и каналы детектора были расположены приблизительно на расстоянии 2°. Этот дифракторметр может обеспечивать картины дифракции с очень точным высоким разрешением, с такой низкой шириной пиков как 0,003° и точностью положений пиков порядка 0,0001°. Данные порошковой дифракции обрабатывали и индексировали с использованием Materials Studio (Reflex модуль). Структуру определяли с использованием PowderSolve модуля Materials Studio. Полученный раствор анализировали на структурную жизнеспособность и затем очищали с использованием Rietveld процедуры очистки.
[00224] XPRD спектры, описанные в примерах для формы A и формы B, регистрировали с использованием инструмента 1 (фиг.10A) или инструмента 2 (фиг.10B) с параметрами, описанными выше. XPRD спектры, описанные в примерах для формы B-HCl и формы A-HCl, регистрировали с использованием инструмента 2 с параметрами, описанными выше. Размеры кристаллической системы, пространственной группы и элементарной ячейки для формы A-HCl и формы B-HCl определяли с использованием инструмента 3.
[00225]Дифференциальная сканирующая калориметрия (DSC)
[00226] Дифференциальную сканирующую калориметрию (DSC) осуществляли с использованием TA DSC Q2000 дифференциального сканирующего калориметра (TA Instruments, New Castle, DE). Инструмент был откалиброван с использованием индия. Образцы приблизительно 2-3 мг взвешивали в герметичных чашках, которые закрывали завинчивающимися крышками с одним отверстием. DSC образцы сканировали от 25°C до 315°C при скорости нагревания 10°C/мин. Данные собирали с использованием программы Thermal Advantage Q Series™ и анализировали с использованием программы Universal Analysis (TA Instruments, New Castle, DE).
[00227]Термогравиметрический анализ (TGA)
[00228] Данные термогравиметрического анализа (TGA) собирали на термогравиметрическом анализаторе TA Q500 (TA Instruments, New Castle, DE). Образец с массой приблизительно 3-5 мг сканировали от 25°C до 350°C при скорости нагревания 10°C/мин. Данные собирали с использованием программы Thermal Advantage Q Series™ и анализировали с использованием программы Universal Analysis (TA Instruments, New Castle, DE).
[00229]FTIR спектроскопия
[00230] FTIR спектры собирали с использованием Thermo Scientific, Nicolet 6700 FT-IR спектрометра, с адаптивным орбитальным отделением для отбора проб (multi-bounce Attenuated Total Reflection accessory), алмазным окном при 45 градусах. Программа, которую использовали для сбора и анализа данных, представляла собой: Omnic, 7,4. Использовали следующие установки для сбора данных:
детектор: DTGS KBr;
делитель пучка: Ge на KBr;
источник: EverGlo IR;
диапазон сканирования: 4000-400 см-1;
усиление: 8,0;
оптическая скорость: 0,6329 см/сек;
апертура: 100;
количество сканов: 32; и
разрешение: 4 см-1
[00231] Порошкообразный образец помещали непосредственно на алмазный кристалл и прилагали давление для приведения поверхности образца в соответствие с поверхностью алмазного кристалла. Регистрировали фоновый спектр и затем регистрировали спектр образца.
[00232]Спектроскопия твердофазного ядерного магнитного резонанса
[00233] Спектроскопию твердофазного ядерного магнитного резонанса (SSNMR) осуществляли на протонном спектрометре Bruker 400 МГц с широким отверстием. Время продольной релаксации (1Н T1) получали путем подгонки восстановленных данных протонного насыщения к экспоненциальной функции. Эти значения использовали для установки оптимальной задержки рецикла эксперимента углеродной поперечной поляризации с вращением под магическим углом (13C CPMAS), который типично устанавливали в пределах от 1,2×1Н T1до 1,5×1Н T1. Углеродные спектры получали при времени контакта 2 мсек с использованием линейного амплитудного изменения протонного канала (от 50% до 100%) и 100 кГц TPPM отщеплением. Типичная скорость вращения под магическим углом (MAS) составляла 15,0 кГц. Спектры фтора получали с использованием эксперимента прямой поляризации MAS с протонным отщеплением. Использовали 100 кГц TPPM отщепление. Задержку рецикла устанавливали на ≥5×l9F T1. Время продольной релаксации фтора (19F T1) получали путем подгонки определенных для фтора восстановленных данных насыщения протонного отщепления к экспоненциальной функции. Спектры углерода, а также фтора сопоставляли с внешним стандартом с использованием резонанса выше области твердофазного адамантана, который был установлен на 29,5 м.д. С использованием этой процедуры углеродные спектры опосредованно соотносили с тетраметилсиланом при 0 м.д. и спектры фтора опосредованно соотносили с нитрометаном при 0 м.д.
Примеры синтеза
[00234]Препаративный пример: 7-азабицикло[2.2.1]гептан гидрохлорид (8-HCl)
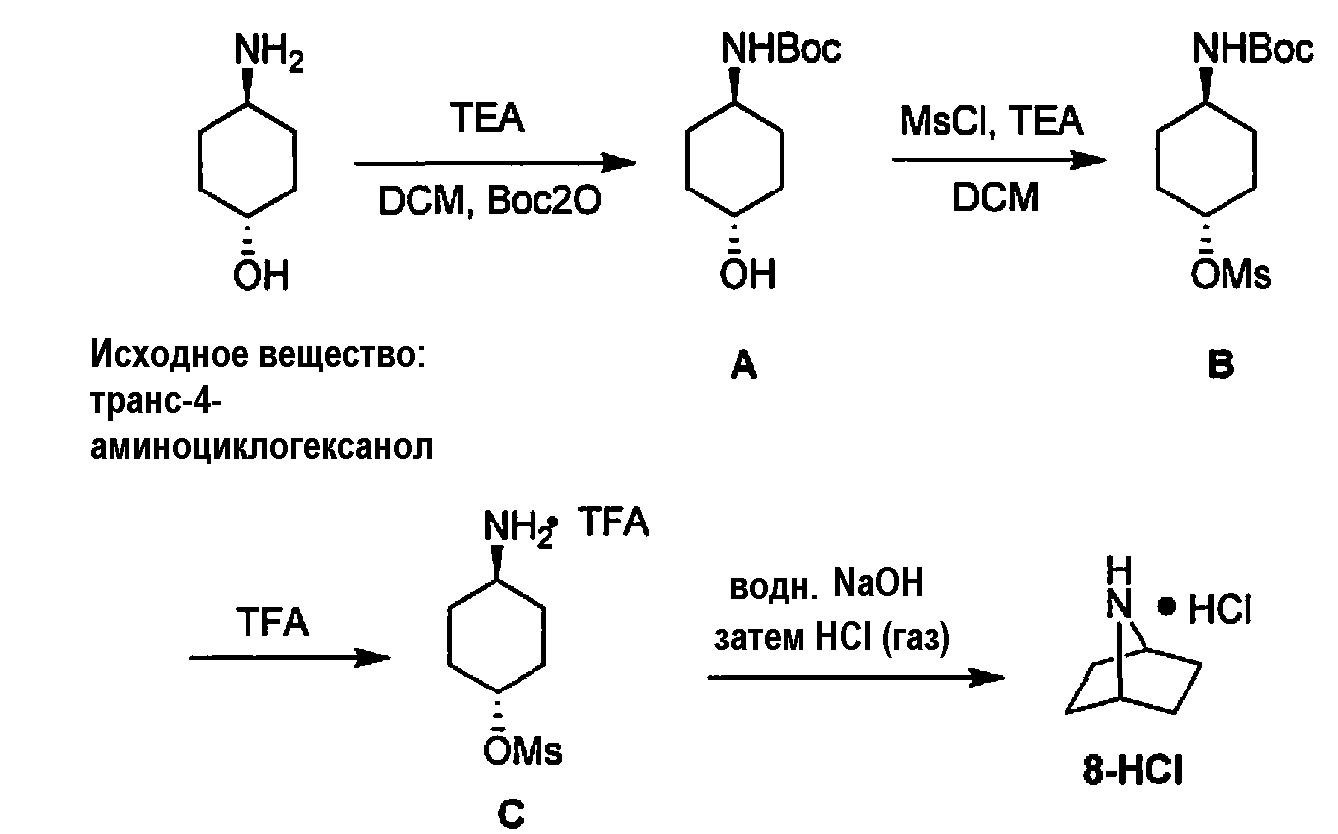
[00235] Получение транс-4-(трет-бутоксикарбониламино)циклогексанол (A), способ 1
Карбонат натрия (920,2 г, 8,682 моль, 2 экв.) добавляли в реакционный сосуд с последующим добавлением воды (3,000 л, 6 об.) и перемешиванием. Добавляли дихлорметан (DCM, 4,000 л, 4 об.) с последующим добавлением транс-4-аминоциклогексанола (500,0 г, 4,341 моль) с образованием бифазной реакционной смеси, которую интенсивно перемешивали при комнатной температуре. Затем в сосуд быстро добавляли по каплям раствор Boc2O (947,4 г, 997,3 мл, 4,341 моль, 1 экв.) в DCM (2 об.) и полученную реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь затем фильтровали и фильтровальную лепешку промывали водой (2×8 об.). Продукт подвергали вакуумной сушке до получения плотной лепешки. Лепешку затем сушили в вакуумной печи при 35°C в течение 24 часов с получением 830 г транс-4-(трет-бутоксикарбониламино)циклогексанола (A) в виде кристаллического твердого вещества.
[00236]Получение транс-4-(трет-бутоксикарбониламино)циклогексанола (A), способ 2
Две 50-л трехгорлые круглодонные колбы снабжали, каждую, механической мешалкой и термопарой. Колбы помещали в охлаждающую ванну и затем в каждую колбу загружали воду (8,87 л) и транс-4-аминоциклогексанол (1479 г). Примерно через 10-30 минут транс-4-аминоциклогексанол растворялся и в каждую колбу добавляли карбонат калия (1774,6 г). Примерно через 10-20 минут карбонат калия растворялся, и в каждую колбу добавляли DCM (2,96 л). Затем в каждую колбу добавляли Boc ангидрид (3082,6 г) в DCM (1479 мл) с такой скоростью, чтобы поддерживать температуру при 20-30°C. Баню лед/вода использовали для контроля экзотермы и для ускорения добавления, которое занимало приблизительно 1-2 часа. В процессе добавления происходило образование суспензии, и реакционным смесям давали нагреться до комнатной температуры и перемешивали в течение ночи вплоть до завершения реакции, как это определяли по исчезновению Boc ангидрида. Затем в каждую колбу добавляли гептан (6 л) и смеси охлаждали до приблизительно 0-5°C. Твердые вещества собирали из каждой колбы путем фильтрования с использованием одного и того же фильтра. Объединенные твердые вещества промывали гептаном (6 л) с последующей промывкой водой (8 л). Твердые вещества загружали в сосуд подходящего размера, снабженный механической мешалкой. Добавляли воду (12 л) и гептан (6 л) и полученную суспензию механически перемешивали в течение 30-60 минут. Твердые вещества собирали фильтрованием и затем промывали на фильтре водой (8 л) и гептаном (8 л), сушили на открытом воздухе на фильтре в течение трех дней и затем сушили в вакууме при 30-35°C до достижения постоянной массы с получением продукта в виде белого твердого вещества.
[00237] Получение транс-4-(трет-бутоксикарбониламино)циклогексилметансульфоната (B), способ 1
12-л колбу снабжали трубопроводом для потока азота и механической мешалкой. Добавляли транс-4-(трет-бутоксикарбониламино)циклогексанол (750 г, 3,484 моль) с последующим добавлением тетрагидрофурана (ТГФ, 6,000 л, 8 об.) и смесь перемешивали. Добавляли триэтиламин (370,2 г, 509,9 мл, 3,658 моль, 1,05 экв.) и смесь охлаждали до 0°C. Осторожно добавляли по каплям метансульфонилхлорид (419,0 г, 283,1 мл, 3,658 моль, 1,05 экв.), поддерживая температуру смеси ниже 5°C. После добавления смесь перемешивали при 0°C в течение 3 часов и затем постепенно нагревали до комнатной температуры (17°C) и перемешивали в течение ночи (около 15 часов). Смесь гасили водой (6 об.) и перемешивали в течение 15 минут. Добавляли этилацетат (EtOAc, 9,000 л, 12 об.) и перемешивание продолжали в течение 15 минут. Перемешивание останавливали и смеси давали выстояться в течение 10 минут и водную фазу удаляли. Добавляли 1н. раствор HCl (6 об., 4,5 л) и перемешивание продолжали в течение 15 минут. Перемешивание останавливали и водную фазу удаляли. Добавляли 10% масс./об. NaHCO3 (4,5 л, 6 об.) и смесь перемешивали в течение 10 минут. Перемешивание останавливали и водную фазу удаляли. Добавляли воду (6 об., 4,5 л) и смесь перемешивали в течение 10 минут. Водный слой удаляли и органический слой фильтровали через барьерный фильтр и концентрировали до 4 об. Добавляли гептан (5,5 об., 4 л) и смесь концентрировали снова досуха с получением 988 г транс-4-(трет-бутоксикарбониламино)циклогексилметансульфоната.
[00238] Получение транс-4-(трет-бутоксикарбониламино)циклогексилметансульфоната (B), способ 2
Трехгорлую круглодонную колбу снабжали механической мешалкой, капельной воронкой, входным отверстием для азота, термопарой и сушильной трубкой и помещали в охлаждающую ванну. В колбу добавляли транс-4-(трет-бутоксикарбониламино)циклогексанол (2599 г, 12,07 моль, 1,0 экв.), тетрагидрофуран (ТГФ) (20,8 л) и триэтиламин (1466 г, 14,49 моль, 1,2 экв.). Смесь охлаждали на бане с ледяной водой и перемешивали. Метансульфонилхлорид (1466 г, 12,80 моль, 1,06 экв.) добавляли по каплям через капельную воронку в течение 1 часа. После завершения добавления охлаждающую баню удаляли и реакционную смесь перемешивали до тех пор, пока ТСХ анализ не показал, что исходное вещество израсходовано (около 30 минут). Реакционную смесь затем гасили водным раствором хлористоводородной кислоты (223 мл HCl в 6,7 л воды) и EtOAc (10,4 л). Смесь перемешивали приблизительно в течение 10-20 минут при температуре окружающей среды и затем переносили в делительную воронку. Слои разделяли и водный слой отбрасывали. Органический слой промывали водой (2×4,5 л), насыщенным водным раствором бикарбоната натрия (1×4,5 л) и сушили над безводным сульфатом магния при перемешивании в течение 5-10 минут. Смесь фильтровали и фильтровальную лепешку промывали при помощи EtOAc (2×600 мл). Объединенные промывки и фильтрат концентрировали при пониженном давлении при 40°C с получением белого твердого вещества. Осуществляли поглощение этого твердого вещества в гептан (3 л) и охлаждали в охлаждающей бане лед/метанол. Добавляли дополнительное количество гептана (5 л) и смесь перемешивали при 0-5°C в течение не меньше чем 1 часа. Твердые вещества затем собирали фильтрованием, промывали охлажденным гептаном (0-5°C, 2×1,3 л) и сушили в вакууме при 40°C до достижения постоянной массы с получением указанного в заголовке соединения.
[00239] Примечание: Можно использовать реактор с кожухом вместо круглодонной колбы с охлаждающей ванной и ледяной баней.
[00240] Получение транс-4-аминоциклогексилметансульфоната (C), способ 1
Транс-4-(трет-бутоксикарбониламино)циклогексилметансульфонат (985 г, 3,357 моль) вводили в 3-горлую 12-л колбу, снабженную мешалкой в атмосфере азота и вентиляционным отверстием. Добавляли DCM (1,970 л, 2 об.) при комнатной температуре и начинали перемешивание. К смеси медленно добавляли трифторуксусную кислоту (TFA) (2,844 кг, 1,922 л, 24,94 моль, 2 об.) двумя партиями по 1 л каждая. После первого добавления смесь перемешивали в течение 30 минут, затем осуществляли второе добавление. Смесь перемешивали в течение ночи (15 часов) при комнатной температуре с получением прозрачного раствора. Затем к реакционной смеси добавляли 2-метилтетрагидрофуран (4 об.) и смесь перемешивали в течение 1 часа. Смесь затем осторожно фильтровали в вытяжном шкафу и сушили в вакууме с образованием 1100 г TFA соли транс-4-аминоциклогексилметансульфоната с избытком TFA.
[00241] Получение транс-4-аминоциклогексилметансульфоната (C), способ 2
50-л трехгорлую круглодонную колбу снабжали механической мешалкой, капельной воронкой и термопарой и помещали в охлаждающую ванну. В колбу добавляли транс-4-(трет-бутоксикарбониламино)циклогексилметансульфонат (3474 г, 1,0 экв.) и DCM (5,9 л). Полученную суспензию перемешивали в течение 5-10 минут при температуре окружающей среды и затем медленно добавляли трифторуксусную кислоту (TFA, 5,9 л) через капельную воронку в течение 2,5 часов для контроля образования экзотермы и скорости выделения газа. Реакционную смесь перемешивали при комнатной температуре в течение ночи и затем охлаждали до 15°C-20°C с использованием бани с ледяной водой. Затем добавляли 2-метилтетрагидрофуран (2-MeTГФ, 11,8 л) через капельную воронку при такой скорости, чтобы поддерживать внутреннюю температуру ниже 25°C (приблизительно 1,5 часов). Добавление первых 4-5 л 2-MeTГФ было экзотермическим. Полученную суспензию перемешивали в течение 1 часа. Твердые вещества собирали фильтрованием и затем промывали при помощи 2-MeTГФ (2×2,2 л) и затем сушили в вакууме при температуре окружающей среды до достижения постоянной массы с получением указанного в заголовке соединения в виде белого твердого вещества.
[00242] Получение 7-азабицикло[2.2.1]гептан гидрохлорида (8-HCl), способ 1
TFA соль транс-4-аминоциклогексилметансульфоната (200 г, 650,9 ммоль) вводили в 3-горлую колбу с последующим добавлением воды (2,200 л, 11 об.). Медленно добавляли NaOH (78,11 г, 1,953 моль, 3 экв.), поддерживая температуру реакционной смеси ниже 25°C и смесь перемешивали в течение ночи. Затем добавляли DCM (1,4 л, 7 об.) и смесь перемешивали и органический слой отделяли. Водный слой затем экстрагировали снова при помощи DCM (1,4 л, 7 об.) и DCM слои объединяли. Затем добавляли HCl (108,5 мл, 12M, 1,3020 моль, 2 экв.), смесь перемешивали в течение 30 минут и затем концентрировали досуха на роторном испарителе. Добавляли ацетонитрил (10 об.) и смесь концентрировали. Это повторяли 3 раза, до тех пор пока не удаляли все следовое количество воды путем азеотропной перегонки, с получением 7-азабицикло[2.2.1]гептан гидрохлорида. Неочищенный продукт перекристаллизовывали из ацетонитрила (10 об.) с получением 7-азабицикло[2.2.1]гептан гидрохлорида 8-HCl в виде бесцветного кристаллического твердого вещества.1Н ЯМР (ДМСО-d6) м.д. 8,02-8,04 (д); 7,23-7,31 (м); 4,59 (с); 3,31 (с); 2,51-3,3 (м); 1,63-1,75 (м); 1,45-1,62 (м).
[00243] В качестве примечания, вместо добавления DCM для экстракции также можно осуществить перегонку неочищенного продукта при около 95°C-97°C с последующей перекристаллизацией.
[00244] Получение 7-азабицикло[2.2.1]гептан гидрохлорида (8-HCl), способ 2
50-л трехгорлую круглодонную колбу снабжали механической мешалкой, капельной воронкой и термопарой и помещали в нагревательную рубашку. В колбу добавляли транс-4-аминоциклогексилметансульфонат трифторацетат в (3000 г, 1 экв.) и воду (30 л). Смесь перемешивали при добавлении 50% NaOH (2343 г, 29,29 моль, 3 экв.) через капельную воронку с такой скоростью, чтобы поддерживать температуру ниже 25°C, поскольку добавление было слегка экзотермическим. После завершения добавления NaOH реакционную смесь перемешивали в течение ночи при комнатной температуре. Продукт выделяли путем фракционной перегонки при температуре кипения с обратным холодильником (приблизительно 100°C) при температуре в верхней части резервуара 95°C-98°C. pH каждой фракции доводили до 2 путем добавления HCl и концентрировали при пониженном давлении при 55°C с получением густой пасты. Добавляли ацетонитрил (ACN 1,5 л) и полученную суспензию перемешивали в течение 30 минут и затем охлаждали до температуры 0°C-5°C в течение 1 часа. Твердые вещества собирали фильтрованием, промывали охлажденным (0-5°C) ACN (2×600 мл) и сушили в вакууме при 50°C до достижения постоянной массы.
[00245] 22-л трехгорлую круглодонную колбу снабжали механической мешалкой, термопарой и холодильником и помещали в нагревательную рубашку. Собранные твердые вещества (2382 г), метанол (4,7 л) и 2-MeTГФ (4,7 л) добавляли в колбу. Полученную суспензию перемешивали и нагревали до температуры кипения с обратным холодильником (приблизительно 65°C). Реакционную колбу переносили в охлаждающую ванну и смесь перемешивали. 2-MeTГФ (4,7 л) затем добавляли через капельную воронку в течение 30 минут. Полученную суспензию охлаждали до 0-5°C и перемешивали при этой температуре в течение 30 минут. Твердые вещества собирали фильтрованием, промывали охлажденным (0-5°C) 2-MeTГФ (2×600 мл) и затем сушили в вакууме при 55°C до достижения постоянной массы.
[00246] 12-л трехгорлую круглодонную колбу снабжали механической мешалкой, термопарой, входным отверстием для азота и холодильником и помещали в нагревательную рубашку. В колбу добавляли неочищенный продукт (2079 г) и ACN (6,2 л). Полученную суспензию перемешивали и нагревали до температуры кипения с обратным холодильником (приблизительно 82°C) в течение 30 минут. Колбу переносили в охлаждающую ванну и суспензию медленно охлаждали до 0-5°C и поддерживали при этой температуре в течение 1 часа. Твердые вещества собирали фильтрованием, промывали охлажденным (0-5°C) ACN (3×600 мл) и сушили в вакууме при 55°C до достижения постоянной массы с получением указанного в заголовке продукта.
[00247] Пример 1A: Получение 4-оксо-5-(трифторметил)-1,4-дигидрохинолин-3-карбоновой кислоты (2)

[00248]Получение диэтил 2-((2-хлор-5-(трифторметил)фениламино)метилен)малоната (6B)
2-Хлор-5-(трифторметил)анилин 4 (200 г, 1,023 моль), диэтил 2-(этоксиметилен)малонат (5) (276 г, 1,3 моль) и толуол (100 мл) объединяли в атмосфере азота в 3-горлой 1-л круглодонной колбе, снабженной ловушкой Дина-Старка. Раствор нагревали при перемешивании до 140°C и эту температуру поддерживали в течение 4 часов. Реакционную смесь охлаждали до 70°C и медленно добавляли гексан (600 мл). Полученную суспензию перемешивали и давали охладиться до комнатной температуры. Твердое вещество собирали фильтрованием, промывали 10% раствором этилацетата в гексане (2×400 мл) и затем сушили в вакууме с получением белого твердого вещества (350 г, 94% выход) в виде желаемого продукта конденсации диэтил 2-((2-хлор-5-(трифторметил)фениламино)метилен)малоната (6B).1Н ЯМР (400 МГц, ДМСО-d6) δ 11,28 (д, J=13,0 Гц, 1H), 8,63 (д, J=13,0 Гц, 1H), 8,10 (c, 1H), 7,80 (д, J=8,3 Гц, 1H), 7,50 (дд, J=1,5, 8,4 Гц, 1H), 4,24 (кв, J=7,1 Гц, 2H), 4,17 (кв, J=7,1 Гц, 2H), 1,27 (м, 6H).
[00249] Получение этил 8-хлор-4-оксо-5-(трифторметил)-1,4-дигидрохинолин-3-карбоксилата (6A) Способ 1
В 3-горлую 1-л колбу загружали Dowtherm® (200 мл, 8 мл/г), который дегазировали при 200°C в течение 1 часа. Растворитель нагревали до 260°C и загружали по порциям в течение 10 минут диэтил 2-((2-хлор-5-(трифторметил)фениламино)метилен)малонат (6B) (25 г, 0,07 моль). Полученную смесь перемешивали при 260°C в течение 6,5 часов (час) и полученный этанольный побочный продукт удаляли путем перегонки. Смеси давали медленно охладиться до 80°C. Медленно добавляли гексан (150 мл) в течение 30 минут (мин) с последующим добавлением дополнительных 200 мл гексана одной порцией. Суспензию перемешивали вплоть до достижения комнатной температуры. Твердое вещество фильтровали, промывали гексаном (3×150 мл) и затем сушили в вакууме с получением этил 8-хлор-4-оксо-5-(трифторметил)-1,4-дигидрохинолин-3-карбоксилата (6A) в виде желто-коричневого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) δ 11,91 (c, 1H), 8,39 (c, 1H), 8,06 (д, J=8,3 Гц, 1H), 7,81 (д, J=8,4 Гц, 1H), 4,24 (кв, J=7,1 Гц, 2H), 1,29 (т, J=7,1 Гц, 3H).
[00250] Получение этил 8-хлор-4-оксо-5-(трифторметил)-1,4-дигидрохинолин-3-карбоксилата (6A) Способ 2
Соединение 6B (2000 г, 5,468 моль) вводили в реактор. В реактор загружали Dowtherm (4,000 л) и дегазировали при комнатной температуре в течение ночи путем продувки азотом. Затем смесь перемешивали и нагревали до 260°C. Образовавшийся EtOH отгоняли. Реакцию отслеживали, и она завершалась через 5,5 часов, реакция была по существу завершена. Источник нагрева удаляли и реакционную смесь охлаждали до 80°C и добавляли гептан (2,000 л). Смесь перемешивали в течение 30 минут. К перемешиваемой смеси добавляли гептан (6,000 л) и перемешивание продолжали в течение ночи. Твердые вещества отфильтровывали и промывали гептаном (4,000 л) и сушили в вакуумной печи при 50°C с получением соединения 6A.
[00251] Получение этил 4-оксо-5-(трифторметил)-1H-хинолин-3-карбоксилата (6C)
В 3-горлую 5-л колбу загружали этил 8-хлор-4-оксо-5-(трифторметил)-1,4-дигидрохинолин-3-карбоксилат (6A) (100 г, 0,3 моль), этанол (1250 мл, 12,5 мл/г) и триэтиламин (220 мл, 1,6 моль). В сосуд затем загружали 10 г 10% Pd/C (50% влаги) при 5°C. Реакционную смесь интенсивно перемешивали в атмосфере водорода в течение 20 часов при 5°C, затем реакционную смесь концентрировали до объема приблизительно 150 мл. Продукт, этил 4-оксо-5-(трифторметил)-1H-хинолин-3-карбоксилат (6C), в виде суспензии с Pd/C непосредственно использовали на следующей стадии.
[00252] Получение 4-оксо-5-(трифторметил)-1,4-дигидрохинолин-3-карбоновой кислоты (2)
Этил 4-оксо-5-(трифторметил)-1H-хинолин-3-карбоксилат (6C) (58 г, 0,2 моль, неочищенная реакционная суспензия, содержащая Pd/C) суспендировали в NaOH (814 мл 5 M, 4,1 моль) в 1-л колбе с обратным холодильником и нагревали при 80°C в течение 18 часов с последующим нагреванием при 100°C в течение 5 часов. Теплую реакционную смесь фильтровали через плотный слой Целита для удаления Pd/C и Целит промывали 1н. раствором NaOH. Фильтрат подкисляли до около pH 1 с получением вязкого белого осадка. Осадок фильтровали, затем промывали водой и охлажденным ацетонитрилом. Твердое вещество затем сушили в вакууме с получением 4-оксо-5-(трифторметил)-1,4-дигидрохинолин-3-карбоновой кислоты (2) в виде белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) δ 15,26 (c, 1H), 13,66 (c, 1H), 8,98 (c, 1H), 8,13 (дд, J=1,6, 7,8 Гц, 1H), 8,06-7,99 (м, 2H).
[00253]Пример 1B: Альтернативное получение 4-оксо-5-(трифторметил)-1,4-дигидрохинолин-3-карбоновой кислоты (2)
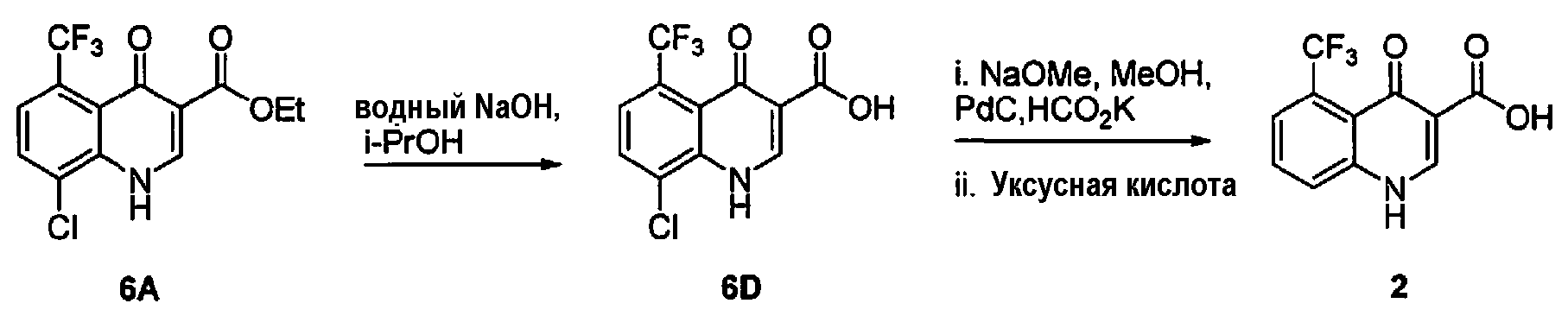
[00254]Получение 8-хлор-4-оксо-5-(трифторметил)-1,4-дигидрохинолин-3-карбоновой кислоты (6D)
Этил 8-хлор-4-оксо-5-(трифторметил)-1,4-дигидрохинолин-3-карбоксилат (6B) (1200 г, 3,754 моль) загружали в сосуд с последующим добавлением 2-пропанола (1,200 л) и воды (7,200 л) и перемешивали. NaOH (600,6 г, 7,508 моль) и воду (1,200 л) смешивали и давали охладиться до комнатной температуры. Полученный NaOH раствор загружали в реакционный сосуд. Реакционную смесь нагревали до 80°C и перемешивали в течение 3,5 часов с получением темной и гомогенной смеси. По прошествии еще одного часа добавляли уксусную кислоту (9,599 л [20% масс./об. раствора], 31,97 моль) через капельную воронку в течение 45 минут. Реакционную смесь охлаждали до 22°C при скорости 6°C/час при перемешивании. Полученное твердое вещество фильтровали, промывали водой (3 л) с образованием мокрой лепешки (1436 г). Фильтрат сушили в вакуумной печи с продувкой азотом над drierite® с образованием 8-хлор-4-оксо-5-(трифторметил)-1,4-дигидрохинолин-3-карбоновой кислоты в виде коричневого твердого вещества. 8-Хлор-4-оксо-5-(трифторметил)-1,4-дигидрохинолин-3-карбоновую кислоту очищали путем суспендирования в 1,5 л метанола при перемешивании в течение 6 часов. Затем смесь фильтровали и сушили с получением 968,8 г очищенной 8-хлор-4-оксо-5-(трифторметил)-1,4-дигидрохинолин-3-карбоновой кислоты (6D).
[00255] Получение 4-оксо-5-(трифторметил)-1,4-дигидрохинолин-3-карбоновой кислоты (2)
8-Хлор-4-оксо-5-(трифторметил)-1,4-дигидрохинолин-3-карбоновую кислоту (6D) (18,5 г, 1,00 экв., ограничивающий реагент) загружали в реакционный сосуд и добавляли MeOH (118 мл, 6,4 об.) в инертной атмосфере при перемешивании. Добавляли в реактор NaOMe (3,53 г, 1,00 экв.) по порциям в течение 10 минут. Смесь перемешивали до тех пор, пока все твердые вещества не переходили в раствор (5-10 минут). Затем к реакционной смеси добавляли палладий-на-углероде (2,7 г, 0,03 экв.). К реакционной смеси добавляли формиат калия (10,78 г, 2 экв.), растворенный в MeOH (67 мл, 3,6 об.), в течение 30 минут. Смесь затем перемешивали в течение около 4,5 часов при температуре окружающей среды. Реакцию считали завершенной, когда 8-хлор-4-оксо-5-(трифторметил)-1,4-дигидрохинолин-3-карбоновая кислота присутствовала в количестве не более чем 1,0% относительно 4-оксо-5-(трифторметил)-1,4-дигидрохинолин-3-карбоновой кислоты. Когда реакция завершалась, смесь фильтровали через слой Целита (37 г [приблизительно в два раза больше массы исходного вещества, 6D]) для удаления твердых веществ. Слой Целита промывали при помощи MeOH (37 мл, 2 об.). Фильтрат загружали в чистый реакционный сосуд и перемешивали. К перемешиваемому раствору непрерывно добавляли уксусную кислоту (7,22 мл, 2 экв.) в течение по меньшей мере 45 минут и полученную суспензию перемешивали в течение 5-16 часов. Твердое вещество фильтровали и лепешку промывали при помощи MeOH (56 мл, 3 об.), сушили с отсосом и затем сушили в вакууме с получением указанной в заголовке карбоновой кислоты 2.
[00256] Альтернативно, калийформиатный реагент можно заменить газообразным водородом.
[00257]Пример 2A: Получение 4-(7-азабицикло[2.2.1]гептан-7-ил)-2-(трифторметил)анилина (3)

[00258]Получение 7-[4-нитро-3-(трифторметил)фенил]-7-азабицикло[2.2.1]гептана (9), способ 1
В колбу, содержащую 7-азабицикло[2.2.1]гептан гидрохлорид (8-HCl) (4,6 г, 34,43 ммоль), в атмосфере азота добавляли раствор 4-фтор-1-нитро-2-(трифторметил)бензол (7) (6,0 г, 28,69 ммоль) и триэтиламин (8,7 г, 12,00 мл, 86,07 ммоль) в ацетонитриле (50 мл). Реакционную колбу нагревали при 80°C в атмосфере азота в течение 16 часов. Реакционной смеси давали охладиться и затем распределяли между водой и дихлорметаном. Органический слой промывали при помощи 1 M HC1, сушили над Na2SO4, фильтровали и концентрировали досуха. Очистка хроматографией на силикагеле (0-10% этилацетата в гексанах) давала 7-[4-нитро-3-(трифторметил)фенил]-7-азабицикло[2.2.1]гептан (9) в виде желтого твердого вещества.1Н ЯМР (400,0 МГц, ДМСО-d6) δ 8,03 (д, J=9,1 Гц, 1H), 7,31 (д, J=2,4 Гц, 1H), 7,25 (дд, J=2,6, 9,1 Гц, 1H), 4,59 (c, 2H), 1,69-1,67 (м, 4H), 1,50 (д, J=7,0 Гц, 4H).
[00259] Получение 7-[4-нитро-3-(трифторметил)фенил]-7-азабицикло[2.2.1]гептана (9), способ 2
4-фтор-1-нитро-2-(трифторметил)бензол (7) (901 г, 4,309 моль) вводили в 30-л снабженный кожухом сосуд вместе с Na2CO3 (959,1 г, 9,049 моль) и DMSO (5 л, 5,5 об.) в атмосфере азота и при перемешивании. Затем в сосуд добавляли по порциям 7-азабицикло[2.2.1]гептан гидрохлорид (8-HCl) (633,4 г, 4,740 моль). Температуру постепенно повышали до 55°C. Когда реакция по существу завершалась, смесь разбавляли 10 об. EtOAc и промывали водой (5,5 об.) три раза или до исчезновения DMSO в водном слое (ВЭЖХ). Органический слой концентрировали до 4 об. и затем растворитель обменивали с циклогексаном до полного удаления EtOAc, и общий объем в колбе составлял около 4 об., содержащих циклогексан. Реакционную смесь нагревали до 60°C на роторном испарителе в течение 30 минут. Затем раствор охлаждали до комнатной температуры при перемешивании или вращении в течение 3 часов. Когда все твердое вещество кристаллизовалось, раствор концентрировали досуха с получением 7-[4-нитро-3-(трифторметил)фенил]-7-азабицикло[2,2.l]гептана (9).
[00260] Получение 7-[4-нитро-3-(трифторметил)фенил]-7-азабицикло[2.2.1]гептана (9), способ 3
4-Фтор-1-нитро-2-(трифторметил)бензол растворяли в 3 об. DCM. Добавляли тетрабутиламмонийбромид (0,05 экв.) и KOH (50% масс., 3,6 экв.). Затем добавляли 7-азабицикло[2.2.1]гептан гидрохлорид (8-HCl) при 0-5°C. Реакционную смесь нагревали до температуры окружающей среды и реакцию отслеживали при помощи ВЭЖХ. Когда реакция была по существу завершена, слои разделяли и органический слой промывали при помощи 1M HCl. Слои разделяли и водный слой отбрасывали. Органический слой промывали один раз водой, один раз насыщенным солевым раствором и затем подвергали перегонке. Полученное вещество перекристаллизовывали из циклогексана при кипячении с обратным холодильником. Твердое вещество фильтровали, промывали циклогексаном и сушили в вакуумной печи при 45°C продувкой газообразным N2 с получением 7-[4-нитро-3-(трифторметил)фенил]-7-азабицикло[2.2.1]гептана (9).
[00261] Получение 4-(7-азабицикло[2.2.1]гептан-7-ил)-2-(трифторметил)анилина (3)
В колбу загружали 7-[4-нитро-3-(трифторметил)фенил]-7-азабицикло[2.2.1]гептан (26) (7,07 г, 24,70 ммоль) и 10% Pd/C (0,71 г, 6,64 ммоль), откачивали газ и затем продували азотом. Добавляли этанол (22 мл) и реакционную колбу снабжали баллоном водорода. После интенсивного перемешивания в течение 12 часов реакционную смесь продували азотом и Pd/C удаляли фильтрованием. Фильтрат концентрировали до получения темного масла при пониженном давлении и остаток очищали хроматографией на силикагеле (0-15% этилацетата в гексанах) с получением 4-(7-азабицикло[2.2.1]гептан-7-ил)-2-(трифторметил)анилина (3) в виде твердого вещества фиолетового цвета (5,76 г, 91% выход).1Н ЯМР (400 МГц, ДМСО-d6) δ 6,95 (дд, J=2,3, 8,8 Гц, 1H), 6,79 (д, J=2,6 Гц, 1H), 6,72 (д, J=8,8 Гц, 1H), 4,89 (c, 2H), 4,09 (c, 2H), 1,61-1,59 (м, 4H) и 1,35 (д, J=6,8 Гц, 4H).
[00262]Пример 2B: Получение гидрохлоридной соли 4-(7-азабицикло[2.2.1]гептан-7-ил)-2-(трифторметил)анилина (3-HCl)

[00263] Получение гидрохлоридной соли 4-(7-азабицикло[2.2.1]гептан-7-ил)-2-(трифторметил)анилина (3-HCl), способ 1
Палладий-на-углероде (150 г, 5% масс./масс.) загружали в гидрогенизатор Büchi (емкость 20 л) в атмосфере азота, с последующим добавлением гидрохлоридной соли 7-[4-нитро-3-(трифторметил)фенил]-7-азабицикло[2.2.1]гептана (9) (1500 г) и 2-метилтетрагидрофуране (10,5 л, 7 об.). Газообразный водород загружали в закрытый сосуд до давления +0,5 бар выше атмосферного давления. Прилагали вакуум в течение около 2 минут с последующим введением газообразного водорода до давления 0,5 бар. Этот способ повторяли 2 раза. Затем газообразный водород непрерывно загружали при +0,5 бар выше атмосферного давления. Смесь перемешивали и температуру поддерживали в пределах 18°C-23°C путем охлаждения кожуха сосуда. Когда реакция больше не потребляла водород и не выделяла тепло, снова прилагали вакуум. Газообразный азот загружали в сосуд при 0,5 бар и снова прилагали вакуум с последующей второй загрузкой газообразного азота при 0,5 бар. Когда реакция была по существу завершена, реакционную смесь переносили в колбу-приемник в атмосфере азота через фильтровальную воронку с использованием фильтра из Целита. Целитный фильтровальный слой промывали 2-метилтетрагидрофураном (3 л, 2 об.). Промывки и фильтрат загружали в сосуд, снабженный мешалкой, устройством для контроля температуры и атмосферой азота. В сосуд добавляли 4M HCl в 1,4-диоксане (1 об.) непрерывно в течение 1 часа при 20°C. Смесь перемешивали еще в течение 10 часов (или в течение ночи), фильтровали и промывали 2-метилтетрагидрофураном (2 об.) и сушили с образованием 1519 г 4-(7-азабицикло[2.2.1]гептан-7-ил)-2-(трифторметил)анилин гидрохлорида (3-HCl) в виде белого кристаллического твердого вещества.
[00264] Альтернативные растворители также можно использовать в этом примере. Например, MeOH и/или EtOH можно использовать вместо 2-MeTГФ.
[00265]Пример 3A: Получение N-(4-(7-азабицикло[2.2.1]гептан-7-ил)-2-(трифторметил)фенил)-4-оксо-5-(трифторметил)-1,4-дигидрохинолин-3-карбоксамида в виде формы A (соединение 1 форма A)

[00266] К раствору 4-оксо-5-(трифторметил)-1H-хинолин-3-карбоновой кислоты (2) (9,1 г, 35,39 ммоль) и 4-(7-азабицикло[2.2.1]гептан-7-ил)-2-(трифторметил)анилина (3) (9,2 г, 35,74 ммоль) в 2-метилтетрагидрофуране (91,00 мл) добавляли циклический ангидрид пропилфосфоновой кислоты (50% раствор в этилацетате, 52,68 мл, 88,48 ммоль) и пиридин (5,6 г, 5,73 мл, 70,78 ммоль) при комнатной температуре. Реакционную колбу нагревали при 65°C в течение 10 часов в атмосфере азота. После охлаждения до комнатной температуры реакционную смесь разбавляли этилацетатом и гасили насыщенным раствором Na2CO3 (50 мл). Слои разделяли и водный слой экстрагировали еще два раза этилацетатом. Объединенные органические слои промывали водой, сушили над Na2SO4, фильтровали и концентрировали до получения желто-коричневого твердого вещества. Неочищенный твердый продукт суспендировали в смеси этилацетат/диэтиловый эфир (2:1), собирали путем вакуумного фильтрования и промывали еще два раза смесью этилацетат/диэтиловый эфир (2:1) с получением неочищенного продукта в виде светло-желтого кристаллического порошка. Порошок растворяли в теплом этилацетате и абсорбировали на Целите. Очистка хроматографией на силикагеле (0-50% этилацетата в дихлорметане) давала Форму A N-(4-(7-азабицикло[2.2.1]гептан-7-ил)-2-(трифторметил)фенил)-4-оксо-5-(трифторметил)-1,4-дигидрохинолин-3-карбоксамида (соединение 1 форма A) в виде белого кристаллического твердого вещества. LC/MS m/z 496,0 [M+H]+, время удерживания 1,48 минут (RP-C18, 10-99% CH3CN/0,05% TFA в течение 3 мин).1Н ЯМР (400,0 МГц, ДМСО-d6) δ J=13,08 (c, 1H), 12,16 (c, 1H), 8,88 (c, 1H), 8,04 (дд, J=2,1, 7,4 Гц, 1H), 7,95-7,88 (м, 3H), 7,22 (дд, J=2,5, 8,9 Гц, 1H), 7,16 (д, J=2,5 Гц, 1H), 4,33 (c, 2H), 1,67 (д, J=6,9 Гц, 4H), 1,44 (д, J=6,9 Гц, 4H).
[00267] Порошковая дифрактограмма соединения 1 формы A показана на фиг.1.
[00268] Таблица 1 представляет XRPD пики, репрезентативные для соединения 1 формы A.

[00269] Репрезентативный образец соединения 1 формы A давал FTIR спектр, представленный на фиг.2.
[00270] Конформационные картины соединения 1 формы А на основании одного рентгеновского анализа представлены на фиг.3. Данные дифракции получали на дифрактометре Bruker Apex II, снабженном герметично закрытой трубкой-источником CuK-альфа и Apex II CCD детектором. Структуру определяли и уточняли с использованием SHELX программы (Sheldrick, G.M., Acta Cryst. A64, pp.112-122 (2008)). На основании интенсивностей, статистики и симметрии структура была разрешена и уточнена в виде тригональной кристаллической системы и R-3 пространственной группы. Соединение 1 форма A имеет следующие размеры элементарной ячейки: a=19,1670(4) Ǻ, b=19,1670(4) Ǻ, c=33,6572(12) Ǻ, α=90°, β=90° и γ=120°.
[00271]Пример 3B: Получение N-(4-(7-азабицикло[2.2.1]гептан-7-ил)-2-(трифторметил)фенил)-4-оксо-5-(трифторметил)-1,4-дигидрохинолин-3-карбоксамида в виде формы A-HCl (соединение 1 форма A-HCl)
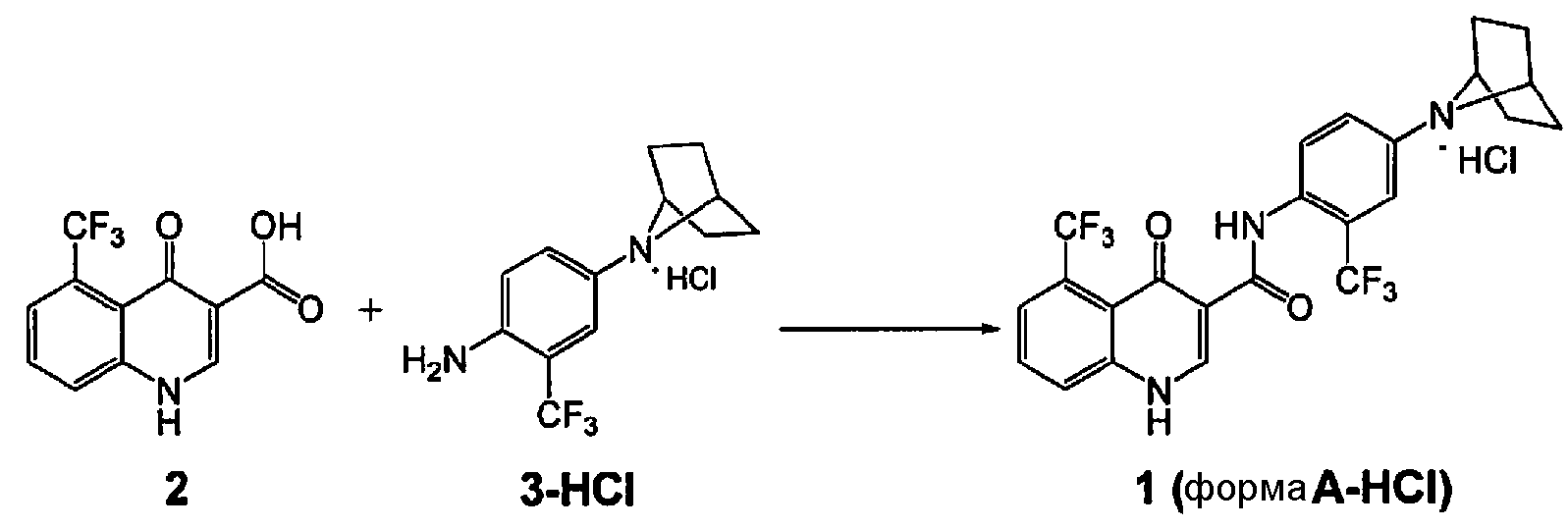
[00272] 2-метилтетрагидрофуран (0,57 л, 1,0 об.) загружали в 30-л снабженный кожухом реакционный сосуд с последующим добавлением гидрохлоридной соли 4-(7-азабицикло[2.2.1] гептан-7-ил)-2-(трифторметил)анилина (3-HCl) (791 г, 2,674 моль) и 4-оксо-5-(трифторметил)-1,4-дигидрохинолин-3-карбоновой кислоты (2) (573 г, 2,2278 моль) и дополнительных 5,2 л (9,0 об.) 2-метилтетрагидрофурана. Начинали перемешивание и к реакционной смеси добавляли T3P в 2-метилтетрагидрофуране (2,836 кг, 4,456 моль) в течение 15 минут. Затем добавляли пиридин (534,0 г, 546,0 мл, 6,684 моль) через капельную воронку по каплям в течение 30 минут. Смесь нагревали до 45°C в течение около 30 минут и перемешивали в течение 12-15 часов. ВЭЖХ анализ показал, что 4-оксо-5-(трифторметил)-1,4-дигидрохинолин-3-карбоновая кислота присутствовала в количестве меньше чем 2%. Смесь затем охлаждали до комнатной температуры. Добавляли 2-метилтетрагидрофуран (4 об., 2,292 л) с последующим добавлением воды (6,9 об., 4 л), при этом температуру поддерживали ниже 30°C. Водный слой удаляли и органический слой осторожно промывали два раза насыщенным водным раствором NaHCO3. Органический слой затем промывали 10% масс./масс. раствором лимонной кислоты (5 об.) и в конце водой (7 об.). Смесь фильтровали через барьерный фильтр и переносили в другой сухой сосуд. Добавляли затравочные кристаллы формы A-HCl гидрохлорида N-(4-(7-азабицикло[2.2.1]гептан-7-ил)-2-(трифторметил)фенил)-4-оксо-5-(трифторметил)-1,4-дигидрохинолин-3-карбоксамида (соединение 1 формы A-HCl) (3,281 г, 5,570 ммоль). HCl (г) (10 экв.) барботировали в течение 2 часов и смесь перемешивали в течение ночи. Полученную суспензию фильтровали, промывали 2-метилтетрагидрофураном (4 об.), сушили с использованием вакуума и сушили в печи при 60°C до постоянной массы с получением соединения 1 формы A-HCl.
[00273] Порошковая дифрактограмма соединения 1 формы A-HCl показана на фиг.4.
Таблица 2 представляет XRPD пики, репрезентативные для соединения 1 формы A-HCl.


[00275] Было определено, что монокристалл соединения 1 формы A-HCl имеет моносимметричную кристаллическую систему, P21/c пространственную группу и следующие размеры элементарной ячейки: a=13,6175(4) Å, b=21,614(3) Å, c=8,3941(4) Å, α=90°, β=112,303° и γ=90°.
[00276] Образец соединения 1 формы A-HCl также анализировали с использованием микроскопии.
[00277] DSC кривая для образца соединения 1 формы A-HCl представлена на фиг.5, и TGA кривая репрезентативного образца соединения 1 формы A-HCl представлена на фиг.6.
[00278] Репрезентативный образец соединения 1 формы A-HCl показал FTIR спектр, представленный на фиг.7.
[00279] Соединение 1 форму A-HCl также анализировали с использованиемl3C и19F ЯМР твердого состояния. Соответствующие ЯМР спектры представлены на фиг.8 и 9. Некоторые пики, обнаруженные в13C SSNMR и19F SSNMR спектрах, описаны в таблицах 3 и 4.


[00280]Пример 4A: Получение N-(4-(7-азабицикло[2.2.1]гептан-7-ил)-2-(трифторметил)фенил)-4-оксо-5(трифторметил)-1,4-дигидрохинолин-3-карбоксамид в виде формы B (соединение 1 форма B)

[00281] 2-Метилтетрагидрофуран (1 об.) загружали в 30-л снабженный кожухом реакционный сосуд с последующим добавлением гидрохлоридной соли 4-(7-азабицикло[2.2.1]гептан-7-ил)-2-(трифторметил)анилина (3-HCl) (1,2 экв.) и 4-оксо-5-(трифторметил)-1,4-дигидрохинолин-3-карбоновой кислоты (2) (573 г, 2,228 моль). В сосуд загружали дополнительное количество 2-метилтетрагидрофурана (9 об.) и начинали перемешивание. К реакционной смеси добавляли T3P в 2-метилтетрагидрофуране (2 экв.) в течение 15 минут. Быстро добавляли пиридин (3 экв.) по каплям с использованием капельной воронки. При перемешивании смесь затем нагревали до 45°C в течение около 30 минут и эту температуру поддерживали в течение около 5 часов. Смесь охлаждали до комнатной температуры. Добавляли 2-метилтетрагидрофуран (4 об.) с последующим медленным добавлением воды (6,9 об.) и температуру реакции поддерживали ниже 30°C. Водный слой удаляли и органический слой промывали два раза насыщенным водным раствором NaHCO3. Органический слой затем осторожно промывали 10% масс./масс. раствором лимонной кислоты (5 об.), промывали водой (7 об.) и фильтровали через барьерный фильтр и переносили в другой сухой сосуд. Добавляли 2-метилтетрагидрофуран (10 об.) и начинали перемешивание. Быстро добавляли гептан (10 об.) по каплям при перемешивании. Смесь перемешивали в течение около 12 часов и затем осуществляли вакуум-фильтрацию. Твердую фильтровальную лепешку вносили в другой сосуд. В сосуд добавляли воду (15 об.) и суспензию интенсивно перемешивали в течение 48 часов, затем фильтровали. Твердую лепешку промывали водой (5 об.) и сушили при 45°C до постоянной массы с получением соединения 1 формы B.
[00282] Порошковые дифрактограммы соединения 1 формы B, полученные с использованием инструментов 1 и 2, показаны на фиг.10A и 10B соответственно.
[00283] Таблица 5 включает репрезентативные XRPD пики соединения 1 формы B
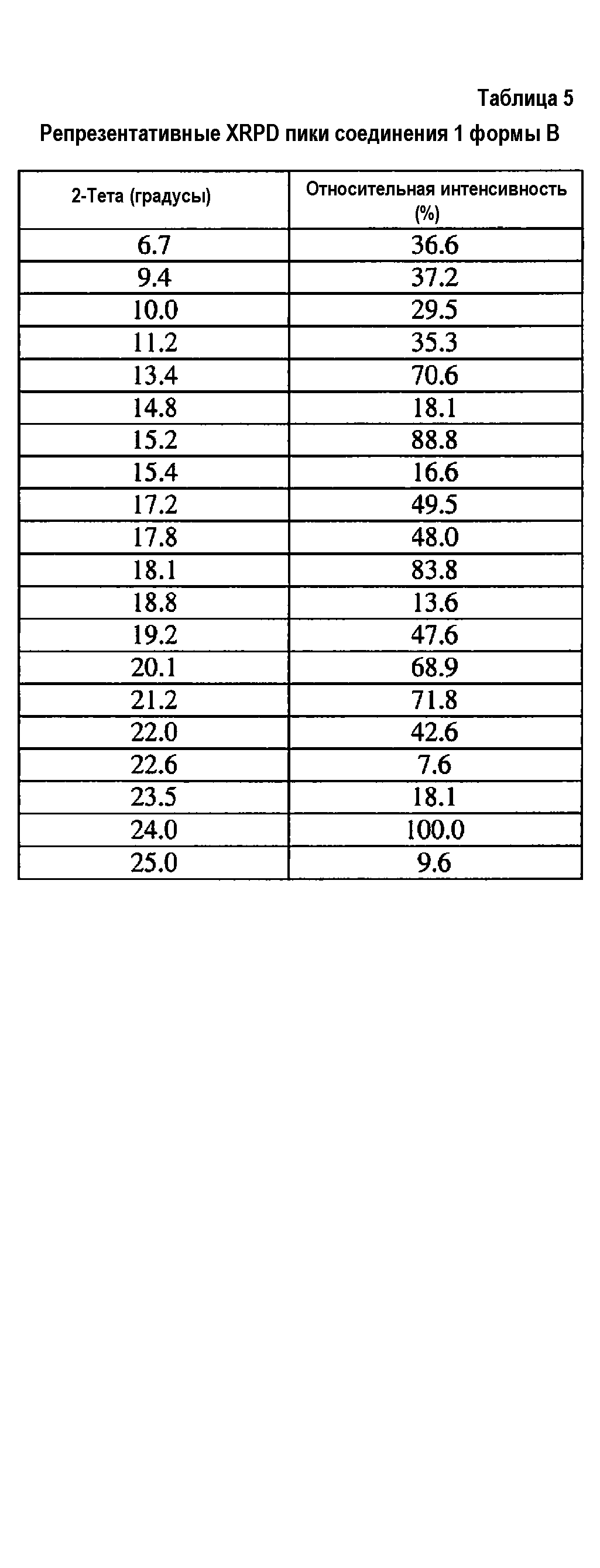

[00284] DSC кривая для образца соединения 1 формы B представлена на фиг.11, и TGA кривая для репрезентативного образца соединения 1 формы B представлена на фиг.12.
[00285] Репрезентативный образец соединения 1 формы B показал FTIR спектр, представленный на фиг.13.
[00286] Соединение 1 форму B также анализировали с использованием13C и19F ЯМР твердого состояния. Соответствующие ЯМР спектры представлены на фиг.14 и 15. Некоторые пики, обнаруженные в13C SSNMR и19F SSNMR спектрах, описаны в таблицах 6 и 7.


[00287] Монокристалл соединения 1 формы B монтировали на MicroMount петле и центрировали на Broker Apex II дифракторметре, который был снабжен герметично закрытой медной рентгеновской трубкой и Apex II CCD детектором. Сначала собирали 3 набора из 40 каркасов для определения предварительной элементарной ячейки. Затем получали полный набор данных, состоящий из 15 сканов и 6084 каркасов. Сбор данных осуществляли при комнатной температуре. Данные интегрировали и масштабировали с использованием Apex II программы от Bruker AXS. Интегрирование и масштабирование давали 6176 отражений, 2250 из которых были уникальными. Структуру решали прямыми способами в пространственной группе P21/c с использованием SHELXTL программы. Уточнение осуществляли методом наименьших квадратов с полной матрицей на F2, также с использованием SHELXTL программы. Для уточнения использовали всего 392 параметра с получением отношения отражения к параметру 5,74. Конечный индекс уточнения был wR2=0,0962 и R1=0,0682 (wR2=0,0850 и R1=0,0412 для отражений с I>2 сигма(I).
[00288] Было определено, что монокристалл N-(4-(7-азабицикло[2.2.1]гептан-7-ил)-2-(трифторметил)фенил)-4-оксо-5-(трифторметил)-1,4-дигидрохинолин-3-карбоксамида в соединении 1 формы B имеет моносимметричную кристаллическую систему, P21/c пространственную группу и следующие размеры элементарной ячейки: a=13,5429(4) Å, b=13,4557(4) Å, c=12,0592(4) Å, α=90°, β=101,193° и γ=90°.
[00289]Пример 4B; Получение N-(4-(7-азабицикло[2.2.1]гептан-7-ил)-2-(трифторметил)фенил)-4-оксо-5-(трифторметил)-1,4-дигидрохинолин-3-карбоксамида в виде формы B-HCl (соединение 1 формы B-HCl)

Способ 1
[00290] 100 мл 2-метилтетрагидрофурана загружали в 3-горлую колбу с атмосферой азота, снабженную мешалкой. Соединение 1 форму A-HCl (55 г, 0,103 моль) добавляли в колбу с последующим добавлением 349 мл 2-метилтетрагидрофурана и начинали перемешивание. В колбу добавляли 28 мл воды и колбу нагревали до внутренней температуры 60°C и перемешивали в течение 48 часов. Колбу охлаждали до комнатной температуры и перемешивали в течение 1 часа. Реакционную смесь подвергали вакуум-фильтрации до получения сухой фильтровальной лепешки. Твердую фильтровальную лепешку промывали 2-метилтетрагидрофураном (4 об.) два раза. Твердую фильтровальную лепешку оставляли в условиях отсоса под разрежением в течение около 30 минут и переносили на сушильный лоток. Фильтровальную лепешку сушили до достижения постоянной массы в вакууме при 60°C. Это приводило к образованию соединения 1 формы B-HCl в виде белого кристаллического твердого вещества.
Способ 2
[00291] Соединение 1 формы A-HCl (14,638 г, 27,52 ммоль) загружали в 100-мл круглодонную колбу. Добавляли EtOH (248,9 мл) и воду (27,82 мл). Белую суспензию нагревали до температуры кипения с обратным холодильником. Прозрачный раствор получали при 77°C. Реакционную смесь охлаждали до 45°C и оставляли для перемешивания в течение 30 минут и затем охлаждали до 20°C. Смесь оставляли для перемешивания еще в течение 3 часов при 20°C. Продукт фильтровали и лепешку промывали при помощи EtOH. Твердое вещество сушили в вакуумной печи при 45°C с продувкой азотом с получением соединения 1 формы B-HCl в виде белого твердого вещества.
[00292] В качестве примечания, можно использовать другие комбинации растворителей, такие как MeOH/Н2О и IPA/H2O или подобные, вместо EtOH/H2O, указанного в этом примере.
[00293] Примеры альтернативных комбинаций растворителей представлены в таблице 8.

[00294] Порошковая дифрактограмма соединения 1 формы B-HCl показана на фиг.16.
В таблице 9 представлены репрезентативные XRPD пики соединения 1 формы B-HCl.


[00295] Было определено, что монокристалл соединения I формы B-HCl имеет моносимметричную кристаллическую систему, a P21/a пространственную группу и следующие размеры элементарной ячейки: a=12,57334(5) Å, b=19,68634(5) Å, c=8,39399(5) Å, α=90°, β=90,0554° и γ=90°.
[00296] Образец соединения Формы B-HCl также анализировали с использованием микроскопии.
[00297] DSC кривая для соединения 1 формы B-HCl представлена на фиг.17, и TGA кривая для репрезентативного образца соединения 1 формы B-HCl представлена на фиг.18.
[00298] Репрезентативный образец соединения 1 формы B-HCl показал FTTR спектр, представленный на фиг.19.
[00299] Соединение 1 форму B-HCl также анализировали с использованием13C иl9F ЯМР твердого состояния. Соответствующие ЯМР спектры представлены на фиг.20 и 21. Некоторые пики, обнаруженные в13C SSNMR и19F SSNMR спектрах, описаны в таблицах 10 и 11:
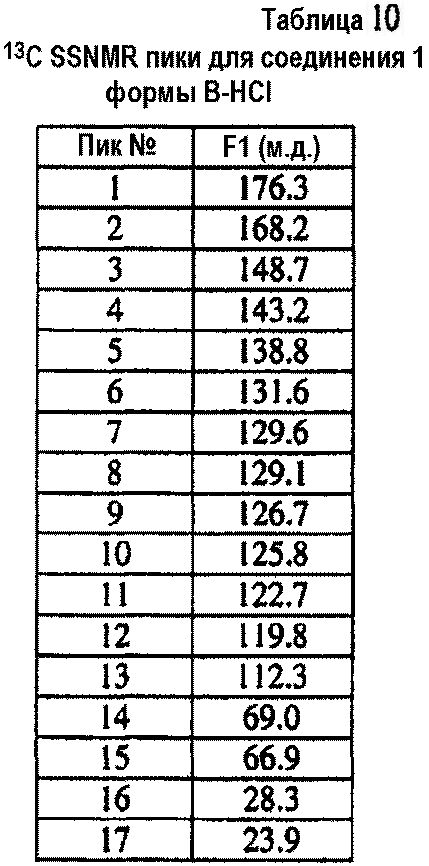
[00300]

[00301] В качестве примечания, в примерах 3A, 3B и 4A-4C, можно использовать EtOAC вместо 2-MeTГФ в качестве растворителя.
[00302]Анализы для определения и измерения AF508-CFTR потенцирующих свойств соединений
[00303]Оптические методы определения мембранного потенциала для анализа ΔF508-CFTR-модулирующих свойств соединений
[00304] В анализе используют флуоресцентные чувствительные к потенциалу красители для измерения изменения мембранного потенциала с использованием планшет-ридера для считывания флуоресценции (например, FLIPR III, Molecular Devices, Inc.) для получения данных, показывающих повышение уровня функционального ΔF508-CFTR в клетках NIH 3T3. Движущей силой для ответа является создание градиента хлоридных ионов в связи с активацией канала путем однократного добавления жидкости после предварительной обработки клеток соединениями с последующей нагрузкой потенциал-чувствительного красителя.
[00305]Идентификация потенцирующих соединений
[00306] Для идентификации ΔF508-CFTR-потенцирующих средств был разработан HTS анализ в формате двойного добавления. В этом HTS анализе используют флуоресцентные чувствительные к потенциалу красители для измерения изменения мембранного потенциала на FLIPR III как показателя усиления воротного механизма (проводимости) ΔF508 CFTR в ΔF508 CFTR NIH 3T3 клетках с коррекцией на температуру. Движущей силой для ответа является градиент Cl- ионов в связи с активацией канала форсколином при однократном добавлением жидкости с использованием планшет-ридера для считывания флуоресценции, такого как FLIPR III, после того как клетки были предварительно обработаны потенцирующими соединениями (или DMSO носителем в качестве контроля) с последующей нагрузкой красителя редистрибуции.
[00307]Растворы
[00308] Раствор в ванночке #1: (в мМ) NaCl 160, KCl 4,5, CaCl2 2, MgCl2 1, HEPES 10, pH 7,4 при помощи NaOH.
[00309] Альтернатива раствору в ванночке #1 включает раствор в ванночке, где хлоридные соли замещены глюконатными солями.
[00310]Клеточная культура
[00311] Мышиные фибробласты NIH3T3, стабильно экспрессирующие ΔF508-CFTR, использовали для оптических измерений мембранного потенциала. Клетки поддерживали при 37°C в 5% CO2 и 90% влажности в модифицированной Дульбекко среде Игла, дополненной 2 мМ глутамина, 10% фетальной бычьей сыворотки, 1×NEAA, β-ME, 1×пенициллина/стрептомицина и 25 мМ HEPES в 175 см2 культуральных колбах. Для всех оптических анализов клетки высевали при плотности ~20000/лунка в 384-луночных матригель-покрытых планшетах и культивировали в течение 2 часов при 37°C, затем культивировали при 27°C в течение 24 часов для анализа потенцирующего средства. Для корректирующих анализов клетки культивировали при 27°C или 37°C с и без соединения в течение 16-24 часов.
[00312]Электрофизиологические анализы для определения ΔF508-CFTR-модулирующих свойств соединений
[00313] 1. Анализ с использованием камеры Ussing
[00314] Эксперименты с использованием камеры Ussing осуществляли на поляризованных эпителиальных клетках дыхательных путей, экспрессирующих ΔF508-CFTR, для дальнейшей характеризации модуляторов ΔF508-CFTR, идентифицированных в оптических анализах. Не-CF и CF эпителии дыхательных путей выделяли из бронхиальной ткани, культивировали, как описано ранее (Galietta, L.J.V., Lantero, S., Gazzolo, A., Sacco, O., Romano, L., Rossi, G.A., и Zegarra-Moran, O. (1998) In Vitro Cell. Dev. Biol. 34, 478-481), и высевали на Costar® Snapwell™ фильтры, которые были предварительно покрыты NIH3T3-кондиционированной средой. Через четыре дня апикальную среду удаляли и клетки выращивали на границе раздела воздух-жидкость в течение >14 дней перед их использованием. Это приводило к образованию монослоя полностью дифференцированных цилиндрических клеток, которые были реснитчатыми, особенность, которая является характерной для эпителия дыхательных путей. Не-CF HBE выделяли у некурящих субъектов, которые не страдали каким-либо известным легочным заболеванием. CF-HBE выделяли у пациентов, гомозиготных для ΔF508-CFTR.
[00315] Включения клеточной культуры HBE, выращенной на Costar® Snapwell™, помещали в камеру Ussing (Physiologic Instruments, Inc., San Diego, CA) и измеряли трансэпителиальное сопротивление и ток короткого замыкания в присутствии базолатерального → апикального градиента Cl- (ISC) с использованием системы фиксации потенциала (Department of Bioengineering, University of Iowa, IA). Вкратце, HBE исследовали в условиях регистрации фиксации потенциала (Vhold=0 мВ) при 37°C. Базолатеральный раствор содержал (в мМ) 145 NaCl, 0,83 K2HPO4, 3,3 KH2PO4, 1,2 MgCl2, 1,2 CaCl2, 10 Глюкозы, 10 HEPES (pH доводили до 7,35 при помощи NaOH), и апикальный раствор содержал (в мМ) 145 NaГлюконата, 1,2 MgCl2, 1,2 CaCl2, 10 глюкозы, 10 HEPES (pH доводили до 7,35 при помощи NaOH).
[00316]Идентификация потенцирующих соединений
[00317] Типичный протокол включал использование градиента концентрации Cl-на базолатеральной → апикальной мембране. Для установления этого градиента на базолатеральной мембране использовали нормальные растворы Рингера, тогда как на апикальной NaCl заменяли эквимолярным количеством глюконата натрия (титровали до pH 7,4 при помощи NaOH) с получением высокого градиента концентрации Cl- через эпителий. Форсколин (10 мкМ) и все испытываемые соединения добавляли на апикальной стороне включений клеточной культуры. Эффективность предполагаемых ΔF508-CFTR-потенцирующих средств сравнивали с эффективностью известного потенцирующего средства генистеина.
[00318]2. Пэтч-кламп регистрация
[00319] Общий Cl- ток в ΔF508-NIH3T3 клетках отслеживали с использованием перфорированный-пэтч-кламп метода, как описано ранее (Rae, J., Cooper, K., Gates, P., и Watsky, M. (1991) J. Neurosci. Methods 37, 15-26). Вольт-кламп регистрации осуществляли при 22°C с использованием Axopatch 200B пэтч-кламп усилителя (Axon Instruments Inc., Foster City, CA). Раствор в пипетке содержал (в мМ) 150 N-метил-D-глюкамина (NMDG)-Cl, 2 MgCl2, 2 CaCl2, 10 EGTA, 10 HEPES и 240 мкг/мл амфотерицина-B (pH доводили до 7,35 при помощи HCl). Внеклеточная среда содержала (в мМ) 150 NMDG-Cl, 2 MgCl2, 2 CaCl2, 10 HEPES (pH доводили до 7,35 при помощи HCl). Генерирование импульсов, сбор данных и анализ осуществляли с использованием ПК, снабженного Digidata 1320 AJD интерфейсом, в сочетании с Clampex 8 (Axon Instruments Inc.). Для активации ΔF508-CFTR, 10 мкМ форсколина и 20 мкМ генистеина добавляли в ванночку и отношение ток-напряжение контролировали через каждые 30 сек.
[00320]Идентификация потенцирующих соединений
[00321] Способность ΔF508-CFTR-потенцирующих средств увеличивать макроскопический ΔF508-CFTR Cl- ток (IΔF508) в NIH3T3 клетках, стабильно экспрессирующих ΔF508-CFTR, также исследовали с использованием перфорированный-пэтч-кламп метода. Потенцирующие средства, идентифицированные в оптических анализах, вызывали дозозависимое повышение IΔF508 с такой же активностью и эффективностью, как наблюдали в оптических анализах. Во всех исследованных клетках потенциал реверсии до и в процессе аппликации потенцирующего средства был около -30 мВ, что представляет собой рассчитанное значение ECl (-28 мВ).
[00322]Клеточная культура
[00323] Мышиные фибробласты NIH3T3, стабильно экспрессирующие ΔF508-CFTR, использовали для регистрации в конфигурации “целая клетка”. Клетки поддерживали при 37°C в условиях 5% CO2 и 90% влажности в модифицированной Дульбекко среде Игла, дополненной 2 мМ глутамина, 10% фетальной бычьей сыворотки, 1×NEAA, β-ME, 1×пенициллина/стрептомицина и 25 мМ HEPES, в 175 см2 колбах для культивирования. Для регистрации в конфигурации “целая клетка” 2500-5000 клеток высевали на поли-1-лизин-покрытые покровные стекла и культивировали в течение 24-48 часов при 27°C перед их использованием для испытания активности потенцирующих средств и инкубировали с или без корректирующего соединения при 37°C для измерения активности корректирующих соединений.
[00324]Анализы одиночных каналов
[00325] Воротную активность wt-CFTR и температура-скорректированного ΔF508-CFTR, экспрессируемого в NIH3T3 клетках, наблюдали с использованием пэтч-регистраций в изолированных участках мембран в конфигурации “внутренняя сторона наружу”, как описано ранее (Dalemans, W., Barbry, P., Champigny, G., Jallat, S., Dott, K., Dreyer, D., Crystal, R.G., Pavirani, A., Lecocq, J-P., Lazdunski, M. (1991) Nature 354, 526-528), с использованием Axopatch 200B пэтч-кламп усилителя (Axon Instruments Inc.). Раствор в пипетке содержал (в мМ): 150 NMDG, 150 аспарагиновой кислоты, 5 CaCl2, 2 MgCl2 и 10 HEPES (pH доводили до 7,35 при помощи Tris основания). Раствор в ванночке содержал (в мМ): 150 NMDG-Cl, 2 MgCl2, 5 EGTA, 10 TES и 14 Tris основания (pH доводили до 7,35 при помощи HCl). После эксцизии оба wt- и ΔF508-CFTR активировали путем добавления 1 мМ Mg-АТФ, 75 нМ каталитической субъединицы cAMP-зависимой протеинкиназы (PKA; Promega Corp. Madison, WI) и 10 мМ NaF для ингибирования протеинфосфатаз, которые препятствовали прохождению тока. Потенциал в пипетке поддерживали при 80 мВ. Активность каналов анализировали из мембранных пэтчей, содержащих ≤2 активных канала. Максимальное количество одновременных открытий определяло количество активных каналов в процессе эксперимента. Для определения амплитуды тока одиночного канала данные, зарегистрированные от 120 с ΔF508-CFTR активности, фильтровали "off-line" при 100 Гц и затем использовали для построения амплитудных гистограмм по всем точкам, которые подгоняли при помощи множества функций Гаусса с использованием программы Bio-Patch Analysis (Bio-Logic Comp. France). Общий микроскопический ток и вероятность раскрытия (P0) определяли из 120 с активности канала. P0 определяли с использованием программы Bio-Patch или из зависимости P0=I/i(N), где I = означает ток, i = амплитуда тока одиночного канала и N = количество активных каналов в пэтче.
[00326]Клеточная культура
[00327] Мышиные фибробласты NIH3T3, стабильно экспрессирующие ΔF508-CFTR, использовали для пэтч-кламп регистраций в изолированных участках мембран. Клетки поддерживали при 37°C в условиях 5% CO2 и 90% влажности в модифицированной Дульбекко среде Игла, дополненной 2 мМ глутамина, 10% фетальной бычьей сыворотки, 1×NEAA, β-ME, 1×пенициллина/стрептомицина и 25 мМ HEPES, в 175 см2 колбах для культивирования. Для регистрации одиночных каналов 2500-5000 клеток высевали на поли-L-лизин-покрытые покровные стекла и культивировали в течение 24-48 часов при 27°C перед их использованием.
[00328] Соединения формулы 1 являются полезными в качестве модуляторов АТФ связывающих кассетных транспортеров. Измеренное значение EC50 (мкм) соединения 1 формы A было меньше чем 2,0 мкМ. Рассчитанная эффективность соединения 1 формы A составляла от 100% до 25%. Следует отметить, что 100% эффективность представляет собой максимальный ответ, полученный с использованием 4-метил-2-(5-фенил-1H-пиразол-3-ил)фенола.
[00329] ДРУГИЕ ВАРИАНТЫ ВОПЛОЩЕНИЯ
[00330] Все публикации и патенты, на которые имеются ссылки в настоящем раскрытии, включены в настоящую заявку посредством ссылки в той степени, как если бы каждая такая публикация или патентная заявка была конкретно и индивидуально указана как включенная посредством ссылки. В случае если значения терминов в каком-либо из патентов или публикаций, включенных посредством ссылки, противоречат значению терминов, используемых в настоящем раскрытии, предполагается, что значения терминов в настоящем раскрытии являются определяющими. Кроме того, представленное выше обсуждение раскрывает и описывает только иллюстративные варианты воплощения настоящего изобретения. Специалисты в данной области смогут легко определить исходя из такого обсуждения и из сопутствующих чертежей и формулы изобретения, что возможны различные изменения, модификации и варианты, без отступления от сути и объема настоящего изобретения, как оно определено в следующей далее формуле изобретения.
Реферат
Изобретение относится к области органической химии, а именно к способу получения твердых форм N-(4-(7-азабицикло[2.2.1]гептан-7-ил)-2-(трифторметил)фенил)-4-оксо-5-(трифторметил)-1,4-дигидрохинолин-3-карбоксамида (соединение 1 формы A, А-HCl, B и B-HCl). А также описываются способы получения промежуточных соединений 2 и 3-HCl. Технический результат: разработаны способы получения соединения 1 в твердой форме, полезные в качестве модуляторов CFTR. 5 н. и 16 з.п. ф-лы, 22 ил., 11 табл., 8 пр.
Формула

включающий
(a) взаимодействие соединения 4 с диэтил 2-(этоксиметилен)малонатом 5 с образованием сложного эфира 6А

(b) обработку сложного эфира 6А основанием, выбранным из водного раствора гидроксида натрия и водного раствора гидроксида калия с получением соединения 6D

(c) обработку соединения 6D газообразным водородом или формиатом в присутствии палладиевого катализатора с получением соединения 2


включающий
(a) взаимодействие соединения 7 с соединением 8 или его солью в присутствии основания и полярного апротонного растворителя, где Hal представляет собой F, Cl, Br или I, с получением соединения 9

(b) восстановление нитрогруппы в соединении 9 газообразным водородом в присутствии катализатора и растворителя с получением анилина 3, где катализатор включает Pd, Ni или Pt и растворитель включает изопропанол, этанол или метанол

(с) взаимодействие соединения 3 с HCl с получением гидрохлорида соединения 3-HCl



включающий
взаимодействие соединения 2 с гидрохлоридной солью соединения 3 (3-HCl) в присутствии связующего вещества, основания и растворителя; где связующее вещество представляет собой ангидрид пропанфосфиновой кислоты; где основание выбрано из группы, состоящей из K2CO3, Et3N, N-метилморфолина (NMM), пиридина или DIEA, и где растворитель выбран из группы, состоящей из EtOAc, IPAc, ТГФ, МЕК, NMP, ацетонитрила, DMF или 2-метилтетрагидрофурана


включающий
(a) взаимодействие соединения 2 с гидрохлоридной солью формулы 3 (3-HCl) в присутствии связующего вещества, основания и полярного апротонного растворителя; где связующее вещество представляет собой ангидрид пропанфосфиновой кислоты; где основание выбрано из группы, состоящей из K2CO3, Et3N, N-метилморфолина (NMM), пиридина или DIEA, и где полярный апротонный растворитель выбран из группы, состоящей из этилацетата, изопропилацетата, тетрагидрофурана, метилэтилкетона, N-метил-2-пирролидона, ацетонитрила, Ν,Ν-диметилформамида или 2-метилтетрагидрофурана,

(b) обработку смеси продукта со стадии (а) при помощи HCl.

включающий
(а) смешивание гидрохлоридной соли соединения 1 формы А·HCl с органическим растворителем и водой, где органический растворитель включает диметилсульфоксид, диметилформамид, диоксан, гексаметилфосфоротриамид, тетрагидрофуран, EtOAc, IPAc, ТГФ, MEK, NMP, ацетонитрил, DMF, EtOH, МеОН, изопропиловый спирт или 2-метилтетрагидрофуран, с образованием смеси

(b) нагревание смеси при температуре в пределах от около 30°С до около 80°С.
Документы, цитированные в отчёте о поиске
4-гидрокси-3-хинолинкарбоксамиды и гидразиды, фармацевтическая композиция и способ лечения на их основе

Комментарии