Способ лечения инфекционных заболеваний с использованием композиции, включающей полученный из плазмы иммуноглобулин м (igm) - RU2731108C2
Код документа: RU2731108C2
Чертежи







Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка имеет приоритет заявки на предварительный патент США №62/201,910, поданной 6 августа 2015 года, содержание которой конкретно включено в данный документ посредством ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу лечения инфекционных заболеваний, включающему введение нуждающемуся в этом пациенту композиции, содержащей IgM, полученный из плазмы крови. Настоящее изобретение также относится к способу нейтрализации секретированных цитотоксических экзотоксинов во время активных микробных инфекций, включающему введение нуждающемуся в этом пациенту композиции, содержащей IgM, полученный из плазмы крови.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Микробные виды могут стать крайне опасными для инфицированного пациента, если этот индивидуум не может избавиться от инфекции. Инфекции могут стать также септическими, распространяясь из инфицированного органа в кровоток. Эти септические инфекции имеют плохой прогноз для пациентов.
Проблема заключается в том, что для лечения инфекции большинство антибиотиков направленно воздействуют на сами живые бактерии. IgM характеризуется тем, что он предупреждает токсические септические аспекты бактериальных инфекций, являющиеся следствием системных эффектов микробных эндотоксинов. Эти эндотоксины являются компонентами клеточной стенки (в частности в грамотрицательных бактериях). Ни один из этих способов лечения не воздействует направленно или, как было показано, не воздействует направленно на микробные экзотоксины, суперантигены или секретированные ферменты.
Хотя хорошо изучено, что IgM, полученный из плазмы крови, может связываться с эндотоксинами и предупреждать опосредованную эндотоксинами токсичность по отношению к пациенту, это не распространяется на другие белки и токсины, которые активно секретируются микробами. Токсические эффекты эндотоксинов обычно являются ответом на гибель или лизис бактерий, индуцированный антибиотиком или иммунной системой пациента. Эти эффекты стоят отдельно от токсических событий, которые наблюдаются во время микробной инфекции из-за белков, таких как экзотоксины, которые активно секретируются микробом. Остается потребность в композициях и способах, которые предупреждают, ингибируют или ослабляют токсические эффекты белков и токсинов, секретированных микробами, иных, чем эндотоксины.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано на обнаружении неожиданного нейтрализующего эффекта терапевтических доз IgM, полученного из плазмы крови, для нейтрализации пагубного воздействия секретированных микробных белков, таких как секретированные цитотоксические экзотоксины, во время активных микробных инфекций. Настоящее изобретение предусматривает использование специфичности IgM, полученного из плазмы крови, по отношению к микробным белкам. Как объясняется выше, общеизвестно, что IgM связывает микробные эндотоксины, которые являются гликопротеинами, и что это связывание предусматривает использование обычного связывания IgM с гликопротеинами и углеводами.
В предшествующем уровне техники описано несколько моноклональных антител, но они индивидуально направлены только на единственный антиген-мишень. Напротив, природный IgM, полученный из плазмы крови, содержит множество сайтов связывания потенциальных антигенов, которые могут направленно воздействовать на многие разные антигены одновременно и поэтому не находятся в полной зависимости от единственного способа терапевтического воздействия.
Кроме того, настоящее изобретение предусматривает использование источника IgM, полученного из отходящего потока стандартного процесса фракционирования крови, например процесса фракционирования Gamunex компании Grifols.
Таким образом, в первом аспекте настоящее изобретение относится к способу лечения инфекционных заболеваний, включающему введение нуждающемуся в этом пациенту композиции, содержащей IgM, полученный из плазмы крови. Иначе говоря, в одном из воплощений настоящего изобретения предложен способ лечения инфекционного заболевания у субъекта, включающий введение указанному субъекту композиции, содержащей, по существу состоящей из или состоящей из IgM, полученного из плазмы крови, и возможно одного или более эксципиентов в фармацевтическом носителе, где композицию вводят в количестве, эффективном для нейтрализации микробных белковых продуктов у указанного пациента.
Во втором аспекте настоящее изобретение относится к способу нейтрализации секретированных цитотоксических экзотоксинов во время активных микробных инфекций, включающему введение нуждающемуся в этом пациенту композиции, содержащей IgM, полученный из плазмы крови. Иначе говоря, в одном из воплощений настоящего изобретения предложен способ нейтрализации микробных белковых продуктов у субъекта, включающий введение указанному субъекту композиции, содержащей, по существу состоящей из или состоящей из IgM, полученного из плазмы крови, и возможно одного или более эксципиентов в фармацевтическом носителе, где композицию вводят в количестве, эффективном для нейтрализации указанных микробных белковых продуктов.
Указанные цитотоксические экзотоксины могут секретироваться несколькими микроорганизмами, такими как Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus, Klebsiella pneumoniae, Streptococcus pneumoniae, Clostridium difficile, Clostridium botulinum, Aspergillus flavus и их комбинации.
Предпочтительно, композиция, содержащая IgM, полученный из плазмы крови, получена из отходящего потока стандартного процесса фракционирования. IgM, полученный из плазмы крови, имеет чистоту по меньшей мере 70% (масс./об.), более предпочтительно по меньшей мере 90% (масс./об.) и наиболее предпочтительно по меньшей мере 95% (масс./об.).
Также предпочтительно, доза IgM, полученного из плазмы крови, которую вводят, находится в диапазоне от 75 мг до 1 г на килограмм массы тела пациента, предпочтительно от 75 мг/кг до 600 мг/кг, более предпочтительно от 75 мг/кг до 300 мг/кг. Дозу можно вводить в режиме каждый день, через день, 3 раза в неделю или один раз в неделю.
Возможно, композиция IgM, полученного из плазмы крови, дополнительно содержит другие молекулы, выбранные из антибиотиков, имеющих небольшую молекулу, природных или синтетических пептидных противомикробных средств, или белков с противомикробными свойствами, или их комбинаций.
Примерами антибиотиков, имеющих небольшую молекулу, являются ванкомицин и меропенем. Примером белков с противомикробными свойствами является лактоферрин.
В способе по настоящему изобретению композиция IgM, полученного из плазмы крови, может быть использована сама по себе или в комбинации с другими терапевтическими молекулами, выбранными из группы, состоящей из терапевтических молекул, включающих противовоспалительные агенты и иммуномодуляторы.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Воплощения настоящего изобретения ниже будут описаны со ссылкой на графические материалы, в которых:
На Фиг. 1 показана иммунореактивность IgM против Экзотоксина А Р. aeruginosa. Данные по поглощению OD (оптическая плотность) при 450 нм показаны для репрезентативного анализа ELISA (иммуноферментный анализ). Антиген-мишень, Экзотоксин А P. aeruginosa (Р.А. ЕхА), наносили на планшеты для ELISA. Собранную плазму или IgM, очищенный из процесса Gammunex, использовали в качестве источников IgM. Различные разведения этого образца тестировали, как указано, в PBS (забуференный фосфатами физиологический раствор). Контролями являются лунки, которые не были покрыты антигеном (непокрытые). Стандартные отклонения показаны для каждого столбика.
На Фиг. 2А и Фиг. 2В показана нейтрализация цитотоксичности Токсина В С.difficile. Клетки Сасо-2 (полученные из АТСС (Американская коллекция типовых культур)) культивировали в рекомендованной среде для пролиферации. Клетки засевали в 96-луночные планшеты при 8000 клеток на лунку. Через 24 часа после начального посева клетки обрабатывали различными препаратами IgM и/или Токсина В Clostridium difficile, которые описаны в надписях на этих диаграммах. Данные по относительному количеству клеток показаны в единицах RLU (относительные световые единицы), измеренных в анализе Cell Titer Glow (Promega Corp. Madison, WI, USA), который осуществляли согласно инструкциям производителя. Фиг. 2А демонстрирует специфичность нейтрализации Токсина В (Тох В) С.difficile двумя дозами смеси IgG и IgM (концентрация фракции 45% и 70-80% IgM для сплошных черных столбиков и заштрихованных столбиков соответственно, но не для неспецифического контроля, сывороточного альбумина человека (незакрашенный столбик); Фиг. 2В также демонстрирует нейтрализацию Токсина В (ТохВ) С.difficile и спасение жизнеспособности клеток увеличивающимися концентрациями только практически чистого IgM (в микромоль/л или мкМ; сплошной черный столбик).
На Фиг. 3 показана нейтрализация проницаемости Сасо-2, индуцированной токсином С.difficile. Клетки Сасо-2 дифференцировали обычными методами во вставках в многолуночные планшеты Transwell. После 21 суток дифференцировки измеряли трансэпителиальное электрическое сопротивление (TEER) непосредственно перед началом обработок. Только те лунки, которые имели измеренное TEER выше 200, включали в эксперимент. После 16-часовых обработок измеряли TEER для определения влияния обработок на TEER. Контроли (необработанные клетки) были приняты за 100% в качестве клеток сравнения. Группы обработок показаны в виде относительных процентов по сравнению с TEER контрольной группы. Для экспериментов по определению проницаемости с использованием красителя Lucifer Yellow (люциферовый желтый) клетки, имеющие TEER выше 200 и обработанные, как указано на Фиг. 3, инкубировали с раствором Lucifer Yellow (Life Technologies, Grand Island, NY USA) в течение 1 часа при 37°C. Образцы из апикальных и базальных ячеек вставок Transwell оценивали в отношении присутствия Lucifer Yellow. Процент Lucifer Yellow, который проходил через монослой Сасо-2, определяли измерением флуоресценции образцов. Данные по проценту прохождения через монослой Сасо-2 представлены в виде кратного увеличения проницаемости относительно Контролен, которым было присвоено значение 1. Зависимость доза-ответ продемонстрирована по отношению к опосредованной Токсином В (Тох В) С.difficile проницаемости клеток для красителя, Lucifer Yellow (А), или для электрического сопротивления эпителиальных слоев (TEER, смотри выше) (В); в обоих случаях включены данные для контроля без Токсина В (слева на диаграмме). Положительный нейтрализующий эффект совместного введения IgM с Токсином В (Тох В) продемонстрирован в исследовании проницаемости Lucifer Yellow. Для репрезентативной проницаемости на диаграмме (С) контрольный образец (без белка, крайний слева столбик) показывает проницаемость только Lucifer Yellow, а остальные столбики показывают увеличенную проницаемость для Токсина В (Тох В) С.difficile, с или без добавления сывороточного альбумина человека (HSA), но нейтрализующий эффект на Токсин В (Тох В) в присутствии IgM (Фракция С), второй столбик справа). Для репрезентативных измерений трансэпителиального электрического сопротивления (TEER) на диаграмме (D) контрольный образец без белка (крайний слева столбик) демонстрирует нормальное электрическое сопротивление клеточного слоя, которое значительно снижается в присутствии Токсина В (Тох В) С.difficile как без (второй слева столбик), так и с сывороточным альбумином человека (HSA; крайний справа столбик). Восстановление TEER под действием IgM (Фракция С) в присутствии Токсина В (ТохВ) показано на этой диаграмме (Тох В + Frac С; второй справа).
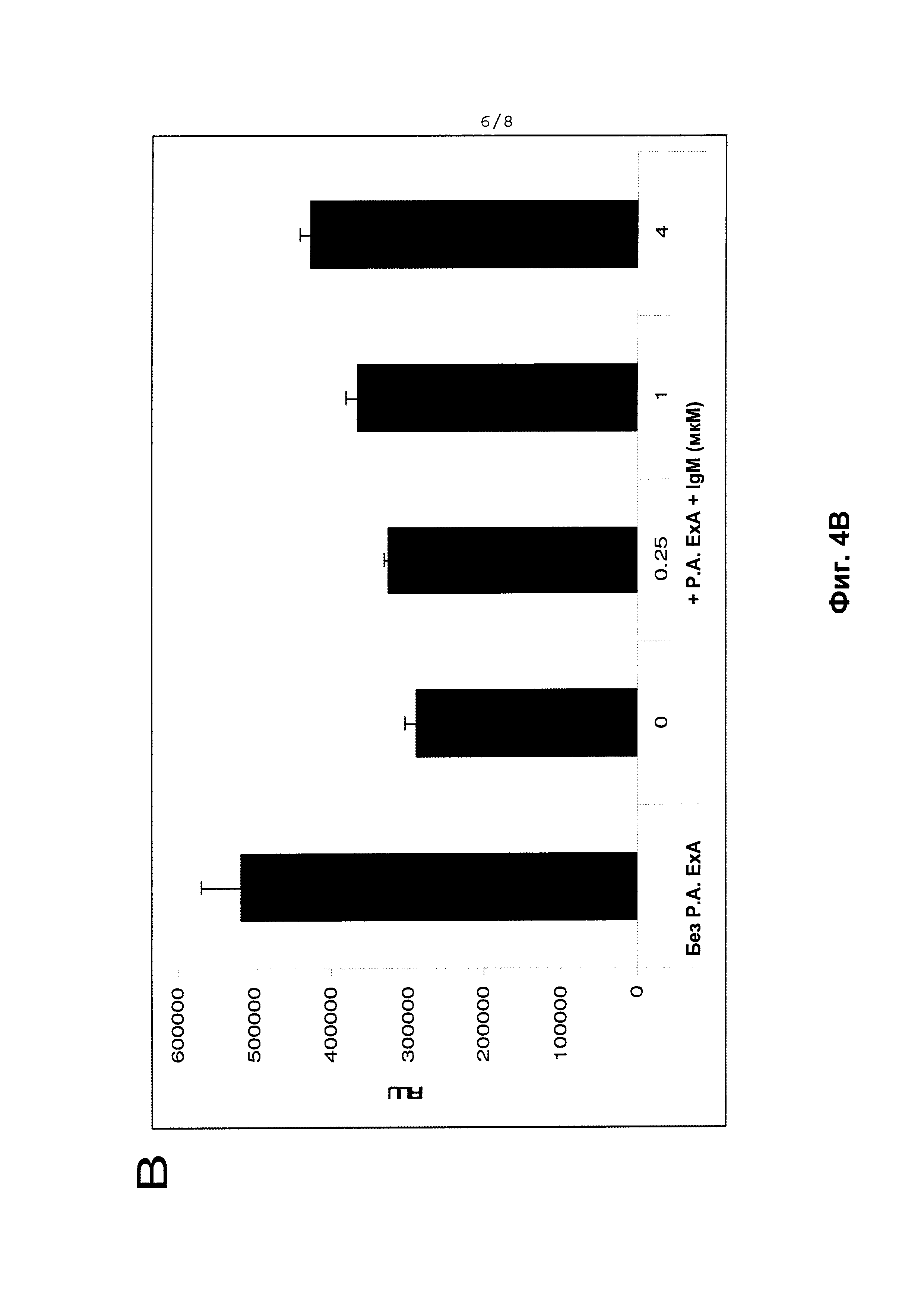
На Фиг. 4А и Фиг. 4В показана нейтрализация цитотоксичности Экзотоксина A Pseudomonas aeruginosa. Клетки Сасо-2 (полученные из АТСС) культивировали в рекомендованной среде для пролиферации. Клетки засевали в 96-луночные планшеты при 4000 клеток на лунку. Через 24 часа после начального посева клетки обрабатывали различными препаратами IgM и/или Экзотоксина A Pseudomonas aeruginosa, как указано в надписях на этих диаграммах. Данные по относительному количеству клеток показаны в виде единиц RLU, измеренных в анализе Cell Titer Glow (Promega Corp. Madison, WI, USA) согласно инструкциям производителя. Фиг. 4А демонстрирует специфичность нейтрализации Экзотоксина А (ЕхА) Pseudomonas двумя разными дозами смеси IgG и IgM (концентрация фракции 45% и 70-80% IgM для сплошных черных столбиков и заштрихованных столбиков соответственно, но не для неспецифического контроля, сывороточного альбумина человека (незакрашенный столбик); Фиг. 4В также демонстрирует нейтрализацию Экзотоксина А (Р.А. ЕхА) Pseudomonas и спасение жизнеспособности клеток увеличивающимися концентрациями только практически чистого IgM (в микромоль/л или мкМ; сплошные черные столбики).
На Фиг. 5 показана нейтрализация эффектов анатоксина Clostridium tetani. Мононуклеарные клетки периферической крови человека культивировали в среде RPMI с 10% инактивированной нагреванием сыворотки человека. Для анализов пролиферации 3x105 клеток засевали в каждую лунку 96-луночного планшета, используя культуральную среду. Клетки обрабатывали так, как описано в надписях на диаграмме. Относительную клеточную пролиферацию определяли анализом Cell Titer Glow (Promega Corp.Madison, WI, USA), который осуществляли согласно инструкциям производителя. Клеточную пролиферацию стандартизировали по отношению к экспериментальному контролю, имеющему значение 1.
На Фиг. 6 показана иммунореактивность IgM в отношении бактерий Pseudomonas aeruginosa, Streptococcus pneumoniae и Klebsiella pneumoniae. Данные по поглощению OD при 450 нм показаны для репрезентативных ELISA на цельных клетках. Антигенами-мишенями были обработанные формальдегидом Pseudomonas aeruginosa (белые столбики), Streptococcus pneumoniae (столбики с диагональными полосками) и Klebsiella pneumoniae (черные столбики), цельные клетки бактерий наносили на планшеты для ELISA. Контроли: покрытые бактериями лунки, инкубированные только с вторичным антителом, или лунки, которые не были покрыты антигеном.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном из воплощений настоящего изобретения предложен способ лечения инфекционного заболевания у субъекта, включающий введение указанному субъекту композиции, содержащей, по существу состоящей из или состоящей из IgM, полученного из плазмы крови, и возможно одного или более эксципиентов в фармацевтическом носителе, где композицию вводят в количестве, эффективном для нейтрализации микробных белковых продуктов у указанного пациента.
В другом воплощении настоящего изобретения предложен способ нейтрализации микробных белковых продуктов у субъекта, включающий введение указанному субъекту композиции, содержащей, по существу состоящей из или состоящей из IgM, полученного из плазмы крови, и возможно одного или более эксципиентов в фармацевтическом носителе, где композицию вводят в количестве, эффективном для нейтрализации указанных микробных белковых продуктов.
В другом воплощении настоящего изобретения предложена композиция, содержащая, по существу состоящая из или состоящая из IgM, полученного из плазмы крови, и возможно одного или более эксципиентов в фармацевтическом носителе. Согласно конкретным воплощениям один или более эксципиентов и/или фармацевтический носитель являются синтетическими, т.е. не встречающимися в природе.
В данном документе "нейтрализация" микробных белковых продуктов относится к ослаблению, предупреждению или устранению токсических эффектов микробных белковых продуктов на субъекта, например к ослаблению, предупреждению или устранению опосредованной экзотоксином токсичности в отношении пациента.
Согласно конкретным воплощениям микробные белковые продукты выбраны из группы, состоящей из экзотоксинов, суперантигенов и секретированных ферментов. Предпочтительно, в число микробных белковых продуктов не входят микробные эндотоксины.
Согласно конкретным воплощениям до введения композиции у субъекта была диагностирована бактериальная инфекция.
Используемый в данном документе термин "фармацевтически приемлемый носитель" относится к разбавителю, вспомогательному веществу, эксципиенту или носителю, с которым вводят IgM, полученный из плазмы крови, по настоящему изобретению. Такие носители могут представлять собой стерильные жидкости, такие как вода и масла, включая масла нефтяного, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и т.п., полипропиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители. Физиологические растворы и водные растворы декстрозы и глицерина также могут быть использованы в качестве жидких носителей, в частности для инъецируемых растворов. Согласно конкретным воплощениям фармацевтически приемлемый носитель является синтетическим (т.е. носителем, не встречающимся в природе).
Не ограничительные примеры подходящих эксципиентов включают крахмал, глюкозу, лактозу, сахарозу, желатин, силикагель, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, глицерин, пропиленгликоль, воду, этанол и т.п. Эксципиенты могут также включать увлажняющие или эмульгирующие агенты; или pH буферные агенты, такие как ацетаты, цитраты или фосфаты; антибактериальные агенты, такие как бензиловый спирт или метилпарабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие агенты, такие как этилендиаминтетрауксусная кислота; и агенты для регулирования тоничности, такие как хлорид натрия или декстроза. Согласно конкретным воплощениям один или более эксципиентов являются синтетическими (т.е. эксципиентами, не встречающимися в природе).
Цитотоксические экзотоксины могут секретироваться несколькими микроорганизмами, такими как Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus, Klebsiella pneumoniae, Streptococcus pneumoniae, Clostridium difficile, Clostridium botulinum, Aspergillus flavus и их комбинации.
Предпочтительно, композиция, содержащая IgM, полученный из плазмы крови, получена из отходящего потока стандартного процесса фракционирования. IgM, полученный из плазмы крови, имеет чистоту по меньшей мере 70% (масс./об.), более предпочтительно по меньшей мере 90% (масс./об.) и наиболее предпочтительно по меньшей мере 95% (масс./об.).
Также предпочтительно, доза IgM, полученного из плазмы крови, которую вводят, находится в диапазоне от 75 мг до 1 г на килограмм массы тела пациента, предпочтительно от 75 мг/кг до 600 мг/кг, более предпочтительно от 75 мг/кг до 300 мг/кг. Дозу можно вводить в режиме каждый день, через день, 3 раза в неделю или один раз в неделю.
Возможно, композиция IgM, полученного из плазмы крови, дополнительно содержит другие молекулы, выбранные из антибиотиков, имеющих небольшую молекулу, природных или синтетических пептидных противомикробных средств, или белков с противомикробными свойствами, или их комбинаций.
Примерами антибиотиков, имеющих небольшую молекулу, являются ванкомицин и меропенем. Примером белков с противомикробными свойствами является лактоферрин.
В способе по настоящему изобретению композиция IgM, полученного из плазмы крови, может быть использована сама по себе или в комбинации с другими терапевтическими молекулами, выбранными из группы, состоящей из терапевтических молекул, включающих противовоспалительные агенты и иммуномодуляторы.
Воплощения, описанные в данном документе, являются иллюстрацией изобретения и не ограничивают его. Специалисту в данной области очевидно, что могут быть произведены модификации воплощений и примеров, приведенных в настоящем описании изобретения, не выходя за рамки объема настоящего изобретения.
Воплощения изобретения описаны выше с использованием термина "содержащая" и его вариантов. Однако согласно замыслу авторов изобретения термин "содержащая" может быть заменен в любом из воплощений, описанных в данном документе, терминами "состоящая из" и "по существу состоящая из" без отклонения от объема изобретения. Если конкретно не указано иное, все числовые значения, приведенные в данном документе, включают вплоть до и включая указанные исходные точки и конечные точки.
Приведенные ниже примеры дополнительно иллюстрируют воплощения изобретения и должны рассматриваться как иллюстративные, а не ограничивающие изобретение.
ПРИМЕРЫ
Пример 1. Иммунореактивность IgM с экзотоксинами, секретированными бактериальными ферментами и суперантигенами
Несколько анализов ELISA были разработаны авторами настоящего изобретения для оценки иммунореактивности по отношению к целому ряду антигенов-мишеней, продуцируемых бактериями P. aeruginosa, Staphilococcus aureus, С.tetani и С.difficile (смотри Таблицу 1). Неожиданно, все белковые экзотоксины и ферменты распознавались иммуноглобулином IgM, полученным из плазмы крови. Наблюдалась положительная реактивность по отношению ко всем оцененным белковым антигенам из этих патогенов. Пример ELISA, показывающий реактивность IgM в очищенном препарате и в плазме крови, представлен на Фиг. 1.

Пример 2. Нейтрализации цитотоксических эффектов Токсина В С.difficile
Главной целью настоящего изобретения было обеспечить доказательство концепции нейтрализации экзотоксинов иммуноглобулином IgM. Поскольку С.difficile представляет собой интестинальную инфекцию, она была выбрана, чтобы использовать для исследований физиологически релевантную клеточную линию. Клетки Сасо-2 представляют собой линию эпителиальных колоректальных клеток, обычно используемых для исследований интестинальной проницаемости. Клеточная линия Сасо-2 была создана для использования в анализах цитотоксичности. Время инкубирования и концентрации Токсина В С.difficile были оптимизированы (данные не показаны). Инкубирование Токсина В в течение 24 часов не показало никакой токсичности, и по мере увеличения времени инкубирования цитотоксичность также увеличивалась. Дополнительно, авторами изобретения было установлено, что 25 нг/мл дают наивысшее аналитическое окно токсичности через 48 часов и показывают плато в этой точке. Заключительные условия анализа были установлены при 15 нг/мл Токсина В при инкубировании в течение 48 часов с пролифирирующими клетками. Используя эти условия, нейтрализацию токсина фракциями очистки, обогащенными IgM, оценивали и сравнивали, а также очищенным IgM (Фиг. 2). Фракция А содержит 40-50% IgM, и Фракция В содержит 70-80% IgM. HSA не оказывал влияния на токсичность Токсина В, тогда как 2 разные фракции, содержащие IgM, нейтрализовали токсин (Фиг. 2А). Также было показано, что очищенный IgM (≥95% IgM), эффективен в нейтрализации Токсина В С.difficile (Фиг.2 В). Несомненно, имеет место нейтрализация антител к С.difficile во Фракции А, Фракции Вив очищенном IgM.
Пример 3. Нейтрализация проницаемости, индуцированной Токсином В С.difficile
Как указано в предыдущем примере, клетки Сасо-2 являются хорошо охарактеризованной моделью интестинального эпителиального транспорта и проницаемости. Одним из известных последствий токсинов С.difficile является интестинальная проницаемость. Чтобы протестировать, могут ли фракции очистки, содержащие IgM, нейтрализовать эффект этого токсина, была создана линия клеток Сасо-2 для использования в качестве модели интестинальной проницаемости. В этой модели клетки Сасо-2 дифференцируются в монослое на луночной вставке с проницаемой мембраной в течение 21 суток. После дифференцировки проницаемость можно контролировать путем измерения способности флуоресцентных небольших молекул (Lucifer Yellow в этом случае) проходить через клеточный монослой и использования метода TEER (трансэпителиальное электрическое сопротивление) для измерения электрического сопротивления монослоя. При увеличении проницаемости клеток количество Lucifer Yellow, обнаруженного на базолатеральной стороне мембраны, также увеличивается. В показателях электрического сопротивления клетки с более высокой проницаемостью имеют более низкое сопротивление. Чтобы показать, что эти различия могут быть измерены, определяли зависимость доза-ответ для Токсина В С.difficile (Фиг. 3А и Фиг. 3В). Как способность красителя Lucifer Yellow проходить через монослой, так и электрическое сопротивление монослоя имели должные соответствующие изменения в ответ на увеличение доз Токсина В. Тестировали способность Фракции С (обогащенной до 90-95% IgM) нейтрализовать опосредованную Токсином В проницаемость. Фракцию С и Токсин В предварительно инкубировали в течение 1 ч, чтобы дать возможность IgM связаться с токсином. После предварительного инкубирования клетки обрабатывали смесью Фракции С и Токсина В в течение 16 часов. После этого 16-часового периода проницаемость клеток оценивали по диффузии Lucifer Yellow через монослой (Фиг. 3С) и по TEER монослоя (Фиг. 3D). По результатам анализов обоими методами Фракция С обеспечивала защиту от Токсина В, тогда как HSA не оказывал никакого влияния на Токсин В. Краситель Lucifer Yellow полностью изменял направление движения на обратное, в то время как сопротивление показало только частичное спасение. Это может быть следствием того, что метод анализа TEER является более чувствительным, чем метод анализа с использованием красителя Lucifer Yellow.
Пример 4. Нейтрализация цитотоксических эффектов Экзотоксина А Pseudomonas aeruginosa
Учитывая положительные данные от клеток Сасо-2 с нейтрализацией Токсина В С.difficile, подобный анализ в Сасо-2 был разработан для тестирования Экзотоксина A Pseudomonas aeruginosa. Когда оценивали Фракцию А или Фракцию В в этой модели, наблюдалась нейтрализация Экзотоксина А (Фиг. 4А). Интересно, что противоположные результаты были обнаружены с Экзотоксином А относительно эффективности фракций по сравнению с Токсином В С.difficile; Фракция А была более эффективной, чем Фракция В, для нейтрализации Экзотоксина А. Кроме того, наблюдалась также нейтрализация цитотоксичности Экзотоксина A Pseudomonas aeruginosa с использованием очищенного IgM (Фиг. 4В).
Пример 5. Нейтрализация анатоксина Clostridium tetani
Столбнячный токсин является сильнодействующим нейротоксином, который блокирует высвобождение GABA (гамма-аминомасляная кислота). Большинство индивидуумов в Соединенных штатах вакцинированы против столбняка. В качестве модели нейтрализации столбнячного токсина использовали нетоксичный анатоксин из столбнячного токсина, чтобы оценить, может ли очищенный IgM нейтрализовать этот белок. Было показано антигенное связывание IgM с анатоксином столбняка (смотри Таблицу 1). Так как этот анатоксин не блокирует высвобождение GABA, нейтрализующий эффект IgM оценивали по пролиферации мононуклеарных клеток периферической крови (РВМС). Известно, что стимуляция антигенов TCR (Т-клеточный рецептор) может индуцировать пролиферацию Т-клеток, и столбняк является известным стимулятором для этой пролиферации. Поэтому тестировали индуцированную анатоксином столбняка пролиферацию РВМС в присутствии и в отсутствие IgM (Фиг. 5). Наблюдалось 3-кратное увеличение количества клеток в присутствии только анатоксина столбняка, тогда как совместная обработка иммуноглобулином IgM почти полностью блокировала этот эффект при 2,5 мкМ и показала полное ингибирование при 5 мкМ.
Пример 6. IgM обладает способностью распознавания антигенов различных микробов
Для лучшего понимания разнообразия различных мишеней выполняли ряд ELISA-анализов. Различные коммерчески доступные наборы для ELISA использовали для детектирования реактивности с бактериальными и вирусными патогенами. Дополнительно, использовали ELISA-анализы, в которых цельные, убитые нагреванием или обработанные формальдегидом микробы наносили на планшеты для ELISA. Это дает возможность оценивать реактивность против "глобальных" антигенов-мишеней, продуцируемых микробами. Результаты всех ELISA и ELISA на основе цельных клеток суммированы в Таблице 2, и из этих результатов можно сделать вывод, что IgM обладает способностью убиквитарного распознавания антигенов. Пример данных ELISA по реактивности IgM в ELISA на цельных клетках с использованием бактерий Pseudomonas aeruginosa, Streptococcus pneumoniae и Klebsiella pneumonia, представлен на Фиг. 6.


Реферат
Группа изобретений относится к медицине и касается способа нейтрализации секретированных цитотоксических экзотоксинов во время активных микробных инфекций у субъекта, включающего введение указанному субъекту композиции, содержащей природный полученный из плазмы крови IgM (иммуноглобулин М), полученный из отходящего потока процесса фракционирования крови, в фармацевтическом носителе, где композицию вводят в количестве, эффективном для нейтрализации указанных секретированных цитотоксических экзотоксинов, и где эти цитотоксические экзотоксины секретируются микроорганизмами,и их комбинациями. Группа изобретений также касается способа лечения инфекционного заболевания, вызываемого микроорганизмами,и их комбинациями, у субъекта, включающего введение указанному субъекту композиции, содержащей природный полученный из плазмы крови IgM, полученный из отходящего потока процесса фракционирования крови, в фармацевтическом носителе; применения указанной композиции для лечения состояния, связанного с цитотоксическими экзотоксинами, секретированными микроорганизмами,и их комбинациями, во время активных микробных инфекций. Группа изобретений обеспечивает лечение инфекционного заболевания, вызываемого микроорганизмами,и их комбинациями. 3 н. и 21 з.п. ф-лы, 6 ил., 2 табл., 6 пр.

Комментарии