Способы повышения эффективности противоопухолевого иммунного ответа - RU2689162C2
Код документа: RU2689162C2
Чертежи












Описание
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Больные раком, как правило, демонстрируют адаптивный иммунный ответ против различных опухолевых антигенов. Несмотря на наличие такого противоопухолевого иммунного ответа, во многих случаях иммунный ответ пациента является недостаточным для блокирования роста опухоли и продления выживаемости. Противораковые вакцины исходно разрабатывали для повышения собственного иммунного ответа пациента. На сегодняшний день терапевтический потенциал таких противораковых вакцин не был реализован. Соответственно, крайне необходимы способы повышения эффективности противоопухолевого иммунного ответа.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Как описано ниже, в настоящем изобретении представлены способы повышения эффективности противоопухолевого иммунного ответа путем введения агониста OX40 и ингибитора индоламин-2,3-диоксигеназы (IDO) вместе с опухолевым антигеном. Опухолевый антиген может присутствовать в противораковой вакцине или может высвобождаться из опухоли, имеющейся у субъекта, например, путем индукции апоптоза опухолевой клетки. Апоптоз опухолевых клеток можно индуцировать любым способом, известным из уровня техники (например, лучевой терапией, химиотерапией).
В одном аспекте настоящего изобретения представлен способ повышения у субъекта иммунного ответа против опухолевого антигена, при этом способ включает применение по отношению к субъекту агониста OX40 (например, агониста OX40, представляющего собой антитело), ингибитора индоламин-2,3-диоксигеназы (IDO) (например, 1MT) и иммуногенной композиции, содержащей опухолевый антиген (например, противораковую вакцину), повышая тем самым у субъекта иммунный ответ против опухолевого антигена по сравнению с применением иммуногенной композиции отдельно.
В другом аспекте настоящего изобретения представлен способ замедления или уменьшения (например, по меньшей мере на приблизительно 10%, 20%, 30%, 40%, 50%, 75%, 80%, 90% или 100%) роста опухоли у субъекта, при этом способ включает применение по отношению к субъекту агониста OX40, ингибитора индоламин-2,3-диоксигеназы (IDO) и иммуногенной композиции, содержащей опухолевый антиген, замедляя или уменьшая тем самым рост опухоли у субъекта по сравнению с необработанным контрольным субъектом.
В другом аспекте настоящего изобретения представлен способ повышения у субъекта иммунного ответа против опухолевого антигена, при этом способ включает применение по отношению к субъекту лучевой терапии или химиотерапевтического средства (например, антрациклинов (например, даунорубицина, доксорубицина, эпирубицина, идарубицина и вальрубицина) или оксалиплатина), достаточных для индукции апоптоза опухолевых клеток, агониста OX40 и ингибитора индоламин-2,3-диоксигеназы (IDO), повышая тем самым у субъекта иммунный ответ против опухолевого антигена по сравнению с применением лучевой терапии или антрациклина отдельно.
В другом аспекте настоящего изобретения представлен способ замедления или уменьшения роста опухоли у субъекта, при этом способ включает применение по отношению к субъекту лучевой терапии или химиотерапевтического средства (например, антрациклинов (например, даунорубицина, доксорубицина, эпирубицина, идарубицина и вальрубицина) или оксалиплатина), достаточных для индукции апоптоза опухолевых клеток, агониста OX40 и ингибитора индоламин-2,3-диоксигеназы (IDO), замедляя или уменьшая тем самым рост опухоли у субъекта по сравнению с необработанным контрольным субъектом.
В другом аспекте настоящего изобретения представлен способ повышения соотношения CD8+ T-клеток и регуляторных T-клеток в опухоли у субъекта, при этом способ включает применение по отношению к субъекту эффективного количества агониста OX40, ингибитора индоламин-2,3-диоксигеназы (IDO) и иммуногенной композиции, содержащей опухолевый антиген, увеличивая тем самым соотношение CD8/Treg в опухоли.
В другом аспекте настоящего изобретения представлен способ увеличения соотношения CD8+ T-клеток и регуляторных T-клеток в опухоли у субъекта, при этом способ включает применение по отношению к субъекту лучевой терапии или химиотерапевтического средства (например, антрациклинов (например, даунорубицина, доксорубицина, эпирубицина, идарубицина и вальрубицина) или оксалиплатина), достаточных для индукции апоптоза опухолевых клеток, эффективного количества агониста OX40 и ингибитора индоламин-2,3-диоксигеназы (IDO), увеличивая тем самым соотношение CD8/Treg в опухоли.
В другом аспекте настоящего изобретения представлен способ повышения у субъекта иммунного ответа против опухолевого антигена HPV, при этом способ включает применение по отношению к субъекту агониста OX40, представляющего собой антитело, которое связывает тот же самый эпитоп OX40, что и mAb 9B12, 1-MT и иммуногенной композиции, содержащей антиген HPV16 и адъювант, повышая тем самым у субъекта иммунный ответ против опухолевого антигена по сравнению с применением иммуногенной композиции отдельно.
В другом аспекте настоящего изобретения представлен способ лечения у субъекта рака, связанного с HPV, при этом способ включает применение по отношению к субъекту агониста OX40, представляющего собой антитело, которое связывает тот же самый эпитоп OX40, что и mAb 9B12, 1-MT и иммуногенной композиции, содержащей антиген HPV16 и адъювант, осуществляя тем самым лечение связанного с HPV рака у субъекта.
В различных вариантах осуществления указанных выше аспектов или любых других аспектов настоящего изобретения, описанных в данном документе, способ увеличивает (например, по меньшей мере на приблизительно 5%, 10%, 20%, 30% или более) соотношение CD8+ T-клеток и регуляторных T-клеток в опухоли у субъекта. В других вариантах осуществления указанных выше аспектов количество применяемого агониста OX40 является достаточным для увеличения соотношения CD8+ T-клеток и регуляторных T-клеток в опухоли у субъекта. В других вариантах осуществления указанных выше аспектов количество применяемого агониста OX40 является достаточно низким для того, чтобы не увеличивать у субъекта количество Treg-клеток, инфильтрирующих опухоль. В еще одних вариантах осуществления указанных выше аспектов применение увеличивает у субъекта (например, по меньшей мере на приблизительно 10%, 25%, 50%, 75% или 100%) противоопухолевый иммунный ответ по сравнению с применением иммуногенной композиции отдельно. В других вариантах осуществления указанных выше аспектов ингибитор индоламин-2,3-диоксигеназы (IDO) представляет собой 1-метилтриптофан (1-MT), D-изомер 1-метилтриптофана или NLG919. В других вариантах осуществления указанных выше аспектов агонист OX40 специфически связывает OX40. В других вариантах осуществления указанных выше аспектов агонист OX40 представляет собой антитело, которое специфически связывает OX40, или его антиген-связывающий фрагмент. В других вариантах осуществления указанных выше аспектов антитело или его антиген-связывающий фрагмент представляет собой моноклональное антитело, химерное антитело или гуманизированное антитело. В других вариантах осуществления указанных выше аспектов антитело или его антиген-связывающий фрагмент связывает тот же самый эпитоп OX40, что и mAb 9B12. В других вариантах осуществления указанных выше аспектов опухолевый антиген представляет собой какое-либо одно или несколько из альфа-фетопротеина, канцероэмбрионального антигена, cdk4, бета-катенина, CA125, каспазы-8, эпителиального опухолевого антигена, антигена HPV, антигена HPV16, эпитопа CTL из антигена E7 HPV16, ассоциированного с меланомой антигена (MAGE)-1, MAGE-3, тирозиназы, идиотипа поверхностного Ig, Her-2/neu, MUC-1, специфического антигена предстательной железы (PSA), сиалил-Tn (STn), белков теплового шока, gp96, молекул ганглиозида GM2, GD2, GD3, канцероэмбрионального антигена (CEA) и MART-1. В других вариантах осуществления указанных выше аспектов количество опухолевого антигена, присутствующее в иммуногенной композиции, является достаточным для индукции у субъекта противоракового иммунного ответа. В других вариантах осуществления указанных выше аспектов введение иммуногенной композиции стимулирует у субъекта активность Т-лимфоцитов. В других вариантах осуществления указанных выше аспектов иммуногенная композиция дополнительно содержит адъювант. В других вариантах осуществления указанных выше аспектов у субъекта имеется рак, выбранный из группы, состоящей из HPV-ассоциированного рака, рака шейки матки, рака полового члена, рака анального канала, плоскоклеточной карциномы головы и шеи и рака вульвы. В других вариантах осуществления указанных выше аспектов способ увеличивает выживаемость субъекта по меньшей мере на 10%, 20% или 30% или более по сравнению с субъектом, по отношению к которому применяли только иммуногенную композицию. В других вариантах осуществления указанных выше аспектов способ уменьшает рост опухоли по меньшей мере на приблизительно 20% по сравнению с ростом опухоли у необработанного контрольного субъекта или индуцирует регрессию опухоли. В других вариантах осуществления указанных выше аспектов субъектом является пациент-человек. В других вариантах осуществления указанных выше аспектов иммуногенная композиция представляет собой противораковую вакцину.
Другие признаки и преимущества настоящего изобретения будут очевидны из подробного описания и формулы изобретения.
Определения
Если не определено иначе, все технические и научные термины, используемые в данном документе, имеют значение, обычно понятное специалисту в данной области, к которой принадлежит настоящее изобретение. Следующие литературные источники предлагают специалисту общее определение многих терминов, используемых в настоящем изобретении: Singleton et al., Dictionary of Microbiology and Molecular Biology (2nd ed. 1994); The Cambridge Dictionary of Science and Technology (Walker ed., 1988); The Glossary of Genetics, 5th Ed., R. Rieger et al. (eds.), Springer Verlag (1991) и Hale & Marham, The Harper Collins Dictionary of Biology (1991). Используемые в данном документе следующие термины имеют значения, приписываемые им ниже, если не указано иначе.
"OX40" означает представителя TNFR-суперсемейства рецепторов, которые экспрессируются на поверхности активированных антигеном CD4+ и CD8+ T-лимфоцитов и регуляторных T-лимфоцитов млекопитающих. Смотри, например, Paterson D.J., et al. Mol Immunol 24, 1281-1290 (1987); Mallett S. et al. EMBO J 9, 1063-1068 (1990); и Calderhead D.M. et al. J Immunol 151, 5261-5271 (1993)). Термины ʺOX40ʺ и ʺрецептор OX40ʺ используются взаимозаменяемо в данном документе. OX40 также упоминается как CD134, TNFRSF4, ACT-4 и ACT35. Последовательности рецептора OX40 известны из уровня техники и представлены, например, под номерами доступа в GenBank: AAB33944 или CAE11757.
Иллюстративная последовательность OX40 человека приведена ниже:
1 mcvgarrlgr gpcaallllg lglstvtglh cvgdtypsnd rcchecrpgn gmvsrcsrsq
61 ntvcrpcgpg fyndvvsskp ckpctwcnlr sgserkqlct atqdtvcrcr agtqpldsyk
121 pgvdcapcpp ghfspgdnqa ckpwtnctla gkhtlqpasn ssdaicedrd ppatqpqetq
181 gpparpitvq pteawprtsq gpstrpvevp ggravaailg lglvlgllgp laillalyll
241 rrdqrlppda hkppgggsfr tpiqeeqada hstlaki
Под термином "лиганд OX40" подразумевается белок, который специфично взаимодействует с рецептором OX40. Смотри, например, Baum P.R. et al. EMBO J. 13:3992-4001(1994)). Лиганд OX40 также упоминается как CD252, CD143L, gp34 и TNFSF4. Термин OX40L включает в себя полный лиганд OX40, растворимый лиганд OX40 и белки слияния, содержащие функционально активную часть лиганда OX40, ковалентно связанную со вторым фрагментом, например, белковым доменом. В определение OX40L также включены варианты, которые отличаются по аминокислотной последовательности от встречающихся в природе OX4L, но сохраняют способность специфично связываться с рецептором OX40. В определение OX40L дополнительно включены варианты, которые повышают биологическую активность OX40.
Под термином "агонист Ox40" подразумевается молекула, которая специфично взаимодействует и увеличивает или повышает биологическую активность рецептора OX40. Желательно, чтобы биологическая активность увеличивалась по меньшей мере на приблизительно 10%, 20%, 30%, 50%, 70%, 80%, 90%, 95% или даже 100%. В определенных аспектах агонисты OX40, раскрываемые в данном документе, включают OX40-связывающие полипептиды, такие как антитела к OX40 (например, агонисты OX40, представляющие собой антитело), лиганды OX40 или фрагменты или производные этих молекул.
Под выражением "антитело к OX40" подразумевается антитело, которое специфично связывает OX40. Антитела к OX40 включают моноклональные и поликлональные антитела, которые являются специфичными для OX40, и их антиген-связывающие фрагменты. В определенных аспектах антитела к OX40, описываемые в данном документе, представляют собой моноклональные антитела (или их антиген-связывающие фрагменты), например, мышиные, гуманизированные или полные человеческие моноклональные антитела. В одном конкретном варианте осуществления антитело к OX40 представляет собой агонист рецептора OX40, такой как мышиное моноклональное антитело к OX40 человека (9B12), описанное в Weinberg A.D. et al. J Immunother 29, 575-585 (2006). В других вариантах осуществления антитело, которое специфично связывается с OX40, или его антиген-связывающий фрагмент, связываются с тем же самым эпитопом OX40, что и mAb 9B12.
Под термином "антитело" подразумевается молекула иммуноглобулина, которая распознает мишень и специфично с ней. Используемый в данном документе термин "антитело" охватывает интактные поликлональные антитела, интактные моноклональные антитела, фрагменты антител (такие как Fab, Fab', F(ab')2 и Fv-фрагменты), одноцепочечные Fv (scFv) мутанты, полиспецифические антитела, такие как биспецифические антитела, полученные из по меньшей мере двух интактных антител, химерные антитела, гуманизированные антитела, человеческие антитела, гибридные белки, содержащие антиген-распознающую часть антитела, и любую другую модифицированную молекулу иммуноглобулина, содержащую сайт распознавания антигена, при условии, что антитела проявляют необходимую биологическую активность. Антитело может быть любыим из пяти основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM или их подклассов (изотипов) (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2), исходя из идентичности их константных доменов тяжелой цепи, обозначаемых как альфа, дельта, эпсилон, гамма и мю соответственно. Разные классы иммуноглобулинов характеризуются разными и хорошо известными структурами субъединиц и пространственными конфигурациями.
Выражение "уменьшить интенсивность" означает снизить, подавить, ослабить, уменьшить, задержать или стабилизировать развитие или прогрессирование заболевания.
Под термином "антиген-связывающий фрагмент" подразумевается часть интактного антитела, которая связывает антиген. В частности, выражение антиген-связывающий фрагмент относится к вариабельным участкам интактного антитела, распознающим антиген. Антиген-связывающая функция антитела может быть реализована фрагментами полноразмерного антитела. Примеры фрагментов антитела включают без ограничения Fab, Fab', F(ab')2 и Fv-фрагменты, линейные антитела, одноцепочечные антитела и полиспецифические антитела, образованные из фрагментов антитела.
Под термином "рак" подразумевается заболевание или нарушение, характеризующееся избыточной пролиферацией или сниженным апоптозом. Иллюстративные формы рака, для которых можно использовать настоящее изобретение, включают без ограничения лейкозы (например, острый лейкоз, острый лимфолейкоз, острый миелолейкоз, острый миелобластный лейкоз, острый промиелоцитарный лейкоз, острый миеломоноцитарный лейкоз, острый моноцитарный лейкоз, острый эритролейкоз, хронический лейкоз, хронический миелолейкоз, хронический лимфолейкоз), истинную полицитемию, лимфому (болезнь Ходжкина, неходжкинскую лимфому), макроглобулинемию Вальденстрема, болезнь тяжелых цепей и солидные опухоли, такие как саркомы и карциномы (например, фибросаркома, миксосаркома, липосаркома, хондросаркома, остеогенная саркома, хордома, ангиосаркома, эндотелиосаркома, лимфангиосаркома, лимфангиоэндотелиосаркома, синовиома, мезотелиома, опухоль Юинга, лейомиосаркома, рабдомиосаркома, карцинома толстого кишечника, рак поджелудочной железы, рак молочной железы, рак яичников, рак предстательной железы, плоскоклеточный рак, базально-клеточная карцинома, аденокарцинома, карцинома потовых желез, карцинома сальных желез, папиллярная карцинома, папиллярные аденокарциномы, цистаденокарцинома, медуллярная карцинома, бронхогенная карцинома, почечно-клеточная карцинома, гепатома, карцинома желчных протоков, хориокарцинома, семинома, эмбриональная карцинома, опухоль Вильмса, рак шейки матки, рак матки, рак яичка, карцинома легкого, мелкоклеточная карцинома легкого, карцинома мочевого пузыря, эпителиальная карцинома, глиома, мультиформная глиобластома, астроцитома, медуллобластома, краниофарингиома, эпендимома, пинеалома, гемангиобластома, невринома слухового нерва, олигодендроглиома, шваннома, менингиома, меланома, нейробластома и ретинобластома).
Под термином "химерное антитело" подразумевается антитело, в котором аминокислотная последовательность молекулы иммуноглобулина получена от двух или более видов. Как правило, вариабельный участок как легкой, так и тяжелой цепей соответствует вариабельному участку антител, полученных от одного вида млекопитающих (например, мыши, крысы, кролика и т. д.) с требуемой специфичностью, аффинностью и функциональной способностью, в то время как константные участки гомологичны последовательностям антител, полученным от другого (обычно человека), чтобы избежать вызова иммунного ответа у тех видов.
В настоящем раскрытии "содержит", "содержащий", "заключающий", а также "имеющий" и подобные могут иметь значение, приписываемое им в патентном законодательстве США, и могут означать "включает", "включающий" и подобное; аналогично, "состоящий по сути из" и "состоит по сути" имеют значения, приписываемые в патентном законодательстве США, и термин является неограничивающим, допускающим наличие не только того, что упоминается, при условии, что основные или новые характеристики того, что упоминается, не изменяются благодаря наличию не только того, что упоминается, но исключает варианты осуществления из предшествующего уровня техники.
"Выявление" относится к определению наличия, отсутствия или количества анализируемого компонента, подлежащего выявлению.
Под выражением "эффективное количество" подразумевается количество средства, описанного в данном документе (например, агониста OX40), необходимого для уменьшения интенсивности симптомов заболевания по сравнению с нелеченным пациентом. Эффективное количество такого средства, используемого в практике настоящего изобретения для терапевтического лечения заболевания, варьирует в зависимости от способа введения, возраста, массы тела и общего состояния здоровья субъекта. В конечном итоге, лечащий врач или ветеринар будет определять соответствующее количество и режим дозирования. Такое количество обозначается как "эффективное" количество.
Под термином "фрагмент" подразумевается часть полипептида или молекулы нуклеиновой кислоты. Данная часть содержит, предпочтительно, по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% полной длины референтной молекулы нуклеиновой кислоты или полипептида. Фрагмент может содержать 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 нуклеотидов или аминокислот.
Под термином "гуманизированное антитело" подразумевается антитело, полученное из не являющегося человеческим иммуноглобулина, которое было сконструировано таким образом, чтобы содержать последовательности человека. Как правило, гуманизированные антитела представляют собой иммуноглобулины человека, в которых остатки определяющего комплементарность участка (CDR) заменены остатками CDR видов, отличных от человека (например, мыши, крысы, кролика или хомяка), которые характеризуются требуемой специфичностью, аффинностью и функциональной способностью (Jones et al., 1986, Nature, 321:522-525; Riechmann et al., 1988, Nature, 332:323-327; Verhoeyen et al., 1988, Science, 239:1534-1536). В ряде случаев остатки каркасного участка (FW) Fv иммуноглобулина человека заменены соответствующими остатками антитела из видов, отличных от человека, которые характеризуются необходимой специфичностью, аффинностью и функциональной способностью.
Гуманизированные антитела можно дополнительно модифицировать посредством замены дополнительных остатков в каркасном участке Fv и/или в замененных, не относящихся к человеческим остатках для усовершенствования и оптимизации специфичности, аффинности и/или функциональной способности антитела. Как правило, гуманизированное антитело будет включать практически все из по меньшей мере одного, а, как правило, двух или трех вариабельных доменов, содержащих все или практически все из CDR-участков, которые соответствуют таковым у иммуноглобулина, отличного от иммуноглобулина человека, тогда как все или практически все из FW-участков являются таковыми из консенсусной последовательности иммуноглобулина человека. Гуманизированное антитело может также содержать по меньшей мере часть константного участка или домена (Fc) иммуноглобулина, как правило, иммуноглобулина человека. Примеры способов, используемых для получения гуманизированных антител, описаны в патентах США №№ 5225539 или 5639641.
Используемое в данном документе выражение "антитела человека" или "полные антитела человека" включает антитела, имеющие аминокислотную последовательность иммуноглобулина человека, и включает антитела, выделенные из библиотек иммуноглобулинов человека или из животных, трансгенных по одному или нескольким иммуноглобулинам человека и не экспрессирующих эндогенные иммуноглобулины, как описано ниже и, например, в патенте США № 5939598 от Kucherlapati et al. Выражение "антитела человека" или "полные антитела человека" также включает антитела, содержащие по меньшей мере вариабельный домен тяжелой цепи или по меньшей мере вариабельные домены тяжелой цепи и легкой цепи, где вариабельный домен (домены) имеет аминокислотную последовательность вариабельного домена (доменов) иммуноглобулина человека.
Выражение "антитела человека" или "полные антитела человека" также включает антитела, которые содержат, состоят по существу из или состоят из вариантов (в том числе, производных). Для введения мутаций в нуклеотидную последовательность, кодирующую антитело человека, можно использовать стандартные методики, известные специалистам в данной области, включая без ограничений сайт-направленный мутагенез и ПЦР-опосредованный мутагенез, которые приводят в результате к аминокислотным заменам. Предпочтительно, варианты (включая производные) кодируют менее 50 аминокислотных замен, менее 40 аминокислотных замен, менее 30 аминокислотных замен, менее 25 аминокислотных замен, менее 20 аминокислотных замен, менее 15 аминокислотных замен, менее 10 аминокислотных замен, менее 5 аминокислотных замен, менее 4 аминокислотных замены, менее 3 аминокислотных замены или менее 2 аминокислотных замены по сравнению с реферетным VH-участком, VHCDR1, VHCDR2, VHCDR3, VL-участком, VLCDR1, VLCDR2 или VLCDR3.
Под термином "иммуногенная композиция" подразумевается композиция, содержащая антиген, способный индуцировать иммунный ответ при введении субъекту. Антиген (включая опухолевый антиген), как правило, предоставляется в фармацевтически приемлемом вспомогательном веществе. При необходимости иммуногенная композиция содержит адъювант. В конкретных вариантах осуществления опухолевый антиген обеспечивается путем индуцирования апоптоза опухоли in situ, высвобождая тем самым опухолевые антигены, способные индуцировать иммунный ответ против опухоли.
Под термином "моноклональное антитело" подразумевается гомогенное антитело, вовлеченное в высокоспецифичное распознавание и связывание одной антигенной детерминанты или эпитопа. Этим они отличаются от поликлональных антител, которые, как правило, включают разные антитела, направленные против разных антигенных детерминант. Термин "моноклональное антитело" охватывает как интактные, так и полноразмерные моноклональные антитела, а также фрагменты антитела (такие как Fab, Fab', F(ab')2, Fv), одноцепочечные (scFv) мутанты, белки слияния, содержащие часть антитела, и любую другую модифицированную молекулу иммуноглобулина, содержащую сайт распознавания антигена. Кроме того, "моноклональное антитело" относится к таким антителам, которые получены любым из ряда способов, в том числе без ограничения посредством гибридомы, отбора с помощью фагового дисплея, рекомбинантной экспрессии и с использованием трансгенных животных.
Под выражением "повышать" подразумевается положительное изменение по меньшей мере на 10%, 25%, 50%, 75% или 100%.
Под "референтным" подразумевается стандартное или контрольное условие.
Под "специфично связывает" подразумевается соединение или антитело, которое распознает и связывает полипептид по настоящему изобретению, но по сути не распознает и не связывает другие молекулы в образце, например, биологическом образце, который в естественных условиях содержит полипептид по настоящему изобретению.
Под "субъектом" подразумевается млекопитающее, в том числе без ограничения человек или отличное от человека млекопитающее, такое как корова, лошадь, собака, овца или кошка.
"Вариабельный участок" антитела относится к вариабельному участку легкой цепи антитела или вариабельному участку тяжелой цепи антитела либо по отдельности, либо в комбинации. Каждые из вариабельных участков тяжелой и легкой цепей состоят из четырех каркасных участков (FW), соединенных тремя определяющими комплементарность участками (CDR), также известными как гипервариабельные участки. В каждой цепи CDR удерживаются в непосредственной близости с помощью FW-участков и вместе с CDR из другой цепи участвуют в образовании антиген-связывающего участка антител. Существует по меньшей мере две методики определения CDR: (1) подход, основанный на межвидовой вариабельности последовательностей (т. е. Kabat et al. Sequences of Proteins of Immunological Interest, (5th ed., 1991, National Institutes of Health, Bethesda Md.)); и (2) подход, основанный на кристалографических исследованиях комплексов антиген-антитело (Al-lazikani et al. (1997) J. Molec. Biol. 273:927-948)). Кроме того, для определения CDR в данной области иногда используют комбинации этих двух подходов.
Диапазоны, предусмотренные в данном документе, понимают как сокращенную запись всех значений в пределах диапазона. Например, понимают, что диапазон от 1 до 50 включает любое число, комбинацию чисел или поддиапазон из группы, состоящей из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 или 50.
Используемые в данном документе выражения "лечить", "осуществление лечения", "лечение" и им подобные относятся к снижению или облегчению нарушения и/или ассоциированных с ним симптомов. Будет понятно, что при проведении лечения нарушения или состояния не требуется, чтобы нарушение, состояние или ассоциированные с ними симптомы полностью устранялись, хоть это и не исключается.
Субъект успешно "проходит лечение", если он демонстрирует одно или несколько из следующих: уменьшение количества или полное отсутствие раковых клеток; уменьшение размера опухоли; стабилизацию, замедление роста опухоли или обратное ее развитие, ингибирование роста опухоли, которое включает в себя, например, подавление, предупреждение, замедление, сокращение или обратное развитие метастазов (например, ингибирование инфильтрации раковых клеток в периферические органы, включая, например, распространение рака в мягкие ткани и кости); облегчение тяжести одного или нескольких симптомов, ассоциированных с раком; снижение заболеваемости и смертности; улучшение качества жизни или какую-либо комбинацию этих эффектов.
Благоприятные или желаемые клинические результаты включают без ограничения облегчение симптомов, уменьшение степени заболевания, стабилизированное (т.е. не ухудшающееся) состояние заболевания, задержку или замедление прогрессирования заболевания, улучшение или временное облегчение болезненного состояния и ремиссию (либо частичную, либо полную), независимо от того, поддается она обнаружению или нет. "Лечение" может также означать продление выживаемости по сравнению с ожидаемой выживаемостью при отсутствии лечения или по сравнению с субъектами, получавшими стандартную терапию. К тем, кто нуждается в лечении, относятся те, у кого уже есть состояние или нарушение, а также те, кто склонен иметь состояние или нарушение, или те, у кого нужно предупредить развитие состояния или нарушения.
Термины "T-клетка" и "T-лимфоцит" могут использоваться взаимозаменяемо для обозначения популяции лимфоцитов, несущих рецепторный комплекс T-клеток на клеточной поверхности. Несмотря на то, что Т-лимфоциты, как правило, функционируют в клеточно-опосредованном иммунитете, их можно разделить на ряд субпопуляций не только на основе их конкретных функций, но также и по дифференциальной экспрессии определенных поверхностных и внутриклеточных антигенов, которые могут функционировать в качестве "маркеров" для конкретных субпопуляций Т-лимфоцитов. В целом, хелперные T-клетки экспрессируют поверхностный антиген CD4, а цитотоксические T-клетки экспрессируют CD8. Субпопуляции в пределах этих групп и перекрывающиеся между этими группами можно идентифицировать по другим маркерам клеточной поверхности, в том числе без ограничения по CD95, CD25, FoxP3, CD28, CCR7, CD127, CD38, HLA-DR и Ki-67. Субпопуляции T-лимфоцитов можно идентифицировать и/или выделять из смешанной популяции клеток крови посредством использования меченых антител, например, посредством проточной цитометрии или сортировки клеток с активированной флуоресценцией, описанных более подробно в примерах ниже. Например, хелперные Т-клетки можно идентифицировать как экспрессирующие CD3 и CD4, но не FoxP3. Другие перекрывающиеся и неперекрывающиеся субпопуляции Т-лимфоцитов включают Т-клетки памяти, незрелые Т-клетки, зрелые Т-клетки, регуляторные Т-клетки (Treg), активированные T-клетки и натуральные киллерные Т-клетки (NKT).
Если специально не указывается или не очевидно из контекста, используемое в данном документе выражение "или" понимают как подлежащий включению. Если специально не указывается или не очевидно из контекста, используемые в данном документе формы единственного числа понимают как означающие единственное или множественное число.
Если специально не указывается или не очевидно из контекста, используемое в данном документе выражение "приблизительно" понимают как нахождение в пределах диапазона допустимой погрешности для данной области, например, в пределах 2 стандартных отклонений от среднего. «Приблизительно» можно понимать как нахождение в пределах 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,5%, 0,1%, 0,05% или 0,01% от указанного значения. Если иное не ясно из контекста, все числовые значения, предусмотренные в данном документе, модифицированы при помощи выражения "приблизительно".
Изложение перечня химических групп в любом определении переменной в данном документе включает определения такой переменной в качестве любой отдельной группы или комбинации перечисленных групп. Изложение варианта осуществления для переменной или аспекта в данном документе включает такой вариант осуществления в качестве любого отдельного варианта осуществления или в комбинации с любыми другими вариантами осуществления или их частями.
Любые композиции или способы, предусмотренные в данном документе, можно комбинировать с одними или несколькими из любых других композиций и способов, представленных в данном документе.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На фигурах 1A и 1B показано, что введение противораковой вакцины в комбинации с агонистом, OX40, представляющим собой антитело, увеличивало выживаемость мышей в мышиной модели онкогенеза. На фигуре 1A изображен план клинического исследования эффекта противораковой вакцины (эпитоп CTL из антигена E7 HPV16, эпитоп Т-хелперов PADRE и адъювант QuilA) и антитела к OX40 посредством измерения выживаемости мышей в мышиной модели онкогенеза. На фигуре 1B представлены графики, показывающие, что введение противораковой вакцины и агониста OX40, представляющего собой антитело, в дозе 1 мг/кг повышало выживаемость мышей в мышиной модели онкогенеза (верхняя правая панель) по сравнению с применением противораковой вакцины отдельно или отдельно антитела к OX40, или с применением противораковой вакцины и антитела к OX40 в более низкой (0,5 мг/кг, верхняя левая панель) или более высокой (2,5 мг/кг, нижняя панель) дозах. Из мышей, получавших противораковую вакцину и агонист OX40, представляющий собой антитело, в дозе 1 мг/кг, ~20% оставались живыми вплоть до приблизительно 62 дней после инъекции опухолевых клеток TC-1.
На фигурах 2A и 2B показано, что введение противораковой вакцины в комбинации с агонистом, OX40, представляющим собой антитело, ингибировало рост опухоли у мышей в мышиной модели онкогенеза. На фигуре 2A изображен план клинического исследования эффекта противораковой вакцины (эпитоп CTL из антигена E7 HPV16, эпитоп Т-хелперов PADRE и адъювант QuilA) и антитела к OX40 посредством измерения роста опухоли у мышей в мышиной модели онкогенеза. На фигуре 2B представлены графики, показывающие, что введение противораковой вакцины и агониста OX40, представляющего собой антитело, в дозе 1 мг/кг ингибировало рост опухоли в мышиной модели онкогенеза (нижняя средняя панель) по сравнению с применением противораковой вакцины отдельно (нижняя левая панель) или отдельно антитела к OX40 (1 мг/кг, верхняя средняя панель; 2,5 мг/кг, верхняя правая панель), или с применением противораковой вакцины и антитела к OX40 в более высоких (2,5 мг/кг, нижняя правая панель) дозах. Среди мышей, получавших противораковую вакцину и агонист OX40, представляющий собой антитело, в дозе 1 мг/кг, мыши демонстрировали уменьшенный объем опухоли и/или задержку роста опухоли по сравнению с другими группами исследования.
На фигурах 3A-3С показано, что введение противораковой вакцины в комбинации с агонистом, OX40, представляющим собой антитело, стимулирует антиген-специфичный иммунный ответ у мышей на мышиной модели онкогенеза. На фигуре 3A изображен план клинического исследования эффекта противораковой вакцины (эпитоп CTL из антигена E7 HPV16, эпитоп Т-хелперов PADRE и адъювант QuilA) и антитела к OX40 посредством оценки антиген-специфического иммунного ответа и профилей Т-клеток, инфильтрирующих опухоль, у мышей в мышиной модели онкогенеза. На фигуре 3B представлены графики, показывающие, что мыши, получавшие противораковую вакцину и агонист OX40, представляющий собой антитело, показали повышение антиген (E7)-специфических CD8 T-клеток в мышиной модели онкогенеза по сравнению с мышами, получавшими отдельно противораковую вакцину или отдельно антитело к OX40. Мыши, получавшие противораковую вакцину и агонист OX40, представляющий собой антитело, в дозе 1 мг/кг, демонстрировали наивысшее соотношение E7-специфические CD8 T-клетки:общее количество CD8 T-клеток по сравнению с другими группами, получавшими противораковую вакцину и антитело к OX40. На фигуре 3С представлены графики, показывающие, что мыши, получавшие противораковую вакцину и агонист OX40, представляющий собой антитело, показали увеличение количества антиген (E7)-специфических CD8 T-клеток в мышиной модели онкогенеза по сравнению с мышами, получавшими отдельно противораковую вакцину или отдельно антитело к OX40. Мыши, получавшие противораковую вакцину и агонист OX40, представляющий собой антитело, в дозе 1 мг/кг, демонстрировали наивысшее соотношение E7-специфические CD8 T-клетки:регуляторные T-клетки (Treg) по сравнению с другими группами, получавшими противораковую вакцину и антитело к OX40 в более низкой (0,5 мг/кг) или более высокой (2,5 мг/кг) дозах.
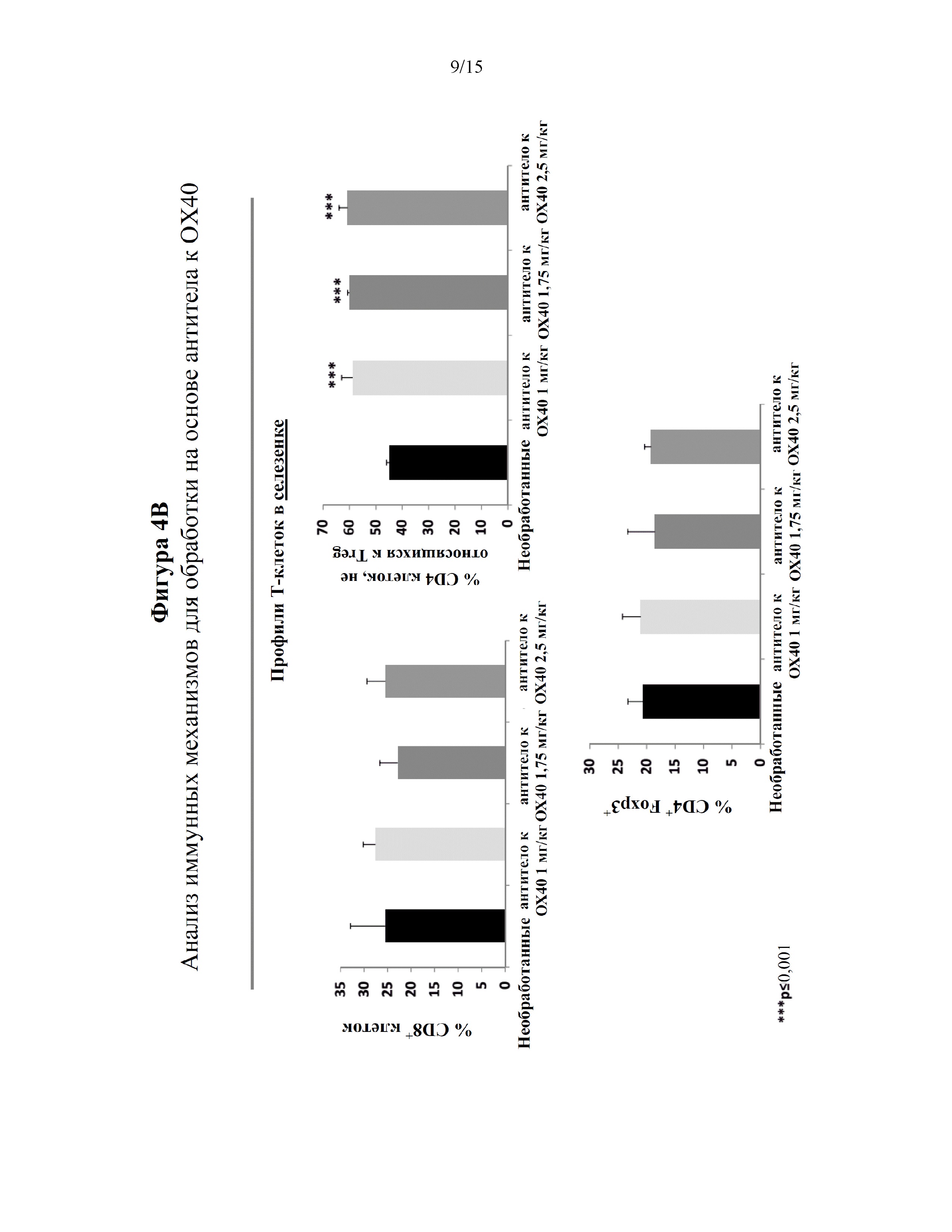
На фигурах 4A-4С показано, что введение противораковой вакцины в комбинации с агонистом, OX40, представляющим собой антитело, увеличивало инфильтрацию опухоли регуляторными Т-клетками (Treg) в мышиной модели онкогенеза. На фигуре 4A изображен план клинического исследования эффекта лечения на основе антитела к OX40 путем оценки профилей селезеночных и инфильтрирующих опухоль Т-клеток в мышиной модели онкогенеза. На фигуре 4B представлены графики, показывающие, что мыши, получавшие агонист OX40, представляющий собой антитело (1 мг/кг; 1,75 мг/кг; 2,5 мг/кг), демонстрировали значительное увеличение количества не относящихся к Treg CD4 T-клеток (CD4+FoxP3-) в селезенке по сравнению с мышами, не получавшими лечение. Мыши, получавшие агонист OX40, представляющий собой антитело (1 мг/кг; 1,75 мг/кг; 2,5 мг/кг), имели аналогичные уровни CD8+ клеток (верхняя левая панель) и Treg-клеток (CD4+ Foxp3+; нижняя панель) в селезенке по сравнению с мышами, не получавшими лечение. На фигуре 4С представлены графики, показывающие, что мыши, получавшие антитело к OX40, демонстрировали повышенные уровни Treg-клеток, инфильтрирующих опухоль, с повышением дозировки антитела к OX40 (нижняя панель).
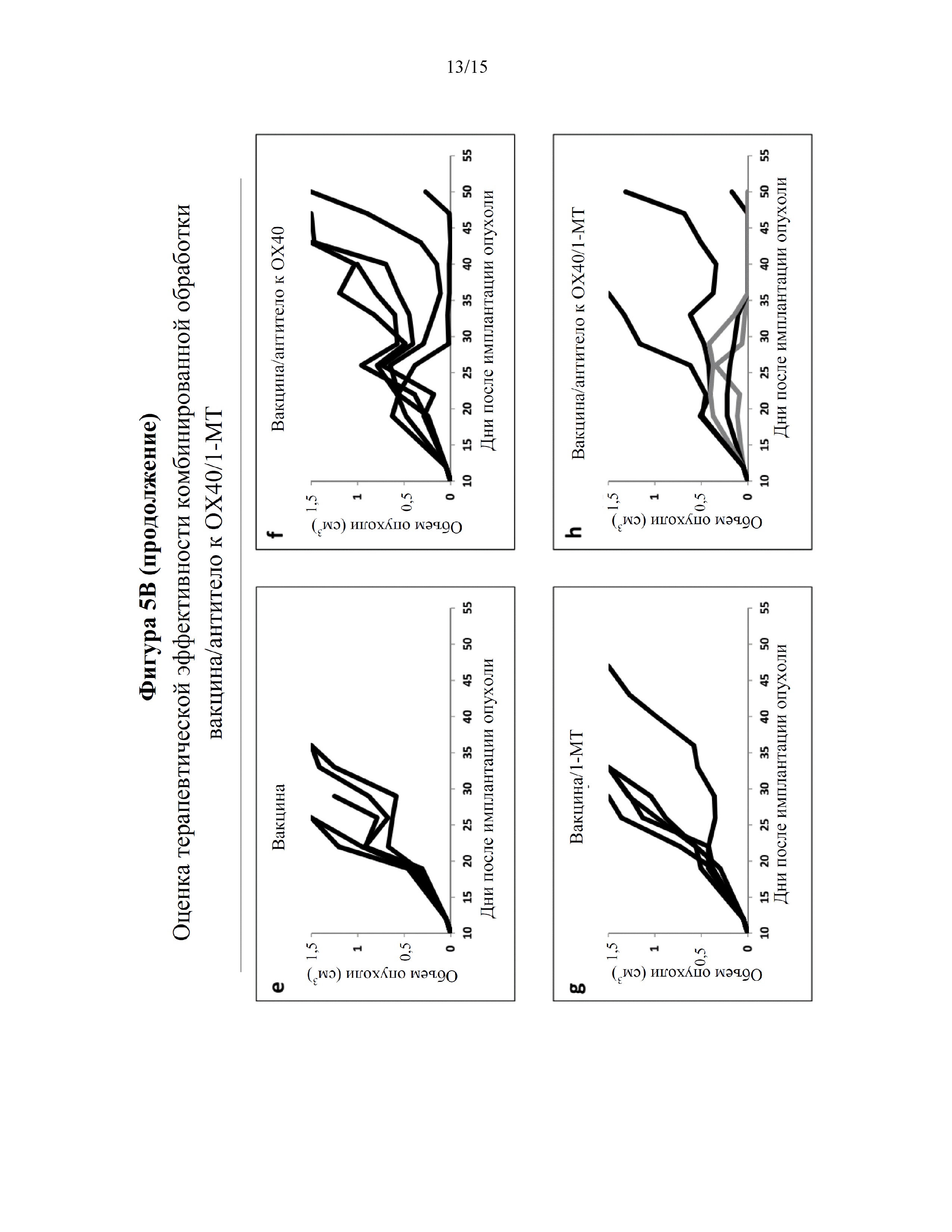
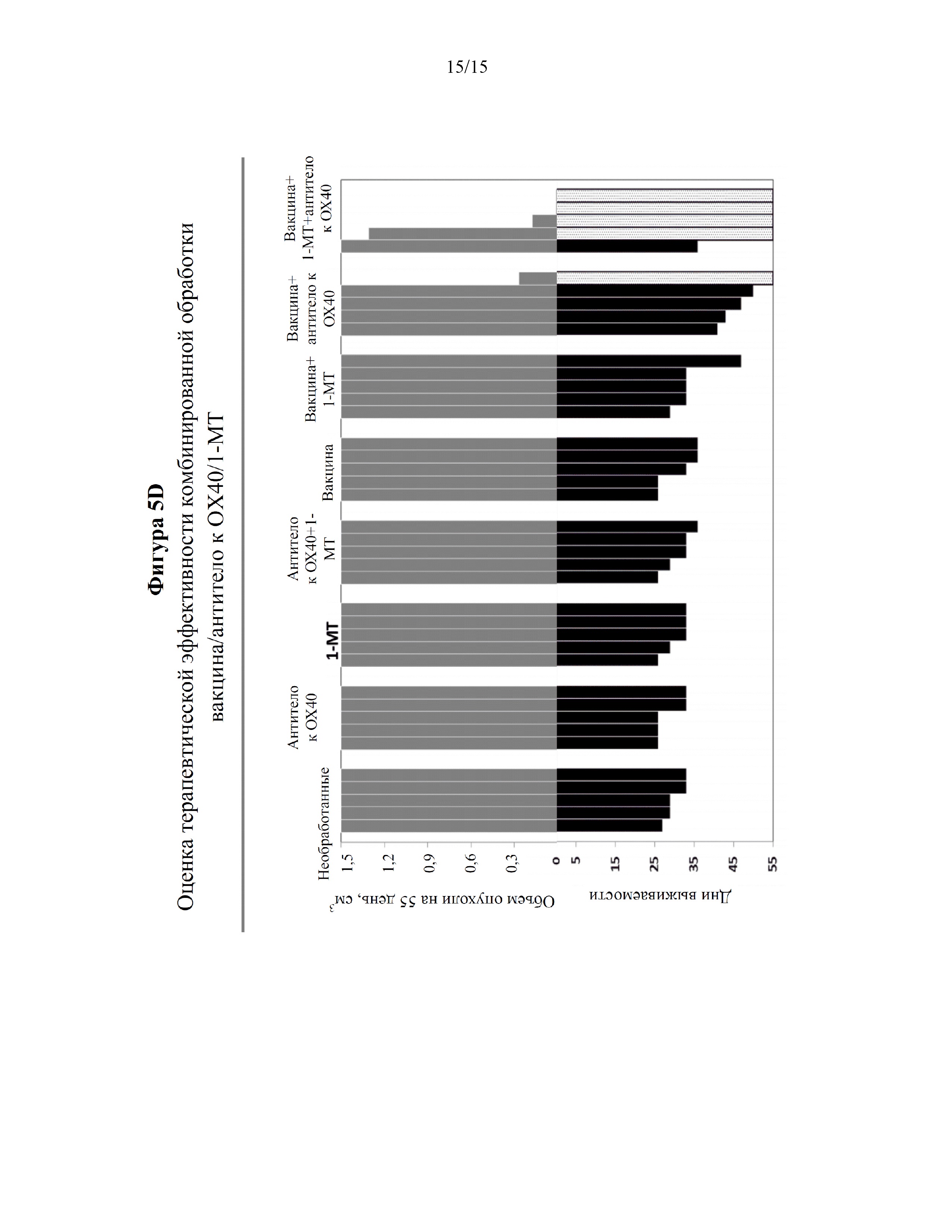
На фигурах 5A-5D показано, что введение противораковой вакцины в комбинации с агонистом, OX40, представляющим собой антитело, и ингибитором индоламин-2,3-диоксигеназы (IDO) ингибировало рост опухоли и увеличивало выживаемость в мышиной модели онкогенеза. На фигуре 5A изображен план клинического исследования эффекта противораковой вакцины (эпитоп CTL из антигена E7 HPV16, эпитоп Т-хелперов PADRE и адъювант QuilA), антитела к OX40 и 1-метилтриптофана (1-МТ) посредством измерения роста опухоли и выживаемости мышей в мышиной модели онкогенеза. На фигуре 5B представлены графики, показывающие, что у мышей, получавших противораковую вакцину, агонист OX40, представляющий собой антитело (1 мг/кг), и 1-MT, значительно ингибировался и/или задерживался рост опухоли в мышиной модели онкогенеза (панель h) по сравнению с другими группами мышей, в том числе мышей, получавших противораковую вакцину и антитело к OX40 (панель f) или противораковую вакцину и 1-MT (панель g). Среди мышей, получавших противораковую вакцину, агонист OX40, представляющий собой антитело, и 1-MT, две мыши продемонстрировали полное сокращение объема опухоли через ~35 дней после инъекции опухолевых клеток TC-1. На фигуре 5C представлен график, показывающий увеличенную выживаемость мышей, получавших противораковую вакцину, агонист OX40, представляющий собой антитело (1 мг/кг), и 1-MT, по сравнению с другими группами мышей, в том числе мышей, получавших противораковую вакцину и антитело к OX40 (синий) или противораковую вакцину и 1-MT (зеленый). Мыши, получавшие противораковую вакцину, агонист OX40, представляющий собой антитело, и 1-МТ, демонстрировали уменьшенный объем опухоли и/или задержку роста опухоли по сравнению с другими исследуемыми группами. У этих мышей наблюдали выживаемость до ~80% вплоть до приблизительно 55 дней после инъекции опухолевых клеток TC-1. На фигуре 5D представлены графики, показывающие, что ингибирование роста опухоли и выживаемость мышей коррелировали. Объемы опухоли и дни выживания строили на графике для отдельных мышей в исследовании.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении представлены способы, которые применимы для повышения эффективности противораковой вакцины.
По меньшей мере частично настоящее изобретение основано на обнаружении того факта, что целенаправленное воздействие агонистом OX40, представляющим собой антитело, на эффекторную ветвь иммунной системы и ингибитором IDO на супрессорную ветвь иммунной системы повышает эффективность противораковой вакцины. Молекула OX40 представляет собой костимуляторный рецептор, экспрессируемый на Т-клетках, который может вызывать пролиферацию и усиление эффекторной функции Т-клеток при целенаправленном воздействии антителом-агонистом. Однако эффекторные Т-клетки подавляются ингибитором индоламин-2,3-диоксигеназы (IDO), который секретируется опухолями в качестве защитного механизма против разрушения опухоли. Как описано подробно ниже, лечение агонистом OX40, представляющим собой антитело, в комбинации с противораковой вакциной ведет к усилению антиген-специфичных Т-клеточных ответов. Доза 1 мг/кг антитела к OX40 стимулирует эффекторную ветвь Т-клеток, что в конечном итоге приводит к значительному увеличению соотношения CD8+/регуляторные T-клетки (Treg) в опухолях. Кроме того, это комбинированное лечение вакциной и антителом к OX40 ведет к значительному ингибированию роста опухоли и продлению выжиемости мышей по сравнению с необработанными мышами, несущими опухоль (TC-1). Полную регрессию опухоли наблюдали у 20% обработанных мышей. Этот эффект значительно повышался, когда лечение вакциной и антителом к OX40 комбинировали с 1-MT, ингибитором индоламин-(2,3)-диоксигеназной (IDO) активности. Было показано, что IDO секретируется опухолевыми клетками, подавляющими дендритные клетки и макрофаги в окружении опухоли, и, как известно, отвечает за подавление эффекторных клеток и индукцию регуляторных Т-клеток. Эти данные демонстрируют, что комбинация вакцины и антитела к OX40 с 1-метилтриптофаном (1-MT, ингибитор IDO) ведет к более выраженному ингибированию роста опухоли и полной регрессии развившихся опухолей у 60% мышей. В заключение, данные результаты указывают на то, что одновременное целенаправленное воздействие антитела к OX40 на эффекторную ветвь иммунитета и 1-МТ на супрессорную ветвь иммунитета характеризуется синергическим эффектом, что приводит к ликвидации опухоли и является многообещающей стратегией, которая может повысить общую эффективность лечения рака у пациентов.
OX40
OX40 является представителем семейства TNF-рецепторов, который экспрессируется в основном на активированных CD4+ и CD8+ T-клетках и регуляторных T-клетках. Агонисты OX40 характеризуются мощной противоопухолевой активностью против разных типов опухолей, которая зависит от CD4+ и CD8+ T-клеток (Kjaergaard J. et al.Cancer Res60, 5514-5521 (2000); Weinberg A.D. et al.J Immunol164, 2160-2169 (2000); Gough M.J. et al.Cancer Res68, 5206-5215 (2008); Piconese S., Valzasina B. и Colombo M.P. J Exp Med205, 825-839 (2008)). Агонисты OX40 повышают пролиферацию Т-клеток, продуцирование эффекторных цитокинов, цитотоксичность, снижают индуцированную активацией гибель клеток и увеличивают образование Т-клеток памяти в модельных системах кроме человека (Gramaglia I. et al.J Immunol165, 3043-3050. (2000); Maxwell J.R. et al.J Immunol164, 107-112 (2000); Lee S.W. et al.J Immunol177, 4464-4472 (2006); Ruby C.E. и Weinberg A.D. Cancer Immunol Immunother58, 1941-1947 (2009)).
Агонисты OX40
Агонисты ОХ40 взаимодействуют с рецептором OX40 на CD4+ Т-клетках во время или вскоре после примирования антигеном, что в результате приводит к повышению ответа CD4+ Т-клеток на антиген. Взаимодействие агониста OX40 с рецептором OX40 на антиген-специфичных CD4+ T-клетках может увеличивать пролиферацию T-клеток по сравнению с ответом на один антиген. Возросший ответ против антигена может сохранятся в течение определенного периода времени значительно дольше, чем при отсутствии агониста OX40. Таким образом, стимуляция посредством агониста OX40 усиливает антиген-специфический иммунный ответ благодаря стимуляции распознавания антигенов T-клетками, например, опухолевых клеток. Агонисты OX40 описаны, например, в патентах США №№ 6312700, 7504101, 7622444 и 7959925, которые включены в данный документ посредством ссылки во всей своей полноте. Способы применения таких агонистов в лечении рака описаны, например, в патентном документе WO/2013/119202 и в WO/2013/130102, каждый из которых включен в данный документ посредством ссылки во всей своей полноте.
Агонисты OX40 включают без ограничения OX40-связывающие молекулы, например, связывающие полипептиды, например, лиганд OX40 ("OX40L") или его OX40-связывающий фрагмент, вариант или производное, такие как растворимые внеклеточные домены лиганда и белки слияния OX40L, и антитела к OX40 (например, моноклональные антитела, такие как гуманизированные моноклональные антитела), или их антиген-связывающий фрагмент, вариант или производное. Примеры моноклональных антител к OX40 описаны, например, в патентных документах WO 95/12673 и WO/95/21915, раскрытия которых включены в данный документ посредством ссылки во всей своей полноте. В определенных вариантах осуществления моноклональное антитело к OX40 представляет собой 9B12 или его антиген-связывающий фрагмент, вариант или производное, как описано в публикации Weinberg A.D. et al. J Immunother 29, 575-585 (2006), которая включена в данный документ посредством ссылки во всей своей полноте.
9B12 представляет собой мышиный IgG1, mAb к OX40, направленное против внеклеточного домена OX40 человека (CD134) (Weinberg A.D. et al. J Immunother 29, 575-585 (2006)). Его выбрали из панели моноклональных антител к OX40 из-за его способности вызывать агонистический ответ для передачи сигнала OX40, стабильности и за высокий уровень производства с помощью гибридомы. Дли применения в клинической практике mAb 9B12 уравновешивают фосфатно-буферным солевым раствором, pH 7,0, и диафильтрацией доводят его концентрацию до 5,0 мг/мл.
Агонисты OX40 включают белок слияния, в котором один или несколько доменов OX40L ковалентно связаны с одним или несколькими дополнительными белковыми доменами. Иллюстративные белки слияния OX40L, которые можно использовать в качестве агонистов OX40, описаны в патенте США № 6312700, раскрытие которого включено в данный документ посредством ссылки во всей своей полноте. В одном из вариантов осуществления агонист OX40 включает OX40L-гибридный полипептид, который способен к самосборке в мультимерный (например, тримерный или гексамерный) белок слияния OX40L. Такие гибридные белки описаны, например, в патенте США № 7959925, который включен в данный документ посредством ссылки во всей своей полноте. Мультимерный белок слияния OX40L проявляет повышенную эффективность в усилении антиген-специфического иммунного ответа у субъекта, в частности, у субъекта-человека, благодаря его способности к спонтанной сборке в высокоустойчивые тримеры и гексамеры.
В другом варианте осуществления агонист OX40, способный к сборке в мультимерную форму, включает в себя полипептид слияния, содержащий в направлении от N-конца к C-концу: домен иммуноглобулина, где домен иммуноглобулина включает Fc-домен, домен тримеризации, где домен тримеризации включает суперспиральный домен тримеризации, и рецептор-связывающий домен, где рецептор-связывающий домен представляет собой рецептор-связывающий домен OX40, например, OX40L или его OX40-связывающий фрагмент, вариант или производное, где белок слияния способен к самосборке в тримерный белок cлияния. В одном из аспектов агонист OX40, способный к сборке в мультимерную форму, способен связываться с рецептором OX40 и стимулировать по меньшей мере одну OX40-опосредованную активность. В определенных аспектах агонист OX40 включает внеклеточный домен лиганда OX40.
Домен тримеризации агониста OX40, способный к сборке в мультимерную форму, служит для стимуляции самосборки отдельных молекул полипептида слияния OX40L в тримерный белок. Таким образом, полипептид слияния OX40L с помощью отвечающего домена тримеризации самостоятельно собирается в тримерный белок слияния OX40L. В одном из аспектов домен тримеризации представляет собой домен изолейциновой застежки или другую суперспиральную полипептидную структуру. Иллюстративные суперспиральные домены тримеризации включают: TRAF2 (№ доступа в GENBANK® Q12933, аминокислоты 299-348); тромбоспондин 1 (№ доступа PO7996, аминокислоты 291-314); матрилин-4 (№ доступа O95460, аминокислоты 594-618); CMP (матрилин-1) (№ доступа NP-002370, аминокислоты 463-496); HSF1 (№ доступа AAX42211, аминокислоты 165-191); и кубилин (№ доступа NP-001072, аминокислоты 104-138). В определенных специфических аспектах домен тримеризации включает домен тримеризации TRAF2, домен тримеризации матрилин-4 или их комбинацию.
В конкретных вариантах осуществления агонист OX40 модифицируют для увеличения его времени полужизни в сыворотке крови. Например, время полужизни агониста OX40 в сыворотке крови можно увеличить путем конъюгирования с гетерологичной молекулой, такой как сывороточный альбумин, Fc-участок антитела или ПЭГ. Кроме того, в определенных вариантах осуществления в антителах или их функциональных частях могут быть введены мутации, такие как мутации по типу делеции, добавления или замены, для улучшения их времени полужизни. В одном варианте осуществления Fc-участок можно подвергнуть мутации с включением одной, двух или всех трех следующих замен: M252Y, S254T и T256E, где нумерация соответствует EU-индексу у Kabat. В одном варианте осуществления Fc-участок можно подвергнуть мутации с включением всех следующих замен: M252Y, S254T и T256E, где нумерация соответствует EU-индексу у Kabat. Dall'Acqua et al., Properties of Human IgG1s Engineered for Enhanced Binding to the Neonatal Fc Receptor (FcRn), J Biol Chem 281(33):23514-23524 (2006). Вариант осуществления со всеми тремя заменами обозначается как YTE-вариант. Иными словами, в одном варианте осуществления антитело или его функциональная часть имеют Fc-участок с Y в положении 252Y, T в положении 254T и E в положении 256, где нумерация соответствует EU-индексу у Kabat.
В определенных вариантах осуществления агонист OX40 можно конъюгировать с другими терапевтическими средствами или токсинами с образованием иммуноконъюгатов и/или белков слияния.
В определенных аспектах агонист OX40 можно составить таким образом, чтобы облегчить введение и способствовать стабильности активного средства. В определенных аспектах фармацевтические композиции в соответствии с настоящим раскрытием содержат фармацевтически приемлемый, нетоксичный, стерильный носитель, такой как физиологический солевой раствор, нетоксичные буферы, консерванты и им подобные. Подходящие составы для применения в способах лечения, раскрытых в данном документе, описаны, например, в Remington's Pharmaceutical Sciences (Mack Publishing Co.) 16th ed. (1980).
Желательно, чтобы введение агониста OX40 приводило к повышенному ответу Т-лимфоцитов на антигены на множестве раковых клетках, поскольку активация OX40, несмотря на то, что функционирует совместно с антигенной стимуляцией Т-лимфоцитов, сама по себе не является специфичной в отношении антигена или клетки. Таким образом, введение агониста OX40 можно использовать для повышения иммунного ответа против фактически любого опухолевого антигена.
Эффективное количество агониста OX40, подлежащее введению, может быть определено обычным специалистом в данной области при помощи хорошо известных способов.
Клинический ответ на введение агониста ОХ40 можно оценить с использованием диагностических методик, известных клиницистам, включая без ограничения магнитно-резонансную томографию (MRI), рентгенографию, компьютерную томографию (CT), анализ с применением проточной цитометрии или сортировки клеток с активацией флуоресценции (FACS), гистологическое исследование, макропатологию и биохимический анализ крови, включая без ограничения изменения, выявляемые с помощью ELISA, RIA и хроматографии. Кроме того, субъект, получающий терапию агонистом ОХ40, может испытывать благотворный эффект ослабления симптомов, связанных с заболеванием.
Введение агониста ОХ40 можно осуществлять с использованием любого применимого пути, определяемого природой состава и потребностями пациента. В определенных вариантах осуществления применение агониста ОХ40 осуществляют путем внутривенной инфузии.
Учитывая, что иммунная стимуляция агонистом ОХ40 не является антиген-специфической, разные формы рака можно лечить с использованием способов, предусмотренных в данном документе, например, в определенных аспектах рак представляет собой солидную опухоль или ее метастаз. Типы рака включают без ограничения меланому, рак желудочно-кишечного тракта, почечно-клеточную карциному, рак предстательной железы, рак легкого или любую их комбинацию. Участок метастазирования не ограничивается и может включать, например, метастазы в лимфатический узел, легкое, печень, кость или любую их комбинацию.
Способы лечения рака, предусмотренные в данном документе, включают традиционные и нетрадиционные способы лечения рака в дополнение к введению противораковой вакцины, агониста ОХ40 и ингибитора IDO. В качестве неограничивающего примера, введение противораковой вакцины, агониста ОХ40 и ингибитора IDO можно комбинировать с хирургическим вмешательством, лучевой терапией, химиотерапией, иммунотерапией, целенаправленно воздействующей противораковой терапией, гормональной терапией или любой их комбинацией.
Эффективное лечение с помощью агониста OX40 включает, например, снижение скорости прогрессирования рака, замедление или стабилизацию роста опухоли или метастазов, сокращение размеров опухоли и/или регрессию опухоли либо в месте первичной опухоли, либо в одном или нескольких метастазах.
Как описано в данном документе ниже, введение агониста OX40 и ингибитора IDO неожиданно повышает эффективность иммуногенной композиции, содержащей опухолевый антиген.
Ингибитор индоламин-2,3-диоксигеназы
Триптофан (Trp) является незаменимой аминокислотой, необходимой для биосинтеза белков, ниацина и нейромедиатора 5-гидрокситриптамина (серотонина). Фермент индоламин-2,3-диоксигеназа (также известный как INDO или IDO) катализирует первую и лимитирующую скорость реакции стадию расщепления L-триптофана до N-формилкинуренина. В клетках человека стимуляция с IFN-y индуцирует активацию IDO, которая ведет к истощению Trp, задерживая тем самым рост Trp-зависимых внутриклеточных патогенов, таких как Toxoplasma gondii и Chlamydia trachomatis. Активность IDO также оказывает антипролиферативный эффект на многие опухолевые клетки, и индукция IDO наблюдалась in vivo во время отторжения аллогенных опухолей, что указывает на возможную роль этого фермента в процессе отторжения опухоли.
Наблюдали, что клетки HeLa, совместно культивированные с лимфоцитами периферической крови (PBL), приобретают иммуноингибиторный фенотип благодаря повышению активности IDO. Снижение пролиферации PBL при обработке интерлейкином-2 (IL-2), как полагают, было результатом IDO, выделенной опухолевыми клетками в ответ на секрецию IFN-y клетками PBL. Данный эффект отменяли обработкой 1-метилтриптофаном (1-MT), специфическим ингибитором IDO. Предположили, что активность IDO в опухолевых клетках может способствовать ухудшению противоопухолевых ответов (Logan, et al., 2002, Immunology, 105: 478-87).
Низкомолекулярные ингибиторы IDO, применимые в способах по настоящему изобретению, описаны, например, в публикации PCT WO 99/29310, в которой представлены способы изменения Т-клеточного иммунитета, включающие изменение локальных внеклеточных концентраций триптофана и метаболитов триптофана с использованием ингибитора IDO, такого как 1-метил-DL-триптофан, п-(3-бензофуранил)-DL-аланин, п-[3-бензо(b)тиенил]-DL-аланин и 6-нитро-L-триптофан) (Munn, 1999). О соединениях, обладающих ингибиторной активностью в отношении индоламин-2,3-диоксигеназы (IDO), дополнительно сообщается в патентном документе WO 2004/094409; а публикация заявки на патент США № 2004/0234623 направлена на способы лечения субъекта с раком или инфекцией посредством введения ингибитора индоламин-2,3-диоксигеназы в комбинации с другими терапевтическими воздействиями. Ингибиторы IDO, в том числе индоксимод, D-изомер 1-метилтриптофана, и NLG919 известны из уровня техники и являются доступными для приобретения, например, от NewLink Genetics (Эймс, Айова). Другие ингибиторы IDO описаны, например, в публикации заявки на патент США № 20130289083, которая включена в данный документ посредством ссылки во всей своей полноте.
Формирование противоракового иммунного ответа
Противораковые вакцины являются потенциально применимыми в качестве терапевтических средств для лечения определенных видов рака. Их преимущество заключается в том, что эти вакцины можно адаптировать для лечения форм рака у конкретных лиц, создавая иммуногенные композиции, которые нацелены на конкретные опухолевые антигены, экспрессируемые на опухоли у субъекта. Противораковые вакцины обычно содержат инактивированные опухолевые клетки или опухолевые антигены, которые стимулируют иммунную систему пациента. Иммунная система отвечает на эту стимуляцию путем формирования иммунореактивных клеток, которые целенаправленно воздействуют на раковые клетки. В отличие от вакцин против других заболеваний, которые предупреждают возникновение заболевания, противораковые вакцины обычно вводят после того, как у субъекта идентифицировали наличие новообразования.
В антигенных вакцинах используют опухолеспецифические антигены -- белки, представленные на опухолевой клетке -- для стимуляции иммунной системы. При введении этих антигенов в раково-перерожденную область пациента иммунная система продуцирует антитела или цитотоксические Т-лимфоциты для воздействия на раковые клетки, которые несут эти конкретные антигены. Множество антигенов можно использовать в этом типе вакцины, чтобы варьировать ответ иммунной системы.
Соответственно, опухолевый антиген представляет собой опухолеспецифический антиген (TSA) или ассоциированный с опухолью антиген (TAA). Некоторые опухолевые антигены и их профили экспрессии известны в данной области и могут быть выбраны в зависимости от типа опухоли, подлежащей лечению. Неограничивающие примеры опухолевых антигенов включают альфа-фетопротеин (гепатоцеллюлярная карцинома), канцероэмбриональный антиген (рак толстого кишечника), CDK4 (меланома), бета-катенин (меланома), BING-4, СА125 (рак яичников), кальций-активированный хлоридный канал 2, канцероэмбриональный антиген, каспазу-8 (плоскоклеточная карцинома), CDK4, CML66, циклин-В1, Ep-Cam, эпителиальный опухолевый антиген (рак молочной железы), EphA3, фибронектин, антиген HPV, антиген HPV16, HPV 36, 37, эпитоп CTL из антигена E7 HPV16, ART-2, ассоциированный с меланомой антиген (MAGE)-1 и MAGE-3 (меланома, рак молочной железы, глиома), мезотелин, SAP-1, surviving, теломеразу, тирозиназу (меланома), идиотип поверхностного Ig (например, BCR) (лимфома), Her-2/neu (рак молочной железы, рак яичников), MUC-1 (рак молочной железы, рак поджелудочной железы), TAG-72, тирозиназу (меланома) и Е6 и Е7 HPV (карцинома шейки матки). Дополнительные подходящие опухолевые антигены включают специфический антиген предстательной железы (PSA), RAS, сиалил-Tn (STn), белки теплового шока и связанные с ними опухолевые пептиды (например, gp96), молекулы ганглиозида (например, GM2, GD2 и GD3), канцероэмбриональный антиген (СЕА) и MART-1.
Как правило, иммуногенные композиции, содержащие опухолевый антиген, получают в инъекционной форме, либо в виде жидкого раствора, либо в виде суспензии. Твердые формы, подходящие для инъекций, также можно получать в виде эмульсий или с полипептидами, инкапсулированными в липосомах. Опухолевый антиген (антигены) вводят в любом подходящем носителе, известном в данной области. Подходящие носители, как правило, содержат большие макромолекулы, которые медленно метаболизируются, такие как белки, полисахариды, полимеры молочной кислоты, полимеры гликолевой кислоты, полимерные аминокислоты, сополимеры аминокислот, липидные агрегаты и инактивированные вирусные частицы. Такие носители хорошо известны специалистам в данной области. Эти носители могут также функционировать в качестве адъювантов.
Адъюванты представляют собой иммуностимулирующие средства, которые повышают эффективность вакцин. Эффективные адъюванты включают без ограничения соли алюминия, такие как гидроксид алюминия и фосфат алюминия, мурамилпептиды, компоненты клеточной стенки бактерий, адъюванты из сапонинов, а также другие вещества, которые действуют в качестве иммуностимулирующих средств для повышения эффективности композиции.
Иммуногенные композиции (например, противораковые вакцины) вводят способом, совместимым с составом дозы. Под эффективным количеством понимают единичную дозу или вакцину, вводимую согласно режиму многократного приема, который является эффективным для лечения или предупреждения заболевания или нарушения. Предпочтительно, доза является эффективной для ингибирования роста новообразования. Доза будет варьировать в зависимости от субъекта, подлежащего лечению, здоровья и физического состояния субъекта, способности иммунной системы субъекта продуцировать антитела, степени требуемой защиты, а также других соответствующих факторов. Точные количества требуемого активного компонента будут зависеть от оценки лечащего врача.
Как описано в данном документе ниже, введение ингибитора IDO (например, 1-MT) и агониста OX40 (например, агониста OX40, представляющего собой антитело) синергетически повышает эффективность противораковой вакцины. Предпочтительно, введение иммуногенной композиции, содержащей опухолевый антиген, агонист OX40, представляющий собой антитело, и ингибитор IDO, уменьшает или замедляет рост опухоли, индуцирует регрессию опухоли или увеличивает выживаемость пациента по сравнению с применением таких средств по отдельности.
В дополнение к применению противораковых вакцин виды терапии, индуцирующие апоптоз опухолевых клеток, высвобождают в организм опухолевые антигены, которые способны индуцировать противораковый иммунный ответ. В одном из вариантов осуществления можно использовать лучевую терапию для индукции апоптоза опухолевых клеток. Соответственно, настоящее изобретение предусматривает способы повышения эффективности опухолевого антигена в индукции противоракового иммунного ответа путем введения агониста OX40 и ингибитора индоламин-2,3-диоксигеназы (IDO) в комбинации с лучевой терапией. В другом варианте осуществления химиотерапию, которая индуцирует апоптоз опухолевых клеток (например, антрациклины, оксалиплатин), можно вводить в комбинации с агонистом OX40 и ингибитором индоламин-2,3-диоксигеназы (IDO). Иллюстративные антрациклины включают без ограничения даунорубицин, доксорубицин, эпирубицин, идарубицин и вальрубицин.
При практическом применении настоящего изобретения используют, если не указано иное, общепринятые методики молекулярной биологии (в том числе рекомбинантные методики), микробиологии, клеточной биологии, биохимии и иммунологии, которые полностью находятся в пределах компетенции специалиста в данной области. Такие методики в полном объеме изложены в литературе, такой как ʺMolecular Cloning: A Laboratory Manual", second edition (Sambrook, 1989); "Oligonucleotide Synthesis" (Gait, 1984); "Animal Cell Culture" (Freshney, 1987); "Methods in Enzymology" "Handbook of Experimental Immunology" (Weir, 1996); "Gene Transfer Vectors for Mammalian Cells" (Miller and Calos, 1987); "Current Protocols in Molecular Biology" (Ausubel, 1987); "PCR: The Polymerase Chain Reaction", (Mullis, 1994); "Current Protocols in Immunology" (Coligan, 1991). Эти методики применимы для получения полинуклеотидов и полипептидов по настоящему изобретению и в силу этого могут быть приняты во внимание при осуществлении и практическом применении настоящего изобретения. Особенно применимые методики для конкретных вариантов осуществления будут обсуждаться в следующих разделах.
Следующие примеры предложены с тем, чтобы обеспечить обычных специалистов в данной области полным раскрытием и описанием того, как осуществлять и применять аналитические, скрининговые и терапевтические способы по настоящему изобретению, и не предназначены для ограничения объема того, что авторы настоящего изобретения считают своим изобретением.
ПРИМЕРЫ
Пример 1. Лечение противораковой вакциной и агонистом, OX40, представляющим собой антитело, увеличивало выживаемость в мышиной модели онкогенеза
Исследование проводили на мышиной модели онкогенеза для определения эффекта лечения противораковой вакциной (эпитоп CTL из антигена E7 HPV16, эпитоп Т-хелперов PADRE и адъювант QuilA) и агонистом ОХ40 в отношении выживаемости (фигура 1А). Мышам (C57BL6; самки 6-8-недельного возраста) инъецировали опухолевые клетки TC-1 (7×104 подкожно). Введение антитела к OX40 (клон OX86) начинали на 4 или 10 день после инъекции клеток TC-1. Первый день появления опухоли приходился приблизительно на 10 день. Антитело к OX40 вводили дважды в неделю в дозах 0,5, 1,0 и 2,5 мг/кг, внутрибрюшинно. Всего исследовали 14 групп мышей (n=5/группа), включая мышей, не получавших лечение, получавших отдельно вакцину, отдельно антитело к OX40 в 4 день (0,5, 1,0 и 2,5 мг/кг), отдельно антитело к OX40 в 10 день (0,5, 1,0 и 2,5 мг/кг), антитело к OX40 в 4 день (0,5, 1,0 и 2,5 мг/кг) и противораковую вакцину и антитело к OX40 на 10 день (0,5, 1,0 и 2,5 мг/кг) и противораковую вакцину. Исследование повторяли дважды.
Мыши, которым вводили противораковую вакцину и агонист к ОХ40, представляющий собой антитело, в дозе 1 мг/кг, показали повышенную выживаемость по сравнению с мышами, которым вводили отдельно противораковую вакцину или только антитело к ОХ40 (фигура 1В). В частности, мыши, которым вводили противораковую вакцину и антитело к ОХ40 в более низких (0,5 мг/кг, верхняя левая панель) или более высоких (2,5 мг/кг, нижняя панель) дозах, не показали повышенной выживаемости. Из мышей, получавших противораковую вакцину и агонист OX40, представляющий собой антитело, в дозе 1 мг/кг, ~20% оставались живыми вплоть до приблизительно 62 дней после инъекции опухолевых клеток TC-1. Никаких существенных различий в выживаемости не было получено, когда антитело к OX40 вводили до появления опухоли (4 день после имплантации опухоли) или в первый день появления опухоли (10-й день после имплантации опухоли).
Пример 2. Лечение противораковой вакциной и агонистом, OX40, представляющим собой антитело, снижало рост опухоли в мышиной модели онкогенеза
Исследование проводили на мышиной модели онкогенеза для определения эффекта лечения противораковой вакциной (эпитоп CTL из антигена E7 HPV16, эпитоп Т-хелперов PADRE и адъювант QuilA) и агонистом ОХ40 в отношении роста опухоли (фигура 2А). Мышам (C57BL6; самки 6-8-недельного возраста) инъецировали опухолевые клетки TC-1 (7×104 подкожно). Введение антитела к OX40 (клон OX86) начинали на 4 или 10 день после инъекции клеток TC-1. Антитело к OX40 вводили дважды в неделю в дозах 1,0 и 2,5 мг/кг, внутрибрюшинно. Всего исследовали 6 групп мышей (n=5/группа), включая мышей, которых не обрабатывали, получавших отдельно вакцину, отдельно антитело к OX40 (1,0 и 2,5 мг/кг) и антитело к OX40 (1,0 и 2,5 мг/кг) и противораковую вакцину. Исследование повторяли дважды.
Мыши, которым вводили противораковую вакцину и агонист ОХ40, представляющий собой антитело, в дозе 1 мг/кг, показали сниженный объем опухоли и/или задержку роста опухоли (фигура 2В: нижняя средняя панель) по сравнению с мышами, которым вводили отдельно противораковую вакцину (фигура 2В: нижняя левая панель) или отдельно антитело к ОХ40 (фигура 2В: верхняя средняя панель, верхняя правая панель). В соответствии с другими результатами (смотри, например, фигуру 1В) мыши, которым вводили противораковую вакцину и антитело к ОХ40 в более высокой дозе (2,5 мг/кг), не показывали такого эффекта в отношении роста опухоли, как мыши, получавшие противораковую вакцину и агонист ОХ40, представляющий собой антитело, в дозе 1 мг/кг (фигура 2B: нижняя правая панель). Таким образом, лечение противораковой вакциной и агонистом, OX40, представляющим собой антитело, в дозе 1 мг/кг ингибирует рост опухоли у мышей.
Пример 3. Лечение противораковой вакциной и агонистом, OX40, представляющим собой антитело, увеличивало соотношение CD8/Treg в опухоли в мышиной модели онкогенеза
Исследование проводили на мышиной модели онкогенеза для оценки эффекта лечения противораковой вакциной (эпитоп CTL из антигена E7 HPV16, эпитоп Т-хелперов PADRE и адъювант QuilA) и агонистом ОХ40 в отношении иммунного ответа (фигура 3А). Мышам (C57BL6; самки 6-8-недельного возраста) инъецировали опухолевые клетки TC-1 (7×104 подкожно). Введение антитела к OX40 (клон OX86) начинали на 10 день после инъекции клеток TC-1. Антитело к OX40 вводили дважды в неделю в дозах 0,5, 1,0 или 2,5 мг/кг, внутрибрюшинно. Всего исследовали 8 групп мышей (n=5/группа), включая мышей, которых не обрабатывали, получавших отдельно вакцину, отдельно антитело к OX40 (0,5 и 1,0 мг/кг) и антитело к OX40 (0,5, 1,0 и 2,5 мг/кг) и противораковую вакцину. Исследование повторяли дважды. На фигурах 3B и 3C показан эффект различных доз Ox40 отдельно или в комбинации с вакциной в отношении CD8 T-клеток, E7-специфических CD8 T-клеток, Treg-клеток и соотношения CD8/Treg.
Пример 4. Лечение противораковой вакциной и агонистом, OX40, представляющим собой антитело, стимулировало антиген-специфический иммунный ответ в мышиной модели онкогенеза
Исследование проводили на мышиной модели онкогенеза для оценки эффекта лечения противораковой вакциной (эпитоп CTL из антигена E7 HPV16, эпитоп Т-хелперов PADRE и адъювант QuilA) и агонистом ОХ40 в отношении иммунного ответа (фигура 4А). Мышам (C57BL6; самки 6-8-недельного возраста) инъецировали опухолевые клетки TC-1 (7×104 подкожно). Введение антитела к OX40 (клон OX86) начинали на 10 день после инъекции клеток TC-1. Антитело к OX40 вводили дважды в неделю в дозах 1,0, 1,75 или 2,5 мг/кг, внутрибрюшинно. Всего исследовали 4 группы мышей (n=5/группа), включая мышей, которых не обрабатывали, и получавших отдельно антитело к OX40 (1,0, 1,75 и 2,5 мг/кг). Исследование повторяли дважды.
Никакого эффекта в отношении процента или количества CD8+ T-клеток в селезенке (фигура 4B: верхняя левая панель) или опухоли (фигура 4C: верхняя правая панель) не обнаружили после лечения антителом к OX40 во всех дозах. Все три дозы в значительной степени значительно повышали не являющиеся Treg CD4 T-клетки (CD4+ FoxP3-) в селезенке (фигура 4B, верхняя правая панель) и в опухоли (фигура 4C, верхняя правая панель). Мыши, получавшие агонист OX40, представляющий собой антитело, имели аналогичные уровни Treg-клеток (CD4+ Foxp3+; фигура 4B: нижняя панель) по сравнению с мышами, не получавшими лечение. Однако мыши, получавшие антитело к OX40, демонстрировали повышенные уровни Treg-клеток, инфильтрирующих опухоль, с повышением дозировки антитела к OX40 (фигура 4С: нижняя панель). Не углубляясь в определенную теорию, увеличение количества Treg-клеток, инфильтрирующих опухоль, может объяснить отсутствие терапевтического эффекта при использовании 2,5 мг/кг антитела к OX40 с противораковой вакциной.
Пример 5. Лечение противораковой вакциной, агонистом, OX40, представляющим собой антитело, и ингибитором индоламин-2,3-диоксигеназы (IDO) снижало рост опухоли и увеличивало выживаемость в мышиной модели онкогенеза
Мышиную опухоль TC-1, которая экспрессирует онкогенный белок E7 из HPV-16, использовали в качестве суррогата человеческих опухолей, инфицированных HPV-16. Мышам (C57BL6; самки 6-8-недельного возраста) инъецировали опухолевые клетки TC-1 (7×104 подкожно) в день 0. Введение антитела к OX40 (клон OX86) начинали на 10 день после инъекции клеток TC-1. Антитело к OX40 вводили дважды в неделю в дозе 1,0 мг/кг, внутрибрюшинно. Начиная с 10 дня, мышам вводили 1-метилтриптофан (1-MT) путем добавления 1-MT (2 мг/мл) в питьевую воду. Всего исследовали 8 групп мышей (n=5/группа), включая мышей, которых не обрабатывали, получавших отдельно антитело к OX40 (1,0 мг/кг), отдельно 1-MT, антитело к OX40 и 1-MT, отдельно противораковую вакцину, противораковую вакцину и антитело к OX40 (1,0 мг/кг), противораковую вакцину и 1-MT, и противораковую вакцину, антитело к OX40 и 1-MT.
У мышей, получавших противораковую вакцину, агонист OX40, представляющий собой антитело (1 мг/кг), и 1-MT, значительно ингибировался и/или задерживался рост опухоли в мышиной модели онкогенеза (фигура 5B: панель h) по сравнению с другими группами мышей, в том числе мышей, получавших противораковую вакцину и антитело к OX40 (фигура 5B: панель f) или противораковую вакцину и 1-MT (фигура 5B: панель g). Среди мышей, получавших противораковую вакцину, агонист OX40, представляющий собой антитело, и 1-MT, две мыши продемонстрировали полное сокращение объема опухоли через ~35 дней после инъекции опухолевых клеток TC-1. Мыши, получавшие противораковую вакцину, агонист OX40, представляющий собой антитело (1 мг/кг) (красный), и 1-MT, характеризовались увеличенной выживаемостью по сравнению с другими группами мышей, в том числе мышей, получавших противораковую вакцину и антитело к OX40 (синий) или противораковую вакцину и 1-MT (зеленый) (фигура 5С). У этих мышей наблюдали выживаемость до ~80% вплоть до приблизительно 55 дней после инъекции опухолевых клеток TC-1. В отличие от этого, ~20% мышей, получавших противораковую вакцину и агонист OX40, представляющий собой антитело, оставались живыми вплоть до приблизительно 55 дней после инъекции опухолевых клеток TC-1 в соответствии с полученными ранее результатами (смотри, например, фигуру 1B). Ингибирование роста опухоли и выживаемость мышей коррелировали (фигура 5D). Таким образом, добавление 1-MT к лечению противораковой вакциной и антителом к OX40 приводило к значительному увеличению терапевтической эффективности лечения (например, 60% против 20% полной регрессии). Результаты, представленные в данном документе, демонстрируют, что применение агонистов OX40 и ингибиторов IDO в комбинации с противораковыми вакцинами характеризуется потенциалом к увеличению эффективности противораковых вакцин.
Реализацию результатов, описанных в данном документе выше, обеспечивали с применением следующих материалов и способов.
Мышей (C57BL6; самок 6-8-недельного возраста) получали из Jackson Laboratory (Бар Харбор, Мэн) и содержали в свободных от патогенной микрофлоры условиях.
Клетки TC-1, полученные путем котрансфекции ранних белков 6 и 7 (E6 и E7) из штамма 16 папиллома-вируса человека (HPV16) и активированного онкогена ras в первичные эпителиальные клетки легких мыши C57BL/6, получили из ATCC (Манассас, Виргиния). Клетки TC-1 выращивали в RPMI 1640, дополненной 10% FBS, пенициллином и стрептомицином (100 ед/мл каждого) и L-глутамина (2 мM) при 37°C с 5% CO2.
Вакцина состояла из эпитопа CTL из антигена E7 (E749-57, 9-мерный пептид (RAHYNIVTF)), смешанного с 13-мерным эпитопом Т-хелперов PADRE (aKChaVAAWTLKAAa) (оба от Celtek Bioscience (Нешвилл, Теннесси)) и адъювантом QuilA (Brenntag, Дания). Антитело к OX40 (клон OX86) предоставлено Medimmune. 1-метил-D-триптофан (1-MT) получен от Sigma-Aldrich (Сент-Луис, Миссури).
В экспериментах, где конечной точкой был анализ роста опухоли и выживаемости, мышам (n=5/группа) имплантировали 70000 клеток TC-1 в 0 день. Антитело к OX40 (1 мг/кг, внутрибрюшинно) вводили либо на 4 день, либо на 10 день после имплантации опухоли. На 10 день, когда все мыши имели опухоли ~3-4 мм в диаметре, животным из соответствующих групп вводили вакцину (E7-100μг/мышь, PADRE-20μг/мышь, QuilA-10μг/мышь) подкожно. Также начиная с 10 дня после имплантации опухоли в течение всего эксперимента мышам из соответствующих групп выпаивали 1-MT (2 мг/мл) с питьевой водой. Мышей обрабатывали вакциной еженедельно в течение всего эксперимента; антитело к ОХ40 вводили дважды в неделю. Опухоли измеряли каждые 3-4 дня с использованием цифровых штангенциркулей, и объем опухоли рассчитывали с помощью формулы V=(W2 x L)/2, где V означает объем, L означает длину (более длинный диаметр) и W означает ширину (более короткий диаметр). В этих экспериментах мышей умерщвляли, когда они начинали агонизировать, наблюдали изъязвление опухоли или объем опухоли достигал 1,5 см3.
Другие варианты осуществления
Из вышеприведенного описания будет очевидным, что в настоящее изобретение, описанное в данном документе, можно вносить варианты и модификации для его адаптации к различным способам использования и условиям. Такие варианты осуществления также находятся в пределах объема следующей формулы изобретения.
Изложение перечня элементов в любом определении переменной в данном документе включает определения такой переменной в качестве любого отдельного элемента или комбинации (или подкомбинации) перечисленных элементов. Изложение варианта осуществления в данном документе включает такой вариант осуществления в качестве любого отдельного варианта осуществления или в комбинации с любыми другими вариантами осуществления или их частями.
Все патенты и публикации, упоминаемые в данном описании, включены в данный документ посредством ссылки в той же степени, как если бы каждый независимый патент или публикация были конкретно и отдельно указаны как включенные посредством ссылки.
Реферат
Группа изобретений относится к медицине, а именно, к онкологии и может быть использована для повышения противоопухолевого иммунного ответа. Способы по изобретению включают введение антитела или его антиген-связывающего фрагмента, являющихся агонистами OX40, 1-метилтриптофана (1-MT) и иммуногенной композиции, содержащей опухолевый антиген, где указанный опухолевый антиген представляет собой антиген HPV. Использование изобретений позволяет добиться регрессии опухоли за счет синергетического эффекта комбинации путем индукции иммунного ответа на опухолевый антиген и увеличения соотношения CD8T-клеток и регуляторных T-клеток в опухоли. 5 н. и 20 з.п. ф-лы, 5 ил., 5 пр.

Комментарии