Селективные лиганды-разрушители андрогенных рецепторов (sard) и способы их применения - RU2689988C2
Код документа: RU2689988C2
Чертежи




























Описание
Область техники, к которой относится изобретение
Данное изобретение относится к новым соединениям индола, индазола, бензимидазола, индолина, хинолона, изохинолина и карбазола как селективным разрушителям андрогенных рецепторов (SARD), фармацевтическим композициям и их применению при лечении рака предстательной железы, поздней стадии рака предстательной железы, кастрационно-резистентного рака предстательной железы, андрогенной алопеции или других гипер андрогенных кожных заболеваний, болезни Кеннеди, амиотрофического бокового склероза (ALS), и миомы матки, а также способы снижения уровней андрогенных рецепторов полной длины (AR-FL), включая патогенные и/или резистентные мутации, вариант AR-сплайсинга (AR-SV) и патогенные полиглутаминовые (polyQ) полиморфизмы AR у субъекта.
Уровень техники
Рак предстательной железы (PCa) является одним из наиболее часто диагностируемых некожных видов рака среди мужчин в США и является второй наиболее распространенной причиной смертей от рака в более чем 200 000 новых случаев и более 30 000 смертей в год в Соединенных Штатах. Рынок терапии PCa растет с ежегодной скоростью 15-20% в глобальном масштабе.
Терапия андрогенной депривации (ADT) является стандартом лечения прогресирующего PCa. Пациенты с прогрессирующим раком предстательной железы подвергаются ADT либо агонистами лютеинизирующего гормона, высвобождающего гормон (LHRH), антагонистами LHRH, либо двусторонней орхиэктомией. Несмотря на первоначальный ответ на ADT, прогрессия болезни неизбежна, и рак возникает как кастрационно-резистентный рак предстательной железы (CRPC). Вплоть у 30% пациентов с раком предстательной железы, которые переносят первичное лечение облучением или хирургическим вмешательством, развивается метастатическое заболевание в течение 10 лет после первичной терапии. Приблизительно у 50 000 пациентов в год развивается метастатическое заболевание, которое называется метастатическим CRPC (mCRPC).
Пациенты с CRPC имеют среднюю продолжительность жизни 12-18 месяцев. Несмотря на кастрационно-резистентность, CRPC по-прежнему зависит от оси сигнализации андрогенного рецептора (AR) для дальнейшего роста. Основной причиной повторного появления CRPC является повторная активация AR альтернативными механизмами, такими как: 1) интракриновый синтез андрогенов; 2) варианты AR-сплайсинга (AR-SV), у которых отсутствует лиганд связывающий домен (LBD); 3) AR-LBD мутации, способные противостоять антагонистам АR (то есть, мутанты, которые не чувствительны к ингибированию антагонистами АR, а в некоторых случаях антагонисты АR действуют, как агонисты АR, несущие эти LBD мутации); и 4) амплификация AR-гена в опухоли.
Критический барьер для прогресса в лечении CRPC заключается в том, что ингибиторы передачи сигналов AR, такие как энзалутамид, флутамид, бикалутамид и абиратор, действующие через LBD, не могут ингибировать рост, обусловленный N-концевым доменом (NTD)-зависимым конститутивно активным АR-СВ. Недавние высокоэффективные клинические исследования с энзалутамидом и абиратероном у пациентов с CRPC продемонстрировали, что 0% пациентов, выражающих AR-V7 (преобладающий AR-SV), ответили на любой из этих способов лечения, показывая необходимость в антагонистах АR следующего поколения, которые нацелены на AR-SV. Кроме того, значительное число пациентов с CRPC становятся невосприимчивыми к абиратерану или энзалутамиду, подчеркивая необходимость применения антагонистов АR следующего поколения.
Современные данные показывают, что рост CRPC зависит от конститутивно активного AR, включая AR-SV, которые не имеют LBD, таких как AR-V7, и поэтому не могут быть ингибированы обычными антагонистами. AR-ингибирование и деградация посредством привязки к домену, отличному от AR LBD, предоставляют альтернативные стратегии для управления CRPC.
Молекулы, которые разрушают АR, предотвращают любую непреднамеренную активацию АR посредством факторов роста или сигнальных путей, или смешанной лиганд-зависимой активации АR. Кроме того, молекулы, которые ингибируют конститутивную активацию AR-SV, чрезвычайно важны для обеспечения продолжительной пользы для пациентов с CRPC.
В настоящее время известны лишь несколько хемотипов, разрушающих AR, которые включают SARD AZD-3514, ARN-509 и ASC-J9. Однако, эти молекулы разрушают AR опосредованно в гораздо более высоких концентрациях, чем их коэффициент связывания, и они не способны разрушить AR-SV, которые в последние годы стали основной причиной возобновления, не подлежащего лечению CRPC.
Данное изобретение описывает новые антагонисты AR с уникальной фармакологией, которые сильно (высокая потенциальность и эффективность) и избирательно связывают AR (лучше, чем известные антагонисты), антагонизируют AR и разрушают AR полной длины (AR-FL) и AR-SV. Соединения селективных разрушителей андрогенных рецепторов (SARD) обладают двойной деградацией и ингибиторными функциями AR-SV и, следовательно, отличаются от любой доступной терапевтической терапии с помощью CRPC. Эти новые соединения селективных разрушителей андрогенных рецепторо7в (SARD) ингибируют рост клеток РСа и опухолей, которые зависят от AR-FL и AR-SV для пролиферации.
SARD имеют потенциал развиваться как новые терапевтические средства для лечения CRPC, которые не поддаются лечению с любыми другими антагонистами. Это уникальное свойство разрушения AR-SV имеет чрезвычайно важные следствия для здоровья при раке предстательной железы. Сообщается, что до настоящего времени только одна молекула (EPI-001) связывается с AR-NTD и ингибирует функцию AR и рост клеток PCa, хотя и с более низкой аффинностью, и имеет неспособность разрушать рецептор. SARD этого изобретения также связывают AR-NTD и ингибируют NTD-управляемую (то есть, лиганд независимую) AR активность.
Положительная корреляция между AR и PCa и отсутствие надежного AR-антагониста подчеркивает потребность в молекулах, которые ингибируют функцию AR посредством новых или альтернативных механизмов и/или участков связывания, и которые могут вызывать антагонистические действия в измененной клеточной среде.
Традиционные антиандрогены, такие как бикалютамид и флутамид, были одобрены для использования при раке предстательной железы. Последующие исследования продемонстрировали полезность антиандрогенов (например, флутамида, спиронолактона, ципротерон ацетата, финастерида и хлормадинон ацетата) в андрогензависимых дерматологических состояниях, таких как андрогенная алопеция (облысение мужского пола), юношеские угри и избыточное оволосение. Препубертатная кастрация предотвращает образование кожного сала и андрогенную алопецию, но это может быть отменено с помощью тестостерона, что указывает на его андрогенную зависимость.
Ген AR имеет полиморфизм повторов глутамина (polyQ) в экзоне 1, который при сокращении может усиливать трансактивацию AR (то есть, гиперандрогенизм). Было обнаружено, что укороченые полиоморфизмы polyQ чаще встречаются у людей с алопецией, избыточным оволосением и акне. Классические антиандрогены нежелательны для этих целей, потому что они неэффективны путем кожной дозировки, а их долгосрочное системное использование повышает риск неблагоприятных сексуальных эффектов, таких как гинекомастия и импотенция. Кроме того, подобно описаному выше CRPC, ингибирование активности, зависящей только от лиганда, может быть недостаточным, поскольку AR может быть активирован различными клеточными факторами, отличными от эндогенных тестостерона (T) и дигидротестостерона (DHT), такими как факторы роста, киназы, избыточная экспрессия со-активатора и/или смешанная активность к другим гормонами (например, эстрогены или глюкокортикоиды). Следовательно, блокирование связывания T и DHT к AR с классическим антиандрогеном может быть недостаточным для достижения желаемой эффективности.
Новая концепция представляет собой местное применение SARD для уничтожения АR, локализованного в пораженных областях кожи или другой ткани (тканях) без какого-либо системного антиандрогенизма. Для этого использование SARD, который не проникает в кожу или быстро метаболизируется, будет предпочтительным.
Подтверждением этого подхода является наблюдение, что было показано, что заживление кожной раны подавляется андрогенами. Кастрация мышей ускоряет заживление кожных ран, ослабляя воспаление в ранах. Отрицательная корреляция между уровнями андрогенов и кожным заживлением, и воспалением, в частности, объясняет еще один механизм, при котором высокие уровни эндогенных андрогенов усугубляют гиперандрогенные дерматологические состояния, такие как описанные в данном документе. Кроме того, он дает обоснование для лечения ран, таких как диабетические язвы или даже травмы, или кожные заболевания с воспалительным компонентом, таким как акне или псориаз, с местными SARD.
Андрогенная алопеция встречается у ~ 50% кавказских мужчин среднего возраста и до 90% в возрасте 80 лет. Миноксидил (местный сосудорасширяющий агент) и финастерид (системный ингибитор 5-альфа-редуктазы II типа) одобрены FDA для алопеции, но требуют 4-12 месяцев лечения, чтобы получить терапевтический эффект и только остановить потерю волос в большинстве случаев с легкой до умеренной, отрастания волос на 30-60%. Поскольку доступные в настоящее время способы лечения имеют медленную и ограниченную эффективность, которые широко варьируются между людьми и производят нежелательные сексуальные побочные эффекты, важно найти новый подход к лечению андрогенной алопеции и других гиперандрогенных дерматологических заболеваний.
Амиотрофический боковой склероз (ALS) является смертельным нейродегенеративным заболеванием. Пациенты с ALS характеризуются длительными повторениями полиглютаминов АR. Рилузол - доступный препарат для лечения ALS, однако он обеспечивает только кратковременные эффекты. Существует срочная необходимость в лекарствах, которые продлят выживание пациентов с ALS. Показано, что трансгенные животные ALS выживают дольше при кастрации и снижении уровня АR по сравнению с добавлением кастрации + нандролона (агониста). Кастрация снижает уровень АR, что может быть причиной длительного выживания.
Андрогены способствуют маточной пролиферации. Более высокие уровни тестостерона повышают риск развития миомы матки. Лечение миомы матки с помощью SARD поможет предотвратить или вылечить миому матки.
В данном документе мы описываем индольные, индазольные, бензимидазольные, индолиновые, хинолоновые, изохинолиновые и карбазольные SARD, которые связываются с LBD и альтернативным доменом связывания и деградации (BDD; расположенный за пределами LBD, возможно, в NTD), антагонизируют AR и разрушают AR, тем самым блокируют лиганд-зависимые и лиганд-независимые AR-активности. Этот новый механизм обеспечивает улучшенную эффективность при дозировке системно (например, для рака предстательной железы) или местно (например, дерматологические заболевания).
Х-связаная спинномозговая мышечная атрофия позвоночника (SBMA, также известная как болезнь Кеннеди) представляет собой мышечную атрофию, которая возникает из-за дефекта гена андрогенного рецептора на Х-хромосоме. Проксимальная конечность и слабость бульбарных мышц в некоторых случаях приводят к физическим ограничениям, включая зависимость от инвалидной коляски. Мутация приводит к затягиванию полиглутаминового тракта, добавленного к N-концевому домену андрогенного рецептора (polyQ AR). Связывание и активация этого удлиненного polyQ AR эндогенными андрогенами (тестостерон и DHT) приводит к развертыванию и ядерной транслокации мутантного андрогенного рецептора. Эти шаги необходимы для патогенеза и приводят к частичной потере функции трансактивации (то есть, нечувствительности к андрогенам) и плохо понимаемой нейромышечной дегенерации. В настоящее время нет болезнь-модифицирующего лечения, а скорее только направленные лечения симптомов. Усилия по нацеливанию polyQ AR болезни Кеннеди в качестве проксимального медиатора токсичности с помощью клеточного оборудования для стимулирования его разрушния, то есть, через использование SARD, обещают терапевтическое вмешательство. Селективные разрушители андрогенных рецепторов, такие как описанны в настоящем документе, связывают и разрушают различные рецепторы андрогенов (полноразмерный, сплайсинговый вариант, антиандроген-резистентные мутанты и, вероятно, также разрушают полиморфизмы polyQ AR), что указывает на то, что они являются перспективными для лечения SBMA.
Краткое описание сущности изобретения
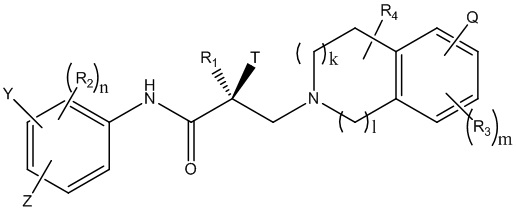
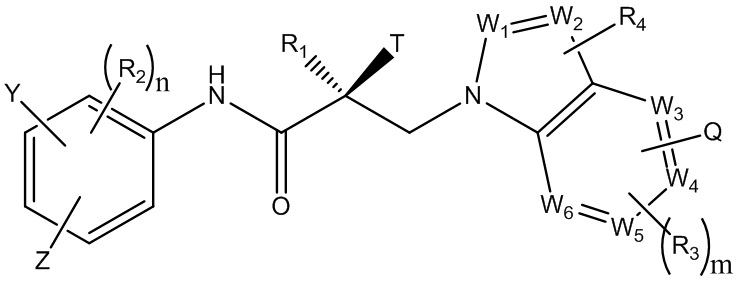
В одном варианте реализации изобретения, настоящее изобретение относится к соединению селективного разрушителя андрогенных рецепторов (SARD), представленному структурой формулы I:

I
где
W1 и W2 каждый независимо выбран из N или CH;
W3, W4, W5 и W6 каждый независимо выбран из CH или N;
где любой из W1, W2, W3, W4, W5 и W6 представляет собой CH, тогда H при необходимости заменен R4, Q или R3 в соответствующем положении, и если любой из W1, W2, W3, W4, W5 и W6 не является CH, тогда соответствующее положение является незамещенным;
T представляет собой OH, OR, -NHCOCH3, NHCOR или

Z представляет собой NO2, CN, COOH, COR, NHCOR или CONHR;
Y представляет собой CF3, F, I, Br, Cl, CN или C(R)3;
R представляет собой алкил, галоалкил, дигалоалкил, тригалоалкил, CH2F, CHF2,CF3, CF2CF3, арил, фенил, F, Cl, Br, I, алкенил или OH;
R1 представляет собой CH3, CH2F,CHF2,CF3, CH2CH3, или CF2CF3;
R2 представляет собой водород, галоген, CN, NO2, COOH, COOR, COR, NHCOR, CONHR, OH, OR, SH, SR, NH2, NHR, NR2, C1-C12-алкил, C1-C12-галоалкил, O-C1-C12-алкил, O-C1-C12-галоалкил, -SO2-арил, -SO2-фенил, -CO-арил, арилалкил, бензил, арил, или C3-C7-циклоалкил;
Q представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO, или OCN;
R3 представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, NH2, SH, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
R4 представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, NH2, SH, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
n равен целому числу между 1-3; и
m равен целому числу между 1-3.
В другом варианте реализации изобретения W1, W2, W3, W4, W5, и W6представляют собой CH. В другом варианте реализации изобретения W2 представляет собой N и W1, W3, W4, W5, и W6 представляют собой CH. В другом варианте реализации изобретения W3 представляет собой N и W1, W2, W4, W5, и W6 представляют собой CH. В другом варианте реализации изобретения W1 представляет собой N и W2, W3, W4, W5, и W6представляют собой CH.
В другом варианте реализации изобретения соединение селективного разрушителя андрогенных рецепторов (SARD) представлено структурой формулы III:

где
T представляет собой OH, OR, -NHCOCH3, NHCOR или

Z представляет собой NO2, CN, COOH, COR, NHCOR или CONHR;
Y представляет собой CF3, F, I, Br, Cl, CN или C(R)3;
R представляет собой алкил, галоалкил, дигалоалкил, тригалоалкил, CH2F,CHF2,CF3, CF2CF3, арил, фенил, F, Cl, Br, I, алкенил или OH;
R1 представляет собой CH3, CH2F,CHF2,CF3, CH2CH3, или CF2CF3;
R2 представляет собой водород, галоген, CN, NO2, COOH, COOR, COR, NHCOR, CONHR, OH, OR, SH, SR, NH2, NHR, NR2, C1-C12-алкил, C1-C12-галоалкил, O-C1-C12-алкил, O-C1-C12-галоалкил, -SO2-арил, -SO2-фенил, -CO-арил, арилалкил, бензил, арил, или C3-C7-циклоалкил;
Q представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
R3 представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, NH2, SH, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
R4 представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, NH2, SH, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
n равен целому числу между 1-3; и
m равен целому числу между 1-3.
В другом варианте реализации изобретения соединение селективного разрушителя андрогенных рецепторов (SARD) представлено структурой формулы V:
V
где Z, Y, R, Q, R1, R2, R3, R4, T, m и n являются такими, как описано в структуре формулы III; и l равен 0 или 1; и k равен 0, 1 и 2.
В другом варианте реализации изобретения соединение селективного разрушителя андрогенных рецепторов (SARD) представлено структурой формулы VI:

VI
где Z, Y, R, Q, R1, R2, R3, R4, T, m и n являются такими, как описано в структуре формулы III.
В другом варианте реализации изобретения соединение селективного разрушителя андрогенных рецепторов (SARD) представлено структурой формулы VII:

где Z, Y, R, Q, R1, R2, R3, R4, T, m и n являются такими, как описано в структуре формулы III.
В другом варианте реализации изобретения соединение селективного разрушителя андрогенных рецепторов (SARD) представлено структурой формулы IV:

IV
где Z, Y, R, Q, R1, R2, R3, R4, T, m и n являются такими, как описано в структуре формулы III.
В другом варианте реализации изобретения соединение SARD по настоящему изобретению представлено структурой любого из следующих соединений:
Индолы:




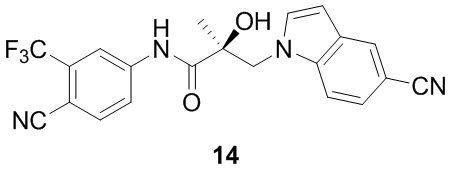


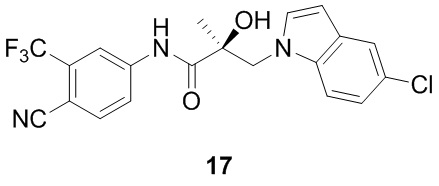




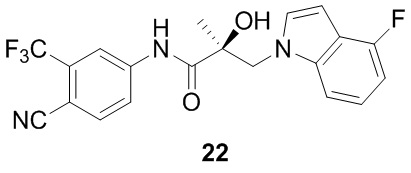
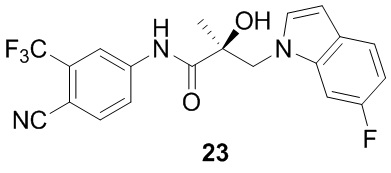








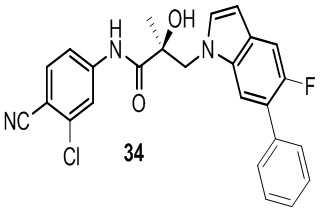

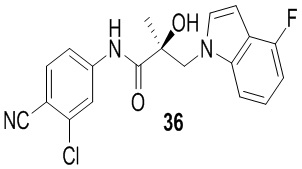






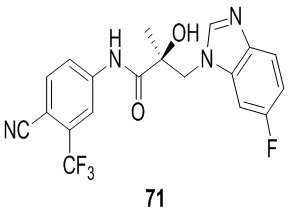
Бензимидазолы:

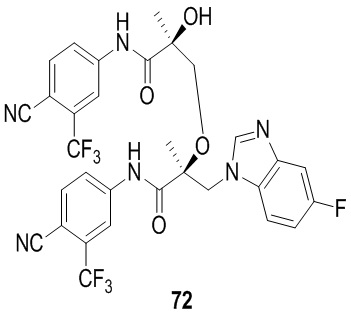


Пирроло-пиридины:

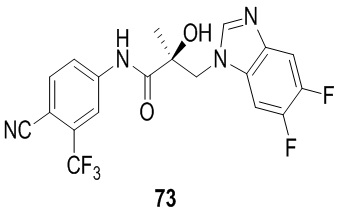
Индазолы:




Индолины:

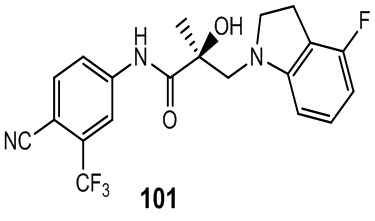
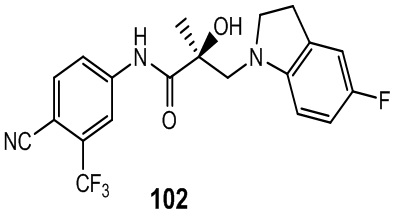

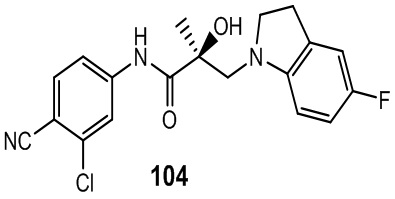

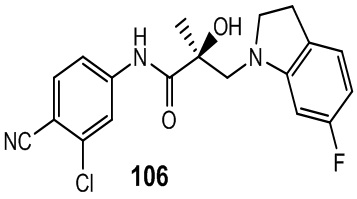








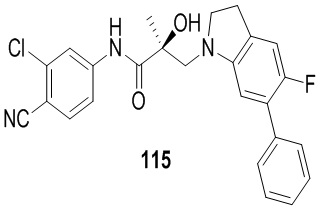
Изохинолины и хинолины:



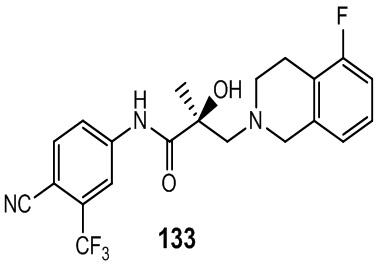




В другом варианте реализации изобретения соединение по настоящему изобретению связывается с АR через альтернативный домен связывания и деградации (BDD). В другом варианте реализации изобретения некоторые из соединений по настоящему изобретению дополнительно связывают AR-лиганд связывающего домена (LBD). В другом варианте реализации изобретения соединение демонстрирует активность деградации AR-сплайсинга (AR-SV). В другом варианте реализации изобретения соединение дополнительно проявляет активность деградации AR-полной длины (AR-FL). В другом варианте реализации изобретения соединение проявляет ингибирующую активность AR-SV (то есть является антагонистом AR-SV). В другом варианте реализации изобретения соединение дополнительно проявляет ингибирующую активность AR-FL (то есть является антагонистом AR-FL). В другом варианте реализации изобретения соединение обладает двойной AR-SV деградацией и AR-SV ингибирующими функциями. В другом варианте реализации изобретения соединение дополнительно обладает двойной AR-FL деградацией и AR-FL ингибиторными функциями.
В одном варианте реализации изобретения настоящее изобретение относится к фармацевтической композиции, содержащей соединение SARD в соответствии с настоящим изобретением или его изомер, фармацевтически приемлемую соль, фармацевтический продукт, полиморф, гидрат или любую их комбинацию и фармацевтически приемлемый носитель. В другом варианте реализации изобретения фармацевтическая композиция составлена для местного применения. В другом варианте реализации изобретения фармацевтическая композиция находится в форме раствора, лосьона, мази, крема, протирки, липосомы, спрея, геля, пены, роликовой палочки, очищающих мыл или батончиков, эмульсии, мусса, аэрозоля, шампуня или любой их комбинации.
В одном варианте реализации изобретения настоящее изобретение направлено на способ лечения, подавления, уменьшения частоты возникровения заболевания, снижения тяжести или ингибирования прогрессирования рака предстательной железы (PCa) и его симпотмов, или увеличения выживаемости субъекта мужского пола, страдающего раком предстательной железы, включая введение указанному субъекту терапевтически эффективного количества соединения по настоящему изобретению или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения рак предстательной железы представляет собой прогрессирующий рак предстательной железы, кастрационно-резистентный рак предстательной железы (CRPC), метастатический CRPC (mCRPC), неметастатический CRPC (nmCRPC), высокорисковый nmCRPC или любая их комбинация.
В одном варианте реализации изобретения настоящее изобретение направлено на способ лечения, подавления, уменьшения частоты возникровения заболевания, снижения тяжести или ингибирования прогрессирования прогрессирующего рака предстательной железы и его симптомов или увеличения выживаемости субъекта мужского пола, страдающего от прогрессирующего рака предстательной железы, включая введение указанному субъекту терапевтически эффективное количество соединения по настоящему изобретению или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любую их комбинацию.
В одном варианте реализации изобретения настоящее изобретение направлено на способ лечения, подавления, уменьшения частоты возникровения заболевания, снижения тяжести или ингибирования кастрационно-резистентного рака простаты (CRPC) и его симптомов, или увеличения выживаемости субъекта мужского пола, страдающего от кастрационно-резистентного рака предстательной железы, включающий введение указанному субъекту терапевтически эффективного количества соединения по настоящему изобретению или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации.
В другом варианте реализации изобретения рак предстательной железы зависит от AR-SV для пролиферации. В другом варианте реализации изобретения рак предстательной железы дополнительно зависит от AR-FL для пролиферации. В другом варианте реализации изобретения AR-SV представляет собой AR-V7 или ARv567es. В другом варианте реализации изобретения рак предстательной железы зависит от АR, который содержит мутацию W741L или мутацию T877A или другую антиандрогенную резистентность к AR-LBD-мутациям или любую их комбинацию. В другом варианте реализации изобретения рак предстательной железы зависит от амплификации гена AR в опухоли. В другом варианте реализации изобретения может быть гетерогенная экспрессия AR, так что рак предстательной железы может зависеть от множественных вариаций AR и/или амплификаций внутри одного пациента. В другом варианте реализации изобретения субъект далее получает терапию андрогенной депривации (ADT). В другом варианте реализации изобретения субъект не прошел терапию андрогенной депривации (ADT). В другом варианте реализации изобретения рак устойчив к лечению антагонистом андрогенного рецептора. В другом варианте реализации изобретения антагонистом андрогенного рецептора является энзалутамид, флутамид, бикалютамид, абиратор, ARN-509, AZD-3514, галетерон, ASC-J9, флутамид, гидроксифлутамид, нилутамид, ацетат ципротерона, кетоконазол, спиронолактон или любую их комбинацию. В другом варианте реализации изобретения введение соединения снижает уровни AR, AR-полной длины (AR-FL), AR-FL с антиандрогенной устойчивостью, ассоциирующими мутации AR-LBD, варианта AR-сплайсинга (AR-SV), ген-амплифицированного AR, или любой их комбинация, у указанного субъекта.
В одном варианте реализации изобретения настоящее изобретение относится к способу снижения уровней вариантов AR-сплайсинга у субъекта, включающему введение указанному субъекту терапевтически эффективного количества соединения по настоящему изобретению или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения способ дополнительно уменьшает уровни AR-полной длины у указанного субъекта. В другом варианте реализации изобретения восстановление достигается за счет деградации, ингибирования или двойной деградации и ингибирующей функции вариантов AR-сплайсинга (AR-SV) или AR-FL, включая мутанты устойчивости к ангиотензинмеру, такие как W741L и T877A. В другом варианте реализации изобретения восстановление дополнительно достигается деградацией, ингибированием или двойной деградацией и ингибирующей функцией AR-FL. В другом варианте реализации изобретения восстановление дополнительно достигается деградацией или ингибированием AR из амплифицированного гена AR в опухоли.
В одном варианте реализации изобретения настоящее изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования болезни Кеннеди у субъекта, включающий введение указанному субъекту соединения по настоящему изобретению.
В одном варианте реализации изобретения настоящее изобретение направлено на способ снижения уровней полиглутаминовых (polyQ) AR полиморфов у субъекта, включающий введение соединения в соответствии с настоящим изобретением. В другом варианте реализации изобретения восстановление достигается путем деградации, ингибирования или двойной деградации и ингибирующей функции указаных полиглутаминов (polyQ) AR полиморфов (polyQ-AR). В другом варианте реализации изобретения polyQ-AR представляет собой короткий polyQ полиморф или динный polyQ полиморф. В другом варианте реализации изобретения polyQ-AR представляет собой короткий polyQ полиморф, и этот способ дополнительно лечит кожную болезнь. В другом варианте реализации изобретения polyQ-AR представляет собой длинный polyQ полиморф, и указанный способ дополнительно лечит болезнь Кеннеди.
В одном варианте реализации изобретения настоящее изобретение направлено на способ лечения, подавления, снижения частоты возникновения, снижения тяжести или ингибирования прогрессирования бокового амиотрофического склероза (ALS) у субъекта, включающий введение терапевтически эффективного количества соединения по настоящему изобретению или его изомер, фармацевтически приемлемая соль, фармацевтический продукт, полиморф, гидрат или любой их комбинации; или его фармацевтической композиции.
В одном варианте реализации изобретения настоящее изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения, снижения тяжести или ингибирования прогрессирования миомы матки у субъекта, включающий введение терапевтически эффективного количества соединения по настоящему изобретению или его изомера, фармацевтически приемлемую соль, фармацевтический продукт, полиморф, гидрат или любой их комбинации; или его фармацевтической композиции.
В одном варианте реализации изобретения настоящее изобретение направлено на способ: (a) лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования акне у субъекта; (b) уменьшение производства кожного сала у субъекта; (c) лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования избыточного оволосения у субъекта; (d) лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования алопеции у субъекта; (e) лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования гормонального состояния у женщин; (f) лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования сексуальных извращений, гиперсексуальности или парафилий у субъекта; (g) лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования андрогенного психоза у субъекта; (h) лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования вирилизации у субъекта; (i) лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования синдрома андрогенной нечувствительности у субъекта; (j) увеличение, модулирование или улучшение овуляции у животного; (k) лечения, подавления, уменьшения частоты возникновения заболевания, уменьшения тяжести или ингибирования прогрессирования рака у субъекта; (l) лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования бокового амиотрофического склероза (ALS); (m) лечения, подавления, уменьшения частоты возникновения заболевания, снижение тяжести или ингибирование прогрессирования миомы матки или любой их комбинации, включающей введение соединения по настоящему изобретению или его фармацевтической композиции.
Краткое описание чертежей
Предмет, рассматриваемый в качестве изобретения, особо указывается и четко заявлен в заключительной части спецификации. Изобретение, однако, как к организации, так и к способу работы вместе с объектами, особенностями и преимуществами, может быть лучше всего понято со ссылкой на следующее подробное описание при чтении с прилагаемыми графическими матералами, на которых:
Фигура 1 представляет ингибирование трансактивации AR для соединений SARD: (A) 14, 18, и 20; (B) 11 и 12; и (C) 1123 и 27; этого изобретения.
Фигура 2 A демонстрирует деградацию в клетках LNCaP с использованием соединений SARD по данному изобретению (11 и 20): клетки LNCaP высевали в 6-луночные планшеты по 1 млн клеток/лунка. Клетки поддерживали в бессывороточных условиях в течение 3 дней. Клетки обрабатывали, как указано на фигуре, собирали, белок экстрагировали и Проводили вестерн-блоттинг для AR. Фигура 2B представляет эффекты антагонистов AR и SARD 11 на рост клеток LNCaP: клетки LNCaP высевали в 96-луночные планшеты по 10000 клеток/лунка в RPMI + 1% csFBS без фенолового красного. Клетки обрабатывали, как указано на фигуре, в комбинации с 0.1 нМ R1881 в течение 6 дней со средним изменением на 3-й день. По истечении 6 дней клетки фиксировали и окрашивали сульфородаминовым в синие пятно.
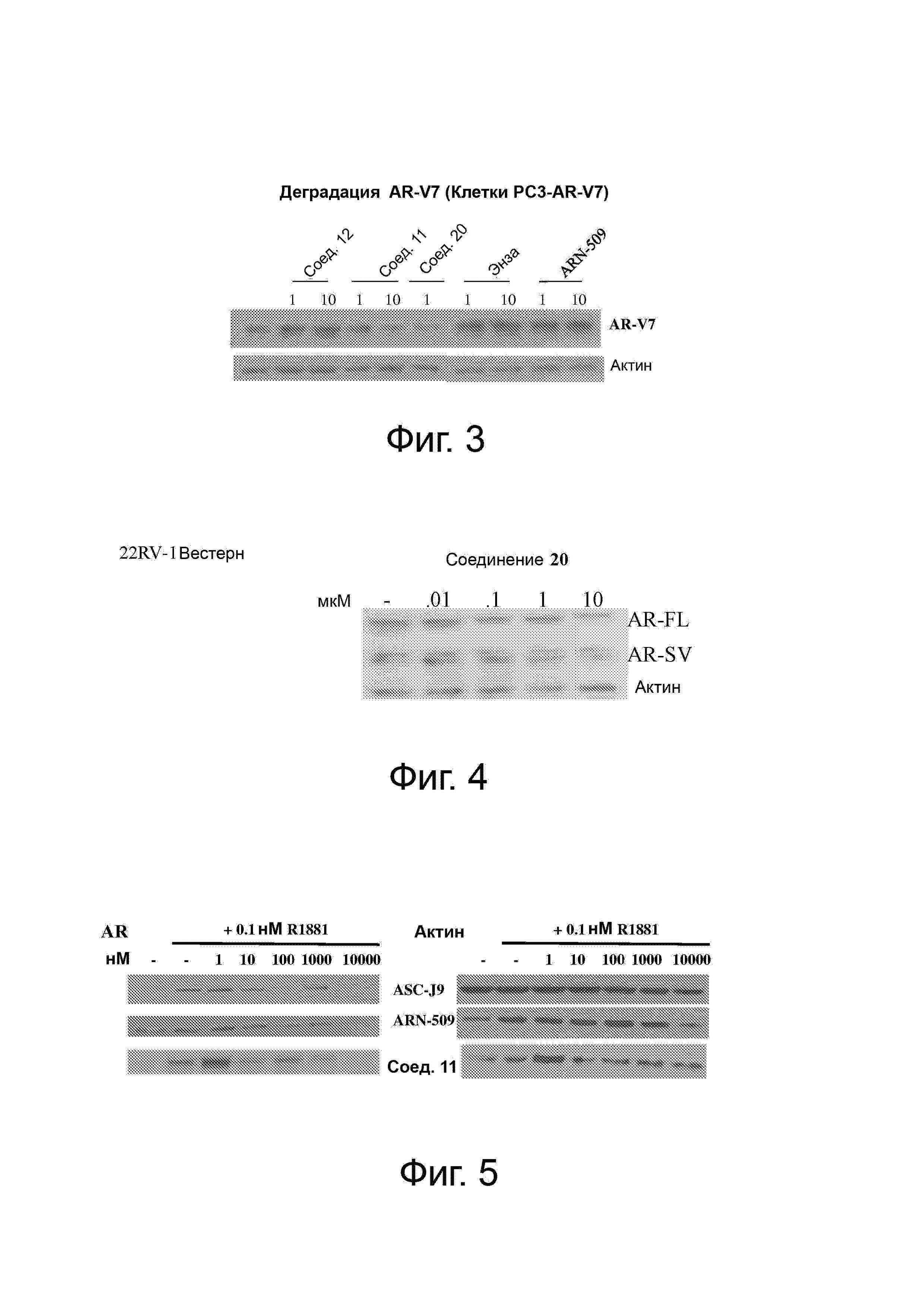
Фигура 3 представляет собой деградацию AR-V7 (клетки PC3-AR-V7) с использованием соединений SARD по настоящему изобретению (11, 12 и 20). Клетки PC-3 рака предстательной железы были сыроткой, стабильно трансфицированной с помощью конструкции лентивируса для AR-V7. Как только стабильные клетки были выбраны, клетки высевали в 6-луночные планшеты по 1 млн клеток/лунка. Клетки обрабатывали, как указано на фигуре (мкМ) и Вестерн-блот выполняли для AR и актина. Результаты показывают, что SARD имеет потенциал к деградации процессированной версии AR типа AR-V7, в то время как энзалутамид или ARN-509 не влияют на экспрессию AR-V7, что указывает на то, что SARD по настоящему изобретению, в отличие от энзалутамида и ARN-509, может лечить AR-V7-зависимый CRPC.
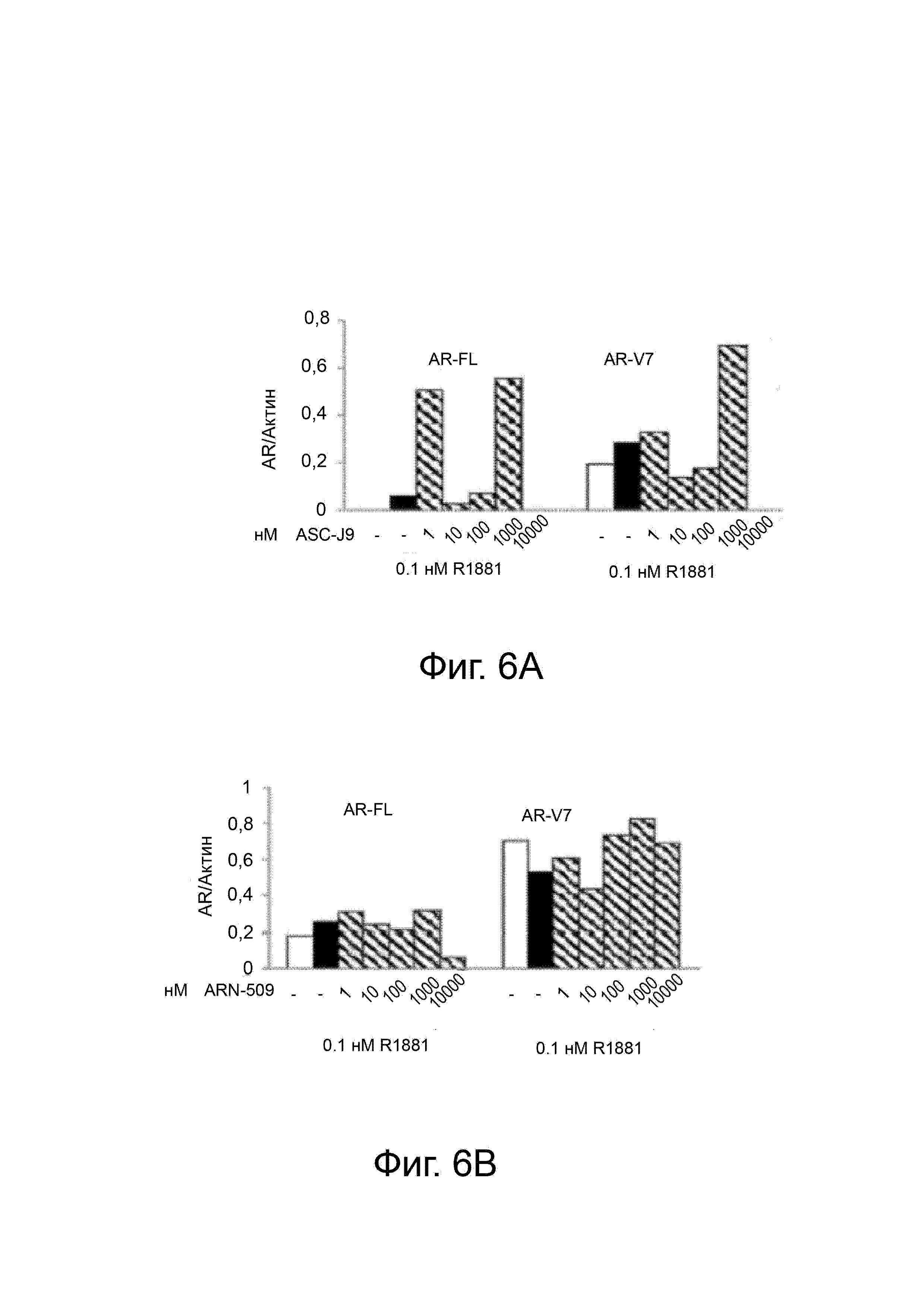
Фигура 4 демонстрирует через Вестерн-блот, что 20 разрушило AR-FL и AR-SV в клетках 22RV-1, что далее способствовало их использованию при лечении AR-SV-зависимого CRPC.
Фигура 5 представляет SARD-деградацию AR в клетках LNCaP при использовании 11.
Фигура 6 представляет SARD-деградацию AR-FL и AR-V7 в клетках 22RV-1 при использовании (A) ASC-J9, (B) ARN-509 и (C) 11.
Фигура 7, что 11 ингибирует трансактивацию AR AR-NTD-DBD-зависимую (A/BCD) конструкцию AR, в которой отсутствует LBD. (A) AR A/BCD увеличивает направленную активность GRE-LUC. Конструкция AR A/BCD, в которой отсутствует лигандсвязывающий домен или пустой вектор, трансфицировали в клетки HEK-293 вместе с GRE-LUC и CMV-ренилла LUC. Через 40 часов после трансфекции клетки собирали и проводили анализ люциферазы. (B) AR A/BCD активность была ингибирована с помощью 11. Конструкция A/BCD AR, которая лишена связывающего лиганда домена (LBD), была трансфицирована вместе с GRE-LUC и CMV-LUC. Клетки обрабатывали через 24 часа после трансфекции, как указано на фигуре, и проводили анализ люциферазы через 48 часов после трансфекции. 11 (SARD) ингибирует активность конструкции, лишенной LBD, подтверждает связывание с альтернативным участком в дополнение к LBD. (C) и (D) Не-SARD антагонисты ARN-509 и энзалутамид не ингибировал активность этой конструкции AR, не содержащей LBD, что указывает на то, что из тестируемых соединений только SARD по настоящему изобретению обладают способностью ингибировать независимую от лиганда активность AR.
Фигура 8 представляет данные, сравнивающие соединения 11, 12 и 14 с галетероном, EPI-001 и энзалутамидом в исследованиях трансактивации AR. (A) 11, 12, и 14, галетерон, EPI-001, и энзалутамид; и (B) 11, галетерон, и энзалутамид. SARD настоящего изобретения более сильно ингибируют (AR-FL) транзакцию.
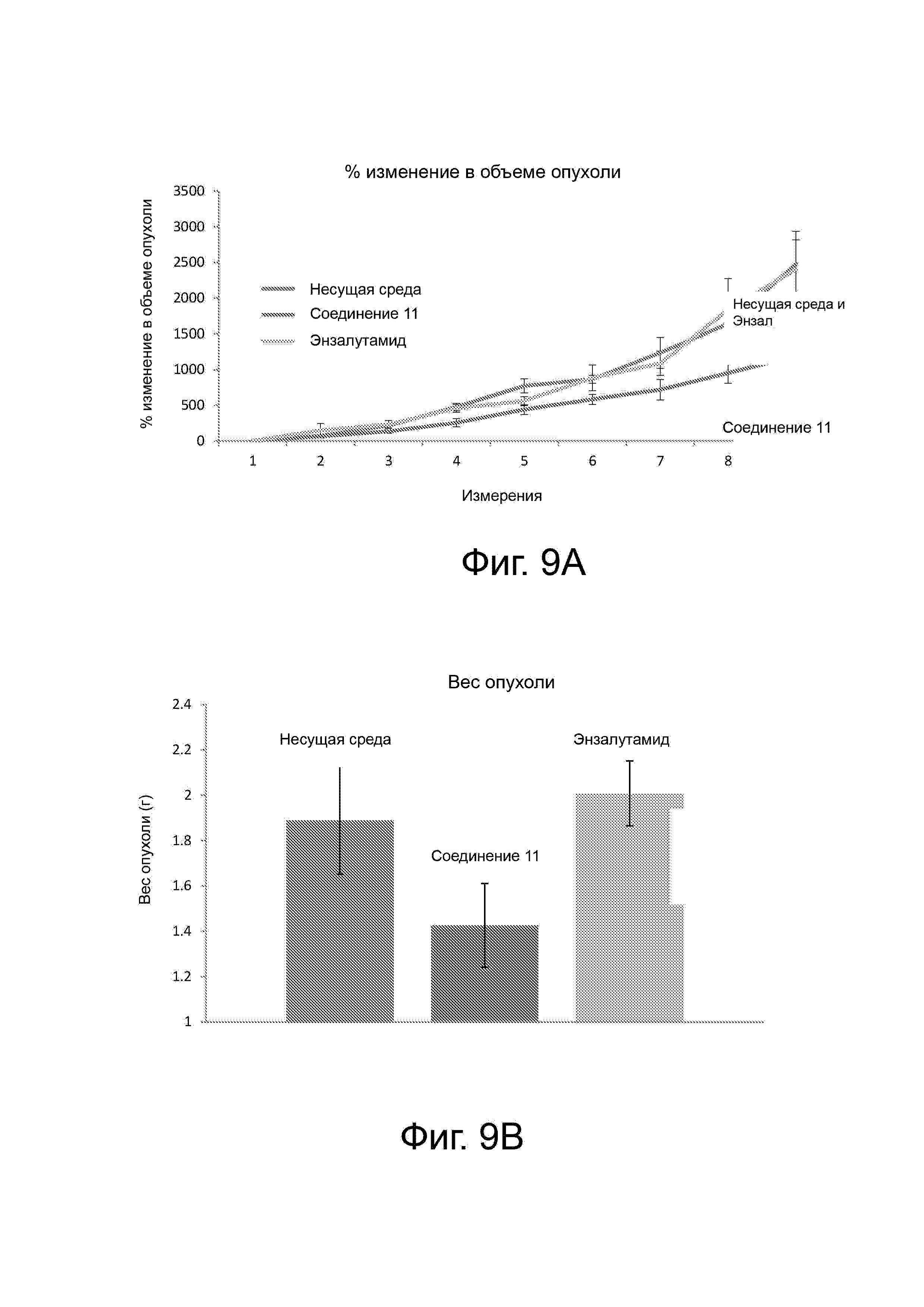
Фигура 9 демонстрирует, что 11 ингибирует рост опухоли агрессивного рака предстательной железы (22RV-1), который экспрессирует вариант AR-сплайсинга (рост, обусловленный AR-V7). (A) 11 значительно уменьшил объем опухоли и (В) массу опухоли в исследовании опухоли ксенотрансплантата 22RV-1, тогда как антагонист антагонистов АR не имел никакого эффекта по сравнению с несущей средой. (C) показывает, что опухолевые экспрессируемые уровни AR-FL и AR-V7 были уменьшены на 11, но не энзалутамид, что свидетельствует о том, что активность in vivo коррелирует с деградацией AR в опухолях; и (D) демонстрирует in vivo антиандрогенный тон в экспрессии генов, поскольку уровень PSA в сыворотке у этих животных был уменьшен с помощью 11, а не с энзалутамидом в этом исследовании 22RV-1 ксенотрансплантата.
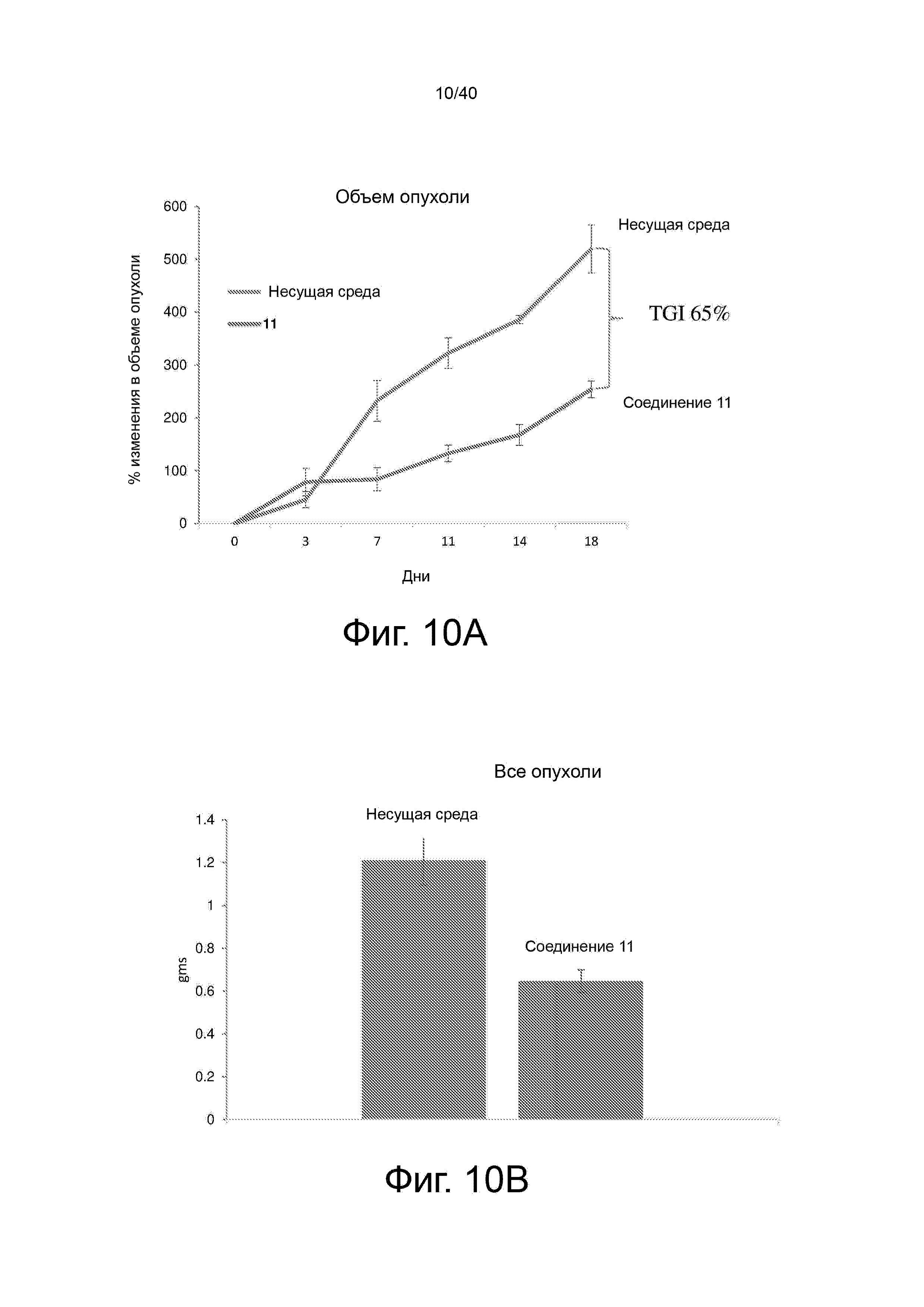
Фигура 10 демонстрирует, что 11 ингибировал рост ксенотрансплантата опухоли LNCaP через (A) уменьшенние объема опухоли и (B) массы и (C) уровней PSA в сыворотке у животных, получавших 11 по сравнению с несущей средой.
Фигура 11 представляет деградацию в клетках LNCaP с использованием 27, 20, 12, 23 и 32. Клетки LNCaP высевали в 6-луночные планшеты с 1 млн клеток/лунка. Клетки поддерживали в бессывороточных условиях в течение 3 дней. Клетки обрабатывали, как указано на фигуре, собирали, белок экстрагировали и Проводили вестерн-блоттинг для AR. SARD демонстрировали селективную деградацию AR (то есть активность SARD) в нM диапазоне, то есть в концентрациях, сравнимых с значениями IC50 их антагониста. Известно, что клетки LNCaP экспрессируют AR-мутант T877A, демонстрируя способность деградировать резистентность к мутантным андрогенным рецепторам.
Фигура 12 представляет 22RV-1 Вестерн-блоты: клетки 22RV-1 высевали в 6-луночные планшеты при 1-1,5 млн. клеток/лунка в среде роста (RPMI + 10% FBS). На следующий день среду меняли и обрабатывали несущей средой или ответной дозой соединений 20, 24 и 30. После ночного лечения (12-16 часов) клетки промывали в ледяном PBS и собирали путем разделения в 1 мл PBS. Клетки подвергали гранулированию, белок экстрагировали, количественно определяли с использованием анализа BCA, и равное количество белка фракционировали на SDS-PAGE. Белки переносили на нейлоновую мембрану и проводили вестерн-блоттинг с AR-антителом (N20 из SCBT) и актин-антителом. Compounds 20, 24 и 30 были способны разрушать полноразмерный андрогенный рецептор (AR-FL) и обрезаный AR (AR-SV) в клетках 22RV-1, что указывает на то, что SARD могут преодолевать рак предстательной железы дикого типа или зависящий от AR-V7.
Фигура 13 представляет деградацию в клетках LNCaP (сверху) и 22RV-1 (снизу) с использованием 31 против галетерона. Используя способы, описанные в надписях на Фигуре 11 (LNCaP) и Фигуре 12 (22RV-1), 31 сравнивали с галетероном (клиническое руководство SARD). В то время как 31 продемонстрировала активность SARD как в LNCaP (мутантной AR, несущей мутацию T877A), так и в 22RV-1 (рост, зависящий от AR-SV, лишенный LBD-клеток), галетерон мало продемонстрировал отсутствие деградации AR на этих моделях.
Фигура 14 представляет деградацию в клетках LNCaP с использованием доза-ответ 12 или ARN-509. Используя способы, описанные на надписи для Фигуры 11 (LNCaP), активность SARD для 12 сравнивали с известным SARD ARN-509. 12 продемонстрировал активность в нM диапазоне (100-1000 nМ), тогда как ARN-509 имела активность только при 10,000 нM.
Фигура 15 представляет деградацию в клетках 22RV-1 при использовании 31. Используя способы, описанные на надписи для Фигуры 12 (22RV-1), активность SARD для 31 была продемонстрирована как деградация андрогенных рецепторов с полной длиной (AR) и обрезанного варианта сплайсинга (AR-V7).
Фигура 16 представляет деградацию в клетках LNCaP при использовании 70 и 73. Используя способы, описанные на надписи для Фигуры 11 (LNCaP), активность SARD для 70 и 73 была продемонстрирована при концентрациях ниже 100 нM. Это демонстрирует, что бензимидазолы по настоящему изобретению также проявляют мощную активность SARD.
Фигура 17 представляет биофизические данные, которые предполагают, что SARD связываются с N-терминальным доменом AR (в дополнение к LBD на C-конце). (A) и (B) Дозозависимый сдвиг интенсивности флуоресценции, т.е. флуоресцентного гашения, наблюдался с 11 при инкубировании с AR AF-1. Флуоресцентное плечо, наблюдаемое при 307 нм, что соответствует остаткам тирозина в AF-1, смещается для 11. Общая флуоресценция также заметно изменяется для 11. (C) Показанные данные были представлены как разница в флуоресценции между контрольным и обработанными образцами 11 (флуоресценция в отсутствие соединения - флуоресценция в присутствии соединения), увеличение дозозависимости наблюдалось в присутствии 11. В совокупности эти данные указывают на прямое взаимодействие между 11 и AR AF-1.
Фигура 18 демонстрирует деградацию в клетках LNCaP с использованием соединения SARD по данному изобретению (100). Клетки LNCaP высевали в 6-луночные планшеты с 1 млн клеток/лунка. Клетки поддерживали в бессывороточных условиях в течение 3 дней. Клетки обрабатывали, как указано на фигуре, собирали, белок экстрагировали и Проводили вестерн-блоттинг для AR.
Фигура 19 демонстрирует через Вестерн-блот, как описано выше для Фигуры 12, что 100, 102, и 130 разрушают AR-FL и AR-SV в клетках 22RV-1. 100, 102, и 130 были способны разрушать андрогенный рецептор полной длины (AR-FL) и обрезанный AR (AR-SV) в клетках 22RV-1, предполагая, что индолиновые и изохинолиновые SARD по настоящему изобретению могут быть способны преодолевать AR-V7 зависимые раковые заболевания предстательной железы.
Фигура 20 представляет деградацию в клетках 22RV-1, как описано выше для Фигуры 12 при использовании 130 против галетерона. 130 был сопоставлен с галетероном (клиническое руководство SARD). 114 продемонстрировали активность SARD в клетках 22RV-1 (рост зависимый от AR-SV, вариант AR без LBD), который был сопоставим с галетероном.
Фигура 21 представляет деградацию в клетках LNCaP при использовании 135 и 102. Используя способы, описанные на надписи для Фигуры 11, были продемонстрированы активности SARD для 135 и 102. Эти соединения от частично до полностью разлагают мутантный AR (T877A), предполагая, что хинолиновые и индолиновые SARD по настоящему изобретению, такие как эти, могут быть полезны при прогрессирующем раке предстательной железы и/или CRPC.
Фигура 22 представляет деградацию в клетках LNCaP и 22RV-1 при использовании 103 и 104. Используя способы, описанные на надписях для Фигуры 11 (LNCaP) и Фигуры 12 (22RV-1), 103 и 104 продемонстрировали активность SARD как в LNCaP (мутантный AR, несущий мутацию T877A), так и 22RV-1 (рост зависимый от AR-SV без LBD) клетках.
Фигура 23 представляет деградацию в клетках 22RV-1 при использовании 130. Используя способы, описанные на надписи для Фигуры 12, cоединение 130 продемонстрировало активность SARD по меньшей мере при концентрации 10 μM.
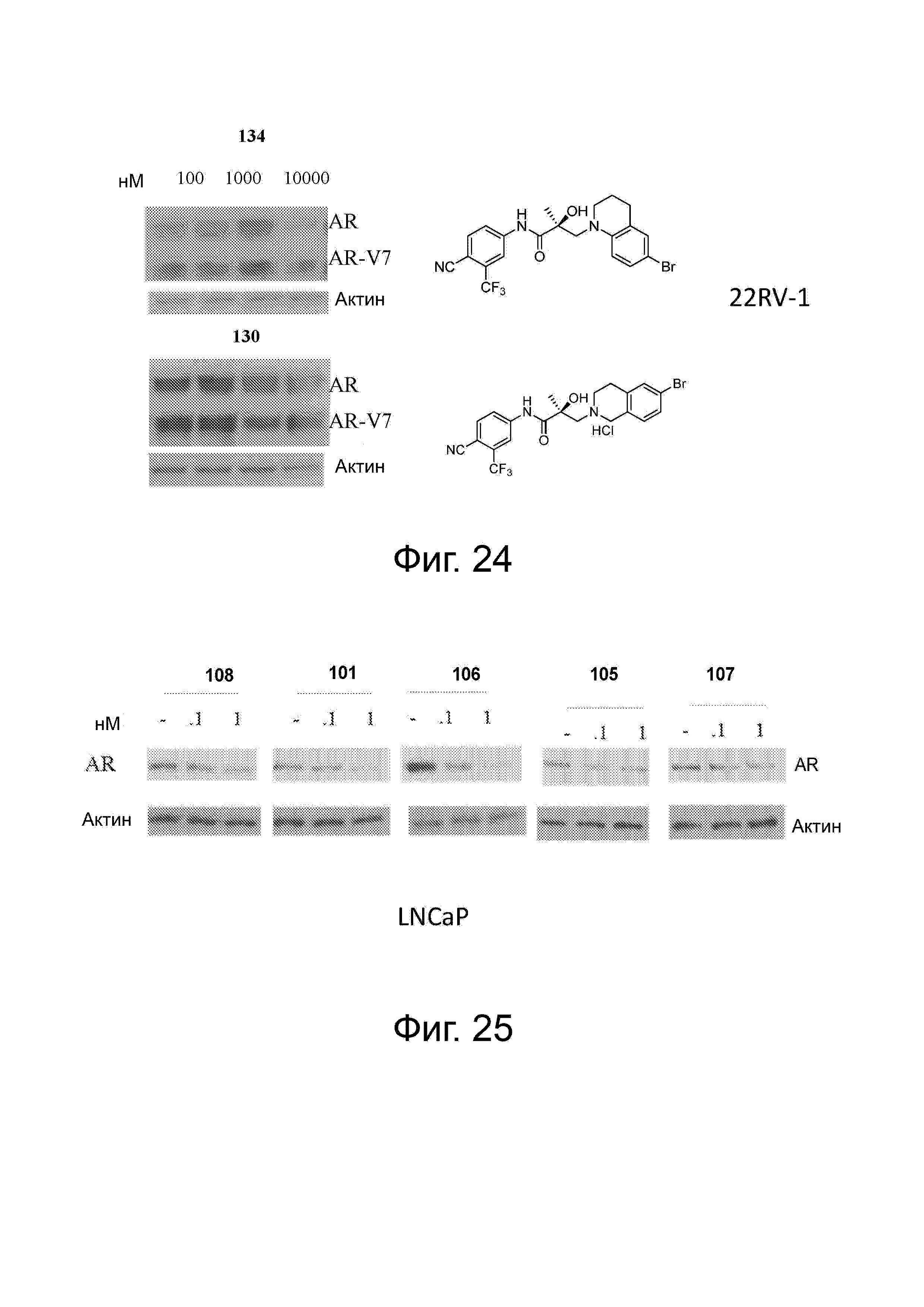
Фигура 24 представляет деградацию в клетках 22RV-1 при использовании 134 и 130. Используя способы, описанные на надписи для Фигуры 12, каждый из соединений 134 и 130 продемонстрировали активность SARD по меньшей мере при концентрации 10 μM.
Фигура 25 представляет деградацию в клетках LNCaP при использовании 101, 105, 106, 107 и 108. Используя способы для описанной выше Фигуры 11, каждый из 101, 105, 106, 107 и 108 продемонстрировал способность разрушать AR в нM диапазоне.
Фигура 26 изображает деградацию в LNCaP при использовании 200 и ARN-509. Клетки LNCaP, обработанные 200, растворяли и подвергали Вестерн-блот-анализу, как описано выше.
Фигура 27 изображает деградацию в клетках 22RV-1 при использовании 200 и 202. Клетки 22RV-1, обработанные 200 или 202, растворяли и подвергали Вестерн-блот-анализу, как описано выше.
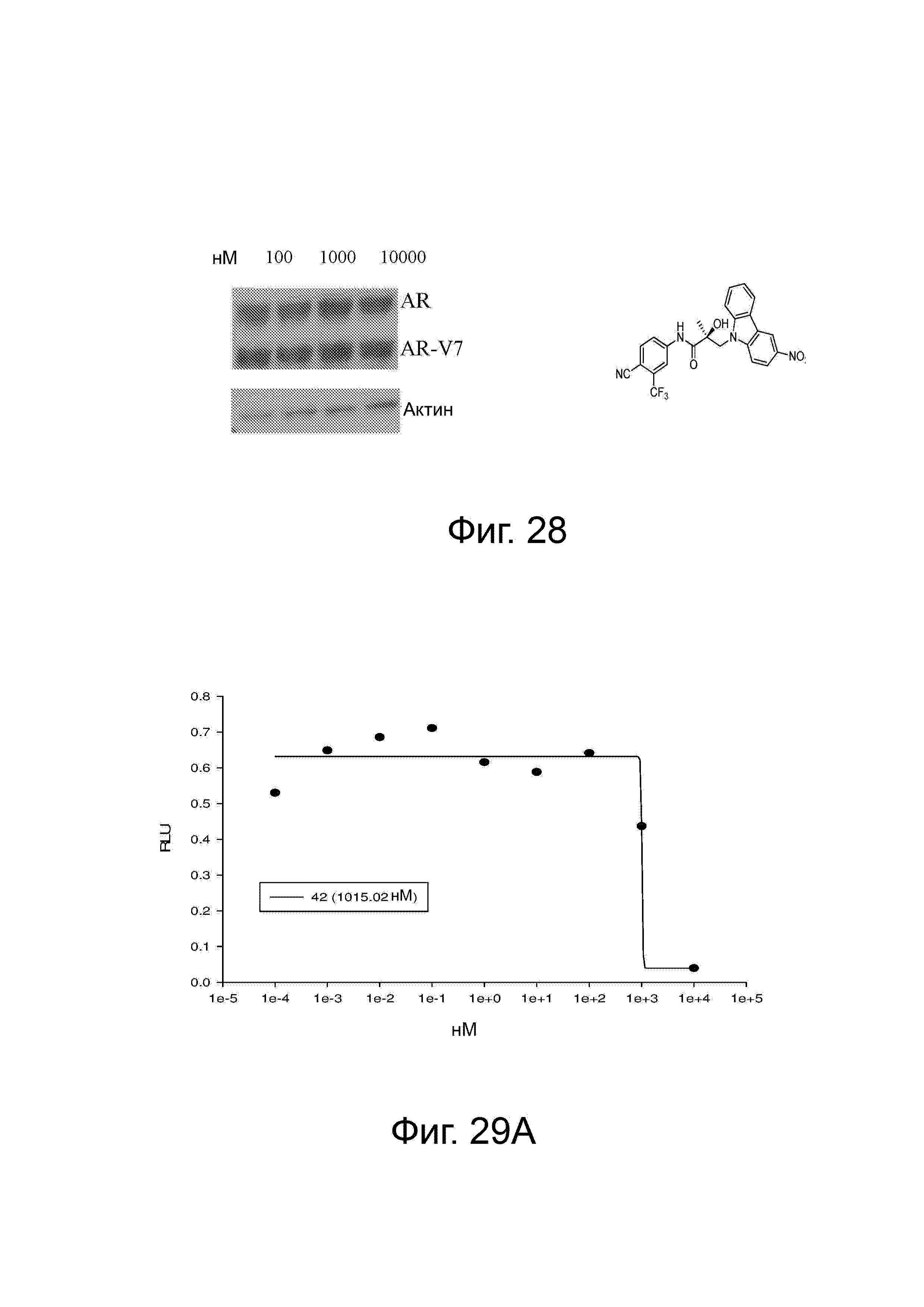
Фигура 28 изображает деградацию в клетках 22RV-1 при использовании 202. Клетки 22RV-1, обработанные 202, растворяли и подвергали Вестерн-блот-анализу, как описано выше.
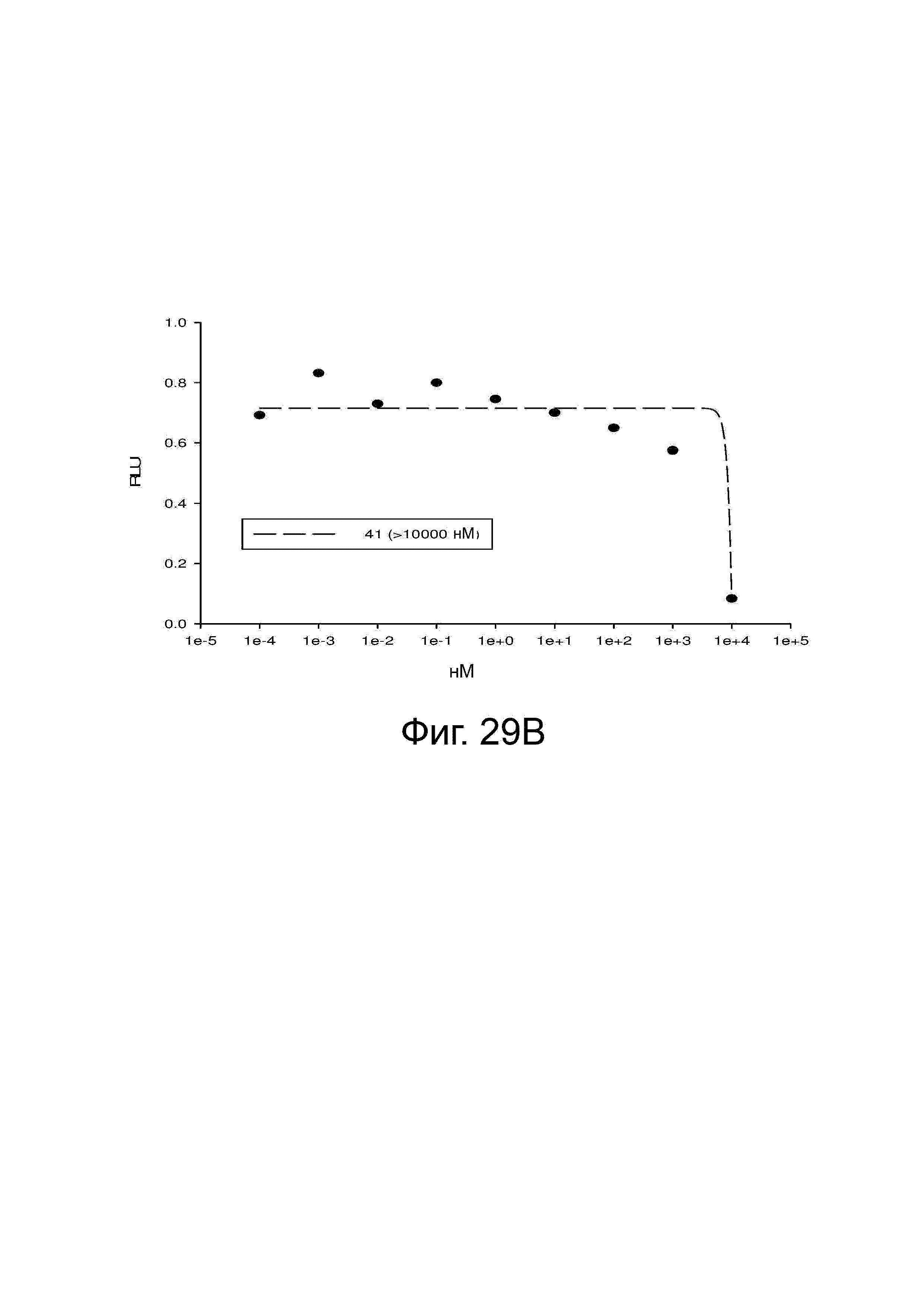
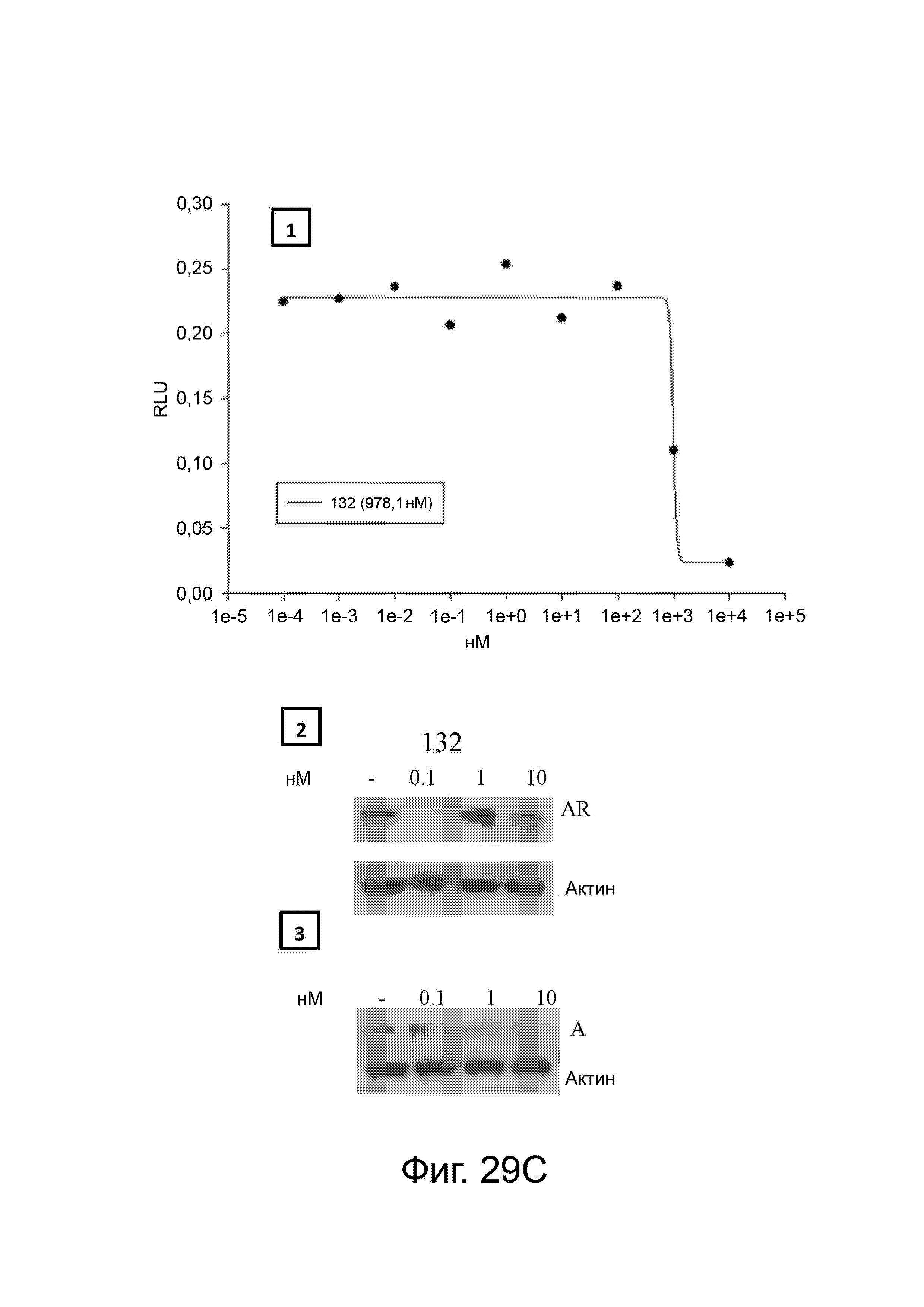
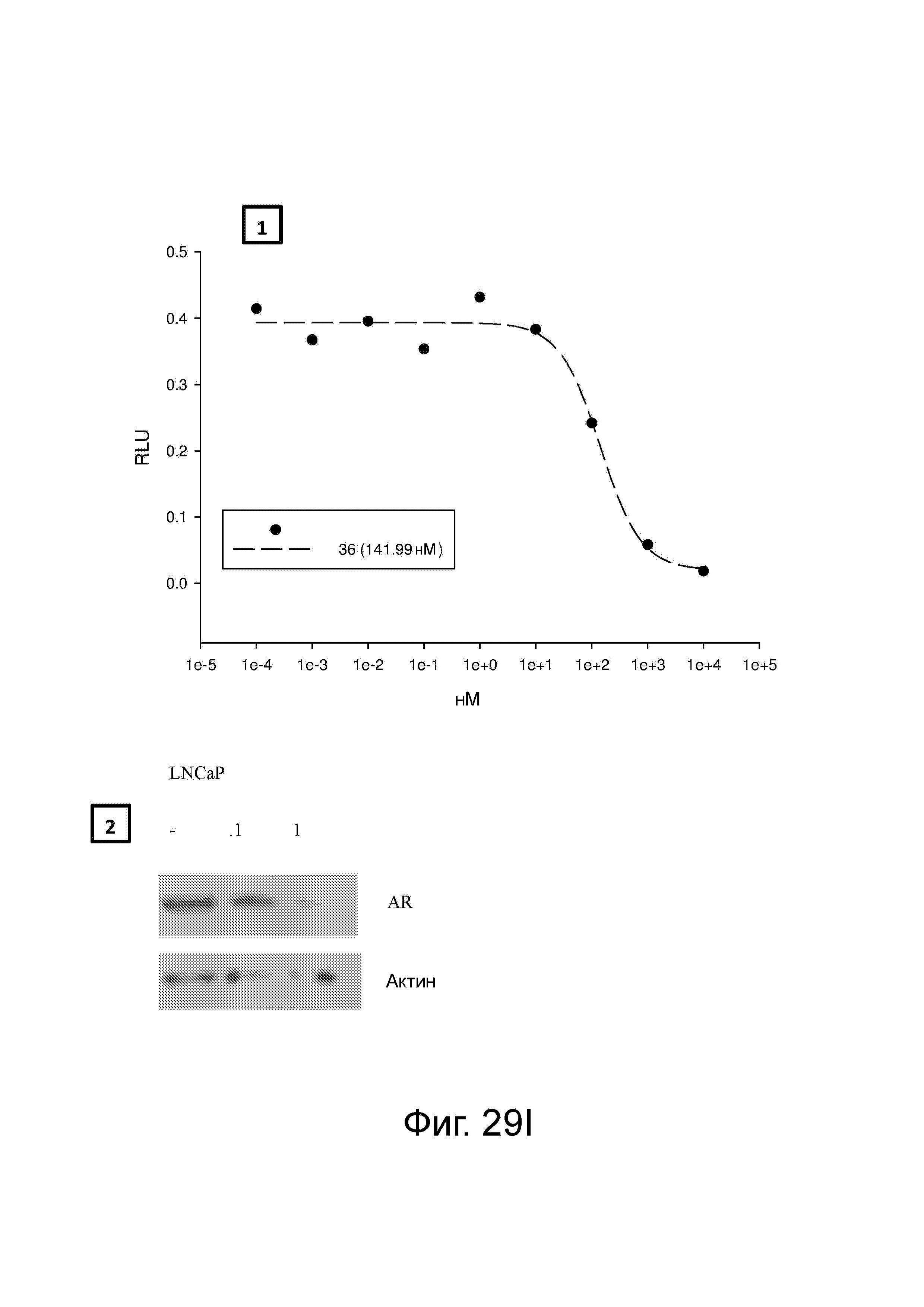
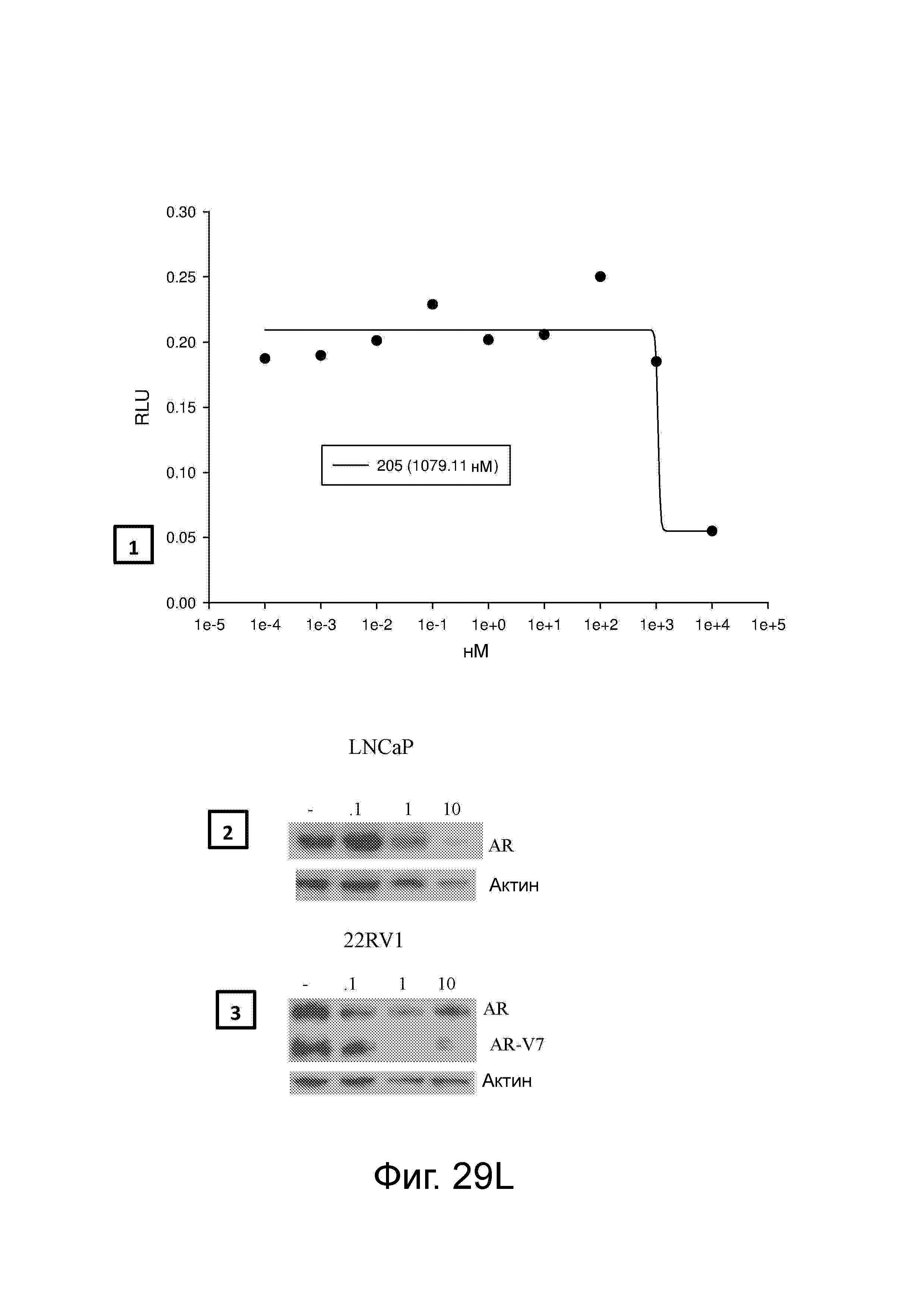
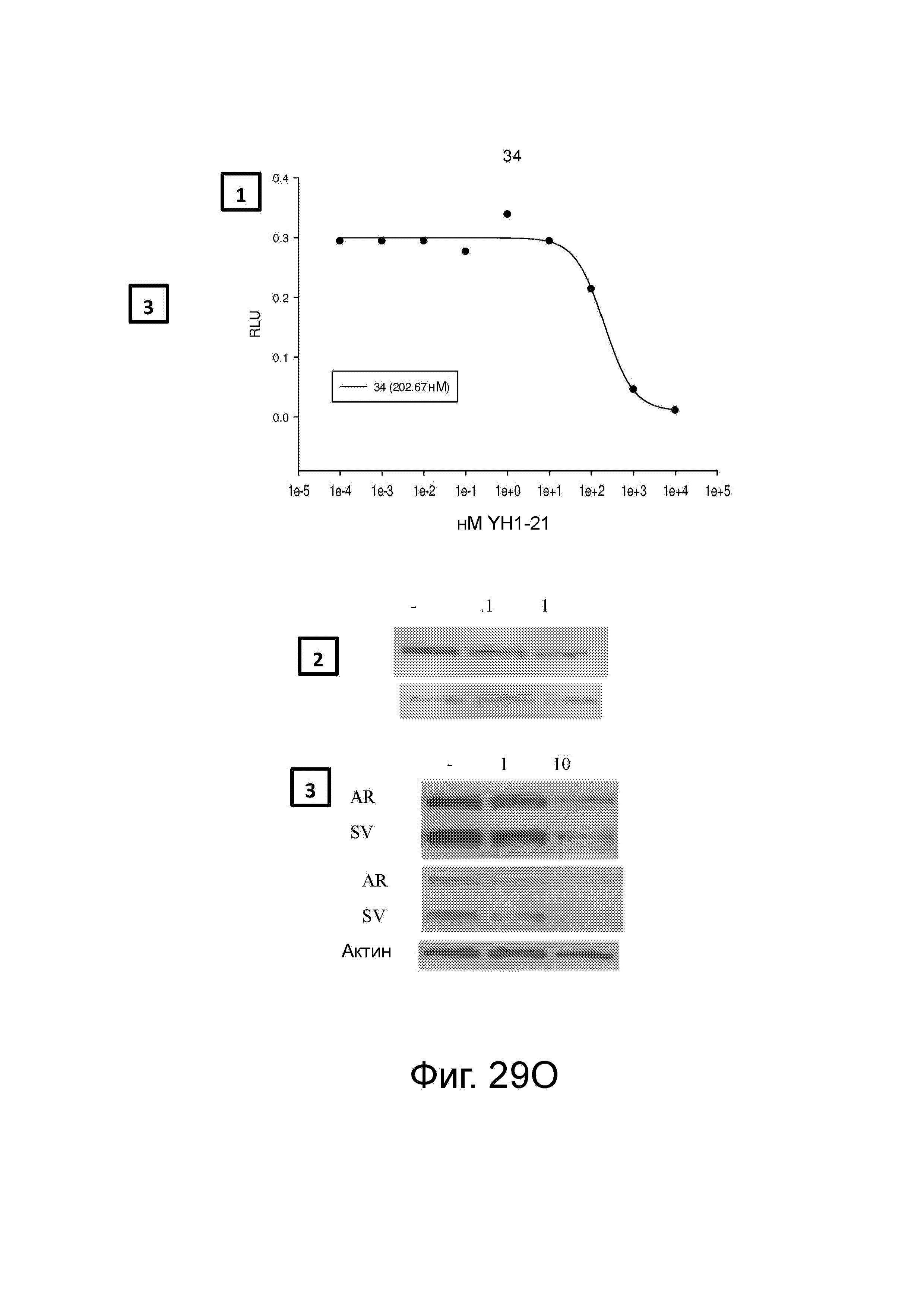
Фигура 29 изображает данные о трансактивации, связывании и AR-FL и AR-SV деградации для соединений SARD по настоящему изобретению. (A) представлены данные трансактивации для 42 (IC50 = 1015 нM) и связывания (Ki = 86.1 нM). (B) представлены данные трансактивации для 41 (IC50 = >10,000 нM) и связывания (Ki = 84.3 нM). (C) представлены (1) данные трансактивации для 132 (IC50 = 978.1 нM) и связывания (Ki = 353.2 нM); (2) деградация AR полной длины; и (3) деградация варианта AR сплайсинга. (D) представлены (1) данные трансактивации для 40 (IC50 = 1032.1 нM) и связывания (Ki = 134.9 нM). (E) представлены (1) данные трансактивации для 92 (IC50 = 946.8 нM) и связывания (Ki = нM); (2) деградация AR полной длины; и (3) деградация варианта D567es AR сплайсинга. (F) представлены (1) данные трансактивации для 39 (IC50 = 233.8 нM) и связывания (Ki = 719.9 нM); (2) деградация AR полной длины. (G) представлены (1) данные трансактивации для 38 (IC50 = 318.4 нM) и связывания (Ki = 331.8 нM); (2) деградация AR полной длины; и (3) деградация варианта AR-V7 AR сплайсинга. (H) представлены (1) данные трансактивации для 11 (IC50 = 96.4 нM) и 37 (IC50 = 94.0 нM) и связывания (Ki = 252.6 нM); (2) деградация AR полной длины; и (3) деградация варианта AR сплайсинга. (I) представлены (1) данные трансактивации для 36 (IC50 = 1142.0 нM) и связывания (Ki = 315.3 нM); (2) деградация AR полной длины. (J) представлены (1) данные трансактивации для 115 (IC50 = 244.4 нM) и связывания (Ki = 71.5 нM); (2) деградация AR полной длины; и (3) деградация варианта AR-V7 AR сплайсинга. (K) представлены (1) данные трансактивации для 35 (IC50 = 98.47 нM (данные не показаны)) и связывания (Ki = 155.7 нM); (2) деградация AR полной длины. (L) представлены (1) данные трансактивации для 205 (IC50 = 1079.1 нM) и связывания (Ki = 90.7 нM), (2) деградация AR полной длины; и (3) деградация варианта AR-V7 AR сплайсинга. (M) представлены (1) данные трансактивации для 114 (IC50 = 834.7 нM) и связывания (Ki = 204.4 нM); (2) деградация AR полной длины; и (3) деградация варианта AR-V7AR сплайсинга. (N) представлены (1) данные трансактивации для 204 (IC50 = 1025.4 нM) и связывания (Ki = 809.6 нM). (O) представлены (1) данные трансактивации для 34 (IC50 = нM) и связывания (Ki = нM); (2) деградация AR полной длины; и (3) деградация варианта AR сплайсинга.
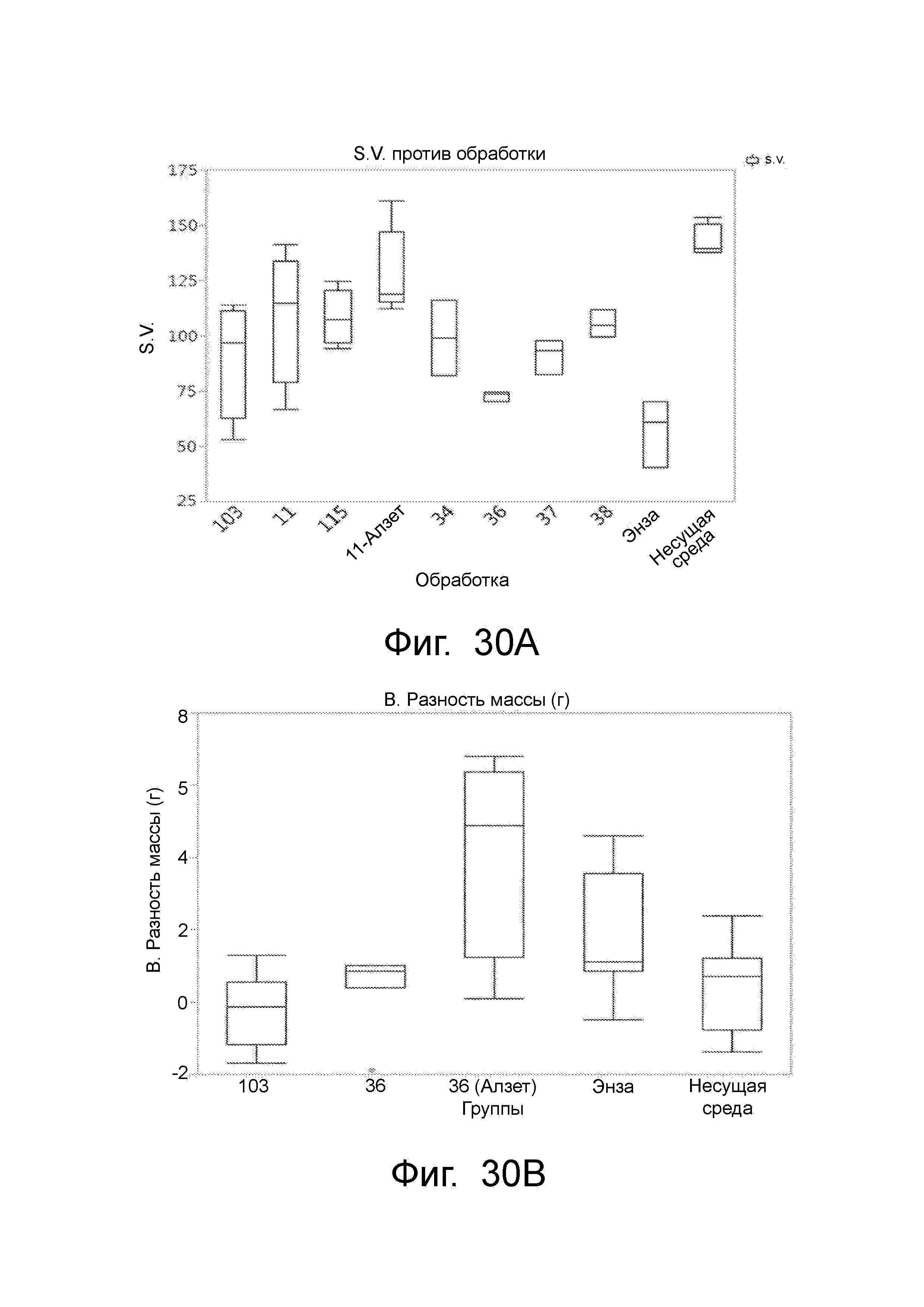
Фигура 30 представляет анализ Хершбергера: Мышей (6-7 недель) лечили несущей средой или обозначали SARD (100 мг/кг/день два раза в день) в течение 14 дней перорально. Животных умертвляли и вес семенных везикул регистрировали и представляли результаты: (A) и (D) SARD продемонстрировали различные степени снижения веса семенных везикул, (B) увеличение массы тела, и (C) снижение массы предстательной железы. Такое поведение согласуется с антиандрогенным эффектом in vivo, оказываемым SARD по данному изобретению.
Фигура 31 демонстрирует, что 103 замедлили рост опухоли рака предстательной железы, несмотря на низкие уровни в плазме. SARD 103 выборочно накапливается в опухоли. Мышам NSG были имплантированы ксенотрансплантаты рака предстательной железы. Животных лечили в течение 14 дней и объемы опухоли измеряли два раза в неделю. Животных умертвляли, 103 экстрагировали из сыворотки и опухоли измеряли с использованием способа ЖХ-MС/MС. 103 выборочно накапливается в опухоли с почти в 10 раз большим накоплением в опухоли, чем в плазме, что, возможно, дает объяснение противоопухолевой активности, несмотря на низкий уровень SARD в плазме.
Фигура 32 представляет данные в модели ксенотрансплантата мыши после лечения 103 и 36. % изменения объема опухоли представлено с использованием 103 и 36. Клетки LNCaP имплантировали (5 миллионов клеток/мышь) мышам NSG. Как только опухоли достигали 70-200 мм3, животные были рандомизированы и обработаны SARD (100 мг/кг/два раза в день). Объем опухоли измерялся через равные промежутки времени и представлялся как % от базовой линии. 36 значительно ингибировал рост опухоли.
Понятно, что для простоты и ясности иллюстрации элементы, показанные на графических материалах, необязательно должны быть вычерченны в масштабе. Например, размеры некоторых элементов могут быть преувеличены по сравнению с другими элементами для ясности. Кроме того, если считать целесообразным, ссылочные позиции могут быть повторены среди фигур, чтобы указать соответствующие или аналогичные элементы.
Подробное описание сущности изобретения
В нижеследующем подробном описании множество конкретных деталей изложены для обеспечения полного понимания изобретения. Однако специалистам в данной области техники будет понятно, что настоящее изобретение может быть осуществлено на практике без этих конкретных деталей. В других случаях хорошо известные способы, процедуры и компоненты не были подробно описаны, чтобы не скрывать настоящее изобретение.
Андрогены действуют в клетках путем связывания с AR, членом суперсемейства стероидных рецепторов транскрипционных факторов. Поскольку рост и содержание рака предстательной железы (РСа) в значительной степени контролируется циркулирующими андрогенами, лечение РСа в значительной степени зависит от способов лечения, которые нацелены на AR. Лечение антагонистами AR, такими как энзалутамид, флутамид, бикалютамид или гидроксифлутамид, для нарушения активации рецептора, успешно использовалось в прошлом для снижения роста РСа. Все имеющиеся в настоящее время антагонисты AR конкурентно связаны с AR и привлекают корепрессоры, такие как NCoR и SMRT, чтобы подавить транскрипцию целевых генов. Однако измененная внутриклеточная сигнализация, AR-мутации и повышенная экспрессия коактиваторов приводят к функциональному нарушению антагонистов или даже к трансформации антагонистов в агонисты. Исследования показали, что мутация W741 и T877 внутри AR превращает бикалютамид и гидроксифлутамид, соответственно, в агонисты. Аналогичным образом, увеличеные внутриклеточные цитокины привлекают коактиваторы вместо корепрессоров для AR-реагирующих промоторов, впоследствии превращая бикалютамид в агонист.
Несмотря на первоначальный ответ на терапию лишения андрогенов (ADT), прогрессирование заболевания PCa неизбежно, и рак возникает как кастрационно-резистентный рак предстательной железы (CRPC). Первичной причиной повторного появления кастрационно-резистентного рака предстательной железы (CRPC) является повторная активация рецептора андрогенов (AR) с помощью альтернативных механизмов, таких как:
интракриновый синтез андрогенов;
экспрессия вариантов AR-сплайсинга (AR-SV), которые не имеют лиганд связывающего домена (LBD);
мутации AR-LBD, способные противостоять антагонистам;
гиперсенсибилизация AR до низких уровней андрогенов, например, из-за амплификации гена AR или мутации AR;
амплификация гена AR в опухоли; и
сверхэкспрессия коактиваторов.
В одном варианте реализации изобретения настоящее изобретение относится к новым соединениям селективных разрушителей андрогенных рецепторов (SARD), которые ингибируют рост клеток рака предстательной железы (РСа) и опухолей, которые зависят от полной длины AR (AR-FL), включая патогенную и резистентно-сопоставимую мутацию и/или дикого типа и/или варианты AR-сплайсинга (AR-SV) для пролиферации.
В соответствии с настоящим изобретением соединение «селективных разрушителей андрогенных рецепторов» (SARD) представляет собой антагонист андрогенового рецептора, который способен ингибировать рост клеток РСа и опухолей, которые зависят от полной длины AR (AR-FL) и/или вариантов AR-сплайсинга (AR-SV) для пролиферации. В другом варианте реализации изобретения соединение SARD не связывается с лиганд связывающим доменом (LBD). В другом варианте реализации изобретения соединение SARD связывается с N-терминальным доменом (NTD) AR. В другом варианте реализации изобретения соединение SARD связывается с альтернативным доменом связывания и деградации (BDD) AR. В другом варианте реализации изобретения соединение SARD связывается как с лиганд связывающим доменом AR (LBD), так и с альтернативным доменом связывания и деградации (BDD). В другом варианте реализации изобретения соединение SARD связывается как с N-терминальным доменом (NTD), так и с лиганд связывающим доменом (LBD) AR. В другом варианте реализации изобретения соединение SARD способно ингибировать рост, обусловленный N-концевым доменом (NTD)-зависимым конститутивно активным AR-SV. В другом варианте реализации изобретения соединение SARD ингибирует AR посредством связывания с доменом, который отличается от AR LBD. В другом варианте реализации изобретения соединение SARD является сильным (то есть сильнодействующим и высокоэффективным) селективным антагонистом андрогенного рецептора, который противодействует AR сильнее, чем другие известные антагонисты AR (например, энзалутамид, флутамид, бикалютамид и абиратор). В другом варианте реализации изобретения соединение SARD представляет собой антагонист селективного андрогенного рецептора, который нацеливается на AR-SV, которые не могут ингибироваться обычными антагонистами. В другом варианте реализации изобретения соединение SARD демонстрирует деградационную активность варианта AR-сплайсинга (AR-SV). В другом варианте реализации изобретения соединение SARD дополнительно демонстрирует деградационную активность AR-полной длины (AR-FL). В другом варианте реализации изобретения соединение SARD проявляет ингибирующую активность варианта AR-сплайсинга (AR-SV) (то есть является антагонистом AR-SV). В другом варианте реализации изобретения соединение SARD дополнительно проявляет ингибирующую активность AR-полной длины (AR-FL) (то есть является антагонистом AR-FL). В другом варианте реализации изобретения соединение SARD обладает двойной деградацией AR-SV и ингибирующими функциями AR-SV. В другом варианте реализации изобретения соединение SARD дополнительно обладает двойной деградацией AR-FL и ингибиторными функциями AR-FL. В другом варианте реализации изобретения соединение SARD представляет собой антагонист селективного андрогенного рецептора, который нацелен на AR-SV. В другом варианте реализации изобретения соединение SARD дополнительно нацелено на AR-FL. В другом варианте реализации изобретения соединение SARD ингибирует конститутивную активацию AR-SV. В другом варианте реализации изобретения соединение SARD дополнительно ингибирует конститутивную активацию AR-FL. В другом варианте реализации изобретения соединение SARD представляет собой антагонист селективного андрогенного рецептора, который разрушает AR-полной длины (AR-FL) и варианты AR-сплайсинга (AR-SV). В другом варианте реализации изобретения соединение SARD разрушает AR посредством связывания с доменом, который отличается от AR LBD. В другом варианте реализации изобретения соединение SARD обладает двойной деградацией и ингибиторными функциями AR-SV, которые отличаются от любых доступных CRPC терапий. В другом варианте реализации изобретения соединение SARD ингибирует повторную активацию АR альтернативными механизмами, такими как: интракриновый синтез андрогенов, экспрессия вариантов AR-сплайсинга (AR-SV), которые не обладают мутациями лиганд связывающего домена (LBD) и AR-LBD с потенциальным противодействием антагонистам. В другом варианте реализации изобретения соединение SARD ингибирует повторно активированные андрогенные рецепторы, присутствующие в патогенно измененных клеточных средах.
Неограничивающими примерами вариантов AR-сплайсинга (AR-SV) являются: AR-V7 и ARv567es (a.k.a. AR-V12). Неограничивающими примерами AR-мутаций, обеспечивающих антиандрогенную резистентность являются: W741L мутация и T877A мутация. AR-V7 представляет собой вариант AR-сплайсинга, в котором отсутствует LBD. Он является конститутивно активным и, как было продемонстрировано, отвечает за агрессивный РСа и устойчивость к эндокринной терапии.
В одном варианте реализации изобретения настоящее изобретение относится к новым соединениям селективных разрушителей андрогенных рецепторов (SARD), которые связываются с АR через альтернативный домен связывания и деградации (BDD). В другом варианте реализации изобретения SARD далее связывает AR-лиганд связывающего домена (LBD).
В одном варианте реализации изобретения настоящее изобретение относится к новым соединениям селективных разрушителей андрогенных рецепторов (SARD), которые проявляют ингибирующую активность варианта AR-сплайсинга (AR-SV) (то есть является антагонистом AR-SV). В другом варианте реализации изобретения новые соединения селективных разрушителей андрогенных рецепторов (SARD), дополнительно проявляют ингибирующую активность AR-полной длины (AR-FL) (то есть антагонист AR-FL).
В одном варианте реализации изобретения настоящее изобретение относится к новым соединениям селективных разрушителей андрогенных рецепторов (SARD), которые проявляют деградирующую активность варианта AR-сплайсинга (AR-SV). В другом варианте реализации изобретения новые соединения селективных разрушителей андрогенных рецепторов (SARD), дополнительно проявляют деградирующую активность AR-полной длины (AR-FL).
В одном варианте реализации изобретения настоящее изобретение относится к новым соединениям селективных разрушителей андрогенных рецепторов (SARD), которые обладают двойной деградацией AR-SV и ингибирующими функциями AR-SV. В другом варианте реализации изобретения SARD дополнительно обладают функциями двойной деградации AR-FL и ингибирования AR-FL. В другом варианте реализации изобретения настоящее изобретение относится к новым соединениям селективных разрушителей андрогенных рецепторов (SARD), которые обладают двойной деградацией AR-SV и AR-FL, а также ингибирующими функциями AR-SV и AR-FL.
В одном варианте реализации изобретения настоящее изобретение относится к новым соединениям селективных разрушителей андрогенных рецепторов (SARD), для использования при лечении CRPC, которые не могут быть излечимы каким-либо другим антагонистом.
В одном варианте реализации изобретения настоящее изобретение относится к новым соединениям селективных разрушителей андрогенных рецепторов (SARD), для использования при лечении CRPC, путем снижения AR-SV.
В одном варианте реализации изобретения новые соединения SARD в соответствии с настоящим изобретением поддерживают их антагонистическую активность в AR-мутантах, которые обычно превращают антагонисты AR в агонисты. В другом варианте реализации изобретения соединения SARD сохраняют свою антагонистическую активность с AR-мутантами W741 и T877. В другом варианте реализации изобретения соединения SARD вызывают антагонистическую активность в измененной клеточной среде, в которой LBD-целевые агенты не эффективны. В другом варианте реализации изобретения соединения SARD вызывают антагонистическую активность в измененной клеточной среде, в которой активность, зависящая от NTD-активности, является конститутивно активной.
Соединения Селективных Разрушителей Андрогенных Рецепторов (SARD)
В одном варианте реализации изобретения настоящее изобретение относится к соединению селективных разрушителей андрогенных рецепторов (SARD), представленному структурой формулы I:
I
где
W1 и W2 каждый независимо выбран из N или CH;
W3, W4, W5 и W6 каждый независимо выбран из CH или N;
где любой из W1, W2, W3, W4, W5 и W6 представляет собой CH, тогда H при необходимости заменен R4, Q или R3 в соответствующем положении, и если любой из W1, W2, W3, W4, W5 и W6 не является CH, тогда соответствующее положение является незамещенным;
T представляет собой OH, OR, -NHCOCH3, NHCOR или

Z представляет собой NO2, CN, COOH, COR, NHCOR или CONHR;
Y представляет собой CF3, F, I, Br, Cl, CN или C(R)3;
R или алкил, галоалкил, дигалоалкил, тригалоалкил, CH2F,CHF2,CF3, CF2CF3, арил, фенил, F, Cl, Br, I, алкенил или OH;
R1 представляет собой CH3, CH2F,CHF2,CF3, CH2CH3, или CF2CF3;
R2 представляет собой водород, галоген, CN, NO2, COOH, COOR, COR, NHCOR, CONHR, OH, OR, SH, SR, NH2, NHR, NR2, C1-C12-алкил, C1-C12-галоалкил, O-C1-C12-алкил, O-C1-C12-галоалкил, -SO2-арил, -SO2-фенил, -CO-арил, арилалкил, бензил, арил, или C3-C7-циклоалкил;
Q представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
R3 и R4 независимо выбран из водорода, F, Cl, Br, I, CF3, CN, NO2, NH2, SH, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
n равен целому числу между 1-3; и
m равен целому числу между 1-3.
В другом варианте реализации изобретения W1, W2, W3, W4, W5, и W6 формулы I каждый независимо представляет собой CH. В другом варианте реализации изобретения W1 представляет собой N. В другом варианте реализации изобретения W2 представляет собой N. В другом варианте реализации изобретения W1 представляет собой CH. В другом варианте реализации изобретения W2 представляет собой CH. В другом варианте реализации изобретения W3 представляет собой N. В другом варианте реализации изобретения W4 представляет собой N. В другом варианте реализации изобретения W5 представляет собой N. В другом варианте реализации изобретения W6 представляет собой N.
В другом варианте реализации изобретения W1 представляет собой N и W1, W3, W4, W5, и W6 представляют собой CH. В другом варианте реализации изобретения W2 представляет собой N и W1, W3, W4, W5, и W6 представляют собой CH. В другом варианте реализации изобретения W3 представляет собой N и W1, W2, W4, W5, и W6 представляют собой CH. В другом варианте реализации изобретения W4 представляет собой N и W1, W2, W3, W5, и W6 представляют собой CH. В другом варианте реализации изобретения W5 представляет собой N и W1, W2, W3, W4, и W6 представляют собой CH. В другом варианте реализации изобретения W6представляет собой N и W1, W2, W3, W4, и W5 представляют собой CH.
В одном варианте реализации изобретения настоящее изобретение относится к соединению селективных разрушителей андрогенных рецепторов (SARD), представленному структурой формулы II:

II
где

T представляет собой OH, OR, -NHCOCH3, NHCOR или

Z представляет собой NO2, CN, COOH, COR, NHCOR или CONHR;
Y представляет собой CF3, F, I, Br, Cl, CN или C(R)3;
R представляет собой алкил, галоалкил, дигалоалкил, тригалоалкил, CH2F,CHF2,CF3, CF2CF3, арил, фенил, F, Cl, Br, I, алкенил или OH;
R1 представляет собой CH3, CH2F,CHF2,CF3, CH2CH3, или CF2CF3;
R2 представляет собой водород, галоген, CN, NO2, COOH, COOR, COR, NHCOR, CONHR, OH, OR, SH, SR, NH2, NHR, NR2, C1-C12-алкил, C1-C12-галоалкил, O-C1-C12-алкил, O-C1-C12-галоалкил, -SO2-арил, -SO2-фенил, -CO-арил, арилалкил, бензил, арил, или C3-C7-циклоалкил;
Q представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
R3 представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, NH2, SH, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
R4 представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, NH2, SH, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
n равен целому числу между 1-3; и
m равен целому числу между 1-3.
В одном варианте реализации изобретения настоящее изобретение относится к соединению селективных разрушителей андрогенных рецепторов (SARD), представленному структурой формулы III:

где
T представляет собой OH, OR, -NHCOCH3, NHCOR или

Z представляет собой NO2, CN, COOH, COR, NHCOR или CONHR;
Y представляет собой CF3, F, I, Br, Cl, CN или C(R)3;
R представляет собой алкил, галоалкил, дигалоалкил, тригалоалкил, CH2F,CHF2,CF3, CF2CF3, арил, фенил, F, Cl, Br, I, алкенил или OH;
R1 представляет собой CH3, CH2F,CHF2,CF3, CH2CH3, или CF2CF3;
R2 представляет собой водород, галоген, CN, NO2, COOH, COOR, COR, NHCOR, CONHR, OH, OR, SH, SR, NH2, NHR, NR2, C1-C12-алкил, C1-C12-галоалкил, O-C1-C12-алкил, O-C1-C12-галоалкил, -SO2-арил, -SO2-фенил, -CO-арил, арилалкил, бензил, арил, или C3-C7-циклоалкил;
Q представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
R3 представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, NH2, SH, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
R4 представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, NH2, SH, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
n равен целому числу между1-3; и
m равен целому числу между1-3.
В одном варианте реализации изобретения настоящее изобретение относится к соединению селективных разрушителей андрогенных рецепторов (SARD), представленному структурой формулы IV:

IV
где
T представляет собой OH, OR, -NHCOCH3, NHCOR или

Z представляет собой NO2, CN, COOH, COR, NHCOR или CONHR;
Y представляет собой CF3, F, I, Br, Cl, CN или C(R)3;
R представляет собой алкил, галоалкил, дигалоалкил, тригалоалкил, CH2F, CHF2,CF3, CF2CF3, арил, фенил, F, Cl, Br, I, алкенил или OH;
R1 представляет собой CH3, CH2F,CHF2,CF3, CH2CH3, или CF2CF3;
R2 представляет собой водород, галоген, CN, NO2, COOH, COOR, COR, NHCOR, CONHR, OH, OR, SH, SR, NH2, NHR, NR2, C1-C12-алкил, C1-C12-галоалкил, O-C1-C12-алкил, O-C1-C12-галоалкил, -SO2-арил, -SO2-фенил, -CO-арил, арилалкил, бензил, арил, или C3-C7-циклоалкил;
Q представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
R3 представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, NH2, SH, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
R4 представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, NH2, SH, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
n равен целому числу между1-3; и
m равен целому числу между1-3.
В одном варианте реализации изобретения настоящее изобретение относится к соединению селективных разрушителей андрогенных рецепторов (SARD), представленному структурой формулы V:

V
где
T представляет собой OH, OR, -NHCOCH3, NHCOR или

Z представляет собой NO2, CN, COOH, COR, NHCOR или CONHR;
Y представляет собой CF3, F, I, Br, Cl, CN или C(R)3;
R представляет собой алкил, галоалкил, дигалоалкил, тригалоалкил, CH2F, CHF2,CF3, CF2CF3, арил, фенил, F, Cl, Br, I, алкенил или OH;
R1 представляет собой CH3, CH2F,CHF2,CF3, CH2CH3, или CF2CF3;
R2 представляет собой водород, галоген, CN, NO2, COOH, COOR, COR, NHCOR, CONHR, OH, OR, SH, SR, NH2, NHR, NR2, C1-C12-алкил, C1-C12-галоалкил, O-C1-C12-алкил, O-C1-C12-галоалкил, -SO2-арил, -SO2-фенил, -CO-арил, арилалкил, бензил, арил, или C3-C7-циклоалкил;
Q представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
R3 представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, NH2, SH, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
R4 представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, NH2, SH, COOH, COOR, кето (=O), алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
n равен целому числу между1-3;
m равен целому числу между1-3;
l равен 0 или 1; и
k равен 0, 1 или 2.
В одном варианте реализации изобретения настоящее изобретение относится к соединению селективных разрушителей андрогенных рецепторов (SARD), представленному структурой формулы VI:

VI
где
T представляет собой OH, OR, -NHCOCH3, NHCOR или

Z представляет собой NO2, CN, COOH, COR, NHCOR или CONHR;
Y представляет собой CF3, F, I, Br, Cl, CN или C(R)3;
R представляет собой алкил, галоалкил, дигалоалкил, тригалоалкил, CH2F,CHF2,CF3, CF2CF3, арил, фенил, F, Cl, Br, I, алкенил или OH;
R1 представляет собой CH3, CH2F,CHF2, CF3, CH2CH3, или CF2CF3;
R2 представляет собой водород, галоген, CN, NO2, COOH, COOR, COR, NHCOR, CONHR, OH, OR, SH, SR, NH2, NHR, NR2, C1-C12-алкил, C1-C12-галоалкил, O-C1-C12-алкил, O-C1-C12-галоалкил, -SO2-арил, -SO2-фенил, -CO-арил, арилалкил, бензил, арил, или C3-C7-циклоалкил;
Q представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
R3 представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, NH2, SH, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
R4 представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, NH2, SH, COOH, COOR, кето (=O), алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
n равен целому числу между1-3; и
m равен целому числу между1-3.
В одном варианте реализации изобретения настоящее изобретение относится к соединению селективных разрушителей андрогенных рецепторов (SARD), представленному структурой формулы VII:

VII
где
T представляет собой OH, OR, -NHCOCH3, NHCOR или

Z представляет собой NO2, CN, COOH, COR, NHCOR или CONHR;
Y представляет собой CF3, F, I, Br, Cl, CN или C(R)3;
R представляет собой алкил, галоалкил, дигалоалкил, тригалоалкил, CH2F, CHF2,CF3, CF2CF3, арил, фенил, F, Cl, Br, I, алкенил или OH;
R1 представляет собой CH3, CH2F, CHF2,CF3, CH2CH3, или CF2CF3;
R2 представляет собой водород, галоген, CN, NO2, COOH, COOR, COR, NHCOR, CONHR, OH, OR, SH, SR, NH2, NHR, NR2, C1-C12-алкил, C1-C12-галоалкил, O-C1-C12-алкил, O-C1-C12-галоалкил, -SO2-арил, -SO2-фенил, -CO-арил, арилалкил, бензил, арил, или C3-C7-циклоалкил;
Q представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
R3 представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, NH2, SH, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
R4 представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, NH2, SH, COOH, COOR, кето (=O), алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
n равен целому числу между1-3; и
m равен целому числу между1-3.
В одном варианте реализации изобретения настоящее изобретение относится к соединению селективных разрушителей андрогенных рецепторов (SARD), представленному структурой формулы VIII:

VIII
где
Z представляет собой NO2, CN, COOH, COR, NHCOR или CONHR;
Y представляет собой CF3, F, I, Br, Cl, CN или C(R)3;
R представляет собой алкил, галоалкил, дигалоалкил, тригалоалкил, CH2F,CHF2,CF3, CF2CF3, арил, фенил, F, Cl, Br, I, алкенил или OH;
Q представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
R3 представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, NH2, SH, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
m равен целому числу между1-3;
l равен 0 или 1; и
k равен 0, 1 или 2.
В одном варианте реализации изобретения настоящее изобретение относится к соединению селективных разрушителей андрогенных рецепторов (SARD), представленному структурой формулы IXa, IXb, IXc или IXd:

IXa,

IXb,

IXc, или

IXd
где
Z представляет собой NO2, CN, COOH, COR, NHCOR или CONHR;
Y представляет собой CF3, F, I, Br, Cl, CN или C(R)3;
R представляет собой алкил, галоалкил, дигалоалкил, тригалоалкил, CH2F, CHF2,CF3, CF2CF3, арил, фенил, F, Cl, Br, I, алкенил или OH;
Q представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
R3 представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, NH2, SH, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN; и
m равен целому числу между1-3.
В одном варианте реализации изобретения настоящее изобретение относится к соединению селективных разрушителей андрогенных рецепторов (SARD), представленному структурой формулы X:

X
где
Z представляет собой NO2, CN, COOH, COR, NHCOR или CONHR;
Y представляет собой CF3, F, I, Br, Cl, CN или C(R)3;
R представляет собой алкил, галоалкил, дигалоалкил, тригалоалкил, CH2F, CHF2,CF3, CF2CF3, арил, фенил, F, Cl, Br, I, алкенил или OH;
Q представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
R3 представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, NH2, SH, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
m равен целому числу между1-3;
l равен 0 или 1; и
k равен 0, 1 или 2.
В одном варианте реализации изобретения настоящее изобретение относится к соединению селективных разрушителей андрогенных рецепторов (SARD), представленному структурой формулы XIa, XIb, XIc или XId:

Xia,

XIb,

XIc,

XId
где
Z представляет собой NO2, CN, COOH, COR, NHCOR или CONHR;
Y представляет собой CF3, F, I, Br, Cl, CN или C(R)3;
R представляет собой алкил, галоалкил, дигалоалкил, тригалоалкил, CH2F, CHF2,CF3, CF2CF3, арил, фенил, F, Cl, Br, I, алкенил или OH;
Q представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
R3 представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, NH2, SH, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN; и
m равен целому числу между1-3.
В одном варианте реализации изобретения настоящее изобретение относится к соединению селективных разрушителей андрогенных рецепторов (SARD), представленному структурой формулы XII:

XII
где
Z представляет собой NO2, CN, COOH, COR, NHCOR или CONHR;
Y представляет собой CF3, F, I, Br, Cl, CN или C(R)3;
R представляет собой алкил, галоалкил, дигалоалкил, тригалоалкил, CH2F, CHF2,CF3, CF2CF3, арил, фенил, F, Cl, Br, I, алкенил или OH;
Q представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
l равен 0 или 1; и
k равен 0, 1 или 2.
В одном варианте реализации изобретения настоящее изобретение относится к соединению селективных разрушителей андрогенных рецепторов (SARD), представленному структурой формулы XIIIa, XIIIb, XIIIc или IIIId:

XIIIa,
XIIIb,

XIIIc,

XIIId
где
Z представляет собой NO2, CN, COOH, COR, NHCOR или CONHR;
Y представляет собой CF3, F, I, Br, Cl, CN или C(R)3;
R представляет собой алкил, галоалкил, дигалоалкил, тригалоалкил, CH2F, CHF2,CF3, CF2CF3, арил, фенил, F, Cl, Br, I, алкенил или OH; и
Q представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN.
В одном варианте реализации изобретения настоящее изобретение относится к соединению селективных разрушителей андрогенных рецепторов (SARD), представленному структурой формулы XIV:

XIV
где
T представляет собой OH, OR, -NHCOCH3, или NHCOR;
Z представляет собой NO2, CN, COOH, COR, NHCOR или CONHR;
Y представляет собой CF3, F, I, Br, Cl, CN или C(R)3;
R представляет собой алкил, галоалкил, дигалоалкил, тригалоалкил, CH2F, CHF2,CF3, CF2CF3, арил, фенил, F, Cl, Br, I, алкенил или OH;
R1 представляет собой CH3, CH2F, CHF2,CF3, CH2CH3, или CF2CF3;
R2 представляет собой водород, галоген, CN, NO2, COOH, COOR, COR, NHCOR, CONHR, OH, OR, SH, SR, NH2, NHR, NR2, C1-C12-алкил, C1-C12-галоалкил, O-C1-C12-алкил, O-C1-C12-галоалкил, -SO2-арил, -SO2-фенил, -CO-арил, арилалкил, бензил, арил, или C3-C7-циклоалкил;
Q представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
R3 представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, NH2, SH, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
R4 представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, NH2, SH, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
n равен целому числу между1-3; и
m равен целому числу между1-3.
В одном варианте реализации изобретения настоящее изобретение относится к соединению селективных разрушителей андрогенных рецепторов (SARD), представленному структурой формулы XV:

XV
где
Z представляет собой NO2, CN, COOH, COR, NHCOR или CONHR;
Y представляет собой CF3, F, I, Br, Cl, CN или C(R)3;
R представляет собой алкил, галоалкил, дигалоалкил, тригалоалкил, CH2F, CHF2,CF3, CF2CF3, арил, фенил, F, Cl, Br, I, алкенил или OH;
R2 представляет собой водород, галоген, CN, NO2, COOH, COOR, COR, NHCOR, CONHR, OH, OR, SH, SR, NH2, NHR, NR2, C1-C12-алкил, C1-C12-галоалкил, O-C1-C12-алкил, O-C1-C12-галоалкил, -SO2-арил, -SO2-фенил, -CO-арил, арилалкил, бензил, арил, или C3-C7-циклоалкил;
Q представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
R3 представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, NH2, SH, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил, C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
R4 представляет собой водород, F, Cl, Br, I, CF3, CN, NO2, NH2, SH, COOH, COOR, алкокси, галоалкил, при необходимости замещенный линейный или разветвленный алкил, при необходимости замещенный линейный или разветвленный гетероалкил, при необходимости замещенный арил, при необходимости замещенный фенил, при необходимости замещенный циклоалкил, при необходимости замещенный гетероциклоалкил, при необходимости замещенный арилалкил,C(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR, NCS, SCN, NCO или OCN;
n равен целому числу между1-3; и
m равен целому числу между1-3.
В одном варианте реализации изобретения Q соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV представляет собой водород. В одном варианте реализации изобретения Q соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV представляет собой галоген. В одном варианте реализации изобретения Q соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV представляет собой F. В одном варианте реализации изобретения Q соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV представляет собой Br. В одном варианте реализации изобретения Q соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV представляет собой Cl. В одном варианте реализации изобретения Q соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV представляет собой I. В одном варианте реализации изобретения Q соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV представляет собой CN. В одном варианте реализации изобретения Q соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV представляет собой NO2. В одном варианте реализации изобретения Q соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV представляет собой при необходимости замещенный линейный или разветвленный алкил. В одном варианте реализации изобретения Q соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV представляет собой CH3. В одном варианте реализации изобретения Q соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV представляет собой алкокси. В одном варианте реализации изобретения Q соединения формул I - VI представляет собой OCH3. В одном варианте реализации изобретения Q соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV представляет собой CF3. В одном варианте реализации изобретения Q соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV представляет собой при необходимости замещенный фенил. В одном варианте реализации изобретения Q соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV иXV представляет собой незамещенный фенил.
В одном варианте реализации изобретения R3 соединения формул I-VIII, IXa-IXd, X, XIa-XId, XIV и XV представляет собой водород. В одном варианте реализации изобретения R3 соединения формул I-VIII, IXa-IXd, X, XIa-XId, XIV и XV представляет собой галоген. В одном варианте реализации изобретения R3 соединения формул I-VIII, IXa-IXd, X, XIa-XId, XIV и XV представляет собой F. В одном варианте реализации изобретения R3 соединения формул I-VIII, IXa-IXd, X, XIa-XId, XIV и XV представляет собой Cl. В одном варианте реализации изобретения R3 соединения формул I-VIII, IXa-IXd, X, XIa-XId, XIV и XV представляет собой Br. В одном варианте реализации изобретения R3 соединения формул I-VIII, IXa-IXd, X, XIa-XId, XIV и XV представляет собой I. В одном варианте реализации изобретения R3 соединения формул I-VIII, IXa-IXd, X, XIa-XId, XIV и XV представляет собой CN. В одном варианте реализации изобретения R3 соединения формул I-VIII, IXa-IXd, X, XIa-XId, XIV и XV представляет собой COOH. В одном варианте реализации изобретения R3 соединения формул I-VIII, IXa-IXd, X, XIa-XId, XIV и XV представляет собой NO2. В одном варианте реализации изобретения R3 соединения формул I-VIII, IXa-IXd, X, XIa-XId, XIV и XV представляет собой CF3.
В одном варианте реализации изобретения R4 соединения формул I-VII, XIV, XV представляет собой водород. В одном варианте реализации изобретения R4 соединения формул I-VII, XIV, XV представляет собой галоген. В одном варианте реализации изобретения R4 соединения формул I-VII, XIV, XV представляет собой F. В одном варианте реализации изобретения R4 соединения формул I-VII, XIV, XV представляет собой Cl. В одном варианте реализации изобретения R4 соединения формул I-VII, XIV, XV представляет собой Br. В одном варианте реализации изобретения R4 соединения формул I-VII, XIV, XV представляет собой I. В одном варианте реализации изобретения R4 соединения формул I - III представляет собой CN. В одном варианте реализации изобретения R4 соединения формул I-VII, XIV, XV представляет собой COOH. В одном варианте реализации изобретения R4 соединения формул I - III представляет собой NO2. В одном варианте реализации изобретения R4 соединения формул I - III представляет собой CF3. В одном варианте реализации изобретения R4 соединения формул I-VII, XIV, XV представляет собой метил. В одном варианте реализации изобретения R4 соединения формул I-VII, XIV, XV представляет собой COOR.
В одном варианте реализации изобретения Z соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV представляет собой CN. В другом варианте реализации изобретения Z соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV представляет собой NO2. В другом варианте реализации изобретения Z соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV представляет собой COOH. В другом варианте реализации изобретения Z соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV представляет собой COR. В другом варианте реализации изобретения Z соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV представляет собой NHCOR. В другом варианте реализации изобретения Z соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV представляет собой CONHR. В другом варианте реализации изобретения Z соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV находится в пара положении.
В одном варианте реализации изобретения Y соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV представляет собой CF3. В другом варианте реализации изобретения Y соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV представляет собой F. В другом варианте реализации изобретения Y соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV представляет собой I. В другом варианте реализации изобретения Y соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV представляет собой Br. В другом варианте реализации изобретения Y соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV представляет собой Cl. В другом варианте реализации изобретения Y соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV представляет собой CN. В другом варианте реализации изобретения Y соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV представляет собой C(R)3. В другом варианте реализации изобретения Y соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV находится в мета положении.
В одном варианте реализации изобретения Z соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV представляет собой CN и Y представляет собой CF3. В другом варианте реализации изобретения Z представляет собой NO2 и Y представляет собой CF3. В другом варианте реализации изобретения Z представляет собой NO2 и Y представляет собой галоген. В другом варианте реализации изобретения Z представляет собой CN и Y представляет собой галоген. В другом варианте реализации изобретения Z соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV находится в пара положении и Y находится в мета положении.
В одном варианте реализации изобретения R2 соединения формул I-VII, XIV и XV представляет собой водород. В одном варианте реализации изобретения R2 соединения формул I-VII, XIV и XV представляет собой галоген. В одном варианте реализации изобретения R2 соединения формул I-VII, XIV и XV представляет собой CN. В одном варианте реализации изобретения R2 соединения формул I-VII, XIV и XV представляет собой NO2. В одном варианте реализации изобретения R2 соединения формул I-VII, XIV и XV представляет собой C1-C12-алкил. В одном варианте реализации изобретения R2 соединения формул I-VII, XIV и XV представляет собой арил. В одном варианте реализации изобретения R2 соединения формул I-VII, XIV и XV представляет собой фенил. В одном варианте реализации изобретения R2 соединения формул I-VII, XIV и XV представляет собой COOH. В одном варианте реализации изобретения R2 соединения формул I-VII, XIV и XV представляет собой COOR. В одном варианте реализации изобретения R2 соединения формул I-VII, XIV и XV представляет собой COR. В одном варианте реализации изобретения R2 соединения формул I-VII, XIV и XV представляет собой NHCOR. В одном варианте реализации изобретения R2 соединения формул I-VII, XIV и XV представляет собой CONHR. В одном варианте реализации изобретения R2 соединения формул I-VII, XIV и XV представляет собой OH. В одном варианте реализации изобретения R2 соединения формул I-VII, XIV и XV представляет собой OR. В одном варианте реализации изобретения R2 соединения формул I-VII, XIV и XV представляет собой SH. В одном варианте реализации изобретения R2 соединения формул I-VII, XIV и XV представляет собой SR. В одном варианте реализации изобретения R2 соединения формул I-VII, XIV и XV представляет собой NH2. В одном варианте реализации изобретения R2 соединения формул I-VII, XIV и XV представляет собой NHR. В одном варианте реализации изобретения R2 соединения формул I-VII, XIV и XV представляет собой N(R)2. В одном варианте реализации изобретения R2 соединения формул I-VII, XIV и XV представляет собой C1-C12-галоалкил. В одном варианте реализации изобретения R2 соединения формул I-VII, XIV и XV представляет собой O-C1-C12-алкил. В одном варианте реализации изобретения R2 соединения формул I-VII, XIV и XV представляет собой O-C1-C12-галоалкил. В одном варианте реализации изобретения R2 соединения формул I-III представляет собой -SO2-арил. В одном варианте реализации изобретения R2 соединения формул I-VII, XIV и XV представляет собой -SO2-фенил. В одном варианте реализации изобретения R2 соединения формул I-VII, XIV и XV представляет собой -CO-арил. В одном варианте реализации изобретения R2 соединения формул I-VII, XIV и XV представляет собой арилалкил. В одном варианте реализации изобретения R2 соединения формул I-VII, XIV и XV представляет собой бензил. В одном варианте реализации изобретения R2 соединения формул I-VII, XIV и XV представляет собой C3-C7-циклоалкил.
В одном варианте реализации изобретения R1 соединения формул I-VII и XIV представляет собой CH3. В другом варианте реализации изобретения R1 соединения формул I-VII и XIV представляет собой CF3.
В одном варианте реализации изобретения T соединения формул I-VII и XIV представляет собой OH. В другом варианте реализации изобретения T соединения формул I-VII и XIV представляет собой OCH3. В другом варианте реализации изобретения T соединения формул I-VII и XIV представляет собой

В одном варианте реализации изобретения R соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV представляет собой алкил. В другом варианте реализации изобретения R представляет собой галоалкил. В другом варианте реализации изобретения R представляет собой дигалоалкил. В другом варианте реализации изобретения R представляет собой тригалоалкил. В другом варианте реализации изобретения R представляет собой CH2F. В другом варианте реализации изобретения R представляет собой CHF2. В другом варианте реализации изобретения R представляет собой CF3. В другом варианте реализации изобретения R представляет собой CF2CF3. В другом варианте реализации изобретения R представляет собой арил. В другом варианте реализации изобретения R представляет собой фенил. В другом варианте реализации изобретения R представляет собой F. В другом варианте реализации изобретения R представляет собой Cl. В другом варианте реализации изобретения R представляет собой Br. В другом варианте реализации изобретения R представляет собой I. В другом варианте реализации изобретения R представляет собой алкенил. В другом варианте реализации изобретения R представляет собой гидроксил (OH).
В одном варианте реализации изобретения m соединения формул I-VIII, IXa-IXd, X, XIa-XId, XIV и XV равен 1. В одном варианте реализации изобретения m соединения формул I-VIII, IXa-IXd, X, XIa-XId, XIV и XV равен 2. В одном варианте реализации изобретения m соединения формул I-VIII, IXa-IXd, X, XIa-XId, XIV и XV равен 3.
В одном варианте реализации изобретения n соединения формул I-VII, XIV и XV равен 1. В одном варианте реализации изобретения n соединения формул I-VII, XIV и XV равен 2. В одном варианте реализации изобретения m соединения формул I-VII, XIV и XV равен 3.
В одном варианте реализации изобретения настоящее изобретение относится к соединению селективных разрушителей андрогенных рецепторов (SARD), выбранному из следующих структур:
Индолы:































Бензимидазолы:






Пирроло-пиридин:

Индазолы:




Индолины:
















Изохинолины и Хинолины:








Карбазолы:


200 201

202

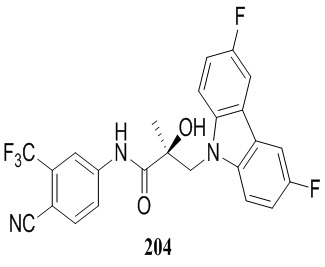

Термин «гетероциклоалкил» относится в одном варианте реализации изобретения к циклоалкильной структуре, содержащей помимо атомов углерода, серы, кислорода, азота или любую их комбинацию в качестве части кольца. В другом варианте реализации изобретения гетероциклоалкил представляет собой 3-12 членное кольцо. В другом варианте реализации изобретения гетероциклоалкил представляет собой 6 членное кольцо. В другом варианте реализации изобретения гетероциклоалкил представляет собой 5-7 членное кольцо. В другом варианте реализации изобретения гетероциклоалкил представляет собой 4-8 членное кольцо. В другом варианте реализации изобретения гетероциклоалкильная может быть незамещенной или замещенной галогеном, галоалкилом, гидроксилом, алкоксилом, карбонилом, амидом, алкиламидом, диалкиламидом, циан, нитро, CO2H, амином, алкиламином, диалкиламином, карбоксилом, тио и/или тиоалкилом. В другом варианте реализации изобретения гетероциклоалкил может быть конденсирован с другим насыщенным или ненасыщенным циклоалкилом или гетероциклическим 3-8-членным кольцом. В другом варианте реализации изобретения гетероциклическое кольцо представляет собой насыщенное кольцо. В другом варианте реализации изобретения гетероциклическое кольцо представляет собой ненасыщенное кольцо. В другом варианте реализации изобретения гетероциклоалкил представляет собой пиперидин, тетрагидрофуран, морфолин, пирролидин, или пиперазин.
Термин «циклоалкил» относится к неароматическому, моноциклическому или полициклическому кольцу, содержащему атомы углерода и водорода. Циклоалкильная группа может иметь одну или несколько углерод-углеродных двойных связей в кольце до тех пор, пока кольцо не становится ароматическим в их присутствии. Примеры циклоалкильных групп включают, но не ограничиваются ими, (C3-C7) циклоалкильные группы, такие как циклопропил, циклобутил, циклопентил, циклогексил, и циклогептил, и насыщенные циклические и бициклические терпены, и (C3-C7) циклоалкенильные группы, такие как циклопропенил, циклобутенил, циклопентенил, циклогексенил, и циклогептенил, и ненасыщенные циклические и бициклические терпены. Циклоалкил группа может быть незамещенной или замещенной одним или двумя заместителями. Предпочтительно, циклоалкильная группа представляет собой моноциклическое кольцо или бициклическое кольцо.
Термин «алкил» относится в одном варианте реализации изобретения к насыщенному алифатическому углеводороду, включая группы с линейной цепью, разветвленной цепью и циклоалкилкильные группы. В одном варианте реализации изобретения алкильная группа имеет 1-12 атомов углегода. В другом варианте реализации изобретения алкильная группа имеет 1-7 атомов углегода. В другом варианте реализации изобретения алкильная группа имеет 1-6 атомов углегода. В другом варианте реализации изобретения алкильная группа имеет 1-4 атомов углегода. В другом варианте реализации изобретения алкильная группа имеет 3-8 атомов углегода. В другом варианте реализации изобретения алкильная группа имеет 3-12 атомов углегода. В другом варианте реализации изобретения разветвленный алкил представляет собой алкил, замещенный алкилом с боковыми цепями от 1 до 5 атомов углерода. В другом варианте реализации изобретения разветвленный алкил представляет собой алкил, замещенный галоалкилом с боковыми цепями от 1 до 5 атомов углерода. Алкильная группа может быть незамещенной или замещенной галогеном, галоалкилом, гидроксилом, алкоксикарбонилом, амидом, алкилламидом, диалкиламидом, нитро, амином, алкилламином, диалкиламином, карбоксилом, тио и/или тиоалкилом.
Термин «гетероалкил» относится к любому алкилу, как определено выше, где один или несколько атомов углерода заменяются кислородом, азотом, серой, фосфором или их комбинацией.
«Арилалкильая» группа относится к алкилу, связанному с арилом, где алкил и арил являются такими, как определено выше. Примером арилалкильной группы является бензильная группа.
«Алкенильная» группа относится, в другом варианте реализации изобретения, к ненасыщенному углеводороду, включая линейные, разветвленные и циклические группы, имеющие одну или более двойных связей. Алкенальная группа может иметь одну двойную связь, две двойные связи, три двойные связи и т.д. В другом варианте реализации изобретения алкенильная группа имеет 2-12 утомов углерода. В другом варианте реализации изобретения алкенильная группа имеет 2-6 утомов углерода. В другом варианте реализации алкенильная группа имеет 2-4 утомов углерода. Примерами алкенильных груп являются этенил, пропенил, бутенил, циклогексенил и т.д. Алкенильная группа может быть незамещенной или замещенной галогеном, гидроксилом, алкоксикарбонилом, амидом, алкиламидом, диалкиламидом, нитро, амином, алкиламином, диалкиламином, карбоксилом, тио и/или тиоалкилом.
«Арильная» группа относится к ароматической группе, имеющей по меньшей мере одну карбоциклическую ароматическую группу или гетероциклическую ароматическую группу, которая может быть незамещенной или замещенной одной или более группами, выбранными из галогена, галоалкила, гидрокси, алкоксикарбонила, амидо, алкилламидо, диалкиламидо, нитро, амино, алкилламино, диалкиламино, карбокси или тио, или тиоалкила. Неограничивающими примерами арильных колец являются фенил, нафтил, пиранил, пирролил, пиразинил, пиримидинил, пиразолил, пиридинил, фуранил, тиофенил, тиазолил, имидазолил, изоксазолил и тому подобное. В одном варианте реализации изобретения арильная группа представляет собой 4-8 членный цикл. В другом варианте реализации изобретения арильная группа представляет собой 4-12 членный цикл(ы). В другом варианте реализации изобретения арильная группа представляет собой 6 членный цикл. В другом варианте реализации изобретения арильная группа представляет собой 5 членный цикл. В другом варианте реализации изобретения арильная группа представляет собой 2-4 конденсированную систему колец. В другом варианте реализации изобретения арил представляет собой фенил.
«Галоалкильная» группа относится, в другом варианте реализации изобретения, к алкильной группе как определено выше, которая замещена одним или более атомами галогена, например, F, Cl, Br или I.
«Гидроксильная» группа относится, в другом варианте реализации изобретения, к OH группе. Специалисту в данной области понятно, что когда Т, Q, R2, R3 или R4 в соединениях по настоящему изобретению представляет собой OR, то соответствующее R не является OH.
В одном варианте реализации изобретения термин “галоген" или "гало" относится к галогену, такому как F, Cl, Br или I.
В одном варианте реализации изобретения данное изобретение предусматривает использование соединения, описанного в данном документе и/или его производного, изомера, метаболита, фармацевтически приемлемой соли, фармацевтического продукта, гидрата, N-оксида, пролекарства, полиморфа, кристалла или их комбинаций.
В одном варианте реализации изобретения способы по настоящему изобретению используют «фармацевтически приемлемые соли» соединений, которые могут быть получены путем взаимодействия соединения по настоящему изобретению с кислотой или основанием.
Подходящие фармацевтически приемлемые соли аминов соединений способов по настоящему изобретению могут быть получены из неорганической кислоты или из органической кислоты. В одном варианте реализации изобретения примерами неорганических солей аминов являются бисульфаты, бораты, бромиды, хлориды, гемисульфаты, гидроброматы, гидрохлораты, 2-гидроксиэтилсульфонаты (гидроксиэтансульфонаты), йодаты, иодиды, изотионаты, нитраты, персульфаты, фосфаты, сульфаты, сульфаматы, сульфанилаты, сульфоновые кислоты (алкилсульфонаты, арилсульфонаты, галогензамещенные алкилсульфонаты, галогензамещенные арилсульфонаты), сульфонаты и тиоцианаты.
В одном варианте реализации изобретения примеры органических солей аминов могут быть выбраны из алифатических, циклоалифатических, ароматических, аралифатических, гетероциклических, карбоновых и сульфоновых классов органических кислот, примерами которых являются ацетаты, аргинины, аспартаты, аскорбаты, адипаты, антранилаты, альгены, алканкарбоксилаты, замещенные алканкарбоксилаты, альгинаты, бензолсульфонаты, бензоаты, бисульфаты, бутираты, бикарбонаты, битартраты, карбоксилаты, цитраты, камфораты, камфорсульфонаты, циклогексилсульфаматы, циклопентанпропионаты, эдетаты кальция, камцилаты, карбонаты, клавуланаты, циннаматы, дикарбоксилаты, диглюконаты, додецилсульфонаты, дигидрохлориды, деканоаты, энантаты, этансульфонаты, эдетаты, эдисилаты, эстолаты, эзилаты, фумараты, формиаты, фториды, галактуронаты, глюконаты, глутаматы, гликоляты, глюкораты, глюкогептаноаты, глицерофосфаты, глюэптаты, гликолилларсанилаты, глутараны, глутаматы, гептаноаты, гексааноаты, гидроксималеаты, гидроксикарбоксильные кислоты, гексилресорцинаты, гидроксибензоаты, гидроксинафтоаты, гидрофтороататы, лактаты, лактобионаты, лаураты, малаты, малеаты, метиленбис (бета-оксинафтоат), малонаты, манделаты, мезилаты, метансульфонаты, метилбромиды, метилнитраты, метилсульфонаты, малеаты монокалия, мукаты, монокарбоксилаты, нитраты, нафталинсульфонаты, 2-нафталинсульфонаты, никотинаты, напсилаты, N-метилглюкамины, оксалаты, октаноаты, олеаты, памоаты, фенилацетаты, пикраты, фенилбензоаты, пивалаты, пропионаты, фталаты, пектины, фенилпропионаты, пальмитаты, пантотенаты, полигалактураны, пируваты, хианаты, салицилаты, сукцинаты, стеараты, сульфанилаты, субацетаты, тартраты, теофиллинацетаты, п-толуолсульфонаты (тозилаты), трифторацетаты, терефталаты, таннаты, теоклаты, тригалоацетаты, триэтиодиды, трикарбоксилаты, ундеканоаты и валериаты.
В одном варианте реализации изобретения примеры неорганических солей карбоновых кислот или фенолов могут быть выбраны из аммония, щелочных металлов и включают литий, натрий, калий, цезий; щелочноземельные металлы включают кальций, магний, алюминий; цинк, барий, холины, четвертичный аммоний.
В другом варианте реализации изобретения примеры органических солей карбоновых кислот или фенолов могут быть выбраны из аргинина, органических аминов, чтобы включать алифатические органические амины, алициклические органические амины, ароматические органические амины, бензатины, t-бутиламины, бенатамины (N-бензилфенэтиламин), дициклогексиламины, диметиламины, диэтаноламины, этаноламины, этилендиамины, гидрабамины, имидазолы, лизины, метиламины, мегламины, N-метил-D-глюкамины, N,N'-дибензиэтилендиамины, никотинамиды, органические амины, орнитины, пиридины, пиколи, пиперазины, прокаин, трис(гидроксиметил)метиламины, триэтиламины, триэтаноламины, триметиламины, трометамины и мочевины.
В одном варианте реализации соли могут быть образованы обычными способами, такими как взаимодействие свободной основаной или свободной кислотной формы продукта с одним или более эквивалентами соответствующей кислоты или основания в растворителе или среде, в которой соль является нерастворимой или в растворителе, таком как вода, которая удаляется in vacuo или путем сушки вымораживанием или путем обмена ионов существующей соли для другого иона или подходящей ионообменной смолы.
В одном варианте реализации изобретения способы по настоящему изобретению используют фармацевтически приемлемую соль соединений по настоящему изобретению. В одном варианте реализации изобретения способы по настоящему изобретению используют фармацевтически приемлемую соль соединений формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV. В одном варианте реализации изобретения способы по данному изобретению используют соль амина соединений формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV по настоящему изобретению. В одном варианте реализации изобретения способы по данному изобретению используют соль фенола соединений формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV по настоящему изобретению.
В одном варианте реализации изобретения способы по настоящему изобретению используют свободное основание, свободную кислоту, не заряженные или не комплексованные соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV и/или их изомеров, фармацевтического продукта, гидрата, полиморфа или их комбинации.
В одном варианте реализации изобретения способы по данному изобретению используют изомер соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV. В одном варианте реализации изобретения способы по данному изобретению используют фармацевтический продукт соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV. В одном варианте реализации изобретения способы по данному изобретению используют гидрат соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV. В одном варианте реализации изобретения способы по данному изобретению используют полиморф соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV. В одном варианте реализации изобретения способы по данному изобретению используют метаболит соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV. В другом варианте реализации изобретения способы по настоящему изобретению используют композицию, содержащую соединение формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV, как описано в данном документе, или, в другом варианте реализации изобретения, комбинация изомера, метаболита, фармацевтического продукта, гидрата, полиморфа соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV и XV.
В одном варианте реализации изобретения термин “изомер” включает, но не ограничивается ими, оптические изомеры и аналоги, структурные изомеры и аналоги, конформационные изомеры и аналоги и тому подобное.
В одном варианте реализации изобретения термин «изомер» означает оптические изомеры соединения SARD. Специалистам в данной области техники будет понятно, что SARD по настоящему изобретению содержат по меньшей мере один хиральный центр. Соответственно, SARD, используемые в способах по настоящему изобретению, могут существовать и быть выделены в оптически активных или рацемических формах. Некоторые соединения могут также проявлять полиморфизм. Следует понимать, что настоящее изобретение охватывает любую рацемическую, оптически активную, полиморфную или стереоизомерную форму или их смеси, которые образуют свойства, полезные для лечения андроген-родственных состояний, описанных в данном документе. В одном варианте реализации изобретения SARD представляют собой чистые (R)-изомеры. В другом варианте реализации изобретения SARD представляют собой чистые (S)-изомеры. В другом варианте реализации изобретения SARD представляют собой смесь (R) и (S) изомеров. В другом варианте реализации изобретения SARD представляют собой рацемическую смесь, содержащую равное количество (R) и (S) изомеров. В данной области техники хорошо известно, как получать оптически активные формы (например, путем растворения рацемической формы способами перекристаллизации, путем синтеза из оптически активных исходных материалов, путем хирального синтеза или путем хроматографического разделени с использованием хиральной стационарной фазы).
В другом варианте реализации изобретения данное изобретение дополнительно включает гидраты соединений. Изобретение также включает использование N-оксидов аминозаместителей соединений, описанных в данном документе.
В одном варианте реализации изобретения термин «гидрат» относится к гемигидрату, моногидрату, дигидрату, тригидрату или другие, какие известны в данной области техники.
Данное изобретение обеспечивает в других вариантах реализации изобретения использование метаболитов соединений, как описано в данном документе. В одном варианте реализации изобретения «метаболит» означает любое вещество, производимое из другого вещества путем метаболизма или метаболического процесса.
В одном варианте реализации изобретения соединения по данному изобретению получают согласно Примерам 1-4.
Биологическая Активность Селективных Разрушителей Андрогенных Рецепторов
В одном варианте реализации изобретения настоящее изобретение предусматривает способ лечения, подавления, уменьшение частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования рака предстательной железы (РСа) и его симптомов или увеличения выживаемости субъекта мужского пола, страдающего раком предстательной железы, включая введение указанному субъекту терапевтически эффективного количества соединения или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации, представленной структурой формулы I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV или XV как описано выше, фармацевтически приемлемая соль.
В другом варианте реализации изобретения рак предстательной железы представляет собой прогрессирующий рак предстательной железы, кастрационно-резистентный рак престательной железы (CRPC), метастатический CRPC (mCRPC), неметастатический CRPC (nmCRPC), высокорисковый nmCRPC или любая их комбинация. В другом варианте реализации изобретения рак предстательной железы зависит от AR-FL и/или AR-SV для пролиферации. В другом варианте реализации изобретения субъект далее получает терапию андрогенной депривации (ADT). В другом варианте реализации изобретения субъект не прошел андрогенную терапию лишения (ADT). В другом варианте реализации изобретения рак устойчив к лечению антагонистом андрогеннвого рецептора. В другом варианте реализации изобретения рак устойчив к лечению энзалутамидом, флутамидом, бикалютамидом, абиратероном, ARN-509, AZD-3514, галетероном, ASC-J9, флутамидом, гидроксифлутамидом, нилутамидом, ацетатом ципротерона, кетоконазолом, спиронолактоном или любой их комбинации. В другом варианте реализации изобретения введение соединения субъекту снижает уровни AR, AR-полной длины (AR-FL), AR-FL с антиандрогенной резистентно-ассоциирующиих мутаций AR-LBD, варианта AR-сплайсинга (AR-SV), ген-амплифицированного АR или любуй их комбинаций у указанного субъекта.
В одном варианте реализации изобретения данное изобретение предусматривает способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования рака предстательной железы (РСа) и его симптомов или увеличения выживаемости субъекта мужского пола, страдающего раком предстательной железы, включая введение указанному субъекту терапевтически эффективного количества соединения или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или люой их комбинации, выбранной из следующих структур:
Индолы:































Бензимидазолы:

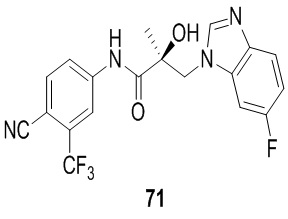




Пирроло-пиридин:

Индазолы:




Индолины:
















Изохинолины и хинолины:








Карбазолы:


200 201

202


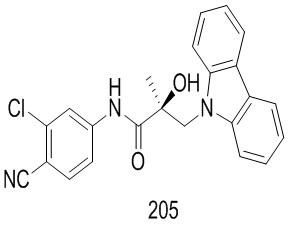
В другом варианте реализации изобретения рак предстательной железы представляет собой прогрессирующий рак предстательной железы, кастрационно-резистентный рак предстательной железы (CRPC), метастатический CRPC (mCRPC), неметастатический CRPC (nmCRPC), высокорисковый nmCRPC или любая их комбинация. В другом варианте реализации изобретения рак предстательной железы зависит от AR-FL и/или AR-SV для пролиферации. В другом варианте реализации изобретения субъект далее получает терапию андрогенной депривации (ADT). В другом варианте реализации изобретения субъект не прошел терапию андрогенной депривации (ADT). В другом варианте реализации изобретения рак устойчив к лечению антагонистом андрогенного рецептора. В другом варианте реализации изобретения рак устойчив к лечению энзалутамидом, флутамидом, бикалютамидом, абиратероном, ARN-509, AZD-3514, галетероном, ASC-J9, флутамидом, гидроксифлутамидом, нилутамидом, ацетатом ципротерона, кетоконазолом, спиронолактоном или любой их комбинацией. В другом варианте реализации изобретения введение соединения субъекту снижает уровни AR, AR-полной длины (AR-FL), AR-FL с антиандрогенной резистентно-ассоциирующими мутациями AR-LBD, варианта AR-сплайсинга (AR-SV), ген-амплифицированный АR или любой их комбинации указанному субъекта.
В одном варианте реализации изобретения способы настоящего изобретения направлены на лечение, подавление, уменьшение частоты возникновения заболевания, снижение тяжести, ингибирование, обеспечение паллиативной помощи или увеличение выживаемости субъекта, страдающего раком предстательной железы. В одном варианте реализации изобретения способы настоящего изобретения направлены на лечение, подавление, уменьшение частоты возникновения заболевания, снижение тяжести, ингибирование, обеспечение паллиативной помощи или увеличение выживаемости субъекта, страдающего прогрессирующим раком предстательной железы. В одном варианте реализации изобретения способы настоящего изобретения направлены на лечение, подавление, уменьшение частоты возникновения заболевания, снижение тяжести, ингибирование, обеспечение паллиативной помощи или увеличение выживаемости субъекта, страдающего кастрациотнно-резистентным раком предстательной железы (CRPC). В одном варианте реализации изобретения способы настоящего изобретения направлены на лечение, подавление, уменьшение частоты возникновения заболевания, снижение тяжести, ингибирование, обеспечение паллиативной помощи или увеличение выживаемости субъекта, страдающего метастатическим кастрационно-резистентным раком предстательной железы (mCRPC). В одном варианте реализации изобретения способы настоящего изобретения направлены на лечение, подавление, уменьшение частоты возникновения заболевания, снижение тяжести, ингибирование, обеспечение паллиативной помощи или увеличение выживаемости субъекта, страдающего неметастатическим кастрациотнно-резистентным раком предстательной железы (nmCRPC). В одном варианте реализации изобретения nmCRPC представляет собой высокорисковый nmCRPC. В другом варианте реализации изобретения субъект имеет высокий или повышенный уровень антигена предстательной железы (PSA).
В одном варианте реализации изобретения данное изобретение предусматривает способ лечения, подавления, снижения частоты возникновения заболеваения, снижения тяжести или ингибирования прогрессирования рака предстательной железы (РСа) и его симптомов или увеличения выживаемости субъекта мужского пола, страдающего раком предстательной железы, включая введение указанному субъекту терапевтически эффективного количества соединения SARD или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации, указанное соединение представлено соединением формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV или XV или любым из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137, или 200-205.
В одном варианте реализации изобретения данное изобретение предусматривает способ лечения, подавления, снижения частоты возникновения заболеваения, снижения тяжести или ингибирования развития прогрессирующего рака предстательной железы и его симптомов или увеличения выживаемости субъекта мужского пола, страдающего прогрессирующим раком предстательной железы, включая введение указанному субъекту терапевтически эффективного количества соединения SARD или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации, указанное соединение представлено соединением формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV или XV или любым из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137, или 200-205.
В одном варианте реализации изобретения данное изобретение предусматривает способ лечения, подавления, снижения частоты возникновения заболеваения, снижения тяжести или ингибирования прогрессирования метастатического рака предстательной железы и его симптомов или увеличения выживаемости субъекта мужского пола, страдающего метастатическим раком предстательной железы, включая введение указанному субъекту терапевтически эффективного количества соединения SARD или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации, указанное соединение представлено соединением формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV илиr XV или любым из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137, или 200-205.
В одном варианте реализации изобретения данное изобретение предусматривает способ лечения, подавления, снижения частоты возникновения заболеваения, снижения тяжести или ингибирования прогрессирования кастрационно-резистентного рака предстательной железы (CRPC) и его симптомов или увеличения выживаемости субъекта мужского пола, страдающего кастрационно-резистентным раком предстательной железы (CRPC), включая введение указанному субъекту терапевтически эффективного количества соединения SARD или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации, указанное соединение представлено соединением формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV или XV или любым из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137, или 200-205.
В одном варианте реализации изобретения соединения SARD, как описано в данном документе, и/или композиции, содержащие их, могут быть использованы для лечения, подавления, уменьшения частоты возникновения забеолевания, снижения тяжести или ингибирования прогрессирования кастрационно-резистентного рака предстательной железы (CRPC) и его симптомов, или увеличения выживаемости мужчины с кастрационно-резистентным раком предстательной железы. В другом варианте реализации изобретения CRPC представляет собой метастатический CRPC (mCRPC). В другом варианте реализации изобретения CRPC представляет собой метастатический CRPC (nmCRPC). В одном варианте реализации изобретения nmCRPC представляет собой высокорисковый nmCRPC. В другом варианте реализации изобретения субъект далее получает терапию андрогенной депривации.
Используемые в данном документе термины «увеличение» и «продление» могут использоваться взаимозаменяемо, имея все одинаковые значения и качества, причем эти термины могут в одном варианте осуществления относиться к удлинению времени. В другом варианте реализации изобретения как используется здесь, термины «увеличение», «увеличивающий», «увеличенный», могут использоваться взаимозаменяемо и ссылаться на объект, который становится все более значительным (как в размере, количестве, числе или интенсивности), где, например, объект представляет собой половой гормон-связывающй глобулин (SHBG) или специфический антиген предстательной железы (PSA).
В одном варианте реализации изобретения описанные в данном документе соединения и/или композиции, содержащие их, могут быть использованы для увеличения выживаемости без метастазов (MFS) у субъекта, страдающего неметастатическим раком предстательной железы. В одном варианте реализации изобретения неметастатический рак предстательной железы представляет собой неметастатический прогрессирующий рак предстательной железы. В одном варианте реализации изобретения неметастатический рак предстательной железы представляет собой неметастатический CRPC (nmCRPC). В одном варианте реализации изобретения nmCRPC представляет собой высокорисковый nmCRPC.
В одном варианте реализации изобретения соединения SARD, как описано в данном документе, и/или композиции, содержащие их, могут быть использованы для обеспечения двойного действия, например, лечения рака предстательной железы и предотвращения метастазов. В одном варианте реализации изобретения рак предстательной железы, подвергающийся лечению, представляет собой прогрессирующий рак предстательной железы. В одном варианте реализации изобретения рак предстательной железы, подвергающийся лечению, представляет собой кастрационно-резистентный рак предстательной железы (CRPC). В одном варианте реализации изобретения рак предстательной железы, подвергающийся лечению, представляет собой метастатический CRPC (mCRPC). В одном варианте реализации изобретения рак предстательной железы, подвергающийся лечению, представляет собой неметастатический CRPC (nmCRPC). В одном варианте реализации изобретения nmCRPC представляет собой высокорисковый nmCRPC.
Мужчины с прогрессирующим раком предстательной железы, которые подвержены высокому риску прогрессирования кастрационно-резистентного рака предстательной железы (CRPC), в одном варианте реализации изобретения, мужчины с ADT с общей концентрацией тестостерона в сыворотке более 20 нг/дл или в другом варианте реализации изобретения, мужчины с прогрессирующим раком предстательной железы, которые во время начала ADT имели либо (1) подтвержденный патерн Глисона 4 или 5 стадии рака предстательной железы, (2) метастатический рак предстательной железы, (3) время удвоения PSA < 3 месяцев, (4) PSA ≥20 нг/мл, или (5) рецидив PSA в течение < 3 лет после окончательной местной терапии (радикальная простатэктомия или лучевая терапия).
Мужчины с высокорисковым неметастатическим кастрационно-резистентным раком предстательной железы (высокорисковый nmCRPC) могут влючать тех, у которых быстрое время удвоения PSA, имеющих ожидаемую выживаемость без прогрессирования примерно 18 месяцев или меньше (Miller K, Moul JW, Gleave M, et al. 2013. Phase III, randomized, placebo-controlled study of once-daily oral zibotentan (ZD4054) in patients with non-metastatic castration-resistant prostate cancer. Prostate Canc Prost Dis. Feb; 16:187-192). Это относительно быстрое прогрессирование их заболевания подчеркивает важность новых способов лечения этих лиц. В одном варианте реализации изобретения уровни PSA выше 8 нг/мл у субъекта, страдающего от высокорискового nmCRPC. В одном варианте реализации изобретения время удвоения PSA составляет менее 8 месяцев у субъекта, страдающего от высокорискового nmCRPC. В другом варианте реализации изобретения время удвоения PSA составляет менее 10 месяцев у субъекта, страдающего от высокорискового nmCRPC. В одном варианте реализации изобретения общий уровень тестостерона в сыворотке выше 20 нг/мл у субъекта, страдающего от высокорискового nmCRPC. В одном варианте реализации изобретения уровни свободного тестостерона в сыворотке больше, чем те, которые наблюдаются у охриддэктомированного субъекта мужского пола, страдающего от высокорискового nmCRPC.
В одном варианте реализации изобретения описанные здесь соединения и/или композиции, содержащие их, могут быть использованы в комбинации с агонистом или антагонистом LHRH для увеличения выживаемости без прогрессирования или общей выживаемости пациента, страдающего раком предстательной железы. В другом варианте реализации изобретения рак предстательной железы представляет собой прогрессирующий рак предстательной железы. В другом варианте реализации изобретения рак предстательной железы представляет собой кастрационно-резистентый рак предстательной железы (CRPC). В другом варианте реализации изобретения CRPC представляет собой метастатический CRPC (mCRPC). В другом варианте реализации изобретения CRPC представляет собой неметастатический CRPC (nmCRPC). В одном варианте реализации изобретения nmCRPC представляет собой высокорисковый nmCRPC. В другом варианте реализации изобретения субъект хирургически кастрирован. В другом варианте реализации изобретения субъект химически кастрирован.
В одном варианте реализации изобретения описанные в данном документе соединения и/или композиции, содержащие их, могут быть использованы в комбинации с лекрственными средствами рецептора антипрограммируемой смерти 1 (anti-PD-1) (например, AMP-224, ниволумаб, пембролизумаб, пидилизумаб, AMP-554 и подобное) для увеличения выживаемости без прогрессирования или общей выживаемости пациента, страдающего раком предстательной железы. В другом варианте реализации изобретения рак предстательной железы представляет собой прогрессирующий рак предстательной железы. В другом варианте реализации изобретения рак предстательной железы представляет собой кастрационно-резистентый рак предстательной железы (CRPC). В другом варианте реализации изобретения CRPC представляет собой метастатический CRPC (mCRPC). В другом варианте реализации изобретения CRPC представляет собой неметастатический CRPC (nmCRPC). В одном варианте реализации изобретения nmCRPC представляет собой высокорисковый nmCRPC. В другом варианте реализации изобретения субъект хирургически кастрирован. В другом варианте реализации изобретения субъект химически кастрирован.
В одном варианте реализации изобретения описанные здесь соединения и/или композиции, содержащие их, могут быть использованы в комбинации с анти-PD-L1-лекарственными средствами (например, BMS-936559, MEDI4736, MPDL3280A, MEDI4736, MSB0010718C и т.п.) для увеличения выживаемости без прогрессирования или общей выживаемости субъекта, страдающего раком предстательной железы. В другом варианте реализации изобретения рак предстательной железы представляет собой прогрессирующий рак предстательной железы. В другом варианте реализации изобретения рак предстательной железы представляет собой кастрационно-резистентый рак предстательной железы (CRPC). В другом варианте реализации изобретения CRPC представляет собой метастатический CRPC (mCRPC). В другом варианте реализации изобретения CRPC представляет собой неметастатический CRPC (nmCRPC). В одном варианте реализации изобретения nmCRPC представляет собой высокорисковый nmCRPC. В другом варианте реализации изобретения субъект хирургически кастрирован. В другом варианте реализации изобретения субъект химически кастрирован.
В некоторых вариантах реализации изобретения лечение рака предстательной железы, прогрессирующего рака предстательной железы, CRPC, mCRPC и/или nmCRPC может привести к клинически значимому улучшению симптомов, функций и/или выживаемости, связанных с раком предстательной железы. Клинически значимые улучшения включают, но не ограничиваются ими, увеличение выживаемости без прогрессирования рака (rPFS), если рак является метастатическим, и увеличение выживаемости без метастазов (MFS), если рак является неметастатическим.
В одном варианте реализации изобретения соединения, как описано в данном документе, и/или композиции, содержащие их, могут быть использованы для увеличения выживаемости мужчин с кастрационно-резистентным раком предстательной железы (CRPC). В другом варианте реализации изобретения CRPC представляет собой метастатический CRPC (mCRPC). В другом варианте реализации изобретения CRPC представляет собой неметастатический CRPC (nmCRPC). В одном варианте реализации изобретения nmCRPC представляет собой высокорисковый nmCRPC. В другом варианте реализации изобретения субъект далее получает терапию андрогенной депривации.
В одном варианте реализации изобретения уровни специфического антигена предстательной железы (PSA), которые считаются нормальными, зависят от возраста. В одном варианте реализации изобретения уровни специфического антигена предстательной железы (PSA), которые считаются нормальными, зависят размера предстательной железы самца. В одном варианте реализации изобретения уровни PSA в диапазоне от 2,5 до 10 нг/мл считаются «граничными». В другом варианте реализации изобретения уровни PSA выше 10 нг/мл считаются «высокими».
В одном варианте реализации изобретения скорость изменения или «скорость роста содержания PSA» высока. В одном варианте реализации изобретения скорость изменения или «скорость роста содержания PSA», превышающая 0,75/год, считается высокой.
В одном варианте реализации изобретения данное изобретение предусматривает способ снижения уровней специфического антигена предстательной железы (PSA) в сыворотке у субъекта-мужчины, страдающего раком предстательной железы, прогрессирующем раком предстательной железы, метастатическим раком предстательной железы или кастрационно-резистентным раком предстательной железы (CRPC), включающим введение терапевтически эффективного количества соединения SARD или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации, указанное соединение представлено структурой формулы I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV или XV или любым из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137, или 200-205. В одном варианте реализации изобретения данное изобретение направлено на лечение субъекта с высоким или повышенным уровнями PSA, включающим введение соединения SARD по настоящему изобретению. В одном варианте реализации изобретения данное изобретение направлено на лечение субъекта с высоким или повышенным уровнем PSA, несмотря на постоянный ADT или историю ADT, хирургическую кастрацию или несмотря на лечение антиандрогенами и/или агонистом LHRH. В другом варианте реализации изобретения для лечения используют соединения формулы I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV или XV или любым из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137, или 200-205.
В одном варианте реализации изобретения данное изобретение предусматривает способ лечения, подавления, снижения частоты возникновения заболеваний, снижения тяжести или ингибирования прогрессирования кастрационно-резистентного рака предастательной железы (CRPC) и его симптомов, или увеличения выживаемости мужчин с кастрационно-резистентным раком предастательной железы, включающим введение терапевтически эффективного количество соединения формул I-III, IXa, XIa, XIIIa или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой соединение 11. В другом варианте реализации изобретения соединение представляет собой соединение 11R. В другом варианте реализации изобретения соединение представляет собой соединение 12. В другом варианте реализации изобретения соединение представляет собой соединение 13. В другом варианте реализации изобретения соединение представляет собой соединение 14. В другом варианте реализации изобретения соединение представляет собой соединение 15. В другом варианте реализации изобретения соединение представляет собой соединение 16. В другом варианте реализации изобретения соединение представляет собой соединение 17. В другом варианте реализации изобретения соединение представляет собой соединение 18. В другом варианте реализации изобретения соединение представляет собой соединение 19. В другом варианте реализации изобретения соединение представляет собой соединение 20. В другом варианте реализации изобретения соединение представляет собой соединение 21. В другом варианте реализации изобретения соединение представляет собой соединение 22. В другом варианте реализации изобретения соединение представляет собой соединение 23. В другом варианте реализации изобретения соединение представляет собой соединение 24. В другом варианте реализации изобретения соединение представляет собой соединение 25. В другом варианте реализации изобретения соединение представляет собой соединение 26. В другом варианте реализации изобретения соединение представляет собой соединение 27. В другом варианте реализации изобретения соединение представляет собой соединение 30. В другом варианте реализации изобретения соединение представляет собой соединение 31. В другом варианте реализации изобретения соединение представляет собой соединение 32. В другом варианте реализации изобретения соединение представляет собой соединение 33. В другом варианте реализации изобретения соединение представляет собой соединение 34. В другом варианте реализации изобретения соединение представляет собой соединение 35. В другом варианте реализации изобретения соединение представляет собой соединение 36. В другом варианте реализации изобретения соединение представляет собой соединение 37. В другом варианте реализации изобретения соединение представляет собой соединение 38. В другом варианте реализации изобретения соединение представляет собой соединение 39. В другом варианте реализации изобретения соединение представляет собой соединение 40. В другом варианте реализации изобретения соединение представляет собой соединение 41. В другом варианте реализации изобретения соединение представляет собой соединение 42. В другом варианте реализации изобретения соединение представляет собой соединение 70. В другом варианте реализации изобретения соединение представляет собой соединение 71. В другом варианте реализации изобретения соединение представляет собой соединение 72. В другом варианте реализации изобретения соединение представляет собой соединение 73. В другом варианте реализации изобретения соединение представляет собой соединение 74. В другом варианте реализации изобретения соединение представляет собой соединение 75. В другом варианте реализации изобретения соединение представляет собой соединение 80. В другом варианте реализации изобретения соединение представляет собой соединение 90. В другом варианте реализации изобретения соединение представляет собой соединение 91. В другом варианте реализации изобретения соединение представляет собой соединение 92. В другом варианте реализации изобретения соединение представляет собой соединение 93.
В одном варианте реализации изобретения данное изобретение предусматривает способ лечения, подавления, снижения частоты возникновения заболеваний, снижения тяжести или ингибирования прогрессирования кастрационно-резистентного рака предстательной железы (CRPC) и его симптомов, или увеличения выживаемости мужчин с кастрационно-резистентным раком предстательной железы, включающим введение терапевтически эффективного количество соединения формул II, IV-VIII, IXb-IXd, X, XIb-XId, XII, XIIIb-XIIId или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой соединение 100. В другом варианте реализации изобретения соединение представляет собой соединение 101. В другом варианте реализации изобретения соединение представляет собой соединение 102. В другом варианте реализации изобретения соединение представляет собой соединение 103. В другом варианте реализации изобретения соединение представляет собой соединение 104. В другом варианте реализации изобретения соединение представляет собой соединение 105. В другом варианте реализации изобретения соединение представляет собой соединение 106. В другом варианте реализации изобретения соединение представляет собой соединение 107. В другом варианте реализации изобретения соединение представляет собой соединение 108. В другом варианте реализации изобретения соединение представляет собой соединение 109. В другом варианте реализации изобретения соединение представляет собой соединение 110. В другом варианте реализации изобретения соединение представляет собой соединение 111. В другом варианте реализации изобретения соединение представляет собой соединение 112. В другом варианте реализации изобретения соединение представляет собой соединение 113. В другом варианте реализации изобретения соединение представляет собой соединение 114. В другом варианте реализации изобретения соединение представляет собой соединение 115. В другом варианте реализации изобретения соединение представляет собой соединение 130. В другом варианте реализации изобретения соединение представляет собой соединение 131. В другом варианте реализации изобретения соединение представляет собой соединение 132. В другом варианте реализации изобретения соединение представляет собой соединение 133. В другом варианте реализации изобретения соединение представляет собой соединение 134. В другом варианте реализации изобретения соединение представляет собой соединение 135. В другом варианте реализации изобретения соединение представляет собой соединение 136. В другом варианте реализации изобретения соединение представляет собой соединение 137.
В одном варианте реализации изобретения данное изобретение предусматривает способ лечения, подавления, снижения частоты возникновения заболеваний, снижения тяжести или ингибирования прогрессирования кастрационно-резистентного рака предастательной железы (CRPC) и его симптомов, или увеличения выживаемости мужчин с кастрационно-резистентным раком предастательной железы, включающим введение терапевтически эффективного количество соединения формул XIV или XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение соединение представляет собой соединение 200. В другом варианте реализации изобретения соединение представляет собой соединение 201. В другом варианте реализации изобретения соединение представляет собой соединение 202. В другом варианте реализации изобретения соединение представляет собой соединение 203. В другом варианте реализации изобретения соединение представляет собой соединение 204. В другом варианте реализации изобретения соединение представляет собой соединение 205.
В одном варианте реализации изобретения данное изобретение предусматривает способ вторичной гормональной терапии, который снижает уровень PSA в сыворотке у субъекта-мужчины, страдающего от кастрационн-резистентного рака предстательной железы (CRPC), включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения кастрация представляет собой хирургическую кастрацию.
В другом варианте реализации изобретения, с учетом способов, описанных выше, рак предстательной железы зависит от AR-FL и/или AR-SV для пролиферации. В другом варианте реализации изобретения рак устойчив к лечению антагонистом андрогенного рецептора. В другом варианте реализации изобретения рак устойчив к лечению энзалутамидом, флутамидом, бикалютамидом, абиратероном, ARN-509, AZD-3514, галетероном, ASC-J9, флутамидом, гидроксифлутамидом, нилутамидом, ацетатом ципротерона, кетоконазолом, спиронолактоном или любой их комбинацией. В другом варианте реализации изобретения введение соединений формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV или XV, уменьшает уровни AR, AR полной длины (AR-FL), AR-FL с антиандрогенной устойчивостью, ассоциируя AR-LBD-мутации, вариант AR-сплайсингаа (AR-SV), амплифицированный ген AR или любую их комбинацию субъекту. В другом варианте реализации изобретения кастрация представляет собой хирургическую кастрацию. В другом варианте реализации изобретения кастрация представляет собой химическую кастрацию. В другом варианте реализации изобретения CRPC представляет собой метастатический CRPC (mCRPC). В другом варианте реализации изобретения CRPC представляет собой неметастатический CRPC (nmCRPC). В одном варианте реализации изобретения nmCRPC представляет собой высокорисковый nmCRPC. В другом варианте реализации изобретения способ дополнительно увеличивает выживаемость без рентгенографической прогрессии (rPFS) у субъекта, страдающего метастатическим раком. В другом варианте реализации изобретения способ дополнительно увеличивает выживаемость без метастазов (MFS) у субъекта, страдающего неметастатическим раком. В одном варианте реализации изобретения способ может быть использован для обеспечения двойного действия, например, лечения рака предстательной железы и предотвращения метастазов. В другом варианте реализации изобретения субъект не прошел терапию андрогенной депривации (ADT). В другом варианте реализации изобретения субъект далее получает терапию андрогенной депривации (ADT). В другом варианте реализации изобретения субъект дополнительно получает агонист или антагонист LHRH. В другом варианте реализации изобретения агонист LHRH предствляет собой ацетат лейпролида. В другом варианте реализации изобретения субъект подвергся орхидэктомии. В другом варианте реализации изобретения субъект имеет высокий или повышенный уровень специфического антигена простаты (PSA). В другом варианте реализации изобретения субъект представляет собой пациента с раком предстательной железы. В другом варианте реализации изобретения субъект представляет собой пациента с раком предстательной железы на ADT. В другом варианте реализации изобретения субъект представляет собой пациента с раком предстательной железы на ADT с уровнями кастрации всего Т. В другом варианте реализации субъект представляет собой пациента с прогрссирующим раком предстательной железы. В другом варианте реализации изобретения субъект представляет собой пациента с прогрссирующим раком предстательной железы на ADT. В другом варианте реализации изобретения субъект представляет собой пациента с прогрссирующим раком предстательной железы на ADT с уровнями кастрации всего Т. В другом варианте реализации изобретения субъект представляет собой CRPC пациента. В другом варианте реализации изобретения субъект представляет собой CRPC пациента на ADT. В другом варианте реализации изобретения субъект представляет собой CRPC пациента на ADT с уровнями кастрации всего Т. В другом варианте реализации субъект представляет собой пациента с метастатическим кастрационно-резистентным раком предстательной железы (mCRPC). В другом варианте реализации изобретения реализации субъект представляет собой mCRPC пациента, поддерживаемый ADT. В другом варианте реализации изобретения субъект представляет собой mCRPC пациента, поддерживаемый ADT с уровнями кастрации всего Т. В другом варианте реализации изобретения реализации субъект представляет собой пациента с неметастатическим кастрационно-резистентным раком предстательной железы (nmCRPC). В другом варианте реализации изобретения субъект представляет собой nmCRPC пациента, поддерживаемый ADT. В другом варианте реализации изобретения субъект представляет собой nmCRPC пациента, поддерживаемый ADT с уровнями кастрации всего Т. В другом варианте реализации изобретения nmCRPC представляет собой высокорисковый nmCRPC. В другом варианте реализации изобретения способ дополнительно лечит, подавляет, уменьшает частоту возникновения заболеваемость, уменьшает тяжесть или ингибирует прогрессирующий рак предстательной железы. В другом варианте реализации изобретения способ дополнительно обеспечивает паллиативное лечение прогрессирующего рака предстательной железы.
В одном варианте реализации изобретения данное изобретение направлено на способ снижения уровней AR, AR полной длины, AR-FL с антиандрогенной устойчивостью, ассоциирующими AR-LBD мутации и/или вариантов AR-сплайсинг у субъекта, включающий введение указанному субъекту терапевтически эффективного количества соединения SARD в соответствии с настоящим изобретением или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения снижение достигается за счет деградации указанных AR, AR-полной длины (AR-FL) и/или вариантов AR-сплайсинга (AR-SV). В другом варианте реализации изобретения снижение достигается за счет ингибирования указанных AR, AR-полной длины (AR-FL) и/или вариантов AR-сплайсинга (AR-SV). В другом варианте реализации изобретения снижение достигается за счет двойной деградации AR-SV/AR-FL и ингибирующих функций AR-SV/AR-FL.
В одном варианте реализации изобретения данное изобретение направлено на способ снижения уровней вариантов AR-сплайсинга у субъекта, включающий введение указанному субъекту терапевтически эффективного количества соединения SARD в соответствии с настоящим изобретением или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрат или любой их комбинации. В другом варианте реализации изобретения способ дополнительно уменьшает уровни AR-полной длины (AR-FL) у субъекта. В другом варианте реализации изобретения уменьшение достигается за счет деградации указанных вариантов AR-сплайсинга (AR-SV). В другом варианте реализации изобретения уменьшение дополнительно достигается за счет деградации упомянутого AR-FL. В другом варианте реализации изобретения снижение достигается за счет ингибирования указанных вариантов AR-сплайсинга (AR-SV). В другом варианте реализации изобретения снижение дополнительно достигается за счет ингибирования указанного AR-FL. В другом варианте реализации изобретения снижение достигается за счет двойной деградации AR-SV и ингибирующих функций AR-SV. В другом варианте реализации изобретения снижение достигается за счет двойной деградации AR-FL и ингибирующих функций AR-FL.
В одном варианте реализации изобретения «субъект, страдающий кастрационно-резистентным раком предстательной железы» относится к субъекту, который ранее лечился терапией андрогенной депривации (ADT), откликнулся на ADT и в настоящее время имеет уровень PSA в плазме > 2 нг/мл или > 2 нг/мл и что на около 25% больше, чем самый низкий уровень, достигнутым на ADT. В другом варианте реализации изобретения термин относится к субъекту, у которого, несмотря на поддерживаение терапии андрогенной депривации, диагностировано прогрессирование PSA в сыворотке. В другом варианте реализации изобретения субъект имеет уровень кастрации общего тестостерона в сыворотке (<50 нг/дл). В другом варианте реализации изобретения субъект имеет уровень кастрации общего тестостерона в сыворотке (<20 нг/дл). В другом варианте реализации изобретения субъект имеет повышенныйя уровень PSA в сыворотке на двух последовательных оценках, по меньшей мере, в течение 2 недель. В другом варианте реализации изобретения субъект был эффективно вылечен с помощью ADT. В другом варианте реализации изобретения субъект имеет историю ответа PSA в сыворотке после начала ADT. В другом варианте реализации изобретения субъект лечился ADT и имел исходный ответ PSA в сыворотке, но теперь имеет уровень PSA в сыворотке > 2 нг/мл и увеличение на около 25%, чем самоый низкий уровень, наблюдаемый на ADT. В одном варианте реализации изобретения CRPC представляет собой метастатический CRPC (mCRPC). В другом варианте реализации изобретения CRPC представляет собой неметастатический CRPC (nmCRPC). В одном варианте реализации изобретения nmCRPC представляет собой высокорисковый nmCRPC.
Термин «ответ PSA в сыворотке» относится, в одном варианте реализации изобретения к снижению уровня PSA в сыворотке крови по меньшей мере на 90% до начала ADT до <10 нг/мл или неопределяемого уровня PSA в сыворотке крови (<0,2 нг/мл) в любое время или в другом варианте реализации изобретения по меньшей мере на 50% снижается от исходного уровня PSA в сыворотке, или в другом варианте реализации изобретения по меньшей мере на 90% снижается от исходного уровня PSA в сыворотки, или в другом варианте по меньшей мере на 30% снижается от исходного уровня PSA в сыворотки, или в другом варианте реализации изобретения по меньшей мере на 10% снижении от исходного уровня PSA в сыворотке.
Термин «прогрессирование PSA в сыворотке» относится в одном варианте реализации изобретения к увеличению реализации изобретения в сыворотке на 25% или более и абсолютному увеличению 2 нг/мл или более от самого низкого уровня или в другом варианте реализации изобретения, PSA в сыворотке > 2 нг/мл или > 2 нг/мл и на 25% выше, чем самй низкий уровень после начала терапии андрогенной депривации (ADT).
В другом варианте реализации изобретения термин «самый низкий уровень» относится к самому низкому уровню PSA, когда пациент проходит ADT.
Тестостерон может быть измерен как «свободный» (то есть, биодоступный и несвязанный) или как «общий» (включая процент, который связан с белком и недоступный) уровни в сыворотке. В одном варианте реализации изобретения общий тестостерон в сыворотке содержит свободный тестостерон и связанный тестостерон.
Способы по данному изобретению включают введение комбинации форм ADT и соединения по настоящему изобретению. В одном варианте реализации изобретения формы ADT включают агонист LHRH. В другом варианте реализации изобретения агонист LHRH включает ацетат лейпролида (Lupron®) (США 5,480,656; US 5,575,987; 5,631,020; 5,643,607; 5,716,640; 5,814,342; 6,036,976 которые включены в настоящее описание посредством ссылки) или ацетат гозерелина (Zoladex®) (США 7,118,552; 7,220,247; 7,500,964 которые включены в настоящее описание посредством ссылки). В одном варианте реализации изобретения формы ADT включают антагонист LHRH. В другом варианте реализации изобретения антагонист LHRH включает дегарелик. В другом варианте реализации изобретения антагонист LHRH включает абареликс. В другом варианте реализации изобретения формы ADT включают обратимые антиандрогены. В другом варианте реализации изобретения антиандрогены включают бикалютамид, флутамид, финастерид, дутастерид, энзалутамид, нилутамид, хлормадинон, абиратор или любую их комбинацию. В одном варианте реализации изобретения формы ADT включают двустороннюю орхидэктомию.
В одном варианте реализации изобретения данное изобретение предусматривает способ лечения, подавления, уменьшение частоты возникновения заболеваний, снижения тяжести или ингибирования прогрессирования кастрационно-резистентного рака предстательной железы (CRPC) и его симптомов, или увеличения выживаемости мужчин кастрационно-резистентным раком предстательной железы, включающим введение терапевтически эффективного количества комбинации одной или более форм ADT и соединение формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения субъект не прошел терапию андрогенной депривации (ADT).
В одном варианте реализации изобретения данное изобретение предусматривает способ снижения уровней PSA в сыворотке у самца, страдающего от кастрационно-резистентного рака предстательной железы (CRPC), включающий введение терапевтически эффективного количества комбинации одной или нескольких форм ADT и соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения субъект не прошел терапию андрогенной депривации (ADT).
В одном варианте реализации изобретения способы по настоящему изобретению включают введение терапевтически эффективного количества антиандрогена и соединения по настоящему изобретению. В одном варианте реализации изобретения способы по настоящему изобретению включают введение терапевтически эффективного количества агониста LHRH и соединения по настоящему изобретению. В одном варианте реализации изобретения способы по настоящему изобретению включают введение терапевтически эффективного количества антиандрогена, агониста LHRH и соединения по настоящему изобретению. В другом варианте реализации изобретения соединение представляет собой соединение формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV или XV. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137, или 200-205.
В одном варианте реализации изобретения способы по настоященну изобретению включают введение терапевтически эффективного количества ингибитора лиазы (например, абиратера) и соединения по настоящему изобретению. В другом варианте реализации изобретения соединение представляет собой соединение формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV или XV. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137, или 200-205.
В другом варианте реализации изобретения данное изобретение предусматривает способ терапии андрогенной депривации (ADT) у субъекта, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения указанный субъект имеет рак предстательной железы. В другом варианте реализации изобретения рак предстательной железы представляет собой кастрационно-резистентный рак предстательной железы (CRPC). В другом варианте реализации изобретения CRPC пердставляет собой метастатический CRPC (mCRPC). В одном варианте реализации изобретения CRPC представляет собой метастатический кастрационно-резистентный рак предстательной железы (nmCRPC). В одном варианте реализации изобретения nmCRPC пердставляет собой высокорисковый nmCRPC. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137, или 200-205. В другом варианте реализации изобретения субъект не прошел андрогенную терапию депривации (ADT). В другом варианте реализации изобретения субъект далее получает терапию андрогенной депривации (ADT).
В одном варианте реализации изобретения данное изобретение относится к способу лечения рака предстательной железы или замедлению прогрессирования рака предстательной железы, включающему введение соединения SARD по настоящему изобретению. В одном варианте реализации изобретения данное изобретение предусматривает способ профилактики и/или лечения рецидива рака предстательной железы, включающий соединения SARD по настоящему изобретению. В другом варианте реализации изобретения рак предстательной железы представляет собой кастрационно-резистентный рак предстательной железы (CRPC). В другом варианте реализации изобретения CRPC представляет собой метастатический CRPC (mCRPC). В одном варианте реализации изобретения CRPC представляет собой неметастатический кастрационно-резистентный рак предстательной железы (nmCRPC). В одном варианте реализации изобретения nmCRPC представляет собой высорисковый nmCRPC.
В одном варианте реализации изобретения данное изобретение предусматривает способ увеличения выживаемости субъекта, имеющего рак предстательной железы, прогрессирующий рак предстательной железы, кастрационно-резистентный рак предстательной железы или метастатический кастрационно-резистентный рак предстательной железы или неметастатический кастрационно-резистентный рак предстательной железы или высокочувствительный неметастатический кастрационно-резистентный рак предстательной железы, включающий введение соединения по настоящему изобретению. В другом варианте реализации изобретения введение соединения по настоящему изобретению в комбинации с аналогами LHRH, обратимыми антиандрогенами (такими как бикалютамид, флутамид или энзалутамид), антиэстрогенами, эстрогенами (такими как эстрадиол, этинилэстрадиол или капесар), противораковыми лекарственными средствами, ингибиторами 5-альфа-редуктазы, ингибиторами ароматазы, прогестинами, селективными модуляторами андрогенных рецепторов (SARM) или агентами, действующими через другие рецепторы ядерных гормонов. В другом варианте реализации изобретения субъект не прошел андрогенную терапию депривации (ADT). В одном варианте реализации изобретения соединение представляет собой соединение формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV или XV. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137, или 200-205.
Термин «прогрессирующий рак предстательной железы» относится к метастатическому раку, возникшему в предстательной железе, и широко метастазирующемуся за пределы предстательной железы, например, окружающих тканях, включая семенные железы, тазовые лимфатические узлы или кости, или другие части тела. Патологии рака предстательной железы оцениваются с оценкой Глисона от 1 до 5 в порядке возрастания злокачественности. В другом варианте реализации изобретения пациенты со значительным риском прогрессирования заболевания и/или смерти от рака предстательной железы должны быть включены в определение и что любой пациент с раком вне капсулы предстательной железы с стадиями заболевания ниже, чем IIB явно имеет «прогрессирующую» болезнь. В другом варианте реализации изобретения «прогрессирующий рак предстательной железы» может относиться к местно-распространенному раку предстательной железы.
Мужчины с распространенным раком предстательной железы часто получают лечение, чтобы блокировать производство андрогенов, которые являются мужскими половыми гормонами, которые могут способствовать росту опухолей предстательной железы. Однако рак предстательной железы, который первоначально реагирует на антиандрогенную терапию, в конечном итоге развивает способность расти без андрогенов. Такие виды рака часто называют гормонально-рефрактерными, андроген-независимыми или кастрационно-резистентными.
В одном варианте реализации изобретения прогрессирующий рак предстательной железы представляет собой кастрационно-резистентный рак предстательной железы.
Термин «кастрационно-резистентный рак предстательной железы» (CRPC) относится к проогрессирующему раку предстательной железы, который ухудшается или прогрессирует, в то время как пациент остается на ADT или других способах лечения для снижения уровня тестостерона или рака предстательной железы, который считается гормонально-рефрактерным, не имеющим предшествующей гормональной терапии, андроген-независимая или химически, или хирургически кастрационно-резистентным. В другом варианте реализации изобретения CRPC представляет собой результат активации AR путем интракринового синтеза андрогенов. В другом варианте реализации изобретения CRPC представляет собой результат экспрессии вариантов AR-сплайсинга (AR-SV), у которых отсутствует лигандсвязывающий домен (LBD). В другом варианте реализации изобретения CRPC представляет собой результат экспрессии мутаций AR-LBD, способных противостоять антагонистам. В другом варианте реализации изобретения кастрационно-резистентный рак предстательной железы (CRPC) представляет собой прогрессирующий рак предстательной железы, который развился, несмотря на продолжающуюся ADT и/или хирургическую кастрацию. В одном варианте реализации изобретения кастрационно-резистентный рак предстательной железы определяется как рак предстательной железы, который продолжает прогрессировать или ухудшает или отрицательно влияет на здоровье пациента, несмотря на предшествующую хирургическую кастрацию, продолжающееся лечение агонистами гонадотропин-высвобождающих гормонов (например, лейпролид) или антагонистами (например, дегареликс), антиандрогенами (например, бикалютамид, флутамид, энзалутамид, кетоконазол, аминоглутамид), химиотерапевтические агенты (например, доцетаксел, паклитаксел, кабазитаксел, адриамицин, митоксантрон, эстрамустин, циклофосфамид), ингибиторы киназы (иматиниб (Gleevec®) или гефитиниб (Iressa®), кабозантиниб (Cometriq ™, также известный как XL184)) или другие способы лечения рака предстательной железы (например, вакцины (сипулеуль-T (Provenge®), GVAX и т.д.), травяной (PC-SPES) и ингибиторы лиазы (абиратерон)), о чем свидетельствует увеличение или более высокие уровни сывороточного антигена простаты (PSA), метастазы, метастазы в кости, боль, вовлечение лимфатических узлов, увеличение размеров или маркеров сыворотки для роста опухоли, ухудшение диагностических маркеров прогнозирования или состояние пациента.
В одном варианте реализации изобретения кастрационно-резистентный рак предстательной железы определяется как не имеющий предшествующей гормональной терапии рак предстательной железы.
Многие ранние раковые заболевания предстательной железы требуют андрогенов для роста, но прогрессирующие раковые заболевания предстательной железы в некоторых вариантах реализации изобретения представляют собой андроген-независимые или не имеющие предшествующей гормональной терапии. В одном варианте реализации изобретения у мужчин с кастрационно-резистентным раком предстательной железы опухолевые клетки могут иметь способность расти в отсутствие андрогенов (гормонов, которые способствуют развитию и поддержанию мужских половых характеристик).
В одном варианте реализации изобретения термин «терапия андрогенной депривации» (ADT) или «традиционная терапия андрогенной депривации» направлена на орхидэктомию (хирургическую кастрацию), при которой хирург удаляет яички. В другом варианте реализации изобретения термин «терапия андрогенной депривации» или «традиционная терапия андрогенной депривации» направлена на введение аналогов лютеинизирующего гормона-высвобождающего гормона (LHRH): эти препараты снижают количество тестостерона, полученного яичками. Примерами аналогов LHRH, доступных в Соединенных Штатах, являются лейпролид (Lupron®, Viadur®, Eligard®), госерелин (Zoladex®), трипторелин (Trelstar®) и гистрелин (Vantas®). В другом варианте реализации изобретения термин «терапия андрогенной депривации» или «традиционная терапия андрогенной депривации» направлена на введение антиандрогенов: антиандрогены блокируют способность организма использовать любые андрогены. Даже после орхидэктомии или во время лечения аналогами LHRH небольшое количество андрогенов все еще производится надпочечниками. Примеры антиандрогенных препаратов включают энзалутамид (Xtandi®), флутамид (Eulexin®), бикалютамид (Casodex®) и нилутамид (Nilandron®). В другом варианте реализации изобретения термин «терапия андрогенной депривации» или «традиционная терапия андрогенной депривации» направлена на введение антагонистов лютеинизирующего гормона-высвобождающего гормона (LHRH), таких как абареликс (Plenaxis ®) или дегареликс (Firmagon®) (одобрен для использования FDA в 2008 году для лечения прогрессирующего рака предстательной железы). В другом варианте реализации изобретения термин «терапия андрогенной депривации» или «традиционная терапия андрогенной депривации» направлена на введение ингибиторов 5α-редуктазы, таких как финастерид (Proscar®) и дутастерид (Avodart®): ингибиторы 5α-редуктазы блокируют способность организма превращать тестостерон в более активный андроген, 5α-дигидротестостерон (DHT). В другом варианте реализации изобретения термин «терапия андрогенной депривации» или «традиционная терапия андрогенной депривации» направлена на введение ингибиторов биосинтеза тестостерона, таких как кетоконазол (Nizoral®). В другом варианте реализации изобретения термин «терапия андрогенной депривации» или «традиционная терапия андрогенной депривации» направлена на введение эстрогенов, таких как диэтилстильбестрол, этинилэстрадиол, капесарис или 17β-эстрадиол. В другом варианте реализации изобретения термин «терапия андрогенной депривации» или «традиционная терапия андрогенной депривации» направлена на введение ингибиторов 17α-гидроксилазы/C17,20 лиазы (CYP17A1), таких как абиратор (Zytiga®).
В одном варианте реализации изобретения данное изобретение предусматривает способ лечения, подавления, уменьшение частоты взоникновения заболеваний, снижения тяжести, увеличения выживаемости или ингибирования антиандроген-резистентного рака предстательной железы. В другом варианте реализации изобретения антиандроген представляет собой бикалютамид, гидроксифлутамид, флутамид или энзалутамид.
В одном варианте реализации изобретения данное изобретение предусматривает способ лечения, подавления, уменьшения частоты возникновения заболеваний, снижения тяжести, увеличения выживаемости или ингибирования устойчивости к абаратерону рака предстательной железы.
В одном варианте реализации изобретения термины «лечить» или «лечение» включают профилактическое, а также ремиттирующее лечение расстройства. Термины «сокращение», «подавление» и «ингибирование» имеют общепринятое значение уменьшения или убывания, в другом варианте реализации изобретения, или задержки, в другом варианте реализации изобретения, или сокращение, в другом варианте реализации изобретения, частоты, тяжести или патогенеза заболевания, нарушения или состояния. В варианте осуществления термин «лечение» относится к задержке прогрессирования, длительной ремиссии, сокращения заболеваемости или ослаблению симптомов, связанных с заболеванием, расстройством или состоянием. В одном варианте реализации изобретения термины «лечение» «снижение», «подавление» или «ингибирование» относятся к снижению заболеваемости, смертности или их комбинации в сочетании с указанным заболеванием, расстройством или состоянием. В одном варианте реализации изобретения термин «прогрессирование» относится к увеличению масштабов или степени тяжести, продвижению, росту или ухудшению. Термин «повторение» означает, в другом варианте реализации изобретения, возвращение заболевания после ремиссии. В одном варианте реализации изобретения способы лечения по изобретению сокращают тяжесть заболевания или, в другом варианте реализации изобретения, симптомы, связанные с этим заболеванием, или, в другом варианте реализации изобретения, сокращают уровни биомаркеров, выраженных во время болезни.
Атрофия мышц (MA) характеризуется потерей или сокращением мышечной массы и уменьшением мышечной массы. Например, пост-полио MA - это мышечное истощение, которое происходит как часть постполиотического синдрома (PPS). Атрофия включает слабость, усталость мышц и боль.
Другим типом МА является Х-связанная спинномозговая мышечная атрофия (SBMA - также известная как болезнь Кеннеди). Эта болезнь возникает из-за дефекта гена андрогенного рецептора на Х-хромосоме, затрагивает только мужчин, и ее начало происходит от позднего подросткового возраста до взрослой жизни. Проксимальная конечность и слабость мышц бульбара в некоторых случаях приводят к физическим ограничениям, включая зависимость от инвалидной коляски. Мутация приводит к расширению полиглутаминового тракта в N-концевом домене андрогенного рецептора (polyQ AR). Связывание и активация polyQ AR эндогенными андрогенами (тестостерон и DHT) приводит к разворачиванию и ядерной транслокации мутантного андрогенного рецептора. Эти шаги необходимы для патогенеза и приводят к частичной потере функции трансактивации (то есть нечувствительности к андрогенам) и плохо понимаемой нейромышечной дегенерации. В настоящее время нет лечения, модифицирующего болезнь, а скорее только лечение, направленное на симптомы. Усилия по нацеливанию polyQ AR как проксимального медиатора токсичности путем использования клеточного оборудования для содействия его деградации обещают терапевтическое изобретение. Селективные деградирующие рецепторы андрогенов, такие как описанные в настоящем документе, связывают и деградируют различные рецепторы андрогенов (полной длины, варианта сплайсинга, мутанты с антиандрогенной устойчивостью и т.д.), что указывает на то, что они являются перспективными для лечения SBMA. Это мнение подтверждается наблюдением, что периферическая анти-смысловая терапия polyQ AR избавляет в мышиных моделях от болезни SBMA (Cell Reports 7, 774-784, May 8, 2014).
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменишения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования болезни Кеннеди, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137, или 200-205.
Используемый в данном документе термин «связанные с андрогенным рецептором состояния» или «чувствительные к андрогену заболевания или расстройства» представляет собой состояния, заболевания или нарушения, которые модулируются или патогенез которых зависит от активности рецептора андрогена. Андрогенный рецептор выражен в большинстве тканей организма, однако он сверхэкспрессируется в, между прочим, предстательной железе и коже. ADT является основой лечения рака предстательной железы в течение многих лет, а SARD также может быть полезен при лечении различных раковых заболеваний предстательной железы, доброкачественной гипертрофии предстательной железы, простамегалии и других заболеваний предстательной железы.
В одном варианте реализации изобретения настоящее изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования доброкачественной гипертрофии предстательной железы, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137, или 200-205.
В одном варианте реализации изобретения настоящее изобретение относится к способу лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования простамегали, включающему введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137, или 200-205.
В одном варианте реализации изобретения настоящее изобретение относится к способу лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования гиперпролиферативных предстательных заболеваний и заболеваний, включающих введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137, или 200-205.
Эффект АR на коже проявляется в гендерных диморфизмах и связанных с половым созреванием дерматологических проблемах, характерных для подростков и молодых взрослых. Гиперандрогенизм полового созревания стимулирует рост терминальных волос, производство кожного сала и предрасполагает подростков мужского пола к угрям, юношеским угрям, себорее, избыточному кожному салу, гидрадениту, суппуративу, гирсутизму, гипертрихозу, сверхволосатости, андрогенной алопеции, облысению по мужскому типу и другим дерматологическим заболеваниям. Хотя антиандрогены теоретически должны предотвращать обсуждаемые гиперандрогенные дерматологические заболевания, они ограничены токсичностью, половыми побочными эффектами и отсутствием эффективности при местном применении. SARD по данному изобретению эффективно ингибируют лиганд-зависимую и лиганд-независимую активацию АР и имеют короткие биологические периоды полураспада в сыворотке, что указывает на то, что местно сформулированные SARD по данному изобретению могут быть применены к участкам, затронутыми угрями, себорейным дерматитом и/или гирсутизм без риска системных побочных эффектов.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования акне, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования угревой болезни, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования себореи, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования себорейного дерматита, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования гидраденита суппоратива, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования избыточного оволосения, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования гипертрихоза, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования сверхволосатости, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования алопеции, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения соединения, описанные в данном документе и/или композиции, могут быть использованы для применения в или лечении выпадения волос, алопеции, андрогенной алопеции, алопеции ареата, вторичной алопеции по отношению к химиотерапии, вторичной алопеции по отношению к лучевой терапии, облысения, алопеции, вызванной рубцеванием или алопеции, вызванной стрессом. В одном варианте реализации изобретения «выпадение волос» или «алопеция» относится к облысению как к общему типу облысения по мужскому типу. Облысение обычно начинается с выпадения волос клочками на волосистой части головы и иногда прогрессирует до полного облысения и даже потери волос на теле. Выпадение волос поражает как мужчин, так и женщин.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования андрогенной алопеции, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
SARD по данному изобретению могут также быть полезны при лечении гормональных состояний у женщин, таких как преждевременное половое созревание, раннее половое созревание, дисменорея, аменорея, синдром многоклеточной матки, эндометриоз, гистериомиома, аномальное маточное кровотечение, раннее менархе, фиброзно-кистозная болезнь молочной железы, фибромы матки, кисты яичников, синдром поликистозных яичников, преэклампсия, эклампсия беременности, преждевременные роды, предменструальный синдром и сухость влагалища. В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования любых гиперандрогенных заболеваний (например, синдром поликистоза яичников (PCOS)), включающий введение терапевтически эффективного количества соединения формулы I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137, или 200-205.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования преждевременного полового созревания или раннего полового созревания, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования дисменореи или аменореи, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования синдрома многокамерной матки, эндометриоза, миомы матки или аномального маточного кровотечения, включающего введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137, или200-205.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования фиброзно-кистозного заболевания молочной железы, фибромы матки, кисты яичника или синдрома поликистоза яичников, включающих введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования преэклампсии, эклампсии беременности, преждевременных родов, предменструального синдрома или сухости влагалища, включающий введение терапевтически эффективного количества соединение формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
SARD по настоящему изобретению также могут найти полезность в лечении сексуальных извращений, гиперсексуальности, парафилий, андрогенного психоза, вирилизации, синдромов андрогенной нечувствительности (AIS), таких как полная AIS (CAIS) и частичная AIS (PAIS), и улучшение овуляции у животного. В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования сексуальных извращений, гиперсексуальности или парафилий, включающих введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования андрогенного психоза, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования вирилизации, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования синдромов андрогенной нечувствительности, включающих введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205. В одном варианте реализации изобретения синдром андрогенной нечувствительности представляет собой синдром полной андрогенной нечувствительности. В другом варианте реализации изобретения синдром андрогенной нечувствительности представляет собой синдром частичной андрогенной нечувствительности.
В одном варианте реализации изобретения данное изобретение направлено на способ увеличения, модуляции или улучшения овуляции у животного, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
SARD по данному изобретени. могут также быть полезными для лечения гормонозависимых видов рака, таких как рак предстательной железы, рак молочной железы, рак яичек, рак яичников и урогенитальный рак и т.д. Кроме того, местное или системное введение SARD может быть полезным для лечения предшественников гормонозависимых видов рака, таких как интраэпителиальная неоплазия предстательной железы (PIN) и атипичная малая ацинарная пролиферация (ASAP).
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования связанных с АР массивных опухолей. В другом варианте реализации изобретения опухоль представляет собой гепатоцеллюлярную карциному. В другом варианте реализации изобретения опухоль представляет собой рак мочевого пузыря. Тестостерон в сыворотке может быть положительно связан с развитием HCC. Исходя из эпидемиологических, экспериментальных наблюдений и, в частности, того факта, что у мужчин значительно выше риск развития рака мочевого пузыря, чем у женщин, андрогены и/или АР также играют роль в инициировании рака мочевого пузыря.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования рака молочной железы, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования рака яичка, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования рака матки, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования рака яичников, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования урогенитального рака, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования предшественников рака предстательной железы, включающий местное или системное введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205. В одном варианте реализации изобретения предшественник рака предстательной железы представляет собой простатическую интраэпителиальную неоплазия (PIN). В другом варианте реализации изобретения предшественник рака предстательной железы представляет собой атипичную малую ацинарную пролиферация (ASAP).
SARD по настоящему изобретению можгут также быть полезными для лечения других злокачественных опухолей, содержащих АR, таких как опухоль молочной железы, мозга, кожи, яичника, мочевого пузыря, лимфомы, печени, почек, поджелудочной железы, эндометрия, легкого (например, NSCLC), перианальной аденомы, остеосаркома, ЦНС, меланома и т.д.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования рака мозга, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования рака кожи, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования рака яичников, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования рака мочевого пузыря, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования лимфомы, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования рака печени, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования рака почки, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования остеосаркомы, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования рака поджелудочной железы, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205. В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования рака эндометрия, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования рака легких, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения рак легких представляет собой немелкоклеточный рак легких (NSCLC).
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования рака центральной нервной системы, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования рака толстой кишки, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования меланомы, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования амиотрофического бокового склероза (ALS) у субъекта, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения данное изобретение направлено на способ лечения, подавления, уменьшения частоты возникновения заболевания, снижения тяжести или ингибирования прогрессирования миомы матки у субъекта, включающий введение терапевтически эффективного количества соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения данное изобретение предусматривает способ лечения субъекта, страдающего от раны или уменьшения частоты возникновения заболевания, или ослабления тяжести или усиления или ускорения заживления раны у субъекта, способ включает введение указанному субъекту терапевтически эффективного количества соединение формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения данное изобретение предусматривает способ лечения субъекта, страдающего от ожога или уменьшения частоты возникновения заболевания, или уменьшения тяжести или усиления или ускорения заживления ожога у субъекта, способ включает введение указанному субъекту терапевтически эффективного количества соединение формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, гидрата или любой их комбинации. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205. Раны и/или язвы обычно обнаруживаются как выступающие из кожи или на поверхность слизистой оболочки, или в результате инфаркта в органе. Рана может быть результатом дефекта мягкой ткани или поражения, или основного состояния. В одном варианте реализации изобретения термин «рана» означает телесное повреждение с нарушением нормальной целостности тканевых структур. Этот термин также предназначен для охвата терминов «боль», «поражение», «некроз» и «язва». В одном варианте реализации изобретения термин «боль» относится к любому поражению кожи или слизистых оболочек, а термин «язва» относится к местному дефекту или углублению в поверхности органа или ткани, который образуется при шелушении некротической ткани. Повреждение обычно относится к любому дефекту ткани. Некроз связан с мертвой тканью в результате инфекции, травмы, воспаления или инфарктов. Все они охватываются термином «рана», который обозначает любую рану на любой конкретной стадии процесса заживления, включая стадию до того, как началось какое-либо заживление или даже до того, как была сделана конкретная рана, например, хирургический разрез (профилактическое лечение).
Примерами ран, которые могут быть предотвращены и / или обработаны в соответствии с настоящим изобретением, являются, например, асептические раны, раны ушибов, резаные раны, рваные раны, не проникающие раны (например, раны, в которых нет разрушения кожи, но есть повреждение основных структур), открытые раны, проникающие раны, перфорирующие раны, проколотые раны, септические раны, подкожные раны и т.д. Примерами язв являются пролежни, язвенные стоматиты, кожные язвы, герпес, намин и т.д. Примерами язв являются, например, язвенная болезнь, язва двенадцатиперстной кишки, язва желудка, язва подагры, диабетическая язва, гипертоническая ишемическая язва, варикозная язва, трофические язвы (венозная язва), сублингвальная язва, субмукозная язва, симптоматическая язва, трофическая язва, тропическая язва, венерическая язва, например вызванная гонореей (включая уретрит, эндоцервицит и проктит). Условия, связанные с ранами или язвами, которые могут быть успешно обработаны в соответствии с изобретением, представляют собой ожоги, сибирская язва, столбняк, газовая гангрена, скарлатина, рожистое воспаление, сикоз обыкновенный, фолликулит, контагиозное импетиго или буллезное импетиго и т.д. Часто существует определенное совпадение между использованием терминов «рана» и «язва» и «рана» и «боль», и, кроме того, термины часто используются случайным образом. Поэтому, как упоминалось выше, в настоящем контексте термин «раны» охватывает термин «язва», «поражение», «боль» и «инфаркт», и термины используются без разбора, если не указано иное.
Виды ран, подлежащих обработке в соответствии с изобретением, включают также: i) общие раны, такие как, например, хирургические, травматические, инфекционные, ишемические, термические, химические и буллезные раны; ii) раны, специфичные для полости рта, такие как, например, постэкстракционные раны, эндодонтические раны, особенно связанные с лечением кист и абсцессов, язв и поражений бактериального, вирусного или аутоиммунологического происхождения, механических, химических, термических, инфекционных и лихеноидных ран; герпесных язв, афтоза стоматита, острого некротизирующего язвенного гингивита и синдрома жжения, являющиеся конкретными примерами; а также iii) раны на коже, такие как, например, новообразование, ожоги (например, химические, термические), поражения (бактериальные, вирусные, аутоиммунологические), укусы и хирургические разрезы. Другим способом классификации ран является: i) небольшие потери тканей из-за хирургических разрезов, незначительных ссадин и мелких укусов или ii) значительная потеря ткани. Последняя группа включает ишемические язвы, язвы под давлением, свищи, рваные раны, серьезные укусы, термические ожоги и раны донорского участка (в мягких и твердых тканях) и инфаркты.
В других аспектах изобретения рану, которая должна быть предотвращена и/или обработана, выбирается из группы, состоящей из асептических ран, инфарктов, контузионных ран, резаных ран, рванных ран, непроникающих ран, открытых ран, проникающих ран, перфорирующих ран, колотых ран, септических ран и подкожных ран.
Другие раны, которые имеют важное значение в связи с настоящим изобретением, представляют собой раны, такие как ишемические язвы, язвы под давлением, свищи, серьезные укусы, термические ожоги и раны донорского участка.
Ишемические язвы и язвы под давлением представляют собой раны, которые обычно заживают очень медленно, и особенно в таких случаях улучшение и более быстрое заживление, конечно, имеет большое значение для пациента. Кроме того, затраты, связанные с лечением пациентов, страдающих такими ранами, значительно снижаются, когда лечение улучшается и происходит быстрее.
Раны донорского участка представляют собой раны, которые, например, происходят в связи с удалением твердой ткани из одной части тела в другую часть тела, например, в связи с трансплантацией. Раны, возникающие в результате таких операций, очень болезненны, поэтому наиболее скорое заживление является самым ценным.
Термин «кожа» используется в очень широком смысле, охватывая эпидермальный слой кожи, и в тех случаях, когда поверхность кожи более или менее повреждена, также дермальный слой кожи. Помимо рогового слоя, эпидермальный слой кожи представляет собой внешний (эпителиальный) слой и более глубокий слой соединительной ткани кожи называется дермой.
Поскольку кожа является наиболее открытой частью тела, она особенно подвержена различным видам травм, таких как, например, разрывы, порезы, ссадины, ожоги и обморожения или травмы, возникающие в результате различных заболеваний. Кроме того, много кожи часто разрушается при авариях. Однако из-за важного барьера и физиологической функции кожи целостность кожи важна для благополучия человека и любое нарушение или разрыв представляет угрозу, которая должна быть встречена организмом, чтобы защитить его продолжение существования.
Помимо травм на коже, травмы могут также присутствовать во всех видах тканей (то есть в мягких и твердых тканях). Травмы на мягких тканях, включая слизистые оболочки и/или кожу, особенно актуальны в связи с настоящим изобретением.
Заживление раны на коже или на слизистой оболочке подвергается серии стадий, которые приводят либо к восстановлению или регенерации кожи, или слизистой оболочки. В последние годы регенерация и восстановление были отмечены как два типа заживления, которые могут возникнуть. Регенерация может быть определена как биологический процесс, в результате чего архитектура и функция утраченной ткани полностью обновляются. Восстановление, с другой стороны, является биологическим процессом, при котором непрерывность разрушенной ткани восстанавливается новыми тканями, которые не реплицируют структуру и функцию потеряных.
Большинство ран заживает через восстановление, что означает, что новая сформированная ткань является структурно и химически непохожей на исходную ткань (рубцовую ткань). На ранней стадии восстановления тканей одним из процессов, который почти всегда участвует, является образование переходной соединительной ткани в области повреждения ткани. Этот процесс начинается с образования новой внеклеточной коллагеновой матрицы фибробластами. Эта новая внеклеточная коллагеновая матрица является опорой соединительной ткани во время конечного процесса заживления. Конечным заживлением является, в большинстве тканей, образование рубцов, содержащих соединительную ткань. В тканях, которые обладают регенеративными свойствами, такими как, например, кожа и кость, конечное заживление включает регенерацию исходной ткани. Эта регенерированная ткань часто также имеет некоторые характеристики рубца, например, утолщение излеченного перелома кости.
В нормальных условиях тело обеспечивает механизмы для лечения поврежденной кожи или слизистой оболочки, чтобы восстановить целостность барьера кожи или слизистой оболочки. Процесс восстановления даже незначительных разрывов или ран может длиться от нескольких часов до нескольких недель. Однако, при язвообразовании, заживление может быть очень медленным и рана может сохраняться в течение длительного периода времени, то есть месяцев или даже лет.
Ожоги связаны с пониженным уровнем тестостерона, а гипогонадизм связан с задержкой заживления ран. В одном варианте реализации изобретения способы по настоящему изобретению обеспечивают лечение пациента, страдающего раной или ожогом, посредством введения SARD в соответствии с настоящим изобретением. В одном варианте реализации изобретения SARD способствует заживлению ожога или раны, или в другом варианте реализации изобретения участвует в процессе заживления ожога или раны, или в другом варианте реализации изобретения лечит вторичное осложнение ожога или раны.
В одном варианте реализации изобретения лечение ожогов или ран дополнительно включает использование дополнительных факторов роста, таких как фактор эпидермального роста (EGF), трансформирующий α-фактор роста (TGF-α), тромбоцитарный фактор роста (PDGF), фибробластовные факторы роста (FGF), включающий фактор роста кислых фибробластов (α-FGF) и фактор роста основных фибробластов (β-FGF), трансформирующий β-фактор роста (TGF-β) и инсулиноподобные факторы роста (IGF-1 и IGF-2), или любой их комбинации, которые являются промоторами заживления ран.
Заживление раны может быть измерено многими способами, известными в данной области техники, включая прочность растяжения раны, содержание гидроксипролин или коллагена, экспрессию проколлагена и повторную эпителизацию. В качестве примера, SARD, как описано в данном документе, вводится перорально или местно с дозой около 0.1-1 мг в день. Терапевтическая эффективность измеряется как эффективность в улучшении заживления ран. Усиленное заживление ран может быть измерено с помощью известных способов, таких как уменьшение времени заживления, увеличение плотности коллагена, увеличение гидроксипролина, уменьшение осложнений, увеличение прочности растяжения и увеличение клеточности рубцовой ткани.
В одном варианте реализации изобретения термин «лечение» и включенные его аспекты относится к введению субъекту с указанным заболеванием, расстройством или состоянием, или в некоторых вариантах реализации изобретения субъекту, предрасположенному к указанному заболеванию, расстройству или состоянию. Термин «предрасположенность» относится, в частности, к генетическому профилю или семейным отношениям, связанным с тенденцией или статистическим увеличением заболеваемости, тяжести и т.д. указанного заболевания. В некоторых вариантах реализиции термин «предрасположенность» следует рассматривать как относящийся, в частности, к образу жизни, который связан с повышенным риском указанного заболевания. В некоторых вариантах реализации изобретения термин «предрасположенность» следует рассматривать как относящийся, в частности, к наличию биомаркеров, которые связаны с указаным заболеванием, например, при раке, термин «предрасположенный к» раку может включать присутствие предраковых предшественников для указанного рака.
В некоторых вариантах реализации изобретения термин «снижение патогенеза» следует понимать, как охватывающий уменьшение повреждения ткани или повреждение органа, связанное с конкретным заболеванием, расстройством или состоянием. В другом варианте реализации изобретения термин «снижение патогенеза» следует понимать, как охватывающий уменьшение частоты возникновения заболевания или тяжести связанного с заболеванием, расстройством или состоянием заболевания, с учетом этого вопроса. В другом варианте реализации изобретения термин «снижение патогенеза» следует понимать как охватывающий уменьшение числа связанных заболеваний, расстройств или состояний с указанными или связанными с ними симптомами.
Фармацевтические композиции
В некоторых вариантах реализации изобретения настоящее изобретение относится к способам применения, которые включают введение композиции, содержащей описанные соединения. Используемый здесь термин «фармацевтическая композиция» означает «терапевтически эффективное количество» активного ингредиента, то есть соединения по настоящему изобретению, вместе с фармацевтически приемлемым носителем или разбавителем. Используемое здесь «терапевтически эффективное количество» относится к тому количеству, которое обеспечивает терапевтический эффект для данного состояния и режима введения.
Используемый здесь термин «введение» относится к приведению субъекта в контакт с соединением по настоящему изобретению. Как используется здесь, введение может быть осуществлено in vitro, то есть в пробирке или in vivo, то есть в клетках или тканях живых организмов, например, человека. В одном варианте реализации изобретения настоящее изобретение охватывает введение соединений по настоящему изобретению субъекту мужского пола. В одном варианте реализации изобретения настоящее изобретение охватывает введение соединений по настоящему изобретению субъекту женщинского пола.
Данное изобретение обеспечивает, в других вариантах реализации изобретения, фармацевтические продукты соединений, описанных в данном документе. Термин «фармацевтический продукт», в других вариантах реализации изобретения, относится к композиции, подходящей для фармацевтического применения (фармацевтическая композиция), например, как описано в данном документе.
Соединения по изобретению можно вводить отдельно или в качестве активного ингредиента препарата. Таким образом, настоящее изобретение также включает фармацевтические композиции соединений формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV, XV или его изомера, фармацевтически приемлемой соли, фармацевтического продукт, полиморфа, гидрата или любой их комбинации, содержащей, например, один или более фармацевтически приемлемых носителей.
Имеются многочисленные стандартные ссылки, которые описывают процедуры для приготовления различных композиций, подходящих для введения соединений согласно изобретению. Примеры потенциальных составов и препаратов содержатся, например, в Handbook of Pharmaceutical Excipients, American Pharmaceutical Association (текущее издание); Фармацевтические лекарственные формы: Tablets (Lieberman, Lachman and Schwartz, редакторы) текущее издание, опубликованное Marcel Dekker, Inc., а также Remington's Pharmaceutical Sciences (Arthur Osol, редактор), 1553-1593 (текущее издание).
Способ введения и лекарственная форма тесно связаны с терапевтическими количествами соединений или композиций, которые являются желательными и эффективными по данному применению для лечения.
Фармацевтические композиции, содержащие соединение по настоящему изобретению, могут вводиться субъекту любым способом, известным специалисту в данной области, таким как перорально, парентерально, внутрисосудисто, паракансерально, чрезслизисто, чрезкожно, внутримышечно, интраназально, внутривенно, внутрикожно, подкожно, сублингвально, внутрибрюшинно, интравентрикулярно, интракраниально, интравагинально, путем ингаляции, ректально, внутримышечно или любыми способами, в которых композиция может быть доставлена в ткань (например, иглу или катетер). Альтернативно, местное введение может быть желательным для применения на кожных, глазных или слизистых поверхностях. Другим способом введения является аспирация или аэрозольная композиция. Кроме того, в другом варианте реализации изобретения фармацевтические композиции могут вводиться местно на поверхности тела и, таким образом, составлены в форме, подходящей для местного введения. Подходящие актуальные составы включают гели, мази, кремы, лосьоны, капли и тому подобное. Для местного введения, соединения по настоящему изобретению или их физиологически переносимые производные, такие как соли, сложные эфиры, N-оксиды и тому подобное, получают и применяют в виде растворов, суспензий или эмульсий в физиологически приемлемом разбавителе с фармацевтическим носителем или без него.
Подходящие дозированные формы включают, но не ограничиваются ими, пероральное, ректальное, сублингвальное, слизистое, назальное, офтальмологическое, подкожное, внутримышечное, внутривенное, трансдермальное, спинальное, интратекальное, внутрисуставное, внутриартериальное, субарахиноидное, бронхиальное, лимфатическое и внутриматочное введение, и других дозированных форм для системной доставки активных ингредиентов. В некоторых применениях предпочтительными являются композиции, подходящие для перорального введения. В некоторых применениях предпочтительными являются композиции, подходящие для местного введения.
Местное введение: В типичном варианте реализации изобретения соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV или XV вводятся местно. Местное применение особенно подходит для гирсутизма, алопеции, угревой сыпи и избыточного кожного сала. Доза будет варьироваться, но в качестве общего руководства соединение будет присутствовать в дерматологически приемлемом носителе в количестве от около 0.01 до 50 мас.% и более типично от около 0.1 до 10 мас.%. Как правило, дерматологический препарат применяется к пораженному участку от 1 до 4 раз в день. «Дерматологически приемлемый» относится к носителю, который может быть нанесен на кожу или волосы, и который позволит лекарству диффундировать к месту действия. Более конкретно, это относится к участку, где ингибируется андрогенный рецептор или желательна деградация андрогенного рецептора.
В следующем варианте реализации изобретения соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV или XV используются местно для облегчения алопеции, особенно андрогенной алопеции. Андрогены оказывают глубокое влияние как на рост волос, так и на потерю волос. На большинстве участков тела, таких как борода и лобковая кожа, андрогены стимулируют рост волос, продлевая фазу роста цикла волос (анаген) и увеличивают размер фолликула. Рост волос на коже черепа не требует андрогенов, но, как ни парадоксально, андрогены необходимы для облысения на коже черепа у генетически предрасположенных людей (андрогенная алопеция), где наблюдается постепенное снижение продолжительности анагена и размера волосяного фолликула. Андрогенная алопеция также распространена у женщин, где она обычно представляет собой диффузную потерю волос, а не показывает паттерн, наблюдаемый у мужчин.
Хотя соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV или XV наиболее типично будет использоваться для облегчения андрогенной алопеции, изобретение не ограничивается этим конкретным состоянием. Соединеня формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV или XV могут быть использованы для облегчения любого типа алопеции. Примеры неандрогенной алопеции включают очаговую алопецию, алопецию из-за лучевой терапии или химиотерапии, рубцовую алопецию, алопецию, связанную со стрессом и т.д. Как используется в этом приложении, «алопеция» относится к частичному или полному выпадению волос на волосистой части головы.
Таким образом, соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV или XV могут применяться местно для кожи головы и волос, чтобы предотвратить или облегчить облысение. Кроме того, соединение формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV или XV могут применяться местно, чтобы стимулировать или способствовать росту, или отрастанию волос на волосистой части головы.
В следующем варианте реализации изобретения соединение формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV или XV применяется местно, чтобы предотвратить рост волос в областях, где такой рост волос нежелателен. Одним из таких способов использования будет облегчение избыточного оволосения. Избыточное оволовение представляет собой чрезмерный рост волос в областях, которые обычно не имеют волос (то есть женское лицо). Такой неуместный рост волос чаще встречается у женщин и часто наблюдается при менопаузе. Местное введение соединений формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV или XV облегчит это состояние, что приведет к уменьшению или устранению этого неуместного или нежелательного роста волос.
Соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV или XV могут также использоваться местно для уменьшения производства кожного сала. Кожное сало состоит из триглицеридов, эфиров воска, жирных кислот, сложных эфиров стерола и сквалена. Кожное сало образуется в ацинарных клетках сальных желез и накапливается по мере роста этих клеток. При созревании ацинарные клетки рузрушают, перенося кожное сало в просветный канал так, чтобы он мог откладываться на поверхность кожи.
У некоторых людей чрезмерное количество кожного сала секретируется на коже. Это может иметь ряд неблагоприятных последствий. Это может усугубить угревую сыпь, поскольку кожное сало является основным источником пищи для Propionibacterium acnes, возбудителя акне. Это может привести к тому, что кожа будет иметь жирный вид, который обычно считается косметически непривлекательным.
Образование кожного сала регулируется факторами роста и различными гормонами, включая андрогены. Клеточный и молекулярный механизм, с помощью которого андрогены оказывают свое влияние на сальную железу, не был полностью выяснен. Тем не менее, клинический опыт свидетельствует о влиянии андрогенов на производство кожного сала. Производство кожного сала значительно увеличивается во время полового созревания, когда уровни андрогенов являются самыми высокими. Таким образом, соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV или XV ингибируют секрецию кожного сала и таким образом уменьшают количество кожного сала на поверхности кожи. Соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV или XV моут быть использованы для лечения различных кожных заболеваний, таких как угри или себорейный дерматит.
Помимо лечения заболеваний, связанных с образованием избыточного кожного сала, соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV или XV также могут быть использованы для достижения косметического эффекта. Некоторые потребители считают, что они страдают от сверхактивных сальных желез. Они чувствуют, что их кожа жирная и, следовательно, непривлекательна. Эти индивидуумы могут использовать соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV или XV для уменьшения количества кожного сала на коже. Снижение секреции кожного сала облегчит жирную кожу в индивидуумов, пораженной такими состояниями.
Соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV или XV по настоящему изобретению обычно вводят местно. Используемый в данном документе термин «местное» относится к применению соединений формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV или XV (и дополнительный носитель) непосредственно на кожу и/или волосы. Местная композиция в соответствии с настоящим изобретением может быть в виде растворов, лосьонов, мазей, кремов, мазей, липосом, спреев, гелей, пены, роликовых палочек и любой другой композиции, обычно применяемой в дерматологии.
Таким образом, еще один вариант реализации изобретения относится к косметическим или фармацевтическим композициям, в частности дерматологическим композициям, которые содержат по меньшей мере одно из соединений, соответствующих формулам I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV или XV описанных выше. Такие дерматологические композиции будут содержать от 0.001 до 10% мас./мас.% соединений в смеси с дерматологически приемлемым носителем и более типично от 0.1 до 5 мас./мас. % соединений. Такие композиции обычно наносят от 1 до 4 раз в день. Внимание читателя обращено на Remington's Pharmaceutical Science, Edition 17, Mark Publishing Co., Easton, PA для обсуждения того, как подготовить такие рецептуры.
Композиции в соответствии с изобретением могут также состоять из твердых препаратов, составляющих очищающие мыла или пластины. Эти композиции получают в соответствии с обычными способами.
Соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV или XV также могут быть использованы для волос в виде водных, спиртовых или водно-спиртовых растворов, или в виде кремов, гелей, эмульсий или муссов или, альтернативно, в форме аэрозольных композиций, также содержащих пропеллент под давлением. Композиция в соответствии с изобретением может также представлять собой композицию для ухода за волосами и, в частности, шампунь, лосьон для волос, лечебный лосьон, крем для укладки или гель, красильную композицию, лосьон или гель для предотвращения выпадения волос и т.д. Количества различных составляющих в дерматологических композициях в соответствии с изобретением представляют собой те, которые обычно используются в рассматриваемых областях.
Лекарственное средство и косметические средства, содержащие соединения формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV или XV как правило, будут упакованы для розничной продажи (то есть изделия производства). Такие изделия будут помечены и упакованы таким образом, чтобы инструктировать пациента, как использовать продукт. Такие инструкции будут включать состояние, подлежащее лечению, продолжительность лечения, график дозирования и т.д.
Было показано, что антиандрогены, такие как финастерид или флутамид, снижают активность андрогенов или блокируют действие андрогена в коже до некоторой степени, но страдают от нежелательных системных эффектов. Альтернативным подходом является местное применение селективного разрушителя андрогенного рецептора (SARD) для пораженных участков. В одном варианте реализации изобретения такое соединение SARD проявляет сильное, но локальное ингибирование активности АР. В другом варианте реализации изобретения соединение SARD проявляет сильную, но локальную деградацию активности AR. В другом варианте реализации изобретения соединение SARD не будет проникать в системную циркуляцию субъекта. В другом варианте реализации изобретения соединение SARD быстро метаболизируется при попадании в кровь, что ограничивает системное воздействие.
Для приготовления таких фармацевтических лекарственных форм активный ингредиент можно смешивать с фармацевтическим носителем в соответствии с обычными способами фармацевтического смешивания. Носитель может принимать самые разнообразные формы в зависимости от формы препарата, желательной для введения.
Используемые здесь «фармацевтически приемлемые носители или разбавители» хорошо известны специалистам в данной области. Носитель или разбавитель может быть твердым носителем или разбавителем для твердых форм, жидким носителем или разбавителем для жидких композиций или их смесей.
Твердые носители/разбавители включают, но не ограничиваются ими, смолу, крахмал (например, кукурузный крахмал, прегелетанизированный крахмал), сахар (например, лактозу, маннит, сахарозу, декстрозу), целлюлозный материал (например, микрокристаллическую целлюлозу), акрилат (например, полиметилакрилата), карбоната кальция, оксида магния, талька или их смесь.
Пероральное или парентеральное введение: При приготовлении композиций в пероральной дозированной форме может быть использована любая из обычных фармацевтических сред. Таким образом, для жидких пероральных препаратов, таких как, например, суспензии, эликсиры и растворы, подходящие носители и добавки включают воду, гликоли, масла, спирты, ароматизаторы, консерванты, красители и тому подобное. Для твердых пероральных препаратов, таких как, например, порошки, капсулы и таблетки, подходящие носители и добавки включают крахмалы, сахара, разбавители, гранулирующие агенты, смазывающие вещества, связующие вещества, дезинтегрирующие агенты и тому подобное. Из-за их легкости при введении таблетки и капсулы представляют собой наиболее предпочтительную пероральную дозированную единичную форму. При желании таблетки могут быть покрыты сахаром или покрыты энтеросолюбильной оболочкой стандартными способами.
Для парентеральных композиций носитель обычно будет содержать стерильную воду, хотя могут быть включены другие ингредиенты, например, ингредиенты, которые способствуют растворимости или сохранению. Также могут быть приготовлены растворы для инъекций, и в этом случае могут быть использованы подходящие стабилизирующие агенты.
В некоторых применениях может быть выгодным использовать активный агент в «векторизованной» форме, такой как инкапсуляция активного агента в липосому или другую инкапсулирующую среду, или путем фиксации активного агента, например, путем ковалентного связывания, хелатирования или ассоциативной координации на подходящей биомолекуле, такой как те, которые выбраны из белков, липопротеинов, гликопротеинов и полисахаридов.
Способы лечения по настоящему изобретению с использованием композиций, подходящих для перорального введения, могут быть представлены в виде отдельных единиц, таких как капсулы, облатки, таблетки или лепешки, каждый из которых содержит заданное количество активного ингредиента в виде, например, порошок или гранулы. При необходимости, можно использовать суспензию в водном растворе или неводную жидкость, такую как сироп, эликсир, эмульсию или осадок.
Таблетка может быть изготовлена путем прессования или формования, или влажной грануляции, при необходимости с одним или более вспомогательными ингредиентами. Прессованные таблетки могут быть получены путем прессования в подходящей машине, причем активное соединение находится в свободно текучей форме, такой как порошок или гранулы, которые при необходимости смешиваются, например, с связующим веществом, разрыхлителем, смазкой, инертным разбавителем, поверхностно активным агентом или разгружающим агентом. Формованные таблетки, состоящие из смеси порошкообразного активного соединения с подходящим носителем, могут быть изготовлены путем формования в подходящей машине.
Сироп может быть получен путем добавления активного соединения к концентрированному водному раствору сахара, например, сахарозы, к которому также может быть добавлен любой вспомогательный ингредиент(ы). Такой вспомогательный ингредиент(ы) может включать ароматизаторы, подходящий консервант, агенты для замедления кристаллизации сахара и средства для повышения растворимости любого другого ингредиента, такого как полигидрокси спирт, например, глицерин или сорбитол.
Препараты, подходящие для парентерального введения, могут содержать стерильный водный препарат активного соединения, который предпочтительно является изотоническим с кровью реципиента (например, физиологическим солевым раствором). Такие составы могут включать суспендирующие агенты и загустители и липосомы или другие системы микрочастиц, которые предназначены для нацеливания на компоненты крови или одного или более органов. Препараты могут быть представлены в виде единичной дозы или в виде нескольких доз.
Парентеральное введение может включать любую подходящую форму системной доставки. Введение может быть, например, внутривенным, внутриартериальным, интратекальным, внутримышечным, подкожным, внутримышечным, внутрибрюшным (например, внутрибрюшинным) и т.д. и может осуществляться инфузионными насосами (внешними или имплантируемыми) или любыми другими соответствующими средствами, подходящими для желаемый способ введения.
Препараты для носа и других слизистых оболочек (например, ингаляционные формы) могут содержать очищенные водные растворы активных соединений с консервантами и изотоническими агентами. Такие композиции предпочтительно доводят до рН и изотонического состояния, совместимого с носовой или другой слизистой оболочкой. Альтернативно, они могут быть в виде тонкоизмельченных твердых порошков, суспендированных в газовом носителе. Такие композиции могут быть доставлены любыми подходящими средством или способом, например, с помощью распылителя, пульверизатора, дозирующего ингалятора или тому подобного.
Препараты для ректального введения могут быть представлены в виде суппозитория с подходящим носителем, таким как масло какао, гидрированные жиры или гидрированные жирные карбоновые кислоты.
Трансдермальные препараты могут быть получены путем включения активного агента в тиксотропный или желатиновый носитель, такой как целлюлозная среда, например, метилцеллюлоза или гидроксиэтилцеллюлоза, причем полученный препарат затем упаковывается в трансдермальное устройство, приспособленное для гарантированного кожного контакта с кожей пользователя.
В дополнение к указанным выше ингредиентам композиции по настоящему изобретению могут дополнительно включать один или несколько дополнительных ингредиентов, выбранных, например, из разбавителей, буферов, ароматизаторов, связующих веществ, разрыхлителей, поверхностно-активных агентов, загустителей, смазывающих веществ, консерванты (включая антиоксиданты) и тому подобное.
Композиции настоящего изобретения могут иметь немедленное высвобождение, замедленное высвобождение, отложенное высвобождение или любой другой профиль высвобождения, известный специалисту в данной области.
Следует понимать, что данное изобретение охватывает любой вариант осуществления соединения, как описано в данном документе, которое в некоторых вариантах относится к «соединению по настоящему изобретению».
Для введения млекопитающим и, особенно, людям ожидается, что врач определит фактическую дозу и продолжительность лечения, которая будет наиболее подходящей для индивидуума и может варьироваться в зависимости от возраста, веса и реакции конкретного человека.
В одном варианте реализации изобретения способы настоящего изобретения могут включать введение соединения по настоящему изобретению в различных дозах. В одном варианте реализации изобретения соединение по данному изобретению вводят в дозе 1-3000 мг в день. В дополнительном варианте реализации изобретения соединение по данному изобретению вводят в дозе 1-10 мг в день, 3-26 мг в день, 3-60 мг в день, 3-16 мг в день, 3-30 мг в день, 10-26 мг в день, 15-60 мг, 50-100 мг в день, 50-200 мг в день, 100-250 мг в день, 125-300 мг в день, 20-50 мг в день, 5-50 мг в день, 200-500 мг в день, 125-500 мг в день, 500-1000 мг в день, 200-1000 мг в день, 1000-2000 мг в день, 1000-3000 мг в день, 125-3000 мг в день, 2000-3000 мг в день, 300-1500 мг в день или 100-1000 мг в день. В одном варианте реализации изобретения соединение по данному изобретению вводят в дозе 25 мг в день. В одном варианте реализации изобретения соединение по данному изобретению вводят в дозе 40 мг в день. В одном варианте реализации изобретения соединение по данному изобретению вводят в дозе 50 мг в день. В одном варианте реализации изобретения соединение по данному изобретению вводят в дозе 67.5 мг в день. В одном варианте реализации изобретения соединение по данному изобретению вводят в дозе 75 мг в день. В одном варианте реализации изобретения соединение по данному изобретению вводят в дозе 80 мг в день. В одном варианте реализации изобретения соединение по данному изобретению вводят в дозе 100 мг в день. В одном варианте реализации изобретения соединение по данному изобретению вводят в дозе 125 мг в день. В одном варианте реализации изобретения соединение по данному изобретению вводят в дозе 250 мг в день. В одном варианте реализации изобретения соединение по данному изобретению вводят в дозе 300 мг в день. В одном варианте реализации изобретения соединение по данному изобретению вводят в дозе 500 мг в день. В одном варианте реализации изобретения соединение по данному изобретению вводят в дозе 600 мг в день. В одном варианте реализации изобретения соединение по данному изобретению вводят в дозе 1000 мг в день. В одном варианте реализации изобретения соединение по данному изобретению вводят в дозе 1500 мг в день. В одном варианте реализации изобретения соединение по данному изобретению вводят в дозе 2000 мг в день. В одном варианте реализации изобретения соединение по данному изобретению вводят в дозе 2500 мг в день. В одном варианте реализации изобретения соединение по данному изобретению вводят в дозе 3000 мг в день. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137, или 200-205.
В одном варианте реализации изобретения способы настоящего изобретения могут включать введение соединения по настоящему изобретению в различных дозах. В одном варианте реализации изобретения соединение по данному изобретению вводят в дозе 3 мг. В дополнительном варианте реализации изобретения соединение по данному изобретению вводят в дозе 10 мг, 30 мг, 40 мг, 50 мг, 80 мг, 100 мг, 120 мг, 125 мг, 200 мг, 250 мг, 300 мг, 450 мг, 500 мг, 600 мг, 900 мг, 1000 мг, 1500 мг, 2000 мг, 2500 мг или 3000 мг. В другом варианте реализации изобретения соединение представляет собой любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В одном варианте реализации изобретения способы настоящего изобретения могут включать введение соединения по настоящему изобретению в различных дозах. В одном варианте реализации изобретения соединение по данному изобретению вводят в дозе 0.1 мг/кг/день. В дополнительном варианте реализации изобретения соединение по данному изобретению вводят в дозировке между от 0.2 до 30 мг/кг/день, или 0.2 мг/кг/день, 0.3 мг/кг/день, 1 мг/кг/день, 3 мг/кг/день, 5 мг/кг/день, 10 мг/кг/день, 20 мг/кг/день, 30 мг/кг/день, 50 мг/кг/день или 100 мг/кг/день.
В одном варианте реализации изобретения способы настоящего изобретения обеспечивают применение фармацевтической композиции, содержащей соединение формул I-VIII, IXa-IXd, X, XIa-XId, XII, XIIIa-XIIId, XIV или XV или любое из соединений 11-27, 30-42, 11R, 70-75, 80, 90-93, 100-115, 130-137 или 200-205.
В определенном варианте реализации изобретения фармацевтическая композиция представляет собой твердую лекарственную форму. В другом варианте реализации изобретения фармацевтическая композиция представляет собой таблетку. В другом варианте реализации изобретения фармацевтическая композиция представляет собой карсулу. В другом варианте реализации изобретения фармацевтическая композиция представляет собой раствор. В другом варианте реализации изобретения фармацевтическая композиция представляет собой трансдермальный пластырь.
В одном варианте реализации изобретения использование соединения по настоящему изобретению или композиции, содержащей его, будет иметь полезность в ингибировании, подавлении, усилении или стимулировании желаемого ответа у субъекта, как будет понятно специалисту в данной области. В другом варианте реализации изобретения композиции могут дополнительно содержать дополнительные активные ингредиенты, активность которых полезна для конкретного применения, для которого вводится соединение по настоящему изобретению.
Для введения млекопитающим и, особенно, людям ожидается, что врач определит фактическую дозу и продолжительность лечения, которая будет наиболее подходящей для индивидуума и может варьироваться в зависимости от возраста, веса, генетики и/или ответа конкретного человека.
В некоторых вариантах реализации изобретения любая из композиций по настоящему изобретению будет содержать соединение по настоящему изобретению в любой форме или варианте реализации изобретения, как описано в данном документе. В некоторых вариантах реализации изобретения любая из композиций данного изобретения будет состоять из соединения по настоящему изобретению в любой форме или варианте реализации изобретения, как описано в данном документе. В некоторых вариантах реализации композиций по настоящему изобретению будет состоять в основном из соединения по настоящему изобретению в любой форме или варианте реализации изобретения, как описано в данном документе. В некоторых вариантах реализации изобретения термин «включает» относится к включению указанного активного агента, такого как соединение по настоящему изобретению, а также к включению других активных агентов и фармацевтически приемлемых носителей, эксципиентов, смягчающих средств, стабилизаторов и т.д., как известно в фармацевтической промышленности. В некоторых вариантах реализации изобретения термин «состоящий в основном из» относится к композиции, единственным активным ингредиентом которой является указанный активный ингредиент, однако могут быть включены другие соединения, которые предназначены для стабилизации, сохранения и т.д. состава, но не связаны непосредственно с терапевтическим эффектом указанного активного ингредиента. В некоторых вариантах реализации изобретения термин «состоящий в основном из» может относиться к компонентам, которые облегчают высвобождение активного ингредиента. В некоторых вариантах реализации изобретения ермин «состоящий» относится к композиции, которая содержит активный ингредиент и фармацевтически приемлемый носитель или эксципиент.
Следует понимать, что любое использование любого из соединений, описанных в данном документе, может быть использовано для лечения любого заболевания, расстройства или состояния, как описано в данном документе, и представляет собой вариант реализации настоящего изобретения. В одном варианте реализации изобретения соединения представляют собой свободное основание, свободную кислоту, незаряженное или некомплексное соединение.
Следующие примеры представлены для более полной иллюстрации предпочтительных вариантов реализации изобретения. Однако они никоим образом не должны истолковываться как ограничивающие широкий объем изобретения.
ПРИМЕРЫ
ПРИМЕР 1
Синтез Индол/Пирроло-пиридиновых соединений SARD по данному изобретению


Схема 1.
(2R)-1-Метакрилоилпирролидин -2-карбоновая кислота(2).
D-Пролин (14.93 г, 0.13 моль) растворяли в 71 мл of 2 н NaOH и охлаждали на ледяной бане. Полученный щелочной раствор разбавляли ацетоном (71 мл). Ацетоновый раствор (71 мл) метакрилоил хлорида (13.56 г, 0.13 моль) и раствор 2 н NaOH (71 мл) одновременно добавляли в течение 40 минут к водному раствору D-пролина на ледяной бане. Температуру смеси поддерживали при 10-11°С во время добавления метакрилоил хлорида. После перемешивания (3 ч, комнатная температура (RT)) смесь выпаривали в вакууме при температуре 35-45°С для удаления ацетон. Полученный раствор промывали этиловым эфиром и подкисляли до рН 2 концентрированной HCl. Кислую смесь насыщали NaCl и экстрагировали EtOAc (100 мл × 3). Объединенные экстракты сушили над Na2SO4, фильтровали через Celite® и выпаривали в вакууме, получая неочищенный продукт в виде бесцветного масла. Перекристаллизация масла из этилового эфира и гексана давала 16.2 г (68%) целевого соединения в виде бесцветных кристаллов: т. пл. 102.1-103.4°C (Marhefka, C.A.; Moore, B.M., 2nd; Bishop, T.C.; Kirkovsky, L.; Mukherjee, A.; Dalton, J.T.; Miller, D.D. Гомологичное моделирование с использованием моделирования множественной молекулярной динамики и докинговых исследований лиганд связанного андрогенного рецептора человека области связавания с тестостероном и нестероидными лигандами. J Med Chem 2001, 44, 1729-40: т. пл. 102.5-103.5°C); спектр ЯМР этого соединения продемонстрировал существование двух ротамеров указанного в заголовке соединения. 1H ЯМР (300 MHz, ДМСО-d6) δ 5.28 (с) и 5.15 (с) для первого ротамера, 5.15 (с) и 5.03 (с) для второго ротамера (в итоге 2H для двух ротамеров, винил CH2), 4.48-4.44 для первого ротамера, 4.24-4.20 (м) для второго ротамера (в итоге 1H для двух ротамеров, CH в хиральном центре), 3.57-3.38 (м, 2H, CH2), 2.27-2.12 (1H, CH), 1.97-1.72 (м, 6H, CH2, CH, Me); 13C ЯМР (75 МГц, ДМСО-d6) δ для мажорного ротамера 173.3, 169.1, 140.9, 116.4, 58.3, 48.7, 28.9, 24.7, 19.5: для минорного ротамера 174.0, 170.0, 141.6, 115.2, 60.3, 45.9, 31.0, 22.3, 19.7; ИК (KBr) 3437 (OH), 1737 (C=O), 1647 (CO, COOH), 1584, 1508, 1459, 1369, 1348, 1178 см-1; [α]D26 +80.8° (c = 1, MeOH); Aнал. вычислено для C9H13NO3: C 59.00, H 7.15, N 7.65. Найдено: C 59.13, H 7.19, N 7.61.
(3R,8aR)-3-Бромметил-3-метил-тетрагидро-пирроло[2,1-c][1,4]оксазин-1,4-дион (3).
Раствор NBS (23.5 г, 0.132 моль) в 100 мл ДМФА добавляли по каплям к перемешиваемому раствору (2R)-1-метакрилоилпирролидин-2-карбоновой кислоти (2) (16.1 г, 88 ммоль) в 70 мл ДМФА под аргоном при RT, и полученную смесь перелешивали в течение 3 дней. Растворитель удаляли in vacuo и осаждали желтое твердое вещество. Твердое вещество суспендировали в воде, перемешивали в течение ночи при RT, фильтровали и сушили с получением 18.6 г (81%) (меньший вес при высушивании ~ 34%) названного бромлактона (3) в виде желтого твердого вещества: т. пл. 158.1-160.3°C; 1H ЯМР (300 МГц, ДМСО-d6) δ 4.69 (дд, J = 9.6 Гц, J = 6.7 Гц, 1H, CH в хиральном центре), 4.02 (д, J = 11.4 Гц, 1H, CHHa), 3.86 (д, J = 11.4 Гц, 1H, CHHb), 3.53-3.24 (м, 4H, CH2), 2.30-2.20 (м, 1H, CH), 2.04-1.72 (м, 3H, CH2 и CH), 1.56 (с, 2H, Me); 13C ЯМР (75 МГц, ДМСО-d6) δ 167.3, 163.1, 83.9, 57.2, 45.4, 37.8, 29.0, 22.9, 21.6; ИК (KBr) 3474, 1745 (C=O), 1687 (C=O), 1448, 1377, 1360, 1308, 1227, 1159, 1062 см-1; [α]D26 +124.5° (c = 1.3, хлороформ); Aнал. вычислено для C9H12BrNO3: C 41.24, H 4.61, N 5.34. Найдено: C 41.46, H 4.64, N 5.32.
(2R)-3-Бром-2-гидрокси-2-метилпропановой кислоты (4).
Смесь бромлактона (3) (18.5 г, 71 ммоль) в 300 мл 24% HBr нагревали с обратным холодильником в течение1 ч. Полученный раствор разбавляли соляным раствором (200 мл) и экстрагировали этилацетатом (100 мл × 4). Объединенные экстракты промывали насыщенным NaHCO3 (100 мл × 4). Водный раствор подкисляли концентрированной HCl до pH = 1, которую, в свою очередь, экстрагировали этилацетатом (100 мл × 4). Объединенный органический раствор сушили над Na2SO4, фильтровали через Celite®, и упаривали in vacuo до суха. Перекристаллизация из толуола давала 10.2 г (86%) желаемого соединения в виде бесцветных кристаллов: т. пл. 110.3-113.8°C; 1H ЯМР (300 МГц, ДМСО-d6) δ 3.63 (д, J = 10.1 Гц, 1H, CHHa), 3.52 (д, J = 10.1 Гц, 1H, CHHb), 1.35 (с, 3H, Me); ИК (KBr) 3434 (OH), 3300-2500 (COOH), 1730 (C=O), 1449, 1421, 1380, 1292, 1193, 1085 см-1; [α]D26 +10.5° (c = 2.6, MeOH); Aнал. вычислено для C4H7BrO3: C 26.25, H 3.86. Найдено: C 26.28, H 3.75.
(2R)-3-Бром-N-[4-циано-3-(трифторметил)фенил]-2-гидрокси-2-метилпропанамид (8).
Тионил хлорид (46.02 г, 0.39 моль) добавляли по каплям к охлажденному раствору (мешьще, чем 4°C) (R)-3-бром-2-гидрокси-2-метилпропановой кислоты (4) (51.13 г, 0.28 моль) в 300 мл ТГФ в атмосфере аргона. Полученную смесь перемешивали в течение 3 ч в тех же условиях. К этому добавляли Et3N (39.14 г, 0.39 моль) и перемешивали в течение 20 мин в тех же условиях. После 20 мин, 5-амино-2-цианобензотрифторид (40.0 г, 0.21 моль), 400 мл ТГФ добавляли и потом смесь оставляли перемешиваться в течение ночи при RT. Растворитель удаляли при пониженном давлении с получением твердого вещества, которое обрабатывали с 300 мл H2O, экстрагировали с EtOAc (2 × 400 мл). Объединенные органические экстракты промывали насыщенным раствором NaHCO3 (2 × 300 мл) и соляным раствором (300 мл). Органический слой сушили над MgSO4 и концентрировали при пониженном давлении с получением твердого вещества, которое очищали колоночной хроматографии с использованием CH2Cl2/EtOAc (80:20) с получением твердого вещества. Это твердое вещество перекристаллизовывали из CH2Cl2/гексан с получением 55.8 г (73.9%) (2R)-3-бром-N-[4-циано-3-(трифторметил)фенил]-2-гидрокси-2-метилпропанамида (8) в виде светло-желтого твердого вещества. Т пл. 134.0-136.5°C; 1H ЯМР (CDCl3/ТМС) δ 1.66 (с, 3H, CH3), 3.11 (с, 1H, OH), 3.63 (д, J = 10.8 Гц, 1H, CH2), 4.05 (д, J = 10.8 Гц, 1H, CH2), 7.85 (д, J = 8.4 Гц, 1H, ArH), 7.99 (дд, J = 2.1, 8.4 Гц, 1H, ArH), 8.12 (д, J = 2.1 Гц, 1H, ArH), 9.04 (уш с, 1H, NH). Вычисленная масса: 349.99, [M-H]- 349.0.
Структуры соединений, синтезированных с различными заместителями: (R)- или (с)-N-(4-циано-3-(трифторметил)-фенил)-3-(замещенный-1H-индол-1-ил)-2-гидрокси-2-метилпропанамиды (11-27, 11R, 30-32, и 80).
Соединения 11-27, 11R, 30-32, и 80 были получены с помощью общих процедур, как показано на Схеме 1 или Схеме 2, или Примере 2. 11R был синтезирован теми же способами, что и другие соединения, но с использованием L-пролин вместо D-пролина в качестве исходного материала. Кроме того, 19 был изолирован от синтетического продукта 11 в качестве побочного продукта.

Общая синтетическая процедура соединений 11-27, 11R, 30-32, и 80.
Стадия 1. Получение (s)-N-(4-циано-3-(трифторметил)фенил)-2-метилоксиран-2-карбоксамида (10) в ТГФ: Смесь гидроксилбромид 8 (1.0 г, 2.84 ммоль) и карбонат калия (790 мг, 5.70 ммоль) в 60 мл ацетона нагревали с обратным холодильником в течение 30 мин. После полной конверсии исходного бромида 8 в желаемый эпоксид 10, которe. контролировали с помощью ТСХ, растворитель выпаривали при пониженном давлении с получением желтоватого осадка, который выливали в 20 мл безводного EtOAc. Раствор фильтровали через слой Celite® для удаления ос1татка K2CO3 и конденсировали при пониженном давлении с получением желтоватого твердого вещества эпоксида 10, которое растворяли в 5 мл безводного ТГФ для получения раствора эпоксида 10 в ТГФ. Полученный раствор непосредственно использовали в качестве следующего реагента без анализа.
Стадия 2. NaH 60% дисперсию в минеральном масле (228 мг, 5.7 ммоль) добавляли в 30 мл безводного растворителя ТГФ в 100 mL сухую двухгорлую круглодонную колбу, снабженную капельной воронкой и замещенный индол/пиррол-пиридин (2.84 ммоль) добавляли к раствору в атмосфере аргона в водно-ледяной бане и полученный раствор перемешивали в течение 30 мин в водно-ледяной бане. В колбу добавляли готовый раствор эпоксида 10 (2.84 ммоль в ТГФ) через капельную воронку в атмосфере аргона на водно-ледяной бане и перемешивали в течение ночи при RT. После добавления1 мл H2O (1н HCl в случае соединения 15), реакционную смесь конденсировали при пониженном давлении и затем диспергировали в 50 мл EtOAc, мыли с 50 мл (× 2) воды, соляного раствора, сушили на безводным MgSO4, и упаривали досуха. Смесь очищали колоночной флэш-хроматографией в качестве элюента EtOAc/гексан, а затем конденсированные соединения перекристаллизовывали в EtOAc/гексан, получая любой из целевых продуктов 11-27, 11R, 30-32 и 80.
(s)-N-(4-Циано-3-(трифторметил)фенил)-3-(5-фтор-1H-индол-1-ил)-2-гидрокси-2-метилпропанамид (11): Выход 68%; Белое твердое вещество. МС (ИЭР): 404.0 [M-H]-; 428.2 [M+Na]+; т. пл. 147.5-148.9°C; 1H ЯМР (CDCl3, 400 МГц) δ 8.77 (уш с, 1H, NH), 7.90 (д, J = 1.7 Гц, 1H), 7.78-7.76 (м, 2H), 7.38 (дд, J = 9.0, 4.2 Гц, 1H), 7.23 (дд, J = 9.3, 2.5 Гц, 1H), 7.19 (д, J = 3.2 Гц, 1H), 6.98 (дт, J = 9.0, 2.5 Гц, 1H), 6.50 (д, J = 3.2 Гц, 1H), 4.62 (д, J = 14.8 Гц, 1H), 4.38 (д, J = 14.8 Гц, 1H), 2.49 (уш с, 1H, OH), 1.61 (с, 3H).
(s)-N-(4-Циано-3-(трифторметил)фенил)-2-гидрокси-2-метил-3-(4-нитро-1H-индол-1-ил)пропанамид (12): Выход 41%; Желтоватое твердое вещество; т. пл. 152.9-154.8°C; МС (ИЭР): 430.9 [M-H]-; 1H ЯМР (CDCl3, 400 МГц) δ 8.88 (уш с, 1H), 8.04 (д, J = 1.6 Гц, 1H), 7.89 (с, 1H), 7.79-7.75 (м, 3H), 7.31 (м, 1H), 7.26 (м, 2H), 4.69 (д, J = 14.8 Гц, 1H), 4.42 (д, J = 14.8 Гц, 1H), 2.43 (уш с, 1H, OH), 1.63 (с, 3H).
(s)-N-(4-Циано-3-(трифторметил)фенил)-2-гидрокси-2-метил-3-(5-метил-1H-индол-1-ил)пропанамид (13): Выход 59%; Желтоватое твердое вещество: т. пл. 148.6-150.2°C; МС (ИЭР): 400.0 [M-H]-; 424.2 [M+Na]+; 1H ЯМР (CDCl3, 400 МГц) δ 8.72 (уш с, 1H), 7.86 (д, J = 2.0 Гц, 1H), 7.78 (м, 2H), 7.31 (д, J = 8.8 Гц, 1H), 6.84 (дд, J = 21.2, 3.2 Гц, 1H), 6.84 (дд, J = 8.8, 2.4 Гц, 1H), 6.43 (д, J = 2.4 Гц, 1H), 6.63 (д, J = 14.8 Гц, 1H), 4.31 (д, J = 14.8 Гц, 1H), 3.82 (с, 3H), 2.51 (с, 1H, OH), 1.60 (с, 3H).
(s)-3-(5-Циано-1H-индол-1-ил)-N-(4-циано-3-(трифторметил)фенил)-2-гидрокси-2-метилпропанамид (14): Выход 54%; Белое твердое вещество: МС (ИЭР): 411.0 [M-H]-; 1H ЯМР (CDCl3, 400 МГц) δ 8.85 (уш с, 1H), 7.91 (д, J = 1.6 Гц, 1H), 7.85 (с, 1H), 7.80-7.73 (м, 2H), 7.53 (д, J = 8.6 Гц, 1H), 7.34 (д, J = 8.6 Гц, 1H), 7.26 (м, 1H), 6.59 (д, J = 3.2 Гц, 1H), 4.68 (д, J = 14.8 Гц, 1H), 4.40 (д, J = 14.8 Гц, 1H), 2.94 (уш с, 1H, OH), 1.64 (с, 3H).
(s)-1-(3-((4-Циано-3-(трифторметил)фенил)амино)-2-гидрокси-2-метил-3-оксопропил)-1H-индол-3-карбоновая кислота(15): Выход 31%; Светло-желтоватое твердое вещество: МС (ИЭР): 429.9 [M-H]-; 1H ЯМР (CDCl3, 400 МГц) δ 9.10 (уш с, 1H), 8.11 (м, 1H), 8.01 (с, 1H), 7.91 (м, 2H), 7.84 (д, J = 1.6 Гц, 1H), 7.74-7.67 (м, 2H), 7.51-7.49 (м, 1H), 7.22-7.20 (м, 1H), 4.62 (д, J = 14.8 Гц, 1H), 4.43 (д, J = 14.8 Гц, 1H), 2.94 (с, 1H, OH), 1.61 (с, 3H).
(s)-N-(4-Циано-3-(трифторметил)фенил)-2-гидрокси-3-(5-метокси-1H-индол-1-ил)-2-метилпропанамид (16):Выход 53%; Коричневое твердое вещество: МС (ИЭР): 416.0 [M-H]-; 418.2 [M+H]+; 440.2 [M+Na]+; 1H ЯМР (CDCl3, 400 МГц) δ 8.74 (уш с, 1H), 7.87 (д, J = 2.2 Гц, 1H), 7.81-7.75 (м, 2H), 7.30 (д, J = 3.2 Гц, 1H), 7.09 (д, J = 3.2 Гц, 1H), 7.03 (д, J = 2.2 Гц, 1H), 6.43 (д, J = 2.8 Гц, 1H), 4.63 (д, J = 14.8 Гц, 1H), 4.30 (д, J = 14.8 Гц, 1H), 3.82 (с, 3H), 2.60 (уш с, 1H, OH), 1.62 (с, 3H).
(s)-3-(5-Хлор-1H-индол-1-ил)-N-(4-циано-3-(трифторметил)фенил)-2-гидрокси-2-метилпропанамид (17): Выход 62%; Белое твердое вещество: МС (ИЭР): 420.0 [M-H]-; 1H ЯМР (CDCl3, 400 МГц) δ 8.85 (уш с, 1H), 7.88 (д, J = 1.6 Гц, 1H), 7.78 (м, 2H), 7.62 (с, 1H), 7.32 (д, J = 3.2 Гц, 1H), 7.12 (м, 2H), 6.65 (д, J = 3.2 Гц, 1H), 4.65 (д, J = 14.8 Гц, 1H), 4.31 (д, J = 14.8 Гц, 1H), 2.52 (уш с, 1H, OH), 1.61 (с, 3H).
(s)-N-(4-Циано-3-(трифторметил)фенил)-2-гидрокси-2-метил-3-(5-(трифторметил)-1H-индол-1-ил)пропанамид (18): Выход 57%; Белое твердое вещество: МС (ИЭР): 453.9 [M-H]-; 1H ЯМР (CDCl3, 400 МГц) δ 8.80 (уш с, 1H), 7.83 (д, J = 1.6 Гц, 1H), 7.75 (м, 2H), 7.51 (д, J = 3.2 Гц, 1H), 7.41 (м, 1H), 7.21 (м, 1H), 6.62 (д, J = 3.2 Гц, 1H), 4.68 (д, J = 14.8 Гц, 1H), 4.38 (д, J = 14.8 Гц, 1H), 2.49 (с, 1H, OH), 1.61 (с, 3H).
(s)-N-(4-Циано-3-(трифторметил)фенил)-2-((s)-3-((4-циано-3-(трифторметил)фенил)амино)-2-гидрокси-2-метил-3-оксопропокси)-3-(5-фтор-1H-индол-1-ил)-2-метилпропанамид (19): Белое твердое вещество: МС (ИЭР): 673.9 [M-H]-; 698.2 [M+Na]+; 1H ЯМР (CDCl3, 400 МГц) δ 9.14 (уш с, 1H), 8.62 (уш с, 1H), 8.16 (д, J =1.8 Гц, 1H), 8.06 (дд, J = 8.8, 1.8 Гц, 1H), 7.94 (д, J = 1.8 Гц, 1H), 7.84 (д, J = 8.8 Гц, 1H), 7.75 (д, J = 8.8 Гц, 1H), 7.55 (дд, J = 8.4, 2.0 Гц, 1H), 7.45 (с, 1H), 7.35 (м, 1H), 7.24 (м, 1H), 6.98 (д, J = 3.2 Гц, 1H), 6.24 (д, J = 3.2 Гц, 1H), 4.54 (д, J = 14.8 Гц, 1H), 4.36 (д, J = 14.8 Гц, 1H), 3.96 (д, J = 8.8 Гц, 1H), 3.55 (д, J = 8.8 Гц, 1H), 2.76 (с, 1H, OH), 1.69 (с, 3H), 1.38 (с, 3H).
(s)-N-(4-Циано-3-(трифторметил)фенил)-2-гидрокси-2-метил-3-(5-нитро-1H-индол-1-ил)пропанамид (20): Выход 47%; Желтоватое твердое вещество: МС (ИЭР): 431.0 [M-H]-; 1H ЯМР (Ацетон-d6, 400 МГц) δ 9.68 (уш с, 1H, NH), 8.35 (д, J = 2.0 Гц, 1H), 8.16 (с, 1H), 8.01 (м, 1H), 7.88-7.81 (м, 2H), 7.58 (д, J = 8.8 Гц, 1H), 7.38 (д, J = 3.4 Гц, 1H), 6.58 (д, J = 3.4 Гц, 1H), 5.49 (с, 1H, OH), 4.66 (д, J = 14.8 Гц, 1H), 4.38 (д, J = 14.8 Гц, 1H), 1.50 (с, 3H).
(s)-N-(4-Циано-3-(трифторметил)фенил)-2-гидрокси-3-(5-иод-1H-индол-1-ил)-2-метилпропанамид (21): Выход 48%; МС (ИЭР) 511.9 [M-H]-; 1H ЯМР (CDCl3, 400 МГц) δ 8.71 (уш с, 1H, NH), 7.91 (д, J = 1.6 Гц, 1H), 7.74 (м, 2H), 7.43 (дд, J = 8.8, 1.6 Гц, 1H), 7.21 (д, J = 8.8 Гц, 1H), 7.08 (д, J = 3.2 Гц, 1H), 6.44 (д, J = 3.2 Гц, 1H), 4.62 (д, J = 15.0 Гц, 1H), 4.32 (д, J = 15.0 Гц, 1H), 2.44 (уш с, 1H, OH), 1.61 (с, 3H).
(s)-N-(4-Циано-3-(трифторметил)фенил)-3-(4-фтор-1H-индол-1-ил)-2-гидрокси-2-метилпропанамид (22): Выход 48%; МС (ИЭР) 511.9 [M-H]-; 1H ЯМР (CDCl3, 400 МГц) δ 8.71 (уш с, 1H, NH), 7.91 (д, J = 1.6 Гц, 1H), 7.74 (м, 2H), 7.43 (дд, J = 8.8, 1.6 Гц, 1H), 7.21 (д, J = 8.8 Гц, 1H), 7.08 (д, J = 3.2 Гц, 1H), 6.44 (д, J = 3.2 Гц, 1H), 4.62 (д, J = 15.0 Гц, 1H), 4.32 (д, J = 15.0 Гц, 1H), 2.44 (уш с, 1H, OH), 1.61 (с, 3H).
(s)-N-(4-Циано-3-(трифторметил)фенил)-3-(6-фтор-1H-индол-1-ил)-2-гидрокси-2-метилпропанамид (23): Выход 48%; Белое твердое вещество; МС (ИЭР) 404.0 [M-H]-; 1H ЯМР (CDCl3, 400 МГц) δ 8.79 (уш с, 1H, NH), 7.89 (д, J = 1.6 Гц, 1H), 7.83 (д, J = 8.4 Гц, 1H), 7.77 (д, J = 8.0 Гц, 1H), 7.51 (дд, J = 8.4, 5.2 Гц, 1H), 7.14 (дд, J = 10.0, 2.0 Гц, 1H), 7.11 (д, J = 3.2 Гц, 1H), 6.87 (дт, J = 8.8, 2.0 Гц, 1H), 6.51 (д, J = 3.2 Гц, 1H), 4.62 (д, J = 14.8 Гц, 1H), 4.32 (д, J = 14.8 Гц, 1H), 2.56 (уш с, 1H, OH), 1.65 (с, 3H).
(s)-3-(5-Бром-1H-индол-1-ил)-N-(4-циано-3-(трифторметил)фенил)-2-гидрокси-2-метилпропанамид (24): Выход; 71%; МС (ИЭР) 465.1 [M-H]-; 1H ЯМР (CDCl3, 400 МГц) δ 8.73 (уш с, 1H, NH), 7.88 (с, 1H), 7.74 (д, J = 1.8 Гц, 1H), 7.69 (д, J = 1.8 Гц, 1H), 7.30 (д, J = 8.8 Гц, 1H), 7.24 (м, 1H), 7.24 (дд, J = 8.8, 2.0 Гц, 1H), 7.13 (д, J = 3.2 Гц, 1H), 6.45 (д, J = 3.2 Гц, 1H), 4.39 (д, J = 14.8 Гц, 1H), 2.60 (уш с, 1H, OH), 1.65 (с, 3H).
(s)-N-(4-Циано-3-(трифторметил)фенил)-2-гидрокси-3-(1H-индол-1-ил)-2-метилпропанамид (27):

Выход 55%; Светло-коричневое твердое вещество; МС (ИЭР) 358.9 [M-H]-; 1H ЯМР (CDCl3, 400 МГц) δ 8.67 (уш с, 1H, NH), 7.96 (дд, J = 8.4, 2.0 Гц, 1H), 7.80 (с, 1H), 7.71-7.65 (м, 2H), 7.51 (д, J = 8.0 Гц, 1H), 7.35 (д, J = 8.0 Гц, 1H), 7.12 (т, J = 8.0 Гц, 1H), 7.02 (м, 1H), 6.45 (д, J = 3.2 Гц, 1H), 4.58 (д, J = 14.8 Гц, 1H), 4.30 (д, J = 14.8 Гц, 1H), 2.50 (уш с, 1H, OH), 1.54 (с, 3H).
Получение 30 из 15:
(s)-Этил 1-(3-((4-циано-3-(трифторметил)фенил)амино)-2-гидрокси-2-метил-3-оксопропил)-1H-индол-3-карбоксилат (30)
К раствору карбоновой кислоты 15 (200 мг, 0.46 ммоль) 10 мл абсолютного этанола добавляли по каплям каталитическое количество конц-H2SO4 в атмосфере аргона. Раствор нагревали с обратным холодильником в течение 30 мин и охлаждали до комнатной температуры. Раствор концентрировали при пониженном давлении и диспергировали в EtOAc, и затем промывали водой. Полученный раствор сушили над безводным Na2SO4 и очищали колоночной флэш-хроматографией в качестве элюента EtOAc/гексан (1/2, об./об.) с получением указанного в заголовке соединения.
Выход: 92%; МС (ИЭР) m/z 458.1 [M-H]-; 482.4 [M+Na]+;1H ЯМР (400 МГц, CDCl3) δ 8.86 (уш с, 1H, NH), 8.00 (м, 2H), 7.81 (с, 1H), 7.65 (с, 2H), 7.46 (д, J = 8.0 Гц, 1H), 7.24-7.18 (м, 2H), 4.65 (д, J = 14.4 Гц, 1H), 4.39 (д, J = 14.4 Гц, 1H), 4.36 (уш с, 1H, OH), 4.23-4.11 (м, 2H), 1.66 (с, 3H), 1.35 (т, J = 7.2 Гц, 3H).
(s)-N-(4-Циано-3-(трифторметил)фенил)-3-(5-фтор-3-метил-1H-индол-1-ил)-2-гидрокси-2-метилпропанамид (31)
Выход; 64% ; МС (ИЭР) m/z 418.1 [M-H]-;1H ЯМР (400 МГц, CDCl3) δ 8.85 (уш с, 1H, NH), 7.86 (м, 1H), 7.81-7.74 (м, 2H), 7.29 (дд, J = 9.0, 4.0 Гц, 1H), 7.14 (дд, J = 9.0, 2.4 Гц, 1H), 6.92 (м, 2H), 4.60 (д, J = 15.2 Гц, 1H), 4.27 (д, J = 15.2 Гц, 1H), 2.22 (с, 3H), 1.57 (с, 3H).

(s)-3-(5-Циано-1H-пирроло[3,2-b]пиридин-1-ил)-N-(4-циано-3-(трифторметил)фенил)-2-гидрокси-2-метилпропанамид (80)
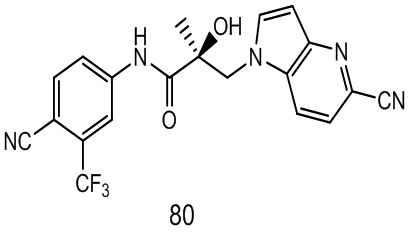
Выход; 67%; МС (ИЭР) m/z 412.1 [M-H]-; 436.1 [M+Na]+;1H ЯМР (400 МГц, ацетон-d6) δ 9.84 (уш с, 1H, NH), 8.31 (с, 1H), 8.14 (м, 2H), 8.01 (м, 1H), 7.81 (д, J = 2.8 Гц, 1H), 7.60 (д, J = 8.4 Гц, 1H), 6.67 (д, J = 2.8 Гц, 1H), 5.64 (уш с, 1H), 4.84 (д, J = 14.8 Гц, 1H), 4.52 (д, J = 14.8 Гц, 1H), 1.66 (с, 3H).
(s)-N-(4-Циано-3-(трифторметил)фенил)-2-гидрокси-2-метил-3-(6-нитро-1H-индол-1-ил)пропанамид (32):

Выход; 31% ; МС (ИЭР) m/z 431.1 [M-H]-;1H ЯМР (400 МГц, CDCl3) δ 8.87 (уш с, 1H, NH), 8.53 (м, 1H), 8.01 (дд, J = 8.8, 2.0 Гц, 1H), 7.92 (д, J = 2.0 Гц, 1H), 7.86 (дд, J = 8.4, 2.0 Гц, 1H), 7.78 (д, J = 8.4 Гц, 1H), 7.64 (д, J = 8.8 Гц, 1H), 7.43 (д, J = 3.0 Гц, 1H), 6.61 (д, J = 3.0 Гц, 1H), 4.76 (д, J = 14.8 Гц, 1H), 4.48 (д, J = 14.8 Гц, 1H), 3.14 (с, 1H, OH), 1.74 (с, 3H).
(R)-N-(4-Циано-3-(трифторметил)фенил)-3-(5-фтор-1H-индол-1-ил)-2-гидрокси-2-метилпропанамид (11R): 11R был синтезирован теми же способами, что и другие соединения, но с использованием L-пролина вместо D-пролина в качестве исходного материала.

Схема 2:
NaH 60% дисперсию в минеральном масле (228 мг, 5.7 ммоль) добавляли в 20 мл безводного растворителя ТГФ в 100 мл сухую двухгорлую круглодонную колбу, снабженную капельной воронкой. 5-Фториндол (390 мг, 2.84 ммоль) добавляли к раствору в атмосфере аргона в водно-ледяной бане и полученный раствор перемешивали в течение 30 мин в водно-ледяной бане. В колбу добавляли эпоксид 10R (2.84 ммоль в ТГФ) через капельную воронку в атмосфере аргона в водно-ледяной бане и перемешивали в течение ночи при RT. После добавления 1 мл H2O, реакционную смесь конденсировали при пониженном давлении и затем диспергировали в 50 мл EtOAc, промывали 50 мл (× 2) воды, соляным раствором, сушили над безводным MgSO4 и выпаривали досуха. Смесь очищали колоночной флэш-хроматографией в качестве элюента EtOAc/гексан и затем конденсированные соединения перекристаллизовывали из EtOAc/гексан с получением целевого продукта 11R.
Выход 69%; Белое твердое вещество. МС (ИЭР): 404.1 [M-H]-; 428.1 [M+Na]+; 1H ЯМР (CDCl3, 400 МГц) δ 8.69 (уш с, 1H, NH), 7.80 (д, J = 1.2 Гц, 1H), 7.71-7.66 (м, 2H), 7.29 -7.26 (м, 2H), 7.14 (дд, J = 9.2, 2.4 Гц, 1H), 7.09 (д, J = 3.2 Гц, 1H), 6.86 (дт, J = 9.0, 2.5 Гц, 1H), 6.39 (д, J = 3.2 Гц, 1H), 4.56 (д, J = 14.8 Гц, 1H), 4.26 (д, J = 14.8 Гц, 1H), 2.51 (уш с, 1H, OH), 1.54 (с, 3H).
ПРИМЕР 2
Синтез бензимидазольных и индазольных соединений SARD по данному изобретению

(s)-N-(4-Циано-3-трифторметил-фенил)-3-(5-фтор-бензоимидазол-1-ил)-2-гидрокси-2-метил-пропионамид (C19H14F4N4O2) (70):
К раствору 5-фтор-1H-бензоимидазол (0.50 г, 0.00367 моль) в безводном ТГФ (10 мл), который охлаждали на бане с ледяной водой в атмосфере аргона, добавляли гидрид натрия (60% дисперсия в масле, 0.44 г, 0.011 моль). После добавления, полученную смесь перемешивали в течение 2 ч. (s)-N-(4-Циано-3-(трифторметил)фенил)-2-метилоксиран-2-карбоксамид (1.29 г, 0.00367 моль) добавляли к вышеуказанному раствору и полученную реакционную смесь оставляли перемешиваться в течение ночи при комнатной температуре в атмосфере аргона. Реакцию гасили водой, экстрагировали этилацетатом. Органический слой сушили над MgSO4, фильтровали и концентрировали в вакууме. Продукт очищали колонкой с силикагелем, используя в качестве элюента метиленхлорид и метанол (19:1), чтобы получить 0.17 г целевого соединения в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6)δ10.37 (с, 1H, NH), 8.31 (д, J = 17.2 Гц, 1H, ArH), 8.16-8.05 (м, 3H, ArH), 7.62-7.56 (м, 1H, ArH), 7.44 (дд, J = 9.60 Гц, J = 2.4 Гц, 1H, ArH), 7.04 (дд, J = 9.60 Гц, J = 2.4 Гц, 1H, ArH), 6.49 (с, 1H, OH), 4.65 (д, J = 5.6 Гц, 1H, CH), 4.62 (д, J = 5.6 Гц, 1H, CH), 1.47 (с, 3H, CH3). Масс (ИЭР, Отрицательная): 404.8[M-H]-; (ИЭР, Позитивная): 429.0[M+Na]+.

(s)-N-(4-Циано-3-(трифторметил)фенил)-2-((s)-3-((4-циано-3-(трифторметил)фенил)амино)-2-гидрокси-2-метил-3-оксопропокси)-3-(5-фтор-1H-бензо[d]имидазол-1-ил)-2-метилпропанамид (C31H23F7N6O4) (72).
Этот побочный продукт очищали колонкой с силикагелем, используя в качестве элюента метиленхлорид и метанол (19:1), с получением 50 мг указанного в заголовке соединения в виде желтоватого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6) δ 10.75 (с, 1H, NH), 9.64 (с, 1H, NH), 8.31 (д, J = 17.2 Гц, 1H, ArH), 8.33-8.30 (м, 1H, ArH), 8.11-7.86 (м, 6H, ArH), 7.54-7.52 (м, 1H, ArH), 7.35-7.33 (м, 1H, ArH), 6.77-6.73 (м, 1H, ArH), 6.31 (с, 1H, OH), 4.66-4.63 (м, 1H, CH), 4.50-4.44 (м, 1H, CH), 3.83-3.82 (м, 1H, CH), 3.66-3.64 (м, 1H, CH), 1.54 (с, 3H, CH3), 1.34 (с, 3H, CH3). Масс (ИЭР, Отрицательная): 675.0 [M-H]-; (ИЭР, Позитивная): 699.3 [M+Na]+.

К раствору 5,6-дифтор-1H-бензоимидазол (0.23 г, 0.00148 моль) в безводном ТГФ (10 мл), который охлаждали в бане с ацетоном в сухом льду в атмосфере аргона, добавляли LDA (2.0 M в ТГФ, 1.11 мл, 0.0022 моль). После добавления полученную смесь перемешивали в течение 2 ч. (s)-N-(4-Циано-3-(трифторметил)фенил)-2-метилоксиран-2-карбоксамид (0.40 г, 0.00148 моль) добавляли к вышеуказанному раствору и полученную реакционную смесь оставляли перемешиваться в течение ночи при комнатной температуре в атмосфере аргона. Реакцию гасили водой, экстрагировали этилацетатом. Органический слой сушили над MgSO4, фильтровали и концентрировали в вакууме. Продукт очищали колонкой с силикагелем, используя в качестве элюента метиленхлорид и метанол (19:1), с получением желаемого соединения в виде белого твердого вещества.
(s)-N-(4-Циано-3-трифторметил-фенил)-3-(5,6-дифтор-бензоимидазол-1-ил)-2-гидрокси-2-метил-пропионамид (C19H13F5N4O2) (73)
1H ЯМР (400 МГц, ДМСО-d6) δ10.36 (с, 1H, NH), 8.25 (д, J = 2.0 Гц, 1H, ArH), 8.21 (с, 1H, ArH), 8.14 (дд, J = 8.8 Гц, J = 2.0 Гц, 1H, ArH), 8.06 (д, J = 8.8 Гц, 1H, ArH), 7.43-7.40 (м, 1H, ArH), 7.26-7.19 (м, 1H, ArH), 6.51 (с, 1H, OH), 4.65 (д, J = 14.8Гц, 1H, CH), 4.41(д, J = 14.8 Гц, 1H, CH), 1.42 (с, 3H, CH3). Масс (ИЭР, Отрицательная): 422.7 [M-H]-; (ИЭР, Позитивная): 447.0 [M+Na]+.
(s)-N-(4-Циано-3-(трифторметил)фенил)-3-(5,6-дифтор-1H-бензо[d]имидазол-2-ил)-2-гидрокси-2-метилпропанамид (C19H13F5N4O2) (74)
1H ЯМР (400МГц, ДМСО-d6) δ 10.44 (с, 1H, NH), 8.36 (д, J = 2.0 Гц, 1H, ArH), 8.17 (дд, J = 8.4 Гц, J = 2.0 Гц, 1H, ArH), 8.11 (с, 1H, ArH), 8.07 (д, J = 8.4Гц, 1H, ArH), 7.44-7.41 (м, 1H, ArH), 7.21-7.14 (м, 1H, ArH), 6.54 (с, 1H, OH), 4.62 (д, J = 14.4Гц, 1H, CH), 4.52 (д, J = 14.4Гц, 1H, CH), 1.41 (с, 3H, CH3). Mass (ИЭР, Отрицательная): 422.7[M-H]-; (ИЭР, Позитивная): 447.0[M+Na]+.
(s)-N-(4-Циано-3-(трифторметил)фенил)-3-(7-фтор-1H-бензо[d]имидазол-1-ил)-2-гидрокси-2-метилпропанамид (C19H14F4N4O2) (75)
К раствору 7-фтор-бензимидазол (0.30 г, 0.0022 моль) в безводном ТГФ (10 мл), который охлаждали на бане с ледяной водой в атмосфере аргона, добавляли гидрид натрия (60% дисперсия в масле, 0.132 г, 0.00331 моль). После добавления полученную смесь перемешивали в течение двух часов. (R)-3-Бром-N-(4-циано-3-трифторметил-фенил)-2-гидрокси-2-метилпропанамид (0.77 г, 0.0022 моль) добавляли к вышеуказанному раствору и полученную реакционную смесь оставляли перемешиваться в течение ночи при комнатной температуре в атмосфере аргона. Реакцию гасили водой, экстрагировали этилацетатом. Органический слой сушили над MgSO4, фильтровали и концентрировали в вакууме. Продукт очищали на колонке с силикагелем, используя в качестве элюента метиленхлорид и метанол (19:1), чтобы получить 0.18 г указанного в заголовке соединения в виде желтоватого твердого вещества.
1H ЯМР (400МГц, ДМСО-d6) δ 10.49 (с, 1H, NH), 8.39 (д, J = 2.0Гц, 1H, ArH), 8.21 (дд, J = 8.8Гц, J = 2.0Гц, 1H, ArH), 8.11 (с, 1H, ArH), 8.08 (д, J = 8.8Гц, 1H, ArH), 7.46 (д, J = 8.0Гц, 1H, ArH), 7.16-7.10 (м, 1H, ArH), 7.05-7.00 (м, 1H, ArH), 6.52 (с, 1H, OH), 4.64-4.56 (м, 2H, CH), 1.35 (с, 3H, CH3). Масс (ИЭР, Отрицательная): 404.8[M-H]-.
Синтез имидазольных SARD:

К раствору замещенного-1H-индазола (0.00148 моль; например, 5-фтор-1H-индазол для 90) в безводном ТГФ (10 мл), который охлаждали в бане с сухим льдом в ацетоне в атмосфере аргона, добавляли LDA (2.0 M в ТГФ, 1.11 мл, 0.0022 моль). После добавления, полученную смесь перемешивали в течение 2 ч. (s)-N-(4-Циано-3-(трифторметил)фенил)-2-метилоксиран-2-карбоксамид (0.40 г, 0.00148 моль) добавляли к вышеуказанному раствору и полученную реакционную смесь оставляли перемешиваться в течение ночи при комнатной температуре в атмосфере аргона. Реакцию гасили водой, экстрагировали этилацетатом. Органический слой сушили над MgSO4, фильтровали и концентрировали в вакууме. Продукт очищали колонкой с силикагелем, используя в качестве элюента метиленхлорид и метанол (19:1), с получением желаемого соединения в виде белого твердого вещества.
ПРИМЕР 3
Синтез хинолиновых, изохиноиновых и индольных соединений SARD по данному изобретению
Хинолиновые соединения


Изохинолиновые соединения

Индолиновые соединения




Общая процедура: Способ A: Общая Схема для синтеза индолиновых, хинолиновых и изохинолиновых производных
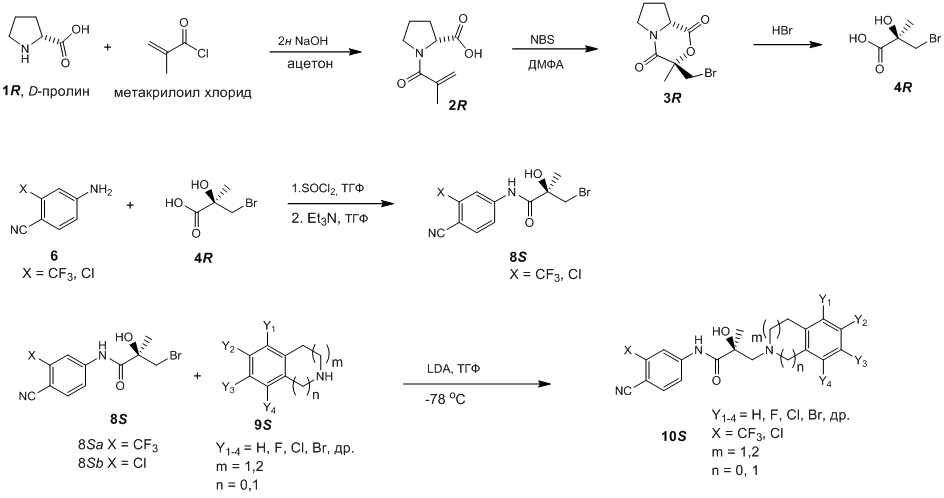
Схема 1.
(2R)-1-Метакрилоилпирролидин -2-карбоновая кислота(2R).
D-Пролин (1R) (14.93 г, 0.13 моль) растворяли в 71 мл 2 н NaOH и охлаждали на ледяной бане; полученный щелочной раствор разбавляли ацетоном (71 мл). Ацетоновый раствор (71 мл) метакрилоил хлорида (13.56 г, 0.13 моль) и 2 н раствор NaOH (71 мл) одновременно добавляли в течение 40 мин к водному раствору D-пролина на ледяной бане. Температуру смеси держали при 10-11°C во время добавления метакрилоил хлорида. После перемешивания (3 часа, комнатная температура (RT)) смесь упаривали in vacuo при температуре 35-45°С для удаления ацетона. Полученный раствор промывали этиловым эфиром и подкисляли до рН 2 концентрированной HCl. Кислую смесь насыщали NaCl и экстрагировали EtOAc (100 мл × 3). Объединенные экстракты сушили над Na2SO4, фильтровали через Celite® и выпаривали in vacuo, получая неочищенный продукт в виде бесцветного масла. Перекристаллизация масла из этилового эфира и гексана давала 16.2 г (68%) целевого соединения в виде бесцветных кристаллов: т. пл. 102.1-103.4°C (мarhefka, C.A.; Moore, B.M., 2nd; Bishop, T.C.; Kirkovsky, L.; Mukherjee, A.; Dalton, J.T.; Miller, D.D. Homology modeling using multiple molecular dynamics simulations and docking studies of the human androgen receptor ligand binding domain bound to testosterone and nonsteroidal ligands. J Med Chem 2001, 44, 1729-40) т. пл. 102.5-103.5°C; спектр ЯМР данного соединения продемонстрировал существование двух ротамеров указанного в заголовке соединения.
1H ЯМР (300 МГц, ДМСО-d6) δ 5.28 (с) и 5.15 (с) для первого ротамера, 5.15 (с) и 5.03 (с) для второго ротамера (в итоге 2H для обоих ротамеров, винил CH2), 4.48-4.44 для первого ротамера, 4.24-4.20 (м) для второго ротамера (в итоге 1H для обоих ротамеров, CH в хиральном центре), 3.57-3.38 (м, 2H, CH2), 2.27-2.12 (1H, CH), 1.97-1.72 (м, 6H, CH2, CH, Me); 13C ЯМР (75 МГц, ДМСО-d6) δ для мажорного ротамера 173.3, 169.1, 140.9, 116.4, 58.3, 48.7, 28.9, 24.7, 19.5 для минорного ротамера 174.0, 170.0, 141.6, 115.2, 60.3, 45.9, 31.0, 22.3, 19.7; ИК (KBr) 3437 (OH), 1737 (C=O), 1647 (CO, COOH), 1584, 1508, 1459, 1369, 1348, 1178 см-1; [α]D26 +80.8° (c = 1, MeOH); Aнал. вычислено для C9H13NO3: C 59.00, H 7.15, N 7.65. Найдено: C 59.13, H 7.19, N 7.61.
(3R,8aR)-3-Бромметил-3-метил-тетрагидро-пирроло[2,1-c][1,4]оксазин-1,4-дион (3R).
Раствор NBS (23.5 г, 0.132 моль) в 100 мл ДМФА добавляли по каплям к перемешиваемому раствору (2R)-1-метакрилоилпирролидин-2-карбоновой кислоты (2R) (16.1 г, 88 ммоль) в 70 мл ДМФА под аргоном при комнатной температуре, и полученную смесь перемешивали в течение 3 дней. Растворитель удаляли in vacuo и осаждали желтое твердое вещество. Твердое вещество суспендировали в воде, перемешивали в течение ночи при комнатной температуре, фильтровали и сушили с получением 18.6 g (81%) (меньший вес при высушивании ~ 34%) указанного в названии бромлактона (3R) в виде желтого твердого вещества: т. пл. 158.1-160.3°C;
1H ЯМР (300 МГц, ДМСО-d6) δ 4.69 (дд, J = 9.6 Гц, J = 6.7 Гц, 1H, CH в хиральном центре), 4.02 (д, J = 11.4 Гц, 1H, CHHa), 3.86 (д, J = 11.4 Гц, 1H, CHHb), 3.53-3.24 (м, 4H, CH2), 2.30-2.20 (м, 1H, CH), 2.04-1.72 (м, 3H, CH2 и CH), 1.56 (с, 2H, Me); 13C ЯМР (75 МГц, ДМСО-d6) δ 167.3, 163.1, 83.9, 57.2, 45.4, 37.8, 29.0, 22.9, 21.6; ИК (KBr) 3474, 1745 (C=O), 1687 (C=O), 1448, 1377, 1360, 1308, 1227, 1159, 1062 см-1; [α]D26 +124.5° (c = 1.3, хлороформ); Aнал. вычислено для C9H12BrNO3: C 41.24, H 4.61, N 5.34. Найдено: C 41.46, H 4.64, N 5.32.
(2R)-3-Бром-2-гидрокси-2-метилпропановой кислоты (4R)
Смесь бромлактона (3R) (18.5 г, 71 ммоль) в 300 мл 24% HBr нагревали с обратным холодильником в течение 1 ч. Полученный раствор разбавляли соляным раствором (200 мл) и экстрагировали этилацетатом (100 мл × 4). Объединенные экстракты промывали насыщенным NaHCO3 (100 мл × 4). Водный раствор подкисляли концентрированной HCl до pH = 1, которую, в свою очередь, экстрагировали этилацетатом (100 мл × 4). Объединенный органический раствор сушили над Na2SO4, фильтровали через Celite и выпаривали in vacuo досуха. Перекристаллизация из толуола давала 10.2 г (86%) целевого соединения в виде бесцветных кристаллов: т. пл. 110.3-113.8°C;
1H ЯМР (300 МГц, ДМСО-d6) δ 3.63 (д, J = 10.1 Гц, 1H, CHHa), 3.52 (д, J = 10.1 Гц, 1H, CHHb), 1.35 (с, 3H, Me);
ИК (KBr) 3434 (OH), 3300-2500 (COOH), 1730 (C=O), 1449, 1421, 1380, 1292, 1193, 1085 см-1;
[α]D26+10.5° (c = 2.6, MeOH);
Aнал. вычислено для C4H7BrO3: C 26.25, H 3.86. Найдено: C 26.28, H 3.75.
(2R)-3-Бром-N-[4-циано-3-(трифторметил)фенил]-2-гидрокси-2-метилпропанамид (8S, X=CF3).
Тионил хлорид (46.02 г, 0.39 моль) добавляли по каплям к охлажденному раствору (меньше, чем 4°C) (R)-3-бром-2-гидрокси-2-метилпропановой кислоты (4R) (51.13 г, 0.28 моль) в 300 мл ТГФ в атмосфере аргона. Полученную смесь перемешивали в течение 3 ч в тех же условиях. К этому добавляли Et3N (39.14 г, 0.39 моль) перемешивали в течение 20 мин в тех же условиях. После 20 мин, добавляли 5-амино-2-цианобензотрифторид (40.0 г, 0.21 моль), 400 мл ТГФ и потом смесь оставляли перемешиваться в течение ночи при RT. Растворитель удаляли при пониженном давлении с получением твердого вещества, которое обрабатывали 300 мл H2O, экстрагировали с EtOAc (2 × 400 мл). Объединенные экстракты промывали насыщенным раствором NaHCO3 (2 × 300 мл) и соляным раствором (300 мл). Органический слой сушили над MgSO4 и концентрировали при пониженном давлении с получением твердого вещества, которое очищали колоночной хроматографии с использованием CH2Cl2/EtOAc (80:20) с получением твердого вещества. Это твердое вещество перекристаллизовывали из CH2Cl2/гексан с получением 55.8 г (73.9%) (2R)-3-бром-N-[4-циано-3-(трифторметил)фенил]-2-гидрокси-2-метилпропанамид (8S, X=CF3) в виде светло-желтого твердого вещества. Т пл. 134.0-136.5°C.
1H ЯМР (CDCl3/ТМС) δ 1.66 (с, 3H, CH3), 3.11 (с, 1H, OH), 3.63 (д, J = 10.8 Гц, 1H, CH2), 4.05 (д, J = 10.8 Гц, 1H, CH2), 7.85 (д, J = 8.4 Гц, 1H, ArH), 7.99 (дд, J = 2.1, 8.4 Гц, 1H, ArH), 8.12 (д, J = 2.1 Гц, 1H, ArH), 9.04 (уш с, 1H, NH). Вычисленная масс: 349.99, [M-H]- 349.0.
Общая процедура получания индолиновых, хинолиновых и изохинолиновых производных (посдедняя Стадия):
Получение раствора LDA в ТГФ. К перемешиваемому раствору свежеперегнанного диизопропаламина (0.14 мл, 1.2 ммоль) в безводном 5 мл ТГФ добавляли раствор н-бутиллития (0.53 мл, 1.32 ммоль, 2.5 M раствор в гексан) при -78°C в атмосфере аргона. Полученный раствор LDA или 2.0 M LDA медленно нагревали до 0°C и перемешивали в течение 10 мин и охлаждали опять до -78°C.
К раствору LDA добавляли по каплям раствор 9S (1.0 ммоль) в 5 мл ТГФ в течение 20 мин. Реакционную смесь перемешивали при той же температуре в течение 30 мин и гасили добавлением насщ. NH4Cl. Раствор концентрировали при пониженном давлении и диспергировали в избытке EtOAc, и сушили над Na2SO4. Раствор концентрировали и полученное твердое вещество перекристаллизовывали из EtOAc/гексан или ДХМ/гексан с получением желаемого соединения 10S. Маточный раствор концентрировали и очищали колоночной флэш-хроматографией (EtOAc/гексан) с получением дополнительного количества 10S.
Альтернативная процедура получения индолиновых соединений (последняя Стадия):

К NaH 60% дисперсия в минеральном масле (61 мг, 1.5 ммоль) добавляли 5 мл безводного растворителя ТГФ в 50 мл сухую двухгорлую круглодонную колбу, снабженную капельной воронкой. 5-Фториндолин или 5-броминдолин (1.48 ммоль) добавляли к раствору в атмосфере аргона в бане с ледяной водой и полученый раствор перемешивали в течение 30 минут в бане с ледяной водой. В колбу добавляли полученный раствор оксирана: (s)-N-(4-циано-3-(трифторметил)фенил)-2-метилоксиран-2-карбоксамида, (1.48 ммоль в ТГФ) через капельную воронку в атмосфере аргона в бане с ледяной водой и перемешивали в течение ночи при комнатной температуре. После добавления 1 мл H2O, реакционную смесь конденсировали при пониженном давлении и затем диспергировали в 20 мл EtOAc, промывали 20 мл (× 2) воды, соляным раствором, сушили над безводным Na2SO4 и выпаривали досуха. Смесь очищали флэш-хроматографией (40%-ный растворитель EtOAc/гексан, SIO2) и получали желаемые продукты 100 или 102.
(s)-3-(5-Броминдолин-1-ил)-N-(4-циано-3-(трифторметил)фенил)-2-гидрокси-2-метилпропанамид (100):

Выход 45%; Светло-коричневое твердое вещество; МС (ИЭР) 466.3 [M-H]-; 1H ЯМР (CDCl3, 400 МГц) δ 9.17 (уш с, 1H, NH), 8.09 (д, J = 2.0 Гц, 1H), 7.96 (дд, J = 8.4, 2.0 Гц, 1H), 7.80 (д, J = 8.4 Гц, 1H), 7.19-7.16 (м, 2H), 6.49 (д, J = 8.4 Гц, 1H), 3.66 (д, J = 14.4 Гц, 1H), 3.48 (уш с, 1H, OH), 3.47-3.41 (м, 1H), 3.34 (кв, J = 9.2 Гц, 1H), 3.25 (д, J = 14.4 Гц, 1H), 3.00-2.91 (м, 2H), 1.56 (с, 3H).
(s)-3-(6-Бром-3,4-дигидрохинолин-1(2H)-ил)-N-(4-циано-3-(трифторметил) фенил)-2-гидрокси-2-метилпропанамид (134).Выход; 62%; МС (ИЭР) m/z 481.6 [M-H]-;1H ЯМР (400 МГц, CDCl3) δ 9.19 (уш с, 1H, NH), 8.00 (с, 1H), 7.97-7.92 (м, 1H), 7.78 (д, J = 8.4 Гц, 1H), 7.12 (дд, J = 8.8, 2.4 Гц, 1H), 7.08 (д, J = 2.4 Гц, 1H), 6.67 (д, J = 8.8 Гц, 1H), 3.86 (д, J = 15.2 Гц, 1H), 3.45 (д, J = 15.2 Гц, 1H), 3.21 (т, J = 5.4 Гц, 2H), 2.74 (м, 2H), 1.87 (м, 2H), 1.60 (с, 3H).
(s)-N-(4-Циано-3-(трифторметил)фенил)-3-(4-фториндолин-1-ил)-2-гидрокси-2-метилпропанамид (101). Выход; 68%; МС (ИЭР) m/z 406.0 [M-H]-; 1H ЯМР (400 МГц, CDCl3) δ 9.21 (уш с, 1H, NH), 8.10 (д, J = 2.4 Гц, 1H), 7.96 (дд, J = 8.8, 2.4 Гц, 1H), 7.89 (д, J = 8.8 Гц, 1H), 7.07-7.02 (м, 1H), 6.47 (т, J = 8.4 Гц, 1H), 6.39 (д, J = 8.0 Гц, 1H), 3.69 (д, J = 14.4 Гц, 1H), 3.53 (уш с, 1H, OH), 3.50 (м, 1H), 3.40 (кв, J = 8.0 Гц, 1H), 3.29 (д, J = 14.4 Гц, 1H), 3.09 (м, 1H), 2.99 (м, 1H), 1.57 (с, 3H).
(s)-N-(4-Циано-3-(трифторметил)фенил)-3-(5-фториндолин-1-ил)-2-гидрокси-2-метилпропанамид (102). Выход; 75%; МС (ИЭР) m/z 406.0 [M-H]-; 1H ЯМР (400 МГц, CDCl3) δ 9.24 (уш с, 1H, NH), 8.10 (д, J = 2.2 Гц, 1H), 7.95 (дд, J = 8.8, 2.2 Гц, 1H), 7.79 (д, J = 8.8 Гц, 1H), 6.83 (дд, J = 8.4, 2.4 Гц, 1H), 6.77 (м. 1H), 6.52 (дд, J = 8.4, 4.0 Гц, 1H), 3.75 (уш с, 1H, OH), 3.64 (д, J = 14.0 Гц, 1H), 3.44 (м, 1H), 3.30 (кв, J = 9.2 Гц, 1H), 3.22 (д, J = 14.0 Гц, 1H), 2.94 (м, 2H), 1.56 (с, 3H).
(s)-N-(4-Циано-3-(трифторметил)фенил)-3-(6-фтор-3,4-дигидрохинолин-1(2H)-ил)-2-гидрокси-2-метилпропанамид (135). Выход; 42%; МС (ИЭР) m/z 420.0 [M-H]-; 1H ЯМР (400 МГц, CDCl3) δ 9.25 (уш с, 1H, NH), 8.09 (д, J = 2.0 Гц, 1H), 7.95 (дд, J = 8.4, 2.0 Гц, 1H), 7.80 (д, J = 8.4 Гц, 1H), 6.78-6.69 (м, 1H), 6.77 (м. 3H), 3.88 (д, J = 15.2 Гц, 1H), 3.82 (уш с, 1H, OH), 3.36 (д, J = 15.2 Гц, 1H), 3.16 (м, 2H), 3.16-2.70 (м, 2H), 1.94-1.83 (м, 2H), 1.56 (с, 3H).
(s)-N-(4-Циано-3-(трифторметил)фенил)-3-(6-фтор-3,4-дигидроизoхинолин-2(1H)-ил)-2-гидрокси-2-метилпропанамид (131). Выход; 43%; МС (ИЭР) m/z 419.9 [M-H]-; 1H ЯМР (400 МГц, CDCl3) δ 9.51 (уш с, 1H, NH), 8.10 (д, J = 1.8 Гц, 1H), 7.95 (дд, J = 8.6, 1.8 Гц, 1H), 7.79 (д, J = 8.6 Гц, 1H), 6.88 (м, 1H), 6.81 (м. 2H), 3.69 (с, 2H), 3.42 (д, J = 13.2 Гц, 1H), 2.91 (м, 4H), 2.60 (д, J = 13.2 Гц, 1H), 2.17 (с, 1H, OH), 1.46 (с, 3H).
(s)-N-(4-Циано-3-(трифторметил)фенил)-3-(6-фториндолин-1-ил)-2-гидрокси-2-метилпропанамид (105). Выход; 70%; МС (ИЭР) m/z 405.9 [M-H]-; 1H ЯМР (400 МГц, CDCl3) δ 9.21 (уш с, 1H, NH), 8.10 (с, 1H), 7.97 (д, J = 8.4 Гц, 1H), 7.79 (д, J = 8.4 Гц, 1H), 6.98 (т, J = 6.8 Гц, 1H), 6.41 (т, J = 7.6 Гц, 1H), 3.35 (м, 1H), 3.66 (д, J = 14.0 Гц, 1H), 3.52 (уш с, 1H, OH), 3.47 (м, 1H), 3.41 (кв, J = 9.2 Гц, 1H), 3.24 (д, J = 14.0 Гц, 1H), 3.00-2.87 (м, 2H), 1.57 (с, 3H).
(s)-N-(4-Циано-3-(трифторметил)фенил)-3-(7-фтор-3,4-дигидроизoхинолин-2(1H)-ил)-2-гидрокси-2-метилпропанамид (132). Выход; 69%; МС (ИЭР) 420.0 [M-H]-;1H ЯМР (400 МГц, CDCl3) δ 9.09 (уш с, 1H, NH), 7.93 (д, J = 8.4 Гц, 1H), 7.80 (д, J = 8.4 Гц, 1H), 7.05 (т, J = 8.0 Гц, 1H), 6.86 (м, 1H), 6.63 (д, J = 8.0 Гц, 1H), 3.71 (с, 2H), 3.42 (д, J = 13.2 Гц, 1H), 2.91-2.82 (м, 5H), 2.60 (д, J = 13.2 Гц, 1H), 1.46 (с, 3H).
ПРИМЕР 4
Синтез соединений SARD по данному изобретению
Способ A. Общая Схема получения индолиновых, хинолоновых и изoхинолиновых производных

Получение раствора LDA в ТГФ: К перемешиваемому раствору свежеперегнанного диизопропаламина (0.14 мл, 1.2 ммоль) в безводном 5 мл ТГФ добавляли раствор н-бутиллития (0.53 мл, 1.32 ммоль, 2.5 M раствор в гексан) при -78°C в атмосфере аргона. Полученный раствор LDA или 2.0 M LDA медленно нагревали до 0°C и перемешивали в течение 10 мин и охлаждали опять до -78°C. К раствору LDA добавляли по каплям раствор 9 (1.0 ммоль) в 5 мл ТГФ в течение 20 мин. 8R в ТГФ добавляли по каплям через капетельную воронку в атмосфере аргона при -78°C. Реакционную смесь перемешивали при той же температуре в течение 30 мин и гасили добавлением насщ. NH4Cl. Раствор концентрировали при пониженном давлении и диспергировали в избытке EtOAc, и сушили над Na2SO4. Раствор концентрировали и полученное твердое вещество перекристаллизовывали из EtOAc/гексан или ДХМ/гексан с получением желаемого соединения 10. Маточный раствор концентрировали и очищали колоночной флэш-хроматографией (EtOAc/гексан) с получением 10 дополнительно.
Способ B. Получение индолов и карбазолов

К NaH 60% дисперсии в минеральном масле (228 мг, 5.7 ммоль) добавляли 20 мл безводного растворителя ТГФ в 100 мл сухую двухгорлую круглодонную колбу, снабженную капельной воронкой. Индол (12, 2.84 ммоль) добавляли к раствору в атмосфере аргона в бане с ледяной водой, и полученный раствор перемешивали в течение 30 мин на бане с ледяной водой. В колбу добавляли эпоксид 11 (2.84 ммоль в ТГФ) через капельную воронку в атмосфере аргона на бане с ледяной водой и перемешивали в течение ночи при комнатной температуре. После добавления 1 мл H2O, реакционную смесь конденсировали при пониженном давлении и затем диспергировали в 50 мл EtOAc, промывали 50 мл (× 2) воды, соляным раствором, сушили над безводным MgSO4 и выпаривали досуха. Смесь очищали колоночной флэш-хроматографией с элюентом EtOAc/гексан и затем конденсированные соединения перекристаллизовывали в EtOAc/гексан с получением целевого продукта 13.
(s)-N-(3-Хлор-4-цианофенил)-2-метилоксиран-2-карбоксамид (эпоксидный интермедиат)

Выход 98%;
Светло-коричневое твердое вещество;
МС (ИЭР) m/z 235.4 [M-H]-;
1H ЯМР (CDCl3, 400 МГц) 400 МГц) H] idH), 7.90 (д, J = 2.0 Гц, 1H), 7.61 (д, J = 8.4 Гц, 1H), 7.50 (дд, J = 8.4, 2.0 Гц, 1H), 2.99 (с, 2H), 1.67 (с, 3H).
Производные Индола
(s)-N-(4-Циано-3-(трифторметил)фенил)-3-(5-фтор-6-фенил-1H-индол-1-ил)-2-гидрокси-2-метилпропанамид (33)

К раствору 5-фтор-6-фенил-1H-индола (0.37 г, 0.00175 моль) в безводном ТГФ (10 мл), который охлаждали на бане с ледяной водой в атмосфере аргона, добавляли гидрид натрия (60% дисперсия в масле, 0.11 г, 0.00263 моль). После добавления, полученную смесь перемешивали в течение трех часов. (s)-N-(4-Циано-3-(трифторметил)фенил)-2-метилоксиран-2-карбоксамид (0.47 г, 0.002175 моль) добавляли к вышеуказанному раствору и полученную реакционную смесь оставляли перемешиваться в течение ночи при комнатной температуре в атмосфере аргона. Реакцию гасили водой, экстрагировали этилацетатом. Органический слой промывали соляным раствором, сушили над MgSO4, фильтровали и концентрировали в вакууме. Продукт очищали колонкой с силикагелем, используя этилацетат и гексан (1: 2) в качестве элюента, чтобы получить 0.83 г (98%) названого соединения в виде не совсем белой пены.
1H ЯМР (400 МГц, ДМСО-d6) δ10.29 (с, 1H, NH), 8.28 (с, 1H, ArH), 8.08 (д, J = 8.8 Гц, 1H, ArH), 7.96 (д, J = 8.8 Гц, 1H, ArH), 7.58 (д, J = 6.8 Гц, 1H, ArH), 7.49-7.31 (м, 7H, ArH), 6.42 (д, J = 3.2 Гц, 1H, ArH), 6.35 (с, 1H, OH), 4.61 (д, J = 14.4 Гц, 1H, CH), 4.35 (д, J = 14.4 Гц, 1H, CH), 1.46 (с, 3H, CH3).
Mass (ИЭР, Отрицательная): 479.9[M-H]-; (ИЭР, Позитивная): 504.1[M+Na]+.
(s)-N-(3-Хлор-4-цианофенил)-3-(5-фтор-6-фенил-1H-индол-1-ил)-2-гидрокси-2-метилпропанамид (34)
5-Фтор-6-фенил-1H-индол (C14H10FN)

К суспензии тетракис(трифенилфосфин)палладия (0) [Pd(PPh3)4, 0.54 г, 0.467 ммоль] в 20 мл этиленгликоль диметилового эфира (DME) добавляли 6-бром-5-фториндол (1.00 г, 4.67 ммоль), и смесь перемешивали в течение 15 минут в атмосфере аргона при комнатной температуре. Раствор фенилборной кислоты (0.57 г, 4.67 ммоль) в 2-3 мл этанола добавляли и смесь перемешивали в течение 10 минут в тех же условияхs. Раствор карбоната калия (0.97 г, 7.01 ммоль) в 2 мл воды добавляли к вышеуказанной смеси и полученную реакционную смесь нагревали с обратным холодильником в течение 3-4 часов в атмосфере аргона. После завершения реакции, контроль по ТСХ, реакционную смесь разбавляли соляным раствором, экстрагировали этилацетатом. Органический слой промывали соляным раствором, сушили над MgSO4, фильтровали и концентрировали в вакууме. Продукт очищали колонкой с силикагелем, используя этилацетат и гексан (1:3) в качестве элюента, чтобы получить 0.90 г (92% выход) указанного в названии соединения в виде светло-коричневого твердого вещества.
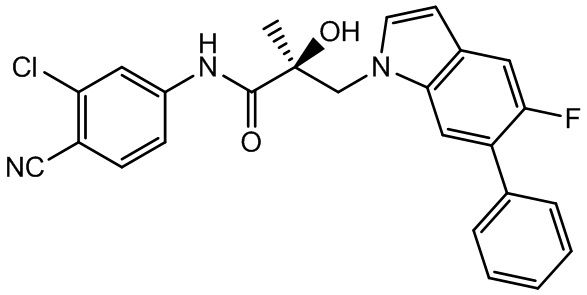
К раствору 5-фтор-6-фенил-1H-индола (0.20 г, 0.000947 моль) в безводном ТГФ (10 мл), который охлаждали на бане с ледяной водой в атмосфере аргона, добавляли гидрид натрия (60% дисперсия в масле, 0.076 г, 0.00189 моль). После добавления, полученную смесь перемешивали в течение трех часов. (R)-3-бром-N-(4-циано-3-хлор-фенил)-2-гидрокси-2-метилпропанамид (0.30 г, 0.000947 моль) добавляли к вышеуказанному раствору и полученную реакционную смесь оставляли перемешиваться в течение ночи при комнатной температуре в атмосфере аргона. Реакцию гасили водой, экстрагировали этилацетатом. Органический слой промывали соляным раствором, сушли MgSO4, фильтровали и концентрировали в вакууме. Продукт очищали колонкой с силикагелем, используя этилацетат и гексан (1:2) в качестве элюента, чтобы получить 0.26 г указанного в названии соединения в виде желтоватого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6) δ10.11 (с, 1H, NH), 8.04 (д, J = 1.6 Гц, 1H, ArH), 7.80 (д, J = 8.8 Гц, 1H, ArH), 7.74 (дд, J = 8.2 Гц, J = 2.0 Гц, 1H, ArH), 7.62 (д, J = 6.4Гц, 1H, ArH), 7.51-7.44 (м, 4H, ArH), 7.39-7.32 (м, 3H, ArH), 6.42 (д, J = 3.2 Гц, 1H, ArH), 6.33 (с, 1H, OH), 4.60 (д, J = 15.2 Гц, 1H, CH), 4.35 (д, J = 15.2 Гц, 1H, CH), 1.45(с, 3H, CH3).
Mass (ИЭР, Отрицательная): 445.8[M-H]-; (ИЭР, Позитивная): 470.0[M+Na]+.
(s)-N-(3-Хлор-4-цианофенил)-3-(6-фтор-1H-индол-1-ил)-2-гидрокси-2-метилпропанамид (35)

Способ B
Выход 67%;
Белое твердое вещество;
МС (ИЭР) m/z 376.9 [M-H]-;
1H ЯМР (CDCl3, 400 МГц) δ 8.67 (уш с, 1H, NH), 7.79 (д, J = 2.0 Гц, 1H), 7.56 (д, J = 8.4 Гц, 1H), 7.49 (дд, J = 8.4, 5.4 Гц, 1H), 7.38 (дд, J = 8.4, 2.0 Гц, 1H), 7.13 (дд, J = 10.0, 2.0 Гц, 1H), 7.09 (д, J = 3.2 Гц, 1H), 6.86 (м, 2H), 6.48 (д, J = 3.2 Гц, 1H), 4.58 (д, J = 14.8 Гц, 1H), 4.28 (д, J = 14.8 Гц, 1H), 2.61 (уш с, 1H, OH), 1.60 (с, 3H);
19F ЯМР (CDCl3) δ -120.03.
(s)-N-(3-Хлор-4-цианофенил)-3-(4-фтор-1H-индол-1-ил)-2-гидрокси-2-метилпропанамид (36)

Способ B
В атмосфере аргона в 100 мл, сухую, двухгорлую круглодонную колбу, снабженную капельной воронкой в бане с ледяной водой, к NaH 60% дисперсию в минеральном масле (228 мг, 5.70 ммоль) добавляли в 20 мл безводного растворителя ТГФ в колбу и раствор 4-фториндола (390 мг, 2.84 ммоль) в 10 мл безводного ТГФ добавляли к раствору в атмосфере аргона в бане с ледяной водой, и потом полученный раствор перемешивали на бане с ледяной водой. После 30 мин, в колбу добавляли раствор (s)-N-(3-хлор-4-цианофенил)-2-метилоксиран-2-карбоксамида (2.84 ммоль в ТГФ) через капельную воронку в атмосфере аргона на бане с ледяной водой и перемешивали в течение ночи при комнатной температуре. После добавления 1 мл H2O, реакционную смесь конденсировали при пониженном давлении и затем диспергировали в 50 мл EtOAc, промывали 50 мл (× 2) воды, соляным раствором, сушили над безводным MgSO4 и выпаривали досуха. Смесь очищали колоночной флэш-хроматографией в качестве элюента EtOAc/гексан и затем конденсированные соединения перекристаллизовывали из EtOAc/гексан с получением целевого продукта, 36.
Выход 73%;
Белое твердое вещество;
МС (ИЭР) m/z 369.9 [M-H]-; HRМС (ИЭР) m/z вычислено для C19H16ClFN3O2: 372.0915. Найдено: 372.0915 [M+H]+;
1H ЯМР (CDCl3, 400 МГц) δ 8.64 (уш с, 1H, NH), 7.81 (с, 1H), 7.57 (д, J = 8.4 Гц, 1H), 7.35 (д, J = 7.2 Гц, 1H), 7.21 (д, J = 8.4 Гц, 1H), 7.14-7.10 (м, 2H), 6.77 (т, J = 8.4 Гц, 1H), 6.63 (д, J = 2.8 Гц, 1H), 6.60 (с, 1H), 4.64 (д, J = 14.8 Гц, 1H), 4.35 (д, J = 14.8 Гц, 1H), 2.48 (уш с, 1H, OH), 1.60 (с, 3H);
13C ЯМР (ацетон-d6, 100 МГц) δ 174.8, 158.1, 155.7, 144.3, 141.5 (д, J = 11.0 Hz), 137.2, 135.5, 130.7, 122.4 (д, J = 7.0 Hz), 121.0, 119.3, 118.0 (д, J = 22.0 Hz), 116.6, 107.9 (т, J = 5.0 Hz), 104.4 (д, J = 19.0 Hz), 97.7, 77.6, 55.0, 24.2.
19F ЯМР (CDCl3, расщепленный) δ -121.78.
(s)-N-(3-Хлор-4-цианофенил)-3-(5-фтор-1H-индол-1-ил)-2-гидрокси-2-метилпропанамид (37)
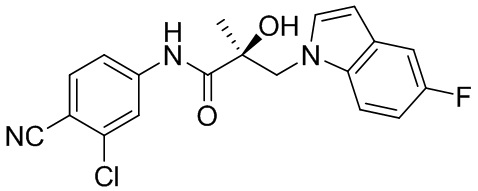
Способ B
Выход 79%;
Белое твердое вещество;
МС (ИЭР) m/z 371.0 [M-H]-; HRМС (ИЭР) m/z вычислено для C19H16ClFN3O2: 372.0915. Найдено: 372.0922 [M+H]+
1H ЯМР (CDCl3, 400 МГц) δ 8.62 (уш с, 1H, NH), 7.80 (д, J = 2.0 Гц, 1H), 7.56 (д, J = 8.4 Гц, 1H), 7.38-7.34 (м, 2H), 7.23 (дд, J = 9.2, 2.4 Гц, 1H), 7.15 (д, J = 3.2 Гц, 1H), 7.22 (дт, J = 9.2, 2.8 Гц, 1H), 6.47 (д, J = 3.2 Гц, 1H), 4.63 (д, J = 14.8 Гц, 1H), 4.32 (д, J = 14.8 Гц, 1H), 2.49 (уш с, 1H, OH), 1.60 (с, 3H);
19F ЯМР (CDCl3) δ -124.52.
(s)-N-(3-Хлор-4-цианофенил)-3-(3-фтор-1H-индол-1-ил)-2-гидрокси-2-метилпропанамид (38)

Способ B
Выход 68%;
Т. пл. 168.9-170.1°C;
Светло-коричневое твердое вещество;
МС (ИЭР) m/z 369.8 [M-H]-; LСМS (ESI) m/z вычислено для C19H16ClFN3O2: 372.0915. Найдено: 372.0910 [M+H]+
1H ЯМР (CDCl3, 400 МГц) δ 8.66 (уш с, 1H, NH), 7.81 (д, J = 2.0 Гц, 1H), 7.60-7.56 (м, 2H), 7.37 (дд, J = 8.4, 2.0 Гц, 2H), 7.23 (м, 1H), 7.12 (т, J = 7.4 Гц, 1H), 6.93 (д, J = 2.8 Гц, 1H), 4.56 (д, J = 15.2 Гц, 1H), 4.27 (д, J = 15.2 Гц, 1H), 2.44 (с, 1H, OH), 1.59 (с, 3H).
19F ЯМР (CDCl3) δ -173.91
(s)-N-(3-Хлор-4-цианофенил)-3-(7-фтор-1H-индол-1-ил)-2-гидрокси-2-метилпропанамид (39)

Способ B
Выход 73%;
Белое твердое вещество;
МС (ИЭР) m/z 370.0 [M-H]-;
1H ЯМР (CDCl3, 400 МГц) δ 8.60 (уш с, 1H, NH), 8.82 (д, J = 2.0 Гц, 1H), 7.55 (д, J = 8.4 Гц, 1H), 7.37-7.34 (м, 2H), 7.02 (д, J = 3.2 Гц, 1H), 7.00 (м, 1H), 7.01-6.98 (м, 1H), 6.91 (м, 1H), 6.46 (т, J = 2.8 Гц, 1H), 4.68 (д, J = 15.0 Гц, 1H), 4.62 (д, J = 15.0 Гц, 1H), 2.73 (д, J = 4.4 Гц, 1H, OH), 1.61 (с, 3H);
19F ЯМР (CDCl3) δ -133.54.
(s)-N-(3-Хлор-4-цианофенил)-3-(5-фтор-3-фенил-1H-индол-1-ил)-2-гидрокси-2-метилпропанамид (40)

К раствору 5-фтор-3-фенил-1H-индола (0.50 г, 0.002267 моль) в безводном ТГФ (10 мл), который охлаждали на бане с ледяной водой в атмосфере аргона, добавляли гидрид натрия (60% дисперсия в масле, 0.24 г, 0.005918 моль). После добавления, полученную смесь перемешивали в течение трех часов. (R)-3-бром-N-(4-циано-3-хлор-фенил)-2-гидрокси-2-метилпропанамид (0.75 г, 0.002267 моль) добавляли к вышеуказанному раствору и полученную реакционную смесь оставляли перемешиваться в течение ночи при комнатной температуре в атмосфере аргона. Реакцию гасили водой, экстрагировали этилацетатом. Органический слой промывали соляным раствором, сушили над MgSO4, фильтровали и концентрировали в вакууме. Продукт очищали колонкой с силикагелем, используя этилацетат и гексан (от 1:2 до 1:1) в качестве элюента, чтобы получить 0.43 г указанного в названии соединения в виде желтоватого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6) δ10.17 (с, 1H, NH), 8.06 (д, J = 2.0 Гц, 1H, ArH), 7.86-7.79 (м, 2H, ArH), 7.64 (с, 1H, ArH), 7.62-7.58 (м, 1H, ArH), 7.55-7.52 (м, 2H, ArH), 7.50 (дд, J = 10.4 Гц, J = 2.4 Гц, 1H, ArH), 7.43-7.40 (м, 2H, ArH), 7.26-7.22 (м, 1H, ArH), 7.03-6.98 (м, 1H, ArH), 6.37 (с, 1H, OH), 4.60 (д, J = 14.8 Гц, 1H, CH), 4.38 (д, J = 14.8 Гц, 1H, CH), 1.46 (с, 3H, CH3).
Mass (ИЭР, Отрицательная): 446.8[M-H]-; (ИЭР, Позитивная): 448.1248[M+H]+.
(s)-N-(4-Циано-3-(трифторметил)фенил)-2-гидрокси-2-метил-3-(4-фенил-1H-индол-1-ил)пропанамид (41)
Фенил-1H-индол (C14H11N)

К суспензии тетракис(трифенилфосфин)палладия(0) [Pd(PPh3)4, 1.179 г, 1.0212 ммоль] в 40 мл этилeн гликоль диметиловом эфире (DME) добавляли 4-бром-индол (2.00 г, 10.202 ммоль), и смесь перемешивали в течение 15 минут в атмосфере аргона при комнатной температуре. Добавляли раствор фенилбензойной кислоты (1.24 г, 10.202 ммоль) в 4.5 мл этанола и смесь перемешивали в течение 10 минут в тех же условиях. Раствор карбоната калия (2.16 г, 15.306 ммоль) в 3.5 мл воды добавляли к вышеуказанной смеси и полученную реакционную смесь нагревали с обратным холодильником в течение 3-4 часов в атмосфере аргона. После завершения реакции, контроль по ТСХ, реакционную смесь разбавляли соляным раствором, экстрагировали этилацетатом. Органический слой промывали соляным раствором, сушили над MgSO4, фильтровали и концентрировали в вакууме. Продукт очищали колонкой с силикагелем, используя этилацетат и гексан (от 1:3 до 2:1) в качестве элюента, чтобы получить 1.67 г (84,8% выход) указанного в названии соединения в виде желтоватого масла.

К раствору 4-фенил-1H-индола (0.42 г, 0.002173 моль) в безводном ТГФ (10 мл), который охлаждали на бане с ледяной водой в атмосфере аргона, добавляли гидрид натрия (60% дисперсия в масле, 0.22 г, 0.005434 моль). После добавления, полученную смесь перемешивали в течение трех часов. (s)-N-(4-циано-3-(трифторметил)фенил)-2-метилоксиран-2-карбоксамид (0.76 г, 0.002173 моль) добавляли к вышеуказанному раствору и полученную реакционную смесь оставляли перемешиваться в течение ночи при комнатной температуре в атмосфере аргона. Реакцию гасили водой, экстрагировали этилацетатом. Органический слой промывали соляным раствором, сушили над MgSO4, фильтровали и концентрировали в вакууме. Продукт очищали колонкой с силикагелем, используя этилацетат и гексан (1:2) в качестве элюента, чтобы получить 0.69 г (69%) указанного в названии соединения в виде не совсем белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6) δ10.37 (с, 1H, NH), 8.37 (д, J = 2.0 Гц, 1H, ArH), 8.18 (дд, J = 8.4 Гц, J = 2.0 Гц, 1H, ArH), 8.05 (д, J = 8.4 Гц, 1H, ArH), 7.60-7.54 (м, 3H, ArH), 7.49-7.45 (м, 2H, ArH), 7.38-7.34 (м, 2H, ArH), 7.18-7.14 (м, 1H, ArH), 7.04 (д, J = 7.2 Гц, 1H, ArH), 6.51 (д, J = 3.2 Гц, 1H, ArH), 6.35 (с, 1H, OH), 4.58 (д, J = 14.4 Гц, 1H, CH), 4.38 (д, J = 14.4 Гц, 1H, CH), 1.45 (с, 3H, CH3).
Масс (ИЭР, Позитивная): 464.1536 [M+H]+; 486.1351 [M+Na]+.
(s)-N-(4-Циано-3-(трифторметил)фенил)-3-(4-фтор-5-фенил-1H-индол-1-ил)-2-гидрокси-2-метилпропанамид (42)
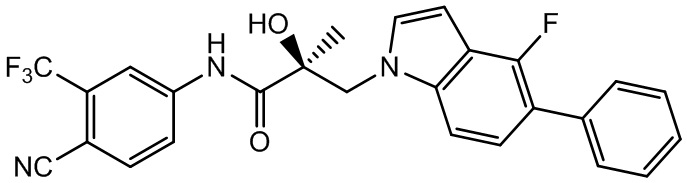
К раствору 4-фтор-5-фенил-1H-индола (0.33 г, 0.00156 моль) в безводном ТГФ (10 мл), который охлаждали на бане с ледяной водой в атмосфере аргона, добавляли гидрид натрия (60% дисперсия в масле, 0.16 г, 0.00391 моль). После добавления полученную смесь перемешивали в течение трех часов. (s)-N-(4-циано-3-(трифторметил)фенил)-2-метилоксиран-2-карбоксамид (0.55 г, 0.00156 моль) добавляли к вышеуказанному раствору и полученную реакционную смесь оставляли перемешиваться в течение ночи при комнатной температуре в атмосфере аргона. Реакцию гасили водой, экстрагировали этилацетатом. Органический слой промывали соляным раствором, сушили над MgSO4, фильтровали и концентрировали в вакууме. Продукт очищали колонкой с силикагелем, используя этилацетат и гексан (1:2) в качестве элюента, чтобы получить 0.47 г (63%) указанного в названии соединения в виде не совсем белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6) δ10.33 (с, 1H, NH), 8.35 (д, J = 2.0 Гц, 1H, ArH), 8.17 (дд, J = 8.4 Гц, J = 2.0 Гц, 1H, ArH), 8.05 (д, J = 8.4 Гц, 1H, ArH), 7.51-7.40 (м, 5H, ArH), 7.36-7.32 (м, 2H, ArH и индол-H), 7.17-7.13 (м, 1H, ArH), 6.53 (д, J = 3.2 Гц, 1H, ArH), 6.38 (с, 1H, OH), 4.60 (д, J = 14.8 Гц, 1H, CH), 4.38 (д, J = 14.8 Гц, 1H, CH), 1.45 (с, 3H, CH3).
Масс (ИЭР, Отрицательная): [M-H]-; (ИЭР, Позитивная): 482.1490[M+H]+; 504.1310[M+Na]+.
Карбазал
Способы A и B: Получение карбазолов

Способ A (не микроволновый): Смесь фенил трифторметансульфоната (500 мг, 2.21 ммоль), ацетата палладия (II) (50 мг, 0.22 ммоль), (±) 2,2'-бис(дифенилфосфин)-1,1'-бинафтила (317 мг, 0.66 ммоль) и карбоната цезия (1.09 г, 3.31 ммоль) в 50 мл толуоле была инертиризирована аргоном. Затем, добавляли замещенный анилин (2.43 ммоль) и смесь нагревали при 110°C в течение ночи. Реакционной смеси давали остыть до комнатной температуры и фильтровали через слой Celite®. Фильтрат разбавляли CH2Cl2 и водой. Фазы разделяли и водную фазу повторно экстрагировали 2 раза с CH2Cl2. Объединенные органические фазы сушили над Na2SO4 и растворитель выпаривали.
Способ B (микроволновый): Смесь фенил трифторметансульфоната (200 мг, 0.88 ммоль), ацетата палладия (II) (20 мг, 0.09 ммоль), (±) 2,2'-бис(дифенилфосфин)-1,1'-бинафтила (64 мг, 0.13 ммоль) и карбоната цезия (430 мг, 1.32 ммоль), и замещенного анилина (0.97 ммоль) в 5 мл толуола загружали в сосуд с крышкой. Реакционные сосуды помещали в реакторный блок в микроволновой печи. Выполняли программируемый цикл СВЧ-излучения 30 мин при 300 Вт при 110°С и 25 мин охлаждали вентилятором (время облучения - 30 мин). Смесь переносили в круглодонную колбу для концентрирования при пониженном давлении и выливали в EtOAc, который промывали водой и сушили над безводным MgSO4, концентрировали. Полученный неочищенный продукт очищали хроматографией на силикагеле с использованием EtOAc/гексан (6/1, об./об.) в качестве элюента для получения целевого продукта (~ 89%) в виде темно-коричневого масла.
4-Фтор-N-фенил анилин:1H ЯМР (400 МГц, CDCl3) δ 7.27-7.24 (м, 2H), 7.07-7.02 (м, 2H), 7.01-6.95 (м, 4H), 6.89 (т, J = 7.2 Гц, 1H), 5.57 (уш с, 1H, NH).
3-Нитро-9H-карбазол

Смесь фенилтрифторметансульфоната (500 мг, 2.21 ммоль), ацетата палладия (II) (50 мг, 0.22 ммоль), (±) 2,2'-бис(дифенилфосфин)-1,1'-бинафтила (317 мг, 0.66 ммоль) и карбоната цезия (1.09 г, 3.31 ммоль) в 50 мл толуола была инертиризирована аргоном. Потом, добавляли 4-нитроанилин (331 мг, 2.43 ммоль) и смесь нагревали при 110°C в течение ночи. Реакционной смеси давали остыть до комнатной температуры и фильтровали через слой Celite®. Фильтрат разбавляли CH2Cl2 и водой. Фазы разделяли и водную фазу повторно экстрагировали 2 раза с CH2Cl2. Объедененные органические фазы сушили над Na2SO4 и полученный раствор сушили над безводным Na2SO4 и очищали колоночной флэш-хроматографией, в качестве элюента EtOAc/гексан (1/6, об./об.), с получением 4-нитро-N-фениланилин. Анилин (450 мг, 2 ммоль), Pd(OAc)2 (23 мг, 0.1 ммоль), K2CO3 (30 мг, 0.2 ммоль), и пивалиновую кислоту (408 мг, 4 ммоль) помещали в стеклянную пробирку. Незакрытую пробирку помещали в масляную баню и смесь перемешивали на воздухе при указанной температуре. Затем раствор охлаждали до комнатной температуры, разбавляли EtOAc, промывали насыщенным Na2CO3, сушили над Na2SO4, концентрировали и очищали колоночной флэш-хроматографией, в качестве элюента EtOAc/гексан, с получением3-нитро-9H-карбазола.
(s)-3-(9H-Карбазол-9-ил)-N-(4-циано-3-(трифторметил)фенил)-2-гидрокси-2-метилпропанамид (200)
Способ B: Выход 88%; МС (ИЭР) m/z 436.1 [M-H]-;
1H ЯМР (CDCl3, 400 МГц) δ 8.82 (уш с, 1H, NH), 8.09-8.06 (м, 3H), 7.84 (д, J = 1.6 Гц, 1H), 7.77-7.71 (м, 2H), 7.54 (д, J = 8.4 Гц, 2H), 7.45-7.39 (м, 3H), 7.24-7.23 (м, 2H), 4.80 (д, J = 15.2 Гц, 1H), 4.63 (д, J = 15.2 Гц, 1H) 2.57 (с, 1H, OH), 1.69 (с, 3H).
(s)-N-(4-Циано-3-(трифторметил)фенил)-2-гидрокси-2-метил-3-(3-нитро-9H-карбазол-9-ил)пропанамид (201)
Способ B: МС (ИЭР) m/z 481.1 [M-H]-
1H ЯМР (CDCl3, 400 МГц) δ 9.01 (с, 1H), 8.92 (уш с, 1H, NH), 8.39 (м, 1H), 8.08 (м, 1H), 7.92 (д, J = 1.6 Гц, 1H), 7.78 (д, J = 8.4 Гц, 1H), 7.62 (дд, J = 8.4, 1.6 Гц, 1H), 7.45 (м, 1H), 7.48-7.22 (м, 3H), 4.91 (д, J = 15.0 Гц, 1H), 4.85 (д, J = 15.0 Гц, 1H) 2.62 (с, 1H, OH), 1.70 (с, 3H).
(s)-N-(4-Циано-3-(трифторметил)фенил)-3-(3-фтор-9H-карбазол-9-ил)-2-гидрокси-2-метилпропанамид (202)
К раствору 4-фтор-карбазола (0.20 г, 0.00108 моль) в безводном ТГФ (10 мл), который охлаждали на бане с ледяной водой в атмосфере аргона, добавляли гидрид натрия (60% дисперсия в масле, 0.09 г, 0.00216 моль). После добавления, полученную смесь перемешивали в течение двух часов. (R)-3-бром-N-(4-циано-3-трифторметил-фенил)-2-гидрокси-2-метилпропанамид (0.38 г, 0.00108 моль) добавляли к вышеуказанному раствору и полученную реакционную смесь оставляли перемешиваться в течение ночи при комнатной температуре в атмосфере аргона. Реакцию гасили водой, экстрагировали этилацетатом. Органический слой сушили над MgSO4, фильтровали и концентрировали в вакууме. Продукт очищали колонкой с силикагелем, используя в качестве элюента метиленхлорид, чтобы получить 0.36 г (73,5%) указанного в названии соединения в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6) δ 10.36 (с, 1H, NH), 8.25 (д, J = 1.6 Гц, 1H, ArH), 8.12-8.09 (м, 2H, ArH), 8.04 (д, J = 8.8 Гц, 1H, ArH), 7.95 (дд, J = 9.2 Гц, J = 2.1 Гц, 1H, ArH), 7.66 (т, J = 4.8 Гц, 1H, ArH), 7.64 (с, 1H, ArH), 7.37 (дт, J = 9.2 Гц, J = 1.2 Гц, 1H, ArH), 7.20 (тд, J = 9.2 Гц, J = 2.0 Гц, 1H, ArH), 7.13 (т, J = 8.0 Гц, 1H, ArH), 6.34 (с, 1H, OH), 4.70 (д, J = 14.8 Гц, 1H, CH), 4.55 (д, J = 14.8 Гц, 1H, CH), 1.52 (с, 3H, CH3).
Масс (ИЭР, Отрицательная): 453.9 [M-H]-; (ИЭР, Позитивная): 478.1 [M+Na]+.
(s)-N-(3-Хлор-4-цианофенил)-3-(3-фтор-9H-карбазол-9-ил)-2-гидрокси-2-метилпропанамид (203)

К раствору 3-фтор-карбазола (0.10 г, 0.00054 моль) в безводном ТГФ (5 мл), который охлаждали на бане с ледяной водой в атмосфере аргона, добавляли гидрид натрия (60% дисперсия в масле, 0.033 г, 0.00081 моль). После добавления, полученную смесь перемешивали в течение двух часов. (R)-3-бром-N-(4-циано-3-хлор-фенил)-2-гидрокси-2-метилпропанамид (0.17 г, 0.00054 моль) добавляли к вышеуказанному раствору и полученную реакционную смесь оставляли перемешиваться в течение ночи при комнатной температуре в атмосфере аргона. Реакцию гасили водой, экстрагировали этилацетатом. Органический слой сушили MgSO4, фильтровали и концентрировали в вакууме. Продукт очищали колонкой с силикагелем, используя гексан и этилацетат (2:1) в качестве элюента, чтобы получить 0.22 г (98%) указанного в названии соединения в виде белого твердого вещества/иглы.
1H ЯМР (400 МГц, ДМСО-d6) δ10.20 (с, 1H, NH), 8.12 (д, J = 7.6 Гц, 1H, ArH), 8.05 (д, J = 2.0 Гц, 1H, ArH), 7.96 (дд, J = 9.2 Гц, J = 2.0 Гц, 1H, ArH), 7.86 (д, J = 8.8 Гц, 1H, ArH), 7.80 (дд, J = 8.4 Гц, J = 2.0 Гц, 1H, ArH), 7.69-7.66 (м, 2H, ArH), 7.41 (т, J = 8.0 Гц, 1H, ArH), 7.24 (дт, J = 9.6 Гц, J = 2.4 Гц, 1H, ArH), 7.16 (т, J = 7.2 Гц, 1H, ArH), 6.34 (с, 1H, OH), 4.70 (д, J = 15.2 Гц, 1H, CH), 4.54 (д, J = 15.2 Гц, 1H, CH), 1.52(с, 3H, CH3).
Масс (ИЭР, Отрицательная): 420.1[M-H]-; (ИЭР, Позитивная): 444.1[M+Na]+.
(s)-N-(4-Циано-3-(трифторметил)фенил)-3-(3,6-дифтор-9H-карбазол-9-ил)-2-гидрокси-2-метилпропанамид (204)

К раствору 3,6-дифторкарбазола (0.20 г, 0.00098 моль) в безводном ТГФ (10 мл), который охлаждали на бане с ледяной водой в атмосфере аргона, добавляли гидрид натрия (60% дисперсия в масле, 0.06 г, 0.001476 моль). После добавления, полученную смесь перемешивали в течение трех часов. (s)-N-(4-циано-3-(трифторметил)фенил)-2-метилоксиран-2-карбоксамид (0.266 г, 0.00098 моль) добавляли к вышеуказанному раствору и полученную реакционную смесь оставляли перемешиваться в течение ночи при комнатной температуре в атмосфере аргона. Реакцию гасили водой, экстрагировали этилацетатом. Органический слой промывали соляным раствором, сушили MgSO4, фильтровали и концентрировали в вакууме. Продукт очищали колонкой с силикагелем, используя этилацетат и гексан (1:2) в качестве элюента, чтобы получить 0.40 г укаазанного в названии соединения в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6) δ10.33 (с, 1H, NH), 8.22 (д, J = 1.6 Гц, 1H, ArH), 8.11 (дд, J = 8.8 Гц, J = 2.0 Гц, 1H, ArH), 8.05 (д, J = 8.8 Гц, 1H, ArH), 7.98 (д, J = 2.4 Гц, 1H, ArH), 7.96 (д, J = 2.4Гц, 1H, ArH), 7.68-7.65 (м, 2H, ArH), 7.27-7.22 (м, 2H, ArH), 6.36 (с, 1H, OH), 4.72 (д, J = 15.2 Гц, 1H, CH), 4.54 (д, J = 15.2 Гц, 1H, CH), 1.53 (с, 3H, CH3).
Масс (ИЭР, Отрицательная): 471.9 [M-H]-; (ИЭР, Позитивная): 496.1 [M+Na]+.
(s)-3-(9H-Карбазол-9-ил)-N-(3-хлор-4-цианофенил)-2-гидрокси-2-метилпропанамид (205)

Способ B
Выход 77%;
МС (ИЭР) m/z 402.3 [M-H]-;
1H ЯМР (400 МГц, CDCl3) δ 8.75 (уш с, 1H, NH), 8.08 (д, J = 7.6 Гц, 2H), 7.78 (д, J = 1.6 Гц, 1H), 7.56-7.54 (м, 3H), 7.44 (т, J = 7.6 Гц, 2H), 7.37 (дд, J = 8.8, 1.8 Гц, 1H), 7.27-7.25 (м, 2H), 4.78 (д, J = 15.6 Гц, 1H), 4.63 (д, J = 15.6 Гц, 1H), 2.65 (уш с, 1H, OH), 1.66 (с, 3H).
Изoхинолин
(s)-N-(4-Циано-3-(трифторметил)фенил)-3-(7-фтор-3,4-дигидроизoхинолин-2(1H)-ил)-2-гидрокси-2-метилпропанамид (132)

Способ A
Выход 69%;
МС (ИЭР) m/z 420.0 [M-H]-;
1H ЯМР (400 МГц, CDCl3) δ 9.09 (уш с, 1H, NH), 7.93 (д, J = 8.4 Гц, 1H), 7.80 (д, J = 8.4 Гц, 1H), 7.05 (т, J = 8.0 Гц, 1H), 6.86 (м, 1H), 6.63 (д, J = 8.0 Гц, 1H), 3.71 (с, 2H), 3.42 (д, J = 13.2 Гц, 1H), 2.91-2.82 (м, 5H), 2.60 (д, J = 13.2 Гц, 1H), 1.46 (с, 3H).
Производные индолина
(s)-N-(3-Хлор-4-цианофенил)-3-(4-фториндолин-1-ил)-2-гидрокси-2-метилпропанамид (103)
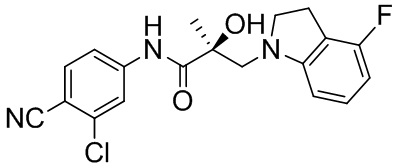
Получение раствора LDA в ТГФ.
К раствору свежеперегнанного диизопропаламин (0.14 мл, 1,2 ммоль) в безводном 5 мл ТГФ добавляли раствор н-бутиллития (0.53 мл, 1.32 ммоль, 2.5 М раствор в гексане) при -78°C в атмосфере аргона.
В атмосфере аргона в 100 мл сухую двухгорлую круглодонную колбу, снабженную капельной воронкой, полученный раствор LDA или комерческий раствор 2.0 M LDA (1.2 ммоль, Aldrich) в ТГФ помещали в колбу, и потом 4-фториндолин (1.0 ммоль) в 10 мл безводного ТГФ добавляли по каплям к раствору LDA при -78°C в атмосфере аргона. Раствор перемешивали в течение 10 мин и нагревали до 0°C и охлаждали опять до -78°C. К раствору добавляли раствор (R)-3-бром-N-(3-хлор-4-цианофенил)-2-гидрокси-2-метилпропанамида (1.0 ммоль в ТГФ) через капельную воронку в атмосфере аргона при -78°C и давали постепенно нагреться до комнатной температуры и перемешивали в течение ночи. А затем гасили добавлением 0.5 мл насыщ. NH4Cl. Раствор уменьшали в объеме при пониженном давлении и диспергировали в избытке EtOAc, а затем сушили над безводным MgSO4. Раствор концентрировали и очищали колоночной флэш-хроматографией (EtOAc / гексан) или перекристаллизовывали из EtOAc/гексан (или ДХМ/гексан) с получением задуманного соединения 573.
Выход 71%;
Белое твердое вещество;
МС (ИЭР) m/z 372.0 [M-H]-;
HRМС (ИЭР) m/z вычислено для C19H18ClFN3O2: 374.1072. Найдено: 374.1072 [M+H]+
[α]D20 -173o (c 1.0, CH3OH);
1H ЯМР (ацетон-d6, 400 МГц) δ 9.84 (уш с, 1H, NH), 8.26 (д, J = 2.0 Гц, 1H), 7.90 (дд, J = 8.4, 2.0 Гц, 1H), 7.80 (д, J = 8.4 Гц, 1H), 6.99 (м, 1H), 6.43 (д, J = 8.0 Гц, 1H), 6.31 (т, J = 8.4 Гц, 1H), 5.21 (уш с, 1H, OH), 3.66 (м, 1H), 3.63 (д, J = 14.4 Гц, 1H), 3.53 (кв, J = 8.0 Гц, 1H), 3.26 (д, J = 14.4 Гц, 1H), 2.89 (м, 2H), 1.53 (с, 3H).
13C ЯМР (ацетон-d6, 100 МГц) δ 175.9, 160.6 (д, J = 239.7 Hz), 160.6 (д, J = 9.3Hz), 144.6, 137.3, 135.6, 129.9 (д, J = 8.7 Hz), 120.8, 119.2, 116.7, 114.8 (д, J = 21.7 Hz), 107.8, 105.1 (д, J = 21.0 Hz), 104.1 (д, J = 8.0 Hz), 77.8, 60.4, 56.7, 25.4, 24.3.
19F ЯМР (CDCl3, расщепленный) δ 118.95.
(s)-N-(3-Хлор-4-цианофенил)-3-(5-фториндолин-1-ил)-2-гидрокси-2-метилпропанамид (104)

Способ A
Выход; 68%;
1H ЯМР (400 МГц, CDCl3) δ 9.09 (уш с, 1H, NH), 7.98 (д, J = 2.0 Гц, 1H), 7.61 (д, J = 8.4 Гц, 1H), 7.52 (дд, J = 8.4, 2.0 Гц, 1H), 6.83 (м, 1H), 6.77 (м, 1H), 6.51 (м, 1H), 3.62 (д, J = 14.4 Гц, 1H), 3.56 (уш с, 1H, OH), 3.42 (м, 1H), 3.30 (кв, J = 9.2 Гц, 1H), 3.21 (д, J = 14.4 Гц, 1H), 3.01 (т, J = 8.4 Гц, 2H), 1.54 (с, 3H).
МС (ИЭР) m/z 372.0 [M-H]-;
[α]D20 -202o (c 1.0, CH3OH)
19F ЯМР (CDCl3, расщепленный) δ 125.35.
(s)-N-(3-Хлор-4-цианофенил)-3-(6-фториндолин-1-ил)-2-гидрокси-2-метилпропанамид (106)

Способ A
Выход 76%;
МС (ИЭР) m/z 372.1 [M-H]-;
1H ЯМР (400 МГц, CDCl3) δ 9.08 (уш с, 1H, NH), 7.97 (д, J = 1.6 Гц, 1H), 7.60 (д, J = 8.4 Гц, 1H), 7.53 (дд, J = 8.4, 1.6 Гц, 1H), 6.77 (т, J = 6.4 Гц, 1H), 6.39 (м, 1H), 6.33 (д, J = 10.0 Гц, 1H), 3.64 (д, J = 14.2 Гц, 1H), 3.49 (уш с, 1H, OH), 3.47 (м, 1H), 3.38 (кв, J = 9.2 Гц, 1H), 3.23 (д, J = 14.2 Гц, 1H), 2.95 (м, 2H), 1.56 (с, 3H).
(s)-3-(5-Хлор-6-фториндолин-1-ил)-N-(4-циано-3-(трифторметил)фенил)-2-гидрокси-2-метилпропанамид (107)

Способ A
Выход; 47%
МС (ИЭР) m/z 440.3 [M-H]-;
1H ЯМР (400 МГц, CDCl3) δ 9.15 (уш с, 1H, NH), 8.08 (с, 1H), 7.97 (д, J = 8.4 Гц, 1H), 7.80 (д, J = 8.4 Гц, 1H), 7.03 (д, J = 7.2 Гц, 1H), 6.42 (д, J = 10.0 Гц, 1H), 3.66 (д, J = 14.4 Гц, 1H), 3.52-3.42 (м, 2H), 3.38 (с, 1H, OH), 3.21 (д, J = 14.4 Гц, 1H), 2.96-2.80 (м, 2H), 1.52 (с, 3H).
(s)-N-(4-Циано-3-(трифторметил)фенил)-3-(5,6-дифториндолин-1-ил)-2-гидрокси-2-метилпропанамид (108)

Способ A
Выход; 59%
МС (ИЭР) m/z 423.9 [M-H]-
1H ЯМР (400 МГц, CDCl3) δ 9.18 (уш с, 1H, NH), 8.09 (д, J = 2.0 Гц, 1H), 7.97 (дд, J = 8.4, 2.0 Гц, 1H), 7.80 (д, J = 8.4 Гц, 1H), 6.89 (т, J = 8.8 Гц, 1H), 6.43 (м, 1H), 3.64 (д, J = 14.4 Гц, 1H), 3.46 (с, 1H, OH), 3.40-3.35 (м, 2H), 3.17 (д, J = 14.4 Гц, 1H), 2.99-2.91 (м, 2H), 1.57 (с, 3H).
(s)-N-(4-Циано-3-(трифторметил)фенил)-2-гидрокси-3-(индолин-1-ил)-2-метилпропанамид (109)

Способ A
Выход 69%;
МС (ИЭР) m/z 387.8 [M-H]-;
1H ЯМР (400 МГц, CDCl3) δ 9.24 (уш с, 1H, NH), 8.09 (д, J = 2.0 Гц, 1H), 7.94 (дд, J = 8.8, 2.0 Гц, 1H), 7.79 (д, J = 2.0 Гц, 1H), 7.13-7.10 (м, 2H), 6.78 (дт, J = 8.0, 0.8 Гц, 1H), 6.62 (д, J = 8.0, 1H), 3.77 (уш с, 1H, OH), 3.66 (д, J = 14.4 Гц, 1H), 3.54 (т, J = 8.4 Гц, 1H), 3.46-3.40 (м, 1H), 3.30 (д, J = 14.4 Гц, 1H), 3.04-2.92 (м, 2H), 1.57 (с, 3H).
(s)-N-(3-Хлор-4-цианофенил)-3-(5,6-дифториндолин-1-ил)-2-гидрокси-2-метилпропанамид (110)
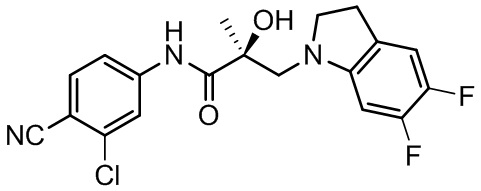
Способ A
Выход 64%;
МС (ИЭР) m/z 390.0 [M-H]-;
1H ЯМР (400 МГц, CDCl3) δ 9.05 (уш с, 1H, NH), 7.98 (с, 1H), 7.62 (д, J = 8.2 Гц, 1H), 7.53 (д, J = 8.2 Гц, 1H), 6.88 (т, J = 8.8 Гц, 1H), 6.43 (м, 1H), 3.64 (д, J = 14.4 Гц, 1H), 3.46 (с, 1H, OH), 3.44 (м, 1H), 3.42-3.34 (м, 1H), 3.16 (д, J = 14.4 Гц, 1H), 3.95-3.88 (м, 2H), 1.55 (с, 3H).
(s)-3-(5-Броминдолин-1-ил)-N-(3-хлор-4-цианофенил)-2-гидрокси-2-метилпропанамид (114)
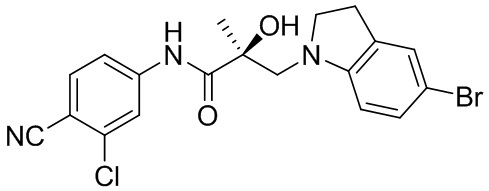
Способ A
Выход 54%;
МС (ИЭР) m/z 433.6 [M-H]-;
1H ЯМР (400 МГц, CDCl3) δ 9.04 (уш с, 1H, NH), 7.98 (д, J = 2.0 Гц, 1H), 7.60 (д, J = 6.0 Гц, 1H), 7.52 (дд, J = 6.0, 2.0 Гц, 1H), 7.19-7.17 (м, 2H), 6.49 (д, J = 8.4 Гц, 1H), 3.65 (д, J = 14.4, 1H), 3.47 (уш с, 1H, OH), 3.36-3.41 (м, 1H), 3.32 (кв, J = 9.2 Гц, 1H), 3.23 (д, J = 14.4, 1H), 2.99-2.91 (м, 2H), 1.56 (с, 3H).
(s)-N-(3-Хлор-4-цианофенил)-3-(5-фтор-6-фенилиндолин-1-ил)-2-гидрокси-2-метилпропанамид (115)

К раствору (s)-N-(3-хлор-4-цианофенил)-3-(5-фтор-6-фенил-1H-индол-1-ил)-2-гидрокси-2-метилпропанамида (34, 0.185 г, 0.000413 моль) в 5 мл ледяной уксусной кислоты, который охлаждали в бане с ледяной водой, добавляли по каплям цианоборогидрид натрия (1.0 M в ТГФ, 0.62 мл, 0.00124 моль) в атмосфере аргона. После добавления полученную реакционную смесь перемешивали в течение ночи при комнатной температуре в атмосфере аргона. Реакцию гасили водным раствором NH4Cl, экстрагировали этилацетатом. Органический слой дважды промывали соляным раствором, сушили над MgSO4, фильтровали и концентрировали в вакууме. Продукт очищали колонкой с силикагелем, используя этилацетат и гексан (1:2) в качестве элюента, чтобы получить 0.17 г указанного в названии соединения в виде желтоватой пены.
1H ЯМР (400 МГц, ДМСО-d6) δ10.29 (с, 1H, NH), 8.21 (д, J = 2.0 Гц, 1H, ArH), 7.92-7.84 (м, 2H, ArH), 7.45-7.34 (м, 5H, ArH), 6.95 (д, J = 10.4 Гц, 1H, ArH), 6.55 (д, J = 6.4 Гц, 1H, ArH), 6.02 (с, 1H, OH), 3.61 (кв, J = 8.8 Гц, 1H, CH), 4.50 (д, J = 14.4 Гц, 1H, CH), 3.40 (д, J = 14.4 Гц, 1H, CH), 4.19 (д, J = 14.4 Гц, 1H, CH), 2.91 (т, J = 8.4 Гц, 2H, CH2), 1.42 (с, 3H, CH3).
Масс (ИЭР, Отрицательная): [M-H]-; (ИЭР, Позитивная): 450.1394[M+H]+.
Производные индазола
(s)-N-(4-Циано-3-(трифторметил)фенил)-3-(5-фтор-1H-индазол-1-ил)-2-гидрокси-2-метилпропанамид (90, 91)

Способ B
Выход; 67%
МС (ИЭР) 405.1 [M-H]-
1H ЯМР (400 МГц, CDCl3) δ 9.16 (уш с, 1H, NH), 8.05-7.88 (м, 2H), 7.81-7.72 (м, 2H), 7.62-7.13 (м, 4H), 6.72 (уш с, OH, 0.56H), 6.15 (с, OH, 0.44H), 4.94 (д, J = 13.6 Гц, 0.56H), 4.95 (д, J = 14.2 Гц, 0.46H), 4.52 (д, J = 13.6 Гц, 0.56H), 4.43 (д, J = 14.2 Гц, 0.46H), 1.53 (с, 3H).
(s)-N-(3-Хлор-4-цианофенил)-3-(5-фтор-1H-индазол-1-ил)-2-гидрокси-2-метилпропанамид (92, 93)

Способ B
Выход; 74%
МС (ИЭР) 370.8 [M-H]-
1H ЯМР (400 МГц, CDCl3) δ 8.97 (уш с, 1H, NH), 7.99 (с, 0.56H), 7.95 (с, 0.46H), 7.83 (д, J = 2.4 Гц, 0.46H), 7.83 (д, J = 2.0 Гц, 0.54H), 7.64-7.45 (м, 2H), 7.39-7.31 (м, 1H), 7.24-7.22 (м, 1H), 7.16-7.11 (м, 1H), 6.63 (с, OH, 0.46H), 6.04 (с, OH, 0.54H), 4.92 (д, J = 13.6 Гц, 0.46H), 4.92 (д, J = 14.0 Гц, 0.54H), 4.50 (д, J = 13.6 Гц, 0.46H), 4.40 (д, J = 14.0 Гц, 0.54H), 1.58 (с, 3H).
ПРИМЕР 5
Связывание рецептора андрогена, трансактивация и метаболизм SARD на основе индола
Анализ связывания лиганда
Цель: Определить сродство связывания SARD к AR-LBD.
Способ: hAR-LBD (633-919) клонировали в pGex4t.1. Крупномасштабный AR-LBD с маркировкой GST был приготовлен и очищен с использованием колонки GST. Рекомбинантный AR-LBD объединяли с [3H]миболероном (PerkinElmer, Waltham, MA) в буфере A (10 мМ Трис, pH 7.4, 1.5 мМ динатриевой EDTA, 0.25 М сахарозы, 10 мМ молибдата натрия, 1 мМ PMSF) для определения константы равновесной диссоциации (Kd) [3H]миболерона. Белок инкубировали с увеличением концентрации [3H]миболерона и без высокой концентрации немеченого миболерона при 4°C в течение 18 ч для определения общего и неспецифического связывания. Затем неспецифическое связывание вычитали из полного связывания для определения специфического связывания и нелинейной регрессии для кривой связывания лиганда с одним насыщением участка для определения Kd миболерона.
Увеличивающиеся концентрации SARD или DHT (диапазон от 10-12 до 10-2 М) инкубировали с [3H]миболероном и AR LBD с использованием условий, описанных выше. После инкубации связанный с лигандом AR-LBD-комплекс выделяли с использованием BiogelHT® гидроксиапатита, промывали и подсчитывали в сцинтилляционном счетчике после добавления сцинтилляционного коктейля. Значения выражаются как Ki.
Анализ трансактивации для wt и мутантного AR
Цель: Для определения влияния SARD на андроген-индуцированную трансактивацию AR дикого типа (wt.) или AR, несущей известные AR-LBD-мутанты (то есть W741L или T877A).
Способ: Клетки HEK-293 высевали в 125,000 клеток/лунка планшета с 24 лунками в DME + 5% csFBS без фенольного красного. Клетки трансфицировали 0,25 мкг GRE-LUC, 10 нг СМV-renilla LUC и 50 нг СМV-hAR (wt) или СМV-hAR (W741L) или СМV-hAR (T877A) с использованием реагента для трансфекции липофектамина в среде optiMEM. Среда была изменена через 24 часа после трансфекции до DME + 5% csFBS без фенольного красного и обрабатывалась дозовым ответом различных лекарств (Таблица 1: 11-18, 20-27, 30, 31, 33, 70-74) (от 1 пM до 10 мкМ). SARD и антагонисты обрабатывали в комбинации с 0.1 нM R1881. Анализ люциферазы проводили через 24 часа после обработки на планшетном считывателе Biotek synergy 4. Значения люциферазы светлячков были нормированы на значения люциферазы renilla. Для Фигуры 1A-1C, следующие вариации способа были использованы:
Клетки HEK высевали в 24-луночные планшеты при 60 000 клеток на лунку в DMEM + 5% csFBS без фенольного красного. После инкубации в течение ночи изменяли среду до OptiMEM (0.25 мл). Все лунки трансфицировали 0.25 мкг GRE-LUC, 5 нг СМV-renilla LUC и 25 нг СМV-hAR. Через двадцать четыре часа после трансфекции среду заменяли 1 мл DME + 5% csFBS без фенольного красного. Через 24 ч после трансфекции клетки обрабатывали с 20, 18, и 14 (Фигура 1A), 12 и 11 (Фигура 1B), 11, 27, и 23 (Фигура 1C), 34-42 (Фигуры 29A, 29B, 29D, 29E, 29F, 29Г, 29H, 29I, 29K, 29O) и были собраны через 48 часов после трансфекции и светлячка и проводили анализ люциферазы renilla.
Трансактивация. Клетки HEK-293 высевали на 120000 клеток на лунку планшета с 24 лунками в DME+5% csFBS. Клетки трансфицировали с использованием Липофектамина (Invitrogen, Carlsbad, CA) с 0.25 мкг GRE-LUC, 0.01 мкг СМV-LUC (люцифераза renilla) и 25 нг AR. Клетки обрабатывали через 24 часа после трансфекции, как указано в фигурах, и анализ люциферазы проводили через 48 часов после трансфекции. Данные представлены как IC50, полученные из четырех параметров логистической кривой.
Разрушение AR с использованием соединений настоящего изобретения
Цель: Для определения эффективности и активности деградации AR с помощью соединений SARD в клетках AD1, LNCaP (T877A AR) или 22RV-1 (AR поной длины и урезанного варианта AR-сплайсинга (AR-V7)) клеточных линий.
Способ: Смотри ПРИМЕР 6 ниже.
Определение метаболической стабильности (in vitro CLint) испытуемых соединений:
Фаза I метаболизма
Анализ проводили в конечном объеме 0,5 мл в дубликатах (n = 2). Испытуемое соединение (1 мкМ) предварительно инкубировали в течение 10 минут при 37 °С в 100 мМ Трис-HCl, рН 7.5, содержащем микросомальный белок 0.5 мг/мл печени. После предварительной инкубации реакцию начинали добавлением 1 мМ НАДФН (предварительно инкубированном при 37°С). Инкубации проводили в трех повторностях, и в различные моменты времени (0.5, 10, 15, 30 и 60 минут) 100 мкл аликвоты отбирали и гасили с 100 мкл ацетонитрила, содержащего внутренний стандарт. Образцы перемешивали на вихревой мешалке и центрифугировали при 4000 об/мин в течение 10 минут. Супернатанты переносили в 96-луночные планшеты и представляли для анализа ЖХ-MС/MС. В качестве контроля были включены инкубации образцов, выполненные в отсутствие НАДФН. Из %PCR (% оставшегося исходного соединения) определяют скорость исчезновения соединения (наклон) и вычисляют in vitro CLint (мкл/мин/мг белка).
Метаболическая стабильность в путях Фазы I и Фазы II
В этом анализе тестируемое соединение инкубировали с микросомами печени и определяли исчезновение лекарственного средства с использованием оценки ЖХ-MС/MС для обнаружения. Чтобы стимулировать метаболический путь Фазы II (глюкуронидирование), UDPGA и аламетицин были включены в анализ.
ЖХ-MС/MС анализ: Анализ исследуемых соединений проводили с использованием системы ЖХ-МС/МС, состоящей из ВЭЖХ Agilent 1100 с масс-спектрометром MDS/Sciex 4000 Q-Trap™. Разделение было достигнуто с использованием аналитической колонки (Alltima™, 2.1 X 100 мм, 3 мкм) защищенной системой защитных картриджей C18 (SecurityGuard™ ULTRA картриджи УВЭЖХ для 4.6 мм ID колонок, Phenomenex). Подвижная фаза состояла из канала А (95% ацетонитрил + 5% вода + 0.1% муравьиная кислота) и канала C (95% вода + 5% ацетонитрил + 0.1% муравьиная кислота) и подавалась со скоростью потока 0.4 мл/мин. Соотношение объема ацетонитрила и воды оптимизировано для каждого из анализируемых веществ. Сканирование мониторинга множественных реакций (мRM) проводи с помощью газовой завесы, газа для соударений, распылителя раза, и вспомогательного газа, оптимизированного для каждого соединения, и температуры источника при 550°C. Молекулярные ионы были сформированы с использованием напряжения распыления ионов (IS) -4200 В (отрицательный режим). Для каждого соединения были оптимизированы потенциал расщепления (DP), потенциал входа (EP), энергия столкновения (CE), масса ионов продукта и потенциал выхода клеток (CXP).

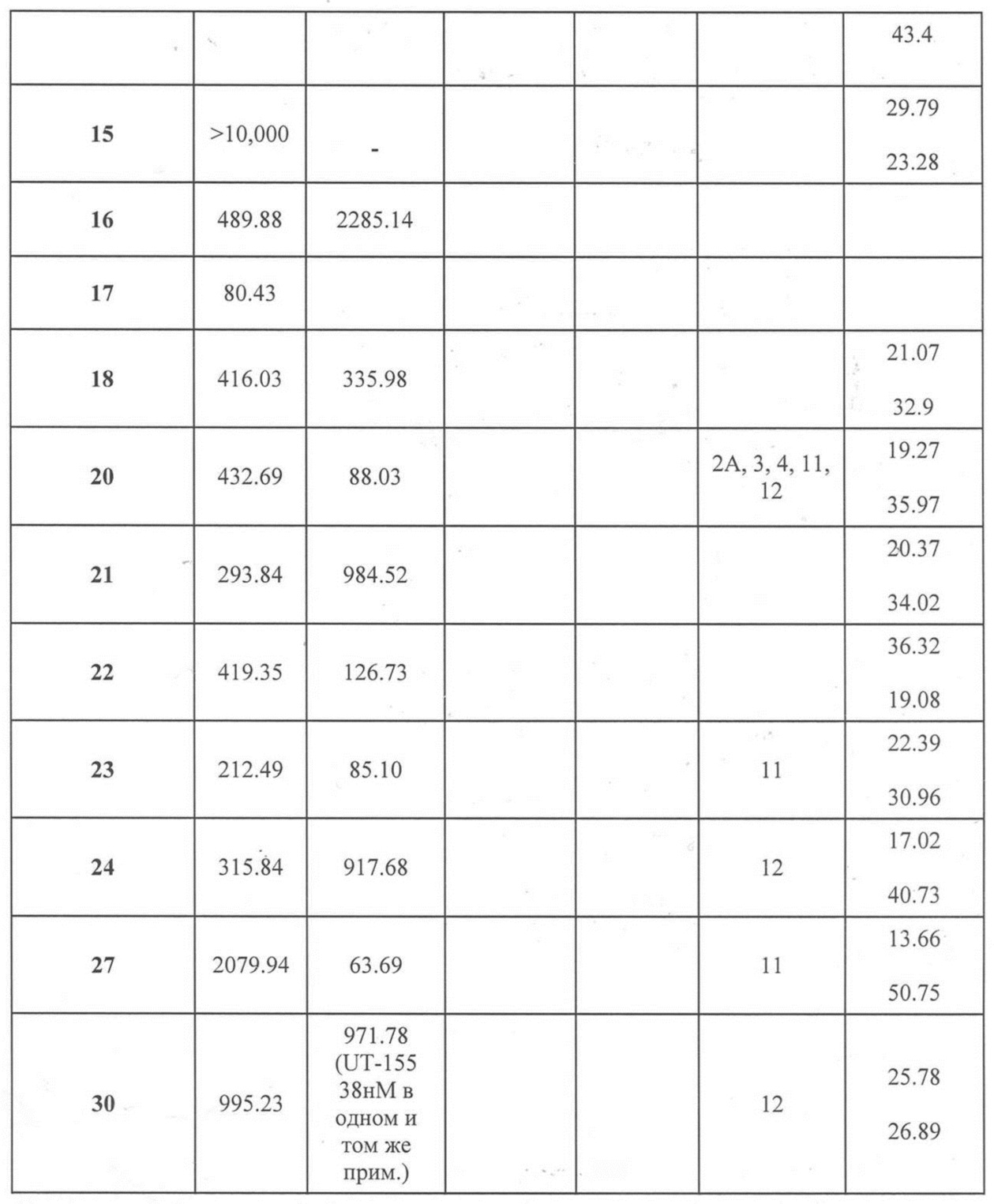

Короткие периоды полураспада (t1/2) и высокие значения метаболического клиренса (CLint) многих соединений по настоящему изобретению предполагают быстрый клиренс плазмы in vitro, который может быть благоприятным для местного лечения андрогенных дерматологических расстройств, поскольку он ограничивает риск системных побочных эффектов, даже при проникновении через кожу.
Таблица 2: Сродство связывания соединений SARD понастоящему изобретению
Фигура 1A-1C и Фигуры 29A-29O и Таблицы 1-3 показывают, что многие SARD по настоящему изобретению имели высокое сродство AR связывания (смотри таблицы) и более сильный АР-антагонизм in vitro (см. Таблицы 1, 2, 3 и фигуры, упомянутые выше и в таблицах), чем все другие протестированные антагонисты AR (бикалютамид, энзалутамид, ARN-509 и ASC-J9). Далее соединение 11 сохраняло активность сильнодействующего антагониста в двух резистентных тестируемых мутациях (Таблица 1) в отличие от протестированных известных антиандрогенов.



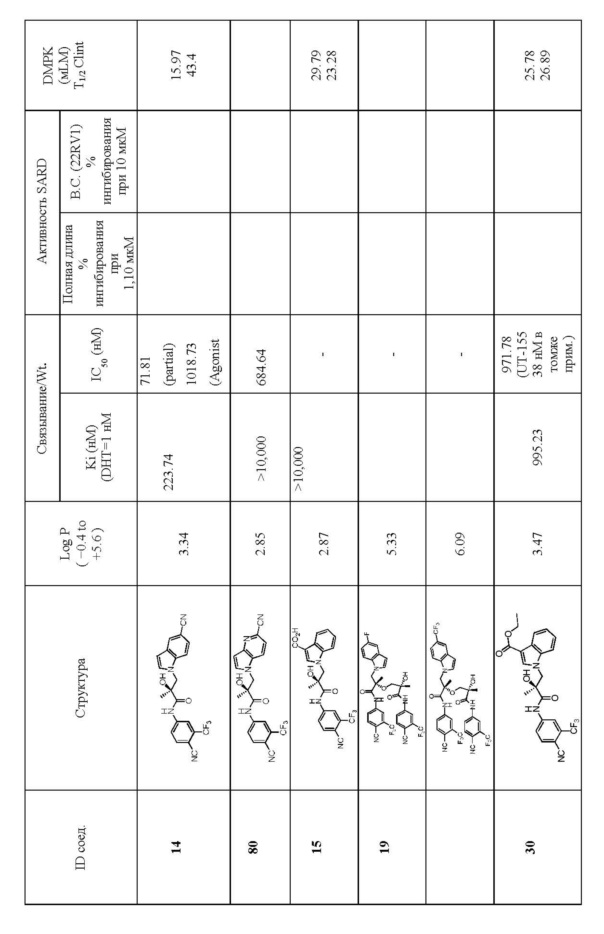

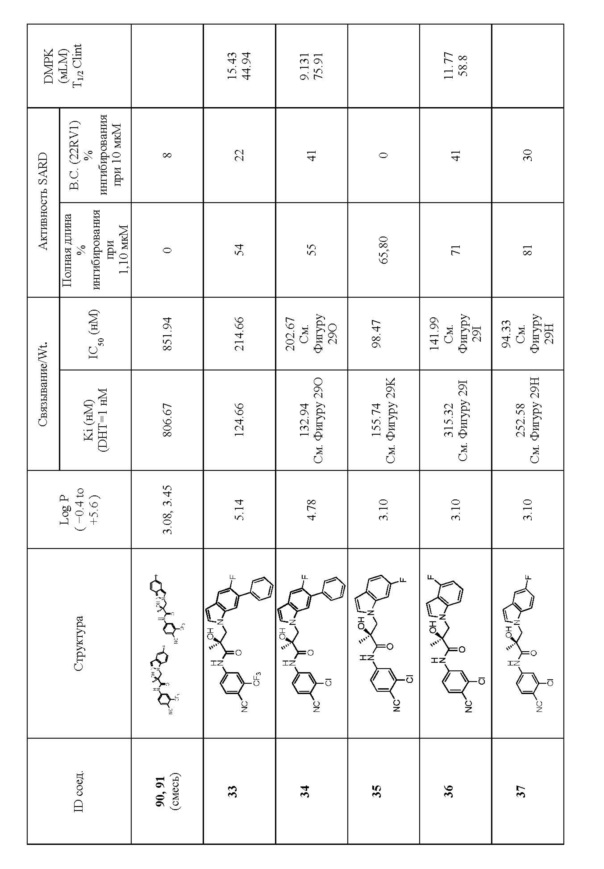



ПРИМЕР 6
Связывание и трансактивация андрогенного рецептора, деградация АР и метаболизм in vitro индолиновых, хинолоновых и изохинолиновых SARD
Анализ связывания лиганда
Цель: Определить сродство связывния SARD к AR-LBD.
Способ: hAR-LBD (633-919) клонировали в pGex4t.1. Крупномасштабный AR-LBD с маркировкой GST был приготовлен и очищен с использованием колонки GST. Рекомбинантный ARLBD объединяли с [3H]миболероном (PerkinElmer, Waltham, MA) в буфере A (10 мМ Трис, pH 7.4, 1.5 мМ динатриевой EDTA, 0.25 М сахарозы, 10 мМ молибдата натрия, 1 мМ PMSF) для определения константы равновесной диссоциации (Kd) [3H]миболерона. Белок инкубировали с увеличением концентрации [3H]миболерона и без высокой концентрации немеченого миболерона при 4°C в течение 18 ч для определения общего и неспецифического связывания. Затем неспецифическое связывание вычитали из полного связывания для определения специфического связывания и нелинейной регрессии для кривой связывания лиганда с одним насыщением участа для определения Kd миболерона.
Увеличивающиеся концентрации SARD или DHT (диапазон от 10-12 до 10-2 М) инкубировали с [3H]миболероном и AR LBD с использованием условий, описанных выше. После инкубации связанный с лигандом AR-LBD-комплекс выделяли с использованием BiogelHT® гидроксиапатита, промывали и подсчитывали в сцинтилляционном счетчике после добавления сцинтилляционного коктейля. Значения выражаются как Ki.
Анализ трансактивации для wt и мутантного AR
Цель: Для определения влияния SARD на андроген-индуцированную трансактивацию AR дикого типа (wt) или AR, несущей известные AR-LBD-мутанты (то есть W741L или T877A.
Способ: Клетки HEK-293 высевали в 125000 клеток/лунка планшета с 24 лунками в DME + 5% csFBS без фенольного красного. Клетки трансфицировали 0,25 мкг GRE-LUC, 10 нг СМV-renilla LUC и 50 нг СМV-hAR (wt) или СМV-hAR (W741L), или СМV-hAR (T877A) с использованием реагента для трансфекции липофекктамина в среде optiMEM. Среда была изменена через 24 часа после трансфекции до DME + 5% csFBS без фенольного красного и обрабатывалась дозовым ответом различных лекарств (от 1 пM до 10 мкМ). SARD и антагонисты обрабатывали в комбинации с 0.1 нM R1881. Анализ люциферазы проводили через 24 часа после обработки на планшетном считывателе Biotek synergy 4. Значения люциферазы светлячков были нормированы на значения люциферазы renilla. (Таблица 3)
Плазмидная конструкция и транзиентная трансфекция.
Для исследования трансактивации использовали AR человека, клонированный в векторную основу СМV. Клетки HEK-293 высевали на 120 000 клеток на лунку планшета с 24 лунками в DME+5% csFBS. Клетки трансфицировали с использованием Липофектамина (Invitrogen, Carlsbad, CA) с 0.25 мкг GRE-LUC, 0.01 мкг СМV-LUC (люцифераза renilla) и 25 нг AR. Клетки обрабатывали через 24 часа после трансфекции, как указано в фигурах, и анализ люциферазы проводили через 48 часов после трансфекции. Данные представлены как IC50, полученные из четырех параметров логистической кривой.
Анализ связывания лиганда.
hAR-LBD (633-919) клонировали в pGex4t.1. Крупномасштабный AR-LBD с маркировкой GST готовили и очищали с использованием колонки GST. Рекомбинантный AR-LBD объединяли с [3H]миболероном (PerkinElmer, Waltham, MA) в буфере A (10 мМ Трис, pH 7.4, 1.5 мМ динатриевой EDTA, 0.25 М сахарозы, 10 мМ молибдата натрия, 1 мМ PMSF) для определения константы равновесной диссоциации (Kd) [3H]миболерона. Белок инкубировали с увеличением концентрации [3H]миболерона и без высокой концентрации немеченого миболерона при 4°C в течение 18 ч для определения общего и неспецифического связывания. Затем неспецифическое связывание вычитали из полного связывания для определения специфического связывания и нелинейной регрессии для кривой связывания лиганда с одним насыщением участа для определения Kd миболерона.
Увеличивающиеся концентрации SARD или DHT (диапазон от 10-12 до 10-2 М) инкубировали с [3H]миболероном и AR LBD с использованием условий, описанных выше. После инкубации связаный с лигандом AR-LBD-комплекс выделяли с использованием biogelHT гидроксиапатита, промывали и подсчитывали в сцинтилляционном счетчике после добавления сцинтилляционного коктейля. Значения выражаются как Ki.
Анализ экспрессии гена LNCaP.
Способ: Клетки LNCaP высевали на 15,000 клеток/лунка планшета с 96 лунками в RPMI + 1% csFBS без фенольного красного. Спустя сорок восемь часов после нанесения покрытия клетки обрабатывали дозовым ответом SARD. Спустя двадцать четыре часа после обработки РНК выделяли с использованием реагента с временем коагуляции клеток, синтезировали кДНК и измеряли экспрессию различных генов в реальном времени rtPCR (ABI 7900) с использованием такмановских праймеров и зондов. Результаты экспрессии гена были нормированы на GAPDH.
Анализ роста LNCaP.
Способ: Клетки LNCaP высевали на 10000 клеток/лунка планшета с 96 лунками в RPMI + 1% csFBS без фенольного красного. Клетки обрабатывали дозовым ответом SARD. Через три дня после обработки клетки снова обрабатывали. Через шесть дней после обработки клетки фиксировали и жизнеспособность клеток измеряли с помощью анализа SRB.
Деградация LNCaP или AD1.
Способ: Клетки LNCaP или AD1, экспрессирующие AR полной длины, высевали на 750000-1000000 клеток/лунка 6-луночного планшета в среде роста (RPMI + 10% FBS). Спустя двадцать четыре часа после нанесения покрытия среду заменяли на RPMI + 1% csFBS без фенольного красного и выдерживали в этой среде в течение 2 дней. Среду опять заменяли на RPMI + 1% csFBS без фенольного красного и клетки обрабатывали с SARD (от 1 нM до 10 мкM) в комбинации с 0.1 нM R1881. Через 24 ч обработки клетки промывали холодным PBS и собирали. Белок экстрагировали, используя соль-содержащий лизисный буфер с тремя циклами свободного оттаивания. Расчетную концентрацию белка и пять мкг общего белка загружали на SDS-PAGE, фракционировали и переносили в PVDF-мембрану. Мембрану исследовали с антителом AR N-20 от SantaCruz и актин-антителом от Sigma.
Деградации 22RV1 и D567es.
Способ: Клетки 22RV1 и D567es, экспрессирующие варианты AR-сплайсинга, высевали на 750000-1000000 клеток/лунка 6-луночного планшета в среде роста (RPMI + 10% FBS). Спустя двадцать четыре часа после нанесения покрытия, среду меняли и обрабатывали. Через 24-30 ч обработки клетки промывали холодным PBS и собирали. Белок экстрагировали, используя соль-содержащий лизисный буфер с тремя циклами свободного оттаивания. Расчетную концентрацию белка и пять мкг общего белка загружали на SDS-PAGE, фракционировали и переносили в PVDF-мембрану. Мембрану исследовали с антителом AR N-20 от SantaCruz и актин-антителом от Sigma.
Рост и экспрессия гена 22RV1.
Способы: Рост клеток оценивали, как описано выше, способом SRB. Клетки высевали в 96-луночный планшет в полной сыворотке и обрабатывали в течение 6 дней с изменением среды после 3-го дня. Исследования экспрессии генов проводили в клетках 22RV1, которые высевали в 96-луночный планшет при 10000 клеток/лунка в RPMI + 10% FBS. Через двадцать четыре часа после нанесения покрытия клетки обрабатывали в течение 3 дней, и выполняли исследования экспрессии генов, как описано ранее.
Определение метаболической стабильности (in vitro CLint) испытуемых соединений:
Фаза I метаболизма
Анализ проводили в конечном объеме 0,5 мл в дубликатах (n = 2). Испытуемое соединение (1 мкМ) предварительно инкубировали в течение 10 минут при 37°С в 100 мМ Трис-HCl, рН 7.5, содержащем 0.5 мг/мл микросомальный белок печени. После предварительной инкубации реакцию начинали добавлением 1 мМ НАДФН (предварительно инкубированном при 37°С). Инкубации проводили в трех повторностях и в различные моменты времени (0.5, 10, 15, 30 и 60 минут) 100 мкл аликвоты отбирали и гасили с 100 мкл ацетонитрила, содержащего внутренний стандарт. Образцы перемешивали на вихревой мешалке и центрифугировали при 4000 об/мин в течение 10 минут. Супернатанты переносили в 96-луночные планшеты и представляли для анализа ЖХ-MС/MС. В качестве контроля были включены инкубации образцов, выполненные в отсутствие НАДФН. Из % PCR (% оставшегося исходного соединения), определяют скорость исчезновения соединения (наклон) и вычисляют in vitro CLint (мкл/мин/мг белка).
Метаболическая стабильность в путях Фазы I и Фазы II
В этом анализе тестируемое соединение инкубировали с микросомами печени и определяли исчезновение лекарственного средства с использованием оценки ЖХ-MС/MС для обнаружения. Чтобы стимулировать метаболический путь Фазы II (глюкуронидирование), UDPGA и аламетицин были включены в анализ.
Анализ ЖХ-MС/MС:
Анализ исследуемых соединений проводили с использованием системы ЖХ-МС/МС, состоящей из ВЭЖХ Agilent 1100 с масс-спектрометром MDS/Sciex 4000 Q-Trap™. Разделение было достигнуто с использованием аналитической колонки (Alltima™, 2.1 X 100 мм, 3 мкм) защищенной системой защитных картриджей C18 (SecurityGuard™ ULTRA картриджи УВЭЖХ дляr 4.6 мм ID колонок, Phenomenex). Подвижная фаза состояла из канала А (95% ацетонитрил + 5% вода + 0.1% муравьиная кислота) и канала C (95% вода + 5% ацетонитрил + 0.1% муравьиная кислота) и подавалась со скоростью потока 0.4 мл/мин. Соотношение объема ацетонитрила и воды оптимизировано для каждого из анализируемых веществ. Сканирование мониторинга множественных реакций (мRM) проводи с помощью газовой завесы, газа для соударений, распылителя газа, и вспомогательного газа, оптимизированного для каждого соединения, и температуры источника при 550°C. Молекулярные ионы были сформированы с использованием напряжения распыления ионов (IS) -4200 В (отрицательный режим). Для каждого соединения были оптимизированы потенциал расщепления (DP), потенциал входа (EP), энергия столкновения (CE), масса ионов продукта и потенциал выхода клеток (CXP).




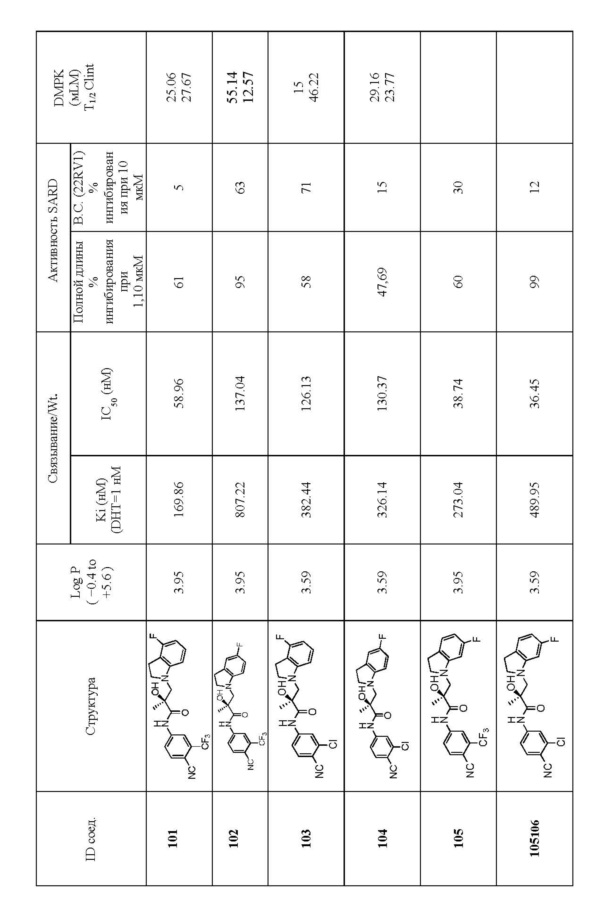



ПРИМЕР 7
Дерградация AR с использованием соединений по данному изобретению (индолы)
Анализ экспресси гена LNCaP
Цель: Определить влияние SARD на экспрессию гена AR-мишени в клетках LNCaP.
Способ: Клетки LNCaP высевали на 15,000 клеток/лунка планшета с 96 лунками в RPMI + 1% csFBS без фенольного красного. Спустя сорок восемь часов после нанесения покрытия клетки обрабатывали дозовым ответом SARD. Спустя шестнадцать-двадцать часов после обработки РНК выделяли с использованием реагента с временем коагуляции клеток, синтезировали кДНК и измеряли экспрессию различных генов в реальном времени rtPCR (ABI 7900) с использованием такмановских праймеров и зондов. Результаты экспрессии гена были нормированы на GAPDH.
Анализ роста LNCaP
Цель: Определить влияние SARD на рост клеток LNCaP.
Способ: Клетки LNCaP высевали на 10,000 клеток/лунка планшета с 96 лунками в RPMI + 1% csFBS без фенольного красного. Клетки обрабатывали дозовым ответом SARD. Через три дня после обработки клетки снова обрабатывали. Через шесть дней после обработки клетки фиксировали и жизнеспособность клеток измеряли с помощью анализа SRB.
Анализ деградации LNCaP
Цель: Определить влияние SARD на экспрессию AR в клетках LNCaP.
Способ: Клетки LNCaP высевали на 750 000-1000000 клеток/лунка 6-луночного планшета в среде роста (RPMI + 10% FBS). Спустя двадцать четыре часа после нанесения покрытия среду меняли на RPMI + 1% csFBS без фенольного красного и выдерживали в этой среде в течение 2 дней. Среду опять заменяли на RPMI + 1% csFBS без фенольного красного и клетки обрабатывали с SARD (от 1 нM до 10 мкM) в комбинации с 0.1 нM R1881. Через 16-20 ч обработки клетки промывали холодным PBS и собирали. Белок экстрагировали, используя соль-содержащий лизисный буфер с тремя циклами свободного оттаивания. Расчетную концентрацию белка и пять мкг общего белка загружали на SDS-PAGE, фракционировали и переносили в PVDF-мембрану. Мембрану исследовали с антителом AR N-20 от SantaCruz и актин-антителом от Sigma.
Анализ дегрдации 22RV-1
Цель: Определить влияние SARD на AR-полной длины и экспрессию варианта сплайсинга в клетках 22RV-1.
Способ: Клетки 22RV-1 высевали на 750 000-1000000 клеток/лунка 6-луночного планшета в среде роста (RPMI + 10% FBS). Спустя двадцать четыре часа после нанесения покрытия, среду меняли и обрабатывали. Через 16-20 ч обработки клетки промывали холодным PBS и собирали. Белок экстрагировали, используя соль-содержащий лизисный буфер с тремя циклами свободного оттаивания. Расчетную концентрацию белка и пять мкг общего белка загружали на SDS-PAGE, фракционировали и переносили в PVDF-мембрану. Мембрану исследовали с антителом AR N-20 от SantaCruz и актин-антителом от Sigma.
Фигура 2A представляет деградацию в клетах LNCaP с использованием 11 и 20. Клетки LNCaP высевали в 6-луночные планшеты с 1 млн клеток/лунка. Клетки выдерживали в сыворотке в течение 3 дней. Клетки обрабатывали, как указано в фигуре, собирали, белок экстрагировали и проводили вестерн-блоттинг для АR. 11 продемонстрировал селективную деградацию AR (то есть, активность SARD) в диапазоне нM, то есть в концентрациях, сравнимых с его значением IC50 антагониста. Известно, что клетки LNCaP экспрессируют AR-мутант T877A, демонстрируя способность деградировать резистентно к рецепторам мутантных андрогенов.
Фигура 2B представляет эффект антагонистов AR и SARD на рост клеток LNCaP: Клетки LNCaP высевали в 96-луночные планшеты при 10000 клеток/лунка в RPMI + 1% csFBS без фенольного красного. Клетки обрабатывали, как указано в фигуре, в комбинации с 0,1 нМ R1881 в течение 6 дней с изменением среды на 3-й день. По истечении 6 дней клетки фиксировали и окрашивали сульфородаминовым синим красителем. 11 продемонстрировал более сильную антипролиферативную активность в клетках LNCaP при 1 и 10 мкМ по сравнению с энзалутамид и ARN-509.
Фигура 3 представляет деградацию AR-V7 (PC3-AR-V7 клеткиs) с использованием 11, 12 и 20 при 1 мкМ и 10 мкМ. Клетки рака предстательной железы PC-3 были сывороткой, стабильно трансфицированной с помощью конструкции лентивируса для AR-V7. Как только стабильные клетки были выбраны, клетки высевали в 6-луночные планшеты с 1 миллионом клеток/лунка. Клетки обрабатывали, как указано в фигуре, и вестерн-блоттингом, выполненного для АR и актина. Результаты показывают, что SARD имеют потенциал для деградации обрезанной версии AR, тогда как энзалутамид или ARN-509 не влияют на экспрессию AR-V7.
Соединения SARD по данному изобретению разрушают AR-SV в клетках 22RV-1
Фигура 4 - 22RV-1 Western blot: Клетки 22RV-1 высевали в 6-луночный планшет при 1-1,5 млн клеток/лунка в среде роста (RPMI + 10% FBS). На следующий день среду меняли и обрабатывали несущей средой или дозовым ответом 20. После ночной обработки (12-16 часов) клетки промывали в ледяном PBS и собирали путем разделения в 1 мл PBS. Клетки подвергали гранулированию, белок экстрагировали, количественно определяли с использованием анализа BCA и равное количество белка фракционировали на SDS-PAGE. Белки переносили на нейлоновую мембрану и проводили вестерн-блоттинг с AR-антителом (N20 из SCBT) и актин-антителом. 20 был способен разрушать рецепторы андрогенов (AR-FL) и обрезанные AR (AR-SV) в клетках 22RV-1, что указывает на то, что SARD могут преодолевать AR-V7 зависимые раковые заболевания предстательной железы (например, CRPC). 11 деградировал AR-FL, но не актин в клетках LNCaP (Фигура 5) и AR-FL и AR-SV в клетках 22RV-1 (Фигура 6). Фигура 6 показывает, что 11 деградировал AR-FL и AR-V7 в концентрациях нМ (Фигура 6C), тогда как ARN-509 не деградировал их (Фигура 6B) Хотя ASC-J9 обнаружил некоторую деградацию в диапазоне нM, концентрации мкM не привели к деградации AR (Фигура 6A). 11 также ингибировал AR-зависимую экспрессию гена в клетках LNCaP, трансактивацию AR в клетках 22RV-1 и клеточный рост в обоих типах клеток (Таблица 8 и Таблица 9). В совокупности эти наблюдения показывают, что SARD по настоящему изобретению могут быть полезны при раках предстательной железы, которые зависят от мутантных AR, AR-FL и/или AR-SV.
Фигура 11 представляет деградацию в клетках LNCaP с использованием 27, 20, 12, 23 и 32. Клетки LNCaP высевали в 6-луночные планшеты с 1 млн клеток/лунка. Клетки выдерживали в бессывороточных условиях в течение 3 дней. Клетки обрабатывали, как указано в фигуре, собирали, белок экстрагировали и вестерн-блоттингом для АR. Все SARD продемонстрировали селективную деградацию AR (то есть, активность SARD) в концентрациях, сравнимых с их значениями IC50 антагониста. Известно, что клетки LNCaP экспрессируют AR-мутант T877A, демонстрируя способность деградировать антиандрогенную резистентность, дающую рецепторы мутантного андрогена (то есть прогрессирующе раковые заболевания предстательной железы и CRPC).
Фигура 12: 22RV-1 вестерн блоттинг: клетки 22RV-1 высевали в 6-луночные планшеты при 1-1,5 млн. клеток/лунка в среде роста (RPMI + 10% FBS). На следующий день среду меняли и обрабатывали несущей средой или дозовым ответом 20, 24 и 30. После ночной обработки (12-16 часов) клетки промывали в ледяном PBS и собирали путем разделения в 1 мл PBS. Клетки подвергали гранулированию, белок экстрагировали, количественно определяли с использованием анализа BCA и равное количество белка фракционировали на SDS-PAGE. Белки переносили на нейлоновую мембрану и проводили вестерн-блоттинг с AR-антителом (N20 из SCBT) и актин-антителом. 20, 24 и 30 были способны разрушать рецепторы андрогенов (AR-FL) и обрезанные AR (AR-SV) в клетках 22RV-1, что указывает на то, что SARD могут преодолевать AR-V7 зависимые раковые заболевания предстательной железы (например, CRPC).
Фигура 13 представляет деградацию в клетках LNCaP и клетках 22RV-1 с использованием 31 против галогена. Эксперименты выполнялись описанными выше способами. Дозовый ответ SARD 31 продемонстрировал способность деградировать АR-полной длины в линиях клеток LNCaP и 22RV-1, тогда как галетерону не удалось существенно снизить AR в обеих клеточных линиях.
Фигура 14 представляет деградацию в клетках LNCaP с использованием 12 против ARN-509. 12 и ARN-509 оба продемонстрировали способность деградировать АR в клетках LNCaP, однако 12 продемонстрировали активность при 1 мкМ, тогда как ARN-509 продемонстрировала активность только при 10 мкМ.
Фигура 15 представляет деградацию в клетках 22RV-1 с использованием 31. 31 продемонстрировал способность деградировать AR-FL и AR-SV в клетках 22RV-1 при 10 мкМ уровнях активации актина (то есть селективной деградации AR).
Фигура 16 представляет деградацию в клетках LNCaP с использованием 70 и 73. Используя способы, описанные в подписи для Фигуры 11 (LNCaP), активность SARD для 70 и 73 была продемонстрирована при концентрациях до 100 нМ. Это демонстрирует, что бензимидазолы по настоящему изобретению также демонстрируют мощную активность SARD.
Эти демонстрации активности SARD показывают, что соединения по настоящему изобретению способны деградировать различные варианты AR и, следовательно, должны обеспечивать способность ингибировать активность оси AR независимо от того, является ли она андроген-зависимой или андроген-независимой. Деградация AR устраняет возможность беспорядочной автивации мутантных AR, активацию внутриклеточными процессами, таких как трансдукция сигнала и активация киназы и т.д.; и предполагает, что SARD также должны разрушать полиморфизмы polyQ в гиперандрогенных дерматологических расстройствах (сокращенном polyQ) или болезни Кеннеди (расширенном polyQ), обеспечивая обоснование для лечения любого типа заболевания путем разрушения AR в пораженных тканях (кожа и нервно-мышечная система, соответственно).
Таблица 8: Ингибирование роста и экспрессии генов клеток PCA LNCaP
Таблица 9: Влияние SARD на AR-трансактивацию и рост 22RV-1
ПРИМЕР 8
Дергадация AR с использованием индолиновых, хинолиновых или изoхинолиновых соединений SARD по данному изобретению
Плазмидные конструкции и переходная трансфекция.
Человеческий AR, клонированный в векторную магистраль СМV, использовался для исследования трансактивации. Клетки HEK-293 высевали на 120,000 клеток на лунку планшета с 24 лунками в DME + 5% csFBS. Клетки трансфицировали с использованием Липофектамина (Invitrogen, Carlsbad, CA) с 0.25 мкг GRE-LUC, 0.01 мкг СМV-LUC (люцефираза renilla) и 25 нг AR. Клетки обрабатывали через 24 часа после трансфекции, как указано в фигурах, и анализ люциферазы проводили через 48 часов после трансфекции. Данные представлены как IC50, полученные из четырех параметров логистической кривой.
Анализ связывания лиганда.
hAR-LBD (633-919) клонировали в pGex4t.1. Крупномасштабный AR-LBD с маркировкой GST готовили и очищали с использованием колонки GST. Рекомбинантный ARLBD объединяли с [3H]миболероном (PerkinElmer, Waltham, MA) в буфере A (10 мМ Трис, pH 7.4, 1.5 мМ динатриевой EDTA, 0.25 М сахарозы, 10 мМ молибдата натрия, 1 мМ PMSF) для определения константа равновесной диссоциации (Kd) [3H]миболерона. Белок инкубировали с увеличением концентрации [3H]миболерона и без высокой концентрации немеченого миболерона при 4°C в течение 18 ч для определения общего и неспецифического связывания. Затем неспецифическое связывание вычитали из полного связывания для определения специфического связывания и нелинейной регрессии для кривой связывания лиганда с одним насыщением участа для определения Kd миболерона.
Увеличивающиеся концентрации SARD или DHT (диапазон от 10-12 до 10-2 М) инкубировали с [3H]миболероном и AR LBD с использованием условий, описанных выше. После инкубации связанный с лигандом AR-LBD-комплекс выделяли с использованием biogelHT гидроксиапатита, промывали и подсчитывали в сцинтилляционном счетчике после добавления сцинтилляционного коктейля. Значения выражаются как Ki.
Анализ экспресси гена LNCaP.
Способ: Клетки LNCaP высевали на 15,000 клеток/лунка планшета с 96 лунками в RPMI + 1% csFBS без фенольного красного. Спустя сорок восемь часов после нанесения покрытия клетки обрабатывали дозовым ответом SARD. Спустя двадцать четыре часа после обработки РНК выделяли с использованием реагента с временем коагуляции клеток, синтезировали кДНК и измеряли экспрессию различных генов в реальном времени rtPCR (ABI 7900) с использованием такмановских праймеров и зондов. Результаты экспрессии гена были нормированы на GAPDH.
Анализ роста LNCaP.
Способ: Клетки LNCaP высевали на 10,000 клеток/лунка планшета с 96 лунками в RPMI + 1% csFBS без фенольного красного. Клетки обрабатывали дозовым ответом SARD. Через три дня после обработки клетки снова обрабатывали. Через шесть дней после обработки клетки фиксировали и жизнеспособность клеток измеряли с помощью анализа SRB.
Деградация LNCaP или AD1.
Способ: Клетки LNCaP или AD1, экспрессирующие AR полной длины, высевали на 750 000-1000000 клеток/лунка 6-луночного планшета в среде роста (RPMI + 10% FBS). Спустя двадцать четыре часа после нанесения покрытия среду заменяли на RPMI + 1% csFBS без фенольного красного и выдерживали в этой среде в течение 2 дней. Среду опять заменяли на RPMI + 1% csFBS без фенольного красного и клетки обрабатывали с SARD (от 1 нM до 10 мкM) в комбинации с 0.1 нM R1881. Через 24 ч обработки клетки промывали холодным PBS и собирали. Белок экстрагировали, используя соль-содержащий лизисный буфер с тремя циклами свободного оттаивания. Расчетную концентрацию белка и пять мкг общего белка загружали на SDS-PAGE, фракционировали и переносили в PVDF-мембрану. Мембрану исследовали с антителом AR N-20 от SantaCruz и актин-антителом от Sigma.
Деградации 22RV1 и D567es.
Способ: Клетки 22RV1 и D567es, экспрессирующие варианты AR-сплайсинга, высевали на 750 000-1000000 клеток/лунка 6-луночного планшета в среде роста (RPMI + 10% FBS). Спустя двадцать четыре часа после нанесения покрытия, среду меняли и обрабатывали. Через 24-30 ч обработки клетки промывали холодным PBS и собирали. Белок экстрагировали, используя соль-содержащий лизисный буфер с тремя циклами свободного оттаивания. Расчетную концентрацию белка и пять мкг общего белка загружали на SDS-PAGE, фракционировали и переносили в PVDF-мембрану. Мембрану исследовали с антителом AR N-20 от SantaCruz и актин-антителом от Sigma.
Рост и экспрессия гена 22RV1.
Способы: Рост клеток оценивали, как описано выше, способом SRB. Клетки высевали в 96-луночный планшет в полной сыворотке и обрабатывали в течение 6 дней с изменением среды после 3-го дня. Исследования экспрессии генов проводили в клетках 22RV1, которые высевали в 96-луночный планшет при 10,000 клеток/лунка в RPMI + 10% FBS. Через двадцать четыре часа после нанесения покрытия клетки обрабатывали в течение 3 дней, и выполняли исследования экспрессии генов, как описано ранее.
Результаты:
Фигура 18 представляет деградацию в клетах LNCaP с использованием 100 в сравнении с ARN-509. Клетки LNCaP высевали в 6-луночные планшеты с 1 млн клеток/лунка. Клетки выдерживали в сыворотке в течение 3 дней. Клетки обрабатывали, как указано в фигуре, собирали, белок экстрагировали и проводили вестерн-блоттинг для АR. 100 продемонстрировал селективную деградацию AR (то есть, активность SARD) в диапазоне нM, то есть в концентрациях, сравнимых с его значением IC50 антагониста, тогда как ARN-509 продемонстрировал только активность SARD при самой высокой тестируемой концентрации. Известно, что клетки LNCaP экспрессируют AR-мутант T877A, демонстрируя способность соединений по настоящему изобретению деградировать антиандроген резистентно к рецепторам мутантных андрогенов.
Фигура 19 демонстрирует через вестерн-блот, что 100, 102, и 130 деградирует AR-FL и AR-SV в клетках 22RV-1. Клетки 22RV-1 высевали в 6-луночный планшет при 1-1,5 млн. клеток/лунка в среде роста (RPMI + 10% FBS). На следующий день среду меняли и обрабатывали несущей средой или дозововым ответом 100, 102, и 130. После ночной обработки (12-16 часов) клетки промывали ледяным PBS и собирали путем разделения в 1 мл PBS. Клетки подвергали гранулированию, белок экстрагировали, количественно определяли с использованием анализа BCA и равное количество белка фракционировали на SDS-PAGE. Белки переносили на нейлоновую мембрану и проводили вестерн-блоттинг с AR-антителом (N20 из SCBT) и актин-антителом. 87, 43, и 35 были способны разрушать рецепторы андрогенов (AR-FL) и обрезанные AR (AR-SV) в клетках 22RV-1, что указывает на то, что SARD могут преодолевать AR-V7 зависимые раковые заболевания предстательной железы (например, CRPC).
Фигура 20 показует деградацию в клетках 22RV-1 с использованием 130 против галетерона. Используя способы, описанные в подписи для Фигуры 18 (22RV-1), 130 сравнивали с галетероном (клиническое описание SARD). 130 демонстрировал активность SARD в клетках 22RV-1 (рост, зависящий от AR-SV, варианта AR без LBD), который был сопоставим с галетероном.
Фигура 21 показует деградацию в клетках LNCaP с использованием 135 и 102. Используя способы, описанные в подписи для Фигуры 1, были продемонстрированы активности SARD для 135 и 102. Эти соединения частично и полностью деградировали мутант AR (T877A), предполагая, что SARD, такие как эти, могут быть полезны при прогрессирующем раке предстательной железы и/или CRPC.
Фигура 22 показует деградацию в клетках LNCaP и клетках 22RV-1 с использованием 103 и 104. Используя способы, описанные в подписях для Фигуры 1 (LNCaP) и Фигуры 2 (22RV-1), 103 и 104 демонстрировали активность SARD в обоих LNCaP (мутант AR, несущий мутацию T877A) и 22RV-1 (рост, зависящий от AR-SV, варианта AR без LBD) клетках.
Фигура 23 показует деградацию в клетках 22RV-1 с использованием 130. Используя способы, описанные в подписи для Фигуры 19, соединение 130 демонстрировало активность SARD по меньшей мере, при концентрации 10 мкМ.
Фигура 24 показует деградацию в клетках 22RV-1 с использованием 134 и 130. Используя способы, описанные в подписи для Фигуры 19, соединения 134 и 130 каждый демонстрировал активность SARD по меньшей мере, при концентрации 10 мкМ.
Фигура 25 показует деградацию в клетках LNCaPcells с использованием 101, 105, 106, 107 и 108. Клетки LNCaP, который высевали в 6-луночные планшеты при 500,000 клеток/лунка, выдерживали в RPMI + 1% csFBS без фенольного красного в течение 2 дней. Клетки обрабатывали, как указано выше, в комбинации с 0,1 нМ R1881 в течение 24 часов. Клетки собирали через 24 часа после обработки, белок экстрагировали, вестерн-блоттингом с AR-антителом (Santacruz AR N-20) и актин-антителом. 101, 105, 106, 107 и 108 продемонстрировали способность разрушать AR в диапазоне нM.
Эти демонстрации активности SARD показывают, что соединения по настоящему изобретению способны деградировать различные варианты AR и, следовательно, должны обеспечивать способность ингибировать активность оси AR независимо от того, является ли она андроген-зависимой или андроген-независимой. Деградация AR устраняет возможность беспорядочной активации мутантных AR, активацию внутриклеточными процессами, такими как трансдукция сигнала и активация киназы и т.д.; и предполагает, что SARD также должны разрушать полиморфизмы polyQ в гиперандрогенных дерматологических расстройствах (сокращенном polyQ) или болезни Кеннеди (расширенном polyQ), обеспечивая обоснование для лечения любого типа заболевания путем разрушения AR в пораженных тканях (кожа и нервно-мышечная система, соответственно). Кроме того, наблюдался спектр метаболической устойчивости in vitro, предполагающий возможность либо местного применения (короткий период полураспада, так что системное воздействие ограничено), либо системного введения (например, перорального, требует относительно длительного периода полураспада).
ПРИМЕР 9
SARD (Индолы) ингибирование лиганд-зависимой тринаскрипции AR
Соединение 11 ингибировало трансактивация в AR-NTD-DBD-шарнир (A/BCD) конструкции AR, в которой отсутствует лиганд связывающий домен (Фигура 7). (A.) AR A/BCD увеличил отчетную активность GRE-LUC. Конструкция AR A/BCD, лишенная лиганда связывания домена или пустого вектора, трансфицировалась в клетки HEK-293 вместе с GRE-LUC и СМV-renilla LUC. Через сорок восемь часов после трансфекции клетки собирали и проводили анализ люциферазы. (B.-D.) Активность AR A/BCD ингибировалась с помощью 11. Конструкция AR A/BCD, лишенная лиганд связывающего домена (LBD), была трансфектирована вместе с GRE-LUC и СМV-LUC. Клетки обрабатывали через 24 часа после трансфекции, как указано в анализе фигуры и анализ люциферазы проводили через 48 часов после трансфекции. 11 (SARD) ингибировало активность конструкции без LBD, подтверждающей связывание альтернативного участка в дополнение к LBD. Не-SARD антагонисты ARN-509 и энзалутамид не ингибировали активность этой конструкции AR без LBD, что указывает на то, что SARD могут ингибировать независимую от лиганда активность AR посредством альтернативного связывания и деградации домена (BDD), расположенного за пределами LBD.
ПРИМЕР 10
Сравнение SARD и клинических кандидатов в связывании и трансактивации
Плазмидные конструкции и переходная трансфекция. Человеческий AR, клонированный в векторную магистраль СМV, использовался для исследования трансактивации. Клетки HEK-293 высевали на 120,000 клеток на лунку планшета с 24 лунками в DME + 5% csFBS. Клетки трансфицировали с использованием Липофектамина (Invitrogen, Carlsbad, CA) с 0.25 мкг GRE-LUC, 0.02 мкг СМV-LUC (люцефираза renilla) и 25 нг AR. Клетки обрабатывали через 24 часа после трансфекции, как указано в фигурах, и анализ люциферазы проводили через 48 часов после трансфекции. Данные представлены как IC50, полученные из четырех параметров логистической кривой.
Фигура 8A представляет данные сравнения 11, 12, и 14 с галетероном, EPI-001, и энзалутамидом в исследовании трансактивации. Фигура 8B показывает данные сравнения 11 с галетероном иэнзалутамидом в исследовании трансактивации. Результаты показывают, что соединения SARD по настоящему изобретению были несколько более эффективными, чем галетерон и энзалутамид, в ингибировании DHT-активированной AR трансактивации in vitro.
Анализ связывания лиганда. hAR-LBD (633-919) клонировали в pGex4t.1. Крупномасштабный AR-LBD с маркировкой GST готовили и очищали с использованием колонки GST. Рекомбинантный AR-LBD объединяли с [3H]миболероном (PerkinElmer, Waltham, MA) в буфере A (10 мМ Трис, pH 7.4, 1.5 мМ динатриевой EDTA, 0.25 М сахарозы, 10 мМ молибдата натрия, 1 мМ PMSF) для определения константа равновесной диссоциации (Kd) [3H]миболерона. Белок инкубировали с увеличением концентрации [3H]миболерона и без высокой концентрации немеченого миболерона при 4°C в течение 18 ч для определения общего и неспецифического связывания. Затем неспецифическое связывание вычитали из полного связывания для определения специфического связывания и нелинейной регрессии для кривой связывания лиганда с одним насыщением участа для определения KD миболерона.
Увеличивающиеся концентрации SARD или DHT (диапазон от 10-12 до 10-2 М) инкубировали с [3H]миболероном и AR LBD с использованием условий, описанных выше. После инкубации связанный с лигандом AR-LBD-комплекс выделяли с использованием biogelHT гидроксиапатита, промывали и подсчитывали в сцинтилляционном счетчике после добавления сцинтилляционного коктейля. Значения выражаются как Ki. Таблица 10 показывает, что соединения SARD по настоящему изобретению по меньшей мере приблизительно в 8-10 раз более жестко связаны, чем галетерон и энзалутамид, в исследованиях AR связывания.
Таблица 10: Результаты анализа связывания
ПРИМЕР 11
Соединение 11 нгибирует рост опухоли агрессивного рака предстательной железы, выражающего вариант AR сплайсинга
Эксперимент ксенотрансплантата. Мышей NOD SCID gaммa (NSG) (n = 8-10) помещали по пять животных в клетку и им разрешался свободный доступ к водопроводной воде и коммерческой крысиной еде (диета Harlan Teklad 22/5 для грызунов - 8640). Ксенотрансплантаты клеточной линии были выполнены как ранее опубликованные (Narayanan et al., 2010; Yepuru et al., 2013). Опухоли LNCaP выращивали у интактных мышей, а 22RV-1 опухоли выращивали у кастрированных мышей. После того, как размер опухоли достиг 100 мм3, животные были рандомизированы и обработаны с контролем несущей средой (соотношение полиэтил-гликоль:ДМСО 9:1) или 11 (50 мг/кг/день с.ч.). Объем опухоли рассчитывали по формуле длина*ширина*ширина*0.5236. В конце эксперимента животных умертвляли, опухоли собирали, взвешивали PSA сыворотки с использованием ELISA.
Все эксперименты проводили трижды и каждый эксперимент in vitro проводили в трех повторностях. Статистический анализ выполнялся с использованием программного обеспечения JMP-Pro (SAS; Cary, NC). Эксперименты, содержащие только две группы, анализировали простым t-тестом, в то время как эксперименты, содержащие более двух групп, анализировали односторонним ANOVA с последующим соответствующим послеоперационным тестом.
Исследования ксенотрансплантата 22RV-1 с соединением 11: Поскольку 11 деградировали как AR-FL, так и AR-SV в клетках LNCaP и 22RV-1, молекулу оценивали в исследованиях ксенотрансплантата 22RV-1 и LNCaP. Фигуры 9A-9B показывают, что соединение 11 ингибирует рост опухоли агрессивного рака предстательной железы, выражающего вариант AR сплайсинга. 22RV-1 представляет собой очень агрессивную модель опухоли, которая не реагирует на любые доступные в настоящее время процедуры. Соединение SARD по настоящему изобретению, 11, ограничивало ее рост примерно на 50%. Никаких побочных эффектов не наблюдалось в течение 3-4 недель исследования. Фигура 9C продемонстрировала, что 11 деградировал как AR-FL, так и AR-V7 в ксенотрансплантатах 22RV-1, тогда как энзалутамид не продемонстрировал деградации любой АR в этих ксенотрансплантатах. Фигура 9D продемонстрировала, что 11, но не энзалутамид подавляет сыворотку PSA при ксенотрансплантации, несущей животными, демонстрируя, что 11 подавлял экспрессия гена AR в этих опухолях. Это продемонстрировало, что 11, но не энзалутамид могут преодолевать антиандрогенную резистентность, присутствующую в клетках 22CV-1 (например, зависимое от AR-V7 рост), разрушая AR-V7, что приводит к значительному подавлению андрогенного тонуса в этих опухолях. Это обеспечивает доказательство концепции, что SARD, такие как 11, будут иметь клиническую пользу для пациентов с CRPC, особенно если бы системные воздействия были бы улучшены.
Фигуры 10A-10C оказывают, что 11 ингибирует рост ксенотрансплантата опухоли LNCaP. Как показано в Фигура 10C, уровень PSA в сыворотке ингибировался более чем на 75%.
ПРИМЕР 12
Связывание SARD с AR-AF1
В AF1 AR имеются два остатка триптофана и до 12 тирозиновых остатков. Это позволило изучить свойства сгибания этого домена, используя собственные спектры флуоресценции устойчивого состояния. Возбуждение при 287 нм возбуждает остатки тирозина и триптофана. Максимум излучения (λmax) для триптофана чувствителен к воздействию растворителя. В присутствии природного осмолита TMAO существует характерный «синий сдвиг», согласующийся с остатками триптофана, которые менее подвержены воздействию растворителя, и потерей плеча (~ 307 нм) для тирозина, поскольку происходит увеличение передачи энергии в триптофан в виде складок полипептидов. Чтобы проверить, взаимодействуют ли соединения (Энобозарм (отрицательный контроль) и 17) с AF-1 и/или изменяют свертывание этого домена, измеряли стационарную флуоресценцию для каждого соединения только с AR-AF1 или в присутствии TMAO (3 M) или мочевины (4 или 6 М). Использовали 1 мкм AR-AF1 и 5 мкм индивидуальных соединений и предварительно инкубировали в течение, по меньшей мере, 30 мин до измерения спектров излучения. Спектры эммисии были скорректированы только для буфера или буфера с TMAO/мочевиной/соединениями по мере необходимости. Фигуры 17A-C представляют биофизические данные, которые предполагают, что SARD связываются с N-терминальным доменом AR (в дополнение к LBD на C-конце). Фигура 17A: Дозозависимый сдвиг интенсивности флуоресценции для 11 при инкубации с AR AF-1. Флуоресцентное плечо, наблюдаемое при 307 нм, что соответствует остаткам тирозина в AF-1, смещается для 11. Общая флуоресценция также заметно изменяется для 11. Фигура 17C: Данные, показанные на левой панели, были отображены как разница в флуоресценции между обработанными образцами контрольного и 11 (флуоресценция при отсутствии соединения - флуоресценция в присутствии соединения), наблюдалось увеличение дозы зависемости в присутствии 11.
На основе полумаксимального насыщения для изменения сигнала флуоресценции (при λmax 242 нм), константа связывания с AR-AF1 была рассчитана как KD=1.34 ±0.32 мкм (n=3, среднее ±SEM).
1 мкм AR-AF1 предварительно инкубировали без или с увеличением концентраций соединения 11 (до 15 мкм) и установившегося флуоресцентного излучения после возбуждения при 287 нм, измеренного от 300 до 400 нм. Данные анализировали, как описано в Epps et al (1999) J. Pharm 51, 41-48, Rawel et al (2006) Mol. Nutr. Food Res. 50, 705-713 and Wang et al (2011) Mol. Endcor. 25, 2041-2053, которые включены в настоящее описание посредством ссылки.
ПРИМЕР 13
Связывание и трансактивация андрогенного рецептора, основанного на карбазоле SARD
Анализ связывания лиганда
Цель: Определить сродство связывания SARD к AR-LBD.
Способ: hAR-LBD (633-919) клонировали в pGex4t.1. Крупномасштабный AR-LBD с маркировкой GST готовили и очищали с использованием колонки GST. Рекомбинантный ARLBD объединяли с [3H]миболероном (PerkinElmer, Waltham, MA) в буфере A (10 мМ Трис, pH 7.4, 1.5 мМ динатриевой EDTA, 0.25 М сахарозы, 10 мМ молибдата натрия, 1 мМ PMSF) для определения константы равновесной диссоциации (Kd) [3H]миболерона. Белок инкубировали с увеличением концентрации [3H]миболерона и без высокой концентрации немеченого миболерона при 4°C в течение 18 ч для определения общего и неспецифического связывания. Затем неспецифическое связывание вычитали из полного связывания для определения специфического связывания и нелинейной регрессии для кривой связывания лиганда с одним насыщением участа для определения Kd миболерона.
Увеличивающиеся концентрации SARD или DHT (диапазон от 10-12 до 10-2 М) инкубировали с [3H]миболероном и AR LBD с использованием условий, описанных выше. После инкубации связаный с лигандом AR-LBD-комплекс выделяли с использованием BiogelHT® гидроксиапатита, промывали и подсчитывали в сцинтилляционном счетчике после добавления сцинтилляционного коктейля. Значения выражаются как Ki (Таблица 1).
Анализ трансактивации для wt и мутантного AR
Цель: Для определения влияния SARD на андроген-индуцированную трансактивацию AR дикого типа (wt.) или AR, несущей известные AR-LBD-мутанты (то есть W741L или T877A).
Способ: Клетки HEK-293 высевали в 125,000 клеток/лунка планшет с 24 лунками в DME + 5% csFBS без фенольного красного. Клетки трансфицировали с 0,25 мкг GRE-LUC, 10 нг СМV-renilla LUC и 50 нг СМV-hAR (wt) или СМV-hAR (W741L) или СМV-hAR (T877A) с использованием реагента для трансфекции липофекктамина в среде optiMEM. Среда была изменена через 24 часа после трансфекции до DME + 5% csFBS без фенольного красного и обрабатывалась дозовым ответом различных лекарств (Таблица 11: соединения 200-205) (1 пM to 10 мкМ). SARD и антагонисты обрабатывали в комбинации с 0.1 нM R1881. Анализ люциферазы проводили через 24 часа после обработки на планшетном считывателе Biotek synergy 4. Значения люциферазы светлячков были нормированы на значения люциферазы renilla.
Анализ трансактивации для wt и мутантного AR
Цель: Для определения влияния SARD на андроген-индуцированную трансактивацию AR, несущую известные AR-LBD-мутанты.
Способ: Клетки HEK-293 высевали в 125,000 клеток/лунка планшет с 24 лунками в DME + 5% csFBS без фенольного красного. Клетки трансфицировали с 0,25 мкг GRE-LUC, 10 нг СМV-renilla LUC и 50 нг СМV-hAR/W741L-AR/T877A-AR с использованием реагента для трансфекции липофектамина в среде optiMEM. Среда была изменена через 24 часа после трансфекции до DME + 5% csFBS без фенольного красного и обрабатывалась дозовым ответом различных лекарств (1 пM до 10 мкМ). SARD и антагонисты обрабатывали в комбинации с 0.1 нM R1881. Анализ люциферазы проводили через 24 часа после обработки на планшетном считывателе Biotek synergy 4. Значения люциферазы светлячков были нормированы на значения люциферазы renilla. (Таблица 11).
Деградация AR с использованием соединений по настоящему ихобретению
Определение метаболической стабильности (in vitro CLint) испытуемых соединений:
Фаза I метаболизма
Анализ проводили в конечном объеме 0,5 мл в дубликатах (n = 2). Испытуемое соединение (1 мкМ) предварительно инкубировали в течение 10 минут при 37 °С в 100 мМ Трис-HCl, рН 7.5, содержащем микросомальный белок 0.5 мг/мл печени. После предварительной инкубации реакцию начинали добавлением 1 мМ НАДФН (предварительно инкубированном при 37°С). Инкубации проводили в трех повторностях и в различные моменты времени (0.5, 10, 15, 30 и 60 минут). 100 мкл аликвоты отбирали и гасили с 100 мкл ацетонитрила, содержащего внутренний стандарт. Образцы перемешивали на вихревой мешалке и центрифугировали при 4000 об/мин в течение 10 минут. Супернатанты переносили в 96-луночные планшеты и представляли для анализа ЖХ-MС/MС. В качестве контроля были включены инкубации образцов, выполненные в отсутствие НАДФН. Из % PCR (% оставшегося исходного соединения), определяют скорость исчезновения соединения (наклон) и вычисляют in vitro CLint (мкл/мин/мг белка). Образцы перемешивали на вихревой мешалке и центрифугировали при 4000 об/мин в течение 10 мин.
Метаболическая стабильность в путях Фазы I и Фазы II
В этом анализе тестируемое соединение инкубировали с микросомами печени и определяли исчезновение лекарственного средства с использованием оценки ЖХ-MС/MС для обнаружения. Чтобы стимулировать метаболический путь Фазы II (глюкуронидирование), UDPGA и аламетицин были включены в анализ.
Анализ ЖХ-MС/MС:
Анализ исследуемых соединений проводили с использованием системы ЖХ-МС/МС, состоящей из ВЭЖХ Agilent 1100 с масс-спектрометром MDS/Sciex 4000 Q-Trap ™. Разделение было достигнуто с использованием C18 аналитической колонки (Alltima™, 2.1 X 100 мм, 3 мкм) защищенной системой защитных картриджей C18 (SecurityGuard™ ULTRA картриджи УВЭЖХ дляr 4.6 мм ID колонок, Phenomenex). Подвижная фаза состояла из канала А (95% ацетонитрил + 5% вода + 0.1% муравьиная кислота) и канала C (95% вода + 5% ацетонитрил + 0.1% муравьиная кислота) и подавалась со скоростью потока 0.4 мл/мин. Соотношение объема ацетонитрила и воды оптимизировано для каждого из анализируемых веществ. Сканирование мониторинга множественных реакций (мRM) проводи с помощью газовой завесы, газа для соударений, распылителя газа, и вспомогательного газа, оптимизированного для каждого соединения, и температуры источника при 550°C. Молекулярные ионы были сформированы с использованием напряжения распыления ионов (IS) -4200 В (отрицательный режим). Для каждого соединения были оптимизированы потенциал расщепления (DP), потенциал входа (EP), энергия столкновения (CE), масса ионов продукта и потенциал выхода клеток (CXP).
Таблица 11. Связывание с AR, ингибирование трансактивации AR, деградация AR и метаболическая стабильность SARD in vitro:
Относительно длительный период полураспада (t1/2) и низкое значение метаболического клиренса (CLint) in vitro для соединений 200-202 по настоящему изобретению предполагают возможности пероральной биодоступности и стабильности в сыворотке, что было бы выгодно для системного лечения заболеваний по данному изобретению таких, как рак предстательной железы, рак молочной железы, болезнь Кеннеди и различные андрогензависимые заболевания.

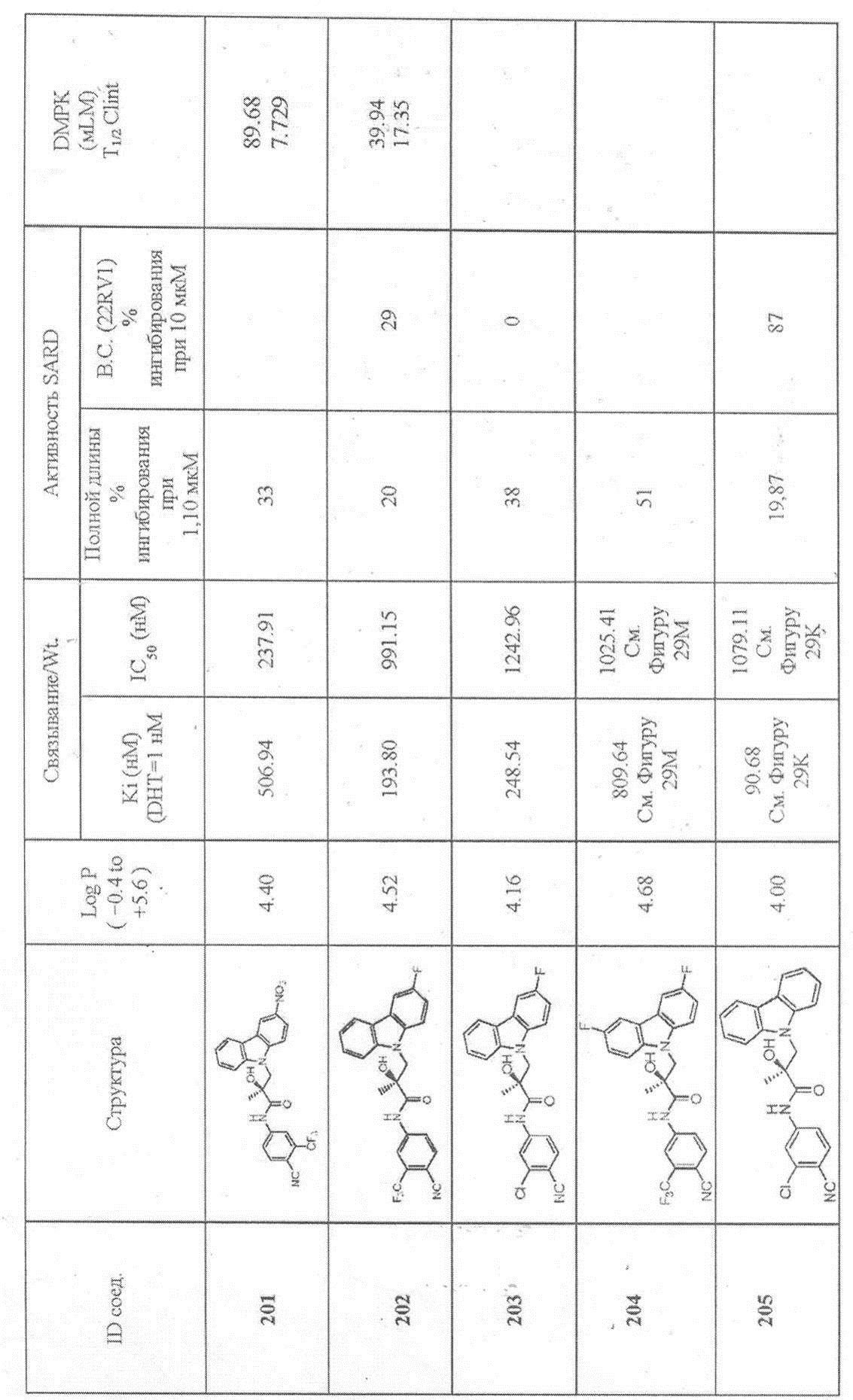

ПРИМЕР 14
Деградация AR с использованием соединений по данному изобретению
Анализ дергадации LNCaP
Цель: Определить влияние SARD на экспрессию AR в клетках LNCaP. Плазмидные конструкции и переходная трансфекция.
Человеческий AR, клонированный в векторную магистраль СМV, использовался для исследования трансактивации. Клетки HEK-293 высевали на 120,000 клеток на лунку планшета с 24 лунками в DME + 5% csFBS. Клетки трансфицировали с использованием Липофектамина (Invitrogen, Carlsbad, CA) с 0.25 мкг GRE-LUC, 0.01 мкг СМV-LUC (люцефираза renilla) и 25 нг AR. Клетки обрабатывали через 24 часа после трансфекции, как указано в фигурах, и анализ люциферазы проводили через 48 часов после трансфекции. Данные представлены как IC50, полученные из четырех параметров логистической кривой.
Анализ связывания лиганда
hAR-LBD (633-919) клонировали в pGex4t.1. Крупномасштабный AR-LBD с маркировкой GST готовили и очищали с использованием колонки GST. Рекомбинантный ARLBD объединяли с [3H]миболероном (PerkinElmer, Waltham, MA) в буфере A (10 мМ Трис, pH 7.4, 1.5 мМ динатриевой EDTA, 0.25 М сахарозы, 10 мМ молибдата натрия, 1 мМ PMSF) для определения константа равновесной диссоциации (Kd) [3H]миболерона. Белок инкубировали с увеличением концентрации [3H]миболерона и без высокой концентрации немеченого миболерона при 4°C в течение 18 ч для определения общего и неспецифического связывания. Затем неспецифическое связывание вычитали из полного связывания для определения специфического связывания и нелинейной регрессии для кривой связывания лиганда с одним насыщением участа для определения Kd миболерона
Увеличивающиеся концентрации SARD или DHT (диапазон от 10-12 до 10-4 М) инкубировали с [3H]миболероном и AR LBD с использованием условий, описанных выше. После инкубации связаный с лигандом AR-LBD-комплекс выделяли с использованием biogelHT гидроксиапатита, промывали и подсчитывали в сцинтилляционном счетчике после добавления сцинтилляционного коктейля. Значения выражаются как Ki.
Анализ экспресси гена LNCaP
Способ: Клетки LNCaP высевали на 15,000 клеток/лунка планшета с 96 лунками в RPMI + 1% csFBS без фенольного красного. Спустя сорок восемь часов после нанесения покрытия клетки обрабатывали дозовым ответом SARD. Спустя двадцать четыре часа после обработки РНК выделяли с использованием реагента с временем коагуляции клеток, синтезировали кДНК и измеряли экспрессию различных генов в реальном времени rtPCR (ABI 7900) с использованием такмановских праймеров и зондов. Результаты экспрессии гена были нормированы на GAPDH.
Анализ роста LNCaP
Способ: Клетки LNCaP высевали на 10,000 клеток/лунка планшета с 96 лунками в RPMI + 1% csFBS без фенольного красного. Клетки обрабатывали дозовым ответом SARD. Через три дня после обработки клетки снова обрабатывали. Через шесть дней после обработки клетки фиксировали, и жизнеспособность клеток измеряли с помощью анализа SRB.
Деградация LNCaP или AD1
Способ: Клетки LNCaP или AD1, экспрессирующие AR полной длины, высевали на 750 000-1000000 клеток/лунка 6-луночного планшета в среде роста (RPMI + 10% FBS). Спустя двадцать четыре часа после нанесения покрытия среду заменяли на RPMI + 1% csFBS без фенольного красного и выдерживали в этой среде в течение 2 дней. Среду опять заменяли на RPMI + 1% csFBS без фенольного красного и клетки обрабатывали с SARD (от 1 нM до 10 мкM) в комбинации с 0.1 нM R1881. Через 24 ч обработки клетки промывали холодным PBS и собирали. Белок экстрагировали, используя соль-содержащий лизисный буфер с тремя циклами свободного оттаивания. Расчетную концентрацию белка и пять мкг общего белка загружали на SDS-PAGE, фракционировали и переносили в PVDF-мембрану. Мембрану исследовали с антителом AR N-20 от SantaCruz и актин-антителом от Sigma.
Деградации 22RV1 и D567es
Способ: Клетки 22RV1 и D567es, экспрессирующие варианты AR-сплайсинга, высевали на 750,000-1,000,000 клеток/лунка 6-луночного планшета в среде роста (RPMI + 10% FBS). Спустя двадцать четыре часа после нанесения покрытия, среду меняли и обрабатывали. Через 24-30 ч обработки клетки промывали холодным PBS и собирали. Белок экстрагировали, используя соль-содержащий лизисный буфер с тремя циклами свободного оттаивания. Расчетную концентрацию белка и пять мкг общего белка загружали на SDS-PAGE, фракционировали и переносили в PVDF-мембрану. Мембрану исследовали с антителом AR N-20 от SantaCruz и актин-антителом от Sigma.
Рост и экспрессия гена 22RV1
Способы: Рост клеток оценивали, как описано выше, способом SRB. Клетки высевали в 96-луночный планшет в полной сыворотке и обрабатывали в течение 6 дней с изменением среды после 3-го дня. Исследования экспрессии генов проводили в клетках 22RV1, которые высевали в 96-луночный планшет при 10,000 клеток/лунка в RPMI + 10% FBS. Через двадцать четыре часа после нанесения покрытия клетки обрабатывали в течение 3 дней, и выполняли исследования экспрессии генов, как описано ранее.
Результаты
Фигура 26 представляет деградацию AR в клетах LNCaP с использованием 1 против ARN-509. Вестерн-блот-анализ по описанному выше способу продемонстрировал способность 200 деградировать мутантный AR (т. е. T877A) при 100 нМ и 10 мкМ в клетках LNCaP, тогда как ARN-509 только деградировал при 10 мкМ, что указывает на то, что SARD, такие как 200 будут иметь клиническую полезность при раковых заболеваниях предстательной железы, в том числе тех, чей рост обусловлен антиандрогенными резистентно-сопоставимыми мутантными АR (то есть прогрессирующие раковые заболевания предстательной железы и CRPC).
Фигура 27 и Фигура 28 показывают деградации AR и AR-V7 в клетках 22RV-с помощью 200 и 201. 200 был способен разрушать андрогенный рецептор полной длины (AR-FL) и обрезанный AR (AR-V7) в клетках 22RV-1, что указывает на то, что SARD могут преодолевать AR-V7-зависимые раковые заболевания предстательной железы (то есть CRPC). Для сравнения, 201 продемонстрировал низкие уровни деградации в клетках 22RV-1.
Эти демонстрации активности SARD показывают, что соединения по настоящему изобретению способны деградировать различные варианты AR и, следовательно, должны обеспечивать способность ингибировать активность оси AR независимо от того, является ли она андроген-зависимой или андроген-независимой. Деградация AR устраняет возможность беспорядочной активации мутантных AR, активацию внутриклеточными процессами, таких как трансдукция сигнала и активация киназы и т.д.; и предполагает, что SARD также должны разрушать полиморфизмы polyQ в гиперандрогенных дерматологических расстройствах (сокращенном polyQ) или болезни Кеннеди (расширенном polyQ), обеспечивая обоснование для лечения любого типа заболевания путем разрушения AR в пораженных тканях (кожа и нервно-мышечная система, соответственно).
ПРИМЕР 15
Дальнейшие исследования с SARD
Экспрессия гена и рост клеток PCa:
Клетки PCa (LNCaP и 22RV1) будут высеваться на 10000 клеток на лунку 96-луночного планшета в соответствующей среде с 1% csFBS или в полной сыворотке. Клетки будут выдерживаться в течение 3 дней и будут обработаны SARD или только с контрольными, или в комбинации с 0,1 нМ R1881 (1% csFBS). РНК будет выделена и кДНК получена с использованием наборов клеток (Life Technologies). Экспрессия различных андроген-регулируемых генов будет измеряться с использованием праймер зонд микс TaqMan на машине PCI реального времени ABI 7900. Экспрессия отдельных генов будет нормирована на уровни 18S рРНК.
Клетки PCa будут высеваться на 10000 клеток на лунку 96-луночного планшета в соответствующей среде с 1% csFBS или в чистой сыворотке. Клетки будут обрабатываться только SARD или в комбинации с 0,1 нМ R1881. Жизнеспособность клеток будет измеряться с использованием реагента Сульфородамина синего. В качестве отрицательного контроля AR-негативные клетки PC3 будут обрабатываться аналогично, чтобы гарантировать отсутствие какого-либо неспецифического роста ингибирующих свойств SARD.
Доклинические фармакокинетические (PK) исследования на грызунах:
PK параметры SARD в различных формулировках будут определяться у крыс и мышей в зависимости от требований. Крысы Sprague-Dawley приблизительно по 250 грамм будут рандомизированы в группы по 5 и катетер будет хирургически имплантирован в яремную вену. После периода восстановления крысам будет назначено тестовое соединение и 250 мкл венозной крови будут последовательно отбираться из катетера в 0, 10, 20, 30, 60, 120, 240, 480, 720, 1440 и 2880 минут после введения для внутривенной дозы или 0, 20, 40, 60, 90, 120, 150, 180, 210, 240, 480, 720, 1440 и 2880 минут после введения для невнутривенной дозы. Для мышей, мыши C57BL/6 приблизительно по 20 грамм будут сгруппированы по трем точкам времени на один путь введения. После введения внутривенной дозы мыши будут умертвлены, и кровь будет собрана путем сердечной пункции в 0, 10, 20, 30, 60, 120, 240, 480, 720, 1440 и 2880 минут после внутривенного введения дозы или 0, 30, 60, 90, 120, 150, 180, 210, 240, 480, 720, 1440, 2880 минут после ввеедения для невнутривенной дозы. Образцы будут собираться в соответствующих пробирках, содержащих антикоагулянт и плазму, приготовленных для ЖХ-MС-MС анализа. Соответствующие параметры PK будут оцениваться с помощью некомпартментных анализов с использованием Phoenix WinNonlin.
Исследования Ксенографа PCa:
В экспериментах ксенотрансплантата будут использоваться мыши Nod Scid γ (NSG)/nude (возраст 6-8 недель). Вкратце, 1:1 смесь клеток LNCaP или 22RV-1 в среде (10% FBS дополненная среда): смесь матригелей будет имплантирована подкожно самцам мышей NSG. Номер клетки, подлежащей имплантации, будет зависеть от типа клетки. Опухоли будут имплантированы самцам мышей nude, у которых есть высокие циркулирующие андрогены или у кастрированных животных, дополненных DHT, чтобы ускорить циркуляцию гормонов и уменьшить изменчивость между животными. Для модели CRPC животные будут кастрироваться, когда опухоли VCaP достигнут 100 мм3, и опухолям будет разрешено повторно расти как CRPC. Животные будут рандомизированы в группы после того, как опухоли достигнут 200 мм3 и будут обрабатываться ежедневно с помощью несущей среды или соответствующего SARD. Объем опухоли будет измеряться три раза в неделю, и животные будут умертвлены в конце исследования. При умертвлении опухоли будут взвешиваться и храниться для дальнейшего гистологического и молекулярно-биологического анализа. Объем опухоли будет рассчитываться по формуле длина×ширина×ширина×0,5236.
ПРИМЕР 16
In Vivo исследования SARD
Анализ Хершбергера: Мышей (6-7 недель) обрабатывали перорально несущей средой или указыным SARD (100 мг/кг/день два раза в день) в течение 14 дней. Животных умертвляли и вес семенной железы регистрировали и представляли.
Результаты: SARD 11, 34, 37, 38, 103, и 115 продемонстрировали различные уровни ингибирования роста семенных желез. 103 имел наибольший эффект SV (Фигуры 30A и 30D), предстательной железы (Фигура 30C), и также имел эффект массы тела (Фигура 30B).
SARD были также изучены в исследованиях ксенотрансплантата. 103 продемонстрировал низкий уровень эффективности выявленных ксенотрансплантатов у пациентов (Фигура 31) и мышей (Фигура 32), несмотря на очень низкие уровни в плазме.
Таблица 14: SARD обнаруживаются в плазме и опухоли.
Однако неожиданно было обнаружено, что 103 накапливается в опухоли, возможно объясняя его активность (смотри диаграмму выше). SARD выборочно накапливаются в опухоли: мышам NSG имплантировали ксенотрансплантат рака предстательной железы выявленные у пациента. Животных обрабатывали в течение 14 дней, и объемы опухоли измеряли два раза в неделю. Животных умерщвляли, 103 экстрагировали из сыворотки и опухоли и измеряли с использованием способы ЖХ-МС/МС.
103 выборочно накапливается в опухоли с почти в 10 раз большим накоплением в опухоли, чем в плазме. (Фигура 31). В то время как у 103 была слабая активность в ксенотрансплантатах опухолей, 36 продемонстрировали многообещающее ингибирование роста опухоли.
Реферат
Данное изобретение относится к новым индольным, индазольным, бензимидазольным, индолиновым, хинолиновым, изoхинолиновым и карбазольным соединениям общей формулы I - селективным разрушителям андрогенных рецепторов (SARD), фармацевтическим композициям и их применению при лечении рака предстательной железы, прогрессирующего рака предстательной железы, кастрационно-резистентного рака предстательной железы, андрогенной алопеции или других гиперандрогенных кожных заболеваний, болезни Кеннеди, амиотрофического бокового склероза (ALS) и миомы матки, а также к способам уменьшения уровней андрогенных рецепторов полной длины (AR-FL), содержащим патогенные и/или резистентные мутации, варианты AR-сплайсинга (AR-SV) и патогенные полиглютаминные (polyQ) полиморфизмы AR у субъекта. 3 н. и 13 з.п. ф-лы, 32 ил., 14 табл., 18 пр.I
Формула



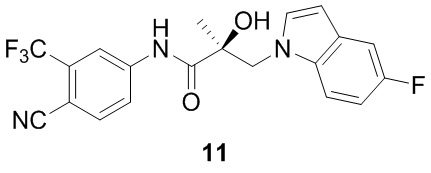
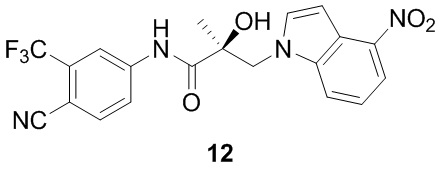
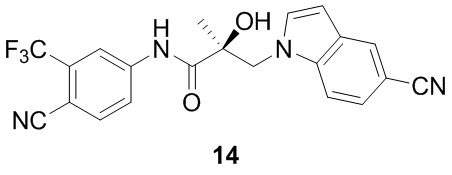
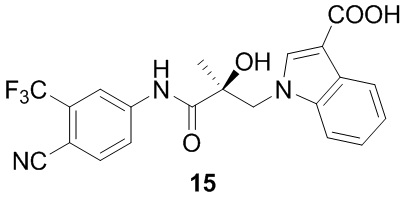
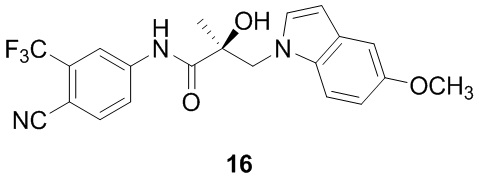
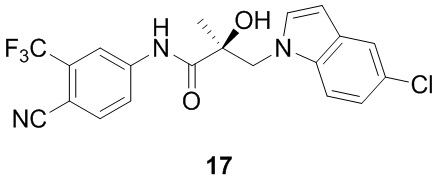





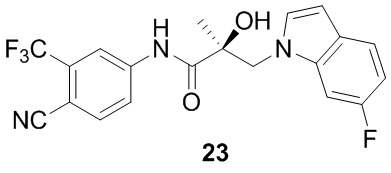




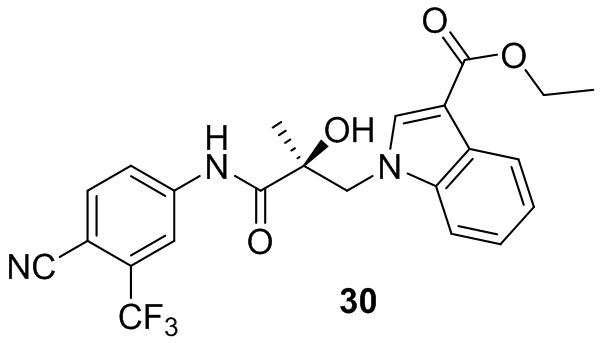


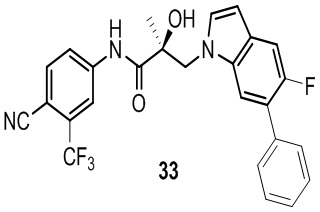
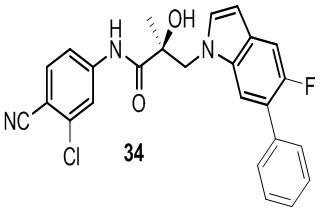
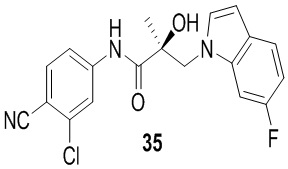



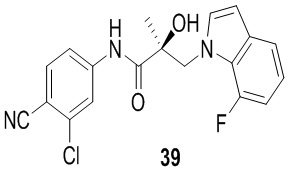













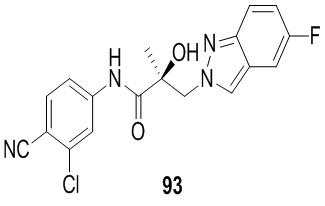
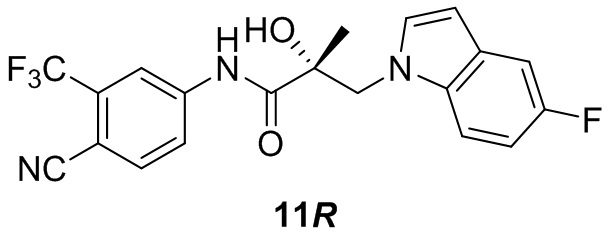
Документы, цитированные в отчёте о поиске
N-(пирид-4-ил)амиды и n-(пиримидин-4-ил)амиды и их фармацевтическое и косметическое применение

Комментарии