Комбинация для коррекции неврологического и психоэмоционального статуса при органических нарушениях цнс - RU2536270C1
Код документа: RU2536270C1
Чертежи






Описание
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ.
Производное адамантана, мемантин, по современным представлениям, является неконкурентным антагонистом подтипа глутаматных рецепторов, чувствительных к Р-метил-Д-аспартату (НМДА рецептор).
Структурная формула мемантина (3,5-диметиладамантан-1-амин):

Мемантин был внедрен в клиническую практику в Европе в 2002 году как лекарство для лечения болезни Альцгеймера. Вскоре мемантин по тем же показаниям был также зарегистрирован в США. В многочисленных экспериментах на животных было показано улучшение когнитивных функций под влиянием мемантина. В первую очередь, это действие мемантина проявлялось на моделях болезни Альцгеймера [Filali М, Lalonde R, Riivest S. Subchronic memantine administration on spatial learning, exploratory activity, and nest building in an APP/PS1 mouse model of Alzheimer′s disease. Neuropharmacology, 2011, v.60, pp.930-936.; Van Dam D, De Deyn PP. Cgnitive evaluation of disease modifying efficacy of galantamine and memantine in the APP23 model. Eur. Neuropsychopharmacol., 2006, v.16, pp.59-69].
По современным представлениям, влияние мемантина на обучение связано с его нейропротективным действием, т.е. способностью защищать нервные клетки от гибели Kutzing МК, Luo V, Firestein BL. Protection from glutamate-induced excitotoxicity by memantine. BMES, 2011, DOI:10.107/s10439011-094-z]. Многочисленные опыты показывают, что мемантин защищает нервные клетки от токсического действия нейромедиатора глутамата, который усиленно высвобождается в мозге при различных заболеваниях, включая болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, эпилепсию, ишемию мозга, энцефалопатию, вызванную ВИЧ инфекцией (Kutzing МК, Luo V, Firestein BL. Protection from glutamate-induced excitotoxicity by memantine. BMES, 2011, DOI:10.107/s10439011-094-z., Van Dam D, De Deyn PP. Cgnitive evaluation of disease modifying efficacy of galantamine and memantine in the APP23 model. Eur. Neuropsychopharmacol., 2006, v.16, pp.59-69).
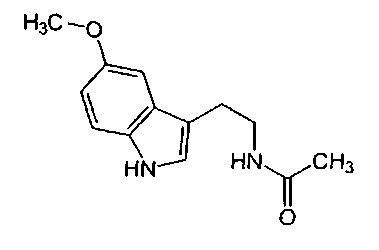
Мелатонин является эпифизарным гормоном, который синтезируется из серотонина. Структурная формула мелатонина (N-ацетил-5-метокситриптамин):
Мелатонин оказывает свое биологическое действие через мелатониновые рецепторы и участвует в регуляции циркадных ритмов. Кроме воздействия на биологические ритмы, мелатонин обладает сильным антиоксидантным действием, которое, по-видимому, не связано с его стимулирующим влиянием на мелатониновые рецепторы. Антиоксидантное действие мелатонина было отчетливо показано на бесклеточных моделях [Cagnoli С, Atabay CM, Kharlamova Е, Manev Н. Melatonin protects neurns from singlrt oxygen-induced apoptosis. J. Pineal Res., 1995, v.18, 222-226]. На основании этих опытов было предположено, что мелатонин может оказывать нейропротективное действие путем подавления оксидативного стресса. В настоящее время доказано, что в биологических системах оксидативный стресс вызывает гибель клеток путем прямого повреждения молекулы ДНК, что ведет к ее фрагментации и последующей гибели клетки путем апоптоза [Cagnoli С, Atabay CM, Kharlamova E, Manev H. Melatonin protects neurns from singlrt oxygen-induced apoptosis. J. Pineal Res., 1995, v.18, 222-226.; 6.; Giusti P, Gusella M, Lipartiti M, Milani D, Zhu W, Vicini S, Manev H. Melatonin protects primary cultures of cerebellar granule neurons from kainate but not from N-methyl-D-aspartate excitotoxicity. Exp. Neurol., 1995, v.131, pp.39-46]. Особую патогенетическую роль оксидативный стресс играет в гибели нервных клеток при различных патологиях, включая постишемическую реперфузию мозга и травматические повреждения мозга [Yamamoto Н-А, Tang H-W. Melatonin attenuates L-cysteine-induced seizures and lipid peroxidation in the brain of mice. J. Pineal Res., 1996, v.21, pp.108-113.]. Повышенная продукция свободных радикалов наблюдается также при старении головного мозга, эпилепсии и у больных с различными нейродегенеративными заболеваниями, такими как болезни Альцгеймера, Паркинсона и Хантингтона [Yamamoto Н-А, Tang Н-W. Melatonin attenuates L-cysteine-induced seizures and lipid peroxidation in the brain of mice. J. Pineal Res., 1996, v.21, pp.108-113].
В экспериментах на культурах нейронов головного мозга, мелатонин снижает токсическое действие многих токсинов, в том числе, квинолиновой и каиновой кислоты. В опытах на животных было показано протективное действие мелатонина при судорогах, вызванных цианидами и л-цистеином [Yamamoto Н-А, Tang H-W. Melatonin attenuates L-cysteine-induced seizures and lipid peroxidation in the brain of mice. J. Pineal Res., 1996, v.21, pp.108-113]. В опытах на мышах, у которых нарушение обучения в тесте пассивного избегания вызывалось введением холиноблокатора скополамина, мелатонин в дозе 20 мг/кг при в/б введении оказывал отчетливое антиамнестическое действие [Agrawal R, Tyagi Е, Shukla R, Nath С. Effect of insulin and melatonin on acetylcholinesterase activity in the brain of amnestic mice. Behav. Brain. Res. 2008, v.189, pp.381-386]. При хроническом введении мелатонин в дозе 10 мг/кг устранял нарушения памяти у мышей, вызванные старением или хроническим введением алкоголя.
На долю психоорганического синдрома, не достигающего степени деменции, сосудистого генеза приходится 25% диагностированных случаев психической патологии, у лиц старше 60 лет, обратившихся в общую поликлинику [Михайлова Н.М., 1996]. У таких больных могут определяться психоорганические расстройства с явлениями торпидности, замедленностью психомоторных реакций, легкими дисмнестическими расстройствами, нарушениями внимания и в значительной мере соответствуют критериям «мягкого когнитивного расстройства» (МКБ-10, рубрика F06.7 «Легкое когнитивное расстройство»). У других более выражены изменения личности, сопровождающиеся пассивностью и значительным снижением круга интересов, со стойким налетом благодушия, или же повышенная раздражительность при склонности к психопатоподобному поведению (по МКБ-10, рубрика F07.0 «Органическое расстройство личности»).
Из перечня расстройств, входящих в органический психосиндром, вытекает близость, если не идентичность, этих состояний с нерезко выраженными, находящимися в начальной стадии своего развития, симптомами деменций.
Имеется данные о том, что при острых и долгосрочных последствиях спортивной черепно-мозговой травмы (ЧМТ), повреждение аксона вызывает как регенеративные и дегенеративные реакции в тканях мозга и повторяющиеся сотрясения могут инициировать долгосрочный нейродегенеративный процесс, вызывающий, т.н. боксерскую деменцию или хроническую травматическую энцефалопатию (СТЕ). Хроническая травматическая энцефалопатия во многом напоминает другие нейродегенеративные заболевания, такие как болезнь Альцгеймера, в частности в отношении метаболизма и агрегации тау, β-амилоида и TDP-43 (TAR-DNA binding protein) [Neuron. 2012 Dec 6; 76 (5): 886-99. doi: 10.1016/j.neuron.2012.11.021. The neuropathology and neurobiology of traumatic brain injury. Blennow K, Hardy J, Zetterberg H.].
Известно, что у больных с гиперпродукцией β-амилоида стабилизации состояния способствовало применение НПВС, в частности индометацина (Rogers J,, et al., Clinical trial of indomethacin in Alzheimer′s disease Neurology, 1993 Aug; 43 (8): 1609-11).
Также было изучена роль циклооксигеназы-1 в β-амилоида-индуцированной нейровоспалении и предприняты попытки использования ингибиторов ЦОГ (циклооксигеназы) в качестве протекторов от развития болезни Альцгеймера (A role for cyclooxygenase-1 in β-amyloid-induced neuroinflammation, Eduardo Candelario-Jalil AGING, Vol 1, No 4, pp 350-353).
Поскольку как при нейродегенеративных процессах, так и при ишемии головного мозга важную патогенетическую роль играет гиперактивация глютаминергической системы, для лечения легкого когнитивного расстройства исследователями предполагалась возможность использования антагонистов NMDA рецепторов.
В качестве ближайшего аналога может быть указано применение мемантина в качестве нейропротектора при амилоидной интоксикации (Hidalgo JJM, Alvarez ХА, Cacabelos R, Quack G. Neuroprotection by memantine against neurodegeneration induced by beta-amyloid (1-40). Brain Research, 2002, v.958, 210-221). Однако клинически эффекты мемантина при монотерапии умеренных когнитивных расстройств (УКР) незначительны.
Задача настоящего изобретения создание эффективной комбинации для устранения нарушений у больных с патологиями мозга, для профилактики, коррекции и терапии проявлений амилоидной интоксикации.
Настоящая задача решается применением композиции, сочетанно содержащей Мелатонин и Мемантин, для профилактики, коррекции и терапии проявлений амилоидной интоксикации.
Данную композицию назначают млекопитающему, в то числе и человеку.
В том числе при амилоидной интоксикация в случаях УКР, когнитивного снижения при сосудистых поражениях и посттравматических состояниях.
Активные компоненты препаративной формы комбинации Мелатонин и Мемантин содержатся в терапевтически эффективных количествах. Предпочтительные дозировки составляют от 5 до 300 мг мемантина и от 3 до 10 мг мелатонина.
Форма композиции, содержащей Мелатонин и Мемантин, может быть представлена в виде: таблетки, включая сублингвальные формы, капсулы, лекарственные формы с модифицированным высвобождением, инъекционной форме, свечи, порошок для приготовления напитка, капли, включая капли в нос, трансдермальная, трансбуккальная, аэрозольные формы.
Фармацевтически приемлемые вспомогательные вещества выбирают для обеспечения доставки терапевтически эффективного в разовой дозе количества Мемантина и Мелатонина в обычной единичной лекарственной форме и для оптимизации стоимости, облегчения и стабильности процесса производства. Необходимое условие для вспомогательных веществ - это инертность, химико-физическая совместимость с Мемантином и Мелатонином. Вспомогательные вещества, используемые в твердых лекарственных формах, как таблетки и капсулы, могут дополнительно включать красители и пигменты, вещества, маскирующие вкус, ароматизаторы, подсластители и адсорбенты.
Разбавители способствуют увеличению размера таблетки при незначительном количестве активного лекарственного вещества. К разбавителям относят лактозу, в формах - альфа-лактоза или бета-лактоза. Различные типы лактозы могут состоять из моногидрата лактозы, моногидрата альфа-лактозы, безводной альфа-лактозы, безводной бета-лактозы и агломерированной лактозы. Прочие разбавители могут включать в себя сахара, такие как сукроза, инвертирований сахар, декстроза и декстраты. Более предпочтительным разбавителем считается моногидрат лактозы. Еще одним разбавителем может быть микрокристаллическая целлюлоза, в том числе микронизированная.
Разбавители могут включать крахмал и производные крахмала. Крахмалы включают природные крахмалы, полученные из различных зерновых и/или других сельскохозяйственных культур. Крахмалы могут также включать предварительно крахмал и крахмал, модифицированный гликолатом натрия. Крахмалы и производные крахмалов несут также в себе свойство дезинтегрирующих веществ. Многие разбавители также действуют как дезинтегрирующие вещества и связующие вещества, и эти дополнительные свойства стоит учитывать при технологии изготовления лекарственной композиции. Дезинтегрирующие вещества добавляют с целью разрушения таблетки на частицы активного фармацевтического компонента и вспомогательные, для облегчения растворения и повышения биодоступности терапевтически активных ингредиентов. Крахмал и производные крахмала, в том числе натриевая соль карбоксиметилового эфира крахмала как, например, крахмал, модифицированный гликолатом натрия, являются применяемыми дезинтегрирующими веществами. Предпочтительным, но не исключительным, дезинтегрирующим веществом может быть желатинированный крахмал. Другим предпочтительным дезинтегрирующим веществом является карбоксиметилцеллюлоза натрия.
Связующие вещества используют в качестве вспомогательных фармацевтически приемлемых веществ для влажной грануляции для повышения концентрации терапевтически активных веществ и других вспомогательных ингредиентов в образующих гранулах. Связующее вещество добавляют для улучшения текучести порошка и для улучшения прессования. Связующие вещества включают в себя производные целлюлозы, такие как микрокристаллическая целлюлоза, метилцеллюлоза, карбоксиметилцеллюлоза, гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза и гидроксипропилцеллюлоза. Другие связующие ингредиенты выбраны из таких веществ, как повидон, поливинилпирролидон, желатин, природная камедь, а именно акациевая, трагакантовая, гуаровая и пектиновая смола, крахмальная паста, предварительно желатинированный крахмал, полиэтиленгликоли и альгинат натрия.
Антифрикционными агентами являются смазывающие и скользящие вещества, которые применяются в производстве твердых лекарственных форм с целью препятствования склеиванию таблетки с технологическими поверхностями и для уменьшения налипания во время стадий прессования. Такие вещества включают стеариновую кислоту, соли стеариновой кислоты, например стеарат кальция, стеарат магния и стеарил фумарат натрия, тальк, бензоат натрия, ацетат натрия и олеат натрия.
Лекарственные формы для ректального применения могут представлять собой растворы или суспензии или их можно получать в форме суппозиториев, содержащих активные вещества в смеси с нейтральной жировой основой, или желатиновых ректальных капсул, содержащих активные вещества в смеси с растительным маслом или вазелиновым маслом.
Растворы для парентерального применения посредством инъекции можно получить в виде водного раствора водорастворимой фармацевтически приемлемой соли активных веществ, предпочтительно в концентрации от приблизительно 0,5% до приблизительно 2% по массе. Эти растворы могут содержать также стабилизаторы и/или буферные вещества и их можно для удобства получать в ампулах с различными единицами дозирования.
Технический результат изобретения: более высокая эффективность, в том числе при умеренных когнитивных расстройствах.
Возможность осуществления изобретения может быть продемонстрирована ниже представленными примерами.
Пример 1 Исследование фармакологической активности заявленной комбинации
Исследование проводилось по двум направлениям
1) Изучение влияния комбинации мемантин + мелатонин в сравнении с мемантином на нарушения двигательной активности и эпизодической памяти, вызванных введением пептида бета-амилоида в латеральный желудочек мозга мыши;
2) Изучение влияние комбинации мемантин + мелатонин в сравнении с мемантином на нейродегенерацию, вызванную введением пептида бета-амилоида в латеральный желудочек мозга мыши.
Исследование было проведено на базе Института Фармакологии Тартуского университета по адресу Биомедицинский Центр Тартуского университета, ул. Равила 19, 51014 Тарту, Эстония.
Методы исследования
Все эксперименты проводились в соответствии с принципами работы с лабораторными животными (Principles of Animal Care, директива 86/609/EEC) согласно Хельсинкской декларации. Закупка животных и проведение опытов были сделаны на основании соответствующей лицензии от Комитета по этике (Министерство Сельского хозяйства Эстонской республики). Все лица, осуществляющие уход за животными и проводившие эксперименты обладают персональными лицензиями, позволяющими проводить опыты на животных. При проведении экспериментов были предприняты все усилия, чтобы минимизировать количество животных и их страдания.
Все эксперименты проводились на мышах самцах линии C57BL/6. Животные были закуплены в фирме Harlan (Англия). Средний возраст животных в момент прибытия в виварий Биомедицинского центра Тартуского университета был 5,5 (40 мышей) и 6 недель (20 мышей). По прибытии, животные были помещены на 2 недели на карантин в виварий Биомедицинского центра Тартуского университета. После чего животные были перенесены в виварий Института Фармакологии (комната номер 3028). Животные содержались в пластиковых клетках (5 мышей в клетке) размерами 25 см×45 см×12 см (Ш×Д×В) без ограничения в пище и воде с 12-часовым световым циклом (свет включается автоматически в 8.00). Клетки с животными находились в специальных климатических контейнерах (Scanbur, Дания). Контейнеры снабжены фильтрами НЕРА для очистки воздуха и имеют 24-часовой мониторинг влажности и температуры воздуха. Относительная влажность в контейнерах поддерживается в пределах 50±2%, температура 22±1°C. Доступ к животным разрешен только персоналу, имеющему соответствующую лицензию. Чистка клеток и обеспечение кормом и водой проводятся один раз в сутки. Корм животных: гранулированный R70 (Lactamin, Stockholm, Швеция). Животные находились в климатических контейнерах в течение 1 недели до начала опытов. Таким образом, возраст животных к началу опытов составлял 8,5-9 недель. Масса тела мышей к началу опытов составляла 25,8±0,30 г (n=60). Перед началом опытов животных разделили на 6 групп (Таблица 1), по 10 животных в каждой, с помощью программы рандомизации.
Постановка опыта и введение исследуемых веществ
Схема постановки опытов представлена на фиг.1. В таблице 1 приведена схема введения веществ. Первое введение исследуемых веществ проводилось спустя 24 часа после введения бета-амилоида в латеральный желудочек мозга мышей. Вещества вводились в течение 8 дней (один раз в день), в одно и тоже время с 9.00 до 11.00 часов. Все растворы исследуемых веществ приготавливались каждый день непосредственно перед введением и после их приготовления кодировались руководителем и передавались в кодированном виде экспериментатору. На 6-ой и 7-ой день введения исследуемых веществ с животными проводились поведенческие опыты (см. фиг.1).
Группы животных (n=10) и схема введения исследуемых веществ.
Мемантин был представлен в виде соли (мемантина гидорохлорид), молекулярная масса=215,8, партия номер 80611. Имеется сертификат качества. Все дозы мемантина рассчитывались на соль. Мелатонин: молекулярная масса 232.278, партия номер 20110915. Имеется сертификат качества.
Приготовление растворов исследуемых веществ.
1) Раствор мемантина гидрохлорида (0,5 мг/мл) + мелатонина (0,3 мг/мл)
5 мг мемантина HCl растворяли в 9 мл воды. Отдельно отвешивали 3 мг мелатонина, помещали в ступу и добавляли 2 капли эмульгатора Твин-80, растирали до образования однородной массы, добавляя порциями 1 мл воды. Полученную эмульсию смешивали с раствором мемантина (9 мл). Перед введением эмульсию интенсивно встряхивали на шейкере. Полученную эмульсию вводили в объеме 0,1 мл на 10 г массы тела мыши, что соответствует дозам мемантина 5 мг/кг и мелатонина 3 мг/кг.
2) Раствор мемантина гидрохлорида (1 мг/мл) + мелатонина (0,6 мг/мл)
10 мг мемантина HCl растворяли в 9 мл воды. Отдельно отвешивали 6 мг мелатонина, помещали в ступу и добавляли 2 капли эмульгатора Твин-80, растирали до образования однородной массы, добавляя порциями 1 мл воды. Полученную эмульсию смешивали с раствором мемантина (9 мл). Перед введением эмульсию интенсивно встряхивали на шейкере. Полученную эмульсию вводили в объеме 0,1 мл на 10 г массы тела мыши, что соответствует дозам мемантина 10 мг/кг и мелатонина 6 мг/кг.
3) Раствор мемантина гидрохлорида 0,5 мг/мл
5 мг мемантина HCl растворяли в 10 мл воды, куда добавляли 2 капли эмульгатора Твин-80 и смешивали при интенсивном встряхивании с помощью шейкера. Полученную эмульсию вводили в объеме 0,1 мл на 10 г массы тела мыши, что соответствует дозе 5 мг/кг.
4) Раствор мемантина гидрохлорида 1 мг/мл
10 мг мемантина гидрохлорида растворяли в 10 мл воды, добавляли 2 капли эмульгатора Твин-80 и смешивали при интенсивном встряхивании с помощью шейкера. Полученную эмульсию вводили в объеме 0,1 мл на 10 г массы тела мыши, что соответствует дозе 10 мг/кг.
5) Контрольный раствор
К 10 мл воды добавляли 2 капли эмульгатора Твин-80 и смешивали при интенсивном встряхивании с помощью шейкера. Полученную эмульсию вводили в объеме 0,1 мл на 10 г массы тела мыши.
Растворы 1-5 вводили внутрь желудка с помощью металлического зонда для мышей (FTSS-20S-38) фирмы Salomon Scientific (США).
6) Раствор пептида бета-амилоида (48 пикограмм/3 мкл) Пептидный фрагмент бета-амилоида, соответствующий аминокислотной последовательности бета-амилоида человека (25-35), был получен от фирмы Tocris (Англия) (Batch No: 6, молекулярная масса: 1060,27, имеется сертификат качества).
1 мг субстанции пептида растворяли в 1 мл стерильной воды и помещали в стерильный инкубатор при температуре 37°C на 96 часов для агрегации пептида (олигомерная форма). Непосредственно перед употреблением раствор разводили стерильной водой до концентрации пептида 16 нМ и вводили в левый латеральный желудочек мозга мыши в количестве 48 пикограмм в объеме 3 микролитра.
7) Контроль для бета-амилоида
Стерильная вода в объеме 3 микролитра вводилась в левый латеральный желудочек мозга мыши.
Введение пептида бета-амилоида в латеральный желудочек мозга мыши.
Введение бета-амилоида в латеральный желудочек мозга мыши проводили под общей анестезией. Для анестезии использовалась смесь гипнорма (Hypnorm, VetaPharma; Lot P736/001; содержит 0,315 mg фентанила и 10 мг флуанизона в 1 мл), дормикума (Dormicum, Roche; Lot: F1038F71, 5 мг/ мл) и воды в соотношении 1:1:2. Смесь вводили в/б в объеме 0,1 мл на 10 гр массы тела. Спустя 2-3 мин после введения анестетика у животных развивалась хирургическая стадия анестезии, после чего животное фиксировалось в стереотаксическом аппарате David Kopf (Leica Microsystems, Германия). На черепе мыши делался разрез, очищалась поверхность кости и находилась брегма. Координаты для введения бета-амилоида в латеральный желудочек находились с помощью компьютерной системы (Computer-assisted Stereotaxic system), использующей параметры атласа мозга мыши (The Mouse Brain, in Stereotaxic Coordinates, KBJ Franklin and G. Paxinos, 2012). Координаты для введения бета-амилоида по отношению к брегме были следующими: вперед - 0,5 мм, латерально - 1 мм, вентрально - 2 мм.
В черепе просверливалось отверстие с помощью бора и в левый латеральный желудочек мозга вводилась игла, соединенная с программируемым микронасосом (Syringe pump SP101IZ, Gentaur, Германия), подающим раствор бета-амилоида. Раствор вещества вводился со скоростью 0,75 мкл/мин и после окончания инфузии игла оставалась в мозге в течение 1 мин. Контрольная группа получала инфузию стерильной воды в объеме 3 мкл. После этого рану обрабатывали раствором антисептика, зашивали и животных помещали на подогреваемый столик до полного выхода из анестезии.
Хирургическая операция вызвала гибель четырех мышей, по одному животному в группах, предназначенных для введения исследуемых веществ. Таким образом, группы животных, которым должен был вводиться мемантин или мемантин + мелатонин состояли из 9 мышей.
Определение двигательной активности и эпизодической памяти на модели распознования нового объекта у мышей.
На 6-й день опыта, спустя 1 час после введения исследуемых веществ животные брались в поведенческие опыты для изучения когнитивных функций.
Для оценки когнитивных функций использовался тест распознавания нового объекта. Этот тест широко используется для оценки эпизодической памяти у животных и ее нарушение характерно для больных Альцгеймера. Тест основан на том, что здоровое животное исследует значительно больше времени новый объект, чем старый.
Опыт состоял из трех фаз: фазы привыкания, фазы тренировки и фазы ретенции.
1) Фаза привыкания.
В течение этой фазы мышей индивидуально помещали в деревянный ящик размерами 50 cm×50 cm×50 cm (длина×ширина×высота), находящийся в экспериментальной комнате, слабо освещенной лампами накаливания, с постоянным освещением 60 люкс. Пол ящика был разделен на 16 одинаковых квадратов с длиной стороны 12,5 см. Животное находилось в ящике в течение 5 мин и экспериментатор регистрировал число пересеченных квадратов. Этот показатель, в дальнейшем, использовался для оценки двигательной активности мышей. Спустя 5 мин животное извлекалось из ящика и пол ящика протирался 5% раствором этанола для устранения запаха.
2) Фаза тренировки.
Спустя 2 часа после окончания фазы привыкания, проводилась фаза тренировки. Для этого животное снова помещали в центр ящика, на полу которого были установлены два одинаковых объекта. Объекты представляли собой два деревянных кубика, расположенных в противоположных углах ящика (Фиг.2).
Животному давалась возможность исследовать объекты в течение 5 мин и при этом фиксировалось время, в течение которого животное исследовало каждый из объектов. Эти данные необходимы для оценки степени мотивации и исследовательской активности животных. После каждого животного пол ящика протирался 5% раствором этанола. По окончании опыта животное помещалась в домашнюю клетку.
3) Фаза ретенции.
Спустя 24 часа после проведения фазы тренировки мышам вводились исследуемые вещества (седьмое введение) и спустя 1 час после введения веществ животные снова помещались в ящик для исследования, в котором один объект был заменен на новый объект другой формы и цвета (фиг. 4).
Животному снова давалась возможность исследовать старый и новый объекты в течение пяти минут и время исследования каждого объекта регистрировалось экспериментатором.
Коэффициент предпочтения исследования нового объекта представлялся как отношение времени исследования нового объекта по отношению к общему времени исследования старого и нового объектов по формуле (Тнов×100)/(Тст+Тнов), где Тст и Тнов - время исследования старого и нового объектов.
Приготовление гистологических препаратов и определение гибели клеток.
Спустя 24 часа после окончания поведенческих тестов животным вводились последний раз исследуемые вещества и, спустя 1 час после введения, мышам вводили раствор анестетика хлоралгидрата (350 мг/кг, в/б). В течение 5 мин у животных развивалась глубокая анестезия. По достижению анестезии животных фиксировали, вскрывали грудную клетку и вводили перфузионную иглу в левый желудочек сердца. Одновременно вскрывали правое предсердие и проводили транскардиальную перфузию кровеносной системы, сначала физиологическим раствором (0,9% NaCl), затем 4%) раствором параформальдегида в 0,1М фосфатном буфере. Перфузия проводилась с помощью перистальтического насоса Biorad Econo Pump (Biorad, Швеция). По окончании перфузии извлекался мозг и помещался на 24 часа в 4% раствор параформальдегида (постфиксация).
Сагиттальные срезы мозга (толщиной 40 мкм), проходящие через дорсальный гиппокамп, приготавливали с помощью вибрационного микротома (Leica, Германия). Срезы помещались в планшеты (по одному срезу в лунку), заполненные 0,1 М фосфатным буфером и хранились при 4°C (срок хранения 3-4 дня). Для каждого животного выбирались 4 среза, проходящие через дорсальный гиппокамп. Для этого, все срезы от каждого животного распределялись на серии по 6 срезов в каждой. Для каждого животного выборка срезов проводилась исходя из принципа Кавальери: сначала рандомизированно выбирался срез из первой серии и затем из каждой последующей серии брался срез с тем же порядковым номером.
Окрашивание проводилось на свободно-плавающих срезах в 24-местном планшете. Срезы промывались в 0,1 М фосфатом буфере, затем инкубировались в растворе 0,025% трипсина (Sigma, США) и 0,1% CaCl2 в фосфатном буфере в течение 10 мин. После промывания срезов в фосфатном буфере, к ним добавлялся 0,25% раствор Тритона х-100 (Sigma, США) и срезы инкубировались в течение 1 часа. После этого, срезы снова промывались и к ним добавлялся раствор гематоксилин-эозина на 2 мин, после чего срезы промывались проточной водой и погружались на 5 секунд в спиртовой раствор соляной кислоты (1% HCl в 70% этаноле) и снова промывались водой. Окрашенные срезы помещались на предметные стекла, заливались средой Vectashild (Vector Laboratories, США) и покрывались покровными стеклами.
Анализ гибели клеток проводился с помощью микроскопа BX51 (Olympus, Япония). Микроскоп снабжен видеокамерой DFC495 (Leica, Германия). Работа микроскопа управляется программным обеспечением NewCAST фирмы Visiopharm (Дания). Сначала под малым увеличением с помощью объектива UPlan АРО 4×/0.16 и с помощью программы Newcast конструировался суперимидж, на котором определялись интересующие нас структуры (Фиг.3) и программа записывала координаты структур, в которых должно проводиться определение числа пикнотических клеток.
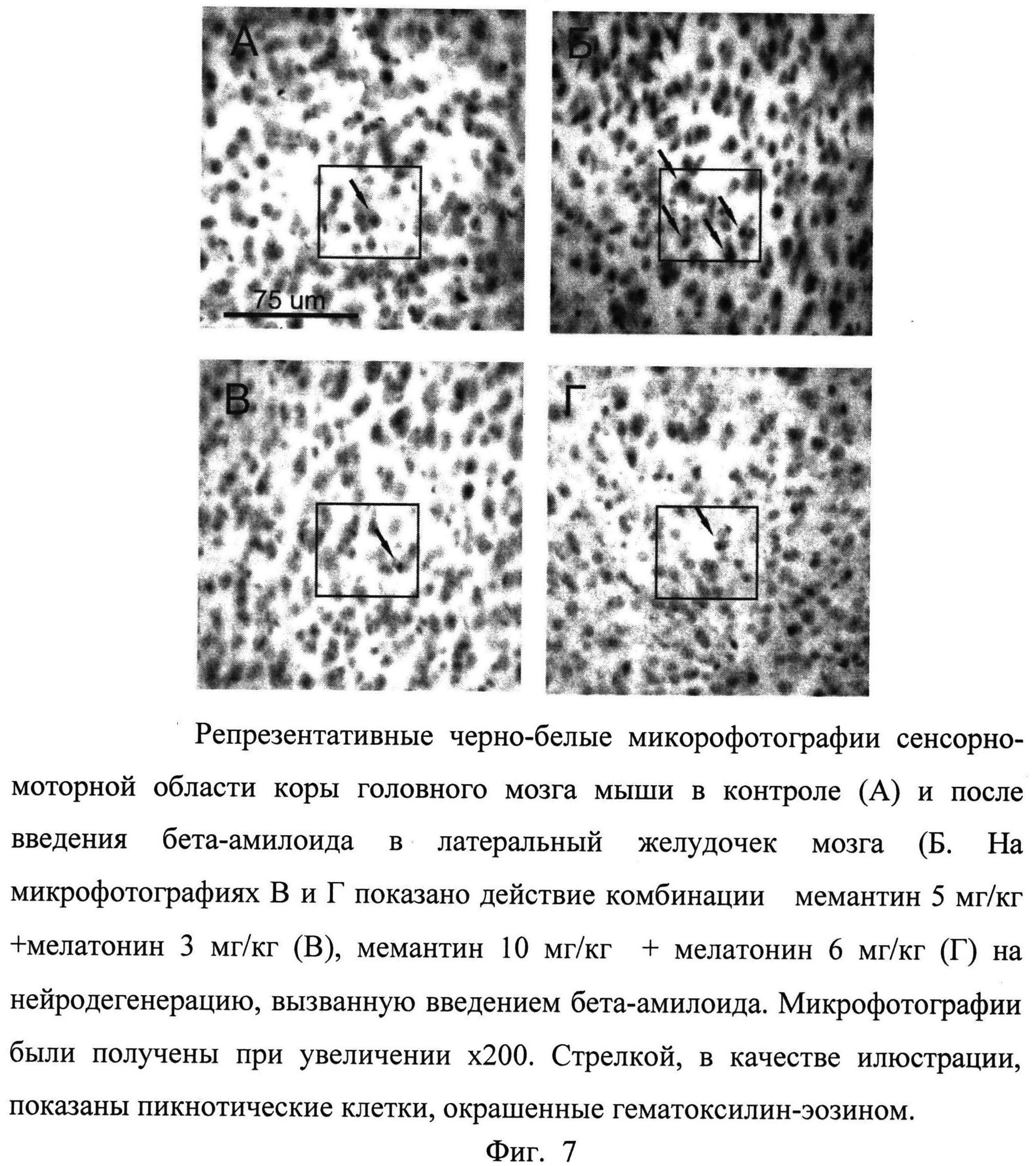
Затем, с использованием объектива LCAch 20×/0.40 PhC ∞/1, анализировались и подсчитывались пикнотические клетки в структурах CA1 и CA3 области гиппокампа и сенсорно-моторной области коры. Пикнотические клетки определялись как клетки, содержащие конденсированные гиперхромные ядра, фрагменты ядер и конденсированную цитоплазму. Подсчет проводился в каждом квадрате, как показано на фиг. 7, 8 и 9. Площадь квадратов задавалась программой NewCast и, в зависимости от размеров структуры и плотности клеток, она варьировалась в пределах 0,1-0,5 мм2. Для каждого животного, число пикнотических клеток и площади, на которых они определялись на четырех выбранных срезах, суммировались и рассчитывалась средняя плотность пикнотических клеток на 1 мм2 среза. Полученные средние значения плотности пикнотических клеток в областях CA1, CA3 гиппокампа и сенсорно-моторной области коры для каждого животного в дальнейшем использовались для статистического анализа.
Статистический анализ
Для каждой группы мышей рассчитывались средние значения (M) ± стандартная ошибка среднего значения (m). Далее, данные анализировалиь с помощью т-теста Стьюдента (контроль и бета-амилоид), однофакторного дисперсионного анализа с последующим применением ретроспективного критерия Бонферрони (действие исследуемых веществ, влияние дозы). При сравнительной оценке действия комбинаций веществ использовался двухфакторный дисперсионный анализ. Различия между группами считались достоверными при p<0,05. Статистическая обработка данных проводилась с использованием статистического программного обеспечения GraphPad PRISM-5 (США).
Результаты исследования и обсуждение результатов.
Обоснование выбора доз мемантина и мелатонина для исследований.
В клинической практике терапевтическая дневная доза мемантина 20 мг/день обеспечивает уровень концентрации вещества в плазме 0,5-1 мкмоль/литр плазмы (12). У грызунов (мыши), соответствующие концентрации мемантина (1 мкмоль/литр плазмы) наблюдались после введения мемантина в дозе 30 мг/кг/день (9). Поскольку целью исследования было проанализировать может ли мелатонин усилить действие мемантина, то в исследовании мемантин использовался в дозах меньших, чем те, которые дают максимальные терапевтические концентрации в плазме. В данном исследовании использовались дозы мемантина 5 и 10 мг/кг, и, соответственно, концентрации мемантина в этих дозах должны быть ниже максимальной терапевтической (1 мкмоль/литр плазмы).
Дозы мелатонина подбирались из соотношения мемантин: мелатонин = 5:3.
Таким образом, исследуемые дозы комбинации мемантин + мелатонин были 5+3 мг/кг и 10+6 мг/кг. Отдельно, взятый для сравнения, мемантин изучался в дозах 5 и 10 мг/кг.
Характеристика популяции животных, используемых в опытах.
В данном исследовании, для анализа гомогенности популяции животных, использовались показатели массы тела (Таблица 2). Как видно из таблицы 2, группы животных не отличались по массе тела (данные дисперсионного анализа: F5,59=0,93; p=0,47; различия статистически недостоверны). Это свидетельствует о том, что по этому показателю в опытах использовалась гомогенная группа животных.
Влияние исследуемых веществ на двигательную активность и уровень исследовательской мотивации у мышей после введения бета-амилоида в латеральный желудочек мозга.
Данные по влиянию исследуемых веществ на двигательную активность в фазе привыкания и уровень исследовательской мотивации в фазе тренировки приведены в таблице 2. Как видно из таблицы 2, спустя 6 дней после введения бета-амилоида в латеральный желудочек мозга, у животных наблюдалась повышенная двигательная активность по сравнению с контрольной группой мышей. Повторное введение мемантина в дозах 5 и 10 мг/кг не влияло на повышенную локомоторную активность. Введение комбинации веществ мемантин + мелатонин в дозах 5+3 мг/кг и 10+6 мг/кг снижало двигательную активность до контрольного уровня. Однофакторный дисперсионный анализ показал достоверное влияние комбинации веществ (F2,27=16,97; p<0,0001), причем тест Бонферрони показал высокодостоверное действие обеих комбинаций: мемантин 5 мг/кг + мелатонин 3 мг/кг (p<0,01) и мемантин 10 мг/кг + мелатонин 6 мг/кг (p<0,01).
При оценке мотивационного поведения животных, после введения бета-амилоида и исследуемых веществ, статистически достоверных различий выявлено не было (Таблица 2).
Многочисленные исследования свидетельствуют, что у больных болезнью Альгеймера, нарушены суточные ритмы, причем в течение ночной фазы у них наблюдается психомоторная активация. Поскольку у мышей существует обратная ритмика, и фаза сна у них совпадает с дневным временем суток, то успокаивающее действие комбинации мемантин + мелатонин на гиперактивность мышей в дневное время суток свидетельствует о восстановлении нормальных суточных ритмов, что может иметь терапевтическое значение у пациентов с болезнью Альцгеймера.
Масса тела, двигательная активность (число пересеченных секторов) в фазе привыкания и время исследования объектов (уровень мотивации) в фазе тренировки у мышей после введения бета амилоида и исследуемых веществ. Представлены средние значения ± стандартные ошибки среднего значения (M±m) для групп из 9-10 животных. ##p<0,0001 по сравнению с контролем; **p<0,01 по сравнению с бета-амилоидом.
Влияние исследуемых веществ на нарушения памяти у мышей, вызванные введением бета-амилоида, в тесте распознавания нового объекта.
Результаты изучения влияния исследуемых веществ на нарушение эпизодической памяти у мышей, вызванное внутримозговым введением бета-амилоида, представлены в таблице 3 и на рисунке 4.
У животных контрольной группы наблюдалось выраженное предпочтение в исследовании нового объекта: индекс предпочтения в контрольной группе составлял 87,8±2,3%. Спустя 7 дней после введения бета-амилоида в латеральный желудочек мозга у мышей наблюдалось снижение индекса предпочтения нового объекта до 49,7±14%. Статистический анализ показал высокодостоверное (p<0,0001, т-тест Стьюдента) различие по сравнению с контрольной группой. Снижение индекса предпочтения указывает на нарушение памяти у мышей после введения бета-амилоида. Мемантин и мемантин в комбинации с мелатонином увеличивали индекс предпочтения, что свидетельствует об улучшении памяти, нарушенной введением бета-амилоида. Для статистического анализа действия исследуемых веществ применялся однофакторный дисперсионный анализ, где в качестве контроля использовалась группа с введением бета-амилоида. Анализ действия мемантина выявил улучшение памяти (F2,27=34,23; p<0,0001), причем это действие мемантина проявлялось в обеих дозах 5 мг/кг (p<0,01) и 10 мг/кг (p<0,01). Изучение влияния комбинации мемантин + мелатонин выявило более значительное улучшающее влияние на память: F2,27=71,90; p<0,0001, причем тест Бонферрони выявил высокодостоверное действие обеих комбинаций мемантин 5 мг/кг + мелатонин 3 мг/кг (p<0,01) и мемантин 10 мг/кг + мелатонин 6 мг/кг (p<0,01).
Влияние исследуемых веществ на нарушения памяти у мышей, вызванные бета-амилоидом, в тесте распознавания нового объекта. Представлены средние значения индекса предпочтения нового объекта ± стандартные ошибки среднего значения (M±m) для групп из 9-10 животных.
Следующим этапом статистического анализа было сравнить, отличаются ли между собой по антиамнестическому действию комбинация мемантин + мелатонин от действия мемантина. Для сравнения использовался двухфакторный дисперсионный анализ, где одним фактором было «вещество» и другим фактором «доза» (Таблица 4). Анализ показал сильное влияние фактора «вещество» (F1,32=17,72; p=0,0002) и отсутствие влияния фактора «доза» (F1,32=1,837; p=0,18), а также отсутствие взаимодействия «вещество» × «доза» (F1,32=0,04; p=0,8). Из данных анализа следует, что антиамнестическое действие комбинации мемантин + мелатонин достоверно превосходит антиамнестическое действие мемантина на модели амнезии у мышей, вызванной введением бета-амилоида, в тесте распознавания нового объекта. Кроме того, улучшающее влияние на нарушение памяти, вызванное бета-амилоидом, проявлялось уже в дозах комбинации мемантин 5 мг/кг + мелатонин 3 мг/кг.
Матрица для сравнения антиамнестического действия комбинации мемантин + мелатонин с действием мемантина на нарушения памяти у мышей, вызванные бета-амилоидом, в тесте распознавания нового объекта. В таблице приведены средние значения индекса предпочтения нового объекта ± стандартные ошибки среднего значения на группу из 9 животных.
Влияние исследуемых веществ на гибель нейронов, вызванную введением бета-амилоида
Данные по влиянию исследуемых веществ на гибель нейронов в областях CA1, CA3 гиппокампа и сенсорно-моторной области коры после введения бета-амилоида представлены в таблице 5. Как видно из таблицы, в мозге мышей контрольной группы во всех исследуемых структурах были выявлены единичные пикнотические клетки, что, по-видимому, связано с механическим повреждением ткани мозга при введении контрольного раствора в латеральный желудочек. Введение бета-амилоида вызывало значительную гибель нейронов во всех исследуемых структурах мозга: CA1, CA3 гиппокампа и область сенсорно-моторной коры. Статистический анализ показал высокодостоверное (p<0,0001; т-тест Стьюдента) действие бета-амилоида, по сравнению с контролем во всех исследуемых структурах (Таблица 5). Введение мемантина снижало гибель клеток, причем однофакторный дисперсионный анализ выявил достоверное влияние вещества: показатели дисперсионного анализа для области CA1 были (F2,27=9,42; p<0,001). Последующий анализ с помощью теста Бонферрони показал достоверное влияние дозы мемантина 10 мг/кг (p<0.01) и не выявил достоверного эффекта мемантина в дозе 5 мг/кг. Влияние комбинации мелатонин + мемантин на гибель нейронов, вызванную введением бета-амилоида в области CA1, показаны на фиг.5. Результаты статистического анализа показаны в таблице 5. Комбинация мемантин + мелатонин высокодостоверно снижала плотность пикнотических клеток в CA1 области гиппокампа (F2,27=14,13; p<0,0001), причем этот эффект проявлялся после введения комбинаций мемантин 5 мг/кг + мелатонин 3 мг/кг (p<0,001) и мемантин 10 мг/кг + мелатонин 6 мг/кг (p<0,001).
Введение мемантина также снижало гибель клеток в области CA3, причем однофакторный дисперсионный анализ выявил достоверное влияние вещества: показатели дисперсионного анализа для области CA3 были (F2,27=20,84; p<0,0001). Последующий анализ с помощью теста Бонферрони показал достоверное влияние дозы мемантина 5 мг/кг (p<0,001) и 10 мг/кг (p<0.0001) (Таблица 5). Влияние комбинации мелатонин + мемантин на гибель нейронов, вызванную введением бета-амилоида в CA3 области гиппокампа представлены на фиг.6.
Результаты статистического анализа показаны в таблице 5. Комбинация мемантин + мелатонин высокодостоверно снижала плотность пикнотических клеток в CA3 области гиппокампа (F2,27=34,45; p<0,0001), причем этот эффект проявлялся после введения комбинаций мемантин 5 мг/кг + мелатонин 3 мг/кг (p<0,001) и мемантин 10 мг/кг + мелатонин 6 мг/кг (p<0,001).
Мемантин также достоверно снижал плотность пикнотических клеток в сенсорно-моторной коре (F2,27=48,08; p<0,0001), причем обе дозы 5 мг/кг и 10 мг/кг оказывали достоверный эффект (Таблица 5). Комбинация мемантин + мелатонин также высокодостоверно снижала плотность пикнотических клеток в сенсорно-моторной области коры (F2,27=34,45; p<0,0001), причем этот эффект проявлялся после доз комбинации мемантин 5 мг/кг + мелатонин 3 мг/кг (p<0,001) и мемантин 10 мг/кг + мелатонин 6 мг/кг (p<0,001) (Фиг.7 9, Таблица 5).
Влияние исследуемых вещества на плотность пикнотических клеток в мозге мышей после введения бета-амилоида в латеральный желудочек мозга. Приведены средние значения плотности (N/mm2) ± стандартная ошибка среднего значения (M±m) на группу из 9-10 мышей. ##p<0.001 (т-тест Стьюдента) по сравнению с контролем, **p<0,01; ***p<0,0001 по сравнению с группой получившей бета-амилоид.
Следующим этапом статистического анализа было сравнение влияния комбинации мемантин + мелатонин и мемантина на гибель нейронов в областях CA1 и CA3 гиппокампа и в сенсорно-моторной области коры головного мозга мышей после введения бета-амилоида. Для этих целей использовался двухфакторный дисперсионный анализ на основе матричной таблицы 6.
Матрица для сравнения влияния комбинации мемантин+мелатонин с мемантином на гибель нейронов, вызванную бета-амилоидом, у мышей. В таблице приведены средние значения плотности (N/mm2) пикнотических клеток в областях CA1, CA3 гиппокампа и сенсорно-моторной области коры головного мозга мышей ± стандартные ошибки среднего значения на группу из 9 животных.
Для области CA1 двухфакторный дисперсионный анализ выявил достоверное влияние фактора "вещество" (F1,32=7,77; p<0,01), достоверное влияние фактора «доза» (F1,32=5,53; p<0,05) и отсутствие интеракции между факторами «вещество» и «доза» (F1,32=3,38; p=0,07)
Для области CA3 двухфакторный дисперсионный анализ не выявил достоверного влияния фактора "вещество" (f1,32=2.09; p=0,15), показал достоверное влияние фактора «доза» (F1,32=5,46; р=0,03) и отсутствие достоверного взаимодействия между факторами «вещество» и «доза» (F1,32=0,63; p=0,4)
Для сенсорно-моторной области коры двухфакторный дисперсионный анализ выявил достоверное влияние фактора "вещество" (F1,32=13,35; p=0,0009), достоверное влияние фактора «доза» (F1,32=44,17; p=0,0001) и достоверное взаимодействие между факторами «вещество» и «доза» (F1,32=16,66; p=0,0003).
Таким образом, на основании проведенного статистического анализа можно сделать вывод, что комбинация мемантин + мелатонин оказывает более выраженное нейропротективное действие, чем отдельно вводимый мемантин при нейродегенерации, вызванной бета-амилоидом в CA1 области гиппокампа и сенсорно-моторной области коры головного мозга мышей.
В опытах на мышах при использовании модели нейродегенерации, вызванной введением бета-амилоида в латеральный желудочек мозга, были получены следующие результаты.
1) Комбинация веществ мемантин + мелатонин при введении внутрь в течение 8 дней нормализовала моторную активность животных, повышенную после введения бета-амилоида. Этот эффект проявлялся уже при дозах комбинации мемантин 5 мг/кг + мелатонин 3 мг/кг и достигал максимума при дозах мемантин 10 мг/кг + мелатонин 6 мг/кг. Мемантин, вводимый отдельно, в отличие от комбинаций, не влиял на гиперактивность мышей, вызванную бета-амилоидом.
2) Комбинация веществ мемантин + мелатонин при введении внутрь в течение 8 дней восстанавливала эпизодическую память у мышей в тесте распознавания нового объекта, нарушенную после введения бета-амилоида. Этот эффект проявлялся в дозах комбинации мемантин 5 мг/кг + мелатонин 3 мг/кг и мемантин 10 мг/кг + мелатонин 6 мг/кг. По своему антиамнестическому действию комбинация мемантин + мелатонин превосходила антиамнестическое действие отдельно вводимого мемантина в соответствующих дозах 5 и 10 мг/кг.
3) Комбинация веществ мемантин + мелатонин при введении внутрь в течение 8 дней проявляла выраженное нейропротективное действие при нейродегенерации, вызванной введением бета-амилоида. Это действие проявлялось в снижении плотности пикнотичеких клеток во всех изученных областях мозга: CA1, CA3 гиппокампа и сенсорно-моторной области коры головного мозга. Такое же нейропротективное действие оказывал и отдельно вводимый мемантин в дозах 5 и 10 мг/кг, однако нейропротективное действие комбинации было достоверно выше в области CA1 и сенсорно-моторной коре по сравнению с эффектом отдельно вводимого мемантина. В области гиппокампа CA3 нейропротективное действие комбинации мемантин + мелатонин не отличалось от нейропротективного действия отдельно вводимого мемантина.
Таким образом, результаты исследования свидетельствуют о том, что комбинация мемантин + мелатонин является более эффективной по сравнению с мемантином по устранению функциональных (повышенная моторика, нарушения эпизодической памяти) и морфологических (нейродегенерация) нарушений у мышей, вызванных введением бета-амилоида в латеральный желудочек. Предложенная комбинация мемантин + мелатонин является более эффективной у больных с патологиями мозга, вызванными повышенной продукцией бета-амилоида.
Пример 2 Лекарственные формы
Состав таблеток: Мемантин и Мелатонин
Вещество мг
Мемантин 100
Мелатонин 5
Лактоза 5,25
Микрокристалическая целлюлоза 1,25
Крахмал 2,25
Повидон 2
Кроскармелоза 2,25
Стеарат кальция 2
Состав капсул
Мемантин 100
Мелатонин 5
Лактоза 5,25
Реферат
Изобретение относится к фармацевтической промышленности и представляет собой фармацевтическую композицию для коррекции и терапии проявлений амилоидной интоксикации у больных с патологиями мозга, характеризующуюся тем, что она содержит мелатонин 3-10 мг и мемантин 5-300 мг. Изобретение обеспечивает более эффективное лечение пациентов, в том числе при умеренных когнитивных расстройствах. 2 н. и 2 з.п. ф-лы, 2 пр., 6 табл.,7 ил.
Формула
Документы, цитированные в отчёте о поиске
Фармацевтическая композиция для профилактики и лечения психических, поведенческих, когнитивных расстройств

Комментарии