Новое производное амина или его соль - RU2668550C2
Код документа: RU2668550C2
Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к новым производным амина или их солям.
Предпосылки создания настоящего изобретения
Эпидермис кожи играет роль в защите внутренней части кожи от бактерий, вирусов, ультрафиолетовых лучей, химических веществ и т.п. В эпидермисе кератиноциты претерпевают кератинизацию и клеточную гибель с образованием рогового слоя, хотя другие кератиноциты растут и многократно дифференцируются. Затем роговой слой превращается в отходы и отшелушивается от эпидермиса. Как правило, такой цикл (оборот) повторяется через каждые 28 суток. Однако при кожных заболеваниях, таких как рак кожи, псориаз, иммунологические/аллергические заболевания кожи и хроническая рана, наблюдается поломка механизма контроля пролиферации кератиноцитов, и кожа утолщается за счет аномальной пролиферации клеток эпителия кожи (непатентный документ 1).
Стероидные лекарственные формы традиционно использовались для лечения псориаза. Стероидные лекарственные формы активны при ингибировании воспаления и супрессии иммунной функции, а также являются терапевтически высокоэффективными. Однако известно, что ежедневное использование стероидных лекарственных форм вызывает различные побочные эффекты, такие как атрофия кожи и истончение кожи.
Недавно сообщалось о нескольких соединениях, которые ингибируют пролиферацию кератиноцитов. Например, сообщалось, что активный витамин D3 или его производные ингибируют пролиферацию кератиноцитов и являются эффективными при псориазе и кератозе (патентный документ 1 и 2 и непатентный документ 2). Также сообщалось, что производные зеараленона (патентный документ 3), производные азасахаров (патентный документ 4), производные гидроксамовой кислоты (патентный документ 5) и фосфодиэфиры с аскорбиновой кислотой и токоферолом (патентный документ 6) ингибируют пролиферацию кератиноцитов.
Также сообщалось об ингибиторах DHODH в качестве других соединений для ингибирования пролиферации кератиноцитов (патентные документы 7 и 8).
Документы, известные из уровня техники
Патентные документы
Патентный документ 1: JP 07-330714 A
Патентный документ 2: JP 10-139669 A
Патентный документ 3: JP 2004-292314 A
Патентный документ 4: брошюра WO 2004/002959
Патентный документ 5: брошюра WO 01/070269
Патентный документ 6: JP 08-003049 A
Патентный документ 7: брошюра WO 2008/077639
Патентный документ 8: брошюра WO 2009/021696
Непатентные документы
Непатентный документ 1: N Engl J Med, vol. 352, pp. 1899-18912, 2005
Непатентный документ 2: Biochem. Biophys. Res. Commun., vol. 166, pp. 916-923, 1990
Краткое описание сущности изобретения
Техническая задача
В качестве способов терапии заболеваний, ассоциированных с пролиферацией клеток эпидермиса кожи, известны способы терапии, нацеленные на молекулы, связанные с пролиферацией клеток. Тем не менее любой эффект таких способов является неудовлетворительным, и требуются более эффективные терапевтические лекарства.
Решение задачи
В качестве результата широких исследований в таких обстоятельствах, авторы настоящего изобретения обнаружили, что соединение, представленное общей формулой (1), или его соль характеризуются превосходным эффектом ингибирования пролиферации кератиноцитов и применимы для лечения, такого как профилактика или терапия заболеваний, связанных с чрезмерной пролиферацией кератиноцитов. Кроме того, авторы настоящего изобретения также обнаружили, что соединение, представленное общей формулой (1), или его соль согласно настоящему изобретению, которые характеризуются превосходным эффектом ингибирования продукции TNFα, применимы для лечения, такого как профилактика или терапия заболеваний, связанных с чрезмерной продукцией TNFα, оформив тем самым настоящее изобретение.
Настоящее изобретение относится к следующему.
[1] Соединение, представленное общей формулой (1), или его соль:
[Формула 1]

(где
G1, G2 и G3 являются одинаковыми или разными и представляют собой CH или атом азота;
R1 представляет собой атом хлора, атом брома, атом йода, необязательно замещенную C1-6алкильную группу, необязательно замещенную C3-8циклоалкильную группу, необязательно замещенную арильную группу, необязательно замещенную C1-6алкоксигруппу, необязательно замещенную арилоксигруппу, необязательно замещенную C1-6алкилтиогруппу, необязательно замещенную арилтиогруппу, необязательно замещенную C1-6алкиламиногруппу, необязательно замещенную ди(C1-6алкил)аминогруппу или необязательно замещенную гетероциклическую группу;
R2 представляет собой -COOR5 (где R5 представляет собой атом водорода или карбоксилзащитную группу) или -C(O)N(R6)SO2R7 (где R6 представляет собой атом водорода или иминозащитную группу; и R7 представляет собой необязательно замещенную C1-6алкильную группу или необязательно замещенную C3-8циклоалкильную группу);
R3 представляет собой атом водорода или иминозащитную группу; и
R4 представляет собой необязательно замещенную конденсированную бициклическую углеводородную кольцевую группу, необязательно замещенную конденсированную трициклическую углеводородную кольцевую группу, необязательно замещенную бициклическую гетероциклическую группу или необязательно замещенную трициклическую гетероциклическую группу,
при условии, что
(1) если R4 представляет собой необязательно замещенную конденсированную бициклическую углеводородную кольцевую группу, то G3 представляет собой атом азота; и
(2) если G1 представляет собой CH, G2 представляет собой CH, G3 представляет собой CH, R1 представляет собой атом хлора, атом брома, атом йода, C1-4алкильную группу, трифторметильную группу, дибутиламиногруппу, метоксигруппу или замещенную фенилоксигруппу, R2 представляет собой -COOH, и R3 представляет собой атом водорода, то R4 представляет собой группу, представленную общими формулами (2-1)-(2-4):
[Формула 2]

(где
X1aa, X1ba, X1ca, X1da и X1e являются одинаковыми или разными и представляют собой CR9a (где R9a представляет собой атом водорода, атом галогена, необязательно замещенную C1-6алкильную группу, необязательно замещенную C3-8циклоалкильную группу или необязательно замещенную арильную группу) или атом азота;
X2 представляет собой CR10 (где R10 представляет собой атом водорода, необязательно защищенную карбоксильную группу, необязательно замещенную карбамоильную группу, необязательно замещенную C1-6алкильную группу или необязательно замещенную арильную группу) или атом азота;
X3 представляет собой CR11 (где R11 представляет собой атом водорода, необязательно замещенную C1-6алкильную группу, необязательно замещенную C3-8циклоалкильную группу, необязательно замещенную арильную группу, необязательно замещенную ар-C1-6алкильную группу или необязательно замещенную ацильную группу) или атом азота;
X4 представляет собой CH2, CH2-CH2, C=O, атом кислорода или атом серы;
X5 представляет собой CH2 или C=O;
X6 представляет собой CH2, CH2-CH2, C=O, NR12 (где R12 представляет собой атом водорода, иминозащитную группу, необязательно замещенную C1-6алкильную группу, необязательно замещенную C3-8циклоалкильную группу или необязательно замещенную C3-8циклоалкил-C1-6алкильную группу), атом кислорода или атом серы; и
R8a представляет собой необязательно замещенную C3-6алкильную группу, необязательно замещенную C3-8циклоалкильную группу, необязательно замещенную C3-8циклоалкил-C1-6алкильную группу, необязательно замещенную арильную группу, необязательно замещенную ар-C1-6алкильную группу, необязательно замещенную ацильную группу, необязательно замещенную гетероциклическую группу или необязательно замещенную гетероциклическую C1-6алкильную группу)).
[2] Соединение или его соль в соответствии с [1], где R1 представляет собой атом хлора, атом брома, необязательно замещенную C1-6алкильную группу, необязательно замещенную C3-8циклоалкильную группу, необязательно замещенную арильную группу, необязательно замещенную арилоксигруппу, необязательно замещенную C1-6алкилтиогруппу или необязательно замещенную гетероциклическую группу.
[3] Соединение или его соль в соответствии с [1] или [2], где R1 представляет собой атом хлора, атом брома, C1-6алкильную группу, C3-8циклоалкильную группу, арильную группу, арилоксигруппу, необязательно замещенную метилсульфонильной группой, C1-6алкилтиогруппу или гетероциклическую группу.
[4] Соединение или его соль в соответствии с любым из [1]-[3], где R2 представляет собой -COOH.
[5] Соединение или его соль в соответствии с любым из [1]-[4], где R3 представляет собой атом водорода.
[6] Соединение или его соль в соответствии с любым из [1]-[5], где R4 представляет собой необязательно замещенную бициклическую гетероциклическую группу.
[7] Соединение или его соль в соответствии с любым из [1]-[6], где R1 представляет собой атом хлора или C3-8циклоалкильную группу.
[8'] Соединение или его соль в соответствии с любым из [1]-[7], где R4 представляет собой группу, представленную общими формулами (3-1')-(3-3'):
[Формула 3]

(где
X1a, X1b, X1c и X1d являются одинаковыми или разными и представляют собой CR9' (где R9' представляет собой атом водорода, атом галогена, необязательно замещенную C1-6алкильную группу, необязательно замещенную C2-6алкенильную группу, необязательно замещенную C3-8циклоалкильную группу, необязательно замещенную C4-8циклоалкенильную группу, необязательно замещенную C3-8циклоалкил-C1-6алкильную группу, необязательно замещенную арильную группу или необязательно замещенную гетероциклическую группу) или атом азота;
X2 представляет собой CR10 (где R10 представляет собой атом водорода, необязательно защищенную карбоксильную группу, необязательно замещенную карбамоильную группу, необязательно замещенную C1-6алкильную группу или необязательно замещенную арильную группу) или атом азота;
X3 представляет собой CR11 (где R11 представляет собой атом водорода, необязательно замещенную C1-6алкильную группу, необязательно замещенную C3-8циклоалкильную группу, необязательно замещенную арильную группу, необязательно замещенную ар-C1-6алкильную группу или необязательно замещенную ацильную группу) или атом азота;
X4a представляет собой CH2, CH2-CH2 или C=O;
X5 представляет собой CH2 или C=O;
X6 представляет собой CH2, CH2-CH2, C=O, NR12 (где R12 представляет собой атом водорода, иминозащитную группу, необязательно замещенную C1-6алкильную группу, необязательно замещенную C3-8циклоалкильную группу или необязательно замещенную C3-8циклоалкил-C1-6алкильную группу), атом кислорода или атом серы; и
R8' представляет собой атом водорода, необязательно замещенную C1-12алкильную группу, необязательно замещенную C3-8циклоалкильную группу, необязательно замещенную C3-8циклоалкил-C1-6алкильную группу, необязательно замещенную арильную группу, необязательно замещенную ар-C1-6алкильную группу, необязательно замещенную ацильную группу, необязательно замещенную гетероциклическую группу или необязательно замещенную гетероциклическую C1-6алкильную группу,
при условии, что если G1 представляет собой CH, G2 представляет собой CH, G3 представляет собой CH, R1 представляет собой атом хлора, атом брома, атом йода, C1-4алкильную группу, трифторметильную группу, дибутиламиногруппу, метоксигруппу или замещенную фенилоксигруппу, R2 представляет собой -COOH, и R3 представляет собой атом водорода, то R4 представляет собой группу, представленную общими формулами (3-1a) (3-3a):
[Формула 4]

(где
X1aa, X1ba, X1ca и X1da являются одинаковыми или разными и представляют собой CR9a (где R9a представляет собой атом водорода, атом галогена, необязательно замещенную C1-6алкильную группу, необязательно замещенную C3-8циклоалкильную группу или необязательно замещенную арильную группу) или атом азота;
X2 представляет собой CR10 (где R10 представляет собой атом водорода, необязательно защищенную карбоксильную группу, необязательно замещенную карбамоильную группу, необязательно замещенную C1-6алкильную группу или необязательно замещенную арильную группу) или атом азота;
X3 представляет собой CR11 (где R11 представляет собой атом водорода, необязательно замещенную C1-6алкильную группу, необязательно замещенную C3-8циклоалкильную группу, необязательно замещенную арильную группу, необязательно замещенную ар-C1-6алкильную группу или необязательно замещенную ацильную группу) или атом азота;
X5 представляет собой CH2 или C=O;
X6 представляет собой CH2, CH2-CH2, C=O, NR12 (где R12 представляет собой атом водорода, иминозащитную группу, необязательно замещенную C1-6алкильную группу, необязательно замещенную C3-8циклоалкильную группу или необязательно замещенную C3-8циклоалкил-C1-6алкильную группу), атом кислорода или атом серы;
R8a представляет собой необязательно замещенную C3-6алкильную группу, необязательно замещенную C3-8циклоалкильную группу, необязательно замещенную C3-8циклоалкил-C1-6алкильную группу, необязательно замещенную арильную группу, необязательно замещенную ар-C1-6алкильную группу, необязательно замещенную ацильную группу, необязательно замещенную гетероциклическую группу или необязательно замещенную гетероциклическую C1-6алкильную группу; и
значение X4a определено выше)).
[8] Соединение или его соль в соответствии с любым из [1]-[7], где R4 представляет собой группу, представленную общими формулами (3-1)-(3-3):
[Формула 5]

(где
X1a, X1b, X1c и X1d являются одинаковыми или разными и представляют собой CR9 (где R9 представляет собой атом водорода, атом галогена, необязательно замещенную C1-6алкильную группу, необязательно замещенную C2-6алкенильную группу, необязательно замещенную C3-8циклоалкильную группу, необязательно замещенную C4-8циклоалкенильную группу, необязательно замещенную C3-8циклоалкил-C1-6алкильную группу или необязательно замещенную арильную группу) или атом азота;
X2 представляет собой CR10 (где R10 представляет собой атом водорода, необязательно защищенную карбоксильную группу, необязательно замещенную карбамоильную группу, необязательно замещенную C1-6алкильную группу или необязательно замещенную арильную группу) или атом азота;
X3 представляет собой CR11 (где R11 представляет собой атом водорода, необязательно замещенную C1-6алкильную группу, необязательно замещенную C3-8циклоалкильную группу, необязательно замещенную арильную группу, необязательно замещенную ар-C1-6алкильную группу или необязательно замещенную ацильную группу) или атом азота;
X4a представляет собой CH2, CH2-CH2 или C=O;
X5 представляет собой CH2 или C=O;
X6 представляет собой CH2, CH2-CH2, C=O, NR12 (где R12 представляет собой атом водорода, иминозащитную группу, необязательно замещенную C1-6алкильную группу, необязательно замещенную C3-8циклоалкильную группу или необязательно замещенную C3-8циклоалкил-C1-6алкильную группу), атом кислорода или атом серы; и
R8 представляет собой атом водорода, необязательно замещенную C1-6алкильную группу, необязательно замещенную C3-8циклоалкильную группу, необязательно замещенную C3-8циклоалкил-C1-6алкильную группу, необязательно замещенную арильную группу, необязательно замещенную ар-C1-6алкильную группу, необязательно замещенную ацильную группу, необязательно замещенную гетероциклическую группу или необязательно замещенную гетероциклическую C1-6алкильную группу,
при условии, что если G1 представляет собой CH, G2 представляет собой CH, G3 представляет собой CH, R1 представляет собой атом хлора, атом брома, атом йода, C1-4алкильную группу, трифторметильную группу, дибутиламиногруппу, метоксигруппу или замещенную фенилоксигруппу, R2 представляет собой -COOH, и R3 представляет собой атом водорода, то R4 представляет собой группу, представленную общими формулами (3-1a)-(3-3a):
[Формула 6]

(где
X1aa, X1ba, X1ca и X1da являются одинаковыми или разными и представляют собой CR9a (где R9a представляет собой атом водорода, атом галогена, необязательно замещенную C1-6алкильную группу, необязательно замещенную C3-8циклоалкильную группу или необязательно замещенную арильную группу) или атом азота;
X2 представляет собой CR10 (где R10 представляет собой атом водорода, необязательно защищенную карбоксильную группу, необязательно замещенную карбамоильную группу, необязательно замещенную C1-6алкильную группу или необязательно замещенную арильную группу) или атом азота;
X3 представляет собой CR11 (где R11 представляет собой атом водорода, необязательно замещенную C1-6алкильную группу, необязательно замещенную C3-8циклоалкильную группу, необязательно замещенную арильную группу, необязательно замещенную ар-C1-6алкильную группу или необязательно замещенную ацильную группу) или атом азота;
X5 представляет собой CH2 или C=O;
X6 представляет собой CH2, CH2-CH2, C=O, NR12 (где R12 представляет собой атом водорода, иминозащитную группу, необязательно замещенную C1-6алкильную группу, необязательно замещенную C3-8циклоалкильную группу или необязательно замещенную C3-8циклоалкил-C1-6алкильную группу), атом кислорода или атом серы;
R8a представляет собой необязательно замещенную C3-6алкильную группу, необязательно замещенную C3-8циклоалкильную группу, необязательно замещенную C3-8циклоалкил-C1-6алкильную группу, необязательно замещенную арильную группу, необязательно замещенную ар-C1-6алкильную группу, необязательно замещенную ацильную группу, необязательно замещенную гетероциклическую группу или необязательно замещенную гетероциклическую C1-6алкильную группу; и
значение X4a определено выше)).
[9] Соединение или его соль в соответствии с любым из [1]-[8], где R4 представляет собой группу, представленную общей формулой (4-1) или (4-2):
[формула 7]
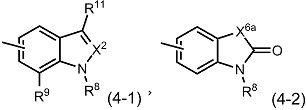
(где
X2 представляет собой CR10 (где R10 представляет собой атом водорода, необязательно защищенную карбоксильную группу, необязательно замещенную карбамоильную группу, необязательно замещенную C1-6алкильную группу или необязательно замещенную арильную группу) или атом азота;
X6a представляет собой CH2, C=O, NR12 (где R12 представляет собой атом водорода, иминозащитную группу, необязательно замещенную C1-6алкильную группу, необязательно замещенную C3-8циклоалкильную группу или необязательно замещенную C3-8циклоалкил-C1-6алкильную группу), атом кислорода или атом серы;
R8 представляет собой атом водорода, необязательно замещенную C1-6алкильную группу, необязательно замещенную C3-8циклоалкильную группу, необязательно замещенную C3-8циклоалкил-C1-6алкильную группу, необязательно замещенную арильную группу, необязательно замещенную ар-C1-6алкильную группу, необязательно замещенную ацильную группу, необязательно замещенную гетероциклическую группу или необязательно замещенную гетероциклическую C1-6алкильную группу;
R9 представляет собой атом водорода, атом галогена, необязательно замещенную C1-6алкильную группу, необязательно замещенную C2-6алкенильную группу, необязательно замещенную C3-8циклоалкильную группу, необязательно замещенную C4-8циклоалкенильную группу, необязательно замещенную C3-8циклоалкил-C1-6алкильную группу или необязательно замещенную арильную группу; и
R11 представляет собой атом водорода, необязательно замещенную C1-6алкильную группу, необязательно замещенную C3-8циклоалкильную группу, необязательно замещенную арильную группу, необязательно замещенную ар-C1-6алкильную группу или необязательно замещенную ацильную группу,
при условии, что если G1 представляет собой CH, G2 представляет собой CH, G3 представляет собой CH, R1 представляет собой атом хлора, атом брома, атом йода, C1-4алкильную группу, трифторметильную группу, дибутиламиногруппу, метоксигруппу или замещенную фенилоксигруппу, R2 представляет собой -COOH, и R3 представляет собой атом водорода, то R4 представляет собой группу, представленную общей формулой (4-1a) или (4-2a):
[Формула 8]
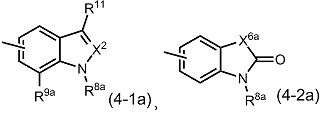
(где
R8a представляет собой необязательно замещенную C3-6алкильную группу, необязательно замещенную C3-8циклоалкильную группу, необязательно замещенную C3-8циклоалкил-C1-6алкильную группу, необязательно замещенную арильную группу, необязательно замещенную ар-C1-6алкильную группу, необязательно замещенную ацильную группу, необязательно замещенную гетероциклическую группу или необязательно замещенную гетероциклическую C1-6алкильную группу;
R9a представляет собой атом водорода, атом галогена, необязательно замещенную C1-6алкильную группу, необязательно замещенную C3-8циклоалкильную группу или необязательно замещенную арильную группу; и
значения R11, X2, X4a и X6a определены выше)).
[10] Соединение или его соль в соответствии с любым из [1]-[9], где G1 и G2 представляют собой CH; G3 представляет собой атом азота; и R4 представляет собой группу, представленную общей формулой (5-1):
[Формула 9]

(где
R8b представляет собой необязательно замещенную C1-6алкильную группу, необязательно замещенную C3-8циклоалкильную группу, необязательно замещенную C3-8циклоалкил-C1-6алкильную группу, необязательно замещенную арильную группу или необязательно замещенную ар-C1-6алкильную группу;
R9 представляет собой атом водорода, атом галогена, необязательно замещенную C1-6алкильную группу, необязательно замещенную C2-6алкенильную группу, необязательно замещенную C3-8циклоалкильную группу, необязательно замещенную C4-8циклоалкенильную группу, необязательно замещенную C3-8циклоалкил-C1-6алкильную группу или необязательно замещенную арильную группу;
R10 представляет собой атом водорода, необязательно защищенную карбоксильную группу, необязательно замещенную карбамоильную группу, необязательно замещенную C1-6алкильную группу или необязательно замещенную арильную группу; и
R11 представляет собой атом водорода, необязательно замещенную C1-6алкильную группу, необязательно замещенную C3-8циклоалкильную группу, необязательно замещенную арильную группу, необязательно замещенную ар-C1-6алкильную группу или необязательно замещенную ацильную группу).
[11] Соединение или его соль в соответствии с любым из [1]-[10], где G1 и G2 представляют собой CH; G3 представляет собой атом азота; и R4 представляет собой группу, представленную общей формулой (5-1a):
[Формула 10]

(где
R8b представляет собой необязательно замещенную C1-6алкильную группу, необязательно замещенную C3-8циклоалкильную группу, необязательно замещенную C3-8циклоалкил-C1-6алкильную группу, необязательно замещенную ар-C1-6алкильную группу или необязательно замещенную арильную группу).
[12] Соединение или его соль в соответствии с любым из [1]-[10], где G1 и G2 представляют собой CH; G3 представляет собой атом азота; и R4 представляет собой группу, представленную общей формулой (5-1b):
[Формула 11]

(где
R8c представляет собой необязательно замещенную C1-6алкильную группу; и
R9b представляет собой необязательно замещенную C1-6алкильную группу, необязательно замещенную C3-8циклоалкильную группу, необязательно замещенную C3-8циклоалкил-C1-6алкильную группу или необязательно замещенную арильную группу).
[13] Соединение или его соль в соответствии с любым из [1]-[10], где G1 и G2 представляют собой CH; G3 представляет собой атом азота; и R4 представляет собой группу, представленную общей формулой (5-1c):
[Формула 12]

(где
R8c представляет собой необязательно замещенную C1-6алкильную группу; и
R11a представляет собой необязательно замещенную арильную группу).
[14] Соединение или его соль в соответствии с [1], где соединение представляет собой, по меньшей мере, одно соединение, выбранное из группы, включающей в себя 5-циклопропил-2-((1-(3-фторбензил)-1H-индол-5-ил)амино)никотиновую кислоту, 5-циклопропил-2-((1-(2-фторбензил)-1H-индол-5-ил)амино)никотиновую кислоту, 5-циклопропил-2-(1-метил-3-фенил-1H-индол-5-ил)амино)никотиновую кислоту, 5-циклопропил-2-((1-метил-7-фенил-1H-индол-5-ил)амино)никотиновую кислоту, 2-((7-(2-цианофенил)-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту, 2-((1-бензил-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту, 5-циклопропил-2-((1-этил-2-фенил-1H-индол-5-ил)амино)никотиновую кислоту, 5-циклопропил-2-(1-изопентил-1H-индол-5-иламино)никотиновую кислоту, 2-((1-(циклогексилметил)-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту, 2-((1-(циклобутилметил)-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту, 2-((7-(4-цианофенил)-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту, 5-циклопропил-2-((7-(2-метоксифенил)-1-метил-1H-индол-5-ил)амино)никотиновую кислоту, 5-циклопропил-2-((1-фенил-1H-индол-5-ил)амино)никотиновую кислоту, 2-((1-(циклопентилметил)-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту, 5-циклопропил-2-((1-(4-фторбензил)-1H-индол-5-ил)амино)никотиновую кислоту, 5-циклопропил-2-((1-(3-(трифторметил)бензил)-1H-индол-5-ил)амино)никотиновую кислоту, 2-((1-(циклогексилметил)-1H-индазол-5-ил)амино)-5-циклопропилникотиновую кислоту, 5-циклопропил-2-((1-(4-фторфенил)-1H-индол-5-ил)амино)никотиновую кислоту, 2-((1-бензил-1H-индол-5-ил)амино)-5-циклопропилбензойную кислоту, 3-((1-бензил-1H-индол-5-ил)амино)-6-циклопропилпиразин-2-карбоновую кислоту, 5-циклопропил-2-((3-(2-фторфенил)-1-метил-1H-индол-5-ил)амино)никотиновую кислоту, 5-циклопропил-2-((7-(4-фторфенил)-1-метил-1H-индол-5-ил)амино)никотиновую кислоту, 2-((1-изобутил-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту, 5-циклопропил-2-((7-(2-фторфенил)-1-метил-1H-индол-5-ил)амино)никотиновую кислоту, 5-циклопропил-2-((7-(3-метоксипропил)-1-метил-1H-индол-5-ил)амино)никотиновую кислоту, 5-циклопропил-2-((7-(2-циклопропилэтил)-1-метил-1H-индол-5-ил)амино)никотиновую кислоту, 5-циклопропил-2-((7-изопропил-1-метил-1H-индол-5-ил)амино)никотиновую кислоту, 2-((1-бензил-1H-индол-5-ил)амино)-5-циклопропил-N-(метилсульфонил)никотинамид, 2-((3-бензил-2-оксо-2,3-дигидробензо[d]тиазол-6-ил)амино)-5-циклопропилникотиновую кислоту и 2-((1-(циклобутилметил)-1H-индол-4-ил)амино)-5-циклопропилникотиновую кислоту.
[14'] Соединение или его соль в соответствии с [1], где соединение представляет собой, по меньшей мере, одно соединение, выбранное из группы, включающей в себя 5-циклопропил-2-((1-(3-метоксибензил)-1H-индол-5-ил)амино)никотиновую кислоту, 2-((1-(3-цианобензил)-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту, 5-циклопропил-2-((1-(2-метилбензил)-1H-индол-5-ил)амино)никотиновую кислоту, 5-циклопропил-2-((1-(3-метилбензил)-1H-индол-5-ил)амино)никотиновую кислоту, 5-циклопропил-2-((1-(4-метилбензил)-1H-индол-5-ил)амино)никотиновую кислоту, 2-((1-(3-хлорбензил)-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту, 2-((1-бензил-6-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту, 5-циклопропил-2-((1-(2-фенилэтил)-1H-индол-5-ил)амино)никотиновую кислоту, 5-циклопропил-2-((1-(3-фторбензил)-7-метил-1H-индол-5-ил)амино)никотиновую кислоту, 2-((1-бензил-7-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту, 5-циклопропил-2-((1-(2-этилбутил)-1H-индол-5-ил)амино)никотиновую кислоту, 5-циклопропил-2-((1-(3,4-дифторбензил)-1H-индол-5-ил)амино)никотиновую кислоту, 2-((1-бутил-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту, 5-циклопропил-2-((1-(2,5-дифторбензил)-1H-индол-5-ил)амино)никотиновую кислоту и 5-циклопропил-2-((1-(2,3-дифторбензил)-1H-индол-5-ил)амино)никотиновую кислоту.
[15] Фармацевтическая композиция, содержащая соединение или его соль в соответствии с любым из [1]-[14].
[16] Ингибитор пролиферации кератиноцитов, содержащий соединение или его соль в соответствии с любым из [1]-[14].
[17] Средство для лечения заболевания, связанного с чрезмерной пролиферацией кератиноцитов, содержащее соединение или его соль в соответствии с любым из [1]-[14].
[18] Ингибитор продукции TNFα, содержащий соединение или его соль в соответствии с любым из [1]-[14].
[19] Средство для лечения заболевания, связанного с чрезмерной продукцией TNFα, содержащее соединение или его соль в соответствии с любым из [1]-[14].
[20] Лекарственное средство, содержащее соединение или его соль в соответствии с любым из [1] [14].
[21] Способ ингибирования пролиферации кератиноцитов, включающий стадию введения субъекту соединения или его соли в соответствии с любым из [1]-[14].
[22] Способ лечения заболевания, связанного с чрезмерной пролиферацией кератиноцитов, включающий стадию введения субъекту соединения или его соли в соответствии с любым из [1]-[14].
[23] Способ ингибирования продукции TNFα, включающий стадию введения субъекту соединения или его соли в соответствии с любым из [1]-[14].
[24] Способ лечения заболевания, связанного с чрезмерной продукцией TNFα, включающий стадию введения субъекту соединения или его соли в соответствии с любым из [1]-[14].
[25] Соединение или его соль в соответствии с любым из [1]-[14] для применения в способе ингибирования пролиферации кератиноцитов.
[26] Соединение или его соль в соответствии с любым из [1] [14] для применения в способе лечения заболевания, связанного с чрезмерной пролиферацией кератиноцитов.
[27] Соединение или его соль в соответствии с любым из [1] [14] для применения в способе ингибирования продукции TNFα.
[28] Соединение или его соль в соответствии с любым из [1]-[14] для применения в способе лечения заболевания, связанного с чрезмерной продукцией TNFα.
[29] Применение соединения или его соли в соответствии с любым из [1]-[14] в производстве ингибитора пролиферации кератиноцитов.
[30] Применение соединения или его соли в соответствии с любым из [1]-[14] в производстве лекарственного средства для лечения заболевания, связанного с чрезмерной пролиферацией кератиноцитов.
[31] Применение соединения или его соли в соответствии с любым из [1]-[14] в производстве ингибитора продукции TNFα.
[32] Применение соединения или его соли в соответствии с любым из [1]-[14] в производстве лекарственного средства для лечения заболевания, связанного с чрезмерной продукцией TNFα.
Благоприятные эффекты настоящего изобретения
Новые производные амина или их соли согласно настоящему изобретению, которые характеризуются превосходным эффектом ингибирования пролиферации кератиноцитов и являются наилучшими с точки зрения безопасности и фармакокинетики, применимы для лечения, такого как профилактика или терапия заболеваний, связанных с чрезмерной пролиферацией кератиноцитов, например, кожных заболеваний, таких как рак кожи, псориаз, иммунологические/аллергические заболевания и хроническая рана.
Кроме того, новые производные амина и их соли согласно настоящему изобретению, которые характеризуются превосходным эффектом ингибирования продукции TNFα, также применимы для лечения, такого как профилактика или терапия заболеваний, связанных с чрезмерной продукцией TNFα.
Описание вариантов осуществления
Далее, настоящее изобретение будет описано более подробно.
Если не указано иное, то в настоящем описании следующие термины имеют следующие значения.
Атом галогена относится к атому фтора, атому хлора, атому брома или атому йода.
C1-3алкильная группа относится к метильной группе, этильной группе, пропильной группе или изопропильной группе.
C1-4алкильная группа относится к метильной группе, этильной группе, пропильной группе, изопропильной группе, бутильной группе, втор-бутильной группе, изобутильной группе или трет-бутильной группе.
C1-6алкильная группа относится к неразветвленным или разветвленным C1-6алкильным группам, таким как метильная группа, этильная группа, пропильная группа, изопропильная группа, бутильная группа, втор-бутильная группа, изобутильная группа, трет-бутильная группа, пентильная группа, изопентильная группа и гексильная группа.
C1-12алкильная группа относится к неразветвленным или разветвленным C1-12алкильным группам, таким как метильная группа, этильная группа, пропильная группа, изопропильная группа, бутильная группа, втор-бутильная группа, изобутильная группа, трет-бутильная группа, пентильная группа, изопентильная группа, гексильная группа, гептильная группа и октильная группа.
C3-6алкильная группа относится к неразветвленным или разветвленным C3-6алкильным группам, таким как пропильная группа, изопропильная группа, бутильная группа, втор-бутильная группа, изобутильная группа, трет-бутильная группа, пентильная группа, изопентильная группа и гексильная группа.
C2-6алкенильная группа относится к неразветвленным или разветвленным C2-6алкенильным группам, таким как винильная группа, аллильная группа, пропенильная группа, изопропенильная группа, бутенильная группа, изобутенильная группа, 1,3-бутадиенильная группа, пентенильная группа и гексенильная группе.
C3-6циклоалкильная группа относится к циклопропильной группе, циклобутильной группе, циклопентильной группе или циклогексильной группе.
C3-8циклоалкильная группа относится к C3-8циклоалкильным группам, таким как циклопропильная группа, циклобутильная группа, циклопентильная группа и циклогексильная группа.
C3-8циклоалкил-C1-6алкильная группа относится к C3-8циклоалкил-C1-6алкильным группам, таким как циклопропилметильная группа, 2-(циклопропил)этильная группа, циклобутилметильная группа, 2-(циклобутил)этильная группа, циклопентилметильная группа и циклогексилметильная группа.
C4-8циклоалкенильная группа относится к C4-8циклоалкенильным группам, таким как циклобутенильная группа, циклопентенильная группа, циклогексенильная группа и циклогексадиенильная группа.
Конденсированная бициклическая углеводородная кольцевая группа относится к конденсированным бициклическим углеводородным кольцам, которые могут быть частично гидрированы, таким как пенталенильная группа, инданильная группа, инденильная группа и нафтильная группа.
Конденсированная трициклическая углеводородная кольцевая группа относится к конденсированным трициклическим углеводородным кольцам, которые могут быть частично гидрированы, таким как бифениленильная группа, аценафтенильная группа, аценафтиленильная группа, флуоренильная группа, феналенильная группа, фенантренильная группа и антраценильная группа.
Арильная группа относится к фенильной группе, конденсированной бициклической углеводородной кольцевой группе или конденсированной трициклической углеводородной кольцевой группе.
Ар-C1-6алкильная группа относится к арил-C1-6алкильным группам, таким как бензильная группа, дифенилметильная группа, тритильная группа, фенэтильная группа и нафтилметильная группа.
C1-3алкоксигруппа относится к метоксигруппе, этоксигруппе, пропоксигруппе или изопропоксигруппе.
C1-6алкоксигруппа относится к неразветвленным или разветвленным C1-6алкилоксигруппам, таким как метоксигруппа, этоксигруппа, пропоксигруппа, изопропоксигруппа, бутоксигруппа, изобутоксигруппа, втор-бутоксигруппа, трет-бутоксигруппа, пентилоксигруппа и гексилоксигруппа.
C1-6алкокси-C1-6алкильная группа относится к C1-6алкилокси-C1-6алкильным группам, таким как метоксиметильная группа и 1-этоксиэтильная группа.
Ар-C1-6алкокси-C1-6алкильная группа относится к ар-C1-6алкилокси-C1-6алкильным группам, таким как бензилоксиметильная группа и фенэтилоксиметильная группа.
Арилоксигруппа относится к арилоксигруппам, таким как феноксигруппа и нафтилоксигруппа.
C1-3алкилтиогруппа относится к метилтиогруппе, этилтиогруппе, пропилтиогруппе или изопропилтиогруппе.
C1-6алкилтиогруппа относится к C1-6алкилтиогруппам, таким как метилтиогруппа, этилтиогруппа, пропилтиогруппа и бутилтиогруппа.
Арилтиогруппа относится к арилтиогруппам, таким как фенилтиогруппа и нафтилтиогруппа.
C1-6алкилсульфонильная группа относится к C1-6алкилсульфонильным группам, таким как метилсульфонильная группа, этилсульфонильная группа и пропилсульфонильная группа.
Арилсульфонильная группа относится к арилсульфонильным группам, таким как бензолсульфонильная группа, пара-толуолсульфонильная группа и нафталинсульфонильная группа.
C1-3алкиламиногруппа относится к метиламиногруппе, этиламиногруппе, пропиламиногруппе или изопропиламиногруппе.
C1-6алкиламиногруппа относится к неразветвленным или разветвленным C1-6алкиламиногруппам, таким как метиламиногруппа, этиламиногруппа, пропиламиногруппа, изопропиламиногруппа, бутиламиногруппа, втор-бутиламиногруппа, трет-бутиламиногруппа, пентиламиногруппа и гексиламиногруппа.
Ди(C1-3алкил)аминогруппа относится к неразветвленным или разветвленным ди(C1-3алкил)аминогруппам, таким как диметиламиногруппа, диэтиламиногруппа, дипропиламиногруппа, диизопропиламиногруппа, (этил)(метил)аминогруппа и (метил)(пропил)аминогруппа.
Ди(C1-6алкил)аминогруппа относится к неразветвленным или разветвленным ди(C1-6алкил)аминогруппам, таким как диметиламиногруппа, диэтиламиногруппа, дипропиламиногруппа, диизопропиламиногруппа, дибутиламиногруппа, ди(трет-бутил)аминогруппа, дипентиламиногруппа, дигексиламиногруппа, (этил)(метил)аминогруппа и (метил)(пропил)аминогруппа.
C2-12алканоильная группа относится к неразветвленным или разветвленным C2-12алканоильным группам, таким как ацетильная группа, пропионильная группа, валерильная группа, изовалерильная группа и пивалоильная группа.
Ароильная группа относится к бензоильной группе или нафтоильной группе.
Гетероциклическая карбонильная группа относится к никотиноильной группе, теноильной группе, пирролидинокарбонильной группе или фуроильной группе.
(α-замещенная)аминоацетильная группа относится к (α-замещенным)аминоацетильным группам, содержащим необязательно замещенный N-концевой атом, которые получены из аминокислот (включая такие аминокислоты, как глицин, аланин, валин, лейцин, изолейцин, серин, треонин, цистеин, метионин, аспарагиновая кислота, глутаминовая кислота, аспарагин, глутамин, аргинин, лизин, гистидин, гидроксилизин, фенилаланин, тирозин, триптофан, пролин и гидроксипролин).
Ацильная группа относится к формильной группе, сукцинильной группе, глутарильной группе, малеоильной группе, фталоильной группе, C2-12алканоильной группе, ароильной группе, гетероциклической карбонильной группе или (α-замещенной)аминоацетильной группе.
Ацил-C1-6алкильная группа относится к ацетилметильной группе, бензоилметильной группе, 1-бензоилэтильной группе и т.п.
Ацилокси-C1-6алкильная группа относится к ацетоксиметильной группе, пропионилоксиметильной группе, пивалоилоксиметильной группе, бензоилоксиметильной группе, 1-(бензоилокси)этильной группе и т.п.
C1-6алкоксикарбонильная группа относится к неразветвленным или разветвленным C1-6алкилоксикарбонильным группам, таким как метоксикарбонильная группа, этоксикарбонильная группа, изопропоксикарбонильная группа, трет-бутоксикарбонильная группа и 1,1-диметилпропоксикарбонильная группа.
Ар-C1-6алкоксикарбонильная группа относится к арил-C1-6алкоксикарбонильным группам, таким как бензилоксикарбонильная группа и фенэтилоксикарбонильная группа.
Арилоксикарбонильная группа относится к арилоксикарбонильным группам, таким как фенилоксикарбонильная группа и нафтилоксикарбонильная группа.
Моноциклическая азотсодержащая гетероциклическая группа относится к моноциклическим азотсодержащим гетероциклическим группам, содержащим в качестве гетероатома(ов) только атом(ы) азота и образующим кольцо, таким как азетидинильная группа, пирролидинильная группа, пирролинильная группа, пирролильная группа, пиперидильная группа, тетрагидропиридильная группа, пиридильная группа, гомопиперидинильная группа, октагидроазоцинильная группа, имидазолидинильная группа, имидазолинильная группа, имидазолильная группа, пиразолидинильная группа, пиразолинильная группа, пиразолильная группа, пиперазинильная группа, пиразинильная группа, пиридизанильная группа, пиримидинильная группа, гомопиперазинильная группа, триазолильная группа и тетразолильная группа.
Моноциклическая кислородсодержащая гетероциклическая группа относится к тетрагидрофуранильной группе, фуранильной группе, тетрагидропиранильной группе, дигидропиранильной группе или пиранильной группе.
Моноциклическая серосодержащая гетероциклическая группа относится к тиенильной группе.
Моноциклическая азот- и кислородсодержащая гетероциклическая группа относится к моноциклическим азот- и кислородсодержащим гетероциклическим группам, содержащим в качестве гетероатомов только атомы азота и кислорода и образующим кольцо, таким как оксазолильная группа, изоксазолильная группа, оксадиазолильная группа и морфолинильная группа.
Моноциклическая азот- и серосодержащая гетероциклическая группа относится к моноциклическим азот- и серосодержащим гетероциклическим группам, содержащим в качестве гетероатомов только атомы азота и серы и образующим кольцо, таким как тиазолильная группа, изотиазолильная группа, тиадиазолильная группа, тиоморфолинильная группа, 1-оксидотиоморфолинильная группа и 1,1-диоксидотиоморфолинильная группа.
Моноциклическая гетероциклическая группа относится к моноциклической азотсодержащей гетероциклической группе, моноциклической кислородсодержащей гетероциклической группе, моноциклической серосодержащей гетероциклической группе, моноциклической азот- и кислородсодержащей гетероциклической группе или моноциклической азот- и серосодержащей гетероциклической группе.
Бициклическая азотсодержащая гетероциклическая группа относится к бициклическим азотсодержащим гетероциклическим группам, содержащим в качестве гетероатома(ов) только атом(ы) азота и образующим кольцо, таким как индолинильная группа, индолильная группа, изоиндолинильная группа, изоиндолильная группа, пирролопиридинильная группа, индазолильная группа, бензимидазолильная группа, бензотриазолильная группа, тетрагидрохинолинильная группа, дигидрохинолинильная группа, хинолинильная группа, тетрагидрохинолинильная группа, тетрагидроизохинолинильная группа, изохинолинильная группа, дигидрохиназолинильная группа, циннолинильная группа, фталазинильная группа, хиназолинильная группа, дигидрохиноксалинильная группа, хиноксалинильная группа, нафтиридинильная группа, пуринильная группа, птеридинильная группа и хинуклидинильная группа.
Бициклическая кислородсодержащая гетероциклическая группа относится к бициклическим кислородсодержащим гетероциклическим группам, содержащим в качестве гетероатома(ов) только атом(ы) кислорода и образующим кольцо, таким как 2,3-дигидробензофуранильная группа, бензофуранильная группа, изобензофуранильная группа, хроманильная группа, хроменильная группа, изохроманильная группа, 1,3-бензодиоксолильная группа, 1,3-бензодиоксанильная группа и 1,4-бензодиоксанильная группа.
Бициклическая серосодержащая гетероциклическая группа относится к бициклическим серосодержащим гетероциклическим группам, содержащим в качестве гетероатома(ов) только атом(ы) серы и образующим кольцо, таким как 2,3-дигидробензотиенильная группа и бензотиенильная группа.
Бициклическая азот- и кислородсодержащая гетероциклическая группа относится к бициклическим азот- и кислородсодержащим гетероциклическим группам, содержащим в качестве гетероатомов только атомы азота и кислорода и образующим кольцо, таким как дигидробензоксазолильная группа, бензоксазолильная группа, бензизоксазолильная группа, бензоксадиазолильная группа, бензоморфолинильная группа, дигидропиранопиридильная группа, дигидродиоксинопиридильная группа и дигидропиридоксазинильная группа.
Бициклическая азот- и серосодержащая гетероциклическая группа относится к бициклическим азот- и серосодержащим гетероциклическим группам, содержащим в качестве гетероатомов атомы азота и серы и образующим кольцо, таким как дигидробензотиазолильная группа, бензотиазолильная группа, бензизотиазолильная группа и бензотиадиазолильная группа.
Бициклическая гетероциклическая группа относится к бициклической азотсодержащей гетероциклической группе, бициклической кислородсодержащей гетероциклической группе, бициклической серосодержащей гетероциклической группе, бициклической азот- и кислородсодержащей гетероциклической группе или бициклической азот- и серосодержащей гетероциклической группе.
Трициклическая азотсодержащая гетероциклическая группа относится к трициклическим азотсодержащим гетероциклическим группам, содержащим в качестве гетероатома(ов) атом(ы) азота и образующим кольцо, таким как тетрагидрокарбазолильная группа, карбазолильная группа, акридинильная группа и фенантридинильная группа.
Трициклическая кислородсодержащая гетероциклическая группа относится к трициклическим кислородсодержащим гетероциклическим группам, содержащим в качестве гетероатома(ов) атом(ы) кислорода и образующим кольцо, таким как ксантенильная группа.
Трициклическая серосодержащая гетероциклическая группа относится к трициклическим серосодержащим гетероциклическим группам, содержащим в качестве гетероатома(ов) атом(ы) серы и образующим кольцо, таким как тиантренильная группа.
Трициклическая азот- и кислородсодержащая гетероциклическая группа относится к трициклическим азот- и кислородсодержащим гетероциклическим группам, содержащим в качестве гетероатомов атомы азота и кислорода и образующим кольцо, таким как феноксазинильная группа.
Трициклическая азот- и серосодержащая гетероциклическая группа относится к трициклическим азот- и серосодержащим гетероциклическим группам, содержащим в качестве гетероатомов атомы азота и серы и образующим кольцо, таким как фенотиазинильная группа.
Трициклическая гетероциклическая группа относится к трициклической азотсодержащей гетероциклической группе, трициклической кислородсодержащей гетероциклической группе, трициклической серосодержащей гетероциклической группе, трициклической азот- и кислородсодержащей гетероциклической группе или трициклической азот- и серосодержащей гетероциклической группе.
Гетероциклическая группа относится к моноциклической гетероциклической группе, бициклической гетероциклической группе или трициклической гетероциклической группе.
Гетероциклическая C1-6алкильная группа относится к моноциклическим азотсодержащим гетероциклическим C1-6алкильным группам, таким как азетидинилметильная группа, азетидинилэтильная группа, пирролидинилметильная группа, пирролидинилэтильная группа, пиперидилметильная группа, пиперидилэтильная группа, пиридилметильная группа, пиридилэтильная группа, имидазолилметильная группа, имидазолилэтильная группа, пиперазинилметильная группа и пиперазинилэтильная группа; моноциклическим кислородсодержащим гетероциклическим C1-6алкильным группам, таким как тетрагидрофуранилметильная группа и тетрагидропиранилметильная группа; моноциклическим серосодержащим гетероциклическим C1-6алкильным группам, таким как тиенилметильная группа; моноциклическим азот- и кислородсодержащим гетероциклическим C1-6алкильным группам, таким как оксазолилметильная группа, оксазолилэтильная группа, изоксазолилметильная группа, изоксазолилэтильная группа, морфолинилметильная группа и морфолинилэтильная группа; моноциклическим азот- и серосодержащим гетероциклическим C1-6алкильным группам, таким как тиазолилметильная группа, тиазолилэтильная группа, изотиазолилметильная группа и изотиазолилэтильная группа; бициклическим азотсодержащим гетероциклическим C1-6алкильным группам, таким как индолилметильная группа, индолилэтильная группа, бензимидазолилметильная группа, бензимидазолилэтильная группа, хинолилметильная группа и хинолилэтильная группа; бициклическим кислородсодержащим гетероциклическим C1-6алкильным группам, таким как бензофуранилметильная группа, изобензофуранилметильная группа и хроманилметильная группа; бициклическим серосодержащим гетероциклическим C1-6алкильным группам, таким как бензотиенилметильная группа; бициклическим азот- и кислородсодержащим гетероциклическим C1-6алкильным группам, таким как бензоксазолилметильная группа и бензизоксазолилметильная группа; бициклическим азот- и серосодержащим гетероциклическим C1-6алкильным группам, таким как бензотиазолилметильная группа и бензизотиазолилметильная группа; трициклическим азотсодержащим гетероциклическим C1-6алкильным группам, таким как карбазолилметильная группа; трициклическим кислородсодержащим гетероциклическим C1-6алкильным группам, таким как ксантенилметильная группа; и трициклическим серосодержащим гетероциклическим C1-6алкильным группам, таким как тиантренилметильная группа.
Силильная группа относится к триметилсилильной группе, триэтилсилильной группе, трибутилсилильной группе, трет-бутилдиметилсилильной группе и т.п.
Аминозащитные группы включают в себя все группы, которые могут быть использованы в качестве обычных защитных групп для аминогрупп, примеры которых включают в себя группы, описанные в W. Greene et al., Protective Groups in Organic Synthesis, 4th ed., pp. 696-926, 2007, John Wiley & Sons, Inc. Конкретные примеры включают в себя ар-C1-6алкильную группу, C1-6алкокси-C1-6алкильную группу, ацильную группу, C1-6алкоксикарбонильную группу, ар-C1-6алкоксикарбонильную группу, арилоксикарбонильную группу, C1-6алкилсульфонильную группу, арилсульфонильную группу или силильную группу.
Иминозащитные группы включают в себя все группы, которые могут быть использованы в качестве обычных защитных групп для иминогрупп, примеры которых включают в себя группы, описанные в W. Greene et al., Protective Groups in Organic Synthesis, 4th ed., pp. 696-926, 2007, John Wiley & Sons, Inc. Конкретные примеры включают в себя ар-C1-6алкильную группу, C1-6алкокси-C1-6алкильную группу, ацильную группу, C1-6алкоксикарбонильную группу, ар-C1-6алкоксикарбонильную группу, арилоксикарбонильную группу, C1-6алкилсульфонильную группу, арилсульфонильную группу или силильную группу.
Гидроксилзащитные группы включают в себя все группы, которые могут быть использованы в качестве обычных защитных групп для гидроксильных групп, примеры которых включают в себя группы, описанные в W. Greene et al., Protective Groups in Organic Synthesis, 4th ed., pp. 16-366, 2007, John Wiley & Sons, Inc. Конкретные примеры включают в себя C1-6алкильную группу, C2-6алкенильную группу, ар-C1-6алкильную группу, C1-6алкокси-C1-6алкильную группу, ар-C1-6алкокси-C1-6алкильную группу, ацильную группу, C1-6алкоксикарбонильную группу, ар-C1-6алкоксикарбонильную группу, C1-6алкилсульфонильную группу, арилсульфонильную группу, силильную группу, тетрагидрофуранильную группу или тетрагидропиранильную группу.
Карбоксилзащитные группы включают в себя все группы, которые могут быть использованы в качестве обычных защитных групп для карбоксильных групп, примеры которых включают в себя группы, описанные в W. Greene et al., Protective Groups in Organic Synthesis, 4th ed., pp. 533-646, 2007, John Wiley & Sons, Inc. Конкретные примеры включают в себя C1-6алкильную группу, C2-6алкенильную группу, арильную группу, ар-C1-6алкильную группу, C1-6алкокси-C1-6алкильную группу, ар-C1-6алкокси-C1-6алкильную группу, ацил-C1-6алкильную группу, ацилокси-C1-6алкильную группу или силильную группу.
Уходящие группы включают в себя атом галогена, C1-6алкилсульфонилоксигруппу или арилсульфонилоксигруппу. C1-6алкилсульфонилоксигруппа и арилсульфонилоксигруппа могут быть замещены.
Алифатические углеводороды включают в себя пентан, гексан или циклогексан.
Галогенированные углеводороды включают в себя метиленхлорид, хлороформ или дихлорэтан.
Спирты включают в себя метанол, этанол, пропанол, 2-пропанол, бутанол или 2-метил-2-пропанол.
Гликоли включают в себя этиленгликоль, пропиленгликоль или диэтиленгликоль.
Эфиры включают в себя диэтиловый эфир, диизопропиловый эфир, диоксан, тетрагидрофуран, анизол, диметиловый эфир этиленгликоля, диметиловый эфир диэтиленгликоля или диэтиловый эфир диэтиленгликоля.
Кетоны включают в себя ацетон, 2-бутанон или 4-метил-2-пентанон.
Сложные эфиры включают в себя метилацетат, этилацетат, пропилацетат или бутилацетат.
Амиды включают в себя N,N-диметилформамид, N,N-диметилацетамид или 1-метил-2-пирролидон.
Нитрилы включают в себя ацетонитрил или пропионитрил.
Сульфоксиды включают в себя диметилсульфоксид.
Ароматические углеводороды включают в себя бензол, толуол или ксилол.
Неорганические кислоты включают в себя соляную кислоту, азотную кислоту, фосфорную кислоту, серную кислоту, борную кислоту и фтористоводородную кислоту.
Органические кислоты включают в себя муравьиную кислоту, уксусную кислоту, трифторуксусную кислоту, фталевую кислоту, фумаровую кислоту, щавелевую кислоту, виннокаменную кислоту, малеиновую кислоту, лимонную кислоту, янтарную кислоту, яблочную кислоту, метансульфоновую кислоту, бензолсульфоновую кислоту или пара-толуолсульфоновую кислоту.
Кислота относится к неорганической кислоте или органической кислоте.
Неорганические основания включают в себя гидроксид натрия, гидроксид калия, бикарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия, ортофосфат калия, трет-бутоксид калия или гидрид натрия.
Органические основания включают в себя триэтиламин, диизопропилэтиламин, пиридин, 4-диметиламинопиридин или N-метилморфолин.
Основание относится к неорганическому основанию или органическому основанию.
Палладиевые катализаторы включают в себя металлический палладий, такой как палладий на угле и палладиевая чернь; неорганические палладиевые соли, такие как хлорид палладия; органические палладиевые соли, такие как ацетат палладия; палладийорганические комплексы, такие как тетракис(трифенилфосфин)палладий(0), дихлорид бис(трифенилфосфин)палладия(II), бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлорпалладий(II), дихлорид 1,1'-бис(дифенилфосфино)ферроценпалладия(II), (E)-ди(μ-ацетато)бис(o-(ди-o-толилфосфино)бензил)дипалладий(II) и трис(дибензилиденацетон)дипалладий(0); и палладийорганические комплексы на полимерной подложке, такие как бис(ацетато)трифенилфосфинпалладий(II) на полимерной подложке и ди(ацетато)дициклогексилфенилфосфинпалладий(II) на полимерной подложке.
Медные катализаторы включают в себя бромид меди(I), йодид меди(I) и ацетат меди(II).
Металлические катализаторы включают в себя металлический палладий, такой как палладий на угле и палладиевая чернь; палладиевые соли, такие как оксид палладия и гидроксид палладия; металлический никель, такой как никель Ренея; и платиновые соли, такие как оксид платины.
Лиганды включают в себя триалкилфосфины, такие как триметилфосфин и три-трет-бутилфосфин; алкилбисциклоалкилфосфины, такие как бутилбис(1-адамантил)фосфин; трициклоалкилфосфины, такие как трициклогексилфосфин; триарилфосфины, такие как трифенилфосфин и тритолилфосфин; триалкилфосфиты, такие как триметилфосфит, триэтилфосфит и трибутилфосфит; трициклоалкилфосфиты, такие как трициклогексилфосфит; триарилфосфиты, такие как трифенилфосфит; имидазоловые соли, такие как 1,3-бис(2,4,6-триметилфенил)-имидазолхлорид; дикетоны, такие как ацетилацетон и октафторацетилацетон; амины, такие как триметиламин, триэтиламин, трипропиламин и триизопропиламин; 1,1'-бис(дифенилфосфино)ферроцен, 2,2'-бис(дифенилфосфино)-1,1'-бинафтил, 2-дициклогексилфосфино-2',6'-диметоксибифенил, 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил, 2-(дициклогексилфосфино)-3,6-диметокси-2',4',6'-триизопропил-1,1'-бифенил, 2-(ди-трет-бутилфосфино)-2',4',6'-триизопропилбифенил, 4,5'-бис(дифенилфосфино)-9,9'-диметилксантен и 2-(ди-трет-бутилфосфино)бифенил.
Конденсирующие агенты включают в себя BOP (гексафторфосфат 1H-1,2,3-бензотриазол-1-илокси(три(диметиламино))фосфония), WSC (гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида), DCC (N,N-дициклогексилкарбодиимид), HATU (гексафторфосфат O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония) и CDI (1,1'-карбонилдиимидазол).
Соли соединений общей формулы (1) включают в себя общеизвестные соли при основных группах, таких как аминогруппа, или кислотных группах, таких как фенольная гидроксильная группа или карбоксильная группа.
Примеры солей при основных группах включают в себя соли с неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, азотная кислота и серная кислота; соли с органическими карбоновыми кислотами, такими как муравьиная кислота, уксусная кислота, лимонная кислота, щавелевая кислота, фумаровая кислота, малеиновая кислота, янтарная кислота, яблочная кислота, винная кислота, аспарагиновая кислота, трихлоруксусная кислота и трифторуксусная кислота; и соли с сульфоновыми кислотами, такими как метансульфоновая кислота, бензолсульфоновая кислота, пара-толуолсульфоновая кислота, мезитиленсульфоновая кислота и нафталинсульфоновая кислота.
Примеры солей при кислотных группах включают в себя соли со щелочными металлами, такими как натрий и калий; соли со щелочноземельными металлами, такими как кальций и магний; аммонийные соли; и соли с азотсодержащими органическими основаниями, такими как триметиламин, триэтиламин, трибутиламин, пиридин, N,N-диметиланилин, N-метилпиперидин, N-метилморфолин, диэтиламин, дициклогексиламин, прокаин, дибензиламин, N-бензил-β-фенэтиламин, 1-эфенамин и N,N'-дибензилэтилендиамин.
Примеры заболеваний, связанных с чрезмерной пролиферацией кератиноцитов, включают в себя кожные заболевания, такие как рак кожи, псориаз, иммунологические и аллергические заболевания кожи и хроническая рана. Рак кожи или псориаз являются предпочтительными, и псориаз является более предпочтительным.
Примеры заболеваний, связанных с чрезмерной продукцией TNFα, включают в себя септический шок, системную красную волчанку, ревматоидный артрит, псориаз, воспалительное заболевание кишечника, рассеянный склероз, анкилозирующий спондилит, аллергическое заболевание, артериосклероз, инсулин-резистентный сахарный диабет, реакцию «трансплантат против хозяина», вирусный гепатит и инфекции, такие как ВИЧ-инфекция. Ревматоидный артрит, псориаз, воспалительное заболевание кишечника и рассеянный склероз являются предпочтительными, и псориаз является более предпочтительным.
Примеры заболеваний, связанных с пролиферацией клеток, включают в себя злокачественную опухоль, атеросклероз, рестеноз сосудов, ангиогенез, диабетическую ретинопатию, псориаз и эндометриоз. Злокачественная опухоль и псориаз являются предпочтительными, и псориаз является более предпочтительным.
Лекарственное средство, согласно изложенному в настоящем документе, включает в себя лекарственное средство для людей и лекарственное средство для животных, отличных от людей (ветеринарное лекарственное средство). Лечение включает в себя профилактику или терапию. Профилактика включает в себя ингибирование начала, снижение риска возникновения и отсрочку возникновения. Терапия включает в себя ослабление симптомов или ингибирование прогрессирования (поддержание или задержку) соответствующего заболевания или состояния. Субъекты лечения включают в себя людей или отличных от людей животных, нуждающихся в таком лечении. «Лекарственное средство», «средство» или «фармацевтическая композиция», согласно изложенному в настоящем изобретении, могут быть предоставлены в виде композиций, в которых соединения или их соли согласно настоящему изобретению в качестве активных ингредиентов соответствующим образом смешаны со вспомогательными лекарственными средствами, используемыми для составления лекарственных форм, такими как наполнители, носители и разбавители. «Лекарственное средство», «средство» или «фармацевтическая композиция» могут содержать другие активные ингредиенты, и могут быть использованы совместно с лекарственным средством, содержащим другие активные ингредиенты.
Предпочтительные соединения согласно настоящему изобретению описаны ниже.
R1 предпочтительно представляет собой атом хлора, атом брома, необязательно замещенную C1-6алкильную группу, необязательно замещенную C3-8циклоалкильную группу, необязательно замещенную арильную группу, необязательно замещенную арилоксигруппу, необязательно замещенную C1-6алкилтиогруппу или необязательно замещенную гетероциклическую группу, более предпочтительно атом хлора, атом брома, C1-6алкильную группу, C3-8циклоалкильную группу, арильную группу, арилоксигруппу, необязательно замещенную метилсульфонильной группой, C1-6алкилтиогруппу или гетероциклическую группу, еще более предпочтительно атом хлора или C3-8циклоалкильную группу.
Заместители для C1-6алкильной группы, C3-8циклоалкильной группы, арильной группы, C1-6алкоксигруппы, арилоксигруппы, C1-6алкилтиогруппы, арилтиогруппы, C1-6алкиламиногруппы, ди(C1-6алкил)аминогруппы и гетероциклической группы R1 включают в себя, по меньшей мере, одну группу, выбранную из замещающей группы α.
C1-6алкильная группа R1 предпочтительно представляет собой C1-4алкильную группу, более предпочтительно метильную группу, этильную группу или изопропильную группу.
C3-8циклоалкильная группа R1 предпочтительно представляет собой C3-6циклоалкильную группу, более предпочтительно циклопропильную группу.
Арильная группа R1 предпочтительно представляет собой фенильную группу.
C1-6алкоксигруппа R1 предпочтительно представляет собой C1-3алкоксигруппу, более предпочтительно метоксигруппу.
Арилоксигруппа R1 предпочтительно представляет собой фенилоксигруппу.
C1-6алкилтиогруппа R1 предпочтительно представляет собой C1-3алкилтиогруппу, более предпочтительно метилтиогруппу.
Арилтиогруппа R1 предпочтительно представляет собой фенилтиогруппу.
C1-6алкиламиногруппа R1 предпочтительно представляет собой C1-3алкиламиногруппу, более предпочтительно метиламиногруппу.
Ди(C1-6алкил)аминогруппа R1 предпочтительно представляет собой ди(C1-3алкил)аминогруппу, более предпочтительно диметиламиногруппу.
Гетероциклическая группа R1 предпочтительно представляет собой моноциклическую гетероциклическую группу, более предпочтительно моноциклическую азотсодержащую гетероциклическую группу.
R2 предпочтительно представляет собой -COOR5.
R5 предпочтительно представляет собой атом водорода.
R6 предпочтительно представляет собой атом водорода.
R7 предпочтительно представляет собой необязательно замещенную C1-3алкильную группу или необязательно замещенную C3-6циклоалкильную группу, более предпочтительно C1-3алкильную группу, необязательно замещенную атомом галогена, или C3-6циклоалкильную группу, еще более предпочтительно метильную группу, трифторметильную группу или циклопропильную группу.
Заместители для C1-6алкильной группы и C3-8циклоалкильной группы R7 включают в себя, по меньшей мере, одну группу, выбранную из замещающей группы α.
R3 предпочтительно представляет собой атом водорода.
R4 предпочтительно представляет собой необязательно замещенную конденсированную бициклическую углеводородную кольцевую группу или необязательно замещенную бициклическую гетероциклическую группу.
Однако если R4 представляет собой необязательно замещенную конденсированную бициклическую углеводородную кольцевую группу, то G3 представляет собой атом азота.
Если G1 представляет собой CH, G2 представляет собой CH, G3 представляет собой CH, R1 представляет собой атом хлора, атом брома, атом йода, C1-4алкильную группу, трифторметильную группу, дибутиламиногруппу, метоксигруппу или замещенную фенилоксигруппу, R2 представляет собой -COOH, и R3 представляет собой атом водорода, то R4 представляет собой группу, представленную общими формулами (2-1)-(2-4):
[Формула 13]

(где значения X1aa, X1ba, X1ca, X1da, X1e, X2, X3, X4, X5, X6 и R8a определены выше).
R4 более предпочтительно представляет собой необязательно замещенную бициклическую гетероциклическую группу, еще более предпочтительно группу, представленную общими формулами (3-1)-(3-3):
[Формула 14]

(где значения X1a, X1b, X1c, X1d, X2, X3, X4a, X5, X6 и R8 определены выше), еще более предпочтительно, группу, представленную общей формулой (4-1) или (4-2):
[Формула 15]

(где значения X2, X6a, R8, R9 и R11 определены выше).
X1a, X1b, X1c и X1d предпочтительно представляют собой CR9.
R9 предпочтительно представляет собой атом водорода, необязательно замещенную C1-6алкильную группу, необязательно замещенную C3-8циклоалкильную группу, необязательно замещенную C3-8циклоалкил-C1-6алкильную группу или необязательно замещенную арильную группу, более предпочтительно атом водорода, необязательно замещенную C1-6алкильную группу, необязательно замещенную C3-8циклоалкил-C1-6алкильную группу или необязательно замещенную арильную группу, еще более предпочтительно атом водорода или необязательно замещенную арильную группу.
Заместители для C1-6алкильной группы, C2-6алкенильной группы, C3-8циклоалкильной группы, C4-8циклоалкенильной группы, C3-8циклоалкил-C1-6алкильной группы и арильной группы R9 включают в себя, по меньшей мере, одну группу, выбранную из замещающей группы α.
Если R4 представляет собой группу, представленную общей формулой (3-1), то X1a, X1b и X1c предпочтительно представляют собой CH, и X1d предпочтительно представляет собой CR9.
Если R4 представляет собой группу, представленную общей формулой (3-1), то X2 предпочтительно представляет собой CR10.
R10 предпочтительно представляет собой атом водорода или необязательно замещенную C1-6алкильную группу, более предпочтительно атом водорода.
Заместители для карбамоильной группы, C1-6алкильной группы и арильной группы R10 включают в себя, по меньшей мере, одну группу, выбранную из замещающей группы α.
Если R4 представляет собой группу, представленную общей формулой (3-1), то X3 предпочтительно представляет собой CR11.
R11 предпочтительно представляет собой атом водорода или необязательно замещенную арильную группу, более предпочтительно атом водорода.
Заместители для C1-6алкильной группы, C3-8циклоалкильной группы, арильной группы, ар-C1-6алкильной группы и ацильной группы R11 включают в себя, по меньшей мере, одну группу, выбранную из замещающей группы α.
Если R4 представляет собой группу, представленную общей формулой (3-2), то X1a, X1b, X1c и X1d предпочтительно представляют собой CH.
Если R4 представляет собой группу, представленную общей формулой (3-2), то X4a предпочтительно представляет собой CH2.
Если R4 представляет собой группу, представленную общей формулой (3-3), то X1a, X1b, X1c и X1d предпочтительно представляют собой CH.
Если R4 представляет собой группу, представленную общей формулой (3-3), то X5 предпочтительно представляет собой C=O.
Если R4 представляет собой группу, представленную общей формулой (3-3), то X6 предпочтительно представляет собой CH2, C=O, атом кислорода, атом серы или NR12.
R12 предпочтительно представляет собой необязательно замещенную C1-6алкильную группу или необязательно замещенную C3-8циклоалкильную группу.
Заместители для C1-6алкильной группы, C3-8циклоалкильной группы и C3-8циклоалкил-C1-6алкильной группы R12 включают в себя, по меньшей мере, одну группу, выбранную из замещающей группы α.
R8' предпочтительно представляет собой атом водорода, необязательно замещенную C1-6алкильную группу, необязательно замещенную C3-8циклоалкильную группу, необязательно замещенную C3-8циклоалкил-C1-6алкильную группу, необязательно замещенную арильную группу, необязательно замещенную ар-C1-6алкильную группу, необязательно замещенную ацильную группу, необязательно замещенную гетероциклическую группу или необязательно замещенную гетероциклическую C1-6алкильную группу.
Заместители для C1-12алкильной группы, C3-8циклоалкильной группы, C3-8циклоалкил-C1-6алкильной группы, арильной группы, ар-C1-6алкильной группы, ацильной группы, гетероциклической группы и гетероциклической C1-6алкильной группы R8' включают в себя, по меньшей мере, одну группу, выбранную из замещающей группы α.
R8 предпочтительно представляет собой необязательно замещенную C1-6алкильную группу, необязательно замещенную C3-8циклоалкильную группу, необязательно замещенную C3-8циклоалкил-C1-6алкильную группу, необязательно замещенную арильную группу или необязательно замещенную ар-C1-6алкильную группу.
Заместители для C1-6алкильной группы, C3-8циклоалкильной группы, C3-8циклоалкил-C1-6алкильной группы, арильной группы, ар-C1-6алкильной группы, ацильной группы, гетероциклической группы и гетероциклической C1-6алкильной группы R8 включают в себя, по меньшей мере, одну группу, выбранную из замещающей группы α.
R11 предпочтительно представляет собой атом водорода или необязательно замещенную арильную группу.
Заместители для C1-6алкильной группы, C3-8циклоалкильной группы, арильной группы, ар-C1-6алкильной группы и ацильной группы R11 включают в себя, по меньшей мере, одну группу, выбранную из замещающей группы α.
Еще более предпочтительно, G1 и G2 представляют собой CH, G3 представляет собой атом азота, и R4 представляет собой группу, представленную общей формулой (5-1):
[Формула 16]

(где значения R8b, R9, R10 и R11 определены выше).
R8b предпочтительно представляет собой необязательно замещенную арильную группу или необязательно замещенную ар-C1-6алкильную группу.
Заместители для C1-6алкильной группы, C3-8циклоалкильной группы, C3-8циклоалкил-C1-6алкильной группы, арильной группы и ар-C1-6алкильной группы R8b включают в себя, по меньшей мере, одну группу, выбранную из замещающей группы α.
R9' предпочтительно представляет собой атом водорода, атом галогена, необязательно замещенную C1-6алкильную группу, необязательно замещенную C2-6алкенильную группу, необязательно замещенную C3-8циклоалкильную группу, необязательно замещенную C4-8циклоалкенильную группу, необязательно замещенную C3-8циклоалкил-C1-6алкильную группу или необязательно замещенную арильную группу.
Заместители для C1-6алкильной группы, C2-6алкенильной группы, C3-8циклоалкильной группы, C4-8циклоалкенильной группы, C3-8циклоалкил-C1-6алкильной группы, арильной группы и гетероциклической группы R9' включают в себя, по меньшей мере, одну группу, выбранную из замещающей группы α.
R9 предпочтительно представляет собой атом водорода, необязательно замещенную C3-6алкильную группу, необязательно замещенную C3-8циклоалкильную группу, необязательно замещенную C3-8циклоалкил-C1-6алкильную группу или необязательно замещенную арильную группу, более предпочтительно атом водорода или необязательно замещенную арильную группу.
Заместители для C1-6алкильной группы, C2-6алкенильной группы, C3-8циклоалкильной группы, C4-8циклоалкенильной группы, C3-8циклоалкил-C1-6алкильной группы и арильной группы R9 включают в себя, по меньшей мере, одну группу, выбранную из замещающей группы α.
R10 предпочтительно представляет собой атом водорода или необязательно замещенную C1-6алкильную группу, более предпочтительно атом водорода.
Заместители для карбамоильной группы, C1-6алкильной группы и арильной группы R10 включают в себя, по меньшей мере, одну группу, выбранную из замещающей группы α.
R11 предпочтительно представляет собой атом водорода или необязательно замещенную арильную группу.
Заместители для C1-6алкильной группы, C3-8циклоалкильной группы, арильной группы, ар-C1-6алкильной группы и ацильной группы R11 включают в себя, по меньшей мере, одну группу, выбранную из замещающей группы α.
Особенно предпочтительно, G1 и G2 представляют собой CH, G3 представляет собой атом азота, и R4 представляет собой группу, представленную общей формулой (5-1a):
[Формула 17]

(где значение R8b определено выше).
R8b предпочтительно представляет собой необязательно замещенную C1-6алкильную группу, необязательно замещенную C3-8циклоалкил-C1-6алкильную группу или необязательно замещенную ар-C1-6алкильную группу.
Заместители для C1-6алкильной группы, C3-8циклоалкильной группы, C3-8циклоалкил-C1-6алкильной группы, арильной группы и ар-C1-6алкильной группы R8b включают в себя, по меньшей мере, одну группу, выбранную из замещающей группы α.
Особенно предпочтительно, G1 и G2 представляют собой CH, G3 представляет собой атом азота, и R4 представляет собой группу, представленную общей формулой (5-1b):
[Формула 18]

(где значения R8c и R9b определены выше).
R8c предпочтительно представляет собой необязательно замещенную C1-6алкильную группу.
Заместители для C1-3алкильной группы R8c включают в себя, по меньшей мере, одну группу, выбранную из замещающей группы α.
R9b предпочтительно представляет собой необязательно замещенную C1-6алкильную группу, необязательно замещенную C3-8циклоалкил-C1-6алкильную группу или необязательно замещенную арильную группу.
Заместители для C1-6алкильной группы, C3-8циклоалкильной группы, C3-8циклоалкил-C1-6алкильной группы и арильной группы R9b включают в себя, по меньшей мере, одну группу, выбранную из замещающей группы α.
Особенно предпочтительно, G1 и G2 представляют собой CH, G3 представляет собой атом азота, и R4 представляет собой группу, представленную общей формулой (5-1c):
[Формула 19]

(где значения R8c и R11a определены выше).
R8c предпочтительно представляет собой необязательно замещенную C1-6алкильную группу.
Заместители для C1-6алкильной группы R8c включают в себя, по меньшей мере, одну группу, выбранную из замещающей группы α.
R11a предпочтительно представляет собой необязательно замещенную арильную группу.
Заместители для арильной группы R11a включают в себя, по меньшей мере, одну группу, выбранную из замещающей группы α.
Новое производное амина или его соль согласно настоящему изобретению наиболее предпочтительно представляет собой, по меньшей мере, одно соединение, выбранное из 5-циклопропил-2-((1-(3-фторбензил)-1H-индол-5-ил)амино)никотиновой кислоты, 5-циклопропил-2-((1-(2-фторбензил)-1H-индол-5-ил)амино)никотиновой кислоты, 5-циклопропил-2-(1-метил-3-фенил-1H-индол-5-ил)амино)никотиновой кислоты, 5-циклопропил-2-((1-метил-7-фенил-1H-индол-5-ил)амино)никотиновой кислоты, 2-((7-(2-цианофенил)-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты, 2-((1-бензил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты, 5-циклопропил-2-((1-этил-2-фенил-1H-индол-5-ил)амино)никотиновой кислоты, 5-циклопропил-2-(1-изопентил-1H-индол-5-иламино)никотиновой кислоты, 2-((1-(циклогексилметил)-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты, 2-((1-(циклобутилметил)-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты, 2-((7-(4-цианофенил)-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты, 5-циклопропил-2-((7-(2-метоксифенил)-1-метил-1H-индол-5-ил)амино)никотиновой кислоты, 5-циклопропил-2-((1-фенил-1H-индол-5-ил)амино)никотиновой кислоты, 2-((1-(циклопентилметил)-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты, 5-циклопропил-2-((1-(4-фторбензил)-1H-индол-5-ил)амино)никотиновой кислоты, 5-циклопропил-2-((1-(3-(трифторметил)бензил)-1H-индол-5-ил)амино)никотиновой кислоты, 2-((1-(циклогексилметил)-1H-индазол-5-ил)амино)-5-циклопропилникотиновой кислоты, 5-циклопропил-2-((1-(4-фторфенил)-1H-индол-5-ил)амино)никотиновой кислоты, 2-((1-бензил-1H-индол-5-ил)амино)-5-циклопропилбензойной кислоты, 3-((1-бензил-1H-индол-5-ил)амино)-6-циклопропилпиразин-2-карбоновой кислоты, 5-циклопропил-2-((3-(2-фторфенил)-1-метил-1H-индол-5-ил)амино)никотиновой кислоты, 5-циклопропил-2-((7-(4-фторфенил)-1-метил-1H-индол-5-ил)амино)никотиновой кислоты, 2-((1-изобутил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты, 5-циклопропил-2-((7-(2-фторфенил)-1-метил-1H-индол-5-ил)амино)никотиновой кислоты, 5-циклопропил-2-((7-(3-метоксипропил)-1-метил-1H-индол-5-ил)амино)никотиновой кислоты, 5-циклопропил-2-((7-(2-циклопропилэтил)-1-метил-1H-индол-5-ил)амино)никотиновой кислоты, 5-циклопропил-2-((7-изопропил-1-метил-1H-индол-5-ил)амино)никотиновой кислоты, 2-((1-бензил-1H-индол-5-ил)амино)-5-циклопропил-N-(метилсульфонил)никотинамида, 2-((3-бензил-2-оксо-2,3-дигидробензо[d]тиазол-6-ил)амино)-5-циклопропилникотиновой кислоты и 2-((1-(циклобутилметил)-1H-индол-4-ил)амино)-5-циклопропилникотиновой кислоты, или его соль.
Согласно другому варианту осуществления, новое производное амина или его соль согласно настоящему изобретению предпочтительно представляет собой, по меньшей мере, одно соединение, выбранное из 5-циклопропил-2-((1-(3-метоксибензил)-1H-индол-5-ил)амино)никотиновой кислоты, 2-((1-(3-цианобензил)-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты, 5-циклопропил-2-((1-(2-метилбензил)-1H-индол-5-ил)амино)никотиновой кислоты, 5-циклопропил-2-((1-(3-метилбензил)-1H-индол-5-ил)амино)никотиновой кислоты, 5-циклопропил-2-((1-(4-метилбензил)-1H-индол-5-ил)амино)никотиновой кислоты, 2-((1-(3-хлорбензил)-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты, 2-((1-бензил-6-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты, 5-циклопропил-2-((1-(2-фенилэтил)-1H-индол-5-ил)амино)никотиновой кислоты, 5-циклопропил-2-((1-(3-фторбензил)-7-метил-1H-индол-5-ил)амино)никотиновой кислоты, 2-((1-бензил-7-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты, 5-циклопропил-2-((1-(2-этилбутил)-1H-индол-5-ил)амино)никотиновой кислоты, 5-циклопропил-2-((1-(3,4-дифторбензил)-1H-индол-5-ил)амино)никотиновой кислоты, 2-((1-бутил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты, 5-циклопропил-2-((1-(2,5-дифторбензил)-1H-индол-5-ил)амино)никотиновой кислоты и 5-циклопропил-2-((1-(2,3-дифторбензил)-1H-индол-5-ил)амино)никотиновой кислоты, или его соль.
Замещающая группа α: атом галогена, необязательно защищенная гидроксильная группа, необязательно защищенная карбоксильная группа, необязательно защищенная аминогруппа, нитрогруппа, цианогруппа, карбамоильная группа, необязательно замещенная, по меньшей мере, одной группой, выбранной из замещающей группы β, C1-6алкильная группа, необязательно замещенная, по меньшей мере, одной группой, выбранной из замещающей группы β, C2-6алкенильная группа, необязательно замещенная, по меньшей мере, одной группой, выбранной из замещающей группы β, C3-8циклоалкильная группа, необязательно замещенная, по меньшей мере, одной группой, выбранной из замещающей группы β, C1-6алкоксигруппа, необязательно замещенная, по меньшей мере, одной группой, выбранной из замещающей группы β, ацильная группа, необязательно замещенная, по меньшей мере, одной группой, выбранной из замещающей группы β, алкоксикарбонильная группа, необязательно замещенная, по меньшей мере, одной группой, выбранной из замещающей группы β, C1-6алкиламиногруппа, необязательно замещенная, по меньшей мере, одной группой, выбранной из замещающей группы β, ди(C1-6алкил)аминогруппа, необязательно замещенная, по меньшей мере, одной группой, выбранной из замещающей группы β, C1-6алкилтиогруппа, необязательно замещенная, по меньшей мере, одной группой, выбранной из замещающей группы β, C1-6алкилсульфонильная группа, необязательно замещенная, по меньшей мере, одной группой, выбранной из замещающей группы β, арильная группа, необязательно замещенная, по меньшей мере, одной группой, выбранной из замещающей группы β, гетероциклическая группа, необязательно замещенная, по меньшей мере, одной группой, выбранной из замещающей группы β, и оксогруппа.
Замещающая группа β: атом галогена, необязательно защищенная гидроксильная группа, необязательно защищенная карбоксильная группа, необязательно защищенная аминогруппа, карбамоильная группа, C1-6алкильная группа, необязательно замещенная атомом галогена, C1-6алкоксигруппа, необязательно замещенная атомом галогена, C1-6алкиламиногруппа, ди(C1-6алкил)аминогруппа, гетероциклическая группа и оксогруппа.
Новое производное амина или его соль согласно настоящему изобретению предпочтительно используют для лечения, например, для профилактики или терапии рака кожи и псориаза, и более предпочтительно используют для лечения, например, для профилактики или терапии псориаза.
Если для соединений, представленных общей формулой (1), или их солей согласно настоящему изобретению существуют изомеры (такие как оптические изомеры, геометрические изомеры и таутомеры), то настоящее изобретение охватывает такие изомеры. Если для соединений или солей существуют сольваты, гидраты и различные формы кристаллов, то настоящее изобретение охватывает такие сольваты, гидраты и различные формы кристаллов.
Далее будут описаны способы получения соединений согласно настоящему изобретению.
Соединения согласно настоящему изобретению получают путем объединения способов, известных per se, и могут быть получены, например, способами получения, представленными ниже.
[Способ получения 1]
[Формула 20]

(в формулах L1 представляет собой уходящую группу; и значения G1, G2, G3, R1, R2, R3 и R4 определены выше).
В качестве соединений общей формулы [A] известны, например, метил-2-бром-5-хлорбензоат, метил-2-бром-5-(трифторметил)-бензоат, метил-2-хлор-5-циклопропилникотинат и т.п.
В качестве соединений общей формулы [B] известны, например, 1-бензил-1H-индол-5-амин, 1-бензил-1H-индазол-5-амин и т.п.
Соединение общей формулы [C] или его соль могут быть получены путем осуществления взаимодействия соединения общей формулы [A] или его соли с соединением общей формулы [B] или его солью в присутствии или в отсутствие основания, в присутствии палладиевого катализатора и в присутствии или в отсутствие лиганда.
Используемый в указанной реакции растворитель конкретно не ограничен при условии, что он не оказывает неблагоприятного воздействия на реакцию. Примеры растворителя включают в себя алифатические углеводороды, галогенированные углеводороды, спирты, гликоли, эфиры, кетоны, сложные эфиры, амиды, нитрилы, сульфоксиды, ароматические углеводороды и воду. Также могут быть использованы смеси указанных растворителей.
Предпочтительные растворители включают в себя эфиры, сложные эфиры и ароматические углеводороды.
Количество используемого растворителя конкретно не ограничено, но предпочтительно от 1 до 100 раз (об./масс.), более предпочтительно от 1 до 10 раз (об./масс.), еще более предпочтительно от 1 до 5 раз (об./масс.) больше количества соединения общей формулы [A] или его соли.
Примеры используемого в указанной реакции основания включают в себя неорганические основания и органические основания.
Предпочтительные основания включают в себя неорганические основания, такие как бикарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия и ортофосфат калия; и органические основания, такие как пиридин, 4-(диметиламино)-пиридин, триэтиламин и диизопропилэтиламин.
Основание используют в количестве предпочтительно от 1 до 10 моль, более предпочтительно от 1 до 5 моль, еще более предпочтительно от 1 до 2 моль, на 1 моль соединения общей формулы [A] или его соли.
Используемые в указанной реакции предпочтительные катализаторы включают в себя ацетат палладия, тетракис(трифенилфосфин)палладий(0) и трис(дибензилиденацетон)дипалладий(0). Также могут быть использованы комбинации указанных катализаторов.
Палладиевый катализатор используют в количестве предпочтительно от 0,00001 до 1 моль, более предпочтительно от 0,001 до 0,2 моль, на 1 моль соединения общей формулы [A] или его соли.
Используемые в указанной реакции предпочтительные лиганды включают в себя трифенилфосфин, тритолилфосфин, три-трет-бутилфосфин, трициклогексилфосфин, 2,2'-бис(дифенилфосфино)-1,1'-бинафтил, 2-дициклогексилфосфино-2',6'-диметоксибифенил, 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил, 2-(ди-трет-бутилфосфино)-2',4',6'-триизопропилбифенил, 2-(ди-трет-бутилфосфино)бифенил, 4,5'-бис(дифенилфосфино)-9,9'-диметилксантен и 2-(дициклогексилфосфино)-3,6-диметокси-2',4',6'-триизопропил-1,1'-бифенил. Также могут быть использованы комбинации указанных лигандов.
Лиганд используют в количестве предпочтительно от 0,00001 до 1 моль, более предпочтительно от 0,001 до 0,4 моль, на 1 моль соединения общей формулы [A] или его соли.
Соединение общей формулы [B] или его соль используют в количестве предпочтительно от 1 до 50 моль, более предпочтительно от 1 до 2 моль, на 1 моль соединения общей формулы [A] или его соли.
Указанная реакция может быть предпочтительно проведена при температуре от 40 до 170°C в течение от 1 минуты до 24 часов в атмосфере инертного газа (такого как азот или аргон).
Указанная реакция может быть проведена при микроволновом облучении.
[Способ получения 2]
[Формула 21]
(в формулах L2 представляет собой уходящую группу; и значения G1, G2, G3, R1, R2, R3 и R4 определены выше).
В качестве соединений общей формулы [D] известны, например, метил-2-амино-5-хлорбензоат, метил-2-амино-5-циклопропилбензоат и т.п.
В качестве соединений общей формулы [E] известны, например, 1-бензил-5-бром-1H-индол, 1-бензил-4-бром-1H-индол и т.п.
Соединение общей формулы [C] или его соль могут быть получены путем осуществления взаимодействия соединения общей формулы [D] или его соли с соединением общей формулы [E] или его солью в присутствии или в отсутствие основания, в присутствии палладиевого катализатора и в присутствии или в отсутствие лиганда.
Указанный способ может быть осуществлен согласно способу получения [1].
[Способ получения 3]
[Формула 22]

(в формулах L3 представляет собой уходящую группу; R2a представляет собой -COOR5a (где R5a представляет собой карбоксильную защитную группу) или -C(O)N(R6a)SO2R7 (где R6a представляет собой иминозащитную группу; и значение R7 определено выше); и значения G1, G2, G3, R1, R3, R8, X1a, X1b, X1c, X1d, X2 и X3 определены выше).
В качестве соединений общей формулы [G] известны, например, бензилбромид, 1-бромбутан, 1-(бромметил)-3-(2,2,2-трифторэтокси)бензол и т.п.
Соединение общей формулы [H] или его соль могут быть получены путем осуществления взаимодействия соединения общей формулы [F] или его соли с соединением общей формулы [G] или его солю в присутствии основания.
Используемый в указанной реакции растворитель конкретно не ограничен при условии, что он не оказывает неблагоприятного воздействия на реакцию. Примеры растворителя включают в себя алифатические углеводороды, галогенированные углеводороды, спирты, гликоли, эфиры, кетоны, сложные эфиры, амиды, нитрилы, сульфоксиды, ароматические углеводороды и воду. Также могут быть использованы смеси указанных растворителей.
Количество используемого растворителя конкретно не ограничено, но предпочтительно от 1 до 100 раз (об./масс.), более предпочтительно от 1 до 10 раз (об./масс.), еще более предпочтительно от 1 до 5 раз (об./масс.) больше количества соединения общей формулы [F] или его соли.
Примеры используемого в указанной реакции основания включают в себя неорганические основания и органические основания.
Предпочтительные основания включают в себя неорганические основания, такие как бикарбонат натрия, карбонат натрия, карбонат калия, гидрид натрия и трет-бутоксид калия; и органические основания, такие как 1,8-диазабицикло(5,4,0)ундец-7-ен.
Основание используют в количестве предпочтительно от 1 до 5 моль, более предпочтительно от 1 до 2 моль, на 1 моль соединения общей формулы [F] или его соли.
Если R8 необязательно представляет собой замещенную ацильную группу, то реакция может быть проведена в присутствии добавки.
Примеры используемой в указанной реакции добавки включают в себя 4-(диметиламино)пиридин.
Добавку используют в количестве предпочтительно от 0,01 до 1 моль, более предпочтительно от 0,1 до 0,5 моль, на 1 моль соединения общей формулы [F] или его соли.
Соединение общей формулы [G] или его соль используют в указанной реакции в количестве предпочтительно от 1 до 5 моль, более предпочтительно от 1 до 1,5 моль, на 1 моль соединения общей формулы [F] или его соли.
Обычно указанная реакция может быть проведена при температуре от 0 до 200°C, предпочтительно при температуре от 0 до 100°C, в течение от 10 минут до 24 часов.
[Способ получения 4]
[Формула 23]
(в формулах значения G1, G2, G3, L3, R1, R2a, R3, R8, X1a, X1b, X1c, X1d и X1e определены выше).
Соединение общей формулы [J] или его соль могут быть получены путем осуществления взаимодействия соединения общей формулы [I] или его соли с соединением общей формулы [G] или его солью в присутствии основания.
Указанный способ может быть осуществлен согласно способу получения [3].
[Способ получения 5]
[Формула 24]

(в формулах значения G1, G2, G3, L3, R1, R2a, R3, R8, X1a, X1b, X1c, X1d, X2 и X3 определены выше).
Соединение общей формулы [H] или его соль могут быть получены путем осуществления взаимодействия соединения общей формулы [F] или его соли с соединением общей формулы [G] или его солью в присутствии или в отсутствие основания, в присутствии палладиевого катализатора или медного катализатора и в присутствии или в отсутствие лиганда.
Используемый в указанной реакции растворитель конкретно не ограничен при условии, что он не оказывает неблагоприятного воздействия на реакцию. Примеры растворителя включают в себя алифатические углеводороды, галогенированные углеводороды, спирты, гликоли, эфиры, кетоны, сложные эфиры, амиды, нитрилы, сульфоксиды, ароматические углеводороды и воду. Также могут быть использованы смеси указанных растворителей.
Предпочтительные растворители включают в себя эфиры, сложные эфиры, ароматические углеводороды и амиды.
Количество используемого растворителя конкретно не ограничено, но предпочтительно от 1 до 100 раз (об./масс.), более предпочтительно от 1 до 10 раз (об./масс.), еще более предпочтительно от 1 до 5 раз (об./масс.) больше количества соединения общей формулы [F] или его соли.
Примеры используемого в указанной реакции основания включают в себя неорганические основания и органические основания.
Предпочтительные основания включают в себя неорганические основания, такие как бикарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия и ортофосфат калия; и органические основания, такие как пиридин, 4-(диметиламино)-пиридин, триэтиламин и диизопропилэтиламин.
Основание используют в количестве предпочтительно от 1 до 10 моль, более предпочтительно от 1 до 5 моль, еще более предпочтительно от 1 до 1,5 моль, на 1 моль соединения формулы [F] или его соли.
Используемые в указанной реакции предпочтительные катализаторы включают в себя ацетат палладия, тетракис(трифенилфосфин)палладий(0) и трис(дибензилиденацетон)дипалладий(0). Также могут быть использованы комбинации указанных катализаторов.
Палладиевый катализатор используют в количестве предпочтительно от 0,00001 до 1 моль, более предпочтительно от 0,001 до 0,2 моль, на 1 моль соединения общей формулы [F] или его соли.
Используемые в указанной реакции предпочтительные лиганды при использовании палладиевого катализатора включают в себя 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил, 2-(ди-трет-бутилфосфино)-2',4',6'-триизопропилбифенил, 2-(ди-трет-бутилфосфино)бифенил, 4,5'-бис(дифенилфосфино)-9,9'-диметилксантен и 2-(дициклогексилфосфино)-3,6-диметокси-2',4',6'-триизопропил-1,1'-бифенил. Также могут быть использованы комбинации указанных лигандов.
Лиганд используют в количестве предпочтительно от 0,00001 до 1 моль, более предпочтительно от 0,001 до 0,4 моль, на 1 моль соединения общей формулы [F] или его соли.
Примеры используемого в указанной реакции медного катализатора включают в себя медный порошок и йодид меди. Также могут быть использованы комбинации указанных катализаторов.
Медный катализатор используют в количестве предпочтительно от 0,00001 до 1 моль, более предпочтительно от 0,01 до 0,5 моль, на 1 моль соединения общей формулы [F] или его соли.
Используемые в указанной реакции предпочтительные лиганды при использовании медного катализатора включают в себя 1,10-фенантролин, транс-1,2-циклогександиамин и транс-N,N'-диметилциклогексан-1,2-диамин. Также могут быть использованы комбинации указанных лигандов.
Лиганд используют в количестве предпочтительно от 0,00001 до 1 моль, более предпочтительно от 0,001 до 0,4 моль, на 1 моль соединения общей формулы [F] или его соли.
Соединение общей формулы [G] или его соль используют в количестве предпочтительно от 1 до 50 моль, более предпочтительно от 1 до 2 моль, на 1 моль соединения общей формулы [F] или его соли.
Указанная реакция может быть осуществлена предпочтительно при температуре от 40 до 170°C в течение от 1 минуты до 24 часов в атмосфере инертного газа (такого как азот или аргон).
Указанная реакция может быть осуществлена при микроволновом облучении.
[Способ получения 6]
[Формула 25]
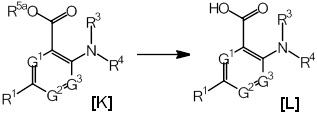
(в формулах значения G1, G2, G3, R1, R3, R4 и R5a определены выше).
Соединение общей формулы [L] или его соль могут быть получены путем снятия защитных групп с соединения общей формулы [K] или его соли.
Указанная реакция может быть осуществлена способом, описанным в W. Greene et al., Protective Groups in Organic Synthesis, 4th ed., pp. 533-646, 2007, John Wiley & Sons, Inc., или, например, способом, эквивалентным указанному способу.
Примеры реакции снятия защитных групп включают в себя реакцию гидролиза с применением кислоты или основания, реакцию деалкилирования с применением соли и реакцию восстановительного деалкилирования, включая реакцию гидрирования с металлическим катализатором.
Используемый в указанной реакции растворитель конкретно не ограничен при условии, что он не оказывает неблагоприятного воздействия на реакцию. Примеры растворителя включают в себя алифатические углеводороды, галогенированные углеводороды, спирты, гликоли, эфиры, кетоны, сложные эфиры, амиды, нитрилы, сульфоксиды, ароматические углеводороды и воду. Также могут быть использованы смеси указанных растворителей.
Количество используемого растворителя конкретно не ограничено, но предпочтительно от 1 до 100 раз (об./масс.), более предпочтительно от 1 до 10 раз (об./масс.), еще более предпочтительно от 1 до 5 раз (об./масс.) больше количества соединения общей формулы [K] или его соли.
Примеры кислоты, используемой в реакции гидролиза с применением кислоты, включают в себя муравьиную кислоту, соляную кислоту, серную кислоту, бромистоводородную кислоту, трифторуксусную кислоту, хлорид алюминия и йодтриметилсилан.
Кислоту используют в количестве предпочтительно от 1 до 100000 моль, более предпочтительно от 1 до 1000 моль, на 1 моль соединения общей формулы [K] или его соли.
Примеры основания, используемого в реакции гидролиза с применением основания, включают в себя неорганические основания, такие как гидроксид натрия, гидроксид калия и гидроксид лития; органические основания, такие как метилат натрия, этилат натрия и трет-бутоксид калия; карбонаты, такие как карбонат калия и карбонат натрия; и тетрабутиламмония фторид.
Основание используют в количестве предпочтительно от 1 до 1000 моль, более предпочтительно от 1 до 50 моль, на 1 моль соединения общей формулы [K] или его соли.
Примеры соли, используемой в реакции деалкилирования с применением соли, включают в себя йодид лития и хлорид натрия.
Соль используют в количестве предпочтительно от 1 до 100 моль, более предпочтительно от 1 до 10 моль, на 1 моль соединения общей формулы [K] или его соли.
Примеры металлического катализатора, используемого в реакции восстановительного деалкилирования, включая реакцию гидрирования с металлическим катализатором, включают в себя металлический палладий, такой как палладий на угле и палладиевая чернь; соли палладия, такие как оксид палладия и гидроксид палладия; металлический никель, такой как никель Ренея; и соли платины, такие как оксид платины.
Количество используемого металлического катализатора предпочтительно составляет от 0,001 до 5 раз (масс./масс.), более предпочтительно от 0,01 до 1 раз (масс./масс.), относительно количества соединения общей формулы [K] или его соли.
Примеры восстановителя включают в себя водород; муравьиную кислоту; формиаты, такие как формиат натрия, формиат аммония и триэтилформиат аммония; циклогексен и циклогексадиен.
Восстановитель используют в количестве предпочтительно от 2 до 100 моль, более предпочтительно от 2 до 10 моль, на 1 моль соединения общей формулы [K] или его соли.
Указанная реакция может быть осуществлена при температуре от 0 до 200°C, предпочтительно при температуре от 0 до 100°C, в течение от 1 минуты до 24 часов.
[Способ получения 7]
[Формула 26]

(в формулах значения G1, G2, G3, R1, R3, R4 и L1 определены выше).
В качестве соединения общей формулы [M] известна, например, 5-бром-2-хлорникотиновая кислота и т.п.
В качестве соединения общей формулы [B] известен, например, 1-бензил-1H-индол-5-амин и т.п.
Соединение общей формулы [L] или его соль могут быть получены путем осуществления взаимодействия соединения общей формулы [M] или его соли с соединением общей формулы [B] или его солью в присутствии кислоты или основания.
Используемый в указанной реакции растворитель конкретно не ограничен при условии, что он не оказывает неблагоприятного воздействия на реакцию. Примеры растворителя включают в себя алифатические углеводороды, галогенированные углеводороды, спирты, гликоли, эфиры, кетоны, сложные эфиры, амиды, нитрилы, сульфоксиды, ароматические углеводороды, воду и уксусную кислоту. Также могут быть использованы смеси указанных растворителей.
Количество используемого растворителя конкретно не ограничено, но предпочтительно от 1 до 100 раз (об./масс.), более предпочтительно от 1 до 10 раз (об./масс.), еще более предпочтительно от 1 до 5 раз (об./масс.) больше количества соединения общей формулы [M] или его соли.
Примеры используемого в указанной реакции основания включают в себя неорганические основания и органические основания.
Предпочтительные основания включают в себя неорганические основания, такие как бикарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия и ортофосфат калия; и органические основания, такие как пиридин, 4-(диметиламино)-пиридин, триэтиламин, диизопропилэтиламин и 1,8-диазабицикло(5,4,0)ундец-7-ен.
Основание используют в количестве предпочтительно от 1 до 20 моль, более предпочтительно от 1 до 5 моль, на 1 моль соединения общей формулы [M] или его соли.
Примеры используемой в указанной реакции кислоты включают в себя соляную кислоту, серную кислоту, бромистоводородную кислоту, уксусную кислоту и пара-толуолсульфоновую кислоту.
Кислоту используют в количестве предпочтительно от 1 до 100000 моль, более предпочтительно от 1 до 1000 моль, на 1 моль соединения общей формулы [M] или его соли.
Кислоту используют в количестве предпочтительно от 1 до 20 моль, более предпочтительно от 1 до 5 моль, на 1 моль соединения общей формулы [M] или его соли.
Соединение общей формулы [B] или его соль используют в указанной реакции в количестве предпочтительно от 1 до 20 моль, более предпочтительно от 1 до 5 моль, на 1 моль соединения общей формулы [M] или его соли.
Указанная реакция обычно может быть осуществлена при температуре от 0 до 200°C, предпочтительно при температуре от 100 до 170°C, в течение от 10 минут до 24 часов.
Указанная реакция может быть осуществлена при микроволновом облучении.
[Способ получения 8]
[Формула 27]
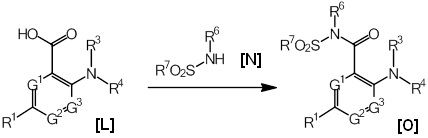
(в формулах значения G1, G2, G3, R1, R3, R4, R6 и R7 определены выше).
В качестве соединения общей формулы [N] известен, например, метансульфонамид и т.п.
Соединение общей формулы [O] или его соль могут быть получены путем осуществления взаимодействия соединения общей формулы [L] или его соли с соединением общей формулы [N] в присутствии агента конденсации и в присутствии основания.
Используемый в указанной реакции растворитель конкретно не ограничен при условии, что он не оказывает неблагоприятного воздействия на реакцию. Примеры растворителя включают в себя алифатические углеводороды, галогенированные углеводороды, спирты, гликоли, эфиры, кетоны, сложные эфиры, амиды, нитрилы, сульфоксиды, ароматические углеводороды и воду. Также могут быть использованы смеси указанных растворителей.
Предпочтительные растворители включают в себя эфиры и амиды.
Количество используемого растворителя конкретно не ограничено, но предпочтительно от 1 до 100 раз (об./масс.), более предпочтительно от 1 до 10 раз (об./масс.), еще более предпочтительно от 1 до 5 раз (об./масс.) больше количества соединения общей формулы [L] или его соли.
Примеры используемого в указанной реакции агента конденсации включают в себя карбодиимиды, такие как N,N'-дициклогексилкарбодиимид и N-этил-N'-(3-диметиламинопропил)-карбодиимид; карбонилы, такие как карбонилдиимидазол; азиды кислоты, такие как дифенилфосфорилазид; цианиды кислоты, такие как диэтилфосфорилцианид; 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин; гексафторфосфат O-бензотриазол-1-ил-1,1,3,3-тетраметилурония; и гексафторфосфат O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония.
Примеры используемого в указанной реакции основания включают в себя неорганические основания и органические основания.
Предпочтительные основания включают в себя неорганические основания, такие как бикарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия и ортофосфат калия; и органические основания, такие как пиридин, 4-(диметиламино)-пиридин, триэтиламин, диизопропилэтиламин и 1,8-диазабицикло(5,4,0)ундец-7-ен.
Основание используют в количестве предпочтительно от 1 до 20 моль, более предпочтительно от 1 до 5 моль, на 1 моль соединения общей формулы [L] или его соли.
Агент конденсации или основание предпочтительно используют в количестве от одного до нескольких моль, более предпочтительно от 1 до 5 моль, на 1 моль соединения общей формулы [L] или его соли.
Указанная реакция может быть осуществлена при температуре от -20 до 150°C, предпочтительно при температуре от 0 до 100°C, в течение от 1 минуты до 24 часов.
[Способ получения 9]
[Формула 28]

(в формулах R8e представляет собой атом водорода или иминозащитную группу; и значения G1, G2, G3, L1, R1, R2, R3, X1a, X1b, X1c, X1d, X2 и X3 определены выше).
Соединение общей формулы [Q] или его соль могут быть получены путем осуществления взаимодействия соединения общей формулы [A] или его соли с соединением общей формулы [P] или его солью в присутствии или в отсутствие основания, в присутствии палладиевого катализатора и в присутствии или в отсутствие лиганда.
Указанный способ может быть осуществлен согласно способу получения [1].
[Способ получения 10]
[Формула 29]
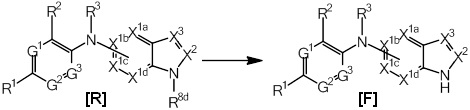
(в формулах R8d представляет собой иминозащитную группу; и значения G1, G2, G3, R1, R2, R3, X1a, X1b, X1c, X1d, X2 и X3 определены выше).
Соединение общей формулы [F] или его соль могут быть получены путем снятия защитных групп с соединения общей формулы [R] или его соли.
Указанная реакция может быть осуществлена способом, описанным в M. Wuts, W. Greene, Protective Groups in Organic Synthesis, 4th ed., John Wiley & Sons, Inc., 2006, pp. 696-926 и т.п., или, например, способом, эквивалентным указанному способу.
Полученные таким образом соединения общих формул [C], [F], [H], [J], [L], [O] и [Q] или их соли могут быть преобразованы в другие соединения общей формулы [1] или их соли путем осуществления реакций, известных per se, таких как конденсация, присоединение, окисление, восстановление, перегруппировка, замещение, галогенирование, дегидратация или гидролиз, или путем соответствующего объединения указанных реакций реакциям.
Если для соединений в описанных выше способах получения существуют изомеры (такие как оптические изомеры, геометрические изомеры и таутомеры), то указанные изомеры также могут быть использованы. Также могут быть использованы сольваты, гидраты и различные формы кристаллов указанных соединений.
Далее, будут описаны методики получения соединений, используемых в качестве сырья для получения соединений согласно настоящему изобретению.
[Способ получения A]
[Формула 30]

(в формулах L4 представляет собой уходящую группу; Ra представляет собой атом водорода или необязательно замещенную C1-6алкильную группу; и значения G1, G2, G3, L1, R1 и R2 определены выше).
В качестве соединения общей формулы [S] известен, например, метил 5-бром-2-хлорникотинат и т.п.
Примеры соединений общей формулы [T1] включают в себя циклопропилбороновую кислоту.
Примеры соединений общей формулы [T2] включают в себя циклобутилтрифторборат калия.
Соединение общей формулы [A] или его соль могут быть получены путем осуществления взаимодействия соединения общей формулы [S] или его соли с соединением общей формулы [T] или его солью в присутствии или в отсутствие основания, в присутствии палладиевого катализатора и в присутствии или в отсутствие лиганда.
Используемый в указанной реакции растворитель конкретно не ограничен при условии, что он не оказывает неблагоприятного воздействия на реакцию. Примеры растворителя включают в себя алифатические углеводороды, галогенированные углеводороды, спирты, гликоли, эфиры, кетоны, сложные эфиры, амиды, нитрилы, сульфоксиды, ароматические углеводороды и воду. Также могут быть использованы смеси указанных растворителей.
Предпочтительные растворители включают в себя эфиры, ароматические углеводороды и воду.
Количество используемого растворителя конкретно не ограничено, но предпочтительно от 1 до 100 раз (об./масс.), более предпочтительно от 1 до 10 раз (об./масс.), еще более предпочтительно от 1 до 5 раз (об./масс.) больше количества соединения общей формулы [S] или его соли.
Примеры используемого в указанной реакции основания включают в себя неорганические основания и органические основания.
Предпочтительные основания включают в себя неорганические основания, такие как бикарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия и ортофосфат калия.
Основание используют в количестве предпочтительно от 1 до 10 моль, более предпочтительно от 1 до 5 моль, еще более предпочтительно от 1 до 1,5 моль, на 1 моль соединения общей формулы [S] или его соли.
Используемые в указанной реакции предпочтительные катализаторы включают в себя ацетат палладия, тетракис(трифенилфосфин)палладий(0), трис(дибензилиденацетон)дипалладий(0) и бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлорпалладий(II). Также могут быть использованы комбинации указанных катализаторов.
Палладиевый катализатор используют в количестве предпочтительно от 0,00001 до 1 моль, более предпочтительно от 0,001 до 0,2 моль, на 1 моль соединения общей формулы [S] или его соли.
Используемые в указанной реакции предпочтительные лиганды включают в себя трифенилфосфин, тритолилфосфин, три-трет-бутилфосфин, трициклогексилфосфин, 2,2'-бис(дифенилфосфино)-1,1'-бинафтил, 2-дициклогексилфосфино-2',6'-диметоксибифенил, 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил, 2-(ди-трет-бутилфосфино)-2',4',6'-триизопропилбифенил, 2-(ди-трет-бутилфосфино)бифенил, 4,5'-бис(дифенилфосфино)-9,9'-диметилксантен и 2-(дициклогексилфосфино)-3,6-диметокси-2',4',6'-триизопропил-1,1'-бифенил. Также могут быть использованы комбинации указанных лигандов.
Лиганд используют в количестве предпочтительно от 0,00001 до 1 моль, более предпочтительно от 0,001 до 0,4 моль, на 1 моль соединения общей формулы [S] или его соли.
Соединение общей формулы [T] или его соль используют в количестве предпочтительно от 1 до 50 моль, более предпочтительно от 1 до 2 моль, на 1 моль соединения общей формулы [S] или его соли.
Указанная реакция может быть осуществлена предпочтительно при температуре от 40 до 170°C в течение от 1 минуты до 24 часов в атмосфере инертного газа (такого как азот или аргон).
Указанная реакция может быть осуществлена при микроволновом облучении.
[Способ получения B]
[Формула 31]
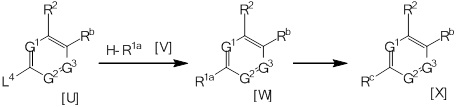
(в формулах R1a представляет собой необязательно замещенную C3-8циклоалкенильную группу; Rb представляет собой атом галогена или необязательно защищенную аминогруппу; Rc представляет собой необязательно замещенную C3-8циклоалкильную группу; и значения G1, G2, G3, L4 и R2 определены выше).
(B-1)
В качестве соединения общей формулы [U] известен, например, метил-5-бром-2-хлорникотинат и т.п.
В качестве соединений общей формулы [V] известны, например, циклопентен, циклогексен и т.п.
Соединение общей формулы [W] или его соль могут быть получены путем осуществления взаимодействия соединения общей формулы [U] или его соли с соединением общей формулы [V] в присутствии или в отсутствие основания, в присутствии палладиевого катализатора и в присутствии или в отсутствие лиганда.
Используемый в указанной реакции растворитель конкретно не ограничен при условии, что он не оказывает неблагоприятного воздействия на реакцию. Примеры растворителя включают в себя алифатические углеводороды, галогенированные углеводороды, спирты, гликоли, эфиры, кетоны, сложные эфиры, амиды, нитрилы, сульфоксиды, ароматические углеводороды и воду. Также могут быть использованы смеси указанных растворителей.
Предпочтительные растворители включают в себя эфиры, ароматические углеводороды и амиды.
Количество используемого растворителя конкретно не ограничено, но предпочтительно от 1 до 100 раз (об./масс.), более предпочтительно от 1 до 10 раз (об./масс.), еще более предпочтительно от 1 до 5 раз (об./масс.) больше количества соединения общей формулы [U] или его соли.
Примеры используемого в указанной реакции основания включают в себя неорганические основания и органические основания.
Предпочтительные основания включают в себя неорганические основания, такие как бикарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия и ортофосфат калия; и органические основания, такие как пиридин, 4-(диметиламино)-пиридин, триэтиламин и диизопропилэтиламин.
Основание используют в количестве предпочтительно от 1 до 10 моль, более предпочтительно от 1 до 5 моль, еще более предпочтительно от 1 до 1,5 моль, на 1 моль соединения общей формулы [U] или его соли.
Используемые в указанной реакции предпочтительные катализаторы включают в себя ацетат палладия, тетракис(трифенилфосфин)палладий(0) и трис(дибензилиденацетон)дипалладий(0). Также могут быть использованы комбинации указанных катализаторов.
Палладиевый катализатор используют в количестве предпочтительно от 0,00001 до 1 моль, более предпочтительно от 0,001 до 0,2 моль, на 1 моль соединения общей формулы [U] или его соли.
Используемые в указанной реакции предпочтительные лиганды включают в себя трифенилфосфин, тритолилфосфин, три-трет-бутилфосфин, трициклогексилфосфин, 2,2'-бис(дифенилфосфино)-1,1'-бинафтил, 2-дициклогексилфосфино-2',6'-диметоксибифенил, 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил, 2-(ди-трет-бутилфосфино)-2',4',6'-триизопропилбифенил, 2-(ди-трет-бутилфосфино)бифенил, 4,5'-бис(дифенилфосфино)-9,9'-диметилксантен и 2-(дициклогексилфосфино)-3,6-диметокси-2',4',6'-триизопропил-1,1'-бифенил. Также могут быть использованы комбинации указанных лигандов.
Лиганд используют в количестве предпочтительно от 0,00001 до 1 моль, более предпочтительно от 0,001 до 0,4 моль, на 1 моль соединения общей формулы [U] или его соли.
Соединение общей формулы [V] или его соль используют в количестве предпочтительно от 1 до 50 моль, более предпочтительно от 1 до 2 моль, на 1 моль соединения общей формулы [U] или его соли.
Указанная реакция может быть осуществлена предпочтительно при температуре от 40 до 170°C в течение от 1 минуты до 24 часов в атмосфере инертного газа (такого как азот или аргон).
Указанная реакция может быть осуществлена при микроволновом облучении.
(B-2)
Соединение общей формулы [X] или его соль могут быть получены путем восстановления соединения общей формулы [W].
Примеры реакции восстановления включают в себя реакцию каталитического гидрирования с применением металлического катализатора.
Используемый в указанной реакции растворитель конкретно не ограничен при условии, что он не оказывает неблагоприятного воздействия на реакцию. Примеры растворителя включают в себя алифатические углеводороды, галогенированные углеводороды, спирты, гликоли, эфиры, кетоны, сложные эфиры, амиды, нитрилы, сульфоксиды, ароматические углеводороды и воду. Также могут быть использованы смеси указанных растворителей.
Предпочтительные растворители включают в себя эфиры, сложные эфиры, спирты и амиды.
Количество используемого растворителя конкретно не ограничено, но предпочтительно от 1 до 100 раз (об./масс.), более предпочтительно от 1 до 10 раз (об./масс.), еще более предпочтительно от 1 до 5 раз (об./масс.) больше количества соединения общей формулы [W] или его соли.
Примеры используемого в указанной реакции металлического катализатора включают в себя металлический палладий, такой как палладий на угле и палладиевая чернь; соли палладия, такие как оксид палладия и гидроксид палладия; металлический никель, такой как никель Ренея; и соли платины, такие как оксид платины.
Количество используемого металлического катализатора предпочтительно составляет от 0,001 до 5 раз (масс./масс.), более предпочтительно от 0,01 до 1 раз (масс./масс.) больше относительно количества соединения общей формулы [W] или его соли.
Примеры восстановителя включают в себя водород; муравьиную кислоту; формиаты, такие как формиат натрия, формиат аммония и триэтилформиат аммония; циклогексен и циклогексадиен.
Восстановитель используют в количестве предпочтительно от 2 до 100 моль, более предпочтительно от 2 до 10 моль, на 1 моль соединения общей формулы [W] или его соли.
Указанная реакция может быть осуществлена при температуре от 0 до 200°C, предпочтительно при температуре от 0 до 100°C, в течение от 1 минуты до 24 часов.
[Способ получения C]
[Формула 32]

(в формулах Rd представляет собой атом галогена, нитрогруппу или необязательно защищенную аминогруппу; и значения L3, R8, X1a, X1b, X1c, X1d, X2 и X3 определены выше).
Соединение общей формулы [Z] или его соль могут быть получены путем осуществления взаимодействия соединения общей формулы [Y] или его соли с соединением общей формулы [G] или его солью в присутствии основания.
Указанный способ может быть осуществлен согласно способу получения [3].
[Способ получения D]
[Формула 33]

(в формулах значения R8, X1a, X1b, X1c, X1d, X2 и X3 определены выше).
Соединение общей формулы [b] или его соль могут быть получены путем восстановления соединения общей формулы [a] или его соли.
Указанная реакция может быть осуществлена способом, описанным в Richard C. Larock et al., Comprehensive Organic Transformations, 2nd ed., pp. 823-827, 1999, John Wiley & Sons, Inc., или способом, эквивалентным указанному способу.
Конкретные примеры реакции включают в себя реакцию каталитического гидрирования с применением металлического катализатора, и реакцию восстановления с применением металла, такого как железо или цинк, в присутствии или в отсутствие кислоты и в присутствии или в отсутствие соли.
Реакция каталитического гидрирования соединения общей формулы [a] или его соли может быть проведена согласно способу получения (B-2).
Растворитель, используемый для восстановления соединения общей формулы [a] или его соли с применением металла, конкретно не ограничен при условии, что он не оказывает неблагоприятного воздействия на реакцию. Примеры растворителя включают в себя алифатические углеводороды, галогенированные углеводороды, спирты, гликоли, эфиры, кетоны, сложные эфиры, амиды, нитрилы, сульфоксиды, ароматические углеводороды и воду. Также могут быть использованы смеси указанных растворителей.
Предпочтительные растворители включают в себя спирты и воду.
Количество используемого растворителя конкретно не ограничено, но предпочтительно от 1 до 100 раз (об./масс.), более предпочтительно от 1 до 10 раз (об./масс.), еще более предпочтительно от 1 до 5 раз (об./масс.) больше количества соединения общей формулы [a] или его соли.
Примеры используемого в указанной реакции металла включают в себя железо, цинк, олово и хлорид олова(II).
Металл используют в количестве предпочтительно от 1 до 50 моль, более предпочтительно от 1 до 10 моль, на 1 моль соединения общей формулы [a] или его соли.
Примеры используемой в указанной реакции кислоты включают в себя хлороводород, бромоводород и уксусную кислоту.
Количество используемой кислоты предпочтительно от 0,001 до 100 раз (масса/объем), более предпочтительно от 0,01 до 20 раз (масса/объем) больше количества соединения общей формулы [a] или его соли.
Примеры соли, используемой в указанной реакции, включают в себя хлорид аммония.
Соль используют в количестве предпочтительно от 0,01 до 10 моль, более предпочтительно от 0,1 до 5 моль, на 1 моль соединения общей формулы [a] или его соли.
Указанная реакция может быть осуществлена при температуре от 0 до 200°C, предпочтительно при температуре от 0 до 100°C, в течение от 1 минуты до 24 часов.
[Способ получения E]
[Формула 34]

(в формулах значения L3, R8, Rd, X1a, X1b, X1c, X1d, X5 и X6 определены выше).
Соединение общей формулы [d] или его соль могут быть получены путем осуществления взаимодействия соединения общей формулы [c] или его соли с соединением общей формулы [G] или его солью в присутствии основания.
Указанный способ может быть осуществлен согласно способу получения [3].
[Способ получения F]
[Формула 35]

(в формулах значения R8, X1a, X1b, X1c, X1d, X5 и X6 определены выше).
Соединение общей формулы [f] или его соль могут быть получены путем восстановления соединения общей формулы [e] или его соли.
Указанный способ может быть осуществлен согласно способу получения [D].
[Способ получения G]
[Формула 36]

(в формулах значения L3, R8, Rd, X1a, X1b, X1c, X1d, X2 и X3 определены выше).
Соединение общей формулы [Z] или его соль могут быть получены путем осуществления взаимодействия соединения общей формулы [Y] или его соли с соединением общей формулы [G] или его солью в присутствии или в отсутствие основания, в присутствии палладиевого катализатора или медного катализатора и в присутствии или в отсутствие лиганда.
[Способ получения H]
[Формула 37]

(в формулах значения G1, G2, G3, L1, R1, R2 и R3 определены выше).
Соединение общей формулы [h] или его соль могут быть получены путем осуществления взаимодействия соединения общей формулы [A] или его соли с соединением общей формулы [g] или его солью в присутствии или в отсутствие основания, в присутствии палладиевого катализатора и в присутствии или в отсутствие лиганда.
Указанный способ может быть осуществлен согласно способу получения [1].
[Способ получения I]
[Формула 38]

(в формулах значения G1, G2, G3, R1, R2, R3 и R8 определены выше).
Соединение общей формулы [j] или его соль могут быть получены путем осуществления взаимодействия соединения общей формулы [h] или его соли с соединением общей формулы [i] или его солью в присутствии основания.
Указанный способ может быть осуществлен согласно способу получения [3].
[Способ получения J]
[Формула 39]

(в формулах значения G1, G2, G3, R1, R2, R3 и R8 определены выше).
Соединение общей формулы [k] или его соль могут быть получены путем восстановления соединения общей формулы [j] или его соли.
Указанный способ может быть осуществлен согласно способу получения [D].
[Способ получения K]
[Формула 40]

(в формулах значения G1, G2, G3, R1, R2, R3 и R8 определены выше).
Соединение общей формулы [l] или его соль могут быть получены путем осуществления взаимодействия соединения общей формулы [k] или его соли с карбонилдиимидазолом в присутствии или в отсутствие основания.
Используемый в указанной реакции растворитель конкретно не ограничен при условии, что он не оказывает неблагоприятного воздействия на реакцию. Примеры растворителя включают в себя алифатические углеводороды, галогенированные углеводороды, спирты, гликоли, эфиры, кетоны, сложные эфиры, амиды, нитрилы, сульфоксиды, ароматические углеводороды и воду. Также могут быть использованы смеси указанных растворителей.
Предпочтительные растворители включают в себя эфиры и амиды.
Количество используемого растворителя конкретно не ограничено, но предпочтительно от 1 до 100 раз (об./масс.), более предпочтительно от 1 до 10 раз (об./масс.), еще более предпочтительно от 1 до 5 раз (об./масс.) больше количества соединения общей формулы [k] или его соли.
Примеры используемого в указанной реакции основания включают в себя неорганические основания и органические основания.
Предпочтительные основания включают в себя неорганические основания, такие как бикарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия и ортофосфат калия; и органические основания, такие как пиридин, 4-(диметиламино)-пиридин, триэтиламин, диизопропилэтиламин и 1,8-диазабицикло(5,4,0)ундец-7-ен.
Основание используют в количестве предпочтительно от 1 до 20 моль, более предпочтительно от 1 до 5 моль, на 1 моль соединения общей формулы [k] или его соли.
Карбонилдиимидазол используют в количестве предпочтительно от одного до нескольких моль, более предпочтительно от 1 до 2 моль, на 1 моль соединения общей формулы [k] или его соли.
Указанная реакция может быть осуществлена при температуре от -20 до 150°C, предпочтительно при температуре от 0 до 100°C, в течение от 1 минуты до 24 часов.
[Способ получения L]
[Формула 41]
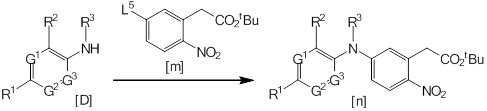
(в формулах L5 представляет собой уходящую группу; и значения G1, G2, G3, R1, R2 и R3 определены выше).
Соединение общей формулы [n] или его соль могут быть получены путем осуществления взаимодействия соединения общей формулы [D] или его соли с соединением общей формулы [m] в присутствии или в отсутствие основания, в присутствии палладиевого катализатора и в присутствии или в отсутствие лиганда.
Указанный способ может быть осуществлен согласно способу получения [1].
[Способ получения M]
[Формула 42]

(в формулах значения G1, G2, G3, R1, R2 и R3 определены выше).
Соединение общей формулы [o] или его соль могут быть получены путем восстановления соединения общей формулы [n] или его соли.
Указанный способ может быть осуществлен согласно способу получения [D].
[Способ получения N]
[Формула 43]

(в формулах значения G1, G2, G3, R1, R2, R3, L3 и R8 определены выше).
Соединение общей формулы [p] или его соль могут быть получены путем осуществления взаимодействия соединения общей формулы [o] или его соли с соединением общей формулы [G] или его солью в присутствии основания.
Указанный способ может быть осуществлен согласно способу получения [3].
[Способ получения O]
[Формула 44]

(в формулах значения G1, G2, G3, R1, R3, R5a и R8 определены выше).
Соединение общей формулы [r] или его соль могут быть получены путем снятия защитных групп с соединения общей формулы [q] или его соли, с последующим осуществлением реакции замыкания кольца.
Примеры реакции снятия защитных групп включают в себя реакцию гидролиза с применением кислоты или основания, реакцию деалкилирования с применением соли и реакцию восстановительного деалкилирования, включая реакцию гидрирования с металлическим катализатором.
Примеры реакции замыкания кольца включают в себя реакцию замыкания кольца с применением кислоты, примеры которой включают в себя соляную кислоту и трифторуксусную кислоту.
Указанный способ может быть осуществлен согласно способу получения [6].
В описанных выше способах получения могут быть использованы микроволновые синтезаторы.
Соединения, полученные описанными выше способами получения, могут быть преобразованы в другие соединения посредством реакций, известных per se, таких как конденсация, присоединение, окисление, восстановление, перегруппировка, замещение, галогенирование, дегидратация или гидролиз или, например, путем соответствующего объединения указанных реакций.
Если в соединениях и в их промежуточных продуктах, полученных описанными выше способами получения, существуют амино, гидроксильные или карбоксильные группы, то реакции могут быть осуществлены путем соответствующей замены защитных групп на указанных группах. Если в указанном соединении или промежуточном продукте существуют две или несколько защитных групп, то с них могут быть селективно сняты защитные группы посредством реакции, известной per se.
Соединения, используемые в описанных выше способах получения, т.е. соединения, которые могут необязательно находиться в форме солей, также могут быть использованы в виде соли. Примеры таких солей включают в себя соли, подобные солям упомянутых выше соединений, представленных общей формулой (1), которые являются соединениями согласно настоящему изобретению.
Если для соединений, используемых в описанных выше способах получения, существуют изомеры (такие как оптические изомеры, геометрические изомеры и таутомеры), то указанные изомеры также могут быть использованы. Если для соединений существуют сольваты, гидраты и различные формы кристаллов, то указанные сольваты, гидраты и различные формы кристаллов также могут быть использованы.
При использовании в качестве лекарственного средства, соединения, представленные общей формулой (1), или их соли согласно настоящему изобретению при необходимости обычно могут быть смешаны со вспомогательными лекарственными средствами, используемыми для составления лекарственных форм, такими как наполнители, носители и разбавители.
Примеры добавок включают в себя наполнители, разрыхлители, связующие вещества, смазки, средства, маскирующие вкус, красители, вкусоароматизаторы, поверхностно-активные вещества, покровные средства и пластификаторы.
Примеры наполнителей включают в себя сахарные спирты, такие как эритрит, маннит, ксилит и сорбит; сахариды, такие как белый мягкий сахар, сахарная пудра, лактоза и глюкоза; циклодекстрины, такие как α-циклодекстрин, β-циклодекстрин, γ-циклодекстрин, гидроксипропил-β-циклодекстрин и натриевая соль сульфобутилового эфира β-циклодекстрина; целлюлозы, такие как кристаллическая целлюлоза и микрокристаллическая целлюлоза; и крахмалы, такие как кукурузный крахмал, картофельный крахмал и прежелатинизированный крахмал.
Примеры разрыхлителей включают в себя кармеллозу, кармеллозу кальция, кроскармеллозу натрия, карбоксиметилкрахмал натрия, кросповидон, низкозамещенную гидроксипропилцеллюлозу и частично прежелатинизированный крахмал.
Примеры связующих веществ включают в себя гидроксипропилцеллюлозу, кармеллозу натрия и метилцеллюлозу.
Примеры смазок включают в себя стеариновую кислоту, стеарат магния, стеарат кальция, тальк, водный диоксид кремния, неуплотненную безводную кремниевую кислоту и сложный эфир жирной кислоты и сахарозы.
Примеры средств, маскирующих вкус, включают в себя аспартам, сахарин, стевию, тауматин и ацесульфам калия.
Примеры красителей включают в себя диоксид титана, окись железа, желтую окись железа, черный оксид железа, краситель пищевой красный № 102, краситель пищевой желтый № 4 и краситель пищевой желтый № 5.
Примеры вкусоароматизаторов включают в себя эфирные масла, такие как апельсиновое масло, лимонное масло, мятное масло и сосновое масло; эссенции, такие как апельсиновая эссенция и мятная эссенция; вкусоароматизаторы, такие как вишневый вкусоароматизатор, ванильный ароматизатор и фруктовый ароматизатор; порошкообразные вкусоароматизаторы, такие как микронизированные частицы яблока, микронизированные частицы банана, микронизированные частицы персика, микронизированные частицы земляники и микронизированные частицы апельсина; ванилин; и этилванилин.
Примеры поверхностно-активных веществ включают в себя лаурилсульфат натрия, (диоктил)сульфосукцинат натрия, полисорбат и полиоксиэтилен-гидрогенизированное касторовое масло.
Примеры покровных средств включают в себя гидроксипропил-метилцеллюлозу, сополимер Е аминоалкилметакрилата, сополимер RS аминоалкилметакрилата, этилцеллюлозу, ацетатфталат целлюлозы, фталат гидроксипропилметилцеллюлозы, сополимер L метакриловой кислоты, сополимер LD метакриловой кислоты и сополимер S метакриловой кислоты.
Примеры пластификаторов включают в себя триэтилцитрат, макрогол, триацетин и пропиленгликоль.
Указанные добавки могут быть использованы по отдельности или в виде сочетания двух или нескольких из них.
Количество каждой добавки конкретно не ограничено, и при необходимости добавка может быть добавлена для придания достаточной эффективности в зависимости от предполагаемой цели.
Указанные соединения или соли могут вводиться перорально или парентерально, в соответствии с общепринятыми способами, в форме таблеток, капсул, порошков, сиропов, гранул, пилюль, суспензий, эмульсий, жидкостей, порошкообразных лекарственных форм, суппозиториев, глазных капель, назальных капель, ушных капель, пластырей, мазей, инъекций и т.п. Способ введения, дозировка и частота введения могут быть соответствующим образом подобраны в зависимости от возраста, веса и симптомов пациента. Как правило, соединение или соль могут вводиться взрослому перорально или парентерально в количестве от 0,01 до 1000 мг/кг в одной или нескольких дозах в сутки.
Примеры
Настоящее изобретение будет описано со ссылкой на сравнительные примеры, примеры и тестовые примеры; тем не менее, настоящее изобретение ими не ограничивается.
Если не указано иное, то для очистки методом колоночной хроматографии использовали автоматическую систему очистки ISOLERA (производства Biotage AB) или жидкостной хроматограф среднего давления YFLC-Wprep2XY.N (Yamazen Corporation).
Если не указано иное, то для колоночной хроматографии на силикагеле в качестве неподвижной фазы использовали картридж SNAP KP-Sil (производства Biotage AB) или колонки Hi-Flash W001, W002, W003, W004 или W005 (Yamazen Corporation), и для колоночной хроматографии на щелочном силикагеле в качестве неподвижной фазы использовали картридж SNAP KP-NH (производства Biotage AB).
Для препаративной тонкослойной хроматографии использовали стеклянный пластины PLC с силикагелем F60 (производства Merck KGaA).
Соотношение компонентов элюента представляет собой соотношение по объему. Например, выражение «градиентное элюирование смесью гексан/этилацетат = 100/0-50/50» фактически означает, что элюент, состоящий из 100% гексана/0% этилацетата, в завершение заменяется элюентом, состоящим из 50% гексана/50% этилацетата.
В качестве микроволновой установки для синтеза использовали Initiator Sixty (производства Biotage AB).
В качестве реактора для гидрогенизации проточного типа использовали H-Cube (производства ThalesNano, Inc.).
Масс-спектры измеряли с использованием ЖХ/МС-системы ACQUITY SQD (производства Waters Corporation, метод ионизации: ESI (ионизация электрораспылением)), M-8000 (производства Hitachi Ltd., метод ионизации: ESI), LCMS-2010EV (производства Shimadzu Corporation, метод ионизации: ESI одновременно с APCI (химическая ионизация при атмосферном давлении)) или JMS-T100LP (DART) (производства JEOL Ltd., метод ионизации: DART (прямой анализ в реальном времени)).
ЯМР-спектры регистрировали с использованием тетраметилсилана в качестве внутреннего стандарта, используя спектрометры Bruker AV300 (производства Bruker Corporation) или JNM-AL400 (производства JEOL Ltd.), и все значения δ выражали в м.д.
Сокращения при описании ЯМР-спектров имеют следующие значения:
с: синглет
уш.с: уширенный синглет
д: дублет
дд: двойной дублет
т: триплет
кв.: квартет
квин.: квинтет
секст.: секстет
септ.: септет
м: мультиплет
ДМСО-d6: дейтерированный диметилсульфоксид
Сокращения, используемые в справочных примерах и примерах, имеют следующие значения:
Boc: трет-бутоксикарбонил
Bu: бутил
Et: этил
Me: метил
Tf: трифторметилсульфонил
TBS: трет-бутилдиметилсилил
tBu: трет-бутил
Ph: фенил
[Справочный пример 1]
[Формула 45]
К раствору 0,50 г 4-бром-1H-пирроло(2,3-b)пиридина в 3 мл N,N-диметилацетамида при охлаждении на льду добавляли 0,31 г трет-бутоксида калия и перемешивали полученную смесь в течение 15 минут. К реакционной смеси при охлаждении на льду по каплям добавляли 0,33 мл бензилбромида, и перемешивали полученную смесь при комнатной температуре в течение 30 минут. К реакционной смеси добавляли этилацетат и воду, и корректировали полученную смесь до pH 3,0 добавлением 2 M соляной кислоты. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-50/50) с получением 0,64 г 1-бензил-4-бром-1H-пирроло(2,3-b)пиридина в виде бледно-коричневого масла.
1H-ЯМР (ДМСО-d6) δ: 5,50 (2H, с), 6,50 (1H, д, J=3,3 Гц), 7,20-7,37 (5H, м), 7,40 (1H, д, J=5,3 Гц), 7,79 (1H, д, J=3,3 Гц), 8,15 (1H, д, J=5,3 Гц).
[Справочный пример 2]
[Формула 46]

К раствору 0,50 г 5-бром-1H-пирроло(2,3-b)пиридина в 3 мл N,N-диметилацетамида при охлаждении на льду добавляли 0,31 г трет-бутоксида калия и перемешивали полученную смесь в течение 15 минут. К реакционной смеси при охлаждении на льду по каплям добавляли 0,33 мл бензилбромида, и перемешивали полученную смесь при комнатной температуре в течение 1 часа. К реакционной смеси добавляли этилацетат и воду, и корректировали полученную смесь до pH 2,0 добавлением 2 M соляной кислоты. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-80/20) с получением 0,45 г 1-бензил-5-бром-1H-пирроло(2,3-b)пиридина в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 5,48 (2H, с), 6,52 (1H, д, J=3,3 Гц), 7,19-7,34 (5H, м), 7,71 (1H, д, J=3,3 Гц), 8,24 (1H, д, J=2,6 Гц), 8,33 (1H, д, J=2,0 Гц).
[Справочный пример 3]
[Формула 47]

Смесь 1,06 г 1H-индол-5-амина, 2,0 г метил-2-бром-5-хлорбензоата, 0,37 г трис(дибензилиденацетон)дипалладия(0), 0,46 г 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 5,23 г карбоната цезия и 20 мл толуола нагревали с обратным холодильником в течение 4 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-80/20) с получением 0,77 г метил-2-((1H-индол-5-ил)амино)-5-хлорбензоата в виде желтого масла.
1H-ЯМР (ДМСО-d6) δ: 3,88 (3H, с), 6,40-6,44 (1H, м), 6,89 (1H, д, J=9,2 Гц), 6,97 (1H, дд, J=8,6, 2,0 Гц), 7,33 (1H, дд, J=9,2, 2,6 Гц), 7,37-7,47 (3H, м), 7,80 (1H, д, J=2,6 Гц), 9,24 (1H, с), 11,17 (1H, с).
[Справочный пример 4]
[Формула 48]
Смесь 192 мг 6-аминохинолин-2(1H)-она, 300 мг метил-2-бром-5-хлорбензоата, 54,9 мг трис(дибензилиденацетон)дипалладия(0), 69,4 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 0,78 г карбоната цезия и 3 мл толуола нагревали с обратным холодильником в течение 4 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Твердое вещество собирали путем фильтрования и промывали водой, этилацетатом и ацетоном с получением 40 мг метил-5-хлор-2-((2-оксо-1,2-дигидрохинолин-6-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 3,87 (3H, с), 6,51 (1H, дд, J=9,2, 1,3 Гц), 7,06 (1H, д, J=9,2 Гц), 7,33 (1H, д, J=8,6 Гц), 7,38-7,45 (2H, м), 7,58 (1H, д, J=2,0 Гц), 7,83 (1H, д, J=2,6 Гц), 7,87 (1H, д, J=9,9 Гц), 9,24 (1H, с), 11,77 (1H, с).
[Справочный пример 5]
[Формула 49]

К раствору 150 мг 6-бром-3,4-дигидроизохинолин-1(2H)-она в 3 мл N,N-диметилацетамида при охлаждении на льду добавляли 90 мг трет-бутоксида калия и перемешивали полученную смесь в течение 10 минут. К реакционной смеси при охлаждении на льду добавляли 87 мкл бензилбромида, и перемешивали полученную смесь при комнатной температуре в течение 30 минут. К реакционной смеси добавляли этилацетат и воду, и корректировали полученную смесь до pH 2,0 добавлением 2 M соляной кислоты. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-70/30) с получением 190 мг 2-бензил-6-бром-3,4-дигидроизохинолин-1(2H)-она в виде бесцветного масла.
МС (ESI, m/z): 316 (M+H)+.
[Справочный пример 6]
[Формула 50]

К раствору 120 мг 6-бром-3,4-дигидрохинолин-2(1H)-она в 3 мл N,N-диметилацетамида при охлаждении на льду добавляли 71,4 мг трет-бутоксида калия и перемешивали полученную смесь в течение 10 минут. К реакционной смеси при охлаждении на льду добавляли 69 мкл бензилбромида, и перемешивали полученную смесь при комнатной температуре в течение 30 минут. К реакционной смеси добавляли этилацетат и воду, и корректировали полученную смесь до pH 2,0 добавлением 2 M соляной кислоты. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-70/30) с получением 140 мг 1-бензил-6-бром-3,4-дигидрохинолин-2(1H)-она в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 2,66-2,75 (2H, м), 2,91-3,00 (2H, м), 5,13 (2H, с), 6,84 (1H, д, J=8,6 Гц), 7,16-7,25 (3H, м), 7,26-7,35 (3H, м), 7,45 (1H, д, J=2,0 Гц).
[Справочный пример 7]
[Формула 51]

Смесь 1,06 г 1H-индол-4-амина, 2,0 г метил-2-бром-5-хлорбензоата, 220 мг трис(дибензилиденацетон)дипалладия(0), 54 мг ацетата палладия, 0,56 г 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 5,2 г карбоната цезия и 15 мл толуола нагревали с обратным холодильником в течение 1 часа в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-70/30), к полученному таким образом остатку добавляли гексан и циклогексан, и собирали твердое вещество путем фильтрования с получением 1,05 г метил-2-((1H-индол-4-ил)амино)-5-хлорбензоата в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,90 (3H, с), 6,24-6,29 (1H, м), 6,98 (1H, д, J=7,3 Гц), 7,06-7,15 (2H, м), 7,25 (1H, д, J=7,9 Гц), 7,34 (1H, т, J=2,6 Гц), 7,41 (1H, дд, J=8,9, 3,0 Гц), 7,86 (1H, д, J=2,6 Гц), 9,59 (1H, с), 11,28 (1H, с).
[Справочный пример 8]
[Формула 52]

Смесь 6,0 г метил-2-амино-5-бромбензоата, 4,05 г моногидрата циклопропилбороновой кислоты, 0,29 г ацетата палладия, 0,73 г трициклогексилфосфина, 11 г ортофосфата калия, 48 мл толуола и 12 мл воды нагревали с обратным холодильником в течение 5 часов в атмосфере азота. После охлаждения реакционной смеси до комнатной температуры, к смеси добавляли 0,9 г моногидрата циклопропилбороновой кислоты, 0,15 г ацетата палладия и 0,37 г трициклогексилфосфина, и нагревали полученную смесь с обратным холодильником в течение 4 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-80/20) с получением 3,5 г метил-2-амино-5-циклопропилбензоата в виде бледно-коричневого масла.
1H-ЯМР (CDCl3) δ: 0,54-0,62 (2H, м), 0,81-0,90 (2H, м), 1,75-1,86 (1H, м), 3,86 (3H, с), 5,55 (2H, уш.с), 6,59 (1H, д, J=8,6 Гц), 7,03 (1H, дд, J=8,6, 2,6 Гц), 7,59 (1H, д, J=2,0 Гц).
[Справочный пример 9]
[Формула 53]

К раствору 1,46 г метил-2-амино-5-циклопропилбензоата в 10 мл диоксана добавляли 10 мл 47% бромистоводородной кислоты. При охлаждении на льду к смеси добавляли 5 мл раствора 0,58 г нитрита натрия в воде, и перемешивали полученную смесь в течение 10 минут. При охлаждении на льду к смеси добавляли 5 мл раствора 2,74 г бромида меди в 47% бромистоводородной кислоте, и перемешивали полученную смесь в течение 10 минут. Реакционную смесь нагревали до комнатной температуры, перемешивали в течение 3 часов, а затем оставляли отстаиваться в течение ночи. К реакционной смеси добавляли этилацетат и воду. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-70/30) с получением 1,12 г метил-2-бром-5-циклопропилбензоата в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 0,66-0,74 (2H, м), 0,96-1,05 (2H, м), 1,82-1,95 (1H, м), 3,92 (3H, с), 7,02 (1H, дд, J=8,3, 2,3 Гц), 7,48 (1H, д, J=2,6 Гц), 7,51 (1H, д, J=7,9 Гц).
[Справочный пример 10]
[Формула 54]

Смесь 0,58 г метил-5-бром-2-хлорникотината, 0,36 г моногидрата циклопропилбороновой кислоты, 26 мг ацетата палладия, 65 мг трициклогексилфосфина, 1,48 г ортофосфата калия, 5 мл толуола и 0,5 мл воды нагревали с обратным холодильником в течение 2 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-50/50) с получением 0,28 г метил-2-хлор-5-циклопропилникотината в виде бледно-желтого масла.
1H-ЯМР (CDCl3) δ: 0,72-0,80 (2H, м), 1,05-1,15 (2H, м), 1,87-1,99 (1H, м), 3,95 (3H, с), 7,75 (1H, д, J=2,6 Гц), 8,31 (1H, д, J=2,6 Гц).
[Справочный пример 11]
[Формула 55]

К раствору 30 г 5-нитро-1H-индола в 150 мл N,N-диметилацетамида при охлаждении на льду порциями добавляли 22,9 г трет-бутоксида калия и перемешивали полученную смесь в течение 10 минут. К реакционной смеси при охлаждении на льду по каплям добавляли 24,3 мл бензилбромида, и перемешивали полученную смесь при комнатной температуре в течение 1 часа. К реакционной смеси при охлаждении на льду добавляли воду, твердое вещество собирали путем фильтрования и промывали водой и диизопропиловым эфиром с получением 45,5 г 1-бензил-5-нитро-1H-индола в виде бледно-коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 5,54 (2H, с), 6,81 (1H, д, J=3,3 Гц), 7,18-7,35 (5H, м), 7,69 (1H, д, J=9,2 Гц), 7,78 (1H, д, J=3,3 Гц), 8,00 (1H, дд, J=9,2, 2,0 Гц), 8,59 (1H, д, J=2,0 Гц).
[Справочный пример 12]
[Формула 56]

К смеси 45,5 г 1-бензил-5-нитро-1H-индола, 6,15 г хлорида аммония, 360 мл этанола и 90 мл воды при внешней температуре 70-75°C порциями добавляли 35,2 г железного порошка, и нагревали полученную смесь с обратным холодильником в течение 3 часов и 30 минут. После охлаждения реакционной смеси до комнатной температуры к ней добавляли воду и этилацетат, и отфильтровывали нерастворимое вещество. Осадок на фильтре промывали водой и этилацетатом. Фильтрат и смывы объединяли, органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, а затем сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли диизопропиловый эфир и этилацетат, и собирали твердое вещество путем фильтрования. Полученное твердое вещество очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-50/50), к полученному таким образом остатку добавляли гексан, и собирали твердое вещество путем фильтрования с получением 22,4 г 1-бензил-1H-индол-5-амина в виде бледно-коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 4,47 (2H, с), 5,27 (2H, с), 6,17 (1H, д, J=2,6 Гц), 6,47 (1H, дд, J=8,6, 2,0 Гц), 6,68 (1H, д, J=2,0 Гц), 7,08 (1H, д, J=8,6 Гц), 7,12-7,17 (2H, м), 7,21-7,32 (4H, м).
[Справочный пример 13]
[Формула 57]

Смесь 0,50 г 1H-индол-5-амина, 0,42 мл йодбензола, 36 мг йодида меди (I), 91 мкл транс-циклогексан-1,2-диамина, 1,6 г ортофосфата калия и 5 мл диоксана нагревали с обратным холодильником в течение 4 часов в атмосфере азота. После охлаждения реакционной смеси до комнатной температуры, к ней добавляли воду и этилацетат, и отфильтровывали нерастворимое вещество. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, а затем сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-70/30) с получением 0,61 г 1-фенил-1H-индол-5-амина в виде бледно-коричневого масла.
1H-ЯМР (CDCl3) δ: 3,55 (2H, уш.с), 6,50 (1H, д, J=3,3 Гц), 6,68 (1H, дд, J=8,9, 2,3 Гц), 6,97 (1H, д, J=2,6 Гц), 7,24-7,36 (2H, м), 7,39 (1H, д, J=8,6 Гц), 7,45-7,53 (4H, м).
[Справочный пример 14]
[Формула 58]
К раствору 0,30 г 6-нитро-3-фенил-1H-индола в 3 мл N,N-диметилацетамида при охлаждении на льду добавляли 56 мг 60% гидрида натрия и перемешивали полученную смесь в течение 5 минут. К реакционной смеси при охлаждении на льду по каплям добавляли 94 мкл метилйодида, и перемешивали полученную смесь при комнатной температуре в течение 1 часа. К реакционной смеси добавляли этилацетат и воду, и корректировали смесь до pH 2,0 добавлением 2 M соляной кислоты. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли диизопропиловый эфир и гексан, и собирали твердое вещество путем фильтрования с получением 235 мг 1-метил-6-нитро-3-фенил-1H-индола в виде коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 3,96 (3H, с), 7,30-7,38 (1H, м), 7,43-7,53 (3H, м), 7,58-7,65 (2H, м), 7,95 (1H, д, J=9,2 Гц), 8,08 (1H, дд, J=8,6, 2,0 Гц), 8,36 (1H, д, J=2,0 Гц).
[Справочный пример 15]
[Формула 59]

Смесь 235 мг 1-метил-6-нитро-3-фенил-1H-индола, 32 мг хлорида аммония, 180 мг железного порошка, 5 мл этанола и 1 мл воды нагревали с обратным холодильником в течение 1 часа в атмосфере азота. После охлаждения реакционной смеси до комнатной температуры, к ней добавляли воду и этилацетат, и отфильтровывали нерастворимое вещество. Осадок на фильтре промывали этилацетатом и водой. Фильтрат и смывы объединяли, органический слой разделяли, промывали насыщенным водным раствором хлорида натрия, а затем сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления с получением 0,19 г 1-метил-3-фенил-1H-индол-6-амина в виде коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,65 (3H, с), 4,90 (2H, с), 6,48-6,56 (2H, м), 7,13-7,21 (1H, м), 7,32 (1H, с), 7,33-7,42 (2H, м), 7,53 (1H, д, J=8,6 Гц), 7,56-7,62 (2H, м).
[Справочный пример 16]
[Формула 60]

Смесь 1,05 г 3-бром-6-нитро-1H-индола, 0,64 г фенилбороновой кислоты, 1,39 г карбоната натрия, 93 мг бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлорпалладия(II), 10 мл диметилового эфира этиленгликоля и 1,0 мл воды нагревали с обратным холодильником в течение 3 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли диизопропиловый эфир и гексан, и собирали твердое вещество путем фильтрования с получением 0,95 г 6-нитро-3-фенил-1H-индола в виде коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 7,27-7,35 (1H, м), 7,44-7,52 (2H, м), 7,69-7,75 (2H, м), 7,97 (1H, дд, J=8,6, 2,0 Гц), 8,03 (1H, д, J=9,2 Гц), 8,15 (1H, д, J=2,6 Гц), 8,40 (1H, д, J=2,0 Гц), 12,14 (1H, уш.с).
[Справочный пример 17]
[Формула 61]

Смесь 0,50 г 6-нитро-3-фенил-1H-индола, 72 мг хлорида аммония, 0,41 г железного порошка, 5 мл этанола и 1 мл воды нагревали с обратным холодильником в течение 1 часа в атмосфере азота. После охлаждения реакционной смеси до комнатной температуры, к ней добавляли воду и этилацетат, и отфильтровывали нерастворимое вещество. Осадок на фильтре промывали этилацетатом. Фильтрат и смывы объединяли, органический слой разделяли, промывали насыщенным водным раствором хлорида натрия, а затем сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления с получением 0,41 г 3-фенил-1H-индол-6-амина в виде коричневой пены.
1H-ЯМР (ДМСО-d6) δ: 4,80 (2H, с), 6,47 (1H, дд, J=8,6, 2,0 Гц), 6,59 (1H, д, J=2,0 Гц), 7,12-7,20 (1H, м), 7,30-7,42 (3H, м), 7,52 (1H, д, J=8,6 Гц), 7,58-7,66 (2H, м), 10,72 (1H, с).
[Справочный пример 18]
[Формула 62]

Реакционную смесь из 0,30 г метил-2-амино-5-бромбензоата, 0,264 мл циклогексена, 14,6 мг ацетата палладия, 39,6 мг три(о-толил)фосфина, 0,544 мл триэтиламина и 1,5 мл N,N-диметилформамида перемешивали при внешней температуре 80°C в течение 3 часов в атмосфере азота. Затем к смеси добавляли 14,6 мг ацетата палладия и 39,6 мг три(о-толил)фосфина, и перемешивали полученную смесь при 80°C в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры, и добавляли к ней воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением 0,181 г масла. Раствор 0,170 г полученного масла в 10 мл метанола подвергали реакции гидрогенизации (комнатная температура, нормальное давление, скорость потока: 1,5 мл/мин, 10% Pd/C) с использованием реактора для гидрогенизации проточного типа. Растворитель полученного раствора отгоняли в условиях пониженного давления с получением 0,125 г метил-2-амино-5-циклогексилбензоата в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,11-1,94 (10H, м), 2,31-2,48 (1H, м), 3,87 (3H, с), 5,56 (2H, с), 6,62 (1H, д, J=7,9 Гц), 7,15 (1H, дд, J=8,3, 2,3 Гц), 7,68 (1H, д, J=2,0 Гц).
[Справочный пример 19]
[Формула 63]

Смесь 0,50 г метил-2-амино-5-бромбензоата, 0,766 мл циклопентена, 48,7 мг ацетата палладия, 0,132 г три(о-толил)фосфина, 0,907 мл триэтиламина и 2,5 мл N,N-диметилформамида перемешивали при внешней температуре 100°C в течение 4 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, и добавляли к ней воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением 0,379 г масла. Раствор 0,370 г полученного масла в 20 мл метанола подвергали реакции гидрогенизации (комнатная температура, нормальное давление, скорость потока: 1,5 мл/мин, 10% Pd/C) с использованием реактора для гидрогенизации проточного типа. Растворитель полученного раствора отгоняли в условиях пониженного давления с получением 0,349 г метил-2-амино-5-циклопентилбензоата в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,42-1,88 (6H, м), 1,94-2,09 (2H, м), 2,78-2,96 (1H, м), 3,87 (3H, с), 6,62 (1H, д, J=7,9 Гц), 7,18 (1H, дд, J=8,3, 2,3 Гц), 7,71 (1H, д, J=2,0 Гц).
[Справочный пример 20]
[Формула 64]

К раствору 100 мг 6-бромбензо[d]оксазол-2(3H)-она в 1,0 мл тетрагидрофурана при охлаждении на льду добавляли 57,7 мг трет-бутоксида калия и перемешивали полученную смесь при охлаждении на льду в течение 10 минут, а затем добавляли 61,1 мкл бензилбромида. Реакционную смесь перемешивали при комнатной температуре в течение 20 минут и при внешней температуре 50°C в течение 2 часов, затем охлаждали до комнатной температуры и оставляли отстаиваться в течение ночи. К реакционной смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением 133 мг 3-бензил-6-бромбензо[d]оксазол-2(3H)-она в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ: 4,99 (2H, с), 6,55-6,92 (1H, м), 6,98-7,98 (7H, м).
[Справочный пример 21]
[Формула 65]
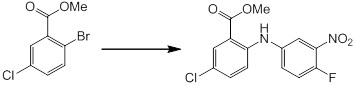
Смесь 0,20 г метил-2-бром-5-хлорбензоата, 0,125 г 4-фтор-3-нитроанилина, 36,7 мг трис(дибензилиденацетон)дипалладия(0), 46,4 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 0,521 г карбоната цезия и 2,0 мл толуола перемешивали при внешней температуре 80°C в течение 30 минут в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем к смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученное твердое вещество перекристаллизовывали из 2-пропанола с получением 0,20 г метил-5-хлор-2-((4-фтор-3-нитрофенил)амино)бензоата в виде зеленого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,86 (3H, с), 7,28 (1H, д, J=8,6 Гц), 7,46-7,61 (2H, м), 7,62-7,71 (1H, м), 7,86 (1H, д, J=2,6 Гц), 7,96 (1H, дд, J=6,6, 3,3 Гц), 9,22 (1H, с).
[Справочный пример 22]
[Формула 66]

К раствору 100 мг метил-5-хлор-2-((4-фтор-3-нитрофенил)амино)бензоата в 1,0 мл N,N-диметилформамида при комнатной температуре в атмосфере азота добавляли 79,6 мкл диизопропилэтиламина и 50,5 мкл бензиламина, и перемешивали полученную смесь при внешней температуре 50°C в течение 30 минут и при 70°C в течение 25 минут. Реакционную смесь оставляли отстаиваться при комнатной температуре в течение ночи, а затем добавляли к ней этилацетат и воду. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением 130 мг метил-2-((4-(бензиламино)-3-нитрофенил)амино)-5-хлорбензоата в виде масла.
1H-ЯМР (ДМСО-d6) δ: 3,85 (3H, с), 4,66 (2H, д, J=5,9 Гц), 6,89 (1H, д, J=9,2 Гц), 6,98 (1H, д, J=9,2 Гц), 7,20-7,50 (7H, м), 7,80 (1H, д, J=2,6 Гц), 7,94 (1H, д, J=2,6 Гц), 8,71 (1H, т, J=6,3 Гц), 9,03 (1H, с).
[Справочный пример 23]
[Формула 67]

К смешанному раствору 125 мг метил-2-((4-(бензиламино)-3-нитрофенил)амино)-5-хлорбензоата, 1,9 мл этанола и 0,6 мл воды при комнатной температуре в атмосфере азота добавляли 119 мг восстановленного железа, и перемешивали полученную смесь при внешней температуре 50°C в течение 30 минут, затем охлаждали до комнатной температуры, а затем добавляли воду. Твердое вещество удаляли путем фильтрования через целит, отгоняли этанол в условиях пониженного давления, а затем добавляли этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением 31,3 мг метил-2-((3-амино-4-(бензиламино)фенил)амино)-5-хлорбензоата в виде масла.
1H-ЯМР (CDCl3) δ: 3,89 (3H, с), 4,32 (2H, с), 5,47 (1H, с), 6,60-6,70 (3H, м), 6,93 (1H, д, J=9,2 Гц), 7,04-7,54 (7H, м), 7,66-7,76 (1H, м), 7,87 (1H, д, J=2,0 Гц), 9,12 (1H, с).
[Справочный пример 24]
[Формула 68]
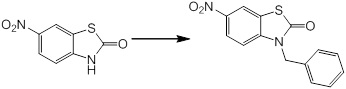
К раствору 0,50 г 6-нитробензо[d]тиазол-2(3H)-она в 2,5 мл N,N-диметилформамида при комнатной температуре добавляли 0,334 мл бензилбромида и 0,705 г карбоната калия и перемешивали полученную смесь при комнатной температуре в течение 25 минут. К реакционной смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток промывали этилацетатом и водой с получением 0,609 г 3-бензил-6-нитробензо[d]тиазол-2(3H)-она в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 5,21 (2H, с), 7,06 (1H, д, J=8,6 Гц), 7,24-7,41 (5H, м), 8,15 (1H, дд, J=8,9, 2,3 Гц), 8,37 (1H, д, J=2,6 Гц).
[Справочный пример 25]
[Формула 69]

К смешанному раствору 0,20 г 3-бензил-6-нитробензо[d]тиазол-2(3H)-она, 2,0 мл этанола, 0,68 мл воды и 336 мг хлорида аммония при комнатной температуре в атмосфере азота добавляли 273 мг восстановленного железа, и перемешивали полученную смесь при внешней температуре 80°C в течение 30 минут. После охлаждения реакционной смеси до комнатной температуры, твердое вещество удаляли путем фильтрования через целит, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли этилацетат и воду. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления с получением 0,173 г 6-амино-3-бензилбензо[d]тиазол-2(3H)-она в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 5,00-5,10 (4H, м), 6,52 (1H, дд, J=8,6, 2,0 Гц), 6,79 (1H, д, J=2,6 Гц), 6,93 (1H, д, J=8,6 Гц), 7,21-7,39 (5H, м).
[Справочный пример 26]
[Формула 70]

К раствору 50 мг 6-бромхиноксалин-2(1H)-она в 0,5 мл N,N-диметилацетамида при комнатной температуре добавляли 26,4 мкл бензилбромида и 61,4 мг карбоната калия, и перемешивали полученную смесь при комнатной температуре в течение 30 минут и при внешней температуре 50°C в течение 30 минут. Реакционную смесь охлаждали до комнатной температуры, а затем к смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением 50 мг 1-бензил-6-бромхиноксалин-2(1H)-она в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 5,47 (2H, с), 7,20-7,38 (5H, м), 7,41 (1H, д, J=9,2 Гц), 7,73 (1H, дд, J=8,9, 2,3 Гц), 8,06 (1H, д, J=2,6 Гц), 8,39 (1H, с).
[Справочный пример 27]
[Формула 71]

Способом, аналогичным описанному в справочном примере 21, метил-5-циклопропил-2-((4-фтор-3-нитрофенил)амино)бензоат получали из метил-2-бром-5-циклопропилбензоата и 4-фтор-3-нитроанилина.
1H-ЯМР (CDCl3) δ: 0,60-0,71 (2H, м), 0,85-1,01 (2H, м), 1,80-1,93 (1H, м), 3,91 (3H, с), 7,02-7,84 (5H, м), 7,88 (1H, дд, J=6,6, 2,6 Гц), 9,41 (1H, с).
[Справочный пример 28]
[Формула 72]

К раствору 0,385 г метил-5-циклопропил-2-((4-фтор-3-нитрофенил)амино)бензоата в 3,4 мл N,N-диметилформамида при комнатной температуре в атмосфере азота добавляли 0,597 мл диизопропилэтиламина и 0,213 мл анилина, и перемешивали полученную смесь при внешней температуре 80°C в течение 19 часов. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением 0,175 г метил-5-циклопропил-2-((3-нитро-4-(фениламино)фенил)амино)бензоата в виде масла.
1H-ЯМР (CDCl3) δ: 0,58-0,68 (2H, м), 0,83-0,97 (2H, м), 1,78-1,91 (1H, м), 3,90 (3H, с), 7,00 (1H, д, J=8,6 Гц), 7,09 (1H, дд, J=8,6, 2,6 Гц), 7,13-7,47 (7H, м), 7,70 (1H, д, J=2,0 Гц), 8,08 (1H, с), 9,21 (1H, с), 9,40 (1H, с).
[Справочный пример 29]
[Формула 73]
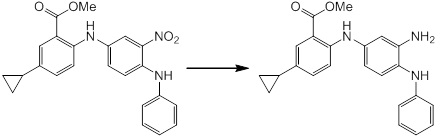
Раствор 0,170 г метил-5-циклопропил-2-((3-нитро-4-(фениламино)фенил)амино)бензоата в 4,2 мл тетрагидрофурана подвергали реакции гидрогенизации (комнатная температура, нормальное давление, скорость потока: 1,5 мл/мин, 10% Pd/C) с использованием реактора для гидрогенизации проточного типа. Полученный реакционный раствор добавляли к раствору 0,137 г 1,1'-карбонилдиимидазола в 4,2 мл тетрагидрофурана, и перемешивали полученную смесь при комнатной температуре в течение 30 минут. К реакционной смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Взаимодействие с 1,1'-карбонилдиимидазолом не проходило, и получали метил-2-((3-амино-4-(фениламино)фенил)амино)-5-циклопропилбензоата в виде масла.
МС (ESI, m/z): 374 (M+H)+.
[Справочный пример 30]
[Формула 74]

Смесь 0,89 г метил-2-амино-5-циклопропилбензоата, 1,47 г трет-бутил-2-(5-бром-2-нитрофенил)ацетата, 52 мг ацетата палладия, 270 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 3,03 г карбоната цезия и 10 мл толуола нагревали с обратным холодильником в течение 6 часов и 30 минут в атмосфере азота. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и добавляли к фильтрату этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-30/70). К полученному таким образом остатку добавляли гексан, и собирали твердое вещество путем фильтрования с получением 1,12 г метил-2-((3-(2-(трет-бутокси)-2-оксоэтил)-4-нитрофенил)амино)-5-циклопропилбензоата в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 0,65-0,71 (2H, м), 0,94-1,00 (2H, м), 1,46 (9H, с), 1,85-1,94 (1H, м), 3,89 (2H, с), 3,91 (3H, с), 6,96 (1H, д, J=2,0 Гц), 7,15 (1H, дд, J=9,2, 2,6 Гц), 7,20 (1H, дд, J=8,6, 2,0 Гц), 7,42 (1H, д, J=8,6 Гц), 7,74 (1H, д, J=2,6 Гц), 8,15 (1H, д, J=9,2 Гц), 9,59 (1H, с).
МС (ESI, m/z): 425 (M-H)-.
[Справочный пример 31]
[Формула 75]

Смесь 820 мг метил-2-((3-(2-(трет-бутокси)-2-оксоэтил)-4-нитрофенил)амино)-5-циклопропилбензоата, 537 мг железного порошка, 72 мг хлорида аммония, 15 мл этанола и 3 мл воды нагревали с обратным холодильником в течение 2 часов и 20 минут. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-50/50). К полученному таким образом остатку добавляли гексан, и собирали твердое вещество путем фильтрования с получением 497 мг метил-2-((4-амино-3-(2-(трет-бутокси)-2-оксоэтил)фенил)амино)-5-циклопропилбензоата в виде белого твердого вещества.
МС (ESI, m/z): 397 (M+H)+.
[Справочный пример 32]
[Формула 76]

К раствору 200 мг метил-2-((4-амино-3-(2-(трет-бутокси)-2-оксоэтил)фенил)амино)-5-циклопропилбензоата в 1 мл N,N-диметилформамида добавляли 77 мг карбоната калия и 66 мкл бензилбромида и перемешивали полученную смесь при комнатной температуре в течение 1 часа. Реакционную смесь оставляли отстаиваться в течение ночи, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления с получением 237 мг метил-2-((4-бензиламино-3-(2-(трет-бутокси)-2-оксоэтил)фенил)амино)-5-циклопропилбензоата в виде желтого масла.
МС (ESI, m/z): 488 (M+H)+.
[Справочный пример 33]
[Формула 77]

К раствору 100 мг метил-2-((4-амино-3-(2-(трет-бутокси)-2-оксоэтил)фенил)амино)-5-циклопропилбензоата в 1 мл N,N-диметилформамида добавляли 37 мг карбоната калия и 26 мкл бромметилциклопропана, и перемешивали полученную смесь при комнатной температуре в течение 14 часов и 55 минут, а затем перемешивали при внешней температуре 60°C в течение 1 часа и 55 минут. После добавления к смеси 37 мг карбоната калия полученную смесь перемешивали при внешней температуре 80°C в течение 2 часов и 50 минут. После отстаивания реакционной смеси в течение ночи, к ней добавляли 37 мг карбоната калия и 26 мкл бромметилциклопропана, и перемешивали полученную смесь при внешней температуре 110°C в течение 7 часов и 20 минут. Нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-60/40) с получением 65 мг метил-2-((3-(2-(трет-бутокси)-2-оксоэтил)-4-((циклопропилметил)амино)фенил)амино)-5-циклопропилбензоата в виде желтого масла.
МС (ESI, m/z): 451 (M+H)+.
[Справочный пример 34]
[Формула 78]

Смесь 64 мг 5-нитро-3-фенил-1H-индола, 53 мг железного порошка, 10 мг хлорида аммония, 2,5 мл этанола и 0,6 мл воды нагревали с обратным холодильником в течение 3 часов и 15 минут. Нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-80/20) с получением 26 мг 3-фенил-1H-индол-5-амина в виде коричневого масла.
МС (ESI, m/z): 209 (M+H)+.
[Справочный пример 35]
[Формула 79]

К раствору 500 мг 2-хлор-5-(трифторметил)никотиновой кислоты в 2 мл тетрагидрофурана при охлаждении на льду добавляли 197 мкл оксалилхлорида и 10 мкл N,N-диметилформамида и перемешивали полученную смесь в течение 1 часа. Реакционную смесь при охлаждении на льду по каплям добавляли к раствору 462 мкл триэтиламина в 5 мл метанола, а затем добавляли этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-80/20) с получением 400 мг метил-2-хлор-5-(трифторметил)никотината в виде бесцветного масла.
МС (ESI, m/z): 240 (M+H)+.
[Справочный пример 36]
[Формула 80]

Смесь 1,0 г метил-5-бром-2-хлорникотината, 820 мкл пинаколинового эфира изопропенилбороновой кислоты, 44 мг ацетата палладия, 112 мг трициклогексилфосфина, 2,12 г ортофосфата калия, 10 мл толуола и 1 мл воды нагревали с обратным холодильником в течение 3 часов и 15 минут в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-70/30) с получением 700 мг метил-2-хлор-5-(проп-1-ен-2-ил)никотината в виде бесцветного масла.
1H-ЯМР (ДМСО-d6) δ: 2,15 (3H, с), 3,90 (3H, с), 5,32 (1H, с), 5,67 (1H, с), 8,30 (1H, д, J=2,0 Гц), 8,74 (1H, д, J=2,0 Гц).
[Справочный пример 37]
[Формула 81]
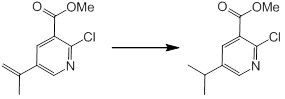
С использованием реактора для гидрогенизации проточного типа 30 мл раствора 700 мг метил-2-хлор-5-(проп-1-ен-2-ил)никотината в метаноле подвергали реакции гидрогенизации (45-50°C, 1 бар, скорость потока: 1 мл/мин, 5% Pd/C). Растворитель отгоняли в условиях пониженного давления, а затем очищали полученный остаток методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-50/50) с получением 530 мг метил-2-хлор-5-изопропилникотината в виде бесцветного масла.
1H-ЯМР (ДМСО-d6) δ: 1,23 (6H, д, J=7,3 Гц), 3,03 (1H, с, J=6,6 Гц), 3,89 (3H, с), 8,12 (1H, д, J=2,6 Гц), 8,51 (1H, д, J=2,6 Гц).
МС (ESI, m/z): 214 (M+H)+.
[Справочный пример 38]
[Формула 82]

Смесь 500 мг метил-5-бром-2-хлорникотината, 736 мкл циклопентена, 45 мг ацетата палладия, 122 мг три(о-толил)фосфина, 836 мкл триэтиламина и 2 мл N,N-диметилацетамида перемешивали при внешней температуре 100°C в течение 2 часов и 40 минут в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-50/50) с получением 288 мг метил-2-хлор-5-(циклопент-2-ен-1-ил)никотината в виде желтого масла.
1H-ЯМР (ДМСО-d6) δ: 1,60-1,70 (1H, м), 2,34-2,48 (3H, м), 3,88 (3H, с), 3,98-4,03 (1H, м), 5,77-5,82 (1H, м), 6,01-6,06 (1H, м), 7,98 (1H, д, J=2,6 Гц), 8,43 (1H, д, J=2,6 Гц).
МС (ESI, m/z): 238 (M+H)+.
[Справочный пример 39]
[Формула 83]

С использованием реактора для гидрогенизации проточного типа 20 мл раствора 288 мг метил-2-хлор-5-(циклопент-2-ен-1-ил)никотината в метаноле подвергали реакции гидрогенизации (комнатная температура, 1 бар, скорость потока: 2 мл/мин, 10% Pd/C). Растворитель отгоняли в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-70/30) с получением 257 мг метил-2-хлор-5-циклопентилникотината в виде бесцветного масла.
1H-ЯМР (ДМСО-d6) δ: 1,48-1,82 (6H, м), 2,01-2,10 (2H, м), 3,02-3,14 (1H, м), 3,88 (3H, с), 8,10 (1H, д, J=2,6 Гц), 8,50 (1H, д, J=2,6 Гц).
МС (ESI, m/z): 240 (M+H)+.
[Справочный пример 40]
[Формула 84]

Смесь 126 мг метил-5-бром-2-хлорникотината, 163 мг циклобутилтрифторбората калия, 5,4 мг бутилбис(1-адамантил)фосфина, 2,2 мг ацетата палладия, 492 мг карбоната цезия, 4,5 мл толуола и 0,5 мл воды перемешивали при внешней температуре 100°C в течение 19 часов и 15 минут в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-80/20) с получением 26 мг метил-2-хлор-5-циклобутилникотината в виде бесцветного масла.
МС (ESI, m/z): 226 (M+H)+.
[Справочный пример 41]
[Формула 85]

К раствору 1,0 г 5-нитро-1H-индол-2-карбоновой кислоты в 10 мл N,N-диметилацетамида добавляли 2,68 г карбоната калия и 2,11 мл 1-бром-2-метилпропана и перемешивали полученную смесь при внешней температуре 60°C в течение 1 часа и 20 минут. К ней добавляли 2,1 мл 1-бром-2-метилпропан, и перемешивали полученную смесь при внешней температуре 80°C в течение 5 часов. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления с получением изобутил-1-изобутил-5-нитро-1H-индол-2-карбоксилата в виде масла.
МС (ESI, m/z): 319 (M+H)+.
[Справочный пример 42]
[Формула 86]

Смесь изобутил-1-изобутил-5-нитро-1H-индол-2-карбоксилата, полученного в справочном примере 41, 5 мл 5 M водного раствора гидроксида натрия, 20 мл тетрагидрофурана и 10 мл метанола нагревали с обратным холодильником в течение 2 часов и 10 минут. После охлаждения реакционной смеси до комнатной температуры, к ней добавляли 5 мл 5 M соляной кислоты, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли воду и метанол, и собирали твердое вещество путем фильтрования с получением 1,21 г 1-изобутил-5-нитро-1H-индол-2-карбоновой кислоты в виде бледно-коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,81 (6H, д, J=6,6 Гц), 2,03-2,17 (1H, м), 4,50 (2H, д, J=7,3 Гц), 7,54 (1H, с), 7,87 (1H, д, J=9,2 Гц), 8,14 (1H, дд, J=9,2, 2,6 Гц), 8,74 (1H, д, J=2,0 Гц).
МС (ESI, m/z): 263 (M+H)+, 261 (M-H)-.
[Справочный пример 43]
[Формула 87]

К раствору 600 мг 1-изобутил-5-нитро-1H-индол-2-карбоновой кислоты в 30 мл тетрагидрофурана при охлаждении на льду добавляли 477 мкл триэтиламина, 56 мг 4-(диметиламино)пиридина и 1,05 мл ди-трет-бутилдикарбоната, и перемешивали полученную смесь при внешней температуре 60°C в течение 4 часов и 10 минут. К ней добавляли 477 мкл триэтиламина и 1,05 мл ди-трет-бутилдикарбоната и перемешивали полученную смесь при внешней температуре 60°C в течение 1 часа и 20 минут. К ней добавляли 0,5 мл ди-трет-бутилдикарбоната и перемешивали полученную смесь при внешней температуре 60°C в течение 3 часов и 5 минут, затем к смеси добавляли 0,5 мл ди-трет-бутилдикарбоната и 477 мкл триэтиламина и перемешивали полученную смесь при внешней температуре 60°C в течение 1 часа и 5 минут. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления с получением трет-бутил-1-изобутил-5-нитро-1H-индол-2-карбоксилата в виде коричневого масла.
МС (ESI, m/z): 319 (M+H)+.
[Справочный пример 44]
[Формула 88]

Смесь трет-бутил-1-изобутил-5-нитро-1H-индол-2-карбоксилата, полученного в справочном примере 43, 86 мг хлорида аммония, 0,38 г железного порошка, 60 мл этанола и 15 мл воды нагревали с обратным холодильником в течение 2 часов и 20 минут. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали. Осадок на фильтре промывали этилацетатом. Фильтрат и смывы объединяли, к ним добавляли воду, органический слой разделяли, промывали насыщенным водным раствором хлорида натрия, а затем сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением 0,52 г трет-бутил-5-амино-1-изобутил-1H-индол-2-карбоксилата в виде коричневого масла.
МС (ESI, m/z): 289 (M+H)+.
[Справочный пример 45]
[Формула 89]

Смесь 600 мг (6-аминонафталин-1-ил)трифторметансульфоната, 252 мг фенилбороновой кислоты, 798 мг ортофосфата калия, 133 мг бис(ди-трет-бутил(4-диметиламинофенил)фосфин)-дихлорпалладия(II), 20 мл диоксана и 5 мл воды нагревали с обратным холодильником в течение 3,5 часов. К реакционной смеси добавляли 69 мг фенилбороновой кислоты, и нагревали полученную смесь с обратным холодильником в течение 55 минут. После охлаждения реакционной смеси до комнатной температуры, органический слой разделяли. Органический слой промывали водой, водные слои объединяли и экстрагировали этилацетатом. Органический слой и экстракт объединяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 95/5-70/30) с получением 265 мг 5-фенилнафталин-2-амина в виде желтого твердого вещества.
МС (ESI, m/z): 220 (M+H)+.
[Справочный пример 46]
[Формула 90]

К раствору 1,0 г 8-фенилнафталин-2-ола в 15 мл тетрагидрофурана при охлаждении на льду добавляли 352 мг трет-бутоксида натрия, затем к нему добавляли 1,3 г N-фенилбис(трифторметансульфонимид), и перемешивали полученную смесь в течение 1,5 часов. К реакционной смеси добавляли воду и этилацетат, органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-85/15) с получением 1,28 г (8-фенилнафталин-2-ил)трифторметансульфоната в виде белого твердого вещества.
МС (ESI, m/z): 351 (M-H)-.
[Справочный пример 47]
[Формула 91]

Смесь 500 мг (8-фенилнафталин-2-ил)трифторметансульфоната, 200 мг трет-бутилкарбамата, 65 мг трис(дибензилиденацетон)-дипалладия(0), 82 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 925 мг карбоната цезия и 5 мл толуола перемешивали при 190°C в течение 1 часа с использованием микроволновой установки. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-70/30) с получением 130 мг 8-фенилнафталин-2-амина в виде желтого масла.
МС (ESI, m/z): 220 (M+H)+.
[Справочный пример 48]
[Формула 92]

Смесь 50 мг 6-нитро-1,2,3,4-тетрагидрохинолина, 32 мкл бромбензола, 13 мг трис(дибензилиденацетон)дипалладия(0), 16 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 183 мг карбоната цезия и 1,5 мл толуола перемешивали при 150°C в течение 1 часа, а затем при 190°C в течение 1 часа с использованием микроволновой установки. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-80/20) с получением 40 мг 6-нитро-1-фенил-1,2,3,4-тетрагидрохинолина в виде желтого масла.
МС (ESI, m/z): 255 (M+H)+.
[Справочный пример 49]
[Формула 93]

Раствор 40 мг 6-нитро-1-фенил-1,2,3,4-тетрагидрохинолина в 8 мл метанола подвергали реакции гидрогенизации (комнатная температура, 1 бар, скорость потока: 1 мл/мин, 10% Pd/C) с использованием реактора для гидрогенизации проточного типа. Растворитель отгоняли в условиях пониженного давления с получением 36 мг 1-фенил-1,2,3,4-тетрагидрохинолин-6-амина в виде желтого масла.
МС (ESI, m/z): 225 (M+H)+.
[Справочный пример 50]
[Формула 94]

Смесь 130 мг 1-бензил-6-нитро-1,2,3,4-тетрагидрохинолина, 24 мг хлорида аммония, 75 мг железного порошка, 2 мл этанола и 0,5 мл воды нагревали с обратным холодильником в течение 1 часа и 20 минут. После охлаждения реакционной смеси до комнатной температуры, к ней добавляли 113 мг железного порошка и нагревали полученную смесь с обратным холодильником в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали. Осадок на фильтре промывали метанолом, смывы и фильтрат объединяли, и отгоняли растворитель в условиях пониженного давления. К смеси добавляли этилацетат, воду и насыщенный водный раствор бикарбоната натрия, органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-60/40) с получением 84 мг 1-бензил-1,2,3,4-тетрагидрохинолин-6-амина в виде желтого масла.
МС (ESI, m/z): 239 (M+H)+.
[Справочный пример 51]
[Формула 95]
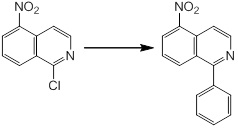
Смесь 237 мг 1-хлор-5-нитроизохинолина, 153 мг фенилбороновой кислоты, 484 мг ортофосфата калия, 40 мг бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлорпалладия(II), 8 мл диоксана и 2 мл воды перемешивали при 100°C в течение 1,5 часов. К реакционной смеси добавляли 28 мг фенилбороновой кислоты, и нагревали полученную смесь с обратным холодильником в течение 30 минут. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-80/20) с получением 233 мг 5-нитро-1-фенилизохинолина в виде желтого твердого вещества.
МС (ESI, m/z): 251 (M+H)+.
[Справочный пример 52]
[Формула 96]
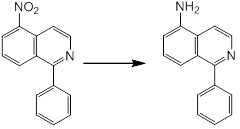
Смешанный раствор 233 мг 5-нитро-1-фенилизохинолина, 10 мл метанола и 2 мл тетрагидрофурана подвергали реакции гидрогенизации (комнатная температура, 1 бар, скорость потока: 1,5 мл/мин, 10% Pd/C) с использованием реактора для гидрогенизации проточного типа. Растворитель отгоняли в условиях пониженного давления с получением 1-фенилизохинолин-5-амина в виде желтого твердого вещества.
МС (ESI, m/z): 221 (M+H)+.
[Справочный пример 53]
[Формула 97]

Смесь 100 мг 7-йод-5-нитро-1H-индола, 76 мг 3-бифенилбороновой кислоты, 147 мг ортофосфата калия, 25 мг бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлорпалладия(II), 10 мл диоксана и 2 мл воды перемешивали при 100°C в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-70/30) с получением 137 мг 7-([1,1'-бифенил]-3-ил)-5-нитро-1H-индола в виде коричневого твердого вещества.
МС (ESI, m/z): 315 (M+H)+.
[Справочный пример 54]
[Формула 98]

К раствору 137 мг 7-([1,1'-бифенил]-3-ил)-5-нитро-1H-индола и 35 мкл метилйодида в 4 мл N,N-диметилформамида при охлаждении на льду добавляли 19 мг 60% гидрида натрия и перемешивали полученную смесь при комнатной температуре в течение 30 минут. К реакционной смеси добавляли воду и этилацетат, органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-70/30) с получением 132 мг 7-([1,1'-бифенил]-3-ил)-1-метил-5-нитро-1H-индола в виде коричневого масла.
МС (ESI, m/z): 329 (M+H)+.
[Справочный пример 55]
[Формула 99]

Смесь 132 мг 7-([1,1'-бифенил]-3-ил)-1-метил-5-нитро-1H-индола, 11 мг хлорида аммония, 67 мг железного порошка, 2 мл этанола и 0,5 мл воды перемешивали при 60°C в течение 40 минут. К смеси добавляли 33 мг хлорида аммония и 112 мг железного порошка, и перемешивали полученную смесь при 60°C в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали. К нему добавляли этилацетат, воду и насыщенный водный раствор бикарбоната натрия. Органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-60/40) с получением 90 мг 7-([1,1'-бифенил]-3-ил)-1-метил-1H-индол-5-амина в виде желтой пены.
МС (ESI, m/z): 299 (M+H)+.
[Справочный пример 56]
[Формула 100]

Смесь 100 мг 7-йод-5-нитро-1H-индола, 76 мг 4-бифенилбороновой кислоты, 147 мг ортофосфата калия, 25 мг бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлорпалладия(II), 10 мл диоксана и 2 мл воды перемешивали при 100°C в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-70/30) с получением 145 мг 7-([1,1'-бифенил]-4-ил)-5-нитро-1H-индола в виде коричневого твердого вещества.
МС (ESI, m/z): 313 (M-H)-.
[Справочный пример 57]
[Формула 101]

К раствору 137 мг 7-([1,1'-бифенил]-4-ил)-5-нитро-1H-индола и 35 мкл метилйодида в 4 мл N,N-диметилформамида при охлаждении на льду добавляли 19 мг 60% гидрида натрия и перемешивали полученную смесь при комнатной температуре в течение 30 минут. К реакционной смеси добавляли воду и этилацетат, органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-70/30) с получением 32 мг 7-([1,1'-бифенил]-4-ил)-1-метил-5-нитро-1H-индола в виде черного твердого вещества.
МС (ESI, m/z): 329 (M+H)+.
[Справочный пример 58]
[Формула 102]

Смесь 32 мг 7-([1,1'-бифенил]-4-ил)-1-метил-5-нитро-1H-индола, 2,9 мг хлорида аммония, 18 мг железного порошка, 2 мл этанола и 0,5 мл воды перемешивали при 60°C в течение 40 минут. К смеси добавляли 8,7 мг хлорида аммония и 30 мг железного порошка, и перемешивали полученную смесь при 60°C в течение 4 часов и 20 минут. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и добавляли к растворителю этилацетат, воду и насыщенный водный раствор бикарбоната натрия. Органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-60/40) с получением 8,7 мг 7-([1,1'-бифенил]-4-ил)-1-метил-1H-индол-5-амина в виде коричневого масла.
МС (ESI, m/z): 299 (M+H)+.
[Справочный пример 59]
[Формула 103]

К раствору 300 мг 6-бром-3-хлорпиколиновой кислоты в 7 мл метанола добавляли 0,3 мл концентрированной серной кислоты и нагревали полученную смесь с обратным холодильником в течение 2 часов. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. К полученному остатку добавляли этилацетат и насыщенный водный раствор бикарбоната натрия. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления с получением 225 мг метил-6-бром-3-хлорпиколината в виде белого твердого вещества.
Смесь 225 мг метил-6-бром-3-хлорпиколината, 140 мг моногидрата циклопропилбороновой кислоты, 10 мг ацетата палладия, 25 мг трициклогексилфосфина, 401 мг ортофосфата калия, 10 мл толуола и 1 мл воды нагревали с обратным холодильником в течение 7 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 95/5-80/20) с получением 221 мг метил-3-хлор-6-циклопропилпиколината в виде бесцветного масла.
МС (ESI, m/z): 212 (M+H)+.
[Справочный пример 60]
[Формула 104]

К раствору 239 мг 7-аминонафталин-2-ола в 10 мл тетрагидрофурана при охлаждении на льду добавляли 144 мг трет-бутоксида натрия и перемешивали полученную смесь в течение 10 минут, затем добавляли 535 мг N-фенил-бис(трифторметансульфонимида) и дополнительно перемешивали полученную смесь в течение 30 минут. Растворитель отгоняли в условиях пониженного давления. К полученному остатку добавляли хлороформ, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный таким образом остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 95/5-67/33) с получением (7-аминонафталин-2-ил)трифторметансульфоната.
МС (ESI, m/z): 292 (M+H)+.
[Справочный пример 61]
[Формула 105]
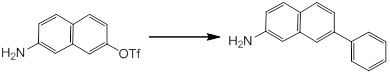
Смесь (7-аминонафталин-2-ил)трифторметансульфоната, полученного в справочном примере 60, 183 мг фенилбороновой кислоты, 543 мг ортофосфата калия, 53 мг бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлорпалладия(II), 3 мл диоксана и 1 мл воды перемешивали при 150°C в течение 20 минут с использованием микроволновой установки. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 91/9-67/33), к полученному таким образом остатку добавляли гексан, и собирали твердое вещество путем фильтрования с получением 61 мг 7-фенил-нафталин-2-амина в виде коричневого твердого вещества.
МС (ESI, m/z): 220 (M+H)+.
[Справочный пример 62]
[Формула 106]

Смесь 720 мг 7-йод-5-нитро-1H-индола, 365 мг фенилбороновой кислоты, 815 мг ортофосфата калия, 88 мг бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлорпалладия(II), 9 мл диоксана и 3 мл воды перемешивали при 150°C в течение 20 минут с использованием микроволновой установки. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью хлороформ/этилацетат = 100/0-75/25), к полученному таким образом остатку добавляли этилацетат и гексан, и собирали твердое вещество путем фильтрования с получением 376 мг 5-нитро-7-фенил-1H-индола в виде желтого твердого вещества.
МС (ESI, m/z): 237 (M-H)-.
[Справочный пример 63]
[Формула 107]

К раствору 119 мг 5-нитро-7-фенил-1-индола в 2 мл N,N-диметилформамида при охлаждении на льду добавляли 22 мг 60% гидрида натрия и перемешивали полученную смесь в течение 30 минут. К реакционной смеси при охлаждении на льду добавляли 34 мкл метилйодида, и перемешивали полученную смесь в течение 30 минут. К реакционной смеси добавляли этилацетат и воду. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 95/5-75/25) с получением 1-метил-5-нитро-7-фенил-1H-индола.
МС (ESI, m/z): 253 (M+H)+.
[Справочный пример 64]
[Формула 108]

Раствор 1-метил-5-нитро-7-фенил-1H-индола, полученного в справочном примере 63, в метаноле подвергали реакции гидрогенизации (комнатная температура, скорость потока: 1 мл/мин, 10% Pd/C) с использованием реактора для гидрогенизации проточного типа, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 91/9-33/67) с получением 1-метил-7-фенил-1H-индол-5-амина.
МС (ESI, m/z): 223 (M+H)+.
[Справочный пример 65]
[Формула 109]
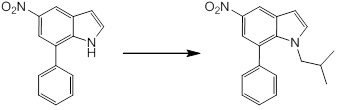
К раствору 119 мг 5-нитро-7-фенил-1H-индола в 2 мл N,N-диметилформамида при охлаждении на льду добавляли 22 мг 60% гидрида натрия и перемешивали полученную смесь в течение 30 минут. К реакционной смеси добавляли 60 мкл 1-бром-2-метилпропана, и перемешивали полученную смесь в течение 1 часа. К реакционной смеси добавляли этилацетат и воду. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 95/5-75/25) с получением 1-изобутил-5-нитро-7-фенил-1H-индола.
МС (ESI, m/z): 295 (M+H)+.
[Справочный пример 66]
[Формула 110]
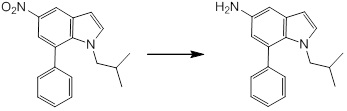
Раствор 1-изобутил-5-нитро-7-фенил-1H-индола, полученного в справочном примере 65, в метаноле подвергали реакции гидрогенизации (комнатная температура, скорость потока: 1 мл/мин, 10% Pd/C) с использованием реактора для гидрогенизации проточного типа. Затем отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 91/9-33/67) с получением 1-изобутил-7-фенил-1H-индол-5-амина.
МС (ESI, m/z): 265 (M+H)+.
[Справочный пример 67]
[Формула 111]

Смесь 131 мг 5-нитро-7-фенил-1H-индола, 133 мг ди-трет-бутилдикарбоната, 7,0 мг 4-(диметиламино)пиридина, 0,4 мл триэтиламина и 4 мл дихлорметана перемешивали в течение 1 часа. Растворитель отгоняли в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 95/5-75/25) с получением трет-бутил-5-нитро-7-фенил-1H-индол-1-карбоксилата.
МС (ESI, m/z): 339 (M+H)+.
[Справочный пример 68]
[Формула 112]

Раствор трет-бутил-5-нитро-7-фенил-1H-индол-1-карбоксилата, полученного в справочном примере 67, в метаноле подвергали реакции гидрогенизации (комнатная температура, скорость потока: 1 мл/мин, 10% Pd/C) с использованием реактора для гидрогенизации проточного типа. Затем отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 91/9-33/67) с получением трет-бутил-5-амино-7-фенил-1H-индол-1-карбоксилата.
МС (ESI, m/z): 309 (M+H)+.
[Справочный пример 69]
[Формула 113]

Смесь 405 мг 2-хлор-5-нитроизоникотиновой кислоты, 873 мг ди-трет-бутилдикарбоната, 80,6 мг 4-(диметиламино)пиридина, 5 мл трет-бутанола и 5 мл дихлорметана перемешивали в течение 1 часа. Реакционную смесь оставляли отстаиваться в течение ночи, а затем нагревали с обратным холодильником в течение 3 часов. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 95/5-67/33), к полученному таким образом остатку добавляли метанол и воду, и собирали твердое вещество путем фильтрования с получением 244 мг трет-бутил-2-хлор-5-нитроизоникотината в виде белого твердого вещества.
[Справочный пример 70]
[Формула 114]

Смесь 170 мг трет-бутил-2-хлор-5-нитроизоникотината, 21 мг хлорида аммония, 129 мг железного порошка, 4 мл 2-пропанола и 1 мл воды нагревали с обратным холодильником в течение 2 часов. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли насыщенный водный раствор бикарбоната натрия и этилацетат. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный таким образом остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 95/5-50/50) с получением 114 мг трет-бутил-5-амино-2-хлоризоникотината в виде зеленого твердого вещества.
МС (ESI, m/z): 229 (M+H)+.
[Справочный пример 71]
[Формула 115]
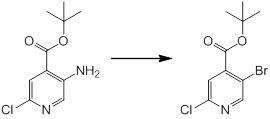
Смесь 114 мг трет-бутил-5-амино-2-хлоризоникотината, 135 мкл изоамилнитрита, 193 мкл триметилсилилбромида и 5 мл дихлорметана перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли этилацетат и насыщенный водный раствор бикарбоната натрия. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-83/17) с получением трет-бутил-5-бром-2-хлоризоникотината.
МС (ESI, m/z): 294 (M+H)+.
[Справочный пример 72]
[Формула 116]

Способом, аналогичным описанному в справочном примере 11, 1-бензил-5-нитро-1H-индазол получали из 5-нитро-1H-индазола и бензилбромида.
1H-ЯМР (ДМСО-d6) δ: 5,77 (2H, с), 7,22-7,39 (5H, м), 7,96 (1H, д, J=9,2 Гц), 8,23 (1H, дд, J=9,2, 2,0 Гц), 8,45 (1H, с), 8,85 (1H, д, J=2,0 Гц).
[Справочный пример 73]
[Формула 117]

Способом, аналогичным описанному в справочном примере 12, 1-бензил-1H-индазол-5-амин получали из 1-бензил-5-нитро-1H-индазола.
1H-ЯМР (ДМСО-d6) δ: 4,80 (2H, с), 5,51 (2H, с), 6,72-6,81 (2H, м), 7,13-7,38 (6H, м), 7,74 (1H, с).
[Справочный пример 74]
[Формула 118]

К раствору 0,77 г этил-1-бензил-5-нитро-1H-индол-2-карбоксилата в 3,0 мл этанола и 5 мл тетрагидрофурана при комнатной температуре добавляли 0,95 мл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при внешней температуре 50-60°C в течение 2 часов. После охлаждения реакционной смеси до комнатной температуры, к ней добавляли воду. Реакционную смесь корректировали до pH 2,0 добавлением 2 M соляной кислоты. Полученное твердое вещество собирали путем фильтрования с получением 0,68 г 1-бензил-5-нитро-1H-индол-2-карбоновой кислоты в виде бледно-коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 5,96 (2H, с), 7,00-7,07 (2H, м), 7,18-7,33 (3H, м), 7,62 (1H, с), 7,79 (1H, д, J=9,2 Гц), 8,14 (1H, дд, J=9,2, 2,0 Гц), 8,77 (1H, д, J=2,0 Гц).
[Справочный пример 75]
[Формула 119]

Смесь 0,66 г 1-бензил-5-нитро-1H-индол-2-карбоновой кислоты, 82 мг 4-(диметиламино)пиридина, 0,97 г ди-трет-бутилдикарбоната и 6 мл трет-бутанола перемешивали при внешней температуре 50-60°C в течение 15 минут. Добавляли 6 мл тетрагидрофурана и перемешивали полученную смесь при внешней температуре 50-70°C в течение 4 часов. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Реакционную смесь корректировали до pH 2,0 добавлением к ней 2 M соляной кислоты. Органический слой разделяли, последовательно промывали водой, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли хлороформ, нерастворимое вещество отфильтровывали, и промывали осадок на фильтре хлороформом. Фильтрат и смывы объединяли, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 80/20-50/50) с получением 0,51 г трет-бутил-1-бензил-5-нитро-1H-индол-2-карбоксилата в виде бледно-желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,50 (9H, с), 5,91 (2H, с), 6,97-7,04 (2H, м), 7,18-7,33 (3H, м), 7,57 (1H, с), 7,81 (1H, д, J=9,2 Гц), 8,15 (1H, дд, J=9,2, 2,6 Гц), 8,76 (1H, д, J=2,6 Гц).
[Справочный пример 76]
[Формула 120]

Способом, аналогичным описанному в справочном примере 12, трет-бутил-5-амино-1-бензил-1H-индол-2-карбоксилат получали из трет-бутил-1-бензил-5-нитро-1H-индол-2-карбоксилата.
1H-ЯМР (ДМСО-d6) δ: 1,47 (9H, с), 4,73 (2H, с), 5,70 (2H, с), 6,65-6,76 (2H, м), 6,92-7,02 (3H, м), 7,13-7,31 (4H, м).
[Справочный пример 77]
[Формула 121]

Способом, аналогичным описанному в справочном примере 12, трет-бутил-4-((5-амино-1H-индол-1-ил)метил)пиперидин-1-карбоксилат получали из трет-бутил-4-((5-нитро-1H-индол-1-ил)метил)пиперидин-1-карбоксилата.
1H-ЯМР (CDCl3) δ: 1,09-1,30 (2H, м), 1,44 (9H, с), 1,48-1,60 (2H, м), 1,89-2,04 (1H, м), 2,52-2,68 (2H, м), 3,92 (2H, д, J=7,3 Гц), 4,00-4,20 (2H, м), 6,29 (1H, д, J=2,6 Гц), 6,68 (1H, дд, J=8,6, 2,0 Гц), 6,93 (1H, д, J=2,0 Гц), 6,96 (1H, д, J=3,3 Гц), 7,12 (1H, д, J=8,6 Гц).
[Справочный пример 78]
[Формула 122]

Способом, аналогичным описанному в справочном примере 30, 5-нитро-1-фенилиндолин получали из 5-нитроиндолина и бромбензола.
1H-ЯМР (CDCl3) δ: 3,22 (2H, т, J=8,3 Гц), 4,15 (2H, т, J=8,6 Гц), 6,93 (1H, д, J=8,6 Гц), 7,11-7,19 (1H, м), 7,24-7,32 (2H, м), 7,37-7,46 (2H, м), 7,98-8,07 (2H, м).
[Справочный пример 79]
[Формула 123]

Способом, аналогичным описанному в справочном примере 12, 1-фенилиндолин-5-амин получали из 5-нитро-1-фенилиндолина.
1H-ЯМР (CDCl3) δ: 3,05 (2H, т, J=8,3 Гц), 3,38 (2H, уш.с), 3,89 (2H, т, J=8,3 Гц), 6,46 (1H, д, J=8,6 Гц), 6,60-6,65 (1H, м), 6,88 (1H, т, J=7,3 Гц), 7,01 (1H, д, J=8,6 Гц), 7,12-7,18 (2H, д, J=7,9 Гц), 7,27-7,35 (2H, м).
[Справочный пример 80]
[Формула 124]

В соответствии со способом, описанным в справочном примере 11, за исключением того, что использовали в качестве растворителя N,N-диметилформамид, 5-нитро-1-(пиридин-3-илметил)-1H-индол получали из 5-нитро-1H-индола и 3-(хлорметил)пиридина.
1H-ЯМР (ДМСО-d6) δ: 5,59 (2H, с), 6,83 (1H, д, J=2,6 Гц), 7,34 (1H, дд, J=7,3, 4,6 Гц), 7,57-7,64 (1H, м), 7,76 (1H, д, J=9,2 Гц), 7,83 (1H, д, J=3,3 Гц), 8,02 (1H, дд, J=8,9, 2,3 Гц), 8,48 (1H, дд, J=5,0, 1,7 Гц), 8,57 (1H, д, J=2,0 Гц), 8,59 (1H, д, J=2,0 Гц).
[Справочный пример 81]
[Формула 125]

К раствору 330 мг 5-нитро-1-(пиридин-3-илметил)-1H-индола в 16,5 мл этанола и 16,5 мл этилацетата добавляли 66 мг 10% Pd/C и перемешивали полученную смесь при комнатной температуре в течение 3 часов и 30 минут в атмосфере водорода. Нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления с получением 280 мг 1-(пиридин-3-илметил)-1H-индол-5-амина.
1H-ЯМР (ДМСО-d6) δ: 4,49 (2H, с), 5,32 (2H, с), 6,18 (1H, д, J=4,0 Гц), 6,49 (1H, дд, J=8,6, 2,0 Гц), 6,68 (1H, д, J=2,0 Гц), 7,14 (1H, д, J=8,6 Гц), 7,27-7,34 (2H, м), 7,48-4-7,55 (1H, м), 8,41-8,47 (2H, м).
[Справочный пример 82]
[Формула 126]

В соответствии со способом, описанным в справочном примере 11, за исключением того, что в качестве растворителя использовали N,N-диметилформамид, 1-(4-метоксибензил)-5-нитро-1H-индол получали из 5-нитро-1H-индола и 1-(хлорметил)-4-метоксибензола.
1H-ЯМР (ДМСО-d6) δ: 3,70 (3H, с), 5,44 (2H, с), 6,78 (1H, д, J=3,3 Гц), 6,84-6,91 (2H, м), 7,18-7,25 (2H, м), 7,71 (1H, д, J=9,2 Гц), 7,76 (1H, д, J=3,3 Гц), 8,00 (1H, дд, J=9,2, 2,0 Гц), 8,57 (1H, д, J=2,6 Гц).
[Справочный пример 83]
[Формула 127]

Способом, аналогичным описанному в справочном примере 81, 1-(4-метоксибензил)-1H-индол-5-амин получали из 1-(4-метоксибензил)-5-нитро-1H-индола.
1H-ЯМР (ДМСО-d6) δ: 3,69 (3H, с), 4,45 (2H, с), 5,18 (2H, с), 6,14 (1H, д, J=2,6 Гц), 6,47 (1H, дд, J=8,6, 2,0 Гц), 6,67 (1H, д, J=2,0 Гц), 6,80-6,86 (2H, м), 7,07-7,16 (3H, м), 7,24 (1H, д, J=3,3 Гц).
[Справочный пример 84]
[Формула 128]

Суспензию 0,86 мл бензоилхлорида и 0,99 г хлорида алюминия в 10 мл дихлорметана при 0°C добавляли к 20 мл дихлорметана и перемешивали полученную смесь при 0°C в течение 15 минут. К смеси добавляли суспензию 0,75 г 5-нитро-1H-индола в 10 мл дихлорметана, и перемешивали полученную смесь при комнатной температуре в течение 1 часа, а затем при 45°C в течение 3 часов и 20 минут. К реакционной смеси добавляли этилацетат и воду. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли гексан. Твердое вещество собирали путем фильтрования с получением 0,2 г (5-нитро-1H-индол-3-ил)(фенил)метанона в виде твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 7,49-8,02 (6H, м), 8,18 (1H, дд, J=8,9, 2,3 Гц), 8,27 (1H, д, J=3,3 Гц), 9,14 (1H, д, J=2,0 Гц), 12,68 (1H, уш.с).
[Справочный пример 85]
[Формула 129]

В соответствии со способом, описанным в справочном примере 11, за исключением того, что в качестве растворителя использовали N,N-диметилформамид, (1-бензил-5-нитро-1H-индол-3-ил)(фенил)метанон получали из (5-нитро-1H-индол-3-ил)(фенил)метанона и бензилбромида.
1H-ЯМР (ДМСО-d6) δ: 5,66 (2H, с), 7,20-7,40 (5H, м), 7,53-7,73 (3H, м), 7,80 (1H, д, J=8,6 Гц), 7,84-7,94 (2H, м), 8,12-8,20 (1H, м), 8,58 (1H, с), 9,15 (1H, с).
[Справочный пример 86]
[Формула 130]

Способом, аналогичным описанному в справочном примере 12, (5-амино-1-бензил-1H-индол-3-ил)(фенил)метанон получали из (1-бензил-5-нитро-1H-индол-3-ил)(фенил)метанона.
1H-ЯМР (ДМСО-d6) δ: 4,89 (2H, с), 5,41 (2H, с), 6,54-6,6 (1H, м), 7,17 (1H, д, J=8,6 Гц), 7,21-7,36 (5H, м), 7,48-7,62 (4H, м), 7,71-7,78 (2H, м), 7,97 (1H, с).
[Справочный пример 87]
[Формула 131]

Способом, аналогичным описанному в справочном примере 84, (4-бром-1H-индол-3-ил)(фенил)метанон получали из 4-бром-1H-индола и бензоилхлорида.
1H-ЯМР (ДМСО-d6) δ: 7,17 (1H, т, J=7,9 Гц), 7,38 (1H, д, J=6,6 Гц), 7,49-7,68 (4H, м), 7,79-7,87 (3H, м), 12,17 (1H, уш.с).
[Справочный пример 88]
[Формула 132]

В соответствии со способом, описанным в справочном примере 11, за исключением того, что в качестве растворителя использовали N,N-диметилформамид, (1-бензил-4-бром-1H-индол-3-ил)(фенил)метанон получали из (4-бром-1H-индол-3-ил)(фенил)метанона и бензилбромида.
1H-ЯМР (ДМСО-d6) δ: 5,54 (2H, с), 7,17 (1H, т, J=7,9 Гц), 7,22-7,44 (6H, м), 7,50-7,71 (4H, м), 7,81-7,90 (2H, м), 8,13 (1H, с).
[Справочный пример 89]
[Формула 133]
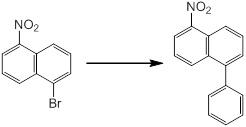
Способом, аналогичным описанному в справочном примере 45, 1-нитро-5-фенилнафталин получали из 1-бром-5-нитронафталина и фенилбороновой кислоты.
МС (ESI, m/z): 250 (M+H)+.
[Справочный пример 90]
[Формула 134]

Способом, аналогичным описанному в справочном примере 49, 5-фенилнафталин-1-амин получали из 1-нитро-5-фенилнафталина.
МС (ESI, m/z): 220 (M+H)+.
[Справочный пример 91]
[Формула 135]
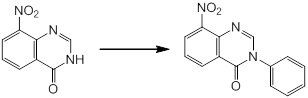
Смесь 50 мг 8-нитрохиназолин-4(3H)-она, 96 мг фенилбороновой кислоты, 143 мг ацетата меди(II), 0,30 мл пиридина и 1,2 мл дихлорметана перемешивали при 100°C в течение 1 часа с использованием микроволновой установки. Реакционную смесь дополнительно перемешивали при 120°C в течение 1 часа с использованием микроволновой установки. Реакционную смесь охлаждали до комнатной температуры, а затем оставляли отстаиваться в течение ночи. К смеси добавляли воду и этилацетат, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-60/40) с получением 23 мг 8-нитро-3-фенилхиназолин-4(3H)-она в виде желтого масла.
МС (ESI, m/z): 268 (M+H)+.
[Справочный пример 92]
[Формула 136]

Способом, аналогичным описанному в справочном примере 49, 8-амино-3-фенилхиназолин-4(3H)-он получали из 8-нитро-3-фенилхиназолин-4(3H)-она.
МС (ESI, m/z): 238 (M+H)+.
[Справочный пример 93]
[Формула 137]

Смесь 191 мг 6-нитрохиноксалин-2(1H)-она, 244 мг фенилбороновой кислоты, 36 мг ацетата меди(II), 0,3 г 4Å молекулярных сит, 178 мкл пиридина и 10 мл дихлорметана перемешивали в течение 4 суток, а затем отфильтровывали нерастворимое вещество, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью хлороформ/этилацетат = 100/0-91/9) с получением 6-нитро-1-фенилхиноксалин-2(1H)-она в виде желтого твердого вещества.
МС (ESI, m/z): 268 (M+H)+.
[Справочный пример 94]
[Формула 138]
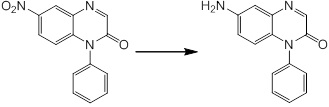
Смесь 6-нитро-1-фенилхиноксалин-2(1H)-она, полученного в справочном примере 93, 32 мг хлорида аммония, 168 мг железного порошка, 16 мл 2-пропанола и 4 мл воды нагревали с обратным холодильником в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. К остатку добавляли насыщенный водный раствор бикарбоната натрия и этилацетат. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли этилацетат и гексан, и собирали твердое вещество путем фильтрования с получением 162 мг 6-амино-1-фенилхиноксалин-2(1H)-она в виде желтого твердого вещества.
МС (ESI, m/z): 238 (M+H)+.
[Справочный пример 95]
[Формула 139]
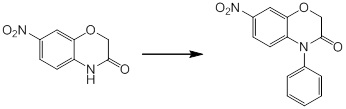
Способом, аналогичным описанному в справочном примере 93, 7-нитро-4-фенил-2H-бензо[b][1,4]оксазин-3(4H)-он получали из 7-нитро-2H-бензо[b][1,4]оксазин-3(4H)-она и фенилбороновой кислоты.
МС (ESI, m/z): 271(M+H)+.
[Справочный пример 96]
[Формула 140]

Способом, аналогичным описанному в справочном примере 64, 7-амино-4-фенил-2H-бензо[b][1,4]оксазин-3(4H)-он получали из 7-нитро-4-фенил-2H-бензо[b][1,4]оксазин-3(4H)-она.
МС (ESI, m/z): 241 (M+H)+.
[Справочный пример 97]
[Формула 141]

Способом, аналогичным описанному в справочном примере 93, 5-нитро-1-фенилхинолин-2(1H)-он получали из 5-нитрохинолин-2(1H)-она и фенилбороновой кислоты.
МС (ESI, m/z): 267 (M+H)+.
[Справочный пример 98]
[Формула 142]

Способом, аналогичным описанному в справочном примере 70, 5-амино-1-фенилхинолин-2(1H)-он получали из 5-нитро-1-фенилхинолин-2(1H)-она.
МС (ESI, m/z): 237 (M+H)+.
[Справочный пример 99]
[Формула 143]

Способом, аналогичным описанному в справочном примере 63, 1,7-диметил-5-нитро-1H-индол получали из 7-метил-5-нитро-1H-индола.
МС (ESI, m/z): 191 (M+H)+.
[Справочный пример 100]
[Формула 144]

Способом, аналогичным описанному в справочном примере 64, 1,7-диметил-1H-индол-5-амин получали из 1,7-диметил-5-нитро-1H-индола.
МС (ESI, m/z): 161 (M+H)+.
[Справочный пример 101]
[Формула 145]

Способом, аналогичным описанному в справочном примере 62, 7-циклопропил-5-нитро-1H-индол получали из 7-йод-5-нитро-1H-индола и циклопропилбороновой кислоты.
МС (ESI, m/z): 201 (M-H)-.
[Справочный пример 102]
[Формула 146]
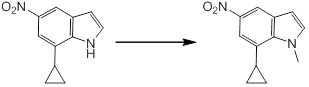
Способом, аналогичным описанному в справочном примере 63, 7-циклопропил-1-метил-5-нитро-1H-индол получали из 7-циклопропил-5-нитро-1H-индола.
МС (ESI, m/z): 217 (M+H)+.
[Справочный пример 103]
[Формула 147]

Способом, аналогичным описанному в справочном примере 64, 7-циклопропил-1-метил-1H-индол-5-амин получали из 7-циклопропил-1-метил-5-нитро-1H-индола.
МС (ESI, m/z): 187 (M+H)+.
[Справочный пример 104]
[Формула 148]

Способом, аналогичным описанному в справочном примере 62, 5-нитро-7-(проп-1-ен-2-ил)-1H-индол получали из 7-йод-5-нитро-1H-индола и пинаколинового эфира изопропенилбороновой кислоты.
МС (ESI, m/z): 201 (M-H)-.
[Справочный пример 105]
[Формула 149]

Способом, аналогичным описанному в справочном примере 63, 1-метил-5-нитро-7-(проп-1-ен-2-ил)-1H-индол получали из 5-нитро-7-(проп-1-ен-2-ил)-1H-индола.
[Справочный пример 106]
[Формула 150]

Способом, аналогичным описанному в справочном примере 64, 7-изопропил-1-метил-1H-индол-5-амин получали из 1-метил-5-нитро-7-(проп-1-ен-2-ил)-1H-индола.
МС (ESI, m/z): 189 (M+H)+.
[Справочный пример 107]
[Формула 151]

Способом, аналогичным описанному в справочном примере 62, 5-нитро-7-винил-1H-индол получали из 7-йод-5-нитро-1H-индола и пинаколинового эфира винилбороновой кислоты.
МС (ESI, m/z): 187 (M-H)-.
[Справочный пример 108]
[Формула 152]
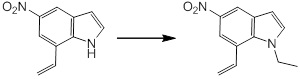
Способом, аналогичным описанному в справочном примере 63, 1-этил-5-нитро-7-винил-1H-индол получали из 5-нитро-7-винил-1H-индола и этилйодида.
[Справочный пример 109]
[Формула 153]

Способом, аналогичным описанному в справочном примере 64, 1,7-диэтил-1H-индол-5-амин получали из 1-этил-5-нитро-7-винил-1H-индола.
МС (ESI, m/z): 189 (M+H)+.
[Справочный пример 110]
[Формула 154]

Смесь 1,51 г 2-хлор-5-циклопропилникотиновой кислоты, 3,62 г ди-трет-бутилдикарбоната, 335 мг 4-(диметиламино)пиридина, 30 мл трет-бутанола и 30 мл дихлорметана нагревали с обратным холодильником в течение 2 часов. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. К полученному остатку добавляли этилацетат и насыщенный водный раствор бикарбоната натрия. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный таким образом остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-20/80) с получением 2,04 г трет-бутил-2-хлор-5-циклопропилникотината в виде бесцветного масла.
МС (ESI, m/z): 254 (M+H)+.
[Справочный пример 111]
[Формула 155]

К раствору 10,0 г 7-бром-5-нитро-1H-индола в 100 мл N,N-диметилформамида при охлаждении на льду добавляли 4,89 г трет-бутоксида калия и перемешивали полученную смесь в течение 10 минут. К смеси добавляли 3,36 мл метилйодида, и перемешивали полученную смесь при комнатной температуре в течение 1 часа. При охлаждении на льду к смеси добавляли воду, а затем перемешивали. Твердое вещество собирали путем фильтрования и промывали водой с получением 10,2 г 7-бром-1-метил-5-нитро-1H-индола в виде желтого твердого вещества.
МС (ESI, m/z): 257 (M+H)+.
[Справочный пример 112]
[Формула 156]

Смесь 3,0 г 7-бром-1-метил-5-нитро-1H-индола, 7,63 г хлорида аммония, 13,1 г железного порошка, 160 мл 2-пропанола и 40 мл воды нагревали с обратным холодильником в течение 45 минут. После охлаждения реакционной смеси до 65°C, к смеси добавляли 3,5 г 7-бром-1-метил-5-нитро-1H-индола, и нагревали полученную смесь с обратным холодильником в течение 15 минут. После охлаждения реакционной смеси до 65°C, к смеси добавляли 3,5 г 7-бром-1-метил-5-нитро-1H-индола, и нагревали полученную смесь с обратным холодильником в течение 3 часов. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали. К смеси добавляли этилацетат, органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-60/40), и проводили перекристаллизацию путем добавления этилацетата и гексана к полученному таким образом остатку с получением 4,21 г 7-бром-1-метил-1H-индол-5-амина в виде бледно-коричневых игольчатых кристаллов.
МС (ESI, m/z): 225, 227 (M+H)+.
[Справочный пример 113]
[Формула 157]

Смесь 100 мг 1-хлор-5-нитроизохинолина и 150 мкл пиперидина в 2,0 мл N,N-диметилформамида перемешивали при 60°C в течение 5 часов. К смеси добавляли воду и этилацетат, органический слой разделяли и дважды промывали водой. Растворитель отгоняли из органического слоя в условиях пониженного давления с получением 111 мг 5-нитро-1-(пиперидин-1-ил)изохинолина в виде оранжевого твердого вещества.
МС (ESI, m/z): 258 (M+H)+.
[Справочный пример 114]
[Формула 158]
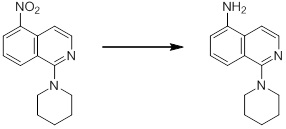
Раствор 100 мг 5-нитро-1-(пиперидин-1-ил)изохинолина в 16 мл метанола и 4 мл тетрагидрофурана подвергали реакции гидрогенизации (комнатная температура, 1 бар, скорость потока: 1 мл/мин, 10% Pd/C) с использованием реактора для гидрогенизации проточного типа. Растворитель отгоняли в условиях пониженного давления с получением 105 мг 1-(пиперидин-1-ил)изохинолин-5-амина в виде желтого твердого вещества.
МС (ESI, m/z): 228 (M+H)+.
[Справочный пример 115]
[Формула 159]
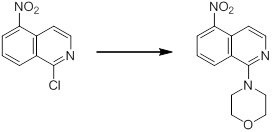
Способом, аналогичным описанному в справочном примере 113, 4-(5-нитроизохинолин-1-ил)морфолин получали из 1-хлор-5-нитроизохинолина и морфолина.
МС (ESI, m/z): 260 (M+H)+.
[Справочный пример 116]
[Формула 160]

Способом, аналогичным описанному в справочном примере 114, 1-морфолиноизохинолин-5-амин получали из 4-(5-нитроизохинолин-1-ил)морфолина.
МС (ESI, m/z): 230 (M+H)+.
[Справочный пример 117]
[Формула 161]

Способом, аналогичным описанному в справочном примере 63, 1-метил-6-нитро-1H-индол получали из 6-нитро-1H-индола.
[Справочный пример 118]
[Формула 162]

Способом, аналогичным описанному в справочном примере 64, 1-метил-1H-индол-6-амин получали из 1-метил-6-нитро-1H-индола.
[Справочный пример 119]
[Формула 163]

Способом, аналогичным описанному в справочном примере 63, 1-этил-6-нитро-1H-индол получали из 6-нитро-1H-индола.
МС (ESI, m/z): 191 (M+H)+.
[Справочный пример 120]
[Формула 164]

Способом, аналогичным описанному в справочном примере 64, 1-этил-1H-индол-6-амин получали из 1-этил-6-нитро-1H-индола.
МС (ESI, m/z): 161 (M+H)+.
[Справочный пример 121]
[Формула 165]
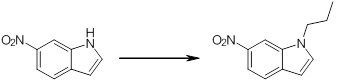
Способом, аналогичным описанному в справочном примере 63, 6-нитро-1-пропил-1H-индол получали из 6-нитро-1H-индола.
МС (ESI, m/z): 205 (M+H)+.
[Справочный пример 122]
[Формула 166]
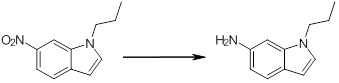
Способом, аналогичным описанному в справочном примере 64, 1-пропил-1H-индол-6-амин получали из 6-нитро-1-пропил-1H-индола.
МС (ESI, m/z): 175 (M+H)+.
[Справочный пример 123]
[Формула 167]

Способом, аналогичным описанному в справочном примере 63, 1-изопропил-6-нитро-1H-индол получали из 6-нитро-1H-индола.
МС (ESI, m/z): 205 (M+H)+.
[Справочный пример 124]
[Формула 168]

Способом, аналогичным описанному в справочном примере 64, 1-изопропил-1H-индол-6-амин получали из 1-изопропил-6-нитро-1H-индола.
МС (ESI, m/z): 175 (M+H)+.
[Справочный пример 125]
[Формула 169]

Способом, аналогичным описанному в справочном примере 63, 1-изобутил-6-нитро-1H-индол получали из 6-нитро-1H-индола.
МС (ESI, m/z): 219 (M+H)+.
[Справочный пример 126]
[Формула 170]

Способом, аналогичным описанному в справочном примере 64, 1-изобутил-1H-индол-6-амин получали из 1-изобутил-6-нитро-1H-индола.
МС (ESI, m/z): 189 (M+H)+.
[Справочный пример 127]
[Формула 171]

Способом, аналогичным описанному в справочном примере 63, 1-(циклогексилметил)-6-нитро-1H-индол получали из 6-нитро-1H-индола.
МС (ESI, m/z): 259 (M+H)+.
[Справочный пример 128]
[Формула 172]

Способом, аналогичным описанному в справочном примере 64, 1-(циклогексилметил)-1H-индол-6-амин получали из 1-(циклогексилметил)-6-нитро-1H-индола.
МС (ESI, m/z): 229 (M+H)+.
[Справочный пример 129]
[Формула 173]

Способом, аналогичным описанному в справочном примере 64, 1H-индол-6-амин получали из 6-нитро-1H-индола.
[Справочный пример 130]
[Формула 174]

Способом, аналогичным описанному в примере 230, 1-фенил-1H-индол-6-амин получали из 1H-индол-6-амина.
МС (ESI, m/z): 209 (M+H)+.
[Справочный пример 131]
[Формула 175]
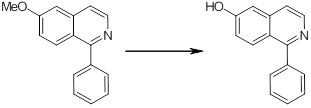
К 321 мг 6-метокси-1-фенилизохинолина добавляли 4 мл 48% бромистоводородной кислоты и нагревали полученную смесь с обратным холодильником в течение 7 часов. После охлаждения реакционной смеси до комнатной температуры, к реакционной смеси добавляли этилацетат и насыщенный водный раствор бикарбоната натрия, и отфильтровывали твердое вещество. Органический слой фильтрата разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли этилацетат, гексан и полученное ранее твердое вещество, и собирали твердое вещество путем фильтрования с получением 329 мг 1-фенилизохинолин-6-ола в виде белого твердого вещества.
МС (ESI, m/z): 222 (M+H)+.
[Справочный пример 132]
[Формула 176]

К смешанному раствору 329 мг 1-фенилизохинолин-6-ола в 5 мл дихлорметана и 0,5 мл триэтиламина при охлаждении на льду добавляли 276 мкл трифторметансульфонового ангидрида и перемешивали полученную смесь в течение 1 часа. Реакционную смесь очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 80/20-40/60) с получением 382 мг 1-фенилизохинолин-6-илтрифторметансульфоната в виде коричневого масла.
МС (ESI, m/z): 354 (M+H)+.
[Справочный пример 133]
[Формула 177]

Способом, аналогичным описанному в справочном примере 132, 4-фенилхиназолин-7-илтрифторметансульфонат получали из 4-фенилхиназолин-7-ола.
МС (ESI, m/z): 355 (M+H)+.
[Справочный пример 134]
[Формула 178]

Смесь 270 мг 8-метокси-4-фенилхиназолина, 4 мл дихлорметана и 472 мг хлорида алюминия перемешивали при 100°C в течение 20 минут с использованием микроволновой установки. После охлаждения реакционной смеси до комнатной температуры, к ней добавляли лед, насыщенный водный раствор бикарбоната натрия и этилацетат. После удаления твердого вещества путем фильтрования через целит, органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 80/20-50/50), к полученному таким образом остатку добавляли этилацетат и гексан, и собирали твердое вещество путем фильтрования с получением 92 мг 4-фенилхиназолин-8-ола в виде белого твердого вещества.
МС (ESI, m/z): 221 (M-H)-.
[Справочный пример 135]
[Формула 179]

Способом, аналогичным описанному в справочном примере 132, 4-фенилхиназолин-8-илтрифторметансульфонат получали из 4-фенилхиназолин-8-ола.
МС (ESI, m/z): 355 (M+H)+.
[Справочный пример 136]
[Формула 180]

Способом, аналогичным описанному в справочном примере 134, 4-фенилхиназолин-6-ол получали из 6-метокси-4-фенилхиназолина.
МС (ESI, m/z): 223 (M+H)+.
[Справочный пример 137]
[Формула 181]

Способом, аналогичным описанному в справочном примере 132, 4-фенилхиназолин-6-илтрифторметансульфонат получали из 4-фенилхиназолин-6-ола.
МС (ESI, m/z): 355 (M+H)+.
[Справочный пример 138]
[Формула 182]

Способом, аналогичным описанному в справочном примере 63, 3-йод-1-изобутил-5-нитро-1H-индол получали из 3-йод-5-нитро-1H-индола.
МС (ESI, m/z): 344 (M+H)+.
[Справочный пример 139]
[Формула 183]

Способом, аналогичным описанному в справочном примере 62, 1-изобутил-3-метил-5-нитро-1H-индол получали из 3-йод-1-изобутил-5-нитро-1H-индола.
МС (ESI, m/z): 233 (M+H)+.
[Справочный пример 140]
[Формула 184]

Способом, аналогичным описанному в справочном примере 64, 1-изобутил-3-метил-1H-индол-5-амин получали из 1-изобутил-3-метил-5-нитро-1H-индола.
МС (ESI, m/z): 203 (M+H)+.
[Справочный пример 141]
[Формула 185]

К раствору 700 мг 5-нитро-1H-индазола в 10 мл N,N-диметилацетамида при охлаждении на льду добавляли 578 мг трет-бутоксида калия и перемешивали полученную смесь в течение 5 минут. К реакционной смеси при охлаждении на льду добавляли 0,93 мл 1-бром-2-метилпропана, и перемешивали полученную смесь в течение 3 часов и 20 минут, а затем перемешивали при 50-60°C в течение 3 часов и 50 минут. Реакционную смесь оставляли отстаиваться в течение ночи, затем к смеси добавляли 240 мг трет-бутоксида калия и 310 мкл 1-бром-2-метилпропана, и перемешивали полученную смесь при 50°C в течение 1 часа и 40 минут. После добавления к реакционной смеси этилацетата и воды, органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-80/20) с получением 495 мг 1-изобутил-5-нитро-1H-индазола в виде оранжевого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,86 (6H, д, J=6,6 Гц), 2,24 (1H, с, J=6,6 Гц), 4,32 (2H, д, J=7,3 Гц), 7,93 (1H, д, J=9,9 Гц), 8,22 (1H, дд, J=9,2, 2,6 Гц), 8,42 (1H, с), 8,84 (1H, д, J=2,0 Гц).
МС (ESI, m/z): 220 (M+H)+.
[Справочный пример 142]
[Формула 186]
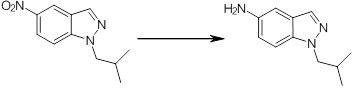
Смесь 485 мг 1-изобутил-5-нитро-1H-индазола, 83 мг хлорида аммония, 432 мг железного порошка, 35 мл этанола и 10 мл воды нагревали с обратным холодильником в течение 4 часов и 20 минут. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали. Осадок на фильтре промывали метанолом, смывы и фильтрат объединяли, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли воду, и собирали твердое вещество путем фильтрования с получением 332 мг 1-изобутил-1H-индазол-5-амина в виде бледно-красного твердого вещества.
МС (ESI, m/z): 190 (M+H)+.
[Справочный пример 143]
[Формула 187]

Способом, аналогичным описанному в справочном примере 141, 1-(циклогексилметил)-5-нитро-1H-индазол получали из 5-нитро-1H-индазола.
1H-ЯМР (ДМСО-d6) δ: 0,94-1,22 (5H, м), 1,42-1,51 (2H, м), 1,55-1,70 (3H, м), 1,83-1,99 (1H, м), 4,34 (2H, д, J=7,3 Гц), 7,92 (1H, д, J=9,9 Гц), 8,21 (1H, дд, J=9,2, 2,0 Гц), 8,41 (1H, с), 8,83 (1H, д, J=2,0 Гц).
МС (ESI, m/z): 260 (M+H)+.
[Справочный пример 144]
[Формула 188]

Способом, аналогичным описанному в справочном примере 142, 1-(циклогексилметил)-1H-индазол-5-амин получали из 1-(циклогексилметил)-5-нитро-1H-индазола.
МС (ESI, m/z): 230 (M+H)+.
[Справочный пример 145]
[Формула 189]

Способом, аналогичным описанному в справочном примере 141, 1-бензил-5-нитро-1H-пирроло(2,3-b)пиридин получали из 5-нитро-1H-пирроло(2,3-b)пиридина.
МС (ESI, m/z): 254 (M+H)+.
[Справочный пример 146]
[Формула 190]

Способом, аналогичным описанному в справочном примере 142, 1-бензил-1H-пирроло(2,3-b)пиридин-5-амин получали из 1-бензил-5-нитро-1H-пирроло(2,3-b)пиридина.
1H-ЯМР (ДМСО-d6) δ: 4,72 (2H, с), 5,35 (2H, с), 6,21 (1H, д, J=3,3 Гц), 7,10 (1H, д, J=2,6 Гц), 7,15-7,32 (5H, м), 7,39 (1H, д, J=3,3 Гц), 7,74 (1H, д, J=2,6 Гц).
МС (ESI, m/z): 224 (M+H)+.
[Справочный пример 147]
[Формула 191]

Способом, аналогичным описанному в справочном примере 141, 1-изобутил-5-нитро-1H-пирроло(2,3-b)пиридин получали из 5-нитро-1H-пирроло(2,3-b)пиридина.
МС (ESI, m/z): 220 (M+H)+.
[Справочный пример 148]
[Формула 192]

Способом, аналогичным описанному в справочном примере 142, 1-изобутил-1H-пирроло(2,3-b)пиридин-5-амин получали из 1-изобутил-5-нитро-1H-пирроло(2,3-b)пиридина.
МС (ESI, m/z): 190 (M+H)+.
[Справочный пример 149]
[Формула 193]
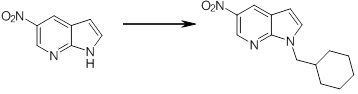
Способом, аналогичным описанному в справочном примере 141, 1-(циклогексилметил)-5-нитро-1H-пирроло(2,3-b)пиридин получали из 5-нитро-1H-пирроло(2,3-b)пиридина и (бромметил)циклогексана.
МС (ESI, m/z): 260 (M+H)+.
[Справочный пример 150]
[Формула 194]

Способом, аналогичным описанному в справочном примере 142, 1-(циклогексилметил)-1H-пирроло(2,3-b)пиридин-5-амин получали из 1-(циклогексилметил)-5-нитро-1H-пирроло(2,3-b)пиридина.
МС (ESI, m/z): 230 (M+H)+.
[Справочный пример 151]
[Формула 195]

К раствору 200 мг 6-фтор-5-нитро-1H-индол-2,3-диона в 4 мл тетрагидрофурана при охлаждении на льду и в атмосфере азота по каплям добавляли 2,2 мл 1,1 M борана в тетрагидрофуране, и перемешивали полученную смесь при комнатной температуре в течение 1 часа и 30 минут а затем перемешивали при 50°C в течение 15 минут. После охлаждения реакционной смеси до комнатной температуры, к ней по каплям добавляли воду и 1 мл 1 M соляной кислоты, и отгоняли растворитель в условиях пониженного давления. После добавления этилацетата и воды, органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления с получением 172 мг 6-фтор-5-нитро-1H-индола в виде желто-коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 6,71 (1H, с), 7,47 (1H, д, J=11,9 Гц), 7,60 (1H, с), 8,48 (1H, д, J=7,3 Гц), 11,82 (1H, с).
МС (ESI, m/z): 179 (M-H)-.
[Справочный пример 152]
[Формула 196]

Способом, аналогичным описанному в справочном примере 141, 1-бензил-6-фтор-5-нитро-1H-индол получали из 6-фтор-5-нитро-1H-индола.
1H-ЯМР (ДМСО-d6) δ: 5,49 (2H, с), 6,78 (1H, д, J=3,3 Гц), 7,23-7,38 (5H, м), 7,73-7,80 (2H, м), 8,49 (1H, д, J=7,9 Гц).
МС (ESI, m/z): 271 (M+H)+.
[Справочный пример 153]
[Формула 197]

Способом, аналогичным описанному в справочном примере 142, 1-бензил-6-фтор-1H-индол-5-амин получали из 1-бензил-6-фтор-5-нитро-1H-индола.
МС (ESI, m/z): 241 (M+H)+.
[Справочный пример 154]
[Формула 198]
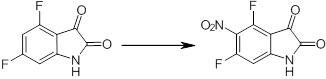
К раствору 250 мг 4,6-дифтор-1H-индол-2,3-диона в 3 мл серной кислоты при -20°C по каплям добавляли 109 мкл 60% азотной кислоты и перемешивали полученную смесь в течение 15 минут. К реакционной смеси по каплям добавляли воду, а затем добавляли этилацетат. Органический слой разделяли, последовательно промывали насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат) с получением 180 мг 4,6-дифтор-5-нитро-1H-индол-2,3-диона в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 6,95 (1H, д, J=10,6 Гц), 11,95 (1H, с).
МС (ESI, m/z): 227 (M-H)-.
[Справочный пример 155]
[Формула 199]

Способом, аналогичным описанному в справочном примере 151, 4,6-дифтор-5-нитро-1H-индол получали из 4,6-дифтор-5-нитро-1H-индол-2,3-диона.
1H-ЯМР (ДМСО-d6) δ: 6,74-6,78 (1H, м), 7,42 (1H, д, J=11,1 Гц), 7,61-7,64 (1H, м), 12,08 (1H, уш.с).
МС (ESI, m/z): 197 (M-H)-.
[Справочный пример 156]
[Формула 200]

Способом, аналогичным описанному в справочном примере 141, 1-бензил-4,6-дифтор-5-нитро-1H-индол получали из 4,6-дифтор-5-нитро-1H-индола и бензилбромида.
МС (ESI, m/z): 291 (M+H)+.
[Справочный пример 157]
[Формула 201]
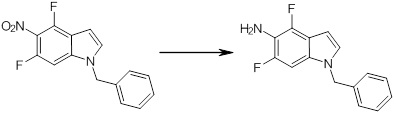
Способом, аналогичным описанному в справочном примере 142, 1-бензил-4,6-дифтор-1H-индол-5-амин получали из 1-бензил-4,6-дифтор-5-нитро-1H-индола.
МС (ESI, m/z): 259 (M+H)+.
[Справочный пример 158]
[Формула 202]

Способом, аналогичным описанному в справочном примере 141, 3-изобутил-6-нитро-1,3-бензотиазол-2(3H)-он получали из 6-нитро-1,3-бензотиазол-2(3H)-она и 1-бром-2-метилпропана.
МС (ESI, m/z): 253 (M+H)+.
[Справочный пример 159]
[Формула 203]
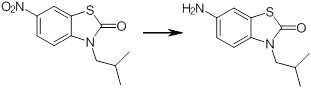
Способом, аналогичным описанному в справочном примере 142, 6-амино-3-изобутил-1,3-бензотиазол-2(3H)-он получали из 3-изобутил-6-нитро-1,3-бензотиазол-2(3H)-она.
[Справочный пример 160]
[Формула 204]

Способом, аналогичным описанному в справочном примере 141, 3-(циклогексилметил)-6-нитро-1,3-бензотиазол-2(3H)-он получали из 6-нитро-1,3-бензотиазол-2(3H)-она.
МС (ESI, m/z): 293 (M+H)+.
[Справочный пример 161]
[Формула 205]

Способом, аналогичным описанному в справочном примере 142, 6-амино-3-(циклогексилметил)-1,3-бензотиазол-2(3H)-он получали из 3-(циклогексилметил)-6-нитро-1,3-бензотиазол-2(3H)-она.
МС (ESI, m/z): 263 (M+H)+.
[Справочный пример 162]
[Формула 206]

Способом, аналогичным описанному в справочном примере 154, 4-метил-5-нитро-1H-индол-2,3-дион получали из 4-метил-1H-индол-2,3-диона.
1H-ЯМР (ДМСО-d6) δ: 2,72 (3H, с), 6,91 (1H, д, J=8,6 Гц), 8,25 (1H, д, J=8,6 Гц), 11,55 (1H, уш.с).
[Справочный пример 163]
[Формула 207]
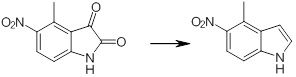
Способом, аналогичным описанному в справочном примере 151, 4-метил-5-нитро-1H-индол получали из 4-метил-5-нитро-1H-индол-2,3-диона.
1H-ЯМР (ДМСО-d6) δ: 2,76 (3H, с), 6,78-6,82 (1H, м), 7,39 (1H, д, J=9,2 Гц), 7,54-7,59 (1H, м), 7,81 (1H, д, J=8,6 Гц), 11,73 (1H, уш.с).
МС (ESI, m/z): 175 (M-H)-.
[Справочный пример 164]
[Формула 208]

Способом, аналогичным описанному в справочном примере 141, 1-бензил-4-метил-5-нитро-1H-индол получали из 4-метил-5-нитро-1H-индола.
МС (ESI, m/z): 267 (M+H)+.
[Справочный пример 165]
[Формула 209]

Способом, аналогичным описанному в справочном примере 142, 1-бензил-4-метил-1H-индол-5-амин получали из 1-бензил-4-метил-5-нитро-1H-индола.
МС (ESI, m/z): 237 (M+H)+.
[Справочный пример 166]
[Формула 210]
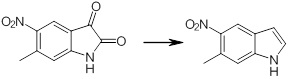
Способом, аналогичным описанному в справочном примере 151, 6-метил-5-нитро-1H-индол получали из 6-метил-5-нитро-1H-индол-2,3-диона.
1H-ЯМР (ДМСО-d6) δ: 2,62 (3H, с), 6,61-6,65 (1H, м), 7,39 (1H, с), 7,50-7,54 (1H, м), 8,37 (1H, с), 11,59 (1H, уш.с).
МС (ESI, m/z): 175 (M-H)-.
[Справочный пример 167]
[Формула 211]
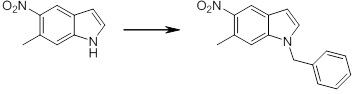
Способом, аналогичным описанному в справочном примере 141, 1-бензил-6-метил-5-нитро-1H-индол получали из 6-метил-5-нитро-1H-индола.
МС (ESI, m/z): 267 (M+H)+.
[Справочный пример 168]
[Формула 212]

Способом, аналогичным описанному в справочном примере 142, 1-бензил-6-метил-1H-индол-5-амин получали из 1-бензил-6-метил-5-нитро-1H-индола.
МС (ESI, m/z): 237 (M+H)+.
[Справочный пример 169]
[Формула 213]

К раствору 1,0 г 7-бром-5-нитро-1H-индола в 10 мл N,N-диметилформамида при охлаждении на льду добавляли 0,48 г трет-бутоксида калия и перемешивали полученную смесь в течение 5 минут. К смеси добавляли 0,43 мл этилйодида, и перемешивали полученную смесь при комнатной температуре в течение 1 часа и 5 минут. При охлаждении на льду к смеси добавляли 0,046 г трет-бутоксида калия и 0,066 мл этилйодида, и перемешивали полученную смесь при комнатной температуре в течение 20 минут. При охлаждении на льду к смеси добавляли воду и этилацетат, органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-85/15) с получением 0,52 г 7-бром-1-этил-5-нитро-1H-индола в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,51 (3H, т, J=7,2 Гц), 4,65 (2H, кв., J=7,2 Гц), 6,71 (1H, д, J=3,4 Гц), 7,25 (1H, д, J=3,2 Гц), 8,30 (1H, д, J=2,2 Гц), 8,50 (1H, д, J=2,2 Гц).
[Справочный пример 170]
[Формула 214]
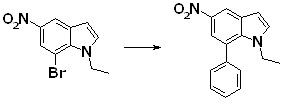
Смесь 0,26 г 7-бром-1-этил-5-нитро-1H-индола, 0,18 г фенилбороновой кислоты, 0,41 г ортофосфата калия, 0,068 г бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлорпалладия(II), 7,5 мл диоксана и 2 мл воды нагревали с обратным холодильником в течение 1 часа и 10 минут в атмосфере азота. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и добавляли к фильтрату этилацетат и воду. Органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-90/10) с получением 0,24 г 1-этил-5-нитро-7-фенил-1H-индола в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,91 (3H, т, J=7,1 Гц), 3,76 (2H, кв., J=7,1 Гц), 6,89 (1H, д, J=3,4 Гц), 7,50-7,55 (5H, м), 7,66 (1H, д, J=3,2 Гц), 7,72 (1H, д, J=2,4 Гц), 8,61 (1H, д, J=2,4 Гц).
[Справочный пример 171]
[Формула 215]

К раствору 0,23 г 1-этил-5-нитро-7-фенил-1H-индола в 15 мл метанола добавляли 0,05 г 10% Pd/C и перемешивали полученную смесь при комнатной температуре в течение 1 часа и 15 минут в атмосфере водорода. Нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли 15 мл метанола и 0,05 г 10% Pd/C и перемешивали полученную смесь при комнатной температуре в течение 1 часа в атмосфере водорода. Нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный таким образом остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-60/40) с получением 0,12 г 1-этил-7-фенил-1H-индол-5-амина в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,79 (3H, т, J=7,1 Гц), 3,58 (2H, кв., J=7,1 Гц), 4,55 (2H, с), 6,22 (1H, д, J=3,2 Гц), 6,30 (1H, д, J=2,2 Гц), 6,69 (1H, д, J=2,2 Гц), 7,12 (1H, д, J=2,9 Гц), 7,36-7,48 (5H, м).
МС (ESI, m/z): 237 (M+H)+.
[Справочный пример 172]
[Формула 216]

Способом, аналогичным описанному в справочном примере 170, 1-этил-7-((1E)-3-метоксипроп-1-ен-1-ил)-5-нитро-1H-индол получали из 7-бром-1-этил-5-нитро-1H-индола и (E)-2-(3-метоксипроп-1-енил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана.
1H-ЯМР (ДМСО-d6) δ: 1,37 (3H, т, J=7,1 Гц), 3,36 (3H, с), 4,16 (2H, дд, J=5,4, 1,7 Гц), 4,42 (2H, кв., J=7,3 Гц), 6,31 (1H, дт, J=15,4, 5,4 Гц), 6,78 (1H, д, J=3,2 Гц), 7,31 (1H, д, J=15,6 Гц), 7,63 (1H, д, J=3,2 Гц), 7,90 (1H, д, J=2,2 Гц), 8,49 (1H, д, J=2,4 Гц).
[Справочный пример 173]
[Формула 217]

Способом, аналогичным описанному в справочном примере 171, 1-этил-7-(3-метоксипропил)-1H-индол-5-амин получали из 1-этил-7-((1E)-3-метоксипроп-1-ен-1-ил)-5-нитро-1H-индола.
1H-ЯМР (ДМСО-d6) δ: 1,25 (3H, т, J=7,1 Гц), 1,75-1,86 (2H, м), 2,80-2,88 (2H, м), 3,26 (3H, с), 3,36-3,42 (2H, м), 4,19 (2H, кв., J=7,1 Гц), 4,41 (2H, с), 6,11 (1H, д, J=2,9 Гц), 6,30 (1H, д, J=2,2 Гц), 6,51 (1H, д, J=2,2 Гц), 7,08 (1H, д, J=3,2 Гц).
МС (ESI, m/z): 233 (M+H)+.
[Справочный пример 174]
[Формула 218]
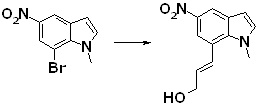
Смесь 0,5 г 7-бром-1-метил-5-нитро-1H-индола, 0,77 мл ((1E)-3-((трет-бутил(диметил)силил)окси)проп-1-ен-1-ил)бороновой кислоты, 0,83 г ортофосфата калия, 0,14 г бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлорпалладия(II), 15 мл диоксана и 4 мл воды нагревали с обратным холодильником в течение 1 часа и 15 минут в атмосфере азота. Затем к ней добавляли 0,1 мл ((1E)-3-((трет-бутил(диметил)силил)окси)проп-1-ен-1-ил)бороновой кислоты и нагревали полученную смесь с обратным холодильником в течение 1 часа и 20 минут. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и добавляли к фильтрату воду и этилацетат. Органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-90/10). К полученному таким образом остатку добавляли 15 мл метанола и 2 мл 6 M соляной кислоты и перемешивали полученную смесь при комнатной температуре в течение 10 минут. Реакционную смесь корректировали до pH 6,5 добавлением к ней 2 M водного раствора гидроксида натрия. Добавляли этилацетат, органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления с получением 0,45 г (2E)-3-(1-метил-5-нитро-1H-индол-7-ил)проп-2-ен-1-ола в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 4,06 (3H, с), 4,17-4,24 (2H, м), 5,01 (1H, т, J=5,6 Гц), 6,32 (1H, дт, J=15,4, 4,6 Гц), 6,73 (1H, д, J=3,2 Гц), 7,39 (1H, д, J=15,6 Гц), 7,53 (1H, д, J=3,4 Гц), 7,90 (1H, д, J=2,3 Гц), 8,46 (1H, д, J=2,2 Гц).
[Справочный пример 175]
[Формула 219]

К раствору 0,15 г (2E)-3-(1-метил-5-нитро-1H-индол-7-ил)проп-2-ен-1-ола в 1,5 мл N,N-диметилформамида при охлаждении на льду добавляли 0,039 г 60% гидрида натрия и перемешивали полученную смесь в течение 30 минут в атмосфере азота. К смеси добавляли 0,11 мл этилйодида, и перемешивали полученную смесь при комнатной температуре в течение 35 минут. При охлаждении на льду к смеси добавляли 0,053 мл этилйодида, и перемешивали полученную смесь при комнатной температуре в течение 15 минут. При охлаждении на льду к смеси добавляли лед и воду, и собирали твердое вещество путем фильтрования с получением 0,15 г 7-((1E)-3-этоксипроп-1-ен-1-ил)-1-метил-5-нитро-1H-индола в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,18 (3H, т, J=7,1 Гц), 3,54 (2H, кв., J=6,8 Гц), 4,05 (3H, с), 4,18 (2H, дд, J=5,6, 1,7 Гц), 6,29 (1H, дт, J=15,6, 5,4 Гц), 6,74 (1H, д, J=3,2 Гц), 7,45 (1H, д, J=15,6 Гц), 7,54 (1H, д, J=3,4 Гц), 7,92 (1H, д, J=2,2 Гц), 8,47 (1H, д, J=2,2 Гц).
[Справочный пример 176]
[Формула 220]

Способом, аналогичным описанному в справочном примере 171, 7-(3-этоксипропил)-1-метил-1H-индол-5-амин получали из 7-((1E)-3-этоксипроп-1-ен-1-ил)-1-метил-5-нитро-1H-индола.
1H-ЯМР (ДМСО-d6) δ: 1,13 (3H, т, J=7,1 Гц), 1,80-1,92 (2H, м), 2,94-3,01 (2H, м), 3,36-3,53 (4H, м), 3,87 (3H, с), 4,45-4,50 (2H, м), 6,05 (1H, д, J=3,2 Гц), 6,29 (1H, д, J=2,0 Гц), 6,49 (1H, д, J=2,2 Гц), 6,98 (1H, д, J=3,2 Гц).
МС (ESI, m/z): 233 (M+H)+.
[Справочный пример 177]
[Формула 221]

Способом, аналогичным описанному в справочном примере 170, 7-(циклогекс-1-ен-1-ил)-1-метил-5-нитро-1H-индол получали из 7-бром-1-метил-5-нитро-1H-индола и 2-(циклогекс-1-ен-1-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана.
1H-ЯМР (ДМСО-d6) δ: 1,65-1,84 (4H, м), 2,16-2,26 (2H, м), 2,29-2,37 (2H, м), 3,88 (3H, с), 5,73-5,78 (1H, м), 6,76 (1H, д, J=3,2 Гц), 7,55 (1H, д, J=3,2 Гц), 7,64 (1H, д, J=2,2 Гц), 8,46 (1H, д, J=2,4 Гц).
[Справочный пример 178]
[Формула 222]
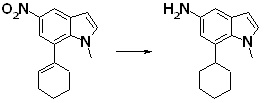
К смеси 0,343 г 7-(циклогекс-1-ен-1-ил)-1-метил-5-нитро-1H-индола, 1,5 мл уксусной кислоты и 15 мл метанола добавляли 0,17 г 10% гидроксида палладия на угле, и перемешивали полученную смесь при 55°C в течение 7 часов в атмосфере водорода. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли 1,5 мл уксусной кислоты, 10 мл метанола и 0,17 г 10% гидроксида палладия на угле и перемешивали полученную смесь при 55°C в течение 3 часов в атмосфере водорода. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. К полученному таким образом остатку добавляли 2,0 мл уксусной кислоты, 10 мл метанола и 0,17 г 10% гидроксида палладия на угле и перемешивали полученную смесь при 55°C в течение 4 часов и 15 минут в атмосфере водорода. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли насыщенный водный раствор бикарбоната натрия и этилацетат, органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный таким образом остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-60/40) с получением 0,046 г 7-циклогексил-1-метил-1H-индол-5-амина в виде желтого масла.
1H-ЯМР (ДМСО-d6) δ: 1,38-1,53 (5H, м), 1,71-1,91 (6H, м), 3,88 (3H, с), 4,34-4,44 (2H, м), 6,05 (1H, д, J=2,9 Гц), 6,41 (1H, д, J=2,2 Гц), 6,47 (1H, д, J=2,0 Гц), 6,97 (1H, д, J=2,9 Гц).
МС (ESI, m/z): 229 (M+H)+.
[Справочный пример 179]
[Формула 223]

К раствору 0,30 г 7-бром-5-нитро-1H-индола в 3 мл N,N-диметилформамида при охлаждении на льду добавляли 0,18 г трет-бутоксида калия и перемешивали полученную смесь в течение 5 минут. К смеси добавляли 0,16 мл 1-йод-2-метилпропана, и перемешивали полученную смесь при комнатной температуре в течение 1 часа. К смеси добавляли 0,18 г трет-бутоксида калия и 0,16 мл 1-йод-2-метилпропана, и перемешивали полученную смесь при комнатной температуре в течение 1 часа и 10 минут. К смеси добавляли 0,18 г трет-бутоксида калия и 0,16 мл 1-йод-2-метилпропана, и перемешивали полученную смесь при 60°C в течение 1 часа и 20 минут. К смеси добавляли 0,36 г трет-бутоксида калия и 0,31 мл 1-йод-2-метилпропана, и перемешивали полученную смесь при 60°C в течение 2 часов. К смеси добавляли 0,18 г трет-бутоксида калия и 0,16 мл 1-йод-2-метилпропана, и перемешивали полученную смесь при 90°C в течение 1 часа. К смеси добавляли 0,18 г трет-бутоксида калия и 0,16 мл 1-йод-2-метилпропана, и перемешивали полученную смесь при 90°C в течение 1 часа. К смеси добавляли 0,18 г трет-бутоксида калия и 0,16 мл 1-йод-2-метилпропана, и перемешивали полученную смесь при 90°C в течение 4 часов. К реакционной смеси при охлаждении на льду добавляли воду, этилацетат и 2 M соляную кислоту, органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-85/15) с получением 0,24 г 7-бром-1-(2-метилпропил)-5-нитро-1H-индола в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,86 (6H, д, J=6,8 Гц), 2,14 (1H, с, J=6,8 Гц), 4,39 (2H, д, J=7,6 Гц), 6,86 (1H, д, J=3,2 Гц), 7,71 (1H, д, J=3,2 Гц), 8,17 (1H, д, J=2,2 Гц), 8,61 (1H, д, J=2,2 Гц).
[Справочный пример 180]
[Формула 224]

Смесь 0,24 г 7-бром-1-(2-метилпропил)-5-нитро-1H-индола, 0,34 мл (E)-2-(3-метоксипроп-1-енил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана, 0,35 г ортофосфата калия, 0,057 г бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлорпалладия(II), 2 мл диоксана и 0,5 мл воды нагревали с обратным холодильником в течение 3 часов и 10 минут в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-85/15) с получением 0,17 г 7-((1E)-3-метоксипроп-1-ен-1-ил)-1-(2-метилпропил)-5-нитро-1H-индола в виде коричневого масла.
1H-ЯМР (ДМСО-d6) δ: 0,84 (6H, д, J=6,6 Гц), 1,94-2,06 (1H, м), 3,36 (3H, с), 4,15 (2H, дд, J=5,1, 1,4 Гц), 4,18 (2H, д, J=7,3 Гц), 6,31 (1H, дт, J=15,6, 5,1 Гц), 6,76 (1H, д, J=3,2 Гц), 7,29 (1H, д, J=15,4 Гц), 7,58 (1H, д, J=3,4 Гц), 7,91 (1H, д, J=2,2 Гц), 8,49 (1H, д, J=2,2 Гц).
[Справочный пример 181]
[Формула 225]

К раствору 0,17 г 7-((1E)-3-метоксипроп-1-ен-1-ил)-1-(2-метилпропил)-5-нитро-1H-индола в 10 мл метанола добавляли 0,085 г 10% Pd/C и перемешивали полученную смесь при 50°C в течение 3 часов в атмосфере водорода. Нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления с получением 0,14 г 7-(3-метоксипропил)-1-(2-метилпропил)-1H-индол-5-амина в виде коричневого масла.
1H-ЯМР (ДМСО-d6) δ: 0,80 (6H, д, J=6,6 Гц), 1,72-1,82 (2H, м), 1,89 (1H, с, J=6,6 Гц), 2,77-2,85 (2H, м), 3,27 (3H, с), 3,37-3,42 (2H, м), 3,92 (2H, д, J=7,3 Гц), 4,40 (2H, с), 6,07 (1H, д, J=2,9 Гц), 6,30 (1H, д, J=2,2 Гц), 6,51 (1H, д, J=1,9 Гц), 7,04 (1H, д, J=3,2 Гц).
МС (ESI, m/z): 261 (M+H)+.
[Справочный пример 182]
[Формула 226]
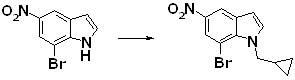
Способом, аналогичным описанному в справочном примере 179, 7-бром-1-(циклопропилметил)-5-нитро-1H-индол получали из 7-бром-5-нитро-1H-индола и (бромметил)циклопропана.
1H-ЯМР (ДМСО-d6) δ: 0,40-0,54 (4H, м), 1,28-1,40 (1H, м), 4,49 (2H, д, J=7,1 Гц), 6,87 (1H, д, J=3,2 Гц), 7,77 (1H, д, J=3,2 Гц), 8,17 (1H, д, J=2,2 Гц), 8,60 (1H, д, J=2,2 Гц).
[Справочный пример 183]
[Формула 227]

Способом, аналогичным описанному в справочном примере 180, 1-(циклопропилметил)-7-((1E)-3-метоксипроп-1-ен-1-ил)-5-нитро-1H-индол получали из 7-бром-1-(циклопропилметил)-5-нитро-1H-индола.
1H-ЯМР (ДМСО-d6) δ: 0,35-0,41 (2H, м), 0,48-0,54 (2H, м), 1,18-1,28 (1H, м), 3,36 (3H, с), 4,16 (2H, дд, J=5,4, 1,7 Гц), 4,27 (2H, д, J=6,8 Гц), 6,31 (1H, дт, J=15,4, 5,4 Гц), 6,78 (1H, д, J=3,2 Гц), 7,38 (1H, д, J=15,6 Гц), 7,66 (1H, д, J=3,4 Гц), 7,91 (1H, д, J=2,2 Гц), 8,50 (1H, д, J=2,2 Гц).
[Справочный пример 184]
[Формула 228]

Способом, аналогичным описанному в справочном примере 181, 1-(циклопропилметил)-7-(3-метоксипропил)-1H-индол-5-амин получали из 1-(циклопропилметил)-7-((1E)-3-метоксипроп-1-ен-1-ил)-5-нитро-1H-индола.
1H-ЯМР (ДМСО-d6) δ: 0,25-0,32 (2H, м), 0,41-0,50 (2H, м), 1,09-1,18 (1H, м), 1,76-1,86 (2H, м), 2,86-2,94 (2H, м), 3,27 (3H, с), 3,36-3,42 (2H, м), 4,05 (2H, д, J=6,6 Гц), 4,43 (2H, с), 6,10 (1H, д, J=3,2 Гц), 6,30 (1H, д, J=2,0 Гц), 6,51 (1H, д, J=2,0 Гц), 7,13 (1H, д, J=2,9 Гц).
МС (ESI, m/z): 259 (M+H)+.
[Справочный пример 185]
[Формула 229]

Способом, аналогичным описанному в справочном примере 179, 7-бром-5-нитро-1-пентил-1H-индол получали из 7-бром-5-нитро-1H-индола и 1-бромпентана.
1H-ЯМР (ДМСО-d6) δ: 0,82-0,89 (3H, м), 1,20-1,37 (4H, м), 1,73-1,85 (2H, м), 4,53-4,61 (2H, м), 6,85 (1H, д, J=3,2 Гц), 7,73 (1H, д, J=3,2 Гц), 8,16 (1H, д, J=2,2 Гц), 8,60 (1H, д, J=2,2 Гц).
[Справочный пример 186]
[Формула 230]

Способом, аналогичным описанному в справочном примере 180, 7-((1E)-3-метоксипроп-1-ен-1-ил)-5-нитро-1-пентил-1H-индол получали из 7-бром-5-нитро-1-пентил-1H-индола.
1H-ЯМР (ДМСО-d6) δ: 0,82-0,88 (3H, м), 1,21-1,34 (4H, м), 1,68-1,78 (2H, м), 3,36 (3H, с), 4,15 (2H, дд, J=5,4, 1,7 Гц), 4,35 (2H, т, J=7,3 Гц), 6,31 (1H, дт, J=15,6, 5,1 Гц), 6,76 (1H, д, J=3,4 Гц), 7,29 (1H, д, J=15,6 Гц), 7,61 (1H, д, J=3,2 Гц), 7,90 (1H, д, J=2,2 Гц), 8,48 (1H, д, J=2,4 Гц).
[Справочный пример 187]
[Формула 231]

Способом, аналогичным описанному в справочном примере 181, 7-(3-метоксипропил)-1-пентил-1H-индол-5-амин получали из 7-((1E)-3-метоксипроп-1-ен-1-ил)-5-нитро-1-пентил-1H-индола.
1H-ЯМР (ДМСО-d6) δ: 0,85 (3H, т, J=6,8 Гц), 1,16-1,33 (4H, м), 1,57-1,66 (2H, м), 1,74-1,84 (2H, м), 2,78-2,87 (2H, м), 3,27 (3H, с), 3,39 (2H, т, J=6,4 Гц), 4,12 (2H, т, J=7,1 Гц), 4,33-4,44 (2H, м), 6,08 (1H, д, J=3,2 Гц), 6,29 (1H, д, J=2,2 Гц), 6,50 (1H, д, J=2,2 Гц), 7,06 (1H, д, J=3,2 Гц),
МС (ESI, m/z): 275 (M+H)+.
[Справочный пример 188]
[Формула 232]

Смесь 5,9 мл триэтилсилана, 3,0 г трихлоруксусной кислоты и 10 мл толуола перемешивали при 75°C в течение 35 минут. К реакционной смеси по каплям добавляли смесь 2,0 г 5-нитро-1H-индола, 1,4 мл циклогексанона и 10 мл толуола, и перемешивали полученную смесь при 75°C в течение 4 часов и 20 минут. Реакционную смесь охлаждали до комнатной температуры, а затем к смеси при охлаждении на льду добавляли насыщенный водный раствор бикарбоната натрия и этилацетат. Органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-80/20) с получением 0,87 г 3-циклогексил-5-нитро-1H-индола в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,20-1,34 (1H, м), 1,38-1,54 (4H, м), 1,70-1,86 (3H, м), 1,94-2,03 (2H, м), 2,82-2,93 (1H, м), 7,36 (1H, д, J=2,2 Гц), 7,50 (1H, д, J=9,0 Гц), 7,97 (1H, дд, J=8,9, 2,3 Гц), 8,52 (1H, д, J=2,2 Гц), 11,56 (1H, уш.с).
МС (ESI, m/z): 243 (M-H)-.
[Справочный пример 189]
[Формула 233]
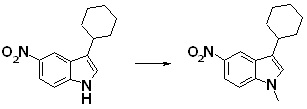
К раствору 0,91 г 3-циклогексил-5-нитро-1H-индола в 4,6 мл N,N-диметилформамида при охлаждении на льду добавляли 0,50 г трет-бутоксида калия и перемешивали полученную смесь в течение 2 минут. К смеси добавляли 0,28 мл метилйодида, и перемешивали полученную смесь при комнатной температуре в течение 1 часа. К смеси добавляли 0,503 г трет-бутоксида калия и 0,28 мл метилйодида, и перемешивали полученную смесь при комнатной температуре в течение 50 минут. К смеси добавляли 0,101 г трет-бутоксида калия и 0,06 мл метилйодида, и перемешивали полученную смесь при комнатной температуре в течение 2 часов. К реакционной смеси добавляли воду, и собирали твердое вещество путем фильтрования с получением 0,93 г 3-циклогексил-1-метил-5-нитро-1H-индола в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,20-1,32 (1H, м), 1,35-1,54 (4H, м), 1,69-1,85 (3H, м), 1,93-2,04 (2H, м), 2,82-2,94 (1H, м), 3,82 (3H, с), 7,35 (1H, с), 7,58 (1H, д, J=9,0 Гц), 8,02 (1H, дд, J=9,0, 2,2 Гц), 8,53 (1H, д, J=2,2 Гц).
[Справочный пример 190]
[Формула 234]
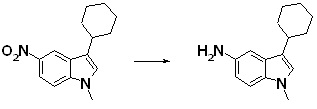
К раствору 0,93 г 3-циклогексил-1-метил-5-нитро-1H-индола в 30 мл метанола добавляли 0,45 г 10% Pd/C и перемешивали полученную смесь при комнатной температуре в течение 2 часов и 15 минут в атмосфере водорода. Нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-60/40) с получением 0,75 г 3-циклогексил-1-метил-1H-индол-5-амина в виде коричневого масла.
1H-ЯМР (ДМСО-d6) δ: 1,20-1,29 (1H, м), 1,30-1,46 (4H, м), 1,67-1,83 (3H, м), 1,91-1,98 (2H, м), 2,55-2,65 (1H, м), 3,56 (3H, с), 4,45 (2H, с), 6,50 (1H, дд, J=8,6, 2,0 Гц), 6,70 (1H, д, J=2,2 Гц), 6,81 (1H, с), 7,03 (1H, д, J=8,5 Гц).
МС (ESI, m/z): 229 (M+H)+.
[Справочный пример 191]
[Формула 235]

Способом, аналогичным описанному в справочном примере 188, 3-циклопентил-5-нитро-1H-индол получали из 5-нитро-1H-индола и циклопентанона.
1H-ЯМР (ДМСО-d6) δ: 1,57-1,83 (6H, м), 2,04-2,19 (2H, м), 3,20-3,40 (1H, м), 7,36-7,42 (1H, м), 7,50 (1H, д, J=8,8 Гц), 7,98 (1H, дд, J=9,0, 2,4 Гц), 8,51 (1H, д, J=2,2 Гц), 11,55 (1H, уш.с).
МС (ESI, m/z): 229 (M-H)-.
[Справочный пример 192]
[Формула 236]

Способом, аналогичным описанному в справочном примере 189, 3-циклопентил-1-метил-5-нитро-1H-индол получали из 3-циклопентил-5-нитро-1H-индола.
1H-ЯМР (ДМСО-d6) δ: 1,53-1,83 (6H, м), 2,06-2,18 (2H, м), 3,25-3,30 (1H, м), 3,81 (3H, с), 7,40 (1H, с), 7,59 (1H, д, J=9,0 Гц), 8,03 (1H, дд, J=9,0, 2,2 Гц), 8,51 (1H, д, J=2,2 Гц).
[Справочный пример 193]
[Формула 237]

Способом, аналогичным описанному в справочном примере 190, 3-циклопентил-1-метил-1H-индол-5-амин получали из 3-циклопентил-1-метил-5-нитро-1H-индола.
1H-ЯМР (ДМСО-d6) δ: 1,51-1,79 (6H, м), 1,95-2,15 (2H, м), 2,99-3,10 (1H, м), 3,59 (3H, с), 4,45 (2H, с), 6,51 (1H, дд, J=8,5, 2,2 Гц), 6,70 (1H, д, J=1,7 Гц), 6,85 (1H, с), 7,03 (1H, д, J=8,5 Гц).
МС (ESI, m/z): 215 (M+H)+.
[Справочный пример 194]
[Формула 238]

К раствору 2,0 г 5-нитро-1H-индола в 10 мл N,N-диметилформамида при охлаждении на льду добавляли 5,5 г трет-бутоксида калия и перемешивали полученную смесь в течение 9 минут. К смеси добавляли 6,6 мл (2-бромэтил)бензол, и перемешивали полученную смесь при комнатной температуре в течение 1 часа. К реакционной смеси добавляли 3 мл (2-бромэтил)бензола, и перемешивали полученную смесь при комнатной температуре в течение 30 минут. Затем добавляли 2,8 г трет-бутоксида калия и перемешивали полученную смесь при комнатной температуре в течение 30 минут. К реакционной смеси при охлаждении на льду добавляли воду и этилацетат. Органический слой разделяли, последовательно промывали 2 M соляной кислотой, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-80/20) с получением 1,44 г 5-нитро-1-(2-фенилэтил)-1H-индола в виде оранжевого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,09 (2H, т, J=7,2 Гц), 4,52 (2H, т, J=7,2 Гц), 6,71 (1H, д, J=3,2 Гц), 7,14-7,27 (5H, м), 7,57 (1H, д, J=3,2 Гц), 7,65 (1H, д, J=9,0 Гц), 7,97 (1H, дд, J=9,0, 2,4 Гц), 8,54 (1H, д, J=2,2 Гц).
[Справочный пример 195]
[Формула 239]

К раствору 1,44 г 5-нитро-1-(2-фенилэтил)-1H-индола в 15 мл тетрагидрофурана добавляли 0,3 г 10% Pd/C и перемешивали полученную смесь при комнатной температуре в течение 2 часов и 10 минут в атмосфере водорода. К реакционной смеси добавляли 0,4 г 10% Pd/C, и перемешивали полученную смесь при 45°C в течение 1 часа и 10 минут. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-50/50) с получением 1,14 г 1-(2-фенилэтил)-1H-индол-5-амина в виде коричневого масла.
1H-ЯМР (ДМСО-d6) δ: 3,00 (2H, т, J=7,6 Гц), 4,26 (2H, т, J=7,3 Гц), 4,45 (2H, с), 6,06 (1H, д, J=2,9 Гц), 6,52 (1H, дд, J=8,6, 2,2 Гц), 6,66 (1H, д, J=2,0 Гц), 7,05 (1H, д, J=3,0 Гц), 7,15-7,29 (6H, м).
МС (ESI, m/z): 237 (M+H)+.
[Справочный пример 196]
[Формула 240]
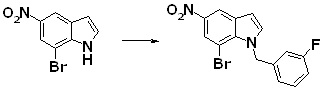
К раствору 1,0 г 7-бром-5-нитро-1H-индола в 5 мл N,N-диметилформамида при охлаждении на льду добавляли 0,56 г трет-бутоксида калия и перемешивали полученную смесь в течение 4 минут. К смеси добавляли 0,62 мл 3-фторбензилбромид, и перемешивали полученную смесь в течение 10 минут. К реакционной смеси добавляли воду, этилацетат и гексан, органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-80/20) с получением 1,4 г 7-бром-1-(3-фторбензил)-5-нитро-1H-индола в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 5,93 (2H, с), 6,74 (1H, д, J=7,8 Гц), 6,82 (1H, д, J=10,2 Гц), 6,98 (1H, д, J=3,2 Гц), 7,06-7,14 (1H, м), 7,31-7,40 (1H, м), 7,86 (1H, д, J=3,2 Гц), 8,15 (1H, д, J=2,2 Гц), 8,66 (1H, д, J=2,2 Гц).
[Справочный пример 197]
[Формула 241]
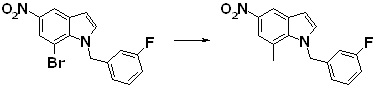
Смесь 1,4 г 7-бром-1-(3-фторбензил)-5-нитро-1H-индола, 0,72 г метилбороновой кислоты, 1,7 г ортофосфата калия, 0,28 г бис(ди-трет-бутил(4-диметиламинофенил)фосфин)-дихлорпалладия(II), 14 мл диоксана и 3,5 мл воды нагревали с обратным холодильником в течение 1 часа и 30 минут. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали и добавляли к фильтрату этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 95/5-75/25) с получением 1,16 г 1-(3-фторбензил)-7-метил-5-нитро-1H-индола в виде оранжевого масла.
1H-ЯМР (ДМСО-d6) δ: 2,53 (3H, с), 5,76 (2H, с), 6,65-6,76 (2H, м), 6,86 (1H, д, J=3,2 Гц), 7,06-7,15 (1H, м), 7,33-7,41 (1H, м), 7,70 (1H, д, J=3,2 Гц), 7,76 (1H, д, J=1,5 Гц), 8,46 (1H, д, J=2,4 Гц).
[Справочный пример 198]
[Формула 242]

Смесь 0,92 г 1-(3-фторбензил)-7-метил-5-нитро-1H-индола, 0,12 г хлорида аммония, 0,54 г железного порошка, 15 мл этанола и 4,5 мл воды нагревали с обратным холодильником в течение 1 часа и 40 минут. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и промывали осадок на фильтре этилацетатом. Фильтрат и смывы объединяли, и добавляли к смеси воду, органический слой разделяли, промывали насыщенным водным раствором хлорида натрия, а затем сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-50/50) с получением 0,62 г 1-(3-фторбензил)-7-метил-1H-индол-5-амина в виде оранжевого масла.
1H-ЯМР (ДМСО-d6) δ: 2,27 (3H, с), 4,42 (2H, с), 5,52 (2H, с), 6,18-6,23 (2H, м), 6,51-6,61 (2H, м), 6,66-6,72 (1H, м), 7,00-7,08 (1H, м), 7,18-7,23 (1H, м), 7,28-7,37 (1H, м).
МС (ESI, m/z): 255 (M+H)+.
[Справочный пример 199]
[Формула 243]
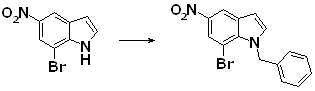
К раствору 1,0 г 7-бром-5-нитро-1H-индола в 5 мл N,N-диметилформамида при охлаждении на льду добавляли 0,51 г трет-бутоксида калия и перемешивали полученную смесь в течение 5 минут. К смеси добавляли 0,54 мл (бромметил)бензола и перемешивали полученную смесь при комнатной температуре в течение 2 часов и 15 минут. К реакционной смеси при охлаждении на льду добавляли 0,093 г трет-бутоксида калия и 0,098 мл (бромметил)бензола, и перемешивали полученную смесь при комнатной температуре в течение 25 минут. К реакционной смеси добавляли воду, и собирали твердое вещество путем фильтрования с получением 1,4 г 1-бензил-7-бром-5-нитро-1H-индола в виде коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 5,91 (2H, с), 6,93-7,01 (3H, м), 7,21-7,36 (3H, м), 7,84 (1H, д, J=3,2 Гц), 8,14 (1H, д, J=2,2 Гц), 8,65 (1H, д, J=2,2 Гц).
[Справочный пример 200]
[Формула 244]
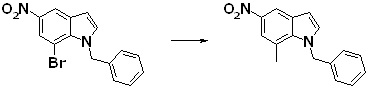
Смесь 1,4 г 1-бензил-7-бром-5-нитро-1H-индола, 0,50 г метилбороновой кислоты, 1,8 г ортофосфата калия, 0,29 г бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлорпалладия(II), 14 мл диоксана и 3,5 мл воды перемешивали при 100°C в течение 1 часа и 40 минут. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-85/15) с получением 0,91 г 1-бензил-7-метил-5-нитро-1H-индола в виде оранжевого масла.
1H-ЯМР (ДМСО-d6) δ: 2,53 (3H, с), 5,74 (2H, с), 6,85 (1H, д, J=3,2 Гц), 6,86-6,92 (2H, м), 7,20-7,36 (3H, м), 7,69 (1H, д, J=3,2 Гц), 7,72-7,76 (1H, м), 8,46 (1H, д, J=2,2 Гц).
[Справочный пример 201]
[Формула 245]

Смесь 0,91 г 1-бензил-7-метил-5-нитро-1H-индола, 0,13 г хлорида аммония, 0,57 г железного порошка, 7,5 мл этанола и 0,9 мл воды нагревали с обратным холодильником в течение 2 часов и 30 минут. К реакционной смеси добавляли 0,19 г железного порошка, и нагревали полученную смесь с обратным холодильником в течение 30 минут. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и промывали осадок на фильтре этилацетатом и водой. Фильтрат и смывы объединяли, органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-60/40) с получением 0,55 г 1-бензил-7-метил-1H-индол-5-амина в виде коричневого масла.
1H-ЯМР (ДМСО-d6) δ: 2,28 (3H, с), 4,40 (2H, с), 5,49 (2H, с), 6,16-6,20 (2H, м), 6,51-6,55 (1H, м), 6,81-6,87 (2H, м), 7,17-7,23 (2H, м), 7,23-7,30 (2H, м).
МС (ESI, m/z): 237 (M+H)+.
[Справочный пример 202]
[Формула 246]

К раствору 20 г 5-нитро-1H-индола в 100 мл N,N-диметилформамида при 7°C добавляли 15,3 г трет-бутоксида калия и перемешивали полученную смесь в течение 10 минут. К ней при 10°C добавляли 16,9 мл 3-фторбензилбромида и перемешивали полученную смесь при комнатной температуре в течение 4 часов. К реакционной смеси при охлаждении на льду добавляли 400 мл воды, твердое вещество собирали путем фильтрования и промывали водой и диизопропиловым эфиром с получением 32,3 г 1-(3-фторбензил)-5-нитро-1H-индола в виде коричневого твердого вещества.
1H-ЯМР (ДМСО-D6) δ: 5,56 (2H, с), 6,83 (1H, дд, J=3,2, 0,7 Гц), 7,01-7,14 (3H, м), 7,33-7,41 (1H, м), 7,71 (1H, д, J=9,3 Гц), 7,81 (1H, д, J=3,2 Гц), 8,02 (1H, дд, J=9,0, 2,4 Гц), 8,60 (1H, д, J=2,4 Гц).
[Справочный пример 203]
[Формула 247]

Смесь 32,2 г 1-(3-фторбензил)-5-нитро-1H-индола, 260 мл этанола, 30 мл воды, 4,11 г хлорида аммония и 11,8 г железного порошка нагревали с обратным холодильником в течение 30 минут в атмосфере азота. К реакционной смеси добавляли 11,8 г железного порошка, и нагревали полученную смесь с обратным холодильником в течение 5 часов. После охлаждения реакционной смеси до комнатной температуры, к ней добавляли этилацетат и воду, нерастворимое вещество отфильтровывали, и промывали осадок на фильтре этилацетатом и водой. Фильтрат и смывы объединяли, органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли диизопропиловый эфир, этилацетат и циклогексан, и отфильтровывали твердое вещество с получением 20,1 г 1-(3-фторбензил)-1H-индол-5-амина в виде коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 3,48 (2H, уш.с), 5,24 (2H, с), 6,37 (1H, дд, J=3,0, 0,9 Гц), 6,63 (1H, дд, J=8,5, 2,2 Гц), 6,73-6,79 (1H, м), 6,84-6,89 (1H, м), 6,90-6,97 (2H, м), 7,02 (1H, д, J=8,5 Гц), 7,04 (1H, д, J=3,2 Гц), 7,20-7,28 (1H, м).
[Пример 1]
[Формула 248]

Смесь 1,0 г 1-бензил-5-бром-1H-индола, 0,65 г метил-2-амино-5-хлорбензоата, 39,2 мг ацетата палладия, 202 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 2,27 г карбоната цезия и 10 мл толуола нагревали с обратным холодильником в течение 4 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-80/20) с получением 380 мг метил-2-((1-бензил-1H-индол-5-ил)амино)-5-хлорбензоата в виде желтого масла.
1H-ЯМР (ДМСО-d6) δ: 3,87 (3H, с), 5,43 (2H, с), 6,47 (1H, д, J=3,3 Гц), 6,90 (1H, д, J=9,2 Гц), 6,99 (1H, дд, J=8,6, 2,0 Гц), 7,19-7,36 (6H, м), 7,44 (1H, д, J=2,0 Гц), 7,49 (1H, д, J=9,2 Гц), 7,56 (1H, д, J=3,3 Гц), 7,80 (1H, д, J=2,6 Гц), 9,22 (1H, с).
[Пример 2]
[Формула 249]
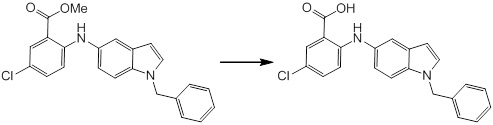
К раствору 0,38 г метил-2-((1-бензил-1H-индол-5-ил)амино)-5-хлорбензоата в 2,0 мл этанола и 1,0 мл тетрагидрофурана при комнатной температуре добавляли 0,39 мл 5 M водного раствора гидроксида натрия и перемешивали полученную смесь при комнатной температуре в течение 4 часов. К реакционной смеси добавляли воду, и корректировали полученную смесь до pH 2,0 добавлением 2 M соляной кислоты. Твердое вещество собирали путем фильтрования и промывали водой и циклогексаном. Полученное твердое вещество очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат = 0/100), к полученному остатку добавляли циклогексан, и собирали твердое вещество путем фильтрования с получением 0,24 г 2-((1-бензил-1H-индол-5-ил)амино)-5-хлорбензойной кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 5,43 (2H, с), 6,47 (1H, д, J=3,3 Гц), 6,90 (1H, д, J=8,6 Гц), 6,98 (1H, дд, J=8,6, 2,0 Гц), 7,18-7,36 (6H, м), 7,43 (1H, д, J=2,0 Гц), 7,48 (1H, д, J=8,6 Гц), 7,55 (1H, д, J=2,6 Гц), 7,78 (1H, д, J=2,6 Гц), 9,51 (1H, уш.с).
МС (ESI, m/z): 377 (M+H)+, 375 (M-H)-.
[Пример 3]
[Формула 250]

Смесь 0,3 г 1-бензил-6-бром-1H-индола, 0,2 г метил-2-амино-5-хлорбензоата, 7 мг ацетата палладия, 30,4 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 0,68 г карбоната цезия и 5 мл толуола нагревали с обратным холодильником в течение 1 часа в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем оставляли отстаиваться при комнатной температуре в течение ночи. К реакционной смеси добавляли 7 мг ацетата палладия, и нагревали полученную смесь с обратным холодильником в течение 3 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-90/10) с получением 0,12 г метил-2-((1-бензил-1H-индол-6-ил)амино)-5-хлорбензоата в виде желтого масла.
1H-ЯМР (ДМСО-d6) δ: 3,86 (3H, с), 5,40 (2H, с), 6,49 (1H, д, J=2,6 Гц), 6,91 (1H, дд, J=8,3, 1,7 Гц), 6,95 (1H, д, J=8,6 Гц), 7,16-7,37 (7H, м), 7,50 (1H, д, J=3,3 Гц), 7,57 (1H, д, J=7,9 Гц), 7,81 (1H, д, J=2,6 Гц), 9,30 (1H, с).
[Пример 4]
[Формула 251]
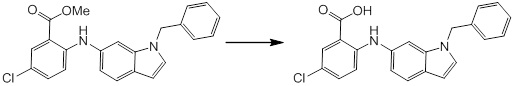
К раствору 0,11 г метил-2-((1-бензил-1H-индол-6-ил)амино)-5-хлорбензоата в 2,0 мл этанола и 2,0 мл тетрагидрофурана при комнатной температуре добавляли 0,11 мл 5 M водного раствора гидроксида натрия и перемешивали полученную смесь в течение 1 часа. К смеси добавляли 0,11 мл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при внешней температуре 40°C в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры, к ней добавляли воду. Реакционную смесь корректировали до pH 2,0 добавлением 3 M соляной кислоты. Твердое вещество собирали путем фильтрования с получением 80 мг 2-((1-бензил-1H-индол-6-ил)амино)-5-хлорбензойной кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 5,40 (2H, с), 6,48 (1H, д, J=2,6 Гц), 6,91 (1H, дд, J=8,3, 1,7 Гц), 6,95 (1H, д, J=9,2 Гц), 7,16-7,37 (7H, м), 7,49 (1H, д, J=3,3 Гц), 7,56 (1H, д, J=8,6 Гц), 7,80 (1H, д, J=2,6 Гц), 9,58 (1H, с).
МС (ESI, m/z): 377 (M+H)+, 375 (M-H)-.
[Пример 5]
[Формула 252]

Смесь 0,2 г 1-бензил-4-бром-1H-индола, 0,13 г метил-2-амино-5-хлорбензоата, 7,9 мг ацетата палладия, 41 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 0,46 г карбоната цезия и 3 мл толуола нагревали с обратным холодильником в течение 3 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-80/20) с получением 0,16 г метил-2-((1-бензил-1H-индол-4-ил)амино)-5-хлорбензоата в виде желтого масла.
1H-ЯМР (ДМСО-d6) δ: 3,90 (3H, с), 5,44 (2H, с), 6,35 (1H, д, J=2,6 Гц), 7,01 (1H, д, J=7,3 Гц), 7,10 (1H, д, J=7,9 Гц), 7,16 (1H, д, J=9,2 Гц), 7,19-7,36 (6H, м), 7,42 (1H, дд, J=9,2, 2,6 Гц), 7,52 (1H, д, J=3,3 Гц), 7,87 (1H, д, J=2,6 Гц), 9,60 (1H, с).
[Пример 6]
[Формула 253]

К раствору 0,15 г метил-2-((1-бензил-1H-индол-4-ил)амино)-5-хлорбензоата в 2,0 мл этанола и 1,0 мл тетрагидрофурана при комнатной температуре добавляли 154 мкл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при внешней температуре 40-50°C в течение 2 часов и 10 минут. После охлаждения реакционной смеси до комнатной температуры, к ней добавляли воду. Реакционную смесь корректировали до pH 2,0 добавлением 3 M соляной кислоты. Твердое вещество собирали путем фильтрования с получением 0,13 г 2-((1-бензил-1H-индол-4-ил)амино)-5-хлорбензойной кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 5,44 (2H, с), 6,35 (1H, д, J=3,3 Гц), 7,02 (1H, д, J=7,3 Гц), 7,06-7,36 (8H, м), 7,40 (1H, дд, J=9,2, 2,6 Гц), 7,51 (1H, д, J=3,3 Гц), 7,86 (1H, д, J=2,6 Гц), 9,93 (1H, с).
МС (ESI, m/z): 377 (M+H)+.
[Пример 7]
[Формула 254]

Смесь 80 мг 2-((1-бензил-1H-индол-4-ил)амино)-5-хлорбензойной кислоты, 31 мг фенилбороновой кислоты, 45 мг карбоната натрия, 4,5 мг бис(ди-трет-бутил(4-диметиламинофенил)-фосфин)дихлорпалладия(II), 1,2 мл диметилового эфира этиленгликоля и 0,3 мл воды нагревали с обратным холодильником в течение 2 часов в атмосфере азота. К реакционной смеси добавляли 4,5 мг бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлор-палладия(II), и нагревали полученную смесь с обратным холодильником в течение 5 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду, и корректировали полученную смесь до pH 2,0 добавлением 2 M соляной кислоты. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат = 80/20), к полученному таким образом остатку добавляли циклогексан, и собирали твердое вещество путем фильтрования с получением 50 мг 4-((1-бензил-1H-индол-4-ил)амино)-[1,1'-бифенил]-3-карбоновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 5,45 (2H, с), 6,42 (1H, д, J=3,3 Гц), 7,04-7,38 (10H, м), 7,39-7,47 (2H, м), 7,52 (1H, д, J=3,3 Гц), 7,58-7,65 (2H, м), 7,73 (1H, дд, J=8,9, 2,3 Гц), 8,21 (1H, д, J=2,6 Гц), 10,06 (1H, с).
МС (ESI/APCI, m/z): 419 (M+H)+, 417 (M-H)-.
[Пример 8]
[Формула 255]

Смесь 0,3 г 1-бензил-4-бром-1H-пирроло(2,3-b)пиридина, 0,19 г метил-2-амино-5-хлорбензоата, 11,7 мг ацетата палладия, 60 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 0,68 г карбоната цезия и 3 мл толуола нагревали с обратным холодильником в течение 4 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-50/50) с получением 0,33 г метил-2-((1-бензил-1H-пирроло(2,3-b)пиридин-4-ил)амино)-5-хлорбензоата в виде бледно-желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,87 (3H, с), 5,46 (2H, с), 6,48 (1H, д, J=3,3 Гц), 6,98 (1H, д, J=5,9 Гц), 7,20-7,35 (5H, м), 7,51 (1H, д, J=3,3 Гц), 7,58-7,64 (2H, м), 7,90-7,94 (1H, м), 8,11 (1H, д, J=5,9 Гц), 9,71 (1H, с).
[Пример 9]
[Формула 256]

К раствору 200 мг метил-2-((1-бензил-1H-пирроло(2,3-b)пиридин-4-ил)амино)-5-хлорбензоата в 2,0 мл этанола и 1,0 мл тетрагидрофурана при комнатной температуре добавляли 204 мкл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при комнатной температуре в течение 2 часов. К реакционной смеси добавляли воду, и корректировали полученную смесь до pH 2,5 добавлением 2 M соляной кислоты. Твердое вещество собирали путем фильтрования с получением 0,14 г 2-((1-бензил-1H-пирроло(2,3-b)пиридин-4-ил)амино)-5-хлорбензойной кислоты в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 5,47 (2H, с), 6,47 (1H, д, J=3,3 Гц), 7,04 (1H, д, J=5,3 Гц), 7,20-7,35 (5H, м), 7,52 (1H, д, J=4,0 Гц), 7,55-7,66 (2H, м), 7,93 (1H, д, J=2,0 Гц), 8,12 (1H, д, J=5,9 Гц), 10,24 (1H, с).
МС (ESI/APCI, m/z): 378 (M+H)+, 376 (M-H)-.
[Пример 10]
[Формула 257]

Смесь 0,2 г 1-бензил-5-бром-1H-пирроло(2,3-b)пиридина, 0,13 г метил-2-амино-5-хлорбензоата, 7,8 мг ацетата палладия, 40 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 0,45 г карбоната цезия и 2 мл толуола нагревали с обратным холодильником в течение 5 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на щелочном силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-80/20), к полученному таким образом остатку добавляли этанол, и собирали твердое вещество путем фильтрования с получением 35 мг метил-2-((1-бензил-1H-пирроло(2,3-b)пиридин-5-ил)амино)-5-хлорбензоата в виде бледно-желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,88 (3H, с), 5,49 (2H, с), 6,51 (1H, д, J=3,3 Гц), 6,81 (1H, д, J=9,2 Гц), 7,21-7,38 (6H, м), 7,69 (1H, д, J=4,0 Гц), 7,82 (1H, д, J=2,6 Гц), 7,92 (1H, д, J=2,6 Гц), 8,18 (1H, д, J=2,6 Гц), 9,21 (1H, с).
[Пример 11]
[Формула 258]

К раствору 35 мг метил-2-((1-бензил-1H-пирроло(2,3-b)пиридин-5-ил)амино)-5-хлорбензоата в 1,0 мл этанола и 1,0 мл тетрагидрофурана при комнатной температуре добавляли 36 мкл 5 M водного раствора гидроксида натрия и перемешивали полученную смесь при комнатной температуре в течение 1 часа. К раствору при комнатной температуре добавляли 36 мкл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при внешней температуре 40°C в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры, к смеси добавляли воду, и корректировали полученную смесь до pH 3,0 добавлением 2 M соляной кислоты. Твердое вещество собирали путем фильтрования с получением 25 мг 2-((1-бензил-1H-пирроло(2,3-b)пиридин-5-ил)амино)-5-хлорбензойной кислоты в виде бледно-желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 5,49 (2H, с), 6,51 (1H, д, J=3,3 Гц), 6,82 (1H, д, J=8,6 Гц), 7,22-7,40 (6H, м), 7,68 (1H, д, J=3,3 Гц), 7,82 (1H, д, J=2,6 Гц), 7,92 (1H, д, J=2,6 Гц), 8,18 (1H, д, J=2,6 Гц), 9,48 (1H, с).
МС (ESI/APCI, m/z): 378 (M+H)+, 376 (M-H)-.
[Пример 12]
[Формула 259]
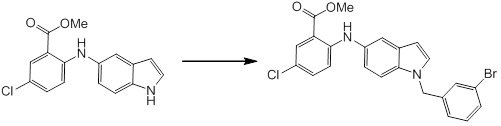
К раствору 100 мг метил-2-((1H-индол-5-ил)амино)-5-хлорбензоата в 1 мл N,N-диметилацетамида при охлаждении на льду добавляли 41 мг трет-бутоксида калия и перемешивали полученную смесь в течение 15 минут. К реакционной смеси при охлаждении на льду добавляли 92 мг 1-бром-3-(бромметил)бензола, и перемешивали полученную смесь при охлаждении на льду в течение 1 часа. К реакционной смеси добавляли этилацетат и воду, и корректировали полученную смесь до pH 2,0 добавлением 2 M соляной кислоты. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-80/20) с получением 0,12 г метил-2-((1-(3-бромбензил)-1H-индол-5-ил)амино)-5-хлорбензоата в виде желтого масла.
1H-ЯМР (ДМСО-d6) δ: 3,87 (3H, с), 5,45 (2H, с), 6,49 (1H, д, J=3,3 Гц), 6,91 (1H, д, J=9,2 Гц), 7,00 (1H, дд, J=9,2, 2,0 Гц), 7,18-7,36 (3H, м), 7,42-7,53 (4H, м), 7,58 (1H, д, J=3,3 Гц), 7,80 (1H, д, J=2,6 Гц), 9,23 (1H, с).
[Пример 13]
[Формула 260]

К раствору 0,12 г метил-2-((1-(3-бромбензил)-1H-индол-5-ил)амино)-5-хлорбензоата в 2 мл толуола добавляли 22,3 мкл морфолина, 2,9 мг ацетата палладия, 14,8 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена и 166 мг карбоната цезия, и нагревали полученную смесь с обратным холодильником в течение 4 часов в атмосфере азота. К реакционной смеси добавляли 11,2 мкл морфолина, 11,7 мг трис(дибензилиденацетон)-дипалладия(0), 12,2 мг 2-дициклогексилфосфино-2',4',6'-триизопропилбифенила и 83 мг карбоната цезия, и нагревали полученную смесь с обратным холодильником в течение 3 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-80/20) с получением 10 мг метил-5-хлор-2-((1-(3-морфолинобензил)-1H-индол-5-ил)амино)бензоата в виде желтого масла.
1H-ЯМР (CDCl3) δ: 3,06-3,13 (4H, м), 3,79-3,86 (4H, м), 3,90 (3H, с), 5,28 (2H, с), 6,50 (1H, д, J=2,6 Гц), 6,61-6,70 (2H, м), 6,82 (1H, дд, J=8,3, 2,3 Гц), 6,91 (1H, д, J=9,2 Гц), 7,02 (1H, дд, J=8,6, 2,0 Гц), 7,11-7,30 (4H, м), 7,48 (1H, д, J=2,0 Гц), 7,90 (1H, д, J=2,6 Гц), 9,32 (1H, с).
[Пример 14]
[Формула 261]

К раствору 10 мг метил-5-хлор-2-((1-(3-морфолинобензил)-1H-индол-5-ил)амино)бензоата в 0,5 мл этанола и 0,5 мл тетрагидрофурана при комнатной температуре добавляли 16,8 мкл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при комнатной температуре в течение 4 часов. К реакционной смеси добавляли воду, и корректировали полученную смесь до pH 3,0 добавлением 2 M соляной кислоты. Твердое вещество собирали путем фильтрования с получением 7,0 мг 5-хлор-2-((1-(3-морфолинобензил)-1H-индол-5-ил)амино)бензойной кислоты в виде бледно-коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,02-3,10 (4H, м), 3,67-3,76 (4H, м), 5,34 (2H, с), 6,45 (1H, д, J=2,6 Гц), 6,62 (1H, д, J=7,3 Гц), 6,82 (1H, дд, J=8,3, 2,3 Гц), 6,86-6,95 (2H, м), 6,98 (1H, дд, J=8,9, 2,3 Гц), 7,15 (1H, т, J=7,9 Гц), 7,28 (1H, дд, J=9,2, 2,6 Гц), 7,42 (1H, д, J=2,0 Гц), 7,49 (1H, д, J=9,2 Гц), 7,54 (1H, д, J=2,6 Гц), 7,78 (1H, д, J=2,6 Гц).
МС (ESI/APCI, m/z): 460 (M-H)-.
[Пример 15]
[Формула 262]

К раствору 0,4 г метил-2-((1H-индол-5-ил)амино)-5-хлорбензоата в 3 мл N,N-диметилацетамида при охлаждении на льду добавляли 164 мг трет-бутоксида калия и перемешивали полученную смесь в течение 10 минут. К реакционной смеси при охлаждении на льду добавляли раствор 0,4 г (3-(бромметил)фенокси)(трет-бутил)диметилсилан в 1 мл N,N-диметилацетамида, и перемешивали полученную смесь при охлаждении на льду в течение 35 минут. К реакционной смеси добавляли воду со льдом и этилацетат, и корректировали полученную смесь до pH 2,5 добавлением 2 M соляной кислоты. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-80/20) с получением 0,27 г метил-2-((1-(3-((трет-бутилдиметилсилил)окси)-бензил)-1H-индол-5-ил)амино)-5-хлорбензоата в виде желтого масла.
1H-ЯМР (ДМСО-d6) δ: 0,07 (6H, с), 0,87 (9H, с), 3,87 (3H, с), 5,40 (2H, с), 6,48 (1H, д, J=3,3 Гц), 6,53-6,57 (1H, м), 6,71 (1H, дд, J=7,9, 2,0 Гц), 6,82-6,91 (2H, м), 6,98 (1H, дд, J=8,6, 2,0 Гц), 7,19 (1H, т, J=7,9 Гц), 7,31 (1H, дд, J=9,2, 2,6 Гц), 7,42-7,48 (2H, м), 7,54 (1H, д, J=2,6 Гц), 7,80 (1H, д, J=2,6 Гц), 9,23 (1H, с).
[Пример 16]
[Формула 263]

К раствору 25 мг метил-2-((1-(3-((трет-бутилдиметилсилил)окси)бензил)-1H-индол-5-ил)амино)-5-хлорбензоата в 0,5 мл тетрагидрофурана при комнатной температуре добавляли 48 мкл 1,0 M раствор фторида тетрабутиламмония в тетрагидрофуране, и перемешивали полученную смесь при комнатной температуре в течение 30 минут. К реакционной смеси добавляли воду и этилацетат. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления с получением 20 мг метил-5-хлор-2-((1-(3-гидроксибензил)-1H-индол-5-ил)амино)бензоата в виде желтого масла.
1H-ЯМР (CDCl3) δ: 3,90 (3H, с), 5,25 (2H, с), 6,49 (1H, д, J=2,6 Гц), 6,53-6,57 (1H, м), 6,68-6,78 (2H, м), 6,92 (1H, д, J=9,2 Гц), 7,01 (1H, дд, J=8,6, 2,0 Гц), 7,10-7,24 (4H, м), 7,47 (1H, д, J=2,0 Гц), 7,89 (1H, д, J=2,6 Гц), 9,31 (1H, с).
[Пример 17]
[Формула 264]

К раствору 20 мг метил-5-хлор-2-((1-(3-гидроксибензил)-1H-индол-5-ил)амино)бензоата в 1,0 мл этанола при комнатной температуре добавляли 39 мкл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при внешней температуре 40°C в течение 15 минут. К смеси добавляли 39 мкл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при внешней температуре 50°C в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры, к смеси добавляли воду, и корректировали полученную смесь до pH 2,0 добавлением 2 M соляной кислоты. Твердое вещество собирали путем фильтрования и промывали водой и диизопропиловым эфиром с получением 10 мг 5-хлор-2-((1-(3-гидроксибензил)-1H-индол-5-ил)амино)бензойной кислоты в виде бледно-коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 5,34 (2H, с), 6,46 (1H, д, J=3,3 Гц), 6,52-6,57 (1H, м), 6,60-6,70 (2H, м), 6,91 (1H, д, J=9,2 Гц), 6,99 (1H, дд, J=8,6, 2,0 Гц), 7,11 (1H, т, J=7,6 Гц), 7,30 (1H, дд, J=8,6, 2,6 Гц), 7,40-7,47 (2H, м), 7,51 (1H, д, J=3,3 Гц), 7,79 (1H, д, J=2,6 Гц), 9,38 (1H, с), 9,51 (1H, уш.с).
МС (ESI/APCI, m/z): 393 (M+H)+, 391 (M-H)-.
[Пример 18]
[Формула 265]

К раствору 100 мг метил-5-хлор-2-((1-(3-гидроксибензил)-1H-индол-5-ил)амино)бензоата в 1 мл N,N-диметилацетамида добавляли 85 мг карбоната калия и 48,4 мг гидрохлорида 2-(хлорметил)пиридина, и перемешивали полученную смесь при внешней температуре 60-80°C в течение 1 часа, а затем перемешивали при внешней температуре 100-110°C в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-70/30) с получением 90 мг метил-5-хлор-2-((1-(3-(пиридин-2-илметокси)бензил)-1H-индол-5-ил)амино)бензоата в виде бледно-коричневого масла.
1H-ЯМР (ДМСО-d6) δ: 3,87 (3H, с), 5,12 (2H, с), 5,39 (2H, с), 6,47 (1H, д, J=2,6 Гц), 6,81 (1H, д, J=7,9 Гц), 6,87-6,95 (3H, м), 6,98 (1H, дд, J=8,6, 2,0 Гц), 7,19-7,28 (1H, м), 7,29-7,36 (2H, м), 7,41-7,50 (3H, м), 7,55 (1H, д, J=3,3 Гц), 7,76-7,84 (2H, м), 8,53-8,58 (1H, м), 9,22 (1H, с).
[Пример 19]
[Формула 266]

К раствору 80 мг метил-5-хлор-2-((1-(3-(пиридин-2-илметокси)бензил)-1H-индол-5-ил)амино)бензоата в 2,0 мл этанола и 0,5 мл тетрагидрофурана при комнатной температуре добавляли 64 мкл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при комнатной температуре в течение 1 часа. К смеси добавляли 64 мкл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при внешней температуре 45-50°C в течение 4 часов. Реакционную смесь охлаждали до комнатной температуры, к смеси добавляли воду, и корректировали полученную смесь до pH 2,8 добавлением 2 M соляной кислоты. Твердое вещество собирали путем фильтрования с получением 70 мг 5-хлор-2-((1-(3-(пиридин-2-илметокси)бензил)-1H-индол-5-ил)амино)бензойной кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 5,12 (2H, с), 5,39 (2H, с), 6,46 (1H, д, J=3,3 Гц), 6,81 (1H, д, J=7,3 Гц), 6,87-6,95 (3H, м), 6,97 (1H, дд, J=8,6, 2,0 Гц), 7,18-7,36 (3H, м), 7,41-7,49 (3H, м), 7,53 (1H, д, J=3,3 Гц), 7,75-7,85 (2H, м), 8,55 (1H, д, J=4,0 Гц), 9,48 (1H, с).
МС (ESI/APCI, m/z): 484 (M+H)+, 482 (M-H)-.
[Пример 20]
[Формула 267]

Смесь 179 мг 1-бензил-1H-индазол-5-амина, 200 мг метил-2-бром-5-хлорбензоата, 36,6 мг трис(дибензилиденацетон)-дипалладия(0), 46,3 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 0,52 г карбоната цезия и 2 мл толуола перемешивали при внешней температуре 110 120°C в течение 3 часов и 30 минут в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-70/30) с получением 156 мг метил-2-((1-бензил-1H-индазол-5-ил)амино)-5-хлорбензоата в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,87 (3H, с), 5,67 (2H, с), 6,96 (1H, д, J=9,2 Гц), 7,22-7,40 (7H, м), 7,65 (1H, д, J=2,0 Гц), 7,74 (1H, д, J=9,2 Гц), 7,82 (1H, д, J=2,6 Гц), 8,07 (1H, с), 9,26 (1H, с).
[Пример 21]
[Формула 268]

К раствору 124 мг метил-2-((1-бензил-1H-индазол-5-ил)амино)-5-хлорбензоата в 1 мл этанола и 1 мл тетрагидрофурана при комнатной температуре добавляли 127 мкл 5 M водного раствора гидроксида натрия и перемешивали полученную смесь при комнатной температуре в течение 7 часов. К реакционной смеси добавляли воду, и корректировали полученную смесь до pH 2,0 добавлением 2 M соляной кислоты. Твердое вещество собирали путем фильтрования и промывали водой и метил-трет-бутиловым эфиром с получением 85 мг 2-((1-бензил-1H-индазол-5-ил)амино)-5-хлорбензойной кислоты в виде бледно-желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 5,66 (2H, с), 6,97 (1H, д, J=9,2 Гц), 7,21-7,38 (7H, м), 7,64 (1H, д, J=1,3 Гц), 7,73 (1H, д, J=9,2 Гц), 7,81 (1H, д, J=2,6 Гц), 8,06 (1H, с), 9,55 (1H, с).
МС (ESI/APCI, m/z): 378 (M+H)+, 376 (M-H)-.
[Пример 22]
[Формула 269]

Способом, аналогичным описанному в примере 20, трет-бутил-1-бензил-5-((4-хлор-2-(метоксикарбонил)фенил)амино)-1H-индол-2-карбоксилат получали из трет-бутил-5-амино-1-бензил-1H-индол-2-карбоксилата и метил-2-бром-5-хлорбензоата.
1H-ЯМР (ДМСО-d6) δ: 1,50 (9H, с), 3,87 (3H, с), 5,84 (2H, с), 6,97 (1H, д, J=9,2 Гц), 7,01-7,07 (2H, м), 7,17-7,33 (5H, м), 7,36 (1H, дд, J=9,2, 2,6 Гц), 7,57-7,63 (2H, м), 7,82 (1H, д, J=2,6 Гц), 9,27 (1H, с).
[Пример 23]
[Формула 270]
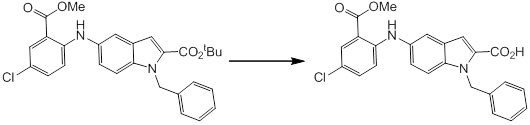
К раствору 0,51 г трет-бутил-1-бензил-5-((4-хлор-2-(метоксикарбонил)фенил)амино)-1H-индол-2-карбоксилата в 2 мл метилхлорида при комнатной температуре добавляли 2 мл трифторуксусной кислоты и перемешивали полученную смесь при комнатной температуре в течение 2 часов. Растворитель отгоняли в условиях пониженного давления, и добавляли к полученному остатку этилацетат и циклогексан. Твердое вещество собирали путем фильтрования с получением 0,39 г 1-бензил-5-((4-хлор-2-(метоксикарбонил)фенил)амино)-1H-индол-2-карбоновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,87 (3H, с), 5,89 (2H, с), 6,97 (1H, д, J=9,2 Гц), 7,03-7,09 (2H, м), 7,15-7,32 (5H, м), 7,37 (1H, дд, J=9,2, 2,6 Гц), 7,55-7,62 (2H, м), 7,81 (1H, д, J=2,6 Гц), 9,25 (1H, с).
МС (ESI/APCI, m/z): 435 (M+H)+, 433 (M-H)-.
[Пример 24]
[Формула 271]

К раствору 60 мг 1-бензил-5-((4-хлор-2-(метоксикарбонил)фенил)амино)-1H-индол-2-карбоновой кислоты в 2 мл тетрагидрофурана при охлаждении на льду добавляли 21 мкл триэтиламина и 20 мкл изобутилхлороформиата и перемешивали полученную смесь в течение 30 минут. К реакционной смеси при охлаждении на льду добавляли 5,2 мг боргидрида натрия, и перемешивали полученную смесь в течение 30 минут. К реакционной смеси при охлаждении на льду добавляли 10,4 мг боргидрида натрия и несколько капель воды, и перемешивали полученную смесь в течение 30 минут. К реакционной смеси при охлаждении на льду добавляли 10,4 мг боргидрида натрия, и перемешивали полученную смесь в течение 30 минут. К реакционной смеси добавляли этилацетат и воду. Органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-60/40) с получением 41 мг метил-2-((1-бензил-2-(гидроксиметил)-1H-индол-5-ил)амино)-5-хлорбензоата в виде бледно-желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,87 (3H, с), 4,60 (2H, д, J=5,3 Гц), 5,36 (1H, т, J=5,3 Гц), 5,49 (2H, с), 6,45 (1H, с), 6,90 (1H, д, J=9,2 Гц), 6,95 (1H, дд, J=8,6, 2,0 Гц), 7,05-7,11 (2H, м), 7,19-7,39 (5H, м), 7,41 (1H, д, J=1,3 Гц), 7,80 (1H, д, J=2,6 Гц), 9,22 (1H, с).
[Пример 25]
[Формула 272]

Способом, аналогичным описанному в примере 6, 2-((1-бензил-2-(гидроксиметил)-1H-индол-5-ил)амино)-5-хлорбензойную кислоту получали из метил-2-((1-бензил-2-(гидроксиметил)-1H-индол-5-ил)амино)-5-хлорбензоата.
1H-ЯМР (ДМСО-d6) δ: 4,60 (2H, д, J=5,3 Гц), 5,36 (1H, т, J=5,6 Гц), 5,48 (2H, с), 6,44 (1H, с), 6,91 (1H, д, J=9,2 Гц), 6,95 (1H, дд, J=8,6, 2,0 Гц), 7,04-7,11 (2H, м), 7,19-7,38 (5H, м), 7,41 (1H, д, J=1,3 Гц), 7,78 (1H, д, J=2,6 Гц), 9,49 (1H, с).
[Пример 26]
[Формула 273]

Смесь 126 мг метил-2-амино-5-циклопропилбензоата, 157 мг 1-бензил-5-бром-1H-пирроло(2,3-b)пиридина, 25,1 мг трис(дибензилиденацетон)дипалладия(0), 31,7 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 0,36 г карбоната цезия и 2 мл толуола нагревали с обратным холодильником в герметизированной пробирке в течение 5 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-70/30) с получением 38 мг метил-2-((1-бензил-1H-пирроло(2,3-b)пиридин-5-ил)амино)-5-циклопропилбензоата в виде бледно-коричневого масла.
1H-ЯМР (ДМСО-d6) δ: 0,50-0,58 (2H, м), 0,82-0,90 (2H, м), 1,80-1,91 (1H, м), 3,86 (3H, с), 5,48 (2H, с), 6,49 (1H, д, J=4,0 Гц), 6,78 (1H, д, J=8,6 Гц), 7,07 (1H, дд, J=8,9, 2,3 Гц), 7,21-7,36 (5H, м), 7,62 (1H, д, J=2,6 Гц), 7,66 (1H, д, J=3,3 Гц), 7,87 (1H, д, J=2,0 Гц), 8,15 (1H, д, J=2,0 Гц), 9,07 (1H, с).
[Пример 27]
[Формула 274]

К раствору 34 мг метил-2-((1-бензил-1H-пирроло(2,3-b)пиридин-5-ил)амино)-5-циклопропилбензоата в 0,5 мл этанола и 0,5 мл тетрагидрофурана при комнатной температуре добавляли 34 мкл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при внешней температуре 40-50°C в течение 4 часов. После охлаждения реакционной смеси до комнатной температуры, к смеси добавляли воду, корректировали полученную смесь до pH 3,0 добавлением 2 M соляной кислоты, и добавляли к ней этилацетат. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли циклогексан. Твердое вещество собирали путем фильтрования с получением 20 мг 2-((1-бензил-1H-пирроло(2,3-b)пиридин-5-ил)амино)-5-циклопропилбензойной кислоты в виде бледно-коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,50-0,58 (2H, м), 0,81-0,90 (2H, м), 1,79-1,90 (1H, м), 5,48 (2H, с), 6,48 (1H, д, J=3,3 Гц), 6,78 (1H, д, J=8,6 Гц), 7,05 (1H, дд, J=8,9, 2,3 Гц), 7,21-7,36 (5H, м), 7,62 (1H, д, J=2,0 Гц), 7,65 (1H, д, J=3,3 Гц), 7,87 (1H, д, J=2,6 Гц), 8,15 (1H, д, J=2,0 Гц), 9,33 (1H, с), 12,96 (1H, уш.с).
[Пример 28]
[Формула 275]

Смесь 200 мг метил-2-бром-5-циклопропилбензоата, 175 мг 1-бензил-1H-индазол-5-амина, 35,9 мг трис(дибензилиденацетон)-дипалладия(0), 45,3 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 0,51 г карбоната цезия и 2 мл толуола нагревали с обратным холодильником в герметизированной пробирке в течение 2 часов и 30 минут в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-70/30) с получением 230 мг метил-2-((1-бензил-1H-индазол-5-ил)амино)-5-циклопропилбензоата в виде бледно-коричневого масла.
1H-ЯМР (CDCl3) δ: 0,56-0,64 (2H, м), 0,83-0,92 (2H, м), 1,76-1,88 (1H, м), 3,90 (3H, с), 5,59 (2H, с), 6,94-7,06 (2H, м), 7,18-7,36 (7H, м), 7,54-7,57 (1H, м), 7,70 (1H, д, J=2,0 Гц), 7,97 (1H, с), 9,25 (1H, с).
[Пример 29]
[Формула 276]

К раствору 220 мг метил-2-((1-бензил-1H-индазол-5-ил)амино)-5-циклопропилбензоата в 1 мл этанола и 1 мл тетрагидрофурана при комнатной температуре добавляли 222 мкл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при внешней температуре 40-50°C в течение 4 часов. После охлаждения реакционной смеси до комнатной температуры, к смеси добавляли воду, корректировали полученную смесь до pH 2,0 добавлением 2 M соляной кислоты, и добавляли к ней этилацетат. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли этилацетат и циклогексан, и собирали твердое вещество путем фильтрования. К полученному таким образом твердому веществу добавляли метанол. Твердое вещество собирали путем фильтрования с получением 80 мг 2-((1-бензил-1H-индазол-5-ил)амино)-5-циклопропилбензойной кислоты в виде бледно-желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,50-0,59 (2H, м), 0,81-0,91 (2H, м), 1,79-1,91 (1H, м), 5,65 (2H, с), 6,96 (1H, д, J=8,6 Гц), 7,07 (1H, дд, J=8,6, 2,0 Гц), 7,20-7,36 (6H, м), 7,58 (1H, д, J=1,3 Гц), 7,62 (1H, д, J=2,0 Гц), 7,69 (1H, д, J=9,2 Гц), 8,03 (1H, с), 9,40 (1H, с), 12,97 (1H, уш.с).
[Пример 30]
[Формула 277]

К раствору 200 мг 5-бром-2-хлорникотиновой кислоты в 2 мл уксусной кислоты добавляли 176 мг 1-фенил-1H-индол-5-амина и перемешивали полученную смесь в герметизированной пробирке при внешней температуре 140 150°C в течение 4 часов. Реакционную смесь охлаждали до комнатной температуры, а затем к смеси добавляли этилацетат и циклогексан. Нерастворимое вещество отфильтровывали, и добавляли к фильтрату этилацетат и воду. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 50/50-0/100), к полученному таким образом остатку добавляли циклогексан, и собирали твердое вещество путем фильтрования с получением 15 мг 5-бром-2-((1-фенил-1H-индол-5-ил)амино)никотиновой кислоты в виде бледно-коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 6,68 (1H, д, J=3,3 Гц), 7,28 (1H, дд, J=8,6, 2,0 Гц), 7,36-7,44 (1H, м), 7,51-7,64 (5H, м), 7,66 (1H, д, J=3,3 Гц), 8,06 (1H, д, J=2,0 Гц), 8,28 (1H, д, J=2,6 Гц), 8,45 (1H, д, J=2,6 Гц), 10,35 (1H, с).
[Пример 31]
[Формула 278]

Смесь 19 мг метил-2-бром-5-(трифторметил)бензоата, 15 мг 1-бензил-1H-индол-5-амина, 6,2 мг трис(дибензилиденацетон)-дипалладия(0), 7,8 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 44 мг карбоната цезия и 2,5 мл толуола перемешивали при 150°C в течение 30 минут в атмосфере азота с использованием микроволновой установки. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-80/20) с получением 26 мг метил-2-((1-бензил-1H-индол-5-ил)амино)-5-(трифторметил)бензоата в виде бледно-коричневого масла.
1H-ЯМР (ДМСО-d6) δ: 3,90 (3H, с), 5,45 (2H, с), 6,50 (1H, д, J=2,6 Гц), 6,96 (1H, д, J=8,6 Гц), 7,03 (1H, дд, J=8,6, 2,0 Гц), 7,20-7,37 (5H, м), 7,47-7,62 (4H, м), 8,08-8,13 (1H, м), 9,60 (1H, с).
[Пример 32]
[Формула 279]

К раствору 25 мг метил-2-((1-бензил-1H-индол-5-ил)амино)-5-(трифторметил)бензоата в 0,5 мл этанола и 0,5 мл тетрагидрофурана при комнатной температуре добавляли 24 мкл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при внешней температуре 40-50°C в течение 2 часов. К реакционной смеси добавляли воду, и корректировали полученную смесь до pH 2,0 добавлением 2 M соляной кислоты. Твердое вещество собирали путем фильтрования с получением 20 мг 2-((1-бензил-1H-индол-5-ил)амино)-5-(трифторметил)бензойной кислоты в виде бледно-желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 5,45 (2H, с), 6,49 (1H, д, J=3,3 Гц), 6,96 (1H, д, J=8,6 Гц), 7,03 (1H, дд, J=8,9, 2,3 Гц), 7,21-7,37 (5H, м), 7,47-7,60 (4H, м), 8,10 (1H, д, J=2,0 Гц), 9,88 (1H, с).
[Пример 33]
[Формула 280]

Смесь 1,45 г 1H-индол-5-амина, 2,8 г метил-2-бром-5-циклопропилбензоата, 123 мг ацетата палладия, 0,64 г 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 7,19 г карбоната цезия и 25 мл толуола нагревали с обратным холодильником в течение 5 часов в атмосфере азота. К реакционной смеси добавляли 504 мг трис(дибензилиденацетон)дипалладия(0), и нагревали полученную смесь с обратным холодильником в течение 2 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Нерастворимое вещество отфильтровывали и промывали осадок на фильтре этилацетатом и водой. Фильтрат и смывы объединяли, органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-80/20) с получением 1,6 г метил-2-((1H-индол-5-ил)амино)-5-циклопропилбензоата в виде бледно-коричневого масла.
1H-ЯМР (ДМСО-d6) δ: 0,50-0,57 (2H, м), 0,80-0,89 (2H, м), 1,78-1,90 (1H, м), 3,85 (3H, с), 6,37-6,41 (1H, м), 6,87 (1H, д, J=8,6 Гц), 6,94 (1H, дд, J=8,6, 2,0 Гц), 7,05 (1H, дд, J=8,9, 2,3 Гц), 7,33-7,43 (3H, м), 7,61 (1H, д, J=2,6 Гц), 9,09 (1H, с), 11,11 (1H, с).
[Пример 34]
[Формула 281]

К раствору 100 мг метил-2-((1H-индол-5-ил)амино)-5-циклопропилбензоата в 2 мл N,N-диметилацетамида при охлаждении на льду добавляли 40 мг трет-бутоксида калия и перемешивали полученную смесь в течение 10 минут. К реакционной смеси при охлаждении на льду добавляли 97 мг 1-(бромметил)-3-(2,2,2-трифторэтокси)бензола, и перемешивали полученную смесь при комнатной температуре в течение 1 часа. К реакционной смеси добавляли этилацетат и воду, и корректировали полученную смесь до pH 2,0 добавлением 2 M соляной кислоты. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-80/20) с получением 110 мг метил-5-циклопропил-2-((1-(3-(2,2,2-трифторэтокси)бензил)-1H-индол-5-ил)амино)бензоата в виде бледно-желтого масла.
1H-ЯМР (CDCl3) δ: 0,55-0,63 (2H, м), 0,81-0,90 (2H, м), 1,75-1,82 (1H, м), 3,90 (3H, с), 4,28 (2H, кв., J=8,1 Гц), 5,29 (2H, с), 6,50 (1H, д, J=3,3 Гц), 6,69-6,74 (1H, м), 6,79-6,87 (2H, м), 6,92-7,07 (3H, м), 7,13 (1H, д, J=3,3 Гц), 7,18-7,31 (2H, м), 7,50 (1H, д, J=2,0 Гц), 7,68 (1H, д, J=2,0 Гц), 9,20 (1H, с).
[Пример 35]
[Формула 282]

К раствору 100 мг метил-5-циклопропил-2-((1-(3-(2,2,2-трифторэтокси)бензил)-1H-индол-5-ил)амино)бензоата в 1 мл этанола и 1 мл тетрагидрофурана при комнатной температуре добавляли 81 мкл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при внешней температуре 40-50°C в течение 2 часов. К реакционной смеси добавляли 162 мкл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при внешней температуре 40-50°C в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду, и корректировали полученную смесь до pH 2,0 добавлением 2 M соляной кислоты. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-50/50), к полученному таким образом остатку добавляли циклогексан и диизопропиловый эфир, и собирали твердое вещество путем фильтрования с получением 43 мг 5-циклопропил-2-((1-(3-(2,2,2-трифторэтокси)бензил)-1H-индол-5-ил)амино)бензойной кислоты в виде бледно-коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,48-0,56 (2H, м), 0,79-0,88 (2H, м), 1,76-1,88 (1H, м), 4,73 (2H, кв., J=8,8 Гц), 5,38 (2H, с), 6,43 (1H, д, J=2,6 Гц), 6,82-7,03 (6H, м), 7,23-7,32 (1H, м), 7,38 (1H, д, J=2,0 Гц), 7,44 (1H, д, J=9,2 Гц), 7,52 (1H, д, J=3,3 Гц), 7,60 (1H, д, J=2,6 Гц).
[Пример 36]
[Формула 283]

Смесь 105 мг 1-бензил-1H-индол-5-амина, 100 мг метил-2-хлор-5-циклопропилникотината, 21,7 мг трис(дибензилиденацетон)-дипалладия(0), 27,3 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 308 мг карбоната цезия и 2 мл толуола перемешивали в герметизированной пробирке при внешней температуре 120-130°C в течение 3 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-70/30) с получением 126 мг метил-2-((1-бензил-1H-индол-5-ил)амино)-5-циклопропилникотината в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 0,58-0,66 (2H, м), 0,87-0,95 (2H, м), 1,75-1,87 (1H, м), 3,92 (3H, с), 5,31 (2H, с), 6,51 (1H, д, J=3,3 Гц), 7,07-7,14 (3H, м), 7,19-7,33 (5H, м), 7,89 (1H, д, J=2,0 Гц), 7,91 (1H, д, J=2,6 Гц), 8,19 (1H, д, J=2,6 Гц), 9,83 (1H, с).
[Пример 37]
[Формула 284]

К раствору 120 мг метил-2-((1-бензил-1H-индол-5-ил)амино)-5-циклопропилникотината в 1,0 мл этанола и 1,0 мл тетрагидрофурана при комнатной температуре добавляли 120 мкл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при внешней температуре 50-60°C в течение 2 часов. После охлаждения реакционной смеси до комнатной температуры, к смеси добавляли воду, корректировали полученную смесь до pH 3,0 добавлением 2 M соляной кислоты, и к ней добавляли этилацетат и воду. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли диизопропиловый эфир, этилацетат и циклогексан, и собирали твердое вещество путем фильтрования с получением 70 мг 2-((1-бензил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,58-0,68 (2H, м), 0,85-0,96 (2H, м), 1,82-1,95 (1H, м), 5,40 (2H, с), 6,43 (1H, д, J=2,6 Гц), 7,11-7,40 (7H, м), 7,47 (1H, д, J=2,6 Гц), 7,86 (1H, д, J=2,0 Гц), 7,93-7,99 (1H, м), 8,18 (1H, д, J=2,0 Гц), 10,11 (1H, с).
МС (ESI, m/z): 384 (M+H)+, 382 (M-H)-.
[Пример 38]
[Формула 285]
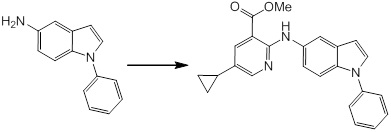
Смесь 99 мг 1-фенил-1H-индол-5-амина, 100 мг метил-2-хлор-5-циклопропилникотината, 21,7 мг трис(дибензилиденацетон)-дипалладия(0), 27,3 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 308 мг карбоната цезия и 2 мл толуола перемешивали в герметизированной пробирке при внешней температуре 120-130°C в течение 3 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-70/30), к полученному таким образом остатку добавляли циклогексан, и собирали твердое вещество путем фильтрования с получением 120 мг метил-5-циклопропил-2-((1-фенил-1H-индол-5-ил)амино)никотината в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,71 (2H, м), 0,88-0,97 (2H, м), 1,87-2,00 (1H, м), 3,90 (3H, с), 6,67 (1H, д, J=3,3 Гц), 7,28 (1H, дд, J=8,6, 2,0 Гц), 7,35-7,43 (1H, м), 7,49-7,63 (5H, м), 7,65 (1H, д, J=3,3 Гц), 7,91 (1H, д, J=2,6 Гц), 8,12 (1H, д, J=2,0 Гц), 8,26 (1H, д, J=2,6 Гц), 9,93 (1H, с).
[Пример 39]
[Формула 286]

К суспензии 112 мг метил-5-циклопропил-2-((1-фенил-1H-индол-5-ил)амино)никотината в 1,0 мл этанола и 1,0 мл тетрагидрофурана при комнатной температуре добавляли 117 мкл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при внешней температуре 40-50°C в течение 1 часа и 30 минут. Реакционную смесь охлаждали до комнатной температуры, затем к ней добавляли воду, и корректировали полученную смесь до pH 3,0 добавлением 2 M соляной кислоты. Твердое вещество собирали путем фильтрования с получением 60 мг 5-циклопропил-2-((1-фенил-1H-индол-5-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,71 (2H, м), 0,87-0,97 (2H, м), 1,86-1,98 (1H, м), 6,67 (1H, д, J=3,3 Гц), 7,27 (1H, дд, J=8,6, 2,0 Гц), 7,35-7,44 (1H, м), 7,49-7,63 (5H, м), 7,65 (1H, д, J=3,3 Гц), 7,91 (1H, д, J=2,6 Гц), 8,13 (1H, д, J=2,0 Гц), 8,21 (1H, д, J=2,0 Гц), 10,25 (1H, с).
[Пример 40]
[Формула 287]

Смесь 100 мг 1-метил-3-фенил-1H-индол-6-амина, 95 мг метил-2-хлор-5-циклопропилникотината, 20,6 мг трис(дибензилиденацетон)-дипалладия(0), 26 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 0,29 г карбоната цезия и 2 мл бутилацетата нагревали с обратным холодильником в течение 4 часов в атмосфере азота. К реакционной смеси добавляли 20,6 мг трис(дибензилиденацетон)дипалладия(0) и 24 мг 2-(дициклогексилфосфино)-3,6-диметокси-2',4',6'-триизопропил-1,1'-бифенила, и нагревали полученную смесь с обратным холодильником в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-70/30) с получением 120 мг метил-5-циклопропил-2-((1-метил-3-фенил-1H-индол-6-ил)амино)никотината в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,65-0,72 (2H, м), 0,89-0,98 (2H, м), 1,89-2,00 (1H, м), 3,81 (3H, с), 3,92 (3H, с), 7,21 (1H, д, J=7,3 Гц), 7,26 (1H, дд, J=8,9, 1,7 Гц), 7,38-7,47 (2H, м), 7,61 (1H, с), 7,67 (2H, д, J=7,9 Гц), 7,80 (1H, д, J=8,6 Гц), 7,93 (1H, д, J=2,6 Гц), 8,05 (1H, д, J=2,0 Гц), 8,30 (1H, д, J=2,6 Гц), 10,09 (1H, с).
[Пример 41]
[Формула 288]

К раствору 120 мг метил-5-циклопропил-2-((1-метил-3-фенил-1H-индол-6-ил)амино)никотината в 1,0 мл этанола и 1,0 мл тетрагидрофурана при комнатной температуре добавляли 121 мкл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при внешней температуре 50-60°C в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры, затем к ней добавляли воду, и корректировали полученную смесь до pH 2,7 добавлением 2 M соляной кислоты. Полученное твердое вещество собирали путем фильтрования с получением 95 мг 5-циклопропил-2-((1-метил-3-фенил-1H-индол-6-ил)амино)никотиновой кислоты в виде бледно-коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,64-0,72 (2H, м), 0,88-0,98 (2H, м), 1,87-2,00 (1H, м), 3,81 (3H, с), 7,17-7,27 (2H, м), 7,37-7,47 (2H, м), 7,61 (1H, с), 7,63-7,69 (2H, м), 7,79 (1H, д, J=8,6 Гц), 7,92 (1H, д, J=2,6 Гц), 8,08 (1H, д, J=1,3 Гц), 8,27 (1H, д, J=2,6 Гц), 10,38 (1H, с).
МС (ESI, m/z): 384 (M+H)+, 382 (M-H)-.
[Пример 42]
[Формула 289]
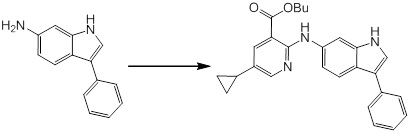
Смесь 0,41 г 3-фенил-1H-индол-6-амина, 0,41 г метил-2-хлор-5-циклопропилникотината, 88,7 мг трис(дибензилиденацетон)-дипалладия(0), 112 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 1,26 г карбоната цезия и 4 мл бутилацетата перемешивали в герметизированной пробирке при внешней температуре 110-130°C в течение 2 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-70/30) с получением 0,17 г бутил-5-циклопропил-2-((3-фенил-1H-индол-6-ил)амино)никотината в виде бледно-коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 0,60-0,69 (2H, м), 0,85-1,05 (5H, м), 1,50 (2H, с, J=7,6 Гц), 1,73-1,91 (3H, м), 4,35 (2H, т, J=6,6 Гц), 7,14 (1H, дд, J=8,6, 2,0 Гц), 7,22-7,31 (3H, м), 7,38-7,47 (2H, м), 7,67 (1H, д, J=6,6 Гц), 7,84 (1H, д, J=8,6 Гц), 7,94 (1H, д, J=2,0 Гц), 8,15-8,28 (2H, м), 10,14 (1H, с).
[Пример 43]
[Формула 290]

К раствору 30 мг бутил-5-циклопропил-2-((3-фенил-1H-индол-6-ил)амино)никотината в 1,0 мл этанола и 1,0 мл тетрагидрофурана при комнатной температуре добавляли 28 мкл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при внешней температуре 40-50°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры, затем к ней добавляли воду, и корректировали полученную смесь до pH 3,0 добавлением 2 M соляной кислоты. Твердое вещество собирали путем фильтрования и очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 20/80-0/100), к полученному остатку добавляли гексан и этилацетат, и собирали твердое вещество путем фильтрования с получением 7 мг 5-циклопропил-2-((3-фенил-1H-индол-6-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,63-0,70 (2H, м), 0,89-0,97 (2H, м), 1,88-2,00 (1H, м), 7,03 (1H, дд, J=8,9, 1,7 Гц), 7,21 (1H, т, J=7,6 Гц), 7,38-7,46 (2H, м), 7,59 (1H, д, J=2,6 Гц), 7,65-7,71 (2H, м), 7,77 (1H, д, J=8,6 Гц), 7,90 (1H, д, J=2,6 Гц), 8,22-8,28 (2H, м), 10,56 (1H, уш.с), 11,23 (1H, с).
МС (ESI, m/z): 370 (M+H)+, 368 (M-H)-.
[Пример 44]
[Формула 291]
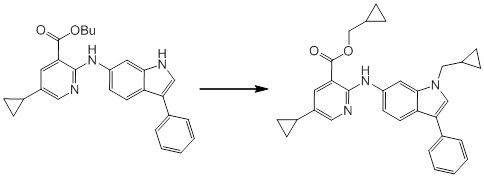
К раствору 82 мг бутил-5-циклопропил-2-((3-фенил-1H-индол-6-ил)амино)никотината в 2 мл N,N-диметилацетамида при охлаждении на льду добавляли 8,5 мг 60% гидрида натрия и перемешивали полученную смесь в течение 10 минут. К реакционной смеси при охлаждении на льду по каплям добавляли 21 мкл (бромметил)циклопропана, и перемешивали полученную смесь при комнатной температуре в течение 1 часа. К реакционной смеси по каплям добавляли 8,5 мл 60% гидрида натрия и 63 мкл (бромметил)циклопропана, и перемешивали полученную смесь при комнатной температуре в течение 30 минут, а затем перемешивали при внешней температуре 30-50°C в течение 2 часов. К реакционной смеси добавляли этилацетат и воду, и корректировали полученную смесь до pH 2,0 добавлением 2 M соляной кислоты. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-70/30) с получением 53,3 мг циклопропилметил-5-циклопропил-2-((1-(циклопропилметил)-3-фенил-1H-индол-6-ил)амино)никотината в виде желтого масла.
1H-ЯМР (CDCl3) δ: 0,36-0,48 (4H, м), 0,62-0,72 (6H, м), 0,89-1,00 (2H, м), 1,24-1,39 (2H, м), 1,81-1,93 (1H, м), 4,01 (2H, д, J=6,6 Гц), 4,18 (2H, д, J=7,3 Гц), 7,21 (1H, дд, J=8,6, 2,0 Гц), 7,24-7,29 (1H, м), 7,34 (1H, с), 7,38-7,47 (2H, м), 7,64-7,71 (2H, м), 7,85 (1H, д, J=8,6 Гц), 7,99 (1H, д, J=2,6 Гц), 8,05 (1H, д, J=2,0 Гц), 8,25 (1H, д, J=2,6 Гц), 10,12 (1H, с).
[Пример 45]
[Формула 292]

К раствору 53 мг циклопропилметил-5-циклопропил-2-((1-(циклопропилметил)-3-фенил-1H-индол-6-ил)амино)никотината в 1,0 мл этанола и 1,0 мл тетрагидрофурана при комнатной температуре добавляли 44 мкл 5 M водного раствора гидроксида натрия и перемешивали полученную смесь при внешней температуре 40-50°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры, затем к ней добавляли воду, и корректировали полученную смесь до pH 2,7 добавлением 2 M соляной кислоты. Твердое вещество собирали путем фильтрования с получением 40 мг 5-циклопропил-2-((1-(циклопропилметил)-3-фенил-1H-индол-6-ил)амино)никотиновой кислоты в виде бледно-коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,43-0,61 (4H, м), 0,63-0,72 (2H, м), 0,88-0,99 (2H, м), 1,22-1,39 (1H, м), 1,88-2,00 (1H, м), 4,05 (2H, д, J=7,3 Гц), 7,17-7,27 (2H, м), 7,39-7,47 (2H, м), 7,63-7,72 (3H, м), 7,79 (1H, д, J=8,6 Гц), 7,91 (1H, д, J=2,0 Гц), 8,17 (1H, д, J=1,3 Гц), 8,27 (1H, д, J=2,0 Гц), 10,35 (1H, с).
МС (ESI, m/z): 424 (M+H)+.
[Пример 46]
[Формула 293]

Реакционную смесь 50 мг метил-2-((1H-индол-5-ил)амино)-5-хлорбензоата, 38,1 мг 4-бромхлорбензола, 1,9 мг ацетата палладия, 9,6 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 108 мг карбоната цезия и 0,58 мл толуола нагревали с обратным холодильником в течение 3 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем к смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением 49 мг метил-5-хлор-2-((1-(4-хлорфенил)-1H-индол-5-ил)амино)бензоата в виде масла.
1H-ЯМР (CDCl3) δ: 3,92 (3H, с), 6,65 (1H, д, J=3,3 Гц), 6,96 (1H, д, J=9,2 Гц), 7,09 (1H, дд, J=8,6, 2,0 Гц), 7,17 (1H, дд, J=8,9, 2,3 Гц), 7,32 (1H, д, J=3,3 Гц), 7,40-7,56 (6H, м), 7,92 (1H, д, J=2,6 Гц), 9,37 (1H, уш.с).
[Пример 47]
[Формула 294]

К раствору 40,5 мг метил-5-хлор-2-((1-(4-хлорфенил)-1H-индол-5-ил)амино)бензоата в 0,5 мл этанола при комнатной температуре добавляли 78,8 мкл 5 M водного раствора гидроксида натрия и перемешивали полученную смесь при внешней температуре 80°C в течение 10 минут. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к смеси воду и 3 M соляную кислоту. Твердое вещество собирали путем фильтрования с получением 35,5 мг 5-хлор-2-((1-(4-хлорфенил)-1H-индол-5-ил)амино)бензойной кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 6,68 (1H, д, J=3,3 Гц), 7,02 (1H, д, J=9,2 Гц), 7,06 (1H, дд, J=8,9, 2,3 Гц), 7,24 (1H, дд, J=9,2, 2,6 Гц), 7,50 (1H, д, J=2,0 Гц), 7,56 (1H, д, J=8,6 Гц), 7,59-7,66 (4H, м), 7,67 (1H, д, J=3,3 Гц), 7,82 (1H, д, J=2,6 Гц).
МС (ESI, m/z): 395 (M-H)-.
[Пример 48]
[Формула 295]

Реакционную смесь 50 мг метил-2-((1H-индол-5-ил)амино)-5-хлорбензоата, 19,4 мкл 3-бромпиридина, 1,6 мг йодида меди (I), 70,5 мг ортофосфата калия, 5,2 мкл транс-N,N'-диметилциклогексан-1,2-диамина и 0,58 мл толуола перемешивали при 100°C в течение 2 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, и добавляли к ней воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением 16 мг метил-5-хлор-2-((1-(пиридин-3-ил)-1H-индол-5-ил)амино)бензоата в виде масла.
[Пример 49]
[Формула 296]
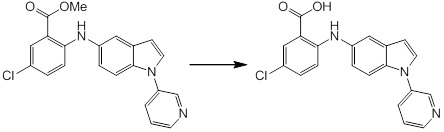
К раствору 16 мг метил-5-хлор-2-((1-(пиридин-3-ил)-1H-индол-5-ил)амино)бензоата в 0,2 мл этанола при комнатной температуре добавляли 16,9 мкл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при внешней температуре 80°C в течение 10 минут. Реакционную смесь охлаждали до комнатной температуры, а затем к смеси добавляли воду и 3 M соляную кислоту, и собирали твердое вещество путем фильтрования с получением 14,9 мг 5-хлор-2-((1-(пиридин-3-ил)-1H-индол-5-ил)амино)бензойной кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 6,74 (1H, д, J=3,3 Гц), 7,01 (1H, д, J=9,2 Гц), 7,12 (1H, дд, J=8,6, 2,0 Гц), 7,30-7,39 (1H, м), 7,53-7,67 (3H, м), 7,75-7,84 (2H, м), 8,06-8,15 (1H, м), 8,62 (1H, д, J=4,6 Гц), 8,88 (1H, д, J=2,6 Гц), 9,50-9,76 (1H, м).
МС (ESI, m/z): 362 (M-H)-.
[Пример 50]
[Формула 297]

К раствору 50 мг 2-((1-бензил-1H-индол-5-ил)амино)-5-хлорбензойной кислоты в 0,5 мл тетрагидрофурана при охлаждении на льду добавляли 50,4 мг 1,1'-карбонилдиимидазола и перемешивали полученную смесь при комнатной температуре в течение 30 минут. К реакционной смеси при охлаждении на льду добавляли 46,6 мкл 1,8-диазабицикло[5.4.0]ундец-7-ена и 29,6 мг метансульфонамида, и перемешивали полученную смесь при комнатной температуре в течение 2,5 часов. К реакционной смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (хлороформ/метанол) с получением 14,3 мг 2-((1-бензил-1H-индол-5-ил)амино)-5-хлор-N-(метилсульфонил)бензамида в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 2,90 (3H, с), 5,40 (2H, с), 6,43 (1H, д, J=3,3 Гц), 6,88-6,95 (2H, м), 7,09 (1H, дд, J=9,2, 2,6 Гц), 7,19-7,36 (6H, м), 7,42 (1H, д, J=8,6 Гц), 7,49 (1H, д, J=3,3 Гц), 7,92 (1H, д, J=3,3 Гц), 10,85 (1H, уш.с).
МС (ESI, m/z): 454 (M+H)+, 452 (M-H)-.
[Пример 51]
[Формула 298]

Смесь 46,2 мг метил-2-((1H-индол-5-ил)амино)-5-хлорбензоата, 26,8 мг 2-фторфенил(метил)сульфона, 100 мг карбоната цезия и 0,5 мл N,N-диметилацетамида перемешивали при внешней температуре 80°C в течение 2,5 часов. Реакционную смесь охлаждали до комнатной температуры и оставляли отстаиваться в течение ночи. Реакционную смесь перемешивали при 80°C в течение 2 часов, а затем добавляли воду, 2 M соляную кислоту и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (хлороформ/метанол) с получением 4,9 мг 5-хлор-2-((1-(2-(метилсульфонил)фенил)-1H-индол-5-ил)амино)бензойной кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 2,74 (3H, с), 6,67 (1H, д, J=3,3 Гц), 6,95-7,01 (2H, м), 7,04 (1H, д, J=9,2 Гц), 7,15-7,25 (1H, м), 7,44-7,54 (2H, м), 7,58 (1H, дд, J=7,9, 1,3 Гц), 7,78-7,95 (3H, м), 8,21 (1H, дд, J=7,9, 2,0 Гц).
МС (ESI, m/z): 441 (M+H)+, 439 (M-H)-.
[Пример 52]
[Формула 299]

Смесь 0,500 г этил-2-амино-5-гидроксибензоата, 0,856 г 1-бензил-5-бром-1H-индола, 0,137 г ацетата палладия, 0,174 г 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 1,95 г карбоната цезия и 5,0 мл толуола нагревали с обратным холодильником в течение 1 часа в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем к смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением 84 мг этил-2-((1-бензил-1H-индол-5-ил)амино)-5-гидроксибензоата в виде масла.
[Пример 53]
[Формула 300]
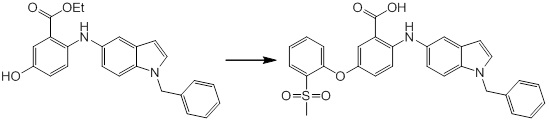
К раствору 44,3 мг этил-2-((1-бензил-1H-индол-5-ил)амино)-5-гидроксибензоата в 0,5 мл N,N-диметилацетамида при охлаждении на льду добавляли 14,3 мг трет-бутоксида калия. После перемешивания полученной таким образом смеси в течение 10 минут к смеси при охлаждении на льду добавляли 22,1 мг 2-фторфенил(метил)сульфона, и перемешивали полученную смесь при внешней температуре 80°C в течение 4 часов. Реакционную смесь охлаждали до комнатной температуры и оставляли отстаиваться в течение ночи, а затем добавляли к ней 74,9 мг карбоната цезия, и перемешивали полученную смесь при 80°C в течение 1,5 часов. Реакционную смесь охлаждали до комнатной температуры, а затем к смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (хлороформ/метанол). Полученное твердое вещество очищали методом препаративной тонкослойной хроматографии (хлороформ/метанол) с получением 8,4 мг 2-((1-бензил-1H-индол-5-ил)амино)-5-(2-(метилсульфонил)-фенокси)бензойной кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,36 (3H, с), 5,43 (2H, с), 6,47 (1H, д, J=2,6 Гц), 6,90-7,06 (3H, м), 7,15-7,37 (7H, м), 7,43-7,52 (2H, м), 7,54 (1H, д, J=2,6 Гц), 7,57-7,69 (2H, м), 7,89 (1H, дд, J=7,6, 1,7 Гц), 9,49 (1H, с).
МС (ESI, m/z): 513 (M+H)+, 511 (M-H)-.
[Пример 54]
[Формула 301]
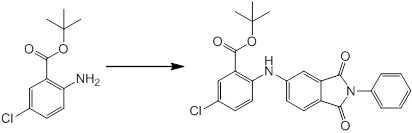
Смесь 0,226 г трет-бутил-2-амино-5-хлорбензоата, 0,300 г 5-бром-2-фенилизоиндолин-1,3-диона, 54,6 мг трис(дибензилиденацетон)дипалладия(0), 68,9 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 0,648 г карбоната цезия и 2,3 мл толуола перемешивали при внешней температуре 80°C в течение 3 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры и оставляли отстаиваться в течение 64,5 часов, а затем к смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат). Полученное твердое вещество промывали метанолом с получением 0,199 г трет-бутил-5-хлор-2-((1,3-диоксо-2-фенилизоиндолин-5-ил)амино)бензоата в виде желтого твердого вещества.
[Пример 55]
[Формула 302]
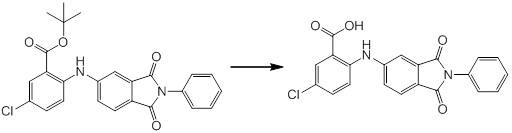
К 0,100 г трет-бутил-5-хлор-2-((1,3-диоксо-2-фенилизоиндолин-5-ил)амино)бензоата при комнатной температуре добавляли 0,5 мл трифторуксусной кислоты и перемешивали полученную смесь при внешней температуре 60°C в течение 10 минут. После охлаждения реакционной смеси до комнатной температуры, трифторуксусную кислоту отгоняли в условиях пониженного давления. К полученному остатку добавляли этилацетат, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления с получением 45 мг 5-хлор-2-((1,3-диоксо-2-фенилизоиндолин-5-ил)амино)бензойной кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 7,39-7,47 (3H, м), 7,48-7,65 (6H, м), 7,85 (1H, д, J=8,6 Гц), 7,91 (1H, д, J=2,6 Гц), 9,80 (1H, с).
МС (ESI, m/z): 393 (M+H)+, 391 (M-H)-.
[Пример 56]
[Формула 303]

Смесь 0,100 г метил-2-амино-5-циклогексилбензоата, 0,123 г 1-бензил-5-бром-1H-индола, 19,7 мг трис(дибензилиденацетон)-дипалладия(0), 24,8 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 0,280 г карбоната цезия и 1,0 мл толуола перемешивали при внешней температуре 100°C в течение 2 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем к смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток последовательно очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) и препаративной тонкослойной хроматографии (гексан/этилацетат) с получением 3,5 мг метил-2-((1-бензил-1H-индол-5-ил)амино)-5-циклогексилбензоата в виде желтого масла.
1H-ЯМР (CDCl3) δ: 1,13-2,11 (10H, м), 2,28-2,60 (1H, м), 3,91 (3H, с), 5,33 (2H, с), 6,43-6,66 (1H, м), 6,88-7,67 (11H, м), 7,70-7,95 (1H, м), 9,23 (1H, с).
[Пример 57]
[Формула 304]

К раствору 3,5 мг метил-2-((1-бензил-1H-индол-5-ил)амино)-5-циклогексилбензоата в 0,5 мл этанола при комнатной температуре добавляли 0,1 мл 5 M водного раствора гидроксида натрия и перемешивали полученную смесь при внешней температуре 80°C в течение 20 минут. Реакционную смесь охлаждали до комнатной температуры, а затем к смеси добавляли 2 M соляную кислоту и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (хлороформ/метанол) с получением 3 мг 2-((1-бензил-1H-индол-5-ил)амино)-5-циклогексилбензойной кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,13-1,44 (5H, м), 1,61-1,86 (5H, м), 2,30-2,45 (1H, м), 5,41 (2H, с), 6,44 (1H, д, J=3,3 Гц), 6,89 (1H, д, J=8,6 Гц), 6,95 (1H, дд, J=8,6, 2,0 Гц), 7,08-7,47 (8H, м), 7,51 (1H, д, J=2,6 Гц), 7,69 (1H, д, J=2,0 Гц).
МС (ESI/APCI, m/z): 425 (M+H)+, 423 (M-H)-.
[Пример 58]
[Формула 305]

Смесь 40 мг метил-2-((1H-индол-5-ил)амино)-5-циклопропилбензоата, 14,7 мкл йодбензола, 12 мг трис(дибензилиденацетон)дипалладия(0), 25 мг 2-дициклогексилфосфино-2',4',6'-триизопропилбифенила, 55,6 мг ортофосфата калия и 0,4 мл толуола перемешивали при внешней температуре 100°C в течение 16 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем к смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления, а затем очищали полученный остаток методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением 18,1 мг метил-5-циклопропил-2-((1-фенил-1H-индол-5-ил)амино)бензоата в виде желтого масла.
1H-ЯМР (CDCl3) δ: 0,54-0,72 (2H, м), 0,79-1,02 (2H, м), 1,75-1,89 (1H, м), 3,91 (3H, с), 6,58-6,73 (1H, м), 6,94-7,18 (3H, м), 7,30-7,44 (2H, м), 7,46-7,65 (6H, м), 7,66-7,76 (1H, м), 9,25 (1H, с).
[Пример 59]
[Формула 306]

К раствору 18,1 мг метил-5-циклопропил-2-((1-фенил-1H-индол-5-ил)амино)бензоата в 0,18 мл этанола при комнатной температуре добавляли 37,8 мкл 5 M водного раствора гидроксида натрия и перемешивали полученную смесь при внешней температуре 70°C в течение 15 минут. Реакционную смесь охлаждали до комнатной температуры, а затем к смеси добавляли воду и 2 M соляную кислоту. Твердое вещество собирали путем фильтрования и перекристаллизовывали из этанола с получением 5,4 мг 5-циклопропил-2-((1-фенил-1H-индол-5-ил)амино)бензойной кислоты в виде зеленого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,49-0,61 (2H, м), 0,79-0,92 (2H, м), 1,77-1,91 (1H, м), 6,66 (1H, д, J=2,6 Гц), 6,92-7,13 (3H, м), 7,33-7,73 (9H, м), 9,41 (1H, уш.с), 12,92 (1H, уш.с).
МС (ESI, m/z): 369 (M+H)+, 367 (M-H)-.
[Пример 60]
[Формула 307]

Смесь 50 мг 3-бензил-6-бромбензо[d]оксазол-2(3H)-она, 37,3 мг трет-бутил-2-амино-5-хлорбензоата, 7,5 мг трис(дибензилиденацетон)дипалладия(0), 9,5 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 107 мг карбоната цезия и 0,3 мл толуола перемешивали при внешней температуре 80°C в течение 2,5 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры и оставляли отстаиваться в течение ночи, а затем к смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением 47,5 мг трет-бутил-2-((3-бензил-2-оксо-2,3-дигидробензо[d]оксазол-6-ил)амино)-5-хлорбензоата в виде масла.
1H-ЯМР (CDCl3) δ: 1,60 (9H, с), 5,00 (2H, с), 6,77 (1H, д, J=8,6 Гц), 6,90-7,00 (2H, м), 7,13 (1H, д, J=2,0 Гц), 7,19 (1H, дд, J=9,2, 2,6 Гц), 7,28-7,41 (5H, м), 7,84 (1H, д, J=2,6 Гц), 9,45 (1H, с).
[Пример 61]
[Формула 308]

К раствору 20 мг трет-бутил-2-((3-бензил-2-оксо-2,3-дигидробензо[d]оксазол-6-ил)амино)-5-хлорбензоата в 0,2 мл дихлорметана при охлаждении на льду добавляли 0,1 мл трифторуксусной кислоты, и перемешивали полученную смесь при комнатной температуре в течение 3 часов и 20 минут. Трифторуксусную кислоту отгоняли в условиях пониженного давления. Полученное твердое вещество промывали этилацетатом с получением 8,9 мг 2-((3-бензил-2-оксо-2,3-дигидробензо[d]оксазол-6-ил)амино)-5-хлорбензойной кислоты в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 5,05 (2H, с), 7,03 (1H, д, J=9,2 Гц), 7,08 (1H, дд, J=8,6, 2,0 Гц), 7,20 (1H, д, J=8,6 Гц), 7,27-7,46 (7H, м), 7,80 (1H, с), 9,50 (1H, с).
МС (ESI/APCI, m/z): 395 (M+H)+, 393 (M-H)-.
[Пример 62]
[Формула 309]
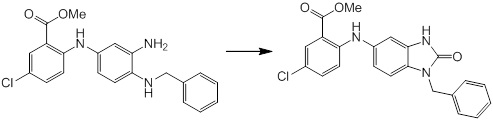
К раствору 31,3 мг метил-2-((3-амино-4-(бензиламино)фенил)амино)-5-хлорбензоата в 0,6 мл тетрагидрофурана при комнатной температуре добавляли 19,9 мг 1,1'-карбонилдиимидазола и перемешивали полученную смесь при комнатной температуре в течение 1 часа и 10 минут. К смеси добавляли 19,9 мг 1,1'-карбонилдиимидазола, и перемешивали полученную смесь при комнатной температуре в течение 55 минут. К реакционной смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением 22,3 мг метил-2-((1-бензил-2-оксо-2,3-дигидро-1H-бензо[d]имидазол-5-ил)амино)-5-хлорбензоата в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ: 3,90 (3H, с), 5,07 (2H, с), 6,78-6,98 (4H, м), 7,18 (1H, дд, J=8,9, 2,3 Гц), 7,23-7,39 (5H, м), 7,90 (1H, д, J=2,6 Гц), 8,32 (1H, с), 9,29 (1H, с).
[Пример 63]
[Формула 310]

К раствору 3,0 мг метил-2-((1-бензил-2-оксо-2,3-дигидро-1H-бензо[d]имидазол-5-ил)амино)-5-хлорбензоата в 0,1 мл этанола при комнатной температуре добавляли 50 мкл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при внешней температуре 50°C в течение 20 минут. Реакционную смесь охлаждали до комнатной температуры, затем к смеси добавляли воду и 2 M соляную кислоту, и собирали твердое вещество путем фильтрования с получением 2,0 мг 2-((1-бензил-2-оксо-2,3-дигидро-1H-бензо[d]имидазол-5-ил)амино)-5-хлорбензойной кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 5,00 (2H, с), 6,81-6,92 (2H, м), 6,95 (1H, д, J=8,6 Гц), 7,03 (1H, д, J=7,9 Гц), 7,22-7,39 (6H, м), 7,78 (1H, д, J=2,6 Гц), 9,44 (1H, уш.с), 11,01 (1H, с).
МС (ESI/APCI, m/z): 394 (M+H)+, 392 (M-H)-.
[Пример 64]
[Формула 311]

К раствору 18 мг метил-2-((1-бензил-2-оксо-2,3-дигидро-1H-бензо[d]имидазол-5-ил)амино)-5-хлорбензоата в 0,4 мл тетрагидрофурана при комнатной температуре добавляли 5,5 мкл йодметана и 12,2 мг карбоната калия, и перемешивали полученную смесь при 40°C в течение 30 минут. К смеси добавляли 5,5 мкл йодметана, и перемешивали полученную смесь при внешней температуре 40°C в течение 15 минут. Реакционную смесь охлаждали до комнатной температуры, и добавляли к ней воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления с получением 19 мг метил-2-((1-бензил-3-метил-2-оксо-2,3-дигидро-1H-бензо[d]имидазол-5-ил)амино)-5-хлорбензоата в виде масла.
[Пример 65]
[Формула 312]

Способом, аналогичным описанному в примере 63, 2-((1-бензил-3-метил-2-оксо-2,3-дигидро-1H-бензо[d]имидазол-5-ил)амино)-5-хлорбензойную кислоту получали из метил-2-((1-бензил-3-метил-2-оксо-2,3-дигидро-1H-бензо[d]имидазол-5-ил)амино)-5-хлорбензоата.
1H-ЯМР (ДМСО-d6) δ: 3,36 (3H, с), 5,06 (2H, с), 6,91 (1H, дд, J=8,6, 2,0 Гц), 6,98 (1H, д, J=9,2 Гц), 7,06-7,17 (2H, м), 7,22-7,41 (6H, м), 7,80 (1H, д, J=2,6 Гц), 9,51 (1H, с).
МС (ESI/APCI, m/z): 406 (M-H)-.
[Пример 66]
[Формула 313]
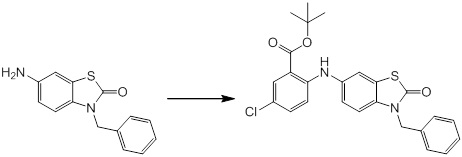
Смесь 50 мг 6-амино-3-бензилбензо[d]тиазол-2(3H)-она, 56,4 мг трет-бутил-2-бром-5-хлорбензоата, 10,1 мг трис(дибензилиденацетон)дипалладия(0), 12,7 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 143 мг карбоната цезия и 1,0 мл толуола перемешивали при внешней температуре 80°C в течение 1 часа в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем к смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (хлороформ/метанол) с получением 83,2 мг трет-бутил-2-((3-бензил-2-оксо-2,3-дигидробензо[d]тиазол-6-ил)амино)-5-хлорбензоата в виде масла.
[Пример 67]
[Формула 314]

К 83,2 мг трет-бутил-2-((3-бензил-2-оксо-2,3-дигидробензо[d]тиазол-6-ил)амино)-5-хлорбензоата при комнатной температуре добавляли 0,2 мл трифторуксусной кислоты и перемешивали полученную смесь при внешней температуре 50°C в течение 30 минут. После охлаждения реакционной смеси до комнатной температуры, трифторуксусную кислоту отгоняли в условиях пониженного давления. К полученному твердому веществу добавляли этилацетат, и собирали твердое вещество путем фильтрования с получением 15,2 мг 2-((3-бензил-2-оксо-2,3-дигидробензо[d]тиазол-6-ил)амино)-5-хлорбензойной кислоты в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 5,19 (2H, с), 7,04 (1H, д, J=8,6 Гц), 7,16-7,42 (8H, м), 7,66 (1H, д, J=2,0 Гц), 7,81 (1H, д, J=2,6 Гц), 9,54 (1H, с).
МС (ESI/APCI, m/z): 409 (M-H)-.
[Пример 68]
[Формула 315]
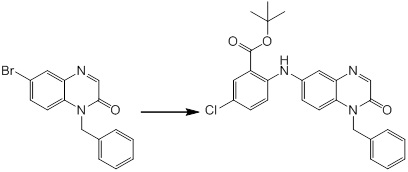
Смесь 21,7 мг 1-бензил-6-бромхиноксалин-2(1H)-она, 30 мг трет-бутил-2-амино-5-хлорбензоата, 4,4 мг трис(дибензилиденацетон)дипалладия(0), 5,5 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 61,9 мг карбоната цезия и 0,3 мл толуола нагревали с обратным холодильником в течение 30 минут в атмосфере азота, затем к смеси добавляли 4,4 мг трис(дибензилиденацетон)дипалладия(0) и 5,5 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, и нагревали полученную смесь с обратным холодильником в течение 30 минут. К смеси дополнительно добавляли 4,4 мг трис(дибензилиденацетон)-дипалладия(0) и 5,5 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, и нагревали полученную смесь с обратным холодильником в течение 30 минут. Реакционную смесь охлаждали до комнатной температуры, а затем к смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением 6,4 мг трет-бутил-2-((1-бензил-2-оксо-1,2-дигидрохиноксалин-6-ил)амино)-5-хлорбензоата в виде масла.
1H-ЯМР (CDCl3) δ: 1,60 (9H, с), 5,49 (2H, с), 7,07-7,41 (9H, м), 7,75 (1H, д, J=2,6 Гц), 7,87 (1H, д, J=2,6 Гц), 8,41 (1H, с), 9,61 (1H, с).
[Пример 69]
[Формула 316]

К 6,3 мг трет-бутил-2-((1-бензил-2-оксо-1,2-дигидрохиноксалин-6-ил)амино)-5-хлорбензоата при комнатной температуре добавляли 0,2 мл трифторуксусной кислоты и перемешивали полученную смесь при комнатной температуре в течение 1 часа. Трифторуксусную кислоту отгоняли в условиях пониженного давления. Полученный остаток последовательно очищали методом колоночной хроматографии на силикагеле (хлороформ/метанол) и препаративной тонкослойной хроматографии (хлороформ/метанол) с получением 1,3 мг 2-((1-бензил-2-оксо-1,2-дигидрохиноксалин-6-ил)амино)-5-хлорбензойной кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 5,49 (2H, с), 7,18 (1H, д, J=9,2 Гц), 7,23-7,42 (6H, м), 7,43-7,50 (2H, м), 7,69 (1H, с), 7,84 (1H, д, J=2,6 Гц), 8,36 (1H, с).
МС (ESI/APCI, m/z): 404 (M-H)-.
[Пример 70]
[Формула 317]
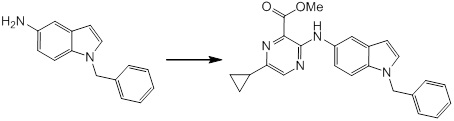
Смесь 260 мг 1-бензил-1H-индол-5-амина, 0,3 г метил-3-бром-6-циклопропилпиразин-2-карбоксилата, 54 мг трис(дибензилиденацетон)дипалладия(0), 68 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 0,76 г карбоната цезия и 3 мл толуола перемешивали при 150°C в течение 50 минут в атмосфере азота с использованием микроволновой установки. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-50/50), к полученному таким образом остатку добавляли гексан, и собирали твердое вещество путем фильтрования с получением 80 мг метил-3-((1-бензил-1H-индол-5-ил)амино)-6-циклопропилпиразин-2-карбоксилата в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,80-0,99 (4H, м), 2,05-2,17 (1H, м), 3,90 (3H, с), 5,41 (2H, с), 6,45 (1H, д, J=3,3 Гц), 7,14 (1H, дд, J=8,6, 2,0 Гц), 7,17-7,35 (5H, м), 7,39 (1H, д, J=8,6 Гц), 7,50 (1H, д, J=3,3 Гц), 7,87 (1H, д, J=2,0 Гц), 8,33 (1H, с), 9,71 (1H, с).
[Пример 71]
[Формула 318]

К раствору 0,15 г метил-3-((1-бензил-1H-индол-5-ил)амино)-6-циклопропилпиразин-2-карбоксилата в 1,0 мл этанола и 1,0 мл тетрагидрофурана при комнатной температуре добавляли 0,15 мл 5 M водного раствора гидроксида натрия, и нагревали полученную смесь до внешней температуры 40-50°C. К реакционной смеси добавляли 5,0 мл этанола и 5,0 мл воды, и перемешивали полученную смесь при внешней температуре 40-50°C в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры, к смеси добавляли воду, и корректировали полученную смесь до pH 2,8 добавлением 2 M соляной кислоты. Твердое вещество собирали путем фильтрования и очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью хлороформ/метанол = 100/0-90/10), к полученному остатку добавляли диизопропиловый эфир, и собирали твердое вещество путем фильтрования с получением 80 мг 3-((1-бензил-1H-индол-5-ил)амино)-6-циклопропилпиразин-2-карбоновой кислоты в виде оранжевого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,86-0,96 (4H, м), 2,03-2,16 (1H, м), 5,41 (2H, с), 6,45 (1H, д, J=2,6 Гц), 7,14 (1H, дд, J=8,6, 2,0 Гц), 7,17-7,35 (5H, м), 7,39 (1H, д, J=9,2 Гц), 7,49 (1H, д, J=3,3 Гц), 7,90 (1H, д, J=2,0 Гц), 8,31 (1H, с), 10,11 (1H, с).
МС (ESI, m/z): 385 (M+H)+, 383 (M-H)-.
[Пример 72]
[Формула 319]
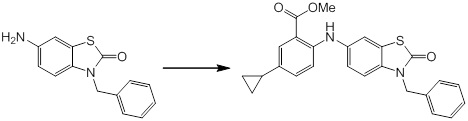
Смесь 50 мг 6-амино-3-бензилбензо[d]тиазол-2(3H)-она, 50 мг метил-2-бром-5-циклопропилбензоата, 8,9 мг трис(дибензилиденацетон)дипалладия(0), 11,3 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 128 мг карбоната цезия и 0,5 мл толуола перемешивали при внешней температуре 80°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры, а затем к смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением 12,2 мг метил-2-((3-бензил-2-оксо-2,3-дигидробензо[d]тиазол-6-ил)амино)-5-циклопропилбензоата в виде масла.
1H-ЯМР (CDCl3) δ: 0,56-0,66 (2H, м), 0,81-0,95 (2H, м), 1,77-1,89 (1H, м), 3,89 (3H, с), 5,14 (2H, с), 6,90 (1H, д, J=8,6 Гц), 6,97-7,14 (3H, м), 7,23-7,45 (6H, м), 7,68 (1H, д, J=2,0 Гц), 9,22 (1H, с).
[Пример 73]
[Формула 320]

К раствору 12,2 мг метил-2-((3-бензил-2-оксо-2,3-дигидробензо[d]тиазол-6-ил)амино)-5-циклопропилбензоата в 0,12 мл этанола при комнатной температуре добавляли 11,3 мкл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при внешней температуре 50°C в течение 1 часа и перемешивали при 70°C в течение 30 минут. Реакционную смесь охлаждали до комнатной температуры, а затем к смеси добавляли воду, 1 M соляную кислоту и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом препаративной тонкослойной хроматографии (хлороформ/метанол) с получением 3,3 мг 2-((3-бензил-2-оксо-2,3-дигидробензо[d]тиазол-6-ил)амино)-5-циклопропилбензойной кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,51-0,59 (2H, м), 0,82-0,91 (2H, м), 1,80-1,92 (1H, м), 5,17 (2H, с), 7,02 (1H, д, J=8,6 Гц), 7,08 (1H, дд, J=8,6, 2,0 Гц), 7,15 (1H, дд, J=8,9, 2,3 Гц), 7,19-7,41 (6H, м), 7,56-7,64 (2H, м), 9,42 (1H, уш.с), 13,04 (1H, уш.с).
МС (ESI/APCI, m/z): 415 (M-H)-.
[Пример 74]
[Формула 321]
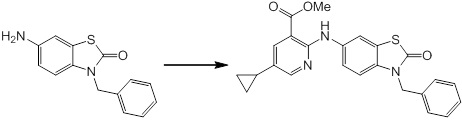
Смесь 41,5 мг 6-амино-3-бензилбензо[d]тиазол-2(3H)-она, 50,2 мг метил-2-хлор-5-циклопропилникотината, 8,9 мг трис(дибензилиденацетон)дипалладия(0), 11,3 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 128 мг карбоната цезия и 0,5 мл толуола перемешивали при внешней температуре 80°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры, а затем к смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом хроматографии на силикагеле (гексан/этилацетат) с получением 23,4 мг метил-2-((3-бензил-2-оксо-2,3-дигидробензо[d]тиазол-6-ил)амино)-5-циклопропилникотината в виде масла.
1H-ЯМР (CDCl3) δ: 0,59-0,68 (2H, м), 0,90-0,99 (2H, м), 1,77-1,89 (1H, м), 3,92 (3H, с), 5,14 (2H, с), 6,89 (1H, д, J=9,3 Гц), 7,19-7,38 (6H, м), 7,90 (1H, д, J=2,6 Гц), 8,04 (1H, д, J=2,0 Гц), 8,19 (1H, д, J=2,6 Гц), 9,97 (1H, с).
[Пример 75]
[Формула 322]

К раствору 23,4 мг метил-2-((3-бензил-2-оксо-2,3-дигидробензо[d]тиазол-6-ил)амино)-5-циклопропилникотината в 0,23 мл этанола при комнатной температуре добавляли 21,6 мкл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при внешней температуре 50°C в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры, а затем к смеси добавляли воду, 1 M соляную кислоту и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученное твердое вещество промывали метанолом с получением 4,8 мг 2-((3-бензил-2-оксо-2,3-дигидробензо[d]тиазол-6-ил)амино)-5-циклопропилникотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,70 (2H, м), 0,88-0,97 (2H, м), 1,84-1,97 (1H, м), 5,17 (2H, с), 7,21 (1H, д, J=9,2 Гц), 7,24-7,40 (5H, м), 7,47 (1H, дд, J=8,6, 2,0 Гц), 7,89 (1H, д, J=2,0 Гц), 8,15 (1H, д, J=2,0 Гц), 8,21 (1H, д, J=2,6 Гц), 10,22 (1H, с), 13,57 (1H, с).
МС (ESI/APCI, m/z): 418 (M+H)+, 416 (M-H)-.
[Пример 76]
[Формула 323]

К раствору метил-2-((3-амино-4-(фениламино)фенил)амино)-5-циклопропилбензоата, полученного в справочном примере 29, в 1,7 мл N,N-диметилформамида при комнатной температуре добавляли 137 мг 1,1'-карбонилдиимидазола и перемешивали полученную смесь при комнатной температуре в течение 30 минут. К реакционной смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением 82,3 мг метил-5-циклопропил-2-((2-оксо-1-фенил-2,3-дигидро-1H-бензо[d]имидазол-5-ил)амино)бензоата в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,52-0,61 (2H, м), 0,83-0,92 (2H, м), 1,81-1,93 (1H, м), 3,85 (3H, д, J=2,6 Гц), 6,86 (1H, дд, J=8,6, 2,0 Гц), 6,91-7,06 (3H, м), 7,12 (1H, дд, J=8,6, 2,0 Гц), 7,37-7,48 (1H, м), 7,51-7,65 (5H, м), 9,06 (1H, с), 11,14 (1H, с).
[Пример 77]
[Формула 324]

К раствору 10 мг метил-5-циклопропил-2-((2-оксо-1-фенил-2,3-дигидро-1H-бензо[d]имидазол-5-ил)амино)бензоата в 0,2 мл N,N-диметилформамида при комнатной температуре добавляли 7,8 мкл йодметана и 16,4 мг карбоната цезия и перемешивали полученную смесь при комнатной температуре в течение 30 минут. К реакционной смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением 11,3 мг метил-5-циклопропил-2-((3-метил-2-оксо-1-фенил-2,3-дигидро-1H-бензо[d]имидазол-5-ил)амино)бензоата в виде масла.
1H-ЯМР (CDCl3) δ: 0,58-0,67 (2H, м), 0,81-0,98 (2H, м), 1,77-1,90 (1H, м), 3,46 (3H, с), 3,92 (3H, с), 6,89-6,99 (2H, м), 7,00-7,12 (3H, м), 7,35-7,45 (1H, м), 7,46-7,60 (4H, м), 7,71 (1H, с), 9,27 (1H, с).
[Пример 78]
[Формула 325]

К раствору 11,3 мг метил-5-циклопропил-2-((3-метил-2-оксо-1-фенил-2,3-дигидро-1H-бензо[d]имидазол-5-ил)амино)бензоата в 0,2 мл этанола при комнатной температуре добавляли 21,8 мкл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при комнатной температуре в течение 13 часов и 10 минут и перемешивали при 50°C в течение 10 минут. Реакционную смесь охлаждали до комнатной температуры, а затем к смеси добавляли воду и 1 M соляную кислоту. Полученное твердое вещество собирали путем фильтрования с получением 10,3 мг 5-циклопропил-2-((3-метил-2-оксо-1-фенил-2,3-дигидро-1H-бензо[d]имидазол-5-ил)амино)бензойной кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,52-0,61 (2H, м), 0,81-0,92 (2H, м), 1,81-1,92 (1H, м), 3,39 (3H, с), 6,92 (1H, дд, J=8,6, 2,0 Гц), 6,98-7,14 (3H, м), 7,18 (1H, д, J=2,0 Гц), 7,39-7,50 (1H, м), 7,51-7,66 (5H, м), 9,44 (1H, уш.с), 12,99 (1H, уш.с).
МС (ESI/APCI, m/z): 400 (M+H)+, 398 (M-H)-.
[Пример 79]
[Формула 326]

Способом, аналогичным описанному в примере 77, метил-5-циклопропил-2-((2-оксо-1-фенил-3-(2,2,2-трифторэтил)-2,3-дигидро-1H-бензо[d]имидазол-5-ил)амино)бензоат получали из метил-5-циклопропил-2-((2-оксо-1-фенил-2,3-дигидро-1H-бензо[d]имидазол-5-ил)амино)бензоата и 2,2,2-трифторэтилтрифторметансульфоната.
1H-ЯМР (CDCl3) δ: 0,58-0,67 (2H, м), 0,82-0,96 (2H, м), 1,78-1,90 (1H, м), 3,92 (3H, с), 4,50 (2H, кв., J=8,6 Гц), 6,97 (1H, дд, J=8,6, 2,0 Гц), 7,01-7,12 (4H, м), 7,37-7,48 (1H, м), 7,50-7,60 (4H, м), 7,71 (1H, с), 9,31 (1H, с).
[Пример 80]
[Формула 327]

К раствору 11,3 мг метил-5-циклопропил-2-((2-оксо-1-фенил-3-(2,2,2-трифторэтил)-2,3-дигидро-1H-бензо[d]имидазол-5-ил)амино)бензоата в 0,2 мл этанола при комнатной температуре добавляли 18,8 мкл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при комнатной температуре в течение 15 часов. К реакционной смеси добавляли воду и 2 M соляную кислоту, и собирали твердое вещество путем фильтрования с получением 9,0 мг 5-циклопропил-2-((2-оксо-1-фенил-3-(2,2,2-трифторэтил)-2,3-дигидро-1H-бензо[d]имидазол-5-ил)амино)бензойной кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,53-0,61 (2H, м), 0,83-0,92 (2H, м), 1,80-1,93 (1H, м), 4,88 (2H, кв., J=9,5 Гц), 6,94-7,13 (4H, м), 7,34-7,53 (2H, м), 7,55-7,65 (5H, м), 9,51 (1H, с).
МС (ESI/APCI, m/z): 468 (M+H)+, 466 (M-H)-.
[Пример 81]
[Формула 328]
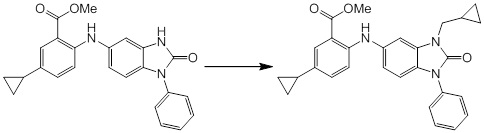
Способом, аналогичным описанному в примере 77, метил-5-циклопропил-2-((3-(циклопропилметил)-2-оксо-1-фенил-2,3-дигидро-1H-бензо[d]имидазол-5-ил)амино)бензоат получали из метил-5-циклопропил-2-((2-оксо-1-фенил-2,3-дигидро-1H-бензо[d]имидазол-5-ил)амино)бензоата и (бромметил)циклопропана.
1H-ЯМР (CDCl3) δ: 0,42-0,50 (2H, м), 0,54-0,66 (4H, м), 0,83-0,95 (2H, м), 1,20-1,33 (1H, м), 1,78-1,89 (1H, м), 3,79 (2H, д, J=6,6 Гц), 3,92 (3H, д, J=2,0 Гц), 6,92 (1H, дд, J=8,6, 2,0 Гц), 6,99-7,10 (4H, м), 7,35-7,43 (1H, м), 7,49-7,61 (4H, м), 7,71 (1H, с), 9,28 (1H, с).
[Пример 82]
[Формула 329]
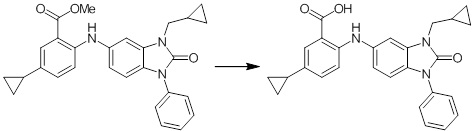
Способом, аналогичным описанному в примере 63, 5-циклопропил-2-((3-(циклопропилметил)-2-оксо-1-фенил-2,3-дигидро-1H-бензо[d]имидазол-5-ил)амино)бензойную кислоту получали из метил-5-циклопропил-2-((3-(циклопропилметил)-2-оксо-1-фенил-2,3-дигидро-1H-бензо[d]имидазол-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 0,36-0,61 (6H, м), 0,82-0,93 (2H, м), 1,18-1,32 (1H, м), 1,81-1,92 (1H, м), 3,80 (2H, д, J=6,6 Гц), 6,92 (1H, дд, J=8,3, 1,7 Гц), 6,99-7,14 (3H, м), 7,29 (1H, д, J=2,0 Гц), 7,40-7,50 (1H, м), 7,52-7,65 (5H, м), 9,42 (1H, с).
МС (ESI/APCI, m/z): 440 (M+H)+, 438 (M-H)-.
[Пример 83]
[Формула 330]

К раствору 80 мг метил-5-хлор-2-((1-(3-гидроксибензил)-1H-индол-5-ил)амино)бензоата в 0,8 мл N,N-диметилформамида при комнатной температуре добавляли 30 мг карбоната калия, и перемешивали полученную смесь в герметизированной пробирке в течение 10 минут. К реакционной смеси добавляли 21 мкл 1,1,1-трифтор-2-йодэтана, и перемешивали полученную смесь при внешней температуре 50°C в течение 1 часа и 55 минут. К реакционной смеси добавляли 21 мкл 1,1,1-трифтор-2-йодэтана, и перемешивали полученную смесь при внешней температуре 80°C в течение 3 часов и 50 минут. К реакционной смеси добавляли 21 мкл 1,1,1-трифтор-2-йодэтана, и перемешивали полученную смесь при внешней температуре 100°C в течение 3 часов. К реакционной смеси добавляли этилацетат и воду, и корректировали полученную смесь до pH 2,0 добавлением 2 M соляной кислоты. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле с получением 30 мг метил-5-хлор-2-((1-(3-(2,2,2-трифторэтокси)бензил)-1H-индол-5-ил)амино)бензоата в виде желтого масла.
1H-ЯМР (CDCl3) δ: 3,90 (3H, с), 4,28 (2H, кв., J=8,1 Гц), 5,29 (2H, с), 6,52 (1H, д, J=2,6 Гц), 6,69-6,74 (1H, м), 6,78-6,86 (2H, м), 6,92 (1H, д, J=9,2 Гц), 7,02 (1H, дд, J=8,6, 2,0 Гц), 7,10-7,17 (2H, м), 7,20-7,31 (2H, м), 7,49 (1H, д, J=2,0 Гц), 7,90 (1H, д, J=2,6 Гц), 9,33 (1H, с).
[Пример 84]
[Формула 331]

Способом, аналогичным описанному в примере 63, 5-хлор-2-((1-(3-(2,2,2-трифторэтокси)бензил)-1H-индол-5-ил)амино)бензойную кислоту получали из метил-5-хлор-2-((1-(3-(2,2,2-трифторэтокси)бензил)-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 4,73 (2H, кв., J=9,0 Гц), 5,40 (2H, с), 6,47 (1H, д, J=3,3 Гц), 6,84-7,02 (5H, м), 7,23-7,34 (2H, м), 7,43 (1H, д, J=2,0 Гц), 7,49 (1H, д, J=8,6 Гц), 7,56 (1H, д, J=3,3 Гц), 7,78 (1H, д, J=2,6 Гц), 9,50 (1H, уш.с).
МС (ESI/APCI, m/z): 473 (M-H)-.
[Пример 85]
[Формула 332]

Способом, аналогичным описанному в примере 20, метил-2-((3-бензоил-1-бензил-1H-индол-5-ил)амино)-5-хлорбензоат получали из (5-амино-1-бензил-1H-индол-3-ил)(фенил)метанона и метил-2-бром-5-хлорбензоата.
1H-ЯМР (ДМСО-d6) δ: 3,88 (3H, с), 5,56 (2H, с), 7,04 (1H, д, J=8,6 Гц), 7,14-7,20 (1H, м), 7,23-7,86 (13H, м), 8,12-8,17 (1H, м), 8,30 (1H, с), 9,31 (1H, с).
[Пример 86]
[Формула 333]

Способом, аналогичным описанному в примере 37, 2-((3-бензоил-1-бензил-1H-индол-5-ил)амино)-5-хлорбензойную кислоту получали из метил-2-((3-бензоил-1-бензил-1H-индол-5-ил)амино)-5-хлорбензоата.
1H-ЯМР (ДМСО-d6) δ: 5,56 (2H, с), 7,05 (1H, д, J=9,2 Гц), 7,17 (1H, дд, J=8,6, 2,0 Гц), 7,24-7,41 (6H, м), 7,52-7,66 (4H, м), 7,77-7,86 (3H, м), 8,14 (1H, д, J=2,0 Гц), 8,29 (1H, с), 9,63 (1H, уш.с).
МС (ESI/APCI, m/z): 479 (M-H)-.
[Пример 87]
[Формула 334]
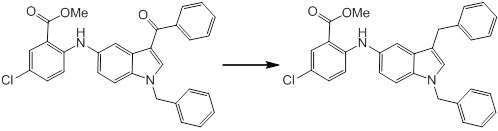
К раствору 30 мг метил-2-((3-бензоил-1-бензил-1H-индол-5-ил)амино)-5-хлорбензоата в 0,6 мл тетрагидрофурана при 0°C добавляли 0,2 мл 1 M раствора комплекса боран/тетрагидрофуран в тетрагидрофуране, и перемешивали полученную смесь при комнатной температуре в течение 5 часов и 50 минут. К реакционной смеси добавляли 0,2 мл 1 M раствора комплекса боран/тетрагидрофуран в тетрагидрофуране, и перемешивали полученную смесь в течение 3 часов и 30 минут, а затем оставляли отстаиваться в течение 2 суток. К реакционной смеси добавляли этилацетат и воду. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле с получением 22 мг метил-5-хлор-2-((1,3-дибензил-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (CDCl3) δ: 3,89 (3H, с), 4,07 (2H, с), 5,26 (2H, с), 6,82-7,37 (16H, м), 7,88 (1H, д, J=2,6 Гц), 9,30 (1H, с).
[Пример 88]
[Формула 335]
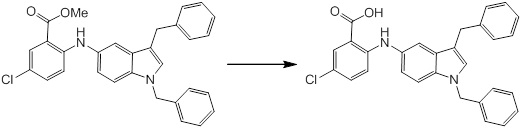
Способом, аналогичным описанному в примере 63, 5-хлор-2-((1,3-дибензил-1H-индол-5-ил)амино)бензойную кислоту получали из метил-5-хлор-2-((1,3-дибензил-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 4,03 (2H, с), 5,37 (2H, с), 6,81 (1H, д, J=9,2 Гц), 6,93-6,99 (1H, м), 7,11-7,38 (13H, м), 7,43 (1H, д, J=8,6 Гц), 7,77 (1H, д, J=2,6 Гц), 9,48 (1H, уш.с).
МС (ESI/APCI, m/z): 465 (M-H)-.
[Пример 89]
[Формула 336]
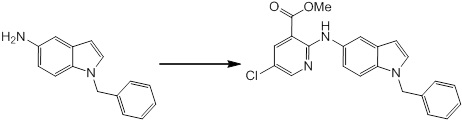
Смесь 216 мг 1-бензил-1H-индол-5-амина, 200 мг метил-2,5-дихлорникотината, 89 мг трис(дибензилиденацетон)дипалладия(0), 112 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 0,63 г карбоната цезия и 3 мл толуола нагревали с обратным холодильником в течение 3 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-70/30) с получением 45 мг метил-2-((1-бензил-1H-индол-5-ил)амино)-5-хлорникотината в виде бледно-коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,90 (3H, с), 5,41 (2H, с), 6,46 (1H, д, J=2,6 Гц), 7,12-7,55 (8H, м), 7,87 (1H, д, J=2,0 Гц), 8,18 (1H, д, J=3,3 Гц), 8,37 (1H, д, J=2,6 Гц), 9,89 (1H, с).
МС (ESI, m/z): 392 (M+H)+.
[Пример 90]
[Формула 337]

К раствору 45 мг метил-2-((1-бензил-1H-индол-5-ил)амино)-5-хлорникотината в 1,0 мл этанола при комнатной температуре добавляли 46 мкл 5 M водного раствора гидроксида натрия и 2,0 мл тетрагидрофурана, и перемешивали полученную смесь при внешней температуре 40-60°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры, затем к ней добавляли воду, и корректировали полученную смесь до pH 2,0 добавлением 2 M соляной кислоты. Твердое вещество собирали путем фильтрования и промывали водой и диизопропиловым эфиром с получением 30 мг 2-((1-бензил-1H-индол-5-ил)амино)-5-хлорникотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 5,41 (2H, с), 6,45 (1H, д, J=2,6 Гц), 7,12-7,35 (6H, м), 7,39 (1H, д, J=8,6 Гц), 7,50 (1H, д, J=2,6 Гц), 7,89 (1H, д, J=2,0 Гц), 8,15 (1H, д, J=2,6 Гц), 8,34 (1H, д, J=2,6 Гц), 10,20 (1H, с).
МС (ESI, m/z): 378 (M+H)+, 376 (M-H)-.
[Пример 91]
[Формула 338]

Смесь 100 мг метил-2-((1-бензил-1H-индол-5-ил)амино)-5-хлорбензоата, 127 мг (3-пиридин)циклотриолбората калия, 18 мг бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлорпалладия(II) и 2,0 мл толуола перемешивали в герметизированной пробирке при внешней температуре 110°C в течение 7 часов в атмосфере азота. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле с получением 23 мг метил-2-((1-бензил-1H-индол-5-ил)амино)-5-(пиридин-3-ил)бензоата.
1H-ЯМР (ДМСО-d6) δ: 3,90 (3H, с), 5,45 (2H, с), 6,49 (1H, д, J=3,3 Гц), 6,99-7,08 (2H, м), 7,20-7,60 (9H, м), 7,72 (1H, дд, J=9,2, 2,0 Гц), 7,94-8,02 (1H, м), 8,18 (1H, д, J=2,0 Гц), 8,46-8,52 (1H, м), 8,77-8,83 (1H, м), 9,37 (1H, с).
МС (ESI, m/z): 434 (M+H)+.
[Пример 92]
[Формула 339]

Способом, аналогичным описанному в примере 37, 2-((1-бензил-1H-индол-5-ил)амино)-5-(пиридин-3-ил)бензойную кислоту получали из метил-2-((1-бензил-1H-индол-5-ил)амино)-5-(пиридин-3-ил)бензоата.
1H-ЯМР (ДМСО-d6) δ: 5,44 (2H, с), 6,48 (1H, д, J=2,6 Гц), 7,03 (2H, д, J=9,2 Гц), 7,20-7,37 (5H, м), 7,39-7,53 (3H, м), 7,56 (1H, д, J=3,3 Гц), 7,70 (1H, дд, J=8,9, 2,3 Гц), 7,95-8,02 (1H, м), 8,17 (1H, д, J=2,6 Гц), 8,49 (1H, д, J=4,0 Гц), 8,78-8,83 (1H, с), 9,63 (1H, с), 13,15 (1H, уш.с).
МС (ESI, m/z): 420 (M+H)+, 418 (M-H)-.
[Пример 93]
[Формула 340]

Смесь 245 мг 1-бензил-1H-индол-5-амина, 0,28 г метил-2-бром-5-циклопропилбензоата, 50 мг трис(дибензилиденацетон)-дипалладия(0), 64 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 0,72 г карбоната цезия и 3 мл толуола нагревали с обратным холодильником в герметизированной пробирке в течение 3 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-80/20) с получением 0,3 г метил-2-((1-бензил-1H-индол-5-ил)амино)-5-циклопропилбензоата в виде желтого масла.
1H-ЯМР (CDCl3) δ: 0,55-0,63 (2H, м), 0,81-0,90 (2H, м), 1,75-1,86 (1H, м), 3,90 (3H, с), 5,32 (2H, с), 6,49 (1H, д, J=3,3 Гц), 6,92-7,07 (3H, м), 7,10-7,17 (3H, м), 7,21-7,36 (4H, м), 7,49 (1H, д, J=2,0 Гц), 7,68 (1H, д, J=2,0 Гц), 9,20 (1H, с).
[Пример 94]
[Формула 341]

К раствору 0,3 г метил-2-((1-бензил-1H-индол-5-ил)амино)-5-циклопропилбензоата в 2,0 мл этанола и 2,0 мл тетрагидрофурана при комнатной температуре добавляли 0,3 мл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при внешней температуре 50-60°C в течение 2 часов. После охлаждения реакционной смеси до комнатной температуры, к смеси добавляли воду, полученную смесь корректировали до pH 2,0 добавлением 2 M соляной кислоты, и добавляли к ней этилацетат. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли диизопропиловый эфир, и собирали твердое вещество путем фильтрования с получением 0,18 г 2-((1-бензил-1H-индол-5-ил)амино)-5-циклопропилбензойной кислоты в виде бледно-желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,49-0,56 (2H, м), 0,79-0,89 (2H, м), 1,77-1,88 (1H, м), 5,41 (2H, с), 6,44 (1H, д, J=3,3 Гц), 6,88 (1H, д, J=8,6 Гц), 6,95 (1H, дд, J=8,6, 2,0 Гц), 7,02 (1H, дд, J=8,6, 2,0 Гц), 7,19-7,36 (5H, м), 7,39 (1H, д, J=2,0 Гц), 7,44 (1H, д, J=8,6 Гц), 7,52 (1H, д, J=3,3 Гц), 7,60 (1H, д, J=2,0 Гц), 9,33 (1H, уш.с), 12,86 (1H, уш.с).
МС (ESI, m/z): 383 (M+H)+.
[Пример 95]
[Формула 342]

К раствору 100 мг метил-2-((1H-индол-5-ил)амино)-5-хлорбензоата в 2 мл N,N-диметилацетамида при охлаждении на льду добавляли 42 мг трет-бутоксида калия и перемешивали полученную смесь в течение 5 минут. К реакционной смеси при охлаждении на льду добавляли 36 мкл (бромметил)циклопропана, и перемешивали полученную смесь при той же температуре в течение 45 минут, а затем перемешивали при комнатной температуре в течение 1 часа и 20 минут. К реакционной смеси добавляли воду и этилацетат. Органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-50/50) с получением 80 мг метил-5-хлор-2-((1-(циклопропилметил)-1H-индол-5-ил)амино)бензоата в виде желтого масла.
1H-ЯМР (CDCl3) δ: 0,34-0,40 (2H, м), 0,61-0,67 (2H, м)1,23-1,32 (1H, м), 3,90 (3H, с), 3,97 (2H, д, J=6,6 Гц), 6,46 (1H, д, J=3,3 Гц), 6,91 (1H, д, J=9,2 Гц), 7,05 (1H, дд, J=8,6, 2,0 Гц), 7,13 (1H, дд, J=9,2, 2,6 Гц), 7,24 (1H, д, J=2,6 Гц), 7,34 (1H, д, J=8,6 Гц), 7,47 (1H, д, J=2,0 Гц), 7,90 (1H, д, J=2,6 Гц), 9,33 (1H, с).
[Пример 96]
[Формула 343]

К смешанному раствору 79 мг метил-5-хлор-2-((1-(циклопропилметил)-1H-индол-5-ил)амино)бензоата в 0,8 мл этанола и 0,4 мл тетрагидрофурана при комнатной температуре добавляли 90 мкл 5 M водного раствора гидроксида натрия, и нагревали полученную смесь с обратным холодильником в течение 30 минут. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. К полученному остатку добавляли 6 M соляную кислоту и воду, и собирали твердое вещество путем фильтрования с получением 62 мг 5-хлор-2-((1-(циклопропилметил)-1H-индол-5-ил)амино)бензойной кислоты в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 0,36-0,42 (2H, м), 0,63-0,69 (2H, м), 1,27-1,36 (1H, м), 4,00 (2H, д, J=6,6 Гц), 6,48 (1H, д, J=3,3 Гц), 6,91 (1H, д, J=9,2 Гц), 7,07 (1H, дд, J=8,6, 2,0 Гц), 7,18 (1H, дд, J=8,9, 2,3 Гц), 7,27 (1H, д, J=2,6 Гц), 7,38 (1H, д, J=8,6 Гц), 7,49 (1H, д, J=2,0 Гц), 7,95 (1H, д, J=2,6 Гц), 9,23 (1H, уш.с).
МС (ESI, m/z): 341 (M+H)+, 339 (M-H)-.
[Пример 97]
[Формула 344]

К раствору 90 мг метил-2-((1H-индол-5-ил)амино)-5-хлорбензоата в 3 мл 1,2-дихлорэтана добавляли 52 мг циклопропилбороновой кислоты, 64 мг карбоната натрия, 24 мкл пиридина и 60 мг ацетата меди(II), и нагревали полученную смесь с обратным холодильником в течение 3 часов и 10 минут в атмосфере азота. Реакционную смесь оставляли отстаиваться в течение ночи, а затем нагревали с обратным холодильником в течение 8 часов и 10 минут. К смеси добавляли 52 мг циклопропилбороновой кислоты, 64 мг карбоната натрия, 24 мкл пиридина и 60 мг ацетата меди(II), и нагревали полученную смесь с обратным холодильником в течение 1 часа и 15 минут. После охлаждения реакционной смеси до комнатной температуры, к смеси добавляли этилацетат и водный раствор хлорида аммония, и отфильтровывали нерастворимое вещество. К фильтрату добавляли воду и этилацетат, органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью хлороформ/метанол = 100/0-80/20) с получением 55 мг метил-5-хлор-2-((1-(циклопропил)-1H-индол-5-ил)амино)бензоата в виде коричневого масла.
1H-ЯМР (CDCl3) δ: 1,02-1,08 (4H, м), 3,30-3,38 (1H, м), 3,89 (3H, с), 6,39 (1H, д, J=3,3 Гц), 6,90 (1H, д, J=9,2 Гц), 7,07 (1H, дд, J=8,6, 2,0 Гц), 7,11-7,15 (2H, м), 7,44 (1H, д, J=2,0 Гц), 7,54 (1H, д, J=8,6 Гц), 7,90 (1H, д, J=2,6 Гц), 9,33 (1H, с).
[Пример 98]
[Формула 345]
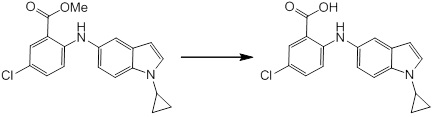
Способом, аналогичным описанному в примере 96, 5-хлор-2-((1-(циклопропил)-1H-индол-5-ил)амино)бензойную кислоту получали из метил-5-хлор-2-((1-(циклопропил)-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (CDCl3) δ: 1,02-1,11 (4H, м), 3,32-3,41 (1H, м), 6,41 (1H, д, J=2,6 Гц), 6,90 (1H, д, J=9,2 Гц), 7,08 (1H, дд, J=8,6, 2,0 Гц), 7,16-7,20 (2H, м), 7,46 (1H, д, J=2,0 Гц), 7,57 (1H, д, J=8,6 Гц), 7,95 (1H, д, J=2,6 Гц), 9,24 (1H, уш.с).
МС (ESI, m/z): 327 (M+H)+, 325 (M-H)-.
[Пример 99]
[Формула 346]
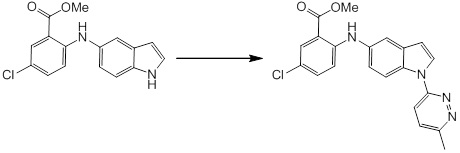
Смесь 34 мг метил-2-((1H-индол-5-ил)амино)-5-хлорбензоата, 27 мг 3-йод-6-метилпиридазина, 2 мг йодида меди(I), 70 мг ортофосфата калия, 4 мкл транс-N,N'-диметилциклогексан-1,2-диамина и 3 мл толуола перемешивали при 135 145°C в течение 30 минут в атмосфере азота с использованием микроволновой установки. Реакционную смесь оставляли отстаиваться в течение ночи, затем к смеси добавляли 2 мг йодида меди(I) и 4 мкл транс-N,N'-диметилциклогексан-1,2-диамина, и перемешивали полученную смесь при 160°C в течение 30 минут в атмосфере азота с использованием микроволновой установки. Реакционную смесь охлаждали до комнатной температуры, а затем фильтровали через мембранный фильтр, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-30/70) с получением 27 мг метил-5-хлор-2-((1-(6-метилпиридазин-3-ил)-1H-индол-5-ил)амино)бензоата в виде желтого масла.
МС (ESI, m/z): 393 (M+H)+.
[Пример 100]
[Формула 347]
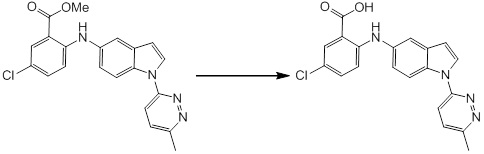
Способом, аналогичным описанному в примере 96, 5-хлор-2-((1-(6-метилпиридазин-3-ил)-1H-индол-5-ил)амино)бензойную кислоту получали из метил-5-хлор-2-((1-(6-метилпиридазин-3-ил)-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 2,67 (3H, с), 6,82 (1H, д, J=3,3 Гц), 7,09 (1H, д, J=8,6 Гц), 7,20 (1H, дд, J=8,6, 2,0 Гц), 7,38 (1H, дд, J=9,2, 2,6 Гц), 7,57 (1H, д, J=2,0 Гц), 7,78 (1H, д, J=9,2 Гц), 7,83 (1H, д, J=2,6 Гц), 8,08 (1H, д, J=7,9 Гц), 8,10 (1H, д, J=2,0 Гц), 8,47 (1H, д, J=8,6 Гц), 9,66 (1H, уш.с).
МС (ESI, m/z): 379 (M+H)+, 377 (M-H)-.
[Пример 101]
[Формула 348]
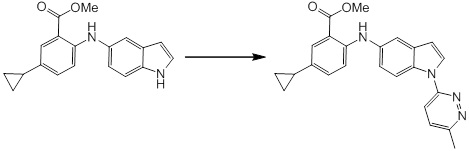
Смесь 100 мг метил-2-((1H-индол-5-ил)амино)-5-циклопропилбензоата, 92 мг 3-йод-6-метилпиридазина, 6 мг йодида меди(I), 210 мг ортофосфата калия, 13 мкл транс-N,N'-диметилциклогексан-1,2-диамина и 3 мл толуола нагревали с обратным холодильником в течение 6 часов и 45 минут в атмосфере азота. Реакционную смесь оставляли отстаиваться в течение ночи, а затем нагревали с обратным холодильником в течение 12 часов и 20 минут. Реакционную смесь фильтровали через мембранный фильтр, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-70/30) с получением 112 мг метил-5-циклопропил-2-((1-(6-метилпиридазин-3-ил)-1H-индол-5-ил)амино)бензоата в виде желтого масла.
МС (ESI, m/z): 399 (M+H)+.
[Пример 102]
[Формула 349]

Способом, аналогичным описанному в примере 96, 5-циклопропил-2-((1-(6-метилпиридазин-3-ил)-1H-индол-5-ил)амино)бензойную кислоту получали из метил-5-циклопропил-2-((1-(6-метилпиридазин-3-ил)-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 0,54-0,59 (2H, м), 0,83-0,90 (2H, м), 1,82-1,91 (1H, м), 2,67 (3H, с), 6,79 (1H, д, J=3,3 Гц), 7,08-7,10 (2H, м), 7,17 (1H, дд, J=9,2, 2,0 Гц), 7,51 (1H, д, J=2,0 Гц), 7,64 (1H, с), 7,77 (1H, д, J=9,2 Гц), 8,07 (1H, д, J=3,3 Гц), 8,09 (1H, д, J=2,0 Гц), 8,44 (1H, д, J=8,6 Гц), 9,47 (1H, с).
МС (ESI, m/z): 385 (M+H)+, 383 (M-H)-.
[Пример 103]
[Формула 350]
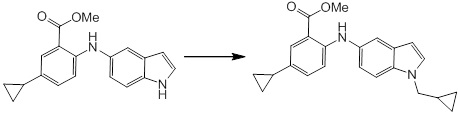
К раствору 100 мг метил-2-((1H-индол-5-ил)амино)-5-циклопропилбензоата в 1 мл N,N-диметилформамида при охлаждении на льду добавляли 40 мг трет-бутоксида калия и перемешивали полученную смесь в течение 5 минут. К смеси при охлаждении на льду добавляли 35 мкл 1-(бромметил)циклопропана, полученную смесь нагревали до комнатной температуры и перемешивали в течение 30 минут. К реакционной смеси добавляли воду и этилацетат. Органический слой разделяли, промывали водой и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-30/70) с получением 135 мг метил-5-циклопропил-2-((1-(циклопропилметил)-1H-индол-5-ил)амино)бензоата в виде желто-коричневого масла.
МС (ESI, m/z): 361 (M+H)+.
[Пример 104]
[Формула 351]

Смесь 135 мг метил-5-циклопропил-2-((1-(циклопропилметил)-1H-индол-5-ил)амино)бензоата, 0,5 мл 5 M водного раствора гидроксида натрия, 2 мл этанола и 2 мл тетрагидрофурана нагревали с обратным холодильником в течение 3 часов. После охлаждения реакционной смеси до комнатной температуры, к смеси добавляли 6 M соляную кислоту и воду, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли воду и метанол, и собирали твердое вещество путем фильтрования с получением 60 мг 5-циклопропил-2-((1-(циклопропилметил)-1H-индол-5-ил)амино)бензойной кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,36-0,41 (2H, м), 0,49-0,56 (4H, м), 0,81-0,88 (2H, м), 1,20-1,30 (1H, м), 1,79-1,88 (1H, м), 4,03 (2H, д, J=7,3 Гц), 6,38 (1H, д, J=3,3 Гц), 6,88 (1H, д, J=8,6 Гц), 6,98 (1H, дд, J=8,6, 2,0 Гц), 7,03 (1H, дд, J=8,9, 2,3 Гц), 7,37 (1H, д, J=2,0 Гц), 7,44 (1H, д, J=3,3 Гц), 7,51 (1H, д, J=8,6 Гц), 7,60 (1H, д, J=2,0 Гц), 9,34 (1H, уш.с).
МС (ESI, m/z): 347 (M+H)+, 345 (M-H)-.
[Пример 105]
[Формула 352]

К раствору 50 мг метил-2-((1H-индол-5-ил)амино)-5-циклопропилбензоата в 2 мл толуола добавляли 37 мг 4-йодбензонитрила, 7 мг трис(дибензилиденацетон)дипалладия(0), 8 мг 2-дициклогексилфосфино-2',4',6'-триизопропилбифенила и 68 мг ортофосфата калия, и нагревали полученную смесь с обратным холодильником в течение 1 часа и 20 минут в атмосфере азота. Реакционную смесь оставляли отстаиваться в течение ночи, к смеси добавляли 14 мг трис(дибензилиденацетон)дипалладия(0) и 16 мг 2-дициклогексилфосфино-2',4',6'-триизопропилбифенила, и нагревали полученную смесь с обратным холодильником в течение 8 часов и 10 минут в атмосфере азота. К реакционной смеси добавляли 37 мг 4-йодбензонитрила, и нагревали полученную смесь с обратным холодильником в течение 2 часов и 30 минут в атмосфере азота. Реакционную смесь оставляли отстаиваться в течение ночи, затем к смеси добавляли 14 мг трис(дибензилиденацетон)-дипалладия(0) и 16 мг 2-дициклогексилфосфино-2',4',6'-триизопропилбифенила, и нагревали полученную смесь с обратным холодильником в течение 9 часов и 50 минут в атмосфере азота. Реакционную смесь оставляли отстаиваться в течение ночи, затем фильтровали через мембранный фильтр, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-50/50). К полученному таким образом остатку добавляли гексан и метанол, и собирали твердое вещество путем фильтрования с получением 20 мг метил-2-((1-(4-цианофенил)-1H-индол-5-ил)амино)-5-циклопропилбензоата в виде желтого твердого вещества.
МС (ESI, m/z): 408 (M+H)+.
[Пример 106]
[Формула 353]
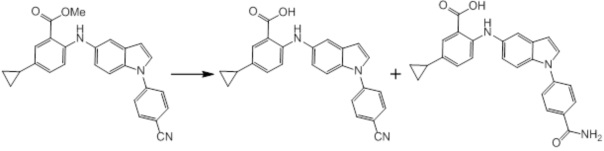
Смесь 20 мг метил-2-((1-(4-цианофенил)-1H-индол-5-ил)амино)-5-циклопропилбензоата, 150 мкл 5 M водного раствора гидроксида натрия, 2 мл тетрагидрофурана и 2 мл этанола нагревали с обратным холодильником в течение 1 часа и 45 минут. К реакционной смеси добавляли 6 M соляную кислоту и воду. Твердое вещество собирали путем фильтрования и очищали методом препаративной тонкослойной хроматографии с получением 6,2 мг 2-((1-(4-цианофенил)-1H-индол-5-ил)амино)-5-циклопропилбензойной кислоты и 2,3 мг 2-((1-(4-карбамоилфенил)-1H-индол-5-ил)амино)-5-циклопропилбензойной кислоты.
[Пример 106-1]
2-((1-(4-Цианофенил)-1H-индол-5-ил)амино)-5-циклопропилбензойная кислота1H-ЯМР (ДМСО-d6) δ: 0,51-0,62 (2H, м), 0,95-1,80 (2H, м), 1,80-1,95 (1H, м), 6,75 (1H, с), 7,02-7,14 (3H, м), 7,51-7,90 (6H, м), 8,04 (2H, д, J=6,6 Гц), 9,47 (1H, уш.с).
МС (ESI, m/z): 394 (M+H)+, 392 (M-H)-.
[Пример 106-2]
2-((1-(4-Карбамоилфенил)-1H-индол-5-ил)амино)-5-циклопропилбензойная кислота1H-ЯМР (ДМСО-d6) δ: 0,54-0,59 (2H, м), 0,84-0,90 (2H, м), 1,82-1,91 (1H, м), 6,72 (1H, д, J=3,3 Гц), 7,01 (1H, д, J=8,6 Гц), 7,07-7,13 (2H, м), 7,46 (1H, с), 7,52 (1H, д, J=2,0 Гц), 7,63-7,77 (5H, м), 8,07-8,11 (3H, м), 9,44 (1H, с).
МС (ESI, m/z): 412 (M+H)+, 410 (M-H)-.
[Пример 107]
[Формула 354]

Смесь 138 мг метил-2-((4-бензиламино-3-(2-(трет-бутокси)-2-оксоэтил)фенил)амино)-5-циклопропилбензоата, 139 мг моногидрата гидроксида лития, 2 мл тетрагидрофурана, 2 мл метанола и 0,5 мл воды перемешивали при внешней температуре 55°C в течение 2 часов и 15 минут. Реакционную смесь оставляли отстаиваться в течение ночи, а затем концентрировали, к полученному остатку добавляли 5 мл трифторуксусной кислоты и 4Å молекулярные сита, и перемешивали полученную смесь при комнатной температуре в течение 1 часа и 40 минут. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия и этилацетат. Органический слой разделяли и последовательно промывали водой и насыщенным водным раствором хлорида натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-0/100). К полученному таким образом остатку добавляли метанол, и собирали твердое вещество путем фильтрования с получением 20 мг 2-((1-бензил-2-оксоиндолин-5-ил)амино)-5-циклопропилбензойной кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,51-0,58 (2H, м), 0,82-0,88 (2H, м), 1,79-1,90 (1H, м), 3,68 (2H, с), 4,88 (2H, с), 6,84 (1H, д, J=7,9 Гц), 6,92 (1H, д, J=8,6 Гц), 7,00-7,08 (2H, м), 7,16 (1H, с), 7,26-7,36 (5H, м), 7,60 (1H, д, J=2,0 Гц).
МС (ESI, m/z): 399 (M+H)+, 397 (M-H)-.
[Пример 108]
[Формула 355]

Смесь 65 мг метил-2-((3-(2-(трет-бутокси)-2-оксоэтил)-4-((циклопропилметил)амино)фенил)амино)-5-циклопропилбензоата, 61 мг моногидрата гидроксида лития, 2 мл тетрагидрофурана, 2 мл метанола и 1 мл воды перемешивали при внешней температуре 55°C в течение 3 часов и 30 минут. Растворитель отгоняли в условиях пониженного давления, к полученному остатку добавляли 3 мл трифторуксусной кислоты и 4Å молекулярные сита, и перемешивали полученную смесь при комнатной температуре в течение 2 часов и 10 минут. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия и этилацетат. Органический слой разделяли и последовательно промывали водой и насыщенным водным раствором хлорида натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-0/100). К полученному таким образом остатку добавляли метанол, и собирали твердое вещество путем фильтрования с получением 5 мг 5-циклопропил-2-((1-(циклопропилметил)-2-оксоиндолин-5-ил)амино)бензойной кислоты в виде оранжевого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,31-0,36 (2H, м), 0,43-0,50 (2H, м), 0,52-0,58 (2H, м), 0,82-0,90 (2H, м), 1,08-1,20 (1H, м), 1,80-1,90 (1H, м), 3,18-3,66 (4H, м), 6,94 (1H, д, J=8,6 Гц), 7,04-7,17 (4H, м), 7,61 (1H, с), 9,31 (1H, уш.с).
МС (ESI, m/z): 363 (M+H)+, 361 (M-H)-.
[Пример 109]
[Формула 356]

Смесь 100 мг 2-(трет-бутил)-1H-индол-5-амина, 142 мг метил-2-бром-5-циклопропилбензоата, 24 мг трис(дибензилиденацетон)-дипалладия(0), 31 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 346 мг карбоната цезия и 2 мл толуола нагревали с обратным холодильником в течение 15 часов и 30 минут в атмосфере азота. Нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-80/20) с получением 178 мг метил-2-((2-(трет-бутил)-1H-индол-5-ил)амино)-5-циклопропилбензоата в виде желтого масла.
МС (ESI, m/z): 363 (M+H)+.
[Пример 110]
[Формула 357]

Способом, аналогичным описанному в примере 96, 2-((2-(трет-бутил)-1H-индол-5-ил)амино)-5-циклопропилбензойную кислоту получали из метил-2-((2-(трет-бутил)-1H-индол-5-ил)амино)-5-циклопропилбензоата.
1H-ЯМР (ДМСО-d6) δ: 0,50-0,56 (2H, м), 0,81-0,87 (2H, м), 1,35 (9H, с), 1,78-1,87 (1H, м), 6,09 (1H, д, J=2,0 Гц), 6,80-6,87 (2H, м), 7,01 (1H, дд, J=8,6, 2,0 Гц), 7,25 (1H, д, J=2,0 Гц), 7,29 (1H, д, J=7,9 Гц), 7,59 (1H, д, J=2,0 Гц), 9,29 (1H, уш.с), 10,90 (1H, с), 12,82 (1H, уш.с).
МС (ESI, m/z): 349 (M+H)+, 347 (M-H)-.
[Пример 111]
[Формула 358]
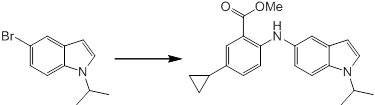
Смесь 100 мг 5-бром-1-изопропил-1H-индола, 84 мг метил-2-амино-5-циклопропилбензоата, 19 мг трис(дибензилиденацетон)-дипалладия(0), 20 мг 2-дициклогексилфосфино-2',4',6'-триизопропилбифенила, 178 мг ортофосфата калия и 2 мл толуола нагревали с обратным холодильником в течение 15 часов и 30 минут в атмосфере азота. Нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-60/40) с получением 16 мг метил-5-циклопропил-2-((1-изопропил-1H-индол-5-ил)амино)бензоата в виде желтого масла.
МС (ESI, m/z): 349 (M+H)+.
[Пример 112]
[Формула 359]

Способом, аналогичным описанному в примере 96, 5-циклопропил-2-((1-изопропил-1H-индол-5-ил)амино)бензойную кислоту получали из метил-5-циклопропил-2-((1-изопропил-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 0,50-0,56 (2H, м), 0,82-0,88 (2H, м), 1,46 (6H, д, J=6,6 Гц), 1,78-1,88 (1H, м), 4,73 (1H, с, J=6,6 Гц), 6,40 (1H, д, J=3,3 Гц), 6,89 (1H, д, J=8,6 Гц), 6,98 (1H, дд, J=8,6, 2,0 Гц), 7,03 (1H, дд, J=8,9, 2,3 Гц), 7,37 (1H, д, J=1,3 Гц), 7,47-7,52 (2H, м), 7,60 (1H, д, J=2,0 Гц), 9,34 (1H, уш.с), 12,86 (1H, уш.с).
МС (ESI, m/z): 335 (M+H)+, 333 (M-H)-.
[Пример 113]
[Формула 360]

Смесь 80 мг 1-бензил-1H-индол-5-амина, 100 мг метил-2-йод-5-изопропилбензоата, 15 мг трис(дибензилиденацетон)дипалладия(0), 19 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 214 мг карбоната цезия и 2 мл толуола нагревали с обратным холодильником в течение 3 часов и 10 минут в атмосфере азота. Нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-80/20) с получением 122 мг метил-2-((1-бензил-1H-индол-5-ил)амино)-5-изопропилбензоата в виде желтого масла.
МС (ESI, m/z): 399 (M+H)+.
[Пример 114]
[Формула 361]

Способом, аналогичным описанному в примере 96, 2-((1-бензил-1H-индол-5-ил)амино)-5-изопропилбензойную кислоту получали из метил-2-((1-бензил-1H-индол-5-ил)амино)-5-изопропилбензоата.
1H-ЯМР (ДМСО-d6) δ: 1,15 (6H, д, J=6,6 Гц), 2,73 (1H, с, J=6,6 Гц), 5,37 (2H, с), 6,36 (1H, д, J=2,6 Гц), 6,85 (1H, дд, J=8,6, 2,0 Гц), 6,90 (1H, дд, J=8,6, 2,0 Гц), 6,96 (1H, д, J=8,6 Гц), 7,18-7,35 (7H, м), 7,41 (1H, д, J=3,3 Гц), 7,75 (1H, д, J=2,6 Гц), 11,50 (1H, с).
МС (ESI, m/z): 385 (M+H)+, 383 (M-H)-.
[Пример 115]
[Формула 362]
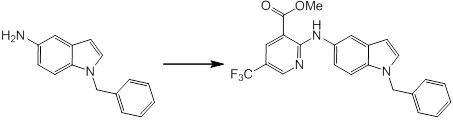
Смесь 97 мг 1-бензил-1H-индол-5-амина, 100 мг метил-2-хлор-5-(трифторметил)никотината, 19 мг трис(дибензилиденацетон)-дипалладия(0), 24 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 272 мг карбоната цезия и 1 мл бутилацетата нагревали с обратным холодильником в течение 2 часов и 20 минут. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-50/50). К полученному таким образом остатку добавляли воду и метанол, и собирали твердое вещество путем фильтрования с получением 91 мг метил-2-((1-бензил-1H-индол-5-ил)амино)-5-(трифторметил)никотината в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,93 (3H, с), 5,43 (2H, с), 6,48 (1H, д, J=2,6 Гц), 7,18-7,34 (6H, м), 7,43 (1H, д, J=8,6 Гц), 7,54 (1H, д, J=3,3 Гц), 7,88 (1H, д, J=2,0 Гц), 8,38 (1H, д, J=2,6 Гц), 8,66 (1H, д, J=2,0 Гц), 10,20 (1H, с).
МС (ESI, m/z): 426 (M+H)+.
[Пример 116]
[Формула 363]

Смесь 91 мг метил-2-((1-бензил-1H-индол-5-ил)амино)-5-(трифторметил)никотината, 85 мкл 5 M водного раствора гидроксида натрия, 2 мл тетрагидрофурана и 2 мл метанола перемешивали при внешней температуре 40°C в течение 2 часов и 15 минут. Реакционную смесь охлаждали до комнатной температуры, а затем корректировали до pH 3 добавлением к ней 71 мкл 6 M соляной кислоты и воды, и отгоняли растворитель в условиях пониженного давления. К остатку добавляли воду и метанол, и собирали твердое вещество путем фильтрования с получением 80 мг 2-((1-бензил-1H-индол-5-ил)амино)-5-(трифторметил)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 5,43 (2H, с), 6,48 (1H, д, J=3,3 Гц), 7,18-7,34 (6H, м), 7,43 (1H, д, J=8,6 Гц), 7,53 (1H, д, J=2,6 Гц), 7,90 (1H, д, J=2,0 Гц), 8,35 (1H, д, J=2,6 Гц), 8,64 (1H, д, J=2,0 Гц), 10,55 (1H, с).
МС (ESI, m/z): 412 (M+H)+, 410 (M-H)-.
[Пример 117]
[Формула 364]

Смесь 3,96 г трет-бутил-5-амино-1H-индол-1-карбоксилата, 3,50 г метил-2-хлор-5-циклопропилникотината, 0,76 г трис(дибензилиденацетон)дипалладия(0), 0,95 г 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 13,5 г карбоната цезия и 50 мл бутилацетата нагревали с обратным холодильником в течение 2 часов в атмосфере азота, а затем оставляли отстаиваться в течение ночи. Реакционную смесь нагревали с обратным холодильником в течение 5 часов и 55 минут, затем добавляли к ней 100 мг метил-2-хлор-5-циклопропилникотината, нагревали полученную смесь с обратным холодильником в течение 4 часов и 5 минут. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-30/70) с получением 4,35 г трет-бутил-5-((5-циклопропил-3-(метоксикарбонил)пиридин-2-ил)амино)-1H-индол-1-карбоксилата в виде желтого масла.
МС (ESI, m/z): 408 (M+H)+.
[Пример 118]
[Формула 365]

Раствор 4,35 г трет-бутил-5-((5-циклопропил-3-(метоксикарбонил)пиридин-2-ил)амино)-1H-индол-1-карбоксилата в 15 мл N,N-диметилацетамида перемешивали при 150°C в течение 6 часов. Растворитель отгоняли в условиях пониженного давления, а затем очищали полученный остаток методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-80/20). К полученному таким образом остатку добавляли гексан и этилацетат, и собирали твердое вещество путем фильтрования с получением 2,59 г метил-2-((1H-индол-5-ил)амино)-5-циклопропилникотината в виде бледно-коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,68 (2H, м), 0,87-0,95 (2H, м), 1,85-1,96 (1H, м), 3,89 (3H, с), 6,37 (1H, с), 7,15 (1H, дд, J=8,6, 2,0 Гц), 7,29-7,35 (2H, м), 7,88 (1H, д, J=2,7 Гц), 7,93 (1H, д, J=2,1 Гц), 8,21 (1H, д, J=2,0 Гц), 9,82 (1H, с), 10,99 (1H, с).
МС (ESI, m/z): 308 (M+H)+.
[Пример 119]
[Формула 366]

К раствору 150 мг метил-2-((1H-индол-5-ил)амино)-5-циклопропилникотината в 1,5 мл N,N-диметилацетамида при охлаждении на льду добавляли 60 мг трет-бутоксида калия и 33 мкл йодметана, и перемешивали полученную смесь в течение 3 часов и 15 минут, а затем перемешивали при внешней температуре 40°C в течение 1 часа и 50 минут. К смеси добавляли 27 мг трет-бутоксида калия и 15 мкл йодметана, и перемешивали полученную смесь при внешней температуре 40°C в течение 3 часов и 10 минут, затем добавляли к ней 2 мл воды, и перемешивали полученную смесь при той же температуре в течение 45 минут. Реакционную смесь оставляли отстаиваться в течение ночи, затем добавляли к ней 195 мкл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при комнатной температуре в течение 1 часа и 5 минут. Реакционную смесь корректировали до pH 2 добавлением к ней 5 M соляной кислоты и воды. Твердое вещество собирали путем фильтрования и промывали водой и метанолом с получением 28 мг 5-циклопропил-2-((1-метил-1H-индол-5-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,67 (2H, м), 0,87-0,94 (2H, м), 1,85-1,95 (1H, м), 3,77 (3H, с), 6,36 (1H, д, J=2,6 Гц), 7,21 (1H, дд, J=8,6, 2,0 Гц), 7,28 (1H, д, J=3,3 Гц), 7,36 (1H, д, J=9,2 Гц), 7,87 (1H, д, J=2,6 Гц), 7,98 (1H, д, J=2,0 Гц), 8,19 (1H, д, J=2,0 Гц), 10,15 (1H, с), 13,41 (1H, уш.с).
МС (ESI, m/z): 308 (M+H)+, 306 (M-H)-.
[Пример 120]
[Формула 367]

К раствору 150 мг метил-2-((1H-индол-5-ил)амино)-5-циклопропилникотината в 1 мл N,N-диметилацетамида при охлаждении на льду добавляли 60 мг трет-бутоксида калия и 43 мкл йодэтана, и перемешивали полученную смесь в течение 3 часов и 15 минут, а затем перемешивали при внешней температуре 40°C в течение 1 часа и 50 минут. К смеси добавляли 27 мг трет-бутоксида калия и 18 мкл йодэтана, и перемешивали полученную смесь при внешней температуре 40°C в течение 3 часов и 10 минут, затем добавляли к ней 2 мл воды, и перемешивали полученную смесь при той же температуре в течение 45 минут. Реакционную смесь оставляли отстаиваться в течение ночи, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-70/30) с получением 115 мг метил-5-циклопропил-2-((1-этил-1H-индол-5-ил)амино)никотината в виде желтого масла.
МС (ESI, m/z): 336 (M+H)+.
[Пример 121]
[Формула 368]
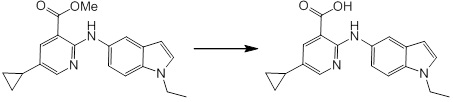
Способом, аналогичным описанному в примере 116, 5-циклопропил-2-((1-этил-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((1-этил-1H-индол-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,67 (2H, м), 0,87-0,94 (2H, м), 1,36 (3H, т, J=6,9 Гц), 1,85-1,95 (1H, м), 4,18 (2H, кв., J=7,0 Гц), 6,37 (1H, д, J=2,6 Гц), 7,20 (1H, дд, J=8,9, 1,7 Гц), 7,35 (1H, д, J=2,6 Гц), 7,40 (1H, д, J=8,6 Гц), 7,88 (1H, д, J=2,0 Гц), 7,95 (1H, д, J=1,3 Гц), 8,18 (1H, д, J=2,6 Гц), 10,14 (1H, с), 13,41 (1H, уш.с).
МС (ESI, m/z): 322 (M+H)+, 320 (M-H)-.
[Пример 122]
[Формула 369]

Смесь 91 мг 1-изопропил-1H-индол-5-амина, 100 мг метил-2-хлор-5-циклопропилникотината, 22 мг трис(дибензилиденацетон)-дипалладия(0), 27 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 308 мг карбоната цезия и 1 мл бутилацетата нагревали с обратным холодильником в течение 3 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем оставляли отстаиваться в течение ночи, и добавляли к ней этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-80/20) с получением 150 мг метил-5-циклопропил-2-((1-изопропил-1H-индол-5-ил)амино)никотината в виде коричневого масла.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,67 (2H, м), 0,85-0,95 (2H, м), 1,45 (6H, д, J=6,6 Гц), 1,88-1,93 (1H, м), 3,84 (3H, с), 4,71 (1H, с, J=6,9 Гц), 6,40 (1H, д, J=2,6 Гц), 7,19 (1H, дд, J=8,6, 2,0 Гц), 7,42-7,47 (2H, м), 7,88 (1H, д, J=2,6 Гц), 7,93 (1H, д, J=2,0 Гц), 8,21 (1H, д, J=2,0 Гц), 9,83 (1H, с).
МС (ESI, m/z): 350 (M+H)+.
[Пример 123]
[Формула 370]

Способом, аналогичным описанному в примере 116, 5-циклопропил-2-((1-изопропил-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((1-изопропил-1H-индол-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,67 (2H, м), 0,87-0,94 (2H, м), 1,45 (6H, д, J=6,6 Гц), 1,86-1,93 (1H, м), 4,71 (1H, с, J=6,6 Гц), 6,39 (1H, д, J=3,3 Гц), 7,19 (1H, дд, J=8,6, 2,0 Гц), 7,41-7,45 (2H, м), 7,87 (1H, д, J=2,6 Гц), 7,94 (1H, д, J=2,0 Гц), 8,19 (1H, д, J=2,0 Гц), 10,12 (1H, с), 13,40 (1H, уш.с).
МС (ESI, m/z): 336 (M+H)+.
[Пример 124]
[Формула 371]

Смесь 118 мг 1-бензил-1H-индол-5-амина, 100 мг метил-2-хлор-5-метилникотината, 25 мг трис(дибензилиденацетон)дипалладия(0), 31 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 352 мг карбоната цезия и 5 мл толуола нагревали с обратным холодильником в течение 5 часов и 30 минут в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-70/30). К полученному таким образом остатку добавляли воду и метанол, и собирали твердое вещество путем фильтрования с получением 60 мг метил-2-((1-бензил-1H-индол-5-ил)амино)-5-метилникотината в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 2,27 (3H, с), 3,88 (3H, с), 5,40 (2H, с), 6,44 (1H, д, J=2,6 Гц), 7,14-7,39 (7H, м), 7,48 (1H, д, J=2,6 Гц), 7,95 (1H, д, J=1,3 Гц), 8,05 (1H, д, J=2,0 Гц), 8,21 (1H, д, J=2,0 Гц), 9,82 (1H, с).
МС (ESI, m/z): 372 (M+H)+.
[Пример 125]
[Формула 372]
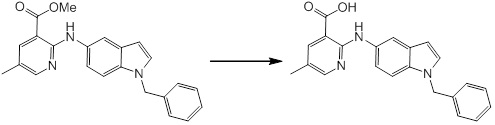
Способом, аналогичным описанному в примере 116, 2-((1-бензил-1H-индол-5-ил)амино)-5-метилникотиновую кислоту получали из метил-2-((1-бензил-1H-индол-5-ил)амино)-5-метилникотината.
1H-ЯМР (ДМСО-d6) δ: 2,21 (3H, с), 5,41 (2H, с), 6,46 (1H, д, J=2,6 Гц), 7,13-7,34 (6H, м), 7,41 (1H, д, J=9,2 Гц), 7,51 (1H, д, J=3,3 Гц), 7,90 (1H, с), 8,10-8,15 (2H, м), 10,19 (1H, с).
МС (ESI, m/z): 358 (M+H)+, 356 (M-H)-.
[Пример 126]
[Формула 373]

К раствору 120 мг метил-2-((1H-индол-5-ил)амино)-5-циклопропилникотината в 2 мл N,N-диметилацетамида при охлаждении на льду добавляли 120 мг трет-бутоксида калия, 85 мкл 1-бром-2-метилпропана и 4Å молекулярные сита и перемешивали полученную смесь в течение 2 часов и 15 минут. К смеси при охлаждении водой добавляли 53 мг трет-бутоксида калия и 85 мкл 1-бром-2-метилпропана, и перемешивали полученную смесь в течение 1 часа и 25 минут. Реакционную смесь оставляли отстаиваться в течение ночи, затем к смеси при охлаждении водой добавляли 53 мг трет-бутоксида калия и 85 мкл 1-бром-2-метилпропана, и перемешивали полученную смесь в течение 2 часов и 20 минут. Реакционную смесь корректировали до pH 3 добавлением к ней 260 мкл 6 M соляной кислоты и воды, а затем добавляли этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-0/100) с получением 67 мг 2-((1-изобутил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,67 (2H, м), 0,85 (6H, д, J=6,6 Гц), 0,89-0,94 (2H, м), 1,86-1,94 (1H, м), 2,06-2,12 (1H, м), 3,95 (2H, д, J=7,3 Гц), 6,36 (1H, д, J=3,3 Гц), 7,18 (1H, дд, J=8,6, 1,3 Гц), 7,30 (1H, д, J=3,3 Гц), 7,40 (1H, д, J=8,6 Гц), 7,87 (1H, д, J=2,6 Гц), 7,95 (1H, д, J=1,3 Гц), 8,19 (1H, д, J=2,6 Гц), 10,11 (1H, с), 13,39 (1H, уш.с).
МС (ESI, m/z): 350 (M+H)+, 348 (M-H)-.
[Пример 127]
[Формула 374]
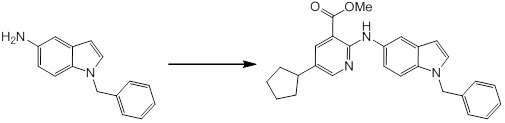
Смесь 100 мг 1-бензил-1H-индол-5-амина, 103 мг метил-2-хлор-5-циклопентилникотината, 20 мг трис(дибензилиденацетон)-дипалладия (0), 25 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 280 мг карбоната цезия и 1 мл бутилацетата нагревали с обратным холодильником в течение 4 часов и 5 минут в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-30/70). К полученному таким образом остатку добавляли диизопропиловый эфир, и собирали твердое вещество путем фильтрования с получением 132 мг метил-2-((1-бензил-1H-индол-5-ил)амино)-5-циклопентилникотината в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,41-1,82 (6H, м), 1,95-2,05 (2H, м), 2,86-2,99 (1H, м), 3,89 (3H, с), 5,40 (2H, с), 6,44 (1H, д, J=2,6 Гц), 7,15-7,39 (7H, м), 7,48 (1H, д, J=3,3 Гц), 7,96 (1H, д, J=2,0 Гц), 8,06 (1H, д, J=2,6 Гц), 8,28 (1H, д, J=2,6 Гц), 9,84 (1H, с).
МС (ESI, m/z): 426 (M+H)+, 424 (M-H)-.
[Пример 128]
[Формула 375]
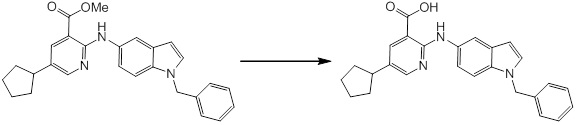
Смесь 132 мг метил-2-((1-бензил-1H-индол-5-ил)амино)-5-циклопентилникотината, 124 мкл 5 M водного раствора гидроксида натрия, 2 мл тетрагидрофурана и 1 мл метанола перемешивали при внешней температуре 40°C в течение 3 часов и 20 минут. После охлаждения реакционной смеси до комнатной температуры, к смеси добавляли 103 мкл 6 M соляной кислоты и добавляли к ней этилацетат и воду. Органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстрагированный слой объединяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью хлороформ/метанол = 100/0-90/10). К полученному таким образом остатку добавляли гексан и этилацетат, и собирали твердое вещество путем фильтрования с получением 65 мг 2-((1-бензил-1H-индол-5-ил)амино)-5-циклопентилникотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,42-1,55 (2H, м), 1,56-1,80 (4H, м), 1,95-2,05 (2H, м), 2,86-2,98 (1H, м), 5,40 (2H, с), 6,43 (1H, д, J=3,3 Гц), 7,15-7,38 (7H, м), 7,47 (1H, д, J=2,6 Гц), 7,97 (1H, д, J=2,0 Гц), 8,05 (1H, д, J=2,6 Гц), 8,24 (1H, д, J=2,0 Гц), 10,15 (1H, с).
МС (ESI, m/z): 412 (M+H)+, 410 (M-H)-.
[Пример 129]
[Формула 376]

К раствору 120 мг метил-2-((1H-индол-5-ил)амино)-5-циклопропилникотината в 1 мл N,N-диметилацетамида при охлаждении на льду добавляли 53 мг трет-бутоксида калия, 74 мкл 2-бромэтилметилового эфира и 4Å молекулярные сита, и перемешивали полученную смесь в течение 2 часов и 15 минут. При охлаждении на льду к смеси добавляли 53 мг трет-бутоксида калия и 74 мкл 2-бромэтилметилового эфира, и перемешивали полученную смесь в течение 1 часа и 25 минут, а затем оставляли отстаиваться в течение ночи. Реакционную смесь корректировали до pH 2 добавлением к ней 167 мкл 6 M соляной кислоты и воды, а затем добавляли этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат с 2% уксусной кислоты = 100/0-50/50) с получением 7 мг 5-циклопропил-2-((1-(2-метоксиэтил)-1H-индол-5-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,65 (2H, м), 0,85-0,95 (2H, м), 1,85-1,94 (1H, м), 3,22 (3H, с), 3,65 (2H, т, J=5,3 Гц), 4,30 (2H, т, J=5,3 Гц), 6,36 (1H, д, J=3,3 Гц), 7,19 (1H, д, J=8,6, 2,0 Гц), 7,31 (1H, д, J=2,6 Гц), 7,41 (1H, д, J=9,2 Гц), 7,87 (1H, д, J=2,6 Гц), 7,95 (1H, с), 8,19 (1H, д, J=2,6 Гц), 10,14 (1H, с), 13,41 (1H, уш.с).
МС (ESI, m/z): 352 (M+H)+, 350 (M-H)-.
[Пример 130]
[Формула 377]
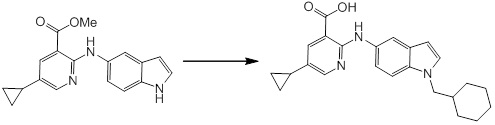
К раствору 100 мг метил-2-((1H-индол-5-ил)амино)-5-циклопропилникотината в 1,5 мл N,N-диметилацетамида добавляли 135 мг трет-бутоксида калия и 136 мкл (бромметил)циклогексан и перемешивали полученную смесь в течение 1 часа и 30 минут. К смеси добавляли 90 мг трет-бутоксида калия и 91 мкл (бромметил)циклогексана, и перемешивали полученную смесь в течение 2 часов и 50 минут. Реакционную смесь оставляли отстаиваться в течение ночи, а затем корректировали до pH 3 добавлением к ней 1 M соляной кислоты и воды, а затем добавляли этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 50/50-0/100). К полученному таким образом остатку добавляли диизопропиловый эфир и гексан, и собирали твердое вещество путем фильтрования с получением 60 мг 2-((1-(циклогексилметил)-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,67 (2H, м), 0,80-1,22 (7H, м), 1,45-1,70 (5H, м), 1,73-1,83 (1H, м), 1,85-1,95 (1H, м), 3,98 (2H, д, J=7,3 Гц), 6,35 (1H, д, J=3,3 Гц), 7,17 (1H, дд, J=8,9, 1,7 Гц), 7,28 (1H, д, J=2,6 Гц), 7,39 (1H, д, J=8,6 Гц), 7,86 (1H, д, J=2,6 Гц), 7,93 (1H, д, J=1,3 Гц), 8,17-8,20 (1H, м), 10,12 (1H, с), 13,40 (1H, уш.с).
МС (ESI, m/z): 390 (M+H)+, 388 (M-H)-.
[Пример 131]
[Формула 378]

Смесь 745 мг 1-бензил-1H-индол-5-амина, 700 мг метил-5-бром-2-хлорникотината, 1,82 г карбоната цезия и 5 мл N,N-диметилацетамида перемешивали при 170°C в течение 30 минут в атмосфере азота с использованием микроволновой установки. Реакционную смесь охлаждали до комнатной температуры, а затем подкисляли добавлением к ней 1 M соляной кислоты и воды. К смеси добавляли этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью хлороформ/метанол = 100/0-90/10). К полученному таким образом остатку добавляли этилацетат и метанол, и собирали твердое вещество путем фильтрования с получением 280 мг 2-((1-бензил-1H-индол-5-ил)амино)-5-бромникотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 5,41 (2H, с), 6,45 (1H, д, J=3,3 Гц), 7,14-7,33 (6H, м), 7,39 (1H, д, J=8,6 Гц), 7,50 (1H, д, J=2,6 Гц), 7,88 (1H, д, J=2,0 Гц), 8,25 (1H, д, J=2,6 Гц), 8,39 (1H, д, J=2,6 Гц), 10,21 (1H, с).
МС (ESI, m/z): 424 (M+H)+, 422 (M-H)-.
[Пример 132]
[Формула 379]

Смесь 80 мг 2-((1-бензил-1H-индол-5-ил)амино)-5-бромникотиновой кислоты, 35 мг бромида меди(I), 760 мкл 5 M раствора метоксида натрия в метаноле и 760 мкл N,N-диметилацетамида перемешивали при внешней температуре 140°C в течение 20 минут в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем подкисляли добавлением к ней 760 мкл 5 M соляной кислоты и воды. К смеси добавляли этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат с 1% уксусной кислоты = 100/0-50/50). К полученному таким образом остатку добавляли воду и метанол, и собирали твердое вещество путем фильтрования с получением 15 мг 2-((1-бензил-1H-индол-5-ил)амино)-5-метоксиникотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,78 (3H, с), 5,39 (2H, с), 6,42 (1H, д, J=3,3 Гц), 7,10-7,38 (7H, м), 7,46 (1H, д, J=3,3 Гц), 7,79 (1H, д, J=3,3 Гц), 7,96 (1H, д, J=2,0 Гц), 8,16 (1H, д, J=3,3 Гц), 9,97 (1H, с), 13,54 (1H, уш.с).
МС (ESI, m/z): 374 (M+H)+, 372 (M-H)-.
[Пример 133]
[Формула 380]

К раствору 100 мг метил-2-((1H-индол-5-ил)амино)-5-циклопропилникотината в 2 мл N,N-диметилацетамида при охлаждении на льду добавляли 135 мг трет-бутоксида калия и 109 мкл (бромметил)циклобутана и перемешивали полученную смесь в течение 3 часов и 35 минут. При охлаждении на льду к смеси добавляли 90 мг трет-бутоксида калия и 73 мкл (бромметил)циклобутана, и перемешивали полученную смесь в течение 1 часа и 25 минут. При охлаждении на льду к смеси добавляли 23 мг трет-бутоксида калия и 18 мкл (бромметил)циклобутана, и перемешивали полученную смесь в течение 20 минут. Реакционную смесь корректировали до pH 2 добавлением к ней 1 M соляной кислоты и воды, а затем добавляли этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью этилацетат/метанол = 100/0-95/5) с получением 50 мг 2-((1-(циклобутилметил)-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,66 (2H, м), 0,87-0,93 (2H, м), 1,73-1,99 (7H, м), 2,71-2,82 (1H, м), 4,15 (2H, д, J=7,3 Гц), 6,35 (1H, д, J=2,6 Гц), 7,18 (1H, дд, J=8,6, 2,0 Гц), 7,32 (1H, д, J=2,6 Гц), 7,40 (1H, д, J=8,6 Гц), 7,86 (1H, д, J=2,6 Гц), 7,95 (1H, д, J=2,0 Гц), 8,17 (1H, д, J=2,6 Гц), 10,25 (1H, уш.с), 13,42 (1H, уш.с),
МС (ESI, m/z): 362 (M+H)+, 360 (M-H)-.
[Пример 134]
[Формула 381]
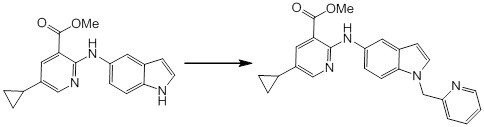
Смесь 90 мг метил-2-((1H-индол-5-ил)амино)-5-циклопропилникотината, 89 мг трет-бутоксида калия, 89 мг гидробромида 2-(бромметил)пиридина и 1 мл N,N-диметилацетамида перемешивали в течение 3 часов и 30 минут при охлаждении на льду. К реакционной смеси добавляли этилацетат и воду, органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью этилацетат/метанол =100/0-95/5) с получением 77 мг метил-5-циклопропил-2-((1-(пиридин-2-илметил)-1H-индол-5-ил)амино)никотината в виде белого твердого вещества.
МС (ESI, m/z): 399 (M+H)+.
[Пример 135]
[Формула 382]

Способом, аналогичным описанному в примере 116, 5-циклопропил-2-((1-(пиридин-2-илметил)-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((1-(пиридин-2-илметил)-1H-индол-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,68 (2H, м), 0,88-0,93 (2H, м), 1,85-1,94 (1H, м), 5,48 (2H, с), 6,45 (1H, д, J=2,6 Гц), 6,94 (1H, д, J=7,9 Гц), 7,15 (1H, дд, J=8,6, 2,0 Гц), 7,24-7,29 (1H, м), 7,33 (1H, д, J=9,2 Гц), 7,47 (1H, д, J=3,3 Гц), 7,71 (1H, тд, J=7,8, 1,8), 7,86 (1H, д, J=2,6 Гц), 7,98 (1H, д, J=2,0 Гц), 8,18 (1H, д, J=2,6 Гц), 8,54 (1H, дд, J=4,0, 2,0 Гц), 10,11 (1H, с), 13,42 (1H, уш.с).
МС (ESI, m/z): 385 (M+H)+, 383 (M-H)-.
[Пример 136]
[Формула 383]
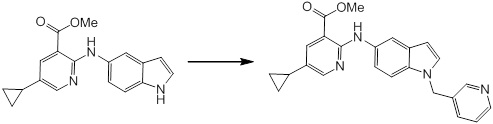
Смесь 60 мг метил-2-((1H-индол-5-ил)амино)-5-циклопропилникотината, 59 мг трет-бутоксида калия, 59 мг гидробромида 3-(бромметил)пиридина и 1 мл N,N-диметилацетамида перемешивали в течение 2 часов и 15 минут при охлаждении на льду. К реакционной смеси добавляли этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 50/50-0/100) с получением 46 мг метил-5-циклопропил-2-((1-(пиридин-3-илметил)-1H-индол-5-ил)амино)никотината в виде серого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,67 (2H, м), 0,87-0,95 (2H, м), 1,86-1,94 (1H, м), 3,89 (3H, с), 5,45 (2H, с), 6,45 (1H, д, J=2,6 Гц), 7,17 (1H, дд, J=8,9, 2,3 Гц), 7,33 (1H, дд, J=7,9, 4,6 Гц), 7,43 (1H, д, J=9,2 Гц), 7,51 (1H, д, J=2,6 Гц), 7,54-7,59 (1H, м), 7,88 (1H, д, J=2,6 Гц), 7,97 (1H, д, J=2,0 Гц), 8,20 (1H, д, J=2,6 Гц), 8,46 (1H, дд, J=4,6, 2,0 Гц), 8,52 (1H, д, J=2,0 Гц), 9,82 (1H, с).
МС (ESI, m/z): 399 (M+H)+.
[Пример 137]
[Формула 384]
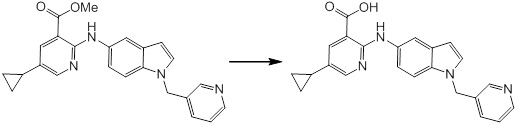
Способом, аналогичным описанному в примере 116, 5-циклопропил-2-((1-(пиридин-3-илметил)-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((1-(пиридин-3-илметил)-1H-индол-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,68 (2H, м), 0,86-0,94 (2H, м), 1,85-1,94 (1H, м), 5,45 (2H, с), 6,45 (1H, д, J=3,3 Гц), 7,18 (1H, дд, J=8,6, 2,0 Гц), 7,33 (1H, дд, J=7,9, 4,6 Гц), 7,42 (1H, д, J=8,6 Гц), 7,51 (1H, д, J=2,6 Гц), 7,54-7,59 (1H, м), 7,86 (1H, д, J=2,6 Гц), 7,97 (1H, д, J=2,0 Гц), 8,18 (1H, д, J=2,6 Гц), 8,46 (1H, дд, J=4,6, 1,3 Гц), 8,52 (1H, д, J=1,3 Гц), 10,11 (1H, с), 13,40 (1H, уш.с).
МС (ESI, m/z): 385 (M+H)+, 383 (M-H)-.
[Пример 138]
[Формула 385]

К раствору 100 мг метил-2-((1H-индол-5-ил)амино)-5-циклопропилникотината в 1 мл N,N-диметилацетамида при охлаждении на льду добавляли 89 мг трет-бутоксида калия и 50 мг (бромметил)циклопентана и перемешивали полученную смесь в течение 2 часов. Реакционную смесь оставляли отстаиваться в течение ночи, затем при охлаждении на льду к смеси добавляли 45 мг трет-бутоксида калия и 50 мг (бромметил)циклопентана, и перемешивали полученную смесь в течение 12 часов. Реакционную смесь оставляли отстаиваться в течение ночи, а затем корректировали до pH 2 добавлением к ней 1 M соляной кислоты и воды, а затем добавляли этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью хлороформ/метанол = 100/0-90/10). К полученному таким образом остатку добавляли диизопропиловый эфир, и собирали твердое вещество путем фильтрования с получением 2-((1-(циклопентилметил)-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,59-0,64 (2H, м), 0,86-0,92 (2H, м), 1,19-1,30 (2H, м), 1,46-1,67 (6H, м), 1,83-1,92 (1H, м), 2,38 (1H, с, J=7,3 Гц), 4,04 (2H, д, J=7,3 Гц), 6,34 (1H, д, J=2,6 Гц), 7,17 (1H, дд, J=8,6, 2,0 Гц), 7,32 (1H, д, J=2,6 Гц), 7,38 (1H, д, J=9,2 Гц), 7,86 (1H, д, J=2,0 Гц), 8,00 (1H, д, J=2,0 Гц), 8,11 (1H, д, J=2,6 Гц), 10,82 (1H, уш.с).
МС (ESI, m/z): 376 (M+H)+, 374 (M-H)-.
[Пример 139]
[Формула 386]

К раствору 70 мг метил-5-циклопропил-2-((2-фенил-1H-индол-5-ил)амино)никотината в 750 мкл N,N-диметилацетамида при охлаждении на льду добавляли 30 мг трет-бутоксида калия и 13 мкл йодметана, и перемешивали полученную смесь в течение 3 часов. При охлаждении на льду к смеси добавляли 4 мкл йодметана, и перемешивали полученную смесь в течение 20 минут. К реакционной смеси добавляли этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-50/50) с получением 53 мг метил-5-циклопропил-2-((1-метил-2-фенил-1H-индол-5-ил)амино)никотината в виде желтого масла.
1H-ЯМР (ДМСО-d6) δ: 0,63-0,69 (2H, м), 0,88-0,96 (2H, м), 1,87-1,97 (1H, м), 3,74 (3H, с), 3,91 (3H, с), 6,54 (1H, с), 7,27 (1H, дд, J=8,6, 2,0 Гц), 7,41-7,47 (2H, м), 7,49-7,55 (2H, м), 7,59-7,62 (2H, м), 7,90 (1H, д, J=2,6 Гц), 8,03 (1H, д, J=2,0 Гц), 8,25 (1H, д, J=2,6 Гц), 9,91 (1H, с).
МС (ESI, m/z): 398 (M+H)+.
[Пример 140]
[Формула 387]

Способом, аналогичным описанному в примере 116, 5-циклопропил-2-((1-метил-2-фенил-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((1-метил-2-фенил-1H-индол-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,63-0,68 (2H, м), 0,88-0,95 (2H, м), 1,87-1,96 (1H, м), 3,74 (3H, с), 6,54 (1H, с), 7,27 (1H, дд, J=9,2, 2,0 Гц), 7,41-7,47 (2H, м), 7,49-7,56 (2H, м), 7,59-7,63 (2H, м), 7,90 (1H, д, J=2,6 Гц), 8,04 (1H, д, J=2,0 Гц), 8,21 (1H, д, J=2,6 Гц), 10,22 (1H, с), 13,47 (1H, уш.с).
МС (ESI, m/z): 384 (M+H)+, 382 (M-H)-.
[Пример 141]
[Формула 388]

Смесь 103 мг метил-5-циклопропил-2-((2-фенил-1H-индол-5-ил)амино)никотината, 38 мг трет-бутоксида калия, 32 мкл йодэтана и 2 мл N,N-диметилацетамида перемешивали в течение 3 часов и 50 минут при охлаждении на льду. К реакционной смеси добавляли этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли этилацетат и метанол, и собирали твердое вещество путем фильтрования с получением 70 мг метил-5-циклопропил-2-((1-этил-2-фенил-1H-индол-5-ил)амино)никотината в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,63-0,69 (2H, м), 0,88-0,96 (2H, м), 1,21 (3H, т, J=6,9 Гц), 1,87-1,97 (1H, м), 3,91 (3H, с), 4,20 (2H, кв., J=7,3 Гц), 6,49 (1H, с), 7,26 (1H, дд, J=9,2, 2,0 Гц), 7,45-7,58 (6H, м), 7,90 (1H, д, J=2,6 Гц), 8,00 (1H, д, J=2,0 Гц), 8,25 (1H, д, J=2,0 Гц), 9,90 (1H, с).
МС (ESI, m/z): 412 (M+H)+.
[Пример 142]
[Формула 389]

Смесь 69 мг метил-5-циклопропил-2-((1-этил-2-фенил-1H-индол-5-ил)амино)никотината, 100 мкл 5 M водного раствора гидроксида натрия, 4 мл тетрагидрофурана и 1 мл метанола перемешивали при внешней температуре 50°C в течение 5 часов и 45 минут. После охлаждения реакционной смеси до комнатной температуры, к смеси добавляли 100 мкл 5 M соляной кислоты и добавляли к ней этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли гексан и этилацетат, и собирали твердое вещество путем фильтрования с получением 50 мг 5-циклопропил-2-((1-этил-2-фенил-1H-индол-5-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,68 (2H, м), 0,88-0,95 (2H, м), 1,21 (3H, т, J=6,6 Гц), 1,86-1,96 (1H, м), 4,20 (2H, кв., J=7,3 Гц), 6,49 (1H, с), 7,27 (1H, дд, J=9,2, 2,0 Гц), 7,45-7,57 (6H, м), 7,89 (1H, д, J=2,6 Гц), 8,00-8,03 (1H, м), 8,22 (1H, д, J=2,0 Гц), 10,18 (1H, с), 13,43 (1H, уш.с).
МС (ESI, m/z): 398 (M+H)+, 396 (M-H)-.
[Пример 143]
[Формула 390]

Смесь 3,72 г трет-бутил-5-амино-1H-индол-1-карбоксилата, 3,05 г метил-2-хлор-5-циклопропилникотината, 730 мг трис(дибензилиденацетон)дипалладия(0), 930 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 13,1 г карбоната цезия и 50 мл бутилацетата перемешивали при внешней температуре 90°C в течение 3 часов в атмосфере азота, а затем нагревали с обратным холодильником в течение 4 часов и 20 минут. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-50/50) с получением 2,10 г трет-бутил-5-((3-(бутоксикарбонил)-5-циклопропилпиридин-2-ил)амино)-1H-индол-1-карбоксилата в виде желтого масла.
1H-ЯМР (ДМСО-d6) δ: 0,63-0,70 (2H, м), 0,89-0,99 (5H, м), 1,39-1,48 (2H, м), 1,63 (9H, с), 1,74 (2H, квин., J=7,9 Гц), 1,90-1,99 (1H, м), 4,33 (2H, т, J=6,6 Гц), 6,68 (1H, д, J=3,3 Гц), 7,43 (1H, дд, J=8,6, 2,0 Гц), 7,64 (1H, д, J=4,0 Гц), 7,93 (1H, д, J=2,6 Гц), 7,96 (1H, д, J=9,2 Гц), 8,11 (1H, д, J=2,0 Гц), 8,26 (1H, д, J=2,6 Гц), 10,01 (1H, с).
МС (ESI, m/z): 450 (M+H)+.
[Пример 144]
[Формула 391]

Раствор 1,50 г трет-бутил-5-((3-(бутоксикарбонил)-5-циклопропилпиридин-2-ил)амино)-1H-индол-1-карбоксилата в 5 мл N,N-диметилацетамида перемешивали при внешней температуре 150°C в течение 9 часов и 20 минут. Реакционную смесь оставляли отстаиваться в течение ночи, а затем перемешивали при внешней температуре 150°C в течение 2 часов и 30 минут. Растворитель отгоняли в условиях пониженного давления, а затем очищали полученный остаток методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-60/40). К полученному таким образом остатку добавляли гексан и этилацетат, и собирали твердое вещество путем фильтрования с получением 930 мг бутил-2-((1H-индол-5-ил)амино)-5-циклопропилникотината в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,67 (2H, м), 0,88-0,95 (2H, м), 0,96 (3H, т, J=7,3 Гц), 1,44 (2H, с, J=7,9 Гц), 1,73 (2H, квин., J=7,9 Гц), 1,86-1,95 (1H, м), 4,32 (2H, т, J=6,6 Гц), 6,37 (1H, с), 7,15 (1H, дд, J=8,6, 2,0 Гц), 7,29-7,35 (2H, м), 7,89 (1H, д, J=1,3 Гц), 7,93 (1H, д, J=1,3 Гц), 8,20 (1H, д, J=2,0 Гц), 9,84 (1H, с), 10,99 (1H, с).
МС (ESI, m/z): 350 (M+H)+.
[Пример 145]
[Формула 392]

Смесь 60 мг бутил-2-((1H-индол-5-ил)амино)-5-циклопропилникотината, 29 мг трет-бутоксида калия, 50 мкл (бромметил)циклопропана и 1 мл N,N-диметилацетамида перемешивали в течение 1 часа и 20 минут при охлаждении на льду. К реакционной смеси добавляли этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-80/20) с получением 58 мг бутил-5-циклопропил-2-((1-(циклопропилметил)-1H-индол-5-ил)амино)никотината в виде желтого масла.
1H-ЯМР (ДМСО-d6) δ: 0,35-0,42 (2H, м), 0,46-0,57 (2H, м), 0,61-0,67 (2H, м), 0,88-0,95 (2H, м), 0,96 (3H, т, J=7,3 Гц), 1,19-1,30 (1H, м), 1,40-1,51 (2H, м), 1,74 (2H, квин., J=7,3 Гц), 1,88-1,96 (1H, м), 4,01 (2H, д, J=7,3 Гц), 4,32 (2H, т, J=6,6 Гц), 6,37 (1H, д, J=3,3 Гц), 7,19 (1H, дд, J=8,6, 2,0 Гц), 7,39 (1H, д, J=2,6 Гц), 7,44 (1H, д, J=8,6 Гц), 7,90 (1H, д, J=2,6 Гц), 7,93 (1H, д, J=2,0 Гц), 8,20 (1H, д, J=2,6 Гц), 9,84 (1H, с).
МС (ESI, m/z): 404 (M+H)+.
[Пример 146]
[Формула 393]
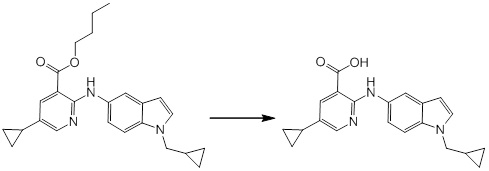
Смесь 57 мг бутил-5-циклопропил-2-((1-(циклопропилметил)-1H-индол-5-ил)амино)никотината, 85 мкл 5 M водного раствора гидроксида натрия, 2 мл тетрагидрофурана и 1 мл метанола перемешивали при внешней температуре 40°C в течение 4 часов и 10 минут. Реакционную смесь подкисляли добавлением к ней 85 мкл 5 M соляной кислоты и воды, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли смесь воды и метанола, и собирали твердое вещество путем фильтрования с получением 31 мг 5-циклопропил-2-((1-(циклопропилметил)-1H-индол-5-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,34-0,40 (2H, м), 0,47-0,54 (2H, м), 0,57-0,63 (2H, м), 0,84-0,92 (2H, м), 1,20-1,28 (1H, м), 1,81-1,91 (1H, м), 4,00 (2H, д, J=7,3 Гц), 6,34 (1H, д, J=2,6 Гц), 7,18 (1H, дд, J=8,6, 2,0 Гц), 7,35 (1H, д, J=3,3 Гц), 7,39 (1H, д, J=8,6 Гц), 7,83 (1H, д, J=2,6 Гц), 8,03-8,07 (2H, м), 11,32 (1H, уш.с).
МС (ESI, m/z): 348 (M+H)+, 346 (M-H)-.
[Пример 147]
[Формула 394]
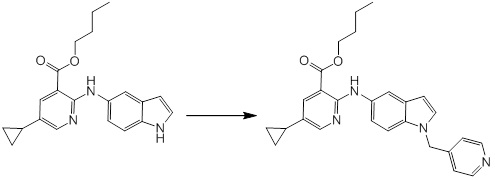
Смесь 60 мг бутил-2-((1H-индол-5-ил)амино)-5-циклопропилникотината, 52 мг трет-бутоксида калия, 52 мг гидробромида (4-бромметил)пиридина и 1 мл N,N-диметилацетамида перемешивали в течение 1 часа и 40 минут при охлаждении на льду. К реакционной смеси добавляли этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью этилацетат/метанол =100/0-95/5) с получением 48 мг бутил-5-циклопропил-2-((1-(пиридин-4-илметил)-1H-индол-5-ил)амино)никотината в виде желтого масла.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,67 (2H, м), 0,88-0,94 (2H, м), 0,95 (3H, т, J=7,3 Гц), 1,43 (2H, с, J=7,3 Гц), 1,72 (2H, квин., 6,6 Гц), 1,88-1,96 (1H, м), 4,31 (2H, т, J=6,6 Гц), 5,48 (2H, с), 6,48 (1H, д, J=3,3 Гц), 7,07 (2H, д, J=5,9 Гц), 7,16 (1H, дд, J=8,9, 1,7 Гц), 7,31 (1H, д, J=8,6 Гц), 7,50 (1H, д, J=3,3 Гц), 7,89 (1H, д, J=2,6 Гц), 7,99 (1H, д, J=2,0 Гц), 8,19 (1H, д, J=2,6 Гц), 8,46-8,50 (2H, м), 9,84 (1H, с).,
МС (ESI, m/z): 441 (M+H)+.
[Пример 148]
[Формула 395]
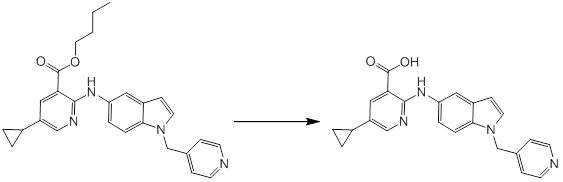
Способом, аналогичным описанному в примере 116, 5-циклопропил-2-((1-(пиридин-4-илметил)-1H-индол-5-ил)амино)никотиновую кислоту получали из бутил-5-циклопропил-2-((1-(пиридин-4-илметил)-1H-индол-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,67 (2H, м), 0,85-0,94 (2H, м), 1,85-1,95 (1H, м), 5,48 (2H, с), 6,48 (1H, д, J=3,3 Гц), 7,07 (2H, д, J=5,9 Гц), 7,16 (1H, дд, J=8,9, 1,7 Гц), 7,30 (1H, д, J=8,6 Гц), 7,49 (1H, д, J=3,3 Гц), 7,86 (1H, д, J=2,6 Гц), 8,00 (1H, д, J=2,0 Гц), 8,18 (1H, д, J=2,6 Гц), 8,48 (2H, д, J=5,9 Гц), 10,11 (1H, с).
МС (ESI, m/z): 385 (M+H)+, 383 (M-H)-.
[Пример 149]
[Формула 396]

К 5 мл раствора 300 мг 2-((1-бензил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты в тетрагидрофуране при охлаждении на льду добавляли 165 мг 1,1'-карбонилдиимидазола и перемешивали полученную смесь в течение 1 часа и 10 минут. К смеси добавляли 224 мг метансульфонамида и 350 мкл 1,8-диазабицикло[5.4.0]ундец-7-ена, а затем нагревали полученную смесь с обратным холодильником в течение 4 часов и 30 минут. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду, и корректировали полученную смесь до pH 2 добавлением 5 M соляной кислоты. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли этилацетат, и собирали твердое вещество путем фильтрования с получением 107 мг 2-((1-бензил-1H-индол-5-ил)амино)-5-циклопропил-N-(метилсульфонил)никотинамида в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,67-0,73 (2H, м), 0,91-0,98 (2H, м), 1,87-1,98 (1H, м), 3,22 (3H, с), 5,41 (2H, с), 6,51 (1H, д, J=3,3 Гц), 7,14 (1H, дд, J=8,6, 2,0 Гц), 7,22-7,36 (5H, м), 7,46 (1H, д, J=8,6 Гц), 7,53 (1H, д, J=2,6 Гц), 7,81 (1H, д, J=2,0 Гц), 7,98 (2H, с).
МС (ESI, m/z): 459 (M-H)-.
[Пример 150]
[Формула 397]

К 3 мл раствора 100 мг метил-2-((1H-индол-5-ил)амино)-5-циклопропилникотината в тетрагидрофуране при охлаждении на льду добавляли 64 мг N-бромсукцинимида и перемешивали полученную смесь в течение 25 минут. К реакционной смеси добавляли этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли гексан и диизопропиловый эфир, и собирали твердое вещество путем фильтрования с получением 87 мг метил-2-((3-бром-1H-индол-5-ил)амино)-5-циклопропилникотината в виде оранжевого твердого вещества.
С (ESI, m/z): 386 (M+H)+, 384 (M-H)-.
[Пример 151]
[Формула 398]

К раствору 600 мг метил-2-((3-бром-1H-индол-5-ил)амино)-5-циклопропилникотината в 7 мл N,N-диметилацетамида при охлаждении на льду добавляли 236 мг трет-бутоксида калия и 290 мкл йодметана и перемешивали полученную смесь в течение 1 часа. При охлаждении на льду к смеси добавляли 96 мг трет-бутоксида калия, и перемешивали полученную смесь в течение 1 часа и 35 минут. При охлаждении на льду к смеси добавляли 96 мг трет-бутоксида калия, и перемешивали полученную смесь в течение 1 часа и 25 минут. К реакционной смеси добавляли этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли метанол, и собирали твердое вещество путем фильтрования с получением 432 мг метил-2-((3-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотината в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,65-0,71 (2H, м), 0,89-0,95 (2H, м), 1,88-1,98 (1H, м), 3,78 (3H, с), 3,90 (3H, с), 7,29 (1H, дд, J=9,2, 2,0 Гц), 7,45 (1H, д, J=9,2 Гц), 7,52 (1H, с), 7,90-7,93 (2H, м), 8,26 (1H, д, J=2,6 Гц), 9,95 (1H, с).
МС (ESI, m/z): 400 (M+H)+.
[Пример 152]
[Формула 399]

Смесь 80 мг метил-2-((3-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотината, 49 мг фенилбороновой кислоты, 7 мг бис(ди-трет-бутил(4-диметиламинофенил)фосфин)-дихлорпалладия(II), 55 мг карбоната калия, 1 мл толуола и 100 мкл воды перемешивали при внешней температуре 110°C в течение 2 часов в атмосфере азота. К реакционной смеси добавляли этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-70/30). К полученному таким образом остатку добавляли метанол, и собирали твердое вещество путем фильтрования с получением 50 мг метил-5-циклопропил-2-((1-метил-3-фенил-1H-индол-5-ил)амино)никотината в виде желтого твердого вещества.
МС (ESI, m/z): 398 (M+H)+.
[Пример 153]
[Формула 400]
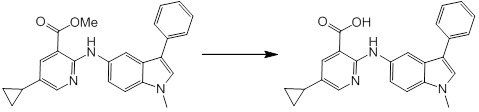
Смесь 50 мг метил-5-циклопропил-2-(1-метил-3-фенил-1H-индол-5-ил)амино)никотината, 60 мкл 5 M водного раствора гидроксида натрия, 2 мл тетрагидрофурана и 1 мл метанола перемешивали при внешней температуре 50°C в течение 4 часов и 30 минут. Растворитель отгоняли в условиях пониженного давления, к полученному остатку добавляли 60 мкл 5 M соляной кислоты, воду и метанол, и собирали твердое вещество путем фильтрования с получением 50 мг 5-циклопропил-2-(1-метил-3-фенил-1H-индол-5-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,68 (2H, м), 0,88-0,94 (2H, м), 1,88-1,96 (1H, м), 3,81 (3H, с), 7,20-7,26 (1H, м), 7,33 (1H, дд, J=8,6, 2,0 Гц), 7,40-7,48 (3H, м), 7,64-7,68 (3H, м), 7,92 (1H, д, J=2,6 Гц), 8,14 (1H, д, J=2,6 Гц), 8,24 (1H, д, J=1,3 Гц), 10,21 (1H, с).
МС (ESI, m/z): 384 (M+H)+, 382 (M-H)-.
[Пример 154]
[Формула 401]
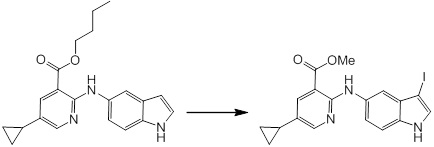
Смесь 200 мг бутил-2-((1H-индол-5-ил)амино)-5-циклопропилникотината, 160 мг йода, 46 мг гидроксида натрия и 5 мл метанола перемешивали в течение 2 часов и 20 минут при охлаждении на льду. Растворитель отгоняли в условиях пониженного давления, и делали реакционную смесь нейтральной добавлением к ней 1 M соляной кислоты и воды, а затем добавляли этилацетат и воду. Органический слой разделяли, последовательно промывали насыщенным водным раствором бисульфита натрия, водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли этилацетат и метанол, и собирали твердое вещество путем фильтрования с получением 55 мг метил-5-циклопропил-2-((3-йод-1H-индол-5-ил)амино)никотината в виде коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,64-0,70 (2H, м), 0,88-0,98 (2H, м), 1,88-1,97 (1H, м), 3,90 (3H, с), 7,26 (1H, дд, J=8,6, 2,0 Гц), 7,37 (1H, д, J=8,6 Гц), 7,52 (1H, д, J=2,6 Гц), 7,70 (1H, д, J=2,6 Гц), 7,90 (1H, д, J=2,6 Гц), 8,24 (1H, д, J=2,6 Гц), 9,90 (1H, с), 11,45 (1H, с).
МС (ESI, m/z): 434 (M+H)+.
[Пример 155]
[Формула 402]
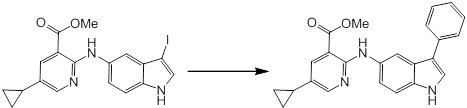
Смесь 50 мг метил-5-циклопропил-2-((3-йод-1H-индол-5-ил)амино)никотината, 28 мг фенилбороновой кислоты, 4 мг бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлорпалладия(II), 32 мг карбоната калия, 1 мл толуола и 100 мкл воды перемешивали при 90°C в течение 2 часов и 45 минут. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-50/50) с получением 45 мг метил-5-циклопропил-2-((3-фенил-1H-индол-5-ил)амино)никотината в виде бесцветного масла.
МС (ESI, m/z): 384 (M+H)+.
[Пример 156]
[Формула 403]

Смесь 45 мг метил-5-циклопропил-2-((3-фенил-1H-индол-5-ил)амино)никотината, 70 мкл 5 M водного раствора гидроксида натрия, 2 мл тетрагидрофурана и 1 мл метанола перемешивали при внешней температуре 40°C в течение 3 часов, а затем оставляли отстаиваться в течение ночи. Реакционную смесь корректировали до pH 2 добавлением к ней 5 M соляной кислоты и воды. Растворитель отгоняли в условиях пониженного давления, и добавляли к полученному остатку этилацетат и тетрагидрофуран. Твердое вещество собирали путем фильтрования и очищали методом препаративной тонкослойной хроматографии (гексан/этилацетат с 1% уксусной кислоты = 25:75), к полученному таким образом остатку добавляли гексан и этилацетат, и собирали твердое вещество путем фильтрования с получением 6 мг 5-циклопропил-2-((3-фенил-1H-индол-5-ил)амино)никотиновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,54-0,60 (2H, м), 0,82-0,89 (2H, м), 1,78-1,88 (1H, м), 7,18-7,25 (1H, м), 7,28-7,37 (2H, м), 7,40-7,47 (2H, м), 7,58 (1H, д, J=2,6 Гц), 7,68 (2H, д, J=7,3 Гц), 7,80 (1H, д, J=2,0 Гц), 7,94 (1H, д, J=2,6 Гц), 8,33 (1H, с), 11,13 (1H, с), 12,31 (1H, уш.с).
МС (ESI, m/z): 370 (M+H)+, 368 (M-H)-.
[Пример 157]
[Формула 404]
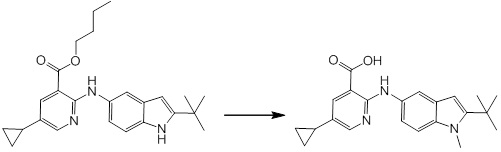
К раствору 89 мг бутил-2-((2-(трет-бутил)-1H-индол-5-ил)амино)-5-циклопропилникотината в 1 мл N,N-диметилацетамида при охлаждении на льду добавляли 33 мг трет-бутоксида калия и 14 мкл йодметана, и перемешивали полученную смесь в течение 2 часов и 35 минут. При охлаждении на льду к смеси добавляли 66 мг трет-бутоксида калия, 5 мкл йодметана и 1 мл N,N-диметилацетамида, и перемешивали полученную смесь в течение 30 минут, а затем оставляли отстаиваться в течение ночи. При охлаждении на льду к смеси добавляли 33 мг трет-бутоксида калия и 5 мкл йодметана, полученную смесь перемешивали в течение 20 минут, а затем добавляли к реакционной смеси этилацетат, воду и 5 M соляную кислоту. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат), к полученному таким образом остатку добавляли гексан и этилацетат, и собирали твердое вещество путем фильтрования с получением 42 мг 2-((2-(трет-бутил)-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,68 (2H, м), 0,86-0,94 (2H, м), 1,42 (9H, с), 1,84-1,95 (1H, м), 3,85 (3H, с), 6,19 (1H, с), 7,17 (1H, дд, J=8,6, 2,0 Гц), 7,31 (1H, д, J=8,6 Гц), 7,84 (1H, д, J=1,8 Гц), 7,86 (1H, д, J=2,1 Гц), 8,17 (1H, д, J=2,6 Гц), 10,14 (1H, с).
МС (ESI, m/z): 364 (M+H)+, 362 (M-H)-.
[Пример 158]
[Формула 405]

К раствору 90 мг метил-2-((2-(трет-бутил)-1H-индол-5-ил)амино)-5-циклопропилникотината в 1 мл N,N-диметилацетамида при охлаждении на льду добавляли 31 мг трет-бутоксида калия и 22 мкл йодэтана и перемешивали полученную смесь в течение 2 часов и 20 минут. К смеси добавляли 62 мг трет-бутоксида калия, и перемешивали полученную смесь в течение 4 часов и 40 минут, а затем оставляли отстаиваться в течение ночи. При охлаждении на льду к смеси добавляли 31 мг трет-бутоксида калия и 5 мкл йодэтана, и перемешивали полученную смесь в течение 3 часов и 40 минут. При охлаждении на льду к смеси добавляли 31 мг трет-бутоксида калия и 10 мкл йодэтана, полученную смесь перемешивали в течение 3 часов и 30 минут и оставляли отстаиваться в течение ночи. Реакционную смесь корректировали до pH 2 добавлением к ней этилацетата, воды и 5 M соляной кислоты. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-50/50), к полученному таким образом остатку добавляли гексан и этилацетат, и собирали твердое вещество путем фильтрования с получением 25 мг 2-((2-(трет-бутил)-1-этил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,66 (2H, м), 0,85-0,96 (2H, м), 1,32 (3H, т, J=6,9 Гц), 1,48 (9H, с), 1,85-1,95 (1H, м), 4,35 (2H, кв., J=6,8 Гц), 6,14 (1H, с), 7,17 (1H, дд, J=8,6, 2,0 Гц), 7,28 (1H, д, J=8,4 Гц), 7,82 (1H, д, J=2,1 Гц), 7,86 (1H, д, J=2,7 Гц), 8,17 (1H, д, J=2,6 Гц), 10,10 (1H, с).
МС (ESI, m/z): 378 (M+H)+, 376 (M-H)-.
[Пример 159]
[Формула 406]
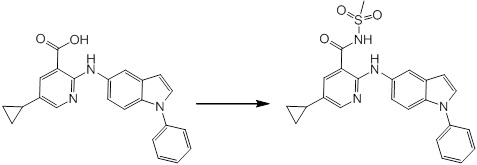
К 1 мл раствора 150 мг 5-циклопропил-2-((1-фенил-1H-индол-5-ил)амино)никотиновой кислоты в тетрагидрофуране при охлаждении на льду добавляли 132 мг 1,1'-карбонилдиимидазола, и перемешивали полученную смесь при той же температуре в течение 1 часа и 40 минут. К смеси добавляли 193 мг метансульфонамида и 303 мкл 1,8-диазабицикло[5.4.0]ундец-7-ена, и нагревали полученную смесь с обратным холодильником в течение 1 часа и 30 минут. Реакционную смесь оставляли отстаиваться в течение ночи, добавляли к ней этилацетат и воду, а затем добавляли 800 мкл 5 M соляной кислоты. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью этилацетат/метанол = 100/0-90/10). К полученному таким образом остатку добавляли воду и метанол, и собирали твердое вещество путем фильтрования с получением 29 мг 5-циклопропил-N-(метилсульфонил)-2-((1-фенил-1H-индол-5-ил)амино)никотинамида в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,63-0,70 (2H, м), 0,87-0,95 (2H, м), 1,83-1,94 (1H, м), 3,12 (3H, с), 6,65 (1H, д, J=3,3 Гц), 7,26 (1H, дд, J=8,6, 2,0 Гц), 7,35-7,42 (1H, м), 7,49-7,63 (6H, м), 7,93 (1H, д, J=2,0 Гц), 8,13 (1H, д, J=2,0 Гц), 8,18 (1H, д, J=2,0 Гц).
МС (ESI, m/z): 447 (M+H)+, 445 (M-H)-.
[Пример 160]
[Формула 407]
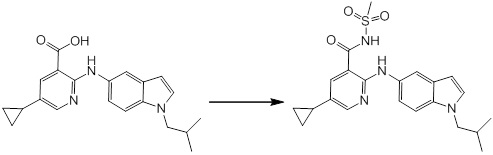
Способом, аналогичным описанному в примере 149, 5-циклопропил-2-((1-изобутил-1H-индол-5-ил)амино)-N-(метилсульфонил)никотинамид получали из 5-циклопропил-2-((1-изобутил-1H-индол-5-ил)амино)никотиновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,71-0,78 (2H, м), 0,85 (6H, д, J=6,6 Гц), 0,88-0,95 (2H, м), 1,84-1,95 (1H, м), 2,05-2,22 (1H, м), 3,96 (2H, д, J=7,3 Гц), 6,39 (1H, д, J=2,6 Гц), 7,16 (1H, дд, J=9,2, 2,0 Гц), 7,34 (1H, д, J=2,6 Гц), 7,44 (1H, д, J=8,6 Гц), 7,83-7,92 (2H, м), 8,09-8,21 (1H, м).
МС (ESI, m/z): 427 (M+H)+, 425 (M-H)-.
[Пример 161]
[Формула 408]

К 5 мл раствора 205 мг 2-((1-циклогексилметил)-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты в тетрагидрофуране при охлаждении на льду добавляли 256 мг 1,1'-карбонилдиимидазола и перемешивали полученную смесь в течение 50 минут, а затем перемешивали при комнатной температуре в течение 2 часов и 30 минут. К смеси добавляли 301 мг метансульфонамида и 469 мкл 1,8-диазабицикло[5.4.0]ундец-7-ена, и перемешивали полученную смесь при комнатной температуре в течение 30 минут, а затем оставляли отстаиваться в течение ночи. Реакционную смесь корректировали до pH 2 добавлением к ней 5 M соляной кислоты и воды, а затем добавляли этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли воду и метанол, и собирали твердое вещество путем фильтрования с получением 211 мг 2-((1-(циклогексилметил)-1H-индол-5-ил)амино)-5-циклопропил-N-(метилсульфонил)никотинамида в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,67-0,74 (2H, м), 0,92-1,19 (7H, м), 1,45-1,73 (5H, м), 1,73-1,84 (1H, м), 1,89-1,99 (1H, м), 3,17 (3H, с), 4,02 (2H, д, J=6,6 Гц), 6,47 (1H, д, J=3,3 Гц), 7,14 (1H, дд, J=8,6, 2,0 Гц), 7,36 (1H, д, J=3,3 Гц), 7,52 (1H, д, J=8,6 Гц), 7,73 (1H, с), 7,89 (1H, с), 8,09 (1H, с).
МС (ESI, m/z): 467 (M+H)+, 465 (M-H)-,.
[Пример 162]
[Формула 409]

К раствору 80 мг 2-((1-бензил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты в 3 мл тетрагидрофурана добавляли 68 мг 1,1'-карбонилдиимидазола и перемешивали полученную смесь при комнатной температуре в течение 3 часов и 35 минут. К смеси добавляли 101 мг циклопропансульфонамида и 125 мкл 1,8-диазабицикло[5.4.0]ундец-7-ена, перемешивали полученную смесь в течение 5 минут, а затем оставляли отстаиваться в течение ночи. Реакционную смесь корректировали до pH 3 добавлением 5 M соляной кислоты и воды, а затем добавляли этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-20/80). К полученному таким образом остатку добавляли воду и метанол, и собирали твердое вещество путем фильтрования с получением 51 мг 2-((1-бензил-1H-индол-5-ил)амино)-5-циклопропил-N-(циклопропилсульфонил)никотинамида.
1H-ЯМР (ДМСО-d6) δ: 0,67-0,76 (2H, м), 0,90 (2H, м), 0,95-1,19 (4H, м), 1,83-1,94 (1H, м), 3,10-3,20 (1H, м), 5,40 (2H, с), 6,44 (1H, д, J=2,6 Гц), 7,14 (1H, дд, J=8,9, 1,7 Гц), 7,17-7,42 (6H, м), 7,48 (1H, д, J=2,6 Гц), 7,80-7,94 (2H, м), 8,16 (1H, с).
МС (ESI, m/z): 487 (M+H)+, 485 (M-H)-.
[Пример 163]
[Формула 410]
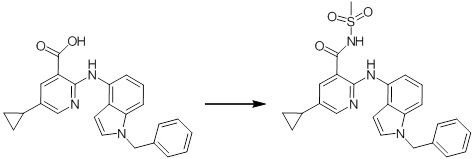
Способом, аналогичным описанному в примере 149, 2-((1-бензил-1H-индол-4-ил)амино)-5-циклопропил-N-(метилсульфонил)никотинамид получали из 2-((1-бензил-1H-индол-4-ил)амино)-5-циклопропилникотиновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,71-0,77 (2H, м), 0,89-0,97 (2H, м), 1,87-1,96 (1H, м), 3,28 (3H, с), 5,42 (2H, с), 6,75 (1H, м), 7,01-7,08 (2H, м), 7,16-7,33 (5H, м), 7,47 (1H, д, J=3,3 Гц), 7,93 (1H, д, J=2,6 Гц), 8,14 (1H, д, J=6,6 Гц), 8,26 (1H, с).
МС (ESI, m/z): 461 (M+H)+, 459 (M-H)-.
[Пример 164]
[Формула 411]
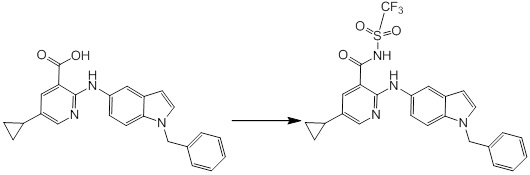
К раствору 80 мг 2-((1-бензил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты в 3 мл тетрагидрофурана добавляли 85 мг 1,1'-карбонилдиимидазола и перемешивали полученную смесь при комнатной температуре в течение 3 часов и 30 минут. К смеси добавляли 93 мг трифторметансульфонамида и 94 мкл 1,8-диазабицикло[5.4.0]ундец-7-ена, и перемешивали полученную смесь при комнатной температуре в течение 4 часов и 10 минут, а затем нагревали с обратным холодильником в течение 2 часов и 40 минут. Реакционную смесь охлаждали до комнатной температуры, затем корректировали до pH 2 добавлением к ней 5 M соляной кислоты и воды, а затем добавляли этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-0/100) с получением 66 мг 2-((1-бензил-1H-индол-5-ил)амино)-5-циклопропил-N-((трифторметил)сульфонил)никотинамида в виде желтого масла.
1H-ЯМР (ДМСО-d6) δ: 0,55-0,61 (2H, м), 0,85-0,93 (2H, м), 1,82-1,90 (1H, м), 5,38 (2H, с), 6,41 (1H, д, J=2,6 Гц), 7,11 (1H, дд, J=8,6, 2,0 Гц), 7,17-7,37 (6H, м), 7,44 (1H, д, J=2,6 Гц), 7,98 (1H, д, J=2,0 Гц), 8,04 (2H, м), 11,02 (1H, с).
МС (ESI, m/z): 515 (M+H)+, 513 (M-H)-.
[Пример 165]
[Формула 412]
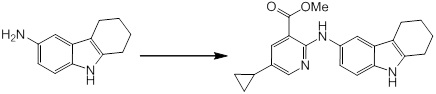
Смесь 500 мг 2,3,4,9-тетрагидро-1H-карбазол-6-амина, 567 мг метил-2-хлор-5-циклопропилникотината, 123 мг трис(дибензилиденацетон)дипалладия(0), 155 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 2,0 г карбоната цезия и 10 мл амилацетата перемешивали при внешней температуре 135°C в течение 3 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-80/20). К полученному таким образом остатку добавляли метанол, и собирали твердое вещество путем фильтрования с получением 550 мг метил-5-циклопропил-2-((2,3,4,9-тетрагидро-1H-карбазол-6-ил)амино)никотината в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,67 (2H, м), 0,86-0,93 (2H, м), 1,75-1,85 (4H, м), 1,85-1,95 (1H, м), 2,55-2,62 (2H, м), 2,65-2,72 (2H, м), 3,89 (3H, с), 7,13 (1H, дд, J=8,6, 1,3 Гц), 7,18 (1H, д, J=8,6 Гц), 7,60 (1H, д, J=1,3 Гц), 7,87 (1H, д, J=2,6 Гц), 8,19 (1H, д, J=2,0 Гц), 9,79 (1H, с), 10,54 (1H, с).
МС (ESI, m/z): 362 (M+H)+.
[Пример 166]
[Формула 413]

Способом, аналогичным описанному в примере 141, 5-циклопропил-2-((9-этил-2,3,4,9-тетрагидро-1H-карбазол-6-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((2,3,4,9-тетрагидро-1H-карбазол-6-ил)амино)никотината и йодэтана.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,66 (2H, м), 0,86-0,93 (2H, м), 1,21 (3H, т, J=6,9 Гц), 1,73-1,93 (5H, м), 2,56-2,63 (2H, м), 2,67-2,74 (2H, м), 4,06 (2H, кв., J=7,0 Гц), 7,19 (1H, дд, J=8,6, 2,0 Гц), 7,29 (1H, д, J=8,6 Гц), 7,64 (1H, д, J=2,0 Гц), 7,86 (1H, д, J=2,6 Гц), 8,16 (1H, д, J=2,0 Гц), 10,11 (1H, с), 13,39 (1H, уш.с).
МС (ESI, m/z): 376 (M+H)+, 374 (M-H)-.
[Пример 167]
[Формула 414]

Способом, аналогичным описанному в примере 116, 5-циклопропил-2-((2,3,4,9-тетрагидро-1H-карбазол-6-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((2,3,4,9-тетрагидро-1H-карбазол-6-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,67 (2H, м), 0,86-0,93 (2H, м), 1,76-1,93 (5H, м), 2,55-2,63 (2H, м), 2,65-2,72 (2H, м), 7,11-7,18 (2H, м), 7,61 (1H, с), 7,85 (1H, д, J=2,6 Гц), 8,16 (1H, д, J=2,0 Гц), 10,10 (1H, с), 10,51 (1H, с).
МС (ESI, m/z): 348 (M+H)+, 346 (M-H)-.
[Пример 168]
[Формула 415]

Способом, аналогичным описанному в примере 150, метил-2-((3-бром-1-этил-1H-индол-5-ил)амино)-5-циклопропилникотинат получали из метил-5-циклопропил-2-((1-этил-1H-индол-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,64-0,71 (2H, м), 0,88-0,95 (2H, м), 1,36 (3H, т, J=7,3 Гц), 1,87-1,97 (1H, м), 3,90 (3H, с), 4,19 (2H, кв., J=7,0 Гц), 7,28 (1H, дд, J=8,6, 2,0 Гц), 7,50 (1H, д, J=9,2 Гц), 7,59 (1H, с), 7,92-7,89 (2H, м), 8,26 (1H, д, J=2,6 Гц), 9,94 (1H, с).
МС (ESI, m/z): 414 (M+H)+.
[Пример 169]
[Формула 416]

Смесь 60 мг метил-2-((3-бром-1-этил-1H-индол-5-ил)амино)-5-циклопропилникотината, 25 мг фенилбороновой кислоты, 4,7 мг бис(ди-трет-бутил(4-диметиламинофенил)фосфин)-дихлорпалладия(II), 46 мг карбоната калия, 1 мл толуола и 100 мкл воды нагревали с обратным холодильником в течение 1 часа и 50 минут в атмосфере азота. К реакционной смеси добавляли этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-80/20) с получением 46 мг метил-5-циклопропил-2-((1-этил-3-фенил-1H-индол-5-ил)амино)никотината в виде желтого масла.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,68 (2H, м), 0,87-0,94 (2H, м), 1,42 (3H, т, J=6,9 Гц), 1,86-1,96 (1H, м), 3,90 (3H, с), 4,24 (2H, кв., J=7,3 Гц), 7,26-7,20 (1H, м), 7,35 (1H, дд, J=8,6, 2,0 Гц), 7,41-7,52 (3H, м), 7,66 (2H, д, J=7,3 Гц), 7,73 (1H, с), 7,89 (1H, д, J=2,6 Гц), 8,21-8,19 (2H, м), 9,87 (1H, с).
МС (ESI, m/z): 412 (M+H)+.
[Пример 170]
[Формула 417]
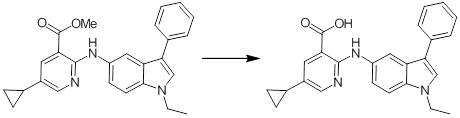
Смесь 45 мг метил-5-циклопропил-2-((1-этил-3-фенил-1H-индол-5-ил)амино)никотината, 66 мкл 5 M водного раствора гидроксида натрия и 1 мл смеси тетрагидрофуран/метанол перемешивали при внешней температуре 50°C в течение 3 часов. Реакционную смесь оставляли отстаиваться в течение ночи, затем добавляли к ней 60 мкл 5 M соляной кислоты, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли воду и метанол, и собирали твердое вещество путем фильтрования с получением 38 мг 5-циклопропил-2-((1-этил-3-фенил-1H-индол-5-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,63-0,69 (2H, м), 0,88-0,95 (2H, м), 1,42 (3H, т, J=6,9 Гц), 1,88-1,98 (1H, м), 4,25 (2H, кв., J=7,3 Гц), 7,23 (1H, т, J=7,3 Гц), 7,31 (1H, дд, J=8,6, 2,0 Гц), 7,44 (2H, т, J=7,6 Гц), 7,52 (1H, д, J=8,6 Гц), 7,66 (2H, д, J=7,3 Гц), 7,75 (1H, с), 7,94 (1H, д, J=2,6 Гц), 8,12 (1H, д, J=2,6 Гц), 8,20 (1H, д, J=1,3 Гц), 10,21 (1H, с).
МС (ESI, m/z): 398 (M+H)+, 396 (M-H)-.
[Пример 171]
[Формула 418]

Способом, аналогичным описанному в примере 165, трет-бутил-5-((5-циклопропил-3-(метоксикарбонил)пиридин-2-ил)амино)-1-изобутил-1H-индол-2-карбоксилат получали из трет-бутил-5-амино-1-изобутил-1H-индол-2-карбоксилата и метил-2-хлор-5-циклопропилникотината.
МС (ESI, m/z): 465 (M+H)+.
[Пример 172]
[Формула 419]

К 20 мл раствора 650 мг трет-бутил-5-((5-циклопропил-3-(метоксикарбонил)пиридин-2-ил)амино)-1-изобутил-1H-индол-2-карбоксилата в 1,2-дихлорметане добавляли 2,08 мл трифторуксусной кислоты и нагревали полученную смесь с обратным холодильником в течение 2 часов и 30 минут. Растворитель отгоняли из реакционной смеси в условиях пониженного давления. К полученному остатку добавляли воду и метанол, и собирали твердое вещество путем фильтрования с получением 760 мг 5-((5-циклопропил-3-(метоксикарбонил)пиридин-2-ил)амино)-1-изобутил-1H-индол-2-карбоновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,70 (2H, м), 0,81 (6H, д, J=6,6 Гц), 0,89-0,95 (2H, м), 1,89-1,98 (1H, м), 2,05-2,15 (1H, м), 3,56-4,22 (3H, м), 4,40 (2H, д, J=7,3 Гц), 7,19 (1H, с), 7,38 (1H, дд, J=9,2, 2,0 Гц), 7,56 (1H, д, J=9,2 Гц), 7,93 (1H, д, J=2,6 Гц), 8,07 (1H, д, J=2,0 Гц), 8,22 (1H, д, J=2,6 Гц), 9,91 (1H, с).
МС (ESI, m/z): 408 (M+H)+, 406 (M-H)-.
[Пример 173]
[Формула 420]
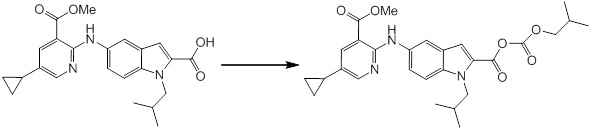
К раствору 50 мг 5-((5-циклопропил-3-(метоксикарбонил)-пиридин-2-ил)амино)-1-изобутил-1H-индол-2-карбоновой кислоты в 2 мл тетрагидрофурана при охлаждении на льду добавляли 24 мкл триэтиламина и 24 мкл изобутилхлороформиата и перемешивали полученную смесь в течение 40 минут. При охлаждении на льду к смеси добавляли 12 мкл триэтиламина и 12 мкл изобутилхлороформиата, и перемешивали полученную смесь в течение 30 минут. К реакционной смеси добавляли этилацетат и ледяную 0,5 M соляную кислоту. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления с получением ангидрида 5-((5-циклопропил-3-(метоксикарбонил)-пиридин-2-ил)амино)-1-изобутил-1H-индол-2-карбоновой кислоты и изобутоксикарбоновой кислоты в виде желтого масла.
МС (ESI, m/z): 509 (M+H)+.
[Пример 174]
[Формула 421]

К раствору ангидрида 5-((5-циклопропил-3-(метоксикарбонил)-пиридин-2-ил)амино)-1-изобутил-1H-индол-2-карбоновой кислоты и изобутоксикарбоновой кислоты, полученного в примере 173, в 2 мл тетрагидрофурана при охлаждении на льду добавляли раствор 19 мг боргидрида натрия в 200 мкл воды, и перемешивали полученную смесь в течение 55 минут. Реакционную смесь оставляли отстаиваться в течение ночи, а затем к смеси добавляли 1 M соляную кислоту и этилацетат. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-50/50) с получением 23 мг метил-5-циклопропил-2-((2-гидроксиметил)-1-изобутил-1H-индол-5-ил)амино)никотината в виде желтого масла.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,68 (2H, м), 0,86 (6H, д, J=6,6 Гц), 0,88-0,95 (2H, м), 1,86-1,96 (1H, м), 2,14-2,25 (1H, м), 3,89 (3H, с), 3,99 (2H, д, J=7,9 Гц), 4,62 (2H, д, J=5,3 Гц), 5,22 (1H, т, J=5,6 Гц), 6,32 (1H, с), 7,17 (1H, дд, J=8,6, 2,0 Гц), 7,36 (1H, д, J=8,6 Гц), 7,87 (1H, д, J=2,0 Гц), 7,88 (1H, д, J=2,6 Гц), 8,22 (1H, д, J=2,6 Гц), 9,82 (1H, с).
МС (ESI, m/z): 394 (M+H)+.
[Пример 175]
[Формула 422]

Способом, аналогичным описанному в примере 116, 5-циклопропил-2-((2-(гидроксиметил)-1-изобутил-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((2-(гидроксиметил)-1-изобутил-1H-индол-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,68 (2H, м), 0,86 (6H, д, J=6,6 Гц), 0,88-0,94 (2H, м), 1,86-1,96 (1H, м), 2,14-2,25 (1H, м), 3,99 (2H, д, J=7,3 Гц), 4,62 (2H, с), 6,32 (1H, с), 7,17 (1H, дд, J=8,6, 2,0 Гц), 7,37 (1H, д, J=8,6 Гц), 7,86 (1H, д, J=2,0 Гц), 7,89 (1H, д, J=2,0 Гц), 8,17 (1H, д, J=2,6 Гц), 10,12 (1H, с).
МС (ESI, m/z): 380 (M+H)+, 378 (M-H)-.
[Пример 176]
[Формула 423]

Смесь 265 мг 5-фенилнафталин-2-амина, 282 мг метил-2-хлор-5-циклопропилникотината, 55 мг трис(дибензилиденацетон)-дипалладия(0), 70 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 788 мг карбоната цезия и 4 мл толуола перемешивали при 190°C в течение 1 часа с использованием микроволновой установки. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/хлороформ = 80/20-40/60) с получением 360 мг метил-5-циклопропил-2-((5-фенилнафталин-2-ил)амино)никотината в виде желтого масла.
МС (ESI, m/z): 395 (M+H)+.
[Пример 177]
[Формула 424]

К смешанному раствору 360 мг метил-5-циклопропил-2-((5-фенилнафталин-2-ил)амино)никотината в 2 мл метанола и 4 мл тетрагидрофурана при комнатной температуре добавляли 1 мл 1 M водного раствора гидроксида натрия, и перемешивали полученную смесь при внешней температуре 70-80°C в течение 5 часов. Реакционную смесь оставляли отстаиваться при комнатной температуре в течение ночи. К смеси добавляли 1 мл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при внешней температуре 70-80°C в течение 2 часов. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. К полученному остатку добавляли воду и метанол, и корректировали полученную смесь до pH 2,7 добавлением 1 M соляной кислоты. Твердое вещество собирали путем фильтрования с получением 340 мг 5-циклопропил-2-((5-фенилнафталин-2-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,63-0,65 (2H, м), 0,88-0,95 (2H, м), 1,85-1,94 (1H, м), 7,18 (1H, д, J=6,6 Гц), 7,43-7,56 (7H, м), 7,68 (1H, д, J=8,6 Гц), 7,77 (1H, д, J=8,6 Гц), 7,88 (1H, д, J=2,6 Гц), 8,13 (1H, д, J=2,0 Гц), 8,64 (1H, д, J=2,0 Гц), 12,65 (1H, с).
МС (ESI, m/z): 381 (M+H)+, 379 (M-H)-.
[Пример 178]
[Формула 425]

Смесь 130 мг 8-фенилнафталин-2-амина, 138 мг метил-2-хлор-5-циклопропилникотината, 27 мг трис(дибензилиденацетон)-дипалладия(0), 34 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 386 мг карбоната цезия и 5 мл толуола перемешивали при 190°C в течение 1 часа с использованием микроволновой установки. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/хлороформ = 70/30-40/60) с получением 150 мг метил-5-циклопропил-2-((8-фенилнафталин-2-ил)амино)никотината в виде желтого масла.
МС (ESI, m/z): 395 (M+H)+.
[Пример 179]
[Формула 426]
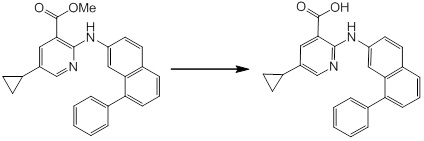
К смешанному раствору 150 мг метил-5-циклопропил-2-((8-фенилнафталин-2-ил)амино)никотината в 2 мл метанола и 4 мл тетрагидрофурана при комнатной температуре добавляли 1 мл 1 M водного раствора гидроксида натрия, и перемешивали полученную смесь при внешней температуре 70-80°C в течение 50 минут. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. К реакционной смеси добавляли воду, и корректировали полученную смесь до pH 2,8 добавлением 1 M соляной кислоты. Твердое вещество собирали путем фильтрования с получением 125 мг 5-циклопропил-2-((8-фенилнафталин-2-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,63-0,68 (2H, м), 0,90-0,96 (2H, м), 1,90-1,99 (1H, м), 7,38-7,51 (3H, м), 7,54-7,61 (4H, м), 7,69 (1H, дд, J=9,2, 2,0 Гц), 7,85-7,87 (2H, м), 7,93 (1H, д, J=8,6 Гц), 8,13 (1H, д, J=2,6 Гц), 8,48 (1H, д, J=2,0 Гц), 10,43 (1H, с), 13,62 (1H, с).
МС (ESI, m/z): 381 (M+H)+, 379 (M-H)-.
[Пример 180]
[Формула 427]

Смесь 36 мг 1-фенил-1,2,3,4-тетрагидрохинолин-6-амина, 37 мг метил-2-хлор-5-циклопропилникотината, 7,3 мг трис(дибензилиденацетон)дипалладия(0), 9,3 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 104 мг карбоната цезия и 2 мл толуола перемешивали при 190°C в течение 1 часа с использованием микроволновой установки. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-80/20) с получением 20 мг метил-5-циклопропил-2-((1-фенил-1,2,3,4-тетрагидрохинолин-6-ил)амино)никотината в виде желтого масла.
МС (ESI, m/z): 400 (M+H)+.
[Пример 181]
[Формула 428]

К смешанному раствору 20 мг метил-5-циклопропил-2-((1-фенил-1,2,3,4-тетрагидрохинолин-6-ил)амино)никотината в 2 мл метанола и 4 мл тетрагидрофурана при комнатной температуре добавляли 1 мл 1 M водного раствора гидроксида натрия, и перемешивали полученную смесь при внешней температуре 70-80°C в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. К полученному остатку добавляли метанол и воду, и корректировали полученную смесь до pH 2,8 добавлением 1 M соляной кислоты, затем к ней добавляли этилацетат, органический слой разделяли, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом препаративной тонкослойной хроматографии (градиентное элюирование смесью гексан/этилацетат = 60/40), к полученному таким образом остатку добавляли гексан, и собирали твердое вещество путем фильтрования с получением 3,2 мг 5-циклопропил-2-((1-фенил-1,2,3,4-тетрагидрохинолин-6-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,67 (2H, м), 0,80-0,94 (2H, м), 1,85-1,97 (3H, м), 2,76 (2H, т, J=6,6 Гц), 3,57 (2H, т, J=5,6 Гц), 6,69 (1H, д, J=8,6 Гц), 7,01 (1H, т, J=7,3 Гц), 7,17-7,23 (3H, м), 7,29-7,34 (3H, м), 7,85 (1H, д, J=2,0 Гц), 8,17 (1H, д, J=2,0 Гц), 9,99 (1H, с).
МС (ESI, m/z): 386 (M+H)+, 384 (M-H)-.
[Пример 182]
[Формула 429]

Смесь 80 мг 1-бензил-1,2,3,4-тетрагидрохинолин-6-амина, 85 мг метил-2-хлор-5-циклопропилникотината, 15,5 мг трис(дибензилиденацетон)дипалладия(0), 19,4 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 219 мг карбоната цезия и 4 мл толуола перемешивали при 190°C в течение 1 часа с использованием микроволновой установки. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-80/20) с получением 170 мг метил-2-((1-бензил-1,2,3,4-тетрагидрохинолин-6-ил)амино)-5-циклопропилникотината в виде желтого масла.
МС (ESI, m/z): 414 (M+H)+.
[Пример 183]
[Формула 430]
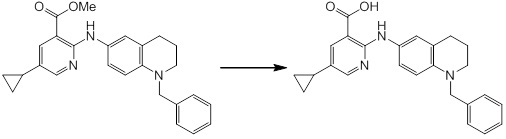
К смешанному раствору 170 мг метил-2-((1-бензил-1,2,3,4-тетрагидрохинолин-6-ил)амино)-5-циклопропилникотината в 1 мл метанола и 2 мл тетрагидрофурана при комнатной температуре добавляли 0,5 мл 1 M водного раствора гидроксида натрия, и нагревали полученную смесь с обратным холодильником в течение 45 минут. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. К полученному остатку добавляли метанол и воду, и корректировали полученную смесь до pH 2,8 добавлением 1 M соляной кислоты. Твердое вещество собирали путем фильтрования с получением 120 мг 2-((1-бензил-1,2,3,4-тетрагидрохинолин-6-ил)амино)-5-циклопропилникотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,58-0,64 (2H, м), 0,85-0,91 (2H, м), 1,82-1,98 (3H, м), 2,69-2,77 (2H, м), 3,35-3,47 (2H, м), 4,46 (2H, с), 6,43 (1H, д, J=9,2 Гц), 7,11-7,14 (2H, м), 7,20-7,35 (5H, м), 7,82 (1H, с), 8,11 (1H, с), 9,81 (1H, с).
МС (ESI, m/z): 400 (M+H)+, 398 (M-H)-.
[Пример 184]
[Формула 431]
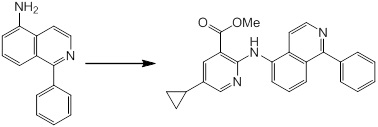
Смесь 110 мг 1-фенилизохинолин-5-амина, 116 мг метил-2-хлор-5-циклопропилникотината, 46 мг трис(дибензилиденацетон)-дипалладия(0), 58 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 326 мг карбоната цезия и 5 мл толуола перемешивали при 190°C в течение 1 часа с использованием микроволновой установки. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-75/25) с получением 119 мг метил-5-циклопропил-2-((1-фенилизохинолин-5-ил)амино)никотината в виде желтого масла.
МС (ESI, m/z): 396 (M+H)+.
[Пример 185]
[Формула 432]

К смешанному раствору 119 мг метил-5-циклопропил-2-((1-фенилизохинолин-5-ил)амино)никотината в 1 мл метанола и 4 мл тетрагидрофурана при комнатной температуре добавляли 1 мл 1 M водного раствора гидроксида натрия, и перемешивали полученную смесь при 60°C в течение 2 часов и 30 минут. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. К полученному остатку добавляли метанол и воду, и корректировали полученную смесь до pH 2,8 добавлением 1 M соляной кислоты. Твердое вещество собирали путем фильтрования с получением желтого твердого вещества. Полученное твердое вещество растворяли в 3 мл воды, и корректировали реакционный раствор до pH 12 добавлением к нему при комнатной температуре 1 M водного раствора гидроксида натрия, а затем корректировали до pH 4,0 добавлением 1 M соляной кислоты. Твердое вещество собирали путем фильтрования с получением 50 мг 5-циклопропил-2-((1-фенилизохинолин-5-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,69-0,71 (2H, м), 0,92-0,98 (2H, м), 1,92-2,01 (1H, м), 7,52-7,70 (7H, м), 7,91 (1H, д, J=5,9 Гц), 8,00 (1H, д, J=2,6 Гц), 8,26 (1H, д, J=2,6 Гц), 8,64-8,67 (2H, м), 11,04 (1H, с).
МС (ESI, m/z): 382 (M+H)+, 380 (M-H)-.
[Пример 186]
[Формула 433]

Смесь 80 мг 4-фенилхинолин-8-амина, 115 мг метил-2-хлор-5-циклопропилникотината, 66 мг трис(дибензилиденацетон)-дипалладия(0), 78 мг 2-(дициклогексилфосфино)-3,6-диметокси-2',4',6'-триизопропил-1,1'-бифенила, 237 мг карбоната цезия и 5 мл толуола перемешивали при 190°C в течение 5 часов с использованием микроволновой установки, а затем перемешивали при 190°C в течение 2 часов с использованием микроволновой установки. Реакционную смесь охлаждали до комнатной температуры, а затем оставляли отстаиваться в течение ночи. Нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-85/15) с получением 110 мг метил-5-циклопропил-2-((4-фенилхинолин-8-ил)амино)никотината в виде коричневого масла.
МС (ESI, m/z): 396 (M+H)+.
[Пример 187]
[Формула 434]

К смешанному раствору 110 мг метил-5-циклопропил-2-((4-фенилхинолин-8-ил)амино)никотината в 2 мл метанола и 4 мл тетрагидрофурана при комнатной температуре добавляли 1 мл 1 M водного раствора гидроксида натрия и перемешивали полученную смесь при 60°C в течение 30 минут. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. К реакционной смеси добавляли метанол и воду, и корректировали полученную смесь до pH 4,0 добавлением 1 M соляной кислоты. К смеси добавляли этилацетат, органический слой разделяли, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат = 50/50). К полученному таким образом остатку добавляли гексан, и собирали твердое вещество путем фильтрования с получением 32 мг 5-циклопропил-2-((4-фенилхинолин-8-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,72-0,73 (2H, м), 0,94-1,00 (2H, м), 1,95-2,04 (1H, м), 7,37 (1H, дд, J=8,6, 1,3 Гц), 7,51-7,61 (7H, м), 8,00 (1H, д, J=2,6 Гц), 8,39 (1H, д, J=2,6 Гц), 8,94 (1H, д, J=4,0 Гц), 9,13 (1H, дд, J=7,9, 1,3 Гц), 12,30 (1H, с).
МС (ESI, m/z): 382 (M+H)+, 380 (M-H)-.
[Пример 188]
[Формула 435]

Смесь 90 мг 7-([1,1'-бифенил]-3-ил)-1-метил-1H-индол-5-амина, 70 мг метил-2-хлор-5-циклопропилникотината, 28 мг трис(дибензилиденацетон)дипалладия(0), 35 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 197 мг карбоната цезия и 4 мл толуола перемешивали при 190°C в течение 1 часа с использованием микроволновой установки. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-80/20) с получением 112 мг метил-2-((7-([1,1'-бифенил]-3-ил)-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотината в виде желтого масла.
МС (ESI, m/z): 474 (M+H)+.
[Пример 189]
[Формула 436]

К смешанному раствору 112 мг метил-2-((7-([1,1'-бифенил]-3-ил)-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотината в 2 мл метанола и 4 мл тетрагидрофурана при комнатной температуре добавляли 1 мл 1 M водного раствора гидроксида натрия и перемешивали полученную смесь при 60°C в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. К полученному остатку добавляли метанол и воду, и корректировали полученную смесь до pH 3,0 добавлением 1 M соляной кислоты. Твердое вещество собирали путем фильтрования с получением 58 мг 2-((7-([1,1'-бифенил]-3-ил)-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,64-0,65 (2H, м), 0,87-0,93 (2H, м), 1,85-1,94 (1H, м), 3,31 (3H, с), 6,47 (1H, д, J=3,3 Гц), 7,09 (1H, д, J=2,0 Гц), 7,25 (1H, д, J=2,6 Гц), 7,38 (1H, т, J=7,3 Гц), 7,47 (3H, т, J=7,6 Гц), 7,57 (1H, т, J=7,6 Гц), 7,76 (4H, т, J=6,9 Гц), 7,88 (1H, д, J=2,6 Гц), 8,07 (1H, д, J=2,6 Гц), 8,21 (1H, д, J=2,6 Гц), 10,23 (1H, с).
МС (ESI, m/z): 460 (M+H)+.
[Пример 190]
[Формула 437]

Смесь 8,7 мг 7-([1,1'-бифенил]-4-ил)-1-метил-1H-индол-5-амина, 6,8 мг метил-2-хлор-5-циклопропилникотината, 2,7 мг трис(дибензилиденацетон)дипалладия(0), 3,4 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 19 мг карбоната цезия и 1,5 мл толуола перемешивали при 190°C в течение 1 часа с использованием микроволновой установки, а затем перемешивали при 190°C в течение 1 часа с использованием микроволновой установки. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-85/15) с получением 7,5 мг метил-2-((7-([1,1'-бифенил]-4-ил)-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотината в виде желтого масла.
МС (ESI, m/z): 474 (M+H)+.
[Пример 191]
[Формула 438]

К смешанному раствору 7,5 мг метил-2-((7-([1,1'-бифенил]-4-ил)-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотината в 0,5 мл метанола и 1 мл тетрагидрофурана при комнатной температуре добавляли 0,5 мл 1 M водного раствора гидроксида натрия и перемешивали полученную смесь при 60°C в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. К полученному остатку добавляли метанол и воду, и корректировали полученную смесь до pH 2,5 добавлением 1 M соляной кислоты, затем добавляли к ней этилацетат, органический слой разделяли, и отгоняли растворитель в условиях пониженного давления. Полученный таким образом остаток очищали методом препаративной тонкослойной хроматографии (гексан/этилацетат = 70/30) с получением 1,9 мг 2-((7-([1,1'-бифенил]-4-ил)-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,63-0,65 (2H, м), 0,81-0,96 (2H, м), 1,86-1,89 (1H, м), 3,36 (3H, с), 6,46 (1H, д, J=2,6 Гц), 7,06 (1H, д, J=2,0 Гц), 7,25 (1H, д, J=2,6 Гц), 7,40 (1H, т, J=7,3 Гц), 7,49-7,58 (4H, м), 7,76-7,80 (4H, м), 7,87 (1H, д, J=2,6 Гц), 8,07 (1H, д, J=2,0 Гц), 8,18 (1H, д, J=2,6 Гц).
МС (ESI, m/z): 460 (M+H)+.
[Пример 192]
[Формула 439]

К раствору 400 мг метил-2-((1H-индол-5-ил)амино)-5-циклопропилбензоата в 4 мл N,N-диметилацетамида при охлаждении на льду добавляли 161 мг трет-бутоксида калия и перемешивали полученную смесь в течение 10 минут. К реакционной смеси при охлаждении на льду добавляли 426 мг 4-йодбензилбромида, и перемешивали полученную смесь при комнатной температуре в течение 4 часов. К реакционной смеси добавляли этилацетат и воду. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 91/9-50/50) с получением 641 мг метил-5-циклопропил-2-((1-(4-йодбензил)-1H-индол-5-ил)амино)бензоата в виде желтого масла.
[Пример 193]
[Формула 440]

Смесь 160 мг метил-5-циклопропил-2-((1-(4-йодбензил)-1H-индол-5-ил)амино)бензоата, 0,1 мл пиперидина, 6 мг трис(дибензилиденацетон)дипалладия(0), 11 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 319 мг карбоната цезия и 2 мл диоксана перемешивали в герметизированной пробирке при внешней температуре 130°C в течение 4 часов в атмосфере азота. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 91/9-67/33) с получением метил-5-циклопропил-2-((1-(4-(пиперидин-1-ил)бензил)-1H-индол-5-ил)амино)бензоата в виде желтого масла.
[Пример 194]
[Формула 441]
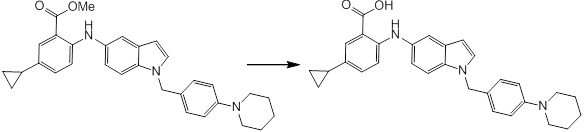
К смешанному раствору метил-5-циклопропил-2-((1-(4-(пиперидин-1-ил)бензил)-1H-индол-5-ил)амино)бензоата, полученного в примере 193, в 2 мл метанола и 4 мл тетрагидрофурана добавляли 1 мл 1 M водного раствора гидроксида натрия, и перемешивали полученную смесь при внешней температуре 40-50°C в течение 10 часов. Реакционную смесь охлаждали до комнатной температуры, а затем к смеси добавляли 1 мл 1 M соляной кислоты, этилацетат и насыщенный водный раствор дикалийгидрофосфата. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 83/17-50/50). К полученному таким образом остатку добавляли этилацетат, твердое вещество собирали путем фильтрования и промывали метанолом с получением 47 мг 5-циклопропил-2-((1-(4-(пиперидин-1-ил)бензил)-1H-индол-5-ил)амино)бензойной кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,49-0,57 (2H, м), 0,80-0,90 (2H, м), 1,44-1,63 (6H, м), 1,76-1,89 (1H, м), 3,03-3,11 (4H, м), 5,26 (2H, с), 6,40 (1H, д, J=2,6 Гц), 6,83-6,90 (3H, м), 6,92-7,05 (2H, м), 7,12 (2H, д, J=8,6 Гц), 7,37 (1H, д, J=2,0 Гц), 7,44-7,50 (2H, м), 7,59 (1H, д, J=2,0 Гц), 9,32 (1H, уш.с).
МС (ESI, m/z): 466 (M+H)+.
[Пример 195]
[Формула 442]

Смесь 160 мг метил-5-циклопропил-2-((1-(4-йодбензил)-1H-индол-5-ил)амино)бензоата, 0,1 мл морфолина, 6 мг трис(дибензилиденацетон)дипалладия(0), 11 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 319 мг карбоната цезия и 2 мл диоксана перемешивали в герметизированной пробирке при внешней температуре 130°C в течение 4 часов в атмосфере азота. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 83/17-0/100) с получением метил-5-циклопропил-2-((1-(4-морфолинобензил)-1H-индол-5-ил)амино)бензоата в виде желтого масла.
[Пример 196]
[Формула 443]

К смешанному раствору метил-5-циклопропил-2-((1-(4-морфолинобензил)-1H-индол-5-ил)амино)бензоата, полученного в примере 195, в 2 мл метанола и 4 мл тетрагидрофурана добавляли 1 мл 1 M водного раствора гидроксида натрия, и перемешивали полученную смесь при внешней температуре 40-50°C в течение 8 часов. Реакционную смесь охлаждали до комнатной температуры, а затем к смеси добавляли 1 мл 1 M соляной кислоты, этилацетат и насыщенный водный раствор дикалийгидрофосфата. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью хлороформ/метанол = 100/0-91/9). К полученному таким образом остатку добавляли хлороформ, твердое вещество собирали путем фильтрования и промывали метанолом с получением 33 мг 5-циклопропил-2-((1-(4-морфолинобензил)-1H-индол-5-ил)амино)бензойной кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,49-0,57 (2H, м), 0,80-0,90 (2H, м), 1,77-1,87 (1H, м), 3,02-3,08 (4H, м), 3,67-3,74 (4H, м), 5,28 (2H, с), 6,40 (1H, д, J=2,6 Гц), 6,84-6,91 (3H, м), 6,91-7,04 (2H, м), 7,15 (2H, д, J=8,6 Гц), 7,37 (1H, д, J=1,3 Гц), 7,44-7,50 (2H, м), 7,59 (1H, д, J=2,0 Гц), 9,32 (1H, уш.с).
МС (ESI, m/z): 468 (M+H)+.
[Пример 197]
[Формула 444]

Смесь 160 мг метил-5-циклопропил-2-((1-(4-йодбензил)-1H-индол-5-ил)амино)бензоата, 0,4 мл 2 M раствора диметиламина в тетрагидрофуране, 6 мг трис(дибензилиденацетон)дипалладия(0), 11 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 319 мг карбоната цезия и 3 мл диоксана перемешивали при 130°C в течение 1,5 часов с использованием микроволновой установки. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 91/9-50/50) с получением метил-5-циклопропил-2-((1-(4-(диметиламино)бензил)-1H-индол-5-ил)амино)бензоата в виде желтого масла.
[Пример 198]
[Формула 445]

К смешанному раствору метил-5-циклопропил-2-((1-(4-(диметиламино)бензил)-1H-индол-5-ил)амино)бензоата, полученного в примере 197, в 2 мл метанола и 4 мл тетрагидрофурана добавляли 1 мл 1 M водного раствора гидроксида натрия, и перемешивали полученную смесь при внешней температуре 40-50°C в течение 8 часов. Реакционную смесь охлаждали до комнатной температуры, а затем к смеси добавляли 1 мл 1 M соляной кислоты, этилацетат и насыщенный водный раствор дикалийгидрофосфата. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 83/17-33/67), к полученному таким образом остатку добавляли хлороформ, твердое вещество собирали путем фильтрования и промывали метанолом с получением 20 мг 5-циклопропил-2-((1-(4-(диметиламино)бензил)-1H-индол-5-ил)амино)бензойной кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,49-0,57 (2H, м), 0,80-0,90 (2H, м), 1,77-1,87 (1H, м), 2,84 (6H, с), 5,24 (2H, с), 6,39 (1H, д, J=2,6 Гц), 6,66 (2H, д, J=9,2 Гц), 6,86 (1H, д, J=8,6 Гц), 6,91-7,04 (2H, м), 7,13 (2H, д, J=8,6 Гц), 7,34-7,38 (1H, м), 7,44-7,50 (2H, м), 7,59 (1H, д, J=2,6 Гц), 9,32 (1H, уш.с).
МС (ESI, m/z): 426 (M+H)+.
[Пример 199]
[Формула 446]

К смешанному раствору 306 мг метил-2-((1H-индол-5-ил)амино)-5-циклопропилбензоата в 4 мл метанола и 8 мл тетрагидрофурана добавляли 2 мл 2 M водного раствора гидроксида натрия, и перемешивали полученную смесь при внешней температуре 60-70°C в течение 4 часов. Реакционную смесь охлаждали до комнатной температуры, а затем к смеси добавляли 1 M соляной кислоты и этилацетат. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия, а затем сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 83/17-67/33), к полученному таким образом остатку добавляли диизопропиловый эфир и гексан, твердое вещество собирали путем фильтрования и промывали гексаном с получением 264 мг 2-((1H-индол-5-ил)амино)-5-циклопропилбензойной кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,49-0,57 (2H, м), 0,80-0,90 (2H, м), 1,78-1,88 (1H, м), 6,35-6,42 (1H, м), 6,85-7,05 (3H, м), 7,33-7,41 (3H, м), 7,60 (1H, д, J=2,0 Гц), 9,33 (1H, уш.с), 11,09 (1H, с), 12,85 (1H, уш.с).
[Пример 200]
[Формула 447]

К раствору 260 мг 2-((1H-индол-5-ил)амино)-5-циклопропилбензойной кислоты в 5 мл N,N-диметилформамида добавляли 374 мг бикарбоната натрия и перемешивали полученную смесь в течение 10 минут. К реакционной смеси добавляли 184 мкл аллилбромида, и перемешивали полученную смесь при комнатной температуре в течение 1 часа. Реакционную смесь оставляли отстаиваться в течение ночи, а затем перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли этилацетат и насыщенный водный раствор бикарбоната натрия. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления с получением аллил-2-((1H-индол-5-ил)амино)-5-циклопропилбензоата в виде желтого масла.
Полученный аллил-2-((1H-индол-5-ил)амино)-5-циклопропил-бензоат растворяли в дихлорметане до общего объема 6 мл.
[Пример 201]
[Формула 448]

К раствору аллил-2-((1H-индол-5-ил)амино)-5-циклопропилбензоата, полученного в примере 200, в 3 мл дихлорметана добавляли 186 мкл триэтиламина, 56 мкл бензоилхлорида и 5 мг 4-(диметиламино)пиридина, и перемешивали полученную смесь при комнатной температуре в течение 1 часа, а затем оставляли отстаиваться в течение ночи. К реакционной смеси добавляли этилацетат и насыщенный водный раствор бикарбоната натрия. Органический слой разделяли, промывали водой и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-67/33). к полученному таким образом остатку добавляли этилацетат и гексан, твердое вещество собирали путем фильтрования и промывали гексаном с получением 114 мг аллил-2-((1-бензоил-1H-индол-5-ил)амино)-5-циклопропилбензоата в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,55-0,63 (2H, м), 0,84-0,93 (2H, м), 1,86-1,95 (1H, м), 4,83 (2H, д, J=5,9 Гц), 5,26-5,47 (2H, м), 6,00-6,15 (1H, м), 6,71 (1H, д, J=3,3 Гц), 7,14 (2H, с), 7,24 (1H, дд, J=8,9, 2,3 Гц), 7,39 (1H, д, J=4,0 Гц), 7,50-7,80 (7H, м), 8,25 (1H, д, J=8,6 Гц), 9,22 (1H, с).
[Пример 202]
[Формула 449]

К раствору 44 мг аллил-2-((1-бензоил-1H-индол-5-ил)амино)-5-циклопропилбензоата в 2 мл ацетонитрила добавляли 18 мкл пирролидина и 6 мг тетракис(трифенилфосфин)палладия(0) и перемешивали полученную смесь при комнатной температуре в течение 2 часов. К реакционной смеси добавляли этилацетат и 1 M соляную кислоту. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли диизопропиловый эфир, твердое вещество собирали путем фильтрования и промывали гексаном с получением 30 мг 2-((1-бензоил-1H-индол-5-ил)амино)-5-циклопропилбензойной кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,55-0,63 (2H, м), 0,84-0,93 (2H, м), 1,83-1,92 (1H, м), 6,71 (1H, д, J=3,3 Гц), 7,08-7,17 (2H, м), 7,23 (1H, дд, J=8,6, 2,0 Гц), 7,38 (1H, д, J=4,0 Гц), 7,52-7,80 (7H, м), 8,25 (1H, д, J=8,6 Гц), 9,54 (1H, уш.с).
МС (ESI, m/z): 397 (M+H)+.
[Пример 203]
[Формула 450]
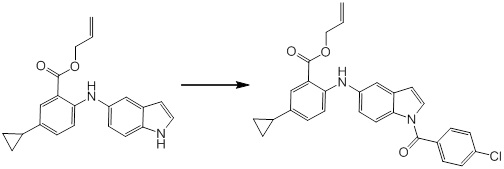
К раствору аллил-2-((1H-индол-5-ил)амино)-5-циклопропилбензоата, полученного в примере 200, в 3 мл дихлорметана добавляли 186 мкл триэтиламина, 63 мкл 4-хлорбензоилхлорида и 5 мг 4-(диметиламино)пиридина, и перемешивали полученную смесь при комнатной температуре в течение 1 часа, а затем оставляли отстаиваться в течение ночи. К реакционной смеси добавляли этилацетат и насыщенный водный раствор бикарбоната натрия. Органический слой разделяли, промывали водой и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-67/33). К полученному таким образом остатку добавляли этилацетат и гексан, твердое вещество собирали путем фильтрования и промывали гексаном с получением 108 мг аллил-2-((1-(4-хлорбензоил)-1H-индол-5-ил)амино)-5-циклопропилбензоата в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,55-0,63 (2H, м), 0,84-0,93 (2H, м), 1,84-1,96 (1H, м), 4,80-4,86 (2H, м), 5,27-5,46 (2H, м), 6,05-6,16 (1H, м), 6,72 (1H, д, J=3,3 Гц), 7,14 (2H, д, J=1,3 Гц), 7,24 (1H, дд, J=9,2, 2,0 Гц), 7,41 (1H, д, J=3,3 Гц), 7,52 (1H, д, J=2,0 Гц), 7,65-7,72 (3H, м), 7,78-7,83 (2H, м), 8,25 (1H, д, J=9,2 Гц), 9,22 (1H, с).
[Пример 204]
[Формула 451]

К раствору 47 мг аллил-2-((1-(4-хлорбензоил)-1H-индол-5-ил)амино)-5-циклопропилбензоата в 2 мл ацетонитрила добавляли 18 мкл пирролидина и 6 мг тетракис(трифенилфосфин)палладия(0) и перемешивали полученную смесь при комнатной температуре в течение 2 часов. К реакционной смеси добавляли этилацетат и 1 M соляную кислоту. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли диизопропиловый эфир, твердое вещество собирали путем фильтрования и промывали гексаном с получением 16 мг 2-((1-(4-хлорбензоил)-1H-индол-5-ил)амино)-5-циклопропилбензойной кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,52-0,62 (2H, м), 0,82-0,91 (2H, м), 1,83-1,94 (1H, м), 6,71 (1H, д, J=4,0 Гц), 7,08-7,17 (2H, м), 7,23 (1H, дд, J=8,9, 2,3 Гц), 7,41 (1H, д, J=4,0 Гц), 7,52 (1H, д, J=2,0 Гц), 7,64-7,70 (3H, м), 7,77-7,83 (2H, м), 8,25 (1H, д, J=8,6 Гц), 9,52 (1H, уш.с).
МС (ESI, m/z): 431 (M+H)+.
[Пример 205]
[Формула 452]

К раствору 108 мг 2-бром-5-метилбензойной кислоты в 10 мл метанола добавляли 0,5 мл концентрированной серной кислоты и нагревали полученную смесь с обратным холодильником в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры, а затем к смеси добавляли насыщенный водный раствор бикарбоната натрия и этилацетат. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления с получением метил-2-бром-5-метилбензоата.
К полученному метил-2-бром-5-метилбензоату добавляли 110 мг 1-бензил-1H-индол-5-амина, 10 мг трис(дибензилиденацетон)-дипалладия(0), 18 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 342 мг карбоната цезия и 4 мл толуола, и перемешивали полученную смесь при 190°C в течение 1 часа и 30 минут с использованием микроволновой установки. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-75/25) с получением метил-2-((1-бензил-1H-индол-5-ил)амино)-5-метилбензоата в виде желтого масла.
МС (ESI, m/z): 371 (M+H)+.
[Пример 206]
[Формула 453]
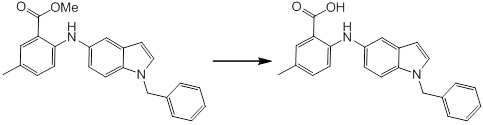
К смешанному раствору метил-2-((1-бензил-1H-индол-5-ил)амино)-5-метилбензоата, полученного в примере 205, в 2 мл метанола и 4 мл тетрагидрофурана добавляли 1 мл 1 M водного раствора гидроксида натрия, и перемешивали полученную смесь при внешней температуре 60-70°C в течение 5 часов. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. К полученному остатку добавляли 1,5 мл 1 M соляной кислоты, 1 мл метанола и 5 мл воды, и собирали твердое вещество путем фильтрования с получением 10 мг 2-((1-бензил-1H-индол-5-ил)амино)-5-метилбензойной кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 2,18 (3H, с), 5,42 (2H, с), 6,44 (1H, д, J=2,6 Гц), 6,89 (1H, д, J=8,6 Гц), 6,96 (1H, дд, J=8,6, 2,0 Гц), 7,08-7,68 (10H, м), 9,34 (1H, уш.с).
МС (ESI, m/z): 357 (M+H)+.
[Пример 207]
[Формула 454]

Смесь 184 мг 1-бензил-1H-индол-4-амина, 172 мг метил-2-хлор-5-циклопропилникотината, 16 мг трис(дибензилиденацетон)-дипалладия(0), 28 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 624 мг карбоната цезия и 14 мл толуола перемешивали при 190°C в течение 1 часа и 30 минут с использованием микроволновой установки. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 91/9-50/50) с получением метил-2-((1-бензил-1H-индол-4-ил)амино)-5-циклопропилникотината.
МС (ESI, m/z): 398 (M+H)+.
[Пример 208]
[Формула 455]
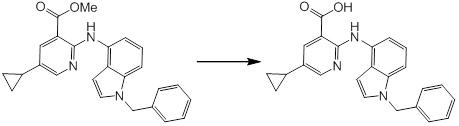
К смешанному раствору метил-2-((1-бензил-1H-индол-4-ил)амино)-5-циклопропилникотината, полученного в примере 207, в 2 мл метанола и 4 мл тетрагидрофурана добавляли 1 мл 1 M водного раствора гидроксида натрия, и нагревали полученную смесь с обратным холодильником в течение 2 часов. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. К полученному остатку добавляли воду, и корректировали полученную смесь до pH 2,5-3,0 добавлением 1 M соляной кислоты, а затем добавляли метанол. Твердое вещество собирали путем фильтрования с получением 220 мг 2-((1-бензил-1H-индол-4-ил)амино)-5-циклопропилникотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,64-0,72 (2H, м), 0,90-0,98 (2H, м), 1,88-2,00 (1H, м), 5,42 (2H, с), 6,54 (1H, д, J=3,3 Гц), 7,02-7,12 (2H, м), 7,16-7,34 (5H, м), 7,51 (1H, д, J=3,3 Гц), 7,94 (1H, д, J=2,6 Гц), 8,17 (1H, дд, J=6,9, 1,7 Гц), 8,30 (1H, д, J=2,0 Гц), 10,82 (1H, уш.с).
МС (ESI, m/z): 384 (M+H)+.
[Пример 209]
[Формула 456]

Смесь 221 мг метил-3-хлор-6-циклопропилпиколината, 253 мг 1-бензил-1H-индол-5-амина, 19 мг трис(дибензилиденацетон)-дипалладия(0), 36 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 710 мг карбоната цезия и 15 мл диоксана перемешивали при 180°C в течение 1 часа с использованием микроволновой установки. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 95/5-67/33) с получением метил-3-((1-бензил-1H-индол-5-ил)амино)-6-циклопропилпиколината.
МС (ESI, m/z): 398 (M+H)+.
[Пример 210]
[Формула 457]

К смешанному раствору метил-3-((1-бензил-1H-индол-5-ил)амино)-6-циклопропилпиколината, полученного в примере 209, в 4 мл метанола и 8 мл тетрагидрофурана добавляли 2 мл 1 M водного раствора гидроксида натрия, и перемешивали полученную смесь при внешней температуре 40-50°C в течение 3 часов. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. К полученному остатку добавляли воду, и корректировали полученную смесь до pH 2,5-3,0 добавлением 1 M соляной кислоты. Твердое вещество собирали путем фильтрования с получением 70 мг 3-((1-бензил-1H-индол-5-ил)амино)-6-циклопропилпиколиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,80-0,87 (4H, м), 1,96-2,07 (1H, м), 5,40 (2H, с), 6,41 (1H, д, J=2,6 Гц), 6,90 (1H, дд, J=8,6, 2,0 Гц), 7,01 (1H, д, J=8,6 Гц), 7,18-7,35 (7H, м), 7,41 (1H, д, J=8,6 Гц), 7,49 (1H, д, J=3,3 Гц).
МС (ESI, m/z): 384 (M+H)+.
[Пример 211]
[Формула 458]

Смесь 92 мг 1-бензил-1H-индол-6-амина, 86 мг метил-2-хлор-5-циклопропилникотината, 8 мг трис(дибензилиденацетон)-дипалладия(0), 14 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 312 мг карбоната цезия и 4 мл толуола перемешивали при 190°C в течение 1 часа и 30 минут с использованием микроволновой установки. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 91/9-50/50) с получением метил-2-((1-бензил-1H-индол-6-ил)амино)-5-циклопропилникотината.
МС (ESI, m/z): 398 (M+H)+.
[Пример 212]
[Формула 459]
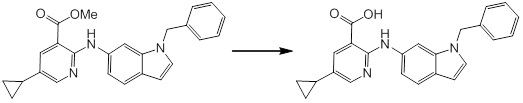
К смешанному раствору метил-2-((1-бензил-1H-индол-6-ил)амино)-5-циклопропилникотината, полученного в примере 211, в 2 мл метанола и 4 мл тетрагидрофурана добавляли 1 мл 1 M водного раствора гидроксида натрия и нагревали полученную смесь с обратным холодильником в течение 3 часов. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. К полученному остатку добавляли метанол и воду, и корректировали полученную смесь до pH 2,5-3,0 добавлением 1 M соляной кислоты. Твердое вещество собирали путем фильтрования с получением 136 мг 2-((1-бензил-1H-индол-6-ил)амино)-5-циклопропилникотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,68 (2H, м), 0,88-0,97 (2H, м), 1,86-1,98 (1H, м), 5,36 (2H, с), 6,41 (1H, д, J=2,6 Гц), 7,11 (1H, дд, J=8,6, 1,3 Гц), 7,20-7,48 (7H, м), 7,86 (1H, д, J=2,6 Гц), 8,02 (1H, с), 8,19 (1H, д, J=2,6 Гц), 10,38 (1H, уш.с).
МС (ESI, m/z): 384 (M+H)+.
[Пример 213]
[Формула 460]

Смесь 96 мг 7-фенилнафталин-1-амина, 85 мг метил-2-хлор-5-циклопропилникотината, 7 мг трис(дибензилиденацетон)-дипалладия(0), 14 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 274 мг карбоната цезия и 4 мл толуола перемешивали при 190°C в течение 1 часа с использованием микроволновой установки. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 95/5-75/25) с получением метил-5-циклопропил-2-((7-фенилнафталин-1-ил)амино)никотината в виде желтого твердого вещества.
МС (ESI, m/z): 395 (M+H)+.
[Пример 214]
[Формула 461]

К смешанному раствору метил-5-циклопропил-2-((7-фенилнафталин-1-ил)амино)никотината, полученного в примере 213, в 2 мл метанола и 4 мл тетрагидрофурана добавляли 1 мл 1 M водного раствора гидроксида натрия и нагревали полученную смесь с обратным холодильником в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. К полученному остатку добавляли метанол и воду, и корректировали полученную смесь до pH 2,5-3,0 добавлением 1 M соляной кислоты. Твердое вещество собирали путем фильтрования с получением 79 мг 5-циклопропил-2-((7-фенилнафталин-1-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,66-0,74 (2H, м), 0,91-0,99 (2H, м), 1,91-2,02 (1H, м), 7,38-7,58 (4H, м), 7,64 (1H, д, J=7,9 Гц), 7,78-7,83 (2H, м), 7,88 (1H, дд, J=8,6, 1,3 Гц), 7,97-8,08 (2H, м), 8,29 (1H, д, J=2,6 Гц), 8,40 (1H, с), 8,60 (1H, д, J=7,9 Гц), 11,23 (1H, уш.с).
МС (ESI, m/z): 381 (M+H)+.
[Пример 215]
[Формула 462]

Смесь 96 мг 6-фенилнафталин-1-амина, 85 мг метил-2-хлор-5-циклопропилникотината, 7 мг трис(дибензилиденацетон)-дипалладия(0), 14 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 274 мг карбоната цезия и 4 мл толуола перемешивали при 190°C в течение 1 часа с использованием микроволновой установки. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 95/5-75/25) с получением метил-5-циклопропил-2-((6-фенилнафталин-1-ил)амино)никотината в виде желтого твердого вещества.
МС (ESI, m/z): 395 (M+H)+.
[Пример 216]
[Формула 463]

К смешанному раствору метил-5-циклопропил-2-((6-фенилнафталин-1-ил)амино)никотината, полученного в примере 215, в 2 мл метанола и 4 мл тетрагидрофурана добавляли 1 мл 1 M водного раствора гидроксида натрия и нагревали полученную смесь с обратным холодильником в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. К полученному остатку добавляли метанол и воду, и корректировали полученную смесь до pH 2,5-3,0 добавлением 1 M соляной кислоты. Твердое вещество собирали путем фильтрования с получением 30 мг 5-циклопропил-2-((6-фенилнафталин-1-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,64-0,72 (2H, м), 0,90-0,98 (2H, м), 1,90-1,99 (1H, м), 7,41 (1H, т, J=7,3 Гц), 7,49-7,56 (3H, м), 7,69 (1H, д, J=7,9 Гц), 7,82-7,98 (4H, м), 8,18-8,26 (3H, м), 8,46 (1H, д, J=7,9 Гц).
МС (ESI, m/z): 381 (M+H)+.
[Пример 217]
[Формула 464]

Способом, аналогичным описанному в примере 215, метил-5-циклопропил-2-((6-фенилнафталин-2-ил)амино)никотинат получали из 6-фенилнафталин-2-амина и метил-2-хлор-5-циклопропилникотината.
МС (ESI, m/z): 395 (M+H)+.
[Пример 218]
[Формула 465]
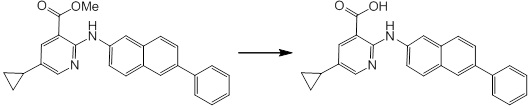
Способом, аналогичным описанному в примере 216, 5-циклопропил-2-((6-фенилнафталин-2-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((6-фенилнафталин-2-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,68-0,75 (2H, м), 0,92-1,01 (2H, м), 1,92-2,03 (1H, м), 7,38 (1H, т, J=7,3 Гц), 7,51 (2H, т, J=7,6 Гц), 7,66-7,98 (7H, м), 8,14 (1H, с), 8,35 (1H, д, J=2,6 Гц), 8,49 (1H, с), 10,59 (1H, с).
МС (ESI, m/z): 381 (M+H)+.
[Пример 219]
[Формула 466]

Смесь 61 мг 7-фенилнафталин-2-амина, 65 мг метил-2-хлор-5-циклопропилникотината, 5 мг трис(дибензилиденацетон)-дипалладия(0), 10 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 128 мг карбоната цезия и 4 мл толуола перемешивали при 190°C в течение 1 часа с использованием микроволновой установки. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-75/25) с получением метил-5-циклопропил-2-((7-фенилнафталин-2-ил)амино)никотината.
МС (ESI, m/z): 395 (M+H)+.
[Пример 220]
[Формула 467]
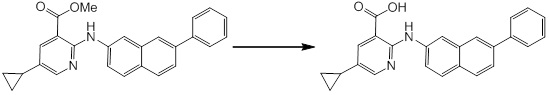
К смешанному раствору метил-5-циклопропил-2-((7-фенилнафталин-2-ил)амино)никотината, полученного в примере 219, в 2 мл метанола и 4 мл тетрагидрофурана добавляли 1 мл 1 M водного раствора гидроксида натрия,и нагревали полученную смесь с обратным холодильником в течение 2 часов. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. К полученному остатку добавляли метанол и воду, и корректировали полученную смесь до pH 2,5-3,0 добавлением 1 M соляной кислоты. Твердое вещество собирали путем фильтрования и промывали водой с получением 23 мг 5-циклопропил-2-((7-фенилнафталин-2-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,67-0,74 (2H, м), 0,92-0,99 (2H, м), 1,91-2,03 (1H, м), 7,40 (1H, т, J=7,3 Гц), 7,52 (2H, т, J=7,3 Гц), 7,65-7,71 (2H, м), 7,79-7,97 (5H, м), 8,08 (1H, с), 8,33 (1H, д, J=2,6 Гц), 8,53 (1H, д, J=1,3 Гц), 10,64 (1H, уш.с).
МС (ESI, m/z): 381 (M+H)+.
[Пример 221]
[Формула 468]

Смесь 1-метил-7-фенил-1H-индол-5-амина, полученного в справочном примере 64, 106 мг метил-2-хлор-5-циклопропил-никотината, 9 мг трис(дибензилиденацетон)дипалладия(0), 17 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 228 мг карбоната цезия и 4 мл толуола перемешивали при 190°C в течение 1 часа с использованием микроволновой установки. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 95/5-75/25) с получением метил-5-циклопропил-2-((1-метил-7-фенил-1H-индол-5-ил)амино)никотината.
МС (ESI, m/z): 398 (M+H)+.
[Пример 222]
[Формула 469]

К смешанному раствору метил-5-циклопропил-2-((1-метил-7-фенил-1H-индол-5-ил)амино)никотината, полученного в примере 221, в 2 мл метанола и 4 мл тетрагидрофурана добавляли 1 мл 1 M водного раствора гидроксида натрия, и нагревали полученную смесь с обратным холодильником в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. К полученному остатку добавляли метанол и воду, и корректировали полученную смесь до pH 2,5-3,0 добавлением 1 M соляной кислоты. Твердое вещество собирали путем фильтрования с получением 171 мг 5-циклопропил-2-((1-метил-7-фенил-1H-индол-5-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,67 (2H, м), 0,85-0,94 (2H, м), 1,84-1,95 (1H, м), 3,25 (3H, с), 6,45 (1H, д, J=3,3 Гц), 7,00 (1H, д, J=2,0 Гц), 7,23 (1H, д, J=3,3 Гц), 7,43-7,49 (5H, м), 7,87 (1H, д, J=2,6 Гц), 8,05 (1H, д, J=2,0 Гц), 8,19 (1H, д, J=2,6 Гц), 10,35 (1H, уш.с).
МС (ESI, m/z): 384 (M+H)+.
[Пример 223]
[Формула 470]

Смесь 1-изобутил-7-фенил-1H-индол-5-амина, полученного в справочном примере 66, 106 мг метил-2-хлор-5-циклопропил-никотината, 9 мг трис(дибензилиденацетон)дипалладия(0), 17 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 228 мг карбоната цезия и 4 мл толуола перемешивали при 190°C в течение 1 часа с использованием микроволновой установки. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 95/5-75/25) с получением метил-5-циклопропил-2-((1-изобутил-7-фенил-1H-индол-5-ил)амино)никотината.
МС (ESI, m/z): 440 (M+H)+.
[Пример 224]
[Формула 471]

К смешанному раствору метил-5-циклопропил-2-((1-изобутил-7-фенил-1H-индол-5-ил)амино)никотината, полученного в примере 223, в 2 мл метанола и 4 мл тетрагидрофурана добавляли 1 мл 1 M водного раствора гидроксида натрия, и нагревали полученную смесь с обратным холодильником в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. К полученному остатку добавляли метанол и воду, и корректировали полученную смесь до pH 2,5-3,0 добавлением 1 M соляной кислоты. Твердое вещество собирали путем фильтрования с получением 17 мг 5-циклопропил-2-((1-изобутил-7-фенил-1H-индол-5-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,35 (6H, д, J=6,6 Гц), 0,62-0,69 (2H, м), 0,80-0,93 (2H, м), 1,31-1,42 (1H, м), 1,84-1,95 (1H, м), 3,52 (2H, д, J=6,6 Гц), 6,45 (1H, д, J=3,3 Гц), 6,98 (1H, д, J=2,0 Гц), 7,27 (1H, д, J=2,6 Гц), 7,43-7,51 (5H, м), 7,87 (1H, д, J=2,6 Гц), 8,04 (1H, д, J=2,0 Гц), 8,20 (1H, д, J=2,0 Гц), 10,24 (1H, с).
МС (ESI, m/z): 426 (M+H)+.
[Пример 225]
[Формула 472]
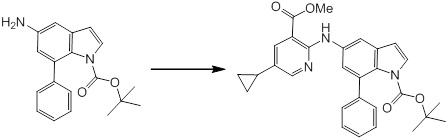
Смесь трет-бутил-5-амино-7-фенил-1H-индол-1-карбоксилата, полученного в справочном примере 68, 116 мг метил-2-хлор-5-циклопропилникотината, 23 мг трис(дибензилиденацетон)-дипалладия(0), 43 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 407 мг карбоната цезия и 10 мл бутилацетата нагревали с обратным холодильником в течение 7 часов в атмосфере азота. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 95/5-75/25) с получением трет-бутил-5-((5-циклопропил-3-(метоксикарбонил)пиридин-2-ил)амино)-7-фенил-1H-индол-1-карбоксилата.
МС (ESI, m/z): 484 (M+H)+.
[Пример 226]
[Формула 473]

Раствор трет-бутил-5-((5-циклопропил-3-(метоксикарбонил)пиридин-2-ил)амино)-7-фенил-1H-индол-1-карбоксилата, полученного в примере 225, в 10 мл N,N-диметилацетамида перемешивали при 150-160°C в течение 6 часов. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 95/5-67/33) с получением метил-5-циклопропил-2-((7-фенил-1H-индол-5-ил)амино)никотината в виде желтого масла.
МС (ESI, m/z): 384 (M+H)+.
[Пример 227]
[Формула 474]
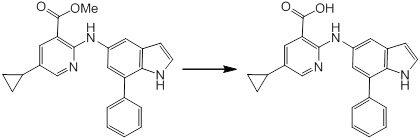
К смешанному раствору метил-5-циклопропил-2-((7-фенил-1H-индол-5-ил)амино)никотината, полученного в примере 226, в 2 мл метанола и 4 мл тетрагидрофурана добавляли 1 мл 1 M водного раствора гидроксида натрия, и нагревали полученную смесь с обратным холодильником в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. К полученному остатку добавляли метанол и воду, и корректировали полученную смесь до pH 2,5-3,0 добавлением 1 M соляной кислоты. Твердое вещество собирали путем фильтрования с получением 5 мг 5-циклопропил-2-((7-фенил-1H-индол-5-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,69 (2H, м), 0,87-0,97 (2H, м), 1,84-1,95 (1H, м), 6,44-6,50 (1H, м), 7,22 (1H, д, J=2,0 Гц), 7,29 (1H, т, J=2,6 Гц), 7,42 (1H, т, J=7,3 Гц), 7,53 (2H, т, J=7,3 Гц), 7,67 (2H, д, J=7,3 Гц), 7,88 (1H, д, J=2,6 Гц), 7,96 (1H, д, J=1,3 Гц), 8,20 (1H, д, J=2,6 Гц), 10,18 (1H, с), 10,89 (1H, с).
МС (ESI, m/z): 370 (M+H)+.
[Пример 228]
[Формула 475]

К трет-бутил-5-бром-2-хлоризоникотинату, полученному в справочном примере 71, добавляли 111 мг 1-бензил-1H-индол-5-амина, 10 мг трис(дибензилиденацетон)дипалладия(0), 18 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 342 мг карбоната цезия и 4 мл толуола, и перемешивали полученную смесь при 190°C в течение 1 часа с использованием микроволновой установки. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-80/20) с получением трет-бутил-5-((1-бензил-1H-индол-5-ил)амино)-2-хлоризоникотината.
МС (ESI, m/z): 434 (M+H)+.
[Пример 229]
[Формула 476]

К смешанному раствору трет-бутил-5-((1-бензил-1H-индол-5-ил)амино)-2-хлоризоникотината, полученного в примере 228, в 2 мл метанола и 4 мл тетрагидрофурана добавляли 1 мл 1 M водного раствора гидроксида натрия, и перемешивали полученную смесь в течение 3 часов. Растворитель отгоняли из реакционной смеси в условиях пониженного давления. К полученному остатку добавляли воду, и корректировали полученную смесь до pH 2,5-3,0 добавлением 1 M соляной кислоты, а затем добавляли этилацетат. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. К полученному таким образом остатку добавляли этилацетат и гексан, и собирали твердое вещество путем фильтрования с получением 3 мг 5-((1-бензил-1H-индол-5-ил)амино)-2-хлоризоникотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 5,44 (2H, с), 6,48 (1H, д, J=3,3 Гц), 7,05 (1H, дд, J=8,6, 2,0 Гц), 7,19-7,38 (5H, м), 7,47-7,53 (2H, м), 7,56 (1H, д, J=2,6 Гц), 7,65 (1H, с), 8,08 (1H, с), 9,09 (1H, с).
МС (ESI, m/z): 378 (M+H)+.
[Пример 230]
[Формула 477]

Смесь 50 мг метил-2-((1H-индол-5-ил)амино)-5-циклопропил-никотината, 19 мкл 1-фтор-3-йодбензола, 2 мг йодида меди(I), 4 мкл транс-циклогексан-1,2-диамина, 70 мг ортофосфата калия и 2 мл диоксана перемешивали при 180°C в течение 3 часов с использованием микроволновой установки. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-75/25) с получением метил-5-циклопропил-2-((1-(3-фторфенил)-1H-индол-5-ил)амино)никотината.
МС (ESI, m/z): 402 (M+H)+.
[Пример 231]
[Формула 478]

К смешанному раствору метил-5-циклопропил-2-((1-(3-фторфенил)-1H-индол-5-ил)амино)никотината, полученного в примере 230, в 2 мл метанола и 4 мл тетрагидрофурана добавляли 1 мл 1 M водного раствора гидроксида натрия, и нагревали полученную смесь с обратным холодильником в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. К полученному остатку добавляли метанол и воду, и корректировали полученную смесь до pH 2,5-3,0 добавлением 1 M соляной кислоты. Твердое вещество собирали путем фильтрования с получением 12 мг 5-циклопропил-2-((1-(3-фторфенил)-1H-индол-5-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,63-0,71 (2H, м), 0,89-0,96 (2H, м), 1,87-1,98 (1H, м), 6,69 (1H, д, J=3,3 Гц), 7,18-7,34 (2H, м), 7,46-7,71 (5H, м), 7,90 (1H, д, J=2,6 Гц), 8,15 (1H, д, J=2,0 Гц), 8,23 (1H, д, J=2,6 Гц), 10,26 (1H, с).
МС (ESI, m/z): 388 (M+H)+.
[Пример 232]
[Формула 479]

Смесь 50 мг метил-2-((1H-индол-5-ил)амино)-5-циклопропил-никотината, 19 мкл 1-фтор-4-йодбензола, 2 мг йодида меди(I), 4 мкл транс-циклогексан-1,2-диамина, 70 мг ортофосфата калия и 2 мл диоксана перемешивали при 180°C в течение 3 часов с использованием микроволновой установки. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-75/25) с получением метил-5-циклопропил-2-((1-(4-фторфенил)-1H-индол-5-ил)амино)никотината.
МС (ESI, m/z): 402 (M+H)+.
[Пример 233]
[Формула 480]

К смешанному раствору метил-5-циклопропил-2-((1-(4-фторфенил)-1H-индол-5-ил)амино)никотината, полученного в примере 232, в 2 мл метанола и 4 мл тетрагидрофурана добавляли 1 мл 1 M водного раствора гидроксида натрия, и нагревали полученную смесь с обратным холодильником в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. К полученному остатку добавляли метанол и воду, и корректировали полученную смесь до pH 2,5-3,0 добавлением 1 M соляной кислоты. Твердое вещество собирали путем фильтрования с получением 14 мг 5-циклопропил-2-((1-(4-фторфенил)-1H-индол-5-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,69 (2H, м), 0,89-0,95 (2H, м), 1,87-1,97 (1H, м), 6,66 (1H, д, J=3,3 Гц), 7,27 (1H, дд, J=9,2, 2,0 Гц), 7,37-7,48 (3H, м), 7,59-7,66 (3H, м), 7,89 (1H, д, J=2,6 Гц), 8,14 (1H, д, J=2,0 Гц), 8,22 (1H, д, J=2,6 Гц), 10,23 (1H, с).
МС (ESI, m/z): 388 (M+H)+.
[Пример 234]
[Формула 481]

Смесь 407 мг трет-бутил-5-((5-циклопропил-3-(метоксикарбонил)пиридин-2-ил)амино)-1H-индол-1-карбоксилата, 167 мкл трифторуксусного ангидрида, 0,5 мл триэтиламина и 10 мл дихлорметана перемешивали в течение 30 минут. Растворитель отгоняли из реакционной смеси в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-75/25) с получением трет-бутил-5-(N-(5-циклопропил-3-(метоксикарбонил)пиридин-2-ил)-2,2,2-трифторацетамидо)-1H-индол-1-карбоксилата.
МС (ESI, m/z): 504 (M+H)+.
[Пример 235]
[Формула 482]

Раствор трет-бутил-5-(N-(5-циклопропил-3-(метоксикарбонил)-пиридин-2-ил)-2,2,2-трифторацетамидо)-1H-индол-1-карбоксилата, полученного в примере 234, в 20 мл N,N-диметилацетамида перемешивали при 150-160°C в течение 4 часов. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 91/9-67/33) с получением метил-5-циклопропил-2-(2,2,2-трифтор-N-(1H-индол-5-ил)ацетамидо)никотината. Полученный метил-5-циклопропил-2-(2,2,2-трифтор-N-(1H-индол-5-ил)ацетамидо)-никотинат растворяли в N,N-диметилформамиде до общего объема 8 мл.
МС (ESI, m/z): 404 (M+H)+.
[Пример 236]
[Формула 483]
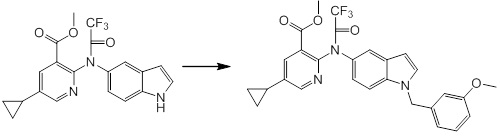
К 2 мл раствора метил-5-циклопропил-2-(2,2,2-трифтор-N-(1H-индол-5-ил)ацетамидо)никотината, полученного в примере 235, в N,N-диметилформамиде при охлаждении на льду добавляли 12 мг 60% гидрида натрия и перемешивали полученную смесь в течение 15 минут. К реакционной смеси при охлаждении на льду добавляли 45 мкл 3-метоксибензилбромида, и перемешивали полученную смесь при комнатной температуре в течение 30 минут. К реакционной смеси добавляли этилацетат и насыщенный водный раствор хлорида натрия. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-75/25) с получением метил-5-циклопропил-2-(2,2,2-трифтор-N-(1-(3-метоксибензил)-1H-индол-5-ил)ацетамидо)никотината.
МС (ESI, m/z): 524 (M+H)+.
[Пример 237]
[Формула 484]

К смешанному раствору метил-5-циклопропил-2-(2,2,2-трифтор-N-(1-(3-метоксибензил)-1H-индол-5-ил)ацетамидо)никотината, полученного в примере 236, в 2 мл метанола и 4 мл тетрагидрофурана добавляли 1 мл 1 M водного раствора гидроксида натрия, и нагревали полученную смесь с обратным холодильником в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. К полученному остатку добавляли этилацетат и воду, и корректировали полученную смесь до pH 2,5-3,0 добавлением 1 M соляной кислоты. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 50/50-0/100), к полученному таким образом остатку добавляли этилацетат и гексан, и собирали твердое вещество путем фильтрования с получением 5 мг 5-циклопропил-2-((1-(3-метоксибензил)-1H-индол-5-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,66 (2H, м), 0,87-0,93 (2H, м), 1,84-1,95 (1H, м), 3,69 (3H, с), 5,36 (2H, с), 6,43 (1H, д, J=2,6 Гц), 6,70-6,84 (3H, м), 7,13-7,24 (2H, м), 7,36 (1H, д, J=9,2 Гц), 7,47 (1H, д, J=3,3 Гц), 7,86 (1H, д, J=2,6 Гц), 7,96 (1H, д, J=2,0 Гц), 8,17 (1H, д, J=2,6 Гц), 10,10 (1H, с).
МС (ESI, m/z): 414 (M+H)+.
[Пример 238]
[Формула 485]

К раствору 65 мг метил-5-циклопропил-2-(2,2,2-трифтор-N-(1H-индол-5-ил)ацетамидо)никотината в 2 мл N,N-диметилформамида при охлаждении на льду добавляли 8 мг 60% гидрида натрия и 25 мкл 3-фторбензилбромида и перемешивали полученную смесь при комнатной температуре в течение 30 минут. К реакционной смеси добавляли этилацетат и воду. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-67/33) с получением метил-5-циклопропил-2-(2,2,2-трифтор-N-(1-(3-фторбензил)-1H-индол-5-ил)ацетамидо)никотината.
МС (ESI, m/z): 512 (M+H)+.
[Пример 239]
[Формула 486]

К смешанному раствору метил-5-циклопропил-2-(2,2,2-трифтор-N-(1-(3-фторбензил)-1H-индол-5-ил)ацетамидо)никотината, полученного в примере 238, в 2 мл метанола и 4 мл тетрагидрофурана добавляли 1 мл 1 M водного раствора гидроксида натрия, и нагревали полученную смесь с обратным холодильником в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. К полученному остатку добавляли этилацетат и воду, и корректировали полученную смесь до pH 2,5-3,0 добавлением 1 M соляной кислоты. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный таким образом остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 50/50-0/100), к смеси добавляли этилацетат и гексан, и собирали твердое вещество путем фильтрования с получением 22 мг 5-циклопропил-2-((1-(3-фторбензил)-1H-индол-5-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,68 (2H, м), 0,86-0,96 (2H, м), 1,85-1,96 (1H, м), 5,43 (2H, с), 6,45 (1H, д, J=3,3 Гц), 6,95-7,20 (4H, м), 7,32-7,40 (2H, м), 7,50 (1H, д, J=3,3 Гц), 7,87 (1H, д, J=2,6 Гц), 7,97 (1H, д, J=2,0 Гц), 8,18 (1H, д, J=2,6 Гц), 10,10 (1H, с).
МС (ESI, m/z): 402 (M+H)+.
[Пример 240]
[Формула 487]

К раствору 65 мг метил-5-циклопропил-2-(2,2,2-трифтор-N-(1H-индол-5-ил)ацетамидо)никотината в 2 мл N,N-диметилформамида при охлаждении на льду добавляли 8 мг 60% гидрида натрия и 25 мкл 4-фторбензилбромида и перемешивали полученную смесь при комнатной температуре в течение 30 минут. К реакционной смеси добавляли этилацетат и воду. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-67/33) с получением метил-5-циклопропил-2-(2,2,2-трифтор-N-(1-(4-фторбензил)-1H-индол-5-ил)ацетамидо)никотината.
МС (ESI, m/z): 512 (M+H)+.
[Пример 241]
[Формула 488]
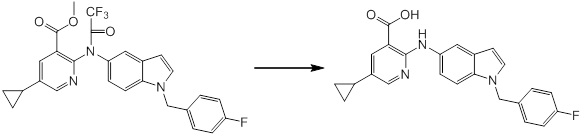
К смешанному раствору метил-5-циклопропил-2-(2,2,2-трифтор-N-(1-(4-фторбензил)-1H-индол-5-ил)ацетамидо)никотината, полученного в примере 240, в 2 мл метанола и 4 мл тетрагидрофурана добавляли 1 мл 1 M водного раствора гидроксида натрия, и нагревали полученную смесь с обратным холодильником в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. К полученному остатку добавляли этилацетат и воду, и корректировали полученную смесь до pH 2,5-3,0 добавлением 1 M соляной кислоты. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 50/50-0/100), к полученному таким образом остатку добавляли этилацетат и гексан, и собирали твердое вещество путем фильтрования с получением 21 мг 5-циклопропил-2-((1-(4-фторбензил)-1H-индол-5-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,68 (2H, м), 0,85-0,95 (2H, м), 1,84-1,95 (1H, м), 5,38 (2H, с), 6,43 (1H, д, J=3,3 Гц), 7,09-7,30 (5H, м), 7,38 (1H, д, J=8,6 Гц), 7,48 (1H, д, J=3,3 Гц), 7,86 (1H, д, J=2,6 Гц), 7,96 (1H, д, J=1,3 Гц), 8,17 (1H, д, J=2,6 Гц), 10,10 (1H, с).
МС (ESI, m/z): 402 (M+H)+.
[Пример 242]
[Формула 489]

Способом, аналогичным описанному в примере 5, метил-2-((1-бензил-1H-индол-4-ил)амино)-5-феноксибензоат получали из 1-бензил-4-бром-1H-индола и метил-2-амино-5-феноксибензоата.
1H-ЯМР (ДМСО-d6) δ: 3,85 (3H, с), 5,44 (2H, с), 6,42 (1H, д, J=3,3 Гц), 6,93-7,13 (5H, м), 7,18-7,41 (10H, м), 7,51 (1H, д, J=2,6), 7,54 (1H, д, J=3,3 Гц), 9,53 (1H, с).
[Пример 243]
[Формула 490]

Способом, аналогичным описанному в примере 37, 2-((1-бензил-1H-индол-4-ил)амино)-5-феноксибензойную кислоту получали из метил-2-((1-бензил-1H-индол-4-ил)амино)-5-феноксибензоата.
1H-ЯМР (ДМСО-d6) δ: 5,43 (2H, с), 6,42 (1H, д, J=3,3 Гц), 6,93-7,13 (5H, м), 7,15-7,41 (10H, м), 7,50 (1H, д, J=3,3 Гц), 7,53 (1H, д, J=2,6 Гц), 9,83 (1H, с), 13,30 (1H, уш.с).
МС (ESI/APCI, m/z): 435 (M+H)+, 433 (M-H)-.
[Пример 244]
[Формула 491]

Способом, аналогичным описанному в примере 5, метил-2-((1-бензил-2,3-диоксоиндолин-4-ил)амино)-5-хлорбензоат получали из 1-бензил-4-броминдолин-2,3-диона и метил-2-амино-5-хлорбензоата.
1H-ЯМР (ДМСО-d6) δ: 3,90 (3H, с), 4,90 (2H, с), 6,45 (1H, д, J=7,9 Гц), 7,00 (1H, д, J=8,6 Гц), 7,24-7,46 (6H, м), 7,63-7,67 (2H, м), 7,92-7,95 (1H, м), 10,43 (1H, с).
[Пример 245]
[Формула 492]

Способом, аналогичным описанному в примере 37, 2-((1-бензил-2,3-диоксоиндолин-4-ил)амино)-5-хлорбензойную кислоту получали из метил-2-((1-бензил-2,3-диоксоиндолин-4-ил)амино)-5-хлорбензоата.
1H-ЯМР (ДМСО-d6) δ: 4,90 (2H, с), 6,44 (1H, д, J=7,9 Гц), 7,03 (1H, д, J=8,6 Гц), 7,24-7,45 (6H, м), 7,57-7,66 (2H, м), 7,90-7,94 (1H, м), 10,74 (1H, с).
МС (ESI/APCI, m/z): 407 (M+H)+, 405 (M-H)-.
[Пример 246]
[Формула 493]
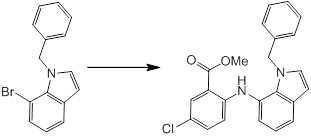
Способом, аналогичным описанному в примере 5, метил-2-((1-бензил-1H-индол-7-ил)амино)-5-хлорбензоат получали из 1-бензил-7-бром-1H-индола и метил-2-амино-5-хлорбензоата.
1H-ЯМР (ДМСО-d6) δ: 3,85 (3H, с), 5,38 (2H, с), 6,19 (1H, д, J=8,6 Гц), 6,61 (1H, д, J=3,3 Гц), 6,63-6,69 (2H, м), 6,93 (1H, д, J=7,3 Гц), 7,03-7,11 (4H, м), 7,13 (1H, дд, J=9,2, 2,6 Гц), 7,47 (1H, д, J=3,3 Гц), 7,57 (1H, д, J=7,9 Гц), 7,72 (1H, д, J=2,6 Гц), 8,94 (1H, с).
[Пример 247]
[Формула 494]

Способом, аналогичным описанному в примере 37, 2-((1-бензил-1H-индол-7-ил)амино)-5-хлорбензойную кислоту получали из метил-2-((1-бензил-1H-индол-7-ил)амино)-5-хлорбензоата.
1H-ЯМР (ДМСО-d6) δ: 5,39 (2H, с), 6,21 (1H, д, J=8,6 Гц), 6,60 (1H, д, J=3,3 Гц), 6,67-6,73 (2H, м), 6,94 (1H, д, J=7,3 Гц), 7,03-7,10 (4H, м), 7,14 (1H, дд, J=9,2, 2,6 Гц), 7,47 (1H, д, J=2,6 Гц), 7,55 (1H, д, J=7,9 Гц), 7,74 (1H, д, J=2,6 Гц), 9,30 (1H, с), 13,31 (1H, уш.с).
[Пример 248]
[Формула 495]
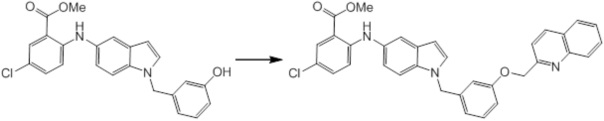
Способом, аналогичным описанному в примере 18, метил-5-хлор-2-((1-(3-(хинолин-2-илметокси)бензил)-1H-индол-5-ил)амино)бензоат получали из метил-5-хлор-2-((1-(3-гидроксибензил)-1H-индол-5-ил)амино)бензоата и 2-(бромметил)хинолина.
1H-ЯМР (ДМСО-d6) δ: 3,87 (3H, с), 5,32 (2H, с), 5,39 (2H, с), 6,42 (1H, д, J=2,6 Гц), 6,82 (1H, д, J=7,3 Гц), 6,85-6,92 (2H, м), 6,93-7,00 (2H, м), 7,20-7,28 (1H, м), 7,32 (1H, дд, J=8,6, 2,6 Гц), 7,38-7,46 (2H, м), 7,53 (1H, д, J=2,6 Гц), 7,56-7,64 (2H, м), 7,74-7,82 (2H, м), 7,94-8,04 (2H, м), 8,38 (1H, д, J=8,6 Гц), 9,21 (1H, с).
[Пример 249]
[Формула 496]

Способом, аналогичным описанному в примере 37, 5-хлор-2-((1-(3-(хинолин-2-илметокси)бензил)-1H-индол-5-ил)амино)бензойную кислоту получали из метил-5-хлор-2-((1-(3-(хинолин-2-илметокси)бензил)-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 5,32 (2H, с), 5,38 (2H, с), 6,41 (1H, д, J=2,6 Гц), 6,79-7,00 (5H, м), 7,20-7,33 (2H, м), 7,36-7,45 (2H, м), 7,52 (1H, д, J=3,3 Гц), 7,56-7,65 (2H, м), 7,73-7,83 (2H, м), 7,93-8,05 (2H, м), 8,37 (1H, д, J=7,9 Гц), 9,47 (1H, с).
МС (ESI/APCI, m/z): 534 (M+H)+.
[Пример 250]
[Формула 497]

Способом, аналогичным описанному в примере 12, метил-5-хлор-2-((1-(хинолин-2-илметил)-1H-индол-5-ил)амино)бензоат получали из метил-2-((1H-индол-5-ил)амино)-5-хлорбензоата и 2-(бромметил)хинолина.
1H-ЯМР (ДМСО-d6) δ: 3,86 (3H, с), 5,72 (2H, с), 6,54 (1H, д, J=2,6 Гц), 6,90 (1H, д, J=9,2 Гц), 6,97 (1H, дд, J=8,9, 1,7 Гц), 7,10 (1H, д, J=8,6 Гц), 7,32 (1H, дд, J=8,9, 3,0 Гц), 7,44-7,50 (2H, м), 7,56-7,63 (1H, м), 7,64 (1H, д, J=3,3 Гц), 7,74-7,82 (2H, м), 7,91-7,96 (1H, м), 8,02 (1H, д, J=8,6 Гц), 8,30 (1H, д, J=8,6 Гц), 9,22 (1H, с).
[Пример 251]
[Формула 498]

Способом, аналогичным описанному в примере 37, 5-хлор-2-((1-(хинолин-2-илметил)-1H-индол-5-ил)амино)бензойную кислоту получали из метил-5-хлор-2-((1-(хинолин-2-илметил)-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 5,72 (2H, с), 6,53 (1H, д, J=3,3 Гц), 6,91 (1H, д, J=9,2 Гц), 6,97 (1H, дд, J=8,6, 2,0 Гц), 7,10 (1H, д, J=8,6 Гц), 7,30 (1H, дд, J=9,2, 2,6 Гц), 7,43-7,50 (2H, м), 7,55-7,66 (2H, м), 7,74-7,82 (2H, м), 7,94 (1H, д, J=8,6 Гц), 8,02 (1H, д, J=7,9 Гц), 8,30 (1H, д, J=7,9 Гц), 9,49 (1H, с).
МС (ESI/APCI, m/z): 428 (M+H)+, 426 (M-H)-.
[Пример 252]
[Формула 499]

К суспензии 40 мг метил-5-хлор-2-((2-оксо-1,2-дигидрохинолин-6-ил)амино)бензоата в 1 мл N,N-диметилацетамида добавляли 25,3 мг карбоната калия и 17,4 мкл бензилбромида, и перемешивали полученную смесь при внешней температуре 70-80°C в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры, затем добавляли к ней этилацетат и воду, и корректировали полученную смесь до pH 3,0 добавлением 2 M соляной кислоты. Органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-70/30) с получением 23 мг метил-2-((1-бензил-2-оксо-1,2-дигидрохинолин-6-ил)амино)-5-хлорбензоата в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 3,91 (3H, с), 5,56 (2H, с), 6,82 (1H, д, J=9,2 Гц), 7,02 (1H, д, J=8,6 Гц), 7,19-7,36 (8H, м), 7,40 (1H, д, J=2,6 Гц), 7,67 (1H, д, J=9,2 Гц), 7,93 (1H, д, J=2,6 Гц), 9,39 (1H, с).
[Пример 253]
[Формула 500]

Способом, аналогичным описанному в примере 37, 2-((1-бензил-2-оксо-1,2-дигидрохинолин-6-ил)амино)-5-хлорбензойную кислоту получали из метил-2-((1-бензил-2-оксо-1,2-дигидрохинолин-6-ил)амино)-5-хлорбензоата.
1H-ЯМР (ДМСО-d6) δ: 5,52 (2H, с), 6,74 (1H, д, J=9,9 Гц), 7,11 (1H, д, J=9,2 Гц), 7,18-7,46 (8H, м), 7,67 (1H, д, J=2,0 Гц), 7,82 (1H, д, J=3,3 Гц), 7,96 (1H, д, J=9,2 Гц), 9,57 (1H, с).
МС (ESI/APCI, m/z): 405 (M+H)+, 403 (M-H)-.
[Пример 254]
[Формула 501]

Способом, аналогичным описанному в примере 12, метил-2-((1-бутил-1H-индол-5-ил)амино)-5-хлорбензоат получали из метил-2-((1H-индол-5-ил)амино)-5-хлорбензоата и 1-бромбутана.
1H-ЯМР (ДМСО-d6) δ: 0,89 (3H, т, J=7,6 Гц), 1,26 (2H, секст., J=7,6 Гц), 1,74 (2H, квин., J=7,6 Гц), 3,87 (3H, с), 4,18 (2H, т, J=7,3 Гц), 6,40 (1H, д, J=2,6 Гц), 6,90 (1H, д, J=9,2 Гц), 7,01 (1H, дд, J=8,6, 2,0 Гц), 7,34 (1H, дд, J=9,2, 2,6 Гц), 7,39-7,44 (2H, м), 7,51 (1H, д, J=8,6 Гц), 7,80 (1H, д, J=2,6 Гц), 9,24 (1H, с).
[Пример 255]
[Формула 502]
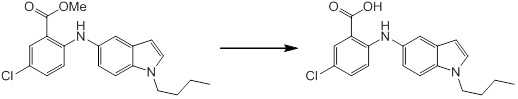
Способом, аналогичным описанному в примере 37, 2-((1-бутил-1H-индол-5-ил)амино)-5-хлорбензойную кислоту получали из метил-2-((1-бутил-1H-индол-5-ил)амино)-5-хлорбензоата.
1H-ЯМР (ДМСО-d6) δ: 0,90 (3H, т, J=7,3 Гц), 1,26 (2H, секст., J=7,6 Гц), 1,74 (2H, квин., J=7,6 Гц), 4,17 (2H, т, J=7,3 Гц), 6,40 (1H, д, J=2,6 Гц), 6,91 (1H, д, J=8,6 Гц), 7,01 (1H, дд, J=8,9, 2,3 Гц), 7,32 (1H, дд, J=8,6, 2,6 Гц), 7,38-7,43 (2H, м), 7,51 (1H, д, J=8,6 Гц), 7,79 (1H, д, J=2,6 Гц), 9,49 (1H, с), 13,26 (1H, уш.с).
МС (ESI/APCI, m/z): 343 (M+H)+, 341 (M-H)-.
[Пример 256]
[Формула 503]
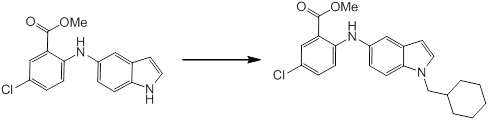
Способом, аналогичным описанному в примере 12, метил-5-хлор-2-((1-(циклогексилметил)-1H-индол-5-ил)амино)бензоат получали из метил-2-((1H-индол-5-ил)амино)-5-хлорбензоата и (бромметил)-циклогексана.
1H-ЯМР (ДМСО-d6) δ: 0,90-1,30 (5H, м), 1,45-1,85 (6H, м), 3,87 (3H, с), 4,01 (2H, д, J=7,3 Гц), 6,40 (1H, д, J=3,3 Гц), 6,91 (1H, д, J=9,2 Гц), 7,00 (1H, дд, J=8,6, 2,0 Гц), 7,31-7,38 (2H, м), 7,42 (1H, д, J=2,0 Гц), 7,52 (1H, д, J=9,2 Гц), 7,80 (1H, д, J=2,6 Гц), 9,23 (1H, с).
[Пример 257]
[Формула 504]

Способом, аналогичным описанному в примере 37, 5-хлор-2-((1-(циклогексилметил)-1H-индол-5-ил)амино)бензойную кислоту получали из метил-5-хлор-2-((1-(циклогексилметил)-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 0,90-1,25 (5H, м), 1,45-1,90 (6H, м), 4,01 (2H, д, J=7,3 Гц), 6,39 (1H, д, J=3,3 Гц), 6,92 (1H, д, J=8,6 Гц), 7,00 (1H, дд, J=8,6, 2,0 Гц), 7,32 (1H, дд, J=9,2, 2,6 Гц), 7,36 (1H, д, J=3,3 Гц), 7,38-7,43 (1H, м), 7,50 (1H, д, J=8,6 Гц), 7,79 (1H, д, J=2,6 Гц), 9,50 (1H, с).
МС (ESI/APCI, m/z): 383 (M+H)+, 381 (M-H)-.
[Пример 258]
[Формула 505]

К раствору 120 мг 1-бензил-5-((4-хлор-2-(метоксикарбонил)-фенил)амино)-1H-индол-2-карбоновой кислоты в 2 мл N,N-диметилацетамида добавляли 56 мг гидрохлорида метиламина, 157 мг гексафторфосфата O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония и 231 мкл триэтиламина, полученную смесь перемешивали при комнатной температуре в течение 1 часа, а затем оставляли отстаиваться в течение ночи. К реакционной смеси добавляли этилацетат и воду, и корректировали полученную смесь до pH 2 добавлением 2 M соляной кислоты. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-20/80) с получением 103 мг метил-2-((1-бензил-2-(метилкарбамоил)-1H-индол-5-ил)амино)-5-хлорбензоата в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 2,77 (3H, д, J=4,6 Гц), 3,87 (3H, с), 5,88 (2H, с), 6,94 (1H, д, J=9,2 Гц), 7,06-7,15 (4H, м), 7,16-7,31 (3H, м), 7,35 (1H, дд, J=9,2, 2,6 Гц), 7,49-7,57 (2H, м), 7,81 (1H, д, J=2,6 Гц), 8,52-8,60 (1H, м), 9,24 (1H, с).
[Пример 259]
[Формула 506]

Способом, аналогичным описанному в примере 37, 2-((1-бензил-2-(метилкарбамоил)-1H-индол-5-ил)амино)-5-хлорбензойную кислоту получали из метил-2-((1-бензил-2-(метилкарбамоил)-1H-индол-5-ил)амино)-5-хлорбензоата.
1H-ЯМР (ДМСО-d6) δ: 2,77 (3H, д, J=4,6 Гц), 5,87 (2H, с), 6,94 (1H, д, J=9,2 Гц), 7,06-7,14 (4H, м), 7,16-7,30 (3H, м), 7,33 (1H, дд, J=9,2, 2,6 Гц), 7,48-7,56 (2H, м), 7,80 (1H, д, J=2,6 Гц), 8,51-8,60 (1H, м), 9,51 (1H, с).
МС (ESI/APCI, m/z): 434 (M+H)+, 432 (M-H)-.
[Пример 260]
[Формула 507]

Способом, аналогичным описанному в примере 258, метил-2-((1-бензил-2-((2-((трет-бутоксикарбонил)амино)этил)карбамоил)-1H-индол-5-ил)амино)-5-хлорбензоат получали из 1-бензил-5-((4-хлор-2-(метоксикарбонил)фенил)амино)-1H-индол-2-карбоновой кислоты и трет-бутил-(2-аминоэтил)карбамата.
1H-ЯМР (ДМСО-d6) δ: 1,38 (9H, с), 3,02-3,15 (2H, м), 3,23-3,40 (2H, м), 3,87 (3H, с), 5,85 (2H, с), 6,86-6,97 (2H, м), 7,08-7,31 (7H, м), 7,35 (1H, дд, J=9,2, 2,6 Гц), 7,50-7,58 (2H, м), 7,81 (1H, д, J=2,6 Гц), 8,53-8,62 (1H, м), 9,24 (1H, с).
[Пример 261]
[Формула 508]

Способом, аналогичным описанному в примере 37, 2-((1-бензил-2-((2-((трет-бутоксикарбонил)амино)этил)карбамоил)-1H-индол-5-ил)амино)-5-хлорбензойную кислоту получали из метил-2-((1-бензил-2-((2-((трет-бутоксикарбонил)амино)этил)карбамоил)-1H-индол-5-ил)амино)-5-хлорбензоата.
1H-ЯМР (ДМСО-d6) δ: 1,38 (9H, с), 3,02-3,50 (4H, м), 5,84 (2H, с), 6,86-6,99 (2H, м), 7,05-7,15 (4H, м), 7,16-7,31 (4H, м), 7,45-7,53 (2H, м), 7,80 (1H, д, J=2,6 Гц), 8,51-8,60 (1H, м).
[Пример 262]
[Формула 509]

Способом, аналогичным описанному в примере 20, трет-бутил-4-((5-((4-хлор-2-(метоксикарбонил)фенил)амино)-1H-индол-1-ил)метил)пиперидин-1-карбоксилат получали из трет-бутил-4-((5-амино-1H-индол-1-ил)метил)пиперидин-1-карбоксилата и метил-2-бром-5-хлорбензоата.
1H-ЯМР (ДМСО-d6) δ: 1,03-1,22 (2H, м), 1,35-1,52 (2H, м), 1,38 (9H, с), 1,90-2,08 (1H, м), 2,54-2,75 (2H, м), 3,85-3,98 (2H, м), 3,88 (3H, с), 4,08 (2H, д, J=7,9 Гц), 6,41 (1H, д, J=2,6 Гц), 6,92 (1H, д, J=9,2 Гц), 7,01 (1H, дд, J=8,6, 2,0 Гц), 7,35 (1H, дд, J=9,2, 2,6 Гц), 7,39 (1H, д, J=2,6 Гц), 7,42 (1H, д, J=1,3 Гц), 7,56 (1H, д, J=8,6 Гц), 7,81 (1H, д, J=2,6 Гц), 9,24 (1H, с).
[Пример 263]
[Формула 510]

Способом, аналогичным описанному в примере 37, 2-((1-((1-(трет-бутоксикарбонил)пиперидин-4-ил)метил)-1H-индол-5-ил)амино)-5-хлорбензойную кислоту получали из трет-бутил-4-((5-((4-хлор-2-(метоксикарбонил)фенил)амино)-1H-индол-1-ил)метил)пиперидин-1-карбоксилата.
1H-ЯМР (ДМСО-d6) δ: 1,02-1,21 (2H, м), 1,35-1,52 (2H, м), 1,38 (9H, с), 1,88-2,09 (1H, м), 2,55-2,75 (2H, м), 3,86-3,99 (2H, м), 4,08 (2H, д, J=6,6 Гц), 6,40 (1H, д, J=2,6 Гц), 6,93 (1H, д, J=9,2 Гц), 7,01 (1H, дд, J=8,6, 2,0 Гц), 7,30 (1H, дд, J=9,2, 2,6 Гц), 7,38 (1H, д, J=2,6 Гц), 7,41 (1H, д, J=2,0 Гц), 7,55 (1H, д, J=8,6 Гц), 7,80 (1H, д, J=2,6 Гц).
МС (ESI/APCI, m/z): 482 (M-H)-.
[Пример 264]
[Формула 511]

Способом, аналогичным описанному в примере 5, метил-2-((2-бензил-1-оксо-1,2,3,4-тетрагидроизохинолин-6-ил)амино)-5-хлорбензоат получали из 2-бензил-6-бром-3,4-дигидроизохинолин-1-(2H)-она и метил-2-амино-5-хлорбензоата.
1H-ЯМР (ДМСО-d6) δ: 2,91 (2H, т, J=6,6 Гц), 3,46 (2H, т, J=6,6 Гц), 3,86 (3H, с), 4,69 (2H, с), 7,09 (1H, д, J=2,0 Гц), 7,17 (1H, дд, J=8,3, 2,3 Гц), 7,23-7,39 (5H, м), 7,45 (1H, д, J=9,2 Гц), 7,53 (1H, дд, J=8,9, 2,3 Гц), 7,83-7,89 (2H, м), 9,32 (1H, с).
[Пример 265]
[Формула 512]
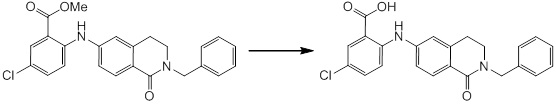
Способом, аналогичным описанному в примере 37, 2-((2-бензил-1-оксо-1,2,3,4-тетрагидроизохинолин-6-ил)амино)-5-хлорбензойную кислоту получали из метил-2-((2-бензил-1-оксо-1,2,3,4-тетрагидроизохинолин-6-ил)амино)-5-хлорбензоата.
1H-ЯМР (ДМСО-d6) δ: 2,92 (2H, т, J=6,6 Гц), 3,46 (2H, т, J=6,6 Гц), 4,70 (2H, с), 7,11 (1H, д, J=2,0 Гц), 7,19 (1H, дд, J=8,6, 2,0 Гц), 7,23-7,39 (5H, м), 7,45 (1H, д, J=9,2 Гц), 7,51 (1H, дд, J=9,2, 2,6 Гц), 7,84-7,90 (2H, м), 9,71 (1H, с).
МС (ESI/APCI, m/z): 405 (M-H)-.
[Пример 266]
[Формула 513]
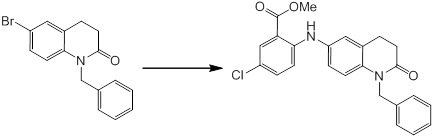
Способом, аналогичным описанному в примере 5, метил-2-((1-бензил-2-оксо-1,2,3,4-тетрагидрохинолин-6-ил)амино)-5-хлорбензоат получали из 1-бензил-6-бром-3,4-дигидрохинолин-2-(1H)-она и метил-2-амино-5-хлорбензоата.
1H-ЯМР (ДМСО-d6) δ: 2,66-2,75 (2H, м), 2,90-3,00 (2H, м), 3,85 (3H, с), 5,14 (2H, с), 6,91 (1H, д, J=8,6 Гц), 6,99-7,09 (2H, м), 7,16 (1H, д, J=2,0 Гц), 7,19-7,27 (3H, м), 7,28-7,36 (2H, м), 7,40 (1H, дд, J=8,6, 2,6 Гц), 7,80 (1H, д, J=2,6 Гц), 9,14 (1H, с).
[Пример 267]
[Формула 514]

Способом, аналогичным описанному в примере 37, 2-((1-бензил-2-оксо-1,2,3,4-тетрагидрохинолин-6-ил)амино)-5-хлорбензойную кислоту получали из метил-2-((1-бензил-2-оксо-1,2,3,4-тетрагидрохинолин-6-ил)амино)-5-хлорбензоата.
1H-ЯМР (ДМСО-d6) δ: 2,66-2,75 (2H, м), 2,90-2,99 (2H, м), 5,14 (2H, с), 6,90 (1H, д, J=8,6 Гц), 7,02 (1H, дд, J=8,6, 2,0 Гц), 7,06 (1H, д, J=9,2 Гц), 7,16 (1H, д, J=2,6 Гц), 7,19-7,26 (3H, м), 7,28-7,34 (2H, м), 7,37 (1H, дд, J=8,6, 2,6 Гц), 7,80 (1H, д, J=2,6 Гц), 9,46 (1H, с).
МС (ESI/APCI, m/z): 405 (M-H)-.
[Пример 268]
[Формула 515]
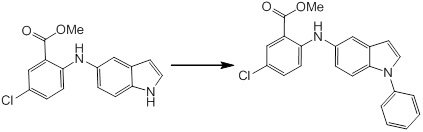
Смесь 80 мг метил-2-((1H-индол-5-ил)амино)-5-хлорбензоата, 60 мкл йодбензола, 24,7 мг трис(дибензилиденацетон)-дипалладия(0), 50,5 мг 2-дициклогексилфосфино-2',4',6'-триизопропилбифенила, 113 мг ортофосфата калия и 2 мл толуола нагревали с обратным холодильником в течение 3 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-70/30) с получением 42 мг метил-5-хлор-2-((1-фенил-1H-индол-5-ил)амино)бензоата в виде бледно-коричневого масла.
1H-ЯМР (CDCl3) δ: 3,91 (3H, с), 6,64 (1H, д, J=2,6 Гц), 6,97 (1H, д, J=9,2 Гц), 7,07 (1H, дд, J=8,9, 2,3 Гц), 7,16 (1H, дд, J=8,9, 2,3 Гц), 7,30-7,40 (2H, м), 7,48-7,57 (6H, м), 7,91 (1H, д, J=2,6 Гц), 9,37 (1H, с).
[Пример 269]
[Формула 516]

Способом, аналогичным описанному в примере 37, 5-хлор-2-((1-фенил-1H-индол-5-ил)амино)бензойную кислоту получали из метил-5-хлор-2-((1-фенил-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 6,69 (1H, д, J=3,3 Гц), 7,00 (1H, д, J=9,2 Гц), 7,09 (1H, дд, J=8,6, 2,0 Гц), 7,35 (1H, дд, J=8,6, 2,6 Гц), 7,38-7,45 (1H, м), 7,53-7,65 (6H, м), 7,70 (1H, д, J=3,3 Гц), 7,81 (1H, д, J=2,6 Гц), 9,56 (1H, с).
[Пример 270]
[Формула 517]

Способом, аналогичным описанному в примере 268, метил-5-хлор-2-((1-(тиазол-4-ил)-1H-индол-5-ил)амино)бензоат получали из метил-2-((1H-индол-5-ил)амино)-5-хлорбензоата и 4-бромтиазола.
МС (ESI, m/z): 384 (M+H)+.
[Пример 271]
[Формула 518]

Способом, аналогичным описанному в примере 37, 5-хлор-2-((1-(тиазол-4-ил)-1H-индол-5-ил)амино)бензойную кислоту получали из метил-5-хлор-2-((1-(тиазол-4-ил)-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 6,71 (1H, д, J=3,3 Гц), 7,03 (1H, д, J=9,2 Гц), 7,16 (1H, дд, J=8,9, 2,3 Гц), 7,36 (1H, дд, J=9,2, 2,6 Гц), 7,54 (1H, д, J=2,0 Гц), 7,80-7,84 (2H, м), 7,94 (1H, д, J=3,3 Гц), 8,09 (1H, д, J=8,6 Гц), 9,26 (1H, д, J=2,0 Гц), 9,60 (1H, уш.с).
МС (ESI, m/z): 368 (M-H)-.
[Пример 272]
[Формула 519]

Способом, аналогичным описанному в примере 12, метил-5-хлор-2-((1-(4-(метилсульфонил)бензил)-1H-индол-5-ил)амино)бензоат получали из метил-2-((1H-индол-5-ил)амино)-5-хлорбензоата и 1-(бромметил)-4-(метилсульфонил)бензола.
1H-ЯМР (CDCl3) δ: 3,03 (3H, с), 3,91 (3H, с), 5,43 (2H, с), 6,57 (1H, д, J=3,3 Гц), 6,90-6,96 (1H, м), 7,04 (1H, дд, J=8,6, 2,0 Гц), 7,13-7,20 (3H, м), 7,24-7,31 (2H, м), 7,51 (1H, д, J=2,0 Гц), 7,86-7,93 (3H, м), 9,34 (1H, с).
[Пример 273]
[Формула 520]
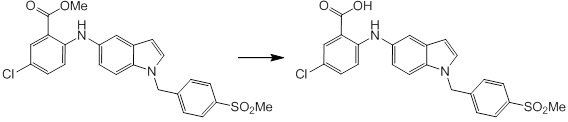
Способом, аналогичным описанному в примере 37, 5-хлор-2-((1-(4-(метилсульфонил)бензил)-1H-индол-5-ил)амино)бензойную кислоту получали из метил-5-хлор-2-((1-(4-(метилсульфонил)бензил)-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 3,17 (3H, с), 5,57 (2H, с), 6,51 (1H, д, J=3,3 Гц), 6,92 (1H, д, J=9,2 Гц), 7,00 (1H, дд, J=8,6, 2,0 Гц), 7,31 (1H, дд, J=9,2, 2,6 Гц), 7,40-7,50 (4H, м), 7,59 (1H, д, J=2,6 Гц), 7,79 (1H, д, J=2,6 Гц), 7,88 (2H, д, J=7,9 Гц), 9,50 (1H, с).
[Пример 274]
[Формула 521]

Способом, аналогичным описанному в примере 268, метил-5-хлор-2-((1-фенил-1H-индол-4-ил)амино)бензоат получали из метил-2-((1H-индол-4-ил)амино)-5-хлорбензоата и йодбензола.
[Пример 275]
[Формула 522]
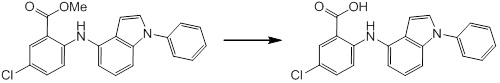
Способом, аналогичным описанному в примере 37, 5-хлор-2-((1-фенил-1H-индол-4-ил)амино)бензойную кислоту получали из метил-5-хлор-2-((1-фенил-1H-индол-4-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 6,56 (1H, д, J=3,3 Гц), 7,13 (1H, д, J=7,3 Гц), 7,18-7,25 (2H, м), 7,35 (1H, д, J=7,9 Гц), 7,39-7,47 (2H, м), 7,56-7,64 (4H, м), 7,66 (1H, д, J=3,3 Гц), 7,88 (1H, д, J=2,6 Гц), 10,00 (1H, с).
[Пример 276]
[Формула 523]

Способом, аналогичным описанному в примере 12, метил-5-хлор-2-((1-(3-(дифторметокси)бензил)-1H-индол-5-ил)амино)бензоат получали из метил-2-((1H-индол-5-ил)амино)-5-хлорбензоата и 1-(бромметил)-3-(дифторметокси)бензола.
1H-ЯМР (CDCl3) δ: 3,91 (3H, с), 5,32 (2H, с), 6,47 (1H, т, J=73,7 Гц), 6,53 (1H, д, J=3,3 Гц), 6,88-6,98 (3H, м), 7,00-7,07 (2H, м), 7,11-7,18 (2H, м), 7,20-7,34 (2H, м), 7,50 (1H, д, J=2,0 Гц), 7,90 (1H, д, J=2,6 Гц), 9,33 (1H, с).
[Пример 277]
[Формула 524]

Способом, аналогичным описанному в примере 37, 5-хлор-2-((1-(3-(дифторметокси)бензил)-1H-индол-5-ил)амино)бензойную кислоту получали из метил-5-хлор-2-((1-(3-(дифторметокси)бензил)-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 5,45 (2H, с), 6,48 (1H, д, J=3,3 Гц), 6,91 (1H, д, J=9,2 Гц), 7,00 (1H, дд, J=8,6, 2,0 Гц), 7,03-7,10 (3H, м), 7,20 (1H, т, J=74,0 Гц), 7,31 (1H, дд, J=9,2, 2,6 Гц), 7,33-7,46 (2H, м), 7,49 (1H, д, J=8,6 Гц), 7,56 (1H, д, J=2,6 Гц), 7,79 (1H, д, J=2,6 Гц), 9,49 (1H, с).
[Пример 278]
[Формула 525]

Способом, аналогичным описанному в примере 5, метил-2-((2-бензил-1-оксоизоиндолин-5-ил)амино)-5-хлорбензоат получали из 2-бензил-5-бромизоиндолин-1-она и метил-2-амино-5-хлорбензоата.
1H-ЯМР (CDCl3) δ: 3,91 (3H, с), 4,23 (2H, с), 4,79 (2H, с), 7,19 (1H, с), 7,24-7,38 (8H, м), 7,83 (1H, д, J=8,6 Гц), 7,95 (1H, т, J=1,3 Гц), 9,59 (1H, с).
[Пример 279]
[Формула 526]

Способом, аналогичным описанному в примере 37, 2-((2-бензил-1-оксоизоиндолин-5-ил)амино)-5-хлорбензойную кислоту получали из метил-2-((2-бензил-1-оксоизоиндолин-5-ил)амино)-5-хлорбензоата.
1H-ЯМР (ДМСО-d6) δ: 4,31 (2H, с), 4,70 (2H, с), 7,23-7,50 (9H, м), 7,66 (1H, д, J=7,9 Гц), 7,86 (1H, д, J=2,6 Гц), 9,76 (1H, с).
[Пример 280]
[Формула 527]

Способом, аналогичным описанному в примере 5, метил-5-хлор-2-((1-оксо-2-фенилизоиндолин-5-ил)амино)бензоат получали из 5-бром-2-фенилизоиндолин-1-она и метил-2-амино-5-хлорбензоата.
1H-ЯМР (CDCl3) δ: 3,94 (3H, с), 4,83 (2H, с), 7,14-7,21 (1H, м), 7,28-7,48 (6H, м), 7,82-7,89 (3H, м), 7,98 (1H, д, J=2,0 Гц), 9,67 (1H, с).
[Пример 281]
[Формула 528]

Способом, аналогичным описанному в примере 37, 5-хлор-2-((1-оксо-2-фенилизоиндолин-5-ил)амино)бензойную кислоту получали из метил-5-хлор-2-((1-оксо-2-фенилизоиндолин-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 4,97 (2H, с), 7,16 (1H, т, J=7,3 Гц), 7,32-7,37 (1H, м), 7,39-7,57 (5H, м), 7,71 (1H, д, J=8,6 Гц), 7,86-7,93 (3H, м), 9,81 (1H, с).
[Пример 282]
[Формула 529]

Способом, аналогичным описанному в примере 5, метил-5-хлор-2-((1-фенилиндолин-5-ил)амино)бензоат получали из 1-фенилиндолин-5-амина и метил-2-бром-5-хлорбензоата.
1H-ЯМР (CDCl3) δ: 3,13 (2H, т, J=8,3 Гц), 3,90 (3H, с), 3,99 (2H, т, J=8,3 Гц), 6,87-7,05 (4H, м), 7,12 (1H, д, J=7,9 Гц), 7,15-7,26 (3H, м), 7,30-7,40 (2H, м), 7,89 (1H, д, J=2,6 Гц), 9,16 (1H, с).
[Пример 283]
[Формула 530]
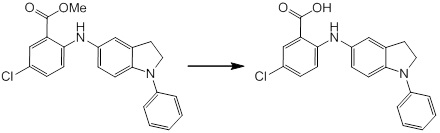
Способом, аналогичным описанному в примере 37, 5-хлор-2-((1-фенилиндолин-5-ил)амино)бензойную кислоту получали из метил-5-хлор-2-((1-фенилиндолин-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 3,10 (2H, т, J=8,3 Гц), 3,96 (2H, т, J=8,6 Гц), 6,90-6,99 (3H, м), 7,07-7,15 (2H, м), 7,20-7,27 (2H, м), 7,31-7,40 (3H, м), 7,78 (1H, д, J=2,6 Гц), 9,37 (1H, с).
[Пример 284]
[Формула 531]
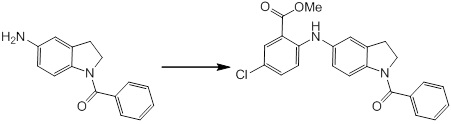
Способом, аналогичным описанному в примере 5, метил-2-((1-бензоилиндолин-5-ил)амино)-5-хлорбензоат получали из (5-аминоиндолин-1-ил)(фенил)метанона и метил-2-бром-5-хлорбензоата.
1H-ЯМР (CDCl3) δ: 3,11 (2H, т, J=8,3 Гц), 3,91 (3H, с), 4,00-4,22 (2H, м), 6,97-7,11 (3H, м), 7,22 (1H, дд, J=9,2, 2,6 Гц), 7,40-7,62 (5H, м), 7,91 (1H, д, J=2,6 Гц), 8,18 (1H, уш.с), 9,31 (1H, с).
[Пример 285]
[Формула 532]
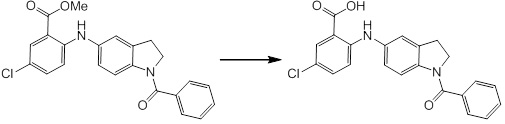
Способом, аналогичным описанному в примере 37, 2-((1-бензоилиндолин-5-ил)амино)-5-хлорбензойную кислоту получали из метил-2-((1-бензоилиндолин-5-ил)амино)-5-хлорбензоата.
1H-ЯМР (ДМСО-d6) δ: 3,09 (2H, т, J=8,3 Гц), 4,02 (2H, т, J=8,3 Гц), 7,09 (2H, д, J=9,2 Гц), 7,19 (1H, с), 7,40 (1H, дд, J=9,2, 2,6 Гц), 7,45-7,64 (5H, м), 7,82 (1H, д, J=2,6 Гц), 8,06 (1H, уш.с), 9,55 (1H, с).
[Пример 286]
[Формула 533]
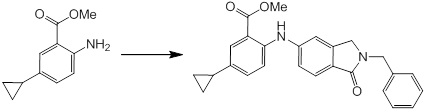
Смесь 46 мг метил-2-амино-5-циклопропилбензоата, 60 мг 2-бензил-5-бромизоиндолин-1-она, 9,2 мг трис(дибензилиденацетон)-дипалладия(0), 12 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 0,13 г карбоната цезия и 2,5 мл толуола перемешивали при 150°C в течение 20 минут в атмосфере азота с использованием микроволновой установки. Реакционную смесь охлаждали до комнатной температуры, к смеси добавляли 2,2 мг ацетата палладия, и перемешивали полученную смесь при 150°C в течение 20 минут в атмосфере азота с использованием микроволновой установки. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-70/30) с получением 60 мг метил-2-((2-бензил-1-оксоизоиндолин-5-ил)амино)-5-циклопропилбензоата в виде бледно-коричневого масла.
1H-ЯМР (CDCl3) δ: 0,60-0,67 (2H, м), 0,88-0,96 (2H, м), 1,80-1,90 (1H, м), 3,89 (3H, с), 4,20 (2H, с), 4,78 (2H, с), 7,11 (1H, дд, J=8,6, 2,0 Гц), 7,14-7,17 (1H, м), 7,20-7,38 (7H, м), 7,71 (1H, д, J=2,0 Гц), 7,79 (1H, д, J=8,6 Гц), 9,46 (1H, с).
[Пример 287]
[Формула 534]
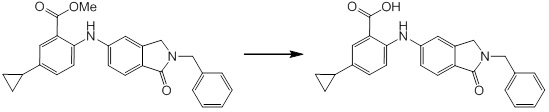
Способом, аналогичным описанному в примере 37, 2-((2-бензил-1-оксоизоиндолин-5-ил)амино)-5-циклопропилбензойную кислоту получали из метил-2-((2-бензил-1-оксоизоиндолин-5-ил)амино)-5-циклопропилбензоата.
1H-ЯМР (ДМСО-d6) δ: 0,56-0,65 (2H, м), 0,86-0,96 (2H, м), 1,85-1,97 (1H, м), 4,28 (2H, с), 4,69 (2H, с), 7,13-7,41 (9H, м), 7,61 (1H, д, J=7,9 Гц), 7,66 (1H, д, J=2,0 Гц), 9,58 (1H, с), 13,19 (1H, уш.с).
[Пример 288]
[Формула 535]

Способом, аналогичным описанному в примере 5, метил-2-хлор-5-(5-((4-хлор-2-(метоксикарбонил)фенил)амино)-1H-индол-1-ил)бензоат получали из метил-2-((1H-индол-5-ил)амино)-5-хлорбензоата и метил-5-бром-2-хлорбензоата.
1H-ЯМР (CDCl3) δ: 3,92 (3H, с), 3,98 (3H, с), 6,67 (1H, д, J=2,6 Гц), 6,97 (1H, д, J=9,2 Гц), 7,11 (1H, дд, J=8,6, 2,0 Гц), 7,18 (1H, дд, J=9,2, 2,6 Гц), 7,34 (1H, д, J=3,3 Гц), 7,44-7,68 (4H, м), 7,92 (1H, д, J=2,6 Гц), 7,99 (1H, д, J=2,0 Гц), 9,38 (1H, уш.с).
[Пример 289]
[Формула 536]

Способом, аналогичным описанному в примере 47, 2-((1-(3-карбокси-4-хлорфенил)-1H-индол-5-ил)амино)-5-хлорбензойную кислоту получали из метил-2-хлор-5-(5-((4-хлор-2-(метоксикарбонил)фенил)амино)-1H-индол-1-ил)бензоата.
1H-ЯМР (ДМСО-d6) δ: 6,72 (1H, д, J=3,3 Гц), 7,01 (1H, д, J=9,2 Гц), 7,13 (1H, дд, J=8,6, 2,0 Гц), 7,36 (1H, дд, J=9,2, 2,6 Гц), 7,56 (1H, д, J=2,0 Гц), 7,61 (1H, д, J=8,6 Гц), 7,70-7,85 (4H, м), 7,97 (1H, д, J=2,6 Гц), 9,57 (1H, уш.с).
МС (ESI/APCI, m/z): 439 (M-H)-.
[Пример 290]
[Формула 537]

К раствору 50 мг метил-5-хлор-2-((1-(3-гидроксибензил)-1H-индол-5-ил)амино)бензоата и 19,3 мг 2-бромацетамида в 0,26 мл N,N-диметилформамида при комнатной температуре добавляли 70,2 мг карбоната калия и перемешивали полученную смесь при комнатной температуре в течение 4 часов. К реакционной смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением 26 мг метил-2-((1-(3-(2-амино-2-оксоэтокси)бензил)-1H-индол-5-ил)амино)-5-хлорбензоата в виде масла.
1H-ЯМР (CDCl3) δ: 3,91 (3H, с), 4,43 (2H, с), 5,31 (2H, с), 5,46-5,69 (1H, м), 6,32-6,57 (2H, м), 6,64-6,70 (1H, м), 6,78-6,87 (2H, м), 6,93 (1H, д, J=9,2 Гц), 7,02 (1H, дд, J=8,9, 2,3 Гц), 7,11-7,19 (2H, м), 7,20-7,33 (2H, м), 7,50 (1H, д, J=2,0 Гц), 7,90 (1H, д, J=2,6 Гц), 9,33 (1H, уш.с).
[Пример 291]
[Формула 538]

Способом, аналогичным описанному в примере 47, 2-((1-(3-(2-амино-2-оксоэтокси)бензил)-1H-индол-5-ил)амино)-5-хлорбензойную кислоту получали из метил-2-((1-(3-(2-амино-2-оксоэтокси)бензил)-1H-индол-5-ил)амино)-5-хлорбензоата.
1H-ЯМР (ДМСО-d6) δ: 4,62 (2H, с), 5,39 (2H, с), 6,46 (1H, д, J=3,3 Гц), 6,73-6,84 (3H, м), 6,91 (1H, д, J=9,2 Гц), 6,99 (1H, дд, J=8,6, 2,0 Гц), 7,16-7,35 (2H, м), 7,43 (1H, д, J=2,0 Гц), 7,49 (1H, д, J=8,6 Гц), 7,55 (1H, д, J=3,3 Гц), 7,78 (1H, д, J=2,6 Гц), 9,49 (1H, уш.с).
МС (ESI/APCI, m/z): 448 (M-H)-.
[Пример 292]
[Формула 539]

Способом, аналогичным описанному в примере 290, метил-5-хлор-2-((1-(3-(2-метокси-2-оксоэтокси)бензил)-1H-индол-5-ил)амино)бензоат получали из метил-5-хлор-2-((1-(3-гидрокси-бензил)-1H-индол-5-ил)амино)бензоата и метил-2-бромацетата.
1H-ЯМР (CDCl3) δ: 3,76 (3H, с), 3,91 (3H, с), 4,56 (2H, с), 5,29 (2H, с), 6,51 (1H, д, J=2,6 Гц), 6,63-6,70 (1H, м), 6,75-6,83 (2H, м), 6,93 (1H, д, J=9,2 Гц), 7,02 (1H, дд, J=8,6, 2,0 Гц), 7,10-7,19 (2H, м), 7,20-7,29 (2H, м), 7,48 (1H, д, J=2,0 Гц), 7,90 (1H, д, J=2,6 Гц), 9,32 (1H, уш.с).
[Пример 293]
[Формула 540]

Способом, аналогичным описанному в примере 47, 2-((1-(3-(карбоксиметокси)бензил)-1H-индол-5-ил)амино)-5-хлорбензойную кислоту получали из метил-5-хлор-2-((1-(3-(2-метокси-2-оксоэтокси)бензил)-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 4,62 (2H, с), 5,39 (2H, с), 6,46 (1H, д, J=2,6 Гц), 6,74-6,84 (3H, м), 6,91 (1H, д, J=9,2 Гц), 6,99 (1H, дд, J=8,6, 2,0 Гц), 7,18-7,26 (1H, м), 7,30 (1H, дд, J=9,2, 2,6 Гц), 7,43 (1H, д, J=2,0 Гц), 7,49 (1H, д, J=8,6 Гц), 7,54 (1H, д, J=2,6 Гц), 7,78 (1H, д, J=2,6 Гц), 9,50 (1H, уш.с).
МС (ESI/APCI, m/z): 451 (M+H)+, 449 (M-H)-.
[Пример 294]
[Формула 541]

К раствору 89,4 мг метил-5-хлор-2-((1-(3-гидроксибензил)-1H-индол-5-ил)амино)бензоата и 190 мкл 1,2-дибромэтана в 0,47 мл N,N-диметилформамида при комнатной температуре добавляли 91,2 мг карбоната калия и перемешивали полученную смесь в течение 6,5 часов. Реакционную смесь оставляли отстаиваться в течение ночи, а затем к смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением 20 мг метил-2-((1-(3-(2-бромэтокси)бензил)-1H-индол-5-ил)амино)-5-хлорбензоата в виде масла.
1H-ЯМР (CDCl3) δ: 3,59 (2H, т, J=6,3 Гц), 3,91 (3H, с), 4,22 (2H, т, J=6,3 Гц), 5,29 (2H, с), 6,51 (1H, д, J=3,3 Гц), 6,66-6,70 (1H, м), 6,76 (1H, д, J=7,9 Гц), 6,82 (1H, дд, J=8,3, 2,3 Гц), 6,92 (1H, д, J=9,2 Гц), 7,02 (1H, дд, J=8,6, 2,0 Гц), 7,10-7,19 (2H, м), 7,20-7,29 (2H, м), 7,49 (1H, д, J=2,0 Гц), 7,90 (1H, д, J=2,6 Гц), 9,32 (1H, уш.с).
[Пример 295]
[Формула 542]
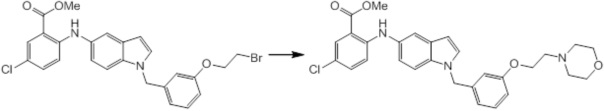
Смесь 19 мг метил-2-((1-(3-(2-бромэтокси)бензил)-1H-индол-5-ил)амино)-5-хлорбензоата, 9,7 мкл морфолина, 15,3 мг карбоната калия и 0,2 мл N,N-диметилформамида перемешивали при внешней температуре 80°C в течение 30 минут. Реакционную смесь охлаждали до комнатной температуры, а затем к смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением 20,1 мг метил-5-хлор-2-((1-(3-(2-морфолиноэтокси)бензил)-1H-индол-5-ил)амино)бензоата в виде масла.
1H-ЯМР (CDCl3) δ: 2,45-2,67 (4H, м), 2,68-2,88 (2H, м), 3,64-3,82 (4H, м), 3,91 (3H, с), 3,99-4,21 (2H, м), 5,28 (2H, с), 6,45-6,60 (1H, м), 6,65-7,10 (5H, м), 7,10-7,36 (4H, м), 7,43-7,58 (1H, м), 7,85-7,98 (1H, м), 9,24-9,44 (1H, м).
[Пример 296]
[Формула 543]

Способом, аналогичным описанному в примере 47, 5-хлор-2-((1-(3-(2-морфолиноэтокси)бензил)-1H-индол-5-ил)амино)бензойную кислоту получали из метил-5-хлор-2-((1-(3-(2-морфолиноэтокси)бензил)-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (CD3OD) δ: 3,25-3,34 (8H, м), 3,51-3,61 (2H, м), 4,25-4,35 (2H, м), 5,39 (2H, с), 6,49 (1H, д, J=3,3 Гц), 6,67-6,75 (1H, м), 6,85-7,02 (4H, м), 7,12-7,22 (1H, м), 7,23-7,36 (3H, м), 7,38-7,46 (1H, м), 7,86 (1H, д, J=2,6 Гц).
МС (ESI/APCI, m/z): 506 (M+H)+, 504 (M-H)-.
[Пример 297]
[Формула 544]

Способом, аналогичным описанному в примере 290, метил-5-хлор-2-((1-(3-(2-метоксиэтокси)бензил)-1H-индол-5-ил)амино)-бензоат получали из метил-5-хлор-2-((1-(3-гидроксибензил)-1H-индол-5-ил)амино)бензоата и 1-бром-2-метоксиэтана.
1H-ЯМР (CDCl3) δ: 3,42 (3H, с), 3,59-3,86 (2H, м), 3,91 (3H, с), 3,99-4,20 (2H, м), 5,28 (2H, с), 6,46-6,59 (1H, м), 6,63-7,08 (5H, м), 7,10-7,36 (4H, м), 7,41-7,61 (1H, м), 7,83-8,02 (1H, м), 9,31 (1H, уш.с).
[Пример 298]
[Формула 545]

Способом, аналогичным описанному в примере 47, 5-хлор-2-((1-(3-(2-метоксиэтокси)бензил)-1H-индол-5-ил)амино)бензойную кислоту получали из метил-5-хлор-2-((1-(3-(2-метоксиэтокси)бензил)-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 3,27 (3H, с), 3,55-3,67 (2H, м), 3,94-4,08 (2H, м), 5,39 (2H, с), 6,46 (1H, д, J=2,6 Гц), 6,73-6,87 (3H, м), 6,91 (1H, д, J=8,6 Гц), 6,99 (1H, дд, J=8,6, 2,0 Гц), 7,17-7,27 (1H, м), 7,30 (1H, дд, J=9,2, 2,6 Гц), 7,43 (1H, д, J=1,3 Гц), 7,48 (1H, д, J=8,6 Гц), 7,55 (1H, д, J=3,3 Гц), 7,78 (1H, д, J=2,6 Гц), 9,48 (1H, уш.с), 13,26 (1H, уш.с).
МС (ESI, m/z): 451 (M+H)+, 449 (M-H)-.
[Пример 299]
[Формула 546]

Способом, аналогичным описанному в примере 290, метил-2-((1-(3-(2-ацетоксиэтокси)бензил)-1H-индол-5-ил)амино)-5-хлорбензоат получали из метил-5-хлор-2-((1-(3-гидроксибензил)-1H-индол-5-ил)амино)бензоата и 2-бромэтилацетата.
[Пример 300]
[Формула 547]

К раствору 24,1 мг метил-2-((1-(3-(2-ацетоксиэтокси)бензил)-1H-индол-5-ил)амино)-5-хлорбензоата в 0,3 мл этанола при комнатной температуре добавляли 39,2 мкл 5 M водного раствора гидроксида натрия и перемешивали полученную смесь при внешней температуре 80°C в течение 10 минут. Реакционную смесь охлаждали до комнатной температуры, а затем к смеси добавляли воду и 3 М соляную кислоту. Твердое вещество собирали путем фильтрования и очищали методом колоночной хроматографии на силикагеле (хлороформ/метанол) с получением 12,1 мг 5-хлор-2-((1-(3-(2-гидроксиэтокси)бензил)-1H-индол-5-ил)амино)бензойной кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,61-3,72 (2H, м), 3,86-3,96 (2H, м), 4,82 (1H, т, J=5,6 Гц), 5,39 (2H, с), 6,47 (1H, д, J=3,3 Гц), 6,71-6,86 (3H, м), 6,91 (1H, д, J=9,2 Гц), 6,99 (1H, дд, J=8,6, 2,0 Гц), 7,17-7,27 (1H, м), 7,30 (1H, дд, J=9,2, 2,6 Гц), 7,43 (1H, д, J=2,0 Гц), 7,48 (1H, д, J=9,2 Гц), 7,55 (1H, д, J=3,3 Гц), 7,78 (1H, д, J=2,6 Гц), 9,50 (1H, уш.с).
МС (ESI, m/z): 437 (M+H)+, 435 (M-H)-.
[Пример 301]
[Формула 548]

К раствору 50 мг метил-2-((1H-индол-5-ил)амино)-5-хлорбензоата и 33,8 мг гидрохлорида 4-(хлорметил)тиазола в 0,5 мл N,N-диметилацетамида при охлаждении на льду добавляли 46,6 мг трет-бутоксида калия, и перемешивали полученную смесь при охлаждении на льду в течение 5 минут, а затем перемешивали при комнатной температуре в течение 25 минут. К реакционной смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением 27,4 мг метил-5-хлор-2-((1-(тиазол-4-илметил)-1H-индол-5-ил)амино)бензоата в виде масла.
1H-ЯМР (CDCl3) δ: 3,91 (3H, с), 5,52 (2H, с), 6,53 (1H, д, J=3,3 Гц), 6,88 (1H, д, J=1,3 Гц), 6,92 (1H, д, J=9,2 Гц), 7,05 (1H, дд, J=8,9, 2,3 Гц), 7,14 (1H, дд, J=9,2, 2,6 Гц), 7,25 (1H, д, J=3,3 Гц), 7,33 (1H, д, J=8,6 Гц), 7,49 (1H, д, J=2,0 Гц), 7,90 (1H, д, J=2,6 Гц), 8,81 (1H, д, J=2,0 Гц), 9,33 (1H, уш.с).
[Пример 302]
[Формула 549]

Способом, аналогичным описанному в примере 47, 5-хлор-2-((1-(тиазол-4-илметил)-1H-индол-5-ил)амино)бензойную кислоту получали из метил-5-хлор-2-((1-(тиазол-4-илметил)-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 5,54 (2H, с), 6,44 (1H, д, J=3,3 Гц), 6,90 (1H, д, J=9,2 Гц), 7,01 (1H, дд, J=8,6, 2,0 Гц), 7,31 (1H, дд, J=9,2, 2,6 Гц), 7,42 (1H, д, J=2,0 Гц), 7,50 (1H, д, J=3,3 Гц), 7,55 (1H, д, J=2,0 Гц), 7,59 (1H, д, J=8,6 Гц), 7,79 (1H, д, J=2,6 Гц), 9,06 (1H, д, J=2,0 Гц), 9,49 (1H, уш.с), 13,28 (1H, уш.с).
МС (ESI/APCI, m/z): 382 (M-H)-.
[Пример 303]
[Формула 550]

К раствору 30 мг метил-2-((1H-индол-5-ил)амино)-5-хлорбензоата и 65,2 мг карбоната цезия в 0,3 мл диметилсульфоксида при комнатной температуре добавляли 10,5 мкл 2-фторнитробензола. После перемешивания при внешней температуре 50°C в течение 1 часа, к смеси добавляли 5 мкл 2-фторнитробензола, и дополнительно перемешивали полученную смесь при 50°C в течение 75 минут. Реакционную смесь охлаждали до комнатной температуры, а затем к смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением 39 мг метил-5-хлор-2-((1-(2-нитрофенил)-1H-индол-5-ил)амино)бензоата в виде масла.
1H-ЯМР (CDCl3) δ: 3,91 (3H, с), 6,70 (1H, д, J=3,3 Гц), 6,98 (1H, д, J=9,2 Гц), 7,05 (1H, дд, J=8,9, 2,3 Гц), 7,12 (1H, д, J=8,6 Гц), 7,15-7,21 (2H, м), 7,49-7,66 (3H, м), 7,72-7,82 (1H, м), 7,91 (1H, д, J=2,6 Гц), 8,06 (1H, д, J=8,6 Гц), 9,35 (1H, уш.с).
[Пример 304]
[Формула 551]

Способом, аналогичным описанному в примере 47, 5-хлор-2-((1-(2-нитрофенил)-1H-индол-5-ил)амино)бензойную кислоту получали из метил-5-хлор-2-((1-(2-нитрофенил)-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 6,71 (1H, д, J=3,3 Гц), 7,00 (1H, д, J=9,2 Гц), 7,05 (1H, дд, J=8,6, 2,0 Гц), 7,12 (1H, д, J=8,6 Гц), 7,35 (1H, дд, J=9,2, 2,6 Гц), 7,51-7,58 (2H, м), 7,71-7,84 (3H, м), 7,89-7,99 (1H, м), 8,22 (1H, дд, J=8,3, 1,7 Гц), 9,58 (1H, с).
МС (ESI, m/z): 408 (M+H)+, 406 (M-H)-.
[Пример 305]
[Формула 552]
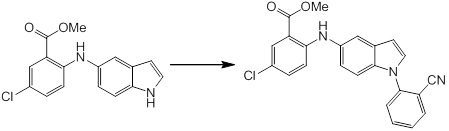
Способом, аналогичным описанному в примере 303, метил-5-хлор-2-((1-(2-цианофенил)-1H-индол-5-ил)амино)бензоат получали из метил-2-((1H-индол-5-ил)амино)-5-хлорбензоата и 2-фторбензонитрила.
1H-ЯМР (CDCl3) δ: 3,92 (3H, с), 6,65-6,85 (1H, м), 6,91-8,04 (11H, м), 9,38 (1H, уш.с).
[Пример 306]
[Формула 553]

Способом, аналогичным описанному в примере 47, 5-хлор-2-((1-(2-цианофенил)-1H-индол-5-ил)амино)бензойную кислоту получали из метил-5-хлор-2-((1-(2-цианофенил)-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 6,76 (1H, д, J=3,3 Гц), 7,02 (1H, д, J=9,2 Гц), 7,11 (1H, дд, J=8,6, 2,0 Гц), 7,28-7,39 (2H, м), 7,58 (1H, д, J=1,3 Гц), 7,65-7,72 (1H, м), 7,74 (1H, д, J=3,3 Гц), 7,77 (1H, д, J=7,3 Гц), 7,82 (1H, д, J=2,6 Гц), 7,89-7,97 (1H, м), 8,11 (1H, дд, J=7,6, 1,7 Гц), 9,58 (1H, уш.с), 13,33 (1H, уш.с).
МС (ESI, m/z): 388 (M+H)+, 386 (M-H)-.
[Пример 307]
[Формула 554]

К смеси 140 мг 5-хлор-2-((1-(2-нитрофенил)-1H-индол-5-ил)амино)бензойной кислоты, 160 мг хлорида аммония, 1,8 мл этанола и 0,42 мл воды добавляли 130 мг восстановленного железа, и нагревали полученную смесь с обратным холодильником в течение 1,5 часов. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением 133 мг метил-2-((1-(2-аминофенил)-1H-индол-5-ил)амино)-5-хлорбензоата в виде масла.
1H-ЯМР (CDCl3) δ: 3,63 (2H, с), 3,91 (3H, с), 6,66 (1H, д, J=3,3 Гц), 6,82-6,92 (2H, м), 6,97 (1H, д, J=9,2 Гц), 7,05 (1H, дд, J=8,6, 2,0 Гц), 7,10-7,19 (2H, м), 7,19-7,31 (3H, м), 7,53 (1H, д, J=2,0 Гц), 7,91 (1H, д, J=2,6 Гц), 9,36 (1H, с).
[Пример 308]
[Формула 555]

К раствору 30 мг метил-2-((1-(2-аминофенил)-1H-индол-5-ил)амино)-5-хлорбензоата и 12,3 мкл пиридина в 0,23 мл дихлорметана при охлаждении на льду добавляли 8,2 мкл ацетилхлорида и перемешивали полученную смесь в течение 10 минут. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, затем полученную смесь нагревали до комнатной температуры, и добавляли к ней этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением 30 мг метил-2-((1-(2-ацетамидофенил)-1H-индол-5-ил)амино)-5-хлорбензоата в виде масла.
1H-ЯМР (CDCl3) δ: 1,95 (3H, с), 3,92 (3H, с), 6,67-6,92 (2H, м), 6,93-7,41 (7H, м), 7,42-7,65 (2H, м), 7,85-8,03 (1H, м), 8,33-8,54 (1H, м), 9,40 (1H, уш.с).
[Пример 309]
[Формула 556]

Способом, аналогичным описанному в примере 300, 2-((1-(2-ацетамидофенил)-1H-индол-5-ил)амино)-5-хлорбензойную кислоту получали из метил-2-((1-(2-ацетамидофенил)-1H-индол-5-ил)амино)-5-хлорбензоата.
1H-ЯМР (ДМСО-d6) δ: 1,82 (3H, с), 6,66 (1H, д, J=3,3 Гц), 6,91-7,12 (3H, м), 7,25-7,55 (6H, м), 7,72 (1H, д, J=8,6 Гц), 7,81 (1H, д, J=2,6 Гц), 9,33 (1H, с).
[Пример 310]
[Формула 557]

Реакционную смесь 50 мг метил-2-((1H-индол-5-ил)амино)-5-хлорбензоата, 19,3 мкл 2-бромпиридина, 1,6 мг йодида меди(I), 70,5 мг ортофосфата калия, 5,2 мкл транс-N,N'-диметилциклогексан-1,2-диамина и 0,58 мл толуола нагревали с обратным холодильником в течение 2 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры и добавляли к ней воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением 14,4 мг метил-5-хлор-2-((1-(пиридин-2-ил)-1H-индол-5-ил)амино)бензоата в виде масла.
1H-ЯМР (CDCl3) δ: 3,92 (3H, с), 6,68 (1H, д, J=4,0 Гц), 7,00 (1H, д, J=9,2 Гц), 7,12-7,23 (3H, м), 7,44-7,52 (2H, м), 7,73 (1H, д, J=4,0 Гц), 7,79-7,89 (1H, м), 7,92 (1H, д, J=2,0 Гц), 8,26 (1H, д, J=9,2 Гц), 8,54-8,60 (1H, м), 9,39 (1H, уш.с).
[Пример 311]
[Формула 558]

Способом, аналогичным описанному в примере 47, 5-хлор-2-((1-(пиридин-2-ил)-1H-индол-5-ил)амино)бензойную кислоту получали из метил-5-хлор-2-((1-(пиридин-2-ил)-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 6,75 (1H, д, J=4,0 Гц), 7,06 (1H, д, J=9,2 Гц), 7,16 (1H, дд, J=9,2, 2,0 Гц), 7,27-7,41 (2H, м), 7,54 (1H, д, J=2,0 Гц), 7,74-7,86 (2H, м), 7,94-8,05 (1H, м), 8,09 (1H, д, J=3,3 Гц), 8,46 (1H, д, J=8,6 Гц), 8,58 (1H, д, J=4,0 Гц), 9,60 (1H, уш.с).
МС (ESI/APCI, m/z): 364 (M+H)+, 362 (M-H)-.
[Пример 312]
[Формула 559]

Способом, аналогичным описанному в примере 310, метил-5-хлор-2-((1-(пиразин-2-ил)-1H-индол-5-ил)амино)бензоат получали из метил-2-((1H-индол-5-ил)амино)-5-хлорбензоата и 2-бромпиразина.
1H-ЯМР (CDCl3) δ: 3,93 (3H, с), 6,69-6,86 (1H, м), 6,98-7,14 (1H, м), 7,15-7,38 (2H, м), 7,46-7,60 (1H, м), 7,70-7,86 (1H, м), 7,89-8,03 (1H, м), 8,25-8,65 (3H, м), 8,78-9,07 (1H, м), 9,34-9,53 (1H, м).
[Пример 313]
[Формула 560]

Способом, аналогичным описанному в примере 47, 5-хлор-2-((1-(пиразин-2-ил)-1H-индол-5-ил)амино)бензойную кислоту получали из метил-5-хлор-2-((1-(пиразин-2-ил)-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 6,83 (1H, д, J=3,3 Гц), 7,08 (1H, д, J=9,2 Гц), 7,20 (1H, дд, J=8,9, 2,3 Гц), 7,38 (1H, дд, J=9,2, 2,6 Гц), 7,57 (1H, д, J=2,6 Гц), 7,83 (1H, д, J=2,6 Гц), 8,24 (1H, д, J=3,3 Гц), 8,49 (1H, д, J=8,6 Гц), 8,53 (1H, д, J=2,6 Гц), 8,57-8,64 (1H, м), 9,20 (1H, д, J=1,3 Гц), 9,61 (1H, с).
МС (ESI/APCI, m/z): 363 (M-H)-.
[Пример 314]
[Формула 561]

Способом, аналогичным описанному в примере 48, метил-5-хлор-2-((1-(пиридин-4-ил)-1H-индол-5-ил)амино)бензоат получали из метил-2-((1H-индол-5-ил)амино)-5-хлорбензоата и 4-йодпиридина.
1H-ЯМР (CDCl3) δ: 3,92 (3H, с), 6,65-6,83 (1H, м), 6,91-7,36 (5H, м), 7,38-7,83 (5H, м), 7,87-8,05 (1H, м), 9,41 (1H, уш.с).
[Пример 315]
[Формула 562]

Способом, аналогичным описанному в примере 49, 5-хлор-2-((1-(пиридин-4-ил)-1H-индол-5-ил)амино)бензойную кислоту получали из метил-5-хлор-2-((1-(пиридин-4-ил)-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 6,79 (1H, д, J=4,0 Гц), 7,05 (1H, д, J=9,2 Гц), 7,17 (1H, дд, J=8,6, 2,0 Гц), 7,37 (1H, дд, J=8,6, 2,6 Гц), 7,58 (1H, д, J=2,0 Гц), 7,70-7,79 (2H, м), 7,80-7,94 (3H, м), 8,72 (2H, д, J=5,3 Гц), 9,59 (1H, уш.с).
МС (ESI/APCI, m/z): 362 (M-H)-.
[Пример 316]
[Формула 563]

Способом, аналогичным описанному в примере 48, метил-5-хлор-2-((1-(хинолин-3-ил)-1H-индол-5-ил)амино)бензоат получали из метил-2-((1H-индол-5-ил)амино)-5-хлорбензоата и 3-бромхинолина.
1H-ЯМР (CDCl3) δ: 3,93 (3H, с), 6,75 (1H, д, J=3,3 Гц), 7,00 (1H, д, J=9,2 Гц), 7,10-7,23 (2H, м), 7,47 (1H, д, J=3,3 Гц), 7,54-7,71 (3H, м), 7,74-7,84 (1H, м), 7,87-7,96 (2H, м), 8,21 (1H, д, J=9,2 Гц), 8,26 (1H, д, J=2,6 Гц), 9,16 (1H, д, J=2,6 Гц), 9,40 (1H, с).
[Пример 317]
[Формула 564]

Способом, аналогичным описанному в примере 49, 5-хлор-2-((1-(хинолин-3-ил)-1H-индол-5-ил)амино)бензойную кислоту получали из метил-5-хлор-2-((1-(хинолин-3-ил)-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 6,80 (1H, д, J=3,3 Гц), 7,03 (1H, д, J=9,2 Гц), 7,16 (1H, дд, J=8,6, 2,0 Гц), 7,37 (1H, дд, J=8,9, 3,0 Гц), 7,60 (1H, д, J=2,0 Гц), 7,68-7,78 (2H, м), 7,78-7,87 (2H, м), 7,93 (1H, д, J=3,3 Гц), 8,13 (2H, д, J=8,6 Гц), 8,67 (1H, д, J=2,6 Гц), 9,21 (1H, д, J=2,6 Гц), 9,59 (1H, с).
МС (ESI/APCI, m/z): 414 (M+H)+, 412 (M-H)-.
[Пример 318]
[Формула 565]
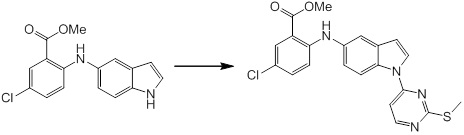
Способом, аналогичным описанному в примере 5, метил-5-хлор-2-((1-(2-(метилтио)пиримидин-4-ил)-1H-индол-5-ил)амино)бензоат получали из метил-2-((1H-индол-5-ил)амино)-5-хлорбензоата и 4-хлор-2-(метилтио)пиримидина.
1H-ЯМР (ДМСО-d6) δ: 2,64 (3H, с), 3,88 (3H, с), 6,85 (1H, д, J=3,3 Гц), 7,12 (1H, д, J=9,2 Гц), 7,25 (1H, дд, J=8,6, 2,0 Гц), 7,41 (1H, дд, J=9,2, 2,6 Гц), 7,55 (1H, д, J=2,0 Гц), 7,60 (1H, д, J=5,9 Гц), 7,84 (1H, д, J=2,6 Гц), 8,21 (1H, д, J=4,0 Гц), 8,60-8,67 (2H, м), 9,33 (1H, с).
[Пример 319]
[Формула 566]

Способом, аналогичным описанному в примере 49, 5-хлор-2-((1-(2-(метилтио)пиримидин-4-ил)-1H-индол-5-ил)амино)бензойную кислоту получали из метил-5-хлор-2-((1-(2-(метилтио)пиримидин-4-ил)-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 2,64 (3H, с), 6,80 (1H, д, J=3,3 Гц), 7,06-7,21 (3H, м), 7,42 (1H, д, J=2,0 Гц), 7,55 (1H, д, J=5,9 Гц), 7,84 (1H, д, J=2,0 Гц), 8,13 (1H, д, J=4,0 Гц), 8,53 (1H, д, J=8,6 Гц), 8,58 (1H, д, J=5,9 Гц).
МС (ESI/APCI, m/z): 409 (M-H)-.
[Пример 320]
[Формула 567]

К раствору 100 мг метил-5-хлор-2-((1-(2-(метилтио)пиримидин-4-ил)-1H-индол-5-ил)амино)бензоата в 1,0 мл дихлорметана при охлаждении на льду добавляли 69,1 мг 3-хлорпербензойной кислоты (77%). Полученную смесь перемешивали при комнатной температуре в течение 15 минут. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия и насыщенный водный раствор сульфита натрия. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, а затем сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления с получением 108 мг метил-5-хлор-2-((1-(2-(метилсульфинил)пиримидин-4-ил)-1H-индол-5-ил)амино)бензоата в виде масла.
1H-ЯМР (CDCl3) δ: 3,04 (3H, с), 3,93 (3H, с), 6,78 (1H, д, J=4,0 Гц), 7,09 (1H, д, J=9,2 Гц), 7,18-7,32 (2H, м), 7,39 (1H, д, J=5,9 Гц), 7,46 (1H, д, J=2,0 Гц), 7,74 (1H, д, J=4,0 Гц), 7,94 (1H, д, J=2,6 Гц), 8,69 (1H, д, J=9,2 Гц), 8,78 (1H, д, J=5,9 Гц), 9,46 (1H, с).
[Пример 321]
[Формула 568]

Смесь 30 мг метил-5-хлор-2-((1-(2-(метилсульфинил)пиримидин-4-ил)-1H-индол-5-ил)амино)бензоата, 18,9 мкл триэтиламина, 8,9 мкл морфолина и 0,3 мл тетрагидрофурана перемешивали при комнатной температуре в течение 14,5 часов, а затем перемешивали при внешней температуре 70°C в течение 2 часов. К смеси добавляли 8,9 мкл морфолина, полученную смесь перемешивали при 70°C в течение 5 часов, затем реакционный раствор охлаждали до комнатной температуры, оставляли отстаиваться в течение ночи, а затем перемешивали при 70°C в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением 30 мг метил-5-хлор-2-((1-(2-морфолинопиримидин-4-ил)-1H-индол-5-ил)амино)бензоата в виде масла.
[Пример 322]
[Формула 569]

К раствору 29 мг метил-5-хлор-2-((1-(2-морфолинопиримидин-4-ил)-1H-индол-5-ил)амино)бензоата в 0,37 мл этанола при комнатной температуре добавляли 25,8 мкл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при 70°C в течение 20 минут. Реакционную смесь охлаждали до комнатной температуры, и добавляли к смеси воду и 3 M соляную кислоту. Твердое вещество собирали путем фильтрования с получением 27,3 мг 5-хлор-2-((1-(2-морфолинопиримидин-4-ил)-1H-индол-5-ил)амино)бензойной кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,65-3,89 (8H, м), 6,78 (1H, д, J=3,3 Гц), 7,04-7,15 (2H, м), 7,21 (1H, дд, J=8,9, 2,3 Гц), 7,39 (1H, дд, J=9,2, 2,6 Гц), 7,53 (1H, д, J=2,0 Гц), 7,83 (1H, д, J=2,6 Гц), 8,14 (1H, д, J=3,3 Гц), 8,43 (1H, д, J=5,3 Гц), 8,50 (1H, д, J=9,2 Гц), 9,61 (1H, уш.с).
МС (ESI, m/z): 450 (M+H)+, 448 (M-H)-.
[Пример 323]
[Формула 570]

Способом, аналогичным описанному в примере 321, метил-5-хлор-2-((1-(2-((2-метоксиэтил)(метил)амино)пиримидин-4-ил)-1H-индол-5-ил)амино)бензоат получали из метил-5-хлор-2-((1-(2-(метилсульфинил)пиримидин-4-ил)-1H-индол-5-ил)амино)бензоата и N-(2-метоксиэтил)-N-метиламина.
[Пример 324]
[Формула 571]

Способом, аналогичным описанному в примере 322, 5-хлор-2-((1-(2-((2-метоксиэтил)(метил)амино)пиримидин-4-ил)-1H-индол-5-ил)амино)бензойную кислоту получали из метил-5-хлор-2-((1-(2-((2-метоксиэтил)(метил)амино)пиримидин-4-ил)-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 3,19-3,36 (6H, м), 3,53-3,74 (2H, м), 3,80-3,98 (2H, м), 6,84 (1H, д, J=4,0 Гц), 7,02-7,27 (3H, м), 7,40 (1H, дд, J=9,2, 2,6 Гц), 7,55 (1H, д, J=2,0 Гц), 7,83 (1H, д, J=2,6 Гц), 8,19 (1H, д, J=3,3 Гц), 8,38 (1H, д, J=5,9 Гц), 8,59 (1H, д, J=7,3 Гц), 9,63 (1H, с).
МС (ESI, m/z): 452 (M+H)+, 450 (M-H)-.
[Пример 325]
[Формула 572]

Смесь 0,7 г метил-5-бром-2-(метилтио)пиримидин-4-карбоксилата, 0,352 г 5-аминоиндола, 73,1 мг трис(дибензилиденацетон)дипалладия(0), 17,9 мг ацетата палладия, 0,185 г 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 1,73 г карбоната цезия и 7,0 мл толуола перемешивали при внешней температуре 80°C в течение 2 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем к смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением 0,34 г метил-5-((1H-индол-5-ил)амино)-2-(метилтио)пиримидин-4-карбоксилата в виде желтого твердого вещества.
[Пример 326]
[Формула 573]
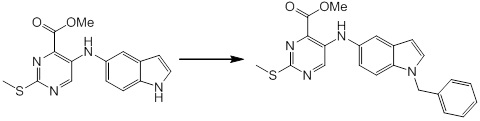
К раствору 0,264 г метил-5-((1H-индол-5-ил)амино)-2-(метилтио)пиримидин-4-карбоксилата в 3,0 мл N,N-диметилацетамида при охлаждении на льду добавляли 94,3 мг трет-бутоксида калия и перемешивали полученную смесь в течение 10 минут при охлаждении на льду. К реакционной смеси добавляли 100 мкл бензилбромида, и перемешивали полученную смесь в течение 10 минут при охлаждении на льду, а затем перемешивали при комнатной температуре в течение 30 минут. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония и этилацетат. Органический слой разделяли, последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением 97 мг метил-5-((1-бензил-1H-индол-5-ил)амино)-2-(метилтио)пиримидин-4-карбоксилата в виде желтого масла.
[Пример 327]
[Формула 574]

Способом, аналогичным описанному в примере 49, 5-((1-бензил-1H-индол-5-ил)амино)-2-(метилтио)пиримидин-4-карбоновую кислоту получали из метил-5-((1-бензил-1H-индол-5-ил)амино)-2-(метилтио)пиримидин-4-карбоксилата.
1H-ЯМР (ДМСО-d6) δ: 2,45-2,56 (3H, м), 5,43 (2H, с), 6,46 (1H, д, J=2,6 Гц), 7,03 (1H, дд, J=8,6, 2,0 Гц), 7,18-7,37 (5H, м), 7,45-7,51 (2H, м), 7,54 (1H, д, J=2,6 Гц), 8,53 (1H, с), 8,83 (1H, с).
МС (ESI, m/z): 391 (M+H)+, 389 (M-H)-
[Пример 328]
[Формула 575]
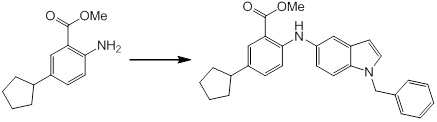
Реакционную смесь 0,150 г метил-2-амино-5-циклопентилбензоата, 0,196 г 1-бензил-5-бром-1H-индола, 31,3 мг трис(дибензилиденацетон)дипалладия(0), 39,6 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 0,446 г карбоната цезия и 1,5 мл толуола перемешивали при внешней температуре 80°C в течение 2 часов, а затем дополнительно перемешивали при 100°C в течение 2 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем к смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением 12,8 мг метил-2-((1-бензил-1H-индол-5-ил)амино)-5-циклопентилбензоата в виде масла.
1H-ЯМР (CDCl3) δ: 1,43-1,88 (6H, м), 1,93-2,10 (2H, м), 2,81-2,96 (1H, м), 3,90 (3H, с), 5,32 (2H, с), 6,52 (1H, дд, J=12,9, 3,0 Гц), 6,62 (1H, д, J=8,6 Гц), 6,98 (1H, дд, J=8,6, 2,6 Гц), 7,05 (1H, дд, J=8,6, 2,0 Гц), 7,09-7,38 (7H, м), 7,50 (1H, д, J=2,0 Гц), 7,80 (1H, д, J=2,6 Гц), 9,22 (1H, с).
[Пример 329]
[Формула 576]

Способом, аналогичным описанному в примере 57, 2-((1-бензил-1H-индол-5-ил)амино)-5-циклопентилбензойную кислоту получали из метил-2-((1-бензил-1H-индол-5-ил)амино)-5-циклопентилбензоата.
1H-ЯМР (ДМСО-d6) δ: 1,33-1,85 (6H, м), 1,87-2,06 (2H, м), 2,74-2,99 (1H, м), 5,42 (2H, с), 6,44 (1H, д, J=2,6 Гц), 6,86-7,03 (2H, м), 7,15-7,50 (8H, м), 7,52 (1H, д, J=3,3 Гц), 7,71 (1H, д, J=2,0 Гц), 9,36 (1H, с), 12,83 (1H, с).
МС (ESI/APCI, m/z): 409 (M-H)-
[Пример 330]
[Формула 577]

Смесь 30 мг метил-2-((1H-индол-5-ил)амино)-5-хлорбензоата, 13,8 мкл 1-фтор-4-йодбензола, 9,1 мг трис(дибензилиденацетон)-дипалладия(0), 11,6 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 65 мг карбоната цезия и 0,3 мл толуола перемешивали при внешней температуре 100°C в течение 15 часов и 50 минут в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем к смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением 31 мг метил-5-хлор-2-((1-(4-фторфенил)-1H-индол-5-ил)амино)бензоата в виде желтого масла.
1H-ЯМР (ДМСО-d6) δ: 3,88 (3H, с), 6,65-6,76 (1H, м), 6,98 (1H, дд, J=9,2, 3,3 Гц), 7,09 (1H, дд, J=9,2, 2,0 Гц), 7,31-7,77 (8H, м), 7,82 (1H, д, J=2,6 Гц), 9,29 (1H, с).
[Пример 331]
[Формула 578]

Способом, аналогичным описанному в примере 47, 5-хлор-2-((1-(4-фторфенил)-1H-индол-5-ил)амино)бензойную кислоту получали из метил-5-хлор-2-((1-(4-фторфенил)-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 6,65-6,73 (1H, м), 6,99 (1H, дд, J=9,2, 3,3 Гц), 7,09 (1H, дд, J=8,9, 2,3 Гц), 7,30-7,74 (8H, м), 7,81 (1H, д, J=2,6 Гц), 9,58 (1H, с).
МС (ESI/APCI, m/z): 379 (M-H)-.
[Пример 332]
[Формула 579]

Способом, аналогичным описанному в примере 330, метил-5-хлор-2-((1-(3-(трифторметил)фенил)-1H-индол-5-ил)амино)бензоат получали из метил-2-((1H-индол-5-ил)амино)-5-хлорбензоата и 1-йод-3-(трифторметил)бензола.
1H-ЯМР (ДМСО-d6) δ: 3,88 (3H, с), 6,74 (1H, д, J=3,3 Гц), 7,01 (1H, д, J=9,2 Гц), 7,14 (1H, дд, J=8,6, 2,0 Гц), 7,39 (1H, дд, J=9,2, 2,6 Гц), 7,53-7,66 (2H, м), 7,74-7,88 (4H, м), 7,91-8,02 (2H, м), 9,30 (1H, с).
[Пример 333]
[Формула 580]

К раствору 14,6 мг метил-5-хлор-2-((1-(3-(трифторметил)фенил)-1H-индол-5-ил)амино)бензоата в 0,2 мл этанола при комнатной температуре добавляли 26,2 мкл 5 M водного раствора гидроксида натрия и перемешивали полученную смесь при внешней температуре 80°C в течение 15 минут. Реакционную смесь охлаждали до комнатной температуры, а затем к смеси добавляли воду, 2 M соляную кислоту и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (хлороформ/метанол) с получением 5 мг 5-хлор-2-((1-(3-(трифторметил)фенил)-1H-индол-5-ил)амино)бензойной кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 6,74 (1H, д, J=3,3 Гц), 7,02 (1H, д, J=9,2 Гц), 7,14 (1H, дд, J=8,6, 2,0 Гц), 7,36 (1H, дд, J=9,2, 2,6 Гц), 7,54-7,65 (2H, м), 7,73-7,88 (4H, м), 7,91-8,01 (2H, м), 9,60 (1H, с).
МС (ESI/APCI, m/z): 429 (M-H)-.
[Пример 334]
[Формула 581]

Смесь 30 мг метил-2-((1H-индол-5-ил)амино)-5-хлорбензоата, 13,1 мкл 1-бром-2-фторбензола, 9,1 мг трис(дибензилиденацетон)-дипалладия(0), 19,1 мг 2-дициклогексилфосфино-2',4',6'-триизопропилбифенила, 42,5 мг ортофосфата калия и 0,3 мл толуола перемешивали при внешней температуре 100°C в течение 3 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем к смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления, а затем очищали остаток методом колоночной хроматографии на силикагеле (гексан/этилацетат), и промывали полученное твердое вещество этанолом с получением 20,3 мг метил-5-хлор-2-((1-(2-фторфенил)-1H-индол-5-ил)амино)бензоата в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,88 (3H, с), 6,72 (1H, д, J=3,3 Гц), 6,98 (1H, д, J=9,2 Гц), 7,09 (1H, дд, J=8,6, 2,0 Гц), 7,26 (1H, дд, J=8,6, 2,0 Гц), 7,33-7,72 (7H, м), 7,82 (1H, д, J=2,6 Гц), 9,29 (1H, с).
[Пример 335]
[Формула 582]

Способом, аналогичным описанному в примере 57, 5-хлор-2-((1-(2-фторфенил)-1H-индол-5-ил)амино)бензойную кислоту получали из метил-5-хлор-2-((1-(2-фторфенил)-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 6,71 (1H, д, J=3,3 Гц), 6,99 (1H, д, J=8,6 Гц), 7,08 (1H, дд, J=8,6, 2,0 Гц), 7,25 (1H, дд, J=8,6, 2,0 Гц), 7,35 (1H, дд, J=8,6, 2,6 Гц), 7,38-7,48 (1H, м), 7,49-7,71 (5H, м), 7,81 (1H, д, J=2,6 Гц), 9,56 (1H, с), 13,34 (1H, с).
МС (ESI/APCI, m/z): 381 (M+H)+, 379 (M-H)-
[Пример 336]
[Формула 583]

Способом, аналогичным описанному в примере 334, метил-5-хлор-2-((1-(2-трифторметил)фенил)-1H-индол-5-ил)амино)бензоат получали из метил-2-((1H-индол-5-ил)амино)-5-хлорбензоата и 1-йод-2-(трифторметил)бензола.
1H-ЯМР (ДМСО-d6) δ: 3,88 (3H, с), 6,74 (1H, д, J=3,3 Гц), 7,01 (1H, д, J=9,2 Гц), 7,14 (1H, дд, J=8,6, 2,0 Гц), 7,39 (1H, дд, J=9,2, 2,6 Гц), 7,54-7,66 (2H, м), 7,73-7,89 (4H, м), 7,91-8,02 (2H, м), 9,30 (1H, с).
[Пример 337]
[Формула 584]

Способом, аналогичным описанному в примере 57, 5-хлор-2-((1-(2-(трифторметил)фенил)-1H-индол-5-ил)амино)бензойную кислоту получали из метил-5-хлор-2-((1-(2-(трифторметил)фенил)-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 6,74 (1H, д, J=3,3 Гц), 7,02 (1H, д, J=8,6 Гц), 7,14 (1H, дд, J=8,6, 2,0 Гц), 7,36 (1H, дд, J=9,2, 2,6 Гц), 7,54-7,65 (2H, м), 7,73-7,88 (4H, м), 7,91-8,02 (2H, м), 9,58 (1H, с), 13,35 (1H, с).
МС (ESI/APCI, m/z): 431 (M+H)+, 429 (M-H)-.
[Пример 338]
[Формула 585]

Способом, аналогичным описанному в примере 58, метил-5-циклопропил-2-((1-(пиридин-3-ил)-1H-индол-5-ил)амино)бензоат получали из метил-2-((1H-индол-5-ил)амино)-5-циклопропилбензоата и 3-йодпиридина.
1H-ЯМР (CDCl3) δ: 0,56-0,65 (2H, м), 0,80-0,97 (2H, м), 1,75-1,89 (1H, м), 3,92 (3H, д, J=2,0 Гц), 6,68 (1H, д, J=4,0 Гц), 6,99-7,07 (2H, м), 7,13 (1H, дд, J=8,6, 2,0 Гц), 7,34 (1H, д, J=3,3 Гц), 7,43-7,59 (3H, м), 7,67-7,73 (1H, м), 7,82-7,90 (1H, м), 8,62 (1H, дд, J=4,6, 1,3 Гц), 8,85 (1H, д, J=2,0 Гц), 9,27 (1H, с).
[Пример 339]
[Формула 586]

К раствору 34,8 мг метил-5-циклопропил-2-((1-(пиридин-3-ил)-1H-индол-5-ил)амино)бензоата в 0,35 мл этанола при комнатной температуре добавляли 72,6 мкл 5 M водного раствора гидроксида натрия и перемешивали полученную смесь при внешней температуре 70°C в течение 15 минут. Реакционную смесь охлаждали до комнатной температуры, а затем к смеси добавляли воду и 2 M соляную кислоту. Твердое вещество собирали путем фильтрования и промывали водой. Полученное твердое вещество перекристаллизовывали из смеси этанола и этилацетата с получением 11,2 мг 5-циклопропил-2-((1-(пиридин-3-ил)-1H-индол-5-ил)амино)бензойной кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,47-0,64 (2H, м), 0,77-0,96 (2H, м), 1,77-1,94 (1H, м), 6,72 (1H, д, J=2,6 Гц), 6,92-7,18 (3H, м), 7,45-7,70 (4H, м), 7,76 (1H, д, J=3,3 Гц), 8,10 (1H, д, J=7,9 Гц), 8,61 (1H, д, J=4,0 Гц), 8,88 (1H, д, J=2,0 Гц), 9,42 (1H, уш.с), 12,93 (1H, уш.с).
МС (ESI, m/z): 370 (M+H)+, 368 (M-H)-.
[Пример 340]
[Формула 587]

В соответствии со способом, описанным в примере 12, за исключением того, что N,N-диметилформамид использовали в качестве растворителя и карбонат калия в качестве основания, метил-5-хлор-2-((1-(пиридин-2-илметил)-1H-индол-5-ил)амино)бензоат получали из метил-2-((1H-индол-5-ил)амино)-5-хлорбензоата и 2-(хлорметил)пиридина.
1H-ЯМР (ДМСО-d6) δ: 3,87 (3H, с), 5,52 (2H, с), 6,49 (1H, д, J=2,6 Гц), 6,90 (1H, д, J=9,2 Гц), 6,95-7,06 (2H, м), 7,25-7,37 (2H, м), 7,42-4-7,50 (2H, м), 7,55 (1H, д, J=2,6 Гц), 7,73 (1H, тд, J=7,8, 1,8 Гц), 7,80 (1H, д, J=2,6 Гц), 8,52-8,57 (1H, м), 9,23 (1H, с)
[Пример 341]
[Формула 588]
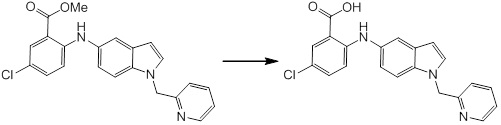
Способом, аналогичным описанному в примере 63, 5-хлор-2-((1-(пиридин-2-илметил)-1H-индол-5-ил)амино)бензойную кислоту получали из метил-5-хлор-2-((1-(пиридин-2-илметил)-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 5,51 (2H, с), 6,48 (1H, д, J=3,3 Гц), 6,91 (1H, д, J=9,2 Гц), 6,95-7,05 (2H, м), 7,25-7,34 (2H, м), 7,42-7,48 (2H, м), 7,54 (1H, д, J=3,3 Гц), 7,73 (1H, тд, J=7,6, 2,0 Гц), 7,78 (1H, д, J=2,6 Гц), 8,51-8,57 (1H, м), 9,48 (1H, с).
МС (ESI/APCI, m/z): 376 (M-H)-.
[Пример 342]
[Формула 589]

Способом, аналогичным описанному в примере 20, метил-2-((1-бензил-1H-бензо[d]имидазол-5-ил)амино)-5-хлорбензоат получали из 1-бензил-1H-бензо[d]имидазол-5-амина и метил-2-бром-5-хлорбензоата.
1H-ЯМР (ДМСО-d6) δ: 3,87 (3H, с), 5,51 (2H, с), 6,96 (1H, д, J=8,6 Гц), 7,08-7,15 (1H, м), 7,25-7,40 (6H, м), 7,50-7,58 (2H, м), 7,81 (1H, д, J=2,6 Гц), 8,45 (1H, с), 9,26 (1H, с).
[Пример 343]
[Формула 590]

Способом, аналогичным описанному в примере 63, 2-((1-бензил-1H-бензо[d]имидазол-5-ил)амино)-5-хлорбензойную кислоту получали из метил-2-((1-бензил-1H-бензо[d]имидазол-5-ил)амино)-5-хлорбензоата.
1H-ЯМР (ДМСО-d6) δ: 5,55 (2H, с), 7,02 (1H, д, J=8,6 Гц), 7,18 (1H, дд, J=8,6, 2,0 Гц), 7,29-7,40 (6H, м), 7,56 (1H, д, J=1,3 Гц), 7,59 (1H, д, J=8,6 Гц), 7,81 (1H, д, J=2,6 Гц), 8,68 (1H, с), 9,55 (1H, с).
МС (ESI/APCI, m/z): 376 (M-H)-.
[Пример 344]
[Формула 591]

Способом, аналогичным описанному в примере 20, метил-2-((1-бензил-1H-бензо[d]имидазол-6-ил)амино)-5-хлорбензоат получали из 1-бензил-1H-бензо[d]имидазол-6-амина и метил-2-бром-5-хлорбензоата.
1H-ЯМР (ДМСО-d6) δ: 3,86 (3H, с), 5,47 (2H, с), 6,97 (1H, д, J=9,2 Гц), 7,05-7,12 (1H, м), 7,25-7,50 (7H, м), 7,66 (1H, д, J=8,6 Гц), 7,82 (1H, д, J=2,6 Гц), 8,40 (1H, с), 9,32 (1H, с).
[Пример 345]
[Формула 592]

Способом, аналогичным описанному в примере 63, 2-((1-бензил-1H-бензо[d]имидазол-6-ил)амино)-5-хлорбензойную кислоту получали из метил-2-((1-бензил-1H-бензо[d]имидазол-6-ил)амино)-5-хлорбензоата.
1H-ЯМР (ДМСО-d6) δ: 5,64 (2H, с), 7,05 (1H, д, J=8,6 Гц), 7,31-7,47 (7H, м), 7,66 (1H, д, J=2,0 Гц), 7,77 (1H, д, J=8,6 Гц), 7,85 (1H, д, J=2,6 Гц), 9,30 (1H, с), 9,69 (1H, с).
МС (ESI/APCI, m/z): 376 (M-H)-.
[Пример 346]
[Формула 593]

Способом, аналогичным описанному в примере 20, метил-5-хлор-2-((1-(4-метоксибензил)-1H-индол-5-ил)амино)бензоат получали из 1-(4-метоксибензил)-1H-индол-5-амина и метил-2-бром-5-хлорбензоата.
1H-ЯМР (ДМСО-d6) δ: 3,71 (3H, с), 3,87 (3H, с), 5,34 (2H, с), 6,45 (1H, д, J=3,3 Гц), 6,84-6,92 (3H, м), 6,98 (1H, дд, J=8,6, 2,0 Гц), 7,17-7,25 (2H, м), 7,32 (1H, дд, J=9,2, 2,6 Гц), 7,38-7,55 (3H, м), 7,80 (1H, д, J=2,6 Гц), 9,22 (1H, с).
[Пример 347]
[Формула 594]
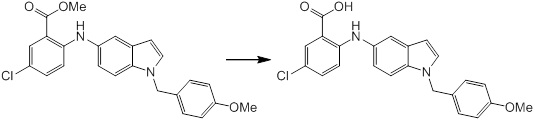
Способом, аналогичным описанному в примере 37, 5-хлор-2-((1-(4-метоксибензил)-1H-индол-5-ил)амино)бензойную кислоту получали из метил-5-хлор-2-((1-(4-метоксибензил)-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 3,71 (3H, с), 5,34 (2H, с), 6,44 (1H, д, J=3,3 Гц), 6,84-6,92 (3H, м), 6,98 (1H, дд, J=8,6, 2,0 Гц), 7,17-7,25 (2H, м), 7,30 (1H, дд, J=9,2, 2,6 Гц), 7,42 (1H, д, J=2,0 Гц), 7,47-7,55 (2H, м), 7,78 (1H, д, J=2,6 Гц), 9,48 (1H, уш.с).
МС (ESI/APCI, m/z): 405 (M-H)-.
[Пример 348]
[Формула 595]

Способом, аналогичным описанному в примере 20, метил-5-хлор-2-((1-(пиридин-3-илметил)-1H-индол-5-ил)амино)бензоат получали из 1-(пиридин-3-илметил)-1H-индол-5-амина и метил-2-бром-5-хлорбензоата.
1H-ЯМР (ДМСО-d6) δ: 3,87 (3H, с), 5,49 (2H, с), 6,49 (1H, д, J=3,3 Гц), 6,90 (1H, д, J=8,6 Гц), 7,01 (1H, дд, J=8,6, 2,0 Гц), 7,29-7,38 (2H, м), 7,45 (1H, д, J=2,0 Гц), 7,52-7,65 (3H, м), 7,80 (1H, д, J=2,6 Гц), 8,44-8,50 (1H, м), 8,52-8,57 (1H, м), 9,23 (1H, с).
[Пример 349]
[Формула 596]

Способом, аналогичным описанному в примере 37, 5-хлор-2-((1-(пиридин-3-илметил)-1H-индол-5-ил)амино)бензойную кислоту получали из метил-5-хлор-2-((1-(пиридин-3-илметил)-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 5,48 (2H, с), 6,48 (1H, д, J=3,3 Гц), 6,91 (1H, д, J=9,2 Гц), 7,01 (1H, дд, J=8,6, 2,0 Гц), 7,27-7,38 (2H, м), 7,44 (1H, д, J=2,0 Гц), 7,51-7,64 (3H, м), 7,79 (1H, д, J=2,6 Гц), 8,47 (1H, дд, J=4,6, 1,3 Гц), 8,54 (1H, д, J=2,0 Гц), 9,50 (1H, уш.с).
МС (ESI/APCI, m/z): 376 (M-H)-.
[Пример 350]
[Формула 597]
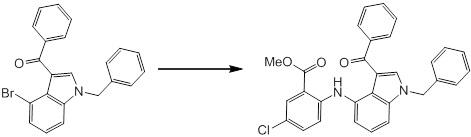
Способом, аналогичным описанному в примере 5, метил-2-((3-бензоил-1-бензил-1H-индол-4-ил)амино)-5-хлорбензоат получали из (1-бензил-4-бром-1H-индол-3-ил)(фенил)метанона и метил-2-амино-5-хлорбензоата.
1H-ЯМР (ДМСО-d6) δ: 3,90 (3H, с), 5,53 (2H, с), 7,07-7,44 (10H, м), 7,50-7,68 (3H, м), 7,76-7,86 (3H, м), 8,14 (1H, с), 10,18 (1H, с).
[Пример 351]
[Формула 598]
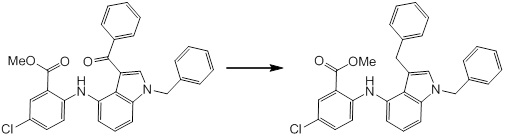
Способом, аналогичным описанному в примере 87, метил-5-хлор-2-((1,3-дибензил-1H-индол-4-ил)амино)бензоат получали из метил-2-((3-бензоил-1-бензил-1H-индол-4-ил)амино)-5-хлорбензоата.
1H-ЯМР (ДМСО-d6) δ: 3,84 (3H, с), 3,99 (2H, с), 5,40 (2H, с), 6,64 (1H, д, J=9,2 Гц), 6,84-7,16 (7H, м), 7,18-7,39 (8H, м), 7,73 (1H, д, J=2,6 Гц), 9,19 (1H, с).
[Пример 352]
[Формула 599]
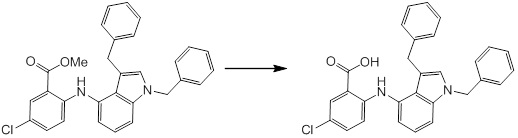
Способом, аналогичным описанному в примере 37, 5-хлор-2-((1,3-дибензил-1H-индол-4-ил)амино)бензойную кислоту получали из метил-5-хлор-2-((1,3-дибензил-1H-индол-4-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 4,03 (2H, с), 5,39 (2H, с), 6,72 (1H, д, J=9,2 Гц), 6,89 (1H, д, J=7,3 Гц), 6,93-7,13 (6H, м), 7,16-7,36 (8H, м), 7,74 (1H, д, J=2,6 Гц), 9,63 (1H, с).
МС (ESI/APCI, m/z): 465 (M-H)-.
[Пример 353]
[Формула 600]

Способом, аналогичным описанному в примере 20, метил-2-((1-бензил-1H-индазол-5-ил)амино)-5-хлорникотинат получали из 1-бензил-1H-индазол-5-амина и метил 2,5-дихлорникотината.
1H-ЯМР (ДМСО-d6) δ: 3,92 (3H, с), 5,65 (2H, с), 7,18-7,50 (6H, м), 7,67 (1H, д, J=9,2 Гц), 8,08 (1H, с), 8,14 (1H, д, J=2,0 Гц), 8,22 (1H, д, J=2,6 Гц), 8,42 (1H, д, J=2,6 Гц), 9,97 (1H, с).
[Пример 354]
[Формула 601]

Способом, аналогичным описанному в примере 63, 2-((1-бензил-1H-индазол-5-ил)амино)-5-хлорникотиновую кислоту получали из метил-2-((1-бензил-1H-индазол-5-ил)амино)-5-хлорникотината.
1H-ЯМР (ДМСО-d6) δ: 5,64 (2H, с), 7,13-7,52 (6H, м), 7,64 (1H, д, J=9,2 Гц), 8,05 (1H, с), 8,12-8,24 (2H, м), 8,30-8,36 (1H, м), 10,80 (1H, уш.с)
[Пример 355]
[Формула 602]

Способом, аналогичным описанному в справочном примере 7, метил-2-((1H-индол-5-ил)амино)-5-хлорникотинат получали из 1H-индол-5-амина и метил 2,5-дихлорникотината.
1H-ЯМР (ДМСО-d6) δ: 3,91 (3H, с), 6,36-6,42 (1H, м), 7,11-7,20 (1H, м), 7,30-7,39 (2H, м), 7,86 (1H, с), 8,19 (1H, д, J=2,6 Гц), 8,38 (1H, д, J=2,6 Гц), 9,90 (1H, с), 11,04 (1H, уш.с).
МС (ESI, m/z): 302 (M+H)+, 300 (M-H)-.
[Пример 356]
[Формула 603]

Способом, аналогичным описанному в примере 12, метил-5-хлор-2-((1-(3-(2,2,2-трифторэтокси)бензил)-1H-индол-5-ил)амино)никотинат получали из метил-2-((1H-индол-5-ил)амино)-5-хлорникотината и 1-(бромметил)-3-(2,2,2-трифторэтокси)бензола.
[Пример 357]
[Формула 604]

Способом, аналогичным описанному в примере 63, 5-хлор-2-((1-(3-(2,2,2-трифторэтокси)бензил)-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-хлор-2-((1-(3-(2,2,2-трифторэтокси)бензил)-1H-индол-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 4,72 (2H, кв., J=8,8 Гц), 5,38 (2H, с), 6,46 (1H, д, J=2,6 Гц), 6,84 (1H, д, J=7,3 Гц), 6,91-6,98 (2H, м), 7,17 (1H, дд, J=8,6, 2,0 Гц), 7,23-7,31 (1H, м), 7,41 (1H, д, J=9,2 Гц), 7,51 (1H, д, J=2,6 Гц), 7,90 (1H, д, J=2,0 Гц), 8,15 (1H, д, J=2,6 Гц), 8,34 (1H, д, J=2,6 Гц), 10,22 (1H, уш.с).
[Пример 358]
[Формула 605]

Способом, аналогичным описанному в примере 7, метил-4-((1-бензил-1H-индол-5-ил)амино)-[1,1'-бифенил]-3-карбоксилат получали из метил-2-((1-бензил-1H-индол-5-ил)амино)-5-хлорбензоата и фенилбороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 3,90 (3H, с), 5,44 (2H, с), 6,49 (1H, д, J=3,3 Гц), 6,98-7,06 (2H, м), 7,20-7,70 (14H, м), 8,14 (1H, д, J=2,6 Гц), 9,32 (1H, с).
МС (ESI, m/z): 433 (M+H)+.
[Пример 359]
[Формула 606]

Способом, аналогичным описанному в примере 37, 4-((1-бензил-1H-индол-5-ил)амино)-[1,1'-бифенил]-3-карбоновую кислоту получали из метил-4-((1-бензил-1H-индол-5-ил)амино)-[1,1'-бифенил]-3-карбоксилата.
1H-ЯМР (ДМСО-d6) δ: 5,44 (2H, с), 6,48 (1H, д, J=2,6 Гц), 6,99-7,06 (2H, м), 7,20-7,60 (13H, м), 7,64 (1H, дд, J=8,6, 2,6 Гц), 8,14 (1H, д, J=2,6 Гц), 9,58 (1H, с).
МС (ESI, m/z): 419 (M+H)+.
[Пример 360]
[Формула 607]

Способом, аналогичным описанному в примере 12, метил-5-хлор-2-((1-(3-(трифторметокси)бензил)-1H-индол-5-ил)амино)никотинат получали из метил-2-((1H-индол-5-ил)амино)-5-хлорникотината и 1-(бромметил)-3-(трифторметокси)бензола.
1H-ЯМР (ДМСО-d6) δ: 3,90 (3H, с), 5,48 (2H, с), 6,48 (1H, д, J=2,6 Гц), 7,10-7,60 (7H, м), 7,86-7,93 (1H, м), 8,18 (1H, д, J=2,6 Гц), 8,37 (1H, д, J=2,0 Гц), 9,89 (1H, с).
МС (ESI, m/z): 476, 478 (M+H)+
[Пример 361]
[Формула 608]
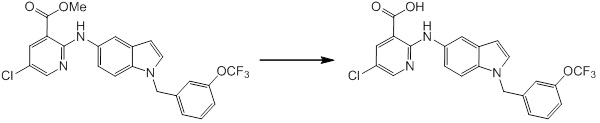
Способом, аналогичным описанному в примере 37, 5-хлор-2-((1-(3-(трифторметокси)бензил)-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-хлор-2-((1-(3-(трифторметокси)бензил)-1H-индол-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 5,48 (2H, с), 6,48 (1H, д, J=3,3 Гц), 7,13-7,29 (4H, м), 7,38-7,48 (2H, м), 7,53 (1H, д, J=2,6 Гц), 7,92 (1H, д, J=2,0 Гц), 8,16 (1H, д, J=2,6 Гц), 8,35 (1H, д, J=2,6 Гц), 10,24 (1H, с).
МС (ESI, m/z): 462, 464 (M+H)+, 460 (M-H)-.
[Пример 362]
[Формула 609]

Способом, аналогичным описанному в примере 12, метил-5-хлор-2-((1-(3-(трифторметокси)бензил)-1H-индол-5-ил)амино)бензоат получали из метил-2-((1H-индол-5-ил)амино)-5-хлорбензоата и 1-(бромметил)-3-(трифторметокси)бензола.
1H-ЯМР (ДМСО-d6) δ: 3,87 (3H, с), 5,51 (2H, с), 6,50 (1H, д, J=2,6 Гц), 6,90 (1H, д, J=9,2 Гц), 7,00 (1H, дд, J=9,2, 2,0 Гц), 7,18-7,29 (3H, м), 7,33 (1H, дд, J=9,2, 2,6 Гц), 7,42-7,54 (3H, м), 7,59 (1H, д, J=3,3 Гц), 7,80 (1H, д, J=2,6 Гц), 9,23 (1H, с).
МС (ESI, m/z): 475 (M+H)+.
[Пример 363]
[Формула 610]
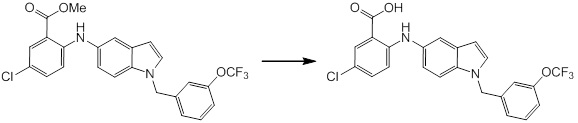
Способом, аналогичным описанному в примере 63, 5-хлор-2-((1-(3-(трифторметокси)бензил)-1H-индол-5-ил)амино)бензойную кислоту получали из метил-5-хлор-2-((1-(3-(трифторметокси)бензил)-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 5,50 (2H, с), 6,49 (1H, д, J=2,6 Гц), 6,91 (1H, д, J=8,6 Гц), 7,00 (1H, дд, J=8,6, 2,0 Гц), 7,17-7,34 (4H, м), 7,42-7,53 (3H, м), 7,58 (1H, д, J=2,6 Гц), 7,79 (1H, д, J=2,6 Гц), 9,50 (1H, уш.с).
МС (ESI, m/z): 461 (M+H)+, 459 (M-H)-.
[Пример 364]
[Формула 611]

Способом, аналогичным описанному в примере 12, метил-5-хлор-2-((1-(3-(дифторметокси)бензил)-1H-индол-5-ил)амино)никотинат получали из метил-2-((1H-индол-5-ил)амино)-5-хлорникотината и 1-(бромметил)-3-(дифторметокси)бензола.
1H-ЯМР (ДМСО-d6) δ: 3,90 (3H, с), 5,44 (2H, с), 6,47 (1H, д, J=3,3 Гц), 7,00-7,09 (3H, м), 7,14-7,20 (2H, м), 7,32-7,45 (2H, м), 7,52 (1H, д, J=2,6 Гц), 7,88 (1H, д, J=1,3 Гц), 8,18 (1H, д, J=2,6 Гц), 8,37 (1H, д, J=2,6 Гц), 9,89 (1H, с).
МС (ESI, m/z): 458 (M+H)+.
[Пример 365]
[Формула 612]
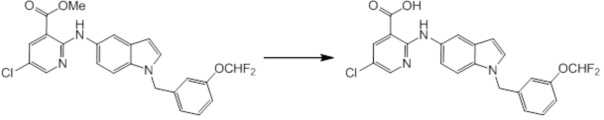
Способом, аналогичным описанному в примере 63, 5-хлор-2-((1-(3-(дифторметокси)бензил)-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-хлор-2-((1-(3-(дифторметокси)бензил)-1H-индол-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 5,43 (2H, с), 6,47 (1H, д, J=2,6 Гц), 6,99-7,10 (3H, м), 7,14-7,20 (2H, м), 7,32-7,45 (2H, м), 7,52 (1H, д, J=2,6 Гц), 7,91 (1H, д, J=2,0 Гц), 8,16 (1H, д, J=2,6 Гц), 8,34 (1H, д, J=2,6 Гц), 10,24 (1H, уш.с).
МС (ESI, m/z): 444 (M+H)+, 442 (M-H)-.
[Пример 366]
[Формула 613]

Способом, аналогичным описанному в примере 176, метил-5-циклопропил-2-((5-фенилнафталин-1-ил)амино)никотинат получали из 5-фенилнафталин-1-амина и метил-2-хлор-5-циклопропилникотината.
МС (ESI, m/z): 395 (M+H)+.
[Пример 367]
[Формула 614]

Способом, аналогичным описанному в примере 116, 5-циклопропил-2-((5-фенилнафталин-1-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((5-фенилнафталин-1-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,67-0,69 (2H, м), 0,92-0,95 (2H, м), 1,90-1,99 (1H, м), 7,47-7,55 (8H, м), 7,64 (1H, дд, J=8,6, 7,3 Гц), 7,97 (1H, д, J=2,6 Гц), 8,12 (1H, д, J=8,6 Гц), 8,22 (1H, д, J=2,6 Гц), 8,32 (1H, дд, J=7,3, 1,3 Гц), 10,84 (1H, с), 13,72 (1H, с).
МС (ESI, m/z): 381 (M+H)+, 379 (M-H)-.
[Пример 368]
[Формула 615]

Способом, аналогичным описанному в примере 176, метил-5-циклопропил-2-((4-оксо-3-фенил-3,4-дигидрохиназолин-8-ил)амино)никотинат получали из 8-амино-3-фенилхиназолин-4(3H)-она и метил-2-хлор-5-циклопропилникотината.
МС (ESI, m/z): 413 (M+H)+.
[Пример 369]
[Формула 616]

Способом, аналогичным описанному в примере 116, 5-циклопропил-2-((4-оксо-3-фенил-3,4-дигидрохиназолин-8-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((4-оксо-3-фенил-3,4-дигидрохиназолин-8-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,71-0,73 (2H, м), 0,94-1,00 (2H, м), 1,94-2,03 (1H, м), 7,50-7,59 (6H, м), 7,73 (1H, дд, J=7,9, 1,3 Гц), 7,98 (1H, д, J=2,6 Гц), 8,37 (1H, д, J=2,6 Гц), 8,42 (1H, с), 9,21 (1H, дд, J=7,9, 1,3 Гц), 11,74 (1H, с).
МС (ESI, m/z): 399 (M+H)+, 397 (M-H)-.
[Пример 370]
[Формула 617]

Способом, аналогичным описанному в примере 176, метил-5-циклопропил-2-(нафталин-1-иламино)никотинат получали из нафталин-1-амина и метил-2-хлор-5-циклопропилникотината.
МС (ESI, m/z): 319 (M+H)+.
[Пример 371]
[Формула 618]

Способом, аналогичным описанному в примере 116, 5-циклопропил-2-(нафталин-1-иламино)никотиновую кислоту получали из метил-5-циклопропил-2-(нафталин-1-иламино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,66-0,71 (2H, м), 0,91-0,97 (2H, м), 1,90-1,99 (1H, м), 7,48-7,66 (4H, м), 7,96 (2H, дд, J=8,3, 2,3 Гц), 8,08 (1H, д, J=7,9 Гц), 8,24 (1H, д, J=2,6 Гц), 8,39 (1H, д, J=6,6 Гц), 10,85 (1H, с).
МС (ESI, m/z): 305 (M+H)+, 303 (M-H)-.
[Пример 372]
[Формула 619]

Смесь 50 мг метил-2-((1H-индол-5-ил)амино)-5-циклопропилбензоата, 56 мг 1-йод-4-метоксибензола, 30 мг йодида меди(I), 102 мг ортофосфата калия, 6 мкл транс-N,N'-диметилциклогексан-1,2-диамина и 2 мл толуола нагревали с обратным холодильником в течение 9 часов в атмосфере азота. Реакционную смесь оставляли отстаиваться в течение ночи, затем отфильтровывали нерастворимое вещество через мембранный фильтр, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-50/50) с получением 45 мг метил-5-циклопропил-2-((1-(4-метоксифенил)-1H-индол-5-ил)амино)бензоата в виде желтого масла.
МС (ESI, m/z): 413 (M+H)+.
[Пример 373]
[Формула 620]

Способом, аналогичным описанному в примере 96, 5-циклопропил-2-((1-(4-метоксифенил)-1H-индол-5-ил)амино)бензойную кислоту получали из метил-5-циклопропил-2-((1-(4-метоксифенил)-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 0,52-0,58 (2H, м), 0,82-0,87 (2H, м), 1,80-1,89 (1H, м), 3,83 (3H, с), 6,62 (1H, д, J=3,3 Гц), 6,96 (1H, д, J=8,6 Гц), 7,08-7,11 (2H, м), 7,13 (2H, д, J=8,6 Гц), 7,42-7,53 (4H, м), 7,58 (1H, д, J=2,6 Гц), 7,62 (1H, д, J=2,0 Гц), 9,39 (1H, с).
МС (ESI, m/z): 399 (M+H)+, 397 (M-H)-.
[Пример 374]
[Формула 621]
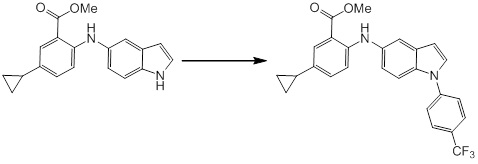
Смесь 50 мг метил-2-((1H-индол-5-ил)амино)-5-циклопропилбензоата, 35 мкл 1-йод-4-(трифторметил)бензола, 30 мг йодида меди(I), 169 мг карбоната цезия и 2 мл N,N-диметилформамида перемешивали при 130°C в течение 3 часов в атмосфере азота. Реакционную смесь оставляли отстаиваться в течение ночи, а затем отфильтровывали нерастворимое вещество через мембранный фильтр, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-70/30) с получением 45 мг метил-5-циклопропил-2-((1-(4-(трифторметил)фенил)-1H-индол-5-ил)амино)бензоата в виде желтого масла.
МС (ESI, m/z): 451 (M+H)+.
[Пример 375]
[Формула 622]

Способом, аналогичным описанному в примере 96, 5-циклопропил-2-((1-(4-(трифторметил)фенил)-1H-индол-5-ил)амино)бензойную кислоту получали из метил-5-циклопропил-2-((1-(4-(трифторметил)фенил)-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 0,53-0,58 (2H, м), 0,83-0,89 (2H, м), 1,80-1,90 (1H, м), 6,72 (1H, д, J=3,3 Гц), 7,03 (2H, с), 7,09 (1H, дд, J=9,2, 2,0 Гц), 7,50 (1H, д, J=2,0 Гц), 7,63 (1H, с), 7,67 (1H, д, J=9,2 Гц), 7,78 (1H, д, J=3,3 Гц), 7,87 (2H, д, J=9,2 Гц), 7,94 (2H, д, J=9,2 Гц).
МС (ESI, m/z): 437 (M+H)+, 435 (M-H)-.
[Пример 376]
[Формула 623]

Способом, аналогичным описанному в примере 20, метил-5-циклопропил-2-((3-фенил-1H-индол-5-ил)амино)бензоат получали из 3-фенил-1H-индол-5-амина и метил-2-бром-5-циклопропилбензоата.
МС (ESI, m/z): 383 (M+H)+
[Пример 377]
[Формула 624]

Способом, аналогичным описанному в примере 96, 5-циклопропил-2-((3-фенил-1H-индол-5-ил)амино)бензойную кислоту получали из метил-5-циклопропил-2-((3-фенил-1H-индол-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 0,50-0,56 (2H, м), 0,80-0,88 (2H, м), 1,77-1,87 (1H, м), 6,88 (1H, д, J=8,6 Гц), 7,03 (2H, д, J=8,6 Гц), 7,18-7,23 (1H, м), 7,38-7,48 (3H, м), 7,60-7,75 (5H, м), 9,38 (1H, уш.с), 11,40 (1H, с), 12,88 (1H, уш.с).
МС (ESI, m/z): 369 (M+H)+, 367 (M-H)-.
[Пример 378]
[Формула 625]
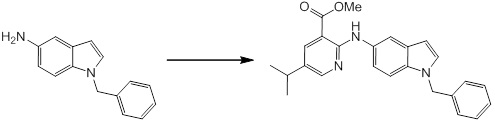
Способом, аналогичным описанному в примере 115, метил-2-((1-бензил-1H-индол-5-ил)амино)-5-изопропилникотинат получали из 1-бензил-1H-индол-5-амина и метил-2-хлор-5-изопропилникотината.
1H-ЯМР (ДМСО-d6) δ: 1,20 (6H, д, J=6,6 Гц), 2,88 (1H, септ., J=6,6 Гц), 3,90 (3H, с), 5,40 (2H, с), 6,44 (1H, д, J=3,3 Гц), 7,15-7,39 (7H, м), 7,48 (1H, д, J=3,3 Гц), 7,96 (1H, д, J=2,0 Гц), 8,07 (1H, д, J=2,6 Гц), 8,29 (1H, д, J=2,6 Гц), 9,84 (1H, с).
МС (ESI, m/z): 400 (M+H)+.
[Пример 379]
[Формула 626]

Способом, аналогичным описанному в примере 116, 2-((1-бензил-1H-индол-5-ил)амино)-5-изопропилникотиновую кислоту получали из метил-2-((1-бензил-1H-индол-5-ил)амино)-5-изопропилникотината.
1H-ЯМР (ДМСО-d6) δ: 1,20 (6H, д, J=6,6 Гц), 2,87 (1H, септ., J=6,6 Гц), 5,40 (2H, с), 6,44 (1H, д, J=3,3 Гц), 7,14-7,38 (7H, м), 7,48 (1H, д, J=3,3 Гц), 7,97 (1H, д, J=2,0 Гц), 8,07 (1H, д, J=2,6 Гц), 8,25 (1H, д, J=2,6 Гц), 10,13 (1H, с), 13,40 (1H, уш.с).
МС (ESI, m/z): 386 (M+H)+, 384 (M-H)-
[Пример 380]
[Формула 627]
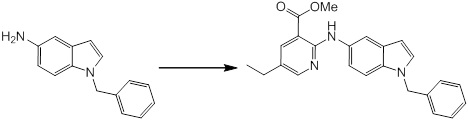
Способом, аналогичным описанному в примере 115, метил-2-((1-бензил-1H-индол-5-ил)амино)-5-этилникотинат получали из 1-бензил-1H-индол-5-амина и метил-2-хлор-5-этилникотината.
1H-ЯМР (ДМСО-d6) δ: 1,16 (3H, т, J=7,6 Гц), 2,54 (2H, кв., J=7,9 Гц), 3,89 (3H, с), 5,40 (2H, с), 6,44 (1H, д, J=3,3 Гц), 7,14-7,37 (7H, м), 7,48 (1H, д, J=3,3 Гц), 7,96 (1H, д, J=2,0 Гц), 8,07 (1H, д, J=2,6 Гц), 8,24 (1H, д, J=2,0 Гц), 9,84 (1H, с).
МС (ESI, m/z): 387 (M+H)+.
[Пример 381]
[Формула 628]

Способом, аналогичным описанному в примере 116, 2-((1-бензил-1H-индол-5-ил)амино)-5-этилникотиновую кислоту получали из метил-2-((1-бензил-1H-индол-5-ил)амино)-5-этилникотината.
1H-ЯМР (ДМСО-d6) δ: 1,16 (3H, т, J=7,6 Гц), 2,53 (2H, кв., J=7,6 Гц), 5,40 (2H, с), 6,44 (1H, д, J=2,6 Гц), 7,15-7,34 (6H, м), 7,36 (1H, д, J=3,6 Гц), 7,47 (1H, д, J=3,3 Гц), 7,97 (1H, д, J=2,0 Гц), 8,05 (1H, д, J=2,6 Гц), 8,21 (1H, д, J=2,0 Гц), 10,13 (1H, с).
МС (ESI, m/z): 372 (M+H)+, 370 (M-H)-.
[Пример 382]
[Формула 629]

Способом, аналогичным описанному в примере 115, метил-2-((1-бензил-1H-индол-5-ил)амино)-5-циклобутилникотинат получали из 1-бензил-1H-индол-5-амина и метил-2-хлор-5-циклобутилникотината.
1H-ЯМР (ДМСО-d6) δ: 1,78-1,87 (1H, м), 1,91-2,13 (3H, м), 2,22-2,32 (2H, м), 3,48 (1H, квин., J=8,6 Гц), 3,90 (3H, с), 5,40 (2H, с), 6,44 (1H, д, J=3,3 Гц), 7,13-7,34 (6H, м), 7,37 (1H, д, J=8,6 Гц), 7,48 (1H, д, J=3,3 Гц), 7,96 (1H, д, J=2,0 Гц), 8,08 (1H, д, J=2,6 Гц), 8,26 (1H, д, J=2,6 Гц), 9,85 (1H, с).
МС (ESI, m/z): 412 (M+H)+.
[Пример 383]
[Формула 630]

Способом, аналогичным описанному в примере 116, 2-((1-бензил-1H-индол-5-ил)амино)-5-циклобутилникотиновую кислоту получали из метил-2-((1-бензил-1H-индол-5-ил)амино)-5-циклобутилникотината.
1H-ЯМР (ДМСО-d6) δ: 1,81-2,11 (4H, м), 2,24-2,31 (2H, м), 3,48 (1H, квин., J=8,6 Гц), 5,36 (2H, с), 6,43 (1H, д, J=3,3 Гц), 7,16-7,35 (7H, м), 7,42 (1H, д, J=3,3 Гц), 8,01-8,05 (2H, м), 8,11 (1H, д, J=2,6 Гц).
МС (ESI, m/z): 398 (M+H)+, 396 (M-H)-.
[Пример 384]
[Формула 631]

Способом, аналогичным описанному в примере 115, метил-5-циклопропил-2-((2-фенил-1H-индол-5-ил)амино)никотинат получали из 2-фенил-1H-индол-5-амина и метил-2-хлор-5-циклопропилникотината.
1H-ЯМР (ДМСО-d6) δ: 0,63-0,69 (2H, м), 0,88-0,96 (2H, м), 0,87-1,96 (1H, м), 3,90 (3H, с), 6,87 (1H, д, J=1,3 Гц), 7,18 (1H, дд, J=8,6, 2,0 Гц), 7,30-7,36 (2H, м), 7,43-7,49 (2H, м), 7,86 (2H, д, J=7,3 Гц), 7,89 (1H, д, J=2,6 Гц), 7,97 (1H, д, J=1,3 Гц), 8,24 (1H, д, J=2,6 Гц), 9,86 (1H, с), 11,45 (1H, с).
МС (ESI, m/z): 384 (M+H)+.
[Пример 385]
[Формула 632]

Способом, аналогичным описанному в примере 116, 5-циклопропил-2-((2-фенил-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((2-фенил-1H-индол-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,63-0,68 (2H, м), 0,88-0,95 (2H, м), 1,86-1,96 (1H, м), 6,86 (1H, д, J=1,3 Гц), 7,17 (1H, дд, J=8,6, 2,0 Гц), 7,27-7,35 (2H, м), 7,43-7,49 (2H, м), 7,83-7,88 (3H, м), 7,99 (1H, д, J=1,3 Гц), 8,21 (1H, д, J=2,6 Гц), 10,21 (1H, уш.с), 11,42 (1H, с), 13,42 (1H, уш.с).
МС (ESI, m/z): 370 (M+H)+, 368 (M-H)-.
[Пример 386]
[Формула 633]
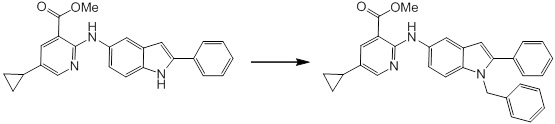
Смесь 60 мг метил-5-циклопропил-2-((2-фенил-1H-индол-5-ил)амино)никотината, 26 мг трет-бутоксида калия, 22 мкл бензилбромида и 1 мл N,N-диметилацетамида перемешивали в течение 1 часа при охлаждении на льду. К реакционной смеси добавляли этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-60/40) с получением 30 мг метил-2-((1-бензил-2-фенил-1H-индол-5-ил)амино)-5-циклопропилникотината в виде желтого масла.
МС (ESI, m/z): 474 (M+H)+.
[Пример 387]
[Формула 634]

Способом, аналогичным описанному в примере 116, 2-((1-бензил-2-фенил-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту получали из метил-2-((1-бензил-2-фенил-1H-индол-5-ил)амино)-5-циклопропилникотината.
1H-ЯМР (ДМСО-d6) δ: 0,52-0,65 (2H, м), 0,82-0,92 (2H, м), 1,76-1,87 (1H, м), 5,42 (2H, с), 6,57 (1H, с), 6,92 (2H, д, J=6,6 Гц), 7,09-7,28 (5H, м), 7,35-7,53 (5H, м), 7,79 (1H, д, J=1,3 Гц), 7,93 (1H, д, J=2,0 Гц), 8,24 (1H, с), 12,73 (1H, с).
МС (ESI, m/z): 460 (M+H)+, 458 (M-H)-.
[Пример 388]
[Формула 635]

Способом, аналогичным описанному в примере 115, метил-2-((2-(трет-бутил)-1H-индол-5-ил)амино)-5-циклопропилникотинат и бутил-2-((2-(трет-бутил)-1H-индол-5-ил)амино)-5-циклопропилникотинат получали из 2-(трет-бутил)-1H-индол-5-амина и метил-2-хлор-5-циклопропилникотината.
Метил-2-((2-(трет-бутил)-1H-индол-5-ил)амино)-5-циклопропилникотинат1H-ЯМР (ДМСО-d6) δ: 0,61-0,67 (2H, м), 0,87-0,94 (2H, м), 1,34 (9H, с), 1,85-1,95 (1H, м), 3,84 (3H, с), 6,07 (1H, д, J=2,0 Гц), 7,10 (1H, дд, J=8,6, 2,0 Гц), 7,23 (1H, д, J=8,6 Гц), 7,75 (1H, д, J=2,0 Гц), 7,87 (1H, д, J=2,6 Гц), 8,19 (1H, д, J=2,0 Гц), 9,78 (1H, с), 10,78 (1H, с).
МС (ESI, m/z): 364 (M+H)+
Бутил-2-((2-(трет-бутил)-1H-индол-5-ил)амино)-5-циклопропилникотинат
МС (ESI, m/z): 406 (M+H)+.
[Пример 389]
[Формула 636]

Способом, аналогичным описанному в примере 116, 2-((2-(трет-бутил)-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту получали из бутил-2-((2-(трет-бутил)-1H-индол-5-ил)амино)-5-циклопропилникотината.
1H-ЯМР (ДМСО-d6) δ: 0,57-0,63 (2H, м), 0,85-0,92 (2H, м), 1,34 (9H, с), 1,81-1,92 (1H, м), 6,04 (1H, д, J=2,0 Гц), 7,11 (1H, дд, J=8,6, 2,0 Гц), 7,19 (1H, д, J=8,6 Гц), 7,83-7,86 (2H, м), 8,06 (1H, д, J=2,6 Гц), 10,69 (1H, с), 10,98 (1H, уш.с).
МС (ESI, m/z): 350 (M+H)+, 348 (M-H)-.
[Пример 390]
[Формула 637]

Способом, аналогичным описанному в примере 115, метил-5-циклопропил-2-((2-метил-1H-индол-5-ил)амино)никотинат получали из 2-метил-1H-индол-5-амина и метил-2-хлор-5-циклопропилникотината.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,68 (2H, м), 0,87-0,95 (2H, м), 1,85-1,95 (1H, м), 2,36 (3H, с), 3,92 (3H, с), 6,06 (1H, с), 7,06 (1H, дд, J=8,6, 2,0 Гц), 7,20 (1H, д, J=8,7 Гц), 7,75-7,80 (1H, м), 7,87 (1H, д, J=2,7 Гц), 8,20 (1H, д, J=2,0 Гц), 9,79 (1H, с), 10,80 (1H, с).
МС (ESI, m/z): 322 (M+H)+
[Пример 391]
[Формула 638]

Способом, аналогичным описанному в примере 157, 5-циклопропил-2-((1,2-диметил-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((2-метил-1H-индол-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,68 (2H, м), 0,86-0,95 (2H, м), 1,84-1,95 (1H, м), 2,38 (3H, с), 3,64 (3H, с), 6,15 (1H, с), 7,14 (1H, д, J=8,6 Гц), 7,29 (1H, д, J=8,6 Гц), 7,84 (1H, с), 7,87 (1H, д, J=1,8 Гц), 8,18 (1H, д, J=2,0 Гц), 10,11 (1H, с), 13,40 (1H, уш.с).
МС (ESI, m/z): 322 (M+H)+, 320 (M-H)-.
[Пример 392]
[Формула 639]

Способом, аналогичным описанному в примере 152, метил-5-циклопропил-2-((3-циклопропил-1-метил-1H-индол-5-ил)амино)никотинат получали из метил-2-((3-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотината и циклопропилбороновой кислоты.
МС (ESI, m/z): 362 (M+H)+.
[Пример 393]
[Формула 640]

Способом, аналогичным описанному в примере 116, 5-циклопропил-2-((3-циклопропил-1-метил-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((3-циклопропил-1-метил-1H-индол-5-ил)амино)никотината.
.1H-ЯМР (ДМСО-d6) δ: 0,52-0,59 (2H, м), 0,59-0,66 (2H, м), 0,81-0,94 (4H, м), 1,82-1,93 (2H, м), 3,67 (3H, с), 6,95 (1H, с), 7,27 (1H, д, J=8,6 Гц), 7,32 (1H, дд, J=8,6, 2,0 Гц), 7,85 (1H, д, J=2,6 Гц), 7,93 (1H, д, J=1,3 Гц), 8,10 (1H, д, J=2,6 Гц), 10,88 (1H, уш.с).
МС (ESI, m/z): 348 (M+H)+, 346 (M-H)-
[Пример 394]
[Формула 641]
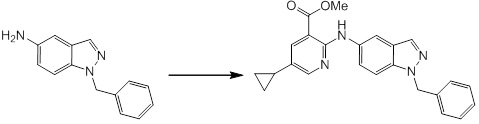
Способом, аналогичным описанному в примере 165, метил-2-((1-бензил-1H-индазол-5-ил)амино)-5-циклопропилникотинат получали из 1-бензил-1H-индазол-5-амина и метил-2-хлор-5-циклопропилникотината.
1H-ЯМР (ДМСО-d6) δ: 0,63-0,69 (2H, м), 0,88-0,94 (2H, м), 1,87-1,97 (1H, м), 3,90 (3H, с), 5,64 (2H, с), 7,20-7,35 (5H, м), 7,41 (1H, дд, J=9,2, 2,0 Гц), 7,63 (1H, д, J=9,2 Гц), 7,90 (1H, д, J=2,0 Гц), 8,04 (1H, с), 8,26-8,22 (2H, м), 9,92 (1H, с).
МС (ESI, m/z): 399 (M+H)+
[Пример 395]
[Формула 642]
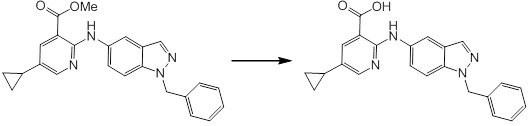
Способом, аналогичным описанному в примере 116, 2-((1-бензил-1H-индазол-5-ил)амино)-5-циклопропилникотиновую кислоту получали из метил-2-((1-бензил-1H-индазол-5-ил)амино)-5-циклопропилникотината.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,68 (2H, м), 0,88-0,96 (2H, м), 1,86-1,96 (1H, с), 5,64 (2H, с), 7,20-7,35 (5H, м), 7,40 (1H, дд, J=9,2, 2,0 Гц), 7,62 (1H, д, J=9,2 Гц), 7,89 (1H, д, J=2,6 Гц), 8,04 (1H, с), 8,22 (1H, д, J=2,6 Гц), 8,26 (1H, д, J=2,0 Гц), 10,24 (1H, с).
МС (ESI, m/z): 385 (M+H)+, 383 (M-H)-
[Пример 396]
[Формула 643]
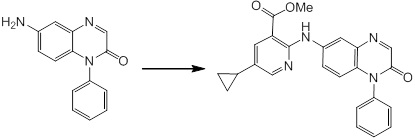
Способом, аналогичным описанному в примере 223, метил-5-циклопропил-2-((2-оксо-1-фенил-1,2-дигидрохиноксалин-6-ил)амино)никотинат получали из 6-амино-1-фенилхиноксалин-2(1H)-она и метил-2-хлор-5-циклопропилникотината.
МС (ESI, m/z): 413 (M+H)+.
[Пример 397]
[Формула 644]

Способом, аналогичным описанному в примере 224, 5-циклопропил-2-((2-оксо-1-фенил-1,2-дигидрохиноксалин-6-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((2-оксо-1-фенил-1,2-дигидрохиноксалин-6-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,65-0,72 (2H, м), 0,90-0,98 (2H, м), 1,90-2,00 (1H, м), 6,55 (1H, д, J=9,2 Гц), 7,41-7,46 (2H, м), 7,51-7,70 (4H, м), 7,92 (1H, д, J=2,6 Гц), 8,28 (1H, д, J=2,6 Гц), 8,32 (1H, с), 8,55 (1H, д, J=2,6 Гц), 10,35 (1H, с).
МС (ESI, m/z): 399 (M+H)+.
[Пример 398]
[Формула 645]

Способом, аналогичным описанному в примере 223, метил-5-циклопропил-2-((3-оксо-4-фенил-3,4-дигидро-2H-бензо[b][1,4]оксазин-7-ил)амино)никотинат получали из 7-амино-4-фенил-2H-бензо[b][1,4]оксазин-3(4H)-она и метил-2-хлор-5-циклопропилникотината.
МС (ESI, m/z): 416 (M+H)+.
[Пример 399]
[Формула 646]

Способом, аналогичным описанному в примере 224, 5-циклопропил-2-((3-оксо-4-фенил-3,4-дигидро-2H-бензо[b][1,4]оксазин-7-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((3-оксо-4-фенил-3,4-дигидро-2H-бензо[b][1,4]оксазин-7-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,69 (2H, м), 0,88-0,97 (2H, м), 1,86-1,98 (1H, м), 4,80 (2H, с), 6,24 (1H, д, J=9,2 Гц), 6,95 (1H, дд, J=8,9, 2,3 Гц), 7,31-7,37 (2H, м), 7,46-7,61 (3H, м), 7,81 (1H, д, J=2,0 Гц), 7,88 (1H, д, J=2,6 Гц), 8,20-8,24 (1H, м), 10,38 (1H, уш.с).
МС (ESI, m/z): 402 (M+H)+.
[Пример 400]
[Формула 647]
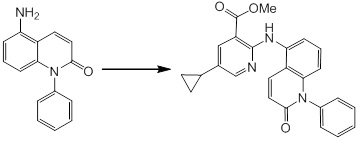
Способом, аналогичным описанному в примере 223, метил-5-циклопропил-2-((2-оксо-1-фенил-1,2-дигидрохинолин-5-ил)амино)никотинат получали из 5-амино-1-фенилхинолин-2(1H)-она и метил-2-хлор-5-циклопропилникотината.
МС (ESI, m/z): 412 (M+H)+.
[Пример 401]
[Формула 648]

Способом, аналогичным описанному в примере 224, 5-циклопропил-2-((2-оксо-1-фенил-1,2-дигидрохинолин-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((2-оксо-1-фенил-1,2-дигидрохинолин-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,64-0,71 (2H, м), 0,90-0,98 (2H, м), 1,88-2,00 (1H, м), 6,22 (1H, д, J=8,6 Гц), 6,72 (1H, д, J=9,9 Гц), 7,30-7,41 (3H, м), 7,52-7,67 (3H, м), 7,88 (1H, д, J=7,3 Гц), 7,95 (1H, д, J=2,6 Гц), 8,07 (1H, д, J=9,9 Гц), 8,20 (1H, д, J=2,6 Гц), 10,58 (1H, с).
МС (ESI, m/z): 398 (M+H)+.
[Пример 402]
[Формула 649]
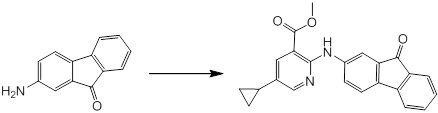
Способом, аналогичным описанному в примере 223, метил-5-циклопропил-2-((9-оксо-9H-флуорен-2-ил)амино)никотинат получали из 2-амино-9H-флуорен-9-она и метил-2-хлор-5-циклопропилникотината.
МС (ESI, m/z): 371 (M+H)+.
[Пример 403]
[Формула 650]

Способом, аналогичным описанному в примере 224, 5-циклопропил-2-((9-оксо-9H-флуорен-2-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((9-оксо-9H-флуорен-2-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,65-0,73 (2H, м), 0,90-0,97 (2H, м), 1,88-2,00 (1H, м), 7,27 (1H, т, J=6,9 Гц), 7,52-7,59 (2H, м), 7,65-7,70 (3H, м), 7,93 (1H, д, J=2,6 Гц), 8,22-8,28 (2H, м), 11,18 (1H, уш.с).
МС (ESI, m/z): 357 (M+H)+.
[Пример 404]
[Формула 651]

Способом, аналогичным описанному в примере 223, метил-2-((9H-флуорен-2-ил)амино)-5-циклопропилникотинат получали из 9H-флуорен-2-амина и метил-2-хлор-5-циклопропилникотината.
МС (ESI, m/z): 357 (M+H)+.
[Пример 405]
[Формула 652]

Способом, аналогичным описанному в примере 224, 2-((9H-флуорен-2-ил)амино)-5-циклопропилникотиновую кислоту получали из метил-2-((9H-флуорен-2-ил)амино)-5-циклопропилникотината.
1H-ЯМР (ДМСО-d6) δ: 0,64-0,73 (2H, м), 0,90-0,97 (2H, м), 1,89-1,99 (1H, м), 3,91 (2H, с), 7,21-7,27 (1H, м), 7,35 (1H, т, J=7,3 Гц), 7,51-7,64 (2H, м), 7,76-7,83 (2H, м), 7,93 (1H, д, J=2,6 Гц), 8,06-8,10 (1H, м), 8,29 (1H, д, J=2,6 Гц), 10,46 (1H, с).
МС (ESI, m/z): 343 (M+H)+
[Пример 406]
[Формула 653]

Способом, аналогичным описанному в примере 223, метил-5-циклопропил-2-((1,7-диметил-1H-индол-5-ил)амино)никотинат получали из 1,7-диметил-1H-индол-5-амина и метил-2-хлор-5-циклопропилникотината.
МС (ESI, m/z): 336 (M+H)+
[Пример 407]
[Формула 654]

Способом, аналогичным описанному в примере 224, 5-циклопропил-2-((1,7-диметил-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((1,7-диметил-1H-индол-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,70 (2H, м), 0,86-0,95 (2H, м), 1,87-1,97 (1H, м), 2,71 (3H, с), 4,03 (3H, с), 6,31 (1H, д, J=2,6 Гц), 6,84 (1H, с), 7,19 (1H, д, J=2,6 Гц), 7,80 (1H, д, J=1,3 Гц), 7,94 (1H, д, J=2,0 Гц), 8,13 (1H, д, J=2,0 Гц), 10,16 (1H, с).
МС (ESI, m/z): 322 (M+H)+.
[Пример 408]
[Формула 655]

Способом, аналогичным описанному в примере 223, метил-5-циклопропил-2-((7-циклопропил-1-метил-1H-индол-5-ил)амино)никотинат получали из 7-циклопропил-1-метил-1H-индол-5-амина и метил-2-хлор-5-циклопропилникотината.
МС (ESI, m/z): 362 (M+H)+.
[Пример 409]
[Формула 656]
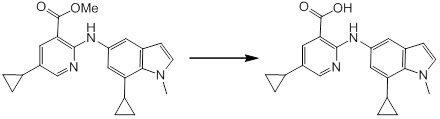
Способом, аналогичным описанному в примере 224, 5-циклопропил-2-((7-циклопропил-1-метил-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((7-циклопропил-1-метил-1H-индол-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,68 (2H, м), 0,76-1,02 (6H, м), 1,84-1,95 (1H, м), 3,10-3,50 (1H, м), 4,16 (3H, с), 6,31 (1H, д, J=2,6 Гц), 6,82 (1H, д, J=1,3 Гц), 7,19 (1H, д, J=2,6 Гц), 7,82-7,88 (2H, м), 8,19 (1H, д, J=2,6 Гц), 10,06 (1H, с).
МС (ESI, m/z): 348 (M+H)+.
[Пример 410]
[Формула 657]

Способом, аналогичным описанному в примере 223, метил-5-циклопропил-2-((7-изопропил-1-метил-1H-индол-5-ил)амино)никотинат получали из 7-изопропил-1-метил-1H-индол-5-амина и метил-2-хлор-5-циклопропилникотината.
МС (ESI, m/z): 364 (M+H)+.
[Пример 411]
[Формула 658]

Способом, аналогичным описанному в примере 224, 5-циклопропил-2-((7-изопропил-1-метил-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((7-изопропил-1-метил-1H-индол-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,68 (2H, м), 0,86-0,95 (2H, м), 1,32 (6H, д, J=7,3 Гц), 1,84-1,95 (1H, м), 3,74-3,85 (1H, м), 3,99 (3H, с), 6,32 (1H, д, J=2,6 Гц), 6,97 (1H, д, J=2,0 Гц), 7,17 (1H, д, J=3,3 Гц), 7,84-7,93 (2H, м), 8,20 (1H, д, J=2,6 Гц), 10,13 (1H, с).
МС (ESI, m/z): 350 (M+H)+
[Пример 412]
[Формула 659]
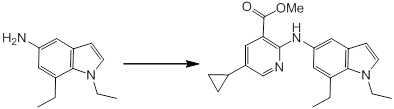
Способом, аналогичным описанному в примере 223, метил-5-циклопропил-2-((1,7-диэтил-1H-индол-5-ил)амино)никотинат получали из 1,7-диэтил-1H-индол-5-амина и метил-2-хлор-5-циклопропилникотината.
МС (ESI, m/z): 364 (M+H)+.
[Пример 413]
[Формула 660]

Способом, аналогичным описанному в примере 224, 5-циклопропил-2-((1,7-диэтил-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((1,7-диэтил-1H-индол-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,68 (2H, м), 0,87-0,95 (2H, м), 1,25-1,37 (6H, м), 1,84-1,95 (1H, м), 2,98 (2H, кв., J=7,5 Гц), 4,30 (2H, кв., J=7,0 Гц), 6,37 (1H, д, J=2,6 Гц), 6,90 (1H, д, J=2,0 Гц), 7,27 (1H, д, J=3,3 Гц), 7,84-7,94 (2H, м), 8,20 (1H, д, J=2,6 Гц), 10,13 (1H, с).
МС (ESI, m/z): 350 (M+H)+.
[Пример 414]
[Формула 661]

Смесь 49 мг метил-2-((1H-индол-5-ил)амино)-5-циклопропилникотината, 90 мг трет-бутоксида калия, 143 мг 2-(бромметил)тетрагидро-2H-пирана и 2 мл N,N-диметилформамида перемешивали в течение 3 часов. Реакционную смесь корректировали до pH 2,5-3,0 добавлением к ней этилацетата, воды и концентрированной соляной кислоты. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 75/25-0/100), к полученному таким образом остатку добавляли этилацетат и гексан, и собирали твердое вещество путем фильтрования с получением 8 мг 5-циклопропил-2-((1-((тетрагидро-2H-пиран-2-ил)метил)-1H-индол-5-ил)амино)никотиновой кислоты в виде красного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,68 (2H, м), 0,87-0,95 (2H, м), 1,11-1,28 (1H, м), 1,35-1,60 (4H, м), 1,70-1,82 (1H, м), 1,84-1,96 (1H, м), 3,20-3,50 (1H, м), 3,54-3,65 (1H, м), 3,80-3,88 (1H, м), 4,10-4,18 (2H, м), 6,35 (1H, д, J=3,3 Гц), 7,17 (1H, дд, J=8,6, 2,0 Гц), 7,27 (1H, д, J=2,6 Гц), 7,40 (1H, д, J=8,6 Гц), 7,86 (1H, д, J=2,6 Гц), 7,93 (1H, д, J=2,0 Гц), 8,18 (1H, д, J=2,6 Гц), 10,17 (1H, с).
МС (ESI, m/z): 392 (M+H)+.
[Пример 415]
[Формула 662]
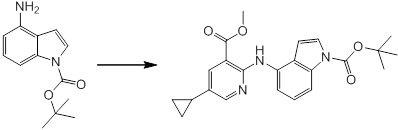
Способом, аналогичным описанному в примере 225, трет-бутил-4-((5-циклопропил-3-(метоксикарбонил)пиридин-2-ил)амино)-1H-индол-1-карбоксилат получали из трет-бутил-4-амино-1H-индол-1-карбоксилата и метил-2-хлор-5-циклопропилникотината.
МС (ESI, m/z): 408 (M+H)+.
[Пример 416]
[Формула 663]

Способом, аналогичным описанному в примере 234, трет-бутил-4-(N-(5-циклопропил-3-(метоксикарбонил)пиридин-2-ил)-2,2,2-трифторацетамидо)-1H-индол-1-карбоксилат получали из трет-бутил-4-((5-циклопропил-3-(метоксикарбонил)пиридин-2-ил)амино)-1H-индол-1-карбоксилата.
МС (ESI, m/z): 504 (M+H)+.
[Пример 417]
[Формула 664]

Способом, аналогичным описанному в примере 235, метил-5-циклопропил-2-(2,2,2-трифтор-N-(1H-индол-4-ил)ацетамидо)никотинат получали из трет-бутил-4-(N-(5-циклопропил-3-(метоксикарбонил)пиридин-2-ил)-2,2,2-трифторацетамидо)-1H-индол-1-карбоксилата.
МС (ESI, m/z): 404 (M+H)+.
[Пример 418]
[Формула 665]
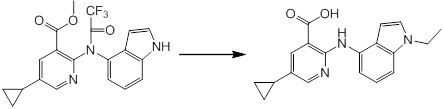
К раствору 65 мг метил-5-циклопропил-2-(2,2,2-трифтор-N-(1H-индол-4-ил)ацетамидо)никотината в 2 мл N,N-диметилформамида при охлаждении на льду добавляли 8 мг 60% гидрида натрия и 16 мкл этилйодида и перемешивали полученную смесь в течение 30 минут. К реакционной смеси добавляли этилацетат и воду. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. После очистки полученного остатка методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-75/25), к полученному таким образом остатку добавляли 2 мл метанола, 4 мл тетрагидрофурана и 1 мл 1 M водного раствора гидроксида натрия, и нагревали полученную смесь с обратным холодильником в течение 30 минут. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. К полученному остатку добавляли воду, и корректировали полученную смесь до pH 2,5-3,0 добавлением 1 M соляной кислоты, а затем добавляли этилацетат. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 67/33-0/100), к полученному таким образом остатку добавляли этилацетат и гексан, и собирали твердое вещество путем фильтрования с получением 11 мг 5-циклопропил-2-((1-этил-1H-индол-4-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,65-0,73 (2H, м), 0,90-0,97 (2H, м), 1,36 (3H, т, J=7,3 Гц), 1,89-2,00 (1H, м), 4,20 (2H, кв., J=7,3 Гц), 6,48 (1H, д, J=3,3 Гц), 7,05-7,15 (2H, м), 7,38 (1H, д, J=3,3 Гц), 7,94 (1H, д, J=2,6 Гц), 8,18 (1H, дд, J=6,6, 2,0 Гц), 8,30 (1H, д, J=2,0 Гц), 10,82 (1H, с).
МС (ESI, m/z): 322 (M+H)+.
[Пример 419]
[Формула 666]

Способом, аналогичным описанному в примере 418, 5-циклопропил-2-((1-пропил-1H-индол-4-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-(2,2,2-трифтор-N-(1H-индол-4-ил)ацетамидо)никотината и 1-йодпропана.
1H-ЯМР (ДМСО-d6) δ: 0,65-0,73 (2H, м), 0,84 (3H, т, J=7,6 Гц), 0,90-0,98 (2H, м), 1,71-1,85 (2H, м), 1,89-2,00 (1H, м), 4,13 (2H, т, J=6,9 Гц), 6,48 (1H, д, J=3,3 Гц), 7,05-7,15 (2H, м), 7,37 (1H, д, J=3,3 Гц), 7,94 (1H, д, J=2,6 Гц), 8,18 (1H, дд, J=6,9, 1,7 Гц), 8,30 (1H, д, J=2,6 Гц), 10,83 (1H, с).
МС (ESI, m/z): 336 (M+H)+.
[Пример 420]
[Формула 667]

Способом, аналогичным описанному в примере 225, трет-бутил-4-((3-трет-бутоксикарбонил)-5-циклопропилпиридин-2-ил)амино)-1H-индол-1-карбоксилат получали из трет-бутил-2-хлор-5-циклопропилникотината и трет-бутил-4-амино-1H-индол-1-карбоксилата.
МС (ESI, m/z): 450 (M+H)+.
[Пример 421]
[Формула 668]

Способом, аналогичным описанному в примере 235, трет-бутил-2-((1H-индол-4-ил)амино)-5-циклопропилникотинат получали из трет-бутил-4-((3-трет-бутоксикарбонил)-5-циклопропилпиридин-2-ил)амино)-1H-индол-1-карбоксилата.
МС (ESI, m/z): 350 (M+H)+
[Пример 422]
[Формула 669]

К раствору 56 мг трет-бутил-2-((1H-индол-4-ил)амино)-5-циклопропилникотината в 2 мл N,N-диметилформамида добавляли 22 мг трет-бутоксида калия и 36 мг 2-(бромметил)тетрагидро-2H-пирана, и перемешивали полученную смесь в течение 1 часа, а затем оставляли отстаиваться в течение ночи. К реакционной смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-67/33) с получением трет-бутил-5-циклопропил-2-((1-((тетрагидро-2H-пиран-2-ил)метил)-1H-индол-4-ил)амино)никотината в виде желтого масла.
МС (ESI, m/z): 448 (M+H)+.
[Пример 423]
[Формула 670]

После перемешивания в течение 4 часов смешанного раствора трет-бутил-5-циклопропил-2-((1-((тетрагидро-2H-пиран-2-ил)метил)-1H-индол-4-ил)амино)никотината, полученного в примере 422, в 3 мл дихлорметана и 3 мл трифторуксусной кислоты, растворитель отгоняли в условиях пониженного давления. К полученному остатку добавляли этилацетат и воду, и корректировали полученную смесь до pH 2,5-3,0 добавлением 1 M водного раствора гидроксида натрия. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 75/25-0/100), к полученному таким образом остатку добавляли этилацетат и гексан, и собирали твердое вещество путем фильтрования с получением 13 мг 5-циклопропил-2-((1-((тетрагидро-2H-пиран-2-ил)метил)-1H-индол-4-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,65-0,73 (2H, м), 0,90-0,98 (2H, м), 1,10-1,77 (6H, м), 1,90-2,00 (1H, м), 3,20-3,70 (2H, м), 3,80-3,88 (1H, м), 4,13-4,20 (2H, м), 6,46 (1H, д, J=3,3 Гц), 7,04-7,17 (2H, м), 7,31 (1H, д, J=3,3 Гц), 7,94 (1H, д, J=2,6 Гц), 8,14 (1H, д, J=7,3 Гц), 8,30 (1H, д, J=2,6 Гц), 10,76 (1H, с).
МС (ESI, m/z): 392 (M+H)+.
[Пример 424]
[Формула 671]

К раствору 56 мг трет-бутил-2-((1H-индол-4-ил)амино)-5-циклопропилникотината в 2 мл N,N-диметилформамида добавляли 22 мг трет-бутоксида калия и 36 мг 4-(бромметил)тетрагидро-2H-пирана, и перемешивали полученную смесь в течение 1 часа, а затем оставляли отстаиваться в течение ночи. К реакционной смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-67/33) с получением трет-бутил-5-циклопропил-2-((1-((тетрагидро-2H-пиран-4-ил)метил)-1H-индол-4-ил)амино)никотината в виде желтого масла.
МС (ESI, m/z): 448 (M+H)+.
[Пример 425]
[Формула 672]

После перемешивания в течение 4 часов смешанного раствора трет-бутил-5-циклопропил-2-((1-((тетрагидро-2H-пиран-4-ил)метил)-1H-индол-4-ил)амино)никотината, полученного в примере 424, в 3 мл дихлорметана и 3 мл трифторуксусной кислоты, растворитель отгоняли в условиях пониженного давления. К полученному остатку добавляли этилацетат и воду, и корректировали полученную смесь до pH 2,5-3,0 добавлением 1 M водного раствора гидроксида натрия. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 75/25-0/100), к полученному таким образом остатку добавляли этилацетат и гексан, и собирали твердое вещество путем фильтрования с получением 11 мг 5-циклопропил-2-((1-((тетрагидро-2H-пиран-4-ил)метил)-1H-индол-4-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,65-0,73 (2H, м), 0,90-0,97 (2H, м), 1,20-1,43 (4H, м), 1,88-2,14 (2H, м), 3,10-3,50 (2H, м), 3,76-3,86 (2H, м), 4,07 (2H, д, J=7,3 Гц), 6,48 (1H, д, J=3,3 Гц), 7,05-7,19 (2H, м), 7,35 (1H, д, J=3,3 Гц), 7,93 (1H, д, J=2,6 Гц), 8,18 (1H, д, J=7,3 Гц), 8,30 (1H, д, J=2,6 Гц), 10,83 (1H, с).
МС (ESI, m/z): 392 (M+H)+.
[Пример 426]
[Формула 673]
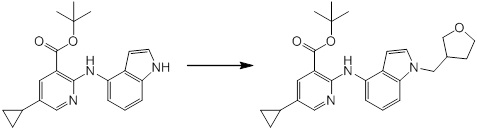
К раствору 56 мг трет-бутил-2-((1H-индол-4-ил)амино)-5-циклопропилникотината в 2 мл N,N-диметилформамида добавляли 22 мг трет-бутоксида калия и 33 мг 3-(бромметил)тетрагидрофурана, и перемешивали полученную смесь в течение 1 часа, а затем оставляли отстаиваться в течение ночи. К реакционной смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-67/33) с получением трет-бутил-5-циклопропил-2-((1-((тетрагидрофуран-3-ил)метил)-1H-индол-4-ил)амино)никотината в виде желтого масла.
МС (ESI, m/z): 434 (M+H)+.
[Пример 427]
[Формула 674]

После перемешивания в течение 4 часов смешанного раствора трет-бутил-5-циклопропил-2-((1-((тетрагидрофуран-3-ил)метил)-1H-индол-4-ил)амино)никотината, полученного в примере 426, в 3 мл дихлорметана и 3 мл трифторуксусной кислоты, растворитель отгоняли в условиях пониженного давления. К полученному остатку добавляли этилацетат и воду, и корректировали полученную смесь до pH 2,5-3,0 добавлением 1 M водного раствора гидроксида натрия. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 75/25-0/100), к полученному таким образом остатку добавляли этилацетат и гексан, и собирали твердое вещество путем фильтрования с получением 5 мг 5-циклопропил-2-((1-((тетрагидрофуран-3-ил)метил)-1H-индол-4-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,65-0,73 (2H, м), 0,90-0,98 (2H, м), 1,54-1,68 (1H, м), 1,82-1,99 (2H, м), 2,69-2,83 (1H, м), 3,20-3,50 (1H, м), 3,58-3,68 (2H, м), 3,77-3,87 (1H, м), 4,18 (2H, д, J=7,3 Гц), 6,49 (1H, д, J=2,6 Гц), 7,06-7,19 (2H, м), 7,41 (1H, д, J=3,3 Гц), 7,94 (1H, д, J=2,6 Гц), 8,19 (1H, д, J=6,6 Гц), 8,30 (1H, д, J=2,6 Гц), 10,83 (1H, с).
МС (ESI, m/z): 378 (M+H)+.
[Пример 428]
[Формула 675]

К раствору 56 мг трет-бутил-2-((1H-индол-4-ил)амино)-5-циклопропилникотината в 2 мл N,N-диметилформамида добавляли 22 мг трет-бутоксида калия и 28 мкл (бромметил)циклогексана, и перемешивали полученную смесь в течение 1 часа, а затем оставляли отстаиваться в течение ночи. К реакционной смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-67/33) с получением трет-бутил-2-((1-(циклогексилметил)-1H-индол-4-ил)амино)-5-циклопропилникотината в виде желтого масла.
МС (ESI, m/z): 446 (M+H)+.
[Пример 429]
[Формула 676]
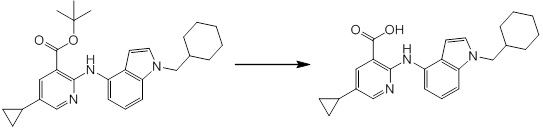
Смешанный раствор трет-бутил-2-((1-(циклогексилметил)-1H-индол-4-ил)амино)-5-циклопропилникотината, полученного в примере 428, в 3 мл дихлорметана и 3 мл трифторуксусной кислоты перемешивали в течение 4 часов, а затем отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли этилацетат и воду, и корректировали полученную смесь до pH 2,5-3,0 добавлением 1 M водного раствора гидроксида натрия. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 75/25-60/100), к полученному таким образом остатку добавляли этилацетат и гексан, и собирали твердое вещество путем фильтрования с получением 3 мг 2-((1-(циклогексилметил)-1H-индол-4-ил)амино)-5-циклопропилникотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,65-2,00 (16H, м), 4,00 (2H, д, J=7,3 Гц), 6,47 (1H, д, J=3,3 Гц), 7,04-7,15 (2H, м), 7,32 (1H, д, J=2,6 Гц), 7,94 (1H, д, J=2,6 Гц), 8,17 (1H, дд, J=6,9, 1,7 Гц), 8,30 (1H, д, J=2,6 Гц), 10,80 (1H, с).
МС (ESI, m/z): 390 (M+H)+.
[Пример 430]
[Формула 677]
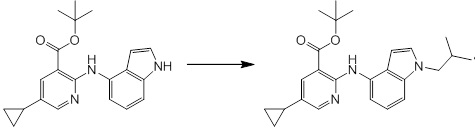
К раствору 56 мг трет-бутил-2-((1H-индол-4-ил)амино)-5-циклопропилникотината в 2 мл N,N-диметилформамида добавляли 22 мг трет-бутоксида калия и 22 мкл 1-бром-2-метилпропана, и перемешивали полученную смесь в течение 1 часа, а затем оставляли отстаиваться в течение ночи. К реакционной смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-67/33) с получением трет-бутил-5-циклопропил-2-((1-изобутил-1H-индол-4-ил)амино)никотината в виде желтого масла.
МС (ESI, m/z): 406 (M+H)+.
[Пример 431]
[Формула 678]

Смешанный раствор трет-бутил-5-циклопропил-2-((1-изобутил-1H-индол-4-ил)амино)никотината, полученного в примере 430, в 3 мл дихлорметана и 3 мл трифторуксусной кислоты перемешивали в течение 4 часов, а затем отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли этилацетат и воду, и корректировали полученную смесь до pH 2,5-3,0 добавлением 1 M водного раствора гидроксида натрия. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 75/25-60/100), к полученному таким образом остатку добавляли этилацетат и гексан, и собирали твердое вещество путем фильтрования с получением 3 мг 5-циклопропил-2-((1-изобутил-1H-индол-4-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,65-0,73 (2H, м), 0,82-0,98 (8H, м), 1,90-2,01 (1H, м), 2,05-2,20 (1H, м), 3,98 (2H, д, J=7,3 Гц), 6,48 (1H, д, J=3,3 Гц), 7,04-7,16 (2H, м), 7,35 (1H, д, J=3,3 Гц), 7,94 (1H, д, J=2,0 Гц), 8,17 (1H, д, J=7,3 Гц), 8,31 (1H, д, J=2,6 Гц), 10,78 (1H, с).
МС (ESI, m/z): 350 (M+H)+.
[Пример 432]
[Формула 679]

Смесь 56 мг трет-бутил-2-((1H-индол-4-ил)амино)-5-циклопропилникотината, 18 мкл йодбензола, 2 мг йодида меди(I), 4 мкл транс-циклогексан-1,2-диамина, 70 мг ортофосфата калия и 2 мл диоксана перемешивали при 140°C в течение 2 часов с использованием микроволновой установки. После охлаждения реакционной смеси до комнатной температуры добавляли этилацетат, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-67/33) с получением трет-бутил-5-циклопропил-2-((1-фенил-1H-индол-4-ил)амино)никотината в виде желтого масла.
МС (ESI, m/z): 426 (M+H)+.
[Пример 433]
[Формула 680]

Смешанный раствор трет-бутил-5-циклопропил-2-((1-фенил-1H-индол-4-ил)амино)никотината, полученного в примере 432, в 3 мл дихлорметана и 3 мл трифторуксусной кислоты перемешивали в течение 4 часов, а затем отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли этилацетат и воду, и корректировали полученную смесь до pH 2,5-3,0 добавлением 1 M водного раствора гидроксида натрия. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 75/25-60/100), к полученному таким образом остатку добавляли этилацетат и гексан, и собирали твердое вещество путем фильтрования с получением 8 мг 5-циклопропил-2-((1-фенил-1H-индол-4-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,66-0,74 (2H, м), 0,91-0,99 (2H, м), 1,90-2,02 (1H, м), 6,74 (1H, д, J=3,3 Гц), 7,13-7,24 (2H, м), 7,37-7,49 (1H, м), 7,56-7,69 (5H, м), 7,97 (1H, д, J=2,6 Гц), 8,24-8,34 (2H, м), 10,93 (1H, с).
МС (ESI, m/z): 370 (M+H)+.
[Пример 434]
[Формула 681]
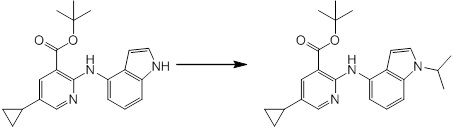
К раствору 56 мг трет-бутил-2-((1H-индол-4-ил)амино)-5-циклопропилникотината в 2 мл N,N-диметилформамида добавляли 22 мг трет-бутоксида калия и 20 мкл 2-йодпропана и перемешивали полученную смесь в течение 3 часов. К реакционной смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-67/33) с получением трет-бутил-5-циклопропил-2-((1-изопропил-1H-индол-4-ил)амино)никотината в виде масла.
МС (ESI, m/z): 392 (M+H)+.
[Пример 435]
[Формула 682]

К смешанному раствору трет-бутил-5-циклопропил-2-((1-изопропил-1H-индол-4-ил)амино)никотината, полученного в примере 434, в 1 мл метанола и 2 мл тетрагидрофурана добавляли 0,5 мл 1 M водного раствора гидроксида натрия, и перемешивали полученную смесь при 150°C в течение 15 минут с использованием микроволновой установки. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. К смеси добавляли воду и метанол, и корректировали полученную смесь до pH 2,5-3,0 добавлением 1 M соляной кислоты. Твердое вещество собирали путем фильтрования с получением 13 мг 5-циклопропил-2-((1-изопропил-1H-индол-4-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,65-0,73 (2H, м), 0,91-0,98 (2H, м), 1,46 (6H, д, J=6,6 Гц), 1,89-2,00 (1H, м), 4,66-4,79 (1H, м), 6,51 (1H, д, J=3,3 Гц), 7,06-7,19 (2H, м), 7,48 (1H, д, J=3,3 Гц), 7,94 (1H, д, J=2,6 Гц), 8,17 (1H, д, J=7,3 Гц), 8,30 (1H, д, J=2,6 Гц), 10,79 (1H, с).
МС (ESI, m/z): 336 (M+H)+.
[Пример 436]
[Формула 683]
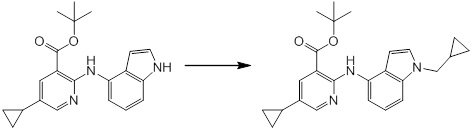
К раствору 56 мг трет-бутил-2-((1H-индол-4-ил)амино)-5-циклопропилникотината в 2 мл N,N-диметилформамида добавляли 22 мг трет-бутоксида калия и 19 мкл (бромметил)циклопропана и перемешивали полученную смесь в течение 3 часов. К реакционной смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-67/33) с получением трет-бутил-5-циклопропил-2-((1-(циклопропилметил)-1H-индол-4-ил)амино)никотината в виде масла.
МС (ESI, m/z): 404 (M+H)+.
[Пример 437]
[Формула 684]
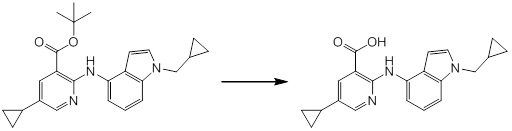
К смешанному раствору трет-бутил-5-циклопропил-2-((1-(циклопропилметил)-1H-индол-4-ил)амино)никотината, полученного в примере 436, в 1 мл метанола и 2 мл тетрагидрофурана добавляли 0,5 мл 1 M водного раствора гидроксида натрия, и перемешивали полученную смесь при 150°C в течение 15 минут с использованием микроволновой установки. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. К полученному остатку добавляли метанол и воду, и корректировали полученную смесь до pH 2,5-3,0 добавлением 1 M соляной кислоты. Твердое вещество собирали путем фильтрования с получением 40 мг 5-циклопропил-2-((1-(циклопропилметил)-1H-индол-4-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,36-0,55 (4H, м), 0,65-0,73 (2H, м), 0,90-0,98 (2H, м), 1,17-1,31 (1H, м), 1,89-2,01 (1H, м), 4,04 (2H, д, J=7,3 Гц), 6,48 (1H, д, J=3,3 Гц), 7,06-7,19 (2H, м), 7,43 (1H, д, J=3,3 Гц), 7,94 (1H, д, J=2,6 Гц), 8,17 (1H, д, J=7,3 Гц), 8,31 (1H, д, J=2,6 Гц), 10,78 (1H, с).
МС (ESI, m/z): 348 (M+H)+
[Пример 438]
[Формула 685]
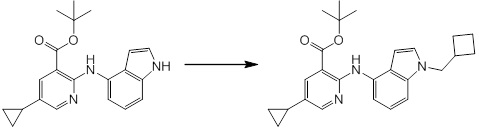
К раствору 56 мг трет-бутил-2-((1H-индол-4-ил)амино)-5-циклопропилникотината в 2 мл N,N-диметилформамида добавляли 22 мг трет-бутоксида калия и 22 мкл (бромметил)циклобутана и перемешивали полученную смесь в течение 3 часов. К реакционной смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-67/33) с получением трет-бутил-2-((1-(циклобутилметил)-1H-индол-4-ил)амино)-5-циклопропилникотината в виде масла.
МС (ESI, m/z): 418 (M+H)+.
[Пример 439]
[Формула 686]

К смешанному раствору трет-бутил-2-((1-(циклобутилметил)-1H-индол-4-ил)амино)-5-циклопропилникотината, полученного в примере 438, в 1 мл метанола и 2 мл тетрагидрофурана добавляли 0,5 мл 1 M водного раствора гидроксида натрия, и перемешивали полученную смесь при 150°C в течение 15 минут с использованием микроволновой установки. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. К полученному остатку добавляли метанол и воду, и корректировали полученную смесь до pH 2,5-3,0 добавлением 1 M соляной кислоты. Твердое вещество собирали путем фильтрования с получением 36 мг 2-((1-(циклобутилметил)-1H-индол-4-ил)амино)-5-циклопропилникотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,64-0,72 (2H, м), 0,90-0,98 (2H, м), 1,70-2,01 (7H, м), 2,70-2,84 (1H, м), 4,18 (2H, д, J=7,3 Гц), 6,47 (1H, д, J=2,6 Гц), 7,03-7,16 (2H, м), 7,36 (1H, д, J=3,3 Гц), 7,93 (1H, д, J=2,6 Гц), 8,17 (1H, д, J=6,6 Гц), 8,30 (1H, д, J=2,6 Гц), 10,79 (1H, с).
МС (ESI, m/z): 362 (M+H)+.
[Пример 440]
[Формула 687]

К раствору 56 мг трет-бутил-2-((1H-индол-4-ил)амино)-5-циклопропилникотината в 2 мл N,N-диметилформамида добавляли 22 мг трет-бутоксида калия и 19 мкл 1-бром-2-метоксиэтана и перемешивали полученную смесь в течение 3 часов. К реакционной смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-67/33) с получением трет-бутил-5-циклопропил-2-((1-(2-метоксиэтил)-1H-индол-4-ил)амино)никотината в виде масла.
МС (ESI, m/z): 408 (M+H)+.
[Пример 441]
[Формула 688]

К смешанному раствору трет-бутил-5-циклопропил-2-((1-(2-метоксиэтил)-1H-индол-4-ил)амино)никотината, полученного в примере 440, в 1 мл метанола и 2 мл тетрагидрофурана добавляли 0,5 мл 1 M водного раствора гидроксида натрия, и перемешивали полученную смесь при 150°C в течение 15 минут с использованием микроволновой установки. После охлаждения реакционной смеси до комнатной температуры, в условиях пониженного давления отгоняли растворитель. К полученному остатку добавляли метанол и воду, и корректировали полученную смесь до pH 2,5-3,0 добавлением 1 M соляной кислоты. Твердое вещество собирали путем фильтрования с получением 20 мг 5-циклопропил-2-((1-(2-метоксиэтил)-1H-индол-4-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,65-0,73 (2H, м), 0,90-0,97 (2H, м), 1,89-2,04 (1H, м), 3,22 (3H, с), 3,66 (2H, т, J=5,3 Гц), 4,32 (2H, т, J=5,3 Гц), 6,48 (1H, д, J=3,3 Гц), 7,05-7,16 (2H, м), 7,34 (1H, д, J=3,3 Гц), 7,93 (1H, д, J=2,6 Гц), 8,17 (1H, д, J=7,3 Гц), 8,29 (1H, д, J=2,6 Гц), 10,91 (1H, уш.с).
МС (ESI, m/z): 352 (M+H)+.
[Пример 442]
[Формула 689]
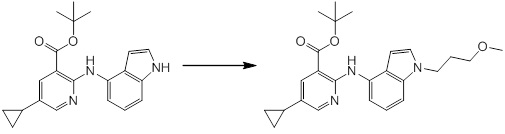
К раствору 56 мг трет-бутил-2-((1H-индол-4-ил)амино)-5-циклопропилникотината в 2 мл N,N-диметилформамида добавляли 22 мг трет-бутоксида калия и 22 мкл 1-бром-3-метоксипропана и перемешивали полученную смесь в течение 3 часов. К реакционной смеси добавляли воду и этилацетат. Органический слой разделяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-67/33) с получением трет-бутил-5-циклопропил-2-((1-(3-метоксипропил)-1H-индол-4-ил)амино)никотината в виде масла.
МС (ESI, m/z): 422 (M+H)+
[Пример 443]
[Формула 690]
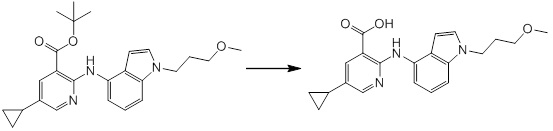
К смешанному раствору трет-бутил-5-циклопропил-2-((1-(3-метоксипропил)-1H-индол-4-ил)амино)никотината, полученного в примере 442, в 1 мл метанола и 2 мл тетрагидрофурана добавляли 0,5 мл 1 M водного раствора гидроксида натрия, и перемешивали полученную смесь при 150°C в течение 15 минут с использованием микроволновой установки. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. К полученному остатку добавляли метанол и воду, и корректировали полученную смесь до pH 2,5-3,0 добавлением 1 M соляной кислоты. Твердое вещество собирали путем фильтрования с получением 23 мг 5-циклопропил-2-((1-(3-метоксипропил)-1H-индол-4-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,65-0,73 (2H, м), 0,91-0,97 (2H, м), 1,89-2,04 (3H, м), 3,21-3,28 (5H, м), 4,22 (2H, т, J=6,9 Гц), 6,49 (1H, д, J=3,3 Гц), 7,11 (2H, д, J=4,6 Гц), 7,34 (1H, д, J=3,3 Гц), 7,94 (1H, д, J=2,6 Гц), 8,18 (1H, т, J=4,3 Гц), 8,31 (1H, д, J=2,6 Гц), 10,80 (1H, с).
МС (ESI, m/z): 366 (M+H)+
[Пример 444]
[Формула 691]

К раствору 50 мг 1-бензил-1H-индол-5-амина и 74 мг 3,6-дихлорпиридазин-4-карбоновой кислоты в 2 мл тетрагидрофурана при внешней температуре -70°C в атмосфере азота по каплям добавляли 100 мкл 1,6 M раствора бис(триметилсилил)амида лития в тетрагидрофуране, и перемешивали полученную смесь в течение 50 минут. Реакционную смесь нагревали до комнатной температуры, перемешивали в течение 8 часов и 10 минут и оставляли отстаиваться в течение 2 суток. К реакционной смеси добавляли этилацетат и воду, органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью хлороформ/метанол = 100/0-70/30). К полученному таким образом остатку добавляли метанол, и собирали твердое вещество путем фильтрования с получением 20 мг 3-((1-бензил-1H-индол-5-ил)амино)-6-хлорпиридазин-4-карбоновой кислоты в виде оранжево-коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 5,40 (2H, с), 6,45 (1H, д, J=3,3 Гц), 7,17-7,34 (6H, м), 7,39 (1H, д, J=8,6 Гц), 7,46 (1H, д, J=2,6 Гц), 7,74 (1H, с), 8,18 (1H, д, J=2,0 Гц), 12,22 (1H, уш.с).
МС (ESI, m/z): 379 (M+H)+, 377 (M-H)-.
[Пример 445]
[Формула 692]

К раствору 202 мг 3-((1-бензил-1H-индол-5-ил)амино)-6-хлорпиридазин-4-карбоновой кислоты в 12 мл N,N-диметилацетамида при охлаждении на льду добавляли 221 мг карбоната калия и 50 мкл йодметана и перемешивали полученную смесь при внешней температуре 60°C в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры, и добавляли к ней гексан, этилацетат и воду. Органический слой разделяли и промывали водой, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли гексан, и собирали твердое вещество путем фильтрования с получением 204 мг метил-3-((1-бензил-1H-индол-5-ил)амино)-6-хлорпиридазин-4-карбоксилата в виде красно-коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,94 (3H, с), 5,43 (2H, с), 6,49 (1H, д, J=2,6 Гц), 7,18-7,34 (6H, м), 7,44 (1H, д, J=8,6 Гц), 7,53 (1H, д, J=3,3 Гц), 7,94-7,97 (2H, м), 9,46 (1H, с).
МС (ESI, m/z): 393 (M+H)+.
[Пример 446]
[Формула 693]

Смесь 79 мг метил-3-((1-бензил-1H-индол-5-ил)амино)-6-хлорпиридазин-4-карбоксилата, 31 мг моногидрата циклопропилбороновой кислоты, 4,5 мг ацетата палладия, 8,3 мг 2-дициклогексилфосфино-2',6'-диметоксибифенила, 128 мг фосфата калия и 2 мл толуола нагревали с обратным холодильником в течение 9 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры и оставляли отстаиваться в течение ночи. Нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-80/20) с получением 43 мг метил-3-((1-бензил-1H-индол-5-ил)амино)-6-циклопропилпиридазин-4-карбоксилата в виде коричневого масла.
МС (ESI, m/z): 399 (M+H)+.
[Пример 447]
[Формула 694]

Смесь 43 мг метил-3-((1-бензил-1H-индол-5-ил)амино)-6-циклопропилпиридазин-4-карбоксилата, 110 мкл 5 M водного раствора гидроксида натрия, 2 мл тетрагидрофурана и 2 мл метанола перемешивали при внешней температуре 60°C в течение 2 часов и 15 минут. После охлаждения реакционной смеси до комнатной температуры, добавляли 6 M соляную кислоту и воду, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли воду и метанол, и собирали твердое вещество путем фильтрования с получением 36 мг 3-((1-бензил-1H-индол-5-ил)амино)-6-циклопропилпиридазин-4-карбоновой кислоты в виде оранжевого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,94-1,04 (4H, м), 2,17-2,29 (1H, м), 5,42 (2H, с), 6,47 (1H, д, J=2,6 Гц), 7,18-7,34 (6H, м), 7,41 (1H, д, J=8,6 Гц), 7,50 (1H, д, J=3,3 Гц), 7,75 (1H, с), 8,08 (1H, с).
МС (ESI, m/z): 385 (M+H)+, 383 (M-H)-.
[Пример 448]
[Формула 695]

К раствору 100 мг метил-2-((1H-индол-5-ил)амино)-5-циклопропилникотината в 2 мл N,N-диметилформамида при охлаждении на льду добавляли 44 мг трет-бутоксида калия и 59 мкл 1-бром-3-метилбутана, и перемешивали полученную смесь при комнатной температуре в течение 2 часов и 20 минут. К смеси при комнатной температуре добавляли 44 мг трет-бутоксида калия и 59 мкл 1-бром-3-метилбутана и перемешивали полученную смесь в течение 3 часов и 30 минут. Реакционную смесь оставляли отстаиваться в течение ночи, а затем к смеси добавляли 44 мг трет-бутоксида калия и 59 мкл 1-бром-3-метилбутана, и перемешивали полученную смесь в течение 2 часов. К смеси дополнительно добавляли 44 мг трет-бутоксида калия и 59 мкл 1-бром-3-метилбутана, и перемешивали полученную смесь в течение 1 часа и 30 минут. К реакционной смеси добавляли этилацетат и воду, полученную смесь подкисляли добавлением к ней 2 M соляной кислоты, а затем разделяли органический слой. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-50/50). К полученному таким образом остатку добавляли воду и метанол, и собирали твердое вещество путем фильтрования с получением 82 мг 5-циклопропил-2-(1-изопентил-1H-индол-5-иламино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,67 (2H, м), 0,87-0,94 (8H, м), 1,44-1,55 (1H, м), 1,65 (2H, кв., J=7,2 Гц), 1,85-1,93 (1H, м), 4,15 (2H, т, J=7,3 Гц), 6,36 (1H, д, J=2,4 Гц), 7,19 (1H, дд, J=8,8, 2,0 Гц), 7,33 (1H, д, J=2,9 Гц), 7,38 (1H, д, J=9,0 Гц), 7,87 (1H, д, J=2,4 Гц), 7,94 (1H, д, J=1,7 Гц), 8,18 (1H, д, J=2,7 Гц), 10,12 (1H, с), 13,38 (1H, уш.с).
[Пример 449]
[Формула 696]

К смеси 50 мг метил-5-циклопропил-2-(2,2,2-трифтор-N-(1H-индол-5-ил)ацетамидо)никотината, 33 мг 1-(бромметил)-2-(трифторметил)бензола и 1,5 мл N,N-диметилформамида при охлаждении на льду добавляли 6,4 мг 60% гидрида натрия и перемешивали полученную смесь в течение 15 минут. К смеси дополнительно добавляли 6,4 мг 60% гидрида натрия, и перемешивали полученную смесь в течение 40 минут. К смеси добавляли 50 мкл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при комнатной температуре в течение 4 часов. Реакционную смесь оставляли отстаиваться при комнатной температуре в течение ночи. К реакционной смеси добавляли этилацетат и воду, и корректировали полученную смесь до pH 2,5 добавлением к ней 1 M соляной кислоты. Органический слой разделяли, и дважды экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-20/80), к полученному таким образом остатку добавляли этилацетат и гексан, и собирали твердое вещество путем фильтрования с получением 36 мг 5-циклопропил-2-((1-(2-(трифторметил)бензил)-1H-индол-5-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 0,61-0,67 (2H, м), 0,90-0,96 (2H, м), 1,77-1,86 (1H, м), 5,47 (2H, с), 6,53-6,58 (2H, м), 7,06-7,13 (2H, м), 7,20-7,35 (3H, м), 7,69 (1H, д, J=7,1 Гц), 7,89-7,97 (2H, м), 8,14 (1H, с), 9,96 (1H, уш.с).
МС (ESI, m/z): 452 (M+H)+, 450 (M-H)-.
[Пример 450]
[Формула 697]

Способом, аналогичным описанному в примере 449, 5-циклопропил-2-((1-(3-(трифторметил)бензил)-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-(2,2,2-трифтор-N-(1H-индол-5-ил)ацетамидо)никотината и 1-(бромметил)-3-(трифторметил)бензола.
1H-ЯМР (ДМСО-d6) δ: 0,59-0,67 (2H, м), 0,84-0,94 (2H, м), 1,82-1,96 (1H, м), 5,52 (2H, с), 6,46 (1H, д, J=2,6 Гц), 7,12-7,20 (1H, м), 7,36-7,46 (2H, м), 7,50-7,65 (4H, м), 7,86 (1H, д, J=2,0 Гц), 7,99 (1H, д, J=1,3 Гц), 8,18 (1H, д, J=2,0 Гц), 10,15 (1H, с).
МС (ESI, m/z): 452 (M+H)+, 450 (M-H)-
[Пример 451]
[Формула 698]

Способом, аналогичным описанному в примере 449, 5-циклопропил-2-((1-(4-(трифторметил)бензил)-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-(2,2,2-трифтор-N-(1H-индол-5-ил)ацетамидо)никотината и 1-(бромметил)-4-(трифторметил)бензола.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,68 (2H, м), 0,84-0,94 (2H, м), 1,82-1,96 (1H, м), 5,53 (2H, с), 6,47 (1H, д, J=2,6 Гц), 7,16 (1H, дд, J=8,9, 1,7 Гц), 7,30-7,38 (3H, м), 7,50 (1H, д, J=3,3 Гц), 7,68 (2H, д, J=7,9 Гц), 7,86 (1H, д, J=2,6 Гц), 7,99 (1H, д, J=1,3 Гц), 8,18 (1H, д, J=2,0 Гц), 10,13 (1H, с).
МС (ESI, m/z): 452 (M+H)+, 450 (M-H)-.
[Пример 452]
[Формула 699]

Способом, аналогичным описанному в примере 449, 2-((1-(2-цианобензил)-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту получали из метил-5-циклопропил-2-(2,2,2-трифтор-N-(1H-индол-5-ил)ацетамидо)никотината и 2-(бромметил)бензонитрила.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,68 (2H, м), 0,86-0,95 (2H, м), 1,83-1,96 (1H, м), 5,64 (2H, с), 6,49 (1H, д, J=2,6 Гц), 6,87 (1H, д, J=7,9 Гц), 7,19 (1H, дд, J=8,6, 2,0 Гц), 7,35 (1H, д, J=9,2 Гц), 7,42-7,52 (2H, м), 7,55-7,64 (1H, м), 7,84-7,94 (2H, м), 8,01 (1H, с), 8,19 (1H, д, J=2,6 Гц), 10,15 (1H, с).
МС (ESI, m/z): 409 (M+H)+, 407 (M-H)-.
[Пример 453]
[Формула 700]

Способом, аналогичным описанному в примере 449, 2-((1-(3-цианобензил)-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту получали из метил-5-циклопропил-2-(2,2,2-трифтор-N-(1H-индол-5-ил)ацетамидо)никотината и 3-(бромметил)бензонитрила.
1H-ЯМР (ДМСО-d6) δ: 0,59-0,68 (2H, м), 0,84-0,95 (2H, м), 1,83-1,95 (1H, м), 5,47 (2H, с), 6,46 (1H, д, J=2,6 Гц), 7,18 (1H, дд, J=8,6, 2,0 Гц), 7,39 (1H, д, J=8,6 Гц), 7,45-7,57 (3H, м), 7,64-7,76 (2H, м), 7,86 (1H, д, J=2,6 Гц), 7,98 (1H, д, J=1,3 Гц), 8,18 (1H, д, J=2,6 Гц), 10,14 (1H, с).
МС (ESI, m/z): 409 (M+H)+.
[Пример 454]
[Формула 701]
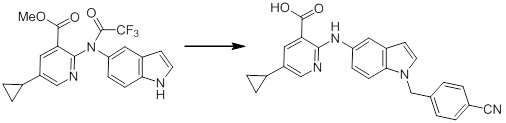
Способом, аналогичным описанному в примере 449, 2-((1-(4-цианобензил)-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту получали из метил-5-циклопропил-2-(2,2,2-трифтор-N-(1H-индол-5-ил)ацетамидо)никотината и 4-(бромметил)бензонитрила.
1H-ЯМР (ДМСО-d6) δ: 0,59-0,68 (2H, м), 0,84-0,95 (2H, м), 1,83-1,96 (1H, м), 5,52 (2H, с), 6,47 (1H, д, J=2,6 Гц), 7,16 (1H, дд, J=8,9, 1,7 Гц), 7,26-7,35 (3H, м), 7,49 (1H, д, J=2,6 Гц), 7,79 (2H, д, J=7,8 Гц), 7,86 (1H, д, J=2,6 Гц), 7,99 (1H, д, J=2,0 Гц), 8,17 (1H, д, J=2,0 Гц), 10,14 (1H, с).
МС (ESI, m/z): 409 (M+H)+.
[Пример 455]
[Формула 702]
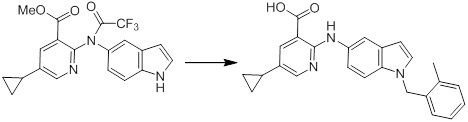
Способом, аналогичным описанному в примере 449, 5-циклопропил-2-((1-(2-метилбензил)-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-(2,2,2-трифтор-N-(1H-индол-5-ил)ацетамидо)никотината и 1-(бромметил)-2-метилбензола.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,68 (2H, м), 0,84-0,96 (2H, м), 1,82-1,98 (1H, м), 2,32 (3H, с), 5,40 (2H, с), 6,46 (1H, д, J=3,3 Гц), 6,53 (1H, д, J=7,3 Гц), 7,00-7,10 (1H, м), 7,12-7,24 (3H, м), 7,26-7,34 (2H, м), 7,86 (1H, д, J=2,6 Гц), 8,01 (1H, д, J=2,0 Гц), 8,18 (1H, д, J=2,6 Гц), 10,15 (1H, с).
МС (ESI, m/z): 398 (M+H)+, 396 (M-H)-.
[Пример 456]
[Формула 703]
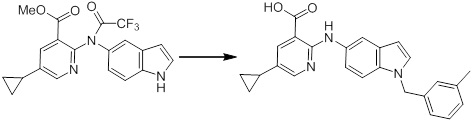
Способом, аналогичным описанному в примере 449, 5-циклопропил-2-((1-(3-метилбензил)-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-(2,2,2-трифтор-N-(1H-индол-5-ил)ацетамидо)никотината и 1-(бромметил)-3-метилбензола.
1H-ЯМР (ДМСО-d6) δ: 0,58-0,68 (2H, м), 0,84-0,94 (2H, м), 1,82-1,94 (1H, м), 2,24 (3H, с), 5,35 (2H, с), 6,42 (1H, д, J=2,6 Гц), 6,94-7,23 (5H, м), 7,35 (1H, д, J=8,6 Гц), 7,45 (1H, д, J=2,6 Гц), 7,86 (1H, д, J=2,6 Гц), 7,96 (1H, д, J=2,0 Гц), 8,17 (1H, д, J=2,6 Гц), 10,14 (1H, с).
МС (ESI, m/z): 398 (M+H)+, 396 (M-H)-.
[Пример 457]
[Формула 704]

Способом, аналогичным описанному в примере 449, 5-циклопропил-2-((1-(4-метилбензил)-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-(2,2,2-трифтор-N-(1H-индол-5-ил)ацетамидо)никотината и 1-(бромметил)-4-метилбензола.
1H-ЯМР (ДМСО-d6) δ: 0,59-0,68 (2H, м), 0,84-0,96 (2H, м), 1,80-1,95 (1H, м), 2,24 (3H, с), 5,33 (2H, с), 6,41 (1H, д, J=3,3 Гц), 7,10 (4H, с), 7,14 (1H, дд, J=9,2, 2,0 Гц), 7,34 (1H, д, J=8,6 Гц), 7,44 (1H, д, J=3,3 Гц), 7,85 (1H, д, J=2,6 Гц), 7,95 (1H, д, J=1,3 Гц), 8,17 (1H, д, J=2,6 Гц), 10,12 (1H, с).
МС (ESI, m/z): 398 (M+H)+, 396 (M-H)-.
[Пример 458]
[Формула 705]
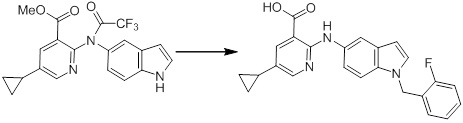
Способом, аналогичным описанному в примере 449, 5-циклопропил-2-((1-(2-фторбензил)-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-(2,2,2-трифтор-N-(1H-индол-5-ил)ацетамидо)никотината и 1-(бромметил)-2-фторбензола.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,67 (2H, м), 0,86-0,94 (2H, м), 1,84-1,94 (1H, м), 5,45 (2H, с), 6,44 (1H, д, J=3,2 Гц), 6,98-7,05 (1H, м), 7,07-7,26 (3H, м), 7,28-7,36 (1H, м), 7,39 (1H, д, J=8,8 Гц), 7,42 (1H, д, J=2,9 Гц), 7,86 (1H, д, J=2,7 Гц), 7,97 (1H, д, J=2,0 Гц), 8,18 (1H, д, J=2,4 Гц), 10,13 (1H, с).
МС (ESI, m/z): 402 (M+H)+, 400 (M-H)-.
[Пример 459]
[Формула 706]

Способом, аналогичным описанному в примере 449, 2-((1-(2-хлорбензил)-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту получали из метил-5-циклопропил-2-(2,2,2-трифтор-N-(1H-индол-5-ил)ацетамидо)никотината и 1-(бромметил)-2-хлорбензола.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,68 (2H, м), 0,84-0,96 (2H, м), 1,83-1,96 (1H, м), 5,50 (2H, с), 6,48 (1H, д, J=3,3 Гц), 6,62-6,68 (1H, м), 7,12-7,36 (4H, м), 7,42 (1H, д, J=2,6 Гц), 7,48-7,54 (1H, м), 7,87 (1H, д, J=2,0 Гц), 8,01 (1H, д, J=2,0 Гц), 8,19 (1H, д, J=2,6 Гц), 10,14 (1H, с).
МС (ESI, m/z): 418 (M+H)+, 416 (M-H)-
[Пример 460]
[Формула 707]
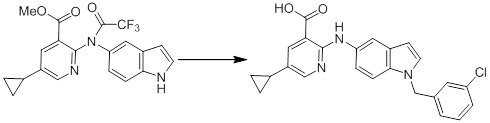
Способом, аналогичным описанному в примере 449, 2-((1-(3-хлорбензил)-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту получали из метил-5-циклопропил-2-(2,2,2-трифтор-N-(1H-индол-5-ил)ацетамидо)никотината и 1-(бромметил)-3-хлорбензола.
1H-ЯМР (ДМСО-d6) δ: 0,59-0,68 (2H, м), 0,84-0,96 (2H, м), 1,82-1,96 (1H, м), 5,42 (2H, с), 6,45 (1H, д, J=3,3 Гц), 7,10-7,26 (3H, м), 7,28-7,41 (3H, м), 7,50 (1H, д, J=3,3 Гц), 7,86 (1H, д, J=2,6 Гц), 7,98 (1H, д, J=2,0 Гц), 8,17 (1H, д, J=2,6 Гц).
МС (ESI, m/z): 418 (M+H)+, 416 (M-H)-.
[Пример 461]
[Формула 708]

Способом, аналогичным описанному в примере 449, 2-((1-(4-хлорбензил)-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту получали из метил-5-циклопропил-2-(2,2,2-трифтор-N-(1H-индол-5-ил)ацетамидо)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,59-0,68 (2H, м), 0,84-0,96 (2H, м), 1,83-1,95 (1H, м), 5,40 (2H, с), 6,44 (1H, д, J=3,3 Гц), 7,12-7,24 (3H, м), 7,30-7,40 (3H, м), 7,47 (1H, д, J=2,6 Гц), 7,86 (1H, д, J=2,6 Гц), 7,97 (1H, д, J=2,0 Гц), 8,17 (1H, д, J=2,6 Гц), 10,12 (1H, с).
МС (ESI, m/z): 418 (M+H)+, 416 (M-H)-.
[Пример 462]
[Формула 709]

Смешанный раствор 7,47 г 7-бром-1-метил-1H-индол-5-амина, 6,56 г 2-хлор-5-циклопропилникотиновой кислоты и 3,16 г моногидрата пара-толуолсульфоновой кислоты в 50 мл этанола и 25 мл воды добавляли к 25 мл 5 M соляной кислоты при нагревании с обратным холодильником, и перемешивали полученную смесь в течение 20 часов. К смеси добавляли 656 мг 2-хлор-5-циклопропилникотиновой кислоты и 20 мл 5 M соляной кислоты, и нагревали полученную смесь с обратным холодильником в течение 9 часов. Реакционную смесь корректировали до pH 3,0 добавлением водного раствора гидроксида натрия при комнатной температуре. К смеси добавляли этилацетат, органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-0/100) с получением 2,55 г 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты в виде желтого твердого вещества.
МС (ESI, m/z): 386, 388 (M+H)+.
[Пример 463]
[Формула 710]

Смесь 50 мг 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты, 28 мг 2-бифенилбороновой кислоты, 55 мг ортофосфата калия, 9,0 мг бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлорпалладия(II), 0,75 мл диоксана и 0,25 мл воды нагревали с обратным холодильником в течение 4 часов. К реакционной смеси добавляли 28 мг 2-бифенилбороновой кислоты, и оставляли полученную смесь отстаиваться при комнатной температуре в течение ночи. Реакционную смесь нагревали с обратным холодильником в течение 7 часов. Реакционную смесь охлаждали до комнатной температуры, а затем корректировали до pH 2,0 добавлением к ней воды и соляной кислоты. К смеси добавляли этилацетат, органический слой разделяли, и дважды экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-20/80), к полученному таким образом остатку добавляли этилацетат и гексан, и собирали твердое вещество путем фильтрования с получением 10,2 мг 2-((7-([1,1'-бифенил]-2-ил)-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 0,57-0,68 (2H, м), 0,82-0,96 (2H, м), 1,75-1,86 (1H, м), 3,22 (3H, с), 6,37 (1H, д, J=3,2 Гц), 6,79 (1H, д, J=2,9 Гц), 6,95-7,53 (10H, м), 7,84-8,14 (3H, м).
МС (ESI, m/z): 460 (M+H)+, 458 (M-H)-.
[Пример 464]
[Формула 711]
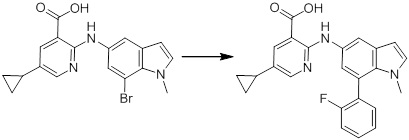
Способом, аналогичным описанному в примере 463, 5-циклопропил-2-((7-(2-фторфенил)-1-метил-1H-индол-5-ил)амино)никотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,70 (2H, м), 0,84-0,96 (2H, м), 1,82-1,96 (1H, м), 3,28 (3H, с), 6,45 (1H, д, J=3,3 Гц), 7,06 (1H, д, J=2,0 Гц), 7,24 (1H, д, J=3,3 Гц), 7,28-7,40 (2H, м), 7,46-7,58 (2H, м), 7,88 (1H, д, J=2,6 Гц), 8,07 (1H, д, J=2,0 Гц), 8,20 (1H, д, J=2,6 Гц), 10,26 (1H, с).
МС (ESI, m/z): 402 (M+H)+, 400 (M-H)-.
[Пример 465]
[Формула 712]
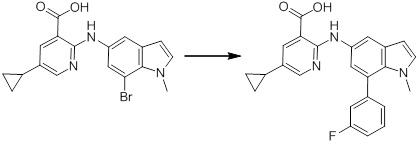
Способом, аналогичным описанному в примере 463, 5-циклопропил-2-((7-(3-фторфенил)-1-метил-1H-индол-5-ил)амино)никотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты.
1H-ЯМР (CDCl3) δ: 0,60-0,66 (2H, м), 0,82-0,95 (2H, м), 1,76-1,85 (1H, м), 3,29 (3H, с), 6,51 (1H, д, J=2,9 Гц), 6,95 (1H, д, J=2,9 Гц), 7,04-7,12 (2H, м), 7,15-7,29 (2H, м), 7,32-7,41 (1H, м), 7,90-7,98 (2H, м), 8,13-8,20 (1H, м), 9,89 (1H, уш.с).
МС (ESI, m/z): 402 (M+H)+, 400 (M-H)-.
[Пример 466]
[Формула 713]

Способом, аналогичным описанному в примере 463, 5-циклопропил-2-((7-(4-фторфенил)-1-метил-1H-индол-5-ил)амино)никотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,69 (2H, м), 0,84-0,95 (2H, м), 1,83-1,95 (1H, м), 3,26 (3H, с), 6,45 (1H, д, J=2,6 Гц), 7,00 (1H, д, J=2,0 Гц), 7,24 (1H, д, J=2,6 Гц), 7,25-7,34 (2H, м), 7,46-7,55 (2H, м), 7,88 (1H, д, J=2,6 Гц), 8,05 (1H, д, J=2,0 Гц), 8,20 (1H, д, J=2,0 Гц), 10,25 (1H, с).
МС (ESI, m/z): 402 (M+H)+, 400 (M-H)-.
[Пример 467]
[Формула 714]
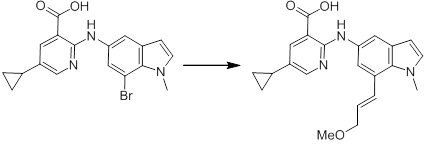
Способом, аналогичным описанному в примере 463, (E)-5-циклопропил-2-((7-(3-метоксипроп-1-ен-1-ил)-1-метил-1H-индол-5-ил)амино)никотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и пинаколинового эфира (E)-3-метокси-1-пропенилбороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,70 (2H, м), 0,84-0,98 (2H, м), 1,80-2,00 (1H, м), 3,20-3,50 (3H, м), 3,96 (3H, с), 4,06-4,14 (2H, м), 6,13 (1H, дт, J=15,4, 5,8 Гц), 6,34 (1H, д, J=3,3 Гц), 7,17 (1H, д, J=2,0 Гц), 7,22 (1H, д, J=3,3 Гц), 7,43 (1H, д, J=15,9 Гц), 7,87 (1H, д, J=2,6 Гц), 7,95 (1H, д, J=1,3 Гц), 8,20 (1H, д, J=2,6 Гц), 10,14 (1H, с).
МС (ESI, m/z): 378 (M+H)+, 376 (M-H)-.
[Пример 468]
[Формула 715]

Раствор 40 мг (E)-5-циклопропил-2-((7-(3-метоксипроп-1-ен-1-ил)-1-метил-1H-индол-5-ил)амино)никотиновой кислоты в 8 мл метанола подвергали реакции гидрогенизации (комнатная температура, 1 бар, скорость потока: 1,5 мл/мин, 10% Pd/C) с использованием реактора для гидрогенизации проточного типа. Растворитель отгоняли в условиях пониженного давления, а затем очищали полученный остаток методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-0/100) с получением 2,0 мг 5-циклопропил-2-((7-(3-метоксипропил)-1-метил-1H-индол-5-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,68 (2H, м), 0,84-0,96 (2H, м), 1,80-1,96 (3H, м), 2,98-3,10 (2H, м), 3,27 (3H, с), 3,42 (2H, т, J=6,3 Гц), 3,97 (3H, с), 6,32 (1H, д, J=3,3 Гц), 6,86 (1H, д, J=2,0 Гц), 7,17 (1H, д, J=3,3 Гц), 7,87 (1H, д, J=2,6 Гц), 7,93 (1H, д, J=2,0 Гц), 8,20 (1H, д, J=2,6 Гц), 10,14 (1H, с).
МС (ESI, m/z): 380 (M+H)+.
[Пример 469]
[Формула 716]
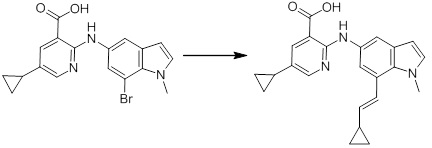
Способом, аналогичным описанному в примере 463, (E)-5-циклопропил-2-((7-(2-циклопропилвинил)-1-метил-1H-индол-5-ил)амино)никотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и пинаколинового эфира транс-2-циклопропилвинилбороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,52-0,70 (4H, м), 0,75-0,96 (4H, м), 1,60-1,76 (1H, м), 1,82-1,96 (1H, м), 3,98 (3H, с), 5,63 (1H, дд, J=15,2, 9,2 Гц), 6,31 (1H, д, J=3,3 Гц), 7,03 (1H, д, J=2,0 Гц), 7,19 (1H, д, J=3,3 Гц), 7,26 (1H, д, J=15,9 Гц), 7,86 (1H, д, J=2,6 Гц), 7,91 (1H, д, J=2,0 Гц), 8,19 (1H, д, J=2,6 Гц), 10,10 (1H, уш.с).
МС (ESI, m/z): 374 (M+H)+.
[Пример 470]
[Формула 717]

Способом, аналогичным описанному в примере 468, 5-циклопропил-2-((7-(2-циклопропилэтил)-1-метил-1H-индол-5-ил)амино)никотиновую кислоту в виде желтого твердого вещества получали из (E)-5-циклопропил-2-((7-(2-циклопропилвинил)-1-метил-1H-индол-5-ил)амино)никотиновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,08-0,16 (2H, м), 0,38-0,50 (2H, м), 0,60-0,68 (2H, м), 0,76-0,96 (3H, м), 1,50-1,62 (2H, м), 1,82-1,96 (1H, м), 3,04-3,14 (2H, м), 3,98 (3H, с), 6,31 (1H, д, J=3,3 Гц), 6,87 (1H, д, J=2,0 Гц), 7,17 (1H, д, J=2,6 Гц), 7,86 (1H, д, J=2,6 Гц), 7,92 (1H, д, J=2,0 Гц), 8,20 (1H, д, J=2,6 Гц), 10,09 (1H, с).
МС (ESI, m/z): 376 (M+H)+, 374 (M-H)-
[Пример 471]
[Формула 718]
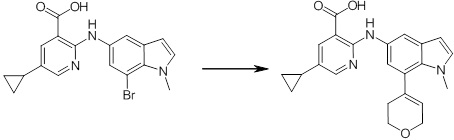
Способом, аналогичным описанному в примере 463, 5-циклопропил-2-((7-(3,6-дигидро-2H-пиран-4-ил)-1-метил-1H-индол-5-ил)амино)никотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и пинаколинового эфира 3,6-дигидро-2H-пиран-4-бороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,70 (2H, м), 0,84-0,96 (2H, м), 1,83-1,96 (1H, м), 2,36-2,48 (2H, м), 3,78 (3H, с), 3,88 (2H, т, J=5,3 Гц), 4,20-4,28 (2H, м), 5,74-5,80 (1H, м), 6,38 (1H, д, J=2,6 Гц), 6,86 (1H, д, J=2,0 Гц), 7,23 (1H, д, J=2,6 Гц), 7,87 (1H, д, J=2,6 Гц), 8,00 (1H, д, J=2,0 Гц), 8,20 (1H, д, J=2,6 Гц), 10,26 (1H, уш.с).
МС (ESI, m/z): 390 (M+H)+, 388 (M-H)-.
[Пример 472]
[Формула 719]
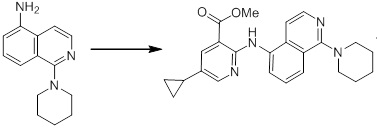
Смесь 105 мг 1-(пиперидин-1-ил)изохинолин-5-амина, 100 мг метил-2-хлор-5-циклопропилникотината, 42 мг трис(дибензилиденацетон)дипалладия(0), 53 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 301 мг карбоната цезия и 5 мл толуола перемешивали при 190°C в течение 1 часа с использованием микроволновой установки. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-70/30) с получением 86 мг метил-5-циклопропил-2-(1-(пиперидин-1-ил)изохинолин-5-иламино)никотината в виде коричневого масла.
МС (ESI, m/z): 403 (M+H)+.
[Пример 473]
[Формула 720]

К смешанному раствору 86 мг метил-5-циклопропил-2-(1-(пиперидин-1-ил)изохинолин-5-иламино)никотината в 1 мл метанола и 2 мл тетрагидрофурана при комнатной температуре добавляли 86 мкл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при внешней температуре 60°C в течение 30 минут. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. Реакционную смесь корректировали до pH 4,0 добавлением к ней соляной кислоты. К смеси добавляли этилацетат, органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью хлороформ/метанол = 100/0-95/5), к полученному таким образом остатку добавляли этилацетат и гексан, и собирали твердое вещество путем фильтрования с получением 12 мг 5-циклопропил-2-(1-(пиперидин-1-ил)изохинолин-5-иламино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,64-0,72 (2H, м), 0,89-0,99 (2H, м), 1,58-1,83 (6H, м), 1,88-2,00 (1H, м), 3,20-3,50 (4H, м), 7,45 (1H, д, J=5,9 Гц), 7,56 (1H, т, J=8,3 Гц), 7,73 (1H, д, J=8,6 Гц), 7,96 (1H, д, J=2,0 Гц), 8,15 (1H, д, J=5,9 Гц), 8,24 (1H, д, J=2,0 Гц), 8,60 (1H, д, J=7,9 Гц).
МС (ESI, m/z): 389 (M+H)+.
[Пример 474]
[Формула 721]

Способом, аналогичным описанному в примере 472, метил-5-циклопропил-2-(1-морфолиноизохинолин-5-иламино)никотинат получали из 1-морфолиноизохинолин-5-амина и метил-2-хлор-5-циклопропилникотината.
МС (ESI, m/z): 405 (M+H)+.
[Пример 475]
[Формула 722]
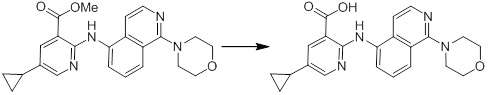
Способом, аналогичным описанному в примере 473, 5-циклопропил-2-(1-морфолиноизохинолин-5-иламино)никотиновую кислоту получали из метил-5-циклопропил-2-(1-морфолиноизохинолин-5-иламино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,64-0,73 (2H, м), 0,90-0,99 (2H, м), 1,88-2,02 (1H, м), 3,20-3,50 (4H, м), 3,82-3,92 (4H, м), 7,50 (1H, д, J=5,9 Гц), 7,58 (1H, т, J=8,3 Гц), 7,81 (1H, д, J=7,9 Гц), 7,97 (1H, д, J=2,6 Гц), 8,19 (1H, д, J=5,9 Гц), 8,25 (1H, д, J=2,6 Гц), 8,60 (1H, д, J=7,9 Гц), 10,89 (1H, с), 13,78 (1H, уш.с).
МС (ESI, m/z): 391 (M+H)+.
[Пример 476]
[Формула 723]
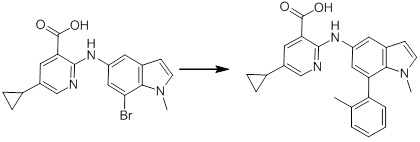
Способом, аналогичным описанному в примере 463, 5-циклопропил-2-((1-метил-7-(о-толил)-1H-индол-5-ил)амино)никотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и 2-метилфенилбороновой кислоты.
1H-ЯМР (CDCl3) δ: 0,60-0,67 (2H, м), 0,84-0,96 (2H, м), 1,77-1,86 (1H, м), 2,11 (3H, с), 3,15 (3H, с), 6,49 (1H, д, J=2,9 Гц), 6,91 (1H, д, J=3,2 Гц), 6,97 (1H, д, J=2,0 Гц), 7,20-7,38 (4H, м), 7,94 (1H, д, J=2,4 Гц), 8,02-8,09 (1H, м), 8,22 (1H, с), 9,86 (1H, уш.с).
МС (ESI, m/z): 398 (M+H)+.
[Пример 477]
[Формула 724]

Способом, аналогичным описанному в примере 463, 5-циклопропил-2-((1-метил-7-(мета-толил)-1H-индол-5-ил)амино)никотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и 3-метилфенилбороновой кислоты.
1H-ЯМР (CDCl3) δ: 0,60-0,66 (2H, м), 0,88-0,95 (2H, м), 1,76-1,86 (1H, м), 2,40 (3H, с), 3,27 (3H, с), 6,50 (1H, д, J=3,2 Гц), 6,93 (1H, д, J=2,9 Гц), 7,04 (1H, д, J=2,0 Гц), 7,16-7,32 (4H, м), 7,90-8,00 (2H, м), 8,18 (1H, с), 9,89 (1H, уш.с).
МС (ESI, m/z): 398 (M+H)+, 396 (M-H)-.
[Пример 478]
[Формула 725]

Способом, аналогичным описанному в примере 463, 5-циклопропил-2-((1-метил-7-(пара-толил)-1H-индол-5-ил)амино)никотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и 4-метилфенилбороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,67 (2H, м), 0,85-0,93 (2H, м), 1,84-1,93 (1H, м), 2,39 (3H, с), 3,26 (3H, с), 6,43 (1H, д, J=3,2 Гц), 6,97 (1H, д, J=2,0 Гц), 7,21 (1H, д, J=2,9 Гц), 7,27 (2H, д, J=7,8 Гц), 7,34 (2H, д, J=8,0 Гц), 7,87 (1H, д, J=2,7 Гц), 8,03 (1H, д, J=2,2 Гц), 8,18 (1H, д, J=2,4 Гц).
МС (ESI, m/z): 398 (M+H)+, 396 (M-H)-.
[Пример 479]
[Формула 726]

Способом, аналогичным описанному в примере 463, 5-циклопропил-2-((1-метил-7-(2-трифторметил)фенил)-1H-индол-5-ил)амино)никотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и 2-(трифторметил)фенилбороновой кислоты.
1H-ЯМР (CDCl3) δ: 0,60-0,66 (2H, м), 0,86-0,95 (2H, м), 1,76-1,87 (1H, м), 3,11 (3H, с), 6,48 (1H, д, J=2,9 Гц), 6,90 (1H, д, J=3,2 Гц), 7,04 (1H, с), 7,47-7,59 (3H, м), 7,75-7,82 (1H, м), 7,91-7,96 (1H, м), 8,00-8,06 (1H, м), 8,14-8,22 (1H, м).
МС (ESI, m/z): 452 (M+H)+, 450 (M-H)-.
[Пример 480]
[Формула 727]

Способом, аналогичным описанному в примере 463, 5-циклопропил-2-((1-метил-7-(3-трифторметил)фенил)-1H-индол-5-ил)амино)никотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и 3-(трифторметил)фенилбороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,69 (2H, м), 0,84-0,96 (2H, м), 1,83-1,96 (1H, м), 3,24 (3H, с), 6,48 (1H, д, J=2,6 Гц), 7,06 (1H, д, J=2,6 Гц), 7,27 (1H, д, J=2,6 Гц), 7,66-7,86 (4H, м), 7,88 (1H, д, J=2,6 Гц), 8,10 (1H, д, J=2,0 Гц), 8,20 (1H, д, J=2,6 Гц), 10,27 (1H, уш.с).
МС (ESI, m/z): 452 (M+H)+.
[Пример 481]
[Формула 728]

Способом, аналогичным описанному в примере 463, 5-циклопропил-2-((1-метил-7-(4-трифторметил)фенил)-1H-индол-5-ил)амино)никотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и 4-(трифторметил)фенилбороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,69 (2H, м), 0,84-0,96 (2H, м), 1,83-1,96 (1H, м), 3,27 (3H, с), 6,48 (1H, д, J=2,6 Гц), 7,08 (1H, д, J=2,0 Гц), 7,28 (1H, д, J=3,3 Гц), 7,72 (2H, д, J=7,9 Гц), 7,83 (2H, д, J=7,9 Гц), 7,88 (1H, д, J=2,6 Гц), 8,08 (1H, д, J=2,0 Гц), 8,20 (1H, д, J=2,6 Гц), 10,26 (1H, уш.с).
МС (ESI, m/z): 452 (M+H)+, 450 (M-H)-.
[Пример 482]
[Формула 729]
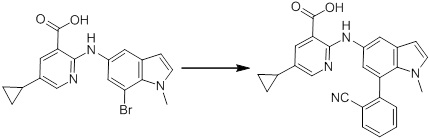
Способом, аналогичным описанному в примере 463, 2-((7-(2-цианофенил)-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и 2-цианофенилбороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,70 (2H, м), 0,84-0,95 (2H, м), 1,84-1,96 (1H, м), 3,20 (3H, с), 6,49 (1H, д, J=3,3 Гц), 7,12 (1H, д, J=2,0 Гц), 7,28 (1H, д, J=2,6 Гц), 7,65-7,72 (2H, м), 7,77-7,83 (1H, м), 7,89 (1H, д, J=2,6 Гц), 7,98 (1H, д, J=7,9 Гц), 8,15 (1H, д, J=2,0 Гц), 8,21 (1H, д, J=2,0 Гц), 10,30 (1H, уш.с).
МС (ESI, m/z): 409 (M+H)+, 407 (M-H)-.
[Пример 483]
[Формула 730]
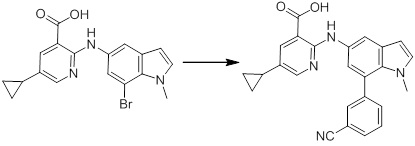
Способом, аналогичным описанному в примере 463, 2-((7-(3-цианофенил)-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и 3-цианофенилбороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,69 (2H, м), 0,85-0,95 (2H, м), 1,83-1,96 (1H, м), 3,26 (3H, с), 6,47 (1H, д, J=3,3 Гц), 7,04 (1H, д, J=2,0 Гц), 7,27 (1H, д, J=2,6 Гц), 7,67 (1H, т, J=7,9 Гц), 7,83 (1H, д, J=7,9 Гц), 7,88 (1H, д, J=2,7 Гц), 7,92 (1H, д, J=8,1 Гц), 7,98 (1H, с), 8,11 (1H, д, J=2,0 Гц), 8,20 (1H, д, J=2,6 Гц), 10,23 (1H, уш.с).
МС (ESI, m/z): 409 (M+H)+, 407 (M-H)-.
[Пример 484]
[Формула 731]

Способом, аналогичным описанному в примере 463, 2-((7-(4-цианофенил)-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и 4-цианофенилбороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,69 (2H, м), 0,84-0,96 (2H, м), 1,84-1,95 (1H, м), 3,27 (3H, с), 6,48 (1H, д, J=2,6 Гц), 7,06 (1H, д, J=2,6 Гц), 7,28 (1H, д, J=2,6 Гц), 7,69 (2H, д, J=7,9 Гц), 7,88 (1H, д, J=2,0 Гц), 7,94 (2H, д, J=7,9 Гц), 8,09 (1H, д, J=2,0 Гц), 8,20 (1H, д, J=2,6 Гц), 10,25 (1H, с).
МС (ESI, m/z): 409 (M+H)+, 407 (M-H)-.
[Пример 485]
[Формула 732]

Способом, аналогичным описанному в примере 463, 5-циклопропил-2-((7-(2-метоксифенил)-1-метил-1H-индол-5-ил)амино)никотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и 2-метоксифенилбороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,69 (2H, м), 0,84-0,95 (2H, м), 1,80-2,00 (1H, м), 3,21 (3H, с), 3,70 (3H, с), 6,39 (1H, д, J=2,6 Гц), 6,90 (1H, д, J=2,0 Гц), 7,04 (1H, т, J=6,9 Гц), 7,12 (1H, д, J=7,9 Гц), 7,17 (1H, д, J=3,3 Гц), 7,28 (1H, дд, J=7,3, 1,3 Гц), 7,38-7,48 (1H, м), 7,87 (1H, д, J=2,6 Гц), 8,01 (1H, д, J=2,0 Гц), 8,20 (1H, д, J=2,6 Гц), 10,22 (1H, с).
МС (ESI, m/z): 414 (M+H)+.
[Пример 486]
[Формула 733]

Способом, аналогичным описанному в примере 463, 5-циклопропил-2-((7-(3-метоксифенил)-1-метил-1H-индол-5-ил)амино)никотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и 3-метоксифенилбороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,69 (2H, м), 0,84-0,95 (2H, м), 1,82-1,95 (1H, м), 3,29 (3H, с), 3,81 (3H, с), 6,45 (1H, д, J=3,3 Гц), 6,96-7,06 (4H, м), 7,23 (1H, д, J=3,3 Гц), 7,32-7,42 (1H, м), 7,88 (1H, д, J=2,6 Гц), 8,04 (1H, д, J=2,0 Гц), 8,20 (1H, д, J=2,0 Гц), 10,25 (1H, уш.с).
МС (ESI, m/z): 414 (M+H)+, 412 (M-H)-.
[Пример 487]
[Формула 734]
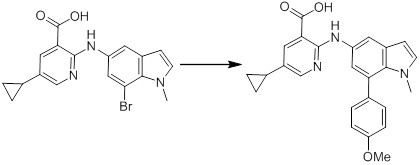
Способом, аналогичным описанному в примере 463, 5-циклопропил-2-((7-(4-метоксифенил)-1-метил-1H-индол-5-ил)амино)никотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и 4-метоксифенилбороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,69 (2H, м), 0,84-0,95 (2H, м), 1,82-1,96 (1H, м), 3,28 (3H, с), 3,83 (3H, с), 6,43 (1H, д, J=3,3 Гц), 6,96 (1H, д, J=2,0 Гц), 7,02 (2H, д, J=8,6 Гц), 7,22 (1H, д, J=3,3 Гц), 7,38 (2H, д, J=8,6 Гц), 7,87 (1H, д, J=2,6 Гц), 8,02 (1H, д, J=2,6 Гц), 8,20 (1H, д, J=2,0 Гц), 10,23 (1H, уш.с).
МС (ESI, m/z): 414 (M+H)+, 412 (M-H)-.
[Пример 488]
[Формула 735]

Способом, аналогичным описанному в примере 463, 2-((7-(2-хлорфенил)-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и 2-хлорфенилбороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,69 (2H, м), 0,84-0,95 (2H, м), 1,82-1,96 (1H, м), 3,20 (3H, с), 6,43 (1H, д, J=3,3 Гц), 6,99 (1H, д, J=2,0 Гц), 7,22 (1H, д, J=3,3 Гц), 7,40-7,64 (4H, м), 7,88 (1H, д, J=2,6 Гц), 8,09 (1H, д, J=2,0 Гц), 8,19 (1H, д, J=2,6 Гц), 10,43 (1H, уш.с).
МС (ESI, m/z): 418 (M+H)+.
[Пример 489]
[Формула 736]

Способом, аналогичным описанному в примере 463, 2-((7-(3-хлорфенил)-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и 3-хлорфенилбороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,69 (2H, м), 0,84-0,95 (2H, м), 1,82-1,95 (1H, м), 3,28 (3H, с), 6,46 (1H, д, J=2,6 Гц), 7,04 (1H, д, J=2,0 Гц), 7,25 (1H, д, J=3,3 Гц), 7,41-7,57 (4H, м), 7,88 (1H, д, J=2,6 Гц), 8,07 (1H, д, J=2,0 Гц), 8,19 (1H, д, J=2,6 Гц), 10,34 (1H, уш.с).
МС (ESI, m/z): 418 (M+H)+, 416 (M-H)-.
[Пример 490]
[Формула 737]

Способом, аналогичным описанному в примере 463, 2-((7-(4-хлорфенил)-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и 4-хлорфенилбороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,68 (2H, м), 0,85-0,95 (2H, м), 1,80-1,95 (1H, м), 3,28 (3H, с), 6,46 (1H, д, J=2,6 Гц), 7,01 (1H, д, J=2,0 Гц), 7,25 (1H, д, J=2,6 Гц), 7,46-7,60 (4H, м), 7,88 (1H, д, J=2,6 Гц), 8,06 (1H, д, J=2,0 Гц), 8,20 (1H, д, J=2,0 Гц), 10,25 (1H, уш.с).
МС (ESI, m/z): 418 (M+H)+, 416 (M-H)-.
[Пример 491]
[Формула 738]

Способом, аналогичным описанному в примере 463, 5-циклопропил-2-((1-метил-7-(2-(трифторметокси)фенил)-1H-индол-5-ил)амино)никотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и 2-(трифторметокси)фенилбороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,69 (2H, м), 0,86-0,95 (2H, м), 1,82-1,96 (1H, м), 3,20 (3H, с), 6,44 (1H, д, J=3,3 Гц), 7,03 (1H, д, J=2,0 Гц), 7,23 (1H, д, J=3,3 Гц), 7,46-7,66 (4H, м), 7,88 (1H, д, J=2,6 Гц), 8,09 (1H, д, J=2,0 Гц), 8,20 (1H, д, J=2,6 Гц), 10,27 (1H, с).
МС (ESI, m/z): 468 (M+H)+, 466 (M-H)-.
[Пример 492]
[Формула 739]

Способом, аналогичным описанному в примере 463, 5-циклопропил-2-((1-метил-7-(3-(трифторметокси)фенил)-1H-индол-5-ил)амино)никотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и 3-(трифторметокси)фенилбороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,69 (2H, м), 0,84-0,95 (2H, м), 1,84-1,95 (1H, м), 3,26 (3H, с), 6,47 (1H, д, J=3,3 Гц), 7,05 (1H, д, J=2,0 Гц), 7,26 (1H, д, J=3,3 Гц), 7,42-7,66 (4H, м), 7,88 (1H, д, J=2,6 Гц), 8,08 (1H, д, J=2,0 Гц), 8,20 (1H, д, J=2,6 Гц), 10,25 (1H, с).
МС (ESI, m/z): 468 (M+H)+, 466 (M-H)-.
[Пример 493]
[Формула 740]

Способом, аналогичным описанному в примере 463, 5-циклопропил-2-((1-метил-7-(4-(трифторметокси)фенил)-1H-индол-5-ил)амино)никотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и 4-(трифторметокси)фенилбороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,69 (2H, м), 0,86-0,95 (2H, м), 1,83-1,96 (1H, м), 3,27 (3H, с), 6,46 (1H, д, J=2,6 Гц), 7,04 (1H, д, J=2,0 Гц), 7,26 (1H, д, J=3,3 Гц), 7,45 (2H, д, J=7,9 Гц), 7,61 (2H, д, J=8,6 Гц), 7,88 (1H, д, J=2,6 Гц), 8,07 (1H, д, J=2,0 Гц), 8,20 (1H, д, J=2,6 Гц), 10,25 (1H, с).
МС (ESI, m/z): 468 (M+H)+, 466 (M-H)-
[Пример 494]
[Формула 741]
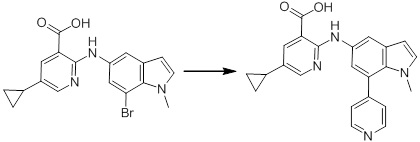
Способом, аналогичным описанному в примере 463, 5-циклопропил-2-((1-метил-7-(пиридин-4-ил)-1H-индол-5-ил)амино)никотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и 4-пиридинилбороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,68 (2H, м), 0,84-0,94 (2H, м), 1,82-1,94 (1H, м), 3,20-3,40 (3H, м), 6,48 (1H, д, J=3,3 Гц), 7,06 (1H, д, J=2,0 Гц), 7,28 (1H, д, J=3,3 Гц), 7,49-7,56 (2H, м), 7,87 (1H, д, J=2,6 Гц), 8,11 (1H, д, J=2,0 Гц), 8,17 (1H, д, J=2,6 Гц), 8,62-8,69 (2H, м).
МС (ESI, m/z): 385 (M+H)+, 383 (M-H)-.
[Пример 495]
[Формула 742]

Способом, аналогичным описанному в примере 463, 5-циклопропил-2-((1-метил-7-(пиридин-3-ил)-1H-индол-5-ил)амино)никотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и 3-пиридинилбороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,69 (2H, м), 0,84-0,96 (2H, м), 1,82-1,96 (1H, м), 3,28 (3H, с), 6,47 (1H, д, J=3,3 Гц), 7,06 (1H, д, J=2,0 Гц), 7,27 (1H, д, J=3,3 Гц), 7,50 (1H, дд, J=7,6, 5,0 Гц), 7,85-7,96 (2H, м), 8,10 (1H, д, J=2,0 Гц), 8,20 (1H, д, J=2,6 Гц), 8,65 (1H, дд, J=4,6, 1,3 Гц), 8,70 (1H, д, J=1,3 Гц), 10,30 (1H, уш.с).
МС (ESI, m/z): 385 (M+H)+, 383 (M-H)-.
[Пример 496]
[Формула 743]

К смеси 50 мг метил-2-((1H-индол-5-ил)амино)-5-циклопропилникотината, 40 мкл 1-(бромметил)-3-(трифторметокси)бензола и 1,5 мл N,N-диметилформамида при охлаждении на льду добавляли 15 мг 60% гидрида натрия, и перемешивали полученную смесь при комнатной температуре в течение 20 минут. К смеси добавляли 100 мкл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при комнатной температуре в течение 2 часов и 40 минут. Реакционную смесь оставляли отстаиваться при комнатной температуре в течение ночи. Реакционную смесь корректировали до pH 2,5 добавлением к ней соляной кислоты. К смеси добавляли этилацетат, органический слой разделяли, и дважды экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-50/50) с получением 58 мг 5-циклопропил-2-((1-(3-(трифторметокси)бензил)-1H-индол-5-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,59-0,67 (2H, м), 0,86-0,95 (2H, м), 1,82-1,95 (1H, м), 5,47 (2H, с), 6,46 (1H, д, J=3,3 Гц), 7,13-7,22 (3H, м), 7,24 (1H, д, J=8,6 Гц), 7,38 (1H, д, J=8,6 Гц), 7,44 (1H, т, J=7,9 Гц), 7,50 (1H, д, J=2,6 Гц), 7,86 (1H, д, J=2,6 Гц), 7,99 (1H, д, J=2,0 Гц), 8,18 (1H, д, J=2,6 Гц), 10,14 (1H, с).
МС (ESI, m/z): 468 (M+H)+, 466 (M-H)-.
[Пример 497]
[Формула 744]
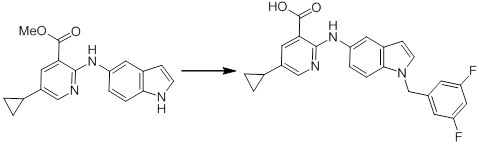
Способом, аналогичным описанному в примере 496, 5-циклопропил-2-((1-(3,5-дифторбензил)-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-2-((1H-индол-5-ил)амино)-5-циклопропилникотината и 1-(бромметил)-3,5-дифторбензола.
1H-ЯМР (ДМСО-d6) δ: 0,59-0,68 (2H, м), 0,85-0,95 (2H, м), 1,82-1,96 (1H, м), 5,44 (2H, с), 6,46 (1H, д, J=2,6 Гц), 6,82-6,92 (2H, м), 7,07-7,22 (2H, м), 7,38 (1H, д, J=8,6 Гц), 7,51 (1H, д, J=3,3 Гц), 7,86 (1H, д, J=2,0 Гц), 7,99 (1H, д, J=2,0 Гц), 8,18 (1H, д, J=2,6 Гц), 10,16 (1H, уш.с).
МС (ESI, m/z): 420 (M+H)+, 418 (M-H)-.
[Пример 498]
[Формула 745]

Способом, аналогичным описанному в примере 496, 5-циклопропил-2-((1-(3,5-диметилбензил)-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-2-((1H-индол-5-ил)амино)-5-циклопропилникотината и 1-(бромметил)-3,5-диметилбензола.
1H-ЯМР (ДМСО-d6) δ: 0,59-0,64 (2H, м), 0,87-1,00 (2H, м), 1,86-1,93 (1H, м), 2,20 (6H, с), 5,30 (2H, с), 6,42 (1H, д, J=3,3 Гц), 6,78-6,92 (3H, м), 7,16 (1H, дд, J=8,6, 2,0 Гц), 7,35 (1H, д, J=8,6 Гц), 7,44 (1H, д, J=2,6 Гц), 7,86 (1H, д, J=2,6 Гц), 7,95 (1H, д, J=2,0 Гц), 8,17 (1H, д, J=2,0 Гц), 10,10 (1H, с).
МС (ESI, m/z): 412 (M+H)+, 410 (M-H)-.
[Пример 499]
[Формула 746]

Способом, аналогичным описанному в примере 496, 2-((1-(3,5-бис(трифторметил)бензил)-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту получали из метил-2-((1H-индол-5-ил)амино)-5-циклопропилникотината и 1-(бромметил)-3,5-бис(трифторметил)бензола.
1H-ЯМР (ДМСО-d6) δ: 0,59-0,68 (2H, м), 0,85-0,95 (2H, м), 1,82-1,96 (1H, м), 5,62 (2H, с), 6,49 (1H, д, J=2,6 Гц), 7,19 (1H, дд, J=8,6, 2,0 Гц), 7,45 (1H, д, J=9,2 Гц), 7,58 (1H, д, J=2,6 Гц), 7,83-7,90 (3H, м), 7,98-8,05 (2H, м), 8,18 (1H, д, J=2,0 Гц), 10,15 (1H, уш.с).
МС (ESI, m/z): 520 (M+H)+, 518 (M-H)-.
[Пример 500]
[Формула 747]

Реакционную смесь 100 мг 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты, 286 мг 2-(трибутилстаннил)пиридина, 47 мг трис(дибензилиденацетон)-дипалладия(0), 32 мг три(о-толил)фосфина и 2,0 мл N,N-диметилформамида нагревали с обратным холодильником при внешней температуре 120°C в течение 3 часов в атмосфере азота. После охлаждения смеси до комнатной температуры, к смеси добавляли насыщенный водный раствор фторида калия, и перемешивали полученную смесь в течение 1 часа. Нерастворимое вещество отфильтровывали, и корректировали фильтрат до pH 4,0 добавлением к нему соляной кислоты. К смеси добавляли этилацетат, органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью хлороформ/метанол = 100/0-95/5). Остаток снова очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 80/20-0/100). Получали 6,3 мг 5-циклопропил-2-((1-метил-7-(пиридин-2-ил)-1H-индол-5-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,69 (2H, м), 0,85-0,95 (2H, м), 1,83-1,96 (1H, м), 3,20-3,50 (3H, м), 6,47 (1H, д, J=3,3 Гц), 7,15 (1H, д, J=2,0 Гц), 7,26 (1H, д, J=3,3 Гц), 7,38-7,48 (1H, м), 7,65 (1H, д, J=7,9 Гц), 7,85-7,96 (2H, м), 8,08 (1H, д, J=2,0 Гц), 8,19 (1H, д, J=2,0 Гц), 8,69 (1H, д, J=4,6 Гц).
МС (ESI, m/z): 385 (M+H)+, 383 (M-H)-.
[Пример 501]
[Формула 748]

Способом, аналогичным описанному в примере 463, 5-циклопропил-2-((7-(2-гидроксифенил)-1-метил-1H-индол-5-ил)амино)никотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и 2-гидроксифенилбороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,69 (2H, м), 0,84-0,95 (2H, м), 1,83-1,95 (1H, м), 3,20-3,40 (3H, м), 6,39 (1H, д, J=3,3 Гц), 6,84-6,98 (3H, м), 7,14-7,30 (3H, м), 7,87 (1H, д, J=2,6 Гц), 8,01 (1H, д, J=2,0 Гц), 8,20 (1H, д, J=2,6 Гц), 9,45 (1H, с), 10,23 (1H, уш.с).
МС (ESI, m/z): 400 (M+H)+, 398 (M-H)-.
[Пример 502]
[Формула 749]

Способом, аналогичным описанному в примере 463, 5-циклопропил-2-((7-(3-гидроксифенил)-1-метил-1H-индол-5-ил)амино)никотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и 3-гидроксифенилбороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,69 (2H, м), 0,84-0,94 (2H, м), 1,83-1,95 (1H, м), 3,30 (3H, с), 6,44 (1H, д, J=3,3 Гц), 6,78-6,89 (3H, м), 6,99 (1H, д, J=2,0 Гц), 7,20-7,29 (2H, м), 7,88 (1H, д, J=2,6 Гц), 8,01 (1H, д, J=2,0 Гц), 8,20 (1H, д, J=2,6 Гц), 9,57 (1H, с), 10,25 (1H, уш.с).
МС (ESI, m/z): 400 (M+H)+, 398 (M-H)-.
[Пример 503]
[Формула 750]

Способом, аналогичным описанному в примере 463, 5-циклопропил-2-((7-(4-гидроксифенил)-1-метил-1H-индол-5-ил)амино)никотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и 4-гидроксифенилбороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,69 (2H, м), 0,84-0,95 (2H, м), 1,82-1,95 (1H, м), 3,28 (3H, с), 6,42 (1H, д, J=3,3 Гц), 6,84 (2H, д, J=8,6 Гц), 6,93 (1H, д, J=2,0 Гц), 7,20 (1H, д, J=3,3 Гц), 7,24 (2H, д, J=8,7 Гц), 7,87 (1H, д, J=2,6 Гц), 8,00 (1H, д, J=2,0 Гц), 8,20 (1H, д, J=2,0 Гц), 9,55 (1H, с), 10,23 (1H, уш.с).
МС (ESI, m/z): 400 (M+H)+, 398 (M-H)-.
[Пример 504]
[Формула 751]

Способом, аналогичным описанному в примере 463, 2-((7-циклогекс-1-ен-1-ил)-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и пинаколинового эфира (1-циклогексен-1-ил)бороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,69 (2H, м), 0,84-0,95 (2H, м), 1,62-1,96 (5H, м), 2,14-2,36 (4H, м), 3,78 (3H, с), 5,63-5,72 (1H, м), 6,36 (1H, д, J=2,6 Гц), 6,76 (1H, д, J=2,0 Гц), 7,20 (1H, д, J=2,6 Гц), 7,87 (1H, д, J=2,6 Гц), 7,98 (1H, д, J=2,0 Гц), 8,20 (1H, д, J=2,6 Гц), 10,17 (1H, уш.с).
МС (ESI, m/z): 388 (M+H)+.
[Пример 505]
[Формула 752]

К раствору 500 мг метил-2-((1H-индол-5-ил)амино)-5-циклопропилникотината в 10 мл N,N-диметилформамида при охлаждении на льду добавляли 456 мг трет-бутоксида калия и перемешивали полученную смесь в течение 5 минут. При охлаждении на льду к смеси добавляли раствор 516 мг (3-(бромметил)фенокси)-(трет-бутил)диметилсилана в 2 мл N,N-диметилформамида, и перемешивали полученную смесь в течение 55 минут. К смеси добавляли 2 мл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при комнатной температуре в течение 5 часов и 30 минут. Реакционную смесь корректировали до pH 2,5 добавлением к ней соляной кислоты. К смеси добавляли этилацетат, органический слой разделяли, и дважды экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 70/30-20/80) с получением 220 мг 5-циклопропил-2-((1-(3-гидроксибензил)-1H-индол-5-ил)амино)никотиновой кислоты в виде бледно-коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,58-0,68 (2H, м), 0,83-0,95 (2H, м), 1,82-1,94 (1H, м), 5,31 (2H, с), 6,42 (1H, д, J=2,6 Гц), 6,50 (1H, с), 6,58-6,68 (2H, м), 7,04-7,18 (2H, м), 7,32 (1H, д, J=9,2 Гц), 7,42 (1H, д, J=2,6 Гц), 7,85 (1H, д, J=2,6 Гц), 7,94-8,02 (1H, м), 8,12-8,18 (1H, м), 9,35 (1H, с).
МС (ESI, m/z): 400 (M+H)+.
[Пример 506]
[Формула 753]

Реакционную смесь 50 мг 5-циклопропил-2-((1-(3-гидроксибензил)-1H-индол-5-ил)амино)никотиновой кислоты, 24 мкл 1-бром-2-метоксиэтана, 51 мг карбоната калия и 1,0 мл N,N-диметилформамида перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь перемешивали при внешней температуре 60°C в течение 1 часа и 30 минут. После охлаждения смеси до комнатной температуры, к ней добавляли 24 мкл 1-бром-2-метоксиэтана и 20 мг 60% гидрида натрия, и перемешивали полученную смесь в течение 30 минут. Реакционную смесь корректировали до pH 2,5 добавлением к ней соляной кислоты. К смеси добавляли этилацетат, органический слой разделяли, и дважды экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-20/80). Полученное твердое вещество очищали методом препаративной тонкослойной хроматографии (этилацетат) с получением 18,8 мг 5-циклопропил-2-((1-(3-(2-метоксиэтокси)бензил)-1H-индол-5-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,58-0,68 (2H, м), 0,80-0,95 (2H, м), 1,82-1,95 (1H, м), 3,27 (3H, с), 3,56-3,65 (2H, м), 3,96-4,04 (2H, м), 5,35 (2H, с), 6,43 (1H, д, J=2,6 Гц), 6,70-6,85 (3H, м), 7,12-7,25 (2H, м), 7,36 (1H, д, J=9,2 Гц), 7,47 (1H, д, J=2,6 Гц), 7,86 (1H, д, J=2,6 Гц), 7,97 (1H, д, J=1,3 Гц), 8,17 (1H, д, J=2,6 Гц), 10,14 (1H, уш.с).
МС (ESI, m/z): 458 (M+H)+, 456 (M-H)-.
[Пример 507]
[Формула 754]
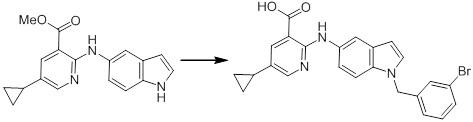
Способом, аналогичным описанному в примере 496, 2-((1-(3-бромбензил)-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту получали из метил-2-((1H-индол-5-ил)амино)-5-циклопропилникотината и 1-(бромметил)-3-бромбензола.
МС (ESI, m/z): 464 (M+H)+.
[Пример 508]
[Формула 755]

Смесь 42 мг 2-((1-(3-бромбензил)-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты, 23 мкл пинаколинового эфира транс-3-метокси-1-пропенилбороновой кислоты, 39 мг ортофосфата калия, 6,4 мг бис(ди-трет-бутил(4-диметиламинофенил)фосфин)-дихлорпалладия(II), 1,5 мл диоксана и 0,4 мл воды нагревали с обратным холодильником в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры, а затем корректировали до pH 2,5 добавлением к ней соляной кислоты. К смеси добавляли этилацетат, органический слой разделяли, и дважды экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-30/70) с получением 25,5 мг (E)-5-циклопропил-2-((1-(3-(3-метоксипроп-1-ен-1-ил)бензил)-1H-индол-5-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,58-0,68 (2H, м), 0,85-0,94 (2H, м), 1,80-1,95 (1H, м), 3,26 (3H, с), 3,98-4,04 (2H, м), 5,38 (2H, с), 6,22-6,35 (1H, м), 6,43 (1H, д, J=2,6 Гц), 6,54 (1H, д, J=15,9 Гц), 7,05 (1H, д, J=7,3 Гц), 7,16 (1H, дд, J=8,6, 2,0 Гц), 7,26 (1H, т, J=7,9 Гц), 7,30-7,42 (3H, м), 7,49 (1H, д, J=3,3 Гц), 7,86 (1H, д, J=2,6 Гц), 7,90-8,00 (1H, м), 8,17 (1H, д, J=2,6 Гц), 10,12 (1H, уш.с).
МС (ESI, m/z): 454 (M+H)+, 452 (M-H)-.
[Пример 509]
[Формула 756]

Раствор 23 мг (E)-5-циклопропил-2-((1-(3-(3-метоксипроп-1-ен-1-ил)бензил)-1H-индол-5-ил)амино)никотиновой кислоты в 5 мл метанола и 1 мл тетрагидрофурана подвергали реакции гидрогенизации (комнатная температура, 1 бар, скорость потока: 2 мл/мин, 10% Pd/C) с использованием реактора для гидрогенизации проточного типа. Растворитель отгоняли в условиях пониженного давления, а затем очищали полученный остаток методом препаративной тонкослойной хроматографии (этилацетат) с получением 1,1 мг 5-циклопропил-2-((1-(3-(3-метоксипропил)бензил)-1H-индол-5-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 0,58-0,65 (2H, м), 0,87-0,94 (2H, м), 1,76-1,88 (3H, м), 2,62 (2H, т, J=7,8 Гц), 3,30 (3H, с), 3,33 (2H, т, J=6,5 Гц), 5,25 (2H, с), 6,46-6,51 (1H, м), 6,89-6,98 (2H, м), 7,05-7,10 (2H, м), 7,16-7,32 (3H, м), 7,82-7,89 (1H, м), 7,92-7,99 (1H, м), 8,08-8,18 (1H, м).
МС (ESI, m/z): 456 (M+H)+, 454 (M-H)-.
[Пример 510]
[Формула 757]
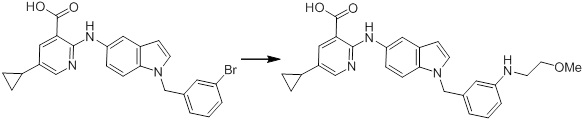
Смесь 50 мг 2-((1-(3-бромбензил)-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты, 188 мкл 2-метоксиэтиламина, 9,9 мг трис(дибензилиденацетон)дипалладия(0), 11,6 мг 2-(дициклогексилфосфино)-3,6-диметокси-2',4',6'-триизопропил-1,1'-бифенила, 106 мг трет-бутоксида натрия и 4 мл диоксана перемешивали при 160°C в течение 1 часа с использованием микроволновой установки. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Реакционную смесь корректировали до pH 4,0 добавлением к ней соляной кислоты. К смеси добавляли этилацетат, органический слой разделяли, дважды экстрагировали водный слой этилацетатом, и дополнительно дважды экстрагировали тетрагидрофураном. Органический слой и экстракт объединяли, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование: смесь гексан/этилацетат = 70/30-0/100 → смесь этилацетат/метанол = 95/5) с получением 7,5 мг 5-циклопропил-2-((1-(3-((2-метоксиэтил)амино)бензил)-1H-индол-5-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,55-0,62 (2H, м), 0,83-0,91 (2H, м), 1,80-1,90 (1H, м), 3,06-3,15 (2H, м), 3,23 (3H, с), 3,41 (2H, т, J=5,9 Гц), 5,11-5,25 (2H, м), 5,56 (1H, уш.с), 6,32-6,47 (4H, м), 6,94-7,00 (1H, м), 7,13 (1H, дд, J=8,5, 2,0 Гц), 7,30 (1H, д, J=8,8 Гц), 7,37 (1H, д, J=3,2 Гц), 7,84 (1H, д, J=2,4 Гц), 8,02-8,08 (2H, м).
МС (ESI, m/z): 457 (M+H)+.
[Пример 511]
[Формула 758]

Смесь 50 мг 2-((1-(3-бромбензил)-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты, 235 мкл (2-метоксиэтил)метиламина, 9,9 мг трис(дибензилиденацетон)-дипалладия(0), 11,6 мг 2-(дициклогексилфосфино)-3,6-диметокси-2',4',6'-триизопропил-1,1'-бифенила, 106 мг трет-бутоксида натрия и 4 мл диоксана перемешивали при 160°C в течение 1 часа с использованием микроволновой установки. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Реакционную смесь корректировали до pH 4,0 добавлением к ней соляной кислоты. К смеси добавляли этилацетат, органический слой разделяли, и дважды экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью хлороформ/метанол = 100/0-95/5) с получением 26,5 мг 5-циклопропил-2-((1-(3-((2-метоксиэтил)(метил)амино)бензил)-1H-индол-5-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 0,60-0,67 (2H, м), 0,89-0,96 (2H, м), 1,76-1,85 (1H, м), 2,90 (3H, с), 3,30 (3H, с), 3,39-3,49 (4H, м), 5,18 (2H, с), 6,38-6,45 (2H, м), 6,48 (1H, д, J=2,9 Гц), 6,57-6,64 (1H, м), 7,05-7,15 (2H, м), 7,19-7,30 (2H, м), 7,85 (1H, с), 7,94-8,00 (1H, м), 8,09 (1H, с), 10,04 (1H, уш.с).
МС (ESI, m/z): 471 (M+H)+, 469 (M-H)-.
[Пример 512]
[Формула 759]
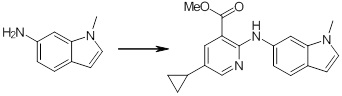
Способом, аналогичным описанному в примере 221, метил-5-циклопропил-2-((1-метил-1H-индол-6-ил)амино)никотинат получали из 1-метил-1H-индол-6-амина и метил-2-хлор-5-циклопропилникотината.
МС (ESI, m/z): 322 (M+H)+.
[Пример 513]
[Формула 760]

Способом, аналогичным описанному в примере 222, 5-циклопропил-2-((1-метил-1H-индол-6-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((1-метил-1H-индол-6-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,63-0,71 (2H, м), 0,88-0,97 (2H, м), 1,86-1,99 (1H, м), 3,75 (3H, с), 6,35 (1H, д, J=2,6 Гц), 7,13 (1H, дд, J=8,3, 1,7 Гц), 7,22 (1H, д, J=3,3 Гц), 7,45 (1H, д, J=8,6 Гц), 7,90 (1H, д, J=2,6 Гц), 7,96 (1H, с), 8,24 (1H, д, J=2,6 Гц), 10,32 (1H, с).
МС (ESI, m/z): 308 (M+H)+.
[Пример 514]
[Формула 761]

Способом, аналогичным описанному в примере 221, метил-5-циклопропил-2-((1-этил-1H-индол-6-ил)амино)никотинат получали из 1-этил-1H-индол-6-амина и метил-2-хлор-5-циклопропилникотината.
МС (ESI, m/z): 336 (M+H)+.
[Пример 515]
[Формула 762]

Способом, аналогичным описанному в примере 222, 5-циклопропил-2-((1-этил-1H-индол-6-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((1-этил-1H-индол-6-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,63-0,70 (2H, м), 0,88-0,96 (2H, м), 1,37 (3H, т, J=7,3 Гц), 1,86-1,98 (1H, м), 4,15 (2H, кв., J=7,3 Гц), 6,36 (1H, д, J=2,6 Гц), 7,13 (1H, дд, J=8,3, 1,7 Гц), 7,28 (1H, д, J=3,3 Гц), 7,44 (1H, д, J=8,6 Гц), 7,89 (1H, д, J=2,6 Гц), 7,97 (1H, с), 8,23 (1H, д, J=2,0 Гц), 10,28 (1H, с).
МС (ESI, m/z): 322 (M+H)+.
[Пример 516]
[Формула 763]

Способом, аналогичным описанному в примере 221, метил-5-циклопропил-2-((1-пропил-1H-индол-6-ил)амино)никотинат получали из 1-пропил-1H-индол-6-амина и метил-2-хлор-5-циклопропилникотината.
МС (ESI, m/z): 350 (M+H)+.
[Пример 517]
[Формула 764]

Способом, аналогичным описанному в примере 222, 5-циклопропил-2-((1-пропил-1H-индол-6-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((1-пропил-1H-индол-6-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,70 (2H, м), 0,82-0,96 (5H, м), 1,72-1,98 (3H, м), 4,08 (2H, т, 6,9 Гц), 6,35 (1H, д, J=2,6 Гц), 7,13 (1H, дд, J=8,6, 2,0 Гц), 7,27 (1H, д, J=3,3 Гц), 7,44 (1H, д, J=8,6 Гц), 7,89 (1H, д, J=2,6 Гц), 7,96 (1H, с), 8,22 (1H, д, J=2,6 Гц), 10,28 (1H, с).
МС (ESI, m/z): 336 (M+H)+.
[Пример 518]
[Формула 765]

Способом, аналогичным описанному в примере 221, метил-5-циклопропил-2-((1-изопропил-1H-индол-6-ил)амино)никотинат получали из 1-изопропил-1H-индол-6-амина и метил-2-хлор-5-циклопропилникотината.
МС (ESI, m/z): 350 (M+H)+.
[Пример 519]
[Формула 766]

Способом, аналогичным описанному в примере 222, 5-циклопропил-2-((1-изопропил-1H-индол-6-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((1-изопропил-1H-индол-6-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,70 (2H, м), 0,87-0,96 (2H, м), 1,46 (6H, д, J=6,6 Гц), 1,86-1,97 (1H, м), 4,59-4,74 (1H, м), 6,38 (1H, д, J=2,6 Гц), 7,11 (1H, дд, J=8,6, 2,0 Гц), 7,38 (1H, д, J=3,3 Гц), 7,44 (1H, д, J=8,6 Гц), 7,89 (1H, д, J=2,6 Гц), 8,02 (1H, с), 8,23 (1H, д, J=2,6 Гц), 10,32 (1H, с).
МС (ESI, m/z): 336 (M+H)+.
[Пример 520]
[Формула 767]

Способом, аналогичным описанному в примере 221, метил-5-циклопропил-2-((1-изобутил-1H-индол-6-ил)амино)никотинат получали из 1-изобутил-1H-индол-6-амина и метил-2-хлор-5-циклопропилникотината.
МС (ESI, m/z): 364 (M+H)+.
[Пример 521]
[Формула 768]

Способом, аналогичным описанному в примере 222, 5-циклопропил-2-((1-изобутил-1H-индол-6-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((1-изобутил-1H-индол-6-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,70 (2H, м), 0,85-0,95 (8H, м), 1,86-1,97 (1H, м), 2,06-2,22 (1H, м), 3,92 (2H, д, J=6,6 Гц), 6,35 (1H, д, J=2,6 Гц), 7,13 (1H, дд, J=8,6, 2,0 Гц), 7,24 (1H, д, J=3,3 Гц), 7,44 (1H, д, J=8,6 Гц), 7,88 (1H, д, J=2,6 Гц), 7,95 (1H, с), 8,21 (1H, д, J=2,6 Гц), 10,32 (1H, с).
МС (ESI, m/z): 350 (M+H)+.
[Пример 522]
[Формула 769]

Способом, аналогичным описанному в примере 221, метил-2-((1-(циклогексилметил)-1H-индол-6-ил)амино)-5-циклопропилникотинат получали из 1-(циклогексилметил)-1H-индол-6-амина и метил-2-хлор-5-циклопропилникотината.
МС (ESI, m/z): 404 (M+H)+.
[Пример 523]
[Формула 770]

Способом, аналогичным описанному в примере 222, 2-((1-(циклогексилметил)-1H-индол-6-ил)амино)-5-циклопропилникотиновую кислоту получали из метил-2-((1-(циклогексилметил)-1H-индол-6-ил)амино)-5-циклопропилникотината.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,69 (2H, м), 0,83-1,26 (7H, м), 1,48-1,98 (7H, м), 3,95 (2H, д, J=7,3 Гц), 6,34 (1H, д, J=3,3 Гц), 7,14 (1H, дд, J=8,6, 2,0 Гц), 7,22 (1H, д, J=2,6 Гц), 7,43 (1H, д, J=7,9 Гц), 7,87 (1H, д, J=2,6 Гц), 7,91 (1H, с), 8,21 (1H, д, J=2,6 Гц), 10,28 (1H, с).
МС (ESI, m/z): 390 (M+H)+.
[Пример 524]
[Формула 771]

Способом, аналогичным описанному в примере 221, метил-5-циклопропил-2-((1-фенил-1H-индол-6-ил)амино)никотинат получали из 1-фенил-1H-индол-6-амина и метил-2-хлор-5-циклопропилникотината.
МС (ESI, m/z): 384 (M+H)+.
[Пример 525]
[Формула 772]
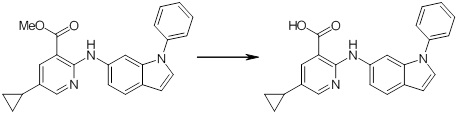
Способом, аналогичным описанному в примере 222, 5-циклопропил-2-((1-фенил-1H-индол-6-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((1-фенил-1H-индол-6-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,69 (2H, м), 0,85-0,95 (2H, м), 1,84-1,97 (1H, м), 6,64 (1H, д, J=2,6 Гц), 7,17 (1H, дд, J=8,6, 1,3 Гц), 7,35-7,46 (1H, м), 7,53-7,65 (6H, м), 7,88 (1H, д, J=2,6 Гц), 8,17 (1H, д, J=2,6 Гц), 8,30 (1H, с), 10,36 (1H, с).
МС (ESI, m/z): 370 (M+H)+.
[Пример 526]
[Формула 773]
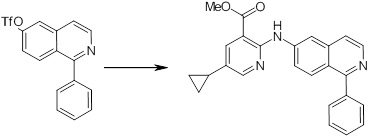
Смесь 129 мг 1-фенилизохинолин-6-илтрифторметансульфоната, 70 мг метил-2-амино-5-циклопропилникотината, 8 мг трис(дибензилиденацетон)дипалладия(0), 14 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 214 мг карбоната цезия и 4 мл толуола перемешивали при 195°C в течение 1 часа с использованием микроволновой установки. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 70/30-30/70) с получением 94 мг метил-5-циклопропил-2-((1-фенилизохинолин-6-ил)амино)никотината в виде коричневого масла.
МС (ESI, m/z): 396 (M+H)+.
[Пример 527]
[Формула 774]

К смешанному раствору 94 мг метил-5-циклопропил-2-((1-фенилизохинолин-6-ил)амино)никотината в 2 мл метанола и 4 мл тетрагидрофурана добавляли 1 мл 1 M водного раствора гидроксида натрия и нагревали полученную смесь с обратным холодильником в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры, растворитель отгоняли в условиях пониженного давления. Реакционную смесь корректировали до pH 3,0-3,5 добавлением к ней метанола, воды и 1 M соляной кислоты. Органический слой разделяли, и трижды экстрагировали водный слой хлороформом. Органический слой и экстракт объединяли и сушили над безводным сульфатом магния, и отгоняли растворитель в условиях пониженного давления. К остатку добавляли этилацетат и гексан, твердое вещество собирали путем фильтрования и промывали водой с получением 13 мг 5-циклопропил-2-((1-фенилизохинолин-6-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,69-0,77 (2H, м), 0,93-1,02 (2H, м), 1,94-2,06 (1H, м), 7,50-7,73 (7H, м), 7,93 (1H, д, J=9,2 Гц), 7,98 (1H, д, J=2,6 Гц), 8,39 (1H, д, J=2,6 Гц), 8,46 (1H, д, J=5,3 Гц), 8,68 (1H, д, J=2,0 Гц), 10,87 (1H, с).
МС (ESI, m/z): 382 (M+H)+.
[Пример 528]
[Формула 775]

Способом, аналогичным описанному в примере 526, метил-5-циклопропил-2-((4-фенилхиназолин-7-ил)амино)никотинат получали из 4-фенилхиназолин-7-илтрифторметансульфоната и метил-2-амино-5-циклопропилникотината.
МС (ESI, m/z): 397 (M+H)+.
[Пример 529]
[Формула 776]

Способом, аналогичным описанному в примере 527, 5-циклопропил-2-((4-фенилхиназолин-7-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((4-фенилхиназолин-7-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,71-0,79 (2H, м), 0,94-1,04 (2H, м), 1,96-2,08 (1H, м), 7,58-7,69 (4H, м), 7,74-7,82 (2H, м), 7,94-8,02 (2H, м), 8,45 (1H, д, J=2,0 Гц), 8,89 (1H, д, J=2,6 Гц), 9,18 (1H, с), 10,93 (1H, с).
МС (ESI, m/z): 383 (M+H)+.
[Пример 530]
[Формула 777]

Способом, аналогичным описанному в примере 526, метил-5-циклопропил-2-((4-фенилхиназолин-8-ил)амино)никотинат получали из 4-фенилхиназолин-8-илтрифторметансульфоната и метил-2-амино-5-циклопропилникотината.
МС (ESI, m/z): 397 (M+H)+.
[Пример 531]
[Формула 778]

Способом, аналогичным описанному в примере 527, 5-циклопропил-2-((4-фенилхиназолин-8-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((4-фенилхиназолин-8-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,70-0,78 (2H, м), 0,94-1,03 (2H, м), 1,94-2,07 (1H, м), 7,54-7,73 (5H, м), 7,77-7,86 (2H, м), 8,02 (1H, д, J=2,6 Гц), 8,41 (1H, д, J=2,6 Гц), 9,27-9,34 (1H, м), 9,39 (1H, с), 12,19 (1H, с).
МС (ESI, m/z): 383 (M+H)+.
[Пример 532]
[Формула 779]

Способом, аналогичным описанному в примере 526, метил-5-циклопропил-2-((4-фенилхиназолин-6-ил)амино)никотинат получали из 4-фенилхиназолин-6-илтрифторметансульфоната и метил-2-амино-5-циклопропилникотината.
МС (ESI, m/z): 397 (M+H)+.
[Пример 533]
[Формула 780]

Способом, аналогичным описанному в примере 527, 5-циклопропил-2-((4-фенилхиназолин-6-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((4-фенилхиназолин-6-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,64-0,72 (2H, м), 0,91-1,01 (2H, м), 1,92-2,04 (1H, м), 7,62-7,73 (3H, м), 7,86-7,94 (3H, м), 7,98-8,09 (2H, м), 8,20 (1H, д, J=2,6 Гц), 8,97 (1H, д, J=2,0 Гц), 9,20 (1H, с), 10,82 (1H, с).
МС (ESI, m/z): 383 (M+H)+.
[Пример 534]
[Формула 781]

Способом, аналогичным описанному в примере 221, метил-5-циклопропил-2-((1-изобутил-3-метил-1H-индол-5-ил)амино)никотинат получали из 1-изобутил-3-метил-1H-индол-5-амина и метил-2-хлор-5-циклопропилникотината.
МС (ESI, m/z): 378 (M+H)+.
[Пример 535]
[Формула 782]

Способом, аналогичным описанному в примере 222, 5-циклопропил-2-((1-изобутил-3-метил-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((1-изобутил-3-метил-1H-индол-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,69 (2H, м), 0,80-0,95 (8H, м), 1,85-1,96 (1H, м), 2,00-2,16 (1H, м), 2,23 (3H, с), 3,88 (2H, д, J=7,3 Гц), 7,08 (1H, с), 7,22 (1H, дд, J=8,6, 2,0 Гц), 7,35 (1H, д, J=8,6 Гц), 7,75 (1H, д, J=2,0 Гц), 7,89 (1H, д, J=2,0 Гц), 8,15 (1H, д, J=2,6 Гц), 10,11 (1H, с).
МС (ESI, m/z): 364 (M+H)+.
[Пример 536]
[Формула 783]

Способом, аналогичным описанному в справочном примере 82, трет-бутил-2-((1-(циклопентилметил)-1H-индол-4-ил)амино)-5-циклопропилникотинат получали из трет-бутил-5-циклопропил-2-(1H-индол-4-иламино)никотината и (йодметил)циклопентана.
МС (ESI, m/z): 432 (M+H)+.
[Пример 537]
[Формула 784]
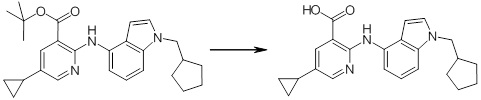
Способом, аналогичным описанному в примере 222, 2-((1-(циклопентилметил)-1H-индол-4-ил)амино)-5-циклопропилникотиновую кислоту получали из трет-бутил-2-((1-(циклопентилметил)-1H-индол-4-ил)амино)-5-циклопропилникотината.
1H-ЯМР (ДМСО-d6) δ: 0,64-0,72 (2H, м), 0,89-0,98 (2H, м), 1,15-1,35 (2H, м), 1,40-1,74 (6H, м), 1,88-2,00 (1H, м), 2,32-2,45 (1H, м), 4,07 (2H, д, J=7,9 Гц), 6,48 (1H, д, J=2,6 Гц), 7,03-7,16 (2H, м), 7,37 (1H, д, J=3,3 Гц), 7,93 (1H, д, J=2,6 Гц), 8,18 (1H, дд, J=7,3, 1,3 Гц), 8,29 (1H, д, J=2,6 Гц), 10,93 (1H, с).
МС (ESI, m/z): 376 (M+H)+.
[Пример 538]
[Формула 785]

Способом, аналогичным описанному в примере 221, метил-5-циклопропил-2-((2-оксо-1-фенил-1,2-дигидрохинолин-5-ил)амино)бензоат получали из 5-амино-1-фенилхинолин-2(1H)-она и метил-2-бром-5-циклопропилбензоата.
МС (ESI, m/z): 411 (M+H)+.
[Пример 539]
[Формула 786]

Способом, аналогичным описанному в примере 222, 5-циклопропил-2-((2-оксо-1-фенил-1,2-дигидрохинолин-5-ил)амино)бензойную кислоту получали из метил-5-циклопропил-2-((2-оксо-1-фенил-1,2-дигидрохинолин-5-ил)амино)бензоата.
1H-ЯМР (ДМСО-d6) δ: 0,55-0,64 (2H, м), 0,86-0,94 (2H, м), 1,84-1,96 (1H, м), 6,23 (1H, д, J=8,6 Гц), 6,69 (1H, д, J=9,9 Гц), 6,95 (1H, д, J=8,6 Гц), 7,10-7,19 (2H, м), 7,30-7,41 (3H, м), 7,51-7,71 (4H, м), 8,06 (1H, д, J=9,9 Гц), 9,79 (1H, с).
МС (ESI, m/z): 397 (M+H)+.
[Пример 540]
[Формула 787]
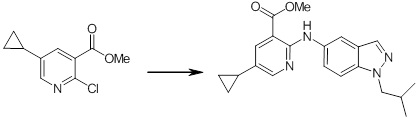
Смесь 80 мг метил-2-хлор-5-циклопропилникотината, 75 мг 1-изобутил-1H-индазол-5-амина, 17 мг трис(дибензилиденацетон)-дипалладия(0), 22 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 246 мг карбоната цезия и 3 мл бутилацетата перемешивали при 130°C в течение 3 часов и 45 минут в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-60/40) с получением 128 мг метил-5-циклопропил-2-((1-изобутил-1H-индазол-5-ил)амино)никотината в виде желтого масла.
1H-ЯМР (ДМСО-d6) δ: 0,63-0,69 (2H, м), 0,85 (6H, д, J=6,6 Гц), 0,89-0,96 (2H, м), 1,88-1,98 (1H, м), 2,22 (1H, септ., J=6,6 Гц), 3,90 (3H, с), 4,19 (2H, д, J=6,9 Гц), 7,41 (1H, дд, J=8,6, 2,0 Гц), 7,62 (1H, д, J=9,2 Гц), 7,91 (1H, д, J=2,6 Гц), 7,99 (1H, с), 8,21 (1H, д, J=2,0 Гц), 8,26 (1H, д, J=2,6 Гц), 9,92 (1H, с).
МС (ESI, m/z): 365 (M+H)+.
[Пример 541]
[Формула 788]

К раствору 128 мг метил-5-циклопропил-2-((1-изобутил-1H-индазол-5-ил)амино)никотината в 3 мл тетрагидрофурана и 1,5 мл метанола добавляли 100 мкл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь в течение 14 часов и 50 минут, а затем при 50°C в течение 1 часа и 40 минут. К реакционной смеси добавляли 100 мкл 5 M соляной кислоты, и отгоняли растворитель в условиях пониженного давления, к смеси добавляли смесь воды и метанола, и собирали твердое вещество путем фильтрования с получением 96 мг 5-циклопропил-2-((1-изобутил-1H-индазол-5-ил)амино)никотиновой кислоты в виде светло-оранжевого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,63-0,69 (2H, м), 0,85 (6H, д, J=6,6 Гц), 0,88-0,96 (2H, м), 1,86-1,97 (1H, м), 2,22 (1H, септ., J=7,2 Гц), 4,19 (2H, д, J=7,3 Гц), 7,40 (1H, дд, J=8,6, 2,0 Гц), 7,61 (1H, д, J=9,2 Гц), 7,90 (1H, д, J=2,6 Гц), 7,98 (1H, с), 8,21-8,26 (2H, м), 10,28 (1H, с), 13,53 (1H, уш.с).
МС (ESI, m/z): 351 (M+H)+, 349 (M-H)-.
[Пример 542]
[Формула 789]
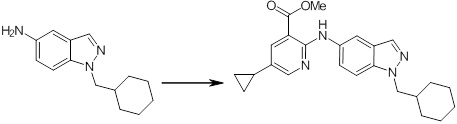
Способом, аналогичным описанному в примере 540, метил-2-((1-(циклогексилметил)-1H-индазол-5-ил)амино)-5-циклопропилникотинат получали из 1-(циклогексилметил)-1H-индазол-5-амина и метил-2-хлор-5-циклопропилникотината.
1H-ЯМР (ДМСО-d6) δ: 0,63-0,70 (2H, м), 0,88-0,96 (2H, м), 0,96-1,19 (5H, м), 1,43-1,52 (2H, м), 1,55-1,70 (3H, м), 1,84-1,98 (2H, м), 3,90 (3H, с), 4,22 (2H, д, J=7,3 Гц), 7,40 (1H, дд, J=8,6, 2,0 Гц), 7,61 (1H, д, J=9,2 Гц), 7,91 (1H, д, J=2,0 Гц), 7,98 (1H, с), 8,20 (1H, д, J=1,3 Гц), 8,25 (1H, д, J=2,6 Гц), 9,92 (1H, с).
МС (ESI, m/z): 405 (M+H)+.
[Пример 543]
[Формула 790]

Способом, аналогичным описанному в примере 541, 2-((1-(циклогексилметил)-1H-индазол-5-ил)амино)-5-циклопропилникотиновую кислоту получали из метил-2-((1-(циклогексилметил)-1H-индазол-5-ил)амино)-5-циклопропилникотината.
1H-ЯМР (ДМСО-d6) δ: 0,63-0,70 (2H, м), 0,88-0,96 (2H, м), 0,96-1,19 (5H, м), 1,43-1,53 (2H, м), 1,53-1,69 (3H, м), 1,83-1,99 (2H, м), 4,22 (2H, д, J=7,3 Гц), 7,39 (1H, дд, J=8,9, 1,7 Гц), 7,61 (1H, д, J=8,6 Гц), 7,90 (1H, д, J=2,6 Гц), 7,97 (1H, с), 8,20-8,24 (2H, м), 10,24 (1H, с), 13,51 (1H, уш.с).
МС (ESI, m/z): 391 (M+H)+, 389 (M-H)-.
[Пример 544]
[Формула 791]
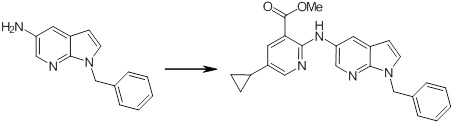
Способом, аналогичным описанному в примере 540, метил-2-((1-бензил-1H-пирроло(2,3-b)пиридин-5-ил)амино)-5-циклопропилникотинат получали из 1-бензил-1H-пирроло(2,3-b)пиридин-5-амина и метил-2-хлор-5-циклопропилникотината.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,68 (2H, м), 0,87-0,95 (2H, м), 1,86-1,96 (1H, м), 3,90 (3H, с), 5,47 (2H, с), 6,48 (1H, д, J=3,3 Гц), 7,21-7,34 (5H, м), 7,61 (1H, д, J=4,0 Гц), 7,89 (1H, д, J=2,6 Гц), 8,19 (1H, д, J=2,6 Гц), 8,29-8,32 (2H, м), 9,76 (1H, с).
МС (ESI, m/z): 399 (M+H)+.
[Пример 545]
[Формула 792]
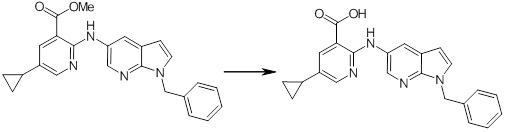
Смесь 73 мг метил-2-((1-бензил-1H-пирроло(2,3-b)пиридин-5-ил)амино)-5-циклопропилникотината, 100 мкл 5 M водного раствора гидроксида натрия, 3 мл тетрагидрофурана и 1 мл метанола перемешивали при 50°C в течение 3 часов и 30 минут. После охлаждения реакционной смеси, к ней добавляли 100 мкл 5 M соляной кислоты, и отгоняли растворитель в условиях пониженного давления. Затем к смеси добавляли смесь вода/метанол, и собирали твердое вещество путем фильтрования с получением 58 мг 2-((1-бензил-1H-пирроло(2,3-b)пиридин-5-ил)амино)-5-циклопропилникотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,68 (2H, м), 0,87-0,95 (2H, м), 1,86-1,96 (1H, м), 5,47 (2H, с), 6,48 (1H, д, J=3,3 Гц), 7,21-7,34 (5H,м), 7,61 (1H, д, J=4,0 Гц), 7,90 (1H, д, J=2,0 Гц), 8,16 (1H, д, J=2,0 Гц), 8,29-8,34 (2H, м), 10,08 (1H, с).
МС (ESI, m/z): 385 (M+H)+, 383 (M-H)-.
[Пример 546]
[Формула 793]

Способом, аналогичным описанному в примере 540, метил-5-циклопропил-2-((1-изобутил-1H-пирроло(2,3-b)пиридин-5-ил)амино)никотинат получали из 1-изобутил-1H-пирроло(2,3-b)пиридин-5-амина и метил-2-хлор-5-циклопропилникотината.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,68 (2H, м), 0,85 (6H, д, J=6,6 Гц), 0,88-0,95 (2H, м), 1,86-1,97 (1H, м), 2,21 (1H, септ., J=6,6 Гц), 3,90 (3H, с), 4,05 (2H, д, J=7,3 Гц), 6,42 (1H, д, J=3,3 Гц), 7,51 (1H, д, J=3,3 Гц), 7,90 (1H, д, J=2,6 Гц), 8,20 (1H, д, J=2,0 Гц), 8,25-8,30 (2H, м), 9,75 (1H, с).
МС (ESI, m/z): 365 (M+H)+.
[Пример 547]
[Формула 794]

Способом, аналогичным описанному в примере 545, 5-циклопропил-2-((1-изобутил-1H-пирроло(2,3-b)пиридин-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((1-изобутил-1H-пирроло(2,3-b)пиридин-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,68 (2H, м), 0,85 (6H, д, J=6,6 Гц), 0,87-0,95 (2H, м), 1,86-1,95 (1H, м), 2,21 (1H, септ., J=6,6 Гц), 4,04 (2H, д, J=7,3 Гц), 6,42 (1H, д, J=4,0 Гц), 7,51 (1H, д, J=3,3 Гц), 7,89 (1H, д, J=2,6 Гц), 8,17 (1H, д, J=2,6 Гц), 8,27 (1H, д, J=2,3 Гц), 8,30 (1H, д, J=2,3 Гц), 10,04 (1H, с).
МС (ESI, m/z): 351 (M+H)+, 349 (M-H)-.
[Пример 548]
[Формула 795]

Способом, аналогичным описанному в примере 540, метил-2-((1-циклогексилметил)-1H-пирроло(2,3-b)пиридин-5-ил)амино)-5-циклопропилникотинат получали из 1-(циклогексилметил)-1H-пирроло(2,3-b)пиридин-5-амина и метил-2-хлор-5-циклопропилникотината.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,68 (2H, м), 0,87-1,07 (4H, м), 1,07-1,19 (3H, м), 1,44-1,54 (2H, м), 1,54-1,70 (3H, м), 1,85-1,95 (2H, м), 3,90 (3H, с), 4,07 (2H, д, J=7,3 Гц), 6,41 (1H, д, J=4,0 Гц), 7,49 (1H, д, J=3,3 Гц), 7,90 (1H, д, J=2,0 Гц), 8,19 (1H, д, J=2,6 Гц), 8,27 (2H, с), 9,74 (1H, с).
МС (ESI, m/z): 405 (M+H)+.
[Пример 549]
[Формула 796]
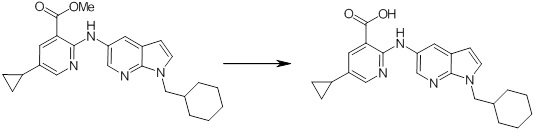
Способом, аналогичным описанному в примере 545, 2-((1-циклогексилметил)-1H-пирроло(2,3-b)пиридин-5-ил)амино)-5-циклопропилникотиновую кислоту получали из метил-2-((1-циклогексилметил)-1H-пирроло(2,3-b)пиридин-5-ил)амино)-5-циклопропилникотината.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,68 (2H, м), 0,83-1,19 (7H, м), 1,44-1,55 (2H, м), 1,56-1,71 (3H, м), 1,83-1,96 (2H, м), 4,07 (2H, д, J=7,3 Гц), 6,40 (1H, д, J=4,0 Гц), 7,48 (1H, д, J=3,3 Гц), 7,88 (1H, д, J=2,6 Гц), 8,16 (1H, д, J=2,6 Гц), 8,27 (1H, д, J=2,0 Гц), 8,30 (1H, д, J=2,0 Гц), 10,13 (1H, с).
МС (ESI, m/z): 391 (M+H)+, 389 (M-H)-.
[Пример 550]
[Формула 797]

К раствору 40 мг метил-5-циклопропил-2-((2-метил-1H-индол-5-ил)амино)никотината в 1 мл N,N-диметилацетамида при охлаждении на льду добавляли 21 мг трет-бутоксида калия и 20 мкл 1-бром-2-метилпропана, и перемешивали полученную смесь при комнатной температуре в течение 1 часа и 5 минут. При охлаждении на льду к смеси добавляли 21 мг трет-бутоксида калия и 20 мкл 1-бром-2-метилпропана, и перемешивали полученную смесь при комнатной температуре в течение 2 часов и 25 минут. При охлаждении на льду к смеси добавляли 21 мг трет-бутоксида калия и 40 мкл 1-бром-2-метилпропана, и перемешивали полученную смесь при комнатной температуре в течение 1 часа и 45 минут. При охлаждении на льду к смеси добавляли 21 мг трет-бутоксида калия и 20 мкл 1-бром-2-метилпропана, и перемешивали полученную смесь при комнатной температуре в течение 1 часа и 50 минут. К реакционной смеси добавляли этилацетат, 175 мкл 5 M соляной кислоты и воду, органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-50/50), к полученному таким образом остатку добавляли смесь воды и метанола, и собирали твердое вещество путем фильтрования с получением 10 мг 5-циклопропил-2-((1-изобутил-2-метил-1H-индол-5-ил)амино)никотиновой кислоты в виде светло-желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,67 (2H, м), 0,83-0,94 (8H, м), 1,84-1,95 (1H, м), 2,11 (1H, септ., J=6,6 Гц), 2,38 (3H, с), 3,89 (2H, д, J=7,9 Гц), 6,15 (1H, с), 7,11 (1H, дд, J=8,6, 2,0 Гц), 7,29 (1H, д, J=8,6 Гц), 7,80 (1H, д, J=1,3 Гц), 7,86 (1H, д, J=2,0 Гц), 8,17 (1H, д, J=2,0 Гц), 10,12 (1H, с).
МС (ESI, m/z): 364 (M+H)+, 362 (M-H)-.
[Пример 551]
[Формула 798]

Способом, аналогичным описанному в примере 540, метил-2-((1-бензил-6-фтор-1H-индол-5-ил)амино)-5-циклопропилникотинат получали из 1-бензил-6-фтор-1H-индол-5-амина и метил-2-хлор-5-циклопропилникотината.
1H-ЯМР (ДМСО-d6) δ: 0,63-0,69 (2H, м), 0,88-0,96 (2H, м), 1,87-1,97 (1H, м), 3,89 (3H, с), 5,38 (2H, с), 6,48 (1H, д, J=2,6 Гц), 7,20-7,37 (5H, м), 7,44 (1H, д, J=11,9 Гц), 7,48 (1H, д, J=3,3 Гц), 7,91 (1H, д, J=2,6 Гц), 8,26 (1H, д, J=2,6 Гц), 8,43 (1H, д, J=7,9 Гц), 9,95 (1H, д, J=2,6 Гц).
МС (ESI, m/z): 416 (M+H)+.
[Пример 552]
[Формула 799]

Способом, аналогичным описанному в примере 545, 2-((1-бензил-6-фтор-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту получали из метил-2-((1-бензил-6-фтор-1H-индол-5-ил)амино)-5-циклопропилникотината.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,69 (2H, м), 0,87-0,95 (2H, м), 1,86-1,96 (1H, м), 5,38 (2H, с), 6,47 (1H, д, J=2,6 Гц), 7,19-7,37 (5H, м), 7,43 (1H, д, J=11,9 Гц), 7,47 (1H, д, J=3,3 Гц), 7,89 (1H, д, J=2,6 Гц), 8,22 (1H, д, J=2,6 Гц), 8,47 (1H, д, J=7,9 Гц), 10,24 (1H, с), 13,50 (1H, уш.с).
МС (ESI, m/z): 402 (M+H)+, 400 (M-H)-.
[Пример 553]
[Формула 800]

Способом, аналогичным описанному в примере 540, метил-2-((1-бензил-4,6-дифтор-1H-индол-5-ил)амино)-5-циклопропилникотинат получали из 1-бензил-4,6-дифтор-1H-индол-5-амина и метил-2-хлор-5-циклопропилникотината.
1H-ЯМР (ДМСО-d6) δ: 0,57-0,64 (2H, м), 0,85-0,91 (2H, м), 1,81-1,92 (1H, м), 3,90 (3H,с), 5,43 (2H, с), 6,55 (1H, д, J=2,6 Гц), 7,24-7,37 (6H, м), 7,58 (1H, д, J=3,3 Гц), 7,86 (1H, д, J=2,0 Гц), 8,04 (1H, д, J=2,0 Гц), 8,93 (1H, с).
МС (ESI, m/z): 434 (M+H)+.
[Пример 554]
[Формула 801]

Способом, аналогичным описанному в примере 545, 2-((1-бензил-4,6-дифтор-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту получали из метил-2-((1-бензил-4,6-дифтор-1H-индол-5-ил)амино)-5-циклопропилникотината.
1H-ЯМР (ДМСО-d6) δ: 0,57-0,64 (2H, м), 0,84-0,92 (2H, м), 1,80-1,91 (1H, м), 5,42 (2H, с), 6,55 (1H, д, J=3,3 Гц), 7,24-7,37 (6H, м), 7,58 (1H, д, J=3,3 Гц), 7,85 (1H, д, J=2,6 Гц), 8,00 (1H, д, J=2,6 Гц), 9,16 (1H, с).
МС (ESI, m/z): 420 (M+H)+, 418 (M-H)-.
[Пример 555]
[Формула 802]
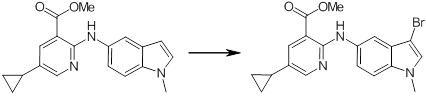
К раствору 700 мг метил-5-циклопропил-2-((1-метил-1H-индол-5-ил)амино)никотината в 20 мл тетрагидрофурана при охлаждении на льду добавляли 388 мг N-бромсукцинимида и перемешивали полученную смесь в течение 10 минут. Растворитель отгоняли из реакционной смеси в условиях пониженного давления, к полученному остатку добавляли метанол, и собирали твердое вещество путем фильтрования. Твердое вещество промывали водой с получением 680 мг метил-2-((3-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотината в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,64-0,71 (2H, м), 0,88-0,95 (2H, м), 1,87-1,98 (1H, м), 3,78 (3H, с), 3,90 (3H, с), 7,29 (1H, дд, J=9,2, 2,0 Гц), 7,45 (1H, д, J=9,2 Гц), 7,52 (1H, с), 7,91 (1H, д, J=2,7 Гц), 7,92 (1H, д, J=1,8 Гц), 8,26 (1H, д, J=2,6 Гц), 9,95 (1H, с).
МС (ESI, m/z): 402 (M+H)+.
[Пример 556]
[Формула 803]

Смесь 70 мг метил-2-((3-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотината, 56 мг 2-фторфенилбороновой кислоты, 6 мг бис(ди-трет-бутил(4-диметиламинофенил)фосфин)-дихлорпалладия(II), 80 мг карбоната калия, 2 мл толуола и 200 мкл воды перемешивали при 120°C в течение 3 часов в атмосфере азота. После добавления к реакционной смеси этилацетата и воды, органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-70/30) с получением 59 мг метил-5-циклопропил-2-((3-(2-фторфенил)-1-метил-1H-индол-5-ил)амино)никотината в виде желтого масла.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,68 (2H, м), 0,87-0,94 (2H, м), 1,85-1,95 (1H, м), 3,86 (3H, с), 3,90 (3H, с), 7,27-7,34 (3H, м), 7,40 (1H, дд, J=8,7, 2,1 Гц), 7,47 (1H, д, J=9,3 Гц), 7,63 (1H, д, J=2,0 Гц), 7,67-7,74 (1H, м), 7,88 (1H, д, J=2,0 Гц), 8,04 (1H, с), 8,19 (1H, д, J=2,0 Гц), 9,88 (1H, с).
МС (ESI, m/z): 416 (M+H)+.
[Пример 557]
[Формула 804]
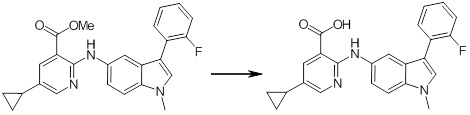
Способом, аналогичным описанному в примере 545, 5-циклопропил-2-((3-(2-фторфенил)-1-метил-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((3-(2-фторфенил)-1-метил-1H-индол-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,68 (2H, м), 0,87-0,94 (2H, м), 1,86-1,96 (1H, м), 3,86 (3H, с), 7,27-7,34 (3H, м), 7,36 (1H, дд, J=8,7, 2,1 Гц), 7,49 (1H, д, J=8,6 Гц), 7,64 (1H, д, J=2,0 Гц), 7,67-7,74 (1H, м), 7,92 (1H, д, J=2,0 Гц), 8,05 (1H, с), 8,12 (1H, д, J=2,0 Гц), 10,21 (1H, с).
МС (ESI, m/z): 402 (M+H)+, 400 (M-H)-.
[Пример 558]
[Формула 805]

Способом, аналогичным описанному в примере 556, метил-5-циклопропил-2-((3-(3-фторфенил)-1-метил-1H-индол-5-ил)амино)никотинат получали из метил-2-((3-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотината и 3-фторфенилбороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,68 (2H, м), 0,87-0,95 (2H, м), 1,87-1,97 (1H, м), 3,84 (3H, с), 3,90 (3H, с), 6,99-7,08 (1H, м), 7,36-7,55 (5H, м), 7,78 (1H, с), 7,89 (1H, д, J=2,6 Гц), 8,21 (1H, д, J=2,6 Гц), 8,25 (1H, д, J=2,0 Гц),9,90 (1H, с).
МС (ESI, m/z): 416 (M+H)+.
[Пример 559]
[Формула 806]

Способом, аналогичным описанному в примере 545, 5-циклопропил-2-((3-(3-фторфенил)-1-метил-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((3-(3-фторфенил)-1-метил-1H-индол-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,68 (2H, м), 0,87-0,95 (2H, м), 1,87-1,97 (1H, м), 3,84 (3H, с), 6,99-7,08 (1H, м), 7,35 (1H, дд, J=8,6, 2,0 Гц), 7,41-7,55 (4H, м), 7,78 (1H, с), 7,91 (1H, д, J=2,6 Гц), 8,15 (1H, д, J=2,0 Гц), 8,28 (1H, д, J=2,0 Гц), 10,21 (1H, с).
МС (ESI, m/z): 402 (M+H)+, 400 (M-H)-.
[Пример 560]
[Формула 807]

Способом, аналогичным описанному в примере 556, метил-5-циклопропил-2-((3-(4-фторфенил)-1-метил-1H-индол-5-ил)амино)никотинат получали из метил-2-((3-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотината и 4-фторфенилбороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,68 (2H, м), 0,87-0,95 (2H, м), 1,86-1,96 (1H, м), 3,83 (3H, с), 3,90 (3H, с), 7,24-7,32 (2H, м), 7,37 (1H, дд, J=8,7, 2,1 Гц),7,45 (1H, д, J=8,7 Гц), 7,63-7,69 (3H, м), 7,89 (1H, д, J=8,9 Гц), 8,19-8,22 (2H, м), 9,89 (1H, с).
МС (ESI, m/z): 416 (M+H)+.
[Пример 561]
[Формула 808]
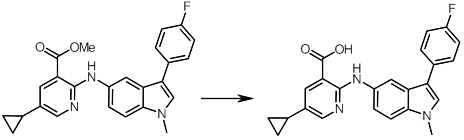
Способом, аналогичным описанному в примере 545, 5-циклопропил-2-((3-(4-фторфенил)-1-метил-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((3-(4-фторфенил)-1-метил-1H-индол-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,63-0,69 (2H, м), 0,87-0,95 (2H, м), 1,87-1,97 (1H, м), 3,84 (3H, с), 7,24-7,35 (3H, м), 7,48 (1H, д, J=8,6 Гц), 7,63-7,70 (3H, м), 7,93 (1H, д, J=2,0 Гц), 8,13 (1H, д, J=2,0 Гц), 8,19-8,22 (1H, м), 10,22 (1H, с).
МС (ESI, m/z): 402 (M+H)+, 400 (M-H)-.
[Пример 562]
[Формула 809]

Способом, аналогичным описанному в примере 540, метил-5-циклопропил-2-((3-изобутил-2-оксо-2,3-дигидро-1,3-бензотиазол-6-ил)амино)никотинат получали из 6-амино-3-изобутил-1,3-бензотиазол-2(3H)-она и метил-2-хлор-5-циклопропилникотината.
1H-ЯМР (ДМСО-d6) δ: 0,63-0,70 (2H, м), 0,88-0,97 (8H, м), 1,88-1,98 (1H, м), 2,12 (1H, септ., J=7,3 Гц), 3,75 (2H, д, J=7,9 Гц), 3,90 (3H, с), 7,32 (1H, д, J=8,6 Гц), 7,51 (1H, дд, J=8,9, 2,3 Гц), 7,91 (1H, д, J=2,6 Гц), 8,13 (1H, д, J=2,6 Гц), 8,25 (1H, д, J=2,6 Гц), 9,91 (1H, с).
МС (ESI, m/z): 398 (M+H)+.
[Пример 563]
[Формула 810]

5-Циклопропил-2-((3-изобутил-2-оксо-2,3-дигидро-1,3-бензотиазол-6-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((3-изобутил-2-оксо-2,3-дигидро-1,3-бензотиазол-6-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,63-0,69 (2H, м), 0,88-0,96 (8H, м), 1,87-1,97 (1H, м), 2,12 (1H, септ., J=6,6 Гц), 3,75 (2H, д, J=7,3 Гц), 7,31 (1H, д, J=8,6 Гц), 7,51 (1H, дд, J=8,6, 2,0 Гц), 7,90 (1H, д, J=2,6 Гц), 8,13 (1H, д, J=2,0 Гц), 8,22 (1H, д, J=2,6 Гц), 10,23 (1H, с), 13,58 (1H, уш.с).
МС (ESI, m/z): 384 (M+H)+, 382 (M-H)-.
[Пример 564]
[Формула 811]

Способом, аналогичным описанному в примере 540, метил-2-((3-(циклогексилметил)-2-оксо-2,3-дигидро-1,3-бензотиазол-6-ил)амино)-5-циклопропилникотинат получали из 6-амино-3-(циклогексилметил)-1,3-бензотиазол-2(3H)-она и метил-2-хлор-5-циклопропилникотината.
1H-ЯМР (ДМСО-d6) δ: 0,63-0,70 (2H, м), 0,89-0,97 (2H, м), 0,97-1,22 (5H, м), 1,54-1,72 (5H, м), 1,73-1,83 (1H, м), 1,88-1,98 (1H, м), 3,78 (2H, д, J=7,3 Гц), 3,90 (3H, с), 7,31 (1H, д, J=8,6 Гц), 7,50 (1H, дд, J=8,6, 2,6 Гц), 7,91 (1H, д, J=2,6 Гц), 8,12 (1H, д, J=2,0 Гц), 8,25 (1H, д, J=2,0 Гц), 9,90 (1H, с).
МС (ESI, m/z): 438 (M+H)+.
[Пример 565]
[Формула 812]
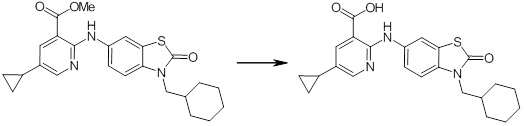
Способом, аналогичным описанному в примере 545, 2-((3-(циклогексилметил)-2-оксо-2,3-дигидро-1,3-бензотиазол-6-ил)амино)-5-циклопропилникотиновую кислоту получали из метил-2-((3-(циклогексилметил)-2-оксо-2,3-дигидро-1,3-бензотиазол-6-ил)амино)-5-циклопропилникотината.
1H-ЯМР (ДМСО-d6) δ: 0,63-0,70 (2H, м), 0,89-0,97 (2H, м), 0,97-1,20 (5H, м), 1,55-1,72 (5H, м), 1,73-1,84 (1H, м), 1,87-1,98 (1H, м), 3,78 (2H, д, J=7,3 Гц), 7,30 (1H, д, J=8,6 Гц), 7,51 (1H, дд, J=8,9, 2,3 Гц), 7,90 (1H, д, J=2,6 Гц), 8,12 (1H, д, J=2,0 Гц), 8,22 (1H, д, J=2,6 Гц), 10,23 (1H, с), 13,59 (1H, уш.с).
МС (ESI, m/z): 424 (M+H)+, 422 (M-H)-.
[Пример 566]
[Формула 813]

Способом, аналогичным описанному в примере 556, метил-5-циклопропил-2-((1-метил-3-(2-метилфенил)-1H-индол-5-ил)амино)никотинат получали из метил-2-((3-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотината и 2-метилфенилбороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,66 (2H, м), 0,85-0,93 (2H, м), 1,84-1,94 (1H, м), 2,33 (3H, с), 3,84 (3H, с), 3,88 (3H, с), 7,18-7,29 (2H, м), 7,29-7,39 (3H, м), 7,41 (1H, с), 7,44 (1H, д, J=8,6 Гц), 7,77 (1H, д, J=1,3 Гц), 7,86 (1H, д, J=2,6 Гц), 8,15 (1H, д, J=2,6 Гц), 9,84 (1H, с).
МС (ESI, m/z): 412 (M+H)+.
[Пример 567]
[Формула 814]

Способом, аналогичным описанному в примере 545, 5-циклопропил-2-((1-метил-3-(2-метилфенил)-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((1-метил-3-(2-метилфенил)-1H-индол-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,59-0,66 (2H, м), 0,85-0,93 (2H, м), 1,83-1,94 (1H, м), 2,33 (3H, с), 3,84 (3H, с), 7,18-7,39 (5H, м), 7,42 (1H, с), 7,45 (1H, д, J=8,4 Гц), 7,78 (1H, д, J=1,3 Гц), 7,88 (1H, д, J=2,0 Гц), 8,09 (1H, д, J=2,6 Гц), 10,16 (1H, с).
МС (ESI, m/z): 398 (M+H)+, 396 (M-H)-.
[Пример 568]
[Формула 815]

Способом, аналогичным описанному в примере 556, метил-5-циклопропил-2-((1-метил-3-(3-метилфенил)-1H-индол-5-ил)амино)никотинат получали из метил-2-((3-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотината и 3-метилфенилбороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,68 (2H, м), 0,87-0,95 (2H, м), 1,86-1,97 (1H, м), 2,38 (3H, с), 3,83 (3H, с), 3,90 (3H, с), 7,01-7,07 (1H, м), 7,29-7,36 (2H, м), 7,42-7,49 (3H, м), 7,64 (1H, с), 7,89 (1H, д, J=2,6 Гц), 8,20 (1H, д, J=2,6 Гц), 8,26 (1H, д, J=2,0 Гц), 9,88 (1H, с).
МС (ESI, m/z): 412 (M+H)+.
[Пример 569]
[Формула 816]

Способом, аналогичным описанному в примере 545, 5-циклопропил-2-((1-метил-3-(3-метилфенил)-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((1-метил-3-(3-метилфенил)-1H-индол-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,67 (2H, м), 0,87-0,94 (2H, м), 1,85-1,96 (1H, м), 2,38 (3H, с), 3,83 (3H, с), 7,04 (1H, д, J=7,3 Гц), 7,28-7,36 (2H, м), 7,41-7,49 (3H, м), 7,63 (1H, с), 7,88 (1H, д, J=2,6 Гц), 8,17 (1H, д, J=2,6 Гц), 8,30 (1H, д, J=2,0 Гц), 10,17 (1H, с), 13,43 (1H, уш.с).
МС (ESI, m/z): 398 (M+H)+, 396 (M-H)-.
[Пример 570]
[Формула 817]
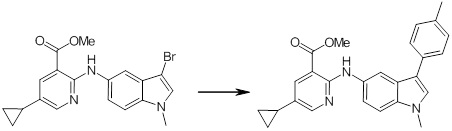
Способом, аналогичным описанному в примере 556, метил-5-циклопропил-2-((1-метил-3-(4-метилфенил)-1H-индол-5-ил)амино)никотинат получали из метил-2-((3-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотината и 4-метилфенилбороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,68 (2H, м), 0,87-0,94 (2H, м), 1,86-1,96 (1H, м), 2,33 (3H, с), 3,82 (3H, с), 3,90 (3H, с), 7,25 (2H, д, J=7,9 Гц), 7,34 (1H, дд, J=8,6, 2,0 Гц), 7,44 (1H, д, J=9,2 Гц), 7,54 (2H, д, J=7,9 Гц), 7,60 (1H, с), 7,89 (1H, д, J=2,6 Гц), 8,19-8,23 (2H, м), 9,88 (1H, с).
МС (ESI, m/z): 412 (M+H)+.
[Пример 571]
[Формула 818]

Способом, аналогичным описанному в примере 545, 5-циклопропил-2-((1-метил-3-(4-метилфенил)-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((1-метил-3-(4-метилфенил)-1H-индол-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,68 (2H, м), 0,86-0,94 (2H, м), 1,85-1,96 (1H, м), 2,30 (3H, с), 3,82 (3H, с), 7,25 (2H, д, J=7,9 Гц), 7,31 (1H, дд, J=8,9, 1,7 Гц), 7,43 (1H, д, J=9,2 Гц), 7,54 (2H, д, J=7,9 Гц), 7,60 (1H, с), 7,89 (1H, д, J=2,6 Гц), 8,17 (1H, д, J=2,0 Гц), 8,24 (1H, д, J=2,0 Гц), 10,18 (1H, с), 13,45 (1H, уш.с).
МС (ESI, m/z): 398 (M+H)+, 396 (M-H)-.
[Пример 572]
[Формула 819]

Способом, аналогичным описанному в примере 540, метил-2-((1-бензил-4-метил-1H-индол-5-ил)амино)-5-циклопропилникотинат получали из 1-бензил-4-метил-1H-индол-5-амина и метил-2-хлор-5-циклопропилникотината.
1H-ЯМР (ДМСО-d6) δ: 0,56-0,63 (2H, м), 0,84-0,92 (2H, м), 1,80-1,91 (1H, м), 2,32 (3H, с), 3,89 (3H, с), 5,40 (2H, с), 6,52 (1H, д, J=3,3 Гц), 7,17-7,34 (7H, м), 7,49 (1H, д, J=3,3 Гц), 7,84 (1H, д, J=2,6 Гц), 8,05 (1H, д, J=2,0 Гц), 9,42 (1H, с).
МС (ESI, m/z): 412 (M+H)+.
[Пример 573]
[Формула 820]

Способом, аналогичным описанному в примере 545, 2-((1-бензил-4-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту получали из метил-2-((1-бензил-4-метил-1H-индол-5-ил)амино)-5-циклопропилникотината.
1H-ЯМР (ДМСО-d6) δ: 0,58-0,65 (2H, м), 0,85-0,93 (2H, м), 1,83-1,94 (1H, м), 2,33 (3H, с), 5,41 (2H, с), 6,55 (1H, д, J=2,7 Гц), 7,19-7,34 (7H, м), 7,52 (1H, д, J=3,3 Гц), 7,91-7,97 (2H, м), 9,84 (1H, с).
МС (ESI, m/z): 398 (M+H)+, 396 (M-H)-.
[Пример 574]
[Формула 821]
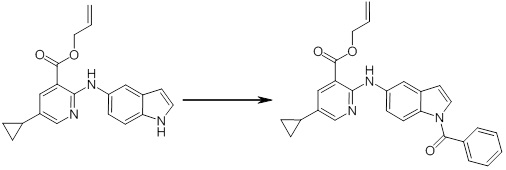
Смесь 50 мг аллил-5-циклопропил-2-(1H-индол-5-иламино)никотината, 105 мкл бензоилхлорида, 250 мкл триэтиламина, 18 мг N,N-диметил-4-аминопиридина и 3 мл дихлорметана перемешивали при комнатной температуре в течение 9 часов и 5 минут. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия и этилацетат, органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-30/70) с получением 64 мг аллил-2-((1-бензоил-1H-индол-5-ил)амино)-5-циклопропилникотината в виде желтого масла.
1H-ЯМР (ДМСО-d6) δ: 0,65-0,72 (2H, м), 0,92-0,98 (2H, м), 1,91-2,02 (1H, м), 4,87 (2H, д, J=5,9 Гц), 5,32 (1H, дд, J=10,2, 1,7 Гц), 5,45 (1H, дд, J=17,2, 1,3 Гц), 6,03-6,17 (1H, м), 6,74 (1H, д, J=4,0 Гц), 7,36 (1H, д, J=4,0 Гц), 7,48 (1H, дд, J=8,9, 2,3 Гц), 7,57-7,64 (2H, м), 7,66-7,73 (1H, м), 7,74-7,79 (2H, м), 7,94 (1H, д, J=6,6 Гц), 8,18-8,23 (2H, м), 8,30 (1H, д, J=2,6 Гц), 10,07 (1H, с).
МС (ESI, m/z): 438 (M+H)+.
[Пример 575]
[Формула 822]

Смесь 62 мг аллил-2-((1-бензоил-1H-индол-5-ил)амино)-5-циклопропилникотината, 23 мкл пирролидина, 8 мг тетракис(трифенилфосфин)палладия и 2 мл ацетонитрила перемешивали при комнатной температуре в течение 2 часов и 50 минут в атмосфере азота. К реакционной смеси добавляли 1 M соляную кислоту и этилацетат, и разделяли органический слой. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли смесь вода/метанол, и собирали твердое вещество путем фильтрования с получением 45 мг 2-((1-бензоил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты в виде светло-желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,64-0,71 (2H, м), 0,89-0,97 (2H, м), 1,88-1,99 (1H, м), 6,74 (1H, д, J=4,0 Гц), 7,35 (1H, д, J=4,0 Гц), 7,47 (1H, дд, J=8,6, 2,0 Гц), 7,57-7,70 (4H, м), 7,74-7,80 (2H, м), 7,92 (1H, д, J=2,6 Гц), 8,21 (1H, д, J=8,6 Гц), 8,25 (1H, дд, J=8,6, 2,0 Гц), 10,45 (1H, с).
МС (ESI, m/z): 398 (M+H)+, 396 (M-H)-.
[Пример 576]
[Формула 823]
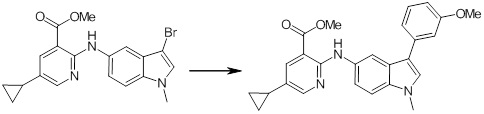
Способом, аналогичным описанному в примере 556, метил-5-циклопропил-2-((3-(3-метоксифенил)-1-метил-1H-индол-5-ил)амино)никотинат получали из метил-2-((3-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотината и 3-метоксифенилбороновой кислоты.
МС (ESI, m/z): 428 (M+H)+.
[Пример 577]
[Формула 824]

Способом, аналогичным описанному в примере 545, 5-циклопропил-2-((3-(3-метоксифенил)-1-метил-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((3-(3-метоксифенил)-1-метил-1H-индол-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,68 (2H, м), 0,87-0,95 (2H, м), 1,87-1,97 (1H, м), 3,83 (3H, с), 3,84 (3H, с), 6,81 (1H, дд, J=7,9, 2,0 Гц), 7,17-7,38 (4H, м), 7,47 (1H, д, J=9,2 Гц), 7,70 (1H, с), 7,93 (1H, д, J=2,6 Гц), 8,12 (1H, д, J=2,0 Гц), 8,29 (1H, с), 10,25 (1H, с).
МС (ESI, m/z): 414 (M+H)+, 412 (M-H)-.
[Пример 578]
[Формула 825]

Способом, аналогичным описанному в примере 556, метил-5-циклопропил-2-((3-(4-метоксифенил)-1-метил-1H-индол-5-ил)амино)никотинат получали из метил-2-((3-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотината и 4-метоксифенилбороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,68 (2H, м), 0,87-0,94 (2H, м), 1,85-1,96 (1H, м), 3,79 (3H, с), 3,81 (3H, с), 3,90 (3H, с), 7,03 (2H, д, J=8,6 Гц), 7,35 (1H, дд, J=8,6, 2,0 Гц), 7,43 (1H, д, J=8,6 Гц), 7,53-7,58 (3H, м), 7,88 (1H, д, J=2,6 Гц), 8,16 (1H, д, J=2,0 Гц), 8,21 (1H, д, J=2,6 Гц), 9,88 (1H, с).
МС (ESI, m/z): 428 (M+H)+.
[Пример 579]
[Формула 826]

Способом, аналогичным описанному в примере 545, 5-циклопропил-2-((3-(4-метоксифенил)-1-метил-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((3-(4-метоксифенил)-1-метил-1H-индол-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,68 (2H, м), 0,86-0,94 (2H, м), 1,84-1,96 (1H, м), 3,79 (3H, с), 3,81 (3H, с), 7,03 (2H, д, J=8,6 Гц), 7,32 (1H, дд, J=8,9, 1,7 Гц), 7,42 (1H, д, J=8,6 Гц), 7,52-7,59 (3H, м), 7,87 (1H, д, J=2,0 Гц), 8,15-8,22 (2H, м), 10,15 (1H, с), 13,41 (1H, уш.с).
МС (ESI, m/z): 414 (M+H)+, 412 (M-H)-.
[Пример 580]
[Формула 827]

Способом, аналогичным описанному в примере 556, метил-5-циклопропил-2-((3-(2-метоксифенил)-1-метил-1H-индол-5-ил)амино)никотинат получали из метил-2-((3-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотината и 2-метоксифенилбороновой кислоты.
МС (ESI, m/z): 428 (M+H)+.
[Пример 581]
[Формула 828]

Способом, аналогичным описанному в примере 545, 5-циклопропил-2-((3-(2-метоксифенил)-1-метил-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-((3-(2-метоксифенил)-1-метил-1H-индол-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,67 (2H, м), 0,85-0,94 (2H, м), 1,85-1,95 (1H, м), 3,81 (3H, с), 3,83 (3H, с), 7,00-7,07 (1H, м), 7,11 (1H, д, J=7,3 Гц), 7,22-7,31 (2H, м), 7,42 (1H, д, J=8,6 Гц), 7,50-7,55 (2H, м), 7,87 (1H, д, J=2,6 Гц), 8,02 (1H, д, J=2,0 Гц), 8,14 (1H, д, J=2,0 Гц), 10,16 (1H, с).
МС (ESI, m/z): 414 (M+H)+, 412 (M-H)-.
[Пример 582]
[Формула 829]
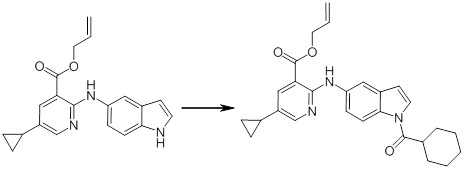
Способом, аналогичным описанному в примере 574, аллил-2-((1-(циклогексилкарбонил)-1H-индол-5-ил)амино)-5-циклопропилникотинат получали из аллил-5-циклопропил-2-((1H-индол-5-иламино)никотината и циклогексанкарбонилхлорида.
1H-ЯМР (ДМСО-d6) δ: 0,64-0,71 (2H, м), 0,90-0,97 (2H, м), 1,15-2,00 (12H, м), 4,84-4,89 (2H, м), 5,32 (1H, дд, J=10,6, 1,3 Гц), 5,44 (1H, дд, J=17,2, 1,3 Гц), 6,02-6,16 (1H, м), 6,73 (1H, д, J=4,0 Гц), 7,41 (1H, дд, J=8,9, 2,3 Гц), 7,97 (1H, д, J=2,4 Гц), 7,99 (1H, д, J=3,9 Гц), 8,14 (1H, д, J=2,0 Гц), 8,25-8,30 (2H, м), 10,01 (1H, с).
МС (ESI, m/z): 444 (M+H)+.
[Пример 583]
[Формула 830]

Способом, аналогичным описанному в примере 575, 2-((1-(циклогексилкарбонил)-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту получали из аллил-2-((1-(циклогексилкарбонил)-1H-индол-5-ил)амино)-5-циклопропилникотината.
МС (ESI, m/z): 404 (M+H)+, 402 (M-H)-.
[Пример 584]
[Формула 831]

Способом, аналогичным описанному в примере 540, метил-2-((1-бензил-6-метил-1H-индол-5-ил)амино)-5-циклопропилникотинат получали из 1-бензил-6-метил-1H-индол-5-амина и метил-2-хлор-5-циклопропилникотината.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,66 (2H, м), 0,86-0,93 (2H, м), 1,83-1,94 (1H, м), 2,28 (3H, с), 3,89 (3H, с), 5,38 (2H, с), 6,40 (1H, д, J=3,3 Гц), 7,16-7,35 (6H, м), 7,40 (1H, д, J=3,3 Гц), 7,88 (1H, д, J=2,0 Гц), 8,05 (1H, с), 8,16 (1H, д, J=2,6 Гц), 9,60 (1H, с).
МС (ESI, m/z): 412 (M+H)+.
[Пример 585]
[Формула 832]

Способом, аналогичным описанному в примере 545, 2-((1-бензил-6-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту получали из метил-2-((1-бензил-6-метил-1H-индол-5-ил)амино)-5-циклопропилникотината.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,67 (2H, м), 0,87-0,95 (2H, м), 1,85-1,96 (1H, м), 2,28 (3H, с), 5,39 (2H, с), 6,42 (1H, д, J=2,6 Гц), 7,17-7,36 (6H, м), 7,43 (1H, д, J=3,3 Гц), 7,95 (1H, с), 8,02 (1H, с), 8,06 (1H, с), 9,99 (1H, с).
МС (ESI, m/z): 398 (M+H)+, 396 (M-H)-.
[Пример 586]
[Формула 833]

Способом, аналогичным описанному в примере 463, 5-циклопропил-2-((7-(3,5-дифторфенил)-1-метил-1H-индол-5-ил)амино)никотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и (3,5-дифторфенил)бороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,68 (2H, м), 0,87-0,94 (2H, м), 1,86-1,94 (1H, м), 3,25-3,40 (3H, м), 6,47 (1H, д, J=2,9 Гц), 7,05 (1H, д, J=2,2 Гц), 7,21-7,38 (4H, м), 7,88 (1H, д, J=2,4 Гц), 8,10 (1H, д, J=2,0 Гц), 8,21 (1H, д, J=2,4 Гц), 10,22 (1H, с).
МС (ESI, m/z): 420 (M+H)+.
[Пример 587]
[Формула 834]

Способом, аналогичным описанному в примере 463, 5-циклопропил-2-((7-(2,3-дифторфенил)-1-метил-1H-индол-5-ил)амино)никотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и (2,3-дифторфенил)бороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,70 (2H, м), 0,86-0,94 (2H, м), 1,86-1,95 (1H, м), 3,30 (3H, с), 6,47 (1H, д, J=2,9 Гц), 7,10 (1H, д, J=2,2 Гц), 7,27 (1H, д, J=3,2 Гц), 7,30-7,38 (2H, м), 7,48-7,52 (1H, м), 7,88 (1H, д, J=2,4 Гц), 8,11 (1H, д, J=2,2 Гц), 8,21 (1H, д, J=2,4 Гц), 10,24 (1H, с).
МС (ESI, m/z): 420 (M+H)+, 418 (M-H)-.
[Пример 588]
[Формула 835]

Способом, аналогичным описанному в примере 463, 5-циклопропил-2-((7-(2,4-дифторфенил)-1-метил-1H-индол-5-ил)амино)никотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и (2,4-дифторфенил)бороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,70 (2H, м), 0,82-0,96 (2H, м), 1,84-1,94 (1H, м), 3,30 (3H, с), 6,45 (1H, д, J=2,9 Гц), 7,05 (1H, д, J=2,0 Гц), 7,16-7,28 (2H, м), 7,36-7,46 (1H, м), 7,50-7,62 (1H, м), 7,88 (1H, д, J=2,4 Гц), 8,09 (1H, д, J=2,0 Гц), 8,21 (1H, д, J=2,4 Гц), 10,22 (1H, с).
МС (ESI, m/z): 420 (M+H)+.
[Пример 589]
[Формула 836]

Способом, аналогичным описанному в примере 463, 5-циклопропил-2-((7-(3-фторпиридин-4-ил)-1-метил-1H-индол-5-ил)амино)никотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и (3-фторпиридин-4-ил)бороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,73 (2H, м), 0,85-0,98 (2H, м), 1,84-1,98 (1H, м), 3,20-3,50 (3H, м), 6,45-6,55 (1H, м), 7,11-7,20 (1H, м), 7,26-7,35 (1H, м), 7,60-7,70 (1H, м), 7,84-7,94 (1H, м), 8,10-8,26 (2H, м), 8,52-8,61 (1H, м), 8,69-8,76 (1H, м), 10,23 (1H, с).
МС (ESI, m/z): 403 (M+H)+, 401 (M-H)-.
[Пример 590]
[Формула 837]

Способом, аналогичным описанному в примере 463, 5-циклопропил-2-((7-(2,5-дифторфенил)-1-метил-1H-индол-5-ил)амино)никотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и (2,5-дифторфенил)бороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,68 (2H, м), 0,86-0,95 (2H, м), 1,85-1,95 (1H, м), 3,30 (3H, с), 6,46 (1H, д, J=3,2 Гц), 7,09 (1H, д, J=2,0 Гц), 7,27 (1H, д, J=3,2 Гц), 7,32-7,46 (3H, м), 7,89 (1H, д, J=2,4 Гц), 8,10 (1H, д, J=2, 0 Гц), 8,22 (1H, д, J=2,7 Гц).
МС (ESI, m/z): 420 (M+H)+, 418 (M-H)-,.
[Пример 591]
[Формула 838]

Способом, аналогичным описанному в примере 463, 5-циклопропил-2-((1-метил-7-(пиримидин-5-ил)-1H-индол-5-ил)амино)никотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и пиримидин-5-илбороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,59-0,70 (2H, м), 0,82-0,95 (2H, м), 1,82-1,95 (1H, м), 3,27-3,37 (3H, м), 6,44-6,52 (1H, м), 7,07-7,14 (1H, м), 7,25-7,34 (1H, м), 7,84-7,92 (1H, м), 8,12-8,25 (2H, м), 8,98 (2H, с), 9,25 (1H, с), 10,23 (1H, с).
МС (ESI, m/z): 386 (M+H)+, 384 (M-H)-.
[Пример 592]
[Формула 839]
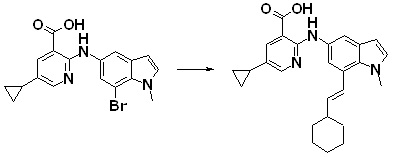
Способом, аналогичным описанному в примере 463, 2-((7-((E)-2-циклогексилэтенил)-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и ((E)-2-циклогексилэтенил)бороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,68 (2H, м), 0,80-0,95 (3H, м), 1,10-1,40 (5H, м), 1,60-1,95 (6H, м), 3,96 (3H, с), 6,00 (1H, дд, J=15,6, 6,8 Гц), 6,33 (1H, д, J=3,2 Гц), 7,02 (1H, д, J=2,0 Гц), 7,15 (1H, д, J=15,4 Гц), 7,19 (1H, д, J=2,9 Гц), 7,87 (1H, д, J=2,4 Гц), 7,94 (1H, д, J=1,7 Гц), 8,19 (1H, д, J=2,4 Гц), 10,14 (1H, с).
МС (ESI, m/z): 416 (M+H)+.
[Пример 593]
[Формула 840]

К раствору 0,06 г 2-((7-((E)-2-циклогексилэтенил)-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты в 5 мл метанола добавляли 0,02 г 10% Pd/C и перемешивали полученную смесь при комнатной температуре в течение 8 часов и 45 минут в атмосфере водорода. Нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-60/40) с получением 0,026 г 2-((7-(2-циклогексилэтил)-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,66 (2H, м), 0,81-1,94 (16H, м), 2,91-3,06 (2H, м), 3,95 (3H, с), 6,30 (1H, д, J=3,2 Гц), 6,80-6,86 (1H, м), 7,15 (1H, д, J=3,2 Гц), 7,85 (1H, д, J=2,4 Гц), 7,88-7,94 (1H, м), 8,19 (1H, д, J=2,2 Гц), 10,09 (1H, с).
МС (ESI, m/z): 418 (M+H)+, 416 (M-H)-.
[Пример 594]
[Формула 841]

Способом, аналогичным описанному в примере 463, 5-циклопропил-2-((7-((1E)-3,3-диметилбут-1-ен-1-ил)-1-метил-1H-индол-5-ил)амино)никотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и ((1E)-3,3-диметилбут-1-ен-1-ил)бороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,59-0,67 (2H, м), 0,77-0,94 (2H, м), 1,14 (9H, с), 1,83-1,93 (1H, м), 3,95 (3H, с), 6,05 (1H, д, J=15,9 Гц), 6,32 (1H, д, J=3,2 Гц), 6,97 (1H, д, J=2,0 Гц), 7,09 (1H, д, J=15,6 Гц), 7,18 (1H, д, J=3,2 Гц), 7,85 (1H, д, J=2,7 Гц), 7,93 (1H, д, J=2,0 Гц), 8,18 (1H, д, J=2,4 Гц), 10,11 (1H, с).
МС (ESI, m/z): 390 (M+H)+.
[Пример 595]
[Формула 842]

К раствору 0,078 г 5-циклопропил-2-((7-((1E)-3,3-диметилбут-1-ен-1-ил)-1-метил-1H-индол-5-ил)амино)никотиновой кислоты в 5 мл метанола добавляли 0,025 г 10% гидроксида палладия на угле и перемешивали полученную смесь при комнатной температуре в течение 4 часов в атмосфере водорода. Нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли 5 мл метанола и 0,028 г 10% гидроксида палладия на угле, и перемешивали полученную смесь при комнатной температуре в течение 4 часов и 35 минут в атмосфере водорода. Нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный таким образом остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-60/40) с получением 0,013 г 5-циклопропил-2-((7-(3,3-диметилбутил)-1-метил-1H-индол-5-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,68 (2H, м), 0,81-0,94 (2H, м), 1,01 (9H, с), 1,48-1,60 (2H, м), 1,84-1,95 (1H, м), 2,90-3,02 (2H, м), 3,98 (3H, с), 6,32 (1H, д, J=2,9 Гц), 6,81 (1H, д, J=1,7 Гц), 7,18 (1H, д, J=3,2 Гц), 7,87 (1H, д, J=2,4 Гц), 7,92-7,98 (1H, м), 8,20 (1H, д, J=2,4 Гц), 10,10 (1H, с).
МС (ESI, m/z): 392 (M+H)+.
[Пример 596]
[Формула 843]
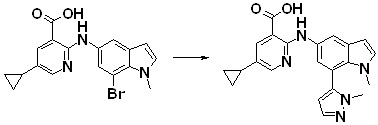
Способом, аналогичным описанному в примере 463, 5-циклопропил-2-((1-метил-7-(1-метил-1H-пиразол-5-ил)-1H-индол-5-ил)амино)никотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и 1-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола.
1H-ЯМР (ДМСО-d6) δ: 0,56-0,67 (2H, м), 0,80-0,93 (2H, м), 1,80-1,93 (1H, м), 3,21 (3H, с), 3,58 (3H, с), 6,38-6,49 (2H, м), 7,11-7,18 (1H, м), 7,22-7,29 (1H, м), 7,50-7,57 (1H, м), 7,83-7,90 (1H, м), 8,03-8,10 (1H, м), 8,14-8,22 (1H, м), 10,24 (1H, с).
МС (ESI, m/z): 388 (M+H)+, 386 (M-H)-.
[Пример 597]
[Формула 844]

Способом, аналогичным описанному в примере 462, 5-циклопропил-2-((1-этил-7-фенил-1H-индол-5-ил)амино)никотиновую кислоту получали из 1-этил-7-фенил-1H-индол-5-амина и 2-хлор-5-циклопропилникотиновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,68 (2H, м), 0,78-0,94 (5H, м), 1,84-1,94 (1H, м), 3,68 (2H, кв., J=7,1 Гц), 6,49 (1H, д, J=3,2 Гц), 6,98 (1H, д, J=2,0 Гц), 7,32 (1H, д, J=2,9 Гц), 7,42-7,50 (5H, м), 7,88 (1H, д, J=2,4 Гц), 8,03 (1H, д, J=2,0 Гц), 8,20 (1H, д, J=2,7 Гц), 10,23 (1H, с).
МС (ESI, m/z): 398 (M+H)+, 396 (M-H)-.
[Пример 598]
[Формула 845]

Способом, аналогичным описанному в примере 462, 5-циклопропил-2-((1-этил-7-(3-метоксипропил)-1H-индол-5-ил)амино)-никотиновую кислоту получали из 1-этил-7-(3-метоксипропил)-1H-индол-5-амина и 2-хлор-5-циклопропилникотиновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,68 (2H, м), 0,86-0,94 (2H, м), 1,28-1,34 (3H, м), 1,80-1,94 (3H, м), 2,90-3,02 (2H, м), 3,27 (3H, с), 3,38-3,44 (2H, м), 4,24-4,34 (2H, м), 6,32-6,40 (1H, м), 6,84-6,92 (1H, м), 7,22-7,30 (1H, м), 7,82-7,88 (1H, м), 7,90-7,94 (1H, м), 8,16-8,22 (1H, м), 10,14 (1H, с).
МС (ESI, m/z): 394 (M+H)+, 392 (M-H)-.
[Пример 599]
[Формула 846]

Способом, аналогичным описанному в примере 463, 2-((7-((1E)-3-((трет-бутил(диметил)силил)окси)проп-1-ен-1-ил)-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и ((1E)-3-((трет-бутил(диметил)силил)окси)проп-1-ен-1-ил)бороновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,12 (6H, с), 0,60-0,67 (2H, м), 0,88-0,94 (11H, м), 1,85-1,95 (1H, м), 3,96 (3H, с), 4,39 (2H, дд, J=4,6, 1,7 Гц), 6,17 (1H, дт, J=15,3, 4,6 Гц), 6,34 (1H, д, J=3,0 Гц), 7,17 (1H, д, J=2,0 Гц), 7,20 (1H, д, J=3,2 Гц), 7,39 (1H, д, J=15,3 Гц), 7,87 (1H, д, J=2,4 Гц), 7,95 (1H, д, J=2,0 Гц), 8,19 (1H, д, J=2,4 Гц).
МС (ESI, m/z): 478 (M+H)+, 476 (M-H)-.
[Пример 600]
[Формула 847]

К раствору 0,10 г 2-((7-((1E)-3-((трет-бутил(диметил)силил)окси)проп-1-ен-1-ил)-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты в 5 мл метанола добавляли 1 мл 6 M соляной кислоты и перемешивали полученную смесь при комнатной температуре в течение 10 минут. Реакционную смесь корректировали до pH 2,3 добавлением к ней этилацетата, воды и 2 M водного раствора гидроксида натрия, органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли этилацетат, и собирали твердое вещество путем фильтрования с получением 0,006 г 5-циклопропил-2-((7-((1E)-3-гидроксипроп-1-ен-1-ил)-1-метил-1H-индол-5-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,69 (2H, м), 0,80-0,95 (2H, м), 1,86-1,96 (1H, м), 3,97 (3H, с), 4,18 (2H, дд, J=4,9, 1,7 Гц), 6,17 (1H, дт, J=15,4, 4,9 Гц), 6,35 (1H, д, J=3,2 Гц), 7,15 (1H, д, J=2,0 Гц), 7,22 (1H, д, J=3,0 Гц), 7,36 (1H, д, J=15,4 Гц), 7,88-7,93 (2H, м), 8,18 (1H, д, J=2,2 Гц), 10,16 (1H, с).
МС (ESI, m/z): 364 (M+H)+, 362 (M-H)-.
[Пример 601]
[Формула 848]

К раствору 0,083 г 5-циклопропил-2-((7-((1E)-3-гидроксипроп-1-ен-1-ил)-1-метил-1H-индол-5-ил)амино)никотиновой кислоты в 5 мл метанола добавляли 0,04 г 10% Pd/C и перемешивали полученную смесь при комнатной температуре в течение 9 часов в атмосфере водорода. Нерастворимое вещество отфильтровывали, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 80/20-0/100), к полученному таким образом остатку добавляли этилацетат и гексан, и собирали твердое вещество путем фильтрования с получением 0,006 г 5-циклопропил-2-((7-(3-гидроксипропил)-1-метил-1H-индол-5-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,67 (2H, м), 0,83-0,93 (2H, м), 1,74-1,94 (3H, м), 3,00-3,08 (2H, м), 3,48-3,56 (2H, м), 3,98 (3H, с), 6,29-6,32 (1H, м), 6,83-6,87 (1H, м), 7,12-7,22 (1H, м), 7,84-7,88 (1H, м), 7,92-7,96 (1H, м), 8,17-8,20 (1H, м), 10,25 (1H, уш.с).
МС (ESI, m/z): 366 (M+H)+, 364 (M-H)-.
[Пример 602]
[Формула 849]
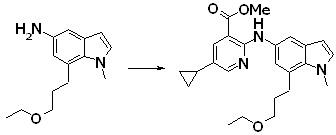
Способом, аналогичным описанному в примере 223, метил-5-циклопропил-2-((7-(3-этоксипропил)-1-метил-1H-индол-5-ил)амино)никотинат получали из 7-(3-этоксипропил)-1-метил-1H-индол-5-амина и метил-2-хлор-5-циклопропилникотината.
1H-ЯМР (ДМСО-d6) δ: 0,59-0,66 (2H, м), 0,86-0,95 (2H, м), 1,21 (3H, т, J=6,8 Гц), 1,76-1,86 (1H, м), 1,92-2,05 (2H, м), 3,13 (2H, т, J=7,6 Гц), 3,45-3,54 (4H, м), 3,92 (3H, с), 4,00 (3H, с), 6,41 (1H, д, J=3,2 Гц), 6,91 (1H, д, J=2,9 Гц), 7,00 (1H, д, J=2,0 Гц), 7,85 (1H, д, J=2,0 Гц), 7,89 (1H, д, J=2,7 Гц), 8,20 (1H, д, J=2,4 Гц), 9,80 (1H, с).
МС (ESI, m/z): 408 (M+H)+.
[Пример 603]
[Формула 850]
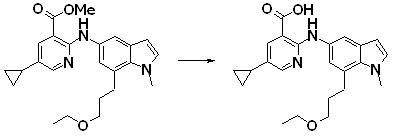
К раствору 0,044 г метил-5-циклопропил-2-((7-(3-этоксипропил)-1-метил-1H-индол-5-ил)амино)никотината в 0,5 мл метанола и 1 мл тетрагидрофурана добавляли 0,05 мл 5 M водного раствора гидроксида натрия, и нагревали полученную смесь с обратным холодильником при 50-52°C в течение 2 часов и 10 минут. Реакционную смесь охлаждали до комнатной температуры, а затем корректировали до pH 2,1 добавлением к ней 6 M соляной кислоты. Растворитель отгоняли в условиях пониженного давления, к остатку добавляли метанол и воду, и собирали твердое вещество путем фильтрования с получением 0,006 г 5-циклопропил-2-((7-(3-этоксипропил)-1-метил-1H-индол-5-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,69 (2H, м), 0,86-0,95 (2H, м), 1,35 (3H, т, J=6,8 Гц), 1,80-1,95 (3H, м), 3,00-3,10 (2H, м), 3,40-3,48 (4H, м), 3,97 (3H, с), 6,32 (1H, д, J=2,9 Гц), 6,84-6,89 (1H, м)7,18 (1H, д, J=2,9 Гц), 7,87 (1H, д, J=2,2 Гц), 7,90-7,95 (1H, м), 8,20 (1H, д, J=2,2 Гц), 10,12 (1H, с).
МС (ESI, m/z): 394 (M+H)+, 392 (M-H)-.
[Пример 604]
[Формула 851]
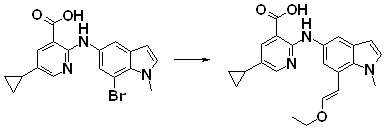
Способом, аналогичным описанному в примере 463, 5-циклопропил-2-((7-((E)-2-этоксиэтенил)-1-метил-1H-индол-5-ил)амино)никотиновую кислоту получали из 2-((7-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты и 2-((E)-2-этоксиэтенил-4,4,5,5-тетраметил-1,3,2-диоксаборолана.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,68 (2H, м), 0,85-0,95 (2H, м), 1,29 (3H, т, J=7,1 Гц), 1,85-1,95 (1H, м), 3,91-4,00 (5H, м), 6,30 (1H, д, J=3,0 Гц), 6,55 (1H, д, J=12,5 Гц), 6,87 (1H, д, J=12,4 Гц), 6,96 (1H, д, J=1,9 Гц), 7,17 (1H, д, J=3,0 Гц), 7,87 (1H, д, J=2,4 Гц), 7,89 (1H, д, J=1,7 Гц), 8,20 (1H, д, J=2,4 Гц), 10,10 (1H, с).
МС (ESI, m/z): 378 (M+H)+, 376 (M-H)-.
[Пример 605]
[Формула 852]

Способом, аналогичным описанному в примере 601, 5-циклопропил-2-((7-(2-этоксиэтил)-1-метил-1H-индол-5-ил)амино)никотиновую кислоту получали из 5-циклопропил-2-((7-((E)-2-этоксиэтенил)-1-метил-1H-индол-5-ил)амино)никотиновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,68 (2H, м), 0,85-0,95 (2H, м), 1,11 (3H, т, J=7,1 Гц), 1,85-1,95 (1H, м), 3,26 (2H, т, J=7,2 Гц), 3,47 (2H, кв., J=7,0 Гц), 3,67 (2H, т, J=7,1 Гц), 3,99 (3H, с), 6,32 (1H, д, J=2,9 Гц), 6,91 (1H, д, J=1,7 Гц), 7,18 (1H, д, J=2,9 Гц), 7,87 (1H, д, J=2,4 Гц), 7,97 (1H, д, J=2,0 Гц), 8,21 (1H, д, J=2,4 Гц), 10,14 (1H, с).
МС (ESI, m/z): 380 (M+H)+, 378 (M-H)-.
[Пример 606]
[Формула 853]

Способом, аналогичным описанному в примере 223, метил-2-((7-циклогексил-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотинат получали из 7-циклогексил-1-метил-1H-индол-5-амина и метил-2-хлор-5-циклопропилникотината.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,69 (2H, м), 0,87-0,95 (2H, м), 1,42-1,61 (3H, м), 1,62-1,96 (9H, м), 3,89 (3H, с), 3,99 (3H, с), 6,32 (1H, д, J=3,2 Гц), 6,93 (1H, д, J=2,0 Гц), 7,18 (1H, д, J=2,9 Гц), 7,88 (1H, д, J=2,7 Гц), 7,93 (1H, д, J=2,2 Гц), 8,24 (1H, д, J=2,4 Гц), 9,85 (1H, с).
[Пример 607]
[Формула 854]

Способом, аналогичным описанному в примере 603, 2-((7-циклогексил-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту получали из метил-2-((7-циклогексил-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотината.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,69 (2H, м), 0,86-0,94 (2H, м), 1,42-1,60 (5H, м), 1,69-1,97 (7H, м), 3,99 (3H, с), 6,28-6,35 (1H, м), 6,90-6,97 (1H, м), 7,14-7,20 (1H, м), 7,84-7,90 (1H, м), 7,90-7,95 (1H, м), 8,16-8,25 (1H, м), 10,12 (1H, с).
МС (ESI, m/z): 390 (M+H)+, 388 (M-H)-.
[Пример 608]
[Формула 855]

Способом, аналогичным описанному в примере 462, 5-циклопропил-2-((7-(3-метоксипропил)-1-(2-метилпропил)-1H-индол-5-ил)амино)никотиновую кислоту получали из 7-(3-метоксипропил)-1-(2-метилпропил)-1H-индол-5-амина и 2-хлор-5-циклопропилникотиновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,68 (2H, м), 0,80-0,87 (6H, м), 0,87-0,94 (2H, м), 1,76-2,02 (4H, м), 2,90-2,98 (2H, м), 3,28 (3H, с), 3,39-3,45 (2H, м), 4,03 (2H, д, J=7,3 Гц), 6,34 (1H, д, J=3,2 Гц), 6,90 (1H, д, J=2,0 Гц), 7,23 (1H, д, J=3,2 Гц), 7,87 (1H, д, J=2,7 Гц), 7,92 (1H, д, J=2,0 Гц), 8,20 (1H, д, J=2,4 Гц), 10,13 (1H, с).
МС (ESI, m/z): 422 (M+H)+, 420 (M-H)-.
[Пример 609]
[Формула 856]

Способом, аналогичным описанному в примере 462, 5-циклопропил-2-((1-(циклопропилметил)-7-(3-метоксипропил)-1H-индол-5-ил)амино)никотиновую кислоту получали из 1-(циклопропилметил)-7-(3-метоксипропил)-1H-индол-5-амина и 2-хлор-5-циклопропилникотиновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,30-0,37 (2H, м), 0,44-0,53 (2H, м), 0,60-0,68 (2H, м), 0,86-0,94 (2H, м), 1,13-1,25 (1H, м), 1,80-1,94 (3H, м), 2,98-3,08 (2H, м), 3,28 (3H, с), 3,38-3,45 (2H, м), 4,15 (2H, д, J=6,6 Гц), 6,36 (1H, д, J=2,4 Гц), 6,90 (1H, д, J=2,0 Гц), 7,31 (1H, д, J=2,9 Гц), 7,87 (1H, д, J=2,4 Гц), 7,93 (1H, д, J=2,0 Гц), 8,20 (1H, д, J=2,2 Гц), 10,15 (1H, с).
МС (DART, m/z): 420 (M+H)+, 418 (M-H)-.
[Пример 610]
[Формула 857]

Способом, аналогичным описанному в примере 462, 5-циклопропил-2-((7-(3-метоксипропил)-1-пентил-1H-индол-5-ил)амино)никотиновую кислоту получали из 7-(3-метоксипропил)-1-пентил-1H-индол-5-амина и 2-хлор-5-циклопропилникотиновой кислоты.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,68 (2H, м), 0,82-0,93 (5H, м), 1,20-1,36 (4H, м), 1,60-1,74 (2H, м), 1,78-1,94 (3H, м), 2,90-3,00 (2H, м), 3,28 (3H, с), 3,42 (2H, т, J=6,0 Гц), 4,22 (2H, т, J=7,3 Гц), 6,35 (1H, д, J=3,2 Гц), 6,89 (1H, д, J=2,0 Гц), 7,25 (1H, д, J=3,2 Гц), 7,87 (1H, д, J=2,4 Гц), 7,91 (1H, д, J=2,0 Гц), 8,20 (1H, д, J=2,4 Гц), 10,14 (1H, с).
МС (DART, m/z): 436 (M+H)+, 434 (M-H)-.
[Пример 611]
[Формула 858]

Смесь 0,75 г 3-циклогексил-1-метил-1H-индол-5-амина, 0,68 г метил-2-хлор-5-циклопропилникотината, 0,15 г трис(дибензилиденацетон)дипалладия(0), 0,19 г 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 2,15 г карбоната цезия и 7,5 мл бутилацетата нагревали с обратным холодильником в течение 4 часов и 30 минут в атмосфере азота. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и добавляли к фильтрату этилацетат и воду. Органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-85/15) с получением 1,08 г метил-2-((3-циклогексил-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотината в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,68 (2H, м), 0,85-0,94 (2H, м), 1,15-1,32 (1H, м), 1,34-1,50 (4H, м), 1,68-2,05 (6H, м), 2,66-2,79 (1H, м), 3,71 (3H, с), 3,89 (3H, с), 7,02 (1H, с), 7,28-7,32 (2H, м), 7,76 (1H, с), 7,87 (1H, д, J=2,4 Гц), 8,19 (1H, д, J=2,4 Гц), 9,79 (1H, с).
МС (ESI, m/z): 404 (M+H)+.
[Пример 612]
[Формула 859]

К раствору 1,08 г метил-2-((3-циклогексил-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотината в 11 мл метанола и 22 мл тетрагидрофурана при комнатной температуре добавляли 1,1 мл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при 55°C в течение 1 часа и 30 минут. После охлаждения реакционной смеси до комнатной температуры, к смеси добавляли воду, и корректировали полученную смесь до pH 1,4 добавлением 6 M соляной кислоты. К смеси добавляли этилацетат, органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-40/60), к полученному таким образом остатку добавляли воду и метанол, и собирали твердое вещество путем фильтрования с получением 0,26 г 2-((3-циклогексил-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,67 (2H, м), 0,85-0,94 (2H, м), 1,18-1,50 (5H, м), 1,66-2,04 (6H, м), 2,65-2,79 (1H, м), 3,70 (3H, с), 7,01 (1H, с), 7,26-7,32 (2H, м), 7,78 (1H, с), 7,86 (1H, д, J=2,4 Гц), 8,16 (1H, д, J=2,4 Гц), 10,06 (1H, с).
МС (ESI, m/z): 390 (M+H)+, 388 (M-H)-.
[Пример 613]
[Формула 860]

Способом, аналогичным описанному в примере 611, метил-2-((3-циклопентил-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотинат получали из 3-циклопентил-1-метил-1H-индол-5-амина и метил-2-хлор-5-циклопропилникотината.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,68 (2H, м), 0,87-0,94 (2H, м), 1,55-1,82 (6H, м), 1,85-1,96 (1H, м), 2,01-2,14 (2H, м), 3,10-3,21 (1H, м), 3,70 (3H, с), 3,89 (3H, с), 7,06 (1H, с), 7,25-7,33 (2H, м), 7,83 (1H, д, J=1,2 Гц), 7,88 (1H, д, J=2,4 Гц), 8,20 (1H, д, J=2,4 Гц), 9,82 (1H, с).
МС (ESI, m/z): 390 (M+H)+.
[Пример 614]
[Формула 861]

Способом, аналогичным описанному в примере 612, 2-((3-циклопентил-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту получали из метил-2-((3-циклопентил-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотината.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,68 (2H, м), 0,85-0,94 (2H, м), 1,55-1,83 (6H, м), 1,85-1,95 (1H, м), 2,05-2,13 (2H, м), 3,10-3,22 (1H, м), 3,70 (3H, с), 7,05 (1H, с), 7,23-7,32 (2H, м), 7,84-7,88 (2H, м), 8,17 (1H, д, J=2,7 Гц), 10,09 (1H, с).
МС (ESI, m/z): 376 (M+H)+, 374 (M-H)-.
[Пример 615]
[Формула 862]

К раствору 0,1 г бутил-2-((1H-индол-5-ил)амино)-5-циклопропилникотината в 1 мл N,N-диметилформамида добавляли 0,072 г трет-бутоксида калия и 0,074 мл 1,1,1-трифтор-4-йодбутана, и перемешивали полученную смесь при комнатной температуре в течение 45 минут, а затем при 80°C в течение 5 часов. Реакционную смесь охлаждали до комнатной температуры, и добавляли к ней этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-70/30) с получением 0,048 г бутил-5-циклопропил-2-((1-(4,4,4-трифторбутил)-1H-индол-5-ил)амино)никотината в виде желтого масла.
1H-ЯМР (ДМСО-d6): 0,61-0,68 (2H, м), 0,88-0,99 (5H, м), 1,38-1,50 (2H, м), 1,68-1,79 (2H, м), 1,86-2,03 (3H, м), 2,12-2,30 (2H, м), 4,25 (2H, т, J=6,6 Гц), 4,32 (2H, т, J=6,6 Гц), 6,40 (1H, д, J=3,2 Гц), 7,21 (1H, дд, J=8,8, 2,0 Гц), 7,37 (1H, д, J=3,0 Гц), 7,45 (1H, д, J=8,8 Гц), 7,90 (1H, д, J=2,4 Гц), 7,96 (1H, д, J=2,2 Гц), 8,21 (1H, д, J=2,7 Гц), 9,85 (1H, с).
МС (ESI, m/z): 460 (M+H)+.
[Пример 616]
[Формула 863]
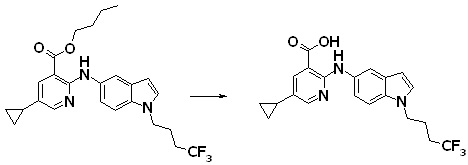
Способом, аналогичным описанному в примере 612, 5-циклопропил-2-((1-(4,4,4-трифторбутил)-1H-индол-5-ил)амино)никотиновую кислоту получали из бутил-5-циклопропил-2-((1-(4,4,4-трифторбутил)-1H-индол-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,68 (2H, м), 0,85-0,94 (2H, м), 1,84-2,03 (3H, м), 2,14-2,29 (2H, м), 4,24 (2H, т, J=6,8 Гц), 6,40 (1H, д, J=2,9 Гц), 7,22 (1H, дд, J=8,8, 2,0 Гц), 7,37 (1H, д, J=3,2 Гц), 7,44 (1H, д, J=9,0 Гц), 7,87 (1H, д, J=2,4 Гц), 7,98 (1H, д, J=1,7 Гц), 8,19 (1H, д, J=2,7 Гц), 10,14 (1H, с).
МС (ESI, m/z): 404 (M+H)+, 402 (M-H)-.
[Пример 617]
[Формула 864]

К раствору 0,1 г бутил-2-((1H-индол-5-ил)амино)-5-циклопропилникотината в 1 мл N,N-диметилформамида при охлаждении на льду добавляли 0,039 г трет-бутоксида калия и перемешивали полученную смесь в течение 5 минут. К смеси добавляли 0,053 мл (3-бромпропил)бензола, и перемешивали полученную смесь в течение 20 минут, а затем перемешивали при комнатной температуре в течение 1 часа и 15 минут. К реакционной смеси добавляли воду, этилацетат и 2 M соляную кислоту, органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-85/15) с получением 0,086 г бутил-5-циклопропил-2-((1-(3-фенилпропил)-1H-индол-5-ил)амино)никотината в виде желтого масла.
1H-ЯМР (ДМСО-d6): 0,60-0,68 (2H, м), 0,88-0,99 (5H, м), 1,38-1,50 (2H, м), 1,68-1,89 (2H, м), 1,87-1,96 (1H, м), 2,02-2,12 (2H, м), 2,54-2,60 (2H, м), 4,18 (2H, т, J=7,1 Гц), 4,32 (2H, т, J=6,6 Гц), 6,39 (1H, д, J=3,0 Гц), 7,15-7,23 (4H, м), 7,25-7,31 (2H, м), 7,34-7,39 (2H, м), 7,90 (1H, д, J=2,4 Гц), 7,95 (1H, д, J=2,0 Гц), 8,20 (1H, д, J=2,7 Гц), 9,85 (1H, с).
МС (ESI, m/z): 468 (M+H)+.
[Пример 618]
[Формула 865]

Способом, аналогичным описанному в примере 612, 5-циклопропил-2-((1-(3-фенилпропил)-1H-индол-5-ил)амино)никотиновую кислоту получали из бутил-5-циклопропил-2-((1-(3-фенилпропил)-1H-индол-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,68 (2H, м), 0,86-0,94 (2H, м), 1,85-1,95 (1H, м), 2,02-2,13 (2H, м), 2,54-2,60 (2H, м), 4,17 (2H, т, J=7,2 Гц), 6,39 (1H, д, J=2,8 Гц), 7,15-7,23 (4H, м), 7,25-7,33 (2H, м), 7,35-7,40 (2H, м), 7,87 (1H, д, J=2,4 Гц), 7,97 (1H, д, J=1,6 Гц), 8,19 (1H, д, J=2,4 Гц), 10,15 (1H, с).
МС (ESI, m/z): 412 (M+H)+, 410 (M-H)-.
[Пример 619]
[Формула 866]

Смесь 1,1 г 1-(2-фенилэтил)-1H-индол-5-амина, 1,9 г 2-хлор-5-циклопропилникотиновой кислоты, 0,36 г пара-толуолсульфоновой кислоты моногидрата, 5 мл изопропилового спирта, 2,5 мл воды и 2,5 мл 6 M соляной кислоты нагревали с обратным холодильником в течение 13 часов и 10 минут. После охлаждения реакционной смеси до комнатной температуры, к смеси добавляли этилацетат и насыщенный водный раствор бикарбоната натрия, органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, промывали насыщенным водным раствором бикарбоната натрия и корректировали до pH 1,7 добавлением 2 M соляной кислоты. Полученную смесь промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-40/60), к полученному таким образом остатку добавляли гексан и этилацетат, и собирали твердое вещество путем фильтрования с получением 0,39 г 5-циклопропил-2-((1-(2-фенилэтил)-1H-индол-5-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,64 (2H, м), 0,82-0,88 (2H, м), 1,83-1,88 (1H, м), 3,06 (2H, т, J=7,3 Гц), 4,38 (2H, т, J=7,3 Гц), 6,33 (1H, д, J=3,0 Гц), 7,18-7,26 (7H, м), 7,43 (1H, д, J=8,8 Гц), 7,87 (1H, д, J=2,4 Гц), 7,94 (1H, д, J=1,7 Гц), 8,19 (1H, д, J=2,4 Гц), 10,12 (1H, с).
МС (ESI, m/z): 398 (M+H)+, 396 (M-H)-.
[Пример 620]
[Формула 867]

Смесь 0,62 г 1-(3-фторбензил)-7-метил-1H-индол-5-амина, 0,52 г метил-2-хлор-5-циклопропилникотината, 0,11 г трис(дибензилиденацетон)дипалладия(0), 0,14 г 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 1,99 г карбоната цезия и 6 мл бутилацетата нагревали с обратным холодильником в течение 11 часов в атмосфере азота. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и промывали осадок на фильтре этилацетатом. Фильтрат и смывы объединяли, к смеси добавляли воду, органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-80/20) с получением 0,76 г метил-5-циклопропил-2-((1-(3-фторбензил)-7-метил-1H-индол-5-ил)амино)никотината в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,68 (2H, м), 0,87-0,95 (2H, м), 1,86-1,96 (1H, м), 2,40 (3H, с), 3,89 (3H, с), 5,64 (2H, с), 6,48 (1H, д, J=2,9 Гц), 6,60-6,66 (1H, м), 6,67-6,74 (1H, м), 6,82-6,87 (1H, м), 7,02-7,11 (1H, м), 7,31-7,39 (1H, м), 7,41 (1H, д, J=2,9 Гц), 7,89 (1H, д, J=2,7 Гц), 7,92 (1H, д, J=1,9 Гц), 8,24 (1H, д, J=2,4 Гц), 9,80 (1H, с).
МС (ESI, m/z): 430 (M+H)+.
[Пример 621]
[Формула 868]
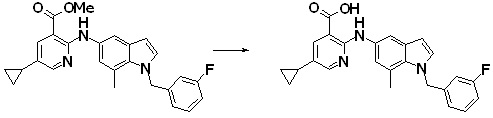
К раствору 0,76 г метил-5-циклопропил-2-((1-(3-фторбензил)-7-метил-1H-индол-5-ил)амино)никотината в 15,2 мл метанола и 10,6 мл тетрагидрофурана при комнатной температуре добавляли 0,76 мл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при 55-60°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры, а затем корректировали до pH 1,8 добавлением 2 M соляной кислоты. К смеси добавляли этилацетат, органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 90/10-40/60), к полученному таким образом остатку добавляли воду и метанол, и собирали твердое вещество путем фильтрования с получением 0,55 г 5-циклопропил-2-((1-(3-фторбензил)-7-метил-1H-индол-5-ил)амино)никотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,69 (2H, м), 0,86-0,96 (2H, м), 1,84-1,95 (1H, м), 2,40 (3H, с), 5,63 (2H, с), 6,47 (1H, д, J=2,8 Гц), 6,59-6,65 (1H, м), 6,67-6,75 (1H, м), 6,83 (1H, м), 7,01-7,12 (1H, м), 7,30-7,43 (2H, м), 7,87 (1H, д, J=2,4 Гц), 7,95 (1H, с), 8,21 (1H, д, J=2,0 Гц), 10,10 (1H, с).
МС (ESI, m/z): 416 (M+H)+, 414 (M-H)-.
[Пример 622]
[Формула 869]
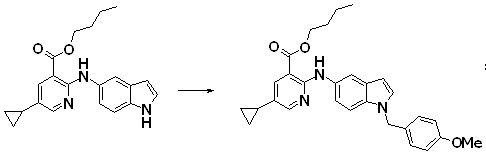
Способом, аналогичным описанному в примере 617, бутил-5-циклопропил-2-((1-(4-метоксибензил)-1H-индол-5-ил)амино)никотинат получали из бутил-2-((1H-индол-5-ил)амино)-5-циклопропилникотината и 4-метоксибензилхлорида.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,66 (2H, м), 0,87-0,98 (5H, м), 1,38-1,50 (2H, м), 1,68-1,79 (2H, м), 1,86-1,95 (1H, м), 3,70 (3H, с), 4,31 (2H, т, J=6,6 Гц), 5,31 (2H, с), 6,41 (1H, д, J=3,2 Гц), 6,83-6,90 (2H, м), 7,12-7,24 (3H, м), 7,38 (1H, д, J=8,8 Гц), 7,45 (1H, д, J=2,9 Гц), 7,89 (1H, д, J=2,4 Гц), 7,93 (1H, д, J=1,9 Гц), 8,19 (1H, д, J=2,4 Гц), 9,81 (1H, с).
МС (ESI, m/z): 470 (M+H)+.
[Пример 623]
[Формула 870]

Способом, аналогичным описанному в примере 612, 5-циклопропил-2-((1-(4-метоксибензил)-1H-индол-5-ил)амино)никотиновую кислоту получали из бутил-5-циклопропил-2-((1-(4-метоксибензил)-1H-индол-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,67 (2H, м), 0,82-0,95 (2H, м), 1,84-1,96 (1H, м), 3,70 (3H, с), 5,31 (2H, с), 6,41 (1H, д, J=2,7 Гц), 6,83-6,90 (2H, м), 7,12-7,24 (3H, м), 7,38 (1H, д, J=9,0 Гц), 7,45 (1H, д, J=3,2 Гц), 7,87 (1H, д, J=2,2 Гц), 7,94 (1H, д, J=1,7 Гц), 8,17 (1H, д, J=2,2 Гц), 10,09 (1H, с).
МС (ESI, m/z): 414 (M+H)+, 412 (M-H)-.
[Пример 624]
[Формула 871]

Смесь 0,10 г 1-метил-7-фенил-1H-индол-5-амина, 0,089 г метил-2,5-дихлорникотината, 0,021 г трис(дибензилиденацетон)-дипалладия(0), 0,026 г 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 0,37 г карбоната цезия и 1 мл бутилацетата нагревали с обратным холодильником в течение 5 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли к ней этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-90/10) с получением 0,049 г метил-5-хлор-2-((1-метил-7-фенил-1H-индол-5-ил)амино)никотината в виде желтого масла.
1H-ЯМР (ДМСО-d6) δ: 3,27 (3H, с), 3,90 (3H, с), 6,48 (1H, д, J=3,2 Гц), 6,98-7,03 (1H, м), 7,27 (1H, д, J=3,2 Гц), 7,40-7,51 (5H, м), 7,91-7,96 (1H, м), 8,19 (1H, д, J=2,2 Гц), 8,41 (1H, д, J=2,7 Гц), 9,96 (1H, с).
МС (ESI, m/z): 392 (M+H)+.
[Пример 625]
[Формула 872]

Способом, аналогичным описанному в примере 612, 5-хлор-2-((1-метил-7-фенил-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-хлор-2-((1-метил-7-фенил-1H-индол-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 3,26 (3H, с), 6, 47 (1H, д, J=3,0 Гц), 6,96-7,01 (1H, м), 7,26 (1H, д, J=2,9 Гц), 7,43-7,50 (5H, м), 7,99 (1H, д, J=1,7 Гц), 8,16 (1H, д, J=2,7 Гц), 8,39 (1H, д, J=2,7 Гц), 10,34 (1H, с).
МС (ESI, m/z): 378 (M+H)+, 376 (M-H)-.
[Пример 626]
[Формула 873]

Смесь 8,9 г 1-(3-фторбензил)-1H-индол-5-амина, 8,8 г метил-5-бром-2-хлорникотината, 8,6 мл 2,6-лутидина, 36 мл ксилола и 9 мл N,N-диметилацетамида перемешивали при 140°C в течение 4 часов. После охлаждения реакционной смеси до комнатной температуры, нерастворимое вещество отфильтровывали, и промывали осадок на фильтре хлороформом. Фильтрат и смывы объединяли, и отгоняли растворитель в условиях пониженного давления. К остатку добавляли воду и этилацетат, органический слой разделяли, последовательно промывали добавлением 2 M соляной кислоты, водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли этилацетат и гексан, и собирали твердое вещество путем фильтрования с получением 2,6 г метил-5-бром-2-((1-(3-фторбензил)-1H-индол-5-ил)амино)никотината в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,90 (3H, с), 5,44 (2H, с), 6,45-6,50 (1H, м), 6,97-7,12 (3H, м), 7,17 (1H, дд, J=8,8, 2,2 Гц), 7,32-7,45 (2H, м), 7,54 (1H, д, J=3,2 Гц), 7,88 (1H, д, J=2,0 Гц), 8,28 (1H, д, J=2,4 Гц), 8,43 (1H, д, J=2,7 Гц), 9,89 (1H, с).
МС (ESI, m/z): 454 (M+H)+.
[Пример 627]
[Формула 874]

Способом, аналогичным описанному в примере 612, 5-бром-2-((1-(3-фторбензил)-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-бром-2-((1-(3-фторбензил)-1H-индол-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 5,44 (2H, с), 6,45-6,49 (1H, м), 6,97-7,12 (3H, м), 7,18 (1H, дд, J=8,8, 2,2 Гц), 7,32-7,44 (2H, м), 7,52 (1H, д, J=3,2 Гц), 7,90 (1H, д, J=2,0 Гц), 8,26 (1H, д, J=2,7 Гц), 8,40 (1H, д, J=2,7 Гц), 10,21 (1H, с).
МС (ESI, m/z): 442 (M+H)+, 440 (M-H)-.
[Пример 628]
[Формула 875]

Смесь 0,55 г 1-бензил-7-метил-1H-индол-5-амина, 0,47 г метил-2-хлор-5-циклопропилникотината, 0,026 г ацетата палладия(II), 0,072 г (S)-(-)-2,2'-бис(дифенилфосфино)-1,1'-бинафтила, 0,64 г карбоната калия и 5,5 мл бутилацетата нагревали с обратным холодильником в течение 2 часов в атмосфере азота. После охлаждения реакционной смеси до комнатной температуры, к ней добавляли этилацетат и воду, органический слой разделяли, и экстрагировали водный слой этилацетатом. Органический слой и экстракт объединяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-85/15) с получением 0,72 г метил-2-((1-бензил-7-метил-1H-индол-5-ил)амино)-5-циклопропилникотината в виде желтого масла.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,68 (2H, м), 0,86-0,95 (2H, м), 1,85-1,95 (1H, м), 2,40 (3H, с), 3,88 (3H, с), 5,61 (2H, с), 6,46 (1H, д, J=2,9 Гц), 6,80-6,84 (1H, м), 6,84-6,90 (2H, м), 7,18-7,25 (1H, м), 7,26-7,33 (2H, м), 7,39 (1H, д, J=3,2 Гц), 7,88 (1H, д, J=2,4 Гц), 7,91 (1H, д, J=2,0 Гц), 8,23 (1H, д, J=2,4 Гц), 9,80 (1H, с).
МС (ESI, m/z): 412 (M+H)+.
[Пример 629]
[Формула 876]
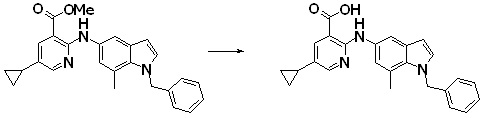
К раствору 0,65 г метил-2-((1-бензил-7-метил-1H-индол-5-ил)амино)-5-циклопропилникотината в 3 мл метанола и 3 мл тетрагидрофурана при комнатной температуре добавляли 0,63 мл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь при 60°C в течение 3 часов и 25 минут. Реакционную смесь охлаждали до комнатной температуры, а затем корректировали до pH 2,1 добавлением 2 M соляной кислоты. К смеси добавляли этилацетат, органический слой разделяли, последовательно промывали насыщенным водным раствором карбоната натрия, 2 M соляной кислоты и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью хлороформ/метанол = 100/0-93/7), и полученный таким образом остаток последовательно промывали водой и метанолом, метанолом, и этилацетатом и метанолом, а затем очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью хлороформ/метанол = 100/0-95/5). К полученному таким образом остатку добавляли воду и метанол, и собирали твердое вещество путем фильтрования с получением 0,22 г 2-((1-бензил-7-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,60-0,68 (2H, м), 0,86-0,94 (2H, м), 1,84-1,94 (1H, м), 2,40 (3H, с), 5,61 (2H, с), 6,45 (1H, д, J=2,9 Гц), 6,81 (1H, с), 6,84-6,90 (2H, м), 7,20-7,33 (3H, м), 7,38 (1H, д, J=3,2 Гц), 7,87 (1H, д, J=2,7 Гц), 7,93 (1H, д, J=1,7 Гц), 8,20 (1H, д, J=2,4 Гц), 10,11 (1H, с).
МС (ESI, m/z): 398 (M+H)+, 396 (M-H)-.
[Пример 630]
[Формула 877]

Смесь 80 мг метил-2-((3-бром-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотината, 59 мг 3-цианофенилбороновой кислоты, 7 мг бис(ди-трет-бутил(4-диметиламинофенил)фосфин)-дихлорпалладия(II), 83 мг карбоната калия, 2 мл толуола и 200 мкл воды нагревали с обратным холодильником в течение 3 часов и 15 минут в атмосфере азота. Реакционную смесь очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-50/50) с получением 15 мг метил-2-((3-(3-цианофенил)-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотината в виде желтого масла.
[Пример 631]
[Формула 878]

Смесь 15 мг метил-2-((3-(3-цианофенил)-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотината, 1 мл метанола, 1 мл тетрагидрофурана и 100 мкл 5 M водного раствора гидроксида натрия перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь корректировали до pH 2 добавлением к ней 2 M соляной кислоты, и отгоняли растворитель в условиях пониженного давления. К полученному остатку добавляли смесь вода/метанол, и собирали твердое вещество путем фильтрования с получением 10 мг 2-((3-(3-цианофенил)-1-метил-1H-индол-5-ил)амино)-5-циклопропилникотиновой кислоты в виде коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,63-0,68 (2H, м), 0,88-0,94 (2H, м), 1,87-1,95 (1H, м), 3,85 (3H, с), 7,36 (1H, дд, J=8,7, 1,8 Гц), 7,48 (1H, д, J=8,8 Гц), 7,64-7,67 (2H, м), 7,87 (1H, с), 7,91 (1H, д, J=2,7 Гц), 8,00-8,04 (1H, м), 8,08 (1H, с), 8,18 (1H, д, J=2,7 Гц), 8,38 (1H, д, J=1,7 Гц), 10,20 (1H, с), 13,46 (1H, уш.с).
МС (ESI, m/z): 410 (M+H)+, 408 (M-H)-.
[Пример 632]
[Формула 879]

К раствору 80 мг метил-5-циклопропил-2-(1H-индол-5-иламино)никотината в 2 мл N,N-диметилформамида добавляли 29 мг трет-бутоксида калия и 36 мкл 1-бром-2-этилбутана и перемешивали полученную смесь при комнатной температуре в течение 1 часа и 15 минут. К смеси дополнительно добавляли 15 мг трет-бутоксида калия и 18 мкл 1-бром-2-этилбутана, и перемешивали полученную смесь в течение 45 минут. К смеси добавляли 15 мг трет-бутоксида калия и 18 мкл 1-бром-2-этилбутана, и перемешивали полученную смесь в течение 50 минут. К смеси добавляли 15 мг трет-бутоксида калия и 18 мкл 1-бром-2-этилбутана, и перемешивали полученную смесь в течение 1 часа и 10 минут. После отстаивания реакционной смеси в течение ночи, к смеси добавляли 200 мкл 5 M водного раствора гидроксида натрия, и перемешивали полученную смесь в течение 3 часов и 30 минут. Реакционную смесь корректировали до pH 2 добавлением к ней 350 мкл 6 M соляной кислоты, а затем добавляли этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-50/50). К полученному таким образом остатку добавляли смесь вода/метанол, и собирали твердое вещество путем фильтрования с получением 56 мг 5-циклопропил-2-((1-(2-этилбутил)-1H-индол-5-ил)амино)никотиновой кислоты в виде светло-оранжевого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,67 (2H, м), 0,85 (6H, т, J=7,6 Гц), 0,87-0,93 (2H, м), 1,24 (4H, квин., J=7,1 Гц), 1,76-1,84 (1H, м), 1,86-1,94 (1H, м), 4,03 (2H, д, J=7,3 Гц), 6,37 (1H, д, J=2,9 Гц), 7,19 (1H, дд, J=8,8, 2,0 Гц), 7,31 (1H, д, J=3,2 Гц), 7,36 (1H, д, J=8,8 Гц), 7,87 (1H, д, J=2,4 Гц), 7,94 (1H, д, J=1,7 Гц), 8,18 (1H, д, J=2,4 Гц), 10,12 (1H, с).
[Пример 633]
[Формула 880]

Смесь 80 мг метил-5-циклопропил-2-(1H-индол-5-иламино)никотината, 38 мг трет-бутоксида калия, 43 мкл 2,4-дифторбензилбромида и 2 мл N,N-диметилформамида перемешивали при комнатной температуре в течение 1 часа и 30 минут, добавляли 200 мкл 5 M водного раствора гидроксида натрия к смеси, и перемешивали полученную смесь в течение ночи. Реакционную смесь корректировали до pH 2 добавлением к ней 6 M соляной кислоты, а затем добавляли этилацетат и воду. Органический слой разделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-50/50). Смесь вода/метанол добавляли к полученному таким образом остатку, и собирали твердое вещество путем фильтрования с получением 69 мг 5-циклопропил-2-((1-(2,4-дифторбензил)-1H-индол-5-ил)амино)никотиновой кислоты в виде бледно-желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,66 (2H, м), 0,86-0,93 (2H, м), 1,85-1,94 (1H, м), 5,43 (2H, с), 6,44 (1H, д, J=2,9 Гц), 6,99-7,06 (1H, м), 7,09-7,16 (1H, м), 7,19 (1H, дд, J=8,8, 2,0 Гц), 7,24-7,32 (1H, м), 7,37-7,43 (2H, м), 7,86 (1H, д, J=2,4 Гц), 7,97 (1H, д, J=1,7 Гц), 8,18 (1H, д, J=2,4 Гц), 10,13 (1H, с).
МС (ESI, m/z): 420 (M+H)+.
[Пример 634]
[Формула 881]
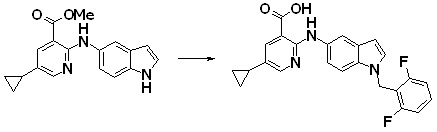
Способом, аналогичным описанному в примере 633, 5-циклопропил-2-((1-(2,6-дифторбензил)-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-(1H-индол-5-иламино)никотината и 2,6-дифторбензилбромида.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,66 (2H, м), 0,87-0,94 (2H, м), 1,85-1,93 (1H, м), 5,43 (2H, с), 6,40 (1H, д, J=3,2 Гц), 7,12-7,19 (2H, м), 7,23 (1H, дд, J=8,7, 1,8 Гц), 7,32 (1H, д, J=2,7 Гц), 7,40-7,48 (2H, м), 7,86 (1H, д, J=2,4 Гц), 7,95 (1H, д, J=1,7 Гц), 8,17 (1H, д, J=2,4 Гц), 10,12 (1H, с), 13,41 (1H, уш.с).
МС (ESI, m/z): 420 (M+H)+.
[Пример 635]
[Формула 882]

Способом, аналогичным описанному в примере 633, 5-циклопропил-2-((1-(3,4-дифторбензил)-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-(1H-индол-5-иламино)никотината и 3,4-дифторбензилбромида.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,67 (2H, м), 0,88-0,94 (2H, м), 1,86-1,94 (1H, м), 5,40 (2H, с), 6,45 (1H, д, J=3,2 Гц), 7,00-7,06 (1H, м), 7,18 (1H, д, J=8,8 Гц), 7,26-7,33 (1H, м), 7,33-7,42 (2H, м), 7,50 (1H, д, J=2,9 Гц), 7,87 (1H, д, J=2,2 Гц), 7,98 (1H, с), 8,18 (1H, д, J=1,7 Гц), 10,12 (1H, с), 13,42 (1H, уш.с).
МС (ESI, m/z): 420 (M+H)+, 418 (M-H)-.
[Пример 636]
[Формула 883]

Способом, аналогичным описанному в примере 633, 5-циклопропил-2-((1-пропил-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-(1H-индол-5-иламино)никотината и 1-бромпропана.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,67 (2H, м), 0,84 (3H, т, J=7,3 Гц), 0,87-0,93 (2H, м), 1,77 (2H, секст., J=7,3 Гц), 1,86-1,93 (1H, м), 4,11 (2H, т, J=6,8 Гц), 6,36 (1H, д, J=2,9 Гц), 7,19 (1H, дд, J=8,5, 1,7 Гц), 7,33 (1H, д, J=2,9 Гц), 7,40 (1H, д, J=8,8 Гц), 7,87 (1H, д, J=2,4 Гц), 7,95 (1H, д, J=1,7 Гц), 8,19 (1H, д, J=2,4 Гц), 10,12 (1H, с), 13,40 (1H, уш.с).
МС (ESI, m/z): 336 (M+H)+, 334 (M-H)-.
[Пример 637]
[Формула 884]

Способом, аналогичным описанному в примере 633, 2-((1-бутил-1H-индол-5-ил)амино)-5-циклопропилникотиновую кислоту получали из метил-5-циклопропил-2-(1H-индол-5-иламино)никотината и 1-бромбутана.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,67 (2H, м), 0,86-0,93 (5H, м), 1,20-1,29 (2H, м), 1,73 (2H, квин., J=7,3 Гц), 1,86-1,94 (1H, м), 4,14 (2H, т, J=7,0 Гц), 6,36 (1H, д, J=2,9 Гц), 7,19 (1H, дд, J=8,7, 1,8 Гц), 7,32 (1H, д, J=2,9 Гц), 7,39 (1H, д, J=8,5 Гц), 7,87 (1H, д, J=2,4 Гц), 7,94 (1H, д, J=2,0 Гц), 8,18 (1H, д, J=2,7 Гц), 10,14 (1H, с), 13,40 (1H, уш.с).
[Пример 638]
[Формула 885]

Способом, аналогичным описанному в примере 633, 5-циклопропил-2-((1-пентил-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-(1H-индол-5-иламино)никотината и 1-бромпентана.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,67 (2H, м), 0,84 (3H, т, J=7,1 Гц), 0,88-0,94 (2H, м), 1,22-1,34 (4H, м), 1,75 (2H, квин., J=7,3 Гц), 1,91-1,99 (1H, м), 4,13 (2H, т, J=7,0 Гц), 6,36 (1H, д, J=2,9 Гц), 7,19 (1H, д, J=8,8 Гц), 7,33 (1H, д, J=2,9 Гц), 7,39 (1H, д, J=8,5 Гц), 7,87 (1H, д, J=2,0 Гц), 7,95 (1H, с), 8,19 (1H, д, J=2,2 Гц), 10,12 (1H, с), 13,39 (1H, уш.с).
[Пример 639]
[Формула 886]

Способом, аналогичным описанному в примере 633, 5-циклопропил-2-((1-гексил-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-(1H-индол-5-иламино)никотината и 1-бромгексана.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,67 (2H, м), 0,81-0,86 (3H, м), 0,88-0,94 (2H, м), 1,25-1,33 (6H, м), 1,66-1,79 (2H, м), 1,86-1,94 (1H, м), 4,13 (2H, т, J=7,0 Гц), 6,36 (1H, д, J=2,7 Гц), 7,19 (1H, дд, J=8,8, 1,7 Гц), 7,32 (1H, д, J=2,9 Гц), 7,39 (1H, д, J=8,5 Гц), 7,87 (1H, д, J=2,4 Гц), 7,95 (1H, д, J=1,7 Гц), 8,19 (1H, д, J=2,4 Гц), 10,12 (1H, с), 13,40 (1H, уш.с).
[Пример 640]
[Формула 887]

Способом, аналогичным описанному в примере 633, 5-циклопропил-2-((1-гептил-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-(1H-индол-5-иламино)никотината и 1-бромгептана.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,67 (2H, м), 0,84 (3H, т, J=6,8 Гц), 0,87-0,94 (2H, м), 1,22-1,31 (8H, м), 1,70-1,79 (2H, м), 1,91-1,99 (1H, м), 4,13 (2H, т, J=7,0 Гц), 6,36 (1H, д, J=2,9 Гц), 7,19 (1H, дд, J=8,8, 2,0 Гц), 7,32 (1H, д, J=2,9 Гц), 7,38 (1H, д, J=8,8 Гц), 7,87 (1H, д, J=2,7 Гц), 7,94 (1H, д, J=1,7 Гц), 8,19 (1H, д, J=2,4 Гц), 10,11 (1H, с), 13,39 (1H, уш.с).
МС (ESI, m/z): 393 (M+H)+, 391 (M-H)-.
[Пример 641]
[Формула 888]

Способом, аналогичным описанному в примере 633, 5-циклопропил-2-((1-(2,5-дифторбензил)-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-(1H-индол-5-иламино)никотината и 2,5-дифторбензилбромида.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,67 (2H, м), 0,88-0,94 (2H, м), 1,85-1,95 (1H, м), 5,45 (2H, с), 6,46 (1H, д, J=2,9 Гц), 6,78-6,84 (1H, м), 7,15-7,23 (2H, м), 7,27-7,34 (1H, м), 7,41 (1H, д, J=8,8 Гц), 7,45 (1H, д, J=3,2 Гц), 7,87 (1H, д, J=2,7 Гц), 7,99 (1H, д, J=2,0 Гц), 8,19 (1H, д, J=2,4 Гц), 10,13 (1H, с), 13,42 (1H, уш.с).
МС (ESI, m/z): 420 (M+H)+, 418 (M-H)-.
[Пример 642]
[Формула 889]

Способом, аналогичным описанному в примере 633, 5-циклопропил-2-((1-(2,3-дифторбензил)-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-(1H-индол-5-иламино)никотината и 2,3-дифторбензилбромида.
1H-ЯМР (ДМСО-d6) δ: 0,62-0,67 (2H, м), 0,88-0,94 (2H, м), 1,87-1,96 (1H, м), 5,53 (2H, с), 6,47 (1H, д, J=2,9 Гц), 6,79-6,85 (1H, м), 7,09-7,17 (1H, м), 7,19 (1H, дд, J=8,7, 2,1 Гц), 7,31-7,39 (1H, м), 7,42 (1H, д, J=8,5 Гц), 7,45 (1H, д, J=2,9 Гц), 7,91 (1H, д, J=2,2 Гц), 7,95 (1H, д, J=2,0 Гц), 8,14 (1H, д, J=2,4 Гц), 10,16 (1H, с).
МС (ESI, m/z): 420 (M+H)+, 418 (M-H)-.
[Пример 643]
[Формула 890]

Способом, аналогичным описанному в примере 633, 5-циклопропил-2-((1-(2,4,5-трифторбензил)-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-циклопропил-2-(1H-индол-5-иламино)никотината и 2,4,5-трифторбензилбромида.
1H-ЯМР (ДМСО-d6) δ: 0,61-0,66 (2H, м), 0,88-0,93 (2H, м), 1,85-1,93 (1H, м), 5,42 (2H, с), 6,45 (1H, д, J=3,2 Гц), 7,17-7,25 (2H, м), 7,41-7,45 (2H, м), 7,56-7,64 (1H, м), 7,87 (1H, д, J=2,4 Гц), 7,98 (1H, д, J=2,0 Гц), 8,18 (1H, д, J=2,4 Гц), 10,13 (1H, с).
МС (ESI, m/z): 438 (M+H)+, 436 (M-H)-.
[Пример 644]
[Формула 891]

Способом, аналогичным описанному в примере 633, метил-5-хлор-2-((1-(3-фторбензил)-1H-индол-5-ил)амино)никотинат получали из метил-5-хлор-2-(1H-индол-5-иламино)никотината и 3-фторбензилбромида.
[Пример 645]
[Формула 892]
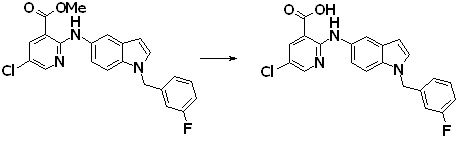
Способом, аналогичным описанному в примере 631, 5-хлор-2-((1-(3-фторбензил)-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-хлор-2-((1-(3-фторбензил)-1H-индол-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 5,44 (2H, с), 6,47 (1H, д, J=3,2 Гц), 6,98-7,04 (2H, м), 7,05-7,11 (1H, м), 7,16-7,20 (1H, м), 7,32-7,42 (2H, м), 7,52 (1H, д, J=2,7 Гц), 7,89-7,92 (1H, м), 8,16 (1H, дд, J=3,9, 1,0 Гц), 8,35 (1H, д, J=2,7 Гц), 10,20 (1H, с), 13,86 (1H, уш.с).
МС (ESI, m/z): 397 (M+H)+, 395 (M-H)-.
[Пример 646]
[Формула 893]
Смесь 89 мг 1-метил-3-фенил-1H-индол-5-амина, 80 мг метил-2,5-дихлорникотината, 17 мг трис(дибензилиденацетон)-дипалладия(0), 23 мг 4,5'-бис(дифенилфосфино)-9,9'-диметилксантена, 253 мг карбоната цезия и 3 мл бутилацетата нагревали с обратным холодильником в течение 4 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, а затем очищали методом колоночной хроматографии на силикагеле (градиентное элюирование смесью гексан/этилацетат = 100/0-30/70), к полученному остатку добавляли метанол, и собирали твердое вещество путем фильтрования с получением 80 мг метил-5-хлор-2-((1-метил-3-фенил-1H-индол-5-ил)амино)никотината в виде желтого твердого вещества.
[Пример 647]
[Формула 894]

Способом, аналогичным описанному в примере 631, 5-хлор-2-((1-метил-3-фенил-1H-индол-5-ил)амино)никотиновую кислоту получали из метил-5-хлор-2-((1-метил-3-фенил-1H-индол-5-ил)амино)никотината.
1H-ЯМР (ДМСО-d6) δ: 3,84 (3H, с), 7,20-7,25 (1H, м), 7,33 (1H, дд, J=8,9, 1,8 Гц), 7,41-7,48 (3H, м), 7,62-7,67 (2H, м), 7,67 (1H, с), 8,15-8,18 (2H, м), 8,34 (1H, д, J=2,7 Гц), 10,23 (1H, с).
МС (ESI, m/z): 379 (M+H)+, 377 (M-H)-.
Далее, применимость типовых соединений согласно настоящему изобретению будет описана со ссылкой на последующие тестовые примеры.
[Тестовый Пример 1]
(Тест на ингибирование пролиферации клеток)
2×103 нормальных неонатальных эпидермальных кератиноцитов крайней плоти человека (NHEK-F) (Kurabo, KK-4009) суспендировали в 100 мкл среды Humedia-EG2 (Kurabo, KK-2150S), помещали в 96-луночный планшет и инкубировали в течение ночи. Тестируемое соединение добавляли на следующие сутки, и инкубировали клетки последующие трое суток. Число клеток определяли с использованием ATPlite (PerkinElmer, 6016739) или CellTiterGlo (Promega, G7573).
Степень ингибирования вычисляли по следующей формуле для определения концентрации соединения, при которой число клеток снижается на 50% (IC50).
Степень ингибирования (%) = 100 - (число клеток в присутствии тестируемого соединения/число клеток в отсутствие тестируемого соединения)×100
Результаты представлены в Таблицах 1-1, 1-2 и 1-3.
Обозначения в таблицах имеют следующие значения:
A: IC50≤10 нмоль/л
B: 10 нмоль/л
C: 100 нмоль/л



Соединения согласно настоящему изобретению демонстрировали превосходный эффект ингибирования пролиферации клеток.
[Тестовый Пример 2]
(Тест на ингибирование продукции TNFα)
7×104 мышиных макрофагов клеточной линии Raw264.7 суспендировали в 100 мкл среды RPMI1640, содержащей 10% фетальной бычьей сыворотки, помещали в 96-луночный планшет и инкубировали в течение ночи. Культуральный супернатант удаляли, и добавляли тестируемое соединение, разбавленное средой RPMI1640, содержащей 1% фетальной бычьей сыворотки (конечная концентрация: 1 мкмоль/л). Спустя час после добавления, добавляли LPS (B4:0111) (Sigma-Aldrich, L2630) до конечной концентрации 1 мкг/мл. Спустя 16 часов после стимуляции, культуральный супернатант собирали, и определяли количество продуцированного TNFα в культуральном супернатанте с использованием набора ELISA (R&D Systems, MTA00B).
Степень ингибирования вычисляли по следующей формуле:
Степень ингибирования (%) = 100 - (количество TNFα, продуцированное в присутствии тестируемого соединения/количество TNFα, продуцированное в отсутствие тестируемого соединения)×100
Соединения примера 2, примера 11, примера 14, примера 17, примера 21, примера 27, примера 29, примера 32, примера 35, примера 37, примера 39, примера 59, примера 61, примера 63, примера 65, примера 67, примера 69, примера 71, примера 73, примера 75, примера 78, примера 80, примера 82, примера 84, примера 90, примера 94, примера 96, примера 98, примера 102, примера 104, примера 106-1, примера 106-2, примера 107, примера 108, примера 110, примера 112, примера 194, примера 196, примера 198, примера 202, примера 255, примера 265, примера 267, примера 269, примера 275, примера 277, примера 281, примера 283, примера 287, примера 298, примера 300, примера 331, примера 333, примера 335, примера 337, примера 339, примера 354, примера 357, примера 361, примера 363, примера 373 и примера 375 ингибировали продукцию TNFα на 50% или более в концентрации 1 мкмоль/л.
Соединения согласно настоящему изобретению были высокоэффективны в ингибировании продукции TNFα.
[Тестовый Пример 3]
(Мышиная модель отека уха, индуцированного TPA)
Использовали самок мышей Balb/c в возрасте 7 недель (Charles River Laboratories Japan). Для индукции отека уха и акантоза, на сутки 0, сутки 2, сутки 4, сутки 7 и сутки 9 на наружную часть уха мыши наносили 20 мкл раствора ТРА в концентрации 20 нг/мл (Wako Pure Chemical Industries, 162-23591), разбавленного 5% ДМСО в ацетоне. Тестируемое соединение разбавляли в 5% растворе ДМСО в ацетоне (концентрация 1% масс./об.), и на сутки 0-9 на наружную часть уха наносили 20 мкл конечного раствора один в сутки. В качестве контрольной группы аналогично наносили 5% раствор ДМСО в ацетоне. Раствор TPA и раствор тестируемого соединения смешивали и наносили в сутки применения ТРА (сутки 0, сутки 2, сутки 4, сутки 7 и сутки 9). Толщину уха хронологически измеряли на сутки 0-4 и на сутки 7-10 с использованием микрометра (Mitutoyo, MDC-25MJT). Изменение толщины уха и степень ингибирования определяли согласно следующим формулам:
Изменение толщины уха = (толщина уха, измеренная на сутки 10) - (толщина уха, измеренная на сутки 0 перед применением TPA)
Степень ингибирования (%) = 100 - (изменение толщины уха в группе с использованием тестируемого соединения/изменение толщины уха в контрольной группе)×100
Степень ингибирования на 10 сутки составляла 20% или более для соединений примера 29, примера 32, примера 35, примера 37, примера 39, примера 71, примера 75, примера 90, примера 94, примера 126, примера 128, примера 130, примера 133, примера 138, примера 142, примера 149, примера 153, примера 189, примера 206, примера 208, примера 222, примера 224, примера 233, примера 237, примера 239, примера 241, примера 275, примера 411, примера 439, примера 448, примера 450, примера 453, примера 455, примера 456, примера 457, примера 458, примера 460, примера 464, примера 466, примера 468, примера 470, примера 482, примера 484, примера 485, примера 497, примера 523, примера 543, примера 557, примера 565, примера 585, примера 588, примера 595, примера 596, примера 597, примера 598, примера 619, примера 621, примера 632, примера 633, примера 635, примера 637, примера 638, примера 639, примера 641 и примера 642.
Было продемонстрировано, что соединения согласно настоящему изобретению обладают эффектом уменьшения толщины уха, а потому применимы для лечения, такого как профилактика или терапия псориаза.
Промышленная применимость
Новые производные амина или их соли согласно настоящему изобретению применимы для лечения, такого как профилактика или терапия заболеваний, связанных с чрезмерной пролиферацией кератиноцитов или чрезмерной продукцией TNFα, поскольку они высокоэффективно ингибируют пролиферацию кератиноцитов и высокоэффективно ингибируют продукцию TNFα.
Реферат
Изобретение относится к области органической химии, а именно к гетероциклическому соединению формулы (1), где G, Gи Gпредставляют собой CH или атом азота, где максимально 2 из G, Gи Gпредставляют собой атом азота; Rпредставляет собой атом хлора, атом брома, Cалкильную группу, трифторметильную группу, Cциклоалкильную группу, фенильную группу или Cалкоксигруппу; Rпредставляет собой -COOR(где Rпредставляет собой атом водорода) или -C(O)N(R)SOR(где Rпредставляет собой атом водорода; и Rпредставляет собой Cалкильную группу;) Rпредставляет собой атом водорода; и Rпредставляет собой необязательно замещенную нафтильную группу, необязательно замещенную флуоренильную группу; необязательно замещенную 1-2 группами индолильную группу; замещенную индазолильную группу; замещенную тетрагидрохинолильную группу; замещенную изохинолильную группу; замещенную дигидрохиназолинильную группу; или замещенную дигидробензотиазолильную группу; необязательно замещенную тетрагидрокарбазолильную группу; при условии, что (1) если Rпредставляет собой необязательно замещенную конденсированную нафтильную группу, то Gпредставляет собой атом азота; и (2) если Gпредставляет собой CH, Gпредставляет собой CH, Gпредставляет собой CH, Rпредставляет собой атом хлора, Cалкильную группу или трифторметильную группу, Rпредставляет собой -COOH, и Rпредставляет собой атом водорода, то Rпредставляет собой группу, представленную общими формулами (2-1)-(2-4), (где X, X, Xявляются одинаковыми и представляют собой CR(где Rпредставляет собой атом водорода); Xпредставляет собой атом азота; Xпредставляет собой CR(где Rпредставляет собой атом водорода) или атом азота; Xпредставляет собой CR(где Rпредставляет собой атом водорода, Cалкильную группу, замещенную 1 гидроксильной группой) или атом азота; Xпредставляет собой CR(где Rпредставляет собой атом водорода, фенил-Салкильную группу, бензоильную группу) или атом азота; Xпредставляет собой CH, CH-CHили C=O; Xпредставляет собой CHили C=O; Xпредставляет собой CH, CH-CH, C=O, NR(где Rпредставляет собой атом водорода, Cалкильную группу), атом кислорода или атом серы; и Rпредставляет собой Cалкильную группу, Cциклоалкильную группу, Cциклоалкил-Cалкильную группу, необязательно замещенную фенильную группу, необязательно замещенную 1 группой фенил-Cалкильную группу, бензоильную группу, гетероциклическую группу (выбранную из пиридинила, тиазолила, пиразинила, хинолинила, метилтиопиримидинила, метилпиридазинила) или гетероцикликлил-Cалкильную группу (где гетероциклическая группа выбрана из хинолинила, тиазолила, пиридинила); при этом указанные заместители раскрыты в формуле изобретения. Также изобретение относится к фармацевтической композиции, ингибитору пролиферации кератинов и продукции TNFα и средству на основе соединения формулы (1). Технический результат: получено новое гетероциклическое соединение, обладающее ингибирующей продукцию TNFα активностью. 3 табл., 650 пр.
Формула







Комментарии