Новые 3,4-дигидро-2н-изохинолин-1-оны и 2,3-дигидро-изоиндол-1-оны - RU2689421C2
Код документа: RU2689421C2
Описание
Настоящее изобретение относится к органическим соединениям, полезным для лечения или профилактики у млекопитающих, и в частности к ингибиторам альдостерон синтазы для лечения или профилактики хронического заболевания почек, застойной сердечной недостаточности, гипертонии, первичного гиперальдостеронизма и синдрома Кушинга.
В настоящем изобретении предложены новые соединения формулы (I)

где
R1, R2, R3 и R4 независимо выбраны из Н, алкила и циклоалкила;
R5, R6, R7 и R9 независимо выбраны из Н, алкила, галогена и гидрокси;
R8 и R11 вместе образуют -CH2-CH2-;
R10 представляет собой Н или R10 и R11 вместе образуют -(CH2)w-;
А представляет собой -C(O)-или -S(O)2-;
В представляет собой -C- или -N-;
R12 представляет собой алкил, циклоалкил или замещенный гетероарил, где замещенный гетероарил замещен одним-тремя заместителями, независимо выбранными из Н, алкила, циклоалкила, гидрокси, алкокси, циано и галогена;
R13 представляет собой галоген, циано, алкокси или галоалкокси;
R14 представляет собой Н, алкил или галоген;
m, n и p независимо выбраны из 0 и 1;
w представляет собой 1, 2 или 3;
при условии, что 2-[5-(1-ацетил-пирролидин-3-ил)-пиридин-3-ил]-5-хлор-3,3-диметил-2,3-дигидро-изоиндол-1-он и 2-(1'-ацетил-1',2',3',4',5',6'-гексагидро-[3,4']бипиридинил-5-ил)-5-хлор-3,3-диметил-2,3-дигидро-изоиндол-1-он исключены;
и их фармацевтически приемлемые соли.
В настоящей заявке описаны ингибиторы альдостерон синтазы, которые имеют потенциал для защиты от повреждений органа/ткани, вызванных абсолютным или относительным избытком альдостерона. Гипертония затрагивает около 20% взрослого населения в развитых странах. У лиц 60 лет и старше этот показатель возрастает до более 60%. Страдающие от гипертонии показывают повышенный риск других физиологических осложнений, включая инсульт, инфаркт миокарда, мерцательную аритмию, сердечную недостаточность, заболевания периферических сосудов и почек. Система ренин-ангиотензин-альдостерон представляет собой путь, который связан с гипертонией, объемом и солевым балансом и, по последним данным, вносит свой вклад непосредственно в конечное повреждение органов на поздних стадиях сердечной недостаточности или заболеваний почек. Ингибиторы АСЕ и блокаторы рецепторов ангиотензина (БРА) успешно используются для повышения продолжительности и качества жизни пациентов. Эти препараты не дают максимальной защиты. У относительно большого количества пациентов АСЕ и БРА приводят к так называемому прорыву альдостерона, явлению, при котором уровень альдостерона после первоначального спада возвращается к патологическому уровню. Было показано, что вредные последствия ненадлежащего повышения уровня альдостерона (в отношении потребления соли/уровней) можно свести к минимуму блокадой альдостерона с помощью минералокортикоидных антагонистов. Прямое ингибирование синтеза альдостерона, как ожидается, обеспечит еще более надежную защиту, поскольку это также уменьшит не-геномные эффекты альдостерона как таковые.
Влияние альдостерона на Na/K транспорт приводит к увеличению реабсорбции натрия и воды и выведения калия в почках. В целом это приводит к увеличению объема крови и, следовательно, повышению артериального давления. Помимо своей роли в регуляции реабсорбции натрия почками альдостерон может оказывать вредное воздействие на почки, сердце и сосудистую систему, особенно в условиях "высокого натрия". Было показано, что при таких условиях альдостерон приводит к повышенному окислительному стрессу, который в конечном счете может способствовать повреждению органов. Инфузия альдостерона крысам с нарушенной функцией почек (либо обработанных высокой концентрацией соли, либо с односторонней нефрэктомией) индуцирует широкий спектр травм почки, включая расширение клубочков, травмы подоцитов, интерстициальные воспаления, пролиферацию мезангиальных клеток и фиброз, проявляемый протеинурией. Более конкретно было показано, что альдостерон увеличивает экспрессию молекул адгезии ICAM-1 в почках. ICAM-1 является критически важным участником воспаления клубочков. Аналогичным образом, было показано, что альдостерон увеличивает экспрессию провоспалительных цитокинов, таких как интерлейкин IL-1b и IL-6, МСР-1 и остеопонтин. На клеточном уровне было показано, что в фибробластах сосудов альдостерон повышал экспрессию мРНК коллагена I типа, медиатора фиброза, альдостерон также стимулирует накопление коллагена типа IV в мезангиальных клетках птиц и индуцирует экспрессию ингибитора активатора плазминогена-1 (PAI-1) в клетках гладких мышц. В целом альдостерон является ключевым гормоном, вовлеченным в повреждение почек, гиперальдостерон играет столь же важную роль в опосредовании сердечнососудистого риска.
Существует достаточно доклинических доказательств того, что MR-антагонисты (спиронолактон и эплеренон) улучшают кровяное давление, сердечную и почечную функции в различных доклинических моделях.
Самые последние доклинические исследования подчеркивают важную роль CYP11B2 в сердечно-сосудистых и почечных заболеваниях и смертности. Ингибитор CYP11B2 FAD286 и MR антагонист спиронолактон были протестированы на крысиной модели хронического заболевания почек (высокий уровень ангиотензина II; высокий уровень соли и уни-нефроэктомия). Ангиотензин II и обработка высокой концентрацией соли вызвали альбуминурию, азотемия, реноваскулярную гипертрофию, травмы клубочков, увеличение PAI-1, и экспрессию мРНК остеопонтина, а также тубулоинтерстициальный фиброз. Оба препарата предотвращают эти почечные эффекты и ослабляются сердечную и аортальную медиальную гипертрофию. После 4 недель лечения с помощью FAD286, уровень альдостерона в плазме сократился, в то время как спиронолактон увеличивал уровень альдостерона через 4 и 8 недель лечения. Аналогично, только спиронолактон, но не FAD286, увеличивает уровень ангиотензина II и стимулированную солью экспрессию мРНК PAI-1 в аорте и сердце. В других исследованиях ингибитор CYP11B2 FAD286 улучшал кровяное давление и сердечно-сосудистую функцию и структуру у крыс с экспериментальной сердечной недостаточностью. В тех же исследованиях было показано, что FAD286 улучшает функцию и морфологию почек.
Введение перорально активного CYP11B2 ингибитора, LCI699, пациентам с первичным гиперальдостеронизмом, приводит к заключению, что он эффективно ингибирует CYP11B2 у пациентов с первичным гиперальдостеронизмом, что позволяет значительно снизить уровни циркулирующего альдостерона, и что он корректирует гипокалиемию и мягко снижает артериальное давление. Воздействие на глюкокортикоидные направления соответствовало низкой селективности соединения и скрытому ингибированию синтеза кортизола. Взятые вместе эти данные поддерживают концепцию, что ингибитор CYP11B2 может понизить неуместно высокие уровни альдостерона. Достижение хорошей селективности против CYP11B1 должно сопровождаться отсутствием нежелательных побочных эффектов на НРА направлении и будет отличать различные ингибиторы CYP11В2.
Соединения настоящего изобретения в соответствии с формулой (I) являются сильными ингибиторами CYPB11B2 и обладают улучшенной селективностью по отношении к CYP11B2 по сравнению с CYP11B1, совмещенной с улучшенной метаболической стабильностью.
Объектами настоящего изобретения являются соединения формулы (I) и их вышеуказанные соли и сложные эфиры и их применение в качестве терапевтически активных веществ, способ получения указанных соединений, промежуточные соединения, фармацевтические композиции, лекарственные средства, содержащие указанные соединения, их фармацевтически приемлемые соли или сложные эфиры, применение указанных соединений, солей или эфиров для лечения или профилактики заболеваний, особенно для лечения или профилактики хронического заболевания почек, застойной сердечной недостаточности, гипертонии, первичного гиперальдостеронизма и синдрома Кушинга и применение указанных соединений, солей или эфиров для изготовления лекарственных средств для лечения или профилактики хронического заболевания почек, застойной сердечной недостаточности, гипертонии, первичного гиперальдостеронизма и синдрома Кушинга.
Термин "алкил" обозначает одновалентную линейную или разветвленную насыщенную углеводородную группу, содержащую от 1 до 12 атомов углерода. В конкретных вариантах осуществления алкил имеет от 1 до 7 атомов углерода, и в более конкретных вариантах осуществления от 1 до 4 атомов углерода. Примеры алкилов включают метил, этил, пропил и изопропил, н-бутил, изо-бутил, втор-бутил, и т.д. Конкретные алкильные группы включают метил, этил, пропил и изопропил. Более конкретными алкильными группами являются метил и этил.
Термин "циклоалкил" обозначает моновалентную насыщенную моноциклическую углеводородную группу из 3-10 кольцевых атомов углерода. В конкретных воплощения изобретения циклоалкил обозначает моновалентную насыщенную моноциклическую углеводородную группу из 3-8 кольцевых атомов углерода. Примерами циклоалкилов являются циклопропил, циклобутанил, циклопентил, циклогексил или циклогептил. Конкретной циклоалкильной группой является циклопропил.
Термин "галоген" и "гало" используются здесь взаимозаменяемо и обозначают фтор, хлор, бром или йод. Конкретным галогенами являются хлор и фтор. Конкретным галогеном является хлор.
Термин "гетероарил" означает одновалентную ароматическую гетероциклическую моно- или бициклическую кольцевую систему из 5-12 кольцевых атомов, содержащую 1, 2, 3 или 4 гетероатома, выбранных из N, О и S, остальные кольцевые атомы являются углеродом. Примеры гетероарильных групп включают пирролил, фуранил, тиенил, имидазолил, оксазолил, тиазолил, триазолил, оксадиазолил, тиадиазолил, тетразолил, пиридинил, пиразинил, пиразолил, пиридазинил, пиримидинил, триазинил, азепинил, диазепинил, изоксазолил, бензофуранил, изотиазолил, бензотиенил, индолил, изоиндолил, изобензофуранил, бензимидазолил, бензоксазолил, бензоизоксазолил, бензотиазолил, бензоизотиазолил, бензооксадиазолил, бензотиадиазолил, бензотриазолил, пуринил, хинолинил, изохинолинил, хиназолинил или хиноксалинил. Конкретная гетероарильная группа представляет собой пиридинил. Также конкретными гетероарильными группами являются имидазолил, изоксазолил, оксазолил, пиразолил и пиримидинил. Дополнительными конкретными гетероарильными группами являются пиридинил и пиразолил.
Термин "гидрокси" обозначает -OH группу.
Термин "фармацевтически приемлемые соли" относится к солям, которые сохраняют биологическую эффективность и свойства свободных оснований или свободных кислот, которые не являются биологически или иным образом нежелательными. Соли образованы с неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п., предпочтительно, соляная кислота, и органическими кислотами, такими как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, малеиновая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота, N-ацетилцистеин и т.п. Кроме того, эти соли могут быть получены путем добавления неорганического основания или органического основания к свободной кислоте. Соли, полученные из неорганических оснований включают, без ограничения, соли натрия, калия, лития, аммония, кальция и магния и т.п. Соли, полученные из органических оснований, включают, без ограничения, соли первичных, вторичных и третичных аминов, замещенных аминов, включая природные замещенные амины, циклические амины и основные ионообменные смолы, такие как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, этаноламин, лизин, аргинин, N-этилпиперидин, пиперидин, полиаминовые смолы и т.п. Конкретными фармацевтически приемлемыми солями соединений формулы (I) являются соли соляной кислоты, соли метансульфоновой кислоты и соли лимонной кислоты.
"Фармацевтически приемлемые эфиры" означает, что соединения общей формулы (I) могут быть дериватизированы по функциональным группам с получением производных, которые способны превратиться обратно в исходные соединения в условиях in vivo. Примеры таких соединений включают физиологически приемлемые и метаболически лабильные эфирные производные, такие как метоксиметиловые эфиры, метилтиометиловые эфиры и пивалоилоксиметиловые эфиры. Дополнительно, любые физиологически приемлемые эквиваленты соединений общей формулы (I), аналогичные метаболически лабильным эфирам, которые способны превращаться в исходные соединения общей формулы (I) in vivo, включены в объем настоящего изобретения.
Термин "защитная группа" обозначает группу, которая селективно блокирует реакционноспособный участок в многофункциональном соединении таким образом, что химическая реакция может быть проведена селективно в другом незащищенном реакционноспособном участке, в значении обычно связанным с ним в синтетической химии. Защитные группы могут быть удалены на соответствующей стадии. Типичные защитные группы представляют собой амино-защитные группы, карбокси-защитные группы или гидрокси-защитные группы. Конкретные защитные группы представляют собой трет-бутоксикарбонил (ВОС), бензилоксикарбонил (CBZ), флуоренилметилоксикарбонил (Fmoc) и бензил (Bn). Дополнительно конкретными защитными группами являются трет-бутоксикарбонил (ВОС) и флуоренилметилоксикарбонил (Fmoc). Более конкретной защитной группой является трет-бутоксикарбонил (ВОС).
Сокращение мкМ означает микромоль и является эквивалентным обозначению μM.
Соединения по настоящему изобретению могут также содержать неестественные пропорции атомных изотопов одного или более атомов, которые составляют такие соединения. Например, настоящее изобретение также включает меченные изотопами варианты настоящего изобретения, которые идентичны приведенным в настоящем документе, за исключением того, что один или более атомов заменен атомом, имеющим атомную массу или массовое число, отличное от преобладающей атомной массы или массового числа, обычно встречающихся в природе атомов. Все изотопы любого конкретного атома или элемента, как указано, рассматриваются в рамках соединения по изобретению, и их применения. Примерами изотопов, которые могут быть включены в соединения по настоящему изобретению включают изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора, хлора и йода, например,2Н ("D"),3Н ("Т"),11С,13С,14С,13N,15N,15O,17O,18O,32Р,33Р,35S,18F,36Cl,123I и125I. Некоторые меченные изотопами соединения по настоящему изобретению (например, меченные3Н или14С) являются полезными для анализа тканевого распределения соединений и/или субстрата. Тритий (3Н) и углерод-14 (14С) изотопы полезны для облегчения их получения и обнаружения. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий (например,2Н), может давать определенные терапевтические преимущества, заключающиеся в большей метаболической стабильности (например, увеличение в естественных условиях периода полураспада или снижение необходимой дозировки) и, следовательно, может быть предпочтительным в некоторых обстоятельствах. Позитронно излучающие изотопы, такие как15O,13N,11С и18F полезны для исследования позитронно-эмиссионной томографией (ПЭТ) для изучения занятости рецептора субстратом. Меченные изотопами соединения настоящего изобретения могут быть получены в соответствии со способами, аналогичными описанным в схемах и/или в примерах, данных ниже, используя меченный изотопом реагент вместо не меченного изотопом реагента. В частности, соединения формулы (I), где один или более атом Н заменен на атом2Н, также являются воплощением настоящего изобретения.
Соединение формулы (I) может содержать несколько асимметричных центров и может присутствовать в форме оптически чистых энантиомеров, смесей энантиомеров, таких как, например, рацематы, смесей диастереоизомеров, диастереоизомерных рацематов или смесей диастереоизомерных рацематов.
Согласно правилам Кана - Ингольда - Прелога асимметричный атом углерода может быть "R" или "S" конфигурации.
Также воплощением настоящего изобретения являются соединения в соответствии с формулой (I), как здесь описано, и их фармацевтически приемлемые соли или эфиры, в частности соединения в соответствии с формулой (I), как здесь описано, и их фармацевтически приемлемые соли, более конкретно соединения в соответствии с формулой (I), как здесь описано.
Настоящее изобретение также относится к соединениям в соответствии с формулой (I) как здесь описано, где
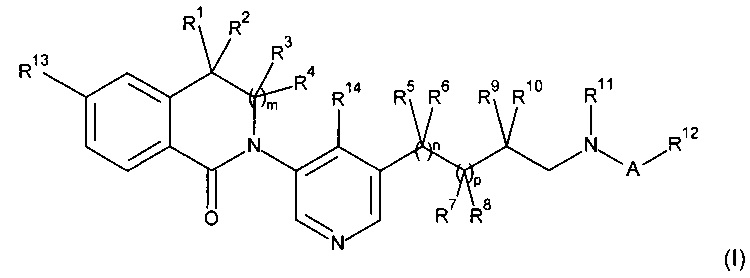
где
R1, R2, R3 и R4 независимо выбраны из Н, алкила и циклоалкила;
R5, R6, R7 и R9 независимо выбраны из Н, алкила, галогена и гидрокси;
R8 и R11 вместе образуют -CH2-CH2-;
R10 представляет собой Н или R10 и R11 вместе образуют -(CH2)w-;
А представляет собой -C(O)-или -S(O)2-;
R12 представляет собой алкил, циклоалкил или замещенный гетероарил, где замещенный гетероарил замещен одним-тремя заместителями, независимо выбранными из Н, алкила и галогена;
R13 представляет собой галоген;
R14 представляет собой Н, алкил или галоген;
m, n и p независимо выбраны из 0 и 1;
w представляет собой 1, 2 или 3;
при условии, что 2-[5-(1-ацетил-пирролидин-3-ил)-пиридин-3-ил]-5-хлор-3,3-диметил-2,3-дигидро-изоиндол-1-он и 2-(1'-ацетил-1',2',3',4',5',6'-гексагидро-[3,4']бипиридинил-5-ил)-5-хлор-3,3-диметил-2,3-дигидро-изоиндол-1-он исключены;
и их фармацевтически приемлемым солям.
Также воплощением настоящего изобретения являются соединения в соответствии с формулой (I) как здесь описано, где R1 и R2 независимо выбраны из Н и алкила.
Частным воплощением настоящего изобретения являются соединения в соответствии с формулой (I) как здесь описано, где R1 и R2 представляют собой алкил.
Дополнительным частным воплощением настоящего изобретения являются соединения в соответствии с формулой (I) как здесь описано, где R1 и R2 представляют собой метил.
Дополнительным воплощением настоящего изобретения являются соединения в соответствии с формулой (I) как здесь описано, где m и n представляют собой 0.
Другим дополнительным воплощением настоящего изобретения являются соединения в соответствии с формулой (I) как здесь описано, где p представляет собой 1.
Другим воплощением настоящего изобретения являются соединения в соответствии с формулой (I) как здесь описано, где R7 представляет собой Н или галоген.
Другим частным воплощением настоящего изобретения являются соединения в соответствии с формулой (I) как здесь описано, где R7 представляет собой Н или фтор.
Еще частным воплощением настоящего изобретения являются соединения в соответствии с формулой (I) как здесь описано, где R7 представляет собой Н.
Частным воплощением настоящего изобретения являются соединения в соответствии с формулой (I) как здесь описано, где R9 представляет собой Н.
Другим частным воплощением настоящего изобретения являются соединения в соответствии с формулой (I) как здесь описано, где R10 представляет собой Н.
Также конкретным воплощением настоящего изобретения являются соединения в соответствии с формулой (I) как здесь описано, где A представляет собой -S(O)2-.
Также конкретным воплощением настоящего изобретения являются соединения в соответствии с формулой (I) как здесь описано, где B представляет собой -C-.
Другим воплощением настоящего изобретения являются соединения в соответствии с формулой (I) как здесь описано, где R12 представляет собой алкил или циклоалкил.
Другим частным воплощением настоящего изобретения являются соединения в соответствии с формулой (I) как здесь описано, где R12 представляет собой алкил.
Дополнительным частным воплощением настоящего изобретения являются соединения в соответствии с формулой (I) как здесь описано, где R12 представляет собой этил, пропил, изопропил.
Еще частным воплощением настоящего изобретения являются соединения в соответствии с формулой (I) как здесь описано, где R12 представляет собой этил.
Также воплощением настоящего изобретения являются соединения в соответствии с формулой (I) как здесь описано, где R13 представляет собой циано или галоген.
Также воплощением настоящего изобретения являются соединения в соответствии с формулой (I) как здесь описано, где R13 представляет собой хлор.
Дополнительным частным воплощением настоящего изобретения являются соединения в соответствии с формулой (I) как здесь описано, где R14 представляет собой Н.
Частным воплощением настоящего изобретения являются соединения в соответствии с формулой (I) как здесь описано, где R1 и R2 представляют собой метил, R7, R9, R10 и R14 представляют собой Н, R13 представляет собой хлор, А представляет собой -S(O)2-, m и n представляют собой 0, p представляет собой 1 и R12 представляет собой алкил или циклоалкил.
Еще частным воплощением настоящего изобретения являются соединения в соответствии с формулой (I) как здесь описано, где R1 и R2 представляют собой метил, R7, R9, R10 и R14 представляют собой Н, R13 представляет собой хлор, А представляет собой -S(O)2-, m и n представляют собой 0, р представляет собой 1 и R12 представляет собой алкил.
Конкретные примеры соединений формулы (I) как здесь описано, выбраны из
5-хлор-3,3-диметил-2-[5-(1-пропаноилпиперидин-4-ил)пиридин-3-ил]изоиндол-1-он;
5-хлор-2-[5-(1-этилсульфонилпиперидин-4-ил)пиридин-3-ил]-3,3-диметилизоиндол-1-он;
5-хлор-3,3-диметил-2-[5-(1-метилсульфонилпиперидин-4-ил)пиридин-3-ил]изоиндол-1-он;
5-хлор-2-[5-(1-этилсульфонилпиперидин-3-ил)пиридин-3-ил]-3,3-диметилизоиндол-1-он;
5-хлор-3,3-диметил-2-[5-[3R или 3S)-1-метилсульфонилпиперидин-3-ил]пиридин-3-ил]изоиндол-1-он;
5-хлор-3,3-диметил-2-[5-[(3S или 3R)-1-метилсульфонилпиперидин-3-ил]пиридин-3-ил]изоиндол-1-он;
5-хлор-2-[5-(1-этилсульфонилпирролидин-3-ил)пиридин-3-ил]-3,3-диметилизоиндол-1-он;
5-хлор-3,3-диметил-2-[5-[(3R или 3S)-1-пропилсульфонилпирролидин-3-ил]пиридин-3-ил]изоиндол-1-он;
5-хлор-3,3-диметил-2-[5-[(3S или 3R)-1-пропилсульфонилпирролидин-3-ил]пиридин-3-ил]изоиндол-1-он;
5-хлор-3,3-диметил-2-[5-[(3R или 3S)-1-пропан-2-илсульфонилпирролидин-3-ил]пиридин-3-ил]изоиндол-1-он;
5-хлор-3,3-диметил-2-[5-[(3S или 3R)-1-пропан-2-илсульфонилпирролидин-3-ил]пиридин-3-ил]изоиндол-1-он;
5-хлop-2-[5-[(3R или 3S)-1-циклопропилсульфонилпирролидин-3-ил]пиридин-3-ил]-3,3-диметилизоиндол-1-он;
5-xлop-2-[5-[(3S или 3R)-1-циклoпpoпилcyльфoнилпиppoлидин-3-ил]пиридин-3-ил]-3,3-диметилизоиндол-1-он;
5-хлор-2-[5-(3-фтор-1-пропан-2-илсульфонилпирролидин-3-ил)пиридин-3-ил]-3,3-диметилизоиндол-1-он;
5-хлор-3,3-диметил-2-[5-(1-пропилсульфонилпиперидин-4-ил)пиридин-3-ил]изоиндол-1-он;
5-хлор-3,3-диметил-2-[5-(1-пропан-2-илсульфонилпиперидин-4-ил)пиридин-3-ил]изоиндол-1-он;
5-хлор-2-[5-(1-циклопропилсульфонилпиперидин-4-ил)пиридин-3-ил]-3,3-диметилизоиндол-1-он;
5-хлор-3,3-диметил-2-[5-[1-(4-метилпиридин-3-карбонил)пиперидин-4-ил]пиридин-3-ил]изоиндол-1-он;
5-хлор-2-[5-[1-(3-хлорпиридин-4-карбонил)пиперидин-4-ил]пиридин-3-ил]-3,3-диметилизоиндол-1-он;
5-хлор-2-[5-[1-(3-хлорпиридин-2-карбонил)пиперидин-4-ил]пиридин-3-ил]-3,3-диметилизоиндол-1-он;
5-хлор-2-[5-(1-этилсульфонилпиперидин-4-ил)пиридин-3-ил]-3Н-изоиндол-1-он;
5-хлор-2-[5-(1-пропан-2-илсульфонилпиперидин-4-ил)пиридин-3-ил]-3Н-изоиндол-1-он;
5-хлор-2-[5-[1-(4-метилпиридин-3-карбонил)пиперидин-4-ил]пиридин-3-ил]-3Н-изоиндол-1-он;
(3R или 3S)-5-хлор-2-[5-(1-этилсульфонилпиперидин-4-ил)пиридин-3-ил]-3-метил-3Н-изоиндол-1-он;
(3S или 3R)-5-хлор-2-[5-(1-этилсульфонилпиперидин-4-ил)пиридин-3-ил]-3-метил-3Н-изоиндол-1-он;
(3R или 3S)-5-хлор-3-метил-2-[5-(1-пропан-2-илсульфонилпиперидин-4-ил)пиридин-3-ил]-3Н-изоиндол-1-он;
(3S или 3R)-5-xлop-3-мeтил-2-[5-(1-пpoпaн-2-илcyльфoнилпипepидин-4-ил)пиридин-3-ил]-3Н-изоиндол-1-он;
(3R или 3S)-5-хлор-3-метил-2-[5-[1-(4-метилпиридин-3-карбонил)пиперидин-4-ил]пиридин-3-ил]-3Н-изоиндол-1-он;
(3S или 3R)-5-xnop-3-метил-2-[5-[1-(4-метилпиридин-3-карбонил)пиперидин-4-ил]пиридин-3-ил]-3Н-изоиндол-1-он;
5-хлор-2-[5-(1-этилсульфонил-4-фторпиперидин-4-ил)пиридин-3-ил]-3,3-диметилизоиндол-1-он;
5-хлор-2-[5-(4-фтор-1-пропан-2-илсульфонилпиперидин-4-ил)пиридин-3-ил]-3,3-диметилизоиндол-1-он;
5-хлор-2-[5-(1-этилсульфонилазетидин-3-ил)пиридин-3-ил]-3,3-диметилизоиндол-1-он;
2-[5-(1-Ацетилазетидин-3-ил)пиридин-3-ил]-5-хлор-3,3-диметилизоиндол-1-он;
5-хлор-3,3-диметил-2-[5-(1-пропилсульфонилазетидин-3-ил)пиридин-3-ил]изоиндол-1-он;
5-хлор-2-[5-(1-циклопропилсульфонилазетидин-3-ил)пиридин-3-ил]-3,3-диметилизоиндол-1-он;
5-хлор-3,3-диметил-2-[5-[1-(4-метилпиридин-3-карбонил)азетидин-3-ил]пиридин-3-ил]изоиндол-1-он;
и их фармацевтически приемлемые соли.
Дополнительные конкретные примеры соединений формулы (I) как здесь описано выбраны из
5-хлор-2-[5-(1-этилсульфонилпиперидин-4-ил)пиридин-3-ил]-3,3-диметилизоиндол-1-он;
5-хлор-3,3-диметил-2-[5-(1-пропилсульфонилпиперидин-4-ил)пиридин-3-ил]изоиндол-1-он;
5-хлор-3,3-диметил-2-[5-(1-пропан-2-илсульфонилпиперидин-4-ил)пиридин-3-ил]изоиндол-1-он;
5-хлор-2-[5-(1-циклопропилсульфонилпиперидин-4-ил)пиридин-3-ил]-3,3-диметилизоиндол-1-он;
и их фармацевтически приемлемые соли.
Также конкретные примеры соединений формулы (I) как здесь описано выбраны из
5-хлор-2-[5-(4-фтор-1-пропилсульфонил-4-пиперидил)-3-пиридил]-3,3-диметил-изоиндолин-1-он;
5-хлор-2-[5-(1-циклопропилсульфонил-4-фтор-4-пиперидил)-3-пиридил]-3,3-диметил-изоиндолин-1-он;
2-[5-(4-фтор-1-изопропилсульфонил-4-пиперидил)-3-пиридил]-3,3-диметил-1-оксо-изоиндолин-5-карбонитрил;
6-[5-(1-этилсульфонил-4-фтор-4-пиперидил)-3-пиридил]-2-метокси-7,7-диметил-пирроло[3,4-b]пиридин-5-он;
6-[5-[4-фтор-1-(1-метилпиразол-4-карбонил)-4-пиперидил]-3-пиридил]-2-метокси-7,7-диметил-пирроло[3,4-b]пиридин-5-он;
6-[5-(4-фтор-1-изопропилсульфонил-4-пиперидил)-3-пиридил]-2-метокси-7,7-диметил-пирроло[3,4-b]пиридин-5-он;
6-[5-(4-фтор-1-пропилсульфонил-4-пиперидил)-3-пиридил]-2-метокси-7,7-диметил-пирроло[3,4-b]пиридин-5-он;
6-[5-[4-фтор-1-(1-метилимидазол-2-карбонил)-4-пиперидил]-3-пиридил]-2-метокси-7,7-диметил-пирроло[3,4-b]пиридин-5-он;
6-[5-(1-Циклопропилсульфонил-4-фтор-4-пиперидил)-3-пиридил]-2-метокси-7,7-диметил-пирроло[3,4-b]пиридин-5-он;
6-[5-(1-этилсульфонил-4-пиперидил)-3-пиридил]-2-метокси-7,7-диметил-пирроло[3,4-b]пиридин-5-он;
2-метокси-7,7-диметил-6-[5-[1-(1-метилпиразол-4-карбонил)-4-пиперидил]-3-пиридил]пирроло[3,4-b]пиридин-5-он;
2-метокси-7,7-диметил-6-[5-[1-(2-метилпиразол-3-карбонил)-4-пиперидил]-3-пиридил]пирроло[3,4-b]пиридин-5-он;
2-метокси-7,7-диметил-6-[5-[1-(4-метилпиридин-3-карбонил)-4-пиперидил]-3-пиридил]пирроло[3,4-b]пиридин-5-он;
и их фармацевтически приемлемые соли.
Также дополнительные конкретные примеры соединений формулы (I), как здесь описано, выбраны из
(3S или 3R)-5-хлор-3-метил-2-[5-(1-пропан-2-илсульфонилпиперидин-4-ил)пиридин-3-ил]-3Н-изоиндол-1-он;
5-хлор-2-[5-(1-этилсульфонил-4-фторпиперидин-4-ил)пиридин-3-ил]-3,3-диметилизоиндол-1-он;
5-хлор-2-[5-(4-фтор-1-пропан-2-илсульфонилпиперидин-4-ил)пиридин-3-ил]-3,3-диметилизоиндол-1-он;
и их фармацевтически приемлемые соли.
Также дополнительные конкретные примеры соединений формулы (I), как здесь описано, выбраны из:
(3R или 3S)-5-хлор-2-[5-(1-этилсульфонилпиперидин-4-ил)пиридин-3-ил]-3-метил-3Н-изоиндол-1-он;
5-хлор-2-[5-(1-циклопропилсульфонил-4-фтор-4-пиперидил)-3-пиридил]-3,3-диметил-изоиндолин-1-он;
2-[5-(4-фтор-1-изопропилсульфонил-4-пиперидил)-3-пиридил]-3,3-диметил-1-оксо-изоиндолин-5-карбонитрил;
и их фармацевтически приемлемые соли.
Более конкретным примером соединений формулы (I) как здесь описано является
5-хлор-2-[5-(1-этилсульфонилпиперидин-4-ил)пиридин-3-ил]-3,3-диметилизоиндол-1-он;
и их фармацевтически приемлемые соли.
Способы получения соединений формулы (I), как здесь описано, являются объектом настоящего изобретения.
Способы получения соединений формулы (I), как здесь описано, являются объектами настоящего изобретения.
Получение соединений формулы (I) по настоящему изобретению может быть проведено последовательными или конвергентными путями синтеза. Синтезы по изобретению показаны на следующих общих схемах. Навыки, необходимые для проведения реакции и очистки полученных продуктов известны специалистам в данной области техники. В случае, если во время реакции получают смесь энантиомеров или диастереоизомеров, эти энантиомеры или диастереоизомеры могут быть разделены с помощью способов, описанных здесь, или способами, известными специалисту в данной области, такими как, например, хиральная хроматография или кристаллизация. Заместители и индексы, используемые в следующем описании способов имеют значения, указанные здесь.
Следующие сокращения используются в настоящем тексте:
АсОН = уксусная кислота, ВОС = трет-бутоксикарбонил, BuLi = бутиллитий, CDI = 1,1-карбонилдиимидазол, ДХМ = дихлорметан, DBU = 2,3,4,6,7,8,9,10-октагидро-пиримидо[1,2-а]азепин, DCE = 1,2-дихлорэтан, DIBALH = ди-изо-бутиалюминия гидрид, DCC = N,N'-дициклогексилкарбодиимид, DMA = N,N-диметилацетамид, DMAP = 4-диметиламинопиридин, DMF = N,N'-диметилфомамид, EDCI = N-(3-диметиламинопропил)-N'-этилкарбодиимида гидрохлорид, EtOAc = этилацетат, EtOH = этанол, Et2O = диэтиловый эфир, Et3N = триэтиламин, экв = эквиваленты, HATU = O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат, ВЭЖХ = высокоэффективная жидкостная хроматография, НОВТ = 1-гидроксибензотриазол, основание Хунига = iPr2NEt = N-этил диизопропиламин, IPC = при контроле способа, LAH = алюмогидрид лития, LDA = диизопропиламид лития, LiBH4 = борогидрид лития, МеОН = метанол, NaBH3CN = цианоборогидрид натрия, NaBH4 = борогидрид натрия, NaI = йодид натрия, Red-Al = натрия бис(2-метоксиэтокси)алюмогидрид, КТ = комнатная температура, TBDMSCI = трет-бутилдиметилсилилхлорид, ТФУ = трифторуксусная кислота, ТГФ = тетраидрофуран, колич. = количественно.
Галоген или трифлат, предпочтительно йодозамещенные соединения пиридина 2 взаимодействуют с ариллактамами 1 в растворителях, таких как 1,4-диоксан, в присутствии йодида меди (I), карбоната калия или цезия, хелатирующего 1,2-диаминосоединения, такого как N,N'-диметилэтилендиамин или транс-1,2-диаминоциклогексан или хелатирующего бета-кетоэфирного соединения, такого как 2-изобутирил-циклогексанон, при повышенных температурах, предпочтительно с использованием нагревания в микроволновой печи с образованием лактамзамещенных гетероциклических соединений 3 как описано на Схеме 1а (стадия а). Соединения 3 могут быть трансформированы в соединения 8 с помощью i) реакции Сузуки с алкенилборонатами 4, 5, 6 или 7 (соединения, которые известны или могут быть легко получены способами, известными в уровне техники) например, в присутствии катализаторов, таких как три-о-толилфосфин/ацетат палладия (II), тетракис-(трифенилфосфин)-палладий, бис(трифенилфосфин)палладия (II) хлорид или дихлор[1,1'-бис(дифенилфосфино)-ферроцен]палладий (II) возможно в виде дихлорметанового комплекса (1:1), и в присутствии основания, такого как водный или безводный фосфат калия, карбонат цезия, натрия или калия, в растворителе, таком как диметилсульфоксид, толуол, этанол, диоксан, тетрагидрофуран или N,N-диметилформамид, и в инертной атмосфере, такой как аргон или азот, в диапазоне температур, предпочтительно между комнатной температурой и приблизительно 130°C; ii) каталитической гидрогенизации (стадия b, с). Соединения 8 с R103 представляющим собой защитную группу, затем могут быть конвертированы в соединения 9 посредством удаления защитной группы R103 и взаимодействия с подходящим активированным карбоксил или сульфонил соединением (стадии d, е). Альтернативно, алкенил боронаты 4, 5, 6 или 7 могут взаимодействовать с амино-пиридинами 10 в условиях, которые описаны для реакции между соединениями 3 и алкенилборонатами 4, 5, 6 или 7 на Схеме 1а с получением амино-пиридиновых соединений 11 (Схема 1b, стадии b, с). Аминопиридиновые соединения 11 затем могут быть конвертированы в соответствующие галосоединения 12 например, с использованием t-BuNO2, CuBr2 или йодида калия, нитрита натрия, п-толуолсульфоновой кислоты в растворителе, таком как ацетонитрил, метанол или этанол при температурах между 0°C и температурой кипения растворителей (Схема 1b, стадии f). Трансформаципя галосоединений 12 в соединения 9 (Схема 1с) может быть проведена, как описано на Схеме 1а.
Cхема 1а

Схема 1b
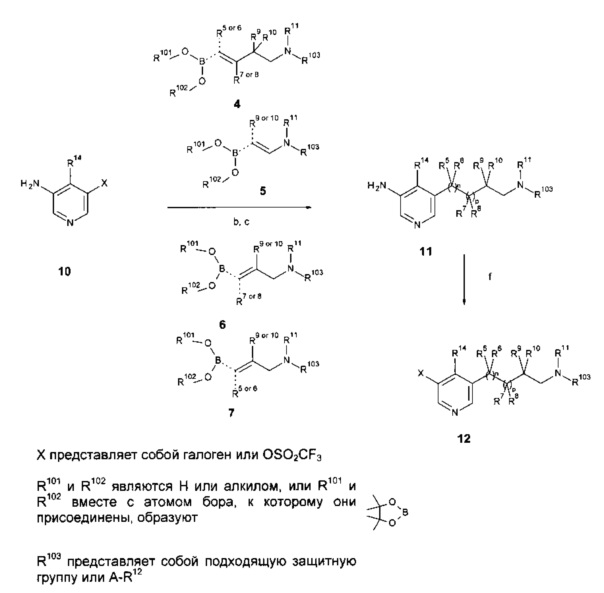
Схема 1с
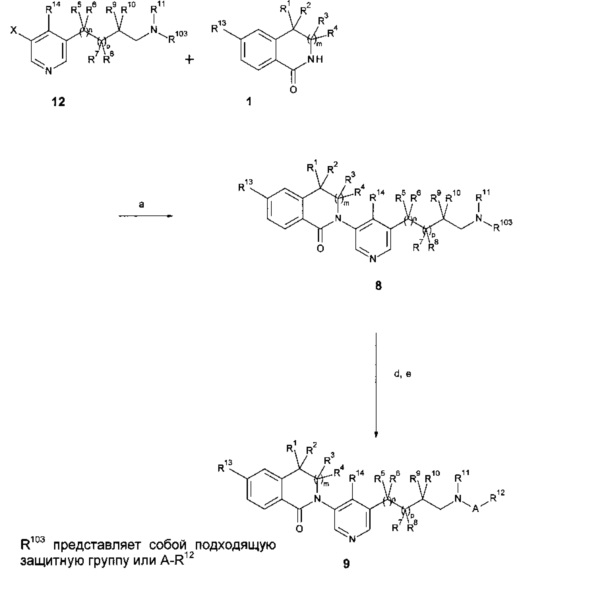
Карбаматы 101 (Схема 2а) взаимодействуют с полифосфорной кислотой при повышенной температуре (например, 100-180°C) с образованием 3,4-дигидро-2H-изохинолин-1-оновых производных 102 (стадия а). Трифторацетамиды 103 могут быть циклизованы в 1-(3,4-дигидро-1H-изохинолин-2-ил)-2,2,2-трифтор-этаноновые соединения 104 посредством обработки параформальдегидом в смеси концентрированной серной кислоты и уксусной кислоты, предпочтительно при околокомнатной температуре (стадия b). Удаление трифторацетильной группы посредством обработки например, гидроксидом калия в растворителе, таком как этанол, при температурах около комнатных дает тетрагидро-изохинолиновые соединения 105 (стадия с). Окисление тетрагидроизохинолиновых соединений 105, например йодозобензолом и бромидом калия, предпочтительно в воде, дает 3,4-дигидро-2Н-изохинолин-1-оновые соединения 102 (стадия d). Взаимодействие изоиндол-1,3-дионовых соединений 106 (Схема 2b) с реактивом Гриньяра R1MgX в растворителе, таком как ТГФ, предпочтительно около 0°C дает аддукты 107 (стадия е). Последующая обработка триэтилсиланом и эфиратом трехфтористого бора в растворителе, таком как дихлорметан, и в диапазоне температур предпочтительно между -25°C и КТ, дает изоиндолоновые соединения 108 (стадия f). Введение метоксибензильной защитной группы в изоиндолоновые соединения 109 (например, посредством обработки бис(триметилсилил)амидом натрия и 1-бромметил-4-метокси-бензолом в ТГФ между 0°C и КТ) дает защищенные соединения 110 (стадия g); аналогично, метоксибензильная защитная группа может быть введена в соединения 108. Обработка соединений 108, несущих дополнительную метоксибензильную защитную группу или соединений 110 основанием, таким как гидрид натрия в растворителе, таком как ТГФ, и затем алкилгалидом, мезилатом или тозилатом, предпочтительно между КТ и температурой кипения растворителя, дает соединения 111 с разными или одинаковыми по структуре группами R1 и R2 (стадия h). Альтернативно, обработка соединений 108, несущих дополнительную метоксибензильную защитную группу или соединений 110 основанием, таким как NaH, LDA или LiHMDS, в растворителях, таких как ДМФ, тетрагидрофуран или 1,2-диметоксиэтан, и затем одним или последовательно двумя различными алкилгалидами, мезилатами или тозилатами, предпочтительно между -78°C и температурой кипения растворителя, дает соединения 111 с разными или одинаковыми по структуре группами R1 и R2 (стадия h). Удаление защитной группы, например, посредством обработки трифторуксусной кислотой при повышенной температуре дает изоиндолоновые соединения 112 (стадия i). Альтернативно (Схема 2с), соединения 114 с R1 и R2 представляющими алкильные группы, могут быть получены из цианосоединений 113 и подходящих реагентов Гриньяра, либо посредством добавления двух различных реагентов последовательно или одного реагента Гриньяра в избытке (с получением соединений с одинаковыми R1 и R2), предпочтительно в присутствии тетра-изопропоксида титана, в растворителях, таких как ТГФ, предпочтительно в температурном диапазоне между 0°C и КТ (стадия k). Соединения 114 c R1=H и R2 представляющим алкильную группу, могут быть получены из цианосоединений 113 и подходящих реагентов Гриньяра в растворителях, таких как ТГФ, предпочтительно в температурном диапазоне между 0°C и КТ (стадия k) с последующим восстановлением образованного имина с помощью борогидрида натрия в, например метаноле, при приблизительно КТ (стадия k). Соединения 114 подвергаются замыканию кольца посредством взаимодействия с катализаторами, такими как дихлор[1,1'-бис(дифенилфосфино)-ферроцен]палладий(II), в растворителях, таких как ДМФ, в присутствии основания, такого как iPr2NEt, предпочтительно в температурном диапазоне между приблизительно 100°C и 150°C в автоклаве в присутствии монооксида углерода с образованием соединений 115 (стадия I).
Схема 2а

Схема 2b

Схема 2с
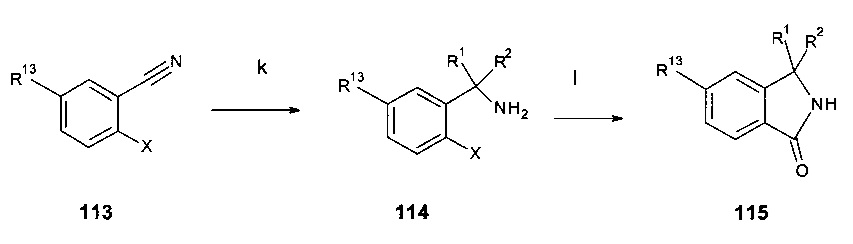
Дополнительные и альтернативные варианты получения соединений 12 (Схема 1b) изображены на Схемах 3а и 3b:
Пиридинбороновые эфиры 201 взаимодействуют с йодосоединениями 202 в присутствии NiI2 и транс-2-аминоциклогексанола гидрохлорида в качестве катализаторов и основания, такого как гексаметилдисилазид натрия, в растворителе, таком как изопропанол, предпочтительно при приблизительно 80°C, предпочтительно при воздействии микроволнового излучения с получением аддуктов 203 (стадия а).
Йодосоединения 202, когда обрабатываются цинковой пылью, TMSCl, 1,2 дибромэтаном в растворителе, таком как диметилацетамид с последующим взаимодействием с дигалоперидиновым соединением 204 в присутствии CuI и PdCl2(dppf) при температурах около 100°C дает аддукты 203 (стадия b).
Дигалопиридиновые соединения 204 взаимодействуют с карбонильными соединениями 205 в присутствии n-BuLi в растворителях, таких как ТГФ или эфир, при температурах между -78°C и КТ с получением аддуктов 206 (стадия с). Обработка аддуктов 206 реагентами, такими как DAST или SOCl2 последующее трансформирование ОН группы в атом галогена дает соединения 207 (стадия d).
Дигалопиридиновые соединения 204 взаимодействуют с олефинами 208 в присутствии муравьиной кислоты, основания, такого как триэтиламин, и катализатора, такого как тетракис(трифенилфосфин)палладий(0), в растворителях, таких как ДМФ, при температурах около 100°C с получением аддуктов 209 и 210 (стадия е).
Так, соединения 203, 206, 207, 209 и 210 представляют собой дополнительные примеры соединений 12 (Схемы 1).
Схема 3а
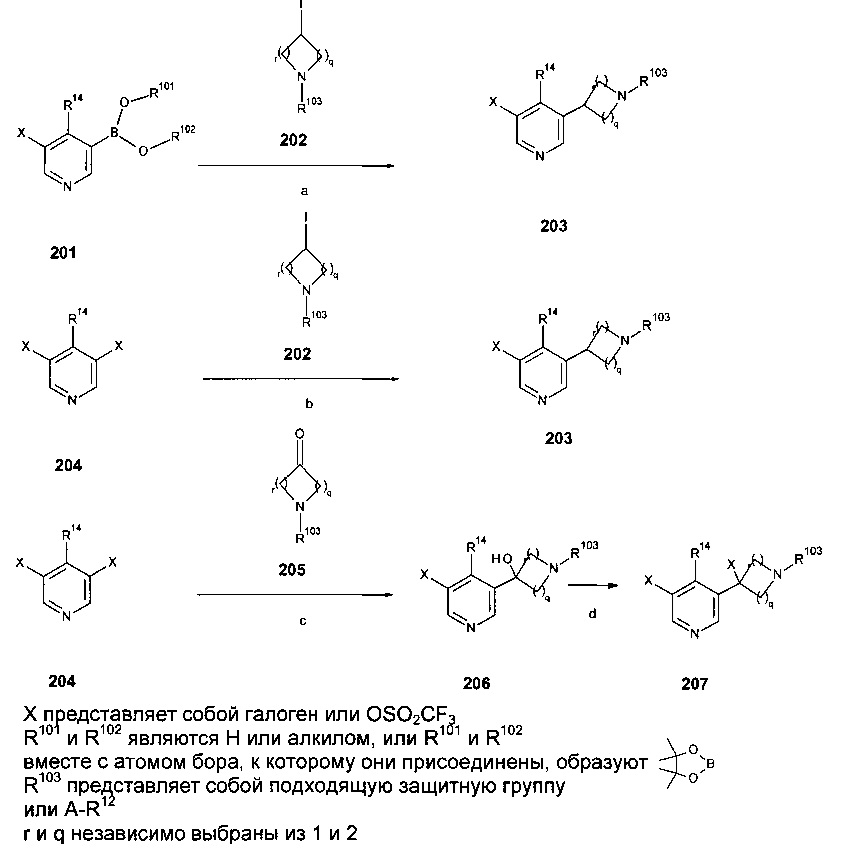
Схема 3b

Также воплощением настоящего изобретения является способ получения соединения формулы (I), как определено выше, содержащий взаимодействие соединения формулы (II) в присутствии соединения формулы (III);
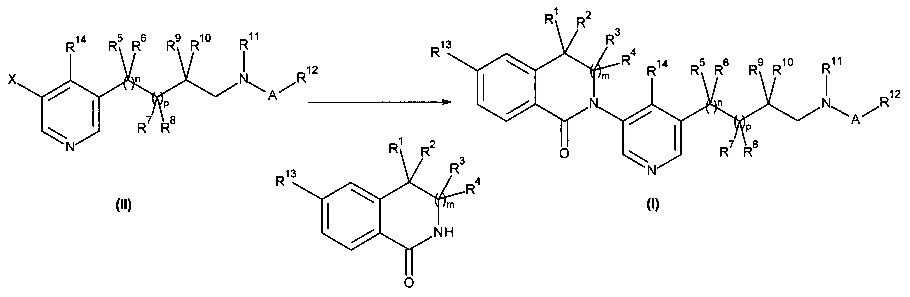
где R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, A, m, n и p являются такими, как здесь описано, а X представляет собой галоген или трифлат.
В частности, в присутствии йодида меди (I), карбоната калия или цезия, хелатирующее 1,2-диаминосоединение, такое как N,N'-диметилэтилендиамин или транс-1,2-диамино-циклогексан, при повышенных температурах, предпочтительно с использованием микроволнового нагревания и в растворителях, таких как 1,4-диоксан.
Также, объектом настоящего изобретения является соединение в соответствии с формулой (I), как здесь описано, для применения в качестве терапевтически активного вещества.
Аналогично, объектом настоящего изобретения является фармацевтическая композиция, содержащая соединение в соответствии с формулой (I), как здесь описано, и терапевтически инертный носитель.
Настоящее изобретение также относится к применению соединения в соответствии с формулой (I), как здесь описано, для лечения или профилактики хронической болезни почек, застойной сердечной недостаточности, гипертонии, первичного гиперальдостеронизма и синдрома Кушинга.
Настоящее изобретение также относится к применению соединения в соответствии с формулой (I) как здесь описано для лечения или профилактики диабетической нефропатии.
Настоящее изобретение также относится к применению соединения в соответствии с формулой (I) как здесь описано для лечения или профилактики фиброза почек или сердца.
Настоящее изобретение также относится к применению соединения в соответствии с формулой (I), как здесь описано, для лечения или профилактики хронической болезни почек.
Настоящее изобретение также относится к применению соединения в соответствии с формулой (I), как здесь описано, для лечения или профилактики застойной сердечной недостаточности.
Настоящее изобретение также относится к применению соединения в соответствии с формулой (I), как здесь описано, для лечения или профилактики гипертонии.
Настоящее изобретение также относится к применению соединения в соответствии с формулой (I), как здесь описано, для лечения или профилактики первичного гиперальдостеронизма.
Частным воплощением настоящего изобретения является соединение в соответствии с формулой (I), как здесь описано, для лечения или профилактики хронической болезни почек, застойной сердечной недостаточности, гипертонии, первичного гиперальдостеронизма и синдрома Кушинга.
Также конкретным воплощением настоящего изобретения является соединение в соответствии с формулой (I) как здесь описано для лечения или профилактики диабетической нефропатии.
Другим частным воплощением настоящего изобретения является соединение в соответствии с формулой (I) как здесь описано для лечения или профилактики фиброза почек или сердца.
Также частным воплощением настоящего изобретения является соединение в соответствии с формулой (I), как здесь описано, для лечения или профилактики хронической болезни почек.
Также частным воплощением настоящего изобретения является соединение в соответствии с формулой (I), как здесь описано, для лечения или профилактики застойной сердечной недостаточности.
Также частным воплощением настоящего изобретения является соединение в соответствии с формулой (I), как здесь описано, для лечения или профилактики гипертонии.
Также частным воплощением настоящего изобретения является соединение в соответствии с формулой (I), как здесь описано, для лечения или профилактики первичного гиперальдостеронизма.
Настоящее изобретение также относится к применению соединения в соответствии с формулой (I), как здесь описано, для получения лекарственного средства для лечения или профилактики хронической болезни почек, застойной сердечной недостаточности, гипертонии, первичного гиперальдостеронизма и синдрома Кушинга.
Настоящее изобретение также относится к применению соединения в соответствии с формулой (I) как здесь описано для получения лекарственного средства для лечения или профилактики диабетической нефропатии.
Настоящее изобретение также относится к применению соединения в соответствии с формулой (I) как здесь описано для получения лекарственного средства для лечения или профилактики фиброза почек или сердца.
Также воплощением настоящего изобретения является применение соединения в соответствии с формулой (I), как здесь описано, для получения лекарственного средства для лечения или профилактики хронической болезни почек.
Также воплощением настоящего изобретения является применение соединения в соответствии с формулой (I), как здесь описано, для получения лекарственного средства для лечения или профилактики застойной сердечной недостаточности.
Также воплощением настоящего изобретения является применение соединения в соответствии с формулой (I), как здесь описано, для получения лекарственного средства для лечения или профилактики гипертонии.
Также воплощением настоящего изобретения является применение соединения в соответствии с формулой (I), как здесь описано, для получения лекарственного средства для лечения или профилактики первичного гиперальдостеронизма.
Также объектом настоящего изобретения является способ лечения или профилактики хронической болезни почек, застойной сердечной недостаточности, гипертонии, первичного гиперальдостеронизма и синдрома Кушинга, который включает введение эффективного количества соединения в соответствии с формулой (I), как здесь описано.
Также объектом настоящего изобретения является способ лечения или профилактики диабетической нефропатии, который включает введение эффективное количество соединения формулы (I) как здесь описано.
Также объектом настоящего изобретения является способ лечения или профилактики фиброза почек или сердца, который включает введение эффективное количество соединения формулы (I) как здесь описано.
Также воплощением настоящего изобретения является способ лечения или профилактики хронического заболевания почек, который включает введение эффективного количества соединения в соответствии с формулой (I) как здесь описано.
Также воплощением настоящего изобретения является способ лечения или профилактики застойной сердечной недостаточности, который включает введение эффективного количества соединения в соответствии с формулой (I) как здесь описано.
Также воплощением настоящего изобретения является способ лечения или профилактики гипертензии, который включает введение эффективного количества соединения в соответствии с формулой (I) как здесь описано.
Также воплощением настоящего изобретения является способ лечения или профилактики первичного гиперальдостеронизма, который включает введение эффективного количества соединения в соответствии с формулой (I) как здесь описано.
Также воплощением настоящего изобретения является соединение формулы (I) как здесь описано, которое получено по любому из описанных способов.
Методика анализа
В настоящем анализе использовалась клеточная линия G-402 в качестве клеток-хозяев для эктопической экспрессии (транзиентной или стабильной) ферментов семейства CYP11. В частности, авторами изобретения были разработаны стабильные G-402 клетки, эктопически экспрессирующие CYP11B1 человека, CYP11B2 человека, CYP11A1 человека, CYP11B1 яванского макака иди CYP11B2 яванского макака. Важно отметить, что идентифицированная клеточная линия G-402 экспрессирует ко-факторы (адренодоксин и адренодоксинредуктазу), важные для активности семейства CYP11 и не было обнаружено никакой ферментативной активности, релевантной семейству CYP11 (по сравнению с клетками H295R) в указанных клетках. Таким образом, клеточная линия G-402 является уникально подходящей в качестве клеток-хозяев для эктопической экспрессии ферментов семейства CYP11.
G-402 клетки могут быть получены из АТСС (CRL-1440) и они первоначально получены из почечной лейкомиобластомы.
Экспрессионные плазмиды, содержащие ORF (открытую рамку считывания) как для CYP11B1 или CYP11B2 человека/макак под контролем подходящего промотора (CMV-промотор), так и для подходящего резистентного маркера (неомицин). С использованием обычных методик экспрессионную плазмиду трансфицировали в клетки G-402n затем эти клетки отобрали на экспрессию данных резистентных маркеров. Затем отобрали индивидуальные клетки-клоны и протестировали их на наличие требуемой ферментативной активности с использованием 11-деоксикортикостерона (Сур11В2) или 11-деоксикортизола (Сур11В1) в качестве субстрата.
G-402 клетки, экспрессирующие CYP11 конструкты были получены как описано выше и хранились в модифицированной среде McCoy's 5а, каталожный номер АТСС No. 30-2007, содержащей 10% ФБС и 400 мкг/мл G418 (генетицин) при 37°C в атмосфере 5% СO2/95% воздуха.
Клеточный ферментативный анализ проводили в DMEM/F12 среде, содержащей 2.5% угля, обработанного FCS и подходящей концентрации субстрата (0.3-10 мкМ 11-деоксикортикостерона, 11-деоксикортизола или кортикостерона). Для исследования ферментативной активности клетки поместили на 96-луночные планшеты и инкубировали в течение 16 ч. Аликвоту супернатанта затем перемещали и анализировали концентрацию ожидаемого продукта (альдостерон для CYP11B2; кортизол для CYP11B1). Концентрации данных стероидов можно определить с использованием HTRF анализа от компании CisBio, анализируя как альдостерон, так и кортизол.
Ингибирование высвобождения производимых стероидов может быть использовано в качестве измерения ингибирования соответствующего фермента тестируемыми соединениями, добавленными во время ферментативного клеточного анализа. Дозозависимое ингибирование ферментативной активности соединениями рассчитывалось с помощью среднего от точек добавленных концентраций ингибитора (x-ось) по отношению к измеренному уровню стероид/продукт (y-ось). Затем подсчитывал ось ингибирование с помощью следующего аппроксимирования 4-параметрической сигмоидальной фунции (модель Morgan-Mercer-Flodin (MMF)) на необработанные точки данных с использованием следующего способа квадратов:

где, А представляет собой максимальное значение y, B представляет собой ЕС50 фактор, определяемый с использованием XLFit, С представляет собой минимальное значение y и D представляет собой наклон кривой.
Максимальное значение A соответствует количеству стероида, произведенному в отсутствие ингибитора, значение C соответствует количеству стероида, определяемому при полном ингибировании фермента.
Значения ЕС50 для заявленных соединений определялись с помощью описанной системы тестирования G402. Активность фермента Сур11В2 тестировалась в присутствии 1 мкМ деоксикортикостерона и различных количеств ингибиторов; активность фермента Сур11В1 тестировалась в присутствии 1 мкМ деоксикортизола и различных количеств ингибиторов.
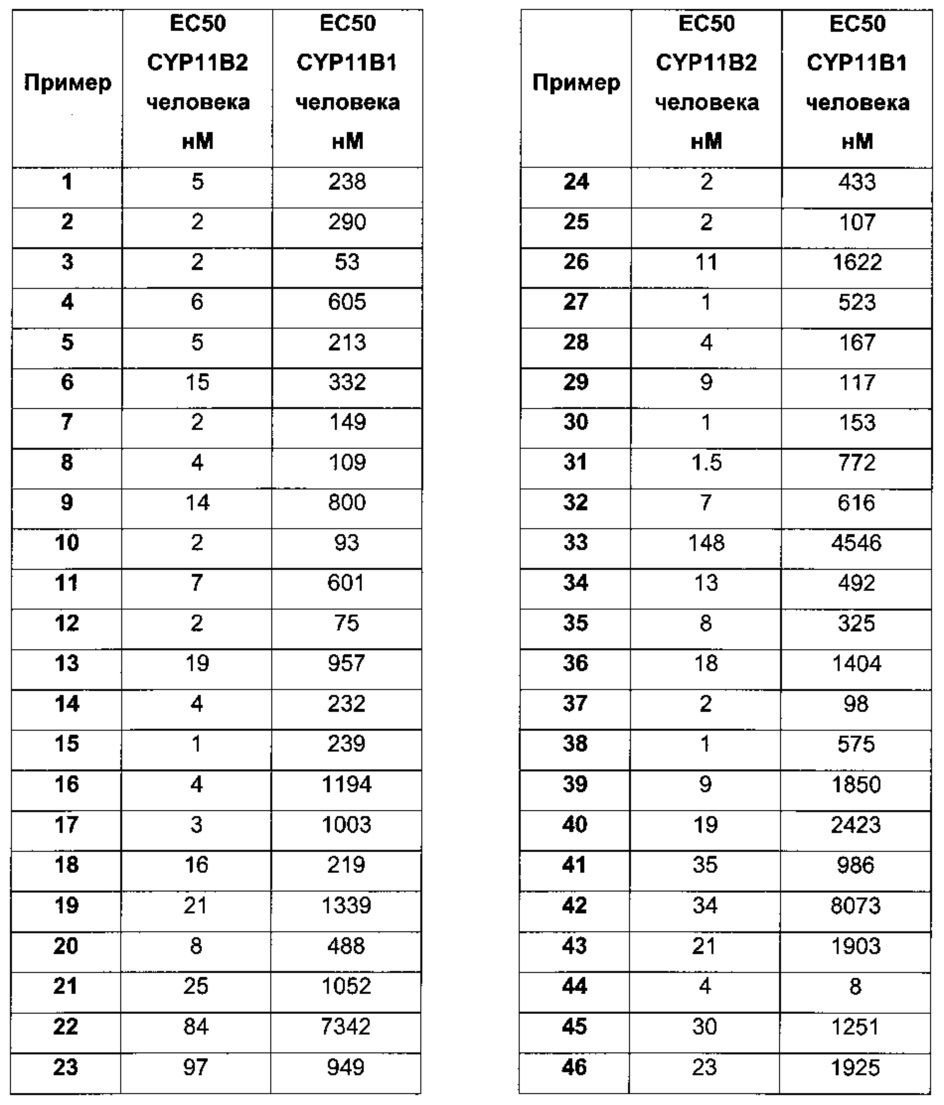

Соединения формулы (I) и их фармацевтически приемлемые соли и эфиры, как здесь описано, обладают значениями ЕС50 (CYP11B2) в диапазоне между 0.000001 мкМ и 1000 мкМ, некоторые соединения обладают значениями ЕС50 (CYP11B2) в диапазоне между 0.00005 мкМ и 500 мкМ, дополнительно, некоторые конкретные соединения обладают значениями ЕС50 (CYP11B2) в диапазоне между 0.0005 мкМ и 50 мкМ, более конкретно соединения обладают значениями ЕС50 (CYP11B2) между 0.0005 мкМ и 5 мкМ. Эти результаты были получены с использованием вышеприведенного ферментативного анализа.
Соединения формулы I, а также их фармацевтически приемлемые соли могут применяться в качестве лекарственных средств (например, в форме фармацевтических препаратов). Фармацевтические препараты могут вводится внутрь, включая перорально (например, в форме таблеток, покрытых оболочкой таблеток, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий), назально (например, в форме назальных аэрозолей) и ректально (например, в форме суппозиториев). Кроме того, введение может осуществляться парентерально, включая внутримышечно и внутривенно (например, в виде растворов для инъекций).
Соединения формулы I и их фармацевтически приемлемые соли могут перерабатываться вместе с фармацевтически инертными, неорганическими или органическими эксципиентами для производства таблеток, таблеток, покрытых оболочкой, драже и твердых желатиновых капсул. Лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли и т.д. могут применяться в качестве таких эксципиентов, например, для таблеток, драже и твердых желатиновых капсул.
Подходящими адъювантами для мягких желатиновых капсул являются, например, растительные масла, воска, жиры, полутвердые и жидкие полиолы и т.д.
Подходящими адъювантами для изготовления растворов и сиропов являются, например, вода, полиолы, сахароза, инвертный сахар, глюкоза и т.д.
Подходящими адъювантами для инъекционных растворов являются, например, вода, спирты, полиолы, глицерин, растительные масла и т.д.
Подходящими адъювантами для суппозиториев являются, например, природные или гидрогенизированные масла, воска, жиры, полужидкие или жидкие полиолы и т.д.
Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, стабилизаторы, увлажняющие агенты, эмульгаторы, подсластители, красители, ароматизаторы, соли для изменения осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они могут также содержать другие терапевтически ценные вещества.
Дозировка может варьироваться в широких пределах и, конечно, будет подобрана к индивидуальным требованиям в каждом конкретном случае. В общем, в случае перорального введения должна быть подходящей суточная доза от около 0,1 мг до 20 мг на кг массы тела, предпочтительно от около 0,5 мг до 4 мг на кг массы тела (например, приблизительно 300 мг на человека), предпочтительно разделить на 1-3 индивидуальных доз, которые могут состоять, например, из одинакового количества. Однако, будет понятно, что указанный здесь верхний предел может быть превышен когда это необходимо.
В соответствии с настоящим изобретением, соединения формулы (I) или их фармацевтически приемлемые соли и эфиры могут применяться для лечения или профилактики опосредуемых альдостероном заболеваний.
Соединения формулы (I) или их фармацевтически приемлемые соли и эфиры, раскрытые в настоящем изобретении являются ингибиторами CYP11B2. Соединения формулы (I) или их фармацевтически приемлемые соли и эфиры также показывают здесь различное ингибирование CYP11B1, но проявляют улучшенную селективность по отношению к CYP11B2 в сравнении с CYP11B1. Такие соединения могут быть использованы для лечения или профилактики состояний, характеризующихся чрезмерными производством/уровнями кортизола или чрезмерных уровней обоих кортизола и альдостерона (например, синдром Кушинга, пациенты с ожоговой травмой, депрессия, посттравматические стрессовые расстройства, хронический стресс, кортикотрофическая аденома, болезнь Кушинга).
В соответствии с настоящим изобретением, соединения формулы (I) или их фармацевтически приемлемые соли и сложные эфиры могут применяться для лечения или профилактики сердечно-cосудистых заболеваний (в том числе гипертонии и сердечной недостаточности), сосудистых заболеваний, дисфункции эндотелия, дисфункции барорецепторов, заболеваний почек, заболеваний печени, фиброзных заболеваний, воспалительных заболеваний, ретинопатии, невропатии (например, периферической невропатии), боли, инсульнопатии, отека, депрессии и т.д.
Сердечно-cосудистые заболевания включают застойную сердечную недостаточность, ишемическую болезнь сердца, аритмию, артериальную фибрилляцию, поражения сердца, снижение фракции выброса, диастолическую и систолическую дисфункции сердца, фибриноидный некроз коронарных артерий, фиброз миокарда, гипертрофическую кардиомиопатию, нарушение податливости сосудистых стенок, нарушение диастолического наполнения, ишемию, гипертрофию левого желудочка, инфаркт и сосудистый фиброз, инфаркт миокарда, инфарктые некротические поражения, сердечную аритмию, профилактику внезапной сердечной смерти, повторного стеноза, инсульт, повреждения сосудов.
Болезни почек включают острую и хроническую почечную недостаточность, нефорпатию, терминальную стадию почечной болезни, диабетическую нефропатию, снижение клиренса креатинина, снижение скорости клубочковой фильтрации, расширение сетчатого мезангиального матрикса с или без значительной гиперклеточности, локальный тромбоз капилляров клубочков, общий фибриноидный некроз, гломерулосклероз, ишемические поражения, злокачественный нефросклероз (например, ишемическая ретракция, микроальбуминурия, протеинурия, снижение почечного кровотока, почечной артериопатия, отек и внутрикапиллярная пролиферация (эндотелиальная и мезангиальная) и/или экстракапиллярные клетки (серповидные).
Болезни почек также включают гломерулонефрит (например, диффузный пролиферативный, очаговый пролиферативный, мезангиальный пролиферативный, мембранопролиферативный, мембранный гломерулонефрит с минимальными изменениями), волчаночный нефрит, неиммунные аномалии базальной мембраны (например, синдром Альпорта), фиброз почек и гломерулосклероз (например узловой или глобальный и очагово-cегментарный гломерулосклероз).
Заболевания печени включают, без ограничения, стеатоз печени, стеатогепатит неалкогольный, цирроз печени, асцит печени, застой печени, неалкогольный стеатогепатит, застой печени и т.д.
Сосудистые заболевания включают, без ограничения, тромботические сосудистые заболевания (такие, как интрамуральный фибриноидный некроз, кровоизлияние и фрагментация эритроцитов и люминальный и/или интрамуральный тромбоз), пролиферативные артериопатии (например, опухшие миоинтимальные клетки, окруженные муцинозным внеклеточным матриксом и узловыми утолщениями), атеросклероз, снижение податливости сосудов (например, жесткость, сниженная податливость желудочка и сниженная податливость сосудов), эндотелиальная дисфункция, и т.д.
Воспалительные состояния включают, без ограничения, артрит (например, остеоартрит), воспалительные заболевания дыхательных путей (например, хроническая обструктивная болезнь легких (ХОБЛ)), и т.д.
Боль включает в себя, без ограничения, острую боль, хроническую боль (например, боль в суставах), и т.д.
Отек включает, без ограничения, отек периферических тканей, застой печени, асцит печени, застой селезенки, респираторный застой или застой легких, и т.д.
Инсулинопатии включают, без ограничения, резистентность к инсулину, диабет I типа, диабет II типа, чувствительность к глюкозе, преддиабетическое состояние, предиабет, синдром X, и т.д.
Фиброзные заболевания включают в себя, без ограничения, инфаркт и внутрипочечный фиброз, интерстициальный фиброз и фиброз печени.
Кроме того, соединения формулы (I) или их фармацевтически приемлемые соли и эфиры, как здесь описано, могут также применяться для лечения или профилактики сердечно-cосудистых заболеваний, выбранных из группы, состоящей из гипертонии, сердечной недостаточности (в частности сердечной недостаточности после инфаркта миокарда), гипертрофии левого желудочка и инсульта.
В другом воплощении, сердечно-сосудистое заболевание представляет собой гипертонию.
В частном воплощении, сердечно-сосудистое заболевание представляет собой устойчивую к лечению гипертонию.
В другом воплощении, сердечно-сосудистое заболевание представляет собой сердечную недостаточность.
В другом воплощении, сердечно-сосудистое заболевание представляет собой гипертрофию левого желудочка.
В другом воплощении, сердечно-сосудистое заболевание представляет собой застойную сердечную недостаточность, в частности у пациентов с сохраненной фракцией выброса левого желудочка
В другом воплощении, сердечно-сосудистое заболевание представляет собой инсульт.
В другом воплощении, соединения формулы (I) или их фармацевтически приемлемые соли и эфиры могут применяться для лечения или профилактики заболеваний почек.
В другом воплощении, заболевание почек представляет собой нефропатию.
В другом воплощении, заболевание почек представляет собой аутоиммунный гломерулонефрит.
В другом воплощении, хроническое заболевание почек представляет собой диабетическую нефропатию.
В другом воплощении, фиброз представляет собой фиброз почек или сердца.
В другом воплощении, соединения формулы (I) или их фармацевтически приемлемые соли и эфиры могут применяться для лечения или профилактики сахарного диабета II типа.
В другом воплощении, соединения формулы (I) или их фармацевтически приемлемые соли и эфиры могут применяться для лечения или профилактики сахарного диабета I типа
В другом воплощении, соединения формулы (I) или их фармацевтически приемлемые соли и эфиры могут быть использованы для лечения или профилактики диабетической ретинопатии.
Настоящее изобретение далее иллюстрируется Примерами, которые не имеют ограничивающего характера.
В случае, если препаративные примеры получают в виде смеси энантиомеров, чистые энантиомеры могут быть разделены с помощью описанных здесь способов или с помощью способов, известных специалисту в данной области, таких как, например, хиральная хроматография или кристаллизация.
Примеры
Все примеры и промежуточные соединения получили в атмосфере аргона, если не указано иного.
Промежуточное соединение А-1
6-хлор-3,4-дигидро-2Н-изохинолин-1-он

[А] [2-(3-хлор-фенил)-этил]-карбаминовой кислоты метиловый эфир

При 0°C, метилхлорформиат (4.6 г, 48 ммоль) добавили по каплям в раствор 2-(3-хлор-фенил)-этиламина (5.0 г, 32 ммоль) и Et3N (6.4 г, 64 ммоль) в ДХМ (100 мл). После добавления, смесь перемешивали при комнатной температуре в течение 0.5 часов. Органический слой промыли водой (3×30 мл), 1 н HCl (20 мл) и солевым раствором (30 мл), высушили над безводным Na2SO4, отфильтровали и сконцентрировали под вакуумом. После вакуумной сушки, соединение, указанное в заголовке, получили (6.49 г, 95%) в виде белого осадка. MS: 214.1 (М+Н)+.
[В] 6-хлор-3,4-дигидро-2H-изохинолин-1-он
Под защитой N2, смесь [2-(3-хлор-фенил)-этил]-карбаминовой кислоты метилового эфира (5.0 г, 23.4 ммоль) и РРА (полифосфорной кислоты) (20 г) в 250 мл круглодонной колбе интенсивно перемешивали при 120°C в течение 2 часов. После охлаждения до комнатной температуры, реакционную смесь обработали водой со льдом и водным раствором аммония для доведения рН до 8. Затем, смесь экстрагировали EtOAc, и органический слой промыли солевым раствором, высушили над безводным Na2SO4 и отфильтровали. После удаления растворителя при пониженном давлении, полученный неочищенный продукт дополнительно промыли этилацетатом с получением соединения, указанного в заголовке (1.66 г, 39%), в виде белого осадка. MS: 182.0 (М+Н)+.
Промежуточное соединение А-2
5-хлор-3-метил-2,3-дигидро-изоиндол-1-он

[А] 1-(2-бромо-5-хлор-фенил)-этиламин
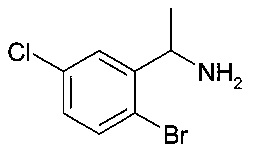
К перемешанному раствору 2-бромо-5-хлорбензонитрила (80 г, 370 ммоль) в ТГФ (1000 мл) при 0°C добавили EtMgBr (370 мл, 1110 ммоль) по каплям. Реакционную смесь перемешивали при 0-5°C в течение 5 часов перед тем, как МеОН (500 мл) добавили по каплям. Затем раствор перемешивали в течение дополнительных 15 мин, осторожно добавили NaBH4 (28 г, 740 ммоль) и получившуюся смесь перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор затем влили в воду, экстрагировали EtOAc (3 x). Объединенные органические слои высушили над безводным Na2SO4, отфильтровали и сконцентрировали под вакуумом с получением неочищенного продукта, который очистили с помощью колонки (петролейный эфир : EtOAc = 3:1) с получением соединения, указанного в заголовке (30 г, 35%), в виде желтоватого масла. MS: 235.5 (М+Н)+.
[В] 5-хлор-3-метил-2,3-дигидро-изоиндол-1-он
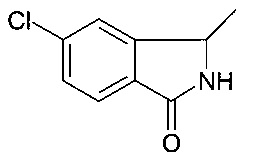
Смесь 1-(2-бромо-5-хлорфенил)этанамина (30 г, 127.9 ммоль), Pd(dppf)Cl2 (3.2 г, 12.79 ммоль), и DIPEA (49.5 г, 383.7 ммоль) в ДМФ (1.2 л) перемешивали в автоклаве при давлении СО 2 МПа при 130°C в течение 24 часов. Затем ее охладили до комнатной температуры, реакционную смесь разбавили EtOAc (500 мл). Органический слой промыли солевым раствором, отфильтровали, и сконцентрировали под вакуумом с получением неочищенного продукта, который очистили посредством хроматографии (петролейный эфир : EtOAc = 3:1) с получением соединения, указанного в заголовке (5.2 г, 23%), в виде коричневого осадка. MS: 181.6 (M+H)+.
Промежуточное соединение А-3
5-хлор-3,3-диметил-2,3-дигидро-изоиндол-1-он
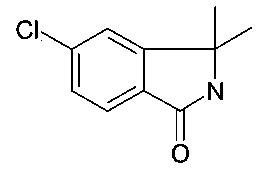
[А] 1-(2-бромо-5-хлор-фенил)-1-метил-этиламин

К перемешанному раствору 2-бромо-5-хлор-бензонитрила (10 г, 46 ммоль) в ТГФ (200 мл) при 0°C, добавили MeMgBr (77 мл, 230 ммоль) по каплям. Реакционной смеси дали нагреться до комнатной температуры и перемешивали в течение 2 часов. Ti(Oi-Pr)4 (13 г, 46 ммоль) добавили и раствор перемешивали в течение дополнительных 16 часов перед тем, как ее погасили водным раствором HCl и промыли EtOAc. Водную фазу довели до рН ~ 10 с помощью водного раствора NaOH, и экстрагировали EtOAc (3х). Объединенные органические слои сконцентрировали с получением неочищенного продукта, указанного в заголовке (3.8 г, 33%) в виде масла, которое сразу использовали на следующей стадии без дополнительной очистки. MS: 249.30 (М+Н)+.
[В] 5-хлор-3,3-диметил-2,3-дигидро-изоиндол-1-он

Смесь 1-(2-бромо-5-хлор-фенил)-1-метил-этиламина (3.8 г, 15.3 ммоль), Pd(dppf)Cl2 (0.4 г, 0.55 ммоль) и DIPEA (6 г, 45.9 ммоль) в ДМФ (20 мл) перемешивали в автоклаве под давлением 2 Мпа CO при 130°C в течение 16 часов. Затем ее охладили до комнатной температуры, реакционную смесь разбавили EtOAc (300 мл). Органический слой промыли солевым раствором (80 мл × 2), отфильтровали, и сконцентрировали под вакуумом с получением неочищенного продукта, который очистили посредством хроматографии с получением соединения, указанного в заголовке (1.13 г, 38%) в виде коричневого осадка. MS: 195.70 (М+Н+)
Промежуточное соединение А-4
3,3-диметил-1-оксо-2,3-дигидро-1H-изоиндол-5-карбонитрил
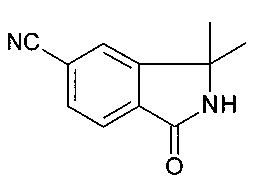
[А] 4-бромо-2-метил-бензойной кислоты метиловый эфир
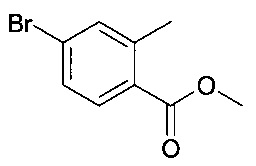
К раствору 4-бромо-2-метил-бензойной кислоты (30.0 г, 0.14 моль) в 115 мл метанола медленно добавили тионилхлорид (20.25 мл, 0.28 моль) и реакционную смесь перемешивали при 70°C в течение 2 часов перед тем, как ее сконцентрировали с получением неочищенного продукта, который затем очистили посредством колоночной хроматографии с получением соединения, указанного в заголовке (30.03 г, 93.6%) в виде осадка.
[В] 4-циано-2-метил-бензойной кислоты метиловый эфир

Смесь 4-бромо-2-метил-бензойной кислоты метилового эфира (26.0 г, 113.5 ммоль) и CuCN (12.48 г, 140.7 ммоль) нагревали при 180°C в течение 5 часов перед тем, как ее влили в воду со льдом. Твердый преципитат собрали с помощью вакуумной фильтрации с получением неочищенного продукта, который затем очистили посредством колоночной хроматографии с получением соединения, указанного в заголовке (12.53 г, 63%), в виде осадка.
[С] 2-Бромметил-4-циано-бензойной кислоты метиловый эфир

Смесь 4-циано-2-метил-бензойной кислоты метилового эфира (12.5 г, 71.35 ммоль), NBS (12.7 г, 71.35 ммоль) и дибензоилпероксида (ВРО) (0.8 г, 3.28 ммоль) в CCl4 (200 мл) нагревали до температуры кипения течение 3 часов. Затем ее охладили до комнатной температуры и реакционную смесь отфильтровали. Фильтрат сконцентрировали под вакуумом с получением неочищенного продукта (18.2 г), который использовали на следующей реакционной стадии без дополнительной очистки.
[D] 2-(4-метокси-бензил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-карбонитрил
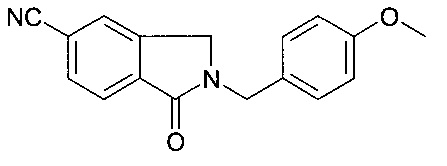
К раствору 2-бромметил-4-циано-бензойной кислоты метилового эфира (18.1 г, 71.24 ммоль) в ТГФ (300 мл) добавили PMBNH2 (23.4 г, 178.1 ммоль) при 0°C и реакционную смесь перемешивали при комнатной температуре в течение 16 часов. После вакуумной фильтрации, фильтрат сконцентрировали под вакуумом. Полученный остаток перерастворили в EtOAc и промыли водой и солевым раствором. Органический слой высушили над безводным Na2SO4, отфильтровали, и сконцентрировали под вакуумом с получением неочищенного продукта, который очистили посредством колоночной хроматографии с получением соединения, указанного в заголовке (11.69 г, 56.0%), в виде осадка.
[Е] 2-(4-метокси-бензил)-3,3-диметил-1-оксо-2,3-дигидро-1H-изоиндол-5-карбонитрил

К раствору 2-(4-метокси-бензил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-карбонитрила (11.6 г, 41.7 ммоль) в ТГФ (300 мл) добавили NaH (8.34 г, 208.4 ммоль, 60% в минеральном масле) и реакционную смесь перемешивали при комнатной температуре в течение 1 часа перед тем как добавили йодометан (35.5 г, 250.1 ммоль). После добавления, реакционную смесь перемешивали при 70°C в течение 2 часов пока весь исходный материал не использовался. Затем ее охладили до комнатной температуры, добавили насыщ. водн. раствор NH4Cl и смесь экстрагировали EtOAc (200 мл × 3). Объединенные органические слои высушили над безводным MgSO4, отфильтровали, и сконцентрировали при пониженном давлении с получением неочищенного продукта, который очистили посредством колоночной хроматографии с получением соединения, указанного в заголовке (7.22 г, 56.5%), в виде осадка.
[F] 3,3-диметил-1-оксо-2,3-дигидро-1H-изоиндол-5-карбонитрил
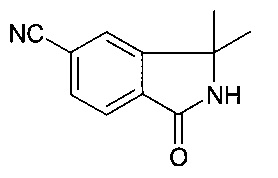
К раствору 2-(4-метокси-бензил)-3,3-диметил-1-оксо-2,3-дигидро-1Н-изоиндол-5-карбонитрила (3.5 г, 11.42 ммоль) в MeCN (70 мл) добавили CAN (18.79 г, 34.27 ммоль) в 30 мл воды при 0°C. Получившуюся реакционную смесь перемешивали при 0°C в течение 1 часа, пока весь исходный материал не израсходовался. Реакционную смесь экстрагировали водой и EtOAc и объединенные органические слои высушили над безводным MgSO4, отфильтровали, и сконцентрировали при пониженном давлении с получением неочищенного продукта, который очистили посредством колоночной хроматографии с получением соединения, указанного в заголовке (1.06 г, 49.8%), в виде осадка.
Промежуточное соединение А-5
2-метокси-7,7-диметил-6,7-дигидро-пирроло[3,4-b]пиридин-5-он
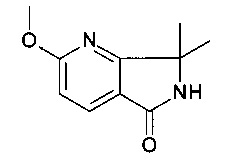
[А] 3-(метоксикарбонил)-2-метилпиридина 1-оксид

К перемешанному раствору метил-2-метилникотината (95 г, 629 ммоль) в ДХМ (1.5 л) добавили m-CРВА (119 г, 692 ммоль) при 0°C. Затем, реакционную смесь перемешивали при комнатной температуре в течение 16 часов; после этого ее промыли смесью насыщ. водн. растворов Na2SO3 и NaHCO3. Органический слой затем высушили над безводным Na2SO4, отфильтровали, и сконцентрировали под вакуумом с получением неочищенного продукта (60 г, выход 57%), который использовали на следующей реакционной стадии без дополнительной очистки.
[В] Метил 2-(хлорметил)никотинат

Неочищенный 3-(метоксикарбонил)-2-метилпиридин-1-оксид (35 г, 210 ммоль) добавили малыми порциями к POCl3 (300 г) при комнатной температуре. После добавления, реакционную смесь кипятили с обратным холодильником в течение 3 часов перед тем, как ее сконцентрировали под вакуумом. Остаток влили в воду со льдом, нейтрализовали насыщенным водным раствором NaHCO3 и экстрагировали AcOEt (125 мл × 3). Объединенные органические слои промыли солевым раствором, высушили над безводным Na2SO4, отфильтровали, и сконцентрировали под вакуумом с получением неочищенного продукта, который затем очистили посредством колоночной хроматографии с получением соединения, указанного в заголовке (12 г, выход 30%).
[С] 2-(Хлорметил)-3-(метоксикарбонил)пиридина 1-оксид

К перемешанному раствору метил-2-(хлорметил)никотината (20 г, 108 ммоль) в ДХМ (300 мл) добавили m-CРВА (20.5 г, 119 ммоль) при 0°C. Затем его перемешивали при комнатной температуре в течение 16 часов; после этого, реакционную смесь промыли смесью насыщ. водн. растворов Na2SO3 и NaHCO3. Органический слой высушили над безводн. Na2SO4, отфильтровали, и сконцентрировали под вакуумом с получением неочищенного соединения, указанного в заголовке (20 г, выход 92%), которое использовали на следующей реакционной стадии без дополнительной очистки.
[D] Метил 6-хлор-2-(хлорметил)никотинат

Неочищенный 2-(хлорметил)-3-(метоксикарбонил)пиридин-1-оксид (20 г, 99.5 ммоль) добавили малыми порциями к POCl3 (200 г) при комнатной температуре. Смесь кипятили с обратным холодильником в течение 3 часов перед тем, как ее сконцентрировали под вакуумом. Остаток влили в воду со льдом, нейтрализовали раствором NaHCO3, и экстрагировали AcOEt (125 мл × 3). Объединенные органические слои сконцентрировали с получением неочищенного соединения, указанного в заголовке (17 г, выход 78%), которое использовали на следующей реакционной стадии без дополнительной очистки.
[Е] 2-хлор-6-(4-метоксибензил)-6,7-дигидро-5Н-пирроло[3,4-b]пиридин-5-он

К перемешанному раствору неочищенного метил 6-хлор-2-(хлорметил)никотината (10 г, 45.4 ммоль) в ТГФ (150 мл) добавили PMBNH2 (15.5 г, 113.5 ммоль) при 0°C. Получившуюся реакционную смесь перемешивали при комнатной температуре в течение 16 часов перед тем, как ее сконцентрировали при пониженном давлении с получением неочищенного продукта. После промывки МТВЕ (100 мл × 3), соединение, указанное в заголовке, получили (8.8 г, выход 67%) в виде белого осадка. MS: 288.8 (М+Н+, 1Cl).
[F] 2-хлор-6-(4-метокси-бензил)-7,7-диметил-6,7-дигидро-пирроло[3,4-b]пиридин-5-он

К раствору 2-хлор-6-(4-метокси-бензил)-6,7-дигидро-пирроло[3,4-b]пиридин-5-она (5.8 г, 20.0 ммоль) в ТГФ (50 мл) добавили гидрид натрия (60% в минеральном масле, 1.7 г, 42.0 ммоль) при комнатной температуре. Получившуюся реакционную смесь перемешивали в течение 30 мин перед тем как добавили йодометан (6.0 г, 42.0 ммоль). После перемешивания при комнатной температуре в течение ночи, смесь погасили водой и экстрагировали EtOAc. Органический слой затем промыли солевым раствором, высушили над безводным Na2SO4, отфильтровали и сконцентрировали под вакуумом с получением неочищенного продукта, который затем очистили с помощью колоночной флеш-хроматографии (силикагель 20 г, 5%-20% этилацетат в ДХМ). Соединение, указанное в заголовке, получили (3.8 г, 57%) в виде белого осадка. MS: 316.2 (М+Н+).
[G] 2-метокси-6-(4-метокси-бензил)-7,7-диметил-6,7-дигидро-пирроло[3,4-b]пиридин-5-он

К раствору 2-хлор-6-(4-метокси-бензил)-7,7-диметил-6,7-дигидро-пирроло[3,4-b]пиридин-5-она (3.15 г, 10 ммоль) в ДМФ (30 мл) добавили метанолят натрия (0.813 г, 15 ммоль) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 4 часов, затем погасили водой и экстрагировали EtOAc. Органический слой промыли солевым раствором, высушили над безводным Na2SO4, отфильтровали и сконцентрировали под вакуумом с получением соединения, указанного в заголовке (2.8 г, 90%), в виде осадка. MS: 313.1 (М+Н+).
[Н] 2-метокси-7,7-диметил-6,7-дигидро-пирроло[3,4-b]пиридин-5-он

К раствору 2-метокси-6-(4-метокси-бензил)-7,7-диметил-6,7-дигидро-пирроло[3,4-b]пиридин-5-она (0.31 г, 1.0 ммоль) в CH3CN (5 мл) добавили аммония-церия нитрат (1.64 г, 3.0 ммоль) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 3 часов перед тем как в смесь добавили воду и EtOAc. Органический слой разделили, высушили над безводным Na2SO4, отфильтровали и сконцентрировали под вакуумом с получением неочищенного продукта, который затем очистили посредством колоночной хроматографии на силикагеле с получением соединения, указанного в заголовке (0.12 г, 63%), в виде осадка. MS: 193.1 (М+Н+).
Пример 1
5-хлор-3,3-диметил-2-[5-(1-пропаноилпиперидин-4-ил)пиридин-3-ил]изоиндол-1-он
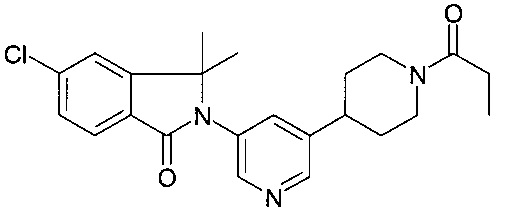
[А] (3,6-дигидро-2Н-пиридин-1-ил)-пропан-1-он

К раствору 1,2,3,6-тетрагидро-пиперидина (800 мг, 9.6 ммоль) и триэтиламина (1.82 г, 18 ммоль) в ДХМ (20 мл) добавили пропионилхлорид (1.06 г, 11.5 ммоль) по каплям. После добавления, смесь перемешивали в течение 30 минут при комнатной температуре перед тем, как добавили воду. Органический слой промыли насыщ. водн. раствором бикарбоната натрия и солевым раствором последовательно и высушили над безводным Na2SO4. После удаления растворителей, неочищенный продукт получили в виде желтого масла (1.1 г) и использовали на следующей стадии без дополнительной очистки. MS: 140.1 (М+Н)+.
[В] 1-(5-бромо-3',4',5',6'-тетрагидро-2'Н-[3,4']бипиридинил-1'-ил)-пропан-1-он

Смесь 1-(3,6-дигидро-2Н-пиридин-1-ил)-пропан-1-она (708 мг, 5.1 ммоль), 3-бромо-5-йод-пиридина (2.5 г, 8.8 ммоль), триэтиламина (1.03 г, 10.2 ммоль), муравьиной кислоты (350 мг, 7.65 ммоль) и тетракис(трифенилфосфин)палладия (0) (360 мг, 0.51 ммоль) в ДМФ (12 мл) перемешивали в течение ночи при 90°C в атмосфере азота. После охлаждения до комнатной температуры, смесь обработали водой и экстрагировали этилацетатом. Органический слой высушили над безводн. Na2SO4. После удаления растворителей, остаток очистили с помощью флеш-хроматографии с получением соединения, указанного в заголовке, в виде смеси с его второстепенным региоизомером (соотношение = приблизительно 9:1) и в виде желтого масла (200 мг). MS: 298.6 (М+Н)+.
[С] 5-хлор-3,3-диметил-2-[5-(1-пропаноилпиперидин-4-ил)пиридин-3-ил]изоиндол-1-он

Смесь 5-хлор-3,3-диметил-2,3-дигидро-изоиндол-1-она (промежуточное соединение А-3, 200 мг, 1.02 ммоль), 1-(5-бромо-3',4',5',6'-тетрагидро-2'Н-[3,4']бипиридинил-1'-ил)-пропан-1-она (200 мг, 0.67 ммоль), CuI (40 мг, 0.21 ммоль), (1S,2S)-циклогексан-1,2-диамина (48 мг, 0.42 ммоль) и CS2CO3 (460 мг, 1.41 ммоль) растворили в диоксане (5 мл). Реакционную смесь подвергли взаимодействию в микроволновой печи при 150°C в течение 2.5 часов перед тем, как ее влили в водн. NaHCO3 (20 мл) и экстрагировали EtOAc (30 мл, 3х). Объединенные органические слои промыли солевым раствором, высушили над безводным Na2SO4, отфильтровали и сконцентрировали под вакуумом с получением неочищенного продукта, который затем очистили посредством препаративной ВЭЖХ с получением соединения, указанного в заголовке (36 мг, 13%) в виде белого осадка. MS: 412.3 (М+Н)+.
Пример 2
5-хлор-2-[5-(1-этилсульфонилпиперидин-4-ил)пиридин-3-ил]-3,3-диметилизоиндол-1-он

[А] 1-этансульфонил-1,2,3,6-тетрагидро-пиридин

По аналогии со способом, описанным для получения примера 1[А], этансульфонилхлорид использовали с получением неочищенного продукта в виде белого осадка (89%). MS: 176.1 (М+Н)+.
[В] 5-бромо-1'-этансульфонил-1',2',3',4',5',6'-гексагидро-[3,4']бипиридинил

По аналогии со способом, описанным для получения примера 1[В], 1-этансульфонил-1,2,3,6-тетрагидро-пиридин использовали с получением соединения, указанного в заголовке, в виде смеси с его региоизомером (соотношение: примерно 1:1) и в виде желтоватого масла (250 мг). MS: 335.1 (М+Н)+.
[С] 5-хлор-2-[5-(1-этилсульфонилпиперидин-4-ил)пиридин-3-ил]-3,3-диметилизоиндол-1-он
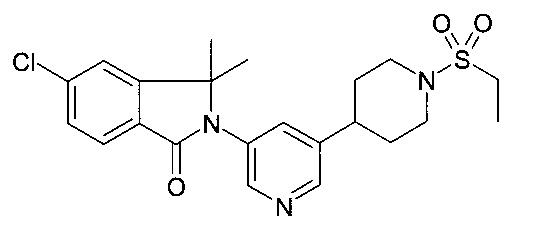
По аналогии со способом, описанным для получения примера 1[С], 5-бромо-1'-этансульфонил-1',2',3',4',5',6'-гексагидро-[3,4']бипиридинил использовали с получением соединения, указанного в заголовке (9 мг), в виде белого осадка. MS: 448.2 (М+Н)+.
Пример 3
5-хлор-3,3-диметил-2-[5-(1-метилсульфонилпиперидин-4-ил)пиридин-3-ил]изоиндол-1-он
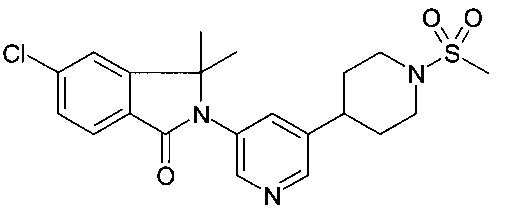
По аналогии со способом, описанным для получения примера 1, метансульфонилхлорид (стадия А), 1-метансульфонил-1,2,3,6-тетрагидро-пиридин (стадия b), и 5-бромо-1'-метансульфонил-1',2',3',4',5',6'-гексагидро-[3,4']бипиридинил (стадия С) использовали с получением соединения, указанного в заголовке (26 мг) в виде белого осадка. MS: 434.3 (М+Н)+.
Пример 4
5-хлор-2-[5-(1-этилсульфонилпиперидин-3-ил)пиридин-3-ил]-3,3-диметил изоиндол-1-он

[А] 5'-бромо-1-этансульфонил-1,2,3,4,5,6-гексагидро-[3,3']бипиридинил

По аналогии со способом, описанным для получения примера 1[В], 1-этансульфонил-1,2,3,6-тетрагидро-пиридин использовали с получением соединения, указанного в заголовке, в виде желтоватого масла (250 мг) в смеси с его региоизомером (соотношение: примерно 1:1). MS: 335.1 (М+Н)+.
[В] 5-хлор-2-[5-(1-этилсульфонилпиперидин-3-ил)пиридин-3-ил]-3,3-диметилизоиндол-1-он
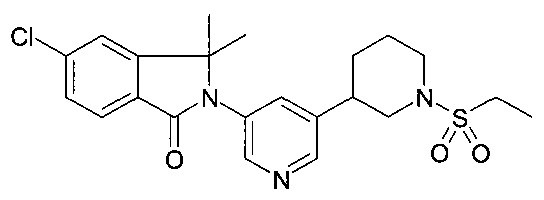
По аналогии со способом, описанным для получения примера 1[С], 5-бромо-1'-этансульфонил-1',2',3',4',5',6'-гексагидро-[3,4']бипиридинил использовали с получением соединения, указанного в заголовке (8 мг) в виде белого осадка. MS: 448.2 (М+Н)+.
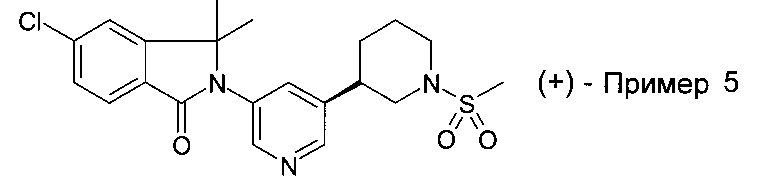
Пример 5 и Пример 6
(+)-5-хлор-3,3-диметил-2-[5-[(3R или 3S)-1-метилсульфонилпиперидин-3-ил]пиридин-3-ил]изоиндол-1-он и (-)-5-хлор-3,3-диметил-2-[5-[(3S или 3R)-1-метилсульфонилпиперидин-3-ил]пиридин-3-ил]изоиндол-1-он
и
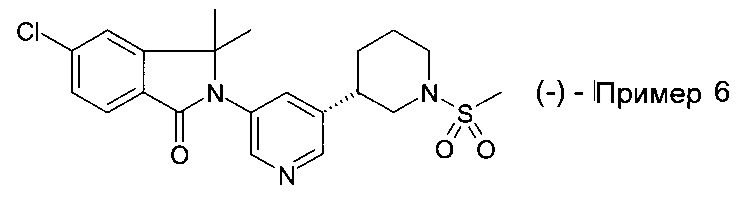
Энантиомерную смесь 5-хлор-3,3-диметил-2-[5-(1-метилсульфонилпиперидин-3-ил)пиридин-3-ил]изоиндол-1-она (полученную по аналогии со способами, описанными для получения примера 4) подвергли СКЖХ разделению (AD 250 мм × 30 мм, 20 мкм, подвижная фаза A: сверхкритический СO2, В: EtOH (0.05% NH3.H2O), А : В=55:45 при 80 мл/мин) с получением (+)-5-хлор-3,3-диметил-2-[5-[(3R или 3S)-1-метилсульфонилпиперидин-3-ил]пиридин-3-ил]изоиндол-1-она (2.4 мг, пример 5), MS: 434.2 (М+Н)+ и (-)-5-хлор-3,3-диметил-2-[5-[(3S или 3R)-1-метилсульфонилпиперидин-3-ил]пиридин-3-ил]изоиндол-1-она (2 мг, пример 6). MS: 434.2 (М+Н)+.
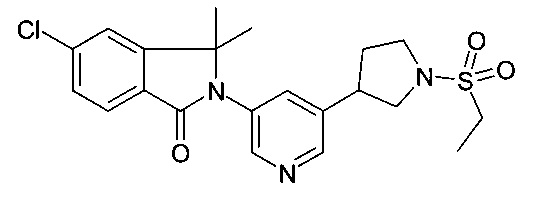
Пример 7
5-хлор-2-[5-(1-этилсульфонилпирролидин-3-ил)пиридин-3-ил]-3,3-диметилизоиндол-1-он
[А] 3,5-Дийод-пиридин

Смесь 3,5-дибром-пиридина (20 г, 84 ммоль), CuI (4.76 г, 25 ммоль), KI (83.7 г, 504 ммоль) и N,N'-диметил-этан-1,2-диамина (4.4 г, 50.4 ммоль) в диоксане (400 мл) перемешивали при 110°C в течение 16 часов. Реакционный раствор отфильтровали и фильтрат сконцентрировали при пониженном давлении с получением неочищенного осадка, который промыли EtOAc (100 мл) и ДХМ (100 мл) с получением продукта, указанного в заголовке, в виде белого осадка (13 г, 47%). MS: 331.5 (М+Н)+. Его сразу использовали на следующей стадии без дополнительной очистки.
[B] 3-(5-бромо-пиридин-3-ил)-пирролидин-1-карбоновой кислоты трет-бутиловый эфир
К суспензии Zn пыли (1.1 г, 16.6 ммоль) в DMA (15 мл) добавили смесь TMSCl и 1,2-дибромэтана (1.2 мл, 7:5). Смесь перемешивали при 40°C в течение 15 мин перед тем, как добавили раствор 3-йод-пирролидин-1-карбоновой кислоты трет-бутилового эфира (4.5 г, 15.1 ммоль) в DMA (15 мл). После перемешивания при комнатной температуре в течение 2 часов, смесь 3,5-дийод-пиридина (6 г, 18.1 ммоль), CuI (435 мг, 2.3 ммоль) и PdCl2(dppf) (1.42 г, 1.8 ммоль) добавили и получившуюся смесь перемешивали при 90°C в течение 16 часов. Реакционную смесь влили в воду (200 мл), экстрагировали EtOAc (100 мл, 3х), промыли солевым раствором, высушили над безводным Na2SO4, и сконцентрировали под вакуумом с получением неочищенного продукта, который очистили с помощью препаративной ВЭЖХ с получением соединения, указанного в заголовке, в виде желтого осадка (80 мг, 1.4%). MS: 327.2 (М+Н)+.
[C] 3-[5-(6-хлор-1,1-диметил-3-оксо-1,3-дигидро-изоиндол-2-ил)-пиридин-3-ил]-пирролидин-1-карбоновой кислоты трет-бутиловый эфир

Смесь 3-(5-бромо-пиридин-3-ил)-пирролидин-1-карбоновой кислоты трет-бутилового эфира (80 мг, 0.21 ммоль), 5-хлор-3,3-диметил-2,3-дигидро-изоиндол-1-она (49 мг, 0.25 ммоль), N,N-диметилбензол-1,2-диамина (19 мг, 0.13 ммоль), CuI (12 мг, 0.064 ммоль) и CS2CO3 (137 мг, 0.42 ммоль) в диоксане (5 мл) перемешивали при 150°C под микроволновым облучением в течение 2 часов. Получившуюся смесь влили в воду (50 мл) и водный слой экстрагировали EtOAc (30 мл, 3х). Объединенные органические слои промыли солевым раствором, высушили над безводным Na2SO4, и сконцентрировали под вакуумом с получением неочищенного продукта, указанного в заголовке (70 мг, 74%). Его использовали сразу на следующей стадии без дополнительной очистки.
[D] 5-хлор-2-[5-(1-этилсульфонилпирролидин-3-ил)пиридин-3-ил]-3,3-диметилизоиндол-1-он
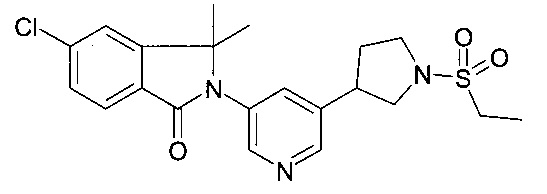
Раствор 3-[5-(6-хлор-1,1-диметил-3-оксо-1,3-дигидро-изоиндол-2-ил)-пиридин-3-ил] -пирролидин-1-карбоновой кислоты трет-бутилового эфира (70 мг, 0.16 ммоль) и ТФУ (5 мл) в ДХМ (25 мл) перемешивали при 0°C в течение 2 часов. Реакционную смесь сконцентрировали при пониженном давлении перед тем, как добавили воду (20 мл). рН довели до 9 с помощью водн. раствора Na2CO3 и смесь экстрагировали с помощью ДХМ (30 мл, 3х). Объединенные органические слои сконцентрировали под вакуумом с получением масла. Это коричневое масла и TEA (32.3 мг, 0.32 ммоль) в ДХМ (25 мл) перемешивали при 0°C перед тем, как добавили этансульфонилхлорид (41 мг, 0.32 ммоль). После перемешивания в течение 30 мин, реакционную смесь сконцентрировали при пониженном давлении с получением неочищенного продукта, который очистили с помощью препаративной ВЭЖХ с получением соединения, указанного в заголовке (12 мг, 18%), в виде белого осадка. MS: 433.8 (М+Н)+.
Пример 8 и Пример 9
(+)-5-хлор-3,3-диметил-2-[5-[(3R или 3S)-1-пропилсульфонилпирролидин-3-ил]пиридин-3-ил]изоиндол-1-он и (-)-5-хлор-3,3-диметил-2-[5-[(3S или 3R)-1-пропилсульфонилпирролидин-3-ил]пиридин-3-ил]изоиндол-1-он

и

[А] 3-(5-бромо-пиридин-3-ил)-3-гидрокси-пирролидин-1-карбоновой кислоты трет-бутиловый эфир

К перемешиваемому раствору 3,5-дибром-пиридина (30 г, 0.13 моль) в Et2O (500 мл) добавили n-BuLi (50 мл, 0.13 моль) при -78°C под N2. Смесь перемешивали при -78°C в течение 1 часа. Затем добавили раствор 3-оксо-пирролидин-1-карбоновой кислоты трет-бутилового эфира (23.7 г, 0.13 моль) в Et2O (100 мл) при -78°C и смеси дали нагреться до комнатной температуры и перемешивали в течение 3 часов. Реакционную смесь влили в воду и экстрагировали EtOAc. Органический слой промыли солевым раствором, высушили над безводным Na2SO4, отфильтровали, и сконцентрировали под вакуумом. Остаток очистили посредством колоночной хроматографии на силикагеле с получением соединения, указанного в заголовке (20 г, 44%) в виде желтого осадка. MS: 343.1 (М+Н)+.
[В] 3-(5-бромо-пиридин-3-ил)-2,5-дигидро-пиррол-1-карбоновой кислоты трет-бутиловый эфир
К раствору 3-(5-бромо-пиридин-3-ил)-3-гидрокси-пирролидин-1-карбоновой кислоты трет-бутилового эфира (15 г, 0.044 моль) в ДХМ добавили Et3N (8.9 г, 0.088 моль) и MsCl (15.1 г, 0.132 моль) при 0°C. Смеси дали нагреться до комнатной температуры и перемешивали при комнатной температуре в течение ночи. Смесь влили в воду со льдом и экстрагировали с помощью ДХМ. Органический слой промыли насыщ. водн. раствором NH4Cl, высушили над безводным Na2SO4, отфильтровали, и сконцентрировали под вакуумом. Остаток очистили посредством колоночной хроматографии на силикагеле с получением соединения, указанного в заголовке (10 г, 67%) в виде желтого осадка. MS: 325.1 (М+Н)+.
[С] 3-(5-амино-пиридин-3-ил)-2,5-дигидро-пиррол-1-карбоновой кислоты трет-бутиловый эфир

В пробирке для работы под давлением с завинчивающейся крышкой, к смеси CuI (0.1 г, 3 ммоль), Н-Hyp-ОН (0.11 г, 0.62 ммоль), и 3-(5-бромо-пиридин-3-ил)-2,5-дигидро-пиррол-1-карбоновой кислоты трет-бутилового эфира (0.5 г, 1.5 ммоль) в ДМСО (25 мл) добавили концентрированную NH3.H2O (20 мл). Ее нагревали при 80°C в течение ночи. После охлаждения до комнатной температуры, реакционную смесь разбавили насыщ. водн. раствором NH4Cl и экстрагировали EtOAc. Органический слой промыли водой, высушили над безводным Na2SO4, отфильтровали, и сконцентрировали под вакуумом с получением неочищенного соединения, указанного в заголовке (0.35 г, 86%), в виде масла. MS: 261.3 (М+Н)+. Его сразу использовали на следующей стадии без дополнительной очистки.
[D] 3-(5-амино-пиридин-3-ил)-пирролидин-1-карбоновой кислоты трет-бутиловый эфир
Раствор 3-(5-амино-пиридин-3-ил)-2,5-дигидро-пиррол-1-карбоновой кислоты трет-бутилового эфира (0.3 г, 0.011 моль) в МеОН (10 мл) обработали Pd/C (0.1 г). Колбу откачали и снова заполнили H2 три раза и перемешивали в атмосфере Н2 (50 фунт/кв. дюйм) при 25°C в течение ночи. Смесь отфильтровали и сконцентрировали с получением соединения, указанного в заголовке (0.3 г, колич.) в виде масла. MS: 264.2 (М+Н+). Его сразу использовали на следующей стадии без дополнительной очистки.
[Е] 3-(5-бромо-пиридин-3-ил)-пирролидин-1-карбоновой кислоты трет-бутиловый эфир
К перемешанному раствору 3-(5-амино-пиридин-3-ил)-пирролидин-1-карбоновой кислоты трет-бутилового эфира в MeCN (50 мл) добавили t-BuNO2 (1.2 г, 9.4 ммоль) при 0°C. Смесь перемешивали при 0°C в течение 1 часа перед тем как добавили CuBr2 (1.6 г, 7.2 ммоль) и смеси дали нагреться до комнатной температуры и перемешивали в течение ночи. Смесь влили в солевой раствор, экстрагировали с помощью ДХМ. Органический слой промыли водой, высушили над безводным Na2SO4 и сконцентрировали под вакуумом. Остаток очистили посредством колоночной хроматографии на силикагеле с получением соединения, указанного в заголовке (1.08 г, 48%) в виде белого осадка. MS: 329.1 (М+Н)+.
[F] 3-[5-(6-хлор-1,1-диметил-3-оксо-1,3-дигидро-изоиндол-2-ил)-пиридин-3-ил]-пирролидин-1-карбоновой кислоты трет-бутиловый эфир

Смесь 3-(5-бромо-пиридин-3-ил)-пирролидин-1-карбоновой кислоты трет-бутилового эфира (80 мг, 0.21 ммоль), 5-хлор-3,3-диметил-2,3-дигидро-изоиндол-1-она (49 мг, 0.25 ммоль), N,N-диметилбензол-1,2-диамина (19 мг, 0.13 ммоль), CuI (12 мг, 0.064 ммоль) и CS2CO3 (137 мг, 0.42 ммоль) в диоксане (5 мл) перемешивали при 150°C под микроволновым излучением в течение 2 часов. Получившуюся смесь влили в воду (50 мл). Водный слой экстрагировали EtOAc (30 мл, 3х). Объединенные органические слои промыли солевым раствором, высушили над безводным Na2SO4 и сконцентрировали под вакуумом с получением неочищенного продукта, указанного в заголовке (70 мг, 74%), который сразу использовали на следующей стадии без дополнительной очистки.
[G] (+)-5-хлор-3,3-диметил-2-[5-[(3R или 3S)-пропилсульфонилпирролидин-3-ил]пиридин-3-ил]изоиндол-1-он и (-)-5-хлор-3,3-диметил-2-[5-[(3S или 3R)-1-пропилсульфонилпирролидин-3-ил]пиридин-3-ил]изоиндол-1-он
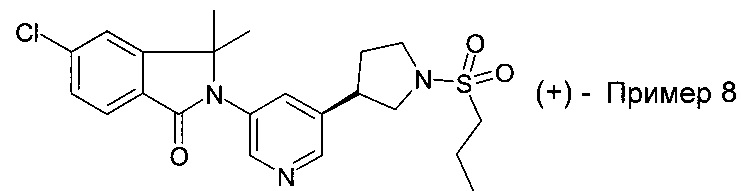
и
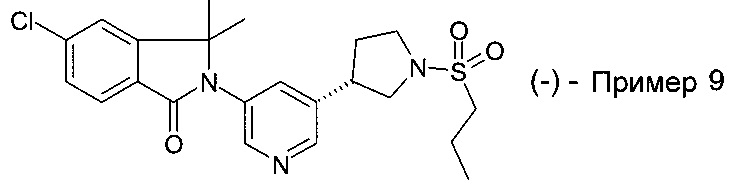
По аналогии со способом, описанным для получения примера 7 (стадия D), пропан-1-сульфонилхлорид использовали с получением рацемической смеси соединения, указанного в заголовке (10 мг), которая после разделения с помощью СКЖХ (колонка: chiralPak AD-H, 250×30 мм ID; подвижная фаза: А для СO2 и В для метанола (0.1% NH3.H2O); градиент: 40% В; скорость потока: 50 мл/мин) дала (+)-5-хлор-3,3-диметил-2-[5-[(3R или 3S)-1-пропилсульфонилпирролидин-3-ил]пиридин-3-ил]изоиндол-1-он (2.9 мг, пример 8), MS: 448.2 (М+Н)+ и (-)-5-хлор-3,3-диметил-2-[5-[(3S или 3R)-1-пропилсульфонилпирролидин-3-ил]пиридин-3-ил]изоиндол-1-он (2.5 мг, пример 9). MS: 448.2 (М+Н)+.
Пример 10 и Пример 11
(+)-5-хлор-3,3-диметил-2-[5-[(3R или 3S)-1-пропан-2-илсульфонилпирролидин-3-ил]пиридин-3-ил]изоиндол-1-он и (-)-5-хлор-3,3-диметил-2-[5-[(3S или 3R)-1-пропан-2-илсульфонилпирролидин-3-ил]пиридин-3-ил]изоиндол-1-он

и
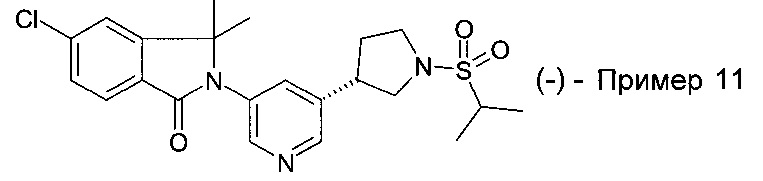
По аналогии со способом, описанным для получения примера 7 (стадия D), пропан-2-сульфонилхлорид использовали с получением рацемической смеси соединения, указанного в заголовке (13 мг), которая после разделения с помощью СКЖХ (колонка: chiralPak AD-H, 250×30 мм ID; подвижная фаза: А для СO2 и В для метанола (0.1% NH3.H2O); градиент: 40% В; скорость потока: 50 мл/мин) дала соединения, указанные в заголовке (+)-5-хлор-3,3-диметил-2-[5-[(3R или 3S)-1-пропан-2-илсульфонилпирролидин-3-ил]пиридин-3-ил]изоиндол-1-он (4 мг, пример 10), MS: 448.1 (М+Н)+ и (-)-5-хлор-3,3-диметил-2-[5-[(3S или 3R)-1-пропан-2-илсульфонилпирролидин-3-ил]пиридин-3-ил]изоиндол-1-он (3.1 мг, пример 11). MS: 448.1 (М+Н)+.
Пример 12 и Пример 13
(+)-5-xлop-2-[5-[(3R или 3S)-1-циклопропилсульфонилпирролидин-3-ил]пиридин-3-ил]-3,3-диметилизоиндол-1-он и (-)-5-хлор-2-[5-[(3S или 3R)-1-циклопропилсульфонилпирролидин-3-ил]пиридин-3-ил]-3,3-диметилизоиндол-1-он

и

По аналогии со способом, описанным для получения примера 7 (стадия D), циклопропансульфонилхлорид использовали с получением рацемической смеси соединения, указанного в заголовке (17 мг), которая после разделения с помощью СКЖХ (колонка: chiralPak AD-H, 250×30 мм ID; подвижная фаза: А для СO2 и В для метанола (0.1% NH3.H2O); градиент: 40% В; скорость потока: 50 мл/мин) дала соединения, указанные в заголовке (+)-5-хлор-2-[5-[(3R или 3S)-1-циклопропилсульфонилпирролидин-3-ил]пиридин-3-ил]-3,3-диметилизоиндол-1-он (4.7 мг, пример 12), MS: 446.1 (М+Н)+ и (-)-5-хлор-2-[5-[(3S или 3R)-1-циклопропилсульфонилпирролидин-3-ил]пиридин-3-ил]-3,3-диметилизоиндол-1-он (4.1 мг, пример 13). MS: 446.1 (М+Н)+
Пример 14
5-хлор-2-[5-(3-фтор-1-пропан-2-илсульфонилпирролидин-3-ил)пиридин-3-ил]-3,3-диметилизоиндол-1-он

[A] 3-(5-бромо-пиридин-3-ил)-3-фтор-пирролидин-1-карбоновой кислоты трет-бутиловый эфир

Dast (1.3 г, 8 ммоль) добавили по каплям в раствор 3-(5-бромо-пиридин-3-ил)-3-гидрокси-пирролидин-1-карбоновой кислоты трет-бутилового эфира (Пример 8[А]) (1.37 г, 4 ммоль) в ДХМ при 0°C. Реакционной смеси дали нагреться до комнатной температуры и перемешивали в течение 2 часов. После того, как ЖХ-МС и ТСХ показали израсходование исходного материала, водный раствор NaHCO3 медленно добавили в реакционную смесь. Отделенный органический слой высушили над безводн. Na2SO4 и сконцентрировали под вакуумом с получением неочищенного остатка, который очистили колоночной хроматографией (петролейный эфир : ЕА=1:1) с получением соединения, указанного в заголовке (410 мг, 30%), в виде желтого осадка.
[В] 3-[5-(6-хлор-1,1-диметил-3-оксо-1,3-дигидро-изоиндол-2-ил)-пиридин-3-ил]-3-фтор-пирролидин-1-карбоновой кислоты трет-бутиловый эфир
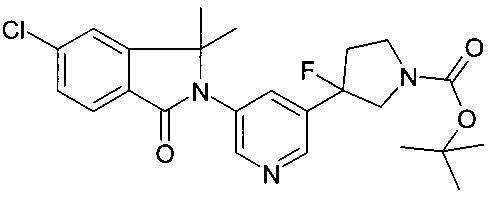
По аналогии со способом, описанным для получения примера 7[С], использовали 3-(5-бромо-пиридин-3-ил)-3-фтор-пирролидин-1-карбоновой кислоты трет-бутиловый эфир с получением соединения, указанного в заголовке, в виде неочищенного продукта. Его сразу использовали на следующей стадии без дополнительной очистки. MS: 345.1 (М+Н)+.
[С] 5-хлор-2-[5-(3-фтор-1-пропан-2-илсульфонилпирролидин-3-ил)пиридин-3-ил]-3,3-диметилизоиндол-1-он

По аналогии со способом, описанным для получения примера 7[D], использовали пропан-2-сульфонилхлорид с получением соединения, указанного в заголовке, в виде белого осадка. MS: 466.2 (М+Н)+.
Пример 15
5-хлор-3,3-диметил-2-[5-(1-пропилсульфонилпиперидин-4-ил)пиридин-3-ил]изоиндол-1-он

[А] 5-амино-3',6'-дигидро-2'Н-[3,4']бипиридинил-1'-карбоновой кислоты трет-бутиловый эфир

Смесь 5-бромпиридин-3-амина (5.5 г, 31.79 ммоль), трет-бутил 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5,6-дигидропиридин-1(2Н)-карбоксилата (9.83 г, 31.79 ммоль), Pd(dppf)Cl2 (1 г), CS2CO3 (20.72 г) в диоксане (80 мл) и Н2O (2 мл) нагревали при кипении с обратным холодильником в течение 12 часов. Затем ее охладили до комнатной температуры, реакционную смесь разбавили EtOAc (300 мл) и органический слой промыли солевым раствором (80 мл, 2х), отфильтровали, и сконцентрировали под вакуумом с получением неочищенного продукта, который очистили посредством хроматографии (петролейный эфир: этилацетат = 10:1) с получением соединения, указанного в заголовке (7 г) в виде желтого осадка. MS: 276.5 (М+Н)+.
[В] 5-амино-3',4',5',6'-тетрагидро-2'Н-[3,4']бипиридинил-1'-карбоновой кислоты трет-бутиловый эфир
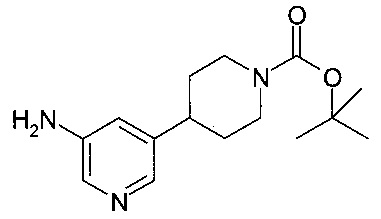
Смесь трет-бутил 5-амино-5',6'-дигидро-[3,4'-бипиридин]-1'(2'Н)-карбоксилата (7 г, 25.4 ммоль) и Pd/C (700 мг) в МеОН (50 мл) перемешивали при давлении 35 фунт/кв. дюйм Н2 при комнатной температуре в течение 8 часов. После того, как ТСХ (петролейный эфир : EtOAc = 3:1) показала полное расходование исходного материала, смесь отфильтровали и фильтрат сконцентрировали под вакуумом с получением неочищенного продукта (7 г). Его сразу использовали на следующей стадии без дополнительной очистки. MS: 278.0 (М+Н)+.
[С] 5-йодо-3',4',5',6'-тетрагидро-2'Н-[3,4']бипиридинил-1'-карбоновой кислоты трет-бутиловый эфир

К смеси трет-бутил 4-(5-аминопиридин-3-ил)пиперидин-1-карбоксилата (7 г, 25.2 ммоль) и p-TsOH (8.7 г, 50.48 ммоль) в MeCN (100 мл) добавили раствор KI (6.28 г, 37.86 ммоль) и NaNO2 (2.61 г, 37.86 ммоль) в воде (20 мл) по каплям при -10°C. Смесь перемешивали при 0°C в течение 2 часов. После того, как ТСХ (петролейный эфир : EtOAc = 3:1) показала полное расходование исходного материала, реакционную смесь разбавили EtOAc (300 мл) и подщелачили с помощью водного раствора NaHCO3 до рН=8. Водный слой экстрагировали EtOAc (300 мл, 3х), и объединенные органические слои промыли водой (200 мл), солевым раствором (100 мл), высушили над безводным Na2SO4, отфильтровали и сконцентрировали под вакуумом. Остаток очистили посредством колоночной хроматографии (ЕА : петролейный эфир = 1:1) с получением соединения, указанного в заголовке (5.5 г) в виде желтого осадка. MS: 332.7 (М+Н)+.
[D] 5-(6-хлор-1,1-диметил-3-оксо-1,3-дигидро-изоиндол-2-ил)-3',4',5',6'-тетрагидро-2'H-[3,4']бипиридинил-1'-карбоновой кислоты трет-бутиловый эфир

По аналогии со способом, описанным для получения примера 7[С], 5-йод-3',4',5',6'-тетрагидро-2'Н-[3,4']бипиридинил-1'-карбоновой кислоты трет-бутиловый эфир использовали с получением соединения, указанного в заголовке, в виде неочищенного продукта. Его сразу использовали на следующей стадии без дополнительной очистки. MS: 456.1 (М+Н)+.
[Е] 5-хлор-3,3-диметил-2-[5-(1-пропилсульфонилпиперидин-4-ил)пиридин-3-ил]изоиндол-1-он
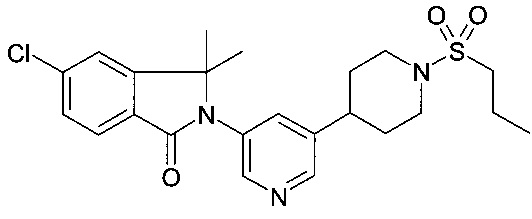
По аналогии со способом, описанным для получения примера 7[D], пропан-1-сульфонилхлорид использовали с получением соединения, указанного в заголовке, в виде белого осадка. MS: 462.1 (М+Н)+
Следующие примеры, перечисленные в Таблице 1 получили по аналогии со способами, описанными для получения примера 15, с использованием подходящих исходных соединений:



Пример 21
5-хлор-2-[5-(1-этилсульфонилпиперидин-4-ил)пиридин-3-ил]-3Н-изоиндол-1-он

[А] 5-(5-хлор-1-оксо-1.3-дигидро-изоиндол-2-ил)-3',4',5',6'-тетрагидро-2'H-[3,4']бипиридинил-1'-карбоновой кислоты трет-бутиловый эфир

Смесь 5-хлор-2,3-дигидро-изоиндол-1-она (71 мг, 0.43 ммоль), 5-йод-3',4',5',6'-тетрагидро-2'Н-[3,4']бипиридинил-1'-карбоновой кислоты трет-бутилового эфира (150 мг, 0.38 ммоль) (Пример 15[С]), CuI (22 мг, 0.11 ммоль), (1S, 2S)-циклогексан-1,2-диамина (0.03 мл, 0.22 ммоль) и K3PO4 (165 мг, 0.77 ммоль) в диоксане (10 мл) перемешивали при 120°C в течение 2 часов. Получившуюся смесь влили в воду (50 мл) и водный слой экстрагировали EtOAc (30 мл, 3х). Объединенные органические слои промыли солевым раствором, высушили над безводным Na2SO4 и сконцентрировали под вакуумом с получением неочищенного продукта, который очистили посредством колоночной хроматографии (EtOAc : РЕ=1:1) с получением соединения, указанного в заголовке (100 мг, 61%) в виде желтой пены. MS: 428.1 (М+Н)+.
[В] 5-хлор-2-(1',2',3',4',5',6'-гексагидро-[3,4']бипиридинил-5-ил)-2,3-дигидро-изоиндол-1-он
Смесь 5-(5-хлор-1-оксо-1,3-дигидро-изоиндол-2-ил)-3',4',5',6'-тетрагидро-2'H-[3,4']бипиридинил-1'-карбоновой кислоты трет-бутилового эфира (100 мг) и ацетилхлорида (0.56 мл) в метаноле (12 мл) перемешивали при комнатной температуре в течение 2 часов. После концентрирования под вакуумом, она дала неочищенный продукт, который использовали без дополнительной очистки в виде светло-желтой пены. MS: 328.1 (М+Н)+.
[С] 5-хлор-2-[5-(1-этилсульфонилпиперидин-4-ил)пиридин-3-ил]-3Н-изоиндол-1-он

К перемешанному коричневому раствору 5-хлор-2-(1',2',3',4',5',6'-гексагидро-[3,4']бипиридинил-5-ил)-2,3-дигидро-изоиндол-1-она (33 мг, 0.1 ммоль) и Et3N (0.50 мл) в ДХМ (5 мл) добавили этансульфонилхлорид (0.014 мл, 0.13 ммоль) при 0°C и смесь перемешивали при 0°C в течение 1 часа. Получившуюся смесь экстрагировали EtOAc (2×50 мл) и объединенные органические слои промыли солевым раствором, высушили над безводным Na2SO4, отфильтровали и сконцентрировали под вакуумом. Остаток очистили с помощью препаративной ВЭЖХ с получением соединения, указанного в заголовке (18 мг, 43%) в виде белой пены. MS: 420.1 (М+Н)+.
Пример 22
5-хлор-2-[5-(1-пропан-2-илсульфонилпиперидин-4-ил)пиридин-3-ил]-3Н-изоиндол-1-он
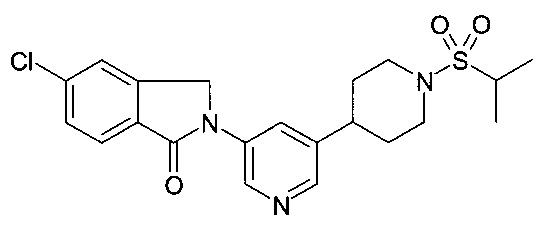
По аналогии со способом, описанным для получения примера 21 [С], пропан-2-сульфонилхлорид использовали с получением соединения, указанного в заголовке, в виде белого осадка. MS: 434.1 (М+Н)+.
Пример 23
5-хлор-2-[5-[1-(4-метилпиридин-3-карбонил)пиперидин-4-ил]пиридин-3-ил]-3Н-изоиндол-1-он
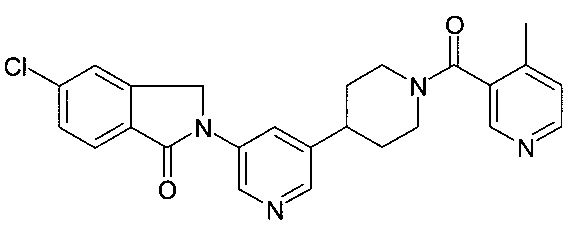
По аналогии со способом, описанным для получения примера 21 [С], 4-метил-никотиноилхлорид использовали с получением соединения, указанного в заголовке, в виде белого осадка. MS: 447.1 (М+Н)+.
Пример 24 и Пример 25
(+)-(3R или 3S)-5-хлор-2-[5-(1-этилсульфонилпиперидин-4-ил)пиридин-3-ил]-3-метил-3H-изоиндол-1-он и (-)-(3S или 3R)-5-хлор-2-[5-(1-этилсульфонилпиперидин-4-ил)пиридин-3-ил]-3-метил-3Н-изоиндол-1-он
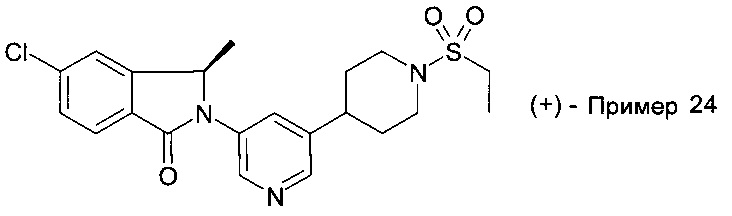
и
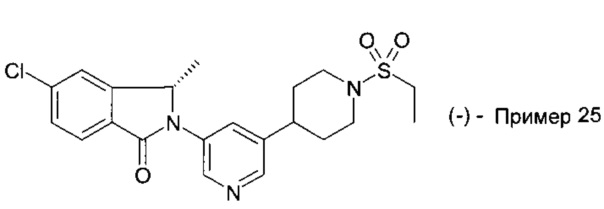
По аналогии со способом, описанным для получения примера 21, 5-хлор-3-метил-2,3-дигидро-изоиндол-1-он (промежуточное соединение А-2) (стадия А) и этансульфонилхлорид (стадия С) использовали с получением соединения, указанного в заголовке, в виде неочищенной рацемической смеси (50 мг), которая после разделения с помощью СКЖХ (IС 250 мм × 50 мм, 5 мкм, подвижная фаза А: сверхкритический СO2, В: этанол (0.05% NH3.H2O), А : В = 50:50 при 2 мл/мин) дала (+)-(3R или 3S)-5-хлор-2-[5-(1-этилсульфонилпиперидин-4-ил)пиридин-3-ил]-3-метил-3Н-изоиндол-1-он (12 мг, пример 24) в виде серо-белой пены, MS: 434.1 (М+Н)+ и (-)-(3S или 3R)-5-хлор-2-[5-(1-этилсульфонилпиперидин-4-ил)пиридин-3-ил]-3-метил-3Н-изоиндол-1-он (15 мг, пример 25) в виде серо-белой пены. MS: 434.1 (M+H)+.
Пример 26 и Пример 27
(+)-(3R или 3S)-5-хлор-3-метил-2-[5-(1-пропан-2-илсульфонилпиперидин-4-ил)пиридин-3-ил]-3Н-изоиндол-1-он и (-)-(3S или 3R)-5-хлор-3-метил-2-[5-(1-пропан-2-илсульфонилпиперидин-4-ил)пиридин-3-ил]-3Н-изоиндол-1-он
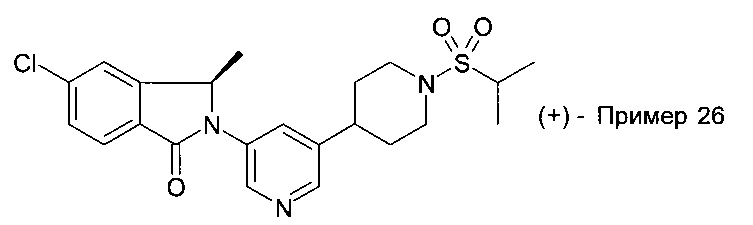
и
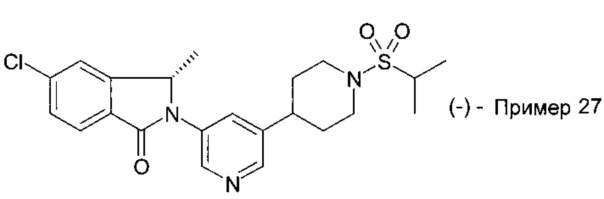
По аналогии со способом, описанным для получения примера 21, 5-хлор-3-метил-2,3-дигидро-изоиндол-1-он (промежуточное соединение А-2) (стадия А) и пропан-2-сульфонилхлорид (стадия С) использовали с получением соединения, указанного в заголовке, в виде неочищенной рацемической смеси (20 мг), которая после разделения с помощью СКЖХ (IС 250 мм × 50 мм, 5 мкм, подвижная фаза A: сверхкритический СO2, В: этанол (0.05% NH3H2O), А : В = 50:50 при 2 мл/мин) дала (+)-(3R или 3S)-5-хлор-3-метил-2-[5-(1-пропан-2-илсульфонилпиперидин-4-ил)пиридин-3-ил]-3Н-изоиндол-1-он (4 мг, пример 26) в виде серо-белой пены, MS: 448.1 (М+Н)+ и (-)-(3S или 3R)-5-хлор-3-метил-2-[5-(1-пропан-2-илсульфонилпиперидин-4-ил)пиридин-3-ил]-3Н-изоиндол-1-он (5 мг, пример 27) в виде серо-белой пены. MS: 448.1 (М+Н)+.
Пример 28 и Пример 29
(+)-(3R или 3S)-5-хлор-3-метил-2-[5-[1-(4-метилпиридин-3-карбонил)пиперидин-4-ил]пиридин-3-ил]-3Н-изоиндол-1-он и (-)-(3S или 3R)-5-хлор-3-метил-2-[5-[1-(4-метилпиридин-3-карбонил)пиперидин-4-ил]пиридин-3-ил]-3Н-изоиндол-1-он

и

По аналогии со способом, описанным для получения примера 21, 5-хлор-3-метил-2,3-дигидро-изоиндол-1-он (промежуточное соединение А-2) (стадия А) и 4-метил-никотиноилхлорид (стадия С) использовали с получением соединения, указанного в заголовке, в виде неочищенной рацемической смеси (50 мг), которая после разделения с помощью СКЖХ (IС 250 мм × 50 мм, 5 мкм, подвижная фаза A: сверхкритический СO2, В: этанол (0.05% NH3.H2O), А : В = 50:50 при 2 мл/мин) дала (+)-(3R или 3S)-5-хлор-3-метил-2-[5-[1-(4-метилпиридин-3-карбонил)пиперидин-4-ил]пиридин-3-ил]-3Н-изоиндол-1-он (13 мг, пример 28) в виде серо-желтой пены, MS: 461.1 (М+Н)+ и (-)-(3S или 3R)-5-хлор-3-метил-2-[5-[1-(4-метилпиридин-3-карбонил)пиперидин-4-ил]пиридин-3-ил]-3Н-изоиндол-1-он (17 мг, пример 29) в виде серо-желтой пены. MS: 461.1 (М+Н)+.
Пример 30
5-хлор-2-[5-(1-этилсульфонил-4-фторпиперидин-4-ил)пиридин-3-ил]-3,3-диметилизоиндол-1-он
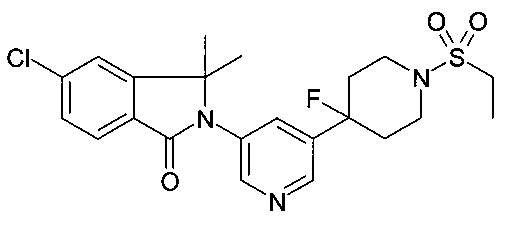
[А] 5-бромо-4'-гидрокси-3',4',5',6'-тетрагидро-2'Н-[3,4']бипиридинил-1'-карбоновой кислоты трет-бутиловый эфир
По аналогии со способом, описанным для получения примера 8[А], 4-оксо-пиперидин-1-карбоновой кислоты трет-бутиловый эфир использовали с получением соединения, указанного в заголовке (2 г, 56%), в виде белого осадка. MS: 357.0 (М+Н)+
[В] 5-бромо-4'-фтор-3',4',5',6'-тетрагидро-2'H-[3,4']бипиридинил-1'-карбоновой кислоты трет-бутиловый эфир
По аналогии со способом, описанным для получения примера 14[А], 5-бромо-4'-гидрокси-3',4',5',6'-тетрагидро-2'Н-[3,4']бипиридинил-1'-карбоновой кислоты трет-бутиловый эфир использовали с получением соединения, указанного в заголовке (500 мг, 48%), в виде белого осадка. MS: 359.1 (М+Н)+
[С] 5-(6-хлор-1,1-диметил-3-оксо-1,3-дигидро-изоиндол-2-ил)-4'-фтор-3',4',5',6'-тетрагидро-2'Н-[3,4']бипиридинил-1'-карбоновой кислоты трет-бутиловый эфир
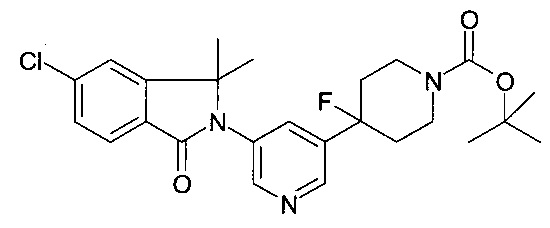
По аналогии со способом, описанным для получения примера 7[С], 5-бромо-4'-фтор-3',4',5',6'-тетрагидро-2'H-[3,4']бипиридинил-1'-карбоновой кислоты трет-бутиловый эфир использовали с получением соединения, указанного в заголовке, в виде неочищенного продукта. Его сразу использовали на следующей стадии без дополнительной очистки. MS: 474.1 (М+Н)+.
[D] 5-хлор-2-[5-(1-этилсульфонил-4-фторпиперидин-4-ил)пиридин-3-ил]-3,3-диметилизоиндол-1-он

По аналогии со способом, описанным для получения примера 7[D], этансульфонилхлорид использовали с получением соединения, указанного в заголовке (6 мг), в виде белого осадка. MS: 466.2 (М+Н)+.
Пример 31
5-хлор-2-[5-(4-фтор-1-пропан-2-илсульфонилпиперидин-4-ил)пиридин-3-ил]-3,3-диметил изоиндол-1-он
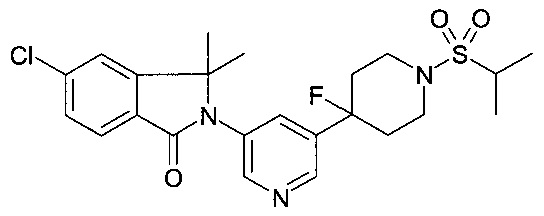
По аналогии со способом, описанным для получения примера 30[D], пропан-2-сульфонилхлорид использовали с получением соединения, указанного в заголовке (6 мг), в виде белого осадка. MS: 480.2 (М+Н)+.
Пример 32
5-хлор-2-[5-(1-этилсульфонилазетидин-3-ил)пиридин-3-ил]-3,3-диметилизоиндол-1-он

[А] 5-хлор-2-(5-йод-пиридин-3-ил)-3,3-диметил-2,3-дигидро-изоиндол-1-он
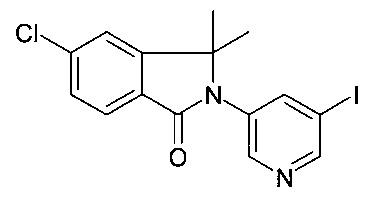
Смесь 5-хлор-3,3-диметил-2,3-дигидро-изоиндол-1-она (промежуточное соединение А-3) (2.3 г, 11.8 ммоль), 3,5-дийод-пиридина (Пример 7[А]) (6.9 г, 21 ммоль), CuI (673 мг, 3.54 ммоль), K3PO4 (5.0 г, 23.6 ммоль) и транс-циклогексан-1,2-диамина (810 мг, 7.1 ммоль) в диоксане (50 мл) перемешивали при 110°C в течение 2 часов. Реакционную смесь отфильтровали и фильтрат сконцентрировали при пониженном давлении с получением неочищенного осадка, который очистили с помощью флеш-хроматографии с получением продукта, указанного в заголовке, в виде белого осадка (1.7 г, 36%). MS: 398.7 (М+Н)+.
[В] 5-хлор-3,3-диметил-2-[5-(4,4,5,5-тетраметил-[1.3.2]диоксаборолан-2-ил)-пиридин-3-ил1-2,3-дигидро-изоиндол-1-он
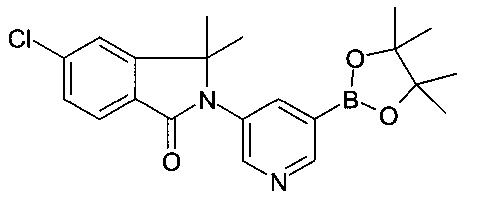
Смесь 5-хлор-2-(5-йод-пиридин-3-ил)-3,3-диметил-2,3-дигидро-изоиндол-1-она (200 мг, 0.5 ммоль), 4,4,4',4',5,5,5',5'-октаметил-2,2,-би(1,3,2-диоксаборолана) (153 мг, 0.6 ммоль), КОАс (98 мг, 1.0 ммоль) в 1,4-диоксане (1 мл) и ДМСО (5 мл) продули азотом в течение 10 ми перед тем, как добавили [1,1'-бис(дифенилфосфино)ферроцен]-дихлорпалладия дихлорметановый аддукт (11 мг, 0.015 ммоль). Смесь продули азотом в течение дополнительных 5 мин и затем нагревали при кипении с обратным холодильником в течение 2 часов. После охлаждения до комнатной температуры, смесь промыли эфиром и солевым раствором, и органический слой высушили над безводн. Na2SO4 и сконцентрировали под вакуумом с получением неочищенного продукта в виде желтоватого масла. Его сразу использовали на следующей стадии без дополнительной очистки. MS: 339.0 (М+Н)+.
[C] 3-[5-(6-хлор-1,1-диметил-3-оксо-1,3-дигидро-изоиндол-2-ил)-пиридин-3-ил]-азетидин-1-карбоновой кислоты трет-бутиловый эфир

Смесь 5-хлор-3,3-диметил-2-[5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-пиридин-3-ил]-2,3-дигидро-изоиндол-1-она (170 мг, 0.5 ммоль), NiI2 (5 мг, 0.015 ммоль), транс-2-аминоциклогексанола гидрохлорида (3 мг, 0.015 ммоль) и NaHMDS (92 мг, 0.5 ммоль) в безводном iPrOH (5 мл) перемешивали при комнатной температуре под N2 в течение 5 мин. Раствор 3-йод-азетидин-1-карбоновой кислоты трет-бутилового эфира (141 мг, 0.5 ммоль) в безводном iPrOH (1 мл) добавили и получившуюся смесь нагревали до 80°C при воздействии микроволнового излучения в течение 30 мин. Реакционный раствор сконцентрировали при пониженном давлении с получением неочищенной смеси, которую очистили с помощью флеш-хроматографии с получением продукта, указанного в заголовке, в виде светло-желтоватого масла (15 мг, 7% за две стадии). MS: 428.3 (М+Н)+.
[D] 5-хлор-2-[5-(1-этилсульфонилазетидин-3-ил)пиридин-3-ил]-3,3-диметилизоиндол-1-он
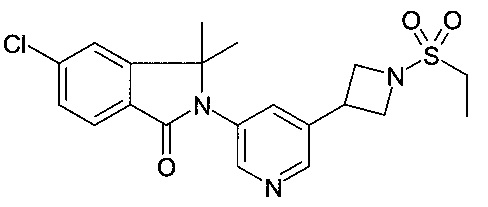
К раствору 3-[5-(6-хлор-1,1-диметил-3-оксо-1,3-дигидро-изоиндол-2-ил)-пиридин-3-ил]-азетидин-1-карбоновой кислоты трет-бутилового эфира (15 мг, 0.04 ммоль) в МеОН (7 мл) добавили AcCl (58 мг, 1 ммоль) при 0°C и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Раствор сконцентрировали под вакуумом с получением желтоватого масла. После того, как высушили в глубоком вакууме в течение 2 часов, его сразу использовали на следующей стадии. Желтоватое масло и TEA (1 г, 10 ммоль) в ДХМ (25 мл) перемешали при 0°C и добавили этансульфонилхлорид (64 мг, 0.5 ммоль). После перемешивания в течение ночи, реакционный раствор сконцентрировали при пониженном давлении. Остаток очистили посредством препаративной ВЭЖХ с получением продукта, указанного в заголовке (2.7 мг), в виде белого осадка. MS: 420.2 (М+Н)+.
Пример 33
2-[5-(1-Ацетилазетидин-3-ил)пиридин-3-ил]-5-хлор-3,3-диметилизоиндол-1-он

[A] 3-(5-бромо-пиридин-3-ил)-азетидин-1-карбоновой кислоты трет-бутиловый эфир
Смесь 3-бромо-5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-пиридина (1.18 г, 5.8 ммоль), NiI2 (200 мг, 0.64 ммоль), транс-2-аминоциклогексанола гидрохлорида (100 мг, 0.66 ммоль) и NaHMDS (2.2 г, 12 ммоль) в безводном iPrOH (10 мл) перемешивали при комнатной температуре под N2 в течение 5 мин. Затем добавили раствор 3-йод-азетидин-1-карбоновой кислоты трет-бутилового эфира (1.6 г, 8.8 ммоль) в безводном iPrOH (1 мл). Получившуюся смесь нагрели до 80°C при воздействии микроволнового излучения в течение 50 мин. Реакционный раствор сконцентрировали при пониженном давлении с получением коричневой смеси, которую очистили с помощью флеш-хроматографии с получением соединения, указанного в заголовке, в виде бесцветного масла (400 мг, 22%). MS: 313.1 (М+Н)+.
[В] 3-[5-(6-хлор-1,1-диметил-3-оксо-1,3-дигидро-изоиндол-2-ил)-пиридин-3-ил]-азетидин-1-карбоновой кислоты трет-бутиловый эфир

Смесь 3-(5-бромо-пиридин-3-ил)-азетидин-1-карбоновой кислоты трет-бутилового эфира (400 мг, 1.3 ммоль), 5-хлор-3,3-диметил-2,3-дигидро-изоиндол-1-она (396 мг, 2 ммоль), CuI (100 мг, 0.52 ммоль), CS2CO3 (700 мг, 2 ммоль) и транс-циклогексан-1,2-диамина (100 мг, 0.88 ммоль) в диоксане (5 мл) перемешивали при 110°C в течение ночи. Раствор отфильтровали и фильтрат сконцентрировали при пониженном давлении с получением неочищенного осадка, который очистили с помощью флеш-хроматографии с получением продукта, указанного в заголовке, в виде светло-желтоватого масла (100 мг, 19%). MS: 428.3 (М+Н)+.
[C] 2-(5-азетидин-3-ил-пиридин-3-ил)-5-хлор-3,3-диметил-2,3-дигидро-изоиндол-1-она гидрохлорид

К раствору 3-[5-(6-хлор-1,1-диметил-3-оксо-1,3-дигидро-изоиндол-2-ил)-пиридин-3-ил]-азетидин-1-карбоновой кислоты трет-бутилового эфира (140 мг, 0.33 ммоль) в МеОН (10 мл) добавили AcCl (5 мл, 7.1 ммоль) при 0°C и смесь затем перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор сконцентрировали под вакуумом с получением желтоватого масла, которое высушили в глубоком вакууме в течение 2 часов. Его сразу использовали на следующей стадии без дополнительной очистки. MS: 328.2 (М+Н)+.
[D] 2-[5-(1-Ацетилазетидин-3-ил)пиридин-3-ил]-5-хлор-3,3-диметилизоиндол-1-он

К раствору 2-(5-азетидин-3-ил-пиридин-3-ил)-5-хлор-3,3-диметил-2,3-дигидро-изоиндол-1-она гидрохлорида (35 мг, 0.096 ммоль) и TEA (101 мг, 1 ммоль) в ДХМ (5 мл) при 0°C добавили AcCl (30 мг, 0.38 ммоль). После перемешивания в течение 30 мин при 0°C, реакционный раствор сконцентрировали при пониженном давлении. Остаток очистили посредством препаративной ВЭЖХ с получением продукта, указанного в заголовке (4.8 мг), в виде белого осадка. MS: 370.2 (М+Н)+.
Пример 34
5-хлор-3,3-диметил-2-[5-(1-пропилсульфонилазетидин-3-ил)пиридин-3-ил] изоиндол-1-он
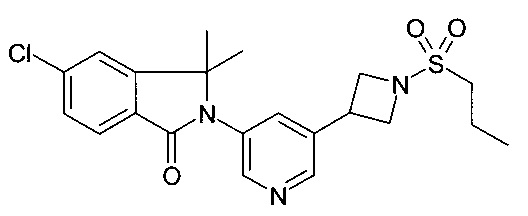
По аналогии со способом для получения примера 33, пропан-1-сульфонилхлорид использовали с получением соединения, указанного в заголовке (5.1 мг) в виде белого осадка. MS: 434.2 (М+Н)+.
Пример 35
5-хлор-2-[5-(1-циклопропилсульфонилазетидин-3-ил)пиридин-3-ил]-3,3-диметилизоиндол-1-он

По аналогии со способом для получения примера 33, циклопропансульфонилхлорид использовали с получением соединения, указанного в заголовке (19.4 мг) в виде белого осадка. MS: 432.2 (М+Н)+.
Пример 36
5-хлор-3,3-диметил-2-[5-[1-(4-метилпиридин-3-карбонил)азетидин-3-ил]пиридин-3-ил]изоиндол-1-он

К раствору 2-(5-азетидин-3-ил-пиридин-3-ил)-5-хлор-3,3-диметил-2,3-дигидро-изоиндол-1-она гидрохлорида (Пример 33[С]) (30 мг, 0.082 ммоль) и DIEPA (50 мг, 0.39 ммоль) в ДХМ (5 мл) при 0°C добавили 4-метил-никотиновую кислоту (30 мг, 0.22 ммоль) и HATU (50 мг, 0.13). После перемешивания при 0°C в течение 2 часов, реакционный раствор сконцентрировали при пониженном давлении. Остаток очистили посредством препаративной ВЭЖХ с получением соединения, указанного в заголовке (10.8 мг), в виде белого осадка. MS: 447.3 (М+Н)+.
Пример 37
5-хлор-2-[5-(4-фтор-1-пропилсульфонил-4-пиперидил)-3-пиридил]-3,3-диметил-изоиндолин-1-он

По аналогии со способом, описанным для получения примера 30[D], пропан-1-сульфонилхлорид использовали с получением соединения, указанного в заголовке (5 мг), в виде белого осадка. MS: 480.1 (М+Н)+.
Пример 38
5-хлор-2-[5-(1-циклопропилсульфонил-4-фтор-4-пиперидил)-3-пиридил]-3,3-диметил-изоиндолин-1-он

По аналогии со способом, описанным для получения примера 30[D], циклопропансульфонилхлорид использовали с получением соединения, указанного в заголовке (6 мг), в виде белого осадка. MS: 478.2 (М+Н)+.
Пример 39
2-[5-(4-фтор-1-изопропилсульфонил-4-пиперидил)-3-пиридил]-3,3-диметил-1-оксо-изоиндолин-5-карбонитрил

По аналогии со способом, описанным для получения примера 30, 3,3-диметил-1-оксо-2,3-дигидро-1Н-изоиндол-5-карбонитрил (стадия С) и пропан-2-сульфонилхлорид (стадия D) использовали с получением соединения, указанного в заголовке (5 мг), в виде белого осадка. MS: 471.2 (М+Н)+.
Пример 40
6-[5-(1-этилсульфонил-4-фтор-4-пиперидил)-3-пиридил]-2-метокси-7,7-диметил-пирроло[3,4-b]пиридин-5-он
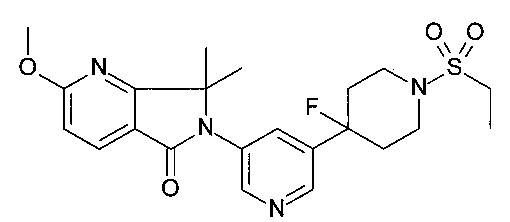
[А] трет-бутил 4-фтор-4-[5-(2-метокси-7,7-диметил-5-оксо-пирроло[3,4-b]-пиридин-6-ил)-3-пиридил]пиперидин-1-карбоксилат
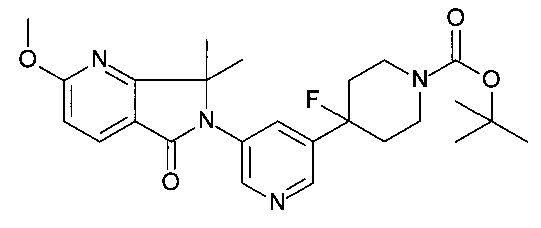
По аналогии со способом, описанным для получения примера 7[С], трет-бутил 4-(5-бромо-3-пиридил)-4-фтор-пиперидин-1-карбоксилат и 2-метокси-7,7-диметил-6Н-пирроло[3,4-b]пиридин-5-он использовали с получением соединения, указанного в заголовке, в виде неочищенного продукта. Его сразу использовали на следующей стадии без дополнительной очистки. MS: 471.1 (М+Н)+.
[В] 6-[5-(1-этилсульфонил-4-фтор-4-пиперидил)-3-пиридил]-2-метокси-7,7-диметил-пирроло[3,4-b]пиридин-5-он
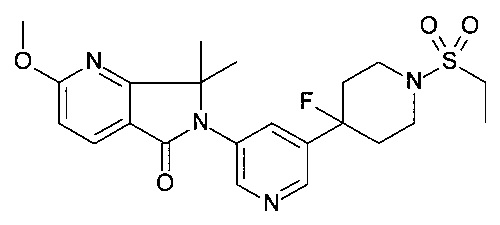
По аналогии со способом, описанным для получения примера 7[D], этансульфонилхлорид использовали с получением соединения, указанного в заголовке (14 мг, 30%), в виде белого осадка. MS: 463.1 (М+Н)+.
Пример 41
6-[5-[4-фтор-1-(1-метилпиразол-4-карбонил)-4-пиперидил]-3-пиридил]-2-метокси-7,7-диметил-пирроло[3,4-b]пиридин-5-он
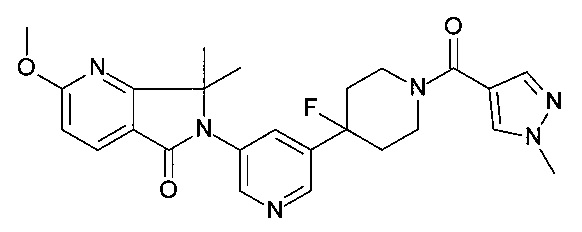
К раствору трет-бутил 4-фтор-4-[5-(2-метокси-7,7-диметил-5-оксо-пирроло[3,4-b]пиридин-6-ил)-3-пиридил]пиперидин-1-карбоксилата (47.0 мг, 0.1 ммоль) (Пример 40 [А]) в МеОН (10 мл) добавили AcCl (0.5 мл, 0.71 ммоль) при 0°C и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор сконцентрировали под вакуумом с получением неочищенного промежуточного соединения в виде желтоватого масла (MS: 371.1 (М+Н)+. Его высушили в глубоком вакууме в течение 2 часов перед тем, как перерастворили в 5 мл ДХМ с последующим добавлением DIEPA (0.5 мл), 1-метилпиразол-4-карбоновой кислоты (28 мг, 0.22 ммоль) и HATU (50 мг, 0.13) при 0°C. Получившуюся смесь перемешивали при 0°C в течение 2 часов и сконцентрировали при пониженном давлении. Остаток очистили посредством препаративной ВЭЖХ с получением требуемого соединения, указанного в заголовке (13 мг, 27%), в виде белого осадка. MS: 479.1 (М+Н)+.
Следующие примеры, перечисленные в Талице 2 получили по аналогии со способами, описанными для получения примеров 40 и 41 с использованием подходящих исходных соединений:


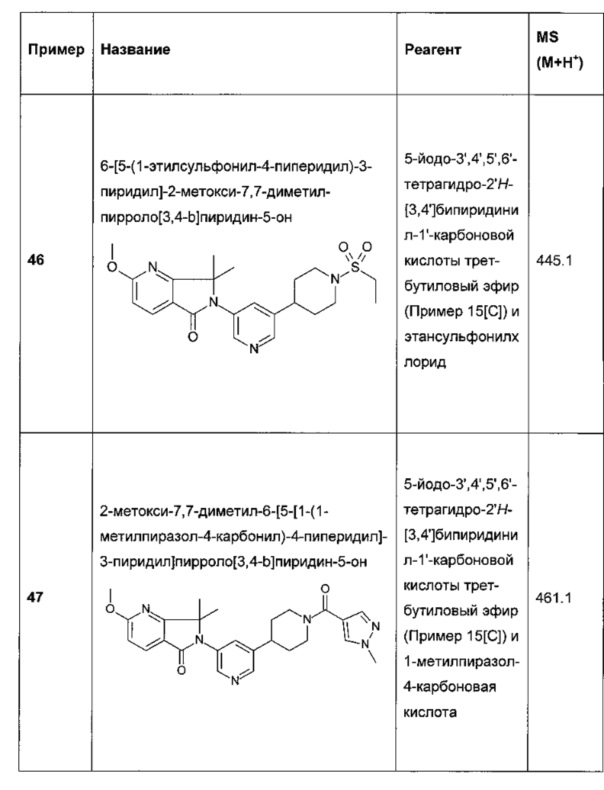
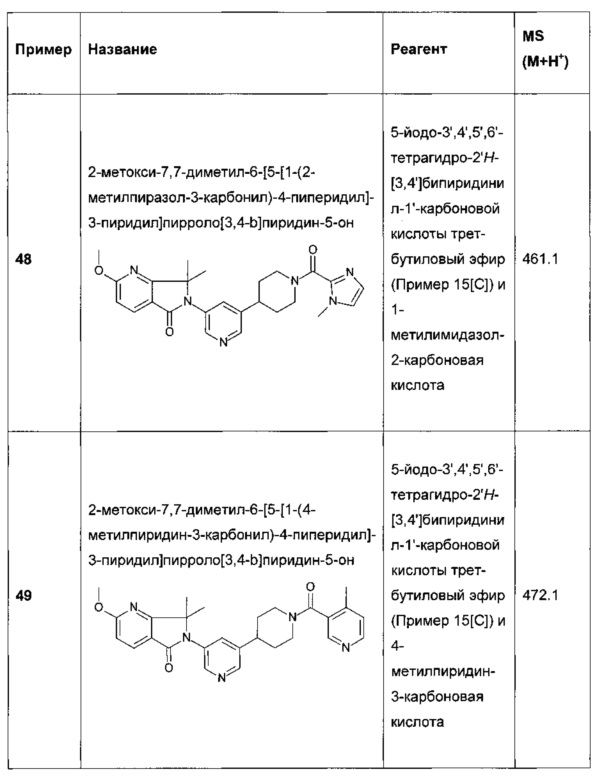
Пример A
Соединение формулы (I) может применяться известными способами само по себе в качестве активного ингредиента для получения таблеток следующего состава:
На таблетку
Пример B
Соединение формулы (I) может применяться известными способами само по себе в качестве активного ингредиента для получения капсул следующего состава:
На капсулу
Реферат
Изобретение относится к соединениям формулы (I), в которой R, Rнезависимо выбраны из Н и алкила; Rи Rнезависимо выбраны из Н и галогена; Rи Rвместе образуют -СН-СН-; Rпредставляет собой Н или Rи Rвместе образуют -(CH)-; А представляет собой -С(O)-или -S(O)-; В представляет собой -С- или -N-; Rпредставляет собой алкил, циклоалкил или замещенный гетероарил, где замещенный гетероарил представляет собой одновалентную ароматическую моноциклическую кольцевую систему из 3-6 кольцевых атомов углерода и 1 или 2 гетероатомов, выбранных из N, где замещенный гетероарил замещен одним-тремя заместителями, независимо выбранными из Н, алкила и галогена; Rпредставляет собой галоген, циано или алкокси; Rпредставляет собой Н; m и n представляют собой 0; р представляет собой из 0 и 1; w представляет собой 1, 2 или 3; и к их фармацевтически приемлемым солям. Изобретение также относится к фармацевтической композиции, ингибирующей альдостеронсинтазу, на основе указанных соединений. Технический результат – получены новые соединения и фармацевтические композиции на их основе, которые могут найти применение в медицине для лечения хронического заболевания почек, застойной сердечной недостаточности, гипертонии. 6 н. и 17 з.п. ф-лы, 2 табл., 49 пр.
Формула
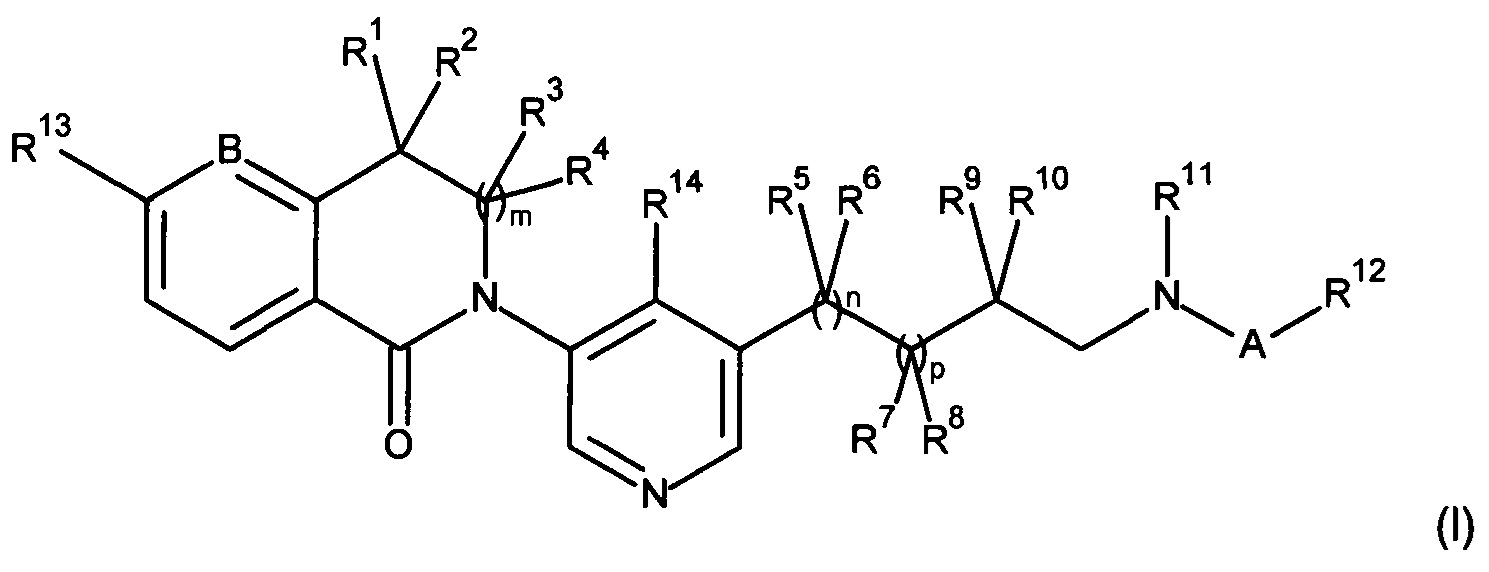
Документы, цитированные в отчёте о поиске
Азотистые гетероциклические производные и лекарственные средства, содержащие их в качестве активного ингредиента

Комментарии