Композиции и способы контроля вредителей растений - RU2745322C2
Код документа: RU2745322C2
Описание
ССЫЛКА НА ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ, ПОДАННЫЙ В ЭЛЕКТРОННОМ ВИДЕ
[0001] Официальная копия перечня последовательностей подана в электронном виде через EFS-Web в виде перечня последовательностей в формате ASCII с названием файла "80668-US-L-ORG-NAT-1_SeqList.txt", созданного 5 декабря 2014 г., и имеющего размер 135 килобайт, и поданного одновременно с описанием. Перечень последовательностей, содержащийся в данном документе в формате ASCII, является частью описания и включен в данный документ посредством ссылки во всей своей полноте.
ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
[0002] Настоящее изобретение относится к пестицидным белкам и молекулам нуклеиновых кислот, которые их кодируют, а также к композициям и способам контроля вредителей растений.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[0003] Bacillus thuringiensis (Bt) является грамположительной спорообразующей почвенной бактерией, которая отличается своей способностью продуцировать кристаллические включения, которые особенно токсичны для определенных отрядов и видов вредителей растений, в том числе насекомых, но безвредны для растений и других нецелевых организмов. По этой причине композиции, содержащие штаммы Bacillus thuringiensis или их инсектицидные белки, могут применяться в качестве приемлемых с точки зрения охраны окружающей среды инсектицидов для контроля насекомых-вредителей, важных с точки зрения сельского хозяйства, или насекомых-переносчиков различных заболеваний человека или животных.
[0004] Кристаллические (Cry) белки из Bacillus thuringiensis обладают сильной инсектицидной активностью в отношении преимущественно личинок чешуекрылых, двукрылых и жесткокрылых. Эти белки также продемонстрировали активность в отношении вредителей из отрядов Hymenoptera, Homoptera, Phthiraptera, Mallophaga и вредителей из отрядов подкласса Acari, а также других групп беспозвоночных, таких как Nemathelminthes, Platyhelminthes и Sarcomastigorphora (Feitelson, J. 1993. The Bacillus Thuringiensis family tree. In Advanced Engineered Pesticides. Marcel Dekker, Inc., New York, N.Y.). Эти белки изначально разделили на классы CryI-CryVI преимущественно на основании их инсектицидной активности. Основными классами были специфические для Lepidoptera (I), специфические для Lepidoptera и Diptera (II), специфические для Coleoptera (III), специфические для Diptera (IV) и специфические для нематод (V) и (VI). Далее белки разделили на подсемейства, белкам с более высокой степенью родства в пределах каждого семейства присвоили буквы для обозначения раздела, как, например, CryIA, CryIB, CryIC и т.д. Еще более близкородственным белкам в пределах каждого раздела присвоили названия, такие как CryIC(a), CryIC(b) и т.д. Термины "токсин Cry" и "дельта-эндотоксин" применялись взаимозаменяемо с термином "белок Cry". Современная номенклатура белков и генов Cry основана на гомологии аминокислотных последовательностей, а не на специфичности в отношении целевых насекомых (Crickmore et al. (1998) Microbiol. Mol. Biol. Rev. 62:807-813). В этой более распространенной классификации каждому токсину присваивается уникальное название, включающее первичный ранг (арабская цифра), вторичный ранг (заглавная буква), третичный ранг (строчная буква) и четвертичный ранг (еще одна арабская цифра). В современной классификации в первичном ранге римские цифры были заменены на арабские цифры. Например, "CryIA(а)" согласно старой номенклатуре в настоящее время имеет название "Cry1Aa" согласно современной номенклатуре.
[0005] Белки Cry представляют собой глобулярные белковые молекулы, которые накапливаются в виде протоксинов в кристаллической форме в ходе стадии споруляции Bt. После поедания вредителем кристаллы, как правило, растворяются с высвобождением протоксинов, размер которых может варьировать, например, от 130-140 кДа в случае белков Cry, активных в отношении чешуекрылых, и 60-80 кДа в случае белков Cry, активных в отношении жесткокрылых. Протоксины превращаются в полноценные токсичные фрагменты (N-концевой участок размером приблизительно 60-70 кДа) под действием протеаз пищеварительного канала целевого вредителя. Многие из этих белков очень токсичны для специфических целевых насекомых, но безвредны для растений и других нецелевых организмов.
[0006] Белки Cry, как правило, имеют пять доменов с консервативной последовательностью и три домена с консервативной структурой (см., например, de Maagd et al. (2001) Trends Genetics 17:193-199). Первый домен с консервативной структурой, называемый домен I, как правило, состоит из семи альфа-спиралей и вовлечен во вставку в мембрану и образовании пор. Домен II, как правило, состоит из трех бета-складчатых слоев, расположенных в конфигурации типа греческий ключ, а домен III состоит из двух антипараллельных бета-складчатых слоев в виде структуры 'jelly-roll' (de Maagd et al., 2001, выше). Домены II и III вовлечены в распознавание и связывание рецепторов, и поэтому считаются детерминантами специфичности токсина.
[0007] Многочисленные коммерчески ценные растения, в том числе широко распространенные сельскохозяйственные культуры, восприимчивы к нападению вредителей растений, в том числе насекомых-вредителей и нематод-вредителей, что приводит к существенному снижению урожайности и качества сельскохозяйственных культур. Например, вредители растений являются главным фактором потери урожая важных мировых сельскохозяйственных культур. Приблизительно 8 миллиардов долларов теряется каждый год только в Соединенных Штатах в связи с повреждениями, вызываемыми вредителями, не являющимися млекопитающими, в том числе насекомыми. В дополнение к потерям урожая полевых культур насекомые-вредители также ложатся бременем на овощеводов и плодоводов, производителей декоративных цветов, а также владельцев приусадебных хозяйств.
[0008] Насекомых-вредителей контролируют главным образом путем интенсивного применения химических пестицидов, которые действуют путем подавления роста насекомых, препятствования питанию или размножению, или вызывая гибель. Средства для биологического контроля вредителей, например, штаммы Bacillus thuringiensis, экспрессирующие пестицидные токсины, такие как белки Cry, также применялись в отношении культурных растений с удовлетворительными результатами, что является альтернативой или дополнением к химическим пестицидам. Были выделены гены, кодирующие некоторые из этих белков Cry, и было показано, что их экспрессия в гетерологичных хозяевах, таких как трансгенные растения, обеспечивает другой инструмент для контроля экономически важных насекомых-вредителей.
[0009] Таким образом, можно достичь надлежащего контроля насекомых, но определенные химические вещества иногда могут наносить вред на нецелевым полезным насекомым, и определенные биологические вещества имеют очень узкий спектр активности. Кроме того, продолжительное применение определенных способов химического и биологического контроля повышает вероятность развития у насекомых-вредителей устойчивости к таким мерам контроля. Частично это ослаблялось путем применения различных агротехнических приемов, связанных с устойчивостью, однако все еще сохраняется потребность в поиске новых и эффективных средств для контроля вредителей, которые обеспечивают экономическую пользу фермерам и которые являются приемлемыми с точки зрения охраны окружающей среды. Особенно необходимыми являются средства для контроля, целенаправленно воздействующие на более широкий спектр экономически важных насекомых-вредителей, и которые обеспечивают эффективный контроль линий насекомых, которые могут стать устойчивыми к существующим средствам для контроля насекомых или являются таковыми.
КРАТКОЕ ОПИСАНИЕ
[0010] Ввиду этих потребностей, целью настоящего изобретения является обеспечение новых средств для контроля вредителей путем обеспечения новых генов и пестицидных белков, которые можно применять для контроля целого ряда вредителей растений.
[0011] В настоящем изобретении предусмотрены композиции и способы придания пестицидной активности бактериям, растениям, растительным клеткам, тканям и семенам. В частности, предусмотрены химерные гены, содержащие новые полинуклеотиды, которые кодируют белки Cry, выделенные из Bacillus thuringiensis (Bt), и последовательности, в значительной степени идентичные им, экспрессия которых приводит к образованию белков, обладающих токсичностью в отношении экономически важных насекомых-вредителей, в частности, насекомых-вредителей, которые поражают растения. Кроме того, настоящее изобретение относится к новым белкам Cry, полученным в результате экспрессии последовательностей нуклеиновых кислот, а также к композициям и составам, содержащим белки Cry, которые оказывают токсическое воздействие на насекомых путем подавления способности насекомых-вредителей к выживанию, росту и размножению, либо путем ограничения повреждения или гибели культурных растений, вызванных насекомыми. Белки Cry по настоящему изобретению включают нативные белки Cry и мутантные белки Cry, которые содержат одну или несколько аминокислотных замен, добавлений или делеций. Примеры мутантных белков Cry включают без ограничения таковые, подвергнутые мутации, чтобы обладать более широким спектром активности по сравнению с их аналогами, нативными белками Cry, или таковые, подвергнутые мутации, чтобы ввести эпитоп для выработки антител, которые избирательно распознают мутантный белок, а не нативный белок. Новые белки Cry по настоящему изобретению обладают высокой активностью в отношении насекомых-вредителей. Например, белки Cry по настоящему изобретению можно применять для контроля одного или нескольких экономически важных насекомых-вредителей, таких как совка-ипсилон (Agrotis ipsilon), кукурузный мотылек (Ostrinia nubilalis), совка травяная (Spodoptera frugiperda), американская кукурузная совка (Helicoverpa zea), огневка тростниковая (Diatraea saccharalis), гусеница совки бархатных бобов (Anticarsia gemmatalis), соевая совка (Chrysodeixis includes), огневка кукурузная юго-западная (Diatraea grandiosella), западная бобовая совка (Richia albicosta), табачная совка (Heliothis virescens), восточный кукурузный мотылек (Ostrinia furnacalis), хлопковая совка (Helicoverpa armigera), огневка желтая рисовая (Chilo suppressalis), розовая стеблевая совка (Sesamia calamistis), огневка рисовая (Cnaphalocrocis medinalis) и т.п.
[0012] В настоящем изобретении также предусмотрены синтетические полинуклеотиды, которые кодируют белки Cry по настоящему изобретению и имеют один или несколько кодонов, оптимизированных для экспрессия в трансгенных организмах, таких как бактерии и растения.
[0013] Настоящее изобретение дополнительно относится к кассетам экспрессии и рекомбинантным векторам, содержащим полинуклеотид, который кодирует белок Cry по настоящему изобретению. В настоящем изобретении также предусмотрены трансформированные бактерии, растения, растительные клетки, ткани и семена, содержащие химерный ген, или кассету экспрессии, или рекомбинантный вектор, которые содержат полинуклеотид, кодирующий белок Cry по настоящему изобретению.
[0014] Настоящее изобретение также относится к способам применения полинуклеотидов, например, в ДНК-конструкциях, или химерных генах, или кассетах экспрессии, или рекомбинантных векторах для трансформация и экспрессии в организмах, в том числе микроорганизмах и растениях. Нуклеотидные или аминокислотные последовательности могут представлять собой синтетические последовательности, которые были сконструированы для экспрессии в организме, в том числе без ограничения в микроорганизме или растении, или для получения гибридных токсинов с усиленной пестицидной активностью. Настоящее изобретение дополнительно относится к способам получения белков Cry и к способам применения последовательностей нуклеиновых кислот, например, в микроорганизмах для контроля насекомых или в трансгенных растениях для обеспечения защиты от повреждения насекомыми, а также к способам применения белков Cry и композиций и составов, содержащих белки Cry, например, применению белков Cry, или композиций, или составов по отношению к пораженным вредителями участкам, или для профилактической обработки уязвимых для насекомых участков или растений, чтобы обеспечить защиту от повреждения насекомыми-вредителями. Нуклеотидные или аминокислотные последовательности могут представлять собой синтетические последовательности, которые были сконструированы для экспрессии в организме, в том числе без ограничения в микроорганизме или растении.
[0015] Композиции и способы по настоящему изобретению применимы для получения организмов, которые токсичны для насекомых, в частности, для получения бактерий и растений. Такие организмы и композиции на их основе актуальны для сельскохозяйственных целей. Композиции по настоящему изобретению также применимы для получения измененных или улучшенных белков Cry, которые обладают пестицидной активностью, или для обнаружения наличия белка Cry или нуклеиновых кислот в продуктах или организмах.
[0016] Эти и другие признаки, аспекты и преимущества настоящего изобретения станут более понятны со ссылкой на следующее подробное описание и формулу изобретения.
КРАТКОЕ ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТЕЙ В ПЕРЕЧНЕ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[0017] SEQ ID NO: 1 представляет собой нуклеотидную последовательность, кодирующую белок ВТ-0044.
[0018] SEQ ID NO: 2 представляет собой нуклеотидную последовательность, кодирующую белок ВТ-0051.
[0019] SEQ ID NO: 3 представляет собой нуклеотидную последовательность, кодирующую белок ВТ-0068.
[0020] SEQ ID NO: 4 представляет собой нуклеотидную последовательность, кодирующую белок ВТ-0128.
[0021] SEQ ID NO: 5 представляет собой кодон-оптимизированную последовательность, кодирующую белок ВТ-0044.
[0022] SEQ ID NO: 6 представляет собой кодон-оптимизированную последовательность, кодирующую белок ВТ-0051.
[0023] SEQ ID NO: 7 представляет собой кодон-оптимизированную последовательность, кодирующую белок ВТ-0068.
[0024] SEQ ID NO: 8 представляет собой кодон-оптимизированную последовательность, кодирующую белок ВТ-0128.
[0025] SEQ ID NO: 9 представляет собой нуклеотидную последовательность, кодирующую мутантный белок ВТ-0044.
[0026] SEQ ID NO: 10 представляет собой нуклеотидную последовательность, кодирующую мутантный белок ВТ-0051.
[0027] SEQ ID NO: 11 представляет собой нуклеотидную последовательность, кодирующую мутантный белок ВТ-0068.
[0028] SEQ ID NO: 12 представляет собой нуклеотидную последовательность, кодирующую мутантный белок ВТ-0128.
[0029] SEQ ID NO: 13 представляет собой аминокислотную последовательность белка ВТ-0044.
[0030] SEQ ID NO: 14 представляет собой аминокислотную последовательность белка ВТ-0051.
[0031] SEQ ID NO: 15 представляет собой аминокислотную последовательность белка ВТ-0068.
[0032] SEQ ID NO: 16 представляет собой аминокислотную последовательность белка ВТ-0128.
[0033] SEQ ID NO: 17 представляет собой аминокислотную последовательность мутантного белка ВТ-0044.
[0034] SEQ ID NO: 18 представляет собой аминокислотную последовательность мутантного белка ВТ-0051.
[0035] SEQ ID NO: 19 представляет собой аминокислотную последовательность мутантного белка ВТ-0068.
[0036] SEQ ID NO: 20 представляет собой аминокислотную последовательность мутантного белка ВТ-0128.
[0037] SEQ ID NO: 21-26 представляют собой праймеры, применимые в настоящем изобретении.
ПОДРОБНОЕ ОПИСАНИЕ
[0038] Не подразумевается, что данное описание является подробным перечнем всех различных путей, с помощью которых может быть реализовано настоящее изобретение, или всех признаков, которые можно добавить к настоящему изобретению. Например, признаки, проиллюстрированные в отношении одного варианта осуществления, могут быть включены в другие варианты осуществления, а признаки, проиллюстрированные в отношении конкретного варианта осуществления, могут быть удалены из этого варианта осуществления. Таким образом, настоящим изобретением предполагается, что в некоторых вариантах осуществления настоящего изобретения можно исключить или опустить любой признак или комбинацию признаков, изложенных в данном документе. Кроме того, многочисленные вариации и дополнения к различным вариантам осуществления, предлагаемым в данном документе, будут очевидны для специалистов в данной области в свете настоящего раскрытия, которое не отступает от сути настоящего изобретения. Следовательно, следующие описания предназначены для иллюстрации некоторых конкретных вариантов осуществления настоящего изобретения, а не исчерпывающего определения всех их преобразований, комбинаций и вариаций.
[0039] Если не указано иное, все технические и научные термины, используемые в данном документе, имеют то же значение, которое обычно понятно специалисту в области техники, к которой относится настоящее изобретение. Терминология, применяемая в описании настоящего изобретения в данном документе, используется только в целях описания конкретных вариантов осуществления, а не предназначена для ограничения настоящего изобретения. Следует также понимать, что терминология, применяемая в данном документе, представлена исключительно с целью описания конкретных вариантов осуществления, а не предназначена для ограничения объема настоящего изобретения.
Определения
[0040] Применяемые в данном документе и прилагаемой формуле изобретения формы единственного числа включают ссылки на множественное число, если в контексте явно не указано иное. Таким образом, например, ссылка на "растение" является ссылкой на одно или несколько растений и включает их эквиваленты, известные специалистам в данной области, и т.д. Применяемое в данном документе слово "или" означает любой элемент из конкретного перечня, а также включает любую комбинацию элементов из такого перечня (то есть, включает также "и").
[0041] Применяемый в данном документе термин "приблизительно" означает примерно, ориентировочно, около или в районе. Если термин "приблизительно" применяется в сочетании с числовым диапазоном, он модифицирует этот диапазон, расширяя границы выше и ниже указанных численных значений. В целом, применяемый в данном документе термин "приблизительно" модифицирует численное значение выше и ниже указанного значения путем отклонения на 20 процентов, предпочтительно 10 процентов вверх или вниз (больше или меньше). Что касается температуры, термин "приблизительно" означает ±1°С, предпочтительно ±0,5°С. Если термин "приблизительно" применяется в контексте настоящего изобретения (например, в комбинациях с температурой или значениями молекулярной массы), предпочтительным является точное значение (то есть, без "приблизительно").
[0042] Под "активностью" токсичного белка Cry по настоящему изобретению подразумевается, что токсичный белок действует как активное при пероральном поступлении средство для контроля насекомых, обладает токсическим действием или способен нарушать или ограничивать питание насекомых, что может или не может вызвать гибель насекомого. Когда токсичный белок по настоящему изобретению доставляется в организм насекомого, как правило, результатом является гибель насекомого, или насекомое не питается источником, который делает токсичный белок доступным для насекомого.
[0043] Применяемый в данном документе термин "амплифицированный" означает создание множества копий молекулы нуклеиновой кислоты или множества копий, комплементарных молекуле нуклеиновой кислоты, с применением по меньшей мере одной из молекул нуклеиновых кислот в качестве матрицы. Системы амплификации включают систему на основе полимеразной цепной реакции (ПЦР), систему на основе лигазной цепной реакции (LCR), систему амплификации, основанную на последовательности нуклеиновых кислот (NASBA, Cangene, Миссиссога, Онтарио), систему на основе Q-бета репликазы, систему амплификации, основанную на транскрипции (TAS), и амплификацию с замещением цепей (SDA). См., например, Diagnostic Molecular Microbiology: Principles and Applications, PERSING et al., Ed., American Society for Microbiology, Washington, D.C. (1993). Продукт амплификации называется "ампликоном".
[0044] Применяемый в данном документе термин "химерная конструкция", или "химерный ген", или "химерный полинуклеотид", или "химерная нуклеиновая кислота" (или подобные термины) относится к конструкции или молекуле, содержащей два или более полинуклеотидов разного происхождения, собранных в одну молекулу нуклеиновой кислоты. Термин "химерная конструкция", "химерный ген", "химерный полинуклеотид" или "химерная нуклеиновая кислота" относится к любой конструкции или молекуле, которая содержит без ограничения (1) полинуклеотиды (например, ДНК), в том числе регуляторные и кодирующие полинуклеотиды, которые вместе не встречаются в природе (то есть, по меньшей мере один из полинуклеотидов в конструкции является гетерологичным по отношению по меньшей мере к одному из его других полинуклеотидов), или (2) полинуклеотиды, кодирующие части белков, не связанные в природе, или (3) части промоторов, которые не связаны в природе. Кроме того, химерная конструкция, химерный ген, химерный полинуклеотид или химерная нуклеиновая кислота могут содержать регуляторные полинуклеотиды и кодирующие полинуклеотиды, полученные из разных источников, или могут содержать регуляторные полинуклеотиды и кодирующие полинуклеотиды, полученные из одного и того же источника, но расположенные иным способом, чем встречающийся в природе. В некоторых вариантах осуществления настоящего изобретения химерная конструкция, химерный ген, химерный полинуклеотид или химерная нуклеиновая кислота содержат кассету экспрессии, содержащую полинуклеотид по настоящему изобретению под контролем регуляторных полинуклеотидов, в частности, под контролем регуляторных полинуклеотидов, функционирующих в растениях или бактериях.
[0045] "Кодирующая последовательность" представляет собой последовательность нуклеиновой кислоты, которая транскрибируется в РНК, такую как mRNA, rRNA, tRNA, snRNA, смысловая РНК или антисмысловая РНК. Предпочтительно РНК затем транслируется в организме с продукцией белка.
[0046] Применяемое в данном документе выражение "кодон-оптимизированная" последовательность означает нуклеотидную последовательность рекомбинантного, трансгенного или синтетического полинуклеотида, в котором кодоны выбраны так, чтобы отражать склонность к определенным кодонам, которая может наблюдаться в клетке- или организме-хозяине. Как правило, это выполняется таким образом, чтобы сохранить аминокислотную последовательность полипептида, кодируемого кодон-оптимизированной нуклеотидной последовательностью. В некоторых вариантах осуществления последовательность ДНК рекомбинантной ДНК-конструкции включает последовательность, которая была кодон-оптимизирована для клетки (например, клетки животного, растения или гриба), в которой данная конструкция будет экспрессироваться. Например, у конструкции, которая будет экспрессироваться в растительной клетке, может быть кодон-оптимизированной для экспрессии в растении вся последовательность или ее часть (например, первый элемент для супрессии гена или элемент для экспрессии гена). См., например, патент США №6121014, включенный в данный документ посредством ссылки.
[0047] "Контроль" насекомых означает подавление, посредством токсического действия, способности насекомых-вредителей к выживанию, росту, питанию и/или размножению, или ограничение повреждения или гибели культурных растений, вызванных насекомыми, или защиту максимального потенциального урожая сельскохозяйственной культуры при выращивании в присутствии насекомых-вредителей. "Контроль" насекомых может означать или может не означать уничтожение насекомых, хотя, предпочтительно, означает уничтожение насекомых.
[0048] При использовании в данном описании термины "содержит" и/или "содержащий" указывают на присутствие изложенных признаков, целых чисел, стадий, операций, элементов и/или компонентов, но не исключают присутствие или добавление одного или нескольких других признаков, целых чисел, стадий, операций, элементов, компонентов и/или их групп.
[0049] Применяемая в данном документе переходная фраза "состоящий главным образом из" (и ее грамматические варианты) означает, что объем пункта формулы изобретения следует интерпретировать как охватывающий указанные материалы или стадии, перечисленные в данном пункте формулы изобретения, и таковые, которые существенно не изменяют основную и новую характеристику(и) заявленного изобретения. Таким образом, термин "состоящий главным образом из", когда применяется в пункте формулы настоящего изобретения, не предназначен для интерпретации как эквивалент термину "содержащий".
[0050] В контексте настоящего изобретения "соответствующий" или "соответствует" означает, что когда аминокислотные последовательности вариантных белков Cry выравнивают друг с другом, аминокислоты, которые "соответствуют" определенным перечисленным положениям в вариантном или гомологичном белке, являются такими, которые выравниваются с этими положениями в эталонном белке, но не обязательно находятся именно в этих числовых положениях относительно конкретной эталонной аминокислотной последовательности по настоящему изобретению. Например, если SEQ ID NO: 13 является эталонной последовательностью, и ее выравнивают с SEQ ID NO: 15, Asn4 SEQ ID NO: 15 "соответствует" Asn6 SEQ ID NO: 13.
[0051] "Доставка" композиции или токсичного белка означает, что композиция или токсичный белок вступает в контакт с насекомым, что приводит к токсическому действию и контролю насекомого. Композиция или токсичный белок могут быть доставлены множеством известных путей, например, перорально при поедании насекомым или при контакте с насекомым посредством экспрессии в трансгенном растении, с помощью составленной белковой композиции(й) белков, распыляемой белковой композиции(й), матрицы приманки или любой другой известной из уровня техники системы доставки белков.
[0052] Термин "домен" относится к набору аминокислот, консервативных в определенных положениях по длине выравнивания последовательностей эволюционно родственных белков. В то время как аминокислоты в других положениях гомологов могут отличаться, аминокислоты, которые являются высококонсервативными в определенных положениях, указывают на аминокислоты, которые, вероятно, являются необходимыми для структуры, стабильности или функции белка. Идентифицированные по их высокой степени консервативности в выравненных последовательностях семейства гомологов белков, они могут применяться в качестве идентификаторов для определения того, принадлежит ли любой рассматриваемый полипептид к ранее идентифицированному семейству полипептидов.
[0053] "Эффективное для контроля насекомых количество" означает, что концентрация токсичного белка, которая обеспечивает подавление, посредством токсического действия, способности насекомых к выживанию, росту, питанию и/или размножению, или ограничение вызванных насекомыми повреждения или гибель культурного растения, или защиту максимального потенциального урожая сельскохозяйственной культуры при выращивании в присутствии насекомых-вредителей. "Эффективное для контроля насекомых количество" может означать или может не означать уничтожение насекомых, хотя предпочтительно оно означает уничтожение насекомых.
[0054] Применяемый в данном документе термин "кассета экспрессии" означает молекулу нуклеиновой кислоты, способную управлять экспрессией по меньшей мере одного представляющего интерес полинуклеотида в соответствующей клетке-хозяине, содержащую промотор, функционально связанный с представляющим интерес полинуклеотидом, который функционально связан с сигналом терминации. "Кассета экспрессии" также, как правило, содержит дополнительные полинуклеотиды, необходимые для надлежащей трансляции представляющего интерес полинуклеотида. Кассета экспрессии также может содержать другие полинуклеотиды, которые не требуются для управления экспрессией представляющего интерес полинуклеотида, но которые присутствует из-за соответствующих сайтов рестрикции для извлечения кассеты из вектора экспрессии. Кассета экспрессии, содержащая представляющий интерес полинуклеотид(ы) может быть химерной, что означает, что по меньшей мере один из ее компонентов является гетерологичным по отношению по меньшей мере к одному из ее других компонентов. Кассета экспрессии может также представлять собой последовательность, которая встречается в природе, но была получена в рекомбинантной форме, пригодной для гетерологичной экспрессии. Тем не менее, как правило, кассета экспрессии является гетерологичной по отношению к хозяину, то есть представляющий интерес полинуклеотид в кассете экспрессии не встречается в природе в клетке-хозяине, и его необходимо было ввести в клетку-хозяина или предка клетки-хозяина с помощью процесса трансформации или процесса скрещивания. Экспрессия представляющего интерес полинуклеотида(ов) в кассете экспрессии обычно находится под контролем промотора. В случае многоклеточного организма, такого как растение, промотор может также быть специфичным или предпочтительным по отношению к конкретной ткани, или органу, или стадии развития. После трансформации в растение кассета экспрессии или ее фрагмент также могут называться "вставленным полинуклеотидом" или "полинуклеотидом вставки".
[0055] "Ген" определяется в данном документе как единица наследственности, состоящая из полинуклеотида, который занимает определенное местоположение на хромосоме или плазмиде и который содержит генетическую инструкцию для определенной характеристики или признака, свойственных организму.
[0056] "Протеаза пищеварительного канала" представляет собой протеазу, которая в встречается в пищеварительном тракте насекомого в природе. Данная протеаза, как правило, участвует в переваривании поглощенных белков.
[0057] Термин "гетерологичный" при применении в отношении гена или нуклеиновой кислоты относится к гену, кодирующему фактор, который не находится в его естественном окружении (то есть, который был изменен посредством вмешательства человека). Например, гетерологичный ген может предусматривать ген организма одного вида, введенный в организм другого вида. Гетерологичный ген также может предусматривать ген, нативный по отношению к организму, но который был изменен определенным образом (например, подвергнут мутации, добавлен в виде множества копий, связан с ненативным промоторным или энхансерным полинуклеотидом и т.д.). Гетерологичные гены дополнительно могут предусматривать полинуклеотиды генов растения, которые включают кДНК-формы гена растения; кДНК могут экспрессироваться либо в смысловой (с получением мРНК), либо антисмысловой ориентации (с получением антисмыслового РНК-транскрипта, комплементарного мРНК-транскрипту). Согласно одному аспекту настоящего изобретения гетерологичные гены отличаются от эндогенных генов растения тем, что полинуклеотид гетерологичного гена, как правило, присоединен к полинуклеотидам, содержащим регуляторные элементы, такие как промоторы, которые в природе не встречаются как ассоциированные с геном для белка, кодируемого гетерологичным геном, или с полинуклеотидом гена растения в хромосоме, или ассоциированы с частями хромосомы, в которых они не встречаются в природе (например, гены экспрессируются в локусах, в которых указанный ген в обычных условиях не экспрессируется). Кроме того, "гетерологичный" полинуклеотид относится к полинуклеотиду, в природе не ассоциированному с клеткой-хозяином, в которую его вводят, в том числе к не встречающимся в природе множественным копиям полинуклеотида, встречающегося в природе.
[0058] "Гомологичная рекомбинация" представляет собой обмен ("кроссинговер") фрагментами ДНК между двумя молекулами ДНК или хроматидами пар хромосом в участке идентичных полинуклеотидов. Будет понятно, что "событие рекомбинации" в данном документе означает мейотический кроссинговер.
[0059] Последовательность нуклеиновой кислоты является "изокодонной" по отношению к эталонной последовательности нуклеиновой кислоты в том случае, когда последовательность нуклеиновой кислоты кодирует полипептид, имеющий такую же аминокислотную последовательность, что и полипептид, кодируемый эталонной последовательностью нуклеиновой кислоты.
[0060] Термин "выделенная" молекула нуклеиновой кислоты, полинуклеотид или токсин представляет собой молекулу нуклеиновой кислоты, полинуклеотид или токсичный белок, которые больше не находится в своей естественной среде. Выделенная молекула нуклеиновой кислоты, полинуклеотид или токсин по настоящему изобретению могут находиться в очищенной форме или могут находиться в рекомбинантном хозяине, таком как трансгенная бактериальная клетка или трансгенное растение.
[0061] "Молекула нуклеиновой кислоты" представляет собой одно- или двунитевую ДНК или РНК, которые могут быть выделены из любого источника. В контексте настоящего изобретения молекула нуклеиновой кислоты предпочтительно является сегментом ДНК.
[0062] "Функционально связанный" относится к ассоциации полинуклеотидов на одном фрагменте нуклеиновой кислоты, вследствие чего функция одного влияет на функцию другого. Например, промотор является функционально связанным с кодирующим полинуклеотидом или функциональной РНК, когда он может влиять на экспрессию такого кодирующего полинуклеотида или функциональной РНК (то есть такой кодирующий полинуклеотид или функциональная РНК находятся под контролем промотора на уровне транскрипции). Кодирующий полинуклеотид в смысловой или антисмысловой ориентации может быть функционально связан с регуляторными полинуклеотидами.
[0063] Применяемые в данном документе выражения "пестицидный," инсектицидный" и т.п. относятся к способности белка Cry по настоящему изобретению обеспечивать контроль вредного организма или к количеству белка Cry, которое может обеспечивать контроль вредного организма, как определено в данном документе. Таким образом, пестицидный белок Cry может подавлять способность вредного организма (например, насекомого-вредителя) к выживанию, росту, питанию и/или размножению или уничтожать его.
[0064] "Растение" представляет собой любое растение на любой стадии развития, в частности, семенное растение.
[0065] "Растительная клетка" представляет собой структурную и физиологическую единицу растения, содержащую протопласт и клеточную стенку. Растительная клетка может находиться в форме выделенной одиночной клетки или культивируемой клетки или в качестве части более высокоорганизованной единицы, такой как, например, растительная ткань, орган растения или целое растение.
[0066] "Культура растительных клеток" означает культуры структурных единиц растения, таких как, например, протопласты, клетки в культуре клеток, клетки растительных тканей, пыльцы, пыльцевых трубок, семязачатков, зародышевых мешков, зиготы и зародышей на различных стадиях развития.
[0067] "Растительный материал" относится к листьям, стеблям, корням, цветкам или частям цветков, плодам, пыльце, яйцеклеткам, зиготам, семенам, черенкам, клеточным или тканевым культурам, или к любым другим частям или продуктам растения.
[0068] "Орган растения" представляет собой отдельную и визуально структурированную и дифференцированную часть растения, такую как корень, стебель, лист, цветочная почка или зародыш.
[0069] Выражение "растительная ткань", применяемое в данном документе, означает группу растительных клеток, организованных в структурную и функциональную единицу. Предусматривается любая ткань растения in planta или в культуре. Данный термин включает без ограничения целые растения, органы растений, семена растений, тканевую культуру и любые группы растительных клеток, организованных в структурные и/или функциональные единицы. Применение данного термина в сочетании с любым специфическим типом растительной ткани, приведенным выше или иным образом охваченным данным определением, или без такового не предназначено для исключения любого другого типа растительной ткани.
[0070] "Полинуклеотид" относится к полимеру, состоящему из большого числа мономеров-нуклеотидов, ковалентно связанных в цепь. Такие "полинуклеотиды" включают ДНК, РНК, модифицированные олигонуклеотиды (например, олигонуклеотиды, содержащие основания, которые не являются типичными для биологической РНК или ДНК, такие как 2'-O-метилированные олигонуклеотиды) и т.п. В некоторых вариантах осуществления нуклеиновая кислота или полинуклеотид могут быть однонитевыми, двунитевыми, многонитевыми или представлять собой комбинацию перечисленного. Если не указано иное, конкретная нуклеиновая кислота или полинуклеотид по настоящему изобретению необязательно содержат или кодируют комплементарные полинуклеотиды, в дополнение к любому явно указанному полинуклеотиду.
[0071] "Представляющий интерес полинуклеотид" относится к любому полинуклеотиду, который при переносе в организм, например растение, придает организму требуемую характеристику, такую как устойчивость к антибиотикам, устойчивость к вирусам, устойчивость к насекомым, устойчивость к болезням или устойчивость к другим вредителям, толерантность к гербицидам, улучшенная питательная ценность, улучшенные показатели в производственном процессе, продукция коммерчески ценных ферментов или метаболитов или измененная репродуктивная способность.
[0072] Термин "промотор" относится к полинуклеотиду, как правило, расположенному выше (5') от его кодирующего полинуклеотида, который осуществляет контроль экспрессии кодирующего полинуклеотида, обеспечивая узнавание РНК-полимеразой и другими факторами, необходимыми для правильной транскрипции.
[0073] "Протопласт" представляет собой выделенную растительную клетку без клеточной стенки или только с частичной клеточной стенкой.
[0074] Применяемый в данном документе термин "рекомбинантный" относится к форме нуклеиновой кислоты (например, ДНК или РНК), и/или белка, и/или организма, которая обычно не будет встречаться в природе и как таковая создана посредством вмешательства человека. Применяемая в данном документе "молекула рекомбинантной нуклеиновой кислоты" представляет собой молекулу нуклеиновой кислоты, содержащую комбинацию полинуклеотидов, которые в природе не встречаются вместе и являются результатом вмешательства человека, например, молекулу нуклеиновой кислоты, которая состоит из комбинации по меньшей мере двух полинуклеотидов, гетерологичных по отношению друг к другу, и/или молекулу нуклеиновой кислоты, синтезированную искусственно и содержащую полинуклеотид, который отличается от полинуклеотида, который будет в норме существовать в природе, и/или молекулу нуклеиновой кислоты, которая содержит трансген, искусственно введенный в геномную ДНК клетки-хозяина, и ассоциированную фланкирующую ДНК генома клетки-хозяина. Примером молекулы рекомбинантной нуклеиновой кислоты является молекула ДНК, полученная в результате вставки трансгена в геномную ДНК растения, что в конечном итоге может приводить к экспрессии молекулы рекомбинантной РНК и/или белка в данном организме. Применяемое в данном документе выражение "рекомбинантное растение" представляет собой растение, которое обычно не будет существовать в природе, и оно является результатом вмешательства человека и содержит трансген и/или гетерологичную молекулу нуклеиновой кислоты, введенную в его геном. В результате такого изменения генома рекомбинантное растение явно отличается от родственного растения дикого типа.
[0075] "Регуляторные элементы" относятся к последовательностям, вовлеченным в контроль экспрессии нуклеотидной последовательности. Регуляторные элементы предусматривают промотор, функционально связанный с представляющей интерес нуклеотидной последовательностью, и сигналы терминации. Как правило, они охватывают также последовательности, необходимые для надлежащей трансляции нуклеотидной последовательности.
[0076] Термин "идентичный" или "в значительной степени идентичный" в контексте двух последовательностей нуклеиновых кислот или белковых последовательностей относится к двум или более последовательностям или подпоследовательностям, которые характеризуются по меньшей мере 60%, предпочтительно 80%, более предпочтительно 90, даже более предпочтительно 95% и наиболее предпочтительно по меньшей мере 99% идентичностью нуклеотидных или аминокислотных остатков при сравнении и выравнивании для максимального соответствия, как определено с применением одного из следующих алгоритмов сравнения последовательностей или путем визуальной проверки. Предпочтительно значительная степень идентичности имеет место в пределах участка последовательностей, который состоит из по меньшей мере приблизительно 50 остатков в длину, более предпочтительно в пределах участка, состоящего из по меньшей мере приблизительно 100 остатков, и наиболее предпочтительно последовательности в значительной степени идентичны в пределах по меньшей мере приблизительно 150 остатков. В особенно предпочтительном варианте осуществления последовательности являются в значительной степени идентичными по всей длине кодирующих участков. Кроме того, в значительной степени идентичные последовательности нуклеиновой кислоты или белка выполняют, по сути, одинаковую функцию.
[0077] При сравнении последовательностей одна последовательность, как правило, выступает в качестве эталонной последовательности, с которой сравнивают тестируемые последовательности. При использовании алгоритма сравнения последовательностей тестируемую и эталонную последовательности вводят в компьютер, при необходимости задают координаты подпоследовательности, и задают программные параметры алгоритма сравнения последовательностей. Затем с помощью алгоритма сравнения последовательностей на основе заданных программных параметров вычисляют процент идентичности последовательностей для тестируемой последовательности(ей) относительно эталонной последовательности.
[0078] Оптимальное выравнивание последовательностей для сравнения можно проводить, например, с помощью алгоритма поиска локальной гомологии по Smith & Waterman, Adv. Appl. Math. 2: 482 (1981), с помощью алгоритма выравнивания областей гомологии по Needleman & Wunsch, J. Mol. Biol. 48: 443 (1970), с помощью способа поиска сходства по Pearson & Lipman, Proc. Nat'l. Acad Sci. USA 85: 2444 (1988), с помощью реализации данных алгоритмов в компьютерных программах (GAP, BESTFIT, FASTA и TFASTA в пакете программного обеспечения Wisconsin Genetics, Genetics Computer Group, 575 Science Dr., Мэдисон, Висконсин) или путем визуальной проверки (в целом см. Ausubel et al., ниже).
[0079] Одним из примеров алгоритма, подходящего для определения процента идентичности последовательностей и сходства последовательностей, является алгоритм BLAST, описанный в Altschul et al., J. Mol. Biol. 215: 403-410 (1990). Программное обеспечение для осуществления анализов BLAST является общедоступным в Национальном центре биотехнологической информации (National Center for Biotechnology Information, U.S. National Library of Medicine, 8600 Rockville Pike, Бетесда, Мэриленд 20894, США). Данный алгоритм включает первоначально идентификацию пар последовательностей с наибольшим сходством (HSP) путем идентификации коротких "слов" длиной W в запрашиваемой последовательности, которые либо совпадают, либо удовлетворяют некоторому положительному пороговому баллу Т при выравнивании со "словом" такой же длины в последовательности из базы данных. Т называется пороговым показателем соседнего "слова" (Altschul et al., 1990). Эти исходные совпадения соседних "слов" выступают в качестве затравки для начала поисков с целью обнаружения более длинных HSP, содержащих их. Совпадения "слов" затем продлеваются в обоих направлениях вдоль каждой последовательности до тех пор, пока может увеличиваться совокупный показатель выравнивания. Совокупные показатели рассчитывают с применением, в случае нуклеотидных последовательностей, параметров М (балл-вознаграждение, начисляемый за пару совпадающих остатков; всегда > 0) и N (штрафной балл, начисляемый за несовпадающие остатки; всегда < 0). В случае аминокислотных последовательностей для расчета совокупного показателя применяют матрицу замен. Продление совпадений "слов" в каждом направлении прекращается, когда совокупный показатель выравнивания снижается на величину X от его максимального достигнутого значения, при этом совокупный показатель падает до нуля или ниже вследствие накопления одного или нескольких выравниваний остатков с отрицательными показателями, либо в случае достижения конца одной из последовательностей. Параметры алгоритма BLAST, W, Т и X, определяют чувствительность и скорость выравнивания. Программа BLASTN (для нуклеотидных последовательностей) использует по умолчанию длину "слова" (W), равную 11, ожидаемое значение (Е), равное 10, пороговое значение, равное 100, М=5, N=-4 и сравнение обеих нитей. Для аминокислотных последовательностей программа BLASTP использует по умолчанию длину "слова" (W), равную 3, ожидаемое значение (Е), равное 10, и матрицу замен BLOSUM62 (см. Henikoff & Henikoff, Proc. Natl. Acad Sci. USA 89: 10915 (1989)).
[0080] В дополнение к расчету процента идентичности последовательностей алгоритм BLAST также выполняет статистический анализ сходства между двумя последовательностями (см., например, Karlin & Altschul, Proc. Nat'l. Acad. Sci. USA 90: 5873-5787 (1993)). Одной мерой сходства, предоставляемой алгоритмом BLAST, является наименьшая суммарная вероятность (P(N)), которая предусматривает показатель вероятности, согласно которому совпадения между двумя нуклеотидными или аминокислотными последовательностями будут наблюдаться случайным образом. Например, тестируемая последовательность нуклеиновой кислоты считается подобной эталонной последовательности, если наименьшая суммарная вероятность при сравнении тестируемой последовательности нуклеиновой кислоты с эталонной последовательностью нуклеиновой кислоты составляет менее приблизительно 0,1, более предпочтительно менее приблизительно 0,01 и наиболее предпочтительно менее приблизительно 0,001.
[0081] Другим показателем того, что две последовательности нуклеиновых кислот в значительной степени идентичны, является то, что две молекулы гибридизируются друг с другом в жестких условиях. Фраза "гибридизируется специфически с" относится к связыванию, образованию дуплекса или гибридизации молекулы только с определенной нуклеотидной последовательностью в жестких условиях, когда такая последовательность присутствует в сложной смеси (например, общих клеточных) ДНК или РНК. "В значительной степени связывается" относится к гибридизации комплементарных последовательностей, нуклеиновой кислоты-зонда и целевой нуклеиновой кислоты, и также охватывает незначительные несовпадения, которые могут компенсироваться за счет снижения жесткости среды для гибридизации, чтобы добиться требуемого обнаружения целевой последовательности нуклеиновой кислоты.
[0082] "Жесткие условия гибридизации" и "жесткие условия отмывки при гибридизации" в контексте экспериментов по гибридизации нуклеиновых кислот, таких как Саузерн- и нозерн-гибридизация, зависят от последовательности и отличаются при разных параметрах окружающей среды. Более длинные последовательности специфично гибридизируются при более высоких температурах. Подробное руководство по гибридизации нуклеиновых кислот входит в состав Tijssen (1993) Laboratory Techniques in Biochemistry and Molecular Biology-Hybridization with Nucleic Acid Probes part I chapter 2 "Overview of principles of hybridization and the strategy of nucleic acid probe assays" Elsevier, New York. Как правило, условия гибридизации и отмывки высокой жесткости выбирают так, чтобы температура была приблизительно на 5°С ниже точки плавления (Tm) для конкретной последовательности при определенных ионной силе и рН. Как правило, в "жестких условиях" зонд будет гибридизироваться со своей целевой подпоследовательностью, а не с другими последовательностями.
[0083] Tm является температурой (при определенных ионной силе и рН), при которой 50% целевой последовательности гибридизируется с абсолютно совпадающим зондом. Для очень жестких условий выбирают температуру, равную Tm для конкретного зонда. Примером жестких условий гибридизации для гибридизации комплементарных нуклеиновых кислот, которые имеют более 100 комплементарных остатков на фильтре при Саузерн- или нозерн-блоттинге, является 50% формамида с 1 мг гепарина при 42°С, при этом гибридизацию проводят в течение ночи. Примером условий отмывки высокой жесткости является 0,15 М NaCl при 72°С в течение приблизительно 15 минут. Примером жестких условий отмывки является отмывка с помощью 0,2 × SSC при 65°С в течение 15 минут (описание буфера SSC см. в Sambrook ниже). Зачастую для избавления от фонового сигнала зонда отмывке в условиях высокой жесткости предшествует отмывка в условиях низкой жесткости. Примером условий отмывки средней жесткости для дуплекса, имеющего, например, более 100 нуклеотидов, является 1 × SSC при 45°С в течение 15 минут. Примером условий отмывки низкой жесткости для дуплекса, имеющего, например, более 100 нуклеотидов, является 4-6 × SSC при 40°С в течение 15 минут. Для коротких зондов (например, длиной от приблизительно 10 до 50 нуклеотидов) жесткие условия, как правило, предусматривают концентрации солей, составляющие менее чем приблизительно 1,0 М ионов Na, как правило, концентрации, составляющие приблизительно 0,01-1,0 М ионов Na (или других солей) при рН 7,0-8,3, а также температуру, как правило, составляющую по меньшей мере приблизительно 30°С. Жестких условий также можно достигать путем добавления дестабилизирующих средств, таких как формамид. В целом, соотношение сигнал-шум, в 2× (или более) раза превышающее наблюдаемое для неродственного зонда в конкретном гибридизационном анализе, указывает на выявление специфической гибридизации. Нуклеиновые кислоты, которые не гибридизируются друг с другом в жестких условиях, все еще являются в значительной степени идентичными, если белки, которые они кодируют, в значительной степени идентичны. Например, это происходит в тем случае, когда копию нуклеиновой кислоты создают с применением максимальной вырожденности кодонов, допускаемой генетическим кодом.
[0084] Примеры комплексов условий гибридизации/отмывки, которые можно применять для клонирования гомологичных нуклеотидных последовательностей, которые в значительной степени идентичны эталонным нуклеотидным последовательностям по настоящему изобретению, являются следующими: эталонная нуклеотидная последовательность предпочтительно гибридизируется с эталонной нуклеотидной последовательностью в 7% додецилсульфате натрия (SDS), 0,5 М NaPO4, 1 мМ EDTA при 50°С с отмывкой в 2 × SSC, 0,1% SDS при 50°С, более желательно в 7% додецилсульфате натрия (SDS), 0,5 М NaPO4, 1 мМ EDTA при 50°С с отмывкой в 1 × SSC, 0,1% SDS при 50°С, еще более желательно в 7% додецилсульфате натрия (SDS), 0,5 М NaPO4, 1 мМ EDTA при 50°С с отмывкой в 0,5 × SSC, 0,1% SDS при 50°С, предпочтительно в 7% додецилсульфате натрия (SDS), 0,5 М NaPO4, 1 мМ EDTA при 50°С с отмывкой в 0,1 × SSC, 0,1% SDS при 50°С, более предпочтительно в 7% додецилсульфате натрия (SDS), 0,5 М NaPO4, 1 мМ EDTA при 50°С с отмывкой в 0,1 × SSC, 0,1% SDS при 65°С.
[0085] Еще одним показателем того, что две последовательности нуклеиновых кислот или белки являются в значительной степени идентичными, является то, что белок, кодируемый первой нуклеиновой кислотой, характеризуется иммунологической перекрестной реактивностью с белком, кодируемым второй нуклеиновой кислотой, или специфически связывается в таких реакциях. Таким образом, белок, как правило, является в значительной степени идентичным второму белку, например, если два белка отличаются только консервативными заменами.
[0086] "Синтетический" относится к нуклеотидной последовательности, содержащей основания и/или структурные признаки, отсутствующие в природной последовательности. Например, синтетической считается искусственная последовательность, кодирующая белок Cry по настоящему изобретению, которая по содержанию G + C и нормальному распределению кодонов больше похожа на гены двудольных и/или однодольных растений.
[0087] "Трансформация" представляет собой процесс введения гетерологичной нуклеиновой кислоты в клетку- или организм-хозяин. В частности, "трансформация" означает стабильную интеграцию молекулы ДНК в геном представляющего интерес организма.
[0088] "Трансформированный/трансгенный/рекомбинантный" относится к организму-хозяину, такому как бактерия или растение, в который была введена гетерологичная молекула нуклеиновой кислоты. Молекулу нуклеиновой кислоты можно стабильно интегрировать в геном хозяина, или же молекула нуклеиновой кислоты также может присутствовать в качестве внехромосомной молекулы. Такая внехромосомная молекула может быть автореплицирующейся. Подразумевается, что трансформированные клетки, ткани или растения охватывают не только конечный продукт процесса трансформации, но также и его трансгенное потомство. "Нетрансформированный", "нетрансгенный" или "нерекомбинантный" хозяин относится к организму дикого типа, например, бактерии или растению, которые не содержат гетерологичную молекулу нуклеиновой кислоты.
[0089] Нуклеотиды обозначены по их основаниям с помощью следующих стандартных сокращений: аденин (А), цитозин (С), тимин (Т) и гуанин (G). Аналогичным образом, аминокислоты обозначены с помощью следующих стандартных сокращений: аланин (Ala; А), аргинин (Arg; R), аспарагин (Asn; N), аспарагиновая кислота (Asp; D), цистеин (Cys; С), глутамин (Gln; Q), глутаминовая кислота (Glu; Е), глицин (Gly; G), гистидин (His; Н), изолейцин (Ile; 1), лейцин (Leu; L), лизин (Lys; K), метионин (Met; М), фенилаланин (Phe; F), пролин (Pro; Р), серии (Ser; S), треонин (Thr, Т), триптофан (Trp; W), тирозин (Tyr; Y) и валин (Val; V).
[0090] В настоящем изобретении предусмотрены композиции и способы для контроля опасных вредителей растений. В частности, настоящее изобретение относится к белкам Cry, которые токсичны для вредителей растений, и к полинуклеотидам, которые содержат нуклеотидные последовательности, которые кодируют белки Cry, а также к получению и применению полинуклеотидов и белков Cry для контроля вредителей растений.
[0091] Соответственно, в некоторых вариантах осуществления предусмотрен химерный ген, который содержит гетерологичный промотор, функционально связанный с полинуклеотидом, содержащим нуклеотидную последовательность, которая кодирует белок, токсичный по меньшей мере для совки-ипсилон (Agrotis ipsilon), где нуклеотидная последовательность (а) характеризуется от по меньшей мере 80% (например, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,1%, 99,2%, 99,3%, 99,4%, 99,5%, 99,6%, 99,7%, 99,8%, 99,9%) до по меньшей мере 99% (99%, 99,1%, 99,2%, 99,3%, 99,4%, 99,5%, 99,6%, 99,7%, 99,8%, 99,9%) идентичностью последовательности с любой из SEQ ID NO: 1-4; или (b) кодирует белок, содержащий аминокислотную последовательность, которая характеризуется от по меньшей мере 80% (например, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,1%, 99,2%, 99,3%, 99,4%, 99,5%, 99,6%, 99,7%, 99,8%, 99,9%) до по меньшей мере 99% (99%, 99,1%, 99,2%, 99,3%, 99,4%, 99,5%, 99,6%, 99,7%, 99,8%, 99,9%) идентичностью последовательности с любой из SEQ ID NO: 13-16; или (с) представляет собой синтетическую последовательность на основании (а) или (b), которая имеет кодоны, оптимизированные для экспрессии в трансгенном организме.
[0092] В других вариантах осуществления гетерологичный промотор представляет собой промотор, обеспечивающий экспрессию в растении. Например, без ограничения, промотор, обеспечивающий экспрессию в растении, может быть выбран из группы, состоящей из промотора убиквитина, cmp, TrpA кукурузы, 5'-UTR гена 9 бактериофага Т3, сахарозосинтетазы 1 кукурузы, алкогольдегидрогеназы 1 кукурузы, светособирающего комплекса кукурузы, белка теплового шока кукурузы, малой субъединицы RuBP карбоксилазы гороха, маннопинсинтазы Ti-плазмиды, нопалинсинтазы Ti-плазмиды, халкон-изомеразы петунии, богатого глицином белка 1 бобов, пататина картофеля, лектина, 35S CaMV и малой субъединицы S-E9 RuBP карбоксилазы.
[0093] В дополнительных вариантах осуществления белок, кодируемый химерным геном, дополнительно токсичен для одного или нескольких видов насекомых, выбранных из группы, состоящей из кукурузного мотылька (Ostrinia nubilalis), совки травяной (Spodoptera frugiperda), американской кукурузной совки (Helicoverpa zea), огневки тростниковой (Diatraea saccharalis), гусеницы совки бархатных бобов (Anticarsia gemmatalis), соевой совки (Chrysodeixis includes), огневки кукурузной юго-западной (Diatraea grandiosella), западной бобовой совки (Richia albicosta), табачной совки (Heliothis virescens), восточного кукурузного мотылька (Ostrinia furnacalis), хлопковой совки (Helicoverpa armigera), огневки желтой рисовой (Chilo suppressalis), розовой стеблевой совки (Sesamia calamistis) и огневки рисовой (Cnaphalocrocis medinalis).
[0094] В дополнительных вариантах осуществления полинуклеотид содержит нуклеотидную последовательность, которая характеризуется от по меньшей мере 80% до по меньшей мере 99% идентичностью последовательности с SEQ ID NO: 1, или характеризуется от по меньшей мере 80% до по меньшей мере 99% идентичностью последовательности с SEQ ID NO: 2, или характеризуется от по меньшей мере 80% до по меньшей мере 99% идентичностью последовательности с SEQ ID NO: 3, или характеризуется от по меньшей мере 80% до по меньшей мере 99% идентичностью последовательности с SEQ ID NO: 4.
[0095] В других вариантах осуществления полинуклеотид содержит нуклеотидную последовательность, которая кодирует белок, содержащий аминокислотную последовательность, которая характеризуется от по меньшей мере 80% до по меньшей мере 99% идентичностью последовательности с любой из SEQ ID NO: 13-16.
[0096] В еще одних вариантах осуществления аминокислотная последовательность характеризуется по меньшей мере 80%, или по меньшей мере 81%, или по меньшей мере 82%, или по меньшей мере 83%, или по меньшей мере 84%, или по меньшей мере 85%, или по меньшей мере 86%, или по меньшей мере 87%, или по меньшей мере 88%, или по меньшей мере 89%, или по меньшей мере 90%, или по меньшей мере 91%, или по меньшей мере 92%, или по меньшей мере 94%, или по меньшей мере 94%, или по меньшей мере 95%, или по меньшей мере 96%, или по меньшей мере 97%, или по меньшей мере 98%, или по меньшей мере 99%, или по меньшей мере 99,1%, или по меньшей мере 99,2%, или по меньшей мере 99,3%, или по меньшей мере 99,4%, или по меньшей мере 99,5% или по меньшей мере 99,6%, или по меньшей мере 99,7%, или по меньшей мере 99,8%, или по меньшей мере 99,9% идентичностью последовательности с SEQ ID NO: 13.
[0097] В дополнительных вариантах осуществления аминокислотная последовательность характеризуется по меньшей мере 99%, или по меньшей мере 99,1%, или по меньшей мере 99,2%, или по меньшей мере 99,3%, или по меньшей мере 99,4%, или по меньшей мере 99,5% или по меньшей мере 99,6%, или по меньшей мере 99,7%, или по меньшей мере 99,8%, или по меньшей мере 99,9% идентичностью последовательности с SEQ ID NO: 14.
[0098] В еще одних вариантах осуществления аминокислотная последовательность характеризуется по меньшей мере 80%, или по меньшей мере 81%, или по меньшей мере 82%, или по меньшей мере 83%, или по меньшей мере 84%, или по меньшей мере 85%, или по меньшей мере 86%, или по меньшей мере 87%, или по меньшей мере 88%, или по меньшей мере 89%, или по меньшей мере 90%, или по меньшей мере 91%, или по меньшей мере 92%, или по меньшей мере 94%, или по меньшей мере 94%, или по меньшей мере 95%, или по меньшей мере 96%, или по меньшей мере 97%, или по меньшей мере 98%, или по меньшей мере 99%, или по меньшей мере 99,1%, или по меньшей мере 99,2%, или по меньшей мере 99,3%, или по меньшей мере 99,4%, или по меньшей мере 99,5% или по меньшей мере 99,6%, или по меньшей мере 99,7%, или по меньшей мере 99,8%, или по меньшей мере 99,9% идентичностью последовательности с SEQ ID NO: 15.
[0099] В других вариантах осуществления аминокислотная последовательность характеризуется по меньшей мере 80%, или по меньшей мере 81%, или по меньшей мере 82%, или по меньшей мере 83%, или по меньшей мере 84%, или по меньшей мере 85%, или по меньшей мере 86%, или по меньшей мере 87%, или по меньшей мере 88%, или по меньшей мере 89%, или по меньшей мере 90%, или по меньшей мере 91%, или по меньшей мере 92%, или по меньшей мере 94%, или по меньшей мере 94%, или по меньшей мере 95%, или по меньшей мере 96%, или по меньшей мере 97%, или по меньшей мере 98%, или по меньшей мере 99%, или по меньшей мере 99,1%, или по меньшей мере 99,2%, или по меньшей мере 99,3%, или по меньшей мере 99,4%, или по меньшей мере 99,5% или по меньшей мере 99,6%, или по меньшей мере 99,7%, или по меньшей мере 99,8%, или по меньшей мере 99,9% идентичностью последовательности с SEQ ID NO: 16.
[00100] В некоторых вариантах осуществления химерный ген по настоящему изобретению содержит полинуклеотид, содержащий синтетическую последовательность нуклеотидной последовательности, которая характеризуется по меньшей мере 80%, или по меньшей мере на 81%, или по меньшей мере 82%, или по меньшей мере 83%, или по меньшей мере 84%, или по меньшей мере 85%, или по меньшей мере 86%, или по меньшей мере 87%, или по меньшей мере 88%, или по меньшей мере 89%, или по меньшей мере 90%, или по меньшей мере 91%, или по меньшей мере 92%, или по меньшей мере 94%, или по меньшей мере 94%, или по меньшей мере 95%, или по меньшей мере 96%, или по меньшей мере 97%, или по меньшей мере 98%, или по меньшей мере 99%, или по меньшей мере 99,1%, или по меньшей мере 99,2%, или по меньшей мере 99,3%, или по меньшей мере 99,4%, или по меньшей мере 99,5% или по меньшей мере 99,6%, или по меньшей мере 99,7%, или по меньшей мере 99,8%, или по меньшей мере 99,9% с любой из SEQ ID NO: 5-12, где синтетическая последовательность имеет кодоны, оптимизированные для экспрессии в трансгенном организме. В других вариантах осуществления химерный ген по настоящему изобретению содержит молекулу нуклеиновой кислоты, содержащую синтетическую последовательность нуклеотидной последовательности, которая кодирует белок, содержащий аминокислотную последовательность, которая характеризуется по меньшей мере 80%, или по меньшей мере 81%, или по меньшей мере 82%, или по меньшей мере 83%, или по меньшей мере 84%, или по меньшей мере 85%, или по меньшей мере 86%, или по меньшей мере 87%, или по меньшей мере 88%, или по меньшей мере 89%, или по меньшей мере 90%, или по меньшей мере 91%, или по меньшей мере 92%, или по меньшей мере 94%, или по меньшей мере 94%, или по меньшей мере 95%, или по меньшей мере 96%, или по меньшей мере 97%, или по меньшей мере 98%, или по меньшей мере 99%, или по меньшей мере 99,1%, или по меньшей мере 99,2%, или по меньшей мере 99,3%, или по меньшей мере 99,4%, или по меньшей мере 99,5% или по меньшей мере 99,6%, или по меньшей мере 99,7%, или по меньшей мере 99,8%, или по меньшей мере 99,9% идентичностью последовательности с любой из SEQ ID NO: 13-20, где синтетическая последовательность имеет ко доны, оптимизированные для экспрессии в трансгенном организме. В дополнительных вариантах осуществления трансгенный организм представляет собой трансгенную бактерию или трансгенное растение.
[00101] В некоторых вариантах осуществления настоящего изобретения предусмотрен синтетический полинуклеотид, содержащий, состоящий главным образом или состоящий из нуклеотидной последовательности, которая кодирует белок, активный в отношении по меньшей мере совки-ипсилон (Agrotis ipsilon), где нуклеотидная последовательность характеризуется по меньшей мере 80%, или по меньшей мере 81%, или по меньшей мере 82%, или по меньшей мере 83%, или по меньшей мере 84%, или по меньшей мере 85%, или по меньшей мере 86%, или по меньшей мере 87%, или по меньшей мере 88%, или по меньшей мере 89%, или по меньшей мере 90%, или по меньшей мере 91%, или по меньшей мере 92%, или по меньшей мере 94%, или по меньшей мере 94%, или по меньшей мере 95%, или по меньшей мере 96%, или по меньшей мере 97%, или по меньшей мере 98%, или по меньшей мере 99%, или по меньшей мере 99,1%, или по меньшей мере 99,2%, или по меньшей мере 99,3%, или по меньшей мере 99,4%, или по меньшей мере 99,5% или по меньшей мере 99,6%, или по меньшей мере 99,7%, или по меньшей мере 99,8%, или по меньшей мере 99,9% идентичностью последовательности с любой из SEQ ID NO: 5-12.
[00102] В других вариантах осуществления настоящего изобретения предусмотрен синтетический полинуклеотид, содержащий, состоящий главным образом или состоящий из нуклеотидной последовательности, которая кодирует белок, активный в отношении по меньшей мере совки-ипсилон (Agrotis ipsilon), где нуклеотидная последовательность кодирует аминокислотную последовательностью, которая характеризуется по меньшей мере 80%, или по меньшей мере 81%, или по меньшей мере 82%, или по меньшей мере 83%, или по меньшей мере 84%, или по меньшей мере 85%, или по меньшей мере 86%, или по меньшей мере 87%, или по меньшей мере 88%, или по меньшей мере 89%, или по меньшей мере 90%, или по меньшей мере 91%, или по меньшей мере 92%, или по меньшей мере 94%, или по меньшей мере 94%, или по меньшей мере 95%, или по меньшей мере 96%, или по меньшей мере 97%, или по меньшей мере 98%, или по меньшей мере 99%, или по меньшей мере 99,1%, или по меньшей мере 99,2%, или по меньшей мере 99,3%, или по меньшей мере 99,4%, или по меньшей мере 99,5% или по меньшей мере 99,6%, или по меньшей мере 99,7%, или по меньшей мере 99,8%, или по меньшей мере 99,9% идентичностью последовательности с любой из SEQ ID NO: 13-20.
[00103] В некоторых вариантах осуществления настоящего изобретения предусмотрен синтетический полинуклеотид, содержащий, состоящий главным образом или состоящий из нуклеотидной последовательности, имеющей по меньшей мере один кодон, оптимизированный для экспрессии в трансгенном организме, и кодирующий белок, токсичный по меньшей мере для совки-ипсилон (Agrotis ipsilon) и американской кукурузной совки (Helicoverpa zea), где белок содержит аминокислотную последовательность, которая характеризуется по меньшей мере 80%, или по меньшей мере 81%, или по меньшей мере 82%, или по меньшей мере 83%, или по меньшей мере 84%, или по меньшей мере 85%, или по меньшей мере 86%, или по меньшей мере 87%, или по меньшей мере 88%, или по меньшей мере 89%, или по меньшей мере 90%, или по меньшей мере 91%, или по меньшей мере 92%, или по меньшей мере 94%, или по меньшей мере 94%, или по меньшей мере 95%, или по меньшей мере 96%, или по меньшей мере 97%, или по меньшей мере 98%, или по меньшей мере 99%, или по меньшей мере 99,1%, или по меньшей мере 99,2%, или по меньшей мере 99,3%, или по меньшей мере 99,4%, или по меньшей мере 99,5% или по меньшей мере 99,6%, или по меньшей мере 99,7%, или по меньшей мере 99,8%, или по меньшей мере 99,9% идентичностью последовательности с SEQ ID NO: 13, и при этом аминокислотная последовательность в положениях, соответствующих аминокислотным положениям 40-44 из SEQ ID NO: 13, представляет собой NLNSC. В дополнительных вариантах осуществления полинуклеотид содержит, состоит главным образом или состоит из SEQ ID NO: 5 или SEQ ID NO: 9. В дополнительных вариантах осуществления аминокислотная последовательность содержит, состоит главным образом или состоит из SEQ ID NO: 13 или SEQ ID NO: 17.
[00104] Согласно некоторым вариантам осуществления настоящего изобретения предусмотрен выделенный белок, токсичный по меньшей мере для совки-ипсилон (Agrotis ipsilon), при этом белок содержит, состоит главным образом или состоит из (а) аминокислотной последовательности, которая характеризуется от по меньшей мере 80% идентичностью последовательности до по меньшей мере 99% идентичностью последовательности с аминокислотной последовательностью, представленной любой из SEQ ID NO: 13-20; или (b) аминокислотная последовательность, которая кодируется нуклеотидной последовательностью, которая характеризуется от по меньшей мере 80% идентичностью последовательности до по меньшей мере 99% идентичностью последовательности с нуклеотидной последовательностью, представленной любой из SEQ ID NO: 5-12.
[00105] В других вариантах осуществления выделенный белок содержит, состоит главным образом или состоит из аминокислотной последовательности, которая характеризуется от по меньшей мере 80% до по меньшей мере 99% идентичностью последовательности с любой из SEQ ID NO: 13-16. В еще одних вариантах осуществления аминокислотная последовательность характеризуется по меньшей мере 80%, или по меньшей мере 81%, или по меньшей мере 82%, или по меньшей мере 83%, или по меньшей мере 84%, или по меньшей мере 85%, или по меньшей мере 86%, или по меньшей мере 87%, или по меньшей мере 88%, или по меньшей мере 89%, или по меньшей мере 90%, или по меньшей мере 91%, или по меньшей мере 92%, или по меньшей мере 94%, или по меньшей мере 94%, или по меньшей мере 95%, или по меньшей мере 96%, или по меньшей мере 97%, или по меньшей мере 98%, или по меньшей мере 99%, или по меньшей мере 99,1%, или по меньшей мере 99,2%, или по меньшей мере 99,3%, или по меньшей мере 99,4%, или по меньшей мере 99,5% или по меньшей мере 99,6%, или по меньшей мере 99,7%, или по меньшей мере 99,8%, или по меньшей мере 99,9% идентичностью последовательности с SEQ ID NO: 13.
[00106] В других вариантах осуществления аминокислотная последовательность характеризуется по меньшей мере 99%, или по меньшей мере 99,1%, или по меньшей мере 99,2%, или по меньшей мере 99,3%, или по меньшей мере 99,4%, или по меньшей мере 99,5% или по меньшей мере 99,6%, или по меньшей мере 99,7%, или по меньшей мере 99,8%, или по меньшей мере 99,9% идентичностью последовательности с SEQ ID NO: 14.
[00107] В дополнительных вариантах осуществления аминокислотная последовательность характеризуется по меньшей мере 80%, или по меньшей мере 81%, или по меньшей мере 82%, или по меньшей мере 83%, или по меньшей мере 84%, или по меньшей мере 85%, или по меньшей мере 86%, или по меньшей мере 87%, или по меньшей мере 88%, или по меньшей мере 89%, или по меньшей мере 90%, или по меньшей мере 91%, или по меньшей мере 92%, или по меньшей мере 94%, или по меньшей мере 94%, или по меньшей мере 95%, или по меньшей мере 96%, или по меньшей мере 97%, или по меньшей мере 98%, или по меньшей мере 99%, или по меньшей мере 99,1%, или по меньшей мере 99,2%, или по меньшей мере 99,3%, или по меньшей мере 99,4%, или по меньшей мере 99,5% или по меньшей мере 99,6%, или по меньшей мере 99,7%, или по меньшей мере 99,8%, или по меньшей мере 99,9% идентичностью последовательности с SEQ ID NO: 15.
[00108] В еще одних вариантах осуществления аминокислотная последовательность характеризуется по меньшей мере 80%, или по меньшей мере 81%, или по меньшей мере 82%, или по меньшей мере 83%, или по меньшей мере 84%, или по меньшей мере 85%, или по меньшей мере 86%, или по меньшей мере 87%, или по меньшей мере 88%, или по меньшей мере 89%, или по меньшей мере 90%, или по меньшей мере 91%, или по меньшей мере 92%, или по меньшей мере 94%, или по меньшей мере 94%, или по меньшей мере 95%, или по меньшей мере 96%, или по меньшей мере 97%, или по меньшей мере 98%, или по меньшей мере 99%, или по меньшей мере 99,1%, или по меньшей мере 99,2%, или по меньшей мере 99,3%, или по меньшей мере 99,4%, или по меньшей мере 99,5% или по меньшей мере 99,6%, или по меньшей мере 99,7%, или по меньшей мере 99,8%, или по меньшей мере 99,9% идентичностью последовательности с SEQ ID NO: 16.
[00109] В некоторых вариантах осуществления аминокислотная последовательность содержит, состоит главным образом или состоит из любой из SEQ ID NO: 13-20.
[00110] Антитела, вырабатываемые в ответ на иммунную стимуляцию нативными или мутантными ВТ-0044, ВТ-0051, ВТ-0068 и ВТ-0128 и подобными или родственными белками по настоящему изобретению, могут быть получены с применением стандартных иммунологических методик получения поликлональной антисыворотки и, при необходимости, иммортализации антителопродуцирующих клеток иммунизированного организма-хозяина для получения источников моноклональных антител. Методики получения антител к любому представляющему интерес веществу хорошо известны, например, как описано в Harlow и Lane (1988) и в Goding (1986). Настоящее изобретение охватывает инсектицидные белки, которые перекрестно реагируют с антителами, вырабатываемыми против одного или нескольких инсектицидных белков Cry по настоящему изобретению.
[00111] Антитела, полученные согласно настоящему изобретению, также применимы в иммунологических анализах для определение количества или наличия нативных или мутантных ВТ-0044, ВТ-0051, ВТ-0068 и ВТ-0128 или родственного белка в биологическом образце. Такие анализы также применимы в получении композиций, содержащих один или несколько токсичных белков по настоящему изобретению или родственных токсичных белков, причем такое получение проводят с обеспечением контроля качества. Кроме того, антитела можно применять для оценки эффективности рекомбинантной продукции одного или нескольких белков по настоящему изобретению или родственного белка, а также для скрининга библиотек экспрессии на наличие нуклеотидной последовательности, кодирующей один или несколько белков по настоящему изобретению или последовательностей, кодирующих родственные белки. Антитела также применимы в качестве аффинных лигандов для очистки и/или выделения любого одного или нескольких белков по настоящему изобретению и родственных белков. Белки по настоящему изобретению и белки, содержащие родственные антигенные эпитопы, могут быть получены в результате сверхэкспрессии полноразмерной или частичной последовательности, кодирующей весь белок по настоящему изобретению или родственный белок, или их часть, в предпочтительной клетке-хозяине.
[00112] Считается, что последовательности ДНК, которые кодируют нативный белок Cry по настоящему изобретению, можно изменять с помощью различных способов, и что эти изменения могут приводить к образованию последовательностей ДНК, кодирующих белки с аминокислотными последовательности, отличающимися от таковых, закодированных в нативном белке Cry по настоящему изобретению. Этот белок может быть изменен различными способами, в том числе с помощью аминокислотных замен, делеций, усечений и вставок одной или нескольких аминокислот из любой из SEQ ID NO: 13-16, включая до приблизительно 2, приблизительно 3, приблизительно 4, приблизительно 5, приблизительно 6, приблизительно 7, приблизительно 8, приблизительно 9, приблизительно 10, приблизительно 15, приблизительно 20, приблизительно 25, приблизительно 30, приблизительно 35, приблизительно 40, приблизительно 45, приблизительно 50, приблизительно 55, приблизительно 60, приблизительно 65, приблизительно 70, приблизительно 75, приблизительно 80, приблизительно 85, приблизительно 90, приблизительно 100, приблизительно 105, приблизительно 110, приблизительно 115, приблизительно 120, приблизительно 125, приблизительно 130, приблизительно 135, приблизительно 140, приблизительно 145, приблизительно 150, приблизительно 155 или больше аминокислотных замен, делеций или вставок. Способы таких манипуляций в целом известны из уровня техники. Например, варианты аминокислотной последовательности нативного белка Cry могут быть получены посредством введения мутаций в полинуклеотид, который кодирует данный белок. Это также можно осуществлять с применением одной из нескольких форм мутагенеза и/или метода направленной эволюции. Согласно некоторым аспектам изменения, кодируемые аминокислотной последовательностью, не будут существенно влиять на функцию белка. Такие варианты будут обладать требуемой инсектицидной активностью. В одном варианте осуществления настоящего изобретения нуклеотидные последовательности, представленные SEQ ID NO: 1-4, изменяют с введением аминокислотных замен в кодируемый белок. В некоторых вариантах осуществления полученный мутантный белок кодируется синтетическим мутантным полинуклеотидом, содержащим нуклеотидную последовательность, представленную любой из SEQ ID NO: 9-12. В других вариантах осуществления мутантные белки содержат, состоят главным образом или состоят из аминокислотной последовательности, представленной любой из SEQ ID NO: 17-20.
[00113] Понятно, что способность инсектицидного белка обеспечивать инсектицидную активность может быть улучшена путем применения таких методик для композиций по настоящему изобретению. Например, можно экспрессировать белок Cry в клетках-хозяевах, которые характеризуются высоким уровнем ошибочного включения оснований в ходе репликации ДНК, например, XL-1 Red (Stratagene, Ла-Хойя, Калифорния). После размножения в таких штаммах можно выделять ДНК (например, путем получения плазмидной ДНК или путем амплификации с помощью ПЦР и клонирования полученного ПЦР-фрагмента в вектор), экспрессировать мутантные последовательности белка Cry в штамме, не приводящем к образованию мутаций, и идентифицировать мутированные гены с инсектицидной активностью, например, путем осуществления анализа для тестирования инсектицидной активности. Обычно белок смешивают и применяют в анализах питания. См., например Marrone et al. (1985) J. of Economic Entomology 78:290-293. Такие анализы могут включать приведение растения в контакт с одним или несколькими вредителями и определение способности растений к выживанию и/или способности вызывать гибель вредителей. Примеры мутаций, которые приводят к повышению токсичности, можно найти в Schnepf et al. (1998) Microbiol. Mol. Biol. Rev. 62:775-806.
[00114] В качестве альтернативы, могут быть выполнены изменения в аминокислотной последовательности по настоящему изобретению на амино- или карбокси-конце, при этом они не оказывают существенное влияние на активность. Они могут включать вставки, делеции или изменения, введенные с применением современных способов молекулярной биологии, таких как ПЦР, в том числе ПЦР-амплификаций, обеспечивающих изменение или расширение последовательности, кодирующей белок, за счет включения последовательностей, кодирующих аминокислоты, в олигонуклеотиды, используемые при ПЦР-амплификации. В качестве альтернативы добавленные последовательности, кодирующие белок, могут включать последовательности, кодирующие весь белок, такие как в большинстве случаев применяются в уровне техники для создания белков слияния. Такие белки слияния зачастую применяют для (1) повышения уровня экспрессии представляющего интерес белка, (2) для введения связывающего домена, ферментативной активности или эпитопа для облегчения одного из очистки белка, выявления белка или других применений в эксперименте, известных из уровня техники, (3) направленной секреции в субклеточную органеллу, такую как периплазматическое пространство грамотрицательных бактерий, или трансляции в эндоплазматическом ретикулуме эукариотических клеток, в последнем случае результатом зачастую является гликозилирования белка.
[00115] Белок Cry по настоящему изобретению также может быть подвергнут мутации с введением эпитопа для получения антител, которые распознают мутантный белок. Таким образом, в некоторых вариантах осуществления настоящего изобретения предусмотрен мутированный белок Cry, где аминокислотная замена в нативном белке Cry дает мутантный белок Cry с антигенным участком, который позволяет отличать мутантный белок Cry от нативного белка Cry в анализе выявления белков. В другом варианте осуществления настоящего изобретения предусмотрен мутированный белок Cry по настоящему изобретению, где аминокислотная последовательность содержит аминокислотную замену в участке, соответствующем аминокислотам 342-354 из SEQ ID NO: 6. В других вариантах осуществления аминокислотная последовательность содержит аминокислотную замену в положении 342, 343, 344, 345, 346, 347, 348, 349, 350, 351, 352, 353 или 354 из SEQ ID NO: 6. В еще одних вариантах осуществления аминокислотная последовательность содержит аминокислотную замену в аминокислотном положении, соответствующем аминокислотам 350, 351 и 354 из SEQ ID NO: 6. В дополнительных вариантах осуществления аминокислотная последовательность содержит аминокислотную замену в аминокислотных положениях 350, 351 и 354 из SEQ ID NO: 6. В еще одних вариантах осуществления аминокислота, соответствующая положению 350, заменена на изолейцин (I), аминокислота, соответствующая положению 351, заменена на глутамин (Q), а аминокислота, соответствующая положению 354, заменена на серии (S). В других вариантах осуществления лейцин (L) в положении 350 из SEQ ID NO: 6 заменен на изолейцин (I), аспарагин (N) в положении 351 из SEQ ID NO: 6 заменен на глутамин (Q), а треонин (Т) в положении 354 из SEQ ID NO: 6 заменен на серии (S). В других вариантах осуществления нативный белок Cry содержит аминокислотную последовательность, представленную любой из SEQ ID NO: 13-16. В еще одних варианты осуществления нативный белок Cry содержит аминокислотную последовательность, представленную SEQ ID NO: 6, а мутантный белок содержит аминокислотную последовательность, представленную SEQ ID NO: 18.
[00116] В некоторых вариантах осуществления настоящего изобретения предусмотрено антитело, которое специфически распознает эпитоп мутантного белка Cry по настоящему изобретению, где эпитоп содержит аминокислотную последовательность с одной или несколькими заменами в аминокислотах, соответствующих аминокислотам 342-354 из SEQ ID NO: 6. В других вариантах осуществления эпитоп содержит аминокислотную последовательность с одной или несколькими заменами в аминокислотах 342-354 из SEQ ID NO: 6. В еще одних вариантах осуществления эпитоп содержит аминокислоты 342-354 из SEQ ID NO: 18.
[00117] В некоторых вариантах осуществления настоящего изобретения предусмотрен способ получения антитела, которое способно дифференцировать мутированный белок Cry и нативный белок Cry, из которого получен мутированный белок Cry, при этом метод включает стадии замены аминокислоты в антигенной петле нативного белка Cry и стимуляции выработки антител, которые специфически распознают мутированную антигенную петлю в мутированном белке Cry и не распознают нативный белок Cry. В одном варианте осуществления антигенную петлю идентифицируют в неконсервативных участках за пределами домена I нативного белка Cry. В другом варианте осуществления антигенная петля не является петлей, вовлеченной в распознавание рецепторов белков Cry в пищеварительном канале насекомого или вовлеченной в активацию белка Cry под действием протеазы. В другом варианте осуществления антигенная петля содержит аминокислотную последовательность, которая соответствует аминокислотам 341-354 из SEQ ID NO: 6. В еще одном варианте осуществления антигенная петля содержит аминокислоты 342-354 из SEQ ID NO: 6.
[00118] Варианты нуклеотидных и аминокислотных последовательностей по настоящему изобретению также охватывают последовательности, полученные в результате процедур мутагенеза и рекомбинации, таких как ДНК-шаффлинг. С помощью такой процедуры один или несколько различных участков, кодирующих токсичный белок, можно применять для создания нового токсичного белка, обладающего требуемыми свойствами. Следовательно, библиотеки рекомбинантных полинуклеотидов получают из популяции полинуклеотидов с родственными последовательностями, содержащими участки последовательности, которые характеризуются значительной степенью идентичности последовательности и могут подвергаться гомологичной рекомбинации in vitro или in vivo. Например, с применением данного подхода, мотивы последовательности, кодирующие представляющий интерес домен, можно подвергать шаффлингу между пестицидным геном по настоящему изобретению и другими известными пестицидными генами с получением нового гена, кодирующего белок с улучшенным представляющим интерес свойством, таким как повышенная инсектицидная активность. Стратегии для такого ДНК-шаффлинга известны из уровня техники. См., например, Stemmer (1994) Proc. Natl. Acad. Sci. USA 91:10747-10751; Stemmer (1994) Nature 370:389-391; Crameri et al. (1997) Nature Biotech. 15:436-438; Moore et al. (1997) J. Mol. Biol. 272:336-347; Zhang et al. (1997) Proc. Natl. Acad. Sci. USA 94:4504-4509; Crameri et al. (1998) Nature 391:288-291; и патенты США №№5605793 и 5837458.
[00119] Обмен доменов или шаффлинг является другим механизмом для получения измененных белков Cry по настоящему изобретению. Домены можно обменивать между белками Cry, что приводит к гибридным или химерным токсичным белкам с улучшенной пестицидной активностью или спектром мишеней. Способы получения рекомбинантных белков и тестирования их в отношении пестицидной активности хорошо известны из уровня техники (см., например, Naimov et al. (2001) Appl. Environ. Microbiol. 67:5328-5330; de Maagd et al. (1996) Appl. Environ. Microbiol. 62:1537-1543; Ge et al. (1991) J. Biol. Chem. 266:17954-17958; Schnepf et al. (1990) J. Biol. Chem. 265:20923-20930; Rang et al. 91999) Appl. Environ. Microbiol. 65:2918-2925).
[00120] В некоторых вариантах осуществления настоящего изобретения предусмотрен рекомбинантный вектор, содержащий полинуклеотид, молекулу нуклеиновой кислоты, кассету экспрессии или химерный ген по настоящему изобретению. В других вариантах осуществления вектор дополнительно определен как плазмида, космида, фагмида, искусственная хромосома, фаг или вирусный вектор. Некоторые векторы для применения в трансформации растений и других организмов известны из уровня техники.
[00121] Таким образом, некоторые варианты осуществления настоящего изобретения относятся к кассетам экспрессии, сконструированным для экспрессии полинуклеотидов и молекул нуклеиновых кислот по настоящему изобретению. Применяемое в данном документе выражение "кассета экспрессии" означает молекулу нуклеиновой кислоты, имеющую по меньшей мере последовательность контроля, функционально связанную с представляющей интерес нуклеотидной последовательностью. Таким образом, например, в кассетах экспрессии для экспрессии в растении, части растения и/или растительной клетке предусмотрены промоторы растений, функционально связанные с нуклеотидными последовательностями, подлежащими экспрессии.
[00122] Кассета экспрессии, содержащая представляющую интерес нуклеотидную последовательность, может быть химерной, что означает, что по меньшей мере один из ее компонентов является гетерологичным по отношению по меньшей мере к одному из ее остальных компонентов. Кассета экспрессии также может представлять собой последовательность, которая встречается в природе, но которая была получена в рекомбинантной форме, применимой для гетерологичной экспрессии. Однако, как правило, кассета экспрессии является гетерологичной по отношению к хозяину, т.е. конкретная последовательность нуклеиновой кислоты в кассете экспрессии не встречается в природе в клетке-хозяине, и ее необходимо было ввести в клетку-хозяина или предка клетки-хозяина с помощью события трансформации.
[00123] В дополнение к промоторам, функционально связанным с нуклеотидными последовательностями по настоящему изобретению, кассета экспрессии по настоящему изобретению также может содержать другие регуляторные последовательности. Применяемое в данном документе выражение "регуляторные последовательности" означает нуклеотидные последовательности, расположенные выше (5'-некодирующие последовательности), в пределах или ниже (3'-некодирующие последовательности) кодирующей последовательности, которые влияют на транскрипцию, процессинг или стабильность РНК или трансляцию ассоциированной кодирующей последовательности. Регуляторные последовательности включают без ограничения энхансеры, интроны, лидерные последовательности, регулирующие трансляцию, сигналы терминации и сигнальные последовательности полиаденилирования.
[00124] В некоторых вариантах осуществления кассета экспрессии по настоящему изобретению также может содержать нуклеотидные последовательности, которые кодируют другие требуемые признаки. Такие нуклеотидные последовательности можно "пакетировать" с любой комбинацией нуклеотидных последовательностей для создания растений, частей растений или растительных клеток с требуемым фенотипом. "Пакетированные" комбинации можно создавать с помощью любого способа, в том числе без ограничения с помощью скрещивания растений с помощью любой общепринятой методики или с помощью генетической трансформации (т.е. молекулярного стэкинга). При "пакетировании" путем генетической трансформации растений представляющие интерес нуклеотидные последовательности можно комбинировать в любой момент времени и в любом порядке. Например, трансгенное растение, содержащее один или несколько требуемых признаков, можно применять в качестве мишени для введения дополнительных признаков путем последующей трансформации. Дополнительные нуклеотидные последовательности можно вводить по протоколу котрансформации одновременно с нуклеотидной последовательностью, молекулой нуклеиновой кислоты, конструкцией нуклеиновой кислоты и/или композицией по настоящему изобретению, обеспечиваемыми любой комбинацией кассет экспрессии. Например, если будут вводить две нуклеотидные последовательности, то их можно встроить в отдельные кассеты (транс), или их можно встроить в одну кассету (цис). Экспрессия полинуклеотидов может управляться одним и тем же промотором или различными промоторами. Кроме того, известно, что полинуклеотиды можно "пакетировать" в требуемом местоположении в геноме при помощи системы сайт-специфической рекомбинации. См., например, публикации международных заявок на патенты №№ WO 99/25821, WO 99/25854, WO 99/25840, WO 99/25855 и WO 99/25853.
[00125] Кассета экспрессии также может содержать кодирующую последовательность, соответствующую одному или нескольким полипептидам, обеспечивающим агрономические признаки, которые преимущественно приносят пользу семенной компании, сельхозпроизводителю или переработчику зерна. Представляющий интерес полипептид может быть любым полипептидом, кодируемым представляющей интерес нуклеотидной последовательностью. Неограничивающие примеры представляющих интерес полипептидов, которые подходят для продуцирования в растениях, включают таковые, обуславливающие возникновение агрономически важных признаков, таких как устойчивость к гербицидам (также иногда называемая "толерантность к гербицидам"), устойчивость к вирусам, устойчивость к патогенным бактериям, устойчивость к насекомым, устойчивость к нематодам и/или устойчивость к грибам. См., например, патенты США №№5569823; 5304730; 5495071; 6329504 и 6337431. Полипептид также может являться таким, который увеличивает мощность или урожайность растений (включая признаки, которые дают возможность растению произрастать при различных температурах, почвенных условиях и уровнях солнечного света и атмосферных осадков), или таким, который дает возможность идентифицировать растение, проявляющее представляющий интерес признак (например, селектируемый маркер, цвет семенной оболочки и т.д.). Разнообразные представляющие интерес полипептиды, а также способы введения этих полипептидов в растение описаны, например, в патентах США №№4761373; 4769061; 4810648; 4940835; 4975374; 5013659; 5162602; 5276268; 5304730;5495071; 5554798; 5561236; 5569823; 5767366; 5879903, 5928937; 6084155; 6329504 и 6337431; а также в публикации заявки на патент США №2001/0016956. См. также во всемирной сети Интернет по адресу lifesci.sussex.ac.uk/home/Neil_Crickmore/Bt/.
[00126] В некоторых вариантах осуществления настоящего изобретения также могут применяться полинуклеотиды, придающие устойчивость/толерантность к гербициду, ингибирующему конус нарастания или меристему, такому как имидазолинон или сульфонилмочевина. Иллюстративные полинуклеотиды из этой категории кодируют мутантные ферменты ALS и AHAS, как описано, например, в патентах США №№5767366 и 5928937. Патенты США №№4761373 и 5013659 относятся к растениям, устойчивым к различным имидазолиноновым или сульфонамидным гербицидам. Патент США №4975374 относится к растительным клеткам и растениям, содержащим нуклеиновую кислоту, кодирующую мутантную глутаминсинтетазу (GS), устойчивую к ингибированию гербицидами, которые, как известно, ингибируют GS, например, фосфинотрицин и метионинсульфоксимин. В патенте США №5162602 раскрыты растения, устойчивые к ингибированию гербицидами на основе циклогександиона и арилоксифеноксипропановой кислоты. Устойчивость придает измененная ацетил-коэнзим А-карбоксилаза (АССаза).
[00127] Полипептиды, кодируемые нуклеотидными последовательностями, придающими устойчивость к глифосату, также подходят для настоящего изобретения. См., например, патент США №4940835 и патент США №4769061. В патенте США №5554798 раскрыты трансгенные растения маиса, устойчивые к глифосату, устойчивость которым придает ген измененной 5-енолпирувил-3-фосфошикиматсинтазы (EPSP).
[00128] Также подходят полинуклеотиды, кодирующие устойчивость к фосфоновым соединениям, таким как глюфосинат аммония или фосфинотрицин, а также пиридинокси- или феноксипропионовым кислотам и циклогексанонам. См. заявку на европейский патент №0242246. См. также патенты США №№5879903, 5276268 и 5561236.
[00129] Другие подходящие полинуклеотиды включают таковые, кодирующие устойчивость к гербицидам, ингибирующим фотосинтез, таким как триазин и бензонитрил (ген нитрилазы). См. патент США №4810648. Дополнительные подходящие полинуклеотиды, кодирующие устойчивость к гербицидам, включают таковые, кодирующие устойчивость к 2,2-дихлорпропионовой кислоте, сетоксидиму, галоксифопу, имидазолиноновым гербицидам, сульфонилмочевинным гербицидам, триазолопиримидиновым гербицидам, s-триазиновым гербицидам и бромоксинилу. Также подходят полинуклеотиды, придающие устойчивость к ингибиторам фермента protox, или которые обеспечивают повышенную устойчивость к заболеваниям растений; повышенную толерантность к неблагоприятным условиям окружающей среды (видам абиотического стресса), в том числе без ограничения к засухе, чрезмерному охлаждению, чрезмерному нагреву, или чрезмерной засоленности почвы, или экстремальной кислотности или щелочности; и изменения строения или развития растений, в том числе изменения сроков развития. См., например, публикацию заявки на патент США №2001/0016956 и патент США №6084155.
[00130] Дополнительные подходящие полинуклеотиды включают таковые, кодирующие пестицидные (например, инсектицидные) полипептиды. Эти полипептиды могут быть получены в количествах, достаточных для контроля, например, насекомых-вредителей (т.е. в количествах, обеспечивающих контроль насекомых). Считается, что количество продуцируемого в растении пестицидного полипептида, необходимое для контроля насекомых или других вредителей, может варьировать в зависимости от сорта, типа вредителя, факторов окружающей среды и т.п. Полинуклеотиды, применимые для придания дополнительной устойчивости к насекомым или вредителям, включают, например, таковые, кодирующие токсины, идентифицированные в организмах Bacillus. Полинуклеотиды, содержащие нуклеотидные последовательности, кодирующие инсектицидные белки Bacillus thuringiensis (Bt) из нескольких подвидов, были клонированы и было обнаружено, что рекомбинантные клоны токсичны для личинок чешуекрылых, двукрылых и жесткокрылых насекомых. Примеры таких инсектицидных белков Bt включают белки Cry, такие как Cry1Aa, Cry1Ab, Cry1Ac, Cry1B, Cry1C, Cry1D, Cry1Ea, Cry1Fa, Cry3A, Cry9A, Cry9B, Cry9C, и т.п., а также вегетативные инсектицидные белки, такие как Vip1, Vip2, Vip3 и т.п. Полный перечень белков Bt можно найти во всемирной сети Интернет в базе данных номенклатуры токсинов Bacillus thuringiensis, поддерживаемой университетом Сассекса (см. также Crickmore et al. (1998) Microbiol. Mol. Biol. Rev. 62:807-813).
[00131] Полипептиды, пригодные для продуцирования в растениях, дополнительно включают таковые, улучшающие превращение собранных растений и/или частей растений в коммерчески применимый продукт или иным образом содействующие ему, в том числе, например, обеспечивающие повышенное или измененное содержание и/или распределение углеводов, улучшенные свойства сбраживаемости, повышенное содержание масла, повышенное содержание белка, улучшенную усвояемость или повышенное содержание нутрицевтиков, например, повышенное содержание фитостерола, повышенное содержание токоферола, повышенное содержание станола и/или повышенное содержание витаминов. Представляющие интерес полипептиды также включают, например, таковые, обуславливающие снижение содержания нежелательного компонента в собранном урожае, например, фитиновой кислоты или ферментов, расщепляющих сахара, или способствующие этому. Под "обуславливающим" или "способствующим" подразумевается, что представляющий интерес полипептид может прямо или косвенно способствовать наличию представляющего интерес признака (например, путем увеличения расщепления целлюлозы с помощью гетерологичного фермента целлюлазы).
[00132] В одном варианте осуществления полипептид способствует улучшению усвояемости еды или корма. Ксиланазы представляют собой ферменты, расщепляющие гемицеллюлозу, которые усиливают разрушение клеточных стенок растений, что приводит к лучшему использованию питательных веществ растения животным. Это приводит к увеличению темпов роста и конверсии корма. Также можно снижать вязкость кормов, содержащих ксилан. Гетерологичное продуцирование ксиланаз в растительных клетках также может содействовать превращению лигноцеллюлозы в сбраживаемые сахара в ходе промышленной переработки.
[00133] Были идентифицированы и охарактеризованы многочисленные ксиланазы из грибковых и бактериальных микроорганизмов (см., например, патент США №5437992; Coughlin et al. (1993) "Proceedings of the Second TRICEL Symposium on Trichoderma reesei Cellulases and Other Hydrolases" Espoo; Souminen and Reinikainen, eds. (1993) Foundation for Biotechnical and Industrial Fermentation Research 8:125-135; публикацию заявки на патент США №2005/0208178; и публикацию согласно РСТ № WO 03/16654). В частности у Т. reesei были идентифицированы три специфические ксиланазы (XYL-I, XYL-II и XYL-III) (Tenkanen et al. (1992) Enzyme Microb. Technol. 14:566; Torronen et al. (1992) Bio/Technology 10:1461; and Xu et al. (1998) Appl. Microbiol. Biotechnol. 49:718).
[00134] В другом варианте осуществления полипептид, применимый для настоящего изобретения, может представлять собой фермент, расщепляющий полисахариды. Растения по настоящему изобретению, вырабатывающие такой фермент, могут быть применимы для получения, например, сбраживаемого сырья для биологической переработки. В некоторых вариантах осуществления ферменты, применимые для способа сбраживания, включают альфа-амилазы, протеазы, пуллуланазы, изоамилазы, целлюлазы, гемицеллюлазы, ксиланазы, циклодекстрингликозилтрансферазы, липазы, фитазы, лакказы, оксидазы, эстеразы, кутиназы, фермент, гидролизующий гранулированный крахмал, и другие глюкоамилазы.
[00135] Ферменты, расщепляющие полисахариды, включают ферменты, расщепляющие крахмал, такие как α-амилазы (ЕС 3.2.1.1), глюкуронидазы (Е.С. 3.2.1.131); экзо-1,4-α-D-глюканазы, такие как амилоглюкозидазы и глюкоамилазы (ЕС 3.2.1.3), β-амилазы (ЕС 3.2.1.2), α-глюкозидазы (ЕС 3.2.1.20) и другие экзоамилазы; крахмал-деветвящие ферменты, такие как а) изоамилаза (ЕС 3.2.1.68), пуллуназа (ЕС 3.2.1.41) и т.п.; b) целлюлазы, такие как экзоо-1,4-3-целлобиогидролаза (ЕС 3.2.1.91), экзо-1,3-β-D-глюканаза (ЕС 3.2.1.39), β-глюкозидаза (ЕС 3.2.1.21); с) L-арабиназы, такие как эндо-1,5-α-L-арабиназа (ЕС 3.2.1.99), α-арабинозидазы (ЕС 3.2.1.55) и т.п.; d) галактаназы, такие как эндо-1,4-β-D-галактаназа (ЕС 3.2.1.89), эндо-1,3-β-D-галактаназа (ЕС 3.2.1.90), α-галактозидаза (ЕС 3.2.1.22), β-галактозидаза (ЕС 3.2.1.23) и т.п.; е) маннаназы, такие как эндо-1,4-β-D-маннаназа (ЕС 3.2.1.78), β-маннозидаза (ЕС 3.2.1.25), α-маннозидаза (ЕС 3.2.1.24) и т.п.; f) ксиланазы, такие как эндо-1,4-β-ксиланаза (ЕС 3.2.1.8), β-D-ксилозидаза (ЕС 3.2.1.37), 1,3-β-D-ксиланаза и т.п.; и g) другие ферменты, такие как α-L-фукозидаза (ЕС 3.2.1.51), α-L-рамнозидаза (ЕС 3.2.1.40), леваназа (ЕС 3.2.1.65), инулиназа (ЕС 3.2.1.7) и т.п. В одном варианте осуществления α-амилаза представляет собой синтетическую α-амилазу, Amy797E, описанную в патенте США №8093453, включенном в данный документ посредством ссылки во всей своей полноте.
[00136] Дополнительные ферменты, которые можно применять в соответствии с настоящим изобретением, включают протеазы, такие как протеазы грибов и бактерий. Протеазы грибов включают без ограничений таковые, полученные из Aspergillus, Trichoderma, Mucor и Rhizopus, как, например, A. niger, A. awamori, A. oryzae и М. miehei. В некоторых вариантах осуществления полипептиды по настоящему изобретению могут представлять собой ферменты целлобиогидролазы (СВН) (ЕС 3.2.1.91). В одном варианте осуществления фермент целлобиогидролаза может представлять собой СВН1 или СВН2.
[00137] Другие ферменты, применимые в соответствии с настоящим изобретением, включают без ограничения гемицеллюлазы, такие как манназы и арабинофуранозидазы (ЕС 3.2.1.55); лигниназы; липазы (например, Е.С. 3.1.1.3), глюкозооксидазы, пектиназы, ксиланазы, трансглюкозидазы, альфа-1,6-глюкозидазы (например, Е.С.3.2.1.20); эстеразы, такие как естераза феруловой кислоты (ЕС 3.1.1.73) и ацетилксиланэстеразы (ЕС 3.1.1.72); и кутиназы (например, Е.С. 3.1.1.74).
[00138] В некоторых вариантах осуществления настоящего изобретения предусмотрена трансгенная клетка-хозяин, отличная от клетки человека, которая содержит полинуклеотид, молекулу нуклеиновой кислоты, химерный ген, кассету экспрессии или рекомбинантный вектор по настоящему изобретению. Трансгенная клетка-хозяин, отличная от клетки человека, может включать без ограничений растительную клетку, дрожжевую клетку, бактериальную клетку или клетку насекомого. Соответственно, в некоторых вариантах осуществления настоящего изобретения предусмотрена бактериальная клетка, выбранная из родов Bacillus, Brevibacillus, Clostridium, Xenorhabdus, Photorhabdus, Pasteuria, Escherichia, Pseudomonas, Erwinia, Serratia, Klebsiella, Salmonella, Pasteurella, Xanthomonas, Streptomyces, Rhizobium, Rhodopseudomonas, Methylophilius, Agrobacterium, Acetobacter, Lactobacillus, Arthrobacter, Azotobacter, Leuconostoc, или Alcaligenes. Таким образом, например, в качестве средств для биологического контроля насекомых можно получать белки Cry по настоящему изобретению путем экспрессии химерного гена, кодирующего белки Cry по настоящему изобретению в бактериальной клетке. Например, в одном варианте осуществления предусмотрена клетка Bacillus thuringiensis, содержащая химерный ген по настоящему изобретению.
[00139] В дополнительных вариантах осуществления настоящего изобретения предусмотрена растительная клетка, которая представляет собой клетку двудольного растения или клетку однодольного растения. В дополнительных вариантах осуществления клетка двудольного растения выбрана из группы, состоящей из клетки сои, клетки подсолнечника, клетки томата, клетки культурной разновидности капусты, клетки хлопчатника, клетки сахарной свеклы и клетки табака. В дополнительных вариантах осуществления клетка однодольного растения выбрана из группы, состоящей из клетки ячменя, клетки маиса, клетки овса, клетки риса, клетки сорго, клетки сахарного тростника и клетки пшеницы. В некоторых вариантах осуществления настоящего изобретения предусмотрена совокупность клеток двудольных растений или клеток однодольных растений, экспрессирующих токсичный белок по настоящему изобретению, кодируемый химерным геном по настоящему изобретению. В других вариантах осуществления клетки в совокупности расположены рядом с образованием апопласта и их выращивают при естественном солнечном свете.
[00140] В другом варианте осуществления настоящего изобретения токсичный белок по настоящему изобретению экспрессируется в высшем организме, например растении. В этом случае трансгенные растения, экспрессируя эффективные количества токсичного белка, защищают себя от вредителей растений, таких как насекомые-вредители. Когда насекомое начинает питаться на таком трансгенном растении, оно также поедает экспрессируемый токсин. Это может удерживать насекомое от дальнейшего вгрызания в растительную ткань или даже может причинять вред насекомому или уничтожать его. Полинуклеотид по настоящему изобретению вставляют в кассету экспрессии, которая затем стабильно интегрируется в геном растения. В другом варианте осуществления полинуклеотид включают в непатогенный самореплицирующийся вирус. Растения, трансформированные в соответствии с настоящим изобретением, могут представлять собой однодольные или двудольные растения, и они включают без ограничения кукурузу (маис), сою, рис, пшеницу, ячмень, рожь, овес, сорго, просо, подсолнечник, сафлор, сахарную свеклу, хлопчатник, сахарный тростник, масличный рапс, люцерну, табак, разновидности арахиса, овощные культуры, в том числе батат, фасоль, горох, цикорий, латук, кочанную капусту, цветную капусту, брокколи, репу, морковь, баклажан, огурец, редьку, шпинат, картофель, томат, спаржу, лук, чеснок, разновидности дыни, перец, сельдерей, тыкву крупноплодную, тыкву обыкновенную, цуккини, плодовые культуры, включая яблоню, грушу, айва, сливу, вишню, персик, нектарин, абрикос, землянику, виноград, малину, ежевику, ананас, авокадо, папайю, манго, банан и специализированные растения, такие как Arabidopsis, а также древесные растения, такие как хвойные и лиственные деревья. Предпочтительно растения по настоящему изобретению представляют собой культурные растения, такие как маис, сорго, пшеница, подсолнечник, томат, крестоцветные, разновидности перца, картофель, хлопчатник, рис, соя, сахарная свекла, сахарный тростник, табак, ячмень, масличный рапс и т.п.
[00141] После того как требуемый полинуклеотид введен в конкретный вид растения путем трансформации, при помощи традиционных методик размножения он может передаваться в пределах данного вида или переходить в другие разновидности того же вида, в частности, включающие коммерческие разновидности.
[00142] Полинуклеотид по настоящему изобретению экспрессируется в трансгенных растениях, обусловливая тем самым биосинтез соответствующего белка Cry в трансгенных растениях. Таким способом получают трансгенные растения с улучшенной защитой урожая в присутствии нагрузки насекомых. Для экспрессии в трансгенных растениях может потребоваться модификация и оптимизация нуклеотидных последовательностей по настоящему изобретению. Хотя во многих случаях гены микроорганизмов могут экспрессироваться в растениях на высоких уровнях и без модификации, низкий уровень экспрессии в трансгенных растениях может быть обусловлен нуклеотидными последовательностями микроорганизмов, имеющими кодоны, которые не являются предпочтительными для растений. Как известно из уровня техники, для живых организмов характерны определенные предпочтения в отношении частоты использования кодонов, и поэтому кодоны нуклеотидных последовательностей, описанных в данном изобретении, могут быть изменены в соответствии с характерными для растений предпочтениями, при этом с сохранением аминокислот, кодируемых ими. Кроме того, высокий уровень экспрессии в растениях, например растениях кукурузы, лучше всего достигается в случае кодирующих последовательностей, которые характеризуются по меньшей мере приблизительно 35% содержанием GC, или по меньшей мере приблизительно 45%, или по меньшей мере приблизительно 50% или по меньшей мере приблизительно 60%. Нуклеотидные последовательности микроорганизмов, которые характеризуются низким содержанием GC, могут экспрессироваться в растениях на недостаточном уровне в связи с наличием мотивов АТТТА, которые могут дестабилизировать транскрипты, и мотивов ААТААА, которые могут обуславливать ненадлежащее полиаденилирование. Хотя определенные последовательности генов могут надлежащим образом экспрессироваться как в видах однодольных, так и двудольных растений, последовательности можно модифицировать с учетом предпочтений в отношении кодонов и предпочтений в отношении содержания GC для однодольных растений или двудольных растений, поскольку было показано, что эти предпочтения отличаются (Murray et al. Nucl. Acids Res. 17: 477-498 (1989)). Кроме того, нуклеотидные последовательности подвергают скринингу на наличие неправильных сайтов сплайсинга, которые могут вызывать усечение транскрипта. Все изменения, которые требуется выполнить в пределах нуклеотидных последовательностей, такие как описанные выше, выполняют с применением хорошо известных методик сайт-направленного мутагенеза, ПЦР и конструирования синтетических генов с помощью способов, описанных, например, в патентах США №№5625136; 5500365 и 6013523.
[00143] В некоторых вариантах осуществления настоящего изобретения предусмотрены синтетические гены, полученные согласно процедуре, раскрытой в патенте США №5625136, включенном в данный документ посредством ссылки. В этой процедуре применяют предпочтительные для маиса кодоны, т.е. один кодон, который чаще всего кодирует данную аминокислоту в маисе. Предпочтительный для маиса кодон, кодирующий конкретную аминокислоту, может быть определен, например, на основании известных последовательностей генов маиса. Например, данные о частоте использования кодонов у маиса для 28 генов из растений маиса можно найти в Murray et al., Nucleic Acids Research 17: 477-498 (1989), раскрытие которого включено в данный документ посредством ссылки. Специально приведенные в качестве примера синтетические последовательности по настоящему изобретению, полученные с применением кодонов, оптимизированных для маиса, представлены любой из SEQ ID NO: 13-20. Подобным образом нуклеотидные последовательности могут быть оптимизированы для экспрессии в любом растении. Следует понимать, что вся нуклеотидная последовательность или любая ее часть могут быть оптимизированными или синтетическими. То есть полинуклеотид может содержать нуклеотидную последовательность, которая частично является нативной последовательностью и частично является синтетической оптимизированной последовательностью.
[00144] Для эффективной инициации трансляции может потребоваться модификация последовательностей, прилегающих к инициирующему метионину. Например, их можно модифицировать путем включения последовательностей, которые, как известно, являются эффективными в растениях. Joshi предложил подходящую консенсусную последовательность для растений (NAR 15: 6643-6653 (1987)), а Clonetech предлагает дополнительную консенсусную последовательность, являющуюся инициатором трансляции (каталог 1993/1994, стр. 210). Эти консенсусные последовательности подходят для использования с нуклеотидными последовательностями по настоящему изобретению. Последовательности встраивают в конструкции, содержащие нуклеотидные последовательности, выше и включительно ATG (при этом вторая аминокислота остается немодифицированной) или в качестве альтернативы выше и включительно GTC, расположенного после ATG (с возможностью модифицирования второй аминокислоты трансгена).
[00145] Последовательности, кодирующие новый белок cry по настоящему изобретению, либо в виде их нативной последовательности, либо в виде синтетических последовательностей, как описано выше, могут быть функционально связаны с целым рядом промоторов для экспрессии в растениях, включая конститутивные, индуцируемые, регулируемые во времени, регулируемые в процессе развития, химически регулируемые, тканепредпочтительные и тканеспецифические промоторы, для получения молекул рекомбинантных ДНК, то есть химерных генов. Выбор промотора будет различаться в зависимости от временных и пространственных требований для экспрессии, а также в зависимости от целевого вида. Таким образом, предпочтительной является экспрессия нуклеотидных последовательностей по настоящему изобретению в листьях, в цветоножках или стеблях, в колосьях, в соцветиях (например, колосках, метелках, початках и т.д.), в корнях и/или проростках. Во многих случаях, однако, требуется защита от более чем одного типа насекомого-вредителя, и, следовательно, желательна экспрессия в нескольких тканях. Хотя, как было показано, многие промоторы из двудольных растений функционируют у однодольных растений и наоборот, по возможности промоторы двудольных выбирают для экспрессии у двудольных растений, а промоторы однодольных выбирают для экспрессии у однодольных растений. Однако не существует каких-либо ограничений в отношении происхождения выбранных промоторов, достаточно того, что они являются функциональными в управлении экспрессией нуклеотидных последовательностей в требуемой клетке.
[00146] Примеры конститутивных промоторов, применимых в настоящем изобретении, включают 35S и 19S промоторы CaMV (Fraley et al., патент США №5352605, включенный в данный документ посредством ссылки). Кроме того, промотор получают из любого из нескольких генов актина, экспрессируемых в большинстве типов клеток. Кассеты экспрессии с промотором, описанные McElroy et al. (Mol. Gen. Genet. 231: 150-160 (1991)), можно легко модифицировать для экспрессии гена нового токсина, и они являются особенно подходящими для применения у однодольных растений-хозяев. Еще один конститутивный промотор получают из гена убиквитина, который представляет собой еще один генный продукт, который, как известно, накапливается во многих типах клеток. Убиквитиновый промотор был клонирован из нескольких видов для применения в трансгенных растениях, например, подсолнечнике (Binet et al., 1991. Plant Science 79: 87-94), маисе (Christensen et al., 1989. Plant Molec. Biol. 12: 619-632) и Arabidopsis (Norris et al. 1993. Plant Molec. Biol. 21: 895-906). Убиквитиновый промотор маиса был разработан для трансгенных систем однодольных растений, и его последовательность и векторы, сконструированные для трансформации однодольных растений, раскрыты в патентной заявке ЕР 0342926. Убиквитиновый промотор подходит для экспрессии гена нового токсина в трансгенных растениях, в частности однодольных.
[00147] Тканеспецифические или тканепредпочтительные промоторы, применимые для экспрессии последовательностей, кодирующих новый белок cry по настоящему изобретению, в растениях, в частности маисе, представляют собой промоторы, которые управляют экспрессией в корне, паренхиме, листе или пыльце. Такие промоторы раскрыты в патенте США №5625136, включенном в данный документ посредством ссылки во всей своей полноте. Другие тканеспецифические промоторы, применимые в настоящем изобретении, включают промотор гена rubisco хлопчатника, раскрытый в патенте США №6040504; промотор гена сахарозосинтазы риса, раскрытый в патенте США №5604121; и промотор вируса желтой курчавости листьев цеструма, раскрытый в патенте США №7166770, все включены посредством ссылки во всей своей полноте. Химически индуцируемые промоторы, применимые для управления экспрессией гена нового токсина в растениях, раскрыты в патенте США №5614395, включенном в данный документ посредством ссылки во всей своей полноте.
[00148] Нуклеотидные последовательности по настоящему изобретению также могут экспрессироваться под контролем промоторов, которые регулируются химическим путем. Это обеспечивает возможность синтеза белков Cry по настоящему изобретению только в случае обработки культурных растений индуцирующими химическими веществами. Примеры такой технологии химической индукции экспрессии генов подробно описаны в публикации заявки ЕР 0332104 и патенте США №5614395. В одном варианте осуществления химически регулируемый промотор представляет собой промотор PR-1a табака.
[00149] Другая категория промоторов, применимых в настоящем изобретении, включает промотор, который индуцируется ранением. Были описаны многочисленные промоторы, которые экспрессируются в участках ранения, а также в участках инфицирования фитопатогеном. В идеальном случае такой промотор должен активироваться локально в участках инвазии насекомых и, таким образом, инсектицидные белки накапливаются исключительно в клетках, где необходим синтез инсектицидных белков для уничтожения нападающего насекомого-вредителя. Примеры промоторов этого типа включают таковые, описанные Stanford et al. Mol. Gen. Genet. 215: 200-208 (1989), Xu et al. Plant Molec. Biol. 22: 573-588 (1993), Logemann et al. Plant Cell 1: 151-158 (1989), Rohrmeier & Lehle, Plant Molec. Biol. 22: 783-792 (1993), Firek et al. Plant Molec. Biol. 22: 129-142 (1993), and Warner et al. Plant J. 3: 191-201 (1993).
[00150] Неограничивающие примеры промоторов, обуславливающих тканеспецифические паттерны экспрессии, применимые в настоящем изобретении, включают специфические для зеленой ткани, специфические для корня, специфические для стебля и/или специфические для цветка. Промоторы, подходящие для экспрессии в зеленой ткани, включают множество промоторов, которые осуществляют регуляцию генов, участвующих в фотосинтезе, и многие из них были клонированы как из однодольных растений, так и из двудольных растений. Одним из таких промоторов является промотор РЕРС маиса из гена фосфоенолкарбоксилазы (Hudspeth & Grula, Plant Molec. Biol. 12: 579-589 (1989)). Другим промотором специфической для корня экспрессии является промотор, описанный de Framond (FEBS 290: 103-106 (1991) или в патенте США №5466785). Другой промотор, применимый в настоящем изобретении, представляет собой специфический для стебля промотор, описанный в патенте США №5625136, который в естественных условиях управляет экспрессией гена trpA маиса.
[00151] В дополнение к выбору подходящего промотора конструкциям для экспрессии инсектицидного токсина в растениях требуется соответствующий терминатор транскрипции, который будет функционально связан ниже гетерологичной нуклеотидной последовательности. Несколько таких терминаторов доступны и известны в данной области техники (например, tml из CaMV, E9 из rbcS). В контексте настоящего изобретения можно применять любой доступный терминатор, о котором известно, что он функционирует в растениях.
[00152] В кассеты экспрессии, описанные в настоящем изобретении, можно вводить множество других последовательностей. Они предусматривают последовательности, которые, как показано, усиливают экспрессию, как, например, интронные последовательности (например, из Adh1 и bronze 1) и вирусные лидерные последовательности (например, из TMV, MCMV и AMV).
[00153] Предпочтительным может быть нацеливание экспрессии нуклеотидных последовательностей по настоящему изобретению в различные клеточные локализации в растении. В некоторых случаях может быть желательной локализация в цитозоле, тогда как в других случаях предпочтительной может быть локализация в определенной субклеточной органелле. Для осуществления настоящего изобретения на практике можно применять любой механизм нацеливания генных продуктов, например в растениях, и, как известно, такие механизмы существуют в растениях, и последовательности, регулирующие функционирование таких механизмов, были описаны довольно подробно. Были охарактеризованы последовательности, которые обеспечивают нацеливание генных продуктов в другие компартменты клетки. Аминоконцевые последовательности могут обусловливать нацеливание представляющего интерес белка в любой компартмент клетки, такой как вакуоль, митохондрия, пероксисома, белковые тельца, эндоплазматический ретикулум, хлоропласт, крахмальное зерно, амилопласт, апопласт или клеточная стенка растения (например, Unger et. al. Plant Molec. Biol. 13: 411-418 (1989); Rogers et. al. (1985) Proc. Natl. Acad. Sci. USA 82: 6512-651; патент США №7102057; WO 2005/096704, все из которых включены в данный документ посредством ссылки. Необязательно, сигнальная последовательность может представлять собой N-концевую сигнальную последовательность из waxy, N-концевую сигнальную последовательность из гамма-зеина, домен, связывающий крахмал, С-концевой домен, связывающий крахмал, последовательность, нацеливающую в хлоропласт, которая обеспечивает доставку зрелого белка в хлоропласт (Comai et. al. (1988) J. Biol. Chem. 263: 15104-15109; van den Broeck, et. al. (1985) Nature 313: 358-363; патент США №5639949) или сигнальную последовательность секреции из клеток алейронового слоя (Koehler & Но, Plant Cell 2: 769-783 (1990)). Кроме того, аминоконцевые последовательности вместе с карбоксиконцевыми последовательностями обусловливают нацеливание генных продуктов в вакуоль (Shinshi et. al. (1990) Plant Molec. Biol. 14: 357-368). В одном варианте осуществления выбранная сигнальная последовательность включает известный сайт расщепления, и при конструировании слияния учитываются любые аминокислоты после сайта(ов) расщепления, необходимые для расщепления. В некоторых случаях это требование может быть выполнено путем добавления небольшого числа аминокислот между сайтом расщепления и ATG трансгена или, в качестве альтернативы, путем замещения некоторых аминокислот в пределах последовательности трансгена. Эти методики конструирования хорошо известны из уровня техники и одинаково применимы к любому клеточному компартменту.
[00154] Будет понятно, что описанные выше механизмы нацеливания в клетке можно использовать не только с сочетании когнатными для них промоторами, но также в сочетании с гетерологичными промоторами, так что специфическая задача нацеливания в клетке осуществляется под транскрипционным контролем промотора, характеризующегося паттерном экспрессии, отличный от такового для промотора, из которого получен нацеливающий сигнал.
Трансформация растений
[00155] Процедуры трансформации растений хорошо известны и общеприняты в данной области техники и описаны в литературе во всех отношениях. Неограничивающие примеры способов трансформации растений включают трансформацию с помощью доставки нуклеиновых кислот, опосредованной бактериями (например, с помощью Agrobacterium), доставки нуклеиновых кислот, опосредованной вирусами, доставки нуклеиновых кислот, опосредованной карбидом кремния или микроиглами с нуклеиновыми кислотами, доставки нуклеиновых кислот, опосредованной липосомами, микроинъекцию, бомбардировку микрочастицами, трансформацию, опосредованную фосфатом кальция, трансформацию, опосредованную циклодекстринами, электропорацию, трансформацию, опосредованную наночастицами, обработку ультразвуком, инфильтрацию, поглощение нуклеиновых кислот, опосредованное PEG, а также любой другой электрический, химический, физический (механический) и/или биологический механизм, который приводит к введению нуклеиновой кислоты в растительную клетку, включая любую их комбинацию. Общие руководства по разнообразным способам трансформации растений, известным в данной области техники, включают Miki et al. ("Procedures for Introducing Foreign DNA into Plants" в Methods in Plant Molecular Biology and Biotechnology, Glick, B.R. and Thompson, J.E., Eds. (CRC Press, Inc., Boca Raton, 1993), pages 67-88) и Rakowoczy-Trojanowska (Cell. Mol. Biol. Lett. 7: 849-858 (2002)).
[00156] Для трансформации, опосредованной Agrobacterium, подходят бинарные векторы или векторы, несущие по меньшей мере одну граничную последовательность T-DNA, тогда как для прямого переноса генов (например, с помощью бомбардировки частицами и т.п.) подходит любой вектор, при этом можно применять линейную ДНК, содержащую только представляющую интерес конструкцию. В случае прямого переноса генов можно применять трансформацию с помощью одного вида ДНК или котрансформацию (Schocher et al., Biotechnology 4: 1093-1096 (1986)). В случае как прямого переноса генов, так и переноса, опосредованного Agrobacterium, трансформацию обычно (но не обязательно) выполняют с селектируемым маркером, который может представлять собой средство для позитивного отбора (фосфоманнозоизомераза), которое обеспечивает устойчивость к антибиотику (канамицину, гигромицину или метотрексату) или гербициду (глифосату или глюфосинату). Однако выбор селектируемого маркера не является критически важным для настоящего изобретения.
[00157] Трансформация, опосредованная Agrobacterium, представляет собой способ, широко применяемый для трансформации растений, в частности двудольных растений, в связи с высокой эффективностью трансформации и в связи с широкой применимостью в отношении множества различных видов. Трансформация, опосредованная Agrobacterium, как правило, предполагает перенос бинарного вектора, несущего представляющую интерес чужеродную ДНК в соответствующий штамм Agrobacterium, что может зависеть от набора vir-генов штамма-хозяина Agrobacterium, расположенного либо на корезидентной Ti-плазмиде, либо на хромосоме (Uknes et al. (1993) Plant Cell 5: 159-169). Перенос рекомбинантного бинарного вектора в Agrobacterium можно выполнять с помощью процедуры трехродительского скрещивания с применением Escherichia coli, несущей рекомбинантный бинарный вектор, хелперного штамма Е. coli, несущего плазмиду, которая способна мобилизовать рекомбинантный бинарный вектор в целевом штамме Agrobacterium. В качестве альтернативы рекомбинантный бинарный вектор можно переносить в Agrobacterium путем трансформации нуклеиновой кислотой (
[00158] Трансформация растения с помощью рекомбинантной Agrobacterium обычно включает совместное культивирование Agrobacterium с эксплантатами растения, и ее проводят в соответствии со способами, хорошо известными из уровня техники. Трансформированную ткань регенерируют на селективной среде, содержащей маркер устойчивости к антибиотикам или гербицидам между граничными последовательностями T-DNA бинарной плазмиды.
[00159] Как обсуждалось ранее, другой способ трансформации растений, частей растений и растительных клеток включает внедрение инертных или биологически активных частиц в растительные ткани и клетки. См, например, патенты США №№4945050; 5036006 и 5100792. В общем случае этот способ включает внедрение в растительные клетки инертных или биологически активных частиц в условиях, эффективных для проникновения через наружную поверхность клетки и возможности включения в ее внутреннюю часть. При использовании инертных частиц вектор можно вводить в клетку путем покрытия частиц вектором, содержащим представляющую интерес нуклеиновую кислоту. В качестве альтернативы клетка или клетки могут быть окружены вектором так, чтобы вектор переносился в клетку вслед за частицей. Биологически активные частицы (например, высушенная дрожжевая клетка, высушенная бактерия или бактериофаг, каждая(каждый) из которых содержит одну или несколько нуклеиновых кислот, подлежащих введению) также можно внедрять в растительную ткань.
[00160] В другом варианте осуществления полинуклеотид по настоящему изобретению можно напрямую вводить в геном пластид путем трансформации. Основное преимущество трансформации пластид состоит в том, что пластиды обычно способны экспрессировать бактериальные гены без существенной модификации, при этом пластиды способны экспрессировать несколько открытых рамок считывания под контролем одного промотора. Технология трансформации пластид подробно описана в патентах США №№5451513, 5545817 и 5545818, в заявке согласно РСТ №WO 95/16783 и в McBride et al. (1994) Proc. Nati. Acad. Sci. USA 91, 7301-7305. Основная методика трансформации хлоропластов включает введение участков клонированной пластидной ДНК, фланкирующих селектируемый маркер, вместе с представляющим интерес геном в подходящую целевую ткань, например, с применением биолистики или трансформации протопластов (например, трансформации, опосредованной хлоридом кальция или PEG). Фланкирующие участки размером 1-1,5 т. о., называемые нацеливающими последовательностями, содействуют гомологичной рекомбинации с геномом пластид и, таким образом, обеспечивают замещение или модификацию специфических участков пластома. Вначале в качестве селектируемых маркеров для трансформации можно использовать точковые мутации в 16S рРНК и генах rps12 хлоропластов, придающие устойчивость к спектиномицину и/или стрептомицину (Svab, Z., Hajdukiewicz, Р., и Maliga, Р. (1990) Proc. Natl. Acad. Sci. USA 87, 8526-8530; Staub, J.M., и Maliga, P. (1992) Plant Cell 4, 39-45). Наличие сайтов клонирования между данными маркерами позволяет создавать вектор, нацеленный на пластиды, для введения чужеродных генов (Staub, J.M., и Maliga, Р. (1993) ЕМВО J. 12, 601-606). Существенного повышения частоты трансформации можно достичь путем замещения рецессивных генов рРНК или r-белков, обеспечивающих устойчивость к антибиотикам, доминантным селектируемым маркером, бактериальным геном aadA, кодирующим фермент аминогликозид-3'-аденилтрансферазу, обезвреживающий спекгиномицин (Svab, Z., и Maliga, P. (1993) Proc. Natl. Acad. Sci. USA 90, 913-917). Ранее этот маркер успешно применяли для трансформации генома пластид зеленой водоросли Chlamydomonas reinhardtii с высокой частотой (Goldschmidt-Clermont, М. (1991) Nucl. Acids Res. 19: 4083-4089). Другие селектируемые маркеры, применимые для трансформации пластид, известны из уровня техники и включены в объем настоящего изобретения. Как правило, для достижения состояния, при котором все пластиды являются одинаковыми, требуется около 15-20 циклов клеточного деления после трансформации. При экспрессии в пластидах, при которой гены вставлены с помощью гомологической рекомбинации во все несколько тысяч копий кольцевого пластидного генома, присутствующего в каждой растительной клетке, используют преимущество огромного числа копий по сравнению с генами, экспрессируемыми в ядре, что допускает уровни экспрессии, которые легко могут превышать 10% общего количества растворимых растительных белков. В одном варианте осуществления полинуклеотид по настоящему изобретению может быть вставлен в вектор, нацеленный на пластиды, и введен в геном пластид требуемого растения-хозяина путем трансформации. Таким образом, можно получить растения, гомопластические в отношении геномов пластид, содержащих нуклеотидную последовательность по настоящему изобретению, способные экспрессировать полинуклеотид на высоком уровне.
[00161] Способы отбора трансформированных трансгенных растений, растительных клеток и/или культур растительных тканей являются общепринятыми в данной области техники и могут использоваться в способах настоящего изобретения, предусмотренных в данном документе. Например, рекомбинантный вектор по настоящему изобретению также может включать кассету экспрессии, содержащую нуклеотидную последовательность селектируемого маркера, который можно применять для отбора трансформированного растения, части растения и/или растительной клетки. Применяемое в данном документе выражение "селектируемый маркер" означает нуклеотидную последовательность, которая при экспрессии придает отличительный фенотип растению, части растения и/или растительной клетке, экспрессирующим данный маркер, и, таким образом, позволяет отличать такие трансформированные растения, части растений и/или растительные клетки от тех, которые не имеют маркера. Такая нуклеотидная последовательность может кодировать либо селектируемый, либо подвергаемый скринингу маркер в зависимости от того, придает ли маркер признак, по которому можно провести отбор с помощью химических средств, например, с помощью селективного средства (например, антибиотика, гербицида и т.п.), или от того, является ли маркер просто признаком, который можно идентифицировать посредством наблюдения или тестирования, например, путем скрининга (например, признаком, определяемым в R-локусе). Разумеется, существует много примеров подходящих селектируемых маркеров, которые известны из уровня техники и могут применяться в кассетах экспрессии, описываемых в данном документе.
[00162] Примеры селектируемых маркеров включают без ограничения нуклеотидную последовательность, кодирующую neo или nptII, придающие устойчивость к канамицину, G418 и т.п. (Potrykus et al. (1985) Mol. Gen. Genet. 199: 183-188); нуклеотидную последовательность, кодирующую bar, придающий устойчивость к фосфинотрицину; нуклеотидную последовательность, кодирующую измененную 5-енолпирувилшикимат-3-фосфатсинтазу (EPSP-синтазу), придающую устойчивость к глифосату (Hinchee et al. (1988) Biotech. 6: 915-922); нуклеотидную последовательность, кодирующую нитрилазу, такую как bxn из Klebsiella ozaenae, придающую устойчивость к бромоксинилу (Stalker et al. (1988) Science 242: 419-423); нуклеотидную последовательность, кодирующую измененную ацетолактатсинтазу (ALS), придающую устойчивость к имидазолинону, сульфонилмочевине или другим ингибирующим ALS химическим веществам (заявка на европейский патент ЕР №154204); нуклеотидную последовательность, кодирующую устойчивую к метотрексату дигидрофолатредуктазу (DHFR) (Thillet et al. (1988) J. Biol. Chem. 263: 12500-12508); нуклеотидную последовательность, кодирующую далапондегалогеназу, придающую устойчивость к далапону; нуклеотидную последовательность, кодирующую маннозо-6-фосфатизомеразу (также называемую фосфоманнозоизомеразой (PMI)), которая придает способность к метаболизму маннозы (патенты США №№5767378 и 5994629); нуклеотидную последовательность, кодирующую измененную антранилатсинтазу, придающую устойчивость к 5-метилтриптофану; и/или нуклеотидную последовательность, кодирующую hph, придающий устойчивость к гигромицину. Специалист в данной области способен выбрать подходящий селектируемый маркер для применения в кассете экспрессии по настоящему изобретению.
[00163] Дополнительные селектируемые маркеры включают без ограничения нуклеотидную последовательность, кодирующую β-глюкуронидазу или uidA (GUS), который кодирует фермент, для которого известны различные хромогенные субстраты; нуклеотидную последовательность R-локуса, которая кодирует продукт, регулирующий продуцирование антоцианиновых пигментов (красного цвета) в растительных тканях (Dellaporta et al., "Molecular cloning of the maize R-nj allele by transposon-tagging with Ac," pp. 263-282, в Chromosome Structure and Function: Impact of New Concepts, 18th Stadler Genetics Symposium (Gustafson & Appels eds., Plenum Press 1988)); нуклеотидную последовательность, кодирующую β-лактамазу, фермент, для которого известны различные хромогенные субстраты (например, PADAC, хромогенный цефалоспорин) (Sutcliffe (1978) Proc. Natl. Acad. Sci. USA 75: 3737-3741); нуклеотидную последовательность, кодирующую xylE, который кодирует катехолдиоксигеназу (Zukowsky et al. (1983) Proc. Natl. Acad. Sci. USA 80: 1101-1105); нуклеотидную последовательность, кодирующую тирозиназу, фермент, способный окислять тирозин до DOPA и допахинона, который, в свою очередь, конденсируется с образованием меланина (Katz et al. (1983) J. Gen. Microbiol. 129: 2703-2714); нуклеотидную последовательность, кодирующую β-галактозидазу, фермент, для которого существуют хромогенные субстраты; нуклеотидную последовательность, кодирующую люциферазу (lux), которая обеспечивает выявление с помощью биолюминесценции (Ow et al. (1986) Science 234: 856-859); нуклеотидную последовательность, кодирующую экворин, который может быть использован в обнаружении чувствительной к кальцию биолюминесценции (Prasher et al. (1985) Biochem. Biophys. Res. Comm. 126: 1259-1268); или нуклеотидную последовательность, кодирующую зеленый флуоресцентный белок (Niedz et al. (1995) Plant Cell Reports 14: 403-406). Специалист в данной области способен выбрать подходящий селектируемый маркер для применения в кассете экспрессии по настоящему изобретению.
[00164] Дополнительно, как хорошо известно из уровня техники, целые трансгенные растения можно регенерировать из трансформированных растительных клеток, культур растительных тканей и/или культивируемых протопластов с помощью любой из множества известных методик. Регенерация растений из растительных клеток, культуры растительных тканей и/или культивируемых протопластов описана, например, в Evans et al. (Handbook of Plant Cell Cultures, Vol. 1, MacMilan Publishing Co. New York (1983)); и Vasil I.R. (ed.) (Cell Culture and Somatic Cell Genetics of Plants, Acad. Press, Orlando, Vol. I (1984), and Vol. II (1986)).
[00165] Кроме того, описанные выше свойства генов, обеспеченные с помощью методов генной инженерии в трансгенных семенах и растениях, частях растения и/или растительных клетках по настоящему изобретению, могут передаваться путем полового размножения или вегетативного роста и, следовательно, могут поддерживаться и передаваться по наследству растениям-потомкам. Как правило, при поддержании и передаче по наследству применяют известные сельскохозяйственные способы, разработанные для соответствия конкретным целям, таким как уборка урожая, посев или возделывание.
[00166] Следовательно, полинуклеотид можно вводить в растение, часть растения и/или растительную клетку с помощью любого из целого ряда способов, хорошо известных из уровня техники, как описано выше. Следовательно, не придерживаются какого-либо конкретного способа введения одного или нескольких полинуклеотидов в растение, а наоборот, можно применять любой способ, обеспечивающий стабильную интеграцию одного или нескольких полинуклеотидов в геном растения. Если требуется ввести более одного полинуклеотида, то соответствующие полинуклеотиды можно собрать как части одной молекулы нуклеиновой кислоты или как отдельные молекулы нуклеиновых кислот и можно расположить в пределах одной и той же или различных молекул нуклеиновых кислот. Соответственно, введение полинуклеотидов в представляющую интерес клетку можно осуществлять в ходе одного события трансформации, в ходе отдельных событий трансформации или, например, в растения, в виде части протокола скрещивания.
[00167] Дополнительные варианты осуществления настоящего изобретения включают собранные продукты, полученные из трансгенных растений и/или их частей по настоящему изобретению, а также переработанный продукт, полученный из данных собранных продуктов. Собранный продукте может представлять собой целое растение или любую часть растения, как раскрыто в данном документе. Таким образом, в некоторых вариантах осуществления неограничивающие примеры собранного продукта включают семя, плод, цветок или его часть (например, пыльник, рыльце и т.п.), лист, стебель и т.п. В других вариантах осуществления переработанный продукт включает без ограничений муку тонкого помола, муку грубого помола, масло, крахмал, крупу и т.п., полученные из собранного семени или другой части растения по настоящему изобретению, при этом указанное семя или другая часть растения содержат молекулу нуклеиновой кислоты/полинуклеотид/нуклеотидную последовательность по настоящему изобретению.
[00168] В других вариантах осуществления настоящего изобретения предусмотрен экстракт из трансгенного семени и/или трансгенного растения по настоящему изобретению, при этом экстракт содержит молекулу нуклеиновой кислоты, полинуклеотид, нуклеотидную последовательность или токсичный белок по настоящему изобретению. Экстракты из растений или частей растений можно получить согласно процедурам, хорошо известным из уровня техники (см., de la Torre et al., Food, Agric. Environ. 2(1): 84-89 (2004); Guidet, Nucleic Acids Res. 22(9): 1772-1773 (1994); Lipton et al.. Food Agric. Immun. 12: 153-164 (2000)).
Инсектицидные композиции
[00169] В некоторых вариантах осуществления настоящего изобретения предусмотрена инсектицидная композиция, содержащая белок Cry по настоящему изобретению в приемлемом с точки зрения сельского хозяйства носителе. Применяемое в данном документе выражение "приемлемый с точки зрения сельского хозяйства носитель" может включать природный или синтетический, органический или неорганический материал, который объединен с активным компонентом для содействия его применения по отношению к растению или его части. Примеры приемлемых с точки зрения сельского хозяйства носителей включают без ограничения порошки, дусты, пеллеты, гранулы, аэрозоли, эмульсии, коллоиды и растворы. Приемлемые с точки зрения сельского хозяйства носители дополнительно включают без ограничения инертные компоненты, диспергирующие вещества, поверхностно-активные вещества, вспомогательные вещества, придающие липкость вещества, клейкие вещества, связующие вещества или их комбинации, которые можно применять в составах, используемых в сельском хозяйстве. Такие композиции можно применять любым способом, посредством которого пестицидные белки или другие средства для контроля вредителей приводят в контакт с вредителями. Соответственно, композиции можно наносить на поверхности растений или частей растений, в том числе на семена, листья, цветки, стебли, клубни, корни и т.п. Другим приемлемым с точки зрения сельского хозяйства носителем может быть трансгенное растение или часть растения.
[00170] В дополнительных вариантах осуществления инсектицидная композиция содержит трансгенную бактериальную клетку по настоящему изобретению, при этом бактериальная клетка содержит химерный ген по настоящему изобретению. Например, такую инсектицидную композицию можно получить путем высушивания, лиофилизации, гомогенизации, экстракции, фильтрации, центрифугирования, осаждения или концентрирования культуры клеток Bacillus thuringiensis, содержащих полинуклеотид по настоящему изобретению. В дополнительных вариантах осуществления композиция содержит от приблизительно 1% до приблизительно 99% по весу белка Cry по настоящему изобретению.
[00171] Белки Cry по настоящему изобретению можно применять в комбинации с другими средствами для контроля вредителей для увеличения спектра целевых вредителей или для предупреждения и/или управления устойчивостью насекомых. Следовательно, в некоторых вариантах осуществления настоящего изобретения предусмотрена композиция, обеспечивающая контроль одного или нескольких вредителей растений, при этом композиция содержит первый белок Cry по настоящему изобретению и второе средство для контроля вредителей, отличное от первого белка Cry. В других вариантах осуществления композиция представляет собой состав для местного нанесения на растение. В еще одних вариантах осуществления композиция представляет собой трансгенное растение. В дополнительных вариантах осуществления композиция представляет собой комбинацию, предусматривающую состав и трансгенное растение, на которое он наносится. В одном варианте осуществления состав содержит первый белок Cry по настоящему изобретению, если трансгенное растение содержит второе средство для контроля вредителей. В другом варианте осуществления состав содержит второе средство для контроля вредителей, если трансгенное растение содержит первый белок Cry по настоящему изобретению.
[00172] В некоторых вариантах осуществления второе средство для контроля вредителей может представлять собой средство, выбранное из группы, состоящей из химического пестицида, инсектицидного белка Bacillus thuringiensis (Bt), инсектицидного белка Xenorhabdus, инсектицидного белка Photorhabdus, инсектицидного белка Brevibacillus laterosporus, инсектицидного белка Bacillus sphaericus, ингибиторов протеаз (как сериновых, так и цистеиновых типов), пектинов, альфа-амилазы, пероксидазы и холестериноксидазы.
[00173] В других вариантах осуществления второе средство для контроля вредителей представляет собой химический пестицид, выбранный из группы, состоящей из пиретроидов, карбаматов, неоникотиноидов, блокаторов натриевых каналов нейронов, инсектицидных макроциклических лактонов, антагонистов гамма-аминомасляной кислоты (GABA), инсектицидных мочевин и миметиков ювенильного гормона. В другом варианте осуществления химический пестицид выбран из группы, состоящей из абамектина, ацефата, ацетамиприда, амидофлумета (S-1955), авермектина, азадирахтина, азинфос-метила, бифентрина, бинфеназата, бупрофезина, карбофурана, хлорфенапира, хлорфлуазурона, хлорпирифоса, хлорпирифос-метила, хромафенозида, клотианидина, цифлутрина, бета-цифлутрина, цигалотрина, лямбда-цигалотрина, циперметрина, циромазина, дельтаметрина, диафентиурона, диазинона, дифлубензурона, диметоата, диофенолана, эмамектина, эндосульфана, эсфенвалерата, этипрола, фенотикарба, феноксикарба, фенпропатрина, фенпроксимата, фенвалерата, фипронила, флоникамида, флуцитрината, тау-флювалината, флуфенерима (UR-50701), флуфеноксурона, фонофоса, галофенозида, гексафлумурона, имидаклоприда, индоксакарба, изофенфоса, луфенурона, малатиона, метальдегида, метамидофоса, метидатиона, метомила, метопрена, метоксихлора, монокротофоса, метоксифенозида, нитиазина, новалурона, новифлумурона (XDE-007), оксамила, паратиона, паратион-метила, перметрина, фората, фозалона, фосмета, фосфамидона, пиримикарба, профенофоса, пиметрозина, пиридалила, пирипроксифена, ротенона, спиносада, спиромезифена (BSN 2060), сульпрофоса, тебуфенозида, тефлубензурона, тефлутрина, тербуфоса, тетрахлорвинфоса, тиаклоприда, тиаметоксама, тиодикарба, тиосултап-натрия, тралометрина, трихлорфона и трифлумурона, алдикарба, оксамила, фенамифоса, амитраза, хинометионата, хлоробензилата, цигексатина, дикофола, диенохлора, этоксазола, феназаквина, оксида фенбутатина, фенпропатрина, фенпироксимата, гекситиазокса, пропаргита, пиридабена и тебуфенпирада. В другом варианте осуществления химический пестицид выбран из группы, состоящей из циперметрина, цигалотрина, цифлутрина и бета-цифлутрина, эсфенвалерата, фенвалерата, тралометрина, фенотикарба, метомила, оксамила, тиодикарба, клотианидина, имидаклоприда, тиаклоприда, индоксакарба, спиносада, абамектина, авермектина, эмамектина, эндосульфана, этипрола, фипронила, флуфеноксурона, трифлумурона, диофенолана, пирипроксифена, пиметрозина и амитраза.
[00174] В дополнительных вариантах осуществления второе средство для контроля вредителей может представлять собой один или несколько из любого числа инсектицидных белков Bacillus thuringiensis, в том числе без ограничения белок Cry, вегетативный инсектицидный белок (VIP) и инсектицидные химерные варианты любого из перечисленных выше инсектицидных белков. В других вариантах осуществления второе средство для контроля вредителей представляет собой белок Cry, выбранный из группы, состоящей из Cry1Aa, Cry1Ab, Cry1Ac, Cry1Ad, Cry1Ae, Cry1Af, Cry1Ag, Cry1Ah, Cry1Ai, Cry1Aj, Cry1Ba, Cry1Bb, Cry1Bc, Cry1Bd, Cry1Be, Cry1Bf, Cry1Bg, Cry1Bh, Cry1Bi, Cry1Ca, Cry1Cb, Cry1Da, Cry1Db, Cry1Dc, Cry1Dd, Cry1Ea, Cry1Eb, Cry1Fa, Cry1Fb, Cry1Ga, Cry1Gb, CryGc, Cry1Ha, Cry1Hb, Cry1Hc, Cry1Ia, Cry1Ib, Cry1Ic, Cry1Id, Cry1Ie, Cry1If, Cry1Ig, Cry1Ja, Cry1Jb, Cry1Jc, Cry1Jd, Cry1Ka, Cry1La, Cry1Ma, Cry1Na, Cry1Nb, Cry2Aa, Cry2Ab, Cry2Ac, Cry2Ad, Cry2Ae, Cry2Af, Cry2Ag, Cry2Ah, Cry2Ai, Cry2Aj, Cry2Ak,Cry2Al, Cry2Ba, Cry3Aa, Cry3Ba, Cry3Bb, Cry3Ca, Cry4Aa, Cry4Ba, Cry4Ca, Cry4Cb, Cry4Cc, Cry5Aa, Cry5Ab, Cry5Ac, Cry5Ad, Cry5Ba, Cry5Ca, Cry5Da, Cry5Ea, Cry6Aa, Cry6Ba, Cry7Aa, Cry7Ab, Cry7Ac, Cry7Ba, Cry7Bb, Cry7Ca, Cry7Cb, Cry7Da, Cry7Ea, Cry7Fa, Cry7Fb, Cry7Ga, Cry7Gb, Cry7Gc, Cry7Gd, Cry7Ha, Cry7Ia, Cry7Ja, Cry7Ka, Cry7Kb, Cry7La, Cry8Aa, Cry8Ab, Cry8Ac, Cry8Ad, Cry8Ba, Cry8Bb, Cry8Bc, Cry8Ca, Cry8Da, Cry8Db, Cry8Ea, Cry8Fa, Cry8Ga, Cry8Ha, Cry8Ia, Cry8Ib, Cry8Ja, Cry8Ka, Cry8Kb, Cry8La, Cry8Ma, Cry8Na, Cry8Pa, Cry8Qa, Cry8Ra, Cry8Sa, Cry8Ta, Cry9Aa, Cry9Ba, Cry9Bb, Cry9Ca, Cry9Da, Cry9Db, Cry9Dc, Cry9Ea, Cry9Eb, Cry9Ec, Cry9Ed, Cry9Ee, Cry9Fa, Cry9Ga, Cry10Aa, Cry11Aa, Cry11Ba, Cry11Bb, Cry12Aa,Cry13Aa, Cry14Aa, Cry14Ab, Cry15Aa, Cry16Aa, Cry17Aa, Cry18Aa, Cry18Ba, Cry18Ca, Cry19Aa, Cry19Ba, Cry19Ca, Cry20Aa, Cry20Ba, Cry21Aa, Cry21Ba, Cry21Ca, Cry21Da, Cry21Ea, Cry21Fa, Cry21Ga, Cry21Ha, Cry22Aa, Cry22Ab, Cry22Ba, Cry22Bb, Cry23Aa, Cry24Aa, Cry24Ba, Cry24Ca, Cry25Aa, Cry26Aa, Cry27Aa, Cry28Aa, Cry29Aa, Cry29Ba, Cry30Aa, Cry30Ba, Cry30Ca, Cry30Da, Cry30Db, Cry30Ea, Cry30Fa, Cry30Ga,Cry31Aa, Cry31Ab, Cry31Ac, Cry31Ad, Cry32Aa, Cry32Ab, Cry32Ba, Cry32Ca, Cry32Cb, Cry32Da, Cry32Ea, Cry32Eb, Cry32Fa, Cry32Ga, Cry32Ha, Cry32Hb, Cry32Ia, Cry32Ja, Cry32Ka, Cry32La, Cry32Ma, Cry32Mb, Cry32Na, Cry32Oa, Cry32Pa, Cry32Qa, Cry32Ra, Cry32Sa, Cry32Ta, Cry32Ua, Cry33Aa, Cry34Aa, Cry34Ab, Cry34Ac, Cry34Ba, Cry35Aa, Cry35Ab, Cry35Ac, Cry35Ba, Cry36Aa, Cry37Aa, Cry38Aa, Cry39Aa, Cry40Aa, Cry40Ba, Cry40Ca, Cry40Da, Cry41Aa, Cry41Ab, Cry41Ba, Cry42Aa, Cry43Aa, Cry43Ba, Cry43Ca, Cry43Cb, Cry43Cc, Cry44Aa, Cry45Aa, Cry46Aa Cry46Ab, Cry47Aa, Cry48Aa, Cry48Ab, Cry49Aa, Cry49Ab, Cry50Aa, Cry50Ba, Cry51Aa, Cry52Aa, Cry52Ba, Cry53Aa, Cry53Ab, Cry54Aa, Cry54Ab, Cry54Ba, Cry55Aa, Cry56Aa, Cry57Aa, Cry57Ab, Cry58Aa, Cry59Aa, Cry59Ba, Cry60Aa, Cry60Ba, Cry61Aa, Cry62Aa, Cry63Aa, Cry64Aa, Cry65Aa, Cry66Aa, Cry67Aa, Cry68Aa, Cry69Aa, Cry69Ab, Cry70Aa, Cry70Ba, Cry70Bb, Cry71Aa, Cry72Aa и Cry73Aa.
[00175] В дополнительных вариантах осуществления второе средство для контроля вредителей представляет собой вегетативный инсектицидный белок Vip3, выбранный из группы, состоящей из Vip3Aa1, Vip3Aa2, Vip3Aa3, Vip3Aa4, Vip3Aa5, Vip3Aa6, Vip3Aa7, Vip3Aa8, Vip3Aa9, Vip3Aa10, Vip3Aa11, Vip3Aa12, Vip3Aa13, Vip3Aa14, Vip3Aa15, Vip3Aa16, Vip3Aa17, Vip3Aa18, Vip3Aa19, Vip3Aa20, Vip3Aa21, Vip3Aa22, Vip3Aa2, Vip3Aa24, Vip3Aa25, Vip3Aa26, Vip3Aa27, Vip3Aa28, Vip3Aa29, Vip3Aa30, Vip3Aa31, Vip3Aa32, Vip3Aa33, Vip3Aa34, Vip3Aa35, Vip3Aa36, Vip3Aa37, Vip3Aa38, Vip3Aa39, Vip3Aa40, Vip3Aa41, Vip3Aa42, Vip3Aa43, Vip3Aa44, Vip3Ab1, Vip3Ab2, Vip3Ac1, Vip3Ad1, Vip3Aa2, Vip3Ae1, Vip3Af1, Vip3Af2, Vip3Af3, Vip3Ag1, Vip3Ag2, Vip3Ag3 HM117633, Vip3Ag4, Vip3Ag5, Vip3Ah1, Vip3Ba1, Vip3Ba2, Vip3Bb1, Vip3Bb2 и Vip3Bb3.
[00176] В еще одних вариантах осуществления первый белок Cry по настоящему изобретению и второе средство для контроля вредителей коэкспрессируются в трансгенном растении. Такой коэкспрессии нескольких пестицидных компонентов в одном и том же трансгенном растении можно достигнуть путем получения растения, содержащего и экспрессирующего все необходимые гены, с помощью методов генной инженерии. В качестве альтернативы растение, родитель 1, может быть получено с помощью методов генной инженерии для экспрессии белка Cry по настоящему изобретению. Второе растение, родитель 2, может быть получено с помощью методов генной инженерии для экспрессии второго средства для контроля вредителей. Путем скрещивания родителя 1 с родителем 2 получают растений-потомков, которые экспрессируют все гены, введенные в родителей 1 и 2.
[00177] В дополнительных вариантах осуществления предусмотрен способ получения белка, токсичного по меньшей мере для совки-ипсилон (Agrotis ipsilon), при этом способ включает культивирование трансгенной клетки-хозяина, отличной от клетки человека, которая содержит полинуклеотид, или химерный ген, или молекулу нуклеиновой кислоты, или рекомбинантный вектор по настоящему изобретению, в условиях, при которых хозяин продуцирует белок, токсичный по меньшей мере для совки-ипсилон (Agrotis ipsilon). В некоторых вариантах осуществления трансгенная клетка-хозяин, отличная от клетки человека, представляет собой растительную клетку. В одном варианте осуществления растительная клетка представляет собой клетку маиса. В других вариантах осуществления условия, при которых выращивают растительную клетку или клетку маиса, включают естественный солнечный свет. В других вариантах осуществления трансгенная клетка-хозяин, отличная от клетки человека, представляет собой бактериальную клетку. В еще одних вариантах осуществления трансгенная клетка-хозяин, отличная от клетки человека, представляет собой дрожжевую клетку.
[00178] В других вариантах осуществления продуцируемый белок обладает инсектицидной активностью в отношении по меньшей мере одного дополнительного насекомого, при этом дополнительное насекомое выбрано из группы, состоящей из кукурузного мотылька (Ostrinia nubilalis), совки травяной (Spodoptera frugiperda), американской кукурузной совки (Helicoverpa zea), огневки тростниковой (Diatraea saccharalis), гусеницы совки бархатных бобов (Anticarsia gemmatalis), соевой совки (Chrysodeixis includes), огневки кукурузной юго-западной (Diatraea grandiosella), западной бобовой совки (Richia albicosta), табачной совки (Heliothis virescens), восточного кукурузного мотылька (Ostrinia furnacalis), хлопковой совки (Helicoverpa armigera), огневки желтой рисовой (Chilo suppressalis), розовой стеблевой совки (Sesamia calamistis) или огневки рисовой (Cnaphalocrocis medinalis) и любой их комбинации.
[00179] В других вариантах осуществления химерный ген содержит любую из SEQ ID NO: 1-4. В еще одних вариантах осуществления продуцируемый белок содержит аминокислотную последовательность под любой из SEQ ID NO: 13-16.
[00180] В некоторых вариантах осуществления химерный ген содержит нуклеотидную последовательность, кодон-оптимизированную для экспрессии в растении. В других вариантах осуществления химерный ген содержит любую из SEQ ID NO: 5-12. В дополнительных вариантах осуществления продуцируемый белок содержит аминокислотную последовательность под любой из SEQ ID NO: 13-20.
[00181] В дополнительных вариантах осуществления настоящего изобретения предусмотрен способ получения устойчивого к вредителям (например, устойчивого к насекомым) трансгенного растения, включающий введение в растение полинуклеотида, химерного гена, рекомбинантного вектора, кассеты экспрессии или молекулы нуклеиновой кислоты по настоящему изобретению, содержащих нуклеотидную последовательность, которая кодирует белок Cry по настоящему изобретению, где нуклеотидная последовательность экспрессируется в растении, за счет чего растению придается устойчивость по меньшей мере к кукурузному мотыльку, и получение устойчивого к вредителям (например, устойчивого к насекомым) трансгенного растения. В некоторых вариантах осуществления устойчивое к вредителям трансгенное растение является устойчивым к по меньшей мере совке-ипсилон (Agrotis ipsilon) в сравнении с контрольным растением, у которого отсутствует полинуклеотид, химерный ген, рекомбинантный вектор, кассета экспрессии или молекула нуклеиновой кислоты по настоящему изобретению. В некоторых вариантах осуществления введение достигается путем трансформации растения. В других вариантах осуществления введение достигается путем скрещивания первого растения, содержащего химерный ген, рекомбинантный вектор, кассету экспрессии или молекулу нуклеиновой кислоты по настоящему изобретению, с отличающимся вторым растением.
[00182] В некоторых вариантах осуществления трансгенное растение по настоящему изобретению, устойчивое к по меньшей мере совке-ипсилон (Agrotis ipsilon), дополнительно является устойчивым к одному дополнительному насекомому, где дополнительное насекомое включает без ограничения кукурузного мотылька (Ostrinia nubilalis), совку травяную (Spodoptera frugiperda), американскую кукурузную совку (Helicoverpa zea), огневку тростниковую (Diatraea saccharalis), гусеницу совки бархатных бобов (Anticarsia gemmatalis), соевую совку (Chrysodeixis includes), огневку кукурузную юго-западную (Diatraea grandiosella), западную бобовую совку (Richia albicosta), табачную совку (Heliothis virescens), восточного кукурузного мотылька (Ostrinia furnacalis), хлопковую совку (Helicoverpa armigera), огневку желтую рисовую (Chilo suppressalis), розовую стеблевую совку (Sesamia calamistis) или огневку рисовую (Cnaphalocrocis medinalis) и любую их комбинацию.
[00183] В дополнительных вариантах осуществления предусмотрен способ контроля по меньшей мере насекомых, представляющих собой совку-ипсилон (Agrotis ipsilon), при этом способ включает доставку в насекомых эффективного количества белка Cry по настоящему изобретению. Для эффективного воздействия белок Cry вначале попадает в насекомое пероральным путем. Однако белок Cry может доставляться в насекомое с помощью многих известных способов. Способы доставки белка в насекомое пероральным путем включают без ограничения обеспечение белка (1) в трансгенном растении, при этом насекомое съедает (поглощает) одну или несколько частей трансгенного растения, поглощая тем самым полипептид, экспрессируемый в трансгенном растении; (2) в составленной белковой композиции(ях), которую можно наносить, например, на питательную среду насекомых или включать в ее состав; (3) в белковой композиции(ях), которую можно наносить на поверхность, например, путем опрыскивания поверхности части растения, и которая затем заглатывается насекомым в силу того, что насекомое съедает одну или несколько подвергнутых опрыскиванию частей растения; (4) в матрице приманки; (5) путем инъекции в насекомое; или (6) с помощью любой другой известной из уровня техники системы доставки белков. Таким образом, для доставки токсичных белков Cry по настоящему изобретению можно применять любой способ пероральной доставки в насекомое. В некоторых конкретных вариантах осуществления белок Cry по настоящему изобретению доставляют в насекомое пероральным путем, при этом насекомое поедает одну или несколько частей трансгенного растения.
[00184] В других вариантах осуществления белок Cry по настоящему изобретению доставляют в насекомое пероральным путем, при этом насекомое поедает одну или несколько частей растения, подвергнутых опрыскиванию композицией, содержащей белки Cry по настоящему изобретению. Доставку композиций по настоящему изобретению на поверхность растения можно осуществлять с помощью любого способа нанесения соединений, композиций, составов и т.п. на поверхности растений, известного специалистам в данной области. Некоторые неограничивающие примеры доставки на растение или его часть или приведения в контакт с ними включают опрыскивание, опыливание, посыпание, распыление, орошение туманом, мелкодисперсное разбрызгивание, разбрасывание, пропитывание, впрыскивание в почву, введение в почву, смачивание (например, обработку корней, почвы), погружение, полив, нанесение покрытия, впитывание в листья или стебли, внесение в междурядья или обработку семян и т.п. и их комбинации. Эти и другие процедуры приведения растения или его части в контакт с соединением(ями), композицией(ями) или составом(ами) хорошо известны специалистам в данной области.
[00185] В некоторых вариантах осуществления настоящее изобретение охватывает способ предоставления фермеру средств для контроля чешуекрылых насекомых-вредителей, при этом способ включает поставку и продажу фермеру растительного материала, такого как семя, при этом растительный материал содержит полинуклеотид, химерный ген, кассету экспрессии или рекомбинантный вектор, способные экспрессировать белок Cry по настоящему изобретению, как описано выше.
[00186] Варианты осуществления настоящего изобретения можно лучше понять со ссылкой на следующие примеры. Предполагается, что предыдущее и последующее описание вариантов осуществления настоящего изобретения и различные варианты осуществления не ограничивают формулу изобретения, а скорее иллюстрируют ее. Таким образом, будет понятно, что формула изобретения не ограничивается конкретными подробностями данных примеров. Специалистам в данной области будет понятно, что другие варианты осуществления настоящего изобретения могут быть осуществлены на практике без отклонения от сущности и объема данного раскрытия, объем которого определяется прилагаемой формулой изобретения.
ПРИМЕРЫ
Пример 1. Идентификация активных штаммов Bt
[00187] Изоляты Bacillus thuringiensis культивировали из спор, присутствующих в текущих коллекциях, и поддерживали на чашках с и Т3 + агаром с добавлением пенициллина. Каждый изолят выращивали в аэробных условиях в 24-луночных планшетах с глубокими лунками в течение приблизительно 10 дней при 28°С до споруляции, которую подтверждали с помощью окрашивания раствором кумасси синего/уксусной кислоты и визуализации с помощью микроскопа. После споруляции как растворимые, так и нерастворимые фракции тестировали, чтобы определить активность в отношении представляющих интерес видов чешуекрылых. Фракции тестировали в биологическом анализе контаминации поверхности, при котором фракциями покрывали искусственную питательную среду для культивирования множества видов. Каждый изолят подвергали скринингу в отношении по меньшей мере четырех видов чешуекрылых, в том числе Helicoverpa zea (американская кукурузная совка), Agrotis ipsilon (совка-ипсилон), Ostrinia nubilalis (кукурузный мотылек) и Spodoptera frugiperda (совка травяная), при размере выборки 12 новорожденных личинок. Продолжительность каждого анализа составляла приблизительно 7 дней при комнатной температуре; планшеты оценивали в отношении смертности, а также ингибирования роста личинок. Наблюдаемое повышение смертности на 30% по сравнению с отрицательным контролем считалось показателем активности. На основе результатов первичного тестирования на насекомых для дальнейшего анализа отобрали штаммы С0633, С2080, М0262 и М1455.
Пример 2. Выделение и секвенирование генов Bt
[00188] Конструирование фосмидной геномной библиотеки: Для некоторых штаммов Bt, идентифицированных в примере 1, гены, кодирующие предположительно активные белки, выделяли с применением способа фосмидной библиотеки, описанного в Park et al. (FEMS Microbiol. Lett. 284: 28-34 (2008). Фосмидную библиотеку конструировали с применением набора для получения фосмидных библиотек CopyControl™ (Epicentre, Мэдисон, Висконсин) согласно протоколу производителя. Вкратце, очищенную ДНК из каждого штамма Bt (примерно 0,5 мкг) обрабатывали ферментами для репарации концов с образованием "тупых" концов и затем лигировали в фосмидный вектор pCC1FOS (Epicentre). После упаковки in vitro в фаги лямбда и инфицирования Escherichia coli (Е. coli) EPI1300-T1® бактериальные клетки высевали на среду Лурия-Бертани (LB), содержащую 12,5 мкг/мл хлорамфеникола. До отбора колоний планшеты инкубировали при приблизительно 37°С в течение 24 ч. Трансфицированные колонии Е. coli переносили в 96-луночные планшеты, содержащие 150 мкл LB-среды, содержащей хлорамфеникол, и инкубировали при 37°С в течение 24 ч.
[00189] Скрининг колоний с помощью гибридизации: Фосмидную библиотеку высевали при плотности 300 КОЕ на 100×15 мм чашку с L-агаром и 15 мкг/мл хлорамфеникола. В общей сложности высевали 3000 бактерий с фосмидами. Гибридизации на фильтре осуществляли с применением фильтров в виде кружков Immobilon-Ny+ размером 87 мм (EMD Millipore, Биллерика, Массачусетс). Перенос колоний выполняли следующим образом: фильтры помещали на чашки приблизительно на 5 мин., затем с помощью пинцета фильтры снимали с поверхности агара и помещали стороной с колониями кверху на фильтровальную бумагу Ватмана, пропитанную 0,5 М NaOH, на 5 мин. Затем фильтры с колониями помещали на фильтровальную бумагу Ватмана, пропитанную 2Х SSC, на 5 мин. ДНК иммобилизировали на мембране с применением UV Stratalinker®, установленного на 2000×100 мДж (Stratagene, Inc., Ла-Хойя, Калифорния). Затем фильтры сушили на воздухе на фильтровальной бумаге Ватмана. Фильтры подвергали предварительной гибридизации и гибридизации в 250 мМ NaPO4, рН 7,0, 7% SDS, 1% BSA при 65°С согласно описанию поставщика. Гибридизационные фильтры промывали в 2Х SSC, 0,5% SDS в течение 30 мин. при 65°С, затем в 0,2Х SSC, 0,2% SDS в течение 30 мин. при 65°С. Фильтры экспонировали на рентгеновскую пленку (Kodak® BIOMAX® XAR, Fisher Scientific, Питтсбург, Пенсильвания) в течение ночи с применением усиливающих экранов при -80°С. Положительные колонии переносили на L-агар с 15 мкг/мл хлорамфеникола.
[00190] Гибридизационные зонды: Конструировали ПЦР-праймеры для амплификации фрагмента cry9B-подобного гена размером 720 п. о. из геномной ДНК штамма Bt, обозначенного как С0633. Пара праймеров включала прямой праймер, обозначенный OAR2613a, имеющий последовательность AAACATGAACCGAAATAATCAAAATG (SEQ ID NO: 21), и обратный праймер, обозначенный OAR2615a, имеющий последовательность ATCCGTCCCTTGTGCGTGTAAA (SEQ ID NO: 22). ПЦР-реакцию проводили при следующих условиях проведения циклов: [94°С, 5 мин.], 12х [94°С, 30 с, от 57°С до 51°С, снижение на 0,5°С в каждом цикле, 30 с, 72°С, 2,5 мин.] и 35х[94°С, 30 с, 52°С, 30 с, 72°С, 2,5 мин.]. Реакционная смесь содержала 1X буфер One Taq® (New England Biolabs, Беверли, Массачусетс), 200 мкМ dNTP, 80 нг ДНК, 2,5 ед. ДНК-полимеразы One Taq®, по 50 нг каждого праймера и стерильную дистиллированную воду, доводящую общий объем реакционной смеси до 50 мкл.
[00191] Полученный ампликон отделяли на 1% агарозном геле с ТАЕ, содержащем бромистый этидий. Ампликон визуализировали под УФ-светом и вырезали из геля. ДНК выделяли с применением набора для экстракции из геля согласно описанию поставщика (Qiagen, Валенсия, Калифорния). Зонды метили с помощью Easy Tide (
[00192] Секвенирование генов Bt: Препараты ДНК для 2-4 независимых клонов готовили в соответствии с инструкциями производителя (Qiagen). Реакции секвенирования с праймерами, сконструированными к двум нитям прогнозируемой представляющей интерес нуклеотидной последовательности, осуществляли с применением набора BigDye™ Terminator (Applied Biosystems, Фостер Сити, Калифорния) в соответствии с инструкциями производителя. Продукты реакции подвергали электрофоретическому разделению на приборах для секвенирования ABI373 или ABI377. Все данные секвенирования анализировали с применением пакета программного обеспечения Phred/Phrap/Consed (Вашингтонский университет) с частотой ошибок, равной или меньше 10-4, на уровне консенсусной последовательности. Последовательность собирали с помощью программы Sequencher™ (версия 4.7, Gene Codes Corp., Энн-Арбор, Мичиган). Каждый ген секвенировали с 4Х перекрыванием.
Пример 3. Клонирование и синтез генов Bt
[00193] Конструировали пары Cry9-специфических праймеров для облегчения идентификации и клонирования генов типа cry9. Пары праймеров конструировали для гибридизации с 5'-концом гена типа cry9 с добавлением сайта рестрикции для PmeI и с 3'-концом с добавлением сайта рестрикции для AscI. Пара праймеров, применяемая для амплификации 5'-конца, включала прямой праймер, имеющий последовательность GTTTAAACATGAATCGAAATAATCAAAATG (SEQ ID NO: 23), и обратный праймер, имеющий последовательность GGCGCGCCCTACTCTTGTGTTTCAATAAA (SEQ ID NO: 24). Пара праймеров, применяемая для амплификации 3'-конца, включала прямой праймер, имеющий последовательность GTTTAAACATGAATCAAAATAAACACGGA (SEQ ID NO: 25), и обратный праймер, имеющий последовательность GGCGCGCCTTACTGTTGGGTTTCCATGAACT (SEQ ID NO: 26). Вставленные сайты рестрикции подчеркнуты в соответствующих праймерах. ПЦР-реакции осуществляли с применением следующих условий проведения циклов: [94°С, 5 мин.] и 30х [94°С, 30 с, 45°С, 30 с, 72°С, 3,5 мин.]. Реакционная смесь содержала 1X буфер OneTaq, 200 мкМ dNTP, 80 нг ДНК, 2,5 ед. ДНК-полимеразы One Taq (New England Biolabs), no 50 нг каждого праймера и стерильную дистиллированную воду, доводящую общий объем реакционной смеси до 50 мкл.
[00194] Полученный ампликон клонировали в вектор ТОРО pCR 4.0 согласно описанию поставщика (Life Technologies). Выделенную плазмидную ДНК расщепляли с применением PmeI и AscI согласно описанию поставщика (New England Biolabs).
[00195] Фрагмент PmeI/AscI клонировали в челночный вектор, обозначенный pCIB5634' сконструированный для экспрессии как в Е. coli,, так и в В. thuringiensis. Вектор pCIB5634' расщепляли с применением PmeI и AscI. Расщепленный вектор и фрагмент гена очищали путем прогона на 1% агарозном геле на основе буфера, содержащего трис-ацетат-EDTA. Фрагменты вырезали из геля и очищали с применением набора для экстракции из геля от QIAGEN согласно описанию поставщика. Фрагменты лигировали вместе с применением набора для лигирования от New England Biolabs согласно описанию поставщика. Продукты реакции лигирования трансформировали в клетки ТОР10 (Life Technologies) согласно описанию поставщика и высевали их на L-агар, содержащий 100 мг/мл ампициллина. Плазмидную ДНК выделяли из отдельной колонии и идентифицированный клон снова секвенировали с 2Х перекрыванием с целью подтверждения правильной последовательности.
[00196] Некоторые гены Bt, которые были отобраны для рекомбинантной продукции, но не были напрямую клонированы из геномной ДНК, были переданы сторонним подрядчикам для синтеза полного гена. Эти синтезированные гены Bt субклонировали в описанные выше челночные векторы для последующей экспрессии и дальнейшего тестирования биологической активности.
Пример 4. Сборка и анализ генома
[00197] Некоторые гены Bt по настоящему изобретению идентифицировали с применением подхода на основе секвенирования полного генома. Вкратце, ДНК Bacillus разрезали с помощью ультразвукового прибора S2 от Covaris (Covaris, Inc., Вобурн, Массачусетс) с применением программы DNA_400bp с такими установками: рабочий режим: 10%; интенсивность: 4; циклы/импульс: 200. ДНК обрабатывали с помощью модуля для репарации концов/добавления dA-хвоста NEBNext® Ultra™ (New England Biolabs, Inc. Ипсвич, Массачусетс). Индексные адаптеры 1-57 от Biooscience (1-27 Бразилия, 28-57 США, Великобритания и Швейцария) лигировали с применением NEB Quick Ligation™ согласно описанию поставщика (New England Biolabs, Inc. Ипсвич, Массачусетс). Продукты лигирования очищали с применением гранул Agencourt AMPure XP согласно описанию поставщика (Beckman Coulter, Inc., Индианаполис, Индиана).
[00198] Библиотеку разделяли на фракции по размеру следующим образом: 50 мкл образца смешивали с 45 мкл 75% смеси гранул (25% гранул AMPure и 75% раствора NaCl/PEG от TekNova, № по кат. Р4136). Смесь перемешивали и помещали на магнитную подставку. Полученный супернатант переносили в новую лунку и добавляли 45 мкл 50% смеси гранул (50% гранул AMPure и 50% раствора NaCl/PEG от TekNova, № по кат. Р4136). Данную смесь перемешивали и помещали на магнитную подставку. Полученный супернатант удаляли и гранулы промывали 80% этанолом. Добавляли 25 мкл элюирующего буфера (ЕВ) и смесь помещали на магнитную подставку. Полученный конечный супернатант удаляли и помещали в пробирку на 1,5 мл. Этот способ позволяет получать библиотеки с диапазоном размеров ДНК 525 пар оснований (п. о.) (вставка плюс адаптер).
[00199] Отсортированную по размеру ДНК-библиотеку амплифицировали с применением KAPA Biosystem HiFi Hot Start (Kapa Biosystems, Inc., Уилмингтон, Массачусетс) с применением следующих условий проведения циклов: [98°С, 45 с]; 12 х [98°С, 15 с, 60°С, 30 с, 72°С, 30 с]; [72°С, 1 мин.]. Каждая реакционная смесь содержала: 5 мкл ДНК-библиотеки, 1 мкл универсальных праймеров от Bioscience (25 мкМ), 18 мкл стерильной воды, 1 мкл индексированных праймеров от Bioscience (25 мкМ), 25 мкл 2Х полимеразы KAPA HiFi.
[00200] Библиотеки анализировали на биоанализаторе Agilent 2100 (Agilent Technologies, Санта-Клара, Калифорния) с применением высокочувствительных чипов для определения диапазона размеров и среднего размера вставок в библиотеке. Все библиотеки подвергали секвенированию спаренных концов (РЕ) (100 циклов на рид; 12-24 библиотек на дорожку) в системе секвенирования HiSeq 2500 с применением стандартных протоколов секвенирования от производителя (Illumina, Inc., Сан-Диего, Калифорния).
[00201] Разрабатывали инструмент для проведения расчетов в отношении Bacillus, чтобы идентифицировать и охарактеризовать вероятные гены токсинов для расстановки приоритетов в отношении направлений дополнительных лабораторных тестов.
[00202] Сборка и анализ генома, а также анализ геномной библиотеки, описанный выше, привели к идентификации в штаммах Bacillus thuringiensis четырех Cry9-подобных генов, проявляющих токсичность в отношении по меньшей мере совки-ипсилон (Agrotis ipsilon). Идентификационные характеристики Сгу9-подобных генов и белков приведены в таблице 1.

Пример 5. Гомология ВТ0044, ВТ0051, ВТ0068 и ВТ0128 с известными белками CryBt
[00203] Поиск по базам данных белков с применением аминокислотных последовательностей белков по настоящему изобретению показал, что они являются гомологичными известным инсектицидным белкам. Сравнение аминокислотных последовательностей белков по настоящему изобретению с неизбыточной (nr) базой данных, поддерживаемой NCBI, с применением алгоритма BLAST позволило выявить следующие белки, как характеризующиеся совокупностью аминокислот с самыми высокими значениями идентичности относительно последовательностей по настоящему изобретению (таблица 2).
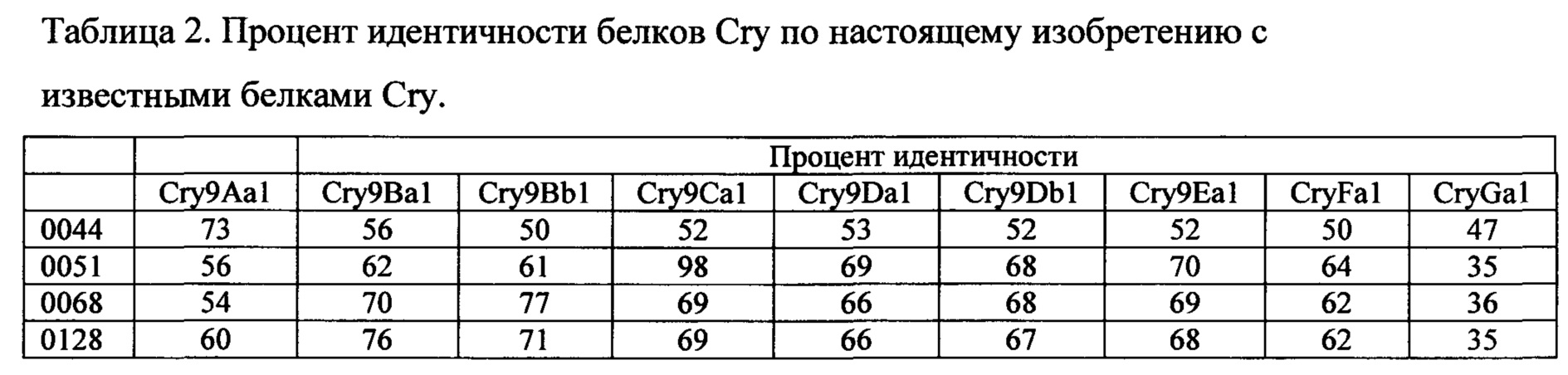
Пример 6. Экспрессия белков Bt в рекомбинантных клетках-хозяевах
[00204] Экспрессия в Bacillus. Представляющие интерес гены экспрессировали в не образующем кристаллы штамме Bacillus, который не характеризовался активностью в отношении жесткокрылых или чешуекрылых, с помощью вектора экспрессии pCIB5634' описанного выше, который содержал соответствующий промотор гена белка Cry и маркер устойчивости к эритромицину. Конструкции трансформировали в штамм-хозяин посредством электропорации и проводили последующий отбор на чашках с агаром, содержащим эритромицин. Эти рекомбинантные штаммы выращивали до фазы споруляции на среде Т3 при 28°С в течение 4-5 дней. Клеточные осадки собирали и промывали несколько раз перед солюбилизацией в карбонатном буфере с высоким рН (50 мМ), содержащем 2 мМ DTT.
[00205] Экспрессия в Е. coli. Представляющие интерес гены экспрессировали в различных штаммах Е. coli с применением векторов рЕТ28а или рЕТ29а (EMD Millipore). Конструкции трансформировали посредством электропорации и проводили последующий отбор на чашках с агаром, содержащим канамицин. Эти рекомбинантные штаммы выращивали, а экспрессию индуцировали с применением индукции с помощью IPTG при 28°С. Клетки ресуспендировали в карбонатном буфере с высоким рН (50 мМ), содержащем 2 мМ DTT, а затем разрушали с применением гомогенизатора Microfluidics LV-1.
[00206] Анализ экспрессии. Полученные лизаты клеток (каждого хозяина) затем очищали путем центрифугирования и образцы анализировали в отношении чистоты с помощью SDS-PAGE и электрофореграммы (BioRad Experion). Концентрации общего белка определяли с помощью анализа по Брэдфорду или Thermo 660. Очищенные белки Cry затем тестировали в биологических анализах.
Пример 7. Активность белков Cry в биологических анализах
[00207] Белки, полученные в примере 6, тестировали с применением известного из уровня техники биологического анализа с использованием искусственной питательной среды в отношении одного или нескольких следующих видов насекомых-вредителей: совка травяная (FAW; Spodoptera frugiperda), американская кукурузная совка (CEW; Helicoverpa zea), кукурузный мотылек (ЕСВ; Ostrinia nubilalis), совка-ипсилон (BCW; Agrotis ipsilon), огневка тростниковая (SCB; Diatraea saccharlis), гусеница совки бархатных бобов (VBC; Anticarsia gemmatalis), соевая совка (SBL; Pseudoplusia includens), огневка кукурузная юго-западная (SWCB; Diatraea grandiosella), западная бобовая совка (WBCW; Striacosta albicosta), табачная совка (TBW; Heliothis virescens), восточный кукурузный мотылек (АСВ; Ostrinia furnacalis), хлопковая совка (CBW; Helicoverpa armigera), огневка желтая рисовая (SSB; Chilo suppressalis), розовая стеблевая совка (PSB; Sesamia inferens) и огневка рисовая (RLF; Cnaphalocrocis medinails).
[00208] Равное количество белка в виде раствора наносили на поверхность искусственной питательной среды для насекомых (Bioserv, Inc., Френчтаун, Нью-Джерси) в 24-луночных планшетах. После высыхания поверхности питательной среды в каждый планшет добавляли личинок видов насекомых, подлежащих тестированию. Планшеты запечатывали и выдерживали в окружающих условиях лаборатории с учетом температуры, освещения и относительной влажности. Группа положительного контроля состояла из личинок, подвергаемых воздействию очень активного штамма Bacillus дикого типа с широким спектром действия. Группы отрицательного контроля состояли из личинок, подвергаемых воздействию питательной среды для насекомых, обработанной только буферным раствором, и личинок на необработанной питательной среде для насекомых; то есть только на питательной среде. Смертность определяли через приблизительно 120 часов и оценивали в баллах в сравнении с контролями.
[00209] Результаты показаны в таблице 3, где "-" означает отсутствие активности в сравнении с контролем, "+/-" означает 0-10% активность в сравнении с контролем (эта категория также включала 0% смертность при сильном ингибировании роста личинок), "+" означает 10-25% активность в сравнении с контролем, "++" означает 25-75% активность в сравнении с контролем, а "+++" означает 75-100% активность в сравнении с контролем.
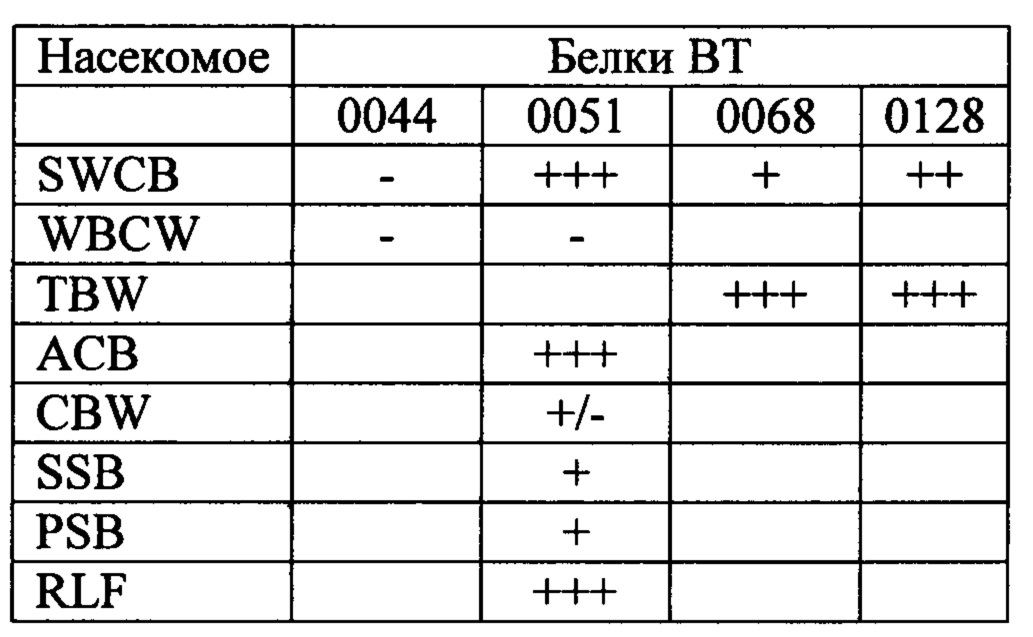
Пример 8. Преобразование белков Cry в анализе с использованием искусственного желудочного сока
[00210] Некоторые белки Cry уже экспрессировали в растениях, и семена таких растений ежегодно продаются фермерам для применения в контроле различных насекомых-вредителей. Такие самозащищенные пестицидные продукты рассматриваются и регистрируются различными регулирующими органами, включая, например. Агентство по охране окружающей среды США (ЕРА).
[00211] Воздействие при поступлении с пищей является основным путем, за счет которого люди могут подвергаться воздействию белков Cry, экспрессируемых трансгенными растениями. Острая пероральная токсичность для млекопитающих и переваримость белка являются конечными точками оценки риска для здоровья человека, определяемыми ЕРА. Дополнительными научными доказательствами безопасности белков Cry является то, что они, как было показано, быстро расщепляются in vitro под действием искусственного желудочного сока. Результаты семи исследований in vitro, проведенных с репрезентативными белками Cry1, Cry2 и Cry3, показали, что белки быстро расщепляются, как правило, в течение 30 секунд. Эти результаты подтверждают более широкий вывод о том, что члены этих групп белков Cry (которые обладают значительной идентичностью аминокислотных последовательностей), вероятно, быстро расщепляются после поедания человеком. Другая область рассмотрения заключается в определении того, могут ли белки Cry вызывать аллергическую реакцию. Продемонстрированное быстрое расщепление белков Cry in vitro должно сводить к минимуму возможность такого явления. Для сравнения, пищевые аллергены обычно не подвергаются распадению в in vitro модели желудочно-кишечного тракта, тогда как обычные белки пищи, для которых не показана аллергенность, быстро расщепляются в искусственном желудочном соке (Metcalfe et al., 1996).
[00212] Дополнительные понимание, касающееся потенциальной аллергенности белка, можно получить с помощью анализа переваримости белка в искусственном желудочном соке (SGF). Почти все белки Cry, экспрессируемые в трансгенных растениях, которые были протестированы на сегодняшний день, быстро переваривались и, следовательно, были определены как неаллергенные. Однако было обнаружено, что белок Cry9C, находящийся в продукте трансгенной кукурузы, известном как Starlink, является частично устойчивым к SGF. Хотя Cry9C Starlink не токсичен для животных, свойства частичной переваримости и частичной стабильности при обработке не позволили ЕРА абсолютно исключить возможность того, что белок Cry9C Starlink может действовать как пищевой аллерген, что в конечном счете привело к тому, что компания, которая разработала Starlink, отозвала продукты с рынка США.
[00213] В настоящее время не существует доказательных тестов для определения аллергенного потенциала новых белков. Таким образом, ЕРА применяет подход, основанный на совокупности доказательств, в котором рассматриваются следующие факторы: источник признака; сравнение аминокислотной последовательности с известными аллергенами и биохимические свойства белка, включая in vitro переваримость в искусственном желудочном соке (SGF) и степень гликозилирования.
[00214] С помощью анализа с использованием искусственного желудочного сока (SGF) измеряют in vitro переваримость тестируемого белка в строго контролируемых условиях, характерных для пищеварительного тракта высших млекопитающих. Вкратце, полученный в бактериях тестируемый белок Cry (в концентрации 0,5-5 мг/мл) подвергали воздействию фермента пепсина (из слизистой оболочки желудка свиньи, растворенного в 2 мг/мл NaCl, pH 1,2) в соотношении 10 единиц активности пепсина/мкг тестируемого белка в течение периода времени, составляющего один час, при 37°С. Образцы отбирали на 1, 2, 5, 10, 30 и 60 минуте и сразу же блокировали путем добавления предварительно нагретого (95°С - 2 минуты) стоп-буфера (65% 0,5 М бикарбоната натрия, pH 11, 35% трициновый загрузочный буфер) для немедленной инактивации пепсина, и снова нагревали в течение дополнительных 5 минут. После завершения анализа образцы, взятые в определенные моменты времени, и контроли (только тестируемый белок, только пепсин) исследовали с помощью SDS-PAGE в геле с 10-20% трис-глицина (при этом пептиды были визуально различимы вплоть до 1 кДа) для отслеживания кинетики и уровня переваривания, осуществляемого пепсином.
[00215] Результаты анализов с SGF продемонстрировали, что все белки Cry по настоящему изобретению расщеплялись очень быстро. Эти результаты предоставили доказательство того, что хотя белки Cry по настоящему изобретению относятся к семейству белков Cry9, они совершенно отличаются от них с точки зрения ответа в анализе с SGF при сравнении с некоторыми опубликованными результатами, например, касающимися Cry9C Starlink, что предполагает существенные структурные отличия в ключевых сайтах расщепления для пепсина в белке. Эти результаты дополнительно позволяют предположить, что аллергенный потенциал белков Cry по настоящему изобретению является минимальным.
Пример 9. Мутагенез ВТ-0051
[00216] Прогнозирование антигенных участков в белке является полезным для рационального подхода к синтезу пептидов, которые могут вызывать образование антител, реактивных в отношении интактного белка, и дифференцировать близкородственные белки. В этом примере аминокислотная последовательность нативного ВТ-0051 (SEQ ID NO: 6) была наложена на кристаллическую структуру белка Cry8Ea1 (номер доступа 3ЕВ7; Protein Databank во всемирной сети Интернет по адресу rcsb.org/pdb/; см. также Berman et al., 2000. Nuc. Acids Res. 28: 235-242), и антигенные участки, спрогнозированные с применением Vector NTI 8.0 (Thermo Fisher Scientific, Inc., Уолтгем, Массачусетс; см. также Welling et al. 1985. FEBS Lett. 188: 215-218) картировали на данной структуре. Отбор подходящего участка для мутагенеза состоял в выборе петлевых доменов в неконсервативных участках за пределами домена I. Петли, которые, как известно, были вовлечены в распознавание рецептора белка Cry, были исключены из отбора, как и любые остатки, которые, согласно прогнозу, вовлечены в активацию под действием протеазы. В результате остался один участок для мутагенеза, представленный аминокислотами 342-354 из SEQ ID NO: 6. Изменения L350I, N351Q и T354S были выбраны (SEQ ID NO: 18) исходя из ожидания, что они приведут к минимальному структурному изменению или функциональному изменению относительно нативного ВТ-0051. Такие изменения привели к образованию антигенного участка, который позволяет отличить мутантный ВТ-0051 (mBT-0051; SEQ ID NO: 18) от нативного ВТ-0051(SEQ ID NO: 14) и от других родственных белков Cry9.
Пример 10. Введение генов в вектор для экспрессии в растении
[00217] Перед экспрессией в растениях синтетический полинуклеотид, содержащий нуклеотидную последовательность, кодирующую каждый из белков Cry Bt, BT-0044, ВТ-0051, ВТ-0068 и ВТ-0128 (SEQ ID N0:5-8 соответственно), и синтетический полинуклеотид, содержащий нуклеотидную последовательность, кодирующую каждый из мутантных белков Cry Bt, mBT-0044, mBT-0051, mBT-0068 и mBT-0128 (SEQ ID NO: 17-20 соответственно), синтезировали в автоматизированной системе для синтеза генов (Genscript, Inc., Пискатауэй, Нью-Джерси). В этом примере получали первую кассету экспрессии, содержащую убиквитиновый промотор маиса (Ubi1), функционально связанный с последовательностью, кодирующей белок Cry, которая была функционально связана с терминатором NOS, а также получали вторую кассету экспрессии, содержащую промотор Ubi1, функционально связанный с последовательностью, кодирующей фосфоманнозоизомеразу (PMI), которая была функционально связана с терминатором NOS. Экспрессия PMI позволяет осуществлять положительную селекцию трансгенных растений на маннозе. Обе кассеты экспрессии клонировали в подходящий вектор для трансформации маиса, опосредованной Agrobacterium.
Пример 11. Экспрессия белков Cry в растениях
[00218] Трансформацию незрелых зародышей маиса выполняли, главным образом, как описано в Negrotto et al., 2000, Plant Cell Reports 19: 798 803. Вкратце, штамм Agrobacterium LBA4404 (pSB1), содержащий вектор, описанный в примере 12, выращивали на твердой среде YEP (дрожжевой экстракт (5 г/л), пептон (10 г/л), NaCl (5 г/л), 15 г/л агара, рН 6,8) в течение 2-4 дней при 28°С. Примерно 0,8Х 109клеток. Agrobacterium суспендировали в среде LS-inf, дополненной 100 мкМ As. Бактерий предварительно индуцировали в данной среде в течение примерно 30-60 минут.
[00219] Незрелых зародышей инбредной линии маиса вырезали из початков возрастом 8-12 дней с переносом в жидкую среду LS-inf + 100 мкМ As. Зародышей однократно ополаскивали свежей средой для инфицирования. Затем добавляли раствор Agrobacterium, и зародышей перемешивали на вихревой мешалке в течение 30 секунд и оставляли осесть с бактериями в течение 5 минут. Затем зародышей переносили стороной со щитком зародыша кверху на среду LSAs и культивировали в темноте в течение двух-трех дней. Впоследствии примерно 20-25 зародышей на чашку Петри переносили на среду LSDc, дополненную цефотаксимом (250 мг/л) и нитратом серебра (1,6 мг/л), и культивировали в темноте при примерно 28°С в течение 10 дней.
[00220] Незрелых зародышей, образующих эмбриогенный каллюс, переносили в среду LSD1M0.5S. Селекцию культур на этой среде осуществляли в течение примерно 6 недель, при этом через приблизительно 3 недели проводили стадию субкультивирования. Выжившие каллюсы переносили на среду Reg1, дополненную маннозой. После культивирования на свету (в режиме 16 часов света/8 часов темноты) зеленые ткани затем переносили на среду Reg2 без регуляторов роста и инкубировали в течение приблизительно 1-2 недель. Проростки переносили в контейнеры Magenta GA-7 (Magenta Corp, Чикаго, Иллинойс), содержащие среду Reg3, и выращивали на свету. Спустя приблизительно 2-3 недели растения тестировали с помощью ПЦР в отношении наличия генов PMI, а также гена cry Bt. Растения, показавшие положительные результаты в ПЦР-анализе, переносили в теплицу для дальнейшей оценки.
[00221] Трансгенные растения оценивали в отношении числа копий (определяли с помощью анализа Taqman), уровня экспрессия белка (определяли с помощью ELISA) и эффективности против представляющих интерес видов насекомых в биологических анализах с вырезанием листа. В частности, ткань листа вырезали из однокопийных объектов (на стадии V3-V4) и заражали новорожденными личинками, затем инкубировали при комнатной температуре в течение 5 дней. Размер выборки для биологического анализа с листовыми дисками варьировал в зависимости от тестируемого вида насекомых (кукурузный мотылек (ЕСВ), n=10; американская кукурузная совка (CEW), n=3, совка-ипсилон (BCW), n=5). Снятие показаний для оценки повреждения ткани и смертности получали примерно в день 3 и день 5; образцы оценивали в отношении повреждения относительно отрицательного контроля с применением следующей шкалы: "+": <5% повреждение ткани, все личинки мертвые;"+/-": 5-20% повреждение ткани, все личинки мертвые; или "-": >20% повреждение ткани, некоторые личинки живые и/или развились до 2ойличиночной стадии.
[00222] Результаты биологического анализа на ткани трансгенного растения подтверждают, что при экспрессии в трансгенных растениях белки Cry по настоящему изобретению токсичны для целевых насекомых. Например, mBT-0051, экспрессируемый в растении маиса, стабильно трансформированном химерным геном по настоящему изобретению, активен в отношении по меньшей мере совки-ипсилон (Agrotis ipsilon), а также восточного кукурузного мотылька (Ostrinia furnacalis), огневки желтой рисовой (Chilo suppressalis) и хлопковой совки (Helicoverpa armigera).
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ЗИНГЕНТА ПАРТИСИПЕЙШНС АГ
<120> Композиции и способы контроля вредителей растений
<130> 80668-WO-REG-ORG-P-1
<160> 26
<170> PatentIn версия 3.5
<210> 1
<211> 3444
<212> ДНК
<213> Bacillus thuringiensis
<400> 1
atggatttag acggtaataa aactgaaact gagactgaaa ttgtaaatgg ttccgaaagt 60
agtatcgatc catcaagcgt gtcttatgcg ggaaataaca gctattcttc cgctttgaat 120
ctcaattctt gtcaaaacag agggattgca cagtgggtta atacgcttgg aggtgcaatc 180
ggtcaggctg tatccatagg aacatccatc atttccttgc ttgcggcgcc tacgcttact 240
ggaagtattt cgttagcttt taatcttata aggagaatgg ggacaggcag taatggaagc 300
tctatttcgg acttgtcaat atgtgactta ctatccataa ttaatttacg tgtaagtcaa 360
gctgtattga acgacgggat tgcagatttt aacggctcag tggctgtata tgatctctat 420
ttgcatgctt tacgcagttg gaacaataac cctaatgctg ctaccgcgga ggaacttcgc 480
actcgttttc gtattgcaga ttccgaattc gaacgtatct taacgcgggg gtccttgaca 540
catggtggtt cattagctag acaagatgct caagtgttac tgttaccttc ttttgtaaat 600
gctgcctatc ttcatttact tatattaagg gatgctagca gatatggggc tagctggggc 660
ttgtttaata cgacaccaca tatcaattat ccagtaagat tacaacaact tattggttct 720
tatacccatt actgcacaca ttggtataat caaggtttaa atgaaatcag acaacgaggc 780
aatacggctg tcaattggtt ggaatttcat agatacagaa gagatatgac attaatggta 840
ctagatgttg tgtcattatt ttcagcgctt gatactataa ggtatccgaa cgcaaccgtt 900
gtccaattaa gcagaaccgt ttatacagac ccgattggtt ttgtaaatcg tggaagcggc 960
aacagattaa gctggtttga ttggcggaat caagctaatt tttcaacgct agaaagtgaa 1020
atgccaaccc cctcgtctcc actttctttg aatcatatga gtatatttac gggtcccctt 1080
actttacctg tctctcctaa tacccataga gccagggtat ggtatggcaa tcaaaatatg 1140
ttcacaacgg gtagtcaaaa ttcaggtcaa acaacaaact ctattcaaaa catttcgggt 1200
ttagaaatat ttagaataga ttctcaagcc tgtaatctaa acaataattc gtatggcgtg 1260
aaccgagctg aattttttca tggcgctagt cagggctccc aaagatctgt ttatcaaggc 1320
tatattagac aaagtggatt ggacaacccg gtagttatga atcttcaaag ctttttacct 1380
ggcgaaaatt cagcgacacc aaccgcacaa gattatacgc atatattaag taatcctgtt 1440
aatataagag gaggacttcg acaaatagta gctgatcgtc gttcttctgt agtcgtttat 1500
ggttggacac acaaaagttt gagtcgacgt agtttagttg caccagatca aattactcaa 1560
gtacctgctg ttaaagcaag tccctcatcc cattgtacca tcattgcagg acctggattt 1620
acgggcgggg atctcgtaag tctgcaacca aatggacaac tcgttatacc gtttcaggta 1680
tcggcgccag aaacaaatta tcatattcga atatgttatg tttctacgtc cgactgttcc 1740
ataaatacaa tatgtaatga tgagacccat ttaagtacgt tgccttccac aacctcatca 1800
cttgaaaatt tacaatgtaa ccatttgcat tattttaacg tgggcacttt caaacctacg 1860
atagatagta aactaacgct tgtaaataca agtccaaatg caaatattat catcgacaaa 1920
attgaattta ttcccgtaga tacggcccaa caacaaaatg aggatctaga agcagcaaaa 1980
aaagcggtgg cgagcttgtt tacacgcaca agggacggat tacaagtaaa tgtgaaagat 2040
tatcaagtcg atcaagcggc aaatttagtg tcatgcttat cagatgaaca atatgggtat 2100
gacaaaaaga tgttattgga agcggtacgt gcggcaaaac gacttagccg agaacgcaac 2160
ttacttcagg acccagattt taatacaatc aatagtacag aagaaaatgg atggaaagca 2220
agtaacggcg ttactattag tgagggcggg ccattctata aaggccgtgc aattcagcta 2280
gcaagtgcac gagaaaatta cccaacatac atctatcaaa aagtagatgc atcggagtta 2340
aagccgtata cacgttatag actggatggg ttcgtgaaga gtagtcaaga tttagaaatt 2400
gatctcattc accatcataa agtccatctt gtgaaaaatg taccagataa tttagtatct 2460
gatacttacc cagatgattc ttgtagtgga atcaatcgat gtcaggaaca acagatggta 2520
aatgcgcaac tggaaacaga gcatcatcat ccgatggatt gctgtgaagc agctcaaaca 2580
catgagtttt cttcctatat tgatacaggg gatttaaatt cgagtgtaga ccagggaatc 2640
tgggcgatct ttaaagttcg aacaaccgat ggttatgcga cgttaggaaa tcttgaattg 2700
gtagaggtcg gaccgttatc gggtgaatct ttagaacgtg aacaaaggga taatacaaaa 2760
tggagtgcag agctaggaag aaagcgtgca gaaacagatc gcgtgtatca agatgccaaa 2820
caatccatca atcatttatt tgtggattat caagatcaac aattaaatcc agaaataggg 2880
atggcagata ttatggacgc tcaaaatctt gtcgcatcaa tttcagatgt atatagcgat 2940
gccgtactgc aaatccctgg aattaactat gagatttaca cagagctgtc caatcgctta 3000
caacaagcat cgtatctgta tacgtctcga aatgcggtgc aaaatgggga ctttaacaac 3060
gggctagata gctggaatgc aacagcgggt gcatcggtac aacaggatgg caatacgcat 3120
ttcttagttc tttctcattg ggatgcacaa gtttctcaac aatttagagt gcagccgaat 3180
tgtaaatatg tattacgtgt aacagcagag aaagtaggcg gcggagacgg atacgtgact 3240
atccgggatg atgctcatca tacagaaacg cttacattta atgcatgtga ttatgatata 3300
aatggcacgt acgtgactga taatacgtat ctaacaaaag aagtggtatt ccatccggag 3360
acacaacaca tgtgggtaga ggtaaatgaa acagaaggtg catttcatat agatagtatt 3420
gaattcgttg aaacagaaaa gtaa 3444
<210> 2
<211> 3474
<212> ДНК
<213> Bacillus thuringiensis
<400> 2
atgaatcgaa ataatcaaaa tgaatatgaa attattgatg ccccccattg tgggtgtcca 60
tcagatgacg atgtgaagta tcctttggca agtgacccaa atgcagcgtt acaaaatatg 120
aactataaag attacttaca aatgacagat gaggactaca ctgattctta tataaatcct 180
agtttatcta ttagtggtag agatgcagtt cagactgcgc ttactgttgt tgggagaata 240
ctcggggctt taggtgttcc gttttctgga caaatagtga gtttttatca attcctttta 300
aatacactgt ggccagttaa tgatacagct atatgggaag ctttcatgcg acaggtggag 360
gaacttgtca atcaacaaat aacagaattt gcaagaaatc aggcacttgc aagattgcaa 420
ggattaggag attcttttaa tgtatatcaa cgttcccttc aaaattggtt ggctgatcga 480
aatgatacac gaaatttaag tgttgttcgt gctcaattta tagctttaga ccttgatttt 540
gttaatgcta ttccattgtt tgcagtaaat ggacagcagg ttccattact gtcagtatat 600
gcacaagctg tgaatttaca tttgttatta ttaaaagatg catctctttt tggagaagga 660
tggggattca cacaggggga aatttccaca tattatgacc gtcaattgga actaaccgct 720
aggtacacta attactgtga aacttggtat aatacaggtt tagatcgttt aagaggaaca 780
aatactgaaa gttggttaag atatcatcaa ttccgtagag aaatgacttt agtggtatta 840
gatgttgtgg cgctatttcc atattatgat gtacgacttt atccaacggg atcaaaccca 900
cagcttacac gtgaggtata tacagatccg attgtattta atccaccagc taatgttgga 960
ctttgccgac gttggggtac taatccctat aatacttttt ctgagctcga aaatgccttc 1020
attcgcccac cacatctttt tgataggctg aatagcttaa caatcagcag taatcgattt 1080
ccagtttcat ctaattttat ggattattgg tcaggacata cgttacgccg tagttatctg 1140
aacgattcag cagtacaaga agatagttat ggcctaatta caaccacaag agcaacaatt 1200
aatcccggag ttgatggaac aaaccgcata gagtcaacgg cagtagattt tcgttctgca 1260
ttgataggta tatatggcgt gaatagagct tcttttgtcc caggaggctt gtttaatggt 1320
acgacttctc ctgctaatgg aggatgtaga gatctctatg atacaaatga tgaattacca 1380
ccagatgaaa gtaccggaag ttcaacccat agactatctc atgttacctt ttttagcttt 1440
caaactaatc aggctggatc tatagctaat gcaggaagtg tacctactta tgtttggacc 1500
cgtcgtgatg tggaccttaa taatacgatt accccaaata gaattacaca attaccattg 1560
gtaaaggcat ctgcacctgt ttcgggtact acggtcttaa aaggtccagg atttacagga 1620
gggggtatac tccgaagaac aactaatggc acatttggaa cgttaagagt aacggttaat 1680
tcaccattaa cacaacaata tcgcctaaga gttcgttttg cctcaacagg aaatttcagt 1740
ataaggttac tccgtggagg ggtttctatc ggtgatgtta gattagggag cacaatgaac 1800
agagggcagg aactaactta cgaatccttt ttcacaagag agtttactac tactggtccg 1860
ttcaatccgc cttttacatt tacacaagct caagagattc taacagtgaa tgcagaaggt 1920
gttagcaccg gtggtgaata ttatatagat agaattgaaa ttgtccctgt gaatccggca 1980
cgagaagcgg aagaggattt agaagcggcg aagaaagcgg tggcgagctt gtttacacgt 2040
acaagagatg gattacaggt aaatgtgaca gattaccaag tggatcgagc ggcaaattta 2100
gtgtcatgct tatcagatga acaatattcg catgataaaa agatgttatt ggaagccgta 2160
cgcgcagcaa aacgcctcag ccgcgaacgc aacttacttc aagatccaga ttttaataca 2220
atcaatagta cagaagaaaa tggctggaag gcaagtaacg gtgttactat tagcgagggc 2280
ggtccattct ttaaaggtcg tgcacttcag ttagcaagcg caagagaaaa ttatccaaca 2340
tacatttatc aaaaagtaga tgcatcggtg ttaaagcctt atacacgcta tagactagat 2400
ggatttgtga agagtagtca agatttagaa attgatctca tccaccatca taaagtccat 2460
cttgtaaaaa atgtaccaga taatttagta tctgatactt actcagatgg ttcttgcagc 2520
ggaatcaacc gttgtgatga acagcagcag gtagatatgc agctagatgc ggagcatcat 2580
ccaatggatt gctgtgaagc ggctcaaaca catgagtttt cttcctatat taatacaggg 2640
gatctaaatg caagtgtaga tcagggcatt tgggttgtat taaaagttcg aacaacagat 2700
gggtatgcga cgttaggaaa tcttgaattg gtagaggttg ggccattatc gggtgaatct 2760
ctagaacgcg aacaaagaga taatgcgaaa tggaatgcag agctaggaag aaagcgtgca 2820
gaaacagatc gcgtgtatct agctgcgaaa caagcaatta atcatctatt tgtagactat 2880
caagatcaac aattaaatcc agaaattggg ctagcggaaa taaatgaagc ttcaaatctt 2940
gtgaagtcaa tttcgggtgt atatagtgat acactattac agattcctgg aattaactac 3000
gaaatttaca cagagttatc cgatcgatta caacaagcat cgtatctgta tacgtctcga 3060
aatgccgtgc aaaatggaga ctttaacagt ggtctagata gttggaatgc aacaacagat 3120
gcatcggttc agcaagatgg cagtacacat ttcttagttc tttcgcattg ggatgcacaa 3180
gtttcccaac aaatgagagt aaatttgaat tgtaagtatg ttttacgtgt aacagcaaaa 3240
aaagtaggag gcggagatgg atacgtcaca atccgagatg gcgctcatca ccaagaaact 3300
cttacattta atgcatgtga ctacgatgta aatggtacgt atgtcaatga caattcgtac 3360
ataacaaaag aagtggtatt ctacccagag acaaaacata tgtgggtaga ggtgagtgaa 3420
tccgaaggtt cattctatat agacagtatt gagtttattg aaacacaaga gtag 3474
<210> 3
<211> 3522
<212> ДНК
<213> Bacillus thuringiensis
<400> 3
atgaatcgaa ataatcaagg tgaatatgaa attattgacg cttccacttg tggttgttcg 60
tcagatgatg ttgttcaata tcctttggca agagatccga atgctgcatt ccaaaatatg 120
aattataaag attatttgaa aatgtctgac ggagactacg tcgattctta tataaaccca 180
ggcttatcta ttggtcgtag agatgtgacc ctaactggag ttggtattgt tgcgctaata 240
gtagggactt taggtggtcc agttgggggt atagtaactg gcttgatttc ctctctttta 300
ggattattgt ggccaagtaa tgataatgat gtatgggaag cttttatggc acaaatagaa 360
gagctaattg aacaaaggat agcagatcaa gtagtaagga atgcactcga taacttaact 420
ggattgcgcg attattataa tcaataccta ttagcattgg aggagtggca ggaaaggccg 480
aacgctgtaa gatctacctt agtttttaat agatttgaaa ccctgcattc tcactttgta 540
actagtatgc caagctttgg tagtggccct ggaagtgaaa ggtatgcggt acaattgctg 600
acagtttatg cacaagcggc aaatctgcat ttgttattat taagagatgc tgacatttat 660
ggggcaaggt ggggacttcg tgaatctcag attgatttat attttaatga gctacaaaat 720
cgtactcgag attataccaa tcattgtgta actgcgtaca ataatgggtt agaggagata 780
cgaggaacaa gccctgcaag ttggttgagg taccatcaat tccgtagaga gacaacacta 840
atagcattgg atttagtggc gatattccca tattacaacg tacgagaata tccaattggg 900
gtaaatcctc agcttacacg tgatgtatat acagatccaa taggggttac tttcagaaga 960
gaagattggg aaacaggagt agaatgcaga ccatgggtaa atactcctta catgagcttt 1020
tcggatcttg aaaatgcaat aattcgtcca ccacatctat ttgaaacatt acgtaattta 1080
acaattcata caggtcgata taacctagta ggaggggcga gatttattga aggatgggtc 1140
ggacattctg taacaaatac tcgcttgggt aattcaacag tatttacaag taattatggt 1200
tctttgccac ctcgttttca agtttttaat tttactaatt ttgatgttta ccaaattaat 1260
acgagagcag attctacagg tacctttaga atccctggat ttgcagttac aagggcccaa 1320
ttcattccgg gtgggactta ttcagtagct caccgagatc caggggcatg tcaacaagat 1380
tatgattcaa ttgaagagtt accaagtcta gacccggatg aacctattaa tagaagttat 1440
agtcatagat tatcgcatgt taccctttat aaatatactc tctcagatac agattatgga 1500
gttatcaatt atacagatta tggaagtatg cctgcatatg tctggacaca tcgcgatgtg 1560
gaccttacta acacgattac tgcagataga attacacaac tcccattagt aaaggcatct 1620
acactacctg cgggtactac tgtggtaaaa ggcccaggat ttacaggagg agatatactc 1680
cgaagaacaa ctaatggaac atttgggaca ttacatgtaa gggttaattc accattaaca 1740
caacaatatc gcctaagagt tcgttttgcc tcaacaggaa atttcagtat aagggtactc 1800
cgtggaggga cttctatcgg tgatgctaga tttgggagca caatgaacag aggacaggaa 1860
ctaacttacg aatcctttgt cacaagagag tttactacta ctggtccgtt caatccgcct 1920
tttacattta cacaaactca agaaattcta acagtgaatg cagaaggtgt tagcaccggt 1980
ggtgaatatt atatagatag tattgagatt gttcctgtaa atccgacgcg agaggcggaa 2040
gaggatctag aagcagcgaa gaaagcggtg gcgagcttgt ttacacgtac aagggacgga 2100
ttacaagtaa atgtgacaga ttaccaagtg gatcgagcgg caaatttagt gttatgctta 2160
tcagatgaac aatatgcgca tgataaaaag atgttattgg aagccgtacg cgcagccaaa 2220
cgactcagcc gcgagcgtaa cttgcttcaa gatccagatt tcaatgaaat aaatagtacg 2280
gaagatagtg gttggaagac aagtaacggc attatcatta gtgagggtgg tccattcttt 2340
aaaggtcgtg cccttcagct agcaagcgca cgtgaaaatt acccaacata catctatcaa 2400
aaggtagact catcaatgtt aaaaccttat acacgatata aactagatgg atttgtgcaa 2460
agtagtcaag atttagaaat tgaactcatt caccatcata aagtccacct cgtgaaaaat 2520
gtaccagata atttagtact tgatacttac ccagatggtt cttgcaacgg aattaaccga 2580
tgtgaggaac aacagatggt gaattcgcaa ctagaaacag aacatcatcc aatggattgc 2640
tgtgaagcat cccaaacaca tgagttttct tcctatattc atacaggtga cctaaatgca 2700
agtgtagatc aaggcatttg ggttgtattg aagattcgga caacagatgg ttctgcgacg 2760
ttaggaaatc ttgaattggt agaggttggt ccattatcgg gtgaatctct agaacgtgaa 2820
caaagagata atgcgaaatg gaatgcagag ttaggaagga agcgtgcaga agcagatcgc 2880
gtgtatcaag gtgcgaaaca agcaattaac catctatttg tagactatca agatcaacaa 2940
ttaaatccag aagttgggct agcagaaatt agtgaagctc gaaatcttat cgaatcaatt 3000
tcagatgtat attgcgatgc agtactgcga attcctggaa ttaactacga gatgtataca 3060
gagttatcta atcgtctaca acaagcagcg tatctgtata cgtctcgaaa tgccgtgcaa 3120
aacggggact ttaacagcgg tttagatagt tggaatgcaa caactgatgc gacggttcag 3180
caggatggca atatgtattt cttagttctt tcccattggg atgcacaagt ttctcaacaa 3240
tttagagtac agccgaattg taaatatgtg ttacgtgtga cagcgaagaa agtagggaac 3300
ggagatggat atgttacgat ccaagatggc gctcatcacc gagaaacact tacattcaat 3360
gcatgtgact acgatgtaaa tggtacgcat gtaaatgaca attcgtatat tacaaaagaa 3420
ttggagttct atccaaagac agaacatatg tgggtagagg taagtgaaac agaaggtacc 3480
ttctatatag acagcattga gctaattgaa acacaagagt ag 3522
<210> 4
<211> 3540
<212> ДНК
<213> Bacillus thuringiensis
<400> 4
atgggaggaa aaagtatgaa tcgaaataat caaggtgaat atgaaattat tgacgcttcc 60
acttgtggtt gttcgtcaga tgatgttgtt caatatcctt tggcaagaga tccgaatgct 120
gcattccaaa atatgaatta taaagattat ttgaaaatgt ctgacggaga ctacgtcgat 180
tcttatataa acccaggctt atctattggt cgtagagatg tgaccctaac tggagttggt 240
attgttgcgc taatagtagg gactttaggt ggtccagttg ggggtatagt aactggcttg 300
atttcctctc ttttaggatt attgtggcca agtaatgata atgatgtatg ggaagctttt 360
atggcacaaa tagaagagct aattgaacaa aggatagcag atcaagtagt aaggaatgca 420
ctcgataact taactggatt gcgcgattat tataatcaat acctattagc attggaggag 480
tggcaggaaa ggccgaacgc tgtaagatct accttagttt ttaatagatt tgaaaccctg 540
cattctcact ttgtaactag tatgccaagc tttggtagtg gccctggaag tgaaaggtat 600
gcggtacaat tgctgacagt ttatgcacaa gcggcaaatc tgcatttgtt attattaaga 660
gatgctgaca tttatggggc aaggtgggga cttcgtgaat ctcagattga tttatatttt 720
aatgagctac aaaatcgtac tcgagattat accaatcatt gtgtaactgc gtacaataat 780
gggttagagg agatacgagg aacaagccct gcaagttggt tgaggtacca tcaattccgt 840
agagagacaa cactaatagc attggattta gtggcgatat tcccatatta caacgtacga 900
gaatatccaa ttggggtaaa tcctcagctt acacgtgatg tatatacaga tccaataggg 960
gttactttca gaagagaaga ttgggaaaca ggagtagaat gcagaccatg ggtaaatact 1020
ccttacatga gcttttcgga tcttgaaaat gcaataattc gtccaccaca tctatttgaa 1080
acattacgta atttaacaat tcatacaggt cgatataacc tagtaggagg ggcgagattt 1140
attgaaggat gggtcggaca ttctgtaaca aatactcgct tgggtaattc aacagtattt 1200
acaagtaatt atggttcttt gccacctcgt tttcaagttt ttaattttac taattttgat 1260
gtttaccaaa ttaatacgag agcagattct acaggtacct ttagaatccc tggatttgca 1320
gttacaaggg cccaattcat tccgggtggg acttattcag tagctcaccg agatccaggg 1380
gcatgtcaac aagattatga ttcaattgaa gagttaccaa gtctagaccc ggatgaacct 1440
attaatagaa gttatagtca tagattatcg catgttaccc tttataaata tactctctca 1500
gatacagatt atggagttat caattataca gattatggaa gtatgcctgc atatgtctgg 1560
acacatcgcg atgtggacct tactaacacg attactgcag atagaattac acaactccca 1620
ttagtaaagg catctacact acctgcgggt actactgtgg taaaaggccc aggatttaca 1680
ggaggagata tactccgaag aacaactaat ggaacatttg ggacattaca tgtaagggtt 1740
aattcaccat taacacaaca atatcgccta agagttcgtt ttgcctcaac aggaaatttc 1800
agtataaggg tactccgtgg agggacttct atcggtgatg ctagatttgg gagcacaatg 1860
aacagaggac aggaactaac ttacgaatcc tttgtcacaa gagagtttac tactactggt 1920
ccgttcaatc cgccttttac atttacacaa actcaagaaa ttctaacagt gaatgcagaa 1980
ggtgttagca ccggtggtga atattatata gatagtattg agattgttcc tgtaaatccg 2040
acgcgagagg cggaagagga tctagaagca gcgaagaaag cggtggcgag cttgtttaca 2100
cgtacaaggg acggattaca agtaaatgtg acagattatc aagtcgatca agcggcaaat 2160
ttagtgtcat gcttatcaga tgaacaatat gggtatgaca aaaagatgtt attggaagcg 2220
gtacgcgcgg caaaacgcct cagccgagaa cgtaacttac ttcaagatcc agattttaat 2280
acaatcaata gtacagaaga aaatggatgg aaagcaagta acggcgttac tattagtgag 2340
ggcggtccat tctataaagg ccgtgcactt cagctagcaa gtgcacgaga aaattatcca 2400
acatacattt atcaaaaagt agatgcatcg gagttaaaac cttatacacg atatagacta 2460
gatgggttcg tgaagagtag tcaagattta gaaattgatc tcattcacca tcataaagtc 2520
catcttgtga aaaatgtacc agataattta gtatctgata cttacccaga tgattcttgt 2580
agtggaatca atcgatgtca ggaacaacag atggtaaatg cgcaactgga aacagagcat 2640
catcatccga tggattgctg tgaagcagct caaacacatg agttttcttc ctatattgat 2700
acaggggatt taaattcgag tgtagaccag ggaatctggg cgatctttaa agttcgaaca 2760
accgatggtt atgcgacgtt aggaaatctt gaattggtag aggtcggacc gttatcgggt 2820
gaatctttag aacgtgaaca aagggataat acaaaatgga gtgcagagct aggaagaaag 2880
cgtgcagaaa cagatcgcgt gtatcaagat gccaaacaat ccatcaatca tttatttgtg 2940
gattatcaag atcaacaatt aaatccagaa atagggatgg cagatattat ggacgctcaa 3000
aatcttgtcg catcaatttc agatgtatat agcgatgccg tactgcaaat ccctggaatt 3060
aactatgaga tttacacaga gctgtccaat cgcttacaac aagcatcgta tctgtatacg 3120
tctcgaaatg cggtgcaaaa tggggacttt aacaacgggc tagatagctg gaatgcaaca 3180
gcgggtgcat cggtacaaca ggatggcaat acgcatttct tagttctttc tcattgggat 3240
gcacaagttt ctcaacaatt tagagtgcag ccgaattgta aatatgtatt acgtgtaaca 3300
gcagagaaag taggcggcgg agacggatac gtgactatcc gggatggtgc tcatcataca 3360
gaaacgctta catttaatgc atgtgattat gatataaatg gcacgtacgt gactgataat 3420
acgtatctaa caaaagaagt gatattctat tcacatacag aacacatgtg ggtagaggta 3480
aatgaaacag aaggtgcatt tcatatagat agtattgaat tcgttgaaac agaaaagtaa 3540
<210> 5
<211> 3444
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический ген Cry
<400> 5
atggacctgg atgggaataa gacagagaca gagaccgaga ttgtgaatgg gagcgagagc 60
agcattgacc cgagcagcgt ttcgtacgct gggaacaata gctactccag cgccctgaac 120
ctcaattcgt gccagaatag gggcatcgct cagtgggtta acacgctggg cggggctatt 180
gggcaggccg tgagcatcgg cacatctatc atttcactcc tggccgcgcc gacactcact 240
gggtctattt cactggcctt caatctcatc aggaggatgg ggaccggctc caacggctcg 300
tctatttccg acctgagcat ctgcgatctc ctgagcatca ttaacctgcg ggtttcgcag 360
gctgtgctca acgacgggat cgctgatttc aatggctccg ttgctgtgta cgacctgtac 420
ctccacgccc tgcgcagctg gaacaataac cctaacgctg ctactgctga ggagctgagg 480
acccgcttca ggatcgccga ttcggagttc gagaggattc tgacgagggg ctcgctcaca 540
catggcggct ccctcgcccg ccaggacgct caggtcctcc tgctcccgtc cttcgttaac 600
gcggcttacc tgcacctgct catcctccgc gatgcttcgc gctacggggc ctcttggggc 660
ctcttcaaca ccacgccgca tatcaattac cccgtgaggc tgcagcagct cattggcagc 720
tacacgcact actgcacaca ttggtacaac caggggctga atgagatccg gcagcgcggc 780
aacactgccg tgaattggct cgagttccac cgctaccgcc gcgacatgac gctgatggtc 840
ctcgatgtgg tctcgctgtt ctctgccctc gacacgatcc gctacccgaa cgctacagtt 900
gtgcagctca gccgcactgt ctacaccgat ccgattggct tcgttaaccg cgggtcaggc 960
aataggctgt cctggttcga ctggaggaac caggcgaatt tctctactct cgagtcagag 1020
atgccgaccc cctcatcccc actgagcctc aaccacatgt cgatcttcac tgggcctctg 1080
accctcccag tgtcccctaa cacgcatagg gcccgggtct ggtacggcaa ccagaatatg 1140
ttcacaactg ggtcacagaa ctccggccag accacgaact ctattcagaa tatctcaggc 1200
ctggagattt tccgcatcga ctctcaggcg tgcaatctca ataacaattc atacggcgtg 1260
aacagggcgg agttcttcca cggggctagc cagggctcgc agcggtctgt ctaccaggga 1320
tacatccgcc agagcggcct ggacaaccct gtcgttatga atctgcagtc tttcctccca 1380
ggcgagaact cagccacccc tacggcgcag gattacaccc acattctgtc caacccggtt 1440
aatatcaggg gcgggctcag gcagattgtg gccgacaggc gctcctccgt ggtcgtttac 1500
ggctggacgc acaagtccct gagcaggagg tcactcgtgg ctccagacca gatcacccag 1560
gtcccagccg ttaaggcgtc cccttcttca cattgcacta tcattgccgg cccaggcttc 1620
accggcgggg acctggtgtc gctccagccc aacggccagc tcgtcatccc gttccaggtt 1680
tctgcgcccg agacgaacta ccacattcgc atctgctacg tctcgacgtc tgattgcagc 1740
attaacacaa tctgcaatga cgagacgcat ctgtccacac tcccgagcac aacttccagc 1800
ctggagaacc tccagtgcaa tcacctgcat tacttcaacg tgggcacttt caagccaacc 1860
atcgactcga agctgacgct cgtcaacaca tctcctaacg ctaacatcat tatcgacaag 1920
atcgagttca tcccggtgga taccgcccag cagcagaacg aggacctcga ggccgcgaag 1980
aaggctgtcg cctccctgtt cacacgcact agggacggcc tccaggtcaa tgttaaggac 2040
taccaggtgg atcaggctgc caacctggtc tcatgcctct ccgacgagca gtacggctac 2100
gataagaaga tgctgctcga ggccgtgagg gctgctaaga ggctgagcag ggagaggaac 2160
ctgctccagg accccgattt caacacaatc aactcgaccg aggagaacgg gtggaaggcg 2220
tcaaatggcg tcaccatctc cgagggcggg ccattctaca agggcagggc tattcagctc 2280
gcgtctgctc gggagaacta ccccacatac atctaccaga aggtggatgc ctccgagctg 2340
aagccataca cccgctaccg cctcgacggc ttcgtcaagt cgtctcagga cctggagatt 2400
gatctcatcc accatcacaa ggtgcacctg gtcaagaacg ttccggacaa tctcgtgagc 2460
gatacgtacc ccgacgattc atgctccgga atcaacaggt gccaggagca gcagatggtc 2520
aacgcgcagc tggagaccga gcatcaccat ccgatggact gctgcgaggc tgctcagacg 2580
cacgagttct catcctacat cgacacaggg gatctgaaca gctcggtcga tcagggcatt 2640
tgggccatct tcaaggttag gaccacggac gggtacgcta ccctcggcaa cctggagctg 2700
gtggaggtcg ggccactgag cggcgagtcg ctcgagaggg agcagaggga caacactaag 2760
tggtccgctg agctgggccg caagagggct gagaccgacc gcgtctacca ggatgccaag 2820
cagagcatca atcacctgtt cgttgactac caggatcagc agctcaaccc cgagattggc 2880
atggcggaca tcatggatgc tcagaacctg gtggccagca tctcggacgt gtacagcgat 2940
gcggtcctcc agattccagg aatcaactac gagatctaca cggagctgtc gaacaggctc 3000
cagcaggcct cctacctgta cacaagccgg aacgcggtcc agaatgggga cttcaacaat 3060
ggcctcgatt catggaatgc tacggctggg gcttccgtgc agcaggatgg caacacacac 3120
ttcctggtcc tctcccattg ggacgcgcag gttagccagc agttccgcgt gcagccgaac 3180
tgcaagtatg tgctgagggt cactgctgag aaggttggcg ggggcgacgg ctacgtgacc 3240
atcagggacg atgcgcacca taccgagacg ctgacattca acgcttgcga ctacgacatc 3300
aacggcacct acgtgacaga caacacttac ctaaccaagg aggtggtctt ccacccggag 3360
actcagcata tgtgggttga ggtgaacgag accgagggcg ccttccacat agactccatc 3420
gagttcgtcg agaccgagaa gtga 3444
<210> 6
<211> 3474
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический ген Cry
<400> 6
atgaacagga acaaccagaa cgagtacgag attattgacg ccccccattg cggctgcccc 60
tccgacgacg atgtgaagta cccactggct agcgacccca acgctgctct gcagaacatg 120
aattacaagg attacctcca gatgaccgac gaggattaca cggactcgta catcaaccca 180
tccctcagca tttcgggcag ggacgctgtc cagacagccc tgactgtggt cggccgcatc 240
ctcggggcgc tgggcgttcc cttctcaggc cagattgtgt ccttctacca gttcctcctg 300
aataccctct ggccagtgaa cgacacggcg atctgggagg ctttcatgcg ccaggtggag 360
gagctggtca atcagcagat tacggagttc gccaggaacc aggctctcgc gcggctgcag 420
ggcctcgggg actccttcaa tgtctaccag aggagcctgc agaactggct cgccgaccgc 480
aacgatacca ggaatctctc cgttgtgcgc gcccagttca tcgcgctcga cctggatttc 540
gtgaatgcca ttcctctgtt cgctgtgaac ggccagcagg tcccgctcct gtccgtttac 600
gctcaggccg tgaacctgca tctcctgctc ctgaaggatg cttcgctctt cggcgagggg 660
tggggcttca cacagggcga gatctctact tactacgacc gccagctcga gctgacagcg 720
aggtacacta attactgcga gacctggtac aacacggggc tggacaggct caggggaacc 780
aacacggagt cctggctccg ctaccaccag ttccgcaggg agatgactct ggtcgttctc 840
gatgtggtcg ccctgttccc atactacgac gtccgcctct acccaaccgg ctccaaccct 900
cagctgacaa gggaggtgta cactgaccct atcgtcttca acccaccagc taatgtgggg 960
ctctgcaggc gctggggaac caacccgtac aatacgttca gcgagctgga gaacgcgttc 1020
atccggccac ctcatctgtt cgatcgcctc aactctctca ccatttccag caataggttc 1080
cctgtctcgt ctaacttcat ggactactgg tctggccaca cgctgaggcg gagctacctc 1140
aacgattcgg ctgtgcagga ggactcctac ggcctcatca ccacgacacg ggccaccatt 1200
aacccggggg tcgatggcac caaccggatc gagtcgacgg cggtggactt ccgctctgct 1260
ctcatcggga tttacggcgt taacagggct tccttcgtgc caggcgggct gttcaatggc 1320
actaccagcc cagctaacgg cgggtgcagg gacctgtacg ataccaacga cgagctgcca 1380
ccagacgagt ccacaggctc atccactcat cgcctctcgc acgtcacatt cttctctttc 1440
cagactaatc aggccgggtc aatcgcgaac gctggctccg ttcccaccta cgtgtggacg 1500
cgcagggacg tcgatctgaa caacacgatc actccgaacc gcattacgca gctcccactg 1560
gtgaaggctt ctgctccagt ctcaggcacg acagttctga aggggcccgg cttcaccggc 1620
gggggcatcc tccggcgcac taccaatggg accttcggca cgctgagggt gaccgtcaac 1680
agcccactga cgcagcagta caggctccgc gtgaggttcg cttctacggg caatttctca 1740
atcaggctcc tgaggggggg cgtgagcatt ggggacgtca ggctgggctc gacaatgaac 1800
cggggccagg agctgacata cgagagcttc ttcactcgcg agttcacgac aactggccca 1860
ttcaatccac ctttcacctt cacgcaggcc caggagatcc tcacagttaa cgctgagggc 1920
gtgtcgactg ggggcgagta ctacattgat aggatcgaga ttgttccagt gaacccagct 1980
agggaggctg aggaggacct ggaggctgcc aagaaggctg tggccagcct gttcacacgc 2040
actagggacg gcctccaggt caatgttacc gattaccagg tcgacagggc ggctaacctg 2100
gtttcatgcc tctccgatga gcagtactcc cacgacaaga agatgctcct ggaggccgtc 2160
cgggctgcta agcgcctgtc acgggagcgc aacctcctgc aggaccctga tttcaacacg 2220
atcaactcca ctgaggagaa tgggtggaag gccagcaacg gcgtgaccat ttcggagggg 2280
ggcccgttct tcaagggccg cgcgctccag ctggctagcg ctagggagaa ctaccctacg 2340
tacatctacc agaaggtcga tgcgtcggtt ctgaagccgt acacacgcta ccgcctcgac 2400
ggcttcgtga agtcctccca ggatctggag atcgacctca ttcaccatca caaggtccat 2460
ctggttaaga acgtgcccga caatctcgtc tccgatacct acagcgacgg gtcctgcagc 2520
ggaatcaacc gctgcgatga gcagcagcag gtggatatgc agctcgacgc cgagcatcac 2580
ccaatggact gctgcgaggc tgcccagacc cacgagttct cttcctacat caatacgggg 2640
gatctgaacg cctccgttga ccagggcatt tgggttgtgc tcaaagtgag gaccacggac 2700
gggtacgcta ccctgggcaa cctcgagctg gtggaggtcg ggccgctgag cggcgagtcg 2760
ctcgagaggg agcagaggga taacgctaag tggaatgctg agctgggcag gaagagggct 2820
gagaccgaca gggtctacct ggctgctaag caggcgatca atcacctctt cgtggattac 2880
caggaccagc agctgaaccc tgagatcggc ctcgctgaga ttaacgaggc ctctaatctg 2940
gtcaagtcga tctctggggt ttactcagat actctcctgc agatcccggg aattaactac 3000
gagatttaca ccgagctgtc cgaccggctc cagcaggctt cctacctcta cacgagccgc 3060
aacgccgtgc agaatgggga tttcaactcg ggcctggact cttggaacgc gacaactgat 3120
gcttctgtcc agcaggacgg ctcaacccat ttcctcgtgc tgtcacactg ggacgctcag 3180
gtgtcccagc agatgagggt caacctgaat tgcaagtacg tcctcagggt tacggcgaag 3240
aaggtcgggg gcggggatgg ctacgtcaca atcagggacg gcgcgcatca ccaggagacc 3300
ctcacgttca atgcttgcga ctacgatgtc aacggcacat acgttaacga caattcctac 3360
atcactaagg aggtcgtttt ctaccccgag accaagcaca tgtgggttga ggtgtctgag 3420
tcggagggct cgttctacat tgatagcatt gagttcattg agacgcagga gtga 3474
<210> 7
<211> 3522
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический ген Cry
<400> 7
atgaaccgga acaaccaggg cgagtacgag attattgatg cctccacttg cggctgctcc 60
tcagatgatg tcgtccagta cccactcgct cgcgacccga acgctgcttt ccagaacatg 120
aattacaagg actacctgaa gatgtctgac ggcgattacg tcgattcata cattaaccca 180
ggcctgtcca tcgggaggag ggacgtcacg ctcacaggcg tcgggatcgt tgctctcatt 240
gtgggcaccc tgggcggccc agttggcggg attgtgacgg gcctgatctc cagcctcctg 300
gggctcctgt ggccaagcaa cgacaatgat gtgtgggagg ccttcatggc gcagatcgag 360
gagctgattg agcagaggat cgctgaccag gtggtccgga acgccctgga caatctcacc 420
ggcctgaggg attactacaa ccagtacctc ctggctctcg aggagtggca ggagaggccc 480
aatgccgtga ggtctacgct ggtcttcaac cggttcgaga cgctccattc acacttcgtg 540
acatcaatgc catccttcgg cagcgggcct ggcagcgagc gctacgcggt tcagctcctg 600
accgtgtacg ctcaggctgc caacctgcac ctcctgctcc tgagggacgc tgatatctac 660
ggcgctcggt gggggctcag ggagtcccag atcgacctct acttcaacga gctgcagaat 720
cggacgcgcg attacacaaa ccattgcgtc acagcctaca acaatggcct ggaggagatc 780
agggggactt cgccagcttc ttggctgcgc taccaccagt tccggcgcga gaccacgctc 840
attgccctcg acctggtggc gatcttccca tactacaatg tcagggagta cccaattggc 900
gttaaccctc agctcacgcg ggacgtgtac acagatccga tcggcgtcac gttcaggcgg 960
gaggactggg agacaggcgt cgagtgcagg ccgtgggtta ataccccata catgtctttc 1020
tcagatctgg agaacgccat cattaggccg ccccatctct tcgagacgct ccggaatctg 1080
acgattcaca caggcaggta caacctggtc ggcggggcga ggttcatcga gggctgggtc 1140
gggcattccg ttactaatac caggctgggc aacagcactg tgttcaccag caattacggg 1200
tcgctcccac ctcggttcca ggtgttcaac ttcacgaatt tcgacgtcta ccagatcaac 1260
acacgggccg attcgacggg cacattccgc attccggggt tcgcggtcac tagggctcag 1320
ttcatccccg gcgggaccta ctccgtggct caccgcgacc caggcgcttg ccagcaggac 1380
tacgattcaa ttgaggagct gccctccctg gacccagatg agcctatcaa ccggtcctac 1440
agccatcgcc tctcacacgt caccctgtac aagtacactc tctccgacac cgattacggc 1500
gtgatcaatt acaccgacta cgggagcatg ccagcttacg tgtggacgca tcgcgacgtc 1560
gatctgacta acaccattac ggcggatagg atcacgcagc tcccgctggt gaaggcttcg 1620
acactccccg ccggcacaac tgttgtgaag gggcccggct tcaccggcgg ggacatcctg 1680
aggaggacca cgaatggcac gttcgggaca ctccacgtga gggtcaacag cccactgacc 1740
cagcagtaca ggctccgggt ccgcttcgct tcgacgggca acttctctat tagggtgctg 1800
aggggcggga catctatcgg cgacgctcgc ttcgggtcaa ctatgaacag gggccaggag 1860
ctgacttacg agtccttcgt gacccgcgag ttcacaacta ccggcccgtt caatccgccc 1920
ttcacattca ctcagaccca ggagatcctg actgtcaacg ctgagggcgt ttcgaccggc 1980
ggggagtact acatcgactc tattgagatc gttccagtga acccaaccag ggaggctgag 2040
gaggatctcg aggctgctaa gaaggccgtc gcgagcctgt tcacgaggac acgggacggc 2100
ctccaggtca atgttacgga ctaccaggtt gatagggctg ctaacctcgt gctgtgcctc 2160
tccgacgagc agtacgccca cgataagaag atgctcctgg aggcggtgag ggctgctaag 2220
aggctgagca gggagaggaa cctcctgcag gaccctgatt tcaacgagat caattctact 2280
gaggactcag gctggaagac cagcaacggg atcattatct cggagggcgg gccgttcttc 2340
aagggccggg ccctgcagct cgcttccgct cgcgagaact accctaccta catctaccag 2400
aaggtggact cgtctatgct gaagccgtac acgaggtaca agctcgacgg cttcgtgcag 2460
tcatcccagg atctcgagat tgagctgatc caccatcaca aggtgcacct cgtcaagaac 2520
gttccagaca atctggtcct cgacacctac cctgatggct cgtgcaacgg aatcaaccgc 2580
tgcgaggagc agcagatggt gaactctcag ctggagacgg agcatcaccc tatggactgc 2640
tgcgaggcct cacagactca tgagttcagc tcgtacatcc acaccggcga cctcaacgcg 2700
tctgtcgatc aggggatttg ggtcgttctg aagatcagga cgacagacgg ctcggctacc 2760
ctcgggaacc tggagctggt ggaggtcggc cccctgtcag gggagtccct cgagagggag 2820
cagagggaca acgccaagtg gaatgctgag ctgggccgga agcgcgctga ggctgatcgc 2880
gtgtaccagg gcgctaagca ggccatcaat cacctcttcg tcgactacca ggatcagcag 2940
ctgaaccctg aggttggcct cgcggagatc agcgaggctc ggaacctgat tgagtcgatc 3000
tctgacgtgt actgcgatgc cgtcctccgc attccgggaa tcaactacga gatgtacacg 3060
gagctgtcca acaggctgca gcaggctgct tacctgtaca caagccgcaa cgcggtgcag 3120
aatggcgact tcaactccgg gctcgatagc tggaatgcta ctaccgacgc caccgttcag 3180
caggatggca acatgtactt cctggtgctc agccactggg acgcccaggt ttcgcagcag 3240
ttccgcgtgc agccaaattg caagtatgtg ctgagggtca cagcgaagaa ggtcgggaac 3300
ggcgacggct acgtgactat ccaggatggc gcgcatcacc gcgagactct gaccttcaat 3360
gcttgcgact acgatgttaa cggcacgcat gtgaacgaca attcctacat tacaaaggag 3420
ctggagttct acccgaagac tgagcacatg tgggttgagg tgagcgagac tgagggcacc 3480
ttctacatag attcgatcga gctgattgag acccaggagt ga 3522
<210> 8
<211> 3540
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический ген Cry
<400> 8
atggggggga agtctatgaa caggaacaac cagggcgagt acgagattat tgatgcctcc 60
acatgcgggt gctccagcga cgacgtggtc cagtacccac tcgctcgcga ccctaacgct 120
gctttccaga acatgaatta caaggactac ctgaagatgt ccgacggcga ttacgtggat 180
agctacatta acccaggcct ctcgatcggg aggagggacg tcactctgac cggggttggc 240
atcgtggcgc tgattgttgg cacactcggc gggcctgtgg gcgggattgt cactggcctc 300
atctccagcc tcctggggct cctgtggcca tccaacgaca atgatgtctg ggaggcgttc 360
atggctcaga tcgaggagct gattgagcag cgcatcgcgg accaggtggt caggaacgct 420
ctcgacaatc tgaccggcct cagggattac tacaaccagt acctcctggc tctcgaggag 480
tggcaggaga ggccaaatgc cgtgcgctcc acgctcgttt tcaaccgctt cgagaccctg 540
cacagccatt tcgtgacgag catgccgtcg ttcgggtctg gccccgggtc ggagcgctac 600
gctgtgcagc tcctgaccgt ctacgcccag gctgccaacc tccacctcct gctcctgcgc 660
gacgctgata tctacggcgc caggtggggg ctcagggaga gccagatcga cctgtacttc 720
aacgagctgc agaatcggac acgcgattac actaaccact gcgtcaccgc ctacaacaat 780
ggcctcgagg agatcagggg gacgtcacca gcttcctggc tccgctacca ccagttccgg 840
agggagacca cgctgattgc gctcgacctg gtggctatct tcccctacta caatgtgcgc 900
gagtacccga ttggcgtcaa cccccagctg accagggacg tttacaccga cccgatcggc 960
gtgacattca ggcgggagga ctgggagact ggcgtggagt gcaggccgtg ggtcaatacc 1020
ccatacatgt ctttctcaga cctcgagaac gccatcatta ggccgcccca cctgttcgag 1080
acgctgagga atctcaccat tcatacgggc aggtacaacc tggtcggcgg ggcgcgcttc 1140
atcgagggct gggttgggca ctcagtgacg aacacaaggc tcggcaattc cacagtgttc 1200
acttccaact acggcagcct gccacctcgg ttccaggttt tcaacttcac aaatttcgac 1260
gtgtaccaga tcaacactag ggccgattcg actggcacct tccggattcc agggttcgcc 1320
gttacccgcg cgcagttcat ccctggcggg acgtactccg tggctcaccg cgacccgggc 1380
gcttgccagc aggactacga tagcattgag gagctgccct cgctcgaccc agatgagcct 1440
atcaacaggt cctacagcca ccggctgtct catgtcaccc tctacaagta caccctgtca 1500
gacacggatt acggcgtgat caattacacc gactacgggt ccatgccagc ttacgtttgg 1560
acgcaccggg acgtggatct cacgaacaca attactgccg accgcatcac acagctccca 1620
ctggtgaagg ccagcactct gcctgcgggc acaactgttg tgaagggccc tgggttcacc 1680
ggcggggaca tcctcaggag gaccacgaat ggcaccttcg ggacgctgca tgtccgcgtt 1740
aactccccgc tcacacagca gtacaggctg cgggtgcgct tcgcttcgac tggcaacttc 1800
tctattcgcg tcctcagggg cgggacctcc atcggcgacg ctaggttcgg gagcacgatg 1860
aacaggggcc aggagctgac atacgagtcc ttcgtcacta gggagttcac aactaccggc 1920
ccgttcaatc cgcccttcac cttcacgcag acacaggaga ttctcaccgt taacgctgag 1980
ggcgtgagca cgggcgggga gtactacatc gactcgatcg agattgtgcc agtcaaccca 2040
accagggagg ctgaggagga tctggaggct gctaagaagg ccgtggcgag cctcttcact 2100
aggacccggg acggcctgca ggttaatgtg acggactacc aggtcgatca ggccgcgaac 2160
ctggttagct gcctctcgga cgagcagtac ggctacgata agaagatgct cctggaggcc 2220
gtccgcgctg ctaagaggct ctcgagggag aggaacctcc tgcaggaccc cgatttcaac 2280
acaattaatt ctactgagga gaacggctgg aaggcctcta atggggtgac catctcagag 2340
ggcgggccat tctacaaggg cagggcgctc cagctggctt cagctcggga gaactacccc 2400
acctacatct accagaaggt cgacgcctcc gagctgaagc catacacgcg ctaccgcctg 2460
gatggcttcg tgaagtcgtc tcaggacctg gagatcgatc tcattcacca tcacaaggtc 2520
cacctcgtta agaacgtgcc ggacaatctg gtctccgata cctaccccga cgattcgtgc 2580
tctggaatca acaggtgcca ggagcagcag atggtgaacg cccagctcga gacggagcat 2640
caccatccta tggactgctg cgaggcggct cagacccatg agttctcatc ctacatcgac 2700
acgggcgatc tcaacagctc ggtcgaccag gggatctggg cgattttcaa ggttaggacg 2760
acagatggct acgctaccct ggggaatctc gagctggtcg aggttggccc cctctctggg 2820
gagtcactgg agagggagca gagggacaac acaaagtggt ctgctgagct gggcaggaag 2880
cgggctgaga ctgaccgcgt ctaccaggat gccaagcagt ccatcaatca cctcttcgtg 2940
gactaccagg atcagcagct gaaccctgag attggcatgg ctgacatcat ggatgcccag 3000
aacctcgtcg cgtcaatctc cgacgtctac agcgatgcgg ttctgcagat cccgggcatt 3060
aattacgaga tctacacaga gctgtcgaac aggctccagc aggcgtcata cctctacacg 3120
tcccggaacg ctgtgcagaa tggcgacttc aacaatgggc tggattcgtg gaatgcgaca 3180
gctggcgcct ctgtgcagca ggacgggaac actcacttcc tcgtcctgtc tcattgggat 3240
gcccaggtct cacagcagtt ccgggttcag ccgaactgca agtatgtgct gcgcgttacc 3300
gctgagaaag tgggcggggg cgacggctac gtcacgatcc gcgatggggc tcaccatacg 3360
gagacactca ctttcaacgc ctgcgactac gatatcaatg gcacatacgt tactgacaac 3420
acctacctga cgaaggaggt catcttctac tcccacacag agcatatgtg ggtggaggtc 3480
aacgagactg agggcgcctt ccacatcgac agcattgagt tcgtggagac cgagaagtga 3540
<210> 9
<211> 3444
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический ген Cry
<400> 9
atggacctgg atgggaataa gacagagaca gagaccgaga ttgtgaatgg gagcgagagc 60
agcattgacc cgagcagcgt ttcgtacgct gggaacaata gctactccag cgccctgaac 120
ctcaattcgt gccagaatag gggcatcgct cagtgggtta acacgctggg cggggctatt 180
gggcaggccg tgagcatcgg cacatctatc atttcactcc tggccgcgcc gacactcact 240
gggtctattt cactggcctt caatctcatc aggaggatgg ggaccggctc caacggctcg 300
tctatttccg acctgagcat ctgcgatctc ctgagcatca ttaacctgcg ggtttcgcag 360
gctgtgctca acgacgggat cgctgatttc aatggctccg ttgctgtgta cgacctgtac 420
ctccacgccc tgcgcagctg gaacaataac cctaacgctg ctactgctga ggagctgagg 480
acccgcttca ggatcgccga ttcggagttc gagaggattc tgacgagggg ctcgctcaca 540
catggcggct ccctcgcccg ccaggacgct caggtcctcc tgctcccgtc cttcgttaac 600
gcggcttacc tgcacctgct catcctccgc gatgcttcgc gctacggggc ctcttggggc 660
ctcttcaaca ccacgccgca tatcaattac cccgtgaggc tgcagcagct cattggcagc 720
tacacgcact actgcacaca ttggtacaac caggggctga atgagatccg gcagcgcggc 780
aacactgccg tgaattggct cgagttccac cgctaccgcc gcgacatgac gctgatggtc 840
ctcgatgtgg tctcgctgtt ctctgccctc gacacgatcc gctacccgaa cgctacagtt 900
gtgcagctca gccgcactgt ctacaccgat ccgattggct tcgttaaccg cgggtcaggc 960
aataggctgt cctggttcga ctggaggaac caggcgaatt tctctactct cgagtcagag 1020
atgccgaccc cctcatcccc actgagcctc aaccacatgt cgatcttcac tgggcctctg 1080
accctcccag tgtcccctaa cacgcatagg gcccgggtct ggtacggcaa ccagaatatg 1140
ttcacaactg ggtcacagaa ctccggccag accacgaact ctattcagaa tatctcaggc 1200
ctggagattt tccgcatcga ctctcaggcg tgcaatctca ataacaattc atacggcgtg 1260
aacagggcgg agttcttcca cggggctagc cagggctcgc agcggtctgt ctaccaggga 1320
tacatccgcc agagcggcct ggacaaccct gtcgttatga atctgcagtc tttcctccca 1380
ggcgagaact cagccacccc tacggcgcag gattacaccc acattctgtc caacccggtt 1440
aatatcaggg gcgggctcag gcagattgtg gccgacaggc gctcctccgt ggtcgtttac 1500
ggctggacgc acaagtccct gagcaggagg tcactcgtgg ctccagacca gatcacccag 1560
gtcccagccg ttaaggcgtc cccttcttca cattgcacta tcattgccgg cccaggcttc 1620
accggcgggg acctggtgtc gctccagccc aacggccagc tcgtcatccc gttccaggtt 1680
tctgcgcccg agacgaacta ccacattcgc atctgctacg tctcgacgtc tgattgcagc 1740
attaacacaa tctgcaatga cgagacgcat ctgtccacac tcccgagcac aacttccagc 1800
ctggagaacc tccagtgcaa tcacctgcat tacttcaacg tgggcacttt caagccaacc 1860
atcgactcga agctgacgct cgtcaacaca tctcctaacg ctaacatcat tatcgacaag 1920
atcgagttca tcccggtgga taccgcccag cagcagaacg aggacctcga ggccgcgaag 1980
aaggctgtcg cctccctgtt cacacgcact agggacggcc tccaggtcaa tgttaaggac 2040
taccaggtgg atcaggctgc caacctggtc tcatgcctct ccgacgagca gtacggctac 2100
gataagaaga tgctgctcga ggccgtgagg gctgctaaga ggctgagcag ggagaggaac 2160
ctgctccagg accccgattt caacacaatc aactcgaccg aggagaacgg gtggaaggcg 2220
tcaaatggcg tcaccatctc cgagggcggg ccattctaca agggcagggc tattcagctc 2280
gcgtctgctc gggagaacta ccccacatac atctaccaga aggtggatgc ctccgagctg 2340
aagccataca cccgctaccg cctcgacggc ttcgtcaagt cgtctcagga cctggagatt 2400
gatctcatcc accatcacaa ggtgcacctg gtcaagaacg ttccggacaa tctcgtgagc 2460
gatacgtacc ccgacgattc atgctccgga atcaacaggt gccaggagca gcagatggtc 2520
aacgcgcagc tggagaccga gcatcaccat ccgatggact gctgcgaggc tgctcagacg 2580
cacgagttct catcctacat cgacacaggg gatctgaaca gctcggtcga tcagggcatt 2640
tgggccatct tcaaggttag gaccacggac gggtacgcta ccctcggcaa cctggagctg 2700
gtggaggtcg ggccactgag cggcgagtcg ctcgagaggg agcagaggga caacactaag 2760
tggtccgctg agctgggccg caagagggct gagaccgacc gcgtctacca ggatgccaag 2820
cagagcatca atcacctgtt cgttgactac caggatcagc agctcaaccc cgagattggc 2880
atggcggaca tcatggatgc tcagaacctg gtggccagca tctcggacgt gtacagcgat 2940
gcggtcctcc agattccagg aatcaactac gagatctaca cggagctgtc gaacaggctc 3000
cagcaggcct cctacctgta cacaagccgg aacgcggtcc agaatgggga cttcaacaat 3060
ggcctcgatt catggaatgc tacggctggg gcttccgtgc agcaggatgg caacacacac 3120
ttcctggtcc tctcccattg ggacgcgcag gttagccagc agttccgcgt gcagccgaac 3180
tgcaagtatg tgctgagggt cactgctgag aaggttggcg ggggcgacgg ctacgtgacc 3240
atcagggacg atgcgcacca taccgagacg ctgacattca acgcttgcga ctacgacatc 3300
aacggcacct acgtgacaga caacacttac atcaccaagg aggtggtctt ccacccggag 3360
actcagcata tgtgggttga ggtgaacgag accgagggcg ccttccacct tgactccatc 3420
gagttcgtcg agaccgagaa gtga 3444
<210> 10
<211> 3474
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический ген Cry
<400> 10
atgaacagga acaaccagaa cgagtacgag attattgacg ccccccattg cggctgcccc 60
tccgacgacg atgtgaagta cccactggct agcgacccca acgctgctct gcagaacatg 120
aattacaagg attacctcca gatgaccgac gaggattaca cggactcgta catcaaccca 180
tccctcagca tttcgggcag ggacgctgtc cagacagccc tgactgtggt cggccgcatc 240
ctcggggcgc tgggcgttcc cttctcaggc cagattgtgt ccttctacca gttcctcctg 300
aataccctct ggccagtgaa cgacacggcg atctgggagg ctttcatgcg ccaggtggag 360
gagctggtca atcagcagat tacggagttc gccaggaacc aggctctcgc gcggctgcag 420
ggcctcgggg actccttcaa tgtctaccag aggagcctgc agaactggct cgccgaccgc 480
aacgatacca ggaatctctc cgttgtgcgc gcccagttca tcgcgctcga cctggatttc 540
gtgaatgcca ttcctctgtt cgctgtgaac ggccagcagg tcccgctcct gtccgtttac 600
gctcaggccg tgaacctgca tctcctgctc ctgaaggatg cttcgctctt cggcgagggg 660
tggggcttca cacagggcga gatctctact cactacgacc gccagctcga gctgacagcg 720
aggtacacta attactgcga gacctggtac aacacggggc tggacaggct caggggaacc 780
aacacggagt cctggctccg ctaccaccag ttccgcaggg agatgactct ggtcgttctc 840
gatgtggtcg ccctgttccc atactacgac gtccgcctct acccaaccgg ctccaaccct 900
cagctgacaa gggaggtgta cactgaccct atcgtcttca acccaccagc taatgtgggg 960
ctctgcaggc gctggggaac caacccgtac aatacgttca gcgagctgga gaacgcgttc 1020
atccggccac ctcatctgtt cgatcgcatc cagtctctct caatttccag caataggttc 1080
cctgtctcgt ctaacttcat ggactactgg tctggccaca cgctgaggcg gagctacctc 1140
aacgattcgg ctgtgcagga ggactcctac ggcctcatca ccacgacacg ggccaccatt 1200
aacccggggg tcgatggcac caaccggatc gagtcgacgg cggtggactt ccgctctgct 1260
ctcatcggga tttacggcgt taacagggct tccttcgtgc caggcgggct gttcaatggc 1320
actaccagcc cagctaacgg cgggtgcagg gacctgtacg ataccaacga cgagctgcca 1380
ccagacgagt ccacaggctc atccactcat cgcctctcgc acgtcacatt cttctctttc 1440
cagactaatc aggccgggtc aatcgcgaac gctggctccg ttcccaccta cgtgtggacg 1500
cgcagggacg tcgatctgaa caacacgatc actccgaacc gcattacgca gctcccactg 1560
gtgaaggctt ctgctccagt ctcaggcacg acagttctga aggggcccgg cttcaccggc 1620
gggggcatcc tccggcgcac taccaatggg accttcggca cgctgagggt gaccgtcaac 1680
agcccactga cgcagcagta caggctccgc gtgaggttcg cttctacggg caatttctca 1740
atcaggctcc tgaggggggg cgtgagcatt ggggacgtca ggctgggctc gacaatgaac 1800
cggggccagg agctgacata cgagagcttc ttcactcgcg agttcacgac aactggccca 1860
ttcaatccac ctttcacctt cacgcaggcc caggagatcc tcacagttaa cgctgagggc 1920
gtgtcgactg ggggcgagta ctacattgat aggatcgaga ttgttccagt gaacccagct 1980
agggaggctg aggaggacct ggaggctgcc aagaaggctg tggccagcct gttcacacgc 2040
actagggacg gcctccaggt caatgttacc gattaccagg tcgacagggc ggctaacctg 2100
gtttcatgcc tctccgatga gcagtactcc cacgacaaga agatgctcct ggaggccgtc 2160
cgggctgcta agcgcctgtc acgggagcgc aacctcctgc aggaccctga tttcaacacg 2220
atcaactcca ctgaggagaa tgggtggaag gccagcaacg gcgtgaccat ttcggagggg 2280
ggcccgttct tcaagggccg cgcgctccag ctggctagcg ctagggagaa ctaccctacg 2340
tacatctacc agaaggtcga tgcgtcggtt ctgaagccgt acacacgcta ccgcctcgac 2400
ggcttcgtga agtcctccca ggatctggag atcgacctca ttcaccatca caaggtccat 2460
ctggttaaga acgtgcccga caatctcgtc tccgatacct acagcgacgg gtcctgcagc 2520
ggaatcaacc gctgcgatga gcagcagcag gtggatatgc agctcgacgc cgagcatcac 2580
ccaatggact gctgcgaggc tgcccagacc cacgagttct cttcctacat caatacgggg 2640
gatctgaacg cctccgttga ccagggcatt tgggttgtgc tcaaagtgag gaccacggac 2700
gggtacgcta ccctgggcaa cctcgagctg gtggaggtcg ggccgctgag cggcgagtcg 2760
ctcgagaggg agcagaggga taacgctaag tggaatgctg agctgggcag gaagagggct 2820
gagaccgaca gggtctacct ggctgctaag caggcgatca atcacctctt cgtggattac 2880
caggaccagc agctgaaccc tgagatcggc ctcgctgaga ttaacgaggc ctctaatctg 2940
gtcaagtcga tctctggggt ttactcagat actctcctgc agatcccggg aattaactac 3000
gagatttaca ccgagctgtc cgaccggctc cagcaggctt cctacctcta cacgagccgc 3060
aacgccgtgc agaatgggga tttcaactcg ggcctggact cttggaacgc gacaactgat 3120
gcttctgtcc agcaggacgg ctcaacccat ttcctcgtgc tgtcacactg ggacgctcag 3180
gtgtcccagc agatgagggt caacctgaat tgcaagtacg tcctcagggt tacggcgaag 3240
aaggtcgggg gcggggatgg ctacgtcaca atcagggacg gcgcgcatca ccaggagacc 3300
ctcacgttca atgcttgcga ctacgatgtc aacggcacat acgttaacga caattcctac 3360
atcactaagg aggtcgtttt ctaccccgag accaagcaca tgtgggttga ggtgtctgag 3420
tcggagggct cgttctacat tgatagcatt gagttcattg agacgcagga gtga 3474
<210> 11
<211> 3522
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический ген Cry
<400> 11
atgaaccgga acaaccaggg cgagtacgag attattgatg cctccacttg cggctgctcc 60
tcagatgatg tcgtccagta cccactcgct cgcgacccga acgctgcttt ccagaacatg 120
aattacaagg actacctgaa gatgtctgac ggcgattacg tcgattcata cattaaccca 180
ggcctgtcca tcgggaggag ggacgtcacg ctcacaggcg tcgggatcgt tgctctcatt 240
gtgggcaccc tgggcggccc agttggcggg attgtgacgg gcctgatctc cagcctcctg 300
gggctcctgt ggccaagcaa cgacaatgat gtgtgggagg ccttcatggc gcagatcgag 360
gagctgattg agcagaggat cgctgaccag gtggtccgga acgccctgga caatctcacc 420
ggcctgaggg attactacaa ccagtacctc ctggctctcg aggagtggca ggagaggccc 480
aatgccgtga ggtctacgct ggtcttcaac cggttcgaga cgctccattc acacttcgtg 540
acatcaatgc catccttcgg cagcgggcct ggcagcgagc gctacgcggt tcagctcctg 600
accgtgtacg ctcaggctgc caacctgcac ctcctgctcc tgagggacgc tgatatctac 660
ggcgctcggt gggggctcag ggagtcccag atcgacctct acttcaacga gctgcagaat 720
cggacgcgcg attacacaaa ccattgcgtc acagcctaca acaatggcct ggaggagatc 780
agggggactt cgccagcttc ttggctgcgc taccaccagt tccggcgcga gaccacgctc 840
attgccctcg acctggtggc gatcttccca tactacaatg tcagggagta cccaattggc 900
gttaaccctc agctcacgcg ggacgtgtac acagatccga tcggcgtcac gttcaggcgg 960
gaggactggg agacaggcgt cgagtgcagg ccgtgggtta ataccccata catgtctttc 1020
tcagatctgg agaacgccat cattaggccg ccccatctct tcgagacgct ccggaatctg 1080
acgattcaca caggcaggta caacctggtc ggcggggcga ggttcatcga gggctgggtc 1140
gggcattccg ttactaatac caggctgggc aacagcactg tgttcaccag caattacggg 1200
tcgctcccac ctcggttcca ggtgttcaac ttcacgaatt tcgacgtcta ccagatcaac 1260
acacgggccg attcgacggg cacattccgc attccggggt tcgcggtcac tagggctcag 1320
ttcatccccg gcgggaccta ctccgtggct caccgcgacc caggcgcttg ccagcaggac 1380
tacgattcaa ttgaggagct gccctccctg gacccagatg agcctatcaa ccggtcctac 1440
agccatcgcc tctcacacgt caccctgtac aagtacactc tctccgacac cgattacggc 1500
gtgatcaatt acaccgacta cgggagcatg ccagcttacg tgtggacgca tcgcgacgtc 1560
gatctgacta acaccattac ggcggatagg atcacgcagc tcccgctggt gaaggcttcg 1620
acactccccg ccggcacaac tgttgtgaag gggcccggct tcaccggcgg ggacatcctg 1680
aggaggacca cgaatggcac gttcgggaca ctccacgtga gggtcaacag cccactgacc 1740
cagcagtaca ggctccgggt ccgcttcgct tcgacgggca acttctctat tagggtgctg 1800
aggggcggga catctatcgg cgacgctcgc ttcgggtcaa ctatgaacag gggccaggag 1860
ctgacttacg agtccttcgt gacccgcgag ttcacaacta ccggcccgtt caatccgccc 1920
ttcacattca ctcagaccca ggagatcctg actgtcaacg ctgagggcgt ttcgaccggc 1980
ggggagtact acatcgactc tattgagatc gttccagtga acccaaccag ggaggctgag 2040
gaggatctcg aggctgctaa gaaggccgtc gcgagcctgt tcacgaggac acgggacggc 2100
ctccaggtca atgttacgga ctaccaggtt gatagggctg ctaacctcgt gctgtgcctc 2160
tccgacgagc agtacgccca cgataagaag atgctcctgg aggcggtgag ggctgctaag 2220
aggctgagca gggagaggaa cctcctgcag gaccctgatt tcaacgagat caattctact 2280
gaggactcag gctggaagac cagcaacggg atcattatct cggagggcgg gccgttcttc 2340
aagggccggg ccctgcagct cgcttccgct cgcgagaact accctaccta catctaccag 2400
aaggtggact cgtctatgct gaagccgtac acgaggtaca agctcgacgg cttcgtgcag 2460
tcatcccagg atctcgagat tgagctgatc caccatcaca aggtgcacct cgtcaagaac 2520
gttccagaca atctggtcct cgacacctac cctgatggct cgtgcaacgg aatcaaccgc 2580
tgcgaggagc agcagatggt gaactctcag ctggagacgg agcatcaccc tatggactgc 2640
tgcgaggcct cacagactca tgagttcagc tcgtacatcc acaccggcga cctcaacgcg 2700
tctgtcgatc aggggatttg ggtcgttctg aagatcagga cgacagacgg ctcggctacc 2760
ctcgggaacc tggagctggt ggaggtcggc cccctgtcag gggagtccct cgagagggag 2820
cagagggaca acgccaagtg gaatgctgag ctgggccgga agcgcgctga ggctgatcgc 2880
gtgtaccagg gcgctaagca ggccatcaat cacctcttcg tcgactacca ggatcagcag 2940
ctgaaccctg aggttggcct cgcggagatc agcgaggctc ggaacctgat tgagtcgatc 3000
tctgacgtgt actgcgatgc cgtcctccgc attccgggaa tcaactacga gatgtacacg 3060
gagctgtcca acaggctgca gcaggctgct tacctgtaca caagccgcaa cgcggtgcag 3120
aatggcgact tcaactccgg gctcgatagc tggaatgcta ctaccgacgc caccgttcag 3180
caggatggca acatgtactt cctggtgctc agccactggg acgcccaggt ttcgcagcag 3240
ttccgcgtgc agccaaattg caagtatgtg ctgagggtca cagcgaagaa ggtcgggaac 3300
ggcgacggct acgtgactat ccaggatggc gcgcatcacc gcgagactct gaccttcaat 3360
gcttgcgact acgatgttaa cggcacgcat gtgaacgaca attcctacct cacaaaggag 3420
ctggagttct acccgaagac tgagcacatg tgggttgagg tgagcgagac tgagggcacc 3480
ttctaccttg attcgatcga gctgattgag acccaggagt ga 3522
<210> 12
<211> 3540
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический ген Cry
<400> 12
atggggggga agtctatgaa caggaacaac cagggcgagt acgagattat tgatgcctcc 60
acatgcgggt gctccagcga cgacgtggtc cagtacccac tcgctcgcga ccctaacgct 120
gctttccaga acatgaatta caaggactac ctgaagatgt ccgacggcga ttacgtggat 180
agctacatta acccaggcct ctcgatcggg aggagggacg tcactctgac cggggttggc 240
atcgtggcgc tgattgttgg cacactcggc gggcctgtgg gcgggattgt cactggcctc 300
atctccagcc tcctggggct cctgtggcca tccaacgaca atgatgtctg ggaggcgttc 360
atggctcaga tcgaggagct gattgagcag cgcatcgcgg accaggtggt caggaacgct 420
ctcgacaatc tgaccggcct cagggattac tacaaccagt acctcctggc tctcgaggag 480
tggcaggaga ggccaaatgc cgtgcgctcc acgctcgttt tcaaccgctt cgagaccctg 540
cacagccatt tcgtgacgag catgccgtcg ttcgggtctg gccccgggtc ggagcgctac 600
gctgtgcagc tcctgaccgt ctacgcccag gctgccaacc tccacctcct gctcctgcgc 660
gacgctgata tctacggcgc caggtggggg ctcagggaga gccagatcga cctgtacttc 720
aacgagctgc agaatcggac acgcgattac actaaccact gcgtcaccgc ctacaacaat 780
ggcctcgagg agatcagggg gacgtcacca gcttcctggc tccgctacca ccagttccgg 840
agggagacca cgctgattgc gctcgacctg gtggctatct tcccctacta caatgtgcgc 900
gagtacccga ttggcgtcaa cccccagctg accagggacg tttacaccga cccgatcggc 960
gtgacattca ggcgggagga ctgggagact ggcgtggagt gcaggccgtg ggtcaatacc 1020
ccatacatgt ctttctcaga cctcgagaac gccatcatta ggccgcccca cctgttcgag 1080
acgctgagga atctcaccat tcatacgggc aggtacaacc tggtcggcgg ggcgcgcttc 1140
atcgagggct gggttgggca ctcagtgacg aacacaaggc tcggcaattc cacagtgttc 1200
acttccaact acggcagcct gccacctcgg ttccaggttt tcaacttcac aaatttcgac 1260
gtgtaccaga tcaacactag ggccgattcg actggcacct tccggattcc agggttcgcc 1320
gttacccgcg cgcagttcat ccctggcggg acgtactccg tggctcaccg cgacccgggc 1380
gcttgccagc aggactacga tagcattgag gagctgccct cgctcgaccc agatgagcct 1440
atcaacaggt cctacagcca ccggctgtct catgtcaccc tctacaagta caccctgtca 1500
gacacggatt acggcgtgat caattacacc gactacgggt ccatgccagc ttacgtttgg 1560
acgcaccggg acgtggatct cacgaacaca attactgccg accgcatcac acagctccca 1620
ctggtgaagg ccagcactct gcctgcgggc acaactgttg tgaagggccc tgggttcacc 1680
ggcggggaca tcctcaggag gaccacgaat ggcaccttcg ggacgctgca tgtccgcgtt 1740
aactccccgc tcacacagca gtacaggctg cgggtgcgct tcgcttcgac tggcaacttc 1800
tctattcgcg tcctcagggg cgggacctcc atcggcgacg ctaggttcgg gagcacgatg 1860
aacaggggcc aggagctgac atacgagtcc ttcgtcacta gggagttcac aactaccggc 1920
ccgttcaatc cgcccttcac cttcacgcag acacaggaga ttctcaccgt taacgctgag 1980
ggcgtgagca cgggcgggga gtactacatc gactcgatcg agattgtgcc agtcaaccca 2040
accagggagg ctgaggagga tctggaggct gctaagaagg ccgtggcgag cctcttcact 2100
aggacccggg acggcctgca ggttaatgtg acggactacc aggtcgatca ggccgcgaac 2160
ctggttagct gcctctcgga cgagcagtac ggctacgata agaagatgct cctggaggcc 2220
gtccgcgctg ctaagaggct ctcgagggag aggaacctcc tgcaggaccc cgatttcaac 2280
acaattaatt ctactgagga gaacggctgg aaggcctcta atggggtgac catctcagag 2340
ggcgggccat tctacaaggg cagggcgctc cagctggctt cagctcggga gaactacccc 2400
acctacatct accagaaggt cgacgcctcc gagctgaagc catacacgcg ctaccgcctg 2460
gatggcttcg tgaagtcgtc tcaggacctg gagatcgatc tcattcacca tcacaaggtc 2520
cacctcgtta agaacgtgcc ggacaatctg gtctccgata cctaccccga cgattcgtgc 2580
tctggaatca acaggtgcca ggagcagcag atggtgaacg cccagctcga gacggagcat 2640
caccatccta tggactgctg cgaggcggct cagacccatg agttctcatc ctacatcgac 2700
acgggcgatc tcaacagctc ggtcgaccag gggatctggg cgattttcaa ggttaggacg 2760
acagatggct acgctaccct ggggaatctc gagctggtcg aggttggccc cctctctggg 2820
gagtcactgg agagggagca gagggacaac acaaagtggt ctgctgagct gggcaggaag 2880
cgggctgaga ctgaccgcgt ctaccaggat gccaagcagt ccatcaatca cctcttcgtg 2940
gactaccagg atcagcagct gaaccctgag attggcatgg ctgacatcat ggatgcccag 3000
aacctcgtcg cgtcaatctc cgacgtctac agcgatgcgg ttctgcagat cccgggcatt 3060
aattacgaga tctacacaga gctgtcgaac aggctccagc aggcgtcata cctctacacg 3120
tcccggaacg ctgtgcagaa tggcgacttc aacaatgggc tggattcgtg gaatgcgaca 3180
gctggcgcct ctgtgcagca ggacgggaac actcacttcc tcgtcctgtc tcattgggat 3240
gcccaggtct cacagcagtt ccgggttcag ccgaactgca agtatgtgct gcgcgttacc 3300
gctgagaaag tgggcggggg cgacggctac gtcacgatcc gcgatggggc tcaccatacg 3360
gagacactca ctttcaacgc ctgcgactac gatatcaatg gcacatacgt tactgacaac 3420
acctacctga cgaaggaggt catcttctac tcccacacag agcatatgtg ggtggaggtc 3480
aacgagactg agggcgcctt ccacctcgac agccttgagt tcgtggagac cgagaagtga 3540
<210> 13
<211> 1147
<212> БЕЛОК
<213> Bacillus thuringiensis
<400> 13
Met Asp Leu Asp Gly Asn Lys Thr Glu Thr Glu Thr Glu Ile Val Asn
1 5 10 15
Gly Ser Glu Ser Ser Ile Asp Pro Ser Ser Val Ser Tyr Ala Gly Asn
20 25 30
Asn Ser Tyr Ser Ser Ala Leu Asn Leu Asn Ser Cys Gln Asn Arg Gly
35 40 45
Ile Ala Gln Trp Val Asn Thr Leu Gly Gly Ala Ile Gly Gln Ala Val
50 55 60
Ser Ile Gly Thr Ser Ile Ile Ser Leu Leu Ala Ala Pro Thr Leu Thr
65 70 75 80
Gly Ser Ile Ser Leu Ala Phe Asn Leu Ile Arg Arg Met Gly Thr Gly
85 90 95
Ser Asn Gly Ser Ser Ile Ser Asp Leu Ser Ile Cys Asp Leu Leu Ser
100 105 110
Ile Ile Asn Leu Arg Val Ser Gln Ala Val Leu Asn Asp Gly Ile Ala
115 120 125
Asp Phe Asn Gly Ser Val Ala Val Tyr Asp Leu Tyr Leu His Ala Leu
130 135 140
Arg Ser Trp Asn Asn Asn Pro Asn Ala Ala Thr Ala Glu Glu Leu Arg
145 150 155 160
Thr Arg Phe Arg Ile Ala Asp Ser Glu Phe Glu Arg Ile Leu Thr Arg
165 170 175
Gly Ser Leu Thr His Gly Gly Ser Leu Ala Arg Gln Asp Ala Gln Val
180 185 190
Leu Leu Leu Pro Ser Phe Val Asn Ala Ala Tyr Leu His Leu Leu Ile
195 200 205
Leu Arg Asp Ala Ser Arg Tyr Gly Ala Ser Trp Gly Leu Phe Asn Thr
210 215 220
Thr Pro His Ile Asn Tyr Pro Val Arg Leu Gln Gln Leu Ile Gly Ser
225 230 235 240
Tyr Thr His Tyr Cys Thr His Trp Tyr Asn Gln Gly Leu Asn Glu Ile
245 250 255
Arg Gln Arg Gly Asn Thr Ala Val Asn Trp Leu Glu Phe His Arg Tyr
260 265 270
Arg Arg Asp Met Thr Leu Met Val Leu Asp Val Val Ser Leu Phe Ser
275 280 285
Ala Leu Asp Thr Ile Arg Tyr Pro Asn Ala Thr Val Val Gln Leu Ser
290 295 300
Arg Thr Val Tyr Thr Asp Pro Ile Gly Phe Val Asn Arg Gly Ser Gly
305 310 315 320
Asn Arg Leu Ser Trp Phe Asp Trp Arg Asn Gln Ala Asn Phe Ser Thr
325 330 335
Leu Glu Ser Glu Met Pro Thr Pro Ser Ser Pro Leu Ser Leu Asn His
340 345 350
Met Ser Ile Phe Thr Gly Pro Leu Thr Leu Pro Val Ser Pro Asn Thr
355 360 365
His Arg Ala Arg Val Trp Tyr Gly Asn Gln Asn Met Phe Thr Thr Gly
370 375 380
Ser Gln Asn Ser Gly Gln Thr Thr Asn Ser Ile Gln Asn Ile Ser Gly
385 390 395 400
Leu Glu Ile Phe Arg Ile Asp Ser Gln Ala Cys Asn Leu Asn Asn Asn
405 410 415
Ser Tyr Gly Val Asn Arg Ala Glu Phe Phe His Gly Ala Ser Gln Gly
420 425 430
Ser Gln Arg Ser Val Tyr Gln Gly Tyr Ile Arg Gln Ser Gly Leu Asp
435 440 445
Asn Pro Val Val Met Asn Leu Gln Ser Phe Leu Pro Gly Glu Asn Ser
450 455 460
Ala Thr Pro Thr Ala Gln Asp Tyr Thr His Ile Leu Ser Asn Pro Val
465 470 475 480
Asn Ile Arg Gly Gly Leu Arg Gln Ile Val Ala Asp Arg Arg Ser Ser
485 490 495
Val Val Val Tyr Gly Trp Thr His Lys Ser Leu Ser Arg Arg Ser Leu
500 505 510
Val Ala Pro Asp Gln Ile Thr Gln Val Pro Ala Val Lys Ala Ser Pro
515 520 525
Ser Ser His Cys Thr Ile Ile Ala Gly Pro Gly Phe Thr Gly Gly Asp
530 535 540
Leu Val Ser Leu Gln Pro Asn Gly Gln Leu Val Ile Pro Phe Gln Val
545 550 555 560
Ser Ala Pro Glu Thr Asn Tyr His Ile Arg Ile Cys Tyr Val Ser Thr
565 570 575
Ser Asp Cys Ser Ile Asn Thr Ile Cys Asn Asp Glu Thr His Leu Ser
580 585 590
Thr Leu Pro Ser Thr Thr Ser Ser Leu Glu Asn Leu Gln Cys Asn His
595 600 605
Leu His Tyr Phe Asn Val Gly Thr Phe Lys Pro Thr Ile Asp Ser Lys
610 615 620
Leu Thr Leu Val Asn Thr Ser Pro Asn Ala Asn Ile Ile Ile Asp Lys
625 630 635 640
Ile Glu Phe Ile Pro Val Asp Thr Ala Gln Gln Gln Asn Glu Asp Leu
645 650 655
Glu Ala Ala Lys Lys Ala Val Ala Ser Leu Phe Thr Arg Thr Arg Asp
660 665 670
Gly Leu Gln Val Asn Val Lys Asp Tyr Gln Val Asp Gln Ala Ala Asn
675 680 685
Leu Val Ser Cys Leu Ser Asp Glu Gln Tyr Gly Tyr Asp Lys Lys Met
690 695 700
Leu Leu Glu Ala Val Arg Ala Ala Lys Arg Leu Ser Arg Glu Arg Asn
705 710 715 720
Leu Leu Gln Asp Pro Asp Phe Asn Thr Ile Asn Ser Thr Glu Glu Asn
725 730 735
Gly Trp Lys Ala Ser Asn Gly Val Thr Ile Ser Glu Gly Gly Pro Phe
740 745 750
Tyr Lys Gly Arg Ala Ile Gln Leu Ala Ser Ala Arg Glu Asn Tyr Pro
755 760 765
Thr Tyr Ile Tyr Gln Lys Val Asp Ala Ser Glu Leu Lys Pro Tyr Thr
770 775 780
Arg Tyr Arg Leu Asp Gly Phe Val Lys Ser Ser Gln Asp Leu Glu Ile
785 790 795 800
Asp Leu Ile His His His Lys Val His Leu Val Lys Asn Val Pro Asp
805 810 815
Asn Leu Val Ser Asp Thr Tyr Pro Asp Asp Ser Cys Ser Gly Ile Asn
820 825 830
Arg Cys Gln Glu Gln Gln Met Val Asn Ala Gln Leu Glu Thr Glu His
835 840 845
His His Pro Met Asp Cys Cys Glu Ala Ala Gln Thr His Glu Phe Ser
850 855 860
Ser Tyr Ile Asp Thr Gly Asp Leu Asn Ser Ser Val Asp Gln Gly Ile
865 870 875 880
Trp Ala Ile Phe Lys Val Arg Thr Thr Asp Gly Tyr Ala Thr Leu Gly
885 890 895
Asn Leu Glu Leu Val Glu Val Gly Pro Leu Ser Gly Glu Ser Leu Glu
900 905 910
Arg Glu Gln Arg Asp Asn Thr Lys Trp Ser Ala Glu Leu Gly Arg Lys
915 920 925
Arg Ala Glu Thr Asp Arg Val Tyr Gln Asp Ala Lys Gln Ser Ile Asn
930 935 940
His Leu Phe Val Asp Tyr Gln Asp Gln Gln Leu Asn Pro Glu Ile Gly
945 950 955 960
Met Ala Asp Ile Met Asp Ala Gln Asn Leu Val Ala Ser Ile Ser Asp
965 970 975
Val Tyr Ser Asp Ala Val Leu Gln Ile Pro Gly Ile Asn Tyr Glu Ile
980 985 990
Tyr Thr Glu Leu Ser Asn Arg Leu Gln Gln Ala Ser Tyr Leu Tyr Thr
995 1000 1005
Ser Arg Asn Ala Val Gln Asn Gly Asp Phe Asn Asn Gly Leu Asp
1010 1015 1020
Ser Trp Asn Ala Thr Ala Gly Ala Ser Val Gln Gln Asp Gly Asn
1025 1030 1035
Thr His Phe Leu Val Leu Ser His Trp Asp Ala Gln Val Ser Gln
1040 1045 1050
Gln Phe Arg Val Gln Pro Asn Cys Lys Tyr Val Leu Arg Val Thr
1055 1060 1065
Ala Glu Lys Val Gly Gly Gly Asp Gly Tyr Val Thr Ile Arg Asp
1070 1075 1080
Asp Ala His His Thr Glu Thr Leu Thr Phe Asn Ala Cys Asp Tyr
1085 1090 1095
Asp Ile Asn Gly Thr Tyr Val Thr Asp Asn Thr Tyr Leu Thr Lys
1100 1105 1110
Glu Val Val Phe His Pro Glu Thr Gln His Met Trp Val Glu Val
1115 1120 1125
Asn Glu Thr Glu Gly Ala Phe His Ile Asp Ser Ile Glu Phe Val
1130 1135 1140
Glu Thr Glu Lys
1145
<210> 14
<211> 1157
<212> БЕЛОК
<213> Bacillus thuringiensis
<400> 14
Met Asn Arg Asn Asn Gln Asn Glu Tyr Glu Ile Ile Asp Ala Pro His
1 5 10 15
Cys Gly Cys Pro Ser Asp Asp Asp Val Lys Tyr Pro Leu Ala Ser Asp
20 25 30
Pro Asn Ala Ala Leu Gln Asn Met Asn Tyr Lys Asp Tyr Leu Gln Met
35 40 45
Thr Asp Glu Asp Tyr Thr Asp Ser Tyr Ile Asn Pro Ser Leu Ser Ile
50 55 60
Ser Gly Arg Asp Ala Val Gln Thr Ala Leu Thr Val Val Gly Arg Ile
65 70 75 80
Leu Gly Ala Leu Gly Val Pro Phe Ser Gly Gln Ile Val Ser Phe Tyr
85 90 95
Gln Phe Leu Leu Asn Thr Leu Trp Pro Val Asn Asp Thr Ala Ile Trp
100 105 110
Glu Ala Phe Met Arg Gln Val Glu Glu Leu Val Asn Gln Gln Ile Thr
115 120 125
Glu Phe Ala Arg Asn Gln Ala Leu Ala Arg Leu Gln Gly Leu Gly Asp
130 135 140
Ser Phe Asn Val Tyr Gln Arg Ser Leu Gln Asn Trp Leu Ala Asp Arg
145 150 155 160
Asn Asp Thr Arg Asn Leu Ser Val Val Arg Ala Gln Phe Ile Ala Leu
165 170 175
Asp Leu Asp Phe Val Asn Ala Ile Pro Leu Phe Ala Val Asn Gly Gln
180 185 190
Gln Val Pro Leu Leu Ser Val Tyr Ala Gln Ala Val Asn Leu His Leu
195 200 205
Leu Leu Leu Lys Asp Ala Ser Leu Phe Gly Glu Gly Trp Gly Phe Thr
210 215 220
Gln Gly Glu Ile Ser Thr Tyr Tyr Asp Arg Gln Leu Glu Leu Thr Ala
225 230 235 240
Arg Tyr Thr Asn Tyr Cys Glu Thr Trp Tyr Asn Thr Gly Leu Asp Arg
245 250 255
Leu Arg Gly Thr Asn Thr Glu Ser Trp Leu Arg Tyr His Gln Phe Arg
260 265 270
Arg Glu Met Thr Leu Val Val Leu Asp Val Val Ala Leu Phe Pro Tyr
275 280 285
Tyr Asp Val Arg Leu Tyr Pro Thr Gly Ser Asn Pro Gln Leu Thr Arg
290 295 300
Glu Val Tyr Thr Asp Pro Ile Val Phe Asn Pro Pro Ala Asn Val Gly
305 310 315 320
Leu Cys Arg Arg Trp Gly Thr Asn Pro Tyr Asn Thr Phe Ser Glu Leu
325 330 335
Glu Asn Ala Phe Ile Arg Pro Pro His Leu Phe Asp Arg Leu Asn Ser
340 345 350
Leu Thr Ile Ser Ser Asn Arg Phe Pro Val Ser Ser Asn Phe Met Asp
355 360 365
Tyr Trp Ser Gly His Thr Leu Arg Arg Ser Tyr Leu Asn Asp Ser Ala
370 375 380
Val Gln Glu Asp Ser Tyr Gly Leu Ile Thr Thr Thr Arg Ala Thr Ile
385 390 395 400
Asn Pro Gly Val Asp Gly Thr Asn Arg Ile Glu Ser Thr Ala Val Asp
405 410 415
Phe Arg Ser Ala Leu Ile Gly Ile Tyr Gly Val Asn Arg Ala Ser Phe
420 425 430
Val Pro Gly Gly Leu Phe Asn Gly Thr Thr Ser Pro Ala Asn Gly Gly
435 440 445
Cys Arg Asp Leu Tyr Asp Thr Asn Asp Glu Leu Pro Pro Asp Glu Ser
450 455 460
Thr Gly Ser Ser Thr His Arg Leu Ser His Val Thr Phe Phe Ser Phe
465 470 475 480
Gln Thr Asn Gln Ala Gly Ser Ile Ala Asn Ala Gly Ser Val Pro Thr
485 490 495
Tyr Val Trp Thr Arg Arg Asp Val Asp Leu Asn Asn Thr Ile Thr Pro
500 505 510
Asn Arg Ile Thr Gln Leu Pro Leu Val Lys Ala Ser Ala Pro Val Ser
515 520 525
Gly Thr Thr Val Leu Lys Gly Pro Gly Phe Thr Gly Gly Gly Ile Leu
530 535 540
Arg Arg Thr Thr Asn Gly Thr Phe Gly Thr Leu Arg Val Thr Val Asn
545 550 555 560
Ser Pro Leu Thr Gln Gln Tyr Arg Leu Arg Val Arg Phe Ala Ser Thr
565 570 575
Gly Asn Phe Ser Ile Arg Leu Leu Arg Gly Gly Val Ser Ile Gly Asp
580 585 590
Val Arg Leu Gly Ser Thr Met Asn Arg Gly Gln Glu Leu Thr Tyr Glu
595 600 605
Ser Phe Phe Thr Arg Glu Phe Thr Thr Thr Gly Pro Phe Asn Pro Pro
610 615 620
Phe Thr Phe Thr Gln Ala Gln Glu Ile Leu Thr Val Asn Ala Glu Gly
625 630 635 640
Val Ser Thr Gly Gly Glu Tyr Tyr Ile Asp Arg Ile Glu Ile Val Pro
645 650 655
Val Asn Pro Ala Arg Glu Ala Glu Glu Asp Leu Glu Ala Ala Lys Lys
660 665 670
Ala Val Ala Ser Leu Phe Thr Arg Thr Arg Asp Gly Leu Gln Val Asn
675 680 685
Val Thr Asp Tyr Gln Val Asp Arg Ala Ala Asn Leu Val Ser Cys Leu
690 695 700
Ser Asp Glu Gln Tyr Ser His Asp Lys Lys Met Leu Leu Glu Ala Val
705 710 715 720
Arg Ala Ala Lys Arg Leu Ser Arg Glu Arg Asn Leu Leu Gln Asp Pro
725 730 735
Asp Phe Asn Thr Ile Asn Ser Thr Glu Glu Asn Gly Trp Lys Ala Ser
740 745 750
Asn Gly Val Thr Ile Ser Glu Gly Gly Pro Phe Phe Lys Gly Arg Ala
755 760 765
Leu Gln Leu Ala Ser Ala Arg Glu Asn Tyr Pro Thr Tyr Ile Tyr Gln
770 775 780
Lys Val Asp Ala Ser Val Leu Lys Pro Tyr Thr Arg Tyr Arg Leu Asp
785 790 795 800
Gly Phe Val Lys Ser Ser Gln Asp Leu Glu Ile Asp Leu Ile His His
805 810 815
His Lys Val His Leu Val Lys Asn Val Pro Asp Asn Leu Val Ser Asp
820 825 830
Thr Tyr Ser Asp Gly Ser Cys Ser Gly Ile Asn Arg Cys Asp Glu Gln
835 840 845
Gln Gln Val Asp Met Gln Leu Asp Ala Glu His His Pro Met Asp Cys
850 855 860
Cys Glu Ala Ala Gln Thr His Glu Phe Ser Ser Tyr Ile Asn Thr Gly
865 870 875 880
Asp Leu Asn Ala Ser Val Asp Gln Gly Ile Trp Val Val Leu Lys Val
885 890 895
Arg Thr Thr Asp Gly Tyr Ala Thr Leu Gly Asn Leu Glu Leu Val Glu
900 905 910
Val Gly Pro Leu Ser Gly Glu Ser Leu Glu Arg Glu Gln Arg Asp Asn
915 920 925
Ala Lys Trp Asn Ala Glu Leu Gly Arg Lys Arg Ala Glu Thr Asp Arg
930 935 940
Val Tyr Leu Ala Ala Lys Gln Ala Ile Asn His Leu Phe Val Asp Tyr
945 950 955 960
Gln Asp Gln Gln Leu Asn Pro Glu Ile Gly Leu Ala Glu Ile Asn Glu
965 970 975
Ala Ser Asn Leu Val Lys Ser Ile Ser Gly Val Tyr Ser Asp Thr Leu
980 985 990
Leu Gln Ile Pro Gly Ile Asn Tyr Glu Ile Tyr Thr Glu Leu Ser Asp
995 1000 1005
Arg Leu Gln Gln Ala Ser Tyr Leu Tyr Thr Ser Arg Asn Ala Val
1010 1015 1020
Gln Asn Gly Asp Phe Asn Ser Gly Leu Asp Ser Trp Asn Ala Thr
1025 1030 1035
Thr Asp Ala Ser Val Gln Gln Asp Gly Ser Thr His Phe Leu Val
1040 1045 1050
Leu Ser His Trp Asp Ala Gln Val Ser Gln Gln Met Arg Val Asn
1055 1060 1065
Leu Asn Cys Lys Tyr Val Leu Arg Val Thr Ala Lys Lys Val Gly
1070 1075 1080
Gly Gly Asp Gly Tyr Val Thr Ile Arg Asp Gly Ala His His Gln
1085 1090 1095
Glu Thr Leu Thr Phe Asn Ala Cys Asp Tyr Asp Val Asn Gly Thr
1100 1105 1110
Tyr Val Asn Asp Asn Ser Tyr Ile Thr Lys Glu Val Val Phe Tyr
1115 1120 1125
Pro Glu Thr Lys His Met Trp Val Glu Val Ser Glu Ser Glu Gly
1130 1135 1140
Ser Phe Tyr Ile Asp Ser Ile Glu Phe Ile Glu Thr Gln Glu
1145 1150 1155
<210> 15
<211> 1173
<212> БЕЛОК
<213> Bacillus thuringiensis
<400> 15
Met Asn Arg Asn Asn Gln Gly Glu Tyr Glu Ile Ile Asp Ala Ser Thr
1 5 10 15
Cys Gly Cys Ser Ser Asp Asp Val Val Gln Tyr Pro Leu Ala Arg Asp
20 25 30
Pro Asn Ala Ala Phe Gln Asn Met Asn Tyr Lys Asp Tyr Leu Lys Met
35 40 45
Ser Asp Gly Asp Tyr Val Asp Ser Tyr Ile Asn Pro Gly Leu Ser Ile
50 55 60
Gly Arg Arg Asp Val Thr Leu Thr Gly Val Gly Ile Val Ala Leu Ile
65 70 75 80
Val Gly Thr Leu Gly Gly Pro Val Gly Gly Ile Val Thr Gly Leu Ile
85 90 95
Ser Ser Leu Leu Gly Leu Leu Trp Pro Ser Asn Asp Asn Asp Val Trp
100 105 110
Glu Ala Phe Met Ala Gln Ile Glu Glu Leu Ile Glu Gln Arg Ile Ala
115 120 125
Asp Gln Val Val Arg Asn Ala Leu Asp Asn Leu Thr Gly Leu Arg Asp
130 135 140
Tyr Tyr Asn Gln Tyr Leu Leu Ala Leu Glu Glu Trp Gln Glu Arg Pro
145 150 155 160
Asn Ala Val Arg Ser Thr Leu Val Phe Asn Arg Phe Glu Thr Leu His
165 170 175
Ser His Phe Val Thr Ser Met Pro Ser Phe Gly Ser Gly Pro Gly Ser
180 185 190
Glu Arg Tyr Ala Val Gln Leu Leu Thr Val Tyr Ala Gln Ala Ala Asn
195 200 205
Leu His Leu Leu Leu Leu Arg Asp Ala Asp Ile Tyr Gly Ala Arg Trp
210 215 220
Gly Leu Arg Glu Ser Gln Ile Asp Leu Tyr Phe Asn Glu Leu Gln Asn
225 230 235 240
Arg Thr Arg Asp Tyr Thr Asn His Cys Val Thr Ala Tyr Asn Asn Gly
245 250 255
Leu Glu Glu Ile Arg Gly Thr Ser Pro Ala Ser Trp Leu Arg Tyr His
260 265 270
Gln Phe Arg Arg Glu Thr Thr Leu Ile Ala Leu Asp Leu Val Ala Ile
275 280 285
Phe Pro Tyr Tyr Asn Val Arg Glu Tyr Pro Ile Gly Val Asn Pro Gln
290 295 300
Leu Thr Arg Asp Val Tyr Thr Asp Pro Ile Gly Val Thr Phe Arg Arg
305 310 315 320
Glu Asp Trp Glu Thr Gly Val Glu Cys Arg Pro Trp Val Asn Thr Pro
325 330 335
Tyr Met Ser Phe Ser Asp Leu Glu Asn Ala Ile Ile Arg Pro Pro His
340 345 350
Leu Phe Glu Thr Leu Arg Asn Leu Thr Ile His Thr Gly Arg Tyr Asn
355 360 365
Leu Val Gly Gly Ala Arg Phe Ile Glu Gly Trp Val Gly His Ser Val
370 375 380
Thr Asn Thr Arg Leu Gly Asn Ser Thr Val Phe Thr Ser Asn Tyr Gly
385 390 395 400
Ser Leu Pro Pro Arg Phe Gln Val Phe Asn Phe Thr Asn Phe Asp Val
405 410 415
Tyr Gln Ile Asn Thr Arg Ala Asp Ser Thr Gly Thr Phe Arg Ile Pro
420 425 430
Gly Phe Ala Val Thr Arg Ala Gln Phe Ile Pro Gly Gly Thr Tyr Ser
435 440 445
Val Ala His Arg Asp Pro Gly Ala Cys Gln Gln Asp Tyr Asp Ser Ile
450 455 460
Glu Glu Leu Pro Ser Leu Asp Pro Asp Glu Pro Ile Asn Arg Ser Tyr
465 470 475 480
Ser His Arg Leu Ser His Val Thr Leu Tyr Lys Tyr Thr Leu Ser Asp
485 490 495
Thr Asp Tyr Gly Val Ile Asn Tyr Thr Asp Tyr Gly Ser Met Pro Ala
500 505 510
Tyr Val Trp Thr His Arg Asp Val Asp Leu Thr Asn Thr Ile Thr Ala
515 520 525
Asp Arg Ile Thr Gln Leu Pro Leu Val Lys Ala Ser Thr Leu Pro Ala
530 535 540
Gly Thr Thr Val Val Lys Gly Pro Gly Phe Thr Gly Gly Asp Ile Leu
545 550 555 560
Arg Arg Thr Thr Asn Gly Thr Phe Gly Thr Leu His Val Arg Val Asn
565 570 575
Ser Pro Leu Thr Gln Gln Tyr Arg Leu Arg Val Arg Phe Ala Ser Thr
580 585 590
Gly Asn Phe Ser Ile Arg Val Leu Arg Gly Gly Thr Ser Ile Gly Asp
595 600 605
Ala Arg Phe Gly Ser Thr Met Asn Arg Gly Gln Glu Leu Thr Tyr Glu
610 615 620
Ser Phe Val Thr Arg Glu Phe Thr Thr Thr Gly Pro Phe Asn Pro Pro
625 630 635 640
Phe Thr Phe Thr Gln Thr Gln Glu Ile Leu Thr Val Asn Ala Glu Gly
645 650 655
Val Ser Thr Gly Gly Glu Tyr Tyr Ile Asp Ser Ile Glu Ile Val Pro
660 665 670
Val Asn Pro Thr Arg Glu Ala Glu Glu Asp Leu Glu Ala Ala Lys Lys
675 680 685
Ala Val Ala Ser Leu Phe Thr Arg Thr Arg Asp Gly Leu Gln Val Asn
690 695 700
Val Thr Asp Tyr Gln Val Asp Arg Ala Ala Asn Leu Val Leu Cys Leu
705 710 715 720
Ser Asp Glu Gln Tyr Ala His Asp Lys Lys Met Leu Leu Glu Ala Val
725 730 735
Arg Ala Ala Lys Arg Leu Ser Arg Glu Arg Asn Leu Leu Gln Asp Pro
740 745 750
Asp Phe Asn Glu Ile Asn Ser Thr Glu Asp Ser Gly Trp Lys Thr Ser
755 760 765
Asn Gly Ile Ile Ile Ser Glu Gly Gly Pro Phe Phe Lys Gly Arg Ala
770 775 780
Leu Gln Leu Ala Ser Ala Arg Glu Asn Tyr Pro Thr Tyr Ile Tyr Gln
785 790 795 800
Lys Val Asp Ser Ser Met Leu Lys Pro Tyr Thr Arg Tyr Lys Leu Asp
805 810 815
Gly Phe Val Gln Ser Ser Gln Asp Leu Glu Ile Glu Leu Ile His His
820 825 830
His Lys Val His Leu Val Lys Asn Val Pro Asp Asn Leu Val Leu Asp
835 840 845
Thr Tyr Pro Asp Gly Ser Cys Asn Gly Ile Asn Arg Cys Glu Glu Gln
850 855 860
Gln Met Val Asn Ser Gln Leu Glu Thr Glu His His Pro Met Asp Cys
865 870 875 880
Cys Glu Ala Ser Gln Thr His Glu Phe Ser Ser Tyr Ile His Thr Gly
885 890 895
Asp Leu Asn Ala Ser Val Asp Gln Gly Ile Trp Val Val Leu Lys Ile
900 905 910
Arg Thr Thr Asp Gly Ser Ala Thr Leu Gly Asn Leu Glu Leu Val Glu
915 920 925
Val Gly Pro Leu Ser Gly Glu Ser Leu Glu Arg Glu Gln Arg Asp Asn
930 935 940
Ala Lys Trp Asn Ala Glu Leu Gly Arg Lys Arg Ala Glu Ala Asp Arg
945 950 955 960
Val Tyr Gln Gly Ala Lys Gln Ala Ile Asn His Leu Phe Val Asp Tyr
965 970 975
Gln Asp Gln Gln Leu Asn Pro Glu Val Gly Leu Ala Glu Ile Ser Glu
980 985 990
Ala Arg Asn Leu Ile Glu Ser Ile Ser Asp Val Tyr Cys Asp Ala Val
995 1000 1005
Leu Arg Ile Pro Gly Ile Asn Tyr Glu Met Tyr Thr Glu Leu Ser
1010 1015 1020
Asn Arg Leu Gln Gln Ala Ala Tyr Leu Tyr Thr Ser Arg Asn Ala
1025 1030 1035
Val Gln Asn Gly Asp Phe Asn Ser Gly Leu Asp Ser Trp Asn Ala
1040 1045 1050
Thr Thr Asp Ala Thr Val Gln Gln Asp Gly Asn Met Tyr Phe Leu
1055 1060 1065
Val Leu Ser His Trp Asp Ala Gln Val Ser Gln Gln Phe Arg Val
1070 1075 1080
Gln Pro Asn Cys Lys Tyr Val Leu Arg Val Thr Ala Lys Lys Val
1085 1090 1095
Gly Asn Gly Asp Gly Tyr Val Thr Ile Gln Asp Gly Ala His His
1100 1105 1110
Arg Glu Thr Leu Thr Phe Asn Ala Cys Asp Tyr Asp Val Asn Gly
1115 1120 1125
Thr His Val Asn Asp Asn Ser Tyr Ile Thr Lys Glu Leu Glu Phe
1130 1135 1140
Tyr Pro Lys Thr Glu His Met Trp Val Glu Val Ser Glu Thr Glu
1145 1150 1155
Gly Thr Phe Tyr Ile Asp Ser Ile Glu Leu Ile Glu Thr Gln Glu
1160 1165 1170
<210> 16
<211> 1179
<212> БЕЛОК
<213> Bacillus thuringiensis
<400> 16
Met Gly Gly Lys Ser Met Asn Arg Asn Asn Gln Gly Glu Tyr Glu Ile
1 5 10 15
Ile Asp Ala Ser Thr Cys Gly Cys Ser Ser Asp Asp Val Val Gln Tyr
20 25 30
Pro Leu Ala Arg Asp Pro Asn Ala Ala Phe Gln Asn Met Asn Tyr Lys
35 40 45
Asp Tyr Leu Lys Met Ser Asp Gly Asp Tyr Val Asp Ser Tyr Ile Asn
50 55 60
Pro Gly Leu Ser Ile Gly Arg Arg Asp Val Thr Leu Thr Gly Val Gly
65 70 75 80
Ile Val Ala Leu Ile Val Gly Thr Leu Gly Gly Pro Val Gly Gly Ile
85 90 95
Val Thr Gly Leu Ile Ser Ser Leu Leu Gly Leu Leu Trp Pro Ser Asn
100 105 110
Asp Asn Asp Val Trp Glu Ala Phe Met Ala Gln Ile Glu Glu Leu Ile
115 120 125
Glu Gln Arg Ile Ala Asp Gln Val Val Arg Asn Ala Leu Asp Asn Leu
130 135 140
Thr Gly Leu Arg Asp Tyr Tyr Asn Gln Tyr Leu Leu Ala Leu Glu Glu
145 150 155 160
Trp Gln Glu Arg Pro Asn Ala Val Arg Ser Thr Leu Val Phe Asn Arg
165 170 175
Phe Glu Thr Leu His Ser His Phe Val Thr Ser Met Pro Ser Phe Gly
180 185 190
Ser Gly Pro Gly Ser Glu Arg Tyr Ala Val Gln Leu Leu Thr Val Tyr
195 200 205
Ala Gln Ala Ala Asn Leu His Leu Leu Leu Leu Arg Asp Ala Asp Ile
210 215 220
Tyr Gly Ala Arg Trp Gly Leu Arg Glu Ser Gln Ile Asp Leu Tyr Phe
225 230 235 240
Asn Glu Leu Gln Asn Arg Thr Arg Asp Tyr Thr Asn His Cys Val Thr
245 250 255
Ala Tyr Asn Asn Gly Leu Glu Glu Ile Arg Gly Thr Ser Pro Ala Ser
260 265 270
Trp Leu Arg Tyr His Gln Phe Arg Arg Glu Thr Thr Leu Ile Ala Leu
275 280 285
Asp Leu Val Ala Ile Phe Pro Tyr Tyr Asn Val Arg Glu Tyr Pro Ile
290 295 300
Gly Val Asn Pro Gln Leu Thr Arg Asp Val Tyr Thr Asp Pro Ile Gly
305 310 315 320
Val Thr Phe Arg Arg Glu Asp Trp Glu Thr Gly Val Glu Cys Arg Pro
325 330 335
Trp Val Asn Thr Pro Tyr Met Ser Phe Ser Asp Leu Glu Asn Ala Ile
340 345 350
Ile Arg Pro Pro His Leu Phe Glu Thr Leu Arg Asn Leu Thr Ile His
355 360 365
Thr Gly Arg Tyr Asn Leu Val Gly Gly Ala Arg Phe Ile Glu Gly Trp
370 375 380
Val Gly His Ser Val Thr Asn Thr Arg Leu Gly Asn Ser Thr Val Phe
385 390 395 400
Thr Ser Asn Tyr Gly Ser Leu Pro Pro Arg Phe Gln Val Phe Asn Phe
405 410 415
Thr Asn Phe Asp Val Tyr Gln Ile Asn Thr Arg Ala Asp Ser Thr Gly
420 425 430
Thr Phe Arg Ile Pro Gly Phe Ala Val Thr Arg Ala Gln Phe Ile Pro
435 440 445
Gly Gly Thr Tyr Ser Val Ala His Arg Asp Pro Gly Ala Cys Gln Gln
450 455 460
Asp Tyr Asp Ser Ile Glu Glu Leu Pro Ser Leu Asp Pro Asp Glu Pro
465 470 475 480
Ile Asn Arg Ser Tyr Ser His Arg Leu Ser His Val Thr Leu Tyr Lys
485 490 495
Tyr Thr Leu Ser Asp Thr Asp Tyr Gly Val Ile Asn Tyr Thr Asp Tyr
500 505 510
Gly Ser Met Pro Ala Tyr Val Trp Thr His Arg Asp Val Asp Leu Thr
515 520 525
Asn Thr Ile Thr Ala Asp Arg Ile Thr Gln Leu Pro Leu Val Lys Ala
530 535 540
Ser Thr Leu Pro Ala Gly Thr Thr Val Val Lys Gly Pro Gly Phe Thr
545 550 555 560
Gly Gly Asp Ile Leu Arg Arg Thr Thr Asn Gly Thr Phe Gly Thr Leu
565 570 575
His Val Arg Val Asn Ser Pro Leu Thr Gln Gln Tyr Arg Leu Arg Val
580 585 590
Arg Phe Ala Ser Thr Gly Asn Phe Ser Ile Arg Val Leu Arg Gly Gly
595 600 605
Thr Ser Ile Gly Asp Ala Arg Phe Gly Ser Thr Met Asn Arg Gly Gln
610 615 620
Glu Leu Thr Tyr Glu Ser Phe Val Thr Arg Glu Phe Thr Thr Thr Gly
625 630 635 640
Pro Phe Asn Pro Pro Phe Thr Phe Thr Gln Thr Gln Glu Ile Leu Thr
645 650 655
Val Asn Ala Glu Gly Val Ser Thr Gly Gly Glu Tyr Tyr Ile Asp Ser
660 665 670
Ile Glu Ile Val Pro Val Asn Pro Thr Arg Glu Ala Glu Glu Asp Leu
675 680 685
Glu Ala Ala Lys Lys Ala Val Ala Ser Leu Phe Thr Arg Thr Arg Asp
690 695 700
Gly Leu Gln Val Asn Val Thr Asp Tyr Gln Val Asp Gln Ala Ala Asn
705 710 715 720
Leu Val Ser Cys Leu Ser Asp Glu Gln Tyr Gly Tyr Asp Lys Lys Met
725 730 735
Leu Leu Glu Ala Val Arg Ala Ala Lys Arg Leu Ser Arg Glu Arg Asn
740 745 750
Leu Leu Gln Asp Pro Asp Phe Asn Thr Ile Asn Ser Thr Glu Glu Asn
755 760 765
Gly Trp Lys Ala Ser Asn Gly Val Thr Ile Ser Glu Gly Gly Pro Phe
770 775 780
Tyr Lys Gly Arg Ala Leu Gln Leu Ala Ser Ala Arg Glu Asn Tyr Pro
785 790 795 800
Thr Tyr Ile Tyr Gln Lys Val Asp Ala Ser Glu Leu Lys Pro Tyr Thr
805 810 815
Arg Tyr Arg Leu Asp Gly Phe Val Lys Ser Ser Gln Asp Leu Glu Ile
820 825 830
Asp Leu Ile His His His Lys Val His Leu Val Lys Asn Val Pro Asp
835 840 845
Asn Leu Val Ser Asp Thr Tyr Pro Asp Asp Ser Cys Ser Gly Ile Asn
850 855 860
Arg Cys Gln Glu Gln Gln Met Val Asn Ala Gln Leu Glu Thr Glu His
865 870 875 880
His His Pro Met Asp Cys Cys Glu Ala Ala Gln Thr His Glu Phe Ser
885 890 895
Ser Tyr Ile Asp Thr Gly Asp Leu Asn Ser Ser Val Asp Gln Gly Ile
900 905 910
Trp Ala Ile Phe Lys Val Arg Thr Thr Asp Gly Tyr Ala Thr Leu Gly
915 920 925
Asn Leu Glu Leu Val Glu Val Gly Pro Leu Ser Gly Glu Ser Leu Glu
930 935 940
Arg Glu Gln Arg Asp Asn Thr Lys Trp Ser Ala Glu Leu Gly Arg Lys
945 950 955 960
Arg Ala Glu Thr Asp Arg Val Tyr Gln Asp Ala Lys Gln Ser Ile Asn
965 970 975
His Leu Phe Val Asp Tyr Gln Asp Gln Gln Leu Asn Pro Glu Ile Gly
980 985 990
Met Ala Asp Ile Met Asp Ala Gln Asn Leu Val Ala Ser Ile Ser Asp
995 1000 1005
Val Tyr Ser Asp Ala Val Leu Gln Ile Pro Gly Ile Asn Tyr Glu
1010 1015 1020
Ile Tyr Thr Glu Leu Ser Asn Arg Leu Gln Gln Ala Ser Tyr Leu
1025 1030 1035
Tyr Thr Ser Arg Asn Ala Val Gln Asn Gly Asp Phe Asn Asn Gly
1040 1045 1050
Leu Asp Ser Trp Asn Ala Thr Ala Gly Ala Ser Val Gln Gln Asp
1055 1060 1065
Gly Asn Thr His Phe Leu Val Leu Ser His Trp Asp Ala Gln Val
1070 1075 1080
Ser Gln Gln Phe Arg Val Gln Pro Asn Cys Lys Tyr Val Leu Arg
1085 1090 1095
Val Thr Ala Glu Lys Val Gly Gly Gly Asp Gly Tyr Val Thr Ile
1100 1105 1110
Arg Asp Gly Ala His His Thr Glu Thr Leu Thr Phe Asn Ala Cys
1115 1120 1125
Asp Tyr Asp Ile Asn Gly Thr Tyr Val Thr Asp Asn Thr Tyr Leu
1130 1135 1140
Thr Lys Glu Val Ile Phe Tyr Ser His Thr Glu His Met Trp Val
1145 1150 1155
Glu Val Asn Glu Thr Glu Gly Ala Phe His Ile Asp Ser Ile Glu
1160 1165 1170
Phe Val Glu Thr Glu Lys
1175
<210> 17
<211> 1147
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мутант BT-0044
<400> 17
Met Asp Leu Asp Gly Asn Lys Thr Glu Thr Glu Thr Glu Ile Val Asn
1 5 10 15
Gly Ser Glu Ser Ser Ile Asp Pro Ser Ser Val Ser Tyr Ala Gly Asn
20 25 30
Asn Ser Tyr Ser Ser Ala Leu Asn Leu Asn Ser Cys Gln Asn Arg Gly
35 40 45
Ile Ala Gln Trp Val Asn Thr Leu Gly Gly Ala Ile Gly Gln Ala Val
50 55 60
Ser Ile Gly Thr Ser Ile Ile Ser Leu Leu Ala Ala Pro Thr Leu Thr
65 70 75 80
Gly Ser Ile Ser Leu Ala Phe Asn Leu Ile Arg Arg Met Gly Thr Gly
85 90 95
Ser Asn Gly Ser Ser Ile Ser Asp Leu Ser Ile Cys Asp Leu Leu Ser
100 105 110
Ile Ile Asn Leu Arg Val Ser Gln Ala Val Leu Asn Asp Gly Ile Ala
115 120 125
Asp Phe Asn Gly Ser Val Ala Val Tyr Asp Leu Tyr Leu His Ala Leu
130 135 140
Arg Ser Trp Asn Asn Asn Pro Asn Ala Ala Thr Ala Glu Glu Leu Arg
145 150 155 160
Thr Arg Phe Arg Ile Ala Asp Ser Glu Phe Glu Arg Ile Leu Thr Arg
165 170 175
Gly Ser Leu Thr His Gly Gly Ser Leu Ala Arg Gln Asp Ala Gln Val
180 185 190
Leu Leu Leu Pro Ser Phe Val Asn Ala Ala Tyr Leu His Leu Leu Ile
195 200 205
Leu Arg Asp Ala Ser Arg Tyr Gly Ala Ser Trp Gly Leu Phe Asn Thr
210 215 220
Thr Pro His Ile Asn Tyr Pro Val Arg Leu Gln Gln Leu Ile Gly Ser
225 230 235 240
Tyr Thr His Tyr Cys Thr His Trp Tyr Asn Gln Gly Leu Asn Glu Ile
245 250 255
Arg Gln Arg Gly Asn Thr Ala Val Asn Trp Leu Glu Phe His Arg Tyr
260 265 270
Arg Arg Asp Met Thr Leu Met Val Leu Asp Val Val Ser Leu Phe Ser
275 280 285
Ala Leu Asp Thr Ile Arg Tyr Pro Asn Ala Thr Val Val Gln Leu Ser
290 295 300
Arg Thr Val Tyr Thr Asp Pro Ile Gly Phe Val Asn Arg Gly Ser Gly
305 310 315 320
Asn Arg Leu Ser Trp Phe Asp Trp Arg Asn Gln Ala Asn Phe Ser Thr
325 330 335
Leu Glu Ser Glu Met Pro Thr Pro Ser Ser Pro Leu Ser Leu Asn His
340 345 350
Met Ser Ile Phe Thr Gly Pro Leu Thr Leu Pro Val Ser Pro Asn Thr
355 360 365
His Arg Ala Arg Val Trp Tyr Gly Asn Gln Asn Met Phe Thr Thr Gly
370 375 380
Ser Gln Asn Ser Gly Gln Thr Thr Asn Ser Ile Gln Asn Ile Ser Gly
385 390 395 400
Leu Glu Ile Phe Arg Ile Asp Ser Gln Ala Cys Asn Leu Asn Asn Asn
405 410 415
Ser Tyr Gly Val Asn Arg Ala Glu Phe Phe His Gly Ala Ser Gln Gly
420 425 430
Ser Gln Arg Ser Val Tyr Gln Gly Tyr Ile Arg Gln Ser Gly Leu Asp
435 440 445
Asn Pro Val Val Met Asn Leu Gln Ser Phe Leu Pro Gly Glu Asn Ser
450 455 460
Ala Thr Pro Thr Ala Gln Asp Tyr Thr His Ile Leu Ser Asn Pro Val
465 470 475 480
Asn Ile Arg Gly Gly Leu Arg Gln Ile Val Ala Asp Arg Arg Ser Ser
485 490 495
Val Val Val Tyr Gly Trp Thr His Lys Ser Leu Ser Arg Arg Ser Leu
500 505 510
Val Ala Pro Asp Gln Ile Thr Gln Val Pro Ala Val Lys Ala Ser Pro
515 520 525
Ser Ser His Cys Thr Ile Ile Ala Gly Pro Gly Phe Thr Gly Gly Asp
530 535 540
Leu Val Ser Leu Gln Pro Asn Gly Gln Leu Val Ile Pro Phe Gln Val
545 550 555 560
Ser Ala Pro Glu Thr Asn Tyr His Ile Arg Ile Cys Tyr Val Ser Thr
565 570 575
Ser Asp Cys Ser Ile Asn Thr Ile Cys Asn Asp Glu Thr His Leu Ser
580 585 590
Thr Leu Pro Ser Thr Thr Ser Ser Leu Glu Asn Leu Gln Cys Asn His
595 600 605
Leu His Tyr Phe Asn Val Gly Thr Phe Lys Pro Thr Ile Asp Ser Lys
610 615 620
Leu Thr Leu Val Asn Thr Ser Pro Asn Ala Asn Ile Ile Ile Asp Lys
625 630 635 640
Ile Glu Phe Ile Pro Val Asp Thr Ala Gln Gln Gln Asn Glu Asp Leu
645 650 655
Glu Ala Ala Lys Lys Ala Val Ala Ser Leu Phe Thr Arg Thr Arg Asp
660 665 670
Gly Leu Gln Val Asn Val Lys Asp Tyr Gln Val Asp Gln Ala Ala Asn
675 680 685
Leu Val Ser Cys Leu Ser Asp Glu Gln Tyr Gly Tyr Asp Lys Lys Met
690 695 700
Leu Leu Glu Ala Val Arg Ala Ala Lys Arg Leu Ser Arg Glu Arg Asn
705 710 715 720
Leu Leu Gln Asp Pro Asp Phe Asn Thr Ile Asn Ser Thr Glu Glu Asn
725 730 735
Gly Trp Lys Ala Ser Asn Gly Val Thr Ile Ser Glu Gly Gly Pro Phe
740 745 750
Tyr Lys Gly Arg Ala Ile Gln Leu Ala Ser Ala Arg Glu Asn Tyr Pro
755 760 765
Thr Tyr Ile Tyr Gln Lys Val Asp Ala Ser Glu Leu Lys Pro Tyr Thr
770 775 780
Arg Tyr Arg Leu Asp Gly Phe Val Lys Ser Ser Gln Asp Leu Glu Ile
785 790 795 800
Asp Leu Ile His His His Lys Val His Leu Val Lys Asn Val Pro Asp
805 810 815
Asn Leu Val Ser Asp Thr Tyr Pro Asp Asp Ser Cys Ser Gly Ile Asn
820 825 830
Arg Cys Gln Glu Gln Gln Met Val Asn Ala Gln Leu Glu Thr Glu His
835 840 845
His His Pro Met Asp Cys Cys Glu Ala Ala Gln Thr His Glu Phe Ser
850 855 860
Ser Tyr Ile Asp Thr Gly Asp Leu Asn Ser Ser Val Asp Gln Gly Ile
865 870 875 880
Trp Ala Ile Phe Lys Val Arg Thr Thr Asp Gly Tyr Ala Thr Leu Gly
885 890 895
Asn Leu Glu Leu Val Glu Val Gly Pro Leu Ser Gly Glu Ser Leu Glu
900 905 910
Arg Glu Gln Arg Asp Asn Thr Lys Trp Ser Ala Glu Leu Gly Arg Lys
915 920 925
Arg Ala Glu Thr Asp Arg Val Tyr Gln Asp Ala Lys Gln Ser Ile Asn
930 935 940
His Leu Phe Val Asp Tyr Gln Asp Gln Gln Leu Asn Pro Glu Ile Gly
945 950 955 960
Met Ala Asp Ile Met Asp Ala Gln Asn Leu Val Ala Ser Ile Ser Asp
965 970 975
Val Tyr Ser Asp Ala Val Leu Gln Ile Pro Gly Ile Asn Tyr Glu Ile
980 985 990
Tyr Thr Glu Leu Ser Asn Arg Leu Gln Gln Ala Ser Tyr Leu Tyr Thr
995 1000 1005
Ser Arg Asn Ala Val Gln Asn Gly Asp Phe Asn Asn Gly Leu Asp
1010 1015 1020
Ser Trp Asn Ala Thr Ala Gly Ala Ser Val Gln Gln Asp Gly Asn
1025 1030 1035
Thr His Phe Leu Val Leu Ser His Trp Asp Ala Gln Val Ser Gln
1040 1045 1050
Gln Phe Arg Val Gln Pro Asn Cys Lys Tyr Val Leu Arg Val Thr
1055 1060 1065
Ala Glu Lys Val Gly Gly Gly Asp Gly Tyr Val Thr Ile Arg Asp
1070 1075 1080
Asp Ala His His Thr Glu Thr Leu Thr Phe Asn Ala Cys Asp Tyr
1085 1090 1095
Asp Ile Asn Gly Thr Tyr Val Thr Asp Asn Thr Tyr Ile Thr Lys
1100 1105 1110
Glu Val Val Phe His Pro Glu Thr Gln His Met Trp Val Glu Val
1115 1120 1125
Asn Glu Thr Glu Gly Ala Phe His Leu Asp Ser Ile Glu Phe Val
1130 1135 1140
Glu Thr Glu Lys
1145
<210> 18
<211> 1157
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мутант BT-0051
<400> 18
Met Asn Arg Asn Asn Gln Asn Glu Tyr Glu Ile Ile Asp Ala Pro His
1 5 10 15
Cys Gly Cys Pro Ser Asp Asp Asp Val Lys Tyr Pro Leu Ala Ser Asp
20 25 30
Pro Asn Ala Ala Leu Gln Asn Met Asn Tyr Lys Asp Tyr Leu Gln Met
35 40 45
Thr Asp Glu Asp Tyr Thr Asp Ser Tyr Ile Asn Pro Ser Leu Ser Ile
50 55 60
Ser Gly Arg Asp Ala Val Gln Thr Ala Leu Thr Val Val Gly Arg Ile
65 70 75 80
Leu Gly Ala Leu Gly Val Pro Phe Ser Gly Gln Ile Val Ser Phe Tyr
85 90 95
Gln Phe Leu Leu Asn Thr Leu Trp Pro Val Asn Asp Thr Ala Ile Trp
100 105 110
Glu Ala Phe Met Arg Gln Val Glu Glu Leu Val Asn Gln Gln Ile Thr
115 120 125
Glu Phe Ala Arg Asn Gln Ala Leu Ala Arg Leu Gln Gly Leu Gly Asp
130 135 140
Ser Phe Asn Val Tyr Gln Arg Ser Leu Gln Asn Trp Leu Ala Asp Arg
145 150 155 160
Asn Asp Thr Arg Asn Leu Ser Val Val Arg Ala Gln Phe Ile Ala Leu
165 170 175
Asp Leu Asp Phe Val Asn Ala Ile Pro Leu Phe Ala Val Asn Gly Gln
180 185 190
Gln Val Pro Leu Leu Ser Val Tyr Ala Gln Ala Val Asn Leu His Leu
195 200 205
Leu Leu Leu Lys Asp Ala Ser Leu Phe Gly Glu Gly Trp Gly Phe Thr
210 215 220
Gln Gly Glu Ile Ser Thr His Tyr Asp Arg Gln Leu Glu Leu Thr Ala
225 230 235 240
Arg Tyr Thr Asn Tyr Cys Glu Thr Trp Tyr Asn Thr Gly Leu Asp Arg
245 250 255
Leu Arg Gly Thr Asn Thr Glu Ser Trp Leu Arg Tyr His Gln Phe Arg
260 265 270
Arg Glu Met Thr Leu Val Val Leu Asp Val Val Ala Leu Phe Pro Tyr
275 280 285
Tyr Asp Val Arg Leu Tyr Pro Thr Gly Ser Asn Pro Gln Leu Thr Arg
290 295 300
Glu Val Tyr Thr Asp Pro Ile Val Phe Asn Pro Pro Ala Asn Val Gly
305 310 315 320
Leu Cys Arg Arg Trp Gly Thr Asn Pro Tyr Asn Thr Phe Ser Glu Leu
325 330 335
Glu Asn Ala Phe Ile Arg Pro Pro His Leu Phe Asp Arg Ile Gln Ser
340 345 350
Leu Ser Ile Ser Ser Asn Arg Phe Pro Val Ser Ser Asn Phe Met Asp
355 360 365
Tyr Trp Ser Gly His Thr Leu Arg Arg Ser Tyr Leu Asn Asp Ser Ala
370 375 380
Val Gln Glu Asp Ser Tyr Gly Leu Ile Thr Thr Thr Arg Ala Thr Ile
385 390 395 400
Asn Pro Gly Val Asp Gly Thr Asn Arg Ile Glu Ser Thr Ala Val Asp
405 410 415
Phe Arg Ser Ala Leu Ile Gly Ile Tyr Gly Val Asn Arg Ala Ser Phe
420 425 430
Val Pro Gly Gly Leu Phe Asn Gly Thr Thr Ser Pro Ala Asn Gly Gly
435 440 445
Cys Arg Asp Leu Tyr Asp Thr Asn Asp Glu Leu Pro Pro Asp Glu Ser
450 455 460
Thr Gly Ser Ser Thr His Arg Leu Ser His Val Thr Phe Phe Ser Phe
465 470 475 480
Gln Thr Asn Gln Ala Gly Ser Ile Ala Asn Ala Gly Ser Val Pro Thr
485 490 495
Tyr Val Trp Thr Arg Arg Asp Val Asp Leu Asn Asn Thr Ile Thr Pro
500 505 510
Asn Arg Ile Thr Gln Leu Pro Leu Val Lys Ala Ser Ala Pro Val Ser
515 520 525
Gly Thr Thr Val Leu Lys Gly Pro Gly Phe Thr Gly Gly Gly Ile Leu
530 535 540
Arg Arg Thr Thr Asn Gly Thr Phe Gly Thr Leu Arg Val Thr Val Asn
545 550 555 560
Ser Pro Leu Thr Gln Gln Tyr Arg Leu Arg Val Arg Phe Ala Ser Thr
565 570 575
Gly Asn Phe Ser Ile Arg Leu Leu Arg Gly Gly Val Ser Ile Gly Asp
580 585 590
Val Arg Leu Gly Ser Thr Met Asn Arg Gly Gln Glu Leu Thr Tyr Glu
595 600 605
Ser Phe Phe Thr Arg Glu Phe Thr Thr Thr Gly Pro Phe Asn Pro Pro
610 615 620
Phe Thr Phe Thr Gln Ala Gln Glu Ile Leu Thr Val Asn Ala Glu Gly
625 630 635 640
Val Ser Thr Gly Gly Glu Tyr Tyr Ile Asp Arg Ile Glu Ile Val Pro
645 650 655
Val Asn Pro Ala Arg Glu Ala Glu Glu Asp Leu Glu Ala Ala Lys Lys
660 665 670
Ala Val Ala Ser Leu Phe Thr Arg Thr Arg Asp Gly Leu Gln Val Asn
675 680 685
Val Thr Asp Tyr Gln Val Asp Arg Ala Ala Asn Leu Val Ser Cys Leu
690 695 700
Ser Asp Glu Gln Tyr Ser His Asp Lys Lys Met Leu Leu Glu Ala Val
705 710 715 720
Arg Ala Ala Lys Arg Leu Ser Arg Glu Arg Asn Leu Leu Gln Asp Pro
725 730 735
Asp Phe Asn Thr Ile Asn Ser Thr Glu Glu Asn Gly Trp Lys Ala Ser
740 745 750
Asn Gly Val Thr Ile Ser Glu Gly Gly Pro Phe Phe Lys Gly Arg Ala
755 760 765
Leu Gln Leu Ala Ser Ala Arg Glu Asn Tyr Pro Thr Tyr Ile Tyr Gln
770 775 780
Lys Val Asp Ala Ser Val Leu Lys Pro Tyr Thr Arg Tyr Arg Leu Asp
785 790 795 800
Gly Phe Val Lys Ser Ser Gln Asp Leu Glu Ile Asp Leu Ile His His
805 810 815
His Lys Val His Leu Val Lys Asn Val Pro Asp Asn Leu Val Ser Asp
820 825 830
Thr Tyr Ser Asp Gly Ser Cys Ser Gly Ile Asn Arg Cys Asp Glu Gln
835 840 845
Gln Gln Val Asp Met Gln Leu Asp Ala Glu His His Pro Met Asp Cys
850 855 860
Cys Glu Ala Ala Gln Thr His Glu Phe Ser Ser Tyr Ile Asn Thr Gly
865 870 875 880
Asp Leu Asn Ala Ser Val Asp Gln Gly Ile Trp Val Val Leu Lys Val
885 890 895
Arg Thr Thr Asp Gly Tyr Ala Thr Leu Gly Asn Leu Glu Leu Val Glu
900 905 910
Val Gly Pro Leu Ser Gly Glu Ser Leu Glu Arg Glu Gln Arg Asp Asn
915 920 925
Ala Lys Trp Asn Ala Glu Leu Gly Arg Lys Arg Ala Glu Thr Asp Arg
930 935 940
Val Tyr Leu Ala Ala Lys Gln Ala Ile Asn His Leu Phe Val Asp Tyr
945 950 955 960
Gln Asp Gln Gln Leu Asn Pro Glu Ile Gly Leu Ala Glu Ile Asn Glu
965 970 975
Ala Ser Asn Leu Val Lys Ser Ile Ser Gly Val Tyr Ser Asp Thr Leu
980 985 990
Leu Gln Ile Pro Gly Ile Asn Tyr Glu Ile Tyr Thr Glu Leu Ser Asp
995 1000 1005
Arg Leu Gln Gln Ala Ser Tyr Leu Tyr Thr Ser Arg Asn Ala Val
1010 1015 1020
Gln Asn Gly Asp Phe Asn Ser Gly Leu Asp Ser Trp Asn Ala Thr
1025 1030 1035
Thr Asp Ala Ser Val Gln Gln Asp Gly Ser Thr His Phe Leu Val
1040 1045 1050
Leu Ser His Trp Asp Ala Gln Val Ser Gln Gln Met Arg Val Asn
1055 1060 1065
Leu Asn Cys Lys Tyr Val Leu Arg Val Thr Ala Lys Lys Val Gly
1070 1075 1080
Gly Gly Asp Gly Tyr Val Thr Ile Arg Asp Gly Ala His His Gln
1085 1090 1095
Glu Thr Leu Thr Phe Asn Ala Cys Asp Tyr Asp Val Asn Gly Thr
1100 1105 1110
Tyr Val Asn Asp Asn Ser Tyr Ile Thr Lys Glu Val Val Phe Tyr
1115 1120 1125
Pro Glu Thr Lys His Met Trp Val Glu Val Ser Glu Ser Glu Gly
1130 1135 1140
Ser Phe Tyr Ile Asp Ser Ile Glu Phe Ile Glu Thr Gln Glu
1145 1150 1155
<210> 19
<211> 1173
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мутант BT-0068
<400> 19
Met Asn Arg Asn Asn Gln Gly Glu Tyr Glu Ile Ile Asp Ala Ser Thr
1 5 10 15
Cys Gly Cys Ser Ser Asp Asp Val Val Gln Tyr Pro Leu Ala Arg Asp
20 25 30
Pro Asn Ala Ala Phe Gln Asn Met Asn Tyr Lys Asp Tyr Leu Lys Met
35 40 45
Ser Asp Gly Asp Tyr Val Asp Ser Tyr Ile Asn Pro Gly Leu Ser Ile
50 55 60
Gly Arg Arg Asp Val Thr Leu Thr Gly Val Gly Ile Val Ala Leu Ile
65 70 75 80
Val Gly Thr Leu Gly Gly Pro Val Gly Gly Ile Val Thr Gly Leu Ile
85 90 95
Ser Ser Leu Leu Gly Leu Leu Trp Pro Ser Asn Asp Asn Asp Val Trp
100 105 110
Glu Ala Phe Met Ala Gln Ile Glu Glu Leu Ile Glu Gln Arg Ile Ala
115 120 125
Asp Gln Val Val Arg Asn Ala Leu Asp Asn Leu Thr Gly Leu Arg Asp
130 135 140
Tyr Tyr Asn Gln Tyr Leu Leu Ala Leu Glu Glu Trp Gln Glu Arg Pro
145 150 155 160
Asn Ala Val Arg Ser Thr Leu Val Phe Asn Arg Phe Glu Thr Leu His
165 170 175
Ser His Phe Val Thr Ser Met Pro Ser Phe Gly Ser Gly Pro Gly Ser
180 185 190
Glu Arg Tyr Ala Val Gln Leu Leu Thr Val Tyr Ala Gln Ala Ala Asn
195 200 205
Leu His Leu Leu Leu Leu Arg Asp Ala Asp Ile Tyr Gly Ala Arg Trp
210 215 220
Gly Leu Arg Glu Ser Gln Ile Asp Leu Tyr Phe Asn Glu Leu Gln Asn
225 230 235 240
Arg Thr Arg Asp Tyr Thr Asn His Cys Val Thr Ala Tyr Asn Asn Gly
245 250 255
Leu Glu Glu Ile Arg Gly Thr Ser Pro Ala Ser Trp Leu Arg Tyr His
260 265 270
Gln Phe Arg Arg Glu Thr Thr Leu Ile Ala Leu Asp Leu Val Ala Ile
275 280 285
Phe Pro Tyr Tyr Asn Val Arg Glu Tyr Pro Ile Gly Val Asn Pro Gln
290 295 300
Leu Thr Arg Asp Val Tyr Thr Asp Pro Ile Gly Val Thr Phe Arg Arg
305 310 315 320
Glu Asp Trp Glu Thr Gly Val Glu Cys Arg Pro Trp Val Asn Thr Pro
325 330 335
Tyr Met Ser Phe Ser Asp Leu Glu Asn Ala Ile Ile Arg Pro Pro His
340 345 350
Leu Phe Glu Thr Leu Arg Asn Leu Thr Ile His Thr Gly Arg Tyr Asn
355 360 365
Leu Val Gly Gly Ala Arg Phe Ile Glu Gly Trp Val Gly His Ser Val
370 375 380
Thr Asn Thr Arg Leu Gly Asn Ser Thr Val Phe Thr Ser Asn Tyr Gly
385 390 395 400
Ser Leu Pro Pro Arg Phe Gln Val Phe Asn Phe Thr Asn Phe Asp Val
405 410 415
Tyr Gln Ile Asn Thr Arg Ala Asp Ser Thr Gly Thr Phe Arg Ile Pro
420 425 430
Gly Phe Ala Val Thr Arg Ala Gln Phe Ile Pro Gly Gly Thr Tyr Ser
435 440 445
Val Ala His Arg Asp Pro Gly Ala Cys Gln Gln Asp Tyr Asp Ser Ile
450 455 460
Glu Glu Leu Pro Ser Leu Asp Pro Asp Glu Pro Ile Asn Arg Ser Tyr
465 470 475 480
Ser His Arg Leu Ser His Val Thr Leu Tyr Lys Tyr Thr Leu Ser Asp
485 490 495
Thr Asp Tyr Gly Val Ile Asn Tyr Thr Asp Tyr Gly Ser Met Pro Ala
500 505 510
Tyr Val Trp Thr His Arg Asp Val Asp Leu Thr Asn Thr Ile Thr Ala
515 520 525
Asp Arg Ile Thr Gln Leu Pro Leu Val Lys Ala Ser Thr Leu Pro Ala
530 535 540
Gly Thr Thr Val Val Lys Gly Pro Gly Phe Thr Gly Gly Asp Ile Leu
545 550 555 560
Arg Arg Thr Thr Asn Gly Thr Phe Gly Thr Leu His Val Arg Val Asn
565 570 575
Ser Pro Leu Thr Gln Gln Tyr Arg Leu Arg Val Arg Phe Ala Ser Thr
580 585 590
Gly Asn Phe Ser Ile Arg Val Leu Arg Gly Gly Thr Ser Ile Gly Asp
595 600 605
Ala Arg Phe Gly Ser Thr Met Asn Arg Gly Gln Glu Leu Thr Tyr Glu
610 615 620
Ser Phe Val Thr Arg Glu Phe Thr Thr Thr Gly Pro Phe Asn Pro Pro
625 630 635 640
Phe Thr Phe Thr Gln Thr Gln Glu Ile Leu Thr Val Asn Ala Glu Gly
645 650 655
Val Ser Thr Gly Gly Glu Tyr Tyr Ile Asp Ser Ile Glu Ile Val Pro
660 665 670
Val Asn Pro Thr Arg Glu Ala Glu Glu Asp Leu Glu Ala Ala Lys Lys
675 680 685
Ala Val Ala Ser Leu Phe Thr Arg Thr Arg Asp Gly Leu Gln Val Asn
690 695 700
Val Thr Asp Tyr Gln Val Asp Arg Ala Ala Asn Leu Val Leu Cys Leu
705 710 715 720
Ser Asp Glu Gln Tyr Ala His Asp Lys Lys Met Leu Leu Glu Ala Val
725 730 735
Arg Ala Ala Lys Arg Leu Ser Arg Glu Arg Asn Leu Leu Gln Asp Pro
740 745 750
Asp Phe Asn Glu Ile Asn Ser Thr Glu Asp Ser Gly Trp Lys Thr Ser
755 760 765
Asn Gly Ile Ile Ile Ser Glu Gly Gly Pro Phe Phe Lys Gly Arg Ala
770 775 780
Leu Gln Leu Ala Ser Ala Arg Glu Asn Tyr Pro Thr Tyr Ile Tyr Gln
785 790 795 800
Lys Val Asp Ser Ser Met Leu Lys Pro Tyr Thr Arg Tyr Lys Leu Asp
805 810 815
Gly Phe Val Gln Ser Ser Gln Asp Leu Glu Ile Glu Leu Ile His His
820 825 830
His Lys Val His Leu Val Lys Asn Val Pro Asp Asn Leu Val Leu Asp
835 840 845
Thr Tyr Pro Asp Gly Ser Cys Asn Gly Ile Asn Arg Cys Glu Glu Gln
850 855 860
Gln Met Val Asn Ser Gln Leu Glu Thr Glu His His Pro Met Asp Cys
865 870 875 880
Cys Glu Ala Ser Gln Thr His Glu Phe Ser Ser Tyr Ile His Thr Gly
885 890 895
Asp Leu Asn Ala Ser Val Asp Gln Gly Ile Trp Val Val Leu Lys Ile
900 905 910
Arg Thr Thr Asp Gly Ser Ala Thr Leu Gly Asn Leu Glu Leu Val Glu
915 920 925
Val Gly Pro Leu Ser Gly Glu Ser Leu Glu Arg Glu Gln Arg Asp Asn
930 935 940
Ala Lys Trp Asn Ala Glu Leu Gly Arg Lys Arg Ala Glu Ala Asp Arg
945 950 955 960
Val Tyr Gln Gly Ala Lys Gln Ala Ile Asn His Leu Phe Val Asp Tyr
965 970 975
Gln Asp Gln Gln Leu Asn Pro Glu Val Gly Leu Ala Glu Ile Ser Glu
980 985 990
Ala Arg Asn Leu Ile Glu Ser Ile Ser Asp Val Tyr Cys Asp Ala Val
995 1000 1005
Leu Arg Ile Pro Gly Ile Asn Tyr Glu Met Tyr Thr Glu Leu Ser
1010 1015 1020
Asn Arg Leu Gln Gln Ala Ala Tyr Leu Tyr Thr Ser Arg Asn Ala
1025 1030 1035
Val Gln Asn Gly Asp Phe Asn Ser Gly Leu Asp Ser Trp Asn Ala
1040 1045 1050
Thr Thr Asp Ala Thr Val Gln Gln Asp Gly Asn Met Tyr Phe Leu
1055 1060 1065
Val Leu Ser His Trp Asp Ala Gln Val Ser Gln Gln Phe Arg Val
1070 1075 1080
Gln Pro Asn Cys Lys Tyr Val Leu Arg Val Thr Ala Lys Lys Val
1085 1090 1095
Gly Asn Gly Asp Gly Tyr Val Thr Ile Gln Asp Gly Ala His His
1100 1105 1110
Arg Glu Thr Leu Thr Phe Asn Ala Cys Asp Tyr Asp Val Asn Gly
1115 1120 1125
Thr His Val Asn Asp Asn Ser Tyr Ile Thr Lys Glu Leu Glu Phe
1130 1135 1140
Tyr Pro Lys Thr Glu His Met Trp Val Glu Val Ser Glu Thr Glu
1145 1150 1155
Gly Thr Phe Tyr Ile Asp Ser Ile Glu Leu Ile Glu Thr Gln Glu
1160 1165 1170
<210> 20
<211> 1179
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мутант BT-0128
<400> 20
Met Gly Gly Lys Ser Met Asn Arg Asn Asn Gln Gly Glu Tyr Glu Ile
1 5 10 15
Ile Asp Ala Ser Thr Cys Gly Cys Ser Ser Asp Asp Val Val Gln Tyr
20 25 30
Pro Leu Ala Arg Asp Pro Asn Ala Ala Phe Gln Asn Met Asn Tyr Lys
35 40 45
Asp Tyr Leu Lys Met Ser Asp Gly Asp Tyr Val Asp Ser Tyr Ile Asn
50 55 60
Pro Gly Leu Ser Ile Gly Arg Arg Asp Val Thr Leu Thr Gly Val Gly
65 70 75 80
Ile Val Ala Leu Ile Val Gly Thr Leu Gly Gly Pro Val Gly Gly Ile
85 90 95
Val Thr Gly Leu Ile Ser Ser Leu Leu Gly Leu Leu Trp Pro Ser Asn
100 105 110
Asp Asn Asp Val Trp Glu Ala Phe Met Ala Gln Ile Glu Glu Leu Ile
115 120 125
Glu Gln Arg Ile Ala Asp Gln Val Val Arg Asn Ala Leu Asp Asn Leu
130 135 140
Thr Gly Leu Arg Asp Tyr Tyr Asn Gln Tyr Leu Leu Ala Leu Glu Glu
145 150 155 160
Trp Gln Glu Arg Pro Asn Ala Val Arg Ser Thr Leu Val Phe Asn Arg
165 170 175
Phe Glu Thr Leu His Ser His Phe Val Thr Ser Met Pro Ser Phe Gly
180 185 190
Ser Gly Pro Gly Ser Glu Arg Tyr Ala Val Gln Leu Leu Thr Val Tyr
195 200 205
Ala Gln Ala Ala Asn Leu His Leu Leu Leu Leu Arg Asp Ala Asp Ile
210 215 220
Tyr Gly Ala Arg Trp Gly Leu Arg Glu Ser Gln Ile Asp Leu Tyr Phe
225 230 235 240
Asn Glu Leu Gln Asn Arg Thr Arg Asp Tyr Thr Asn His Cys Val Thr
245 250 255
Ala Tyr Asn Asn Gly Leu Glu Glu Ile Arg Gly Thr Ser Pro Ala Ser
260 265 270
Trp Leu Arg Tyr His Gln Phe Arg Arg Glu Thr Thr Leu Ile Ala Leu
275 280 285
Asp Leu Val Ala Ile Phe Pro Tyr Tyr Asn Val Arg Glu Tyr Pro Ile
290 295 300
Gly Val Asn Pro Gln Leu Thr Arg Asp Val Tyr Thr Asp Pro Ile Gly
305 310 315 320
Val Thr Phe Arg Arg Glu Asp Trp Glu Thr Gly Val Glu Cys Arg Pro
325 330 335
Trp Val Asn Thr Pro Tyr Met Ser Phe Ser Asp Leu Glu Asn Ala Ile
340 345 350
Ile Arg Pro Pro His Leu Phe Glu Thr Leu Arg Asn Leu Thr Ile His
355 360 365
Thr Gly Arg Tyr Asn Leu Val Gly Gly Ala Arg Phe Ile Glu Gly Trp
370 375 380
Val Gly His Ser Val Thr Asn Thr Arg Leu Gly Asn Ser Thr Val Phe
385 390 395 400
Thr Ser Asn Tyr Gly Ser Leu Pro Pro Arg Phe Gln Val Phe Asn Phe
405 410 415
Thr Asn Phe Asp Val Tyr Gln Ile Asn Thr Arg Ala Asp Ser Thr Gly
420 425 430
Thr Phe Arg Ile Pro Gly Phe Ala Val Thr Arg Ala Gln Phe Ile Pro
435 440 445
Gly Gly Thr Tyr Ser Val Ala His Arg Asp Pro Gly Ala Cys Gln Gln
450 455 460
Asp Tyr Asp Ser Ile Glu Glu Leu Pro Ser Leu Asp Pro Asp Glu Pro
465 470 475 480
Ile Asn Arg Ser Tyr Ser His Arg Leu Ser His Val Thr Leu Tyr Lys
485 490 495
Tyr Thr Leu Ser Asp Thr Asp Tyr Gly Val Ile Asn Tyr Thr Asp Tyr
500 505 510
Gly Ser Met Pro Ala Tyr Val Trp Thr His Arg Asp Val Asp Leu Thr
515 520 525
Asn Thr Ile Thr Ala Asp Arg Ile Thr Gln Leu Pro Leu Val Lys Ala
530 535 540
Ser Thr Leu Pro Ala Gly Thr Thr Val Val Lys Gly Pro Gly Phe Thr
545 550 555 560
Gly Gly Asp Ile Leu Arg Arg Thr Thr Asn Gly Thr Phe Gly Thr Leu
565 570 575
His Val Arg Val Asn Ser Pro Leu Thr Gln Gln Tyr Arg Leu Arg Val
580 585 590
Arg Phe Ala Ser Thr Gly Asn Phe Ser Ile Arg Val Leu Arg Gly Gly
595 600 605
Thr Ser Ile Gly Asp Ala Arg Phe Gly Ser Thr Met Asn Arg Gly Gln
610 615 620
Glu Leu Thr Tyr Glu Ser Phe Val Thr Arg Glu Phe Thr Thr Thr Gly
625 630 635 640
Pro Phe Asn Pro Pro Phe Thr Phe Thr Gln Thr Gln Glu Ile Leu Thr
645 650 655
Val Asn Ala Glu Gly Val Ser Thr Gly Gly Glu Tyr Tyr Ile Asp Ser
660 665 670
Ile Glu Ile Val Pro Val Asn Pro Thr Arg Glu Ala Glu Glu Asp Leu
675 680 685
Glu Ala Ala Lys Lys Ala Val Ala Ser Leu Phe Thr Arg Thr Arg Asp
690 695 700
Gly Leu Gln Val Asn Val Thr Asp Tyr Gln Val Asp Gln Ala Ala Asn
705 710 715 720
Leu Val Ser Cys Leu Ser Asp Glu Gln Tyr Gly Tyr Asp Lys Lys Met
725 730 735
Leu Leu Glu Ala Val Arg Ala Ala Lys Arg Leu Ser Arg Glu Arg Asn
740 745 750
Leu Leu Gln Asp Pro Asp Phe Asn Thr Ile Asn Ser Thr Glu Glu Asn
755 760 765
Gly Trp Lys Ala Ser Asn Gly Val Thr Ile Ser Glu Gly Gly Pro Phe
770 775 780
Tyr Lys Gly Arg Ala Leu Gln Leu Ala Ser Ala Arg Glu Asn Tyr Pro
785 790 795 800
Thr Tyr Ile Tyr Gln Lys Val Asp Ala Ser Glu Leu Lys Pro Tyr Thr
805 810 815
Arg Tyr Arg Leu Asp Gly Phe Val Lys Ser Ser Gln Asp Leu Glu Ile
820 825 830
Asp Leu Ile His His His Lys Val His Leu Val Lys Asn Val Pro Asp
835 840 845
Asn Leu Val Ser Asp Thr Tyr Pro Asp Asp Ser Cys Ser Gly Ile Asn
850 855 860
Arg Cys Gln Glu Gln Gln Met Val Asn Ala Gln Leu Glu Thr Glu His
865 870 875 880
His His Pro Met Asp Cys Cys Glu Ala Ala Gln Thr His Glu Phe Ser
885 890 895
Ser Tyr Ile Asp Thr Gly Asp Leu Asn Ser Ser Val Asp Gln Gly Ile
900 905 910
Trp Ala Ile Phe Lys Val Arg Thr Thr Asp Gly Tyr Ala Thr Leu Gly
915 920 925
Asn Leu Glu Leu Val Glu Val Gly Pro Leu Ser Gly Glu Ser Leu Glu
930 935 940
Arg Glu Gln Arg Asp Asn Thr Lys Trp Ser Ala Glu Leu Gly Arg Lys
945 950 955 960
Arg Ala Glu Thr Asp Arg Val Tyr Gln Asp Ala Lys Gln Ser Ile Asn
965 970 975
His Leu Phe Val Asp Tyr Gln Asp Gln Gln Leu Asn Pro Glu Ile Gly
980 985 990
Met Ala Asp Ile Met Asp Ala Gln Asn Leu Val Ala Ser Ile Ser Asp
995 1000 1005
Val Tyr Ser Asp Ala Val Leu Gln Ile Pro Gly Ile Asn Tyr Glu
1010 1015 1020
Ile Tyr Thr Glu Leu Ser Asn Arg Leu Gln Gln Ala Ser Tyr Leu
1025 1030 1035
Tyr Thr Ser Arg Asn Ala Val Gln Asn Gly Asp Phe Asn Asn Gly
1040 1045 1050
Leu Asp Ser Trp Asn Ala Thr Ala Gly Ala Ser Val Gln Gln Asp
1055 1060 1065
Gly Asn Thr His Phe Leu Val Leu Ser His Trp Asp Ala Gln Val
1070 1075 1080
Ser Gln Gln Phe Arg Val Gln Pro Asn Cys Lys Tyr Val Leu Arg
1085 1090 1095
Val Thr Ala Glu Lys Val Gly Gly Gly Asp Gly Tyr Val Thr Ile
1100 1105 1110
Arg Asp Gly Ala His His Thr Glu Thr Leu Thr Phe Asn Ala Cys
1115 1120 1125
Asp Tyr Asp Ile Asn Gly Thr Tyr Val Thr Asp Asn Thr Tyr Leu
1130 1135 1140
Thr Lys Glu Val Ile Phe Tyr Ser His Thr Glu His Met Trp Val
1145 1150 1155
Glu Val Asn Glu Thr Glu Gly Ala Phe His Leu Asp Ser Leu Glu
1160 1165 1170
Phe Val Glu Thr Glu Lys
1175
<210> 21
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой праймер OAR2613a
<400> 21
aaacatgaac cgaaataatc aaaatg 26
<210> 22
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный праймер OAR2615a
<400> 22
atccgtccct tgtgcgtgta aa 22
<210> 23
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой праймер OAR2611a-F
<400> 23
gtttaaacat gaatcgaaat aatcaaaatg 30
<210> 24
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный праймер OAR2612a-R
<400> 24
ggcgcgccct actcttgtgt ttcaataaa 29
<210> 25
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой праймер OAR2768-F
<400> 25
gtttaaacat gaatcaaaat aaacacgga 29
<210> 26
<211> 31
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный праймер OAR2769-R
<400> 26
ggcgcgcctt actgttgggt ttccatgaac t 31
<---
Реферат
Изобретение относится к области биохимии, в частности к химерной генетической конструкции для экспрессии белка, токсичного для совки-ипсилон (Agrotis ipsilon), а также к содержащему ее вектору, клетке, растению, семени растения. Также раскрыта синтетическая молекула нуклеиновой кислоты для обеспечения экспрессии белка, токсичного для совки-ипсилон (Agrotis ipsilon), а также способ получения устойчивого к совке-ипсилон трансгенного растения. Изобретение также относится к белку, токсичному для совки-ипсилон (Agrotis ipsilon), к способу его получения, а также к содержащей его композиции и к способу борьбы с совкой-ипсилон (Agrotis ipsilon) с его использованием. 11 н. и 16 з.п. ф-лы, 3 табл., 11 пр.

Комментарии