Синтез лактонов резорциловой кислоты, используемых в качестве терапевтических агентов - RU2534527C2
Код документа: RU2534527C2
Чертежи


Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет по заявке на патент США № 61/011163, поданной 15 января 2008 года, которая включена в настоящее описание в полном объеме посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к новым производным, аналогам и промежуточным соединениям природных продуктов радицикола и пошонинов (pochonins) и к их получению. Настоящее изобретение дополнительно относится к применению этих соединений в качестве ингибиторов киназ и семейства ферментов, известных как белки теплового шока 90 (HSP90).
УРОВЕНЬ ТЕХНИКИ
В середине 1950-х годов было обнаружено, что фосфорилирование может обратимо изменить функцию ферментов посредством киназ белка, которые катализируют фосфорилирование, или с помощью фосфатаз белка, которые вовлечены в стадию дефосфорилирования. Эти реакции играют существенную роль в регулировании многих клеточных процессов, особенно путей сигнальной трансдукции. В конце 1970-х годов было обнаружено, что трансформирующий фактор вируса саркомы Рауса (v-Src)'s представляет собой протеинкиназу, и также было обнаружено, что форболовые эфиры, стимулирующие опухоли, являются активаторами протеинкиназы C, проявляя первую известную связь между заболеванием и неправильным фосфорилированием белка. С того времени было обнаружено, что механистические дефекты трансдукции вызывают многочисленные онкогенные процессы и играют роль при диабете, воспалительных нарушениях и сердечно-сосудистых заболеваниях. (Т. Hunter, Cell, 100: 113-127 (2000); P. Cohen, Nat. Rev. Drug Discov., 1:309 (2002)). Таким образом, селективные ингибиторы киназы и фосфатазы проявили себя как важные лекарственные объекты исследований, и ингибирование активности фосфорилирования киназы представляет собой одну из самых перспективных стратегий для химиотерапии.
Макроциклические лактоны резорциловой кислоты, такие как радицикол и родственные пошонины, представляют собой структурно родственную группу вторичных метаболитов, выделенную из культур clavicipitaceous hyphomycete рода Pochonia, такие как Pochonia chlamydosporia вар. расположенный мелкими цепочками штамм P0297. См., например, V. Hellwig et al., J. Natural Prod., 66(6):829-837 (2003). Эти соединения и аналоги или производные соединений оценивали в качестве ингибиторов киназы или ингибиторов HSP90. Галогенгидрин и производные оксима радицикола получали и оценивали их ингибиторную в отношении v-src тирозинкиназы, антипролиферативную и противоопухлевую активность in vitro (Т. Agatsuma et al., Bioorg. & Med. Chem., 10(11):3445-3454 (2002).
Подобно киназам, белки теплового шока (HSP) взаимодействуют с АТФ и представляют собой важные цели для контролирования заболеваний, однако они имеют различный механистический эффект. Непосредственно после воздействия стресса, такого как высокая температура, гипоксия или ацидоз, клетки в большинстве тканей быстро ускоряют объем выработки HSP. Сейчас полагают, что белки теплового шока HSPs являются молекулярными шаперонами, то есть они предотвращают образование несоответствующих ассоциаций и способствуют правильному сворачиванию других клеточных белков, в совокупности называемых клиентами и субстратами. HSP также были обнаружены совместно с опухолями и другими патофизиологическими состояниями. Фактически, белки-шапероны облегчают выживаемость клеток опухоли в стрессовых условиях окружающей среды, способствуя устойчивости к изменениям в клетке. HSPs являются повсеместно распространенными, хорошо сохраняющимися среди разновидностей, и обычно классифицируются по молекулярной массе на следующие основные семейства: HSP100, HSP90, HSP70, HSP60 и небольшие HSPs. Эти семейства имеют структурные и функциональные различия, но действуют совместно на различных стадиях сворачивания белка. HSP90 привлекает особое внимание вследствие его ассоциации со многими типами сигнальных молекул, такими как v-Src и Raf, которые играют важную роль в злокачественной трансформации и развитии метастаза. Таким образом, ингибиторы HSP90 желательны для разработки химиотерапии, а также для выяснения взаимодействий в сложных сетях передачи сигналов.
Белки теплового шока 90 (Hsp90) представляют собой повсеместно распространенные белки-шапероны, которые поддерживают соответствующую конформацию многих белков-«клиентов» (см. Kamal et. al. Trends Mol. Med. 2004, 10, 283-290; Dymock et. al. Expert Opin. Ther. Patents 2004, 14, 837-847; Isaacs et. al. Cancer Cell, 2003, 3, 213; Maloney et. al. Expert Opin. Biol. Ther. 2002, 2, 3-24, и Richter et. al. J. Cell. Physiol. 2001, 188, 281-290), и вовлечены в сворачивание, активирование и сборку широкого диапазона белков, включая основные белки, вовлеченные в сигнальную трансдукцию, контроль клеточного цикла и регулирование транскрипции. Исследователи сообщили, что белки-шапероны HSP90 связаны с важными сигнальными белками, такими как рецепторы стероидных гормонов и протеинкиназы, включая, например, Raf-1, EGFR, семейство киназ v-Src, Cdk4 и ErbB-2 (Buchner, TIBS, 1999, 24, 136-141; Stepanova et. al., Genes Dev. 1996, 10, 1491-502; Dai et. al., J. Biol. Chem. 1996, 271, 22030-4). Дополнительные исследования показывают, что определенные cо-шапероны, например, Hsp70, p60/Hop/Stil, Hip, Bag1, HSP40/Hdj2/Hsj1, иммунофилины, p23 и p50 могут содействовать функциям HSP90 (см., например, Caplan, Trends in Cell Biol., 1999, 9, 262-268). Ингибирование Hsp90 заставляет эти белки-клиенты принимать аберрантные конформации, и эти неправильно свернутые белки быстро удаляются клеткой через убиквитинирование и разрушение протеасомы. Примечательно, что список белков-клиентов Hsp90 включает ряд известных онкогенов. Четыре из них представляют собой клинически утвержденные раковые мишени: HER-2/neu (Герцептин® (трастузумаб)), Bcr-Abl (Гливек® (иматиниб мезилат)), рецептор эстрогена (тамоксифен) и рецептор андрогена (Касодекс® (бикалутамид)), в то время как другие играют важную роль в развитии рака. Некоторые из самых чувствительных клиентов Hsp90 вовлечены в передачу сигналов роста (Raf-1, Akt, cdk4, Src, Bcr-Abl и подобные). Для сравнения, несколько генов-супрессоров опухолевого роста, если такие вообще имеются, по-видимому, являются клиентами Hsp90 (для списков белков-клиентов см. Pratt et. al. Exp. Biol. Med. 2003, 228, 111-133; Workman et. al. Cancer Lett. 2004, 206, 149-157 и Zhang et. al. J. Mol. Med. 2004, 82, 488-499.), и следовательно, ингибирование Hsp90 имеет полный антипролиферативный эффект. Кроме того, некоторые белки-клиенты вовлечены в другие фундаментальные процессы онкогенеза, а именно, избежание апоптоза (например, Apaf-1, RIP, Akt), бессмертие (например, hTert), ангиогенез (например, VEGFR, Flt-3, FAK, HIF-1) и метастаз (c-Met).
Многочисленные белки-клиенты HSP90 играют важную роль в контроле роста, выживаемости клетки и процессах развития, и известно, что такие клиенты включают рецепторы тирозинкиназы, серин/треонин киназы, рецепторы стероидных гормонов, факторы транскрипции и теломеразу.
В дополнение к противораковой и противоопухолевой активности, ингибиторы HSP90 также были вовлечены в широкое разнообразие других использований, включая применение в качестве противовоспалительных агентов, противоинфекционных агентов, агентов для лечения аутоиммунных заболеваний, агентов для лечения ишемии и агентов, полезных при лечении нейродегенеративных заболеваний и при стимулировании регенерации нерва (см. M. Waza et al., Nature Med. 11: 1088 (2005); Rosen et al., WO 02/09696; PCT/US01/23640; Degranco et al., WO 99/51223; PCT/US99/07242; Gold, патент США № 6210974 B1). В литературе существуют сообщения, что можно вылечить фиброгенные нарушения, включая, но не ограничиваясь ими, склеродерму, полимиозит, системную красную волчанку, ревматоидный артрит, цирроз печени, келоидное образование, интерстициальный нефрит и фиброз легких (Strehlow, WO 02/02123; PCT/US01/20578).
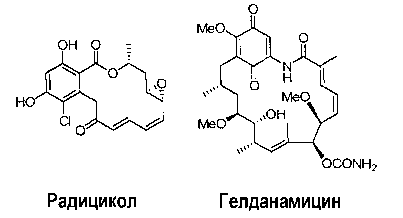
Было обнаружено, что некоторые лактоны резорциловой кислоты ингибируют HSP90, таким образом, было показано, что природные продукты радицикол и гелданамицин (P. Delmotte and J. Delmotte-Plaquee, Nature (London), 171:344 (1953); и C. DeBoer et al.,JAntibiot (Тokyo), 23:442 (1970), соответственно) подавляют трансформированный фенотип клетки, экспрессирующей активированный Src (H.J. Kwon et al., Cancer Research, 52:6926 (1992); Y. Uehara et al., Virology, 164:294 (1988)). Было сообщено, что родственные соединения, такие как гербимицин, имеют подобные эффекты (S. Omura et al.,JAntibiot (Tokyo), 32:255 (1979).
Другие лактоны резорциловой кислоты (RAL), изученные в этом отношении, включают 17-аллиламино-17-деметоксигелданамицин (17AAG) (D.B. Solit et al., Clin. Cancer Res., 8:986 (2002); L.R. Kelland et al., J. Natl. Cancer Inst., 91: 1940 (1999)); 17DMAG (J.L. Eiseman et al., Cancer Chemother. Pharmacol., 55:21-32 (2005)); IPI-504 (J. Ge et al., J. Med. Chem., 49:4606 (2006); производные оксима, такие как KF25706 (S. Soga, et al., Cancer Res., 59:2931 (1999)) и KF55823 (S. Soga, et al., Cancer Chemotherapy and Pharmacology, 48:435 (2001)); и Danishefsky et al. циклопропарадицикол (A. Rivkin et al., Ibid., 44:2838 (2005)). Структурно родственные варианты включают гибридные ингибиторы, имеющие карбоксирезорцин радицикола и бензохинон гелданамицина (R.C. Clevenger and B. S. Blagg, Org. Lett., 6:4459 (2004); G. Shen and B.S. Blagg, Ibid. 7:2157 (2004); G. Shen et al., J. Org. Chem., 71:7618 (2006)).
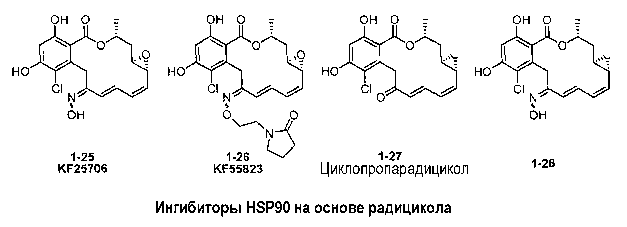
Значительный интерес в медицинских применениях радицикола последовал за первоначально полученными данными. (См. патент США № 6946456; и заявки на патент США №№ 2003-0211469, 2004-0102458, 2005-0074457, 2005-0261263, 2005-0267087, 2006- 0073151, 2006-0251574, 2006-0269618, 2007-0004674 и 2007-0010432).
Поразительно, что некоторые резорциловые макролиды, которые являются близкими аналогами радицикола, как известно, ингибируют киназы, но не HSP90. Действительно, было обнаружено, что LL-Z1640-2 является сильным и селективным ингибитором киназы TAK1, в отношении которой радицикол и другие резорцилиды неактивны. (J. Ninomiya-Tsuji et al., J. Biol. Chem., 278: 18485 (2003); P. Rawlins et al., Int. J. Immunopharma., 21:799 (1999); K. Takehana et al., Biochem. Biophys. Res. Comm., 257: 19 (1999); A. Zhao et al., J. Antibiotics, 52: 1086 (1999)). Близкородственный LL-783227, где один из олефинов восстановлен, является сильным ингибитором киназы MEK. (A. Zhao et al., J. Antibiotics 52: 1086 (1999)). Было обнаружено, что соединение F87-2509.04 вызывает деградацию мРНК, содержащей AU-обогащенные элементы (ARE) (T. Kastelic et al., Cytokine, 8:751 (1996)), и было обнаружено, что гипотемицин ингибирует Ras-опосредованную клеточную передачу сигналов. (H. Tanaka et al., Jap. J. Cancer Res., 90: 1139 (1999)). Было показано, что аигиаломицин D представляет собой ингибитор CDK. (S. Barluenga et al., Angew. Chem., Int. Ed., 46(24):3951 (2006)).
Другие близкие аналоги радицикола действительно ингибируют HSP90. Пошонин D является сильным ингибитором HSP90. (E. Moulin et al., J. Am. Chem. Soc., 127(19):6999 (2005)). Было обнаружено, что и пошонин A является 90 нМ ингибитором HSP90. Было обнаружено, что пошонин C является ингибитором геликазы-праймазы герпеса, которая является АТФазой, а не киназой. (V. Hellwig et al., J. Nat. Prod., 66:829 (2003)). Хотя радицикол и пошонин C структурно очень похожи, они имеют совершенно различные конформации в растворе, и различные биологические активности. (S. Barluenga et al., Chem. Eur. J., 11:4935 (2005). Таким образом, вероятно, «гибкость» макроцикла может играть существенную роль в ингибирующих различиях среди макролидов резорциловой кислоты, и в любом случае создает эффекты, которые трудно предсказать с помощью теоретических способов.
Некоторые макролиды резорциловой кислоты были известны в качестве ингибиторов киназы или фосфатазы (патенты США №№ 5674892; 5728726; 5731343; и 5795910) или для ингибирования других ферментов (патент США № 5710174 ингибирование катализа FXIIIa поперечно-сшитого фибрина). Макролиды резорциловой кислоты также использовали для других медицинских показаний к применению (патенты США №№ 3453367; 3965275; 4035504; 4670249; 4778821; 4902711; и 6635671).
Радицикол и пошонины представляют собой природные продукты; промежуточные соединения для синтезирования некоторых из их аналогов можно получить с помощью ферментации, однако полагаясь только на природные продукты или их производные ферментации, строго ограничивают диапазон соединений. Таким образом, синтезировали ряд новых макролидов резорциловой кислоты. Многие из них представляют собой зеаралан и родственные соединения, в которых макроциклическое кольцо не содержит никаких двойных связей углерод-углерод за исключением между углеродами фенильного кольца. (Патенты США №№ 3373038; 3586701; 3621036; 3631179; 3687982; 3704249; 3751431; 3764614; 3810918; 3836544; 3852307; 3860616; 3901921; 3901922; 3903115; 3957825; 4042602; 4751239; 4849447; и 2005-0256183). Также сообщали о синтезах макролидов резорциловой кислоты, охарактеризованных с помощью одной двойной связи между углеродами кольца вне фенильного кольца. (Патенты США №№ 3196019; 3551454; 3758511; 3887583; 3925423; 3954805; и 4088658). Большинство из них представляют собой макроциклы с 14 членами, но также сообщали о синтезах аналогов макроцикла с 12 членами. (Патенты США №№ 5710174; 6617348; и 2004-0063778. и PCT публикация № WO 02/48135).
Также сообщали о синтезах радицикол-родственных соединений, содержащих две неароматические двойные связи и или галид или 1,2-оксогруппу (то есть эпоксид) в макроциклическом кольце. (Патенты США №№ 4228079; 5597846; 5650430; 5977165; 7115651; и патенты Японии №№ JP 6-279279A, JP 6-298764A, JP 9-202781A, JP 10-265381A2; и JP 2000-236984). Синтезы оксимов радицикол-родственных соединений раскрыты в патентах США №№ 5977165; 6239168; 6316491; 6635662; 2001-0027208; 2004-0053990; патенте Японии JP 2003-113183A2; и PCT публикации № WO 99/55689. Синтез циклопропа-аналогов радицикола раскрыт в патенте США № 7115651 и PCT публикации № WO 05/061481. Синтезы некоторых других аналогов макролидов резорциловой кислоты раскрыты в патенте США № 2006-0247448 и PCT публикации № WO 02/48135. Также синтезировали Радицикол как и Пошонины A и C. (S. Barluenga et al., Angew. Chemie, 43(26):3467-3470 (2004); S. Barluenga et al., Chemistry - A European Journal, 11(17):4935-4952 (August 19, 2005); E. Moulin et al., et al., Organic Letters, 7(25):5637-5639 (8 декабря 2005 года).
Патент США 7115651 от Danishefsky et al., который включен в настоящее описание в полном объеме посредством ссылки, описывает производные радицикола, включая циклопропильные аналоги, и применение этих соединений в качестве терапевтических агентов.
Международная публикация № WO 2008/021213, Winssinger et al., которая включена в настоящее описание в полном объеме посредством ссылки, описывает определенные аналоги и производные радицикола и пошонинов, пригодные в качестве ингибиторов HSP90, включая фармацевтические композиции, содержащие соединения, и способы лечения различных заболеваний, опосредованных HSP90.
Международная публикация № WO 2008/150302, Nexgenix Pharmaceuticals, которая включена в настоящее описание в полном объеме посредством ссылки, описывает применения и способы лечения нейрофиброматоза с помощью аналогов и производных радицикола и пошонинов.
Несмотря на достижения, описанные выше, химические биологи продолжают испытывать неудобства вследствие ограниченной способности составить определенную активность киназы для выполнения операции, обратной свертыванию определенных киназ в пределах сложных сетей передачи сигналов. Маленькие молекулы, которые могут проходить сквозь клетки, способны решить эту проблему. И стало все более очевидно, что биологическую функцию киназ часто регулируют с помощью их конформации, которая, в свою очередь, обусловлена их уровнем фосфорилирования и внутри- и межмолекулярными ассоциациями. Маленькие молекулы ингибиторов также имеют способность распознавать различные конформации данной киназы, таким образом, маленькие молекулы предлагают способ для анализа соответствующих функций таких конформаций. К сожалению, набор известных ингибиторов киназы все же не может поддержать полный диапазон работы, которая доджна быть сделана при анализе ролей различных членов кинома. Это не просто теоретические поиски, потому что рациональность разработки лекарственного средства продолжает испытывать сложности, пока не будут поняты механизмы киназы и их селективность.
Таким образом, существует постоянная потребность в ингибиторах киназы и ингибиторах HSP90, которые бы улучшили эффективность и селективность. Кроме того, разработка и синтез таких ингибиторов и целевых библиотек ингибиторов остается перспективной, таким образом, существует постоянная потребность в улучшенных способах синтеза.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Обеспечивают новые аналоги макролидов пошонина формул I, I', II, II', III, III', IV и V, их таутомеры, фармацевтически приемлемые соли, сольваты, сложные эфиры или их пролекарства, и фармацевтические композиции, содержащие соединения для лечения киназа-опосредованных или HSP90-опосредованных нарушений. Также представляют способы лечения киназа-опосредованных или HSP90-опосредованных нарушений, используя соединения. В другом варианте осуществления изобретение обеспечивает использование соединений формул I, I', II, II', III, III', IV и V при лечении киназа-опосредованных или HSP90-опосредованных нарушений или при изготовлении лекарственного средства для лечения киназа-опосредованных или HSP90-опосредованных нарушений у пациента. Соединения изобретения являются активными в качестве ингибиторов киназы и ингибиторы HSP90. Кроме того, обеспечивают усовершенствованные способы получения соединений.
В одном варианте осуществления изобретение обеспечивает соединение формулы I или I' или его таутомер или фармацевтически приемлемую соль, сольват, сложный эфир или его пролекарство:

в которой:
X представляет собой O, S или NR;
Y представляет собой -OR, -O-(CH2)mCOOR,-O-(CH2)mCON(R)2, -N(R)2, -N(R)SOR или -N(R)SO2R, в которой группы, связанные с атомом азота, могут находиться в Z- или E-конфигурации;
R1 и R2 представляют собой независимо водород, галоген, OR, N(R)2, SR, азидо, нитро, циано, алифатическую группу, арил, алкиларил, арилалкил, гетероциклил, гетероарил, -S(O)R, -S(O)2R, -SO2N(R)2, -N(R)SO2R, -N(CO)R, -N(CO)N(R)2, -N(CO)OR, -O(CO)R, -(CO)R, -(CO)OR, -(CO)N(R)2, -O(CO)OR или -O(CO)N(R)2;
R3, R4, R5, R6, R7, R8, R9 и R10 представляют собой независимо водород, галоген, азидо, нитро, циано, алифатическую группу, алкиларил, аралкил, арил, гетероалкил, алкилгетероарил, гетероциклил, гетероарил, OR, N(R)2, SR, -O(CH2)mN(R)C(O)(CH2)pR, -O(CH2)mOC(O)(CH2)pR, -O(CH2)mC(O)(CH2)pN(R)2, -O(CH2)mC(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pN(R)2, -O(CH2)mOC(O)(CH2)pOR, -O(CH2)mOC(O)(CH2)pN(R)2, -NR(CH2)mN(R)C(O)(CH2)pR, -NR(CH2)mOC(O)(CH2)pR, -NR(CH2)mC(O)(CH2)pN(R)2, -NR(CH2)mC(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pN(R)2, -NR(CH2)mOC(O)(CH2)pOR, -NR(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN(R)C(O)(CH2)pR, -(CH2)mOC(O)(CH2)pR, -(CH2)mC(O)(CH2)pN(R)2, -(CH2)mC(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pN(R)2, -(CH2)mOC(O)(CH2)pOR, -(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN3, -O(CH2)mN3, -(CH2)mN(R)2, -(CH2)mOR, -(CH2)mS(O)(CH2)pR, -(CH2)mS(O)2(CH2)pR, -(CH2)mSO2(CH2)pN(R)2 или -(CH2)mN(R)SO2(CH2)pR; и
каждый R представляет собой независимо R11, водород, алифатическую группу, амино, азидо, циано, нитро, алкиламино, диалкиламино, ОН, алкокси, карбониламино, аминокарбонил, алкоксикарбонил, карбонилокси, карбокси, ацил, арил, алкарил, арилалкил, включая бензил, гетероалкил, гетероарил, гетероциклил или защитную группу; или два R на одном и том же азоте, взятые вместе с азотом, для получения 5-8-членного гетероциклического или гетероарильного кольца; в которой, где группа содержит более одного заместителя R; в которой R необязательно замещен, и каждый R может быть одинаковым или различным;
R11 представляет собой группу:

n представляет собой 0, 1 или 2;
m и p представляют собой независимо 0, 1, 2, 3, 4 или 5; и пунктирные линии обозначают или одинарную, или двойную связь, где необходимые условия валентности выполняют с помощью дополнительных атомов водорода;
в которой в формуле I', когда n представляет собой 1 и X представляет собой O и двойная связь присутствует между атомами углерода, имеющими R9 и R10, тогда, по меньшей мере, один из R5, R6, R7, R8, R9 и R10 не является водородом; и
в которой в формуле I', когда n представляет собой 1 и X представляет собой O и связь между атомами углерода, имеющими R9 и R10, является одинарной связью, тогда, по меньшей мере, один из R5, R6, R7 или R8 не является водородом.
В одном варианте осуществления формул I или I' R1 и R2 представляют собой независимо водород или галоген. В другом варианте осуществления формул I или I' X представляет собой O или NR. В еще другом варианте осуществления формул I или I' X представляет собой O, S или NR; Y представляет собой -OR, -O-(CH2)mCOOR, -O-(CH2)mCON(R)2.
В другом варианте осуществления обеспечивают соединение формулы II или II' или таутомер, фармацевтически приемлемую соль, сольват, сложный эфир или его пролекарство:

в которой переменные X, Y, R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R, m и p определены как для формулы I; и в которой в формуле II', когда X представляет собой O, тогда, по меньшей мере, один из R5, R6, R7, R8, R9 или R10 не является водородом.
В одном варианте осуществления формул II или II' R1 и R2 представляют собой независимо водород или галоген. В другом варианте осуществления R3 и R4 представляют собой независимо алкил или водород. В еще другом варианте осуществления формул II или II' переменные R9 и R10 представляют собой независимо водород или алифатическую группу.
В другом варианте осуществления формул II или II' X представляет собой O; Y представляет собой -O-(CH2)mCOOR или -O-(CH2)mCON(R)2, в которой группы, связанные с атомом азота, могут находиться в Z- или E-конфигурации; R1, R2 представляют собой независимо водород или галоген; и R9 и R10 представляют собой независимо водород или алифатическую группу.
В другом варианте осуществления изобретение обеспечивает соединение формул III или III' или таутомер, фармацевтически приемлемую соль, сольват, сложный эфир или его пролекарство:

III, III'
в которой переменные X, Y, R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R, m и p определены как для формулы I и в которой в формуле III', когда X представляет собой O, тогда, по меньшей мере, один из R5, R6, R7 или R8 не является водородом.
В одном варианте осуществления формул III или III' X представляет собой O или NR. В другом варианте осуществления Y представляет собой -O-(CH2)mCOOR или -O-(CH2)mCON(R)2, в которой группы, связанные с атомом азота, могут находиться в Z- или E-конфигурации. В еще другом варианте осуществления формул III или III' X представляет собой O, Y представляет собой -O-(CH2)mCOOR или -O-(CH2)mCON(R)2, в которой группы, связанные с атомом азота, могут находиться в Z- или E-конфигурации; R1 и R2 представляют собой независимо водород или галоген; и R9 и R10 представляют собой водород.
В другом аспекте изобретение обеспечивает соединение формулы IV или его таутомер или фармацевтически приемлемую соль, сольват, сложный эфир или его пролекарство:
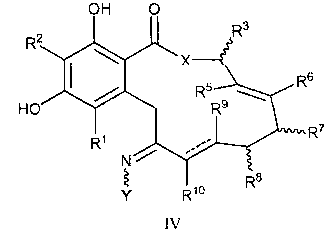
в которой переменные X, Y, R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R, m и p определены как для формулы I выше и пунктирные линии представляют собой одинарную или двойную связь.
В еще одном аспекте изобретение обеспечивает соединение формулы V или его таутомер или фармацевтически приемлемую соль, сольват, сложный эфир или его пролекарство:

V
в которой переменные X, Y, R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R, m и p определены как для формулы I; R4a имеет то же определение, как R4 в формуле I выше; и пунктирные линии представляют собой одинарную или двойную связь.
В различных других вариантах осуществления изобретение обеспечивает макроциклические соединения, показанные в таблице 1 ниже, или их таутомеры или фармацевтически приемлемые соли, сольваты, сложные эфиры или их пролекарства.
Фармацевтические композиции, содержащие эффективное ингибирующее HSP 90 количество соединения формул I, I', II, II', III, III', IV или V в комбинации с фармацевтически приемлемым носителем, обеспечивают для лечения нарушений, опосредованных HSP 90. Также обеспечивают фармацевтические композиции, содержащие эффективное ингибирующее киназу количество соединения изобретения в комбинации с фармацевтически приемлемым носителем. В некоторых вариантах осуществления фармацевтические композиции включают частицы, которые имеют средний размер частиц менее приблизительно 2 микрон. В других вариантах осуществления изобретение обеспечивает фармацевтические композиции, в которых носитель является подходящим для перорального, парентерального, внутривенного, с помощью ингаляции, локального или внутрикожного введения. Кроме того, обеспечивают фармацевтические композиции, включающие соединения изобретения в комбинации с другими активными агентами и фармацевтически приемлемыми носителями.
В другом аспекте изобретения обеспечивают способ лечения пациента с заболеванием, включающий введение пациенту эффективного количества соединения формул I, I', II, II', III, III', IV или V, в котором заболевание может быть аутоиммунным заболеванием, воспалительным заболеванием, неврологическим или нейродегенеративным заболеванием, раком, сердечно-сосудистым заболеванием, аллергией, астмой или гормонально-зависимым заболеванием. В одном варианте осуществления пациентом является человек. В другом варианте осуществления обеспечивают использование соединений при получении лекарственных средств для лечения заболеваний.
В одном варианте осуществления заболевание, которое будут лечить, представляет собой рак. Раковые образования, которые можно вылечить с помощью соединений, включают, но не ограничиваются ими, солидную опухоль, содержащую кровь опухоль, груди, яичника, шейки, простаты, яичка, мочеполового тракта, пищевода, гортани, глиобластому, желудка, кожи, кератоакантому, легкого, эпидермоидную карциному, крупноклеточный рак, мелкоклеточный рак, аденокарциному легкого, кости, толстой кишки, аденому, поджелудочной железы, аденокарциному, щитовидной железы, фолликулярную карциному, недифференцированную карциному, папиллярную карциному, семиному, меланому, саркому, карциному мочевого пузыря, карциному печени и желчных протоков, карциному почек, миелоидные нарушения, лимфатические нарушения, болезнь Ходжкина, клеток волос, полости рта, глотки, губы, языка, рта, глотки, тонкой кишки, прямой кишки, толстой кишки, мозга и центральной нервной системы или лейкемию.
В другом варианте осуществления обеспечивают способ лечения воспалительного заболевания с помощью соединений изобретения. В различных вариантах осуществления воспалительное заболевание может быть избыточным или неправильным раздражением эндотелиальных клеток, атеросклерозом, васкулярными нарушениями, неправильным заживлением раны, воспалительными и иммунными нарушениями, болезнью Бечета, подагрой или подагрическим артритом, неправильным ангиогенезом, сопровождающимся ревматоидным артритом, кожными заболеваниями, псориазом, диабетической ретинопатией, ретинопатией недошенных, ретролентальной фиброплазией, дистрофией желтого пятна, отторжением ткани роговицы, неоваскулярной глаукомой или синдромом Ослера-Вебера.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 изображает изменение объема опухоли и массы животных после обработки соединением 13a или контрольным вспомогательным веществом.
Фиг.2 изображает гистологию опухоли у животных, обработанных соединением 13a, и у животных, обработанных контрольным вспомогательным веществом.
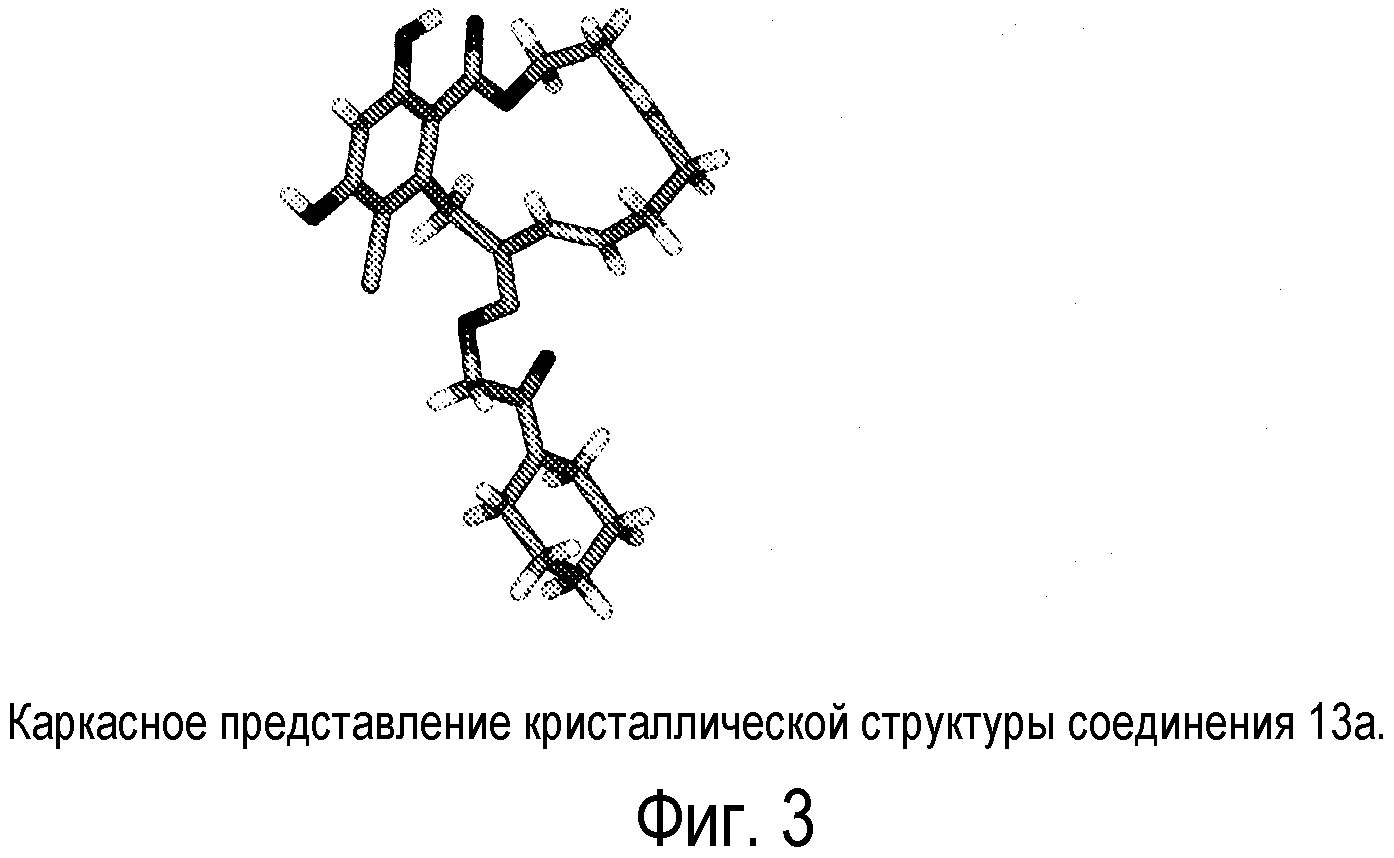
Фиг.3 изображает каркасное представление кристаллической структуры соединения 13a.
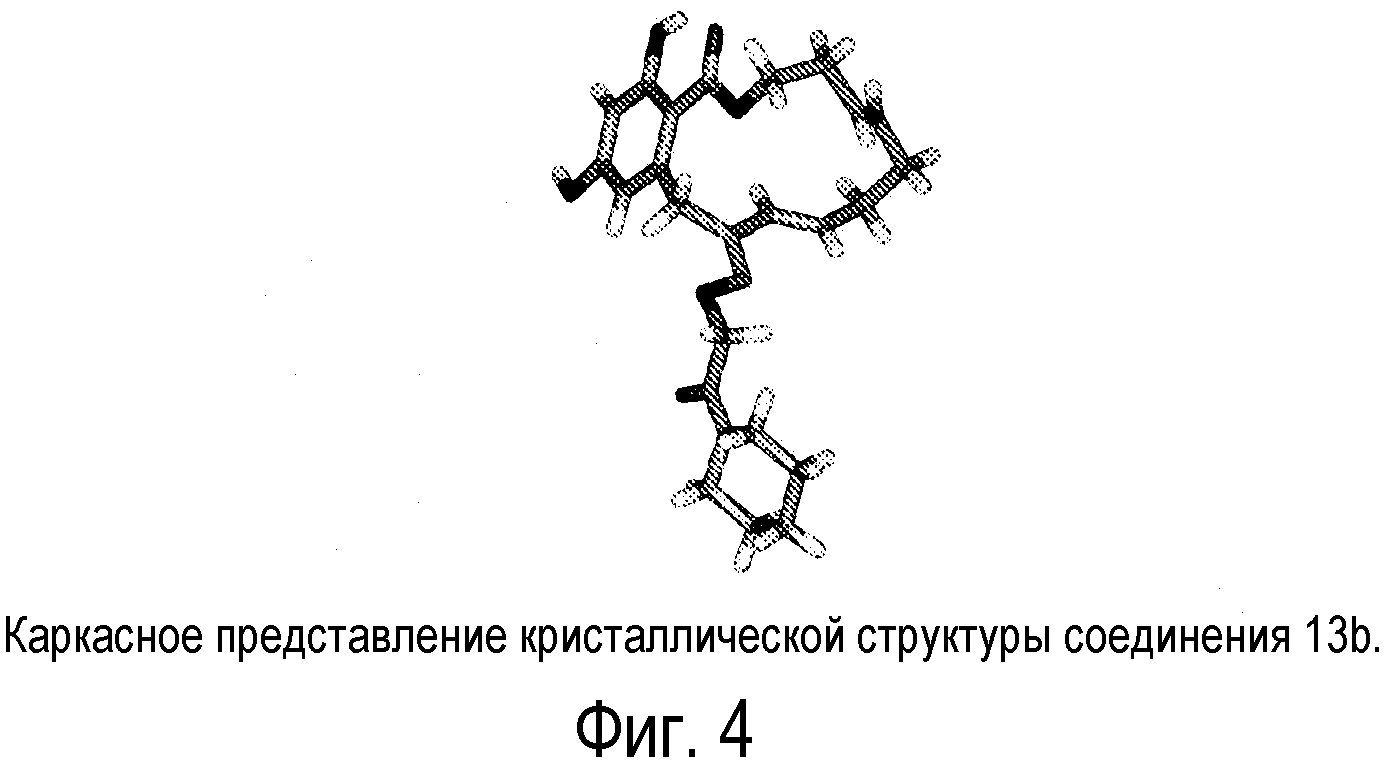
Фиг.4 изображает каркасное представление кристаллической структуры соединения 13b.
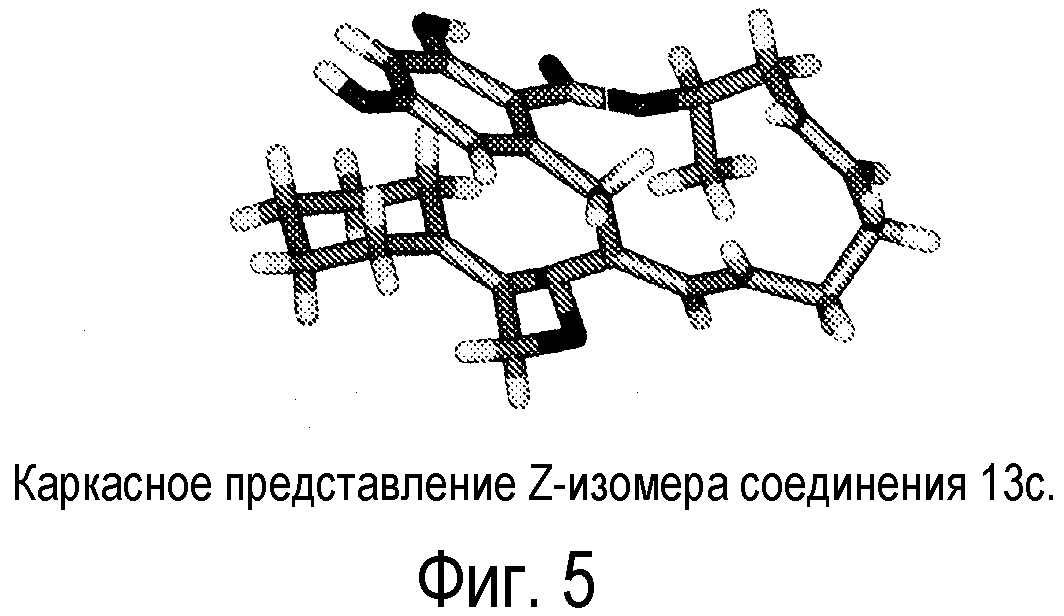
Фиг.5 изображает каркасное представление кристаллической структуры Z-изомера соединения 13c.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Обеспечивают новые соединения на основе лактонов резорциловой кислоты, которые являются пригодными в качестве ингибиторов киназ и HSP90. Также обеспечивают композиции, содержащие соединения, и способы получения соединений. Обеспечивают использование соединений для ингибирования киназ и HSP-90 и способ лечения киназа-опосредованных или HSP90-опосредованных заболеваний, включающий введение эффективного ингибирующего киназу количества или эффективного ингибирующего HSP90 количества соединения формулы I, I', II, II', III, III', IV или V пациенту с киназа-опосредованным или HSP90-опосредованным заболеванием.
Соединения
В первом варианте осуществления изобретения обеспечивают соединение формулы I, его таутомер или фармацевтически приемлемую соль, сольват, сложный эфир или его пролекарство:
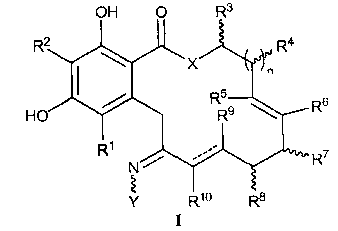
в которой:
X представляет собой O, S или NR;
Y представляет собой -OR, -O-(CH2)mCOOR, -O-(CH2)mCON(R)2, -N(R)2, -N(R)SOR или -N(R)SO2R, в которой группы, связанные с атомом азота, могут находиться в Z- или E-конфигурации;
R1 и R2 представляют собой независимо водород, галоген, OR, N(R)2, SR, азидо, нитро, циано, алифатическую группу, арил, алкиларил, арилалкил, гетероциклил, гетероарил, -S(O)R, -S(O)2R, -SO2N(R)2, -N(R)SO2R, -N(CO)R, -N(CO)N(R)2, -N(CO)OR, -O(CO)R, -(CO)R, -(CO)OR, -(CO)N(R)2, -O(CO)OR или -O(CO)N(R)2;
R3, R4, R5, R6, R7, R8, R9 и R10 представляют собой независимо водород, галоген, азидо, нитро, циано, алифатическую группу, алкиларил, аралкил, арил, гетероалкил, алкилгетероарил, гетероциклил, гетероарил, OR, N(R)2, SR, -O(CH2)mN(R)C(O)(CH2)pR, -O(CH2)mOC(O)(CH2)pR, -O(CH2)mC(O)(CH2)pN(R)2, -O(CH2)mC(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pN(R)2, -O(CH2)mOC(O)(CH2)pOR, -O(CH2)mOC(O)(CH2)pN(R)2, -NR(CH2)mN(R)C(O)(CH2)pR, -NR(CH2)mOC(O)(CH2)pR, -NR(CH2)mC(O)(CH2)pN(R)2, -NR(CH2)mC(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pN(R)2, -NR(CH2)mOC(O)(CH2)pOR, -NR(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN(R)C(O)(CH2)pR, -(CH2)mOC(O)(CH2)pR, -(CH2)mC(O)(CH2)pN(R)2, -(CH2)mC(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pN(R)2, -(CH2)mOC(O)(CH2)pOR, -(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN3, -O(CH2)mN3, -(CH2)mN(R)2, -(CH2)mOR, -(CH2)mS(O)(CH2)pR, -(CH2)mS(O)2(CH2)pR, -(CH2)mSO2(CH2)pN(R)2 или -(CH2)mN(R)SO2(CH2)pR; и
каждый R представляет собой независимо R11, водород, алифатическую группу, амино, азидо, циано, нитро, алкиламино, диалкиламино, ОН, алкокси, карбониламино, аминокарбонил, алкоксикарбонил, карбонилокси, карбокси, ацил, арил, алкарил, арилалкил, включая бензил, гетероалкил, гетероарил, гетероциклил, или защитную группу; или два R на одном и том же азоте, взятые вместе с азотом, для получения 5-8-членного гетероциклического или гетероарильного кольца; в которой, где группа содержит более одного заместителя R; в которой R необязательно замещен, и каждый R может быть одинаковым или различным;
R11 представляет собой группу:

n представляет собой 0, 1 или 2;
m и p представляют собой независимо 0, 1, 2, 3, 4 или 5; и пунктирные линии обозначают или одинарную, или двойную связь, где необходимые условия валентности соблюдают с помощью дополнительных атомов водорода.
Во втором варианте осуществления обеспечивают соединение формулы I', его таутомер или фармацевтически приемлемую соль, сольват, сложный эфир или его пролекарство,
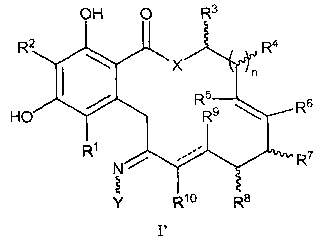
в которой X, Y, R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R, n, m и p определены как для формулы I выше и пунктирные линии представляют собой одинарную или двойную связь, при условии, что когда n представляет собой 1 и X представляет собой O и двойная связь присутствует между атомами углерода, имеющими R9 и R10, тогда, по меньшей мере, один из R5, R6, R7, R8, R9 или R10 не является водородом; и когда n представляет собой 1 и X представляет собой O и связь между атомами углерода, имеющими R9 и R10, представляет собой одинарную связь, тогда, по меньшей мере, один из R5, R6, R7 или R8 не является водородом.
В одном варианте осуществления формулы I или I' n представляет собой 0. В другом варианте осуществления формулы I или I' n представляет собой 1. В еще другом варианте осуществления формулы I или I' n представляет собой 2.
В другом варианте осуществления формулы I или I' X представляет собой O или NR и n представляет собой 1. В другом варианте осуществления формулы I или I' X представляет собой O или NR, n представляет собой 1 и двойная связь присутствует между атомами углерода, имеющими R9 и R10.
В еще одном варианте осуществления формулы I или I' X представляет собой O или NR, n представляет собой 1 и связь между атомами углерода, имеющими R9 и R10, является одинарной связью.
В другом варианте осуществления формулы I или I' Y представляет собой -O-(CH2)mCOOR или -O-(CH2)mCON(R)2, в которой группы, связанные с атомом азота, могут находиться в Z- или E-конфигурации.
В другом варианте осуществления формулы I или I' R1 и R2 представляют собой водород.
В еще другом варианте осуществления формулы I или I' R3 и R4 представляют собой независимо алкил или водород.
В еще другом варианте осуществления формулы I или I' X представляет собой O и R9 и R10 представляют собой водород.
В другом варианте осуществления формулы I или I' X представляет собой O, Y представляет собой -O-(CH2)mCOOR или -O-(CH2)mCON(R)2, в которой группы, связанные с атомом азота, могут находиться в Z- или E-конфигурации; R1 и R2 представляют собой независимо водород или галоген; и R9 и R10 представляют собой водород.
В другом варианте осуществления формулы I или I' R7 или R8 не представляют собой водород или алифатическую группу.
В другом варианте осуществления формулы I или I' R3 или R4 не представляют собой водород или алифатическую группу.
В одном варианте осуществления формулы I или I' изобретение обеспечивает соединение, в котором:
X представляет собой O или NR;
Y представляет собой -O-(CH2)mCOOR или -O-(CH2)mCON(R)2, в которой группы, связанные с атомом азота, могут быть в Z- или E-конфигурации;
R1 и R2 представляют собой независимо водород, галоген, OR, N(R)2 или алифатическую группу;
R3 и R4 представляют собой независимо водород, алифатическую группу, OR, N(R)2, -(CH2)mN(R)C(O)(CH2)pR, -(CH2)mOC(O)(CH2)pR, -(CH2)mC(O)(CH2)pN(R)2, -(CH2)mC(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pN(R)2, -(CH2)mOC(O)(CH2)pOR, -(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN3, -O(CH2)mN3, -(CH2)mN(R)2, -(CH2)mOR, -(CH2)mS(O)(CH2)pR, -(CH2)mS(O)2(CH2)pR, -(CH2)mSO2(CH2)pN(R)2 или -(CH2)mN(R)SO2(CH2)pR;
R5, R6, R9 и R10 представляют собой независимо водород, алифатическую группу, алкиларил, аралкил, арил, гетероалкил, алкилгетероарил, гетероциклил, гетероарил, OR, SR, -O(CH2)mN(R)C(O)(CH2)pR, -O(CH2)mOC(O)(CH2)pR, -O(CH2)mC(O)(CH2)pN(R)2, -O(CH2)mC(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pN(R)2, -O(CH2)mOC(O)(CH2)pOR, -O(CH2)mOC(O)(CH2)pN(R)2, -NR(CH2)mN(R)C(O)(CH2)pR, -NR(CH2)mOC(O)(CH2)pR, -NR(CH2)mC(O)(CH2)pN(R)2, -NR(CH2)mC(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pN(R)2, -NR(CH2)mOC(O)(CH2)pOR, -NR(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN(R)C(O)(CH2)pR, -(CH2)mOC(O)(CH2)pR, -(CH2)mC(O)(CH2)pN(R)2, -(CH2)mC(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pN(R)2, -(CH2)mOC(O)(CH2)pOR, -(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN3, -O(CH2)mN3, -(CH2)mN(R)2, -(CH2)mOR, -(CH2)mS(O)(CH2)pR, -(CH2)mS(O)2(CH2)pR, -(CH2)mSO2(CH2)pN(R)2 или -(CH2)mN(R)SO2(CH2)pR;
R7 и R8 представляют собой независимо водород, галоген, алифатическую группу, алкиларил, aралкил, арил, гетероалкил, алкилгетероарил, гетероциклил, гетероарил, OR, N(R)2, SR, -O(CH2)mN(R)C(O)(CH2)pR, -O(CH2)mOC(O)(CH2)pR, -O(CH2)mC(O)(CH2)pN(R)2, -O(CH2)mC(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pN(R)2, -O(CH2)mOC(O)(CH2)pOR, -O(CH2)mOC(O)(CH2)pN(R)2, -NR(CH2)mN(R)C(O)(CH2)pR, -NR(CH2)mOC(O)(CH2)pR, -NR(CH2)mC(O)(CH2)pN(R)2, -NR(CH2)mC(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pN(R)2, -NR(CH2)mOC(O)(CH2)pOR, -NR(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN(R)C(O)(CH2)pR, -(CH2)mOC(O)(CH2)pR, -(CH2)mC(O)(CH2)pN(R)2, -(CH2)mC(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pN(R)2, -(CH2)mOC(O)(CH2)pOR, -(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN3, -O(CH2)mN3, -(CH2)mN(R)2, -(CH2)mOR, -(CH2)mS(O)(CH2)pR, -(CH2)mS(O)2(CH2)pR, -(CH2)mSO2(CH2)pN(R)2 или -(CH2)mN(R)SO2(CH2)pR.
В еще одном варианте осуществления формулы I или I' X представляет собой O или NR;
Y представляет собой -O-(CH2)mCOOR или -O-(CH2)mCON(R)2, в которой группы, связанные с атомом азота, могут находиться в Z- или E-конфигурации;
R1 и R2 представляют собой независимо водород, галоген;
R3 и R4 представляют собой независимо водород, алифатическую группу, -(CH2)mN(R)C(O)(CH2)pR, -(CH2)mOC(O)(CH2)pR, -(CH2)mN(R)C(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pN(R)2, -(CH2)mOC(O)(CH2)pOR, -(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN3, -(CH2)mN(R)2 или -(CH2)mOR;
R5, R6, R9 и R10 представляют собой независимо водород, алифатическую группу, аралкил, гетероалкил, гетероциклил или гетероарил; и
R7 и R8 представляют собой независимо водород, алифатическую группу, алкиларил, аралкил, арил, гетероалкил, алкилгетероарил, гетероциклил, гетероарил, OR, N(R)2, SR, -O(CH2)mN(R)C(O)(CH2)pR, -O(CH2)mOC(O)(CH2)pR, -O(CH2)mC(O)(CH2)pN(R)2, -O(CH2)mC(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pN(R)2, -O(CH2)mOC(O)(CH2)pOR, -O(CH2)mOC(O)(CH2)pN(R)2, -NR(CH2)mN(R)C(O)(CH2)pR, -NR(CH2)mOC(O)(CH2)pR, -NR(CH2)mC(O)(CH2)pN(R)2, -NR(CH2)mC(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pN(R)2, -NR(CH2)mOC(O)(CH2)pOR или -NR(CH2)mOC(O)(CH2)pN(R)2.
В еще другом варианте осуществления формулы I или I' X представляет собой O или NR;
Y представляет собой -O-(CH2)mCOOR или -O-(CH2)mCON(R)2, в которой группы, связанные с атомом азота, могут находиться в Z- или E-конфигурации;
R1 и R2 представляют собой независимо водород, галоген;
R3 и R4 представляют собой независимо водород, алифатическую группу, -(CH2)mN(R)C(O)(CH2)pR, -(CH2)mOC(O)(CH2)pR, -(CH2)mN(R)C(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pN(R)2, -(CH2)mOC(O)(CH2)pOR, -(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN3, -(CH2)mN(R)2 или -(CH2)mOR;
R5, R6, R9 и R10 представляют собой независимо водород, алифатическую группу, аралкил, гетероалкил, гетероциклил или гетероарил;
R7 и R8 представляют собой независимо алкиларил, аралкил, арил, гетероалкил, алкилгетероарил, гетероциклил, гетероарил, OR, N(R)2, SR, -O(CH2)mN(R)C(O)(CH2)pR, -O(CH2)mOC(O)(CH2)pR, -O(CH2)mC(O)(CH2)pN(R)2, -O(CH2)mC(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pN(R)2, -O(CH2)mOC(O)(CH2)pOR, -O(CH2)mOC(O)(CH2)pN(R)2, -NR(CH2)mN(R)C(O)(CH2)pR, -NR(CH2)mOC(O)(CH2)pR, -NR(CH2)mC(O)(CH2)pN(R)2, -NR(CH2)mC(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pN(R)2, -NR(CH2)mOC(O)(CH2)pOR или -NR(CH2)mOC(O)(CH2)pN(R)2.
В одном варианте осуществления формулы I или I' R представляет собой R11, где противоион Z представляет собой противоион галогена, ацетата, формиата, сульфоната, сульфата или фосфата.
В другом варианте осуществления обеспечивают соединение формулы II, его таутомер или фармацевтически приемлемую соль, сольват, сложный эфир или его пролекарство:
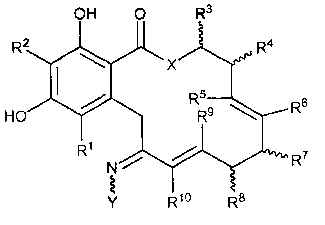
II
в которой переменные X, Y, R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R, m и p определены как для формулы I выше.
В другом варианте осуществления обеспечивают соединение формулы II', его таутомер или фармацевтически приемлемую соль, сольват, сложный эфир или его пролекарство:
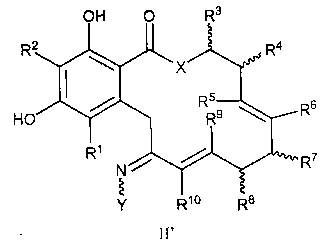
в которой переменные X, Y, R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R, m и p определены как для формулы I выше; при условии, что когда X представляет собой O, тогда, по меньшей мере, один из R5, R6, R7, R8, R9 или R10 не является водородом.
В одном варианте осуществления формулы II или II' X представляет собой O или NR.
В другом варианте осуществления формулы II или II' Y представляет собой -O-(CH2)mCOOR или -O-(CH2)mCON(R)2, в которой группы, связанные с атомом азота, могут находиться в Z- или E-конфигурации.
В другом варианте осуществления формулы II или II' R1 и R2 представляют собой водород.
В еще другом варианте осуществления формулы II или II' R3 и R4 представляют собой независимо алкил или водород.
В еще другом варианте осуществления формулы II или II' X представляет собой O и R9 и R10 представляют собой водород.
В другом варианте осуществления формулы II или II' R7 или R8 не представляют собой водород или алифатическую группу.
В другом варианте осуществления формулы II или II' R3 или R4 не представляют собой водород или алифатическую группу.
В другом варианте осуществления формулы II или II' X представляет собой O, Y представляет собой -O-(CH2)mCOOR или -O-(CH2)mCON(R)2, в которой группы, связанные с атомом азота, могут находиться в Z- или E-конфигурации; R1 и R2 представляют собой независимо водород или галоген; и R9 и R10 представляют собой водород.
В одном варианте осуществления формулы II или II' изобретение обеспечивает соединение, в котором:
X представляет собой O или NR;
Y представляет собой -O-(CH2)mCOOR или -O-(CH2)mCON(R)2, в которой группы, связанные с атомом азота, могут находиться в Z- или E-конфигурации;
R1 и R2 представляют собой независимо водород, галоген, OR, N(R)2 или алифатическую группу;
R3 и R4 представляют собой независимо водород, алифатическую группу, OR, N(R)2, -(CH2)mN(R)C(O)(CH2)pR, -(CH2)mOC(O)(CH2)pR, -(CH2)mC(O)(CH2)pN(R)2, -(CH2)mC(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pN(R)2, -(CH2)mOC(O)(CH2)pOR, -(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN3, -O(CH2)mN3, -(CH2)mN(R)2, -(CH2)mOR, -(CH2)mS(O)(CH2)pR, -(CH2)mS(O)2(CH2)pR, -(CH2)mSO2(CH2)pN(R)2 или -(CH2)mN(R)SO2(CH2)pR;
R5, R6, R9 и R10 представляют собой независимо водород, алифатическую группу, алкиларил, аралкил, арил, гетероалкил, алкилгетероарил, гетероциклил, гетероарил, -(CH2)mN(R)C(O)(CH2)pR, -(CH2)mOC(O)(CH2)pR, -(CH2)mC(O)(CH2)pN(R)2, -(CH2)mC(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pN(R)2, -(CH2)mOC(O)(CH2)pOR, -(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN3, -O(CH2)mN3, -(CH2)mN(R)2, -(CH2)mOR, -(CH2)mS(O)(CH2)pR, -(CH2)mS(O)2(CH2)pR, -(CH2)mSO2(CH2)pN(R)2 или -(CH2)mN(R)SO2(CH2)pR; и
R7 и R8 представляют собой независимо водород, галоген, алифатическую группу, алкиларил, аралкил, арил, гетероалкил, алкилгетероарил, гетероциклил, гетероарил, OR, N(R)2, SR, -O(CH2)mN(R)C(O)(CH2)pR, -O(CH2)mOC(O)(CH2)pR, -O(CH2)mC(O)(CH2)pN(R)2, -O(CH2)mC(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pN(R)2, -O(CH2)mOC(O)(CH2)pOR, -O(CH2)mOC(O)(CH2)pN(R)2, -NR(CH2)mN(R)C(O)(CH2)pR, -NR(CH2)mOC(O)(CH2)pR, -NR(CH2)mC(O)(CH2)pN(R)2, -NR(CH2)mC(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pN(R)2, -NR(CH2)mOC(O)(CH2)pOR, -NR(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN(R)C(O)(CH2)pR, -(CH2)mOC(O)(CH2)pR, -(CH2)mC(O)(CH2)pN(R)2, -(CH2)mC(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pN(R)2, -(CH2)mOC(O)(CH2)pOR, -(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN3, -O(CH2)mN3, -(CH2)mN(R)2, -(CH2)mOR, -(CH2)mS(O)(CH2)pR, -(CH2)mS(O)2(CH2)pR, -(CH2)mSO2(CH2)pN(R)2 или -(CH2)mN(R)SO2(CH2)pR.
В еще одном варианте осуществления формулы II или II' X представляет собой O или NR;
Y представляет собой -O-(CH2)mCOOR или -O-(CH2)mCON(R)2, в которой группы, связанные с атомом азота, могут находиться в Z- или E-конфигурации;
R1 и R2 представляют собой независимо водород или галоген;
R3 и R4 представляют собой независимо водород, алифатическую группу, -(CH2)mN(R)C(O)(CH2)pR, -(CH2)mOC(O)(CH2)pR, -(CH2)mN(R)C(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pN(R)2, -(CH2)mOC(O)(CH2)pOR, -(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN3, -(CH2)mN(R)2 или -(CH2)mOR;
R5, R6, R9 и R10 представляют собой независимо водород, алифатическую группу, аралкил, гетероалкил, гетероциклил или гетероарил; и
R7 и R8 представляют собой независимо водород, алифатическую группу, алкиларил, аралкил, арил, гетероалкил, алкилгетероарил, гетероциклил, гетероарил, OR, N(R)2, SR, -O(CH2)mN(R)C(O)(CH2)pR, -O(CH2)mOC(O)(CH2)pR, -O(CH2)mC(O)(CH2)pN(R)2, -O(CH2)mC(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pN(R)2, -O(CH2)mOC(O)(CH2)pOR, -O(CH2)mOC(O)(CH2)pN(R)2, -NR(CH2)mN(R)C(O)(CH2)pR, -NR(CH2)mOC(O)(CH2)pR, -NR(CH2)mC(O)(CH2)pN(R)2, -NR(CH2)mC(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pN(R)2, -NR(CH2)mOC(O)(CH2)pOR или -NR(CH2)mOC(O)(CH2)pN(R)2.
В еще другом варианте осуществления формулы II или II' X представляет собой O или NR;
Y представляет собой -O-(CH2)mCOOR или -O-(CH2)mCON(R)2, в которой группы, связанные с атомом азота, могут находиться в Z- или E-конфигурации;
R1 и R2 представляют собой независимо водород или галоген;
R3 и R4 представляют собой независимо водород, алифатическую группу, -(CH2)mN(R)C(O)(CH2)pR, -(CH2)mOC(O)(CH2)pR, -(CH2)mN(R)C(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pN(R)2, -(CH2)mOC(O)(CH2)pOR, -(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN3, -(CH2)mN(R)2 или -(CH2)mOR;
R5, R6, R9 и R10 представляют собой независимо водород, алифатическую группу, аралкил, гетероалкил, гетероциклил или гетероарил; и
R7 и R8 представляют собой независимо алкиларил, аралкил, арил, гетероалкил, алкилгетероарил, гетероциклил, гетероарил, OR, N(R)2, SR, -O(CH2)mN(R)C(O)(CH2)pR, -O(CH2)mOC(O)(CH2)pR, -O(CH2)mC(O)(CH2)pN(R)2, -O(CH2)mC(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pN(R)2, -O(CH2)mOC(O)(CH2)pOR, -O(CH2)mOC(O)(CH2)pN(R)2, -NR(CH2)mN(R)C(O)(CH2)pR, -NR(CH2)mOC(O)(CH2)pR, -NR(CH2)mC(O)(CH2)pN(R)2, -NR(CH2)mC(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pN(R)2, -NR(CH2)mOC(O)(CH2)pOR или -NR(CH2)mOC(O)(CH2)pN(R)2.
В еще одном варианте осуществления формулы II или II' X представляет собой O или NR;
Y представляет собой -O-(CH2)mCOOR или -O-(CH2)mCON(R)2, в которой группы, связанные с атомом азота, могут находиться в Z- или E-конфигурации;
R1 и R2 представляют собой независимо водород или галоген;
R3 и R4 представляют собой независимо водород, алифатическую группу, -(CH2)mN(R)C(O)(CH2)pR, -(CH2)mOC(O)(CH2)pR, -(CH2)mN(R)C(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pN(R)2, -(CH2)mOC(O)(CH2)pOR, -(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN3, -(CH2)mN(R)2 или -(CH2)mOR;
R5, R6, R9 и R10 представляют собой независимо водород, алифатическую группу, аралкил, гетероалкил, гетероциклил или гетероарил; и
R7 и R8 представляют собой независимо -OR, -N(R)2, -SR, -O(CH2)mN(R)C(O)(CH2)pR, -O(CH2)mOC(O)(CH2)pR, -O(CH2)mC(O)(CH2)pN(R)2, -O(CH2)mC(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pN(R)2, -O(CH2)mOC(O)(CH2)pOR, -O(CH2)mOC(O)(CH2)pN(R)2, -NR(CH2)mN(R)C(O)(CH2)pR, -NR(CH2)mOC(O)(CH2)pR, -NR(CH2)mC(O)(CH2)pN(R)2, -NR(CH2)mC(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pN(R)2, -NR(CH2)mOC(O)(CH2)pOR или -NR(CH2)mOC(O)(CH2)pN(R)2.
В другом варианте осуществления обеспечивают соединение формулы III, его таутомер или фармацевтически приемлемую соль, сольват, сложный эфир или его пролекарство:

в которой переменные X, Y, R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R, m и p определены как для формулы I выше.
В другом варианте осуществления изобретения обеспечивают соединение формулы III', его таутомер или фармацевтически приемлемую соль, сольват, сложный эфир или его пролекарство:
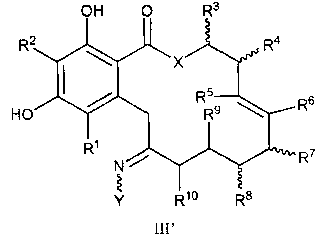
в которой переменные X, Y, R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R, m и p определены как для формулы I выше; при условии, что по меньшей мере, один из R5, R6, R7 или R8 не является водородом.
В одном варианте осуществления формулы III или III' X представляет собой O или NR.
В другом варианте осуществления формулы III или III' Y представляет собой -O-(CH2)mCOOR или -O-(CH2)mCON(R)2, в которой группы, связанные с атомом азота, могут находиться в Z- или E-конфигурации.
В другом варианте осуществления формулы III или III' R1 и R2 представляют собой водород.
В еще другом варианте осуществления формулы III или III' R3 и R4 представляют собой независимо алкил или водород.
В еще другом варианте осуществления формулы III или III' X представляет собой O и R9 и R10 представляют собой водород.
В другом варианте осуществления формулы III или III' R3 или R4 не представляют собой водород или алифатическую группу.
В другом варианте осуществления формулы III или III' R7 или R8 не представляют собой водород или алифатическую группу.
В еще другом варианте осуществления формулы III или III' R9 или R10 представляют собой независимо OR, SR, -O(CH2)mN(R)C(O)(CH2)pR, -O(CH2)mOC(O)(CH2)pR, -O(CH2)mC(O)(CH2)pN(R)2, -O(CH2)mC(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pN(R)2, -O(CH2)mOC(O)(CH2)pOR, -O(CH2)mOC(O)(CH2)pN(R)2, -NR(CH2)mN(R)C(O)(CH2)pR, -NR(CH2)mOC(O)(CH2)pR, -NR(CH2)mC(O)(CH2)pN(R)2, -NR(CH2)mC(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pN(R)2 или -NR(CH2)mOC(O)(CH2)pOR, -NR(CH2)mOC(O)(CH2)pN(R)2.
В другом варианте осуществления формулы III или III' X представляет собой O, Y представляет собой -O-(CH2)mCOOR или -O-(CH2)mCON(R)2, в которой группы, связанные с атомом азота, могут находиться в Z- или E-конфигурации; R1 и R2 представляют собой независимо водород или галоген; и R9 и R10 представляют собой водород.
В одном варианте осуществления формулы III или III' изобретение обеспечивает соединение, в котором:
X представляет собой O или NR;
Y представляет собой -O-(CH2)mCOOR или -O-(CH2)mCON(R)2, в которой группы, связанные с атомом азота, могут находиться в Z- или E-конфигурации;
R1 и R2 представляют собой независимо водород, галоген, OR, N(R)2 или алифатическую группу;
R3 и R4 представляют собой независимо водород, алифатическую группу, OR, N(R)2, -(CH2)mN(R)C(O)(CH2)pR, -(CH2)mOC(O)(CH2)pR, -(CH2)mC(O)(CH2)pN(R)2, -(CH2)mC(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pN(R)2, -(CH2)mOC(O)(CH2)pOR, -(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN3, -O(CH2)mN3, -(CH2)mN(R)2, -(CH2)mOR, -(CH2)mS(O)(CH2)pR, -(CH2)mS(O)2(CH2)pR, -(CH2)mSO2(CH2)pN(R)2 или -(CH2)mN(R)SO2(CH2)pR;
R5 и R6 представляют собой независимо водород, алифатическую группу, алкиларил, аралкил, арил, гетероалкил, алкилгетероарил, гетероциклил, гетероарил, OR, SR, -O(CH2)mN(R)C(O)(CH2)pR, -O(CH2)mOC(O)(CH2)pR, -O(CH2)mC(O)(CH2)pN(R)2, -O(CH2)mC(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pN(R)2, -O(CH2)mOC(O)(CH2)pOR, -O(CH2)mOC(O)(CH2)pN(R)2, -NR(CH2)mN(R)C(O)(CH2)pR, -NR(CH2)mOC(O)(CH2)pR, -NR(CH2)mC(O)(CH2)pN(R)2, -NR(CH2)mC(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pN(R)2, -NR(CH2)mOC(O)(CH2)pOR, -NR(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN(R)C(O)(CH2)pR, -(CH2)mOC(O)(CH2)pR, -(CH2)mC(O)(CH2)pN(R)2, -(CH2)mC(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pN(R)2, -(CH2)mOC(O)(CH2)pOR, -(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN3, -O(CH2)mN3, -(CH2)mN(R)2, -(CH2)mOR, -(CH2)mS(O)(CH2)pR, -(CH2)mS(O)2(CH2)pR, -(CH2)mSO2(CH2)pN(R)2 или -(CH2)mN(R)SO2(CH2)pR;
R7, R8, R9 и R10 представляют собой независимо водород, галоген, алифатическую группу, алкиларил, aралкил, арил, гетероалкил, алкилгетероарил, гетероциклил, гетероарил, OR, N(R)2, SR, -O(CH2)mN(R)C(O)(CH2)pR, -O(CH2)mOC(O)(CH2)pR, -O(CH2)mC(O)(CH2)pN(R)2, -O(CH2)mC(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pN(R)2, -O(CH2)mOC(O)(CH2)pOR, -O(CH2)mOC(O)(CH2)pN(R)2, -NR(CH2)mN(R)C(O)(CH2)pR, -NR(CH2)mOC(O)(CH2)pR, -NR(CH2)mC(O)(CH2)pN(R)2, -NR(CH2)mC(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pN(R)2, -NR(CH2)mOC(O)(CH2)pOR, -NR(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN(R)C(O)(CH2)pR, -(CH2)mOC(O)(CH2)pR, -(CH2)mC(O)(CH2)pN(R)2, -(CH2)mC(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pN(R)2, -(CH2)mOC(O)(CH2)pOR, -(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN3, -O(CH2)mN3, -(CH2)mN(R)2, -(CH2)mOR, -(CH2)mS(O)(CH2)pR, -(CH2)mS(O)2(CH2)pR, -(CH2)mSO2(CH2)pN(R)2 или -(CH2)mN(R)SO2(CH2)pR; и R, m и p определены как для формулы I выше.
В еще одном варианте осуществления формулы III или III' X представляет собой O или NR;
Y представляет собой -O-(CH2)mCOOR или -O-(CH2)mCON(R)2, в которой группы, связанные с атомом азота, могут находиться в Z- или E-конфигурации;
R1 и R2 представляют собой независимо водород, галоген;
R3 и R4 представляют собой независимо водород, алифатическую группу, OR, N(R)2, -(CH2)mN(R)C(O)(CH2)pR, -(CH2)mOC(O)(CH2)pR, -(CH2)mN(R)C(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pN(R)2, -(CH2)mOC(O)(CH2)pOR, -(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN3, -(CH2)mN(R)2 или -(CH2)mOR;
R5 и R6 представляют собой независимо водород, алифатическую группу, аралкил, гетероалкил, гетероциклил или гетероарил; и
R7, R8, R9 и R10 представляют собой независимо водород, алифатическую группу, алкиларил, аралкил, арил, гетероалкил, алкилгетероарил, гетероциклил, гетероарил, OR, N(R)2, SR, -O(CH2)mN(R)C(O)(CH2)pR, -O(CH2)mOC(O)(CH2)pR, -O(CH2)mC(O)(CH2)pN(R)2, -O(CH2)mC(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pN(R)2, -O(CH2)mOC(O)(CH2)pOR, -O(CH2)mOC(O)(CH2)pN(R)2, -NR(CH2)mN(R)C(O)(CH2)pR, -NR(CH2)mOC(O)(CH2)pR, -NR(CH2)mC(O)(CH2)pN(R)2, -NR(CH2)mC(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pN(R)2, -NR(CH2)mOC(O)(CH2)pOR или -NR(CH2)mOC(O)(CH2)pN(R)2.
В еще одном варианте осуществления формулы III или III' X представляет собой O или NR;
Y представляет собой -O-(CH2)mCOOR или -O-(CH2)mCON(R)2, в которой группы, связанные с атомом азота, могут находиться в Z- или E-конфигурации;
R1 и R2 представляют собой независимо водород, галоген;
R3 и R4 представляют собой независимо водород, алифатическую группу, -(CH2)mN(R)C(O)(CH2)pR, -(CH2)mOC(O)(CH2)pR, -(CH2)mN(R)C(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pN(R)2, -(CH2)mOC(O)(CH2)pOR, -(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN3, -(CH2)mN(R)2 или -(CH2)mOR;
R5 и R6 представляют собой независимо водород, алифатическую группу, аралкил, гетероалкил, гетероциклил или гетероарил;
R7, R8 представляют собой независимо алкиларил, аралкил, арил, гетероалкил, алкилгетероарил, гетероциклил, гетероарил, OR, N(R)2, SR, -O(CH2)mN(R)C(O)(CH2)pR, -O(CH2)mOC(O)(CH2)pR, -O(CH2)mC(O)(CH2)pN(R)2, -O(CH2)mC(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pN(R)2, -O(CH2)mOC(O)(CH2)pOR, -O(CH2)mOC(O)(CH2)pN(R)2, -NR(CH2)mN(R)C(O)(CH2)pR, -NR(CH2)mOC(O)(CH2)pR, -NR(CH2)mC(O)(CH2)pN(R)2, -NR(CH2)mC(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pN(R)2, -NR(CH2)mOC(O)(CH2)pOR или -NR(CH2)mOC(O)(CH2)pN(R)2; и
R9 и R10 представляют собой независимо водород, алифатическую группу, алкиларил, аралкил, арил, гетероалкил, алкилгетероарил, гетероциклил, гетероарил, OR, N(R)2, SR, -O(CH2)mN(R)C(O)(CH2)pR, -O(CH2)mOC(O)(CH2)pR, -O(CH2)mC(O)(CH2)pN(R)2, -O(CH2)mC(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pN(R)2, -O(CH2)mOC(O)(CH2)pOR, -O(CH2)mOC(O)(CH2)pN(R)2, -NR(CH2)mN(R)C(O)(CH2)pR, -NR(CH2)mOC(O)(CH2)pR, -NR(CH2)mC(O)(CH2)pN(R)2, -NR(CH2)mC(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pN(R)2, -NR(CH2)mOC(O)(CH2)pOR или -NR(CH2)mOC(O)(CH2)pN(R)2.
В еще одном варианте осуществления формулы III или III' X представляет собой O или NR;
Y представляет собой -O-(CH2)mCOOR или -O-(CH2)mCON(R)2, в которой группы, связанные с атомом азота, могут находиться в Z- или E-конфигурации;
R1 и R2 представляют собой независимо водород, галоген;
R3 и R4 представляют собой независимо водород, алифатическую группу, -(CH2)mN(R)C(O)(CH2)pR, -(CH2)mOC(O)(CH2)pR, -(CH2)mN(R)C(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pN(R)2, -(CH2)mOC(O)(CH2)pOR, -(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN3, -(CH2)mN(R)2 или -(CH2)mOR;
R5 и R6 представляют собой независимо водород, алифатическую группу, аралкил, гетероалкил, гетероциклил или гетероарил;
R7, R8 представляют собой независимо OR, N(R)2, SR, -O(CH2)mN(R)C(O)(CH2)pR, -O(CH2)mOC(O)(CH2)pR, -O(CH2)mC(O)(CH2)pN(R)2, -O(CH2)mC(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pN(R)2, -O(CH2)mOC(O)(CH2)pOR, -O(CH2)mOC(O)(CH2)pN(R)2, -NR(CH2)mN(R)C(O)(CH2)pR, -NR(CH2)mOC(O)(CH2)pR, -NR(CH2)mC(O)(CH2)pN(R)2, -NR(CH2)mC(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pN(R)2, -NR(CH2)mOC(O)(CH2)pOR или -NR(CH2)mOC(O)(CH2)pN(R)2; и
R9 и R10 представляют собой независимо водород, алифатическую группу, алкиларил, аралкил, арил, гетероалкил, алкилгетероарил, гетероциклил, гетероарил, OR, N(R)2, SR, -O(CH2)mN(R)C(O)(CH2)pR, -O(CH2)mOC(O)(CH2)pR, -O(CH2)mC(O)(CH2)pN(R)2, -O(CH2)mC(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pN(R)2, -O(CH2)mOC(O)(CH2)pOR, -O(CH2)mOC(O)(CH2)pN(R)2, -NR(CH2)mN(R)C(O)(CH2)pR, -NR(CH2)mOC(O)(CH2)pR, -NR(CH2)mC(O)(CH2)pN(R)2, -NR(CH2)mC(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pN(R)2, -NR(CH2)mOC(O)(CH2)pOR или -NR(CH2)mOC(O)(CH2)pN(R)2.
В другом варианте осуществления изобретения обеспечивают соединение формулы IV, его таутомер или фармацевтически приемлемую соль, сольват, сложный эфир или его пролекарство:
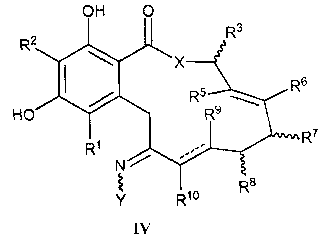
в которой переменные X, Y, R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R, m и p определены как для формулы I выше; и пунктирные линии представляют собой одинарную или двойную связь.
В одном варианте осуществления формулы IV Х представляет собой O или NR.
В другом варианте осуществления формулы IV Y представляет собой -O-(CH2)mCOOR или -O-(CH2)mCON(R)2, в которой группы, связанные с атомом азота, могут находиться в Z- или E-конфигурации.
В другом варианте осуществления формулы IV R1 и R2 представляют собой водород.
В еще другом варианте осуществления формулы IV R3 и R4 представляют собой независимо алкил или водород.
В еще другом варианте осуществления X представляет собой O и R9 и R10 представляют собой водород.
В другом варианте осуществления формулы IV R7 или R8 не представляют собой водород или алифатическую группу.
В другом варианте осуществления формулы IV R3 или R4 не представляют собой водород или алифатическую группу.
В другом варианте осуществления формулы IV X представляет собой O, Y представляет собой -O-(CH2)mCOOR или -O-(CH2)mCON(R)2, в которой группы, связанные с атомом азота, могут находиться в Z- или E-конфигурации; R1 и R2 представляют собой независимо водород или галоген; и R9 и R10 представляют собой водород.
В другом варианте осуществления формулы IV X представляет собой O или NR и двойная связь присутствует между атомами углерода, имеющими R9 и R10.
В еще одном варианте осуществления формулы IV X представляет собой O или NR и связь между атомами углерода, имеющими R9 и R10, является одинарной связью.
В другом варианте осуществления формулы IV Y представляет собой -O-(CH2)mCOOR или -O-(CH2)mCON(R)2, в которой группы, связанные с атомом азота, могут находиться в Z- или E-конфигурации.
В одном варианте осуществления формулы IV изобретение обеспечивает соединение, в котором:
X представляет собой O или NR;
Y представляет собой -O-(CH2)mCOOR или -O-(CH2)mCON(R)2, в которой группы, связанные с атомом азота, могут находиться в Z- или E-конфигурации;
R1 и R2 представляют собой независимо водород, галоген, OR, N(R)2 или алифатическую группу;
R3 представляет собой водород, алифатическую группу, OR, N(R)2, -(CH2)mN(R)C(O)(CH2)pR, -(CH2)mOC(O)(CH2)pR, -(CH2)mC(O)(CH2)pN(R)2, -(CH2)mC(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pN(R)2, -(CH2)mOC(O)(CH2)pOR, -(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN3, -O(CH2)mN3, -(CH2)mN(R)2, -(CH2)mOR, -(CH2)mS(O)(CH2)pR, -(CH2)mS(O)2(CH2)pR, -(CH2)mSO2(CH2)pN(R)2 или -(CH2)mN(R)SO2(CH2)pR;
R5, R6, R9 и R10 представляют собой независимо водород, алифатическую группу, алкиларил, аралкил, арил, гетероалкил, алкилгетероарил, гетероциклил, гетероарил, OR, SR, -O(CH2)mN(R)C(O)(CH2)pR, -O(CH2)mOC(O)(CH2)pR, -O(CH2)mC(O)(CH2)pN(R)2, -O(CH2)mC(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pN(R)2, -O(CH2)mOC(O)(CH2)pOR, -O(CH2)mOC(O)(CH2)pN(R)2, -NR(CH2)mN(R)C(O)(CH2)pR, -NR(CH2)mOC(O)(CH2)pR, -NR(CH2)mC(O)(CH2)pN(R)2, -NR(CH2)mC(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pN(R)2, -NR(CH2)mOC(O)(CH2)pOR, -NR(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN(R)C(O)(CH2)pR, -(CH2)mOC(O)(CH2)pR, -(CH2)mC(O)(CH2)pN(R)2, -(CH2)mC(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pN(R)2, -(CH2)mOC(O)(CH2)pOR, -(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN3, -O(CH2)mN3, -(CH2)mN(R)2, -(CH2)mOR, -(CH2)mS(O)(CH2)pR, -(CH2)mS(O)2(CH2)pR, -(CH2)mSO2(CH2)pN(R)2 или -(CH2)mN(R)SO2(CH2)pR; и
R7 и R8 представляют собой независимо водород, галоген, алифатическую группу, алкиларил, аралкил, арил, гетероалкил, алкилгетероарил, гетероциклил, гетероарил, OR, N(R)2, SR, -O(CH2)mN(R)C(O)(CH2)pR, -O(CH2)mOC(O)(CH2)pR, -O(CH2)mC(O)(CH2)pN(R)2, -O(CH2)mC(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pN(R)2, -O(CH2)mOC(O)(CH2)pOR, -O(CH2)mOC(O)(CH2)pN(R)2, -NR(CH2)mN(R)C(O)(CH2)pR, -NR(CH2)mOC(O)(CH2)pR, -NR(CH2)mC(O)(CH2)pN(R)2, -NR(CH2)mC(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pN(R)2, -NR(CH2)mOC(O)(CH2)pOR, -NR(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN(R)C(O)(CH2)pR, -(CH2)mOC(O)(CH2)pR, -(CH2)mC(O)(CH2)pN(R)2, -(CH2)mC(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pN(R)2, -(CH2)mOC(O)(CH2)pOR, -(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN3, -O(CH2)mN3, -(CH2)mN(R)2, -(CH2)mOR, -(CH2)mS(O)(CH2)pR, -(CH2)mS(O)2(CH2)pR, -(CH2)mSO2(CH2)pN(R)2 или -(CH2)mN(R)SO2(CH2)pR.
В еще одном варианте осуществления формулы IV X представляет собой O или NR;
Y представляет собой -O-(CH2)mCOOR или -O-(CH2)mCON(R)2, в которой группы, связанные с атомом азота, могут находиться в Z- или E-конфигурации;
R1 и R2 представляют собой независимо водород, галоген;
R3 представляет собой водород, алифатическую группу, OR, N(R)2, -(CH2)mN(R)C(O)(CH2)pR, -(CH2)mOC(O)(CH2)pR, -(CH2)mN(R)C(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pN(R)2, -(CH2)mOC(O)(CH2)pOR, -(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN3, -(CH2)mN(R)2 или -(CH2)mOR;
R5, R6, R9 и R10 представляют собой независимо водород, алифатическую группу, аралкил, гетероалкил, гетероциклил или гетероарил; и
R7 и R8 представляют собой независимо водород, алифатическую группу, алкиларил, аралкил, арил, гетероалкил, алкилгетероарил, гетероциклил, гетероарил, OR, N(R)2, SR, -O(CH2)mN(R)C(O)(CH2)pR, -O(CH2)mOC(O)(CH2)pR, -O(CH2)mC(O)(CH2)pN(R)2, -O(CH2)mC(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pN(R)2, -O(CH2)mOC(O)(CH2)pOR, -O(CH2)mOC(O)(CH2)pN(R)2, -NR(CH2)mN(R)C(O)(CH2)pR, -NR(CH2)mOC(O)(CH2)pR, -NR(CH2)mC(O)(CH2)pN(R)2, -NR(CH2)mC(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pN(R)2, -NR(CH2)mOC(O)(CH2)pOR или -NR(CH2)mOC(O)(CH2)pN(R)2.
В еще одном варианте осуществления формулы IV X представляет собой O или NR;
Y представляет собой -O-(CH2)mCOOR или -O-(CH2)mCON(R)2, в которой группы, связанные с атомом азота, могут находиться в Z- или E-конфигурации;
R1 и R2 представляют собой независимо водород, галоген;
R3 представляет собой водород, алифатическую группу, OR, N(R)2, -(CH2)mN(R)C(O)(CH2)pR, -(CH2)mOC(O)(CH2)pR, -(CH2)mN(R)C(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pN(R)2, -(CH2)mOC(O)(CH2)pOR, -(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN3, -(CH2)mN(R)2 или -(CH2)mOR;
R5, R6, R9 и R10 представляют собой независимо водород, алифатическую группу, аралкил, гетероалкил, гетероциклил или гетероарил;
R7 и R8 представляют собой независимо OR, N(R)2, SR, -O(CH2)mN(R)C(O)(CH2)pR, -O(CH2)mOC(O)(CH2)pR, -O(CH2)mC(O)(CH2)pN(R)2, -O(CH2)mC(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pN(R)2, -O(CH2)mOC(O)(CH2)pOR, -O(CH2)mOC(O)(CH2)pN(R)2, -NR(CH2)mN(R)C(O)(CH2)pR, -NR(CH2)mOC(O)(CH2)pR, -NR(CH2)mC(O)(CH2)pN(R)2, -NR(CH2)mC(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pN(R)2, -NR(CH2)mOC(O)(CH2)pOR или -NR(CH2)mOC(O)(CH2)pN(R)2.
В другом варианте осуществления изобретения обеспечивают соединение формулы V, его таутомер или фармацевтически приемлемую соль, сольват, сложный эфир или его пролекарство,
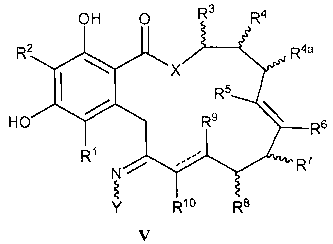
в которой переменные X, Y, R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R, m и p определены как для формулы I выше; и R4a определен как R4 в формуле I выше; и пунктирные линии представляют собой одинарную или двойную связь.
В одном варианте осуществления формулы V X представляет собой O или NR. В другом варианте осуществления формулы V X представляет собой O или NR и двойная связь присутствует между атомами углерода, имеющими R9 и R10.
В еще одном варианте осуществления формулы V X представляет собой O или NR и связь между атомами углерода, имеющими R9 и R10, является одинарной связью.
В другом варианте осуществления формулы V Y представляет собой -O-(CH2)mCOOR или -O-(CH2)mCON(R)2, в которой группы, связанные с атомом азота, могут находиться в Z- или E-конфигурации.
В другом варианте осуществления формулы V R1 и R2 представляют собой водород.
В еще другом варианте осуществления формулы V R3 представляет собой алкил или водород.
В еще другом варианте осуществления формулы V R4 и R4a представляют собой независимо алкил или водород.
В еще другом варианте осуществления формулы V X представляет собой O и R9 и R10 представляют собой водород.
В другом варианте осуществления формулы V X представляет собой O, Y представляет собой -O-(CH2)mCOOR или -O-(CH2)mCON(R)2, в которой группы, связанные с атомом азота, могут находиться в Z- или E-конфигурации; R1 и R2 представляют собой независимо водород или галоген; и R9 и R10 представляют собой водород.
В одном варианте осуществления формулы V изобретение обеспечивает соединение, в котором:
X представляет собой O или NR;
Y представляет собой -O-(CH2)mCOOR или -O-(CH2)mCON(R)2, в которой группы, связанные с атомом азота, могут находиться в Z- или E-конфигурации;
R1 и R2 представляют собой независимо водород, галоген, OR, N(R)2 или алифатическую группу;
R3, R4 и R4a представляют собой независимо водород, алифатическую группу, OR, N(R)2, -(CH2)mN(R)C(O)(CH2)pR, -(CH2)mOC(O)(CH2)pR, -(CH2)mC(O)(CH2)pN(R)2, -(CH2)mC(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pN(R)2, -(CH2)mOC(O)(CH2)pOR, -(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN3, -O(CH2)mN3, -(CH2)mN(R)2, -(CH2)mOR, -(CH2)mS(O)(CH2)pR, -(CH2)mS(O)2(CH2)pR, -(CH2)mSO2(CH2)pN(R)2 или -(CH2)mN(R)SO2(CH2)pR;
R5, R6, R9 и R10 представляют собой независимо водород, алифатическую группу, алкиларил, аралкил, арил, гетероалкил, алкилгетероарил, гетероциклил, гетероарил, OR, SR, -O(CH2)mN(R)C(O)(CH2)pR, -O(CH2)mOC(O)(CH2)pR, -O(CH2)mC(O)(CH2)pN(R)2, -O(CH2)mC(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pN(R)2, -O(CH2)mOC(O)(CH2)pOR, -O(CH2)mOC(O)(CH2)pN(R)2, -NR(CH2)mN(R)C(O)(CH2)pR, -NR(CH2)mOC(O)(CH2)pR, -NR(CH2)mC(O)(CH2)pN(R)2, -NR(CH2)mC(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pN(R)2, -NR(CH2)mOC(O)(CH2)pOR, -NR(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN(R)C(O)(CH2)pR, -(CH2)mOC(O)(CH2)pR, -(CH2)mC(O)(CH2)pN(R)2, -(CH2)mC(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pN(R)2, -(CH2)mOC(O)(CH2)pOR, -(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN3, -O(CH2)mN3, -(CH2)mN(R)2, -(CH2)mOR, -(CH2)mS(O)(CH2)pR, -(CH2)mS(O)2(CH2)pR, -(CH2)mSO2(CH2)pN(R)2 или -(CH2)mN(R)SO2(CH2)pR;
R7 и R8 представляют собой независимо водород, галоген, алифатическую группу, алкиларил, аралкил, арил, гетероалкил, алкилгетероарил, гетероциклил, гетероарил, OR, N(R)2, SR, -O(CH2)mN(R)C(O)(CH2)pR, -O(CH2)mOC(O)(CH2)pR, -O(CH2)mC(O)(CH2)pN(R)2, -O(CH2)mC(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pN(R)2, -O(CH2)mOC(O)(CH2)pOR, -O(CH2)mOC(O)(CH2)pN(R)2, -NR(CH2)mN(R)C(O)(CH2)pR, -NR(CH2)mOC(O)(CH2)pR, -NR(CH2)mC(O)(CH2)pN(R)2, -NR(CH2)mC(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pN(R)2, -NR(CH2)mOC(O)(CH2)pOR, -NR(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN(R)C(O)(CH2)pR, -(CH2)mOC(O)(CH2)pR, -(CH2)mC(O)(CH2)pN(R)2, -(CH2)mC(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pN(R)2, -(CH2)mOC(O)(CH2)pOR, -(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN3, -O(CH2)mN3, -(CH2)mN(R)2, -(CH2)mOR, -(CH2)mS(O)(CH2)pR, -(CH2)mS(O)2(CH2)pR, -(CH2)mSO2(CH2)pN(R)2 или -(CH2)mN(R)SO2(CH2)pR.
В еще одном варианте осуществления формулы V X представляет собой O или NR;
Y представляет собой -O-(CH2)mCOOR или -O-(CH2)mCON(R)2, в которой группы, связанные с атомом азота, могут находиться в Z- или E-конфигурации;
R1 и R2 представляют собой независимо водород, галоген;
R3, R4 и R4a представляют собой независимо водород, алифатическую группу, OR, N(R)2, -(CH2)mN(R)C(O)(CH2)pR, -(CH2)mOC(O)(CH2)pR, -(CH2)mN(R)C(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pN(R)2, -(CH2)mOC(O)(CH2)pOR, -(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN3, -(CH2)mN(R)2 или -(CH2)mOR;
R5, R6, R9 и R10 представляют собой независимо водород, алифатическую группу, аралкил, гетероалкил, гетероциклил или гетероарил; и
R7 и R8 представляют собой независимо водород, алифатическую группу, алкиларил, аралкил, арил, гетероалкил, алкилгетероарил, гетероциклил, гетероарил, OR, N(R)2, SR, -O(CH2)mN(R)C(O)(CH2)pR, -O(CH2)mOC(O)(CH2)pR, -O(CH2)mC(O)(CH2)pN(R)2, -O(CH2)mC(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pN(R)2, -O(CH2)mOC(O)(CH2)pOR, -O(CH2)mOC(O)(CH2)pN(R)2, -NR(CH2)mN(R)C(O)(CH2)pR, -NR(CH2)mOC(O)(CH2)pR, -NR(CH2)mC(O)(CH2)pN(R)2, -NR(CH2)mC(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pN(R)2, -NR(CH2)mOC(O)(CH2)pOR или -NR(CH2)mOC(O)(CH2)pN(R)2.
В еще одном варианте осуществления формулы V X представляет собой O или NR;
Y представляет собой -O-(CH2)mCOOR или -O-(CH2)mCON(R)2, в которой группы, связанные с атомом азота, могут находиться в Z- или E-конфигурации;
R1 и R2 представляют собой независимо водород, галоген;
R3, R4 и R4a представляют собой независимо водород, алифатическую группу, -(CH2)mN(R)C(O)(CH2)pR, -(CH2)mOC(O)(CH2)pR, -(CH2)mN(R)C(O)(CH2)pOR, -(CH2)mN(R)C(O)(CH2)pN(R)2, -(CH2)mOC(O)(CH2)pOR, -(CH2)mOC(O)(CH2)pN(R)2, -(CH2)mN3, -(CH2)mN(R)2 или -(CH2)mOR;
R5, R6, R9 и R10 представляют собой независимо водород, алифатическую группу, аралкил, гетероалкил, гетероциклил или гетероарил;
R7 и R8 представляют собой независимо OR, N(R)2, SR, -O(CH2)mN(R)C(O)(CH2)pR, -O(CH2)mOC(O)(CH2)pR, -O(CH2)mC(O)(CH2)pN(R)2, -O(CH2)mC(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pOR, -O(CH2)mN(R)C(O)(CH2)pN(R)2, -O(CH2)mOC(O)(CH2)pOR, -O(CH2)mOC(O)(CH2)pN(R)2, -NR(CH2)mN(R)C(O)(CH2)pR, -NR(CH2)mOC(O)(CH2)pR, -NR(CH2)mC(O)(CH2)pN(R)2, -NR(CH2)mC(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pOR, -NR(CH2)mN(R)C(O)(CH2)pN(R)2, -NR(CH2)mOC(O)(CH2)pOR или -NR(CH2)mOC(O)(CH2)pN(R)2.
В определенных вариантах осуществления настоящего изобретения обеспечивают соединения, представленные в таблице 1, их таутомеры или фармацевтически приемлемые соли, сольваты, сложные эфиры или их пролекарства:
Фармацевтически приемлемые соли и пролекарства
Термины «фармацевтически приемлемая соль» и «пролекарство» используют повсеместно в спецификации для описания любой фармацевтически приемлемой формы (такой как соль, сложный эфир, фосфатный эфир, соль сложного эфира или родственная группа) соединения, которая при введении пациенту, обеспечивает соединение, описанное в спецификации. В случаях, когда соединения являются достаточно основными или кислыми для образования стабильных нетоксичных кислотных или основных солей, может быть подходящим введение соединений в качестве солей. Термин фармацевтически приемлемые соли или комплексы относится к солям или комплексам, которые сохраняют желательную биологическую активность соединений настоящего изобретения и проявляют минимальные нежелательные токсические эффекты.
Неограничивающие примеры таких солей представляют собой (a) кислотно-аддитивные соли, образованные с неорганическими кислотами, такие как сульфат, нитрат, гидрохлорид, фосфат и подобные. Например, соли, полученные с помощью добавления хлористоводородной кислоты, бромистоводородной кислоты, серной кислоты, фосфорной кислоты, азотной кислоты и подобных. Кроме того, изобретение охватывает соли, образованные с органическими кислотами, такими как уксусная кислота, щавелевая кислота, винная кислота, янтарная кислота, яблочная кислота, аскорбиновая кислота, бензойная кислота, дигалловая кислота, памовая кислота, альгиновая кислота, полиглутаминовая кислота, нафталинсульфоновая кислота, нафталиндисульфоновая кислота и полигалактуроновая кислота, включая соли тозилат, метансульфонат, ацетат, цитрат, малонат, тартрат, сукцинат, бензоат, аскорбат, α-кетоглутарат и α-глицерофосфат. Изобретение также охватывает (b) основно-аддитивные соли, включая образованные с катионами металлов, таких как цинк, кальций, висмут, барий, магний, алюминий, медь, кобальт, никель, кадмий, натрий, калий, литий и подобные, или с катионом, полученным из аммиака, N,N-дибензилэтилендиамин, D-глюкозамин, тетраэтиламмоний или этилендиамин; или (c) комбинации (a) и (b); например, соль таннат цинка или подобные. Также в это определение включены известные специалистам в данной области техники фармацевтически приемлемые четвертичные соли, которые определенно включают четвертичную соль аммония формулы -NR+A-, в которой R определен выше и A представляет собой противоион, включая хлорид, бромид, йодид, -O-алкил, толуолсульфонат, метилсульфонат, сульфонат, фосфат или карбоксилат (такой как бензоат, сукцинат, ацетат, гликолят, малеат, малат, цитрат, тартрат, аскорбат, бензоат, циннамат, манделат, бензилат и дифенилацетат).
Фармацевтически приемлемые соли можно получить, используя стандартные методики, хорошо известные в данной области техники, например, взаимодействием достаточно основного соединения, такого как амин, с соответствующей кислотой, предоставляющей физиологически приемлемый анион.
Фармацевтически приемлемые «пролекарства» относятся к соединению, которое метаболизируется, например, гидролизуется или окисляется, в организме «хозяина» с получением соединения настоящего изобретения. Типичные примеры пролекарств включают соединения, которые имеют биологически нестабильные защитные группы на функциональной части активного соединения. Пролекарства включают соединения, которые можно окислить, восстановить, аминировать, деаминировать, гидроксилировать, дегидроксилировать, гидролизовать, дегидролизовать, алкилировать, деалкилировать, ацилировать, деацилировать, фосфорилировать, дефосфорилировать для получения активного соединения. Например, подходящим пролекарством может быть сложный эфир или амид карбоксильной кислоты, которые гидролизуются с получением кислоты. Неограничивающие примеры пролекарств включают, но не ограничиваются ими, алкильные или аралкильные сложные эфиры или амиды, включая метил, этил, пропил, бензил и бензилзамещенные сложные эфиры или амиды. Пролекарства также включают фосфатные эфиры соединений.
Стереоизомерия и полиморфизм
Соединения настоящего изобретения, имеющие хиральный центр, могут существовать и быть выделены в оптически активных и рацемических формах. Настоящее изобретение охватывает любые рацемические, оптически-активные, диастереомерные, полиморфные или стереоизомерные формы или их смеси соединений изобретения, которые обладают полезными свойствами, описанными в настоящей заявке.
В одном варианте осуществления соединения получают в оптически активной форме с помощью асимметричного синтеза, используя способы, описанные в настоящей заявке, или с помощью синтетических превращений, известных специалистам в данной области техники.
В данной области техники известны другие способы получения оптически активных материалов, и они включают, по меньшей мере, следующие:
i) физическое разделение кристаллов представляет собой методику, в соответствии с которой макроскопические кристаллы отдельных энантиомеров разделяют вручную. Эту методику можно использовать, если существуют кристаллы отдельных энантиомеров, то есть материал представляет собой конгломерат и кристаллы визуально можно различить;
ii) одновременная кристаллизация представляет собой методику, в соответствии с которой отдельные энантиомеры раздельно кристаллизуют из раствора рацемата, возможна, только если последний представляет собой конгломерат в твердом состоянии;
iii) ферментативные разделения представляют собой методику, в соответствии с которой происходит частичное или полное разделение рацемата на основании различных скоростей реакции для энантиомеров с ферментом;
iv) ферментативный асимметрический синтез представляет собой синтетическую методику, в соответствии с которой, по меньшей мере, одна стадия синтеза представляет собой ферментативную реакцию для получения энантиомерно чистого или обогащенного синтетического прекурсора желательного энантиомера;
v) химический асимметрический синтез представляет собой синтетическую методику, в соответствии с которой желательный энантиомер синтезируют из ахирального прекурсора при условиях, которые создают асимметрию (то есть хиральность) в продукте, которые могут быть достигнуты, используя хиральные катализаторы или хиральные вспомогательные средства;
vi) диастереомерные разделения представляют собой методику, в соответствии с которой рацемическое соединение взаимодействует с энантиомерно чистым реагентом (хиральное вспомогательное средство), которое превращает отдельные энантиомеры в диастереомеры. Полученные диастереомеры затем разделяют с помощью хроматографии или кристаллизации на основании их теперь более заметных структурных различий и хиральное вспомогательное средство затем удаляют для получения желательного энантиомера;
vii) асимметрические превращения первого и второго порядка представляют собой методику, в соответствии с которой диастереомеры из рацемата уравновешивают для получения преобладания в растворе диастереомера из желательного энантиомера или где предпочтительная кристаллизация диастереомера из желательного энантиомера смещает равновесие таким образом, что в конечном счете по существу весь материал превращают в кристаллический диастереомер из желательного энантиомера. Желательный энантиомер затем высвобождают из диастереомера;
viii) кинетические разделения представляют собой методику, которая относится к достижению частичного или полного растворения рацемата (или дальнейшего растворения частично растворенного соединения) на основании неравных скоростей реакции энантиомеров с хиральным, нерацемическим реагентом или катализатором при кинетических условиях;
ix) энантиоспецифический синтез из нерацемических прекурсоров представляет собой синтетическую методику, в соответствии с которой желательный энантиомер получают из нехиральных исходных материалов и где стереохимическая чистота не поставлена или только минимально поставлена под угрозу в течение синтеза;
x) хиральная жидкостная хроматография представляет собой методику, в соответствии с которой энантиомеры рацемата разделяют в жидкой подвижной фазе на основании их различных взаимодействий с неподвижной фазой. Неподвижная фаза может быть создана из хиральных материалов, или подвижная фаза может содержать дополнительный хиральный материал для создания различных взаимодействий;
xi) хиральная газовая хроматография представляет собой методику, в соответствии с которой рацемат испаряют и энантиомеры отделяют на основании их различных взаимодействий в газовой подвижной фазе с помощью колонки, содержащей неподвижную нерацемическую хиральную адсорбирующую фазу;
xii) экстракция с помощью хиральных растворителей представляет собой методику, в соответствии с которой энантиомеры разделяют на основании предпочтительного растворения одного энантиомера в определенном хиральном растворителе; или
xiii) перенос через хиральные мембраны представляет собой методику, в соответствии с которой рацемат помещают во взаимодействие с тонким мембранным барьером. Барьер обычно отделяет две смешивающиеся жидкости, одна - содержащая рацемат, и движущая сила, такая как градиент концентраций или давлений, вызывает предпочтительный перенос через мембранный барьер. Разделение происходит в результате нерацемической хиральной природы мембраны, которая позволяет проходить только одному энантиомеру рацемата.
Определения
Во всех случаях, когда термин в спецификации определяют как диапазон (то есть C1-4алкил), диапазон независимо относится к каждому элементу диапазона. В качестве неограничивающего примера, C1-4алкил означает независимо, C1, C2, C3 или C4 алкил. Подобно тому, когда один или более заместителей упоминают как «независимо выбранные из» группы, это означает, что каждый заместитель может быть любым элементом той группы и любая комбинация этих групп может быть отделена из группы. Например, если R1 и R2 могут быть независимо выбраны из X, Y и Z, это отдельно включает группы, R1 представляет собой X и R2 представляет собой X; R1 представляет собой X и R2 представляет собой Y; R1 представляет собой X и R2 представляет собой Z; R1 представляет собой Y и R2 представляет собой X; R1 представляет собой Y и R2 представляет собой Y; R1 представляет собой Y и R2 представляет собой Z; R1 представляет собой Z и R2 представляет собой X; R1 представляет собой Z и R2 представляет собой Y; и R1 представляет собой Z и R2 представляет собой Z.
Используемый в настоящем описании термин «алифатический» означает углеводороды с прямой цепью, разветвленные или циклические, обычно C1-C18 и в определенном варианте осуществления C1-C10 или C1-C6, которые полностью насыщены или содержат одну или более единиц ненасыщенности, но не являются ароматическими. Например, подходящие алифатические группы включают замещенные или незамещенные линейные, разветвленные или циклические алкильные, алкенильные, алкинильные группы и их гибриды, такие как (циклоалкил)алкил, (циклоалкенил)алкил или (циклоалкил)алкенил. Термины «алкил», «алкокси», «гидроксиалкил», «алкоксиалкил» и «алкоксикарбонил», используемые отдельно или как часть большей группы, включают как прямые, так и разветвленные цепи, содержащие от одного до двенадцати атомов углерода. Термины «алкенил» и «алкинил», используемые отдельно или как часть большей группы, включают как прямые, так и разветвленные цепи, содержащие от двух до двенадцати атомов углерода. Термин «циклоалкил», используемый отдельно или как часть большей группы, включает циклические C3-C12 углеводороды, которые полностью насыщены или которые содержат одну или более единиц ненасыщенности, но которые не являются ароматическими, включая, но не ограничиваясь ими, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Cпециалистам в данной области техники известно, что алифатические группы могут необязательно быть замещены одной или более группами, включая, но не ограничиваясь ими, алкил, галогено, галогеналкил, гидроксил, карбоксил, ацил, ацилокси, амино, амидо, производные карбоксила, алкиламино, диалкиламино, ариламино, алкокси, арилокси, нитро, циано, тиол, имин, сульфоновую кислоту, сульфат, сульфонил, сульфанил, сульфинил, сульфамоил, сложный эфир, карбоксильную кислоту, амид, фосфонил, фосфинил, фосфорил, фосфин, сложный тиоэфир, тиоэфир, галид кислоты, ангидрид, оксим, гидразин, карбамат, фосфоновую кислоту, фосфат, фосфонат или любую другую устойчивую функциональную группу, которая не ингибирует фармакологическую активность этого соединения, или незащищенную, или защищенную при необходимости, например, как изложено в Greene, et al., Protective Groups in Organic Synthesis, John Wiley and Sons, Second Edition, 1991, которая включена в настоящее описание посредством ссылки.
Используемый в настоящем описании термин «алкил», если не определено иначе, относится к насыщенному с прямой цепью, разветвленному или циклическому, первичному, вторичному или третичному углеводороду, включая, но не ограничиваясь ими, группы обычно C1-C18 и в определенном варианте осуществления C1-C10 или C1-C6, и определенно включает метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, циклопентил, изопентил, неопентил, гексил, изогексил, циклогексил, циклогексилметил, 3-метилпентил, 2,2-диметилбутил и 2,3-диметилбутил. Алкильные группы могут быть замещенными, как отмечено выше для термина «алифатический».
Используемый в настоящем описании термин «низший алкил», и если не определено иначе, относится к необязательно замещенной C1-C4, насыщенной, с прямой цепью, разветвленной или в соответствующем случае циклической (например, циклопропил) алкильной группе, включая как замещенные, так и незамещенные формы.
Иллюстративные примеры алкильных групп представляют собой метил, этил, пропил, изопропил, циклопропил, бутил, втор-бутил, изобутил, трет-бутил, циклобутил, 1-метилбутил, 1,1-диметилпропил, пентил, циклопентил, изопентил, неопентил, циклопентил, гексил, изогексил и циклогексил. Cпециалистам в данной области техники известно, что если не определено иначе, алкильная группа может быть незамещенной или замещенной одной или более частями, выбранными из группы, состоящей из алкила, галогено, галогеналкила, гидроксила, карбоксила, ацила, ацилокси, амино, амидо, производных карбоксила, алкиламино, диалкиламино, ариламино, алкокси, арилокси, нитро, циано, тиола, имина, сульфоновой кислоты, сульфата, сульфонила, сульфанила, сульфинила, сульфамоила, сложного эфира, карбоксильной кислоты, амида, фосфонила, фосфинила, фосфорила, фосфина, сложного тиоэфира, тиоэфира, галида кислоты, ангидрида, оксима, гидразина, карбамата, фосфоновой кислоты, фосфата, фосфоната или любой другой устойчивой функциональной группы, которая не ингибирует фармакологическую активность этого соединения, или незащищенной, или защищенной при необходимости, например, как изложено в Greene et al., Protective Groups in Organic Synthesis, John Wiley & Sons, 3rd Ed., 1999.
Используемый в настоящем описании термин «галогено» или «галоген» включает хлор, бром, иод и фтор.
Используемый в настоящем описании термин «хиральный» включает соединение, которое обладает свойством не совпадать при наложении на его зеркальное отображение.
В данной области техники известно, что используемый в настоящем описании термин «таутомер» относится к дополнительным структурам, которые находятся в равновесии с изображенной структурой. Например, енольная структура ниже представляет собой таутомер кетонной структуры и известно, что она находится в равновесии с кетонной структурой.

Используемый в настоящем описании термин «сольват» или «фармацевтически приемлемый сольват» представляет собой сольват, образованный из объединения одной или более молекул растворителя с одной или более молекулами соединения любой одной из формул I, I', II, II', III, III', IV или V или соединения, изображенного в таблице 1. Термин сольват включает гидраты (например, гемигидрат, моногидрат, дигидрат, тригидрат, тетрагидрат и подобные).
Термин «алкилтио» относится к прямой или разветвленной цепи алкилсульфида с определенным числом углеродов, такого как, например, C1-4алкилтио, этилтио, -S-алкил, -S-алкенил, -S-алкинил и т.д.
Термины «алкиламино» или «ариламино» относятся к аминогруппе, которая имеет один или два алкильных или арильных заместителя, соответственно. Если иначе определенно не описано в настоящей заявке, когда алкил является соответствующей группой, тогда он представляет собой низший алкил или замещенный, или незамещенный.
Термин «алкилсульфонил» означает прямой или разветвленный алкилсульфон с определенным числом атомов углерода, как например, C1-6алкилсульфонил или метилсульфонил.
Термин «алкоксикарбонил» относится к производному сложного эфира карбоксильной кислоты с прямой или разветвленной цепью с определенным числом атомов углерода, такому как, например, метоксикарбонил, MeOCO-.
Используемый в настоящем описании термин «нитро» означает -NO2; термин «сульфогидрил» означает -SH; и термин «сульфонил» означает -SO2.
Термины «алкенил» и «алкинил» относятся к алкильным частям, включая как замещенные, так и незамещенные формы, в которых, по меньшей мере, одна насыщенная связь C-C замещена двойной или тройной связью. Таким образом, C2-6алкенил может представлять собой винил, аллил, 1-пропенил, 2-пропенил, 1-бутенил, 2-бутенил, 3-бутенил, 1-пентенил, 2-пентенил, 3-пентенил, 4-пентенил, 1-гексенил, 2-гексенил, 3-гексенил, 4-гексенил или 5-гексенил. Подобно этому C2-6алкинил может представлять собой этинил, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил, 3-бутинил, 1-пентинил, 2-пентинил, 3-пентинил, 4-пентинил, 1-гексинил, 2-гексинил, 3-гексинил, 4-гексинил или 5-гексинил.
Термин «алкилен» включает насыщенный, с прямой цепью, двухвалентный алкильный радикал формулы -(CH2)n-, в котором «n» может быть любым целым числом от 1 до 12.
«Алкил», «алкокси», «алкенил», «алкинил» и подобные включает группы как с прямой цепью, так и разветвленные. Однако, ссылка на определенный радикал, такой как «пропил», охватывает только радикал с прямой цепью, тогда как изомер с разветвленной цепью определенно называют как «изопропил».
Используемый в настоящем описании термин «арил», и если иначе не определено, относится к любому стабильному моноциклическому, бициклическому или трициклическому кольцу углеродов до 8 членов в каждом кольце, в котором, по меньшей мере, одно кольцо является ароматическим, как определено с помощью правила Хюккеля 4n+2, и особенно фенилу, бифенилу или нафтилу. Термин включает как замещенные, так и незамещенные группы. Арильная группа может необязательно быть замещенной одной или более группами. Специалистам в данной области техники известно, что примеры заместителей включают алкил, галогено, галогеноалкил, гидроксил, карбоксил, ацил, ацилокси, амино, амидо, производные карбоксила, алкиламино, диалкиламино, ариламино, алкокси, арилокси, нитро, циано, сульфоновую кислоту, тиол, имин, сульфат, сульфонил, сульфанил, сульфинил, сульфамоил, сложный эфир, карбоксильную кислоту, амид, фосфат, фосфонил, фосфинил, фосфорил, фосфин, сложный тиоэфир, тиоэфир, галид кислоты, ангидрид, оксим, гидразин, карбамат, фосфоновую кислоту, фосфонат или незащищенные, или защищенные при необходимости, например, как изложено в Greene, et al., «Protective Groups in Organic Synthesis», John Wiley and Sons, Second Edition, 1991.
В настоящем описании определено, что термин «алкарил» или «алкиларил» относится к алкильной группе с арильным заместителем или алкильной группой, связанной с молекулой через арильную группу. В настоящем описании определено, что термин «аралкил» или «арилалкил» относится к арильной группе, которая замещена алкильным заместителем или связана с молекулой через алкильную группу.
Термин «алкокси» означает алкильную группу с прямой или разветвленной цепью, имеющую присоединенный радикал кислорода, алкильную группу с определенным числом углеродов или любым числом в пределах этого диапазона. Например, «-О-алкил», C1-4алкокси, метокси и подобные.
Термин «ацил» включает группу формулы C(O)R', в которой R' представляет собой с прямой цепью, разветвленный или циклический алкил (включая низший алкил), остаток карбоксилата аминокислоты, арил, включая фенил, гетероарил, алкарил, аралкил, включая бензил, алкоксиалкил, включая метоксиметил, арилоксиалкил, такой как феноксиметил; или замещенный алкил (включая низший алкил), арил, включая фенил, необязательно замещенный хлором, бромом, фтором, иодом, C1-C4алкил или C1-C4алкокси, сложные эфиры сульфоната, такие как алкил или аралкилсульфонил, включая метансульфонил, сложные эфир моно-, ди- или трифосфата, тритил или монометокси-тритил, замещенный бензил, алкарил, аралкил, включая бензил, алкоксиалкил, включая метоксиметил, арилоксиалкил, такой как феноксиметил. Арильные группы необязательно содержат фенильную группу. В неограничивающих вариантах осуществлений ацильные группы включают ацетил, трифторацетил, метилацетил, циклопропилацетил, циклопропилкарбокси, пропионил, бутирил, изобутирил, гексаноил, гептаноил, октаноил, нео-гептаноил, фенилацетил, 2-ацетокси-2-фенилацетил, дифенилацетил, α-метокси-α-трифторметил-фенилацетил, бромацетил, 2-нитробензолацетил, 4-хлор-бензолацетил, 2-хлор-2,2-дифенилацетил, 2-хлор-2-фенилацетил, триметилацетил, хлордифторацетил, перфторацетил, фторацетил, бромдифторацетил, метоксиацетил, 2-тиофенацетил, хлорсульфонилацетил, 3-метоксифенилацетил, феноксиацетил, трет-бутилацетил, трихлорацетил, монохлорацетил, дихлорацетил, 7H-додекафтор-гептаноил, перфтор-гептаноил, 7H-додекафтор-гептаноил, 7-хлордодекафтор-гептаноил, 7-хлор-додекафтор-гептаноил, 7H-додекафторгептаноил, 7H-додека-фторгептаноил, нона-фтор-3,6-диокса-гептаноил, нонафтор-3,6-диоксагептаноил, перфторгептаноил, метоксибензоил, метил 3-амино-5-фенилтиофен-2-карбоксил, 3,6-дихлоро-2-метокси-бензоил, 4-(1,1,2,2-тетрафтор-этокси)-бензоил, 2-бром-пропионил, омега-аминокаприл, деканоил, н-пентадеканоил, стеарил, 3-циклопентил-пропионил, 1-бензол-карбоксил, O-ацетилманделил, пивалоилацетил, 1-адамантан-карбоксил, циклогексан-карбоксил, 2,6-пиридиндикарбоксил, циклопропин-карбоксил, циклобутан-карбоксил, перфторциклогексил-карбоксил, 4-метилбензоил, хлорметил изоксазолилкарбонил, перфторциклогексил-карбоксил, кротонил, 1-метил-1H-индазол-3-карбонил, 2-пропенил, изовалерил, 1-пирролидинкарбонил, 4-фенилбензоил.
Термин «ациламино» включает группу, имеющую структуру «-N(R')-C(=O)-R'», в которой каждый R' независимо представляет собой, как определено выше.
Термин «сложный эфир» включает группу структуры «-C(=O)-O-R'» или «-O-C(=O)-R'», в которой R' представляет собой с прямой цепью, разветвленный или циклический алкил (включая низший алкил), остаток карбоксила аминокислоты, арил, включая фенил, гетероарил, алкарил, аралкил, включая бензил, алкоксиалкил, включая метоксиметил, арилоксиалкил, такой как феноксиметил; или замещенный алкил (включая низший алкил), арил, включая фенил, необязательно замещенный хлором, бромом, фтором, иодом, C1-C4алкил или C1-C4алкокси, сложные эфиры сульфоната, такие как алкил или аралкилсульфонил, включая метансульфонил, сложные эфир моно-, ди- или трифосфата, тритил или монометокси-тритил, замещенный бензил, алкарил, аралкил, включая бензил, алкоксиалкил, включая метоксиметил, арилоксиалкил, такой как феноксиметил. Арильные группы необязательно содержат фенильную группу.
Термин «гетероатом» включает атом, за исключением углерода или водорода, в структуре гетероциклического соединения, неограничивающие примеры которого представляют собой азот, кислород, серу, фосфор или бор.
Термин «карбонил» включает группу структуры «-C(=O)-X-R'» или «X-C(=O)-R'», где X представляет собой O, S или связь, и каждый R независимо представляет собой, как определено выше для «сложного эфира».
Используемый в настоящем описании термин «гетероцикл», «гетероциклил» или «гетероциклический» включает неароматические кольцевые системы, имеющие от четырех до четырнадцати членов, предпочтительно, от пяти до десяти, в которых один или более углеродов кольца, предпочтительно, от одного до четырех, каждый замещен гетероатомом. Примеры гетероциклических колец включают 3-1H-бензимидазол-2-он, (1-замещенный)-2-оксо-бензимидазол-3-ил, 2-тетрагидрофуранил, 3-тетрагидрофуранил, 2-тетрагидропиранил, 3-тетрагидропиранил, 4-тетрагидропиранил, [1,3]-диоксаланил, [1,3]-дитиоланил, [1,3]-диоксанил, 2-тетрагидротиофенил, 3-тетрагидротиофенил, 2-морфолинил, 3-морфолинил, 4-морфолинил, 2-тиоморфолинил, 3-тиоморфолинил, 4-тиоморфолинил, 1-пирролидинил, 2-пирролидинил, 3-пирролидинил, 1-пиперазинил, 2-пиперазинил, 1-пиперидинил, 2-пиперидинил, 3-пиперидинил, 4-пиперидинил, 4-тиазолидинил, диазолонил, N-замещенный диазолонил, 1-фталимидинил, бензоксанил, бензопирролидинил, бензопиперидинил, бензоксоланил, бензотиоланил и бензотианил. Термин «гетероциклил» или «гетероциклический», также включенный в рамки изобретения, поскольку он используется в настоящем описании, представляет собой группу, в которой неароматическое, содержащее гетероатом кольцо присоединено к одному или более ароматическому или неароматическому кольцу, такую как индолинил, хроманил, фенантридинил или тетрагидрохинолинил, где радикал или место присоединения находятся на неароматическом, содержащем гетероатом кольце. Термин «гетероцикл», «гетероциклил» или «гетероциклический» или насыщенный, или частично ненасыщенный также относится к кольцам, которые необязательно замещены.
Термин «гетероарил», используемый отдельно или как часть большей группы как в «гетероаралкиле» или «гетероарилалкокси», относится к группам гетероароматического кольца, имеющим от пяти до четырнадцати членов. Примеры гетероарильных колец включают 2-фуранил, 3-фуранил, 3-фуразанил, N-имидазолил, 2-имидазолил, 4-имидазолил, 5-имидазолил, 3-изоксазолил, 4-изоксазолил, 5-изоксазолил, 2-оксадиазолил, 5-оксадиазолил, 2-оксазолил, 4-оксазолил, 5-оксазолил, 1-пирролил, 2-пирролил, 3-пирролил, 1-пиразолил, 2-пиразолил, 3-пиразолил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидил, 4-пиримидил, 5-пиримидил, 3-пиридазинил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 5-тетразолил, 2-триазолил, 5-триазолил, 2-тиенил, 3-тиенил, карбазолил, бензимидазолил, бензотиенил, бензофуранил, индолил, хинолинил, бензотриазолил, бензотиазолил, бензооксазолил, бензимидазолил, изохинолинил, индазолил, изоиндолил, акридинил и бензоизоксазолил. Термин «гетероарил», также включенный в рамки изобретения, поскольку он используется в настоящем описании, представляет собой группу, в которой гетероароматическое кольцо присоединено к одному или более ароматическому или неароматическому кольцу, где радикал или место присоединения находятся на гетероароматическом кольце. Примеры включают тетрагидрохинолинил, тетрагидроизохинолинил и пиридо[3,4-d]пиримидинил. Термин «гетероарил» также относится к кольцам, которые необязательно замещены. Термин «гетероарил» можно использовать взаимозаменяемо с термином «гетероарильное кольцо» или термином «гетероароматический».
Используемый в настоящем описании термин «амино», если иначе не определено, включает группу, представленную структурой «-N(R)2», и включает первичные, вторичные и третичные амины, необязательно замещенные алкилом, арилом, гетероциклилом и/или сульфонильной группой. Таким образом (R)2 может представлять собой два атома водорода, две алкильных группы или один водород и одну алкильную группу.
Используемый в настоящем описании термин «амидо» включает аминозамещенный карбонил, тогда как термин «амидино» означает группу, имеющую структуру «-C(=NH)-NH2».
Термин «противоион» относится к отрицательно или положительно заряженным видам ионов, которые сопровождают противоположно заряженные виды ионов для поддержания электрической нейтральности. Отрицательно заряженные противоионы включают неорганические противоионы и органические противоионы, включая, но не ограничиваясь ими, хлор, бром, иод, фтор, фосфат, ацетат, формиат, сульфонат, трифторацетат, адипинат, альгинат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, цитрат, камфорат, камфорсульфонат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептаноат, глицерофосфат, гликолят, гемисульфат, гептаноат, гексаноат, гидрохлорид, гидробромид, гидроиодид, 2-гидроксиэтансульфонат, лактат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, оксалат, пальмоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, салицилат, сукцинат, сульфат, тартрат, тиоцианат, тозилат и ундеканоат. Положительно заряженные противоионы включают, но не ограничиваются ими, щелочной металл (например, натрий и калий), щелочноземельный металл (например, магний), аммоний и N+(C1-4алкил)4 противоионы.
Используемый в настоящем описании термин «четвертичный амин» включает четвертичные соли аммония, которые имеют положительно заряженный азот. Они образованы с помощью взаимодействия между основным азотом в интересующем соединении и соответствующим кватернизирующим агентом, таким как, например, метилиодид или бензилиодид. Соответствующие противоионы, дополняющие четвертичный амин, включают ионы ацетата, трифторацетата, хлора, брома и иода.
Термин «замещенный» включает многочисленные степени замещения с помощью одного или более названных заместителей, таких как, например, галогено, гидроксил, тио, алкил, алкенил, алкинил, нитро, циано, азидо, амино, карбоксамидо и т.д. Где существуют возможности многочисленных заместителей, соединение может быть замещено с помощью одной или более раскрытых или заявленных групп заместителей, независимо друг от друга и взятых отдельно или во множественном числе.
Используемый в настоящем описании термин «защищенный» и если иначе не определено, относится к группе, которую добавляют к атому кислорода, азота или фосфора, для предотвращения его дальнейшей реакции или в других целях. Широкое разнообразие защитных групп кислорода и азота известно специалистам в области органического синтеза.
Используемый в настоящем описании термин «защитная группа» относится к группе, которая может быть присоединена к реактивной группе, включая гетероатомы, такие как кислород или азот, для предотвращения участия реакцонной группы во взаимодействии. Можно использовать любые защитные группы, изложенные, например, в Greene et al., Protective Groups in Organic Synthesis, John Wiley & Sons, 3rd Ed., 1999. Примеры подходящих защитных групп включают, но не ограничиваются ими, алкоксиалкилгруппы, такие как этоксиметил и метоксиметил; силильные защитные группы, такие как трет-бутилдиметилсилил (TBS), фенилдиметилсилил, триметилсилил (TMС), 2-триметилсилилэтоксиметил (SEM) и 2-триметилсилилэтил; и бензил и замещенный бензил.
Следует понимать, что различные возможные стереоизомеры упомянутых выше групп и в настоящем описании находятся в пределах значения индивидуальных терминов и примеров, если иначе не определено. В качестве иллюстративного примера «1-метил-бутил» существует как в (R)-, так и в (S)-форме, таким образом, как (R)-1-метил-бутил, так и (S)-1-метил-бутил охвачены термином «1-метил-бутил», если иначе не определено.
Термин «пациент» включает объекты человека и животных.
«Эффективное количество» представляет собой количество соединения, при введении которого пациенту достигают благоприятный результат, или альтернативно, количество соединения, которое обладает желательной активностью в in vivo или in vitro. В случае пролиферативных нарушений благоприятный клинический результат включает сокращение степени или тяжести симптомов, связанных с заболеванием или нарушением, и/или увеличение продолжительности жизни и/или качества жизни пациента по сравнению с отсутствием лечения. Например, для объекта с раком, «благоприятный клинический результат» включает сокращение массы опухоли, сокращение скорости роста опухоли, сокращение метастаза, сокращение тяжести симптомов, связанных с раком, и/или увеличение продолжительности жизни объекта по сравнению с отсутствием лечения. Точное количество соединения, которое вводят объекту, будет зависеть от типа и тяжести заболевания или состояния и от особенностей пациента, таких как общее состояние здоровья, возраст, пол, масса тела и переносимость лекарственных средств. Оно будет также зависеть от степени, тяжести и типа пролиферативного нарушения. Специалист в данной области техники будет в состоянии определить соответствующие дозировки в зависимости от этих и других факторов.
Используемый в настоящем описании термин «количество, ингибирующее киназу» относится к количеству соединения, которое ингибирует фермент киназу по сравнению с контролем, как проверено с помощью способов, описанных в настоящей заявке.
Используемый в настоящем описании термин «количество, ингибирующее HSP90» относится к количеству соединения, которое ингибирует HSP90 по сравнению с контролем, как проверено с помощью способов, описанных в настоящей заявке.
Используемый в настоящем описании термин «биологический образец» включает без ограничения клеточные культуры или их экстракты; ферментативные средства, подходящие для анализа in vitro; биопсийный материал, полученный от млекопитающего или его экстракт; и кровь, слюну, мочу, фекалии, сперму, слезы или другие жидкости тела или их экстракты.
Используемый в настоящем описании термин «рак» включает, но не ограничивается ими, солидные опухоли, содержащие кровь опухоли и включает, но не ограничивается ими, следующие раковые образования: груди, яичника, шейки, простаты, яичка, мочеполового тракта, пищевода, гортани, глиобластому, желудка, кожи, кератоакантому, легкого, эпидермоидную карциному, крупноклеточный рак, мелкоклеточный рак, аденокарциному легкого, кости, толстой кишки, аденому, поджелудочной железы, аденокарциному, щитовидной железы, фолликулярную карциному, недифференцированную карциному, папиллярную карциному, семиному, меланому, саркому, карциному мочевого пузыря, карциному печени и желчных протоков, карциному почек, миелоидные нарушения, лимфатические нарушения, болезнь Ходжкина, клеток волос, полости рта, глотки, губы, языка, рта, глотки, тонкой кишки, прямой кишки, толстой кишки, мозга и центральной нервной системы или лейкемию. Термин «рак» включает первичный рак, вторичный рак для лечения и метастатический рак.
Термин «фармацевтически приемлемый носитель» относится к нетоксичному носителю, активирующему веществу или вспомогательному средству, которые можно вводить пациенту вместе с соединением настоящего изобретения и которые не разрушают его фармакологическую активность.
Используемые в настоящем описании термины «GSK-3-опосредованное заболевание» или «GSK-3-опосредованное состояние» означают любое заболевание или другое болезненное состояние, при котором известно, что GSK-3 играет роль. Такие заболевания или состояния включают без ограничения диабет, болезнь Альцгеймера, болезнь Хантингтона, болезнь Паркинсона, СПИД-обусловленную деменцию, боковой амиотрофический склероз (БАС), рассеянный склероз (РС), шизофрению, гипертрофию кардиомиоцитов, реперфузию/ишемию и облысение.
Используемые в настоящем описании термины «CDK-2-опосредованное заболевание» или «CDK-2-опосредованное состояние» означают любое заболевание или другое болезненное состояние, при котором известно, что CDK-2 играет роль. Термины «CDK-2-опосредованное заболевание» или «CDK-2-опосредованное состояние» также означают такие заболевания или состояния, которые ослабляются при лечении с помощью ингибитора CDK-2. Такие состояния включают без ограничения рак, болезнь Альцгеймера, рестеноз, ангиогенез, гломерулонефрит, цитомегаловирус, ВИЧ, герпес, псориаз, атеросклероз, алопецию и аутоиммунные заболевания, такие как ревматоидный артрит, такие как описаны, например, в Fischer, P. M. and Lane, D. P., Current Medicinal Chemistry, 7, 1213-1245 (2000); Mani, S., Wang, C., Wu, K., Francis, R. and Pestell, R., Exp. Opin. Invest. Drugs, 9, 1849 (2000); Fry, D. W. and Garrett, M. D., Current Opinion in Oncologic, Endocrine & Metabolic Investigational Drugs, 2, 40-59 (2000).
Используемые в настоящем описании термины «ERK-опосредованное заболевание» или «ERK-опосредованное состояние» означают любое заболевание или другое болезненное состояние, при котором ERK может играть роль. Термины «ERK-2-опосредованное заболевание» или «ERK-2-опосредованное состояние» также означают такие заболевания или состояния, которые ослабляются при лечении с помощью ингибитора ERK-2. Такие состояния включают без ограничения рак, инсульт, диабет, гепатомегалию, сердечно-сосудистое заболевание, включая кардиомегалию, болезнь Альцгеймера, кистозный фиброз, вирусное заболевание, аутоиммунные заболевания, атеросклероз, рестеноз, псориаз, аллергические нарушения, включая астму, воспаление, неврологические нарушения и гормон-зависимые заболевания. ERK-2 протеинкиназа и ее значение при различных заболеваниях были описаны, например, в Bokemeyer et al. 1996, Kidney Int. 49, 1187; Anderson et al., 1990, Nature 343, 651; Crews et al., 1992, Science 258, 478; Bjorbaek et al., 1995, J. Biol. Chem. 270, 18848; Rouse et al., 1994, Cell 78, 1027; Raingeaud et al., 1996, Mol. Cell Biol. 16, 1247; Raingeaud et al. 1996; Chen et al., 1993 Proc. Natl. Acad. Sci. USA 90, 10952; Oliver et al., 1995, Proc. Soc. Exp. Biol. Med. 210, 162; Moodie et al., 1993, Science 260, 1658; Frey and Mulder, 1997, Cancer Res. 57, 628; Sivaraman et al., 1997, J Clin. Invest. 99, 1478; Whelchel et al., 1997, Am. J. Respir. Cell Mol. Biol. 16, 589.
Используемые в настоящем описании термины «AKT-опосредованное заболевание» или «AKT-опосредованное состояние» означают любое заболевание или другое болезненное состояние, при котором известно, что AKT играет роль. Термины «AKT-опосредованное заболевание» или «AKT-опосредованное состояние» также означают такие заболевания или состояния, которые ослабляются при лечении с помощью ингибитора AKT. AKT-опосредованные заболевания или состояния включают, но не ограничиваются ими, пролиферативные нарушения, рак и нейродегенеративные нарушения. Взаимосвязь AKT, также известной как протеинкиназа B, с различными заболеваниями была описана, например, в Khwaja, A., Nature, pp. 33-34, 1990; Zang, Q. Y., et al., Oncogene, 19 2000; Kazuhiko, N., et al., The Journal of Neuroscience, 20 2000.
Используемые в настоящем описании термины «Src-опосредованное заболевание» или «Src-опосредованное состояние» означают любое заболевание или другое болезненное состояние, при котором известно, что Src играет роль. Термины «Src-опосредованное заболевание» или «Src-опосредованное состояние» также означают такие заболевания или состояния, которые ослабляются при лечении с помощью ингибитора Src. Такие состояния включают, но не ограничиваются ими, гиперкальцемию, остеопороз, остеоартрит, рак, симптоматическое лечение костного метастаза и болезнь Педжета. Протеинкиназа Src и ее значение при различных заболеваниях были описаны, например, в Soriano, Cell, 69, 551 (1992); Soriano et al., Cell, 64, 693 (1991); Takayanagi, J. Clin. Invest., 104, 137 (1999); Boschelli, Drugs of the Future 2000, 25(7), 717, (2000); Talamonti, J. Clin. Invest., 91, 53 (1993); Lutz, Biochem. Biophys. Res. 243, 503 (1998); Rosen, J. Biol. Chem., 261, 13754 (1986); Bolen, Proc. Natl. Acad. Sci. USA, 84, 2251 (1987); Masaki, Hepatology, 27, 1257 (1998); Biscardi, Adv. Cancer Res., 76, 61 (1999); Lynch, Leukemia, 7, 1416 (1993); Wiener, Clin. Cancer Res., 5, 2164 (1999); Staley, Cell Growth Diff., 8, 269 (1997).
Используемые в настоящем описании термины «Lck-опосредованное заболевание» или «Lck-опосредованное состояние» означают любое заболевание или другое болезненное состояние, при котором известно, что Lck играет роль. Термины «Lck-опосредованное заболевание» или «Lck-опосредованное состояние» также означают такие заболевания или состояния, которые ослабляются при лечении с помощью ингибитора Lck. Lck-опосредованные заболевания или состояния включают, но не ограничиваются ими, аутоиммунные заболевания, такие как отторжение трансплантата, аллергии, ревматоидный артрит и лейкемию. Взаимосвязь Lck с различными заболеваниями была описана, например, в Molina et al., Nature, 357, 161 (1992).
Используемые в настоящем описании термины «Abl-опосредованное заболевание» или «Abl-опосредованное состояние» означают любое заболевание или другое болезненное состояние, при котором известно, что Abl играет роль. Термины «Abl-опосредованное заболевание» или «Abl-опосредованное состояние» также означают такие заболевания или состояния, которые ослабляются при лечении с помощью ингибитора Abl. Abl-опосредованные заболевания или состояния включают, но не ограничиваются ими, лейкемии, особенно хроническую миелоидную лейкемию. Взаимосвязь Abl с различными заболеваниями была описана, например, в Druker, et al., N. Engl. J. Med. 2001, 344, 1038-1042.
Используемые в настоящем описании термины «cKit-опосредованное заболевание» или «cKit-опосредованное состояние» означают любое заболевание или другое болезненное состояние, при котором известно, что cKit играет роль. Термины «cKit-опосредованное заболевание» или «cKit-опосредованное состояние» также означают такие заболевания или состояния, которые ослабляются при лечении с помощью ингибитора cKit. cKit- опосредованные заболевания или состояния включают, но не ограничиваются ими, мастоцитоз/базофильный лейкоз, гастроинтестинальную стромальную опухоль, синоназальный естественный киллер (NK-клетка)/T-клеточную лимфому, семиному/дисгерминому, рак щитовидной железы, мелкоклеточный рак легкого, злокачественную меланому, аденокистозную карциному, карциному яичника, острый миелобластный лейкоз, анапластическую крупноклеточную лимфому, ангиосаркому, карциному эндометрия, педиатрический Т-клеточный ОЛЛ/лимфому, карциному груди и карциному простаты. Взаимосвязь cKit с различными заболеваниями была описана, например, в Heinrich, et al., J. Clinical Oncology 2002, 20, 1692-1703.
Используемые в настоящем описании термины «Flt3-опосредованное заболевание» или «Flt3-опосредованное состояние» означают любое заболевание или другое болезненное состояние, при котором известно, что Flt3 играет роль. Термины «Flt3-опосредованное заболевание» или «Flt3-опосредованное состояние» также означают такие заболевания или состояния, которые ослабляются при лечении с помощью ингибитора Flt3. Flt3-опосредованные заболевания или состояния включают, но не ограничиваются ими, острый миелобластный лейкоз, недифференцированный лейкоз и острый лимфоцитарный лейкоз. Взаимосвязь Flt3 с различными заболеваниями была описана, например, в Sternberg and Licht, Curr. Opin Hematol. 2004, 12, 7-13.
Используемые в настоящем описании термины «KDR-опосредованное заболевание» или «KDR-опосредованное состояние» означают любое заболевание или другое болезненное состояние, при котором известно, что KDR играет роль. Термины KDR-опосредованное заболевание» или «KDR-опосредованное состояние» также означают такие заболевания или состояния, которые ослабляются при лечении с помощью ингибитора KDR. KDR-опосредованные заболевания или состояния включают, но не ограничиваются ими, карциному легкого, груди, желудочно-кишечного тракта, почки, мочевого пузыря, яичника и эндометрия, внутричерепные опухоли, включая мультиформную глиобластому, спорадическую каппилярную гемангиобластому, гемобластозы, включая T-клеточную лимфому, острый лимфобластный лейкоз, лимфосаркому Беркитта и промиелоцитарный лейкоз, возрастную макулярную дистрофию, герпетическое глазное заболевание, ревматоидный артрит, ишемию головного мозга и эндометриоз. Взаимосвязь KDR с различными заболеваниями была описана, например, в Ferrara, Endocrine Reviews 2004, 25, 581-611.
Термин «HSP90-опосредованное заболевание» или «HSP90-опосредованное состояние» относится к состоянию, при котором известно, что HSP90 играет роль. Состояния включают, но не ограничиваются ими, воспалительные нарушения, неправильную клеточную пролиферацию, аутоиммунные нарушения, ишемию, фиброгенные нарушения, включая, но не ограничиваясь ими, склеродерму, полимиозит, системную красную волчанку, ревматоидный артрит, цирроз печени, келоидное образование, интерстициальный нефрит и фиброз легких (Strehlow, WO 02/02123; PCT/US01/20578).
Способ лечения
Соединения, описанные в настоящей заявке, являются наиболее полезными для лечения или предотвращения нарушения, опосредованного киназами или опосредованного HSP90. В одном варианте осуществления соединения, описанные в настоящей заявке, являются полезными для лечения или предотвращения пролиферативного нарушения, включая метастаз рака. В другом варианте осуществления соединения, описанные в настоящей заявке, являются полезными для лечения или предотвращения воспалительного или аутоиммунного нарушения, связанного с киназами или HSP90.
Аспект изобретения относится к соединениям и композициям, которые являются пригодными для лечения рака.
Другой аспект изобретения относится к лечению следующих раковых образований: груди, яичника, шейки, простаты, яичка, мочеполового тракта, пищевода, гортани, глиобластомы, желудка, кожи, кератоакантомы, легкого, эпидермоидной карциномы, крупноклеточного рака, мелкоклеточного рака, аденокарциномы легкого, кости, толстой кишки, аденомы, поджелудочной железы, аденокарциномы, щитовидной железы, фолликулярной карциномы, недифференцированной карциномы, папиллярной карциномы, семиномы, меланомы, саркомы, карциномы мочевого пузыря, карциномы печени и желчных протоков, карциномы почек, миелоидных нарушений, лимфатических нарушений, болезни Ходжкина, клеток волос, полости рта и глотки (ротовые), губы, языка, рта, глотки, тонкой кишки, прямой кишки, толстой кишки, мозга и центральной нервной системы или лейкемии.
Другой аспект изобретения представляет собой способ лечения рака, включающий введение пациенту с раком эффективного количества соединения формулы I, I', II, II', III, III', IV или V, описанного в настоящей заявке.
Ангиогенез характеризуют с помощью пролиферации эндотелиальных клеток для получения новых кровеносных сосудов (часто называемый реваскуляризацией). Ингибирование митоза эндотелиальных клеток приводит к ингибированию ангиогенеза. Другой аспект настоящего изобретения, следовательно, относится к ингибированию нежелательного митоза, включая нежелательный ангиогенез. Заболевание млекопитающих, охарактеризованное с помощью нежелательного митоза клеток, как определено в настоящей заявке, включает, но не ограничивается ими, чрезмерное или неправильное раздражение эндотелиальных клеток (например, атеросклероз), солидные опухоли и метастаз опухоли, доброкачественные опухоли, например, гемангиомы, трахомы и пиогенные гранулемы, сосудистые нарушения, неправильное заживление раны, воспалительные и иммунные нарушения, болезнь Бечета, подагру или подагрический артрит, неправильный ангиогенез, сопровождающийся ревматоидным артритом, кожные заболевания, такие как псориаз, диабетическую ретинопатию и другие офтальмологические ангиогенные заболевания, такие как ретинопатия недоношенных (ретролентальная фиброплазия), дистрофия желтого пятна, отторжение ткани роговицы, неоваскулярная глаукома или синдромом Ослера-Вебера (болезнь Ослера-Вебера-Рандю).
Другой нежелательный ангиогенез включает нормальные процессы, включая овуляцию и имплантацию бластулы. Композиции, описанные выше, можно применять в качестве агента для контроля рождаемости, уменьшая или предотвращая маточную васкуляризацию, необходимую для имплантации эмбриона. Соответственно, композиции, описанные выше, можно применять для блокирования овуляции и имплантации бластулы или блокирования менструального кровотечения (вызывать аменорею).
Заболевания, связанные с нежелательным митозом, включая реваскуляризацию, можно вылечить согласно настоящему изобретению. Такие заболевания включают, но не ограничиваются ими, глазное сосудистое заболевание, диабетическую ретинопатию, ретинопатию недоношенных, отторжение ткани роговицы, неоваскулярную глаукому и ретролентальную фиброплазию, эпидемический кератоконъюнктивит, дефицит витамина А, износ контактных линз, атопический кератит, верхний лимбический кератит, кератит птеригия sicca, синдром Шегрена, красные угри, фликтенулез, сифилис, инфекции Mycobacteria, разрушение липида, химические ожоги, бактериальные язвы, грибковые язвы, инфекции Herpes simplex, инфекции Herpes zoster, протозойные инфекции, саркому Капози, язву Мурена, крайнее вырождение Террина, крайний кератолиз, травму, ревматоидный артрит, системную красную волчанку, полиартрит, саркоидоз Вегенера, склерит, синдром Стивена-Джонсона, пемфигоид, радиальную кератотомию и отторжение ткани роговицы.
Другие заболевания, связанные с нежелательным митозом, включая реваскуляризацию, можно вылечить согласно настоящему изобретению. Такие заболевания включают, но не ограничиваются ими, серповидноклеточную анемию, саркоид, эластическую псевдоксантому, болезнь Педжета, закупорку вен, закупорку артерий, закупорку сонных артерий, хронический увеит/витрит, болезнь Лайма, системную красную волчанку, болезнь Илза, болезнь Бечета, инфекции, вызывающие ретинит или хориоидит, предполагаемый глазной гистоплазмоз, врожденную дегенерацию желтого пятна, миопию, ямки диска зрительного нерва, болезнь Штаргардта, pars planitis, хроническое отслоение сетчатки, синдром повышенной вязкости крови, токсоплазмоз и постлазерные осложнения. Другие заболевания включают, но не ограничиваются ими, заболевания, связанные с рубеозом радужки (реваскуляризация радужной оболочки и угла) и заболевания, вызванные неправильной пролиферацией сосудисто-волокнистой или волокнистой соединительной ткани, включая все формы пролиферативной витреоретинопатии, связанной или несвязанной с диабетом.
Другой аспект изобретения относится к лечению воспалительных заболевания, включая, но не ограничиваясь ими, чрезмерное или неправильное раздражение эндотелиальных клеток (например, атеросклероз), солидные опухоли и метастаз опухоли, доброкачественные опухоли, например, гемангиомы, слуховые невромы, трахомы и пиогенные гранулемы, сосудистые нарушения, неправильное заживление раны, воспалительные и иммунные нарушения, болезнь Бечета, подагру или подагрический артрит, неправильный ангиогенез, сопровождающийся ревматоидным артритом, кожные заболевания, такие как псориаз, диабетическую ретинопатию и другие офтальмологические ангиогенные заболевания, такие как ретинопатия недоношенных (ретролентальная фиброплазия), дистрофия желтого пятна, отторжение ткани роговицы, неоваскулярная глаукома или синдромом Ослера-Вебера (болезнь Ослера-Вебера-Рандю). Другой нежелательный ангиогенез включает нормальные процессы, включая овуляцию и имплантацию бластулы. Соответственно, композиции, описанные выше, можно применять для блокирования овуляции и имплантации бластулы или блокирования менструального кровотечения (вызывать аменорею).
Другой аспект этого изобретения относится к способу ингибирования активности HSP90 у пациента, включающему введение пациенту эффективного количества соединения формулы I, I', II, II', III, III', IV или V, или фармацевтически приемлемой соли, или его пролекарства. Изобретение также обеспечивает способ лечения заболевания, которое опосредовано HSP90.
Другой аспект этого изобретения относится к способу ингибирования активности Aurora A у пациента, включающему введение пациенту эффективного количества соединения формулы I, I', II, II', III, III', IV или V, или фармацевтически приемлемой соли, или его пролекарства.
Другой аспект этого изобретения относится к способу лечения или предотвращения GSK-3-опосредованного заболевания с помощью ингибитора GSK-3, включающему введение пациенту эффективного количества соединения формулы I, I', II, II', III, III', IV или V, или фармацевтически приемлемой соли, или его пролекарства.
Один аспект этого изобретения относится к способу повышения синтеза гликогена и/или понижения уровней глюкозы в крови у пациента, нуждающегося в этом лечении, способ, включающий введение пациенту терапевтически эффективного количества соединения формулы I, I', II, II', III, III', IV или V или его фармацевтической композиции. Этот способ особенно полезен для пациентов с диабетом. Другой способ относится к ингибированию получения гиперфосфорилированного белка Tau, который является полезным при прекращении или замедлении прогрессирования болезни Альцгеймера. Другой способ относится к ингибированию фосфорилирования β-катенина, который является полезным для лечения шизофрении.
Другой аспект изобретения относится к ингибированию GSK-3 в биологическом образце, способ которого включает взаимодействие биологического образца с ингибитором GSK-3 формулы I, I', II, II', III, III', IV или V.
Другой аспект этого изобретения относится к способу ингибирования активности GSK-3 у пациента, включающему введение пациенту соединения формулы I, I', II, II', III, III', IV или V или композиции, содержащей указанное соединение.
Другой аспект этого изобретения относится к способу лечения или предотвращения CDK-2-опосредованного заболевания, включающему введение пациенту, нуждающемуся в таком лечении терапевтически эффективного количества соединения формулы I, I', II, II', III, III', IV или V или его фармацевтической композиции.
Другой аспект изобретения относится к ингибированию активности CDK-2 в биологическом образце или у пациента, способ которого включает введение пациенту соединения формулы I, I', II, II', III, III', IV или V или композиции, содержащей указанное соединение.
Другой аспект этого изобретения относится к способу лечения или предотвращения ERK-2-опосредованных заболеваний, включающему введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы I, I', II, II', III, III', IV или V или его фармацевтической композиции.
Другой аспект изобретения относится к ингибированию активности ERK-2 в биологическом образце или у пациента, способ которого включает введение пациенту соединения формулы I, I', II, II', III, III', IV или V или композиции, содержащей указанное соединение.
Другой аспект этого изобретения относится к способу лечения или предотвращения AKT-опосредованных заболеваний, включающему введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы I, I', II, II', III, III', IV или V или его фармацевтической композиции.
Другой аспект изобретения относится к ингибированию активности AKT в биологическом образце или у пациента, способ которого включает введение пациенту соединения формулы I, I', II, II', III, III', IV или V или композиции, содержащей указанное соединение.
Другой аспект этого изобретения относится к способу лечения или предотвращения Src-опосредованного заболевания, включающему введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы I, I', II, II', III, III', IV или V или его фармацевтической композиции.
Другой аспект изобретения относится к ингибированию активности Src в биологическом образце или у пациента, способ которого включает введение пациенту соединения формулы I, I', II, II', III, III', IV или V или композиции, содержащей указанное соединение.
Другой аспект этого изобретения относится к способу лечения или предотвращения Lck-опосредованного заболевания с помощью ингибитора Lck, способ которого включает введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы I, I', II, II', III, III', IV или V или его фармацевтической композиции.
Другой аспект изобретения относится к ингибированию активности Lck в биологическом образце или у пациента, способ которого включает введение пациенту соединения формулы I, I', II, II', III, III', IV или V или композиции, содержащей указанное соединение.
Другой аспект этого изобретения относится к способу лечения или предотвращения Abl-опосредованного заболевания с помощью ингибитора Abl, способ которого включает введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы I, I', II, II', III, III', IV или V или его фармацевтической композиции.
Другой аспект изобретения относится к ингибированию активности Abl в биологическом образце или у пациента, способ которого включает введение пациенту соединения формулы I, I', II, II', III, III', IV или V или композиции, содержащей указанное соединение.
Другой аспект этого изобретения относится к способу лечения или предотвращения cKit-опосредованного заболевания, включающему введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы I, I', II, II', III, III', IV или V или его фармацевтической композиции.
Другой аспект изобретения относится к ингибированию активности cKit в биологическом образце или у пациента, способ которого включает введение пациенту соединения формулы I, I', II, II', III, III', IV или V или композиции, содержащей указанное соединение.
Другой аспект этого изобретения относится к способу лечения или предотвращения Flt3-опосредованного заболевания, включающему введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы I, I', II, II', III, III', IV или V или его фармацевтической композиции.
Другой аспект изобретения относится к ингибированию активности Flt3 в биологическом образце или у пациента, способ которого включает введение пациенту соединения формулы I, I', II, II', III, III', IV или V или композиции, содержащей указанное соединение.
Другой аспект этого изобретения относится к способу лечения или предотвращения KDR-опосредованного заболевания, включающему введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы I, I', II, II', III, III', IV или V или его фармацевтической композиции.
Другой аспект изобретения относится к ингибированию активности KDR в биологическом образце или у пациента, способ которого включает введение пациенту соединения формулы I, I', II, II', III, III', IV или V или композиции, содержащей указанное соединение.
Количество, эффективное для ингибирования протеинкиназы, является количеством, которое вызывает измеримое ингибирование активности киназы по сравнению с активностью фермента в отсутствие ингибитора. Любой способ можно использовать для определения ингибирования, такой как, например, биологические испытательные примеры, описанные ниже.
Фармацевтические композиции
Млекопитающих, и определенно людей, страдающих от нарушения дыхания, можно лечить с помощью ингаляции, системного, перорального, локального или трансдермального введения композиции, содержащей эффективное количество соединений, описанных в настоящей заявке, или фармацевтически приемлемой соли, сложного эфира или его пролекарства, необязательно в фармацевтически приемлемом носителе или разбавителе.
Соединения или композиции обычно вводят перорально или с помощью ингаляции. Альтернативно, соединения можно вводить подкожно, внутривенно, внутрибрюшинно, внутримышечно, парентерально, перорально, с помощью подслизистого введения, с помощью ингаляции, трансдермально через пластырь с замедленным высвобождением или локально в эффективном диапазоне дозировки для лечения целевого состояния.
Эффективную дозу можно легко определить при помощи стандартных методик и наблюдая результаты, полученные при аналогичных обстоятельствах. При определении эффективной дозы рассматривают множество факторов, включая, но не ограничиваясь ими: тип пациента; его размер, возраст и общее состояние здоровья; определенное рассматриваемое заболевание; степень поражения или тяжести заболевания; ответную реакцию определенного пациента; определенное вводимое соединение; способ введения; особенности биодоступности вводимого лекарственного соединения; выбранный режим дозировки; и применение сопутствующего лечения.
В отдельном варианте осуществления соединения изобретения находятся в форме ингалируемой дозировки. В этом варианте осуществления соединения могут быть в форме аэрозольной суспензии, сухого порошка или форме жидких частиц. Соединения можно получить для доставки в качестве назального спрея или в виде ингалятора, такого как дозирующий ингалятор. Герметичные дозирующие ингаляторы («MDI») обычно доставляют аэрозольные частицы, суспендированные в хлорфторуглеродных пропеллентах, таких как CFC-11, CFC-12 или нехлорфторуглеродных или дополнительных пропеллентах, таких как фторуглероды, HFC-134A или HFC-227 с или без поверхностно-активных веществ и подходящих мостикообразующих агентов. Можно также использовать порошковые ингаляторы или приводимые в действие с помощью дыхания, или доставляемые с помощью давления воздуха или газа, такие как порошковый ингалятор, раскрытый в международной заявке на патент № PCT/US92/05225 от Schering Corporation, опубликованной 7 января 1993 года, так же как Turbuhaler™ (доступный от Astra Pharmaceutical Products, Inc) или Rotahaler™ (доступный от Allen & Hanburys), которые можно использовать для доставки аэрозольных частиц в виде тонко перемолотого порошка в больших скоплениях или отдельно, или в комбинации с некоторым фармацевтически приемлемым носителем, например, лактозой; и распылителями.
Соединения изобретения можно также вводить в определенных, измеренных количествах в форме водной суспензии при использовании пульверизатора. Композиции водных суспензий настоящего изобретения можно получить с помощью смешивания соединений с водой и другими фармацевтически приемлемыми эксципиентами. Композиции водных суспензий согласно настоящему изобретению могут содержать, в числе других, воду, вспомогательные вещества и/или один или более эксципиентов, таких как: суспендирующие агенты, например, микрокристаллическая целлюлоза, натрий-карбоксиметилцеллюлоза, гидроксипропилметилцеллюлоза; смачивающие агенты, например, глицерин и пропиленгликоль; кислоты, основания или буферные вещества для регулирования pH, например, лимонная кислота, цитрат натрия, фосфорная кислота, фосфат натрия, так же как смеси цитратных и фосфатных буферов; поверхностно-активные вещества, например, Полисорбат 80; и противомикробные консерванты, например, бензалкония хлорид, фенилэтиловый спирт и сорбат калия.
Стандартные системные дозировки для всех описанных условий настоящей заявки находятся в пределах от 0,01 мг/кг до 1500 мг/кг массы тела в сутки в качестве единичной ежедневной дозы или разделенных ежедневных доз. Предпочтительные дозировки для описанных состояний располагаются от 0,5 до 1500 мг в сутки. В частности, предпочтительная дозировка для желательных состояний располагается от 5 до 750 мг в сутки. Стандартные дозировки могут также располагаться от 0,01 до 1500, от 0,02 до 1000, от 0,2 до 500, от 0,02 до 200, от 0,05 до 100, от 0,05 до 50, от 0,075 до 50, от 0,1 до 50, от 0,5 до 50, от 1 до 50, от 2 до 50, от 5 до 50, от 10 до 50, от 25 до 50, от 25 до 75, от 25 до 100, от 100 до 150 или 150 или более мг/кг/сутки в качестве единичной ежедневной дозы или разделенных ежедневных доз. В одном варианте осуществления соединения дают в дозах между от приблизительно 1 до приблизительно 5, от приблизительно 5 до приблизительно 10, от приблизительно 10 до приблизительно 25 или от приблизительно 25 до приблизительно 50 мг/кг. Стандартные дозировки для локального применения представляют собой дозировки в пределах от 0,001 до 100 масс.% активного соединения.
Соединения целесообразно вводят в единицах любой подходящей формы дозировки, включая, но не ограничиваясь, форму дозировки, содержащую от приблизительно 7 до 3000 мг, от приблизительно 70 до 1400 мг, или от приблизительно 25 до 1000 мг активного ингредиента в единице формы дозировки. Например, пероральная дозировка обычно целесообразна от приблизительно 50 до 1000 мг, включая одну или множество форм дозировки 50, 100, 200, 250, 300, 400, 500, 600, 700, 800, 900 или 1000 мг. Более низкие дозировки могут быть предпочтительными, например, от приблизительно 10 до 100 или от 1 до 50 мг. Также предполагаемыми являются дозы 0,1-50 мг, 0,1-20 мг или 0,1-10 мг. Кроме того, более низкие дозы можно применять в случае введения непероральным путем, как например, с помощью инъекции или ингаляции.
Соединение вводят в течение достаточного периода времени для снятия нежелательных симптомов и клинических признаков, связанных с состоянием, которое лечат.
Активное соединение включают в фармацевтически приемлемый носитель или разбавитель в количестве, соответствующем для доставки пациенту терапевтического количества соединения in vivo при отсутствии серьезных токсических эффектов. Фармацевтически приемлемые носители, которые можно использовать в этих фармацевтических композициях, являются общеизвестными в данной области техники. Они включают, но не ограничиваются ими, ионообменные смолы, оксид алюминия, стеарат алюминия, лецитин, сывороточные белки, такие как человеческий сывороточный альбумин, буферные вещества, такие как фосфаты, глицин, сорбиновую кислоту, сорбат калия, неполные глицериды смеси насыщенных растительных жирных кислот, воду, растворители, соли или электролиты, такие как протамина сульфат, натрия фосфат двузамещенный, дикалийфосфат, хлорид натрия, соли цинка, силикаты, коллоидную кремнекислоту, трисиликат магния, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, натрий-карбоксиметилцеллюлозу, полиакрилаты, воски, масла, полиэтилен-полиоксипропилен-блок полимеры, полиэтиленгликоль и ланолин. Фармацевтически приемлемые наполнители могут содержать смеси более, чем одного эксципиента, в которых компоненты и отношения могут быть выбраны для оптимизирования желательных характеристик состава, включая, но не ограничиваясь ими, срок годности, стабильность, лекарственную нагрузку, место доставки, скорость растворения, самоэмульгирование, контроль скорости высвобождения и места высвобождения и метаболизм.
Составы можно получить с помощью разнообразия методик, известных в данной области техники. Примеры методик для составов могут быть найдены в литературных публикациях и в текстах, таких как «Water-insoluble drug formulation», edited by Rong Liu, 2000, Interpharm Press.
При внутривенном введении носители могут быть физиологическим солевым раствором, бактериостатической водой, Cremophor EL™ (BASF, Parsippany, NJ) или фосфатно-солевым буфером (ФСБ). Стерильные вводимые формы композиций этого изобретения могут быть водными или маслянистыми суспензиями. Эти суспензии можно получить согласно методикам, известным в данной области техники, используя подходящие диспергирующие или смачивающие агенты и суспендирующие агенты. Стерильное вводимое лекарственное средство может также быть стерильным вводимым раствором или суспензией в нетоксичном парентерально-приемлемом разбавителе или растворителе, как например, раствор в 1,3-бутандиоле. Среди приемлемых наполнителей и растворителей, которые можно применять, находятся вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные, жирные масла целесообразно применять в качестве растворителя или суспендирующей среды. С этой целью любое мягкое жирное масло можно применять, включая синтетические моно- или диглицериды. Жирные кислоты, такие как олеиновая кислота и ее производные глицериды, полезны при получении инъецируемых средств, поскольку они являются природными фармацевтически приемлемыми маслами, такими как оливковое масло или касторовое масло, особенно в их полиоксиэтилированных формах. Эти масляные растворы или суспензии могут также содержать разбавитель спирт с длинной углеродной цепью или диспергирующий агент, такой как карбоксиметилцеллюлоза или подобные диспергирующие агенты, которые обычно используют в составах фармацевтически приемлемых лекарственных форм, включая эмульсии и суспензии. В целях получения состава можно также применять другие обычно используемые поверхностно-активные вещества, такие как Твины, Спаны и другие поверхностно-активные эмульгирующие агенты или усилители биодоступности, которые обычно используют при получении фармацевтически приемлемого твердого вещества, жидкости или других лекарственных форм.
Концентрация активного соединения в композиции лекарственного средства будет зависеть от скорости абсорбции, инактивации и выведения лекарственного средства, так же как других факторов, известных специалистам в данной области техники. Следует отметить, что величины дозировки будут также изменяться в зависимости от тяжести состояния, которое будут лечить. Кроме того, следует понимать, что для любого конкретного объекта должны быть установлены определенные режимы дозировки постепенно согласно индивидуальной потребности и профессиональным навыкам человека, который осуществляет введение или наблюдение за введением композиций, и что диапазоны дозировки, представленные в настоящем описании, являются только образцовыми и не направлены ограничить возможности или практическое применение заявленной композиции. Активный компонент можно вводить за один раз или можно разделить на множество меньших доз, которые вводят при различных интервалах времени.
Один способ введения активного соединения для системной доставки представляет собой пероральный. Пероральные композиции обычно содержат инертный разбавитель или пищевой носитель. Они могут быть заключены в желатиновую капсулу или спрессованы в таблетки. В целях перорального терапевтического введения активное соединение может быть объединено с эксципиентами и использовано в форме таблеток, пастилок или капсул. Можно также включить как часть композиции фармацевтически совместимые связывающие агенты и/или вспомогательные вещества.
Таблетки, пилюли, капсулы, пастилки и подобные могут содержать любой из следующих ингредиентов или соединений подобной природы: связывающее вещество, такое как микрокристаллическая целлюлоза, трагант или желатин; эксципиент, такой как крахмал или лактоза, дезинтегрирующий агент, такой как альгиновая кислота, Примогель или кукурузный крахмал; смазывающий агент, такой как стеарат магния или Стероты; вещество, способствующее скольжению, такое как коллоидный диоксид кремния; подслатитель, такой как сахароза или сахарин; или ароматизатор, такой как перечная мята, метилсалицилат или апельсиновый ароматизатор.
Когда лекарственная форма представляет собой капсулу, она может содержать в дополнение к вышеупомянутому материалу жидкий носитель, такой как жирное масло. Кроме того, лекарственные формы могут содержать различные другие материалы, которые изменяют физическую форму единицы дозировки, например, покрытия сахара, оболочки или другие кишечнорастворимые агенты.
Соединение или его соли можно вводить в качестве компонента эликсира, суспензии, сиропа, вафли, жевательной резинки или подобного. Сироп может содержать в дополнение к активным соединениям сахарозу в качестве подсластителя и определенные консерванты, красители и ароматизаторы.
В предпочтительном варианте осуществления активные соединения получают с носителями, которые защищают соединение от быстрого выведения из организма, такими как составы, контролирующие высвобождение, включая имплантаты и микроинкапсулированные системы доставки. Можно использовать биоразлагаемые, биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота. Способы получения таких составов будут очевидны к специалистам в данной области техники. Материалы могут также быть получены коммерчески от Alza Corporation и Nova Pharmaceuticals, Inc. Липосомальные суспензии (включая липосомы, нацеленные на инфицированные клетки с моноклональными антителами к вирусным антигенам) также являются предпочтительными в качестве фармацевтически приемлемых носителей. Они могут быть получены согласно способам, известным специалистам в данной области техники, например, как описано в патенте США № 4522811 (который включен в настоящее описание в полном объеме посредством ссылки). Липосомальные составы, например, можно получить с помощью растворения соответствующего липида(ов) (такого как стеароилфосфатидилэтаноламин, стеароилфосфатидилхолин, арахадоилфосфатидилхолин и холестерин) в неорганическом растворителе, который затем испаряют, оставляя тонкую пленку высушенного липида на поверхности сосуда. Водный раствор соединения затем вводят в сосуд. Сосуд затем вращают вручную для отделения липидного материала от стенок сосуда и диспергирования липидных комплексов, таким образом получая липосомальную суспензию.
С помощью стандартных методик могут быть получены подходящие наполнители или носители для локального применения, такого как лосьоны, суспензии, мази, кремы, гели, настойки, спреи, порошки, пасты, трансдермальные пластыри с замедленным высвобождением, суппозитории для применения ректального, вагинального, назального или на слизистую оболочку полости рта. Для получения локальных композиций можно использовать для системного введения в дополнение к другим материалам, упомянутым выше, загущающие агенты, смягчающие вещества и стабилизаторы. Примеры включают загущающие агенты, такие как жидкий парафин, пчелиный воск, ксантановая камедь или полиэтилен, смачивающие агенты, такие как сорбит, смягчающие вещества, такие как минеральное масло, ланолин и его производные или сквален.
Комбинированное лечение
Соединение можно также смешать с другими активными материалами, которые не уменьшают желательную активность, или с материалами, которые дополняют желательную активность. Активные соединения можно вводить совместно, то есть в комбинации или при чередовании, с другими лекарственными средствами, используемыми при лечении нарушений, которые опосредованы киназами или HSP90.
Соединения можно вводить в комбинации или при чередовании с лекарственными средствами, обычно пригодными для лечения или предотвращения астмы, такими как определенные противовоспалительные средства и бронхолитические средства. Кортикостероиды (ингалируемые и пероральные), стабилизаторы тучных клеток и лекарственные средства, модифицирующие лейкотриены, являются обычно используемыми противовоспалительными лекарственными средствами для людей, страдающих от астмы. Эти лекарственные средства сокращают опухоль и выделение слизи в дыхательных путях. Бронхолитические средства обычно смягчают симптомы астмы, расслабляя группы мускулов, которые сжимают дыхательные пути. Это действие быстро открывает дыхательные пути, позволяя большему количеству воздуха войти и выйти из легких. Бронхолитические средства также помогают очистить легкие от слизи.
Обычно используемые соединения включают ингалируемые кортикостероиды, которые предотвращают, а не ослабляют симптомы. Ингалируемые кортикостероиды включают: Адваир (комбинированное лекарственное средство, которое включает кортикостероид (флутиказон) плюс бронхолитическое средство длительного действия (в этом случае агонист β-2 адренергического рецептора, салметерол), аэробид (флунизолид), азмакорт (триамцинолон), фловент (флутиказон), метилпреднизолон, преднизон, пульмикорт или серевент дискус (порошок салметерола), теофиллин, квар и ксопенекс (левалбутерол), ингалируемые кортикостероиды выпускают в трех формах: дозирующий ингалятор (MDI), порошковый ингалятор (DPI) и распылитель растворов. Системные стероиды включают: метилпреднизолон (Медрол, Метипред, Солу-медрол), преднизон (Делтазон) и преднизолон (Прелон, Педиапред, Орапред). Стабилизаторы тучных клеток включают Интал и Тайлед, которые действуют, предотвращая высвобождение раздражающих и воспалительных веществ из тучных клеток. Модификаторы лейкотриена включают акколат и сингуляр и акколат (зафирлукаст), сингуляр (монтелукаст) и зифло (зилеутон).
Другие неограничивающие примеры кортикостероидов, которые можно использовать при чередовании или в комбинированной терапии, включают, но не ограничиваются ими, глюкокортикоиды (ГК), Аэробид (Аэробид-М, флунизолид), Азмакорт (триамцинолон ацетонид), Бекловет (Вансерил, беклометазона дипропионат), Фловент (флутиказон), Пульмикорт (будесонид), преднизолон, гидрокортизон, адреналин, Аклометазона дипропионат, Альдостерон, Амцинонид, Беклометазона дипропионат, Бенакорт, Бетаметазон (Бетаметазона ацетат, Бетаметазона бензоат, Бетаметазона дипропионат, Бетаметазона натрия фосфат, Бетаметазона валерат), Будесонид, Циклометазон, Ципроцинонид, Клобетазола пропионат, Клобетазона бутират, Клокортолона пивалат, Клопреднол, Кортизона ацетат, Кортивазол, Дефлазакорт, Дезоксикортикостерона ацетат (Дезоксикортикостерона пивалат), Депродон, Дезонид, Дезоксиметазон, Дексаметазон (Дексаметазона ацетат, Дексаметазона изоникотинат, Дексаметазона фосфат, Дексаметазона натрия метасульфобензоат, Дексаметазона натрия фосфат), Дихлоризона ацетат, Дифлоразона диацетат, Дифлукортолона валерат, Дифлупреднат, Домопреднат, Эндризон, Флуазакорт, Флуклоронида ацетонид, Флудрокортизона ацетат, Флуметазон (Флуметазона пивалат), Флунизолид, Флуоцинолона ацетонид, Флуоцинонид, Бутил-флуокортин, Флуокортолон (Флуокортолона гексаноат, Флуокортолона пивалат), Флуорометолон (Флуорометолона ацетат), Флупреднидена ацетат, Флупреднизолон, Флурандренолон, Флутиказона пропионат, Формокортал, Галцинонид, Галобетазола пропионат, Галометазон, Гидрокортамата гидрохлорид, Гидрокортизон (Гидрокортизона ацетат, Гидрокортизона бутират, Гидрокортизона ципионат, Гидрокортизона гемисукцинат, Гидрокортизона натрия фосфат, Гидрокортизона натрия сукцинат, Гидрокортизона валерат), Медризон, Мепреднизолон, Метилпреднизолон (Метилпреднизолона ацетат, Метилпреднизолона гемисукцинат, Метилпреднизолона натрия сукцинат), Мометазона фуроат, Параметазона ацетат, Предникарбат, Преднизоламата гидрохлорид, Преднизолон (Преднизолона ацетат, Преднизолона гемисукцинат, Преднизолона гексаноат, Преднизолона пивалат, Преднизолона натрия метасульфобензоат, Преднизолона натрия фосфат, Преднизолона натрия сукцинат, Преднизолона стеаглат, Преднизолона тебутат), Преднизон (Преднизона ацетат), Преднилиден, Процинонид, Римексолон, Кору надпочечников, Тиксокортола пивалат, Триамцинолон (Триамцинолона ацетонид, Триамцинолона диацетат и Триамцинолона гексацетонид).
При использовании для лечения ревматоидного артрита соединения настоящего изобретения можно применять в чередовании или в комбинации с любым агентом или лекарственным средством, известным для лечения ревматоидного артрита, включая, но не ограничиваясь ими: Remicade® (инфликсимаб); метотрексат; Нестероидные противовоспалительные препараты (НПВП), такие как аспирин и ибупрофен; кортикостероидные лекарственные средства, такие как Преднизон; Лефлуномид; биологические агенты, такие как этанерцепт, инфликсимаб, адалимумаб и анакинра; целекоксиб; тетрациклины; антагонисты фактора некроза опухолей (ФНО); нестероидные противовоспалительные средства; ингибиторы циклооксигеназы-2; антагонист рецептора интерлeйкина-1.
В клиническом исследовании рассматривают лекарственные средства, включая, но не ограничиваясь ими: 681323 (ингибитор p38 альфа-киназы) (Glaxo SmithKline); 683699 (T-0047) (антагонист двойного альфа 4 интегрина) (GlaxoSmithKline); АВТ-963 (Abbott Laboratories); AGIX-4207 (Atherogenics); альфа-L-идуронидазу (Genzyme General), AMG719 (Amgen); AnergiX.RA (Corixa); анти-CD11 гуманизированное MAb (Genentech); Arava (Aventis Pharmaceuticals); CDP 870 (Pfizer); CDP-870 (Pfizer); Целебрекс (Pfizer); COX 189 (Novartis); экулизумаб (Alexion Pharmaceuticals); HuMax-IL15 (Amgen); IDEC 151 (IDEC Pharmaceuticals); IDEC-151/кленоликсимаб (IDEC Pharmaceuticals); IL-1 ловушка (Rengeneron Pharmaceuticals); интерлeйкин-1 (Rengeneron Pharmaceuticals); интерлeйкин-18 (Rengeneron Pharmaceuticals); J695 (Abbott Laboratories); Ораприн (DORBioPharma); пегсунерцепт (растворимый фактор некроза опухолей - рецептор типа l) (Amgen); пралнакасан (Aventis); Програф (Fujisawa Healthcare); r-IL-18 bp (Serono); R1487 (ингибитор киназы) (Roche); Ритуксан (Genentech); SB281832 (GlaxoSmithKline); SCIO-323 (Scio); SCIO-469 (Scio) и Витаксин (MedImmune).
В одном варианте осуществления соединения настоящего изобретения можно также вводить в комбинации или при чередовании с апазоном, амитриптилином, химопапаином, коллагеназой, циклобензаприном, диазепамом, флуоксетином, пиридоксином, адеметионином, диацереином, глюкозамином, гиланом (гиалуронатом), мизопростолом, парацетамолом, имитаторами супероксиддисмутазы, антагонистами TNFα рецептора, TNFα антителами, ингибиторами P 38 киназы, трициклическими антидепрессантами, ингибиторами cJun киназы или иммунодепрессивными агентами, IV гамма-глобулином, тролеандомицином, циклоспорином (Neoral), метотрексатом, FK-506, соединениями золота, такими как Миокризин (золото-натрий тиомалат), антагонистами фактора активации тромбоцитов (ФАТ), такими как ингибиторы тромбоксана, антагонистами рецептора лейкотриен-D4, такими как Акколат (зафирлукаст), Зифло (зилеутон), антагонистами лейкотриена C1, C2 и ингибиторами синтеза лейкотриенов, такими как зилеутон для лечения артритических нарушений, ингибиторами индуцибельной синтазы оксида азота.
В другом варианте осуществления активное соединение вводят в комбинации или при чередовании с одним или более другими нестероидными противовоспалительными препаратом(ами) (НПВП). Примеры НПВП, которые можно использовать при чередовании или в комбинированной терапии, представляют собой карбоксильные кислоты, пропионовые кислоты, фенаматы, уксусные кислоты, пиразолоны, оксиканы, алканоны, соединения золота и другие, которые ингибируют синтез простагландинов, предпочтительно, селективно ингибируя циклооксигеназу-2 (ЦОГ-2). Некоторые неограничивающие примеры ингибиторов ЦОГ-2 представляют собой Целебрекс (целекоксиб) и Виокс (рофекоксиб). Некоторые неограничивающие примеры НПВП представляют собой аспирин (ацетилсалициловая кислота), Долобид (дифлунисал), Дисалцид (салсалат, салицилсалицилат), Трилисат (трисалицилат холина магния), салицилат натрия, Купримин (пеницилламин), Толектин (толметин), ибупрофен (Мотрин, Адвил, Нуприн, Руфен), Напросин (напроксен, Анапрокс, напроксена натрий), Налфон (фенопрофен), Орудис (кетопрофен), Ансаид (флурбипрофен), Дайпро (оксапрозин), меклофенамат (меклофенамовая кислота, Мекломен), мефенамовую кислоту, Индоцин (индометацин), Клинорил (сулиндак), толметин, Вольтарен (диклофенак), Лодин (этодолак), кеторолак, Бутазолидин (фенилбутазон), Тандеарил (оксифенбутазон), пироксикам (Фелден), Релафен (набуметон), Миокризин (золото-натрий тиомалат), Ридаура (ауранофин), Солганал (ауротиоглюкоза), ацетаминофен, колцихин Зилоприм (аллопуринол), Бенемид (пробенецид), Антуран (сульфинпиризон), Плаквенил (гидроксихлорохин), Ацеклофенак, Ацеметацин, Ацетанилид, Актарит, Алклофенак, Алминопрофен, Алоксиприн, Алюминия Аспирин, Амфенак натрия, Амидопирин, Аминопропилон, Эфир салицилат аммония, Ампироксикам, амилсалицилат, Аниролак, Аспирин, Ауранофин, Ауротиоглюкозу, Ауротиопрол, Азапропазон, Бендазак (бендазак лизин), Бенорилат, Беноксапрофен, Бензпиперилон, Бензидамина гидрохлорид, Бомил салицилат, Бромфенак натрия, Буфексамак, Бумадизон кальция, Бутибуфен натрия, Капсаицин, Карбаспирин кальция, Карпрофен, Хлортеноксазин, холинтрисалицилат магния, холинсалицилат, Цинметацин, Клофексамид, Клофезон, Клометацин, Клониксин, Хлорацетадол, Цимен, Диацереин, Диклофенак (Диклофенак диэтиламмония соль, Диклофенак калия, Диклофенак натрия), Диэтиламинмалицилат, Диэтилсалициламид, Дифенпирамид, Дифлунизал, Дипирон, Дроксикам, Эпиризол, Этензамид, Этерсалат, Этилслаицилат, Этодолак, Этофенамат, Фелбинак, Фенбуфен, Фенхлофенак, Фенопрофен кальция, Фентиазак, Фепрадинол, Фепразон, Флоктафенин, Флуфенамик, Флуноксапрофен, Флурбипрофен (Флурбипрофен натрия), Фосфозал, Фурпрофен, Глафенид, Глюкаметацин, Гликоль-Салицилат, Золота Кератинат, Гарпагофитум распростертый (Harpagophytum Procumbens), Ибуфенак, Ибупрофен, Ибупроксам, Имидазола салицилат, Индометацин (Индометацин натрия), Индопрофен, Изамифазон, Изониксин, Изоксикам, Кебузон, Кетопрофен, Кеторолака трометамол, Салицилат Лития, Лоназолак кальция, Лорноксикам, Локсопрофен Натрия, Лизин-Аспирин, Салицилат Магния, Меклофенам Натрия, Мефенаминовую кислоту, Флуфенаминовую кислоту, Мелоксикам, Метил Бутилсалицилат, Метил Гентисат, Метил Салицилат, Метиазиновую кислоту, Метифеназон, Мофебутазон, Мофезолак, Моразона Гидрохлорид, Морнифлумат, Морфолин Салицилат, Набуметон, Напроксен (Напроксен Натрия), Нифеназон, Нифлумовую кислоту, Нимесулид, Оксаметацин, Оксапрозин, Оксинданак, Оксифенбутазон, Парсалмид, Фенилбутазон, Фенирамидола Гидрохлорид, Пиценадола Гидрохлорид, Пиколамина салицилат, Пикетопрофен, Пиразолак, Пироксикам, Пирпрофен, Пранопрофен, Праносал, Проглуметацин малеат, Проквазон, Протизиновую кислоту, Рамифеназон, Салацетамид, Саламидуксусную кислоту, Салициламид, Саликс, Салол, Салсалат, Ауротиомалат Натрия, Гентисат Натрия, Салицилат Натрия, Тиосалицилат Натрия, Сулиндак, Супероксиддисмутаза (Орготеин, Пегорготеин, Судисмаза), Супрофен, Суксибузон, Тенидап Натрия, Теноксикам, Тетридамин, Турфила салицилат, Тиапрофеновую кислоту, Тиарамида Гидрохлорид, Тиноридина Гидрохлорид, Толфенамовую кислоту, Тометин Натрия, Триэтаноламин Салицилат, Уфенамат, Залтопрофен, Зидометацин и Зомепирак Натрия.
В одном варианте осуществления соединение(я) настоящего изобретения можно вводить в комбинации или при чередовании с одним или более антипролиферативными агентами. Любой из антипролиферативных агентов, упомянутых ниже, или любой другой такой агент, известный или раскрытый, проявляющий антипролиферативный эффект, можно использовать в комбинации или при чередовании в настоящем изобретении для достижения комбинированного терапевтического эффекта.
Типичные вспомогательные вещества включают левамизол, нитрат галлия, гранисетрон, сарграмостим стронций-89 хлорид, филграстим, пилокарпин, дексразоксан и ондансетрон. Physicians' Desk Reference, 50th Edition, 1996.
Типичные ингибиторы андрогенов включают флутамид и лейпролида ацетат. Physicians' Desk Reference, 50th Edition, 1996.
Типичные производные антибиотиков включают доксорубицин, блеомицина сульфат, даунорубицин, дактиномицин и идарубицин.
Типичные антиэстрогены включают тамоксифена цитрат и его аналоги. Physicians' Desk Reference, 50th Edition, 1996. Дополнительные антиэстрогены включают нестероидные антиэстрогены, такие как торемифен, дролоксифен и ралоксифен. Magarian et al., Current Medicinal Chemistry, 1994, Vol. 1, № 1.
Типичные антиметаболиты включают фторурацил, флударабина фосфат, флоксуридин, интерферон альфа-2b рекомбинантный, метотрексат натрия, пликамицин, меркаптопурин и тиогуанин. Physicians' Desk Reference, 50th Edition, 1996.
Типичные цитостатические агенты включают доксорубицин, кармустин (BCNU), ломустин (CCNU), цитарабин USP, циклофосфамид, эстрамустин натрий фосфат, алтретамин, гидроксимочевину, ифосфамид, прокарбазин, митомицин, бусульфан, циклофосфамид, митоксантрон, карбоплатин, цисплатин, интерферон альфа-2а рекомбинантный, паклитаксел, тенипозид и стрептозоцин. Physicians' Desk Reference, 50th Edition, 1996.
Типичные гормоны включают медроксипрогестерона ацетат, эстрадиол, мегестрола ацетат, октреотида ацетат, диэтилстилбестрола дифосфат, тестолактон и гозерелина ацетат. Physicians' Desk Reference, 50th Edition, 1996.
Типичные иммуномодуляторы включают алдеслейкин. Physicians' Desk Reference, 50th Edition, 1996.
Типичные производные нитроиприта включают мелфалан, хлорамбуцил, хлорметин и тиотепу. Physicians' Desk Reference, 50th Edition, 1996.
Типичные стероиды включают бетаметазона натрий фосфат и бетаметазона ацетат. Physicians' Desk Reference, 50th Edition, 1996.
Типичные противоопухолевые агенты включают паклитаксел или доксорубицин.
Дополнительные подходящие химиотерапевтические агенты включают алкилирующие агенты, антимитотические агенты, растительные алкалоиды, биологические лекарственные средства, ингибиторы топоизомеразы I, ингибиторы топоизомеразы II и синтетические лекарственные вещества. AntiСancer Agents by Mechanism.http://www.dtp.nci.nih.gov/docs/cancer/searches/standard_mechanism_list.html, April 12, 1999; Approved Anti-Cancer Agents,http://www.ctep.info.nih.gov/handbook/HandBookText/fda_agen.htm, pages 1-7, June 18, 1999; MCMP 611 Chemotherapeutic Drugs to Know, http//www. vet.purdue.edu/depts/bms/courses/mcmp611/chrx/ drg2no61.html, June 24, 1999; and Chemotherapy, http://www.vetmed.lsu.edu/oncology/ Chemotherapy.htm, April 12, 1999.
Типичные алкилирующие агенты включают асалей, AZQ, BCNU, бусульфан, бисульфан, карбоксифталатоплатину, CBDCA, CCNU, CHIP, хлорамбуцил, хлорозотоцин, цис-платину, кломезон, цианоморфолинодоксорубицин, циклодизон, циклофосфамид, диангидрогалактитол, флуородопан, гепсульфам, гикантон, ифосфамид, мелфалан, метил CCNU, митомицин C, митозоламид, нитроиприт, PCNU, пиперазин, пиперазиндион, пипоброман, порфиромицин, спирогидантоин иприт, стрептозотоцин, тероксирон, тетраплатину, тиотепу, триэтиленмеламин, урацил нитроиприт и Yoshi-864. AntiСancer Agents by Mechanism, http://dtp.nci.nih.gov/docs/cancer/searches/standard_mechanism_list.html, April 12, 1999.
Типичные антимитотические агенты включают аллоколхицин, Галихондрин М, колхицин, производные колхицина, доластатин 10, майтансин, ризоксин, производные паклитаксела, паклитаксел, тиоколхицин, тритилцистеин, винбластина сульфат и винкристина сульфат. AntiСancer Agents by Mechanism, http://dtp.nci.nih.gov/docs/cancer/searches/standard_mechanism_list.html, April 12, 1999.
Типичные растительные алкалоиды включают актиномицин D, блеомицин, L-аспарагиназу, идарубицин, винбластина сульфат, винкристина сульфат, митрамицин, митомицин, даунорубицин, VP-16-213, VM-26, навельбин и таксотер. Approved Anti-Cancer Agents, http://ctep.info.nih.gov/handbook/HandBook Text/fda_agent.htm, June 18, 1999.
Типичные биологические лекарственные средства включают альфа-интерферон, BCG, G-CSF, GM-CSF и интерлeйкин-2. Approved Anti-Cancer Agents, http://ctep.info.nih.gov/handbook/ HandBookText/fda_agent.htm, June 18, 1999.
Типичные ингибиторы топоизомеразы I включают камптотецин, производные камптотецина и морфолинодоксорубицин. AntiСancer Agents by Mechanism, http://dtp.nci.nih. gov/docs/cancer/searches/standard_mechanism_ list.html, April 12, 1999.
Типичные ингибиторы топоизомеразы II включают митоксантрон, амонафид, m-AMSA, производные антрапиразола, пиразолакридин, бисантрен HCL, даунорубицин, дезоксидоксорубицин, меногарил, N,N-дибензил дауномицин, оксантразол, рубидазон, VM-26 и VP-16. AntiСancer Agents by Mechanism, http://dtp.nci.nih.gov/docs/cancer/searches/ standard_mechanism_ list.html, April 12, 1999.
Типичные синтетические лекарственные средства включают гидроксимочевину, прокарбазин, o,p'-DDD, дакарбазин, CCNU, BCNU, цис-диаминодихлорплатину, митоксантрон, CBDCA, левамизол, гексаметилмеламин, all-транс ретиноевую кислоту, глиадел и порфимер натрия. Approved Anti-Cancer Agents, http://ctep.info.nih.gov/handbook/HandBookText/ fda_agen.htm, June 18, 1999.
Типичные антитела включают моноклональные антитела, направленные на пролиферацию клеток, такие как Ритуксимаб (анти-CD20) для B-клеточных опухолей и герцептин.
В клиническом исследовании особенно рассматривают лекарственные средства, включая, но не ограничиваясь ими: 715992 (ингибитор кинезина) (GlaxoSmithKline); Адвексин (Introgen Therapeutics); AG-002037 (Pfizer); APC8024 (Dendreon); атрасентан (ABT-627); BIBH 1 (Boerhinger-Ingelheim); CCI 779 (Wyeth Pharmaceuticals); CEA Vac (Titan Pharmaceuticals); CEA-CIDE (Immunomedics); CEA-Scan (Immunomedics); Целебрекс (Pharmacia); CP-547, 632 (анти-VEGF тирозинкиназа) (OSI Pharmaceuticals); CP-724-714 (анти-ErbB2[HER-2 neu] тирозинкиназа) (OSI Pharmaceuticals); CpG 7909 (Aventis Pharmaceuticals); слияние дендритной/раковой клетки (Genzyme Molecular Oncology); ERA 923 (тканеселективный модулятор-SERM эстрогеновых рецепторов) (Ligand Pharmaceuticals); Этиол (MedImmune Oncology); fowlpox-(6D)-TRICOM/vaccinia-(6D)-TRICOM вакцина (National Cancer Institute); G 3139 (Genta); Гемзар (Eli Lilly); Генасенс (Genta); Геневакс (Centocor); GPI-0100 имунный усиливающий агент (адъювант) (Galencia Pharmaceuticals); GTI 2040 (Lorus Therapeutics); GTI 2501 (Lorus Therapeutics); Н11 (Viventia Biotech); интерлeйкин-4 (IL-4) (National Cancer Institute); ирофулвен (National Cancer Institute); жидкий IL-2 (Chiron); антитело МАb 3A1 (National Cancer Institute); многоцелевой антифолат I (Eli Lilly); Миоцет (Liposome Company); пероральный паклитаксел (IVAX Pharmaceuticals); P53 и RAS вакцина (National Cancer Institute); PD-183805 (Pfizer); Пролейкин (Chiron); Промун (Chiron); R1550 (Antisoma); RAS пептиды (National Cancer Institute); аналог ребеккамицина (National Cancer Institute); рекомбинантный человеческий хорионический гонадотропин (r-hCG) (Serono); RSR-13 (Allos Therapeutics); RSR-13 (Eli Lilly); Таргретин (Ligand Pharmaceuticals); тариквидар (QLT); Таксотер (Aventis Pharmaceuticals); TLK286 (Telik); vaccina-MUC-1 вакцину (Therion Biologies); vaccinia-MUC-1 вакцину (National Cancer Institute); Кстотакс (Cell Therapeutics); Ксиотакс (Cell Therapeutics); Йонделис (ЕТ-743) (Johnson & Johnson); Зарнестру (Johnson & Johnson); ZD6126 и ZD6474 (AstraZeneca); и Золадекс (AstraZeneca).
Способы получения соединений
Ниже представлены способы модульного синтеза, направленные на получение лактонов резорциловой кислоты изобретения. Разработанный синтез можно использовать с помощью смолы или твердофазного синтеза для минимизирования и облегчения выделения промежуточного соединения и конечных продуктов.
В настоящем описании используют следующие сокращения.
Общее ретросинтетическое расщепление стратегии синтеза для получения соединений изобретения показано ниже (см. Barluenga et al., Angew. Chem. Int. Ed., 2008, 47, 4432-4435). Этерификация Мицунобу, ацилирование и метатезис закрытия кольца показаны как главные расщепления, используя три структурных элемента. Используя эти структурные элементы и стратегию синтеза, был разработан дивергентный синтез соединений. Подобную стратегию использовали для получения библиотеки аналогов пошонинов с активностью HSP90 (см. Moulin et al., Chem. Eur. J. 2006, 12, 8819).
Схемы, показанные ниже, являются неограничивающими примерами синтеза соединений изобретения и промежуточных соединений, используемых для получения соединений. Специалистам в данной области техники будет очевидно, что в реакциях, изображенных на схемах, можно использовать дополнительные реактивы и условия для достижения желаемого превращения. Например, в синтезе соединений можно использовать различные защитные группы, и определенные группы, изображенные на схемах, не ограничивают примеры. Например, вместо указанных защитных групп можно использовать любые подходящие защитные группы для гидрокси и карбоксильных групп, изложенные в Greene et al., Protective Groups in Organic Synthesis, John Wiley & Sons, 3rd Ed., 1999. Кроме того, можно применять дополнительные реактивы, известные в данной области техники, для показанных превращений, включая, например, этерификацию ароматической карбоксильной кислоты или реакцию закрытия кольца.
Схема 1 ниже показывает общий синтетический протокол для одного из соединений изобретения, где X=O и n=1, исходя из промежуточного соединения 1-1, который получают из легко доступных защищенных ароматических прекурсоров с помощью ацилирования бензилового положения с помощью подходящего производного замещенной карбоксильной кислоты с последующим образованием замещенного оксима с помощью взаимодействия ацилированной ароматической группы с подходящим реагентом гидроксиламина, таким как аминооксиуксусная кислота. Схема 2 ниже обеспечивает неограничивающий пример получения ароматического соединения структуры 1-1.
Для упрощения выделения и очистки промежуточных соединений и конечных соединений промежуточные соединения, такие как соединение 1-1, могут быть закреплены на соответствующим образом функционализированную смолу, такую как 2-хлортритильная смола, с помощью взаимодействия группы карбоксильной кислоты со смолой. С промежуточного соединения 1-2, закрепленного на смолу, снимают защитную группу для получения промежуточного соединения 1-3 со свободной группой карбоксильной кислоты.
Карбоксильная кислота 1-3 взаимодействует с подходящим спиртом R2OH, содержащим двойную связь, который можно использовать для реакции метатезиса закрытия кольца с подходящим катализатором. Можно использовать различные условия для образования производного ароматического эфира, включая, но не ограничиваясь ими, этерификацию Мицунобу, например, с гомоаллиловым спиртом, для получения соответствующего сложного эфира (не показано). Сложный эфир, связанный со смолой, затем обрабатывают с катализатором, таким как катализатор Грабба второго поколения, для обеспечения закрытия кольца промежуточного соединения 1-4. Было обнаружено, что использование микроволнового излучения во время закрытия кольца улучшало эффективность реакции метатезиса.
Важно отметить, что последовательность реакции не возможна в отсутствие функциональных свойств оксима, так как реакция соответствующего бензилового кетона приводит к побочным продуктам кумарина (см. Barluenga et al., Chem. Eur. J. 2005, 11, 4935).
Макроциклы удаляют из смолы, используя, например, гексафторпропанол (HFIP) для обеспечения кислотного продукта оксима 1-5. Использование мягкого HFIP для удаления соединений из смолы надолго оставило ЕОМ защитные группы, таким образом, дополнительно обеспечивая разработку других функциональных возможностей на макроциклах. Полученный продукт можно получить с помощью взаимодействия свободной карбоксильной кислоты с подходящей группой. В данной области техники известно, что карбоксильные кислоты пригодны для получения различных производных. Свободную карбоксильную кислоту можно получить взаимодействием с разнообразием соединений для создания желаемых продуктов. Например, взаимодействие с R4XH (X=O или NH) в присутствии активирующего агента, такого как дициклогексилкарбодиимид (ДЦК) или дополнительного активирующего агента для получения соответствующего сложного эфира или амида 1-6.
В неограничивающих примерах свободная карбоксильная кислота в соединении 1-5 может взаимодействовать с амином или спиртом с получением амида или сложного эфира. В некоторых вариантах осуществления, амины, показанные ниже, используют для получения соединений изобретения. Будет очевидно, что дополнительные группы можно использовать для получения соответствующего амида или сложного эфира.


Применение закрепленного на смолу карбодиимида и сульфоновой кислоты предпочтительно использовали для получения различных амидов и сложных эфиров из группы карбоксильной кислоты, освобожденной после удаления макроциклов (соединения 1-5) из смолы.
Схема 1
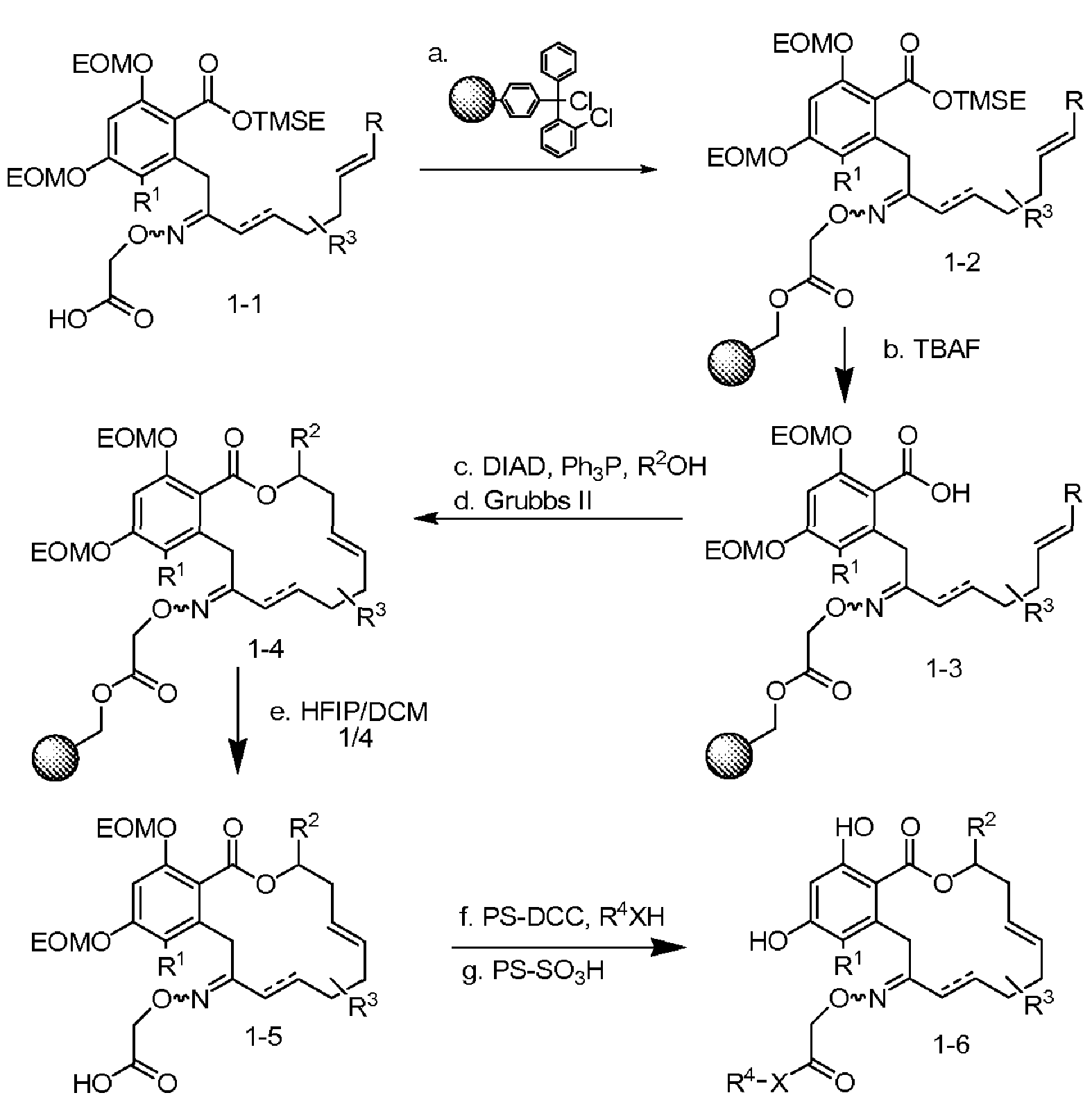
Реагенты и условия: а) PS-ClTr-Cl (3,0 экв.), DIPEA (6,0 экв.), CH2Cl2, 23єС, 24 ч; затем АсОН (20 экв.), 23єС, 24 ч; b) TBAF (4,0 экв.), 23єС, 4 ч; с) R2OH (5,0 экв.), Ph3P (2,0 экв.), DIAD (2,0 экв.), толуол, 23єС, 12 ч; d) Grubbs'II (0,06 экв.), CH2Cl2, 120єС, MW, 3Ч45 мин; е)HFIP/CH2Cl2 1/4, 23єС, 3 ч, 20-30% после 5 стадий; f) PS-DCC (3,0 экв.), DMAP (катализатор), R4XH (2,0 экв.), 23єС, 72 ч, приблизительно 75%; g) PS-SO3H (10 экв.), МеОН, 23єС, 4 ч, приблизительно 85%.
Схема 2 показывает пример синтеза промежуточного соединения 1-1 из соответственно защищенного производного ароматической карбоксильной кислоты 2-1. Депротонирование 2-1 с диизопропиламидом лития (LDA) и взаимодейстиве с амидом Вейнреба 2-2 с последующим гашением со смолой бензойной кислоты обеспечивает промежуточное соединение 2-3. Взаимодействие 2-3 с избытком реагента гидроксиламина приводит к образованию промежуточного соединения оксима 2-4, который далее используют, как описано в схеме 1.
Схема 2
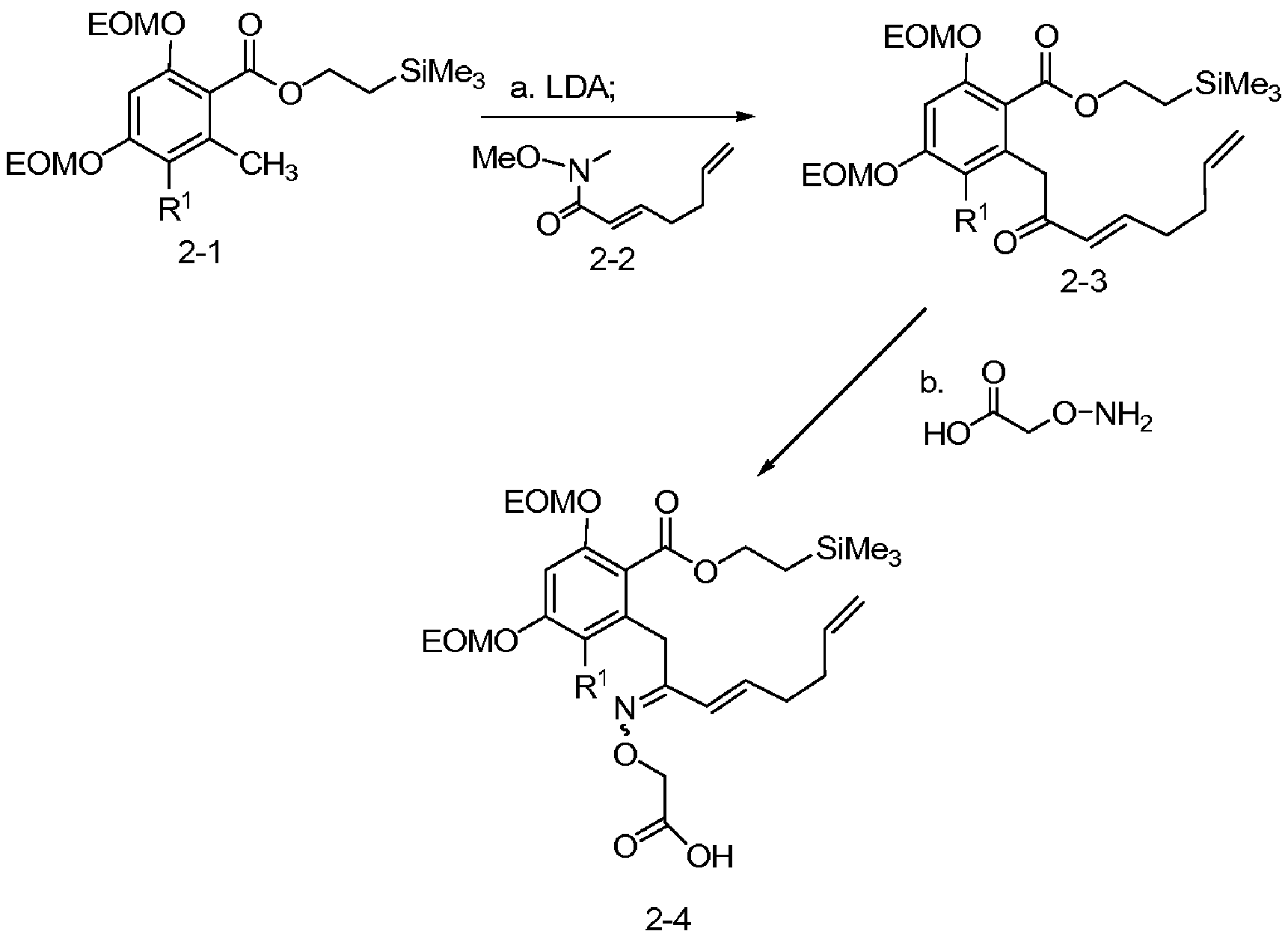
Реагенты и условия: а) LDA (2,0 экв.), ТГФ, -78єС; 1 экв. амид Вейнреба 2-2, затем смоляные кислоты; b) 5,0 экв. карбоксильная кислота 2-4, Py/AcOH, 40єС.
В некоторых вариантах осуществления, неограничивающих вариантах осуществления, исходный ароматический материал может быть соединением, показанным ниже, где R1 представляет собой H или галоген, в частности, водород и хлор. Как обсуждено, другие защитные группы, известные в данной области техники, можно использовать для фенольных и карбоксильных функциональных групп.
Гомоаллильные спирты
Множество гомоаллильных спиртов коммерчески доступно и может использоваться в синтезе. Другие гомоаллильные спирты, имеющие различные заместители, можно получить с помощью способов, известных в данной области техники. Схема 3 ниже иллюстрирует синтез различных гомоаллильных спиртов, которые не являются коммерчески доступными. В одном варианте осуществления гомоаллильные спирты 3-3 получали в их наиболее чистой энантиомерной форме или с помощью ферментативного разделения рацемического спирта (H. E. Master et al., Tet. Lett., 37:9253 (1996); S. Singh et al., Tet. Asymm., 13:2679 (2002) или через аллилирование по Брауну соответствующего альдегида (H. C. Brown and P. K. Jadhav J. Am. Chem. Soc., 105:2092 (1983). Фенильные (3-3a), пиридинильные (3-3b) и фурильные (3-3c) спирты получали с помощью ферментативного разделения (схема 3). Рацемические спирты 3-2a-c получали после добавления Гриньяра коммерчески доступного аллилмагния бромида к их соответствующим альдегидам 3-1a-c.
Схема 3: Синтез хиральных спиртов 3а-с, используя ферментативное разделение
а) АллилMgBr (1,5 экв.), ТГФ, 0,5 ч, 0єС, 71% (3-2а), 41% (3-2b), 74% (3-2с); b) R2=Ph: винилацетат (32,5 экв.), липаза Amano PS-CII (50 мг/моль 3-2), 23єС, 30 ч (показано1Н-ЯМР), R2=Pyr, Fur: винилацетат (10,0 экв.), липаза Amano PS-CII (50 мг/моль 3-2), ТГФ, 23єС, 5-30 ч (показано1Н-ЯМР); с) K2CO3 (0,8 экв.), МеОН, 23єС, 98% ((R)-3-2а), 92% ((R)-3-2b), 84% ((R)-3-2с).
Кинетическое ферментативное разделение рацемических спиртов 3-2a-c было реализовано, используя высокоэффективную липазу Amano (иммобилизованная форма Pseudomonas cepacia). Этот фермент катализировал селективную переэтерификацию спиртов (R)-3-2a-c с винилацетатом в качестве ацильного донора, причем (S)-спирты 3-2a-c выделяли с превосходными выходами и хорошими энантиомерными избытками (таблица 2).
Полученный с помощью данной методологии энантиомерный избыток составлял выше 88%. Ацетилированные спирты (R)-3-3 затем гидролизовали до соответствующих спиртов (R)-3-2a-c с превосходными выходами. Схема 4 ниже иллюстрирует дополнительный способ, основанный на аллилировании по Брауну, для синтеза изопропиловых (4-4d), пропиловых (4-4e) и бензиловых (4-4f) спиртов (схема 4).
Схема 4: Получение хиральных спиртов 4-3d-f, используя аллилирование по Брауну
а) (-)-α-пинен (2,4 экв.), BH3·Me2S (1,0 экв.), ТГФ, 23єС для 1 ч и затем 4єС для 12 ч, 76%; b) МеОН (1,2 экв.), Et2O, 0єС, 2 ч, 94%; с) АллилMgBr (0,95 экв.), Et2O, 0→23єС, 1 ч, 92%; d) 4-3d-f (1,05 экв.), Et2O, -100єС, 0,5 ч; 3 н. NaOH, Н2О2 35%, нагревание с обратным холодильником, 3 ч, 77-93%. Энантиомерные избытки спиртов определяли с помощью анализа хиральной ВЭЖХ после ацилирования с 3,5-динитробензоилхлоридом.
(-)-B-Аллилдиизопинокамфеилборан (4-2, (-)-Ipc2BАллил) синтезировали в три стадии из (-)-α-пинена, включая гидроборирование, образование соответствующего MeO-боринового эфира 4-1 и его обработка реактивом Гриньяра. Дальнейшее конденсирование с альдегидами 4-3d-f с последующим окислением полученных боринатов с помощью щелочного пероксида водорода позволило получить хиральные гомоаллильные спирты 4-4d-f в хорошем энантиомерном избытке.
В некоторых вариантах осуществления изобретения можно использовать гомоаллильные амины, а не спирты. Соответствующие амины можно легко получить из спиртов с помощью способов, известных в данной области техники. В некоторых вариантах осуществления изобретения гомоаллильные спирты и амины, показанные ниже, можно использовать для получения соединений изобретения.
Амиды Вейнреба
Широкое разнообразие амидов Вейнреба можно использовать для получения соединений изобретения. Амиды Вейнреба хорошо известны в данной области техники, и многие амиды Вейнреба или реактивы для получения амидов Вейнреба являются коммерчески доступными. Дополнительно известны способы получения амидов Вейнреба. Например, разнообразие амидов Вейнреба можно получить при взаимодействии альдегида с желаемыми функциональными свойствами с илидом амида Вейнреба (соединение 5-4, схема 5), или фосфонатом амида Вейнреба (соединение 6-6, схема 6) с образованием желаемого α,β-ненасыщенного амида Вейнреба. В одном варианте осуществления амид Вейнреба, содержащий защищенную гидроксигруппу, получают согласно схеме 5 ниже.
Схема 5: Получение амидов Вейнреба
Диметиловый эфир транс-3-гексендионовой кислоты 5-1 восстанавливали до соответствующего диола с помощью алюмогидрида лития. Диол монозащищали с получением трет-бутилдифенилсилилового эфира 5-2, и свободный спирт превращали в альдегид 5-3 в три стадии через нитрил. Альдегид 5-3 затем обрабатывали илидом амида Вейнреба 5-4 для получения диена амида Вейнреба 5-5. Различные другие амиды Вейнреба можно получить, используя соединение 5-4 и альдегид с желаемыми функциональными свойствами.
В другом варианте осуществления амиды Вейнреба, содержащие гидроксизаместитель, можно получить, используя синтетический способ, показанный на схеме 6.
Схема 6: Cинтез гидроксизамещенных амидов Вейнреба
Обработка трет-бутилацетата 6-1 объемным основанием, таким как LDA, и взаимодействие полученного енолята с виниловым альдегидом обеспечивает спирт 6-2. Рацемический спирт разделяют с помощью обработки с аминолипазой PS-C II для получения хирального ацетата 6-3 и хирального спирта 6-4. Гидроксигруппу защищают соответствующим образом, например, в виде трет-бутилдиметилсилильного эфира 6-5, и соответствующий альдегид получают с помощью взаимодействия с DIBAL-H. Взаимодействие с фосфонатом Вейнреба 6-6 обеспечивает желаемый амид Вейнреба 6-7.
В неограничивающих вариантах осуществления амиды Вейнреба, показанные ниже, можно использовать для получения определенных соединений изобретения.
Алкилирование ароматических компонентов, таких как 2-1 (схема 1), с амидами Вейнреба, замещенными защищенной гидроксигруппой или другой защищенной функциональной группой, позволяет получить соединения, содержащие защищенную гидроксигруппу на макроциклическом кольце после снятия защиты. Гидроксигруппу можно получить для создания разнообразия соединений изобретения.
Схема 7 ниже иллюстрирует различные соединения изобретения, полученные из гидроксизамещенного макроцикла, который получают из соответствующего амида Вейнреба, содержащего защищенную гидроксигруппу, такие как 6-7. С силилзащищенной гидроксигруппой в соединении 7-1 селективно снимают защиту для получения соединения 7-2 со свободной гидроксигруппой. Нуклеофильная гидроксигруппа в соединении 7-2 может взаимодействовать с различными реагентами для получения производных соединений, таких как амид 457/458 и азидозамещенного соединения 459/460. Будет очевидно, что различные другие производные соединения можно получить при взаимодействии свободной гидроксильной группы с разнообразием реагентов для получения соответствующих производных макроциклов изобретения.
Схема 7: Производные гидроксизамещенных макроциклов
В другом варианте осуществления изобретения соединения изобретения, замещенные азидогруппой, такие как соединения 459/460, могут быть дополнительно разработаны для получения аминозамещенных макроциклов путем восстановления азидогруппы. Схема 8 иллюстрирует получение аминозамещенного соединения и использование соединения для синтеза определенных содержащих амид производных. Специалисту в данной области техники будет очевидно, что получение аминозамещенных макроциклов обеспечивает основу для замещения макроциклов разнообразными функциональными группами с помощью взаимодействия с нуклеофильной аминогруппой.
Восстановление азидогруппы можно достигнуть различными способами, включая обработку трифенилфосфином, для получения аминоалкилзамещенного соединения 8-1. Использование промежуточных соединений амида Вейнреба, содержащих азидогруппу, приводит к соединениям с азидо-функциональными свойствами в другом положении макроцикла. Другие азидозамещенные соединения могут также быть разработаны аналогично для получения аминогруппы. Взаимодействие свободной аминогруппы 8-1 обеспечивает доступ к разнообразию соединений. Например, взаимодействие аминогруппы с уксусным ангидридом дает соединение 461, и взаимодействие с цианиновым меченым реагентом обеспечивает соединение 462, содержащее флуорофор (см. Ernst et al., Cytometry, 1989, 10(1), 3-10).
Схема 8: Получение аминозамещенных макроциклов
Альтернативно, гидроксизамещенные макроциклы можно получить с помощью аллилового окисления макроцикла, как показано на схеме 9. Обработка защищенного макроцикла, такого как соединение 9-1, с диоксидом селена в этаноле обеспечивает гидроксизамещенный продукт в виде смеси изомеров. Полученные спирты могут быть далее получены, как обсуждено выше, для обеспечения разнообразных соединений изобретения. Схема 9 иллюстрирует образование аллиловых эфиров 449 с помощью взаимодействия продуктов спирта с аллилхлоридом в присутствии основания, такого как гидрид натрия, и последующее удаление фенольных защитных групп.
Схема 9: Аллиловое окисление макроциклов
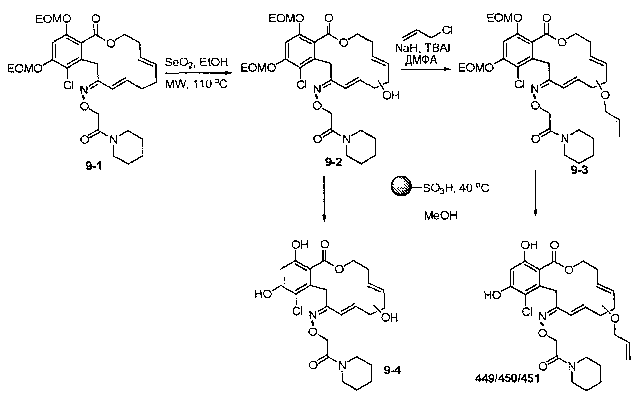
Биологическая активность
Библиотека макроциклов была проанализирована на наличие цитотоксичности для HCC1954 и SK-BR-3 опухолевых клеток. Соединения, проявляющие значительную цитотоксичность, были дополнительно исследованы на их способность вызывать разрушение известных белков клиентов HSP90, таких как ErbB2 в SK-BR3. Таким образом, после 18-часовой обработки соединениями получали клеточные белковые лизаты, нормализовали концентрации белка и количественно определяли концентрацию ErbB2 с помощью Вестерн-блоттинга (C. Chavany et al. J. Biol. Chem. 271:4974-4977(1996)). Несколько соединений из библиотеки были более эффективны, чем радицикол и 17-AAG в сокращении концентрации ErbB2. Например, соединения 13a, 13b и 13c в форме изомера E-оксима были значительно более эффективны и чем радицикол, и чем 17-AAG.
Основываясь на данных in vitro (см. таблица 3, пример 9), соединение 13a далее оценивали in vivo с мышами CB17/SCID с ксенотрансплантатом, имеющим ВТ-474 (клеточная линия опухоли груди), поскольку было показано, что эта линия клеток реагирует на ингибиторы HSP90 на животных моделях (Basso et al., Oncogene 2002, 21, 1159). Исследовали два режима 100 мг через день (q2d) или через четыре дня (q4d) в течение 28 дней. Обработка с помощью соединения 13a привела к дозозависимому ингибированию роста опухоли с 18% сокращением объема опухоли, используя режим q2d. Результаты показаны на фиг.1. Ни режим q2d, ни q4d не привели к значительной потере массы (фиг.1). Гистологическое исследование опухолей, выделенных из животных, получающих или вспомогательное средство (ДМСО), или лекарственное средство в течение 28 дней после режима q2d, показало сильную потерю насыщенности клетками в опухолях, полученных из животных, обработанных лекарственным средством. Ядра оставшихся клеток равномерно конденсировали, предполагая возникновение массивного апоптоза (см. фиг.2, верхние рисунки). Это было подтверждено высокой степенью ядерного TUNEL окрашивания, обнаруженного в опухолях, удаленных у животных, обработанных лекарственным средством, которое показано на фиг.2, нижние рисунки. Эти данные показывают, что регресс опухоли у животных, которых лечат в течение 28 дней согласно режиму q2d, может быть более серьезным, чем оцененный с помощью измерений объема опухоли, так как немногие или никакие жизнеспособные клетки не могут быть идентифицированы в конце периода лечения.
Примеры
Общие методики. Все реакции проводили в атмосфере азота с сухими (безводными) растворителями при безводных условиях, если иначе не обозначено. Безводные растворители получали, пропуская их через коммерчески доступную колонку с оксидом алюминия (Innovative Technology, Inc,® VA). Все замещенные полистирольные смолы (100-200 меш, 1% DVB) приобретали от Novabiochem® или Aldrich®. Катализатор Граббса II заказывали от Materia Inc.® Реакции твердофазного синтеза проводили на Quest® 210 или в круглодонных колбах и отфильтровывали через пористые воронки. За ходом реакции следили с помощью тонкослойной хроматографии (ТСХ), проводимой на 0,25-мм пластинках с силикагелем E. Merck® (60F-254), используя УФ-излучение в качестве визуализирующего агента и 10% спиртовой раствор фосфорномолибденовой кислоты или ванилина и высокую температуру в качестве проявляющих агентов. Силикагель E. Merck® (60, размер частиц 0,040-0,063 мм) использовали для колоночной флеш-хроматографии. ПТСХ (препаративная тонкослойная хроматография) проводили на 0,25-мм пластинках с силикагелем Merck®. Спектры ЯМР регистрировали на приборе Bruker Advance-400® и калибровали, используя остаточный недейтеризованный растворитель в качестве внутреннего стандарта. Использовали следующие сокращения для обозначения мультиплетности: с=синглет, д=дуплет, т=триплет, кв=квартет, м=мультиплет, ушир.=уширенный. Спектры ИК регистрировали на ИК-Фурье спектрометре Perkin-Elmer серии 1600. ЖХ-МС регистрировали, используя Agilent 1100® ВЭЖХ с Bruker® микро-TOF прибором (ESI). Если иначе не обозначено, использовали колонку Supelco® C8 (5 смЧ4,6 мм, 5-мкм частицы) с линейным градиентом элюирования от 100% H2O (0,5% HCO2H) до 100% MeCN через 13 минут при скорости потока 0,5 мл/мин. Если иначе не обозначено, LDA получали с концентрацией 0,566 М, обрабатывая раствор диизопропиламина (1,0 экв.) в ТГФ при -78єC н-бутиллитием (1,0 экв.) и перемешивали в течение 30 минут при этой температуре перед использованием.
ПРИМЕР 1: Получение амидов Вейнреба
Выше обсуждено, что множество амидов Вейнреба, используемых для приготовления соединений изобретения, получали с помощью способов, известных в данной области техники. Характеристические данные показаны ниже для выбранных амидов Вейнреба, используемых для получения соединений изобретения.
1H-ЯМР (400 МГц, CDCl3, 25єC): δ=7,33 (дд, J=15,3, 11,0 Гц, 1H), 6,52 (м, 2H), 5,61 (д, J=16,6 Гц, 1H), 5,48 (д, J=10,2 Гц, 1H), 3,73 (с, 3H), 3,27 (с, 3H);13C-ЯМР (100 МГц, CDCl3, 25єC): δ=166,8, 143,4, 135,1, 124,7, 119,7, 61,7, 32,3; ИК (пленка): νmax=2936, 1658, 1598, 1427, 1382, 1181, 1095, 1005 см-1.

1H-ЯМР (CDCl3, 400 МГц, 25єC) δ 5,40-5,26 (м, 2H), 3,67 (с, 3H), 3,17 (с, 3H), 2,41 (т, J=7,4 Гц, 2H), 2,11-1,97 (м, 4H), 1,64 (тт, J=8,7 Гц, J=6,3 Гц, 2H), 1,39 (тт, J=8,6 Гц, J=6,7 Гц, 2H), 0,95 (т, J=7,8 Гц, 3H);13C-ЯМР (CDCl3, 100 МГц, 25єC) δ 131,9, 128,7, 61,2, 31,8 (x2), 29,5, 26,9, 24,3, 20,5, 14,3, один четвертичный углерод пропущен.
1H-ЯМР (CDCl3, 400 МГц) δ 5,90 (с, 1H), 5,54-5,60 (м, 1H), 4,82 (д, J=17,0 Гц, 1Н), 4,75 (д, J=10,1 Гц, 1Н), 3,43 (с, 3H), 2,96 (с, 3H), 2,02 (м, 4H), 1,90 (с, 3H).13C-ЯМР (CDCl3, 100 МГц) δ 137,55, 115,09, 114,22, 61,36, 40,26, 31,67, 18,64.
1H-ЯМР (CDCl3, 400 МГц, 25єC) δ 6,93 (дт, J=15,5, 7,6 Гц, 1Н); 6,39 (д, J=15,5 Гц, 1Н); 5,70-5,79 (м, 1Н), 4,94-5,02 (м, 2H); 3,69 (с, 3H); 3,23 (с, 3H); 2,18-2,36 (м, 3H); 1,02 (д, J=9,9 Гц, 3H).
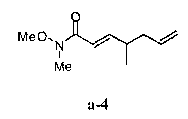
1H-ЯМР (CDCl3, 400 МГц, 25єC) δ 6,93 (дт, J=15,5, 7,6 Гц, 1Н); 6,39 (д, J=15,5 Гц, 1Н); 5,70-5,79 (м, 1Н), 4,94-5,02 (м, 2H); 3,69 (с, 3H); 3,23 (с, 3H); 2,18-2,36 (м, 3H); 1,02 (д, J=9,9 Гц, 3H).
ПРИМЕР 2: Получение гидроксизамещенных амидов Вейнреба
Амиды Вейнреба, содержащие защищенную гидроксигруппу, получают согласно методике, изображенной на схеме 6 и описанной ниже, исходя из получения рацемических спиртов 6-2.
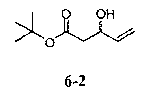
К раствору свежеприготовленного LDA (0,56 М, 60 ммоль) при -78єC под атфосферой азота по каплям добавляли раствор трет-бутилацетата (8,1 мл, 60 ммоль, 1,0 экв.) в ТГФ (10 мл). Затем после одного часа при -78єC, добавляли акролеин (4,5 мл, 60 ммоль, 1,0 экв.) в ТГФ (5 мл), и реакцию перемешивали при той же температуре в течение 5 мин. Реакцию гасили насыщенным раствором NH4Cl и экстрагировали этилацетатом (150 млЧ3), объединенную органическую фазу промывали солевым раствором (120 мл), высушивали над безводным Na2SO4 и испаряли. Осадок подвергали колоночной флеш-хроматографии (ПЭ/ЭА, 8/1) для получения желаемого соединения (8,35 г, 81%).1H-ЯМР (CDCl3, 400 МГц, 25єC) δ 5,82-5,91 (дт, 1Н); 5,30 (дд, J=17,2 Гц, J=0,8 Гц, 1Н); 5,14 (дд, J=10,4 Гц, J=0,8 Гц, 1Н); 4,48 (м, 1Н); 3,13 (д, 1Н); 2,46 (м, 2H); 1,46 (с, 9H).13Н-ЯМР wh3-27 (CDCl3, 400 МГц, 25єC) δ 171,5, 138,9, 114,9, 81,2, 68,9, 42,1, 28,0.
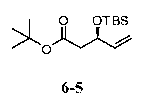
К раствору предварительно приготовленного рацемического спирта (8,35 г, 48,5 ммоль) в винилацетате (120 мл) добавляли Аминолипазу PS-CII (750 мг, 15 мг/ммоль) при 30єC. Реакцию перемешивали в течение 60 часов. После фильтрования раствор концентрировали и подвергали колоночной флеш-хроматографии (ПЭ/ЭА, от 15/1 до 5/1) для получения желаемого соединения (3,86 г) с выходом 46%. К раствору этого хирального спирта (3,75 г, 21,7 ммоль) в ДМФА (60 мл) при 0єC в атмосфере азота добавляли имидазол (2,96 г, 43,5 ммоль, 2,0 экв.) и TBSCl (3,93 г, 26,0 ммоль, 1,2 экв.), затем реакцию нагревали до 23єC и перемешивали в течение 5 часов. Реакцию экстрагировали из насыщенного раствора NH4Cl этилацетатом (100 млЧ3), промывали солевым раствором (100 мл), высушивали над безводным Na2SO4. После удаления растворителя осадок подвергали колоночной флеш-хроматографии (ПЭ/ЭА, 50/1) для получения TBS защищенного спирта (5,85 г, 93%).1H-ЯМР (CDCl3, 400 МГц, 25єC) δ 5,79-5,88 (дт, 1Н); 5,20 (дд, J=16,0 Гц, J=2,8 Гц, 1Н); 5,05 (дд, J=10,4 Гц, J=2,8 Гц, 1Н); 4,51-4,56 (м, 1Н); 2,46 (дд, 1Н); 2,34 (дд, 1Н); 1,44 (с, 9H); 0,88 (с, 9H); 0,05 (д, 6H).13C-ЯМР (CDCl3, 400 МГц, 25°C) δ 170,3, 140,5, 114,4, 80,4, 70,9, 44,8, 28,1, 25,8, 18,1, -4,4, -5,0.

6-7
К раствору сложного эфира, полученного в предыдущей методике (5,85 г, 20,4 ммоль), в CH2Cl2 (100 мл) в атмосфере азота, добавляли DIBAL (24,5 мл, 1 М в толуоле, 1,2 экв.) при -78єC, и реакцию перемешивали при той же температуре в течение получаса. Затем к реакции добавляли насыщенный раствор соли тартрата (100 мл) и перемешивали в течение 2 часов, пока система не станет прозрачной. Две фазы разделяли и экстрагировали с помощью CH2Cl2 (100 млЧ2), промывали солевым раствором, высушивали над Na2SO4. После удаления растворителя полученный осадок (4,33 г) использовали для следующей стадии без дальнейшей очистки. К раствору альдегида (4,33 г) в CH2Cl2 (100 мл) добавляли реагент Виттига (7,33 г, 20,2 ммоль, 1,0 экв.) при 23єC. Реакцию перемешивали в течение ночи. После удаления растворителя в вакууме осадок подвергали колоночной флеш-хроматографии (ПЭ/ЭА=20:1, затем 10/1, 3/1), получали желаемое соединение (4,25 г) с выходом 71% за две стадии.1H-ЯМР (CDCl3, 400 МГц, 25єC) δ 6,89-6,96 (дт, 1Н); 6,41 (д, 1Н); 5,77-5,85 (м, 1Н); 5,18 (дд, 1Н); 5,05 (дд, 1Н); 4,23 (дд, 1Н); 3,67 (с, 3H); 3,22 (с, 3H); 2,42 (дд, 2H); 0,88 (с, 9H); 0,03 (д, 6H).13C (CDCl3, 400 МГц, 25°C) δ 166,6, 143,5, 140,6, 120,9, 114,3, 72,7, 61,6, 41,4, 32,3, 25,8, 18,2, -4,5, -4,9.
ПРИМЕР 3: Ароматические компоненты
Различные соответствующим образом защищенные ароматические группы используют в изобретении. Способы получения подходящих лактонов резорциловой кислоты для создания макроциклов известны в данной области техники. Например, международная публикация № WO 2008/021213, которая включена в настоящее описание в полном объеме посредством ссылки, описывает синтетические способы для множества производных резорциловой кислоты, которые можно использовать для получения соединений изобретения. Выбранные характеристические данные для ароматических соединений, используемых в изобретении, показаны ниже.
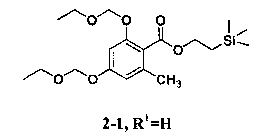
1H-ЯМР сложного эфира (CDCl3, 400 МГц, 25єC) δ 6,69 (с, 1Н); 6,52 (с, 1Н); 5,19 (с, 2H); 5,17 (с, 2H); 4,37 (т, 2H); 3,66-3,74 (м, 4H); 2,28 (с, 3H); 1,18-1,25 (м, 6H); 1,09 (т, 2H); 0,05 (с, 9H).

1H-ЯМР сложного эфира (CDCl3, 400 МГц, 25єC) δ 6,98 (с, 1Н); 5,28 (с, 2H); 5,19 (с, 2H); 4,39 (т, 2H); 3,76 (кв, 2H); 3,70 (кв, 2H); 2,32 (с, 3H); 1,19-1,23 (м, 6H); 1,10 (т, 2H); 0,05 (с, 9H)
ПРИМЕР 4: Алкилированные промежуточные соединения
Создание алкилированных промежуточных соединений, полученных из ароматических производных резорциловой кислоты и амидов Вейнреба, изображено на схеме 2. Различные алкилированные промежуточные соединения с разнообразными заместителями на ароматическом кольце и макроцикле, можно использовать для получения соединений изобретения. Эти соединения можно получить из желаемого ароматического компонента и амида Вейнреба согласно способу, изображенному на схеме. Характеристические данные выбранных алкилированных промежуточных соединений, используемых при получении соединений изобретения, показаны ниже.
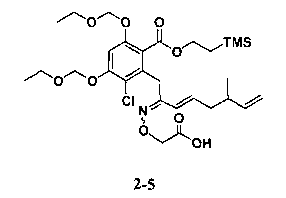
1H-ЯМР двух изомеров (1:1) (CDCl3, 400 МГц, 25єC) δ 9,52 (wЧ2, 2H); 7,04 (сЧ2, 2H); 6,69 (д, J=16,1 Гц, 1Н); 6,26 (дт, J=16,1, 7,0 Гц, 1Н); 5,97 (дт, J=16,1, 7,0 Гц, 1Н); 5,76 (д, J=16,1 Гц, 1Н); 5,53-5,71 (м, 2H); 5,28 (сЧ2, 4H); 5,18 (с, 2H); 5,17 (с, 2H); 4,91-4,96 (м, 2H); 4,81-4,84 (м, 2H); 4,65 (с, 2H); 4,49 (с, 2H); 4,27-4,33 (м, 4H); 4,02 (с, 2H); 3,87 (с, 2H); 3,67-3,77 (м, 8H); 1,98-2,26 (м, 6H); 1,17-1,22 (м, 12Н); 0,99-1,06 (м, 4H); 0,96 (д, J=6,4 Гц, 3H); 0,82 (д, J=6,4 Гц, 3H); 0,05 (с, 9H); 0,03 (с, 9H).
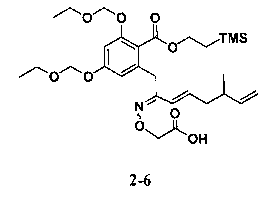
1H-ЯМР двух изомеров (2:1) (CDCl3, 400 МГц, 25єC) δ 9,47 (wЧ2, 2H); 6,75 (д, J=2,0 Гц, 1Н); 6,71 (д, J=2,1 Гц, 1Н); 6,67 (д, J=16,1 Гц, 1Н); 6,57 (д, J=2,1 Гц, 1Н); 6,48 (д, J=2,0 Гц, 1Н); 6,21 (дт, J=16,1, 7,0 Гц, 1Н); 6,03-6,11 (м, 2H); 5,54-5,68 (м, 2H); 5,19 (сЧ2, 4H); 5,17 (с, 2H); 5,15 (с, 2H); 4,82-4,88 (м, 4H); 4,67 (с, 2H); 4,66 (с, 2H); 4,36-4,40 (м, 4H); 3,88 (с, 2H); 3,65-3,74 (м, 10Н); 2,06-2,21 (м, 6H); 1,17-1,23 (м, 12Н); 1,07-1,12 (м, 4H); 0,91 (д, J=6,4 Гц, 3H); 0,86 (д, J=6,4 Гц, 3H); 0,07 (с, 9H); 0,06 (с, 9H)
ПРИМЕР 5: Получение макроциклических соединений изобретения
Общая методика синтеза соединений изобретения
Общий синтез макроциклов, описанный ниже, изображен на схеме 1, исходя из карбоксильной кислоты 1-1. К суспензии 3,0 экв. хлортритильной смолы на основе полистирола (1,1 ммоль/г) в CH2Cl2 при комнатной температуре добавляли 6,0 экв. основания Хунига и 1,0 экв. соответствующей кислоты 1-1 (схема 1). После встряхивания смеси в течение 24 часов, различные смолы покрывали уксусной кислотой еще в течение 24 часов. После этого времени смолы промывали CH2Cl2, ДМФА, CH2Cl2 и Et2O, затем высушивали и снова суспендировали в ТГФ. К этим суспензиям добавляли 4,0 экв. TBAF (1 М), и смеси встряхивали в течение 4 часов. Смолы затем отфильтровывали и тщательно промывали, используя ТГФ, CH2Cl2, 1% AcOH в CH2Cl2, CH2Cl2, Et2O несколько раз. Завершение снятия защиты и полное удаление солей тетрабутиламмония оценивали с помощью ЖХ-МС после отщепления очень маленькой части каждой смолы, используя раствор HFIP в CH2Cl2 1/4 в течение 30 минут (ЖХ-МС регистрировали, используя Agilent 1100 ВЭЖХ с колонкой Supelco C8 (5 смЧ4,6 мм, 5-мкм частицы), используя линейный градиент элюирования от 95% H2O (0,5% HCO2H) до 100% MeCN через 8 минут при скорости потока 0,5 мл/мин). Смолы расщепляли для дальнейшей диверсификации с различными спиртами. Реакции Мицунобу проводили в сухом толуоле, используя 5,0 экв. соответствующего спирта, R2OH, 2,0 экв. Ph3P и 2,0 экв. DIAD, и суспензии перемешивали в течение ночи. Результативность реакций этерификации оценивали с помощью ЖХ-МС после отщепления маленькой части, как описано ранее, и объединения, которые не были завершены, повторно подвергали тем же условиям. После промывания и высушивания смолы суспендировали в толуоле и подвергали реакции метатезиса. К каждой суспензии (3Ч0,06 экв.) добавляли катализатор Граббса второго поколения, и реакции нагревали при 120єC в СЕМ микроволновом реакторе в течение 3Ч45 минут (свежий катализатор добавляли в каждом цикле). Смолы затем несколько раз промывали CH2Cl2, ДМФА, CH2Cl2 и Et2О. Затем соединения отщепляли от смолы, используя раствор HFIP в CH2Cl2 1/4 в течени 3 ч (повторное подвергание смолы отщеплению обеспечивало минимальные количества соединения, предполагая, что первоначальное отщепление приводило к завершению), и соответствующие продукты очищали с помощью ПТСХ и выделяли с выходами между 20-30% после 5 стадий.
Каждое соединение растворяли в CH2Cl2, и затем брали аликвоту для дальнейшего амидирования. В каждую виалу добавляли 2,0 экв. соответствующего амина, 3,0 экв. PS-DCC (DCC полистирольная смола) и катализатор DMAP, и суспензии перемешивали в течение более 72 ч. Завершение каждой реакции проверяли с помощью ЖХ-МС. Соответствующие амиды отфильтровывали, испаряли и повторно растворяли в метаноле. К каждому раствору добавляли 10 экв. полистирольной смолы сульфоновой кислоты и суспензии перемешивали в течение 4 ч при комнатной температуре. Конечные соединения отфильтровывали и выделяли с выходами 75-95%.
Характеристические данные для выбранных соединений изобретения показаны ниже.

1H-ЯМР (CDCl3, 400 МГц, 25єC) δ 11,64 (с, 1Н), 6,64 (с, 1Н), 6,01 (дт, J=15,5, 7,5 Гц, 1Н), 5,11 (д, J=15,5 Гц, 1Н), 5,10-5,03 (м, 2H), 4,85 (с, 2H), 4,37 (т, J=4,8 Гц, 2H), 4,17 (с, 2H), 3,60 (т, J=5,0 Гц, 2H), 3,46 (т, J=5,0 Гц, 2H), 2,34 (кв, J=5,4 Гц, 2H), 2,10-2,02 (м, 2H), 1,99-1,92 (м, 2H), 1,70-1,54 (м, 6H), 1 ОН сигнал невидим;13C-ЯМР (CDCl3, 100 МГц, 25єC) δ 170,27, 167,42, 163,21, 157,38, 155,18, 138,21, 135,62, 131,82, 129,13, 124,76, 115,55, 107,60, 103,47, 72,63, 65,03, 46,38, 43,31, 33,21, 32,76, 31,94, 31,84, 26,65, 25,64, 24,57; МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C24H29ClN2O6Na: 499,1612; найдено: 499,1638.
Геометрию оксима определяли с помощью дифракции рентгеновских лучей. Фиг.3 показывает каркасное представление кристаллической структуры 13a.
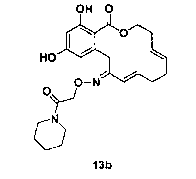
1H-ЯМР (CDCl3, 400 МГц) δ 11,60 (с, 1Н), 6,88 (д, J=1,9 Гц, 1Н), 6,33 (д, J=1,9 Гц, 1Н), 6,14 (дт, J=16,1, 7,5 Гц, 1Н), 5,83 (д, J=16,1 Гц, 1Н), 5,33 (м, 2H), 4,86 (с, 2H), 4,54-4,53 (м, 2H), 4,34 (с, 2H), 3,58-3,55 (м, 2H), 3,40-3,38 (м, 2H), 2,51-2,48 (м, 2H), 2,11-2,07 (м, 4H), 1,61-1,57 (м, 6H), 1 ОН сигнал невидим.13C-ЯМР (CD3OD, 100 МГц) δ 178,0, 175,8, 168,8, 166,6, 165,7, 147,1, 145,5, 141,0, 139,0, 134,4, 122,6, 115,4, 110,4, 81,4, 73,2, 54,7, 51,6, 41,8, 41,3, 40,0, 37,6, 35,5, 34,8, 33,5; МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C24H30N2O6Na: 465,2002; найдено: 465,2015.
Геометрию оксима определяли с помощью дифракции рентгеновских лучей. Фиг.4 показывает каркасное представление кристаллической структуры 13b.

1H-ЯМР (CDCl3, 400 МГц) δ 11,27 (ушир.с, 1Н), 9,03 (ушир.с, 1Н), 6,54 (д, J=2,1 Гц, 1Н), 6,34 (д, J=2,1 Гц, 1Н), 6,05 (м, 1Н), 5,68 (д, J=15,5 Гц, 1Н), 5,43 (м, 2H), 5,28 (м, 1Н), 4,87 (д, J=14,5 Гц, 1Н), 4,82 (д, J=14,5 Гц, 1Н), 4,30 (д, J=15,5 Гц, 1Н), 4,17 (д, J=15,5 Гц, 1Н), 3,58 (м, 2H), 3,41 (м, 2H), 2,68 (м, 1Н), 2,24 (м, 2H), 2,04 (м, 3H), 1,61 (м, 6H), 1,42 (д, J=6,4 Гц, 3H).13C-ЯМР (CDCl3, 100 МГц) δ 167,42, 164,0, 161,85, 159,06, 141,91, 137,79, 132,77, 126,02, 124,63, 111,20, 104,88, 102,10, 71,42, 71,27, 71,21, 45,92, 43,10, 37,82, 32,31, 30,49, 30,24, 26,22, 25,32, 24,24, 18,92; МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C25H32N2O6Na: 479,2158; найдено: 479,2351.
Геометрию оксима установили на основе дифракции рентгеновских лучей Z-изомера 13c. Фиг.5 показывает каркасное представление структуры Z-изомера 13c.
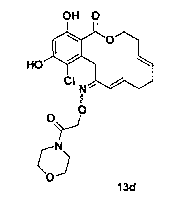
1H-ЯМР (CD3OD, 400 МГц) δ 6,84 (д, J=16,1 Гц, 1Н), 6,63 (д, J=16,1 Гц, 1Н), 6,51 (с, 1Н), 6,46 (д, J=2,7 Гц, 1Н), 6,21 (дт, J=16,1, 6,9 Гц, 1Н), 6,09 (дт, J=16,1, 7,5 Гц, 1Н), 5,31-5,23 (м, 4H), 4,91 (д, J=13,3 Гц, 2H), 4,60 (д, J=13,3 Гц, 2H), 4,45-4,39 (м, 4H), 4,18 (с, 4H), 3,76 (м, 4H), 3,69-3,67 (м, 4H), 3,62-3,46 (м, 8H), 2,59-2,55 (м, 1Н), 2,45-2,43 (м, 5H), 2,37-2,33 (м, 4H), 2,15-2,14 (м, 2H), 4 ОН сигнала невидимы; МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C23H27ClN2O7Na: 501,1405; найдено: 501,1424.

1H-ЯМР (CD3OD, 400 МГц) δ 6,64 (д, J=16,1 Гц, 1Н), 6,53 (с, 1Н), 6,48 (с, 1Н), 6,25 (дт, J=16,1, 7,5 Гц, 1Н), 6,09 (дт, J=15,6, 7,5 Гц, 1Н), 5,52-5,48 (м, 2H), 5,33 (д, J=15,6 Гц, 1Н), 5,26-5,24 (м, 2H), 4,94 (с, 2H), 4,68 (с, 2H), 4,44-4,38 (м, 4H), 4,27 (с, 2H), 4,19 (с, 2H), 3,97-3,93 (м, 4H), 3,86-3,76 (м, 4H), 3,34-3,33 (м, 4H), 3,39-3,20 (м, 4H), 2,59-2,55 (м, 1Н), 2,48-2,40 (м, 3H), 2,37-2,34 (м, 4H), 2,19-2,15 (м, 2H), 2,10-2,06 (м, 2H), 4 ОН и 2 NH невидимы; МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C23H28ClN3O6Na: 500,1564; найдено: 500,1590.

1H-ЯМР (ДМСО-d6, 400 МГц, 25єC) δ 10,2 (с, 1Н), 6,45 (с, 1Н), 6,44 (д, J=16,1 Гц, 1Н), 6,12 (дт, J=16,1 6,4 Гц, 1Н), 5,31-5,29 (м, 2H), 4,57 (с, 2H), 4,16 (т, J=4,8 Гц, 2H), 3,70 (с, 2H), 3,35-3,30 (м, 4H), 2,31 (м, 2H), 2,08-2,05 (м, 4H), 1,56-1,51 (м, 2H), 1,45-1,35 (м, 4H), 1 ОН невидим;13C-ЯМР (ДМСО-d6, 100 МГц, 25єC) δ 167,9, 166,3, 155,4, 155,2, 153,4, 140,6, 134,3, 131,4, 119,4, 113,9, 112,4, 102,1, 71,9, 65,2, 45,4, 42,1, 34,7, 31,8, 31,7, 30,9, 26,0, 25,9, 25,2, 24,0; МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C24H29ClN2O6H: 499,1612; найдено: 499,1624.
Геометрию оксима установили из структуры 13a.
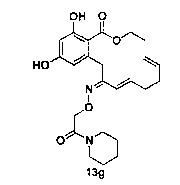
1H-ЯМР (CDCl3, 400 МГц) δ 11,64 (с, 1Н), 6,62 (д, J=16,1 Гц, 1Н), 6,62 (д, J=2,7 Гц, 1Н), 6,33 (д, J=1,9 Гц, 1Н), 6,25 (дт, J=16,1, 7,5 Гц, 1Н), 5,35 (м, 2H), 4,79 (с, 2H), 4,54-4,53 (м, 2H), 4,08 (с, 2H), 3,56-3,54 (м, 2H), 3,38-3,37 (м, 2H), 2,50-2,48 (м, 2H), 2,12-2,08 (м, 4H), 1,66-1,57 (м, 6H), 1 ОH сигнал невидим.13C-ЯМР (CDCl3, 100 МГц) δ 170,8, 167,9, 165,7, 162,0, 157,1, 143,1, 141,9, 132,2, 129,2, 118,4, 110,4, 104,4, 102,5, 71,5, 64,5, 46,0, 43,3, 35,1, 32,9, 32,7, 30,9, 26,4, 25,5, 24,5; МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C24H30N2O6Na: 465,2002; найдено: 465,2027.
Геометрию оксима установили из структуры 13b.
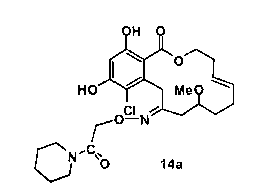
1H-ЯМР (CDCl3, 400 МГц) δ 11,41 (с, 1Н), 11,43 (с, 1Н), 6,58 (сЧ2, 2H), 5,56-5,43 (м, 4H), 4,53 (2Чушир.с, 4H), 4,45-4,42 (м, 4H), 4,40 (2Чд, J=16,6 Гц, 2H), 3,86 (2Чд, J=16,6 Гц, 2H), 3,52-3,50 (м, 4H), 3,46-3,41 (м, 2H), 3,30 (с, 3H), 3,31 (с, 3H), 2,91 (дд, J=14,0, 8,3 Гц, 1Н), 2,89-2,85 (м, 1Н), 2,52-2,51 (м, 4H), 2,41 (дд, J=14,0, 4,0 Гц, 1Н), 2,39-2,35 (м, 1Н), 2,16-2,14 (м, 4H), 1,87-1,77 (м, 4H), 1,61-1,59 (м, 4H), 1,49-1,43 (м, 12Н), 2 ОН сигнала невидимы; МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C25H33ClN2O7Na: 531,1874; найдено: 531,1894.
Геометрия оксима была определена при сравнении с 14a.
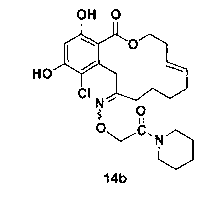
1H-ЯМР (CDCl3, 400 МГц, 25єC) δ 11,44 (с, 1Н), 11,32 (с, 1Н), 6,61 (с, 1Н), 6,57 (с, 1Н), 5,55-5,42 (м, 2H), 5,38-5,35 (м, 2H), 4,77 (с, 2H), 4,52 (с, 2H), 4,48-4,44 (м, 4H), 4,22 (с, 2H), 4,17 (с, 2H), 3,58-3,49 (м, 4H), 3,31-3,28 (м, 4H), 2,50-2,46 (м, 2H), 2,42-2,36 (м, 4H), 2,06-1,99 (м, 6H), 1,96-1,92 (м, 4H), 1,66-1,36 (м, 16Н), 2 ОН сигнала невидимы; МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C24H31ClN2O6Na: 501,1768; найдено: 501,1798.
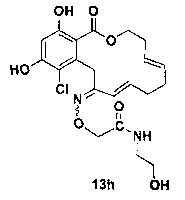
1H-ЯМР (CDCl3, 400 МГц, 25єC) δ 11,35 (с, 1Н), 11,14 (с, 1Н), 6,63 (с, 1Н), 6,56 (с, 1Н), 6,48 (д, J=16,4 Гц, 1Н), 6,00-5,99 (м, 2H), 5,85 (д, J=16,4 Гц, 1Н), 5,37 (с, 2H), 5,15 (с, 2H), 5,14-5,09 (м, 8H), 4,68 (с, 2H), 4,63 (с, 2H), 3,76 (т J=5,0 Гц, 2H), 3,66 (т, J=4,7 Гц, 2H), 3,52-3,48 (м, 2H), 3,39-3,36 (м, 2H), 2,52-2,48 (м, 2H), 2,41-2,32 (м, 4H), 2,30-2,27 (м, 2H), 2,15-2,10 (м, 4H), 4 ОН сигнала и 2 NH сигнала невидимы; МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C21Н25ClN2O7Na: 475,1248; найдено: 475,1275.

1H-ЯМР (CDCl3, 400 МГц, 25єC) δ 11,46 (с, 1Н), 11,02 (с, 1Н), 6,65 (с, 1Н), 6,65 (д, J=16,6 Гц, 1Н), 6,60 (с, 1Н), 6,48 (д, J=15,6 Гц, 1Н), 6,08-6,00 (м, 2H), 5,34-5,25 (м, 4H), 5,16-5,12 (м, 4H), 5,14 (с, 2H), 5,10 (с, 2H), 4,72 (д, J=16,1 Гц, 1Н), 4,65 (д, J=16,1 Гц, 1Н), 4,41 (д, J=17,7 Гц, 1Н), 4,15 (д, J=17,7 Гц, 1Н), 2,91 (д, J=4,8 Гц, 3H), 2,78 (д, J=4,8 Гц, 3H), 2,59-2,52 (м, 1Н), 2,51-2,38 (м, 1Н), 2,24-2,12 (м, 4H), 2,07-2,00 (м, 4H), 1,95-1,87 (м, 2H), 2 ОН сигнала и 2 NH сигнала невидимы; МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C20H23ClN2O6Na: 445,1143; найдено: 445,1178.
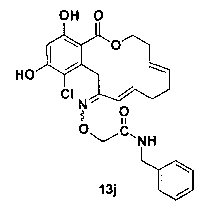
1H-ЯМР (CDCl3, 400 МГц, 25єC) δ 11,32 (с, 1Н), 11,04 (с, 1Н), 7,32-7,29 (м, 10Н), 6,61 (с, 1Н), 6,57 (с, 1Н), 6,42 (д, J=16,4 Гц, 1Н), 6,07 (дт, J=15,8, 6,7 Гц, 1Н), 5,99 (дт, J=16,4, 7,3 Гц, 1Н), 5,67 (д, J=15,8 Гц, 1Н), 5,37-4,95 (м, 8H), 4,73 (с, 2H), 4,69 (с, 2H), 4,64 (с, 2H), 4,56 (с, 2H), 4,54 (с, 2H), 4,52 (с, 2H), 2,34-2,25 (м, 6H), 2,12-2,05 (м, 4H), 2,00-1,99 (м, 2H), 2 ОН сигнала и 2 NH сигнала невидимы; МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C26H27ClN2O6Na: 521,1456; найдено: 521,1498.
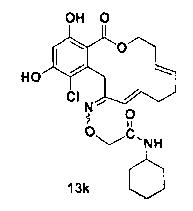
1H-ЯМР (ацетон-d6, 400 МГц, 25єC) δ 6,62 (д, J=15,8 Гц, 1Н), 6,56 (с, 1Н), 6,27 (с, 1Н), 6,14 (дт, J=15,8, 8,5 Гц, 1Н), 6,02 (дт, J=15,5, 7,6 Гц, 1Н), 5,37-5,34 (м, 5H), 5,26 (с, 1Н), 5,22 (с, 1Н), 4,55-4,52 (м, 2H), 4,51 (с, 2H), 4,49 (с, 2H), 4,43-4,41 (м, 2H), 4,26 (с, 2H), 4,19 (с, 2H), 3,76-3,70 (м, 1Н), 3,61-3,54 (м, 1Н), 2,49-2,47 (м, 2H), 2,40-2,36 (м, 2H), 2,16-1,99 (м, 8H), 1,88-1,84 (м, 4H), 1,73-1,66 (м, 4H), 1,62-1,58 (м, 4H), 1,37-1,16 (м, 8H), 2 ОН сигнала и 2 NH сигнала невидимы; МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C25H31ClN2O6Na: 513,1769; найдено: 513,1788.

1H-ЯМР (CDCl3, 400 МГц, 25єC) δ 11,20 (с, 1Н), 11,00 (с, 1Н), 6,62 (с, 1Н), 6,56 (с, 1Н), 6,55 (д, J=15,7 Гц, 1Н), 6,20-6,14 (м, 1Н), 6,02 (дт, J=15,7, 7,32 Гц, 1Н), 5,84 (д, J=16,4 Гц, 1Н), 5,18-5,06 (м, 4H), 4,74 (с, 2H), 4,58-4,55 (м, 4H), 4,44 (с, 2H), 4,26 (с, 2H), 4,22 (с, 2H), 3,78 (с, 3H), 3,66 (с, 3H), 2,51-2,48 (м, 1Н), 2,39-2,36 (м, 3H), 2,32-2,29 (м, 1Н), 2,26-2,24 (м, 1Н), 2,14-2,06 (м, 4H), 2,00-1,99 (м, 2H), 2 ОН сигнала невидимы; МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C20H22ClNO7Na: 446,0983; найдено: 446,0975.
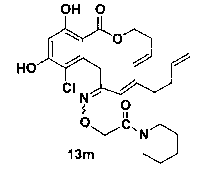
1H-ЯМР (CDCl3, 400 МГц, 25єC) δ 11,57 (с, 1Н), 11,44 (с, 1Н), 6,91 (д, J=16,1 Гц, 1Н), 6,61 (с, 1Н), 6,57 (с, 1Н), 6,27 (дт, J=16,1, 6,96 Гц, 1Н), 6,02 (дт, J=15,6, 6,44 Гц, 1Н), 5,71-5,88 (м, 3H), 5,58-5,67 (м, 1Н), 5,50 (д, J=15,6 Гц, 1Н), 4,99-5,15 (м, 6H), 4,84-4,91 (м, 2H), 4,80 (с, 2H), 4,50 (с, 2H), 4,30-4,36 (дтЧ2, J=12,3, 6,48 Гц, 4H), 4,23 (с, 2H), 4,19 (с, 2H), 3,23-3,58 (м, 8H), 2,38-2,48 (м, 4H), 2,31-2,37 (м, 2H), 2,21-2,26 (м, 2H), 2,00-2,04 (м, 4H), 1,44-1,66 (м, 12Н); МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C26H33ClN2O6Na: 527,1925; найдено: 527,1906.
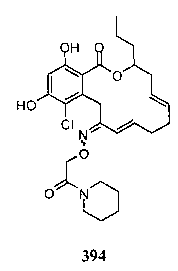
Смесь изомеров 3:1 в оксиме. Основной изомер E:1H-ЯМР (CDCl3, 400 МГц, 25єC) δ 11,46 (ушир.с, 1Н), 6,63 (с, 1Н), 6,03 (м, 1Н), 5,30-5,05 (м, 2H), 5,13 (д, J=16,1 Гц, 1Н), 4,84 (с, 1Н), 4,82 (с, 1Н), 4,27 (с, 1Н), 4,15 (с, 1Н), 3,65-3,40 (м, 4H), 3,34-3,21 (м, 1Н), 2,65-1,92 (м, 6H), 1,35-1,20 (м, 6H), 0,97 (т, J=7,3 Гц, 3H), 0,91 (кв, J=7,3 Гц, 2H), 0,90 (кв, J=7,3 Гц, 2H).
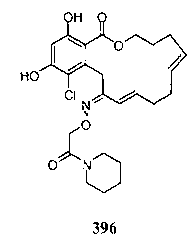
Смесь изомеров 4:1 в оксиме. Основной изомер E:1H-ЯМР (CDCl3, 400 МГц, 25єC) δ 11,31 (с, 1Н), 6,41 (с, 1Н), 6,22 (м, 1Н), 5,50 (д, J=15,8 Гц, 1Н), 5,44-5,26 (м, 2H), 4,79 (с, 2H), 4,49 (т, J=5,6 Гц, 2H), 4,21 (с, 2H), 3,62-3,37 (м, 4H), 2,33-1,93 (м, 8H), 1,34-1,21 (м, 4H), 0,93-0,79 (м, 2H).
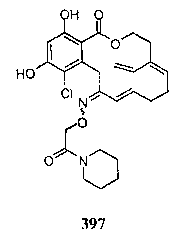
Смесь изомеров 3:1 в оксиме. Основной изомер E:1H-ЯМР (CDCl3, 400 МГц, 25єC) δ 12,07 (с, 1Н), 6,56 (с, 1Н), 6,20-5,88 (м, 1Н), 6,03 (д, J=16 Гц, 1Н), 5,60-5,46 (м, 1Н), 4,92 (д, J=23,1 Гц, 2H), 4,53-4,44 (м, 1Н), 4,48 (с, 2H), 4,08 (с, 2H), 3,60-3,32 (м, 4H), 3,20 (м, 2H), 2,75 (т, J=6,3 Гц, 2H), 2,50-2,39 (м, 2H), 2,28-2,15 (м, 2H), 1,37-1,23 (м, 4H), 0,93-0,78 (м, 2H).
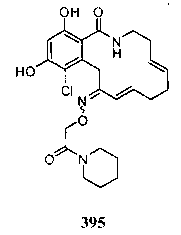
Смесь изомеров 3:1 в оксиме. Основной изомер E:1H-ЯМР (CDCl3, 400 МГц, 25єC) δ 10,58 (с, 1Н), 6,64 (с, 1Н), 6,22-6,15 (м, 1Н), 5,41 (д, J=13,3 Гц, 1Н), 5,31 (с, 2H), 5,27-5,13 (м, 2H), 4,61 (с, 2H), 4,03 (т, J=7 Гц, 2H), 3,63-3,37 (м, 4H), 2,56-2,02 (м, 6H), 1,38-1,22 (м, 4H), 0,93-0,78 (м, 2H).
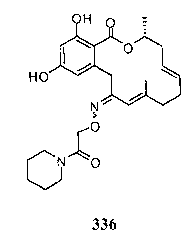
Смесь изомеров 1:1 в оксиме.1H-ЯМР (CDCl3, 400 МГц) δ 11,92 (ушир.с, 1Н), 11,77 (ушир.с, 1Н), 6,56 (д, J=2,4 Гц, 1Н), 6,53 (д, J=2,4 Гц, 1Н), 6,36 (д, J=2,4 Гц, 1Н), 6,35 (д, J=2,8 Гц, 1Н), 5,43-5,17 (м, 6H), 5,11 (с, 1Н), 5,02 (с, 1Н), 4,88 (д, J=14,4 Гц, 1Н), 4,81-4,74 (м, 2H), 4,70 (д, J=14,4 Гц, 1Н), 4,46 (д, J=13,6 Гц, 1Н), 4,16-4,09 (м, 2H), 3,96 (д, J=15,6 Гц, 1Н), 3,64-3,37 (м, 8H), 2,78-2,60 (м, 4H), 2,23-2,12 (м, 8H), 1,79 (с, 3H), 1,65-1,56 (м, 12Н), 1,53 (с, 3H), 1,35 (д, J=6,4 Гц, 3H), 1,29 (д, J=6,4 Гц, 3H).

Смесь изомеров 1:1 в оксиме.1H-ЯМР (CDCl3, 400 МГц) δ 10,95 (ушир.с, 2H), 7,11 (д, J=2,4 Гц, 2H), 6,32 (д, J=2,4 Гц, 2H), 6,09-6,01 (м, 2H), 5,95 (д, J=16,8 Гц, 2H), 5,91 (д, J=16,4 Гц, 2H), 5,76-5,68 (м, 2H), 5,11 (с, 2H), 4,94 (с, 2H), 4,84 (с, 4H), 4,57 (т, J=5,2 Гц, 4H), 4,26 (с, 4H), 3,59-3,53 (м, 4H), 3,39-3,33 (м, 4H), 2,67 (т, J=5,2 Гц, 4H), 2,23-2,17 (м, 8H), 1,60-1,52 (м, 8H), 1,36-1,28 (м, 4H).
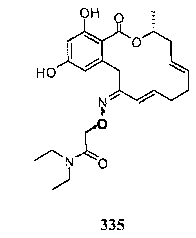
Смесь изомеров 1:1 в оксиме.1H-ЯМР (CDCl3, 400 МГц) δ 11,21 (ушир.с, 1Н), 6,67 (д, J=2,4 Гц, 1Н), 6,62 (д, J=16,4 Гц, 1Н), 6,30 (д, J=2,8 Гц, 1Н), 6,23-6,15 (м, 1Н), 5,52-5,44 (м, 1Н), 5,40-5,31 (м, 1Н), 4,82 (д, J=14,8 Гц, 1Н), 4,75 (д, J=14,8 Гц, 1Н), 4,51 (д, J=14,8 Гц, 1Н), 4,21 (т, J=6,2 Гц, 1Н), 3,66 (д, J=15,2 Гц, 1Н), 3,44-3,35 (м, 2H), 3,34-3,28 (м, 2H), 2,33-2,20 (м, 2H), 2,14-1,98 (м, 4H), 1,45 (д, J=6,8 Гц, 3H), 1,14 (т, J=7,2 Гц, 3H), 0,92 (т, J=7,6 Гц, 3H). МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C24H32NaN2O6: 467,2158; найдено: 467,2176.
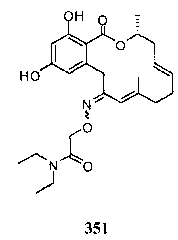
Смесь изомеров 1:1 в оксиме.1H-ЯМР (CDCl3, 400 МГц) δ 11,92 (ушир.с, 1Н), 11,83 (ушир.с, 1Н), 6,98 (д, J=2,4 Гц, 2H), 6,34-6,33 (м, 2H), 5,38-5,15 (м, 6H), 4,93 (д, J=14,4 Гц, 2H), 4,79-4,68 (м, 2H), 4,75 (д, J=14,4 Гц, 2H), 4,27 (д, J=14,4 Гц, 2H), 4,04 (д, J=14,4 Гц, 2H), 3,44-3,26 (м, 8H), 2,24-2,19 (м, 4H), 1,74-1,72 (м, 14Н), 1,36 (д, J=6,8 Гц, 6H), 1,34 (д, J=6,8 Гц, 6H), 1,27-1,21 (м, 6H), 1,14 (т, J=7,4 Гц, 6H). МСВР (MALDI-TOF) m/z [М+H]+ вычислено для C25H35N2O6: 459,2495; найдено: 459,2499.
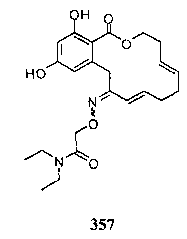
Смесь изомеров 1:1 в оксиме.1H-ЯМР (CDCl3, 400 МГц) δ 11,70 (ушир.с, 1Н), 11,69 (ушир.с, 1Н), 6,99 (ушир.с, 1Н), 6,72 (д, J=2,8 Гц, 1Н), 6,64 (д, J=16,4 Гц, 1Н), 6,32 (д, J=2,4 Гц, 1Н), 6,31 (д, J=2,4 Гц, 1Н), 6,28-6,17 (м, 2H), 5,91 (д, J=16 Гц, 1Н), 5,38-5,33 (м, 4H), 4,87 (с, 2H), 4,79 (с, 2H), 4,57-4,53 (м, 4H), 4,34 (с, 2H), 4,07 (с, 2H), 3,43-3,37 (м, 4H), 3,34-3,28 (кв, J=7,2 Гц, 4H), 2,53-2,48 (м, 4H), 2,16-1,97 (м, 8H), 1,29-1,24 (м, 12Н). МСВР (MALDI-TOF) m/z [М+H]+ вычислено для C23H31N2O6: 431,2182; найдено: 431,2186.
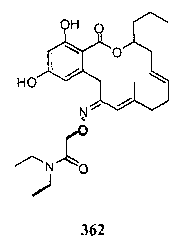
Смесь изомеров 7:1 в оксиме. Основной изомер E:1H-ЯМР (CDCl3, 400 МГц) δ 11,82 (ушир.с, 1Н), 7,75 (ушир.с, 1Н), 7.02 (д, J=2,4 Гц, 1Н), 6,34 (д, J=2,4 Гц, 1Н), 5,35-5,28 (м, 1Н), 5,20 (с, 1Н), 5,14-5,10 (м, 1Н), 4,94 (д, J=14,4 Гц, 1Н), 4,74 (д, J=14,4 Гц, 1Н), 4,31 (д, J=14,4 Гц, 1Н), 4,07 (д, J=14,4 Гц, 1Н), 3,44-3,28 (м, 4H), 2,70-2,63 (м, 1Н), 2,25-2,18 (м, 2H), 2,14-2,07 (м, 2H), 1,73-1,72 (м, 6H), 1,25-1,21 (м, 6H), 1,14 (т, J=7,2 Гц, 3H), 0,95 (т, J=7,2 Гц, 3H). МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C27H38NaN2O6: 509,2627; найдено: 509,2652.

Смесь изомеров 1:1 в оксиме.1H-ЯМР (CDCl3, 400 МГц) δ 11,79 (ушир.с, 1Н), 11,03 (ушир.с, 1Н), 6,61 (с, 1Н), 6,08 (с, 1Н), 5,42-5,28 (м, 6H), 4,79 (д, J=13,2 Гц, 2H), 4,74 (д, J=13,6 Гц, 2H), 4,39 (м, 2H), 4,27-4,23 (м, 3H), 3,61-3,54 (м, 4H), 3,51-3,45 (м, 4H), 2,53-2,47 (м, 2H), 2,33-2,20 (м, 4H), 2,06-1,91 (м, 8H), 1,70-1,58 (м, 12Н), 1,44-129 (м, 13Н), 0,95 (т, J=7,2 Гц, 6H). МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C27H37ClNaN2O6: 543,2237; найдено: 543,2263.
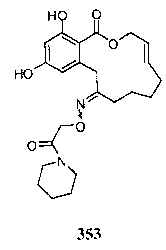
МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C23H30NaN2O6: 453,2001; найдено: 453,2010.
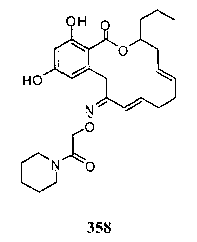
Смесь изомеров 1:1 в оксиме.1H-ЯМР (CDCl3, 400 МГц) δ 6,99 (ушир.с, 1Н), 6,68 (д, J=2,4 Гц, 1Н), 6,61 (д, J=16,8 Гц, 1Н), 6,32 (д, J=2,4 Гц, 1Н), 6,30 (д, J=2,4 Гц, 1Н), 6,25-6,10 (м, 2H), 5,89 (д, J=16,4 Гц, 1Н), 5,50-5,31 (м, 4H), 4,94 (д, J=14,4 Гц, 2H), 4,84-4,76 (м, 4H), 4,50 (д, J=15,2 Гц, 1Н), 4,44 (д, J=14,4 Гц, 1Н), 4,29 (д, J=14,4 Гц, 1Н), 4,21 (т, J=6,0 Гц, 1Н), 2,72-2,61 (м, 4H), 2,35-2,19 (м, 6H), 2,15-1,96 (м, 8H), 1,93-1,82 (м, 3H), 1,38-1,28 (м, 11Н), 0,96 (т, J=7,6 Гц, 3H), 0,92 (т, J=7,6 Гц, 3H). МСВР (MALDI-TOF) m/z [М+H]+ вычислено для C27H37N2O6: 485,2651; найдено: 485,2611.

МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C27H38NaN2O6: 509,2628; найдено: 509,2639.

Смесь изомеров 1:1 в оксиме.1H-ЯМР (CDCl3, 400 МГц) δ 6,61 (с, 1Н), 6,05 (с, 1Н), 5,41-5,26 (м, 6H), 4,80-4,75 (м, 3H), 4,58-4,47 (м, 4H), 4,30-4,17 (м, 3H), 4,21 (т, 2H, J=5,6 Гц), 4,05-4,01 (м, 2H), 3,61-3,54 (м, 4H), 3,49-3,42 (м, 4H), 2,46-2,40 (м, 2H), 2,24-2,20 (м, 3H), 2,07-1,90 (м, 8H), 1,34-1,28 (м, 15Н). МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C27H31NaN2O6: 501,1768; найдено: 501,1718.

Смесь изомеров 5:1 в оксиме. Основной изомер E:1H-ЯМР (CDCl3, 400 МГц) δ 11,85 (ушир.с, 1Н), 7,12 (д, J=2,4 Гц, 1Н), 6,34 (д, J=2,4 Гц, 1Н), 5,38-5,31 (м, 2H), 5,25 (с, 1Н), 5,23-5,11 (м, 2H), 4,96 (д, J=14,4 Гц, 1Н), 4,74 (д, J=14,4 Гц, 1Н), 4,34 (д, J=14 Гц, 1Н), 4,21 (т, J=6 Гц, 1Н), 4,10 (д, J=14 Гц, 1Н), 3,43-3,27 (м, 4H), 1,70 (с, 3H), 1,61-1,59 (м, 4H), 1,37-1,29 (м, 7H), 1,13 (т, J=7,2 Гц, 3H), 0,95 (т, J=7,2 Гц, 3H). МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C27H38NaN2O6: 509,2627; найдено: 509,2680.
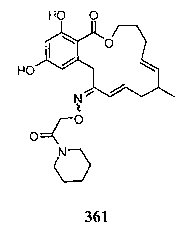
МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C26H34NaN2O6: 493,2314; найдено: 493,2331.

МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C28H37ClNaN2O6: 555,2238; найдено: 555,2242.

МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C25H31ClNaN2O6: 513,1768; найдено: 513,1780.

МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C26H33ClNaN2O6: 527,1925; найдено: 527,1939.
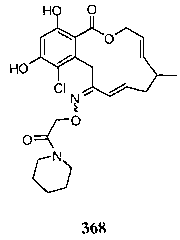
МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C24H29ClNaN2O6: 499,1612; найдено: 499,1626.
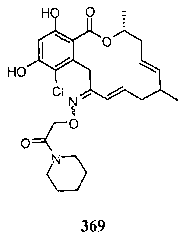
МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C26H33ClNaN2O6: 527,1925; найдено: 527,1932.

МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C25H32NaN2O6: 479,2158; найдено: 479,2174.

МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C26H34NaN2O6: 493,2315; найдено: 493,2319.
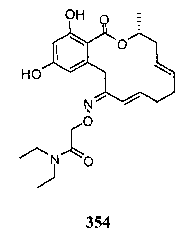
Смесь изомеров 4:1 в оксиме. Основной изомер E:1H-ЯМР (CDCl3, 400 МГц) δ 7,40 (д, J=2,4 Гц, 1Н), 6,31 (д, J=2,4 Гц, 1Н), 6,19-6,11 (м, 1Н), 5,89 (д, J=16 Гц, 1Н), 5,53-5,46 (м, 1Н), 5,41-5,32 (м, 1Н), 4,93 (д, J=14,8 Гц, 1Н), 4,81 (д, J=14,8 Гц, 1Н), 4,44 (д, J=14,8 Гц, 1Н), 4,28 (д, J=14,8 Гц, 1Н), 4,21 (т, J=5,6 Гц, 1Н), 3,44-3,29 (м, 2H), 2,35-2,20 (м, 2H), 2,13-2,01 (м, 2H), 1,45 (д, J=6,8 Гц, 3H), 1,37-1,28 (м, 4H), 1,14 (т, J=7,2 Гц, 3H), 0,92 (т, J=7,6 Гц, 3H). МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C24H32NaN2O6: 467,2158; найдено: 467,2147.
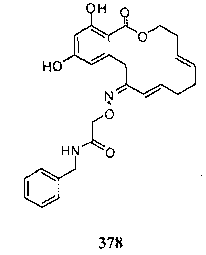
Смесь изомеров 1:1 в оксиме.1H-ЯМР (CDCl3, 400 МГц) δ 11,60 (ушир.с, 1Н), 11,42 (ушир.с, 1Н), 7,35-7,28 (м, 9H), 6,69-6,62 (м, 2H), 6,49 (д, J=16 Гц, 1Н), 6,36 (д, J=2,4 Гц, 1Н), 6,33 (д, J=2,4 Гц, 1Н), 6,32 (д, J=2,4 Гц, 1Н), 6,28-6,24 (м, 1Н), 6,23 (д, J=2,8 Гц, 1Н), 6,10 (дт, J=16, 7,2 Гц, 1Н), 5,73 (д, J=16 Гц, 1Н), 5,36-5,31 (м, 2H), 5,27-5,18 (м, 2H), 4,70 (с, 2H), 4,65 (с, 2H), 4,55-4,51 (м, 5H), 4,45 (т, J=5,3 Гц, 2H), 4,27 (с, 2H), 4,08 (с, 2H), 2,50-2,42 (м, 4H), 2,17-2,07 (м, 8H). МСВР (MALDI-TOF) m/z [М+H]+ вычислено для C26H29N2O6: 465,2025; найдено: 465,1981.

Смесь изомеров 1:1 в оксиме.1H-ЯМР (CDCl3, 400 МГц) δ 11,67 (ушир.с, 1Н), 11,65 (ушир.с, 1Н), 8.00 (ушир.с, 1Н), 7,77 (ушир.с, 1Н), 7,13 (ушир.с, 1Н), 6,63-6,59 (м, 2H), 6,32 (2д, J=2,8 Гц, 2H), 6,27-6,12 (м, 2H), 5,86 (д, J=16,4 Гц, 1Н), 5,37-5,33 (м, 4H), 4,95-4,72 (м, 4H), 4,57-4,51 (м, 4H), 4,34 (с, 2H), 4,10 (д, J=15,2 Гц, 1Н), 4,03 (д, J=15,2 Гц, 1Н), 3,58-3,48 (м, 2H), 3,20-3,09 (м, 2H), 2,77-2,69 (м, 2H), 2,53-2,45 (м, 4H), 2,17-2,05 (м, 8H), 1,71-1,32 (м, 12Н), 1,30-1,12 (м, 6H). МСВР (MALDI-TOF) m/z [М+H]+ вычислено для C25H33N2O6: 457,2338; найдено: 457,2332.

Смесь изомеров 1:1 в оксиме.1H-ЯМР (CDCl3, 400 МГц) δ 11,66 (ушир.с, 1Н), 11,64 (ушир.с, 1Н), 7,56 (ушир.с, 1Н), 7,36 (ушир.с, 1Н), 6,95 (д, J=2,8 Гц, 1Н), 6,59-6,54 (м, 2H), 6,33 (д, J=2,8 Гц, 1Н), 6,32 (д, J=2,8 Гц, 1Н), 6,28-6,13 (м, 2H), 5,84 (д, J=16,1 Гц, 1Н), 5,38-5,32 (м, 4H), 4,85 (с, 2H), 4,78 (с, 2H), 4,54 (т, J=5,2 Гц, 4H), 4,33 (с, 2H), 4,07 (с, 2H), 3,71-3,64 (м, 12Н), 3,52-3,48 (м, 4H), 2,50 (ушир.т, J=4,8 Гц, 4H), 2,17-2,07 (м, 8H). МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C23H28NaN2O7: 467,1794; найдено: 467,1765.
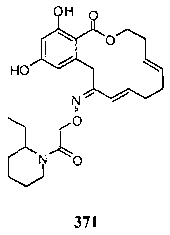
Смесь изомеров 1:1 в оксиме.1H-ЯМР (CDCl3, 400 МГц) δ 11,62 (ушир.с, 2H), 6,96 (д, J=2 Гц, 1Н), 6,58 (д, J=2,8 Гц, 1Н), 6,60 (д, J=2,8 Гц, 1Н), 6,32 (ушир.д, J=2,4 Гц, 2H), 6,24-6,10 (м, 2H), 5,81 (д, J=16 Гц, 1Н), 5,35-5,32 (м, 3H), 4,92-4,72 (м, 4H), 4,56-4,45 (м, 4H), 4,31 (ушир.с, 2H), 4,04 (ушир.с, 2H), 3,75-3,67 (м, 1Н), 3,59-3,51 (м, 1Н), 3,12-3,03 (м, 1Н), 2,64 (т, J=12,8 Гц, 1Н), 2,52-2,46 (м, 4H), 2,14-2,04 (м, 8H), 1,70-1,58 (м, 10Н). МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C26H34NaN2O6: 493,2314; найдено: 493,2332.

Смесь изомеров 1:1 в оксиме.1H-ЯМР (CDCl3, 400 МГц) δ 11,65 (ушир.с, 2H), 7,32-7,27 (м, 4H), 7,24-7,10 (м, 6H), 7.01 (д, J=2,4 Гц, 1Н), 6,64-6,59 (м, 2H), 6,34-6,33 (м, 2H), 6,28-6,18 (м, 2H), 5,85 (д, J=16 Гц, 1Н), 5,37-5,32 (м, 4H), 4,85 (с, 2H), 4,72-4,69 (м, 2H), 4,56-4,51 (м, 4H), 4,15 (д, J=15,2 Гц, 2H), 4,02 (д, J=15,2 Гц, 2H), 3,96-3,92 (м, 2H), 3,21-3,11 (м, 2H), 2,76-2,67 (м, 4H), 2,54-2,45 (м, 4H), 2,12-2,02 (м, 10Н), 1,90-1,87 (м, 4H), 1,67-1,58 (м, 4H). МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C30H34NaN2O6: 541,2314; найдено: 541,2314.
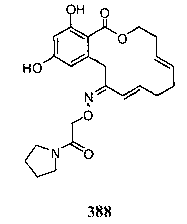
Смесь изомеров 1:1 в оксиме.1H-ЯМР (CDCl3, 400 МГц) δ 11,65 (ушир.с, 1Н), 11,64 (ушир.с, 1Н), 8,70 (ушир.с, 1Н), 8,27 (ушир.с, 1Н), 7,04 (д, J=2,4 Гц, 1Н), 6,64-6,60 (м, 2H), 6,26-6,11 (м, 2H), 6,32 (2д, J=2,6 Гц, 2H), 5,82 (д, J=16 Гц, 1Н), 5,36-5,32 (м, 4H), 4,76 (с, 2H), 4,70 (с, 2H), 4,53 (ушир.т, J=5,2 Гц, 4H), 4,33 (с, 2H), 4,05 (с, 2H), 3,51 (ушир.т, J=6,8 Гц, 4H), 3,44 (кв, J=7,2 Гц, 4H), 2,52-2,46 (м, 4H), 2,16-2,05 (м, 8H), 2,02-1,93 (м, 4H), 1,90-1,84 (м, 4H). МСВР (MALDI-TOF) m/z [М+H]+ вычислено для C23H29N2O6: 429,2025; найдено: 429,2003.
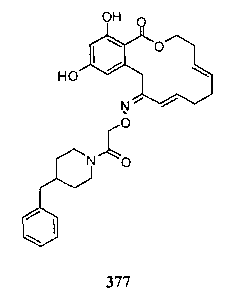
Смесь изомеров 1:1 в оксиме.1H-ЯМР (CDCl3, 400 МГц) δ 11,66 (ушир.с, 1Н), 11,64 (ушир.с, 1Н), 8,15 (ушир.с, 1Н), 7,86 (ушир.с, 1Н), 7,31-7,27 (м, 4H), 7,21-7,18 (м, 2H), 7,15-7,10 (м, 4H), 7,00 (ушир.с, 1Н), 6,60 (д, J=15,6 Гц, 1Н), 6,59 (д, J=2,4 Гц, 1Н), 6,32 (2д, J=2,4 Гц, 2H), 6,27-6,11 (м, 2H), 5,85 (д, J=16 Гц, 1Н), 5,36-5,32 (м, 4H), 4,84 (с, 2H), 4,77 (с, 2H), 4,59-4,48 (м, 4H), 4,33 (с, 2H), 4,11 (д, J=15,2 Гц, 1Н), 4,02 (д, J=15,6 Гц, 1Н), 3,78-3,71 (м, 2H), 3,01-2,92 (м, 2H), 2,59-2,47 (м, 8H), 2,12-2,07 (м, 8H), 1,82-1,68 (м, 6H), 1,36-1,30 (м, 8H). МСВР (MALDI-TOF) m/z [М+H]+ вычислено для C31Н37N2O6: 533,2651; найдено: 533,2625.
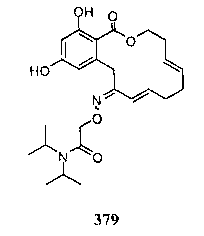
Смесь изомеров 1:1 в оксиме.1H-ЯМР (CDCl3, 400 МГц) δ 11,72 (ушир.с, 1Н), 11,71 (ушир.с, 1Н), 6,71 (д, J=2,4 Гц, 1Н), 6,67 (д, J=16,4 Гц, 1Н), 6,35 (2д, J=3 Гц, 2H), 6,31-6,18 (м, 2H), 5,93 (д, J=16,4 Гц, 1Н), 5,41-5,36 (м, 4H), 4,86 (с, 2H), 4,77 (с, 2H), 4,60-4,54 (м, 4H), 4,37 (с, 2H), 4,10 (с, 2H), 3,94-3,86 (м, 2H), 3,62-3,49 (м, 2H), 2,55-2,49 (м, 4H), 2,20-2,10 (м, 8H), 1,44-1,25 (м, 24Н). МСВР (MALDI-TOF) m/z [М+H]+ вычислено для C25H35N2O6: 459,2495; найдено: 459,2514.
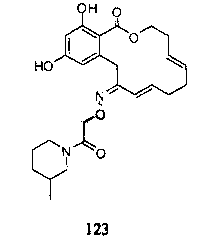
373
Смесь изомеров 1:1 в оксиме.1H-ЯМР (CDCl3, 400 МГц) δ 11,65 (ушир.с, 1Н), 11,64 (ушир.с, 1Н), 7,00 (д, J=2,4 Гц, 1Н), 6,61-6,57 (м, 2H), 6,33-6,32 (м, 2H), 6,25-6,10 (м, 2H), 5,82 (д, J=16 Гц, 1Н), 5,36-5,31 (м, 4H), 4,85 (с, 2H), 4,78 (с, 2H), 4,58-4,48 (м, 4H), 4,41-4,32 (м, 4H), 4,12-3,98 (м, 2H), 3,72-3,58 (м, 2H), 3,02-2,93 (м, 1Н), 2,72-2,62 (м, 2H), 2,53-2,45 (м, 4H), 2,35-2,28 (м, 1Н), 2,16-2,04 (м, 8H), 1,86-1,39 (м, 8H), 1,17-1,07 (м, 2H), 0,93-0,88 (м, 6H). МСВР (MALDI-TOF) m/z [М+H]+ вычислено для C25H33N2O6: 457,2338; найдено: 457,2380.
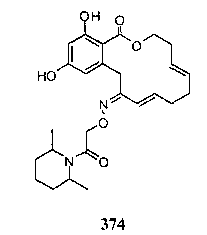
Смесь изомеров 1:1 в оксиме.1H-ЯМР (CDCl3, 400 МГц) δ 11,67 (ушир.с, 2H), 6,99 (с, 1Н), 6,68-6,63 (м, 2H), 6,32 (д, J=2,4 Гц, 1Н), 6,31 (д, J=2,8 Гц, 1Н), 6,27-6,14 (м, 2H), 5,90 (д, J=16 Гц, 1Н), 5,37-5,34 (м, 4H), 4,77 (с, 2H), 4,63-4,46 (м, 4H), 4,36 (ушир.с, 2H), 4,21 (т, J=6 Гц, 4H), 4,05-3,92 (м, 4H), 2,55-2,46 (м, 4H), 2,17-2,06 (м, 8H), 1,37-1,28 (м, 12Н), 0,93-0,86 (м, 12Н). МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C26H34NaN2O6: 493,2314; найдено: 493,2314.
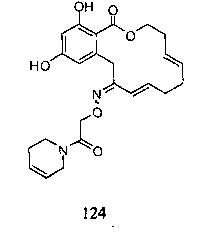
382
Смесь изомеров 2:1 в оксиме. Основной изомер E1H-ЯМР (CDCl3, 400 МГц) δ 11,62 (ушир.с, 1Н), 6,98 (м, 1Н), 6,57 (м, 2H), 6,32 (м, 2H), 6,18 (м, 2H), 5,82 (д, J=15,6 Гц, 1Н), 5,67 (м, 2H), 5,33 (м, 4H), 4,87 (д, J=13,6 Гц, 2H), 4,80 (д, J=10,8 Гц, 2H), 4,53 (м, 3H), 4,33 (с, 2H), 4,05 (ушир.с, 4H), 3,73 (м, 2H), 3,69 (кв, J=6 Гц, 2H), 3,52 (кв, J=5,2 Гц, 2H), 2,48 (м, 5H), 2,13 (м, 13Н). МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C24H28NaN2O6: 463,1845; найдено: 463,1870.
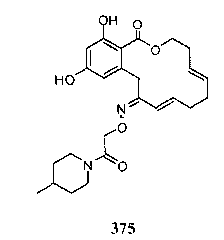
Смесь изомеров 1:1 в оксиме.1H-ЯМР (CDCl3, 400 МГц) δ 11,66 (ушир.с, 1Н), 11,64 (ушир.с, 1Н), 8,29 (ушир.с, 2H), 6,89 (д, J=2,8 Гц, 1Н), 6,59 (д, J=16 Гц, 1Н), 6,57 (д, J=2,4 Гц, 1Н), 6,33-6,32 (м, 2H), 6,24-6,09 (м, 2H), 5,79 (д, J=16 Гц, 1Н), 5,34-5,30 (м, 4H), 4,85 (с, 2H), 4,78 (с, 2H), 4,56-4,48 (м, 4H), 4,31 (с, 2H), 4,10 (д, J=15,6 Гц, 1Н), 4,05 (д, J=15,6 Гц, 1H), 3,80-3,71 (м, 2H), 3,06-2,96 (м, 2H), 2,61 (дт, J=12,8, 2,6 Гц, 2H), 2,52-2,46 (м, 4H), 2,16-2,05 (м, 8H), 1,71-1,58 (м, 6H), 1,17-1,05 (м, 4H), 0,94 (д, J=5,6 Гц, 3H), 0,93-0,94 (д, J=5,6 Гц, 3H). МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C25H32NaN2O6: 479,2158; найдено: 479,2182.

Смесь изомеров 1:1 в оксиме.1H-ЯМР (CDCl3, 400 МГц) δ 11,60 (ушир.с, 1Н), 11,47 (ушир.с, 1Н), 8,58 (ушир.с, 2H), 6,53 (д, J=16,4 Гц, 1Н), 6,50 (д, J=2,4 Гц, 1Н), 6,35 (д, J=2,4 Гц, 1Н), 6,34 (д, J=2,4 Гц, 1Н), 6,30 (д, J=2,4 Гц, 1Н), 6,31-6,27 (м, 2H), 6,14 (м, 1Н), 5,39-5,31 (м, 4H), 4,61 (с, 2H), 4,56-4,53 (м, 6H), 4,33 (с, 2H), 4,09 (с, 2H), 3,86-3,75 (м, 2H), 2,53-2,48 (м, 4H), 2,17-2,09 (м, 8H), 1,93-1,86 (м, 4H), 1,70-1,55 (м, 8H), 1,39-1,11 (м, 8H). МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C25H32NaN2O6: 479,2158; найдено: 479,2157.
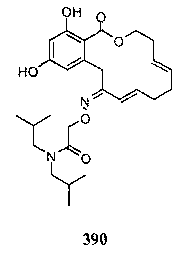
Смесь изомеров 1:1 в оксиме.1H-ЯМР (CDCl3, 400 МГц) δ 11,65 (ушир.с, 2H), 7,06 (д, J=2,4 Гц, 1Н), 6,62-6,57 (м, 2H), 6,33 (д, J=2,4 Гц, 2H), 6,21-6,11 (м, 2H), 5,81 (д, J=16,4 Гц, 1Н), 5,37-5,29 (м, 4H), 4,86 (с, 2H), 4,79 (с, 2H), 4,52 (ушир.т, J=5,2 Гц, 4H), 4,31 (с, 2H), 4,02 (с, 2H), 3,21 (м, 4H), 3,09 (дд, J=10,8, 8,0 Гц, 4H), 2,52-2,44 (м, 4H), 2,11-1,91 (м, 12Н), 0,95 (д, J=6,8 Гц, 6H), 0,93 (д, J=6,8 Гц, 6H), 0,88 (д, J=6,8 Гц, 6H), 0,86 (д, J=6,8 Гц, 6H). МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C27H38NaN2O6: 509,2627; найдено: 509,2626.
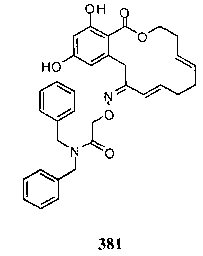
Смесь изомеров 1:1 в оксиме.1H-ЯМР (CDCl3, 400 МГц) δ 11,67 (ушир.с, 1Н), 11,66 (ушир.с, 1Н), 7,38-7,28 (м, 12Н), 7,22-7,14 (м, 8H), 6,94 (д, J=2,4 Гц, 1Н), 6,57-6,53 (м, 2H), 6,33 (ушир.д, J=2,4 Гц, 2H), 6,22-6,12 (м, 2H), 5,85 (д, J=16 Гц, 1Н), 5,35-5,32 (м, 4H), 4,93 (с, 2H), 4,86 (с, 2H), 4,62 (с, 2H), 4,60 (с, 2H), 4,53 (ушир.т, J=5,2 Гц, 4H), 4,46 (с, 2H), 4,43 (с, 2H), 4,30 (с, 2H), 4,07 (с, 2H), 3,52-3,46 (м, 4H), 2,16-2,07 (м, 8H). МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C33H34NaN2O6: 577,2314; найдено: 577,2278.
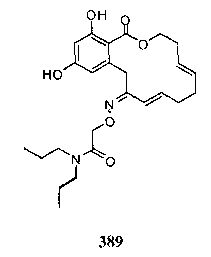
Смесь изомеров 1:1 в оксиме.1H-ЯМР (CDCl3, 400 МГц) δ 11,66 (ушир.с, 1Н), 11,65 (ушир.с, 1Н), 7.05 (д, J=2,4 Гц, 1Н), 6,62-6,55 (м, 2H), 6,32-6,29 (м, 2H), 6,23-6,11 (м, 2H), 5,82 (д, J=16 Гц, 1Н), 5,34-5,29 (м, 4H), 4,85 (с, 2H), 4,77 (с, 2H), 4,54 (ушир.т, J=5,2 Гц, 4H), 4,32 (с, 2H), 4,04 (с, 2H), 3,32-3,27 (м, 4H), 3,21-3,15 (м, 4H), 2,52-2,42 (м, 4H), 2,10-2,04 (м, 8H), 1,67-1,51 (м, 8H), 0,96-0,86 (м, 12Н). МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C25H34NaN2O6: 481,2314; найдено: 481,2307.

Смесь изомеров 1:1 в оксиме.1H-ЯМР (CDCl3, 400 МГц) δ 11,63 (ушир.с, 2H), 6,88 (д, J=2,0 Гц, 1Н), 6,55 (д, J=16,4 Гц, 1Н), 6,43 (д, J=2,4 Гц, 1Н), 6,32 (д, J=2,4 Гц, 1Н), 6,30 (д, J=2 Гц, 1Н), 6,28-6,13 (м, 2H), 5,84 (д, J=16,1 Гц, 1Н), 5,36-5,33 (м, 4H), 4,82 (с, 2H), 4,73 (с, 2H), 4,54 (т, J=5,5 Гц, 4H), 4,32 (с, 2H), 4,09 (с, 2H), 3,91-3,85 (м, 4H), 3,79-3,70 (м, 4H), 2,65-2,60 (м, 8H), 2,49 (ушир.т, J=5,1 Гц, 4H), 2,17-2,04 (м, 8H). МСВР (MALDI-TOF) m/z [М+H]+ вычислено для C23H28N2O6: 461,1746; найдено: 461,1765.
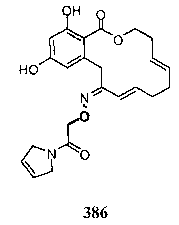
Смесь изомеров 1:1 в оксиме.1H-ЯМР (CDCl3, 400 МГц) δ 11,64 (ушир.с, 2H), 6,98 (д, J=2,3 Гц, 1Н), 6,61 (д, J=16,3 Гц, 1Н), 6,58 (д, J=2,4 Гц, 1Н), 6,31 (2д, J=2,2 Гц, 2H), 6,27-6,12 (м, 2H), 5,87-5,78 (м, 5H), 5,45-5,33 (м, 4H), 4,74 (с, 2H), 4,69 (с, 2H), 4,53 (т, J=5,3 Гц, 4H), 4,33 (с, 2H), 4,28-4,25 (м, 8H), 4,05 (с, 2H), 2,52-2,46 (м, 4H), 2,17-2,05 (м, 8H). МСВР (MALDI-TOF) m/z [М+H]+ вычислено для C23H27N2O6: 427,1869; найдено: 427,1902.

Смесь изомеров 1:1 в оксиме.1H-ЯМР (CDCl3, 400 МГц) δ 11,68 (ушир.с, 2H), 7,16 (д, J=2,8 Гц, 1Н), 6,63 (д, J=16,3 Гц, 1Н), 6,60 (д, J=2,0 Гц, 1Н), 6,31 (ушир.с, 2H), 6,26-6,13 (м, 2H), 5,85 (д, J=16,0 Гц, 1Н), 5,77-5,76 (м, 4H), 5,44-5,34 (м, 4H), 4,87-4,59 (м, 10Н), 4,48-4,43 (м, 2H), 4,33 (ушир.с, 2H), 4,19 (д, J=15,3 Гц, 1Н), 3,91 (д, J=15,3 Гц, 1Н), 2,54-2,44 (м, 4H), 2,19-2,05 (м, 8H), 1,36-1,30 (м, 12Н). МСВР (MALDI-TOF) m/z [М+H]+ вычислено для C25H31N2O6: 455,2182; найдено: 455,2195.

Смесь изомеров 1:1 в оксиме.1H-ЯМР (CDCl3, 400 МГц) δ 11,66 (ушир.с, 1Н), 11,63 (ушир.с, 1Н), 6,93 (д, J=2,4 Гц, 1Н), 6,57 (д, J=16,0 Гц, 1Н), 6,52 (д, J=2,4 Гц, 1Н), 6,32 (д, J=2,4 Гц, 1Н), 6,31 (д, J=2,4 Гц, 1Н), 6,29-6,12 (м, 2H), 5,84 (д, J=16,0 Гц, 1Н), 5,38-5,32 (м, 4H), 4,91-4,71 (м, 4H), 4,59-4,49 (м, 4H), 4,37-4,26 (м, 4H), 4,13-3,97 (м, 4H), 3,78-3,68 (м, 2H), 3,62-3,52 (м, 2H), 3,35-3,15 (м, 4H), 2,50 (ушир.т, J=5,2 Гц, 4H), 2,18-2,08 (м, 8H), 1,24-1,18 (м, 12Н). МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C25H32NaN2O7: 495,2107; найдено: 495,2067.
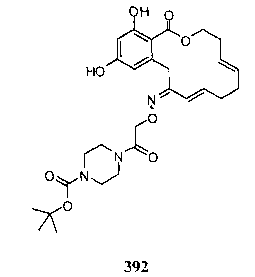
Смесь изомеров 1:1 в оксиме.1H-ЯМР (CDCl3, 400 МГц) δ 11,65 (ушир.с, 1Н), 11,64 (ушир.с, 1Н), 6,92 (д, J=2,0 Гц, 1Н), 6,57 (д, J=16,4 Гц, 1Н), 6,52 (д, J=2,4 Гц, 1Н), 6,32 (д, J=2,4 Гц, 1Н), 6,31 (д, J=2,4 Гц, 1Н), 6,28-6,13 (м, 2H), 5,84 (д, J=16 Гц, 1Н), 5,38-5,31 (м, 4H), 4,86 (с, 2H), 4,77 (с, 2H), 4,56-4,52 (м, 4H), 4,34 (с, 2H), 4,07 (с, 2H), 3,61-3,45 (м, 16Н), 2,54-2,46 (м, 4H), 2,16-2,05 (м, 8H), 1,47 (с, 18Н). МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C28H37NaN3O8: 566,2478; найдено: 566,2459.
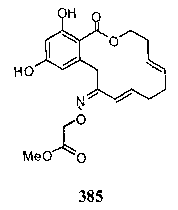
Смесь изомеров 1:1 в оксиме.1H-ЯМР (CDCl3, 400 МГц) δ 11,70 (ушир.с, 1Н), 11,68 (ушир.с, 1Н), 6,84 (д, J=2,4 Гц, 1Н), 6,61 (д, J=16,4 Гц, 1Н), 6,53 (д, J=2,4 Гц, 1Н), 6,34 (д, J=2,4 Гц, 1Н), 6,32 (д, J=2,4 Гц, 1Н), 6,28-6,13 (м, 2H), 5,86 (д, J=16,4 Гц, 1Н), 5,38-5,33 (м, 4H), 4,75 (с, 2H), 4,68 (с, 2H), 4,57-4,54 (м, 4H), 4,36 (с, 2H), 4,08 (с, 2H), 3,79 (2с, 6H), 2,54-2,48 (м, 4H), 2,17-2,04 (м, 8H).

Смесь изомеров 1:1 в оксиме.1H-ЯМР (CDCl3, 400 МГц) δ 6,94 (д, J=2,4 Гц, 1Н), 6,52 (д, J=16,0 Гц, 1Н), 6,34 (д, J=2,8 Гц, 1Н), 6,32 (д, J=2,0 Гц, 1Н), 6,29 (д, J=2,4 Гц, 1Н), 6,25-6,12 (м, 2H), 5,86 (д, J=16,0 Гц, 1Н), 5,38-5,32 (м, 4H), 4,85 (с, 2H), 4,71 (с, 2H), 4,57-4,52 (м, 4H), 4,35 (с, 2H), 4,14 (с, 2H), 3,73-3,58 (м, 8H), 3,02-2,87 (м, 8H), 2,54-2,48 (м, 4H), 2,14-2,09 (м, 8H). МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C23H29NaN3O6: 466,1954; найдено: 466,1938.

Смесь изомеров 1:1 в оксиме.1H-ЯМР (CDCl3, 400 МГц) δ 11,94 (ушир.с, 1Н), 11,80 (ушир.с, 1Н), 6,80 (д, J=2,4 Гц, 2H), 6,35 (д, J=2,4 Гц, 2H), 5,45-5,09 (м, 6H), 4,93 (д, J=14,4 Гц, 2H), 4,82-4,68 (м, 2H), 4,76 (д, J=14,4 Гц, 2H), 4,28 (д, J=14,8 Гц, 2H), 4,06 (д, J=14,4 Гц, 2H), 3,63-3,33 (м, 8H), 2,34-1,96 (м, 10Н), 1,70-1,55 (м, 12Н), 1,45-1,29 (м, 10Н), 1,75 (с, 3H), 1,25 (с, 3H), 0,94 (т, J=7,2 Гц, 6H). МСВР (MALDI-TOF) m/z [М+Na]+ вычислено для C28H38NaN2O6: 521,2627; найдено: 521,2630.

Смесь изомеров 1:1 в оксиме.1H-ЯМР (CDCl3, 400 МГц) δ 11,92 (ушир.с, 1Н), 11,84 (ушир.с, 1Н), 7,08-7,05 (м, 2H), 6,35-6,33 (м, 2H), 5,50-5,20 (м, 6H), 4,87 (с, 2H), 4,73 (с, 2H), 4,44-4,35 (м, 4H), 3,92 (с, 2H), 3,60-3,49 (м, 4H), 3,44-3,33 (м, 4H), 2,47-2,38 (м, 4H), 2,21-1,99 (м, 8H), 1,81-1,76 (м, 6H), 1,70-1,62 (м, 14Н). МСВР (MALDI-TOF) m/z [М+H]+ вычислено для C25H33N2O6: 457,2338; найдено: 457,2339.
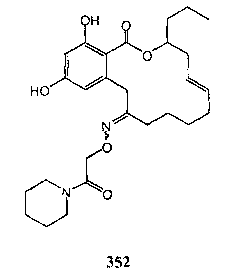
Смесь изомеров 1:1 в оксиме.1H-ЯМР (CDCl3, 400 МГц) δ 11,61 (ушир.с, 1Н), 11,57 (ушир.с, 1Н), 7,86 (ушир.с, 1Н), 7,64 (ушир.с, 1Н), 7,00 (д, J=2,4 Гц, 1Н), 6,51 (д, J=2,4 Гц, 1Н), 6,34 (ушир.д, J=2,0 Гц, 2H), 5,46-5,32 (м, 4H), 5,28-5,22 (м, 2H), 4,90 (д, J=14,8 Гц, 1Н), 4,83 (д, J=14,4 Гц, 1Н), 4,72 (д, J=14,4 Гц, 1Н), 4,71 (д, J=14,8 Гц, 1Н), 4,35 (д, J=16,0 Гц, 1Н), 4,25-4,17 (м, 3H), 4,09 (д, J=15,2 Гц, 1Н), 3,62-3,51 (м, 4H), 3,43-3,38 (м, 4H), 2,67-2,61 (м, 2H), 2,35-2,28 (м, 2H), 2,06-1,95 (м, 4H), 1,90-1,78 (м, 6H), 1,68-1,58 (м, 14Н), 1,44-1,31 (м, 11Н), 0,94 (м, 6H). МСВР (MALDI-TOF) m/z [М+H]+ вычислено для C27H39N2O6: 487,2808; найдено: 487,2806.
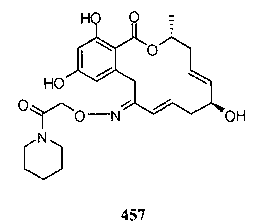
1H (E-изомер, MeOD, 400 МГц, 25°C) δ 6,26 (д, J=2,4 Гц, 1Н); 6,24 (д, J=2,4 Гц, 1Н); 6,05 (д, J=16,4 Гц, 1Н); 5,86-5,93 (м, 1Н); 5,60-5,67 (м, 1Н); 5,44-5,50 (дт, 1Н); 5,20-5,31 (м, 1Н); 4,88 (дд, 2H); 4,44 (д, 1Н); 3,95-4,01 (м, 1Н); 3,53-3,67 (м, 4H); 3,45 (д, 1Н); 2,58 (дд, 1Н); 2,40-2,48 (м, 2H); 2,20 (дд, 1Н); 1,64-1,76 (м, 6H); 1,48 (д, 3H).13C (MeOD, 100 МГц, 25°C) δ 170,4, 169,6, 169,3 (Ч2), 161,6 (Ч2), 159,5, 159,4, 156,7, 140,7, 139,8, 139,4, 136,9, 136,8, 135,8, 129,4, 129,3, 127,8, 121,1, 108,3, 108,1, 102,2, 102,1, 93,4, 73,8, 73,7, 72,8, 72,7, 72,6, 72,4, 72,3, 47,3, 47,2, 47,0, 44,6, 44,2, 44,1, 41,5, 41,0, 40,4, 40,1, 35,8, 29,7, 27,4, 27,3, 26,7, 26,6, 25,4, 24,4, 20,4, 20,2.
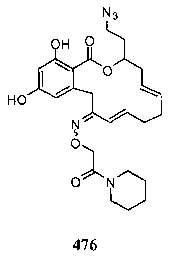
МСВР (MALDI-TOF) m/z [М+H]+ вычислено для C26H34N5O6: 512,2431; найдено: 512,2406.
ПРИМЕР 6: Получение гидроксизамещенных макроциклов
Получение соединений изобретения, которые содержат гидроксизаместители на макроцикле, можно осуществить из амидов Вейнреба, замещенных защищенной гидроксигруппой, или окислением конечного макроцикла, как изображено на схеме 9 выше. Макроциклы, содержащие гидроксизаместители, могут быть получены с помощью реагентов, которые являются реакционноспособными с гидроксигруппами, для получения макроциклов, замещенных различными группами на кольце макроцикла. Использование ортогональных защитных групп на прекурсорах амида Вейнреба обеспечивает селективное высвобождение и реакцию гидроксигрупп макроцикла.
В одном неограничивающем варианте осуществления изобретения макроциклы, содержащие гидроксизаместители, могут быть алкилированы электрофилами для получения макроциклов, замещенных различными группами на макроциклическом кольце.
Снятие защитных групп с гидроксигруппы

Раствор полностью защищенного соединения (140 мг, 0,2 ммоль) в ТГФ (3 мл) обрабатывали раствором TBAF в ТГФ (0,3 мл, 1 М в ТГФ, 1,5 экв.) при 0єC. Реакцию нагревали до 23єC и в течение еще 3 часов. Реакцию экстрагировали из насыщенного раствора NH4Cl этилацетатом (10 млЧ3), промывали солевым раствором (15 мл), высушивали над безводным Na2SO4 и концентрировали. Колоночная флеш-хроматография (ЭА в качестве элюента) давала желаемое соединение (104 мг) с выходом 88%.
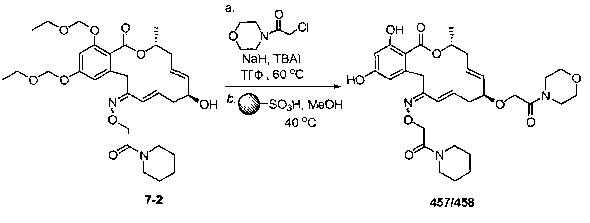
Взаимодействие с α-галогенокарбонильными группами
К раствору свободного спирта (50 мг, 0,085 ммоль) в ТГФ (0,6 мл) при 0єC в атмосфере азота добавляли NaH (20 мг, 0,5 ммоль, 5,8 экв.), и реакцию продолжали перемешивать в течение получаса. Затем последовательно добавляли Bu4NI (10 мг, 0,027 ммоль, 0,3 экв.) и хлорид (79 мг, 0,51 ммоль, 6,0 экв.) при той же температуре. Реакцию медленно нагревали до 60єC в течение ночи. Смесь экстрагировали из насыщенного раствора NH4Cl этилацетатом, и объединяли органические фазы, промывали солевым раствором, высушивали над безводным Na2SO4 и концентрировали. С помощью флеш-хроматографии (ПЭ/ЭА, 1/2, ЭА, затем ЭА/MeOH, 20:1) получали желаемое соединение (36 мг). Раствор соединения, предварительно полученный (36 мг, 0,05 ммоль) в MeOH (5 мл), обрабатывали смолой сульфоновой кислоты (83 мг, 3 ммоль/г, 5,0 экв.) при 40єC. После перемешивания в течение 2 часов, реакцию разбавляли CH2Cl2 (5 мл), отфильтровывали, промывали MeOH и CH2Cl2. Фильтрат концентрировали и подвергали действию колонки с обращенной фазой (CH3CN/H2O, 10%, 20%, 30%) для получения желаемого соединения (19 мг). МСВР (MALDI-TOF) m/z [М+H]+ вычислено для C31H41N3O9: 600,2921; найдено: 600,2919.
Взаимодействие с алкилгалогенидами и образование азидозамещенных макроциклов
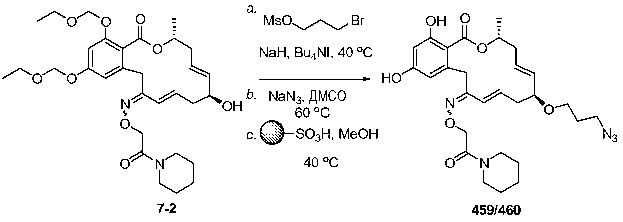
К раствору свободного спирта (20 мг, 0,034 ммоль) в ТГФ (0,5 мл) при 0єC в атмосфере азота добавляли NaH (9,8 мг, 0,24 ммоль, 7,2 экв.), и реакцию продолжали перемешивать еще в течение получаса. Затем последовательно добавляли Bu4NI (13 мг, 0,038 ммоль, 1,1 экв.) и бромид (35 мг, 0,16 ммоль, 4,7 экв.) при той же температуре. Реакцию медленно нагревали до 23єC в течение 4 часов. Смесь экстрагировали из насыщенного раствора NH4Cl этилацетатом, и объединяли органические фазы, промывали солевым раствором, высушивали над безводным Na2SO4 и концентрировали. Полученный осадок использовали на следующей стадии без дальнейшей очистки. К раствору неочищенной смеси, полученной предварительно в ДМСО (0,8 мл), добавляли NaN3 (35 мг) при 60єC и перемешивали в течение 2 часов. Реакцию экстрагировали из насыщенного раствора NH4Cl этилацетатом и объединяли органические фазы, промывали солевым раствором, высушивали над безводным Na2SO4 и концентрировали. Осадок подвергали флеш-хроматографии (ПЭ/ЭA, 1/1) с получением желаемого соединения (4 мг). Раствор этого соединения (4 мг, 0,006 ммоль) в MeOH (1 мл) обрабатывали смолой сульфоновой кислоты (20 мг, 3 ммоль/г, 10,0 экв.) при 40єC. После перемешивания в течение 4 часов, реакцию разбавляли CH2Cl2 (2 мл), отфильтровывали, промывали MeOH и CH2Cl2. Фильтрат концентрировали, и препаративная ТСХ (Гекс/ЭА, 1/2) давала желаемое соединение (точка 1, 4,5 мг, точка 2, 1,3 мг). МСВР (MALDI-TOF) m/z [М+H]+ вычислено для C28H38N5O7: 556,2771; найдено: 556,2745.
Аминозамещенные макроциклы и производные

К раствору азида (30 мг, 0,044) в ТГФ/H2О (0,9/0,1 мл) добавляли трифенилфосфин (23 мг, 0,088 ммоль, 2 экв.) при 40єC, и реакцию перемешивали в течение 1 дня. После испарения для избавления от растворителя осадок подвергали флеш-хроматографии (ПЭ/ЭA, 1/1, затем MeOH/NEt3, 20/1) для получения желаемого амина. К раствору амина (8 мг, 0,012 ммоль) в ДМФА (2 мл) последовательно добавляли 2,6-лутидин (5 капель) и Ac2O при 0єC в атмосфере азота, и реакцию нагревали до 23єC и продолжали перемешивать в течение 1 часа. Смесь экстрагировали из насыщенного раствора NH4Cl этилацетатом, и объединяли органические фазы, промывали солевым раствором, высушивали над безводным Na2SO4 и концентрировали. Полученный осадок использовали на следующей стадии без дальнейшей очистки. Раствор неочищенного соединения, полученного в MeOH (1 мл), обрабатывали смолой сульфоновой кислоты (30 мг, 3 ммоль/г) при 40єC. После перемешивания в течение 1 часа, реакцию отфильтровывали, промывали MeOH и CH2Cl2. Фильтрат концентрировали, и препаративная ТСХ (ЭA/MeOH, 10/1) давала желаемое соединение (1,9 мг). МСВР (MALDI-TOF) m/z [М+H]+ вычислено для C30H42N3O8: 572,2972; найдено: 572,2940.
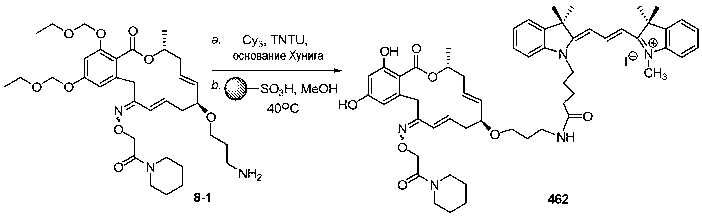
К раствору амина (11 мг, 0,017 ммоль) в ДМФА (1 мл) последовательно добавляли TNTU (10 мг, 1,35 экв.), основание Хунига (20 мкл, 3,0 экв.) и флуорофор (15 мг, 1,5 экв.) при 0єC в атмосфере азота, и реакцию нагревали до 23єC и продолжали перемешивать в течение 1 часа. Реакцию концентрировали, и осадок подвергали флеш-хроматографии (ПЭ/ЭA, 1/2, затем CH2Cl2/MeOH, 10/1) с получением защищенного соединения. Раствор Cy3-меченого защищенного соединения в MeOH (2 мл) обрабатывали смолой сульфоновой кислоты (30 мг, 3 ммоль/г) при 40єC. После перемешивания в течение 2 часов, реакцию отфильтровывали, промывали MeOH и ДХМ. Фильтрат концентрировали, и препаративная ТСХ (CH2Cl2/MeOH, 10/1) давала желаемое со снятой защитой Cy3-меченое соединение. МС(ES) m/z [М]+ вычислено для C57H72N5O8: 954,54; найдено: 954,53.
ПРИМЕР 7: Альтернативный синтез гидроксизамещенных макроциклов
В дополнение к использованию гидроксизамещенных амидов Вейнреба для получения гидроксизамещенных макроциклов гидроксигруппы можно вводить в макроцикл с помощью мягкого аллильного окисления соединений, как изображено на схеме 9 и описано ниже.
К раствору повторно защищенного макроцикла (100 мг, 0,17 ммоль) в EtOH (1 мл) добавляли диоксид селена (56 мг, 0,51 ммоль, 3,0 экв.). Реакцию подвергали микроволновому взаимодействию при 110єC в течение 2 часов. Затем смесь отфильтровывали, и фильтрат концентрировали, флеш-хроматография (ПЭ/ЭA, 1/1, 1/2, 1/4) давала желаемое соединение в качестве смеси изомеров (70 мг). К раствору предварительно полученной смеси (15 мг, 0,025 ммоль) в ДМФА (1,5 мл) при 0єC в атмосфере азота добавляли NaH (6 мг, 0,15 ммоль, 9,0 экв.), и реакцию продолжали перемешивать еще в течение получаса. Затем последовательно добавляли Bu4NI (10 мг, 0,027 ммоль, 1,1 экв.) и аллилхлорид (50 мкл, 20 экв.) при той же температуре. Реакцию нагревали до 23°C и перемешивали в течение 1 часа. Смесь экстрагировали из насыщенного раствора NH4Cl и этилацетата, и органические фазы объединяли, промывали солевым раствором, высушивали над безводным Na2SO4 и концентрировали. Флеш- хроматография (ПЭ/ЭA, 3/1) обеспечивала желаемое соединение (6 мг). Раствор аллилированного спирта (6 мг, 0,009 ммоль) в MeOH (1 мл) обрабатывали смолой сульфоновой кислоты (20 мг, 3 ммоль/г, 6,7 экв.) при 40єC. После перемешивания в течение 2 часов, реакцию разбавляли CH2Cl2 (3 мл), отфильтровывали, промывали MeOH и CH2Cl2. Фильтрат концентрировали и подвергали препаративной ТСХ (Гекс/ЭА, 1/2) с получением желаемого соединения.
ПРИМЕР 8: Дополнительные производные азида
Макроцикл, содержащий азид, может быть изменен для получения аминозамещенных соединений и их производных, подобно примеру 6 выше.

К раствору аналога азида (280 мг, 0,424 ммоль, 1 экв.) в ТГФ/H2О (9/1) смеси (42 мл) добавляли PPh3 (333,6 мг, 1,272 ммоль, 3 экв.). Полученную смесь перемешивали в течение ночи при 40єC. Затем раствор испаряли досуха без любого смешивания. Неочищенный продукт очищали с помощью хроматографии на силикагеле (CH2Cl2/MeOH=20/1) для получения соответствующего амина в качестве белого твердого вещества (232,6 мг, 0,366 ммоль, 86%). МСВР (MALDI-TOF) m/z [М+H]+ вычислено для C32H47ClN3O8: 636,3052; найдено: 636,3071.

Раствор TNTU (8,52 мг, 23,3 мкмоль, 1,35 экв.), DIPEA (8,6 мкл, 51,9 мкмоль, 3 экв.) и Cy3 (14,8 мг, 25,9 мкмоль, 1,5 экв.) в сухом NMP (0,3 мл) встряхивали 45 минут при комнатной температуре. Затем добавляли преактивированную кислоту к раствору предыдущего амина (11 мг, 17,3 ммоль, 1 экв.) в 0,3 мл NMP. После 12 часов реакционную смесь разбавляли AcOEt, промывали водой (2 мл), KOH 2 н. (3 мл), высушивали над Na2SO4 и испаряли досуха. Неочищенный продукт очищали с помощью хроматографии с силикагелем (CH2Cl2/MeOH=8/1) для получения соответствующего Cy3-меченого соединения в качестве розового твердого вещества (20 мг, количественный). MС(ES) m/z [М]+ вычислено для C61Н79ClN5O9: 1061,56; найдено: 1061,25.
ПРИМЕР 9: Биологическая активность
Соединения изобретения оценивали на цитотоксичность на HCC1954 и SK-BR-3 опухолевых клетках. Соединения, которые показали значительную цитотоксичность, далее исследовали на их способность вызывать деградацию известных белков-клиентов HSP90, таких как ErbB2 в SK-BR3. Таким образом, после 18-часовой обработки соединениями получали клеточные белковые лизаты, нормализовали концентрации белка и количественно определяли концентрацию ErbB2 с помощью Вестерн-блоттинга (C. Chavany et al. J. Biol. Chem. 271:4974-4977(1996)). Несколько соединений из библиотеки были более эффективны, чем радицикол и 17-AAG в сокращении концентрации ErbB2. Например, соединения 13a, 13b и 13c в форме изомера E-оксима были значительно более эффективны и чем радицикол, и чем 17-AAG.
Ряд соединений изобретения проверяли на аффинность к HSP90α (см. Kim et al., J. Biomol. Screen., 2004, 9, 375), Her-2 (HSP90 клиент), разрушение (см. Xu et al., J. Biol. Chem., 2001, 276, 3702), и цитотоксичность в отношении SKBr3 и HCC1954, двух линий клеток рака груди, которые сверхэкспрессируют Her-2. Результаты аффинности к HSP90a, Her-2, деградации и цитотоксичности показаны в таблице 3.
Основываясь на данных in vitro, показанных в таблице 3, соединение 13a далее оценивали in vivo. Обработка мышей CB17/SCID соединением 13a при дозе 100 мг/кг в течение пяти последовательных дней хорошо проходила с минимальной наблюдаемой потерей массы. Для исследования in vivo эффективности соединения 13a, использовали ксенотрансплантат, имеющий ВТ-474 (клеточная линия опухоли груди), поскольку было показано, что эта линия клеток реагирует на ингибиторы HSP90 на животных моделях (Basso et al., Oncogene 2002, 21, 1159). Основываясь на клеточной активности соединения 13a, исследовали два режима 100 мг через день (q2d) или через четыре дня (q4d) в течение 28 дней. Обработка с помощью соединения 13a привела к дозозависимому ингибированию роста опухоли с 18% сокращением объема опухоли, используя режим q2d. Результаты показаны на фиг.1. Ни режим q2d, ни q4d не привели к значительной потере массы, которая показана на фиг.2. Гистологическое исследование опухолей, выделенных из животных, получающих или вспомогательное средство (ДМСО), или лекарственное средство в течение 28 дней после режима q2d, показало сильную потерю насыщенности клетками в опухолях, полученных из животных, обработанных лекарственным средством. Ядра оставшихся клеток равномерно конденсировали, предполагая возникновение массивного апоптоза (см. фиг.4, верхние рисунки). Это было подтверждено высокой степенью ядерного TUNEL окрашивания, обнаруженного в опухолях, удаленных у животных, обработанных лекарственным средством, которая показана на фиг.4, нижние рисунки. Эти данные показывают, что регресс опухоли у животных, которых лечат в течение 28 дней согласно режиму q2d, может быть более серьезным, чем оцененный с помощью измерений объем опухоли, так как немногие или никакие жизнеспособные клетки не могут быть идентифицированы в конце периода лечения.
Описание и примеры, представленные в настоящей заявке, просто иллюстративны и не ограчивают изобретение. Многочисленные изменения, преобразования и производные этих соединений, методик и применений будут проводиться специалистами в данной области техники и рассмотрены в рамках изобретения.
Реферат
Изобретение относится к новым макроциклическим соединениям формулы I, I' или их таутомеру, фармацевтически приемлемой соли, сольвату или сложному эфиру, в которой: X представляет собой O или NR; Y представляет собой -O-(СН)COOR или -O-(СН)CON(R), в которой группы, связанные с атомом азота, могут находиться в Z- или E-конфигурации; Rи Rпредставляют собой независимо водород или галоген; R, R, R, R, R, R, Rи Rпредставляют собой независимо водород, алкил, OR, -O(СН)C(O)(СН)N(R), -O(СН)N(R)C(O)(СН)OR, -(СН)Nили -O(СН)N; и каждый R представляет собой независимо R, водород, алкил, алкиламино, диалкиламино, алкоксикарбонил, фенил или защитную группу; или два R на одном и том же азоте взяты вместе с азотом для получения 5-6-членного гетероциклического или гетероарильного кольца; в которой, где группа содержит более одного заместителя R; в которой R необязательно замещен и каждый R может быть одинаковым или различным, где защитная группа выбрана из этоксиметила, метоксиметила, трет-бутилдиметилсилила(ТВS), фенилметилсилила, триметилсилила(ТМS), 2-триметилсилилэтоксиметила(SEM), 2-триметилсилилэтила, бензила и замещенного бензила; Rпредставляет собой группу, в которой Z представляет собой неорганический или органический противоион, выбранный из галогена, -O-алкила, толуолсульфоната, метилсульфоната, сульфоната, фосфата, формиата или карбоксилата; n представляет собой 0, 1 или 2; m и p представляют собой независимо 0, 1 или 2; и пунктирные линии обозначают или одинарную, или двойную связь, где необходимые условия валентности соблюдают с помощью дополнительных атомов водорода; и в которой в формуле I′, когда n представляет собой 1 и X представляет собой O и двойная связь присутствует межд�
Формула

в которой:
X представляет собой O или NR;
Y представляет собой -O-(CH2)mCOOR или -O-(CH2)mCON(R)2, в которой группы, связанные с атомом азота, могут находиться в Z- или E-конфигурации;
R1 и R2 представляют собой независимо водород или галоген;
R3, R4, R5, R6, R7, R8, R9 и R10 представляют собой независимо водород, алкил, OR, -O(CH2)mC(O)(CH2)pN(R)2, -O(CH2)mN(R)C(O)(CH2)pOR, -(CH2)mN3 или -O(CH2)mN3; и
каждый R представляет собой независимо R11, водород, алкил, алкиламино, диалкиламино, алкоксикарбонил, фенил или защитную группу; или два R на одном и том же азоте взяты вместе с азотом для получения 5-6-членного гетероциклического или гетероарильного кольца; в которой, где группа содержит более одного заместителя R; в которой R необязательно замещен и каждый R может быть одинаковым или различным; где защитная группа выбрана из этоксиметила, метоксиметила, трет-бутилдиметилсилила (TBS), фенилдиметилсилила, триметилсилила (TMS), 2-триметилсилилэтоксиметила (SEM), 2-триметилсилилэтила; бензила и замещенного бензила;
R11 представляет собой группу:
n представляет собой 0, 1 или 2;
m и p представляют собой независимо 0, 1 или 2; и пунктирные линии обозначают или одинарную, или двойную связь, где необходимые условия валентности соблюдают с помощью дополнительных атомов водорода; и
в которой в формуле I′, когда n представляет собой 1 и X представляет собой O и двойная связь присутствует между атомами углерода, имеющими R9 и R10, тогда, по меньшей мере, один из R5, R6, R7, R8, R9 или R10 не является водородом; и
в которой в формуле I′, когда n представляет собой 1 и X представляет собой O и связь между атомами углерода, имеющими R9 и R10, представляет собой одинарную связь, тогда, по меньшей мере, один из R5, R6, R7 или R8 не является водородом.

в которой в формуле II′, когда X представляет собой O, тогда, по меньшей мере, один из R5, R6, R7, R8, R9 или R10 не является водородом.
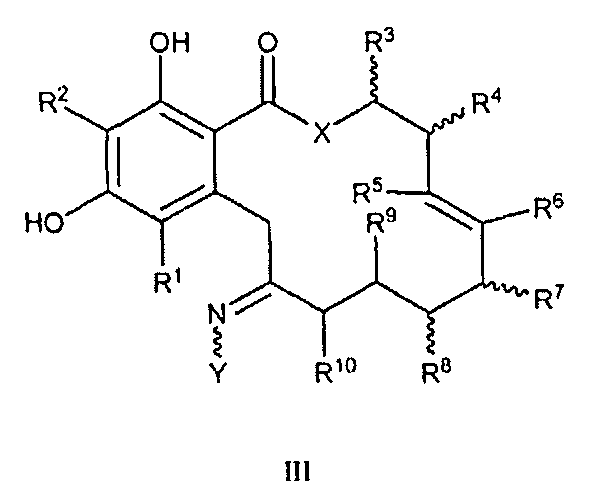
в которой в формуле III′, по меньшей мере, один из R5, R6, R7 или R8 не является водородом.
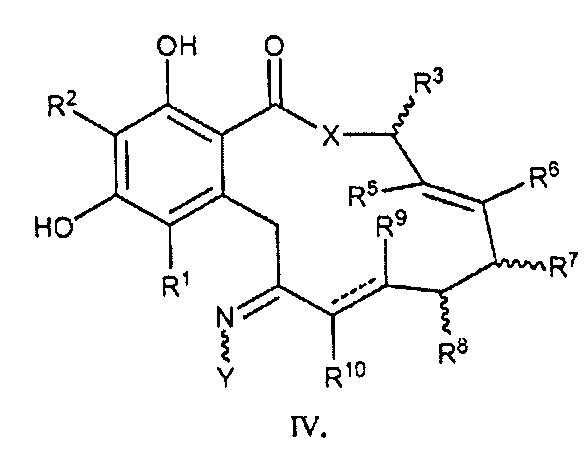
где R1, R2, R3, R5, R6, R7, R8, R9, R10, X и Y определены в п.1.
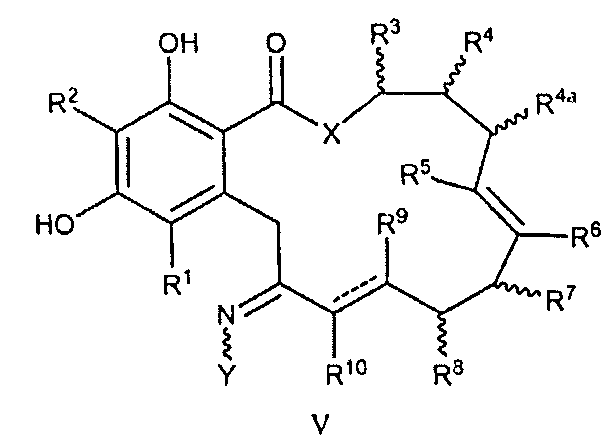
в которой R4a представляет собой водород, алкил, OR, -O(CH2)mC(O)(CH2)pN(R)2 или -O(СН2)mN(R)C(О)(CH2)pOR.

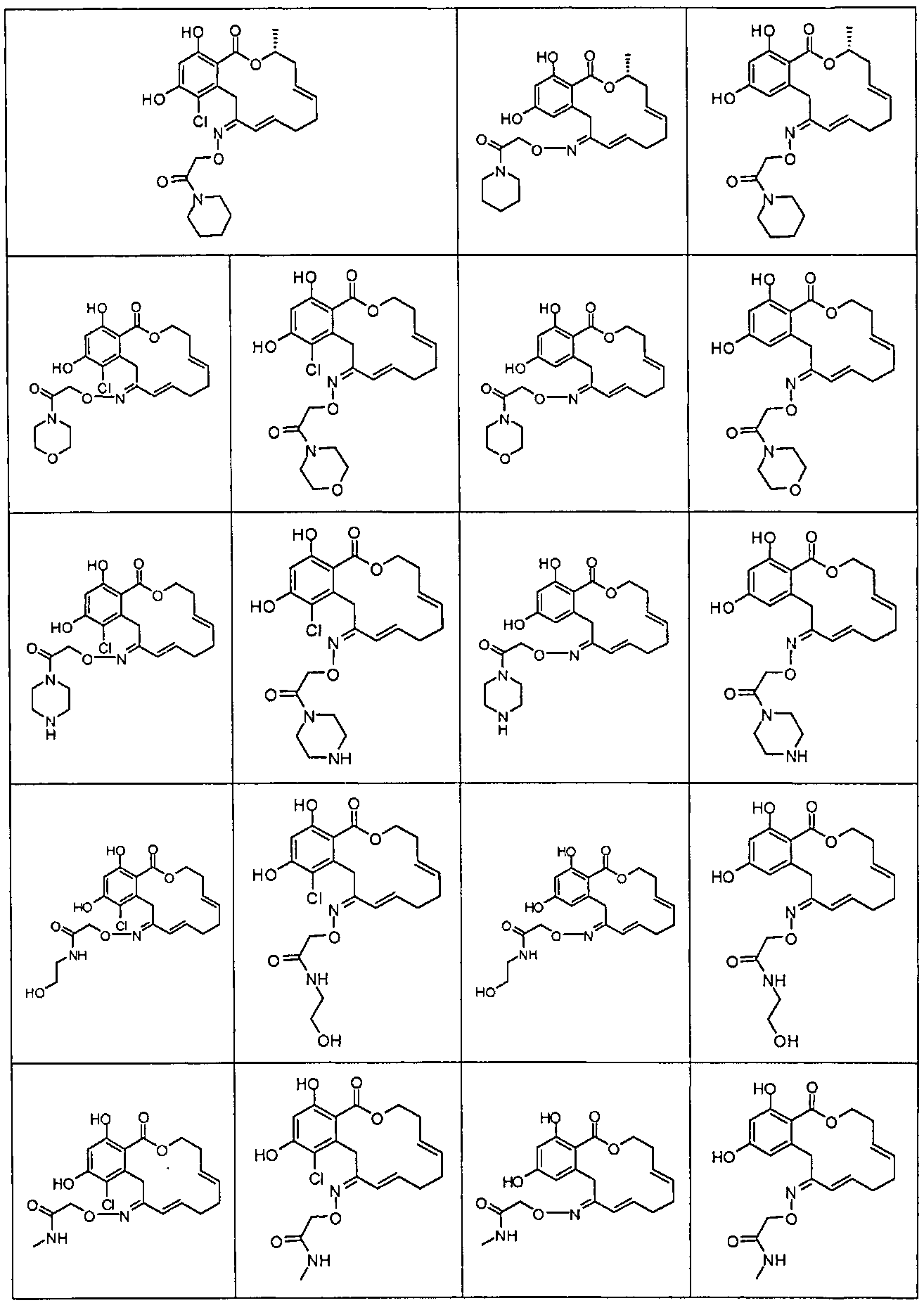

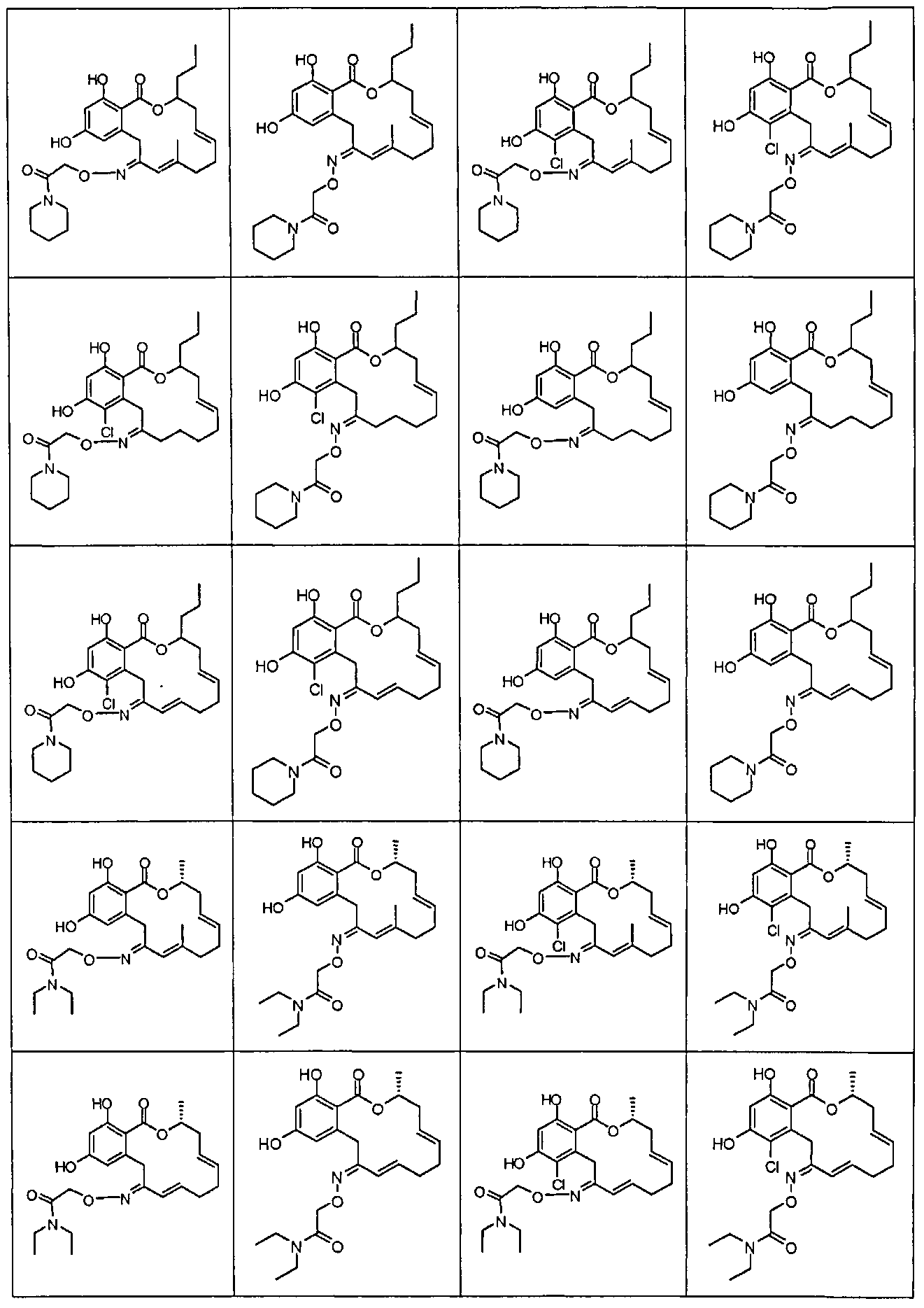
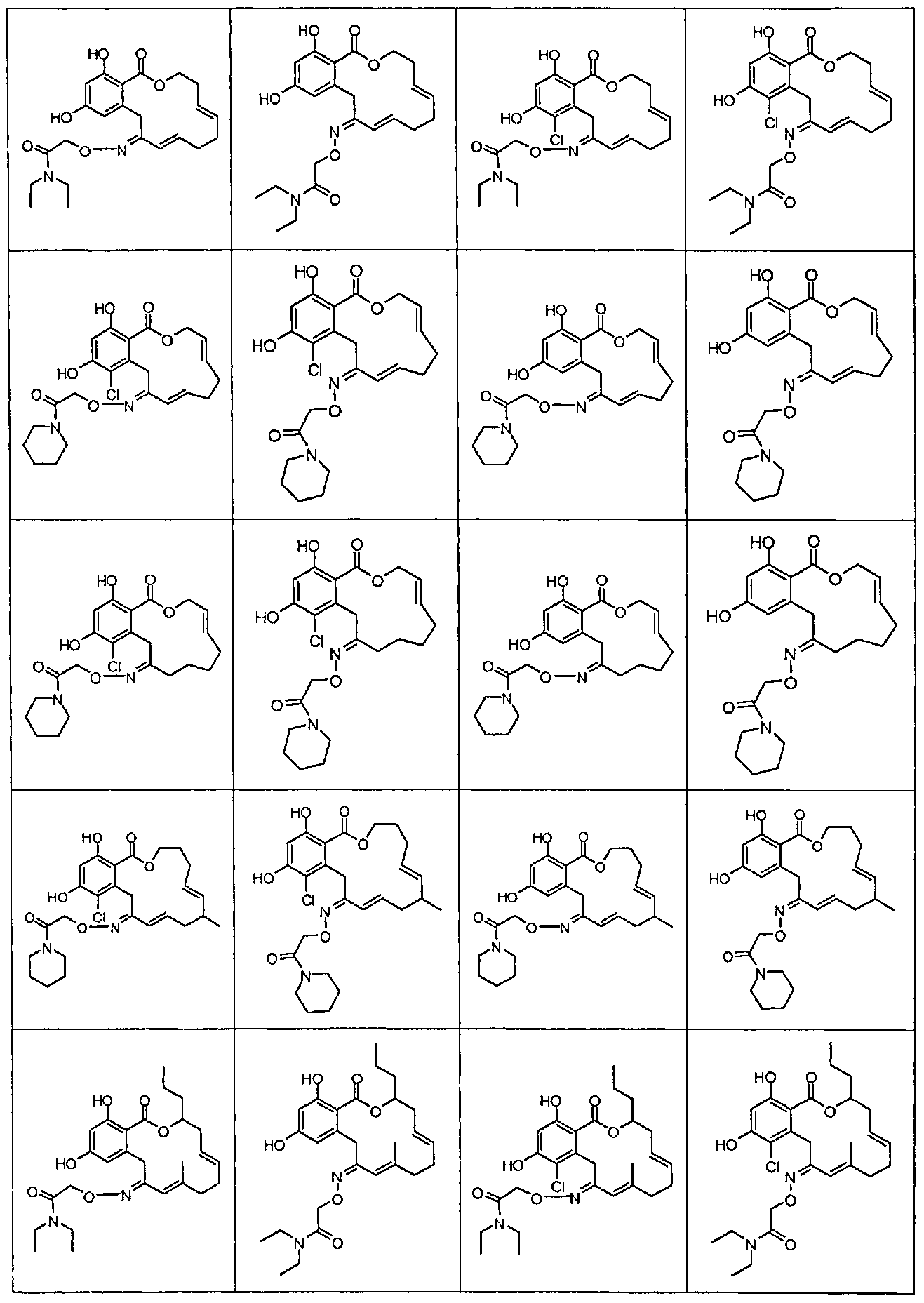
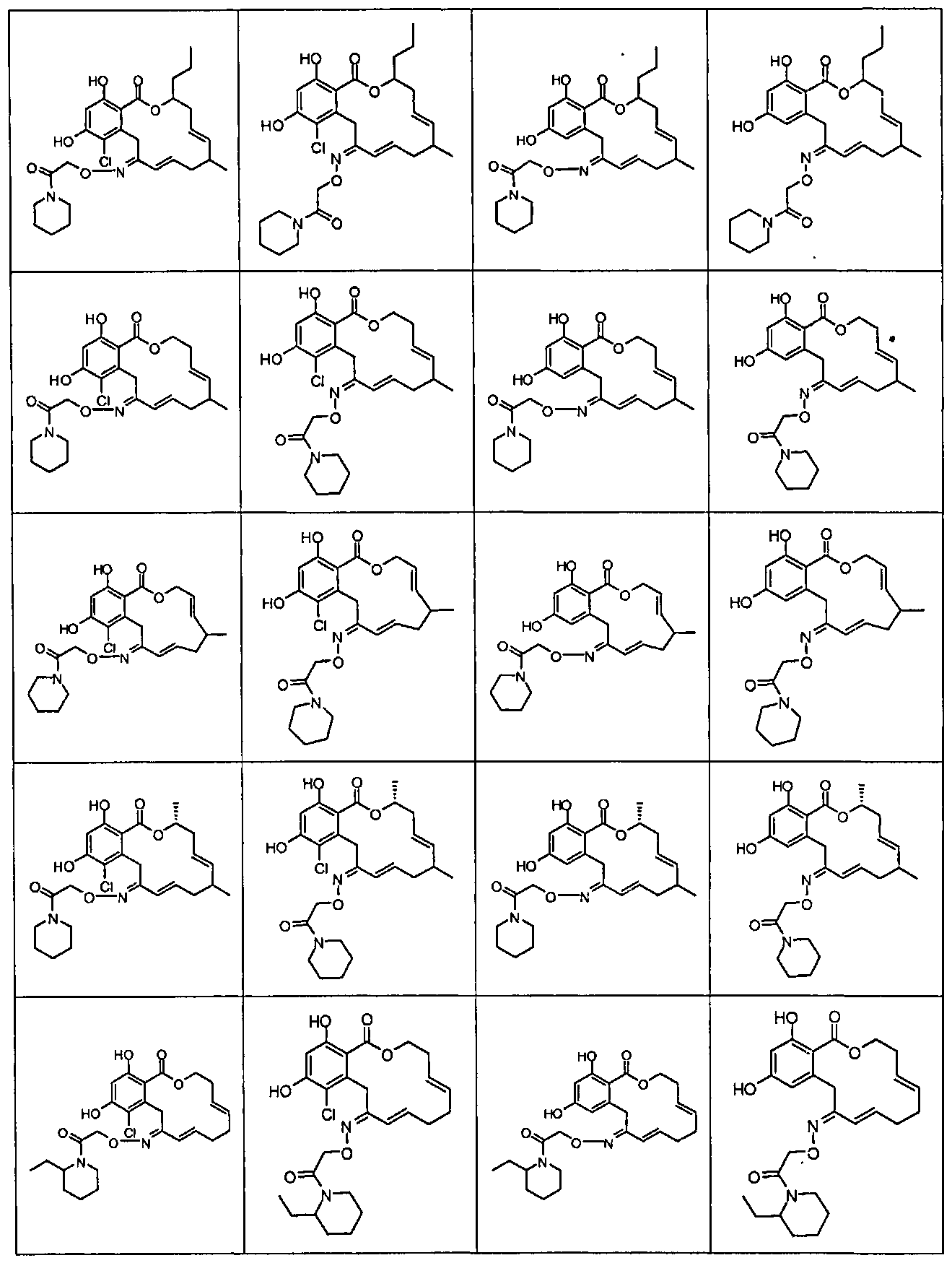

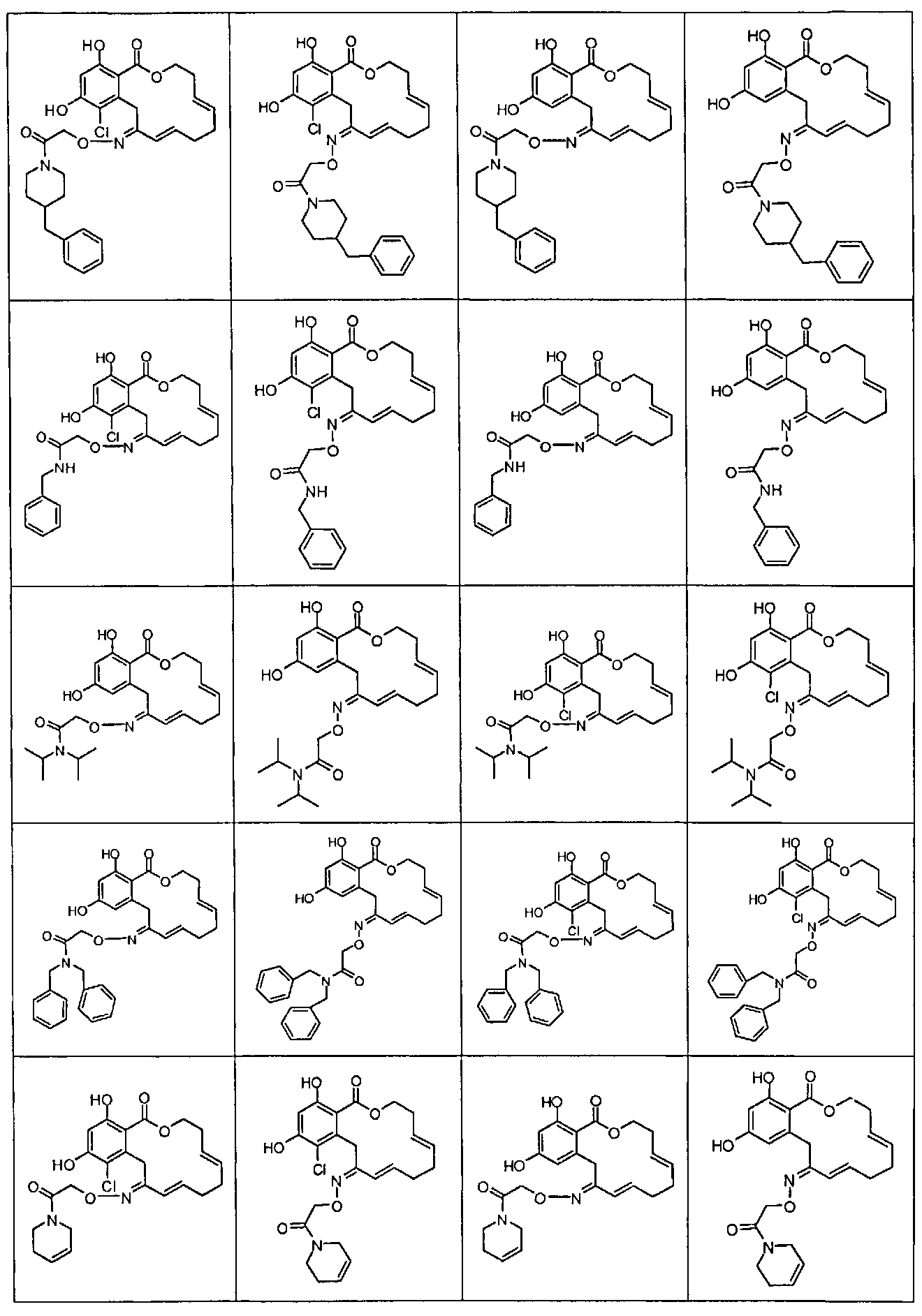


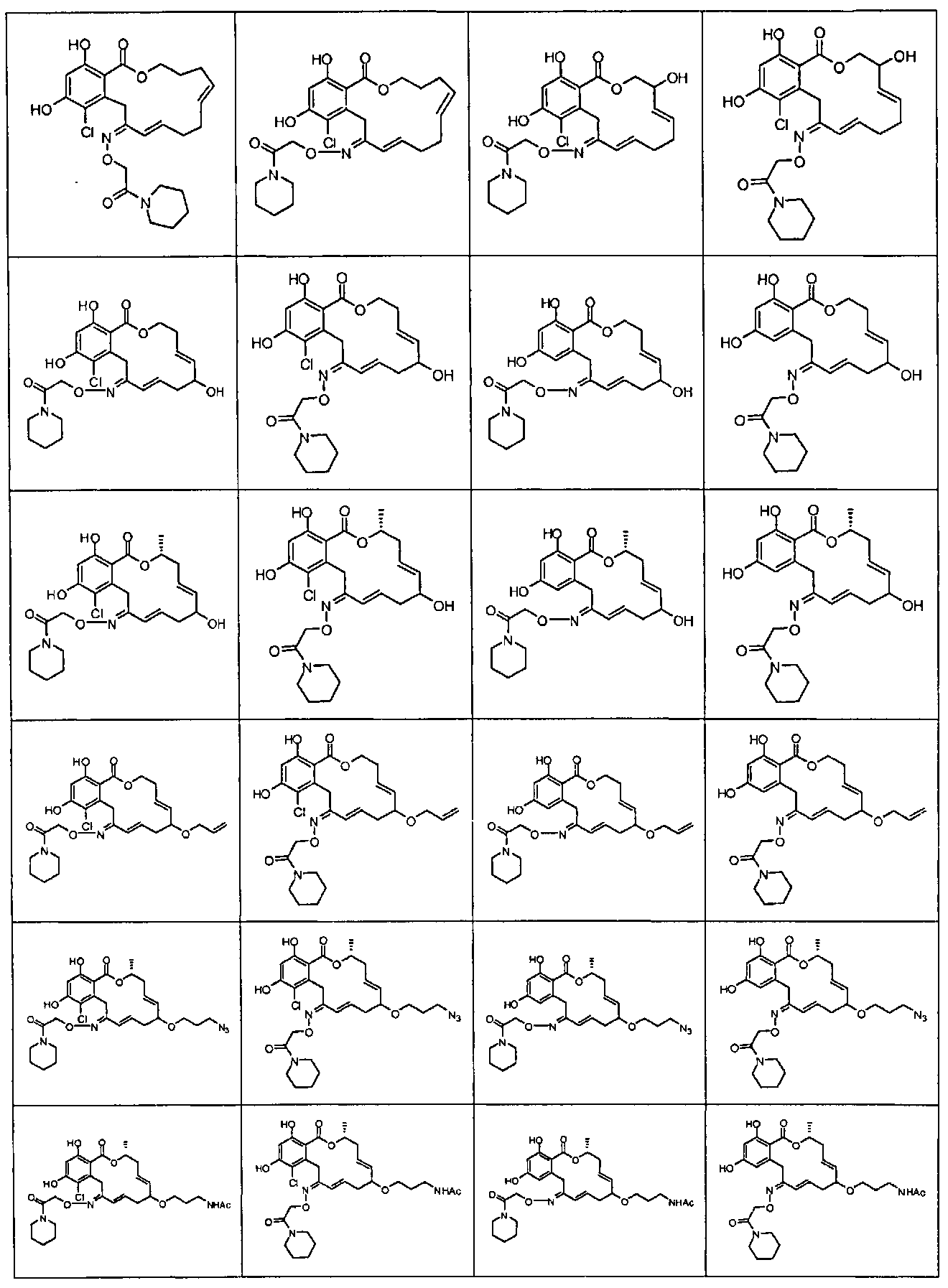
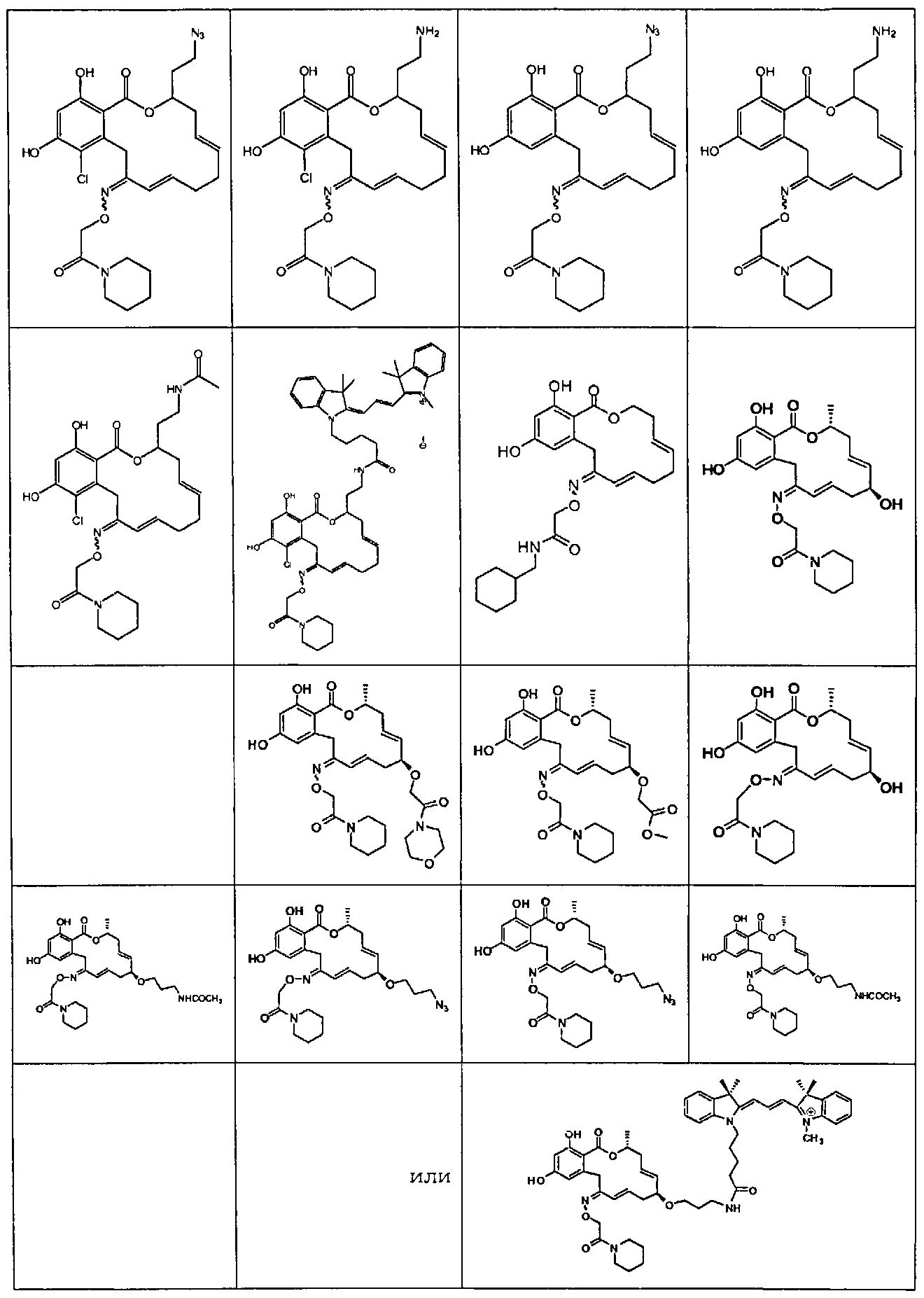

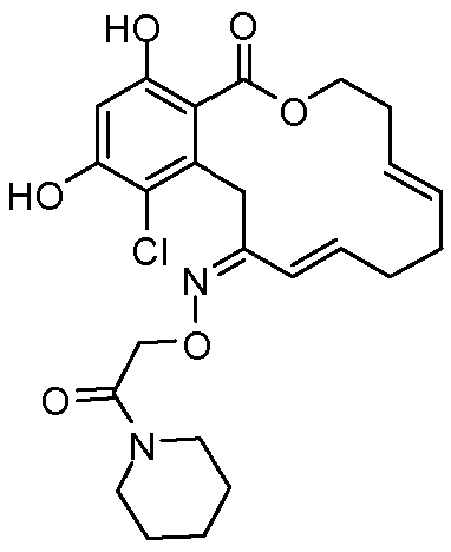

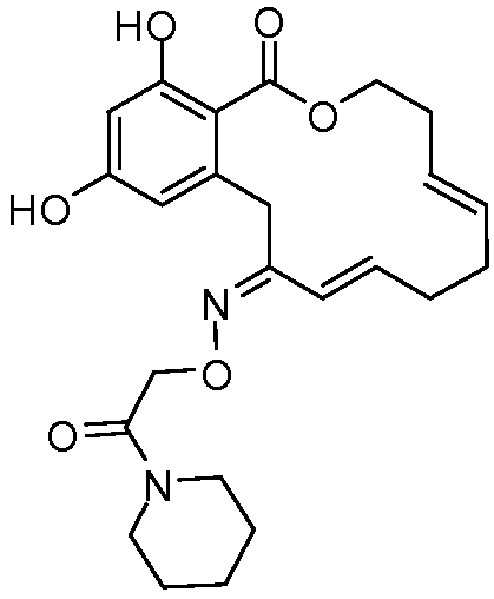




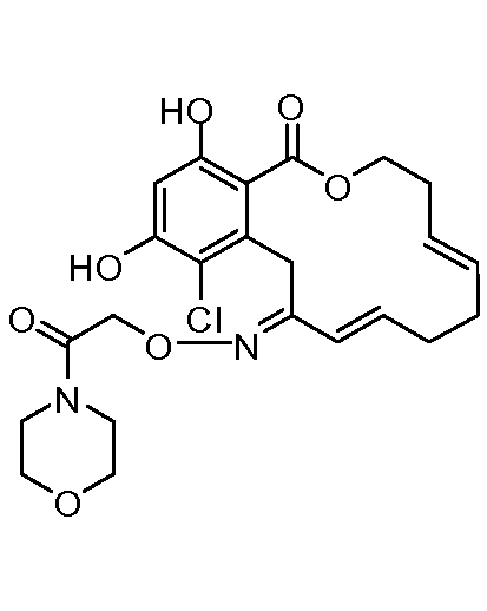
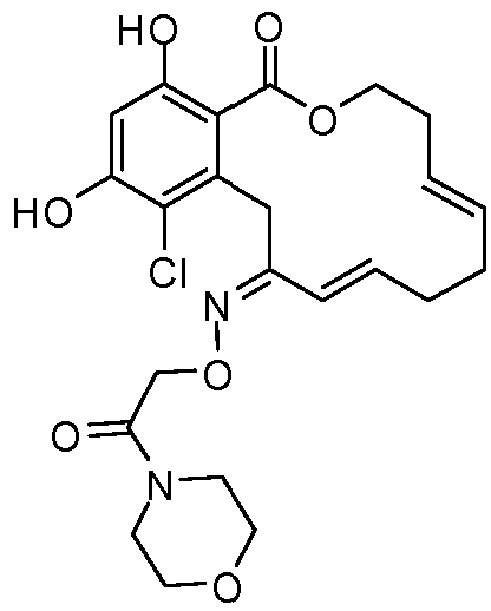
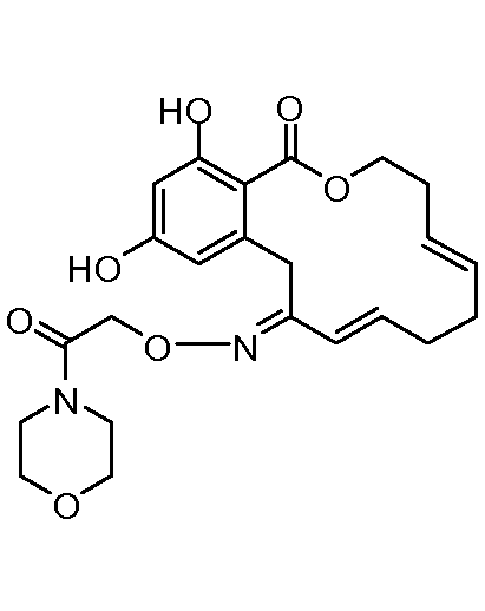
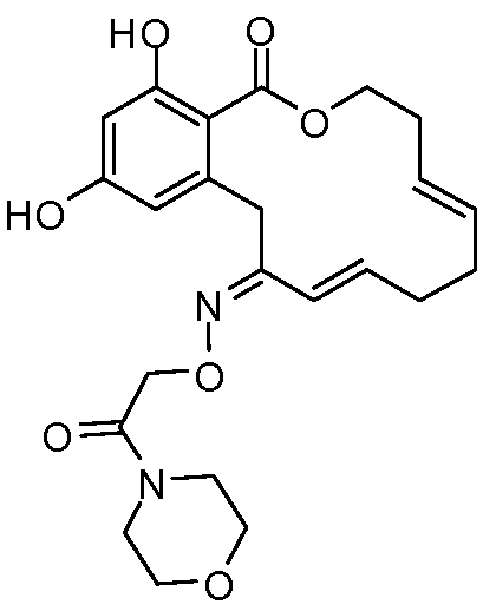
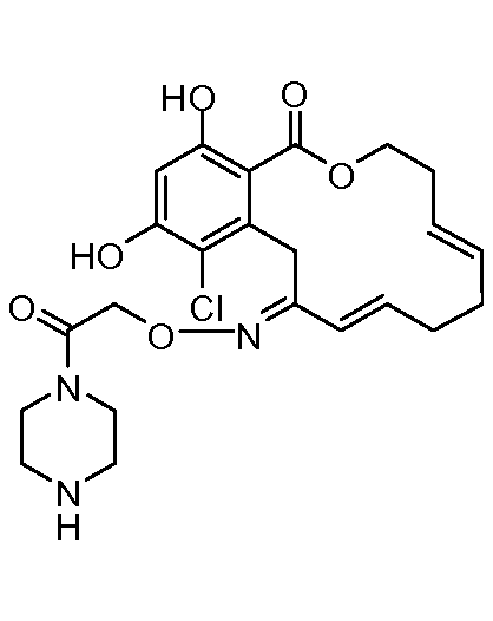




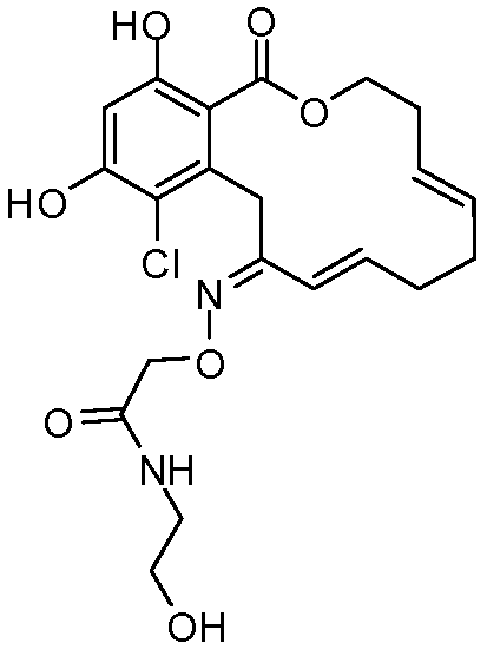
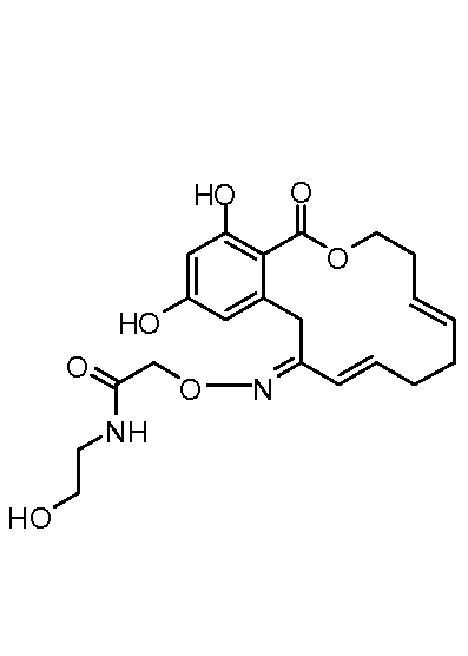
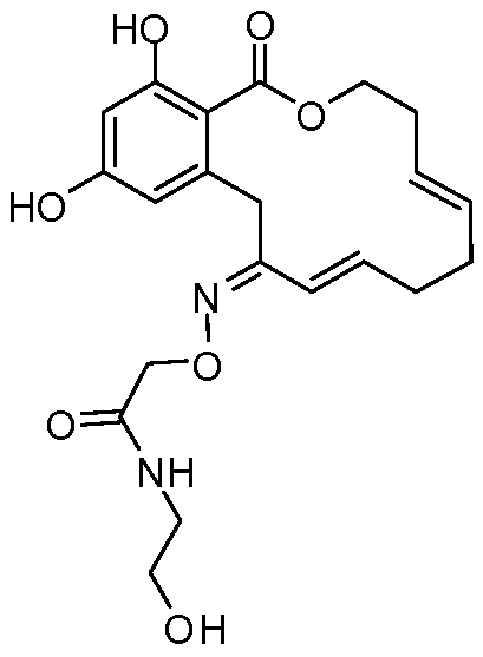
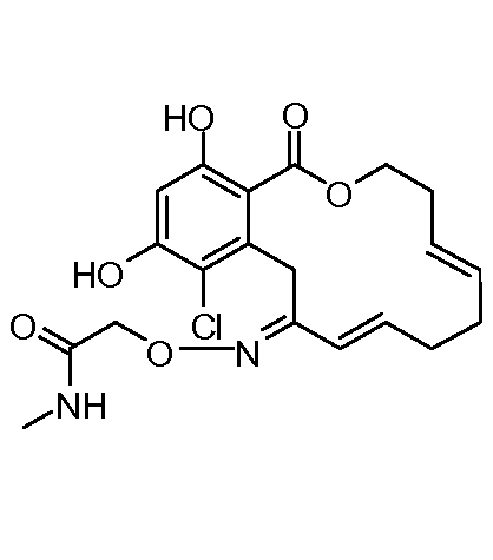

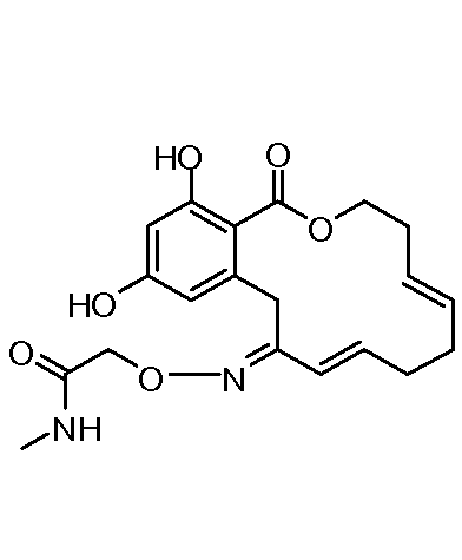

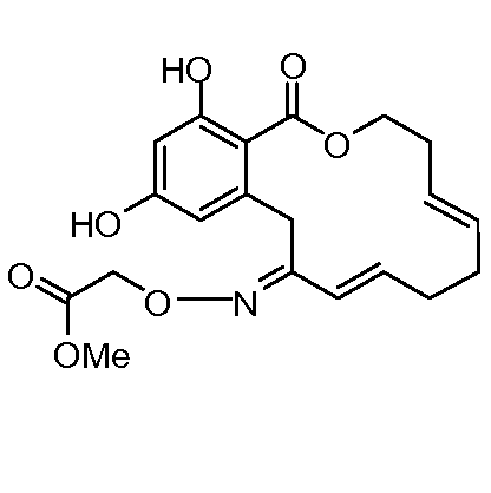
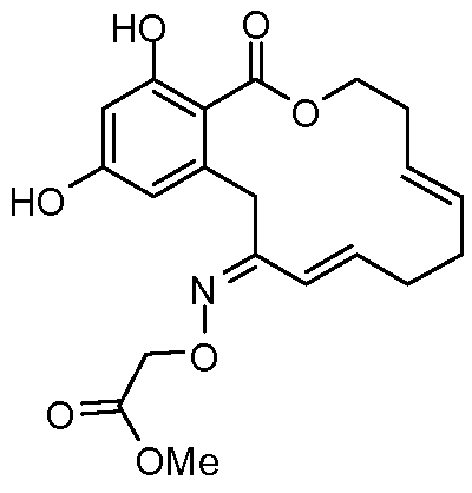
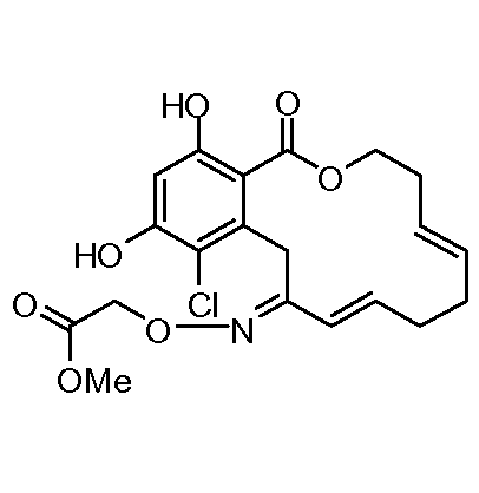
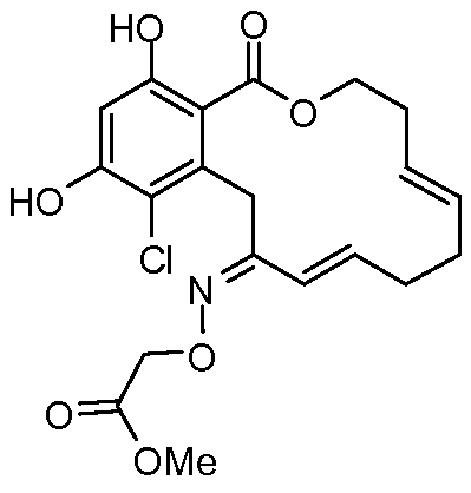
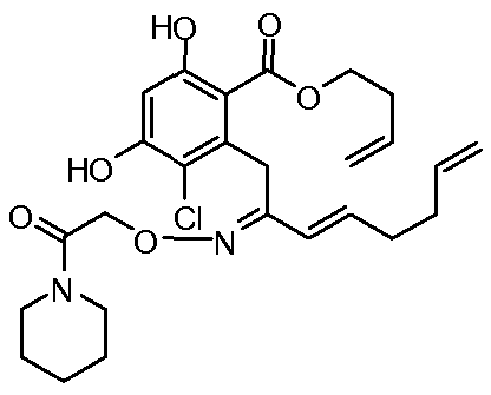
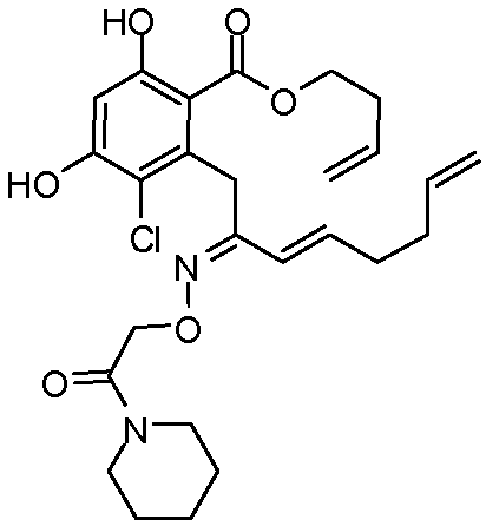
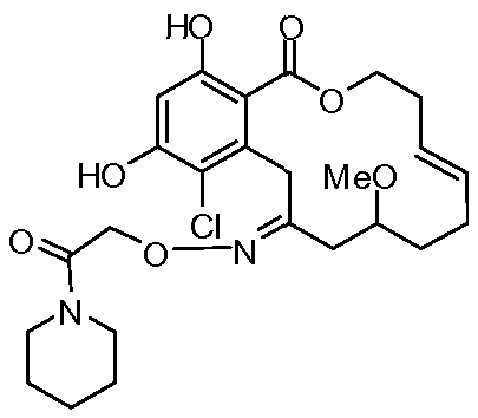



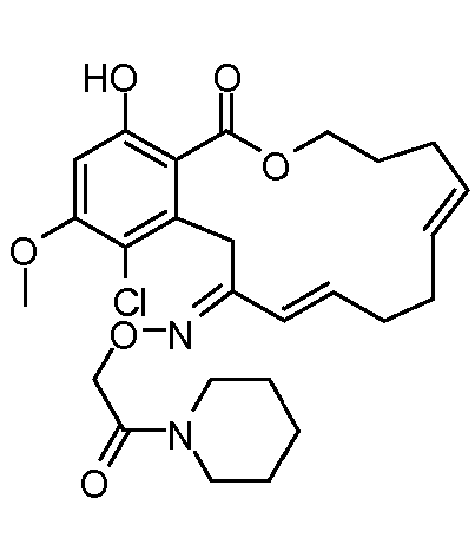
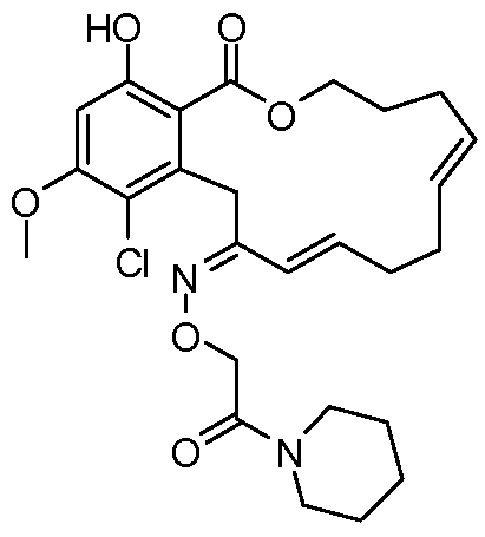


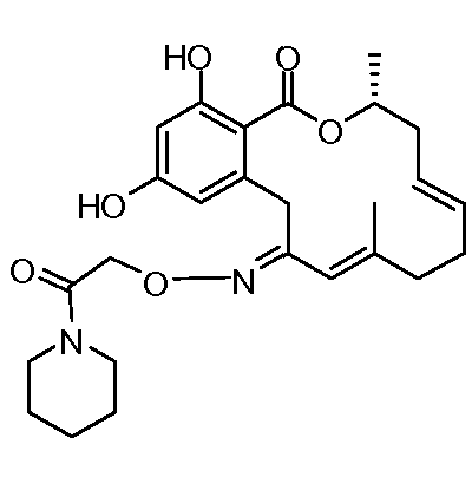
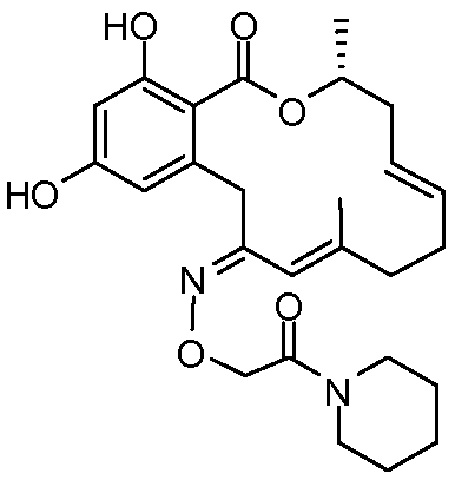
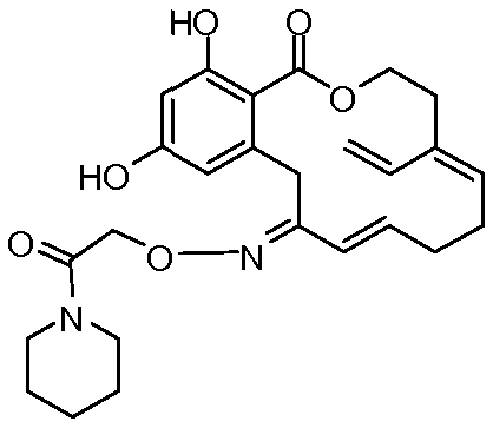
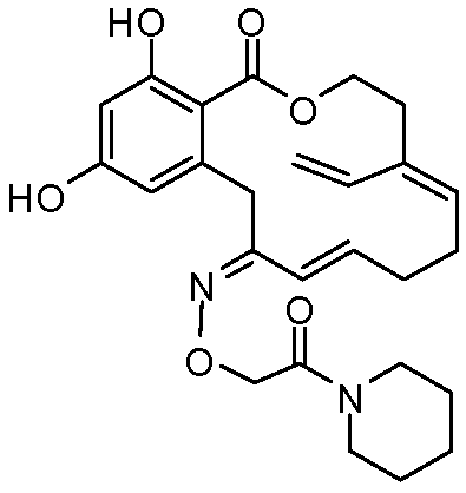
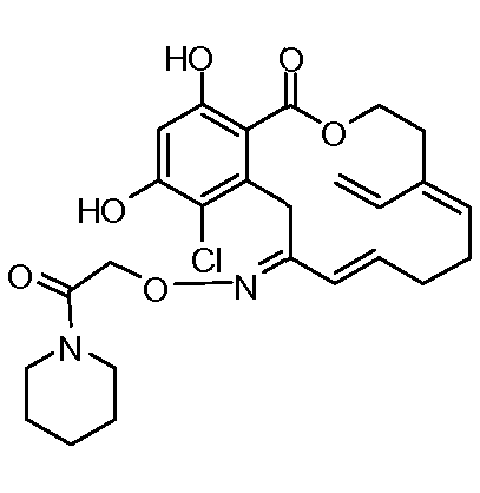
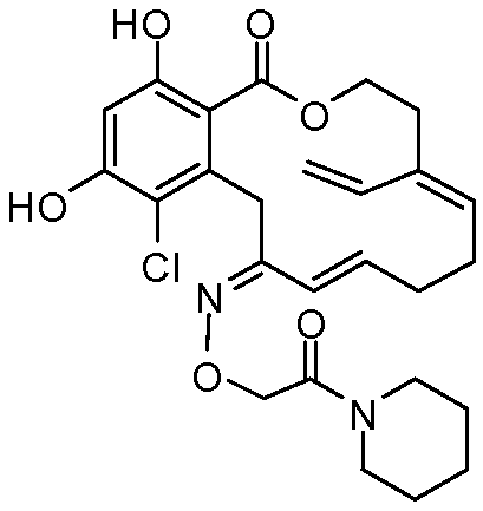


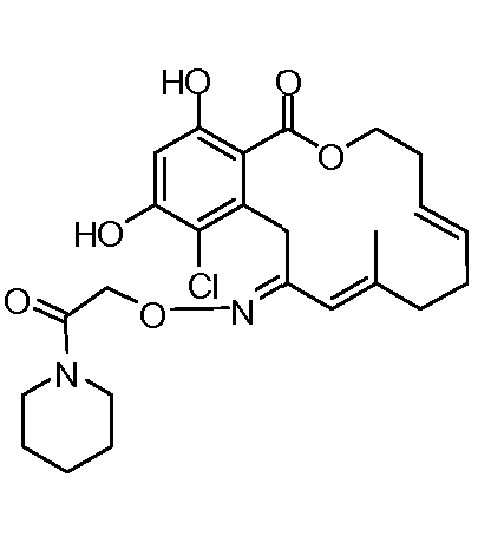
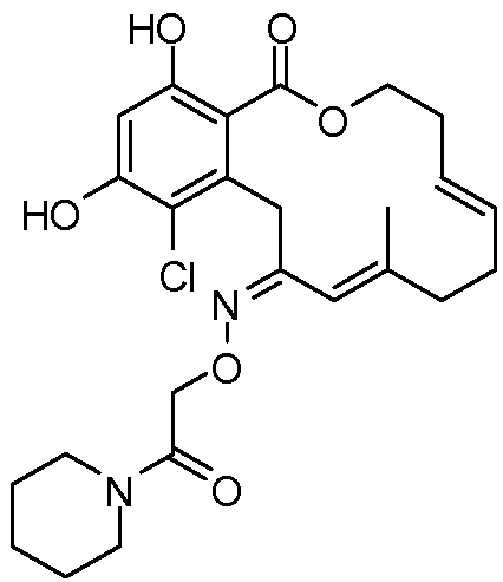


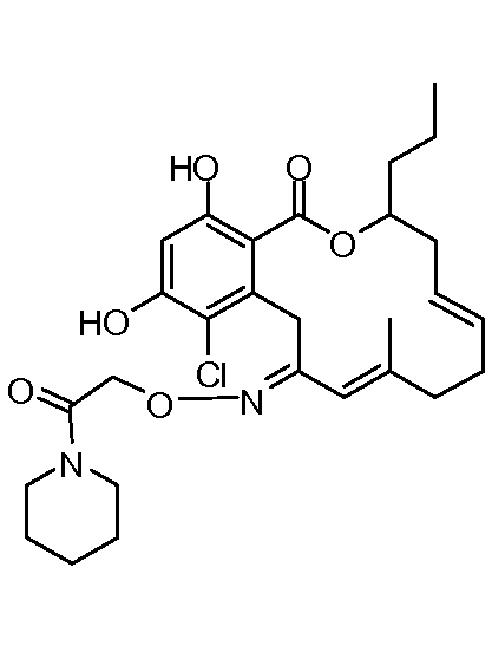
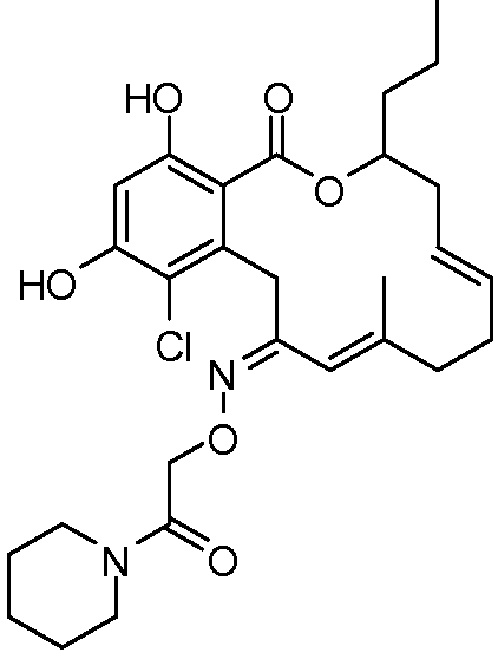

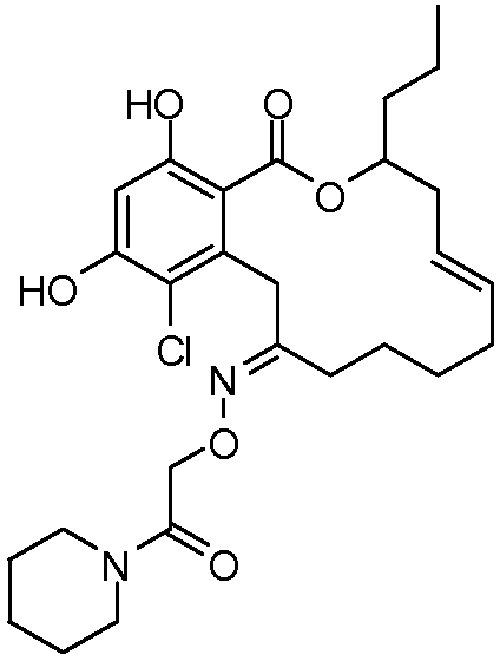
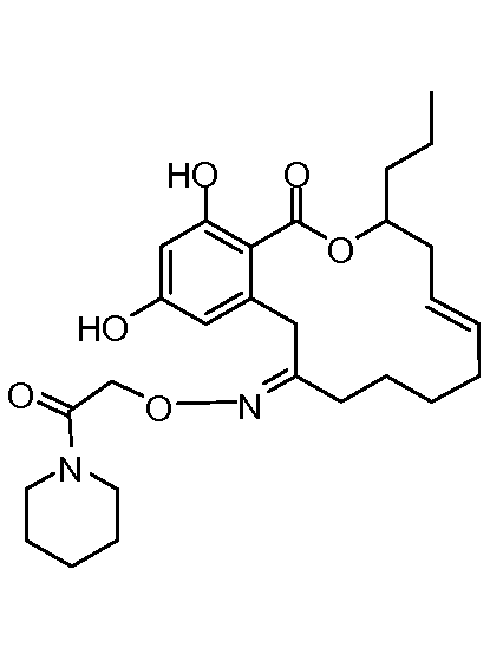
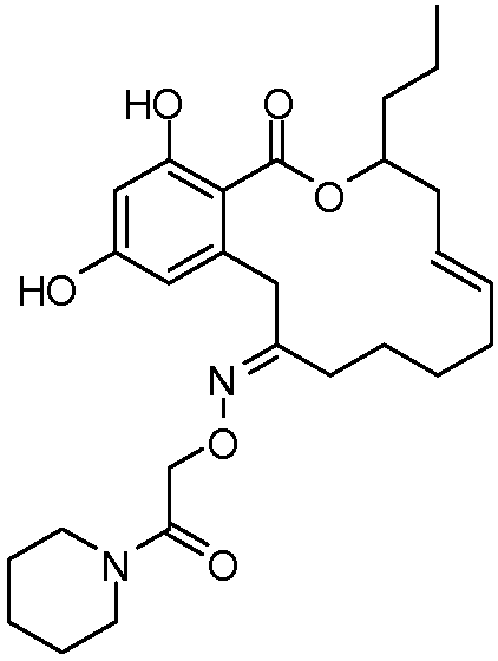
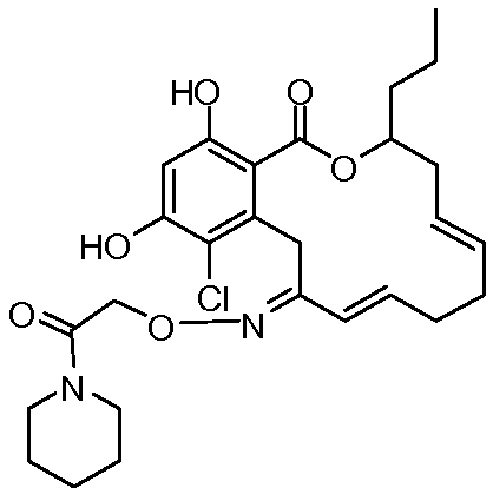
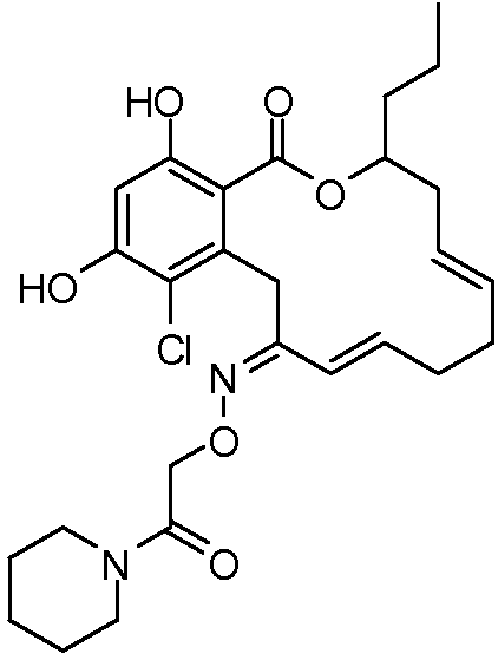
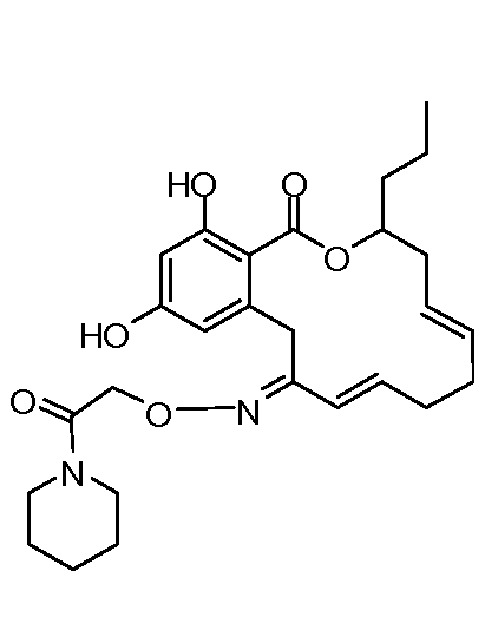

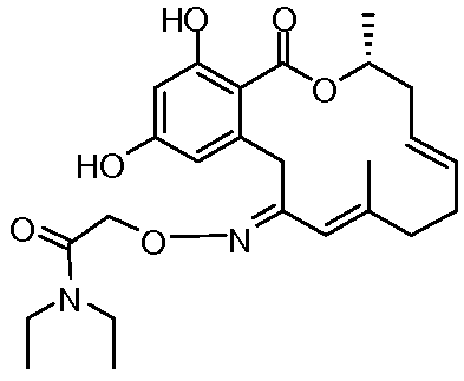
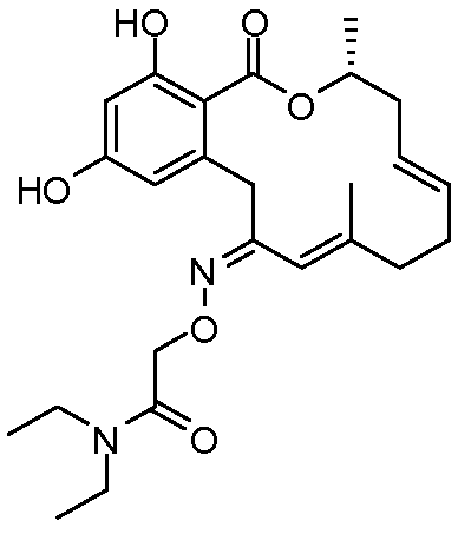


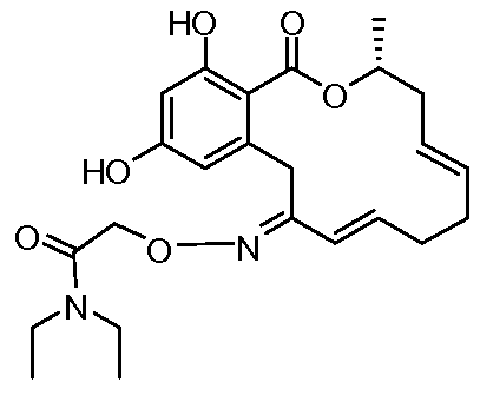
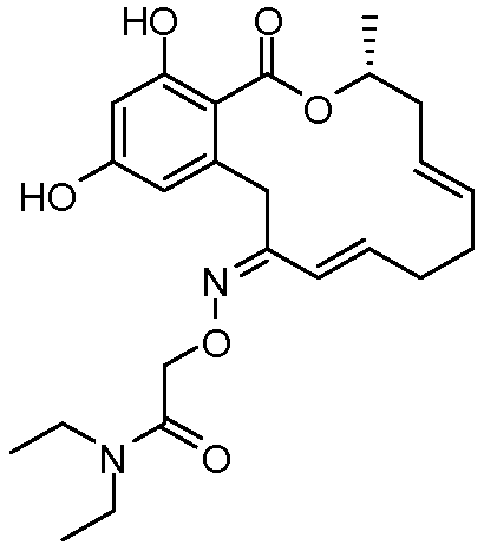
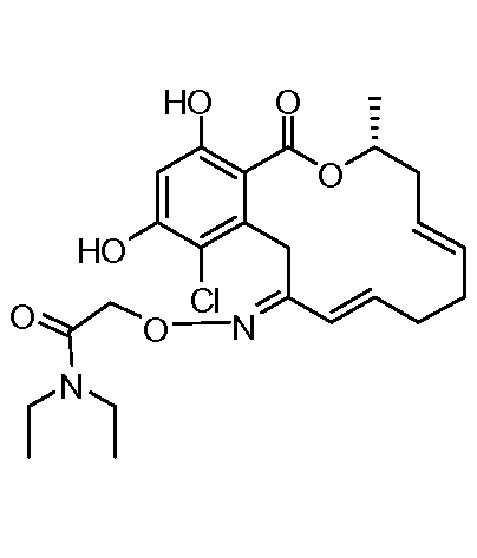

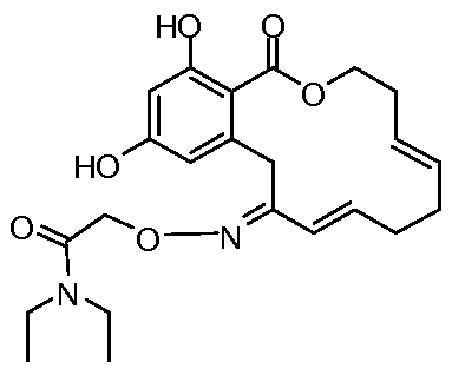
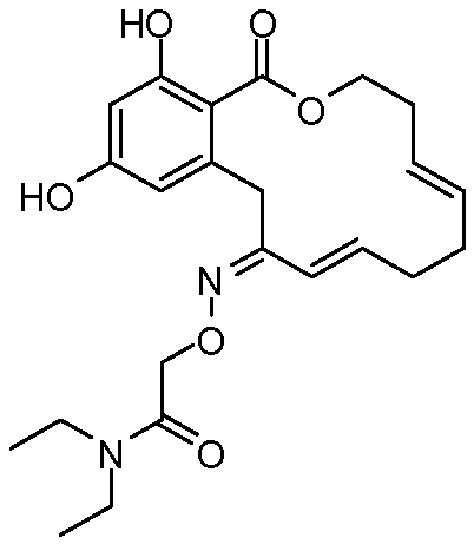
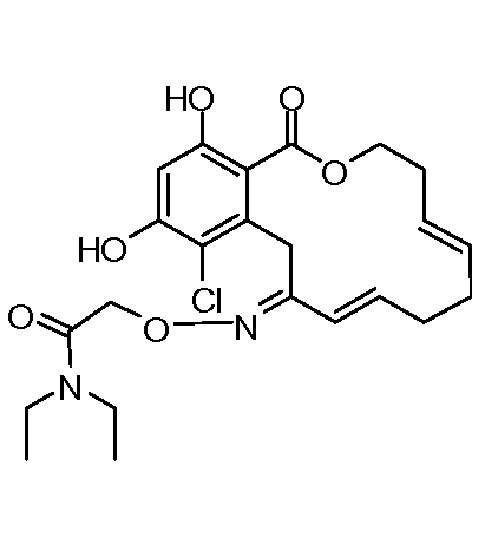
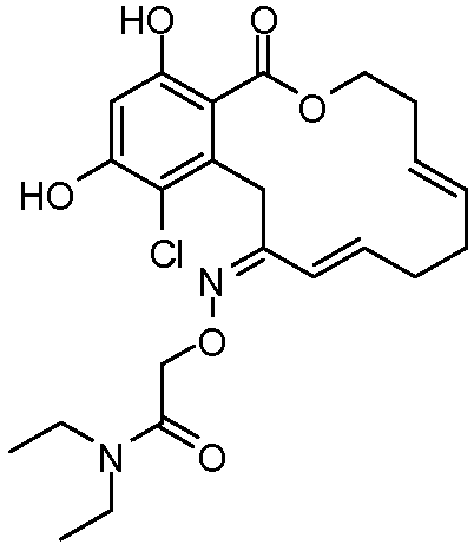
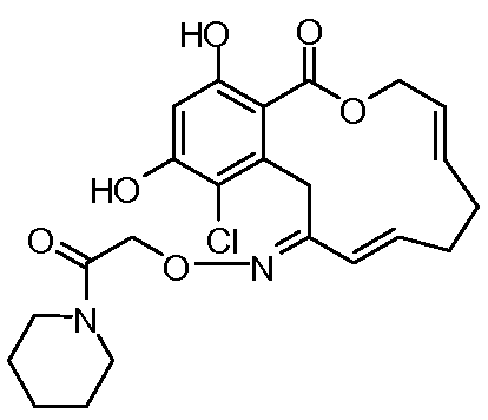



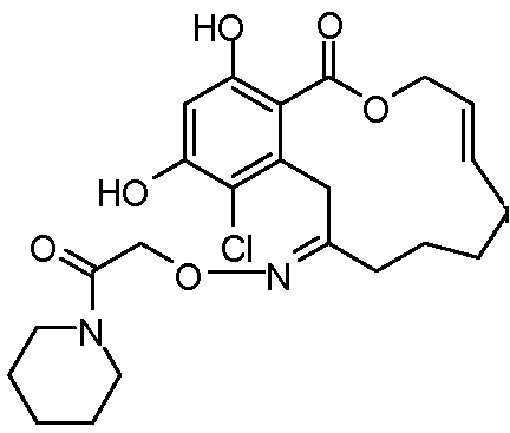


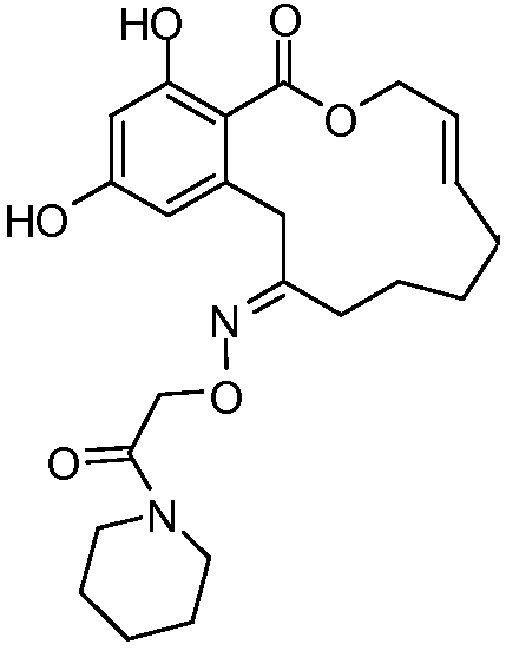
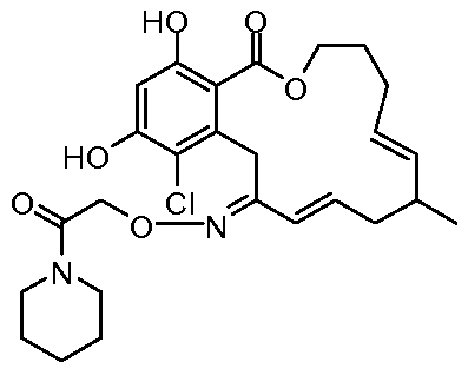



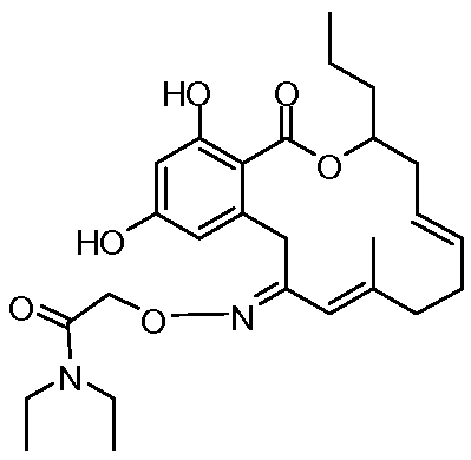
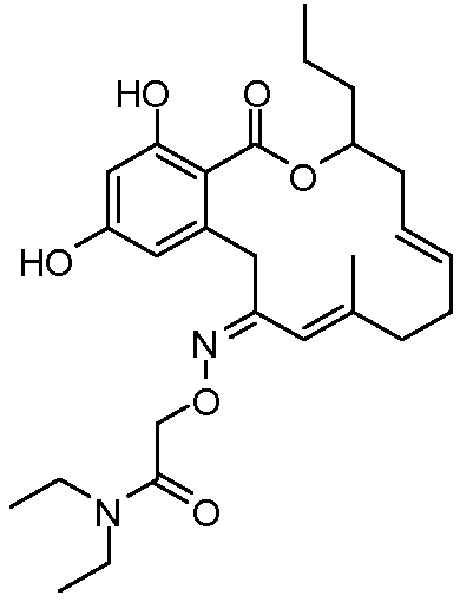


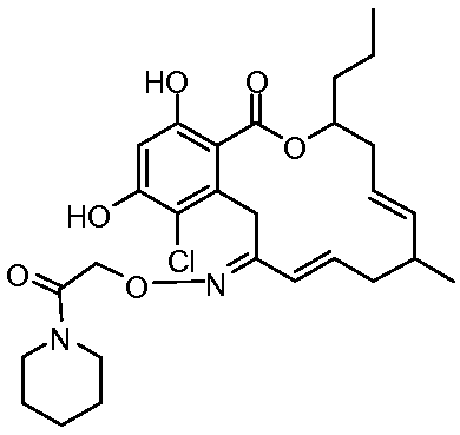


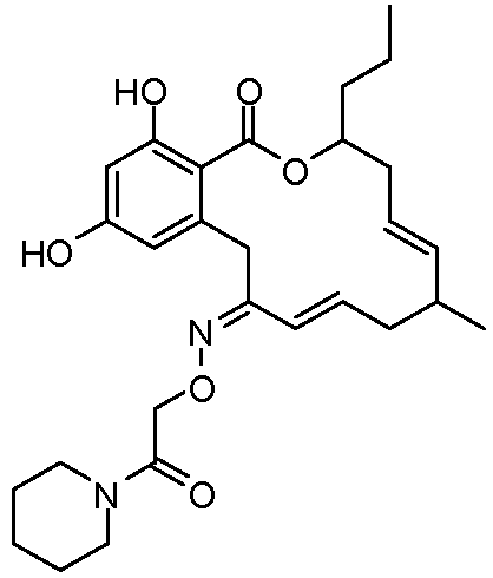
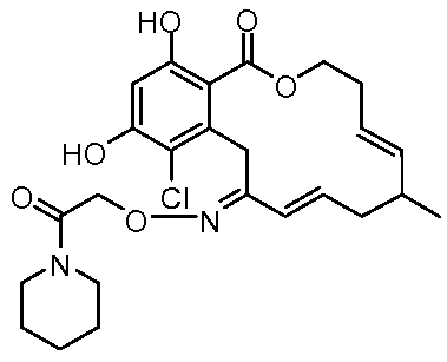
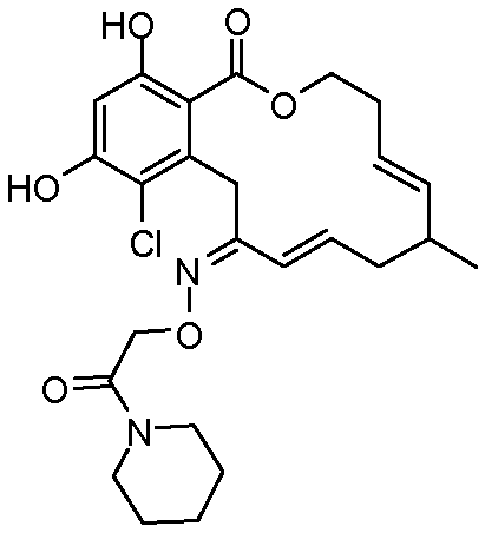

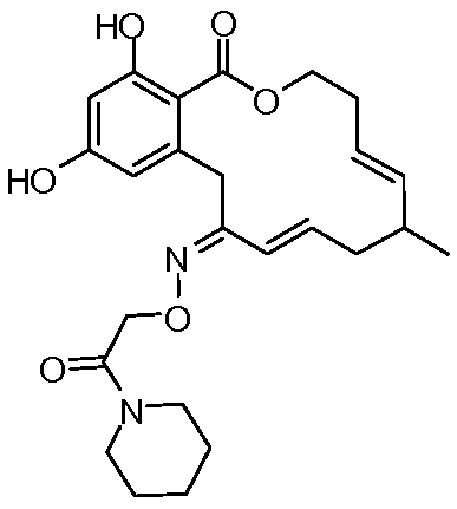
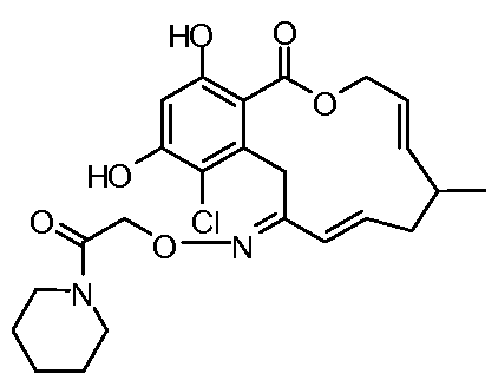
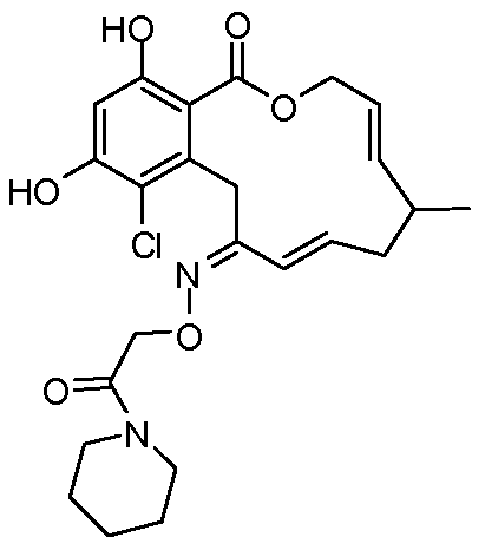
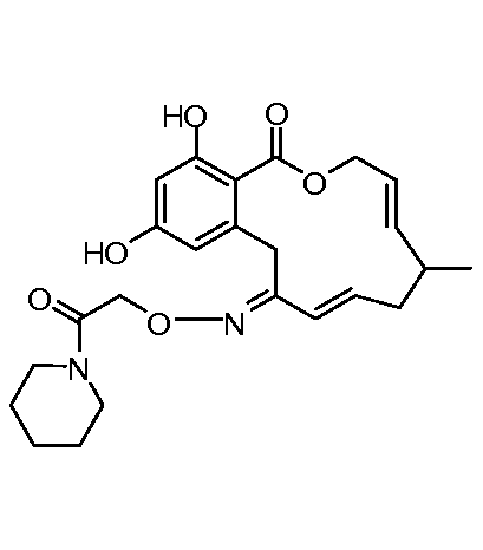
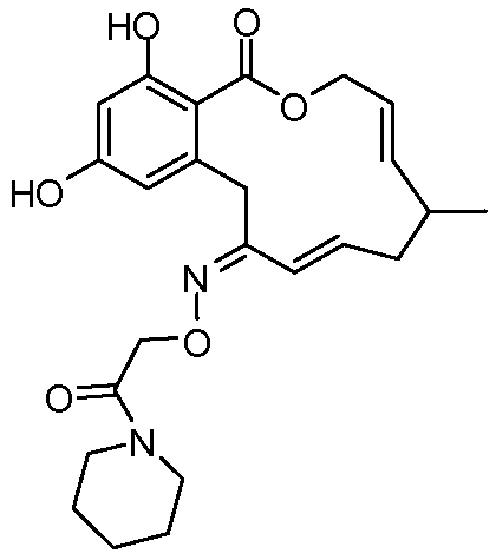


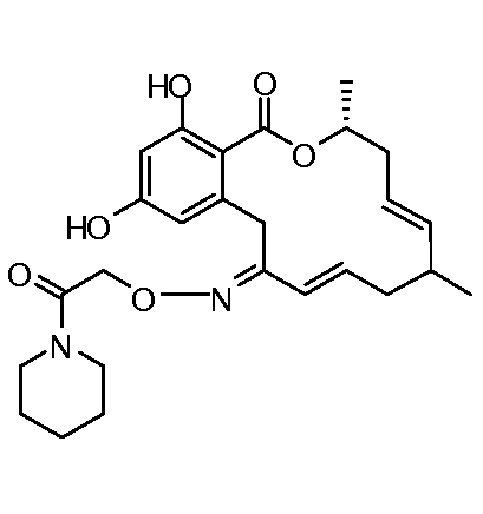
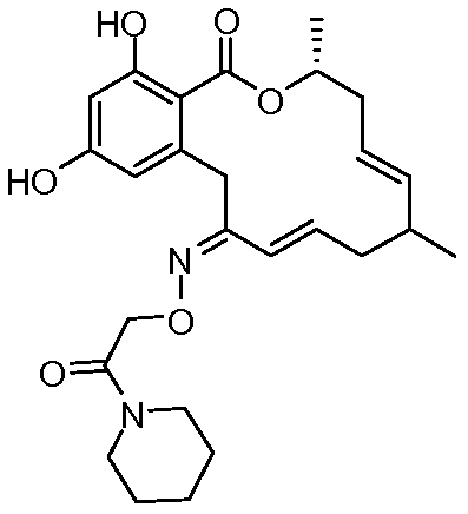
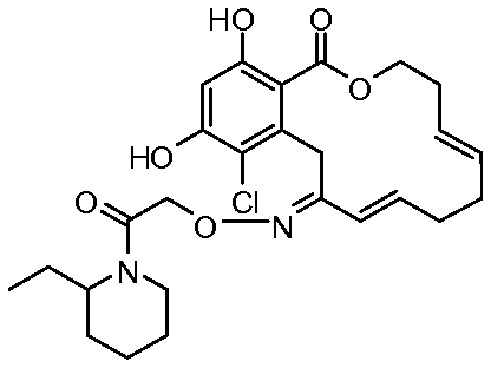


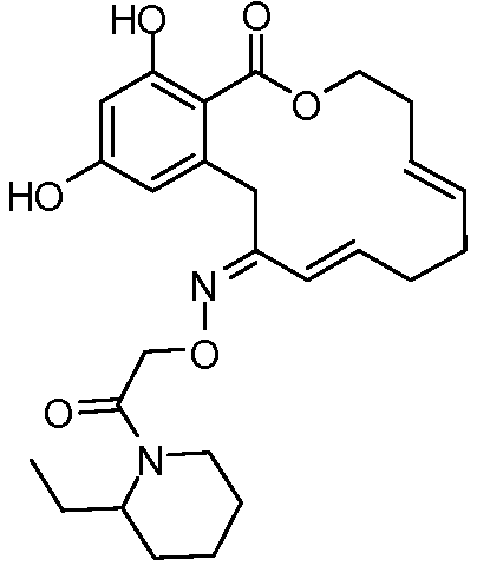
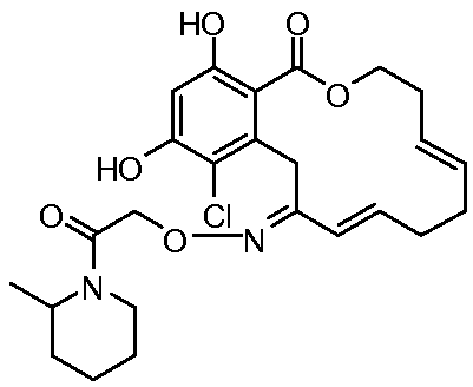
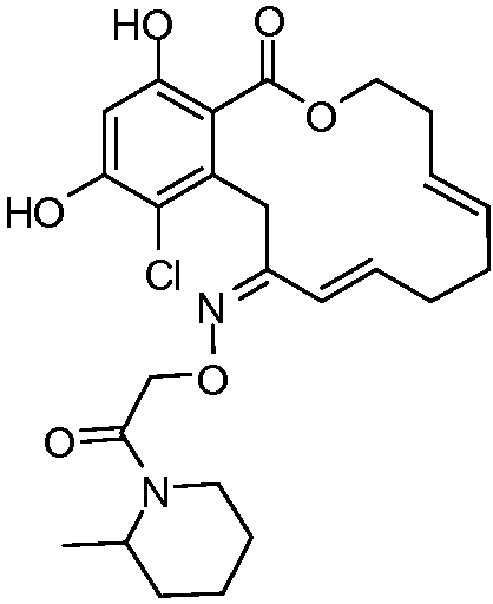


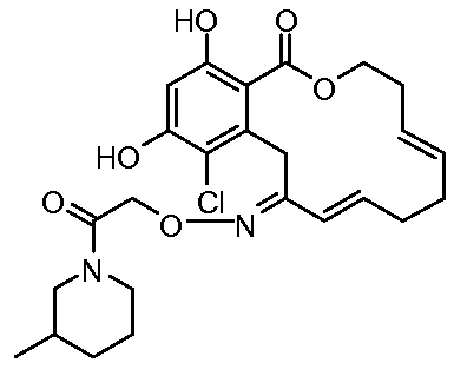
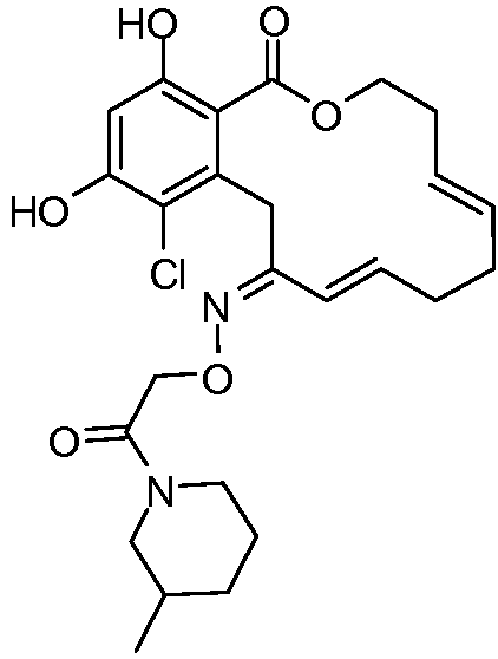
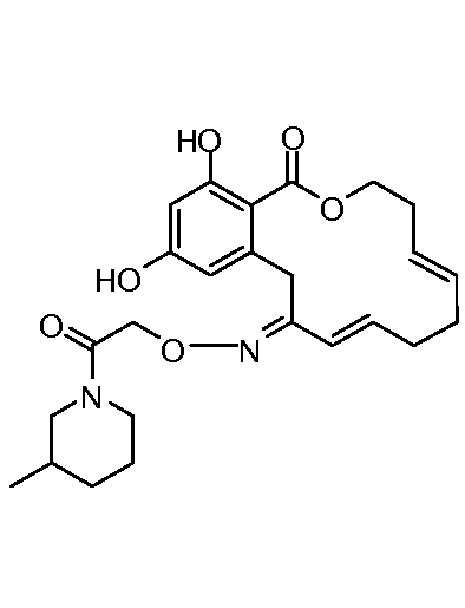
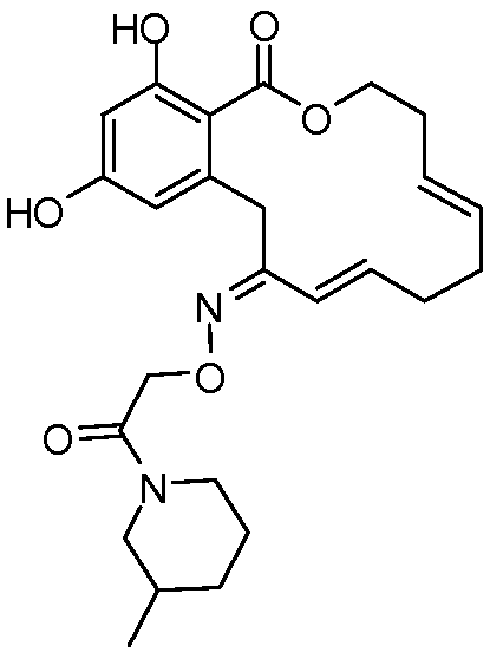
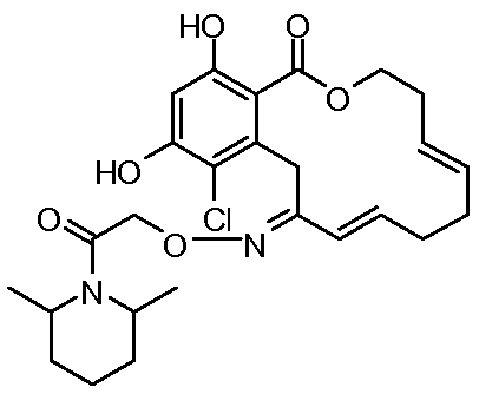




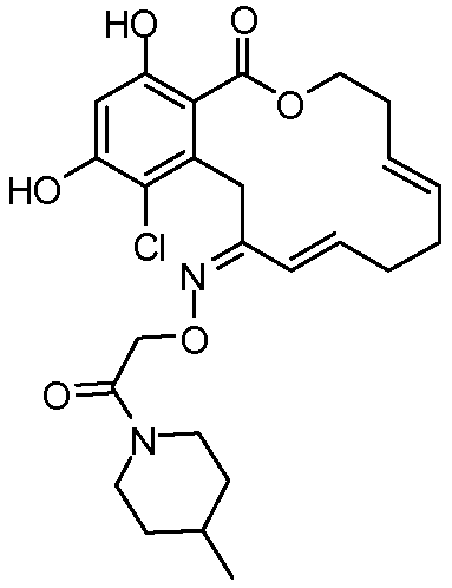

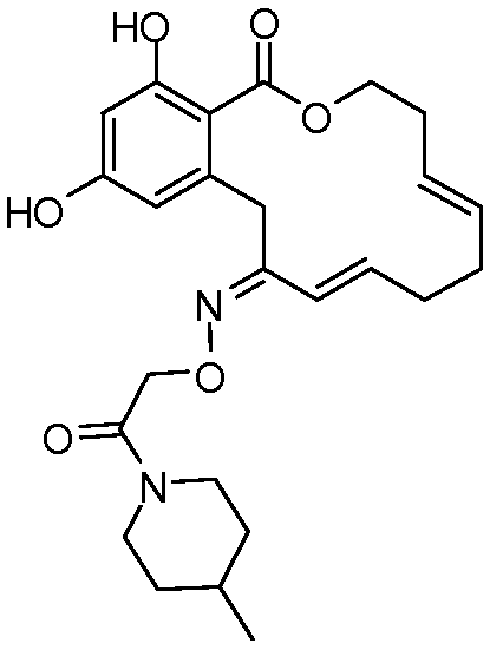
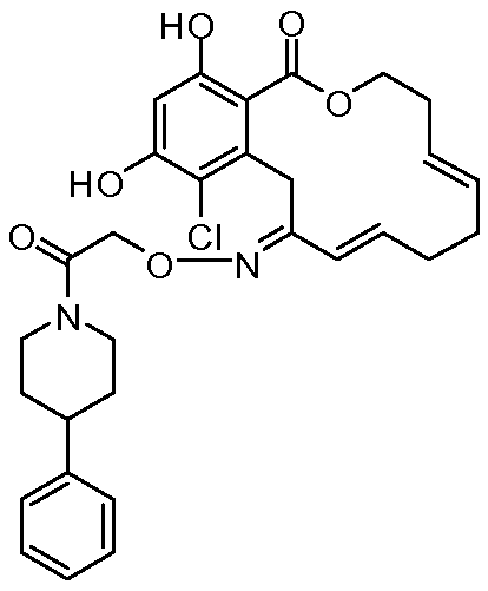
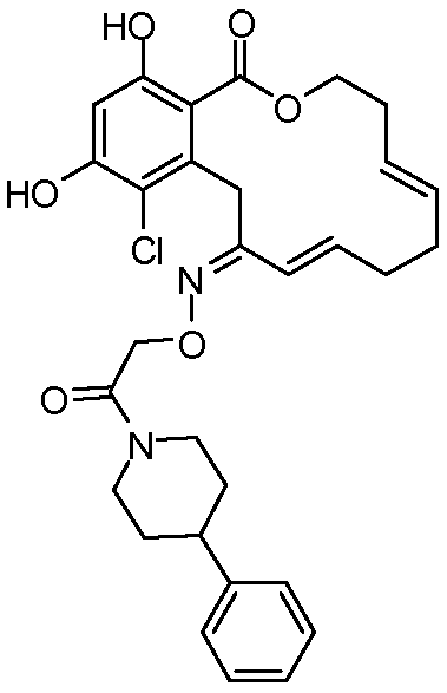

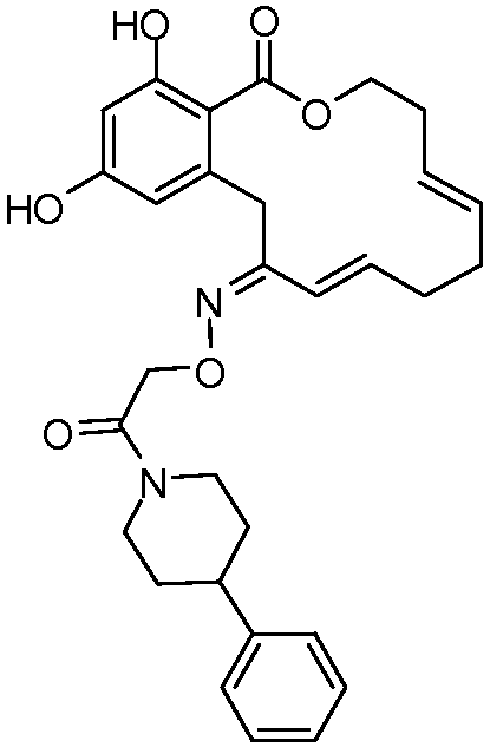
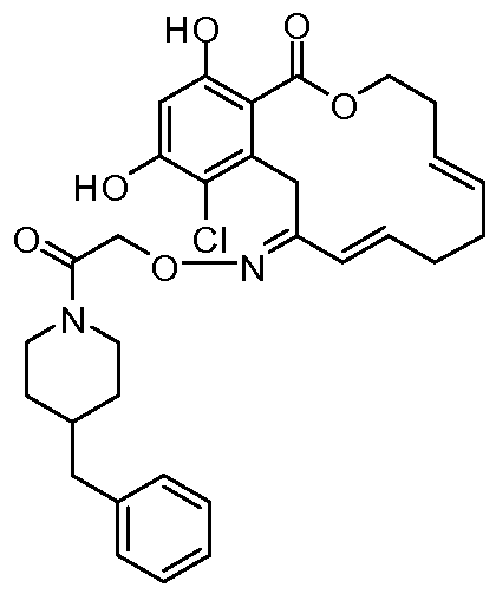
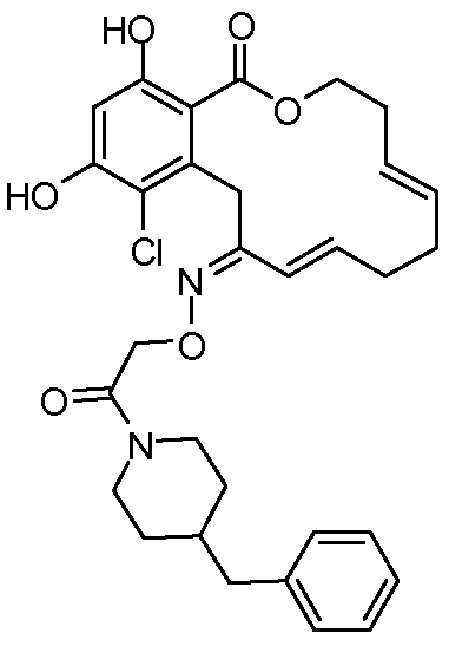
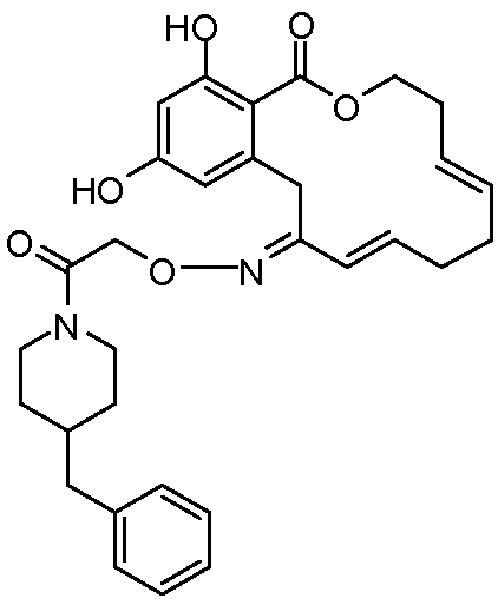

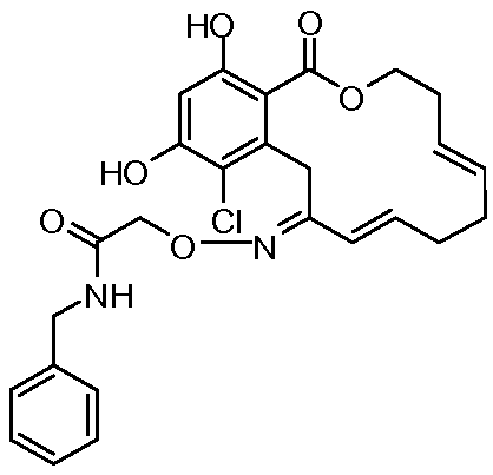
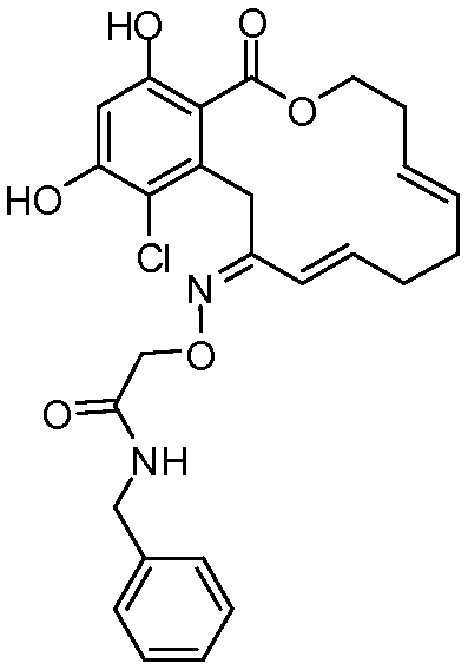
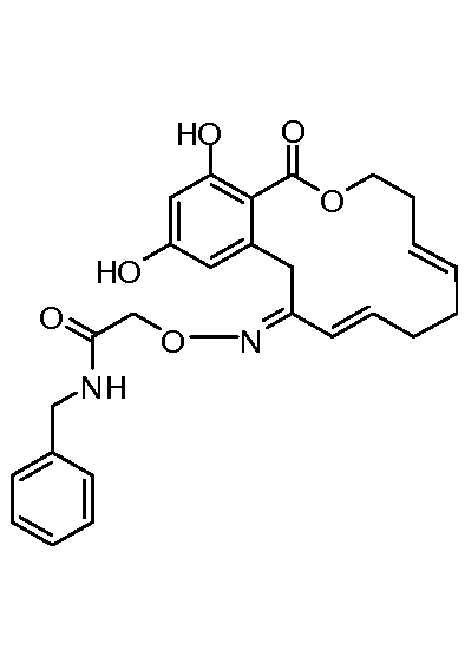

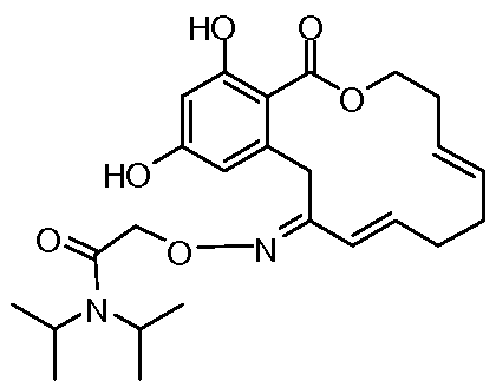
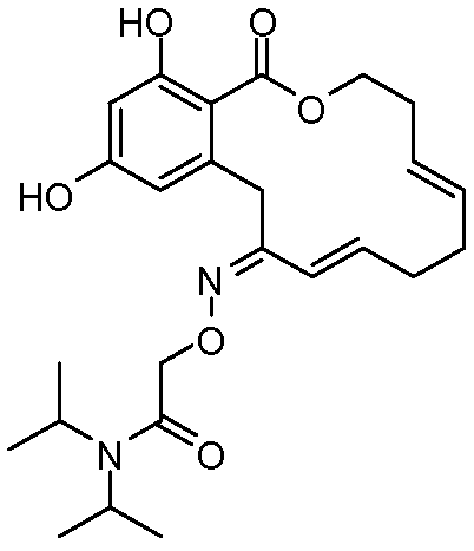
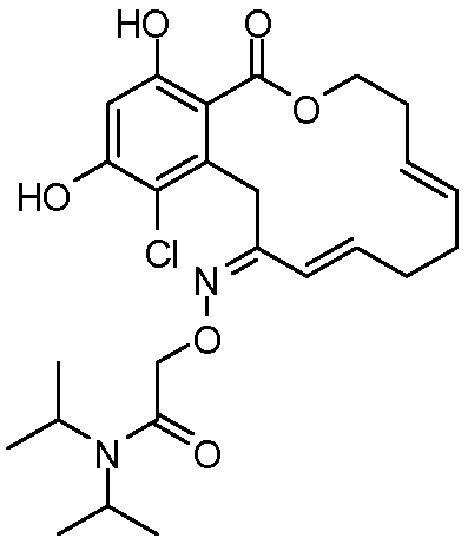
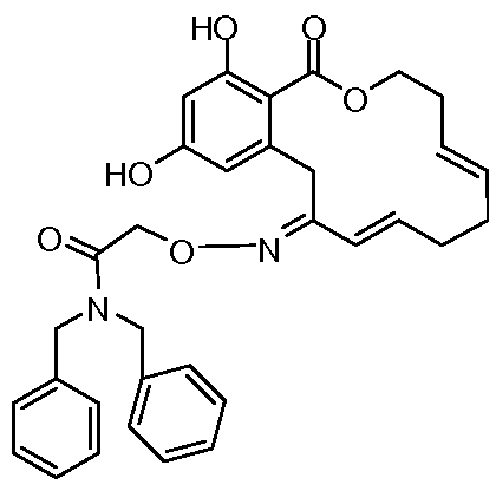
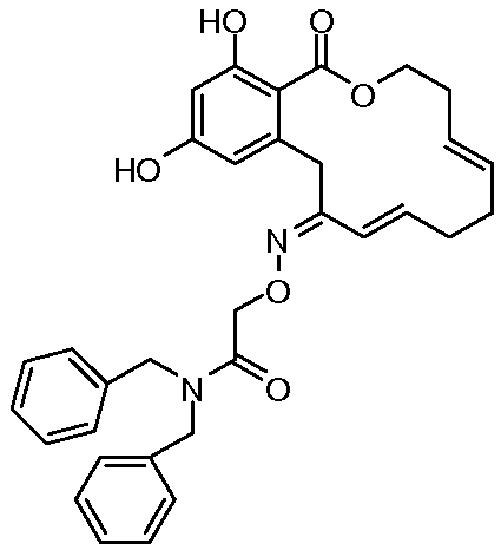
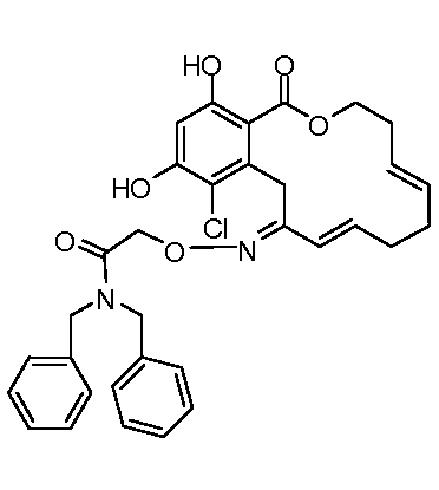
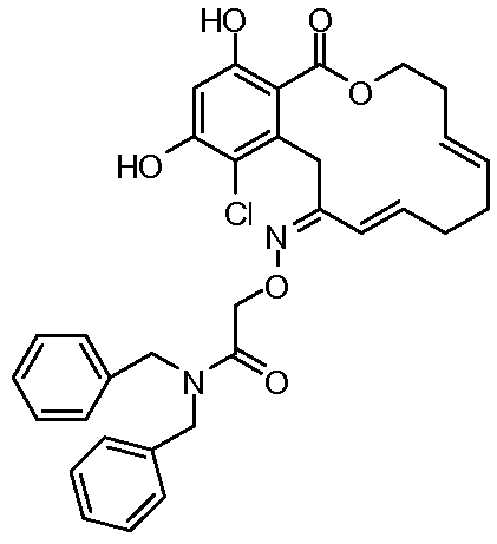

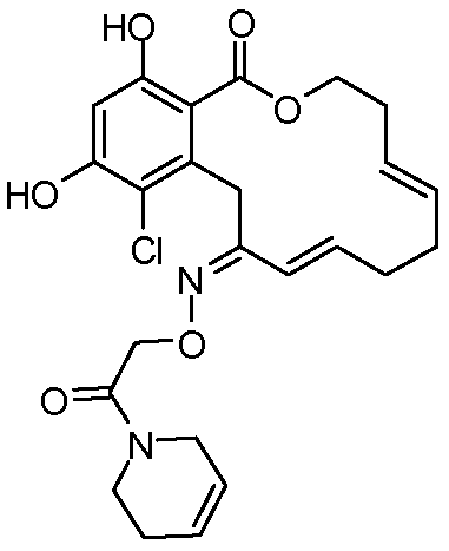
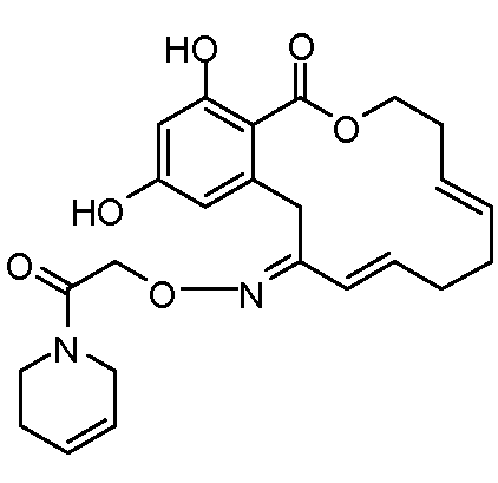
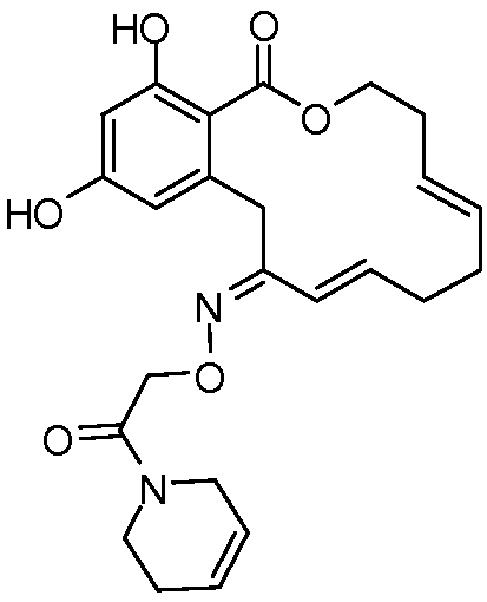
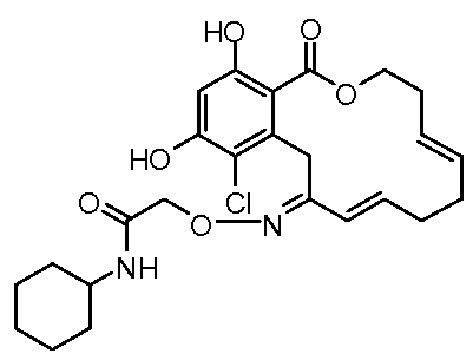
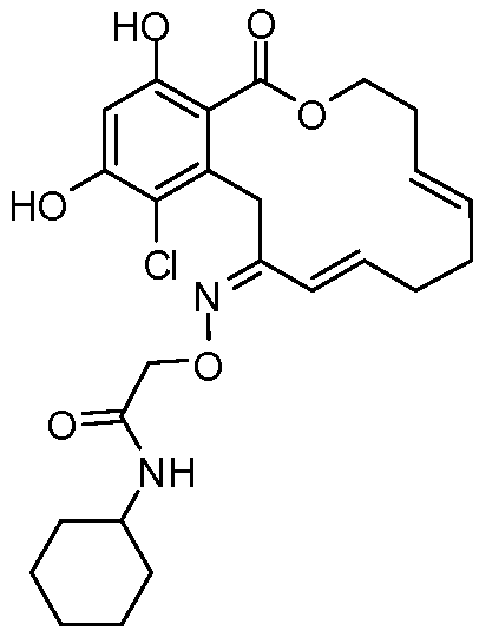
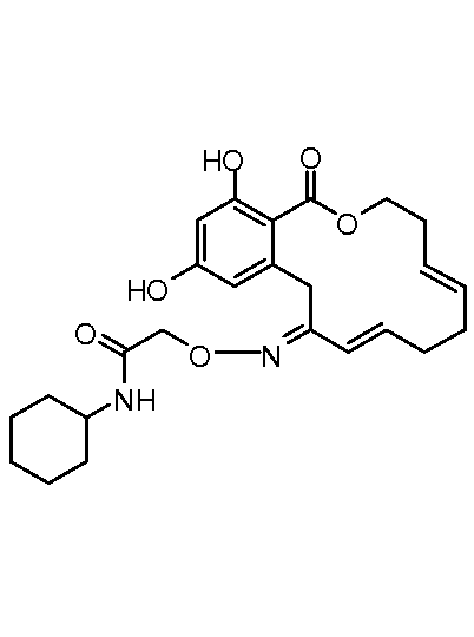


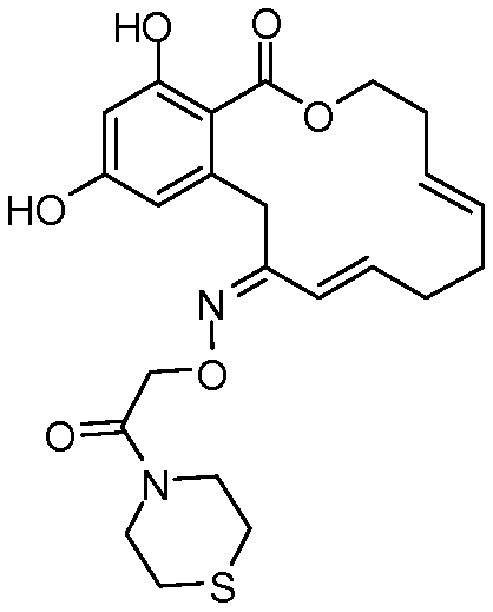
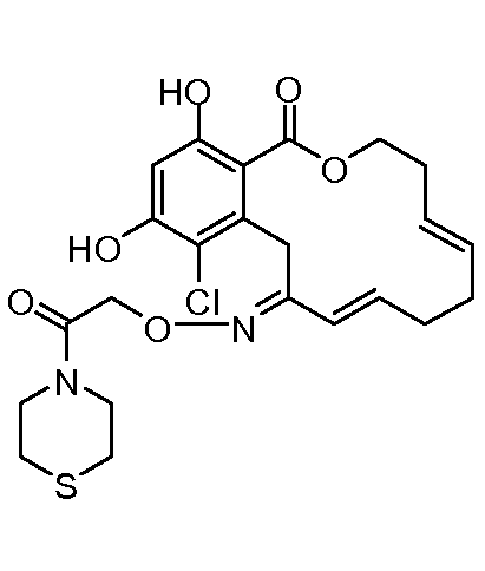
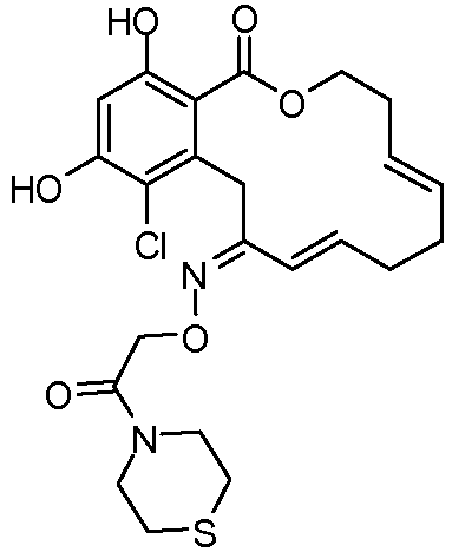
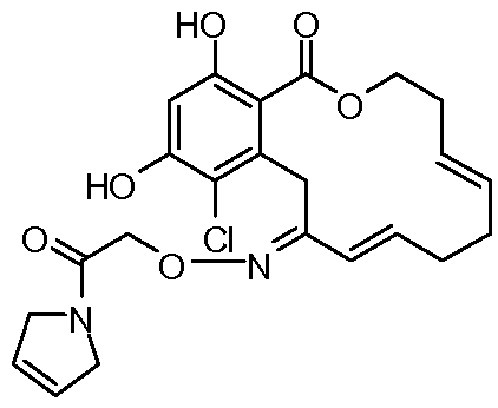


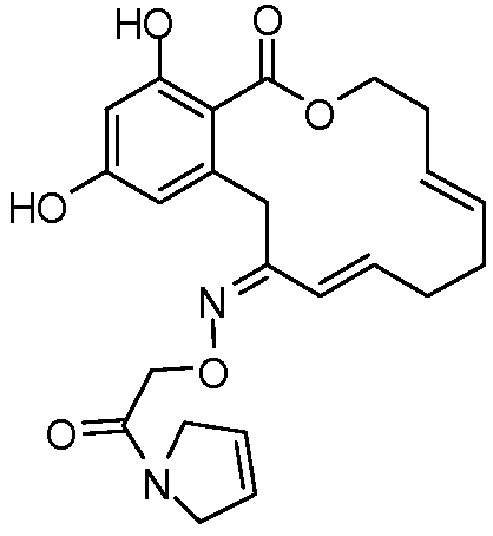

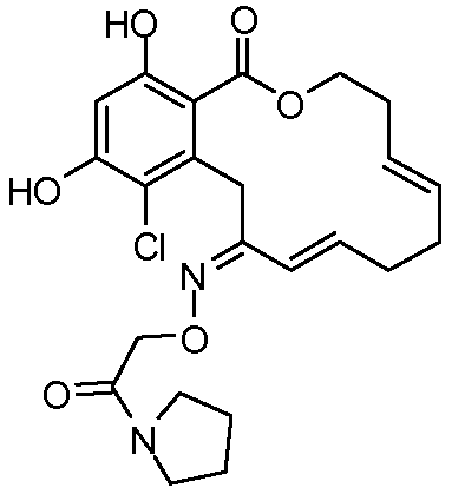

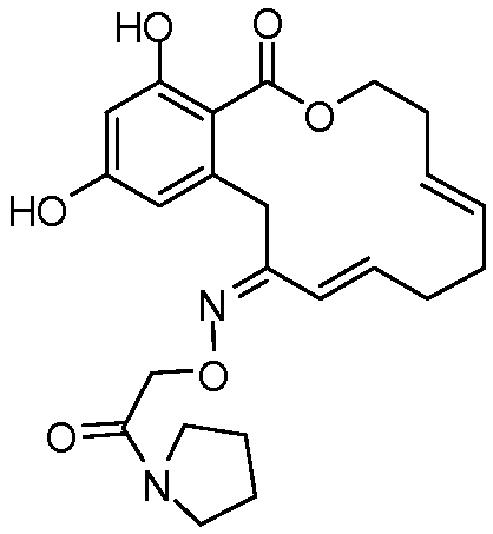


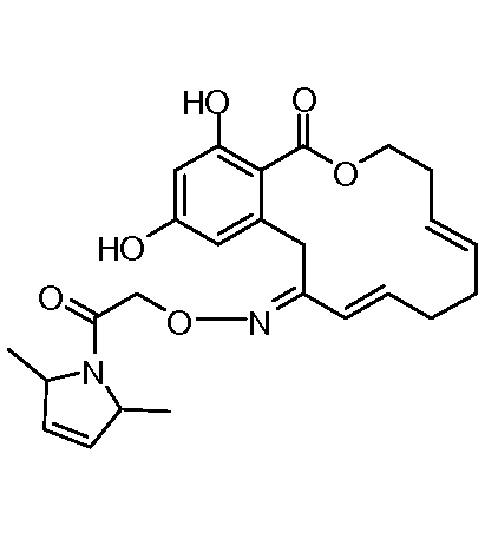
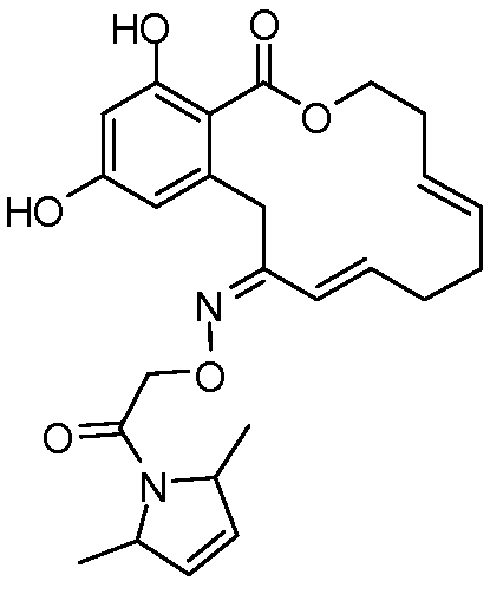

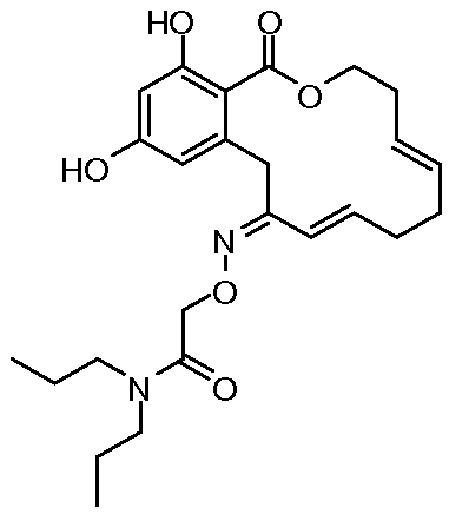

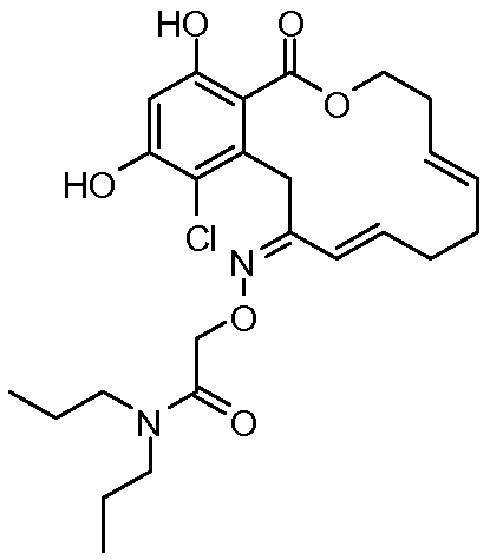
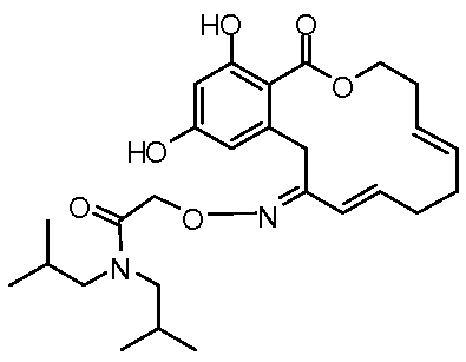

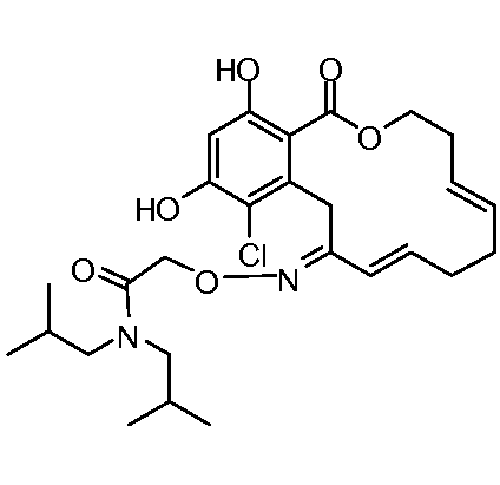
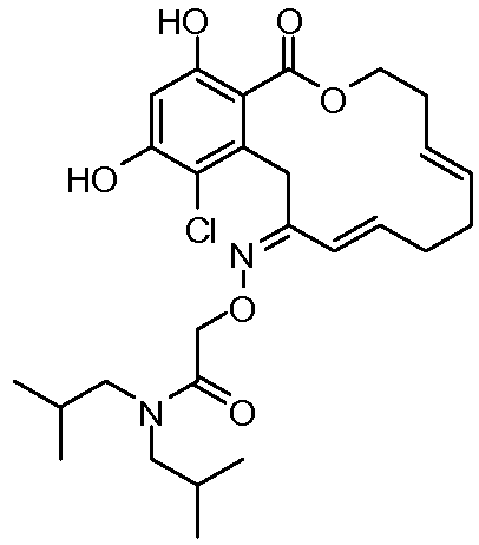
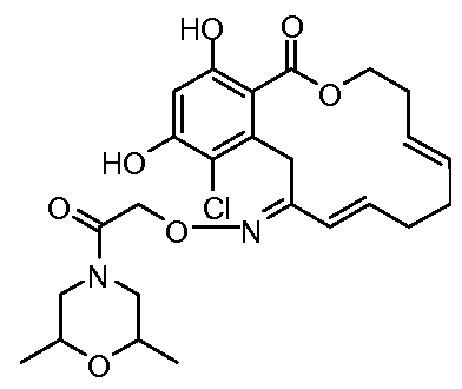

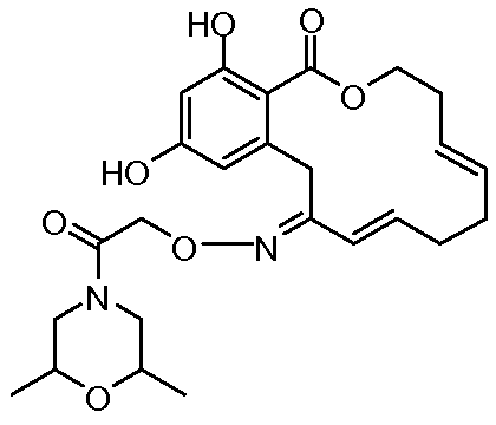

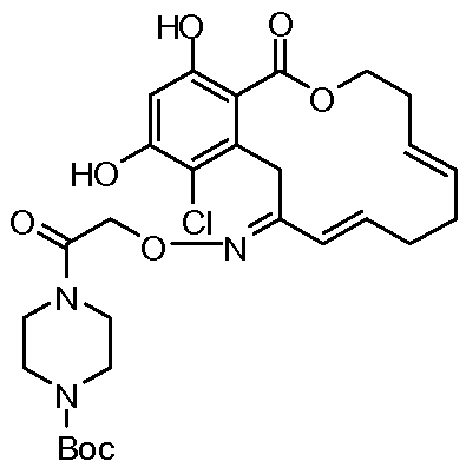
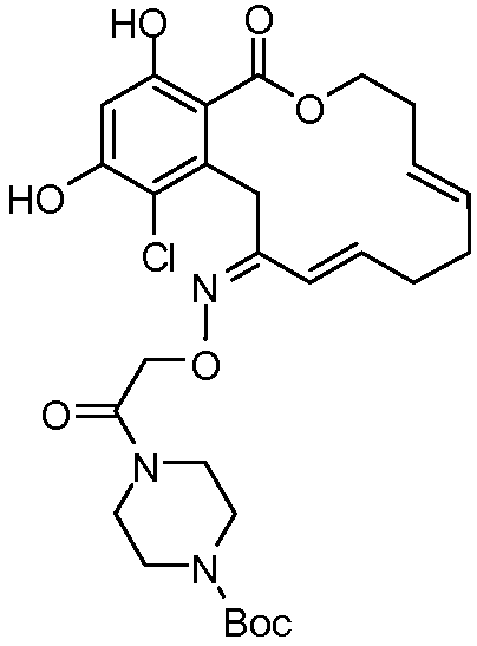





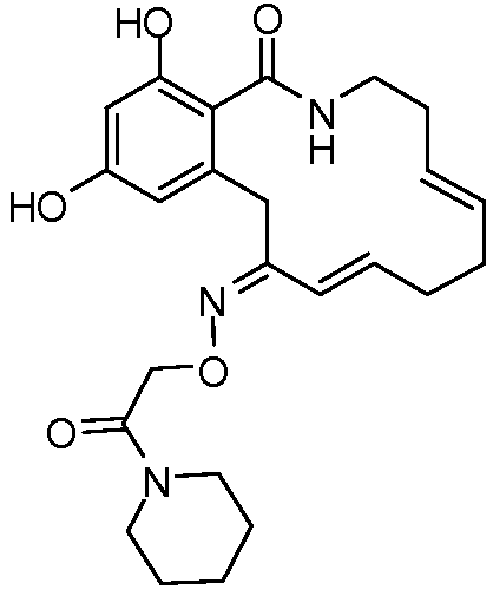
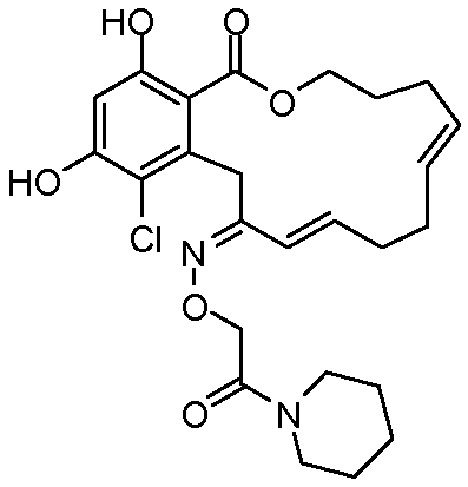


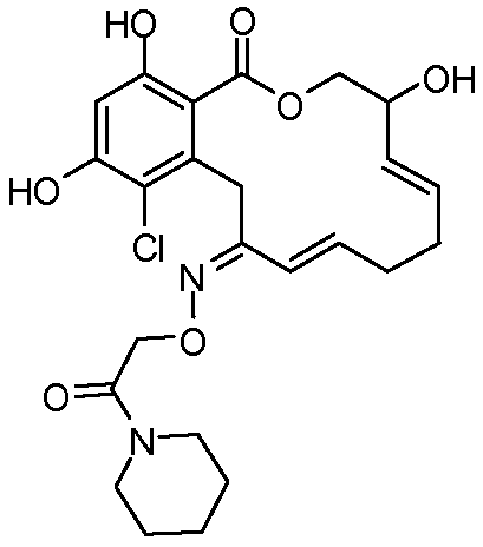
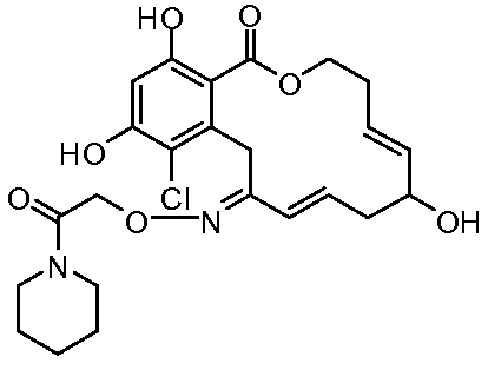
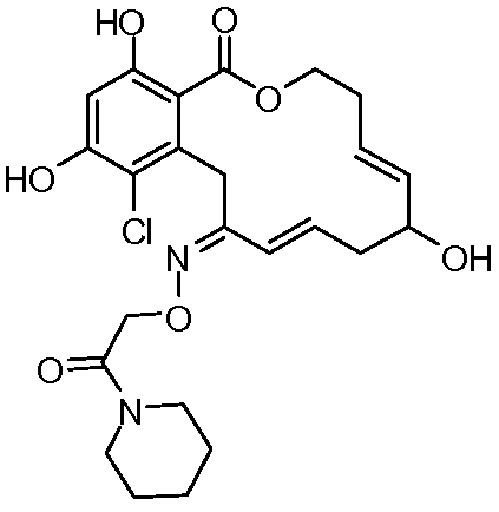
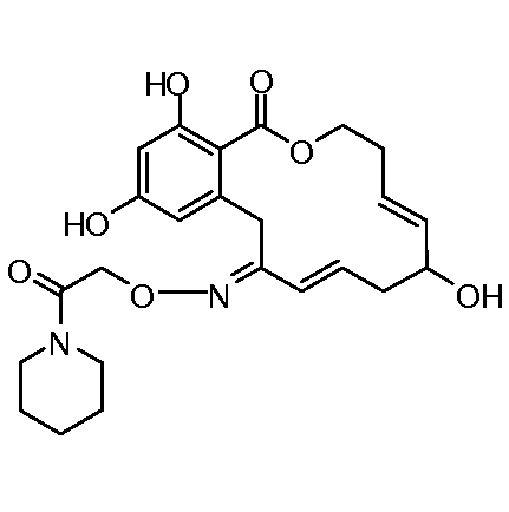
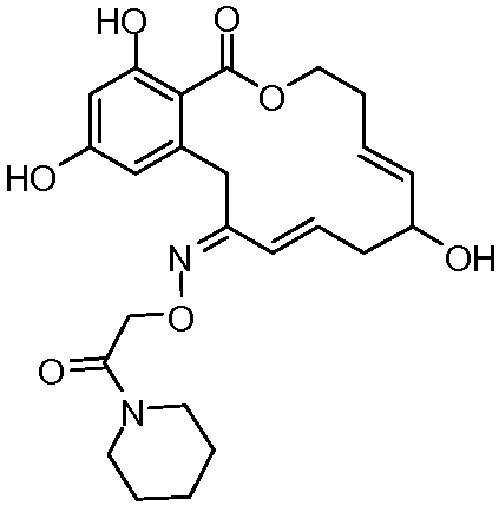
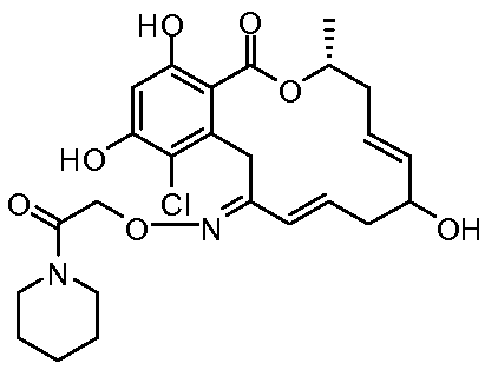
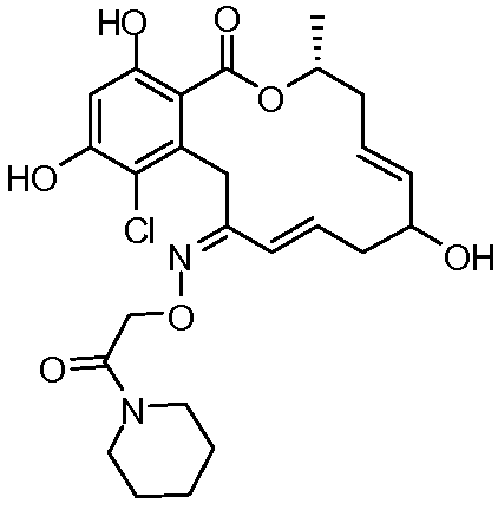

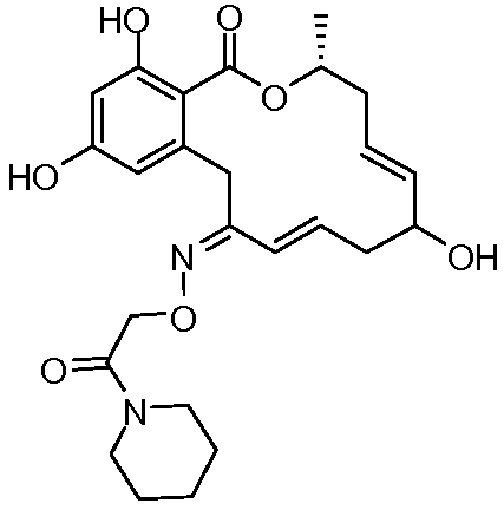
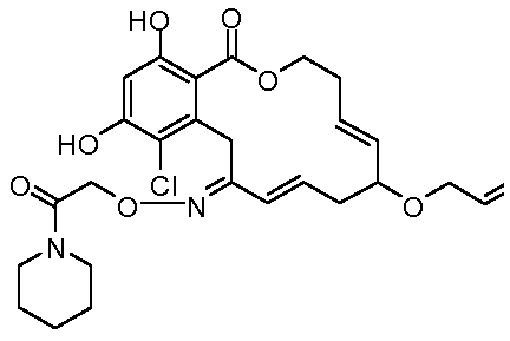
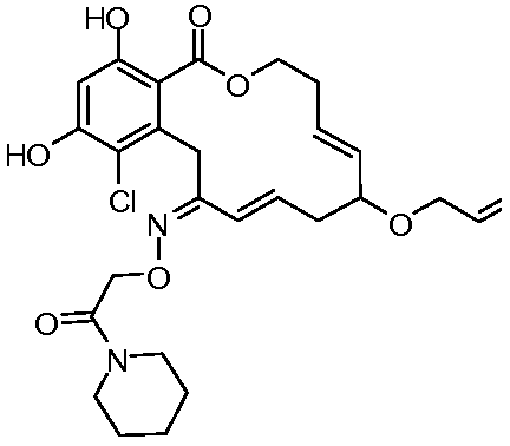
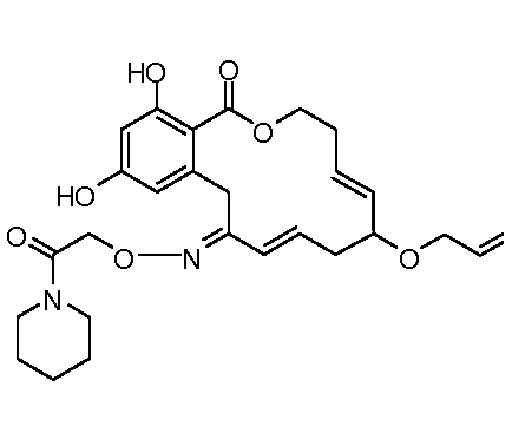
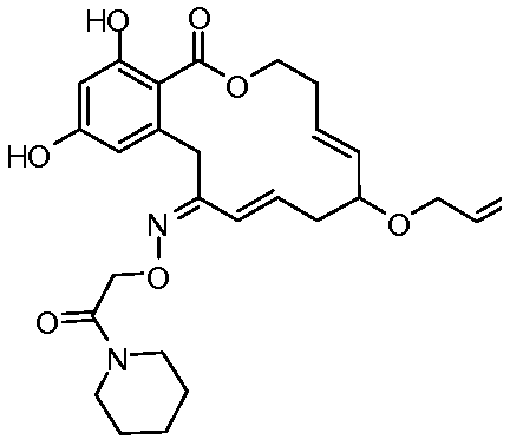
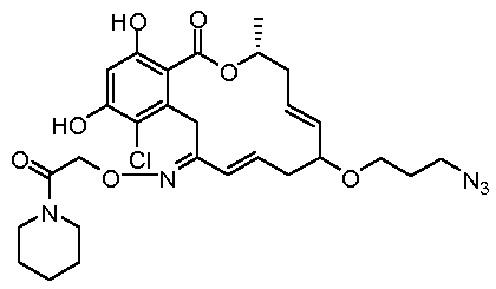
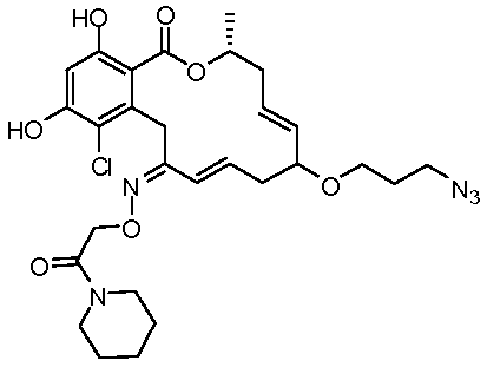


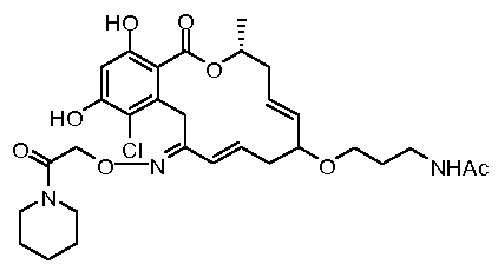
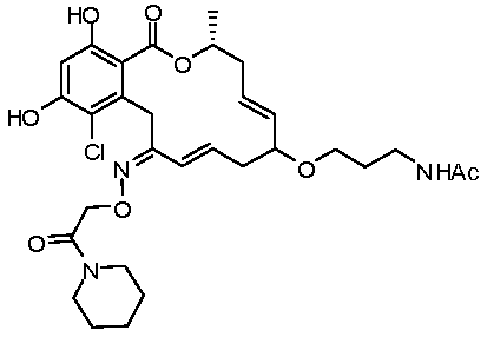
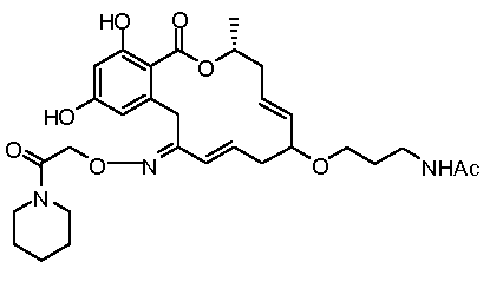
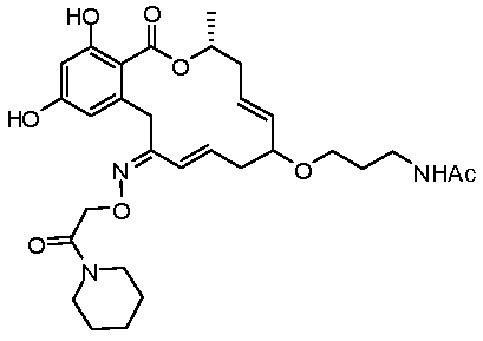
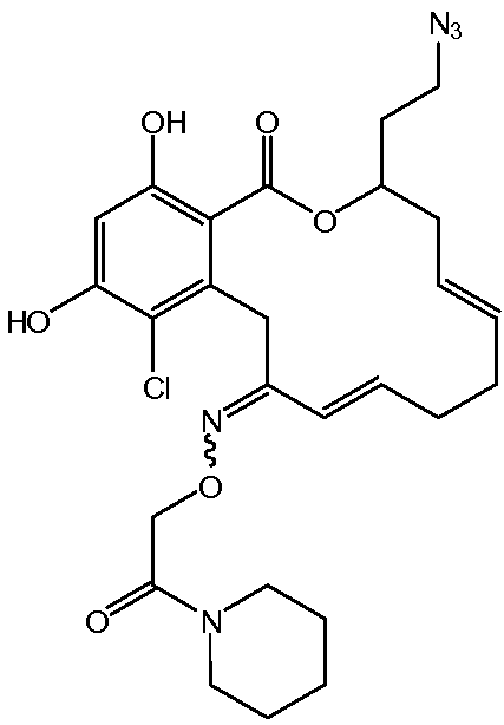
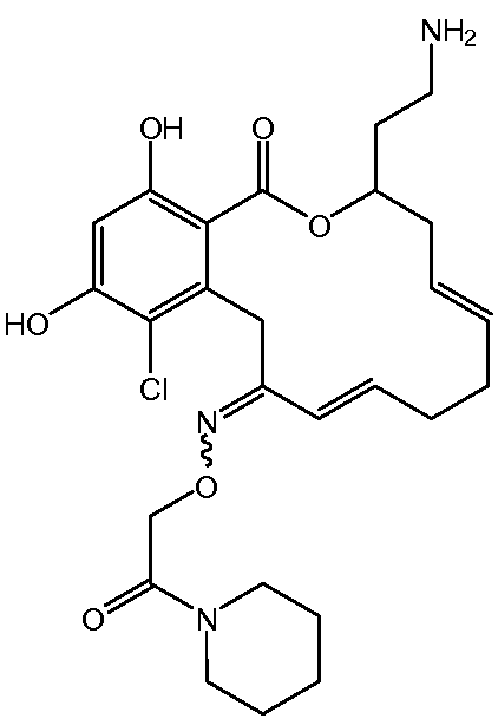
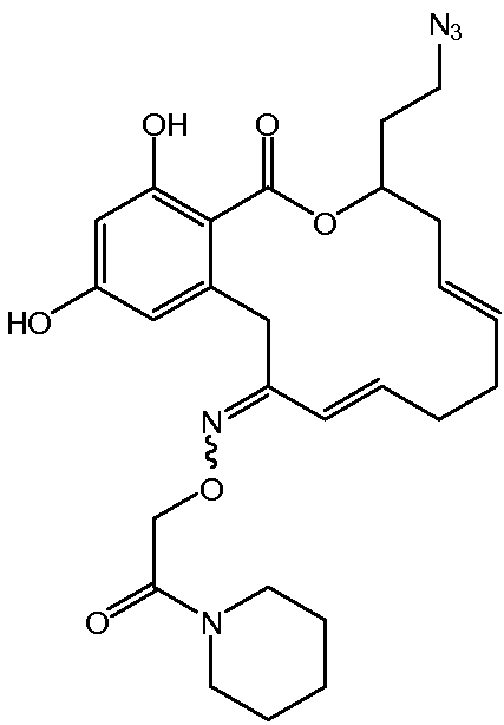




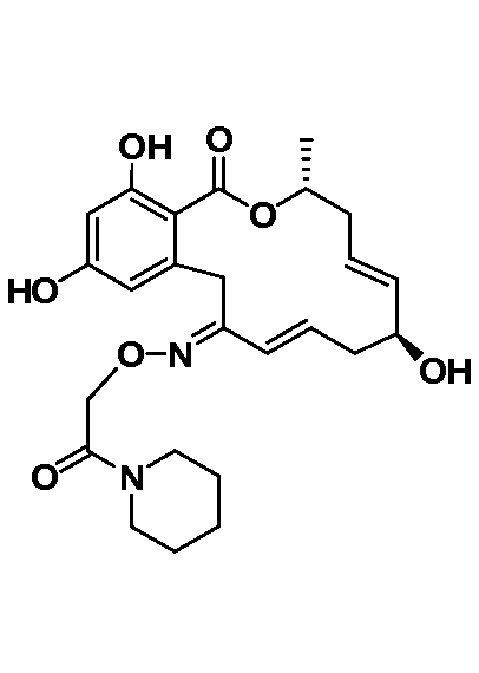

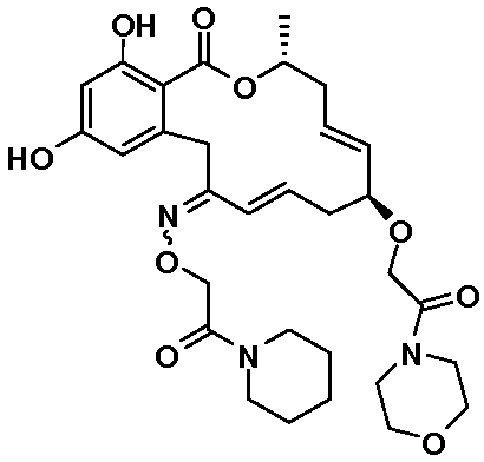



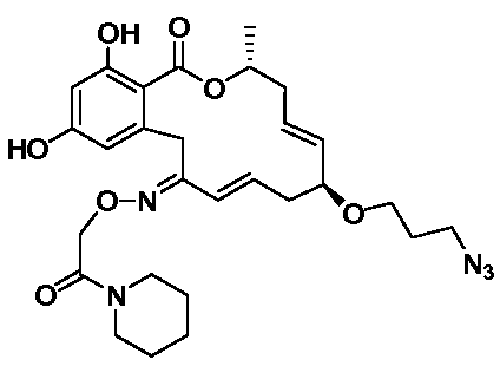

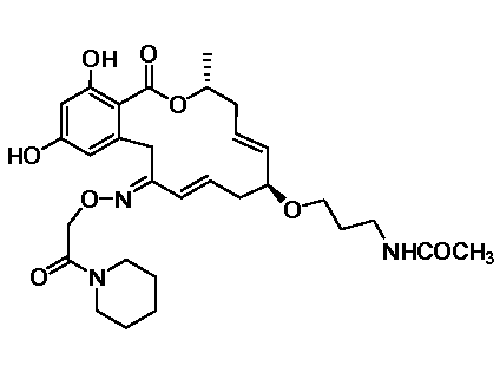

Комментарии