Противовирусные соединения - RU2541571C2
Код документа: RU2541571C2
Описание
По настоящей заявке испрашивается приоритет на основании предварительной патентной заявки США № 61/169449, поданной 15 апреля 2009 года, и предварительной патентной заявки США № 61/222591, поданной 2 июля 2009 года, содержание которых полностью включено в настоящую заявку в качестве ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к соединениям, эффективным для ингибирования репликации вируса гепатита С ("HCV"). Настоящее изобретение также относится к композициям, содержащим эти соединения, и способам применения этих соединений для лечения HCV инфекции.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
HCV представляет собой РНК вирус, относящийся к роду Hepacivirus семейства Flaviviridae. HCV заключает в себе вирионы, которые содержат прямоцепочечный РНК геном, кодирующий все известные вирус-специфические белки в одной единственной непрерываемой открытой рамке считывания. Открытая рамка считывания включает приблизительно 9500 нуклеотидов, кодирующих один большой полипротеин, состоящий из около 3000 аминокислот. Полипротеин включает белок сердцевины, белки оболочки E1 и E2, мембраносвязанный белок p7 и неструктурные белки NS2, NS3, NS4A, NS4B, NS5A и NS5B.
Инфекция HCV связана с прогрессирующей патологией печени, включая цирроз и гепатоцеллюлярную карциному. Хронический гепатит C можно лечить при помощи пэгинтерферона-альфа в сочетании с рибавирином. Остаются существенные ограничения в том, что касается эффективности и переносимости этого средства, поскольку многие пользователи страдают от побочных эффектов, и выведение вируса из организма часто является неадекватным. Поэтому существует необходимость в новых лекарственных средствах для лечения HCV инфекции.
КРАТКОЕ СОДЕРЖАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение включает соединения формул I, IA, IB и Ic и их фармацевтически приемлемые соли. Эти соединения и соли способны к ингибированию репликации HCV, и поэтому их можно использовать для лечения HCV инфекции.
Настоящее изобретение также включает композиции, содержащие соединения или соли по настоящему изобретению. Композиции также могут включать другие терапевтические средства, такие как ингибиторы HCV геликазы, ингибиторы HCV полимеразы, ингибиторы HCV протеазы, ингибиторы HCV NS5A, ингибиторы CD81, ингибиторы циклофилина или ингибиторы сайта проникновения внутрь рибосомы (IRES).
Настоящее изобретение также включает способы применения соединений или солей по настоящему изобретению для ингибирования репликации HCV. Способы включают контактирование клеток, инфицированных HCV вирусом, с соединением или солью по настоящему изобретению, с осуществлением, таким образом, ингибирования репликации HCV вируса в клетках.
Кроме того, настоящее изобретение включает способы применения соединений или солей по настоящему изобретению или композиций, включающих такие соединения или соли, для лечения HCV инфекции. Способы включают введение соединения или соли по настоящему изобретению или фармацевтической композиции, включающей такое соединение или соль, нуждающемуся в этом пациенту, снижая, таким образом, уровень HCV вируса в крови или ткани пациента.
Настоящее изобретение также включает применение соединений или солей по настоящему изобретению для получения лекарственных средств для лечения HCV инфекции.
Кроме того, настоящее изобретение включает способы получения соединений или солей по настоящему изобретению.
Другие характерные признаки, задачи и преимущества настоящего изобретения очевидны из подробного описания, представленного ниже. Однако должно быть понятно, что подробное описание, хотя оно и представляет предпочтительные варианты воплощения настоящего изобретения, представлено исключительно в иллюстративных целях, а не для ограничения. Различные изменения и модификации, не выходящие за рамки объема настоящего изобретения, должны быть очевидны для специалистов в данной области на основании подробного описания изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение включает соединения, имеющие формулу I, и их фармацевтически приемлемые соли,
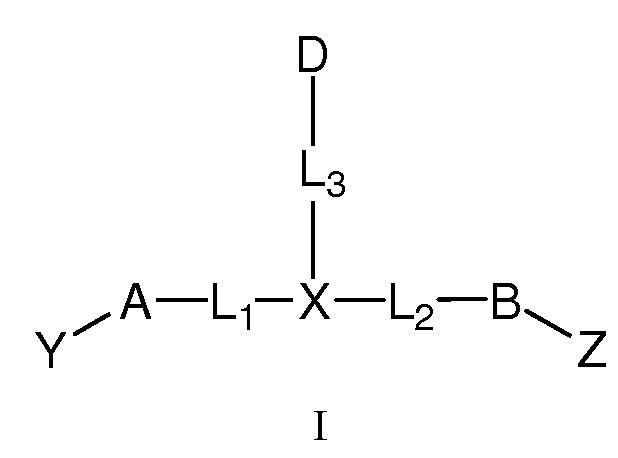
где:
A и B, каждый независимо, представляют собой C3-C10карбоцикл или 3-10-членный гетероцикл и, каждый независимо, необязательно замещены одним или несколькими заместителями RA;
D представляет собой C3-C10карбоцикл или 3-10-членный гетероцикл и необязательно замещен одним или несколькими заместителями RA; или D представляет собой RD;
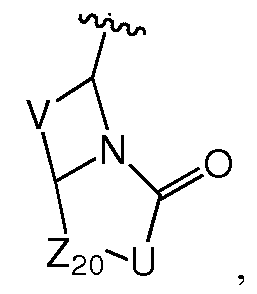
X представляет собой C(RC) или N;
L1 и L2, каждый независимо, выбраны из связи; или С1-C6алкилена, C2-C6алкенилена или C2-C6алкинилена, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, RT, -O-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано;
L3 представляет собой связь или -LS-K-LS'-, где K выбран из связи, -O-, -S-, -N(RB)-, -C(O)-, -S(O)2-, -S(O)-, -OS(O)-, -OS(O)2-, -S(O)2O-, -S(O)O-, -C(O)O-, -OC(O)-, -OC(O)O-, -C(O)N(RB)-, -N(RB)C(O)-, -N(RB)C(O)O-, -OC(O)N(RB)-, -N(RB)S(O)-, -N(RB)S(O)2-, -S(O)N(RB)-, -S(O)2N(RB)-, -C(O)N(RB)C(O)-, -N(RB)C(O)N(RB')-, -N(RB)SO2N(RB')- или -N(RB)S(O)N(RB')-;
Y выбран из -T'-C(R1R2)N(R5)-T-RD, -T'-C(R3R4)C(R6R7)-T-RD, -LK-T-RD или -LK-E;
R1 и R2, каждый независимо, представляют собой Rc, и R5 представляет собой RB; или R1 представляет собой Rc, и R2 и R5, взятые вместе с атомами, к которым они присоединены, образуют 3-8-членное гетероциклическое кольцо, которое необязательно замещено одним или несколькими заместителями RA;
R3, R4, R6 и R7, каждый независимо, представляют собой Rc; или R3 и R6, каждый независимо, представляют собой Rc, и R4 и R7, взятые вместе с атомами, к которым они присоединены, образуют 3-8-членное карбоциклическое или гетероциклическое кольцо, которое необязательно замещено одним или несколькими заместителями RA;
Z выбран из -T'-C(R8R9)N(R12)-T-RD, -T'-C(R10R11)C(R13R14)-T-RD, -LK-T-RD или -LK-E;
R8 и R9, каждый независимо, представляют собой Rc, и R12 представляет собой RB; или R8 представляет собой Rc, и R9 и R12, взятые вместе с атомами, к которым они присоединены, образуют 3-8-членное гетероциклическое кольцо, которое необязательно замещено одним или несколькими заместителями RA;
R10, R11, R13 и R14, каждый независимо, представляют собой Rc; или R10 и R13, каждый независимо, представляют собой Rc, и R11 и R14, взятые вместе с атомами, к которым они присоединены, образуют 3-8-членное карбоциклическое или гетероциклическое кольцо, которое необязательно замещено одним или несколькими заместителями RA;
LK независимо выбран, в каждом случае, из связи; -N(RB)C(О)-LS-; -C(O)N(RB)-LS-; или С1-C6алкилена, C2-C6алкенилена, C2-C6алкинилена, C3-C10карбоцикла или 3-10-членного гетероцикла, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, RT, -О-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано;
E независимо выбран, в каждом случае, из C3-C10карбоцикла или 3-10-членного гетероцикла и является, независимо, необязательно замещенным в каждом случае одним или несколькими заместителями RA;
T и T', каждый независимо, в каждом случае выбраны из связи, -LS-, -LS-M-LS'-, -Ls-M-Ls'-M'-Ls"-, где M и M', каждый независимо, в каждом случае выбраны из связи, -O-, -S-, -N(RB)-, -C(O)-, -S(O)2-, -S(O)-, -OS(O)-, -OS(O)2-, -S(O)2O-, -S(O)O-, -C(O)O-, -OC(O)-, -OC(O)O-, -C(O)N(RB)-, -N(RB)C(O)-, -N(RB)C(O)O-, -OC(O)N(RB)-, -N(RB)S(O)-, -N(RB)S(O)2-, -S(O)N(RB)-, -S(O)2N(RB)-, -C(O)N(RB)C(O)-, -N(RB)C(O)N(RB')-, N(RB)SO2N(RB')-, -N(RB)S(O)N(RB')-, C3-C10карбоцикла или 3-10-членного гетероцикла, и где указанный C3-C10карбоцикл и 3-10-членный гетероцикл, каждый независимо, необязательно замещены в каждом случае одним или несколькими заместителями RA;
RA независимо выбран, в каждом случае, из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила, циано, -LA или -LS-RE, где две смежные группы RA, взятые вместе с атомами, к которым они присоединены, и любыми атомами, расположенными между атомами, к которым они присоединены, необязательно образуют C3-C10карбоцикл или 3-10-членный гетероцикл;
RB и RB', каждый независимо, в каждом случае выбраны из водорода или RF;
RC независимо выбран, в каждом случае, из водорода, галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила, циано или RF;
RD, каждый независимо, выбран в каждом случае из водорода или RA:
RE независимо выбран, в каждом случае, из -О-RS, -S-RS, -C(O)RS, -OC(O)RS, -C(O)ORS, -N(RSRS'), -S(O)RS, -SO2RS, -C(O)N(RSRS'), -N(RS)C(O)RS', -N(RS)C(O)N(RS'RS"), -N(RS)SO2RS', -SO2N(RSRS'), -N(RS)SO2N(RS'RS"), -N(RS)S(O)N(RS'RS"), -OS(O)-RS, -OS(O)2-RS, -S(O)2ORS, -S(O)ORS, -OC(O)ORS, -N(RS)C(O)ORS', -OC(O)N(RSRS'), -N(RS)S(O)-RS', -S(O)N(RSRS'), -C(O)N(RS)C(O)-RS', C3-C10карбоциклила или 3-10-членного гетероциклила, где указанный C3-C10карбоциклил и 3-10-членный гетероциклил, каждый независимо, необязательно замещены в каждом случае одним или несколькими заместителями, выбранными из галогена, RT, -O-RB, -S-RB, -N(RBRB'), -OC(O)RB, -C(O)ORB, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано;
RF независимо выбран, в каждом случае, из С1-C6алкила, C2-C6алкенила, C2-C6алкинила, C3-C6карбоциклила, C3-C6карбоциклилС1-C6алкила, 3-6-членного гетероциклила или (3- или 6-членный гетероциклил)С1-C6алкила, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано;
LA независимо выбран, в каждом случае, из С1-C6алкила, C2-C6алкенила или C2-C6алкинила, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, RT, -O-Rs, -S-Rs, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано;
LS, LS' и LS", каждый независимо, выбраны в каждом случае из связи; или С1-C6лкилена, C2-C6алкенилена или C2-C6алкинилена, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, RT, -О-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано;
RS, RS' и RS", каждый независимо, выбраны в каждом случае из водорода или RT;
RT независимо выбран, в каждом случае, из С1-C6алкила, C2-C6алкенила, C2-C6алкинила, C3-C6карбоциклила, C3-C6карбоциклилС1-C6алкила, 3-6-членного гетероциклила или (3- или 6-членный гетероциклил)С1-C6алкила, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, RF, -O-RB, -S-RB, -N(RBRB'), -OC(O)RB, -C(O)ORB, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано.
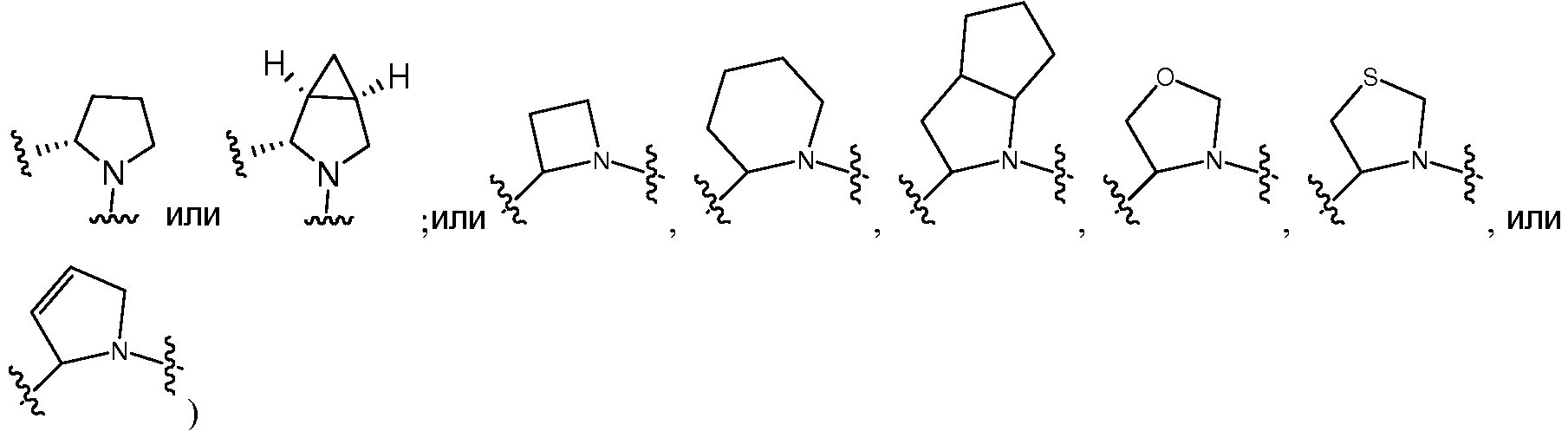
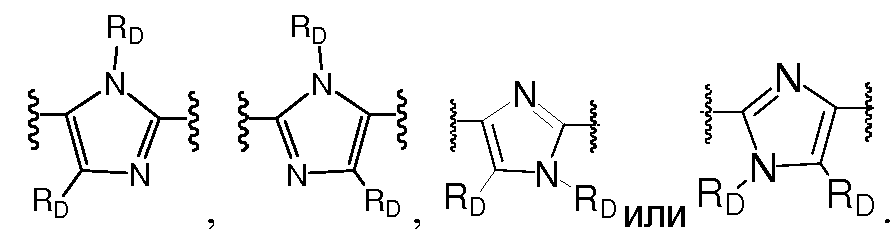
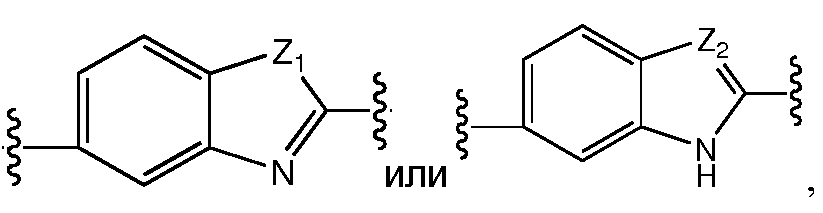
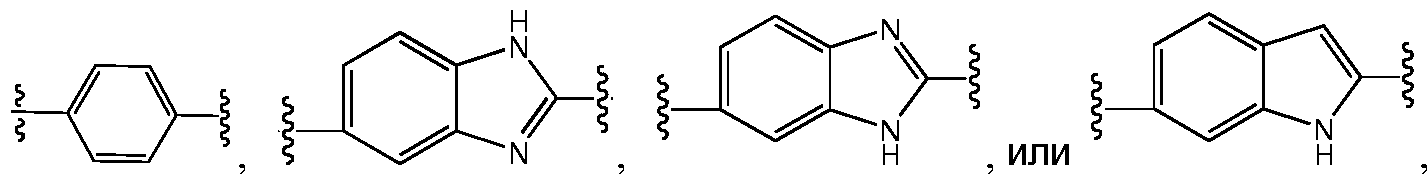
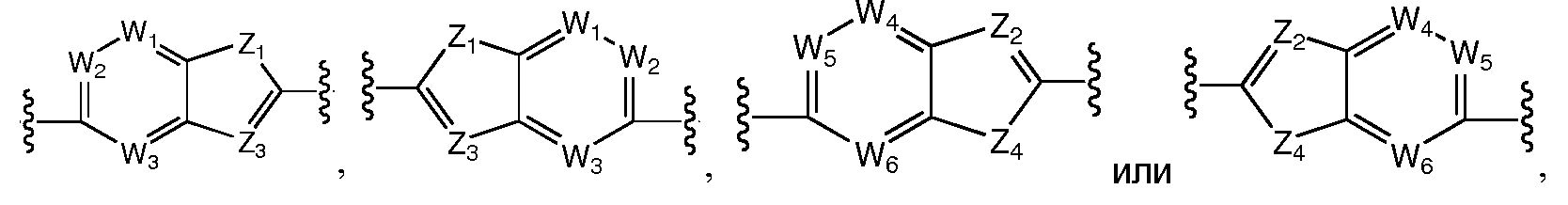
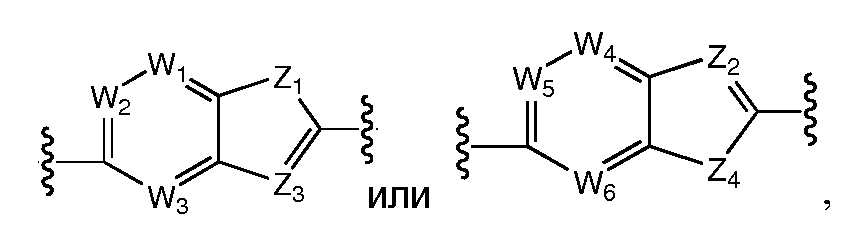
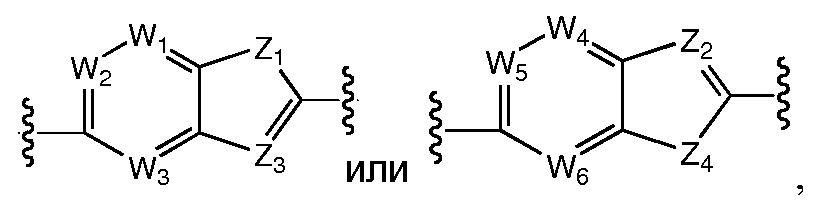
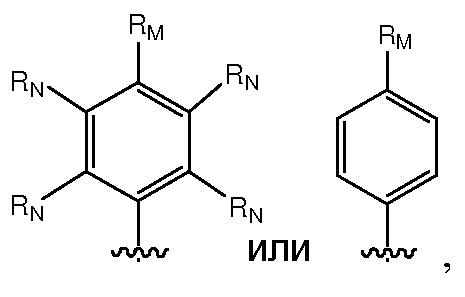
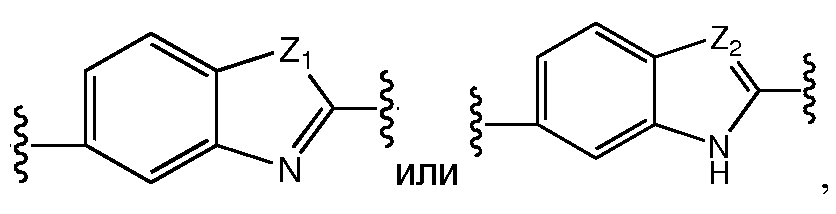
A и B предпочтительно независимо выбраны из С5-C6карбоцикла, 5-6-членного гетероцикла или 8-10-членных бициклов, таких как
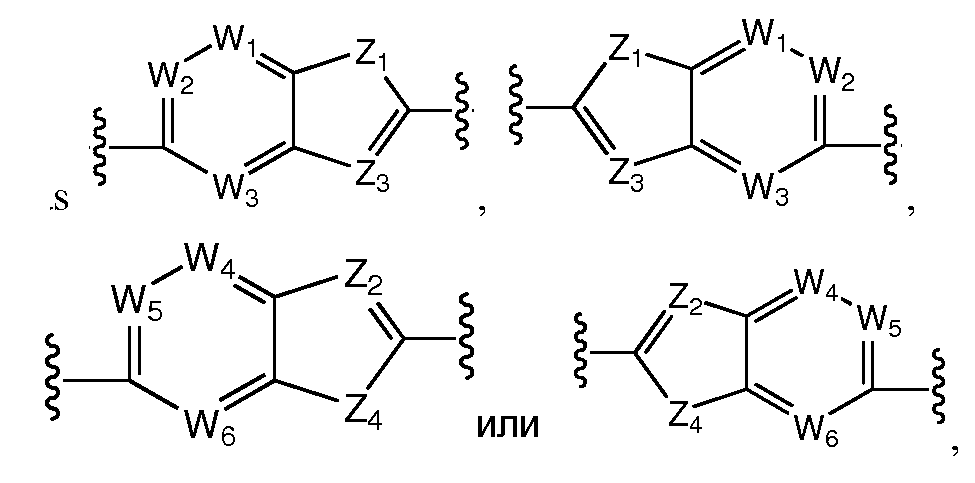
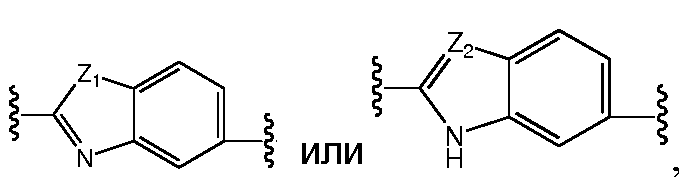
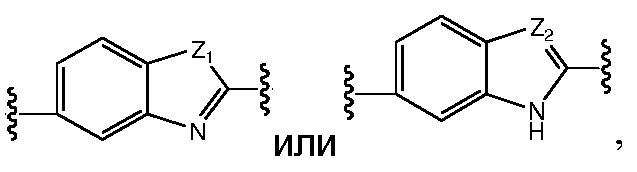
где Z1независимо выбран в каждом случае из O, S, NH или CH2, Z2 независимо выбран в каждом случае из N или CH, Z3 независимо выбран в каждом случае из N или CH, Z4 независимо выбран в каждом случае из O, S, NH или CH2, и W1, W2, W3, W4, W5 и W6, каждый независимо, выбраны в каждом случае из CH или N. A и B, каждый независимо, необязательно замещены одним или несколькими заместителями RA.
Более предпочтительно, A выбран из С5-C6карбоцикла, 5-6-членного гетероцикла
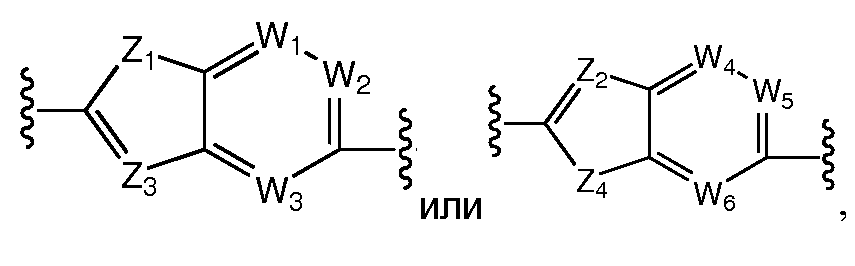



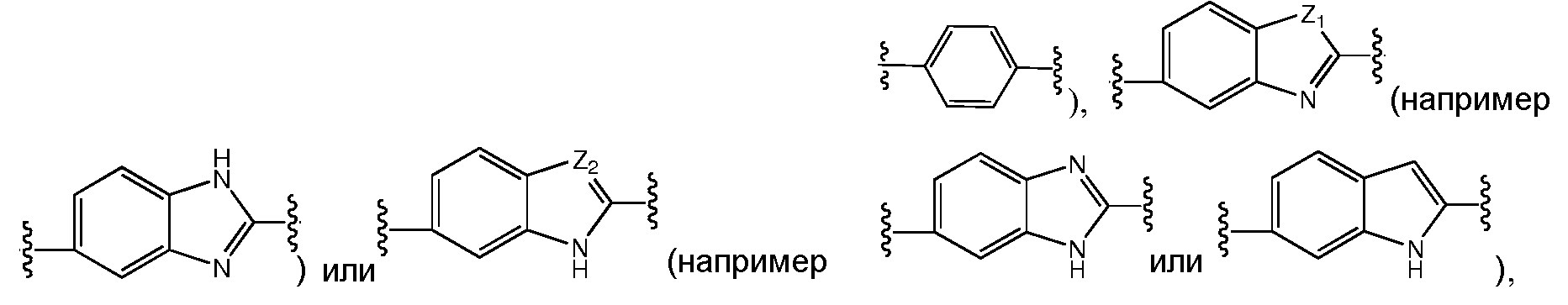
D предпочтительно выбран из C5-C6карбоцикла, 5-6-членного гетероцикла или 8-10-членных бициклов и необязательно замещен одним или несколькими заместителями RA. D также может быть предпочтительно выбран из С1-C6алкила, C2-C6алкенила или C2-C6алкинила и необязательно замещен одним или несколькими заместителями, выбранными из галогена, RT, -O-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано. Более предпочтительно, D представляет собой C5-C6карбоцикл, 5-6-членный гетероцикл или 6-10-членные бициклы и замещен одним или несколькими заместителями RM, где RM представляет собой галоген, нитро, оксо, фосфонокси, фосфоно, тиоксо, циано или -LS-RE. Также предпочтительно, D представляет собой фенил и необязательно замещен одним или несколькими заместителями RA. Более предпочтительно, D представляет собой фенил и замещен одним или несколькими заместителями RM, где RM имеет значение, определенное выше. Наиболее предпочтительно, D представляет собой

Предпочтительно, RM представляет собой галоген, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, циано; или С1-C6алкил, C2-C6алкенил или C2-C6алкинил, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано; или C3-C6карбоцикл или 3-6-членный гетероцикл, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила, циано, С1-C6алкила, C2-C6алкенила, C2-C6алкинила, С1-C6галогеналкила, C2-C6галогеналкенила или C2-C6галогеналкинила. Более предпочтительно, RM представляет собой галоген, гидрокси, меркапто, амино, карбокси; или С1-C6алкил, C2-C6алкенил или C2-C6алкинил, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино или карбокси. Наиболее предпочтительно, RM представляет собой С1-C6алкил, который необязательно замещен одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино или карбокси.
X предпочтительно представляет собой N.
L1 и L2 предпочтительно представляют собой представляют собой, независимо, С1-C6алкилен, и L3 предпочтительно выбран из связи, С1-C6алкилена или -C(O)-. L1, L2 и L3, каждый независимо, необязательно замещены одним или несколькими заместителями, выбранными из галогена, RT, -O-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано. Более предпочтительно, L1 и L2 представляют собой -(CH2)- и, каждый независимо, необязательно замещены одним или несколькими заместителями, выбранными из галогена, RT, -O-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано; и L3 представляет собой связь или -C(O)-.
Y предпочтительно выбран из -LS-C(R1R2)N(R5)-T-RD, -LS-C(R3R4)C(R6R7)-T-RD, -G-C(R1R2)N(R5)-T-RD, -G-C(R3R4)C(R6R7)-T-RD, -N(RB)C(O)C(R1R2)N(R5)-T-RD, -N(RB)C(O)C(R3R4)C(R6R7)-T-RD, -C(O)N(RB)C(R1R2)N(R5)-T-RD, -C(O)N(RB)C(R3R4)C(R6R7)-T-RD, -N(RB)C(O)-LS-E или -C(О)N(RB)-LS-E. G представляет собой C5-C6карбоцикл или 5-6-членный гетероцикл, такой как

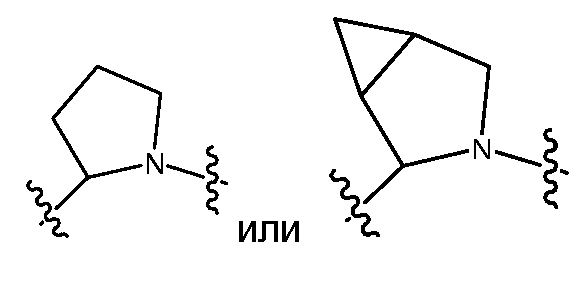

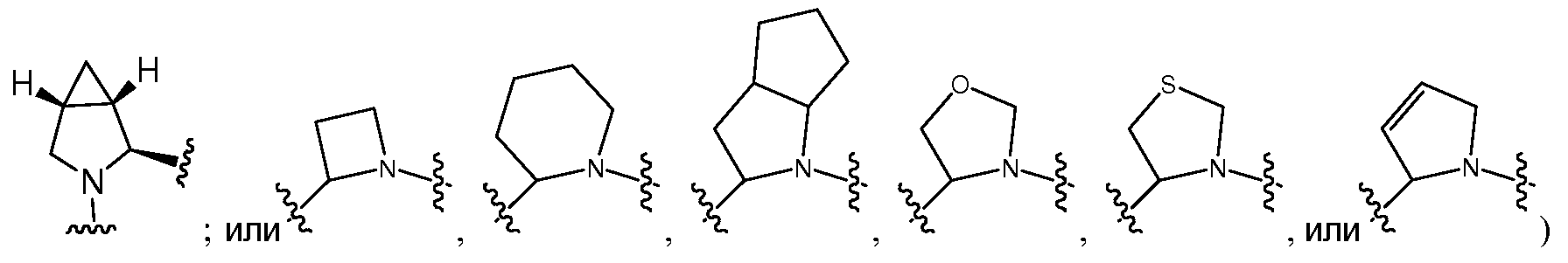
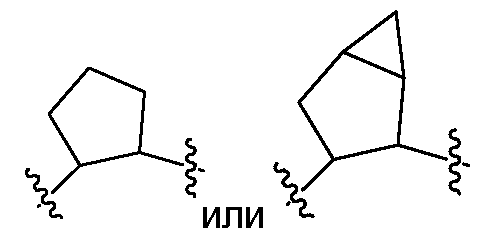
который необязательно замещен одним или несколькими заместителями RA (такими как, но не ограничиваясь этим, гидрокси, галоген (например, фтор), С1-C6алкил (например, метил) или С2-C6алкенил (например, аллил)); и R3 и R6, каждый независимо, представляют собой Rc, и R4 и R7, взятые вместе с атомами, к которым они присоединены, образуют 5-6-членное карбоциклическое или гетероциклическое кольцо или 6-10-членный бицикл (например,

Y также может быть выбран из -M-C(R1R2)N(R5)-C(O)-LY'-M'-RD, -M-C(R1R2)N(R5)-Ly'-M'-RD, -Ls-C(R1R2)N(R5)-C(O)-LY'-M'-RD, -Ls-C(R1R2)N(R5)-LY'-M'-RD, -M-C(R3R4)C(R6R7)-C(O)-LY'-M'-RD, -M-C(R3R4)C(R6R7)-LY'-M'-RD, -LS-C(R3R4)C(R6R7)-С(O)-LY'-M'-RD или -LS-C(R3R4)C(R6R7)-LY'-M'-RD, где M предпочтительно представляет собой связь, -C(O)N(RB)- или -N(RB)C(O)-, M' предпочтительно представляет собой связь, -C(O)N(RB)-, -N(RB)C(O)-, -N(RB)C(O)O-, N(RB)C(O)N(RB')-, -N(RB)S(O)- или -N(RB)S(O)2-, и LY' представляет собой LS', и предпочтительно LY' представляет собой C1-C6алкилен, который необязательно замещен одним или несколькими заместителями, выбранными из галогена, RT, -O-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано. Более предпочтительно, R1 представляет собой Rc, и R2 и R5, взятые вместе с атомами, к которым они присоединены, образуют 5-6-членный гетероцикл или 6-10-членный бицикл (например,


Также предпочтительно, Y выбран из -N(RB)CO-C(R1R2)N(R5)-C(O)-LY'-N(RB)C(O)O-RD, -N(RB)CO-C(R1R2)N(R5)-C(O)-LY'-N(RB)C(O)-RD, -N(RB)CO-C(R1R2)N(R5)-C(O)-LY'-N(RB)S(О)2-RD, -N(RB)CO-C(R1R2)N(R5)-C(O)-LY'-N(RBRB')-RD, -N(RB)CO-C(R1R2)N(R5)-C(O)LY'-O-RD, -N(RB)CO-C(R1R2)N(R5)-C(O)-LY'-RD, -N(RB)CO-C(R1R2)N(R5)-RD, -LS-C(R1R2)N(R5)-C(О)-LY'-N(RB)C(О)O-RD, -LS-C(R1R2)N(R5)-C(O)-LY'-N(RB)C(O)-RD, -LS-C(R1R2)N(R5)-C(O)-LY'-N(RB)S(O)2-RD, -LS-C(R1R2)N(R5)-C(O)-LY'-N(RBRB')-RD, -LS-C(R1R2)N(R5)-C(O)-LY'-О-RD, -LS-C(R1R2)N(R5)-С(О)-LY'-RD, -LS-C(R1R2)N(R5)-RD, -N(RB)CO-C(R3R4)C(R6R7)-C(O)-LY'-N(RB)C(O)O-RD, -N(RB)CO-C(R3R4)C(R6R7)-C(O)-LY'-N(RB)C(O)-RD, -N(RB)CO-C(R3R4)C(R6R7)-C(O)-LY'-N(RB)S(O)2-RD, -N(RB)CO-C(R3R4)C(R6R7)-C(O)-LY'-N(RBRB')-RD, -N(RB)CO-C(R3R4)C(R6R7)-C(O)-LY'-O-RD, -N(RB)CO-C(R3R4)C(R6R7)-C(O)-LY'-RD, -N(RB)CO-C(R3R4)C(R6R7)-RD, -LS-C(R3R4)C(R6R7)-C(О)-LY'-N(RB)C(О)O-RD, -LS-C(R3R4)C(R6R7)-C(O)-LY'-N(RB)C(O)-RD, -LS-C(R3R4)C(R6R7)-C(O)-LY'-N(RB)S(O)2-RD, -LS-C(R3R4)C(R6R7)-C(O)-LY'-N(RBRB')-RD, -LS-C(R3R4)C(R6R7)-C(O)-LY'-O-RD, -LS-C(R3R4)C(R6R7)-C(O)-LY'-RD или -LS-C(R3R4)C(R6R7)-RD, где LY' представляет собой LS', и предпочтительно LY' представляет собой C1-C6алкилен, который необязательно замещен одним или несколькими заместителями, выбранными из галогена, RT, -O-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано. R1 может представлять собой Rc, и R2 и R5, взятые вместе с атомами, к которым они присоединены, могут образовывать 5-6-членный гетероцикл или 6-10-членный бицикл (например,


Наиболее предпочтительно, Y выбран из -N(RB")CO-C(R1R2)N(R5)-C(O)-LY-N(RB")C(O)-LS-RE или -C(R1R2)N(R5)-C(O)-LY-N(RB")C(O)-Ls-RE, где LY представляет собой С1-C6алкилен, необязательно замещенный одним или несколькими заместителями, выбранными из галогена, RT, -O-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано; и где RB", каждый независимо, представляет собой RB. RB" и R1 каждый предпочтительно представляет собой водород или С1-C6алкил, и R2 и R5, взятые вместе с атомами, к которым они присоединены, предпочтительно образуют 5-6-членный гетероцикл или 6-10-членный бицикл (например,
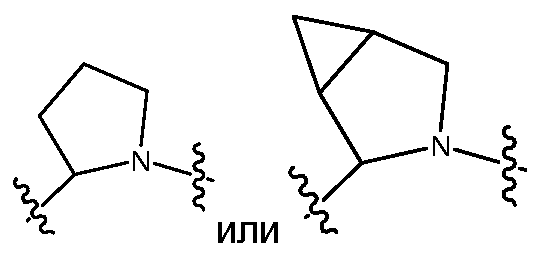
Z предпочтительно выбран из -LS-C(R8R9)N(R12)-T-RD, -LS-C(R10R11)C(R13R14)-T-RD, -G-C(R8R9)N(R12)-T-RD, -G-C(R10R11)C(R13R14)-T-RD, -N(RB)C(O)C(R8R9)N(R12)-T-RD, -N(RB)C(О)C(R10R11)C(R13R14)-T-RD, -C(O)N(RB)C(R8R9)N(R12)-T-RD, -C(О)N(RB)C(R10R11)C(R13R14)-T-RD, -N(RB)C(O)-LS-E или -C(O)N(RB)-LS-E. G представляет собой C5-C6карбоцикл или 5-6-членный гетероцикл, такой как

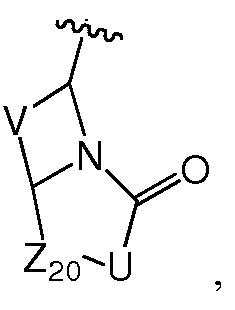
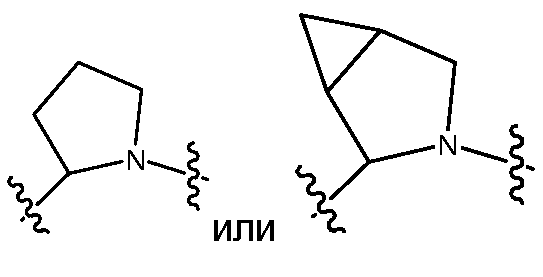

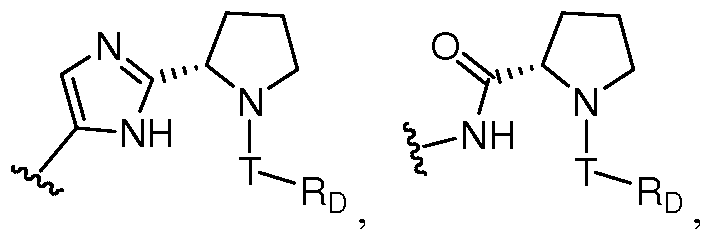
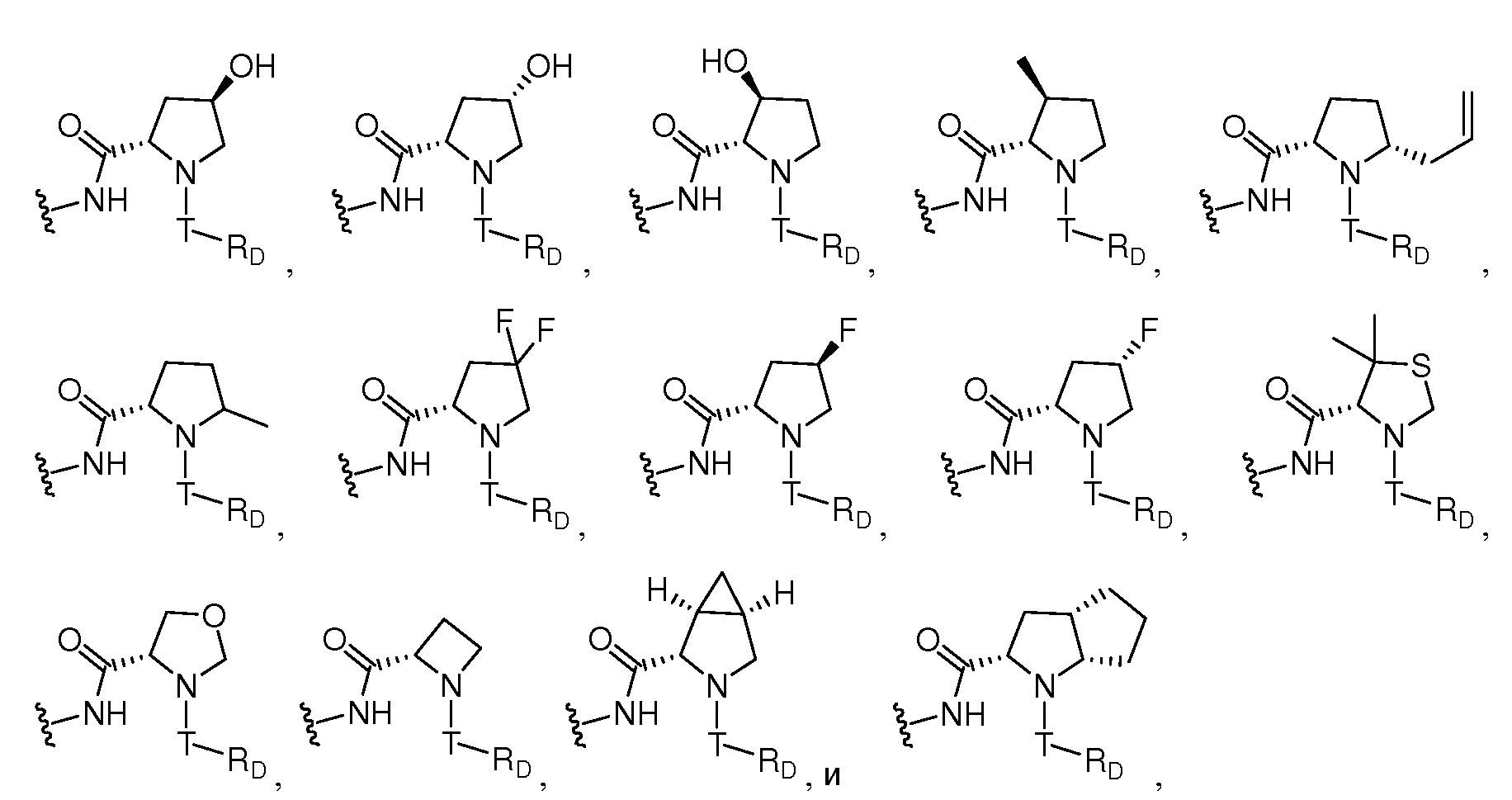
Z также может быть выбран из -M-C(R8R9)N(R12)-C(O)-LY'-M'-RD, -M-C(R8R9)N(R12)-LY'-M'-RD, -LS-C(R8R9)N(R12)-C(O)-LY'-M'-RD, -LS-C(R8R9)N(R12)-LY'-M'-RD, -M-C(R10R11)C(R13R14)-C(O)-LY'-M'-RD, -M-C(R10R11)C(R13R14)-LY'-M'-RD, -LS-C(R10R11)C(R13R14)-C(O)-LY'-M'-RD или -LS-C(R10R11)C(R13R14)-LY'-M'-RD, где M предпочтительно представляет собой связь, -C(O)N(RB)- или -N(RB)C(O)-, M' предпочтительно представляет собой связь, -C(O)N(RB)-, -N(RB)C(O)-, -N(RB)C(O)O-, N(RB)C(O)N(RB')-, -N(RB)S(O)- или -N(RB)S(O)2-, и LY' представляет собой LS', и предпочтительно LY' представляет собой С1-C6алкилен, который необязательно замещен одним или несколькими заместителями, выбранными из галогена, RT, -O-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано. Более предпочтительно, R8 представляет собой Rc, и R9 и R12, взятые вместе с атомами, к которым они присоединены, образуют 5-6-членный гетероцикл или 6-10-членный бицикл (например,


Также предпочтительно, Z выбран из -N(RB)CO-C(R8R9)N(R12)-C(O)-LY'-N(RB)C(O)O-RD, -N(RB)CO-C(R8R9)N(R12)-C(O)-LY'-N(RB)C(O)-RD, -N(RB)CO-C(R8R9)N(R12)-C(O)-LY'-N(RB)S(O)2-RD, -N(RB)CO-C(R8R9)N(R12)-C(O)-LY'-N(RBRB')-RD, -N(RB)CO-C(R8R9)N(R12)-C(O)-LY'-O-RD, -N(RB)CO-C(R8R9)N(R12)-C(O)-LY'-RD, -N(RB)CO-C(R8R9)N(R12)-RD, -LS-C(R8R9)N(R12)-C(O)-LY'-N(RB)C(O)O-RD, -LS-C(R8R9)N(R12)-C(O)-LY'-N(RB)C(O)-RD, -LS-C(R8R9)N(R12)-C(O)-LY'-N(RB)S(O)2-RD, -LS-C(R8R9)N(R12)-C(O)-LY'-N(RBRB')-RD, -LS-C(R8R9)N(R12)-C(O)-LY'-O-RD, -LS-C(R8R9)N(R12)-C(O)-LY'-RD, -LS-C(R8R9)N(R12)-RD, -N(RB)CO-C(R10R11)C(R13R14)-C(O)-LY'-N(RB)C(O)O-RD, -N(RB)CO-C(R10R11)C(R13R14)-C(O)-LY'-N(RB)C(O)-RD, -N(RB)CO-C(R10R11)C(R13R14)-C(O)-LY'-N(RB)S(O)2-RD, -N(R8)CO-C(R10R11)C(R13R14)-C(О)-LY'-N(RBRB')-RD, -N(RB)CO-C(R10R11)C(R13R14)-C(O)-LY'-O-RD, -N(RB)CO-C(R10R11)C(R13R14)-C(O)-LY'-RD, -N(RB)CO-C(R10R11)C(R13R14)-RD, -LS-C(R10R11)C(R13R14)-C(O)-LY'-N(RB)C(O)O-RD, -LS-C(R10R11)C(R13R14)-C(O)-LY'-N(RB)C(O)-RD, -LS-C(R10R11)C(R13R14)-C(O)-LY'-N(RB)S(O)2-RD, -Ls-C(R10R11)C(R13R14)-C(O)-LY'-N(RBRB')-RD, -LS-C(R10R11)C(R13R14)-C(O)-LY'-O-RD, -LS-C(R10R11)C(R13R14)-C(O)-LY'-RD или -LS-C(R10R11)C(R13R14)-RD, где LY' представляет собой LS', и предпочтительно LY' представляет собой С1-C6алкилен, который необязательно замещен одним или несколькими заместителями, выбранными из галогена, RT, -O-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано. R8 может представлять собой Rc, и R9 и R12, взятые вместе с атомами, к которым они присоединены, могут образовывать 5-6-членный гетероцикл или 6-10-членный бицикл (например,


Наиболее предпочтительно, Z выбран из -N(RB")CO-C(R8R9)N(R12)-C(O)-LY-N(RB")C(O)-LS-RE или -C(R8R9)N(R12)-C(O)-LY-N(RB")C(O)-LS-RE, где LY представляет собой С1-C6алкилен, необязательно замещенный одним или несколькими заместителями, выбранными из галогена, RT, -O-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано; и где RB", каждый независимо, представляет собой RB. RB" и R8 каждый предпочтительно представляет собой водород или С1-C6алкил, и R9 и R12, взятые вместе с атомами, к которым они присоединены, предпочтительно образуют 5-6-членный гетероцикл или 6-10-членный бицикл (например,
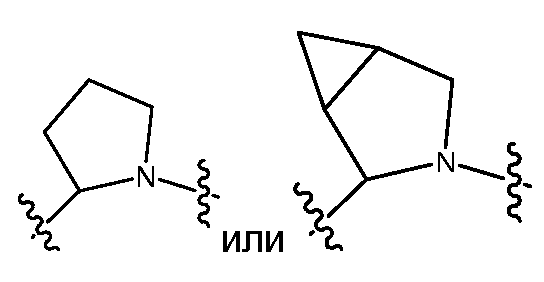
T может быть, без ограничения, независимо выбран в каждом случае из -C(O)-LS'-, -C(O)O-LS'-, -C(O)-LS'-N(RB)C(O)-LS"-, -C(O)-LS'-N(RB)C(O)O-LS"-, -N(RB)C(O)-LS'-N(RB)C(O)-LS"-, -N(RBB)C(O)-LS'-N(RB)C(O)O-LS"- или -N(RB)C(O)-LS'-N(RB)-LS"-. Предпочтительно, T независимо выбран в каждом случае из -C(O)-LS'-M'-LS"- или -N(RB)C(O)-LS'-M'-LS"-. Более предпочтительно, T независимо выбран в каждом случае из -C(O)-LS'-N(RB)C(O)-LS"- или -C(O)-LS'-N(RB)C(O)O-LS"-.
T также может представлять собой, например, -LS-M-LS'-M'-LS"-, где LS представляет собой связь; M представляет собой C(O); LS' представляет собой С1-C6алкилен (например,
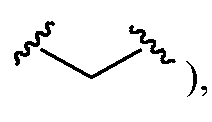
T-RDможет представлять собой, без ограничений,
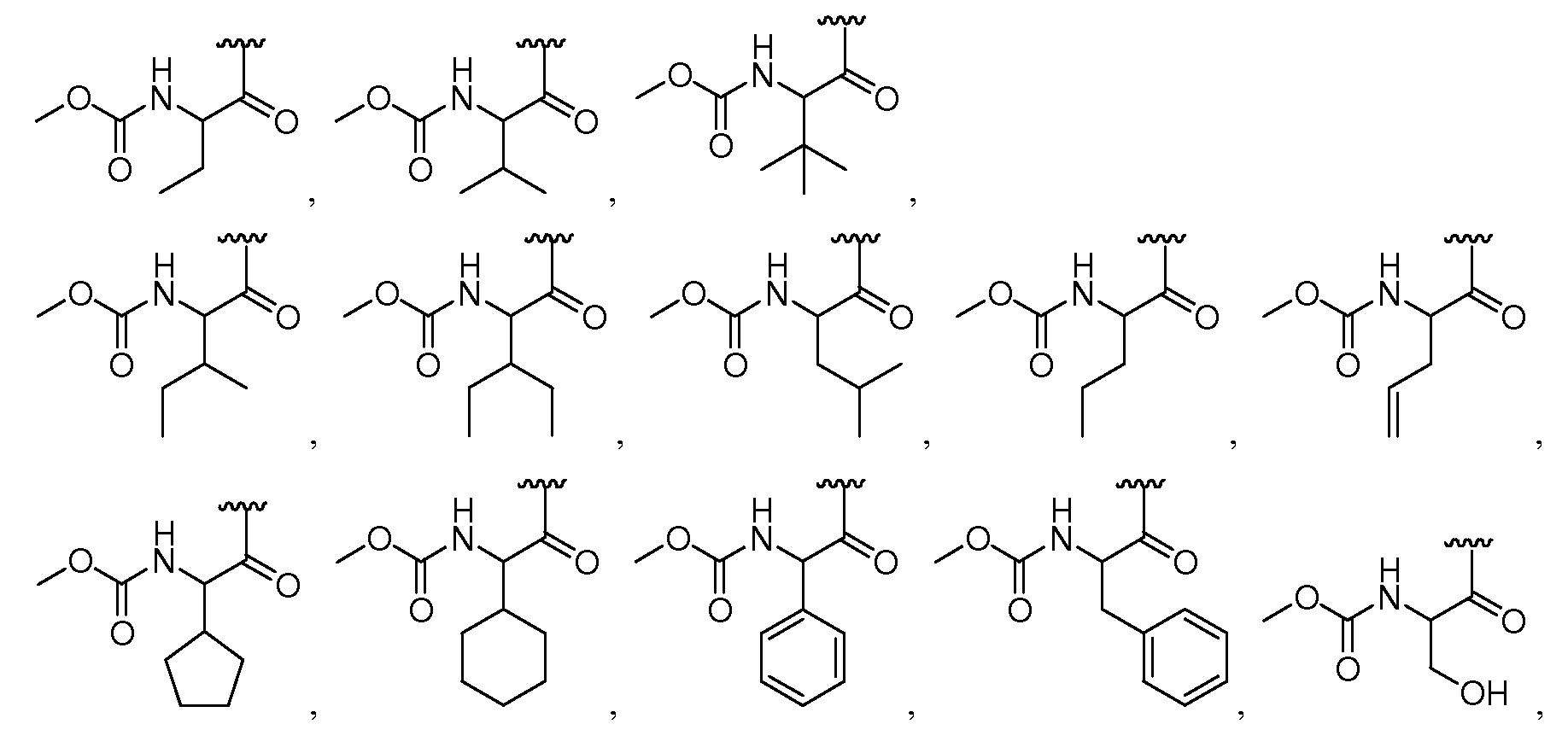

где стереохимия у атома углерода в группе T-RDможет быть либо (R), либо (S).
T также может представлять собой, без ограничений, -LS-M-LS'-, где LS представляет собой связь; M представляет собой C(O); LS' представляет собой С1-C6алкилен (например,



где стереохимия по атому углерода в группе T-RDможет быть либо (R), либо (S).
Для формулы I, также как и для формул IA, IB и Ic, описанных ниже, включая любой и каждый вариант воплощения настоящего изобретения, описанный ниже, RA предпочтительно представляет собой галоген, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, циано; или С1-C6алкил, C2-C6алкенил или C2-C6алкинил, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано; или С3-C6карбоцикл или 3-6-членный гетероцикл, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила, циано, С1-C6алкила, C2-C6алкенила, C2-C6алкинила, С1-C6галогеналкила, C2-C6галогеналкенила или C2-C6галогеналкинила; или -LA-O-RS, -LA-S-RS, -LA-C(O)RS, -LA-OC(O)RS, -LA-C(O)ORS, -LA-N(RSRS'), -LA-S(O)RS, -LA-SO2RS, -LA-C(O)N(RSRS'), -LA-N(RS)C(O)RS', -LA-N(RS)C(O)N(RS'RS"), -LA-N(RS)SO2RS', -LA-SO2N(RSRS'), -LA-N(RS)SO2N(RS'RS"), -LA-N(RS)S(O)N(RS'Rs"), -LA-OS(O)-RS, -LA-OS(O)2-RS, -LA-S(O)2ORS, -LA-S(O)ORS, -LA-OC(O)ORs, -LA-N(RS)C(O)ORS', -LA-OC(О)N(RSRS'), -LA-N(RS)S(O)-RS', -LA-S(O)N(RSRS') или -LA-C(O)N(RS)C(O)-RS', где LA представляет собой связь, С1-C6алкилен, C2-C6алкенилен или C2-C6алкинилен.
Более предпочтительно, RA представляет собой галоген, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, циано; или С1-C6алкил, C2-C6алкенил или C2-C6алкинил, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано; или С3-C6карбоцикл или 3-6-членный гетероцикл, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила, циано, С1-C6алкила, C2-C6алкенила, C2-C6алкинила, С1-C6галогеналкила, C2-C6галогеналкенила или C2-C6галогеналкинила.
Наиболее предпочтительно, RA представляет собой галоген, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, циано; или С1-C6алкил, C2-C6алкенил или C2-C6алкинил, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано.
LS, LS' и LS" предпочтительно, каждый независимо, в каждом случае выбраны из связи; или С1-C6алкилена, C2-C6алкенилена или C2-C6алкинилена.
A и B могут быть одинаковыми или отличными друг от друга. Также, L1 и L2, или Y и Z, или Y-A- и Z-B-, или -A-L1- и -B-L2- могут быть одинаковыми или отличными друг от друга. В некоторых случаях Y-A-L1- идентичен Z-B-L2-. В других случаях Y-A-L1- отличен от Z-B-L2-.
Для каждого соединения формулы I Lκ также может быть независимо выбран в каждом случае из связи; -LS'-N(RB)C(O)-LS-; -LS'-C(O)N(RB)-LS-; или С1-C6алкилена, C2-C6алкенилена, C2-C6алкинилена, C3-C10карбоцикла или 3-10-членного гетероцикла, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, RT, -O-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано, где LS и LS' имеют значения, определенные выше.
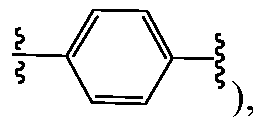
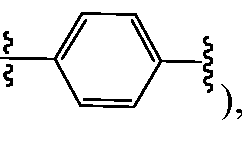
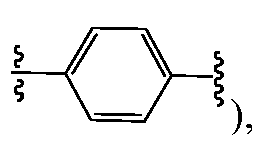
В одном варианте воплощения A, B и D, каждый независимо, представляют собой фенил и, каждый независимо, необязательно замещены одним или несколькими заместителями RA. L1 и L2, каждый независимо, представляют собой С1-C6алкилен, L3 представляет собой связь, С1-C6алкилен или -C(O)-, и L1, L2 и L3, каждый независимо, необязательно замещены одним или несколькими заместителями, выбранными из галогена, RT, -O-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано. Предпочтительно, L1 и L2 представляют собой -(CH2)- и, каждый независимо, необязательно замещены одним или несколькими заместителями, выбранными из галогена, RT, -O-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано; и L3 представляет собой связь или -C(O)-. Y представляет собой -LS-C(R1R2)N(R5)-T-RD, -LS-C(R3R4)C(R6R7)-T-RD, -N(RB)C(O)C(R1R2)N(R5)-T-RD или -N(RB)C(O)C(R3R4)C(R6R7)-T-RD, и Z представляет собой -LS-C(R8R9)N(R12)-T-RD, -LS-C(R10R11)C(R13R14)-T-RD, -N(RB)C(O)C(R8R9)N(R12)-T-RD или -N(RB)C(O)C(R10R11)C(R13R14)-T-RD. R1 представляет собой Rc, и R2 и R5, взятые вместе с атомами, к которым они присоединены, образуют 5-6-членное гетероциклическое кольцо, которое необязательно замещено одним или несколькими заместителями RA; R3 и R6, каждый независимо, представляют собой Rc, и R4 и R7, взятые вместе с атомами, к которым они присоединены, образуют 5-6-членное карбоциклическое или гетероциклическое кольцо, которое необязательно замещено одним или несколькими заместителями RA. R8 представляет собой Rc, и R9 и R12, взятые вместе с атомами, к которым они присоединены, образуют 5-6-членное гетероциклическое кольцо, которое необязательно замещено одним или несколькими заместителями RA; и R10 и R13, каждый независимо, представляют собой Rc, и R11 и R14, взятые вместе с атомами, к которым они присоединены, образуют 5-6-членное карбоциклическое или гетероциклическое кольцо, которое необязательно замещено одним или несколькими заместителями RA. T, предпочтительно, независимо выбран в каждом случае из -C(O)-LS'-N(RB)C(O)-LS"- или -C(O)-LS'-N(RB)C(O)O-LS"-, где LS' предпочтительно представляет собой С1-C6алкилен (например, -CH2-) и необязательно замещен одним или несколькими заместителями, выбранными из галогена, RT, -O-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано. T также может быть, без ограничений, выбран из -C(O)-LS'-LS"-, -C(O)-LS'-O-LS"-, -C(O)-LS'-N(RB)-LS"- или -C(O)-LS'-N(RB)S(O)2-LS"-. В некоторых случаях, по меньшей мере, один из Y и Z представляет собой независимо
В другом варианте воплощения A представляет собой

Еще в одном варианте воплощения A представляет собой фенил,
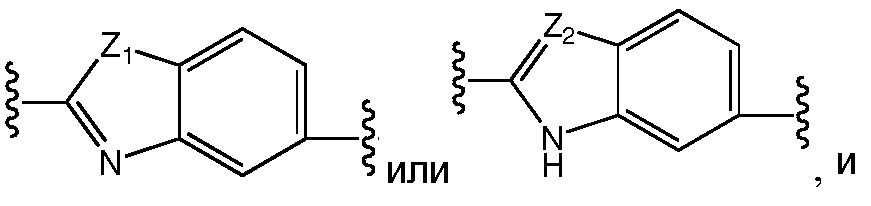
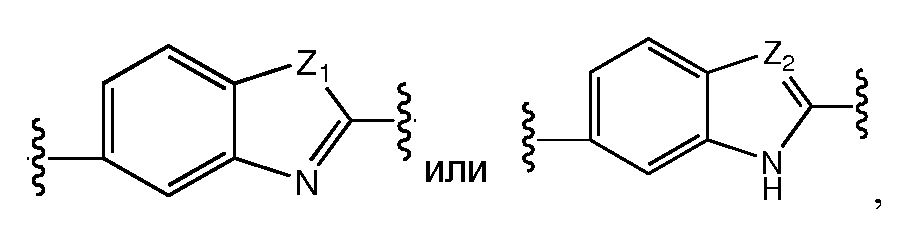
Еще в одном варианте воплощения A представляет собой

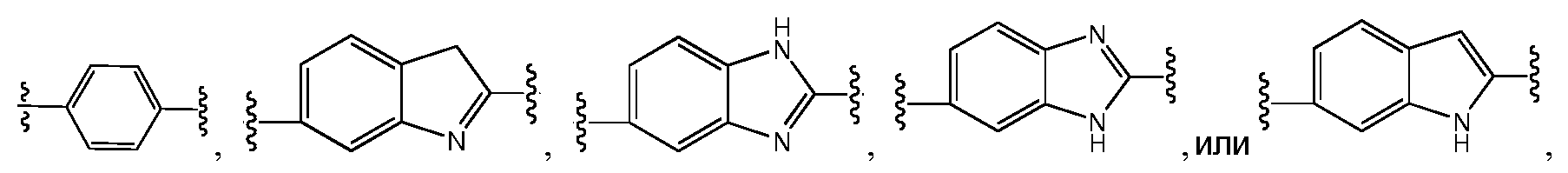

В одном варианте воплощения A, B и D, каждый независимо, представляют собой фенил и, каждый независимо, необязательно замещены одним или несколькими заместителями RA. L1 и L2, каждый независимо, представляют собой С1-C6алкилен, L3 представляет собой связь, С1-C6алкилен или -C(O)-, и L1, L2 и L3, каждый независимо, необязательно замещены одним или несколькими заместителями, выбранными из галогена, RT, -O-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано. Предпочтительно, L1 и L2 представляют собой -(CH2)- и, каждый независимо, необязательно замещены одним или несколькими заместителями, выбранными из галогена, RT, -O-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано; и L3 представляет собой связь или -C(O)-. Y представляет собой -G-C(R1R2)N(R5)-T-RD или -G-C(R3R4)C(R6R7)-T-RD, и Z представляет собой -G-C(R8R9)N(R12)-T-RD или -G-C(R10R11)C(R13R14)-T-RD. G представляет собой C5-C6карбоцикл или 5-6-членный гетероцикл, такой как


Еще в одном варианте воплощения A представляет собой


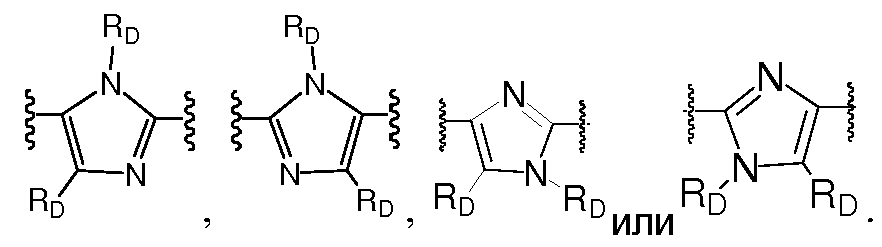

Еще в одном варианте воплощения A представляет собой фенил,
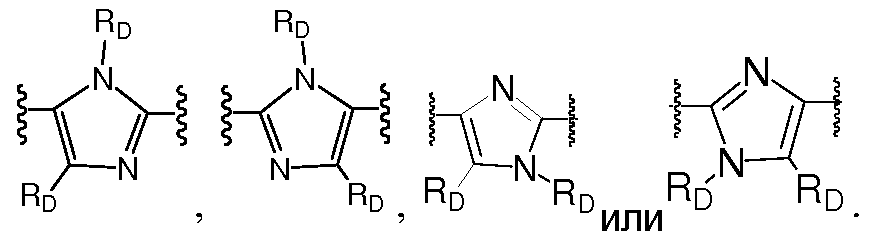
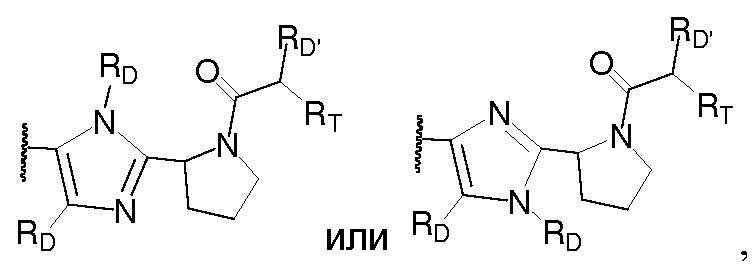
Еще в одном варианте воплощения A представляет собой


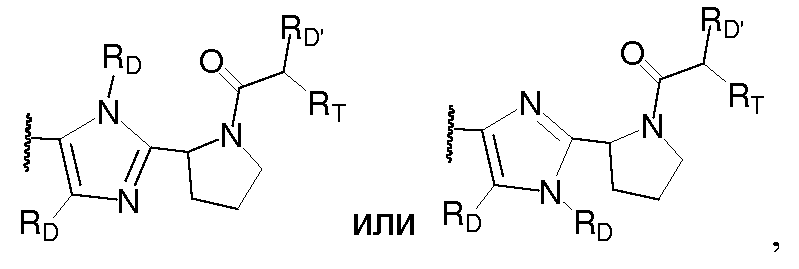
В одном варианте воплощения A и B, каждый независимо, представляют собой 5- или 6-членный карбоцикл или гетероцикл (например, фенил, такой как


В другом варианте воплощения A представляет собой


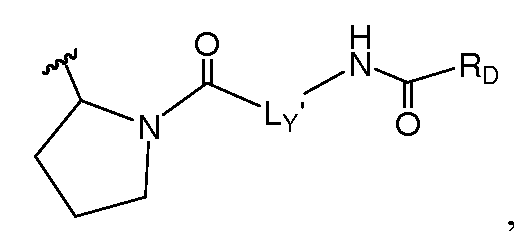
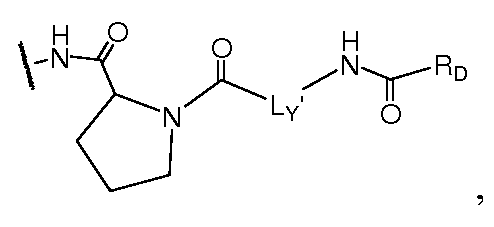
Еще в одном варианте воплощения A и B, каждый независимо, представляют собой 5- или 6-членный карбоцикл или гетероцикл (например, A и B, каждый независимо, представляют собой фенил, такой как
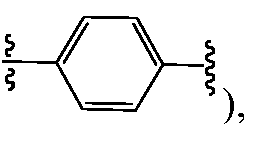
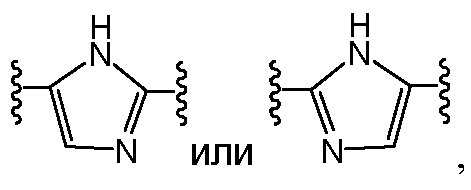

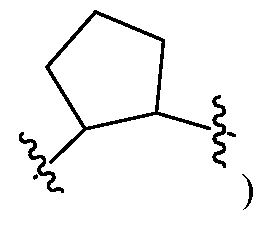



Еще в одном варианте воплощения A и B, каждый независимо, представляют собой 5- или 6-членный карбоцикл или гетероцикл (например, A и B, каждый независимо, представляют собой фенил, такой как

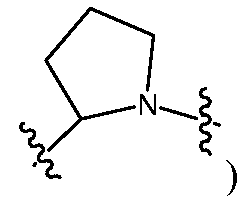




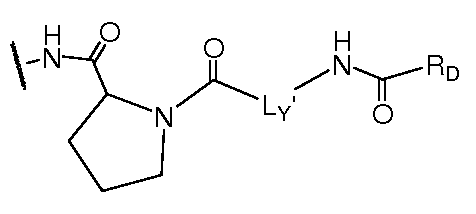


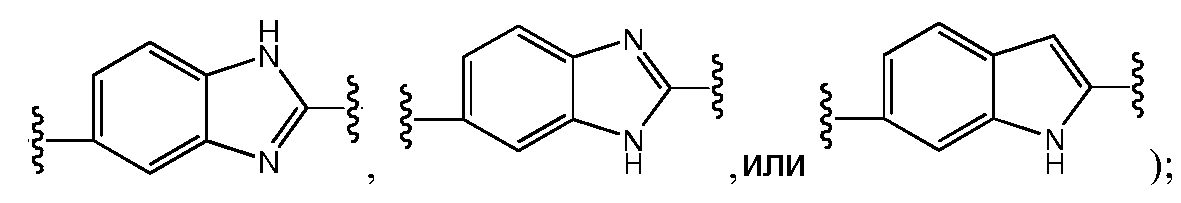
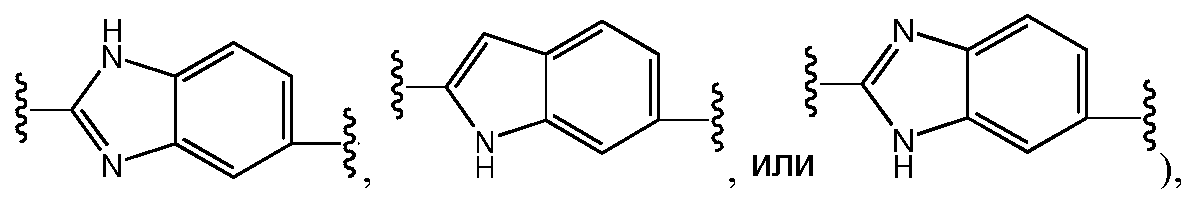
Еще в одном варианте воплощения настоящего изобретения A представляет собой 5- или 6-членный карбоцикл или гетероцикл (например, фенил, такой как











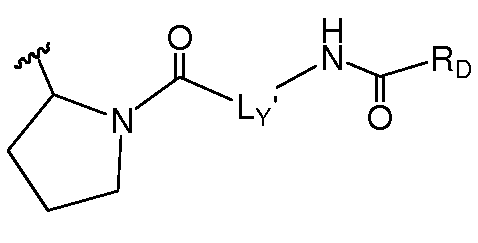
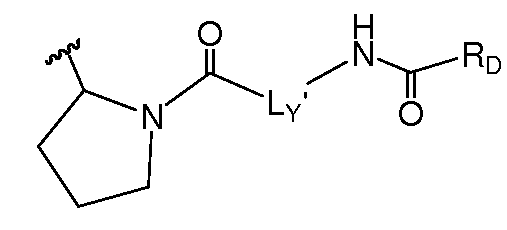

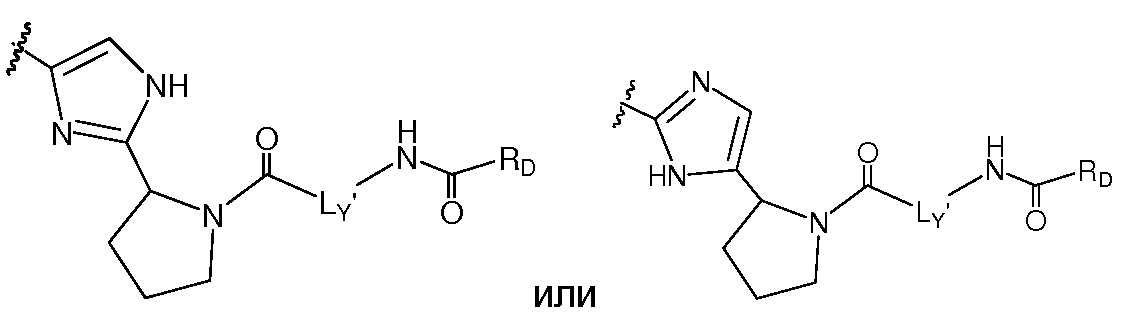
В другом аспекте настоящее изобретение включает соединения формулы IA и их фармацевтически приемлемые соли.

где:
RNB, каждый независимо, выбран из RB;
Rc', каждый независимо, выбран из Rc;
RD', каждый независимо, выбран из RD;
R2 и R5, взятые вместе с атомами, к которым они присоединены, образуют 3-8-членное гетероциклическое кольцо, которое необязательно замещено одним или несколькими заместителями RA;
R9 и R12, взятые вместе с атомами, к которым они присоединены, образуют 3-8-членное гетероциклическое кольцо, которое необязательно замещено одним или несколькими заместителями RA;
A, B, D, L1, L2, L3, T, RA, RB, Rc и RD имеют значения, описанные выше для формулы I.
В этом аспекте A и B, предпочтительно, независимо выбраны из С5-C6карбоцикла, 5-6-членного гетероцикла или 8-10-членных бициклов, таких как
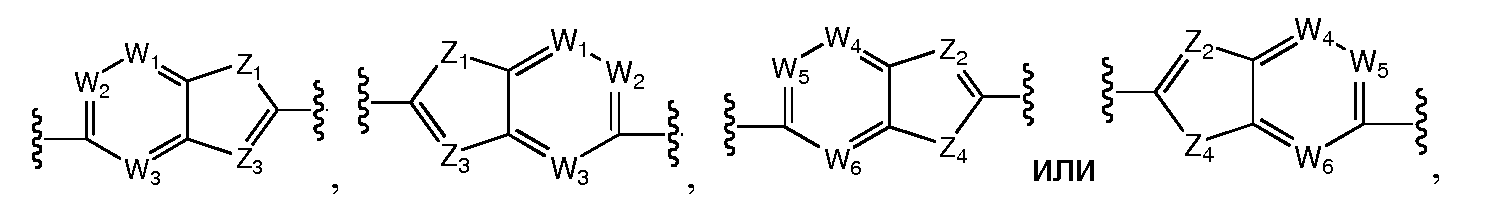
Более предпочтительно, A выбран из C5-C6карбоцикла, 5-6-членного гетероцикла,
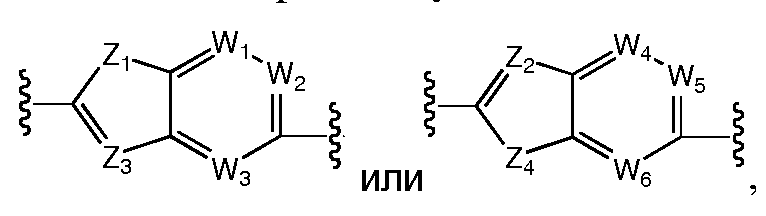
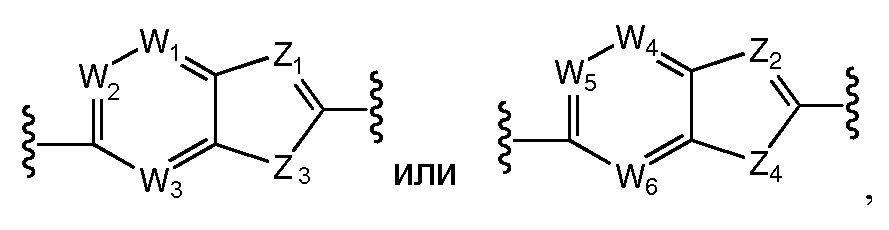


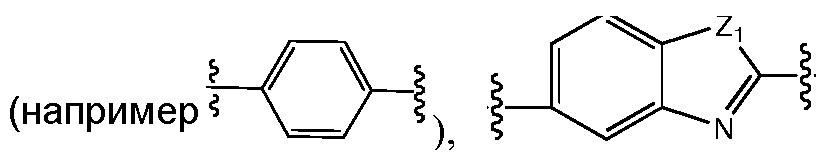
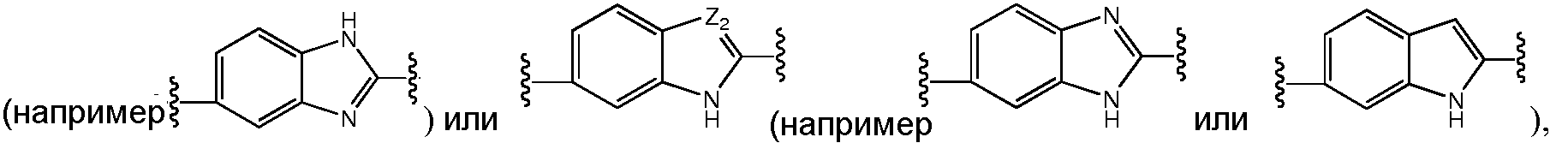
Наиболее предпочтительно, A и B независимо выбраны из С5-C6карбоцикла или 5-6-членного гетероцикла и, каждый независимо, необязательно замещены одним или несколькими заместителями RA. Предпочтительно, по меньшей мере, один из A и B представляет собой фенил (например,
D предпочтительно выбран из С5-C6карбоцикла, 5-6-членного гетероцикла или 8-10-членных бициклов и необязательно замещен одним или несколькими заместителями RA. D также может быть предпочтительно выбран из С1-C6алкила, C2-C6алкенила или C2-C6алкинила и необязательно замещен одним или несколькими заместителями, выбранными из галогена, RT, -O-Rs, -S-Rs, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано. Более предпочтительно, D представляет собой С5-C6карбоцикл, 5-6-членный гетероцикл или 6-10-членные бициклы и замещен одним или несколькими заместителями RM, где RM представляет собой галоген, нитро, оксо, фосфонокси, фосфоно, тиоксо, циано или -LS-RE. Также предпочтительно, D представляет собой фенил и необязательно замещен одним или несколькими заместителями RA. Более предпочтительно, D представляет собой фенил и замещен одним или несколькими заместителями RM, где RM имеет значение, определенное выше. Наиболее предпочтительно, D представляет собой
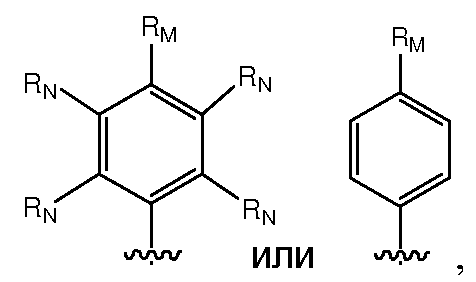
Предпочтительно, RM представляет собой галоген, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, циано; или С1-C6алкил, C2-C6алкенил или C2-C6алкинил, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано; или C3-C6карбоцикл или 3-6-членный гетероцикл, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила, циано, С1-C6алкила, C2-C6алкенила, C2-C6алкинила, С1-C6галогеналкила, C2-C6галогеналкенила или C2-C6галогеналкинила. Более предпочтительно, RM представляет собой галоген, гидрокси, меркапто, амино, карбокси; или С1-C6алкил, C2-C6алкенил или C2-C6алкинил, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино или карбокси. Наиболее предпочтительно, RM представляет собой С1-C6алкил, который необязательно замещен одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино или карбокси.
L1 и L2, предпочтительно, независимо представляют собой С1-C6алкилен, и L3 предпочтительно выбран из связи, С1-C6алкилена или -C(O)-. L1, L2 и L3, каждый независимо, необязательно замещены одним или несколькими заместителями, выбранными из галогена, RT, -O-Rs, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано. Более предпочтительно, L1 и L2 представляют собой -(CH2)- и, каждый независимо, необязательно замещены одним или несколькими заместителями, выбранными из галогена, RT, -О-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано; и L3 представляет собой связь или -C(O)-.
R2 и R5, взятые вместе с атомами, к которым они присоединены, предпочтительно образуют 5-6-членное гетероциклическое кольцо (например,

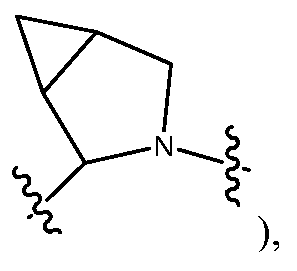
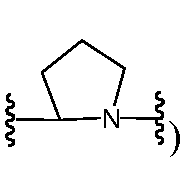
R9 и R12, взятые вместе с атомами, к которым они присоединены, предпочтительно образуют 5-6-членное гетероциклическое кольцо (например,
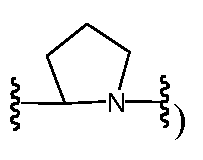

-T-RD' может быть, без ограничения, независимо выбран в каждом случае из -C(O)-LS'-RD', -C(O)O-LS'-RD', -C(O)-LS'-N(RB)C(O)-LS"-RD', -C(O)-LS'-N(RB)C(O)O-LS"-RD', -N(RB)C(O)-LS'-N(RB)C(O)-LS"-RD', -N(RB)C(O)-LS'-N(RB)C(О)О-LS"-RD' или -N(RB)C(O)-LS'-N(RB)-LS"-RD'. Предпочтительно, -T-RD' независимо выбран в каждом случае из -C(O)-Ls'-M'-Ls"-RD' или -N(RB)C(O)-LS'-M'-LS"-RD'. Более предпочтительно, -T-RD' независимо выбран в каждом случае из -C(O)-LS'-N(RB)C(O)-LS"-RD' или -C(O)-LS'-N(RB)C(O)O-LS"-RD'.
-T-RD' также может быть, без ограничений, независимо выбран в каждом случае из -C(O)-LY'-RD', -C(O)O-LY'-RD', -C(О)-LY'-N(RB)C(О)-LS"-RD', -C(О)-LY'-N(RB)C(О)О-LS"-RD', -N(RB)C(O)-LY'-N(RB)C(O)-LS"-RD', -N(RB)C(О)-LY'-N(RB)C(О)О-LS"-RD' или -N(RB)C(О)-LY'-N(RB)-LS"-RD', где LY', каждый независимо, представляет собой LS' и предпочтительно представляет собой каждый независимо С1-C6алкилен (например, -CH2-) и необязательно замещен одним или несколькими заместителями, выбранными из галогена, RT, -О-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано. Предпочтительно, -T-RD' независимо выбран в каждом случае из -C(О)-LY'-M'-LS"-RD' или -N(RB)C(О)-LY'-M'-LS"-RD'. Более предпочтительно, -T-RD' независимо выбран в каждом случае из -C(О)-LY'-N(RB)C(О)-LS"-RD' или -C(O)-LY'-N(RB)C(О)О-LS"-RD'. Наиболее предпочтительно, -T-RD' независимо выбран в каждом случае из -C(О)-LY'-N(RB)C(О)-RD' или -C(О)-LY'-N(RB)C(О)О-RD', где LY' предпочтительно представляет собой каждый независимо С1-C6алкилен (например, -CH2-) и необязательно замещен одним или несколькими заместителями, выбранными из галогена, RT, -O-Rs, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано.
RNB и Rc' представляют собой предпочтительно водород, и RD' предпочтительно независимо выбран в каждом случае из LA или 5- или 6-членного карбоцикла или гетероцикла, который необязательно замещен одним или несколькими заместителями, выбранными из галогена, RT, -O-RB, -S-RB, -N(RBRB'), -OC(O)RB, -C(O)ORB, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано. Более предпочтительно, RD' независимо выбран в каждом случае из С1-C6алкила, C2-C6алкенила или C2-C6алкинила, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила, циано, C3-C6карбоцикла или 3-6-членного гетероцикла; или C3-C6карбоцикла или 3-6-членного гетероцикла, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила, циано, С1-C6алкила, C2-C6алкенила, C2-C6алкинила, С1-C6галогеналкила, C2-C6галогеналкенила или C2-C6галогеналкинила.
Для каждого соединения формулы IA LK также может быть независимо выбран в каждом случае из связи; -LS'-N(RB)C(O)-LS-; -LS'-C(O)N(RB)-LS-; или С1-C6алкилена, C2-C6алкенилена, C2-C6алкинилена, C3-C10карбоцикла или 3-10-членного гетероцикла, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, RT, -О-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано, где LS и LS' имеют значения, определенные выше.
RA предпочтительно представляет собой галоген, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, циано; или С1-C6алкил, C2-C6алкенил или C2-C6алкинил, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано; или C3-C6карбоцикл или 3-6-членный гетероцикл, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила, циано, С1-C6алкила, C2-C6алкенила, C2-C6алкинила, С1-C6галогеналкила, C2-C6галогеналкенила или С2-C6галогеналкинила; или -LA-О-RS, -LA-S-RS, -LA-C(O)RS, -LA-OC(O)RS, -LA-C(O)ORS, -LA-N(RSRS'), -LA-S(O)RS, -LA-SO2RS, -LA-C(O)N(RSRS'), -LA-N(RS)C(O)RS', -LA-N(RS)C(O)N(RS'RS"), -LA-N(RS)SO2RS', -LA-SO2N(RSRS'), -LA-N(RS)SO2N(RS'RS"), -LA-N(RS)S(O)N(RS'RS"), -LA-OS(O)-RS, -LA-OS(O)2-RS, -LA-S(O)2ORS, -LA-S(O)ORS, -LA-OC(O)ORS, -LA-N(RS)C(O)ORS', -LA-OC(O)N(RSRS'), -LA-N(RS)S(O)-RS', -LA-S(O)N(RSRS') или -LA-C(O)N(RS)C(O)-RS', где LA представляет собой связь, С1-C6алкилен, C2-C6алкенилен или C2-C6алкинилен.
Более предпочтительно, RA представляет собой галоген, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, циано; или С1-C6алкил, C2-C6алкенил или C2-C6алкинил, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано; или C3-C6карбоцикл или 3-6-членный гетероцикл, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила, циано, С1-C6алкила, C2-C6алкенила, C2-C6алкинила, С1-C6галогеналкила, C2-C6галогеналкенила или C2-C6галогеналкинила.
Наиболее предпочтительно, RA представляет собой галоген, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, циано; или С1-C6алкил, C2-C6алкенил или C2-C6алкинил, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано.
LS, LS' и LS" предпочтительно, каждый независимо, в каждом случае выбраны из связи; или С1-C6алкилена, C2-C6алкенилена или C2-C6алкинилена.
A и B могут быть одинаковыми или отличными друг от друга. Также, L1 и L2 могут быть одинаковыми или отличными друг от друга.
В одном варианте воплощения этого аспекта, A, B и D, каждый независимо, представляют собой фенил и, каждый независимо, необязательно замещены одним или несколькими заместителями RA. L1 и L2, каждый независимо, представляют собой С1-C6алкилен, L3 представляет собой связь, С1-C6алкилен или -C(O)-, и L1, L2 и L3, каждый независимо, необязательно замещены одним или несколькими заместителями, выбранными из галогена, RT, -O-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано. Предпочтительно, L1 и L2 представляют собой -(CH2)- и, каждый независимо, необязательно замещены одним или несколькими заместителями, выбранными из галогена, RT, -О-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано; и L3 представляет собой связь или -C(O)-. -T-RD' предпочтительно независимо выбран в каждом случае из -C(O)-LS'-N(RB)C(O)-LS"-RD' или -C(O)-LS'-N(RB)C(О)О-LS"-RD', где LS' предпочтительно представляет собой С1-C6алкилен (например, -CH2-) и необязательно замещен одним или несколькими заместителями, выбранными из галогена, RT, -О-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано. -T-RD' также может быть, без ограничений, выбран из -C(O)-LS'-LS"-RD', -C(O)-LS'-O-LS"-RD', -C(O)-LS'-N(RB)-LS"-RD' или -C(O)-LS'-N(RB)S(O)2-LS"-RD'.
В другом варианте воплощения этого аспекта A представляет собой

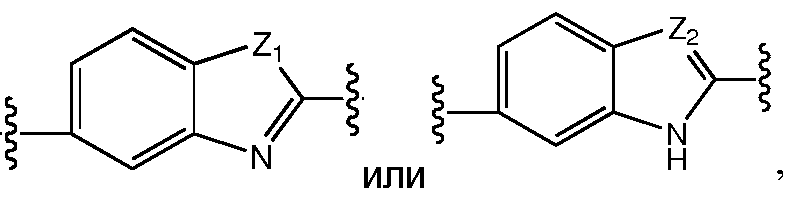
Еще в одном варианте воплощения этого аспекта, A представляет собой фенил,

Еще в одном варианте воплощения этого аспекта A представляет собой

В следующем варианте воплощения этого аспекта A, B и D, каждый независимо, представляют собой С5-C6карбоцикл, 5-6-членный гетероцикл (например, A, B и D, каждый независимо, представляют собой фенил) и, каждый независимо, необязательно замещены одним или несколькими заместителями RA. L1 и L2, каждый независимо, представляют собой С1-C6алкилен, и L3 представляет собой связь, С1-C6алкилен или -C(O)-, и L1, L2 и L3, каждый независимо, необязательно замещены одним или несколькими заместителями, выбранными из галогена, RT, -О-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано. Предпочтительно, L1 и L2, каждый независимо, представляют собой С1-C6алкилен (например, -CH2-), и L3 представляет собой связь. -T-RD' независимо выбран в каждом случае из -C(О)-LY'-N(RB)C(О)-LS"-RD' или -C(O)-LY'-N(RB)C(О)О-LS"-RD', где LY' представляет собой С1-C6алкилен (например, -CH2-) и необязательно замещен одним или несколькими заместителями, выбранными из галогена, RT, -О-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано, и LS" предпочтительно представляет собой связь. -T-RD' также может быть, без ограничений, выбран из -C(O)-LY'-LS"-RD', -C(O)-LY'-O-LS"-RD', -C(O)-LY'-N(RB)-LS"-RD' или -C(O)-LY'-N(RB)S(O)2-LS"-RD'.
Еще в одном аспекте настоящее изобретение включает соединения формулы IB и их фармацевтически приемлемые соли:

где:
RC', каждый независимо, выбран из Rc;
RD', каждый независимо, выбран из RD;
R2 и R5, взятые вместе с атомами, к которым они присоединены, образуют 3-8-членное гетероциклическое кольцо, которое необязательно замещено одним или несколькими заместителями RA;
R9 и R12, взятые вместе с атомами, к которым они присоединены, образуют 3-8-членное гетероциклическое кольцо, которое необязательно замещено одним или несколькими заместителями RA;
A, B, D, L1, L2, L3, T, RA, RC и RD имеют значения, описанные выше для формулы I.
В этом аспекте A и B предпочтительно независимо выбраны из С5-C6карбоцикла, 5-6-членного гетероцикла или 8-10-членных бициклов, таких как
Более предпочтительно, A выбран из С5-C6карбоцикла, 5-6-членного гетероцикла,




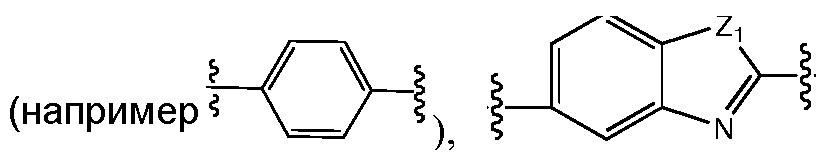
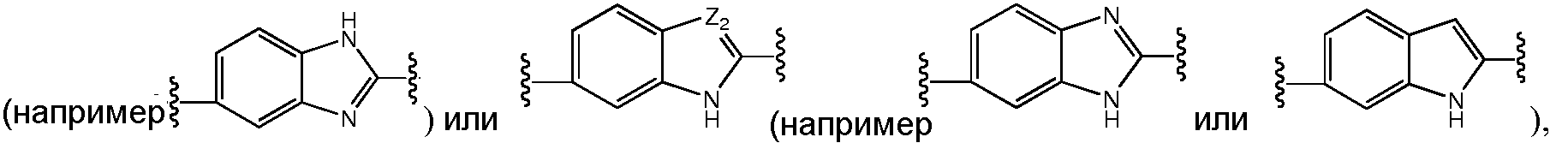
Наиболее предпочтительно, A выбран из






Также предпочтительно, A представляет собой

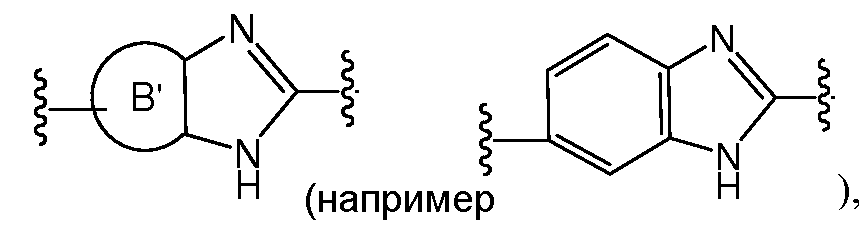
D предпочтительно выбран из C5-C6карбоцикла, 5-6-членного гетероцикла или 8-10-членных бициклов и необязательно замещен одним или несколькими заместителями RA. D также может быть предпочтительно выбран из С1-C6алкила, C2-C6алкенила или C2-C6алкинила и необязательно замещен одним или несколькими заместителями, выбранными из галогена, RT, -О-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано. Более предпочтительно, D представляет собой С5-C6карбоцикл, 5-6-членный гетероцикл или 6-10-членные бициклы и замещен одним или несколькими заместителями RM, где RM представляет собой галоген, нитро, оксо, фосфонокси, фосфоно, тиоксо, циано или -LS-RE. Также предпочтительно, D представляет собой фенил и необязательно замещен одним или несколькими заместителями RA. Более предпочтительно, D представляет собой фенил и замещен одним или несколькими заместителями RM, где RM имеет значение, определенное выше. Наиболее предпочтительно, D представляет собой
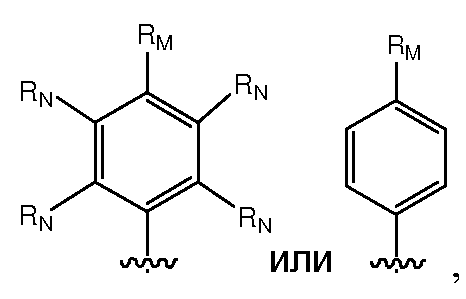
Предпочтительно, RM представляет собой галоген, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, циано; или С1-C6алкил, C2-C6алкенил или C2-C6алкинил, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано; или С3-C6карбоцикл или 3-6-членный гетероцикл, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила, циано, С1-C6алкила, C2-C6алкенила, C2-C6алкинила, С1-C6галогеналкила, C2-C6галогеналкенила или C2-C6галогеналкинила. Более предпочтительно, RM представляет собой галоген, гидрокси, меркапто, амино, карбокси; или С1-C6алкил, C2-C6алкенил или C2-C6алкинил, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино или карбокси. Наиболее предпочтительно, RM представляет собой С1-C6алкил, который необязательно замещен одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино или карбокси.
L1 и L2, предпочтительно, независимо представляют собой С1-C6алкилен, и L3 предпочтительно выбран из связи, С1-C6алкилена или -C(O)-. L1, L2 и L3, каждый независимо, необязательно замещены одним или несколькими заместителями, выбранными из галогена, RT, -О-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано. Более предпочтительно, L1 и L2 представляют собой -(CH2)- и, каждый независимо, необязательно замещены одним или несколькими заместителями, выбранными из галогена, RT, -О-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано; и L3 представляет собой связь или -C(O)-.
R2 и R5, взятые вместе с атомами, к которым они присоединены, предпочтительно образуют 5-6-членное гетероциклическое кольцо (например,


R9 и R12, взятые вместе с атомами, к которым они присоединены, предпочтительно образуют 5-6-членное гетероциклическое кольцо (например,


-T-RD' может быть, без ограничения, независимо выбран в каждом случае из -C(O)-LS'-RD', -C(O)O-LS'-RD', -C(O)-LS'-N(RB)C(O)-LS"-RD', -C(O)-LS'-N(RB)C(O)O-LS"-RD', -N(RB)C(O)-LS'-N(RB)C(O)-LS"-RD', -N(RB)C(O)-LS'-N(RB)C(О)О-LS"-RD' или -N(RB)C(O)-LS'-N(RB)-LS"-RD'. Предпочтительно, -T-RD' независимо выбран в каждом случае из -C(O)-LS'-M'-LS"-RD' или -N(RB)C(O)-LS'-M'-LS"-RD'. Более предпочтительно, -T-RD' независимо выбран в каждом случае из -C(O)-LS'-N(RB)C(O)-LS"-RD' или -C(O)-LS'-N(RB)C(O)O-LS"-RD'.
-T-RD' также может быть, без ограничений, независимо выбран в каждом случае из -C(O)-LY'-RD', -C(O)O-LY'-RD', -C(О)-LY'-N(RB)C(О)-LS"-RD', -C(О)-LY'-N(RB)C(О)О-LS"-RD', -N(RB)C(O)-LY'-N(RB)C(O)-LS"-RD', -N(RB)C(О)-LY'-N(RB)C(О)О-LS"-RD' или -N(RB)C(O)-LY'-N(RB)-LS"-RD', где LY', каждый независимо, представляет собой LS' и предпочтительно, каждый независимо, представляет собой С1-C6алкилен (например, -CH2-) и необязательно замещен одним или несколькими заместителями, выбранными из галогена, RT, -О-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано. Предпочтительно, -T-RD' независимо выбран в каждом случае из -C(O)-LY'-M'-LS"-RD' или -N(RB)C(О)-LY'-M'-LS"-RD'. Более предпочтительно, -T-RD' независимо выбран в каждом случае из -C(O)-LY'-N(RB)C(O)-LS"-RD' или -C(O)-LY'-N(RB)C(O)O-LS"-RD'. Наиболее предпочтительно, -T-RD' независимо выбран в каждом случае из -C(O)-LY'-N(RB)C(O)-RD' или -C(O)-LY'-N(RB)C(O)O-RD', где LY' предпочтительно представляет собой, каждый независимо, С1-C6алкилен (например, -CH2-) и необязательно замещен одним или несколькими заместителями, выбранными из галогена, RT, -О-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано.
Rc' предпочтительно представляет собой водород, и RD' предпочтительно независимо выбран в каждом случае из LA или 5- или 6-членного карбоцикла или гетероцикла, который необязательно замещен одним или несколькими заместителями, выбранными из галогена, RT, -О-RB, -S-RB, -N(RBRB'), -OC(O)RB, -C(O)ORB, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано. Более предпочтительно, RD' независимо выбран в каждом случае из С1-C6алкила, C2-C6алкенила или C2-C6алкинила, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила, циано, C3-C6карбоцикла или 3-6-членного гетероцикла; или С3-C6карбоцикла или 3-6-членного гетероцикла, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила, циано, С1-C6алкила, C2-C6алкенила, C2-C6алкинила, С1-C6галогеналкила, C2-C6галогеналкенила или C2-C6галогеналкинила.
Для каждого соединения формулы IB Lk также может быть независимо выбран, в каждом случае, из связи; -LS'-N(RB)C(O)-LS-; -LS'-C(O)N(RB)-LS-; или С1-C6алкилена, C2-C6алкенилена, C2-C6алкинилена, C3-C10карбоцикла или 3-10-членного гетероцикла, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, RT, -О-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано, где LS и LS' имеют значения, определенные выше.
RA предпочтительно представляет собой галоген, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, циано; или С1-C6алкил, C2-C6алкенил или C2-C6алкинил, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано; или С3-C6карбоцикл или 3-6-членный гетероцикл, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила, циано, С1-C6алкила, C2-C6алкенила, C2-C6алкинила, С1-C6галогеналкила, C2-C6галогеналкенила или C2-C6галогеналкинила; или -LA-O-Rs, -LA-S-RS, -LA-C(O)RS, -LA-OC(O)RS, -LA-C(O)ORS, -LA-N(RSRS'), -LA-S(O)RS, -LA-SO2RS, -LA-C(O)N(RSRS'), -LA-N(RS)C(O)RS', -LA-N(RS)C(O)N(RS'RS"), -LA-N(RS)SO2RS', -LA-SO2N(RSRS'), -LA-N(RS)SO2N(RS'RS"), -LA-N(RS)S(O)N(RS'RS"), -LA-OS(O)-RS, -LA-OS(O)2-RS, -LA-S(O)2ORS, -LA-S(О)ORS, -LA-ОС(О)ORS, -LA-N(RS)C(O)ORS', -LA-OC(O)N(RSRS'), -LA-N(RS)S(O)-RS', -LA-S(O)N(RSRS') или -LA-C(O)N(RS)C(O)-RS', где LA представляет собой связь, С1-C6алкилен, C2-C6алкенилен или C2-C6алкинилен.
Более предпочтительно, RA представляет собой галоген, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, циано; или С1-C6алкил, C2-C6алкенил или C2-C6алкинил, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано; или C3-C6карбоцикл или 3-6-членный гетероцикл, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила, циано, С1-C6алкила, C2-C6алкенила, C2-C6алкинила, С1-C6галогеналкила, C2-C6галогеналкенила или C2-C6галогеналкинила.
Наиболее предпочтительно, RA представляет собой галоген, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, циано; или С1-C6алкил, C2-C6алкенил или C2-C6алкинил, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано.
LS, LS' и LS" предпочтительно, каждый независимо, в каждом случае выбраны из связи; или С1-C6алкилена, C2-C6алкенилена или C2-C6алкинилена.
A и B могут быть одинаковыми или отличными друг от друга. Также, L1 и L2 могут быть одинаковыми или отличными друг от друга.
В одном варианте воплощения этого аспекта, A, B и D, каждый независимо, представляют собой фенил и, каждый независимо, необязательно замещены одним или несколькими заместителями RA. L1 и L2, каждый независимо, представляют собой С1-C6алкилен, L3 представляет собой связь, С1-C6алкилен или -C(O)-, и L1, L2 и L3, каждый независимо, необязательно замещены одним или несколькими заместителями, выбранными из галогена, RT, -О-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано. Предпочтительно, L1 и L2 представляют собой -(CH2)- и, каждый независимо, необязательно замещены одним или несколькими заместителями, выбранными из галогена, RT, -О-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано; и L3 представляет собой связь или -C(O)-. -T-RD' предпочтительно независимо выбран в каждом случае из -C(O)-LS'-N(RB)C(O)-LS"-RD' или -C(O)-LS'-N(RB)C(О)О-LS"-RD', где LS' предпочтительно представляет собой С1-C6алкилен (например, -CH2-) и необязательно замещен одним или несколькими заместителями, выбранными из галогена, RT, -О-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано. -T-RD' также может быть, без ограничений, выбран из -C(O)-LS'-LS"-RD', -C(O)-LS'-O-LS"-RD', -C(O)-LS'-N(RB)-LS"-RD' или -C(O)-LS'-N(RB)S(O)2-LS"-RD'.
В другом варианте воплощения этого аспекта А представляет собой

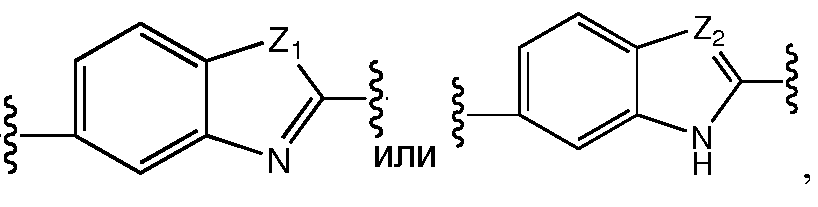
Еще в одном варианте воплощения этого аспекта, A представляет собой фенил,


Еще в одном варианте воплощения этого аспекта, A представляет собой


Еще в одном аспекте настоящее изобретение также включает соединения формулы IC и их фармацевтически приемлемые соли.

где:
RNBпредставляет собой RB;
Rc', каждый независимо, выбран из Rc;
RD', каждый независимо, выбран из RD;
R2 и R5, взятые вместе с атомами, к которым они присоединены, образуют 3-8-членное гетероциклическое кольцо, которое необязательно замещено одним или несколькими заместителями RA;
R9 и R12, взятые вместе с атомами, к которым они присоединены, образуют 3-8-членное гетероциклическое кольцо, которое необязательно замещено одним или несколькими заместителями RA;
A, B, D, L1, L2, L3, T, RA, RB, Rc и RD имеют значения, определенные выше в формуле I.
В этом аспекте A и B, предпочтительно, независимо выбраны из С5-C6карбоцикла, 5-6-членного гетероцикла или 8-10-членных бициклов, таких как

Более предпочтительно, A выбран из C5-C6карбоцикла, 5-6-членного гетероцикла,



Наиболее предпочтительно, A представляет собой C5-C6карбоцикл или 5-6-членный гетероцикл и необязательно замещен одним или несколькими заместителями RA; и B предпочтительно представляет собой 8-10-членный бицикл (такой как

Наиболее предпочтительно, A представляет собой фенил (например,


Также предпочтительно, A представляет собой C5-C6карбоцикл (например, фенил) или 5-6-членный гетероцикл, и B представляет собой
D предпочтительно выбран из С5-C6карбоцикла, 5-6-членного гетероцикла или 8-10-членных бициклов и необязательно замещен одним или несколькими заместителями RA. D также может быть предпочтительно выбран из С1-C6алкила, C2-C6алкенила или C2-C6алкинила и необязательно замещен одним или несколькими заместителями, выбранными из галогена, RT, -О-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано. Более предпочтительно, D представляет собой С5-C6карбоцикл, 5-6-членный гетероцикл или 6-10-членные бициклы и замещен одним или несколькими заместителями RM, где RM представляет собой галоген, нитро, оксо, фосфонокси, фосфоно, тиоксо, циано или -LS-RE. Также предпочтительно, D представляет собой фенил и необязательно замещен одним или несколькими заместителями RA. Более предпочтительно, D представляет собой фенил и замещен одним или несколькими заместителями RM, где RM имеет значение, определенное выше. Наиболее предпочтительно, D представляет собой
Предпочтительно, RM представляет собой галоген, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, циано; или С1-C6алкил, C2-C6алкенил или C2-C6алкинил, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано; или C3-C6карбоцикл или 3-6-членный гетероцикл, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила, циано, С1-C6алкила, C2-C6алкенила, C2-C6алкинила, С1-C6галогеналкила, C2-C6галогеналкенила или C2-C6галогеналкинила. Более предпочтительно, RM представляет собой галоген, гидрокси, меркапто, амино, карбокси; или С1-C6алкил, C2-C6алкенил или С2-C6алкинил, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино или карбокси. Наиболее предпочтительно, RM представляет собой С1-C6алкил, который необязательно замещен одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино или карбокси.
L1 и L2, предпочтительно, независимо представляют собой С1-C6алкилен, и L3 предпочтительно выбран из связи, С1-C6алкилена или -C(O)-. L1, L2 и L3, каждый независимо, необязательно замещен одним или несколькими заместителями, выбранными из галогена, RT, -О-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано. Более предпочтительно, L1 и L2 представляют собой -(CH2)- и, каждый независимо, необязательно замещены одним или несколькими заместителями, выбранными из галогена, RT, -О-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано; и L3 представляет собой связь или -C(O)-.
R2 и R5, взятые вместе с атомами, к которым они присоединены, предпочтительно образуют 5-6-членное гетероциклическое кольцо (например,
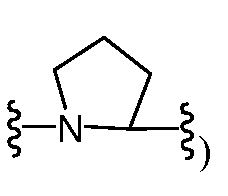
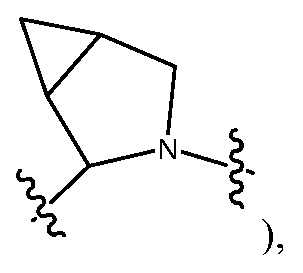
R9 и R12, взятые вместе с атомами, к которым они присоединены, предпочтительно образуют 5-6-членное гетероциклическое кольцо (например,
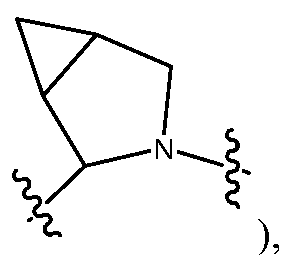
-T-RD' может быть, без ограничения, независимо выбран в каждом случае из -C(O)-LS'-RD', -C(O)O-LS'-RD', -C(O)-LS'-N(RB)C(O)-LS"-RD', -C(O)-LS'-N(RB)C(O)O-LS"-RD', -N(RB)C(O)-LS'-N(RB)C(O)-LS"-RD', -N(RB)C(O)-LS'-N(RB)C(О)О-LS"-RD' или -N(RB)C(O)-LS'-N(RB)-LS"-RD'. Предпочтительно, -T-RD' независимо выбран в каждом случае из -C(O)-LS'-M'-LS"-RD' или -N(RB)C(O)-LS'-M'-LS"-RD'. Более предпочтительно, -T-RD' независимо выбран в каждом случае из -C(O)-LS'-N(RB)C(O)-LS"-RD' или -C(O)-LS'-N(RB)C(O)O-LS"-RD'.
-T-RD' также может быть, без ограничений, независимо выбран в каждом случае из -C(O)-LY'-RD', -C(O)O-LY'-RD', -C(О)-LY'-N(RB)C(О)-LS"-RD', -C(О)-LY'-N(RB)C(О)О-LS"-RD', -N(RB)C(O)-LY'-N(RB)C(O)-LS"-RD', -N(RB)C(О)-LY'-N(RB)C(О)О-LS"-RD' или -N(RB)C(О)-LY'-N(RB)-LS"-RD', где LY', каждый независимо, представляет собой LS' и предпочтительно, каждый независимо, представляет собой С1-C6алкилен (например, -CH2-) и необязательно замещен одним или несколькими заместителями, выбранными из галогена, RT, -О-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано. Предпочтительно, -T-RD' независимо выбран в каждом случае из -C(O)-LY'-M'-LS"-RD' или -N(RB)C(O)-LY'-M'-LS"-RD'. Более предпочтительно, -T-RD' независимо выбран в каждом случае из -C(O)-LY'-N(RB)C(O)-LS"-RD' или -C(O)-LY'-N(RB)C(O)O-LS"-RD'. Наиболее предпочтительно, -T-RD' независимо выбран в каждом случае из -C(O)-LY'-N(RB)C(O)-RD' или -C(O)-LY'-N(RB)C(O)O-RD', где LY' предпочтительно представляет собой каждый независимо С1-C6алкилен (например, -CH2-) и необязательно замещен одним или несколькими заместителями, выбранными из галогена, RT, -О-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано.
RNB и Rc' предпочтительно представляют собой водород, и RD' предпочтительно независимо выбран в каждом случае из LA или 5- или 6-членного карбоцикла или гетероцикла, который необязательно замещен одним или несколькими заместителями, выбранными из галогена, RT, -О-RB, -S-RB, -N(RBRB'), -OC(O)RB, -C(O)ORB, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано. Более предпочтительно, RD' независимо выбран в каждом случае из С1-C6алкила, C2-C6алкенила или C2-C6алкинила, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила, циано, C3-C6карбоцикла или 3-6-членного гетероцикла; или C3-C6карбоцикла или 3-6-членного гетероцикла, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила, циано, С1-C6алкила, C2-C6алкенила, C2-C6алкинила, С1-C6галогеналкила, C2-C6галогеналкенила или С2-C6галогеналкинила.
Для каждого соединения формулы Ic LK также может быть независимо выбран в каждом случае из связи; -LS'-N(RB)C(O)-LS-; -LS'-C(O)N(RB)-LS-; или С1-C6алкилена, C2-C6алкенилена, С2-C6алкинилена, C3-C10карбоцикла или 3-10-членного гетероцикла, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, RT, -О-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано, где LS и LS' имеют значения, определенные выше.
RA предпочтительно представляет собой галоген, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, циано; или С1-C6алкил, C2-C6алкенил или C2-C6алкинил, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано; или C3-C6карбоцикл или 3-6-членный гетероцикл, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила, циано, С1-C6алкила, C2-C6алкенила, C2-C6алкинила, С1-C6галогеналкила, C2-C6галогеналкенила или C2-C6галогеналкинила; или -LA-О-RS, -LA-S-RS, -LA-C(O)RS, -LA-OC(O)RS, -LA-C(O)ORS, -LA-N(RSRS'), -LA-S(O)RS, -LA-SO2RS, -LA-C(O)N(RSRS'), -LA-N(RS)C(О)RS', -LA-N(RS)C(O)N(RS'RS"), -LA-N(RS)SO2RS', -LA-SO2N(RSRS'), -LA-N(RS)SO2N(RS'RS"), -LA-N(RS)S(O)N(RS'RS"), -LA-OS(O)-RS, -LA-OS(O)2-RS, -LA-S(O)2ORS, -LA-S(O)ORS, -LA-OC(O)ORS, -LA-N(RS)C(O)ORS', -LA-OC(O)N(RSRS'), -LA-N(RS)S(O)-RS', -LA-S(O)N(RSRS') или -LA-C(O)N(RS)C(O)-RS', где LA представляет собой связь, С1-C6алкилен, C2-C6алкенилен или C2-C6алкинилен.
Более предпочтительно, RA представляет собой галоген, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, циано; или С1-C6алкил, C2-C6алкенил или C2-C6алкинил, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано; или C3-C6карбоцикл или 3-6-членный гетероцикл, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила, циано, С1-C6алкила, C2-C6алкенила, C2-C6алкинила, С1-C6галогеналкила, C2-C6галогеналкенила или C2-C6галогеналкинила.
Наиболее предпочтительно, RA представляет собой галоген, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, циано; или С1-C6алкил, C2-C6алкенил или C2-C6алкинил, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано.
LS, LS' и LS" предпочтительно, каждый независимо, в каждом случае выбраны из связи; или С1-C6алкилена, C2-C6алкенилена или C2-C6алкинилена.
A и B могут быть одинаковыми или отличными друг от друга. Также, L1 и L2 могут быть одинаковыми или отличными друг от друга.
В одном варианте воплощения этого аспекта, A, B и D, каждый независимо, представляют собой фенил и, каждый независимо, необязательно замещены одним или несколькими заместителями RA. L1 и L2, каждый независимо, представляют собой С1-C6алкилен, L3 представляет собой связь, С1-C6алкилен или -C(O)-, и L1, L2 и L3, каждый независимо, необязательно замещены одним или несколькими заместителями, выбранными из галогена, RT, -О-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано. Предпочтительно, L1 и L2 представляют собой -(CH2)- и, каждый независимо, необязательно замещены одним или несколькими заместителями, выбранными из галогена, RT, -О-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано; и L3 представляет собой связь или -C(O)-. -T-RD' предпочтительно независимо выбран в каждом случае из -C(O)-LS'-N(RB)C(O)-LS"-RD' или -C(O)-LS'-N(RB)C(О)О-LS"-RD', где LS' предпочтительно представляет собой С1-C6алкилен (например, -CH2-) и необязательно замещен одним или несколькими заместителями, выбранными из галогена, RT, -О-RS, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, фосфонокси, фосфоно, оксо, тиоксо, формила или циано. -T-RD' также может быть, без ограничений, выбран из -C(O)-LS'-LS"-RD', -C(O)-LS'-O-LS"-RD', -C(O)-LS'-N(RB)-LS"-RD' или -C(O)-LS'-N(RB)S(O)2-LS"-RD'.
Еще в одном варианте воплощения этого аспекта, A представляет собой

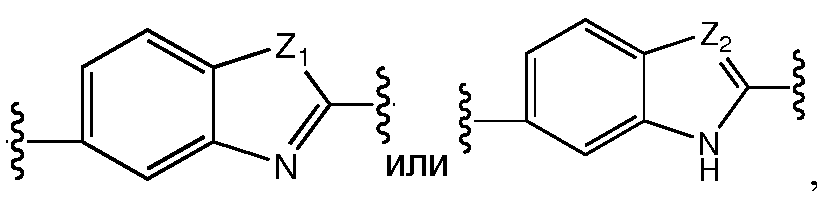
Еще в одном варианте воплощения этого аспекта, A представляет собой фенил,

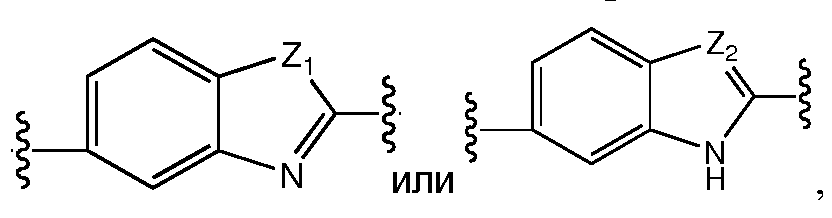
Еще в одном варианте воплощения этого аспекта, A представляет собой

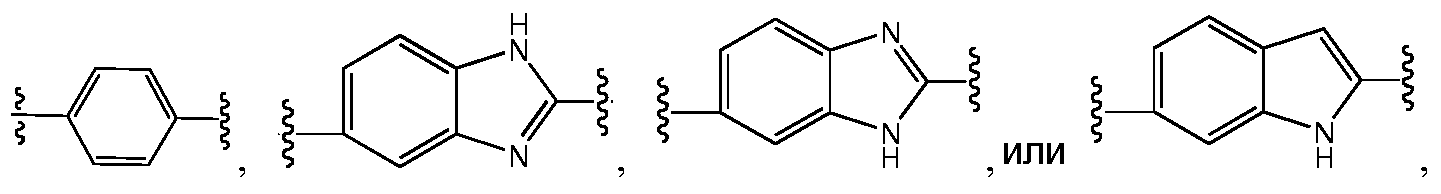
В следующем варианте воплощения этого аспекта, A представляет собой фенил и необязательно замещен одним или несколькими заместителями RA; и B представляет собой
Настоящее изобретение также включает соединения формул I, IA, IB и Ic, описанные в настоящей заявке (включая каждый вариант воплощения, описанный в настоящей заявке), или их соли, за исключением случая, когда D представляет собой C3-C10карбоцикл или 3-10-членный гетероцикл, который замещен J и необязательно замещен одним или несколькими заместителями RA, где J представляет собой C3-C10карбоцикл или 3-10-членный гетероцикл и необязательно замещен одним или несколькими заместителями RA, или J представляет собой -SF5. Предпочтительно, D представляет собой C5-C6карбоцикл, 5-6-членный гетероцикл или 6-10-членный бицикл и необязательно замещен одним или несколькими заместителями RA, и J представляет собой C3-C6карбоцикл или 3-6-членный гетероцикл и необязательно замещен одним или несколькими заместителями RA. Более предпочтительно, D представляет собой С5-C6карбоцикл или 5-6-членный гетероцикл и необязательно замещен одним или несколькими заместителями RA, и J представляет собой C3-C6карбоцикл или 3-6-членный гетероцикл и необязательно замещен одним или несколькими заместителями RA. Наиболее предпочтительно, D представляет собой фенил, замещенный заместителем J, и необязательно замещен одним или несколькими заместителями RA, где J представляет собой С3-C6карбоцикл или 3-6-членный гетероцикл и необязательно замещен одним или несколькими заместителями RA. Предпочтительные группы RA имеют значения, определенные выше. В одном варианте воплощения D представляет собой


Настоящее изобретение также включает соединения формул I, IA, IB и Ic, описанные в настоящей заявке (включая каждый вариант воплощения, описанный в настоящей заявке), или их соли, за исключением случаев, когда:
R1 и R2, каждый независимо, представляют собой Rc, и R5 представляет собой RB; или R1 представляет собой Rc, и R2 и R5, взятые вместе с атомами, к которым они присоединены, образуют 3-10-членное гетероциклическое кольцо, которое необязательно замещено одним или несколькими заместителями RA; и
R3, R4, R6 и R7, каждый независимо, представляют собой Rc; или R3 и R6, каждый независимо, представляют собой Rc, и R4 и R7, взятые вместе с атомами, к которым они присоединены, образуют 3-10-членное карбоциклическое или гетероциклическое кольцо, которое необязательно замещено одним или несколькими заместителями RA.
Соединения по настоящему изобретению можно использовать в форме солей. В зависимости от конкретного соединения, соль соединения может иметь преимущества благодаря одному или нескольким физическим свойствам такой соли, таким как лучшая фармацевтическая стабильность в определенных условиях или желательная растворимость в воде или масле. В некоторых случаях, соль соединения может быть полезной для выделения или очистки соединения.
Когда соль предназначена для введения пациенту, соль предпочтительно представляет собой фармацевтически приемлемую соль. Фармацевтически приемлемые соли включают, но не ограничиваются этим, кислотно-аддитивные соли, основно-аддитивные соли и соли щелочных металлов.
Фармацевтически приемлемые кислотно-аддитивные соли можно получить из неорганических или органических кислот. Примеры подходящих неорганических кислот включают, но не ограничиваются этим, хлористоводородную, бромистоводородную, йодистоводородную, азотную, угольную, серную и фосфорную кислоту. Примеры подходящих органических кислот включают, но не ограничиваются этим, органические кислоты алифатического, циклоалифатического, ароматического, аралифатического, гетероциклильного, карбонового и сульфонового классов. Конкретные примеры солей подходящих органических кислот включают ацетат, трифторацетат, формиат, пропионат, сукцинат, гликолят, глюконат, диглюконат, лактат, малат, соль винной кислоты, цитрат, аскорбат, глюкуронат, малеат, фумарат, пируват, аспартат, глутамат, бензоат, соль антраниловой кислоты, мезилат, стеарат, салицилат, пара-гидроксибензоат, фенилацетат, манделат, эмбонат (памоат), метансульфонат, этансульфонат, бензолсульфонат, пантотенат, толуолсульфонат, 2-гидроксиэтансульфонат, суфанилат, циклогексиламиносульфонат, соль альгеновой кислоты, b-оксимасляной кислоты, галактарат, галактуронат, адипат, альгинат, бисульфат, бутират, камфорат, камфорсульфонат, циклопентанпропионат, додецилсульфат, гликогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, никотинат, 2-нафталинсульфонат, оксалат, пальмоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, тиоцианат, тозилат и ундеканоат.
Фармацевтически приемлемые основно-аддитивные соли включают, но не ограничиваются этим, соли металлов и органические соли. Неограничивающие примеры подходящих солей металлов включают соли щелочных металлов (группа Ia), соли щелочноземельных металлов (группа IIa) и другие фармацевтически приемлемые соли металлов. Такие соли можно получить, без ограничения, из алюминия, кальция, лития, магния, калия, натрия или цинка. Неограничивающие примеры подходящих органических солей могут быть получены из третичных аминов и четвертичного амина, таких как трометамин, диэтиламин, N,N'-дибензилэтилендиамин, хлорпрокаин, холин, диэтаноламин, этилендиамин, меглумин (N-метилглюкамин) и прокаин. Основные азот-содержащие группы могут быть кватернизированы агентами, такими как алкилгалогениды (например, метил, этил, пропил, бутил, децил, лаурил, миристил и стеарил хлориды/бромиды/йодиды), диалкилсульфаты (например, диметил, диэтил, дибутил и диамил сульфаты), аралкилгалогениды (например, бензил и фенетил бромиды) и другие.
Соединения или соли по настоящему изобретению могут существовать в форме сольватов, таких как образованные с водой (т.е. гидраты) или с органическими растворителями (например, с метанолом, этанолом или ацетонитрилом с образованием, соответственно, метанолята, этанолята или ацетонитрилата).
Соединения или соли по настоящему изобретению также можно использовать в форме пролекарств. Некоторые пролекарства представляют собой алифатические или ароматические сложные эфиры, образованные из кислотных групп, содержащихся в соединениях по настоящему изобретению. Другие представляют собой алифатические или ароматические сложные эфиры гидроксильной или аминогруппы соединений по настоящему изобретению. Фосфатные пролекарства, образованные по гидроксильным группам, являются предпочтительными пролекарствами.
Соединения по настоящему изобретению могут включать асимметрически замещенные атомы углерода, известные как хиральные центры. Эти соединения могут существовать, без ограничения, в виде отдельных стереоизомеров (например, отдельные энантиомеры или отдельный диастереомер), смесей стереоизомеров (например, смесь энантиомеров или диастереомеров) или рацемических смесей. Соединения, указанные в настоящей заявке как отдельные стереоизомеры, означают соединения, которые присутствуют в форме, которая, по существу, не содержит других стереоизомеров (например, по существу, не содержит других энантиомеров или диастереомеров). "По существу, не содержит" означает, что, по меньшей мере, 80% соединения в композиции представляет собой описываемый стереоизомер; предпочтительно, по меньшей мере, 90% соединения в композиции представляет собой описывемый стереоизомер; и более предпочтительно, по меньшей мере, 95%, 96%, 97%, 98% или 99% соединения в композиции представляет собой описываемый стереоизомер. Когда стереохимия хирального углерода конкретно не указана в химической структуре соединения, предполагается, что химическая структура охватывает соединения, содержащие любой стереоизомер хирального центра.
Индивидуальные стереоизомеры соединений по настоящему изобретению можно получить, используя различные способы, известные из уровня техники. Эти способы включают, но не ограничиваются этим, стереоспецифический синтез, хроматографическое разделение диастереомеров, хроматографическое разделение энантиомеров, преобразование энантиомеров в энантиомерную смесь до диастереомеров с последующим хроматографическим разделением диастереомеров и восстановлением индивидуальных энантиомеров и ферментативным разделением.
Стереоспецифический синтез обычно включает использование подходящих оптически чистых (энантиомерно чистых) или по существу оптически чистых веществ и реакций синтеза, которые не вызывают рацемизацию или инверсию стереохимии по хиральным центрам. Смеси стереоизомеров соединений, включая рацемические смеси, получаемые в реакциях синтеза, можно разделить, например, хроматографическими методами, как это известно специалистам в данной области, имеющим среднюю квалификацию. Хроматографическое разделение энантиомеров можно осуществить путем использования хиральных смол для хроматографии, многие из которых являются коммерчески доступными. В неограничивающем примере рацемат помещают в раствор и загружают в колонку, содержащую хиральную стационарную фазу. Энантиомеры затем можно разделить при помощи ВЭЖХ.
Разделение энантиомеров также можно осуществить путем преобразования энантиомеров в смесь диастереомеров взаимодействием с хиральными вспомогательными веществами. Полученные диастереомеры можно разделить колоночной хроматографией или кристаллизацией/перекристаллизацией. Такой способ является полезным, когда соединения, подлежащие разделению, содержат карбоксильную, амино или гидроксильную группу, которая будет образовывать соль или ковалентную связь с хиральным вспомогательным веществом. Неограничивающие примеры подходящих хиральных вспомогательных веществ включают хирально чистые аминокислоты, органические карбоновые кислоты или органосульфоновые кислоты. После разделения диастереомеров при помощи хроматографии, могут быть восстановлены индивидуальные энантиомеры. Часто хиральное вспомогательное вещество можно выделить и использовать снова.
Ферменты, такие как эстеразы, фосфатазы или липазы, могут быть полезными для разделения производных энантиомеров в энантиомерной смеси. Например, сложноэфирное производное карбоксильной группы в соединениях, подлежащих разделению, можно обработать ферментом, который селективно гидролизует только один из энантиомеров в смеси. Полученную энантиомерно чистую кислоту затем можно отделить от негидролизованного сложного эфира.
Альтернативно, соли энантиомеров в смеси можно получить, используя любой подходящий способ, известный из уровня техники, включая обработку карбоновой кислоты подходящим оптически чистым основанием, таким как алкалоиды или фенетиламин, с последующим осаждением или кристаллизацией/перекристаллизацией энантиомерно чистых солей. Способы, подходящие для разложения на составные компоненты/разделения смеси стереоизомеров, включая рацемические смеси, можно найти в ENANTIOMERS, RACEMATES, AND RESOLUTIONS (Jacques et al., 1981, John Wiley and Sons, New York, NY).
Соединение по настоящему изобретению может содержать одну или несколько ненасыщенных углерод-углеродных двойных связей. Все изомеры по двойной связи, такие как цис(Z) и транс(E) изомеры, и их смеси охватываются объемом раскрываемого соединения, если не указано иное. Кроме того, когда соединение существует в различных таутомерных формах, указанное соединение не ограничивается каким-либо одним конкретным таутомером, но предполагается, что охватываются все таутомерные формы.
Некоторые соединения по настоящему изобретению могут существовать в разных стабильных конформационных формах, которые могут быть разделены. Торсионная асимметрия в результате ограниченных вращений вокруг асимметрической простой связи, например, из-за пространственного затруднения или деформации кольца, делает возможным разделение различных конформеров. Настоящее изобретение охватывает каждый конформационный изомер таких соединений и их смеси.
Некоторые соединения по настоящему изобретению также могут существовать в цвиттерионной форме, и настоящее изобретение охватывает каждую цвиттерионную форму этих соединений и их смеси.
Соединения по настоящему изобретению в общем виде описаны в настоящей заявке с использованием стандартной номенклатуры. Что касается указанного соединения, содержащего асимметрический центр (центры), должно быть понятно, что все стереоизомеры соединения и их смеси охватываются настоящим изобретением, если не указано иное. Неограничивающие примеры стереоизомеров включают энантиомеры, диастереомеры и цис-транс изомеры. Когда указанное соединение существует в различных таутомерных формах, предполагается, что соединение охватывает все таутомерные формы. Некоторые соединения описаны в настоящей заявке с использованием общих формул, которые включают переменные (например, A, B, D, X, L1, L2, L3, Y, Z, T, RA или RB). Если не указано иное, каждая переменная в такой формуле определена независимо от любой другой переменной, и любая переменная, которая встречается неоднократно в формуле, определена независимо в каждом случае ее присутствия. Если фрагменты описаны как "независимо" выбранные из группы, каждый фрагмент выбран независимо от другого. Каждый фрагмент поэтому может быть идентичным или отличным от другого фрагмента или группы.
Количество атомов углерода в углеводородной группе может быть указано префиксом "Cx-Cy",где x означает минимальное, а y означает максимальное количество атомов углерода в такой группе. Так, например, "С1-C6алкил" относится к алкильному заместителю, содержащему от 1 до 6 атомов углерода. В качестве еще одного примера, C3-C6циклоалкил означает насыщенное углеводородное кольцо, содержащее от 3 до 6 углеродных кольцевых атомов. Префикс, используемый для многокомпонентного заместителя, применим только к первому компоненту, который непосредственно следует за префиксом. Для иллюстрации, термин "карбоциклилалкил" содержит два компонента: карбоциклил и алкил. Таким образом, например, C3-C6карбоциклилС1-C6алкил относится к C3-C6карбоциклилу, присоединенному к исходному молекулярному фрагменту через С1-C6алкильную группу.
Если не указано иное, когда связывающий элемент связывает два других элемента в указанной химической структуре, крайний слева указанный компонент связывающего элемента связан с левым элементом в описываемой структуре, и крайний справа указанный компонент связывающего элемента связан с правым элементом в описываемой структуре. Для иллюстрации, когда химическая структура представляет собой -LS-M-LS'- и M означает -N(RB)S(O)-, тогда химическая структура представляет собой -Ls-N(RB)S(О)-Ls'-.
Когда связывающий элемент в описываемой структуре представляет собой связь, тогда элемент слева от связывающего элемента связан непосредственно с элементом справа от связывающего элемента через ковалентную связь. Например, когда химическая структура указана как -LS-M-LS'- и M выбран как означающий связь, тогда химическая структура будет представлять собой -LS-LS'-. Когда два или более смежных связывающих элементов в указанной структуре представляют собой связи, тогда элемент слева от этих связывающих элементов связан непосредственно с элементом справа от этих связывающих элементов через ковалентную связь. Например, когда химическая структура указана как -LS-M-LS'-M'-LS"- и M и LS' выбраны как означающие связи, тогда химическая структура будет представлять собой -LS-M'-LS"-. Также, когда химическая структура указана как -LS-M-LS'-M'-LS"- и M, LS' и M' представляют собой связи, тогда химическая структура будет представлять собой -LS-LS"-.
Когда химическую формулу используют для описания группы, прерывистая линия (линии) указывает часть группы, которая содержит свободную валентность (валентности).
Когда группа описана как являющаяся "необязательно замещенной", такая группа может быть либо замещенной, либо незамещенной. Когда группа описана как являющаяся необязательно замещенной группой определенным количеством неводородных радикалов, такая группа может быть либо незамещенной, либо замещенной неводородными радикалами в количестве вплоть до указанного или вплоть до максимального количества замещаемых положений в этой группе, которое меньше. Таким образом, например, когда группа описана как гетероцикл, необязательно замещенный неводородными радикалами в количестве вплоть до трех, тогда любой гетероцикл менее чем с тремя замещаемыми положениями будет необязательно замещен лишь столькими неводородными радикалами, сколько замещаемых положений в гетероцикле. Для иллюстрации, тетразолил (который содержит только одно замещаемое положение) будет необязательно замещен неводородным радикалом в количестве вплоть до одного. Для дополнительной иллюстрации, когда азот аминогруппы описан как необязательно замещенный неводородными радикалами в количестве вплоть до двух, тогда азот первичного амина будет необязательно замещен неводородными радикалами в количестве вплоть до двух, тогда как азот вторичного амина будет необязательно замещен только одним неводородным радикалом.
Термин "алкенил" означает линейную или разветвленную углеводородную цепь, содержащую одну или несколько двойных связей. Каждая углерод-углеродная двойная связь может иметь либо цис, либо транс геометрию в алкенильной группе, относительно групп, замещенных по атомам углерода двойной связи. Неограничивающие примеры алкенильных групп включают этенил (винил), 2-пропенил, 3-пропенил, 1,4-пентадиенил, 1,4-бутадиенил, 1-бутенил, 2-бутенил и 3-бутенил.
Термин "алкенилен" относится к двухвалентной ненасыщенной углеводородной цепи, которая может быть линейной или разветвленной и которая содержит по меньшей мере одну углерод-углеродную двойную связь. Неограничивающие примеры алкениленовых групп включают -C(H)=C(H)-, -C(H)=C(H)-CH2-, -C(H)=C(H)-CH2-CH2-, -CH2-C(H)=C(H)-CH2-, -C(H)=C(H)-CH(CH3)- и -CH2-C(H)=C(H)-CH(CH2CH3)-.
Термин "алкил" означает линейную или разветвленную насыщенную углеводородную цепь. Неограничивающие примеры алкильных групп включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, изоамил и гексил.
Термин "алкилен" означает двухвалентную насыщенную углеводородную цепь, которая может быть линейной или разветвленной. Репрезентативные примеры алкилена включают, но не ограничиваются этим, -CH2-, -CH2CH2-, -CH2CH2CH2-, -CH2CH2CH2CH2- и -CH2CH(CH3)CH2-.
Термин "алкинил" означает линейную или разветвленную углеводороднную цепь, содержащую одну или несколько тройных связей. Неограничивающие примеры алкинила включают этинил, 1-пропинил, 2-пропинил, 3-пропинил, децинил, 1-бутинил, 2-бутинил и 3-бутинил.
Термин "алкинилен" относится к двухвалентной ненасыщенной углеводородной группе, которая может быть линейной или разветвленной и которая содержит по меньшей мере одну углерод-углеродную тройную связь. Репрезентативные алкиниленовые группы включают, в качестве примера, -С≡C-, -С≡C-CH2-, -С≡C-CH2-CH2-, -CH2-С≡C-CH2-, -С≡C-CH(CH3)- и -CH2-С≡C-CH(CH2CH3)-.
Термин "карбоцикл" или "карбоциклический" или "карбоциклил" относится к насыщенной (например, "циклоалкил"), частично насыщенной (например, "циклоалкенил" или "циклоалкинил") или полностью ненасыщенной (например, "арил") кольцевой системе, содержащей ноль гетероатомов в числе кольцевых атомом. "Кольцевые атомы" или "кольцевые члены" представляют собой атомы, связанные вместе с образованием кольца или колец. Карбоциклил может представлять собой, без ограничения, одно кольцо, два конденсированных кольца или связанные мостиковой связью или спиро кольца. Замещенный карбоциклил может иметь либо цис, либо транс геометрию. Репрезентативные примеры карбоциклильных групп включают, но не ограничиваются этим, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклопентенил, циклопентадиенил, циклогексадиенил, адамантил, декагидро-нафталенил, октагидро-инденил, циклогексенил, фенил, нафтил, инданил, 1,2,3,4-тетрагидро-нафтил, инденил, изоинденил, декалинил и норпинанил. Карбоциклильная группа может быть присоединена к исходному молекулярному фрагменту через любой замещаемый углеродный кольцевой атом. Когда карбоциклильная группа представляет собой двухвалентную группу, связывающую два других элемента в указанной химической структуре (например, A в формуле I), карбоциклильная группа может быть присоединена к таким двум другим элементам через любые два замещаемых кольцевых атома.
Термин "карбоциклилалкил" относится к карбоциклильной группе, присоединенной к исходному молекулярному фрагменту через алкиленовую группу. Например, C3-C6карбоциклилС1-C6алкил относится к C3-C6карбоциклильной группе, присоединенной к исходному молекулярному фрагменту через С1-C6алкилен.
Термин "циклоалкенил" относится к неароматической, частично ненасыщенной карбоциклильной группе, содержащей ноль гетероатомов в качестве кольцевых членов. Репрезентативные примеры циклоалкенильных групп включают, но не ограничиваются этим, циклобутенил, циклопентенил, циклогексенил и октагидронафталенил.
Термин "циклоалкил" относится к насыщенной карбоциклильной группе, содержащей ноль гетероатомов в качестве кольцевых членов. Неограничивающие примеры циклоалкилов включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, декалинил и норпинанил.
Префикс "галоген" указывает, что заместитель, к которому присоединен такой префикс, замещен одним или несколькими независимо выбранными галогеновыми радикалами. Например, "С1-C6галогеналкил" означает С1-C6алкильный заместитель, где один или несколько атомов водорода замещены независимо выбранными галогеновыми радикалами. Неограничивающие примеры С1-C6галогеналкила включают хлорметил, 1-бромэтил, фторметил, дифторметил, трифторметил и 1,1,1-трифторэтил. Должно быть понятно, что, когда заместитель замещен более чем одним галогеновым радикалом, эти галогеновые радикалы могут быть одинаковыми или отличными друг от друга (если не указано иное).
Термин "гетероцикл" или "гетероцикло" или "гетероциклил" относится к насыщенной (например, "гетероциклоалкил"), частично ненасыщенной (например, "гетероциклоалкенил" или "гетероциклоалкинил") или полностью ненасыщенной (например, "гетероарил") кольцевой системе, где по меньшей мере один из кольцевых атомов представляет собой гетероатом (т.е. азот, кислород или серу), при этом остальные кольцевые атомы независимо выбраны из группы, включающей углерод, азот, кислород и серу. Гетероцикл может представлять собой, без ограничения, одно кольцо, два конденсированных кольца или связанные мостиковой связью или спиро кольца. Гетероциклильная группа может быть связана с исходным молекулярным фрагментом через любой замещаемый атом (атомы) углерода или азота в группе. Когда гетероцикльная группа представляет собой двухвалентную группу, связывающую два других элемента в указанной химической структуре (например, A в формуле I), гетероцикльная группа может быть присоединена к двум другим элементам через любые два замещаемых кольцевых атома.
Гетероциклил может представлять собой, без ограничения, моноцикл, который содержит одно кольцо. Неограничивающие примеры моноциклов включают фуранил, дигидрофуранил, тетрагидрофуранил, пирролил, изопирролил, пирролинил, пирролидинил, имидазолил, изоимидазолил, имидазолинил, имидазолидинил, пиразолил, пиразолинил, пиразолидинил, триазолил, тетразолил, дитиолил, оксатиолил, оксазолил, изоксазолил, тиазолил, изотиазолил, тиазолинил, изотиазолинил, тиазолидинил, изотиазолидинил, тиодиазолил, оксатиазолил, оксадиазолил (включая 1,2,3-оксадиазолил, 1,2,4-оксадиазолил (известный также как "азоксимил"), 1,2,5-оксадиазолил (известный также как "фуразанил") и 1,3,4-оксадиазолил), оксатриазолил (включая 1,2,3,4-оксатриазолил и 1,2,3,5-оксатриазолил), диоксазолил (включая 1,2,3-диоксазолил, 1,2,4-диоксазолил, 1,3,2-диоксазолил и 1,3,4-диоксазолил), оксатиоланил, пиранил (включая 1,2-пиранил и 1,4-пиранил), дигидропиранил, пиридинил, пиперидинил, диазинил (включая пиридазинил (известный также как "1,2-диазинил"), пиримидинил (известный также как "1,3-диазинил") и пиразинил (известный также как "1,4-диазинил")), пиперазинил, триазинил (включая s-триазинил (известный также как "1,3,5-триазинил"), as-триазинил (также известный как 1,2,4-триазинил) и v-триазинил (известный также как "1,2,3-триазинил), оксазинил (включая 1,2,3-оксазинил, 1,3,2-оксазинил, 1,3,6-оксазинил (известный также как "пентоксазолил"), 1,2,6-оксазинил и 1,4-оксазинил), изоксазинил (включая o-изоксазинил и пара-изоксазинил), оксазолидинил, изоксазолидинил, оксатиазинил (включая 1,2,5-оксатиазинил или 1,2,6-оксатиазинил), оксадиазинил (включая 1,4,2-оксадиазинил и 1,3,5,2-оксадиазинил), морфолинил, азепинил, оксепинил, тиепинил и диазепенил.
Гетероциклил также может представлять собой, без ограничения, бицикл, содержащий два конденсированных кольца, такой как, например, нафтиридинил (включая [1,8] нафтиридинил и [1,6] нафтиридинил), тиазолпиримидинил, тиенопиримидинил, пиримидопиримидинил, пиридопиримидинил, пиразолопиримидинил, индолизинил, пириндинил, пиранопирролил, 4H-хинолизинил, пуринил, пиридопиридинил (включая пиридо[3,4-b]-пиридинил, пиридо[3,2-b]-пиридинил и пиридо[4,3-b]-пиридинил), пиридопиримидин и птеридинил. Другие неограничивающие примеры гетероциклов с конденсированными кольцами включают бензо-конденсированные гетероциклилы, такие как индолил, изоиндолил, индоленинил (известный также как "псевдоиндолил"), изоиндазолил (известный также как "бензпиразолил"), бензазинил (включая хинолинил (известный также как "1-бензазинил") и изохинолинил (известный также как "2-бензазинил")), бензимидазолил, фталазинил, хиноксалинил, бензодиазинил (включая циннолинил (известный также как "1,2-бензодиазинил") и хиназолинил (известный также как "1,3-бензодиазинил")), бензопиранил (включая "хроменил" и "изохроменил"), бензотиопиранил (известный также как "тиохроменил"), бензоксазолил, индоксазинил (известный также как "бензизоксазолил"), антранилил, бензодиоксолил, бензодиоксанил, бензоксадиазолил, бензофуранил (известный также как "кумаронил"), изобензофуранил, бензотиенил (известный также как "бензотиофенил", "тионафтенил" и "бензотиофуранил"), изобензотиенил (известный также как "изобензотиофенил", "изотионафтенил" и "изобензотиофуранил"), бензотиазолил, бензотиадиазолил, бензимидазолил, бензотриазолил, бензоксазинил (включая 1,3,2-бензоксазинил, 1,4,2-бензоксазинил, 2,3,1-бензоксазинил и 3,1,4-бензоксазинил), бензизоксазинил (включая 1,2-бензизоксазинил и 1,4-бензизоксазинил) и тетрагидроизохинолинил.
Гетероциклил может включать один или несколько атомов серы в качестве кольцевых членов; и в некоторых случаях атом (атомы) серы является окисленным до SO или SO2. Гетероатом(атомы) азота в гетероциклиле могут быть, или могут не быть, кватернизированы и могут быть, или могут не быть, окислены до N-оксида. Кроме того, гетероатом(атомы) азота могут быть, или могут не быть, N-защищенными.

Термин "фармацевтически приемлемый" используют в качестве прилагательного, означающего, что определяемое существительное является подходящим для использования в качестве фармацевтического продукта или в качестве части фармацевтического продукта.
Термин "терапевтически эффективное количество" относится к общему количеству каждого активного вещества, которое является достаточным для проявления благоприятного эффекта у пациента, например, снижения вирусной нагрузки.
Термин "пролекарство" относится к производным соединений по настоящему изобретению, которые содержат химически или метаболически расщепляемые группы и преобразуются, в результате сольволиза или в физиологических условиях, в соединения по настоящему изобретению, которые являются фармацевтически активными in vivo. Пролекарство соединения может быть образовано обычным способом путем взаимодействия функциональной группы соединения (такой как амино, гидрокси или карбокси группа). Пролекарства часто имеют такие преимущества, как растворимость, совместимость с тканями или замедленное высвобождение в организме млекопитающих (см., Bungard, H., DESIGN OF PRODRUGS, pp. 7-9, 21-24, Elsevier, Amsterdam 1985). Пролекарства включают кислотные производные, хорошо известные специалистам в данной области, такие как, например, сложные эфиры, полученные путем взаимодействия исходного кислотного соединения с подходящим спиртом, или амиды, полученные путем взаимодействия исходного кислотного соединения с подходящим амином. Примеры пролекарств включают, но не ограничиваются этим, ацетат, формиат, бензоат или другие ацилированные производные спиртовой или аминовой функциональной группы в соединениях по настоящему изобретению.
Термин "сольват" относится к физической ассоциации соединения по настоящему изобретению с одной или несколькими молекулами растворителя, органического или неорганического. Эта физическая ассоциация часто включает водородное связывание. В некоторых случаях сольват можно выделить, например, когда одна или несколько молекул растворителя включены в кристаллическую решетку кристаллического твердого вещества. "Сольват" охватывает как сольваты в фазе раствора, так и нерастворимые. Примеры сольватов включают, но не ограничиваются этим, гидраты, этаноляты и метаноляты.
Термин "N-защитная группа" или "N-защищенный" относится к тем группам, которые способны к защите аминогруппы против нежелательных взаимодействий. Обычно используемые N-защитные группы описаны в Greene and Wuts, PROTECTING GROUPS IN CHEMICAL SYNTHESIS (3rd ed., John Wiley & Sons, NY (1999). Неограничивающие примеры N-защитных групп включают ацильные группы, такие как формил, ацетил, пропионил, пивалоил, трет-бутилацетил, 2-хлорацетил, 2-бромацетил, трифторацетил, трихлорацетил, фталил, o-нитрофеноксиацетил, бензоил, 4-хлорбензоил, 4-бромбензоил или 4-нитробензоил; сульфонильные группы, такие как бензолсульфонил или пара-толуолсульфонил; сульфенильные группы, такие как фенилсульфенил (фенил-S-) или трифенилметилсульфенил (тритил-S-); сульфинильные группы, такие как пара-метилфенилсульфинил (p-метилфенил-S(O)-) или трет-бутилсульфинил (t-Bu-S(O)-); карбамат-образующие группы, такие как бензилоксикарбонил, пара-хлорбензилоксикарбонил, пара-метоксибензилоксикарбонил, пара-нитробензилоксикарбонил, 2-нитробензилоксикарбонил, пара-бромбензилоксикарбонил, 3,4-диметоксибензилоксикарбонил, 3,5-диметоксибензилоксикарбонил, 2,4-диметоксибензилоксикарбонил, 4-метоксибензилоксикарбонил, 2-нитро-4,5-диметоксибензилоксикарбонил, 3,4,5-триметоксибензилоксикарбонил, 1-(пара-бифенилил)-1-метилэтоксикарбонил, диметил-3,5-диметоксибензилоксикарбонил, бензгидрилоксикарбонил, трет-бутилоксикарбонил, диизопропилметоксикарбонил, изопропилоксикарбонил, этоксикарбонил, метоксикарбонил, аллилоксикарбонил, 2,2,2-трихлор-этокси-карбонил, феноксикарбонил, 4-нитро-феноксикарбонил, циклопентилоксикарбонил, адамантилоксикарбонил, циклогексилоксикарбонил или фенилтиокарбонил; алкильные группы, такие как бензил, пара-метоксибензил, трифенилметил или бензилоксиметил; пара-метоксифенил; и силильные группы, такие как триметилсилил. Предпочтительно, N-защитные группы включают формил, ацетил, бензоил, пивалоил, трет-бутилацетил, фенилсульфонил, бензил, трет-бутилоксикарбонил (Boc) и бензилоксикарбонил (Cbz).
Соединения по настоящему изобретению можно получить с использованием различных способов. В качестве неограничивающего примера, соединения по настоящему изобретению можно получить путем сочетания соединения формулы II с соединением формулы III, как показано на Схеме I, где Q представляет собой галоген (например, бром, хлор или йод), и A, B, D, L1, L2, L3, Y и Z имеют значения, определенные выше. Аминосоединение II может быть алкилировано путем взаимодействия с галогеналкильным (например, галогенметил) соединением III в присутствии основания, такого как KOH, t-BuOK, амид натрия, гидрид натрия, CsOH, основание Хунига, Na2CO3 или NaHCO3, в подходящем органическом растворителе, таком как ТГФ или ДМФА, или в воде (если основание является совместимым с водным растворителем), с добавлением или без поверхностно-активного вещества, такого как додецилсульфат натрия или тетрабутиламмонийбромид. Образование симметричных продуктов (например, формула F на Схеме I, где B, Z и L2 в формуле I идентичны A, Y и L1, соответственно) можно осуществить с использованием одной процедуры, как показано, или показанные несимметричные продукты можно получить путем последовательного образования моноалкилированного продукта V с последующим взаимодействием со вторым галогеналкильным (например, галогенметильным) соединением VI в условиях, аналогичных тем, которые описаны выше.
Альтернативно, Q в соединениях III и VI (например, бром, хлор или йод) можно заместить 4-метилбензесульфонатом и подвергнуть взаимодействию с II или V, соответственно, в аналогичных условиях. Моноалкилированное соединение V также можно получить путем взаимодействия амина II с альдегидом IV с образованием основания Шиффа (имин), которое может быть восстановлено до продуктов V при помощи гидридного восстановителя, такого как боргидрид натрия или цианоборгидрид натрия (с добавлением или без кислоты, такой как уксусная кислота), в растворителе, таком как этанол, толуол, ТГФ или дихлорметан. Альтернативно, основание Шиффа, образованное из II и IV, можно восстановить до продуктов V путем гидрирования в присутствии подходящего катализатора, такого как палладиевый или платиновый катализатор или никель Ренея.

В качестве еще одного неограничивающего примера, соединения по настоящему изобретению можно получить путем сочетания соединения формулы II с соединением формулы III, как показано на Схеме II, где R представляет собой -LS'-M'-LS"- RD, и LS', M', LS" и RD имеют значения, определенные выше. Аминосоединение II может быть алкилировано путем взаимодействия с 4-нитробензилбромидом III в присутствии основания, такого как KOH, t-BuOK, амид натрия, гидрид натрия, CsOH, основание Хунига, Na2CO3 или NaHCO3, в подходящем органическом растворителе, таком как ТГФ или ДМФА, или в воде (если основание является совместимым с водным растворителем), с добавлением или без поверхностно-активного вещества, такого как додецилсульфат натрия или тетрабутиламмоний бромид. Динитросоединение IV может быть восстановлено до диамино продукта V при помощи гидридного восстановителя, такого как боргидрид натрия (с добавлением или без соли переходного металла, такой как BiCl3, SbCl3, NiCl2, Cu2Cl2 или CoCl2), в растворителе, таком как этанол или ТГФ. Альтернативно, IV можно восстановить до продукта V путем гидрирования в присутствии подходящего катализатора, такого как палладиевый или платиновый катализатор или никель Ренея. Диамин V можно подвергнуть взаимодействию с подходяще защищенной пролиновой кислотой (показан Boc, хотя возможны заместители Cbz, Troc или Fmoc), в присутствии пептидного связывающего реагента, такого как EDAC/HOBT, PyBOP, HATU или DEBPT, в растворителе, таком как ТГФ, ДМФА, дихлорметан или ДМСО, с добавлением или без аминового основания, такого как основание Хунига, пиридин, 2,6-лутидин или триэтиламин, с получением VI. Удаление защитной группы Boc с получением VII можно осуществить путем обработки кислотой, такой как ТФУК, HCl или муравьиная кислота. Соединения по настоящему изобретению можно получить путем сочетания VII с выбранной кислотой с использованием стандартных пептидных связывающих реагентов и условий, описанных выше. Также, соединения формулы IA, описанные выше, могут быть получены аналогичным способом.

В качестве еще одного неограничивающего примера, соединения по настоящему изобретению можно получить способами, показанными на Схеме III, где R представляет собой -LS'-M'-LS"-RD, и LS', M', LS" и RD имеют значения, определенные выше. Диамин II можно подвергнуть взаимодействию с подходящей защищенной пролиновой кислотой (показан Boc, хотя может быть заместитель Cbz, Troc или Fmoc) в присутствии пептидного связывающего реагента, такого как EDAC/HOBT, PyBOP, HATU или DEBPT, в растворителе, таком как ТГФ, ДМФА, дихлорметан или ДМСО, с добавлением или без аминового основания, такого как основание Хунига, пиридин, 2,6-лутидин или триэтиламин, с получением III в виде смеси амидных продуктов. Нагревание III в уксусной кислоте (50-100ºC) дает бензимидазольное соединение IV. Альтернативно, IV можно получить путем взаимодействия II с альдегидом, с последующей обработкой окислителем, таким как Cu(OAc)2 или MnO2. См. Penning et al., BIOORG. MED. CHEM. 16:6965-6975 (2008), который включен в настоящую заявку посредством ссылки во всей полноте. Сложноэфирная функциональная группа IV может быть восстановлена до спирта V в стандартных условиях, таких как обработка литийалюминийгидридом или DIBAL, в подходящем растворителе, таком как ТГФ или дихлорметан. Спирт V может быть преобразован в бромметильное соединение VI с использованием общепринятых условий, например, путем обработки при помощи CBr4 и трифенилфосфина или путем обработки при помощи PBr3. Альтернативно, V может быть окислен различными способами до альдегида VII, например, при помощи MnO2, PCC, PDC, с использованием окисления по методу Сверна или перйодинана Десс-Мартина. Соединение VII можно использовать для получения соединения IX путем взаимодействия с анилином с образованием основания Шиффа (имин), которое может быть восстановлено до IX при помощи гидридного восстановителя, такого как боргидрид натрия или цианоборгидрид натрия (с добавлением или без кислоты, такой как уксусной кислоты), в растворителе, таком как этанол, толуол, ТГФ или дихлорметан. Альтернативно, основание Шиффа, образованное из VII, можно восстановить до продуктов IX путем гидрирования в присутствии подходящего катализатора, такого как палладиевый или платиновый катализатор или никель Ренея. Соединение VI можно подвергнуть взаимодействию с анилином в присутствии основания, такого как KOH, t-BuOK, амид натрия, гидрид натрия, CsOH, основание Хунига, Na2CO3 или NaHCO3, в подходящем органическом растворителе, таком как ТГФ или ДМФА, или в воде (если основание является совместимым с водным растворителем), с добавлением или без поверхностно-активного вещества, такого как додецилсульфат натрия или тетрабутиламмонийбромид, с получением симметричного соединения VIII. Альтернативно, VIII также можно получить путем взаимодействия IX с VI в условиях алкилирования, описанных выше. После удаления защитной группы Boc из VIII (осуществляли путем обработки кислотой, такой как ТФУК, HCl или муравьиная кислота), соединения по настоящему изобретению можно получить путем сочетания полученного диамина с выбранной кислотой с использованием стандартных пептидных связывающих реагентов и условий, описанных выше. Соединение IX также можно подвергнуть взаимодействию с 4-нитробензилбромидом в условиях алкилирования, описанных выше, с получением X. Восстановление нитрогруппы соединения X с использованием условий, описанных выше, и сочетание с подходящей защищенной пролиновой кислотой может обеспечить соединение XI. После удаления защитной группы Boc из соединения XI (осуществляли путем обработки кислотой, такой как ТФУК, HCl или муравьиная кислота), соединения по настоящему изобретению можно получить путем сочетания полученного диамина с выбранной кислотой с использованием стандартных пептидных связывающих реагентов и условий, описанных выше. Также, соединения формулы IB могут быть получены аналогичным способом, где А представляет собой
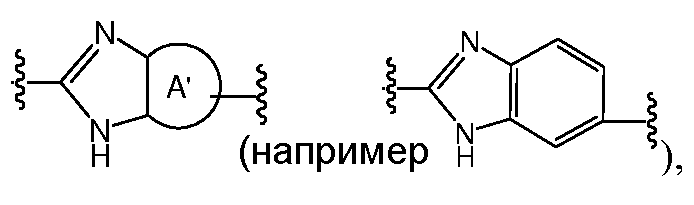

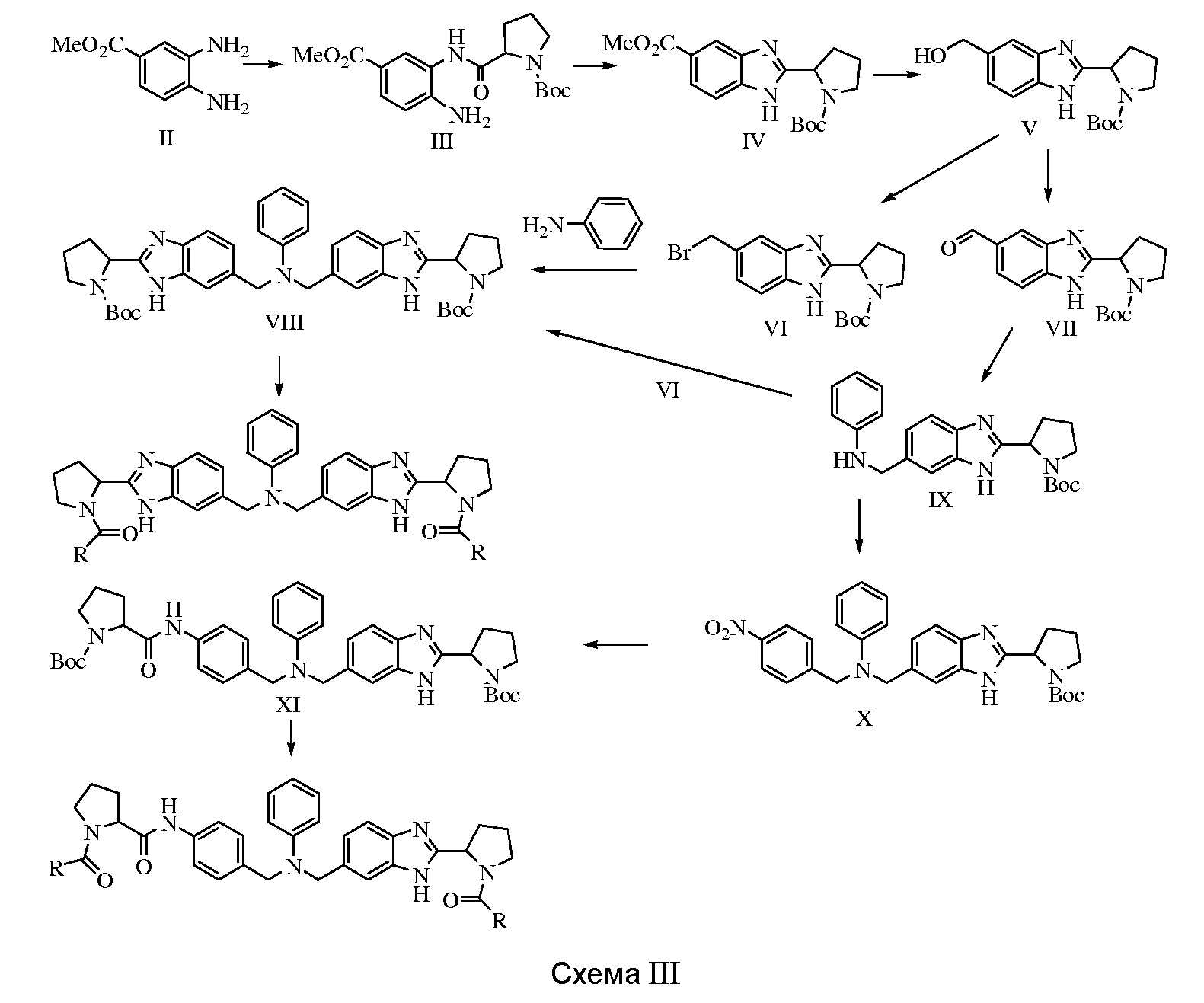
В качестве еще одного неограничивающего примера, соединения по настоящему изобретению можно получить способами, показанными на Схеме IV, где R представляет собой -LS'-M'-LS"-RD, и LS', M', LS", RD, R1, R2 и R5 имеют значения, определенные выше. Соединение II можно получить из 4'-йодацетофенона с использованием известных условий, таких как обработка при помощи Br2. Соединение II можно подвергнуть взаимодействию с солью аминокислоты (полученной из подходяще защищенной аминокислоты и основания, такого как Cs2CO3, KOH, NaOH или Na2CO3, в растворителе, таком как этанол или ТГФ) в растворителе, таком как ТГФ, ДМФА или ДМСО, с получением сложного эфира III. Сложный эфир III можно обработать при помощи источника аммиака, такого как NH4OAc, NH4Cl или аммиачный газ, и подвергнуть нагреванию в растворителе, таком как толуол или ксилол, с азеотропным удалением воды, с получением имидазола IV. См. Gordon et al., TET. LETT. 34:1901-1904 (1993) и Moinet et a, BIOORG. MED. CHEM. LETT. 11:991-995 (2001), которые обе включены в настоящую заявку посредством ссылки во всей их полноте. Йодид IV может быть преобразован в сложный эфир V путем обработки палладиевым катализатором (таким как Pd(PPh3)4 или Pd(dppf)Cl2 или Pd(II) катализатор, такой Pd(OAc)2 или Pd2(dba)3, с добавлением или без фосфорорганических лигандов, таких как PPh3 или P(t-Bu)3) и оксидом углерода в присутствии основания, такого как триэтиламин или основание Хунига, в растворителе, таком как метанол или этанол, с использованием или без нагревания. Полученный сложный эфир V может быть восстановлен до спирта VI и затем окислен до альдегида VII способами, описанными выше. Соединение VII можно использовать для получения соединения VIII путем взаимодействия с анилином с образованием основания Шиффа (имин), которое может быть восстановлено до соединения VIII при помощи гидридного восстановителя, такого как боргидрид натрия или цианоборгидрид натрия (с добавлением или без кислоты, такой как уксусная кислота), в растворителе, таком как этанол, толуол, ТГФ или дихлорметан. Альтернативно, основание Шиффа, образованное из VII, можно восстановить до продуктов VIII путем гидрирования в присутствии подходящего катализатора, такого как палладиевый или платиновый катализатор или никель Ренея. Соединение VIII можно подвергнуть взаимодействию с 4-нитробензилбромидом в условиях алкилирования, описанных выше, с получением соединения IX. Восстановление нитрогруппы соединения IX с использованием условий, описанных выше, и сочетание с подходяще защищенной пролиновой кислотой может обеспечить соединение XI. После удаления защитной группы Boc из XI (осуществляли путем обработки кислотой, такой как ТФУК, HCl или муравьиная кислота), соединения по настоящему изобретению можно получить путем сочетания полученного диамина с выбранной кислотой с использованием стандартных пептидных связывающих реагентов и условий, описанных выше. Также, соединения формулы Ic могут быть получены аналогичным способом.

В качестве еще одного неограничивающего примера, соединения по настоящему изобретению общей формулы I можно получить, как показано на Схеме I'. Сочетание соединения формулы (1) с соединением формулы (2), как показано на Схеме I', где Q представляет собой галоген (например, бром, хлор или йод), и A, B, D, L1, L2, L3, Y и Z имеют значения, определенные выше, дает соединения формулы (4). Аминосоединение (1) может быть алкилировано путем взаимодействия с галогеналкильным (например, галогенметил) соединением (2) в присутствии основания, такого как KOH, t-BuOK, амид натрия, гидрид натрия, CsOH, основание Хунига, Na2CO3 или NaHCO3, в подходящем органическом растворителе, таком как ТГФ или ДМФА, или в воде (если основание является совместимым с водным растворителем), с добавлением или без поверхностно-активного вещества, такого как додецилсульфат натрия или тетрабутиламмонийбромид. Соединения формулы (4) можно подвергнуть взаимодействию с (5), где Q представляет собой галоген (например, бром, хлор или йод), с использованием таких же условий, как условия для взаимодействия (1) с (2), с получением соединений общей формулы I. Когда B, Z и L2 в формуле I идентичны A, Y и L1, соответственно, получают симметричные продукты. Получение симметричных продуктов можно осуществить с использованием одной процедуры, или несимметричные продукты (где один из B, Z или L2 отличен от A, Y или L1, соответственно) можно получить путем последовательного образования моноалкилированного продукта (4) с последующим взаимодействием со вторым галогеналкильным (например, галогенметил) соединением (5) в условиях, аналогичных тем, которые описаны выше. Альтернативно, Q в соединениях (2) и (5) (например, бром, хлор или йод) можно заместить 4-метилбензесульфонатом и подвергнуть взаимодействию с (1) или (4), соответственно, в аналогичных условиях. Моноалкилированное соединение (4) также можно получить путем взаимодействия амина (1) с альдегидом (3) с образованием основания Шиффа (имин), которое может быть восстановлено до продуктов (4) при помощи гидридного восстановителя, такого как боргидрид натрия или цианоборгидрид натрия (с добавлением или без кислоты, такой как уксусная кислота), в растворителе, таком как этанол, толуол, ТГФ или дихлорметан. Альтернативно, основание Шиффа, образованное из (1) и (3), можно восстановить до продуктов (4) путем гидрирования в присутствии подходящего катализатора, такого как палладиевый или платиновый катализатор или никель Ренея.
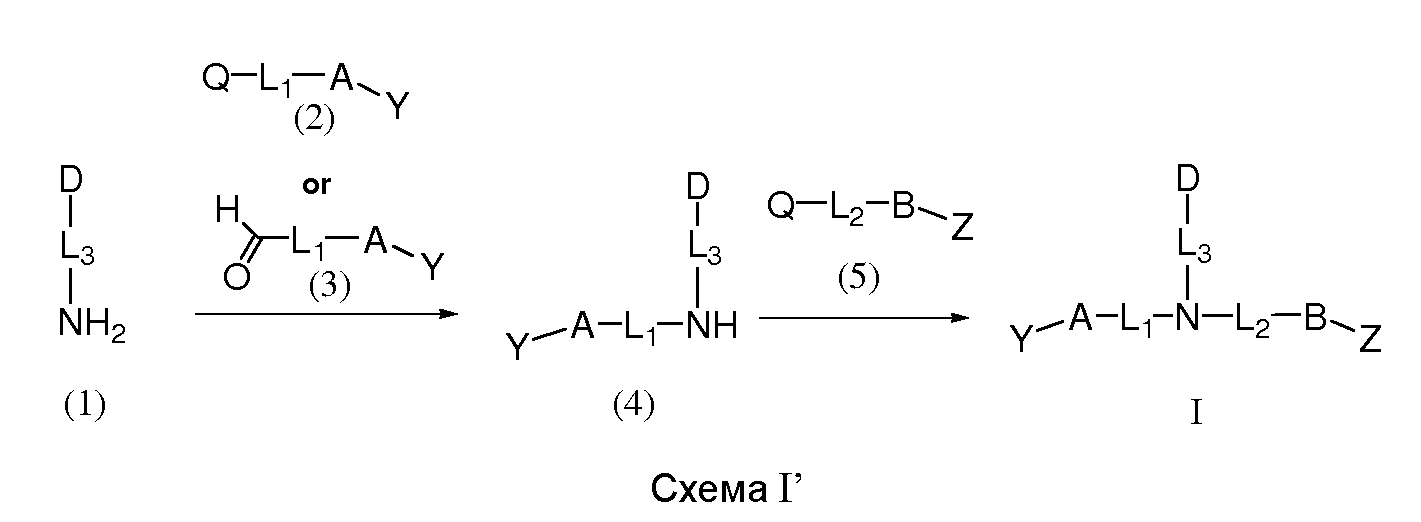
В качестве еще одного неограничивающего примера, соединения по настоящему изобретению можно получить, как показано на Схеме II'. Сочетание соединения формулы (6), где RA имеет значение, определенное выше, и n имеет значение 0, 1, 2, 3, 4 или 5, с соединением формулы (7) может дать соединения формулы (8). Например, аминосоединение (6) может быть алкилировано путем взаимодействия с 4-нитробензилбромидом (7) в присутствии основания, такого как KOH, t-BuOK, амид натрия, гидрид натрия, CsOH, основание Хунига, Na2CO3 или NaHCO3, в подходящем органическом растворителе, таком как ТГФ или ДМФА, или в воде (если основание является совместимым с водным растворителем), с добавлением или без поверхностно-активного вещества, такого как додецилсульфат натрия или тетрабутиламмонийбромид. Динитросоединение (8) может быть восстановлено до диаминопродукта (9) при помощи гидридного восстановителя, такого как боргидрид натрия (с добавлением или без соли переходного металла, такой как BiCl3, SbCl3, NiCl2, Cu2Cl2 или CoCl2), в растворителе, таком как этанол или ТГФ. Альтернативно, (8) можно восстановить до продукта (9) путем гидрирования в присутствии подходящего катализатора, такого как палладиевый или платиновый катализатор или никель Ренея. Диамин (9) можно подвергнуть взаимодействию с подходяще защищенной пролиновой кислотой (показан Boc, хотя можно использовать заместитель Cbz, Troc или Fmoc) в присутствии пептидного связывающего реагента, такого как EDAC/HOBT, PyBOP, HATU или DEBPT, в растворителе, таком как ТГФ, ДМФА, дихлорметан или ДМСО, с добавлением или без аминового основания, такого как основание Хунига, пиридин, 2,6-лутидин или триэтиламин, с получением (10). Удаление защитной группы Boc с получением (11) можно осуществить путем обработки кислотой, такой как ТФУК, HCl или муравьиная кислота. Соединения по настоящему изобретению (12), где R20 представляет собой -LS'-M'-LS"-RD, и LS', M', LS" и RD имеют значения, определенные выше, можно получить путем сочетания (11) с выбранной кислотой с использованием стандартных пептидных связывающих реагентов и условий, описанных выше. Также, соединения формулы IA, описанные выше, могут быть получены аналогичным способом.
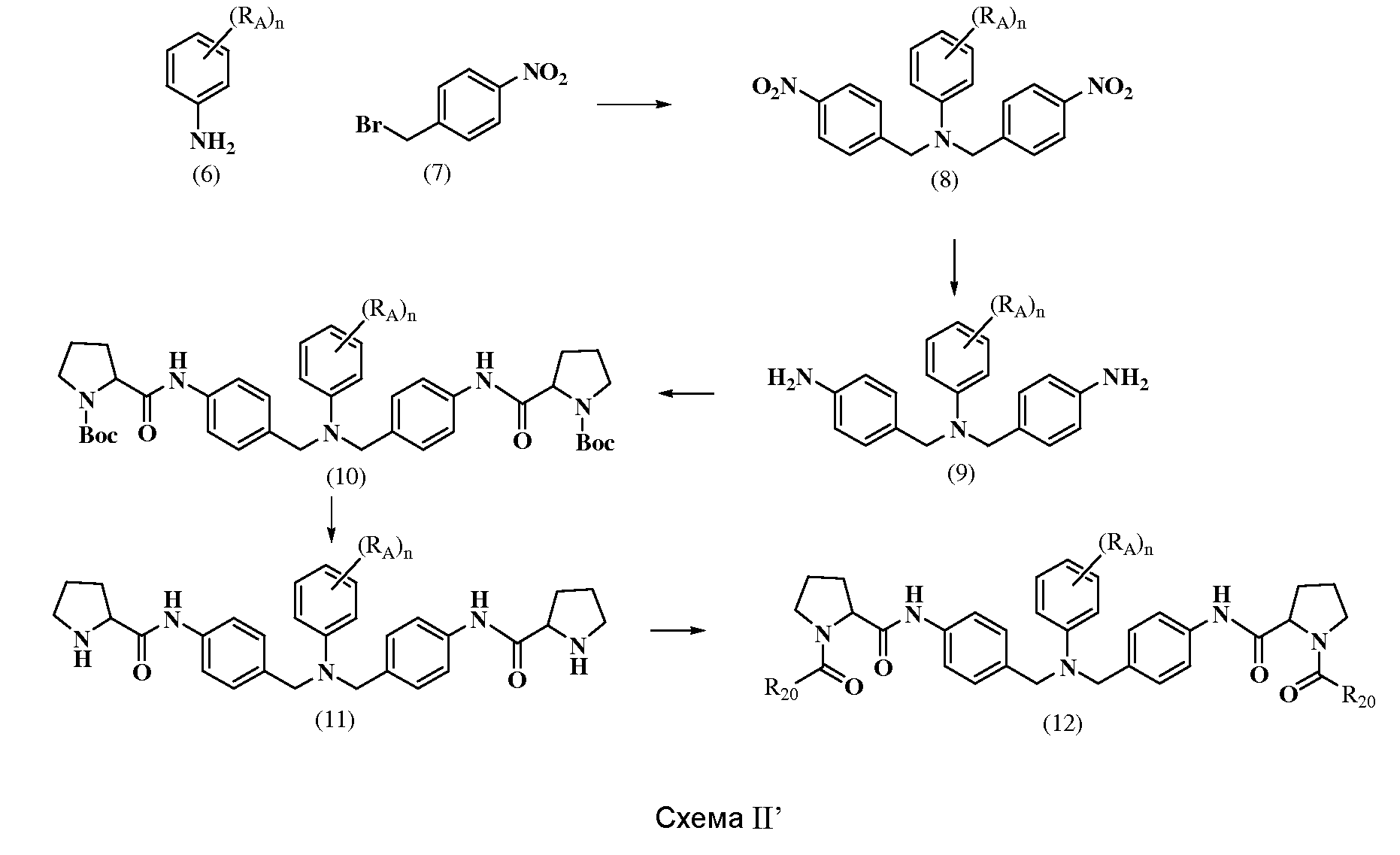
В качестве еще одного неограничивающего примера, соединения по настоящему изобретению (20) и (24) можно получить способами, показанными на Схеме III', где R20 представляет собой -LS'-M'-LS"-RD, и LS', M', LS", RD и RA имеют значения, определенные выше, и n имеет значение 0, 1, 2, 3, 4 или 5. Диамин (13) можно подвергнуть взаимодействию с подходяще защищенной пролиновой кислотой (показан Boc, хотя можно использовать заместитель Cbz, Troc или Fmoc) в присутствии пептидного связывающего реагента, такого как EDAC/HOBT, PyBOP, HATU или DEBPT, в растворителе, таком как ТГФ, ДМФА, дихлорметан или ДМСО, с добавлением или без аминового основания, такого как основание Хунига, пиридин, 2,6-лутидин или триэтиламин, с получением (14) в виде смеси амидных продуктов. Нагревание соединения (14) в уксусной кислоте (50-100°C) дает бензимидазольное соединение (15). Альтернативно, соединение (15) можно получить путем взаимодействия соединения (13) с альдегидом с последующей обработкой окислителем, таким как Cu(OAc)2 или MnO2. См. Penning et al., BIOORG. MED. CHEM. 16:6965-6975 (2008), который включен в настоящую заявку посредством ссылки во всей полноте. Сложноэфирная функциональная группа соединения (15) может быть восстановлена до спирта (16) в стандартных условиях, таких как обработка литийалюминийгидридом или DIBAL, в подходящем растворителе, таком как ТГФ или дихлорметан. Спирт (16) может быть преобразован в бромметильное соединение (17) с использованием общепринятых условий, таких как обработка при помощи CBr4 и трифенилфосфина или обработка при помощи PBr3. Альтернативно, соединение (16) может быть окислено различными способами до альдегида (18), например, с использованием MnO2, PCC, PDC, окисления по методу Сверна или перйодинана Десс-Мартина. Соединение (18) можно использовать для получения соединения (21) путем взаимодействия с анилином с образованием основания Шиффа (имин), которое может быть восстановлено до (21) при помощи гидридного восстановителя, такого как боргидрид натрия или цианоборгидрид натрия (с добавлением или без кислоты, такой как уксусная кислота), в растворителе, таком как этанол, толуол, ТГФ или дихлорметан. Альтернативно, основание Шиффа, образованное из (18), можно восстановить до продуктов (21) путем гидрирования в присутствии подходящего катализатора, такого как палладиевый или платиновый катализатор или никель Ренея. Соединение (17) можно подвергнуть взаимодействию с (6) в присутствии основания, такого как KOH, t-BuOK, амид натрия, гидрид натрия, CsOH, основание Хунига, Na2CO3 или NaHCO3, в подходящем органическом растворителе, таком как ТГФ или ДМФА, или в воде (если основание является совместимым с водным растворителем), с добавлением или без поверхностно-активного вещества, такого как додецилсульфат натрия или тетрабутиламмонийбромид, с получением симметричного соединения (19). Альтернативно, соединение (19) также можно получить путем взаимодействия соединения (21) с соединением (17) в условиях алкилирования, описанных выше. После удаления защитной группы Boc из (19) (осуществляли путем обработки кислотой, такой как ТФУК, HCl или муравьиная кислота), соединения по настоящему изобретению (20) можно получить путем сочетания полученного диамина с выбранной кислотой с использованием стандартных пептидных связывающих реагентов и условий, описанных выше. Соединение (21) также можно подвергнуть взаимодействию с 4-нитробензилбромидом в условиях алкилирования, описанных выше, с получением (22). Восстановление нитрогруппы соединения (22) с использованием условий, описанных выше, и сочетание с подходяще защищенной пролиновой кислотой может обеспечить соединение (23). После удаления защитной группы Boc из (23) (осуществляли путем обработки кислотой, такой как ТФУК, HCl или муравьиная кислота), соединения по настоящему изобретению (24) можно получить путем сочетания полученного диамина с выбранной кислотой с использованием стандартных пептидных связывающих реагентов и условий, описанных выше. Также, соединения формулы IB можно получить аналогичным способом, где А представляет собой

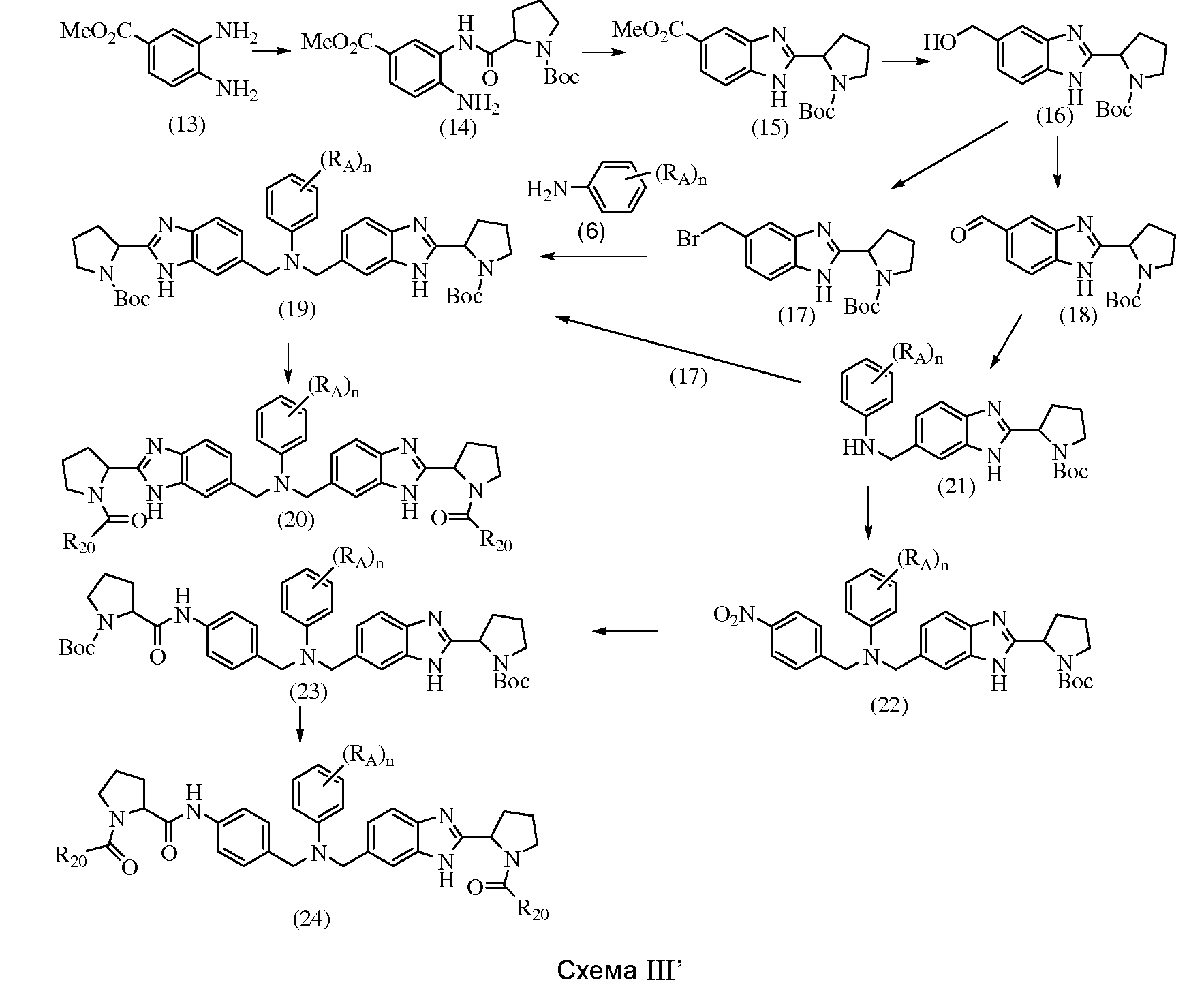
В качестве еще одного неограничивающего примера, соединения по настоящему изобретению (35) можно получить способами, показанными на Схеме IV', где R20 представляет собой -LS'-M'-LS"-RD, и LS', M', LS", RD, R1, R2, R5 и RA имеют значения, определенные выше, и n имеет значение 0, 1, 2, 3, 4 или 5. Соединение (25) можно получить из 4'-йодацетофенона с использованием известных условий, таких как обработка при помощи Br2. Соединение (25) можно подвергнуть взаимодействию с солью аминокислоты (полученной из подходяще защищенной аминокислоты и основания, такого как Cs2CO3, KOH, NaOH или Na2CO3, в растворителе, таком как этанол или ТГФ), в растворителе, таком как ТГФ, ДМФА или ДМСО, с получением сложного эфира (26). Сложный эфир (26) можно обработать при помощи источника аммиака, такого как NH4OAc, NH4Cl или аммиачный газ, и подвергнуть нагреванию в растворителе, таком как толуол или ксилол, с азеотропным удалением воды, с получением имидазола (27). См. Gordon et al., TET. LETT. 34:1901-1904 (1993) и Moinet et al., BIOORG. MED. CHEM. LETT. 11:991-995 (2001), которые оба включены в настоящую заявку посредством ссылки во всей их полноте. Йодид (27) может быть преобразован в сложный эфир (28) путем обработки палладиевым катализатором (таким как Pd(PPh3)4 или Pd(dppf)Cl2 или Pd(II) катализатор, такой Pd(OAc)2 или Pd2(dba)3) с добавлением или без фосфорорганических лигандов, таких как PPh3 или P(t-Bu)3) и оксидом углерода в присутствии основания, такого как триэтиламин или основание Хунига, в растворителе, таком как метанол или этанол, с использованием или без нагревания. Полученный сложный эфир (28) может быть восстановлен до спирта (29) и затем окислен до альдегида (30) способами, описанными выше. Соединение (30) можно использовать для получения соединения (31) путем взаимодействия с анилином с образованием основания Шиффа (имин), которое может быть восстановлено до (31) при помощи гидридного восстановителя, такого как боргидрид натрия или цианоборгидрид натрия (с добавлением или без кислоты, такой как уксусная кислота), в растворителе, таком как этанол, толуол, ТГФ или дихлорметан. Альтернативно, основание Шиффа, образованное из (30), можно восстановить до продуктов (31) путем гидрирования в присутствии подходящего катализатора, такого как палладиевый или платиновый катализатор или никель Ренея. Соединение (31) можно подвергнуть взаимодействию с 4-нитробензилбромидом в условиях алкилирования, описанных выше, с получением (32). Восстановление нитрогруппы соединения (32) с использованием условий, описанных выше, и сочетание с подходяще защищенной пролиновой кислотой может обеспечить соединение (34). После удаления защитной группы Boc из (34) (осуществляли путем обработки кислотой, такой как ТФУК, HCl или муравьиная кислота), соединения по настоящему изобретению (35) можно получить путем сочетания полученного диамина с выбранной кислотой с использованием стандартных пептидных связывающих реагентов и условий, описанных выше. Также, соединения формулы Ic могут быть получены аналогичным способом.

Если группа, описанная в настоящей заявке (например, -NH2 или -OH), не совместима со способами синтеза, такая группа может быть защищена подходящей защитной группой, которая является стойкой к реакционным условиям, используемым в способах. Защитная группа может быть удалена в подходящий момент осуществления последовательных реакций с получением желаемого промежуточного или целевого соединения. Подходящие защитные группы и способы введения или удаления защитных групп хорошо известны из уровня техники, примеры которых можно найти в Greene and Wuts, указанном выше. Оптимальные реакционные условия и время реакции для каждой отдельной стадии могут варьировать в зависимости от конкретных используемых в реакции веществ и заместителей, присутствующих в реагирующих веществах. Растворители, температуры и другие реакционные условия легко может выбрать специалист в данной области со средней квалификацией на основании настоящего изобретения.
Другие соединения по настоящему изобретению могут быть получены аналогичным способом в соответствии с описанными выше схемами, а также процедурами, описанными в представленных ниже примерах, как должно быть понятно специалистам. Должно быть понятно, что описанные выше варианты воплощения и схемы и следующие далее примеры представлены в целях иллюстрации, а не для ограничения. Различные изменения и модификации в пределах объема настоящего изобретения должны быть очевидны для специалистов в данной области из настоящего описания.
Иллюстративные соединения, приведенные ниже, были названы с использованием либо ChemDraw версия 9.0, либо ACD версия 10 (ACD v10). Конечные соединения и промежуточные соединения для Примеров 1-23 были названы с использованием ChemDraw. Конечные соединения для Примеров 24-150 были названы с использованием ACD v10. Промежуточные соединения для Примеров 24-150 были названы с использованием ChemDraw, если не указано иное.

Пример 1
Диметил (2S,2'S)-1,1'-((2S,2'S)-2,2'-(4,4'-(фенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(оксометилен)бис(пирролидин-2,1-диил))бис(3-метил-1-оксобутан-2,1-диил)дикарбамат

Пример 1A
N,N-бис(4-нитробензил)анилин
Объединяли анилин (0,457 мл, 5 ммоль), гидрокарбонат натрия (0,924 г, 11,00 ммоль) и додецилсульфат натрия (0,020 г, 0,070 ммоль) в воде (20 мл) и нагревали в масляной бане при 80°C в течение приблизительно 5 минут. Добавляли 1-(бромметил)-4-нитробензол (2,376 г, 11,00 ммоль) и продолжали нагревание при 80°C в течение приблизительно 1 часа. Через 1 час реакционную смесь охлаждали до комнатной температуры. Продукт собирали при помощи фильтрования, промывали водой и сушили под вакуумом. Продукт перекристаллизовывали из смеси EtOAc и гексана с получением продукта (1,67 г, 92% выход, желтый порошок).

Пример 1B
N,N-бис(4-аминобензил)анилин
Способ A. Объединяли продукт из Примера 1A (436 мг, 1,2 ммоль) и хлорид висмута(III) (1,14 г, 3,60 ммоль) в этаноле (12 мл) и охлаждали в водяной бане. Порциями добавляли боргидрид натрия (726 мг, 19,20 ммоль) (имело место выделение тепла и пузырьков газа) и реакционная смесь становилась темно-черного цвета. Перемешивали при комнатной температуре в течение приблизительно 1 часа. Добавляли MeOH и фильтровали через целит, промывая при помощи MeOH. Концентрировали до половины объема с использованием роторного испарителя, разбавляли смесью 25% изопропанол/CHCl3 и промывали 10% раствором бикарбоната натрия. Органический слой сушили над Na2SO4, фильтровали и концентрировали с получением указанного в заголовке соединения (310,4 мг, 85% выход, желтое масло).
Способ B. К продукту из Примера 1A (200 мг, 0,550 ммоль) в ТГФ (20 мл) в сосуде высокого давления объемом 50 мл добавляли влажный Ra-Ni A-7000 (200 мг, 3,41 ммоль) и смесь перемешивали в течение 2 часов под давлением 30 фунтов/дюйм2 (2,1 кг/см2) при комнатной температуре. Смесь фильтровали через нейлоновую мембрану, и растворитель выпаривали с получением указанного в заголовке соединения, которое использовали без дополнительной очистки.
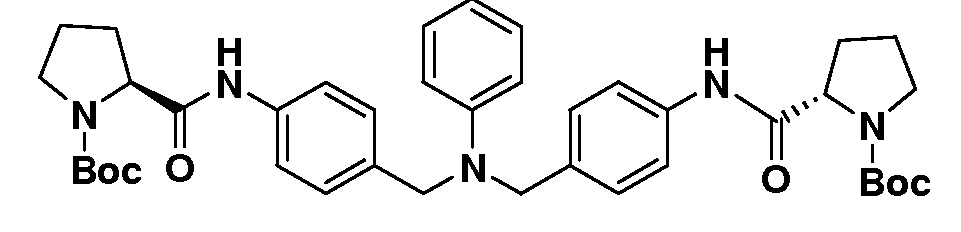
Пример 1C
(2S,2'S)-трет-бутил 2,2'-(4,4'-(фенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(оксометилен)дипирролидин-1-карбоксилат
Растворяли продукт из Примера 1B (310,4 мг, 1,023 ммоль) в ДМСО (5,115 мл) и добавляли N-(трет-бутоксикарбонил)-1-пролин (440 мг, 2,046 ммоль), HATU (817 мг, 2,148 ммоль) и основание Хунига (0,715 мл, 4,09 ммоль). После перемешивания в течение 48 часов добавляли воду и фильтровали для сбора твердого вещества. Твердое вещество очищали при помощи хроматографии на силикагеле, элюируя смесью 0-4% MeOH/CH2Cl2, с получением указанного в заголовке соединения (339,4 мг, 47,5% выход, светло-желтый порошок).

Пример 1D
(2S,2'S)-N,N'-(4,4'-(фенилазанедиил)бис(метилен)бис(4,1-фенилен))дипирролидин-2-карбоксамид
К продукту из Примера 1C (150 мг, 0,215 ммоль) в CH2Cl2 (537 мкл) добавляли ТФУК (537 мкл) и реакционную смесь перемешивали в атмосфере N2 в течение 45 минут и концентрировали при помощи роторного испарителя. Остаток растворяли в смеси 25% изопропанол/CHCl3 и промывали полунасыщенным раствором NaHCO3. Органический слой сушили над Na2SO4, фильтровали и концентрировали с получением указанного в заголовке соединения (93,8 мг, 88% выход, светло-коричневое твердое вещество).

Пример 1E
Диметил (2S,2'S)-1,1'-((2S,2'S)-2,2'-(4,4'-(фенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис (оксометилен)бис(пирролидин-2,1-диил))бис(3-метил-1-оксобутан-2,1-диил)дикарбамат
К смеси продукта из Примера 1D (0,01 г, 0,020 ммоль), (S)-2-(метоксикарбониламино)-3-метилбутановой кислоты (8,80 мг, 0,050 ммоль) и HATU (0,019 г, 0,050 ммоль) в ДМСО (0,100 мл) добавляли основание Хунига (0,021 мл, 0,121 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 15 минут. Реакционную смесь разбавляли ацетонитрилом и водой (0,1% ТФУК) и очищали при помощи обращенно-фазовой хроматографии (C18), элюируя смесью 10-100% ацетонитрила в воде (0,1% ТФУК), с получением указанного в заголовке соединения (14 мг, 86% выход, белое твердое вещество) в виде соли ТФУК.1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,88 (д, J=6,71 Гц, 6H) 0,93 (д, J=6,71 Гц, 6H) 1,81-2,04 (м, 8H) 2,08-2,19 (м, 2H) 3,58-3,65 (м, 2H) 3,77-3,85 (м, 2H) 4,02 (т, J=8,54 Гц, 2H) 4,42 (дд, J=8,16, 4,81 Гц, 2H) 4,59 (с, 4H) 6,57 (т, J=6,33 Гц, 1H) 6,65 (д, J=7,32 Гц, 2H) 7,07 (т, J=7,86 Гц, 2H) 7,17 (д, J=8,70 Гц, 4H) 7,37 (д, J=8,39 Гц, 2H) 7,51 (д, J=8,54 Гц, 4H) 10,01 (с, 2H).
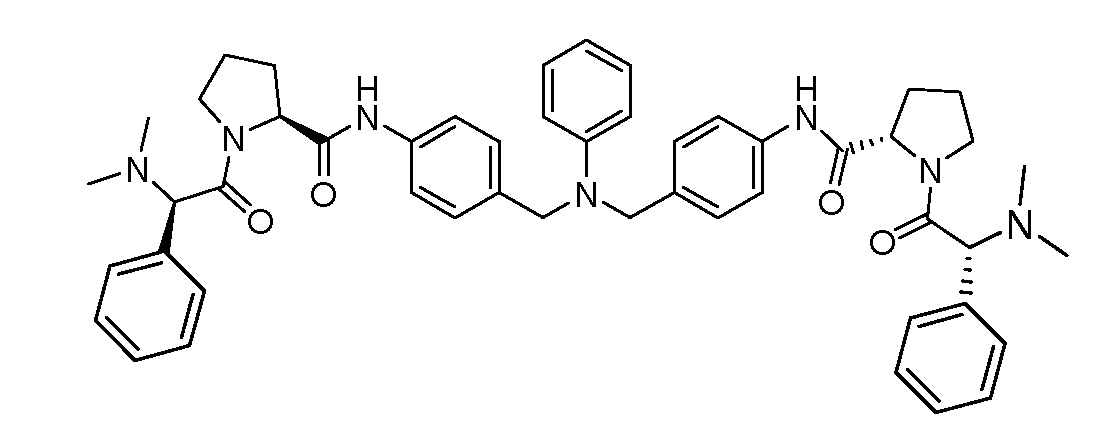
Пример 2
(R,2S,2'S)-N,N'-(4,4'-(фенилазанедиил)бис(метилен)бис(4,1-фенилен))бис(1-((R)-2-(диметиламино)-2-фенилацетил)пирролидин-2-карбоксамид)
К смеси продукта из Примера 1D (45 мг, 0,090 ммоль), (R)-2-(диметиламино)-2-фенилуксусной кислоты (40,5 мг, 0,226 ммоль) и HATU (86 мг, 0,226 ммоль) в ДМСО (0,45 мл) добавляли основание Хунига (95 мкл, 0,543 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь выливали в воду и экстрагировали при помощи EtOAc, с последующим промыванием насыщенным солевым раствором. Органический слой сушили над Na2SO4, фильтровали и концентрировали. Очищали при помощи хроматографии на силикагеле, элюируя смесью 0-5% MeOH/CH2Cl2, с получением указанного в заголовке соединения (7 мг, 9,4% выход).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 10,03 (шир. с, 2H) 7,30-7,60 (м, 14H) 7,15-7,25 (м, 4H) 7,02-7,13 (м, 2H) 6,62-6,73 (м, 2H) 6,58 (т, J=7,17 Гц, 1H) 4,61 (с, 4H) 4,31-4,40 (м, 2H) 3,82-3,91 (м, 2H) 3,10-3,60 (м, 16H) 1,74-2,12 (м, 8H).
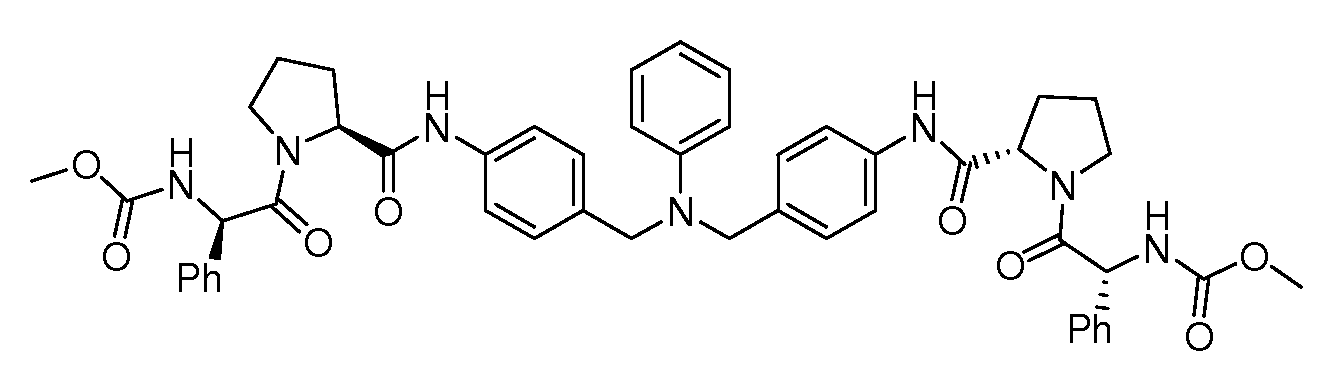
Пример 3
Диметил (1R,1'R)-2,2'-((2S,2'S)-2,2'-(4,4'-(фенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(оксометилен)бис(пирролидин-2,1-диил))бис(2-оксо-1-фенилэтан-2,1-диил)дикарбамат
К смеси продукта из Примера 1D (47,2 мг, 0,095 ммоль), (R)-2-(метоксикарбониламино)-2-фенилуксусной кислоты (49,6 мг, 0,237 ммоль) и HATU (90 мг, 0,237 ммоль) в ДМСО (0,47 мл) добавляли основание Хунига (99 мкл, 0,569 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь выливали в воду и экстрагировали при помощи EtOAc, с последующим промыванием насыщенным солевым раствором. Органический слой сушили над Na2SO4, фильтровали и концентрировали. Очищали при помощи хроматографии на силикагеле, элюируя смесью 0-5% MeOH/CH2Cl2. Второй раз очищали при помощи обращенно-фазовой хроматографии (C18), элюируя смесью 10-100% ацетонитрила в воде (0,1% ТФУК), с получением указанного в заголовке соединения (6,5 мг, 7,7% выход).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 9,79-10,11 (м, 2H) 7,60-7,97 (м, 2H) 7,46-7,62 (м, 3H) 7,28-7,46 (м, 10H) 7,13-7,27 (м, 4H) 7,03-7,14 (м, 3H) 6,63-6,74 (м, 2H) 6,54-6,63 (м, 1H) 5,28-5,54 (м, 2H) 4,61 (с, 4H) 4,34-4,50 (м, 2H) 3,63-3,85 (м, 2H) 3,53 (с, 6H) 3,06-3,24 (м, 2H) 1,70-2,09 (м, 8H).

Пример 4
(2S,2'S)-бензил 2,2'-(4,4'-(фенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(оксометилен)дипирролидин-1-карбоксилат
Продукт из Примера 1D (25 мг, 0,050 ммоль) объединяли с бензил 2,5-диоксопирролидин-1-илкарбонатом (27,5 мг, 0,111 ммоль) и триэтиламином (0,021 мл, 0,151 ммоль) в ДМФА (0,5 мл) и смесь перемешивали при комнатной температуре в течение ночи. Распределяли между водой (5 мл) и EtOAc (3×5 мл). Органический слой сушили над Na2SO4, фильтровали и концентрировали. Очищали при помощи хроматографии на силикагеле, элюируя смесью 10-50% EtOAc в гексане, с получением указанного в заголовке соединения в виде бесцветного твердого вещества (9 мг, 23,4% выход).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 9,97-10,06 (м, 2H) 7,48-7,58 (м, 4H) 7,35-7,41 (м, 3H) 7,29-7,35 (м, 1H) 7,03-7,26 (м, 12H) 6,63-6,74 (м, J=8,32, 8,32 Гц, 2H) 6,54-6,63 (м, 1H) 5,02-5,12 (м, 3H) 4,93 (д, J=13,12 Гц, 1H) 4,58-4,67 (м, 4H) 4,28-4,39 (м, 2H) 3,38-3,55 (м, 4H) 2,14-2,31 (м, 2H) 1,77-1,98 (м, 6H).

Пример 5
Диметил (2R,2'R)-1,1'-((2S,2'S)-2,2'-(4,4'-(фенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(оксометилен)бис(пирролидин-2,1-диил))бис(3-метил-1-оксобутан-2,1-диил)дикарбамат
К раствору продукта из Примера 1D (12 мг, 0,024 ммоль), (R)-2-(метоксикарбониламино)-3-метилбутановой кислоты (8,87 мг, 0,051 ммоль) и HATU (19,25 мг, 0,051 ммоль) в безводном ДМСО (0,25 мл) добавляли основание Хунига (0,013 мл, 0,072 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 90 минут. Смесь распределяли между водой (5 мл) и EtOAc (3×5 мл) и объединенные органические слои сушили над Na2SO4. Смесь фильтровали и концентрировали в вакууме, и неочищенный продукт очищали при помощи хроматографии на силикагеле (C18), элюируя с использованием градиента 10-100% ацетонитрила в воде (0,1% ТФУК). Фракции, содержащие чистый продукт, объединяли и концентрировали в вакууме с получением указанного в заголовке соединения в виде твердого вещества (7 мг, 31%) в виде соли ТФУК.1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 10,23 (с, 0,5H) 9,67 (с, 1,5H) 7,49-7,56 (м, 4H) 7,43 (д, J=8,39 Гц, 0,5H) 7,35 (д, J=8,24 Гц, 1,5H) 7,14-7,22 (м, 4H) 7,03-7,11 (м, 2H) 6,65 (д, J=8,24 Гц, 2H) 6,57 (т, J=7,02 Гц, 1H) 4,98 (д, J=8,09 Гц, 0,5H) 4,56-4,63 (м, 4H) 4,40 (дд, J=8,55, 2,75 Гц, 1,5H) 4,05-4,11 (м, 2H) 3,75-3,84 (м, 2H) 3,56-3,65 (м, 3H) 3,51-3,56 (м, 6H) 3,42-3,49 (м, 1H) 2,05-2,15 (м, 2H) 1,87-2,04 (м, 6H) 0,83-0,93 (м, 12H).
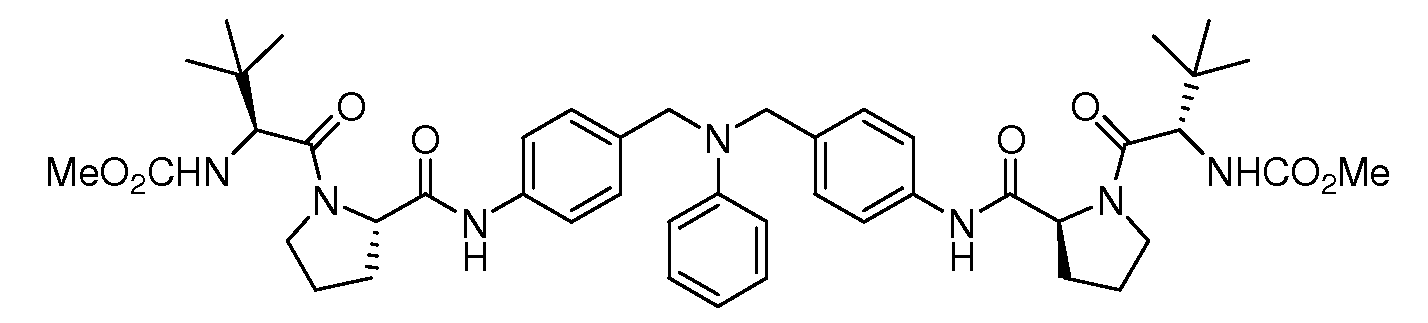
Пример 6
Диметил (2S,2'S)-1,1'-((2S,2'S)-2,2'-(4,4'-(фенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис (оксометилен)бис(пирролидин-2,1-диил))бис(3,3-диметил-1-оксобутан-2,1-диил)дикарбамат
К раствору продукта из Примера 1D (12 мг, 0,024 ммоль) и (S)-2-(метоксикарбониламино)-3,3-диметилбутановой кислоты (9,58 мг, 0,051 ммоль) в ДМСО (0,2 мл) добавляли HATU (19,25 мг, 0,051 ммоль) и основание Хунига (0,013 мл, 0,072 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 90 минут. Смесь распределяли между водой (1 мл) и EtOAc (3×1 мл) и объединенные органические слои сушили над Na2SO4. Неочищенный продукт очищали при помощи хроматографии на силикагеле (C18), элюируя с использованием градиента 10-100% ацетонитрила в 0,1% водном растворе ТФУК, с получением указанного в заголовке соединения (8 мг, 34,8% выход) в виде соли ТФУК.1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 9,99 (с, 2H) 7,51 (д, J=8,54 Гц, 4H) 7,17 (д, J=8,55 Гц, 4H) 7,02-7,13 (м, 4H) 6,66 (д, J=8,09 Гц, 2H) 6,53-6,61 (м, 1H) 4,58 (с, 4H) 4,43 (дд, J=7,93, 5,34 Гц, 2H) 4,21 (д, J=8,85 Гц, 2H) 3,73-3,83 (м, 2H) 3,64 (с, 2H) 3,54 (с, 6H) 2,09-2,20 (м, 2H) 1,93-2,04 (м, 2H) 1,79-1,92 (м, 4H) 0,96 (с, 18H).
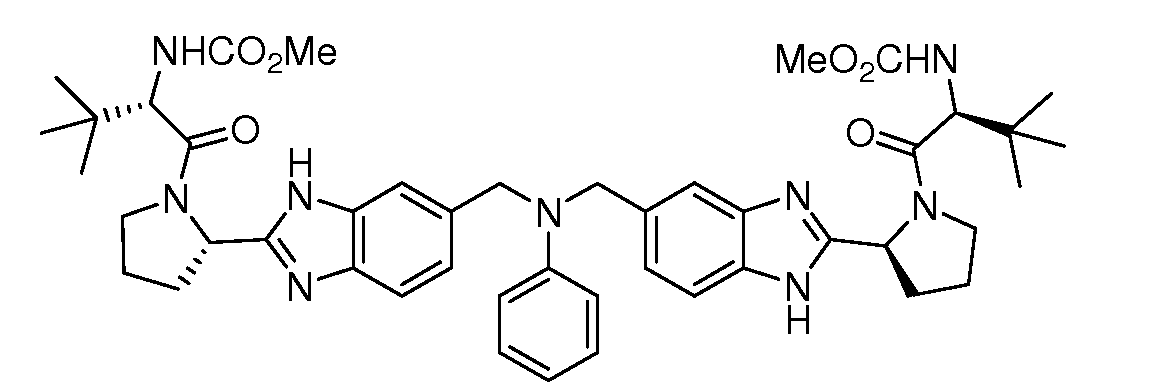
Пример 7
Диметил (2S,2'S)-1,1'-((2S,2'S)-2,2'-(6,6'-(фенилазанедиил)бис(метилен)бис(1H-бензо[d]имидазол-6,2-диил))бис(пирролидин-2,1-диил))бис(3,3-диметил-1-оксобутан-2,1-диил)дикарбамат

Пример 7A
(S)-Метил 2-(1-(трет-бутоксикарбонил)пирролидин-2-ил)-1H-бензо[d]имидазол-5-карбоксилат
Объединяли метил 3,4-диаминобензоат (5,0 г, 30,1 ммоль) с EDAC (17,3 г, 90 ммоль) и Boc-пролином (6,48 г, 30,1 ммоль) в смеси пиридина (50 мл) и ДМФА (50 мл) и смесь затем оставляли при перемешивании при комнатной температуре в течение ночи. Смесь упаривали, и остаток растворяли в EtOAc и промывали водой (3×200 мл), водным раствором 10% NaHCO3 и затем насыщенным солевым раствором. Органический слой сушили над MgSO4, фильтровали и упаривали с получением 10,4 г (95%) светло-желтоватого твердого вещества, которое использовали без дополнительной очистки.
Продукт с первой стадии (10,4 г) растворяли в уксусной кислоте (75 мл) и смесь затем оставляли нагреваться при перемешивании при 70°C в течение 3 часов. Смесь упаривали досуха, подвергали азеотропной перегонке с толуолом и затем сушили под вакуумом. Остаток очищали при помощи хроматографии на силикагеле, элюируя смесью 50-100% EtOAc в гексане, с получением указанного в заголовке соединения (8,96 г, выход 91%) в виде твердого вещества, окрашенного в слабый светло-желтоватый/белый цвет.

Пример 7B
(S)-трет-Бутил 2-(5-(гидроксиметил)-1H-бензо[d]имидазол-2-ил)пирролидин-1-карбоксилат
К раствору продукта из Примера 7A (1,75 г, 5,07 ммоль) в CH2Cl2 (40 мл) по каплям при -78°C добавляли DiBAL (15,7 мл, 1 M раствор в CH2Cl2) и смесь оставляли при перемешивании при -78°C в течение 15 минут и затем давали нагреться до комнатной температуры и перемешивали в течение 1 часа. Реакционную смесь затем охлаждали в ледяной бане и медленно по каплям добавляли MeOH (2 мл), с последующим добавлением насыщенного раствора MgSO4 (60 мл) и смесь перемешивали в течение 30 минут. Добавляли EtOAc (200 мл) и органический слой отделяли, промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и упаривали с получением указанного в заголовке соединения (1,506 г, выход 94%) в виде твердого вещества, окрашенного в слабый желтоватый цвет.
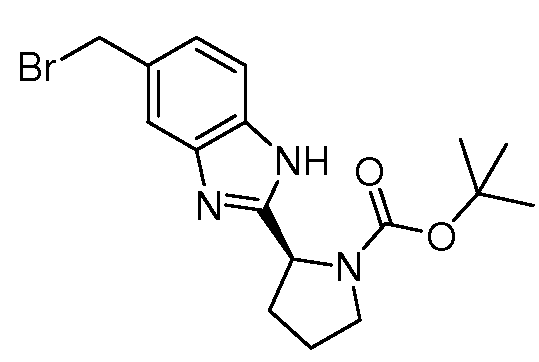
Пример 7C
(S)-трет-Бутил 2-(5-(бромметил)-1H-бензо[d]имидазол-2-ил)пирролидин-1-карбоксилат
К смеси продукта из Примера 7B (0,50 г, 1,57 ммоль) и полимерсвязанного трифенилфосфина (2,1 г, 3,15 ммоль, 150-300 меш) в ТГФ при 0°C добавляли CBr4 и смесь перемешивали при 0°C в течение 10 минут и затем оставляли при перемешивании при комнатной температуре в течение 1,5 часов. Смесь затем фильтровали и промывали при помощи ТГФ. ТГФ упаривали с получением указанного в заголовке соединения (493 мг, выход 82%) в виде твердого вещества, окрашенного в светло-желтоватый цвет, которое использовали без дополнительной очистки.

Пример 7D
(2S,2'S)-трет-Бутил 2,2'-(5,5'-(фенилазанедиил)бис(метилен)бис(1H-бензо[d]имидазол-5,2-диил))дипирролидин-1-карбоксилат
Смесь продукта из Примера 7C (0,20 г, 0,526 ммоль), анилина (0,019 мл, 0,210 ммоль) и K2CO3 (0,087 г, 0,631 ммоль) в ДМФА (1,0 мл) оставляли при перемешивании при комнатной температуре в течение 2 часов. Добавляли дополнительный продукт из Примера 7C (0,10 г) вместе с дополнительным количеством K2CO3 (0,044 г) и смесь оставляли при перемешивании в течение ночи. Смесь выливали в EtOAc, и органические вещества затем промывали водой, насыщенным солевым раствором, сушили (MgSO4), фильтровали и упаривали. Продукт очищали при помощи хроматографии на силикагеле, элюируя смесью 50-100% EtOAc в гексане, с получением указанного в заголовке соединения (46 мг, выход 32%) в виде бесцветного полутвердого вещества.
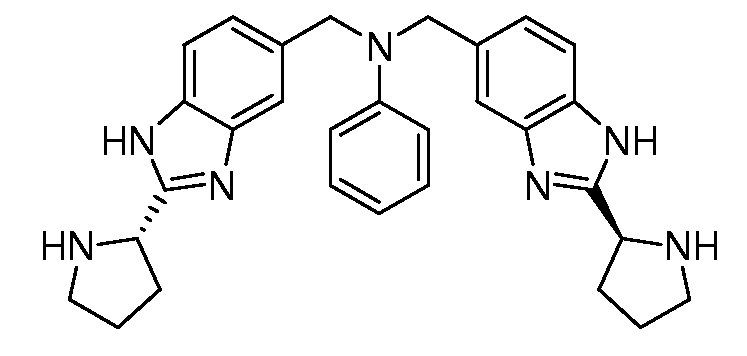
Пример 7E
N,N-бис((2-((S)-пирролидин-2-ил)-1H-бензо[d]имидазол-5-ил)метил)анилин
К раствору продукта из Примера 7D (46 мг, 0,066 ммоль) в CH2Cl2 (1,0 мл) добавляли ТФУК (1,0 мл) и смесь перемешивали при комнатной температуре в течение 30 минут. Растворитель выпаривали и остаток использовали без дополнительной очистки.

Пример 7F
Диметил (2S,2'S)-1,1'-((2S,2'S)-2,2'-(6,6'-(фенилазанедиил)бис(метилен)бис(1H-бензо[d]имидазол-6,2-диил))бис(пирролидин-2,1-диил))бис(3,3-диметил-1-оксобутан-2,1-диил)дикарбамат
К раствору продукта из Примера 7E (32,4 мг, 0,066 ммоль), (S)-2-(метоксикарбониламино)-3,3-диметилбутановой кислоты (26,2 мг, 0,139 ммоль) и HATU (52,7 мг, 0,139 ммоль) в безводном ДМСО (0,5 мл) добавляли основание Хунига (0,035 мл, 0,198 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 90 минут. Смесь распределяли между водой (5 мл) и EtOAc (3×5 мл) и объединенные органические слои сушили над Na2SO4. Смесь фильтровали и концентрировали в вакууме, и неочищенный продукт очищали при помощи обращенно-фазовой хроматографии (C18), элюируя с использованием градиента 10-100% ацетонитрила в воде (0,1% ТФУК). Фракции, содержащие чистый продукт, объединяли и концентрировали в вакууме с получением указанного в заголовке соединения в виде твердого вещества (14 мг, 18%) в виде соли ТФУК.1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 14,55 (шир. с, 2H) 7,72 (д, J=8,39 Гц, 2H) 7,56 (с, 2H) 7,41 (д, J=8,09 Гц, 2H) 7,31 (д, J=8,70 Гц, 2H) 7,07-7,12 (м, 2H) 6,73 (д, J=8,09 Гц, 2H) 6,58-6,63 (м, 1H) 5,19 (дд, J=8,16, 5,87 Гц, 2H) 4,85-4,97 (м, 4H) 4,21 (д, J=8,70 Гц, 2H) 3,81-3,92 (м, 4H) 3,57 (с, 6H) 2,01-2,25 (м, 8H) 0,85 (с, 18H)
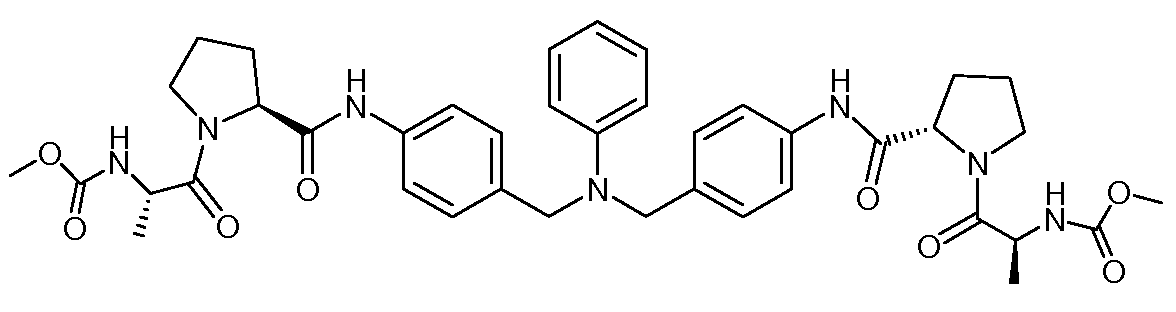
Пример 8
Диметил (2S,2'S)-1,1'-((2S,2'S)-2,2'-(4,4'-(фенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(оксометилен)бис(пирролидин-2,1-диил))бис(1-оксопропан-2,1-диил)дикарбамат
Продукт из Примера 1D (0,024 г, 0,048 ммоль), (S)-2-(метоксикарбониламино)пропановую кислоту (0,015 г, 0,101 ммоль), HATU (0,039 г, 0,101 ммоль) и основание Хунига (0,025 мл, 0,145 ммоль) смешивали в ДМСО (0,5 мл) и перемешивали при комнатной температуре в течение 2,5 часов в атмосфере азота. Реакционную смесь разбавляли при помощи CH2Cl2 и промывали водой. Органический экстракт отделяли, сушили над Na2SO4, фильтровали и упаривали. Продукт очищали при помощи хроматографии на силикагеле, элюируя смесью 0-5% MeOH в CH2Cl2, с получением указанного в заголовке соединения (11,9 мг, 32,6% выход).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 9,92 (с, 2H) 7,50 (д, J=8,54 Гц, 4H) 7,34 (д, J=7,48 Гц, 2H) 7,17 (д, J=8,70 Гц, 4H) 7,06 (дд, J=8,85, 7,32 Гц, 2H) 6,65 (д, J=7,93 Гц, 2H) 6,56 (т, J=7,25 Гц, 1H) 4,59 (с, 4H) 4,41 (дд, J=8,24, 4,42 Гц, 2H) 4,27-4,36 (м, 2H) 3,62-3,70 (м, 2H) 3,54-3,61 (м, 2H) 3,60 (с, 6H) 2,07-2,18 (м, 2H) 1,95-2,04 (м, 2H) 1,81-1,96 (м, 4H) 1,18 (д, J=4,00 Гц, 6H).

Пример 9
Диметил (2S,2'S,3S,3'S)-1,1'-((2S,2'S)-2,2'-(4,4'-(фенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(оксометилен)бис(пирролидин-2,1-диил))бис(3-метил-1-оксопентан-2,1-диил)дикарбамат
Продукт из Примера 1D (0,0179 г, 0,036 ммоль), (2S,3S)-2-(метоксикарбониламино)-3-метилпентановую кислоту (0,014 г, 0,076 ммоль), HATU (0,029 г, 0,076 ммоль) и основание Хунига (0,019 мл, 0,108 ммоль) растворяли в ДМСО (0,360 мл) и реакционную смесь перемешивали при комнатной температуре в течение 2 часов в атмосфере азота. Реакционную смесь разбавляли при помощи CH2Cl2 и промывали водой. Органический экстракт отделяли, сушили над Na2SO4, фильтровали и упаривали. Продукт очищали при помощи хроматографии на силикагеле, элюируя смесью 0-3% MeOH в CH2Cl2, с получением указанного в заголовке соединения (12,6 мг, 41,1% выход).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 9,98 (с, 2H) 7,51 (д, J=8,55 Гц, 4H) 7,37 (д, J=8,55 Гц, 2H) 7,17 (д, J=8,54 Гц, 4H) 7,07 (дд, J=8,77, 7,25 Гц, 2H) 6,65 (д, J=8,09 Гц, 2H) 6,56 (т, J=7,25 Гц, 1H) 4,59 (с, 4H) 4,43 (дд, J=8,16, 4,81 Гц, 2H) 4,07 (т, J=8,93 Гц, 2H) 3,79-3,86 (м, 2H) 3,57-3,66 (м, 2H) 3,52 (с, 6H) 2,08-2,18 (м, 2H) 1,95-2,05 (м, 2H) 1,82-1,93 (м, 4H) 1,66-1,76 (м, 2H) 1,44-1,55 (м, 2H) 1,06-1,15 (м, 2H) 0,89 (д, J=6,71 Гц, 6H) 0,78-0,84 (м, 6H).
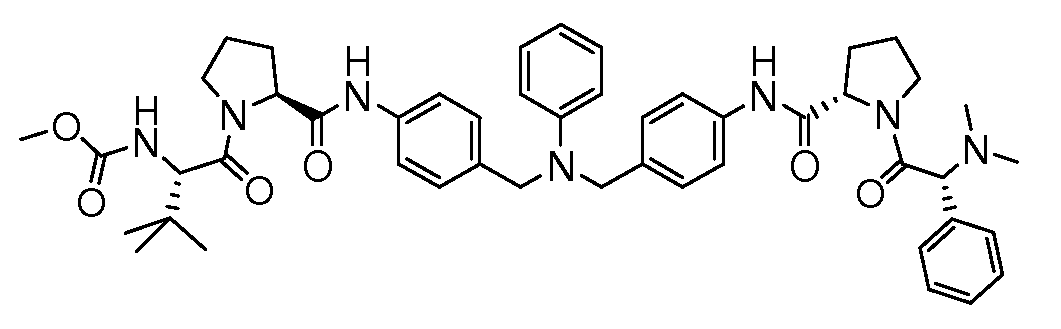
Пример 10
Метил (S)-1-((S)-2-(4-(((4-((S)-1-((R)-2-(диметиламино)-2-фенилацетил)пирролидин-2-карбоксамидо)бензил)(фенил)амино)метил)фенилкарбамоил)пирролидин-1-ил)-3,3-диметил-1-оксобутан-2-илкарбамат

Пример 10A
Метил (S)-3,3-диметил-1-оксо-1-((S)-2-(4-((фенил(4-((S)-пирролидин-2-карбоксамидо)бензил)амино)метил)фенилкарбамоил)пирролидин-1-ил)бутан-2-илкарбамат
Продукт из Примера 1D (120 мг, 0,241 ммоль) объединяли с (S)-2-(метоксикарбониламино)-3,3-диметилбутановой кислотой (45,6 мг, 0,241 ммоль), HATU (92 мг, 0,241 ммоль) и основанием Хунига (0,126 мл, 0,723 ммоль) в ДМСО (3,0 мл) и смесь перемешивали при комнатной температуре в течение 45 минут. Разбавляли водой и собирали твердое вещество при помощи фильтрования. Продукт очищали при помощи обращенно-фазовой хроматографии (C18), элюируя смесью 10-100% ацетонитрила в воде (0,1% ТФУК), с получением указанного в заголовке соединения (32 мг, 19,8% выход).
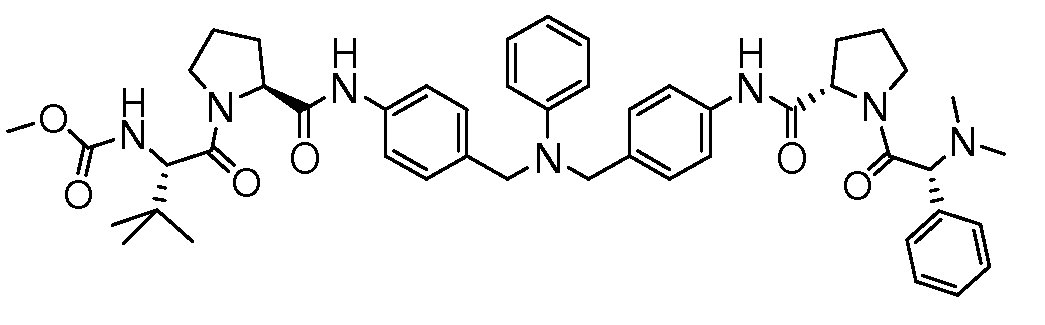
Пример 10B
Метил (S)-1-((S)-2-(4-(((4-((S)-1-((R)-2-(диметиламино)-2-фенилацетил)пирролидин-2-карбоксамидо)бензил)(фенил)амино)метил)фенилкарбамоил)пирролидин-1-ил)-3,3-диметил-1-оксобутан-2-илкарбамат
Продукт из Примера 10A (15 мг, 0,022 ммоль) объединяли с (R)-2-(диметиламино)-2-фенилуксусной кислотой (4,82 мг, 0,027 ммоль), HATU (9,38 мг, 0,025 ммоль) и основанием Хунига (0,014 мл, 0,078 ммоль) в ДМСО (0,5 мл) и смесь перемешивали при комнатной температуре в течение 45 минут. Разбавляли водой и собирали твердое вещество при помощи фильтрования. Продукт очищали при помощи хроматографии на силикагеле, элюируя смесью 0-4% MeOH в CH2Cl2, с получением указанного в заголовке соединения (8 мг, 43% выход).1H ЯМР (500 МГц, ХЛОРОФОРМ-Д) δ м.д. 1,02 (с, 9H) 1,65-1,73 (м, 1H) 1,86-1,95 (м, 2H) 1,99-2,08 (м, 1H) 2,13-2,20 (м, 2H) 2,26 (с, 6H) 2,49 (дд, J=12,21, 6,56 Гц, 1H) 2,53-2,60 (м, 1H) 3,32-3,39 (м, 1H) 3,65-3,68 (м, 1H) 3,69 (с, 3H) 3,74-3,80 (м, 1H) 3,81-3,87 (м, 1H) 4,01 (с, 1H) 4,38 (д, J=9,77 Гц, 1H) 4,56 (с, 4H) 4,76 (д, J=7,17 Гц, 1H) 4,80 (дд, J=8,01, 2,52 Гц, 1H) 5,39 (д, J=9,61 Гц, 1H) 6,70 (т, J=7,25 Гц, 1H) 6,73 (д, J=7,93 Гц, 2H) 7,12-7,19 (м, 6H) 7,36-7,43 (м, 5H) 7,47-7,51 (м, 4H) 9,30 (с, 1H) 9,71 (с, 1H).
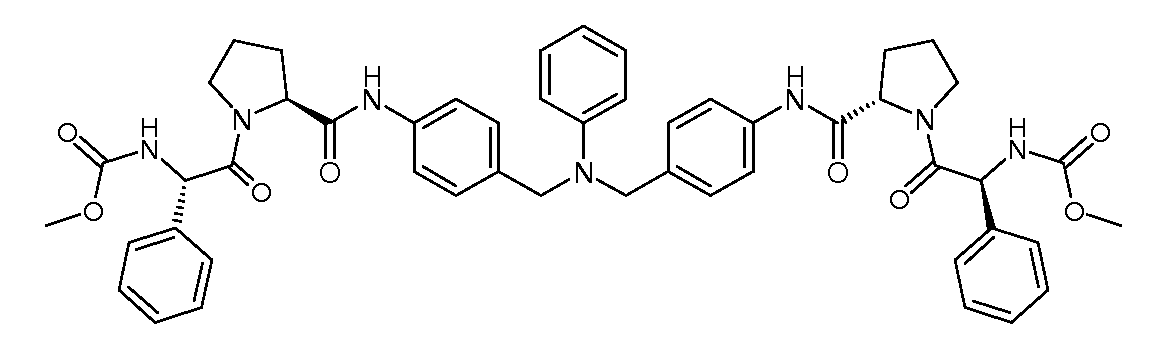
Пример 11
Диметил (1S,1'S)-2,2'-((2S,2'S)-2,2'-(4,4'-(фенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил)) бис(оксометилен)бис(пирролидин-2,1-диил))бис(2-оксо-1-фенилэтан-2,1-диил)дикарбамат
Продукт из Примера 1D (9,0 мг, 0,018 ммоль) объединяли с (S)-2-(метоксикарбониламино)-2-фенилуксусной кислотой (7,95 мг, 0,038 ммоль), HATU (14,44 мг, 0,038 ммоль) и основанием Хунига (0,013 мл, 0,072 ммоль) в ДМСО (1,0 мл) и смесь перемешивали при комнатной температуре в течение 45 минут. Разбавляли водой и собирали твердое вещество при помощи фильтрования. Продукт очищали при помощи хроматографии на силикагеле, элюируя смесью 0-5% MeOH в CH2Cl2, с получением указанного в заголовке соединения (7,2 мг, 45,2% выход).1H ЯМР (500 МГц, ХЛОРОФОРМ-Д) δ м.д. 1,78-1,87 (м, 2H) 1,89-1,99 (м, 4H) 2,38-2,45 (м, 2H) 3,15-3,22 (м, 2H) 3,52-3,67 (м, 8H) 4,49 (с, 4H) 4,77 (дд, J=7,86, 1,91 Гц, 2H) 5,42 (д, J=7,78 Гц, 2H) 5,94 (д, J=7,78 Гц, 2H) 6,61-6,71 (м, 3H) 7,07-7,13 (м, 6H) 7,20-7,25 (м, 5H) 7,30 (дд, J=7,55, 2,67 Гц, 9H) 8,87 (с, 2H).

Пример 12
Метил (S)-1-((S)-2-(4-(((4-((S)-1-((R)-2-(диэтиламино)-2-фенилацетил)пирролидин-2-карбоксамидо)бензил)(фенил)амино)метил)фенилкарбамоил)пирролидин-1-ил)-3,3-диметил-1-оксобутан-2-илкарбамат
Продукт из Примера 10A (15 мг, 0,022 ммоль) объединяли с (R)-2-(диэтиламино)-2-фенилуксусной кислотой (6,04 мг, 0,029 ммоль), HATU (9,38 мг, 0,025 ммоль) и основанием Хунига (0,024 мл, 0,135 ммоль) в ДМСО (1,0 мл) и смесь перемешивали при комнатной температуре в течение 45 минут. Разбавляли водой и собирали твердое вещество при помощи фильтрования. Продукт очищали при помощи хроматографии на силикагеле, элюируя смесью 0-5% MeOH в CH2Cl2, с получением указанного в заголовке соединения (11 мг, 57,2% выход).1H ЯМР (500 МГц, ХЛОРОФОРМ-Д) δ м.д. 0,87 (т, J=7,10 Гц, 6H) 0,94 (с, 9H) 1,59-1,68 (м, 1H) 1,78-1,86 (м, 2H) 1,92-2,00 (м, 1H) 2,04-2,12 (м, 2H) 2,43-2,52 (м, 2H) 2,55-2,67 (м, 4H) 3,23-3,30 (м, 1H) 3,56-3,61 (м, 2H) 3,62 (с, 3H) 3,71-3,78 (м, 1H) 4,30 (д, J=9,61 Гц, 1H) 4,48 (с, 4H) 4,55 (с, 1H) 4,72-4,77 (м, 2H) 5,31 (д, J=9,77 Гц, 1H) 6,63 (т, J=7,25 Гц, 1H) 6,67 (д, J=7,93 Гц, 2H) 7,06-7,12 (м, 6H) 7,24-7,32 (м, 3H) 7,33 (д, J=8,54 Гц, 2H) 7,35-7,42 (м, 4H) 9,22 (с, 1H) 9,64 (с, 1H).

Пример 13
Диметил (2S,2'S)-1,1'-((2S,2'S)-2,2'-(4,4'-(4-фторфенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(оксометилен)бис(пирролидин-2,1-диил))бис(3,3-диметил-1-оксобутан-2,1-диил)дикарбамат
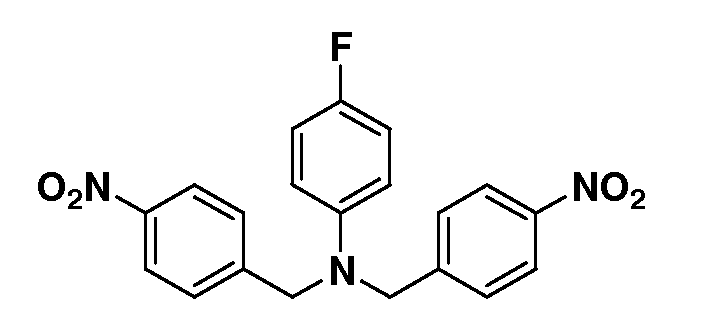
Пример 13A
4-Фтор-N,N-бис(4-нитробензил)анилин
Продукт Примера 13A получали способами, используемыми для получения продукта Примера 1A, заменяя анилин на 4-фторанилин (4,78 г, 93% выход).

Пример 13B
N,N-бис(4-аминобензил)-4-фторанилин
Продукт Примера 13В получали из продукта Примера 13A, при помощи способа А, используемого для получения продукта Примера 1B (0,548 г, 100% выход).

Пример 13C
(2S,2'S)-трет-Бутил 2,2'-(4,4'-(4-фторфенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(оксометилен)дипирролидин-1-карбоксилат
Продукт Примера 13С получали из продукта Примера 13B способами, используемыми для получения продукта Примера 1C (0,650 г, 53,3% выход).

Пример 13D
(2S,2'S)-N,N'-(4,4'-(4-фторфенилазанедиил)бис(метилен)бис (4,1-фенилен))дипирролидин-2-карбоксамид
Продукт Примера 13D получали из продукта Примера 13C способами, используемыми для получения продукта Примера 1D (0,650 г, 53,3% выход).
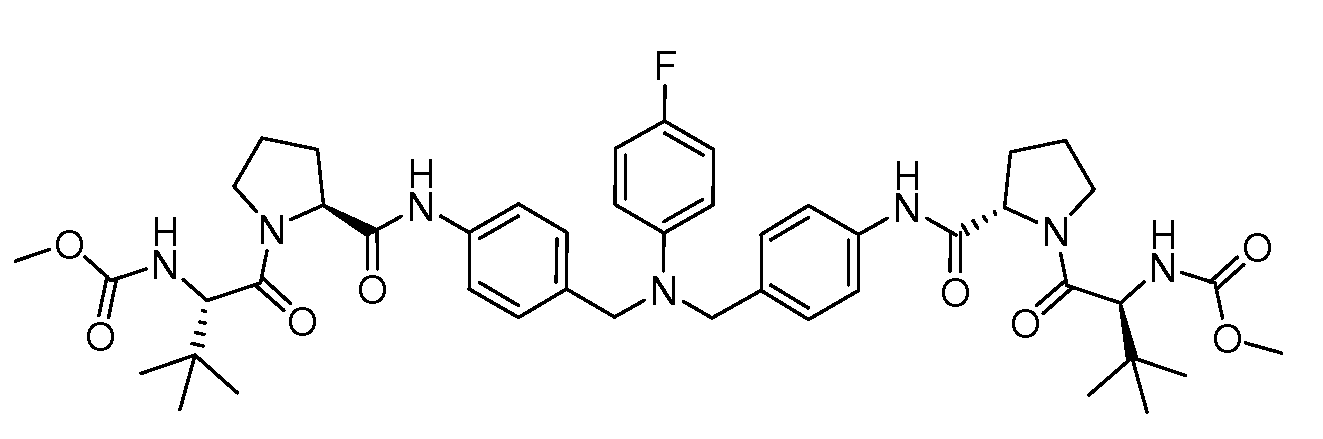
Пример 13E
Диметил (2S,2'S)-1,1'-((2S,2'S)-2,2'-(4,4'-(4-фторфенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(оксометилен)бис(пирролидин-2,1-диил))бис(3,3-диметил-1-оксобутан-2,1-диил)дикарбамат
К смеси продукта из Примера 13D (0,100 г, 0,194 ммоль), (S)-2-(метоксикарбониламино)-3,3-диметилбутановой кислоты (0,111 г, 0,388 ммоль) и HATU (0,162 г, 0,427 ммоль) в ДМФА (2,0 мл) добавляли основание Хунига (0,134 мл, 0,766 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь распределяли между водой и EtOAc. Органическую фазу промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и концентрировали. Остаток очищали при помощи хроматографии на силикагеле, элюируя смесью 0-3% MeOH в CH2Cl2, с получением указанного в заголовке соединения (0,071 г, 42,7% выход).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,96 (с, 18H), 1,81-1,90 (м, 4H), 1,94-2,02 (м, 2H), 2,11-2,18 (м, 2H), 3,54 (с, 6H), 3,61-3,66 (м, 2H), 3,75-3,81 (м, 2H), 4,21 (д, J=8,85 Гц, 2H), 4,43 (дд, J=8,24, 5,49 Гц, 2H), 4,55 (с, 4H), 6,64 (дд, J=9,31, 4,43 Гц, 2H), 6,91 (дд, J=9,00, 9,00 Гц, 2H), 7,09 (шир. д, J=8,85 Гц, 2H), 7,15 (д, J=8,55 Гц, 4H), 7,51 (д, J=8,54 Гц, 4H), 9,99 (шир. с, 2H).
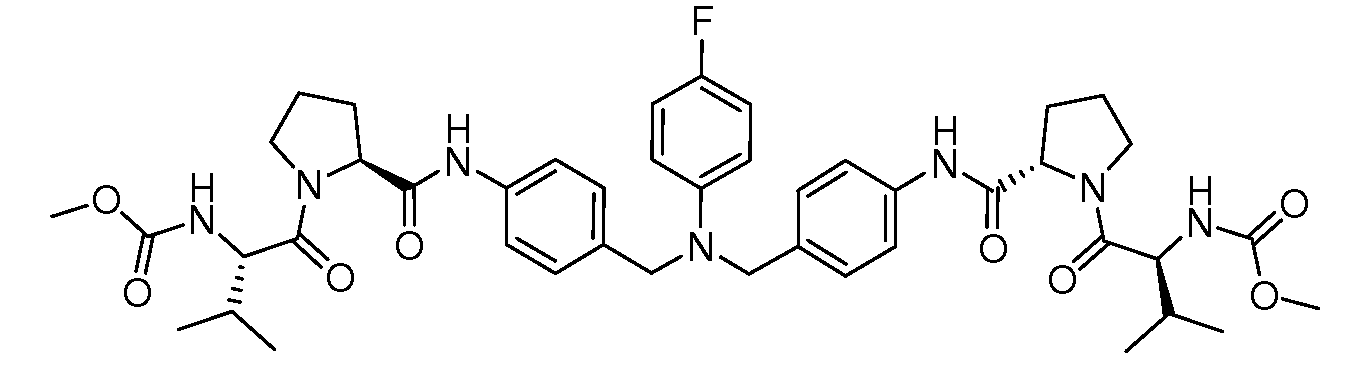
Пример 14
Диметил (2S,2'S)-1,1'-((2S,2'S)-2,2'-(4,4'-(4-фторфенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(оксометилен)бис(пирролидин-2,1-диил))бис(3-метил-1-оксобутан-2,1-диил)дикарбамат
Продукт из Примера 13D подвергали взаимодействию с (S)-2-(метоксикарбониламино)-3-метилбутановой кислотой способами, используемыми для получения продукта Примера 13E, с получением указанного в заголовке соединения (0,108 г, 67,1% выход).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,87 (д, J=6,57 Гц, 6H), 0,93 (д, J=6,72 Гц, 6H), 1,84-2,02 (м, 8H), 2,11-2,17 (м, 2H), 3,52 (с, 6H), 3,60-3,64 (м, 2H), 3,77-3,83 (м, 2H), 4,02 (дд, J=8,39, 8,39 Гц, 2H), 4,43 (дд, J=8,24, 4,88 Гц, 2H), 4,55 (с, 4H), 6,63 (дд, J=9,31, 4,43 Гц, 2H), 6,91 (дд, J=9,0, 9,0 Гц, 2H), 7,16 (д, J=8,54 Гц, 4H), 7,32 (д, J=8,40, 2H), 7,51 (д, J=8,54 Гц, 4H), 9,98 (с, 2H).
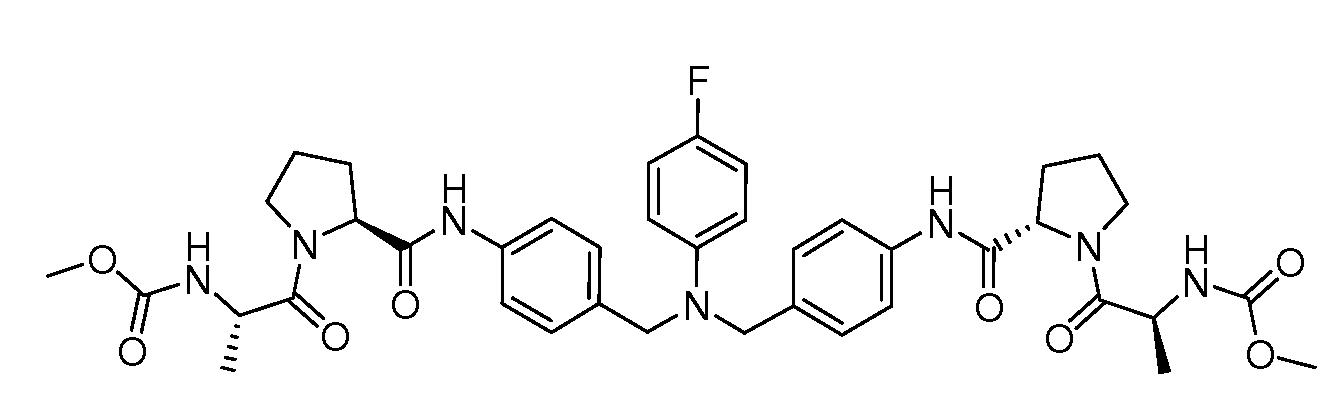
Пример 15
Диметил (2S,2'S)-1,1'-((2S,2'S)-2,2'-(4,4'-(4-фторфенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(оксометилен)бис(пирролидин-2,1-диил))бис(1-оксопропан-2,1-диил)дикарбамат
Продукт из Примера 13D подвергали взаимодействию с (S)-2-(метоксикарбониламино)пропановой кислотой способами, используемыми для получения продукта Примера 13E, с получением указанного в заголовке соединения (0,083 г, 55,3% выход).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 1,18 (д, J=7,48, 6H), 1,83-1,94 (м, 4H), 1,97-2,02 (м, 2H), 2,09-2,15 (м, 2H), 3,51 (с, 6H), 3,56-3,60 (м, 2H), 3,64-3,69 (м, 2H), 4,28-4,34 (м, 2H), 4,40-4,42 (дд, J=8,39, 4,57 Гц, 2H), 4,55 (с, 4H), 6,63 (дд, J=9,46, 4,58 Гц, 2H), 6,91 (дд, J=9,00, 9,00 Гц, 2H), 7,16 (д, J=8,55, 4H), 7,35 (д, J=7,47 Гц, 2H), 7,50 (д, J=8,55 Гц, 4H), 9,92 (с, 2H).
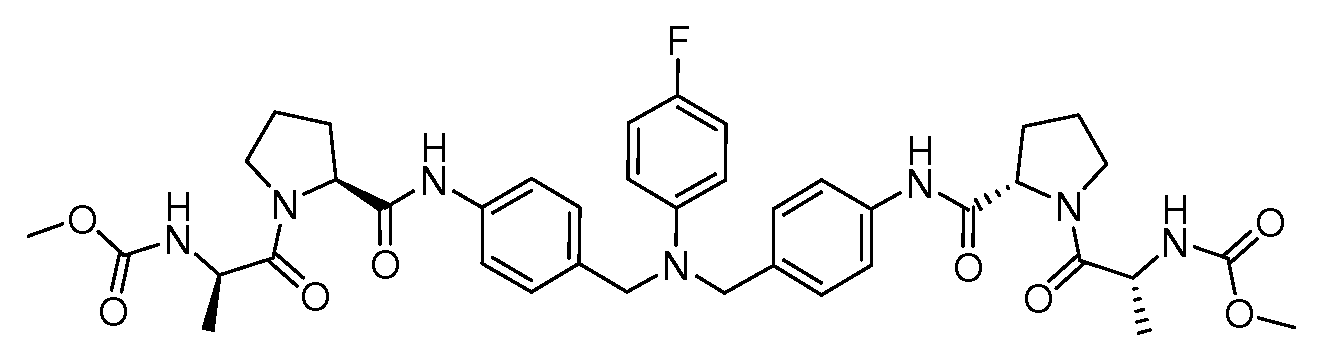
Пример 16
Диметил (2R,2'R)-1,1'-((2S,2'S)-2,2'-(4,4'-(4-фторфенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(оксометилен)бис(пирролидин-2,1-диил))бис(1-оксопропан-2,1-диил)дикарбамат
Продукт из Примера 13D подвергали взаимодействию с (R)-2-(метоксикарбониламино)пропановой кислотой способами, используемыми для получения продукта Примера 13E, с получением указанного в заголовке соединения (0,152 г, 72,9% выход).1H ЯМР (500 МГц, БЕНЗОЛ-d6) δ м.д. 0,97 (д, J=6,56 Гц, 6H), 1,19-1,29 (м, 2H), 1,58-1,68 (м, 2H), 2,30-2,33 (м, 2H), 2,49-2,53 (м, 2H), 3,02-3,06 (м, 2H), 3,37 (с, 6H), 4,09 (с, 4H), 4,14-4,17 (м, 2H), 4,52 (шир. д, J=7,33 Гц, 2H), 5,51 (шир. с, 2H), 6,43 (дд, J=9,31, 4,43 Гц, 2H), 6,77 (дд, J=8,70, 8,70 Гц, 2H), 6,95-7,00 (м, 6H), 7,95 (д, J=8,09 Гц, 4H), 9,43 (шир. с, 2H).

Пример 17
Диметил (2S,2'S)-1,1'-((2S,2'S)-2,2'-(5,5'-(фенилазанедиил)бис(метилен)бис(1H-бензо[d]имидазол-5,2-диил))бис(пирролидин-2,1-диил))бис(3-метил-1-оксобутан-2,1-диил)дикарбамат
Объединяли продукт из Примера 7E (17,4 мг, 0,035 ммоль), HATU (33,6 мг, 0,088 ммоль) и (S)-2-(метоксикарбониламино)-3-метилбутановую кислоту (15,50 мг, 0,088 ммоль) в ДМСО (0,18 мл) и добавляли основание Хунига (37,1 мкл, 0,212 ммоль). Смесь перемешивали при комнатной температуре в течение 1 часа, выливали в воду и экстрагировали при помощи EtOAc. Органический слой сушили над Na2SO4, фильтровали и упаривали. Продукт очищали при помощи хроматографии (C18), элюируя смесью 10-100% ацетонитрила в воде (0,1% ТФУК), с получением указанного в заголовке соединения (14,0 мг, 49,1% выход) в виде соли ТФУК.1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 14,50 (шир. с, 2H) 7,70 (д, J=8,39 Гц, 2H) 7,54 (с, 2H) 7,39 (д, J=7,17 Гц, 2H) 7,33 (д, J=8,55 Гц, 2H) 7,07-7,12 (м, 2H) 6,73 (д, J=8,09 Гц, 2H) 6,61 (т, J=7,25 Гц, 1H) 5,20 (дд, J=8,01, 5,42 Гц, 2H) 4,84-4,96 (м, 4H) 4,11 (т, J=8,01 Гц, 2H) 3,81-3,90 (м, 4H) 3,54 (с, 6H) 2,15-2,22 (м, 2H) 2,02-2,15 (м, 4H) 1,92-2,01 (м, 2H) 0,74-0,89 (м, 14H).
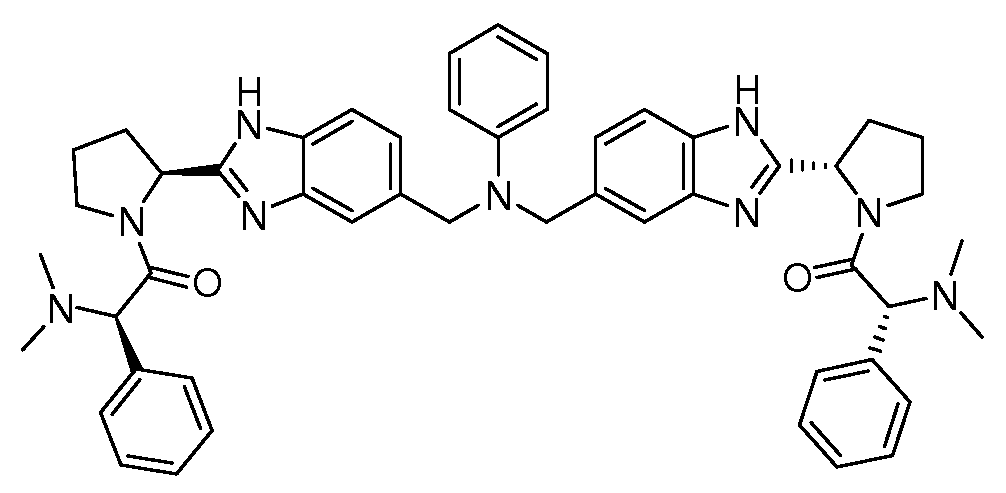
Пример 18
(2R,2'R)-1,1'-((2S,2'S)-2,2'-(5,5'-(фенилазанедиил)бис(метилен)бис(1H-бензо[d]имидазол-5,2-диил))бис(пирролидин-2,1-диил))бис(2-(диметиламино)-2-фенилэтанон)
Продукт из Примера 7E подвергали взаимодействию с (R)-2-(диметиламино)-2-фенилуксусной кислотой способами, используемыми для получения продукта Примера 17, с получением указанного в заголовке соединения (0,041 г, 54,2% выход) в виде соли ТФУК.1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 9,90-10,40 (м, 2H) 7,47-7,70 (м, 12H) 6,90-7,44 (м, 4H) 6,68-6,80 (м, 4H) 6,56-6,66 (м, 1H) 4,78-5,81 (м, 8H) 4,01 (с, 12H) 2,83-3,12 (м, 4H) 1,87-2,28 (м, 8H).
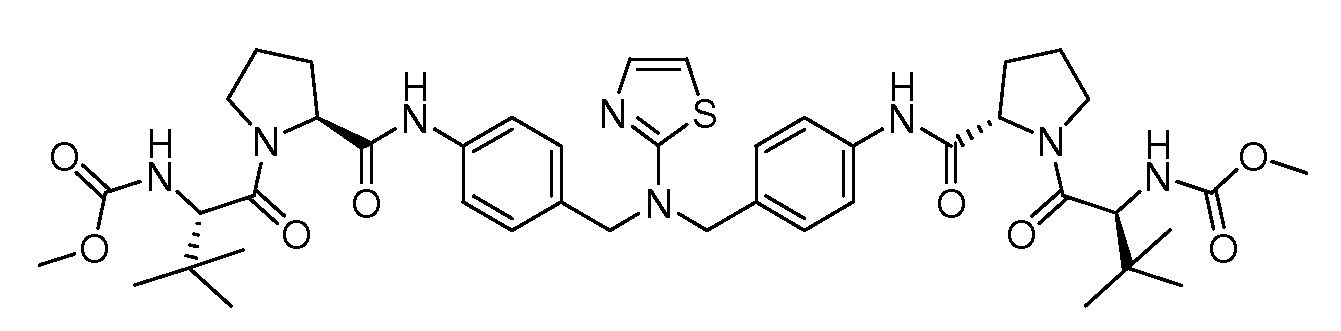
Пример 19
Диметил (2S,2'S)-1,1'-((2S,2'S)-2,2'-(4,4'-(4-диметил(2S,2'S)-1,1'-((2S,2'S)-2,2'-(4,4'-(тиазол-2-илазанедиил)бис(метилен)бис(4,1-фенилен))бис(азанедиил)бис(оксометилен)бис(пирролидин-2,1-диил))бис(3,3-диметил-1-оксобутан-2,1-диил)дикарбамат

Пример 19A
N,N-бис(4-нитробензил)тиазол-2-амин
Продукт Примера 19A получали способами, используемыми для получения продукта Примера 1A, заменяя анилин на 2-аминотиазол(0,915 г, 42,9% выход).
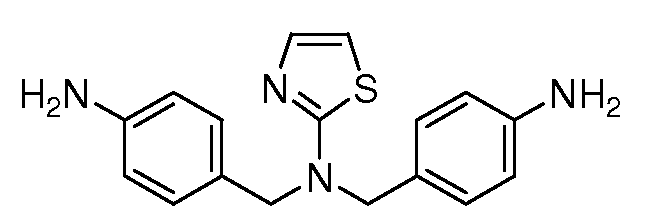
Пример 19B
N,N-бис(4-аминобензил)тиазол-2-амин
Продукт Примера 19B получали из продукта Примера 19A при помощи способа A, используемого для получения продукта Примера 1B (0,211 г, 56,2% выход).

Пример 19C
(2S,2'S)-трет-бутил 2,2'-(4,4'-(тиазол-2-илазанедиил)бис(метилен)бис(4,1-фенилен))бис(азанедиил)бис(оксометилен)дипирролидин-1-карбоксилат
Продукт Примера 19C получали из продукта Примера 19B способами, используемыми для получения продукта Примера 1C (0,25 г, 52,2% выход).

Пример 19D
(2S,2'S)-N,N'-(4,4'-(тиазол-2-илазанедиил)бис(метилен)бис(4,1-фенилен))дипирролидин-2-карбоксамид
Продукт Примера 19D получали из продукта Примера 19C способами, используемыми для получения продукта Примера 1D (0,058 г, 32,5% выход).

Пример 19E
Диметил (2S,2'S)-1,1'-((2S,2'S)-2,2'-(4,4'-(4-диметил(2S,2'S)-1,1'-((2S,2'S)-2,2'-(4,4'-(тиазол-2-илазанедиил)бис(метилен)бис(4,1-фенилен))бис(азанедиил)бис(оксометилен)бис(пирролидин-2,1-диил))бис(3,3-диметил-1-оксобутан-2,1-диил)дикарбамат
К смеси продукта из Примера 19D (0,0581 г, 0,115 ммоль), (S)-2-(метоксикарбониламино)-3,3-диметилбутановой кислоты (0,0529 г, 0,280 ммоль) и HATU (0,100 г, 0,264 ммоль) в CH2Cl2 (2,5 мл) добавляли основание Хунига (0,08 мл, 0,462 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь промывали водой, и органическую фазу сушили (MgSO4), фильтровали и концентрировали. Остаток очищали при помощи хроматографии на силикагеле, элюируя смесью 0-5% MeOH в CH2Cl2, с получением указанного в заголовке соединения (0,047 г, 48,3% выход).1H ЯМР (500 МГц, БЕНЗОЛ-d6) δ 1,00 (д, J=8,2, 18H), 1,75-1,10 (м, 6H), 2,13-1,98 (м, 2H), 3,25-3,14 (м, 2H), 3,40-3,31 (м, 2H), 3,42 (с, 3H), 3,44 (с, 3H), 4,20 (с, 1H), 4,31 (д, J=13,8, 1H), 4,49 (дд, J=24,6, 15,4, 4H), 4,65 (дд, J=7,6, 5,3, 1H), 4,78 (дд, J=7,8, 4,7, 1H), 5,28 (д, J=4,4, 1H), 5,52 (д, J=11,0, 1H), 5,56 (д, J=8,9, 1H), 5,79 (д, J=4,5, 1H), 6,84 (д, J=8,3, 2H), 7,66 (д, J=8,4, 2H), 7,81 (д, J=8,4, 2H), 9,77 (с, 1H), 9,88 (с, 1H).

Пример 20
Метил (S)-1-((S)-2-(5-(((4-((S)-1-((S)-2-(метоксикарбониламино)-3-метилбутаноил)пирролидин-2-карбоксамидо)бензил)(фенил)амино)метил)-1H-бензо[d]имидазол-2-ил)пирролидин-1-ил)-3-метил-1-оксобутан-2-илкарбамат
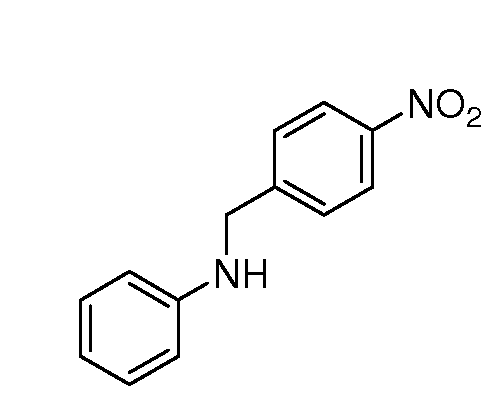
Пример 20A
N-(4-нитробензил)анилин
Объединяли анилин (6,16 г, 66,2 ммоль) и 4-нитробензальдегид (10,0 г, 66,2 ммоль) в MeOH (165 мл) и толуоле (165 мл) и нагревали до 60°C в течение 3 часов. Охлаждали смесь до комнатной температуры, порциями добавляли боргидрид натрия (5,01 г, 132 ммоль) и затем перемешивали при комнатной температуре в течение 1 часа. Добавляли насыщенный раствор NaHCO3 и перемешивали в течение 1 часа. Добавляли воду и экстрагировали при помощи EtOAc. Объединенные экстракты промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и упаривали до получения янтарного масла, которое очищали при помощи хроматографии на силикагеле, элюируя смесью CH2Cl2, с получением указанного в заголовке соединения (9,0 г, 59,6% выход).

Пример 20B
(S)-трет-бутил 2-(5-(((4-нитробензил)(фенил)амино)метил)-1H-бензо[d]имидазол-2-ил)пирролидин-1-карбоксилат
Продукт из Примера 20A (0,530 г, 2,32 ммоль) и K2CO3 (0,802 г, 5,81 ммоль) объединяли в сухом ДМФА (20 мл) при комнатной температуре, и через раствор барботировали азот в течение 10 минут. Продукт из Примера 7C (1,0 г, 2,63 ммоль) добавляли тремя равными порциями через 20-минутные интервалы и реакционную смесь перемешивали в общей сложности в течение 2,5 часов. Смесь выливали в воду, экстрагировали в EtOAc, промывали насыщенным солевым раствором. Органический слой сушили (MgSO4), фильтровали и упаривали. Продукт очищали при помощи хроматографии на силикагеле, элюируя смесью 0-4% MeOH в CH2Cl2, и второй колоночной очистки, элюируя смесью 0-5% EtOAc в CH2Cl2, с получением указанного в заголовке соединения (0,350 г, 28,6% выход).

Пример 20C
(S)-трет-бутил 2-(5-(((4-аминобензил)(фенил)амино)метил)-1H-бензо[d]имидазол-2-ил)пирролидин-1-карбоксилат
Продукт Примера 20C получали из продукта Примера 20B при помощи способа А, используемого для получения продукта Примера 1B.
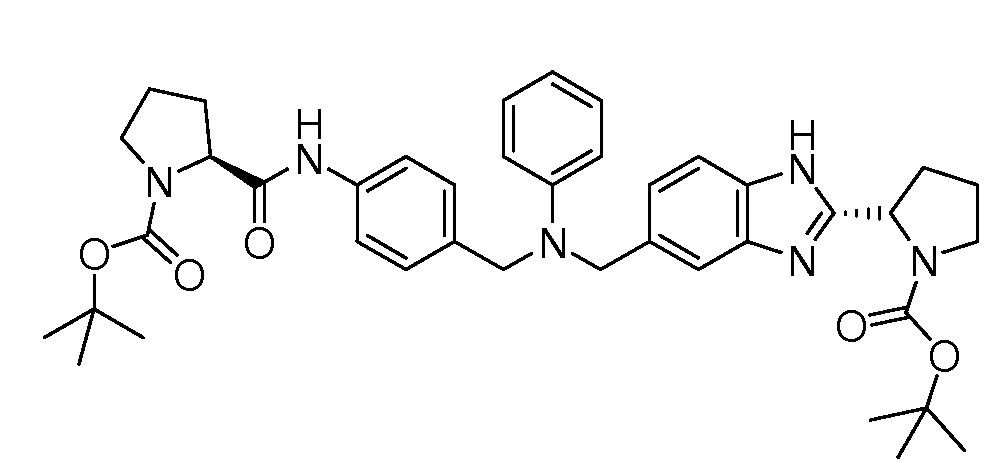
Пример 20D
(S)-трет-бутил 2-(4-((((2-((S)-1-(трет-бутоксикарбонил)пирролидин-2-ил)-1H-бензо[d]имидазол-5-ил)метил)(фенил)амино)метил)фенилкарбамоил)пирролидин-1-карбоксилат
Продукт Примера 20D получали из продукта Примера 20C способами, используемыми для получения продукта Примера 1C (0,15 г, 38,1% выход).
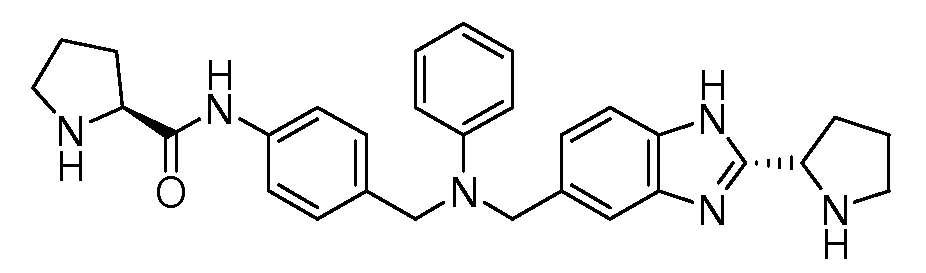
Пример 20E
(S)-N-(4-((фенил((2-((S)-пирролидин-2-ил)-1H-бензо[d]имидазол-5-ил)метил)амино)метил)фенил)пирролидин-2-карбоксамид
Продукт Примера 20E получали из продукта Примера 20D способами, используемыми для получения продукта Примера 1D (0,082 г, 77% выход).
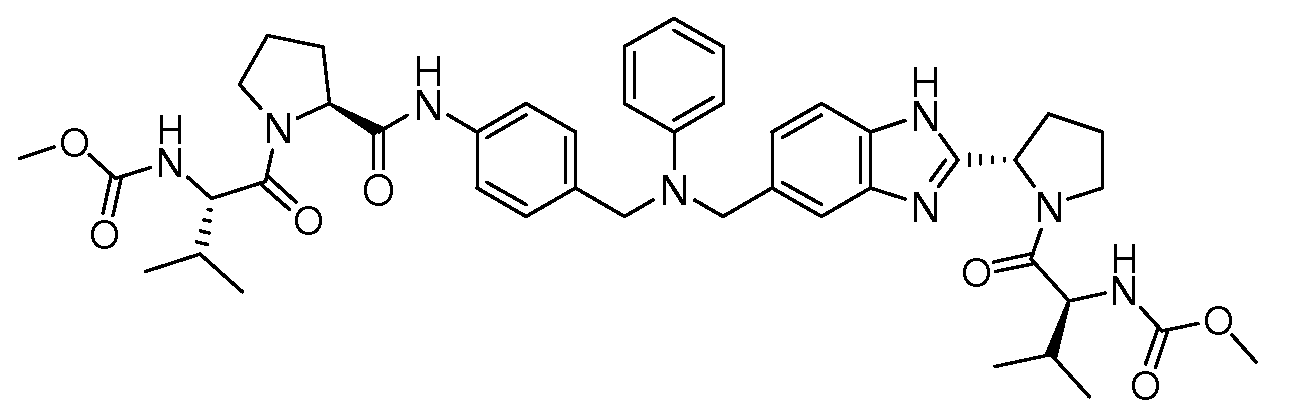
Пример 20F
Метил (S)-1-((S)-2-(5-(((4-((S)-1-((S)-2-(метоксикарбониламино)-3-метилбутаноил)пирролидин-2-карбоксамидо)бензил)(фенил)амино)метил)-1H-бензо[d]имидазол-2-ил)пирролидин-1-ил)-3-метил-1-оксобутан-2-илкарбамат
Продукт Примера 20F получали из продукта Примера 20E и (S)-2-(метоксикарбониламино)-3-метилбутановой кислоты способами, используемыми для получения продукта Примера 10B. Указанное в заголовке соединение очищали при помощи хроматографии на силикагеле, элюируя смесью 0-5% MeOH в CH2Cl2, с последующим элюированием смесью 10-60% EtOAc в CH2Cl2 (содержащей 0,5% NH4OH) (0,044 г, 32,8% выход).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,76 (д, J=6,71 Гц, 3H) 0,78 (дд, J=6,71, 2,75 Гц, 3H) 0,83 (д, J=7,32 Гц, 3H) 0,88 (д, J=6,71 Гц, 3H) 1,23-1,53 (м, 1H) 1,78-1,91 (м, 4H) 1,91-1,99 (м, 2H) 2,05-2,17 (м, 4H) 3,48 (д, J=5,19 Гц, 6H) 3,54-3,60 (м, 1H) 3,72-3,79 (м, 2H) 3,92-4,04 (м, 2H) 4,38 (дд, J=8,09, 4,88 Гц, 1H) 4,56 (с, 2H) 4,68 (д, J=10,99 Гц, 2H) 5,05-5,12 (м, 1H) 6,51 (тд, J=7,21, 4,04 Гц, 1H) 6,64 (д, J=8,24 Гц, 2H) 6,96-7,05 (м, 3H) 7,14 (дд, J=8,62, 2,21 Гц, 2H) 7,20 (с, 1H) 7,22-7,30 (м, 2H) 7,35 (дд, J=35,78, 8,32 Гц, 1H) 7,46 (дд, J=8,62, 1,75 Гц, 2H) 9,94 (с, 1H) 11,98 (д, J=26,25 Гц, 1H).

Пример 21
(R,2S,2'S)-N,N'-(4,4'-(фенилазанедиил)бис(метилен)бис(4,1-фенилен))бис(1-((R)-2-(диэтиламино)-2-фенилацетил)пирролидин-2-карбоксамид)
Продукт Примера 21 получали из продукта Примера 1D и (R)-2-(диэтиламино)-2-фенилуксусной кислоты способами, используемыми для получения продукта Примера 10B. Указанное в заголовке соединение очищали при помощи хроматографии на силикагеле, элюируя смесью 0-5% MeOH в CH2Cl2 (9,0 мг, 14,6% выход).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,96 (т, J=7,10 Гц, 12H) 1,81-1,96 (м, 4H) 2,00-2,07 (м, 2H) 2,08-2,17 (м, 2H) 2,49-2,56 (м, 4H) 2,63-2,72 (м, 4H) 3,42-3,47 (м, 2H) 3,82-3,89 (м, 2H) 4,45 (дд, J=8,16, 4,50 Гц, 2H) 4,67 (с, 4H) 4,74 (с, 2H) 6,64 (т, J=7,25 Гц, 1H) 6,74 (д, J=7,93 Гц, 2H) 7,12-7,18 (м, 2H) 7,26 (д, J=8,54 Гц, 4H) 7,34 (т, J=7,17 Гц, 2H) 7,40 (т, J=7,40 Гц, 4H) 7,47 (д, J=7,17 Гц, 4H) 7,59 (д, J=8,54 Гц, 4H) 10,03 (с, 2H).

Пример 22
Диметил (2S,2'S,3S,3'S)-1,1'-((2S,2'S)-2,2'-(5,5'-(фенилазанедиил)бис(метилен)бис(1H-бензо[d]имидазол-5,2-диил))бис(пирролидин-2,1-диил))бис(3-метил-1-оксопентан-2,1-диил)дикарбамат
К раствору продукта из Примера 7E (12 мг, 0,024 ммоль), (2S,3S)-2-(метоксикарбониламино)-3-метилпентановой кислоты (9,70 мг, 0,051 ммоль) и HATU (19,49 мг, 0,051 ммоль) в безводном ДМСО (0,2 мл) добавляли основание Хунига (0,013 мл, 0,073 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 90 минут. Смесь распределяли между водой (2 мл) и EtOAc (3×2 мл), и объединенные органические слои сушили над Na2SO4. Смесь фильтровали и концентрировали в вакууме, и неочищенный продукт очищали при помощи хроматографии на силикагеле (C18), элюируя с использованием градиента 10-100% ACN в воде (0,1% ТФУК). Фракции, содержащие чистый продукт, объединяли и концентрировали в вакууме с получением указанного в заголовке соединения в виде твердого вещества (9 мг, 31,4%) в виде соли ТФУК.1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 14,70 (шир. с, 2H) 7,73 (д, J=8,39 Гц, 2H) 7,56 (с, 2H) 7,43 (д, J=8,39 Гц, 2H) 7,38 (д, J=8,70 Гц, 2H) 7,07-7,12 (м, 2H) 6,73 (д, J=8,09 Гц, 2H) 6,61 (т, J=7,25 Гц, 1H) 5,21 (дд, J=8,16, 5,57 Гц, 2H) 4,91 (с, 4H) 4,11-4,18 (м, 2H) 3,82-3,94 (м, 4H) 3,54 (с, 6H) 2,01-2,26 (м, 8H) 1,64-1,77 (м, 2H) 1,27-1,37 (м, 2H) 0,96-1,10 (м, 2H) 0,71-0,90 (м, 12H).
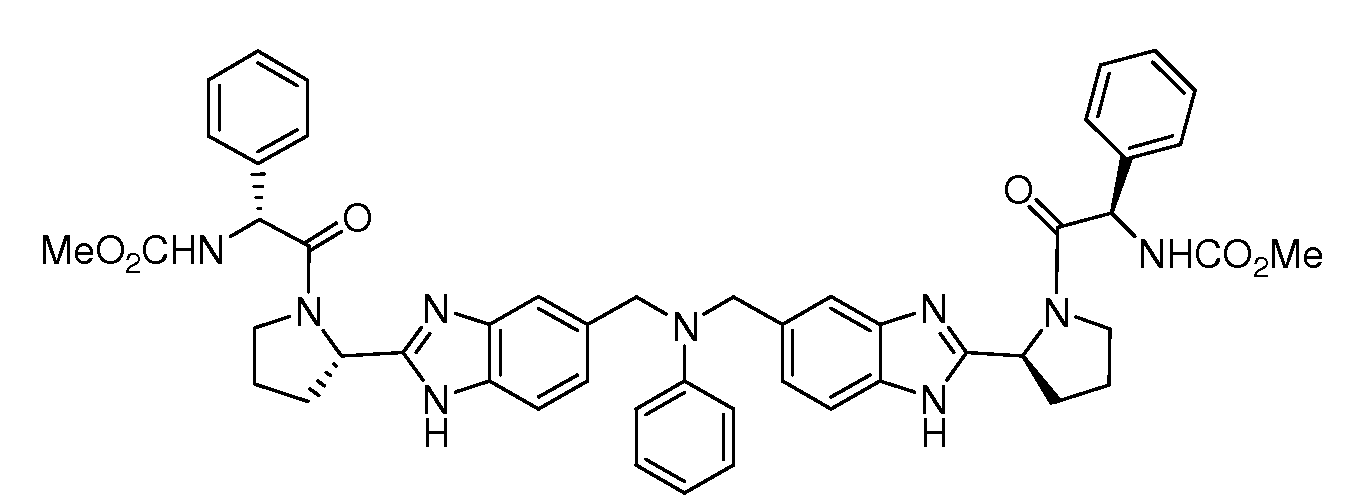
Пример 23
Диметил (1R,1'R)-2,2'-((2S,2'S)-2,2'-(5,5'-(фенилазанедиил)бис(метилен)бис(1H-бензо[d]имидазол-5,2-диил))бис(пирролидин-2,1-диил))бис(2-оксо-1-фенилэтан-2,1-диил)дикарбамат
К смеси продукта из Примера 7E (12 мг, 0,024 ммоль), (R)-2-(метоксикарбониламино)-2-фенилуксусной кислоты (10,72 мг, 0,051 ммоль) и HATU (19,49 мг, 0,051 ммоль) в безводном ДМСО (0,2 мл) добавляли основание Хунига (0,013 мл, 0,073 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 90 минут. Распределяли между водой (2 мл) и EtOAc (2×2 мл), и объединенные органические слои сушили над Na2SO4. Фильтровали и концентрировали в вакууме. Неочищенный продукт очищали при помощи хроматографии на силикагеле (C18), элюируя с использованием градиента 10-100% ацетонитрила в воде (0,1% ТФУК). Чистые фракции объединяли и концентрировали в вакууме с получением указанного в заголовке соединения в виде твердого вещества (13 мг, 43,8%) в виде соли ТФУК.1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 14,50 (шир. с, 2H) 6,87-7,88 (м, 18H) 6,56-6,79 (м, 3H) 5,36-5,58 (м, 2H) 5,22-5,35 (м, 2H) 4,94 (с, 4H) 3,69-3,99 (м, 4H) 3,46-3,56 (м, 6H) 3,13-3,26 (м, 2H) 1,86-2,34 (м, 8H).

Пример 24
Диметил ([(1-метилэтил)имино]бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-3-метил-1-оксобутан-1,2-диил]})бискарбамат

Пример 24A
N,N-бис(4-нитробензил)пропан-2-амин
Смесь бис(4-нитробензил)амина (50 мг, 0,174 ммоль) и ацетона (51,1 мкл, 0,696 ммоль) в смеси метанола (752 мкл)/уксусной кислоты (39,6 мкл)/CH2Cl2 (79 мкл) перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь охлаждали до 0°C и добавляли цианоборгидрид натрия (32,8 мг, 0,522 ммоль). Смесь перемешивали при 0°C в течение 1 часа и давали нагреться до комнатной температуры и перемешивали в течение ночи. Реакционную смесь концентрировали и остаток распределяли между EtOAc и насыщенным водным раствором NaHCO3. Органический слой промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и концентрировали в вакууме. Очистка при помощи флэш-хроматографии (силикагель, 50% EtOAc/гексан) давала указанный в заголовке продукт (42,8 мг, 75%). МС (ESI) m/z 329,9 (M+H)+.

Пример 24B
4-(((4-аминобензил)(изопропил)амино)метил)анилин
К раствору продукта из Примера 24A (42,8 мг, 0,130 ммоль) в этаноле (1,3 мл) в атмосфере N2 добавляли трихлорид висмута (0,026 мл, 0,39 ммоль). Смесь охлаждали в холодной водяной бане и медленно, порциями, добавляли боргидрид натрия (79 мг, 2,079 ммоль) в течение нескольких минут. Когда добавление было завершено, полученную смесь перемешивали при комнатной температуре в течение 1 часа и затем фильтровали через целит и промывали метанолом. Фильтрат концентрировали до ~1/2 объема, разбавляли смесью 1:3 изопропиловый спирт:CH2Cl2 и промывали насыщенным водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения (31,9 мг). МС (APCI) m/s 270,5 (M+H)+.

Пример 24C
(2S,2'S)-трет-бутил 2,2'-(4,4'-(изопропилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(оксометилен)дипирролидин-1-карбоксилат
К раствору продукта из Примера 24B (31,9 мг, 0,118 ммоль) в безводном ДМСО (592 мкл) добавляли N-(трет-бутоксикарбонил)-L-пролин (51 мг, 0,237 ммоль), HATU (95 мг, 0,249 ммоль) и основание Хунига (83 мкл, 0,474 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 часов и затем распределяли между водой и этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и концентрировали в вакууме. Очистка при помощи флэш-хроматографии (силикагель, 50% EtOAc/гексан) давала указанное в заголовке соединение (24,3 мг, 31%). МС (ESI) m/z 664,4 (M+H)+.
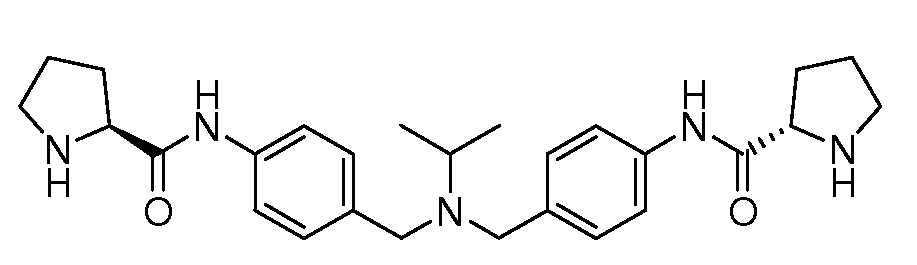
Пример 24D
(2S,2'S)-N,N'-(4,4'-(изопропилазанедиил)бис(метилен)бис(4,1-фенилен))дипирролидин-2-карбоксамид
К раствору продукта из Примера 24C (24,3 мг, 0,037 ммоль) в CH2Cl2 (0,2 мл) добавляли трифторуксусную кислоту (0,100 мл). Полученную смесь перемешивали при комнатной температуре в течение 1 часа и концентрировали в вакууме. Остаток растворяли в смеси 1:3 изопропилового спирта:CH2Cl2 и промывали водным насыщенным раствором NaHCO3, сушили (Na2SO4), фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения (10,4 мг, 61%). МС (ESI) m/z 464,2 (M+H)+.
Пример 24E
Диметил ([(1-метилэтил)имино]бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-3-метил-1-оксобутан-1,2-диил]})бискарбамат
К раствору продукта из Примера 24D (10,4 мг, 0,022 ммоль) в безводном ДМСО (0,15 мл) добавляли (S)-2-(метоксикарбониламино)-3-метилбутановую кислоту (10,61 мг, 0,056 ммоль), HATU (21,3 мг, 0,056 ммоль) и основание Хунига (23,5 мкл, 0,135 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 1 часа и затем распределяли между водой и этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и концентрировали в вакууме. Очистка при помощи C18-обращенно-фазовой ВЭЖХ (10-90% CH3CN/0,1% ТФУК в воде) давала указанное в заголовке соединение в виде соли ТФУК (7,5 мг).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,87 (т, J=7,5 Гц, 7H), 0,93 (д, J=6,7 Гц, 5H), 1,34 (д, J=6,6 Гц, 6H), 1,84-1,94 (м, 6H), 1,95-2,04 (м, 3H), 2,17 (тд, J=7,2, 4,8 Гц, 2H), 2,37-2,42 (м, 3H), 3,60-3,69 (м, 6H), 3,82 (д, J=9,5 Гц, 2H), 4,03 (т, J=8,5 Гц, 3H), 4,34 (д, J=13,4 Гц, 2H), 4,42-4,46 (м, 2H), 7,31 (д, J=8,4 Гц, 2H), 7,40 (т, J=9,2 Гц, 4H), 7,64 (дд, J=8,7, 2,0 Гц, 4H), 9,10 (с, 1H), 10,21 (с, 2H); МС (ECI) м/z 778,4 (М+H)+.
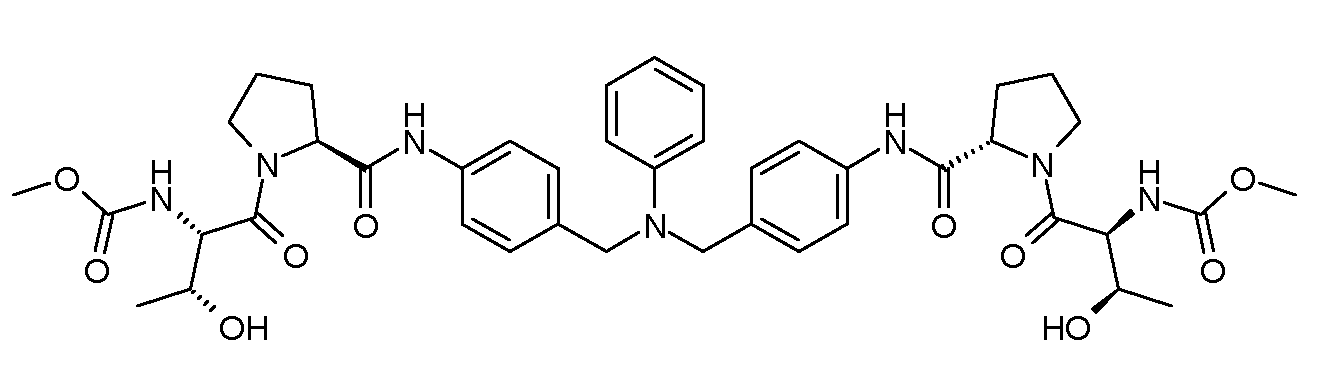
Пример 25
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил (2S)пирролидин-2,1-диил[(2S,3R)-3-гидрокси-1-оксобутан-1,2-диил]}]бискарбамат
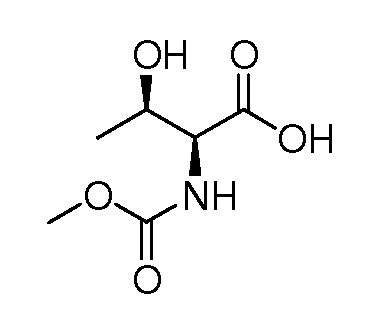
Пример 25A
(2S,3R)-3-гидрокси-2-(метоксикарбониламино)бутановая кислота
L-Треонин (0,50 г, 4,2 ммоль) и бикарбонат натрия (1,13 г, 13,4 ммоль) растворяли в воде (20 мл) затем охлаждали в ледяной бане. Метилхлорформиат (0,36 inL, 4,62 ммоль) растворяли в диэтиловом эфире (2 мл) и добавляли по каплям при тщательном перемешивании. Раствор перемешивали при температуре окружающей среды в течение 5 часов, затем доводили уровень рН до 3 при помощи концентрированной хлористоводородной кислоты и экстрагировали в этилацетат. Органический раствор сушили над сульфатом натрия, фильтровали и концентрировали с получением 0,12 г указанного в заголовке соединения в виде воскообразного твердого вещества.
Пример 25B
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S,3R)-3-гидрокси-1-оксобутан-1,2-диил]}]бискарбамат
Продукт из Примера 25A (0,027 г, 0,16 ммоль) и продукт из Примера 1D (0,035 г, 0,07 ммоль) объединяли в диметилсульфоксиде (1,5 мл) при температуре окружающей среды и обрабатывали диизопропилэтиламином (0,061 мл, 0,35 ммоль) с последующей обработкой HATU (0,056 г, 0,15 ммоль) и перемешивали в течение 45 минут. Раствор разбавляли водой, и твердый продукт отфильтровывали, затем очищали на колонке combi-flash c 4 г диоксида кремния, элюируя смесью 0-10% метанола в дихлорметане, с получением 0,025 г указанного в заголовке соединения в виде желтого твердого вещества.1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 1,12 (д, J=6,41 Гц, 6H) 1,82-1,91 (м, 4H) 1,92-2,01 (м, 2H) 2,09-2,17 (м, 2H) 3,52 (с, 6H) 3,65-3,74 (м, 2H) 3,76-3,84 (м, 4H) 4,20 (т, J=7,40 Гц, 2H) 4,42 (дд, J=8,39, 4,88 Гц, 2H) 4,57 (с, 4H) 4,81 (д, J=5,80 Гц, 2H) 6,55 (т, J=7,25 Гц, 1H) 6,64 (д, J=7,93 Гц, 2H) 7,02-7,11 (м, 4H) 7,16 (д, J=8,54 Гц, 4H) 7,49 (д, J=8,70 Гц, 4H) 9,83 (с, 2H); МС (ТФУК, ELSD+) м/z 816 (М+H)+.

Пример 26
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S')-3-гидрокси-1-оксопропан-1,2-диил]}]бискарбамат

Пример 26A
(S)-3-гидрокси-2-(метоксикарбониламино)пропановая кислота
L-серин (1,0 г, 9,52 ммоль) обрабатывали, как в Примере 25A, с получением 0,125 г (8%) указанного в заголовке соединения в виде воскообразного твердого вещества.
Пример 26B
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-3-гидрокси-1-оксопропан-1,2-диил]}]бискарбамат
Продукт из Примера 26A (0,025 мг, 0,16 ммоль) и продукт из Примера 1D (0,035 г, 0,07 ммоль) обрабатывали, как в Примере 25B, с получением 0,012 г (22%) указанного в заголовке соединения в виде желтого твердого вещества.1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 1,87-1,97 (м, 6H) 2,09-2,17 (м, 2H) 3,19-3,25 (м, J=10,99 Гц, 2H) 3,52 (с, 6H) 3,55-3,63 (м, 2H) 3,66-3,76 (м, 2H) 4,08 (кв, J=5,29 Гц, 2H) 4,37-4,47 (м, 4H) 4,57 (с, 4H) 5,10 (с, 2H) 6,55 (т, J=7,32 Гц, 1H) 6,63 (д, J=8,09 Гц, 2H) 7,02-7,08 (м, 2H) 7,15 (д, J=8,54 Гц, 4H) 7,31 (д, J=7,78 Гц, 2H) 7,48 (д, J=8,54 Гц, 4H) 9,67 (с, 2H); МС (ТФУК, ELSD+) м/z 788 (М+H)+.

Пример 27
Диметил [(циклопентилимино)бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-3-метил-1-оксобутан-1,2-диил]}]бискарбамат
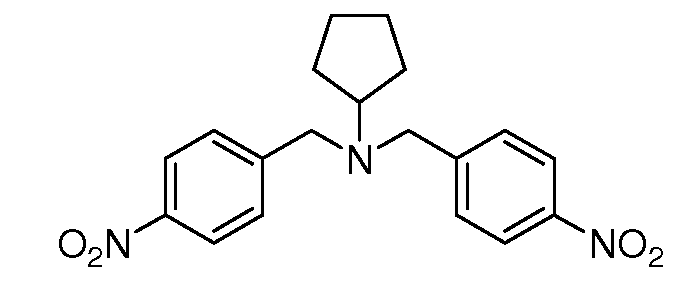
Пример 27A
N,N-бис(4-нитробензил)циклопентанамин
К раствору циклопентиламина (0,148 мл, 1,5 ммоль) в N,N-диметилформамиде (2 мл) добавляли карбонат калия (622 мг, 4,50 ммоль) с последующим добавлением 1-(бромметил)-4-нитробензола (648 мг, 3,00 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 16 часов, добавляли дополнительное количество 1-(бромметил)-4-нитробензола (324 мг, 1,5 ммоль)? и перемешивание продолжали в течение дополнительных 2 часов. Смесь разбавляли водой, экстрагировали при помощи CH2Cl2, и органический слой сушили (Na2SO4), фильтровали и концентрировали. Неочищенный продукт очищали при помощи осаждения из метанола с получением указанного в заголовке соединения (554 мг, количеств.). МС (ESI) m/z 356,0 (M+H)+.
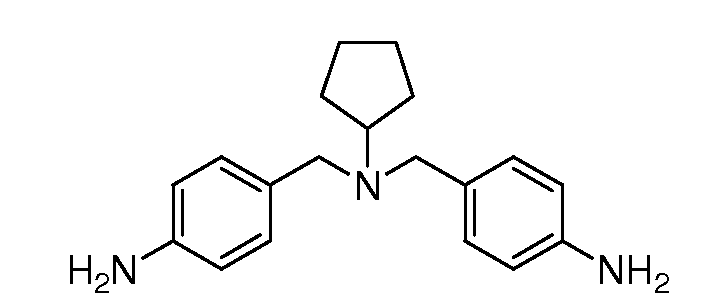
Пример 27B
4-(((4-аминобензил)(циклопентил)амино)метил)анилин
Продукт Примера 27A (231 мг, 0,65 ммоль) подвергали обработке способом, описанным в Примере 24B, с получением указанного в заголовке соединения (360 мг). МС (APCI) m/z 295,9 (M+H)+.

Пример 27C
(2S,2'S)-трет-бутил 2,2'-(4,4'-(циклопентилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(оксометилен)дипирролидин-1-карбоксилат
Продукт Примера 27B (360,3 мг, 1,220 ммоль) подвергали процедуре, описанной в Примере 24C, с получением указанного в заголовке соединения (427 мг, 50%). МС (ESI) m/z 690,5 (M+H)+.
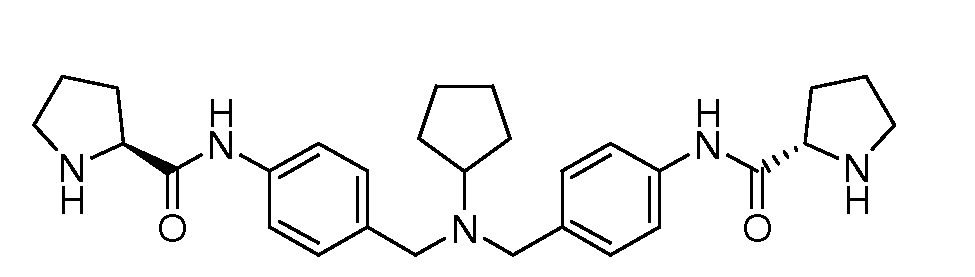
Пример 27D
(2S,2'S)-N,N'-(4,4'-(циклопентилазанедиил)бис(метилен)бис(4,1-фенилен))дипирролидин-2-карбоксамид
Продукт Примера 27C (427,4 мг, 0,620 ммоль) подвергали процедуре, описанной в Примере 24D, с получением указанного в заголовке соединения (255 мг, 84%). МС (ESI) m/z 490,2 (M+H)+.
Пример 27E
Диметил [(циклопентилимино)бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-3-метил-1-оксобутан-1,2-диил]}]бискарбамат
Продукт Примера 27D (50 мг, 0,102 ммоль) подвергали процедуре, описанной в Примере 24E, с получением указанного в заголовке соединения в виде соли ТФУК (11 мг).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. -0,00 (с, 1H), 0,85-0,91 (м, 8H), 0,94 (т, J=6,0 Гц, 6H), 1,21-1,30 (м, 1H), 1,48-1,57 (м, 3H), 1,71 (с, 2H), 1,85-1,94 (м, 8H), 1,97-2,02 (м, 4H), 2,13-2,22 (м, 2H), 3,77-3,87 (м, 3H), 4,03 (т, J=8,5 Гц, 2H), 4,14 (дд, J=13,4, 5,3 Гц, 2H), 4,26 (с, 2H), 4,44 (дд, J=7,8, 5,2 Гц, 2H), 7,32 (д, J=8,2 Гц, 2H), 7,40 (т, J=8,9 Гц, 4H), 7,62-7,67 (м, 4H), 9,52 (с, 1H), 10,22 (с, 2H); МС (ECI) м/z 804,4 (М+H)+.
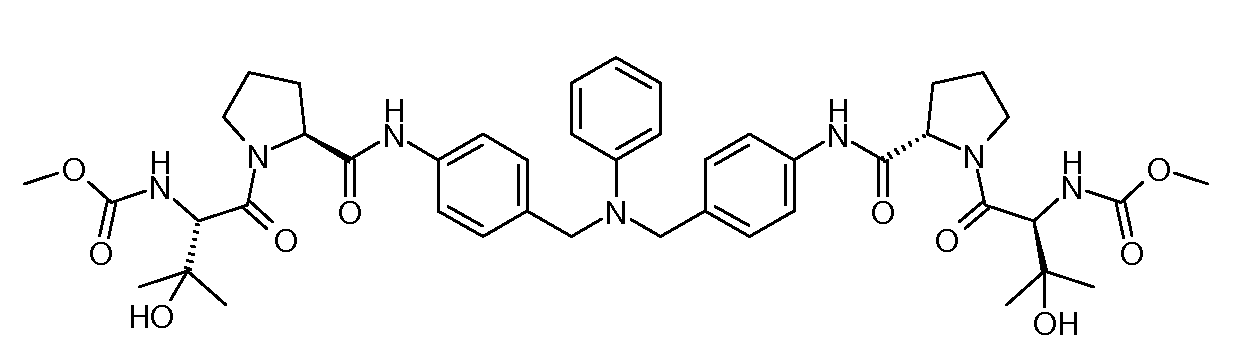
Пример 28
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-3-гидрокси-3-метил-1-оксобутан-1,2-диил]}]бискарбамат

Пример 28A
(S)-3-гидрокси-2-(метоксикарбониламино)-3-метилбутановая кислота
(S)-2-амино-3-гидрокси-3-метилбутановую кислоту (0,52 г, 3,9 ммоль) обрабатывали, как в Примере 25A, с получением 0,55 г (74%) указанного в заголовке соединения в виде воскообразного твердого вещества.
Пример 28B
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-3-гидрокси-3-метил-1-оксобутан-1,2-диил]}]бискарбамат
Продукт из Примера 28A (0,029 мг, 0,16 ммоль) и продукт из Примера 1D (0,035 г, 0,07 ммоль) обрабатывали, как в Примере 25B, с получением 0,016 г (27%) указанного в заголовке соединения в виде желтого твердого вещества.1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 1,14 (с, 6H) 1,21 (с, 6H) 1,84-1,97 (м, 6H) 2,11-2,20 (м, 2H) 3,54 (с, 6H) 3,64-3,73 (м, 2H) 3,84-3,93 (м, 2H) 4,37 (д, J=8,70 Гц, 2H) 4,46 (дд, J=8,62, 3,74 Гц, 2H) 4,58 (с, 4H) 5,09 (с, 2H) 6,55 (т, J=7,25 Гц, 1H) 6,63 (д, J=7,93 Гц, 2H) 7,05 (дд, J=8,77, 7,25 Гц, 2H) 7,14 (д, J=9,61 Гц, 2H) 7,16 (д, J=8,70 Гц, 4H) 7,51 (д, J=8,70 Гц, 4H) 9,65 (с, 2H); МС (ТФУК, ELSD+) м/z 844 (М+H)+.

Пример 29
Диметил [(циклопентилимино)бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-3,3-диметил-1-оксобутан-1,2-диил]}]бискарбамат
Продукт Примера 27D (50 мг, 0,102 ммоль) подвергали процедуре, описанной в Примере 24E, заменяя (S)-2-(метоксикарбониламино)-3-метилбутановую кислоту на (S)-2-(метоксикарбониламино)-3,3-диметилбутановую кислоту, с получением указанного в заголовке соединения в виде соли ТФУК (9 мг).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,81-0,89 (м, 2H), 0,94-0,98 (м, 21H), 1,49-1,57 (м, 2H), 1,72 (д, J=3,2 Гц, 2H), 1,84-1,93 (м, 5H), 1,95-2,02 (м, 4H), 2,14-2,21 (м, 2H), 3,80 (д, J=8,9 Гц, 5H), 4,15 (с, 3H), 4,22 (д, J=8,7 Гц, 3H), 4,28 (с, 1H), 4,42-4,47 (м, 2H), 7,09 (д, J=8,9 Гц, 2H), 7,40 (дд, J=12,6, 8,6 Гц, 4H), 7,65 (дд, J=8,7, 2,3 Гц, 4H), 9,50 (с, 1H), 10,22 (с, 2H); МС (ECI) м/z 832,4 (М+H)+.
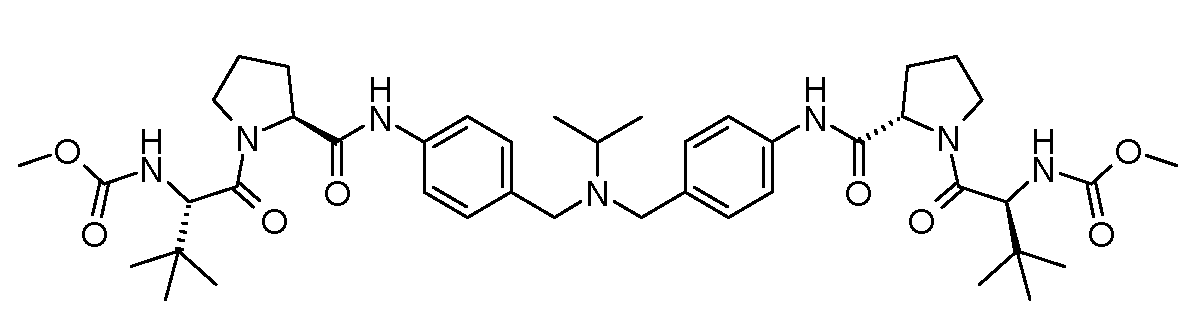
Пример 30
Диметил ([(1-метилэтил)имино]бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-3,3-диметил-1-оксобутан-1,2-диил]})бискарбамат
Продукт Примера 24D (60,0 мг, 0,129 ммоль) подвергали процедуре, описанной в Примере 24E, заменяя (S)-2-(метоксикарбониламино)-3-метилбутановую кислоту на (S)-2-(метоксикарбониламино)-3,3-диметилбутановую кислоту, с получением указанного в заголовке соединения в виде соли ТФУК (25 мг).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,80-0,89 (м, 2H), 0,91 (с, 1H), 0,93-1,00 (м, 20H), 1,22-1,30 (м, 2H), 1,34 (д, J=6,6 Гц, 6H), 1,83-1,92 (м, 4H), 1,95-2,03 (м, 2H), 2,13-2,22 (м, 2H), 3,35 (с, 2H), 4,06 (дд, J=13,4, 5,6 Гц, 4H), 4,21 (д, J=8,9 Гц, 2H), 4,34 (т, J=12,5 Гц, 2H), 4,44 (д, J=6,6 Гц, 2H), 7,09 (д, J=8,9 Гц, 2H), 7,41 (дд, J=13,1, 8,7 Гц, 4H), 7,64 (дд, J=8,7, 2,9 Гц, 4H), 9,13 (с, 1H), 10,22 (с, 2H); МС (ECI) м/z 806,5 (М+H)+.

Пример 31
(2S,2'S)-N,N'-[(фенилимино)бис(метандиилбензол-4,1-диил)]бис{1-[(2S)-3,3-диметил-2-(2-оксоимидазолидин-1-ил)бутаноил]пирролидин-2-карбоксамид}
Продукт Примера 1D (32 мг, 0,064 ммоль) и (S)-3,3-диметил-2-(2-оксоимидазолидин-1-ил)бутановую кислоту (39,6 мг, 0,193 ммоль) обрабатывали с использованием способа, описанного в Примере 43, с получением 22 мг (40%) указанного в заголовке соединения.1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 10,01 (с, 2H), 7,58 (д, J=8,5 Гц, 4H), 7,24 (д, J=8,5 Гц, 4H), 7,13 (м, 2H), 6,73 (д, J=8,1 Гц, 2H), 6,63 (т, J=7,3 Гц, 1H), 6,47 (с, 2H), 4,65 (с, 4H), 4,53 (с, 2H), 4,46 (дд, J=8,4, 5,0 Гц, 2H), 3,67 (м, 6H), 3,55 (м, 2H), 3,24 (м, 4H), 2,21 (м, 2H), 2,03 (м, 2H), 1,91 (м, 4H), 1,06 (с, 18H).

Пример 32
Диметил ([(2-метоксиэтил)имино]бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-3,3-диметил-1-оксобутан-1,2-диил]})бискарбамат
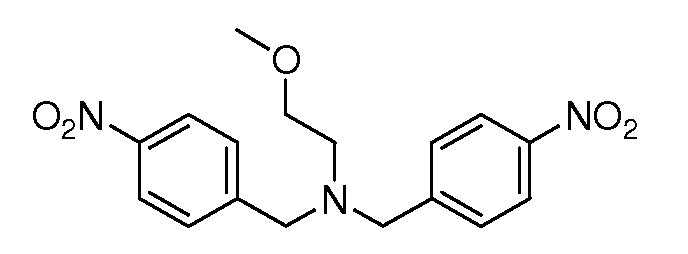
Пример 32A
2-метокси-N,N-бис(4-нитробензил)этанамин
К раствору 2-метоксиэтиламина (0,343 мл, 3,99 ммоль) в ДМФА (20,0 мл) при комнатной температуре добавляли карбонат калия (0,964 мл, 15,98 ммоль) с последующим добавлением 4-нитробензилбромида (1,812 г, 8,39 ммоль). Реакционную смесь перемешивали в течение 2 часов, затем гасили водой, экстрагировали при помощи EtOAc и концентрировали. Остаток очищали при помощи хроматографии (смесь от 20% до 40% EtOAc-гексан) с получением указанного в заголовке соединения. МС (DCI) m/z 346 (M+H)+.
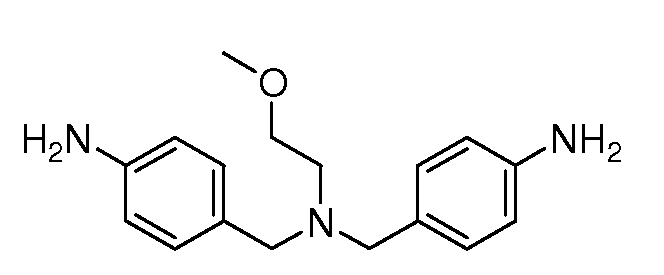
Пример 32B
4-(((4-аминобензил)(2-метоксиэтил)амино)метил)анилин
Продукт из Примера 32A обрабатывали с использованием способа, описанного в Примере 1B (Способ A), с получением указанного в заголовке соединения. МС (ESI) m/z 286 (M+H)+.
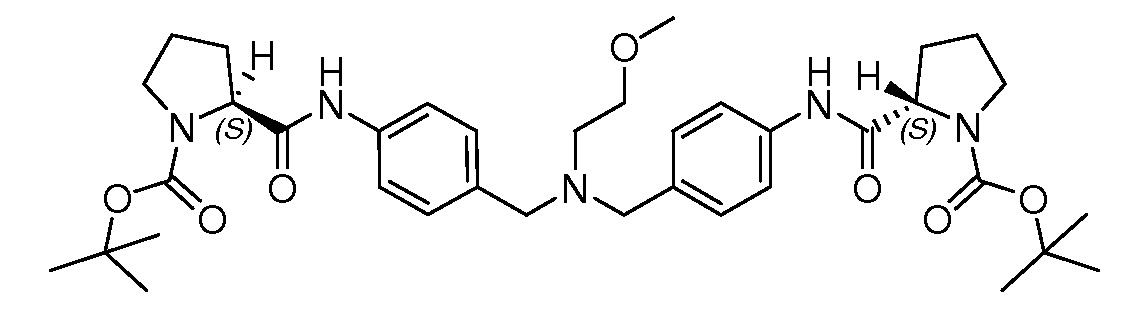
Пример 32C
(2S,2'S)-трет-бутил 2,2'-(4,4'-(2-метоксиэтилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(оксометилен)дипирролидин-1-карбоксилат
Продукт из Примера 32B обрабатывали с использованием способа, описанного в Примере 1C, заменяя ДМСО дихлорметаном с получением указанного в заголовке соединения. МС (ESI) m/z 680 (M+H)+, 678 (M-H)+.

Пример 32D
(2S,2'S)-N,N'-(4,4'-(2-метоксиэтилазанедиил)бис(метилен)бис(4,1-фенилен))дипирролидин-2-карбоксамид
Продукт из Примера 32C обрабатывали с использованием способа, описанного в Примере 1D, с получением указанного в заголовке соединения. МС (ESI) m/z 480 (M+H)+, 478 (M-H)+.
Пример 32E
Диметил ([(2-метоксиэтил)имино]бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-3,3-диметил-1-оксобутан-1,2-диил]})бискарбамат
Продукт из Примера 32D обрабатывали с использованием способа, описанного в Примере 6, заменяя ДМСО дихлорметаном, и очищали с использованием флэш-хроматографии (силикагель, MeOH/дихлорметан) с получением указанного в заголовке соединения (7,5 мг, 3%).1H ЯМР (500 МГц, БЕНЗОЛ-d6) δ 1,02 (с, 18H), 1,39-1,16 (м, 5H), 1,56-1,40 (м, 2H), 1,78-1,60 (м, 2H), 2,19-2,02 (м, 2H), 2,59 (т, J=5,9, 2H), 3,03 (с, 4H), 3,26-3,19 (м, 2H), 3,29 (т, J=5,9, 2H), 3,41-3,35 (м, 6H), 3,44 (с, 6H), 4,53 (д, J=9,7, 2H), 4,82-4,63 (м, 2H), 5,69 (д, J=8,6, 2H), 7,80 (д, J=7,8, 4H), 9,81 (с, 2H); МС (ECI) м/z 822 (М+H)+, 820 (М-H)+.

Пример 33
Диметил [(изоксазол-3-илимино)бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-3,3-диметил-1-оксобутан-1,2-диил]}]бискарбамат
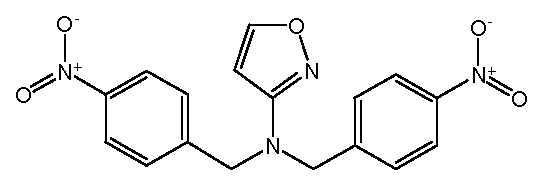
Пример 33A
N,N-бис(4-нитробензил)изоксазол-3-амин
Указанное в заголовке соединение получали с использованием способов из Примера 1A, заменяя анилин на изоксазол-3-амин, с получением указанного в заголовке соединения (0,49 г, 23% выход).

Пример 33B
N,N-бис(4-аминобензил)изоксазол-3-амин
Указанное в заголовке соединение получали с использованием способов из Примера 1B, заменяя продукт из Примера 1A на продукт из Примера 33A, с получением указанного в заголовке соединения (0,32 г, 79% выход).
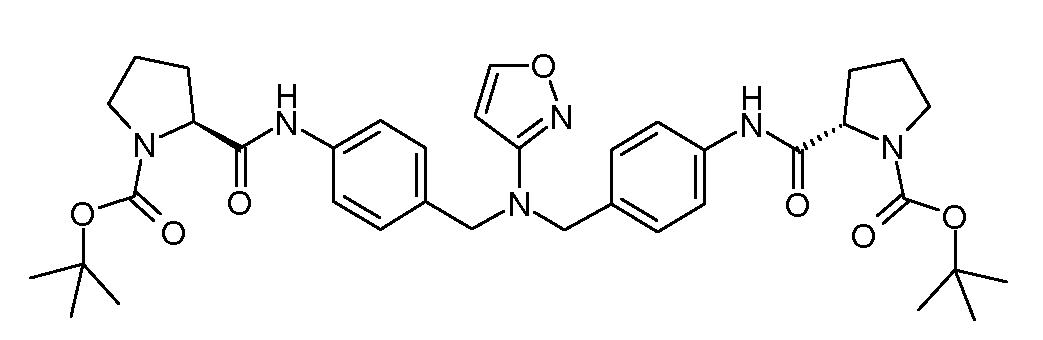
Пример 33C
(2S,2'S)-трет-бутил 2,2'-(4,4'-(изоксазол-3-илазанедиил)бис(метилен)бис(4,1-фенилен))бис(азанедиил)бис(оксометилен)дипирролидин-1-карбоксилат
Указанное в заголовке соединение получали с использованием способов из Примера 1C, заменяя продукт из Примера 1B на продукт из Примера 33B, с получением указанного в заголовке соединения (0,32 г, 43% выход).

Пример 33D
(2S,2'S)-N,N'-(4,4'-(изоксазол-3-илазанедиил)бис(метилен)бис(4,1-фенилен))дипирролидин-2-карбоксамид
Указанное в заголовке соединение получали с использованием способов из Примера 1D, заменяя продукт из Примера 1C на продукт из Примера 33C, с получением указанного в заголовке соединения (0,14 г, 62% выход).
Пример 33E
Диметил [(изоксазол-3-илимино)бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-3,3-диметил-1-оксобутан-1,2-диил]}]бискарбамат
Продукт Примера 33D и (S)-2-(метоксикарбониламино)-3,3-диметилбутановую кислоту подвергали взаимодействию, используя способ из Примера 1E, и продукт очищали при помощи колоночной хроматографии, элюируя смесью 0-4% метанола в дихлорметане, с получением указанного в заголовке соединения (37 мг, 31% выход).1H ЯМР (500 МГц, ДМСО) δ 10,02 (с, 2H), 8,48 (д, J=1,8, 1H), 7,52 (д, J=8,5, 4H), 7,16 (д, J=8,5, 4H), 7,09 (д, J=8,8, 2H), 6,36 (д, J=1,8, 1H), 4,44 (дд, J=5,3, 8,1, 2H), 4,35 (с, 4H), 4,21 (д, J=8,8, 2H), 3,81-3,73 (м, 2H), 3,68-3,60 (м, 2H), 3,53 (д, J=10,5, 6H), 2,21-2,10 (м, 2H), 2,03-1,93 (м, 2H), 1,92-1,80 (м, 4H), 0,97 (с, 18H), МС (ECI; М+H) м/z=832.

Пример 34
Метил [(1S)-2-гидрокси-1-{[(2S)-2-(6-{[({2-[(2S)-1-{(2S)-3-гидрокси-2-[(метоксикарбонил)амино]-3-метилбутаноил}пирролидин-2-ил]-1Н-бензимидазол-6-ил}метил)(фенил)амино]метил}-1H-бензимидазол-2-ил)пирролидин-1-ил]карбонил}-2-метилпропил]карбамат
Продукт Примера 7E (25 мг, 0,051 ммоль) и (S)-3-гидрокси-2-(метоксикарбониламино)-3-метилбутановую кислоту (21,4 мг, 0,112 ммоль) обрабатывали с использованием способа, описанного в Примере 7F, и ВЭЖХ фракции нейтрализовали насыщенным водным раствором NaHCO3 с последующей экстракцией смесью изопропилового спирта/CH2Cl2 (соотношение 1:3; 3×100 мл) и выделением с получением 32 мг (53%) указанного в заголовке соединения.1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 1,02 (с, 6H), 1,14 (с, 6H), 1,91-2,16 (м, 6H), 2,29-2,43 (м, 3H), 2,53 (с, 2H), 3,18 (с, 2H), 3,55 (с, 6H), 3,72-3,82 (м, 2H), 3,97-4,06 (м, 2H), 4,37 (д, J=8,70 Гц, 4H), 4,88 (с, 4H), 4,90 (д, J=10,99 Гц, 2H), 5,26 (дд, J=8,24, 4,58 Гц, 2H), 6,56-6,62 (м, 1H), 6,72 (д, J=8,09 Гц, 2H), 7,04-7,12 (м, 3H), 7,18 (д, J=8,54 Гц, 2H), 7,37 (д, J=8,39 Гц, 2H), 7,52 (с, 2H), 7,66 (д, J=8,24 Гц, 2H), МС (ECI) м/z 838 (М+H)+.
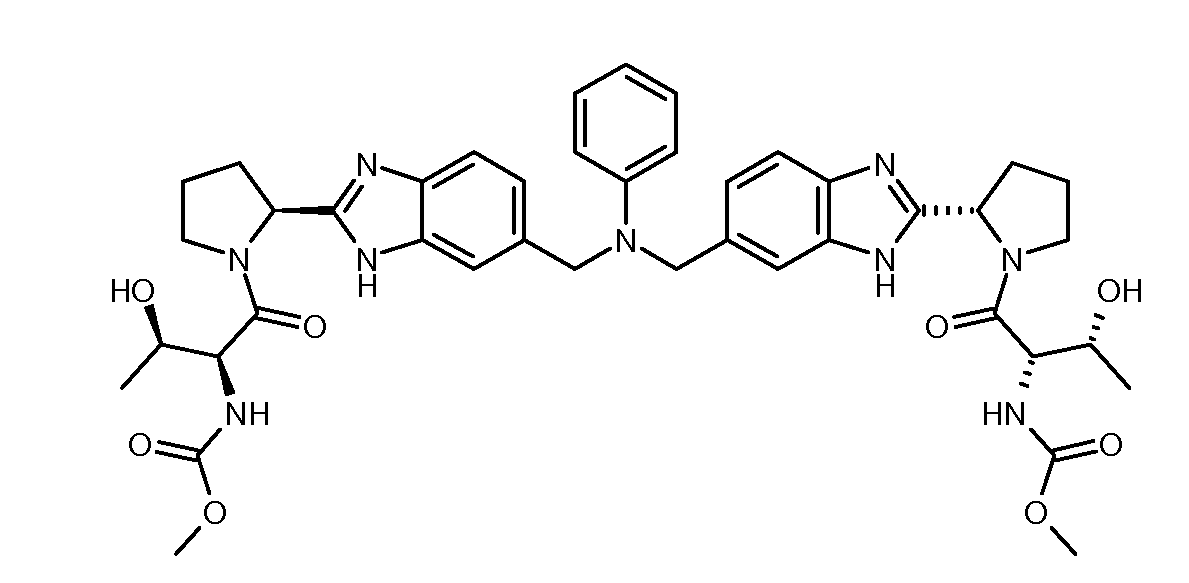
Пример 35
Метил [(1S,2R)-2-гидрокси-1-{[(2S)-2-(6-{[({2-[(2S)-1-{(2S,3R)-3-гидрокси-2-[(метоксикарбонил)амино]бутаноил}пирролидин-2-ил]-1Н-бензимидазол-6-ил}метил)(фенил)амино]метил}-1H-бензимидазол-2-ил)пирролидин-1-ил]карбонил}пропил]карбамат
Продукт Примера 7E (25 мг, 0,051 ммоль) и (2S,3R)-3-гидрокси-2-(метоксикарбониламино)бутановую кислоту (19,8 мг, 0,112 ммоль) обрабатывали с использованием способа, описанного в Примере 7F, и ВЭЖХ фракции нейтрализовали насыщенным водным раствором NaHCO3 с последующей экстракцией смесью изопропилового спирта/CH2Cl2 (соотношение 1:3; 3×100 мл) и выделением с получением 25 мг (43%) указанного в заголовке соединения.1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 1,00 (д, J=6,26 Гц, 6H), 2,00-2,20 (м, 7H), 2,34-2,44 (м, 4H), 3,54 (с, 6H), 3,87 (дт, J=12,40, 6,18 Гц, 2H), 4,26 (дд, J=8,24, 5,34 Гц, 2H), 4,90 (д, J=1,98 Гц, 4H), 5,21 (дд, J=8,24, 5,34 Гц, 2H), 6,60 (т, J=7,25 Гц, 1H), 6,72 (д, J=8,09 Гц, 2H), 6,99 (д, J=8,24 Гц, 2H), 7,05-7,12 (м, 2H), 7,41 (д, J=8,39 Гц, 2H), 7,54 (с, 2H), 7,71 (д, J=8,54 Гц, 2H), МС (ECI) м/z 810 (М+H)+.

Пример 36
(2S,2'S)-N,N'-[(Фенилимино)бис(метандиилбензол-4,1-диил)]бис{1-[(2S)-3-метил-2-(2-оксотетрагидропиримидин-1(2Н)-ил)бутаноил]пирролидин-2-карбоксамид}
Продукт Примера 1D (30 мг, 0,060 ммоль) подвергали процедуре, описанной в Примере 24E, заменяя (S)-2-(метоксикарбониламино)-3-метилбутановую кислоту на (S)-3-метил-2-(2-оксотетрагидропиримидин-1(2H)-ил)бутановую кислоту, с получением указанного в заголовке соединения в виде соли ТФУК (10 мг).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,78-0,85 (м, 7H), 0,88 (д, J=6,4 Гц, 6H), 1,68-1,77 (м, 4H), 1,79-1,88 (м, 4H), 1,97 (д, J=6,0 Гц, 2H), 2,06-2,16 (м, 4H), 3,05-3,13 (м, 6H), 3,54-3,63 (м, 2H), 3,80-3,88 (м, 2H), 4,36 (дд, J=8,2, 5,0 Гц, 2H), 4,59 (с, 4H), 4,78 (д, J=11,1 Гц, 2H), 6,30 (с, 2H), 6,56 (т, J=7,2 Гц, 1H), 6,66 (д, J=8,2 Гц, 2H), 7,07 (т, J=7,9 Гц, 2H), 7,17 (д, J=8,4 Гц, 4H), 7,51 (д, J=8,5 Гц, 4H), 9,95 (с, 2H); МС (ECI) м/z 862,5 (М+H)+.

Пример 37
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(4S)-5-оксопент-1-ен-5,4-диил]}]бискарбамат
Пример 37A
(S)-2-(метоксикарбониламино)пент-4-еновая кислота
Смесь (S)-2-аминопент-4-еновой кислоты (1,0 г, 8,69 ммоль) и NaHCO3 (2,26 мг, 26,9 ммоль) в H2O (40 мл) охлаждали до 0°C. Смесь метилхлорформиата (740 мкл, 9,55 ммоль), растворенного в Et2O (4 мл), медленно добавляли к водной смеси и перемешивали в течение 20 часов, доводя до температуры окружающей среды. Уровень рН смеси доводили до 3,0 при помощи HCl (концентрированный раствор). Смесь экстрагировали при помощи EtOAc и затем сушили (MgSO4), фильтровали и концентрировали с получением 1,25 г (83%) указанного в заголовке соединения. МС (ESI) m/z 174 (M+H)+.
Пример 37B
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(4S)-5-оксопент-1-ен-5,4-диил]}]бискарбамат
Продукт Примера 1D (50 мг, 0,100 ммоль) и продукт Примера 37A (34,8 мг, 0,201 ммоль) обрабатывали с использованием способа, описанного в Примере 1E, с получением 51 мг (53%) указанного в заголовке соединения в виде соли ТФУК.1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 1,81-1,93 (м, 3H), 1,94-2,04 (м, 2H), 2,08-2,17 (м, 2H), 2,20-2,29 (м, 2H), 2,33-2,42 (м, 2H), 2,53 (с, 2H), 3,50 (с, 6H), 3,55-3,63 (м, 2H), 3,64-3,72 (м, 2H), 4,24-4,31 (м, 2H), 4,42 (дд, J=8,09, 4,27 Гц, 2H), 4,58 (с, 4H), 5,03 (д, J=10,22 Гц, 2H), 5,13 (д, J=16,48 Гц, 2H), 5,75-5,86 (м, 2H), 6,56 (т, J=6,71 Гц, 1H), 6,65 (д, J=7,63 Гц, 2H), 7,06 (т, J=7,78 Гц, 2H), 7,16 (д, J=8,54 Гц, 4H), 7,34 (д, J=7,93 Гц, 2H), 7,49 (д, J=8,39 Гц, 4H), 9,93 (с, 2H), МС (ECI) м/z 808 (М+H)+.
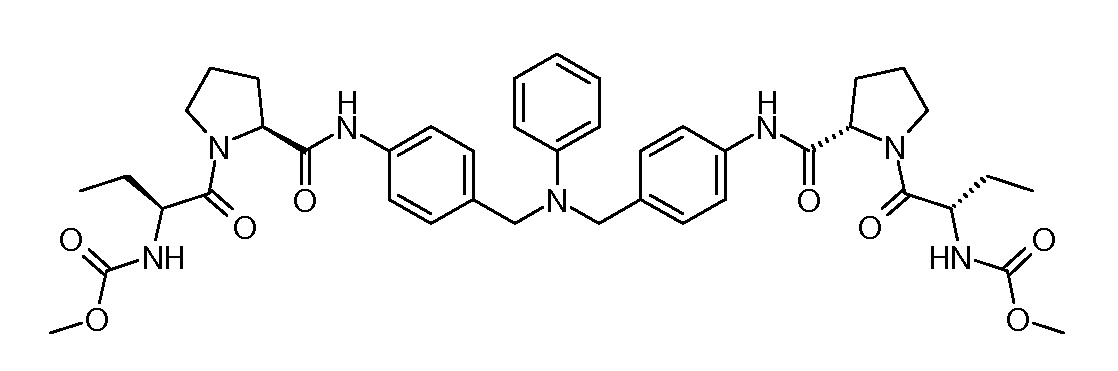
Пример 38
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-1-оксобутан-1,2-диил]}]бискарбамат
Пример 38A
(S)-2-(метоксикарбониламино)бутановая кислота
Соединение (S)-2-аминобутановой кислоты (1,0 г, 9,70 ммоль) обрабатывали с использованием способа, описанного в Примере 37A, с получением 1,15 г (74%) указанного в заголовке соединения. МС (ESI) m/z 162 (M+H)+.
Пример 38B
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-1-оксобутан-1,2-диил]}]бискарбамат
Продукт Примера 1D (50 мг, 0,100 ммоль) и продукт Примера 38A (32 мг, 0,201 ммоль) обрабатывали с использованием способа, описанного в Примере 1E, с получением 34 мг (38%) указанного в заголовке соединения в виде соли ТФУК.1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,89 (т, J=7,40 Гц, 6H), 1,44-1,56 (м, 2H), 1,58-1,70 (м, 2H), 1,80-1,94 (м, 4H), 1,94-2,04 (м, 2H), 2,07-2,16 (м, 2H), 3,50 (с, 6H), 3,55-3,63 (м, 2H), 3,67-3,77 (м, 2H), 4,17 (дд, J=13,81, 7,55 Гц, 2H), 4,41 (дд, J=8,09, 4,58 Гц, 2H), 4,58 (с, 4H), 6,56 (т, J=6,87 Гц, 1H), 6,65 (д, J=7,78 Гц, 2H), 7,06 (т, J=7,86 Гц, 2H), 7,15 (д, J=8,54 Гц, 4H), 7,30 (д, J=7,78 Гц, 2H), 7,49 (д, J=8,39 Гц, 4H), 9,94 (с, 2H), МС (ECI) м/z 784 (М+H)+.
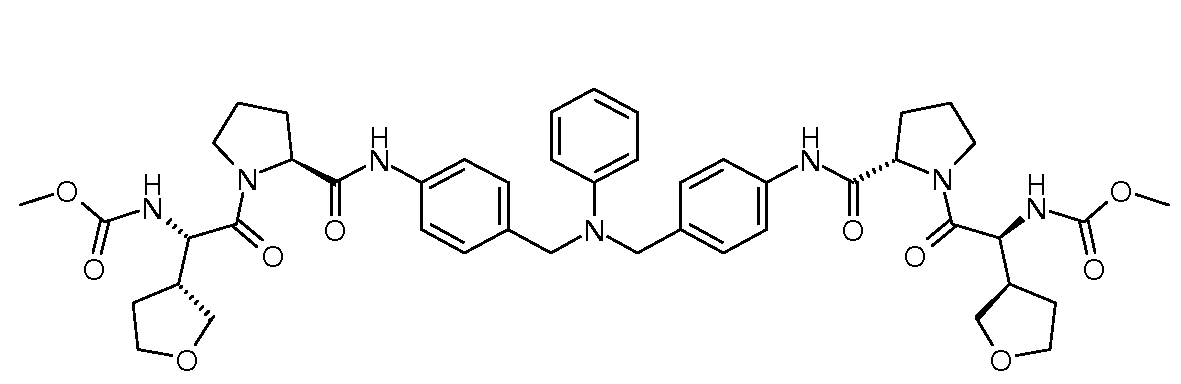
Пример 39
Диметил {(фенилимино)бис[метандиилбензол-4,1-диилкарбамоил (2S)пирролидин-2,1-диил{(1S)-2-оксо-1-[(3R)-тетрагидрофуран-3-ил]этан-2,1-диил}]}бискарбамат
Продукт из Примера 1D (0,05 г, 0,10 ммоль) и (S)-2-(метоксикарбониламино)-2-((R)-тетрагидрофуран-3-ил)уксусную кислоту (0,045 г, 0,22 ммоль) обрабатывали, как в Примере 25B, с получением 0,039 г (45%) указанного в заголовке соединения в виде желтого твердого вещества.1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 1,65-1,76 (м, 2H) 1,82-1,91 (м, 6H) 1,94-2,03 (м, 2H) 2,09-2,18 (м, 2H) 3,43 (дд, J=8,47, 6,33 Гц, 2H) 3,51-3,54 (м, 6H) 3,57-3,70 (м, 7H) 3,70-3,76 (м, 3H) 3,80-3,87 (м, 2H) 4,22 (т, J=8,85 Гц, 2H) 4,42 (дд, J=8,09, 4,73 Гц, 2H) 4,58 (с, 4H) 6,55 (т, J=7,25 Гц, 1H) 6,64 (д, J=8,24 Гц, 2H) 7,05 (т, J=8,01 Гц, 2H) 7,16 (д, J=8,54 Гц, 4H) 7,50 (д, J=8,54 Гц, 4H) 7,59 (д, J=7,93 Гц, 2H) 9,97 (с, 2H); МС ECI- м/z 866 (М-H)-.
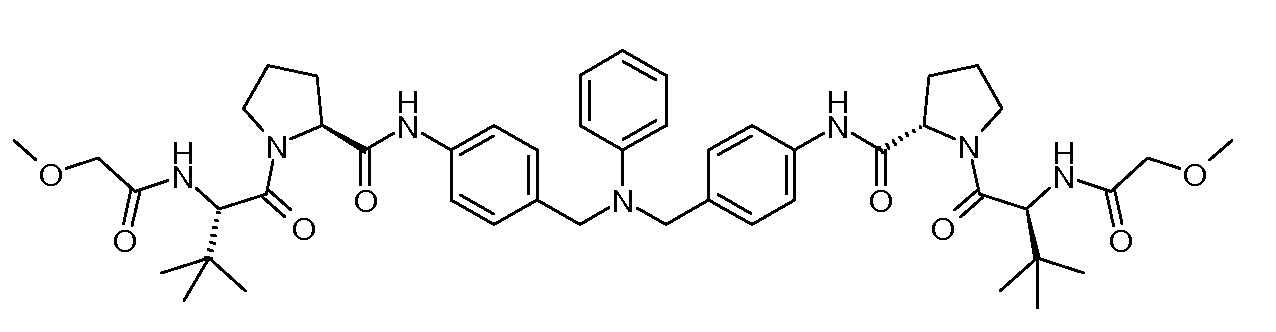
Пример 40
(2S,2'S)-N,N'-[(Фенилимино)бис(метандиилбензол-4,1-диил)]бис(1-{(2S)-2-[(метоксиацетил)амино]-3,3-диметилбутаноил}пирролидин-2-карбоксамид)
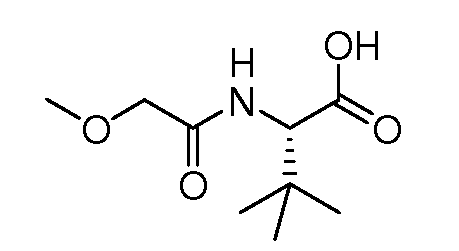
Пример 40A
(S)-2-(2-метоксиацетамидо)-3,3-диметилбутановая кислота
(S)-2-Амино-3,3-диметилбутановую кислоту (0,50 г, 3,8 ммоль) и бикарбонат натрия (0,80 г, 9,5 ммоль) растворяли в воде (20 мл), затем охлаждали в ледяной бане. Метоксиацетилхлорид (0,38 мл, 4,2 ммоль) растворяли в диэтиловом эфире (5 мл) и добавляли по каплям при тщательном перемешивании. Раствор перемешивали при температуре окружающей среды в течение 5 часов, затем доводили уровень рН до 3 при помощи концентрированной хлористоводородной кислоты и экстрагировали в этилацетат. Органический раствор сушили над сульфатом натрия, фильтровали и концентрировали с получением 0,16 г (21%) указанного в заголовке соединения в виде воскообразного твердого вещества.
Пример 40B
(2S,2'S)-N,N'-[(фенилимино)бис(метандиилбензол-4,1-диил)]бис(1-{(2S)-2-[(метоксиацетил)амино]-3,3-диметилбутаноил}пирролидин-2-карбоксамид)
Продукт из Примера 1D (0,05 г, 0,10 ммоль) и продукт из Примера 40A (0,045 г, 0,22 ммоль) обрабатывали, как в Примере 25B, с получением 0,006 г (7%) указанного в заголовке соединения в виде желтого твердого вещества.1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,93 (с, 18H) 1,85-1,93 (м, 4H) 1,94-2,04 (м, 2H) 2,08-2,17 (м, 2H) 3,28 (с, 6H) 3,63-3,76 (м, 4H) 3,81-3,95 (м, 4H) 4,38 (дд, J=8,54, 3,05 Гц, 2H) 4,56-4,62 (м, 6H) 6,55 (т, J=7,17 Гц, 1H) 6,64 (д, J=8,09 Гц, 2H) 7,03-7,08 (м, 2H) 7,15 (д, J=8,54 Гц, 4H) 7,38 (д, J=9,00 Гц, 2H) 7,51 (д, J=8,54 Гц, 4H) 9,82 (с, 2H); МС ECI- м/z 866 (М-H)-.

Пример 41
Ди-трет-бутил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S,3S)-3-метил-1-оксопентан-1,2-диил]}]бискарбамат
К раствору продукта из Примера 1D (0,062 г, 0,125 ммоль) в CH2Cl2 (5 мл) при комнатной температуре добавляли (2S,3S)-2-(трет-бутоксикарбониламино)-3-метилпентановую кислоту (Aldrich, 0,063 г, 0,274 ммоль), N,N-диизопропилэтиламин (0,100 мл) и HATU (0,104 г, 0,274 ммоль). Через 30 минут реакционную смесь промывали насыщенным солевым раствором и органическую фазу концентрировали. Остаток очищали при помощи хроматографии (1% градиент от 0 до 2% MeOH-CH2Cl2) с получением 67 мг (58%) указанного в заголовке соединения.1H ЯМР (500 МГц, ДМСО-d6) δ 0,81 (т, J=7,02 Гц, 6H) 0,85 (д, J=6,71 Гц, 6H) 1,20-1,29 (м, 2H) 1,37 (с, 18H) 1,44-1,53 (м, 2H) 1,65-1,75 (м, 2H) 1,82-1,92 (м, 4H) 1,95-2,04 (м, 2H) 2,08-2,17 (м, 2H) 3,56-3,64 (м, 2H) 3,75-3,83 (м, 2H) 4,04 (т, J=8,70 Гц, 2H) 4,43 (дд, J=7,93, 4,88 Гц, 2H) 4,59 (с, 4H) 6,56 (м, 1H) 6,65 (д, J=8,24 Гц, 2H) 6,88 (д, J=8,39 Гц, 2H) 7,07 (м, 2H) 7,17 (д, J=8,54 Гц, 4H) 7,51 (д, J=8,39 Гц, 4H) 9,97 (с, 2H).
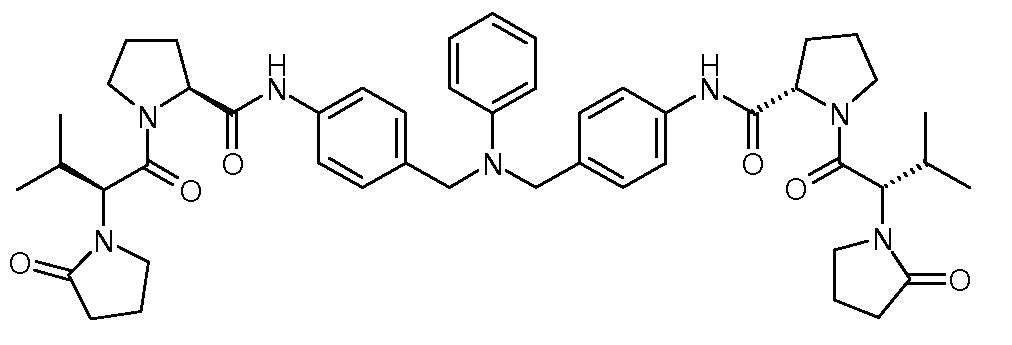
Пример 42
(2S,2'S)-N,N'-[(Фенилимино)бис(метандиилбензол-4,1-диил)]бис{1-[(2S)-3-метил-2-(2-оксопирролидин-1-ил)бутаноил]пирролидин-2-карбоксамид}
Продукт Примера 1D (30 мг, 0,06 ммоль) и (S)-3-метил-2-(2-оксопирролидин-1-ил)бутановую кислоту (24,6 мг, 0,133 ммоль) обрабатывали с использованием способа, описанного в Примере 43, с получением 21 мг (42%) указанного в заголовке соединения.1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 9,92 (с, 2H), 7,46 (д, J=8,6 Гц, 4H), 7,12 (д, J=8,5 Гц, 4H), 7,01 (м, 2H), 6,61 (д, J=8,1 Гц, 2H), 6,51 (т, J=7,2 Гц, 1H), 4,54 (с, 4H), 4,40 (д, J=11,0 Гц, 2H), 4,33 (м, 2H), 3,62 (м, 4H), 3,35 (м, 2H), 3,23 (м, 2H), 2,21 (м, 4H), 2,08 (м, 4H), 1,91 (м, 2H), 1,82 (с, 8H), 0,87 (д, J=6,6 Гц, 6H), 0,72 (д, J=6,6 Гц, 6H).
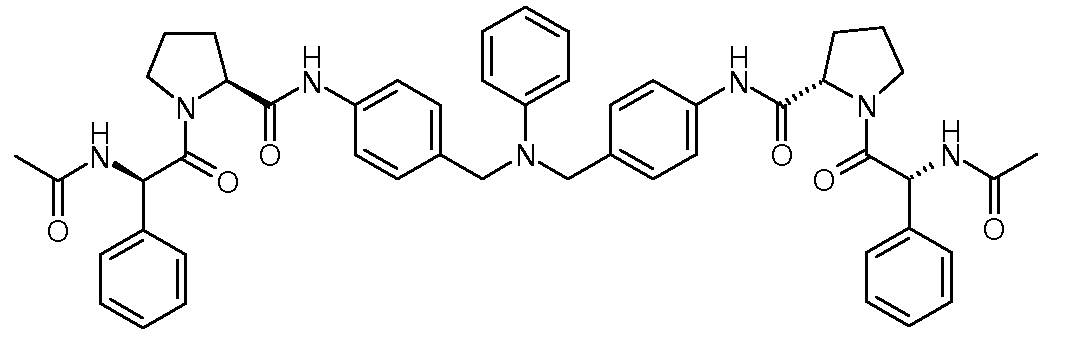
Пример 43
(2S,2'S)-N,N'-[(Фенилимино)бис(метандиилбензол-4,1-диил)]бис{1-[(2R)-2-(ацетиламино)-2-фенилацетил]пирролидин-2-карбоксамид}
Продукт Примера 1D (40 мг, 0,08 ммоль), (R)-2-ацетамидо-2-фенилуксусную кислоту (34,2 мг, 0,177 ммоль) и HATU (67,2, 0,177 ммоль) растворяли в ДМСО (3 мл), затем добавляли основание Хунига (0,07 мл, 0,402 ммоль) и перемешивали смесь при комнатной температуре в течение 1 часа. В раствор добавляли дихлорметан и смесь экстрагировали водой. Органический экстракт затем сушили, фильтровали, концентрировали и очищали при помощи хроматографии (силикагель, 0-20% метанол в дихлорметане) с получением 8 мг (12%) указанного в заголовке соединения.1H ЯМР (500 МГц, ДМСО- d6) δ м.д. 9,73 (с, 2H), 8,60 (д, J=7,9 Гц, 2H), 7,52 (м, 4H), 7,35 (м, 7H), 7,13 (м, 4H), 7,02 (м, 2H), 6,61 (д, J=8,2 Гц, 2H), 4,56 (м, 4H), 4,33 (м, 2H), 3,78 (м, 2H), 3,21 (м, 2H), 2,49 (с, 6H), 1,90 (м, 8H).
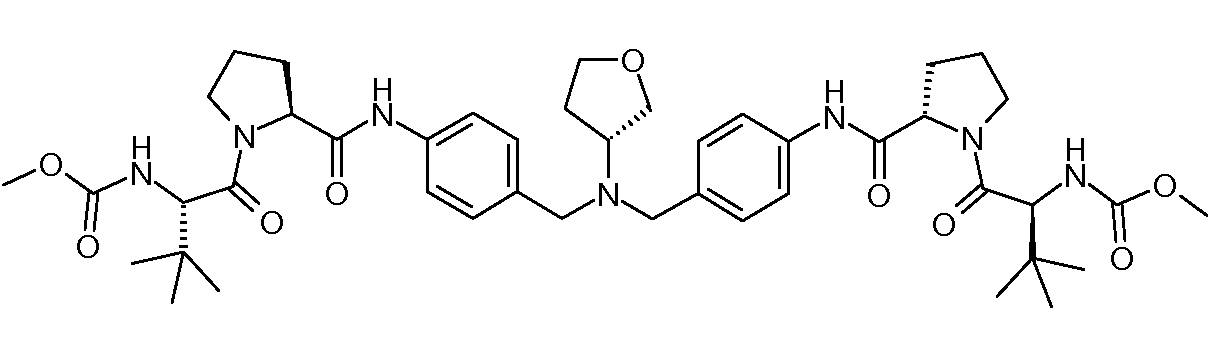
Пример 44
Диметил ([(3R)-тетрагидрофуран-3-илимино]бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-3,3-диметил-1-оксобутан-1,2-диил]})бискарбамат
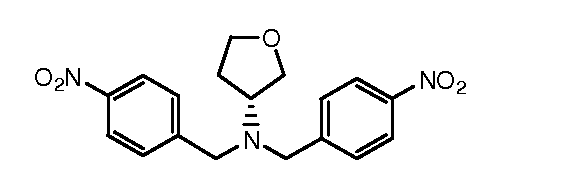
Пример 44A
(R)-N,N-бис(4-нитробензил)тетрагидрофуран-3-амин
Указанное в заголовке соединение получали с использованием способов из Примера 1A, заменяя анилин на (R)-тетрагидрофуран-3-амин, с получением указанного в заголовке соединения (1,12 г, 59% выход).

Пример 44B
(R)-N,N-бис(4-аминобензил)тетрагидрофуран-3-амин
Указанное в заголовке соединение получали с использованием способов из Примера 1B, заменяя продукт из Примера 1A на продукт из Примера 44A, с получением указанного в заголовке соединения (1,02 г, 109% выход).
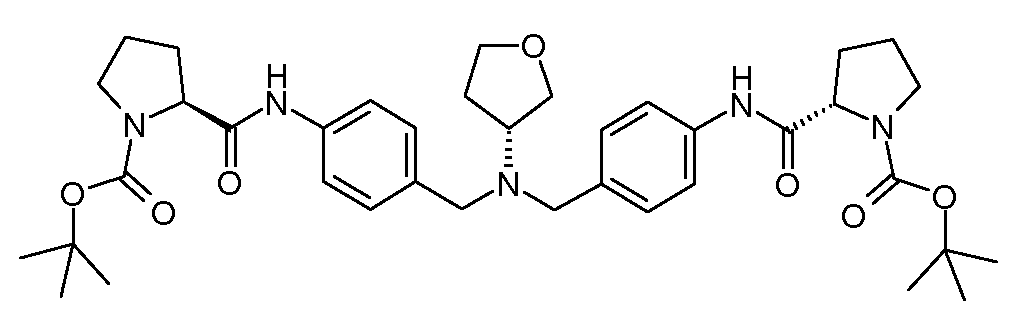
Пример 44C
(2S,2'S)-трет-бутил 2,2'-(4,4'-((R)-тетрагидрофуран-3-илазанедиил)бис(метилен)бис(4,1-фенилен))бис(азанедиил)бис(оксометилен)дипирролидин-1-карбоксилат
Указанное в заголовке соединение получали с использованием способов из Примера 1C, заменяя продукт из Примера 1B на продукт из Примера 44B, с получением указанного в заголовке соединения (0,78 г, 33% выход).
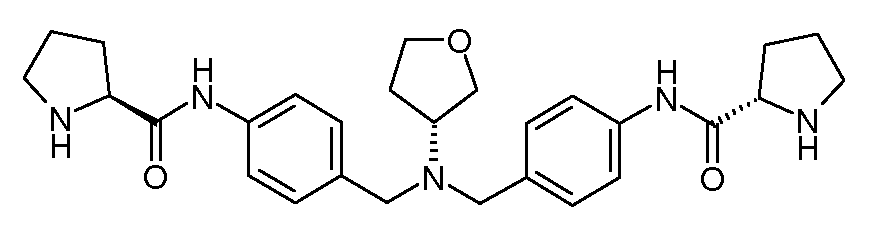
Пример 44D
(2S,2'S)-N,N'-(4,4'-((R)-тетрагидрофуран-3-илазанедиил)бис(метилен)бис(4,1-фенилен))дипирролидин-2-карбоксамид
Указанное в заголовке соединение получали с использованием способов из Примера 1D, заменяя продукт из Примера 1C на продукт из Примера 44C, с получением указанного в заголовке соединения (0,39 г, 70% выход).
Пример 44E
Диметил ([(3R)-тетрагидрофуран-3-илимино]бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-3,3-диметил-1-оксобутан-1,2-диил]})бискарбамат
Продукт Примера 44D и (S)-2-(метоксикарбониламино)-3,3-диметилбутановую кислоту подвергали взаимодействию, используя способ из Примера 1E, и продукт очищали при помощи колоночной хроматографии, элюируя этилацетатом, с получением указанного в заголовке соединения (100 мг, 31% выход).1H ЯМР (500 МГц, БЕНЗОЛ-d6) δ 9,77 (шир. с, 2H), 7,74 (д, J=8,1, 4H), 6,99 (д, J=8,3, 4H), 5,50 (д, J=9,6, 2H), 4,73-4,66 (м, 2H), 4,50 (д, J=9,7, 2H), 3,77 (тд, J=4,3, 8,4, 1H), 3,70 (дд, J=5,4, 9,0, 1H), 3,59-3,53 (м, 1H), 3,48-3,41 (м, 7H), 3,33 (д, J=12,9, 4H), 3,23-3,13 (м, 5H), 2,11 (тд, J=6,1, 11,8, 2H), 1,71-1,53 (м, 4H), 1,52-1,42 (м, 2H), 1,26-1,16 (м, 2H), 0,99 (с, 18H), МС (ECI; М+H) м/z=835.

Пример 45
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-4-метил-1-оксопентан-1,2-диил]}]бискарбамат
Продукт Примера 1D (35 мг, 0,070 ммоль) подвергали процедуре, описанной в Примере 24E, заменяя (S)-2-(метоксикарбониламино)-3-метилбутановую кислоту на (S)-2-(метоксикарбониламино)-4-метилпентановую кислоту, с получением указанного в заголовке соединения в виде соли ТФУК (18 мг).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,85-0,92 (м, 15H), 1,40 (дд, J=9,3, 4,1 Гц, 2H), 1,42-1,46 (м, 2H), 1,62-1,71 (м, 2H), 1,86 (дт, J=11,6, 5,7 Гц, 2H), 1,90-1,94 (м, 2H), 1,96-2,05 (м, 2H), 2,14 (тд, J=7,6, 4,6 Гц, 2H), 3,67-3,75 (м, 3H), 4,23-4,31 (м, 2H), 4,42 (дд, J=8,2, 4,7 Гц, 3H), 4,59 (с, 5H), 6,57 (с, 1H), 6,66 (д, J=8,1 Гц, 2H), 7,07 (т, J=7,9 Гц, 3H), 7,17 (д, J=8,5 Гц, 5H), 7,34 (д, J=8,1 Гц, 2H), 7,50 (д, J=8,5 Гц, 5H), 9,96 (с, 2H); МС (ECI) м/z 840,5 (М+H)+.

Пример 46
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-1-оксопентан-1,2-диил]}]бискарбамат
Продукт Примера 1D (35 мг, 0,070 ммоль) подвергали процедуре, описанной в Примере 24E, заменяя (S)-2-(метоксикарбониламино)-3-метилбутановую кислоту на (S)-2-(метоксикарбониламино)пентановую кислоту, с получением указанного в заголовке соединения в виде соли ТФУК (29 мг).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,83-0,90 (м, 9H), 1,22-1,30 (м, 3H), 1,30-1,40 (м, 4H), 1,43-1,52 (м, 3H), 1,53-1,62 (м, 2H), 1,83-1,93 (м, 4H), 1,95-2,04 (м, 2H), 2,08-2,17 (м, 2H), 3,72 (дт, J=9,5, 6,8 Гц, 2H), 4,24 (тд, J=8,1, 5,4 Гц, 2H), 4,42 (дд, J=8,2, 4,7 Гц, 2H), 4,59 (с, 4H), 6,57 (т, J=7,1 Гц, 1H), 6,66 (д, J=8,1 Гц, 2H), 7,07 (т, J=7,9 Гц, 2H), 7,17 (д, J=8,5 Гц, 4H), 7,32 (д, J=7,8 Гц, 2H), 7,50 (д, J=8,5 Гц, 4H), 9,95 (с, 2H); МС (ECI) м/z 812,4 (М+H)+.
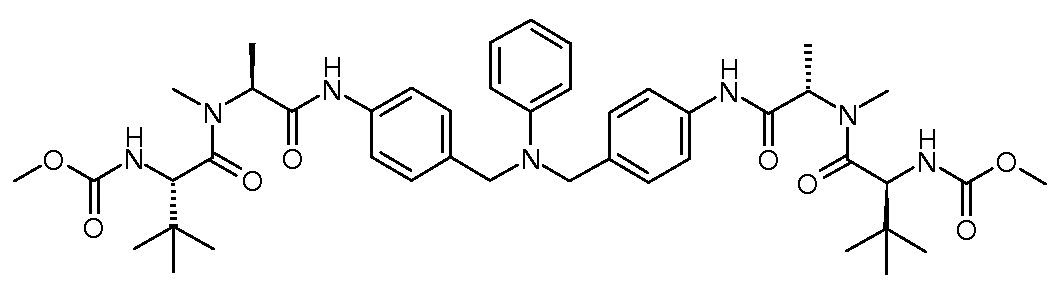
Пример 47
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилимино[(2S)-1-оксопропан-1,2-диил](метилимино)[(2S)-3,3-диметил-1-оксобутан-1,2-диил]}]бискарбамат
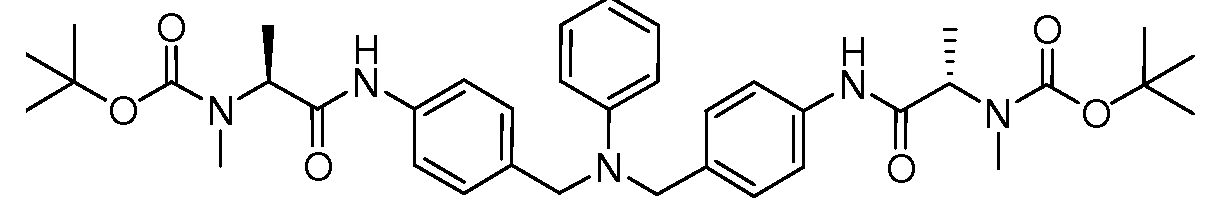
Пример 47A
Трет-бутил (2S,2'S)-1,1'-(4,4'-(фенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(1-оксопропан-2,1-диил)бис(метилкарбамат)
Продукт из Примера 1B и (S)-2-(трет-бутоксикарбонил(метил)амино)пропановую кислоту (Aldrich) обрабатывали с использованием способа, описанного в Примере 41. Неочищенный остаток очищали при помощи хроматографии на силикагеле (40% этилацетат-гексан) с получением указанного в заголовке соединения МС (ESI, M+H) m/z=674.

Пример 47B
(2S,2'S)-N,N'-(4,4'-(фенилазанедиил)бис(метилен)бис(4,1-фенилен))бис(2-(метиламино)пропанамид)
Раствор продукта из Примера 47A (0,469 г, 0,696 ммоль) в CH2Cl2 (10 мл) при комнатной температуре обрабатывали при помощи ТФУК (5,00 мл), и перемешивание продолжали в течение ночи. Реакционную смесь концентрировали, и остаток распределяли между насыщенным раствором NaHCO3 и 25% IPA-CHCl3. Органическую фазу сушили (Na2SO4) и концентрировали с получением 210 мг (64%) указанного в заголовке соединения МС (ESI, M+H) m/z=474.
Пример 47C
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилимино[(2S)-1-оксопропан-1,2-диил](метилимино)[(2S)-3,3-диметил-1-оксобутан-1,2-диил]}]бискарбамат
Продукт из Примера 47B и (S)-2-(метоксикарбониламино)-3,3-диметилбутановую кислоту (DeGussa) обрабатывали с использованием способа, описанного в Примере 41. Неочищенный остаток очищали при помощи хроматографии на силикагеле (2% MeOH-CH2Cl2) с получением 122 мг (34%) указанного в заголовке соединения.1H ЯМР (500 МГц, ДМСО-d6) δ 0,96 (м, 18H) 1,33 (д, J=7,18 Гц, 6H) 2,68 (м, 2H) 3,09 (шир. с, 4H) 3,53 (шир. с, 4H) 3,58 (шир. с, 2H) 4,45 (м, 2H) 4,59 (м, 4H) 5,03 (м, 2H) 6,56 (т, J=7,25 Гц, 1H) 6,65 (д, J=8,70 Гц, 2H) 7,04-7,10 (м, 3H) 7,15-7,21 (м, 4H) 7,47-7,52 (м, 4H) 7,62 (д, J=8,39 Гц, 1H) 9,79 (с, 2H).

Пример 48
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил[(2S,4R)-4-гидроксипирролидин-2,1-диил][(2S)-3,3-диметил-1-оксобутан-1,2-диил]}]бискарбамат
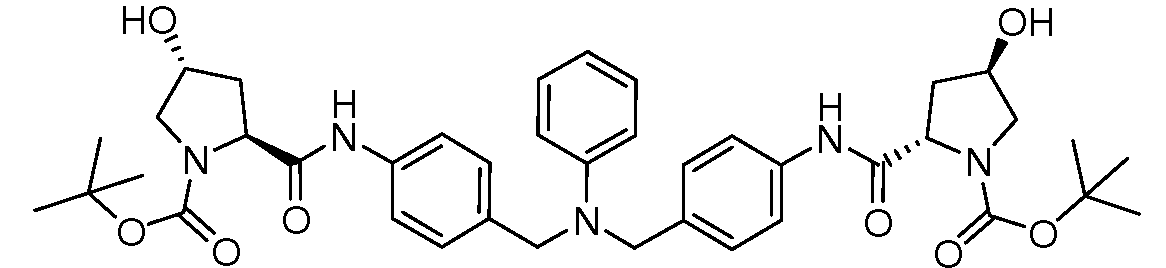
Пример 48A
(3R,3'R,5S,5'S)-трет-бутил 5,5'-(4,4'-(фенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(оксометилен)бис(3-гидроксипирролидин-1-карбоксилат)
Продукт из Примера 1B и (2S,4R)-1-(трет-бутоксикарбонил)-4-гидроксипирролидин-2-карбоновую кислоту (Chem-Impex) обрабатывали с использованием способа, описанного в Примере 41. Реакционную смесь фильтровали, твердое вещество промывали при помощи CH2Cl2 и сушили в вакуумной печи с получением 414 мг (69%) указанного в заголовке соединения. МС (DCI; M+H) m/z=730.

Пример 48B
(2S,2'S,4R,4'R)-N,N'-(4,4'-(фенилазанедиил)бис(метилен)бис(4,1-фенилен))бис(4-гидроксипирролидин-2-карбоксамид)
Продукт из Примера 48A обрабатывали с использованием способа, описанного в Примере 47B, с получением указанного в заголовке соединения. МС (DCI; M+H) m/z=530.
Пример 48C
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил[(2S,4R)-4-гидроксипирролидин-2,1-диил][(2S)-3,3-диметил-1-оксобутан-1,2-диил]}]бискарбамат
Продукт из Примера 48B и (S)-2-(метоксикарбониламино)-3,3-диметилбутановую кислоту (DeGussa) обрабатывали с использованием способа, описанного в Примере 41. Неочищенный остаток очищали при помощи хроматографии на силикагеле (от 0% до 7% MeOH-CH2Cl2) с получением 60 мг (25%) указанного в заголовке соединения.1H ЯМР (500 МГц, ДМСО-d6) δ 0,94 (с, 18H) 1,91 (ддд, J=12,86, 8,81, 4,43 Гц, 2H) 2,04-2,12 (м, 2H) 3,54 (с, 6H) 3,62-3,71 (м, 4H) 4,20 (д, J=9,31 Гц, 2H) 4,36 (шир. с, 2H) 4,49 (т, J=8,09 Гц, 2H) 4,58 (с, 4H) 5,18 (д, J=3,36 Гц, 2H) 6,56 (т, J=7,25 Гц, 1H) 6,65 (д, J=8,09 Гц, 2H) 7,00-7,09 (м, 4H) 7,17 (д, J=8,55 Гц, 4H) 7,51 (д, J=8,54 Гц, 4H) 10,03 (с, 2H).

Пример 49
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S,3S)-3-гидрокси-1-оксобутан-1,2-диил]}]бискарбамат
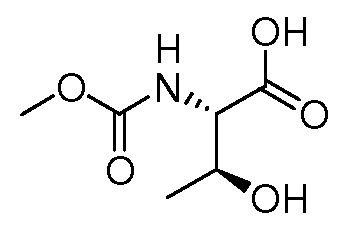
Пример 49A
(2S,3S)-3-гидрокси-2-(метоксикарбониламино)бутановая кислота
(2S,3S)-2-Амино-3-гидроксибутановую кислоту (0,54 г, 4,53 ммоль) обрабатывали, как в Примере 25A, с получением 0,139 г (17%) указанного в заголовке соединения в виде воскообразного твердого вещества.
Пример 49B
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S,3S)-3-гидрокси-1-оксобутан-1,2-диил]}]бискарбамат
Продукт из Примера 1D (0,05 г, 0,10 ммоль) и продукт из Примера 49A (0,039 г, 0,22 ммоль) обрабатывали, как в Примере 25B, с получением 0,041 г (51%) указанного в заголовке соединения в виде не совсем белого твердого вещества.1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 1,16 (д, J=6,10 Гц, 6H) 1,82-1,89 (м, 2H) 1,90-2,00 (м, 4H) 2,08-2,17 (м, 2H) 3,52 (с, 6H) 3,66-3,73 (м, 2H) 3,77-3,87 (м, 4H) 4,19 (т, J=8,39 Гц, 2H) 4,46 (дд, J=8,39, 3,66 Гц, 2H) 4,58 (с, 4H) 5,29 (д, J=4,58 Гц, 2H) 6,55 (т, J=7,17 Гц, 1H) 6,63 (д, J=8,09 Гц, 2H) 7,05 (дд, J=8,77, 7,25 Гц, 2H) 7,16 (д, J=8,70 Гц, 4H) 7,42 (д, J=8,24 Гц, 2H) 7,47 (д, J=8,54 Гц, 4H) 9,49 (с, 2H); МС ECI+м/z 816 (М+H)+; м/z 833 (М+NH4)+.

Пример 50
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S,3R)-3-метил-1-оксопентан-1,2-диил]}]бискарбамат
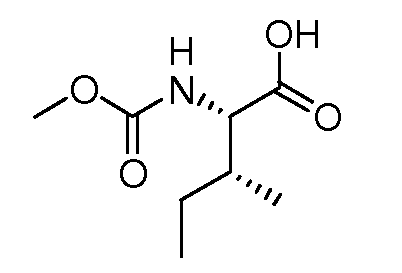
Пример 50A
(2S,3R)-2-(метоксикарбониламино)-3-метилпентановая кислота
(2S,3R)-2-Амино-3-метилпентановую кислоту (0,965 г, 7,36 ммоль) обрабатывали, как в Примере 25A, с получением 1,16 г (83%) указанного в заголовке соединения в виде воскообразного твердого вещества.
Пример 50B
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S,3R)-3-метил-1-оксопентан-1,2-диил]}]бискарбамат
Продукт из Примера 1D (0,05 г, 0,10 ммоль) и продукт из Примера 50A (0,042 г, 0,22 ммоль) обрабатывали, как в Примере 25B, с получением 0,044 г (52%) указанного в заголовке соединения в виде не совсем белого твердого вещества.1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,80 (д, J=6,71 Гц, 6H) 0,85 (т, J=7,32 Гц, 6H) 1,06-1,15 (м, 2H) 1,42-1,50 (м, 2H) 1,73-1,79 (м, 2H) 1,81-1,92 (м, 4H) 1,95-2,03 (м, 2H) 2,10-2,16 (м, 2H) 3,23-3,30 (м, 2H) 3,51 (с, 6H) 3,54-3,63 (м, 1H) 3,69-3,79 (м, 1H) 4,19-4,24 (м, 2H) 4,41 (дд, J=8,01, 5,26 Гц, 2H) 4,57 (с, 4H) 6,55 (т, J=7,25 Гц, 1H) 6,64 (д, J=8,09 Гц, 2H) 7,05 (дд, J=8,77, 7,25 Гц, 2H) 7,12-7,19 (м, 6H) 7,49 (д, J=8,54 Гц, 4H) 9,95 (с, 2H); МС ECI-м/z 838 (М-H)-.

Пример 51
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S,3R)-3-метокси-1-оксобутан-1,2-диил]}]бискарбамат

Пример 51A
(2S,3R)-3-метокси-2-(метоксикарбониламино)бутановая кислота
(2S,3R)-2-Амино-3-метоксибутановую кислоту (1,0 г, 7,51 ммоль) обрабатывали, как в Примере 25A, с получением 0,28 г (20%) указанного в заголовке соединения в виде воскообразного твердого вещества.
Пример 51B
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S,3R)-3-метокси-1-оксобутан-1,2-диил]}]бискарбамат
Продукт из Примера 1D (0,05 г, 0,10 ммоль) и продукт из Примера 51A (0,042 г, 0,22 ммоль) обрабатывали, как в Примере 25B, с получением 0,060 г (71%) указанного в заголовке соединения в виде не совсем белого твердого вещества.1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 1,12 (д, J=6,26 Гц, 6H) 1,82-1,90 (м, 4H) 1,94-2,04 (м, 2H) 2,10-2,18 (м, 2H) 3,23 (с, 6H) 3,42-3,48 (м, 2H) 3,52 (с, 6H) 3,62-3,70 (м, 2H) 3,79-3,86 (м, 2H) 4,25 (т, J=7,78 Гц, 2H) 4,40 (дд, J=8,24, 5,04 Гц, 2H) 4,57 (с, 4H) 6,55 (т, J=7,25 Гц, 1H) 6,64 (д, J=8,09 Гц, 2H) 7,05 (дд, J=8,77, 7,25 Гц, 2H) 7,16 (д, J=8,70 Гц, 4H) 7,32 (д, J=7,93 Гц, 2H) 7,49 (д, J=8,54 Гц, 4H) 9,93 (с, 2H); МС ECI- м/z 842 (М-H)-.
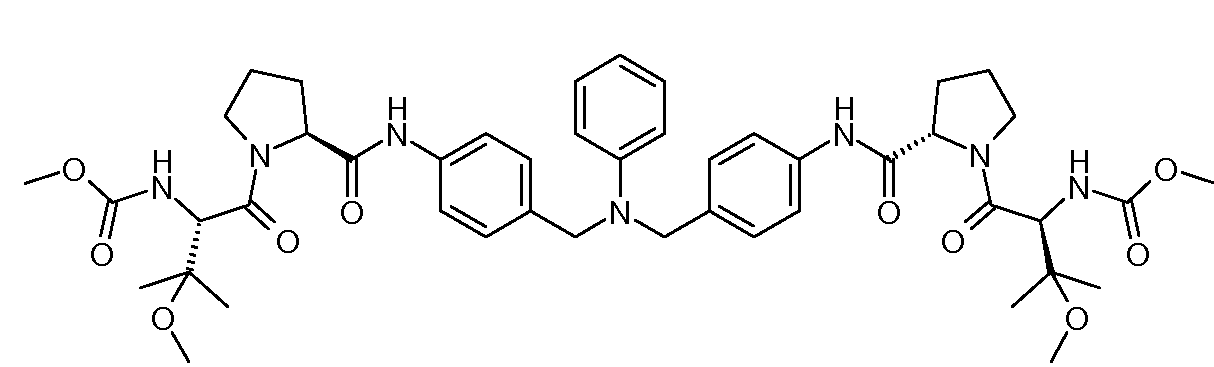
Пример 52
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-3-метокси-3-метил-1-оксобутан-1,2-диил]}]бискарбамат

Пример 52A
(S)-3-метокси-2-(метоксикарбониламино)-3-метилбутановая кислота
(S)-2-Амино-3-метокси-3-метилбутановую кислоту (0,55 г, 3,72 ммоль) обрабатывали, как в Примере 25A, с получением 0,18 г (24%) указанного в заголовке соединения в виде воскообразного твердого вещества.
Пример 52B
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-3-метокси-3-метил-1-оксобутан-1,2-диил]}]бискарбамат
Продукт из Примера 1D (0,05 г, 0,10 ммоль) и продукт из Примера 52A (0,045 г, 0,22 ммоль) обрабатывали, как в Примере 25B, с получением 0,015 г (17%) указанного в заголовке соединения в виде не совсем белого твердого вещества.1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 1,14 (с, 6H) 1,83-1,92 (м, 4H) 1,92-2,02 (м, 2H) 2,10 (дд, J=20,52, 12,13 Гц, 2H) 2,53 (с, 6H) 3,11 (д, J=4,27 Гц, 6H) 3,53 (с, 6H) 3,63-3,81 (м, 4H) 4,33-4,43 (м, 2H) 4,50 (дд, J=13,12, 8,85 Гц, 2H) 4,57 (с, 4H) 6,55 (т, J=7,25 Гц, 1H) 6,64 (д, J=8,39 Гц, 2H) 7,05 (т, J=8,01 Гц, 2H) 7,09-7,25 (м, 6H) 7,48 (дд, J=17,85, 8,54 Гц, 4H) 9,73 (д, J=7,02 Гц, 2H); МС ECI- м/z 870,5 (М-H)-.
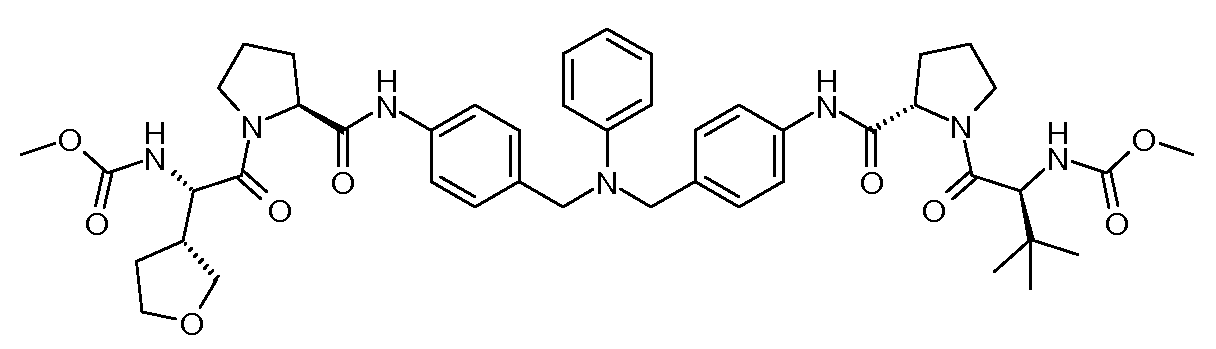
Пример 53
N-(Метоксикарбонил)-3-метил-L-валил-N-(4-{[{4-[(1-{(2S)-2-[(метоксикарбонил)амино]-2-[(3R)-тетрагидрофуран-3-ил]ацетил}-L-пролил)амино]бензил}(фенил)амино]метил}фенил)-L-пролинамид
Продукт Примера 10A (0,035 г, 0.052 ммоль) и (S)-2-(метоксикарбониламино)-2-((R)-тетрагидрофуран-3-ил)уксусную кислоту обрабатывали, как в Примере 25B, с получением 0,030 г (67%) указанного в заголовке соединения в виде густого масла.1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,91 (с, 9H) 1,66 (ддд, J=20,03, 7,21, 7,10 Гц, 1H) 1,77-1,88 (м, 6H) 1,90-1,99 (м, 2H) 2,06-2,14 (м, 2H) 3,48 (с, 6H) 3,54-3,65 (м, 4H) 3,66-3,75 (м, 3H) 3,78-3,85 (м, 1H) 4,14-4,22 (м, 2H) 4,38 (дд, J=8,09, 5,04 Гц, 2H) 4,53 (с, 4H) 6,51 (т, J=7,25 Гц, 1H) 6,60 (д, J=8,09 Гц, 2H) 6,99-7,06 (м, 3H) 7,12 (д, J=7,48 Гц, 4H) 7,45 (д, J=7,93 Гц, 4H) 7,55 (д, J=7,93 Гц, 1H) 9,93 (д, J=6,26 Гц, 2H); МС ECI- м/z 852,5 (М-H)-.

Пример 54
(2S,2'S)-N,N'-{[(4-Фторфенил)имино]бис(метандиилбензол-4,1-диил)}бис{1-[(2R)-2-(диэтиламино)-2-фенилацетил]пирролидин-2-карбоксамид}
Продукт из Примера 13D (0,055 г, 0,107 ммоль) и (R)-2-(диэтиламино)-2-фенилуксусную кислоту (0,048 г, 0,24 ммоль) обрабатывали, как в Примере 25B, с получением 0,046 г (48%) указанного в заголовке соединения в виде не совсем белого твердого вещества. МС (ТФУК, ELSD+) m/z 895 (M+H)+.

Пример 55
(2S,2'S)-N,N'-[(Фенилимино)бис(метандиилбензол-4,1-диил)]бис{1-[(2R)-2-фенил-2-пирролидин-1-илацетил]пирролидин-2-карбоксамид}
Пример 55A
(R)-2-фенил-2-(пирролидин-1-ил)уксусная кислота
К (R)-2-амино-2-фенилуксусной кислоте (1,0 г, 6,62 ммоль), 1,4-дибромбутану (1,57 г, 0,727 ммоль) и карбонату натрия (2,103 г, 19,85 ммоль) добавляли этанол (40 мл) и полученную смесь нагревали при 100°C в течение 65 часов. После охлаждения полученное твердое вещество удаляли при помощи фильтрования и промывали этанолом. Фильтрат концентрировали и затем растворяли в этаноле, затем добавляли 4 н. водный раствор хлористоводородной кислоты. Полученное твердое вещество удаляли и отбрасывали. Фильтрат концентрировали и очищали при помощи обращенно-фазовой хроматографии (C18), элюируя смесью 10-100% ацетонитрила в воде (0,1% ТФУК), с получением указанного в заголовке соединения. МС (ESI) m/z 206 (M+H)+.
Пример 55B
(2S,2'S)-N,N'-[(фенилимино)бис(метандиилбензол-4,1-диил)]бис{1-[(2R)-2-фенил-2-пирролидин-1-илацетил]пирролидин-2-карбоксамид}
Продукт Примера 1D (30 мг, 0,060 ммоль) и продукт Примера 55A (40,8 мг, 0,199 ммоль) обрабатывали с использованием способа, описанного в Примере 43, с получением 34 мг (65%) указанного в заголовке соединения.1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 10,08 (шир. с, 2H), 7,55 (м, 4H), 7,49 (м, 10H), 7,16 (д, J=8,4 Гц, 4H), 7,03 (м, 2H), 6,61 (д, J=8,2 Гц, 2H), 6,53 (т, J=7,2 Гц, 1H), 5,50 (м, 2H), 4,57 (с, 4H), 4,38 (м, 2H), 3,84 (м, 2H), 3,50 (м, 2H), 3,10 (м, 6H), 3,86 (м, 2H), 3,75 (м, 2H), 2,02 (м, 4H), 1,90 (м, 8H), 1,76 (с, 4H).

Пример 56
N-(Метоксикарбонил)-3-метил-L-валил-N-[4-({фенил[4-({1-[(2R)-2-фенил-2-пирролидин-1-илацетил]-L-пролил}амино)бензил]амино}метил)фенил]-L-пролинамид
Продукт из Примера 10A (40 мг, 0,060 ммоль) и продукт Примера 55A (18,4 мг, 0,090 ммоль) обрабатывали с использованием способа, описанного в Примере 43, с получением 31 мг (60%) указанного в заголовке соединения.1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 9,94 (шир. с, 1H), 9,90 (шир. с, 1H), 7,46 (м, 3H), 7,41 (м, 2H), 7,27 (м, 3H), 7,15 (м, 4H), 7,02 (м, 3H), 6,61 (д, J=8,2 Гц, 2H), 6,52 (т, J=7,3 Гц, 1H), 4,55 (шир. с, 4H), 4,38 (м, 1H), 4,27 (м, 1H), 4,17 (м, 2H), 3,79 (м, 1H), 3,72 (м, 1H), 3,58 (м, 1H), 3,49 (с, 3H), 3,40 (м, 1H), 2,43 (м, 3H), 2,29 (м, 2H), 2,09 (м, 1H), 1,95 (м, 3H), 1,89 (м, 4H), 1,57 (м, 3H), 0,91 (с, 9H).
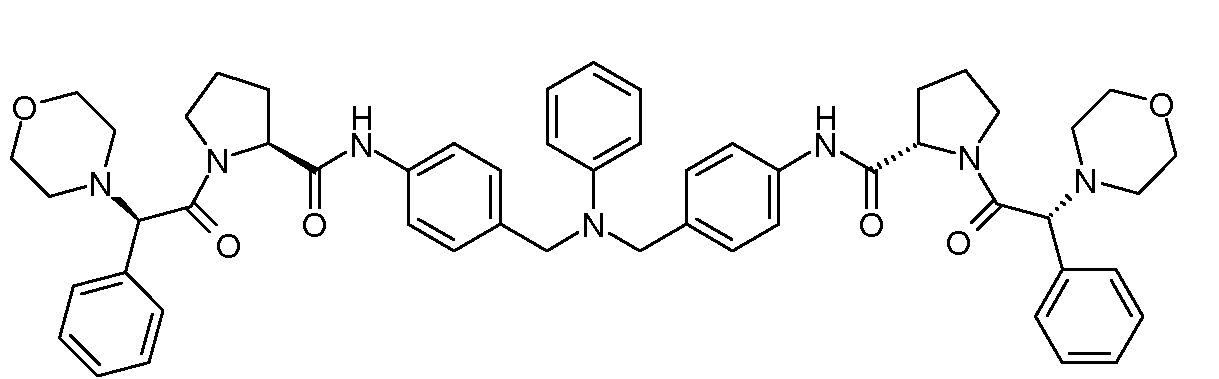
Пример 57
(2S,2'S)-N,N'-[(Фенилимино)бис(метандиилбензол-4,1-диил)]бис{1-[(2R)-2-морфолин-4-ил-2-фенилацетил]пирролидин-2-карбоксамид}
Пример 57A
(R)-2-морфолино-2-фенилуксусная кислота
К (R)-2-амино-2-фенилуксусной кислоте (1,0 г, 6,62 ммоль), 1-бром-2-(2-бромэтокси)этану (1,686 г, 0,727 ммоль) и карбонату натрия (2,103 г, 19,85 ммоль) добавляли этанол (40 мл) и полученную смесь нагревали при 100°C в течение 45 часов. После охлаждения полученное твердое вещество удаляли при помощи фильтрования и промывали этанолом. Фильтрат концентрировали и затем растворяли в этаноле, затем добавляли 4 н. водный раствор хлористоводородной кислоты до достижения уровня pH раствора равного 3. Полученное твердое вещество удаляли и отбрасывали. Фильтрат концентрировали и очищали при помощи обращенно-фазовой хроматографии (C18), элюируя смесью 10-100% ацетонитрила в воде (0,1% ТФУК), с получением указанного в заголовке соединения. МС (ESI) m/z 222 (M+H)+.
Пример 57B
(2S,2'S)-N,N'-[(фенилимино)бис(метандиилбензол-4,1-диил)]бис{1-[(2R)-2-морфолин-4-ил-2-фенилацетил]пирролидин-2-карбоксамид}
Продукт Примера 1D (30 мг, 0,060 ммоль) и продукт Примера 57A (44 мг, 0,199 ммоль) обрабатывали с использованием способа, описанного в Примере 43, с получением 41 мг (75%) указанного в заголовке соединения.1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 9,93 (шир. с, 2H), 7,47 (д, J=8,4 Гц, 4H), 7,41 (д, J=7,0 Гц, 4H), 7,28 (м, 6H), 7,14 (м, 4H), 7,03 (м, 2H), 6,62 (д, J=8,1 Гц, 2H), 6,52 (т, J=7,2 Гц, 1H), 4,56 (шир. с, 4H), 4,24 (м, 4H), 3,81 (м, 2H), 3,45 (м, 8H), 3,40 (м, 2H), 2,63 (м, 8H), 2,39 (м, 4H), 2,29 (м, 4H), 1,95 (м, 4H), 1,77 (м, 4H).

Пример 58
N-(Метоксикарбонил)-3-метил-L-валил-N-[4-({[4-({1-[(2R)-2-морфолин-4-ил-2-фенилацетил]-L-пролил}амино)бензил](фенил)амино}метил)фенил]-L-пролинамид
Продукт из Примера 10A (40 мг, 0,060 ммоль) и продукт Примера 57A (19,9 мг, 0,090 ммоль) обрабатывали с использованием способа, описанного в Примере 43, с получением 35 мг (67%) указанного в заголовке соединения.1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 9,80 (с, 1H), 9,78 (с, 1H), 7,35 (м, 3H), 7,28 (м, 2H), 7,14 (м, 3H), 6,97 (м, 4H), 6,88 (м, 3H), 6,46 (д, J=8,1 Гц, 2H), 6,37 (т, J=7,2 Гц, 1H), 4,40 (шир. с, 4H), 4,22 (м, 1H), 4,11 (м, 1H), 4,05 (м, 2H), 3,67 (м, 1H), 3,57 (м, 1H), 3,43 (м, 1H), 3,34 (с, 3H), 3,30 (м, 3H), 3,24 (м, 2H), 2,49 (с, 8H), 2,22 (м, 2H), 2,12 (м, 2H), 1,92 (м, 1H), 1,79 (м, 3H), 1,62 (м, 4H), 0,77 (с, 9H).

Пример 59
Метил (3S)-тетрагидрофуран-3-ил [(фенилимино)бис {метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-3,3-диметил-1-оксобутан-1,2-диил]}]бискарбамат

Пример 59A
(S)-трет-бутил 3,3-диметил-2-(((S)-тетрагидрофуран-3-илокси)карбониламино)бутаноат
Смесь (S)-трет-бутил 2-амино-3,3-диметилбутаноатгидрохлорида (0,05 г, 0,223 ммоль), тетрагидрофуран-3-илкарбоната (S)-2,5-диоксопирролидин-1-ила (0,056 г, 0,246 ммоль) и основания Хунига (0,078 мл, 0,447 ммоль) в ТГФ (2,25 мл) перемешивали при комнатной температуре в течение 12 часов. Растворитель выпаривали, и продукт очищали при помощи хроматографии на силикагеле, элюируя смесью 0-15% этилацетата в дихлорметане, с получением указанного в заголовке соединения (0,037 г, 55% выход).

Пример 59В
(S)-3,3-диметил-2-(((S)-тетрагидрофуран-3-илокси)карбониламино)бутановая кислота
К раствору продукта из Примера 59A (0,037 г, 0,123 ммоль) в дихлорметане (1,2 мл) добавляли трифторуксусную кислоту (1,2 мл) и смесь перемешивали при комнатной температуре в течение 2 часов. Растворитель выпаривали с получением указанного в заголовке соединения, которое использовали без дополнительной очистки.
Пример 59C
Метил (3S)-тетрагидрофуран-3-ил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-3,3-диметил-1-оксобутан-1,2-диил]}]бискарбамат
К раствору продукта из Примера 10A (0,025 г, 0,037 ммоль) в ДМСО (0,374 мл) при комнатной температуре добавляли продукт из Примера 59B (0,011 г, 0,045 ммоль), HATU (0,017 г, 0,045 ммоль) и основание Хунига (0,033 мл, 0,187 ммоль) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь разбавляли этилацетатом и промывали насыщенным раствором NaHCO3, водой и насыщенным раствором NaCl. Органический сушили над MgSO4, фильтровали и упаривали. Продукт очищали при помощи обращенно-фазовой хроматографии (C18), элюируя смесью 10-100% ацетонитрила в воде (0,1% ТФУК), с получением указанного в заголовке соединения в виде соли ТФУК (0,032 г).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,96 (с, 18H) 1,80-1,92 (м, 5H) 1,93-2,03 (м, 2H) 2,05-2,21 (м, 3H) 3,54 (с, 3H) 3,58-3,85 (м, 7H) 4,20 (дд, J=10,76, 9,08 Гц, 2H) 4,43 (дд, J=8,09, 5,34 Гц, 2H) 4,59 (с, 4H) 5,10 (дд, J=5,87, 4,65 Гц, 1H) 6,49-6,61 (м, 1H) 6,66 (д, J=7,17 Гц, 2H) 7,02-7,14 (м, 3H) 7,17 (д, J=8,55 Гц, 4H) 7,48-7,56 (м, 4H) 9,99 (с, 2H), МС (ECI) м/z 896,5 (М+H)+.
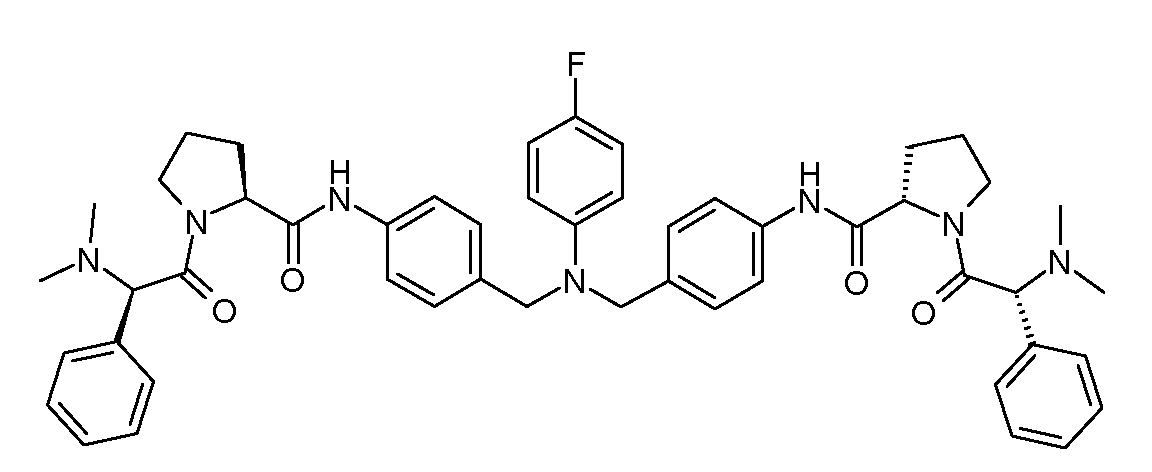
Пример 60
(2S,2'S)-N,N'-{[(4-Фторфенил)имино]бис(метандиилбензол-4,1-диил)}бис{1-[(2R)-2-(диметиламино)-2-фенилацетил]пирролидин-2-карбоксамид}
Указанное в заголовке соединение получали с использованием способов из Примера 2, заменяя продукт из Примера 1D на продукт из Примера 13D, с получением указанного в заголовке соединения (105 мг, 22% выход).1H ЯМР (500 МГц, ДМСО) δ 9,96 (с, 2H), 7,54-7,49 (м, 4H), 7,46-7,40 (м, 4H), 7,35-7,26 (м, 6H), 7,20-7,14 (м, 4H), 6,95-6,87 (м, 2H), 6,67-6,60 (м, 2H), 4,56 (с, 4H), 4,34-4,27 (м, 2H), 4,14 (с, 2H), 3,87-3,79 (м, 2H), 3,46-3,39 (м, 2H), 2,11 (с, 12H), 2,05-1,93 (м, 4H), 1,88-1,72 (м, 4H), МС (ECI; М+H) м/z=839.

Пример 61
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-1-оксо-3-фенилпропан-1,2-диил]}]бискарбамат
Продукт из Примера 1D (0,030 г, 0,060 ммоль) подвергали процедуре, описанной в Примере 24E, заменяя (S)-2-(метоксикарбониламино)-3-метилбутановую кислоту на (S)-2-(метоксикарбониламино)-3-фенилпропановую кислоту, с получением указанного в заголовке соединения в виде соли ТФУК (16 мг).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 1,85-2,06 (м, 8H), 2,10-2,19 (м, 2H), 2,74 (дд, J=14,0, 10,1 Гц, 2H), 2,96 (дд, J=14,0, 3,7 Гц, 2H), 3,44 (с, 6H), 4,37-4,43 (м, 2H), 4,46 (дд, J=8,2, 4,2 Гц, 2H), 4,60 (с, 4H), 6,57 (т, J=6,9 Гц, 1H), 6,67 (д, J=8,1 Гц, 2H), 7,07 (т, J=7,9 Гц, 2H), 7,17-7,22 (м, 6H), 7,26 (т, J=7,4 Гц, 4H), 7,30-7,33 (м, 4H), 7,48-7,55 (м, 6H), 9,95 (с, 2H); МС м/z 908,9 (М+H)+.

Пример 62
N-(Метоксикарбонил)-3-метил-L-валил-N-(4-{[{4-[(1-{(2S)-2-[(метоксикарбонил)амино]бутаноил}-L-пролил)амино]бензил}(фенил)амино]метил}фенил)-L-пролинамид
Продукт из Примера 10A (0,028 г, 0,054 ммоль) подвергали процедуре, описанной в Примере 10B, заменяя (R)-2-(диметиламино)-2-фенилуксусную кислоту на (S)-2-(метоксикарбониламино)бутановую кислоту, и продукт очищали, используя условия для ВЭЖХ Примера 1E, с получением указанного в заголовке соединения в виде соли ТФУК (6,4 мг).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,88-0,92 (м, 3H), 0,96 (с, 9H), 1,52 (дд, J=14,5, 6,9 Гц, 1H), 1,65 (дд, J=14,0, 6,7 Гц, 1H), 1,81-2,04 (м, 8H), 2,09-2,18 (м, 2H), 3,52 (с, 3H), 3,54 (с, 3H), 4,14-4,23 (м, 2H), 4,40-4,46 (м, 2H), 4,59 (с, 4H), 6,57 (т, J=7,1 Гц, 1H), 6,66 (д, J=8,1 Гц, 2H), 7,04-7,11 (м, 2H), 7,17 (д, J=8,5 Гц, 4H), 7,50 (д, 4H), 9,95 (с, 1H), 9,99 (с, 1H); МС м/z 812,1 (М+H)+.
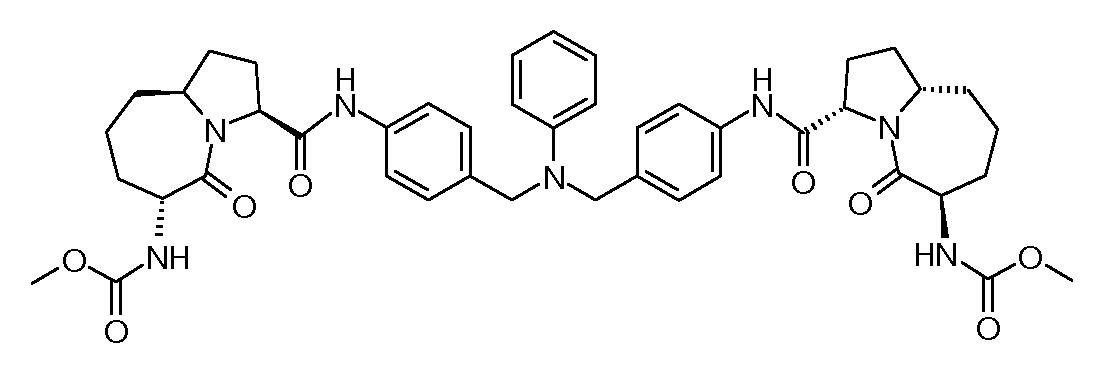
Пример 63
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил[(3S,6R,9aS)-5-оксооктагидро-1H-пирроло[1,2-а]азепин-3,6-диил]}]бискарбамат
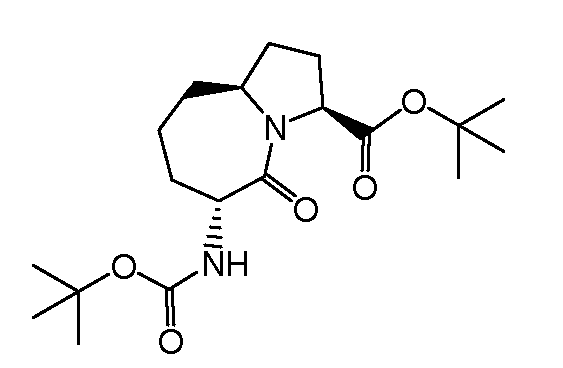
Пример 63A
(3S,6R,9aS)-трет-бутил 6-(трет-бутоксикарбониламино)-5-оксооктагидро-1H-пирроло[1,2-a]азепин-3-карбоксилат
Указанное в заголовке соединение получали в соответствии с описанными процедурами (Angiolini et al. Eur. J. Org. Chem. 2000, 2571-2581).
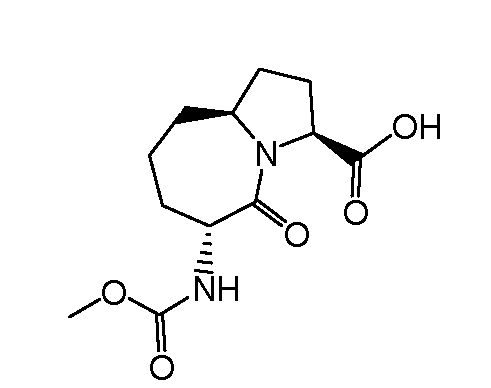
Пример 63B
(3S,6R,9aS)-6-(метоксикарбониламино)-5-оксооктагидро-1H-пирроло[1,2-a]азепин-3-карбоновая кислота
К раствору продукта из Примера 63A (45 мг, 0 122 ммоль) в 1,4-диоксане (0,2 мл) добавляли 2 н. раствор HCl в 1,4-диоксане (0,3 мл, 1,2 ммоль). Полученный раствор перемешивали при комнатной температуре в течение ночи и затем концентрировали в вакууме. Остаток растворяли в H2O (0 4 мл), добавляли NaHCO3 (33 мг, 0,39 ммоль) и полученную смесь перемешивали при 0°C, пока добавляли по каплям раствор метилхлорформиата (0,012 мл, 0,156 ммоль) в Et2O (0,100 мл). Полученную смесь перемешивали при комнатной температуре в течение 3 часов и затем распределяли между 0,2 н. водным раствором HCl и CH2Cl2. Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения в виде твердого вещества (33 мг, количественный выход).
Пример 63C
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил[(3S,6R,9aS)-5-оксооктагидро-1Н-пирроло[1,2-a]азепин-3,6-диил]}]бискарбамат
Продукт из Примера 1B (10 мг, 0,033 ммоль) подвергали обработке в условиях, описанных в Примере 24C, заменяя N-(трет-бутоксикарбонил)-L-пролин на продукт из Примера 63B (19 мг, 0,070 ммоль), с получением указанного в заголовке соединения в виде соли ТФУК (10 мг).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 1,51-1,86 (м, 14H), 1,90-2,01 (м, 4H), 2,02-2,11 (м, 2H), 3,55 (с, 6H), 3,96-4,04 (м, 2H), 4,14 (т, J=5,95 Гц, 2H), 4,44 (д, J=9,46 Гц, 2H), 4,59 (с, 4H), 6,57 (т, J=7,10 Гц, 1H), 6,66 (д, J=7,93 Гц, 2H), 7,07 (т, J=7,86 Гц, 2H), 7,17 (д, J=8,54 Гц, 4H), 7,44 (с, 2H), 7,52 (д, J=8,55 Гц, 4H), 9,99 (с, 2H); МС м/z 809 (М+H)+.

Пример 64
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил[(2S,5R)-5-проп-2-ен-1-илпирролидин-2,1-диил][(2S)-3,3-диметил-1-оксобутан-1,2-диил]}]бискарбамат
Пример 64A
(2S,5R)-1-трет-бутил 2-этил 5-аллилпирролидин-1,2-дикарбоксилат
Указанное в заголовке соединение получали в соответствии с описанными процедурами (Zhang et al. Org. Lett. 2002, 4, 4029-4032).
Пример 64B
(2S,5R)-5-аллил-1-(трет-бутоксикарбонил)пирролидин-2-карбоновая кислота
Раствор продукта из Примера 64A (0,35 г, 1,24 ммоль) в MeOH (10 мл) обрабатывали 3,0 M водным раствором NaOH (2,06 мл, 6,18 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 3 часов. Добавляли 1 н. раствор HCl до достижения уровня pH 2, удаляли MeOH в вакууме, и водный слой экстрагировали при помощи CH2Cl2 (2x). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения.
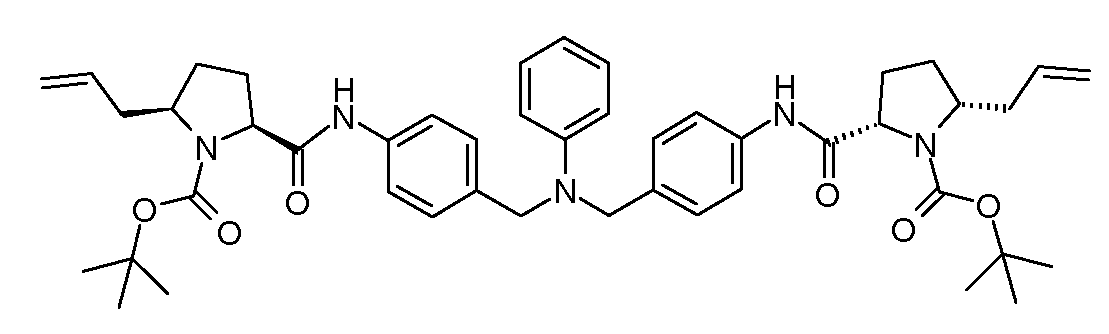
Пример 64C
(2R,2'R,5S,5'S)-трет-бутил 5,5'-(4,4'-(фенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(оксометилен)бис(2-аллилпирролидин-1-карбоксилат)
Продукт из Примера 1B (119 мг, 0,392 ммоль) подвергали процедуре, описанной в Примере 24C, заменяя N-(трет-бутоксикарбонил)-L-пролин на продукт из Примера 64B (0,22 г, 0,862 ммоль), с получением указанного в заголовке соединения (0,24 г, 79%).
Пример 64D
(2S,2'S,5R,5'R)-N,N'-(4,4'-(фенилазанедиил)бис(метилен)бис(4,1-фенилен))бис(5-аллилпирролидин-2-карбоксамид)
Продукт из Примера 64C (0,24 г, 0,31 ммоль) подвергали обработке в условиях, описанных в Примере 1D, с получением указанного в заголовке соединения (0,17 г, 95%).
Пример 64E
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил[(2S,5R)-5-проп-2-ен-1-илпирролидин-2,1-диил][(2S)-3,3-диметил-1-оксобутан-1,2-диил]}]бискарбамат
Продукт из Примера 64D (20 мг, 0,035 ммоль) подвергали обработке в условиях, описанных в Примере 24E, заменяя (S)-2-(метоксикарбониламино)-3-метилбутановую кислоту на (S)-2-(метоксикарбониламино)-3,3-диметилбутановую кислоту, с получением указанного в заголовке соединения в виде соли ТФУК (17 мг).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,89-1,01 (м, 18H), 1,73-1,95 (м, 5H), 2,02-2,28 (м, 3H), 3,50-3,60 (м, 6H), 3,97-4,13 (м, 1H), 4,20 (д, J=9,46 Гц, 2H), 4,26-4,45 (м, 3H), 4,54-4,65 (м, 4H), 4,95-5,21 (м, 4H), 5,71-5,93 (м, 2H), 6,57 (т, J=7,25 Гц, 1H), 6,66 (д, J=8,24 Гц, 2H), 6,88-6,96 (м, J=9,61 Гц, 1H), 7,03-7,10 (м, 2H), 7,13-7,23 (м, 4H), 7,38 (д, J=9,46 Гц, 1H), 7,47-7,56 (м, 4H), 9,98 (с, 2H); МС (ECI) м/z 920,5 (М+H)+.
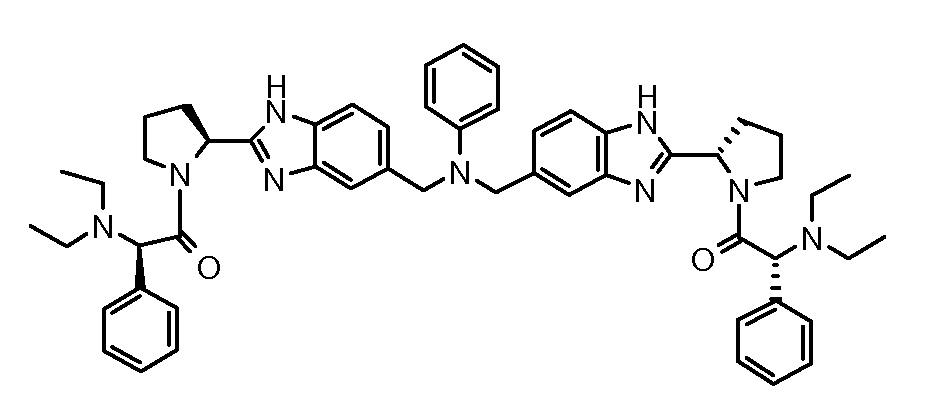
Пример 65
N,N-Бис[(2-{(2S)-1-[(2R)-2-(диэтиламино)-2-фенилацетил]пирролидин-2-ил}-1Н-бензимидазол-5-ил)метил]анилин
Продукт из Примера 7E (18 мг, 0,037 ммоль) подвергали процедуре, описанной в Примере 24E, заменяя (S)-2-(метоксикарбониламино)-3-метилбутановую кислоту на гидрохлорид (R)-2-(диэтиламино)-2-фенилуксусной кислоты, с получением указанного в заголовке соединения в виде соли ТФУК (25 мг).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,93-1,37 (м, 12H), 1,84-2,14 (м, 8H), 2,15-2,28 (м, 2H), 2,77-3,40 (м, 10H), 4,10-4,18 (м, 2H), 4,79-4,95 (м, 4H), 5,22 (дд, J=8,32, 2,37 Гц, 2H), 5,45 (с, 2H), 6,54-6,85 (м, 4H), 6,99-7,18 (м, 3H), 7,23-7,40 (м, 1H), 9,64-9,86 (м, 2H); МС (ECI) м/z 870,6 (М+H)+.

Пример 66
N,N-Бис[(2-{(2S)-1-[(2R)-2-фенил-2-пирролидин-1-илацетил]пирролидин-2-ил}-1Н-бензимидазол-5-ил)метил]анилин
Продукт Примера 7E (20 мг, 0,041 ммоль) подвергали процедуре, описанной в Примере 24E, заменяя (S)-2-(метоксикарбониламино)-3-метилбутановую кислоту на (R)-2-фенил-2-(пирролидин-1-ил)уксусную кислоту, с получением указанного в заголовке соединения в виде соли ТФУК (14 мг).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 1,22-1,29 (м, 3H), 1,87-1,96 (м, 9H), 1,99 (с, 2H), 2,01-2,10 (м, 7H), 2,18-2,28 (м, 3H), 2,95-3,04 (м, 5H), 4,03 (д, J=8,7 Гц, 5H), 4,92 (с, 4H), 5,49 (с, 3H), 6,75 (д, J=8,1 Гц, 3H), 7,08-7,17 (м, 3H), 7,39 (д, J=8,4 Гц, 3H), 7,57 (дд, J=6,9, 2,7 Гц, 8H), 7,61-7,67 (м, 5H), 7,70 (д, J=8,4 Гц, 3H); МС (ECI) м/z 866,3 (М+H)+.
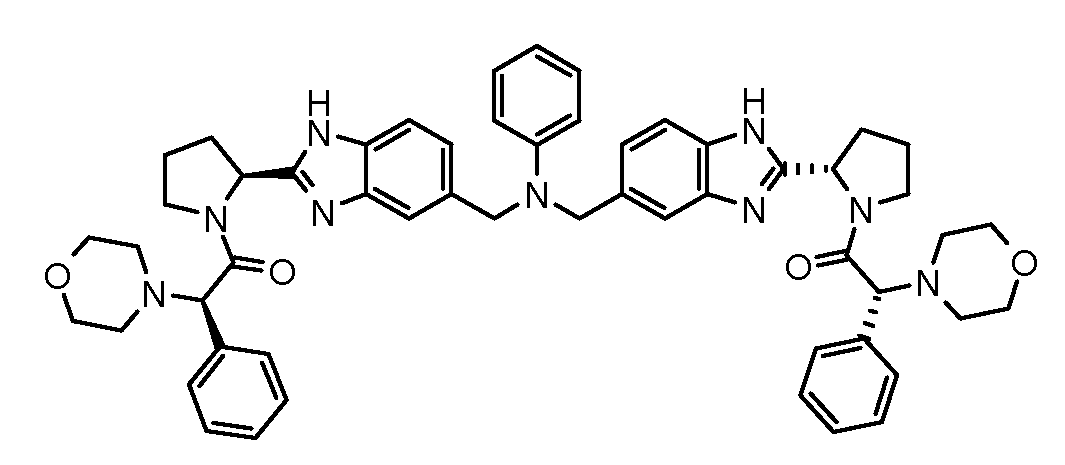
Пример 67
N,N-Бис[(2-{(2S)-1-[(2R)-2-морфолин-4-ил-2-фенилацетил]пирролидин-2-ил}-1Н-бензимидазол-5-ил)метил]анилин
Продукт Примера 7E (20 мг, 0,041 ммоль) подвергали процедуре, описанной в Примере 24E, заменяя (S)-2-(метоксикарбониламино)-3-метилбутановую кислоту на (R)-2-морфолино-2-фенилуксусную кислоту, с получением указанного в заголовке соединения в виде соли ТФУК (17 мг).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 1,91 (д, J=2,6 Гц, 4H), 2,02-2,11 (м, 7H), 2,23 (д, J=6,6 Гц, 4H), 3,04 (д, J=7,2 Гц, 6H), 4,90 (с, 7H), 5,30 (дд, J=8,4, 2,0 Гц, 3H), 5,49 (с, 3H), 6,61 (с, 2H), 6,74 (д, J=8,2 Гц, 4H), 7,07-7,14 (м, 3H), 7,37 (д, J=8,2 Гц, 3H), 7,53-7,59 (м, 11H), 7,59-7,64 (м, 6H), 7,68 (д, J=8,4 Гц, 3H); МС (ECI) м/z 898,6 (М+H)+.
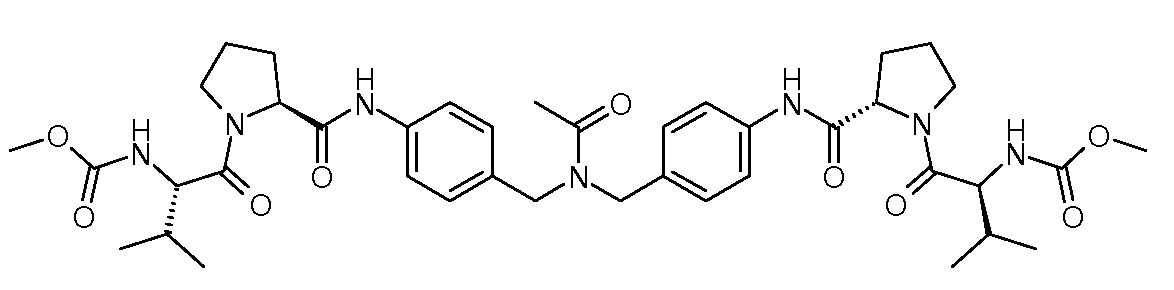
Пример 68
Диметил [(ацетилимино)бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-3-метил-1-оксобутан-1,2-диил]}]бискарбамат
Пример 68A
N,N-бис(4-нитробензил)ацетамид
К раствору бис(4-нитробензил)амина (500 мг, 1,741 ммоль) в пиридине (9 мл) с помощью шприца медленно добавляли уксусный ангидрид (0,18 мл, 1,92 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 часов и реакционную смесь концентрировали в вакууме. Остаток растворяли в толуоле и упаривали досуха в вакууме. Остаток растворяли в смеси 19:1 EtOAc:метанол, промывали водой и насыщенным солевым раствором, сушили (Na2SO4), фильтровали и концентрировали с получением указанного в заголовке соединения (551 мг, 96%). МС (APCI) m/z 330,2 (M+H)+.

Пример 68B
N,N-бис(4-аминобензил)ацетамид
Смесь продукта из Примера 68A (250 мг, 0,759 ммоль), железного порошка (424 мг, 7,59 ммоль) и хлорида аммония (203 мг, 3,80 ммоль) в этаноле (1 мл), тетрагидрофуране (1 мл) и воде (0,250 мл) нагревали при 80°C в течение 18 часов. Смеси давали остыть до комнатной температуры, фильтровали, промывали метанолом и концентрировали в вакууме. Остаток распределяли между EtOAc и H2O, и органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения (226 мг, 90 %). МС (ESI) m/z 269,9 (M+H)+.

Пример 68C
(2S,2'S)-трет-бутил 2,2'-(4,4'-(ацетилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(оксометилен)дипирролидин-1-карбоксилат
Продукт из Примера 68B (264,4 мг, 0,982 ммоль) подвергали процедуре, описанной в Примере 24C, с получением указанного в заголовке соединения (684 мг, количественный выход). МС (ESI) m/z 664,4 (M+H)+.

Пример 68D
(S)-N-(4-((N-(4-((S)-пирролидин-2-карбоксамидо)бензил) ацетамидо)метил)фенил)пирролидин-2-карбоксамид
Продукт из Примера 68C (684 мг, 1,030 ммоль) подвергали процедуре, описанной в Примере 24D, с получением указанного в заголовке соединения (141 мг, 29%) МС (ESI) m/z 464,2 (M+H)+
Пример 68E
Диметил [(ацетилимино)бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-3-метил-1-оксобутан-1,2-диил]}]бискарбамат
Продукт из Примера 68D (35 мг, 0,076 ммоль) подвергали процедуре, описанной в Примере 2, заменяя (R)-2-(диметиламино)-2-фенилуксусную кислоту на (S)-2-(метоксикарбониламино)-3-метилбутановую кислоту, с получением указанного в заголовке соединения (22 мг, 37%).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,88 (д, J=6,7 Гц, 6H), 0,94 (д, J=6,9 Гц, 6H), 1,85-1,94 (м, 6H), 1,96-2,04 (м, 2H), 2,10 (с, 3H), 2,11-2,19 (м, 2H), 3,50-3,56 (м, 6H), 3,59-3,66 (м, 2H), 3,78-3,85 (м, 2H), 4,03 (т, J=8,5 Гц, 2H), 4,38 (с, 4H), 4,44 (дд, J=8,1, 4,9 Гц, 2H), 7,10-7,16 (м, 4H), 7,32 (д, J=8,4 Гц, 2H), 7,50-7,59 (м, 4H), 10,04 (д, J=20,0 Гц, 2H); МС (ECI) м/z 778,4 (М+H)+.

Пример 69
N-(Метоксикарбонил)-3-метил-L-валил-N-(4-{[{4-[(1-{(2R)-2-[(метоксикарбонил)амино]-2-фенилацетил}-L-пролил)амино]бензил}(фенил)амино]метил{фенил)-L-пролинамид
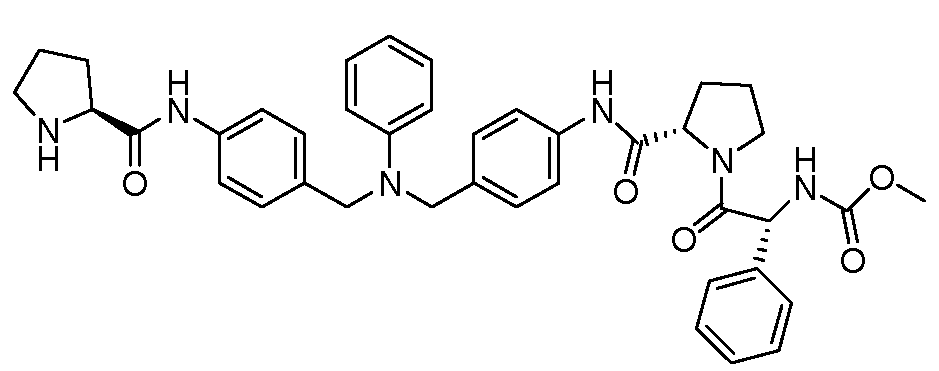
Пример 69А
Метил R-2-оксо-1-фенил-2-((S)-2-(4-((фенил(4-((S)-пирролидин-2-карбоксамидо)бензил)амино)метил)фенилкарбамоил)пирролидин-1-ил)этилкарбамат
К раствору продукта из Примера 1D (1,198 г, 2,408 ммоль) в ДМСО (24 мл) добавляли R-2-(метоксикарбониламино)-2-фенилуксусную кислоту (0,403 г, 1,926 ммоль), HATU (0,732 г, 1,926 ммоль) и основание Хунига (0,673 мл, 3,85 ммоль) и полученную смесь перемешивали при комнатной температуре в течение ночи. Смесь выливали в воду с получением бесцветного осадка, который фильтровали и промывали водой. Твердое вещество растворяли в CH2Cl2, сушили над безводным раствором сульфата натрия, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали при помощи колоночной хроматографии на силикагеле, используя градиент растворителя 0-8% MeOH в CH2Cl2, с получением указанного в заголовке соединения (0,387 г, 24%).
Пример 69B
N-(метоксикарбонил)-3-метил-L-валил-N-(4-{[{4-[(1-{(2R)-2-[(метоксикарбонил)амино]-2-фенилацетил}-L-пролил)амино]бензил}(фенил)амино]метил{фенил)-L-пролинамид
Продукт из Примера 69A (0,031 г, 0,045 ммоль) подвергали процедуре, описанной в Примере 10B, заменяя (R)-2-(диметиламино)-2-фенилуксусную кислоту на (S)-2-(метоксикарбониламино)-3,3-диметилбутановую кислоту, с получением указанного в заголовке соединения (11 мг, 28%).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,96 (с, 9H), 1,80-2,05 (м, 8H), 2,10-2,18 (м, 2H), 3,53 (с, 3H), 3,54 (с, 3H), 3,60-3,68 (м, 1H), 3,74-3,85 (м, 2H), 4,21 (д, J=8,9 Гц, 2H), 4,37 (дд, J=8,1, 3,4 Гц, 1H), 4,44 (дд, J=8,2, 5,3 Гц, 1H), 4,59 (с, 4H), 6,57 (т, J=7,2 Гц, 1H), 6,66 (д, J=8,1 Гц, 2H), 7,04-7,11 (м, 2H), 7,15-7,21 (м, 4H), 7,29-7,42 (м, 5H), 7,48-7,56 (м, 4H), 7,69 (д, J=7,8 Гц, 1H), 9,83 (с, 1H), 9,99 (с, 1H); МС м/z 860,8 (М+H)+.
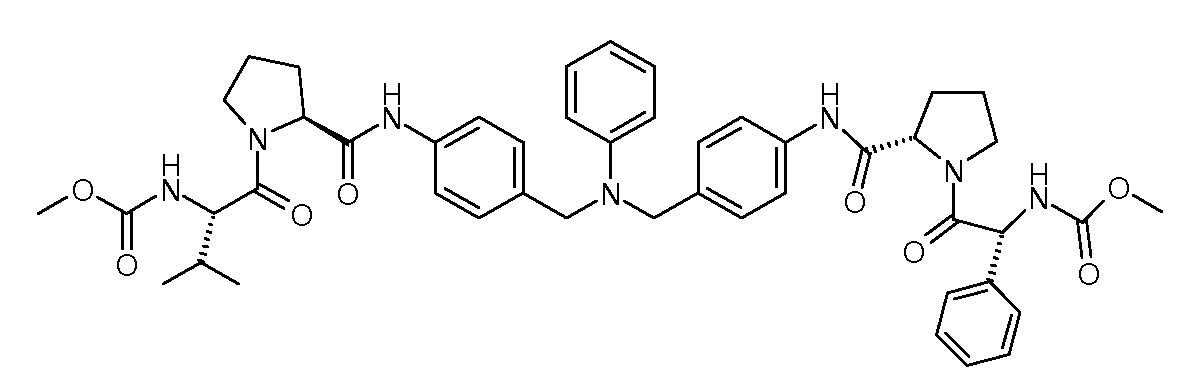
Пример 70
N-(Метоксикарбонил)-L-валил-N-(4-{[{4-[(1-{(2R)-2-[(метоксикарбонил)амино]-2-фенилацетил}-L-пролил) амино]бензил}(фенил)амино]метил}фенил)-L-пролинамид
Продукт из Примера 69A (0,031 г, 0,045 ммоль) подвергали процедуре, описанной в Примере 10B, заменяя (R)-2-(диметиламино)-2-фенилуксусную кислоту на (S)-2-(метоксикарбониламино)-3-метилбутановую кислоту, с получением указанного в заголовке соединения (0,0135 г, 36%).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,88 (д, J=6,7 Гц, 3H), 0,93 (д, J=6,7 Гц, 3H), 1,80-2,05 (м, 8H), 2,09-2,20 (м, 2H), 3,52 (с, 3H), 3,53 (с, 3H), 3,57-3,67 (м, 2H), 3,76-3,86 (м, 2H), 4,02 (т, J=8,5 Гц, 2H), 4,37 (дд, J=8,1, 3,4 Гц, 1H), 4,43 (дд, J=8,2, 4,8 Гц, 1H), 4,59 (с, 4H), 6,57 (т, J=7,2 Гц, 1H), 6,66 (д, J=8,1 Гц, 2H), 7,04-7,10 (м, 2H), 7,15-7,21 (м, 4H), 7,29-7,42 (м, 5H), 7,48-7,57 (м, 4H), 7,69 (д, J=7,9 Гц, 1H), 9,83 (с, 1H), 9,98 (с, 1H); МС м/z 846,3 (М+H)+.

Пример 71
Метил {(1R)-2-[(2S)-2-{[4-({[4-({[(2S)-1-{(2S)-2-[(метоксикарбонил)амино]бутаноил}пирролидин-2-ил]карбонил}амино)бензил](фенил)амино}метил)фенил]карбамоил]-пирролидин-1-ил]-2-оксо-1-фенилэтил}карбамат
Продукт из Примера 69A (0,031 г, 0,045 ммоль) подвергали процедуре, описанной в Примере 10B, заменяя (R)-2-(диметиламино)-2-фенилуксусную кислоту на (S)-2-(метоксикарбониламино)бутановую кислоту, с получением указанного в заголовке соединения (0,0126 г, 34%).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,90 (т, J=7,4 Гц, 3H), 1,46-1,58 (м, 1H), 1,61-1,71 (м, 1H), 1,73-2,05 (м, 8H), 2,07-2,20 (м, 2H), 3,52 (с, 3H), 3,53 (с, 3H), 3,56-3,64 (м, 2H), 3,69-3,76 (м, 1H), 3,77-3,84 (м, 1H), 4,14-4,21 (м, 1H), 4,37 (дд, J=8,2, 3,4 Гц, 1H), 4,43 (дд, J=8,1, 4,6 Гц, 1H), 4,59 (с, 4H), 6,57 (т, J=7,2 Гц, 1H), 6,66 (д, J=8,1 Гц, 2H), 7,04-7,11 (м, 2H), 7,18 (дд, J=8,5, 5,9 Гц, 4H), 7,29-7,42 (м, 5H), 7,48-7,56 (м, 4H), 7,69 (д, J=7,8 Гц, 1H), 9,83 (с, 1H), 9,95 (с, 1H); МС м/z 832,2 (М+H)+.
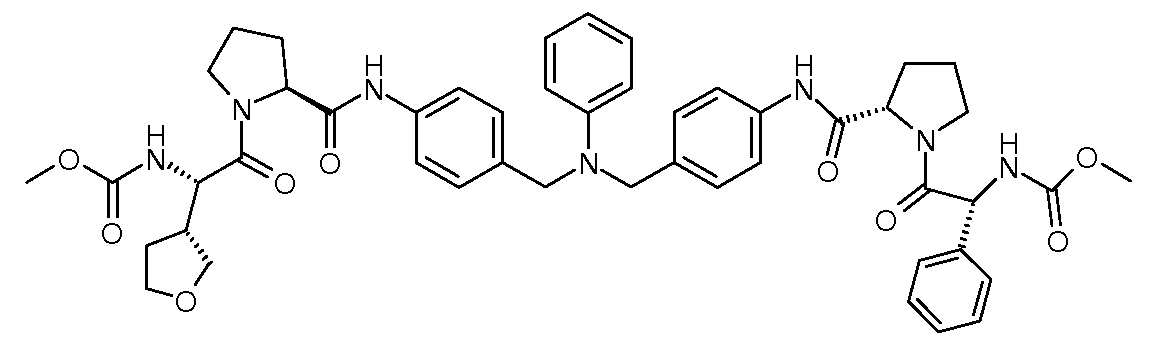
Пример 72
Метил {(1S)-2-[(2S)-2-{[4-({[4-({[(2S)-1-{(2R)-2-[(метоксикарбонил)амино]-2-фенилацетил}пирролидин-2-ил]карбонил}амино)бензил](фенил)амино}метил)фенил]карбамоил}-пирролидин-1-ил]-2-оксо-1-[(3R)-тетрагидрофуран-3-ил]этил}карбамат
Продукт из Примера 69A (0,031 г, 0,045 ммоль) подвергали процедуре, описанной в Примере 10B, заменяя (R)-2-(диметиламино)-2-фенилуксусную кислоту на (S)-2-(метоксикарбониламино)-2-((R)-тетрагидрофуран-3-ил)уксусную кислоту, с получением указанного в заголовке соединения (0,0219 г, 55%).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 1,21-1,29 (м, 4H), 1,69-1,80 (м, 2H), 1,81-2,05 (м, 8H), 2,11-2,20 (м, 2H), 3,53 (с, 3H), 3,53 (с, 3H), 3,58-3,71 (м, 2H), 3,71-3,89 (м, 2H), 4,23 (т, J=8,9 Гц, 1H), 4,37 (дд, J=8,1, 3,2 Гц, 1H), 4,44 (дд, J=8,2, 4,7 Гц, 1H), 4,60 (с, 4H), 6,57 (т, J=7,2 Гц, 1H), 6,66 (д, J=8,1 Гц, 2H), 7,04-7,11 (м, 2H), 7,18 (дд, J=8,6, 3,4 Гц, 3H), 7,32-7,42 (м, 5H), 7,53 (дд, J=13,5, 8,5 Гц, 4H), 7,61 (д, J=7,9 Гц, 1H), 7,69 (д, J=7,8 Гц, 1H), 9,83 (с, 1H), 9,98 (с, 1H); МС м/z 874,3 (М+H)+.
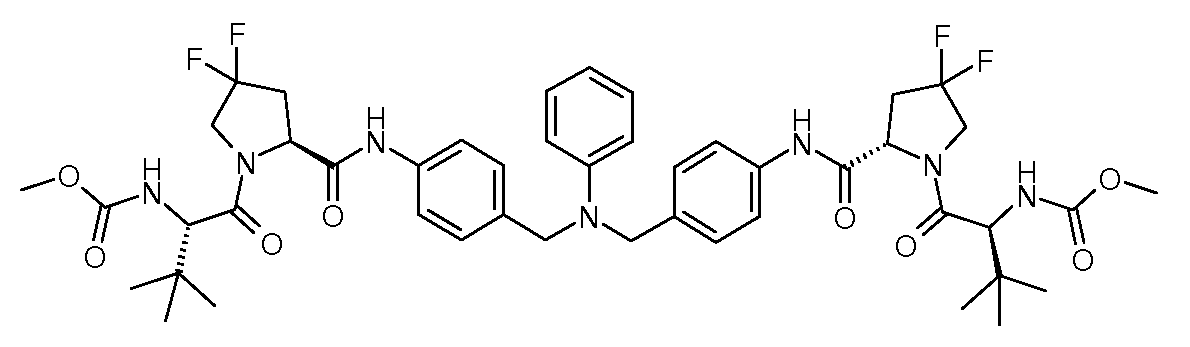
Пример 73
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил[(2S)-4,4-дифторпирролидин-2,1-диил][(2S)-3,3-диметил-1-оксобутан-1,2-диил]}]бискарбамат

Пример 73A
(5S,5'S)-трет-бутил 5,5'-(4,4'-(фенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(оксометилен)бис(3,3-дифторпирролидин-1-карбоксилат)
Продукт из Примера 1B и N-BOC-4,4-дифтор-L-пролин (Aldrich) обрабатывали, используя способ, описанный в Примере 41, с получением 457 мг (87%) указанного в заголовке соединения. МС (ESI; M+H) m/z=770.

Пример 73B
(2S,2'S)-N,N'-(4,4'-(фенилазанедиил)бис(метилен)бис(4,1-фенилен))бис(4,4-дифторпирролидин-2-карбоксамид)
Продукт из Примера 73A обрабатывали с использованием способа, описанного в Примере 47B, с получением 236 мг (70%) указанного в заголовке соединения. МС (DCI; M+H) m/z=570.
Пример 73C
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил [(2S)-4,4-дифторпирролидин-2,1-диил][(2S)-3,3-диметил-1-оксобутан-1,2-диил]}]бискарбамат
Продукт из Примера 73B и (S)-2-(метоксикарбониламино)-3,3-диметилбутановую кислоту (DeGussa) обрабатывали с использованием способа, описанного в Примере 41, с получением 35 мг (9%) указанного в заголовке соединения.1H ЯМР (400 МГц, ДМСО-d6) δ 0,97 (с, 18H) 2,37-2,50 (м, 2H) 2,78-2,85 (м, 2H) 3,54 (с, 6H) 4,00-4,20 (м, 4H) 4,28-4,39 (м, 2H) 4,59 (шир. с, 4H) 4,64 (т, J=8,02 Гц, 2H) 6,57 (т, J=7,21 Гц, 1H) 6,65 (д, J=8,24 Гц, 2H) 7,07 (т, J=7,92 Гц, 2H) 7,19 (д, J=8,57 Гц, 4H) 7,29 (д, J=8,13 Гц, 2H) 7,50 (д, J=8,57 Гц, 4H) 10,13 (с, 2H).

Пример 74
N-(Метоксикарбонил)-3-метил-L-валил-N-(4-{[{4-[(1-{(2R)-2-[(трет-бутоксикарбонил)амино]-2-фенилацетил}-L-пролил)амино]бензил}(фенил)амино]метил{фенил)-L-пролинамид
Продукт Примера 10A (150 мг, 0,224 ммоль) подвергали процедуре, описанной в Примере 10B, заменяя (R)-2-(диметиламино)-2-фенилуксусную кислоту на (R)-2-(трет-бутоксикарбониламино)-2-фенилуксусную кислоту (62,0 мг, 0,247 ммоль), с получением указанного в заголовке соединения (145 мг, 71 %).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,94-0,99 (м, 8H), 1,32-1,38 (м, 9H), 1,76 (д, J=4,1 Гц, 1H), 1,82-1,91 (м, 3H), 1,93-2,02 (м, 3H), 2,11-2,20 (м, 1H), 2,69 (с, 4H), 3,17 (д, J=5,2 Гц, 2H), 3,54 (с, 3H), 3,63 (д, J=9,3 Гц, 1H), 3,78 (дд, J=9,6, 6,4 Гц, 2H), 4,11 (д, J=5,2 Гц, 1H), 4,21 (д, J=9,0 Гц, 1H), 4,37 (дд, J=7,9, 3,1 Гц, 1H), 4,44 (дд, J=8,1, 5,3 Гц, 1H), 4,59 (с, 4H), 6,57 (т, J=7,2 Гц, 1H), 6,66 (д, J=8,1 Гц, 2H), 7,04-7,11 (м, 3H), 7,18 (дд, J=8,5, 3,2 Гц, 4H), 7,34-7,40 (м, 4H), 7,52 (дд, J=9,9, 8,7 Гц, 4H), 10,00 (с, 1H); МС (ECI) м/z 902,8 (М+H)+.

Пример 75
Метил [(1R)-2-{(2S)-2-[(4-{[{4-[({(2S)-1-[(2R)-2-(диэтиламино)-2-фенилацетил]пирролидин-2-ил}карбонил)амино]бензил}(фенил)амино]метил}фенил)карбамоил]-пирролидин-1-ил}-2-оксо-1-фенилэтил]карбамат
Продукт из Примера 69A (0,033 г, 0,048 ммоль) подвергали процедуре, описанной в Примере 10B, заменяя (R)-2-(диметиламино)-2-фенилуксусную кислоту на (R)-2-(диэтиламино)-2-фенилуксусную кислоту, с получением указанного в заголовке соединения (0,0238 г, 57%).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,89 (т, J=6,9 Гц, 3H), 1,07 (т, J=7,2 Гц, 3H), 1,21-1,33 (м, 4H), 1,74-2,03 (м, 8H), 2,05-2,19 (м, 2H), 3,53 (с, 3H), 3,76-3,84 (м, 1H), 3,97-4,04 (м, 1H), 4,35-4,44 (м, 2H), 4,61 (с, 4H), 5,43-5,52 (м, 2H), 6,58 (т, J=7,2 Гц, 1H), 6,67 (д, J=8,1 Гц, 2H), 7,05-7,11 (м, 2H), 7,20 (т, J=8,3 Гц, 4H), 7,33-7,42 (м, 6H), 7,49-7,58 (м, 6H), 7,66-7,71 (м, 2H), 9,84 (с, 1H), 10,16 (с, 1H); МС м/z 878,3 (М+H)+.

Пример 76
Метил {(1R)-2-оксо-1-фенил-2-[(2S)-2-({4-[(фенил{4-[({(2S)-1-[(2S)-тетрагидрофуран-2-илкарбонил]пирролидин-2-ил}карбонил)амино]бензил}амино)метил]фенил}карбамоил)пирролидин-1-ил]этил}карбамат
Продукт из Примера 69A (0,032 г, 0,046 ммоль) подвергали процедуре, описанной в Примере 10B, заменяя (R)-2-(диметиламино)-2-фенилуксусную кислоту на (S)-тетрагидрофуран-2-карбоновую кислоту, с получением указанного в заголовке соединения (0,0244 г, 66%).1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,72-2,16 (м, 12H), 3,53 (с, 3H), 3,58-3,84 (м, 4H), 4,31-4,45 (м, 2H), 6,57 (т, J=7,2 Гц, 1H), 6,66 (д, J=8,2 Гц, 2H), 7,03-7,12 (м, 2H), 7,18 (дд, J=8,3, 4,6 Гц, 4H), 7,32-7,42 (м, 5H), 7,47-7,58 (м, 4H), 7,68 (д, J=7,9 Гц, 1H), 9,83 (с, 1H), 9,96 (с, 1H); МС м/z 787,2 (М+H)+.

Пример 77
N-(Метоксикарбонил)-3-метил-L-валил-N-[4-({[4-({1-[(2R)-2-амино-2-фенилацетил]-L-пролил}амино)бензил](фенил)амино}метил)фенил]-L-пролинамид
К раствору продукта из Примера 74 (136,1 мг, 0,151 ммоль) в CH2Cl2 (0,2 мл) добавляли трифторуксусную кислоту (0,20 мл). Смесь перемешивали при комнатной температуре и концентрировали в вакууме. Неочищенный продукт распределяли между CH2Cl2 и насыщенным водным раствором NaHCO3, и органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения (115 мг, 94%).1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 0,96 (с, 8H), 1,53 (с, 1H), 1,74 (с, 1H), 1,82-1,91 (м, 3H), 1,99 (с, 2H), 2,15 (с, 1H), 2,69 (с, 2H), 2,84 (с, 1H), 3,54 (с, 3H), 3,63 (с, 1H), 3,79 (с, 2H), 4,21 (д, J=8,9 Гц, 1H), 4,41-4,47 (м, 2H), 4,60 (с, 4H), 5,29 (с, 1H), 6,57 (т, J=7,2 Гц, 1H), 6,66 (д, J=8,2 Гц, 2H), 7,05-7,11 (м, 3H), 7,19 (т, J=8,3 Гц, 4H), 7,42-7,49 (м, 4H), 7,53 (дд, J=12,8, 8,5 Гц, 5H), 10,00 (с, 1H), 10,09 (с, 1H); МС (ECI) м/z 802,5 (М+H)+.

Пример 78
Диметил {(фенилимино)бис[метандиил-1Н-бензимидазол-5,2-диил(2S)пирролидин-2,1-диил{(1S)-2-оксо-1-[(3R)-тетрагидрофуран-3-ил]этан-2,1-диил}]}бискарбамат
Продукт из Примера 7E (17 мг, 0,035 ммоль) подвергали процедуре, описанной в Примере 2, заменяя (R)-2-(диметиламино)-2-фенилуксусную кислоту на (S)-2-(метоксикарбониламино)-2-((R)-тетрагидрофуран-3-ил)уксусную кислоту (14,75 мг, 0,073 ммоль), с получением указанного в заголовке соединения (10 мг, 34%).1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 0,80-0,87 (м, 1H), 1,19-1,30 (м, 6H), 1,63 (с, 2H), 1,73 (д, J=12,9 Гц, 2H), 1,96 (с, 3H), 2,10 (с, 2H), 2,17 (с, 1H), 3,39-3,47 (м, 3H), 3,52-3,57 (м, 7H), 3,61 (т, J=7,9 Гц, 2H), 3,70 (д, J=8,0 Гц, 2H), 3,81 (с, 3H), 4,29 (с, 2H), 4,75 (д, J=10,1 Гц, 3H), 5,12 (с, 2H), 6,54 (с, 1H), 6,72 (д, J=8,3 Гц, 2H), 7,01-7,09 (м, 4H), 7,26 (с, 1H), 7,34-7,38 (м, 2H), 7,44 (д, J=8,2 Гц, 1H), 7,57 (с, 1H), 12,00 (с, 2H); МС (ECI) м/z 862,4 (М+H)+.
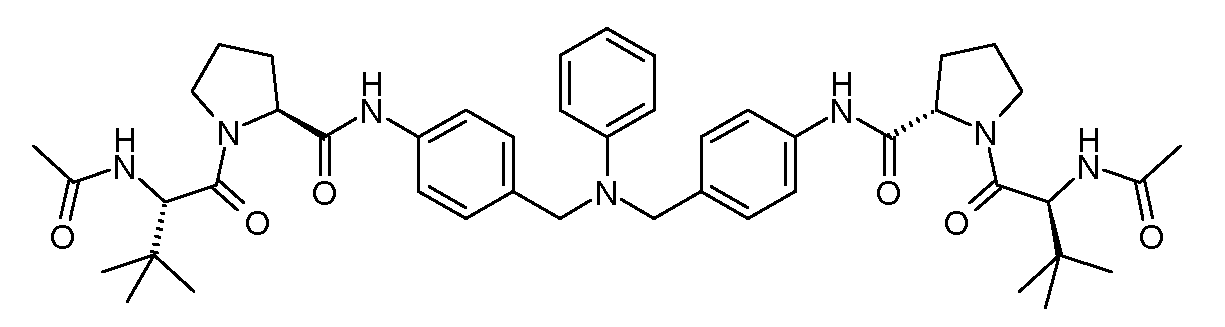
Пример 79
(2S,2'S)-N,N'-[(Фенилимино)бис(метандиилбензол-4,1-диил)]бис{1-[(2S)-2-(ацетиламино)-3,3-диметилбутаноил]пирролидин-2-карбоксамид}

Пример 79A
трет-Бутил (2S,2'S)-1,1'-((2S,2'S)-2,2'-(4,4'-(фенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(оксометилен)бис(пирролидин-2,1-диил))бис(3,3-диметил-1-оксобутан-2,1-диил)дикарбамат
Продукт Примера 1D (1,0 г, 2,01 ммоль) и (S)-2-(трет-бутоксикарбониламино)-3,3-диметилбутановую кислоту (1,02 г, 4,42 ммоль) обрабатывали, как в Примере 25B, с получением 1,46 г (76%) указанного в заголовке соединения в виде не совсем белого твердого вещества.
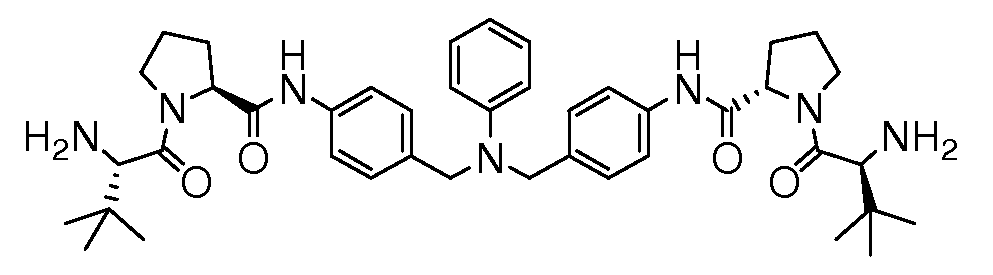
Пример 79B
(S,2S,2'S)-N,N'-(4,4'-(фенилазанедиил)бис(метилен)бис(4,1-фенилен))бис(1-((S)-2-амино-3,3-диметилбутаноил)пирролидин-2-карбоксамид)
Продукт из Примера 79A (1,44 г, 1,56 ммоль) растворяли в дихлорметане (10 мл) при температуре окружающей среды и обрабатывали при помощи трифторуксусной кислоты (5 мл). Через 3 часа раствор концентрировали, переносили в 25% раствор изопропанола в хлороформе и промывали 10% раствором бикарбоната натрия. Органическое вещество сушили над сульфатом натрия, фильтровали и концентрировали досуха с получением указанного в заголовке соединения в виде белого твердого вещества.
Пример 79C
(2S,2'S)-N,N'-[(фенилимино)бис(метандиилбензол-4,1-диил)]бис{1-[(2S)-2-(ацетиламино)-3,3-диметилбутаноил]пирролидин-2-карбоксамид}
Продукт из Примера 79B (0,03 г, 0,041 ммоль) растворяли в дихлорметане (1,5 мл) при температуре окружающей среды и обрабатывали при помощи DMAP (0,012 г, 0,10 ммоль), с последующей обработкой уксусным ангидридом (0,009 мл, 0,091 ммоль) и перемешивали в течение 2 часов. Раствор концентрировали и очищали на колонке combi-flash 12g, элюируя смесью 0-4% метанола в дихлорметане, с получением 0,025 г (75%) указанного в заголовке соединения в виде белого твердого вещества.1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,95 (с, 18H) 1,79-1,90 (м, 10H) 1,90-2,00 (м, 2H) 2,07-2,19 (м, 2H) 3,59-3,67 (м, 2H) 3,73-3,82 (м, 2H) 4,41 (дд, J=8,32, 5,26 Гц, 2H) 4,51 (д, J=9,00 Гц, 2H) 4,57 (с, 4H) 6,55 (т, J=7,25 Гц, 1H) 6,64 (д, J=8,09 Гц, 2H) 7,03-7,10 (м, 2H) 7,16 (д, J=8,54 Гц, 4H) 7,50 (д, J=8,54 Гц, 4H) 7,87 (д, J=9,00 Гц, 2H) 9,97 (с, 2H); МС ECI- м/z 806,6.
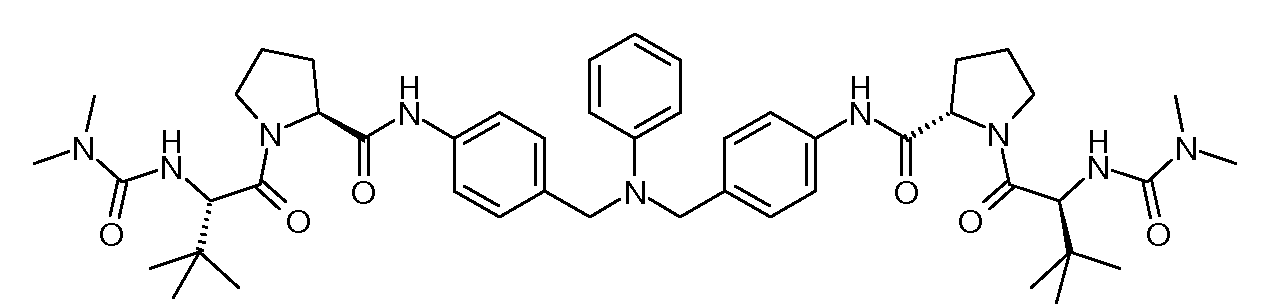
Пример 80
(2S,2'S)-N,N'-[(Фенилимино)бис(метандиилбензол-4,1-диил)]бис(1-{(2S)-2-[(диметилкарбамоил)амино]-3,3-диметилбутаноил}пирролидин-2-карбоксамид)
Продукт из Примера 79B (0,045 г, 0,062 ммоль) растворяли в дихлорметане (2 мл) при температуре окружающей среды и обрабатывали диизопропиламином (0,065 мл, 0,37 ммоль) с последующей обработкой диметилкарбамоилхлоридом (0,013 мл, 0,14 ммоль) и перемешивали в течение 3 дней. Раствор концентрировали досуха и очищали на колонке combi-flash 12g с диоксидом кремния, элюируя смесью 0-10% метанола в дихлорметане, с получением 0,031 г (58%) указанного в заголовке соединения в виде белого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 0,95 (с, 18H) 1,79-1,90 (м, 4H) 1,92-2,04 (м, 2H) 2,08-2,18 (м, 2H) 2,79 (с, 12H) 3,55-3,66 (м, 2H) 3,77-3,86 (м, 2H) 4,35 (д, J=9,11 Гц, 2H) 4,40 (дд, J=8,08, 5,69 Гц, 2H) 4,57 (с, 4H) 5,36 (д, J=9,11 Гц, 2H) 6,55 (т, J=7,26 Гц, 1H) 6,64 (д, J=8,35 Гц, 2H) 7,05 (т, J=7,92 Гц, 2H) 7,16 (д, J=8,46 Гц, 4H) 7,49 (д, J=8,46 Гц, 4H) 9,98 (с, 2H); МС ECI- м/z 864,6.
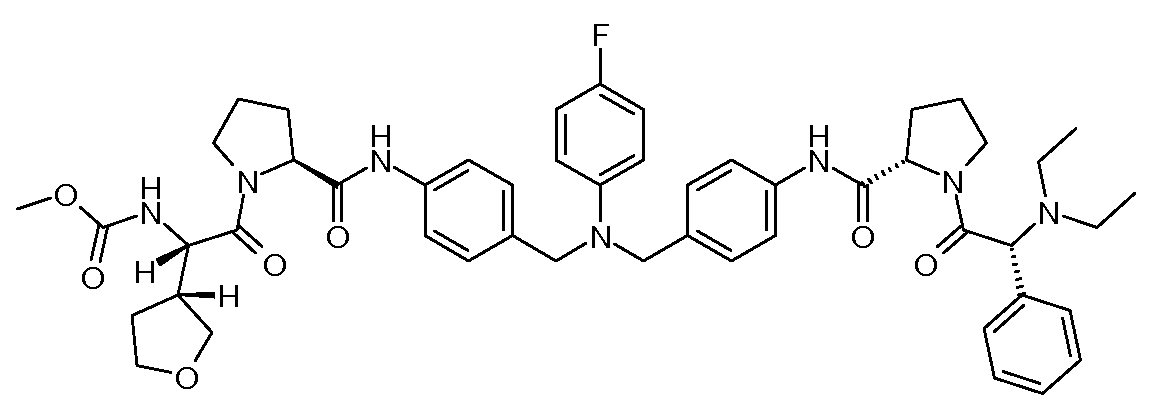
Пример 81
Метил {(1S)-2-{(2S)-2-[(4-{[{4-[({(2S)-1-[(2R)-2-(диэтиламино)-2-фенилацетил]пирролидин-2-ил}карбонил)амино]бензил}(4-фторфенил)амино]метил}фенил)карбамоил]пирролидин-1-ил}-2-оксо-1-[(3R)-тетрагидрофуран-3-ил]этил}карбамат
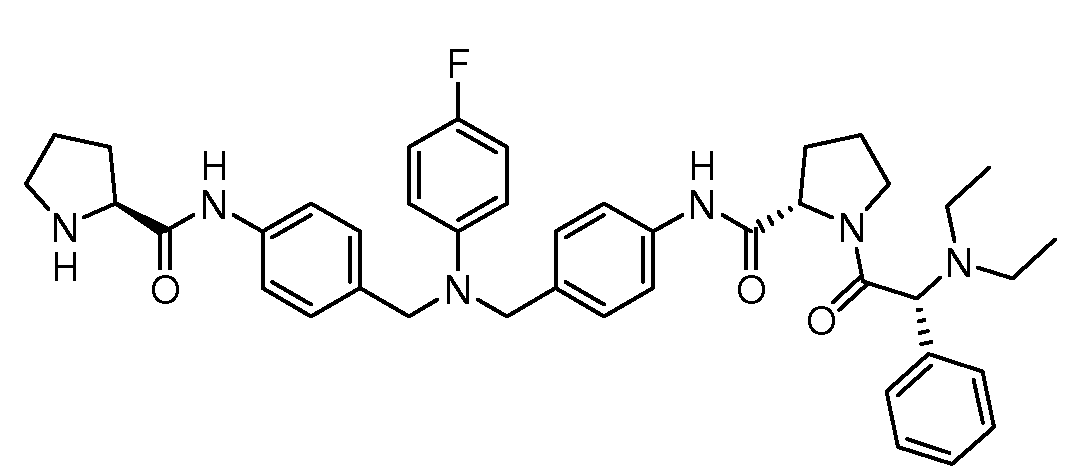
Пример 81A
(S)-1-((R)-2-(диэтиламино)-2-фенилацетил)-N-(4-(((4-фторфенил)(4-((S)-пирролидин-2-карбоксамидо)бензил)амино)метил)фенил)пирролидин-2-карбоксамид
Продукт из Примера 13D (0,428 г, 0,83 ммоль) и (R)-2-(диэтиламино)-2-фенилуксусную кислоту (0,138 г, 0,664 ммоль) объединяли в диметилсульфоксиде (8 мл) при температуре окружающей среды и обрабатывали диизопропилэтиламином (0,26 мл, 1,49 ммоль), с последующей обработкой HATU (0,252 г, 0,664 ммоль). Через один час раствор разбавляли водой и продукт отфильтровывали и очищали на колонке combi-flash 24g, элюируя смесью 0-10% метанола в дихлорметане, с получением 0,159 г (27%) указанного в заголовке соединения в виде белого твердого вещества.
Пример 81B
Метил {(1S)-2-{(2S)-2-[(4-{[{4-[({(2S)-1-[(2R)-2-(диэтиламино)-2-фенилацетил]пирролидин-2-ил}карбонил)амино]бензил}(4-фторфенил)амино]метил}фенил)карбамоил]пирролидин-1-ил}-2-оксо-1-[(3R)-тетрагидрофуран-3-ил]этил}карбамат
Продукт из Примера 81A (0,042 г, 0,060 ммоль) и (S)-2-(метоксикарбониламино)-2-((R)-тетрагидрофуран-3-ил)уксусную кислоту (0,013 г, 0 066 ммоль) обрабатывали, как в Примере 81A, с получением 0,033 г (62%) указанного в заголовке соединения в виде не совсем белого твердого вещества. МС (AA, ELSD+) m/z 890 (M+H)+.

Пример 82
N-(Метоксикарбонил)-3-метил-L-валил-N-[4-({[4-({1-[(2R)-2-(диэтиламино)-2-фенилацетил]-L-пролил}амино)бензил](4-фторфенил)амино}метил)фенил]-L-пролинамид
Продукт из Примера 81A (0,042 г, 0,060 ммоль) и (S)-2-(метоксикарбониламино)-3,3-диметилбутановую кислоту (0,013 г, 0,066 ммоль) обрабатывали, как в Примере 81A, с получением 0,031 г (59%) указанного в заголовке соединения в виде не совсем белого твердого вещества.1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,88 (т, J=7,10 Гц, 6H) 0,95 (с, 9H) 1,76-1,89 (м, 4H) 1,93-2,00 (м, 2H) 2,02-2,10 (м, 1H) 2,10-2,18 (м, 1H) 2,40-2,47 (м, 2H) 2,56-2,65 (м, 2H) 3,52 (с, 3H) 3,61 (дд, J=17,24, 7,48 Гц, 2H) 3,73-3,80 (м, 2H) 4,20 (д, J=9,00 Гц, 1H) 4,37 (дд, J=7,93, 4,27 Гц, 1H) 4,42 (дд, J=7,78, 5,19 Гц, 1H) 4,54 (с, 4H) 4,66 (с, 1H) 6,63 (дд, J=9,31, 4,43 Гц, 2H) 6,90 (т, J=8,85 Гц, 2H) 7,07 (д, J=8,85 Гц, 1H) 7,17 (дд, J=8,47, 3,89 Гц, 4H) 7,26 (т, J=7,17 Гц, 1H) 7,32 (т, J=7,40 Гц, 2H) 7,39 (д, J=7,17 Гц, 2H) 7,50 (дд, J=8,39, 6,10 Гц, 4H) 9,95 (с, 1H) 9,99 (с, 1H); МС ECI+ м/z 876,5.

Пример 83
(2S)-1-[(2R)-2-(Диэтиламино)-2-фенилацетил]-N-(4-{[(4-фторфенил){4-[({(2S)-1-[(2R)-2-фенил-2-пирролидин-1-илацетил]пирролидин-2-ил}карбонил)амино]бензил}амино]метил}фенил)пирролидин-2-карбоксамид
Продукт из Примера 81A (0 032 г, 0,045 ммоль) и (R)-2-фенил-2-(пирролидин-1-ил)уксусную кислоту (0,010 г, 0,05 ммоль) обрабатывали, как в Примере 81A, с получением 0,015 г (37%) указанного в заголовке соединения в виде не совсем белого твердого вещества.1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,89 (т, J=7,10 Гц, 6H) 1,56-1,66 (м, 4H) 1,74-1,88 (м, 4H) 1,94-2,09 (м, 4H) 2,29-2,34 (м, 2H) 2,57-2,62 (м, 4H) 3,36-3,50 (м, 4H) 3,75-3,88 (м, 2H) 4,21 (с, 1H) 4,31 (дд, J=7,93, 4,27 Гц, 1H) 4,38 (дд, J=8,16, 4,50 Гц, 1H) 4,57 (с, 4H) 4,68 (с, 1H) 6,65 (дд, J=9,31, 4,43 Гц, 2H) 6,92 (т, J=8,93 Гц, 2H) 7,19 (д, J=8,24 Гц, 4H) 7,26-7,30 (м, 2H) 7,31-7,36 (м, 4H) 7,40 (д, J=7,17 Гц, 2H) 7,46 (д, J=6,87 Гц, 2H) 7,53 (д, J=8,24 Гц, 4H) 9,96 (д, J=5,34 Гц, 2H); МС ECI-м/z 890,5.

Пример 84
N-(Метоксикарбонил)-O-метил-L-треонил-N-[4-({[4-({1-[(2R)-2-(диэтиламино)-2-фенилацетил]-L-пролил}амино)бензил](4-фторфенил)амино}метил)фенил]-L-пролинамид
Продукт из Примера 81A (0,038 г, 0,054 ммоль) и (2S,3R)-3-метокси-2-(метоксикарбониламино)бутановую кислоту (0,011 г, 0,059 ммоль) обрабатывали, как в Примере 81A, с получением 0,019 г (40%) указанного в заголовке соединения в виде не совсем белого твердого вещества.1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,89 (т, J=7,10 Гц, 3H) 1,07 (т, J=7,17 Гц, 2H) 1,13 (д, J=6,26 Гц, 3H) 1,28 (т, J=7,25 Гц, 1H) 1,76-1,92 (м, 4H) 1,94-2,05 (м, 2H) 2,07-2,23 (м, 2H) 2,39-2,46 (м, 2H) 2,57-2,63 (м, 2H) 3,24 (с, 3H) 3,34-3,42 (м, 1H) 3,43-3,50 (м, 1H) 3,53 (с, 3H) 3,63-3,70 (м, 1H) 3,75-3,87 (м, 2H) 3,97-4,03 (м, 1H) 4,26 (т, J=7,78 Гц, 1H) 4,36-4,46 (м, 2H) 4,56 (с, 4H) 4,67 (с, 1H) 6,64 (дд, J=9,31, 4,43 Гц, 2H) 6,89-6,95 (м, 2H) 7,16-7,22 (м, 4H) 7,28 (т, J=7,17 Гц, 1H) 7,33 (т, J=7,40 Гц, 2H) 7,40 (д, J=7,17 Гц, 1H) 7,49-7,57 (м, 4H) 7,66-7,70 (м, 1H) 9,96 (д, J=7,02 Гц, 2H); МС ECI-м/z 876,5.

Пример 85
(2S,2'S)-N,N'-{[(4-Фторфенил)имино]бис(метандиилбензол-4,1-диил)}бис{1-[(2R)-2-фенил-2-пирролидин-1-илацетил]пирролидин-2-карбоксамид}
Продукт из Примера 13D (0,10 г, 0,19 ммоль) и (R)-2-фенил-2-(пирролидин-1-ил)уксусную кислоту (0,088 г, 0,43 ммоль) обрабатывали, как в Примере 25B, с получением 0,098 г (57%) указанного в заголовке соединения в виде не совсем белого твердого вещества.1H ЯМР (500 МГц, ДМСО- d6) δ м.д. 1,62 (с, 8H) 1,76-1,86 (м, 6H) 1,94-2,06 (м, 6H) 2,28-2,43 (м, 4H) 3,42-3,49 (м, 2H) 3,81-3,89 (м, 2H) 4,21 (с, 2H) 4,31 (дд, J=7,86, 4,20 Гц, 2H) 4,57 (с, 4H) 6,65 (дд, J=9,31, 4,43 Гц, 2H) 6,92 (т, J=8,85 Гц, 2H) 7,19 (д, J=8,54 Гц, 4H) 7,26-7,37 (м, 6H) 7,46 (д, J=7,02 Гц, 4H) 7,52 (д, J=8,54 Гц, 4H) 9,96 (с, 2H); МС ECI-м/z 888,6 (М-H)-.

Пример 86
Диметил {[(4-фторфенил)имино]бис[метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил{(1S)-2-оксо-1-[(3R)-тетрагидрофуран-3-ил]этан-2,1-диил}]}бискарбамат
Продукт из Примера 13D (0,03 г, 0,058 ммоль) и (S)-2-(метоксикарбониламино)-2-((R)-тетрагидрофуран-3-ил)уксусную кислоту (0,026 г, 0,128 ммоль) обрабатывали, как в Примере 25B, с получением 0,040 г (78%) указанного в заголовке соединения в виде не совсем белого твердого вещества.1H ЯМР (500 МГц, ДМСО- d6) δ м.д. 1,71 (дт, J=20,07, 7,21 Гц, 2H) 1,82-1,94 (м, 6H) 1,96-2,05 (м, 2H) 2,10-2,21 (м, 2H) 2,37-2,45 (м, 2H) 3,41-3,47 (м, 2H) 3,53 (с, 6H) 3,58-3,70 (м, 6H) 3,71-3,79 (м, 2H) 3,85 (ддд, J=9,57, 6,71, 6,60 Гц, 2H) 4,20-4,26 (м, 2H) 4,43 (дд, J=8,16, 4,65 Гц, 2H) 4,55 (с, 4H) 6,63 (дд, J=9,31, 4,43 Гц, 2H) 6,91 (т, J=8,93 Гц, 2H) 7,17 (д, J=8,70 Гц, 4H) 7,51 (д, J=8,54 Гц, 4H) 7,61 (д, J=7,93 Гц, 2H) 9,98 (с, 2H); МС ECI- м/z 884 (М-H)-.

Пример 87
N-(Метоксикарбонил)-3-метил-L-валил-N-[4-({фенил[4-({1-[(2R)-2-фенил-2-{[(2S)-тетрагидрофуран-2-илкарбонил]амино}ацетил]-L-пролил}амино)бензил]амино}метил)фенил]-L-пролинамид
Продукт из Примера 77 (20 мг, 0,025 ммоль) подвергали процедуре, описанной в Примере 10B, заменяя (R)-2- (диметиламино)-2-фенилуксусную кислоту на (S)-(-)-2-тетрагидропирослизевую кислоту (3 мкл, 0,031 ммоль), с получением указанного в заголовке соединения (21 мг, 94%).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,96 (с, 8H), 1,22-1,27 (м, 3H), 1,73-1,82 (м, 3H), 1,82-1,90 (м, 3H), 1,94-2,03 (м, 2H), 2,09 (с, 2H), 2,69 (с, 3H), 3,54 (с, 3H), 3,71-3,80 (м, 2H), 3,82-3,89 (м, 2H), 4,19-4,25 (м, 2H), 4,38 (дд, J=8,5, 3,1 Гц, 1H), 4,44 (дд, J=8,0, 5,3 Гц, 1H), 4,60 (с, 4H), 5,65 (д, J=7,2 Гц, 1H), 6,57 (т, J=7,2 Гц, 1H), 6,66 (д, J=8,1 Гц, 2H), 7,05-7,11 (м, 3H), 7,18 (дд, J=8,5, 5,2 Гц, 4H), 7,33 (дд, J=5,7, 3,0 Гц, 1H), 7,37-7,41 (м, 3H), 7,49-7,56 (м, 4H), 8,08 (д, J=7,3 Гц, 1H), 8,31 (с, 1H), 9,88 (с, 1H), 10,00 (с, 1H); МС (ECI) м/z 900,4 (М+H)+.

Пример 88
N-(Метоксикарбонил)-3-метил-L-валил-N-[4-({фенил[4-({1-[(2R)-2-фенил-2-{[(2R)-тетрагидрофуран-2-илкарбонил]амино} ацетил]-L-пролил}амино)бензил]амино}метил)фенил]-L-пролинамид
Продукт из Примера 77 (20 мг, 0,025 ммоль) подвергали процедуре, описанной в Примере 10B, заменяя (R)-2-(диметиламино)-2-фенилуксусную кислоту на (R)-(+)-2-тетрагидропирослизевую кислоту (2,6 мкл, 0,027 ммоль), с получением указанного в заголовке соединения (17 мг, 76%).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,96 (с, 9H), 1,24 (с, 4H), 1,66 (с, 2H), 1,74 (с, 1H), 1,78 (с, 1H), 1,86 (дд, J=5,6, 2,8 Гц, 3H), 1,99 (с, 2H), 2,06 (с, 1H), 2,14 (с, 1H), 2,69 (с, 3H), 3,54 (с, 3H), 3,72-3,79 (м, 2H), 3,82 (д, J=7,9 Гц, 2H), 4,21 (д, J=9,0 Гц, 1H), 4,27 (дд, J=8,2, 5,1 Гц, 1H), 4,37 (с, 1H), 4,44 (с, 1H), 4,60 (с, 4H), 5,64 (д, J=7,0 Гц, 1H), 6,57 (с, 1H), 6,66 (д, J=8,1 Гц, 2H), 7,04-7,10 (м, 3H), 7,18 (дд, J=8,5, 5,0 Гц, 4H), 7,37-7,40 (м, 3H), 7,49-7,55 (м, 4H), 8,14 (д, J=7,0 Гц, 1H), 9,90 (с, 1H), 10,00 (с, 1H); МС (ECI) м/z 900,5 (М+H)+.

Пример 89
(2S,2'S)-N,N'-{[(3,4-Дифторфенил)имино]бис(метандиилбензол-4,1-диил)}бис{1-[(2R)-2-(диэтиламино)-2-фенилацетил]пирролидин-2-карбоксамид}

Пример 89A
3,4-дифтор-Ν,Ν-бис(4-нитробензил)анилин
3,4-Дифторанилин и 4-нитробензилбромид обрабатывали с использованием способа, описанного в Примере 32A, с получением указанного в заголовке соединения. LC/MS Rt 2,15 m/z 400 (M+H)+.
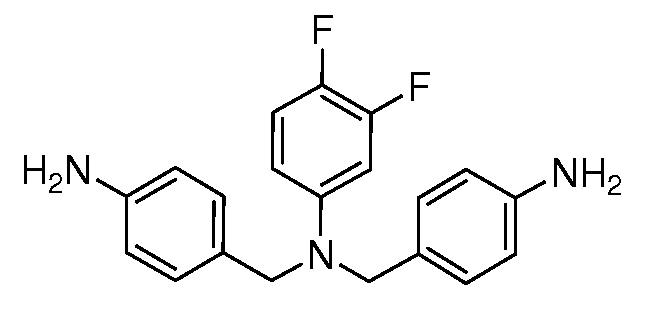
Пример 89B
N,N-бис(4-аминобензил)-3,4-дифторанилин
Продукт из Примера 89A обрабатывали с использованием способа, описанного в Примере 1B, с получением указанного в заголовке соединения.
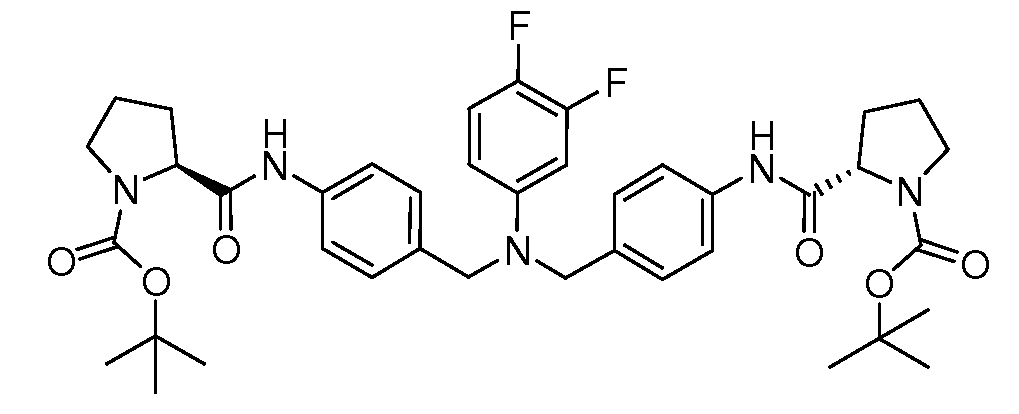
Пример 89C
2S,2'S)-трет-Бутил 2,2'-(4,4'-(3,4-дифторфенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(оксометилен)дипирролидин-1-карбоксилат
Продукт из Примера 89B обрабатывали с использованием способа, описанного в Примере 1C, заменяя ДМСО на дихлорметан, с получением указанного в заголовке соединения.1H ЯМР (400 МГц, ДМСО) δ 0,89-0,80 (м, 1H), 1,26 (с, 12H), 1,39 (с, 6H), 1,93-1,74 (м, 6H), 2,23-2,08 (м, 2H), 3,41 (м, J=9,6, 8,9, 6,4, 3H), 4,17 (дд, J=8,0, 4,4, 1H), 4,24 (дд, J=8,1, 2,6, 1H), 4,60 (с, 4H), 6,41 (д, J=9,4, 1H), 6,68-6,55 (м, 1H), 7,11 (дд, J=19,7, 9,7, 1H), 7,18 (д, J=8,0, 4H), 7,54 (д, J=8,5, 4H), 9,94 (с, 2H), МС (ECI) м/z 734 (М+H)+, 732 (М-H)+.
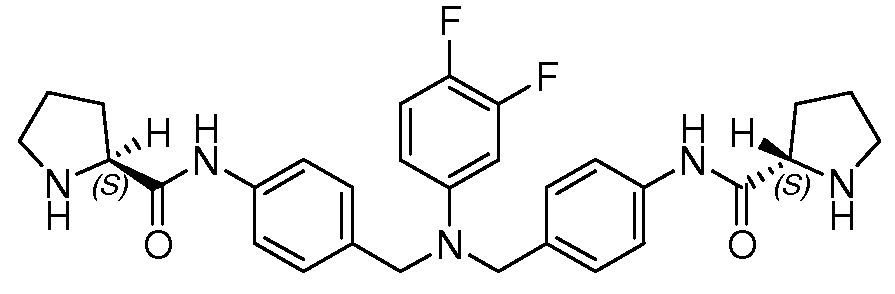
Пример 89D
(2S,2'S)-N,N'-(4,4'-(3,4-дифторфенилазанедиил)бис(метилен)бис(4,1-фенилен))дипирролидин-2-карбоксамид
Продукт из Примера 89C обрабатывали с использованием способа, описанного в Примере 1D, с получением указанного в заголовке соединения. МС (ESI) m/z 534 (M+H+, 60%), 532 (M-H)+.

Пример 89E
(2S,2'S)-N,N'-{[(3,4-дифторфенил)имино]бис(метандиилбензол-4,1-диил)}бис{1-[(2R)-2-(диэтиламино)-2-фенилацетил]пирролидин-2-карбоксамид}
Продукт из Примера 89D обрабатывали с использованием способа, описанного в Примере 12, заменяя ДМСО на дихлорметан, с получением указанного в заголовке соединения (68,5 мг, 52%).1H ЯМР (500 МГц, ДМСО) δ 0,95-0,83 (м, 14H), 1,23 (с, 2H), 1,81 (м, 5H), 2,10-1,91 (м, 5H), 2,61 (дт, J=14,1, 3,5, 3H), 3,84-3,73 (м, 2H), 4,39 (дд, J=8,2, 4,5, 2H), 4,60 (с, 4H), 4,68 (с, 2H), 6,46-6,36 (м, 1H), 6,64 (ддд, J=17,5, 6,8, 3,0, 1H), 7,16-7,06 (м, 2H), 7,19 (д, J=8,6, 4H), 7,30-7,25 (м, 2H), 7,33 (т, J=7,4, 4H), 7,40 (д, J=7,1, 4H), 7,54 (д, J=8,5, 4H), 9,98 (с, 2H), МС (ECI) м/z 912 (М+H+, 40%) 457 (0,5М+H+, 100%), 910 (М-H)+.
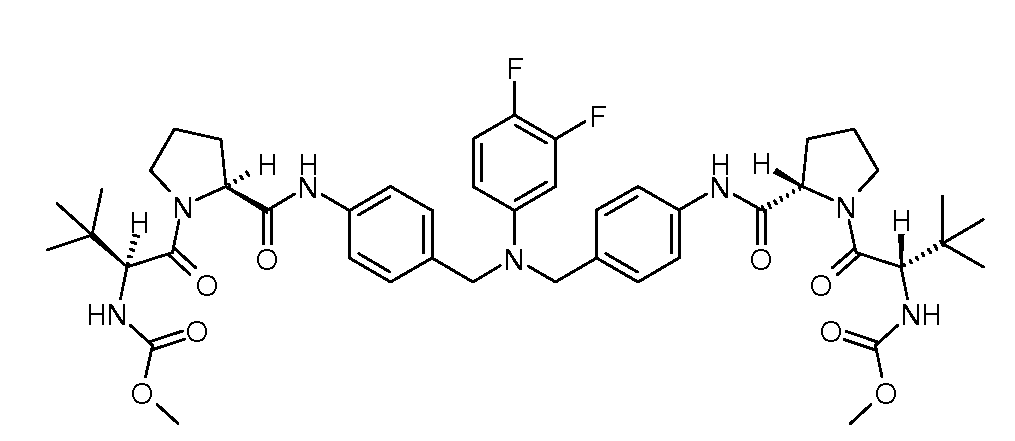
Пример 90
Диметил ([(3,4-дифторфенил)имино]бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-3,3-диметил-1-оксобутан-1,2-диил]})бискарбамат
Продукт из Примера 89D обрабатывали с использованием способа, описанного в Примере 6, заменяя ДМСО на дихлорметан, и очищали с использованием флэш-хроматографии (силикагель, MeOH/дихлорметан) с получением указанного в заголовке соединения (0,14 г, 35%).1H ЯМР (500 МГц, ДМСО) δ 0,96 (с, 18H), 1,93-1,75 (м, 4H), 2,05-1,93 (м, 2H), 2,22-2,08 (м, 2H), 3,54 (с, 6H), 3,63 (дд, J=16,0, 6,8, 2H), 3,84-3,71 (м, 2H), 4,21 (д, J=8,9, 2H), 4,44 (дд, J=7,9, 5,3, 2H), 4,58 (с, 4H), 6,40 (д, J=9,1, 1H), 6,62 (ддд, J=14,5, 6,8, 3,0, 1H), 7,10 (м, 3H), 7,17 (д, J=8,5, 4H), 7,52 (д, J=8,5, 4H), 10,00 (с, 2H), МС (ECI) м/z 876 (М+H)+, 874 (М-H)+.

Пример 91
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-1-оксо-4-фенилбутан-1,2-диил]}]бискарбамат
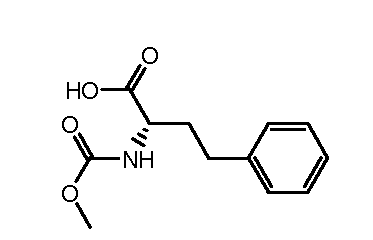
Пример 91A
(S)-2-(метоксикарбониламино)-4-фенилбутановая кислота
(S)-2-Амино-4-фенилбутановую кислоту (0,50 г, 2,8 ммоль) суспендировали в 1M растворе Na2CO3 (8,4 мл, 8,4 ммоль) и затем добавляли раствор метилхлорформиата (0,32 мл, 4,2 ммоль) в ТГФ (4,0 мл) и смесь энергично перемешивали при комнатной температуре в течение 4 часов. Смесь затем концентрировали при пониженном давлении, и остаток растворяли в воде и делали кислотным при помощи 0,1 н. раствора HCl. Смесь экстрагировали этилацетатом, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке соединения (0,64 г, 97% выход).
Пример 91B
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-1-оксо-4-фенилбутан-1,2-диил]}]бискарбамат
Указанное в заголовке соединение получали с использованием способов из Примера 2, заменяя (R)-2-(диметиламино)-2-фенилуксусную кислоту на продукт из Примера 91A, с получением указанного в заголовке соединения (103 мг, 55% выход).1H ЯМР (500 МГц, ДМСО) δ 9,97 (с, 2H), 7,53-7,46 (м, 6H), 7,31-7,26 (м, 4H), 7,23 (д, J=7,0, 4H), 7,18 (т, J=7,3, 2H), 7,15 (д, J=8,6, 4H), 7,05 (дд, J=7,3, 8,7, 2H), 6,64 (д, J=8,1, 2H), 6,56 (т, J=7,2, 1H), 4,58 (с, 4H), 4,42 (дд, J=4,5, 8,3, 2H), 4,22 (дд, J=8,1, 13,5, 2H), 3,61-3,54 (м, 2H), 3,54 (с, 6H), 3,45-3,37 (м, 2H), 2,73-2,57 (м, 4H), 2,18-2,06 (м, 2H), 1,99-1,74 (м, 10H), МС (ECI; М+H) м/z=937.

Пример 92
(2S,2'S)-N,N'-{[(4-Фторфенил)имино]бис(метандиилбензол-4,1-диил)}бис{1-[(2R)-2-фенил-2-пиперидин-1-илацетил]пирролидин-2-карбоксамид}

Пример 92A
(R)-трет-бутил 2-фенил-2-(пиперидин-1-ил)ацетат
К суспензии (R)-трет-бутил 2-амино-2-фенилацетата HCL (Chem-Impex, 0,200 г, 0,821 ммоль), MP-цианоборгидрида (2,44 ммоль/г; 500 мг) и уксусной кислоты (0,141 мл, 2,462 ммоль) в MeOH (2,00 мл) и CH2Cl2 (2 мл) при комнатной температуре добавляли глютаральдегид (0,155 мл, 0,821 ммоль) в виде 50% раствора в воде. Реакционную смесь перемешивали в течение 30 минут, реакционную смесь фильтровали, промывали при помощи MeOH и концентрировали. Остаток переносили в CH2Cl2, промывали насыщенным раствором NaHCO3, сушили (Na2SO4) и концентрировали с получением указанного в заголовке соединения. МС (DCI; M+H) m/z=276.

Пример 92B
(R)-2-фенил-2-(пиперидин-1-ил)уксусная кислота
Продукт из Примера 92A обрабатывали при помощи ТФУК (1,5 мл) при комнатной температуре в течение 3 часов. Летучие компоненты удаляли под вакуумом, остаток концентрировали из толуола (×2) и сушили в вакуумной печи с получением указанного в заголовке соединения, которое использовали без дополнительной очистки. МС (DCI; M+H) m/z=220.

Пример 92C
(2S,2'S)-N,N'-{[(4-фторфенил)имино]бис(метандиилбензол-4,1-диил)}бис{1-[(2R)-2-фенил-2-пиперидин-1-илацетил]пирролидин-2-карбоксамид}
Продукт из Примера 13D и продукт из Примера 92B обрабатывали с использованием способа, описанного в Примере 41, с получением 30 мг (11%) указанного в заголовке соединения.1H ЯМР (500 МГц, метанол-Д4) δ 1,40-1,45 (м, 4H) 1,50-1,58 (м, 8H) 1,79-1,88 (м, 2H) 1,92-2,02 (м, 2H) 2,05-2,14 (м, 4H) 2,30-2,40 (м, 4H) 2,35-2,48 (м, 4H) 3,43-3,51 (м, 2H) 3,87-3,93 (м, 2H) 4,15 (м, 2H) 4,42 (дд, J=7,78, 4,43 Гц, 2H) 4,54 (с, 4H) 6,69-6,75 (м, 2H) 6,81-6,88 (м, 2H) 7,17-7,23 (м, 4H) 7,30-7,38 (м, 8H) 7,46-7,53 (м, 8H).
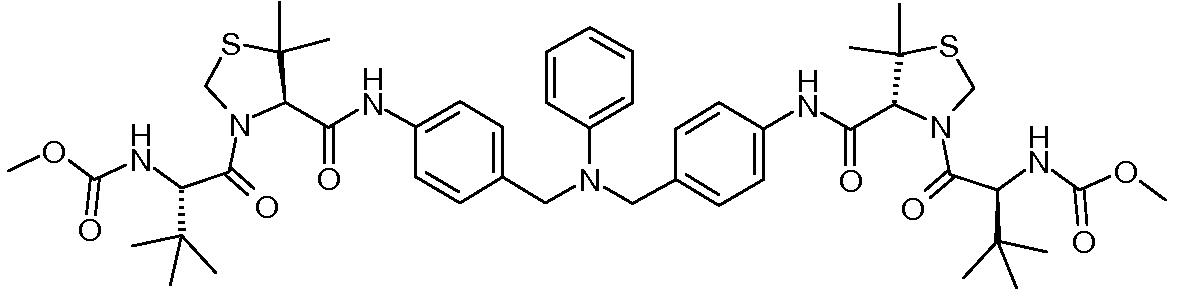
Пример 93
Метил [(1S)-1-{[(4R)-4-{[4-({[4-({[(4R)-3-{(2S)-2-[(метоксикарбонил)амино]-3,3-диметилбутаноил}-5,5-диметил-1,3-тиазолидин-4-ил]карбонил}амино)бензил](фенил)амино}метил)фенил]карбамоил}-5,5-диметил-1,3-тиазолидин-3-ил]карбонил}-2,2-диметилпропил]карбамат

Пример 93A
(4R,4'R)-трет-бутил 4,4'-(4,4'-(фенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(оксометилен)бис(5,5-диметилтиазолидин-3-карбоксилат)
Указанное в заголовке соединение получали с использованием способов из Примера 1C, заменяя N-(трет-бутоксикарбонил)-L-пролин на (R)-3-(трет-бутоксикарбонил)-5,5-диметилтиазолидин-4-карбоновую кислоту, с получением указанного в заголовке соединения (0,32 г, 61% выход).

Пример 93B
(4R,4'R)-N,N'-(4,4'-(фенилазанедиил)бис(метилен)бис(4,1-фенилен))бис(5,5-диметилтиазолидин-4-карбоксамид)
Указанное в заголовке соединение получали с использованием способов из Примера 1D, заменяя продукт из Примера 1C на продукт из Примера 93A, с получением указанного в заголовке соединения (0,23 г, 97% выход).
Пример 93C
Метил [(1S)-1-{[(4R)-4-{[4-({[4-({[(4R)-3-{(2S)-2-[(метоксикарбонил)амино]-3,3-диметилбутаноил}-5,5-диметил-1,3-тиазолидин-4-ил]карбонил}амино)бензил](фенил)амино}метил)фенил]карбамоил}-5,5-диметил-1,3-тиазолидин-3-ил]карбонил}-2,2-диметилпропил]карбамат
Указанное в заголовке соединение получали с использованием способов из Примера 13E, заменяя продукт из Примера 13D на продукт из Примера 93B, с получением указанного в заголовке соединения.1H ЯМР (500 МГц, ДМСО) δ 10,02 (с, 2H), 7,51 (д, J=8,6, 4H), 7,28 (д, J=8,1, 2H), 7,19 (д, J=8,6, 4H), 7,08 (дд, J=7,3, 8,7, 2H), 6,66 (д, J=8,1, 2H), 6,57 (т, J=7,2, 1H), 5,07 (д, J=8,6, 2H), 4,85 (д, J=8,6, 2H), 4,65-4,56 (м, 6H), 4,22 (д, J=8,0, 2H), 3,55 (с, 6H), 1,50 (с, 6H), 1,36 (с, 6H), 0,97 (с, 18H), МС (ECI; М+H) м/z=933.
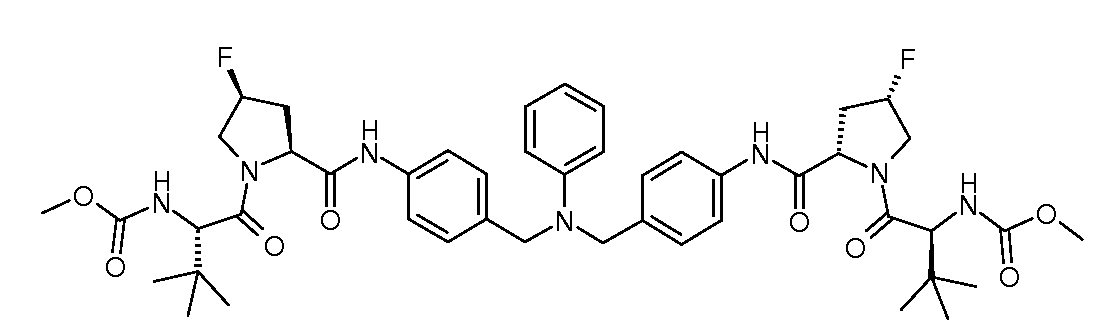
Пример 94
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил[(2S,4S)-4-фторпирролидин-2,1-диил][(2S)-3,3-диметил-1-оксобутан-1,2-диил]}]бискарбамат
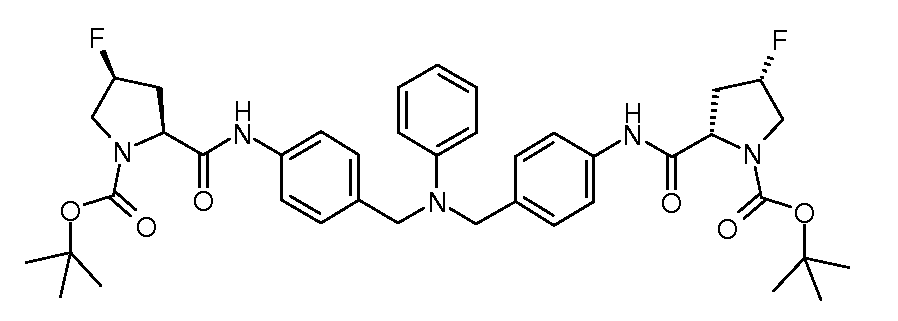
Пример 94A
(3S,3'S,5S,5'S)-трет-бутил 5,5'-(4,4'-(фенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(оксометилен)бис(3-фторпирролидин-1-карбоксилат)
Указанное в заголовке соединение получали с использованием способов из Примера 1C, заменяя N-(трет-бутоксикарбонил)-L-пролин на (2S,4S)-1-(трет-бутоксикарбонил)-4-фторпирролидин-2-карбоновую кислоту, с получением указанного в заголовке соединения (0,42 г, 87% выход).
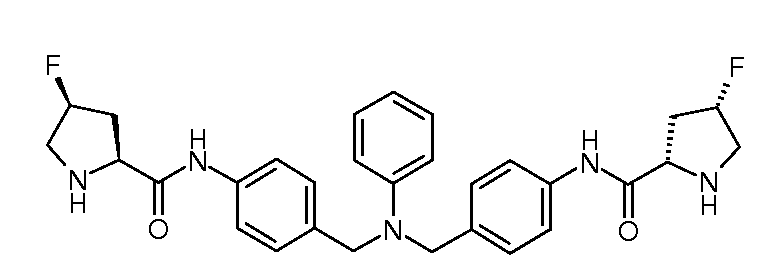
Пример 94B
(2S,2'S,4S,4'S)-N,N'-(4,4'-(фенилазанедиил)бис(метилен)бис(4,1-фенилен))бис(4-фторпирролидин-2-карбоксамид)
Указанное в заголовке соединение получали с использованием способов из Примера 1D, заменяя продукт из Примера 1C на продукт из Примера 94A, с получением указанного в заголовке соединения (0,29 г, 93% выход).
Пример 94C
Диметил [(фенилимино)бис{метандиилбензол-4,1-диилкарбамоил[(2S,4S)-4-фторпирролидин-2,1-диил][(2S)-3,3-диметил-1-оксобутан-1,2-диил]}]бискарбамат
Указанное в заголовке соединение получали с использованием способов из Примера 13E, заменяя продукт из Примера 13D на продукт из Примера 94B, с получением указанного в заголовке соединения (89 мг, 57% выход).1H ЯМР (500 МГц, ДМСО) δ 9,88 (с, 2H), 7,49 (д, J=8,5, 4H), 7,22-7,14 (м, 6H), 7,06 (дд, J=7,3, 8,7, 2H), 6,65 (д, J=8,1, 2H), 6,56 (т, J=7,2, 1H), 5,36 (д, J=53,5, 2H), 4,65 (дд, J=2,1, 10,0, 2H), 4,59 (с, 4H), 4,16 (д, J=8,7, 2H), 4,12-4,04 (м, 1H), 4,04-3,86 (м, 3H), 3,54 (с, 6H), 2,29-2,19 (м, 2H), 0,98 (с, 18H), МС (ECI; М+H) м/z=877.
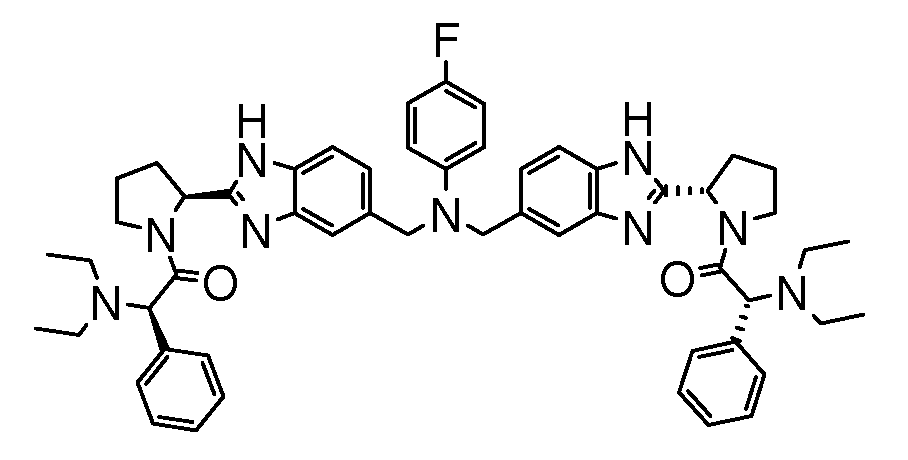
Пример 95
N,N-бис[(2-{(2S)-1-[(2R)-2-(Диэтиламино)-2-фенилацетил]пирролидин-2-ил}-1Н-бензимидазол-5-ил)метил]-4-фторанилин

Пример 95A
(S)-трет-бутил 2-(5-формил-1H-бензо[d]имидазол-2-ил)пирролидин-1-карбоксилат
Продукт Примера 7B (1,0 г, 3,15 ммоль) и MnO2 (1,37 г, 15,75 ммоль) в тетрагидрофуране (20 мл) нагревали до температуры кипения с обратным холодильником в течение 24 часов. Смесь фильтровали и концентрировали с получением указанного в заголовке соединения (0,99 г, 100%). МС (ESI) m/z 316 (M+H)+.

Пример 95B
(S)-трет-бутил 2-(5-((4-фторфениламино)метил)-1H-бензо[d]имидазол-2-ил)пирролидин-1-карбоксилат
К смеси продукта из Примера 95A (1,0 г, 3,17 ммоль), 4-фторанилина (304 мкл, 3,17 ммоль) и AcOH (150 мкл) в MeOH (30 мл) добавляли цианоборгидрид натрия (199 мг, 3,17 ммоль). Смесь перемешивали при комнатной температуре в течение ночи и затем гасили водным 1 н. раствором HCl с последующим перемешивании в течение 5 минут. Добавляли несколько капель водного раствора NH4OH и смесь разбавляли при помощи EtOAc и промывали насыщенным водным NaHCO3, H2O и насыщенным солевым раствором. Органический слой сушили (MgSO4), фильтровали и концентрировали с получением указанного в заголовке соединения (1,3 г, 100%). МС (ESI) m/z 411 (M+H)+.

Пример 95C
(2S,2'S)-трет-бутил 2,2'-(5,5'-(4-фторфенилазанедиил)бис(метилен)бис(1H-бензо[d]имидазол-5,2-диил))дипирролидин-1-карбоксилат
Продукт Примера 95B (1,29 г, 3,14 ммоль), Примера 7C (1,2 г, 3,14 ммоль) и K2CO3 (1,3 г, 9,43 ммоль) в диметилформамиде (25 мл) обрабатывали с использованием способа, описанного в Примере 7D, с получением указанного в заголовке соединения (1,3 г, 58%). МС (ESI) m/z 710 (M+H)+.

Пример 95D
4-фтор-N,N-бис((2-((S)-пирролидин-2-ил)-1H-бензо[d]имидазол-5-ил)метил)анилин
Продукт Примера 95C (1,3 г, 1,83 ммоль) обрабатывали с использованием способа, описанного в Примере 7E, с получением указанного в заголовке соединения (0,46 г, 50%). МС (ESI) m/z 510 (M+H)+.
Пример 95E
N,N-бис[(2-{(2S)-1-[(2R)-2-(диэтиламино)-2-фенилацетил]пирролидин-2-ил}-1Н-бензимидазол-5-ил)метил]-4-фторанилин
Продукт из Примера 95D (20 мг, 0,039 ммоль) подвергали процедуре, описанной в Примере 7F, заменяя (S)-2-(метоксикарбониламино)-3,3-диметилбутановую кислоту на гидрохлорид (R)-2-(диэтиламино)-2-фенилуксусной кислоты (23,9 мг, 0,098 ммоль), с получением указанного в заголовке соединения в виде соли ТФУК (8,5 мг).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,76 (т, J=7,0 Гц, 1H), 0,99 (т, J=7,0 Гц, 2H), 1,07-1,16 (м, 11H), 1,22-1,31 (м, 4H), 1,91 (с, 3H), 1,99-2,08 (м, 5H), 2,17-2,25 (м, 3H), 3,05-3,15 (м, 10H), 4,11-4,18 (м, 2H), 4,83 (с, 3H), 5,21 (дд, J=8,5, 2,7 Гц, 2H), 5,45 (с, 2H), 6,68-6,77 (м, 2H), 6,93 (т, J=8,9 Гц, 2H), 7,27 (д, J=8,2 Гц, 2H), 7,47 (с, 2H), 7,52-7,61 (м, 8H), 7,63-7,70 (м, 4H); МС (ECI) м/z 888,6 (М+H)+.

Пример 96
Метил [(1S)-1-{[(2S)-2-(5-{[(4-фторфенил)({2-[(2S)-1-{(2S)-2-[(метоксикарбонил)амино]-3-метилбутаноил}пирролидин-2-ил]-1Н-бензимидазол-5-ил}метил)амино]метил}-1Н-бензимидазол-2-ил)пирролидин-1-ил]карбонил}-2-метилпропил]карбамат
Продукт из Примера 95D (20 мг, 0,039 ммоль) подвергали процедуре, описанной в Примере 7F, заменяя (S)-2-(метоксикарбониламино)-3,3-диметилбутановую кислоту на (S)-2-(метоксикарбониламино)-3-метилбутановую кислоту (17,2 мг, 0,098 ммоль), с получением указанного в заголовке соединения в виде соли ТФУК (8 мг).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,75-0,84 (м, 11H), 1,20-1,28 (м, 2H), 1,97 (дд, J=13,8, 6,8 Гц, 3H), 2,05-2,14 (м, 4H), 2,18 (дд, J=11,9, 6,4 Гц, 2H), 3,54 (с, 14H), 3,81-3,90 (м, 4H), 4,12 (т, J=7,9 Гц, 2H), 4,87 (с, 3H), 5,20 (дд, J=7,9, 5,5 Гц, 2H), 6,69-6,75 (м, 2H), 6,94 (т, J=8,9 Гц, 2H), 7,33 (д, J=8,4 Гц, 2H), 7,41 (д, J=8,4 Гц, 2H), 7,55 (с, 2H), 7,71 (д, J=8,4 Гц, 2H); МС (ECI) м/z 824,4 (М+H)+.
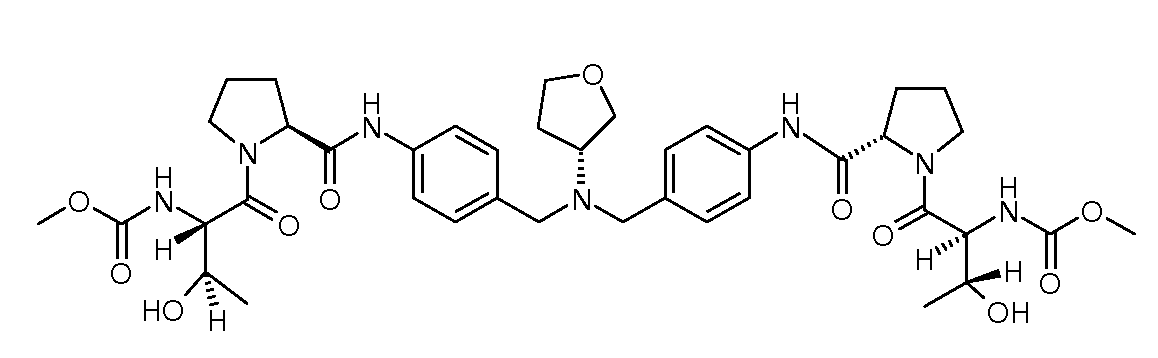
Пример 97
Диметил ([(3R)-тетрагидрофуран-3-илимино]бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S,3R)-3-гидрокси-1-оксобутан-1,2-диил]})бискарбамат
К раствору продукта из Примера 44D (0,05 г, 0,102 ммоль) в ДМСО (1,0 мл) при комнатной температуре добавляли продукт из Примера 25A (0,040 г, 0,224 ммоль), HATU (0,085 г, 0,244 ммоль) и основание Хунига (0,089 мл, 0,509 ммоль) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь разбавляли этилацетатом и промывали насыщенным раствором NaHCO3, водой и насыщенным раствором NaCl. Органический слой сушили над MgSO4, фильтровали и упаривали. Продукт очищали при помощи хроматографии на силикагеле с получением указанного в заголовке соединения.1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,14 (д, J=6,40 Гц, 6H) 1,80-2,03 (м, 8H) 2,10-2,22 (м, 2H) 3,33-3,44 (м, 3H) 3,47-3,53 (м, 2H) 3,53 (с, 6H) 3,56-3,64 (м, 2H) 3,66-3,75 (м, 2H) 3,76-3,87 (м, 4H) 4,21 (т, J=7,37 Гц, 2H) 4,43 (дд, J=8,29, 4,72 Гц, 2H) 4,81 (д, J=5,64 Гц, 2H) 7,09 (д, J=7,48 Гц, 2H) 7,24 (д, J=8,46 Гц, 4H) 7,52 (д, J=8,46 Гц, 4H) 9,83 (с, 2H), МС (ECI) м/z 810,4 (М+H)+.
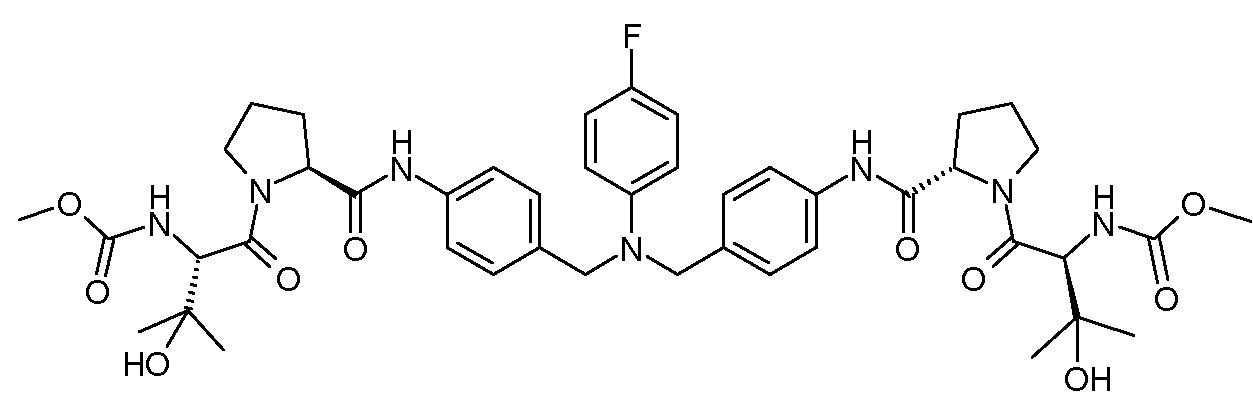
Пример 98
Диметил ([(4-фторфенил)имино]бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-3-гидрокси-3-метил-1-оксобутан-1,2-диил]})бискарбамат
Продукт из Примера 13D (0,03 г, 0,058 ммоль) и (S)-3-гидрокси-2-(метоксикарбониламино)-3-метилбутановую кислоту (0,025 г, 0,128 ммоль) обрабатывали, как в Примере 25B, с получением 0,010 г (82%) указанного в заголовке соединения в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, ДМСО- d6) δ м.д. 1,15 (с, 6H) 1,22 (с, 6H) 1,86-1,98 (м, 6H) 2,11-2,23 (м, 2H) 3,55 (с, 6H) 3,65-3,74 (м, 2H) 3,83-3,94 (м, 2H) 4,38 (д, J=8,67 Гц, 2H) 4,44-4,51 (м, 2H) 4,56 (с, 4H) 5,09 (с, 2H) 6,63 (дд, J=9,22, 4,45 Гц, 2H) 6,91 (т, J=8,89 Гц, 2H) 7,11-7,21 (м, 6H) 7,52 (д, J=8,46 Гц, 4H) 9,66 (с, 2H); МС ECI+м/z 862 (М+H)+; м/z 879 (М+NH4)+.
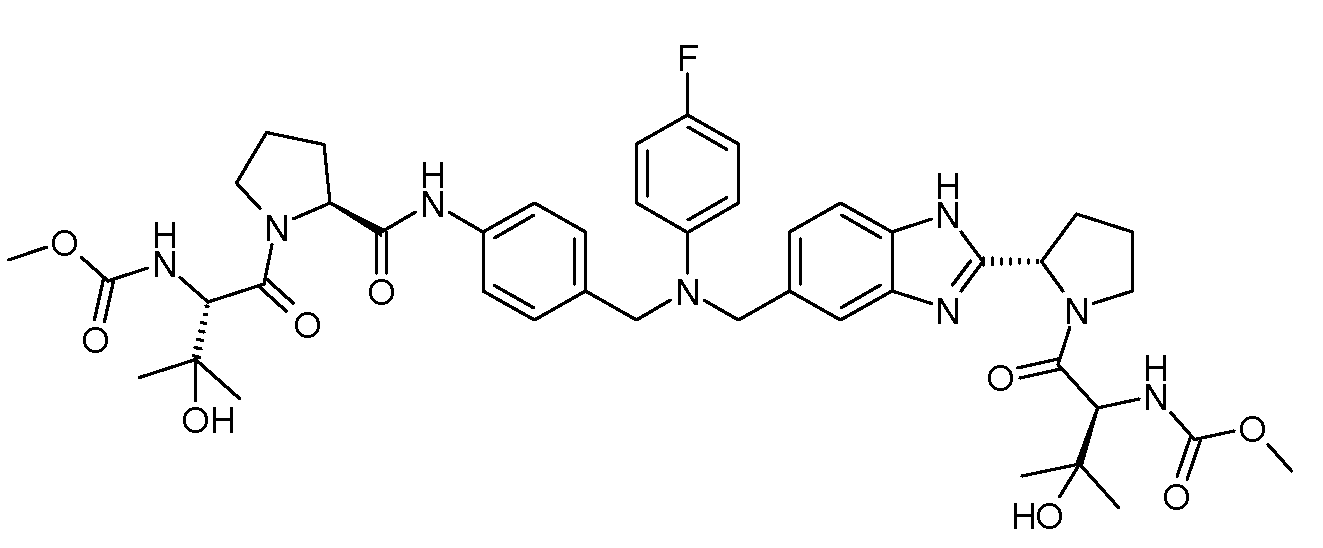
Пример 99
3-Гидрокси-N-(метоксикарбонил)-L-валил-N-[4-({(4-фторфенил)[(2-{(2S)-1-[3-гидрокси-N-(метоксикарбонил)-L-валил]пирролидин-2-ил}-1Н-бензимидазол-5-ил)метил]амино}метил)фенил]-L-пролинамид
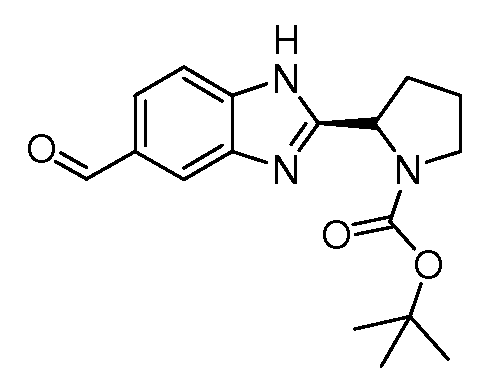
Пример 99A
(S)-трет-бутил 2-(5-формил-1H-бензо[d]имидазол-2-ил)пирролидин-1-карбоксилат
Продукт из Примера 7B (0,50 г, 1,58 ммоль) растворяли в тетрагидрофуране (8 мл), нагревали до 70°C и обрабатывали при помощи диоксида марганца, добавляя его в количестве (0,27 г, 3,5 ммоль) каждые два часа до завершения реакции в общем количестве 10 эквивалентов. Раствор фильтровали через целит и концентрировали досуха с получением указанного в заголовке соединения.
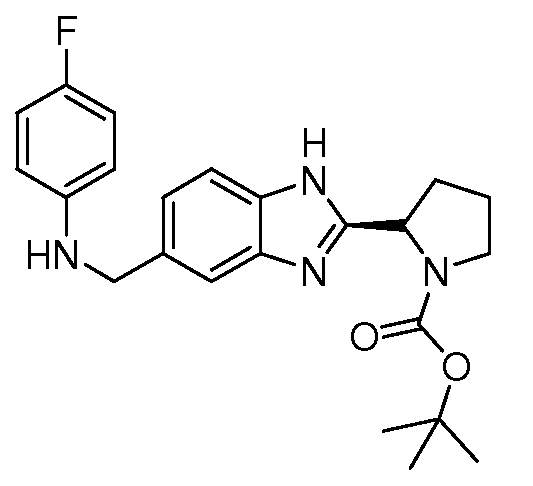
Пример 99B
(S)-трет-бутил 2-(5-((4-фторфениламино)метил)-1H-бензо[d]имидазол-2-ил)пирролидин-1-карбоксилат
Продукт из Примера 99A (0,50 г, 1,59 ммоль), 4-фторанилин (0,15 г, 1,59 ммоль) и уксусную кислоту (0,09 мл, 1,59 ммоль) объединяли при температуре окружающей среды в метаноле (15 мл) и обрабатывали при помощи цианоборгидрида натрия (0,10 г, 1,59 ммоль) и перемешивали 17 часов. Смесь выливали в воду, экстрагировали в этилацетат, сушили над сульфатом натрия, фильтровали и концентрировали с получением 0,65 г (100%) указанного в заголовке соединения.
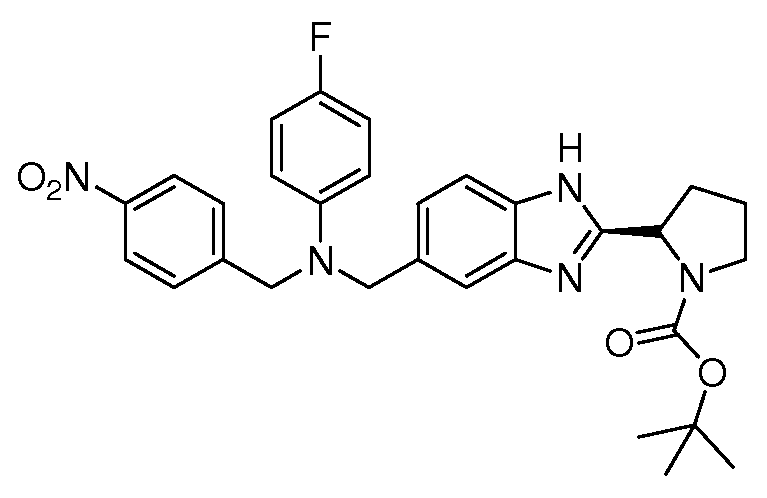
Пример 99C
(S)-трет-бутил 2-(5-(((4-фторфенил)(4-нитробензил)амино)метил)-1H-бензо[d]имидазол-2-ил)пирролидин-1-карбоксилат
Продукт из Примера 99B (0,65 г, 1,58 ммоль), 1-(бромметил)-4-нитробензол (0,479 г, 2,22 ммоль) и карбонат калия (0,547 г, 3,96 ммоль) объединяли в диметилформамиде (15 мл) и нагревали при 40°C в течение 3 часов, затем разбавляли водой и фильтровали. Продукт очищали на колонке combi-flash с 24 г диоксида кремния, элюируя смесью 0-5% метанола в дихлорметане, с получением 0,805 г (93%) указанного в заголовке соединения.

Пример 99D
(S)-трет-бутил 2-(5-(((4-аминобензил)(4-фторфенил)амино)метил)-1H-бензо[d]имидазол-2-ил)пирролидин-1-карбоксилат
Продукт из Примера 99C (0,67 г, 1,23 ммоль) растворяли в этаноле (15 мл) и охлаждали в ледяной бане. Добавляли трихлорид висмута (0,245 мл, 3,68 ммоль) и образовывалась суспензия, к которой порциями добавляли боргидрид натрия (0,743 г, 19,7 ммоль), что приводило к образованию черного осадка. Эту смесь перемешивали при температуре окружающей среды в течение 20 минут, затем повторно охлаждали и гасили метанолом (2 мл), перемешивали в течение 10 минут перед фильтрацией через целит. Отфильтрованное вещество концентрировали с получением указанного в заголовке соединения.

Пример 99E
(R)-(9H-флуорен-9-ил)метил 2-(4-((((2-((S)-1-(трет-бутоксикарбонил)пирролидин-2-ил)-1H-бензо[d]имидазол-5-ил)метил)(4-фторфенил)амино)метил)фенилкарбамоил)пирролидин-1-карбоксилат
Продукт из Примера 99D (0,251 г, 0,75 ммоль), FMOC-PRO-OH (0,32 г, 0,621 ммоль) и диизопропилэтиламин (0,27 мл, 1,55 ммоль) объединяли в диметилсульфоксиде (8 мл) при температуре окружающей среды и обрабатывали при помощи HATU (0,26 г, 0,683 ммоль). Раствор перемешивали в течение 40 минут, затем разбавляли водой, фильтровали и очищали на колонке combi-flash с 24 г диоксида кремния, элюируя смесью 0-5% метанола в дихлорметане, с получением 0,38 г (55%) указанного в заголовке соединения.
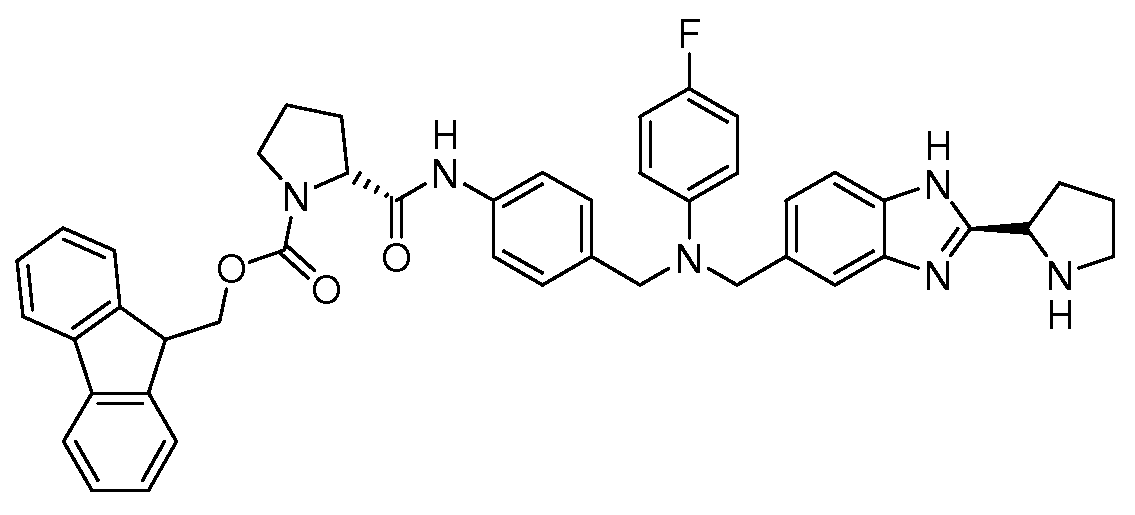
Пример 99F
(R)-(9H-флуорен-9-ил)метил 2-(4-(((4-фторфенил)((2-((S)-пирролидин-2-ил)-1H-бензо[d]имидазол-5-ил)метил)амино)метил)фенилкарбамоил)пирролидин-1-карбоксилат
Продукт из Примера 99E (0,38 г, 0,455 ммоль) растворяли в дихлорметане (4 мл) и обрабатывали при помощи трифторуксусной кислоты (3 мл) при температуре окружающей среды в течение 3 часов, затем концентрировали досуха, переносили в этилацетат и промывали раствором бикарбонат натрия. Органический слой сушили над сульфатом натрия, фильтровали и концентрировали с получением 0,092 г (28%) указанного в заголовке соединения.
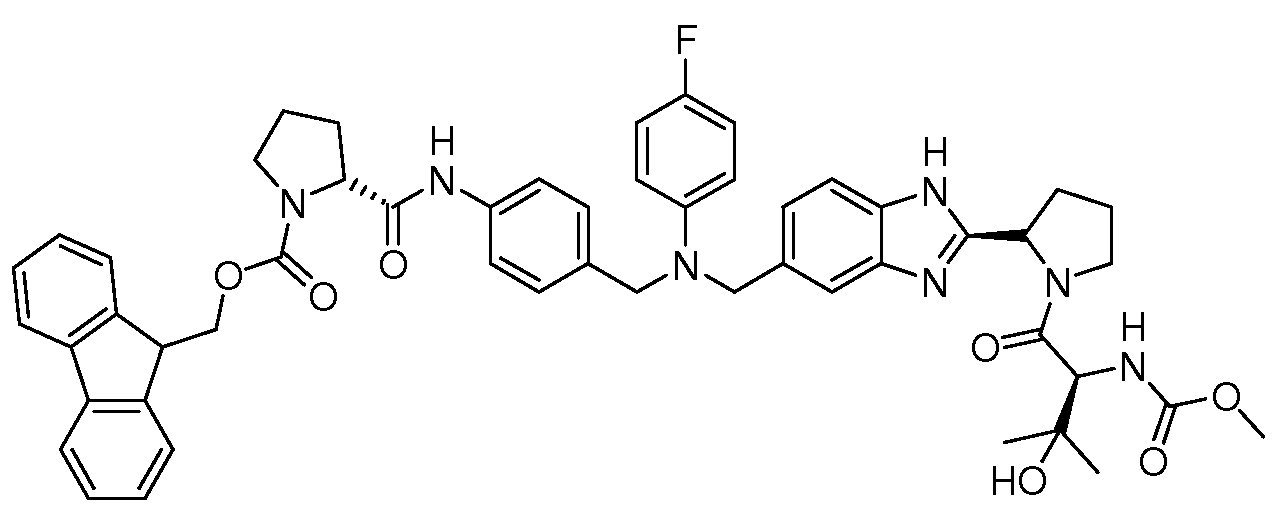
Пример 99G
(R)-(9H-флуорен-9-ил)метил 2-(4-(((4-фторфенил)((2-((S)-1-((S)-3-гидрокси-2-(метоксикарбониламино)-3-метилбутаноил)пирролидин-2-ил)-1H-бензо[d]имидазол-5-ил)метил)амино)метил)фенилкарбамоил)пирролидин-1-карбоксилат
Продукт из Примера 99F (0,092 г, 0,125 ммоль), (S)-3-гидрокси-2-(метоксикарбониламино)-3-метилбутановую кислоту (0,029 г, 0,15 ммоль) обрабатывали, как в Примере 99E, с получением 0,115 г (100%) указанного в заголовке соединения.

Пример 99H
Метил (S)-1-((S)-2-(5-(((4-фторфенил)(4-((R)-пирролидин-2-карбоксамидо)бензил)амино)метил)-1H-бензо[d]имидазол-2-ил)пирролидин-1-ил)-3-гидрокси-3-метил-1-оксобутан-2-илкарбамат
Продукт из Примера 99G (0,115 г, 0,127 ммоль) растворяли в ацетонитриле (2 мл) при температуре окружающей среды и обрабатывали диэтиламином (1 мл) в течение 1 часа. Раствор концентрировали досуха с получением неочищенного указанного в заголовке соединения.
Пример 99I
3-гидрокси-N-(метоксикарбонил)-L-валил-N-[4-({(4-фторфенил)[(2-{(2S)-1-[3-гидрокси-N-(метоксикарбонил)-L-валил]пирролидин-2-ил}-1Н-бензимидазол-5-ил)метил]амино}метил)фенил]-L-пролинамид
Продукт из Примера 99H (0,087 г, 0,127 ммоль) обрабатывали, как в Примере 99G, с получением 0,048 г (44%) не совсем белого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,06 (д, J=7,05 Гц, 3H) 1,15 (с, 3H) 1,17 (с, 3H) 1,23 (с, 3H) 1,87-2,05 (м, 6H) 2,13-2,20 (м, 1H) 2,23-2,30 (м, 1H) 3,55 (с, 6H) 3,69 (ддд, J=16,13, 8,00, 7,86 Гц, 2H) 3,84-3,92 (м, 1H) 4,08-4,15 (м, 1H) 4,40 (дд, J=14,42, 8,78 Гц, 2H) 4,47 (дд, J=8,35, 3,36 Гц, 1H) 4,59 (д, J=2,93 Гц, 2H) 4,70 (д, J=8,67 Гц, 2H) 5,09 (д, J=2,49 Гц, 1H) 5,22-5,28 (м, 1H) 5,84 (д, J=5,64 Гц, 1H) 6,64-6,70 (м, 2H) 6,90 (тд, J=8,84, 4,77 Гц, 2H) 7,03-7,09 (м, 2H) 7,14 (д, J=8,67 Гц, 1H) 7,19 (д, J=7,59 Гц, 2H) 7,30 (д, J=20,28 Гц, 1H) 7,39 (дд, J=11,66, 8,29 Гц, 1H) 7,52 (дд, J=8,51, 1,57 Гц, 2H) 9,67 (д, J=2,39 Гц, 1H) 12,11 (д, J=13,34 Гц, 1H); МС ECI+м/z 859 (М+H)+.
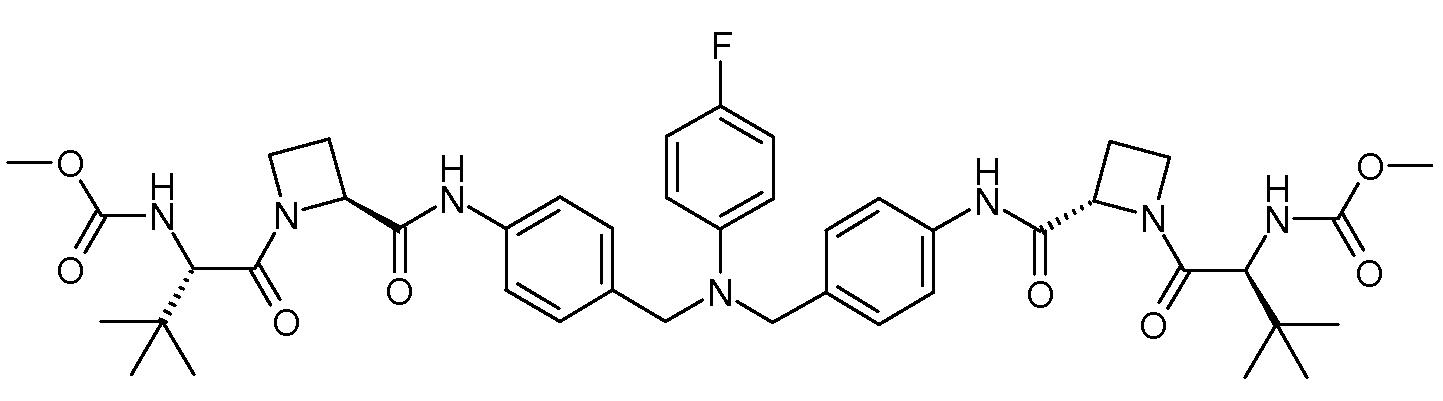
Пример 100
Метил [(1S)-1-{[(2S)-2-{[4-({(4-фторфенил)[4-({[(2S)-1-{(2S)-2-[(метоксикарбонил)амино]-3,3-диметилбутаноил}азетидин-2-ил]карбонил}амино)бензил]амино}метил)фенил]карбамоил}азетидин-1-ил]карбонил}-2,2-диметилпропил]карбамат

Пример 100A
(2S,2'S)-трет-бутил 2,2'-(4,4'-(4-фторфенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(оксометилен)диазетидин-1-карбоксилат
Продукт Примера 13B и (S)-N-Boc-азетидинкарбоновую кислоту обрабатывали с использованием способа, описанного в Примере 1C, заменяя ДМСО на дихлорметан, с получением указанного в заголовке соединения. LC/MS Rt 2,04 m/z 688 (M+H)+.
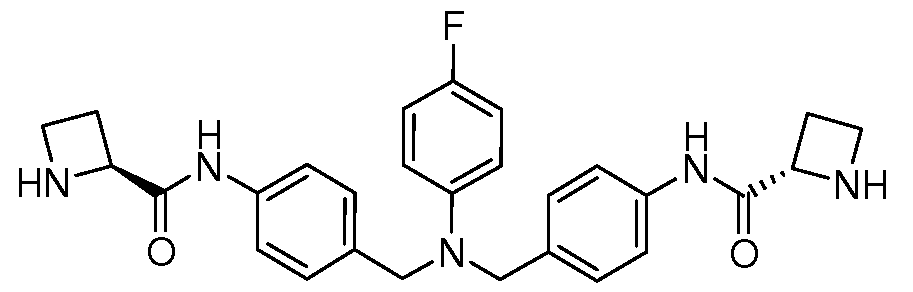
Пример 100B
(2S,2'S)-N,N'-(4,4'-(4-фторфенилазанедиил)бис(метилен)бис(4,1-фенилен))диазетидин-2-карбоксамид
Продукт из Примера 100A обрабатывали с использованием способа, описанного в Примере 1D, с получением указанного в заголовке соединения. МС (ESI) m/z 488 (M+H)+, 486 (M-H)+.
Пример 100C
Метил [(1S)-1-{[(2S)-2-{[4-({(4-фторфенил)[4-({[(2S)-1-{(2S)-2-[(метоксикарбонил)амино]-3,3-диметилбутаноил}азетидин-2-ил]карбонил}амино)бензил]амино}метил)фенил]карбамоил}азетидин-1-ил]карбонил}-2,2-диметилпропил]карбамат
Продукт из Примера 100B обрабатывали с использованием способа, описанного в Примере 13E, с получением указанного в заголовке соединения (93,9 мг, 21%).1H ЯМР (400 МГц, ДМСО) δ 0,96 (с, 18H), 2,28-2,11 (м, 2H), 2,48-2,36 (м, 2H), 3,55 (с, 6H), 3,85 (д, J=8,6, 2H), 4,30-4,14 (м, 4H), 4,57 (с, 4H), 4,79 (дд, J=8,9, 5,7, 2H), 6,64 (дд, J=9,2, 4,4, 2H), 6,91 (т, J=8,9, 2H), 7,20 (т, J=7,9, 6H), 7,53 (д, J=8,4, 4H), 10,05 (с, 2H), МС (ECI) м/z 830 (М+H)+, 828 (М-H)+.
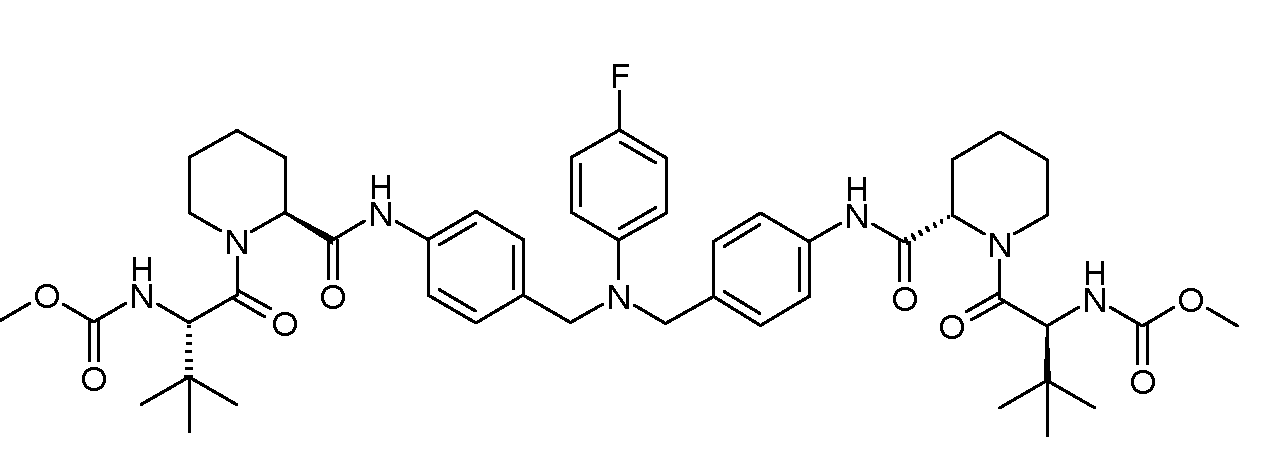
Пример 101
Метил [(1S)-1-{[(2S)-2-{[4-({(4-фторфенил)[4-({[(2S)-1-{(2S)-2-[(метоксикарбонил)амино]-3,3-диметилбутаноил}пиперидин-2-ил]карбонил}амино)бензил]амино}метил)фенил]карбамоил}-пиперидин-1-ил]карбонил}-2,2-диметилпропил]карбамат
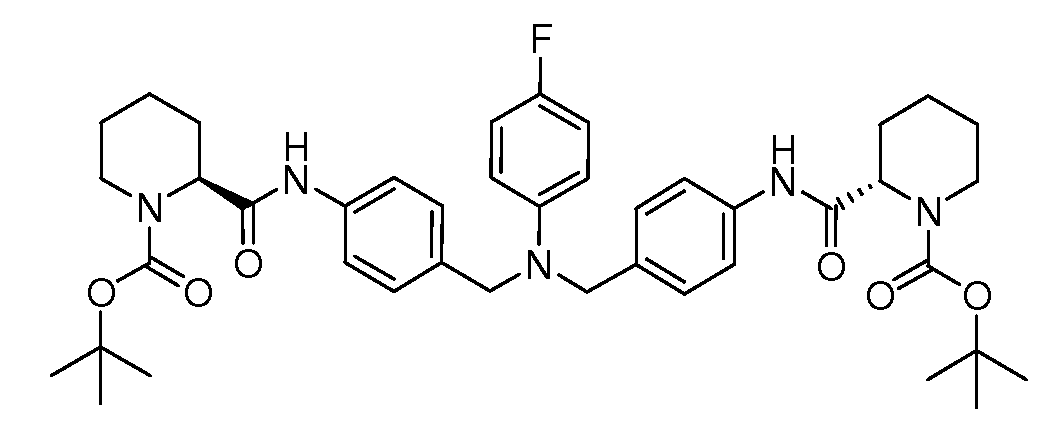
Пример 101A
(2S,2'S)-трет-бутил 2,2'-(4,4'-(4-фторфенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(оксометилен)дипиперидин-1-карбоксилат
Продукт из Примера 13B и Boc-L-пипеколиновую кислоту обрабатывали с использованием способа, описанного в Примере 1C, заменяя ДМСО на дихлорметан, с получением указанного в заголовке соединения. LC/MS Rt 2,31 m/z 744 (M+H)+.
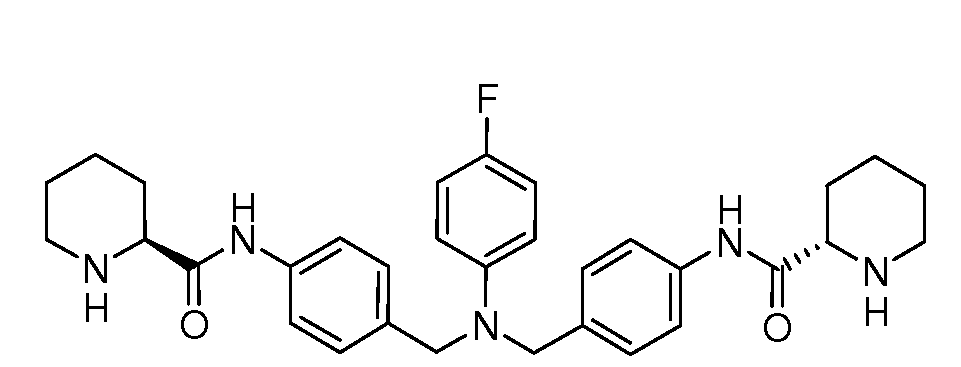
Пример 101B
(2S,2'S)-N,N'-(4,4'-(4-фторфенилазанедиил)бис(метилен)бис(4,1-фенилен))дипиперидин-2-карбоксамид
Продукт из Примера 101A обрабатывали с использованием способа, описанного в Примере 1D, с получением указанного в заголовке соединения. МС (DCI) m/z 544 (M+H)+.
Пример 101C
Метил [(1S)-1-{[(2S)-2-{[4-({(4-фторфенил)[4-({[(2S)-1-{(2S)-2-[(метоксикарбонил)амино]-3,3-диметилбутаноил}пиперидин-2-ил]карбонил}амино)бензил]амино}метил)фенил]карбамоил}-пиперидин-1-ил]карбонил}-2,2-диметилпропил]карбамат
Продукт из Примера 101B обрабатывали с использованием способа, описанного в Примере 13E, заменяя ДМФА на дихлорметан, с получением указанного в заголовке соединения (0,23 г, 57%).1H ЯМР (400 МГц, ДМСО) δ 0,95 (с, 13H), 0,97 (д, J=10,6, 5H), 1,80-1,08 (м, 12H), 2,10 (д, J=13,1, ,51H), 2,27 (д, J=10,5, 0,5H), 3,54 (с, 6H), 4,03 (д, J=12,2, 1H), 4,44 (дд, J=12,9, 6,5, 1H), 4,56 (д, J=5,9, 6H), 5,10 (с, 0,5H), 5,20 (с, 1,5H), 6,64 (дд, J=9,1, 4,4, 2H), 6,91 (т, J=8,9, 2H), 7,05 (д, J=9,1, 1H), 7,20 (дд, J=18,9, 9,9, 5H), 7,50 (д, J=8,5, 3H), 7,60 (д, J=8,3, 1H), 9,83 (с, 0,5H), 9,88 (с, 1,5H), МС (ECI) м/z 886 (М+H+, 20%) 944 (М+CH3CN+NH4, 100%), 884 (М-H)+.
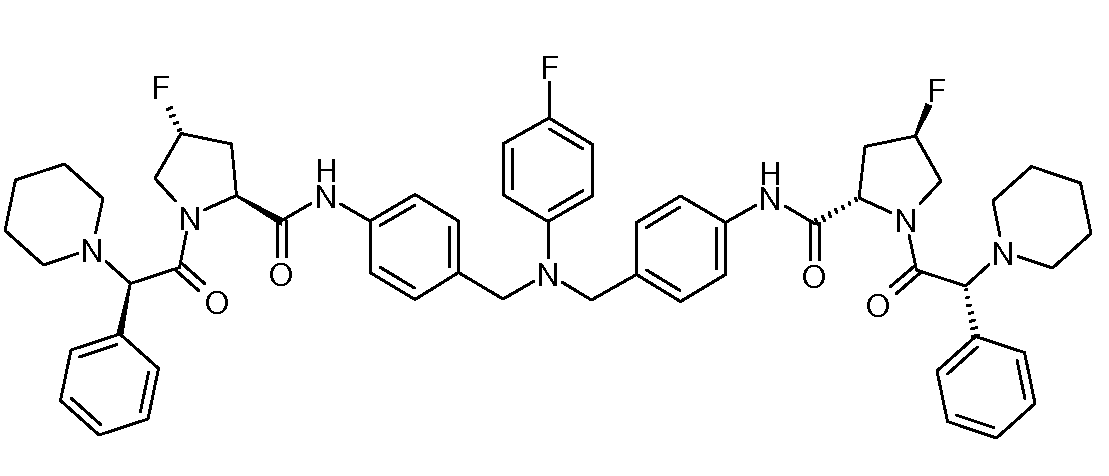
Пример 102
(2S,4R,2'S,4'R)-N,N'-{[(4-Фторфенил)имино]бис(метандиилбензол-4,1-диил)}бис{4-фтор-1-[(2R)-2-фенил-2-пиперидин-1-илацетил]пирролидин-2-карбоксамид}
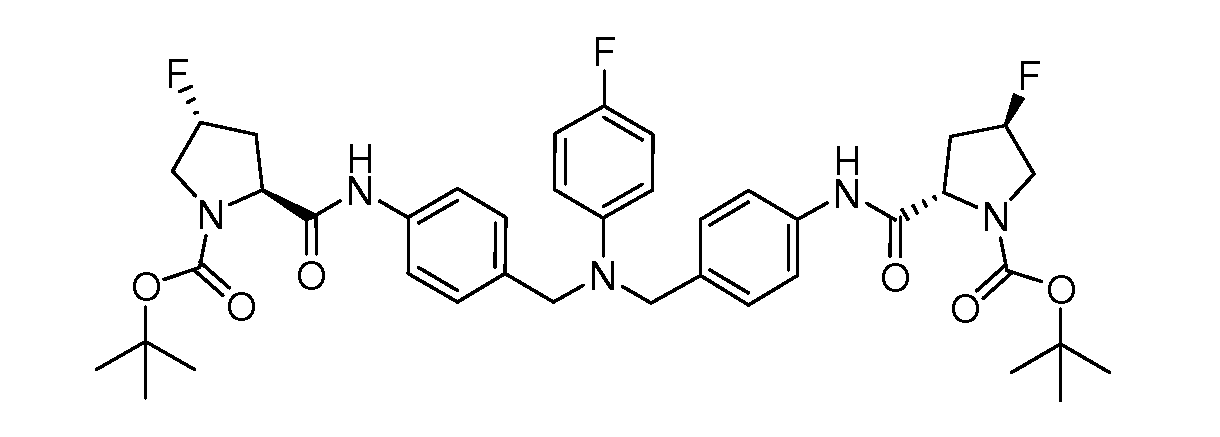
Пример 102 A
(3R,3'R,5S,5'S)-трет-бутил 5,5'-(4,4'-(4-фторфенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(оксометилен)бис(3-фторпирролидин-1-карбоксилат)
Продукт из Примера 13D и (2S,4R)-1-(трет-бутоксикарбонил)-4-фторпирролидин-2-карбоновую кислоту (Aldrich) обрабатывали с использованием способа, описанного в Примере 41, с получением 1,05 г (90%) указанного в заголовке соединения. МС (DCI; M+H) m/z=752.

Пример 102B
(2S,2'S,4R,4'R)-N,N'-(4,4'-(4-фторфенилазанедиил)бис(метилен)бис(4,1-фенилен))бис(4-фторпирролидин-2-карбоксамид)
Продукт из Примера 102A обрабатывали с использованием способа, описанного в Примере 47B, с получением 540 мг (70%) указанного в заголовке соединения. МС (ESI; M+H) m/z=552.
Пример 102C
(2S,4R,2'S,4'R)-N,N'-{[(4-фторфенил)имино]бис(метандиилбензол-4,1-диил)}бис{4-фтор-1-[(2R)-2-фенил-2-пиперидин-1-илацетил]пирролидин-2-карбоксамид}
Продукт из Примера 102B и продукт из Примера 92B обрабатывали с использованием способа, описанного в Примере 41, с получением 25 мг (8%) указанного в заголовке соединения.1H ЯМР (400 МГц, метанол-Д4) δ 1,45-1,55 (м, 4H) 1,58-1,70 (м, 8H) 2,09-2,27 (м, 2H) 2,39-2,90 (м, 10H) 3,75-4,04 (м, 4H) 4,22-4,70 (м, 4H) 4,55 (с, 4H) 5,22 (с, 1H) 5,35 (с, 1H) 6,69-6,76 (м, 2H) 6,81-6,89 (м, 2H) 7,22 (д, J=8,46 Гц, 4H) 7,42 (с, 6H) 7,50 (д, J=8,46 Гц, 4H) 7,54 (д, J=4,23 Гц, 4H).
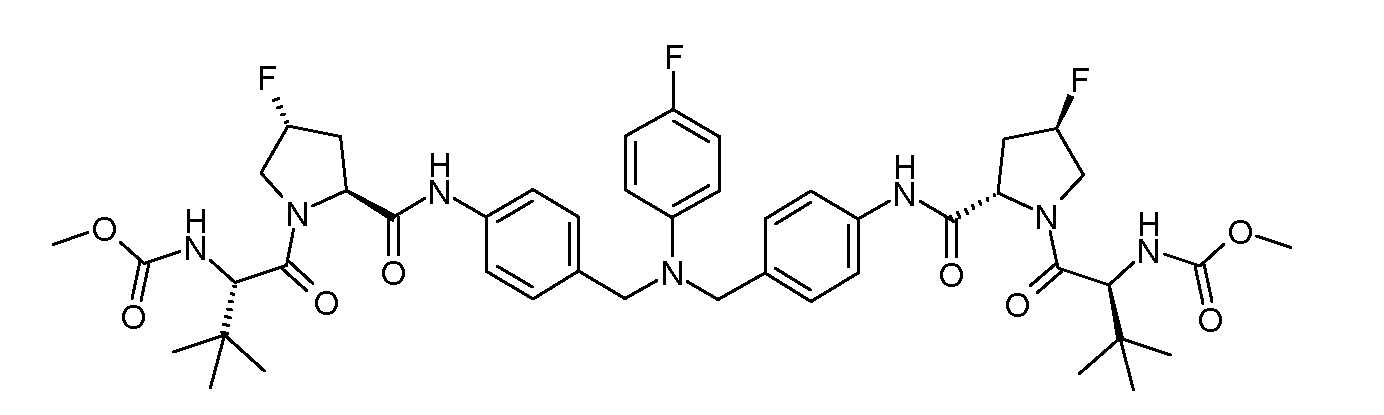
Пример 103
Диметил ([(4-фторфенил)имино]бис{метандиилбензол-4,1-диилкарбамоил[(2S,4R)-4-фторпирролидин-2,1-диил][(2S)-3,3-диметил-1-оксобутан-1,2-диил]})бискарбамат
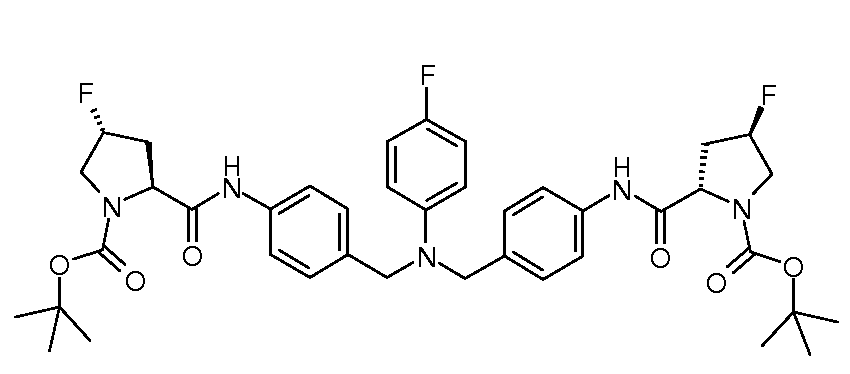
Пример 103A
(3S,3'S,5S,5'S)-трет-бутил 5,5'-(4,4'-(4-фторфенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(оксометилен)бис(3-фторпирролидин-1-карбоксилат)
Указанное в заголовке соединение получали с использованием способов из Примера 13C, заменяя N-(трет-бутоксикарбонил)-L-пролин на (2S,4R)-1-(трет-бутоксикарбонил)-4-фторпирролидин-2-карбоновую кислоту, с получением указанного в заголовке соединения (0,29 г, 83% выход).
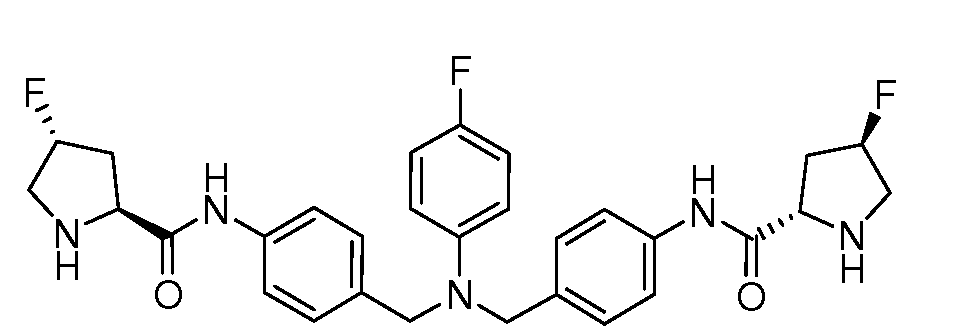
Пример 103B
(2S,2'S,4S,4'S)-N,N'-(4,4'-(4-фторфенилазанедиил)бис(метилен)бис(4,1-фенилен))бис(4-фторпирролидин-2-карбоксамид)
Указанное в заголовке соединение получали с использованием способов из Примера 13D, заменяя продукт из Примера 13C на продукт из Примера 103A, с получением указанного в заголовке соединения.
Пример 103C
Диметил ([(4-фторфенил)имино]бис{метандиилбензол-4,1-диилкарбамоил[(2S,4R)-4-фторпирролидин-2,1-диил][(2S)-3,3-диметил-1-оксобутан-1,2-диил]})бискарбамат
Указанное в заголовке соединение получали с использованием способов из Примера 13E, заменяя продукт из Примера 13D на продукт из Примера 103B, с получением указанного в заголовке соединения (89 мг, 57% выход).1H ЯМР (400 МГц, ДМСО) δ 10,11 (шир. с, 2H), 7,51 (д, J=8,5, 4H), 7,21-7,15 (м, 6H), 6,91 (т, J=8,9, 2H), 6,64 (дд, J=4,4, 9,1, 2H), 5,46 (шир. с, 1H), 5,32 (шир. с, 1H), 4,57-4,48 (м, 6H), 4,20-4,06 (м, 4H), 3,88-3,71 (м, 2H), 3,54 (с, 6H), 3,17 (д, J=5,2, 2H), 2,21-1,97 (м, 2H), 0,96 (с, 18H), МС (ECI; М+H) м/z=895.

Пример 104
Диметил ([(4-фторфенил)имино]бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(1S)-1-циклогексил-2-оксоэтан-2,1-диил]})бискарбамат
Продукт из Примера 13D и (S)-2-циклогексил-2-(метоксикарбониламино)уксусную кислоту обрабатывали с использованием способа, описанного в Примере 13E, заменяя ДМФА на дихлорметан, с получением указанного в заголовке соединения (74,4 мг, 16%).1H ЯМР (400 МГц, ДМСО) δ 1,29-0,83 (м, 10H), 1,69 (дд, J=14,2, 61,5, 12H), 1,93-1,81 (м, 4H), 2,06-1,93 (м, 2H), 2,19-2,06 (м, 2H), 3,51 (с, 6H), 3,66-3,55 (м, 2H), 3,88-3,73 (м, 2H), 4,07 (т, J=8,6, 2H), 4,41 (дд, J=4,8, 8,1, 2H), 4,55 (с, 4H), 6,69-6,56 (м, 2H), 6,97-6,83 (м, 2H), 7,17 (д, J=8,5, 4H), 7,30 (д, J=8,4, 2H), 7,50 (д, J=8,5, 4H), 9,96 (с, 2H), МС (ECI) м/z 910 (М+H)+, 908 (М-H)+.

Пример 105
(2S,2'S)-N,N'-{[(4-Фторфенил)имино]бис(метандиилбензол-4,1-диил)}бис[1-(3-этил-3-гидрокси-2-фенилпентаноил)пирролидин-2-карбоксамид]
Продукт из Примера 13D (30 мг, 0,058 ммоль) подвергали процедуре, описанной в Примере 24E, заменяя (S)-2-(метоксикарбониламино)-3-метилбутановую кислоту на 3-этил-3-гидрокси-2-фенилпентановую кислоту (27 мг, 0,122 ммоль), с получением указанного в заголовке соединения в виде соли ТФУК (11 мг).1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 0,66-0,74 (м, 7H), 0,84 (т, J=7,4 Гц, 6H), 1,00 (д, J=7,9 Гц, 4H), 1,52-1,63 (м, 3H), 1,86 (д, J=7,3 Гц, 4H), 2,05 (д, J=16,6 Гц, 2H), 3,30 (с, 2H), 3,34-3,42 (м, 2H), 3,83 (д, J=13,3 Гц, 3H), 4,32-4,39 (м, 1H), 4,50 (с, 1H), 4,53-4,61 (м, 5H), 6,65 (ддд, J=9,3, 4,9, 4,7 Гц, 2H), 6,88-6,96 (м, 3H), 7,14-7,22 (м, 4H), 7,24-7,33 (м, 7H), 7,39 (д, J=6,7 Гц, 2H), 7,42-7,50 (м, 5H), 7,55 (ддд, J=15,8, 8,6, 2,3 Гц, 3H), 9,94 (с, 1H), 10,00 (с, 1H); МС (ECI) м/z 924,5 (М+H)+.

Пример 106
(2S,2'S)-N,N'-{[(4-Фторфенил)имино]бис(метандиилбензол-4,1-диил)}бис{1-[(1-гидроксициклопентил)(фенил)ацетил]пирролидин-2-карбоксамид}
Продукт из Примера 13D (30 мг, 0,058 ммоль) подвергали процедуре, описанной в Примере 24E, заменяя (S)-2-(метоксикарбониламино)-3-метилбутановую кислоту на 2-(1-гидроксициклопентил)-2-фенилуксусную кислоту (27 мг, 0,122 ммоль), с получением указанного в заголовке соединения в виде соли ТФУК (13 мг).1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,09 (с, 2H), 1,50 (д, J=5,9 Гц, 6H), 1,61 (с, 4H), 1,67 (д, J=4,7 Гц, 6H), 1,77 (с, 1H), 1,81-1,87 (м, 3H), 1,91 (с, 1H), 2,02 (с, 1H), 2,07 (с, 1H), 3,14 (с, 1H), 3,22 (д, J=10,0 Гц, 1H), 3,71 (д, J=10,1 Гц, 2H), 3,80 (с, 1H), 3,91 (д, J=12,8 Гц, 2H), 4,38 (дд, J=8,2, 4,1 Гц, 1H), 4,49 (д, J=3,8 Гц, 1H), 4,57 (д, J=2,9 Гц, 4H), 6,62-6,69 (м, J=4,6, 2,3 Гц, 2H), 6,92 (т, J=8,8 Гц, 2H), 7,16-7,22 (м, 4H), 7,24-7,31 (м, 6H), 7,34-7,37 (м, 2H), 7,47 (дд, J=16,2, 7,6 Гц, 4H), 7,54 (д, J=8,3 Гц, 3H), 9,97 (д, J=1,7 Гц, 2H); МС (ECI) м/z 920,2 (М+H)+.

Пример 107
(2S,2'S)-N,N'-{[(4-Фторфенил)имино]бис(метандиилбензол-4,1-диил)}бис{1-[циклопентил(фенил)ацетил]пирролидин-2-карбоксамид}
Продукт из Примера 13D (30 мг, 0,058 ммоль) подвергали процедуре, описанной в Примере 24E, заменяя (S)-2-(метоксикарбониламино)-3-метилбутановую кислоту на 2-циклопентил-2-фенилуксусную кислоту (25 мг, 0,122 ммоль), с получением указанного в заголовке соединения в виде соли ТФУК (12 мг).1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,03 (с, 2H), 1,16 (д, J=4,2 Гц, 3H), 1,25 (д, J=13,1 Гц, 3H), 1,38 (д, J=3,3 Гц, 3H), 1,48-1,60 (м, 4H), 1,74 (с, 2H), 1,79 (с, 2H), 1,81-1,91 (м, 4H), 1,99 (с, 2H), 2,07 (с, 1H), 3,32 (д, J=9,7 Гц, 2H), 3,42 (с, 1H), 3,70 (с, 2H), 3,81 (с, 1H), 4,29-4,35 (м, 1H), 4,45 (дд, J=8,2, 3,6 Гц, 1H), 4,52-4,62 (м, 4H), 6,60-6,70 (м, 2H), 6,88-6,98 (м, 2H), 7,14-7,26 (м, 6H), 7,27-7,38 (м, 8H), 7,44 (дд, J=8,6, 2,6 Гц, 2H), 7,51-7,56 (м, 2H), 7,58 (дд, J=8,6, 2,6 Гц, 1H), 9,88 (с, 1H), 9,93 (с, 1H); МС (ECI) м/z 888,3 (М+H)+.

Пример 108
(2S,2'S)-N,N'-{[(4-Фторфенил)имино]бис(метандиилбензол-4,1-диил)}бис[l-(3-метил-2-фенилбутаноил)пирролидин-2-карбоксамид]
Продукт из Примера 13D (30 мг, 0,058 ммоль) подвергали процедуре, описанной в Примере 24E, заменяя (S)-2-(метоксикарбониламино)-3-метилбутановую кислоту на 3-метил-2-фенилбутановую кислоту (22 мг, 0,122 ммоль), с получением указанного в заголовке соединения в виде соли ТФУК (24 мг).1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 0,41 (дд, J=6,7, 1,5 Гц, 2H), 0,56 (дд, J=6,6, 4,5 Гц, 4H), 0,75-0,84 (м, 2H), 0,94 (дд, J=8,4, 6,7 Гц, 4H), 1,20 (с, 3H), 1,73-1,88 (м, 5H), 1,96 (с, 3H), 2,10-2,24 (м, 4H), 3,37 (д, J=10,2 Гц, 2H), 4,27 (д, J=7,7 Гц, 1H), 4,43 (дд, J=8,3, 3,4 Гц, 2H), 4,53 (дд, J=16,5, 8,3 Гц, 4H), 6,61 (с, 3H), 6,83-6,93 (м, 3H), 7,08-7,34 (м, 11H), 7,35-7,44 (м, 2H), 7,46-7,53 (м, 2H), 7,53-7,59 (м, 1H), 9,84 (с, 1H), 9,92 (с, 1H); МС (ECI) м/z 836,8 (М+H)+.

Пример 109
Метил [(1S)-1-{[{1S,2S,5R)-2-{[4-({(4-фторфенил)[4-({[(1S,2S,5R)-3-{(2S)-2-[(метоксикарбонил)амино]-3,3-диметилбутаноил}-3-азабицикло[3.1.0]гекс-2-ил]карбонил}амино)бензил]амино}метил)фенил]карбамоил}-3-азабицикло[3.1.0]гекс-3-ил]карбонил}-2,2-диметилпропил]карбамат

Пример 109A
(1S,1'S,2S,2'S,5R,5'R)-трет-бутил 2,2'-(4,4'-(4-фторфенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(оксометилен)бис(3-азабицикло[3.1.0]гексан-3-карбоксилат)
Продукт из Примера 13D и (1S,2S,5R)-3-(трет-бутоксикарбонил)-3-азабицикло[3.1.0]гексан-2-карбоновую кислоту (Tensiid) обрабатывали с использованием способа, описанного в Примере 41, с получением 685 мг (96%) указанного в заголовке соединения. МС (ESI; M+H) m/z=740.

Пример 109B
(1S,1'S,2S,2'S,5R,5'R)-N,N'-(4,4'-(4-фторфенилазанедиил)бис(метилен)бис(4,1-фенилен))бис(3-азабицикло[3.1.0]гексан-2-карбоксамид)
Продукт из Примера 109A обрабатывали с использованием способа, описанного в Примере 47B, с получением 458 мг (92%) указанного в заголовке соединения. МС (ESI; M+H) m/z=540.
Пример 109C
Метил [(1S)-1-{[(lS,2S,5R)-2-{[4-({(4-фторфенил)[4-({[(1S,2S,5R)-3-{(2S)-2-[(метоксикарбонил)амино]-3,3-диметилбутаноил}-3-азабицикло[3.1.0]гекс-2-ил]карбонил}амино)бензил]амино}метил)фенил]карбамоил}-3-азабицикло[3.1.0]гекс-3-ил]карбонил}-2,2-диметилпропил]карбамат
Продукт из Примера 109B и (S)-2-(метоксикарбониламино)-3,3-диметилбутановую кислоту обрабатывали с использованием способа, описанного в Примере 41, с получением 237 мг (73%) указанного в заголовке соединения.1H ЯМР (400 МГц, метанол-Д4) δ 0,20-0,30 (м, 2H) 0,81-0,91 (м, 2H) 0,92-1,03 (м, 18H) 1,67-1,79 (м, 4H) 3,64 (с, 6H) 3,72 (м, 2H) 3,92 (дд, J=9,81, 4,07 Гц, 2H) 4,03-4,13 (м, 2H) 4,21 (с, 2H) 4,53 (с, 4H) 4,72 (с, 2H) 6,67-6,73 (м, 2H) 6,79-6,86 (м, 2H) 7,20 (д, J=8,46 Гц, 4H) 7,48 (д, J=8,46 Гц, 4H).

Пример 110
(2S,2'S)-N,N'-{[(4-Фторфенил)имино]бис(метандиилбензол-4,1-диил)}бис{1-[(2R)-2-гидрокси-2-фенилацетил]пирролидин-2-карбоксамид}
Продукт из Примера 13D (0,045 г, 0,087 ммоль) и (R)-2-гидрокси-2-фенилуксусную кислоту (0,095 г, 0,192 ммоль) обрабатывали, как в Примере 25B, с получением указанного в заголовке соединения в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,71-1,88 (м, 4H) 1,88-2,06 (м, 4H) 3,09-3,18 (м, 2H) 3,62-3,73 (м, 2H) 4,40 (дд, J=8,13, 3,25 Гц, 2H) 4,57 (с, 4H) 5,26 (д, J=3,58 Гц, 2H) 5,50 (д, J=5,64 Гц, 2H) 6,65 (дд, J=9,27, 4,39 Гц, 2H) 6,92 (т, J=8,89 Гц, 2H) 7,13-7,23 (м, 6H) 7,27-7,33 (м, 2H) 7,33-7,42 (м, 6H) 7,53 (д, J=8,57 Гц, 4H) 10,00 (с, 2H); МС ECI- м/z 782 (М-H)-.
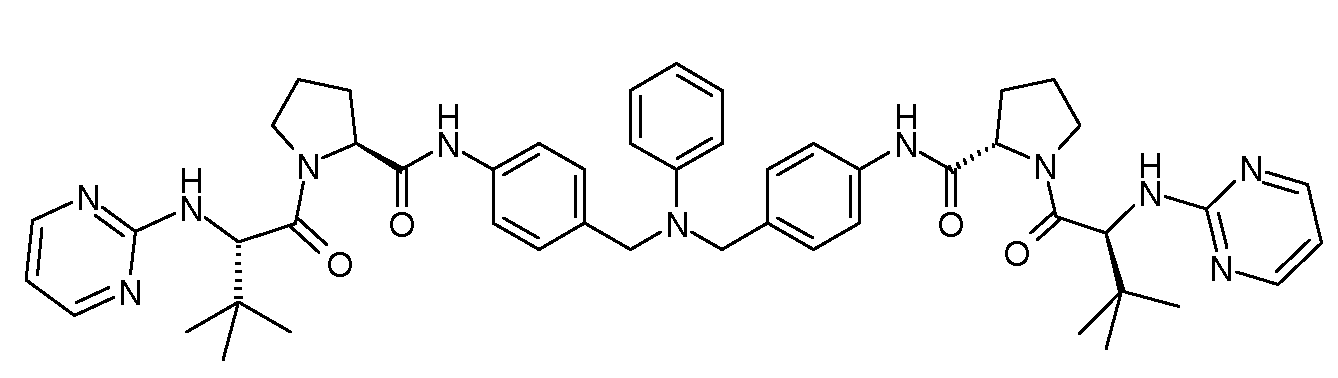
Пример 111
(2S,2'S)-N,N'-[(Фенилимино)бис(метандиилбензол-4,1-диил)]бис{1-[(2S)-3,3-диметил-2-(пиримидин-2-иламино)бутаноил]пирролидин-2-карбоксамид}
Продукт из Примера 79B (0,05 г, 0,069 ммоль) и 2-бромпиримидин (0,066 г, 0,414 ммоль) растворяли в диметилсульфоксиде (1,5 мл), обрабатывали диизопропилэтиламином (0,072 мл, 0,414 ммоль) и нагревали при 100°C в запаянной трубке в микроволновом реакторе в течение 1,5 часов. Раствор выливали в воду, экстрагировали в этилацетат, концентрировали и очищали на колонке combi-flash 12g, элюируя смесью 0-5% метанола в дихлорметане, с получением 0,004 г (7%) указанного в заголовке соединения в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,04 (с, 18H) 1,81-1,94 (м, 4H) 1,97-2,07 (м, 2H) 2,07-2,18 (м, 2H) 3,63-3,72 (м, 2H) 3,96-4,04 (м, 2H) 4,40 (дд, J=7,92, 5,75 Гц, 2H) 4,59 (с, 4H) 4,68 (д, J=9,00 Гц, 2H) 6,51 (д, J=9,00 Гц, 2H) 6,57 (т, J=7,16 Гц, 1H) 6,62 (т, J=4,77 Гц, 2H) 6,66 (д, J=8,13 Гц, 2H) 7,04-7,11 (м, 2H) 7,17 (д, J=8,57 Гц, 4H) 7,51 (д, J=8,57 Гц, 4H) 8,29 (д, J=4,77 Гц, 4H) 9,98 (с, 2H); МС ECI- м/z 878,6 (М-H)-.

Пример 112
Диметил ([(4-фторфенил)имино]бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-1-оксобутан-1,2-диил]})бискарбамат
Продукт из Примера 13D (0,030 г, 0,058 ммоль) и (S)-2-(метоксикарбониламино)бутановую кислоту (0,021 г, 0,128 ммоль) обрабатывали, как в Примере 25B, с получением указанного в заголовке соединения в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 0,90 (т, J=7,37 Гц, 6H) 1,52 (тд, J=14,07, 6,89 Гц, 2H) 1,65 (тд, J=13,61, 6,61 Гц, 2H) 1,81-1,93 (м, 4H) 1,95-2,05 (м, 2H) 2,08-2,20 (м, 2H) 3,52 (с, 6H) 3,56-3,67 (м, 2H) 3,68-3,81 (м, 2H) 4,12-4,23 (м, 2H) 4,42 (дд, J=8,02, 4,55 Гц, 2H) 4,55 (с, 4H) 6,63 (дд, J=9,22, 4,45 Гц, 2H) 6,91 (т, J=8,89 Гц, 2H) 7,16 (д, J=8,46 Гц, 4H) 7,30 (д, J=7,70 Гц, 2H) 7,50 (д, J=8,46 Гц, 4H) 9,94 (с, 2H); МС ECI- м/z 800 (М-H)-.
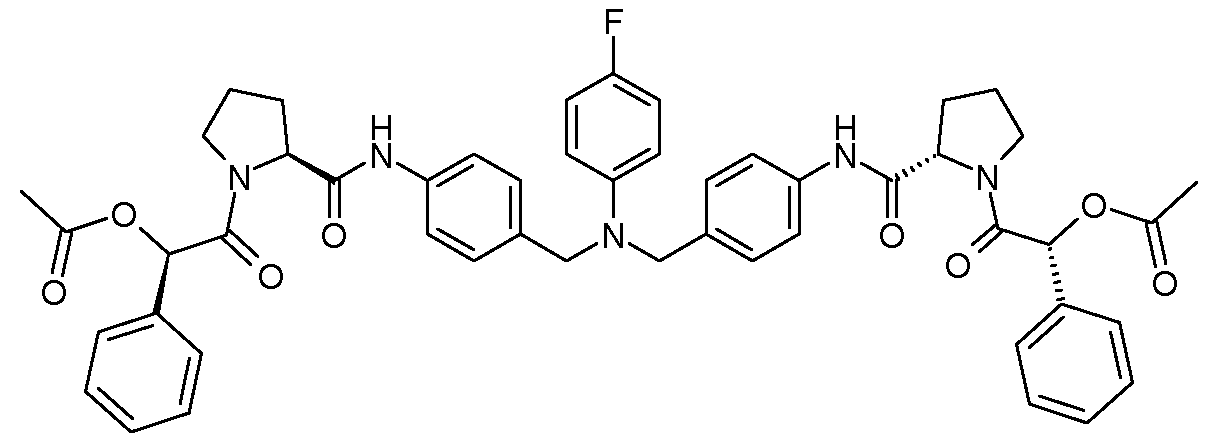
Пример 113
[(4-Фторфенил)имино]бис[метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил(1R)-2-оксо-1-фенилэтан-2,1-диил]диацетат
Продукт из Примера 13D (0,030 г, 0,058 ммоль) и (R)-2-ацетокси-2-фенилуксусную кислоту (0,025 г, 0,128 ммоль) обрабатывали, как в Примере 25B, с получением указанного в заголовке соединения в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,74-2,01 (м, 8H) 2,02-2,09 (м, 6H) 3,07-3,15 (м, 2H) 3,79-3,88 (м, 2H) 4,38 (дд, J=7,75, 2,87 Гц, 2H) 4,57 (с, 4H) 5,98-6,23 (м, 2H) 6,65 (ддд, J=9,30, 4,36, 2,49 Гц, 2H) 6,92 (тд, J=8,95, 3,04 Гц, 2H) 7,11-7,23 (м, 6H) 7,28-7,36 (м, 2H) 7,40-7,47 (м, 6H) 7,48-7,52 (м, 2H) 7,54 (д, J=8,57 Гц, 2H) 9,73-10,02 (м, 2H); МС ECI- м/z 866 (М-H)-.
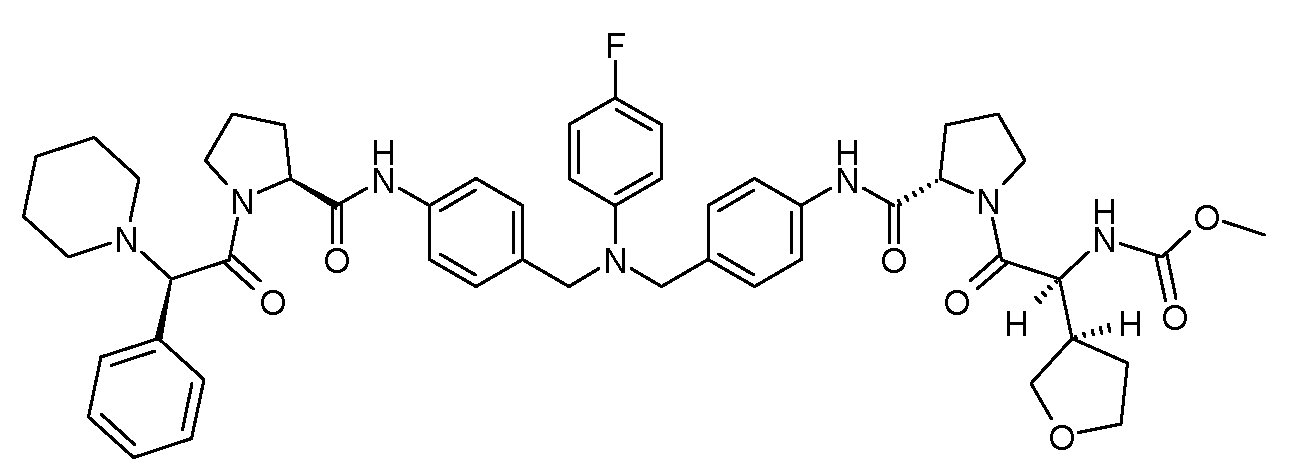
Пример 114
Метил {(1S)-2-{(2S)-2-[(4-{[(4-фторфенил){4-[({(2S)-1-[(2R)-2-фенил-2-пиперидин-1-илацетил]пирролидин-2-ил}карбонил)амино]бензил}амино]метил}фенил)карбамоил]пирролидин-1-ил}-2-оксо-1-[(3R)-тетрагидрофуран-3-ил]этил}карбамат
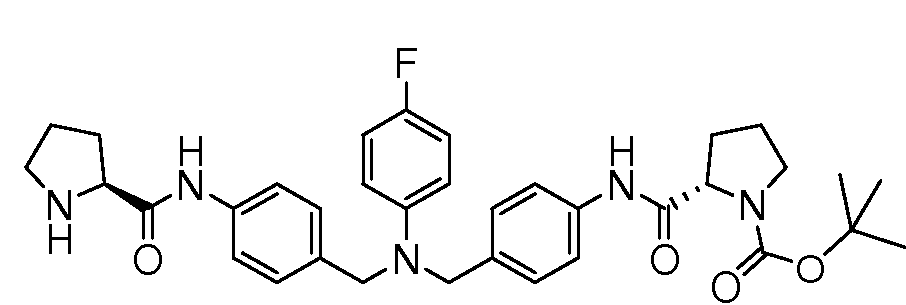
Пример 114A
(S)-трет-бутил 2-(4-(((4-фторфенил)(4-((S)-пирролидин-2- карбоксамидо)бензил)амино)метил)фенилкарбамоил)пирролидин-1-карбоксилат
Раствор из Примера 13C (2,25 г, 3,14 ммоль) в дихлорметане (20 мл) обрабатывали трифторуксусной кислотой при температуре окружающей среды, добавляя по 1 мл каждые 30 минут в суммарном количестве 4 мл. Реакционную смесь тщательно отслеживали, чтобы добиться хорошего распределения бис-Вос, моно-Вос и непрореагировавших соединений. Смесь промывали раствором бикарбоната натрия, экстрагировали в дихлорметан, концентрировали и очищали на колонке combi-flash 40 г с диоксидом кремния, со смесью 0-40% метанола в дихлорметане с получением 0,632 г (33%) указанного в заголовке соединения, содержащего одиночную Вос-группу.

Пример 114B
(S)-трет-бутил 2-(4-(((4-фторфенил)(4-((S)-1-((R)-2-фенил-2-(пиперидин-1-ил)ацетил)пирролидин-2-карбоксамидо)бензил)амино)метил)фенилкарбамоил)пирролидин-1-карбоксилат
Продукт из Примера 114A (0,26 г, 0,42 ммоль) и (R)-2-фенил-2-(пиперидин-1-ил)уксусную кислоту (0,12 г, 0,55 ммоль) обрабатывали, как в Примере 81A, с получением 0,20 г (58%) указанного в заголовке соединения в виде белого твердого вещества.

Пример 114C
(S)-N-(4-(((4-фторфенил)(4-((S)-пирролидин-2-карбоксамидо)бензил)амино)метил)фенил)-1-((R)-2-фенил-2-(пиперидин-1-ил)ацетил)пирролидин-2-карбоксамид
Продукт из Примера 114B (0,20 г, 0,24 ммоль) растворяли в дихлорметане (3 мл) и обрабатывали трифторуксусной кислотой (2 мл) при температуре окружающей среды в течение 2 часов. Раствор концентрировали, переносили в 25% раствор изопропанола в хлороформе, промывали раствором бикарбоната натрия, сушили над сульфатом натрия, фильтровали и концентрировали с получением 0,16 г (91%) указанного в заголовке соединения.
Пример 114D
Метил {(1S)-2-{(2S)-2-[(4-{[(4-фторфенил){4-[({(2S)-1-[(2R)-2-фенил-2-пиперидин-1-илацетил]пирролидин-2-ил}карбонил)амино]бензил}амино]метил}фенил)карбамоил]пирролидин-1-ил}-2-оксо-1-[(3R)-тетрагидрофуран-3-ил]этил}карбамат
Продукт из Примера 114C (0,040 г, 0,056 ммоль) и (S)-2-(метоксикарбониламино)-2-((R)-тетрагидрофуран-3-ил)уксусную кислоту (0,014 г, 0,067 ммоль) обрабатывали, как в Примере 81A, с получением указанного в заголовке соединения.1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,29-1,38 (м, 2H) 1,39-1,47 (м, 4H) 1,68-1,78 (м, 1H) 1,79-1,90 (м, 4H) 1,93-2,06 (м, 4H) 2,10-2,22 (м, 1H) 3,14-3,25 (м, 1H) 3,41-3,50 (м, 4H) 3,53 (с, 3H) 3,58-3,70 (м, 4H) 3,71-3,79 (м, 2H) 3,80-3,90 (м, 2H) 4,20-4,28 (м, 2H) 4,31 (дд, J=7,64, 4,07 Гц, 1H) 4,44 (дд, J=7,97, 4,93 Гц, 1H) 4,56 (с, 4H) 6,64 (дд, J=9,22, 4,34 Гц, 2H) 6,91 (т, J=8,95 Гц, 2H) 7,18 (д, J=8,13 Гц, 4H) 7,25-7,37 (м, 3H) 7,42 (д, J=6,83 Гц, 2H) 7,51 (дд, J=8,57, 1,84 Гц, 4H) 7,60 (д, J=8,02 Гц, 1H) 9,96 (с, 1H) 9,98 (с, 1H); МС ECI- м/z 900,6 (М-H)-.

Пример 115
Метил [(1S)-1-({(2S)-2-[(4-{[(4-фторфенил){4-[({(2S)-1-[(2R)-2-фенил-2-пиперидин-1-илацетил]пирролидин-2-ил}карбонил)амино]бензил}амино]метил}фенил)карбамоил]пирролидин-1-ил}карбонил)пропил]карбамат
Продукт из Примера 114C (0,040 г, 0,056 ммоль) и (S)-2- (метоксикарбониламино)бутановую кислоту (0,011 г, 0,067 ммоль) обрабатывали, как в Примере 81A, с получением указанного в заголовке соединения.1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 0,90 (т, J=7,37 Гц, 3H) 1,29-1,37 (м, 2H) 1,39-1,47 (м, 4H) 1,47-1,58 (м, 1H) 1,61-1,72 (м, 1H) 1,75-2,06 (м, 6H) 2,08-2,20 (м, 1H) 3,39-3,50 (м, 1H) 3,52 (с, 3H) 3,56-3,64 (м, 1H) 3,69-3,77 (м, 1H) 3,79-3,90 (м, 1H) 4,14-4,21 (м, 1H) 4,24 (с, 1H) 4,31 (дд, J=7,81, 4,23 Гц, 1H) 4,43 (дд, J=7,92, 4,34 Гц, 1H) 4,56 (с, 4H) 6,64 (дд, J=9,27, 4,39 Гц, 2H) 6,91 (т, J=8,89 Гц, 2H) 7,17 (дд, J=8,51, 2,55 Гц, 4H) 7,27-7,36 (м, 3H) 7,42 (д, J=6,94 Гц, 2H) 7,51 (дд, J=8,51, 3,74 Гц, 4H) 9,95 (д, J=2,93 Гц, 2H); МС ECI- м/z 858,6 (М-H)-.
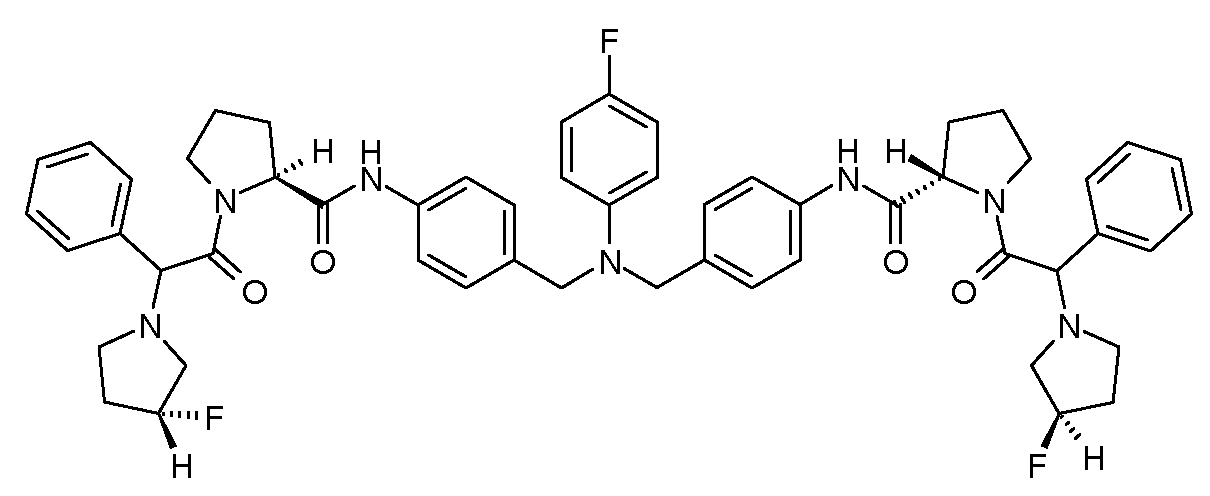
Пример 116
(2S,2'S)-N,N'-{[(4-Фторфенил)имино]бис(метандиилбензол-4,1-диил)}бис(1-{[(3R)-3-фторпирролидин-1-ил](фенил)ацетил}пирролидин-2-карбоксамид)
Продукт из Примера 13D и 2-((R)-3-фторпирролидин-1-ил)-2-фенилуксусную кислоту обрабатывали с использованием способа, описанного в Примере 13E, заменяя ДМФА на дихлорметан, с получением смеси трех стереоизомеров. Указанное в заголовке соединение Примера 116 было первым изомером, который элюировал в результате хроматографии.1H ЯМР (400 МГц, ДМСО) δ 1,90-1,68 (м, 6H), 2,15-1,90 (м, 6H), 2,45-2,35 (м, 2H), 2,65-2,58 (м, 3H), 2,70 (дд, J=4,1, 10,7, 1H), 2,77 (д, J=11,2, 1H), 2,84 (д, J=11,4, 1H), 3,45-3,34 (м, 2H), 3,90-3,76 (м, 2H), 4,36-4,29 (м, 2H), 4,38 (с, 2H), 4,57 (с, 4H), 5,07 (т, J=5,6, 1H), 5,21 (т, J=5,6, 1H), 6,70-6,60 (м, 2H), 6,96-6,87 (м, 2H), 7,19 (д, J=8,5, 4H), 7,38-7,27 (м, 6H), 7,46 (д, J=6,8, 4H), 7,53 (д, J=8,5, 4H), 9,97 (с, 2H), МС (ECI) м/z926 (М+H)+, 924 (М-H)+.

Пример 117
(2S,2'S)-N,N'-{[(4-Фторфенил)имино]бис(метандиилбензол-4,1-диил)}бис(1-{[(3R)-3-фторпирролидин-1-ил](фенил)ацетил}пирролидин-2-карбоксамид)
Указанное в заголовке соединение Примера 117 выделяли из продукта очистки Примера 116 в качестве изомера, который элюировал вторым.1H ЯМР (400 МГц, ДМСО) δ 1,91-1,70 (м, 7H), 2,14-1,93 (м, 6H), 2,46-2,35 (м, 3H), 2,66-2,57 (м, 2H), 2,88-2,69 (м, 4H), 3,39 (дд, J=8,4, 17,4, 1H), 3,68 (тд, J=5,5, 9,6, 1H), 3,86-3,78 (м, 1H), 4,36-4,30 (м, 1H), 4,38 (с, 1H), 4,46 (дд, J=4,3, 8,4, 1H), 4,49 (с, 1H), 4,57 (д, J=10,2, 3H), 5,07 (т, J=5,5, 1H), 5,21 (т, J=5,3, 1H), 6,65 (дт, J=4,4, 9,2, 2H), 6,92 (тд, J=2,8, 9,1, 2H), 7,26-7,13 (м, 4H), 7,39-7,26 (м, 6H), 7,59-7,39 (м, 8H), 10,34-9,87 (м, 2H), МС (ECI) м/z926 (М+H)+, 924 (М-H)+.

Пример 118
(2S,2'S)-N,N'-{[(4-Фторфенил)имино]бис(метандиилбензол-4,1-диил)}бис(1-{[(3R)-3-фторпирролидин-1-ил](фенил)ацетил}пирролидин-2-карбоксамид)
Указанное в заголовке соединение Примера 118 выделяли из продукта очистки Примера 116 в качестве изомера, который элюировал третьим.1H ЯМР (400 МГц, ДМСО) δ 1,00-0,77 (м, 8H), 1,94-1,69 (м, 6H), 2,15-1,94 (м, 6H), 2,87-2,69 (м, 2H), 3,73-3,52 (м, 2H), 4,61-4,40 (м, 7H), 5,06 (т, J=5,5, 1H), 5,21 (т, J=5,3, 1H), 6,64 (дт, J=4,4, 8,9, 2H), 6,91 (тд, J=2,9, 8,9, 2H), 7,60-7,12 (м, 19H), 10,31-9,90 (м, 2H), МС (ECI) м/z 926 (М+H)+, 924 (М-H)+.
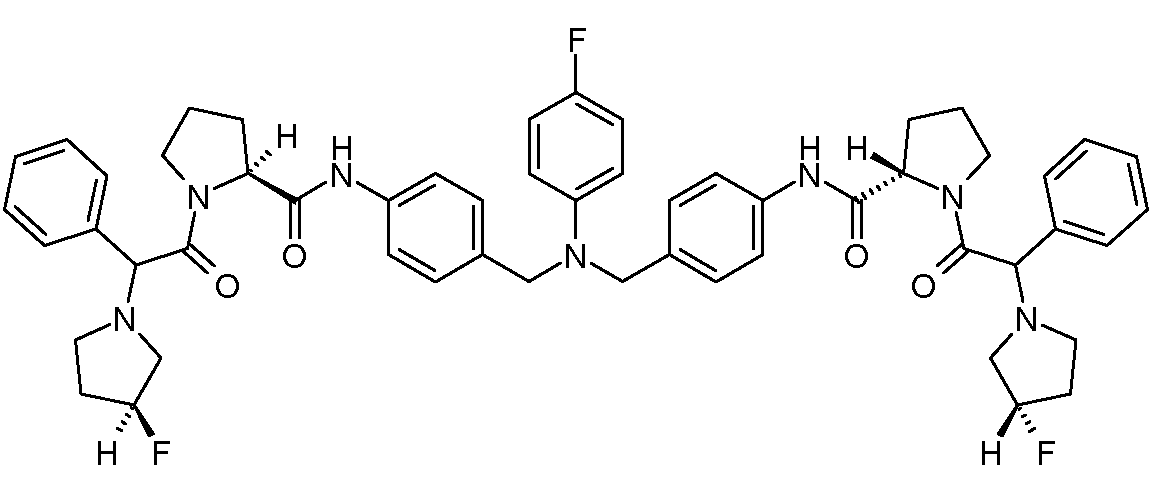
Пример 119
(2S,2'S)-N,N'-{[(4-Фторфенил)имино]бис(метандиилбензол-4,1-диил)}бис(1-{[(3S)-3-фторпирролидин-1-ил](фенил)ацетил}пирролидин-2-карбоксамид)
Продукт из Примера 13D и 2-((S)-3-фторпирролидин-1-ил)-2-фенилуксусную кислоту обрабатывали с использованием способа, описанного в Примере 13E, заменяя ДМФА на дихлорметан, с получением смеси стереоизомеров. Указанное в заголовке соединение Примера 119 было первым изомером, который элюировал в результате хроматографии.1H ЯМР (400 МГц, ДМСО) δ 2,15-1,70 (м, 13H), 2,66-2,57 (м, 2H), 2,81-2,71 (м, 3H), 3,43-3,34 (м, 2H), 3,90-3,78 (м, 2H), 4,32 (дд, J=4,2, 7,9, 2H), 4,36 (с, 2H), 4,57 (с, 4H), 5,06 (с, 1H), 5,20 (с, 1H), 6,70-6,60 (м, 2H), 6,97-6,86 (м, 2H), 7,19 (д, J=8,5, 5H), 7,39-7,24 (м, 7H), 7,46 (д, J=6,9, 4H), 7,53 (д, J=8,5, 4H), 9,96 (с, 2H), МС (ECI) м/z 925 (М+H)+.

Пример 120
(2S,2'S)-N,N'-{[(4-Фторфенил)имино]бис(метандиилбензол-4,1-диил)}бис(1-{[(3S)-3-фторпирролидин-1-ил](фенил)ацетил}пирролидин-2-карбоксамид)
Указанное в заголовке соединение Примера 120 выделяли из продукта очистки Примера 119 в качестве изомера, который элюировал вторым.1H ЯМР (400 МГц, ДМСО) δ 2,16-1,67 (м, 12H), 2,39 (дд, J=11,8, 19,9, 2H), 2,65-2,55 (м, 2H), 2,91-2,70 (м, 4H), 3,44-3,33 (м, 2H), 3,66 (дт, J=6,1, 14,0, 1H), 3,92-3,78 (м, 1H), 4,32 (дд, J=4,2, 7,9, 1H), 4,36 (с, 1H), 4,45 (дд, J=3,9, 8,2, 1H), 4,49 (с, 1H), 4,57 (д, J=10,0, 4H), 5,06 (дд, J=3,5, 9,6, 1H), 5,25-5,15 (м, 1H), 6,65 (дт, J=4,4, 9,2, 2H), 6,92 (тд, J=2,9, 9,1, 2H), 7,59-7,12 (м, 18H), 10,32-9,86 (м, 2H), МС (ECI) м/z 926 (М+H)+, 924 (М-H)+.

Пример 121
(2S,2'S)-N,N'-[(Фенилимино)бис(метандиилбензол-4,1-диил)]бис{1-[(2S)-3,3-диметил-2-(1,3-тиазол-2-иламино)бутаноил]пирролидин-2-карбоксамид}

Пример 121A
(S,2S,2'S)-N,N'-(4,4'-(фенилазанедиил)бис(метилен)бис(4,1-фенилен))бис(1-((S)-3,3-диметил-2-тиоуреидобутаноил)пирролидин-2-карбоксамид)
Продукт из Примера 79B (0,075 г, 0,104 ммоль) растворяли в дихлорметане (2 мл) при температуре окружающей среды и обрабатывали флуоренилметоксикарбонилизотиоцианатом (0,061 г, 0,218 ммоль) и перемешивали в течение 4 часов. По каплям добавляли диэтиламин (0,50 мл) и полученный раствор перемешивали в течение 1 часа, затем концентрировали досуха с получением указанного в заголовке соединения.
Пример 121B
(2S,2'S)-N,N'-[(фенилимино)бис(метандиилбензол-4,1-диил)]бис{1-[(2S)-3,3-диметил-2-(1,3-тиазол-2-иламино)бутаноил]пирролидин-2-карбоксамид}
Продукт из Примера 121A (0,087 г, 0,103 ммоль) растворяли в этаноле (1 мл) и обрабатывали хлорацетальдегидом (0,040 мл, 0,310 ммоль) и раствор нагревали при 70°C в течение 18 часов, в течение этого времени добавляли еще 0,04 мл хлорацетальдегида для ускорения завершения реакции. Раствор концентрировали и очищали на колонке combi-flash с 12 г диоксида кремния, элюируя смесью 0-5% метанола в дихлорметане, с последующей очисткой на второй колонке, элюируя смесью 0-15% этилацетата в дихлорметане, с получением 3,5 мг указанного в заголовке соединения.1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,02 (с, 18H) 1,46-1,65 (м, 4H) 1,67-1,77 (м, 1H) 1,79-1,91 (м, 4H) 2,08-2,20 (м, 1H) 3,63-3,71 (м, 2H) 4,43 (дд, J=7,92, 5,64 Гц, 2H) 4,56-4,63 (м, 6H) 6,54-6,61 (м, 3H) 6,66 (д, J=8,24 Гц, 2H) 6,96 (д, J=3,69 Гц, 2H) 7,07 (т, J=7,97 Гц, 2H) 7,17 (д, J=8,46 Гц, 4H) 7,51 (д, J=8,57 Гц, 4H) 7,64 (д, J=9,11 Гц, 2H) 9,99 (с, 2H); МС ECI- м/z 888,5 (М-H)-.
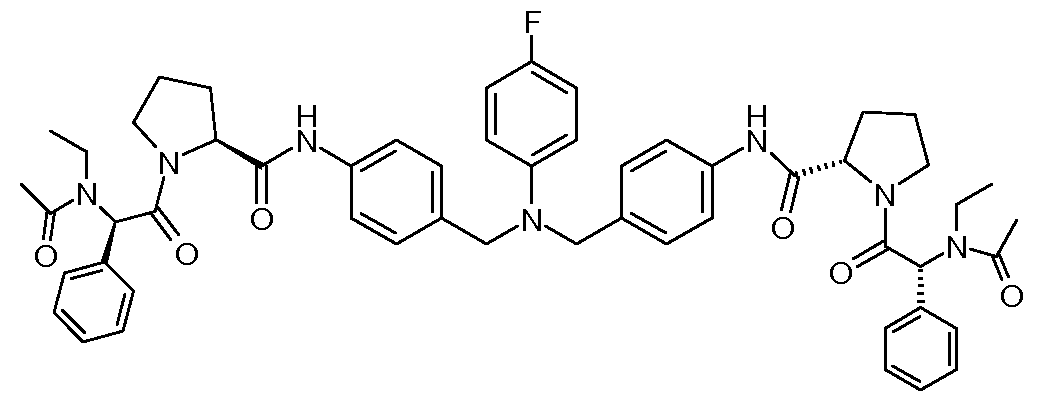
Пример 122
(2S,2'S)-N,N'-{[(4-Фторфенил)имино]бис(метандиилбензол-4,1-диил)}бис(1-{(2R)-2-[ацетил(этил)амино]-2-фенилацетил}пирролидин-2-карбоксамид)

Пример 122A
(R)-трет-бутил 2-(этиламино)-2-фенилацетат
К раствору (R)-трет-бутил 2-амино-2-фенилацетатгидрохлорида (0,25 г, 1,026 ммоль) в MeOH (10,26 мл) добавляли 10% Pd/C (0,080 г, 1,026 ммоль). Полученную смесь охлаждали до 0°C и добавляли ацетальдегид (0,576 мл, 10,26 ммоль). Полученную смесь перемешивали при 0°C в течение 10-15 минут, ледяную баню удаляли, и смесь помещали под баллон с водородом и перемешивали при комнатной температуре в течение 45 минут. Смесь фильтровали через целит, промывали метанолом, и фильтрат концентрировали в вакууме с получением указанного в заголовке соединения (0,267 г).
Пример 122B
(R)-трет-бутил 2-(N-этилацетамидо)-2-фенилацетат
Раствор продукта из Примера 122A (0,267 г, 1,135 ммоль) в уксусном ангидриде (1,073 мл, 11,35 ммоль) и пиридине (0,918 мл, 11,35 ммоль) перемешивали при 98°C в течение 2 часов. Смесь распределяли между CH2Cl2 и 1 н. раствором HCl, и органический экстракт отделяли, сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали при помощи колоночной хроматографии на силикагеле, используя градиент растворителя 1-35% этилацетата в гексане, с получением указанного в заголовке соединения (0,083 г, 27%).
Пример 122C
(R)-2-(N-этилацетамидо)-2-фенилуксусная кислота
К раствору продукта из Примера 122B (81 мг, 0,293 ммоль) в CH2Cl2 (3 мл) добавляли 2,2,2-трифторуксусную кислоту (1,5 мл, 0,293 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 1 часа. Смесь концентрировали в вакууме с получением указанного в заголовке соединения (50 мг, 77%).
Пример 122D
(2S,2'S)-N,N'-{[(4-фторфенил)имино]бис(метандиилбензол-4,1-диил)}бис(1-{(2R)-2-[ацетил(этил)амино]-2-фенилацетил}пирролидин-2-карбоксамид)
Продукт из Примера 13D (0,024 г, 0,047 ммоль) подвергали процедуре, описанной в Примере 24E, заменяя (S)-2-(метоксикарбониламино)-3-метилбутановую кислоту на продукт из Примера 122C, с получением указанного в заголовке соединения в виде соли ТФУК (7 мг).1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 0,49-0,63 (м, 4H), 0,69-0,78 (м, 2H), 1,24 (с, 2H), 1,70-2,04 (м, 8H), 2,05-2,16 (м, 4H), 2,84-3,27 (м, 4H), 3,42-3,69 (м, 3H), 4,42-4,48 (м, 2H), 4,58 (с, 4H), 6,63-6,68 (м, 2H), 6,92 (т, J=8,9 Гц, 2H), 7,20 (дд, J=8,3, 3,8 Гц, 4H), 7,31-7,50 (м, 11H), 7,51-7,64 (м, 6H), 9,62 (с, 1H), 10,05 (с, 1H); МС м/z 923,6 (М+H)+.

Пример 123
Диметил ([(4-фторфенил)имино]бис{метандиилбензол-4,1-диилкарбамоил(2S,3aS,6aS)гексагидроциклопента[b]пиррол-2,1(2Н)-диил[(2S)-3,3-диметил-1-оксобутан-1,2-диил]})бискарбамат
Пример 123A
(2S,3aS,6aS)-2-бензил 1-трет-бутилгексагидроциклопента[b]пиррол-1,2(2H)-дикарбоксилат
К раствору бензилового эфира (S,S,S)-2-азабицикло[3,3,0]-октан-3-карбоновой кислоты, гидрохлорида (0,50 г, 1,8 ммоль) в CH2Cl2 (8,9 мл) при комнатной температуре добавляли ди-трет-бутилдикарбонат (0,45 мл, 2,0 ммоль) и основание Хунига (0,77 мл, 4,4 ммоль) с получением бронзового раствора. Смесь перемешивали в течение 2 часов при комнатной температуре, затем разбавляли при помощи CH2Cl2, промывали насыщенным раствором бикарбоната натрия и насыщенным солевым раствором. Органический слой сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке соединения (0,56 г, 91% выход).

Пример 123B
(2S,3aS,6aS)-1-(трет-бутоксикарбонил)октагидроциклопента[b]пиррол-2-карбоновая кислота
К раствору продукта из Примера 123A (0,56 г, 1,6 ммоль) в MeOH (8,0 мл) добавляли Pd(OH)2/углерод. Из смеси откачивали воздух и через баллон вводили атмосферу H2. Смесь перемешивали в течение ночи, затем фильтровали и растворитель удаляли при пониженном давлении с получением указанного в заголовке соединения (0,42 г, 102% выход).

Пример 123C
(2S,2'S,3aS,3a'S,6aS,6a'S)-трет-бутил 2,2'-(4,4'-(4-фторфенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(оксометилен)бис-(гексагидроциклопента[b]пиррол-1(2H)-карбоксилат)
Указанное в заголовке соединение получали с использованием способов из Примера 13C, заменяя N-(трет-бутоксикарбонил)-L-пролин на продукт из Примера 123B, с получением указанного в заголовке соединения (0,95 г, 100% выход).
Пример 123D
(2S,2'S,3aS,3a'S,6aS,6a'S)-N,N'-(4,4'-(4-фторфенилазанедиил)бис(метилен)бис(4,1-фенилен))бис(октагидроциклопента[b]пиррол-2-карбоксамид)
Указанное в заголовке соединение получали с использованием способов из Примера 13D, заменяя продукт из Примера 13C на продукт из Примера 123C, с получением указанного в заголовке соединения (0,17 г, 81%).
Пример 123E
Диметил ([(4-фторфенил)имино]бис{метандиилбензол-4,1-диилкарбамоил(2S,3aS,6S)гексагидроциклопента[b]пиррол-2,1(2H)-диил[(2S)-3,3-диметил-1-оксобутан-1,2-диил]})бискарбамат
Указанное в заголовке соединение получали с использованием способов из Примера 13E, заменяя продукт из Примера 13D на продукт из Примера 123D, с получением указанного в заголовке соединения (75 мг, 41% выход).1H ЯМР (400 МГц, МЕТАНОЛ-Д4) δ 7,52-7,43 (м, 4H), 7,22-7,15 (м, 4H), 6,83 (т, J=8,6, 2H), 6,74-6,67 (м, 2H), 4,73-4,65 (м, 2H), 4,59-4,50 (м, 6H), 4,39 (шир. с, 2H), 3,65 (с, 6H), 2,85-2,74 (м, 2H), 2,39 (м, 2H), 2,19 (д, J=8,0, 2H), 2,09-1,90 (м, 4H), 1,89-1,56 (м, 8H), 1,03 (с, 18H), МС (ECI; М+H) м/z=939.

Пример 124
(2S,3aS,6aS,2'S,3a'S,6a'S)-N,N'-{[(4-Фторфенил)имино]бис(метандиилбензол-4,1-диил)}бис{1-[(2R)-2-фенил-2-пиперидин-1-илацетил]октагидроциклопента[b]пиррол-2-карбоксамид}
К смеси продукта из Примера 123D (0,17 г, 0,29 ммоль), (R)-2-фенил-2-(пиперидин-1-ил)уксусной кислоты - соли ТФУК (0,21 г, 0,67 ммоль) и HATU (0,24 г, 0,64 ммоль) в CH2Cl2 (2,9 мл) добавляли основание Хунига (0,41 мл, 2,3 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Смесь затем концентрировали при пониженном давлении и очищали при помощи колоночной хроматографии, элюируя смесью 30-70% этилацетата в гексане, с получением указанного в заголовке соединения (39 мг, 13% выход).1H ЯМР (400 МГц, МЕТАНОЛ-Д4) δ 7,54-7,43 (м, 8H), 7,38-7,30 (м, 6H), 7,23-7,17 (м, 4H), 6,84 (т, J=8,6, 2H), 6,72 (дд, J=4,2, 9,2, 2H), 4,54 (шир. с, 4H), 4,46 (т, J=8,3, 2H), 4,31 (дд, J=8,1, 13,9, 2H), 4,12 (с, 2H), 2,73-2,60 (м, 2H), 2,53-2,44 (м, 3H), 2,42-2,24 (м, 8H), 2,17-2,04 (м, 2H), 2,03-1,88 (м, 2H), 1,83-1,64 (м, 7H), 1,55 (с, 10H), 1,43 (с, 4H), МС (ECI; М+H) м/z=999.

Пример 125
Метил [(1S)-1-{[(2S)-2-{[4-({(4-фторфенил)[4-({[(2S)-1-{(2S)-2-[(метоксикарбонил)амино]-3,3-диметилбутаноил}-2,5-дигидро-1Н-пиррол-2-ил]карбонил}амино)бензил]амино}метил)фенил]карбамоил}-2,5-дигидро-1H-пиррол-1-ил]карбонил}-2,2-диметилпропил]карбамат
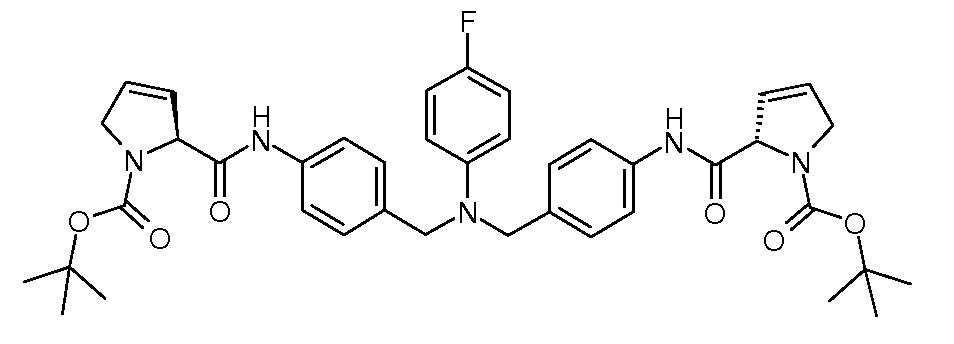
Пример 125A
(2S,2'S)-трет-бутил 2,2'-(4,4'-(4-фторфенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(оксометилен)бис(2,5-дигидро-1H-пиррол-1-карбоксилат)
Указанное в заголовке соединение получали с использованием способов из Примера 13C, заменяя N-(трет-бутоксикарбонил)-L-пролин на (S)-1-(трет-бутоксикарбонил)-2,5-дигидро-1H-пиррол-2-карбоновую кислоту, с получением указанного в заголовке соединения (0,64 г, 96% выход).

Пример 125B
(2S,2'S)-N,N'-(4,4'-(4-фторфенилазанедиил)бис(метилен)бис(4,1-фенилен))бис(2,5-дигидро-1H-пиррол-2-карбоксамид)
Указанное в заголовке соединение получали с использованием способов из Примера 13D, заменяя продукт из Примера 13C на продукт из Примера 125A, с получением указанного в заголовке соединения (0,50 г, 109% выход).
Пример 125C
Метил [(1S)-1-{[(2S)-2-{[4-({(4-фторфенил)[4-({[(2S)-1-{(2S)-2-[(метоксикарбонил)амино]-3,3-диметилбутаноил}-2,5-дигидро-1Н-пиррол-2-ил]карбонил}амино)бензил]амино}метил) фенил]карбамоил}-2,5-дигидро-1H-пиррол-1-ил]карбонил}-2,2-диметилпропил]карбамат
Указанное в заголовке соединение получали с использованием способов из Примера 13E, заменяя продукт из Примера 13D на продукт из Примера 125B, с получением указанного в заголовке соединения (0,15 г, 45% выход).1H ЯМР (400 МГц, ДМСО) δ 10,13 (с, 2H), 7,51 (д, J=8,5, 4H), 7,23 (д, J=8,7, 2H), 7,18 (д, J=8,5, 4H), 6,91 (т, J=8,9, 2H), 6,63 (дд, J=9,2, 4,4, 2H), 6,06 (дд, J=6,3, 1,8, 2H), 5,88 (дд, J=6,2, 2,1, 2H), 5,20-5,13 (м, 2H), 4,61-4,51 (м, 6H), 4,49-4,39 (м, 2H), 4,15 (д, J=8,7, 2H), 3,54 (с, 6H), 0,99 (с, 18H), МС (ECI; М+H) м/z=855.

Пример 126
Дибензил (4S,4'S)-4,4'-{[(4-фторфенил)имино]бис(метандиил-бензол-4,1-диилкарбамоил)}бис(1,3-оксазолидин-3-карбоксилат)
Продукт из Примера 13B (100 мг, 0,311 ммоль) и (S)-3-(бензилоксикарбонил)оксазолидин-4-карбоновую кислоту (195 мг, 0,778 ммоль) обрабатывали с использованием способа, описанного в Примере 43, с получением 215 мг (88%) указанного в заголовке соединения.1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,09 (с, 2H), 7,51 (д, J=7,1 Гц, 4H), 7,36 (м, 4H), 7,18 (м, 10H), 6,91 (д, J=8,9 Гц, 2H), 6,64 (м, 2H), 5,13 (м, 2H), 5,03 (м, 2H), 4,93 (м, 4H), 4,58 (шир. с, 4H), 4,48 (м, 2H), 4,28 (м, 2H), 4,01 (м, 2H).
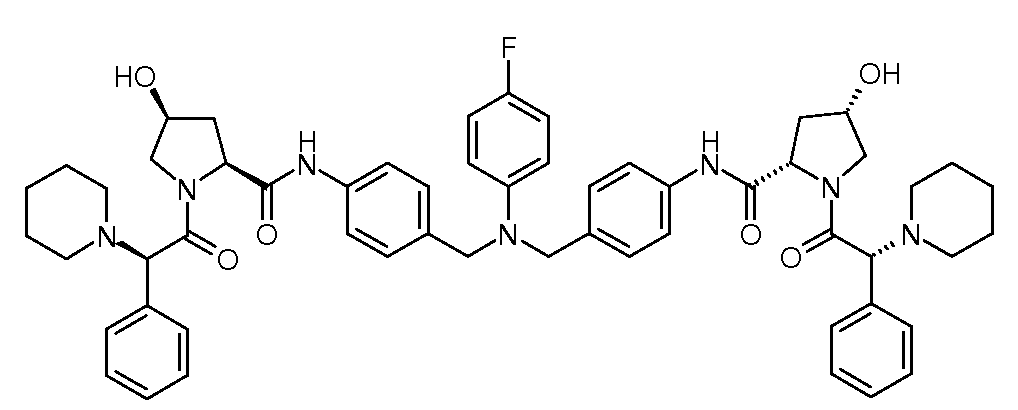
Пример 127
(2S,4S,2'S,4'S)-N,N'-{[(4-Фторфенил)имино]бис(метандиилбензол-4,1-диил)}бис{4-гидрокси-1-[(2R)-2-фенил-2-пиперидин-1-илацетил]пирролидин-2-карбоксамид}
Пример 127A
(2S,4S)-1-(трет-бутоксикарбонил)-4-гидроксипирролидин-2-карбоновая кислота
К раствору (2S,4S)-4-гидроксипирролидин-2-карбоновой кислоты (3,9 г, 29,7 ммоль) в ТГФ (26,7 мл) и воде (13,3 мл) добавляли ди-трет-бутилдикарбонат (7,14 г, 32,7 ммоль) и гидроксид натрия (2,0 н., 22,9 мл, 45,8 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. К смеси затем добавляли 10% раствор лимонной кислоты (50 мл) с последующим добавлением EtOAc и экстрагированием водой и насыщенным солевым раствором. Органический экстракт сушили, фильтровали и концентрировали с получением 5,31 г (77%) указанного в заголовке соединения. МС (ESI) m/z 232 (M+H)+.
Пример 127B
(2S,4S)-1-(трет-бутоксикарбонил)-4-(трет-бутилдиметилсилилокси)пирролидин-2-карбоновая кислота
К раствору Примера 127A (5,31 г, 22,96 ммоль) и имидазола (7,82 г, 115 ммоль) в дихлорметане (106 мл) и ДМФА (21,3 мл) добавляли трет-бутилдиметилсилилхлорид (7,61 г, 50,5 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. К смеси затем добавляли воду (425 мл) и раствор экстрагировали при помощи EtOAc, и органический экстракт концентрировали до получения остатка, который растворяли в 25% растворе EtOAc и 75% растворе гексана, затем экстрагировали насыщенным солевым раствором и органический экстракт концентрировали до получения твердого вещества. Полученное твердое вещество растворяли в метаноле (65 мл) и воде (85 мл), затем добавляли гидроксид лития, моногидрат (1,93 г, 46 ммоль) и раствор перемешивали при комнатной температуре в течение 2 часов. Затем добавляли воду (106 мл) и водный 1 н. раствор хлористоводородной кислоты, пока не достигали уровня pH 2. Смесь затем экстрагировали при помощи смеси 25% EtOAc и 75% гексана, органический экстракт сушили, фильтровали и концентрировали с получением указанного в заголовке соединения в виде бесцветного твердого вещества. МС (ESI) m/z 346 (M+H)+.

Пример 127C
(3S,3'S,5S,5'S)-трет-бутил 5,5'-(4,4'-(4-фторфенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(оксометилен)бис(3-(трет-бутилдиметилсилилокси)пирролидин-1-карбоксилат)
Продукт Примера 127B (161 мг, 0,467 ммоль) и продукт из Примера 13B (50 мг, 0,156 ммоль) обрабатывали с использованием способа, описанного в Примере 43, с получением 110 мг (72%) указанного в заголовке соединения. МС (ESI) m/z 977 (M+H)+.
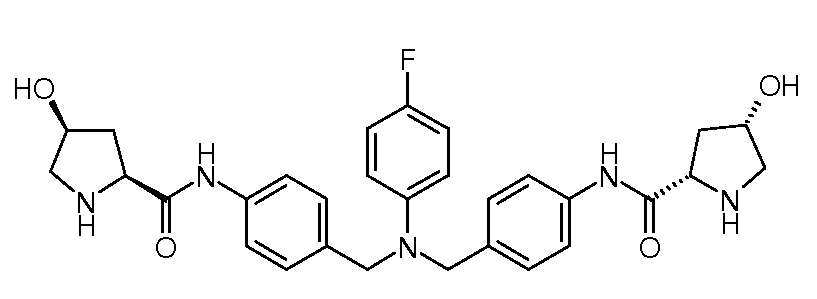
Пример 127D
(2S,2'S,4S,4'S)-N,N'-(4,4'-(4-фторфенилазанедиил)бис(метилен)бис(4,1-фенилен))бис(4-гидроксипирролидин-2-карбоксамид)
Продукт Примера 127C (110 мг, 0,113 ммоль) растворяли в трифторуксусной кислоте (6 мл), воде (0,2 мл) и дихлорметане (0,3 мл) и смесь перемешивали при комнатной температуре в течение 2 часов. После этого смесь концентрировали до получения масла, которое растворяли в 75% растворе CHCl3 и 25% растворе изопропилового спирта, затем экстрагировали насыщенным водным раствором бикарбоната натрия, органический экстракт отделяли, сушили, фильтровали и концентрировали с получением указанного в заголовке соединения в виде бесцветного твердого вещества. МС (ESI) m/z 548 (M+H)+.
Пример 127E
(25,4S,2'S,4'S)-N,N'-{[(4-фторфенил)имино]бис(метандиилбензол-4,1-диил)}бис{4-гидрокси-1-[(2R)-2-фенил-2-пиперидин-1-илацетил]пирролидин-2-карбоксамид}
Продукт из Примера 127D (30 мг, 0,055 ммоль) и (R)-2-фенил-2-(пиперидин-1-ил)уксусную кислоту (36 мг, 0,164 ммоль) обрабатывали с использованием способа, описанного в Примере 43, с получением 8 мг (15%) указанного в заголовке соединения.1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,97 (с, 2H), 7,51 (д, J=8,4 Гц, 4H), 7,40 (м, 4H), 7,30 (м, 6H), 7,19 (д, J=8,6 Гц, 4H), 6,91 (д, J=9,0 Гц, 2H), 6,63 (м, 2H), 5,27 (д, J=6,6 Гц, 2H), 4,56 (шир. с, 4H), 4,24 (м, 2H), 4,,07 (м, 2H), 3,68 (м, 2H), 3,61 (м, 2H), 3,32 (м, 8H), 1,74 (м, 2H), 1,42 (м, 8H), 1,35 (м, 4H).

Пример 128
(25,2'S)-N,N'-{[(4-Фторфенил)имино]бис(метандиилбензол-4,1-диил)}бис{1-[(2-оксопирролидин-1-ил)(фенил)ацетил]пирролидин-2-карбоксамид}
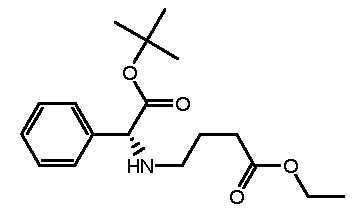
Пример 128A
(R)-этил 4-(2-трет-бутокси-2-оксо-1-фенилэтиламино)бутаноат
Смесь (R)-трет-бутил 2-амино-2-фенилацетатгидрохлорида (0,5 г, 2,051 ммоль), этил 4-бромбутаноата (0,44 г, 2,26 ммоль) и K2CO3 (1,13 г, 8,21 ммоль) в CH3CN (10 мл) нагревали до 50°C в течение 40 часов. Смесь разбавляли при помощи EtOAc и затем промывали H2O и насыщенным солевым раствором. Органический слой затем сушили (MgSO4), фильтровали и концентрировали. Очистка при помощи хроматографии (силикагель, 40% EtOAc в гексане) давала 486 мг (74%) указанного в заголовке соединения. МС (ESI) m/z 322 (M+H)+.

Пример 128B
(R)-4-(2-трет-бутокси-2-оксо-1-фенилэтиламино)бутановая кислота
Продукт Примера 128A (480 мг, 1,49 ммоль) и NaOH (299 мг, 7,47 ммоль) в MeOH (10 мл) перемешивали при температуре окружающей среды в течение 1 часа. В смесь добавляли HCl (1M раствор) и экстрагировали при помощи EtOAc. Органический слой промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали с получением 310 мг (71%) указанного в заголовке соединения. МС (ESI) m/z 294 (M+H)+.

Пример 128C
(R)-трет-бутил 2-(2-оксопирролидин-1-ил)-2-фенилацетат
Продукт Примера 128B (307 мг, 1,05 ммоль) и N1-((этилимино)метилен)-N3,N3-диметилпропан-1,3-диамингидрохлорид (602 мг, 3,14 ммоль) в пиридине (5 мл) и диметилформамиде (5 мл) перемешивали при температуре окружающей среды в течение 16 часов. Смесь разбавляли при помощи EtOAc и промывали H2O и насыщенным солевым раствором. Органический слой сушили (MgSO4), фильтровали и концентрировали. Очистка при помощи хроматографии (силикагель, 60% EtOAc в гексане) давала 249 мг (86%) указанного в заголовке соединения. МС (ESI) m/z 276 (M+H)+.
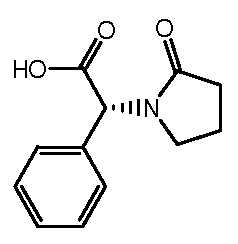
Пример 128D
(R)-2-(2-оксопирролидин-1-ил)-2-фенилуксусная кислота
Продукт Примера 128C (245 мг, 0,89 ммоль) в трифторуксусной кислоте (5 мл) перемешивали при температуре окружающей среды в течение 2 часов. Смесь концентрировали с получением 201 мг (100%) указанного в заголовке соединения. МС (ESI) m/z 276 (M+H)+.
Пример 128E
(2S,2'S)-N,N'-{[(4-фторфенил)имино]бис(метандиилбензол-4,1-диил)}бис{1-[(2S)-2-(2-оксопирролидин-1-ил)-2-фенилацетил]пирролидин-2-карбоксамид}
Продукт Примера 128D (42,5 мг, 0,194 ммоль) и Примера 13E (50 мг, 0,087 ммоль) обрабатывали с использованием способа, описанного в Примере 7F, с получением трех стереоизомеров. Указанное в заголовке соединение было первым изомером, который элюировал, и фракции ВЭЖХ нейтрализовали насыщенным водным раствором NaHCO3 с последующей экстракцией смесью изопропилового спирта/CH2Cl2 (соотношение 1:3; 3×100 мл) и выделением указанного в заголовке соединения. Указанное в заголовке Примера 129 соединение элюировало вторым, и указанное в заголовке Примера 130 соединение элюировало третим.1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,72-2,00 (м, 5H), 2,03-2,14 (м, 2H), 2,27-2,34 (м, 6H), 2,94 (тд, J=8,81, 5,80 Гц, 2H), 3,16 (с, 6H), 3,50-3,58 (м, 2H), 3,65 (тд, J=8,67, 6,07 Гц, 2H), 4,08 (с, 2H), 4,44 (дд, J=8,29, 4,39 Гц, 2H), 4,55 (с, 4H), 6,59-6,65 (м, 2H), 6,90 (т, J=8,89 Гц, 2H), 7,17 (д, J=8,57 Гц, 4H), 7,23 (д, J=6,94 Гц, 4H), 7,30-7,41 (м, 6H), 7,53 (д, J=8,46 Гц, 4H), 9,94 (с, 2H), МС (ECI) м/z 919 (М+H)+.

Пример 129
(2S,2'S)-N,N'-{[(4-Фторфенил)имино]бис(метандиилбензол-4,1-диил)}бис{1-[(2-оксопирролидин-1-ил)(фенил)ацетил]пирролидин-2-карбоксамид}
Указанное в заголовке Примера 129 соединение было вторым элюирующим соединением, описанным в процедурах для примера 128E. Нейтрализация фракций ВЭЖХ насыщенным водным раствором NaHCO3 с последующей экстракцией смесью изопропилового спирта/CH2Cl2 (соотношение 1:3; 3×100 мл) и выделением приводила к получению 26 мг (25%) указанного в заголовке соединения.1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,73-2,00 (м, 10H), 2,04-2,21 (м, 2H), 2,23-2,36 (м, 4H), 2,63-2,70 (м, 2H), 2,90-3,03 (м, 2H), 3,16 (с, 6H), 3,47-3,61 (м, 4H), 3,60-3,72 (м, 1H), 4,09 (с, 2H), 4,46 (тд, J=8,13, 4,88 Гц, 2H), 4,56 (с, 4H), 5,94 (д, J=3,04 Гц, 2H), 6,64 (дд, J=9,27, 4,39 Гц, 2H), 6,91 (т, J=8,89 Гц, 2H), 7,18 (дд, J=8,40, 5,15 Гц, 6H), 7,23 (д, J=6,94 Гц, 1H), 7,32-7,43 (м, 8H), 7,54 (д, J=8,46 Гц, 4H), 9,94 (с, 1H), 10,08 (с, 1H), МС (ECI) м/z 919 (М+H)+.
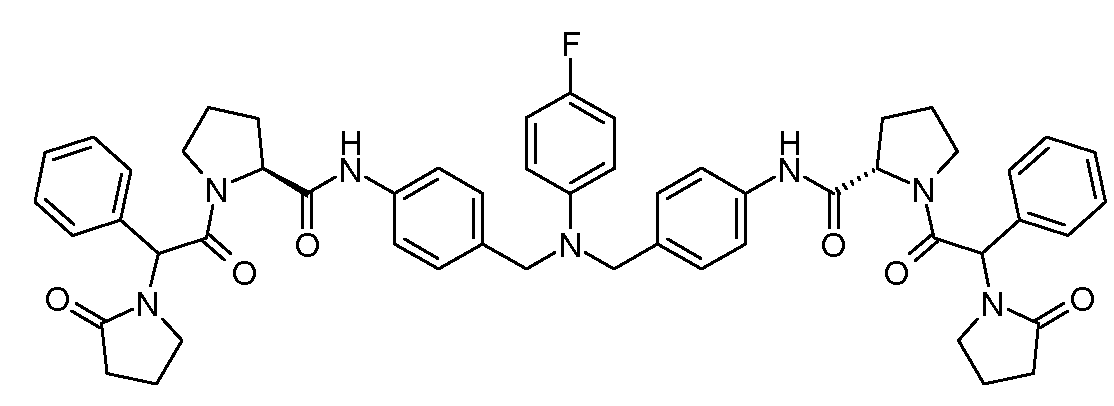
Пример 130
(2S,2'S)-N,N'-{[(4-Фторфенил)имино]бис(метандиилбензол-4,1-диил)}бис{1-[(2-оксопирролидин-1-ил)(фенил)ацетил]пирролидин-2-карбоксамид}
Указанное в заголовке соединение, Пример 130, было третим элюирующим соединением, описанным в процедурах для примера 128E. Нейтрализация фракций ВЭЖХ насыщенным водным раствором NaHCO3 с последующей экстракцией смесью изопропилового спирта/CH2Cl2 (соотношение 1:3; 3×100 мл) и выделением приводила к получению 13 мг (12%) указанного в заголовке соединения.1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,73-1,92 (м, 10H), 2,11-2,34 (м, 7H), 2,64-2,72 (м, 4H), 2,95-3,04 (м, 2H), 3,47-3,63 (м, 6H), 4,43-4,51 (м, 2H), 4,57 (с, 4H), 5,94 (с, 2H), 6,65 (дд, J=9,22, 4,45 Гц, 2H), 6,91 (т, J=8,89 Гц, 2H), 7,20 (д, J=8,57 Гц, 4H), 7,34-7,43 (м, 10H), 7,55 (д, J=8,46 Гц, 4H), 10,09 (с, 2H), МС (ECI) м/z 919 (М+H)+.
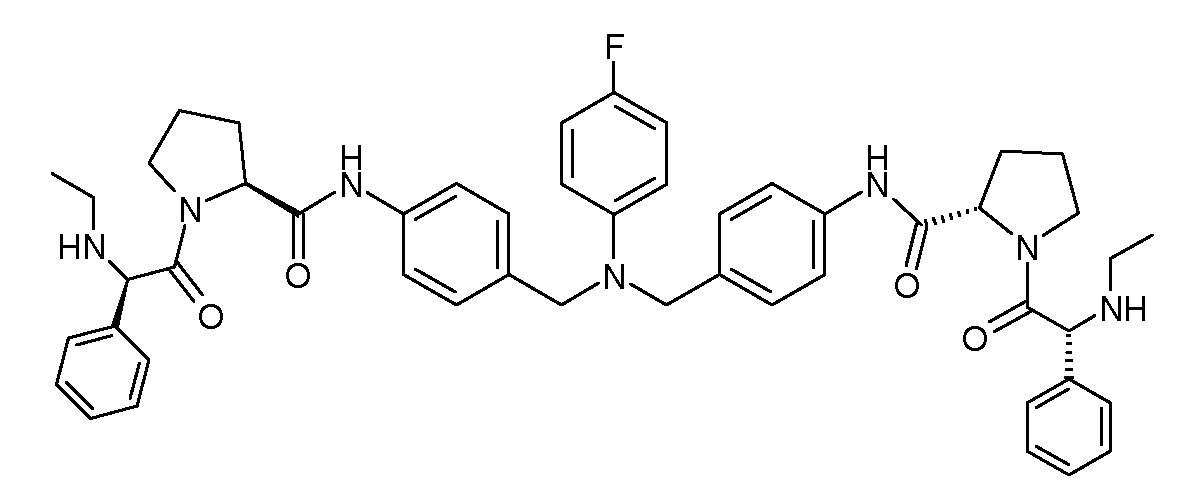
Пример 131
(2S,2'S)-N,N'-{[(4-фторфенил)имино]бис(метандиилбензол-4,1-диил)}бис{1-[(2R)-2-(этиламино)-2-фенилацетил]пирролидин-2-карбоксамид}
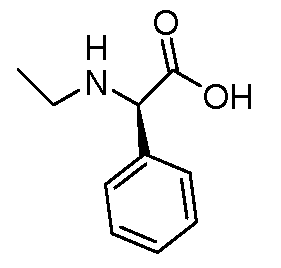
Пример 131A
(R)-2-(этиламино)-2-фенилуксусная кислота
Продукт из Примера 122A подвергали процедуре, описанной в Примере 122C, с получением указанного в заголовке соединения.
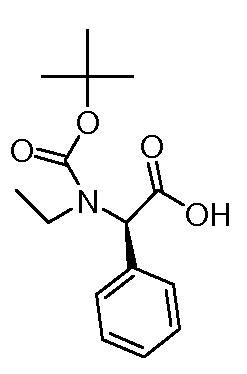
Пример 131B
(R)-2-(трет-бутоксикарбонил(этил)амино)-2-фенилуксусная кислота
К раствору продукта из Примера 131A (0,23 г, 1,28 ммоль) в MeOH (5 мл) добавляли основание Хунига (0,90 мл, 5,13 ммоль) и ди-трет-бутилдикарбонат (0,56 г, 2,57 ммоль). Смесь перемешивали при комнатной температуре в течение 22 часов и распределяли между CH2Cl2 и 1 н. раствором HCl. Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали при помощи колоночной хроматографии на силикагеле, используя градиент растворителя 0-4% MeOH в CH2Cl2, с получением указанного в заголовке соединения (0,086 г, 24%).

Пример 131C
трет-бутил (1R,1'R)-2,2'-((2S,2'S)-2,2'-(4,4'-(4-фторфенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил)) бис(оксометилен)бис(пирролидин-2,1-диил))бис(2-оксо-1-фенилэтан-2,1-диил)бис(этилкарбамат)
Продукт из Примера 13D (0,062 г, 0,120 ммоль) подвергали процедуре, описанной в Примере 2, заменяя (S)-2-(метоксикарбониламино)-3-метилбутановую кислоту на продукт из Примера 131B, с получением указанного в заголовке соединения (0,0427 г, 34%).
Пример 131D
(2S,2'S)-N,N'-{[(4-фторфенил)имино]бис(метандиилбензол-4,1-диил)}бис{1-[(2R)-2-(этиламино)-2-фенилацетил]пирролидин-2-карбоксамид}
К раствору продукта из Примера 131C (0,043 г, 0,041 ммоль) в CH2Cl2 (1,5 мл) добавляли 2,2,2-трифторуксусную кислоту (0,75 мл, 0,041 ммоль) и раствор перемешивали при комнатной температуре в течение 45 минут. Смесь распределяли между CH2Cl2 и насыщенным водным раствором NaHCO3, и органический слой сушили над безводным сульфатом натрия. Осушитель отфильтровывали, и растворитель удаляли в вакууме с получением указанного в заголовке соединения (18 мг, 51%).1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 0,98 (кв., J=6,9 Гц, 6H), 1,70-2,26 (м, 10H), 3,18-3,27 (м, 2H), 3,82 (с, 2H), 4,37 (дд, J=7,9, 3,7 Гц, 2H), 4,56 (д, J=3,9 Гц, 4H), 6,61-6,69 (м, 2H), 6,88-6,96 (м, 2H), 7,14-7,22 (м, 4H), 7,24-7,42 (м, 10H), 7,46-7,58 (м, 4H), 9,97 (д, J=9,7 Гц, 2H); МС м/z 838,3 (М+H)+.
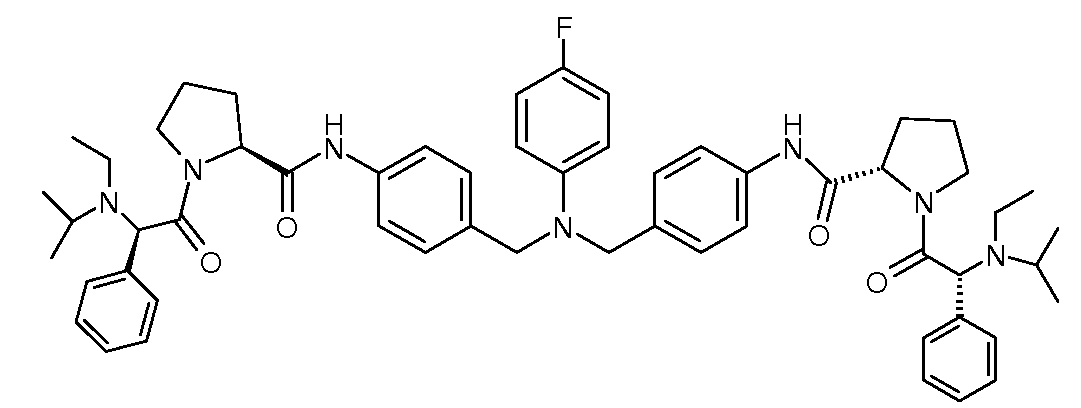
Пример 132
(2S,2'S)-N,N'-{[(4-фторфенил)имино]бис(метандиилбензол-4,1-диил)}бис(1-{(2R)-2-[этил(1-метилэтил)амино]-2-фенилацетил}пирролидин-2-карбоксамид)

Пример 132A
(R)-трет-бутил 2-(этил(изопропил)амино)-2-фенилацетат
К раствору продукта из Примера 122A (0,098 г, 0 416 ммоль) в EtOH (5 мл) добавляли ацетон (0,031 мл, 0,416 ммоль), уксусную кислоту (0,024 мл, 0,416 ммоль) и цианоборгидрид натрия (0,039 г, 0,625 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 8 часов. Смесь распределяли между CH2Cl2 и насыщенным водным раствором NaHCO3, и органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали при помощи колоночной хроматографии на силикагеле, используя градиент растворителя 0-1% MeOH в CH2Cl2, с получением указанного в заголовке соединения (0,0352 г, 31%).

Пример 132B
(R)-2-(этил(изопропил)амино)-2-фенилуксусная кислота
Продукт из Примера 132A (0,035 г, 0,13 ммоль) подвергали процедуре, описанной в Примере 122C, с получением указанного в заголовке соединения (0,027 г).
Пример 132C
(2S,2'S)-N,N'-{[(4-фторфенил)имино]бис(метандиилбензол-4,1-диил)}бис(1-{(2R)-2-[этил(1-метилэтил)амино]-2-фенилацетил}пирролидин-2-карбоксамид)
Продукт из Примера 13D (0,030 г, 0,058 ммоль) подвергали процедуре, описанной в Примере 13E, заменяя (S)-2-(метоксикарбониламино)-3,3-диметилбутановую кислоту на продукт из Примера 132B, с получением указанного в заголовке соединения (0,011 г, 21%).1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 0,78-1,02 (м, 6H), 1,14 (д, J=6,4 Гц, 2H), 1,21-1,35 (м, 12H), 1,39 (д, J=6,4 Гц, 4H), 1,73-2,18 (м, 8H), 2,74-3,21 (м, 6H), 4,41 (дд, J=8,3, 3,4 Гц, 2H), 4,59 (с, 4H), 5,43-5,52 (м, 2H), 6,59-6,69 (м, 2H), 6,92 (т, J=8,8 Гц, 2H), 7,21 (д, J=8,3 Гц, 4H), 7,47-7,82 (м, 12H), 9,32 (с, 1H), 10,14 (с, 1H); МС м/z= 922,6 (М+H)+.

Пример 133
Диметил ([(4-фторфенил)имино]бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(1S)-1-циклопентил-2-оксоэтан-2,1-диил]})бискарбамат
Продукт из Примера 13D (0,035 г, 0,068 ммоль) и (S)-2-циклопентил-2-(метоксикарбониламино)уксусную кислоту (0,030 г, 0,149 ммоль) обрабатывали, как в Примере 25B, с получением указанного в заголовке соединения в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,20-1,36 (м, 4H) 1,41-1,50 (м, 4H) 1,51-1,74 (м, 8H) 1,82-1,92 (м, 4H) 1,95-2,04 (м, 2H) 2,08-2,19 (м, 4H) 3,52 (с, 6H) 3,57-3,65 (м, 2H) 3,79-3,89 (м, 2H) 4,10 (т, J=8,73 Гц, 2H) 4,42 (дд, J=8,13, 4,77 Гц, 2H) 4,55 (с, 4H) 6,64 (дд, J=9,22, 4,45 Гц, 2H) 6,91 (т, J=8,84 Гц, 2H) 7,17 (д, J=8,46 Гц, 4H) 7,41 (д, J=7,92 Гц, 2H) 7,51 (д, J=8,57 Гц, 4H) 9,95 (с, 2H); МС ECI- м/z 880,6 (М-H)-.
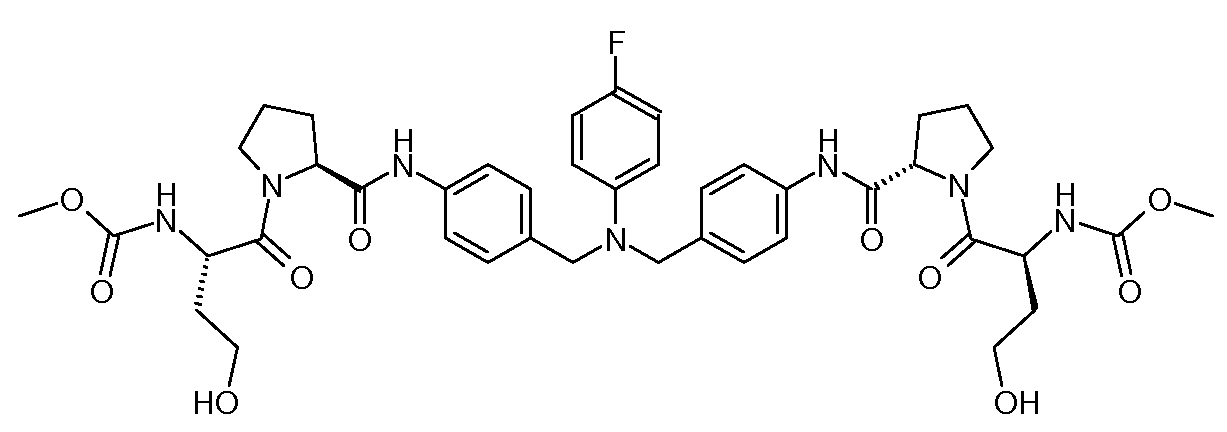
Пример 134
Диметил ([(4-фторфенил)имино]бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-4-гидрокси-1-оксобутан-1,2-диил]})бискарбамат
Продукт из Примера 13D (0,035 г, 0,068 ммоль) и (S)-4-гидрокси-2-(метоксикарбониламино)бутановую кислоту (0,027 г, 0,149 ммоль) обрабатывали, как в Примере 25B, с получением указанного в заголовке соединения в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,58-1,70 (м, 2H) 1,75-1,82 (м, 2H) 1,84-2,04 (м, 6H) 2,07-2,17 (м, 2H) 3,42-3,50 (м, 4H) 3,50-3,54 (м, 6H) 3,68 (т, J=6,45 Гц, 4H) 4,37-4,47 (м, 4H) 4,55 (с, 4H) 4,61 (т, J=4,93 Гц, 2H) 6,63 (дд, J=9,22, 4,34 Гц, 2H) 6,91 (т, J=8,89 Гц, 2H) 7,16 (д, J=8,46 Гц, 4H) 7,34 (д, J=7,70 Гц, 2H) 7,50 (д, J=8,46 Гц, 4H) 9,94 (с, 2H); МС ECI+ м/z 834,4 (М+H)+.

Пример 135
Диметил ([(4-фторфенил)имино]бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-3-этил-1-оксопентан-1,2-диил]})бискарбамат

Пример 135A
(S)-3-этил-2-(метоксикарбониламино)пентановая кислота
(S)-2-Амино-3-этилпентановую кислоту (1,0 г, 6,89 ммоль) обрабатывали, как в Примере 25A, с получением 1,02 г (73%) указанного в заголовке соединения в виде воскообразного твердого вещества.
Пример 135B
Диметил ([(4-фторфенил)имино]бис{метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-3-этил-1-оксопентан-1,2-диил]})бискарбамат
Продукт из Примера 13D (0,040 г, 0,078 ммоль) и продукт из Примера 135A (0,035 г, 0,171 ммоль) обрабатывали, как в Примере 25B, с получением указанного в заголовке соединения в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 0,59-0,93 (м, 12H) 1,05-1,36 (м, 6H) 1,37-1,50 (м, 2H) 1,54-1,70 (м, 2H) 1,78-1,97 (м, 3H) 2,08-2,21 (м, 2H) 3,41-3,49 (м, 2H) 3,51-3,64 (м, 9H) 3,74-3,85 (м, 2H) 4,27-4,48 (м, 4H) 4,55 (с, 4H) 6,63 (дд, J=9,22, 4,34 Гц, 2H) 6,90 (т, J=8,89 Гц, 2H) 7,17 (д, J=8,24 Гц, 4H) 7,20-7,38 (м, 2H) 7,47-7,55 (м, 4H) 9,71-10,24 (м, 2H); МС ECI- м/z 884,6 (М-H)-.

Пример 136
Диметил ([(4-фторфенил)имино]бис{метандиилбензол-4,1-диилкарбамоил[(2S,4S)-4-гидроксипирролидин-2,1-диил][(2S)-3,3-диметил-1-оксобутан-1,2-диил]})бискарбамат
Продукт из Примера 127D (30 мг, 0,057 ммоль) и (S)-2-(метоксикарбониламино)-3,3-диметилбутановую кислоту (26,8 мг, 0,142 ммоль) обрабатывали с использованием способа, описанного в Примере 43, с получением 8,5 мг (15%) указанного в заголовке соединения.1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,97 (с, 2H), 7,49 (д, J=7,6 Гц, 4H), 7,17 (д, J=7,6 Гц, 4H), 7,10 (м, 2H), 6,90 (м, 4H), 6,62 (м, 2H), 5,29 (д, J=5,5 Гц, 2H), 4,54 (шир. с, 4H), 4,38 (м, 2H), 4,22 (м, 2H), 4,15 (м, 2H), 3,96 (м, 2H), 3,52 (с, 6H), 2,53 (с, 4H), 2,38 (м, 2H), 1,65 (м, 2H), 0,95 (с, 18H).
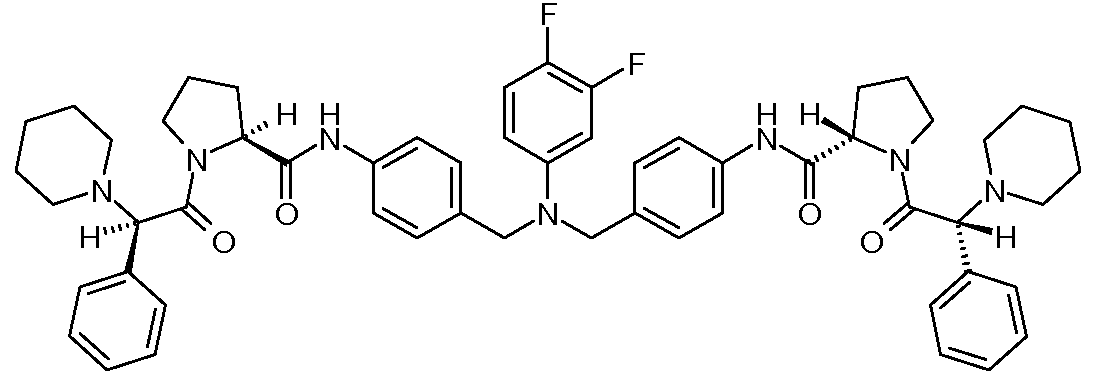
Пример 137
(2S,2'S)-N,N'-{[(3,4-Дифторфенил)имино]бис(метандиилбензол-4,1-диил)}бис{1-[(2R)-2-фенил-2-пиперидин-1-илацетил] пирролидин-2-карбоксамид}
Продукт из Примера 89D и гидрохлорид (R)-2-фенил-2-(пиперидин-1-ил)уксусной кислоты обрабатывали с использованием способа, описанного в Примере 13E, заменяя ДМФА на дихлорметан, с получением указанного в заголовке соединения (55,5 мг, 25%).1H ЯМР (400 МГц, ДМСО) δ 1,51-1,20 (м, 14H), 1,90-1,74 (м, 5H), 2,10-1,91 (м, 5H), 2,40-2,34 (м, 4H), 3,54-3,41 (м, 2H), 3,90-3,78 (м, 2H), 4,24 (с, 2H), 4,36-4,29 (м, 2H), 4,60 (с, 4H), 6,46-6,37 (м, 1H), 6,68-6,57 (м, 1H), 7,14-7,07 (м, 2H), 7,19 (д, J=8,4, 4H), 7,36-7,25 (м, 5H), 7,42 (д, J=7,2, 4H), 7,53 (д, J=8,5, 4H), 9,97 (с, 2H), МС (ECI) м/z 936 (М+H+, 30%) 469 (0,5М+H+, 100%).

Пример 138
(2S,2'S)-N,N'-{[(4-Фторфенил)имино]бис(метандиилбензол-4,1-диил)}бис{1-[(4,4-дифторпиперидин-1-ил)(фенил)ацетил]пирролидин-2-карбоксамид}
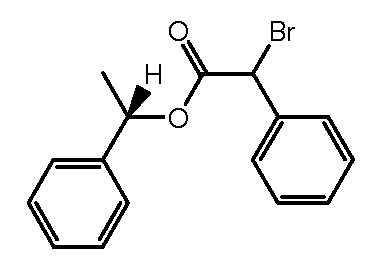
Пример 138A
(S)-1-фенилэтил 2-бром-2-фенилацетат
К смеси α-бромфенилуксусной кислоты (11,20 г, 52,1 ммоль), (S)-(-)-1-фенилэтанола (8,2 мл, 67,9 ммоль) и DMAP (0,63 г, 5,2 ммоль) в CH2Cl2 (100 мл) добавляли EDAC (13,80 г, 72,0 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 3 часов, затем разбавляли этилацетатом (200 мл), промывали водой (2×100 мл) и насыщенным солевым раствором (100 мл). Органический слой сушили (MgSO4), фильтровали и концентрировали, затем очищали при помощи колоночной хроматографии с получением указанного в заголовке соединения (12,6 г, 76% выход).
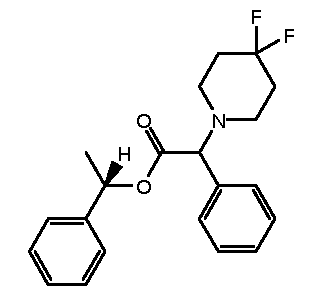
Пример 138B
(S)-1-фенилэтил 2-(4,4-дифторпиперидин-1-ил)-2-фенилацетат
К раствору продукта из Примера 138A (1,00 г, 3,13 ммоль) в тетрагидрофуране (20 мл) при комнатной температуре добавляли триэтиламин (1,75 мл, 12,5 ммоль) и тетрабутиламмониййодид (0,46 г, 1,25 ммоль). Смесь перемешивали в течение 5 минут и затем добавляли 4,4-дифторпиперидингидрохлорид (0,74 г, 4,70 ммоль) в виде свободного основания в ТГФ. Смесь перемешивали в течение 1 часа при комнатной температуре и затем нагревали до 55°C в течение ночи. Охлажденную смесь промывали насыщенным солевым раствором, концентрировали, затем очищали при помощи колоночной хроматографии (EtOAc-гексан) с получением указанного в заголовке соединения (1,04 г, 92% выход).
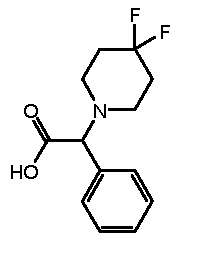
Пример 138C
2-(4,4-дифторпиперидин-1-ил)-2-фенилуксусная кислота
К раствору продукта из Примера 138B (1,04 г, 2,89 ммоль) в CH2Cl2 (6 мл) при комнатной температуре добавляли трифторуксусную кислоту (2,0 мл) и смесь перемешивали в течение 48 часов. Смесь концентрировали при пониженном давлении, и остаток переносили в толуол. Смесь концентрировали при пониженном давлении и сушили в вакуумной печи при 50°C с получением указанного в заголовке соединения (в виде соли ТФУК) в виде светло-желтого твердого вещества (1,07 г, 100%).
Пример 138D
(2S,2'S)-N,N'-{[(4-фторфенил)имино]бис(метандиилбензол-4,1-диил)}бис{1-[(4,4-дифторпиперидин-1-ил)(фенил)ацетил]пирролидин-2-карбоксамид}
Указанное в заголовке соединение получали с использованием способов из Примера 13E, заменяя (S)-2-(метоксикарбониламино)-3,3-диметилбутановую кислоту на продукт из Примера 138C, с получением смеси трех диастереомеров. Указанное в заголовке соединение (176 мг, 31% выход) выделяли при помощи колоночной хроматографии в качестве первого элюирующего диастереомера.1H ЯМР (400 МГц, МЕТАНОЛ-Д4) δ 7,52-7,46 (м, 8H), 7,41-7,31 (м, 6H), 7,21 (д, J=8,4, 4H), 6,85 (т, J=8,8, 2H), 6,72 (дд, J=9,2, 4,3, 2H), 4,54 (с, 4H), 4,42 (дд, J=7,8, 4,8, 2H), 4,31 (с, 2H), 3,94-3,85 (м, 2H), 3,52-3,40 (м, 2H), 2,66-2,44 (м, 8H), 2,19-1,79 (м, 16H), МС (ECI; М+H) м/z=990.
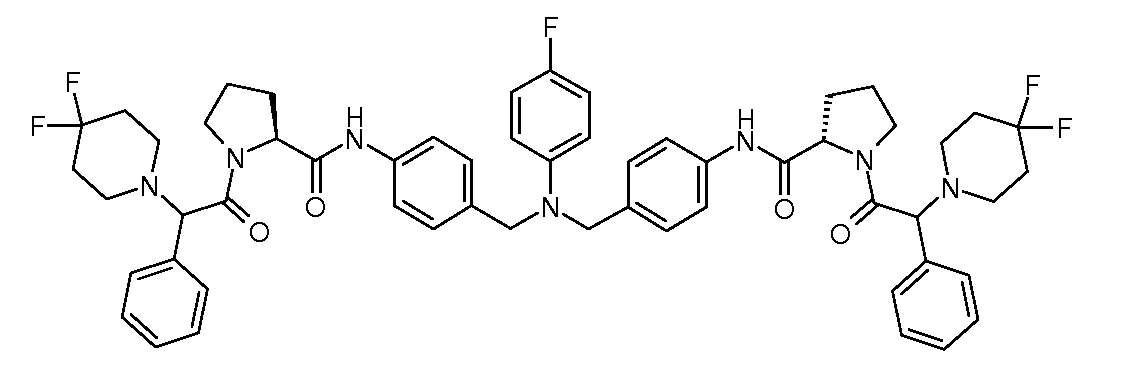
Пример 139
(2S,2'S)-N,N'-{[(4-Фторфенил)имино]бис(метандиилбензол-4,1-диил)}бис{1-[(4,4-дифторпиперидин-1-ил)(фенил)ацетил]пирролидин-2-карбоксамид}
Указанное в заголовке соединение (77 мг, 14% выход) выделяли в результате колоночной хроматографии Примера 138D в качестве второго элюирующего диастереомера.1H ЯМР (400 МГц, МЕТАНОЛ-Д4) δ 7,57-7,44 (м, 6H), 7,43-7,30 (м, 8H), 7,28-7,15 (м, 4H), 6,88-6,81 (м, 2H), 6,77-6,68 (м, 2H), 4,63-4,51 (м, 5H), 4,48 (с, 1H), 4,42 (дд, J=7,4, 4,6, 1H), 4,31 (с, 1H), 3,94-3,86 (м, 1H), 3,81-3,71 (м, 1H), 3,54-3,39 (м, 2H), 2,69-2,35 (м, 8H), 2,23-1,77 (м, 16H), МС (ECI; М+H) м/z=990.
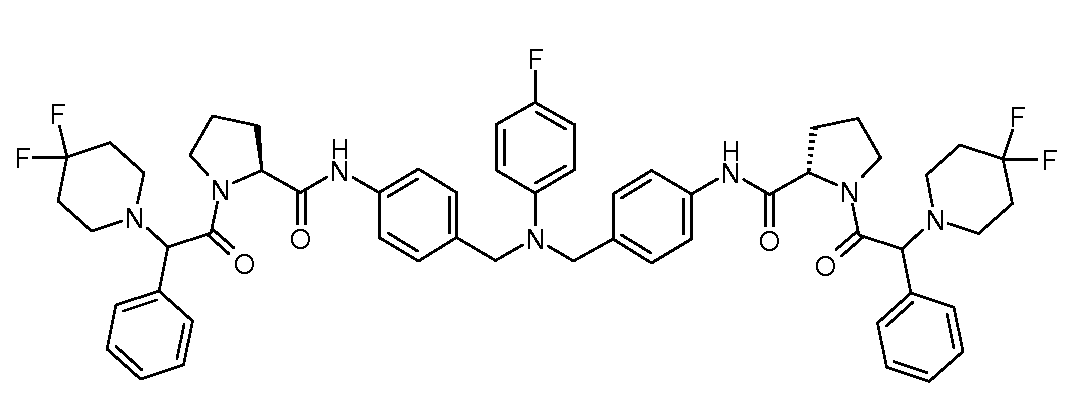
Пример 140
(2S,2'S)-N,N'-{[(4-Фторфенил)имино]бис(метандиилбензол-4,1-диил)}бис{1-[(4,4-дифторпиперидин-1-ил)(фенил)ацетил]пирролидин-2-карбоксамид}
Указанное в заголовке соединение (49 мг, 9% выход) выделяли в результате колоночной хроматографии Примера 138D, элюируя в качестве третьего элюирующего диастереомера.1H ЯМР (400 МГц, МЕТАНОЛ-Д4) δ 7,57-7,15 (м, 18H), 6,88-6,81 (м, 2H), 6,76-6,68 (м, 2H), 4,62-4,51 (м, 4H), 4,50-4,40 (м, 2H), 3,81-3,67 (м, 2H), 3,53-3,33 (м, 2H), 2,70-2,35 (м, 8H), 2,29-1,81 (м, 18H), МС (ECI; М+H) м/z=990.

Пример 141
Диметил ([(4-фторфенил)имино]бис{метандиил(6-метоксибензол-3,1-диил)карбамоил(2S)пирролидин-2,1-диил[(2S)-3,3-диметил-1-оксобутан-1,2-диил]})бискарбамат
Диметил ([(4-фторфенил)имино]бис{метандиилбензол-4,1-диилкарбамоил[(2S,3S)-3-гидроксипирролидин-2,1-диил][(2S)-3,3-диметил-1-оксобутан-1,2-диил]})бискарбамат
Пример 141A
(2S,3S)-1-(трет-бутоксикарбонил)-3-гидроксипирролидин-2-карбоновая кислота
К раствору (2S,3S)-3-гидроксипирролидин-2-карбоновой кислоты (0,50 г, 3,8 ммоль) в CH2Cl2 (19 мл) при комнатной температуре добавляли ди-трет-бутилдикарбонат (0,96 мл, 4,2 ммоль) и основание Хунига (1,32 мл, 7,6 ммоль) с получением бронзового раствора. Реакционную смесь перемешивали в течение ночи при комнатной температуре и затем разбавляли при помощи CH2Cl2 и промывали насыщенным раствором бикарбоната натрия. Водный слой концентрировали при пониженном давлении и затем суспендировали в метанол и фильтровали. Растворитель затем удаляли при пониженном давлении с получением указанного в заголовке соединения (0,91 г, 103% выход).
Пример 141B
(2S,2'S,3S,3'S)-трет-бутил 2,2'-(4,4'-(4-фторфенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(оксометилен)бис(3-гидроксипирролидин-1-карбоксилат)
Указанное в заголовке соединение получали с использованием способов из Примера 13C, заменяя N-(трет-бутоксикарбонил)-L-пролин на продукт из Примера 141A, с получением указанного в заголовке соединения (0,51 г, 77% выход).
Пример 141C
(2S,2'S,3S,3'S)-N,N'-(4,4'-(4-фторфенилазанедиил)бис(метилен)бис(4,1-фенилен))бис(3-гидроксипирролидин-2-карбоксамид)
Указанное в заголовке соединение получали с использованием способов из Примера 13D, заменяя продукт из Примера 13C на продукт из Примера 141B, с получением указанного в заголовке соединения (0,28 г, 76% выход).
Пример 141D
Диметил ([(4-фторфенил)имино]бис{метандиил(6-метоксибензол-3,1-диил)карбамоил(2S)пирролидин-2,1-диил[(2S)-3,3-диметил-1-оксобутан-1,2-диил]})бискарбамат
Диметил ([(4-фторфенил)имино]бис{метандиилбензол-4,1-диилкарбамоил[(2S,3S)-3-гидроксипирролидин-2,1-диил][(2S)-3,3-диметил-1-оксобутан-1,2-диил]})бискарбамат
Указанное в заголовке соединение получали с использованием способов из Примера 13E, заменяя продукт из Примера 13D на продукт из Примера 141C, с получением указанного в заголовке соединения (0,15 г, 45% выход).1H ЯМР (400 МГц, ДМСО) δ 10,14 (с, 2H), 7,52 (д, J=8,5, 4H), 7,15 (д, J=8,5, 4H), 7,08 (д, J=9,3, 2H), 6,89 (т, J=8,6, 2H), 6,62 (дд, J=4,4, 9,2, 2H), 5,39 (с, 2H), 4,53 (шир. с, 4H), 4,30-4,16 (м, 6H), 3,82-3,69 (м, 4H), 3,53 (с, 6H), 2,15-2,02 (м, 2H), 1,88-1,78 (м, 2H), 0,96-0,88 (м, 18H), МС (ECI; М+H) м/z=891.
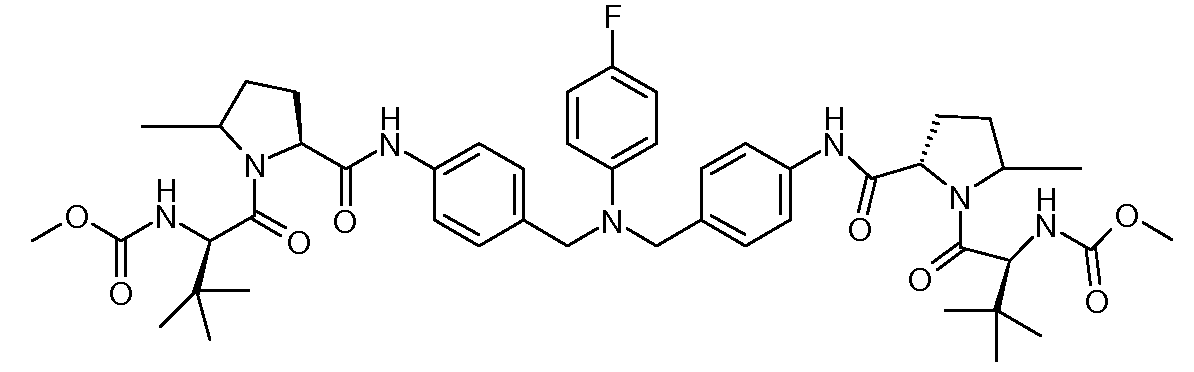
Пример 142
Метил [(1R)-1-{[(2S)-2-{[4-({(4-фторфенил)[4-({[(2S)-1-{(2S)-2-[(метоксикарбонил)амино]-3,3-диметилбутаноил}-5-метилпирролидин-2-ил]карбонил}амино)бензил]амино}метил)фенил]карбамоил}-5-метилпирролидин-1-ил]карбонил}-2,2-диметилпропил]карбамат
Пример 142A
(2S)-1-трет-бутил-2-этил-5-метилпирролидин-1,2-дикарбоксилат
Указанное в заголовке соединение получали из (2S)-1-трет-бутил 2-этил 5-гидроксипирролидин-1,2-дикарбоксилата, следуя способу, описанному Collado et al. J. Org. Chem. 1995, 60, 5011-5015.

Пример 142B
(2S)-1-(трет-бутоксикарбонил)-5-метилпирролидин-2-карбоновая кислота
К раствору продукта из Примера 142A (0,068 г, 0,264 ммоль) в MeOH (2,64 мл) добавляли NaOH (10,57 мг, 0,264 ммоль) и полученную смесь перемешивали при комнатной температуре в течение ночи. Смесь распределяли между CH2Cl2 и водным 1 н. раствором HCl, и органический слой отделяли и сушили над безводным сульфатом натрия. Осушитель отфильтровывали, и растворитель удаляли в вакууме с получением указанного в заголовке соединения (0,050 г, 83%).
Пример 142C
Метил [(1R)-1-{[(2S)-2-{[4-({(4-фторфенил)[4-({[(2S)-1-{(2S)-2-[(метоксикарбонил)амино]-3,3-диметилбутаноил}-5-метилпирролидин-2-ил]карбонил}амино)бензил]амино}метил)фенил]карбамоил}-5-метилпирролидин-1-ил]карбонил}-2,2-диметилпропил]карбамат
Указанное в заголовке соединение получали из продукта Примера 13B, используя процедуры, описанные в Примерах 1C-1E, заменяя N-(трет-бутоксикарбонил)-L-пролин на продукт из Примера 142B и заменяя (S)-2-(метоксикарбониламино)-3-метилбутановую кислоту на (S)-2-(метоксикарбониламино)-3,3-диметилбутановую кислоту, и конечный продукт очищали при помощи хроматографии на силикагеле с градиентным элюированием 0-3% метанола в дихлорметане.1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 0,96 (с, 18H), 1,25 (д, J=6,0 Гц, 6H), 1,61 (дд, J=11,4, 6,1 Гц, 2H), 1,78-2,30 (м, 6H), 3,53 (с, 6H), 3,58-3,67 (м, 2H), 4,27-4,38 (м, 3H), 4,43 (д, J=9,4 Гц, 2H), 4,54 (с, 4H), 6,60-6,67 (м, 2H), 6,85-6,95 (м, 2H), 7,16 (д, J=8,5 Гц, 4H), 7,49 (д, J=8,6 Гц, 4H), 9,97 (с, 2H); МС м/z 886,7 (М+H)+.
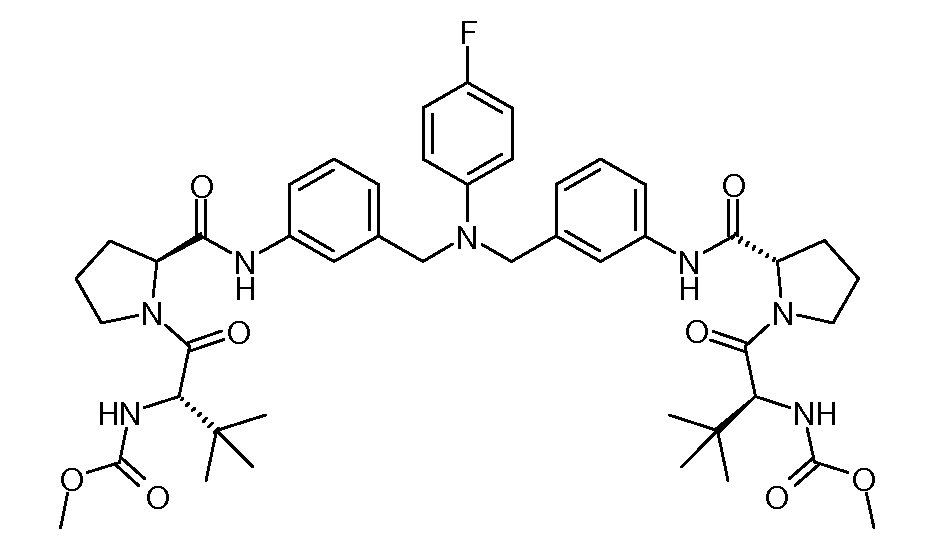
Пример 143
Диметил ([(4-фторфенил)имино]бис{метандиилбензол-3,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-3,3-диметил-1-оксобутан-1,2-диил]})бискарбамат
Пример 143A
4-фтор-N,N-бис(3-нитробензил)анилин
4-Фторанилин и 3-нитробензилбромид обрабатывали с использованием способа, описанного в Примере 1A, с получением 1,46 г (87%) указанного в заголовке соединения.1H ЯМР (400 МГц, ДМСО-d6) δ 4,88 (с, 4H) 6,69-6,75 (м, 2H) 6,97 (т, J=8,89 Гц, 2H) 7,64 (т, J=7,81 Гц, 2H) 7,70-7,74 (м, 2H) 8,08-8,13 (м, 4H).
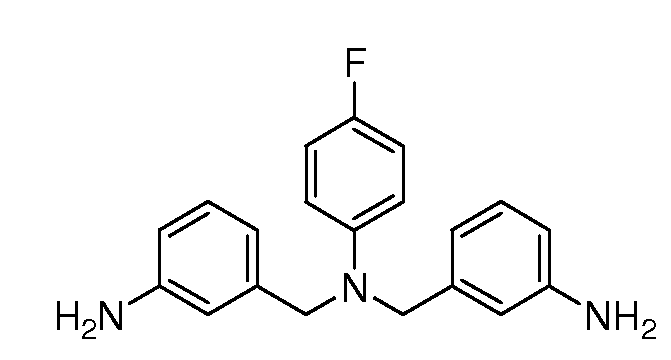
Пример 143B
N,N-бис(3-аминобензил)-4-фторанилин
К суспензии продукта из Примера 143A (0,450 г, 1,180 ммоль) в ТГФ (4 мл), этанола (1,00 мл) и воды (4,00 мл) при комнатной температуре добавляли хлорид аммония (0,189 г, 3,54 ммоль) с последующим добавлением железа (0,329 г, 5,90 ммоль) и смесь нагревали до 80°C. Через 3 часа смесь фильтровали через целит, концентрировали, и остаток распределяли между водой и 25% раствором изопропилового спирта-CHCl3. Органическую фазу сушили (Na2SO4) и концентрировали. Твердое вещество сушили в вакуумной печи с получением 321 мг (85%) указанного в заголовке соединения. МС (ESI; M+H) m/z=322.
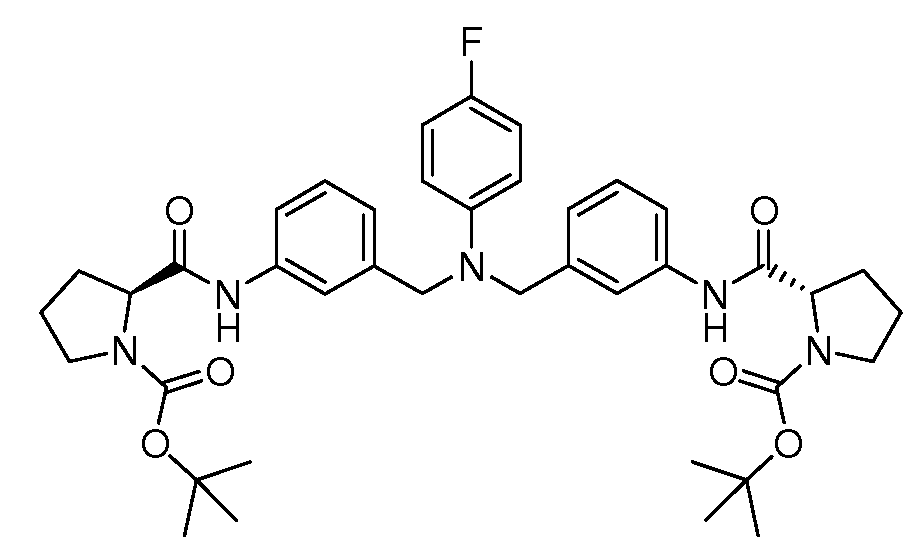
Пример 143C
(2S,2'S)-трет-бутил 2,2'-(3,3'-(4-фторфенилазанедиил)бис(метилен)бис(3,1-фенилен)бис(азанедиил))бис(оксометилен)дипирролидин-1-карбоксилат
Продукт из Примера 143B и (S)-1-(трет-бутоксикарбонил)пирролидин-2-карбоновую кислоту (Aldrich) обрабатывали с использованием способа, описанного в Примере 41, с получением 495 мг (69%) указанного в заголовке соединения. МС (ESI; M+H) m/z=716.

Пример 143D
(2S,2'S)-N,N'-(3,3'-(4-фторфенилазанедиил)бис(метилен)бис(3,1-фенилен))дипирролидин-2-карбоксамид
Продукт из Примера 143C обрабатывали с использованием способа, описанного в Примере 47B, с получением 341 мг (96%) указанного в заголовке соединения.1H ЯМР (400 МГц, ДМСО-d6) δ 1,60-1,68 (м, 4H) 1,71-1,80 (м, 2H) 1,98-2,08 (м, 2H) 2,69 (с, 6H) 2,88 (т, J=6,56 Гц, 4H) 3,67 (дд, J=8,73, 5,69 Гц, 2H) 4,63 (с, 4H) 6,61 (дд, J=9,27, 4,39 Гц, 2H) 6,89-6,97 (м, 4H) 7,25 (дд, J=7,81 Гц, 2H) 7,55 (с, 4H) 9,92 (с, 2H).
Пример 143E
Диметил ([(4-фторфенил)имино]бис{метандиилбензол-3,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-3,3-диметил-1-оксобутан-1,2-диил]})бискарбамат
Продукт из Примера 143D и (S)-2-(метоксикарбониламино)-3,3-диметилбутановую кислоту обрабатывали с использованием способа, описанного в Примере 41, с получением 460 мг (81%) указанного в заголовке соединения.1H ЯМР (400 МГц, ДМСО-d6) δ 0,96 (с, 18H) 1,80-1,90 (м, 4H) 1,93-2,03 (м, 2H) 2,09-2,19 (м, 2H) 3,54 (с, 6H) 3,60-3,68 (м, 2H) 3,71-3,82 (м, 2H) 4,21 (д, J=8,89 Гц, 2H) 4,43 (дд, J=8,02, 5,31 Гц, 2H) 4,63 (с, 4H) 6,57-6,66 (м, 2H) 6,89-6,96 (м, 4H) 7,08 (д, J=8,78 Гц, 2H) 7,24 (т, J=7,86 Гц, 2H) 7,38 (с, 2H) 7,59 (д, J=8,13 Гц, 2H) 10,00 (с, 2H).
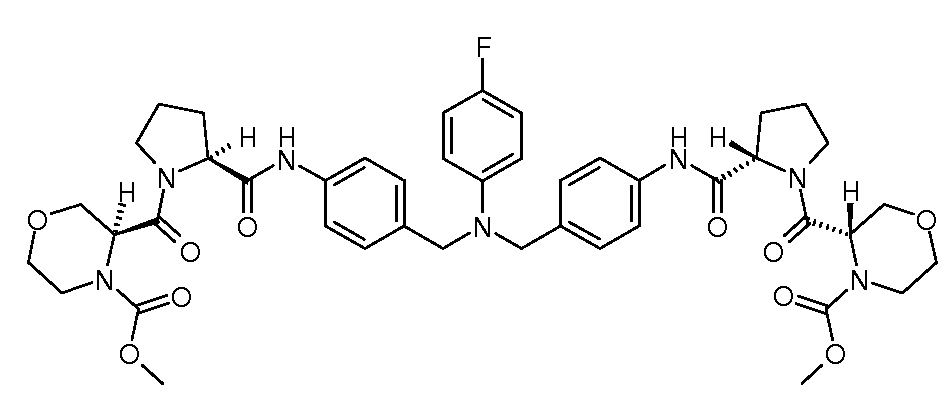
Пример 144
Диметил (3S,3'S)-3,3'-{[(4-фторфенил)имино]бис[метандиилбензол-4,1-диилкарбамоил(2S)пирролидин-2,1-диилкарбонил]}диморфолин-4-карбоксилат
Продукт из Примера 13D и (S)-4-(метоксикарбонил)морфолин-3-карбоновую кислоту обрабатывали с использованием способа, описанного в Примере 13E, заменяя ДМФА на дихлорметан, с получением указанного в заголовке соединения (0,21 г, 52%).1H ЯМР (400 МГц, ДМСО) δ 1,95-1,76 (м, 4H), 2,08-1,95 (м, 2H), 2,23-2,08 (м, 2H), 3,90-3,36 (м, 20H), 4,15 (д, J=11,6, 2H), 4,50-4,38 (м, 2H), 4,55 (с, 6H), 6,63 (дд, J=9,2, 4,4, 2H), 6,91 (т, J=8,9, 2H), 7,17 (д, J=8,5, 4H), 7,51 (д, J=8,4, 4H), 9,90 (с, 2H), МС (ECI) м/z 858 (М+H)+.

Пример 145
Диметил ([(4-фторфенил)имино]бис{метандиилбензол-4,1-диилкарбамоил[(2S,3S)-3-метилпирролидин-2,1-диил][(2S)-3,3-диметил-1-оксобутан-1,2-диил]})бискарбамат
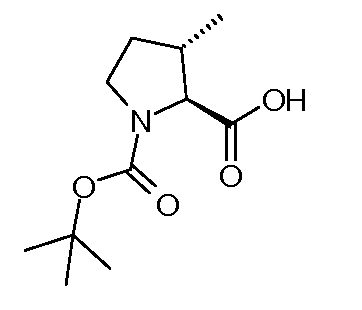
Пример 145A
(2S,3S)-1-(трет-бутоксикарбонил)-3-метилпирролидин-2-карбоновая кислота
Указанное в заголовке соединение получали с использованием способов из Примера 141A, заменяя (2S,3S)-3-гидроксипирролидин-2-карбоновую кислоту на (2S,3S)-3-метилпирролидин-2-карбоновую кислоту, с получением указанного в заголовке соединения (0,31 г, 74% выход).

Пример 145B
(2S,2'S,3S,3'S)-трет-бутил 2,2'-(4,4'-(4-фторфенилазанедиил)бис(метилен)бис(4,1-фенилен)бис(азанедиил))бис(оксометилен)бис(3-метилпирролидин-1-карбоксилат)
Указанное в заголовке соединение получали с использованием способов из Примера 13C, заменяя N-(трет-бутоксикарбонил)-L-пролин на продукт из Примера 145A, с получением указанного в заголовке соединения (0,32 г, 70% выход).

Пример 145C
(2S,2'S,3S,3'S)-N,N'-(4,4'-(4-фторфенилазанедиил)бис(метилен)бис(4,1-фенилен))бис(3-метилпирролидин-2-карбоксамид)
Указанное в заголовке соединение получали с использованием способов из Примера 13D, заменяя продукт из Примера 13C на продукт из Примера 145B, с получением указанного в заголовке соединения (0,20 г, 86% выход).
Пример 145D
Диметил ([(4-фторфенил)имино]бис{метандиил(6-метоксибензол-3,1-диил)карбамоил(2S)пирролидин-2,1-диил[(2S)-3,3-диметил-1-оксобутан-1,2-диил]})бискарбамат
Диметил ([(4-фторфенил)имино]бис{метандиилбензол-4,1-диилкарбамоил[(2S,3S)-3-гидроксипирролидин-2,1-диил][(2S)-3,3-диметил-1-оксобутан-1,2-диил]})бискарбамат
Указанное в заголовке соединение получали с использованием способов из Примера 13E, заменяя продукт из Примера 13D на продукт из Примера 145C, с получением указанного в заголовке соединения (55 мг, 33% выход).1H ЯМР (400 МГц, ДМСО) δ 10,01 (шир. с, 2H), 7,53 (д, J=8,5, 4H), 7,17 (д, J=8,5, 5H), 7,07 (д, J=8,6, 2H), 6,91 (т, J=8,7, 2H), 6,64 (дд, J=4,4, 9,2, 2H), 4,55 (шир. с, 4H), 4,16 (д, J=8,5, 2H), 3,97(д, J=6,8, 2H), 3,90 (с, 2H), 3,62-3,55 (м, 2H), 3,54 (с, 6H), 2,28-2,16 (м, 2H), 2,15-2,03 (м, 2H), 1,62-1,49 (м, 2H), 1,09 (д, J=6,7, 6H), 0,95 (с, 18H), МС (ECI; М+H) м/z=887.

Пример 146
Диметил ([(4-фторфенил)имино]бис{метандиилбензол-3,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-3-метил-1-оксобутан-1,2-диил]})бискарбамат
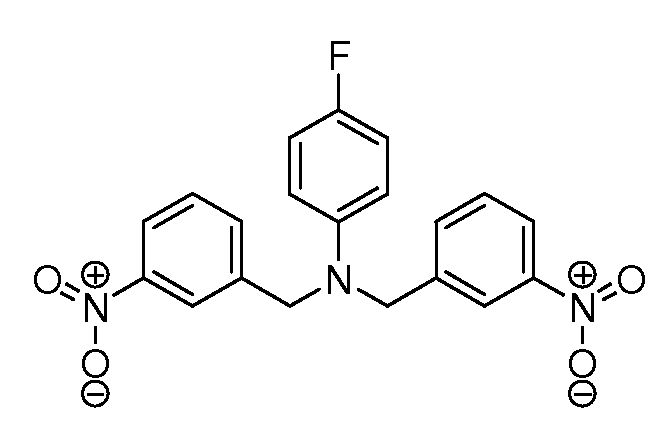
Пример 146A
4-фтор-N,N-бис(3-нитробензил)анилин
4-Фторанилин и 3-нитробензилбромид обрабатывали с использованием способа, описанного в Примере 32A, с получением указанного в заголовке соединения. LC/MS Rt 2,15 m/z 423 (M+CH3CN)+.
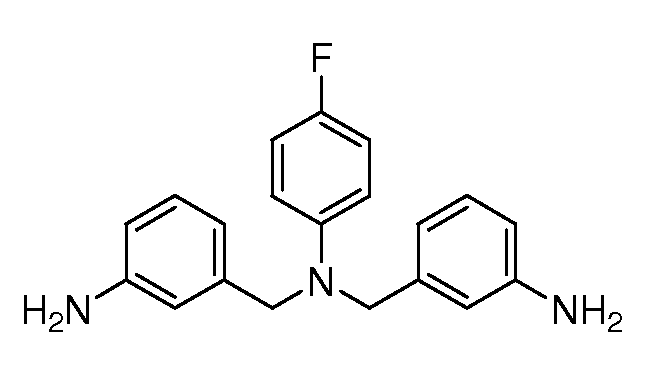
Пример 146B
N,N-бис(3-аминобензил)-4-фторанилин
Продукт из Примера 146A (1 г, 2,62 ммоль), хлорид аммония (0,4965 г, 9,28 ммоль) и железо (0,7849 г, 14,05 ммоль) объединяли в смеси ТГФ (12 мл)/этанол (12,00 мл)/вода (3,00 мл) и нагревали до 80°C. Через 18 часов добавляли дополнительное количество хлорида аммония (0,5162 г, 9,65 ммоль) и железа (0,8541 г, 15,29 ммоль), и нагревание продолжали в течение 3 дней. Реакционную смесь фильтровали через лепешку из целита и концентрировали. Остаток переносили в EtOAc и промывали водой (2x), насыщенным солевым раствором (1x), сушили (MgSO4) и концентрировали. Указанное в заголовке соединение использовали без очистки. МС (DCI) m/z 322 (M+H)+.
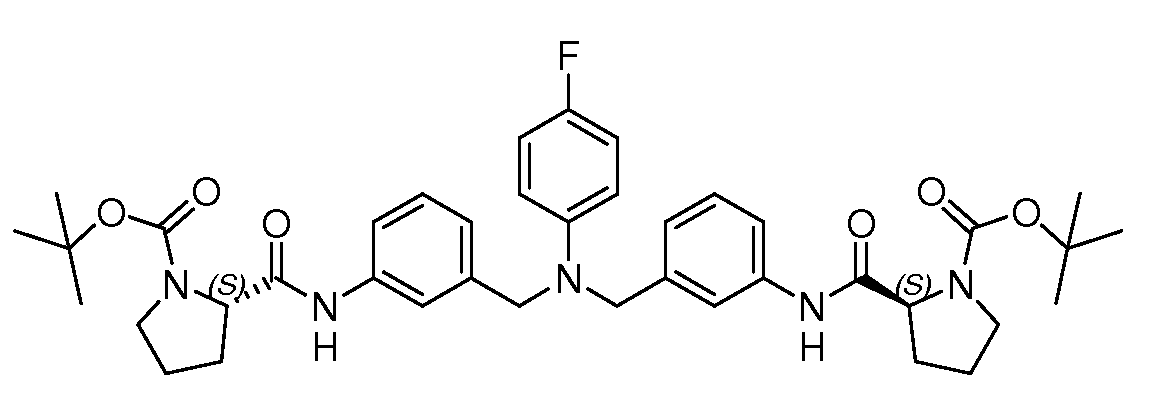
Пример 146C
(2S,2'S)-трет-бутил 2,2'-(3,3'-(4-фторфенилазанедиил)бис(метилен)бис(3,1-фенилен)бис(азанедиил))бис(оксометилен)дипирролидин-1-карбоксилат
Продукт из Примера 146B обрабатывали с использованием способа, описанного в Примере 1C, заменяя ДМСО на дихлорметан, с получением указанного в заголовке соединения (1,34 г, 71%). МС (ESI) m/z 716 (M+H)+.
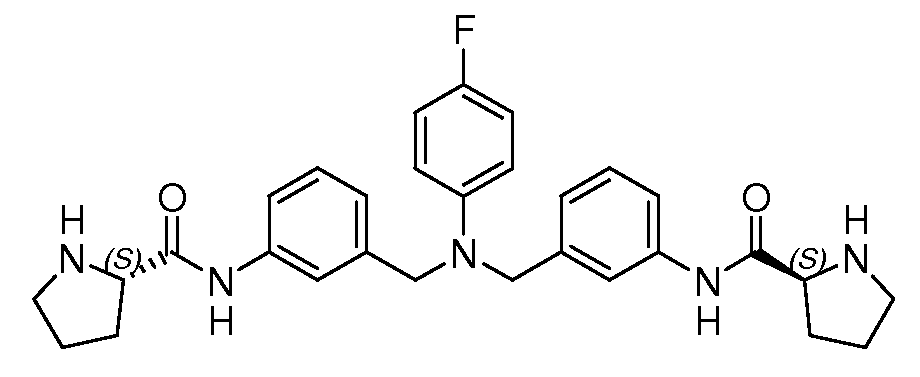
Пример 146D
(2S,2'S)-N,N'-(3,3'-(4-фторфенилазанедиил)бис(метилен)бис(3,1-фенилен))дипирролидин-2-карбоксамид
Продукт из Примера 146C обрабатывали с использованием способа, описанного в Примере 1D, с получением указанного в заголовке соединения. LC/MS Rt 1,26 m/z 516 (M+H)+.
Пример 146E
диметил ([(4-фторфенил)имино]бис{метандиилбензол-3,1-диилкарбамоил(2S)пирролидин-2,1-диил[(2S)-3-метил-1-оксобутан-1,2-диил]})бискарбамат
Продукт из Примера 146D обрабатывали с использованием способа, описанного в Примере 1E, и очищали с использованием флэш-хроматографии (силикагель, MeOH/дихлорметан) с получением указанного в заголовке соединения.1H ЯМР (400 МГц, ДМСО) δ 0,97-0,82 (м, 12H), 2,19-1,79 (м, 10H), 3,52 (с, 6H), 3,67-3,57 (м, 2H), 3,85-3,75 (м, 2H), 4,02 (т, J=8,5, 2H), 4,43 (дд, J=4,7, 8,1, 2H), 4,63 (с, 4H), 6,63-6,56 (м, 2H), 6,92 (дд, J=5,6, 12,0, 4H), 7,24 (т, J=7,9, 2H), 7,31 (д, J=8,4, 2H), 7,40 (с, 2H), 7,58 (д, J=8,1, 2H), 10,00 (с, 2H), МС (ECI) м/z 831 (М+H)+, 828 (М-H)+.
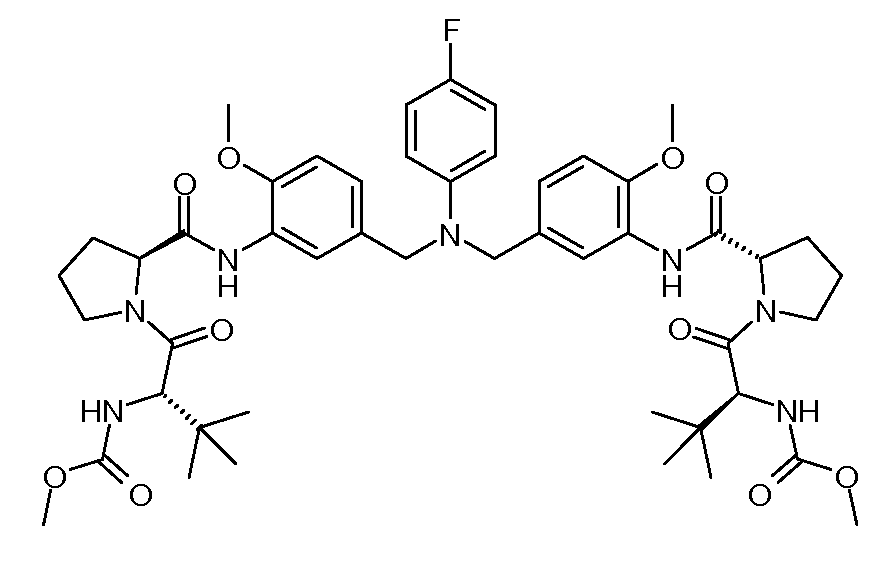
Пример 147
Диметил ([(4-фторфенил)имино]бис{метандиил(6-метоксибензол-3,1-диил)карбамоил(2S)пирролидин-2,1-диил[(2S)-3,3-диметил-1-оксобутан-1,2-диил]})бискарбамат

Пример 147A
4-фтор-N,N-бис(4-метокси-3-нитробензил)анилин
4-Фторанилин и 4-метокси-3-нитробензилбромид обрабатывали с использованием способа, описанного в Примере 1A, с получением 2,33 г (91%) указанного в заголовке соединения. МС (ESI; M+H) m/z=442.
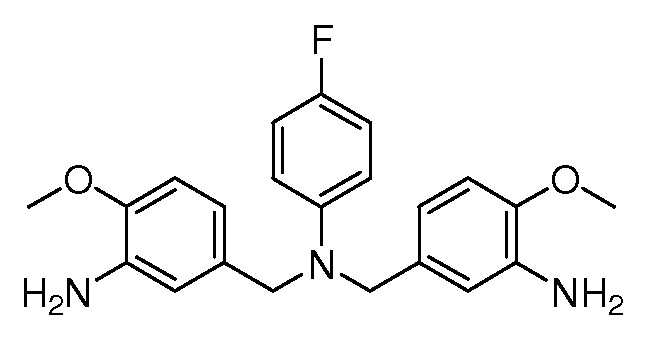
Пример 147B
N,N-бис(3-амино-4-метоксибензил)-4-фторанилин
Продукт из Примера 147A обрабатывали с использованием способа, описанного в Примере 143B, с получением 1,64 г (81%) указанного в заголовке соединения. МС (ESI; M+H) m/z=382.

Пример 147C
(2S,2'S)-трет-бутил 2,2'-(5,5'-(4-фторфенилазанедиил)бис(метилен)бис(2-метокси-5,1-фенилен))бис(азанедиил)бис(оксометилен)дипирролидин-1-карбоксилат
Продукт из Примера 147B и (S)-1-(трет-бутоксикарбонил)пирролидин-2-карбоновую кислоту (Aldrich) обрабатывали с использованием способа, описанного в Примере 41, с получением 2,49 г (75%) указанного в заголовке соединения. МС (ESI; M+H) m/z=776.
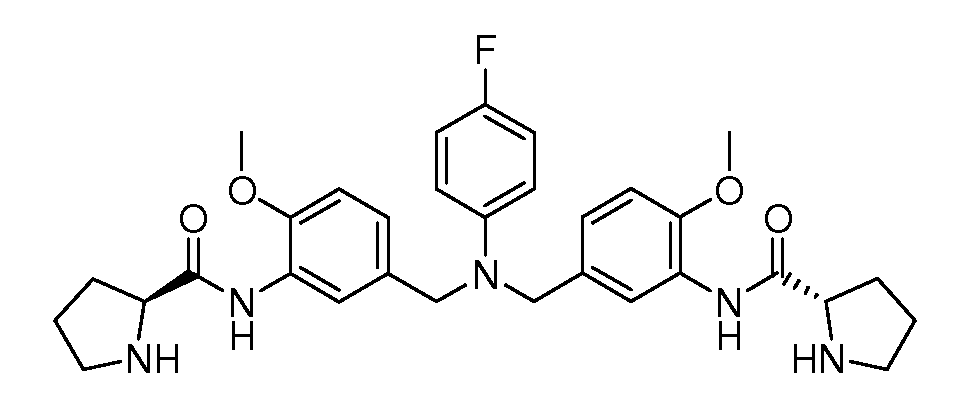
Пример 147D
(2S,2'S)-N,N'-(5,5'-(4-фторфенилазанедиил)бис(метилен)бис(2-метокси-5,1-фенилен))дипирролидин-2-карбоксамид
Продукт из Примера 147C обрабатывали с использованием способа, описанного в Примере 47B, с получением 1,82 г (99%) указанного в заголовке соединения. LC/MS (M+H) m/z=576; время удерживания 1,13 минут.
Пример 147E
диметил ([(4-фторфенил)имино]бис{метандиил(6-метоксибензол-3,1-диил)карбамоил(2S)пирролидин-2,1-диил[(2S)-3,3-диметил-1-оксобутан-1,2-диил]})бискарбамат
Продукт из Примера 147D и (S)-2-(метоксикарбониламино)-3,3-диметилбутановую кислоту обрабатывали с использованием способа, описанного в Примере 41, с получением 250 мг (48%) указанного в заголовке соединения.1H ЯМР (400 МГц, ДМСО-d6) δ 0,97 (с, 18H) 1,88-1,95-2,03 (м, 8H) 3,54 (с, 6H) 3,61-3,67 (м, 2H) 3,73-3,82 (м, 2H) 3,79 (с, 6H) 4,21 (д, J=8,78 Гц, 2H) 4,51 (с, 4H) 4,67 (дд, J=6,89, 5,15 Гц, 2H) 6,58-6,68 (м, 2H) 6,86-6,96 (м, 6H) 7,16 (д, J=8,67 Гц, 2H) 8,05 (шир. с, 2H) 9,20 (шир. с, 2H).

Пример 148
Метил [(1S)-1-{[(2S)-2-(5-{[({2-[(2S)-1-{(2S)-2-[(метоксикарбонил)амино]-3-метилбутаноил}пирролидин-2-ил]-1,3-бензоксазол-5-ил}метил)(фенил)амино]метил}-1,3-бензоксазол-2-ил)пирролидин-1-ил]карбонил}-2-метилпропил]карбамат
Пример 148AA
4-(бромметил)-1-хлор-2-нитробензол
К раствору (4-хлор-3-нитрофенил)метанола (5,0 г, 26,6 ммоль) в толуоле (100 мл) добавляли трибромид фосфора (0,879 мл, 9,32 ммоль) при 40°C. Реакционную смесь перемешивали при 100°C в течение 15 минут и распределяли между водой и этилацетатом. Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения.
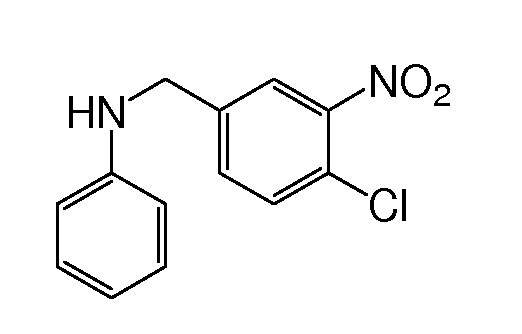
Пример 148BB
N-(4-хлор-3-нитробензил)анилин
К раствору 4-хлор-3-нитробензальдегида (10,0 г, 53,9 ммоль) и анилина (2,34 мл, 25,7 ммоль) в этаноле (200 мл) добавляли уксусную кислоту (7,35 мл, 128 ммоль), с последующим добавлением порциями дополнительного количества цианоборгидрида натрия (4,84 г, 77 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2,5 часов и концентрировали в вакууме. Остаток распределяли между этилацетатом и насыщенным водным раствором NaHCO3, и органический слой сушили над безводным Na2SO4. Осушитель отфильтровывали, и растворитель удаляли в вакууме с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле, используя градиент растворителя 0-1% метанола в дихлорметане с получением указанного в заголовке соединения (5,7 г, 85%).

Пример 148C
N,N-бис (4-хлор-3-нитробензил)анилин
К раствору продукта из Примера 148A (4,0 г, 15,23 ммоль) и продукта из Примера 148B (7,63 г, 30,5 ммоль) в ДМФА (150 мл) добавляли основание Хунига (8,0 мл, 45,7 ммоль) и полученную смесь перемешивали при 90°C в течение ночи. Смесь охлаждали до комнатной температуры и распределяли между CH2Cl2 и H2O, и органический слой сушили над безводным Na2SO4. Осушитель отфильтровывали, и растворитель удаляли в вакууме с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле, используя градиент растворителя 0-5% метанола в дихлорметане, с получением указанного в заголовке соединения.
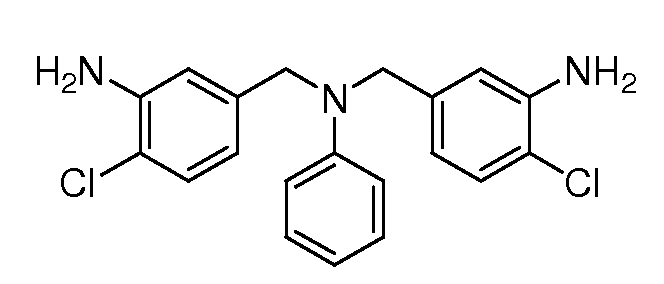
Пример 148D
N,N-бис(3-амино-4-хлорбензил)анилин
К раствору продукта из Примера 148C (0,304 г, 0,703 ммоль) в EtOH (10 мл), ТГФ (10 мл) и H2O (2,5 мл) добавляли железный порошок (0,393 г, 7,03 ммоль) с последующим добавлением хлорида аммония (0,188 г, 3,52 ммоль). Полученную смесь перемешивали при 90°C в течение 2 часов и затем фильтровали через целит и промывали этанолом. Фильтрат концентрировали в вакууме, и остаток распределяли между CH2Cl2 и H2O, и органический слой сушили над безводным Na2SO4. Осушитель отфильтровывали, и растворитель удаляли в вакууме с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле, используя градиент растворителя 0-0,1% MeOH в CH2Cl2, с получением указанного в заголовке соединения (0,259 г, 99%).
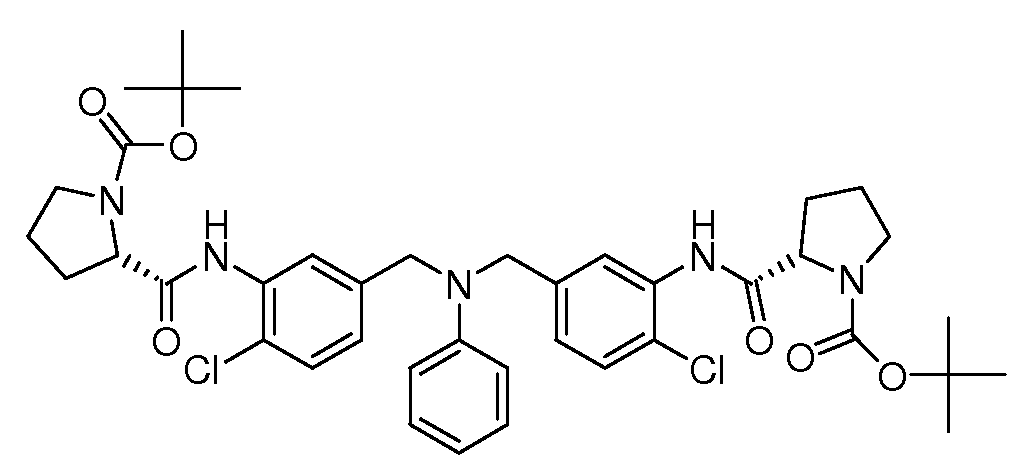
Пример 148E
(2S,2'S)-трет-бутил 2,2'-(5,5'-(фенилазанедиил)бис(метилен)бис(2-хлор-5,1-фенилен))бис(азанедиил)бис (оксометилен)дипирролидин-1-карбоксилат
К раствору продукта из Примера 148D (0,50 г, 1,343 ммоль) в ДМФА (6,7 мл) и пиридине (6,7 мл) добавляли (S)-1-(трет-бутоксикарбонил)пирролидин-2-карбоновую кислоту (0,723 г, 3,36 ммоль) и 1-[3-(диметиламинопропил]-3-этилкарбодиимидгидрохлорид (2,57 г, 13,43 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи и затем распределяли между этилацетатм и 1 н. водным раствором HCl. Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле, используя градиент растворителя 0-2% MeOH в CH2Cl2 с получением указанного в заголовке соединения (0,875 г, 85%).
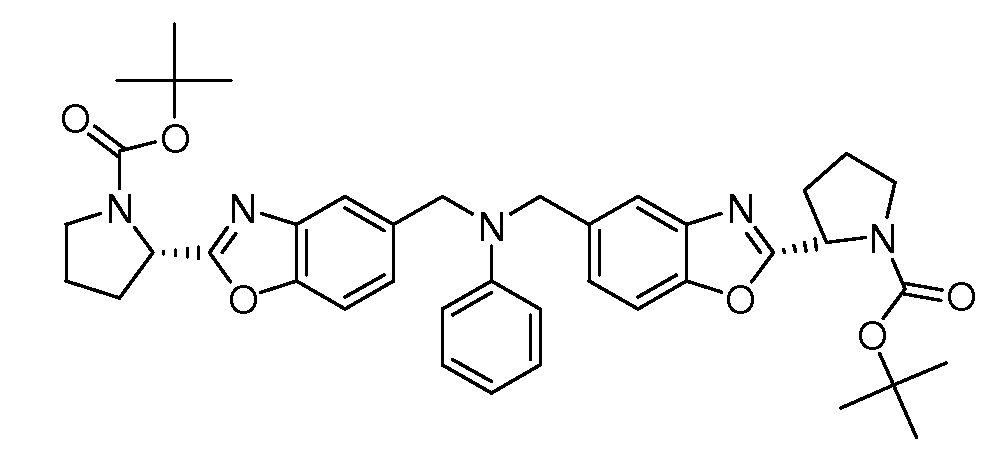
Пример 148F
(2S,2'S)-трет-бутил 2,2'-(5,5'-(фенилазанедиил)бис(метилен)бис(бензо[d]оксазоле-5,2-диил))дипирролидин-1-карбоксилат
К раствору продукта из Примера 148E (0,366 г, 0,477 ммоль) в 1,4-диоксане (5 мл) добавляли 1,10-фенантролин (0,086 г, 0,477 ммоль), карбонат цезия (0,933 г, 2,86 ммоль) и йодид меди(I) (0,045 г, 0,239 ммоль). Полученную смесь перемешивали при 110°C в течение 3,5 дней. Охлажденную смесь распределяли между CH2Cl2 и H2O, и органический слой сушили над безводным сульфатом натрия. Осушитель отфильтровывали, и растворитель удаляли в вакууме с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле, используя градиент растворителя 0-5% MeOH в CH2Cl2, с получением указанного в заголовке соединения (0,150 г, 45%).
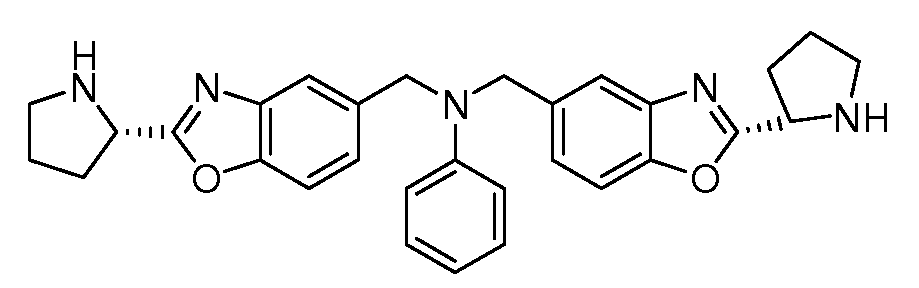
Пример 148G
N,N-бис((2-((S)-пирролидин-2-ил)бензо[d]оксазол-5-ил)метил)анилин
К раствору продукта из Примера 148F (0,150 г, 0,216 ммоль) в CH2Cl2 (2 мл) добавляли 2,2,2-трифторуксусную кислоту (1 мл, 0,216 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 30 минут и концентрировали в вакууме. Смесь распределяли между CH2Cl2 и насыщенным водным раствором NaHCO3, и органический слой сушили над безводным сульфатом натрия. Осушитель отфильтровывали, и растворитель удаляли в вакууме с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле, используя градиент растворителя 0-14% MeOH в CH2Cl2, с получением указанного в заголовке соединения (44,3 мг, 42%).
Пример 148H
метил [(1S)-1-{[(2S)-2-(5-{[({2-[(2S)-1-{(2S)-2-[(метоксикарбонил)амино]-3-метилбутаноил}пирролидин-2-ил]-1,3-бензоксазол-5-ил}метил)(фенил)амино]метил}-1,3-бензоксазол-2-ил)пирролидин-1-ил]карбонил}-2-метилпропил]карбамат
Продукт из Примера 148G (0,019 г, 0,038 ммоль) подвергали процедуре, описанной в Примере 24E, с получением указанного в заголовке соединения в виде соли ТФУК (6 мг).1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,84-0,93 (м, 12H), 1,85-2,34 (м, 12H), 3,53 (с, 6H), 3,87-3,97 (м, 3H), 4,05-4,14 (м, 2H), 4,79-4,86 (м, 4H), 5,12 (дд, 1H), 5,16 (дд, J=7,7, 3,1 Гц, 1H), 6,58 (т, J=7,2 Гц, 1H), 6,71 (д, J=8,1 Гц, 2H), 7,04-7,11 (м, 2H), 7,28 (д, J=8,5 Гц, 2H), 7,32-7,39 (м, 1H), 7,50 (с, 2H), 7,56-7,64 (м, 2H); МС м/z 808,3 (М+H)+.
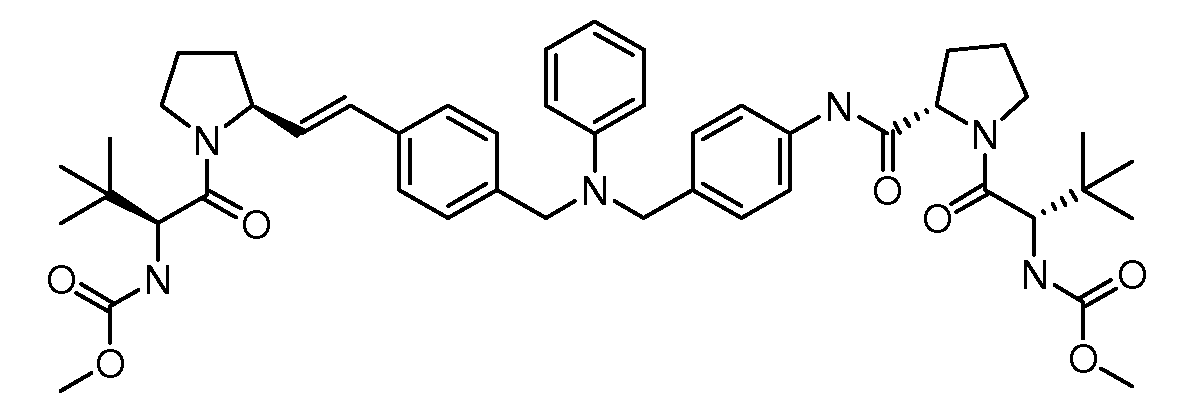
Пример 149
N-(Метоксикарбонил)-3-метил-L-валил-N-(4-{[{4-[(Е)-2-{(2S)-1-[N-(метоксикарбонил)-3-метил-L-валил]пирролидин-2-ил}этенил]бензил}(фенил)амино]метил}фенил)-L-пролинамид
Пример 149A
метил 4-((диэтоксифосфорил)метил)бензоат
Раствор метил 4-(бромметил)бензоата (12,5 г, 54,6 ммоль) в триэтилфосфите (20 мл, 114 ммоль) нагревали при 150°C в течение 2 часов. После охлаждения раствор концентрировали под вакуумом. Очистка при помощи хроматографии (силикагель, 0-2% метанола в дихлорметане) давала указанное в заголовке соединение. МС (ESI) m/z 287 (M+H)+.
Пример 149B
(S,E)-трет-бутил 2-(4-(метоксикарбонил)стирил)пирролидин-1-карбоксилат
К раствору продукта Примера 149A (4,02 г, 14,05 ммоль), растворенному в ТГФ (50 мл) и охлажденному до -78°C, по каплям добавляли литий бис(триметилсилил)амид (1,0M в ТГФ, 12,05 мл, 12,05 ммоль) и полученный раствор перемешивали при -78°C в течение еще 1 часа. Вслед за этим по каплям добавляли раствор (S)-трет-бутил 2-формилпирролидин-1-карбоксилата (2,0 г, 10,04 ммоль) в ТГФ (20 мл), охлаждающую баню затем удаляли и после того, как реакционная смесь достигала комнатной температуры, ее поддерживали при этой температуре в течение дополнительных 3 часов. К этой смеси добавляли раствор EtOAc и смесь экстрагировали водой. Органический экстракт затем сушили, фильтровали, концентрировали и очищали при помощи хроматографии (силикагель, 10-50% EtOAc в гексане) с получением 2,05 г (62%) указанного в заголовке соединения. МС (ESI) m/z 332 (M+H)+.
Пример 149C
(S,E)-трет-бутил 2-(4-(гидроксиметил)стирил)пирролидин-1-карбоксилат
К раствору продукта Примера 149B (1,0 г, 3,02 ммоль), растворенному в дихлорметане (20 мл) и охлажденному до -78°C, по каплям добавляли диизобутилалюмогидрид (1,0M в дихлорметане, 10,56 мл, 10,56 ммоль) и полученный раствор перемешивали при -78°C в течение 10 минут, охлаждающую баню затем удаляли, и после того как реакционная смесь достигала комнатной температуры, ее поддерживали при этой температуре в течение дополнительного 1 часа. К раствору добавляли ацетон (1 мл), затем к нему добавляли EtOAc и смесь экстрагировали водным раствором виннокислого калий-натрия. Органический экстракт затем сушили, фильтровали и концентрировали с получением 0,9 г (98%) указанного в заголовке соединения. МС (ESI) m/z 304 (M+H)+.
Пример 149D
(S,E)-трет-бутил 2-(4-(бромметил)стирил)пирролидин-1-карбоксилат
К раствору продукта Примера 149C (0,9 г, 2,97 ммоль), растворенному в ТГФ (50 мл), добавляли связанный смолой трифенилфосфин (5,93 ммоль) и тетрабромид углерода (1,48 г, 4,45 ммоль) и полученный раствор перемешивали при комнатной температуре в течение 2 часов. Смолу затем отфильтровывали, промывали при помощи ТГФ и объединенный фильтрат затем сушили, фильтровали и концентрировали с получением указанного в заголовке соединения, m/z 368 (M+H)+.

Пример 149E
(S,E)-трет-бутил 2-(4-(((4-нитробензил)(фенил)амино)метил)стирил)пирролидин-1-карбоксилат
К раствору продукта Примера 149D (1,09 г, 2,97 ммоль) и N-(4-нитробензил)анилина (0,677 г, 2,97 ммоль), растворенному в ДМФА (10 мл), добавляли калия карбонат (1,23 г, 8,9 ммоль) и смесь нагревали при 50°C в течение 1 часа. После охлаждения в раствор добавляли дихлорметан и смесь экстрагировали водой. Органический экстракт затем сушили, фильтровали, концентрировали и очищали при помощи хроматографии (силикагель, 0-2% метанола в дихлорметане) с получением 0,85 г (56%) указанного в заголовке соединения. МС (ESI) m/z 514 (M+H)+.

Пример 149F
(S,E)-трет-бутил 2-(4-(((4-аминобензил)(фенил)амино)метил)стирил)пирролидин-1-карбоксилат
Раствор продукта Примера 149E (0,8 г, 1,56 ммоль), растворенный в этаноле (20 мл), охлаждали в ледяной бане до 0°C, затем добавляли хлорид висмута(III) (1,47 г, 4,67 ммоль) с последующим добавлением порциями боргидрида натрия (943 мг, 24,92 ммоль) и нагреванием раствора до комнатной температуры в течение 20 минут. Добавляли метанол, и твердое вещество удаляли при помощи фильтрования, фильтрат концентрировали до получения масла, которое повторно растворяли с дихлорметаном и экстрагировали водным раствором бикарбоната натрия. Органический раствор затем сушили, фильтровали и концентрировали с получением указанного в заголовке соединения, m/z 484 (M+H)+.
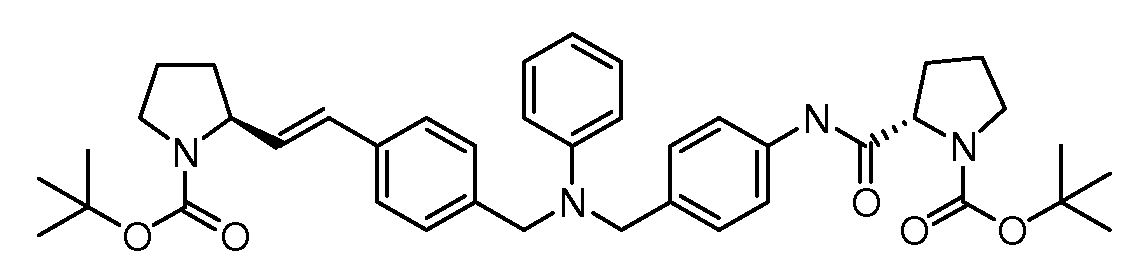
Пример 149G
(S)-трет-бутил 2-(4-(((4-((E)-2-((S)-1-(трет-бутоксикарбонил)пирролидин-2-ил)винил)бензил)(фенил)амино)метил)фенилкарбамоил)пирролидин-1-карбоксилат
Продукт из Примера 149F (700 мг, 1,45 ммоль) и (S)-1-(трет-бутоксикарбонил)пирролидин-2-карбоновую кислоту (374 мг, 1,74 ммоль) обрабатывали с использованием способа, описанного в Примере 43, с получением 240 мг (23%) указанного в заголовке соединения.1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 9,92 (с, 1H), 7,52 (д, J=8,4 Гц, 2H), 7,34 (д, J=7,9 Гц, 2H), 7,18 (м, 4H), 7,07 (м, 2H), 6,64 (д, J=8,1 Гц, 2H), 6,55 (т, J=7,7 Гц, 1H), 6,31 (д, J=15,6 Гц, 1H), 6,14 (дд, J=15,5, 6,5 Гц, 1H), 4,63 (с, 2H), 4,60 (с, 2H), 4,22 (м, 1H), 4,17 (м, 1H), 3,38 (м, 2H), 3,28 (м, 2H), 1,85 (м, 8H), 1,38 (с, 9H), 1,30 (с, 9H).
Пример 149H
(S)-N-(4-((фенил(4-((E)-2-((S)-пирролидин-2-ил)винил)бензил)амино)метил)фенил)пирролидин-2-карбоксамид
К раствору продукта Примера 149G (50 мг, 0,073 ммоль), растворенному в дихлорметане (0,3 мл), добавляли трифторуксусную кислоту (2,7 мл) и полученный раствор перемешивали при комнатной температуре в течение 20 минут. Раствор затем концентрировали под вакуумом, остаток растворяли в смеси хлороформ/изопропанол и экстрагировали водным раствором бикарбоната натрия, органический раствор затем сушили, фильтровали и концентрировали с получением указанного в заголовке соединения, m/z 481 (M+H)+.
Пример 149I
N-(метоксикарбонил)-3-метил-L-валил-N-(4-{[{4-[(Е)-2-{(2S)-1-[N-(метоксикарбонил)-3-метил-L-валил]пирролидин-2-ил}этенил]бензил}(фенил)амино]метил}фенил)-L-пролинамид
Продукт из Примера 149H (35 мг, 0,73 ммоль) и (S)-2-(метоксикарбониламино)-3,3-диметилбутановую кислоту (33,1 мг, 0,175 ммоль) обрабатывали с использованием способа, описанного в Примере 43, с получением 33 мг (55%) указанного в заголовке соединения.1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 9,98 (с, 1H), 7,50 (д, J=8,4 Гц, 2H), 7,28 (д, J=8,3 Гц, 2H), 7,17 (м,4H), 7,06 (м, 3H), 6,63 (м, 2H), 6,55 (т, J=7,3 Гц, 1H), 6,37 (д, J=15,7 Гц, 1H), 6,22 (м, 1H), 6,17 (дд, J=16,0, 6,3 Гц, 1H), 4,63 (м, 1H), 4,61 (с, 2H), 4,58 (с, 2H), 4,42 (м, 1H), 4,19 (м, 2H), 3,77 (м, 1H), 3,70 (м, 1H), 3,63 (м, 2H), 3,52 (с, 6H), 2,16 (м, 2H), 1,96 (м, 2H), 1,84 (м, 4H), 0,95 (с, 9H), 0,93 (с, 9H).
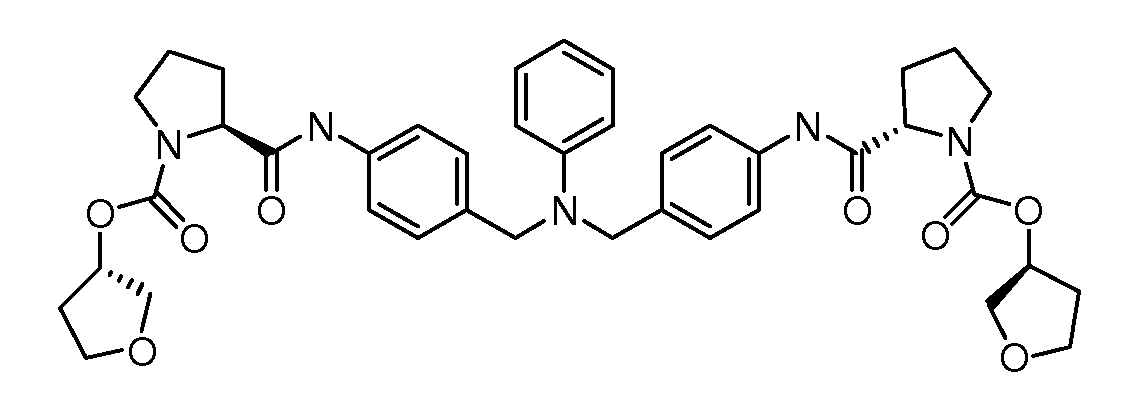
Пример 150
ди[(3S)-тетрагидрофуран-3-ил](2S,2'S)-2,2'-[(фенилимино)бис(метандиилбензол-4,1-диилкарбамоил)]дипирролидин-1-карбоксилат
Продукт Примера 1D (25 мг, 0,050 ммоль) и (S)-2,5-диоксопирролидин-1-ил тетрагидрофуран-3-илкарбонат (25,3 мг, 0,111 ммоль) растворяли в дихлорметане (3 мл), затем добавляли основание Хунига (0,026 мл, 0,151 ммоль) и перемешивали смесь при комнатной температуре в течение 18 часов. Раствор содержал добавленный к нему дихлорметан, и смесь экстрагировали водой. Органический экстракт затем сушили, фильтровали, концентрировали и очищали при помощи хроматографии (силикагель, 0-10% метанол в дихлорметане) с получением 28 мг (77%) указанного в заголовке соединения.1H ЯМР (500 МГц, ДМСО-d6) δ м.д.: 9,96 (с, 2H), 7,48 (д, J=8,4 Гц, 4H), 7,17 (д, J=8,1 Гц, 4H), 7,06 (т, J=8,0 Гц, 2H), 6,64 (д, J=8,4 Гц, 2H), 6,55 (т, J=7,3 Гц, 1H), 5,05 (м, 2H), 4,59 (с, 4H), 4,24 (м, 2H), 3,73 (м, 8H), 3,40 (м, 6H), 2,15 (м, 4H), 1,95 (м, 2H), 1,83 (м, 4H).
Указанные в заголовках Примеров 1, 2, 3, 6, 7, 9, 10, 11, 12, 13, 14, 17, 18, 20, 21, 22, 23, 28, 31, 34, 35, 39, 42, 43, 50, 53, 54, 55, 56, 57, 58, 60, 64, 65, 66, 67, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 92, 95, 96, 98, 99, 101, 102, 103, 104, 105, 106, 110, 113, 114, 115, 116, 117, 119, 120, 121, 123, 124, 125, 127, 128, 131, 132, 133, 136, 137, 138, 142, 143 и 145 соединения показывали значения EC50 менее чем 1 нМ в анализе репликации вируса гепатита С (HCV) 1b-Con-1; указанные в заголовках Примеров 8, 15, 24, 25, 33, 36, 37, 38, 45, 46, 47, 48, 49, 51, 52, 61, 62, 91, 93, 94, 100, 108, 111, 112, 118, 129, 130, 134, 135, 139, 140 и 146 соединения показывали значения EC50 от 1 нМ до 10 нМ в анализе репликации HCV 1b-Con-1; указанные в заголовках Примеров 4, 5, 16, 19, 26, 27, 40, 41, 44, 59, 63, 79, 80, 107, 109, 122, 126, 141, 149 и 150 соединения показывали значения EC50 от 10 нМ до 100 нМ в анализе репликации HCV 1b-Con-1; указанные в заголовках Примеров 29, 30, 32, 68, 97, 144, 147 и 148 соединения показывали значения EC50 от 100 нМ до 250 нМ в анализе репликации HCV 1b-Con-1. Каждую анти-HCV активность соединений определяли путем измерения активности репортерного гена люциферазы в репликоне в присутствии 5% FBS. Репортер ген люциферазы брали под трансляционный контроль полиовируса IRES вместо HCV IRES, и клетки HuH-7 использовали для поддержания репликации репликона.
Следующие соединения были получены аналогичным образом, в соответствии с описанными выше Схемами и Примерами:


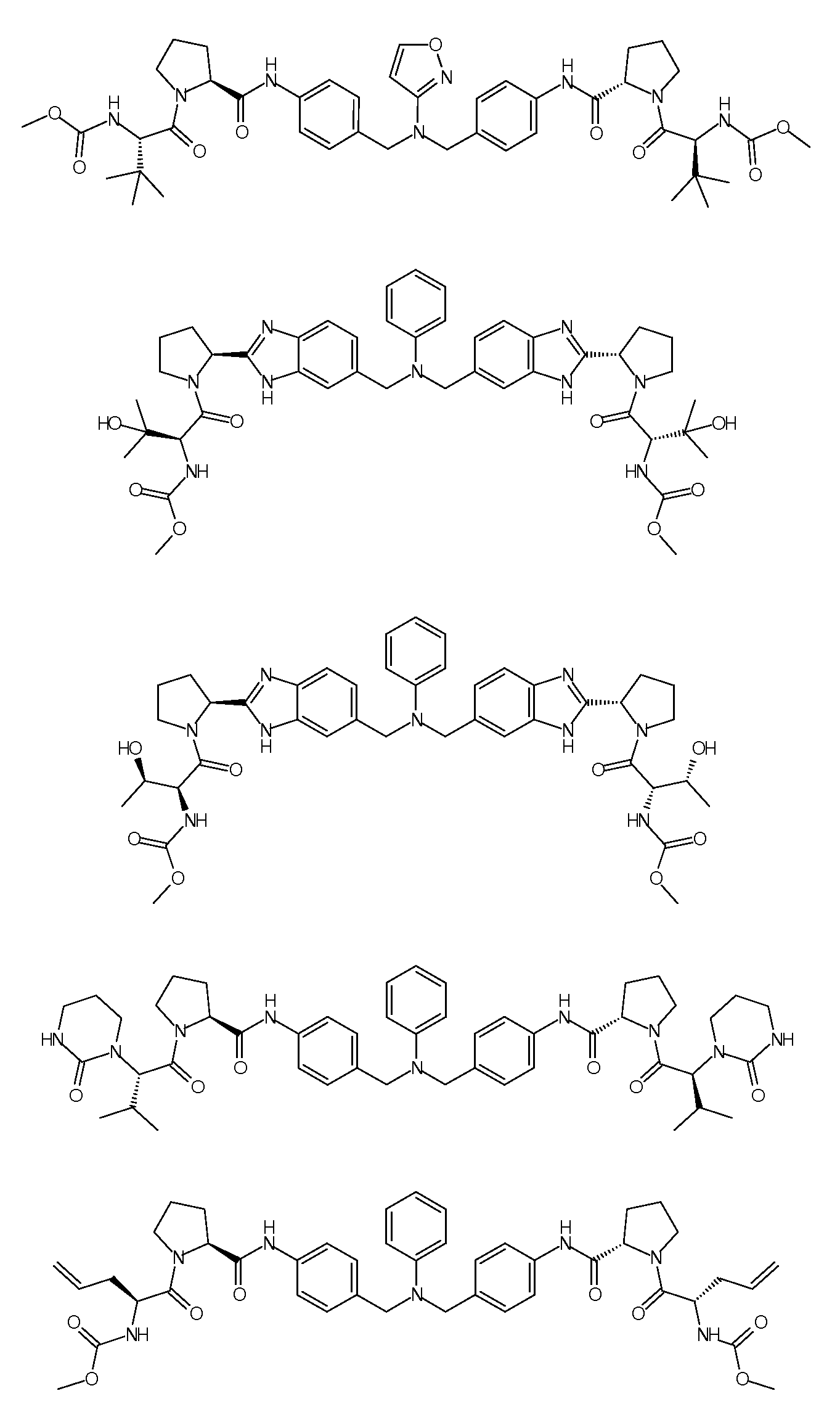

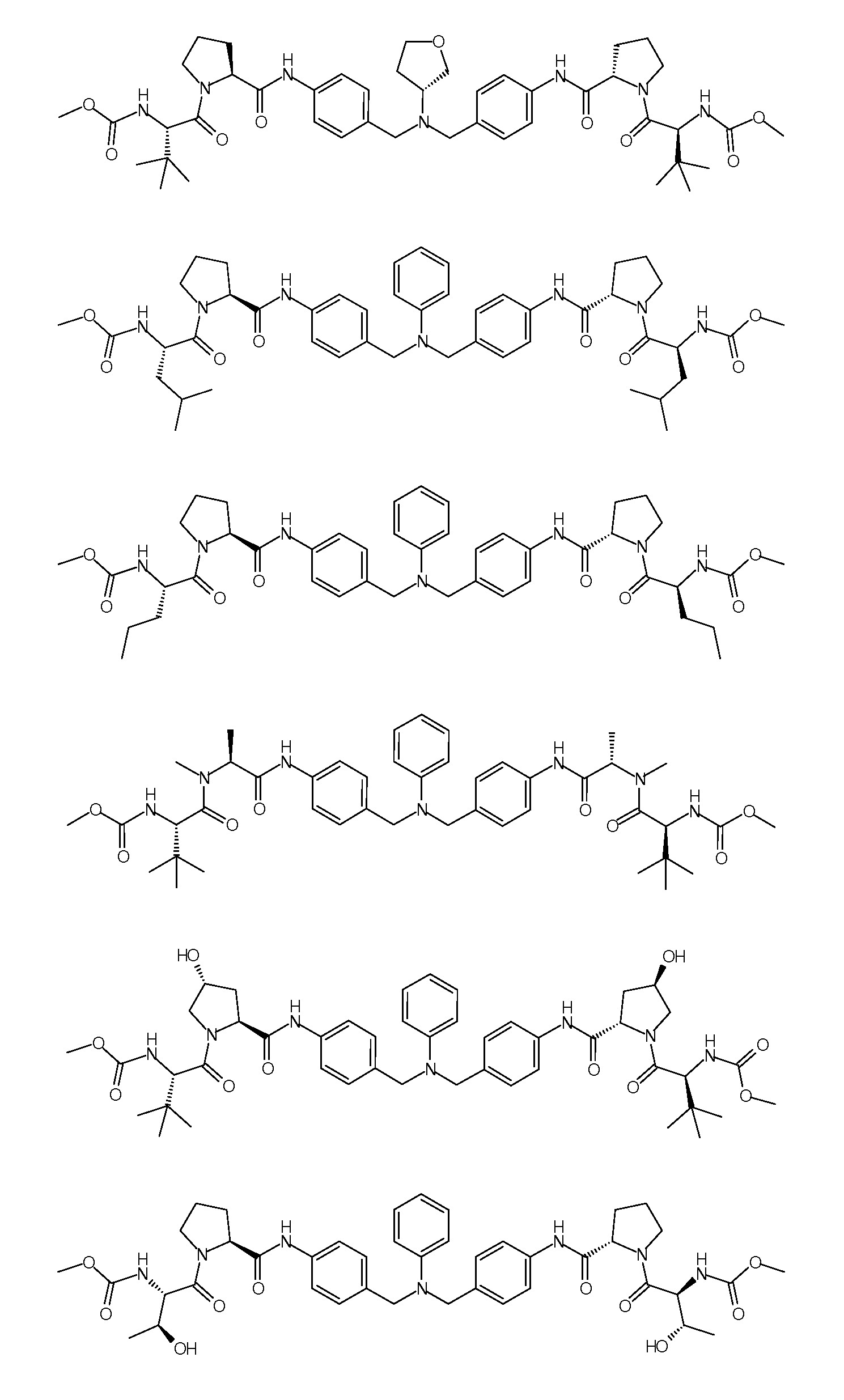
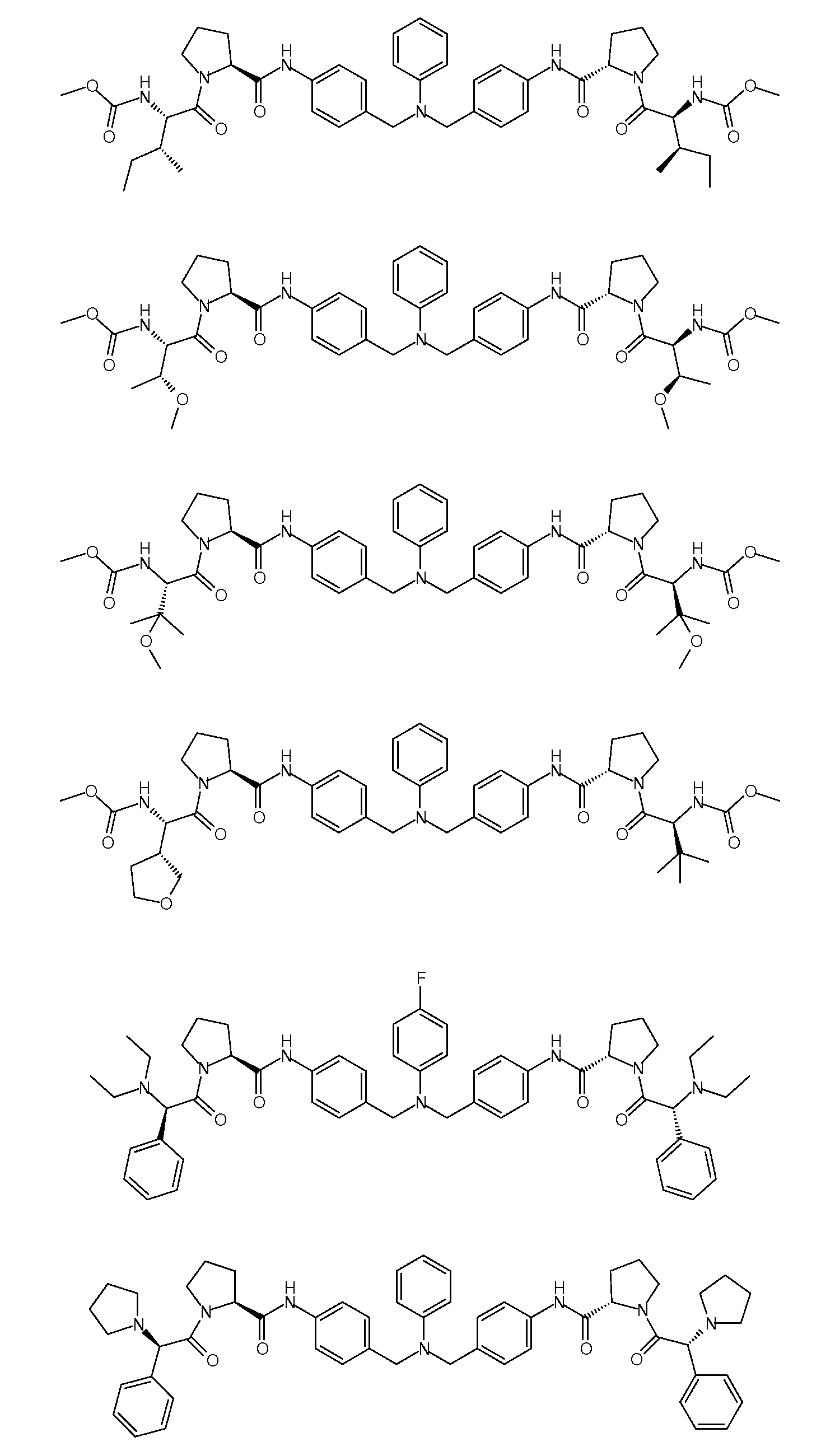
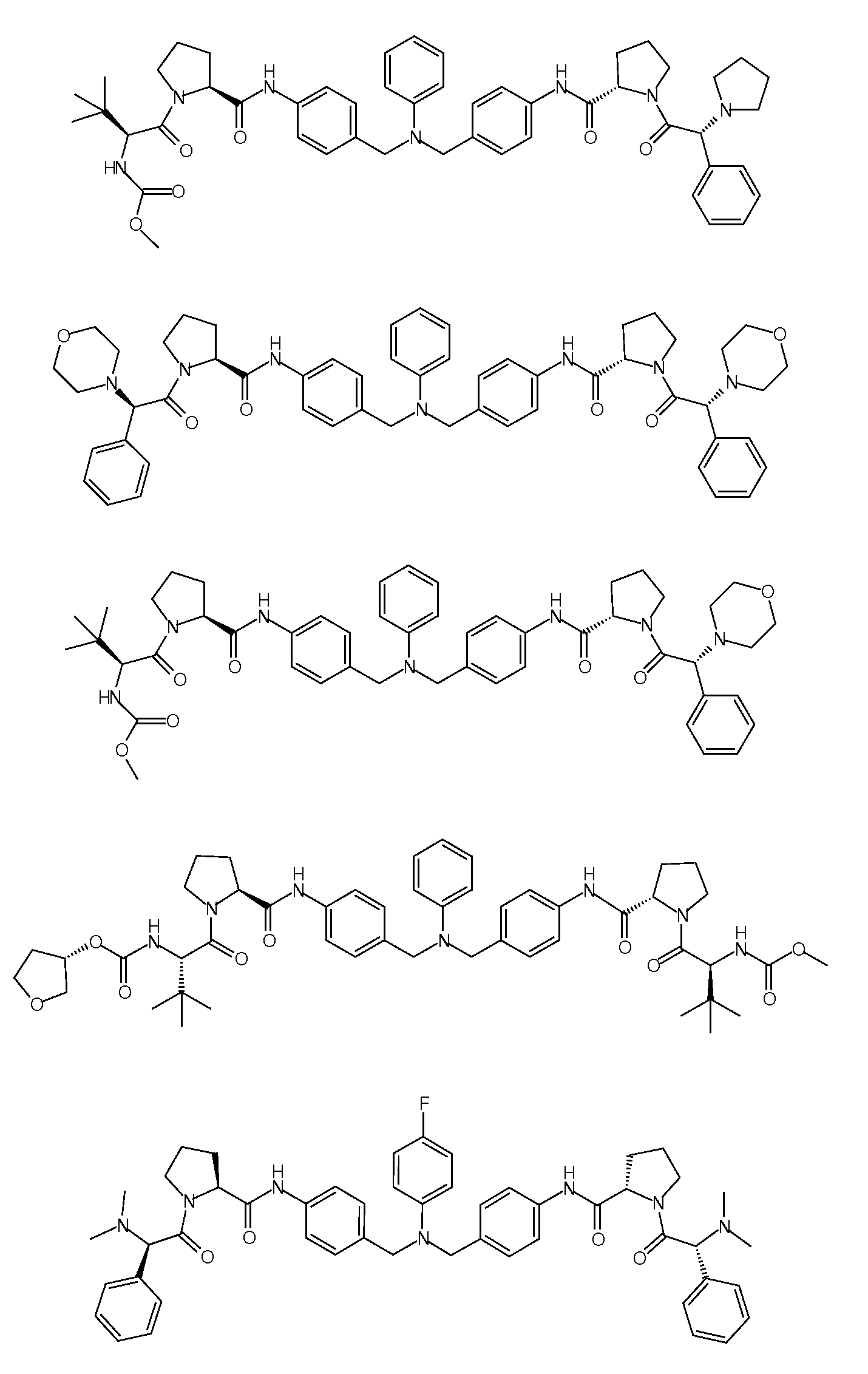
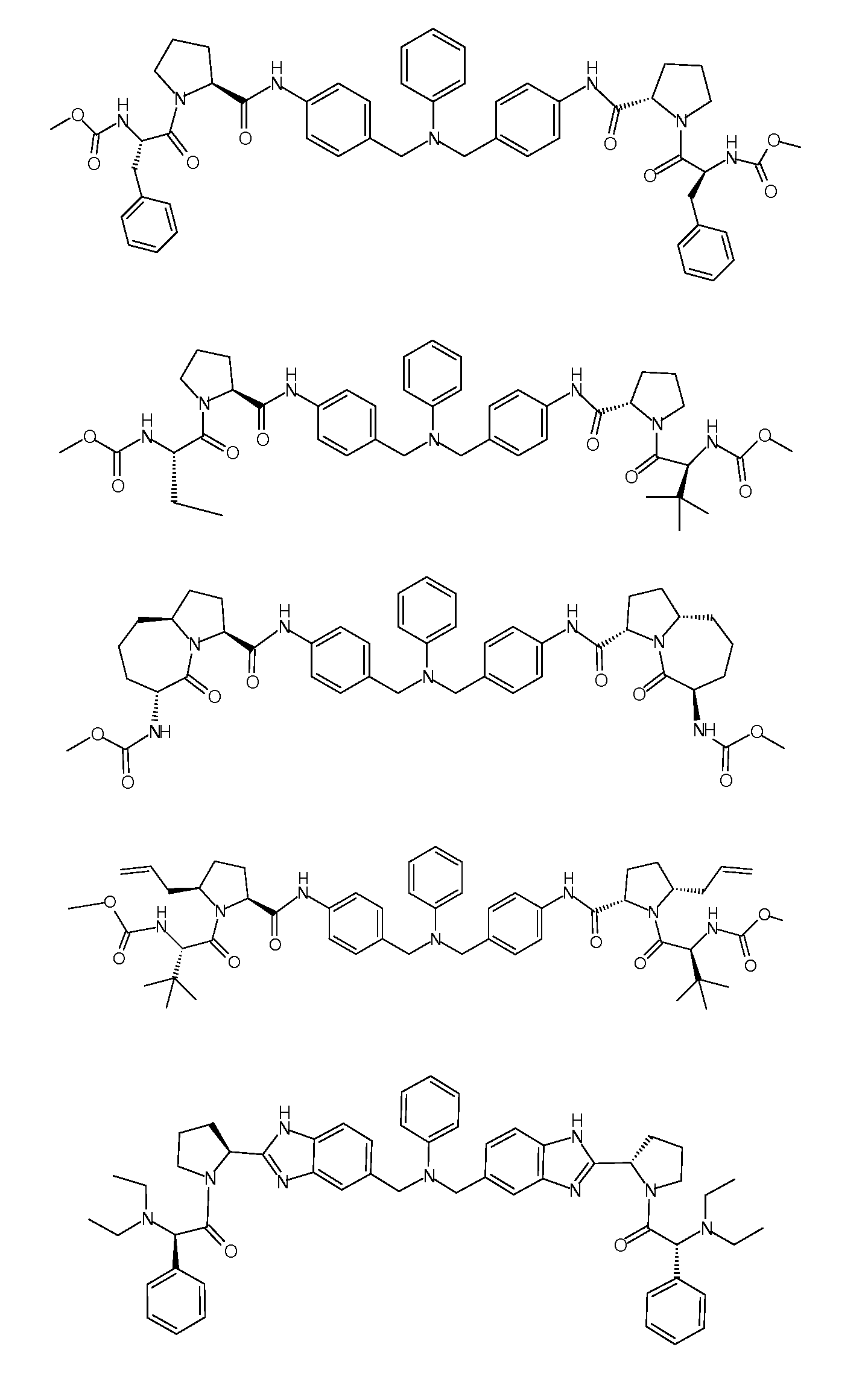


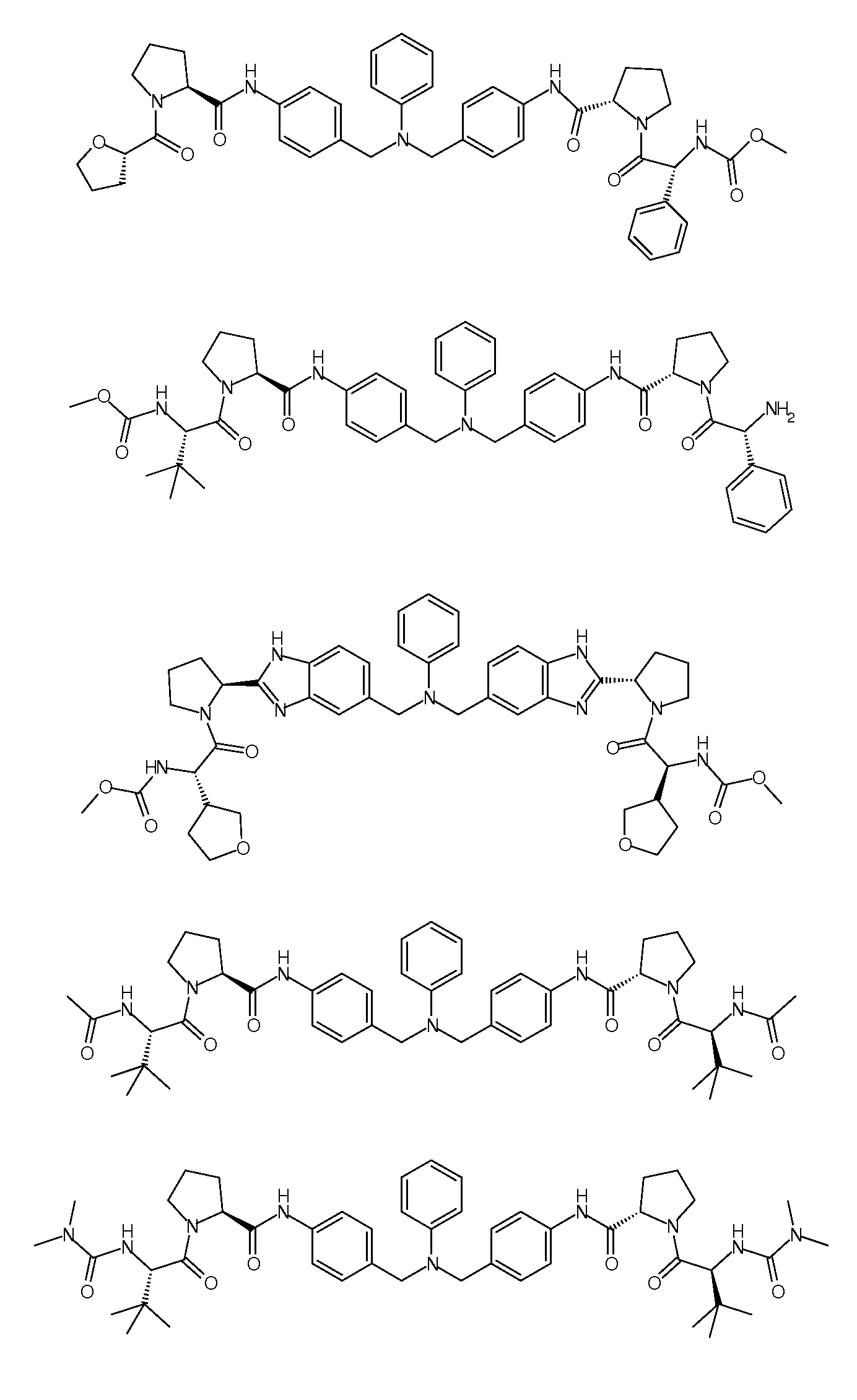


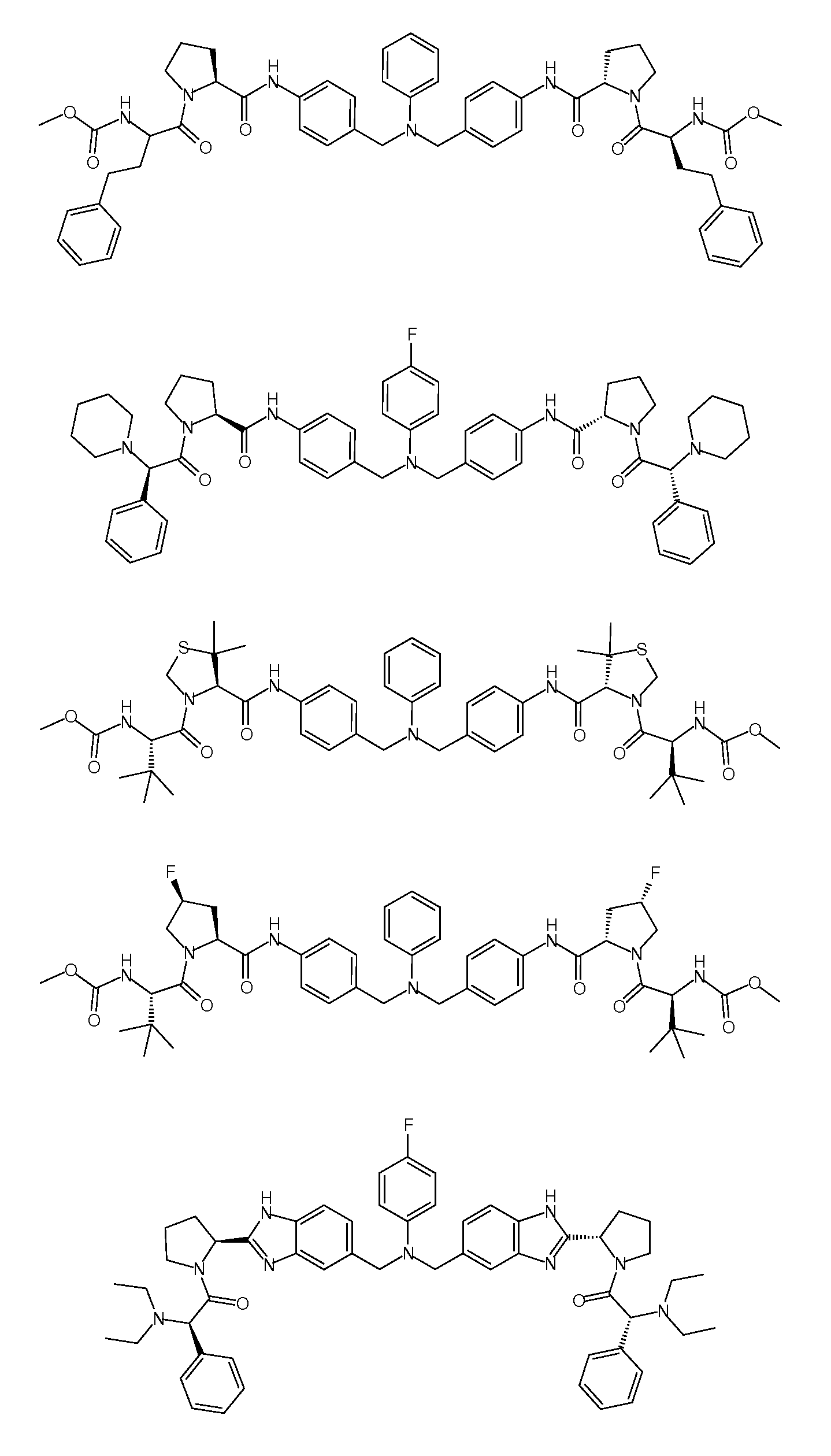
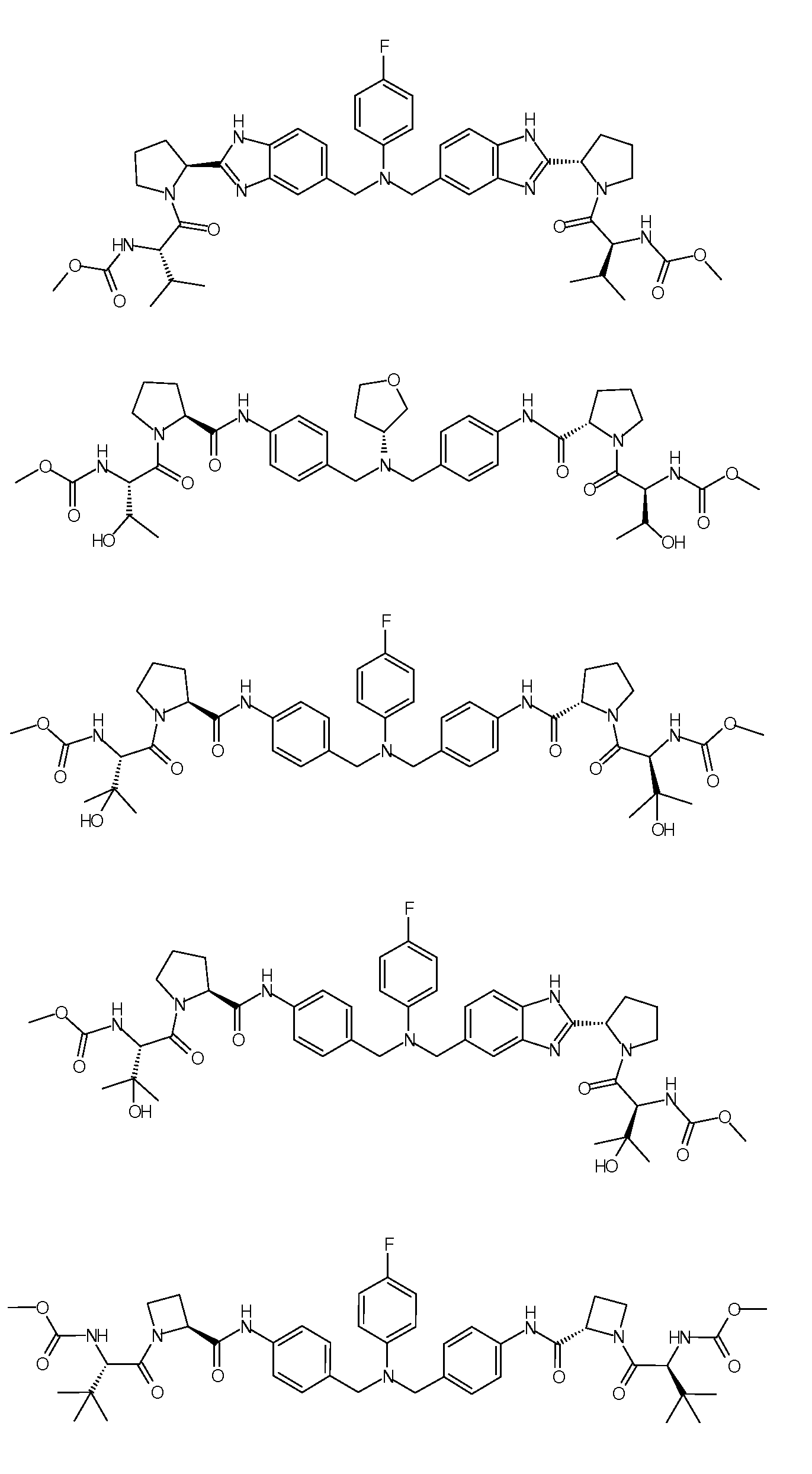
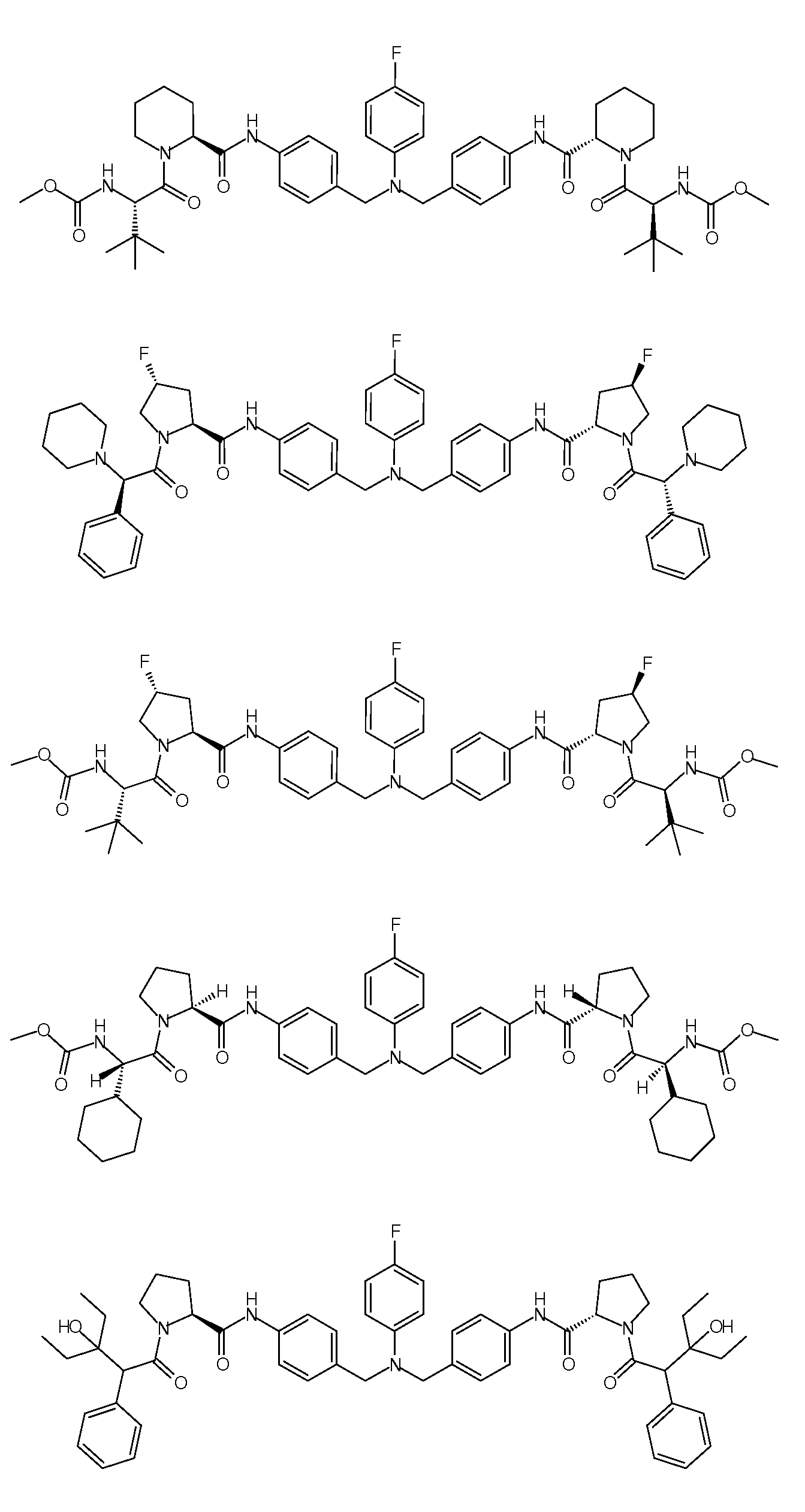

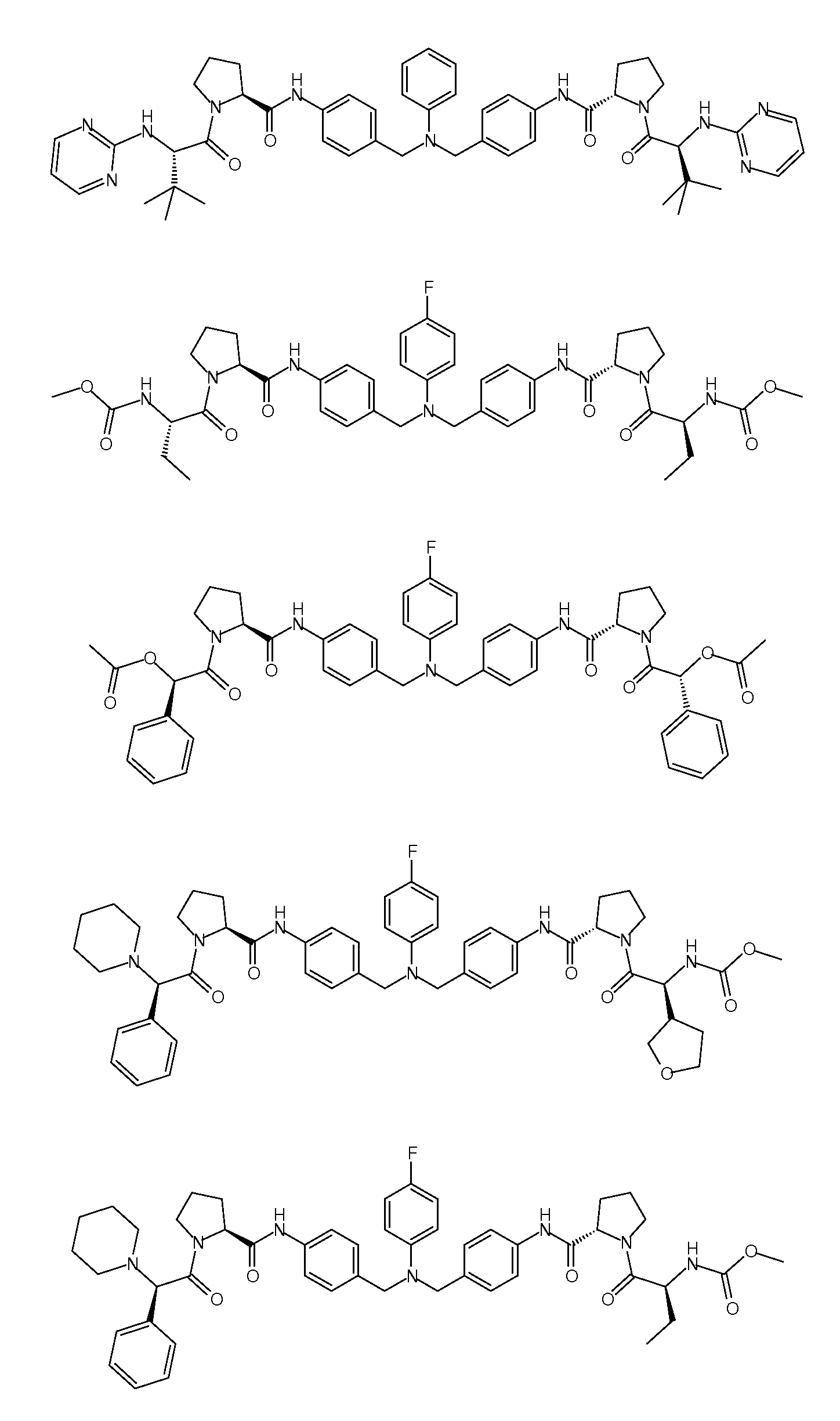

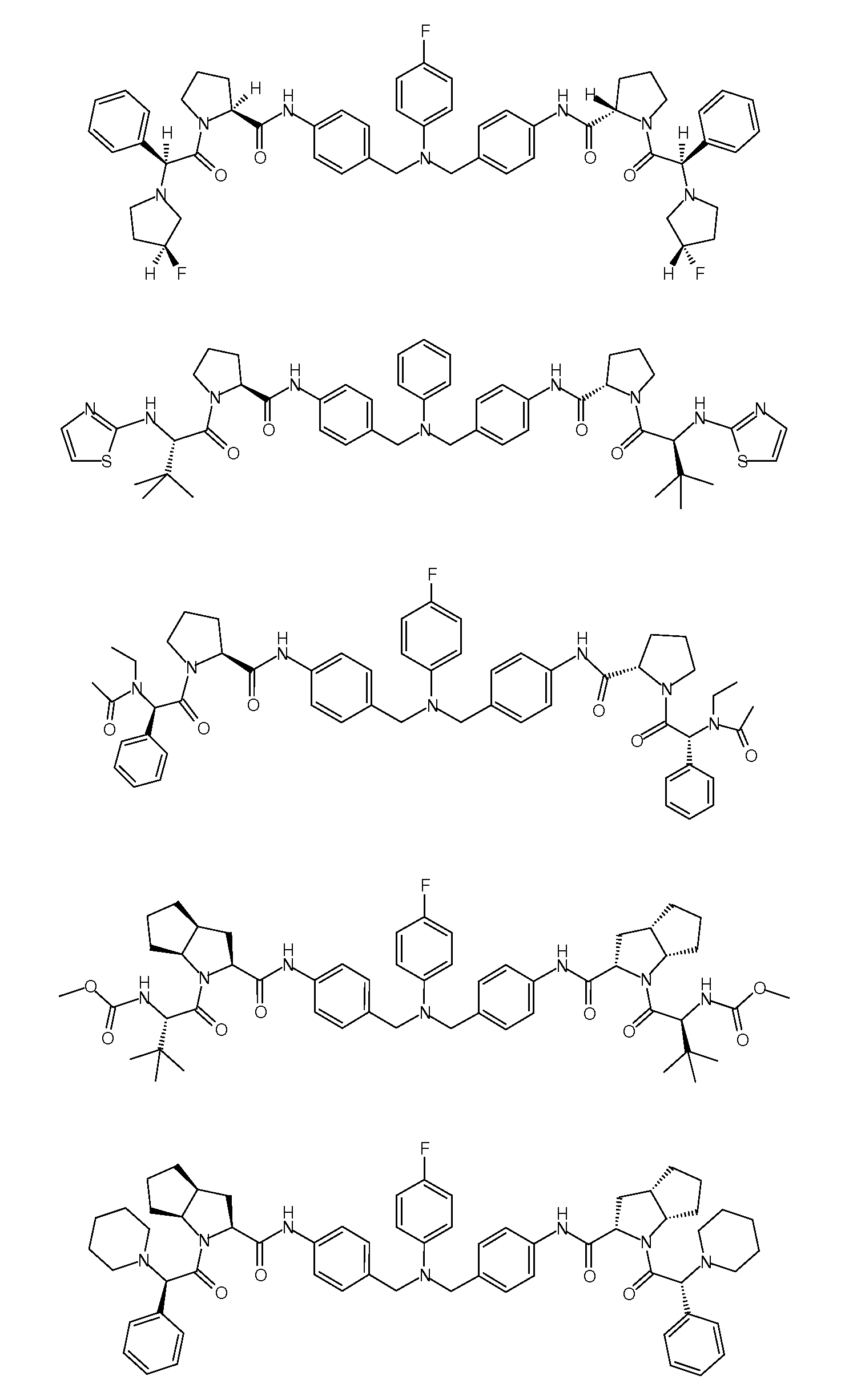
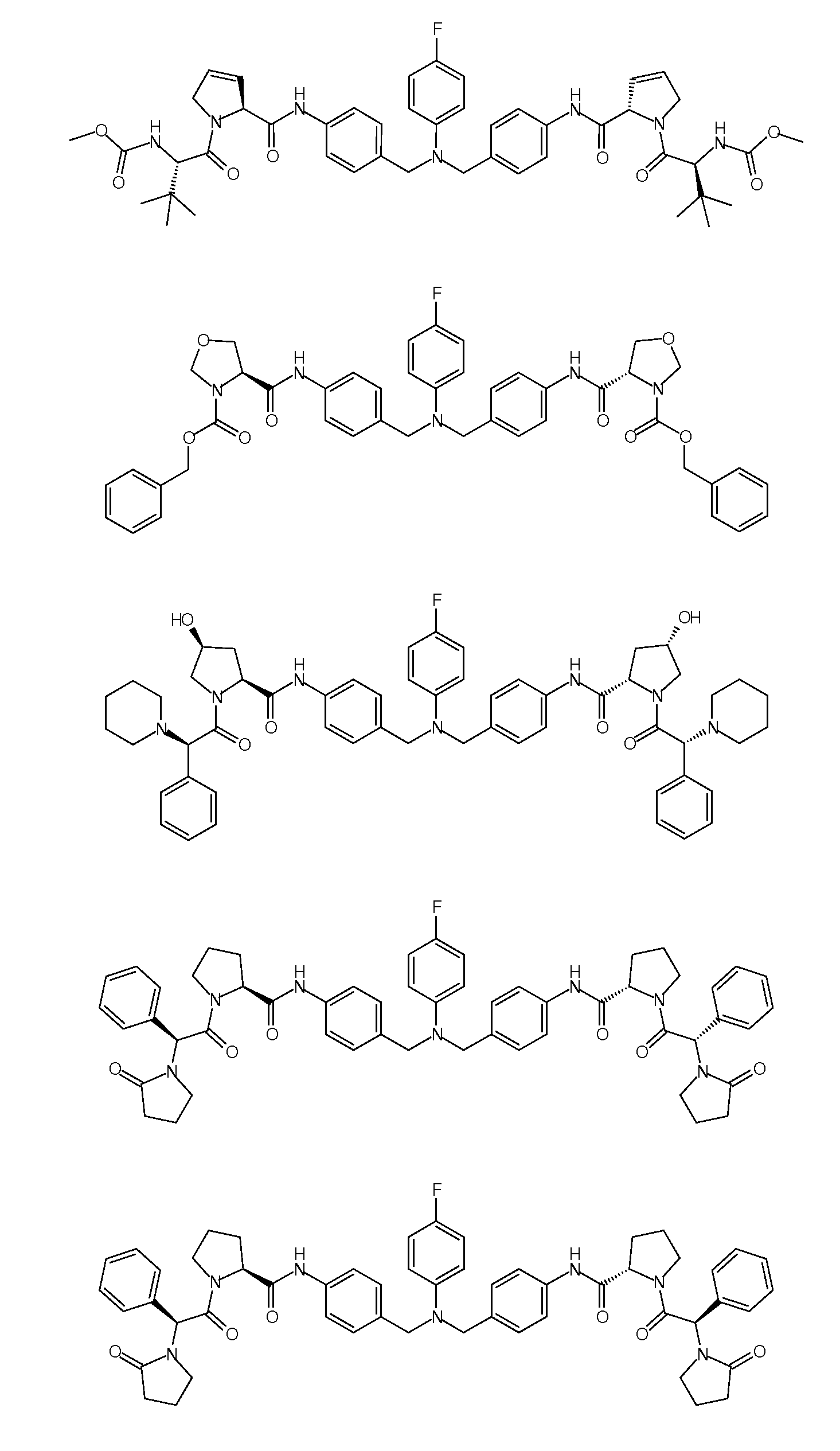
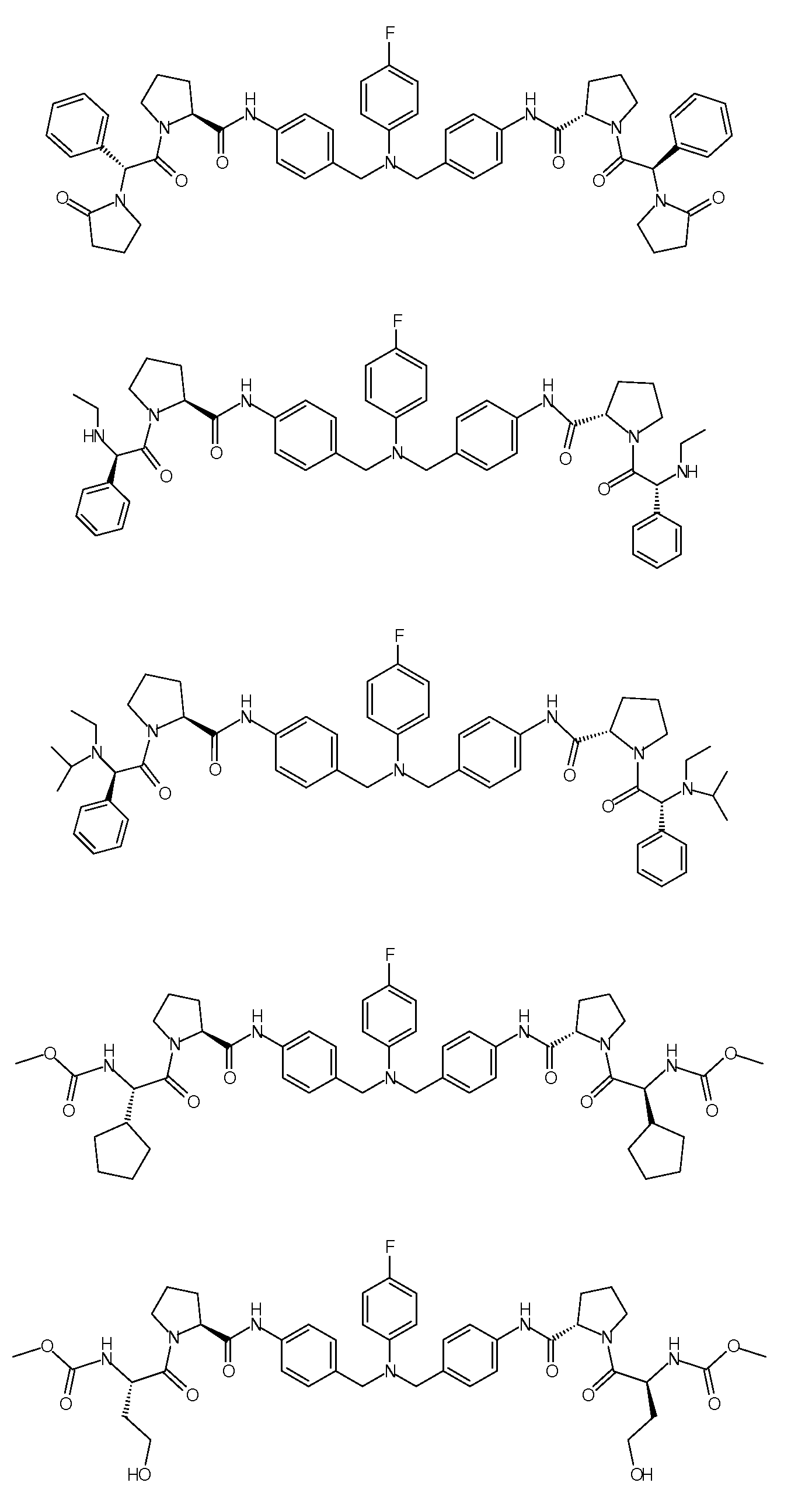
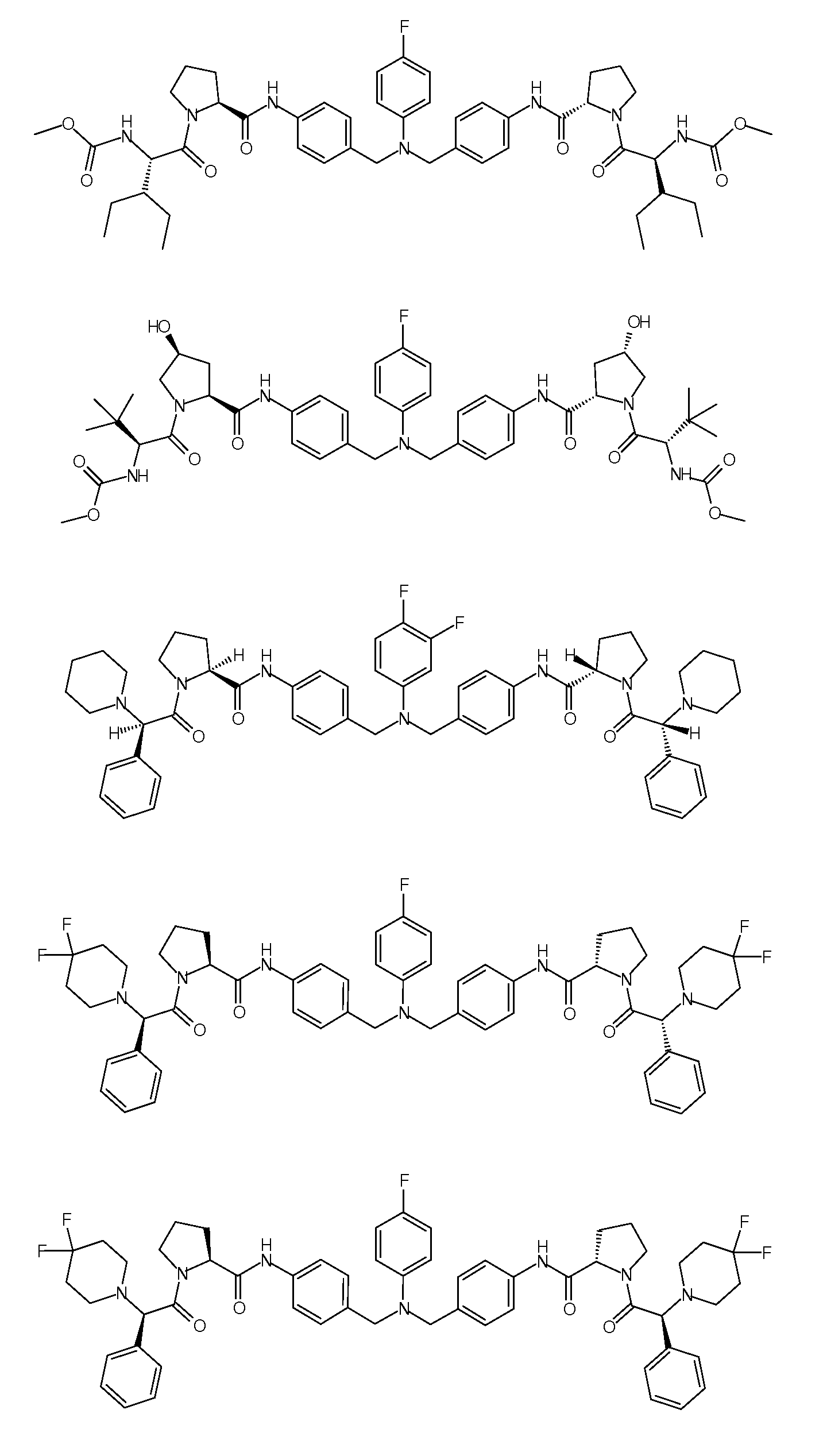


Кроме того, следующие соединения формулы I могут быть аналогичным образом получены в соответствии с настоящим изобретением,
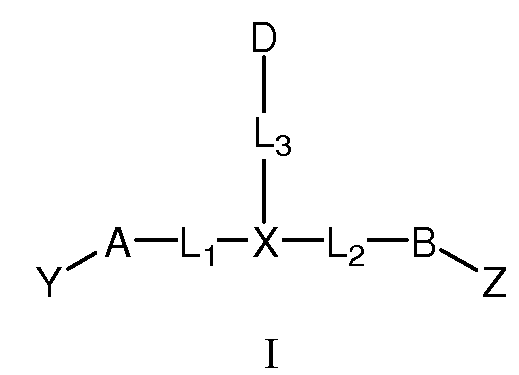
где А выбран из таблицы Ia, B выбран из таблицы Ib, D выбран из таблицы 2, Y и Z, каждый независимо, выбраны из таблицы 3, и A, B и D, каждый независимо, необязательно замещены одним или несколькими заместителями RA, и где X, L1, L2, L3 и RA имеют значения, определенные выше. Предпочтительно, X представляет собой N, L1 и L2, каждый независимо, представляют собой C1-C6алкилен (например, -(CH2)-), и L3 представляет собой связь, где L1 и L2, каждый независимо, необязательно замещен одним или несколькими заместителями, выбранными из галогена, RT, -O-Rs, -S-RS, -N(RSRS'), -OC(O)RS, -C(O)ORS, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано, и RT, RS и RS' имеют значения, определенные выше.

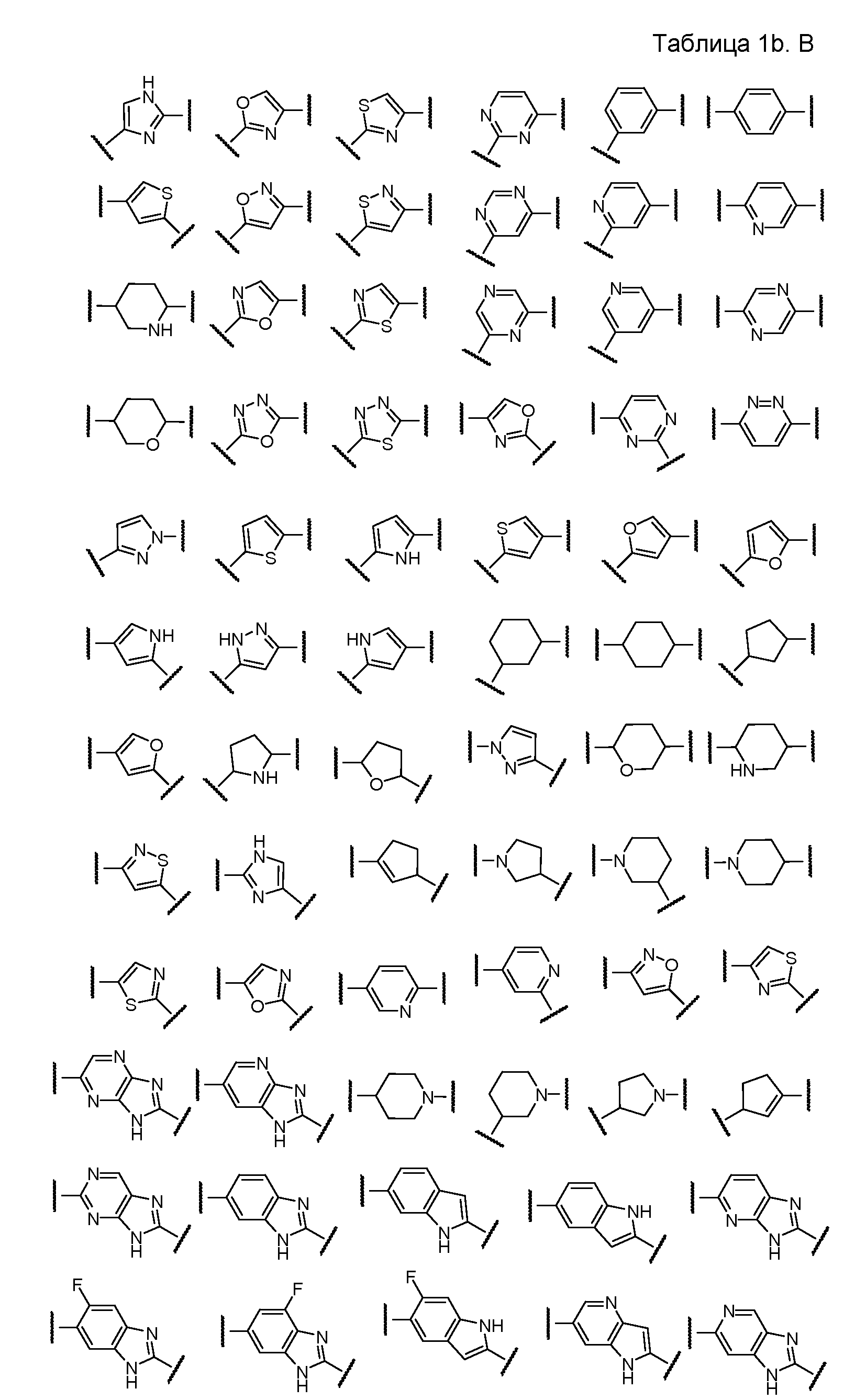
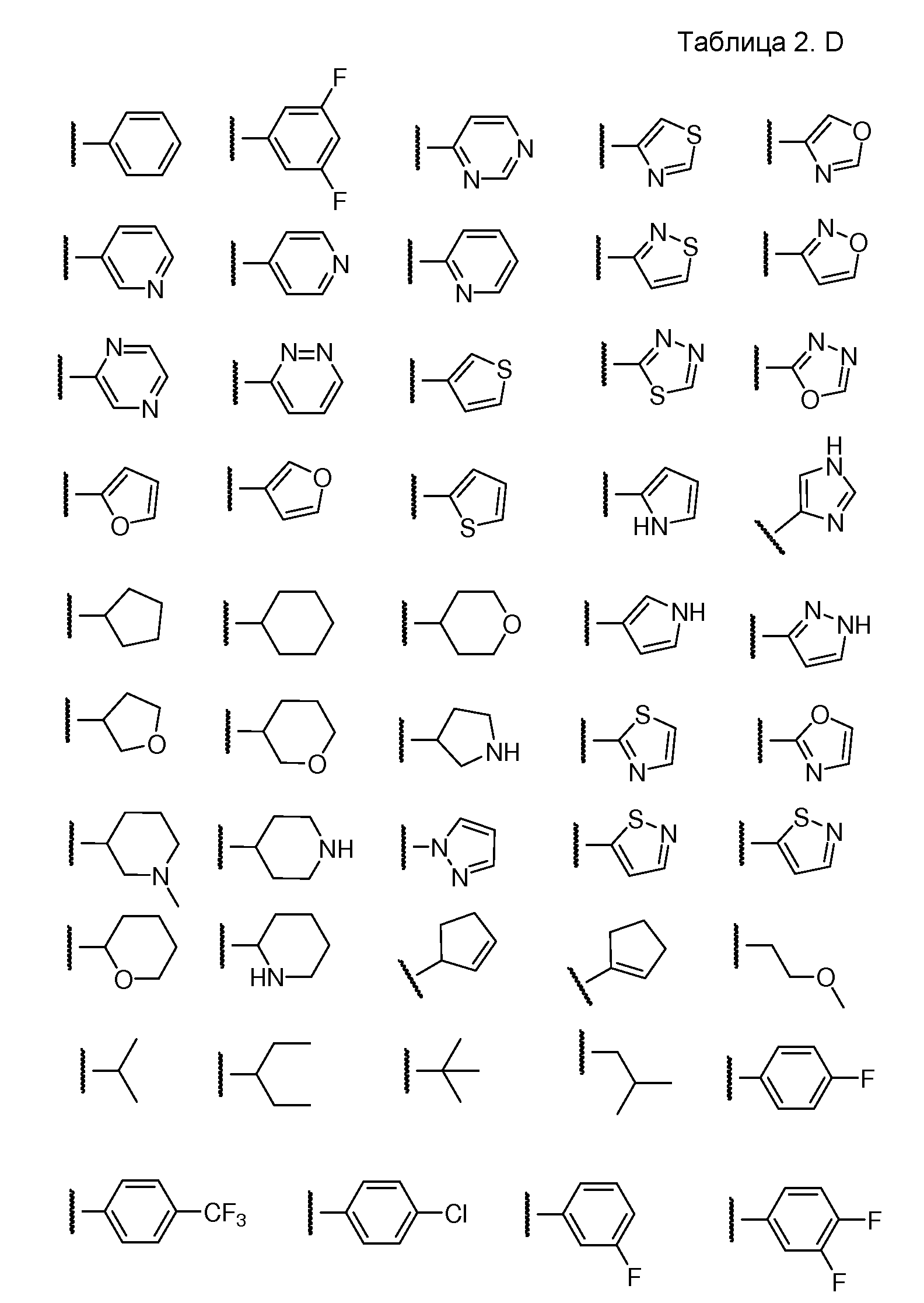

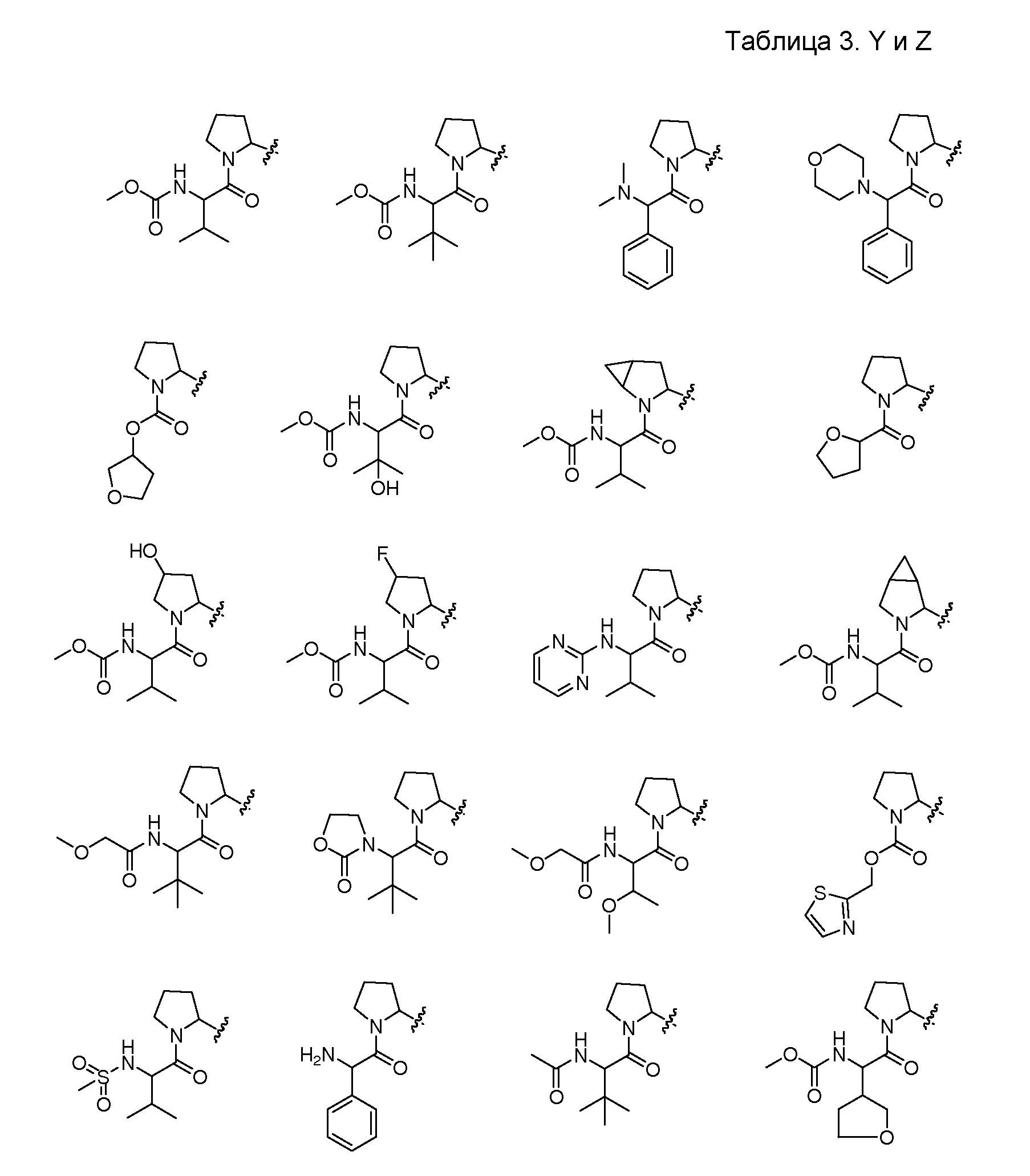

Ингибиторную активность соединений по настоящему изобретению можно оценить с использованием различных анализов, известных из уровня техники. Например, две стабильные содержащие субгеномный репликон клеточные линии можно использовать для характеризации соединения в клеточной культуре: одна, происходящая из генотипа 1a-H77, а другая, происходящая из генотипа 1b-Conl, полученные от University of Texas Medical Branch (Galveston, TX) и Apath, LLC (St. Louis, MO), соответственно. Репликоновые конструкции могут представлять собой бицистронные субгеномные репликоны. Репликоновая конструкция генотипа 1a содержит NS3-NS5B кодирующую область, происходящую из H77 штамма HCV (1a-H77). Репликон также содержит репортерный ген люциферазы светлячка и селектируемый маркер неомицин фосфотрансферазы (Neo). Эти две кодирующих области, разделенные FMDV 2a протеазой, включают первый цистрон бицистронной репликоновой конструкции, со вторым цистроном, содержащим NS3-NS5B кодирующую область с добавлением адаптивных мутаций E1202G, K1691R, K2040R и S2204I. 1b-Conl репликоновая конструкция идентична 1a-H77 репликону, за исключением того, что HCV 5' UTR, 3' UTR и NS3-NS5B кодирующая область происходят из 1b-Con1 штамма, и адаптивные мутации представляют собой K1609E, K1846T и Y3005C. Кроме того, 1b-Con1 репликоновая конструкция содержит полиовирус IRES между HCV IRES и геном люциферазы. Содержащие репликон клеточные линии можно поддерживать в модифицированной Дульбекко среде Игла (DMEM), содержащей 10% (об/об) фетальную бычью сыворотку (FBS), 100 МЕд./мл пенициллина, 100 мг/мл стрептомицина (Invitrogen) и 200 мг/мл G418 (Invitrogen).
Ингибиторные эффекты соединений по настоящему изобретению в отношении репликации HCV можно определить путем измерения активности репортерного гена люциферазы. Например, репликон-содержащие клетки высевают в 96-луночные планшеты при плотности 5000 клеток/лунка в 100 мкл DMEM, содержащей 5% FBS. На следующий день соединения можно разбавить в диметилсульфоксиде (ДМСО) для получения 200x исходного раствора с использованием восьми серийных полу-log разведений. Серийные разведения затем можно далее разбавить 100-кратно в среде, содержащей 5% FBS. Среду с ингибитором добавляют в планшеты, которые содержали клеточную культуру в течение ночи, уже содержащие 100 мкл DMEM с 5% FBS. В анализах измерения ингибиторной активности в присутствии человеческой плазмы, среду из планшетов с клеточной культурой, содержащейся в них в течение ночи, можно заместить средой DMEM, содержащей 40% человеческой плазмы и 5% FBS. Клетки можно инкубировать в течение трех дней в инкубаторах для тканевых культур, после чего 30 мкл пассивного лизисного буфера (Promega) можно добавить в каждую лунку, и затем планшеты инкубируют в течение 15 минут с качанием для лизиса клеток. Можно добавить раствор люциферина (100 мкл, Promega) в каждую лунку, и люциферазную активность можно измерить при помощи люминометра Victor II (Perkin-Elmer). Процент ингибирования репликации РНК HCV можно рассчитать для каждой концентрации соединения, и значение EC50 можно рассчитать с использованием кривой нелинейной регрессии с подгонкой к логистическому уравнению с 4-параметрами и программы GraphPad Prism 4. При использовании описанных выше анализов или подобных клеточных анализов репликации, репрезентативные соединения по настоящему изобретению показали существенную ингибиторную активность против репликации HCV.
Настоящее изобретение также включает фармацевтические композиции, содержащие соединения по настоящему изобретению. Фармацевтическая композиция по настоящему изобретению может содержать одно или несколько соединений по настоящему изобретению, каждое из которых имеет формулу I (или IA, IB или Ic).
Кроме того, настоящее изобретение включает фармацевтические композиции, содержащие фармацевтически приемлемые соли, сольваты или пролекарства соединений по настоящему изобретению. Без ограничения, фармацевтически приемлемые соли могут быть цвиттерионными или полученными из фармацевтически приемлемых неорганических или органических кислот или оснований. Предпочтительно, фармацевтически приемлемая соль сохраняет биологическую эффективность свободной кислоты или основания соединения без излишней токсичности, раздражения или аллергических реакций, имеет разумное соотношение польза/риск, является эффективной для предполагаемого использования и не является биологически или иным образом нежелательной.
Настоящее изобретение также включает фармацевтические композиции, содержащие соединение по настоящему изобретению (или его соль, сольват или пролекарство) и другое терапевтическое средство. В качестве иллюстрации, а не для ограничения, эти другие терапевтические средства могут быть выбраны из противовирусных средств (например, анти-HIV средств, анти-HBV средств или других анти-HCV средств, таких как ингибиторы HCV протеазы, ингибиторы HCV полимеразы, ингибиторы HCV геликазы, ингибиторы IRES или ингибиторы NS5A), антибактериальных средств, противогрибковых средств, иммуномодуляторов, противораковых или химиотерапевтических средств, противовоспалительных средств, антисмысловой РНК, siRNA, антител или средств для лечения цирроза или воспаления печени. Конкретные примеры таких других терапевтических средств включают, но не ограничиваются этим, рибавирин, α-интерферон, β-интерферон, пэгилированный интерферон-α, пэгилированный интерферон-лямбда, рибавирин, вирамидин, R-5158, нитазоксанид, амантадин, Debio-025, NIM-811, R7128, R1626, R4048, T-1106, PSI-7851, PF-00868554, ANA-598, IDX184, IDX102, IDX375, GS-9190, VCH-759, VCH-916, MK-3281, BCX-4678, MK-3281, VBY708, ANA598, GL59728, GL60667, BMS-790052, BMS-791325, BMS-650032, GS-9132, ACH-1095, AP-H005, A-831, A-689, AZD2836, телапревир, боцепревир, ITMN-191, BI-201335, VBY-376, VX-500 (Vertex), PHX-B, ACH-1625, IDX136, IDX316, VX-813 (Vertex), SCH 900518 (Schering-Plough), TMC-435 (Tibotec), ITMN-191 (Intermune, Roche), MK-7009 (Merck), IDX-PI (Novartis), BI-201335 (Boehringer Ingelheim), R7128 (Roche), PSI-7851 (Pharmasset), MK-3281 (Merck), PF-868554 (Pfizer), IDX-184 (Novartis), IDX-375 (Pharmasset), BILB-1941 (Boehringer Ingelheim), GS-9190 (Gilead), BMS-790052 (BMS), Албуферон (Novartis), ритонавир, другой ингибитор монооксидазы цитохрома P450 или любое сочетание таких средств.
В одном варианте воплощения фармацевтическая композиция по настоящему изобретению содержит одно или несколько соединений по настоящему изобретению (или их солей, сольватов или пролекарств) и одно или несколько других противовирусных средств.
В другом варианте воплощения фармацевтическая композиция по настоящему изобретению содержит одно или несколько соединений по настоящему изобретению (или их солей, сольватов или пролекарств) и одно или несколько других анти-HCV средств. Например, фармацевтическая композиция по настоящему изобретению может содержать соединение (соединения) по настоящему изобретению, имеющее формулу I, IA, IB или Ic (или его соль, сольват или пролекарство) и средство, выбранное из ингибиторов HCV полимеразы (включая ингибиторы полимеразы нуклеозидного или ненуклеозидного типа ингибиторы), ингибиторов HCV протеазы, ингибиторов HCV геликазы, ингибиторов CD81, ингибиторов циклофилина, ингибиторов IRES или ингибиторов NS5A.
Еще в одном варианте воплощения фармацевтическая композиция по настоящему изобретению содержит одно или несколько соединений по настоящему изобретению (или их солей, сольватов или пролекарств) и одно или несколько других противовирусных средств, таких как анти-HBV, анти-HIV средства или средства против гепатита A, против гепатита D, против гепатита E или против гепатита G. Неограничивающие примеры анти-HBV средств включают аденовир, ламувудин и тенофовир. Неограничивающие примеры анти-HIV лекарственных средств включают ритонавир, лопинавир, индинавир, нелфинавир, саквинавир, ампренавир, атазанавир, типранавир, TMC-114, фосампренавир, зидовудин, ламивудин, диданозин, ставудин, тенофовир, залцитабин, абакавир, эфавиренц, невирапин, делавирдин, TMC-125, L-870812, S-1360, энфувиртид, T-1249 или другие ингибиторы HIV протеазы, обратной транскриптазы, интегразы или слияния. Любые другие желательные противовирусные средства также могут быть включены в фармацевтическую композицию по настоящему изобретению, как должно быть понятно специалистам а данной области.
Фармацевтическая композиция по настоящему изобретению обычно включает фармацевтически приемлемый носитель или эксципиент. Неограничивающие примеры подходящих фармацевтически приемлемых носителей/эксципиентов включают сахара (например, лактоза, глюкоза или сахароза), крахмалы (например, кукурузный крахмал или картофельный крахмал), целлюлозу или ее производные (например, натрийкарбоксиметилцеллюлоза, этилцеллюлоза или ацетат целлюлозы), масла (например, арахисовое масло, масло семян хлопчатника, саффлоровое масло, кунжутное масло, оливковое масло, кукурузное масло или соевое масло), гликоли (например, пропиленгликоль), буферные агенты (например, гидроксид магния или гидроксид алюминия), агар, альгиновую кислоту, порошкообразный трагакант, солод, желатин, тальк, масло какао, апирогенную воду, изотонический солевой раствор, раствор Рингера, этанол или фосфатно-буферные растворы. Смазывающие вещества, красители, агенты высвобождения, вещества покрытия, подсластители, отдушки или ароматизаторы, консерванты или антиоксиданты также могут быть включены в фармацевтическую композицию по настоящему изобретению.
Фармацевтические композиции по настоящему изобретению могут быть сформулированы с учетом пути их введения с использованием способов, хорошо известных из уровня техники. Например, стерильный препарат для инъекций можно получить в виде стерильной водной или масляной суспензии для инъекций с использованием подходящих диспергирующих или смачивающих веществ и агентов суспендирования. Суппозитории для ректального введения можно получить путем смешивания лекарственных средств с подходящим нераздражающим эксципиентом, таким как масло какао или полиэтиленгликоли, которые являются твердыми при обычных температурах, но жидкими при ректальной температуре, и поэтому плавятся в прямой кишке и высвобождают лекарственное средство. Твердые лекарственные формы для перорального введения могут представлять собой капсулы, таблетки, пилюли, порошки или гранулы. В таких твердых лекарственных формах активные соединения могут быть смешаны с по меньшей мере одним инертным разбавителем, таким как сахароза, лактоза или крахмал. Твердые лекарственные формы также могут включать другие вещества помимо инертных разбавителей, такие как смазывающие вещества. В случае капсул, таблеток и пилюль, лекарственные формы также могут включать буферные агенты. Таблетки и пилюли могут быть также получены с энтеросолюбильными покрытиями. Жидкие лекарственные формы для перорального введения могут включать фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы или эликсиры, содержащие инертные разбавители, традиционно используемые в данной области. Жидкие лекарственные формы также могут включать смачивающие, эмульгирующие, суспендирующие вещества, подсластители, отдушки или ароматизаторы. Фармацевтические композиции по настоящему изобретению также можно вводить в форме липосом, как описано в патенте США № 6703403. Формулирование лекарственных средств, которые применимы для настоящего изобретения, в общем виде обсуждается, например, в Hoover, John E., REMINGTON'S PHARMACEUTICAL SCIENCES (Mack Publishing Co., Easton, PA: 1975) и Lachman, L., eds., PHARMACEUTICAL DOSAGE FORMS (Marcel Decker, New York, N.Y., 1980).
Любое соединение, описанное в настоящей заявке, или его фармацевтически приемлемую соль можно использовать для получения фармацевтических композиций по настоящему изобретению.
Настоящее изобретение также включает способы применения соединений по настоящему изобретению (или их солей, сольватов или пролекарств) для ингибирования репликации HCV. Способы включают контактирование клеток, инфицированных HCV вирусом, с эффективным количеством соединения по настоящему изобретению (или его соли, сольвата или пролекарства), ингибируя, таким образом, репликацию HCV вируса в клетках. Как это используется в настоящей заявке, "ингибирование" означает существенное снижение или уничтожение активности, подлежащей ингибированию (например, репликации вируса). Во многих случаях репрезентативные соединения по настоящему изобретению могут снижать репликацию HCV вируса (например, в HCV анализе репликации, как описано выше) по меньшей мере на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или более.
Соединения по настоящему изобретению могут ингибировать один или несколько подтипов HCV. Примеры подтипов HCV, которые поддаются ингибированию в соответствии с настоящим изобретением, включают, но не ограничиваются этим, HCV генотипы 1, 2, 3, 4, 5 и 6, включая HCV генотипы 1a, 1b, 2a, 2b, 2c или 3a. В одном варианте воплощения соединение или соединения по настоящему изобретению (или их соли, сольваты или пролекарства) используют для ингибирования репликации HCV генотипа 1a. В другом варианте воплощения соединение или соединения по настоящему изобретению (или их соли, сольваты или пролекарства) используют для ингибирования репликации HCV генотипа 1b. Еще в одном варианте воплощения соединение или соединения по настоящему изобретению (или их соли, сольваты или пролекарства) используют для ингибирования репликации HCV обоих генотипов 1a и 1b.
Настоящее изобретение также включает способы применения соединений по настоящему изобретению (или их солей, сольватов или пролекарств) для лечения HCV инфекции. Способы обычно включают введение терапевтически эффективного количества соединения по настоящему изобретению (или его соли, сольвата или пролекарства) или фармацевтической композиции, содержащей их, HCV пациенту, снижая, таким образом, уровень HCV вируса в крови или печени пациента. Как он используется в настоящей заявке, термин "лечение" относится к обратному развитию, облегчению, ингибированию прогрессирования или профилактике расстройства или состояния или одного или нескольких симптомов такого расстройства или состояния, к которому применим такой термин. Термин "лечение" относится к акту лечения. В одном варианте воплощения способы включают введение терапевтически эффективного количества двух или нескольких соединений по настоящему изобретению (или их солей, сольватов или пролекарств) или фармацевтической композиции, содержащей такие соединения, HCV пациенту, снижая, таким образом, уровень HCV вируса в крови или печени пациента.
Соединение по настоящему изобретению (или его соль, сольват или пролекарство) можно вводить в виде единственного активного фармацевтического средства или в сочетании с другим желательным лекарственным средством, таким как другие анти-HCV средства, анти-HIV средства, анти-HBV средства, средства против гепатита A, средства против гепатита D, средства против гепатита E, средства против гепатита G или другие противовирусные лекарственные средства. Любое соединение, описанное в настоящей заявке, или его фармацевтически приемлемую соль можно использовать в способах по настоящему изобретению.
Соединение по настоящему изобретению (или его соль, сольват или пролекарство) можно вводить пациенту в виде одной дозы или раздельными дозами. Типичная суточная доза находится в пределах, без ограничения, от 0,1 до 200 мг/кг массы тела, например, от 0,25 до 100 мг/кг массы тела. Композиции для одной дозы могут содержать такие количества или их дольные единицы, составляющие суточную дозу. Предпочтительно, каждая доза содержит достаточное количество соединения по настоящему изобретению, которое является эффективным для снижения HCV вирусной нагрузки в крови или печени пациента. Количество активного ингредиента или активных ингредиентов, которые объединены, для получения стандартной единицы лекарственной формы может варьировать в зависимости от хозяина, которого лечат, и конкретного способа введения. Должно быть понятно, что конкретный уровень доз для любого конкретного пациента зависит от различных факторов, включая активность конкретного используемого соединения, возраст, массу тела, общее состояние здоровья, пол, режим питания, время введения, путь введения, скорость выведения из организма, сочетание лекарственных средств и тяжесть конкретного заболевания, которое лечат.
Настоящее изобретение также включает способы применения фармацевтических композиций по настоящему изобретению для лечения HCV инфекции. Способы обычно включают введение фармацевтической композиции по настоящему изобретению HCV пациенту, снижая, таким образом, уровень HCV вируса в крови или печени пациента. Любую фармацевтическую композицию, описанную в настоящей заявке, можно использовать в способах по настоящему изобретению.
Кроме того, настоящее изобретение включает применение соединений или солей по настоящему изобретению для получения лекарственных средств для лечения HCV инфекции. Любое соединение, описанное в настоящей заявке, или его фармацевтически приемлемую соль можно использовать для получения лекарственных средств по настоящему изобретению.
Соединения по настоящему изобретению также могут быть изотопно замещенными. Предпочтительные изотопные замещения включают замещения стабильными или нерадиоактивными изотопами, такими как дейтерий,13C,15N или18O. Включение тяжелого атома, например, замещение водорода дейтерием, может привести к изотопному эффекту, который может изменить фармакокинетику лекарственного средства. В одном примере, по меньшей мере 10 мол.% водорода в соединении по настоящему изобретению замещено дейтерием. В другом примере, по меньшей мере, 25 мол.% водорода в соединении по настоящему изобретению замещено дейтерием. В следующем примере, по меньшей мере, 50, 60,70, 80 или 90 мол.% водорода в соединении по настоящему изобретению замещено дейтерием. Природная распространенность дейтерия составляет около 0,015%. Замещение или обогащение дейтерием можно получить, без ограничения, либо путем обмена протонов на дейтерий, либо путем синтеза молекулы с обогащенными или замещенными исходными веществами. Другие способы, известные из уровня техники, также можно использовать для изотопных замещений.
Представленное выше описание настоящего изобретения обеспечивает иллюстрацию и описание, но не предназначено как исчерпывающее или ограничивающее настоящее изобретение конкретно тем, что описано. Модификации и изменения возможны в свете представленных выше указаний или могут потребоваться для осуществления на практике настоящего изобретения. Таким образом, отмечается, что объем настоящего изобретения определен формулой изобретения и ее эквивалентами.
Реферат
Изобретение относится к новым соединениям формулы I, приведенной ниже, или его фармацевтически приемлемым солям. Соединения эффективны для ингибирования репликации вируса гепатита С ("HCV"). Описан способ их получения.,где:A независимо от B означает фенил,, или, иB независимо от A означает фенил,, или,и значения Z, Y, D, L, L, L, Z, Zприведены в формуле изобретения. 6 н. и 11 з.п. ф-лы, 3 табл., 8 ил., 177 пр.
Формула

где:
A независимо от B означает фенил,
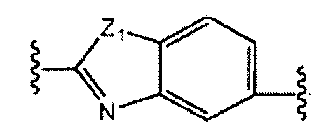
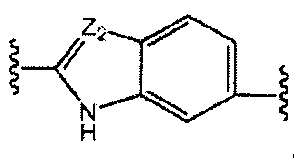
B независимо от A означает фенил,
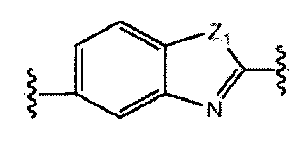
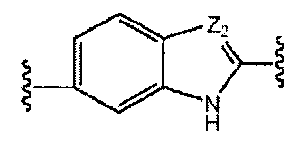
и A и B каждый независимо необязательно замещены одним или несколькими заместителями RA; и Z1 независимо в каждом случае выбирают из О или NH; и Z2 означает N;
D представляет собой фенил, циклопентил, 3-10-членный насыщенный, частично ненасыщенный или полностью ненасыщенный гетероцикл, содержащий один или два гетероатома, независимо выбранных из О, N и S, и необязательно замещенный одним или несколькими заместителями RA;
или D представляет собой C1-C6алкил, необязательно замещенный -O-Rs или оксо;
X представляет собой N;
L1 и L2, каждый независимо, означают C1-C6алкилен;
L3 представляет собой связь;
Y выбран из -Т′-С(R1R2)N(R5)-T-RD или -LK-T-RD;
R1 и R2, каждый независимо, представляют собой Rc, и R5 представляет собой RB; или R1 представляет собой Rc, и R2 и R5, взятые вместе с атомами, к которым они присоединены, образуют 3-8-членное гетероциклическое кольцо, содержащее один или два гетероатома, независимо выбранных из N и S, которое необязательно замещено одним или несколькими заместителями RA;
Z выбран из -Т′-C(R8R9)N(R12)-T-RD или -LK-T-RD;
R8 и R9, каждый независимо, представляют собой Rc, и R12 представляет собой RB; или R8 представляет собой Rc, и R9 и R12, взятые вместе с атомами, к которым они присоединены, образуют 3-8-членное гетероциклическое кольцо, содержащее один или два гетероатома, независимо выбранных из N и S, которое необязательно замещено одним или несколькими заместителями RA;
LK, каждый независимо, в каждом случае выбран из связи или -N(RB) С(О)-Ls;
Т и Т′, каждый независимо, в каждом случае выбраны из связи, -Ls-, -Ls-M-Ls′, -Ls-M-Ls′-М′-Ls″-, где M и M′, каждый независимо, в каждом случае выбраны из -О-, -N(RB)-; -C(O)-, -С(O)O-, -ОС(O); -N(RB)C(O)- или 3-10-членного гетероцикла, содержащего один или два гетероатома, независимо выбранных из N и О, и где указанный 3-10-членный гетероцикл, каждый независимо, необязательно замещен в каждом случае одним или несколькими заместителями RA;
RA независимо выбран в каждом случае из галогена, гидрокси, амино, оксо, -LA или -Ls-RE;
RB независимо в каждом случае выбран из водорода или RF;
Rc независимо выбран в каждом случае из водорода или RF;
RD, каждый независимо, выбран в каждом случае из водорода или RA;
RE независимо выбран в каждом случае из -O-Rs, -C(O)Rs, -C(O)ORs, -N(RsRs′), -N(RS)С(О)ORS′, фенила или 3-10-членного гетероциклила, содержащего один или два гетероатома, независимо выбранных из N и О, где указанный фенил и 3-10-членный гетероциклил, каждый независимо, необязательно замещены в каждом случае одним или несколькими заместителями, выбранными из галогена, -O-RB, оксо;
RF независимо выбран в каждом случае из C1-C6алкила или C3-C6карбоциклила;
LA независимо выбран в каждом случае из C1-C6алкила или C2-C6алкенила, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из -O-RS;
-LS, -LS′ и -LS″, каждый независимо, в каждом случае выбраны из связи; или C1-C6алкилена или C2-C6алкенилена, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, RT, -O-RS или оксо;
RS и RS′, каждый независимо, в каждом случае выбраны из водорода или RT;
RT независимо выбран в каждом случае из C1-C6алкила, C2-C6алкенила, C3-C6карбоциклила или 3-6-членного гетероциклила, содержащего один или два гетероатома, независимо выбранных из N и О, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, RF, -O-RB или оксо.
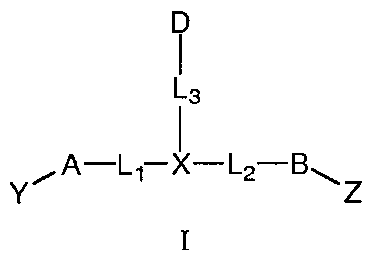
где:
A и B каждый независимо означают фенил и каждый независимо необязательно замещены одним или несколькими заместителями RA;
D представляет собой фенил, циклопентил, 3-10-членный насыщенный, частично ненасыщенный или полностью ненасыщенный гетероцикл, содержащий один или два гетероатома, независимо выбранных из О, N и S, и необязательно замещенный одним или несколькими заместителями RA;
или D представляет собой C1-C6алкил, необязательно замещенный -O-RS или оксо;
X представляет собой N;
L1 и L2, каждый независимо, означают -(СH2)-;
L3 представляет собой связь;
Y выбран из -N(RB)C(O)C(R1R2)N(R5)-T-RD;
R1 представляет собой Rc; и R2 и R5, взятые вместе с атомами, к которым они присоединены, образуют 3-8-членное гетероциклическое кольцо, содержащее один или два гетероатома, независимо выбранных из N и S, которое необязательно замещено одним или несколькими заместителями RA;
Z выбран из -N(Rв)С(О)-С(R8R9)N(R12)-T-RD;
R8 представляет собой Rc, и R9 и R12, взятые вместе с атомами, к которым они присоединены, образуют 3-8-членное гетероциклическое кольцо, содержащее один или два гетероатома, независимо выбранных из N и S, которое необязательно замещено одним или несколькими заместителями RA;
Т независимо в каждом случае выбран из -Ls-, -Ls-M-Ls′-, -Ls-M-Ls′-M′-Ls″ -, где M и M′, каждый независимо, в каждом случае выбраны из -O-, -N(RB)-, -С(O)-, -С(O)O-, -ОС(О)-; -N(RB)C(O)-; -N (RB)С(О)O- или 3-10-членного насыщенного гетероцикла, содержащего один атом азота, и где указанный 3-10-членный гетероцикл, каждый независимо, необязательно замещен в каждом случае одним или несколькими заместителями RA;
RA независимо выбран в каждом случае из галогена, гидрокси, амино, оксо или -LA;
RB и RB′ независимо в каждом случае выбраны из водорода или RF;
Rc независимо выбран в каждом случае из водорода или RF;
RD, каждый независимо, выбран в каждом случае из водорода или RA;
RE независимо выбран в каждом случае из -O-Rs, -C(O)Rs, -C(O)ORs, -N(RsRs′), -N(RS)C(O)ORS′, фенила или 3-10-членного гетероциклила, содержащего один или два гетероатома, независимо выбранных из N и О, где указанный 3-10-членный гетероциклил, каждый независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, -O-RB, оксо;
RF независимо выбран в каждом случае из C1-C6алкила или C3-C6карбоциклила;
LA независимо выбран в каждом случае из C1-C6алкила или C2-C6алкенила, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из -O-RS;
-LS, -LS′ и -LS″, каждый независимо, в каждом случае выбраны из связи; или C1-C6алкилена или C2-C6алкенилена, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из RT, -O-RS или оксо;
RS и RS′, каждый независимо, в каждом случае означают водород;
RT независимо выбран в каждом случае из C1-C6алкила, C2-C6алкенила, C3-C6карбоциклила, (фенил) C1-C6алкила или 3-6-членного гетероциклила, содержащего один или два гетероатома, независимо выбранных из N и O, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, -O-RB или оксо.
Т независимо выбран в каждом случае из -С(O)-LS′-M′-LS″ - или -N(RB)С(O)-LS′-M′-LS″-; и
LS′ независимо представляет собой C1-C6алкилен и, независимо, необязательно замещен, в каждом случае, одним или несколькими заместителями, выбранными из RT, -O-RS или оксо.
Т независимо выбран в каждом случае из -С(O)-LS′-M′-LS″-; и
D представляет собой фенил, циклопентил, 5-6-членный гетероцикл или 6-10-членные бициклы и замещен одним или несколькими заместителями RM, где RM представляет собой галоген или оксо.

где:
A представляет собой:


D представляет собой фенил и необязательно замещен одним или несколькими заместителями RA;
X представляет собой N;
L1 и L2 представляют собой -(СH2)-;
L3 представляет собой связь;
Y выбран из -С(R1R2)N(R5)-T-RD,
R1 представляет собой Rc, и R2 и R5, взятые вместе с атомами, к которым они присоединены, образуют 3-8-членное гетероциклическое кольцо, содержащее один атом азота;
Z выбран из -C(R8R9)N(R12)-T-RD;
R8 представляет собой Rc, и R9 и R12, взятые вместе с атомами, к которым они присоединены, образуют 3-8-членное гетероциклическое кольцо, содержащее один атом азота;
Т независимо выбран в каждом случае из -Ls-M-LS′- или -LS-M-LS′-M′-LS″-, где M и M′, каждый независимо, в каждом случае выбраны из -С(O)-, -N(RB)C(O)-, -N(RB)С(О)О-;
RA независимо выбран в каждом случае из галогена, амино, -LA или -LS-RE;
RB независимо в каждом случае выбран из водорода или RF;
RC означает водород;
RD независимо выбран в каждом случае из водорода или RA;
RE независимо выбран в каждом случае из -O-RS, -C(O)ORS, -N(RSRS′), 5-членного гетероциклила, содержащего один гетероатом N, или 6-членного гетероциклила, содержащего два гетероатома, независимо выбранных из N и О;
RF независимо выбран в каждом случае из C1-C6алкила;
LA независимо выбран в каждом случае из C1-C6алкила;
-LS, -LS′ и -LS″, каждый независимо, в каждом случае выбраны из связи; или C1-C6алкилена, который независимо необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из RT, -O-RS;
RS или RS′, каждый независимо, в каждом случае выбраны из водорода или RT;
RT независимо выбран в каждом случае из C1-C6алкила, фенила или 4-6-членного гетероциклила, содержащего один атом азота или кислорода, или 6-членного гетероцикла, содержащего 2 гетероатома, из которых один является азотом, а другой является кислородом.
Z1 представляет собой NH;
Т независимо выбран в каждом случае из -С(О)-LS′-М′-LS″- или -N(RB)С(O)-LS′-M′-LS″-; и
LS′ независимо представляет собой C1-C6алкилен и, независимо, необязательно замещен, в каждом случае, одним или несколькими заместителями, выбранными из RT или -O-RS.
Z1 представляет собой NH, и
T независимо выбран в каждом случае из -С(О)-LS′-M′-LS.

где:
A представляет собой
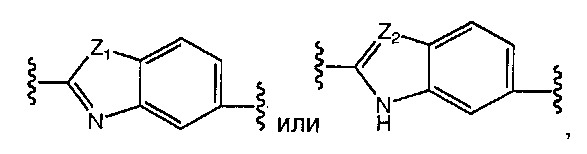
B представляет собой фенил;
D представляет собой фенил и необязательно замещен одним или несколькими заместителями RA;
X представляет собой N;
L1 и L2 представляют собой -(СН2)-;
L3 представляет собой связь;
Y выбран из -С(R1R2)N(R5)-T-RD,
R1 представляет собой Rc, и R2 и R5, взятые вместе с атомами, к которым они присоединены, образуют 3-8-членное гетероциклическое кольцо, содержащее один атом азота;
Z выбран из -N(RB)С(О)С(R8R9)N(R12)-T-RD;
R8 представляет собой RC, и R9 и R12, взятые вместе с атомами, к которым они присоединены, образуют 3-8-членное гетероциклическое кольцо, содержащее один атом азота;
T, независимо, выбран в каждом случае из -LS-M-LS′-, -LS-M-LS′-М′-LS″-, где M и M′, каждый независимо, в каждом случае выбраны из -С(O)-, -N(RB)C(O)- или -N(RB)C(O)O;
RA независимо выбран в каждом случае из галогена или -Ls-RE;
RB выбран из водорода;
Rc означает водород;
RD независимо выбран в каждом случае из водорода или RA;
RE независимо выбран в каждом случае из -O-RS;
RF независимо выбран в каждом случае из C1-C6алкила, C2-С6алкенила, С2-С6алкинила, С3-С6карбоциклила, C3-C6карбоциклилС1-С6алкила, 3-6-членного гетероциклила или (3- или 6-членный гетероциклил) C1-С6алкила, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из галогена, гидрокси, меркапто, амино, карбокси, нитро, оксо, фосфонокси, фосфоно, тиоксо, формила или циано;
-LS, -LS′ и -LS″, каждый независимо, в каждом случае выбраны из связи; или C1-C6алкилена, каждый из которых, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из RT или -O-RS;
RS независимо в каждом случае выбран из водорода или RT;
RT независимо выбран в каждом случае из С1-С6алкила, который, независимо, необязательно замещен в каждом случае одним или несколькими заместителями, выбранными из -O-RB.
Т независимо выбран в каждом случае из -С(О)-LS′-M′-Ls″ - или -N(RB)С(O)-LS′-М′-LS″-; и
LS′ независимо представляет собой C1-C6алкилен и, независимо, необязательно замещен, в каждом случае, одним или несколькими заместителями, выбранными из RT или -O-Rs.
T независимо выбран в каждом случае из -С(O)-LS′-M′-LS″-.
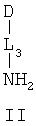
с соединением формулы III

и с соединением формулы VI

где Q означает галоген и А, В, D, L1, L2, L3, X, Y и Z определены в п.1.

Комментарии