Средство для профилактики или лечения невропатии - RU2337682C2
Код документа: RU2337682C2
Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к средству для профилактики или лечения невропатии или к средству для усиления продуцирования или секреции нейротрофического фактора.
Кроме того, настоящее изобретение относится к новому 5-членному ароматическому гетероциклическому соединению, обладающему усиливающим продуцирование или секрецию нейротрофического фактора действием, которое может быть использовано для профилактики или лечения невропатии и тому подобного.
Уровень техники
Что касается 5-членного ароматического гетероциклического соединения, то сообщалось о следующих соединениях.
(1) В качестве антагониста рецептора аденозина A1, соединение, представленное формулой:

где A представляет собой ароматическое кольцо; X, Y и Z представляют собой, каждый, углерод, азот, кислород или серу; R1 представляет собой необязательно замещенный арил или необязательно замещенный гетероарил; R2, R3 и R4 являются одинаковыми или различными, и каждый из них представляет собой водород, низший алкил, низший алкенил, низший алкинил и тому подобное; R5 и R6 являются одинаковыми или различными, и каждый из них представляет собой водород или низший алкил; B представляет собой кислород или серу; R7 и R8 являются одинаковыми или различными, и каждый из них представляет собой водород, низший алкил, низшую алкокси, необязательно замещенный арил, необязательно замещенный арилалкил, необязательно замещенный гетероарил, необязательно замещенный гетероарилалкил, необязательно защищенный карбоксиалкил и тому подобное (смотри Европейский патент EP-A-630894).
(2) В качестве противогиперлипидемического средства и противоатериосклеротического средства соединение, представленное формулой:

где R1 представляет собой C1-6алкил; R2 и R5 представляют собой, каждый, независимо, водород, C1-4алкил, C1-4алкокси (за исключением трет-бутокси), трифторметил, фтор, хлор, фенил, фенокси или бензилокси; R3 и R6 представляют собой, каждый, независимо, водород, C1-3алкил, C1-3алкокси, трифторметил, фтор, хлор, фенокси или бензилокси; R4 и R7 представляют собой, каждый, независимо, водород, C1-3алкил, C1-2алкокси, фтор или хлор;
X представляет собой -(CH2)m- или -(CH2)qCH=CH(CH2)q- (m равен 0, 1, 2 или 3, каждый из q равен 0, или один из них равен 0, а другой равен 1); и
Z представляет собой -CH(OH)-CH2-C(OH)R10-CH2-COOH (R10 представляет собой водород или C1-3алкил);
при условии, что каждое из колец A и B может иметь только одну группу, выбранную из трифторметила, фенокси и бензилокси, и -X-Z присутствует в 4- или 5-положении пиразольного кольца и в орто-положении по отношению к R1 (смотри заявку на Международный патент WO 86/00307).
(3) В качестве промотора продуцирования или секреции нейротропина соединение, представленное формулой:

где R1 представляет собой атом галогена, необязательно замещенную гетероциклическую группу, необязательно замещенную гидроксигруппу, необязательно замещенную тиольную группу или необязательно замещенную аминогруппу, A представляет собой необязательно замещенную ацильную группу, необязательно замещенную гетероциклическую группу, необязательно замещенную гидроксигруппу или необязательно этерифицированную или амидированную карбоксильную группу, B представляет собой необязательно замещенную ароматическую группу, X представляет собой атом кислорода, атом серы или необязательно замещенный атом азота, и Y представляет собой дивалентную углеводородную группу или гетероциклическую группу, (смотри заявку на Международный патент WO 01/14372).
(4) В качестве регулятора действия рецептора, относящегося к ретиноидам, соединение, представленное формулой:
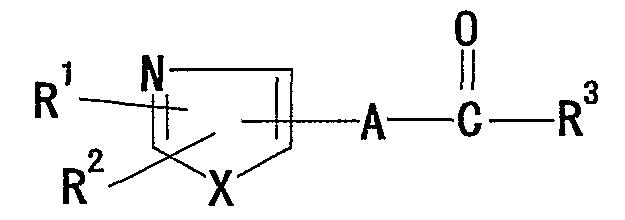
где R1 представляет собой необязательно замещенную ароматическую углеводородную группу или необязательно замещенную ароматическую гетероциклическую группу; R2 представляет собой водород или необязательно замещенную углеводородную группу; X представляет собой O, S или группу, представленную -NR4-, где R4 представляет собой водород или необязательно замещенную алкильную группу; A представляет собой необязательно замещенную ароматическую углеводородную группу или необязательно замещенную ароматическую гетероциклическую группу; R3 представляет собой группу, представленную формулой: -OR5-, где R5 представляет собой водород или необязательно замещенную углеводородную группу, или -NR6R7, где R6 и R7 являются одинаковыми или различными и каждый из них представляет собой водород или необязательно замещенную углеводородную группу, или R6 и R7 могут образовывать кольцо вместе с соседним атомом азота (смотри заявку на Международный патент WO 00/01679).
Сущность изобретения
Объектом настоящего изобретения является средство для профилактики или лечения невропатии и средство для усиления продуцирования или секреции нейротрофического фактора, которые обладают превосходным действием и малотоксичны.
Следующим объектом настоящего изобретения является 5-членное ароматическое гетероциклическое соединение, обладающее превосходным профилактическим или терапевтическим действием на невропатию, и которое является малотоксичным.
Авторы настоящего изобретение обнаружили, что соединение, представленное формулой:
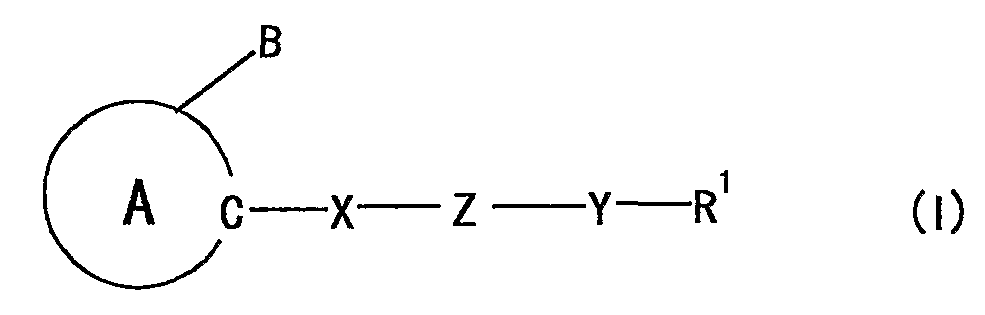
где
кольцо A представляет собой 5-членный ароматический гетероцикл, содержащий 2 или более атомов азота, который может, кроме того, иметь заместитель (заместители);
B представляет собой необязательно замещенную углеводородную группу или необязательно замещенную гетероциклическую группу;
X, Z, Y и R1 являются такими, как определено ниже,
при условии, что, когда 5-членный ароматический гетероцикл, представленный кольцом A, представляет собой имидазол, тогда Z не должен представлять собой -O-,
которое структурно характеризуется тем, что группа, представленная формулой: -X-Z-Y-R1 [X представляет собой дивалентную ациклическую углеводородную группу; Z представляет собой -O-, -S-, -NR2-, -CONR2- или -NR2CO- (R2 представляет собой атом водорода или необязательно замещенную алкильную группу); Y представляет собой связь или дивалентную ациклическую углеводородную группу; R1 представляет собой необязательно замещенную циклическую группу, необязательно замещенную аминогруппу или необязательно замещенную ацильную группу] присоединена к составляющему кольцо атому углерода 5-членного ароматического гетероцикла, содержащего 2 или более атомов азота, демонстрирует превосходное действие на продуцирование или секрецию нейротрофического фактора, определяемое особенностями химической структуры, и на основе этих данных, создали настоящее изобретение.
Таким образом настоящее изобретение относится к
1) средству для профилактики или лечения невропатии, которое содержит соединение, представленное формулой:
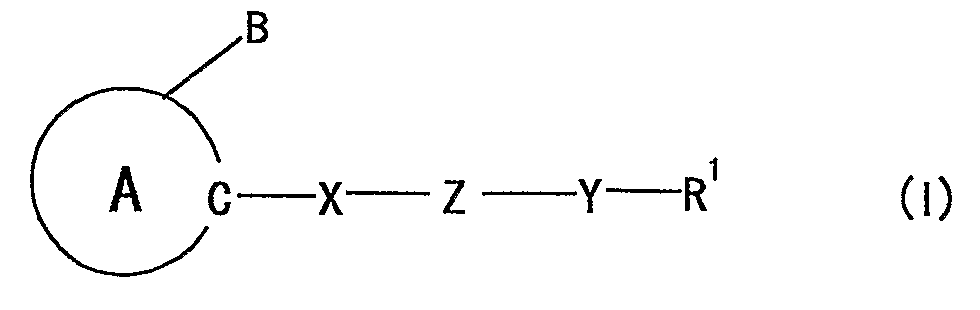
где
кольцо A представляет собой 5-членный ароматический гетероцикл,
содержащий 2 или более атомов азота, который, кроме того, может иметь заместитель (заместители);
B представляет собой необязательно замещенную углеводородную группу или необязательно замещенную гетероциклическую группу;
X представляет собой дивалентную ациклическую углеводородную группу;
Z представляет собой -O-, -S-, -NR2-, -CONR2- или -NR2CO- (R2 представляет собой атом водорода или необязательно замещенную алкильную группу);
Y представляет собой связь или дивалентную ациклическую углеводородную группу; и
R1 представляет собой необязательно замещенную циклическую группу, необязательно замещенную аминогруппу или необязательно замещенную ацильную группу,
при условии, что, когда 5-членный ароматический гетероцикл, представленный кольцом A, представляет собой имидазол, тогда Z не должен представлять собой -O-,
или его соль;
2) средство по указанному выше 1), где 5-членный ароматический гетероцикл, представленный кольцом A, представляет собой пиразольное, оксадиазольное, тиадиазольное, триазольное или тетразольное кольцо;
3) средство по указанному выше 1), где необязательно замещенная циклическая группа, представленная R1, представляет собой группу, представленную формулой:

где D представляет собой кольцо, необязательно имеющее, кроме того, заместитель (заместители); Y1 представляет собой связь или дивалентную ациклическую углеводородную группу; R3' представляет собой группу формулы: -SO2R4, -SOR4 или -PO3R4R5, где R4 и R5 являются одинаковыми или различными и каждый из них представляет собой атом водорода, углеводородную группу или гетероциклическую группу, и R4 и R5 могут образовывать гетероцикл вместе с соседним оксо-замещенным атомом фосфора и двумя атомами кислорода, или необязательно замещенную гетероциклическую группу;
4) средство усиления продуцирования или секреции нейротрофического фактора, которое содержит соединение формулы

где
кольцо A представляет собой 5-членный ароматический гетероцикл, содержащий 2 или более атомов азота, который может, кроме того, иметь заместитель (заместители);
B представляет собой необязательно замещенную углеводородную группу или необязательно замещенную гетероциклическую группу;
X представляет собой дивалентную ациклическую углеводородную группу;
Z представляет собой -O-, -S-, -NR2-, -CONR2- или -NR2CO- (R2 представляет собой атом водорода или необязательно замещенную алкильную группу);
Y представляет собой связь или дивалентную ациклическую углеводородную группу; и
R1 представляет собой необязательно замещенную циклическую группу, необязательно замещенную аминогруппу или необязательно замещенную ацильную группу,
при условии, что, когда 5-членный ароматический гетероцикл, представленный кольцом A, представляет собой имидазол, тогда Z не должен представлять собой -O-,
или его соль;
5) средство по указанному выше 4), где 5-членный ароматический гетероцикл, представленный кольцом A, представляет собой пиразольное, оксадиазольное, тиадиазольное, триазольное или тетразольное кольцо;
6) средство для ослабления боли, содержащее соединение, представленное формулой:

где
кольцо A представляет собой 5-членный ароматический гетероцикл, содержащий 2 или более атомов азота, который может, кроме того, иметь заместитель (заместители);
B представляет собой необязательно замещенную углеводородную группу или необязательно замещенную гетероциклическую группу;
X представляет собой дивалентную ациклическую углеводородную группу;
Z представляет собой -O-, -S-, -NR2-, -CONR2- или -NR2CO- (R2 представляет собой атом водорода или необязательно замещенную алкильную группу);
Y представляет собой связь или дивалентную ациклическую углеводородную группу; и
R1 представляет собой необязательно замещенную циклическую группу, необязательно замещенную аминогруппу или необязательно замещенную ацильную группу,
при условии, что, когда 5-членный ароматический гетероцикл, представленный кольцом A, представляет собой имидазол, тогда Z не должен представлять собой -O-,
или его соль;
7) средство по указанному выше 6), где 5-членный ароматический гетероцикл, представленный кольцом A, представляет собой пиразольное, оксадиазольное, тиадиазольное, триазольное или тетразольное кольцо;
8) нейропротекторное средство, содержащее соединение, представленное формулой:

где
кольцо A представляет собой 5-членный ароматический гетероцикл, содержащий 2 или более атомов азота, который может, кроме того, иметь заместитель (заместители);
B представляет собой необязательно замещенную углеводородную группу или необязательно замещенную гетероциклическую группу;
X представляет собой дивалентную ациклическую углеводородную группу;
Z представляет собой -O-, -S-, -NR2-, -CONR2- или -NR2CO- (R2 представляет собой атом водорода или необязательно замещенную алкильную группу);
Y представляет собой связь или дивалентную ациклическую углеводородную группу; и
R1 представляет собой необязательно замещенную циклическую группу, необязательно замещенную аминогруппу или необязательно замещенную ацильную группу,
при условии, что, когда 5-членный ароматический гетероцикл, представленный кольцом A, представляет собой имидазол, тогда Z не должен представлять собой -O-,
или его соль;
9) соединение, представленное формулой

где
кольцо A представляет собой 5-членный ароматический гетероцикл, содержащий 2 или более атомов азота, который может, кроме того, иметь заместитель (заместители);
B представляет собой необязательно замещенную углеводородную группу или необязательно замещенную гетероциклическую группу;
X представляет собой дивалентную ациклическую углеводородную группу;
Z представляет собой -O-, -S-, -NR2-, -CONR2- или -NR2CO- (R2 представляет собой атом водорода или необязательно замещенную алкильную группу);
Y и Y1 являются одинаковыми или различными, и каждый из них представляет собой связь или дивалентную ациклическую углеводородную группу; и
D представляет собой кольцо, кроме того, необязательно имеющее заместитель (заместители);
R3 представляет собой необязательно замещенную ацильную группу или необязательно замещенную гетероциклическую группу,
при условии, что, когда 5-членный ароматический гетероцикл, представленный кольцом A, представляет собой имидазол, тогда Z не должен представлять собой -O-,
и при условии, что, когда 5-членный ароматический гетероцикл, представленный кольцом A, представляет собой пиразол, X представляет собой метилен, Z представляет собой -S-, и Y представляет собой связь, тогда кольцо, представленное D, не должно представлять собой оксадиазол,
или его соль;
10) соединение по указанному выше 9), где 5-членный ароматический гетероцикл, представленный кольцом A, представляет собой пиразольное, оксадиазольное, тиадиазольное, триазольное или тетразольное кольцо;
11) соединение по указанному выше 9), где необязательно замещенная ацильная группа, представленная R3, представляет собой группу формулы: -SO2R4, -SOR4 или -PO3R4R5, где R4 и R5 являются одинаковыми или различными, и каждый из них представляет собой атом водорода, углеводородную группу или гетероциклическую группу, и R4 и R5 могут образовывать гетероцикл вместе с соседним оксо-замещенным атомом фосфора и двумя атомами кислорода;
12) соединение по указанному выше 9), где 5-членный ароматический гетероцикл, представленный кольцом A, представляет собой пиразольное кольцо;
13) соединение по указанному выше 9), где B представляет собой необязательно замещенную ароматическую углеводородную группу или необязательно замещенную ароматическую гетероциклическую группу;
14) соединение по указанному выше 9), где X представляет собой дивалентную C1-8алифатическую углеводородную группу;
15) соединение по указанному выше 9), где Z представляет собой -CONR2- (R2 представляет собой атом водорода или необязательно замещенную алкильную группу);
16) соединение по указанному выше 9), где Y представляет собой связь или C1-4алкилен;
17) соединение по указанному выше 9), где Y1 представляет собой связь или C1-4алкилен;
18) соединение по указанному выше 9), где кольцо, представленное D, представляет собой C6-14ароматическое углеводородное кольцо;
19) соединение по указанному выше 9), которое представляет собой диэтил [4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат;
(2E)-N-{4-[(2,4-диоксо-1,3-тиазолидин-5-ил)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид;
(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(1H-имидазол-1-илметил)фенил]акриламид;
(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(1H-пиразол-1-илметил)фенил]акриламид;
диэтил [4-({(2E)-3-[1-метил-5-(2-тиенил)-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат;
(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(3-метил-2,4-диоксо-1,3-тиазолидин-5-ил)метил]фенил}акриламид;
(2E)-N-[4-(1H-бензимидазол-1-илметил)фенил]-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид;
(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(метилсульфонил)метил]фенил}акриламид;
(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[гидрокси(2-пиридинил)метил]фенил}акриламид;
(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(4-морфолинилметил)фенил]акриламид; или
(2E)-N-{4-[(этилсульфонил)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид;
20) фармацевтическое средство, содержащее соединение по указанному выше 9) или его пролекарство;
21) способ профилактики или лечения невропатии у млекопитающих, который включает введение соединения, представленного формулой:

где
кольцо A представляет собой 5-членный ароматический гетероцикл, содержащий 2 или более атомов азота, который может, кроме того, иметь заместитель (заместители);
B представляет собой необязательно замещенную углеводородную группу или необязательно замещенную гетероциклическую группу;
X представляет собой дивалентную ациклическую углеводородную группу;
Z представляет собой -O-, -S-, -NR2-, -CONR2- или -NR2CO- (R2 представляет собой атом водорода или необязательно замещенную алкильную группу);
Y представляет собой связь или дивалентную ациклическую углеводородную группу; и
R1 представляет собой необязательно замещенную циклическую группу, необязательно замещенную аминогруппу или необязательно замещенную ацильную группу,
при условии, что, когда 5-членный ароматический гетероцикл, представленный кольцом A, представляет собой имидазол, тогда Z не должен представлять собой -O-,
или его соль, указанному млекопитающему;
22) способ усиления продуцирования или секреции нейротрофического фактора у млекопитающих, который включает введение соединения, представленного формулой:

где
кольцо A представляет собой 5-членный ароматический гетероцикл, содержащий 2 или более атомов азота, который может, кроме того, иметь заместитель (заместители);
B представляет собой необязательно замещенную углеводородную группу или необязательно замещенную гетероциклическую группу;
X представляет собой дивалентную ациклическую углеводородную группу;
Z представляет собой -O-, -S-, -NR2-, -CONR2- или -NR2CO- (R2 представляет собой атом водорода или необязательно замещенную алкильную группу);
Y представляет собой связь или дивалентную ациклическую углеводородную группу; и
R1 представляет собой необязательно замещенную циклическую группу, необязательно замещенную аминогруппу или необязательно замещенную ацильную группу,
при условии, что, когда 5-членный ароматический гетероцикл, представленный кольцом A, представляет собой имидазол, тогда Z не должен представлять собой -O-,
или его соли, указанному млекопитающему;
23) способ ослабления боли у млекопитающих, который включает введение соединения, представленного формулой:

где
кольцо A представляет собой 5-членный ароматический гетероцикл, содержащий 2 или более атомов азота, который может, кроме того, иметь заместитель (заместители);
B представляет собой необязательно замещенную углеводородную группу или необязательно замещенную гетероциклическую группу;
X представляет собой дивалентную ациклическую углеводородную группу;
Z представляет собой -O-, -S-, -NR2-, -CONR2- или -NR2CO- (R2 представляет собой атом водорода или необязательно замещенную алкильную группу);
Y представляет собой связь или дивалентную ациклическую углеводородную группу; и
R1 представляет собой необязательно замещенную циклическую группу, необязательно замещенную аминогруппу или необязательно замещенную ацильную группу,
при условии, что, когда 5-членный ароматический гетероцикл, представленный кольцом A, представляет собой имидазол, тогда Z не должен представлять собой -O-,
или его соли, указанному млекопитающему;
24) способ защиты нерва у млекопитающего, который включает введение соединения, представленного формулой:

где
кольцо A представляет собой 5-членный ароматический гетероцикл, содержащий 2 или более атомов азота, который может, кроме того, иметь заместитель (заместители);
B представляет собой необязательно замещенную углеводородную группу или необязательно замещенную гетероциклическую группу;
X представляет собой дивалентную ациклическую углеводородную группу;
Z представляет собой -O-, -S-, -NR2-, -CONR2- или -NR2CO- (R2 представляет собой атом водорода или необязательно замещенную алкильную группу);
Y представляет собой связь или дивалентную ациклическую углеводородную группу; и
R1 представляет собой необязательно замещенную циклическую группу, необязательно замещенную аминогруппу или необязательно замещенную ацильную группу,
при условии, что, когда 5-членный ароматический гетероцикл, представленный кольцом A, представляет собой имидазол, тогда Z не должен представлять собой -O-,
или его соли, указанному млекопитающему;
25) применение соединения, представленного формулой:
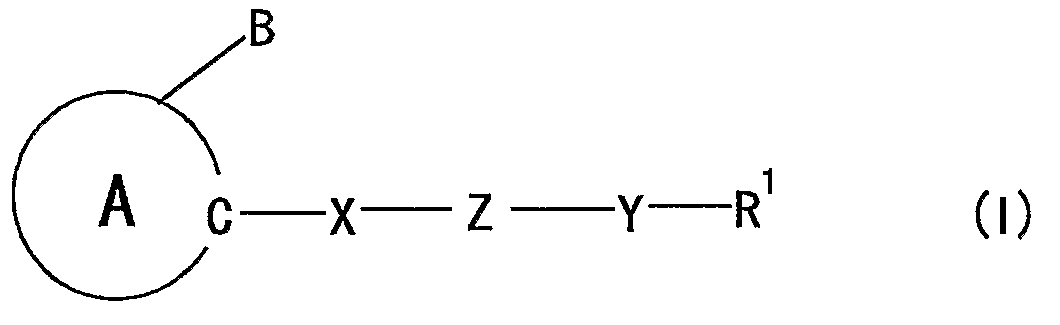
где
кольцо A представляет собой 5-членный ароматический гетероцикл, содержащий 2 или более атомов азота, который может, кроме того, иметь заместитель (заместители);
B представляет собой необязательно замещенную углеводородную группу или необязательно замещенную гетероциклическую группу;
X представляет собой дивалентную ациклическую углеводородную группу;
Z представляет собой -O-, -S-, -NR2-, -CONR2- или -NR2CO- (R2 представляет собой атом водорода или необязательно замещенную алкильную группу);
Y представляет собой связь или дивалентную ациклическую углеводородную группу; и
R1 представляет собой необязательно замещенную циклическую группу, необязательно замещенную аминогруппу или необязательно замещенную ацильную группу,
при условии, что, когда 5-членный ароматический гетероцикл, представленный кольцом A, представляет собой имидазол, тогда Z не должен представлять собой -O-,
или его соли, для получения средства для профилактики или лечения невропатии;
26) применение соединения, представленного формулой:
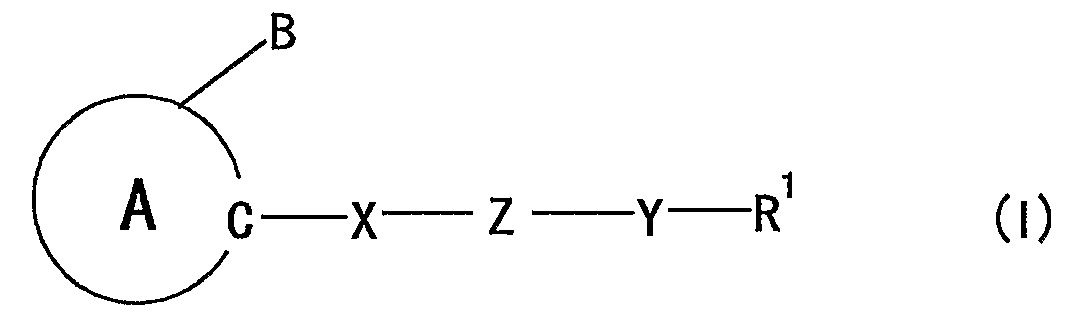
где
кольцо A представляет собой 5-членный ароматический гетероцикл, содержащий 2 или более атомов азота, который может, кроме того, иметь заместитель (заместители);
B представляет собой необязательно замещенную углеводородную группу или необязательно замещенную гетероциклическую группу;
X представляет собой дивалентную ациклическую углеводородную группу;
Z представляет собой -O-, -S-, -NR2-, -CONR2- или -NR2CO- (R2 представляет собой атом водорода или необязательно замещенную алкильную группу);
Y представляет собой связь или дивалентную ациклическую углеводородную группу; и
R1 представляет собой необязательно замещенную циклическую группу, необязательно замещенную аминогруппу или необязательно замещенную ацильную группу,
при условии, что, когда 5-членный ароматический гетероцикл, представленный кольцом A, представляет собой имидазол, тогда Z не должен представлять собой -O-,
или его соли, для получения средства, усиливающего продуцирование или секрецию нейротрофического фактора;
27) применение соединения, представленного формулой:

где
кольцо A представляет собой 5-членный ароматический гетероцикл, содержащий 2 или более атомов азота, который может, кроме того, иметь заместитель (заместители);
B представляет собой необязательно замещенную углеводородную группу или необязательно замещенную гетероциклическую группу;
X представляет собой дивалентную ациклическую углеводородную группу;
Z представляет собой -O-, -S-, -NR2-, -CONR2- или -NR2CO- (R2 представляет собой атом водорода или необязательно замещенную алкильную группу);
Y представляет собой связь или дивалентную ациклическую углеводородную группу; и
R1 представляет собой необязательно замещенную циклическую группу, необязательно замещенную аминогруппу или необязательно замещенную ацильную группу,
при условии, что, когда 5-членный ароматический гетероцикл, представленный кольцом A, представляет собой имидазол, тогда Z не должен представлять собой -O-,
или его соли, для получения средства для ослабления боли;
28) применение соединения, представленного формулой:

где
кольцо A представляет собой 5-членный ароматический гетероцикл, содержащий 2 или более атомов азота, который может, кроме того, иметь заместитель (заместители);
B представляет собой необязательно замещенную углеводородную группу или необязательно замещенную гетероциклическую группу;
X представляет собой дивалентную ациклическую углеводородную группу;
Z представляет собой -O-, -S-, -NR2-, -CONR2- или -NR2CO- (R2 представляет собой атом водорода или необязательно замещенную алкильную группу);
Y представляет собой связь или дивалентную ациклическую углеводородную группу; и
R1 представляет собой необязательно замещенную циклическую группу, необязательно замещенную аминогруппу или необязательно замещенную ацильную группу,
при условии, что, когда 5-членный ароматический гетероцикл, представленный кольцом A, представляет собой имидазол, тогда Z не должен представлять собой -O-,
или его соли, для получения нейропротекторного средства;
29) способ получения соединения, представленного формулой:

где
кольцо A представляет собой 5-членный ароматический гетероцикл, содержащий 2 или более атомов азота, который может, кроме того, иметь заместитель (заместители);
B представляет собой необязательно замещенную углеводородную группу или необязательно замещенную гетероциклическую группу;
X представляет собой дивалентную ациклическую углеводородную группу;
R2 представляет собой атом водорода или необязательно замещенную алкильную группу;
Y и Y1 являются одинаковыми или различными, и каждый из них представляет собой связь или дивалентную ациклическую углеводородную группу;
D представляет собой кольцо необязательно имеющее, кроме того, заместитель (заместители); и
R3 представляет собой необязательно замещенную ацильную группу или необязательно замещенную гетероциклическую группу,
или его соли, который включает взаимодействие соединения, представленного формулой:

где каждый символ является таким, как определено выше, или его соли, с соединением, представленным формулой:

где каждый символ является таким, как определено выше, или с его солью;
30) способ получения соединения, представленного формулой:

где
B представляет собой необязательно замещенную углеводородную группу или необязательно замещенную гетероциклическую группу, и
алк4 представляет собой C1-6алкильную группу или C7-13аралкильную группу,
или его соли, который включает взаимодействие соединения, представленного формулой:

где W представляет собой -OH или -N(алк2)(алк3), где алк2 и алк3 являются одинаковыми или различными и каждый из них представляет собой C1-6алкильную группу, и B является таким, как определено выше, или его соли, с C1-6алкилгидразином или C7-13аралкилгидразином, в присутствии кислоты; и тому подобное.
Подробное описание изобретения
Термины, используемые в настоящем описании, далее определены более конкретно.
В "5-членном ароматическом гетероцикле, содержащем 2 или более атомов азота, который может, кроме того, иметь заместитель (заместители)", обозначенном как кольцо A, в качестве "5-членного ароматического гетероцикла, содержащего 2 или более атомов азота", может быть рассмотрен, например, 5-членный ароматический гетероцикл, содержащий 2 или более атомов азота, кроме атомов углерода, в качестве атомов, составляющих часть кольца, и необязательно, кроме того, содержащий 1 или 2 гетероатома, выбранных из атома кислорода, атома серы и атома азота.
В качестве конкретных примеров "5-членного ароматического гетероцикла, содержащего 2 или более атомов азота", могут быть указаны, например, имидазольное кольцо, пиразольное кольцо, оксадиазольное кольцо, тиадиазольное кольцо, триазольное кольцо, тетразольное кольцо и тому подобное. Среди них пиразольное кольцо, оксадиазольное кольцо, тиадиазольное кольцо, триазольное кольцо и тетразольное кольцо являются предпочтительными, и пиразольное кольцо является особенно предпочтительным.
"5-членный ароматический гетероцикл, содержащий 2 или более атомов азота" может, кроме того, иметь 1 или 2 заместителя в замещаемых положениях. В качестве такого заместителя могут быть указаны, например, атом галогена, необязательно замещенная углеводородная группа, необязательно замещенная гетероциклическая группа, необязательно замещенная гидроксигруппа, необязательно замещенная тиольная группа, необязательно замещенная аминогруппа и тому подобное.
В качестве указанного выше "атома галогена" могут быть указаны, например, атом фтора, атом хлора, атом брома и атом иода. Среди них, атом фтора и атом хлора являются предпочтительными.
В качестве "углеводородной группы", в указанной выше "необязательно замещенной углеводородной группе" могут быть указаны, например, алифатическая углеводородная группа, алициклическая углеводородная группа, ароматическая углеводородная группа, ароматическая алифатическая углеводородная группа, алициклическая алифатическая углеводородная группа и тому подобное.
В качестве алифатических углеводородных групп могут быть указаны, например, алифатические углеводородные группы с прямой цепью или разветвленной цепью, содержащие 1-15 атомов углерода, в частности, алкильная группа, алкенильная группа, алкинильная группа и тому подобное.
В качестве предпочтительных примеров алкильных групп могут быть указаны C1-10алкильные группы, такие как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, 1-этилпропил, гексил, изогексил, 1,1-диметилбутил, 2,2-диметилбутил, 3,3-диметилбутил, 2-этилбутил, гептил, октил, нонил, децил и тому подобное.
В качестве предпочтительных примеров алкенильных групп могут быть указаны C2-10алкенильные группы, такие как этенил, 1-пропенил, 2-пропенил, 2-метил-1-пропенил, 1-бутенил, 2-бутенил, 3-бутенил, 3-метил-2-бутенил, 1-пентенил, 2-пентенил, 3-пентенил, 4-пентенил, 4-метил-3-пентенил, 1-гексенил, 3-гексенил, 5-гексенил, 1-гептенил, 1-октенил и тому подобное.
В качестве предпочтительных примеров алкинильных групп могут быть указаны C2-10алкинильные группы, такие как этинил, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил, 3-бутинил, 1-пентинил, 2-пентинил, 3-пентинил, 4-пентинил, 1-гексинил, 2-гексинил, 3-гексинил, 4-гексинил, 5-гексинил, 1-гептинил, 1-октинил и тому подобное.
В качестве алициклических углеводородных групп могут быть указаны, например, насыщенные или ненасыщенные алициклические углеводородные группы, содержащие 3-12 атомов углерода, в частности, циклоалкильная группа, циклоалкенильная группа, циклоалкадиенильная группа и тому подобное.
В качестве предпочтительных примеров циклоалкильных групп могут быть указаны C3-10циклоалкильные группы, такие как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, бицикло[2.2.1]гептил, бицикло[2.2.2]октил, бицикло[3.2.1]октил, бицикло[3.2.2]нонил, бицикло[3.3.1]нонил, бицикло[4.2.1]нонил, бицикло[4.3.1]децил и тому подобное.
В качестве предпочтительных примеров циклоалкенильных групп могут быть указаны C3-10циклоалкенильные группы, такие как 2-циклопентен-1-ил, 3-циклопентен-1-ил, 2-циклогексен-1-ил, 3-циклогексен-1-ил и тому подобное.
В качестве предпочтительных примеров циклоалкадиенильных групп могут быть указаны C4-10циклоалкадиенильные группы, такие как 2,4-циклопентадиен-1-ил, 2,4-циклогексадиен-1-ил, 2,5-циклогексадиен-1-ил и тому подобное.
В качестве ароматической углеводородной группы, может быть указана, например, C6-14арильная группа и тому подобное. В качестве предпочтительных примеров арильной группы могут быть указаны фенил, нафтил, антрил, фенантрил, аценафтиленил, бифенилил, инденил и тому подобное. Среди них, фенил, нафтил и тому подобное, являются предпочтительными. Арильная группа может быть частично насыщенной, и в качестве частично насыщенной арильной группы, может быть рассмотрен, например, дигидроинденил и тому подобное.
В качестве ароматической алифатической углеводородной группы может быть указана, например, C7-13ароматическая алифатическая углеводородная группа, и конкретно, аралкильная группа, арилалкенильная группа и тому подобное.
В качестве предпочтительных примеров аралкильной группы, может быть указана C7-13аралкильная группа, такая как бензил, фенетил, фенилпропил, нафтилметил, бензгидрил и тому подобное.
В качестве предпочтительных примеров арилалкенильной группы может быть указана C8-13арилалкенильная группа, такая как стирил и тому подобное.
В качестве алициклической алифатической углеводородной группы может быть указана, например, C4-13алициклическая алифатическая углеводородная группа, и конкретно, циклоалкилалкильная группа, циклоалкилалкенильная группа и тому подобное.
В качестве предпочтительных примеров циклоалкилалкильной группы может быть указана C4-13циклоалкилалкильная группа, такая как циклопропилметил, циклопропилэтил, циклопентилметил, циклопентилэтил, циклогексилметил, циклогексилэтил и тому подобное.
В качестве предпочтительных примеров циклоалкилалкенильной группы может быть указана C5-13циклоалкилалкенильная группа, такая как циклопропилэтенил, циклопентилэтенил, циклогексилэтенил и тому подобное.
Указанная выше "углеводородная группа" может иметь 1-3 заместителя в замещаемых положениях. В качестве такого заместителя могут быть указаны, например, атом галогена, нитро, оксо, C1-3алкилендиокси, необязательно замещенная ароматическая гетероциклическая группа, необязательно замещенная неароматическая гетероциклическая группа, необязательно замещенная аминогруппа, необязательно замещенная гидроксигруппа, необязательно замещенная тиольная группа, необязательно замещенная ацильная группа и тому подобное.
В качестве атомов галогена могут быть указаны, например, атом фтора, атом хлора, атом брома и атом иода. Особенно предпочтительными являются атом фтора и атом хлора.
В качестве C1-3алкилендиокси могут быть указаны, например, метилендиокси, этилендиокси и тому подобное.
В качестве "ароматической гетероциклической группы" "необязательно замещенной ароматической гетероциклической группы", может быть указана, например, 5-7-членная моноциклическая ароматическая гетероциклическая группа, которая содержит в качестве атомов, составляющих часть кольца, кроме атомов углерода, 1-4 гетероатома, выбранных из атома кислорода, атома серы и атома азота, или конденсированная ароматическая гетероциклическая группа. В качестве конденсированной ароматической гетероциклической группы может быть указана, например, группа, где эти 5-7-членные моноциклические ароматические гетероциклические группы конденсируются с 6-членным кольцом, содержащим 1 или 2 атома азота, бензольным кольцом, 5-членным кольцом, содержащим 1 атом серы и тому подобное.
В качестве предпочтительных примеров "ароматической гетероциклической группы" могут быть указаны фурил (например, 2-фурил, 3-фурил), тиенил (например, 2-тиенил, 3-тиенил), пиридил (например, 2-пиридил, 3-пиридил, 4-пиридил), пиримидинил (например, 2-пиримидинил, 4-пиримидинил, 5-пиримидинил, 6-пиримидинил), пиридазинил (например, 3-пиридазинил, 4-пиридазинил), пиразинил (например, 2-пиразинил), пирролил (например, 1-пирролил, 2-пирролил, 3-пирролил), имидазолил (например, 1-имидазолил, 2-имидазолил, 4-имидазолил, 5-имидазолил), пиразолил (например, 1-пиразолил, 3-пиразолил, 4-пиразолил), оксазолил (например, 2-оксазолил, 4-оксазолил, 5-оксазолил), изоксазолил, тиазолил (например, 2-тиазолил, 4-тиазолил, 5-тиазолил), изотиазолил, оксадиазолил (например, 1,2,4-оксадиазол-5-ил, 1,3,4-оксадиазол-2-ил), тиадиазолил (например, 1,3,4-тиадиазол-2-ил), триазолил (например, 1,2,4-триазол-1-ил, 1,2,4-триазол-3-ил, 1,2,4-триазол-5-ил, 1,2,3-триазол-1-ил, 1,2,3-триазол-2-ил, 1,2,3-триазол-4-ил), тетразолил (например, тетразол-1-ил, тетразол-5-ил), хинолил (например, 2-хинолил, 3-хинолил, 4-хинолил), хиназолил (например, 2-хиназолил, 4-хиназолил), хиноксалил (например, 2-хиноксалил), бензофурил (например, 2-бензофурил, 3-бензофурил), бензотиенил (например, 2-бензотиенил, 3-бензотиенил), бензоксазолил (например, 2-бензоксазолил), бензотиазолил (например, 2-бензотиазолил), бензимидазолил (например, бензимидазол-1-ил, бензимидазол-2-ил), индолил (например, индол-1-ил, индол-3-ил), 1H-индазолил (например, 1H-индазол-3-ил), 1H-пирроло[2,3-b]пиразинил (например, 1H-пирроло[2,3-b]пиразин-2-ил), 1H-пирролопиридинил (например, 1H-пирроло[2,3-b]пиридин-6-ил), 1H-имидазопиридинил (например, 1H-имидазо[4,5-b]пиридин-2-ил, 1H-имидазо[4,5-c]пиридин-2-ил), 1H-имидазопиразинил (например, 1H-имидазо[4,5-b]пиразин-2-ил), триазинил, изохинолил, бензоксадиазолил, бензотиадиазолил, бензтриазолил и тому подобное.
В качестве "неароматической гетероциклической группы" "необязательно замещенной неароматической гетероциклической группы", может быть указана, например, 5-7-членная моноциклическая неароматическая гетероциклическая группа, которая содержит 1-4 гетероатома, выбранных из атома кислорода, атома серы и атома азота, в качестве атомов, составляющих часть кольца, кроме атомов углерода, или конденсированная неароматическая гетероциклическая группа. В качестве конденсированной неароматической гетероциклической группы может быть указана, например, группа, где эти 5-7-членные моноциклические неароматические гетероциклические группы конденсированы с 6-членным кольцом, содержащим 1 или 2 атома азота, с бензольным кольцом, 5-членным кольцом, содержащим 1 атом серы и тому подобное.
В качестве предпочтительных примеров неароматической гетероциклической группы могут быть указаны пирролидинил (например, 1-пирролидинил), пиперидинил (например, пиперидино), морфолинил (например, морфолино), тиоморфолинил (например, тиоморфолино), пиперазинил (например, 1-пиперазинил), гексаметилениминил (например, гексаметиленимин-1-ил), оксазолидинил (например, оксазолидин-3-ил), тиазолидинил (например, тиазолидин-3-ил), имидазолидинил (например, имидазолидин-3-ил), имидазолинил (например, имидазолин-1-ил, имидазолин-2-ил), оксазолинил (например, оксазолин-2-ил), тиазолинил (например, тиазолин-2-ил), оксазинил (например, оксазин-2-ил), тетрагидрофуранил, азепанил, тетрагидропиридинил (например, 1,2,3,6-тетрагидропиридин-1-ил), дигидробензофуранил, диоксоланил, дитиоланил, диоксотиазолидинил, диоксооксазолидинил и тому подобное.
Указанная выше ароматическая гетероциклическая группа и неароматическая гетероциклическая группа могут иметь 1-3 заместителя в замещаемых положениях. В качестве такого заместителя могут быть указаны, например, нитро, гидрокси, амино, оксо, атом галогена (например, атом фтора, атом хлора, атом брома, атом иода), C1-6 алкил, необязательно замещенный 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода), такой как метил и этил, C1-6алкокси группа, необязательно замещенная 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода), такая как метокси и этокси, C6-14арил (например, фенил) и тому подобное.
В качестве "необязательно замещенной аминогруппы" может быть указана, например, аминогруппа, необязательно моно- или ди-замещенная C1-10алкильной группой, C2-10алкенильной группой, C3-10циклоалкильной группой, C3-10циклоалкенильной группой, C6-14арильной группой, C7-13аралкильной группой, C1-13ацильной группой или гетероарильной группой, каждая из них необязательно имеет заместители.
Здесь, в качестве C1-10алкильной группы, C2-10алкенильной группы, C3-10циклоалкильной группы, C3-10циклоалкенильной группы, C6-14арильной группы и C7-13аралкильной группы могут быть указаны группы, представленные как "углеводородная группа" "необязательно замещенной углеводородной группы", представленные как заместители для кольца A.
В качестве указанной выше C1-13ацильной группы могут быть указаны группы, представленные как ацильная группа "необязательно замещенной ацильной группы", которая будет указана далее. Ацильная группа предпочтительно представляет собой формил, C1-10алкилкарбонил, C1-6алкоксикарбонил, C6-14арилкарбонил, C7-13аралкилкарбонил, 5- или 6-членный ароматический гетероциклкарбонил, 5- или 6-членный неароматический гетероциклкарбонил и тому подобное.
Здесь, в качестве предпочтительных примеров C1-10алкилкарбонила могут быть указаны ацетил, пропионил, бутирил, изобутирил, валерил, изовалерил, пивалоил, гексаноил, гептаноил, октаноил и тому подобное.
В качестве предпочтительных примеров C1-6алкоксикарбонила могут быть указаны, например, трет-бутоксикарбонил и тому подобное.
В качестве предпочтительных примеров C6-14арилкарбонила могут быть указаны бензоил и тому подобное.
В качестве предпочтительных примеров C7-13аралкилкарбонила могут быть указаны бензилкарбонил, фенетилкарбонил и тому подобное.
В качестве предпочтительных примеров 5- или 6-членного ароматического гетероциклкарбонила могут быть указаны фурилкарбонил, пирролилкарбонил, тиенилкарбонил, пиридилкарбонил и тому подобное.
В качестве предпочтительных примеров 5- или 6-членного неароматического гетероциклкарбонила могут быть указаны тетрагидрофурилкарбонил и тому подобное.
В качестве указанной выше гетероарильной группы могут быть указаны, например, ароматические гетероциклические группы, представленные как заместители "необязательно замещенной углеводородной группы", представленные как заместители для кольца A. Среди них, пиридил, имидазолил, триазолил, пиримидинил и тому подобное, являются предпочтительными.
Эти C1-10алкильная группа, C2-10алкенильная группа, C3-10циклоалкильная группа, C3-10циклоалкенильная группа, C6-14арильная группа, C7-13аралкильная группу, C1-13ацильная группа и гетероарильная группа могут иметь 1-6, предпочтительно, 1 или 2 заместителя в замещаемых положениях. В качестве такого заместителя могут быть указаны, например, атом галогена (например, атом фтора, атом хлора, атом брома, атом иода), C1-6алкильная группа, необязательно замещенная 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода), такая как метил и трифторметил, C1-6алкокси группа, необязательно замещенная 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода), такая как метокси и этокси, гидрокси, нитро, амино, C1-6алкилсульфонильная группа (например, метилсульфонил) и тому подобное.
В качестве замещенной аминогруппы могут быть указаны, например, моно- или ди-C1-10алкиламино (например, метиламино, диметиламино, этиламино, диэтиламино, этилметиламино, пропиламино, дибутиламино), моно- или ди-C2-10алкениламино (например, диаллиламино), моно- или ди-C3-10циклоалкиламино (например, циклогексиламино), моно- или ди-C1-10алкилкарбоксамид (например, ацетиламино, пропиониламино), моно- или ди-C6-14ариламино (например, фениламино), N-C1-10алкил-N-C6-14ариламино (например, N-метил-N-фениламино), N-C1-10алкил-N-C7-13аралкиламино (например, N-метил-N-бензиламино), моно- или ди-C1-6алкоксикарбоксамид (например, трет-бутоксикарбоксамид), моно- или ди-C6-14арилкарбоксамид (например, фенилкарбоксамид), моно- или ди-C7-13аралкилкарбоксамид (например, бензилкарбоксамид, фенетилкарбоксамид), моно- или ди-5- или 6-членный ароматический гетероциклкарбоксамид (например, фурилкарбоксамид, пирролилкарбоксамид, тиенилкарбоксамид, пиридилкарбоксамид), моно- или ди-5- или 6-членный неароматический гетероциклкарбоксамид (например, тетрагидрофурилкарбоксамид) и тому подобное.
В качестве "необязательно замещенной гидроксигруппы" могут быть указаны, например, гидроксигруппа, необязательно замещенная C1-10алкильной группой, C2-10алкенильной группой, C3-10циклоалкильной группой, C3-10циклоалкенильной группой, C6-14арильной группой, C7-13аралкильной группой, C1-13ацильной группой или гетероарильной группой, каждая из них является необязательно замещенной и тому подобное.
Здесь, в качестве C1-10алкильной группы, C2-10алкенильной группы, C3-10циклоалкильной группы, C3-10циклоалкенильной группы, C6-14арильной группы и C7-13аралкильной группы могут быть указаны группы, представленные как "углеводородная группа", "необязательно замещенная углеводородная группа", представленные как заместители для кольца A.
В качестве C1-13ацильной группы могут быть указаны группы, представленные как заместитель указанной выше "необязательно замещенной аминогруппы".
В качестве гетероарильной группы могут быть указаны, например, ароматические гетероциклические группы, представленные как заместители "необязательно замещенной углеводородной группы", представленные как заместители для кольца A. Среди них, пиридил, имидазолил, триазолил, пиримидинил и тому подобное являются предпочтительными.
Эти C1-10алкильная группа, C2-10алкенильная группа, C3-10циклоалкильная группа, C3-10циклоалкенильная группа, C6-14арильная группа, C7-13аралкильная группа, C1-13ацильная группа и гетероарильная группа могут иметь 1 или 2 заместителя в замещаемых положениях. В качестве такого заместителя могут быть указаны, например, атом галогена (например, атом фтора, атом хлора, атом брома, атом иода), C1-6алкильная группа, необязательно замещенная 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода), такая как метил и трифторметил, C1-6алкокси группа, необязательно замещенная 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода), такая как метокси и этокси, гидрокси, нитро, амино, C1-6алкилсульфонильная группа (например, метилсульфонил) и тому подобное.
В качестве замещенной гидроксигруппы могут быть указаны, например, алкокси группа, алкенилокси группа, циклоалкилокси группа, циклоалкенилокси группа, арилокси группа, аралкилокси группа, ацилокси группа, гетероарилокси группа, каждая из них является необязательно замещенной и тому подобное.
В качестве предпочтительных примеров алкокси группы, может быть указана C1-10алкокси группа, такая как метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси, пентилокси, изопентилокси, неопентилокси, гексилокси, гептилокси, нонилокси и тому подобное.
В качестве предпочтительных примеров алкенилокси группы, может быть указана C2-10алкенилокси группа, такая как аллилокси, кротилокси, 2-пентенилокси, 3-гексенилокси и тому подобное.
В качестве предпочтительных примеров циклоалкилокси группы, может быть указана C3-10циклоалкилокси группа, такая как циклобутокси, циклопентилокси, циклогексилокси и тому подобное.
В качестве предпочтительных примеров циклоалкенилокси группы, может быть указана C3-10циклоалкенилокси группа, такая как 2-циклопентенилокси, 2-циклогексенилокси и тому подобное.
В качестве предпочтительных примеров арилокси группы, может быть указана C6-14арилокси группа, такая как фенокси, нафтилокси и тому подобное.
В качестве предпочтительных примеров аралкилокси группы, может быть указана C7-13аралкилокси группа, такая как бензилокси, фенетилокси, нафтилметилокси и тому подобное.
В качестве предпочтительных примеров ацилокси группы может быть указана C2-13ацилокси группа, такая как C1-6алкилкарбонилокси группа (например, ацетилокси, пропионилокси, бутирилокси, изобутирилокси) и тому подобное.
В качестве предпочтительных примеров гетероарилокси группы может быть указана 5-7-членная моноциклическая гетероарилокси группа, такая как 2-пиридилокси, 3-пиридилокси, 2-имидазолилокси, 2-пиримидинилокси, 1,2,4-триазол-5-илокси и тому подобное.
Указанная выше алкокси группа, алкенилокси группа, циклоалкилокси группа, циклоалкенилокси группа, арилокси группа, аралкилокси группа, ацилокси группа и гетероарилокси группа могут иметь 1-3, предпочтительно, 1 или 2 заместителя, в замещаемых положениях. В качестве такого заместителя могут быть указаны, например, атом галогена (например, атом фтора, атом хлора, атом брома, атом иода), C1-6алкильная группа, необязательно замещенная 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода), такая как метил и трифторметил, C1-6алкокси группа, необязательно замещенная 1-3 атомами галогена (например, атом фтора, атом хлора, атом брома, атом иода), такая как метокси и этокси, гидрокси, нитро, амино, C1-6алкилсульфонильная группа (например, метилсульфонил) и тому подобное.
В качестве необязательно замещенной тиольной группы может быть указана, например, тиольная группа, необязательно замещенная C1-10алкильной группой, C2-10алкенильной группой, C3-10циклоалкильной группой, C3-10циклоалкенильной группой, C6-14арильной группой, C7-13аралкильной группой, C1-13ацильной группой или гетероарильной группой, каждая из них является необязательно замещенной и тому подобное.
Здесь, в качестве C1-10алкильной группы, C2-10алкенильной группы, C3-10циклоалкильной группы, C3-10циклоалкенильной группы, C6-14арильной группы, C7-13аралкильной группы, C1-13ацильной группы и гетероарильной группы могут быть указаны группы, соответственно, представленные в указанной выше "необязательно замещенной гидроксигруппе". Эти группы могут иметь 1 или 2 заместителя в замещаемых положениях. В качестве такого заместителя могут быть указаны, например, атом галогена (например, атом фтора, атом хлора, атом брома, атом иода), C1-6алкильная группа, необязательно замещенная 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода), такая как метил и трифторметил, C1-6алкокси группа, необязательно замещенная 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода), такая как метокси и этокси, гидрокси, нитро, амино, C1-6алкилсульфонильная группа (например, метилсульфонил), оксо и тому подобное.
В качестве замещенной тиольной группы могут быть указаны, например, алкилтио группа, алкенилтио группа, циклоалкилтио группа, циклоалкенилтио группа, арилтио группа, аралкилтио группа, ацилтио группа, гетероарилтио группа, каждая из них является необязательно замещенной и тому подобное.
В качестве предпочтительных примеров алкилтио группы может быть указана C1-10алкилтио группа, такая как метилтио, этилтио, пропилтио, изопропилтио, бутилтио, изобутилтио, втор-бутилтио, трет-бутилтио, пентилтио, изопентилтио, неопентилтио, гексилтио, гептилтио, нонилтио и тому подобное.
В качестве предпочтительных примеров алкенилтио группы может быть указана C2-10алкенилтио группа, такая как аллилтио, кротилтио, 2-пентенилтио, 3-гексенилтио и тому подобное.
В качестве предпочтительных примеров циклоалкилтио группы может быть указана C3-10циклоалкилтио группа, такая как циклобутилтио, циклопентилтио, циклогексилтио и тому подобное.
В качестве предпочтительных примеров циклоалкенилтио группы может быть указана C3-10циклоалкенилтио группа, такая как 2-циклопентенилтио, 2-циклогексенилтио и тому подобное.
В качестве предпочтительных примеров арилтио группы может быть указана C6-14арилтио группа, такая как фенилтио, нафтилтио и тому подобное.
В качестве предпочтительных примеров аралкилтио группы может быть указана C7-13аралкилтио группа, такая как бензилтио, фенетилтио, нафтилметилтио и тому подобное.
В качестве предпочтительных примеров ацилтио группы может быть указана C2-13ацилтио группа, такая как C1-6алкилкарбонилтио группа (например, ацетилтио, пропионилтио, бутирилтио, изобутирилтирилтио) и тому подобное.
В качестве предпочтительных примеров гетероарилтио группы может быть указана 5-7-членная моноциклическая гетероарилтио группа, такая как 2-пиридилтио, 3-пиридилтио, 2-имидазолилтио, 2-пиримидинилтио, 1,2,4-триазол-5-илтио и тому подобное.
Указанная выше алкилтио группа, алкенилтио группа, циклоалкилтио группа, циклоалкенилтио группа, арилтио группа, аралкилтио группа, ацилтио группа и гетероарилтио группа могут иметь 1 или 2 заместителя в замещаемых положениях. В качестве такого заместителя могут быть указаны, например, атом галогена (например, атом фтора, атом хлора, атом брома, атом иода), C1-6алкил, необязательно замещенный 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода), такой как метил и трифторметил, C1-6алкокси, необязательно замещенная 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода), такая как метокси и этокси, гидрокси, нитро, амино, C1-6алкилсульфонил (например, метилсульфонил), оксо и тому подобное.
В качестве ацильной группы "необязательно замещенной ацильной группы" может быть указана, например, группа, представленная формулой: -COR4, -CO-OR4, -SO2R4, -SOR4, -PO3R4R5 [то есть, -P(=O)(OR4)(OR5)], -CO-NR4aR5a, -CS-NR4aR5a и -SO2-NR4aR5a, где R4 и R5 являются одинаковыми или различными, и каждый из них представляет собой атом водорода, углеводородную группу или гетероциклическую группу, или R4 и R5 могут образовывать гетероцикл вместе с соседним оксо-замещенным атомом фосфора и 2 атомами кислорода; R4a и R5a являются одинаковыми или различными, и каждый из них представляет собой атом водорода, углеводородную группу или гетероциклическую группу, или R4a и R5a могут образовывать азотсодержащий гетероцикл вместе с соседним атомом азота и тому подобное.
В качестве "углеводородной группы" для R4, R5, R4a или R5a могут быть указаны группы, представленные как "углеводородная группа" "необязательно замещенной углеводородной группы", представленные как заместители для кольца A.
Углеводородная группа предпочтительно представляет собой C1-10алкильную группу (предпочтительно метил, этил, пропил, бутил, трет-бутил, пентил, 1-этилпропил, 2,2-диметилпропил); C2-10алкинил группа (предпочтительно 2-пропинил); C3-10циклоалкильную группу, которая может быть конденсирована с бензольным кольцом (предпочтительно циклопропил, циклогексил); C6-14арильную группу, которая может быть конденсирована с C3-10циклоалканом (предпочтительно, циклопентаном) (предпочтительно фенил, дигидроинденил, бифенилил); C7-13аралкильную группу (предпочтительно бензил, фенетил, фенилпропил, нафтилметил, бензгидрил) и тому подобное.
В качестве "гетероциклической группы" для R4, R5, R4a или R5a могут быть указаны ароматическая гетероциклическая группа и неароматическая гетероциклическая группа, представленные как заместители "необязательно замещенной углеводородной группы" представленные как заместители для кольца A.
Гетероциклическая группа предпочтительно представляет собой тиазолил, оксазолил, изотиазолил, изоксазолил, пиразолил, пиридил, пиразинил, бензоксазолил, бензотиазолил, бензотиадиазолил, хинолил, изохинолил, пирролидинил, пиперидинил, пиперазинил и тому подобное.
В качестве гетероцикла, образованного R4 и R5 вместе с соседним оксо-замещенным атомом фосфора и 2 атомами кислорода, может быть рассмотрен, например, 4-7-членный гетероцикл, содержащий оксо-замещенный атом фосфора и 2 атома кислорода, кроме атомов углерода, в качестве атомов, составляющих часть кольца, которое может, кроме того, содержать 1 или 2 гетероатома, выбранных из атома кислорода, атома азота и атома серы и тому подобное. В качестве предпочтительных примеров такого гетероцикла может быть рассмотрен 2-оксид-1,3,2-диоксафосфинан; 2-оксид-1,3,2-диоксафосфоран, 2-оксид-4,7-дигидро-1,3,2-диоксафосфепин и тому подобное.
В качестве "азотсодержащего гетероцикла", образованного R4a и R5a вместе с соседним атомом азота, может быть рассмотрен, например, 5-7-членный азотсодержащий гетероцикл, содержащий, по меньшей мере, один атом азота, кроме атомов углерода, в качестве атома, составляющего часть кольца, который может, кроме того, содержать 1 или 2 гетероатома, выбранных из атома кислорода, атома серы и атома азота и тому подобное. В качестве предпочтительных примеров такого азотсодержащего гетероцикла могут быть указаны, пирролидин, имидазолидин, пиразолидин, пиперидин, пиперазин, морфолин, тиоморфолин и тому подобное.
Ацильная группа может иметь 1-3 заместителя в замещаемых положениях. В качестве такого заместителя может быть рассмотрен, например, C1-6алкил, необязательно замещенный 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода), такой как метил и этил, C1-6алкокси, необязательно замещенная 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода), такая как метокси и этокси, атом галогена (например, атом фтора, атом хлора, атом брома, атом иода), нитро, гидрокси, амино необязательно моно- или ди-замещенная C1-6алкилом (например, метилом, этилом) и тому подобное.
В качестве предпочтительных примеров ацильной группы могут быть указаны формил, карбоксил, карбамоил, тиокарбамоил, C1-10алкилкарбонил (например, ацетил, пропионил, бутирил, изобутирил, валерил, изовалерил, пивалоил, гексаноил, гептаноил, октаноил), C2-10алкенилкарбонил (например, кротоноил), C3-10циклоалкилкарбонил (например, циклобутанкарбонил, циклопентанкарбонил, циклогексанкарбонил, циклогептанкарбонил), C3-10циклоалкенилкарбонил (например, 2-циклогексенкарбонил), C6-14арилкарбонил (например, бензоил, 1-нафтоил, 2-нафтоил), C7-13аралкилкарбонил (например, бензилкарбонил, фенетилкарбонил), ароматический гетероциклический карбонил (например, никотиноил, изоникотиноил), неароматический гетероциклический карбонил (например, пирролидинилкарбонил, пиперидинокарбонил), C1-6алкоксикарбонил (например, метоксикарбонил, этоксикарбонил, пропоксикарбонил, бутоксикарбонил, трет-бутоксикарбонил), C6-14арилоксикарбонил (например, фенилоксикарбонил, нафтилоксикарбонил), C7-13аралкилоксикарбонил (например, бензилоксикарбонил, фенэтилоксикарбонил), моно- или ди-(C1-6алкил необязательно имеющий 1-3 заместителя, выбранные из атома галогена и C1-6алкоксикарбонил)карбамоил (например, метилкарбамоил, этилкарбамоил, диметилкарбамоил, диэтилкарбамоил, этилметилкарбамоил, пропилкарбамоил, трифторэтилкарбамоил), моно- или ди-(C1-6алкил, необязательно замещенный 1-3 атомами галогена)тиокарбамоил (например, метилтиокарбамоил, этилтиокарбамоил), C6-14арилкарбамоил (например, фенилкарбамоил), C3-10циклоалкилкарбамоил (например, циклопропилкарбамоил), C7-13аралкилкарбамоил (например, бензилкарбамоил), C1-6алкоксикарбамоил (например, метоксикарбамоил), C1-10алкилсульфинильная группа (например, метилсульфинил, этилсульфинил), C1-10алкилсульфонильная группа (например, метилсульфонил, этилсульфонил), C6-14арилсульфонил (например, фенилсульфонил), (моно- или ди-C1-10алкил)фосфоно группа необязательно образующая кольцо (например, диметилфосфоно; диэтилфосфоно; диизопропилфосфоно; дибутилфосфоно; 2-оксид-1,3,2-диоксафосфинанил), моно- или ди-(C1-6алкил, необязательно замещенный 1-3 атомами галогена)сульфамоил (например, метилсульфамоил, этилсульфамоил) и тому подобное.
"Углеводородная группа" "необязательно замещенной углеводородной группы", представленная в качестве заместителей для кольца A, предпочтительно представляет собой C1-10алкильную группу, C6-14арильную группу, C3-10циклоалкильную группу, C7-13аралкильную группу, C8-13арилалкенильную группу, C4-13циклоалкилалкильную группу и тому подобное. Углеводородная группа, более предпочтительно, представляет собой C1-10алкильную группу, C6-14арильную группу и тому подобное.
Заместитель "необязательно замещенной углеводородной группы" предпочтительно представляет собой C1-6алкокси группу, необязательно замещенную 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода), такую как метокси и этокси, атом галогена (например, атом фтора, атом хлора, атом брома, атом иода), нитро, гидрокси, амино, C1-3алкилендиокси (например, метилендиокси, этилендиокси) и тому подобное. Количество заместителей составляет, например, 1-3.
В качестве "гетероциклической группы" "необязательно замещенной гетероциклической группы", представленной в качестве заместителей для кольца A, могут быть указаны группы, представленные как указанная выше "гетероциклическая группа" для указанного выше R4.
Гетероциклическая группа предпочтительно представляет собой азолильную группу, необязательно конденсированную с бензольным кольцом, такую как пирролил, имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, оксадиазолил, тиадиазолил, триазолил, тетразолил и тому подобное.
Указанная выше гетероциклическая группа может иметь 1-3 заместителя в замещаемых положениях. В качестве такого заместителя может быть указана, например, необязательно замещенная алифатическая углеводородная группа, необязательно замещенная алициклическая углеводородная группа, необязательно замещенная ароматическая углеводородная группа, необязательно замещенная ароматическая гетероциклическая группа, необязательно замещенная неароматическая гетероциклическая группа, атом галогена, нитро, необязательно замещенная аминогруппа, необязательно замещенная гидроксигруппа, необязательно замещенная тиольная группа, необязательно замещенная ацильная группа, C1-3алкилендиокси, оксо и тому подобное.
Здесь, в качестве "алифатической углеводородной группы", "алициклической углеводородной группы" и "ароматической углеводородной группы" "необязательно замещенной алифатической углеводородной группы", "необязательно замещенной алициклической углеводородной группы" и "необязательно замещенной ароматической углеводородной группы", могут быть указаны группы, представленные как "углеводородная группа" "необязательно замещенной углеводородной группы", представленные как заместители для кольца A.
В качестве заместителей "алифатической углеводородной группы", "алициклической углеводородной группы" и "ароматической углеводородной группы" могут быть указаны группы, представленные как "заместитель" "необязательно замещенной углеводородной группы", представленные как заместители для кольца A. Положение замещения и количество замещений не являются как-либо ограниченными. Количество замещений предпочтительно составляет 1-3.
В качестве "необязательно замещенной ароматической гетероциклической группы" и "необязательно замещенной неароматической гетероциклической группы" могут быть указаны группы, представленные как заместители "необязательно замещенной углеводородной группы", представленные как заместители для кольца A.
Кроме того, в качестве "атома галогена", "необязательно замещенной аминогруппы", "необязательно замещенной гидроксигруппы", "необязательно замещенной тиольной группы", "необязательно замещенной ацильной группы" и "C1-3алкилендиокси", могут быть указаны группы, представленные как заместители "необязательно замещенной углеводородной группы", представленные как заместители для кольца A.
В качестве "необязательно замещенной гидроксигруппы", "необязательно замещенной тиольной группы" и "необязательно замещенной аминогруппы", представленных как заместители для кольца A, могут быть указаны группы, представленные как заместители "необязательно замещенной углеводородной группы", представленные как заместители для кольца A.
Заместитель для кольца A предпочтительно представляет собой необязательно замещенную углеводородную группу, более предпочтительно, C1-10алкильную группу, C6-14арильную группу, C7-13аралкильную группу и тому подобное. Заместитель для кольца A представляет собой, особенно предпочтительно, C1-6алкильную группу (предпочтительно, метил и тому подобное).
Кольцо A предпочтительно представляет собой имидазольное кольцо, пиразольное кольцо, оксадиазольное кольцо, тиадиазольное кольцо, триазольное кольцо или тетразольное кольцо (предпочтительно пиразольное кольцо, оксадиазольное кольцо, тиадиазольное кольцо, триазольное кольцо или тетразольное кольцо, более предпочтительно, пиразольное кольцо), каждое из которых может иметь 1 или 2 заместителя (предпочтительно, C1-6алкильную группу, такую как метил и тому подобное), выбранных из C1-10алкильной группы, C6-14арильной группы и C7-13аралкильной группы.
В качестве "необязательно замещенной углеводородной группы" и "необязательно замещенной гетероциклической группы" для B, соответственно, используются группы, представленные как заместители для кольца A. Здесь, углеводородная группа "необязательно замещенной углеводородной группы" предпочтительно представляет собой алициклическую углеводородную группу или ароматическую углеводородную группу. В дополнение к этому, гетероциклическая группа "необязательно замещенной гетероциклической группы" предпочтительно представляет собой ароматическую гетероциклическую группу.
B предпочтительно представляет собой необязательно замещенную ароматическую углеводородную группу или необязательно замещенную ароматическую гетероциклическую группу.
B, кроме того, предпочтительно представляет собой необязательно замещенную C6-14арильную группу, необязательно замещенную 5-7-членную моноциклическую ароматическую гетероциклическую группу и тому подобное. В качестве предпочтительных конкретных примеров B, может быть указана C6-14арильная группа (предпочтительно, фенил, нафтил) и 5-7-членная моноциклическая ароматическая гетероциклическая группа (предпочтительно фурил, тиенил, пиридил, пиримидинил), каждая из них необязательно имеет 1-3 заместителя, выбранных из C1-6алкила, необязательно замещенного 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода), такого как метил и этил, C1-6алкокси, необязательно замещенной 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода), такой как метокси и этокси, атома галогена (например, атома фтора, атома хлора, атома брома, атома иода), нитро, формила и C1-3алкилендиокси (например, метилендиокси).
Среди них, C6-14арильная группа (предпочтительно, фенил) и 5-7-членная моноциклическая ароматическая гетероциклическая группа (предпочтительно, фурил, тиенил, пиридил, пиримидинил), каждая из них необязательно имеет 1-3 заместителя, выбранных из C1-6алкила, необязательно замещенного 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода), C1-6алкокси, необязательно замещенной 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода), и атом галогена (предпочтительно, атом фтора, атом хлора, атом брома), являются предпочтительными.
B, особенно предпочтительно, представляет собой C6-14арильную группу (предпочтительно, фенил), необязательно имеющую атом галогена (предпочтительно, атом фтора).
"Дивалентная ациклическая углеводородная группа" для X может представлять собой дивалентную углеводородную группу с прямой цепью или разветвленной цепью, и насыщенную или ненасыщенную, постольку, поскольку она является ациклической.
В качестве "дивалентной ациклической углеводородной группы" может быть указана, например, "дивалентная алифатическая углеводородная группа". В частности, предпочтительной является дивалентная C1-8алифатическая углеводородная группа, представленная следующими группами.
(1) C1-8алкиленом (например, -CH2-, -(CH2)2-, -(CH2)3-, -(CH2)4-, -(CH2)5-, -(CH2)6-, -(CH2)7-, -(CH2)8-, -CH(CH3)-, -C(CH3)2-, -(CH(CH3))2-, -(CH2)2C(CH3)2-, -(CH2)3C(CH3)2- и тому подобное);
(2) C2-8алкениленом (например, -CH=CH-, -CH2-CH=CH-, -C(CH3)2-CH=CH-, -CH2-CH=CH-CH2-, -CH2-CH2-CH=CH-, -CH=CH-CH=CH-, -CH=CH-CH2-CH2-CH2- и тому подобное) и так далее.
C2-8алкенилен охватывает как его E форму, так и Z форму.
"Дивалентная ациклическая углеводородная группа" предпочтительно представляет собой C1-4алкилен или C2-4алкенилен, более предпочтительно, -CH2-, -(CH2)2-, -CH=CH- и тому подобное. X представляет собой, особенно предпочтительно, -CH=CH- и тому подобное.
Z представляет собой -O-, -S-, -NR2-, -CONR2- или -NR2CO- (R2 представляет собой атом водорода или необязательно замещенную алкильную группу).
В необязательно замещенной алкильной группе для R2, в качестве алкильной группы, может быть указана, например, C1-6алкильная группа (например, метил, этил, пропил, изопропил). Алкильная группа может иметь 1-3 заместителя. В качестве такого заместителя, может быть рассмотрен, например, атом галогена (например, атом фтора, атом хлора, атом брома, атом иода), C1-6алкокси, необязательно замещенный 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода) такая как метокси и этокси, гидрокси, нитро, амино и тому подобное.
R2 предпочтительно представляет собой атом водорода или C1-6алкильную группу, более предпочтительно, атом водорода.
Z представляет собой предпочтительно -CONR2- (R2 является таким, как определено выше), более предпочтительно, -CONH- (в настоящем изобретении, атом углерода (C) из -CONR2- является связанным с X, и атом азота (N) в ней является связанным с Y).
В качестве дивалентной ациклической углеводородной группы для Y могут быть указаны группы, представленные как указанная выше X.
Y предпочтительно представляет собой связь, C1-4алкилен, более предпочтительно, связь, -CH2-, -(CH2)2-, -(CH2)3- и тому подобное. Y, особенно предпочтительно, представляет собой связь.
В качестве "циклической группы" "необязательно замещенной циклической группы" для R1 может быть указана, например, алициклическая углеводородная группа, ароматическая углеводородная группа, ароматическая гетероциклическая группа, неароматическая гетероциклическая группа и тому подобное.
Здесь, в качестве "алициклической углеводородной группы" и "ароматической углеводородной группы" могут быть указаны группы, представленные как "углеводородная группа" "необязательно замещенной углеводородной группы", представленные как заместители для кольца A.
В качестве "ароматической гетероциклической группы" и "неароматической гетероциклической группы" могут быть указаны группы, представленные как заместители "необязательно замещенной углеводородной группы", представленные как заместители для кольца A.
Циклическая группа предпочтительно представляет собой необязательно частично насыщенную C6-14арильную группу (предпочтительно фенил, дигидроинденил), C3-10циклоалкильную группу (предпочтительно циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил), C3-10циклоалкенильную группу (предпочтительно циклогексенил), 5- или 6-членную ароматическую гетероциклическую группу, необязательно конденсированную с бензольным кольцом (предпочтительно фурил, тиенил, оксазолил, тиазолил, изоксазолил, имидазолил, пиразолил, пиридил, пиразинил, индолил, хинолил, изохинолил и бензотиадиазолил), 5- или 6-членную неароматическую гетероциклическую группу, необязательно конденсированную с бензольным кольцом (предпочтительно пирролидинил, тетрагидрофуранил, тиазолинил, оксазолинил, тиазолидинил, оксазолидинил, диоксоланил, пиперидинил, пиперазинил, морфолинил, тиоморфолинил, дигидробензофуранил, оксодигидробензоксазолил) и тому подобное. Циклическая группа представляет собой, более предпочтительно, C6-14арильную группу, и фенил является особенно предпочтительным.
"Циклическая группа" для R1 может иметь 1-4 заместителя в замещаемых положениях. В качестве такого заместителя могут быть указаны, например,
(1) нитро;
(2) оксо;
(3) гидрокси;
(4) циано;
(5) атом галогена (например, атом фтора, атом хлора, атом брома, атом иода);
(6) C1-6алкилендиокси (например, метилендиокси, этилендиокси);
(7) карбоксил;
(8) C1-6алкильная группа (например, метил, этил, пропил, изопропил, бутил, изобутил, пентил, неопентил) необязательно замещенная 1-3 заместителями, выбранными из атома галогена (например, атома фтора, атома хлора, атома брома, атома иода); гидрокси; циано; C1-6алкокси (например, метокси); амино, необязательно моно- или ди-замещенная C1-6алкилом и C1-6алкилкарбонилом (например, ацетилом, пропионилом, бутирилом, изобутирилом, изовалерилом), таким как амино, метиламино, диметиламино, ацетиламино, бутириламино, изобутириламино и изовалериламино; 5- или 6-членная ароматическая гетероциклическая группа (например, тиазолил, оксазолил, имидазолил, пиразолил, оксадиазолил, тиадиазолил, триазолил, тетразолил, пиридил, пиримидинил), необязательно замещенная 1-3 заместителями, выбранными из C1-6алкила, гидрокси-C1-6алкила, карбоксила, карбамоила и C1-6алкоксикарбонила (например, метоксикарбонила); ароматическая слитая гетероциклическая группа (например, бензимидазолил, бензопиразолил, бензотиазолил, бензоксазолил, бензотриазолил, хинолил, индазолил), необязательно замещенная 1-3 заместителями, выбранными из C1-6алкила, гидрокси-C1-6алкила, карбоксила, карбамоила и C1-6алкоксикарбонила (например, метоксикарбонила); 5- или 6-членная неароматическая гетероциклическая группа (например, тетрагидрофурил, морфолинил, тиоморфолинил, пиперидинил, пирролидинил, пиперазинил, диоксотиазолидинил, диоксооксазолидинил, оксодигидрооксадиазолил, диоксоимидазолидинил, диоксопиперазинил, диоксидетиоморфолинил), необязательно замещенная 1-3 заместителями, выбранными из C1-6алкила, гидрокси-C1-6алкила, карбоксила, карбамоила и C1-6алкоксикарбонила (например, метоксикарбонила); неароматическая слитая гетероциклическая группа (например, оксодигидробензоксазолил, тетрагидробензотиазолил), необязательно замещенная 1-3 заместителями, выбранными из C1-6алкила, гидрокси-C1-6алкила, карбоксила, карбамоила и C1-6алкоксикарбонила (например, метоксикарбонила); карбоксильная группа; C1-6алкоксикарбонил (например, метоксикарбонил, этоксикарбонил, пропоксикарбонил, бутоксикарбонил, трет-бутоксикарбонил); (моно- или ди-C1-10алкил)фосфоно группа, необязательно образующая кольцо (например, диметилфосфоно; диэтилфосфоно; диизопропилфосфоно; дибутилфосфоно; 2-оксид-1,3,2-диоксафосфинанил); карбамоил, необязательно замещенный амино; моно- или ди-C1-6алкилкарбамоил, необязательно замещенный 1-3 заместителями, выбранными из атома галогена, гидрокси и C1-6алкоксикарбонила, такого как метилкарбамоил, этилкарбамоил, диметилкарбамоил, диэтилкарбамоил, этилметилкарбамоил, пропилкарбамоил, трифторэтилкарбамоил, метоксикарбонилэтилкарбамоил, 2-гидрокси-1-метоксикарбонилэтилкарбамоил и 2-гидрокси-1-метоксикарбонилпропилкарбамоил; моно- или ди-C6-14арилкарбамоил, необязательно замещенный 1-3 заместителями, выбранными из необязательно галогенированного C1-6алкила и C1-6алкокси, таких как фенилкарбамоил, метоксифенилкарбамоил и трифторметилфенилкарбамоил; моно- или ди-C7-13аралкилкарбамоил, необязательно замещенный 1-3 заместителями, выбранными из амино, необязательно моно- или ди-замещенной C1-6алкилом, необязательно галогенированного C1-6алкила, гидрокси и C1-6алкоксикарбонила, такой как бензилкарбамоил, фенетилкарбамоил, диметиламинобензилкарбамоил, метоксикарбонилфенетилкарбамоил и трифторметилбензилкарбамоил; сульфамоил; необязательно галогенированный моно- или ди-C1-6алкилсульфамоил (например, метилсульфамоил, этилсульфамоил); C1-6алкилтио (например, метилтио, этилтио и трет-бутилтио); C1-6алкилсульфинил (например, метилсульфинил, этилсульфинил и трет-бутилсульфинил); C1-6алкилсульфонил (например, метилсульфонил, этилсульфонил и трет-бутилсульфонил); C1-6алкилкарбонил (например, ацетил); моно- или ди-C6-14арилкарбоксамид (например, фенилкарбоксамид); C6-14арилтио (например, фенилтио); 5- или 6-членная ароматическая гетероциклическая тио (например, триазолилтио и тетразолилтио) необязательно, замещенная C1-6алкилом; C6-14арилсульфинил (например, фенилсульфинил); 5- или 6-членный ароматический гетероциклический сульфинил (например, триазолилсульфинил и тетразолилсульфинил), необязательно замещенный C1-6алкилом; C6-14арилсульфонил (например, фенилсульфонил); 5- или 6-членный ароматический гетероциклический сульфонил (например, триазолилсульфонил и тетразолилсульфонил), необязательно замещенный C1-6алкилом;
(9) C3-10циклоалкильная группа (например, циклогексил), необязательно замещенная 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода);
(10) C6-14арил (например, фенил), необязательно замещенный 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода);
(11) C7-13аралкил (например, бензил), необязательно замещенный 1-3 заместителями, выбранными из атома галогена (например, атома фтора, атома хлора, атома брома, атома иода) и гидрокси;
(12) 5- или 6-членная ароматическая гетероциклическая группа (например, тиадиазолил и имидазолил), необязательно замещенная 1-3 заместителями, выбранными из атома галогена (например, атома фтора, атома хлора, атома брома, атома иода), C1-6алкила и C6-14арила (например, фенил), необязательно замещенных 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома и атом иода);
(13) C1-6алкокси группа, (например, метокси, этокси), необязательно замещенная 1-3 заместителями, выбранными из атома галогена (например, атома фтора, атома хлора, атома брома, атома иода), 5- или 6-членной ароматической гетероциклической группы, (например, тиазолила, оксазолила, имидазолила, пиразолила, оксадиазолила, тиадиазолила, триазолила, тетразолила, пиридила и пиримидинила), необязательно замещенной 1-3 заместителями, выбранными из C1-6алкила, гидрокси-C1-6алкила, карбоксила, карбамоила и C1-6алкоксикарбонила (например, метоксикарбонила); ароматическая слитая гетероциклическая группа (например, бензимидазолил, бензопиразолил, бензотиазолил, бензоксазолил, бензотриазолил, хинолил и индазолил), необязательно замещенная 1-3 заместителями, выбранными из C1-6алкила, гидрокси-C1-6алкила, карбоксила, карбамоила и C1-6алкоксикарбонила (например, метоксикарбонила); 5- или 6-членная неароматическая гетероциклическая группа (например, тетрагидрофурил, морфолинил, тиоморфолинил, пиперидинил, пирролидинил, пиперазинил, диоксотиазолидинил, диоксооксазолидинил, оксодигидрооксадиазолил, диоксоимидазолидинил, диоксопиперазинил, диоксидетиоморфолинил), необязательно замещенная 1-3 заместителями, выбранными из C1-6алкила, гидрокси-C1-6алкила, карбоксила, карбамоила и C1-6алкоксикарбонила (например, метоксикарбонил); неароматическая слитая гетероциклическая группа (например, оксодигидробензоксазолил и тетрагидробензотиазолил), необязательно замещенная 1-3 заместителями, выбранными из C1-6алкила, гидрокси-C1-6алкила, карбоксила, карбамоила и C1-6алкоксикарбонила (например, метоксикарбонила);
(14) C1-6алкилтио (например, метилтио), необязательно замещенная 1-3 заместителями, выбранными из 5- или 6-членной ароматической гетероциклической группы (например, тиазолила, оксазолила, триазолила, тетразолила, пиридила, пиримидинила), необязательно замещенной C1-6алкилом и атомом галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода);
(15) C6-14арилокси (например, фенокси), необязательно замещенная 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода);
(16) амино, необязательно моно- или ди-замещенная C1-6алкилом, таким как амино, метиламино, диметиламино, этиламино, диэтиламино, этилметиламино, пропиламино и дибутиламино;
(17) фосфоно-C1-6алкиламино, необязательно моно- или ди-замещенная C1-10алкилом, таким как фосфонометиламино и диэтилфосфонометиламино;
(18) моно- или ди-C1-6алкилкарбоксамид, необязательно замещенный 1-6, предпочтительно, 1-3, заместителями, выбранными из атома галогена (например, атома фтора, атома хлора, атома брома, атома иода), C1-6алкила и C1-6алкоксикарбонила (например, метоксикарбонила и этоксикарбонила), такой как ацетиламино, гексаноиламино, трифторацетиламино, N-ацетил-N-метиламино, пентафторпропиониламино и этоксикарбонилпропиониламино;
(19) (моно- или ди-C1-10алкил)фосфоно группа, необязательно образующая кольцо (например, диметилфосфоно; диэтилфосфоно; диизопропилфосфоно; дибутилфосфоно; 2-оксид-1,3,2-диоксафосфинанил);
(20) C1-6алкилкарбонил (например, ацетил), необязательно замещенный 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода);
(21) C1-6алкилсульфинил (например, метилсульфинил), необязательно замещенный 5- или 6-членной ароматической гетероциклической группой (например, тиазолил, оксазолил, триазолил, тетразолил, пиридил, пиримидинил), необязательно замещенной C1-6алкилом;
(22) C1-6алкилсульфонил (например, метилсульфонил и этилсульфонил), необязательно замещенный 5- или 6-членной ароматической гетероциклической группой (например, тиазолилом, оксазолилом, триазолилом, тетразолилом, пиридилом, пиримидинилом), необязательно замещенной C1-6алкилом;
(23) C3-10циклоалкилкарбонил (например, циклогексилкарбонил), необязательно замещенный 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода);
(24) C6-14арилкарбонил (например, бензоил), необязательно замещенный 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода);
(25) C7-13аралкилкарбонил (например, бензилкарбонил и фенэтилкарбонил), необязательно замещенный 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода);
(26) C6-14арил-C2-6алкенилкарбонил (например, стирилкарбонил), необязательно замещенный 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода);
(27) C1-6алкоксикарбонил (например, метоксикарбонил, этоксикарбонил и трет-бутоксикарбонил), необязательно замещенный 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода);
(28) 5- или 6-членный ароматический гетероциклкарбонил (например, фуроил, пирролилкарбонил и пиридилкарбонил), необязательно замещенный C1-6алкилом;
(29) 5- или 6-членный неароматический гетероциклкарбонил (например, тетрагидрофуроил), необязательно замещенный C1-6алкилом;
(30) карбамоил, необязательно моно- или ди-замещенный C1-6алкилом, такой как карбамоил и диметилкарбамоил;
(31) сульфамоил, необязательно замещенный 1 или 2 заместителями, выбранными из 5- или 6-членной ароматической гетероциклической группы (например, тиазолила, оксазолила, триазолила, тетразолила, пиридила, пиримидинила), необязательно замещенной C1-6алкилом, и C1-6алкила такой как сульфамоил и диметилсульфамоил;
(32) C7-13аралкилоксикарбонилтио (например, бензилоксикарбонилтио и фенетилоксикарбонилтио), необязательно замещенный 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода);
(33) C1-6алкоксикарбоксамид (например, трет-бутоксикарбоксамид);
(34) C6-14арилсульфонил (например, фенилсульфонил), необязательно замещенный 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома и атомом иода); и тому подобное.
Заместитель для указанной выше "циклической группы" предпочтительно представляет собой
(1) C1-6алкильную группу (например, метил, этил, пропил, изопропил, бутил, изобутил, пентил, неопентил), необязательно замещенную 1-3 заместителями, выбранными из гидрокси; 5- или 6-членную ароматическую гетероциклическую группу (например, тиазолил, оксазолил, имидазолил, пиразолил, оксадиазолил, тиадиазолил, триазолил, тетразолил, пиридил и пиримидинил), необязательно замещенную 1-3 заместителями, выбранными из C1-6алкила, гидрокси-C1-6алкила, карбоксила, карбамоила и C1-6алкоксикарбонила; ароматическую слитую гетероциклическую группу (например, бензимидазолил, бензопиразолил, бензотиазолил, бензоксазолил, бензотриазолил, хинолил и индазолил), необязательно замещенную 1-3 заместителями, выбранными из C1-6алкила, гидрокси-C1-6алкила, карбоксила, карбамоила и C1-6алкоксикарбонила; 5- или 6-членную неароматическую гетероциклическую группу (например, тетрагидрофурил, морфолинил, тиоморфолинил, пиперидинил, пирролидинил, пиперазинил, диоксотиазолидинил, диоксооксазолидинил, оксодигидрооксадиазолил, диоксоимидазолидинил, диоксопиперазинил и диоксидетиоморфолинил), необязательно замещенную 1-3 заместителями, выбранными из C1-6алкила, гидрокси-C1-6алкила, карбоксила, карбамоила и C1-6алкоксикарбонила; неароматическую слитую гетероциклическую группу (например, оксодигидробензоксазолил и тетрагидробензотиазолил), необязательно замещенную 1-3 заместителями, выбранными из C1-6алкила, гидрокси-C1-6алкила, карбоксила, карбамоила и C1-6алкоксикарбонила; (моно- или ди-C1-10алкил)фосфоно группу, необязательно образующую кольцо (например, диметилфосфоно; диэтилфосфоно; диизопропилфосфоно; дибутилфосфоно; 2-оксид-1,3,2-диоксафосфинанил); C1-6алкилтио; C1-6алкилсульфинил; и C1-6алкилсульфонил;
(2) 5- или 6-членную ароматическую гетероциклическую группу (например, тиадиазолил и имидазолил), необязательно замещенную 1-3 заместителями, выбранными из атома галогена, C1-6алкила и C6-14арила, необязательно замещенного 1-3 атомами галогена; или
(3) C1-6алкилсульфонил (например, метилсульфонил и этилсульфонил), необязательно замещенный 5- или 6-членной ароматической гетероциклической группой (например, тиазолилом, оксазолилом, триазолилом, тетразолилом, пиридилом и пиримидинилом), необязательно замещенной C1-6алкилом.
Заместитель для "циклической группы" более предпочтительно представляет собой C1-6алкильную группу, необязательно замещенную 1-3 заместителями, выбранными из 5- или 6-членной ароматической гетероциклической группы (например, тиазолила, оксазолила, имидазолила, пиразолила, оксадиазолила, тиадиазолила, триазолила, тетразолила, пиридила и пиримидинила), необязательно замещенной C1-6алкилом; ароматическую слитую гетероциклическую группу (например, бензимидазолил, бензопиразолил, бензотиазолил, бензоксазолил, бензотриазолил, хинолил и индазолил), необязательно замещенную C1-6алкилом; 5- или 6-членную неароматическую гетероциклическую группу (например, тетрагидрофурил, морфолинил, тиоморфолинил, пиперидинил, пирролидинил, пиперазинил, диоксотиазолидинил, диоксооксазолидинил, оксодигидрооксадиазолил, диоксоимидазолидинил, диоксопиперазинил и диоксидетиоморфолинил), необязательно замещенную C1-6алкилом; (моно- или ди-C1-10алкил)фосфоно группу, необязательно образующую кольцо (например, диметилфосфоно; диэтилфосфоно; диизопропилфосфоно; дибутилфосфоно; 2-оксид-1,3,2-диоксафосфинанил); C1-6алкилсульфинил; и C1-6алкилсульфонил.
В качестве "необязательно замещенной аминогруппы" и "необязательно замещенной ацильной группы" для R1, используются группы, представленные как заместители "необязательно замещенной углеводородной группы", представленные как заместители для кольца A.
В качестве предпочтительных примеров "необязательно замещенной аминогруппы" для R1 могут быть указаны
1) амино, необязательно моно- или ди-замещенная заместителями, выбранными из C1-6алкила, необязательно замещенного гидрокси, C6-14арилом, и 5- или 6-членной ароматической гетероциклической группой (например, пиридилом), необязательно замещенной нитро, такая как амино, метиламино, диметиламино, диизопропиламино, фениламино и N-фенил-N-метиламино;
2) моно- или ди-C1-6алкилкарбоксамид, необязательно замещенный 1-3 заместителями, выбранными из атома галогена (например, фтора, хлора, брома, иода) и C1-6алкила, такой как ацетиламино, гексаноиламино, трифторацетиламино, N-ацетил-N-метиламино и пентафторпропиониламино;
3) C1-6алкоксикарбоксамид, необязательно замещенный C1-6алкилом, такой как трет-бутоксикарбоксамид и N-трет-бутоксикарбонил-N-метиламино;
4) C6-14арилкарбоксамид (например, фенилкарбоксамид), необязательно замещенный C1-6алкилом;
5) C7-13аралкилкарбоксамид (например, бензилкарбоксамид и фенетилкарбоксамид), необязательно замещенный C1-6алкилом;
6) 5- или 6-членный ароматический гетероциклкарбоксамид (например, фурилкарбоксамид, пирролилкарбоксамид, тиенилкарбоксамид, пиридилкарбоксамид), необязательно замещенный C1-6алкилом;
7) 5- или 6-членный неароматический гетероциклкарбоксамид (например, тетрагидрофурилкарбоксамид), необязательно замещенный C1-6алкилом; и тому подобное.
В качестве предпочтительных примеров "необязательно замещенной ацильной группы" для R1 могут быть указаны
(1) карбоксил;
(2) C1-6алкилкарбонил (например, ацетил);
(3) C1-6алкоксикарбонил (например, метоксикарбонил, этоксикарбонил);
(4) C1-6алкилсульфонил (например, метилсульфонил, этилсульфонил);
(5) карбамоил, необязательно моно- или ди-замещенный C1-6алкилом, такой как карбамоил и диметилкарбамоил;
(6) сульфамоил, необязательно моно- или ди-замещенный C1-6алкилом, такой как сульфамоил и диметилсульфамоил;
(7) моно- или ди-C6-14арилкарбамоил (например, фенилкарбамоил);
(8) моно- или ди-C7-13аралкилкарбамоил (например, бензилкарбамоил);
(9) (моно- или ди-C1-10алкил)фосфоно группа, необязательно образующая кольцо (например, диметилфосфоно; диэтилфосфоно; диизопропилфосфоно; дибутилфосфоно); 2-оксид-1,3,2-диоксафосфинанил; и тому подобное.
R1 предпочтительно представляет собой необязательно замещенную циклическую группу, а более предпочтительно, C6-14арильную группу (предпочтительно, фенил), необязательно замещенную C1-6алкильной группой, необязательно замещенной 1-3 заместителями, выбранными из 5- или 6-членной ароматической гетероциклической группы (например, тиазолила, оксазолила, имидазолила, пиразолила, оксадиазолила, тиазолила, триазолила, тетразолила, пиридила и пиримидинила), необязательно замещенной C1-6алкилом; ароматическую слитую гетероциклическую группу (например, бензимидазолил, бензопиразолил, бензотиазолил, бензоксазолил, бензотриазолил, хинолил и индазолил), необязательно замещенную C1-6алкилом; 5- или 6-членную неароматическую гетероциклическую группа (например, тетрагидрофурил, морфолинил, тиоморфолинил, пиперидинил, пирролидинил, пиперазинил, диоксотиазолидинил, диоксооксазолидинил, оксодигидрооксадиазолил, диоксоимидазолидинил, диоксопиперазинил и диоксидетиоморфолинил), необязательно замещенную C1-6алкилом; (моно- или ди-C1-10алкил)фосфоно группу, необязательно образующую кольцо (например, диметилфосфоно; диэтилфосфоно; диизопропилфосфоно; дибутилфосфоно; 2-оксид-1,3,2-диоксафосфинанил); C1-6алкилсульфинил; и C1-6алкилсульфонил.
Когда, в формуле (I), 5-членный ароматический гетероцикл, представленный кольцом A, представляет собой имидазол, тогда Z не должен представлять собой -O-.
В качестве предпочтительных примеров соединения, представленного формулой (I), могут быть указаны следующие соединения.
Соединение, в котором кольцо A представляет собой имидазольное кольцо, пиразольное кольцо, оксадиазольное кольцо, тиадиазольное кольцо, триазольное кольцо или тетразольное кольцо (предпочтительно, пиразольное кольцо, оксадиазольное кольцо, тиадиазольное кольцо, триазольное кольцо и тетразольное кольцо, более предпочтительно, пиразольное кольцо), каждое из которых может иметь 1 или 2 заместителя, выбранных из C1-10алкильной группы, C6-14арильной группы и C7-13аралкильной группы;
B представляет собой C6-14арильную группу (предпочтительно, фенил) или 5-7-членную моноциклическую ароматическую гетероциклическую группу (предпочтительно, фурил, тиенил, пиридил, пиримидинил), каждая из них необязательно имеет 1-3 заместителя, выбранных из C1-6алкила, необязательно замещенного 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода), C1-6алкокси, необязательно замещенной 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода), и атома галогена (предпочтительно, атома фтора, атома хлора, атома брома);
X представляет собой C1-4алкилен или C2-4алкенилен;
Z представляет собой -CONR2- (где R2 является таким, как определено выше, предпочтительно, атомом водорода или C1-6алкильной группой, и атом углерода (С) из -CONR2- является связанным с X, и атом азота (N) в ней является связанным с Y);
Y представляет собой связь или C1-4алкилен; и
R1 представляет собой C6-14арильную группу (предпочтительно, фенил), необязательно замещенную C1-6алкильной группой, необязательно замещенной 1-3 заместителями, выбранными из 5- или 6-членной ароматической гетероциклической группы (например, тиазолила, оксазолила, имидазолила, пиразолила, оксадиазолила, тиазолила, триазолила, тетразолила, пиридила и пиримидинила), необязательно замещенной C1-6алкилом; ароматическую слитую гетероциклическую группу (например, бензимидазолил, бензопиразолил, бензотиазолил, бензоксазолил, бензотриазолил, хинолил и индазолил), необязательно замещенную C1-6алкилом; 5- или 6-членную неароматическую гетероциклическую группу (например, тетрагидрофурил, морфолинил, тиоморфолинил, пиперидинил, пирролидинил, пиперазинил, диоксотиазолидинил, диоксооксазолидинил, оксодигидрооксадиазолил, диоксоимидазолидинил, диоксопиперазинил и диоксидетиоморфолинил), необязательно замещенную C1-6алкилом; (моно- или ди-C1-10алкил)фосфоно группу, необязательно образующую кольцо (например, диметилфосфоно; диэтилфосфоно; диизопропилфосфоно; дибутилфосфоно; 2-оксид-1,3,2-диоксафосфинанил); C1-6алкилсульфинил; и C1-6алкилсульфонил.
В качестве необязательно замещенной циклической группы для R1 предпочтительной является группа, представленная формулой:

где, как определяется далее, D представляет собой кольцо, необязательно имеющее, кроме того, заместитель (заместители); Y1 представляет собой связь или дивалентную ациклическую углеводородную группу; R3' представляет собой группу формулы: -SO2R4, -SOR4 или -PO3R4R5, где R4 и R5 являются одинаковыми или различными, и каждый из них представляет собой атом водорода, углеводородную группу или гетероциклическую группу, и R4 и R5 могут образовывать гетероцикл вместе с соседним оксо-замещенным атомом фосфора и двумя атомами кислорода, или необязательно замещенную гетероциклическую группу.
"Углеводородная группа" для R4 или R5 является такой, как определено выше.
"Гетероциклическая группа" для R4 или R5 является такой, как определено выше.
Гетероцикл, сформированный R4 и R5 вместе с соседним оксо-замещенным атомом фосфора и двумя атомами кислорода, является таким, как определено выше.
В качестве дивалентной ациклической углеводородной группы для Y1 могут быть указаны группы, представленные как указанный выше X.
Y1 предпочтительно представляет собой связь или C1-4алкилен, более предпочтительно, связь, -CH2-, -(CH2)2-, -(CH2)3- и тому подобное.
В качестве кольца для "кольца, необязательно, кроме того, имеющего заместитель (заместители)", для D, может быть рассмотрено, например, кольцо, соответствующее "циклической группе" для указанного выше R1.
Кольцо для D предпочтительно представляет собой необязательно частично насыщенное C6-14ароматическое углеводородное кольцо (предпочтительно, бензол, дигидроинден), C3-10циклоалкан (предпочтительно циклопропан, циклобутан, циклопентан, циклогексан, циклогептан, циклооктан), C3-10циклоалкен (предпочтительно циклогексен), 5- или 6-членный ароматический гетероцикл, необязательно конденсированный с бензольным кольцом (предпочтительно фуран, тиофен, оксазол, тиазол, изоксазол, имидазол, пиразол, пиридин, пиразин, индол, хинолин, изохинолин и бензотиадиазол), 5- или 6-членный неароматический гетероцикл, необязательно конденсированный с бензольным кольцом (предпочтительно пирролидин, тетрагидрофуран, тиазолин, оксазолин, тиазолидин, оксазолидин, диоксолан, пиперидин, пиперазин, морфолин, тиоморфолин, дигидробензофуран и оксодигидробензоксазол) и тому подобное. Указанное выше кольцо, более предпочтительно, представляет собой C6-14ароматический углеводород, и бензол является особенно предпочтительным.
Указанное выше кольцо может иметь 1-3 заместителя в замещаемых положениях. В качестве такого заместителя могут быть указаны, например, атом галогена (например, атом фтора, атом хлора, атом брома, атом иода), C1-6алкильная группа, необязательно замещенная 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода), такая как метил и трифторметил, C1-6алкокси группа, необязательно замещенная 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода), такая как метокси и этокси и тому подобное.
В качестве "необязательно замещенной ацильной группы" для R3 могут быть указаны, например, группы, представленные как заместители "необязательно замещенной углеводородной группы", представленной как заместители для кольца A. В качестве "необязательно замещенной гетероциклической группы" для R3 или R3' могут быть указаны, например, группы, представленные как заместители для кольца A.
В качестве предпочтительных примеров "необязательно замещенной ацильной группы" для R3 могут быть указаны карбоксильная группа; C1-6алкоксикарбонил (например, метоксикарбонил, этоксикарбонил, пропоксикарбонил, бутоксикарбонил, трет-бутоксикарбонил); (моно- или ди-C1-10алкил)фосфоно группа, необязательно образующая кольцо (например, диметилфосфоно; диэтилфосфоно; диизопропилфосфоно; дибутилфосфоно; 2-оксид-1,3,2-диоксафосфинанил); карбамоил, необязательно замещенный амино; моно- или ди-C1-6алкилкарбамоил, необязательно замещенный 1-3 заместителями, выбранными из атома галогена, гидрокси и C1-6алкоксикарбонила, такой как метилкарбамоил, этилкарбамоил, диметилкарбамоил, диэтилкарбамоил, этилметилкарбамоил, пропилкарбамоил, трифторэтилкарбамоил, метоксикарбонилэтилкарбамоил, 2-гидрокси-1-метоксикарбонилэтилкарбамоил и 2-гидрокси-1-метоксикарбонилпропилкарбамоил; моно- или ди-C6-14арилкарбамоил, необязательно замещенный 1-3 заместителями, выбранными из необязательно галогенированного C1-6алкила и C1-6алкокси, такой как фенилкарбамоил, метоксифенилкарбамоил и трифторметилфенилкарбамоил; моно- или ди-C7-13аралкилкарбамоил, необязательно замещенный 1-3 заместителями, выбранными из амино, необязательно моно- или ди-замещенной C1-6алкилом, необязательно галогенированного C1-6алкила, гидрокси и C1-6алкоксикарбонила, такой как бензилкарбамоил, фенетилкарбамоил, диметиламинобензилкарбамоил, метоксикарбонилфенетилкарбамоил и трифторметилбензилкарбамоил; сульфамоил; необязательно галогенированный моно- или ди-C1-6алкилсульфамоил (например, метилсульфамоил, этилсульфамоил); C1-6алкилсульфинил (например, метилсульфинил, этилсульфинил, трет-бутилсульфинил); C1-6алкилсульфонил (например, метилсульфонил, этилсульфонил, трет-бутилсульфонил); C1-6алкилкарбонил (например, ацетил); 5- или 6-членный ароматический гетероциклический сульфинил (например, триазолилсульфинил и тетразолилсульфинил), необязательно замещенный C1-6алкилом; C6-14арилсульфонил (например, фенилсульфонил); 5- или 6-членный ароматический гетероциклический сульфонил (например, триазолилсульфонил и тетразолилсульфонил), необязательно замещенный C1-6алкилом; и тому подобное. В качестве "необязательно замещенной ацильной группы" для R3 предпочтительными являются группы формулы: -SO2R4, -SOR4 или -PO3R4R5 (где каждый символ является таким, как определено выше).
"Необязательно замещенная ацильная группа" для R3, особенно предпочтительно, представляет собой C1-6алкилсульфонил; и (моно- или ди-C1-10алкил)фосфоно группу, необязательно образующую кольцо (например, диметилфосфоно; диэтилфосфоно; диизопропилфосфоно; дибутилфосфоно; 2-оксид-1,3,2-диоксафосфинанил).
Предпочтительные примеры "необязательно замещенной гетероциклической группы" для R3 или R3' включают в себя 5- или 6-членную ароматическую гетероциклическую группу (например, тиазолил, оксазолил, имидазолил, пиразолил, оксадиазолил, тиадиазолил, триазолил, тетразолил, пиридил, пиримидинил); ароматическую слитую гетероциклическую группу (например, бензимидазолил, бензопиразолил, бензотиазолил, бензоксазолил, бензотриазолил, хинолил, индазолил); 5- или 6-членную неароматическую гетероциклическую группу (например, тетрагидрофурил, морфолинил, тиоморфолинил, пиперидинил, пирролидинил, пиперазинил, диоксотиазолидинил, диоксооксазолидинил, оксодигидрооксадиазолил, диоксоимидазолидинил, диоксопиперазинил, диоксидетиоморфолинил); и неароматическую слитую гетероциклическую группу (например, оксодигидробензоксазолил, тетрагидробензотиазолил), каждая из них является необязательно замещенной 1-3 заместителями, выбранными из C1-6алкила, гидрокси-C1-6алкила, карбоксила, карбамоила и C1-6алкоксикарбонила (например, метоксикарбонила).
Среди них, 5- или 6-членная ароматическая гетероциклическая группа (например, тиазолил, оксазолил, имидазолил, пиразолил, оксадиазолил, тиадиазолил, триазолил, тетразолил, пиридил, пиримидинил), ароматическая слитая гетероциклическая группа (например, бензимидазолил, бензопиразолил, бензотиазолил, бензоксазолил, бензотриазолил, хинолил, индазолил), и 5- или 6-членная неароматическая гетероциклическая группа (например, тетрагидрофуранил, морфолинил, тиоморфолинил, пиперидинил, пирролидинил, пиперазинил, диоксотиазолидинил, диоксооксазолидинил, оксодигидрооксадиазолил, диоксоимидазолидинил, диоксопиперазинил, диоксидетиоморфолинил), каждая из них является необязательно замещенной C1-6алкилом, являются предпочтительными.
Когда, в формуле (II), 5-членный ароматический гетероцикл, представленный кольцом A, представляет собой имидазол, тогда Z не должен представлять собой -O-; когда 5-членный ароматический гетероцикл, представленный кольцом A, представляет собой пиразол, X представляет собой метилен, Z представляет собой -S-, и Y представляет собой связь, тогда кольцо, представленное D, не должно представлять собой оксадиазол.
В качестве предпочтительных примеров соединения, представленного формулой (II), может быть рассмотрено следующее соединение.
[Соединение A]
Соединение, где кольцо A представляет собой имидазольное кольцо, пиразольное кольцо, оксадиазольное кольцо, тиадиазольное кольцо, триазольное кольцо или тетразольное кольцо (предпочтительно пиразольное кольцо, оксадиазольное кольцо, тиадиазольное кольцо, триазольное кольцо и тетразольное кольцо, более предпочтительно, пиразольное кольцо), каждое из которых может иметь 1 или 2 заместителя, выбранных из C1-10алкильной группы, C6-14арильной группы и C7-13аралкильной группы;
B представляет собой необязательно замещенную ароматическую углеводородную группу или необязательно замещенную ароматическую гетероциклическую группу, более предпочтительно, C6-14арильную группу (предпочтительно, фенил) или 5-7-членную моноциклическую ароматическую гетероциклическую группу (предпочтительно фурил, тиенил, пиридил, пиримидинил), каждая из них необязательно имеет 1-3 заместителя, выбранных из C1-6алкила, необязательно замещенного 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода), C1-6алкокси, необязательно замещенной 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода), и атома галогена (предпочтительно атома фтора, атома хлора, атома брома);
X представляет собой дивалентную C1-8алифатическую углеводородную группу, более предпочтительно, C1-4алкилен или C2-4алкенилен;
Z представляет собой -CONR2- (где R2 является таким, как определено выше, и предпочтительно, представляет собой атом водорода или C1-6алкильную группу, и атом углерода (C) из -CONR2- является связанным с X, и атом азота (N) в ней является связанным с Y);
Y и Y1 являются одинаковыми или различными, и каждый из них представляет собой связь или C1-4алкилен;
D представляет собой C6-14ароматическую углеводородную группу необязательно, кроме того, имеющую заместитель (заместители), более предпочтительно, C6-14ароматический углеводород (предпочтительно, бензол) необязательно, имеющий 1-3 заместителя, выбранных из атома галогена (например, атома фтора, атома хлора, атома брома, атома иода), C1-6алкильной группы, необязательно замещенной 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода), такой как метил и трифторметил, и C1-6алкокси группы, необязательно замещенной 1-3 атомами галогена (например, атомом фтора, атомом хлора, атомом брома, атомом иода), такой как метокси и этокси;
R3 представляет собой (моно- или ди-C1-10алкил)фосфоно группу, необязательно образующую кольцо (например, диметилфосфоно; диэтилфосфоно; диизопропилфосфоно; дибутилфосфоно; 2-оксид-1,3,2-диоксафосфинанил); или 5- или 6-членную ароматическую гетероциклическую группу (например, тиазолил, оксазолил, триазолил, тетразолил, пиридил, пиримидинил), или 5- или 6-членную неароматическую гетероциклическую группу (например, тетрагидрофурил, морфолинил, тиоморфолинил, пиперидинил, пирролидинил, пиперазинил, диоксотиазолидинил, диоксооксазолидинил), каждая из них является необязательно замещенной 1-3 C1-6алкилами.
[Соединение B]
Соединение, где кольцо A представляет собой имидазольное кольцо, пиразольное кольцо, оксадиазольное кольцо, тиадиазольное кольцо, триазольное кольцо или тетразольное кольцо (предпочтительно, пиразольное кольцо, оксадиазольное кольцо, тиадиазольное кольцо, триазольное кольцо или тетразольное кольцо, более предпочтительно, пиразольное кольцо), каждое из которых может иметь 1 или 2 заместителя, выбранных из C1-10алкильной группы, C6-14арильной группы и C7-13аралкильной группы (предпочтительно, C1-6алкильной группы, такой как метил и тому подобное);
B представляет собой C6-14арильную группу (предпочтительно, фенил) или 5-7-членную моноциклическую ароматическую гетероциклическую группу (предпочтительно, фурил, тиенил, пиридил, пиримидинил), каждая из них необязательно имеет 1-3 заместителя, выбранных из C1-6алкила, необязательно замещенного 1-3 атомами галогена, C1-6алкокси, необязательно замещенной 1-3 атомами галогена, и атома галогена; более предпочтительно, C6-14арильную группу (предпочтительно, фенил), необязательно, имеющую атом галогена (предпочтительно, атом фтора);
X представляет собой C1-4алкилен или C2-4алкенилен; более предпочтительно, -CH2-, -(CH2)2-, -CH=CH-; особенно предпочтительно, -CH=CH-;
Z представляет собой -CONR2- (где R2 является таким, как определено выше, и атом углерода (C) из -CONR2- является связанным с X, и атом азота (N) в ней является связанным с Y); более предпочтительно, -CONH-;
Y представляет собой связь или C1-4алкилен; более предпочтительно связь, -CH2-, -(CH2)2-, -(CH2)3-; особенно предпочтительно, связь;
Y1 представляет собой связь или C1-4алкилен; более предпочтительно, связь, -CH2-, -(CH2)2-, -(CH2)3-;
D представляет собой C6-14ароматический углеводород (предпочтительно, бензол) необязательно имеющий 1-3 заместителя, выбранных из атома галогена, C1-6алкильной группы, необязательно замещенной 1-3 атомами галогена и C1-6алкокси группы, необязательно замещенной 1-3 атомами галогена; и
R3 представляет собой карбоксильную группу; C1-6алкоксикарбонил; (моно- или ди-C1-10алкил)фосфоно группу, необязательно образующую кольцо (например, диметилфосфоно; диэтилфосфоно; диизопропилфосфоно; дибутилфосфоно; 2-оксид-1,3,2-диоксафосфинанил); карбамоил, необязательно замещенный амино; моно- или ди-C1-6алкилкарбамоил, необязательно замещенный 1-3 заместителями, выбранными из атома галогена, гидрокси и C1-6алкоксикарбонила; моно- или ди-C6-14арилкарбамоил, необязательно замещенный 1-3 заместителями, выбранными из необязательно галогенированных C1-6алкила и C1-6алкокси; моно- или ди-C7-13аралкилкарбамоил, необязательно замещенный 1-3 заместителями, выбранными из амино, необязательно моно- или ди-замещенной C1-6алкилом, необязательно галогенированного C1-6алкила, гидрокси и C1-6алкоксикарбонила; сульфамоил; необязательно галогенированный моно- или ди-C1-6алкилсульфамоил; C1-6алкилсульфинил; C1-6алкилсульфонил (например, метилсульфонил, этилсульфонил); C1-6алкилкарбонил; 5- или 6-членный ароматический гетероциклический сульфинил (например, триазолилсульфинил, тетразолилсульфинил), необязательно замещенный C1-6алкилом; C6-14арилсульфонил (например, фенилсульфонил); 5- или 6-членный ароматический гетероциклический сульфонил (например, триазолилсульфонил, тетразолилсульфонил), необязательно замещенный C1-6алкилом; более предпочтительно, C1-6алкилсульфонил (например, метилсульфонил, этилсульфонил); (моно- или ди-C1-10алкил)фосфоно группу, необязательно образующую кольцо (например, диметилфосфоно; диэтилфосфоно; диизопропилфосфоно; дибутилфосфоно; 2-оксид-1,3,2-диоксафосфинанил).
[Соединение C]
Соединение, где кольцо A представляет собой имидазольное кольцо, пиразольное кольцо, оксадиазольное кольцо, тиадиазольное кольцо, триазольное кольцо или тетразольное кольцо (предпочтительно, пиразольное кольцо, оксадиазольное кольцо, тиадиазольное кольцо, триазольное кольцо и тетразольное кольцо, более предпочтительно, пиразольное кольцо), каждое из которых может иметь 1 или 2 заместителя, выбранных из C1-10алкильной группы, C6-14арильной группы и C7-13аралкильной группы (предпочтительно, C1-6алкильной группы, такой как метил и тому подобное);
B представляет собой C6-14арильную группу (предпочтительно, фенил) или 5-7-членную моноциклическую ароматическую гетероциклическую группу (предпочтительно, фурил, тиенил, пиридил, пиримидинил), каждая из них необязательно имеет 1-3 заместителя, выбранных из C1-6алкила, необязательно замещенного 1-3 атомами галогена, C1-6алкокси, необязательно замещенной 1-3 атомами галогена, и атома галогена; более предпочтительно, C6-14арильную группу (предпочтительно, фенил), необязательно имеющую атом галогена (предпочтительно, атом фтора);
X представляет собой C1-4алкилен или C2-4алкенилен; более предпочтительно, -CH2-, -(CH2)2-, -CH=CH-; особенно предпочтительно, -CH=CH-;
Z представляет собой -CONR2- (где R2 является таким, как определено выше, и атом углерода (C) из -CONR2- является связанным с X, и атом азота (N) в ней является связанным с Y); более предпочтительно, -CONH-;
Y представляет собой связь или C1-4алкилен; более предпочтительно, связь, -CH2-, -(CH2)2-, -(CH2)3-; особенно предпочтительно, связь;
Y1 представляет собой связь или C1-4алкилен; более предпочтительно, связь, -CH2-, -(CH2)2-, -(CH2)3-;
D представляет собой C6-14ароматический углеводород (предпочтительно, бензол), необязательно, имеющий 1-3 заместителя, выбранных из атома галогена, C1-6алкильной группы, необязательно замещенной 1-3 атомами галогена, и C1-6алкокси группы, необязательно замещенной 1-3 атомами галогена; и
R3 представляет собой 5- или 6-членную ароматическую гетероциклическую группу (например, тиазолил, оксазолил, имидазолил, пиразолил, оксадиазолил, тиадиазолил, триазолил, тетразолил, пиридил, пиримидинил); ароматическую слитую гетероциклическую группу (например, бензимидазолил, бензопиразолил, бензотиазолил, бензоксазолил, бензотриазолил, хинолил, индазолил); 5- или 6-членную неароматическую гетероциклическую группу (например, тетрагидрофурил, морфолинил, тиоморфолинил, пиперидинил, пирролидинил, пиперазинил, диоксотиазолидинил, диоксооксазолидинил, оксодигидрооксадиазолил, диоксоимидазолидинил, диоксопиперазинил, диоксидетиоморфолинил); неароматическую слитую гетероциклическую группу (например, оксодигидробензоксазолил, тетрагидробензотиазолил), каждая из них является необязательно замещенной 1-3 заместителями, выбранными из C1-6алкила, гидрокси-C1-6алкила, карбоксила, карбамоила и C1-6алкоксикарбонила;
более предпочтительно, 5- или 6-членную ароматическую гетероциклическую группу (например, тиазолил, оксазолил, имидазолил, пиразолил, оксадиазолил, тиадиазолил, триазолил, тетразолил, пиридил, пиримидинил), ароматическую слитую гетероциклическую группу (например, бензимидазолил, бензопиразолил, бензотиазолил, бензоксазолил, бензотриазолил, хинолил, индазолил) или 5- или 6-членную неароматическую гетероциклическую группу (например, тетрагидрофуранил, морфолинил, тиоморфолинил, пиперидинил, пирролидинил, пиперазинил, диоксотиазолидинил, диоксооксазолидинил, оксодигидрооксадиазолил, диоксоимидазолидинил, диоксопиперазинил, диоксидетиоморфолинил), каждая из них является необязательно замещенной C1-6алкилом.
[Соединение D]
Диэтил [4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат (Пример № 2);
(2E)-N-{4-[(2,4-диоксо-1,3-тиазолидин-5-ил)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид (Пример № 60);
(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(1H-имидазол-1-илметил)фенил]акриламид (Пример № 159);
(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(1H-пиразол-1-илметил)фенил]акриламид (Пример № 161);
диэтил [4-({(2E)-3-[1-метил-5-(2-тиенил)-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат (Пример № 149);
(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(3-метил-2,4-диоксо-1,3-тиазолидин-5-ил)метил]фенил}акриламид (Пример № 110);
(2E)-N-[4-(1H-бензимидазол-1-илметил)фенил]-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид (Пример № 185);
(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(метилсульфонил)метил]фенил}акриламид (Пример № 222);
(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[гидрокси(2-пиридинил)метил]фенил}акриламид (Пример № 49);
(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(4-морфолинилметил)фенил]акриламид (Пример № 192); и
(2E)-N-{4-[(этилсульфонил)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид (Пример № 223).
Соли соединения, представленного формулой (I) или (II), соединение, используемое при синтезе соединения, представленного формулой (I) или (II), и соединение, используемое в настоящем изобретении, предпочтительно представляют собой фармакологически приемлемые соединения и могут представлять собой, например, соль с неорганическим основанием, соль с органическим основанием, соль с неорганической кислотой, соль с органической кислотой и соль с основной или кислотной аминокислотой.
Предпочтительные примеры соли с неорганическим основанием включают в себя соли щелочных металлов, такие как соль натрия, соль калия и тому подобное; соли щелочноземельных металлов, такие как соль кальция, соль магния и тому подобное; и соль алюминия, соль аммония и тому подобное.
Предпочтительные примеры соли с органическим основанием включают в себя соли с триметиламином, триэтиламином, пиридином, пиколином, этаноламином, диэтаноламином, триэтаноламином, дициклогексиламином, N,N-дибензилэтилендиамином и тому подобное.
Предпочтительные примеры соли с неорганической кислотой включают в себя соли с хлористоводородной кислотой, бромистоводородной кислотой, азотной кислотой, серной кислотой и фосфорной кислотой и тому подобное.
Предпочтительные примеры соли с органической кислотой включают в себя соли с муравьиной кислотой, уксусной кислотой, трифторуксусной кислотой, фумаровой кислотой, щавелевой кислотой, винной кислотой, малеиновой кислотой, лимонной кислотой, янтарной кислотой, яблочной кислотой, метансульфоновой кислотой, бензолсульфоновой кислотой, п-толуолсульфоновой кислотой и тому подобное.
Предпочтительные примеры соли с основной аминокислотой включают в себя соли с аргинином, лизином и орнитином и тому подобное.
Предпочтительные примеры соли с кислотной аминокислотой включают в себя соли с аспарагиновой кислотой, глютаминовой кислотой и тому подобное.
Среди этих солей, соль натрия, соль калия, гидрохлорид и тому подобное, являются наиболее предпочтительными.
Пролекарство соединения, представленного формулой (I) или (II), или его соль (далее иногда сокращенно упоминается как соединение по настоящему изобретению) означает соединение, способное к преобразованию в соединение по настоящему изобретению in vivo под действием фермента или желудочного сока и тому подобное, в физиологических условиях, а именно, соединение, способное к преобразованию в соединение по настоящему изобретению при ферментативном окислении, восстановлении или гидролизе и тому подобное, или соединение, способное к преобразованию в соединение по настоящему изобретению при гидролизе и тому подобное, с помощью желудочного сока и тому подобное. В качестве пролекарства соединения по настоящему изобретению могут быть указаны соединения, полученные посредством ацилирования, алкилирования или фосфолирования аминогруппы соединения по настоящему изобретению (например, соединения, полученные посредством эйкозаноилирования, аланилирования, пентиламинокарбонилирования, (5-метил-2-оксо-1,3-диоксолен-4-ил)метоксикарбонилирования, тетрагидрофуранилирования, пирролидилметилирования, пивалоилоксиметилирования или трет-бутилирования аминогруппы соединения по настоящему изобретению и тому подобное); соединения, полученные посредством ацилирования, алкилирования, фосфолирования или борирования гидроксигруппы соединения по настоящему изобретению (например, соединения, полученные посредством ацетилирования, пальмитоилирования, пропаноилирования, пивалоилирования, сукцинилирования, фумарилирования, аланилирования или диметиламинометилкарбонилирования гидроксигруппы соединения по настоящему изобретению и тому подобное); и соединения, полученные посредством этерификации или амидирования карбоксильной группы соединения по настоящему изобретению (например, соединения, полученные посредством этиловой этерификации, фениловой этерификации, карбоксиметиловой этерификации, диметиламинометиловой этерификации, пивалоилоксиметиловой этерификации, этоксикарбонилоксиэтиловой этерификации, фталидиловой этерификации, (5-метил-2-оксо-1,3-диоксолен-4-ил)метиловой этерификации, циклогексилоксикарбонилэтиловой этерификации, или метиламидирования карбоксильной группы соединения по настоящему изобретению и тому подобное) и так далее. Эти соединения могут быть получены из соединения по настоящему изобретению с помощью способов, известных сами по себе.
Пролекарство соединения по настоящему изобретению может представлять собой одно из соединений, способных к преобразованию в соединение по настоящему изобретению в физиологических условиях, как описано в "Iyakuhin no Kaihatsu (Development of Drugs)", vol. 7, Molecular Designing, published by Hirokawa Shoten, 1990, pages 163-198.
Соединение по настоящему изобретению может быть помечено изотопом (например,3H,14C,35S,125I и тому подобное) и тому подобное.
В дополнение к этому, соединение по настоящему изобретению может представлять собой ангидрид или гидрат.
Соединение по настоящему изобретению и его пролекарство являются малотоксичными и могут использоваться для млекопитающих (например, человека, мыши, крысы, кролика, собаки, кошки, крупного рогатого скота, лошади, свиньи, обезьяны и тому подобное), в качестве средства для профилактики или лечения невропатии, средства, усиливающего продуцирование или секрецию нейротрофического фактора и тому подобное, либо само по себе, либо в смеси с фармакологически приемлемым носителем, или чем-либо подобным, для получения фармацевтической композиции.
В качестве указанного выше фармакологически приемлемого носителя могут быть приведены различные органические или неорганические носители, которые обычно используются в качестве материалов для фармацевтических препаратов. Они включаются в качестве наполнителей, смазывающих веществ, связующих веществ, разрыхлителей или чего-либо подобного, в твердые препараты; в качестве растворителей, солюбилизаторов, суспендирующих средств, изотонических средств, буферирующих средств, успокоительных средств, или чего-либо подобного, в жидкие препараты. Там, где это необходимо, могут использоваться добавки, такие как консерванты, антиоксиданты, окрашивающие средства, подсластители и тому подобное.
В качестве предпочтительных примеров наполнителей могут быть указаны лактоза, сахароза, D-маннит, D-сорбит, крахмал, предварительно желатинизированный крахмал, декстрин, кристаллическая целлюлоза, гидроксипропилцеллюлоза с низкой степенью замещения, натрий карбоксиметилцеллюлоза, порошкообразная камедь, пуллулан, кремниевый ангидрид низкой плотности, синтетический силикат алюминия, магний алюмометасиликат и тому подобное.
В качестве предпочтительных примеров смазывающих веществ могут быть указаны стеарат магния, стеарат кальция, тальк, коллоидная окись кремния и тому подобное.
В качестве предпочтительных примеров связующих веществ могут быть указаны предварительно желатинизированный крахмал, сахароза, желатин, порошкообразная камедь, метилцеллюлоза, карбоксиметилцеллюлоза, натрий карбоксиметилцеллюлоза, кристаллическая целлюлоза, сахар, D-маннит, трегалоза, декстрин, пуллулан, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, поливинилпирролидон и тому подобное.
В качестве предпочтительных примеров разрыхлителей могут быть указаны лактоза, сахароза, крахмал, карбоксиметилцеллюлоза, кальций карбоксиметилцеллюлоза, натрий кроскармелоза, натрий карбоксиметилкрахмал, кремниевый ангидрид низкой плотности, гидроксипропилцеллюлоза низкой степени замещения и тому подобное.
В качестве предпочтительных примеров растворителей могут быть указаны вода для инъекций, физиологический солевой раствор, раствор Рингера, спирт, пропиленгликоль, полиэтиленгликоль, кунжутное масло, кукурузное масло, оливковое масло, хлопковое масло и тому подобное.
В качестве предпочтительных примеров солюбилизаторов могут быть указаны полиэтиленгликоль, пропиленгликоль, D-маннит, трегалоза, бензилбензоат, этанол, трис-аминометан, холестерин, триэтаноламин, карбонат натрия, цитрат натрия, салицилат натрия, ацетат натрия и тому подобное.
В качестве предпочтительных примеров суспендирующих средств могут быть указаны поверхностно-активные вещества, такие как стеарилтриэтаноламин, натрий лаурилсульфат, лауриламинопропионовая кислота, лецитин, бензалконий хлорид, бензетоний хлорид, глицерин моностеарат и тому подобное; гидрофильные полимеры, такие как поливиниловый спирт, поливинилпирролидон, натрий карбоксиметилцеллюлоза, метилцеллюлоза, гидроксиметилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза и тому подобное; полисорбаты, полиоксиэтилен-отвержденное касторовое масло и тому подобное.
В качестве предпочтительных примеров изотонических средств могут быть указаны хлорид натрия, глицерин, D-маннит, D-сорбит, глюкоза и тому подобное.
В качестве предпочтительных примеров буферирующих средств могут быть указаны буферные растворы фосфата, ацетата, карбоната, цитрата и тому подобное.
В качестве предпочтительных примеров успокаивающих средств может быть указан бензиловый спирт и тому подобное.
В качестве предпочтительных примеров консервантов могут быть указаны пара-гидроксибензоаты, хлорбутанол, бензиловый спирт, фенетиловый спирт, дегидроуксусная кислота, сорбиновая кислота и тому подобное.
В качестве предпочтительных примеров антиоксидантов могут быть указаны сульфиты, аскорбаты и тому подобное.
В качестве предпочтительных примеров окрашивающих средств могут быть указаны водорастворимые съедобные красители на основе смол (например, пищевые красители, такие как Food Color Red No. 2 и No. 3, Food Color Yellow No. 4 и No. 5, Food Color Blue No. 1 и No. 2), водонерастворимые лаковые красители (например, алюминиевая соль указанных выше водорастворимых съедобных красителей на основе смол и тому подобное), природные красители (например, β-каротин, хлорофилл, красный оксид железа и тому подобное) и так далее.
В качестве предпочтительных примеров подсластителей могут быть указаны натрий сахарин, дикалий глицирризинат, аспартам, посконник крапиволистый и тому подобное.
В качестве стандартной лекарственной формы на основе указанной выше фармацевтической композиции могут быть указаны пероральные препараты, такие как таблетки (включая сублингвальную таблетку и таблетку, разрушающуюся во рту), капсулы (включая мягкие капсулы и микрокапсулы), гранулы, порошки, драже, сиропы, эмульсии, суспензии и тому подобное; или парентеральные препараты, такие как препараты для инъекции (например, подкожной инъекции, внутривенной инъекции, внутримышечной инъекции, внутрибрюшинной инъекции, капельного вливания и тому подобное), наружные препараты (например, трансдермальные препараты, мази и тому подобное), суппозитории (например, ректальные суппозитории, вагинальные суппозитории и тому подобное), гранулы, трансназальные средства, транспульмонарные средства (вдыхаемые средства), глазные капли и так далее и тому подобное, и эти препараты могут безопасно вводиться перорально или парентерально.
Эти препараты могут представлять собой препараты с контролируемым высвобождением (например, микрокапсулы с замедленным высвобождением и тому подобное), такие как препараты с быстрым высвобождением, препараты с замедленным высвобождением и тому подобное.
Фармацевтическая композиция может быть получена с помощью способов, хорошо известных в области технологий фармацевтического производства, например, с помощью способов, описанных в Фармакопее Японии и тому подобное. Далее некоторые конкретные способы получения таких препаратов описаны подробно. Содержание соединения по настоящему изобретению в фармацевтической композиции изменяется в зависимости от формы дозировки, дозы соединения по настоящему изобретению и тому подобное, но оно составляет, например, примерно 0,1-100 мас.%.
Например, препарат для перорального введения может быть получен путем добавления наполнителя (например, лактозы, сахарозы, крахмала, D-маннита и тому подобное), разрыхлителя (например, кальций карбоксиметилцеллюлозы и тому подобное), связующего вещества (например, предварительно желатинизированного крахмала, порошкообразной камеди, карбоксиметилцеллюлозы, гидроксипропилцеллюлозы, поливинилпирролидона и тому подобное), смазывающего вещества (например, талька, стеарата магния, полиэтиленгликоля 6000 и тому подобное) и так далее, к активному ингредиенту и формования прессованием смеси, а затем, если это желательно, посредством нанесения покрытия на сформированный продукт с помощью способа, известного самого по себе, из основы для покрытия, для цели маскировки вкуса или придания энтеральных свойств или стойкости к разрушению.
В качестве основы для покрытия могут быть указаны, например, сахарная основа для покрытия, основа для покрытия в виде водорастворимой пленки, основа для покрытия в виде энтеральной пленки, основа для покрытия в виде пленки с замедленным высвобождением и тому подобное.
В качестве сахарной основы для покрытия используется сахароза и, кроме того, в сочетании, могут использоваться один или несколько видов ингредиентов, выбранных из талька, осажденного карбоната кальция, желатина, порошкообразной камеди, пуллулана, карнаубского воска и тому подобное.
В качестве основы для покрытия в виде водорастворимой пленки могут быть указаны, например, полимеры целлюлозы, такие как гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза, метилгидроксиэтилцеллюлоза и тому подобное; синтетические полимеры, такие как поливинилацеталь диэтиламиноацетат, аминоалкил метакрилатный сополимер E [Eudragit E (торговое наименование), Rohm Pharma], поливинилпирролидон и тому подобное; полисахариды, такие как пуллулан и тому подобное и так далее.
В качестве основы для покрытия в виде энтеральной пленки могут быть указаны, например, полимеры целлюлозы, такие как фталат гидроксипропилметилцеллюлозы, ацетат сукцинат гидроксипропилметилцеллюлозы, карбоксиметилэтилцеллюлоза, ацетат фталат целлюлозы и тому подобное; полимеры акриловой кислоты, такие как сополимер метакриловой кислоты L [Eudragit L (торговое наименование), Rohm Pharma], сополимер метакриловой кислоты LD [Eudragit L-30D55 (торговое наименование), Rohm Pharma], сополимер метакриловой кислоты S [Eudragit S (торговое наименование), Rohm Pharma] и тому подобное; природные продукты, такие как шеллак и так далее и тому подобное.
В качестве основы для покрытия в виде пленки с замедленным высвобождением могут быть указаны, например, полимеры целлюлозы, такие как этилцеллюлоза и тому подобное; полимеры акриловой кислоты, такие как сополимер аминоалкила метакрилата RS [Eudragit RS (торговое наименование), Rhom Pharma], суспензия сополимера этилакрилата-метилметакрилата [Eudragit NE (торговое наименование), Rohm Pharma] и так далее и тому подобное.
Два или более из указанных выше основ для покрытий могут использоваться в смеси с соответствующими пропорциями. В случае нанесения покрытия может использоваться отбеливающее средство, такое как оксид титана, оксид железа и тому подобное.
Препарат для инъекций получают посредством растворения, суспендирования или эмульгирования активного ингредиента в водном растворителе (например, в дистиллированной воде, физиологическом растворе, растворе Рингера) или в масляном растворителе (например, в растительных маслах, таких как оливковое масло, кунжутное масло, хлопковое масло, кукурузное масло и тому подобное; пропиленгликоле и тому подобное), вместе с дисперсантами (например, полисорбатом 80, полиоксиэтилен-отвержденным касторовым маслом 60, полиэтиленгликолем, карбоксиметилцеллюлозой, альгинатом натрия и тому подобное), консервантами (например, метилпарабеном, пропилпарабеном, бензиловым спиртом, хлорбутанолом, фенолом и тому подобное), изотоническими средствами (например, хлоридом натрия, глицерином, D-маннитом, D-сорбитом, глюкозой и тому подобное) и так далее. Если это желательно, могут использоваться, такие добавки как солюбилизаторы (например, салицилат натрия, ацетат натрия и тому подобное), стабилизаторы (например, сывороточный альбумин человека и тому подобное), успокоительные средства (например, бензиловый спирт и тому подобное) и так далее.
Соединение по настоящему изобретению имеет превосходное действие по усилению продуцирования или секреции нейротрофического фактора.
В качестве нейротрофического фактора могут быть указаны, например, нейротропин, суперсемейство TGF-β, семейство нейрокинов, фактор роста и тому подобное.
Нейротропин представляет собой общее наименование семейства генов фактора роста нерва (NGF) и относится к белку, который играет важную роль при дифференциации и функциональном гомеостазе клеток центральной и периферической нервной систем, формировании синапсов, регенерации и исправлении повреждений и тому подобное. В качестве конкретных примеров нейротропина могут быть указаны NGF, BDNF (нейротрофический фактор, полученный из мозга), NT-3 (нейротропин-3), NT-4/5 (нейротропин-4/5), NT-6 (нейротропин-6) и тому подобное. Нейротропин предпочтительно включает в себя NGF, BDNF, NT-3 и тому подобное.
Суперсемейство TGF-β означает группу белков, о которой известно, что она имеет структуру, отличающуюся положением цистеина в зрелой молекуле, и проявляет большое разнообразие воздействий на различные клетки и ткани. В качестве их конкретных примеров могут быть указаны TGF-β1, TGF-β2, TGF-β3, BMP (остеогенный фактор, морфогенетический белок костей)-2, BMP-3, BMP-4, BMP-5, BMP-6, BMP-7, BMP-8A, BMP-8B, BMP-14 (GDF-5), GDNF (нейротрофический фактор, полученный из линии глиальных клеток), нейротурин, артемин, персефин, GDF-1, GDF-8, GDF (фактор роста/дифференциации)-15, ингибин α, ингибин β, DAF (формирование фазы задержки) 7 и тому подобное. Суперсемейство TGF-β предпочтительно представляет собой GDNF, GDF-15 и тому подобное.
В качестве семейства нейрокинов могут быть указаны, например, цилиарный нейротрофический фактор (CNTF), интерлейкин 6 (IL-6) и тому подобное.
В качестве фактора роста могут быть указаны, например, фактор роста инсулина-1 (IGF-1), фактор роста основных фибробластов и тому подобное.
Нейротрофический фактор предпочтительно представляет собой нейротропин, суперсемейство TGF-β и тому подобное, более предпочтительно NGF, BDNF, NT-3, GDNF, GDF-15 и тому подобное.
Соединение по настоящему изобретению имеет воздействие, улучшающее функционирование нервов.
Кроме того, соединение по настоящему изобретению имеет действие, улучшающее скорость прохождения сигнала по моторному нерву или сенсорному нерву, действие, ослабляющее боль (например, невропатическую боль) и нейропротекторное действие.
Здесь, "нейропротекторное действие" обозначает действие роста нейритов, действие формирования нейритной сети, действие подавления сокращения нейритов, действие подавления дегенерации нервных окончаний и тому подобное.
Соединение по настоящему изобретению может быть использовано в качестве средства для профилактики или лечения, например, невропатий (например, периферийных невропатий, таких как диабетическая невропатия, невропатии, вызванной лечением рака и тому подобное, синдрома Гийена-Барре); нейродегеративных заболеваний (например, сенильной деменции Альцгаймера, синдрома Паркинсона, хореи Хантингтона, бокового амитрофического склероза (ALS), синдрома Дауна); диабетической сердечной миопатии; повреждения периферической нервной системы; спинального повреждения; стеноза спинального канала; множественного склероза; церебрального ишемического заболевания; эпилепсии; депрессии; дрожания; синдрома беспокойных ног; воспалительного заболевания кишечника (например, воспалительного колита); невропатических болей (например, болезненной невропатии, постгерпетической невралгии, боли в спине, невралгии тройничного нерва, синдрома канала запястья, фантомной боли, спинальных повреждений, множественного склероза); хронической боли (например, боли при раке); аномалий поведения, сопровождаемых деменцией (например, блужданий, агрессивного поведения); расстройства невроза страха; окоченения, вызванного ранением; автономных аномалий (например, диабетического автономного расстройства, бессимптомной гипогликемии, гастропареза, невропатической диареи и запора, эректильной дисфункции, ортостатической гипотонии, аритмии, сердечной недостаточности, безболезненного инфаркта сердца, дисгидроза, невропатического мочевого пузыря, внезапной глухоты, хронической непроходимости артерий, приливов крови к лицу); дисфункции мочевого пузыря (например, расстройства рефлекса мочевого пузыря); ослабления слуха; диабетического повреждения ступней; заболевания костей (например, остеопороза); заболевания суставов (например, сустава Шарко, остеоартрита, ревматизма); болезни Хиршпрунга и тому подобное.
В дополнение к этому, соединение по настоящему изобретению также может быть использовано в качестве средства для профилактики или лечения заболеваний, таких как диабет (например, диабет типа-1, диабет типа-2, диабет беременных и тому подобное), ослабленной толерантности к глюкозе (IGT), гиперлипидемии (например, гипертриглицеридемии, гиперхолестериномии, гипо-HDL-емии, постпрандиальной гиперлипидемии), гиперинсулинемии, тучности, гиперфагии, гипертонии, сердечно-сосудистого заболевания (например, атеросклероза) и тому подобное; или синдрома (например, синдрома X, висцерального синдрома тучности), включая сочетание некоторых из этих заболеваний.
Кроме того, соединение по настоящему изобретению используется для вторичной профилактики или подавления развития (например, подавления развития ослабленной толерантности к глюкозе при диабете) указанных выше различных заболеваний (например, инфаркта сердца).
Кроме того, соединение по настоящему изобретению может быть использовано в качестве ослабляющего средства для периферической невропатии или метаболического расстройства мозга; промотора лечения повреждения кожи, вызванного заболеванием метаболической или эндокринной системы, таким как диабет, и ранением; средства для регенерации поджелудочной железы (средства для восстановления функции поджелудочной железы; средства для регенерации почек (средства для восстановления функции почек); средства для ослабления или подавления боли (например, невропатической боли); профилактического средства для ампутации нижнего лимба; профилактического средства от внезапной смерти и тому подобное.
Хотя доза соединения по настоящему изобретению изменяется в зависимости от субъекта введения, способа введения, целевого заболевания, состояния и тому подобное, она, например, в случае перорального введения взрослому пациенту с периферической невропатией (например, диабетической невропатией), как правило, составляет примерно 0,01-100 мг/кг массы тела, предпочтительно, 0,05-30 мг/кг массы тела, более предпочтительно, 0,1-2 мг/кг массы тела, на одну дозу, это количество желательно вводить от одного до 3 раз в день.
Соединение по настоящему изобретению может использоваться в сочетании с фармацевтическим средством (далее будет сокращенно упоминаться как комбинированное лекарственное средство), таким как терапевтическое средство от диабета, терапевтическое средство от осложнений диабета, противоэпилептическое средство, антидепрессант, агонист опиоидов, противогиперлипедимическое средство, противогипертоническое средство, средство против аритмии, средство против тучности, диуретик, химиотерапевтическое средство, иммунотерапевтическое средство, противотромботическое средство, терапевтическое средство от остеопороза, средство против деменции, средство для ослабления эректильной дисфункции, терапевтическое средство от недержания или учащенного мочеиспускания, терапевтическое средство от дизурии, нестероидное противовоспалительное лекарственное средство, местный анестетик, витамины и тому подобное. Эти комбинированные лекарственные средства могут представлять собой низкомолекулярное соединение, или могут представлять собой высокомолекулярный белок, полипептид, антитело, вакцину и тому подобное.
В качестве терапевтического средства от диабета могут быть указаны препараты инсулина (например, препараты животного инсулина, полученные посредством экстракции из бычьей или свиной поджелудочной железы); препараты инсулина человека, синтезируемые посредством технологии генной инженерии с использованием Escherichia coli или дрожжей; инсулин-цинк; протамин-инсулин-цинк, фрагмент или производное инсулина (например, INS-1 и тому подобное, пероральные препараты инсулина и тому подобное), сенсибилизаторы инсулина (например, пиоглитазон или его соль (предпочтительно, гидрохлорид), розиглитазон или его соль (предпочтительно, малеат), регликсан (JTT-501), GI-262570, нетоглитазон (MCC-555), YM-440, DRF-2593, BM-131258, KRP-297, R-119702, CS-011, FK-614, соединения, описанные в заявке на Международный патент WO 99/58510 (например, (E)-4-[4-(5-метил-2-фенил-4-оксазолилметокси)бензилоксиимино]-4-фенилмасляная кислота), соединения, описанные в заявке на Международный патент WO 01/38325, тезаглитазар (AZ-242), рагаглитазар (NN-622), BMS-298585, ONO-5816, BM-13-1258, LM-4156, MBX-102, LY-519818, MX-6054, LY-510929, балаглитазон (NN-2344), Т-131 или его соль, THR-0921 и тому подобное), ингибиторы α-глюкозидазы (например, воглибоза, акарбоза, миглитол, эмиглитат и тому подобное), бигуаниды (например, фенформин, метформин, буформин и тому подобное), стимуляторы секреции инсулина, [сульфонилмочевины (например, толбутамид, глибенкламид, гликлазид, хлорпропамид, толазамид, ацетогексамид, гликлопирамид, глимепирид, глипизид, глибузол и тому подобное), репаглинид, сенаглинид, натеглинид, митиглинид или гидрат его кальциевой соли и тому подобное], агонисты GPR40, агонисты рецептора GLP-1 [например, GLP-1, GLP-1MR, NN-2211, AC-2993 (эксендин-4), BIM-51077, Aib(8,35)hGLP-1(7,37)NH2, CJC-1131 и тому подобное], агонисты амирина (например, прамлинтид и тому подобное), ингибиторы фосфотирозин фосфатазы (например, ванадиевая кислота и тому подобное), ингибиторы дипетидилпептидазы IV (например, NVP-DPP-278, PT-100, P32/98, NVP-DDP-728, LAF237, TS-021 и тому подобное), агонисты β3 (например, CL-316243, SR-58611-A, UL-TG-307, SB-226552, AJ-9677, BMS-196085, AZ40140 и тому подобное), ингибиторы глюконеогенеза (например, ингибиторы гликоген фосфорилазы, ингибиторы глюкоза-6-фосфатазы, антагонисты глюкагона и тому подобное), ингибиторы SGLT (сопереносчика натрий-глюкозы) (например, Т-1095 и тому подобное), ингибиторы 11β-гидроксистероид дегидрогеназы (например, BVT-3498 и тому подобное), адипонектин или его агонисты, ингибиторы IKK (например, AS-2868 и тому подобное), лекарственные средства для повышения стойкости к лептину, агонисты рецептора самостатина (соединения, описанные в заявках на Международные патенты WO 01/25228 и WO 03/42204, соединения, описанные в заявках на Международные патенты WO 98/44921, WO 98/45285 и WO 99/22735 и тому подобное), активаторы глюкокиназы (например, Ro-28-1675) и тому подобное.
В качестве терапевтического средства от осложнений при диабете могут быть указаны ингибиторы альдоза редуктазы (например, толрестат, эпалрестат, зенарестат, зополрестат, миналрестат, фидарестат, SNK-860, CTPET-112 и тому подобное), нейротрофические факторы и лекарственные средства для повышения их уровней (например, NGF, NT-3, BDNF, промоторы продуцирования или секреции нейротропина, описанные в заявке на Международный патент WO 01/14372 (например, 4-(4-хлорфенил)-2-(2-метил-1-имидазолил)-5-[3-(2-метилфенокси)пропил]оксазол и тому подобное) и так далее), ускорители регенерации нервов (например, Y-128 и тому подобное), ингибиторы PKC (например, LY-333531 и тому подобное), ингибиторы AGE (например, ALT946, пимагедин, пиротоксантин, N-фенацилтиазолиний бромид (ALT766), ALT-711, EXO-226, пиридорин, пиридоксамин и тому подобное), поглотители активного кислорода (например, тиоктовая кислота и тому подобное), церебральные вазодилаторы (например, тиаприд, мексилетин и тому подобное), агонисты рецепторов соматостатина (BIM23190), ингибиторы киназы-1, регулирующей сигналы апоптоза (ASK-1) и тому подобное.
В качестве противоэпилептического средства могут быть указаны, например, габапентин, габапентин MR, трилептал, кеппра, зонегран, прегабалин, харкосерид, карбамазепин и тому подобное.
В качестве антидепрессантов могут быть указаны, например, амитриптилин, имипрамин и тому подобное.
В качестве агониста опиоидов может быть указан, например, морфин и тому подобное.
В качестве противогиперлипидемического средства могут быть указаны, соединения статина (например, церивастатин, правастатин, симвастатин, ловастатин, аторвастатин, флувастатин, итавастатин, и их соли (например, натриевая соль) и тому подобное), ингибиторы сквален синтазы (например, соединения, описанные в заявке на Международный патент WO 97/10224, такие как N-[[(3R,5S)-1-(3-ацетокси-2,2-диметилпропил)-7-хлор-5-(2,3-диметоксифенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ил]ацетил]пиперидин-4-уксусная кислота и тому подобное), соединения фибрата (например, безафибрат, клофибрат, симфибрат, клинофибрат и тому подобное), антиоксиданты (например, липоевая кислота, пробукол) и тому подобное.
В качестве противогипертонических средств могут быть указаны ингибиторы ангиотензин-преобразующего фермента (например, каптоприл, эналаприл, делаприл и тому подобное) или антагонисты ангиотензина II (например, кандезартан цилексетил, лозартан, эпрозартан, валзартан, телмизартан, ирбезартан, тазозартан, 1-[[2'-(2,5-дигидро-5-оксо-4H-1,2,4-оксадиазол-3-ил)бифенил-4-ил]метил]-2-этокси-1H-бензимидазол-7-карбоновая кислот и тому подобное), антагонисты кальция (например, манидипин, нифедипин, амлодипин, эфонидипин, никардипин и тому подобное), клонидин и тому подобное.
В качестве средства против аритмии может быть указан, например, мексилетин и тому подобное.
В качестве средства против тучности могут быть указаны, например, лекарственные средства против тучности, воздействующие на центральную нервную систему (например, дексфенфлурамин, фенфлурамин, фентермин, сибутрамин, анфепрамон, дексамфетамин, мазиндол, фенилпрропаноламин, клобензорекс; антагонисты рецептора MCH (например, SB-568849; SNAP-7941; соединения, включенные в заявки на Международные патенты WO 01/82925 и WO 01/87834 и тому подобное); антагонисты нейропептида Y (например, CP-422935 и тому подобное); антагонисты рецептора каннабиноидов (например, SR-141716, SR-147778 и тому подобное); антагонисты грелина; ингибиторы 11β-гидроксистероид дегидрогеназы (например, BVT-3498 и тому подобное, и так далее), ингибиторы липазы поджелудочной железы (например, орлистат, ALT-962 и тому подобное), агонисты β3 (например, CL-316243, SR-58611-A, UL-TG-307, SB-226552, AJ-9677, BMS-196085, AZ40140 и тому подобное), аноректические пептиды (например, лептин, CNTF (силиарный нейротрофический фактор) и тому подобное), агонисты холецистокинина (например, линтитрипт, FPL-15849 и тому подобное), аноректики (например, P-57 и тому подобное) и так далее.
В качестве диуретика могут быть указаны, например, производные ксантина (например, салицилат натрия и теобромин, салицилат кальция и теобромин и тому подобное), препараты тиазида (например, этиазид, циклопентиазид, трихлорметиазид, гидрохлортиазид, гидрофлуметиазид, бензилгидрохлортиазид, пенфлутизид, политиазид, метиклотиазид и тому подобное), противоальдостероновые препараты (например, спиронолактон, триамтерен и тому подобное), ингибиторы углеродной ангидразы (например, ацетазоламид и тому подобное), препараты хлорбензолсульфонамида (например, хлорталидон, мефрузид, индапамид и тому подобное), азосемид, изосорбид, этакриновая кислота, пиретанид, буметанид, фуросемид и тому подобное.
В качестве химиотерапевтического средства могут быть указаны, например, алкилирующие средства (например, циклофосфамид, ифосфамид и тому подобное), антагонисты метаболизма (например, метотрексат, 5-фторурацил и тому подобное), противораковые антибиотики (например, митомицин, адриамицин и тому подобное), противораковые средства растительного происхождения (например, винкристин, виндезин, таксол и тому подобное), цисплатин, карбоплатин, этопоксид и тому подобное. Среди них, фуртулон и неофуртулон, которые представляют собой производные 5-фторурацила и тому подобное, являются предпочтительными.
В качестве иммунотерапевтического средства могут быть указаны, например, компоненты микроорганизмов или бактерий (например, производное дипептида мурамила, пицибанил и тому подобное), полисахариды, имеющие активность, повышающую иммунитет (например, лентинан, сизофиран, крестин и тому подобное), цитокины, полученные посредством технологии генной инженерии (например, интерферон, интерлейкин (IL) и тому подобное), факторы, стимулирующие рост колоний (например, фактор, стимулирующий рост колоний гранулоцитов, эритропоэтин и тому подобное) и так далее, при этом предпочтение отдается интерлейкинам, таким как IL-1, IL-2, IL-12 и тому подобное.
В качестве противотромботического средства могут быть указаны, например, гепарин (например, натрий гепарин, кальций гепарин, натрий дальтепарин и тому подобное), варфарин (например, калий варфарин и тому подобное), противотромбинные лекарственные средства (например, арагатробан и тому подобное), тромболитические средства (например, урокиназа, тизокиназа, альтеплаза, натеплаза, монтеплаза, памитеплаза и тому подобное), ингибиторы агрегации тромбоцитов (например, тиклопидин гидрохлорид, цилостазол, этил икозапентат, натрий берапрост, сарпогрелат гидрохлорид и тому подобное) и так далее.
В качестве терапевтического средства от остеопороза могут быть указаны, например, альфакальцидол, кальцитриол, элькатонин, кальцитонин сальмон, эстриол, иприфлавон, динатрий памидронат, натрий альендронат гидрат, динатрий инкадронат и тому подобное.
В качестве средства от деменции могут быть указаны, например, такрин, донепезил, ривастигмин, галантамин и тому подобное.
В качестве средства для ослабления эректильной дисфункции могут быть указаны, например, апоморфин, сильденафил цитрат и тому подобное.
В качестве терапевтического средства от недержания или учащенного мочеиспускания могут быть указаны, например, флавоксат гидрохлорид, оксибутинин гидрохлорид, пропиверин гидрохлорид и тому подобное.
В качестве терапевтического средства от дизурии могут быть указаны ингибиторы ацетилхолин эстеразы (например, дистигмин) и тому подобное.
В качестве нестероидного противовоспалительного лекарственного средства могут быть указаны, например, аспирин, ацетаминофен, индометацин и тому подобное.
В качестве местного анестетика могут быть указаны, например, лидокаин, капсаицин и тому подобное.
В качестве витаминов могут быть указаны, например, витамин B1, витамин B12 и тому подобное.
Кроме того, лекарственные средства, имеющие воздействие, ослабляющее кахексию, установленное на животных моделях или в клинических ситуациях, такие как ингибиторы циклооксигеназы (например, индометацин и тому подобное) [Cancer Research, Vol. 49, 5935-5939, 1989], производные прогестерона (например, мегестерол ацетат) [Journal of Clinical Oncology, Vol. 12, 213-225, 1994], глюкостероид (например, дексаметазон и тому подобное), метоклопрамидные средства, тетрагидроканнабинольные средства (там же), средства, улучшающие метаболизм жиров (например, эйкозапентеновая кислота и тому подобное) [British Journal of Cancer, Vol. 68, 314-318, 1993], гормоны роста, IGF-1, или антитела к фактору, индуцирующему кахексию, такие как TNF-α, LIF, IL-6, Oncostatin M и тому подобное, также могут использоваться в сочетании с соединением по настоящему изобретению.
Комбинированное лекарственное средство предпочтительно представляет собой препарат инсулина, сенсибилизатор к инсулину, ингибитор α-глюкозидазы, бигуанид, стимулятор секреции инсулина (предпочтительно сульфонилмочевина), ингибитор альдоза редуктазы, ингибитор PKC, противоэпилептическое средство, антидепрессант, средство против аритмии, агонист опиоидов, антиоксидант, нестероидное противовоспалительное лекарственное средство и тому подобное.
Время введения указанного выше комбинированного лекарственного средства не ограничивается, и соединение по настоящему изобретению и комбинированное лекарственное средство могут вводиться субъекту введения одновременно, или же они могут вводиться постадийно. Дозировка комбинированного лекарственного средства может определяться в соответствии с клинически используемой дозой, и может быть выбрана соответствующим образом, в зависимости от субъекта введения, способа введения, заболевания, сочетания и тому подобное.
Способ введения комбинированного лекарственного средства не является как-либо ограниченным, постольку, поскольку соединение по настоящему изобретению и комбинированное лекарственное средство объединяются при введении. Примеры такого режима введения включают в себя следующие способы: (1) соединение по настоящему изобретению и комбинированное лекарственное средство обрабатываются одновременно с получением единого препарата, который вводится. (2) Соединение по настоящему изобретению и комбинированное лекарственное средство обрабатываются по-отдельности с получением двух видов препаратов, которые вводятся одновременно, с помощью одного и того же способа введения. (3) Соединение по настоящему изобретению и комбинированное лекарственное средство обрабатываются по-отдельности с получением двух видов препаратов, которые вводятся с помощью одного и того же способа введения постадийно. (4) Соединение по настоящему изобретению и комбинированное лекарственное средство обрабатываются вместе с получением двух видов препаратов, которые вводятся одновременно, посредством различных способов введения. (5) Соединение по настоящему изобретению и комбинированное лекарственное средство обрабатываются по-отдельности с получением двух видов препаратов, которые вводятся с помощью различных способов введения, постадийно (например, соединение по настоящему изобретению и комбинированное лекарственное средство вводятся в данном порядке или в обратном порядке) и тому подобное.
Пропорция соединения по настоящему изобретению к комбинированному лекарственному средству может быть выбрана соответствующим образом, в зависимости от субъекта введения, способа введения, заболеваний и тому подобное. Например, когда субъектом введения является человек, 0,01-100 частей массовых комбинированного лекарственного средства используются на 1 часть массы соединения по настоящему изобретению.
Когда соединение по настоящему изобретению используется в сочетании с комбинированным лекарственным средством, дозировка обоих компонентов может быть уменьшена в пределах безопасного диапазона, с учетом противоположного воздействия компонентов. В частности, комбинированное лекарственное средство, такое как сенсибилизатор к инсулину, стимулятор секреции инсулина (предпочтительно, сульфонилмочевина), бигуанид, ингибитор альдоза редуктазы, ингибитор PKC, противоэпилептическое средство, антидепрессант, средство против аритмии, агонист опиоидов, антиоксидант, нестероидное противовоспалительное лекарственное средство и тому подобное, могут уменьшаться в количестве по сравнению с нормальной дозой. Тем самым, противоположные воздействия, оказываемые этими комбинированными лекарственными средствами, могут безопасно предотвращаться.
Соединение по настоящему изобретению может использоваться в сочетании со способом лечения, включающим в себя нефармакологические средства, такие как спинальная электрическая стимуляция, акупунктура и иглоукалывание с прижиганием и тому подобное.
Далее объясняются способы получения соединения по настоящему изобретению.
Соединение (I) может быть получено в соответствии со способом, который сам по себе известен, таким как способ A, способ D и способ F, которые будут описываться далее, или способом, аналогичным им.
Соединение (Ia) формулы (I), где Z представляет собой -CONR2- (R2 является таким, как определено выше) может быть получено в соответствии, например, со следующим способом A.
[Способ A]

где символы являются такими, как определено выше.
В этом способе, соединение (III) подвергается реакции амидирования с получением соединения (Ia). Эту реакцию осуществляют в соответствии со способом, который сам по себе известен, таким как способ непосредственного конденсирования соединения (III) с соединением (IV), способ взаимодействия реакционноспособного производного соединения (III) с соединением (IV) и тому подобное.
Способ непосредственного конденсирования соединения (III) с соединением (IV), как правило, осуществляют в присутствии катализатора конденсации в растворителе, который не оказывает отрицательного воздействия на реакцию.
В качестве катализатора конденсации может быть указано обычное средство, такое как реагенты для конденсации на основе карбодиимидов, такие как дициклогексилкарбодиимид, диизопропилкарбодиимид, 1-этил-3-(3-диметиламинопропил)карбодиимид или его гидрохлорид и тому подобное; реагенты для конденсации на основе метафосфорной кислоты, такие как диэтил цианофосфат, дифенилфосфорил азид и тому подобное; карбонил диимидазол, 2-хлор-1,3-диметилимидазолий тетрафторборат и тому подобное.
В качестве растворителя, который не оказывает отрицательного воздействия на реакцию, могут быть указаны, например, амиды, такие как N,N-диметилформамид, N,N-диметилацетамид и тому подобное; галогенированные углеводороды, такие как хлороформ, дихлорметан и тому подобное; ароматические углеводороды, такие как бензол, толуол и тому подобное; простые эфиры, такие как тетрагидрофуран, диоксан, простой диэтиловый эфир и тому подобное; этилацетат, вода и тому подобное. Два или более видов этих растворителей могут использоваться в смеси при соответствующих отношениях.
Количество соединения (IV), которое должно использоваться составляет, как правило, 0,1-10 молярных эквивалентов, предпочтительно, 0,3-3 молярных эквивалента, по отношению к соединению (III).
Количество катализатора конденсации, которое должно использоваться, составляет, как правило, 0,1-10 молярных эквивалентов, предпочтительно, 0,3-3 молярных эквивалента, по отношению к соединению (III).
Когда указанный выше реагент для конденсации типа карбодиимидов используется в качестве катализатора конденсации, эффективность реакции может быть улучшена посредством использования соответствующего промотора конденсации (например, 1-гидрокси-1H-1,2,3-бензотриазола гидрата, 1-гидрокси-7-азабензотриазола, 1-гидроксибензотриазола, N-гидроксисукцинимида, N-гидроксифталимида и тому подобное), где это необходимо. Когда указанный выше реагент для конденсации типа фосфорной кислоты используется в качестве катализатора конденсации, эффективность реакции может быть улучшена, как правило, посредством добавления основания типа органического амина, такого как триэтиламин и тому подобное.
Количество указанного выше промотора конденсации органического основания типа амина, которое должно использоваться, составляет, как правило, 0,1-10 молярных эквивалентов, предпочтительно 0,3-3 молярных эквивалента, по отношению к соединению (III).
Температура реакции составляет, как правило, -30°C-100°C.
Время реакции составляет, как правило, 0,5-60 час.
В качестве реакционноспособного производного указанного выше соединения (III) могут быть указаны, например, кислотный ангидрид, галогенангидридид (хлорангидрид, бромангидрид), имидазолид, или смешанный кислотный ангидрид (например, ангидрид с метилкарбонатом, этилкарбонатом или изобутилкарбонатом и тому подобное) и так далее.
Например, когда кислотный ангидрид или галогенангидридид используется в качестве реакционноспособного производного, реакцию, как правило, осуществляют в присутствии основания, в растворителе, который не оказывает отрицательного воздействия на реакцию.
В качестве основания могут быть указаны, например, триэтиламин, диизопропилэтиламин, пиридин, N-метилморфолин, N,N-диметиланилин, 4-диметиламинопиридин, гидроксид лития, гидроксид натрия, гидроксид калия, бикарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия и тому подобное.
В качестве растворителя, который не оказывает отрицательного воздействия на реакцию, могут быть указаны, например, амиды, такие как N,N-диметилформамид, N,N-диметилацетамид и тому подобное; галогенированные углеводороды, такие как хлороформ, дихлорметан и тому подобное; ароматические углеводороды, такие как бензол, толуол и тому подобное; простые эфиры, такие как тетрагидрофуран, диоксан, простой диэтиловый эфир и тому подобное; этилацетат, ацетонитрил, вода и тому подобное. Два или более видов среди этих растворителей могут использоваться в смеси при соответствующих отношениях. Когда указанные выше амиды используются в качестве растворителя, который не оказывает отрицательного воздействия на реакцию, реакция может также осуществляться в отсутствие основания.
Количество соединения (IV), которое должно использоваться, составляет, как правило, 0,1-10 молярных эквивалентов, предпочтительно, 0,3-3 молярных эквивалента, по отношению к соединению (III).
Количество основания, которое должно использоваться, составляет, как правило, 0,1-10 молярных эквивалентов, предпочтительно, 0,3-3 молярных эквивалента, по отношению к соединению (III).
Температура реакции составляет, как правило, -30°C-100°C.
Время реакции составляет, как правило, 0,5-20 час.
Когда смешанный кислотный ангидрид используется в качестве реакционноспособного производного, соединение (III) взаимодействует со сложным эфиром хлоругольной кислоты в присутствии основания, а затем взаимодействует с соединением (IV).
В качестве сложного эфира хлоругольной кислоты могут быть указаны, например, метилхлоркарбонат, этилхлоркарбонат, изобутилхлоркарбонат и тому подобное.
В качестве основания могут быть указаны, например, триэтиламин, анилин, N-метилморфолин, N,N-диметиланилин, 4-диметиламинопиридин, гидроксид натрия, гидроксид калия, гидроксид лития, бикарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия и тому подобное.
Количество соединения (IV), которое должно использоваться, составляет, как правило, 0,1-10 молярных эквивалентов, предпочтительно 0,3-3 молярных эквивалента, по отношению к соединению (III).
Температура реакции составляет, как правило, -30°C-100°C.
Время реакции составляет, как правило, 0,5-20 час.
Соединение (Ia), полученное таким образом, может быть выделено и очищено с помощью известных средств разделения и очистки, таких, как концентрирование, концентрирование при пониженном давлении, экстракция растворителем, кристаллизация, перекристаллизация, перенос фазы, хроматография и тому подобное.
Соединение (IV), которое должно использоваться в качестве исходного соединения в указанном выше способе A, может быть получено с помощью способа, который сам по себе известен.
Соединение (III), которое должно использоваться в качестве исходного соединения в указанном выше способе А, может быть получено, например, с помощью следующего далее способа B.
[Способ B]

где R6 представляет собой необязательно замещенную углеводородную группу, необязательно замещенную гетероциклическую группу или необязательно замещенную ацильную группу, а другие символы являются такими, как определено выше.
В качестве "необязательно замещенной углеводородной группы" и "необязательно замещенной гетероциклической группы" для R6 могут быть использованы группы, соответственно, представленные как указанная выше B.
В качестве "необязательно замещенной ацильной группы" для R6 могут быть использованы группы, представленные как указанная выше R1.
R6 предпочтительно представляет собой C1-6алкильную группу (например, метил, этил, пропил, изопропил, трет-бутил), C7-13аралкильную группу (например, бензил), C6-14арильную группу (например, фенил) и тому подобное.
В этом способе соединение (V) подвергают реакции гидролиза с получением соединения (III).
Эту реакцию осуществляют в соответствии с обычным способом, в присутствии кислоты или основания, в растворителе, содержащем воду.
В качестве кислоты могут быть указаны, например, хлористоводородная кислота, серная кислота, уксусная кислота, бромистоводородная кислота и тому подобное.
В качестве основания могут быть указаны, например, карбонаты щелочных металлов, такие как карбонат калия, карбонат натрия, карбонат цезия и тому подобное; карбонаты щелочноземельных металлов, такие как карбонат бария, карбонат кальция и тому подобное; алкоксид щелочного металла, такой как метоксид натрия и тому подобное; гидроксид щелочного металла, такой как гидроксид калия, гидроксид натрия, гидроксид лития и тому подобное; гидроксиды щелочноземельных металлов, такие как гидроксид бария, гидроксид кальция и тому подобное; и тому подобное.
Количество кислоты или основания, которое должно использоваться, представляет собой, как правило, избыточное количество по отношению к соединению (V). Предпочтительно, количество кислоты, которое должно использоваться, составляет примерно 2 - примерно 50 эквивалентов по отношению к соединению (V), и количество основания, которое должно использоваться, составляет примерно 1,2 - примерно 10 эквиваленты по отношению к соединению (V).
В качестве растворителя, содержащего воду, могут быть указаны, например, смешанный растворитель из воды и одного или нескольких видов растворителей, выбранных из спиртов, таких как метанол, этанол и тому подобное; простых эфиров, таких как тетрагидрофуран, диоксан, простой диэтиловый эфир и тому подобное; диметилсульфоксида и ацетона и тому подобное, и так далее. Когда для реакции гидролиза используется кислота, в качестве растворителя может использоваться избыточное количество кислоты.
Температура реакции составляет, как правило, примерно от -20 - примерно до 150°C, предпочтительно, примерно от -10 примерно до 100°C.
Время реакции составляет, как правило, примерно 0,1 - примерно 20 час.
Соединение (III), полученное таким образом, может быть выделено и очищено с помощью известных средств разделения и очистки, таких, как концентрирование, концентрирование при пониженном давлении, экстракция растворителем, кристаллизация, перекристаллизация, перенос фазы, хроматография и тому подобное.
Соединение (V), которое должно использоваться в качестве исходного соединения в указанном выше способе B, может быть получено с помощью способа, который сам по себе известен. Например, из соединений (V), соединения, где X представляет собой -CH=CH- или -(CH2)2- [соответственно, соединение (V-1) или (V-2)], могут быть получены в соответствии со следующим далее способом C.
[Способ C]

где R7 представляет собой необязательно замещенную углеводородную группу, необязательно замещенную гетероциклическую группу или необязательно замещенную ацильную группу, и другие символы являются такими, как определено выше.
В качестве "необязательно замещенной углеводородной группы", "необязательно замещенной гетероциклической группы" и "необязательно замещенной ацильной группы" для R7, используются группы, соответственно, представленные, как указанная выше R6.
R7 предпочтительно представляет собой C1-6алкильную группу (например, метил, этил, пропил, изопропил, трет-бутил), C7-13аралкильную группу (например, бензил), C6-14арильную группу (например, фенил) и тому подобное.
(Стадия 1a) Реакция восстановления
Эту реакцию осуществляют в соответствии с обычным способом в присутствии восстанавливающего средства в растворителе, который не оказывает отрицательного воздействия на реакцию.
В качестве восстанавливающего средства могут быть указаны, например, боргидрид натрия, боргидрид лития, лития алюминия гидрид, диизобутилалюминий гидрид, дигидробис(2-метоксиэтокси)алюминат натрия, боран и его комплексы (например, боран-тетрагидрофуран, боран-пиридин, боран-диметилсульфид и тому подобное) и так далее.
Количество восстанавливающего средства, которое должно использоваться, предпочтительно составляет примерно 0,5 - примерно 10 молярных эквивалентов по отношению к соединению (VI).
В качестве растворителя, который не оказывает отрицательного воздействия на реакцию, могут быть указаны, например, ароматические углеводороды, такие как бензол, толуол, ксилол и тому подобное; галогенированные углеводороды, такие как хлороформ, дихлорметан и тому подобное; простые эфиры, такие как тетрагидрофуран, диоксан, простой диэтиловый эфир и тому подобное; вода; спирты, такие как метанол, этанол, изопропанол и тому подобное; и так далее. Два или более видов этих растворителей могут использоваться в смеси, при соответствующих отношениях.
Температура реакции составляет, как правило, примерно от -50 - примерно до 150°C, предпочтительно, примерно от -10 примерно до 100°C.
Время реакции составляет, как правило, примерно от 0,5 - примерно 20 час.
Соединение (VII), полученное таким образом, может быть выделено и очищено с помощью известных средств разделения и очистки, таких, как концентрирование, концентрирование при пониженном давлении, экстракция растворителем, кристаллизация, перекристаллизация, перенос фазы, хроматография и тому подобное. Является возможным использование реакционной смеси, содержащей соединение (VII), в качестве исходного материала для следующей реакции без выделения или очистки соединения (VII).
Соединение (VI), которое должно использоваться в качестве исходного соединения, на указанной выше стадии 1a, может быть получено в соответствии со способом, который сам по себе известен, такого как способы, описанные в Tetrahedron Letters, Vol. 41, p. 5453 (2000), заявке на Международный патент WO 99/52882, Journal of Chemical Society, Perkin Trans. Vol. 1, No. 2, pp. 642-645 (1981) и тому подобное, или в соответствии со способом, аналогичным им.
(Стадия 1b) Реакции галогенирования и гидроксилирования
На этой стадии соединение (VIII) подвергается реакции галогенирования, а затем реакции гидроксилирования с получением соединения (VII).
Здесь реакцию галогенирования осуществляют в присутствии галогенирующего средства и, когда необходимо, соответствующего инициатора реакции, в растворителе, который не оказывает отрицательного воздействия на реакцию.
В качестве галогенирующего средства могут быть указаны, например, N-галогенированные имиды, такие как N-бромсукцинимид, N-хлорсукцинимид и тому подобное, и так далее.
Количество галогенирующего средства, которое должно использоваться, предпочтительно составляет примерно 1 - примерно 10 молярных эквивалентов по отношению к соединению (VIII).
В качестве инициатора реакции могут быть указаны, например, органические азосоединения, такие как азобисизобутиронитрил и тому подобное; органические пероксиды, такие как бензоилпероксид и тому подобное, и так далее.
Количество инициатора реакции, которое должно использоваться, предпочтительно составляет примерно 0,001 - примерно 1 молярный эквивалент по отношению к соединению (VIII).
В качестве растворителя, который не оказывает отрицательного воздействия на реакцию, могут быть указаны, например, простые эфиры, такие как тетрагидрофуран, диоксан, простой диэтиловый эфир и тому подобное; галогенированные углеводороды, такие как четыреххлористый углерод, 1,2-дихлорэтан, хлороформ, дихлорметан и тому подобное, ацетонитрил, этилацетат, N,N-диметилформамид и тому подобное. Два или более видов этих растворителей могут использоваться в смеси, при соответствующих отношениях.
Температура реакции составляет, как правило, -50-200°C, предпочтительно, 0-120°C.
Время реакции равно, как правило, 0,1-48 час.
Реакцию гидроксилирования удобно осуществлять в присутствии соответствующего основания, в растворителе, который не оказывает отрицательного воздействия на реакцию.
В качестве основания могут быть указаны, например, ацетаты или формиаты щелочных металлов, такие как ацетат натрия, ацетат калия, формиат натрия и тому подобное; карбонаты щелочных металлов, такие как карбонат калия, карбонат натрия, карбонат цезия и тому подобное; карбонаты щелочноземельных металлов, такие как карбонат бария, карбонат кальция и тому подобное; алкоксиды щелочных металлов, такие как метоксид натрия и тому подобное; гидроксиды щелочных металлов, такие как гидроксид калия, гидроксид натрия, гидроксид лития и тому подобное; гидроксиды щелочноземельных металлов, такие как гидроксид бария, гидроксид кальция и тому подобное, и так далее.
Количество основания, которое должно использоваться, представляет собой, как правило, избыточное количество по отношению к соединению (VIII). Количество основания, которое должно использоваться, предпочтительно составляет примерно 1,2 - примерно 30 эквивалентов, по отношению к соединению (VIII).
В качестве растворителя, который не оказывает отрицательного воздействия на реакцию, могут быть указаны, например, спирты, такие как метанол, этанол и тому подобное; простые эфиры, такие как тетрагидрофуран, диоксан, простой диэтиловый эфир и тому подобное; диметилсульфоксид, ацетон и тому подобное. Два или более видов этих растворителей могут использоваться в смеси, при соответствующих отношениях, или могут использоваться в смеси с водой. Когда указанный выше растворитель используется в смеси с водой, отношение смешивания воды составляет, например, 0,1-1000%, предпочтительно, 1-100%, по объему, по отношению к растворителю.
Температура реакции составляет, как правило, примерно -20 - примерно 150°C, предпочтительно, примерно от -10 примерно до 100°C.
Время реакции составляет, как правило, примерно 0,1 - примерно 20 час.
Соединение (VII), полученное таким образом, может быть выделено и очищено с помощью известных средств разделения и очистки, таких, как концентрирование, концентрирование при пониженном давлении, экстракция растворителем, кристаллизация, перекристаллизация, перенос фазы, хроматография и тому подобное. Является также возможным использование реакционной смеси, содержащей соединение (VII), в качестве исходного материала для следующей реакции, без выделения или очистки соединения (VII).
(Стадия 1c) Реакция дигалогенирования и гидролиза
На этой стадии соединение (VIII) подвергают реакции дигалогенирования, а затем реакции гидролиза с получением соединения (IX).
Реакцию дигалогенирования осуществляют в присутствии галогенирующего средства и, когда необходимо, соответствующего инициатора реакции, в растворителе, который не оказывает отрицательного воздействия на реакцию.
В качестве галогенирующего средства могут использоваться инициатор реакции и растворитель, которые не оказывают отрицательного воздействия на реакцию, соединения, соответственно, соединения, представленные для указанной выше реакции галогенирования на стадии 1b.
Количество галогенирующего средства, которое должно использоваться, предпочтительно представляет собой примерно 2 - примерно 20 молярных эквивалентов, по отношению к соединению (VIII).
Количество инициатора реакции, которое должно использоваться, предпочтительно составляет примерно 0,001 - примерно 1 молярных эквивалента по отношению к соединению (VIII).
Температура реакции составляет, как правило, -50-200°C, предпочтительно, 0-120°C.
Время реакции составляет, как правило, 0,1-48 час.
Реакцию гидролиза осуществляют таким же образом, как и реакцию гидроксилирования на указанной выше стадии 1b.
Соединение (IX), полученное таким образом, может быть выделено и очищено с помощью известных средств разделения и очистки, таких, как концентрирование, концентрирование при пониженном давлении, экстракция растворителем, кристаллизация, перекристаллизация, перенос фазы, хроматография и тому подобное. Является также возможным использование реакционной смеси, содержащей соединение (IX), в качестве исходного материала для следующей реакции, без выделения или очистки соединения (IX).
Соединение (VIII), которое должно использоваться в качестве исходного соединения на указанных выше стадиях 1b и 1c, может быть получено в соответствии со способом, который сам по себе известен, например, способами, описанными в Journal of Organic Chemistry, Vol. 51, p. 4075 (1986) и тому подобное, или в соответствии со способом, аналогичным им.
(Стадия 2) Реакция окисления
Эту реакцию осуществляют в соответствии с обычным способом, в присутствии окислителя в растворителе, который не оказывает отрицательного воздействия на реакцию.
В качестве окислителя могут быть указаны, например, окислители на основе металлов, такие как диоксид марганца, пиридиний хлорхромат, пиридиний дихромат, оксид рутения и тому подобное, и так далее.
Количество окислителя, которое должно использоваться, предпочтительно составляет примерно 1 - примерно 10 молярных эквивалентов по отношению к соединению (VII).
В качестве растворителя, который не оказывает отрицательного воздействия на реакцию, могут быть указаны ароматические углеводороды, такие как бензол, толуол, ксилол и тому подобное; простые эфиры, такие как тетрагидрофуран, диоксан, простой диэтиловый эфир и тому подобное; галогенированные углеводороды, такие как хлороформ, дихлорметан и тому подобное; и так далее. Два или более видов этих растворителей могут использоваться в смеси при соответствующих отношениях.
Температура реакции составляет, как правило, примерно -50 - примерно 150°C, предпочтительно, примерно от -10 примерно до 100°C.
Время реакции составляет, как правило, примерно 0,5 - примерно 20 час.
В дополнение к этому, соединение (IX) может быть также получено посредством добавления реакционноспособного реагента, такого как комплекс триоксида серы и пиридина или оксалил хлорид и тому подобное, к соединению (VII), в смешанном растворителе из сульфоксидов, таких, как диметилсульфоксид и тому подобное, и галогенированных углеводородов, таких как хлороформ, дихлорметан и тому подобное, а затем взаимодействия с органическим основанием, таким как триэтиламин, N-метилморфолин и тому подобное.
Количество реакционноспособного реагента, которое должно использоваться, предпочтительно составляет примерно 1 - примерно 10 молярных эквивалентов, по отношению к соединению (VII).
Количество органического основания, которое должно использоваться, предпочтительно составляет примерно 1 - примерно 10 молярных эквивалентов, по отношению к соединению (VII).
Температура реакции составляет, как правило, примерно от -50 примерно до 150°C, предпочтительно, примерно от -10 примерно до 100°C.
Время реакции составляет, как правило, примерно 0,5 - примерно 20 час.
Соединение (IX), полученное таким образом, может быть выделено и очищено с помощью известных средств разделения и очистки, таких, как концентрирование, концентрирование при пониженном давлении, экстракция растворителем, кристаллизация, перекристаллизация, перенос фазы, хроматография и тому подобное. Является также возможным использование реакционной смеси, содержащей соединение (IX), в качестве исходного материала для следующей реакции, без выделения или очистки соединения (IX).
(Стадия 3) Реакция добавления углерода
На этой стадии, соединение (V-1) получают посредством взаимодействия соединения (IX) с реагентом на основе органического соединения фосфора в присутствии основания в растворителе, который не оказывает отрицательного воздействия на реакцию.
В качестве реагента на основе органического соединения фосфора могут быть указаны, например, метил диметилфосфоноацетат, этил диэтилфосфоноацетат, этил диметилфосфоноацетат и тому подобное.
Количество органического реагента на основе фосфора, которое должно использоваться, предпочтительно составляет примерно 1 - примерно 10 молярных эквивалентов по отношению к соединению (IX).
В качестве основания могут быть указаны, например, соли щелочных металлов, такие как гидроксид калия, гидроксид натрия, бикарбонат натрия, карбонат калия и тому подобное; соли щелочноземельных металлов, такие как карбонат бария, карбонат кальция, гидроксид бария, гидроксид кальция и тому подобное; амины, такие как пиридин, триэтиламин, N,N-диметиланилин, 1,8-диазабицикло[5,4,0]ундек-7-ен и тому подобное; гидриды металлов, такие как гидрид калия, гидрид натрия и тому подобное; алкоксиды щелочных металлов, такие как метоксид натрия, этоксид натрия, трет-бутоксид калия и тому подобное, и так далее.
Количество этих оснований, которое должно использоваться, предпочтительно составляет примерно 1 - примерно 5 молярных эквивалентов по отношению к соединению (IX).
В качестве растворителя, который не оказывает отрицательного воздействия на реакцию, могут быть указаны, например, ароматические углеводороды, такие как бензол, толуол, ксилол и тому подобное; простые эфиры, такие как тетрагидрофуран, диоксан, простой диэтиловый эфир и тому подобное; галогенированные углеводороды, такие как хлороформ, дихлорметан и тому подобное; амиды, такие как N,N-диметилформамид и тому подобное; сульфоксиды, такие как диметилсульфоксид и тому подобное; и так далее. Два или более видов этих растворителей могут использоваться в смеси при соответствующих отношениях.
Температура реакции составляет, как правило, примерно от -50 примерно до 150°C, предпочтительно, примерно -10 примерно до 100°C.
Время реакции составляет, как правило, примерно 0,5 - примерно 20 час.
Соединение (V-1), полученное таким образом, может быть выделено и очищено с помощью известных средств разделения и очистки, таких, как концентрирование, концентрирование при пониженном давлении, экстракция растворителем, кристаллизация, перекристаллизация, перенос фазы, хроматография и тому подобное. Является также возможным использование реакционной смеси, содержащей соединение (V-1), в качестве исходного материала для следующей реакции, без выделения или очистки соединения (V-1).
(Стадия 4) Реакция гидрирования
Эту реакцию осуществляют в соответствии с обычным способом в атмосфере водорода или в присутствии источников водорода из муравьиной кислоты и тому подобное, и катализатора на основе металла, в растворителе, который не оказывает отрицательного воздействия на реакцию.
В качестве катализатора на основе металла могут быть указаны, например, катализаторы на основе переходных металлов, такие как палладий на угле, палладий на карбонате бария, палладий на саже, оксид платина, платина на угле, никелевый катализатор Ренея, катализатор Уилкинсона и тому подобное, и так далее.
Количество катализатора на основе металла, которое должно использоваться, предпочтительно составляет примерно 0,01 - примерно 10 молярных эквивалентов, по отношению к соединению (V-1).
В качестве растворителя, который не оказывает отрицательного воздействия на реакцию, могут быть указаны, например, ароматические углеводороды, такие как бензол, толуол, ксилол и тому подобное; простые эфиры, такие как тетрагидрофуран, диоксан, простой диэтиловый эфир и тому подобное; галогенированные углеводороды, такие как хлороформ, дихлорметан и тому подобное; амиды, такие как N,N-диметилформамид и тому подобное; спирты, такие как метанол, этанол, изопропанол и тому подобное; и так далее. Два или более видов этих растворителей могут использоваться в смеси, при соответствующих отношениях.
Температура реакции составляет, как правило, примерно от -50 примерно до 150°C, предпочтительно, примерно от -10 примерно до 100°C.
Время реакции составляет, как правило, примерно 0,5 - примерно 20 час.
Соединение (V-2), полученное таким образом, может быть выделено и очищено с помощью известных средств разделения и очистки, таких, как концентрирование, концентрирование при пониженном давлении, экстракция растворителем, кристаллизация, перекристаллизация, перенос фазы, хроматография и тому подобное.
Соединение (Ib) формулы (I), где Z представляет собой Za [Za представляет собой -O-, -S- или -NR2- (R2 является таким, как определено выше)] может быть получено, например, с помощью следующего способа D.
[Способ D]

где L представляет собой удаляемую группу, а другие символы являются такими, как определено выше.
В качестве удаляемой группы для L могут быть указаны, например, атом галогена, -OSO2R8 (R8 представляет собой атом водорода, C1-4алкильную группу, C6-10арильную группу, необязательно замещенную C1-4алкильной группой, C7-14аралкильную группу, необязательно замещенную C1-4алкильной группой) и тому подобное.
Здесь в качестве атома галогена могут быть указаны фтор, хлор, бром, иод и тому подобное.
В качестве C1-4алкильной группы "C1-4алкильной группы", "C6-10арильной группы, необязательно замещенной C1-4алкильной группой" и "C7-14аралкильной группы, необязательно замещенной C1-4алкильной группой" для R8, могут быть указаны метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил и трет-бутил. Среди них метил является предпочтительным.
В качестве C6-10арильной группы "C6-10арильной группы, необязательно замещенной C1-4алкильной группой" для R8, могут быть указаны фенил и нафтил. Среди них фенил является предпочтительным.
В качестве C7-14аралкильной группы "C7-14аралкильной группы, необязательно замещенной C1-4алкильной группой" для R8, могут быть указаны бензил, фенетил и нафтилметил. Среди них бензил является предпочтительным.
Удаляемая группа для L предпочтительно представляет собой атом галогена (предпочтительно, хлора), метансульфонилокси и тому подобное.
Соединение (Ib) может быть получено, например, путем воздействия на соединение (X) и соединение (XI) реакции Мицунобу.
Эту реакцию осуществляют в соответствии с обычным способом в присутствии фосфина и азосоединения в растворителе, который не оказывает отрицательного воздействия на реакцию.
В качестве фосфинового соединения могут быть указаны, например, триметилфосфин, триэтилфосфин, трибутилфосфин, трифенилфосфин, дифенилпиридилфосфин, цианометилен трибутилфосфоран и тому подобное.
В качестве азосоединения могут быть указаны, например, диэтил азодикарбоксилат, диизопропил азодикарбоксилат, азодикарбонилдипиперидин и тому подобное.
Когда цианометилен трибутилфосфоран используется в качестве фосфинового соединения, реакция может осуществляться в отсутствие азосоединения.
Количество соединения (XI), которое должно использоваться, составляет, как правило, 1-20 эквивалентов, предпочтительно, 1-10 эквивалентов, по отношению к соединению (X).
Количество фосфинового соединения и азосоединения, которое должно использоваться, составляет, как правило, 1-50 эквивалентов, предпочтительно, 1-10 эквивалентов, по отношению к соединению (X).
В качестве растворителя, который не оказывает отрицательного воздействия на реакцию, могут быть указаны, например, ароматические углеводороды, такие как бензол, толуол, ксилол и тому подобное; простые эфиры, такие как тетрагидрофуран, диоксан, простой диэтиловый эфир и тому подобное; галогенированные углеводороды, такие как хлороформ, дихлорметан и тому подобное; амиды, такие как N,N-диметилформамид и тому подобное; и так далее. Два или более видов этих растворителей могут использоваться в смеси при соответствующих отношениях.
Температура реакции составляет, как правило, примерно от -20 примерно до 150°C, предпочтительно, примерно от -10 примерно до 100°C.
Время реакции составляет, как правило, примерно 0,1 - примерно 20 час.
Соединение (Ib), полученное таким образом, может быть выделено и очищено с помощью известных средств разделения и очистки, таких как концентрирование, концентрирование при пониженном давлении, экстракция растворителем, кристаллизация, перекристаллизация, перенос фазы, хроматография и тому подобное.
Соединение (Ib) также может быть получено посредством преобразования соединения (X) в его реакционно-способное производное, соединение (XII) и взаимодействия соединения (XII) с соединением (XI).
Соединение (XII) может быть получено путем взаимодействия соединения (X) с соответствующим активирующим реагентом в растворителе, который не оказывает отрицательного воздействия на реакцию, когда необходимо, в присутствии основания.
Здесь в качестве активирующего реагента могут использоваться реагенты, соответствующие указанной выше удаляемой группе L. Конкретные примеры активирующего реагента включают в себя тионилхлорид, метансульфонил хлорид и тому подобное.
Количество активирующего реагента, которое должно использоваться, предпочтительно составляет, примерно 1 - примерно 10 молярных эквивалентов, по отношению к соединению (X).
В качестве основания могут быть указаны, например, соли щелочных металлов, такие как гидроксид калия, гидроксид натрия, бикарбонат натрия, карбонат калия и тому подобное; соли щелочноземельных металлов, такие как карбонат бария, карбонат кальция, гидроксид бария, гидроксид кальция и тому подобное; амины, такие как пиридин, триэтиламин, N,N-диметиланилин, 1,8-диазабицикло[5,4,0]ундец-7-ен и тому подобное; гидриды металлов, такие как гидрид калия, гидрид натрия и тому подобное; алкоксиды щелочных металлов, такие как метоксид натрия, этоксид натрия, трет-бутоксид калия и тому подобное; и так далее.
Количество этих оснований, которое должно использоваться, предпочтительно составляет примерно 1 - примерно 10 молярных эквивалентов, по отношению к соединению (X).
В качестве растворителя, который не оказывает отрицательного воздействия на реакцию, могут быть указаны, например, ароматические углеводороды, такие как бензол, толуол, ксилол и тому подобное; простые эфиры, такие как тетрагидрофуран, диоксан, простой диэтиловый эфир и тому подобное; галогенированные углеводороды, такие как хлороформ, дихлорметан и тому подобное; амиды, такие как N,N-диметилформамид и тому подобное; и так далее. Два или более видов этих растворителей могут использоваться в смеси при соответствующих отношениях, или могут использоваться в смеси с водой. Когда указанный выше растворитель используется в смеси с водой, отношение смешивания воды составляет, например, 0,1-1000%, предпочтительно, 1-100%, по объему, по отношению к растворителю.
Температура реакции составляет, как правило, примерно от -20 примерно до 150°C, предпочтительно, примерно от -10 примерно до 100°C.
Время реакции составляет, как правило, примерно 0,1 - примерно 20 час.
Соединение (XII), полученное таким образом, может быть выделено и очищено с помощью известных средств разделения и очистки, таких как концентрирование, концентрирование при пониженном давлении, экстракция растворителем, кристаллизация, перекристаллизация, перенос фазы, хроматография и тому подобное. Является также возможным использование реакционной смеси, содержащей соединение (XII), в качестве исходного материала для следующей реакции, без выделения или очистки соединения (XII).
Взаимодействие соединения (XII) с соединением (XI) осуществляют в растворителе, который не оказывает отрицательного воздействия на реакцию, когда необходимо, в присутствии основания.
В качестве основания могут быть указаны, например, соли щелочных металлов, такие как гидроксид калия, гидроксид натрия, бикарбонат натрия, карбонат калия и тому подобное; соли щелочноземельных металлов, такие как карбонат бария, карбонат кальция, гидроксид бария, гидроксид кальция и тому подобное; амины, такие как пиридин, триэтиламин, N,N-диметиланилин, 1,8-диазабицикло[5,4,0]ундец-7-ен и тому подобное; гидриды металлов, такие как гидрид калия, гидрид натрия и тому подобное; алкоксиды щелочных металлов, такие как метоксид натрия, этоксид натрия, трет-бутоксид калия и тому подобное; и так далее.
Количество этих оснований, которое должно использоваться, предпочтительно составляет примерно 1 - примерно 10 молярных эквивалентов по отношению к соединению (XII).
В качестве растворителя, который не оказывает отрицательного воздействия на реакцию, могут быть указаны, например, ароматические углеводороды, такие как бензол, толуол, ксилол и тому подобное; простые эфиры, такие как тетрагидрофуран, диоксан, простой диэтиловый эфир и тому подобное; галогенированные углеводороды, такие как хлороформ, дихлорметан и тому подобное; амиды, такие как N,N-диметилформамид и тому подобное; и так далее. Два или более видов этих растворителей могут использоваться в смеси при соответствующих отношениях, или могут использоваться в смеси с водой. Когда указанный выше растворитель используется в смеси с водой, отношение смешивания воды составляет, например, 0,1-1000%, предпочтительно, 1-100%, по объему, по отношению к растворителю.
Количество соединения (XI), которое должно использоваться, составляет, как правило, 1-20 эквивалентов, предпочтительно, 1-10 эквивалентов, по отношению к соединению (XII).
Температура реакции составляет, как правило, примерно от -20 примерно до 150°C, предпочтительно, примерно от -10 примерно до 100°C.
Время реакции составляет, как правило, примерно 0,1 - примерно 20 час.
Соединение (Ib), полученное таким образом, может быть выделено и очищено с помощью известных средств разделения и очистки, таких как концентрирование, концентрирование при пониженном давлении, экстракция растворителем, кристаллизация, перекристаллизация, перенос фазы, хроматография и тому подобное.
Соединение (X) и соединение (XI), которые должны использоваться в качестве исходного соединения в указанном выше способе D, могут быть получены с помощью способа, который сам по себе известен, или способа, аналогичного ему.
Из соединений (X), соединение (Xa), где X представляет собой -(CH2)3-, может быть получено, например, с помощью следующего способа E.
[Способ E]
где символы являются такими, как определено выше.
В этом способе соединение (V-2) подвергают реакции восстановления с получением соединения (Xa).
Эту реакцию осуществляют таким же способом, как и на стадии 1a указанного выше способа C.
Соединение (Xa), полученное таким образом, может быть выделено и очищено с помощью известных средств разделения и очистки, таких, как концентрирование, концентрирование при пониженном давлении, экстракция растворителем, кристаллизация, перекристаллизация, перенос фазы, хроматография и тому подобное.
Из соединений (X) соединение, где X является иным, чем -(CH2)3-, также может быть получено с помощью указанного выше способа E, или способа, аналогичного ему.
Соединение (Ic) формулы (I), где Z представляет собой -NR2CO- (R2 является таким, как определено выше), может быть получено, например, с помощью, следующего способа F.
[Способ F]

где символы являются такими, как определено выше.
В этом способе соединение (XIII) подвергают реакции амидирования с получением соединения (Ic). Эту реакцию осуществляют таким же способом, как в указанном выше способе A.
Соединение (XIII) и соединение (XIV) могут быть получены с помощью способа, который сам по себе известен.
Соединение (Ic), полученное таким образом, может быть выделено и очищено с помощью известных средств разделения и очистки, таких, как концентрирование, концентрирование при пониженном давлении, экстракция растворителем, кристаллизация, перекристаллизация, перенос фазы, хроматография и тому подобное.
Из указанных выше соединений (Ia), соединение (Iaa) представленное формулой:

где каждый символ является таким, как определено выше, может быть получено путем взаимодействия указанного выше соединения (III) с соединением, представленным формулой:

где каждый символ является таким, как определено выше.
Эту реакцию осуществляют таким же способом, как в указанном выше способе A. В этой реакции соединение (IV'), которое должно использоваться в качестве исходного соединения, может быть получено с помощью способа, который сам по себе известен.
Соединение (Iaa), полученное таким образом, может быть выделено или очищено с помощью известных способов разделения и очистки, таких как концентрирование, концентрирование при пониженном давлении, экстракция растворителем, кристаллизация, перекристаллизация, перенос фазы, хроматография и тому подобное.
Из указанных выше соединений (IX) соединение (IXa), где кольцо A представляет собой пиразол, замещенный C1-6алкильной группой, может быть также получено, например, с помощью следующего способа G.
[Способ G]

где B является таким как определено выше; W представляет собой -OH или -N(алк2)(алк3); алк1, алк2, алк3 и алк4 являются одинаковыми или различными, и каждый из них представляет собой C1-6алкильную группу.
В качестве C1-6алкильной группы для алк1, алк2, алк3 или алк4 могут быть указаны, например, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил и тому подобное. Среди них метил является предпочтительным.
В качестве C7-13аралкильной группы для алк4 может быть указан, например, бензил и тому подобное.
(Стадия 1)
Эта стадия может осуществляться в соответствии со способом, который сам по себе известен, таким как способ, описанный в Inorganic Chemistry, 28, 1093(1989), или в соответствии со способом, аналогичным ему.
Сначала соединение (XIV) взаимодействует со сложным эфиром муравьиной кислоты (например, низшим сложным алкиловым эфиром, таким как метилформиат, этилформиат, пропилформиат и тому подобное) в присутствии основания с получением соединения (XV), где W представляет собой -OH.
Эту реакцию, как правило, осуществляют в растворителе, который не оказывает отрицательного воздействия на реакцию. В качестве растворителя, который не оказывает отрицательного воздействия на реакцию, используются, например, спирты (например, метанол, этанол, пропанол, изопропанол, бутанол, трет-бутанол, метоксиэтанол и тому подобное), галогенированные углеводороды (например, дихлорметан, хлороформ, 1,2-дихлорэтан, 1,1,2,2-тетрахлорэтан и тому подобное), ароматические углеводороды (например, бензол, толуол, ксилол, хлорбензол, дихлорбензол, нитробензол и тому подобное), простые эфиры (например, простой этиловый эфир, простой изопропиловый эфир, простой трет-бутилметиловый эфир, тетрагидрофуран, диоксан и тому подобное), нитрилы (например, ацетонитрил, пропионитрил и тому подобное), диметилформамид, диметилацетамид, N-метилпирролидон, диметилсульфоксид, гексаметилфосфорамид и тому подобное. Два или более видов этих растворителей могут использоваться в смеси при соответствующих отношениях.
В качестве основания, используются, например, третичные амины (например, триметиламин, триэтиламин, трибутиламин, N-этилдиизопропиламин, N-метилморфолин, DBU (1,8-диазабицикло[5,4,0]-7-ундецен), DBN (1,5-диазабицикло[4,3,0]-5-нонен) и тому подобное), карбонаты щелочных металлов (например, бикарбонат натрия, карбонат калия, карбонат натрия, карбонат цезия и тому подобное), гидроксиды щелочных металлов (например, гидроксид калия, гидроксид натрия, гидроксид кальция и тому подобное), алкоксиды (например, метоксид натрия, этоксид натрия, пропоксид натрия, трет-бутоксид калия, трет-бутоксид натрия и тому подобное), гидрид калия, гидрид натрия, амид натрия, металлический калий, металлический натрий и тому подобное.
Количество сложного эфира муравьиной кислоты и основания, которое должно использоваться, составляет, как правило, 1-10 эквивалентов, предпочтительно, 1-5 эквивалентов, для каждого, по отношению к соединению (XIV).
Температура реакции составляет, как правило, -20-150°C, предпочтительно, -10-100°C.
Время реакции составляет, как правило, 30 мин - 24 час, предпочтительно, 1 час - 15 час.
В дополнение к этому, соединение (XV), где W представляет собой -N(алк2)(алк3) (алк2 и алк3 являются одинаковыми или различными, и каждый из них представляет собой C1-6алкильную группу), может быть получено посредством взаимодействия соединения (XIV) с диметилформамид ди-C1-6алкилацеталями (например, диметилформамид диметилацеталем, диметилформамид диэтилацеталем, диметилформамид дипропилацеталем, диметилформамид диизопропилацеталем и тому подобное), бисдиметиламинометоксиметаном или трисдиметиламинометаном.
Эту реакцию, как правило, осуществляют в растворителе, который не оказывает отрицательного воздействия на реакцию. В качестве растворителя, который не оказывает отрицательного воздействия на реакцию, используются, например, спирты (например, метанол, этанол, пропанол, изопропанол, бутанол, трет-бутанол, метоксиэтанол и тому подобное), галогенированные углеводороды (например, дихлорметан, хлороформ, 1,2-дихлорэтан, 1,1,2,2-тетрахлорэтан и тому подобное), ароматические углеводороды (например, бензол, толуол, ксилол, хлорбензол, дихлорбензол, нитробензол и тому подобное), простые эфиры (например, простой этиловый эфир, простой изопропиловый эфир, простой трет-бутилметиловый эфир, тетрагидрофуран, диоксан и тому подобное), нитрилы (например, ацетонитрил, пропионитрил и тому подобное), диметилформамид, диметилацетамид, N-метилпирролидон, диметилсульфоксид, гексаметилфосфорамид и тому подобное. Два или более видов этих растворителей могут использоваться в смеси при соответствующих отношениях. Является также возможным осуществление реакции без растворителя.
Количество указанных выше диметилформамид ди-C1-6алкилацеталей, бисдиметиламинометоксиметана и трисдиметиламинометана, которое должно использоваться, составляет, как правило, 1-10 эквивалентов, предпочтительно, 1-5 эквивалентов, для каждого, по отношению к соединению (XIV).
Температура реакции составляет, как правило, -20-200°C, предпочтительно, -10-150°C.
Время реакции составляет, как правило, 30 мин - 24 час, предпочтительно 1 час - 15 час.
Соединение (XV), полученное таким образом, может быть выделено или очищено с помощью известных способов разделения и очистки, таких, как концентрирование, концентрирование при пониженном давлении, экстракция растворителем, кристаллизация, перекристаллизация, перенос фазы, хроматография и тому подобное. Реакционная смесь, содержащая соединение (XV), может использоваться в качестве исходного материала для следующей реакции, без выделения или очистки соединения (XV).
Соединение (XIV), используемое в качестве исходного соединения в этой реакции, может быть получено с помощью способа, который сам по себе известен.
(Стадия 2)
Затем соединение (XV) взаимодействует с C1-6алкилгидразином или C7-13аралкилгидразином в присутствии кислоты с получением соединения (XVI).
В качестве C1-6алкилгидразина могут быть указаны, например, метилгидразин, этилгидразин и тому подобное.
В качестве C7-13аралкилгидразина может быть указан, например, бензилгидразин и тому подобное.
Эту реакцию, как правило, осуществляют в растворителе, который не оказывает отрицательного воздействия на реакцию. В качестве растворителя, который не оказывает отрицательного воздействия на реакцию, используются, например, спирты (например, метанол, этанол, пропанол, изопропанол, бутанол, трет-бутанол, метоксиэтанол и тому подобное), галогенированные углеводороды (например, дихлорметан, хлороформ, 1,2-дихлорэтан, 1,1,2,2-тетрахлорэтан и тому подобное), ароматические углеводороды (например, бензол, толуол, ксилол, хлорбензол, дихлорбензол, нитробензол и тому подобное), простые эфиры (например, простой этиловый эфир, простой изопропиловый эфир, простой трет-бутилметиловый эфир, тетрагидрофуран, диоксан и тому подобное), нитрилы (например, ацетонитрил, пропионитрил и тому подобное), сложные эфиры (например, метилацетат, этилацетат, этилпропионат и тому подобное), диметилформамид, диметилацетамид, N-метилпирролидон, диметилсульфоксид, гексаметилфосфорамид и тому подобное. Два или более видов этих растворителей могут использоваться в смеси при соответствующих отношениях.
В качестве кислоты, которая должна использоваться для этой реакции, могут быть указаны, например, неорганические кислоты (например, хлористоводородная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота и тому подобное), органические кислоты (например, муравьиная кислота, уксусная кислота, пропионовая кислота, масляная кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, толуолсульфоновая кислота и тому подобное, камфорсульфоновая кислота и тому подобное) и так далее. Среди них сульфоновые кислоты являются предпочтительными, и п-толуолсульфоновая кислота является особенно предпочтительной.
Количество C1-6алкилгидразина, C7-13аралкилгидразина и кислоты, которые должно использоваться, составляет, как правило, 1-10 эквивалентов, предпочтительно 1-5 эквивалентов, для каждого, по отношению к соединению (XV).
В этой реакции C1-6алкилгидразин и C7-13аралкилгидразин могут использоваться в качестве кислотно-аддитивной соли. В качестве такой кислотно-аддитивной соли, могут быть указаны соли с неорганическими кислотами (например, гидрохлорид, сульфат) и соли с органическими кислотами (например, п-толуолсульфонат), представленные как соли соединений, представленных формулой (I). Когда C1-6алкилгидразин и C7-13аралкилгидразин используются в качестве кислотно-аддитивных солей, реакция может также осуществляться без добавления кислоты.
В этой реакции количество кислоты (включая количество кислоты, образующей кислотно-аддитивную соль), которое должно использоваться, предпочтительно составляет 1 эквивалент, по отношению к C1-6алкилгидразину или C7-13аралкилгидразину, и использование этого количества приводит к получению целевого соединения с высоким выходом.
Температура реакции составляет, как правило, -20-150°C, предпочтительно, -10-100°C.
Время реакции составляет, как правило, 30 мин - 24 час, предпочтительно, 1 час - 15 час.
Соединение (XVI), полученное таким образом, может быть выделено или очищено с помощью известных способов разделения и очистки, таких как концентрирование, концентрирование при пониженном давлении, экстракция растворителем, кристаллизация, перекристаллизация, перенос фазы, хроматография и тому подобное. Реакционная смесь, содержащая соединение (XVI), может использоваться в качестве исходного материал для следующей реакции, без выделения или очистки соединения (XVI).
(Стадия 3)
В дополнение к этому соединение (XVI) подвергают реакции формилирования в присутствии галогенирующего средства (например, фосфор оксихлорида, фосфор оксибромида, фосфор трихлорида, фосфор пентахлорида, тионил хлорида, фосгена и тому подобное) и так далее с получением соединения (IXa).
Эта реакция может осуществляться в соответствии с реакцией Вильсмеера-Хаака, известной, сама по себе, например, в соответствии со способом, изложенным в J. Chem. Soc., Perkin I, 2334(1979) [D. Reid, R. Webster, S. McKenzie], или в соответствии со способом, аналогичным ей.
Реакцию формилирования осуществляют с использованием формилирующего средства, такого как диметилформамид, N-метилацетанилид, N-этилацетанилид и тому подобное.
Эту реакцию, как правило, осуществляют в растворителе, который не оказывает отрицательного воздействия на реакцию. В качестве растворителя, который не оказывает отрицательного воздействия на реакцию, используются, например, галогенированные углеводороды (например, дихлорметан, хлороформ, 1,2-дихлорэтан, 1,1,2,2-тетрахлорэтан и тому подобное), ароматические углеводороды (например, хлорбензол, дихлорбензол, нитробензол и тому подобное), простые эфиры (например, простой этиловый эфир, простой изопропиловый эфир, простой трет-бутилметиловый эфир, простой бис(2-метоксиэтиловый) эфир, тетрагидрофуран, диоксан и тому подобное), нитрилы (например, ацетонитрил, пропионитрил и тому подобное), сложные эфиры (например, метилацетат, этилацетат, этилпропионат и тому подобное) и так далее. Два или более видов этих растворителей могут использоваться в смеси при соответствующих отношениях. В дополнение к этому указанный выше формилирующее средство может использоваться в качестве растворителя. В качестве сочетания галогенирующего средства и формилирующего средства, которое должно использоваться для этой реакции, предпочтительным является сочетание фосфор оксихлорид - диметилформамид.
Количество формилирующего средства и галогенирующего средства, которое должно использоваться, составляет, как правило, 1-10 эквивалентов, предпочтительно, 1-5 эквивалентов, для каждого, по отношению к соединению (XVI).
Температура реакции составляет, как правило, -20-200°C, предпочтительно -10-150°C.
Время реакции составляет, как правило, 30 мин - 24 час, предпочтительно 1 час - 15 час.
Соединение (IXa), полученное таким образом, может быть выделено или очищено с помощью известных способов разделения и очистки, таких как концентрирование, концентрирование при пониженном давлении, экстракция растворителем, кристаллизация, перекристаллизация, перенос фазы, хроматография и тому подобное.
Из соединений (III), которые должны использоваться в качестве исходного соединения, в указанном выше способе A, соединение (III-1), где X представляет собой -CH=CH-, может быть также получено в соответствии со следующим способом H.
[Способ H]

где каждый символ является таким, как определено выше.
В этом способе, соединение (IX) взаимодействует с малоновой кислотой с получением соединения (III-1). Эта реакция может осуществляться в соответствии со способом, который сам по себе известен, например, в соответствии со способами, описанными в New Courses in Experiment Chemistry; 14, Synthesis and Reaction of Organic Compounds [II] pp. 980-981; Organic Syntheses, Coll. Vol. 4, 731 (1963); J. Am. Chem. Soc., 80, 3645 (1958) и тому подобное, или в соответствии со способом, аналогичным им.
Например, эту реакцию осуществляют в присутствии основания, в растворителе, который не оказывает отрицательного воздействия на реакцию.
В качестве основания, используются, например, ароматические амины (например, пиридин, лютидин, хинолин), вторичные амины (например, пиперидин, пирролидин, морфолин, дициклогексиламин), третичные амины (например, триметиламин, триэтиламин, трибутиламин, N-этилдиизопропиламин, N-метилморфолин, DBU (1,8-диазабицикло[5,4,0]-7-ундецен), DBN (1,5-диазабицикло[4,3,0]-5-нонен) и тому подобное), карбонаты щелочных металлов (например, бикарбонат натрия, карбонат калия, карбонат натрия, карбонат цезия и тому подобное), гидроксиды щелочных металлов (например, гидроксид калия, гидроксид натрия, гидроксид кальция и тому подобное), алкоксиды (например, метоксид натрия, этоксид натрия, пропоксид натрия, трет-бутоксид калия, трет-бутоксид натрия и тому подобное), гидрид калия, гидрид натрия, амид натрия, металлический калий, металлический натрий и тому подобное. Из указанных выше оснований жидкие амины могут использоваться в качестве растворителя.
В качестве растворителя, который не оказывает отрицательного воздействия на реакцию, используются, например, спирты (например, метанол, этанол, пропанол, изопропанол, бутанол, трет-бутанол, метоксиэтанол и тому подобное), галогенированные углеводороды (например, дихлорметан, хлороформ, 1,2-дихлорэтан, 1,1,2,2-тетрахлорэтан и тому подобное), ароматические углеводороды (например, бензол, толуол, ксилол, хлорбензол, дихлорбензол, нитробензол и тому подобное), простые эфиры (например, простой этиловый эфир, простой изопропиловый эфир, простой трет-бутилметиловый эфир, простой бис(2-метоксиэтиловый) эфир, тетрагидрофуран, диоксан и тому подобное), нитрилы (например, ацетонитрил, пропионитрил и тому подобное), диметилформамид, диметилацетамид, N-метилпирролидон, диметилсульфоксид, гексаметилфосфорамид, вода и тому подобное. Два или более видов этих растворителей могут использоваться в смеси при соответствующих отношениях.
Количество малоновой кислоты, которое должно использоваться, составляет, как правило, 1-10 эквивалентов, предпочтительно, 1-5 эквивалентов, по отношению к соединению (IX).
Количество основания, которое должно использоваться, составляет, как правило, 1-10 эквивалентов, предпочтительно, 1-5 эквивалентов, по отношению к соединению (IX).
Температура реакции составляет, как правило, -20-180°C, предпочтительно, 0-120°C.
Время реакции составляет, как правило, 30 мин - 36 час, предпочтительно 1 час - 18 час.
Соединение (III-1), полученное таким образом может быть выделено или очищено с помощью известных способов разделения и очистки, таких как концентрирование, концентрирование при пониженном давлении, экстракция растворителем, кристаллизация, перекристаллизация, перенос фазы, хроматография и тому подобное.
В каждой из указанных выше реакций, когда исходное соединение имеет амино, карбокси, гидрокси или карбонил в качестве заместителя, эти группы могут иметь защитную группу, введенную в них, такую как группа, как правило, используемая в химии пептидов и тому подобное. Целевое соединение может быть получено путем удаления защитной группы, при необходимости, после реакции.
В качестве аминозащитной группы могут быть указаны, например, формил, C1-6алкилкарбонил (например, ацетил, пропионил и тому подобное), C1-6алкоксикарбонил (например, метоксикарбонил, этоксикарбонил, трет-бутоксикарбонил и тому подобное), бензоил, C7-13аралкилкарбонил (например, бензилкарбонил и тому подобное), C7-13аралкилоксикарбонил (например, бензилоксикарбонил, 9-фторенилметоксикарбонил и тому подобное), тритил, фталоил, N,N-диметиламинометилен, силил (например, триметилсилил, триэтилсилил, диметилфенилсилил, трет-бутилдиметилсилил, трет-бутилдиэтилсилил и тому подобное), C2-6алкенил (например, 1-аллил и тому подобное), и так далее. Эти группы являются необязательно замещенными 1-3 атомами галогена (например, фтора, хлора, брома, иода и тому подобное), C1-6алкокси (например, метокси, этокси, пропокси и тому подобное) или нитро и тому подобное.
В качестве карбоксизащитной группы могут быть указаны, например, C1-6алкил (например, метил, этил, пропил, изопропил, бутил, трет-бутил и тому подобное), C7-13аралкил (например, бензил и тому подобное), фенил, тритил, силил (например, триметилсилил, триэтилсилил, диметилфенилсилил, трет-бутилдиметилсилил, трет-бутилдиэтилсилил и тому подобное), C2-6алкенил (например, 1-аллил и тому подобное) и тому подобное. Эти группы являются необязательно замещенными 1-3 атомами галогена (например, фтора, хлора, брома, иода и тому подобное), C1-6алкокси (например, метокси, этокси, пропокси и тому подобное) или нитро и тому подобное.
В качестве гидроксизащитной группы могут быть указаны, например, C1-6алкил (например, метил, этил, пропил, изопропил, бутил, трет-бутил и тому подобное), фенил, тритил, C7-13аралкил (например, бензил и тому подобное), формил, C1-6алкилкарбонил (например, ацетил, пропионил и тому подобное), бензоил, C7-13аралкилкарбонил (например, бензилкарбонил и тому подобное), 2-тетрагидропиранил, 2-тетрагидрофуранил, силил (например, триметилсилил, триэтилсилил, диметилфенилсилил, трет-бутилдиметилсилил, трет-бутилдиэтилсилил и тому подобное), C2-6алкенил (например, 1-аллил и тому подобное) и тому подобное. Эти группы являются необязательно замещенными 1-3 атомами галогена (например, фтора, хлора, брома, иода и тому подобное), C1-6алкил (например, метил, этил, пропил и тому подобное), C1-6алкокси (например, метокси, этокси, пропокси и тому подобное) или нитро и тому подобное.
В качестве карбонилзащитной группы могут быть указаны, например, циклический ацеталь (например, 1,3-диоксан и тому подобное), нециклический ацеталь (например, ди-C1-6алкил ацеталь и тому подобное) и так далее.
Способ удаления этих защитных групп может осуществляться с помощью способов, известных, сами по себе, например, способов, описанных в Protective Groups in Organic Synthesis, John Wiley and Sons, 1980 и тому подобное. Например, применяются способы, использующие кислоты, основания, ультрафиолетовые лучи, гидразин, фенилгидразин, натрий N-метилдитиокарбамат, тетрабутиламмоний фторид, палладий ацетат, триалкилсилил галогенид (например, триметилсилил иодид, триметилсилил бромид и тому подобное), и так далее; и способ восстановления и тому подобное.
Когда исходное соединение может образовывать соль в каждой из указанных выше реакций, соединение может использоваться в форме соли. В качестве такой соли могут использоваться, например, соли, представленные, как соль соединения, представленного формулой (I).
Когда соединение по настоящему изобретению содержит оптические изомеры, стереоизомеры, региоизомеры и вращательные изомеры, они также включаются в соединение по настоящему изобретению и могут быть получены как отдельное соединение с помощью способа синтеза и способа разделения, известных, сами по себе. Например, когда существуют оптические изомеры соединения по настоящему изобретению, оптические изомеры, разрешаемые из соединения, также охватываются соединением по настоящему изобретению.
Оптические изомеры могут быть получены с помощью способа, который сам по себе известен. Конкретно, оптически активный изомер может быть получен с использованием оптически активного синтетического промежуточного соединения или с помощью оптического разрешения конечного рацемата посредством обычного способа.
Для оптического разрешения может использоваться способ, который сам по себе известен, такой как способ фракционной перекристаллизации, способ с хиральной колонкой, диастереомерный способ и тому подобное.
1) Способ фракционной перекристаллизации
Способ, согласно которому рацемат и оптически-активное соединение (например, (+)-миндальной кислоте, (-)-миндальной кислоте, (+)-винной кислоте, (-)-винной кислоте, (+)-1-фенэтиламину, (-)-1-фенэтиламину, цинхонину, (-)-цинхонидин, бруцину и тому подобное) образуют соль, которая затем отделяется фракционной перекристаллизацией, с последующим воздействием на соль, если это желательно, стадии нейтрализации с получением свободного оптического изомера.
2) Способ с хиральной колонкой
Способ разделения посредством нанесения рацемата или его соли на колонку для фракционирования оптических изомеров (хиральную колонку). В случае, например, жидкостной колоночной хроматографии, оптические изомеры разделяются посредством нанесения смеси оптических изомеров на хиральную колонку, такую как ENANTIO-OVM (производится Tosoh Corp.), CHIRAL SERIES (производится Daicel Co.) и тому подобное, и проявления водой, различными буферами (например, фосфатным буфером) и органическими растворителями (например, этанолом, метанолом, изопропанолом, ацетонитрилом, трифторуксусной кислотой, диэтиламином и тому подобное), поодиночке, или в виде их соответствующей смеси. В случае, например, газовой хроматографии, для разделения может использоваться хиральная колонка, такая как CP-Chirasil-DeX CB (производится GL Science Co.) и тому подобное.
3) Диастереомерный способ
Способ, где рацемическая смесь химически взаимодействует с оптически-активным реагентом с получением смеси диастереомеров, которая подвергается воздействию обычных средств разделения (например, фракционной перекристаллизации, хроматографии и тому подобное) с получением отдельного соединения, которое затем подвергается химической обработке (например, реакции гидролиза и тому подобное) для отделения активного центра оптически активного реагента от соединения с получением оптического изомера. Например, когда соединение по настоящему изобретению имеет в молекуле гидрокси или первичную или вторичную амино, соединение и оптически-активная органическая кислота (например, MTPA [α-метокси-α-(трифторметил)фенилуксусная кислота], (-)-метоксиуксусная кислота и тому подобное), или что-либо подобное, подвергаются реакции конденсации с получением, соответственно, соответствующего сложноэфирного или амидного диастереомера. С другой стороны, когда соединение по настоящему изобретению имеет группу карбоновой кислоты, соединение и оптически-активный реагент амина или спирта подвергается реакции конденсации с получением амидного или сложноэфирного диастереомера. Выделенный диастереомер затем подвергают реакции кислотного или основного гидролиза, посредством которой он преобразуется в оптический изомер исходного соединения.
Наилучший способ осуществления изобретения
Настоящее изобретение подробно объясняется далее с помощью ссылок на сравнительные примеры, примеры, экспериментальные примеры и примеры приготовления, которые не должны рассматриваться как ограничивающие.
В следующих далее сравнительных примерах и примерах "%" обозначает процент массовый, если конкретно не указывается иного. В дополнение к этому, комнатная температура означает температуру 1-30°C.
В сравнительных примерах и примерах ВЭЖХ измеряется при следующих условиях.
измерительный инструмент: система LC-10Avp, Shimadzu Seisakusho
колонка: CAPSEL PAK C18UG120 S-3 мкм, 2,0×50 мм
растворитель:
Раствор A; вода, содержащая 0,1% трифторуксусной кислоты
Раствор B; ацетонитрил, содержащий 0,1% трифторуксусной кислоты
цикл создания градиента: 0,00 мин (Раствор A/Раствор B=90/10), 4,00 мин (Раствор A/Раствор B=5/95), 5,50 мин (Раствор A/Раствор B=5/95), 5,51 мин (Раствор A/Раствор B=90/10), 8,00 мин (Раствор A/Раствор B=90/10)
инжектируемое количество: 2 мкл, скорость потока: 0,5 мл/мин, способ детектирования: УФ, 220 нм
В сравнительных примерах и примерах масс-спектр (МС) измеряют при следующих условиях.
измерительный инструмент: Micromass Ltd., platform II, Waters Corporation ZQ, или Waters Corporation ZMD
способ ионизации: химическая ионизация при атмосферном давлении (APCI) или электронная ионизация распылением (ESI)
устройство для препаративной ВЭЖХ: Gilson, Inc., высокопроизводительная система очистки
колонка: YMC Combiprep ODS-A S-5 мкм, 20×50 мм
растворитель:
Раствор A; вода, содержащая 0,1% трифторуксусной кислоты
Раствор B; ацетонитрил, содержащий 0,1% трифторуксусной кислоты
цикл создания градиента: 0,00 мин (Раствор A/Раствор B=90/10), 1,20 мин (Раствор A/Раствор B=90/10), 4,75 мин (Раствор A/Раствор B=0/100), 7,30 мин (Раствор A/Раствор B=0/100), 7,40 мин (Раствор A/Раствор B=90/10), 7,50 мин (Раствор A/Раствор B=90/10)
скорость потока: 25 мл/мин, способ детектирования: УФ, 220 нм
Сравнительный пример 1
Смесь этил 4-фторбензоилацетата (20,0 г) и N,N-диметилформамид диметилацеталя (24,5 г) перемешивают в течение 1 час при нагревании с обратным холодильником. Реакционную смесь концентрируют, и добавляют метилгидразин (9,3 г) и этанол (100 мл). Смесь перемешивают в течение 3 час при нагревании с обратным холодильником. Реакционную смесь концентрируют, выливают в воду и экстрагируют этилацетатом. Органический слой промывают водой, сушат над безводным сульфатом натрия и концентрируют с получением желтого масла (20,1 г). Это желтое масло растворяют в тетрагидрофуране (100 мл) и осторожно добавляют литий алюминий гидрид (3,26 г) при 0°C. Смесь перемешивают при 0°C в течение 1 час. Натрий сульфат декагидрат (38 г) осторожно добавляют в реакционную смесь и смесь перемешивают при комнатной температуре в течение 30 мин и фильтруют. Фильтрат концентрируют с получением 15,1 г желтого масла. 14,0 г этого желтого масла растворяют в тетрагидрофуране (200 мл) и добавляют к нему активированный диоксид марганца (50 г). Смесь перемешивают при комнатной температуре в течение 14 час. Реакционную смесь фильтруют и фильтрат концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением 5-(4-фторфенил)-1-метил-1H-пиразол-4-карбальдегида (4,25 г) в виде бесцветных кристаллов из фракции, элюируемой гексаном-этилацетатом (2:1, объем/объем).
ЯМР (CDCl3) δ: 3,81 (3H, c), 7,2-7,3 (2H, м), 7,35-7,45 (2H, м), 8,03 (1H, c), 9,60 (1H, c).
Из фракции, элюируемой после указанного выше соединения, получают 3-(4-фторфенил)-1-метил-1H-пиразол-4-карбальдегид (3,60 г) в виде бесцветных кристаллов.
ЯМР (CDCl3) δ: 3,99 (3H, c), 7,1-7,2 (2H, м), 7,7-7,8 (2H, м), 7,98 (1H, c), 9,90 (1H, c).
С использованием известного сложного β-кетоэфира (включая коммерчески доступные продукты) в качестве исходного материала, и подобным же способом, как и в сравнительном примере 1, получают соединения, описанные в сравнительных примерах 2-13 и 16.
Сравнительный пример 2
5-(4-Метоксифенил)-1-метил-1H-пиразол-4-карбальдегид
Выход: 41%. Бесцветные призматические кристаллы. Температура плавления: 82-83°C (перекристаллизуют из этилацетата-гексана).
Сравнительный пример 3
5-(4-Хлорфенил)-1-метил-1H-пиразол-4-карбальдегид
Выход: 28%. Бесцветные призматические кристаллы. Температура плавления: 78-80°C (перекристаллизуют из этилацетата-гексана).
Сравнительный пример 4
5-(3-Хлорфенил)-1-метил-1H-пиразол-4-карбальдегид
Выход: 25%. Бесцветные призматические кристаллы. Температура плавления: 91-92°C (перекристаллизуют из этилацетата-гексана).
Сравнительный пример 5
5-(4-Бромфенил)-1-метил-1H-пиразол-4-карбальдегид
Выход: 36%. Бесцветный твердый продукт.
МР (CDCl3) δ: 3,82 (3H, c), 7,25-7,35 (2H, м), 7,7-7,75 (2H, м), 8,05 (1H, c), 9,62 (1H, c).
Сравнительный пример 6
1-Метил-5-[4-(трифторметил)фенил]-1H-пиразол-4-карбальдегид
Выход: 31%. Бесцветные призматические кристаллы. Температура плавления: 66-67°C (перекристаллизуют из этилацетата-гексана).
Сравнительный пример 7
5-(2-Фторфенил)-1-метил-1H-пиразол-4-карбальдегид
Выход: 48%. Бледно-желтое масло.
H-ЯМР (CDCl3)δ: 3,80 (3H, c), 7,25-7,4 (3H, м), 7,5-7,6 (1H, м), 8,06 (1H, c), 9,61 (1H, c).
Сравнительный пример 8
5-(3-Фторфенил)-1-метил-1H-пиразол-4-карбальдегид
Выход: 20%. Бесцветные призматические кристаллы. Температура плавления: 115-116°C (перекристаллизуют из этилацетата-гексана).
Сравнительный пример 9
1-Метил-5-(4-метилфенил)-1H-пиразол-4-карбальдегид
Выход: 33%. Бесцветные призматические кристаллы. Температура плавления: 55-56°C (перекристаллизуют из этилацетата-гексана).
Сравнительный пример 10
1-Метил-5-(1-нафтил)-1H-пиразол-4-карбальдегид
Выход: 60%. Бесцветные призматические кристаллы. Температура плавления: 95-97°C (перекристаллизуют из этилацетата-гексана).
Сравнительный пример 11
1-Метил-5-фенил-1H-пиразол-4-карбальдегид
Выход: 34%. Бесцветные призматические кристаллы. Температура плавления: 100-101°C (перекристаллизуют из этилацетата-гексана).
Сравнительный пример 12
5-(2-Фурил)-1-метил-1H-пиразол-4-карбальдегид
Выход: 37%. Бесцветные призматические кристаллы. Температура плавления: 121-122°C (перекристаллизуют из этилацетата-гексана).
Сравнительный пример 13
1-Этил-5-(4-фторфенил)-1H-пиразол-4-карбальдегид
Выход: 24%. Бледно-желтое масло.
ЯМР (CDCl3) δ: 1,42 (3H, т, J=7 Гц), 4,08 (2H, кв, J=7 Гц), 7,2-7,3 (2H, м), 7,35-7,45 (2H, м), 8,06 (1H, c), 9,58 (1H, c).
Сравнительный пример 14
Смесь этил 4-фторбензоилацетата (10,0 г) и N,N-диметилформамид диметилацеталя (8,54 г) перемешивают в течение 1 часа при нагревании с обратным холодильником. Реакционную смесь концентрируют и добавляют бензилгидразин-оксалат (15,2 г) и этанол (100 мл). Смесь перемешивают в течение 3 час при нагревании с обратным холодильником. Реакционную смесь концентрируют, добавляют воду и экстрагируют смесь этилацетатом. Органический слой промывают водой, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением смеси (11,83 г) этил 1-бензил-5-(4-фторфенил)-1H-пиразол-4-карбоксилата и этил 1-бензил-3-(4-фторфенил)-1H-пиразол-4-карбоксилата из фракции, элюируемой гексаном-этилацетатом (4:1, объем/объем).
ЯМР (CDCl3) δ: 1,17 (3H×0,7, т, J=7,2 Гц), 1,26 (3H×0,3, т, J=7,2 Гц), 4,10-4,28 (2H, м), 5,17 (2H×0,7, c), 5,32 (2H×0,3, c), 6,94-7,82 (9H, м), 7,90 (1H×0,3, c), 8,05 (1H×0,7, c).
Эту смесь (11,83 г) растворяют в тетрагидрофуране (200 мл), осторожно добавляют литий алюминий гидрид (1,38 г) при 0°C и смесь перемешивают при 0°C в течение 1 час. 1н. водный раствор гидроксида натрия осторожно добавляют в реакционную смесь до тех пор, пока твердый продукт не перестанет осаждаться. Смесь перемешивают при комнатной температуре в течение 30 мин и фильтруют. Фильтрат концентрируют с получением 10,29 г желтого масла. Это желтое масло растворяют в тетрагидрофуране (200 мл), добавляют активированный диоксид марганца (30 г) и смесь перемешивают при комнатной температуре в течение 14 час. Реакционную смесь фильтруют и фильтрат концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением смеси (7,8 г, выход 59%) 1-бензил-5-(4-фторфенил)-1H-пиразол-4-карбальдегида и 1-бензил-3-(4-фторфенил)-1H-пиразол-4-карбальдегида из фракции, элюируемой гексаном-этилацетатом (4:1-2:1, объем/объем).
ЯМР (CDCl3) δ: 5,24 (2H×0,7, c), 5,35 (2H×0,3, c), 6,98-7,80 (9H, м), 7,92 (1H×0,3, c), 8,11 (1H×0,7, c), 9,59 (1H×0,7, c), 9,87 (1H×0,3, c).
Сравнительный пример 15
Смесь 4-фтор-N-метилбензогидразида (5,0 г), этил ацетоацетата (4,84 г) и этанола (140 мл) перемешивают в течение 14 час при нагревании с обратным холодильником. Реакционную смесь концентрируют, добавляют воду и экстрагируют смесь этилацетатом. Органический слой промывают водой, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением масла из фракции, элюируемой гексаном-этилацетатом (4:1-1:1, объем/объем). Это масло растворяют в этаноле (50 мл), добавляют 1,8-диазабицикло[5,4,0]-7-ундецен (0,5 мл) и смесь перемешивают в течение 4 час при нагревании с обратным холодильником. В реакционную смесь добавляют воду и экстрагируют смесь этилацетатом. Органический слой промывают водой, сушат над безводным сульфатом магния и концентрируют с получением этил 5-(4-фторфенил)-1,3-диметил-1H-пиразол-4-карбоксилата (3,41 г, выход 44%) в виде бесцветных кристаллов.
ЯМР (CDCl3) δ: 1,11 (3H, т, J=7,0 Гц), 2,50 (3H, c), 3,63 (3H, c), 4,11 (2H, кв, J=7,0 Гц), 7,10-7,24 (2H, м), 7,26-7,38 (2H, м).
Этил 5-(4-фторфенил)-1,3-диметил-1H-пиразол-4-карбоксилат (3,25 г) растворяют в тетрагидрофуране (200 мл), осторожно добавляют литий алюминий гидрид (0,47 г), при 0°C и смесь перемешивают при комнатной температуре, в течение 2 час. 2н. Водный раствор гидроксида натрия осторожно добавляют в реакционную смесь до тех пор, пока твердый продукт не перестанет осаждаться и после перемешивания при комнатной температуре в течение 30 мин смесь фильтруют. Фильтрат концентрируют с получением 2,59 г бледно-желтого масла. Это бледно-желтое масло растворяют в тетрагидрофуране (200 мл) и добавляют активированный диоксид марганца (20 г). Смесь перемешивают при комнатной температуре в течение 14 час. Реакционную смесь фильтруют и фильтрат концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением 5-(4-фторфенил)-1,3-диметил-1H-пиразол-4-карбальдегида (1,63 г, выход 61%) в виде бесцветного порошка из фракции, элюируемой гексаном-этилацетатом (4:1-1:1, объем/объем). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 130-131°C.
Сравнительный пример 16
5-Циклогексил-1-метил-1H-пиразол-4-карбальдегид
Выход: 36%. Бесцветные призматические кристаллы. Температура плавления: 83-84°C (перекристаллизуют из этилацетата-гексана).
Сравнительный пример 17-1
Смесь 4-фторанилина (11,1 г), этилформиата (25,0 г) и этанола (150 мл) перемешивают при 65°C в течение 2 час. В реакционную смесь добавляют толуолсульфонилметил изоцианид (23,4 г), и смесь перемешивают в течение 2 час. при нагревании с обратным холодильником. Реакционную смесь концентрируют и выливают в воду. Выпавшие твердые продукты собирают фильтрацией, промывают водой и сушат с получением этил 1-(4-фторфенил)-1H-имидазол-5-карбоксилата (19,8 г, 85%). Его перекристаллизация из этилацетата-гексана дает бледно-желтые призматические кристаллы. Температура плавления: 114-115°C.
Сравнительный пример 17-2
К раствору этил 1-(4-фторфенил)-1H-имидазол-5-карбоксилата (9,37 г) в тетрагидрофуране (100 мл) добавляют по каплям диизобутилалюминий гидрид (1,5 моль/л толуоловый раствор, 60 мл) при 0°C. Смесь перемешивают при 0°C в течение 1 час., добавляют натрий сульфат декагидрат (13,0 г), и смесь перемешивают при комнатной температуре, в течение 1 час. Реакционную смесь фильтруют, и органический слой концентрируют с получением [1-(4-фторфенил)-1H-имидазол-5-ил]метанола (4,10 г, 53%) в виде кристаллов. Его перекристаллизация из этилацетата-простого изопропилового эфира дает бледно-желтые призматические кристаллы. Температура плавления: 96-98°C.
Сравнительный пример 17-3
Смесь [1-(4-фторфенил)-1H-имидазол-5-ил]метанола (2,50 г), активированного диоксида марганца (10 г) и тетрагидрофурана (150 мл) перемешивают при комнатной температуре в течение 3 час. Реакционную смесь фильтруют, и органический слой концентрируют с получением 1-(4-фторфенил)-1H-имидазол-5-карбальдегида (2,20 г, 89%) в виде кристаллов. Его перекристаллизация из этилацетата-гексана дает бледно-желтые призматические кристаллы. Температура плавления: 131-133°C.
Сравнительный пример 18
Смесь 4'-фторпропиофенона (7,50 г), п-толуолсульфонил гидразида (9,30 г), этанола (100 мл) и уксусной кислоты (1 мл) перемешивают в течение 1 час. с обратным холодильником. Реакционную смесь охлаждают до комнатной температуры, и выпавшие твердые продукты собирают фильтрацией и сушат с получением N'-[1-(4-фторфенил)пропилиден]-4-метилбензолсульфоногидразида (12,0 г, выход 73%) в виде белых кристаллов.
ЯМР (CDCl3) δ: 1,09 (3H, т, J=7,5 Гц), 2,42 (3H, c), 2,58 (2H, кв, J=7,5 Гц), 6,95-7,05 (2H, м), 7,32 (2H, д,J=8,5 Гц), 7,55-7,65 (2H, м), 7,90 (2H, д, J=8,5 Гц), 8,07 (1H, ушир.c).
N'-[1-(4-Фторфенил)пропилиден]-4-метилбензолсульфоногидразид (12,0 г) растворяют в тионилхлориде (30 мл), и смесь перемешивают при комнатной температуре в течение 1 час. Реакционную смесь выливают в 1н. водный раствор гидроксида натрия. Выпавшие твердые продукты собирают фильтрацией, промывают водой и сушат в потоке воздуха с получением 4-(4-фторфенил)-5-метил-1,2,3-тиадиазола (6,19 г, 65%) в виде желтого твердого продукта.
ЯМР (CDCl3) δ: 2,71 (3H, c), 7,15-7,25 (2H, м), 7,7-7,8 (2H, м).
Смесь 4-(4-фторфенил)-5-метил-1,2,3-тиадиазола (6,19 г), N-бромсукцинимида (12,4 г), 2,2'-азобис(изобутиронитрила) (100 мг) и четыреххлористого углерода (100 мл) перемешивают в течение 6 час при нагревании с обратным холодильником. Реакционную смесь промывают водой, сушат над безводным сульфатом магния и концентрируют. К остатку добавляют ацетат натрия (30 г) и уксусную кислоту (100 мл), и смесь перемешивают в течение 12 час с обратным холодильником. Добавляют 6н. хлористоводородную кислоту (50 мл), и смесь дополнительно перемешивают в течение 1 час при нагревании с обратным холодильником. Реакционную смесь концентрируют, выливают в насыщенный водный раствор бикарбоната натрия и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением 4-(4-фторфенил)-1,2,3-тиадиазол-5-карбальдегида (360 мг, выход 5,4%) в виде бледно-желтых кристаллов из фракции, элюируемой гексаном-этилацетатом (2:1, объем/объем).
ЯМР (CDCl3) δ: 7,25-7,35 (2H, м), 7,8-7,9 (2H, м), 10,11 (1H, c).
Сравнительный пример 19
Смесь этил диэтоксиацетата (17,6 г), гидразина моногидрата (5,50 г) и этанола (100 мл) перемешивают в течение 6 час при нагревании с обратным холодильником. Реакционную смесь концентрируют и остаток растворяют в этаноле (50 мл). Добавляют 4-фторфенил изотиоцианат (15,3 г) и смесь перемешивают при комнатной температуре в течение 15 мин. Добавляют 2н. водный раствор гидроксида натрия (200 мл) и смесь перемешивают в течение 90 мин при нагревании с обратным холодильником. Реакционную смесь выливают в 6н. водный раствор хлористоводородной кислоты и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением 5-(диэтоксиметил)-4-(4-фторфенил)-2,4-дигидро-3H-1,2,4-триазол-3-тиона (29,3 г, выход: 99%) в виде желтого масла.
ЯМР (CDCl3) δ: 1,13 (6H, т, J=7Гц), 3,45-3,5 (2H, м), 3,6-3,7 (2H, м), 5,29 (1H, c), 7,15-7,25 (2H, м), 7,3-7,4 (2H, м), 11,21 (1H, ушир.c).
К 5-(диэтоксиметил)-4-(4-фторфенил)-2,4-дигидро-3H-1,2,4-триазол-3-тиону (25,7 г) добавляют 3,5н. водный раствор азотной кислоты (содержащий 0,3% нитрита натрия) и смесь перемешивают при комнатной температуре в течение 1 час. Реакционную смесь выливают в насыщенный водный раствор карбоната натрия и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением желтого масла (19,0 г). Это желтое масло растворяют в 10% водном растворе серной кислоты (100 мл), нагревают до 70-75°C и перемешивают в течение 2 час. Реакционную смесь выливают в 10% водный раствор динатрий гидрофосфата и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением 4-(4-фторфенил)-4H-1,2,4-триазол-3-карбальдегида (7,25 г, 43%) в виде желтых кристаллов.
ЯМР (CDCl3) δ: 7,15-7,25 (2H, м), 7,3-7,4 (2H, м), 8,38 (1H, c), 10,14 (1H, c).
Сравнительный пример 20
Смесь метил 4-фторбензоилацетата (3,92 г), п-толуолсульфонил азида (4,00 г), триэтиламина (2,02 г) и ацетонитрила (30 мл) перемешивают при 0°C в течение 1 час. Реакционную смесь выливают в воду и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением желтого масла. В это желтое масло добавляют реагент Лоусона (8,10 г) и тетрагидрофуран (50 мл), и смесь нагревают с обратным холодильником в течение 16 час. Реакционную смесь концентрируют и остаток очищают с помощью колоночной хроматографии на силикагеле с получением метил 5-(4-фторфенил)-1,2,3-тиадиазол-4-карбоксилата (1,95 г, выход 41%) в виде бесцветных кристаллов из фракции, элюируемой этилацетатом-гексаном (1:3, объем/объем).
ЯМР (CDCl3) δ: 3,99 (3H, c), 7,15-7,25 (2H, м), 7,55-7,6 (2H, м).
В раствор метил 5-(4-фторфенил)-1,2,3-тиадиазол-4-карбоксилата (1,19 г) в тетрагидрофуране (30 мл) добавляют диизобутилалюминий гидрид (1,5н толуоловый раствор, 10 мл) при 0°C и смесь перемешивают при 0°C в течение 1 час. Реакционную смесь выливают в водный раствор разбавленной хлористоводородной кислоты и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением [5-(4-фторфенил)-1,2,3-тиадиазол-4-ил]метанола (0,80 г, выход 76%) в виде желтого масла.
ЯМР (CDCl3) δ: 5,05 (2H, c), 7,15-7,25 (2H, м), 7,55-7,6 (2H, м).
[5-(4-Фторфенил)-1,2,3-тиадиазол-4-ил]метанол (0,75 г) растворяют в тетрагидрофуране (30 мл) и добавляют активированный диоксид марганца (3 г). Смесь перемешивают при комнатной температуре в течение 16 час. Реакционную смесь фильтруют и фильтрат концентрируют. Добавляют этил диэтилфосфоноацетат (0,50 г) и N,N-диметилформамид (10 мл) к остатку. К этой смеси добавляют гидрид натрия (60% в масле, 80 мг) при 0°C и смесь перемешивают при 0°C, в течение 1 час. Реакционную смесь выливают в водный раствор разбавленной хлористоводородной кислоты и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением желтого масла. В это желтое масло добавляют 6н водный раствор хлористоводородной кислоты (10 мл) и уксусной кислоты (5 мл), и смесь перемешивают в течение 3 час при нагревании с обратным холодильником. Реакционную смесь концентрируют, выливают в воду и выпавшие твердые продукты собирают фильтрацией, промывают водой и сушат с получением (2E)-3-[5-(4-фторфенил)-1,2,3-тиадиазол-4-ил]акриловой кислоты (190 мг, выход: 21%) в виде бледно-желтых кристаллов.
ЯМР (ДМСО-d6) δ: 6,98 (1H, д, J=15,5 Гц), 7,3-7,5 (3H, м), 7,6-7,8 (2H, м), 12,67 (1H, ушир.c).
Сравнительный пример 21
Смесь 5-(4-фторфенил)-1-метил-1H-пиразол-4-карбальдегида (350 мг), гидрида натрия (60% в масло, 120 мг), этил диэтилфосфоноацетата (673 мг) и N,N-диметилформамида (10 мл) перемешивают при комнатной температуре в течение 1 час. Реакционную смесь выливают в воду и выпавшие твердые продукты собирают фильтрацией. После сушки в потоке воздуха твердые продукты растворяют в смешанном растворителе из тетрагидрофурана (10 мл) и этанола (10 мл). Добавляют 1н. водный раствор гидроксида натрия (5 мл) и смесь перемешивают при комнатной температуре в течение 2 час. Реакционную смесь выливают в 10% водный раствор лимонной кислоты и выпавшие твердые продукты собирают фильтрацией, промывают водой и сушат в потоке воздуха с получением (2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриловой кислоты (354 мг, 84%) в виде кристаллов. Его перекристаллизация из метанола-простого изопропилового эфира дает бесцветные призматические кристаллы. Температура плавления: 212-213°C.
Подобным способом, как и в сравнительных примерах 21, получают соединения, описанные в сравнительных примерах 22-31, 33-35, 37 и 40.
Сравнительный пример 22
(2E)-3-[5-(4-Метоксифенил)-1-метил-1H-пиразол-4-ил]акриловая кислота
Выход: 28%. Бесцветные призматические кристаллы. Температура плавления: 190-192°C (перекристаллизуют из метанола-простого диизопропилового эфира).
Сравнительный пример 23
(2E)-3-[5-(3-Хлорфенил)-1-метил-1H-пиразол-4-ил]акриловая кислота
Выход: 68%. Бесцветные призматические кристаллы. Температура плавления: 185-187°C (перекристаллизуют из метанола-простого диизопропилового эфира).
Сравнительный пример 24
(2E)-3-[5-(4-Хлорфенил)-1-метил-1H-пиразол-4-ил]акриловая кислота
Выход: 59%. Бесцветные призматические кристаллы. Температура плавления: 237-239°C (перекристаллизуют из метанола-простого диизопропилового эфира).
Сравнительный пример 25
(2E)-3-(1-Метил-5-фенил-1H-пиразол-4-ил)акриловая кислота
Выход: 70%. Бесцветные призматические кристаллы. Температура плавления: 215-216°C (перекристаллизуют из метанола-простого диизопропилового эфира).
Сравнительный пример 26
(2E)-3-{1-Метил-5-[4-(трифторметил)фенил]-1H-пиразол-4-ил}акриловая кислота
Выход: 73%. Бесцветные призматические кристаллы. Температура плавления: 195-196°C (перекристаллизуют из метанола-простого диизопропилового эфира).
Сравнительный пример 27
(2E)-3-[5-(2-Фторфенил)-1-метил-1H-пиразол-4-ил]акриловая кислота
Выход: 30%. Бесцветные призматические кристаллы. Температура плавления: 186-187°C (перекристаллизуют из метанола-простого диизопропилового эфира).
Сравнительный пример 28
(2E)-3-[5-(3-Фторфенил)-1-метил-1H-пиразол-4-ил]акриловая кислота
Выход: 38%. Бесцветные призматические кристаллы. Температура плавления: 191-192°C (перекристаллизуют из метанола-простого диизопропилового эфира).
Сравнительный пример 29
(2E)-3-[5-(4-Бромфенил)-1-метил-1H-пиразол-4-ил]акриловая кислота
Выход: 46%. Бесцветные призматические кристаллы. Температура плавления: 246-247°C (перекристаллизуют из метанола-простого диизопропилового эфира).
Сравнительный пример 30
(2E)-3-[1-Метил-5-(1-нафтил)-1H-пиразол-4-ил]акриловая кислота
Выход: 53%. Бесцветные призматические кристаллы. Температура плавления: 216-217°C (перекристаллизуют из метанола-простого диизопропилового эфира).
Сравнительный пример 31
(2E)-3-[1-Метил-5-(4-метилфенил)-1H-пиразол-4-ил]акриловая кислота
Выход: 43%. Бесцветные призматические кристаллы. Температура плавления: 221-222°C (перекристаллизуют из метанола-простого диизопропилового эфира).
Сравнительный пример 32
Смесь из смеси (3,9 г) 1-бензил-5-(4-фторфенил)-1H-пиразол-4-карбальдегида и 1-бензил-3-(4-фторфенил)-1H-пиразол-4-карбальдегида, полученной в сравнительном примере 14, гидрида натрия (60% в масло, 667 мг), этил диэтилфосфоноацетата (3,43 г) и N,N-диметилформамида (30 мл) перемешивают при комнатной температуре в течение 3 час. Реакционную смесь выливают в воду и экстрагируют смесь этилацетатом. Органический слой промывают водой, сушат над безводным сульфатом магния и концентрируют с получением смеси (4,0 г, 82%) этил (2E)-3-[1-бензил-5-(4-фторфенил)-1H-пиразол-4-ил]акрилата и этил (2E)-3-[1-бензил-3-(4-фторфенил)-1H-пиразол-4-ил]акрилата.
ЯМР (CDCl3) δ: 1,20-1,30 (3H, м), 4,08-4,24 (2H, м), 5,20 (2H×0,7, c), 5,33 (2H×0,3, c), 6,08 (1H×0,3, д, J=16,2 Гц), 6,16 (1H×0,7, д, J=15,9 Гц), 6,96-7,60 (10H, м), 7,62 (1H×0,3, c), 7,88 (1H×0,7, c).
Сравнительный пример 33
(2E)-3-[1-Этил-5-(4-фторфенил)-1H-пиразол-4-ил]акриловая кислота
Выход: 62%. Бесцветные призматические кристаллы. Температура плавления: 160-161°C (перекристаллизуют из метанола-простого диизопропилового эфира).
Сравнительный пример 34
(2E)-3-[5-(4-Фторфенил)-1,3-диметил-1H-пиразол-4-ил]акриловая кислота
Выход: 63%. Бесцветные призматические кристаллы. Температура плавления: 208-209°C (перекристаллизуют из метанола-простого диизопропилового эфира).
Сравнительный пример 35
(2E)-3-(5-Циклогексил-1-метил-1H-пиразол-4-ил)акриловая кислота
Выход: 85%. Бесцветные призматические кристаллы. Температура плавления: 160°C (разложение) (перекристаллизуют из метанола-простого диизопропилового эфира).
Сравнительный пример 36
Смесь из смеси (4,0 г) этил (2E)-3-[1-бензил-5-(4-фторфенил)-1H-пиразол-4-ил]акрилата и этил (2E)-3-[1-бензил-3-(4-фторфенил)-1H-пиразол-4-ил]акрилата, полученной в сравнительном примере 32, 2н. водного раствора гидроксида натрия (11 мл) и метанола (20 мл) перемешивают при 60°C в течение 14 час. В реакционную смесь выливают 1н. хлористоводородную кислоту (22 мл). Выпавшие твердые продукты собирают фильтрацией, промывают водой и простым изопропиловым эфиром и сушат в потоке воздуха с получением смеси (3,5 г, 95%) (2E)-3-[1-бензил-5-(4-фторфенил)-1H-пиразол-4-ил]акриловой кислоты и (2E)-3-[1-бензил-3-(4-фторфенил)-1H-пиразол-4-ил]акриловой кислоты в виде порошка.
ЯМР (CDCl3) δ: 5,25 (2H×0,7, c), 5,38 (2H×0,3, c), 6,23 (1H×0,3, д, J=15,6 Гц), 6,25 (1H×0,7, д, J=15,9 Гц), 6,90-7,60 (10H, м), 8,16 (1H×0,7, c), 8,51 (1H×0,3, c).
Сравнительный пример 37
(2E)-3-[5-(2-Фурил)-1-метил-1H-пиразол-4-ил]акриловая кислота
Выход: 63%. Бесцветные призматические кристаллы. Температура плавления: 203-204°C (перекристаллизуют из метанола-простого диизопропилового эфира).
Сравнительный пример 38
Калий бис(триметилсилил)амид (20% толуоловый раствор, 1,0 г) добавляют к смеси бис(2,2,2-трифторэтил) (метоксикарбонилметил) фосфоната (318 мг), 18-краун-6 (1,32 г) и тетрагидрофурана (20 мл) при -78°C. Затем добавляют 5-(4-метоксифенил)-1-метил-1H-пиразол-4-карбальдегид (216 мг) и смесь перемешивают при -78°C в течение 4 час. В реакционную смесь добавляют водный раствор хлорида аммония и экстрагируют смесь этилацетатом. Органический слой последовательно промывают водой и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. К остатку добавляют метанол (5 мл) и 1н. водный раствор гидроксида натрия (5 мл), и смесь перемешивают при 60°C в течение 1 час. Реакционную смесь концентрируют к остатку добавляют 1н. хлористоводородную кислоту и экстрагируют смесь этилацетатом. Органический слой последовательно промывают водой и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Перекристаллизация остатка из этилацетата-гексана дает (2Z)-3-[5-(4-метоксифенил)-1-метил-1H-пиразол-4-ил]акриловую кислоту в виде кристаллов (77 мг, выход 30%). Температура плавления: 205-206°C.
Сравнительный пример 39
Смесь метил (2Z)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акрилата (300 мг), метанола (5 мл) и 1н. водного раствора гидроксида натрия (5 мл) перемешивают при 60°C в течение 30 мин. В реакционную смесь добавляют 1н. хлористоводородную кислоту и экстрагируют смесь этилацетатом. Органический слой последовательно промывают водой и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Перекристаллизация остатка из этилацетата-гексана дает (2Z)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриловую кислоту в виде кристаллов (220 мг, выход 78%). Температура плавления: 205-206°C.
Сравнительный пример 40
(2E)-3-[1-(4-Фторфенил)-1H-имидазол-5-ил]акриловая кислота
Выход: 85%. Бесцветные кристаллы. Температура плавления: разложение при 250°C.
ЯМР (ДМСО-d6) δ: 6,17 (1H, д, J=15,5 Гц), 7,16 (1H, д, J=15,5 Гц), 7,35-7,6 (4H, м), 7,76 (1H, ушир.c), 8,02 (1H, ушир.c), 12,35 (1H, ушир.c).
Сравнительный пример 41
Смесь 4-(4-фторфенил)-4H-1,2,4-триазол-3-карбальдегида (3,83 г), этил диэтилфосфоноацетата (5,60 г), гидрида натрия (60% в масле, 0,88 г) и тетрагидрофурана (130 мл) перемешивают при 0°C в течение 1 час. Реакционную смесь выливают в водный раствор разбавленной хлористоводородной кислоты и экстрагируют смесь этилацетатом. Этилацетатный слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток растворяют в 6н. водном растворе хлористоводородной кислоты (100 мл) и перемешивают в течение 2 час при нагревании с обратным холодильником. Для нейтрализации реакционной смеси добавляют динатрий гидрофосфат. Выпавшие твердые продукты собирают фильтрацией, промывают водой и сушат с получением (2E)-3-[4-(4-фторфенил)-4H-1,2,4-триазол-3-ил]акриловой кислоты (3,60 г, выход 76%) в виде бледно-желтых кристаллов. Температура плавления: 226-229°C (перекристаллизуют из этилацетата-гексана).
Сравнительный пример 42
Гидрид натрия (60% в масле, 60 мг) добавляют при 0°C к смеси 4-(4-фторфенил)-1-метил-1H-пиразол-5-карбальдегида (168 мг), этил диэтилфосфоноацетата (400 мг) и N,N-диметилформамида (3 мл) и смесь перемешивают при комнатной температуре в течение 15 мин. Реакционную смесь выливают в 1н. водный раствор хлористоводородной кислоты и экстрагируют смесь этилацетатом. Этилацетатный слой концентрируют и остаток растворяют в смеси 6н. хлористоводородной кислоты (18 мл) и уксусной кислоты (2 мл). Смесь перемешивают в течение 1 час при нагревании с обратным холодильником. Реакционную смесь концентрируют и выливают в воду. Для нейтрализации добавляют 1н. гидроксид натрия. Выпавшие твердые продукты собирают фильтрацией, промывают водой и сушат с получением (2E)-3-[4-(4-фторфенил)-1-метил-1H-пиразол-5-ил]акриловой кислоты (159 мг, 78%) в виде бесцветных кристаллов.
ЯМР (ДМСО-d6) δ: 3,99 (3H, c), 6,17 (1H, д, J=16 Гц), 7,2-7,3 (2H, м), 7,35-7,45 (2H, м), 7,49 (1H, д, J=16 Гц), 7,61 (1H, c).
Сравнительный пример 43
В соответствии со способом, представленным в сравнительном примере 42, (2E)-3-[4-(4-фторфенил)-1-метил-1H-пиразол-3-ил]акриловую кислоту синтезируют из 4-(4-фторфенил)-1-метил-1H-пиразол-3-карбальдегида. Выход: 56%. Бесцветные кристаллы.
ЯМР (ДМСО-d6) δ: 3,91 (3H, c), 6,38 (1H, д, J=15,5 Гц), 7,2-7,3 (2H, м), 7,3-7,4 (2H, м), 7,41 (1H, д, J=15,5 Гц), 7,95 (1H, c).
Сравнительный пример 44
Смесь (2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриловой кислоты (0,80 г), 5% палладий на угле (0,30 г), тетрагидрофурана (10 мл) и этанола (10 мл) перемешивают при комнатной температуре в течение 6 час в атмосфере водорода при атмосферном давлении. Палладий на угле собирают фильтрацией, и фильтрат концентрируют с получением 3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]пропионовой кислоты (0,78 г, выход 97%) в виде бесцветного твердого продукта.
ЯМР (CDCl3) δ: 2,50 (2H, т, J=7 Гц), 2,69 (2H, т, J=7 Гц), 3,71 (3H, c), 7,1-7,25 (2H, м), 7,25-7,3 (2H, м), 7,42 (1H, c).
Сравнительный пример 45
Смесь 2-(4-нитрофенил)этантиоамида (1,50 г), 1-бром-2-бутанона (1,27г) и этанола (50 мл) нагревают с обратным холодильником в течение 30 мин. Реакционную смесь концентрируют и этилацетат добавляют к остатку. Смесь последовательно промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле и получают 4-этил-2-(4-нитробензил)-1,3-тиазол в виде коричневого масла (1,59 г, выход 84%) из фракции, элюируемой гексаном-этилацетатом (7:1-4:1, объем/объем).
ЯМР (CDCl3) δ: 1,30 (3H, т, J=7,6 Гц), 2,80 (2H, кв д, J=7,6, 1,0 Гц), 4,41 (2H, c), 6,80 (1H, т, J=1,0 Гц), 7,44-7,51 (2H, м), 8,15-8,22 (2H, м).
Сравнительный пример 46
Смесь 2-(4-нитрофенил)этантиоамида (1,50 г), этил бромпирувата (1,64 г) и этанола (50 мл) нагревают с обратным холодильником в течение 30 мин. Реакционную смесь концентрируют и этилацетат добавляют к остатку. Смесь последовательно промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле и получают этил 2-(4-нитробензил)-1,3-тиазол-4-карбоксилат в виде бледно-желтых кристаллов (1,79 г, выход 81%) из фракции, элюируемой гексаном-этилацетатом (1:1, объем/объем). Его перекристаллизация из этилацетата-гексана дает бледно-желтые призматические кристаллы. Температура плавления: 122-123°C.
Сравнительный пример 47
Смесь 2-(4-нитрофенил)этантиоамида (0,50 г), 1-бром-2-пропанона (0,43 г) и этанола (20 мл) нагревают с обратным холодильником в течение 1 час. Реакционную смесь концентрируют и к остатку добавляют насыщенный водный раствор бикарбоната натрия. Смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле и получают 4-метил-2-(4-нитробензил)-1,3-тиазол в виде бледно-желтых кристаллов (0,37 г, выход 63%) из фракции, элюируемой гексаном-этилацетатом (2:1-1:1, объем/объем). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 81-82°C.
Сравнительный пример 48
Смесь 2-(4-нитрофенил)этантиоамида (0,80 г), хлорацетальдегида (40% водный раствор, 2,88 г) и этанола (20 мл) нагревают с обратным холодильником в течение 15 час. В реакционную смесь добавляют насыщенный водный раствор бикарбоната натрия и экстрагируют смесь этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле и получают 2-(4-нитробензил)-1,3-тиазол в виде оранжевого масла (0,35 г, выход 39%) из фракции, элюируемой гексаном-этилацетатом (9:1-2:1, объем/объем).
ЯМР (CDCl3) δ: 4,45 (2H, c), 7,26 (1H, д, J=3,8 Гц), 7,45-7,52 (2H, м), 7,74 (1H, д, J=3,8 Гц), 8,16-8,23 (2H, м).
Сравнительный пример 49
Смесь 2-(4-нитрофенил)ацетогидразида (2,50 г), триэтил ортоформиата (5,69 г), метансульфоновой кислоты (0,25 г) и тетрагидрофурана (50 мл) нагревают с обратным холодильником в течение 1 час. Реакционную смесь разбавляют этилацетатом. Смесь последовательно промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле и получают 2-(4-нитробензил)-1,3,4-оксадиазол в виде бледно-желтых кристаллов (1,92 г, выход 73%) из фракции, элюируемой гексаном-этилацетатом (3:1-1:1, объем/объем). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 104-105°C.
Сравнительный пример 50
Смесь 2-(4-нитрофенил)ацетогидразида (7,0 г), триметил ортобутирата (16,01 г), метансульфоновой кислоты (0,69 г) и тетрагидрофурана (200 мл) нагревают с обратным холодильником в течение 2 час. В реакционную смесь выливают воду и экстрагируют смесь этилацетатом. Органический слой последовательно промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле и получают 2-(4-нитробензил)-5-пропил-1,3,4-оксадиазол в виде бесцветного масла (7,73 г, выход 87%) из фракции, элюируемой гексаном-этилацетатом (3:2-1:2, объем/объем).
ЯМР (CDCl3) δ: 1,00 (3H, т, J=7,2 Гц), 1,69-1,89 (2H, м), 2,79 (2H, т, J=7,2 Гц), 4,28 (2H, c), 7,47-7,53 (2H, м), 8,18-8,25 (2H, м).
Сравнительный пример 51
Смесь 4-нитробензальдегида (15,1 г), 1,3-тиазолидин-2,4-диона (11,70 г), пиперидина (1,70 г) и этанола (300 мл) нагревают с обратным холодильником в течение 24 час. Реакционную смесь концентрируют. Полученный остаток промывают этанолом с получением 5-(4-нитробензилиден)-1,3-тиазолидин-2,4-диона в виде желтых кристаллов (14,8 г, выход 59%). Его перекристаллизация из ацетона-гексана дает бледно-желтые призматические кристаллы. Температура плавления: 272-273°C.
Сравнительный пример 52
К смеси 5-(4-нитробензилиден)-1,3-тиазолидин-2,4-диона (4,0 г) и N,N-диметилформамида (100 мл) при комнатной температуре добавляют гидрид натрия (60% в масле, 0,7 г). Реакционную смесь перемешивают при комнатной температуре в течение 30 мин и добавляют в реакционную смесь иодометан (6,81 г). Смесь дополнительно перемешивают при комнатной температуре в течение 15 час. В реакционную смесь добавляют воду и выпавшие кристаллы собирают фильтрацией с получением 3-метил-5-(4-нитробензилиден)-1,3-тиазолидин-2,4-диона в виде желтых кристаллов (4,02 г, выход 95%). Его перекристаллизация из тетрагидрофурана-гексана дает желтые призматические кристаллы. Температура плавления: 233-234°C.
Сравнительный пример 53
К смеси 5-(4-нитробензилиден)-1,3-тиазолидин-2,4-диона (3,50 г) и N,N-диметилформамида (100 мл) добавляют гидрид натрия (60% в масле, 0,62 г) при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 30 мин и в реакционную смесь добавляют иодоэтан (6,55 г). Смесь перемешивают при комнатной температуре в течение 15 час. В реакционную смесь добавляют воду и выпавшие кристаллы собирают фильтрацией с получением 3-этил-5-(4-нитробензилиден)-1,3-тиазолидин-2,4-диона в виде желтых кристаллов (3,81 г, выход 98%). Его перекристаллизация из ацетона-гексана дает желтые призматические кристаллы. Температура плавления: 217-218°C.
Сравнительный пример 54
Смесь 3-метил-5-(4-нитробензилиден)-1,3-тиазолидин-2,4-диона (1,0 г), 5% палладия на угле (1,0 г) и тетрагидрофурана (150 мл) подвергают каталитическому восстановлению при давлении водорода 5,0 кгс·см-2. Катализатор удаляют фильтрацией и фильтрат концентрируют с получением 5-(4-аминобензил)-3-метил-1,3-тиазолидин-2,4-диона в виде бесцветных кристаллов (0,71 г, выход 79%). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 91-92°C.
Сравнительный пример 55
Смесь 3-этил-5-(4-нитробензилиден)-1,3-тиазолидин-2,4-диона (3,60 г), 5% палладия на угле (5,0 г) и тетрагидрофурана (300 мл) подвергают каталитическому восстановлению при давлении водорода 5,0 кгс·см-2. Катализатор собирают фильтрацией и фильтрат концентрируют. Остаток подвергают колоночной хроматографии на силикагеле и получают 5-(4-аминобензил)-3-этил-1,3-тиазолидин-2,4-дион в виде желтых кристаллов (3,05 г, выход 94%) из фракции, элюируемой гексаном-этилацетатом (3:1-1:1, объем/объем). Его перекристаллизация из этилацетата-гексана дает желтые призматические кристаллы. Температура плавления: 103-104°C.
Сравнительный пример 56
Смесь 2-(4-нитрофенил)ацетогидразида (0,50 г), этил хлоркарбоната (0,34 г) и N,N-диметилацетамида (10 мл) перемешивают при комнатной температуре в течение 1 час. В реакционную смесь добавляют воду и экстрагируют смесь этилацетатом. Органический слой последовательно промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением бесцветных кристаллов. Смесь полученных кристаллов, дифосфор пентаоксида (1,50 г), гексаметилдисилоксана (2,96 г) и 1,2-дихлорбензола (10 мл) перемешивают при 160°C в течение 2 час. В реакционную смесь добавляют воду и экстрагируют смесь этилацетатом. Органический слой последовательно промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением 5-(4-нитробензил)-1,3,4-оксадиазол-2(3H)-она в виде бледно-желтых кристаллов (0,29 г, выход 50%). Его перекристаллизация из этилацетата-гексана дает бледно-желтые призматические кристаллы. Температура плавления: 170-171°C.
Сравнительный пример 57
К смеси 3-(4-нитрофенил)пропионовой кислоты (3,00 г), 4-метилморфолина (2,02 г) и тетрагидрофурана (100 мл) добавляют по каплям изобутил хлоркарбонат (2,95 г) при 0°C. Реакционную смесь перемешивают при 0°C в течение 1 час и нерастворимые материалы собирают фильтрацией. Фильтрат добавляют к смеси гидразина гидрата (3,85 г) и тетрагидрофурана (100 мл) при 0°C. Реакционную смесь перемешивают при 0°C в течение 1 час и в реакционную смесь добавляют насыщенный водный раствор хлорида аммония и экстрагируют смесь этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Смесь полученного остатка, триэтил ортопропионата (8,14 г), метансульфоновой кислоты (0,30 г) и тетрагидрофурана (100 мл) нагревают с обратным холодильником в течение 1 час. Реакционную смесь разбавляют этилацетатом и органический слой последовательно промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Полученный остаток подвергают колоночной хроматографии на силикагеле с получением 2-этил-5-[2-(4-нитрофенил)этил]-1,3,4-оксадиазола в виде бесцветных кристаллов (2,28 г, выход 60%) из фракции, элюируемой гексаном-этилацетатом (1:2, объем/объем). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 65-66°C.
Сравнительный пример 58
К смеси 3-(4-нитрофенил)пропионовой кислоты (3,00 г), 4-метилморфолина (2,02 г) и тетрагидрофурана (100 мл) при 0°C добавляют по каплям изобутил хлоркарбонат (2,95 г). Реакционную смесь перемешивают при 0°C, в течение 1 час и нерастворимые материалы собирают фильтрацией. Фильтрат добавляют к смеси гидразина гидрата (3,85 г) и тетрагидрофурана (100 мл) при 0°C. Реакционную смесь перемешивают при 0°C, в течение 1 час и в реакционную смесь добавляют насыщенный водный раствор хлорида аммония. Смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Смесь полученного остатка, триэтил ортоформиата (6,84 г), метансульфоновой кислоты (0,30 г) и тетрагидрофурана (100 мл) нагревают с обратным холодильником в течение 1 час. Реакционную смесь разбавляют этилацетатом и органический слой последовательно промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Полученный остаток подвергают колоночной хроматографии на силикагеле с получением 2-[2-(4-нитрофенил)этил]-1,3,4-оксадиазола в виде бесцветных кристаллов (2,70 г, выход 80%) из фракции, элюируемой гексаном-этилацетатом (1:2, объем/объем). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 93-94°C.
Сравнительный пример 59
Смесь 4-хлорметил-1,3-оксазола гидрохлорида (5,16 г), карбоната калия (4,19 г), воды (60 мл) и этилацетата (60 мл) перемешивают в течение 15 мин. Реакционную смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Смесь полученного остатка, трифенилфосфина (7,95 г) и ацетонитрила (200 мл) нагревают с обратным холодильником в течение 15 час. Реакционную смесь охлаждают и выпавшие кристаллы промывают простым диэтиловым эфиром с получением [(1,3-оксазол-4-ил)метил]трифенилфосфоний хлорида в виде бесцветных кристаллов (8,11 г, выход 68%). Температура плавления: 268-270°C.
Сравнительный пример 60
Смесь 4-хлорметил-2-этил-1,3-оксазола (4,87 г), трифенилфосфина (7,89 г) и ацетонитрила (100 мл) нагревают с обратным холодильником в течение 15 час. Реакционную смесь концентрируют и полученные кристаллы промывают простым диэтиловым эфиром с получением [(2-этил-1,3-оксазол-4-ил)метил]трифенилфосфоний хлорида в виде бесцветных кристаллов (10,02 г, выход 79%). Его перекристаллизация из ацетонитрила-простого диэтилового эфира дает бесцветные призматические кристаллы. Температура плавления: 222-223°C.
Сравнительный пример 61
Смесь 4-нитробензальдегида (0,42 г), карбоната калия (0,58 г), [(1,3-оксазол-4-ил)метил]трифенилфосфоний хлорида (1,65 г) и N,N-диметилформамида (20 мл) перемешивают при комнатной температуре в течение 15 час. В реакционную смесь выливают воду и экстрагируют смесь этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Полученный остаток подвергают колоночной хроматографии на силикагеле с получением желтых кристаллов из фракции, элюируемой гексаном-тетрагидрофураном (1:1, объем/объем). Полученные кристаллы, 5% палладий на угле (1,00 г) и тетрагидрофуран (50 мл) подвергают каталитическому восстановлению в атмосфере водорода при атмосферном давлении. Катализатор удаляют фильтрацией и фильтрат концентрируют. Полученный остаток подвергают колоночной хроматографии на силикагеле с получением 4-[2-(1,3-тиазол-4-ил)этил]анилина в виде бесцветных кристаллов (0,27 г, выход 47%) из фракции, элюируемой гексаном-этилацетатом (2:1-1:1, объем/объем). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 69-70°C.
Сравнительный пример 62
Смесь 4-нитробензальдегида (1,0 г), карбоната калия (1,37 г), [(2-этил-1,3-оксазол-4-ил)метил]трифенилфосфоний хлорида (4,20 г) и N,N-диметилформамида (50 мл) перемешивают при комнатной температуре в течение 40 час. В реакционную смесь выливают воду и экстрагируют смесь этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Полученный остаток подвергают колоночной хроматографии на силикагеле с получением желтого масла из фракции, элюируемой гексаном-этилацетатом (3:1-2:1, объем/объем). Полученное масло, 5% палладий на угле (2,00 г) и тетрагидрофуран (200 мл) подвергают каталитическому восстановлению в атмосфере водорода при атмосферном давлении. Катализатор удаляют фильтрацией и фильтрат концентрируют. Полученный остаток подвергают колоночной хроматографии на силикагеле с получением 4-[2-(2-этил-1,3-тиазол-4-ил)этил]анилина в виде коричневого масла (1,11 г, выход 73%) из фракции, элюируемой гексаном-этилацетатом (2:1, объем/объем).
ЯМР (CDCl3) δ: 1,39 (3H, т, J=7,6 Гц), 2,84-3,08 (6H, м), 3,56 (2H, ушир.c), 6,59-6,66 (3H, м), 6,95-7,00 (2H, м).
Сравнительный пример 63
Смесь 5-(4-фторфенил)-1H-пиразол-4-карбальдегида (1,0 г), малоновой кислоты (0,67 г), пиперидина (0,54 г) и простого бис(2-метоксиэтилового) эфира (10 мл) перемешивают при 110°C в течение 6 час. В подкисленную реакционную смесь добавляют воду и 1н. хлористоводородную кислоту и экстрагируют смесь этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Полученный остаток подвергают колоночной хроматографии на силикагеле с получением (2E)-3-[5-(4-фторфенил)-1H-пиразол-4-ил]акриловой кислоты в виде бесцветных кристаллов (0,12 г, выход 10%) из фракции, элюируемой гексаном-этилацетатом (1:9, объем/объем). Его перекристаллизация из ацетона-простого диизопропилового эфира дает бесцветные призматические кристаллы. Температура плавления: 276-277°C.
Сравнительный пример 64
К смеси 3-(4-нитрофенил)пропионовой кислоты (13,45 г), N,N-диметилформамида (0,1 мл) и тетрагидрофурана (300 мл) при комнатной температуре добавляют по каплям оксалил хлорид (10,5 г). Реакционную смесь перемешивают при комнатной температуре в течение 1 час и концентрируют. Полученный остаток растворяют в тетрагидрофуране (50 мл) и при комнатной температуре добавляют по каплям к смеси 25% водного раствора аммония (100 мл) и тетрагидрофурана (100 мл). Реакционную смесь перемешивают при комнатной температуре в течение 2 час и экстрагируют смесь этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением 3-(4-нитрофенил)пропанамида в виде бесцветных кристаллов (11,80 г, выход 88%). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 177-178°C.
Сравнительный пример 65
Смесь 3-(4-нитрофенил)пропанамида (0,50 г), 2,4-бис(4-метоксифенил)-1,3-дитиа-2,4-дифосфетан-2,4-дисульфида (0,81 г) и пиридина (5 мл) перемешивают при 50°C в течение 15 час. Реакционную смесь концентрируют и добавляют к полученному остатку 1н. хлористоводородную кислоту и экстрагируют смесь этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением 3-(4-нитрофенил)пропантиоамида в виде бесцветных кристаллов (0,40 г, выход 73%) из фракции, элюируемой гексаном-этилацетатом (2:1-1:1, объем/объем). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 157-158°C.
Сравнительный пример 66
Смесь 3-(4-нитрофенил)пропантиоамида (1,0 г), хлорацетальдегида (40% водный раствор, 2,83 г) и трет-бутанола (20 мл) нагревают с обратным холодильником в течение 2 час. Реакционную смесь концентрируют, и добавляют к остатку насыщенный водный раствор бикарбоната натрия. Смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением 2-[2-(4-нитрофенил)этил]-1,3-тиазола в виде бледно-желтых кристаллов (0,31 г, выход 28%) из фракции, элюируемой гексаном-этилацетатом (3:1, объем/объем). Его перекристаллизация из этилацетата-гексана дает бледно-желтые призматические кристаллы. Температура плавления: 92-93°C.
Сравнительный пример 67
Смесь 3-(4-нитрофенил)пропантиоамида (1,25 г), 1-бром-2-бутанона (0,98 г) и трет-бутанола (30 мл) нагревают с обратным холодильником в течение 30 мин. Реакционную смесь концентрируют и добавляют к остатку насыщенный водный раствор бикарбоната натрия. Смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением 4-этил-2-[2-(4-нитрофенил)этил]-1,3-тиазола в виде желтого масла (1,48 г, выход 95%) из фракции, элюируемой гексаном-этилацетатом (4:1-2:1, объем/объем).
ЯМР (CDCl3) δ: 1,29 (3H, т, J=7,6 Гц), 2,78 (2H, кв д, J=7,6, 1,0 Гц), 3,17-3,37 (4H, м), 6,73 (1H, т, J=1,0 Гц), 7,32-7,39 (2H, м), 8,10-8,18 (2H, м).
Сравнительный пример 68
Смесь 4-нитрофенола (3,92 г), 4-хлорметил-1,3-тиазола гидрохлорида (4,0 г), карбоната калия (8,13 г) и N,N-диметилформамида (100 мл) перемешивают при комнатной температуре в течение 40 час. В реакционную смесь выливают воду и экстрагируют смесь этилацетатом-тетрагидрофураном. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением 4-[(4-нитрофенокси)метил]-1,3-тиазола в виде бесцветных кристаллов (3,38 г, выход 61%). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 175-176°C.
Сравнительный пример 69
Смесь 4-нитрофенола (5,48 г), 4-хлорметил-2-этил-1,3-тиазола (7,40 г), карбоната калия (5,45 г) и N,N-диметилформамида (50 мл) перемешивают при комнатной температуре в течение 15 час. В реакционную смесь выливают воду и экстрагируют смесь этилацетатом. Органический слой последовательно промывают 1н. водным раствором гидроксида натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением 2-этил-4-[(4-нитрофенокси)метил]-1,3-тиазола в виде бесцветных кристаллов (3,60 г, выход 35%) из фракции, элюируемой гексаном-этилацетатом (4:1, объем/объем). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 79-80°C.
Сравнительный пример 70
К смеси 2-(4-нитрофенокси)уксусной кислоты (5,0 г), 4-метилморфолина (3,34 г) и тетрагидрофурана (100 мл) при 0°C добавляют по каплям изобутил хлоркарбонат (4,86 г). Реакционную смесь перемешивают при комнатной температуре в течение 1 час и нерастворимые материалы собирают фильтрацией. Фильтрат добавляют по каплям к смеси гидразина моногидрата (6,36 г) и тетрагидрофурана (50 мл) при 0°C. Реакционную смесь перемешивают при 0°C в течение 2 час. В реакционную смесь добавляют насыщенный водный раствор хлорида аммония, и выпавшие кристаллы собирают фильтрацией с получением 2-(4-нитрофенокси)ацетогидразида в виде бесцветных кристаллов (1,30 г, выход 24%). Его перекристаллизация из тетрагидрофурана-гексана дает бесцветные призматические кристаллы. Температура плавления: 191-192°C.
Сравнительный пример 71
Смесь 2-(4-нитрофенокси)ацетогидразида (1,10 г), метансульфоновой кислоты (0,10 г), триэтил ортоформиата (2,31 г) и тетрагидрофурана (50 мл) нагревают с обратным холодильником в течение 1 час. В реакционную смесь добавляют воду и экстрагируют смесь этилацетатом. Органический слой последовательно промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением 2-[(4-нитрофенокси)метил]-1,3,4-оксадиазола в виде бесцветных кристаллов (0,79 г, выход 69%) из фракции, элюируемой гексаном-этилацетатом (1:1, объем/объем). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 125-126°C.
Сравнительный пример 72
Смесь 2-(4-нитрофенил)ацетамида (15,0 г), 1-бром-2-пропанона (19,03 г), и N,N-диметилформамида (2 мл) перемешивают при 120°C в течение 3 час. Воду, карбонат калия и этилацетат добавляют для подщелачивания реакционной смеси и экстрагируют смесь этилацетатом. Нерастворимые материалы собирают фильтрацией и отделяют органический слой. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением 4-метил-2-(4-нитробензил)-1,3-оксазола в виде оранжевых кристаллов (1,50 г, выход 8,2%) из фракции, элюируемой гексаном-этилацетатом (2:1, объем/объем). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 67-68°C.
Сравнительный пример 73
К смеси 2-(4-нитрофенокси)ацетогидразида (1,57 г) и N,N-диметилацетамида (50 мл) при комнатной температуре добавляют по каплям ацетил хлорид (0,70 г). Реакционную смесь перемешивают в течение 2 час. В реакционную смесь добавляют воду и экстрагируют смесь этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Смесь полученного остатка, дифосфор пентаоксида (1,76 г), гексаметилдисилоксана (4,03 г) и 1,2-дихлорбензола (10 мл) перемешивают при 140°C в течение 3 час. В реакционную смесь добавляют насыщенный водный раствор бикарбоната натрия и экстрагируют смесь этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением 2-метил-5-[(4-нитрофенокси)метил]-1,3,4-оксадиазола в виде бесцветных кристаллов (0,41 г, выход 56%) из фракции, элюируемой гексаном-этилацетатом (3:2-1:1, объем/объем). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 105-106°C.
Сравнительный пример 74
Смесь 2-(4-нитрофенил)ацетамида (14,6 г), 1-бром-2-бутанона (20,46 г) и N,N-диметилформамида (2 мл) перемешивают при 140°C в течение 2 час. Для подщелачивания реакционной смеси добавляют воду, карбонат калия и этилацетат и экстрагируют смесь этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением 4-этил-2-(4-нитробензил)-1,3-оксазола в виде коричневых кристаллов (2,65 г, выход 14%) из фракции, элюируемой гексаном-этилацетатом (2:1, объем/объем). Его перекристаллизация из этилацетата-гексана дает коричневые призматические кристаллы. Температура плавления: 58-59°C.
Сравнительный пример 75
К смеси этил (4-{[(бензилокси)карбонил]амино}фенил)ацетата (0,30 г) и тетрагидрофурана (10 мл) при 0°C добавляют по каплям 1 M метил магний бромид (1 M раствор в тетрагидрофуране, 10 мл). Реакционную смесь перемешивают при комнатной температуре в течение 1 час. В реакционную смесь добавляют 1н. хлористоводородную кислоту и экстрагируют смесь этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением бензил 4-(2-гидрокси-2-метилпропил)фенилкарбамата в виде бесцветных кристаллов (0,17 г, выход 59%) из фракции, элюируемой гексаном-этилацетатом (4:1-2:1, объем/объем). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 117-118°C.
Сравнительный пример 76
К смеси этил (4-{[(бензилокси)карбонил]амино}фенил)ацетата (15,3 г) и тетрагидрофурана (100 мл) при 0°C добавляют по каплям 1 M этил магний бромид (1 M раствор в тетрагидрофуране, 500 г). Реакционную смесь перемешивают при комнатной температуре в течение 15 час. В реакционную смесь добавляют 1н. хлористоводородную кислоту и экстрагируют смесь этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением бензил 4-(2-этил-2-гидроксибутил)фенилкарбамата в виде бесцветных кристаллов из фракции, элюируемой гексаном-этилацетатом (2:1-1:1, объем/объем). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы (6,86 г, выход 43%). Температура плавления: 99-100°C.
Сравнительный пример 77
Смесь бензил 4-(2-гидрокси-2-метилпропил)фенилкарбамата (8,60 г), 10% палладия на угле (9,0 г) и тетрагидрофурана (300 мл) подвергают каталитическому восстановлению в атмосфере водорода, при атмосферном давлении. Катализатор удаляют фильтрацией и фильтрат концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением 1-(4-аминофенил)-2-метилпропан-2-ола в виде бесцветных кристаллов (3,54 г, выход 75%) из фракции, элюируемой гексаном-этилацетатом (1:1, объем/объем). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 107-108°C.
Сравнительный пример 78
Смесь бензил 4-(2-этил-2-гидроксибутил)фенилкарбамата (6,30 г), 10% палладия на угле (5,0 г) и тетрагидрофурана (150 мл) подвергают каталитическому восстановлению в атмосфере водорода при атмосферном давлении. Катализатор удаляют фильтрацией, и фильтрат концентрируют с получением 3-(4-аминобензил)-3-пентанола в виде бесцветных кристаллов (3,51 г, выход 95%). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 85-86°C.
Сравнительный пример 79
К смеси гидроксиламина гидрохлорида (21,5 г) и диметилсульфоксида (50 мл) при комнатной температуре добавляют по каплям 28% раствор метоксида натрия в метаноле (59,6 г). В реакционную смесь дополнительно добавляют по каплям раствор (50 мл) (4-нитрофенил)ацетонитрила (10,0 г) в диметилсульфоксиде. Реакционную смесь перемешивают при 100°C в течение 3 час. В реакционную смесь добавляют воду и экстрагируют смесь этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением N'-гидрокси-2-(4-нитрофенил)этанимидамида в виде коричневых кристаллов (7,10 г, выход 59%). Его перекристаллизация из этилацетата-простого диизопропилового эфира дает коричневые призматические кристаллы. Температура плавления: 170-171°C.
Сравнительный пример 80
К смеси N'-гидрокси-2-(4-нитрофенил)этанимидамида (2,38 г) и N,N-диметилацетамида (30 мл) при комнатной температуре добавляют ацетил хлорид (0,96 г) и смесь перемешивают при комнатной температуре в течение 15 час. В реакционную смесь выливают воду и экстрагируют смесь этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Смесь полученного остатка и ксилола (100 мл) нагревают с обратным холодильником в течение 24 час. Реакционную смесь концентрируют и к полученному остатку добавляют этилацетат. Смесь промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением 5-метил-3-(4-нитробензил)-1,2,4-оксадиазола в виде оранжевых кристаллов (1,00 г, выход 37%) из фракции, элюируемой гексаном-этилацетатом (4:1-3:1, объем/объем). Его перекристаллизация из этилацетата-гексана дает оранжевые призматические кристаллы. Температура плавления: 66-67°C.
Сравнительный пример 81
Смесь 5-метил-3-(4-нитробензил)-1,2,4-оксадиазола (3,89 г), катализатора Линдлара (2,0 г) и тетрагидрофурана (200 мл) подвергают каталитическому восстановлению в атмосфере водорода, при атмосферном давлении. Катализатор удаляют фильтрацией и фильтрат концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением 4-[(5-метил-1,2,4-оксадиазол-3-ил)метил]анилина в виде коричневого масла (0,33 г, выход 10%) из фракции, элюируемой гексаном-этилацетатом (3:1-2:1, объем/объем).
ЯМР (CDCl3) δ: 2,52 (3H, c), 3,62 (2H, ушир.c), 3,92 (2H, c), 6,62-6,66 (2H, м), 7,08-7,12 (2H, м).
Сравнительный пример 82
Смесь 1-бром-3-(4-нитрофенил)-2-пропанона (0,50 г), пропантиоамида (0,17 г) и этанола (10 мл) нагревают с обратным холодильником в течение 2 час. Насыщенный водный раствор бикарбоната натрия выливают в реакционную смесь и экстрагируют смесь этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением 2-этил-4-(4-нитробензил)-1,3-тиазола в виде бесцветного масла (0,45 г, выход 96%) из фракции, элюируемой гексаном-этилацетатом (9:1-4:1, объем/объем).
ЯМР (CDCl3) δ: 1,38 (3H, т, J=7,5 Гц), 3,02 (2H, кв, J=7,5 Гц), 4,19 (2H, c), 6,74 (1H, c), 7,40-7,44 (2H, м), 8,15-8,18 (2H, м).
Сравнительный пример 83
К смеси N'-гидрокси-2-(4-нитрофенил)этанимидамида (6,17 г) и N,N-диметилацетамида (50 мл) добавляют пропионил хлорид (3,22 г) при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 2 час. В реакционную смесь выливают воду и экстрагируют смесь этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Смесь полученного остатка и ксилола (200 мл) нагревают с обратным холодильником в течение 15 час при азеотропном дегидратировании. Реакционную смесь концентрируют и полученный остаток подвергают колоночной хроматографии на силикагеле с получением 5-этил-3-(4-нитробензил)-1,2,4-оксадиазола в виде коричневых кристаллов (4,40 г, выход 60%) из фракции, элюируемой гексаном-этилацетатом (3:1-2:1, объем/объем). Его перекристаллизация из этилацетата-гексана дает бледно-желтые призматические кристаллы. Температура плавления: 69-70°C.
Сравнительный пример 84
Смесь 5-этил-3-(4-нитробензил)-1,2,4-оксадиазола (4,30 г), железа (восстановленного, 5,14 г), хлорида кальция (0,20 г) и 80% этанола (50 мл) нагревают с обратным холодильником в течение 2 час. Нерастворимые материалы собирают фильтрацией и фильтрат концентрируют. К остатку добавляют воду и экстрагируют смесь этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением 4-[(5-этил-1,2,4-оксадиазол-3-ил)метил]анилина в виде оранжевого масла (2,73 г, выход 73%) из фракции, элюируемой гексаном-этилацетатом (2:1-1:1, объем/объем).
ЯМР (CDCl3) δ: 1,35 (3H, т, J=7,6 Гц), 2,86 (2H, кв, J=7,6 Гц), 3,62 (2H, ушир.c), 3,93 (2H, c), 6,61-6,66 (2H, м), 7,08-7,12 (2H, м).
Сравнительный пример 85
Смесь 1-бром-3-(4-нитрофенил)-2-пропанона (0,80 г), тиоацетамида (0,23 г) и этанола (20 мл) нагревают с обратным холодильником в течение 2 час. Реакционную смесь концентрируют и к остатку добавляют насыщенный водный раствор бикарбоната натрия. Смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением 2-метил-4-(4-нитробензил)-1,3-тиазола в виде бледно-желтых кристаллов (0,58 г, выход 79%) из фракции, элюируемой гексаном-этилацетатом (3:1-2:1, объем/объем). Его перекристаллизация из этилацетата-гексана дает бледно-желтые призматические кристаллы. Температура плавления: 118-119°C.
Сравнительный пример 86
К смеси 5-(4-нитробензил)-1,3,4-оксадиазол-2(3H)-она (1,0 г), иодометана (0,97 г) и N,N-диметилформамида (30 мл) добавляют гидрид натрия (60% в масле, 0,20 г) при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 2 час. В реакционную смесь выливают воду и экстрагируют смесь этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением 3-метил-5-(4-нитробензил)-1,3,4-оксадиазол-2(3H)-она в виде бесцветных кристаллов (0,75 г, выход 71%) из фракции, элюируемой гексаном-этилацетатом (3:1-2:1, объем/объем). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 115-116°C.
Сравнительный пример 87
К смеси 5-(4-нитробензил)-1,3,4-оксадиазол-2(3H)-она (1,50 г), иодоэтана (1,59 г) и N,N-диметилформамида (50 мл) при комнатной температуре добавляют гидрид натрия (60% в масле, 0,30 г). Реакционную смесь перемешивают при комнатной температуре в течение 3 час. В реакционную смесь выливают воду и экстрагируют смесь этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением 3-этил-5-(4-нитробензил)-1,3,4-оксадиазол-2(3H)-она в виде бесцветных кристаллов (0,99 г, выход 59%) из фракции, элюируемой гексаном-этилацетатом (3:1-2:1, объем/объем). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 108-109°C.
Сравнительный пример 88
К смеси 5-(4-нитробензил)-1H-тетразола (5,0 г) и N,N-диметилформамида (200 мл) добавляют гидрид натрия (60% в масле, 1,17 г) при 0°C. Реакционную смесь перемешивают при 0°C в течение 1 час и добавляют иодоэтан (5,69 г) при 0°C. Реакционную смесь перемешивают при 0°C в течение 2 час и в реакционную смесь выливают воду. Смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением 2-этил-5-(4-нитробензил)-2H-тетразола в виде коричневого масла (2,70 г, выход 48%) из фракции, элюируемой гексаном-этилацетатом (2:1-1:2, объем/объем).
ЯМР (CDCl3) δ: 1,63 (3H, т, J=7,5 Гц), 4,35 (2H, c), 4,63 (2H, кв, J=7,5 Гц), 7,48-7,52 (2H, м), 8,16-8,20 (2H, м).
В дополнение к этому, 1-этил-5-(4-нитробензил)-1H-тетразол получают в виде коричневых кристаллов (0,65 г, выход 11%) из элюируемой после этого фракции, последовательно. Его перекристаллизация из этилацетата-гексана дает коричневые призматические кристаллы. Температура плавления: 104-105°C.
ЯМР (CDCl3) δ: 1,44 (3H, т, J=7,4 Гц), 4,25 (2H, кв, J=7,4 Гц), 4,40 (2H, c), 7,40-7,44 (2H, м), 8,20-8,24 (2H, м).
Сравнительный пример 89
Смесь 2-(4-нитрофенил)этантиоамида (1,11 г), 2-хлор-3-бутанона (0,75 г) и трет-бутанола (50 мл) нагревают с обратным холодильником в течение 4 дней. Реакционную смесь концентрируют и к остатку добавляют воду и насыщенный водный раствор бикарбоната натрия. Смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением 4,5-диметил-2-(4-нитробензил)-1,3-тиазола в виде бледно-желтых кристаллов (0,67 г, выход 47%) из фракции, элюируемой гексаном-этилацетатом (2:1-1:1, объем/объем). Его перекристаллизация из этилацетата-гексана дает бледно-желтые призматические кристаллы. Температура плавления: 93-94°C.
Сравнительный пример 90
Смесь 2-(4-нитрофенил)этантиоамида (7,0 г), 2-хлор-циклогексанона (7,28 г) и трет-бутанола (100 мл) нагревают с обратным холодильником в течение 3 дней. Реакционную смесь концентрируют и к остатку добавляют насыщенный водный раствор бикарбоната натрия. Смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением 2-(4-нитробензил)-4,5,6,7-тетрагидро-1,3-бензотиазола в виде бледно-коричневых кристаллов (6,58 г, выход 66%) из фракции, элюируемой гексаном-этилацетатом (3:1, объем/объем). Его перекристаллизация из этилацетата-гексана дает бледно-желтые призматические кристаллы. Температура плавления: 118-119°C.
Сравнительный пример 91
2-(4-Нитробензил)-5-пропил-1,3,4-оксадиазол (7,70 г), 5% палладий на угле (7,0 г) и тетрагидрофуран (200 мл) подвергают каталитическому восстановлению в атмосфере водорода, при атмосферном давлении. Катализатор удаляют фильтрацией и фильтрат концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением 4-[(5-пропил-1,3,4-оксадиазол-2-ил)метил]анилина в виде бледно-желтых кристаллов (3,74 г, выход 55%) из фракции, элюируемой гексаном-этилацетатом (1:1-1:2, объем/объем). Его перекристаллизация из этилацетата-гексана дает бледно-желтые призматические кристаллы. Температура плавления: 60-61°C.
Подобным же способом, как и в примере 91, получают соединения, описанные в примерах 92-112.
Сравнительный пример 92
5-(4-Аминобензил)-1,3,4-оксадиазол-2(3H)-он получают в виде бесцветных кристаллов (выход 75%). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 267-268°C.
Сравнительный пример 93
4-[2-(5-Этил-1,3,4-оксадиазол-2-ил)этил]анилин получают в виде бесцветного масла (выход 97%).
ЯМР (CDCl3) δ: 1,35 (3H, т, J=7,6 Гц), 2,83 (2H, кв, J=7,6 Гц), 2,92-3,11 (4H, м), 3,61 (2H, ушир.c), 6,58-6,66 (2H, м), 6,95-7,02 (2H, м).
Сравнительный пример 94
4-[2-(1,3,4-Оксадиазол-2-ил)этил]анилин получают в виде бесцветных кристаллов (выход 77%). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 73-74°C.
Сравнительный пример 95
4-[2-(4-Этил-1,3-тиазол-2-ил)этил]анилин получают в виде коричневого масла (выход 96%).
ЯМР (CDCl3) δ: 1,29 (3H, т, J=7,6 Гц), 2,73-2,85 (2H, м), 2,93-3,07 (2H, м), 3,18-3,27 (2H, м), 3,58 (2H, ушир.c), 6,59-6,71 (3H, м), 6,90-7,11 (2H, м).
Сравнительный пример 96
4-(1,3-Тиазол-4-илметокси)анилин получают в виде бледно-желтых кристаллов (выход 78%). Его перекристаллизация из этилацетата-гексана дает бледно-желтые призматические кристаллы. Температура плавления: 114-115°C.
Сравнительный пример 97
4-[(2-Этил-1,3-тиазол-4-ил)метокси]анилин получают в виде коричневого масла (выход 83%).
ЯМР (CDCl3) δ: 1,40 (3H, т, J=7,2 Гц), 3,04 (2H, кв, J=7,2 Гц), 3,44 (2H, ушир.c), 5,08 (2H, д, J=0,9 Гц), 6,60-6,65 (2H, м), 6,79-6,84 (2H, м), 7,14 (1H, д, J=0,9 Гц).
Сравнительный пример 98
4-(1,3,4-Оксадиазол-2-илметокси)анилин получают в виде бесцветных кристаллов (выход 83%). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 56-57°C.
Сравнительный пример 99
4-[(4-Метил-1,3-оксазол-2-ил)метил]анилин получают в виде бесцветных кристаллов (выход 80%). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 84-85°C.
Сравнительный пример 100
4-[(5-Метил-1,3,4-оксадиазол-2-ил)метокси]анилин получают в виде бесцветного масла (выход 87%).
ЯМР (CDCl3) δ: 2,55 (3H, c), 3,49 (2H, ушир.c), 5,13 (2H, c), 6,60-6,65 (2H, м), 6,80-6,86 (2H, м).
Сравнительный пример 101
4-[(4-Этил-1,3-оксазол-2-ил)метил]анилин получают в виде бесцветного масла (выход 94%).
ЯМР (CDCl3) δ: 1,20 (3H, т, J=7,5 Гц), 2,52 (2H, кв, J=7,5 Гц), 3,63 (2H, ушир.c), 3,96 (2H, c), 6,61-6,66 (2H, м), 7,06-7,09 (2H, м), 7,23 (1H, c).
Сравнительный пример 102
4-[(2-Этил-1,3-тиазол-4-ил)метил]анилин получают в виде бесцветные масла (выход 92%).
ЯМР (CDCl3) δ: 1,37 (3H, т, J=7,5 Гц), 3,01 (2H, кв, J=7,5 Гц), 3,59 (2H, ушир.c), 3,98 (2H, c), 6,56 (1H, c), 6,62-6,67 (2H, м), 7,04-7,08 (2H, м).
Сравнительный пример 103
{4-[(2-Метил-1,3-тиазол-4-ил)метил]анилин получают в виде бесцветного масла (выход 95%).
ЯМР (CDCl3) δ: 2,68 (3H, c), 3,59 (2H, ушир.c), 3,97 (2H, c), 6,56 (1H, c), 6,63-6,67 (2H, м), 7,04-7,07 (2H, м).
Сравнительный пример 104
5-(4-Аминобензил)-3-этил-1,3,4-оксадиазол-2(3H)-он получают в виде бесцветных кристаллов (выход 71%). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 88-89°C.
Сравнительный пример 105
4-[(1-Метил-1H-тетразол-5-ил)метил]анилин получают в виде бледно-желтых кристаллов (выход 81%). Его перекристаллизация из этилацетата-гексана дает бледно-желтые призматические кристаллы. Температура плавления: 104-105°C.
Сравнительный пример 106
4-[(2-Метил-2H-тетразол-5-ил)метил]анилин получают в виде бесцветного масла (выход 94%).
ЯМР (CDCl3) δ: 3,61 (2H, ушир.c), 4,11 (2H, c), 4,28 (3H, c), 6,62-6,65 (2H, м), 7,08-7,13 (2H, м).
Сравнительный пример 107
4-[(1-Этил-1H-тетразол-5-ил)метил]анилин получают в виде бледно-желтых кристаллов (выход 78%). Его перекристаллизация из этилацетата-гексана дает бледно-желтое призматические кристаллы. Температура плавления: 94-95°C.
Сравнительный пример 108
4-[(2-Этил-2H-тетразол-5-ил)метил]анилин получают в виде бесцветного масла (выход 98%).
ЯМР (CDCl3) δ: 1,60 (3H, т, J=7,4 Гц), 3,61 (2H, ушир.c), 4,12 (2H, c), 4,59 (2H, кв, J=7,4 Гц), 6,60-6,65 (2H, м), 7,09-7,13 (2H, м).
Сравнительный пример 109
6-Амино-1,3-бензоксазол-2(3H)-он получают в виде бесцветных кристаллов (выход 96%). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 205-207°C (разложение).
Сравнительный пример 110
4-(1,3-Бензоксазол-2-илметил)анилин получают в виде бесцветных кристаллов (выход 78%). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 105-106°C.
Сравнительный пример 111
4-[(4,5-Диметил-1,3-тиазол-2-ил)метил]анилин получают в виде бесцветных кристаллов (выход 82%). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 91-92°C.
Сравнительный пример 112
4-(4,5,6,7-Тетрагидро-1,3-бензотриазол-2-илметил)анилин получают в виде бледно-желтых кристаллов (выход 95%).
ЯМР (CDCl3) δ: 1,80-1,85 (4H, м), 2,64-2,76 (4H, м), 3,62 (2H, ушир.c), 4,12 (2H, c), 6,62-6,66 (2H, м), 7,08-7,20 (2H, м).
Сравнительный пример 113
Смесь 4'-фторацетофенона (4,00 г), N,N-диметилформамида диметилацеталя (4,48 г) и N,N-диметилформамида (4 мл) перемешивают при 110°C в течение 1 час. Смесь дополнительно перемешивают в течение 6 час с удалением метанола при атмосферном давлении. После охлаждения до 25°C добавляют этилацетат (48 мл) для растворения. Раствор, приготовленный отдельно, путем растворения моногидрата п-толуолсульфоновой кислоты (6,06 г) в воде (7 мл) и добавления по каплям этилгидразина (1,91 г) добавляют при 25-30°C в течение примерно 5 мин к этилацетатному раствору, рассмотренному ранее. Смесь перемешивают при комнатной температуре в течение 5,5 час и распределяют путем добавления 5% водного раствора бикарбоната натрия. Водный слой экстрагируют этилацетатом. Органические слои объединяют и последовательно промывают водой и 10% насыщенным раствором соли. Растворитель выпаривают с количественным получением 1-этил-5-(4-фторфенил)-1H-пиразола в виде масла.
ЯМР (CDCl3) δ: 1,38-1,43 (3H, м), 4,09-4,17 (2H, м), 6,24 (1H, c), 7,14-7,17 (2H, м), 7,34-7,39 (2H, м), 7,53 (1H, c).
К раствору полученного масла в N,N-диметилформамиде (16 мл) при 70-80°C добавляют по каплям фосфор оксихлорид (7,55 г) в течение примерно 2 час. Смесь перемешивают при 80-85°C в течение 1 час и при 90-95°C в течение 3 час. При 40°C или ниже добавляют по каплям воду (16 мл) и при 30°C или ниже добавляют по каплям 4н. водный раствор гидроксида калия, для установления pH 7-8. Смесь экстрагируют этилацетатом и органический слой промывают водой. Растворитель выпаривают и остаток подвергают колоночной хроматографии на силикагеле и элюируют этилацетатом-гексаном (1:5, объем/объем) с получением 1-этил-5-(4-фторфенил)-1H-пиразол-4-карбальдегида (3,66 г, выход 58%) в виде масла.
ЯМР (CDCl3) δ: 1,39-1,45 (3H, м), 4,05-4,16 (2H, м), 7,26-7,29 (2H, м), 7,40-7,46 (2H, м), 8,05 (1H, c), 9,58 (1H, c).
Сравнительный пример 114
Смесь 4'-фторацетофенона (3,95 г), N,N-диметилформамида диметилацеталя (4,43 г) и N,N-диметилформамида (4 мл) перемешивают при 110°C в течение 1 час. Смесь дополнительно перемешивают в течение 6 час с удалением метанола при атмосферном давлении. После охлаждения до 25°C добавляют этилацетат (48 мл) для растворения. Раствор, приготовленный отдельно, путем растворения бензилгидразина моногидрохлорида (4,99 г) в воде (5 мл), добавляют при 25-30°C в течение примерно 5 мин к этилацетатному раствору, рассмотренному ранее. Смесь перемешивают при комнатной температуре в течение 17 час и распределяют путем добавления 5% водного раствора бикарбоната натрия. Водный слой экстрагируют этилацетатом. Органические слои объединяют и последовательно промывают водой и 10% насыщенным раствором соли. Растворитель выпаривают с количественным получением 1-бензил-5-(4-фторфенил)-1H-пиразола в виде масла.
ЯМР (CDCl3)δ: 5,32 (2H, c), 6,32 (1H, д,J=1,84 Гц), 7,02-7,10 (4H, м), 7,24-7,31 (5H, м), 7,60 (1H, д, J=1,82 Гц).
К раствору полученного масла в N,N-диметилформамиде (16 мл) при 70-80°C добавляют по каплям фосфор оксихлорид (7,45 г) в течение примерно 2 час. Смесь перемешивают при 80-85°C в течение 1 час и при 90-95°C в течение 4 час. При 40°C или ниже добавляют по каплям воду (16 мл) и при 30°C или ниже добавляют по каплям 4н. водный раствор гидроксида калия, для установления pH 7-8. Смесь экстрагируют этилацетатом и органический слой промывают водой. Растворитель выпаривают и остаток подвергают колоночной хроматографии на силикагеле и элюируют этилацетатом-гексаном (1:5, объем/объем) с получением 1-бензил-5-(4-фторфенил)-1H-пиразол-4-карбальдегида (5,18 г, выход 65%) в виде масла.
ЯМР (CDCl3) δ: 5,24 (2H, c), 7,02-7,05 (2H, м), 7,15-7,21 (2H, м), 7,27-7,33 (5H, м), 8,10 (1H, c), 9,60 (1H, c).
Сравнительный пример 115
Смесь п-метилацетофенона (5,00 г), N,N-диметилформамида диметилацеталя (6,66 г) и N,N-диметилформамида (5 мл) перемешивают при 110°C в течение 1 час. Смесь дополнительно перемешивают в течение 10 час с удалением метанола при атмосферном давлении. После охлаждения до 25°C этилацетат (60 мл) добавляют для растворения. Раствор, приготовленный отдельно, путем растворения в воде моногидрата п-толуолсульфоновой кислоты (7,80 г) (7 мл) и добавления по каплям метилгидразина (1,89 г), добавляют при 25-30°C в течение примерно 5 мин к этилацетатному раствору, рассмотренному ранее. Смесь перемешивают при комнатной температуре в течение 5 час и распределяют путем добавления 5% водного раствора бикарбоната натрия. Водный слой экстрагируют этилацетатом. Органические слои объединяют и последовательно промывают водой и 10% насыщенным раствором соли. Растворитель выпаривают, с количественным получением 1-метил-5-(4-метилфенил)-1H-пиразола в виде масла.
ЯМР (CDCl3) δ: 2,37 (3H, c), 3,86 (3H, c), 6,26 (1H, д, J=1,88 Гц), 7,23-7,33 (4H, м), 7,49 (1H, д, J=1,86 Гц).
К раствору полученного масла в N,N-диметилформамиде (20 мл) при 70-80°C добавляют по каплям фосфор оксихлорид (9,71 г) в течение примерно 2 час. Смесь перемешивают при 80-85°C в течение 1 час и при 90-95°C в течение 3,5 час. При 40°C или ниже добавляют по каплям воду (16 мл) и при 30°C или ниже добавляют по каплям 4н. водный раствор гидроксида калия, для установления pH 7-8. Смесь экстрагируют этилацетатом и органический слой промывают водой. Растворитель выпаривают и остаток подвергают колоночной хроматографии на силикагеле и элюируют этилацетатом-гексаном (1:7-1:5, объем/объем) с получением 1-метил-5-(4-метилфенил)-1H-пиразол-4-карбальдегида (4,52 г, выход 61%) в виде масла.
ЯМР (CDCl3) δ: 2,47 (3H, c), 3,82 (3H, c), 7,31-7,38 (4H, м), 8,03 (1H, c), 9,61 (1H, c).
Сравнительный пример 116
Смесь п-метоксиацетофенона (5,00 г), N,N-диметилформамида диметилацеталя (5,95 г) и N,N-диметилформамида (5 мл) перемешивают при 110°C в течение 1 час. Смесь дополнительно перемешивают в течение 10 час с удалением метанола при атмосферном давлении. После охлаждения до 25°C для растворения добавляют этилацетат (60 мл). Раствор, приготовленный отдельно, путем растворения моногидрата п-толуолсульфоновой кислоты (6,97 г) в воде (7 мл) и добавления по каплям метилгидразина (1,69 г) добавляют при 25-30°C в течение примерно 5 мин к этилацетатному раствору, рассмотренному ранее. Смесь перемешивают при комнатной температуре в течение 18 час и распределяют посредством добавления 5% водного раствора бикарбоната натрия. Водный слой экстрагируют этилацетатом. Органические слои объединяют и последовательно промывают водой и 10% насыщенным раствором соли. Растворитель выпаривают, с количественным получением 5-(4-метоксифенил)-1-метил-1H-пиразол в виде масла.
ЯМР (CDCl3) δ: 3,85 (3H, c), 3,87 (3H, c), 6,25 (1H, c), 6,97-7,00 (2H, м), 7,33-7,36 (2H, м), 7,49 (1H, c).
К раствору полученного масла в N,N-диметилформамиде (20 мл) при 70-80°C добавляют по каплям фосфор оксихлорид (8,55 г) в течение примерно 2 час. Смесь перемешивают при 80-85°C в течение 1 час и при 90-95°C в течение 3 час. При 40°C или ниже добавляют по каплям воду (20 мл) и при 30°C или ниже добавляют по каплям 4н. водный раствор гидроксида калия, для установления pH 7-8. Смесь экстрагируют этилацетатом и органический слой промывают водой. Растворитель выпаривают и остаток подвергают колоночной хроматографии на силикагеле и элюируют этилацетатом-гексаном (1:7-1:4, объем/объем) с получением 5-(4-метоксифенил)-1-метил-1H-пиразол-4-карбальдегида (4,05 г, выход 56%) в виде масла.
ЯМР (CDCl3) δ: 3,81 (3H, c), 3,89 (3H, c), 7,04-7,08 (2H, м), 7,33-7,38 (2H, м), 8,02 (1H, c), 9,61 (1H, c).
Сравнительный пример 117
Смесь 4'-фторацетофенона (10,00 г), N,N-диметилформамид диметилацеталя (11,21 г) и N,N-диметилформамида (10 мл) перемешивают при 110°C в течение 1 час. Смесь дополнительно перемешивают в течение 8 час с удалением метанола при атмосферном давлении. После охлаждения до 25-30°C для растворения добавляют этилацетат (120 мл). Раствор, приготовленный отдельно, посредством суспендирования моногидрата п-толуолсульфоновой кислоты (15,1 г) в воде (3 мл) и добавления по каплям при 25°C или ниже 35% водного раствора метилгидразина (10,48 г) добавляют при внутренней температуре 25°C в течение примерно 10 мин к этилацетатному раствору, рассмотренному ранее. Смесь перемешивают при комнатной температуре в течение 4 час, добавляют 5% водный раствор бикарбоната натрия и экстрагируют смесь этилацетатом. Органический слой последовательно промывают водой и 5% насыщенным раствором соли. Растворитель выпаривают, с количественным получением 5-(4-фторфенил)-1-метил-1H-пиразола в виде масла.
ЯМР (CDCl3) δ: 3,86 (3H, c), 6,27 (1H, c), 7,11-7,18 (2H,м), 7,36-7,41 (2H, м), 7,50 (1H, c).
К раствору полученного масла в диметилформамиде (40 мл) добавляют по каплям фосфор оксихлорид (18,87 г) при 70-80°C в течение примерно 3 час. Смесь перемешивают при 80°C в течение 1 час и при 90°C в течение 4 час. При 40°C или ниже добавляют по каплям воду (20 мл) и при внутренней температуре 30°C или ниже добавляют по каплям 4н. водный раствор гидроксида калия, для установления pH 7,5-8,0. Воду (28 мл) добавляют по каплям и смесь перемешивают при 25°C в течение 1 час. Выпавшие кристаллы собирают фильтрацией и промывают 20% этанолом. Полученные кристаллы перекристаллизуют из этанола-воды с получением 5-(4-фторфенил)-1-метил-1H-пиразол-4-карбальдегида (11,01 г, выход 74%).
ЯМР (CDCl3) δ: 3,80 (3H, c), 7,22-7,28 (2H, м), 7,39-7,44 (2H, м), 8,03 (1H, c), 9,61 (1H, c).
Сравнительный пример 118
К смеси 5-(4-фторфенил)-1-метил-1H-пиразол-4-карбальдегида (3,00 г), малоновой кислоты (1,99 г) и простого бис(2-метоксиэтилового) эфира (9 мл) в течение примерно 10 мин добавляют по каплям пиперидин (1,89 мл). Смесь перемешивают при 90-95°C в течение 1 час и, дополнительно, при 105-110°C в течение 4 час. После охлаждения до 25°C добавляют толуол (12 мл) и 1н. водный раствор гидроксида натрия (15 мл) и смесь перемешивают. Водный слой отделяют и органический слой экстрагируют 1н. водным раствором гидроксида натрия (6 мл). Водные слои объединяют и промывают толуолом. Слои доводят до pH 3,5-4,0 2н. хлористоводородной кислотой при 20-30°C и добавляют по каплям воду (9 мл). После перемешивания при 25°C в течение 1 час выпавшие кристаллы собирают фильтрацией и промывают 20% этанолом с получением (2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриловой кислоты (3,24 г, выход 90%).
ЯМР (ДМСО-d6) δ: 3,73 (3H, c), 6,25 (1H, д, J=15,9 Гц), 7,14 (1H, д, J=15,9 Гц), 7,41-7,56 (4H, м), 8,09 (1H, c), 12,11 (1H, ушир.).
Сравнительный пример 119
Смесь этил 3-(3-фурил)-3-оксопропионата (7,8 г) и N,N-диметилформамид диметилацеталя (6,15 г) перемешивают при нагревании с обратным холодильником в течение 1 час. Реакционную смесь концентрируют и добавляют метилгидразин (5,92 г) и этанол (50 мл). Смесь перемешивают при нагревании с обратным холодильником в течение 30 мин. Реакционную смесь концентрируют, добавляют к остатку воду и экстрагируют смесь этилацетатом. Органический слой промывают водой, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением бледно-красного масла (7,55 г) из фракции, элюируемой гексаном-этилацетатом (4:1, объем/объем). Это бледно-красное масло растворяют в тетрагидрофуране (250 мл) и при 0°C осторожно добавляют литий алюминий гидрид (1,3 г) и смесь перемешивают при 0°C в течение 30 мин. В реакционную смесь осторожно добавляют 1н. водный раствор гидроксида натрия до тех пор, пока твердый продукт не перестанет осаждаться и после перемешивания при комнатной температуре в течение 30 мин смесь фильтруют. Фильтрат концентрируют с получением желтого масла (4,89 г). Это желтое масло растворяют в тетрагидрофуране (200 мл), в который добавляют активированный диоксид марганца (10 г), и перемешивают при нагревании смесь при комнатной температуре в течение 14 час. Реакционную смесь фильтруют. Фильтрат концентрируют и остаток подвергают колоночной хроматографии на силикагеле с получением 5-(3-фурил)-1-метил-1H-пиразол-4-карбальдегида (4,25 г) в виде кристаллов из фракции, элюируемой гексаном-этилацетатом (2:1, объем/объем). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 70-71°C.
Из фракции, элюируемой после указанного выше соединения, получают 3-(3-фурил)-1-метил-1H-пиразол-4-карбальдегид (0,60 г) в виде кристаллов. Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 77-78°C.
Сравнительный пример 120
Смесь 5-(3-фурил)-1-метил-1H-пиразол-4-карбальдегида (900 мг), гидрида натрия (60% в масле, 245 мг), этил диэтилфосфоноацетата (1,26 г) и N,N-диметилформамида (10 мл) при комнатной температуре перемешивают в течение 1 час. Реакционную смесь выливают в воду и экстрагируют этилацетатом. Органический слой промывают водой, сушат над безводным сульфатом магния и концентрируют. Перекристаллизация остатка из этилацетата-гексана дает этил (2E)-3-[5-(3-фурил)-1-метил-1H-пиразол-4-ил]акрилат (866 мг, 69%) в виде бесцветных призматических кристаллов. Температура плавления: 82-83°C.
Сравнительный пример 121
К смеси этил (2E)-3-[5-(3-фурил)-1-метил-1H-пиразол-4-ил]акрилата (800 мг), тетрагидрофурана (10 мл) и этанола (10 мл) добавляют 2н. водный раствор гидроксида натрия (6,5 мл) и смесь перемешивают при 60°C в течение 1 час. 1н. Хлористоводородную кислоту выливают в реакционную смесь и выпавшие твердые продукты собирают фильтрацией, промывают водой и сушат в потоке воздуха с получением (2E)-3-[5-(3-фурил)-1-метил-1H-пиразол-4-ил]акриловой кислоты (703 мг, 99%) в виде кристаллов. Ее перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 218-219°C.
Сравнительный пример 122
Смесь этил 3-оксо-3-(2-тиенил)пропионата (10,3 г) и N,N-диметилформамид диметилацеталя (7,28 г) перемешивают при нагревании с обратным холодильником в течение 30 мин. Реакционную смесь концентрируют и добавляют метилгидразин (7,19 г) и этанол (50 мл). Смесь перемешивают при нагревании с обратным холодильником в течение 30 мин. Реакционную смесь концентрируют и в остаток выливают воду. Смесь экстрагируют этилацетатом, и органический слой промывают водой, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением бледно-красного масла (9,37 г) из фракции, элюируемой гексаном-этилацетатом (4:1, объем/объем). Это бледно-красное масло растворяют в тетрагидрофуране (250 мл) и при 0°C осторожно добавляют литий алюминий гидрид (1,5 г) и смесь перемешивают при 0°C в течение 30 мин. В реакционную смесь осторожно добавляют 1н. водный раствор гидроксида натрия до тех пор, пока твердый продукт не перестанет осаждаться и после перемешивания при комнатной температуре в течение 30 мин ее фильтруют. Фильтрат концентрируют с получением желтого масла (6,53 г). Это желтое масло растворяют в тетрагидрофуране (250 мл). Добавляют активированный диоксид марганца (15 г) и смесь перемешивают при комнатной температуре в течение 14 час. Реакционную смесь фильтруют. Фильтрат концентрируют, и остаток подвергают колоночной хроматографии на силикагеле с получением 1-метил-5-(2-тиенил)-1H-пиразол-4-карбальдегида (3,10 г) в виде бледно-желтого масла из фракции, элюируемой гексаном-этилацетатом (2:1, объем/объем).
ЯМР (CDCl3) δ: 3,92 (3H, c), 7,20-7,30 (2H, м), 7,62 (1H, дд, J=5,1, 1,2 Гц), 8,03 (1H, c), 9,74 (1H, c).
Из фракции, элюируемой после указанного выше соединения, получают 1-метил-3-(2-тиенил)-1H-пиразол-4-карбальдегид (1,81 г) в виде кристаллов. Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 71-72°C.
Сравнительный пример 123
Смесь 1-метил-5-(2-тиенил)-1H-пиразол-4-карбальдегида (2,0 г), гидрида натрия (60% в масле, 0,5 г), этил диэтилфосфоноацетата (2,57 г) и N,N-диметилформамида (20 мл) перемешивают при комнатной температуре, в течение 1 час. Реакционную смесь выливают в воду и экстрагируют смесь этилацетатом. Органический слой промывают водой, сушат над безводным сульфатом магния и концентрируют. Перекристаллизация остатка из этилацетата-гексана дает этил (2E)-3-[1-метил-5-(2-тиенил)-1H-пиразол-4-ил]акрилат (2,09 г, 77%) в виде бледно-желтых призматических кристаллов. Температура плавления: 73-74°C.
Сравнительный пример 124
К смеси этил (2E)-3-[1-метил-5-(2-тиенил)-1H-пиразол-4-ил]акрилата (2,0 г) и метанола (20 мл) добавляют 2н. водный раствор гидроксида натрия (7,6 мл) и смесь перемешивают при 60°C в течение 30 мин. 1н. Хлористоводородную кислоту выливают в реакционную смесь и выпавшие твердые продукты собирают фильтрацией, промывают водой и сушат в потоке воздуха с получением (2E)-3-[1-метил-5-(2-тиенил)-1H-пиразол-4-ил]акриловой кислоты (1,69 г, 95%) в виде кристаллов. Ее перекристаллизация из метанола-простого изопропилового эфира дает бесцветные призматические кристаллы. Температура плавления: 210-212°C.
Сравнительный пример 125
Смесь этил 3-оксо-3-(3-пиридинил)пропионата (7,58 г) и N,N-диметилформамид диметилацеталя (6,07 г) перемешивают при нагревании с обратным холодильником в течение 30 мин. Реакционную смесь концентрируют и добавляют метилгидразин (5,85 г) и метанол (50 мл). Смесь перемешивают при нагревании с обратным холодильником в течение 30 мин. Реакционную смесь концентрируют и воду выливают в остаток. Смесь экстрагируют этилацетатом. Органический слой промывают водой, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением метил 1-метил-5-(3-пиридинил)-1H-пиразол-4-карбоксилата (1,15 г, 13%) в виде бледно-желтого масла из фракции, элюируемой гексаном-этилацетатом (2:1, объем/объем).
ЯМР (CDCl3) δ: 3,71 (3H, c), 3,78 (3H, c), 7,44-7,50 (1H, м), 7,76-7,82 (1H, м), 8,01 (1H, c), 8,64 (1H, c), 8,72-8,76 (1H, м).
Сравнительный пример 126
К смеси метил 1-метил-5-(3-пиридинил)-1H-пиразол-4-карбоксилата (1,1 г) и тетрагидрофурана (20 мл) при 0°C осторожно добавляют литий алюминий гидрид (192 мг) и смесь перемешивают при комнатной температуре, в течение 30 мин. В реакционную смесь осторожно добавляют 1н. водный раствор гидроксида натрия до тех пор, пока твердый продукт не перестанет осаждаться и после перемешивания при комнатной температуре в течение 30 мин ее фильтруют. Фильтрат концентрируют с получением желтого масла (0,95 г). Это желтое масло растворяют в тетрагидрофуране (50 мл). Добавляют активированный диоксид марганца (3 г) и смесь перемешивают при комнатной температуре в течение 14 час. Реакционную смесь фильтруют и фильтрат концентрируют. Перекристаллизация остатка из этилацетата-гексана дает 1-метил-5-(3-пиридинил)-1H-пиразол-4-карбальдегид (770 мг, 82%) в виде бледно-желтых призматических кристаллов. Температура плавления: 118-119°C.
Сравнительный пример 127
Смесь 1-метил-5-(3-пиридинил)-1H-пиразол-4-карбальдегида (750 мг), гидрида натрия (60% в масле, 176 мг), этил диэтилфосфоноацетата (1,08 г) и N,N-диметилформамида (8 мл) перемешивают при комнатной температуре, в течение 1 часа. Реакционную смесь выливают в воду и экстрагируют смесь этилацетатом. Органический слой промывают водой, сушат над безводным сульфатом магния и концентрируют. Перекристаллизация остатка из этилацетата-гексана дает этил (2E)-3-[1-метил-5-(3-пиридинил)-1H-пиразол-4-ил]акрилат (770 мг, 75%) в виде бледно-желтых призматических кристаллов. Температура плавления: 159-160°C.
Сравнительный пример 128
К смеси этил (2E)-3-[1-метил-5-(3-пиридинил)-1H-пиразол-4-ил]акрилата (700 мг) и метанола (5 мл) добавляют 2н. водный раствор гидроксида натрия (2,7 мл), и смесь перемешивают при 40°C в течение 14 час. В реакционную смесь выливают насыщенный водный раствор лимонной кислоты, для установления pH 5 и экстрагируют смесь этилацетатом. Органический слой промывают водой, сушат над безводным сульфатом магния и концентрируют. Остаток перекристаллизуют из этилацетата-простого изопропилового эфира с получением (2E)-3-[1-метил-5-(3-пиридинил)-1H-пиразол-4-ил]акриловой кислоты (296 мг, 47%) в виде бледно-желтых призматических кристаллов. Температура плавления: 236-237°C.
Сравнительный пример 129
Смесь 1,5-диметил-1H-пиразол-4-карбальдегида (400 мг), гидрида натрия (60% в масле, 155 мг), этил диэтилфосфоноацетата (795 мг) и N,N-диметилформамида (5 мл) перемешивают при комнатной температуре в течение 1 час. Реакционную смесь выливают в воду и экстрагируют смесь этилацетатом. Органический слой промывают водой, сушат над безводным сульфатом магния и концентрируют. Перекристаллизация остатка из этилацетата-гексана дает этил (2E)-3-(1,5-диметил-1H-пиразол-4-ил)акрилат (304 мг, 49%) в виде бесцветных призматических кристаллов. Температура плавления: 82-83°C.
Сравнительный пример 130
К смеси этил (2E)-3-(1,5-диметил-1H-пиразол-4-ил)акрилата (380 мг) и метанола (20 мл) добавляют 2н. водный раствор гидроксида натрия (2,0 мл) и смесь перемешивают при 60°C в течение 14 час. В реакционную смесь выливают 1н. хлористоводородную кислоту и экстрагируют смесь этилацетатом. Органический слой промывают водой, сушат над безводным сульфатом магния и концентрируют. Перекристаллизация остатка из этилацетата-гексана дает (2E)-3-(1,5-диметил-1H-пиразол-4-ил)акриловую кислоту (283 мг, 87%) в виде бесцветных призматических кристаллов. Температура плавления: 217-219°C.
Сравнительный пример 131
Смесь 1-метил-1H-пиразол-4-карбальдегида (2,59 г), гидрида натрия (60% в масле, 1,13 г), этил диэтилфосфоноацетата (5,8 г) и N,N-диметилформамида (50 мл) перемешивают при комнатной температуре, в течение 2 час. Реакционную смесь выливают в воду и экстрагируют смесь этилацетатом. Органический слой промывают водой, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением этил (2E)-3-(1-метил-1H-пиразол-4-ил)акрилата (2,72 г, 64%) в виде кристаллов из фракции, элюируемой гексаном-этилацетатом (1:1, объем/объем). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 43-44°C.
Сравнительный пример 132
К смеси этил (2E)-3-(1-метил-1H-пиразол-4-ил)акрилата (2,5 г), метанола (20 мл) и тетрагидрофурана (20 мл) добавляют 2н. водный раствор гидроксида натрия (13,9 мл) и смесь перемешивают при 60°C в течение 3 час. В реакционную смесь выливают 1н. хлористоводородную кислоту и экстрагируют смесь этилацетатом. Органический слой промывают водой, сушат над безводным сульфатом магния и концентрируют с получением (2E)-3-(1-метил-1H-пиразол-4-ил)акриловой кислоты (1,75 г, 83%) как аморфную форму.
ЯМР (CDCl3) δ: 3,93 (3H, c), 6,16 (1H, д, J=15,8 Гц), 7,57 (1H, c), 7,65 (1H, д, J=15,8 Гц), 7,72 (1H, c).
Сравнительный пример 133
Смесь диэтил [3-(бромметил)бензил]фосфоната (10 г), фталимида калия (5,77 г) и N,N-диметилформамида (100 мл) перемешивают при комнатной температуре в течение 14 час. Реакционную смесь выливают в воду и экстрагируют смесь этилацетатом. Органический слой промывают водой, сушат над безводным сульфатом магния и концентрируют. Перекристаллизация остатка из этилацетата-гексана дает диэтил {3-[(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)метил]бензил}фосфонат (9,40 г, 78%) в виде бесцветных призматических кристаллов. Температура плавления: 100-101°C.
Сравнительный пример 134
Смесь диэтил [2-(бромметил)бензил]фосфоната (11,2 г), фталимида калия (6,46 г) и N,N-диметилформамида (100 мл) перемешивают при комнатной температуре, в течение 14 час. Реакционную смесь выливают в воду и экстрагируют смесь этилацетатом. Органический слой промывают водой, сушат над безводным сульфатом магния и концентрируют. Перекристаллизация остатка из этилацетата-гексана дает диэтил {2-[(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)метил]бензил}фосфонат (11,3 г, 83%) в виде бесцветных призматических кристаллов. Температура плавления: 91-92°C.
Сравнительный пример 135
Смесь метил 1H-1,2,4-триазол-3-карбоксилата (7,06 г), 4-нитробензил бромида (10 г), карбоната калия (16,6 г) и N,N-диметилформамида (60 мл) перемешивают при комнатной температуре в течение 4 час. Реакционную смесь выливают в воду и экстрагируют смесь этилацетатом. Органический слой промывают водой, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением метил 1-(4-нитробензил)-1H-1,2,4-триазол-5-карбоксилата (1,50 г, 12%) в виде кристаллов из фракции, элюируемой гексаном-этилацетатом (1:1, объем/объем). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 126-130°C.
Из фракции, элюируемой после указанного выше соединения, получают метил 1-(4-нитробензил)-1H-1,2,4-триазол-3-карбоксилат (1,49 г, 12%) в виде кристаллов. Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 175-177°C.
Сравнительный пример 136
Смесь метил 1-(4-нитробензил)-1H-1,2,4-триазол-5-карбоксилата (1,3 г), 10% палладия на угле (130 мг) и этанола (200 мл) перемешивают в атмосфере водорода при комнатной температуре в течение 2 час. Палладий на угле удаляют из реакционной смеси фильтрацией и фильтрат концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением метил 1-(4-аминобензил)-1H-1,2,4-триазол-5-карбоксилата (0,88 г, 76%) в виде кристаллов из фракции, элюируемой гексаном-этилацетатом (1:2, объем/объем). Его перекристаллизация из этилацетата-простого изопропилового эфира дает бесцветные призматические кристаллы. Температура плавления: 101-103°C.
Сравнительный пример 137
Смесь 1-(2-бромэтил)-4-нитробензола (18,7 г), пиразола (5,53 г) и гидроксида калия (4,56 г) перемешивают при 140°C в течение 8 мин. Реакционную смесь выливают в воду и экстрагируют смесь этилацетатом. Органический слой промывают водой, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением 1-[2-(4-нитрофенил)этил]-1H-пиразола (1,37 г, 8%) в виде кристаллов из фракции, элюируемой гексаном-этилацетатом (1:2, объем/объем). Его перекристаллизация из этилацетата-гексана дает желтые призматические кристаллы. Температура плавления:92-93°C.
Сравнительный пример 138
Смесь 1-[2-(4-нитрофенил)этил]-1H-пиразола (0,8 г), 10% палладия на угле (80 мг) и этанола (200 мл) перемешивают в атмосфере водорода при комнатной температуре в течение 6 час. Палладий на угле удаляют из реакционной смеси фильтрацией и фильтрат концентрируют. Перекристаллизация остатка из этилацетата-гексана дает 1-[2-(4-аминофенил)этил]-1H-пиразол (520 мг, 75%) в виде бесцветных призматических кристаллов. Температура плавления: 73-74°C.
Сравнительный пример 139
Смесь 4-нитробензиламина гидрохлорида (8,0 г), этил 4-хлор-4-оксобутаноата (10,47 г), насыщенного водного раствора бикарбоната натрия (100 мл) и этилацетата (100 мл) перемешивают при комнатной температуре в течение 2 час. Реакционную смесь экстрагируют этилацетатом. Органический слой промывают водой, сушат над безводным сульфатом магния и концентрируют. Перекристаллизация остатка из этилацетата-гексана дает этил 4-[(4-нитробензил)амино]-4-оксобутаноат (10,3 г, 87%) в виде бесцветных призматических кристаллов. Температура плавления: 104-106°C.
Сравнительный пример 140
Смесь этил 4-[(4-нитробензил)амино]-4-оксобутаноата (10 г), 10% палладия на угле (1 г) и этанола (300 мл) перемешивают в атмосфере водорода при комнатной температуре в течение 14 час. Палладий на угле удаляют из реакционной смеси фильтрацией и фильтрат концентрируют. Перекристаллизация остатка из этилацетата-гексана дает этил 4-[(4-аминобензил)амино]-4-оксобутаноат (3,6 г, 40%) в виде бесцветных призматических кристаллов. Температура плавления: 62-64°C.
Сравнительный пример 141
Смесь 2-(4-нитробензил)-2H-тетразола (5 г), 10% палладия на угле (500 мг), этанола (100 мл) и тетрагидрофурана (100 мл) перемешивают в атмосфере водорода при комнатной температуре в течение 4 час. Палладий на угле удаляют из реакционной смеси фильтрацией и фильтрат концентрируют. Перекристаллизация остатка из этилацетата-гексана дает 2-(4-аминобензил)-2H-тетразол (2,83 г, 66%) в виде желтых призматических кристаллов. Температура плавления: 86-87°C.
Сравнительный пример 142
Смесь 1-(4-нитробензил)-1H-тетразола (5 г), 10% палладия на угле (500 мг), этанола (100 мл) и тетрагидрофурана (100 мл) перемешивают в атмосфере водорода при комнатной температуре в течение 4 час. Палладий на угле удаляют из реакционной смеси фильтрацией и фильтрат концентрируют. Перекристаллизация остатка из этилацетата-гексана дает 1-(4-аминобензил)-1H-тетразол (3,03 г, 71%) в виде желтых призматических кристаллов. Температура плавления: 138-140°C.
Сравнительный пример 143
Смесь [1-(4-нитробензил)-1H-имидазол-2-ил]метанола (3,6 г), 10% палладия на угле (400 мг) и этанола (50 мл) перемешивают в атмосфере водорода при комнатной температуре в течение 4 час. Палладий на угле удаляют из реакционной смеси фильтрацией и фильтрат концентрируют. Перекристаллизация остатка из этилацетата-гексана дает [1-(4-аминобензил)-1H-имидазол-2-ил]метанол (2,53 г, 95%) в виде бесцветных призматических кристаллов. Температура плавления: 125°C (разложение)
Сравнительный пример 144
Смесь 4-метил-1H-имидазола (25,5 г), 4-нитробензил бромида (56 г), карбоната калия (86 г) и N,N-диметилформамида (500 мл) перемешивают при комнатной температуре в течение 14 час. Реакционную смесь выливают в воду и экстрагируют смесь этилацетатом. Органический слой промывают водой, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением 5-метил-1-(4-нитробензил)-1H-имидазола (1,6 г, 3%) в виде кристаллов из фракции, элюируемой метанолом-этилацетатом (1:20, объем/объем). Его перекристаллизация из этилацетата-простого изопропилового эфира дает бесцветные призматические кристаллы. Температура плавления: 120-121°C.
Из фракции, элюируемой перед указанным выше соединением, получают смесь (25 г, содержащую 4-метил-1-(4-нитробензил)-1H-имидазол, примерно на 75%) 4-метил-1-(4-нитробензил)-1H-имидазола и 5-метил-1-(4-нитробензил)-1H-имидазола.
Сравнительный пример 145
Смесь из смеси (25 г, содержащей 4-метил-1-(4-нитробензил)-1H-имидазол, примерно на 75%) 4-метил-1-(4-нитробензил)-1H-имидазола и 5-метил-1-(4-нитробензил)-1H-имидазола, полученной в указанном выше сравнительном примере 144, 10% палладия на угле (3 г) и этанола (500 мл) перемешивают в атмосфере водорода при комнатной температуре в течение 14 час. Палладий на угле удаляют из реакционной смеси фильтрацией, и фильтрат концентрируют. Остаток перекристаллизуют из этилацетата с получением 1-(4-аминобензил)-4-метил-1H-имидазола (3,91 г) в виде бесцветных призматических кристаллов. Температура плавления: 141-142°C.
Сравнительный пример 146
Смесь 5-метил-1-(4-нитробензил)-1H-имидазола (1,4 г), 10% палладия на угле (200 мг) и этанола (20 мл) при комнатной температуре перемешивают в атмосфере водорода в течение 4 час. Палладий на угле удаляют из реакционной смеси фильтрацией и фильтрат концентрируют. Перекристаллизация остатка из этилацетата-гексана дает 1-(4-аминобензил)-5-метил-1H-имидазол (1,17 г, 97%) в виде бесцветных призматических кристаллов. Температура плавления: 124-125°C.
Сравнительный пример 147
Смесь 4-этил-1H-имидазола (2,46 г), 4-нитробензил бромида (6,08 г), карбоната калия (7,08 г) и N,N-диметилформамида (50 мл) перемешивают при комнатной температуре в течение 14 час. Реакционную смесь выливают в воду и экстрагируют смесь этилацетатом. Органический слой промывают водой, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением 4-этил-1-(4-нитробензил)-1H-имидазола (1,95 г) в виде желтого масла из фракции, элюируемой этилацетатом-гексаном (1:1, объем/объем). Смесь 4-этил-1-(4-нитробензил)-1H-имидазола (1,95 г), 10% палладия на угле (200 мг) и этанола (50 мл) при комнатной температуре перемешивают в атмосфере водорода в течение 4 час. Палладий на угле удаляют из реакционной смеси фильтрацией и фильтрат концентрируют. Перекристаллизация остатка из этилацетата-гексана дает 1-(4-аминобензил)-5-метил-1H-имидазол (1,44 г) в виде бесцветных призматических кристаллов. Температура плавления: 137-138°C.
Сравнительный пример 148
Смесь 5,6-диметил-1H-бензимидазола (5,0 г), 4-нитробензил бромида (6,16 г), карбоната калия (7,88 г) и N,N-диметилформамида (60 мл) при 60°C перемешивают в течение 14 час. Реакционную смесь выливают в воду и экстрагируют смесь этилацетатом. Органический слой промывают водой, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением 5,6-диметил-1-(4-нитробензил)-1H-бензимидазола (2,6 г, 32%) в виде кристаллов из фракции, элюируемой метанолом-этилацетатом (1:20, объем/объем). Его перекристаллизация из этилацетата-гексана дает бледно-красные призматические кристаллы. Температура плавления: 175-177°C.
Сравнительный пример 149
Смесь 5,6-диметил-1-(4-нитробензил)-1H-бензимидазола (2,5 г), 10% палладия на угле (300 мг), этанола (150 мл) и тетрагидрофурана (150 мл) перемешивают в атмосфере водорода при комнатной температуре в течение 4 час. Палладий на угле удаляют из реакционной смеси фильтрацией и фильтрат концентрируют. Перекристаллизация остатка из этилацетата-метанола дает 1-(4-аминобензил)-5,6-диметил-1H-бензимидазол (1,88 г, 84%) в виде бесцветных призматических кристаллов. Температура плавления: 238-239°C.
Сравнительный пример 150
Смесь 1-(4-нитробензил)-1H-индазола (9,25 г), 10% палладия на угле (1 г), этанола (100 мл) и тетрагидрофурана (100 мл) при комнатной температуре перемешивают в атмосфере водорода, в течение 4 час. Палладий на угле удаляют из реакционной смеси фильтрацией и фильтрат концентрируют. Перекристаллизация остатка из ацетона-гексана дает 4-(1H-индазол-1-илметил)анилин (6,77 г, 83%) в виде бесцветных призматических кристаллов. Температура плавления: 110-111°C.
Сравнительный пример 151
Смесь 2-(4-нитробензил)-2H-1,2,3-бензотриазола (1,0 г), 10% палладия на угле (100 мг) и этанола (20 мл) при комнатной температуре перемешивают в атмосфере водорода в течение 4 час. Палладий на угле удаляют из реакционной смеси фильтрацией и фильтрат концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением 4-(2H-1,2,3-бензотриазол-2-илметил)анилин (313 мг, 35%) в виде кристаллов из фракции, элюируемой этилацетатом-гексаном (1:1, объем/объем). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 229-230°C.
Сравнительный пример 152
К смеси 5-(4-фторфенил)-1-метил-1H-пиразол-4-карбальдегида (4,50 г) и тетрагидрофурана (50 мл) при 0°C добавляют по каплям метил магний бромид (1 моль/л раствор в тетрагидрофуране, 25 мл) и смесь перемешивают при 0°C в течение 30 мин. Реакционную смесь выливают в насыщенный водный раствор хлорида аммония и экстрагируют смесь этилацетатом. Этилацетатный слой сушат над безводным сульфатом магния и концентрируют и остаток растворяют в ацетоне (60 мл). Этот раствор охлаждают до 0°C и добавляют реагент Джонса (получают с помощью способа, описанного в New Courses in Experiment Chemistry, Vol. 15, p. 151, published by Maruzen Company, Limited) по каплям до тех пор, пока красный цвет реагента не будет больше исчезать. В реакционную смесь добавляют изопропиловый спирт и воду и экстрагируют смесь этилацетатом. Этилацетатный слой сушат над безводным сульфатом магния и концентрируют. Остаток растворяют в N,N-диметилформамиде (50 мл). К этому раствору добавляют этил диэтилфосфоноацетат (6,0 г) и гидрид натрия (60% в масле, 1,0 г) и смесь перемешивают при 80°C в течение 12 час. Реакционную смесь выливают в воду и экстрагируют смесь этилацетатом. Этилацетатный слой сушат над безводным сульфатом магния, концентрируют и остаток очищают с помощью колоночной хроматографии на силикагеле с получением желтого масла из фракции, элюируемой этилацетатом-гексаном (1:1, объем/объем). Это желтое масло растворяют в смеси уксусной кислоты - 37% хлористоводородной кислоты (20-20 мл) и смесь перемешивают при 120°C в течение 3 час. Реакционную смесь концентрируют и выливают в воду. Выпавшие кристаллы собирают фильтрацией, промывают водой и сушат с получением (2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]бут-2-еновой кислоты (4,60 г, 80%) в виде бесцветных кристаллов. Ее перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 123-124°C.
Сравнительный пример 153
В соответствии со способом, описанным в сравнительном примере 44, 3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]бутановую кислоту получают из (2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]бут-2-еновой кислоты, с выходом 85%. Бесцветные призматические кристаллы. Температура плавления: 90-91°C (перекристаллизуют из этилацетата-гексана).
Сравнительный пример 154
К смеси этил 1,5-дифенил-1H-пиразол-4-карбоксилата (14,9 г) и тетрагидрофурана (250 мл) по каплям добавляют диизобутилалюминий гидрид (1 моль/л толуоловый раствор, 120 мл), при охлаждении на льду. Реакционную смесь перемешивают при комнатной температуре в течение 1 час и выливают в 1н. водный раствор хлористоводородной кислоты. Смесь экстрагируют этилацетатом. Этилацетатный слой последовательно промывают 1н. водным раствором хлористоводородной кислоты и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением (1,5-дифенил-1H-пиразол-4-ил)метанола (12,6 г, 99%) в виде бесцветных кристаллов. Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 147-148°C.
Сравнительный пример 155
К смеси (1,5-дифенил-1H-пиразол-4-ил)метанола (11,78 г), триэтиламина (10 мл) и этилацетата (300 мл) при 0°C по каплям добавляют метансульфонил хлорид (4,5 мл). Смесь перемешивают при комнатной температуре в течение 1 час и этилацетатный слой последовательно промывают водой и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением масла. Это масло растворяют в N,N-диметилформамиде (100 мл) и полученный раствор добавляют по каплям к раствору натрий диэтилмалоната в N,N-диметилформамиде (получают с использованием диэтилмалоната, 20,33 г, гидрида натрия (60% в масле, 4,88 г) и N,N-диметилформамида, 200 мл) при 0°C. Смесь перемешивают при комнатной температуре в течение 5 час и выливают в 1н. водный раствор хлористоводородной кислоты. Смесь экстрагируют этилацетатом. Этилацетатный слой последовательно промывают 1н. водным раствором хлористоводородной кислоты и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением масла. Смесь этого масла, 6н. водного раствора хлористоводородной кислоты (100 мл) и уксусной кислоты (50 мл) нагревают с обратным холодильником в течение 5 час. Реакционную смесь охлаждают, концентрируют и выливают в воду. Выпавшие кристаллы собирают фильтрацией, промывают водой и сушат с получением 3-(1,5-дифенил-1H-пиразол-4-ил)пропионовой кислоты.
Выход: 68%. Бесцветные иглообразные кристаллы. Температура плавления: 159-160°C (перекристаллизуют из ацетона-гексана).
Сравнительный пример 156
Смесь 5-(4-хлорфенил)-1-метил-1H-пиразол-4-карбальдегида (6,68 г), этил диэтилфосфоноацетата (7,47 г), гидрида натрия (60% в масле, 1,30 г) и N,N-диметилформамида (100 мл) при комнатной температуре перемешивают в течение 1 час. Реакционную смесь выливают в воду и экстрагируют смесь этилацетатом. Органический слой последовательно промывают водой и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением бесцветных кристаллов (8,37 г). Смесь кристаллов (4,55 г), диоксида платины (228 мг) и этанола (50 мл) при комнатной температуре перемешивают в атмосфере водорода при атмосферном давлении в течение 2 час. Катализатор удаляют фильтрацией и фильтрат концентрируют и очищают с помощью колоночной хроматографии с получением этил 3-[5-(4-хлорфенил)-1-метил-1H-пиразол-4-ил]пропионата (4,70 г) в виде бесцветного масла из фракции, элюируемой гексаном-этилацетатом (1:2, объем/объем).
Элементный анализ: Вычислено (C15H17ClN2O2) C, 61,54; H, 5,85; N, 9,57. Найдено C, 61,28; H, 5,95; N, 9,21.
Сравнительный пример 157
Смесь этил 3-[5-(4-хлорфенил)-1-метил-1H-пиразол-4-ил]пропионата (2,35 г), 1н. водного раствора гидроксида натрия (16 мл), тетрагидрофурана (30 мл) и этанола (30 мл) перемешивают при комнатной температуре в течение 3 час. Реакционную смесь выливают в водный раствор гидросульфата калия и экстрагируют смесь этилацетатом. Этилацетатный слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением 3-[5-(4-хлорфенил)-1-метил-1H-пиразол-4-ил]пропионовой кислоты (1,46 г, 69%) в виде бесцветного порошка. Температура плавления: 138-140°C (перекристаллизуют из ацетона-гексана).
Сравнительный пример 158
Калий бис(триметилсилил)амид (20% толуоловый раствор, 3,05 г) добавляют к смеси бис(2,2,2-трифторэтил) (метоксикарбонилметил)фосфоната (973 мг), 18-краун-6 (4,04 г) и тетрагидрофурана (50 мл) при -78°C. Кроме того, добавляют 5-(4-фторфенил)-1-метил-1H-пиразол-4-карбальдегид (312 мг) и смесь перемешивают в течение ночи, при этом, давая возможность нагреться от -78°C до комнатной температуры. В реакционную смесь добавляют насыщенный водный раствор хлорида аммония и экстрагируют смесь этилацетатом. Органический слой последовательно промывают 1н. хлористоводородной кислотой, водой и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением метил (2Z)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акрилата в виде кристаллов (0,35 г, выход 95%) из фракции, элюируемой гексаном-этилацетатом (4:1-1:1, объем/объем) (перекристаллизуют из этилацетата-гексана). Температура плавления: 108-109°C.
Сравнительный пример 159
Смесь 1-(4-фторфенил)-2-пропанона (10,0 г) и N,N-диметилформамид диметилацеталя (8,00 г) перемешивают при 120°C в течение 2 час. Реакционную смесь охлаждают, и к выпавшим твердым продуктам, которые собирают фильтрацией, добавляют гексан с получением 4-(диметиламино)-3-(4-фторфенил)бут-3-ен-2-она (11,3 г, выход 83%) в виде бледно-желтого твердого продукта.
ЯМР (CDCl3) δ: 1,94 (3H, c), 2,70 (6H, ушир.c), 6,95-7,05 (2H, м), 7,1-7,2 (2H, м), 7,58 (1H, c).
Сравнительный пример 160
Смесь 4-(диметиламино)-3-(4-фторфенил)бут-3-ен-2-он (10,36 г), метилгидразина (2,31 г) и этанола (50 мл) перемешивают в течение 1 час. при нагревании с обратным холодильником. Реакционную смесь концентрируют, выливают в воду и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением желтого масла. Это желтое масло растворяют в четыреххлористом углероде (100 мл), и добавляют N-бромсукцинимид (9,79 г) и 2,2'-азобис(изобутиронитрил) (50 мг). Смесь перемешивают в течение 5 час при нагревании с обратным холодильником. Реакционную смесь концентрируют, выливают в воду и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением желтого масла. Это желтое масло растворяют в метаноле (100 мл) и добавляют формиат натрия (10,0 г). Смесь перемешивают в течение 16 час с обратным холодильником. Реакционную смесь концентрируют, выливают в воду и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают с помощью колоночной хроматографии и элюируют гексаном-этилацетатом (100:0-0:100, объем/объем), для разделения следующих двух видов соединений.
[4-(4-Фторфенил)-1-метил-1H-пиразол-5-ил]метанола: (311 мг). Бледно-желтый твердый продукт.
ЯМР (CDCl3) δ: 3,99 (3H, c), 4,74 (2H, c), 7,05-7,15 (2H, м), 7,3-7,4 (2H, м), 7,53 (1H, c).
[4-(4-Фторфенил)-1-метил-1H-пиразол-3-ил]метанола: (60 мг). бледно-желтый твердый продукт.
ЯМР (CDCl3) δ: 3,92 (3H, c), 4,72 (2H, c), 7,0-7,1 (2H, м), 7,4-7,5 (2H, м), 7,45 (1H, c).
Сравнительный пример 161
Смесь [4-(4-фторфенил)-1-метил-1H-пиразол-5-ил]метанола (250 мг), активированного диоксида марганца (1,0 г) и тетрагидрофурана (10 мл) перемешивают при комнатной температуре в течение 3 час. Реакционную смесь фильтруют и органический слой концентрируют с получением 4-(4-фторфенил)-1-метил-1H-пиразол-5-карбальдегида (172 мг, выход 70%) в виде бледно-желтых кристаллов.
ЯМР (CDCl3) δ: 4,23 (3H, c), 7,1-7,2 (2H, м), 7,35-7,45 (2H, м), 7,59 (1H, c), 9,84 (1H, c).
Сравнительный пример 162
4-(4-фторфенил)-1-метил-1H-пиразол-3-карбальдегид
В соответствии со способом, представленным в сравнительном примере 161, указанное в заголовке соединение синтезируют из [4-(4-фторфенил)-1-метил-1H-пиразол-3-ил]метанола.
Выход: 80%. Бледно-желтый твердый продукт.
ЯМР (CDCl3) δ: 4,05 (3H, c), 7,05-7,15 (2H, м), 7,52 (1H, c), 7,55-7,6 (2H, м), 10,04 (1H, c).
Сравнительный пример 163
Смесь 4-(4-фторфенил)-1,2,3-тиадиазол-5-карбальдегида (180 мг), этил диэтилфосфоноацетата (450 мг), гидрида натрия (60% в масле, 40 мг) и N,N-диметилформамида (3 мл) при комнатной температуре перемешивают в течение 2 час. Реакционную смесь выливают в 1н. водный раствор хлористоводородной кислоты и экстрагируют смесь этилацетатом. Этилацетатный слой концентрируют, и к остатку добавляют 6н. водный раствор хлористоводородной кислоты (3 мл) и уксусной кислоты (3 мл). Смесь перемешивают в течение 3 час при нагревании с обратным холодильником. Реакционную смесь концентрируют и выливают в воду. Выпавшие твердые продукты собирают фильтрацией, промывают водой и сушат с получением (2E)-3-[4-(4-фторфенил)-1,2,3-тиадиазол-5-ил]акриловой кислоты (130 мг, выход 60%) в виде бледно-желтого твердого продукта.
ЯМР (ДМСО-d6) δ: 6,69 (1H, д, J=15,5 Гц), 7,45-7,6 (3H, м), 7,75-7,85 (2H, м).
Пример 1
Смесь диметил 4-аминобензилфосфоната (0,86 г), (2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриловой кислоты (0,74 г), 1-гидрокси-1H-1,2,3-бензотриазола гидрата (0,61 г), 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорида (0,77 г) и N,N-диметилформамида (8 мл) при комнатной температуре перемешивают в течение ночи. Реакционную смесь выливают в 0,5н. водный раствор хлористоводородной кислоты и экстрагируют этилацетатом. Этилацетатный слой промывают насыщенным водным раствором бикарбоната натрия, а затем насыщенным раствором соли, сушат (MgSO4) и концентрируют. Полученный твердый продукт перекристаллизуют из ацетона-воды с получением (2E)-N-[4-(диметилфосфонометил)фенил]-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламида (0,86 г, выход 65%) в виде бесцветных призматических кристаллов. Температура плавления: 209-210°C.
Подобным же способом, как и в примере 1, получают соединения, описанные в примерах 2-33, 36-50, 54-62, 65, 66, 69-77 и 80-82.
Пример 2
(2E)-N-[4-(Диэтилфосфонометил)фенил]-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 68%. Бесцветные призматические кристаллы. Температура плавления: 208-209°C (перекристаллизуют из ацетона-простого изопропилового эфира).
Пример 3
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(2-оксид-1,3,2-диоксафосфинан-2-ил)метил]фенил}акриламид
Выход: 25%. Бесцветные призматические кристаллы. Температура плавления: 223-227°C (перекристаллизуют из ацетона-простого изопропилового эфира).
Пример 4
(2E)-N-[4-(Диметилфосфонометил)фенил]-3-[5-(4-метоксифенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 55%. Бесцветные призматические кристаллы. Температура плавления: 199-200°C (перекристаллизуют из этилацетата-гексана).
Пример 5
(2E)-N-[4-(Диэтилфосфонометил)фенил]-3-[5-(4-метоксифенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 57%. Бесцветные призматические кристаллы. Температура плавления: 199-200°C (перекристаллизуют из этилацетата-гексана).
Пример 6
(2E)-3-[5-(3-Хлорфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(диметилфосфонометил)фенил]акриламид
Выход: 39%. Бесцветные призматические кристаллы. Температура плавления: 248-249°C (перекристаллизуют из этилацетата-гексана).
Пример 7
(2E)-3-[5-(3-Хлорфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(диэтилфосфонометил)фенил]акриламид
Выход: 51%. Бесцветные призматические кристаллы. Температура плавления: 214-216°C (перекристаллизуют из этилацетата-гексана).
Пример 8
(2E)-3-[5-(4-Хлорфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(диметилфосфонометил)фенил]акриламид
Выход: 61%. Бесцветные призматические кристаллы. Температура плавления: 209-210°C (перекристаллизуют из этилацетата-гексана).
Пример 9
(2E)-3-[5-(4-Хлорфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(диэтилфосфонометил)фенил]акриламид
Выход: 45%. Бесцветные призматические кристаллы. Температура плавления: 217-218°C (перекристаллизуют из этилацетата-гексана).
Пример 10
(2E)-N-[4-(Диметилфосфонометил)фенил]-3-(1-метил-5-фенил-1H-пиразол-4-ил)акриламид
Выход: 20%. Бесцветные призматические кристаллы. Температура плавления: 219-220°C (перекристаллизуют из этилацетата-гексана).
Пример 11
(2E)-N-[4-(Диэтилфосфонометил)фенил]-3-(1-метил-5-фенил-1H-пиразол-4-ил)акриламид
Выход: 61%. Бесцветные призматические кристаллы. Температура плавления: 239-240°C (перекристаллизуют из этилацетата-гексана).
Пример 12
(2E)-N-[4-(Диметилфосфонометил)фенил]-3-{1-метил-5-[4-(трифторметил)фенил]-1H-пиразол-4-ил}акриламид
Выход: 49%. Бесцветные призматические кристаллы. Температура плавления: 212-213°C (перекристаллизуют из этилацетата-гексана).
Пример 13
(2E)-N-[4-(Диэтилфосфонометил)фенил]-3-{1-метил-5-[4-(трифторметил)фенил]-1H-пиразол-4-ил}акриламид
Выход: 58%. Бесцветные призматические кристаллы. Температура плавления: 200-201°C (перекристаллизуют из этилацетата-гексана).
Пример 14
(2E)-N-[4-(Диметилфосфонометил)фенил]-3-[5-(2-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 67%. Бесцветные призматические кристаллы. Температура плавления: 220-221°C (перекристаллизуют из этилацетата-гексана).
Пример 15
(2E)-N-[4-(Диэтилфосфонометил)фенил]-3-[5-(2-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 43%. Бесцветные призматические кристаллы. Температура плавления: 238-240°C (перекристаллизуют из этилацетата-гексана).
Пример 16
(2E)-3-[5-(4-Бромфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(диметилфосфонометил)фенил]акриламид
Выход: 57%. Бесцветные призматические кристаллы. Температура плавления: 212-214°C (перекристаллизуют из этилацетата-гексана).
Пример 17
(2E)-3-[5-(4-Бромфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(диэтилфосфонометил)фенил]акриламид
Выход: 52%. Бесцветные призматические кристаллы. Температура плавления: 229-231°C (перекристаллизуют из этилацетата-гексана).
Пример 18
(2E)-N-[4-(Диметилфосфонометил)фенил]-3-[1-метил-5-(1-нафтил)-1H-пиразол-4-ил]акриламид
Выход: 30%. Бесцветные призматические кристаллы. Температура плавления: 207-209°C (перекристаллизуют из этилацетата-гексана).
Пример 19
(2E)-N-[4-(Диэтилфосфонометил)фенил]-3-[1-метил-5-(1-нафтил)-1H-пиразол-4-ил]акриламид
Выход: 33%. Бесцветные призматические кристаллы. Температура плавления: 229-231°C (перекристаллизуют из этилацетата-гексана).
Пример 20
(2E)-N-[4-(Диметилфосфонометил)фенил]-3-[5-(3-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 35%. Бесцветные призматические кристаллы. Температура плавления: 224-226°C (перекристаллизуют из этилацетата-гексана).
Пример 21
(2E)-N-[4-(Диэтилфосфонометил)фенил]-3-[5-(3-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 56%. Бесцветные призматические кристаллы. Температура плавления: 205-206°C (перекристаллизуют из этилацетата-гексана).
Пример 22
(2E)-N-[4-(Диметилфосфонометил)фенил]-3-[1-метил-5-(4-метилфенил)-1H-пиразол-4-ил]акриламид
Выход: 58%. Бесцветные призматические кристаллы. Температура плавления: 207-209°C (перекристаллизуют из этилацетата-гексана).
Пример 23
(2E)-N-[4-(Диэтилфосфонометил)фенил]-3-[1-метил-5-(4-метилфенил)-1H-пиразол-4-ил]акриламид
Выход: 57%. Бесцветные призматические кристаллы. Температура плавления: 243-245°C (перекристаллизуют из этилацетата-гексана).
Пример 24
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(5-метил-2-оксид-1,3,2-диоксафосфинан-2-ил)метил]фенил}акриламид
Выход: 36%. Бесцветные призматические кристаллы. Температура плавления: 253-254°C (перекристаллизуют из этилацетата-гексана).
Пример 25
(2E)-N-{4-[(5,5-Диметил-2-оксид-1,3,2-диоксафосфинан-2-ил)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 69%. Бесцветные призматические кристаллы. Температура плавления: 271-273°C (перекристаллизуют из этилацетата-гексана).
Пример 26
(2E)-N-{4-[(4,6-Диметил-2-оксид-1,3,2-диоксафосфинан-2-ил)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 62%. Бесцветные призматические кристаллы. Температура плавления: 250-252°C (перекристаллизуют из этилацетата-гексана).
Пример 27
(2E)-N-{4-[(5-Бутил-5-этил-2-оксид-1,3,2-диоксафосфинан-2-ил)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 53%. Бесцветные призматические кристаллы. Температура плавления: 220-222°C (перекристаллизуют из этилацетата-гексана).
Пример 28
(2E)-N-[3-(Диэтилфосфонометил)фенил]-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 76%. Бесцветные призматические кристаллы. Температура плавления: 170-172°C (перекристаллизуют из этилацетата-гексана).
Пример 29
(2E)-N-[2-(Диэтилфосфонометил)фенил]-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 65%. Бесцветные призматические кристаллы. Температура плавления: 168-169°C (перекристаллизуют из этилацетата-гексана).
Пример 30
(2E)-N-[4-(Дибутилфосфонометил)фенил]-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 50%. Бесцветный твердый продукт.
ЯМР (CDCl3) δ: 0,89 (6H, т, J=7 Гц), 1,3-1,4 (4H, м), 1,5-1,65 (4H, м), 3,11 (2H, д, J=21,5 Гц), 3,78 (3H, c), 3,9-4,00 (4H, м), 6,35 (1H, д, J=15 Гц), 7,18-7,38 (6H, м), 7,40 (1H, д, J=15 Гц), 7,51 (2H, д, J=8, Гц), 7,66 (1H, c), 7,82 (1H, c).
Пример 31
(2E)-N-[4-(Диэтилфосфоно)фенил]-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 6%. Бесцветные призматические кристаллы. Температура плавления: 174-176°C (перекристаллизуют из этилацетата-гексана).
Пример 32
(2E)-N-{4-[2-(Диэтилфосфоно)этил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 19%. Бесцветные призматические кристаллы. Температура плавления: 157-158°C (перекристаллизуют из этилацетата-гексана).
Пример 33
(2E)-N-[4-(Диэтилфосфонометил)-2-метилфенил]-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 50%. Бесцветные призматические кристаллы. Температура плавления: 154-155°C (перекристаллизуют из этилацетата-гексана).
Пример 34
Смесь из смеси (250 мг) (2E)-3-[1-бензил-5-(4-фторфенил)-1H-пиразол-4-ил]акриловой кислоты и (2E)-3-[1-бензил-3-(4-фторфенил)-1H-пиразол-4-ил]акриловой кислоты, полученной в сравнительном примере 36, 1-гидрокси-1H-1,2,3-бензотриазола гидрата (142 мг), 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорида (178 мг), диэтил 4-аминобензилфосфоната (283 мг) и N,N-диметилформамида (20 мл) перемешивают при комнатной температуре в течение 14 час. Реакционную смесь выливают в 1н. водный раствор хлористоводородной кислоты и экстрагируют смесь этилацетатом. Этилацетатный слой промывают насыщенным водным раствором бикарбоната натрия, а затем насыщенным раствором соли, сушат (MgSO4) и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением (2E)-3-[1-бензил-5-(4-фторфенил)-1H-пиразол-4-ил]-N-[4-(диэтилфосфонометил)фенил]-акриламида (106 мг) в виде бесцветного порошка из фракции, элюируемой этилацетатом. Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 207-208°C.
Пример 35
(2E)-3-[1-Бензил-3-(4-фторфенил)-1H-пиразол-4-ил]-N-[4-(диэтилфосфонометил)фенил]акриламид (242 мг) получают в виде бесцветного порошка из фракции, элюируемой после (2E)-3-[1-бензил-5-(4-фторфенил)-1H-пиразол-4-ил]-N-[4-(диэтилфосфонометил)фенил]акриламида, полученного в примере 34. Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 199-200°C.
Пример 36
(2E)-N-[4-(Диметилфосфонометил)фенил]-3-[1-этил-5-(4-фторфенил)-1H-пиразол-4-ил]акриламид
Выход: 73%. Бледно-желтые призматические кристаллы. Температура плавления: 187-189°C (перекристаллизуют из этилацетата-гексана).
Пример 37
(2E)-N-[4-(Диэтилфосфонометил)фенил]-3-[1-этил-5-(4-фторфенил)-1H-пиразол-4-ил]акриламид
Выход: 74%. Бледно-желтые призматические кристаллы. Температура плавления: 226-227°C (перекристаллизуют из этилацетата-гексана).
Пример 38
(2E)-3-[5-(4-Фторфенил)-1,3-диметил-1H-пиразол-4-ил]-N-[4-(диметилфосфонометил)фенил]акриламид
Выход: 70%. Бледно-желтые призматические кристаллы. Температура плавления: 195-198°C (перекристаллизуют из этилацетата-гексана).
Пример 39
(2E)-N-[4-(Диэтилфосфонометил)фенил]-3-[5-(4-фторфенил)-1,3-диметил-1H-пиразол-4-ил]акриламид
Выход: 16%. Бледно-желтые призматические кристаллы. Температура плавления: 159-160°C (перекристаллизуют из этилацетата-гексана).
Пример 40
(2E)-3-(5-Циклогексил-1-метил-1H-пиразол-4-ил)-N-[4-(диметилфосфонометил)фенил]акриламид
Выход: 19%. Бледно-желтый твердый продукт.
ЯМР (CDCl3) δ: 1,2-1,85 (10H, м), 2,7-3,0 (1H, м), 3,15 (2H, д, J=21,5 Гц), 3,65 (3H, c), 3,69 (3H, c), 3,87 (3H, c), 6,15 (1H, д,J=15,9 Гц), 7,1-7,8 (7H, м).
Пример 41
(2E)-3-(5-Циклогексил-1-метил-1H-пиразол-4-ил)-N-[4-(диэтилфосфонометил)фенил]акриламид
Выход: 13%. Бледно-желтый твердый продукт.
ЯМР (CDCl3) δ: 1,2-1,85 (16H, м), 2,70-3,00 (1H, м), 3,13 (2H, д, J=21,5 Гц), 3,65 (3H, c), 3,95-4,1 (4H, м), 6,15 (1H, д, J=16 Гц), 7,1-7,8 (7H, м).
Пример 42
(2E)-N-[4-(Диметилфосфонометил)фенил]-3-[5-(2-фурил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 72%. Бесцветные призматические кристаллы. Температура плавления: 201-202°C (перекристаллизуют из этилацетата-гексана).
Пример 43
(2E)-N-[4-(Диэтилфосфонометил)фенил]-3-[5-(2-фурил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 84%. Бесцветные призматические кристаллы. Температура плавления: 195-196°C (перекристаллизуют из этилацетата-гексана).
Пример 44
(2E)-N-{4-[(5-Бутил-5-этил-2-оксид-1,3,2-диоксафосфинан-2-ил)метил]фенил}-3-[5-(2-фурил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 88%. Бесцветные призматические кристаллы. Температура плавления: 201-202°C (перекристаллизуют из этилацетата-гексана).
Пример 45
(2E)-N-{4-[(Диэтилфосфоно)(метокси)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 60%. Бесцветные призматические кристаллы. Температура плавления: 200-201°C (перекристаллизуют из этилацетата-гексана).
Пример 46
(2E)-N-{4-[(Диэтилфосфоно)(гидрокси)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 15%. Бесцветные призматические кристаллы. Температура плавления: 194-195°C (перекристаллизуют из этилацетата-гексана).
Пример 47
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(2-оксид-4,7-дигидро-1,3,2-диоксафосфепин-2-ил)метил]фенил}акриламид
Выход: 65%. Бесцветные призматические кристаллы. Температура плавления: 169-171°C (перекристаллизуют из этилацетата-гексана).
Пример 48
(2E)-N-{4-[(Бензилоксикарбонил)сульфанил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 36%. Бесцветный твердый продукт.
ЯМР (CDCl3) δ: 3,78 (3H, c), 5,24 (2H, c), 6,27 (1H, д, J=15,5 Гц), 7,15-7,3 (4H, м), 7,3-7,4 (6H, м), 7,5-7,6 (2H, м), 7,61 (2H, д, J=8,5 Гц), 7,83 (1H, c).
Пример 49
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[гидрокси(2-пиридинил)метил]фенил}акриламид
Выход: 23%. Бледно-желтые кристаллы.
ЯМР (CDCl3) δ: 3,75 (3H, c), 5,30 (1H, ушир.c), 5,72 (1H, c), 6,27 (1H, д, J=15,5 Гц), 7,1-7,4 (9H, м), 7,40 (1H, д, J=15,5 Гц), 7,5-7,65 (3H, м), 7,80 (1H, c), 8,56 (1H, д, J=5 Гц).
Пример 50
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[гидрокси(6-метил-2-пиридинил)метил]фенил}акриламид
Выход: 68%. Бесцветные кристаллы.
ЯМР (ДМСО-d6) δ: 2,59 (3H, c), 3,74 (3H, c), 5,81 (1H, c), 6,52 (1H, д, J=15,5 Гц), 7,14 (1H, д, J=15,5 Гц), 7,3-7,65 (11H, м), 7,89 (1H, c), 8,03 (1H, ушир.c), 10,06 (1H, c).
Пример 51
Смесь (2E)-N-{4-[(бензилоксикарбонил)сульфанил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламида (488 мг), 3-(хлорметил)-4-пропил-4H-1,2,4-триазола (240 мг), 1н. водного раствора гидроксида натрия (3 мл) и этанола (30 мл) при комнатной температуре перемешивают в течение 3 час. Реакционную смесь концентрируют, выливают в воду и экстрагируют этилацетатом. Органический слой промывают водой, сушат над безводным сульфатом магния и концентрируют с получением (2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]-N-(4-{[(4-пропил-4H-1,2,4-триазол-3-ил)метил]тио}фенил)акриламида (310 мг, 65%) в виде бледно-желтых кристаллов.
ЯМР (CDCl3) δ: 1,00 (3H, т, J=7 Гц), 1,8-1,95 (2H, м), 3,77 (3H, c), 3,97 (2H, т, J=7 Гц), 4,19 (2H, c), 6,34 (1H, д, J=15,5 Гц), 7,15-7,4 (8H, м), 7,51 (1H, д, J=8,5 Гц), 7,78 (1H, c), 8,02 (1H, ушир.c), 8,08 (1H, c).
Пример 52
Смесь (2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]-N-(4-{[(4-пропил-4H-1,2,4-триазол-3-ил)метил]тио}фенил)акриламида (96 мг), м-хлорпербензойной кислоты (40 мг) и тетрагидрофурана (3 мл) перемешивают при комнатной температуре в течение 3 час. Реакционную смесь концентрируют и очищают с помощью ВЭЖХ с получением (2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]-N-(4-{[(4-пропил-4H-1,2,4-триазол-3-ил)метил]сульфинил}фенил)-акриламида (36 мг, 37%) в виде бледно-желтых кристаллов.
ЯМР (CDCl3) δ: 0,96 (3H, т, J=7 Гц), 1,7-1,9 (2H, м), 3,79 (3H, c), 3,98 (2H, т, J=7,5 Гц), 4,21 (1H, д, J=9 Гц), 4,32 (1H, д, J=9 Гц), 6,34 (1H, д, J=15,5 Гц), 7,2-7,5 (8H, м), 7,73 (1H, д, J=8,5 Гц), 7,82 (1H, c), 8,01 (1H, ушир.c), 8,14 (1H, c).
Пример 53
Подобным же способом, как и в примере 52, за исключением того, что используемое количество м-хлорпербензойной кислоты составляет 60 мг, синтезируют (2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]-N-(4-{[(4-пропил-4H-1,2,4-триазол-3-ил)метил]сульфонил}фенил)акриламид.
Выход: 30%. Бледно-желтые кристаллы.
ЯМР (CDCl3) δ: 1,05 (3H, т, J=7 Гц), 1,9-2,0 (2H, м), 3,79 (3H, c), 4,18 (2H, т, J=7,5 Гц), 4,64 (2H, c), 6,37 (1H, д, J=15,5 Гц), 7,2-7,45 (6H, м), 7,5-7,6 (2H, м), 7,7-7,8 (3H, м), 8,24 (1H, c).
Пример 54
(2E)-N-[4-(Диэтилфосфонометил)фенил]-3-[3-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 60%. Бледно-желтые призматические кристаллы. Температура плавления: 197-198°C (перекристаллизуют из этилацетата-гексана).
Пример 55
(2E)-N-[4-(Диэтилфосфонометил)фенил]-3-[4-(4-фторфенил)-1-метил-1H-пиразол-5-ил]акриламид
Выход: 74%. Бледно-желтые призматические кристаллы. Температура плавления: 138-139°C (перекристаллизуют из ацетона-гексана).
Пример 56
(2E)-N-[4-(Диэтилфосфонометил)фенил]-3-[4-(4-фторфенил)-1-метил-1H-пиразол-3-ил]акриламид
Выход: 62%. Бледно-желтые призматические кристаллы. Температура плавления: 203-204°C (перекристаллизуют из ацетона-гексана).
Пример 57
N-[4-(Диэтилфосфонометил)фенил]-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]пропионамид
Выход: 53%. Бесцветные призматические кристаллы. Температура плавления: 143-144°C (перекристаллизуют из ацетона-гексана).
Пример 58
N-[4-(Диметилфосфонометил)фенил]-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]пропионамид
Выход: 47%. Бесцветные призматические кристаллы. Температура плавления: 142-143°C (перекристаллизуют из ацетона-гексана).
Пример 59
3-[5-(4-Хлорфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(диэтилфосфонометил)фенил]пропионамид
Выход: 53%. Бесцветные кристаллы.
ЯМР (CDCl3) δ: 1,24 (6H, т, J=7 Гц), 2,53 (2H, т, J=7 Гц), 2,82 (2H, т, J=7 Гц), 3,10 (2H, д, J=21,5 Гц), 3,73 (3H, c), 3,95-4,1 (4H, м), 7,17 (1H, дд, J=1,5/8,5 Гц), 7,2-7,3 (2H, м), 7,37 (2H, д, J=8,5 Гц), 7,4-7,5 (4H, м), 7,72 (1H, ушир.c).
Пример 60
(2E)-N-{4-[(2,4-Диоксо-1,3-тиазолидин-5-ил)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 53%. Бесцветные призматические кристаллы. Температура плавления: 149-150°C (перекристаллизуют из ацетона-гексана).
Пример 61
(2E)-N-[4-(Диэтилфосфонометил)фенил]-3-[1-(4-фторфенил)-1H-имидазол-5-ил]акриламид
Выход: 68%. Бесцветные призматические кристаллы. Температура плавления: 165-166°C (перекристаллизуют из ацетона-простого изопропилового эфира).
Пример 62
(2E)-N-[4-(Диметилфосфонометил)фенил]-3-[1-(4-фторфенил)-1H-имидазол-5-ил]акриламид
Выход: 62%. Бесцветные призматические кристаллы. Температура плавления: 108-109°C (перекристаллизуют из метанола-воды).
Пример 63
Смесь (2E)-N-[4-(диэтилфосфонометил)фенил]-3-[1-(4-фторфенил)-1H-имидазол-5-ил]акриламида (92 мг), 5% палладия на угле (100 мг) и этанола (10 мл) при комнатной температуре перемешивают в атмосфере водорода, при атмосферном давлении, в течение 3 час. Реакционную смесь фильтруют, и органический слой концентрируют с получением N-[4-(диэтилфосфонометил)фенил]-3-[1-(4-фторфенил)-1H-имидазол-5-ил]пропионамида (60 мг, 65%) в виде бесцветного твердого продукта.
ЯМР (CDCl3) δ: 1,24 (6H, т, J=7 Гц), 2,63 (2H, т, J=7 Гц), 2,92 (2H, т, J=7 Гц), 3,10 (2H, д, J=21,5 Гц), 3,9-4,1 (4H, м), 6,94 (1H, c), 7,15-7,25 (4H, м), 7,25-7,35 (2H, м), 7,39 (2H, д, J=8 Гц), 7,53 (1H, c), 7,86 (1H, ушир.c).
Подобным же способом, как и в примере 63, синтезируют соединения примеров 64, 67 и 68.
Пример 64
N-[4-(Диметилфосфонометил)фенил]-3-[1-(4-фторфенил)-1H-имидазол-5-ил]пропионамид
Выход: 63%. Бесцветный твердый продукт.
ЯМР (CDCl3) δ: 2,64 (2H, т, J=7 Гц), 2,91 (2H, т, J=7 Гц), 3,12 (2H, д, J=21,5 Гц), 3,64 (3H, c), 3,68 (3H, c), 6,94 (1H, c), 7,15-7,25 (4H, м), 7,25-7,35 (2H, м), 7,41 (2H, д, J=8 Гц), 7,53 (1H, c), 8,11 (1H, ушир.c).
Пример 65
(2E)-N-[4-(Диэтилфосфонометил)фенил]-3-[4-(4-фторфенил)-4H-1,2,4-триазол-3-ил]акриламид
Выход: 64%. Бесцветные призматические кристаллы. Температура плавления: 217-218°C (перекристаллизуют из ацетона-простого изопропилового эфира).
Пример 66
(2E)-N-[4-(Диметилфосфонометил)фенил]-3-[4-(4-фторфенил)-4H-1,2,4-триазол-3-ил]акриламид
Выход: 81%. Бесцветные призматические кристаллы. Температура плавления: разложение при 250°C или выше (перекристаллизуют из метанола-ацетона).
ЯМР (ДМСО-d6) δ: 3,21 (2H, д, J=21,5 Гц), 3,57 (3H, c), 3,62 (3H, c), 7,08 (1H, д, J=15,5 Гц), 7,2-7,4 (3H, м), 7,4-7,7 (6H, м), 8,90 (1H, c), 10,46 (1H, ушир.c).
Пример 67
N-[4-(Диэтилфосфонометил)фенил]-3-[4-(4-фторфенил)-4H-1,2,4-триазол-3-ил]пропионамид
Выход: 77%. Бледно-желтый твердый продукт.
ЯМР (CDCl3) δ: 1,24 (6H, т, J=7 Гц), 3,0-3,1 (4H, м), 3,10 (2H, д, J=21 Гц), 3,9-4,1 (4H, м), 7,15-7,3 (4H, м), 7,3-7,4 (2H, м), 7,48 (2H, д, J=8,5 Гц), 8,21 (1H, c), 8,8-9,0 (1H, м).
Пример 68
N-[4-(Диметилфосфонометил)фенил]-3-[4-(4-фторфенил)-4H-1,2,4-триазол-3-ил]пропионамид
Выход: 54%. Бледно-желтый твердый продукт.
ЯМР (ДМСО-d6) δ: 3,0-3,1 (4H, м), 3,11 (2H, д, J=21,5 Гц), 3,64 (3H, c), 3,67 (3H, c), 7,15-7,3 (4H, м), 7,3-7,4 (2H, м), 7,48 (2H, д, J=8,5 Гц), 8,20 (1H, c), 9,22 (1H, ушир.c).
Пример 69
(2E)-N-[4-(Диэтилфосфонометил)фенил]-3-[5-(4-фторфенил)-1,2,3-тиадиазол-4-ил]акриламид
Выход: 45%. Бледно-желтый твердый продукт.
ЯМР (CDCl3) δ: 1,30 (6H, т, J=7 Гц), 3,15 (2H, д, J=21,5 Гц), 4,05-4,2 (4H, м), 7,15-7,3 (4H, м), 7,4-7,5 (2H, м), 7,5-7,6 (2H, м), 7,65-7,75 (2H, м), 9,29 (1H, ушир.c).
Пример 70
(2E)-N-[4-(Диметилфосфонометил)фенил]-3-[5-(4-фторфенил)-1,2,3-тиадиазол-4-ил]акриламид
Выход: 54%. Бледно-желтые кристаллы.
ЯМР (CDCl3) δ: 3,20 (2H, д, J=22 Гц), 3,71 (3H, c), 3,75 (3H, c), 7,2-7,3 (4H, м), 7,4-7,5 (3H, м), 7,58 (2H, д, J=8,5 Гц), 7,73 (1H, д, J=15 Гц), 8,06 (1H, ушир.c).
Пример 71
(2E)-N-[4-(Диэтилфосфонометил)фенил]-3-[4-(4-фторфенил)-1,2,3-тиадиазол-5-ил]акриламид
Выход: 37%. Бледно-желтые призматические кристаллы. Температура плавления: 173-175°C (перекристаллизуют из ацетона-гексана).
Пример 72
(2E)-N-[4-(Диметилфосфонометил)фенил]-3-[4-(4-фторфенил)-1,2,3-тиадиазол-5-ил]акриламид
Выход: 53%. Бледно-желтые призматические кристаллы. Температура плавления: 196-197°C (перекристаллизуют из ацетона-гексана).
Пример 73
(2E)-N-[4-(Диэтилфосфонометил)фенил]-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]бут-2-енамид
Выход: 65%. Бледно-желтые кристаллы.
ЯМР (CDCl3) δ: 1,23 (6H, т, J=7 Гц), 2,29 (3H, c), 3,10 (2H, д, J=21,5 Гц), 3,70 (3H, c), 3,95-4,15 (4H, м), 5,78 (1H, c), 7,1-7,4 (7H, м), 7,4-7,5 (2H, м), 7,64 (1H, c).
Пример 74
N-[4-(Диэтилфосфонометил)фенил]-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]бутанамид
Выход: 68%. Бесцветные кристаллы.
ЯМР (CDCl3) δ: 1,2-1,3 (9H, м), 2,4-2,6 (2H, м), 3,10 (2H, д, J=21,5 Гц), 3,15-3,25 (1H, м), 3,68 (3H, c), 3,95-4,1 (4H, м), 7,1-7,2 (4H, м), 7,2-7,3 (2H, м), 7,34 (2H, д, J=8,5 Гц), 7,48 (1H, c), 7,5-7,6 (1H, м).
Пример 75
(2Z)-N-[4-(Диэтилфосфонометил)фенил]-3-[5-(4-метоксифенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 76%. Бесцветные призматические кристаллы. Температура плавления: 187-188°C (перекристаллизуют из этилацетата-гексана).
Пример 76
(2Z)-N-[4-(Диметилфосфонометил)фенил]-3-[5-(4-метоксифенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 76%. Бесцветные призматические кристаллы. Температура плавления: 172-173°C (перекристаллизуют из этилацетата-гексана).
Пример 77
(2Z)-N-[4-(Диэтилфосфонометил)фенил]-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 68%. Бесцветные призматические кристаллы. Температура плавления: 208-209°C (перекристаллизуют из этилацетата-гексана).
Пример 78
Подобным же способом, как и в примере 51, получают (2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]-N-(4-{[(1-пропил-1H-имидазол-5-ил)метил]тио}фенил)акриламид.
Выход: 65%. Бледно-желтая аморфная форма.
ЯМР (CDCl3) δ: 0,97 (3H, т, J=7 Гц), 1,8-1,9 (2H, м), 3,77 (3H, c), 3,92 (2H, т, J=7 Гц), 3,97 (2H, c), 6,33 (1H, д, J=15,5 Гц), 6,67 (1H, c), 7,15-7,4 (7H, м), 7,4-7,45 (2H, м), 7,51 (1H, д, J=8,5 Гц), 7,78 (1H, c), 7,95-8,05 (1H, м).
Пример 79
Смесь 2-(этоксикарбонилокси)-3-[4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]-2-пропеноил}амино)фенил]пропионамида (420 мг), 1,8-диазабицикло[5,4,0]-7-ундецена (266 мг) и ацетонитрила (10 мл) при комнатной температуре перемешивают в течение 1 час. Реакционную смесь концентрируют и разбавляют этилацетатом. Смесь последовательно промывают 1н. водным раствором хлористоводородной кислоты, водой и насыщенным раствором соли. Органический слой сушат над безводным сульфатом магния и концентрируют с получением (2E)-N-{4-[(2,4-диоксо-1,3-оксазолидин-5-ил)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламида (293 мг, 77%) в виде бесцветных кристаллов.
ЯМР (CDCl3) δ: 2,95-3,2 (2H, м), 3,74 (3H, c), 5,15-5,25 (1H, м), 6,52 (1H, д, J=15,5 Гц), 7,05-7,2 (3H, м), 7,35-7,6 (6H, м), 7,89 (1H, c), 10,04 (1H, c), 11,70 (1H, ушир.c).
Пример 80
N-[4-(Диэтилфосфонометил)фенил]-3-(1,5-дифенил-1H-пиразол-4-ил)пропионамид
Выход: 92%. Бесцветные призматические кристаллы. Температура плавления: 157-159°C (перекристаллизуют из этилацетата-гексана).
Пример 81
N-[4-(Этоксикарбонилметил)фенил]-3-(1,5-дифенил-1H-пиразол-4-ил)пропионамид
Выход: 92%. Бесцветные призматические кристаллы. Температура плавления: 143-144°C (перекристаллизуют из этилацетата-гексана).
Пример 82
N-[4-(Метоксикарбонил)фенил]-3-(1,5-дифенил-1H-пиразол-4-ил)пропионамид
Выход: 97%. Бесцветные призматические кристаллы. Температура плавления: 196-197°C (перекристаллизуют из этилацетата-гексана).
Пример 83
Смесь N-[4-(этоксикарбонилметил)фенил]-3-(1,5-дифенил-1H-пиразол-4-ил)пропионамида (0,76 г), 1н. водного раствора гидроксида натрия (5 мл) и этанола (5 мл) перемешивают при 50°C в течение 3 час. Реакционную смесь выливают в 1н. водный раствор хлористоводородной кислоты и выпавшие кристаллы собирают фильтрацией, промывают водой и сушат с получением (4-{[3-(1,5-дифенил-1H-пиразол-4-ил)пропаноил]амино}фенил)уксусной кислоты.
Выход: 94%. Бесцветные призматические кристаллы. Температура плавления: 199-201°C (перекристаллизуют из этилацетата-гексана).
Пример 84
Подобным же способом, как и в примере 83, получают 4-{[3-(1,5-дифенил-1H-пиразол-4-ил)пропаноил]амино}бензойную кислоту.
Выход: 93%. Бесцветные призматические кристаллы. Температура плавления: 254-256°C(перекристаллизуют из ацетона-гексана).
Пример 85
К смеси (2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриловой кислоты (0,50 г), N,N-диметилформамида (0,05 мл) и тетрагидрофурана (15 мл) при комнатной температуре добавляют по каплям оксалил хлорид (0,30 г). Реакционную смесь перемешивают при комнатной температуре в течение 30 мин и концентрируют. Смесь полученного остатка 4-[(5-пропил-1,3,4-оксадиазол-2-ил)метил]анилина (0,48 г) и N,N-диметилацетамида (20 мл) перемешивают при комнатной температуре в течение 2 час. В реакционную смесь выливают воду и экстрагируют смесь этилацетатом. Органический слой последовательно промывают 1н. хлористоводородной кислотой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением (2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(5-пропил-1,3,4-оксадиазол-2-ил)метил]фенил}акриламида в виде бесцветных кристаллов (0,81 г, выход 91%). Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 154-155°C.
Подобным же способом, как и в примере 85, получают соединения, описанные в примерах 86-108.
Пример 86
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)метил]фенил}акриламид получают в виде бесцветных кристаллов (выход 83%). Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 262-263°C.
Пример 87
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(1H-тетразол-5-илметил)фенил]акриламид получают в виде бледно-желтых кристаллов (выход 84%). Его перекристаллизация из ацетона-метанола дает бледно-желтые призматические кристаллы. Температура плавления: 252-253°C.
Пример 88
(2E)-N-{4-[2-(5-Этил-1,3,4-оксадиазол-2-ил)этил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид получают в виде бесцветных кристаллов (выход 93%). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 167-168°C.
Пример 89
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[2-(1,3,4-оксадиазол-2-ил)этил]фенил}акриламид получают в виде бесцветных кристаллов (выход 87%). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 177-178°C.
Пример 90
(2E)-N-{4-[2-(2-Этил-1,3-тиазол-4-ил)этил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид получают в виде бесцветных кристаллов (выход 74%). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 190-191°C.
Пример 91
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[2-(1,3-тиазол-4-ил)этил]фенил}акриламид получают в виде бесцветных кристаллов (выход 65%). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 211-212°C.
Пример 92
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(1,3-тиазол-4-илметокси)фенил]акриламид получают в виде бледно-желтых кристаллов (выход 91%). Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 171-172°C.
Пример 93
(2E)-N-{4-[(2-Этил-1,3-тиазол-4-ил)метокси]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид получают в виде бесцветных кристаллов (выход 97%). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 98-99°C.
Пример 94
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(1,3,4-оксадиазол-2-илметокси)фенил]акриламид получают в виде бесцветных кристаллов (выход 76%). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 154-155°C.
Пример 95
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(4-метил-1,3-оксазол-2-ил)метил]фенил}акриламид получают в виде бесцветных кристаллов (выход 68%). Его перекристаллизация из этилацетата-простого диизопропилового эфира дает бесцветные призматические кристаллы. Температура плавления: 220-221°C.
Пример 96
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(пиридин-2-илметил)фенил]акриламид получают в виде бесцветных кристаллов (выход 87%). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 215-216°C.
Пример 97
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(5-метил-1,3,4-оксадиазол-2-ил)метокси]фенил}акриламид получают в виде бесцветных кристаллов (выход 74%). Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 117-118°C.
Пример 98
(2E)-N-{4-[(4-Этил-1,3-оксазол-2-ил)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид получают в виде бесцветных кристаллов (выход 88%). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 174-175°C.
Пример 99
(2E)-N-{4-[(2-Этил-1,3-тиазол-4-ил)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид получают в виде бесцветных кристаллов (выход 35%).
Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 178-179°C.
Пример 100
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(2-метил-1,3-тиазол-4-ил)метил]фенил}акриламид получают в виде бесцветных кристаллов (выход 63%). Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 192-193°C.
Пример 101
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(1-метил-1H-тетразол-5-ил)метил]фенил}акриламид получают в виде бесцветных кристаллов (выход 32%). Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 243-244°C.
Пример 102
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(2-метил-2H-тетразол-5-ил)метил]фенил}акриламид получают в виде бесцветных кристаллов (выход 96%). Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 159-161°C.
Пример 103
(2E)-N-{4-[(1-Этил-1H-тетразол-5-ил)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид получают в виде бесцветных кристаллов (выход 87%). Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 206-207°C.
Пример 104
(2E)-N-{4-[(2-Этил-2H-тетразол-5-ил)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид получают в виде бесцветных кристаллов (выход 61%). Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 187-188°C.
Пример 105
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-(4-неопентилфенил)акриламид получают в виде бесцветных кристаллов (выход 27%). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 150-151°C.
Пример 106
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-(2-оксо-2,3-дигидро-1,3-бензоксазол-6-ил)акриламид получают в виде бесцветных кристаллов (выход 70%). Его перекристаллизация из тетрагидрофурана-гексана дает бесцветные призматические кристаллы. Температура плавления: >300°C.
Пример 107
(2E)-N-[4-(1,3-Бензоксазол-2-илметил)фенил]-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид получают в виде бесцветных кристаллов (выход 50%). Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 195-196°C.
Пример 108
(2E)-N-[4-(1H-Бензимидазол-2-илметил)фенил]-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид получают в виде бесцветных кристаллов (выход 56%). Его перекристаллизация из N,N-диметилформамида-воды дает бесцветные призматические кристаллы. Температура плавления: >300°C.
Пример 109
Смесь этил (4-аминофенил)ацетата (0,88 г), (2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриловой кислоты (1,0 г), 1-гидрокси-1H-1,2,3-бензотриазола гидрата (0,81 г), 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорида (1,02 г) и N,N-диметилформамида (30 мл) при комнатной температуре перемешивают в течение 15 час. В реакционную смесь выливают воду и экстрагируют смесь этилацетатом. Органический слой последовательно промывают 1н. хлористоводородной кислотой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением этил [4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)фенил]ацетата в виде бесцветных кристаллов (1,49 г, выход 89%). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 177-178°C.
Подобным же способом, как и в примере 109, получают соединения, описанные в примерах 110-124.
Пример 110
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(3-метил-2,4-диоксо-1,3-тиазолидин-5-ил)метил]фенил}акриламид получают в виде бесцветных кристаллов (выход 65%). Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 228-229°C.
Пример 111
(2E)-N-{4-[(3-Этил-2,4-диоксо-1,3-тиазолидин-5-ил)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид получают в виде бесцветных кристаллов (выход 40%). Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 214-215°C.
Пример 112
Диэтил 4-({(2E)-3-[5-(4-фторфенил)-1H-пиразол-4-ил]проп-2-еноил}амино)бензилфосфонат получают в виде бесцветных кристаллов (выход 50%). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 181-182°C.
Пример 113
(2E)-N-{4-[2-(4-Этил-1,3-тиазол-2-ил)этил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид получают в виде бесцветных кристаллов (выход 38%). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 200-201°C.
Пример 114
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(2-гидрокси-2-метилпропил)фенил]акриламид получают в виде бесцветных кристаллов (выход 89%). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 188-189°C.
Пример 115
(2E)-N-[4-(2-Этил-2-гидроксибутил)фенил]-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид получают в виде бесцветных кристаллов (выход 55%). Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 150-151°C.
Пример 116
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(5-метил-1,2,4-оксадиазол-3-ил)метил]фенил}акриламид получают в виде бледно-желтых кристаллов (выход 57%). Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 183-184°C.
Пример 117
(2E)-N-(4-{[Ацетил(метил)амино]метил}фенил)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид получают в виде бесцветных кристаллов (выход 58%). Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 192-193°C.
Пример 118
(2E)-N-{4-[(5-Этил-1,2,4-оксадиазол-3-ил)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид получают в виде бесцветных кристаллов (выход 51%). Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 150-152°C.
Пример 119
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(4-метил-5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)метил]фенил}-акриламид получают в виде бесцветных кристаллов (выход 54%). Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 200-201°C.
Пример 120
(2E)-N-{4-[(4-Этил-5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид получают в виде бесцветных кристаллов (выход 73%). Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 149-150°C.
Пример 121
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(2-оксопропил)фенил]акриламид получают в виде бесцветных кристаллов (выход 17%). Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 186-187°C.
Пример 122
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-(3-метил-2-оксо-2,3-дигидро-1,3-бензоксазол-6-ил)акриламид получают в виде бесцветных кристаллов (выход 56%). Его перекристаллизация из тетрагидрофурана-гексана дает бесцветные призматические кристаллы. Температура плавления: 265-266°C.
Пример 123
(2E)-N-{4-[(4,5-Диметил-1,3-тиазол-2-ил)метил]фенил}-3-{5-(4-фторфенил)-1-метил-1H-пиразол-4-ил}акриламид получают в виде бесцветных кристаллов (выход 56%). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 210-211°C.
Пример 124
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(4,5,6,7-тетрагидро-1,3-бензотиазол-2-илметил)фенил]акриламид получают в виде бесцветных кристаллов (выход 73%). Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 205-206°C.
Пример 125
4-Этил-2-(4-нитробензил)-1,3-тиазол (0,50 г), 5% палладий на угле (0,50 г) и тетрагидрофуран (30 мл) подвергают каталитическому восстановлению в атмосфере водорода при атмосферном давлении. Катализатор удаляют фильтрацией и фильтрат концентрируют. Смесь полученного остатка, (2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриловой кислоты (0,49 г), 1-гидрокси-1H-1,2,3-бензотиазола гидрата (0,46 г), 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорида (0,58 г) и N,N-диметилформамида (10 мл) при комнатной температуре перемешивают в течение 15 час. В реакционную смесь выливают воду и экстрагируют смесь этилацетатом. Органический слой последовательно промывают 0,1н. хлористоводородной кислотой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением (2E)-N-{4-[(4-этил-1,3-тиазол-2-ил)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламида в виде бесцветных кристаллов (0,35 г, выход 39%) из фракции, элюируемой гексаном-этилацетатом (1:5, объем/объем). Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 211-212°C.
Подобным же способом, как и в примере 125, получают соединения, описанные в примерах 126-130.
Пример 126
Этил 2-[4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]-1,3-тиазол-4-карбоксилат получают в виде бесцветных кристаллов (выход 23%). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 189-190°C.
Пример 127
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(4-метил-1,3-тиазол-2-ил)метил]фенил}акриламид получают в виде бесцветных кристаллов (выход 31%). Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 217-218°C.
Пример 128
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(1,3-тиазол-2-ил)метил]фенил}акриламид получают в виде бесцветных кристаллов (выход 22%). Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 209-210°C.
Пример 129
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(1,3,4-оксадиазол-2-илметил)фенил]акриламид получают в виде бесцветных кристаллов (выход 63%). Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 223-224°C.
Пример 130
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[2-(1,3-тиазол-2-ил)этил]фенил}акриламид получают в виде бесцветных кристаллов (выход 24%). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 201-202°C.
Пример 131
Смесь этил 2-[4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]-1,3-тиазол-4-карбоксилата (0,52 г), 1н. водного раствора гидроксида натрия (2 мл), тетрагидрофурана (2 мл) и этанола (2 мл) при 50°C перемешивают в течение 30 мин. В реакционную смесь добавляют 1н хлористоводородную кислоту (2 мл) и воду и выпавшие кристаллы собирают фильтрацией с получением 2-[4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]-1,3-тиазол-4-карбоновой кислоты в виде бесцветных кристаллов (0,41 г, выход 80%). Ее перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 226-227°C.
Пример 132
Смесь 2-[4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]-1,3-тиазол-4-карбоновой кислоты (0,24 г), комплекса аммония и 1-гидрокси-1H-1,2,3-бензотриазол (0,12 г), 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорида (0,15 г) и N,N-диметилформамида (5 мл) перемешивают при комнатной температуре в течение 3 дней. В реакционную смесь выливают воду и экстрагируют смесь этилацетатом. Органический слой последовательно промывают 0,1н. хлористоводородной кислотой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением 2-[4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]-1,3-тиазол-4-карбоксамида в виде бесцветных кристаллов (0,21 г, выход 88%). Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 159-160°C.
Пример 133
Смесь этил [4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)фенил]ацетата (1,33 г), 1н. водного раствора гидроксида натрия (5 мл), тетрагидрофурана (5 мл) и этанола (5 мл) перемешивают при комнатной температуре в течение 1 час. В реакционную смесь добавляют 1н. хлористоводородную кислоту (5 мл) и воду и выпавшие кристаллы собирают фильтрацией с получением [4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил]амино}фенил]уксусной кислоты в виде бесцветных кристаллов (1,14 г, выход 91%). Ее перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 245-246°C.
Пример 134
К смеси [4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)фенил]уксусной кислоты (0,40 г), 4-метилморфолина (0,14 г) и тетрагидрофурана (10 мл) при 0°C добавляют по каплям раствор (5 мл) изобутил хлоркарбоната (0,20 г) в тетрагидрофуране. Реакционную смесь перемешивают при 0°C в течение 1 час и нерастворимые материалы собирают фильтрацией. Фильтрат добавляют к смеси гидразин гидрата (0,28 г) и тетрагидрофурана (10 мл) при 0°C. Реакционную смесь перемешивают при 0°C в течение 1 час и в реакционную смесь добавляют насыщенный водный раствор хлорида аммония. Выпавшие кристаллы собирают фильтрацией с получением бесцветных кристаллов. Смесь полученных кристаллов, триэтил ортопропионата (0,58 г), метансульфоновой кислоты (0,02 г) и тетрагидрофурана (10 мл) нагревают с обратным холодильником в течение 1 час. Реакционную смесь разбавляют этилацетатом, и органический слой последовательно промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Полученный остаток подвергают колоночной хроматографии на силикагеле с получением (2E)-N-{4-[(5-этил-1,3,4-оксадиазол-2-ил)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламида в виде бесцветных кристаллов (0,24 г, выход 51%) из фракции, элюируемой этилацетатом-метанолом (20:1, объем/объем). Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 164-165°C.
Пример 135
К смеси [4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)фенил]уксусной кислоты (5,5 г), 4-метилморфолина (1,91 г) и тетрагидрофурана (100 мл) при 0°C добавляют по каплям раствор (10 мл) изобутил хлоркарбоната (2,98 г) в тетрагидрофуране. Реакционную смесь перемешивают при комнатной температуре в течение 1 час и нерастворимые материалы собирают фильтрацией. Фильтрат добавляют по каплям к смеси гидразин моногидрата (3,63 г) и тетрагидрофурана (30 мл), при 0°C. Реакционную смесь перемешивают при 0°C в течение 2 час и добавляют насыщенный водный раствор бикарбоната натрия. Выпавшие кристаллы собирают фильтрацией с получением (2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(2-гидразино-2-оксоэтил)фенил]акриламида в виде бледно-желтых кристаллов (4,97 г, выход 87%). Его перекристаллизация из N,N-диметилформамида-воды дает бесцветные призматические кристаллы. Температура плавления: 273-274°C.
Пример 136
Смесь (2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(2-гидразино-2-оксоэтил)фенил]акриламида (0,50 г), триэтил ортоацетата (0,63 г), метансульфоновой кислоты (0,025 г) и тетрагидрофурана (10 мл) нагревают с обратным холодильником в течение 1 час. Реакционную смесь разбавляют этилацетатом, последовательно промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением (2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(5-метил-1,3,4-оксадиазол-2-ил)метил]фенил}акриламида в виде бледно-желтых кристаллов (0,25 г, выход 46%) из фракции, элюируемой этилацетатом-метанолом (100:0-20:1, объем/объем). Его перекристаллизация из этилацетата-гексана дает бледно-желтые призматические кристаллы. Температура плавления: 151-152°C.
Пример 137
Смесь трет-бутил [4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]карбамата (2,0 г) и 4н. хлористого водорода в этилацетате (80 мл) при 70°C перемешивают в течение 15 час. Выпавшие кристаллы собирают фильтрацией и промывают этилацетатом. К полученным кристаллам (0,30 г) добавляют 1н. водный раствор гидроксида натрия (50 мл) и экстрагируют смесь этилацетатом-тетрагидрофураном. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением (2E)-N-[4-(аминометил)фенил]-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламида в виде бесцветных кристаллов (0,18 г). Его перекристаллизация из этилацетата-гексана дает бесцветные призматические кристаллы. Температура плавления: 201-202°C.
Пример 138
Смесь трет-бутил [4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]карбамата (2,0 г) и 4н. хлористого водорода в этилацетате (80 мл) при 70°C перемешивают в течение 15 час. Выпавшие кристаллы собирают фильтрацией и промывают этилацетатом. К раствору (10 мл) полученных кристаллов (1,00 г) в N,N-диметилацетамиде при комнатной температуре добавляют триэтиламин (0,39 г). Реакционную смесь перемешивают при комнатной температуре в течение 30 мин и добавляют пропионилхлорид (0,27 г). Реакционную смесь дополнительно перемешивают при комнатной температуре в течение 2,5 дней. В реакционную смесь выливают воду и экстрагируют смесь этилацетатом-тетрагидрофураном. Органический слой последовательно промывают 1н. хлористоводородной кислотой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением (2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(пропиониламино)метил]фенил}акриламида в виде бесцветных кристаллов (0,51 г). Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 271-272°C.
Подобным же способом, как и в примере 138, получают соединения, описанные в примерах 139-142.
Пример 139
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(изобутириламино)метил]фенил}акриламид получают в виде бесцветных кристаллов. Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 258-259°C.
Пример 140
(2E)-N-{4-[(Бутириламино)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид получают в виде бесцветных кристаллов. Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 259-260°C.
Пример 141
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-(4-{[(3-метилбутаноил)амино]метил}фенил)акриламид получают в виде бесцветных кристаллов. Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 226-227°C.
Пример 142
N-[4-({(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]бензамид получают в виде бесцветных кристаллов. Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 250-251°C.
Пример 143
Смесь диметиламина (2M раствор в тетрагидрофуране, 1,7 мл), [4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)фенил]уксусной кислоты (0,70 г), 1-гидрокси-1H-1,2,3-бензотриазола гидрата (0,35 г), 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорида (0,44 г) и N,N-диметилформамида (20 мл) при комнатной температуре перемешивают в течение 15 час. В реакционную смесь выливают воду и экстрагируют смесь этилацетатом. Органический слой последовательно промывают 1н. хлористоводородной кислотой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением (2E)-N-{4-[2-(диметиламино)-2-оксоэтил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламида в виде бесцветных кристаллов (0,36 г, выход 49%) из фракции, элюируемой этилацетатом-метанолом (20:1, объем/объем). Его перекристаллизация из ацетона-простого диизопропилового эфира дает бесцветные призматические кристаллы. Температура плавления: 209-210°C.
Пример 144
Смесь диэтиламина (0,17 г), [4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)фенил]уксусной кислоты (0,70 г), 1-гидрокси-1H-1,2,3-бензотриазола гидрата (0,35 г), 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорида (0,44 г) и N,N-диметилформамид (20 мл) перемешивают при комнатной температуре в течение 15 час. В реакционную смесь выливают воду и экстрагируют смесь этилацетатом. Органический слой последовательно промывают 1н. хлористоводородной кислотой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением ((2E)-N-{4-[2-(диэтиламино)-2-оксоэтил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламида в виде бесцветных кристаллов (0,48 г, выход 62%) из фракции, элюируемой этилацетатом-метанолом (20:1, объем/объем). Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 175-176°C.
Пример 145
К смеси (2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриловой кислоты (35,0 г), ацетонитрила (245 мл) и диметилформамида (0,175 мл) при 40-45°C добавляют тионилхлорид (11,4 мл) и смесь перемешивают в течение 1 час. Затем добавляют диэтил 4-аминобензилфосфонат (36,3 г) при 5°C и дополнительно добавляют по каплям диизопропилэтиламин (61,9 мл). Смесь перемешивают при комнатной температуре в течение 1 час. Добавляют 1н. водный раствор гидроксида натрия (140 мл), для нейтрализации реакционной смеси, и дополнительно добавляют воду (472,5 мл). Смесь перемешивают при комнатной температуре в течение 1 час. Выпавшие кристаллы собирают фильтрацией и промывают 30% раствором ацетонитрила с получением диэтил [4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфоната (61,5 г, выход 92%).
Полученные кристаллы растворяют в 90% этаноле путем нагревания, добавляют теплую воду при 60-65°C, добавляют при перемешивании затравочные кристаллы и смесь охлаждают до комнатной температуры с получением кристаллов. Температура плавления: 208-209°C.
Пример 146
Смесь диметил 4-аминобензилфосфоната (258 мг), (2E)-3-[5-(3-фурил)-1-метил-1H-пиразол-4-ил]акриловой кислоты (218 мг), 1-гидрокси-1H-1,2,3-бензотриазола гидрата (184 мг), 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорида (230 мг) и N,N-диметилформамида (8 мл) при комнатной температуре перемешивают в течение ночи. Реакционную смесь выливают в 0,5н. водный раствор хлористоводородной кислоты и экстрагируют смесь этилацетатом. Этилацетатный слой промывают насыщенным водным раствором бикарбоната натрия, а затем насыщенным раствором соли, сушат (MgSO4) и концентрируют. Полученный твердый продукт перекристаллизуют из этилацетата-гексана с получением диметил 4-{[(2E)-3-[5-(3-фурил)-1-метил-1H-пиразол-4-ил]проп-2-еноил]амино}бензилфосфоната (123 мг, выход 30%) в виде бесцветных призматических кристаллов. Температура плавления: 176-177°C.
Подобным же способом, как и в примере 146, получают соединения, описанные в примерах 147-155.
Пример 147
Диэтил 4-[{(2E)-3-[5-(3-фурил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино]бензилфосфонат
Выход: 37%. Бесцветные призматические кристаллы. Температура плавления: 208-210°C (перекристаллизуют из этилацетата-гексана).
Пример 148
Диметил 4-({(2E)-3-[1-метил-5-(2-тиенил)-1H-пиразол-4-ил]проп-2-еноил}амино)бензилфосфонат
Выход: 24%. Бесцветные призматические кристаллы. Температура плавления: 247-248°C (перекристаллизуют из этилацетата-гексана).
Пример 149
Диэтил [4-({(2E)-3-[1-метил-5-(2-тиенил)-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Выход: 31%. Бесцветные призматические кристаллы. Температура плавления: 262-263°C (перекристаллизуют из этилацетата-гексана).
Пример 150
Диэтил 4-({(2E)-3-[1-метил-5-(3-пиридинил)-1H-пиразол-4-ил]проп-2-еноил}амино)бензилфосфонат
Выход: 37%. Бесцветные призматические кристаллы. Температура плавления: 211-214°C (перекристаллизуют из этанола-этилацетата).
Пример 151
Диэтил 4-{[(2E)-3-(1,5-диметил-1H-пиразол-4-ил)проп-2-еноил]амино}бензилфосфонат
Выход: 29%. Бесцветные призматические кристаллы. Температура плавления: 228-230°C (перекристаллизуют из этилацетата-гексана).
Пример 152
Диэтил 4-{[(2E)-3-(1-метил-1H-пиразол-4-ил)проп-2-еноил]амино}бензилфосфонат
Выход: 34%. Бесцветные призматические кристаллы. Температура плавления: 201-202°C (перекристаллизуют из этилацетата-гексана).
Пример 153
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(гидроксиметил)фенил]акриламид
Выход: 74%. Бесцветные призматические кристаллы. Температура плавления: 117-118°C (перекристаллизуют из этилацетата-простого изопропилового эфира).
Пример 154
Диэтил 4-[({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)метил]бензилфосфонат
Выход: 74%. Аморфная форма.
ЯМР (CDCl3) δ: 1,25 (6H, т, J=7,0 Гц), 3,11 (2H, д, J=21,6 Гц), 3,76 (3H, c), 3,93-4,08 (4H, м), 4,46-4,50 (2H, м), 5,96-6,02 (1H, м), 6,15 (1H, д, J=15,4 Гц), 7,15-7,36 (9H, м), 7,74 (1H, c).
Пример 155
(2E)-N-{4-[(2,4-Диоксо-1,3-тиазолидин-3-ил)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 75%. Бесцветные призматические кристаллы. Температура плавления: 245-247°C (перекристаллизуют из этилацетата-гексана).
Пример 156
Смесь (2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(гидроксиметил)фенил]акриламида (8,4 г), тионил хлорида (2,59 мл) и тетрагидрофурана (70 мл) нагревают с обратным холодильником в течение 3 час. Реакционную смесь выливают в насыщенный водный раствор бикарбоната натрия и экстрагируют смесь этилацетатом. Этилацетатный слой промывают водой, а затем насыщенным раствором соли, сушат (MgSO4) и концентрируют с получением твердого продукта (6,22 г). К смеси 1,3-оксазолидин-2,4-диона (123,3 мг) и N,N-диметилформамида (5 мл) добавляют гидрид натрия (60% в масле, 48,8 мг) и перемешивают смесь при комнатной температуре в течение 30 мин. Полученный твердый продукт (300 мг) добавляют в реакционную смесь и смесь дополнительно при комнатной температуре перемешивают в течение ночи. В реакционную смесь добавляют воду и экстрагируют смесь этилацетатом. Органический слой последовательно промывают 0,1н. хлористоводородной кислотой, водой и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток перекристаллизуют из этилацетата-гексана с получением (2E)-N-{4-[(2,4-диоксо-1,3-оксазолидин-3-ил)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламида в виде желтых призматических кристаллов (132 мг, выход 37%). Температура плавления: 239-240°C.
Подобным же способом, как и в примере 146, получают соединения, описанные в примерах 157-158.
Пример 157
(2E)-N-{4-[(2,5-Диоксо-1-имидазолидинил)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 53%. Желтые призматические кристаллы. Температура плавления: 249-250°C (перекристаллизуют из этилацетата-гексана).
Пример 158
(2E)-N-{4-[(2,6-Диоксо-1-пиперидинил)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 65%. Бесцветные призматические кристаллы. Температура плавления: 218-220°C (перекристаллизуют из этилацетата-гексана).
Пример 159
Смесь (2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриловой кислоты (1,0 г), оксалил хлорида (618 мг), тетрагидрофурана (60 мл) и N,N-диметилформамида (2 капли) перемешивают при комнатной температуре в течение 2 час. Реакционную смесь концентрируют и разбавляют N,N-диметилацетамидом (50 мл). Добавляют 4-(1H-имидазол-1-илметил)анилин (844 мг) и смесь при комнатной температуре перемешивают в течение ночи. В реакционную смесь выливают воду и экстрагируют смесь этилацетатом. Этилацетатный слой промывают водой, сушат (MgSO4) и концентрируют. Полученный твердый продукт перекристаллизуют из ацетона-гексана с получением (2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(1H-имидазол-1-илметил)фенил]акриламида в виде бледно-желтых призматических кристаллов (1,41 г, выход 86%). Температура плавления: 213-214°C.
Подобным же способом, как и в примере 146, получают соединения, описанные в примерах 160-179.
Пример 160
(2E)-N-[4-(2-Амино-2-оксоэтил)фенил]-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 46%. Бесцветные призматические кристаллы. Температура плавления: 253-255°C (перекристаллизуют из этилацетата-гексана).
Пример 161
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(1H-пиразол-1-илметил)фенил]акриламид
Выход: 86%. Бесцветные призматические кристаллы. Температура плавления: 189-191°C (перекристаллизуют из ацетона-гексана).
Пример 162
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(2-изопропил-1H-имидазол-1-ил)метил]фенил}акриламид
Выход: 74%. Бесцветные призматические кристаллы. Температура плавления: 271-272°C (перекристаллизуют из ацетона-гексана).
Пример 163
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(1H-1,2,4-триазол-1-илметил)фенил]акриламид
Выход: 90%. Бесцветные призматические кристаллы. Температура плавления: 225-226°C (перекристаллизуют из ацетона-гексана).
Пример 164
Метил 1-[4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]-1H-1,2,4-триазол-5-карбоксилат
Выход: 87%. Бесцветные призматические кристаллы. Температура плавления: 203-205°C (перекристаллизуют из ацетона-гексана).
Пример 165
(2E)-N-(4-Ацетилфенил)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 65%. Бесцветные призматические кристаллы. Температура плавления: 204-205°C (перекристаллизуют из ацетона-гексана).
Пример 166
(2E)-N-[4-(Ацетиламино)фенил]-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 87%. Бесцветные призматические кристаллы. Температура плавления: 281-282°C (перекристаллизуют из ацетона-гексана).
Пример 167
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(2-гидроксиэтил)фенил]акриламид
Выход: 85%. Бесцветные призматические кристаллы. Температура плавления: 198-200°C (перекристаллизуют из ацетона-гексана).
Пример 168
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-(4-метилфенил)акриламид
Выход: 85%. Бесцветные призматические кристаллы. Температура плавления: 178-180°C (перекристаллизуют из ацетона-гексана).
Пример 169
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-[3-(гидроксиметил)фенил]акриламид
Выход: 42%. Бесцветные призматические кристаллы. Температура плавления: 130-132°C (перекристаллизуют из ацетона-гексана).
Пример 170
трет-Бутил 4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензилкарбамат
Выход: 69%. Бесцветные призматические кристаллы. Температура плавления: 222-223°C (перекристаллизуют из ацетона-простого изопропилового эфира).
Пример 171
(2E)-N-{4-[(4-Этил-1H-имидазол-1-ил)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 30%. Бесцветные призматические кристаллы. Температура плавления: 224-226°C (перекристаллизуют из ацетона-гексана).
Пример 172
(2E)-N-{4-[(5,6-Диметил-1H-бензимидазол-1-ил)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 74%. Бесцветные призматические кристаллы. Температура плавления: 279-280°C (перекристаллизуют из ацетона-метанола).
Пример 173
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(2-метил-1H-бензимидазол-1-ил)метил]фенил}акриламид
Выход: 58%. Бесцветные призматические кристаллы. Температура плавления: 263-264°C (перекристаллизуют из ацетона-метанола).
Пример 174
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[гидрокси(фенил)метил]фенил}акриламид
Выход: 50%. Бесцветные призматические кристаллы. Температура плавления: 192-195°C (перекристаллизуют из этилацетата).
Пример 175
(2E)-N-(4-Бензилфенил)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 28%. Бесцветные призматические кристаллы. Температура плавления: 226-227°C (перекристаллизуют из ацетона-гексана).
Пример 176
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(1H-индазол-1-илметил)фенил]акриламид
Выход: 71%. Бесцветные призматические кристаллы. Температура плавления: 146-148°C (перекристаллизуют из ацетона-гексана).
Пример 177
(2E)-N-[4-(1H-1,2,3-Бензотриазол-1-илметил)фенил]-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 41%. Бесцветные призматические кристаллы. Температура плавления: 226-227°C (перекристаллизуют из ацетона-гексана).
Пример 178
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(2H-индазол-2-илметил)фенил]акриламид
Выход: 53%. Бесцветные призматические кристаллы. Температура плавления: 231-232°C (перекристаллизуют из ацетона-гексана).
Пример 179
(2E)-N-[4-(2H-1,2,3-Бензотриазол-2-илметил)фенил]-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 50%. Бесцветные призматические кристаллы. Температура плавления: 222-223°C (перекристаллизуют из ацетона-гексана).
Пример 180
Смесь (2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриловой кислоты (600 мг), оксалил хлорида (260 мкл), тетрагидрофурана (10 мл) и N,N-диметилформамида (2 капли) при комнатной температуре перемешивают в течение 3 час. Реакционную смесь концентрируют и разбавляют N,N-диметилацетамидом (10 мл). Добавляют этил 4-аминобензоат (482 мг) и смесь при комнатной температуре перемешивают в течение 3 час. Реакционную смесь выливают в 0,1н. водный раствор хлористоводородной кислоты и экстрагируют смесь этилацетатом. Этилацетатный слой промывают насыщенным водным раствором бикарбоната натрия, а затем насыщенным раствором соли, сушат (MgSO4) и концентрируют. Полученный твердый продукт перекристаллизуют из ацетона-гексана с получением этил 4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензоата (810 мг, выход 84%) в виде бесцветных иглообразных кристаллов. Температура плавления: 202-203°C.
Подобным же способом, как и в примере 180, получают соединения, описанные в примерах 181-206.
Пример 181
(2E)-N-[4-(Аминосульфонил)фенил]-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 39%. Бледно-желтые призматические кристаллы. Температура плавления: 300-305°C (разложение) (перекристаллизуют из ацетона-простого изопропилового эфира).
Пример 182
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-(4-гидроксифенил)акриламид
Выход: 65%. Бесцветные призматические кристаллы. Температура плавления: 259-260°C (перекристаллизуют из этилацетата-гексана).
Пример 183
4-({(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензамид
Выход: 76%. Бесцветные призматические кристаллы. Температура плавления: 276-278°C (перекристаллизуют из ацетона-гексана).
Пример 184
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-[2-(гидроксиметил)фенил]акриламид
Выход: 22%. Бесцветные призматические кристаллы. Температура плавления: 119-120°C (перекристаллизуют из ацетона-гексана).
Пример 185
(2E)-N-[4-(1H-Бензимидазол-1-илметил)фенил]-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 79%. Бледно-желтые призматические кристаллы. Температура плавления: 243-244°C (перекристаллизуют из ацетона-гексана).
Пример 186
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[2-(1H-пиразол-1-ил)этил]фенил}акриламид
Выход: 82%. Бесцветные призматические кристаллы. Температура плавления: 205-206°C (перекристаллизуют из этилацетата-гексана).
Пример 187
(2E)-3-{5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил}-N-{4-[2-(1H-имидазол-1-ил)этил]фенил}акриламид
Выход: 71%. Бесцветные призматические кристаллы. Температура плавления: 160-162°C (перекристаллизуют из этилацетата-гексана).
Пример 188
Этил 4-{[4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]амино}-4-оксобутаноат
Выход: 57%. Бесцветные призматические кристаллы. Температура плавления: 195-197°C (перекристаллизуют из ацетона-гексана).
Пример 189
(2E)-N-{4-[(Ацетиламино)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 62%. Бесцветные призматические кристаллы. Температура плавления: 233-234°C (перекристаллизуют из ацетона-гексана).
Пример 190
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(2-метил-1H-имидазол-1-ил)метил]фенил}акриламид
Выход: 63%. Бесцветные призматические кристаллы. Температура плавления: 232-233°C (перекристаллизуют из этанола-гексана).
Пример 191
(2E)-N-{4-[(2-Этил-1H-имидазол-1-ил)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 56%. Бесцветные призматические кристаллы. Температура плавления: 237-238°C (перекристаллизуют из этанола-гексана).
Пример 192
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(4-морфолинилметил)фенил]акриламид
Выход: 75%. Бесцветные призматические кристаллы. Температура плавления: 202-203°C (перекристаллизуют из этанола-гексана).
Пример 193
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(1-пирролидинилметил)фенил]акриламид
Выход: 25%. Бесцветные призматические кристаллы. Температура плавления: 192-193°C (перекристаллизуют из этанола-гексана).
Пример 194
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(1H-1,2,3-триазол-1-илметил)фенил]акриламид
Выход: 50%. Бесцветные призматические кристаллы. Температура плавления: 252-253°C (перекристаллизуют из этанола-гексана).
Пример 195
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(1H-имидазол-1-ил)фенил]акриламид
Выход: 10%. Бесцветные призматические кристаллы. Температура плавления: 238-239°C (перекристаллизуют из этанола-этилацетата).
Пример 196
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(2H-1,2,3-триазол-2-илметил)фенил]акриламид
Выход: 74%. Бесцветные призматические кристаллы. Температура плавления: 178-179°C (перекристаллизуют из этилацетата-гексана).
Пример 197
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(1H-пиразол-1-ил)фенил]акриламид
Выход: 63%. Бледно-желтые призматические кристаллы. Температура плавления: 200-201°C (перекристаллизуют из этилацетата-гексана).
Пример 198
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(2H-тетразол-2-илметил)фенил]акриламид
Выход: 83%. Бледно-желтые призматические кристаллы. Температура плавления: 210-211°C (перекристаллизуют из этилацетата-гексана).
Пример 199
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(1H-тетразол-1-илметил)фенил]акриламид
Выход: 78%. Бесцветные призматические кристаллы. Температура плавления: 233-234°C (перекристаллизуют из этилацетата-гексана).
Пример 200
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-(4-{[2-(гидроксиметил)-1H-имидазол-1-ил]метил}фенил)акриламид
Выход: 38%. Бесцветные призматические кристаллы. Температура плавления: 229-230°C (перекристаллизуют из ацетона-гексана).
Пример 201
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(5-метил-1H-имидазол-1-ил)метил]фенил}акриламид
Выход: 50%. Бесцветные призматические кристаллы. Температура плавления: 260-261°C (перекристаллизуют из ацетона-гексана).
Пример 202
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(4-метил-1H-имидазол-1-ил)метил]фенил}акриламид
Выход: 57%. Бесцветные призматические кристаллы. Температура плавления: 202-203°C (перекристаллизуют из ацетона-гексана).
Пример 203
(2E)-N-{4-[(1,1-Диоксид-4-тиоморфолинил)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 73%. Бесцветные призматические кристаллы. Температура плавления: 237-238°C (перекристаллизуют из ацетона-гексана).
Пример 204
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(метилтио)фенил]акриламид
Выход: 76%. Бесцветные призматические кристаллы. Температура плавления: 164-165°C (перекристаллизуют из этилацетата-гексана).
Пример 205
(2E)-N-(4-Бензоилфенил)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 82%. Бесцветные призматические кристаллы. Температура плавления: 110-112°C (перекристаллизуют из ацетона-гексана).
Пример 206
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(фенилсульфонил)фенил]акриламид
Выход: 61%. Бесцветные призматические кристаллы. Температура плавления: 169-172°C (перекристаллизуют из ацетона-гексана).
Пример 207
Смесь (2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(гидроксиметил)фенил]акриламида (8,4 г), тионилхлорида (2,59 мл) и тетрагидрофурана (70 мл) нагревают с обратным холодильником в течение 3 час. Реакционную смесь выливают в насыщенный водный раствор бикарбоната натрия и экстрагируют смесь этилацетатом. Этилацетатный слой промывают водой, а затем насыщенным раствором соли, сушат (MgSO4) и концентрируют с получением твердого продукта (6,22 г). Смесь этого твердого продукта (1,0 г), тиометоксида натрия (0,57 г) и N,N-диметилформамида (10 мл) перемешивают при 40°C в течение 14 час. Реакционную смесь выливают в 0,1н. водный раствор хлористоводородной кислоты и экстрагируют смесь этилацетатом. Этилацетатный слой промывают насыщенным водным раствором бикарбоната натрия, а затем насыщенным раствором соли, сушат (MgSO4) и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением (2E)-3-{1-метил-5-[4-(метилтио)фенил]-1H-пиразол-4-ил}-N-{4-[(метилтио)метил]фенил}акриламида в виде кристаллов (650 мг) из фракции, элюируемой гексаном-этилацетатом (2:1-1:1, объем/объем). Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 145-146°C.
Пример 208
Смесь (2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(гидроксиметил)фенил]акриламида (8,4 г), тионилхлорида (2,59 мл) и тетрагидрофурана (70 мл) нагревают с обратным холодильником в течение 3 час. Реакционную смесь выливают в насыщенный водный раствор бикарбоната натрия и экстрагируют смесь этилацетатом. Этилацетатный слой промывают водой, а затем насыщенным раствором соли, сушат (MgSO4) и концентрируют с получением твердого продукта (6,22 г). Смесь этого твердого продукта (300 мг), тиометоксида натрия (56,9 мг) и N,N-диметилформамида (10 мл) при комнатной температуре перемешивают в течение 30 мин. Реакционную смесь выливают в 0,1н. водный раствор хлористоводородной кислоты и экстрагируют смесь этилацетатом. Этилацетатный слой промывают насыщенным водным раствором бикарбоната натрия, а затем насыщенным раствором соли, сушат (MgSO4) и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением (2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(метилтио)метил]фенил}акриламида в виде кристаллов (125 мг) из фракции, элюируемой гексаном-этилацетатом (1:1-0:1, объем/объем). Его перекристаллизация из ацетона-гексана дает бесцветные призматические кристаллы. Температура плавления: 165-168°C.
Подобным же способом, как и в примере 208, получают соединения, описанные в примерах 209-214.
Пример 209
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(метоксиметил)фенил]акриламид
Бесцветные призматические кристаллы. Температура плавления: 170-171°C (перекристаллизуют из ацетона-гексана).
Пример 210
(2E)-N-{4-[(Этилтио)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Бесцветные призматические кристаллы. Температура плавления: 157-158°C (перекристаллизуют из этилацетата-гексана).
Пример 211
(2E)-N-{4-[(трет-Бутилтио)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Бесцветные призматические кристаллы. Температура плавления: 166-168°C (перекристаллизуют из ацетона-гексана).
Пример 212
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(фенилтио)метил]фенил}акриламид
Бесцветные призматические кристаллы. Температура плавления: 197-198°C (перекристаллизуют из ацетона-гексана).
Пример 213
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(1H-1,2,3-триазол-4-илтио)метил]фенил}акриламид
Бесцветные призматические кристаллы. Температура плавления: 182-183°C (перекристаллизуют из ацетона-гексана).
Пример 214
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-(4-{[(1-метил-1H-тетразол-5-ил)тио]метил}фенил)акриламид
Бесцветные призматические кристаллы. Температура плавления: 150-152°C (перекристаллизуют из ацетона-гексана).
Пример 215
Смесь (2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(метилтио)метил]фенил}акриламида (600 мг), м-хлорпербензойной кислоты (387 мг) и тетрагидрофурана (50 мл) при 0°C перемешивают в течение 20 мин. В реакционную смесь добавляют насыщенный водный раствор сульфита натрия и экстрагируют смесь этилацетатом. Этилацетатный слой промывают насыщенным водным раствором бикарбоната натрия, а затем насыщенным раствором соли, сушат (MgSO4) и концентрируют. Полученный твердый продукт перекристаллизуют из ацетона-гексана с получением (2E)-3-(5-(4-фторфенил)-1-метил-1H-пиразол-4-ил)-N-(4-((метилсульфинил)-метил)фенил)акриламида (340 мг, выход 54%) в виде бесцветных призматических кристаллов. Температура плавления: 240-241°C.
Подобным же способом, как и в примере 215, получают соединения, описанные в примерах 216-221.
Пример 216
(2E)-N-{4-[(Этилсульфинил)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 66%. Бесцветные призматические кристаллы. Температура плавления: 228-229°C (перекристаллизуют из этилацетата-гексана).
Пример 217
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(метилсульфинил)фенил]акриламид
Выход: 62%. Бесцветные призматические кристаллы. Температура плавления: 260-261°C (перекристаллизуют из ацетона-гексана).
Пример 218
(2E)-N-{4-[(трет-Бутилсульфинил)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 33%. Бесцветные призматические кристаллы. Температура плавления: 242-243°C (перекристаллизуют из ацетона-гексана).
Пример 219
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(фенилсульфинил)метил]фенил}акриламид
Выход: 47%. Бесцветные призматические кристаллы. Температура плавления: 236-237°C (перекристаллизуют из ацетона-метанола).
Пример 220
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-(4-{[(1-метил-1H-тетразол-5-ил)сульфинил]метил}фенил)акриламид
Выход: 66%. Бесцветные призматические кристаллы. Температура плавления: 179-183°C (перекристаллизуют из ацетона-гексана).
Пример 221
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(1H-1,2,3-триазол-4-илсульфинил)метил]фенил}акриламид
Выход: 54%. Бесцветные призматические кристаллы. Температура плавления: 179-183°C (перекристаллизуют из ацетона-гексана).
Пример 222
Смесь (2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(метилтио)метил]фенил}акриламида (600 мг), м-хлорпербензойной кислоты (780 мг) и тетрагидрофурана (50 мл) при 0°C перемешивают в течение 20 мин. В реакционную смесь добавляют насыщенный водный раствор сульфита натрия и смесь дополнительно перемешивают в течение 10 мин и экстрагируют этилацетатом. Этилацетатный слой промывают насыщенным водным раствором бикарбоната натрия, а затем насыщенным раствором соли, сушат (MgSO4) и концентрируют. Полученный твердый продукт перекристаллизуют из ацетона-гексана с получением (2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(метилсульфонил)метил]фенил}акриламида (490 мг, выход 75%) в виде бесцветных призматических кристаллов. Температура плавления: 251-252°C.
Подобным же способом, как и в примере 222, получают соединения, описанные в примерах 223-227.
Пример 223
(2E)-N-{4-[(Этилсульфонил)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 64%. Бесцветные призматические кристаллы. Температура плавления: 257-258°C (перекристаллизуют из этилацетата-гексана).
Пример 224
(2E)-N-{4-[(трет-Бутилсульфонил)метил]фенил}-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриламид
Выход: 71%. Бесцветные призматические кристаллы. Температура плавления: 260-261°C (перекристаллизуют из ацетона-гексана).
Пример 225
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(фенилсульфонил)метил]фенил}акриламид
Выход: 66%. Бесцветные призматические кристаллы. Температура плавления: 223-224°C (перекристаллизуют из ацетона-гексана).
Пример 226
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-(4-{[(1-метил-1H-тетразол-5-ил)сульфонил]метил}фенил)акриламид
Выход: 21%. Бесцветные призматические кристаллы. Температура плавления: 224-225°C (перекристаллизуют из ацетона-гексана).
Пример 227
(2E)-3-[5-(4-Фторфенил)-1-метил-1H-пиразол-4-ил]-N-{4-[(1H-1,2,3-триазол-4-илсульфонил)метил]фенил}акриламид
Выход: 45%. Бесцветные призматические кристаллы. Температура плавления: 204-206°C (перекристаллизуют из ацетона-гексана).
Пример 228
Смесь диэтил {3-[(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)метил]бензил}фосфоната (8,0 г), гидразина гидрата (4 мл) и метанола (100 мл) нагревают с обратным холодильником в течение 14 час. Реакционную смесь охлаждают и выпавшие кристаллы удаляют фильтрацией. Фильтрат концентрируют и к остатку добавляют 1н. водный раствор гидроксида натрия (50 мл). Смесь экстрагируют этилацетатом. Этилацетатный слой промывают водой, а затем насыщенным раствором соли, сушат (MgSO4) и концентрируют с получением бесцветного масла (2,0 г). Смесь этого масла (310 мг), (2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]акриловой кислоты (246 мг), 1-гидрокси-1H-1,2,3-бензотриазола гидрата (184 мг), 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорида (230 мг) и N,N-диметилформамида (8 мл) при комнатной температуре перемешивают в течение ночи. Реакционную смесь выливают в 0,5н. водный раствор хлористоводородной кислоты и экстрагируют смесь этилацетатом. Этилацетатный слой промывают насыщенным водным раствором бикарбоната натрия, а затем насыщенным раствором соли, сушат (MgSO4) и концентрируют. Остаток подвергают колоночной хроматографии на силикагеле с получением диэтил 3-[({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)метил]-бензилфосфоната (391 мг) в виде аморфной формы из фракции, элюируемой гексаном-этилацетатом (4:1-1:1, объем/объем).
ЯМР (CDCl3) δ: 1,24 (6H, т, J=7,0 Гц), 3,12 (2H, д, J=21,6 Гц), 3,76 (3H, c), 3,93-4,08 (4H, м), 4,27 (2H, д, J=5,8 Гц), 5,95-6,10 (1H, м), 6,16 (1H, д, J=15,6 Гц), 7,15-7,37 (9H, м), 7,76 (1H, c).
Подобным же способом, как и в примере 228, получают соединение, описанное в примере 229.
Пример 229
Диэтил 2-[({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)метил]бензилфосфонат получают в виде аморфной формы (357 мг).
ЯМР (CDCl3) δ: 1,28 (6H, т, J=7,0 Гц), 3,23 (2H, д, J=21,6 Гц), 3,74 (3H, c), 3,91-4,11 (4H, м), 4,52 (2H, д, J=5,4 Гц), 6,22 (1H, д, J=15,4 Гц), 7,14-7,42 (9H, м), 7,79 (1H, c), 7,89 (1H, ушир.c).
Подобным способом, как и в примере 1, получают соединения, описанные в примерах 230-231.
Пример 230
3-[5-(4-Хлорфенил)-1-метил-1H-пиразол-4-ил]-N-[4-(диметилфосфонометил)фенил]пропионамид
Выход: 97%. Бесцветные кристаллы.
Анализ ВЭЖХ: чистота 99,6% (время удерживания: 3,389 мин)
МС(ESI+):462(M+H)
Пример 231
Метил 3-[4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)фенил]-2-гидроксипропионат
Выход 97%. Бесцветные кристаллы.
Анализ ВЭЖХ: чистота 80% (время удерживания: 3,385 мин)
МС(ESI+):424(M+H)
Пример 232
Смесь метил 3-[4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)фенил]-2-гидроксипропионата (1,34 г), 2н. водного раствора гидроксида натрия (10 мл) и метанола (20 мл) при комнатной температуре перемешивают в течение 1 час. Реакционную смесь выливают в 1н. водный раствор хлористоводородной кислоты (100 мл). Выпавшие твердые продукты собирают фильтрацией, промывают водой и сушат с получением 3-[4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)фенил]-2-гидроксипропионовой кислоты (800 мг, 62%) в виде бесцветных кристаллов.
Анализ ВЭЖХ: чистота 100% (время удерживания: 3,216 мин)
МС(ESI+):410(M+H)
Пример 233
Смесь 3-[4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)фенил]-2-гидроксипропионовой кислоты (409 мг), этил хлоркарбоната (324 мг), триэтиламина (405 мг) и этилацетата (10 мл) перемешивают при 0°C в течение 1 час. К реакционной смеси добавляют концентрированный водный раствор аммония (10 мл), и смесь перемешивают при комнатной температуре в течение 1 час. Реакционную смесь концентрируют и выпавшие твердые продукты собирают фильтрацией, промывают водой и сушат с получением 2-(этоксикарбонилокси)-3-[4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)фенил]пропионамида (471 мг, 98%) в виде бесцветных кристаллов.
Анализ ВЭЖХ: чистота 94,7% (время удерживания: 3,398 мин.)
МС(ESI+):481(M+H)
Пример 234
Смесь этил 4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензоата (510 мг), 2н водного раствора гидроксида натрия (1,29 мл) и этанола (20 мл) при 50°C перемешивают в течение 14 час. В реакционную смесь добавляют 1н. хлористоводородную кислоту (2,6 мл) и экстрагируют смесь этилацетатом. Этилацетатный слой промывают насыщенным водным раствором бикарбоната натрия, а затем насыщенным раствором соли, сушат (MgSO4) и концентрируют. Полученный твердый продукт перекристаллизуют из ацетона-гексана с получением 4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)-бензойной кислоты (390 мг, выход 82%) в виде бесцветных призматических кристаллов. Температура плавления: 291-292°C.
Из соединений, полученных в указанных выше примерах, соединения, имеющие отличающиеся наименования, указываются далее под отличающимися наименованиями.
Пример 1
Диметил [4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 2
Диэтил [4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 4
Диметил [4-({(2E)-3-[5-(4-метоксифенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 5
Диэтил [4-({(2E)-3-[5-(4-метоксифенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 6
Диметил [4-({(2E)-3-[5-(3-хлорфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 7
Диэтил [4-({(2E)-3-[5-(3-хлорфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 8
Диметил [4-({(2E)-3-[5-(4-хлорфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 9
Диэтил [4-({(2E)-3-[5-(4-хлорфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 10
Диметил (4-{[(2E)-3-(1-метил-5-фенил-1H-пиразол-4-ил)проп-2-еноил]амино}бензил)фосфонат
Пример 11
Диэтил (4-{[(2E)-3-(1-метил-5-фенил-1H-пиразол-4-ил)проп-2-еноил]амино}бензил)фосфонат
Пример 12
Диметил {4-[((2E)-3-{1-метил-5-[4-(трифторметил)фенил]-1H-пиразол-4-ил}проп-2-еноил)амино]бензил}фосфонат
Пример 13
Диэтил {4-[((2E)-3-{1-метил-5-[4-(трифторметил)фенил]-1H-пиразол-4-ил}проп-2-еноил)амино]бензил}фосфонат
Пример 14
Диметил [4-({(2E)-3-[5-(2-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 15
Диэтил [4-({(2E)-3-[5-(2-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 16
Диметил [4-({(2E)-3-[5-(4-бромфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 17
Диэтил [4-({(2E)-3-[5-(4-бромфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 18
Диметил [4-({(2E)-3-[1-метил-5-(1-нафтил)-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 19
Диэтил [4-({(2E)-3-[1-метил-5-(1-нафтил)-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 20
Диметил [4-({(2E)-3-[5-(3-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 21
Диэтил [4-({(2E)-3-[5-(3-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 22
Диметил [4-({(2E)-3-[1-метил-5-(4-метилфенил)-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 23
Диэтил [4-({(2E)-3-[1-метил-5-(4-метилфенил)-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 28
Диэтил [3-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 29
Диэтил [2-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 30
Дибутил [4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 31
Диэтил [4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)фенил]фосфонат
Пример 32
Диэтил {2-[4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)фенил]этил}фосфонат
Пример 33
Диэтил [4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)-3-метилбензил]фосфонат
Пример 34
Диэтил [4-({(2E)-3-[1-бензил-5-(4-фторфенил)-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 35
Диэтил [4-({(2E)-3-[1-бензил-3-(4-фторфенил)-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 36
Диметил [4-({(2E)-3-[1-этил-5-(4-фторфенил)-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 37
Диэтил [4-({(2E)-3-[1-этил-5-(4-фторфенил)-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 38
Диметил [4-({(2E)-3-[5-(4-фторфенил)-1,3-диметил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 39
Диэтил [4-({(2E)-3-[5-(4-фторфенил)-1,3-диметил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 40
Диметил {4-{[(2E)-3-(5-циклогексил-1-метил-1H-пиразол-4-ил)проп-2-еноил]амино}бензил}фосфонат
Пример 41
Диэтил (4-{[(2E)-3-(5-циклогексил-1-метил-1H-пиразол-4-ил)проп-2-еноил]амино}бензил)фосфонат
Пример 42
Диметил [4-({(2E)-3-[5-(2-фурил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 43
Диэтил [4-({(2E)-3-[5-(2-фурил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 45
Диэтил [{4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)фенил}(метокси)метил]фосфонат
Пример 46
Диэтил {[4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)фенил](гидрокси)метил}фосфонат
Пример 48
O-Бензил S-[4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)фенил]тиокарбонат
Пример 54
Диэтил [4-({(2E)-3-[3-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 55
Диэтил [4-({(2E)-3-[4-(4-фторфенил)-1-метил-1H-пиразол-5-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 56
Диэтил [4-({(2E)-3-[4-(4-фторфенил)-1-метил-1H-пиразол-3-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 57
Диэтил [4-({3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]пропаноил}амино)бензил]фосфонат
Пример 58
Диметил [4-({3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]пропаноил}амино)бензил]фосфонат
Пример 59
Диэтил [4-({3-[5-(4-хлорфенил)-1-метил-1H-пиразол-4-ил]пропаноил}амино)бензил]фосфонат
Пример 61
Диэтил [4-({(2E)-3-[1-(4-фторфенил)-1H-имидазол-5-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 62
Диметил [4-({(2E)-3-[1-(4-фторфенил)-1H-имидазол-5-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 63
Диэтил [4-({3-[1-(4-фторфенил)-1H-имидазол-5-ил]пропаноил}амино)бензил]фосфонат
Пример 64
Диметил [4-({3-[1-(4-фторфенил)-1H-имидазол-5-ил]пропаноил}амино)бензил]фосфонат
Пример 65
Диэтил [4-({(2E)-3-[4-(4-фторфенил)-4H-1,2,4-триазол-3-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 66
Диметил [4-({(2E)-3-[4-(4-фторфенил)-4H-1,2,4-триазол-3-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 67
Диэтил [4-({3-[4-(4-фторфенил)-4H-1,2,4-триазол-3-ил]пропаноил}амино)бензил]фосфонат
Пример 68
Диметил [4-({3-[4-(4-фторфенил)-4H-1,2,4-триазол-3-ил]пропаноил}амино)бензил]фосфонат
Пример 69
Диэтил [4-({(2E)-3-[5-(4-фторфенил)-1,2,3-тиадиазол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 70
Диметил [4-({(2E)-3-[5-(4-фторфенил)-1,2,3-тиадиазол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 71
Диэтил [4-({(2E)-3-[4-(4-фторфенил)-1,2,3-тиадиазол-5-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 72
Диметил [4-({(2E)-3-[4-(4-фторфенил)-1,2,3-тиадиазол-5-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 73
Диэтил [4-({(2E)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]бут-2-еноил}амино)бензил]фосфонат
Пример 74
Диэтил [4-({3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]бутаноил}амино)бензил]фосфонат
Пример 75
Диэтил [4-({(2Z)-3-[5-(4-метоксифенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 76
Диметил [4-({(2Z)-3-[5-(4-метоксифенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 77
Диэтил [4-({(2Z)-3-[5-(4-фторфенил)-1-метил-1H-пиразол-4-ил]проп-2-еноил}амино)бензил]фосфонат
Пример 80
Диэтил [4-{[3-(1,5-дифенил-1H-пиразол-4-ил)пропаноил]амино}бензил]фосфонат
Пример 81
Этил (4-{[3-(1,5-дифенил-1H-пиразол-4-ил)пропаноил]амино}-фенил)ацетат
Пример 82
Метил 4-{[3-(1,5-дифенил-1H-пиразол-4-ил)пропаноил]-амино}бензоат
Экспериментальный пример 1
Используя клетки глиомы крыс C6, оценивают действие соединения по настоящему изобретению по усилению продуцировиния GDNF.
Клетки глиомы крыс C6 (ATCC) выращивают в среде Игла, модифицированной Дюльбеко (DMEM), содержащей 10% FBS (фетальной сыворотки теленка) в 75 см2 колбе для культур (SUMITOMO BAKELITE Co., Ltd.), почти полностью покрытой коллагеном типа 1, отсоединяют с помощью обработки трипсином и промывают один раз DMEM, содержащей 10% FBS.
Клетки после промывки разбавляют DMEM, содержащей 10% FBS, до концентрации 5×104/мл и высевают по 0,3 мл/лунку, в каждую лунку 48 луночной чашки для культур (SUMITOMO BAKELITE Co., Ltd.), покрытой коллагеном типа 1. Через 3 дня культуру в чашке для культур помещают в среду DMEM, содержащую 1% BSA (бычьего сывороточного альбумина, Sigma), в которую добавлены различные концентрации исследуемого соединения, и дополнительно культурируют в течение 2 дней. Супернатант культуры отделяют и хранят при -80°C до измерений GDNF.
Содержание GDNF в супернатанте культуры измеряют с помощью следующего способа ELISA.
Антитела анти-GDNF (MAB212, R&D) разбавляют TBS (Трис физиологическим буферным солевым раствором: 25 ммоль/л Трис-HCl (pH 8,0), 150 ммоль/л NaCl) до концентрации 2 мкг/мл и распределяют по 0,1 мл/лунку в каждую лунку 96-луночного планшета для иммуноферментного анализа. 96-луночный планшет для иммуноферментного анализа инкубируют в течение ночи при 4°C и промывают один раз TBS, содержащим Tween 20, при концентрации 0,05% (далее сокращенно упоминается как TBST). Блокирующий раствор (TBS, содержащий 1% BSA и 5% сахарозы) добавляют по 0,2 мл/лунку в каждую лунку, после промывки, и инкубируют планшет при комнатной температуре в течение 1 час, после чего каждую лунку дважды промывают TBST. Супернатант (0,1 мл) культуры указанных выше клеток C6 добавляют в каждую лунку после промывки и планшет инкубируют при комнатной температуре в течение 3 час, после чего лунки промывают 5 раз TBST. 500-кратно разбавленные антитела анти-GDNF (G2791, Promega) добавляют по 0,1 мл в каждую лунку, после промывки, инкубируют при комнатной температуре в течение 2 час и промывают 5 раз TBST. 5000-кратно разбавленные антитела против IgY цыпленка, меченные пероксидазой хрена (G1351, Promega), добавляют по 0,1 мл/лунку в каждую лунку, после промывки, инкубируют при комнатной температуре в течение 2 час и промывают 5 раз TBST. Раствор субстрата (раствор субстрата TMB, BIO-RAD) добавляют по 0,1 мл/лунку в каждую лунку, после промывки, и дают возможность для проявления цвета при комнатной температуре в течение 8 мин. Для прекращения реакции добавляют по 0,1 мл 1 моль/л фосфорной кислоты в каждую лунку, при реакции проявления цвета. Измеряют коэффициент поглощения реакционного раствора на длине волны 450 нм.
Таким же способом, как и выше, за исключением того, что исследуемое соединение не используется, осуществляют способ ELISA, и это используется в качестве контрольной группы.
С использованием различных концентраций GDNF (Promega) осуществляют способ ELISA таким же образом, как и выше, и приготавливают стандартную линию образцов.
Из указанного выше коэффициента поглощения и стандартной линии образцов вычисляют содержание GDNF в образце, и концентрацию (EC50), которая вызывает 50% увеличение GDNF по сравнению с контрольной группой, вычисляют по линейной регрессии. Результаты показаны в таблице 1.
Как показано в таблице 1, соединение по настоящему изобретению имеет действие по усилению продуцирования GDNF.
Экспериментальный пример 2
С использованием клеток PC12 оценивают нейропротекторное действие соединения по настоящему изобретению.
Клетки PC12 предварительно культурируют в течение одного дня в растворе для культур DMEM (среде Игла, модифицированной Дюльбеко), содержащем 10% FCS (фетальной сыворотки теленка), в инкубаторе, при 37°C, 5% CO2, и высевают, по 5×103/лунку, в 24-луночный планшет (Falcon), в такую же среду. После того, как клетки прилипнут к нижней поверхности, культуру заменяют раствором для культур DMEM, содержащим 0,5% FCS и 2 нг/мл NGF (Wako Pure Chemical Industries, Ltd.). После культурирования в течение ночи добавляют исследуемое соединение при концентрации 0,3-3,0 мкмоль/л и клетки культурируют в течение еще двух дней. К культурируемым клеткам добавляют глютаральдегид, до конечной концентрации 2%, и клетки фиксируются в течение 1 час., после чего их окрашивают с помощью Diff-Quick (International Reagents Corporation). Клетки промывают, сушат воздухом и наблюдают под микроскопом.
В результате клетки, обработанные соединениями примера 2, примера 49, примера 60, примера 110, примера 149, примера 159, примера 161, примера 185, примера 192, примера 222 и примера 223, демонстрируют улучшенное образование нейритной сети, что демонстрирует, что эти соединения обладают нейропротекторным действием.
Пример приготовления 1 (получение капсулы)
1), 2), 3) и 4) смешивают и заполняют в желатиновые капсулы.
Пример приготовления 2 (получение таблетки)
Общее количество 1), 2) и 3), и 30 г 4) замешивают с водой и после сушки в вакууме гранулируют. Гранулы смешивают с 14 г 4) и 1 г 5) и прессуют с помощью машины для таблетирования. Таким образом, получают 1000 таблеток, содержащих 30 мг соединения примера 1 на одну таблетку.
Промышленное применение
Соединение по настоящему изобретению имеет превосходное действие по усилению продуцирования или секреции нейротрофического фактора и может быть использовано для профилактики или лечения невропатии и тому подобное.
Эта заявка основана на заявке на патент № 2002-320153, поданной в Японии, все содержание которой, тем самым, включено в качестве ссылки.
Ссылки, цитируемые здесь, включая патенты и заявки на патенты, включены здесь во всей их полноте, в качестве ссылок, в том объеме, в котором они здесь описаны.
Реферат
Настоящее изобретение относится к новому соединению, представленному формулой (II), которое обладает усиливающим продуцирование или секрецию нейротрофического фактора действием. Объектами изобретения также являются фармацевтические средства или средства для профилактики или лечения невропатии, усиления продукции и лечения нейротрофического фактора, для облегчения боли, для защиты нерва, для профилактики и лечения нервопатической боли, содержащие соединение формулы (I) или формулы (II). В соединениях формул (I) и (II) символы и радикалы имеют значения, приведенные в формуле изобретения. Указанные средства имеют превосходное действие и низкую токсичность. Предложены также способы лечения и профилактики вышеуказанных состояний с помощью соединений формул (I) или (II) и применения этих соединений для производства вышеуказанных средств. Кроме того, предложен способы получения заявленных соединений и промежуточных пиразольных соединений. 34 н. и 12 з.п. ф-лы, 1 табл.


Формула

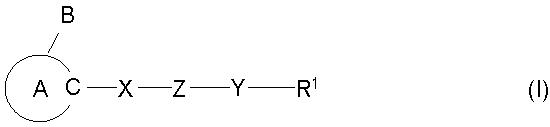










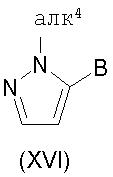


Комментарии