Модифицированные пептиды для применения при лечении нейродегенеративных заболеваний - RU2756052C2
Код документа: RU2756052C2
Чертежи








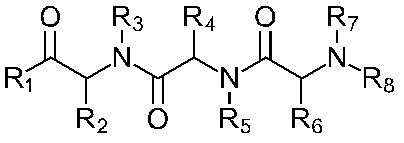
Описание
Изобретение относится к нейродегенеративным заболеваниям, и, конкретнее к новым пептидам, пептидомиметикам, композициям, видам терапии и способам лечения таких заболеваний, например болезни Альцгеймера.
Авторы изобретения ранее предположили, что нейродегенеративный процесс представляет собой аберрантно активированный процесс развития. В подтверждение этой гипотезы, фактически сообщалось об гипертрофии нейронов-хабов в стволовой части мозга у страдающихболезнью Альцгеймера (Bowser et al., 1997, Brain Pathol.7:723-30). Если повреждены большие участки этого хаба, то будет иметь место более чем одно нейродегенеративное заболевание, как это происходит в часто наблюдаемых, но еще не объясненных случаях патологии, сопутствующей болезнями Альцгеймера и Паркинсона. Интересно, что все нейроны в уязвимом хабе глобальных нейронов, несмотря на гетерогенность нейромедиаторов, содержат известный фермент ацетилхолинэстеразу (АХЭ). АХЭ, следовательно, находится в нейронах, в которых она не может выполнять свою нормальную функцию, поскольку такие подгруппы клеток, как норадренергическое голубоватое место, дофаминергическая черная субстанция или серотонергические нейроны ядер шва в мозге, ни в каком случае не содержат обычный субстрат, ацетилхолин. Еще одно неожиданное отклонение от своей обычной ферментативной роли заключается в том, что АХЭ на самом деле сама по себе высвобождается из глобальных нейронов, предположительно как своего рода межклеточный мессенджер. Как правило, АХЭ в настоящее время широко и хорошо известна как сигнальная молекула, которая обладает трофической активностью в разнообразных ситуациях как в нервной, так и в неневральной ткани.
Авторы изобретения ранее показали, что АХЭ, действуя как трофический агент, не зависящий от его ферментативной активности, действительно запускает поступление кальция в нейроны. Следовательно, возможно, что в глобальных нейронах АХЭ оказывает двойное неклассическое действие, которое распространяется вдоль трофически-токсической оси в зависимости от количества, продолжительности доступности и, что наиболее важно, возраста. Если стандартные нейроны повреждаются во взрослом возрасте, как при инсульте, другие будут компенсировать их функции. Напротив, глобальные нейроны будут реагировать, используя свои трофические ресурсы в попытке восстановить. Но поскольку последующий приток кальция будет летальным для старых, зрелых клеток, полученное повреждение вызовет дальнейшие попытки компенсировать пагубный цикл, который характеризует нейродегенерацию.
Ацетилхолинэстераза (АХЭ) экспрессируется на разных этапах развития в различных формах, все из которых имеют одинаковую ферментативную активность, но имеют очень разный молекулярный состав. «Хвостовая» (T-АХЭ) экспрессируется в синапсах, и авторы изобретения ранее идентифицировали два пептида, которые отщепляются от С-конца, один из которых именуется «Т14» внутри другого, который известен как «Т30», и которые оба имеют сильную гомологию последовательности с сопоставимой областью β-амилоида. С-концевой пептид АХЭ «T14» был идентифицирован как существенная часть молекулы АХЭ, ответственная за его диапазон негидролитической активности. Синтетический пептидный аналог из 14 аминокислот (т.е. «Т14»), и, следовательно, более крупная, более стабильная и более сильнодействующая аминокислотная последовательность, в которую он встроен (т.е., «T30») отображают действия, сравнимые с действиями, описанными для «нехолинергической» АХЭ, где инертный остаток в последовательности T30 (т.е. «Т15») без эффекта.
Немедленные эффекты T14 и T30 заключаются в том, что они: (1) изменяют поступление кальция в нейроны в срезах мозга с течением времени от миллисекунд до часов; (2) несут в себе риски для жизнеспособности клеток РС 12, а также нейрональных органотипических культур in vitro; (3) изменяют «компенсаторное», индуцированное кальцием, высвобождение АХЭ из нейронов и клеток PC 12; (4) активируют потоки кальция в ооцитах и нейронах в срезах мозга; (5) усиливают токсические воздействия амилоида; и (6) участвуют в продуцировании белка-предшественника амилоида и высвобождении амилоидного бета (Aβ) пептида. Длительные эффекты T14 и T30 заключаются в том, что они: (1) уменьшают рост нейронов; (2) индуцируют апоптоз; (3) увеличивают высвобождение АХЭ; (4) связывают и изменяют никотиновый рецептор α7 (рецептор α-7nChR) и (5) усиливают экспрессию рецептора α7 на поверхности клетки в течение 24 часов, тем самым обеспечивая предупреждающий механизм дальнейшей токсичности.
Поскольку T14 и T30 являются более селективными, чем β-амилоид, при индуцировании токсичности и также синергетичны с усиливающим токсичность амилоидом, постулируется, что любое средство, которое блокирует токсические воздействия T14 или T30, также уменьшает менее селективное и последующее токсическое воздействие амилоида. Автор изобретения ранее показал, что пептиды T30 и T14 связываются с аллостерическим центром никотинового рецептора α7, вызывая разнообразие трофических-токсических эффектов. Этот рецептор коэкспрессируется с АХЭ во время критических периодов развития мозга, а также демонстрирует почти параллельное распределение во взрослом мозге и представляет собой один из самых мощных кальциевых ионофоров в мозге. Он также может функционировать независимо от холинергической передачи, поскольку холин (полученный с питанием) может служить альтернативным первичным лигандом. Дополнительно, этот рецептор уже связан с болезнью Альцгеймера как одна из целей современной терапии галантамином (Реминил (RTM)), а также связан с воздействиями амилоида.
Однако доказано, что эффективность галантамина является ограниченной, тогда как другие антагонисты никотинового ацетилхолинового рецептора α7 все еще находятся на этапе клинических испытаний. Галантамин обладает не только неспецифическим влиянием на другие рецепторы, а также ингибирует АХЭ, но он имеет низкое сродство к никотиновому рецептору α7 (т.е. всего 10 мкМ) по сравнению с таковым у T30 и T14, которые имеют гораздо более высокое сродство к никотиновому рецептору α7 (т.е. 5 нМ). Следовательно, если в мозгу страдающего от болезни Альцгеймера эндогенный эквивалент пептида Т30 уже занимает соответствующий активный центр рецептора, галантамин необходимо вводить в нефизиологических высоких дозах с неизбежными побочными эффектами и, что наиболее важно, с недостоверной эффективностью.
Авторы изобретения ранее показали в WO 2005/004430, что циклические полипептиды, содержащие аминокислотную последовательность, полученную из С-конца ацетилхолинэстеразы (АХЭ), избирательно ингибируют неклассические влияния АХЭ (то есть влияния АХЭ, которые не зависят от ее ферментативной активности) и/или из ее концевого пептида in vitro, и, следовательно, их можно применять при лечении нейродегенеративных заболеваний. Например, было показано, что циклический пептид, именуемый «NBP14» (т.е. циклический пептид T14), является особенно активным, поскольку он действует как аллостерический модулятор α7-никотинового рецептора, противодействуя влиянию пептидов АХЭ и бета-амилоида. Было показано, что он защищает клетки от токсичности линейных T14, T30 и β-амилоида и блокирует компенсаторное высвобождение АХЭ, вызванное токсичностью линейных T14 и T30. Дополнительно, они обнаружили, что циклический NBP14 сам по себе не оказывает существенного влияния на концентрации Ca2+ в срезах мозга крыс, но блокирует влияния β-амилоида. Однако, несмотря на активность, проявляемую циклическим NBP14, из-за его размера существуют некоторые опасения относительно его способности преодолевать гематоэнцефалический барьер при применении в качестве лекарственного препарата.
Следовательно, существует постоянная потребность в улучшенных лекарственных средствах для лечения нейродегенеративных заболеваний, а именно болезни Альцгеймера и болезни Паркинсона.
Авторы изобретения продолжили свою предыдущую работу, описанную в WO 2005/004430, в которой они продемонстрировали, что циклический NBP-14 защищает от токсического действия Т30 и продуцирования бета-амилоида. Они провели исследование in silico для разработки новых пептидов и пептидомиметиков, которые будут проявлять сродство к рецептору α-7nChR и, следовательно, будут блокировать связывание с его активным центром с помощью эндогенного токсичного пептида T30. После анализа огромного количества возможных подходящих соединений, они теперь определили химические функциональные группы подходящие для защиты от токсического влияния Т30 и продуцирования бета-амилоида, путем изучения взаимодействие между рецептором и циклическим NBP-14. На основании этих экспериментов авторы изобретения разработали, синтезировали и испытали несколько подходящих соединений, которые, как было показано, обладают удивительной терапевтической полезностью для лечения нейродегенеративных заболеваний.
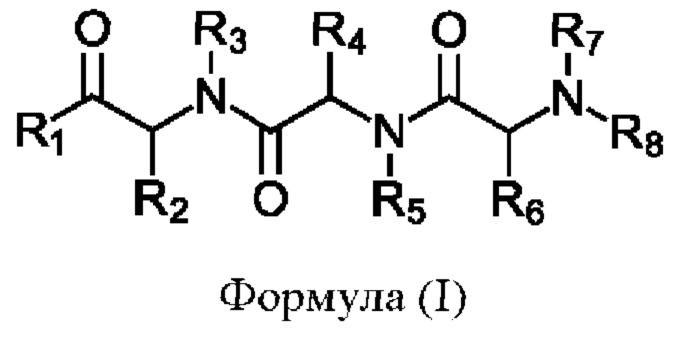
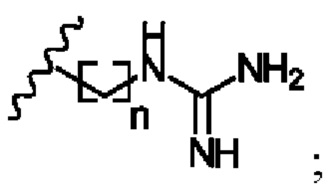
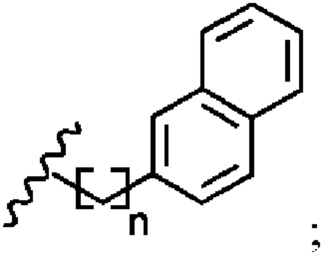
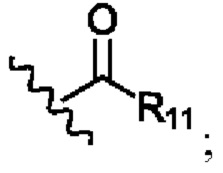
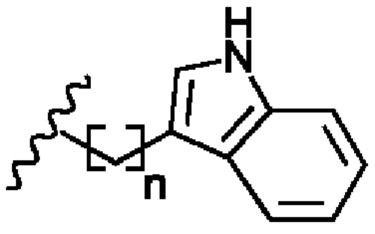
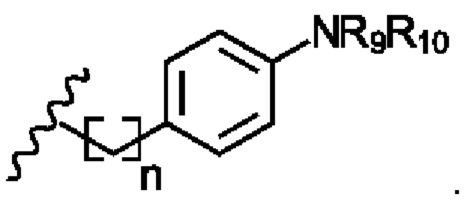
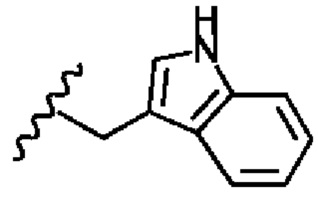
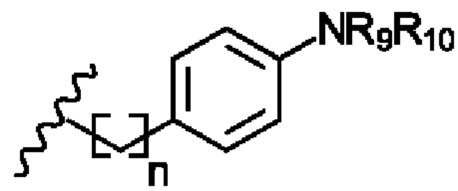
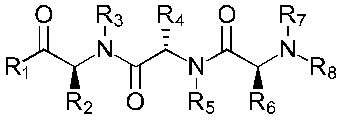
В соответствии с первым аспектом изобретения предложено соединение формулы (I), (II), (III), (IV), (V) или (VI):
Формула (I)
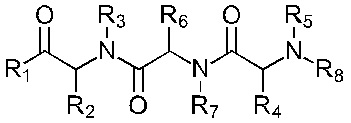
Формула (II)
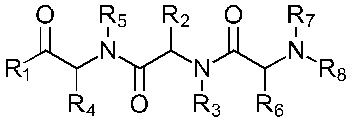
Формула (III)
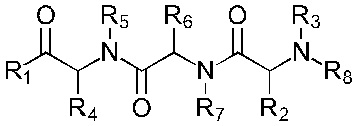
Формула (IV)
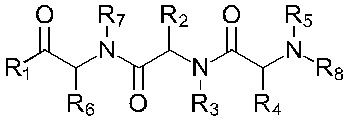
Формула (V)
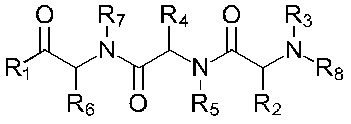
Формула (VI)
где:
R1 представляет собой -NR9R10 или -OH;
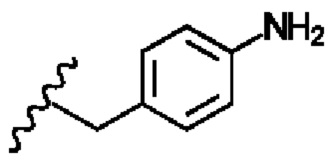
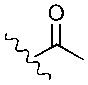
R2 представляет собой

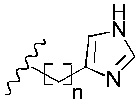

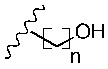
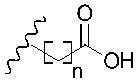
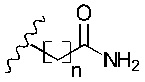
R3 представляет собой -H или С1-5 линейный или разветвленный алкил- или алкенил-;
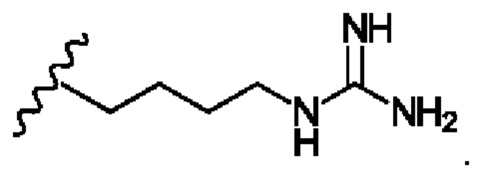
R4 представляет собой






R5 представляет собой -Н или С1-5линейный или разветвленный алкил- или алкенил-; или
R4 и R5 с азотом и углеродом, с которыми они связаны, образуют пятичленное кольцо, замещенное -OH или -NH2;
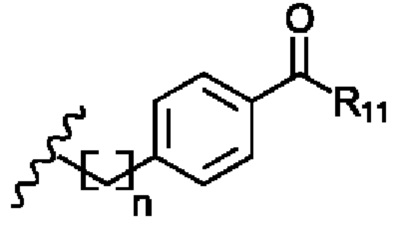
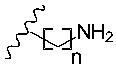
R6 представляет собой
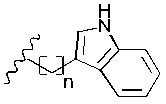
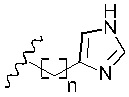

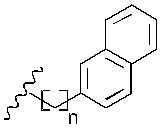





R7 представляет собой -Н или С1-5 линейный или разветвленный алкил- или алкенил-;
R8 представляет собой -H; С1-5 линейный или разветвленный алкил- или алкенил- или
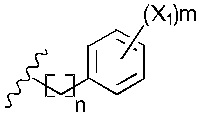
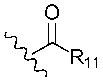
Х1 представляет собой -NR9R10, -ОН или
или каждый R9 и R10, независимо, представляют собой -Н или С1-5 линейный или разветвленный алкил- или алкенил-;
R11 представляет собой -NH2, -OH или арильную группу;
или каждый m, независимо, составляет от 0 до 5; и
каждый n, независимо, составляет от 0 до 10;
или его фармацевтически приемлемую соль, сольват, таутомерную форму или полиморфную форму для применения в терапии.
Как описано в примерах и изображено на Фиг. 9, 10 и 26, соединения по данному изобретению преимущественно разработаны для защиты объекта, обработанного ними, от токсических влияний пептида T30 за счет уменьшения притока кальция и/или активности ацетилхолинэстеразы. Дополнительно, соединения по изобретению преимущественно созданы для защиты субъекта от продуцирования бета-амилоида. Соответственно, авторы изобретения также обнаружили, что соединения формулы (I), (II), (III), (IV), (V) и (VI) подходят для лечения нейродегенеративных заболеваний.
Следовательно, во втором аспекте предложено соединение формулы (I), (II), (III), (IV), (V) или (VI) или его фармацевтически приемлемая соль, сольват, таутомерная форм или полиморфная форма, для применения при лечении, улучшении или профилактики нейродегенеративный заболеваний.
Дополнительно, в третьем аспекте предложен способ лечения, улучшения или профилактики нейродегенеративного заболевания, причем способ включает введение субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы (I), (II), (III), (IV), (V) или (VI) или его фармацевтически приемлемой соли, сольвата, таутомерной формы или полиморфной формы.
Нейродегенеративное заболевание, которое лечат, преимущественно представляет собой заболевание, которое характеризуется повреждением или гибелью «глобальных» нейронов. Например, нейродегенеративное заболевание выбирают из группы, состоящей из болезни Альцгеймера; болезни Паркинсона; болезни Хантингтона; заболевания двигательных нейронов; спиноцеребеллярного типа 1, типа 2 и типа 3; боковго амиотрофического склероза (БАС); шизофрении; деменции с тельцами Леви и лобно-височной деменции.
Предпочтительно нейродегенеративное заболевание, которое лечат, представляет собой болезнь Альцгеймера, болезнь Паркинсона или заболевание двигательных нейронов. Наиболее предпочтительно нейродегенеративное заболевание, которое лечат пептидом, его производным или аналогом по первому аспекту, представляет собой болезнь Альцгеймера.
Следует понимать, что термин «соль» относится к любой соли соединения, предложенного в данном тексте, которая сохраняет свои биологические свойства и которая не является токсичной или иным образом нежелательной для фармацевтического применения. Такие соли получают из различных органических и неорганических противоионов, хорошо известных в данной области. Такие соли включают, но не ограничиваются ими: (1) кислотно-аддитивные соли, образованные с органическими или неорганическими кислотами, а именно: соляной, бромистоводородной, серной, азотной, фосфорной, сульфаминовой, уксусной, трифторуксусной, трихлоруксусной, пропионовой, гексановой, циклопентилпропионовой, гликолевой, глутаровой, пировиноградной, молочной, малоновой, янтарной, сорбиновой, аскорбиновой, яблочной, малеиновой, фумаровой, винной, лимонной, бензойной, 3-(4-гидроксибензоил)бензойной, пикриновой, коричной, миндальной, фталевой, лауриновой, метансульфоновой, этансульфоновой, 1,2-этандисульфоновой, 2-гидроксиэтансульфоновой, бензолсульфоновой, 4-хлорбензолсульфоновой, 2-нафталинсульфоновой, 4-толуолсульфоновой, камфорной, камфорсульфоновой, 4-метилбицикло[2.2.2]-окт-2-ен-1-карбоновой, глюкогептоновой, 3-фенилпропионовой, триметилуксусной, трет-бутилуксусной, лаурилсерной, глюконовой, бензойной, глутаминовой, гидроксинафтойной, салициловой, стеариновой, циклогексилсульфаминовой, хинной, муконовой кислотой и подобными кислотами; или (2) основно-аддитивные соли, образующиеся, когда кислотный протон, находящийся в исходном соединении, либо (а) замещается ионом металла, например ионом щелочного металла, ионом щелочноземельного металла или ионом алюминия, либо гидроксидами щелочных металлов или щелочно-земельных металлов, а именно гидроксидом натрия, калия, кальция, магния, алюминия, лития, цинка и бария, аммиаком или (б) координируются с органическим основанием, а именно алифатическими, алициклическими или ароматическими органическими аминами, а именно: аммиаком, метиламином, диметиламином, диэтиламином, пиколином, этаноламином, диэтаноламином, триэтаноламином, этилендиамином, лизином, аргинином, орнитином, холином, N,N'-дибензилэтилендиамином, хлорпрокаином, диэтаноламином, прокаином, N-бензилфенэтиламином, N-метилгюкаминпиперазином, трис(гидроксиметил)аминометаном, гидроксидом тетраметиламмония и тому подобное.
Соли дополнительно включают в качестве только примера и без ограничения натрий, калий, кальций, магний, аммоний, тетраалкиламмоний и тому подобное, и, когда соединение содержит основные функциональные группы, соли нетоксичных органических или неорганических кислот, а именно гидрогалогениды, например, гидрохлорид и гидробромид, сульфат, фосфат, сульфамат, нитрат, ацетат, трифторацетат, трихлорацетат, пропионат, гексаноат, циклопентилпропионат, гликолат, глутарат, пируват, лактат, малонат, сукцинат, сорбат, аскорбат, малат, малеат, фумарат, тартрат, цитрат, бензоат, 3-(4-гидроксибензоил)бензоат, пикрат, циннамат, манделат, фталат, лаурат, метансульфонат (мезилат), этансульфонат, 1,2-этандисульфонат, 2-гидроксиэтансульфонат, бензолсульфонат (безилат), 4-хлорбензолсульфонат, 2-нафталинсульфонат, 4-толуолсульфонат, камфорат, камфорсульфонат, 4-метилбицикло[2.2.2]-окт-2-ен-1-карбоксилат, глюкогептонат, 3-фенилпропионат, триметилацетат, трет-бутилацетат, лаурилсульфат, глюконат, бензоат, глутамат, гидроксинафтоат, салицилат, стеарат, циклогексилсульфамат, хинат, муконат и тому подобное.
Понятно, что термин «сольват» относится к соединению, предложенному в данном тексте, или его соли, которое дополнительно содержит стехиометрическое или нестехиометрическое количество растворителя, связанного нековалентными межмолекулярными силами. Если растворителем является вода, сольват представляет собой гидрат.
Понятно, что арильная группа относится к заместителю, полученному из ароматического кольца. Арильная группа представляет собой C6-C12 арильную группу. Предпочтительно, арильная группа представляет собой фенил-, бифенил- или нафтил-.
Наиболее предпочтительно, соединение имеет формулы (Ia), (IIa), (IIIa), (IVa), (Va) или (VIa):
Формула (Ia)
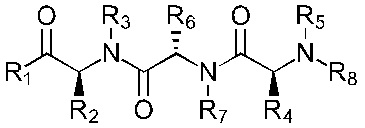
Формула (IIa)
Формула (IIIa)
Формула (IVa)
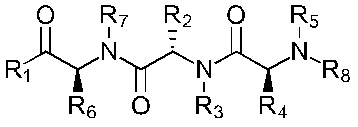
Формула (Va)
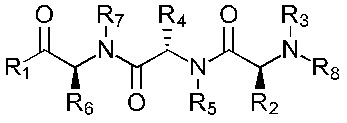
Формула (VIa)
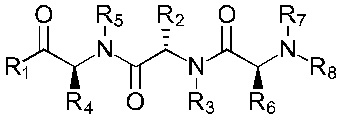
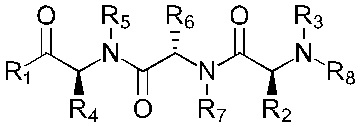
В альтернативном варианте, соединение имеет формулы (Ib), (IIb), (IIIb), (IVb), (Vb) или (VIb)
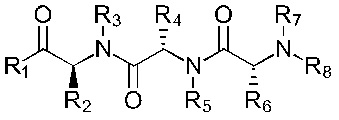
Формула (Ib)
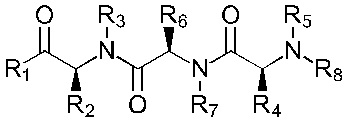
Формула (IIb)
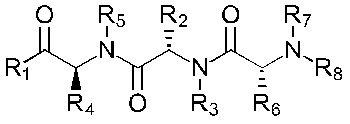
Формула (IIIb)
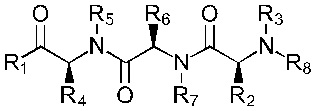
Формула (IVb)
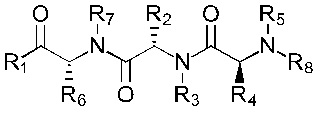
Формула (Vb)
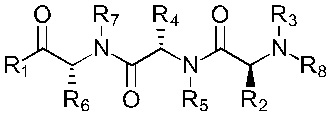
Формула (VIb)
R1 представляет собой -ОН. Однако, предпочтительно, R1 представляет собой -NR9R10, предпочтительнее, R1 представляет собой -NR9H и наиболее предпочтительно R1 представляет собой -NH2.
Предпочтительно, в вариантах реализации изобретения, в которых R2 представляет собой



Предпочтительно, в вариантах реализации изобретения, в которых R2 представляет собой





Предпочтительно, R2 представляет собой






Наиболее предпочтительно, R2 представляет собой



Понятно, что в вариантах реализации изобретения, в которых R2 представляет собой

В предпочтительном варианте реализации изобретения R2 представляет собой

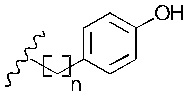


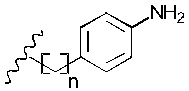
Предпочтительно, в вариантах реализации изобретения, в которых R2 представляет собой

Предпочтительно, в вариантах реализации изобретения, в которых R2 представляет собой

В предпочтительном варианте реализации изобретения R2 представляет собой

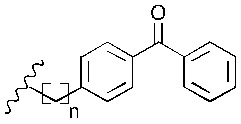

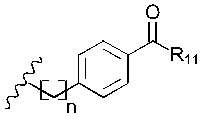
В наиболее предпочтительном варианте реализации изобретения R2 представляет собой

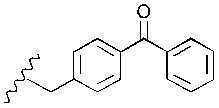
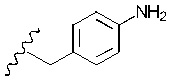
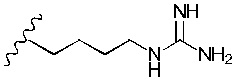
Понятно, что R3 представляет собой метильную, этильную, пропильную, бутильную или пентильную группу. Предпочтительно, R3 представляет собой метил-. Однако в более предпочтительном варианте реализации изобретения R3 представляет собой -H.
В вариантах реализации изобретения, в которых R4 представляет собой

В вариантах реализации изобретения, в которых R4 представляет собой





В одном варианте реализации изобретения R4 предпочтительно представляет собой






Предпочтительнее R4 представляет собой



Понятно, что в вариантах реализации изобретения, в которых R4 представляет собой

Предпочтительно, R4 представляет собой




Предпочтительнее, R4 представляет собой



Предпочтительно в вариантах реализации изобретения, в которых R4 представляет собой

Соответственно, R4 предпочтительно представляет собой



Предпочтительнее R4 представляет собой


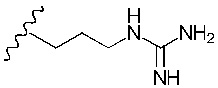
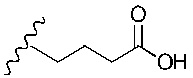
Понятно, что R5 представляет собой метильную, этильную, пропильную, бутильную или пентильную группу. Предпочтительно, R5 представляет собой метил-. Однако в более предпочтительном варианте реализации изобретения R5 представляет собой -H.
В альтернативном варианте реализации изобретения R4 и R5 вместе с азотом и углеродом, с которыми они связаны, образуют пятичленное кольцо, замещенное -OH или -NH2. Соответственно, R4 и R5 вместе с азотом и углеродом, с которыми они связаны, образуют следующую структуру:
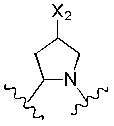
где X2 представляет собой -OH или -NH2.
Предпочтительно, R4 и R5 вместе с азотом и углеродом, с которыми они связаны, образуют следующую структуру:
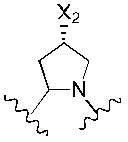
Предпочтительно, R4 и R5 вместе с азотом и углеродом, с которыми они связаны, образуют следующую структуру:
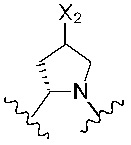
Предпочтительнее R4 и R5 вместе с азотом и углеродом, с которыми они связаны, образуют следующую структуру:
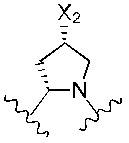
Предпочтительно, X2 представляет собой -NH2.
Еще предпочтительнее, R4 и R5 вместе с азотом и углеродом, с которыми они связаны, образуют следующую структуру:
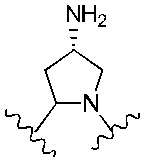
Еще предпочтительнее, R4 и R5 вместе с азотом и углеродом, с которыми они связаны, образуют следующую структуру:
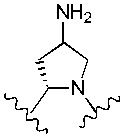
Наиболее предпочтительно R4 и R5 вместе с азотом и углеродом, с которыми они связаны, образуют следующую структуру:
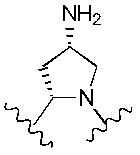
В вариантах реализации изобретения, в которых R6 представляет собой




В вариантах реализации изобретения, в которых R6 представляет собой





Предпочтительно, R6 представляет собой





Предпочтительнее, R6 представляет собой



Понятно, что в вариантах реализации изобретения, в которых R6 представляет собой

В предпочтительном варианте реализации изобретения R6 представляет собой
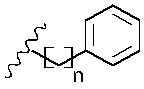




Предпочтительно, в вариантах реализации изобретения, в которых R6 представляет собой

Предпочтительно в вариантах реализации изобретения, в которых R6 представляет собой

В предпочтительном варианте реализации изобретения R6 представляет собой



В наиболее предпочтительном варианте реализации изобретения R6 представляет собой

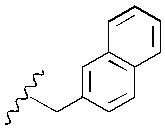

Понятно, что R7 представляет собой метильную, этильную, пропильную, бутильную или пентильную группу. Предпочтительно, R7 представляет собой метил-. Однако в более предпочтительном варианте реализации изобретения R7 представляет собой -H.
В одном предпочтительном варианте реализации изобретения R8 представляет собой -H. Однако в более предпочтительном варианте реализации изобретения R8 представляет собой

В предпочтительном варианте реализации изобретения предложено соединение формулы (I), (II), (III), (IV), (V) или (VI), где:
R2 представляет собой




R3 представляет собой Н или С1-5линейный или разветвленный алки- или алкенил-;
R4 представляет собой



R5 представляет собой Н или С1-5линейный или разветвленный алкил- или алкенил-; или
R4 и R5 вместе с азотом и углеродом, с которыми они связаны, образуют следующую структуру:
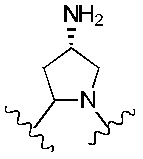
R6 представляет собой



R7 представляет собой Н или С1-5 линейный или разветвленный алкил- или алкенил-.
Предпочтительно, R3 представляет собой H и R7 представляет собой H.
В некоторых вариантах реализации изобретения R3 представляет собой H, R4 и R5 вместе с азотом и углеродом, с которыми они связаны, образуют следующую структуру:

и R7 представляет собой H.
В некоторых альтернативных вариантах реализации изобретения R3 представляет собой H, R5 представляет собой H и R7 представляет собой H.
В более предпочтительном варианте реализации изобретения предложено соединение формулы (I), (II), (III), (IV), (V) или (VI), где:
R2 представляет собой

R3 представляет собой Н или С1-5 линейный или разветвленный алкил- или алкенил-;
R4 представляет собой

R5 представляет собой Н или С1-5 линейный или разветвленный алкил- или алкенил-; или
R6 представляет собой

R7 представляет собой Н или С1-5 линейный или разветвленный алкил- или алкенил-.
Предпочтительно, соединение представляет собой соединение формулы (Ia), (IIa), (IIIa), (IVa), (Va) или (VIa).
Предпочтительно, соединение представляет собой соединение формулы (I) и предпочтительнее соединение формулы (Ia).
Предпочтительно, R3 представляет собой H, R5 представляет собой H и R7 представляет собой H.
В альтернативном более предпочтительном варианте реализации изобретения предложено соединение формулы (I), (II), (III), (IV), (V) или (VI), где:
R2 представляет собой

R3 представляет собой Н или С1-5 линейный или разветвленный алкил- или алкенил-;
R4 и R5 вместе с азотом и углеродом, с которыми они связаны, образуют следующую структуру:

R6 представляет собой

R7 представляет собой Н или С1-5 линейный или разветвленный алкил- или алкенил-.
Предпочтительно, соединение представляет собой соединение формулы (Ia), (IIa), (IIIa), (IVa), (Va) или (VIa).
Предпочтительно, соединение представляет собой соединение формулы (I) и предпочтительнее соединение формулы (Ia).
Предпочтительно, R3 представляет собой H и R7 представляет собой H.
В альтернативном более предпочтительном варианте реализации изобретения предложено соединение формулы (I), (II), (III), (IV), (V) или (VI), где:
R2 представляет собой

R3 представляет собой Н или С1-5 линейный или разветвленный алкил- или алкенил-;
R4 представляет собой

R5 представляет собой Н или С1-5 линейный или разветвленный алкил- или алкенил-; или
R6 представляет собой

R7 представляет собой Н или С1-5 линейный или разветвленный алки- или алкенил-.
Предпочтительно, соединение представляет собой соединение формулы (Ia), (IIa), (IIIa), (IVa), (Va) или (VIa).
Предпочтительно, соединение представляет собой соединение формулы (I) и предпочтительнее соединение формулы (Ia).
Предпочтительно, R3 представляет собой H, R5 представляет собой H и R7 представляет собой H.
В дополнительном более предпочтительном варианте реализации изобретения предложено соединение формулы (I), (II), (III), (IV), (V) или (VI), где:
R2 представляет собой

R3 представляет собой Н или С1-5 линейный или разветвленный алкил- или алкенил-;
R4 представляет собой

R5 представляет собой Н или С1-5 линейный или разветвленный алкил- или алкенил-; или
R6 представляет собой

R7 представляет собой Н или С1-5 линейный или разветвленный алкил- или алкенил-.
Предпочтительно, соединение представляет собой соединение формулы (Ib), (IIb), (IIIb), (IVb), (Vb) или (VIb).
Предпочтительно, соединение представляет собой соединение формулы (I) и предпочтительнее соединение формулы (Ib).
Предпочтительно, R3 представляет собой H, R5 представляет собой H и R7 представляет собой H.
В дополнительном более предпочтительном варианте реализации изобретения предложено соединение формулы (I), (II), (III), (IV), (V) или (VI), где:
R2 представляет собой

R3 представляет собой Н или С1-5 линейный или разветвленный алкил- или алкенил-;
R4 представляет собой

R5 представляет собой Н или С1-5 линейный или разветвленный алкил- или алкенил-; или
R6 представляет собой

R7 представляет собой Н или С1-5 линейный или разветвленный алкил- или алкенил-.
Предпочтительно, соединение представляет собой соединение формулы (Ia), (IIa), (IIIa), (IVa), (Va) или (VIa).
Предпочтительно, соединение представляет собой соединение формулы (I) и предпочтительнее соединение формулы (Ia).
Предпочтительно, R3 представляет собой H, R5 представляет собой H и R7 представляет собой H.
Предпочтительно, R1 представляет собой -ОН и R8 представляет собой Н.Предпочтительнее R1 представляет собой NH2 и R8 представляет собой

В еще более предпочтительном варианте реализации изобретения предложено соединение формулы (I), (II), (III), (IV), (V) или (VI), где:
R2 представляет собой




R3 представляет собой Н или С1-5 линейный или разветвленный алкил- или алкенил-;
R4 представляет собой




R5 представляет собой Н или С1-5 линейный или разветвленный алкил- или алкенил-; или
R4 и R5 вместе с азотом и углеродом, с которыми они связаны, образуют следующую структуру:
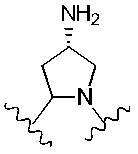
R6 представляет собой



R7 представляет собой Н или С1-5 линейный или разветвленный алкил- или алкенил-.
Предпочтительно, R3 представляет собой H и R7 представляет собой H.
В некоторых вариантах реализации изобретения R3 представляет собой H, R4 и R5 вместе с азотом и углеродом, с которыми они связаны, образуют следующую структуру:

и R7 представляет собой H.
В некоторых альтернативных вариантах реализации изобретения R3 представляет собой H, R5 представляет собой H и R7 представляет собой H.
В более предпочтительном варианте реализации изобретения предложено соединение формулы (I), (II), (III), (IV), (V) или (VI), где:
R2 представляет собой

R3 представляет собой Н;
R4 представляет собой

R5 представляет собой Н; или
R6 представляет собой

R7 представляет собой Н.
Предпочтительно, соединение представляет собой соединение формулы (Ia), (IIa), (IIIa), (IVa), (Va) или (VIa).
Предпочтительно, соединение представляет собой соединение формулы (I) и предпочтительнее соединение формулы (Ia).
Предпочтительно, R3 представляет собой H, R5 представляет собой H и R7 представляет собой H.
В альтернативном более предпочтительном варианте реализации изобретения предложено соединение формулы (I), (II), (III), (IV), (V) или (VI), где:
R2 представляет собой

R3 представляет собой Н;
R4 и R5 вместе с азотом и углеродом, с которыми они связаны, образуют следующую структуру:

R6 представляет собой

R7 представляет собой Н.
Предпочтительно, соединение представляет собой соединение формулы (Ia), (IIa), (IIIa), (IVa), (Va) или (VIa).
Предпочтительно, соединение представляет собой соединение формулы (I) и предпочтительнее соединение формулы (Ia).
Предпочтительно, R3 представляет собой H и R7 представляет собой H.
В альтернативном более предпочтительном варианте реализации изобретения предложено соединение формулы (I), (II), (III), (IV), (V) или (VI), где:
R2 представляет собой

R3 представляет собой Н;
R4 представляет собой

R5 представляет собой Н; или
R6 представляет собой

R7 представляет собой Н.
Предпочтительно, соединение представляет собой соединение формулы (Ia), (IIa), (IIIa), (IVa), (Va) или (VIa).
Предпочтительно, соединение представляет собой соединение формулы (I) и предпочтительнее соединение формулы (Ia).
Предпочтительно, R3 представляет собой H, R5 представляет собой H и R7 представляет собой H.
В дополнительном более предпочтительном варианте реализации изобретения предложено соединение формулы (I), (II), (III), (IV), (V) или (VI), где:
R2 представляет собой

R3 представляет собой Н;
R4 представляет собой

R5 представляет собой Н; или
R6 представляет собой

R7 представляет собой Н.
Предпочтительно, соединение представляет собой соединение формулы (Ib), (IIb), (IIIb), (IVb), (Vb) или (VIb).
Предпочтительно, соединение представляет собой соединение формулы (I) и предпочтительнее соединение формулы (Ib).
Предпочтительно, R3 представляет собой H, R5 представляет собой H и R7 представляет собой H.
В дополнительном более предпочтительном варианте реализации изобретения предложено соединение формулы (I), (II), (III), (IV), (V) или (VI), где:
R2 представляет собой

R3 представляет собой Н;
R4 представляет собой

R5 представляет собой Н; или
R6 представляет собой

R7 представляет собой Н.
Предпочтительно, соединение представляет собой соединение формулы (Ia), (IIa), (IIIa), (IVa), (Va) или (VIa).
Предпочтительно, соединение представляет собой соединение формулы (I) и предпочтительнее соединение формулы (Ia).
Предпочтительно, R3 представляет собой H, R5 представляет собой H и R7 представляет собой H.
Предпочтительно, R1 представляет собой -ОН и R8 представляет собой Н. Предпочтительнее, R1 представляет собой NH2 и R8 представляет собой

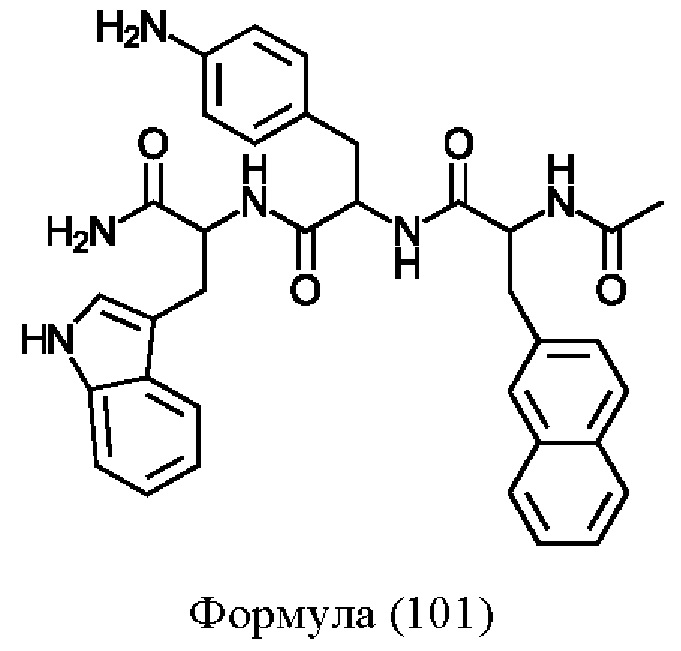
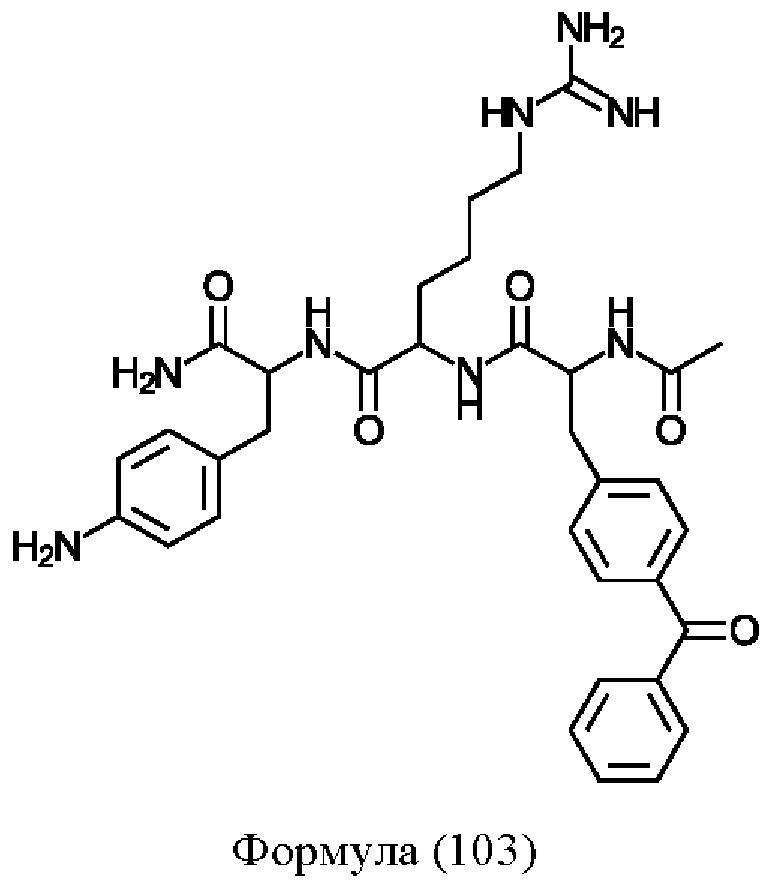
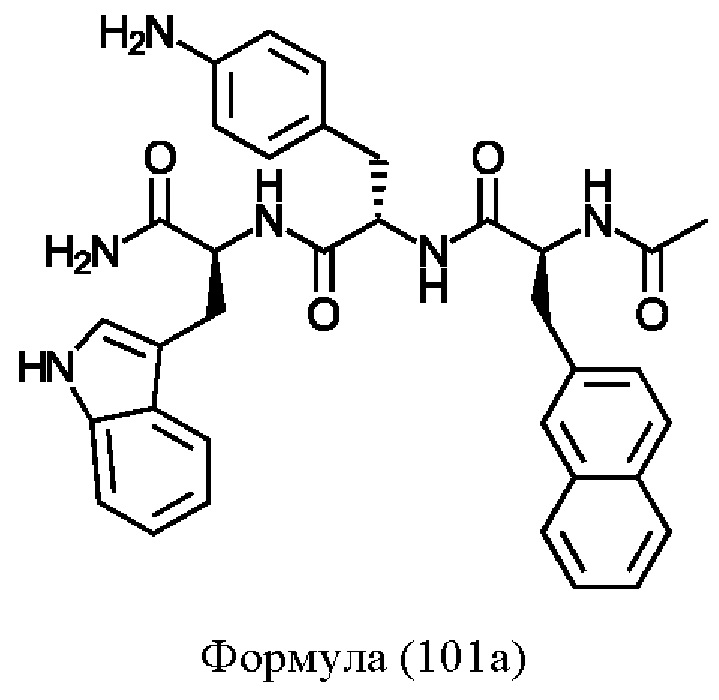
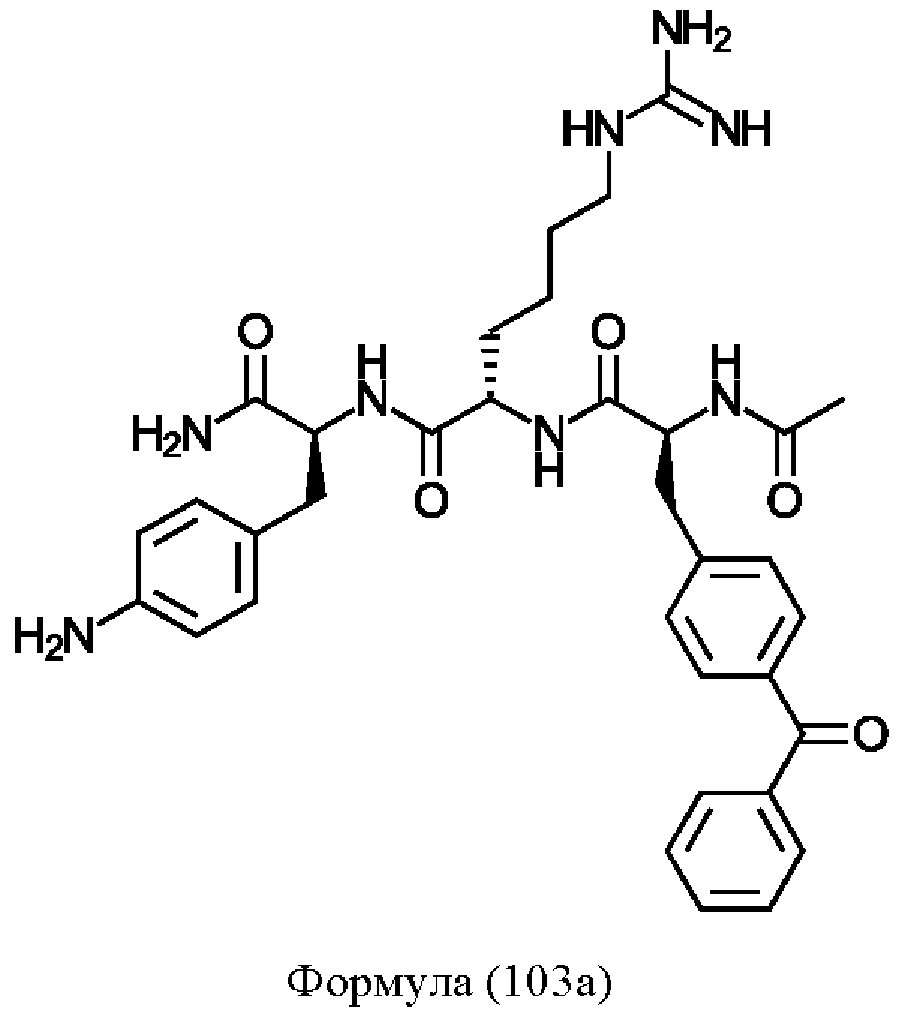
Предпочтительно, соединение представляет собой соединение формулы (101), (102), (103), (104) или (105):
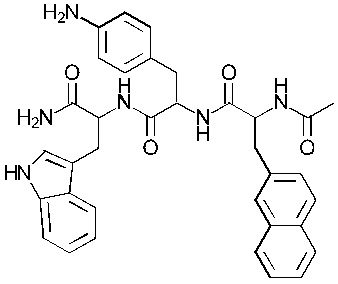
Формула (101)
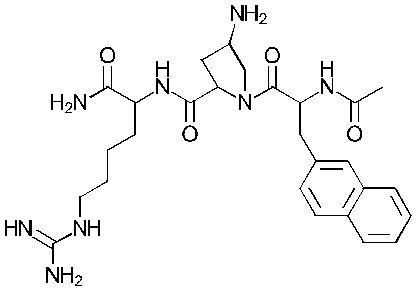
Формула (102)
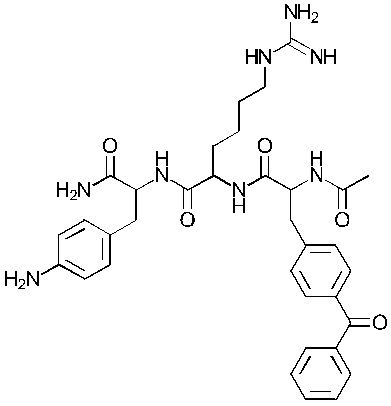
Формула (103)
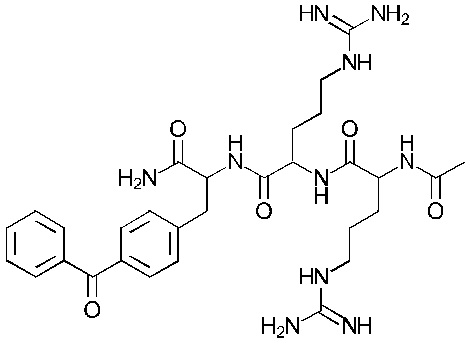
Формула (104)

Формула (105)
Предпочтительнее, соединение представляет собой соединение формулы (101a), (102a), (103a), (104b) или (105a):
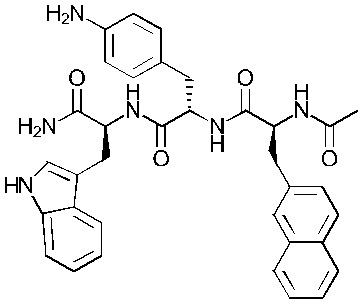
Формула (101а)
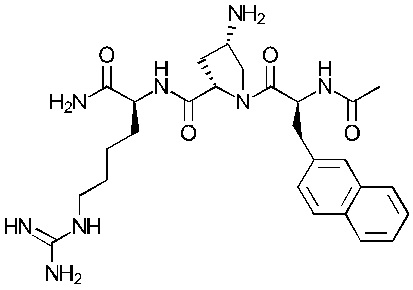
Формула (102а)
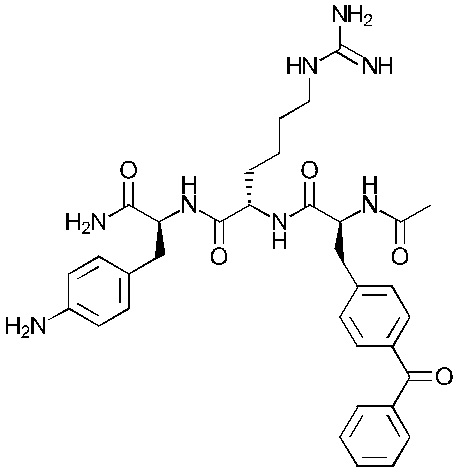
Формула (103а)
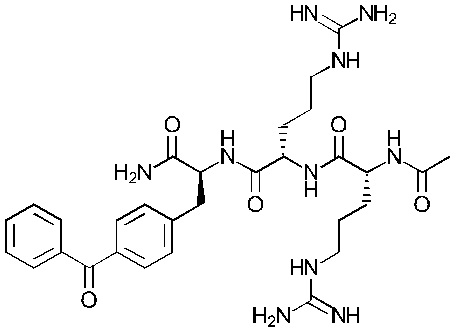
Формула (104b)
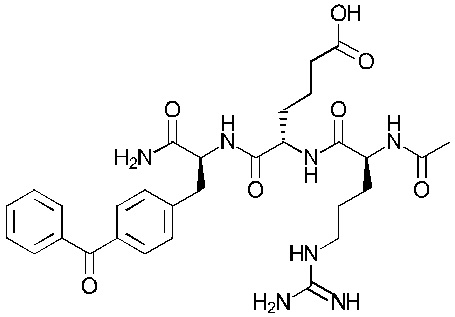
Формула (105а)
Понятно, что соединения формулы (101a), (102a), (103a), (104b) и (105a) соответствуют соединениям Tri02-06, соответственно, которые обсуждаются в примерах.
Считается, что соединения являются по сути новыми.
Соответственно, в соответствии с четвертым аспектом предложено соединение формулы (I), (II), (III), (IV), (V) или (V), где:
R1 представляет собой -NR9R10 или -OH;
R2 представляет собой

R3 представляет собой Н или С1-5 линейный или разветвленный алкил- или алкенил-;
R4 представляет собой

R5 представляет собой Н или С1-5 линейный или разветвленный алкил- или алкенил-;
R6 представляет собой

R7 представляет собой Н или С1-5 линейный или разветвленный алкил- или алкенил-;
R8 представляет собой -Н, С1-5 линейный или разветвленный алкил- или алкенил-, или

R9 и R10, независимо, представляют собой -Н или С1-5 линейный или разветвленный алкил- или алкенил-; и
каждый n, независимо, составляет от 0 до 10;
или его фармацевтически приемлемая соль, сольват, таутомерная форма или полиморфная форма.
В соответствии с пятым аспектом предложено соединение формулы (I), (II), (III), (IV), (V) или (VI), где:
R1 представляет собой -NR9R10 или -OH;
R2 представляет собой

R3 представляет собой Н или С1-5 линейный или разветвленный алкил- или алкенил-;
R4 и R5 вместе с азотом и углеродом, с которыми они связаны, образуют следующую структуру:

R6 представляет собой

R7 представляет собой Н или С1-5 линейный или разветвленный алкил- или алкенил-;
R8 представляет собой -Н, С1-5 линейный или разветвленный алкил- или алкенил-, или

R9 и R10, независимо, представляют собой -Н или С1-5 линейный или разветвленный алкил- или алкенил-; и
каждый n, независимо, составляет от 0 до 10;
или его фармацевтически приемлемая соль, сольват, таутомерная форма, или полиморфная форма.
В соответствии с шестым аспектом предложено соединение формулы (I), (II), (III), (IV), (V) или (VI), где:
R1 представляет собой -NR9R10 или -OH;
R2 представляет собой

R3 представляет собой Н или С1-5 линейный или разветвленный алкил- или алкенил-;
R4 представляет собой

R5 представляет собой Н или С1-5 линейный или разветвленный алкил- или алкенил-;
R6 представляет собой

R7 представляет собой Н или С1-5 линейный или разветвленный алкил- или алкенил-;
R8 представляет собой -Н, С1-5 линейный или разветвленный алкил- или алкенил-, или

R9 и R10, независимо, представляют собой -Н или С1-5 линейный или разветвленный алкил- или алкенил-; и
каждый n, независимо, составляет от 0 до 10;
или его фармацевтически приемлемая соль, сольват, таутомерная форма или полиморфная форма.
В соответствии с седьмым аспектом предложено соединение формулы (I), (II), (III), (IV), (V) или (VI), где:
R1 представляет собой -NR9R10 или -OH;
R2 представляет собой

R3 представляет собой Н или С1-5 линейный или разветвленный алкил- или алкенил-;
R4 представляет собой

R5 представляет собой Н или С1-5 линейный или разветвленный алкил- или алкенил-;
R6 представляет собой

R7 представляет собой Н или С1-5 линейный или разветвленный алкил- или алкенил-;
R8 представляет собой -Н, С1-5 линейный или разветвленный алкил- или алкенил- или

R9 и R10, независимо, представляют собой -Н или С1-5 линейный или разветвленный алкил- или алкенил-; и
каждый n, независимо, составляет от 0 до 10;
или его фармацевтически приемлемая соль, сольват, таутомерная форма или полиморфная форма.
В соответствии с восьмым аспектом предложено соединение формулы (I), (II), (III), (IV), (V) или (VI), где:
R1 представляет собой -NR9R10 или -OH;
R2 представляет собой

R3 представляет собой Н или С1-5 линейный или разветвленный алкил- или алкенил-;
R4 представляет собой

R5 представляет собой Н или С1-5 линейный или разветвленный алкил- или алкенил-;
R6 представляет собой

R7 представляет собой Н или С1-5 линейный или разветвленный алкил- или алкенил-;
R8 представляет собой -Н, С1-5 линейный или разветвленный алкил- или алкенил-, или

R9 и R10, независимо, представляют собой -Н или С1-5 линейный или разветвленный алкил- или алкенил-; и
каждый n, независимо, составляет от 0 до 10;
или его фармацевтически приемлемая соль, сольват, таутомерная форма или полиморфная форма.
Следует понимать, что любое из определений R-групп и формул соединений четвертого, пятого, шестого, седьмого и восьмого аспектов может быть дополнительно ограничено, как описано выше в отношении первого, второго и третьего аспектов.
В дополнительном аспекте предложены соединения по четвертому, пятому, шестому, седьмому и восьмому аспектам для применения в терапии.
В еще одном дополнительном аспекте предложено соединения по четвертому, пятому, шестому, седьмому и восьмому аспектам для применения при лечении, улучшении или профилактике нейродегенеративного заболевания.
Понятно, что соединения по изобретению применяют в лекарственном средстве, которое можно применять в монотерапии (т.е. применение соединения, определенного в первом аспекте), для лечения, улучшения или профилактики нейродегенеративного заболевания, а именно болезни Альцгеймера. В альтернативном варианте, соединения по изобретению применяют в качестве вспомогательного средства или в комбинации с известными видами терапии для лечения, улучшения или профилактики болезни Альцгеймера, а именно ингибиторы ацетилхолинэстеразы.
Соединения по изобретению составляют в композициях, имеющихряд различных форм, в частности, в зависимости от способа применения композиции. Так, например, композиция находится в форме порошка, таблетки, капсулы, жидкости, мази, крема, геля, гидрогеля, аэрозоля, спрея, мицеллярного раствора, трансдермального пластыря, липосомальной суспензии или любой другой подходящей формы, которую вводят человеку или животному, нуждающемуся в лечении. Понятно, что наполнитель лекарственных средств по изобретению должен быть хорошо переносимым субъектом, которому они назначаются, и, предпочтительно, обеспечивать доставку пептида через гематоэнцефалический барьер.
Понятно, что эффективность любого лечения заболеваний головного мозга зависит от способности потенциальных терапевтических соединений преодолевать гематоэнцефалический барьер (ГЭБ). Однако хорошо известно, что во время болезни Альцгеймера проницаемость гематоэнцефалического барьера увеличивается, что позволяет соединениям по изобретению достигать центральной нервной системы, в действительности, в идеале, только в тех местах дегенерации, где это необходимо, т.е. где ГЭБ нарушен.
Для преодоления ГЭБ пептидами по изобретению применяются две основные стратегии, включая: (1) применение наночастиц в качестве транспортеров для специфического нацеливания на мозг и доставки активного соединения. Этот метод успешно используется для доставки пептидов, белков и противораковых лекарственных средств в мозг; и (2) применение пептидов-переносчиков. Добавление такого пептида, который определенным образом преодолевает ГЭБ, позволяет переносить соединения по изобретению облегченным образом.
Лекарственные средства, содержащие соединения по изобретению, применяют рядом способов. Например, может потребоваться пероральное введение, в случае которого соединение находится в композиции, которую, например, принимают перорально в форме таблетки, капсулы или жидкости. Альтернативным вариантом введения соединений является применение назального спрея, поскольку введение пептида назальным спреем позволяет достичь мозга быстрее и эффективнее, чем пероральный или внутривенный способ введения (см. http://memoryzine.com/2010/07/26/nose-sprays-cross-blood-brain-barrier-faster-and-safer/). Следовательно, композиции, содержащие соединения по изобретению, можно вводить путем ингаляции (например, интраназально). Композиции также составляют для местного применения. Например, кремы или мази наносят на кожу, например, рядом с мозгом.
Соединения по изобретению также вводят в устройство с медленным или замедленным высвобождением. Такие устройства вживляют, например, в кожу или под кожу, и лекарственное средство высвобождается в течение недель или даже месяцев. Устройство расположено по меньшей мере рядом с местом, которое лечат, например, головой. Такие устройства являются особенно предпочтительными, когда требуется длительное лечение соединениями, применяемыми по изобретению, и которые обычно требуют частого введения (например, по меньшей мере ежедневного введения).
В предпочтительном варианте реализации изобретения лекарственные средства по изобретению вводят субъекту путем инъекции в кровоток или непосредственно в область, требующую лечения. Например, лекарственное средство вводят по меньшей мере рядом с мозгом. Инъекции являются внутривенными (болюс или вливание) или подкожными (болюс или вливание), или внутрикожными (болюс или вливание).
Понятно, что количество требуемого соединения определяется его биологической активностью и биодоступностью, что, в свою очередь, зависит от способа введения, физико-химических свойств полипептида и от того, используется ли оно в качестве монотерапии или в комбинированной терапии. Частота введения также будет зависеть от периода полужизни соединения в субъекте, подвергаемом лечению. Оптимальные дозы для введения определяются специалистами в данной области и варьируются в зависимости от конкретного применяемого соединения, силы фармацевтической композиции, способа введения и прогресса нейродегенеративного заболевания. Дополнительные факторы, зависящие от конкретного субъекта, подвергаемого лечению, обуславливают необходимость корректировки доз, включая возраст субъекта, вес, пол, питание и время введения.
Как правило, для лечения, улучшения или профилактики нейродегенеративного заболевания, применяется суточная доза от 0,001 мкг/кг массы тела до 10 мг/кг массы тела соединения по изобретению в зависимости от того, какой полипептид применяется. Предпочтительнее, суточная доза составляет от 0,01 мкг/кг массы тела до 1 мг/кг массы тела и наиболее предпочтительно от около 0,1 мкг/кг до 10 мкг/кг массы тела.
Соединение можно вводить до, во время или после начала нейродегенеративного заболевания. Суточные дозы вводят в виде однократного введения (например, однократная ежедневная инъекция или ингаляция назального спрея). В альтернативном варианте, соединение требует введения два или более раз в течение дня. В качестве примера, соединения вводит в виде двух (или более, в зависимости от тяжести нейродегенеративного заболевания, подвергаемого лечению) суточных доз от 0,07 мкг до 700 мг (т.е. при условии, что масса тела составляет 70 кг). Пациент, получающий лечение, принимает первую дозу после пробуждения, а затем вторую дозу вечером (при двухдозовом режиме) или через каждые 3 или 4 часа. В альтернативном варианте, для обеспечения оптимальных доз соединения по изобретению для пациента без необходимости введения повторных доз применяют устройство с медленным высвобождением.
Для составления конкретных составов соединения по изобретению и точных схем лечения (а именно ежедневных доз средств и частоты введения) применяют известные процедуры, а именно те, которые традиционно применяют в фармацевтической промышленности (например, проведение опыта in vivo, клинические испытания и т.п.). Авторы изобретения полагают, что они первыми предложили состав против нейродегенеративного заболевания, основанный на применении соединений по изобретению.
Следовательно, в девятом аспекте изобретения предложена фармацевтическая композиция, содержащая соединение по первому аспекту, или его фармацевтически приемлемую соль, сольват, таутомерную форму или полиморфную форму, и фармацевтически приемлемый наполнитель.
Фармацевтическая композиция предпочтительно представляет собой композицию против нейродегенеративного заболевания, т.е., фармацевтическую композицию, применяемую для терапевтического улучшения, предотвращения или лечения нейродегенеративного заболевания у субъекта, а именно болезни Альцгеймера.
Изобретение также предлагает, в десятом аспекте, способ получения фармацевтической композиции по девятому аспекту, включающий контактирование терапевтически эффективного количества соединения по первому аспекту или его фармацевтически приемлемой соли, сольвата, таутомерной формы или полиморфной формыи фармацевтически приемлемого наполнителя.
Предпочтительно, соединение представляет собой соединение формулы (101), (102), (103), (104) или (105).
Предпочтительнее, соединение представляет собой соединение формулы (101a), (102a), (103a), (104b) или (105a).
«Субъект» представляет собой позвоночное, млекопитающее или домашнее животное. Следовательно, лекарственные средства по изобретению применяются для лечения любого млекопитающего, например, домашнего скота (например, лошади), домашних животных, или для других ветеринарных применениях. Однако, наиболее предпочтительно, субъект представляет собой человека.
«Терапевтически эффективное количество» соединения представляет собой любое количество, которое при введении субъекту представляет собой количество активного средства, необходимого для лечения нейродегенеративного заболевания или для получения целевого эффекта.
Например, терапевтически эффективное количество применяемого соединения составляет от около 0,001 до около 800 мг и, предпочтительно, от около 0,01 до около 500 мг. Предпочтительно, чтобы количество соединения составляло от около 0,1 до около 100 мг.
«Фармацевтически приемлемый наполнитель», как упомянуто в данном тексте, представляет собой любое известное соединение или комбинацию известных соединений, которые, как известно специалистам в данной области, применяются при составлении фармацевтических композиций.
В одном варианте реализации изобретения фармацевтически приемлемый наполнитель представляет собой твердое вещество, и композиция находится в форме порошка или таблетки.Твердый фармацевтически приемлемый наполнитель содержит одно или более веществ, которые также действуют как ароматизаторы, скользящие вещества, солюбилизаторы, диспергаторы, красители, наполнители, скользящие вещества, добавки для прессования, инертные связующие, подсластители, консерванты, покровные средства или средства, улучшающие рассыпаемость. Наполнитель также представляет собой инкапсулирующий материал.В порошках наполнитель представляет собой тонкоизмельченное твердое вещество, которое находится в смеси с тонкоизмельченными активными средством по изобретению. В таблетках активное средство смешано с наполнителем, обладающим необходимыми свойствами сжимаемости, в подходящих пропорциях и спрессовано до желаемой формы и размера. Порошки и таблетки предпочтительно содержат до 99% активных средств. Подходящие твердые наполнители включают, например, фосфат кальция, стеарат магния, тальк, сахара, лактозу, декстрин, крахмал, желатин, целлюлозу, поливинилпирролидин, легкоплавкие воски и ионообменные смолы. В другом варианте реализации изобретения фармацевтический наполнитель представляет собой гель, и композиция находится в форме крема или тому подобного.
Однако, фармацевтический наполнитель может быть жидкостью, и фармацевтическая композиция находится в форме раствора. Жидкие наполнители применяют при приготовлении растворов, суспензий, эмульсий, сиропов, настоек и композиций под давлением. Активное средство по изобретению может быть растворено или суспендировано в фармацевтически приемлемом жидком наполнителе, а именно воде, органическом растворителе, смеси обоих или в фармацевтически приемлемых маслах или жирах. Жидкий наполнитель содержит другие подходящие фармацевтические добавки, а именно солюбилизаторы, эмульгаторы, буферы, консерванты, подсластители, ароматизаторы, диспергаторы, загустители, красители, регуляторы вязкости, стабилизаторы или осмо-регуляторы.Подходящие примеры жидких наполнителей для перорального и парентерального введения включают воду (частично содержащую добавки, как указано выше, например, производные целлюлозы, предпочтительно раствор карбоксиметилцеллюлозы натрия), спирты (включая одноатомные спирты и многоатомные спирты, например, гликоли) и их производные, и масла (например, фракционированное кокосовое масло и арахисовое масло).Для парентерального введения наполнитель также представляет собой жирный сложный эфир, а именно этилолеат и изопропилмиристат. Стерильные жидкие наполнители подходят для композиций в виде стерильных жидких лекарственных форм для парентерального введения. Жидкий наполнитель для композиций под давлением представляет собой галогенированный углеводород или другое фармацевтически приемлемое распыляющее средство.
Жидкие фармацевтические композиции, которые представляют собой стерильные растворы или суспензии, применяют в виде, например, внутримышечной, интратекальной, эпидуральной, внутрибрюшинной, внутривенной и особенно подкожной инъекции. Соединение получают в виде стерильной твердой композиции, которую растворяют или суспендируют во время введения, используя стерильную воду, физиологический раствор или другую подходящую стерильную инъекционную среду.
Соединение и композиции по изобретению вводят перорально в форме стерильного раствора или суспензии, содержащей другие растворенные вещества или суспендируемые средства (например, достаточное количество физиологического раствора или глюкозы, чтобы сделать раствор изотоническим), соли желчных кислот, акацию, желатин, сорбитанмонолеат, полисорбат 80 (эфиры сорбитола и олеиновой кислоты и его ангидриды, сополимеризованные с этиленоксидом) и тому подобное. Соединение, применяемое по изобретению, также вводят перорально в форме жидкой или твердой композиции.Композиции, подходящие для перорального введения, включают твердые формы, а именно пилюли, капсулы, гранулы, таблетки и порошки, и жидкие формы, а именно растворы, сиропы, настойки и суспензии. Формы, подходящие для парентерального введения, включают стерильные растворы, эмульсии и суспензии.
Все описанные в данном тексте признаки (включая любые пункты прилагаемой формулы изобретения, реферат и графические материалы) и/или все этапы любого раскрытого таким образом способа или процесса могут быть объединены с любым из вышеупомянутых аспектов в любой комбинации, за исключением комбинаций, в которых по меньшей мере некоторые такие признаки и/или этапы являются взаимоисключающими.
Для лучшего понимания изобретения и для демонстрации того, как варианты его реализации могут быть реализованы, далее следует ссылка, в качестве примера, на прилагаемые фигуры, на которых:
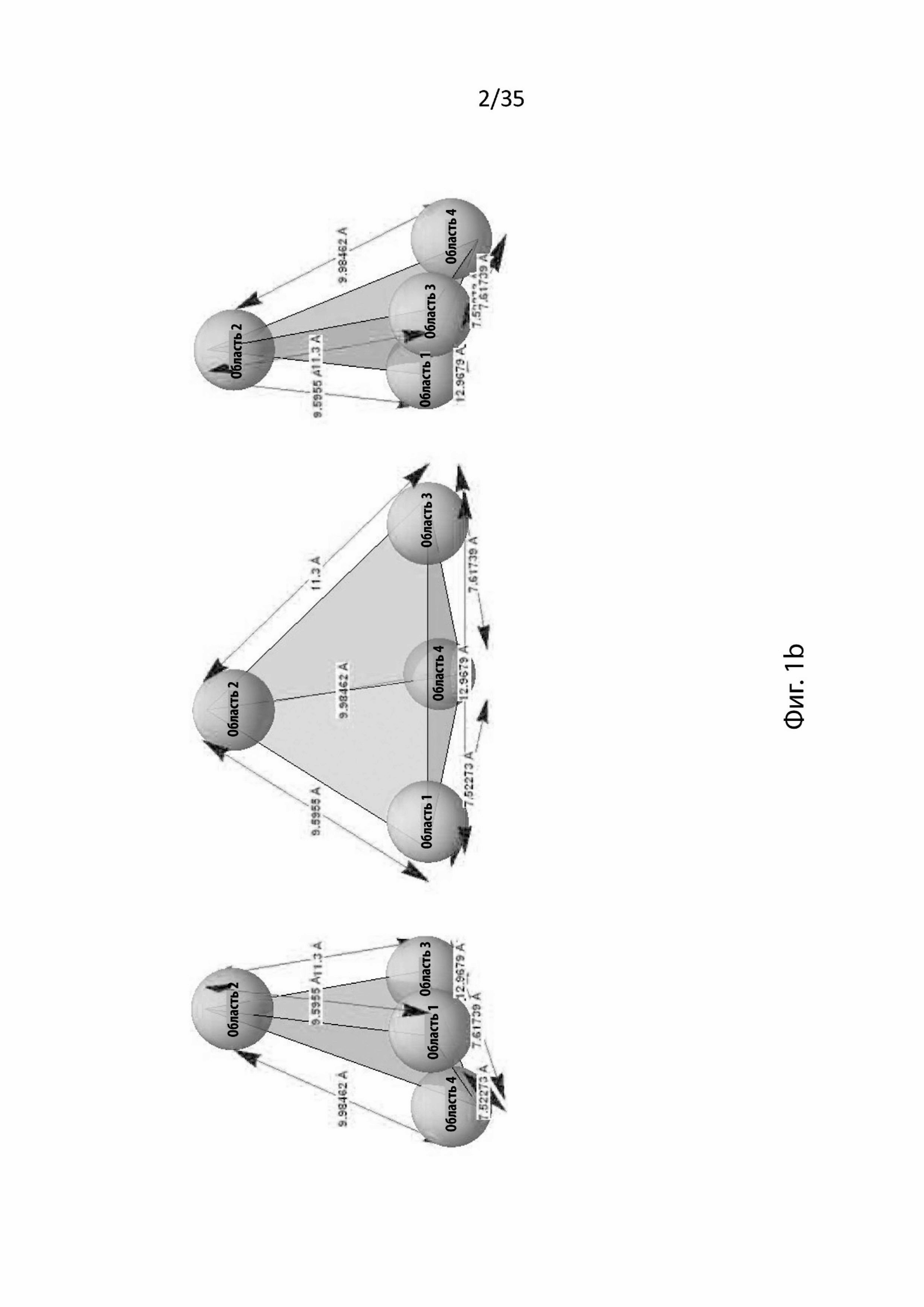
На Фиг. 1a и 1b изображены различные виды изображения четырех ключевых областей (областей 1, 2, 3 и 4) в аллостерическом связывающем кармане (т.е. активном центре) никотинового рецептора α7, который связывается с циклическим пептидом NBP 14, и соответствующие расстояния между этими четырьмя областями в зависимости от того, конкурирует ли NBP-14 с T30 (на Фиг. 1a) или амилоидом (на Фиг. 1b);
На Фиг. 2 изображена трехмерная структура связывающего кармана никотинового рецептора α7 с цветной маркировкой на основе полярности;
На Фиг. 3 изображено карандашное изображение связывающего кармана никотинового рецептора α7 с областями 1-4;
На Фиг. 4 объединены два вида, изображенные на Фиг. 2 и 3;
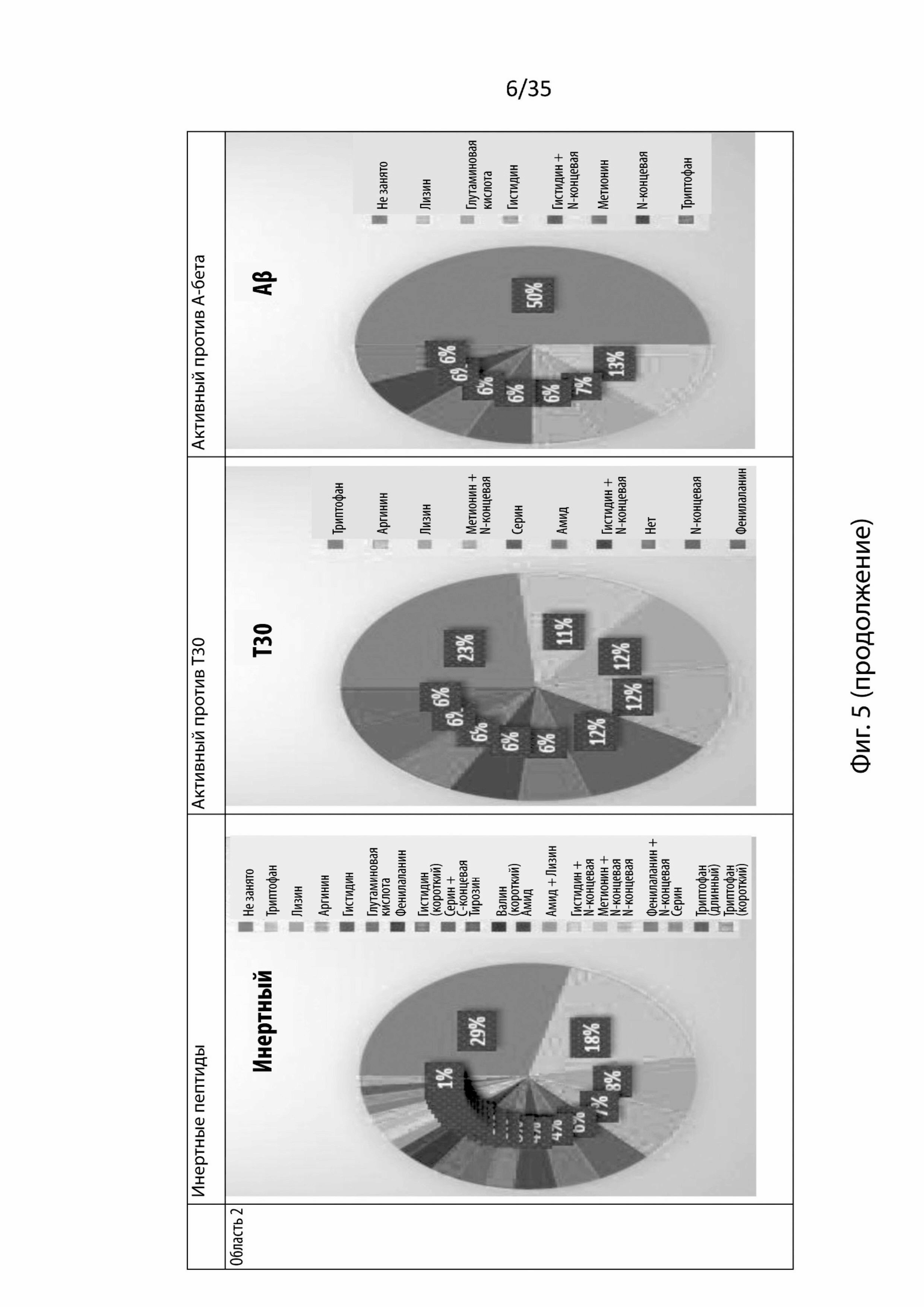
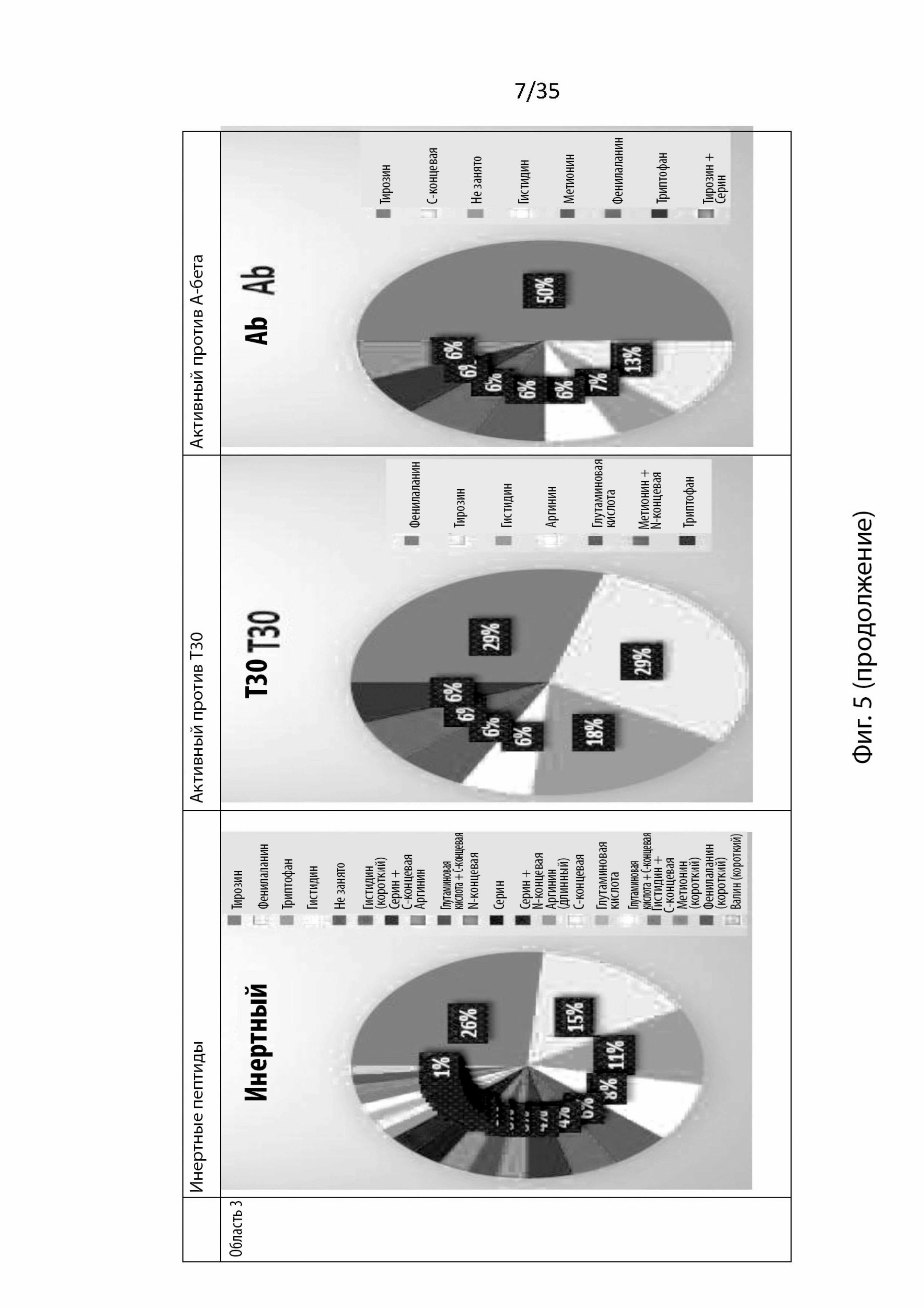
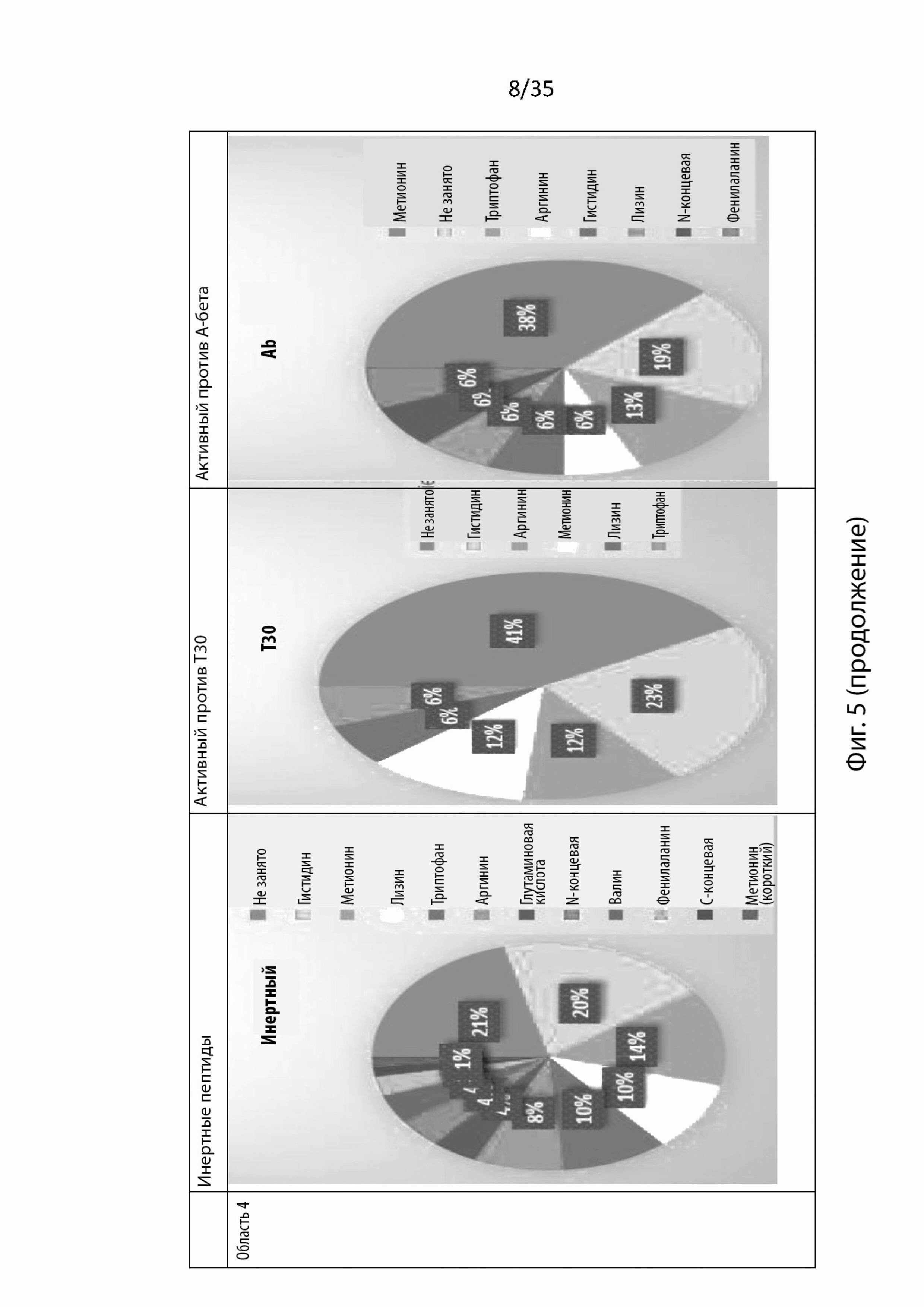
На Фиг. 5 изображены круговые диаграммы аминокислот или химических функциональных групп, участвующих в связывании в каждой области связывания (область 1, 2, 3 или 4) в никотиновом рецепторе α7, и изображено, приводит ли остаток к инертному пептиду, который активен против токсического Т30 или активен против А-бета;
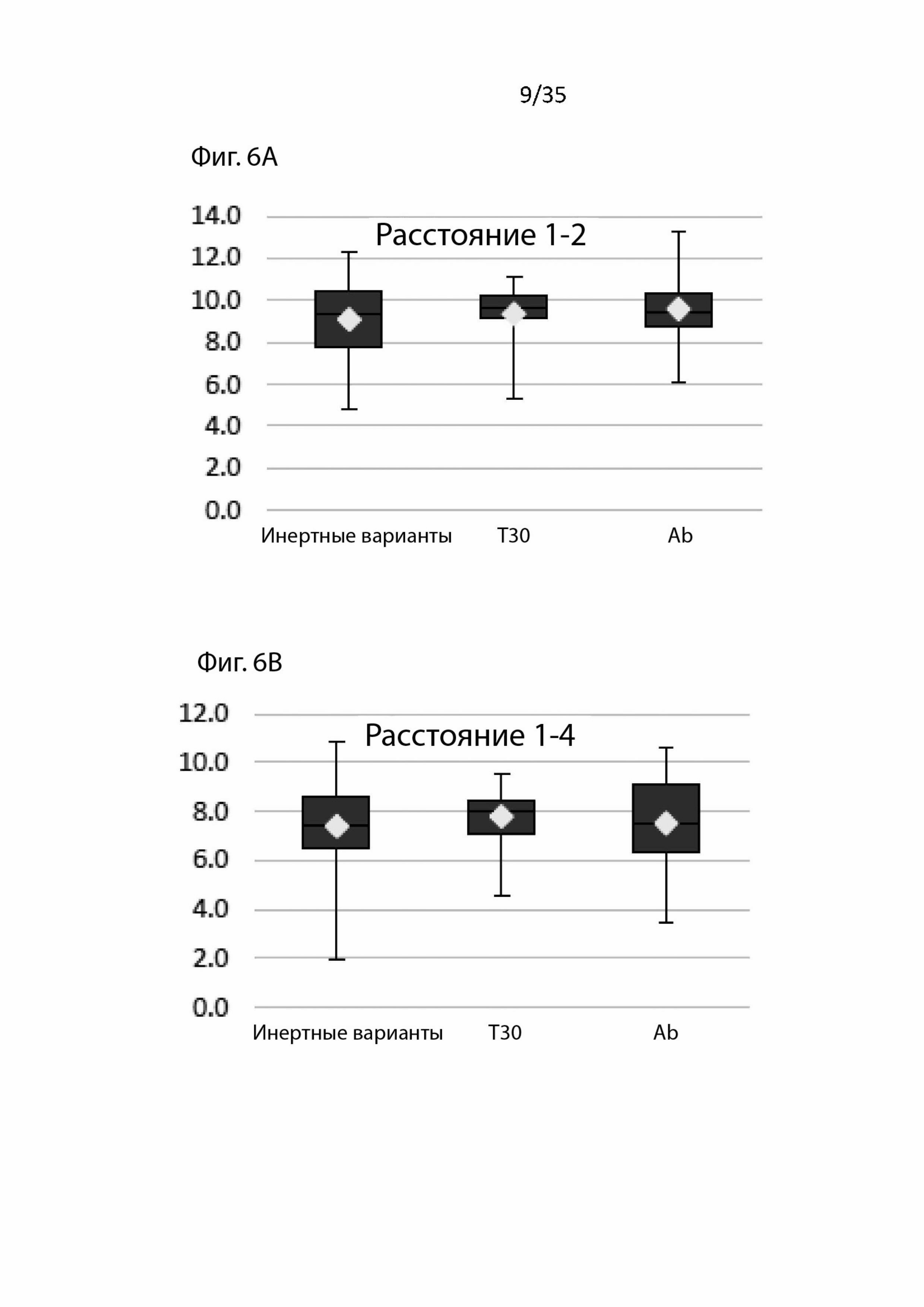
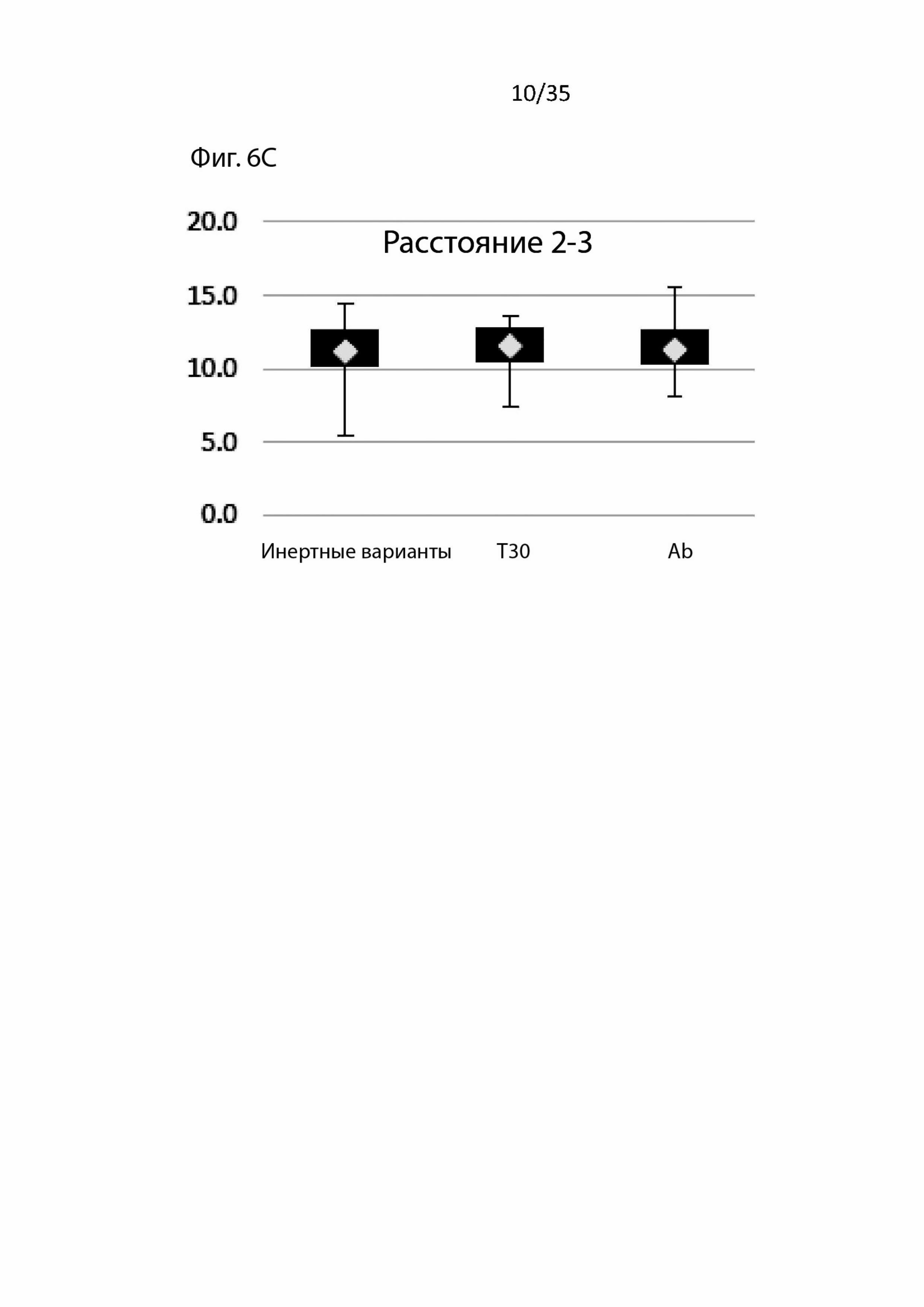
На Фиг. 6А-6F сравнивается расстояние между аминокислотами, связывающимися в разных областях (области 1-4);
На Фиг. 7 представлен перечень химических функциональных групп для связывания с каждой из областей 1, 2, 3 и 4, которые имеют особое значение для обеспечения защиты от токсичности T30;
На Фиг. 8 представлен перечень химических функциональных групп для связывания с каждой из областей 1, 2, 3 и 4, которые имеют особое значение для обеспечения защиты от продуцирования бета-амилоида;
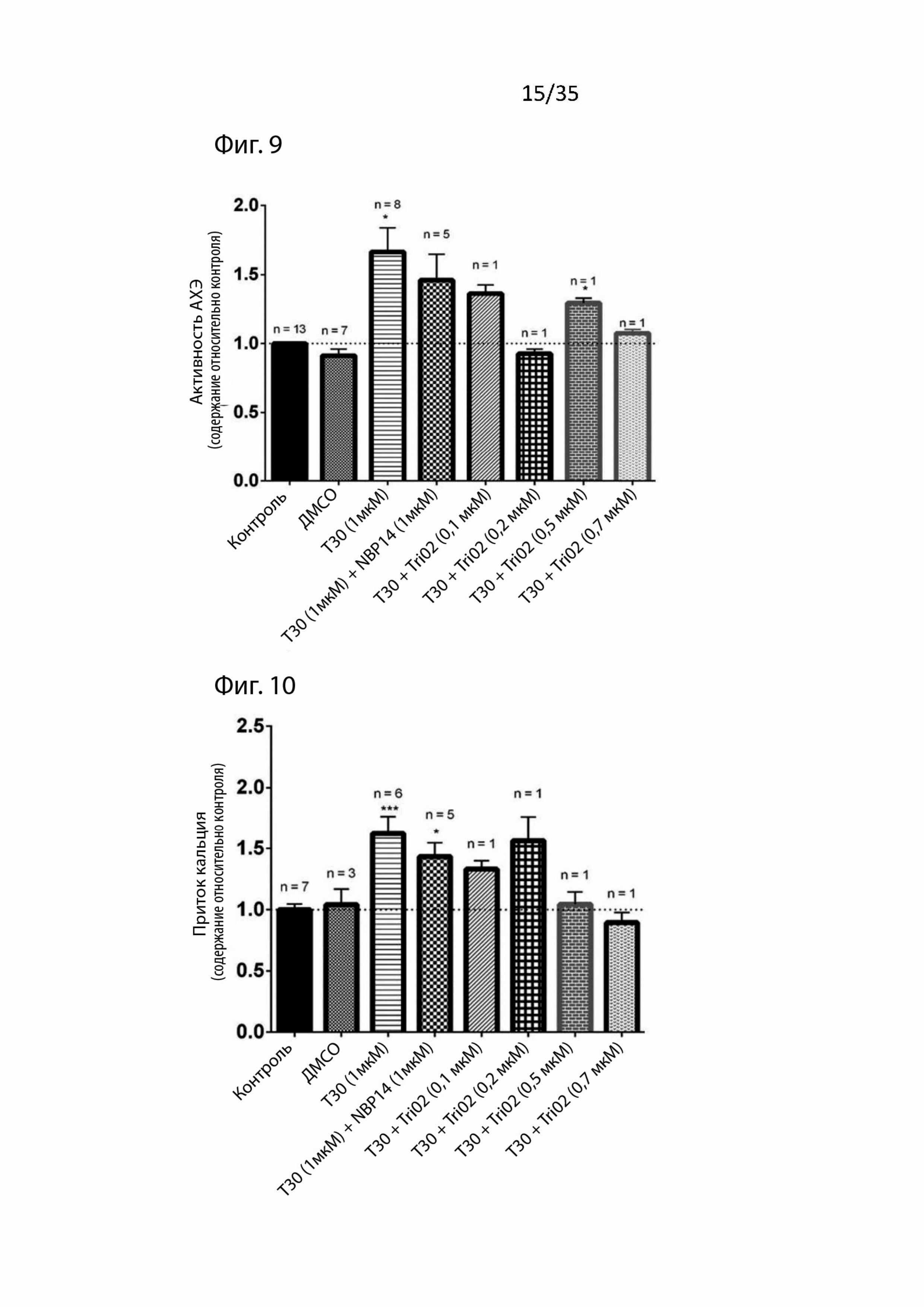
На Фиг. 9 изображены данные клеточной культуры (т.е. активность ацетилхолинэстеразы) для пептидомиметического соединения 1 (т.е. Tri02);
На Фиг. 10 изображены данные клеточной культуры (т.е. приток ионов кальция) для пептидомиметического соединения 1 (т.е. Tri02);
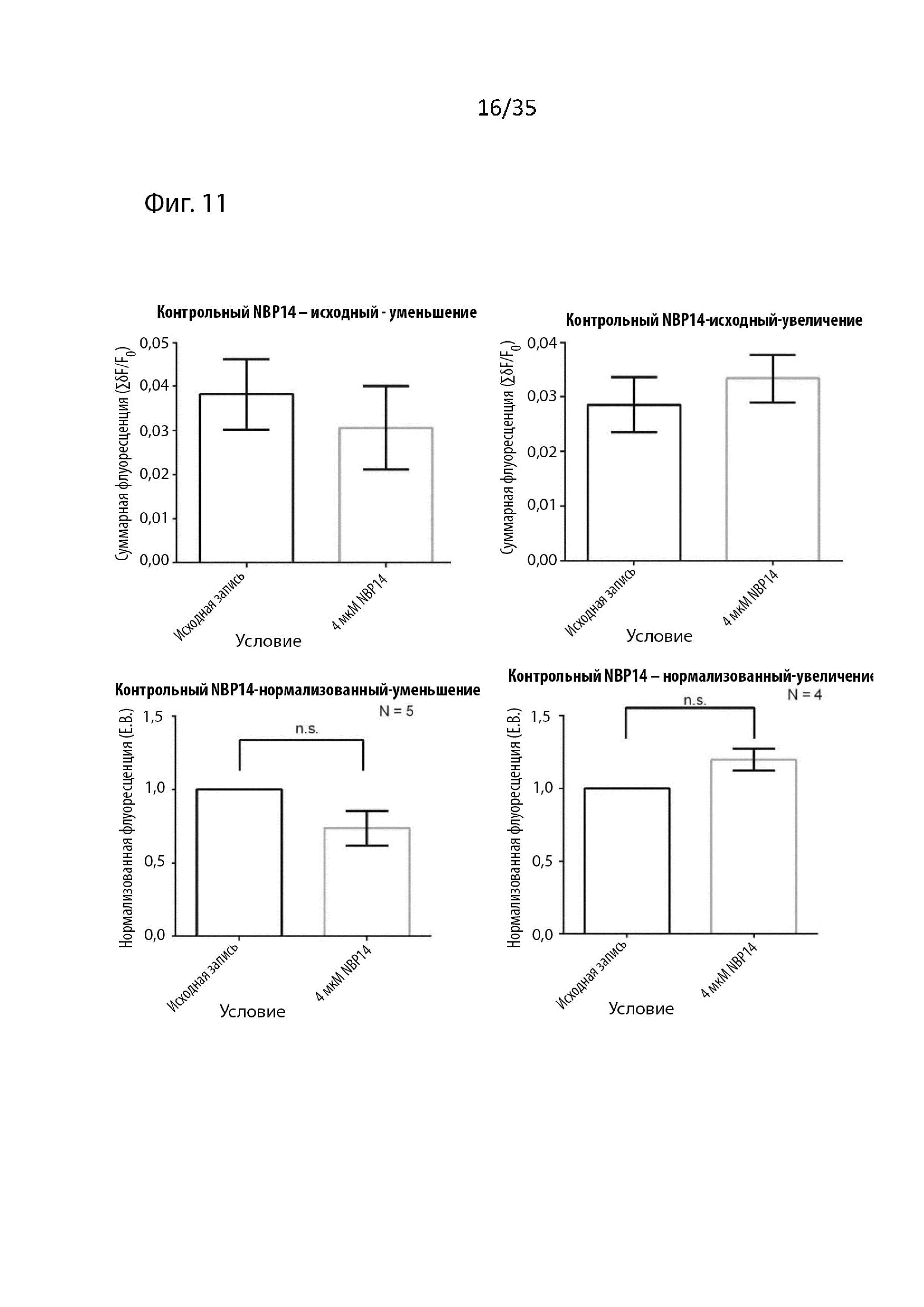
На Фиг. 11 изображены результаты визуализации срезов мозга с помощью потенциал-чувствительного красителя (VSDI) для контроля циклического пептида NBP-14;
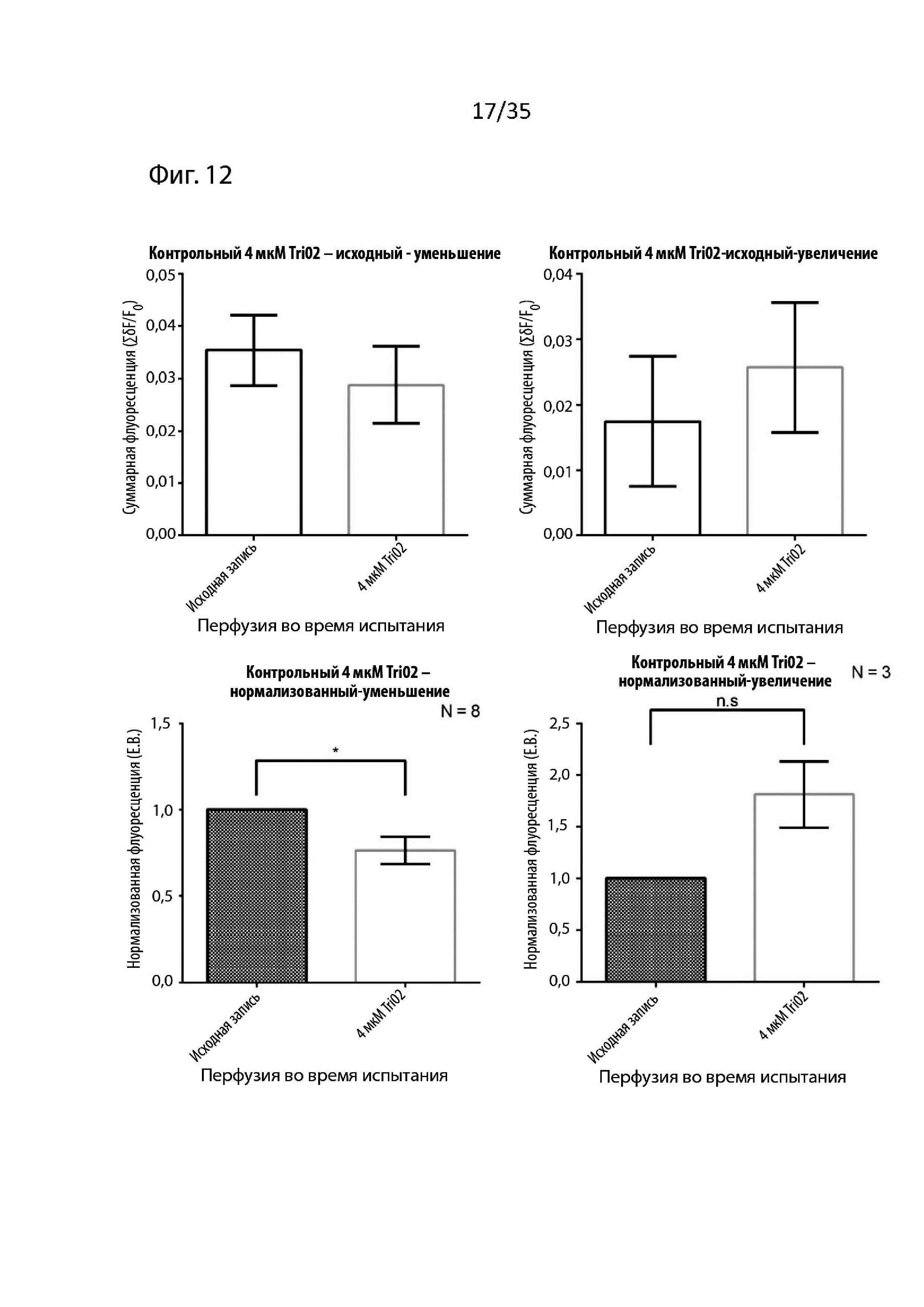
На Фиг. 12 изображены результаты визуализации срезов мозга с помощью потенциал-чувствительного красителя (VSDI) для пептидомиметического соединения 1 (т.е. Tri02);
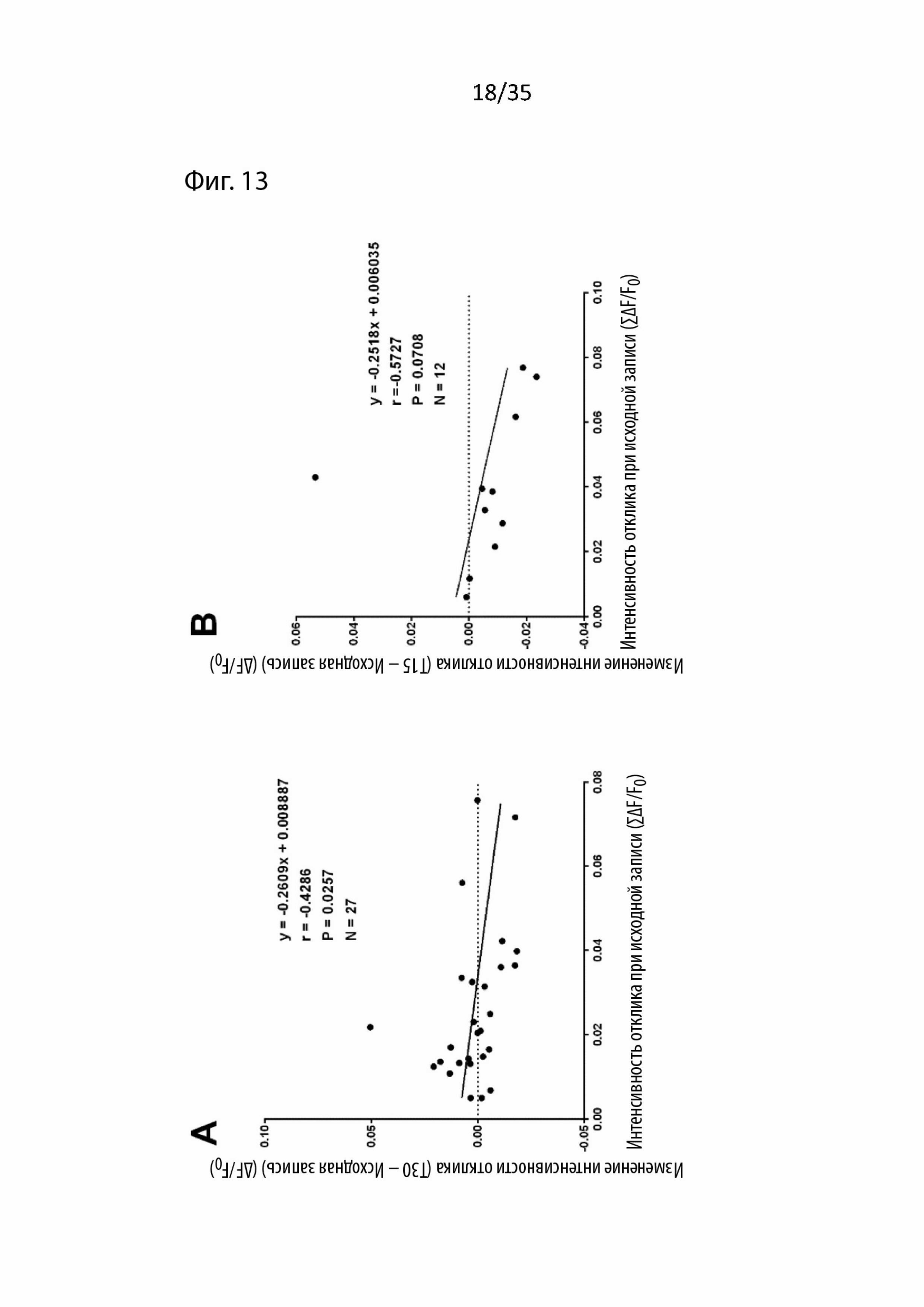
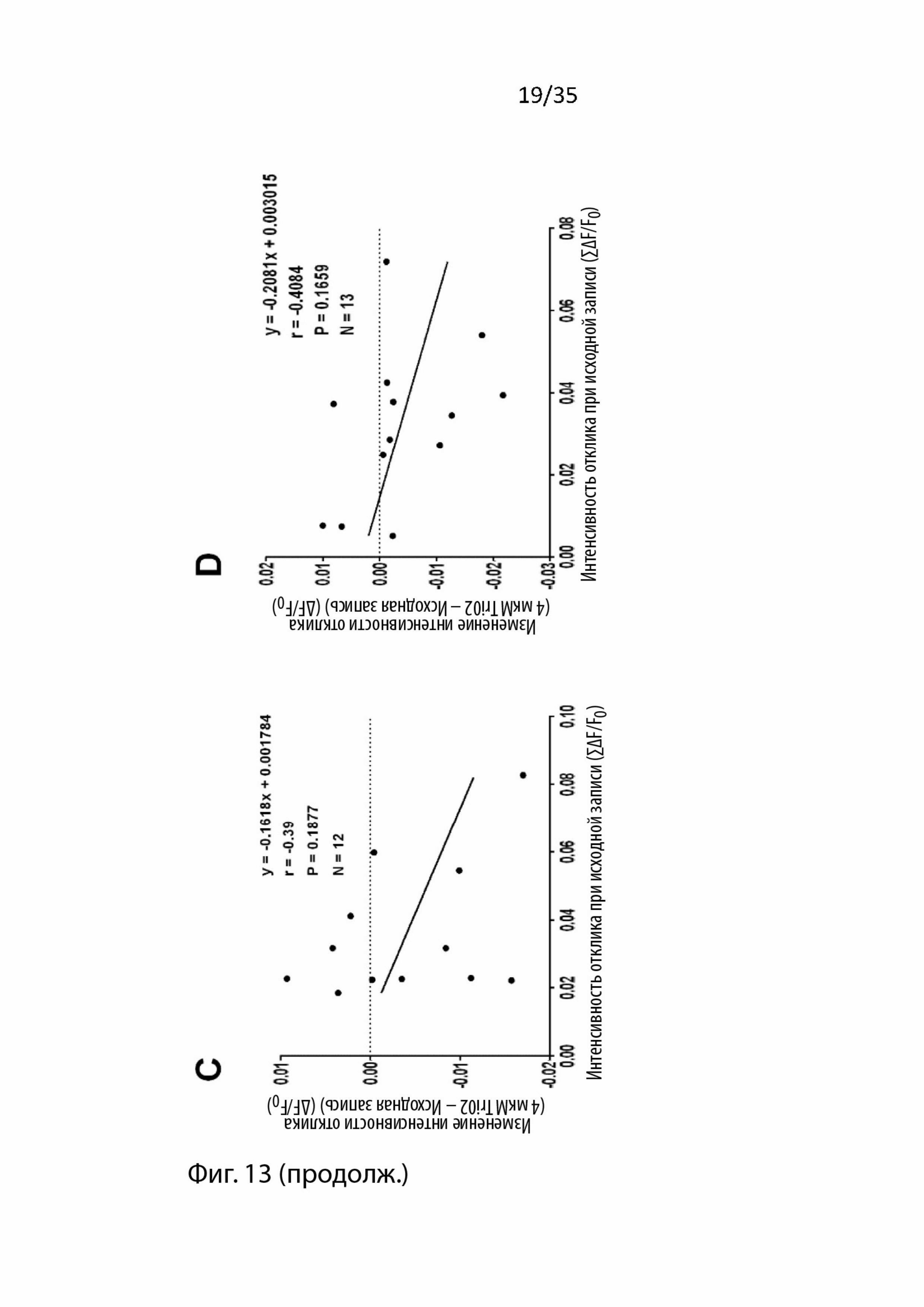
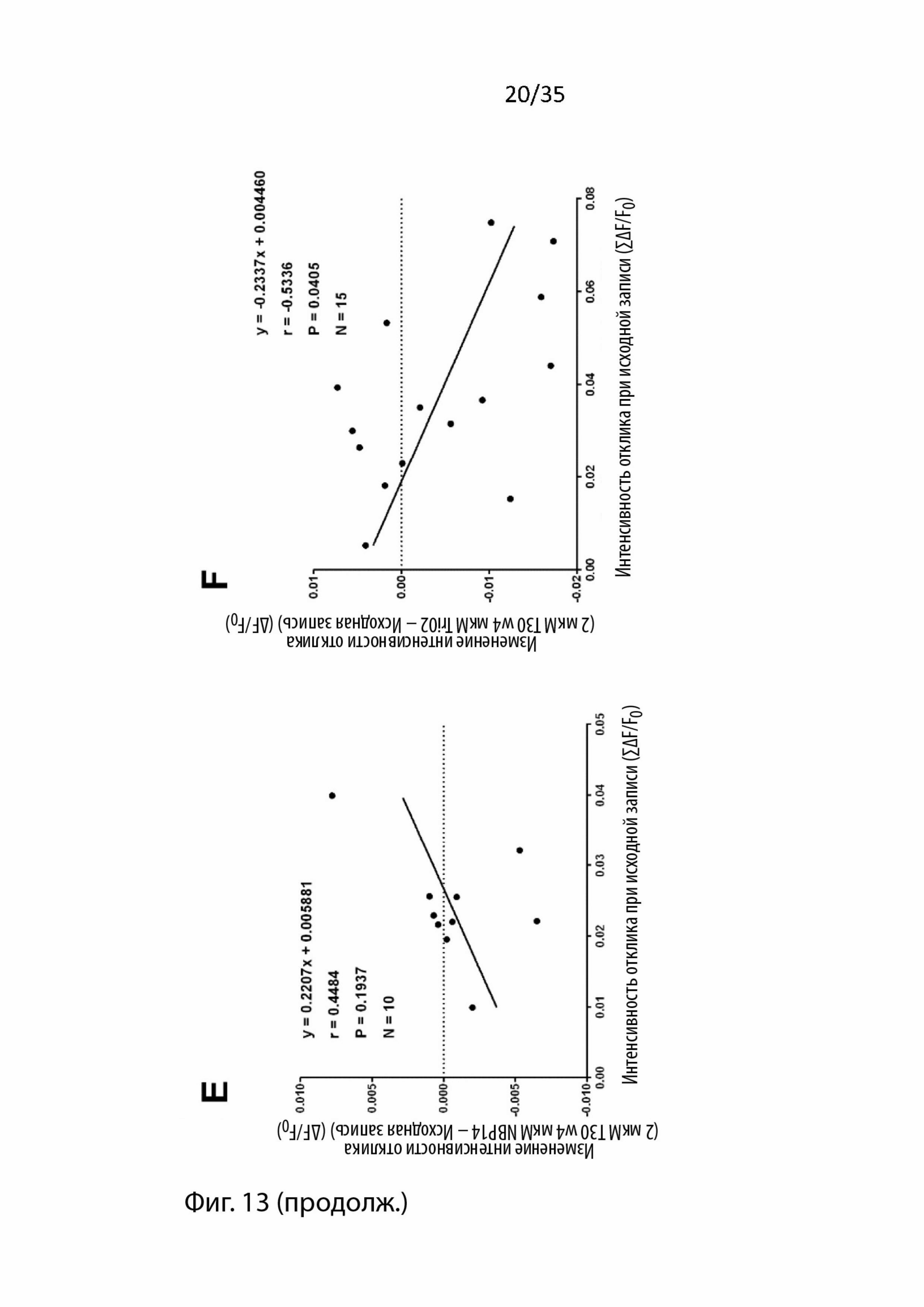
На Фиг. 13 изображен корреляционный анализ изменений, вызванных введением пептидов в отношении соответствующей базовой амплитуды ответа, с использованием визуализации срезов мозга с помощью потенциал-чувствительного красителя (VSDI). Было обнаружено, что изменения амплитуды ответа, вызванные Т30, отрицательно коррелируют с амплитудой их соответствующих исходных записей (А). Следовательно, для каждого эксперимента, в котором перфузировали экзогенные пептиды, проводили последующие корреляционные анализы: B) T15, C) NBP14, D) Tri02, E) T30 в присутствии NBP14 и F) T30 в присутствии Tri02. Единицы по оси Y = ΔF/F0; ось x = ΣδF/F0;
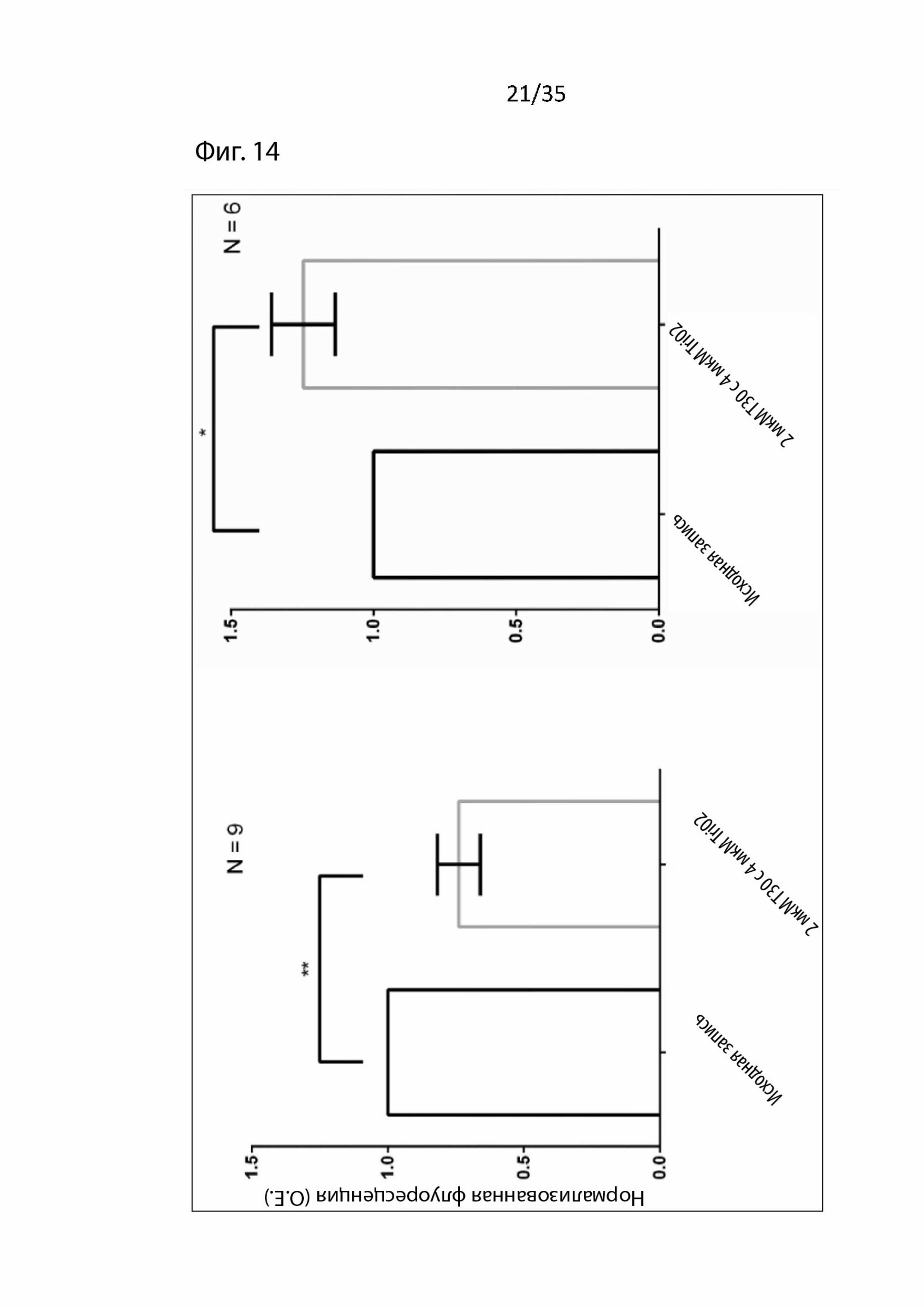
На Фиг. 14 изображена количественная оценка эффектов, опосредованных введением Tri02 и T30;
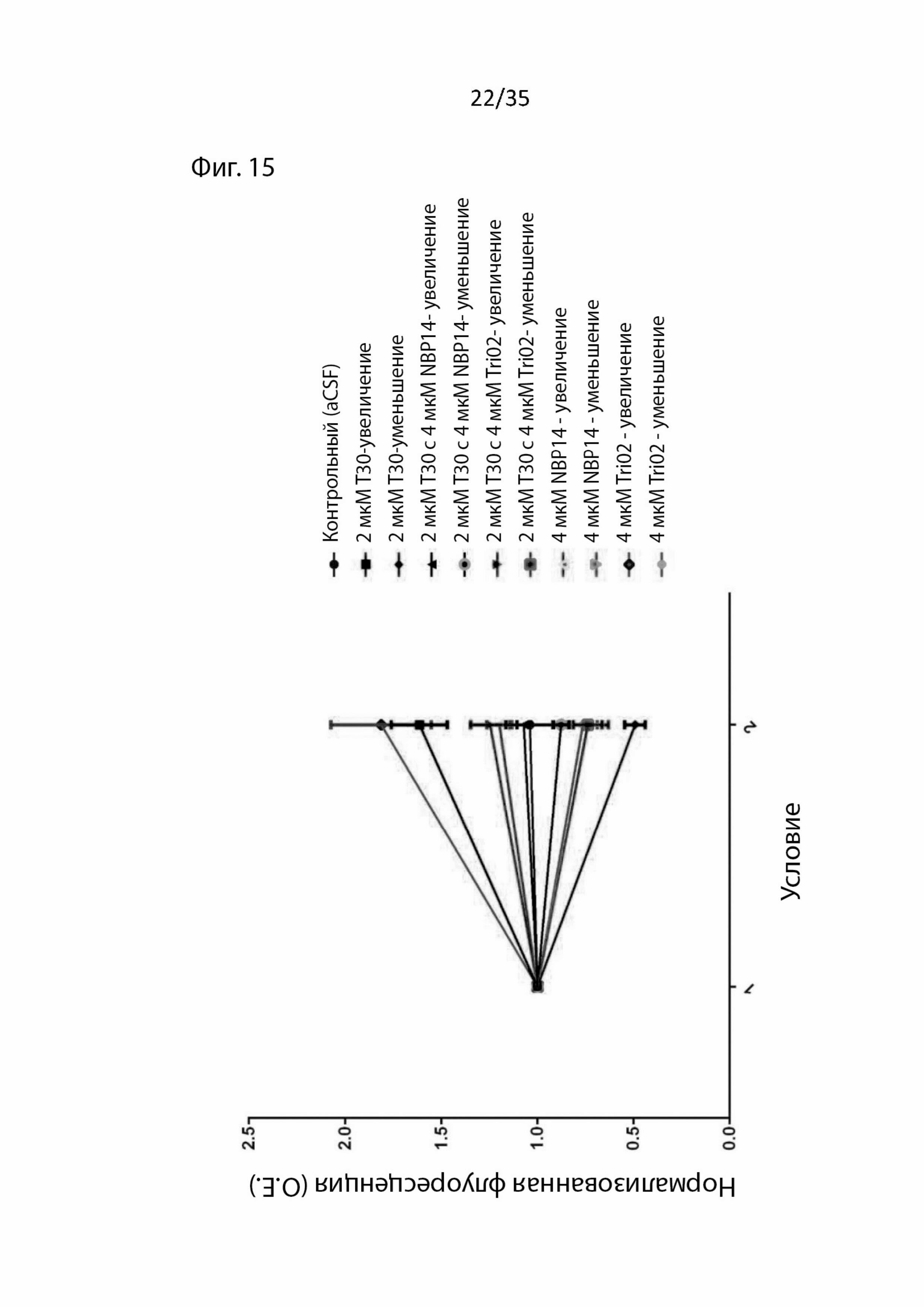
На Фиг. 15 изображен график, сравнивающий совместное применение T30 и NBP14 с таковым для Tri02 и T30 при блокировании влияния T30 на активность в базальном отделе переднего мозга. Совместное применение с NBP14 способно полностью блокировать индуцированные T30 влияния, тогда как T30 с Tri02 вызывает сходный, но приглушенный модулирующий отклик;
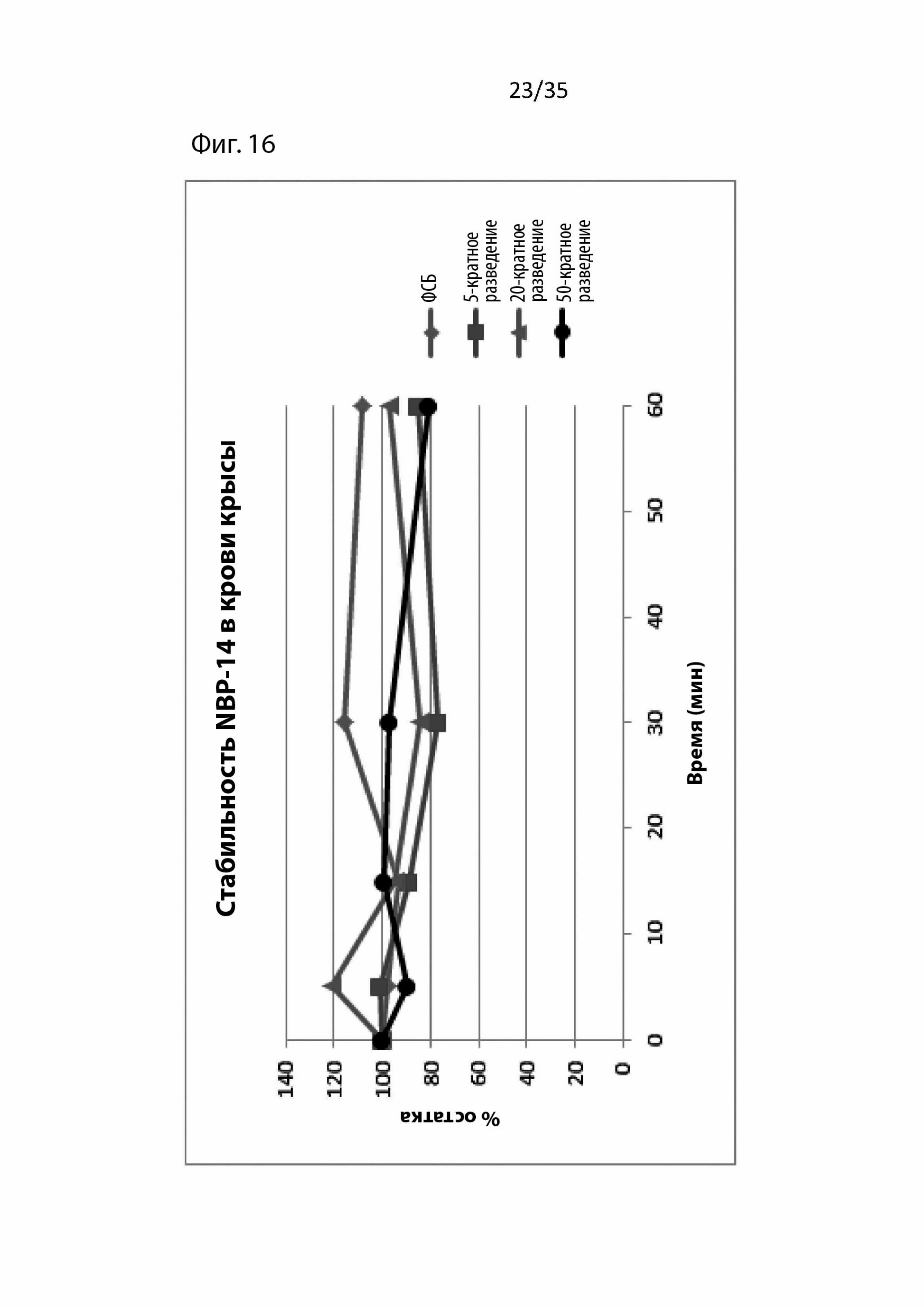
На Фиг. 16 изображены фармакокинетические данные для циклического NBP-14 в крови крыс;
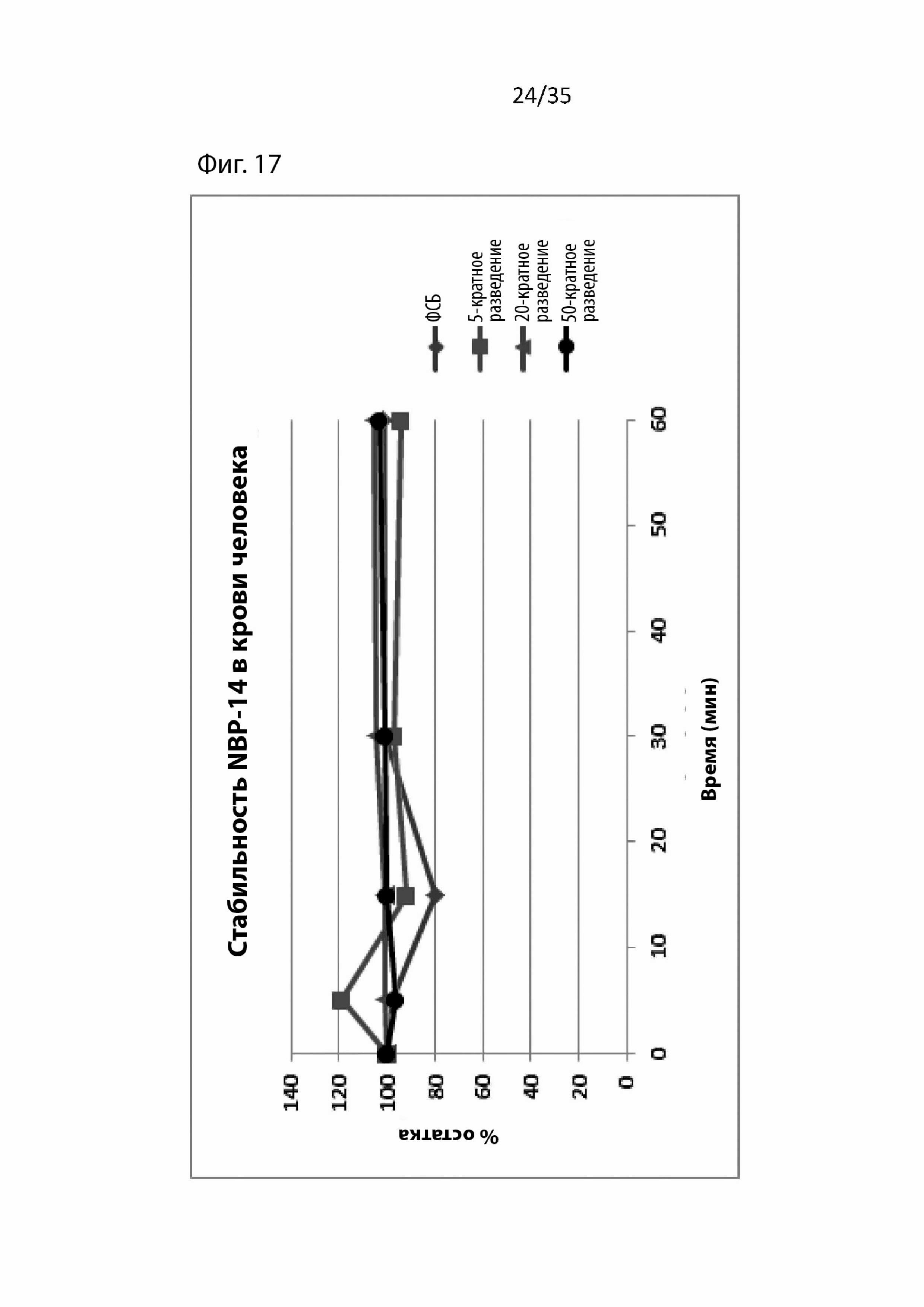
На Фиг. 17 изображены фармакокинетические данные для циклического NBP-14 в крови человека;
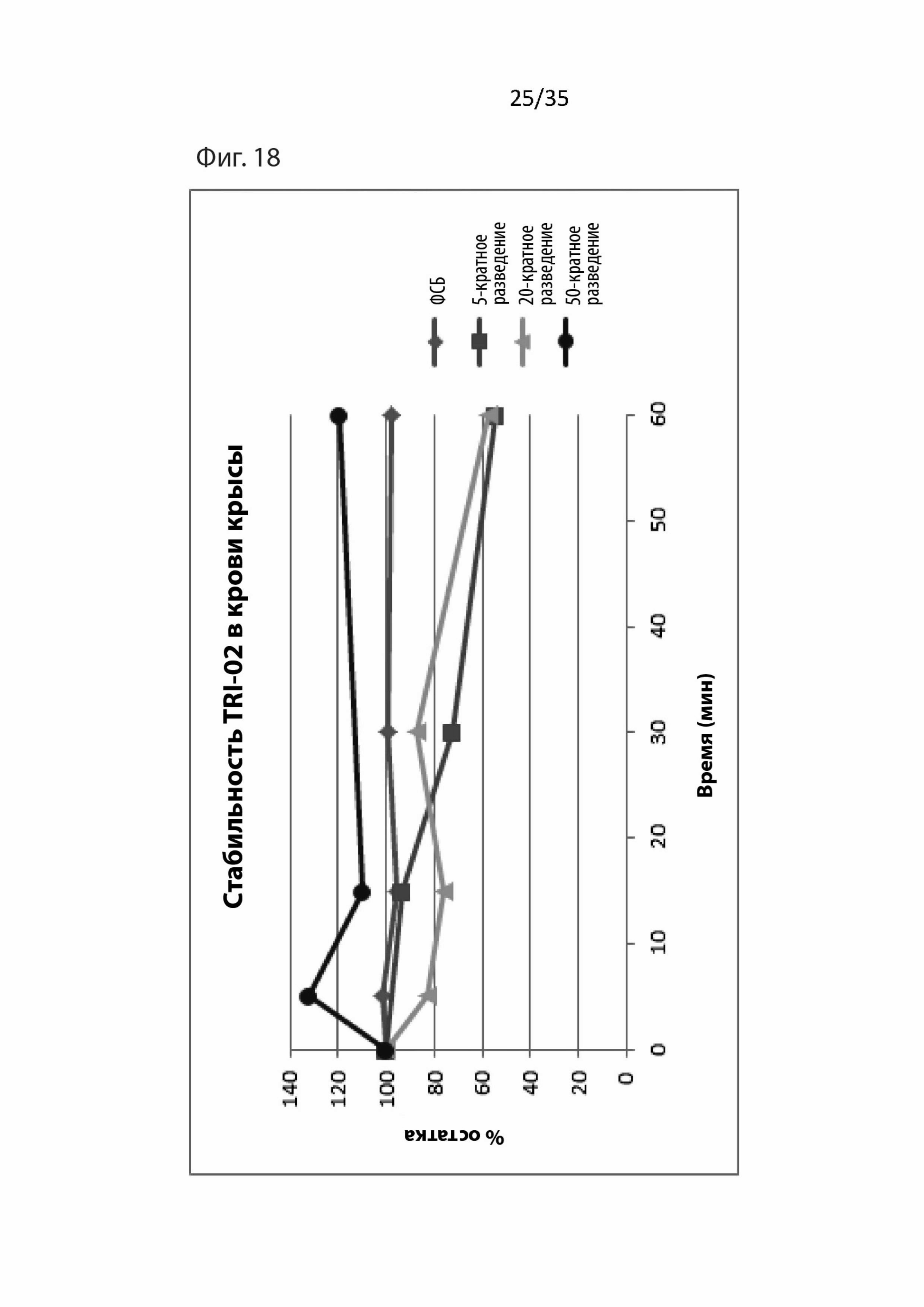
На Фиг. 18 изображены фармакокинетические данные для пептидомиметического соединения 1 (т.е., Tri02) в крови крыс;
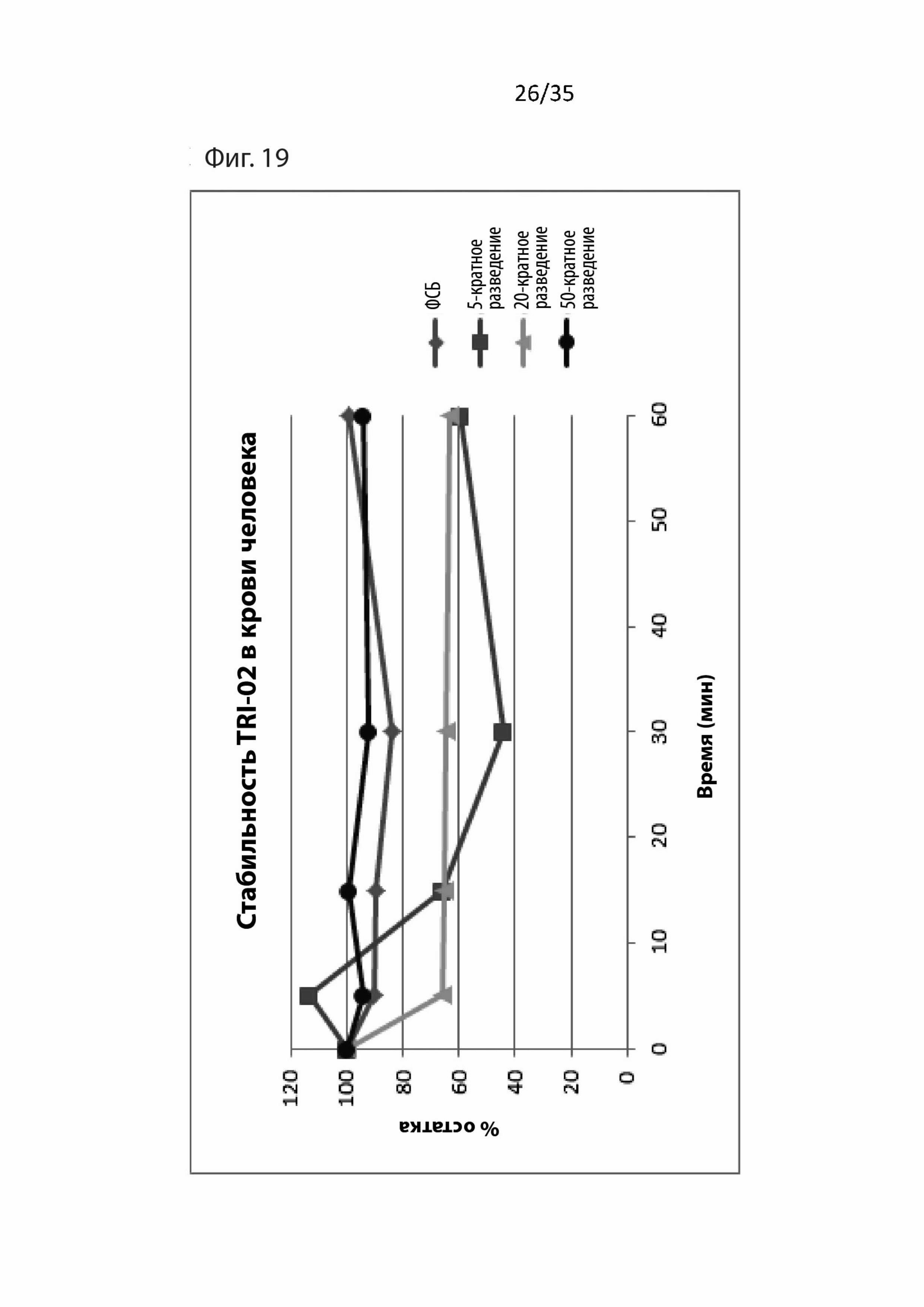
На Фиг. 19 изображены фармакокинетические данные для пептидомиметического соединения 1 (т.е., Tri02) в крови человека;
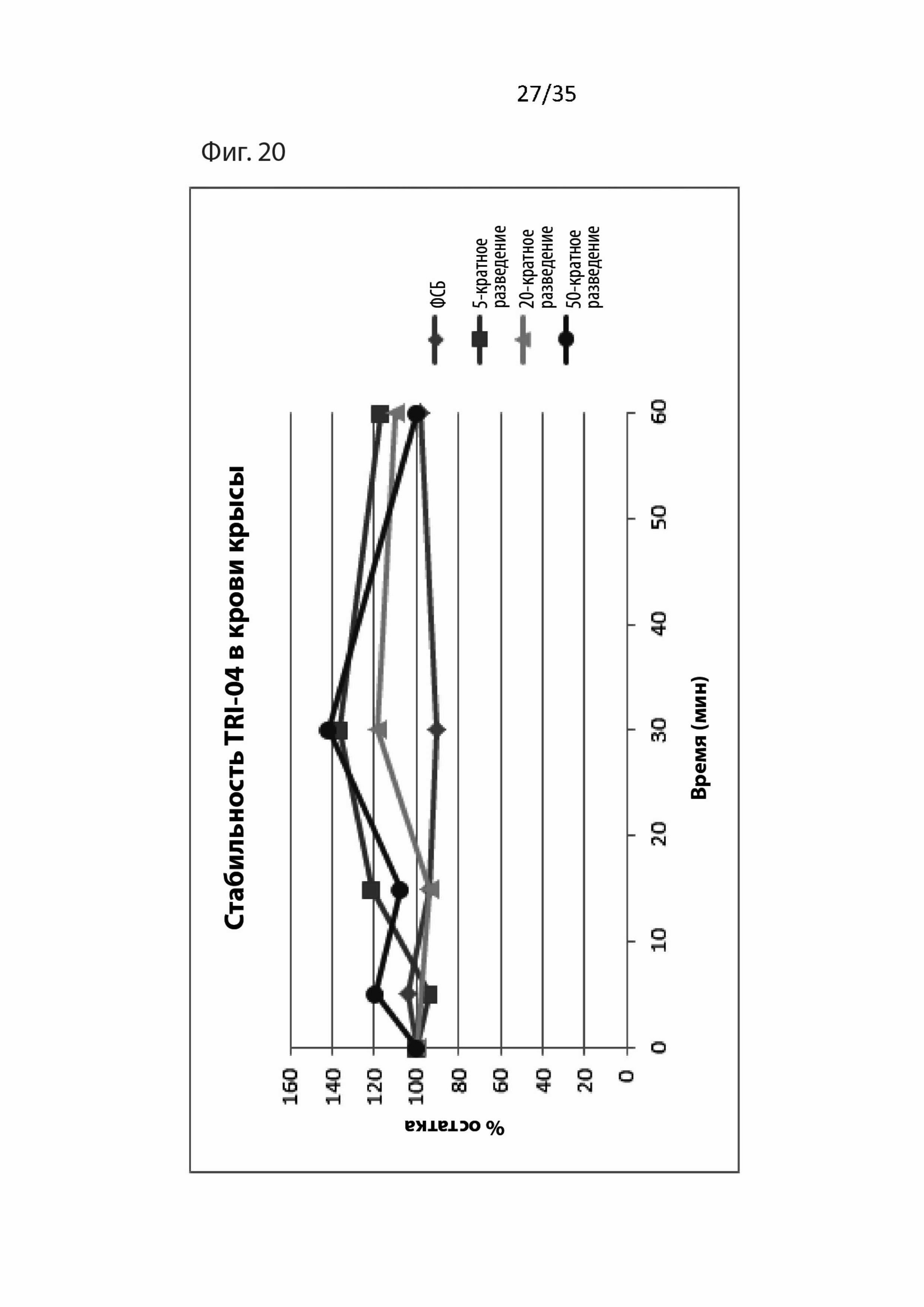
На Фиг. 20 изображены фармакокинетические данные для пептидомиметического соединения 3 (т.е., Tri04) в крови крыс;
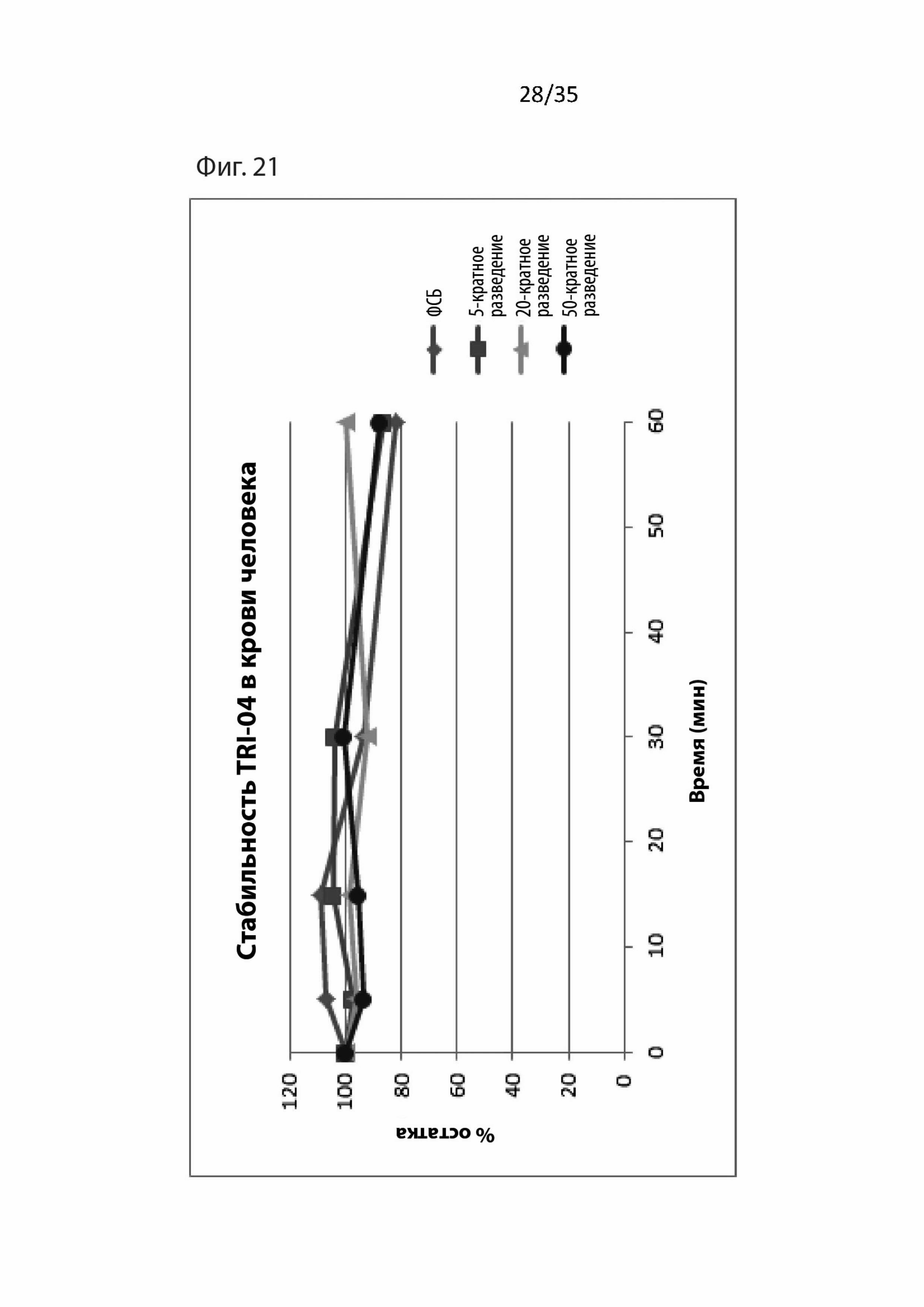
На Фиг. 21 изображены фармакокинетические данные для пептидомиметического соединения 3 (т.е., Tri04) в крови человека;
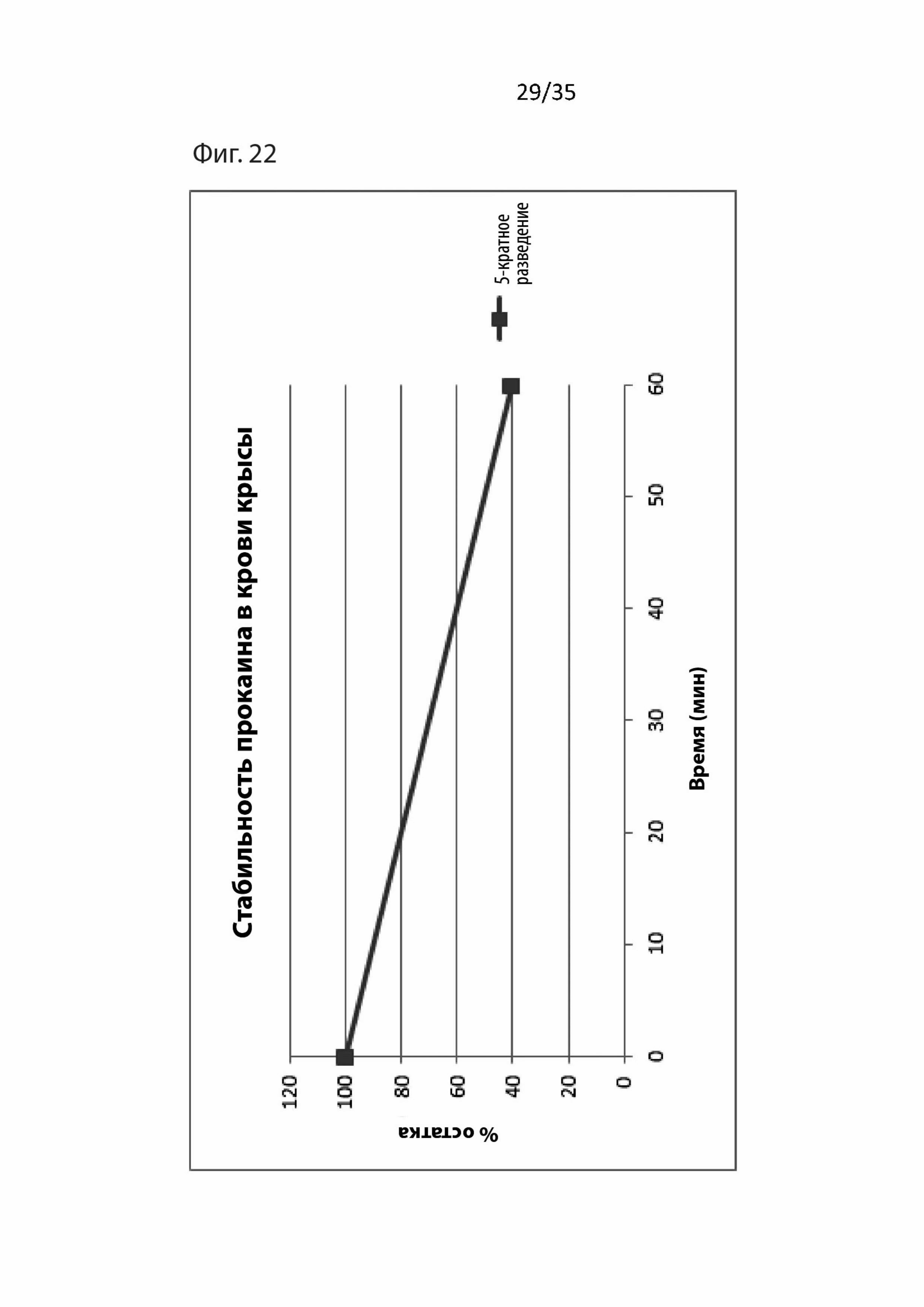
На Фиг. 22 изображены фармакокинетические данные для прокаина в крови крыс;
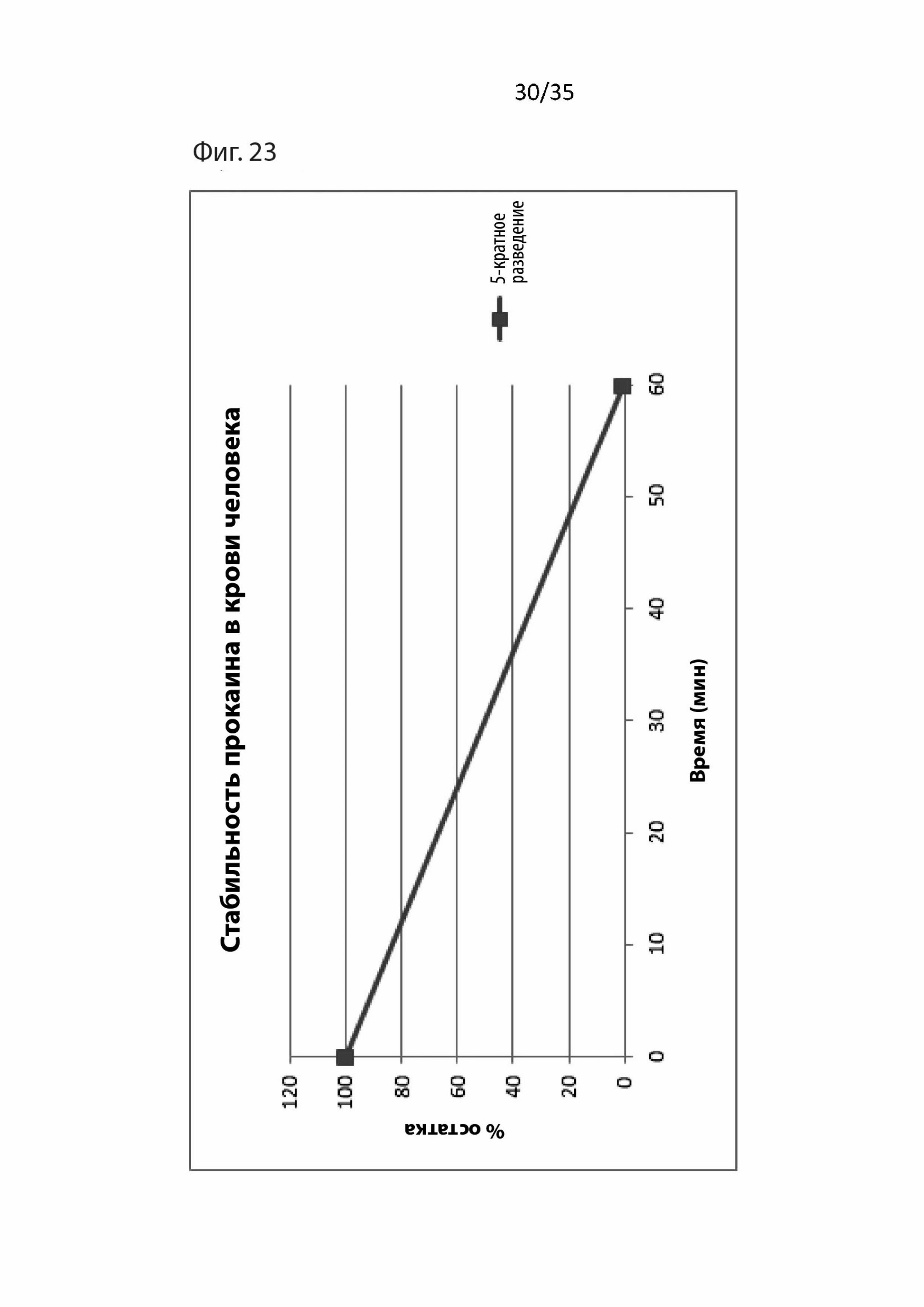
На Фиг. 23 изображены фармакокинетические данные для прокаина в крови человека;
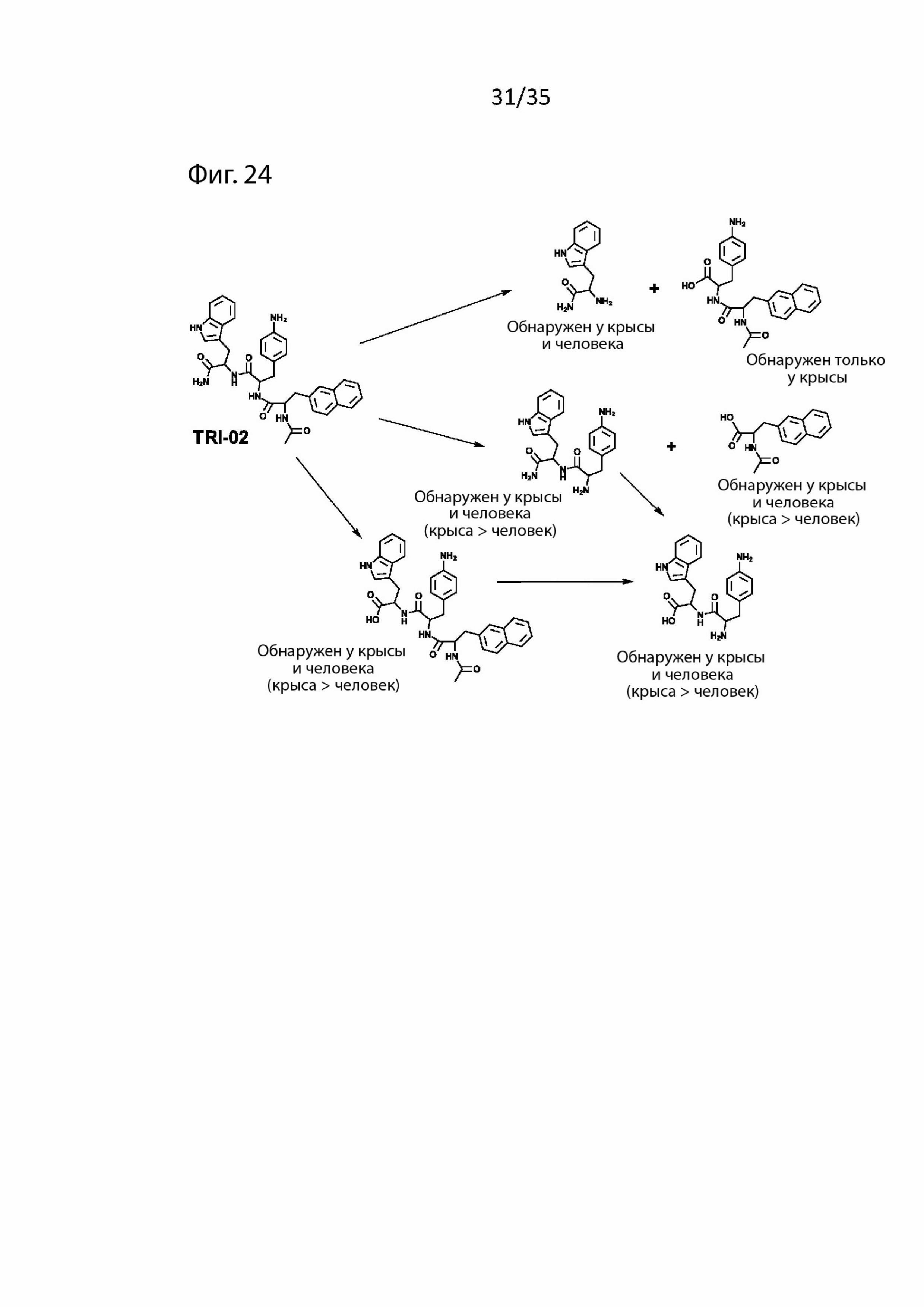
На Фиг. 24 изображены продукты распада пептидомиметического соединения 1 в крови (т.е. Tri02);
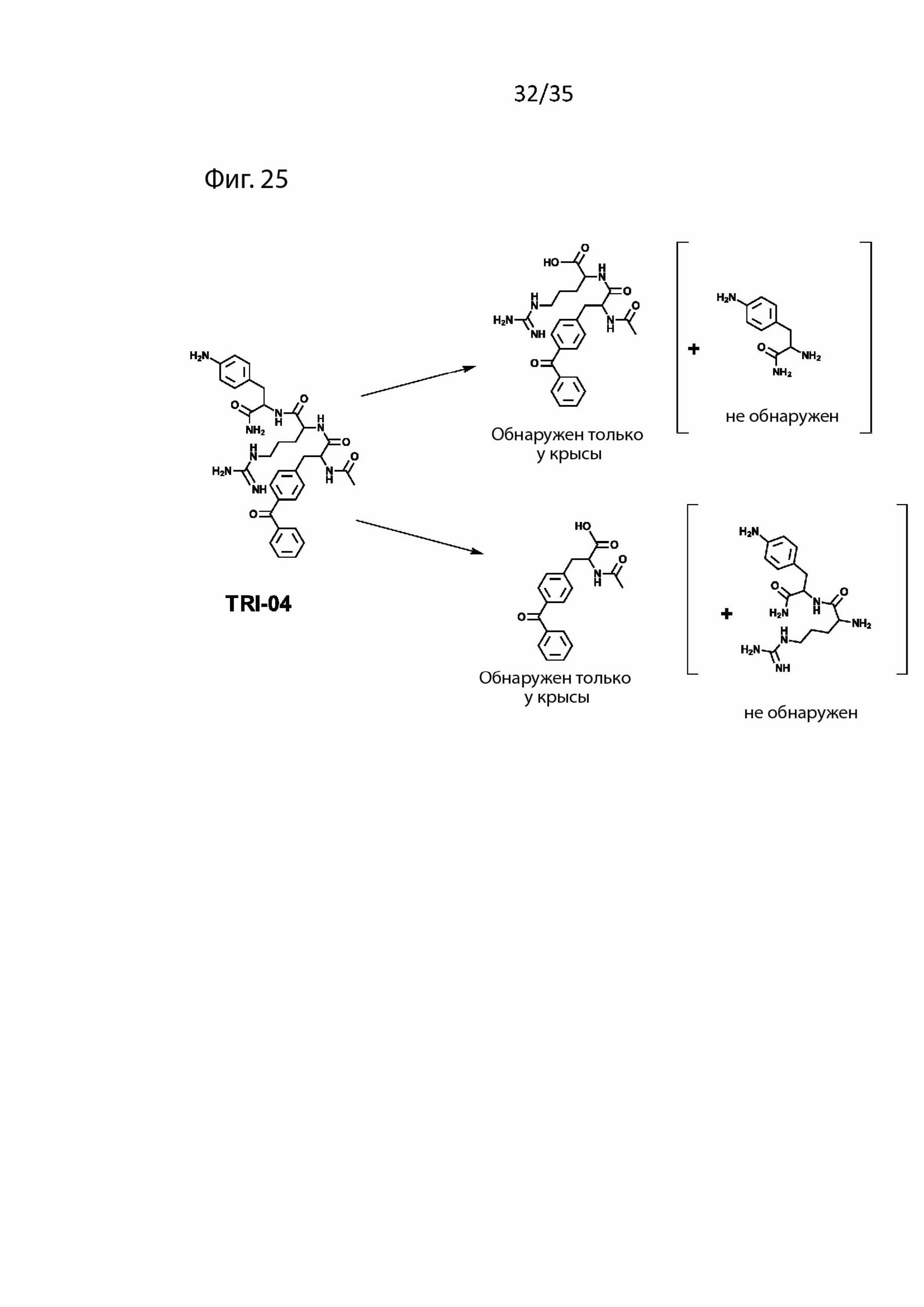
На Фиг. 25 изображены продукты распада пептидомиметического соединения 3 в крови (т.е. Tri04);
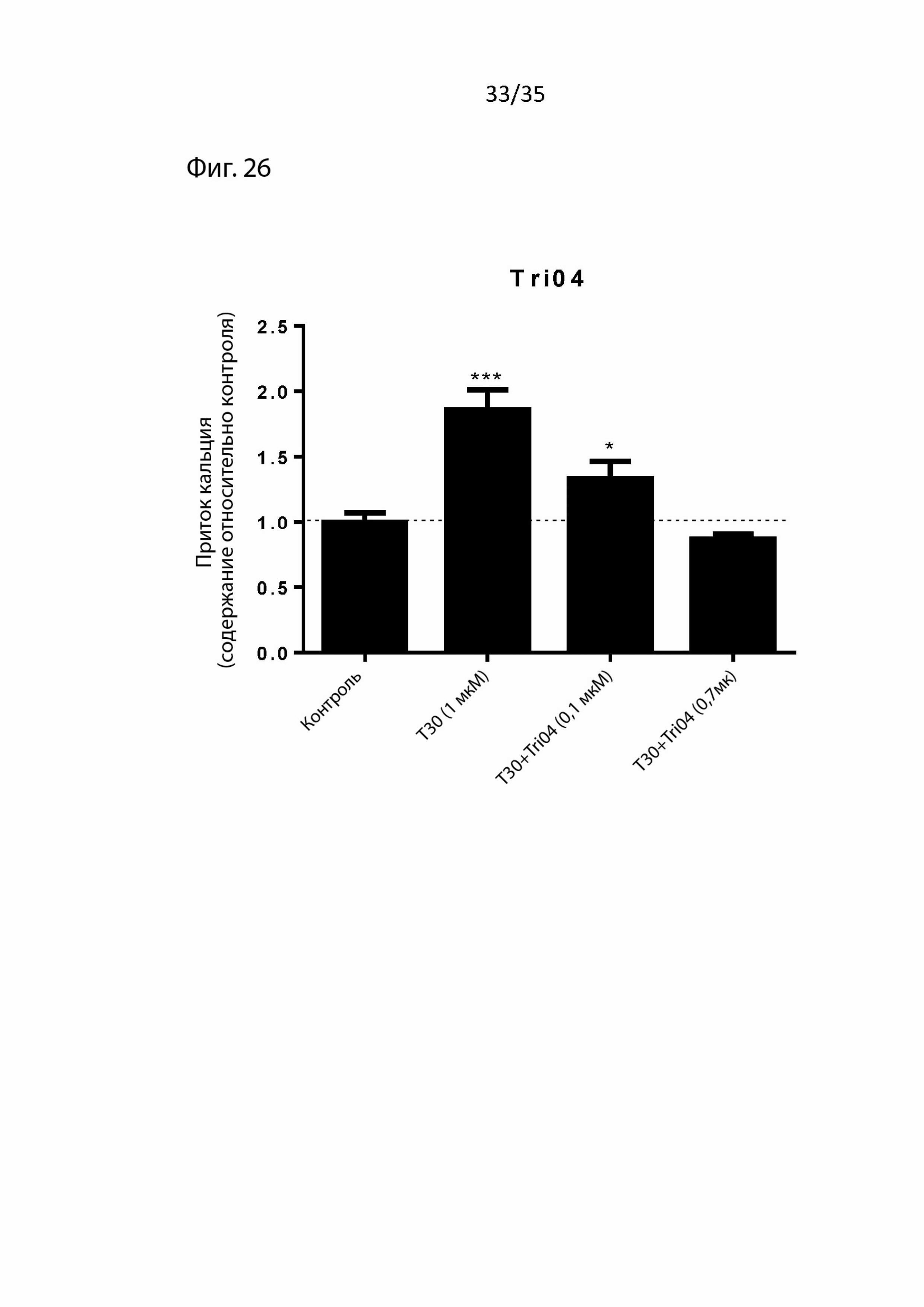
На Фиг. 26 изображены данные клеточной культуры (т.е., приток ионов кальция) для пептидомиметического соединения 3 (т.е. Tri04);
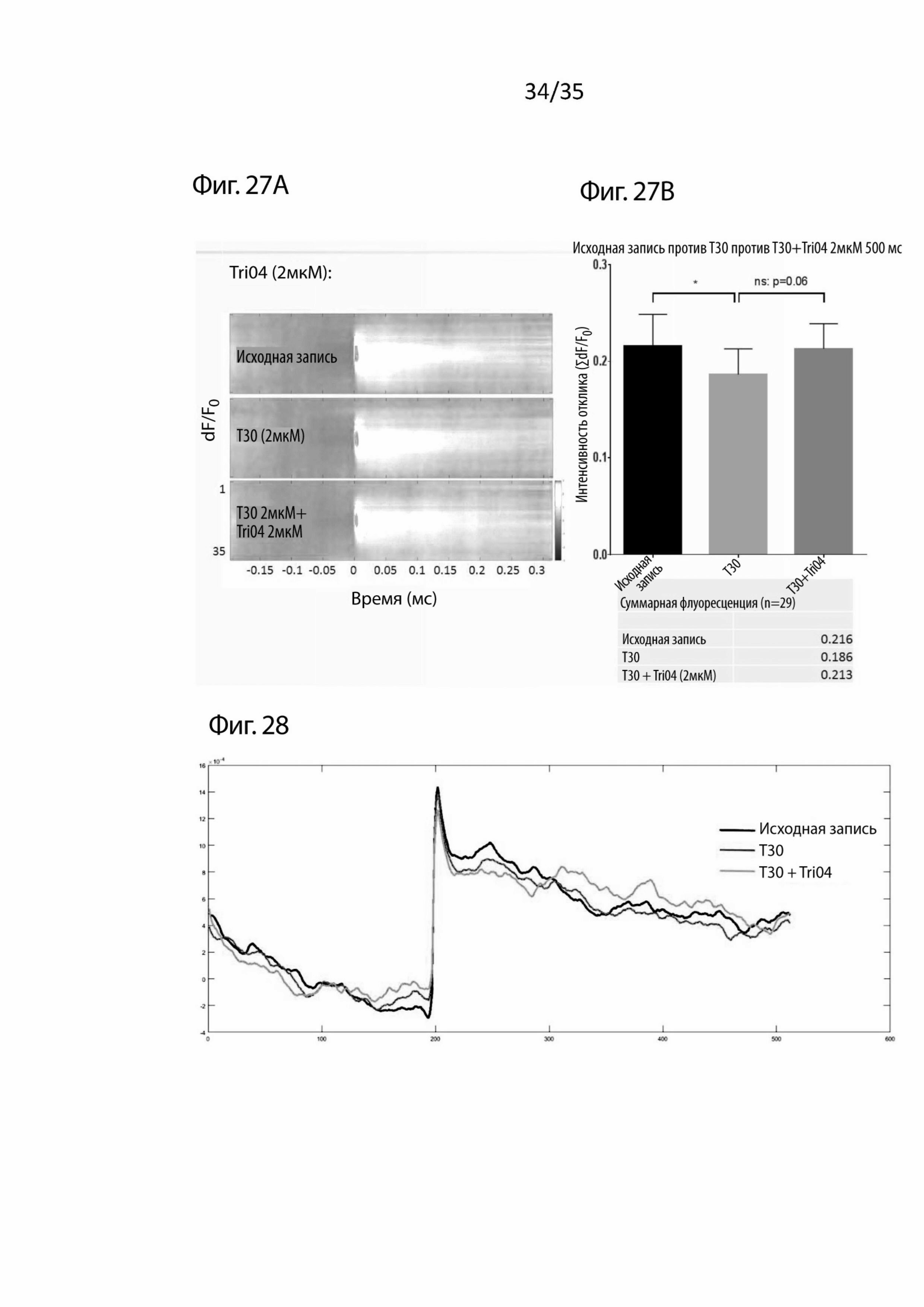
На Фиг. 27 изображены (A) пространственно-временные карты изменений активности базального отдела переднего мозга, вызванные введением пептидов (T30 и Tri04) в зависимости от базовой амплитуды отклика при использовании визуализации срезов мозга с помощью потенциал-чувствительного красителя (VSDI). На (B) изображен график, сравнивающий вызванную активность базального отдела переднего мозга для записей с T30 и Tri04 (2 мкМ) с активностью только T30 в базальном отделе переднего мозга;
На Фиг. 28 изображено относительное изменение флуоресценции (время отклика-серия, n=29) для записей, сделанных в присутствии только T30 или после совместного применения T30 и его блокатора Tri04 по сравнению с условием исходной записи; и
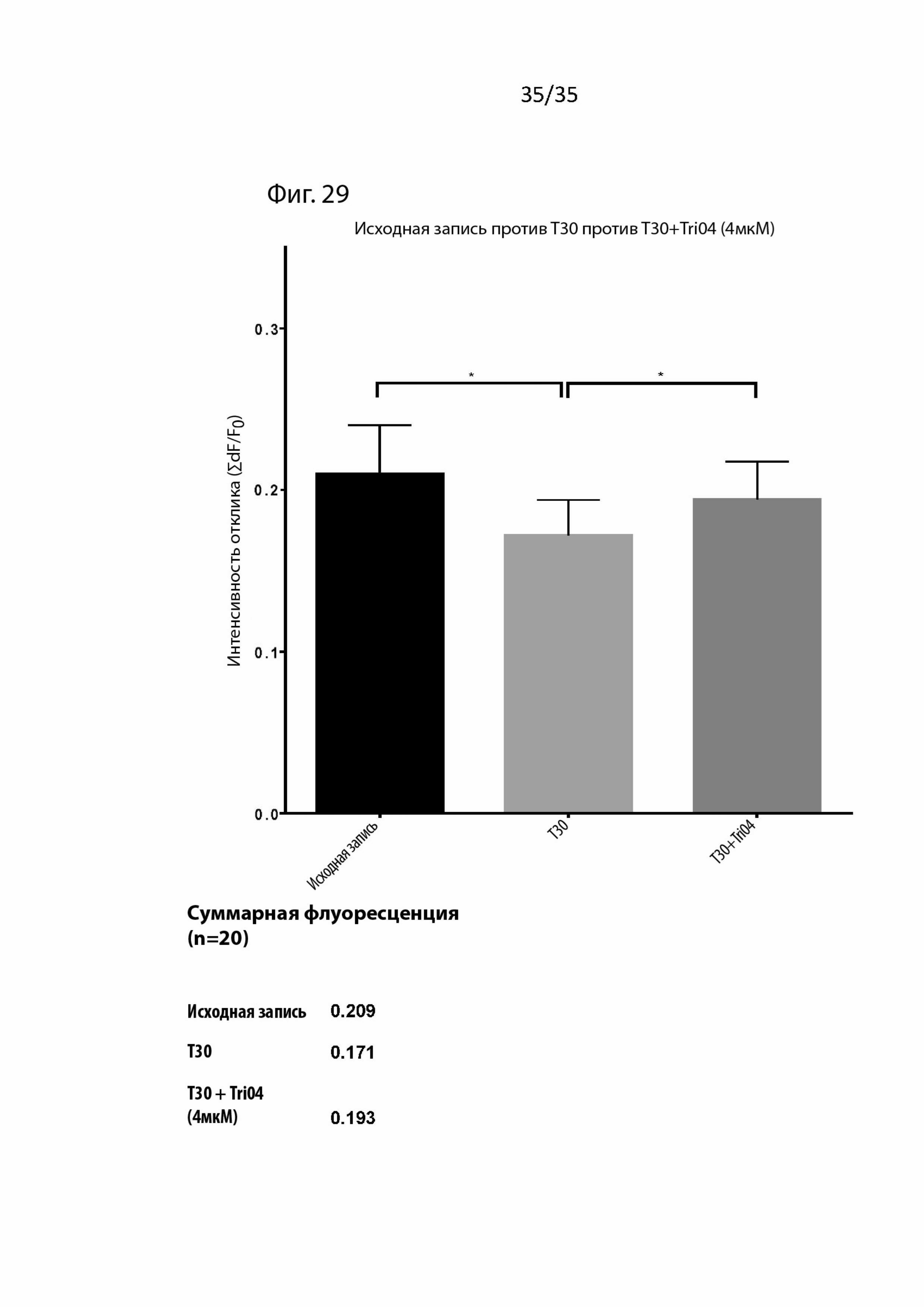
На Фиг. 29 изображена гистограмма активности базальной отдела переднего мозга при применении блокатора Tri04 при концентрации 4 мкМ. Совместное применение с Tri04 позволяет полностью блокировать вызванные Т30 воздействия в базальном отделе переднего мозга крысы.
Примеры
Авторы изобретения провели исследование insilico для разработки новых пептидов и пептидомиметиков, которые проявляли бы сродство к рецептору α-7nChR и, следовательно, блокировали бы связывание с его активным центром с помощью эндогенного токсичного пептида T30 (KAEFHRWSSYMVHWKNQFDHYSKQDRCSDL – SEQ ID No: 1). Исследование in silico помогло определить химические функциональные группы, имеющие отношение к защите от токсического действия Т30 и продуцирования бета-амилоида, путем изучения взаимодействия между рецептором и циклическим NBP-14 (т.е. AEFHRWSSYMVHWK - SEQ ID No: 2), которое, как известно, обеспечивает эту защиту, как продемонстрировано в предыдущей работе (см. WO 2005/004430). Следующие примеры описывают исследование in silico, а также структуры различных пептидов и пептидных миметиков, которые были идентифицированы и испытаны in vitro.
Пример 1 - исследование in-silico для разработки новых пептидов, которые ингибируют рецептор α-7nChR
Используя компьютерный анализ сродства NBP-14 к рецептору-мишени лекарственного средства и исследования на основе структуры, авторы изобретения идентифицировали ряд меньших линейных пептидов с аналогичными NBP-14 свойствами in vitro (SEQ ID No:2). Было исследовано теоретическое взаимодействие между 598 этими меньшими линейными пептидами и рецептором-мишенью α-7nChR. Были химически синтезированы NBP-14 и 168 линейных пептидов, полученные из вышеупомянутого компьютерного анализа. NBP-14 и все 168 пептидов были подвергнуты скринингу in vitro в клетках РС12, которые обычно применяются в качестве модельной системы для исследований нейрональной дифференцировки и нейросекреции. Скрининг на токсичность и нейродегенеративную биоактивность был проведен in vitro, для последней посредством мониторинга активности ацетилхолинэстеразы и внутриклеточных уровней кальция. Исходя из этого, было идентифицировано второе поколение ряда новых молекул с нейродегенеративными защитными свойствами от Т30 при использовании анализа пептидов in silico, которые были испытаны in vitro на клетках PC12, чтобы определить основную химическую функциональную группу, вовлеченную в связывание с рецептором.
Стыковка этих соединений была выполнена на аллостерическом центре рецептора α-7nChR. Связывающий карман рецептора содержит четыре области (обозначенные как области 1, 2, 3 и 4), которые можно представить, как изображено на Фиг. 1-4.
Анализ in silico включал сравнение между пептидами, чтобы определить и дифференцировать химические свойства/функциональные группы, характерные для защиты от токсичности Т30 и продуцирования бета-амилоида, от химических свойств, которые являются инертными. На Фиг. 2-4 изображена трехмерная структура связывающего кармана α-7nChR с цветной маркировкой на основе полярности.
Этапы, выполненные после, а также их результаты, кратко изложены ниже:
Этап 1: Сравнение аминокислот, связывающихся с каждой конкретной областью рецептора
В этом анализе каждая область рассматривалась отдельно, учитывались только аминокислоты, которые связывались с этой областью. Как изображено на Фиг. 5, которая представляет круговые диаграммы аминокислот или химических функциональных групп, участвующих в связывании, этот этап не выявил аминокислот, специфически связывающихся в разных областях.
Этап 2: Сравнение расстояния между аминокислотами, связывающимися в разных областях
В этом анализе расстояние между аминокислотами измеряется с учетом химической функциональной группы, участвующей в связывании. Эти данные, изображенные на Фиг. 6, не показывают существенных изменений расстояний между инертными вариантами и вариантами с активностью в отношении токсичности T30 и бета-амилоидной активности.
Этап 3: Сравнение комбинации аминокислот, участвующих в связывании
Этот этап требует анализа аминокислот, участвующих в связывании, в виде комбинации аминокислот, необходимых для защиты от токсичности Т30 и продуцирования бета-амилоида.
Результаты, представленные в Таблицах 1 и 2 ниже, показывают, что для защиты от токсичности Т30 необходимы 18 комбинаций аминокислот, а для защиты от продуцирования бета-амилоида - 31 комбинация аминокислот.
Таблица 1: Комбинации аминокислот, которые защищают от токсичности Т30
Таблица 2: Комбинации аминокислот, которые защищают от продуцирования бета-амилоида
Принимая во внимание эти результаты, авторы изобретения смогли классифицировать аминокислотные остатки, участвующие в связывании с каждой областью (области 1-4) рецептора, и, следовательно, химические функциональные группы, которые имеют особое значение для обеспечения защиты от токсичности Т30 и продуцирования бета-амилоида, см. Фиг. 7 и 8, соответственно.
Авторы изобретения сделали вывод, что для каждой области требуются определенные химические функциональные группы, которые приведены в Таблице 3
Таблица 3: Тип взаимодействия, происходящего в каждой области аллостерического центра рецептора α-7nChR
Соответственно, с учетом этих результатов авторы изобретения продемонстрировали подходящий пептид, который будет блокировать токсические воздействия эндогенного Т30 посредством блокировки преимущественно активного центра никотинового рецептора.
Пример 2 - Разработка и производство пептидомиметиков
Затем был использован альтернативный подход для разработки и выделения новых пептидомиметических соединений, которые могут (как и в случае пептидов, описанных в примере 2) оттеснить Т30 от аллостерического активного центра никотинового рецептора. Следовательно, было проведено дополнительное исследование in silico, в котором было проведено компьютерное картирование растворителя по исходной начальной рентгеновской структуре аллостерического центра рецептора α-7nChR. Этот анализ был направлен на выяснение преимущественного взаимодействия растворителя в месте связывания, а также на определение наличия горячих точек (гидрофобных, ароматических, полярных или заряженных). Этот метод определил ожидаемые химические свойства, необходимые лиганду для того, чтобы стать активным.
Анализ растворителя IPRO выявил высокую гидрофобную природу места связывания. Наблюдалось идеальное совпадение между прогнозом касательно картирования растворителя IPRO и стыковкой пептида T14.
На основании анализа картирования растворителя структура Т14 была использована для создания линейных библиотек трипептидов и тетрапептидов. На этом этапе было получено более 500000 пептидомиметиков для дальнейшей оценки. Затем пептидомиметики оценивали с помощью пакета программ для молекулярной стыковки AutoDock Vina. Для анализа учитывались теоретическое сродство, а также разнородность лиганда (т.е., склонность к связыванию во множественных местах связывания или разными способами связывания, обозначаемая низким intra-RMSD). Этот анализ дал пять потенциальных пептидомиметических соединений, которые изображены ниже, в которых чем выше оценка (абсолютное значение), тем выше сродство и выше вероятность того, что соединение активно.
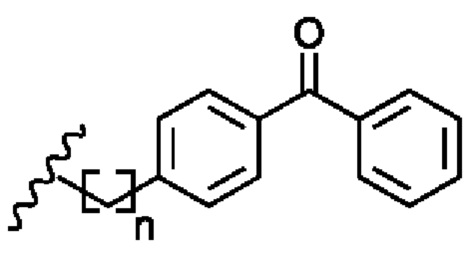
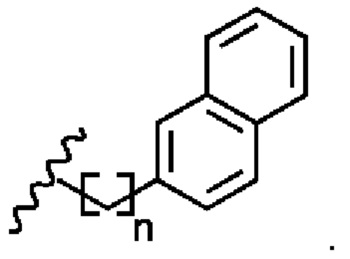
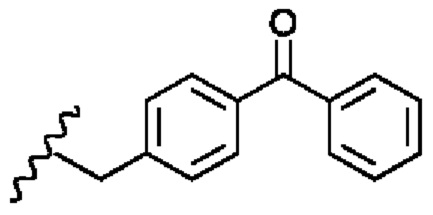
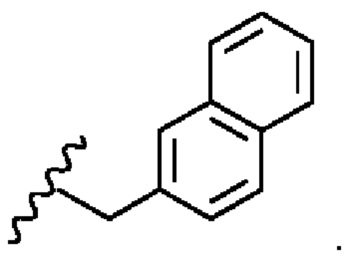
Соединение 1 - Tri02 (оценка: -10,2)
4-((S)-2-((S)-2-ацетамидо-3-(нафталин-2-ил)пропанамидо)-3-(((S)-1-амино-3-(1H-индол-3-ил)-1-оксопропан-2-ил)амино)-3-оксопропил)бензоламиний
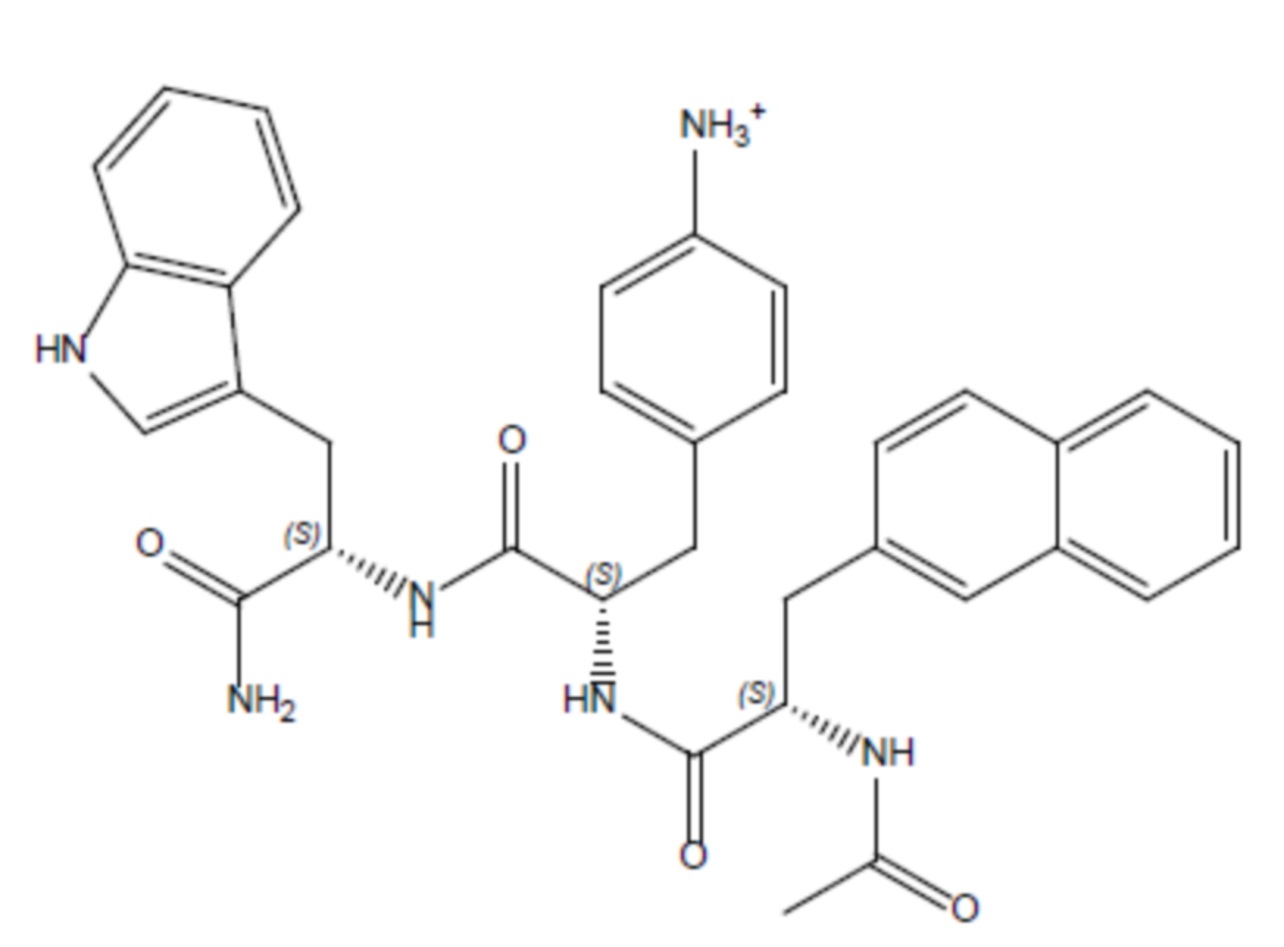
Соединение 2 - Tri03 (оценка: -9,8)
- (3S, 5S)-1-((S)-2-ацетамидо-3-(нафталин-2-ил)пропаноил)-5-(((S)-1-амино-6-((амино(имино)метил)амино)-1-оксогексан-2-ил)карбамоил)пирролидин-3-аминий
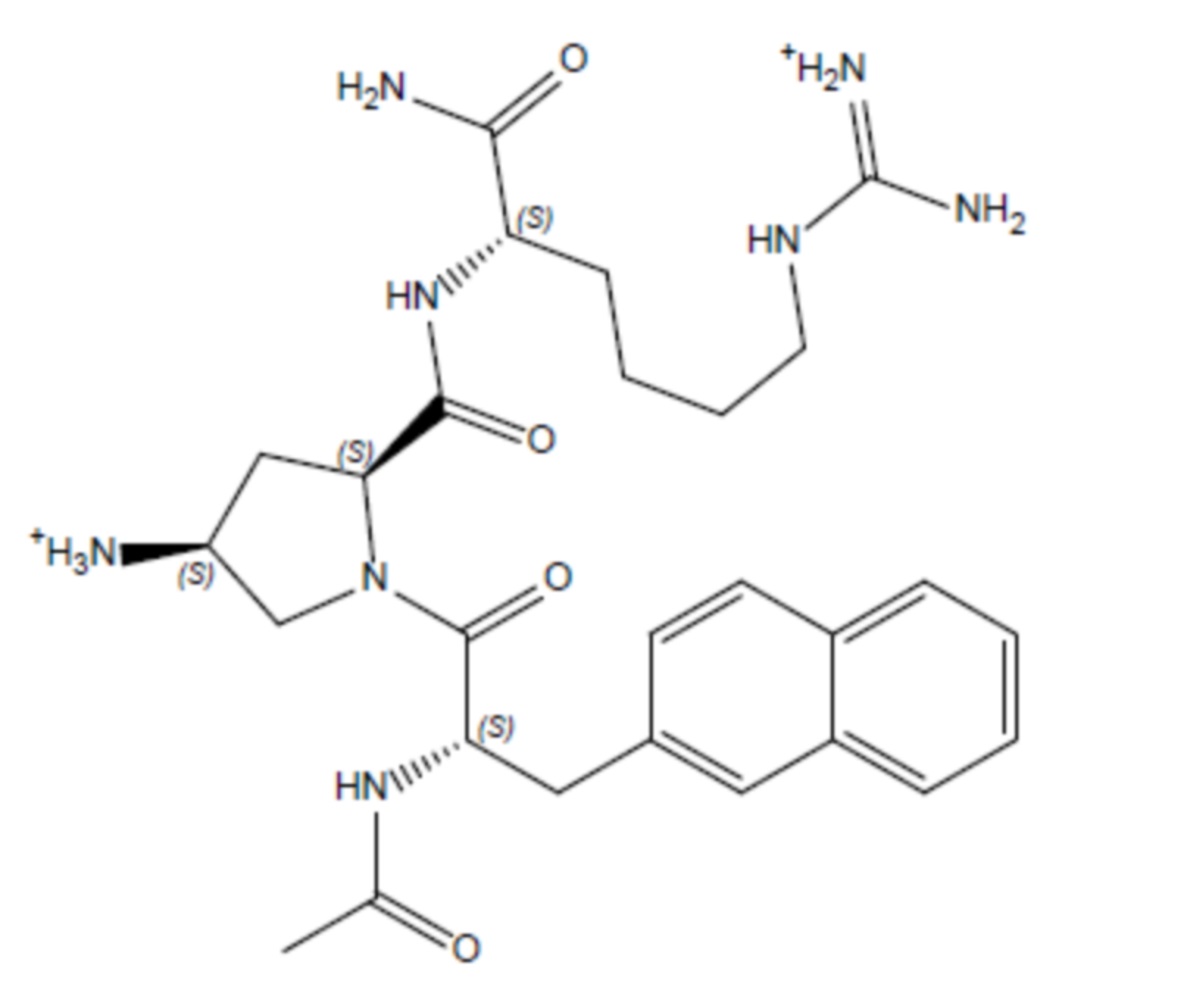
Соединение 3 - Tri04 (оценка: -9,4)
4-((S)-2-((S)-2-((S)-2-ацетамидо-3-(4-бензоилфенил)пропанамидо)-6-((амино(имино)метил)амино)гексанамидо)-3-амино-3-оксопропил)бензоламиний
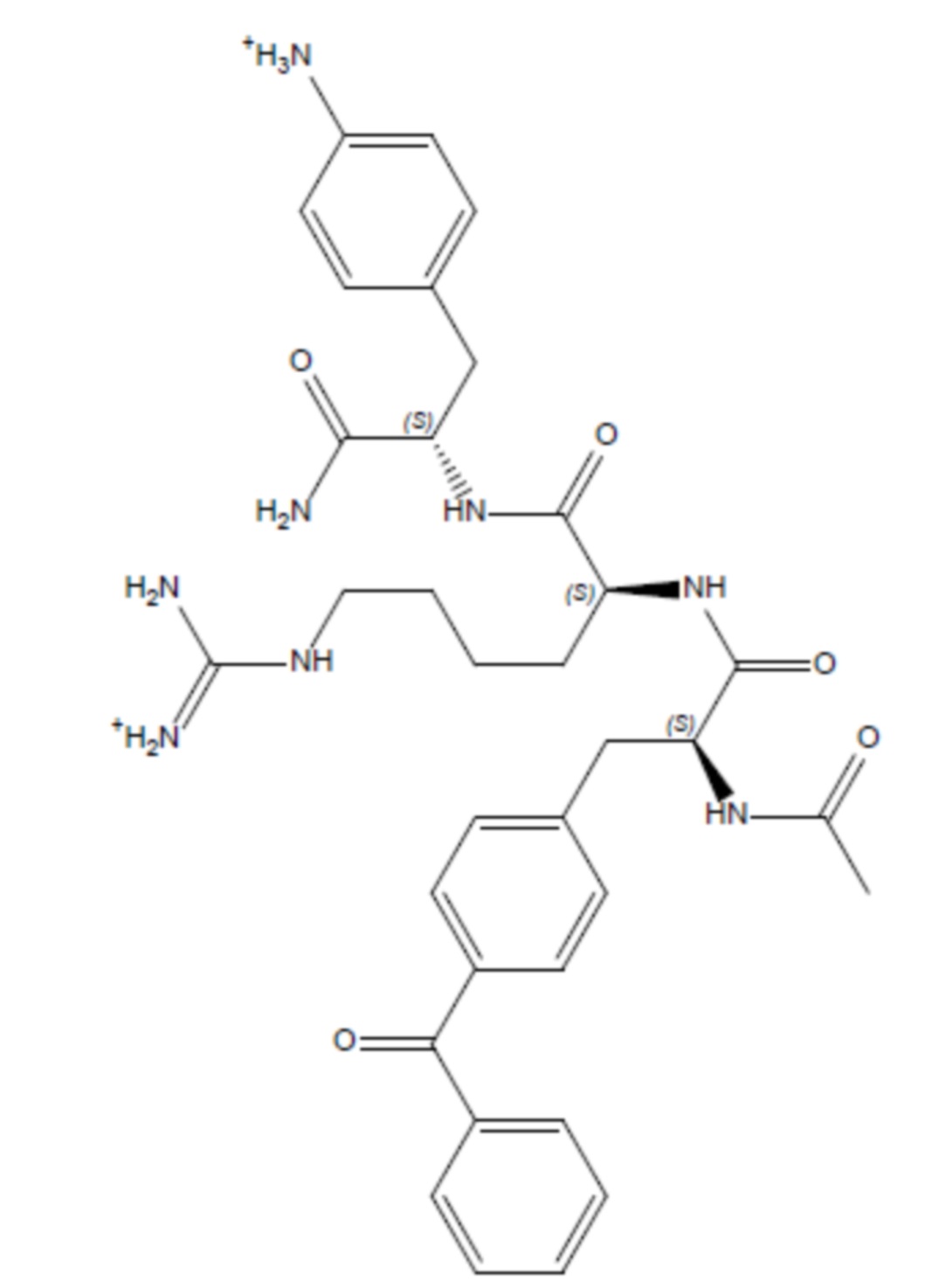
Соединение 4 - Tri05 (оценка: -9,6)
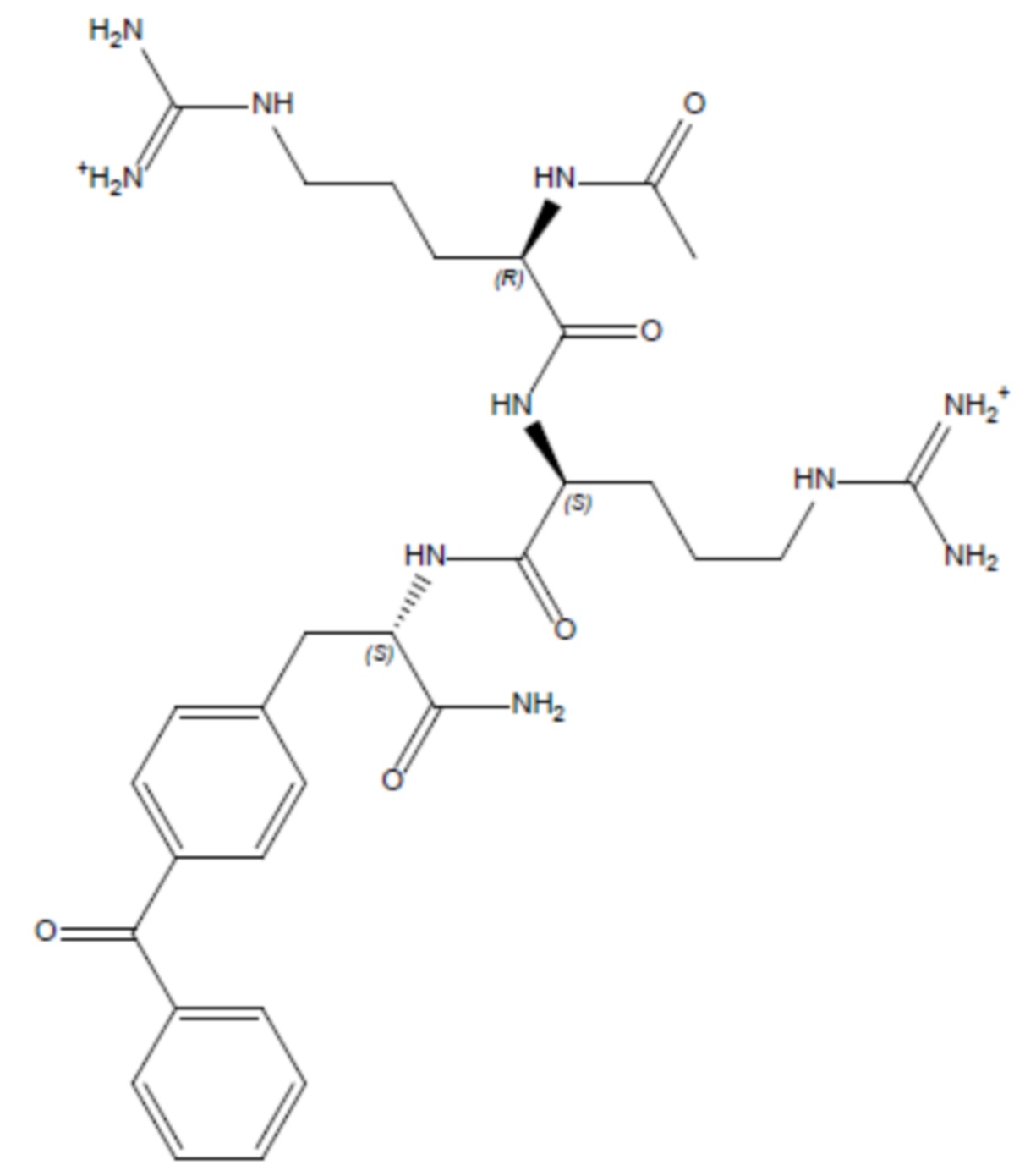
(((R)-4-ацетамидо-5-(((S)-5-((амино(имино)метил)амино)-1-(((S)-1-амино-3-(4-бензоилфенил)-1-оксопропан-2-ил)амино)-1-оксопентан-2-ил)амино)-5-оксопентил)амино)(амино)метаниминий
Соединение 5 - Tri06 (оценка: -8,9)
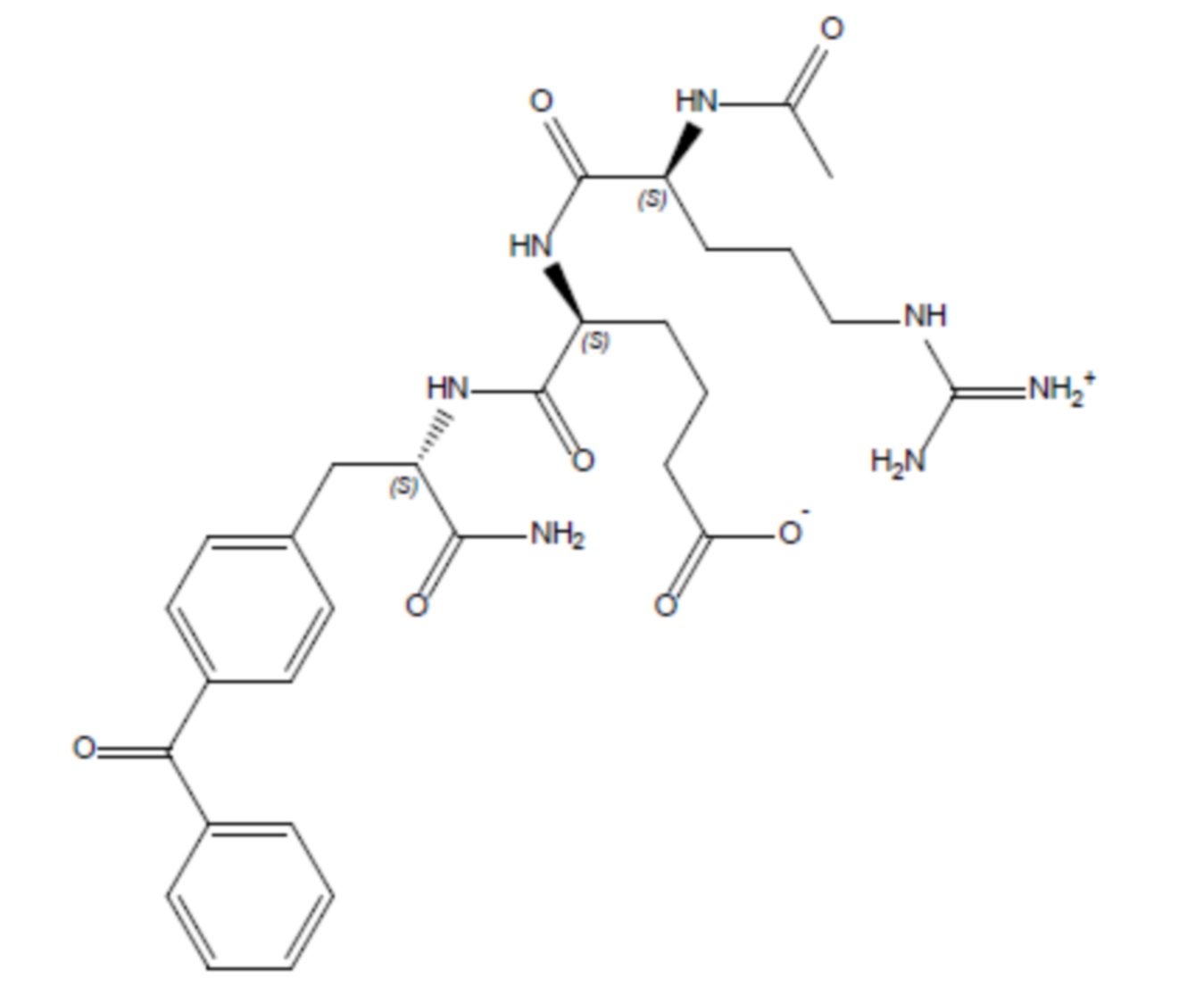
(S)-5-((S)-2-ацетамидо-5-((амино(имино)метил)амино)пентанамидо)-6-(((S)-1-амино-3-(4-бензоилфенил)-1-оксопропан-2-ил)амино)-6-оксогексаноат
Пример 3 - Синтез идентифицированных соединений
Материалы и способы
Соединения 1 и 3 из Примера 2 были синтезированы Genosphere Biotechnologies и проанализированы на чистоту с помощью обращенно-фазовой ВЭЖХ (>99% чистота) и массу посредством масс-спектроскопии (средняя MS 604,79 для Tri02 и 628,83 для Tri04).
Краткое поэтапное описание синтеза TRI02 - Последовательность: [ацетил]-[2Nal][4nh2-F]-Триптофан-[амид]
1) Boc-Trp-OH+ClooEt+NH3.H2O------Boc-Trp-NH2, реакция в THF, экстрагируется этиловым эфиром уксусной кислоты.
2) Boc-Trp-NH2, 4NHcl, удаленный Boc-, полученный H-Trp-NH2.Hcl, реакция осаждения диэтиловым эфиром.
3) (2-Нафтил)-Ala+уксусный ангидрид----Ac-(2-нафтил)-Ala-OH, реакция в THF/H2O, экстрагируется этиловым эфиром уксусной кислоты.
4) Boc-(4-NH2)-Phe-OH+H-Trp-NH2.Hcl----Boc-(4-NH2)-Phe-Trp-NH2, реакция в DMF, экстрагируется этиловым эфиром уксусной кислоты.
5) Boc-(4-NH2)-Phe-Trp-NH2,4NHcl, удаленный Boc-, полученный H-(4-NH2)-Phe-Trp-NH2.Hcl, реакция осаждения диэтиловым эфиром.
6) Ac-(2-нафтил)-Ala-OH+H-(4-NH2)-Phe-Trp-NH2.Hcl--Ac-(2-нафтил)-Ala-(4-NH2)-Phe-Trp-NH2 реакция в DMF, экстрагируется этиловым эфиром уксусной кислоты.
7) Очистка
Краткое поэтапное описание синтеза TRI04 - Последовательность: [ацетил]-[bpa]R[4NH2-F]-[амид]
1) Смола Ринка MBHA. Смолу вымачивают в DCM в течение 30 минут, сушат с помощью насоса, 3 раза промывают DMF, сушат с помощью насоса.
2) Добавляют Fmoc-(4-NH2)Phe-OH, DIEA, HBTU, DMF, N2, дают прореагировать в течение 30 минут, сушат с помощью насоса, промывают DMF 6 раз, сушат с помощью насоса.
3) Добавляют пиперидин/DMF для удаления Fmoc-, дают прореагировать в течение 20 мин, сушат с помощью насоса, промывают DMF 3 раза, сушат с помощью насоса.
4) Добавляют Fmoc-Arg(Pbf)-OH, DIEA, HBTU, DMF, N2, дают прореагировать в течение 30 мин, сушат с помощью насоса, промывают DMF 6 раз, сушат с помощью насоса.
5) Повторяют этап 3.
6) Добавляют Fmoc-Bpa-OH, DIEA, HBTU, DMF, N2, дают прореагировать в течение 30 мин, сушат с помощью насоса, промывают DMF 6 раз, сушат с помощью насоса.
7) Повторяют этап 3.
8) Добавляют уксусный ангидрид/DMF, N2, дают прореагировать в течение 30 мин, сушат с помощью насоса, промывают DMF 3 раза, сушат с помощью насоса, 3 раза промывают DCM, сушат с помощью насоса, 3 раза промывают MeOH, сушат с помощью насоса.
9) Пептид, отщепленный от смолы, сушат с помощью насоса, осаждают реакцией с диэтиловым эфиром, получают неочищенный пептид, сушат центрифугированием.
10) Очистка
Пример 4 - Оценка соединения 1 (Tri02) и соединения 3 (Tri04) в клеточных культурах
Авторы изобретения испытали T30, NBP-14 и Tri02 в исследованиях клеточных культур, чтобы определить их влияние на активность ацетилхолинэстеразы и приток кальция, а также влияние Tri04 на приток кальция.
Материалы и способы
1. Анализ активности АХЭ
Активность АХЭ измеряли с использованием реагента Эллмана, который измеряет присутствие тиоловых групп в результате активности АХЭ. В случае эксперимента G4 активность АХЭ (G4) испытывали отдельно, а также вместе с либо NBP14 пептидом, либо Tri пептидом. Для анализа жизнеспособности клеток клетки РС12 высевали за день до эксперимента. Клетки обрабатывали T30 (1 мкМ) отдельно или в сочетании с NBP14 или Tri пептидом (0,5 мкМ). После обработки надосадочную жидкость (перфузат) от каждой обработки собирали и 25 мкл от каждого условия добавляли в новый плоскодонный 96-луночный планшет с последующим добавлением 175 мкл реагента Эллмана (Раствор A: KH2PO4 139 мМ и K2HPO4 79,66 мМ, pH 7,0; раствор B (субстрат): ацетилтиохолинйодид 11,5 мМ; раствор C (реагент): 5,5'-дитиобис(2-нитробензойная кислота) 8 мМ и NaHCO3 15 мМ). Реагент Эллмана готовили в виде смеси из 3 растворов в соотношении 33(А):3(В):4(С). Измерения абсорбции проводились в течение 60 минут в экспериментах при 405 нм в планшет-ридере Vmax (Molecular devices, Wokingham, UK).
2. Флуорометрия кальция
За день до эксперимента в 96-луночных планшетах клетки РС12 высевали в 200 мкл среды Игла, модифицированной Дульбекко (DMEM), плюс 2 мМ среды L-глутамина. В день эксперимента раствор Fluo-8 (Abcam) готовили, как описано поставщиком, добавляя 20 мкл Fluo-8 в аналитический буфер, который содержит 9 мл сбалансированного солевого раствора Хенкса (HBSS) и 1 мл плюроника F127 Plu. Затем удаляли 100 мкл питательной среды и добавляли 100 мкл раствора Fluo-8. Добавляли средства с T30 в сочетании с пептидами NBP14 или Tri и инкубировали в течение 30 минут в инкубаторе и 30 минут при комнатной температуре. Через 1 ч планшет помещали в планшетный ридер для измерения флуоресценции (Fluostar, Optima, BMG Labtech, Ortenberg, Germany). Перед детекцией флуоресценции, 1 мкМ PNU282987, альфа7-специфический агонист никотиновых рецепторов был подготовлен и помещен в инжектор Fluostar. Для каждой лунки показание формировалось путем детекции базальной флуоресценции с последующей инъекцией PNU282987, которая способствовала увеличению кальция через никотиновые рецепторы.
3. Анализ данных
В каждом из различных способов анализа клеток статистический анализ выполняли со средним процентным значением 3 или более экспериментов. Сравнения между несколькими группами средств и одним и тем же контролем проводили с помощью однофакторного дисперсионного анализа (ОФДА) и апостериорных тестов Тьюки при использовании GraphPAD Instat (программное обеспечение GraphPAD, Сан-Диего, Калифорния). Статистическая значимость была взята при значении р<0,05.
Результаты
Результаты для Tri02 изображены на Фиг. 9 и 10, в которых значения n, изображенные на последовательных графиках, относятся к числу повторных экспериментов. Как видно, 1 мкМ T30 увеличивает приток кальция и активность АХЭ, и, как показано в предыдущей работе (см. WO 2005/004430), 1 мкМ NBP14 защищает от этих токсических воздействий.
Дополнительно, как можно видеть на Фиг. Tri02 также четко защищает от токсического воздействия T30 путем снижения и притока кальция, и активности АХЭ. Следовательно, авторы изобретения убеждены, что Tri02 является нейропротекторным и из-за его меньшего размера, чем у NBP-14, будет иметь гораздо больше шансов пройти через гематоэнцефалический барьер.
Результаты для Tri04 изображены на Фиг. 26. Как можно видеть, Tri04 также защищает от токсических воздействий T30 посредством уменьшения притока кальция
Пример 5 - Оценка соединения 1 в срезах мозга
Авторы изобретения испытали NBP-14 и Tri02 в исследованиях срезов головного мозга при использовании визуализации с помощью потенциал-чувствительного красителя (VSDI).
Материалы и способы
1. Подготовка среза мозга
Самцов крыс Вистар (возрастом 14 дней) анестезировали при применении изофлурана (~15 мл, 100% мас./мас.). Изофлуран наносили на хлопковую подстилку в нижней части камеры для анестезии (стеклянная коробка 20×15×15 см), куда затем помещали крыс на около 45 с до достижения полной анестезии. Чтобы проверить соответствующую глубину анестезии заднюю лапу каждой анестезированной крысы ущипнули. После подтверждения анестезии крыс быстро декапитировали, мозг быстро извлекли и погрузили в ледяную оксигенированную "разделенную" искусственную спинномозговую жидкость (aCSF в ммоль: 120 NaCl, 5 KCl, 20 NaHCO3, 2,4 CaCl2, 2 MgSO4, 1,2 KH2PO4, 10 глюкозы, 6,7 HEPES соли и 3,3 HEPES кислоты; pH = 7,1). Затем были взяты корональные срезы (толщиной 400 мкм) из блока головного мозга, содержащего базальный отдел переднего мозга, а именно комплекс MS-dBB (между +9,20 и + 9,48 мм интерауральный и +0,48 и +0,2 мм брегма, Фиг. 4А) и соматосенсорную зону коры головного мозга (S1BF, от +8,08 до +7,20 мм интерауральный и от -0,92 до -1,80 мм брегма) (Paxinos and Watson, 1998), с применением Vibratome (Leica VT1000S). Затем ломтики перенесли в барботер, содержащий оксигенированный aCSF при комнатной температуре (запись aCSF в ммоль: 124 NaCl, 5 KCL, 20 NaHCO3, 2,4 CaCl2, 2 MgSO4, 1,3 KH2PO4, 10 глюкоза; pH = 7,4), который был идентичен используемому в записи VSDI (визуализация с помощью потенциал-чувствительного красителя). Затем срезы оставили на около 1-1,5 часа до их подготовки к окрашиванию VSD.
2. Настройка VSD
Срезы поместили в темную камеру с высокой влажностью, заполненную aCSF, барботируемым 95 % O2, 5 % CO2. В камере на срезы нанесли раствор красителя (4 % 0,2 мМ стириловый краситель пиридиния 4-[2-[6-(дибутиламино)-2-нафталинил]этенил]-1-(3-сульфопропил)гидроксид (Di-4-NEPPS), Invitrogen, Пейсли, Великобритания, в 48 % aCSF, 48 % фетальной бычьей сыворотки, 3,5 % DMSO и 0,4 % кремофорного EL (Tominaga et al., 2000), в течение 20-25 минут, после чего перенесли обратно в барботер, содержащий оксигенированный aCSF, выдержали при комнатной температуре в течение 30 минут.
Когда начались записи VSDI, срезы поместили в ванну для записи на небольшой кусочек фильтровальной бумаги, чтобы на нижнюю сторону среза капал оксигенированный aCSF и чтобы он оставался живым. Затем срез придавили самодельной пластиковой сеткой, которую расположили сверху среза. Перфузируемый раствор в ванне нагрели до 30±1°С с помощью ступенчатого нагревателя. Концентрический биполярный стимулирующий электрод (FHC, Мэн, США) поместили в переднюю диагональную область базального отдела переднего мозга со стимуляцией, установленной на 30 В. Для сбора данных VSD были записаны 2-мерные изображения, эквивалентные 88×60 пикселям, при использовании камеры высокого разрешения MiCam02 (Brain Vision, Япония) с программным обеспечением обработки изображений BV_Analyze. Получение изображений было соединено с программным обеспечением Spike2 V4.23 (CED Ltd, Кембридж, Великобритания) для синхронизации захвата изображенияс протоколом стимуляции (каждые 28 с при 30 повторениях) через Micro 1401 MkII (CED Ltd, Кембридж, Великобритания). Свет получали с помощью галогеновой ксенофотной лампы Osram 64634 HLX EFR Display/Optic и фильтровали для получения излучения зеленого света (530 ± 10 нм) с помощью MHF-G150LR (Moritex Corporation), соединенного с системой формирования изображений высокого разрешения MiCam02, и фильтровали излучаемую флуоресценцию через фильтр верхних частот >590 нм.
3. Подготовка и применение лекарств
Пептид ацетилхолинэстераза (АХЭ) из 30 С-концевых аминокислот (T30); последовательность:'N' - KAEFHRWSSYMVHWKNQFDHYSKQDRCSDL - SEQ ID No: 1), циклическая версия активной области T30 из 14 аминокислот (NBP14; последовательность: c [AEFHRWSSYMVHWK] - SEQ ID No: 2;c[]=циклическая, от N-концевой до С-концевой) и инертный пептид из 15 аминокислот, содержащийся в последовательности Т30 (Т15; последовательность: 'N' - NQFDHYSKQDRCSDL - SEQ ID No: 3), были специально синтезированы и приобретены у Genosphere Biotechnologies (Париж, Франция) с чистотой >99%. Линейный пептидомиметик Tri02 был разработан in silico Iproteos (Барселона, Испания) и синтезирован и приобретен у Genosphere Biotechnologies с чистотой >99%. Все исходные лекарства и пептиды готовили до экспериментов в замороженных аликвотах. Для получения перфузионных растворов исходные растворы размораживали и при необходимости вводили в aCSF для записи, и применяли ванну с постоянной скоростью перфузии 1,5 мл/мин при использовании перистальтического насоса Minipulse 3 (Gilson Scientific Ltd., Бедфордшир, Великобритания). Каждое экспериментальное испытание длилось 52 минуты, из них 20 минут для установления исходной записи (перфузия с записью только aCSF), 12 минут, чтобы позволить раствору лекарственного средства перфузироваться в ванну, а также позволить молекулам красителя вновь зафиксироваться в мембранах клеток и, наконец, 20-минуный период записи измерения ответа в присутствии раствора лекарственного препарата.
4. Анализ данных и статистика
Из двухмерных изображений, полученных для каждого состояния лекарства, извлекли критические данные, а именно зависимость активации от времени, интенсивность и отклонение общего флуоресцентного сигнала. Эти данные обработали с помощью специального сценария для преобразования их в пригодные для использования файлы MatLab (Mathworks Inc., Массачусетс, США), а затем проанализировали с помощью набора инструментов Matlab, специально созданного для анализа данных VSDI (Bourgeois et al., 2014). Этот набор инструментов позволяет выбрать геометрию фиксированной области интереса (ROI), которую можно применить к каждому срезу, чтобы извлечь и сопоставить данные из идентичного ROI по всем срезам, использованным в каждом эксперименте. Для срезов базального отдела переднего мозга ROI, который будет использоваться, представляет собой комплекс MSdBB, выбранный, поскольку он охватывает MS (медиальные ядра перегородки), VDB (вентральную диагональную ветвь) и HDB (горизонтальную диагональную ветвь). Что еще более важно, этот ROI был выбран для того, чтобы включить всю вызванную реакцию. Этот ответ может быть нанесен в виде одного усредненного временного ряда или по пространству и времени на «карте пространства-времени», чтобы обеспечить качественное описание данных. Однако для получения количественных значений была рассчитана площадь под временным рядом (суммированное относительное изменение флуоресценции) между моментом стимуляции (t=0) и 156 мс после этого. Из-за непостоянства ответов, наблюдаемых между каждым отдельным срезом, первичные данные, полученные в каждом эксперименте, были нормализованы относительно их собственной исходной записи, чтобы получить нормализованные значения флуоресценции. Этот метод количественного определения был выбран для учета множества компонентов сигнала, генерируемого VSDI (Chemla and Chavane, 2010), а именно немедленного пика и ответа с большой задержкой (Badin et al., 2016). Статистика выполнялась в Prism Graphpad 6.
5. Анализ модуляторных пептидов
При экспериментах, в которых применялся Т30, наблюдалось увеличение или уменьшение сигнала. Следовательно, после усреднения этих результатов никаких изменений обнаружено не было. Однако, учитывая прошлые наблюдаемые модулирующие воздействия этого пептида в различных препаратах (Bon and Greenfield, 2003, Day and Greenfield, 2004, Greenfield et al., 2004, Badin et al., 2013) и тот факт, что изменения, вызванные применением T30 в этом типе препарата, умеренно отрицательно коррелированны (r = -0,4286, p = 0,0257, ранговая корреляция Спирмена, n = 27, Фиг. 13A) с исходной интенсивностью отклика, было решено, что эти результаты должны быть поделены на две части в зависимости от того, наблюдалось увеличение или уменьшение.
Впоследствии аналогичный корреляционный анализ выполняли для каждого эксперимента, в котором вводили экзогенное соединение (Фиг. 13). Затем, после определения значимости корреляции, данные классифицировали на основании того, наблюдалось ли увеличение или уменьшение.
Результаты
Ссылаясь на Фиг. 2, 11 и 12, введение 4 мкМ Tri02 повторяет результаты, полученные при применении 4 мкМ NBP14.
Как изображено на Фиг.11, введение NBP14 (4 мкМ) к перфузату вызывало небольшие незначительные изменения величины (суммарной флуоресценции) вызванных откликов. Было обнаружено, что эти индуцированные изменения, хотя они и незначительны, обратно коррелируют с величиной исходного отклика; в результате данные были разделены на испытания, которые вызвали небольшое уменьшение (левые гистограммы) и те, которые вызвали увеличение (правые гистограммы), как в реальном (верхнем), так и в нормализованном (нижнем) формате данных. Если рассматривать их вместе, набор данных не будет показывать никаких изменений по сравнению с исходным (так как увеличение и уменьшение будут компенсировать друг друга), однако крайне важно было проверить, что NBP14 не вызывает значительных влияний, даже когда изменения флуоресценции рассматривались отдельно.
Как изображено на Фиг. 12, введение Tri02 (4 мкМ) к перфузату вызвало небольшие изменения величины (суммарной флуоресценции) вызванных откликов, при этом вызванное снижение (n=8 из 11 в общей сложности) показало значительное отклонение от нормализованного исходного уровня (левая нижняя гистограмма, р<0,05). Эти изменения также оказались обратно коррелированными с величиной исходного отклика; в результате данные были разделены на испытания, которые вызвали уменьшение (левые гистограммы) и те, которые вызвали увеличение (правые гистограммы), как в реальном (вверху), так и в нормализованном (внизу) формате данных. Если рассматривать их вместе, набор данных не будет показывать никаких изменений по сравнению с исходным (так как увеличения и уменьшения будут компенсировать друг друга), однако крайне важно было проверить, что NBP14 не вызывает значительных влияний, даже когда изменения флуоресценции рассматривались отдельно.
Анализ модуляторных пептидомиметиков
На Фиг. 13 изображен корреляционный анализ данных Tri02 (4 мкМ) и T30 (2 мкМ) (n = 15), показывающий, что их совместная перфузия вызывает некоторые изменения в величине вызванных откликов, причем некоторые срезы демонстрируют небольшое увеличение активность (n=6), в то время как большинство показало небольшое снижение (n=9). Эта корреляция была признана значимой (p=0,0405; r2=-0,534), что дает обоснование для разделения данных на те, которые показали увеличение и уменьшение вызванной активности в результате применения Tri02 и T30, как это было сделано в случае введения NBP14 и Tri02 (Фиг. 11 и 12, соответственно).
На Фиг. 14 изображена количественная оценка эффектов, опосредованных добавлением Tri02 и T30: в случае и индуцированного увеличения, и снижения, не было обнаружено, что Tri02 защищает от вызванных T30 отклонений от исходной линии, со значительным снижением (левая панель, р<0,01, n=9) и увеличением (правая панель, р<0,05, n=6) в общих влияниях.
Как изображено на Фиг. 15, общий линейный график нормированных влияний, соответствующих исходной линии для экспериментов на испытание эффектов нормального aCSF (черная линия), 2 мкМ T30 (красные линии), T30 (2 мкМ) и 4 мкМ NBP14 (синие линии), T30 (2 мкМ) и 4 мкМ Tri02, контрольных экспериментов с NBP14 (4 мкМ) (Фиг. 11, оранжевые линии), контрольных экспериментов с Tri02 (4 мкМ) (Фиг. 12, фиолетовые линии). На этом графике изображено нормализованное уменьшение относительно исходной записи и друг друга, причем один только T30 вызывает наибольшее отклонение, а Tri02 демонстрирует некоторую эффективность в блокировании этого вызванного T30 отклонения, но при этом значительные изменения все еще имеют место при их совместной перфузии (зеленые линии).
Пример 6 - Фармакокинетика
Авторы изобретения исследовали продукты разложения NBP-14, Tri-02 и Tri-04 в крови крысы и человека.
Методика
Испытуемые соединения вкалывали в дозе 10 мкг/мл либо в ФСБ, либо в кровь (самец крысы Вистара или человек), разведенную ФСБ, и отбирали серию образцов по следующей схеме:
Прокаин, соединение, известное как нестабильное в крови, было включено в качестве положительного контроля (применялся только при 5-кратном разбавленной крови). Процедура отбора проб заключалась в добавлении аликвоты к ледяному ацетонитрилу, центрифугировании и хранении надосадочной жидкости на сухом льду до анализа.Анализ с помощью УВЭЖХ-времяпролетной МС при использовании электрораспылительной ионизации проводили в тот же день, что и инкубацию.
Результаты
Прокаин показал 60 % и 100 % кругооборота в 5-кратно разведенной крови крысы и человека, соответственно, что указывает на приемлемую метаболическую компетентность для используемой крови, как изображено на Фиг. 22 и 23.
Данные по стабильности NBP-14, Tri-02 и Tri-04 в крови крысы и человека изображены на Фиг. 16-21. NBP-14 продемонстрировал хорошую стабильность и продуктов разложения обнаружено не было. Tri-02 продемонстрировал некоторую нестабильность как в 5-кратно, так и в 20-кратно разведенной крови крысы и человека, и был обнаружен ряд продуктов разложения, что изображено на Фиг. 24. Tri-04 продемонстрировал лучшую стабильность, чем TRI-02, но, тем не менее, некоторые продукты разложения все же были обнаружены в 5-кратно разведенной крови крысы, что изображено на Фиг.25. Соответственно, Tri-02 и Tri-04 стабильны и поэтому являются хорошими потенциальными лекарственными средствами.
Пример 7 - Оценка соединения 3 в срезах мозга
Авторы изобретения испытали Tri04 в исследованиях срезов головного мозга при применении визуализации с помощью потенциал-чувствительного красителя (VSDI).
Материалы и способы
1. Подготовка среза мозга
Срезы мозга готовили, как в Примере 5.
2. Настройка VSD
Срезы поместли в темную камеру с высокой влажностью, заполненную aCSF, барботируемым 95% O2 и 5% CO2. В камере раствор красителя (4% 0,2 мМ стириловый краситель пиридиния 4-[2-[6-(дибутиламино)-2-нафталинил]этенил]-1-(3-сульфопропил)гидроксид (Di-4-ANEPPS, Invitrogen, Paisley, Великобритания) (Tominaga et al., 2000) в aCSF 48 %, эмбриональной бычьей сыворотке 48 %, DMSO 3,5 % и кремофоре EL 0,4 %) нанесли на срезы на 20-25 мин перед тем, как перенести в барботер для aCSF (комнатная температура, 22°С +/- 1,5°С) на 1 час, чтобы смыть избыток красителя и восстановить.
При запуске записи VSD срезы поместили в ванну для записи на небольшой кусочек фильтровальной бумаги, чтобы сохранить срез живым, и придавили соответствующим образом, используя самодельную пластиковую сетку, помещенную сверху на срез. Перфузионный раствор в ванне нагрели до 30±1°С с помощью регенеративного нагревателя. Концентрический биполярный стимулирующий электрод (FHC, Мэн, США) поместили в вентральную диагональную ветвь базального отдела переднего мозга при стимуляции, установленной на 30 В. Для получения данных VSD были записаны 16-битные изображения с разрешением 1 мс на цифровую камеру (Brain Vision MiCAM Ultima R3-V20 Master) с программным обеспечением для обработки изображений Ultima 2004/08 (Brain Vision) в сочетании со Spike 2 V6.0 (CED Ltd, Кембридж, Великобритания), который использовался для запуска стимуляции в отношении соответствующего ISI. Свет получали с помощью галогеновой ксенофотной лампы Osram 64634 HLX EFR Display/Optic и фильтровали для выделения зеленого (530 +/- 10 нм) света с помощью MHF-G150LR (Moritex Corporation), подключенного к сверхбыстрой системе формирования изображений MiCAM Ultima, и фильтровали излучаемую флуоресценция через фильтр верхних частот >590 нм.
3. Подготовка и применение лекарств
Линейный пептидомиметик, Tri04, был разработан in silico Iproteos (Барселона, Испания) и синтезирован и приобретен у Genosphere Biotechnologies с чистотой >99 %. До экспериментов все запасы лекарств и пептидов готовили в замороженных аликвотах. Для получения перфузионных растворов исходные растворы размораживали и при необходимости добавляли для записи aCSF и применяли ванну с постоянной скоростью перфузии 1,5 мл/мин при использовании перистальтического насоса Minipulse 3 (Gilson Scientific Ltd., Бедфордшир, Великобритания). Каждое экспериментальное испытание длилось 52 минуты, из них 20 минут для получения исходной записи (перфузия с записью только aCSF), 12 минут для перфузирования раствора лекарственного средства в ванне, а также для повторного фиксирования молекул красителя в мембранах клеток и наконец, 15-минутный период записи для измерения отклика в присутствии раствора препарата.
5. Анализ модуляторных пептидов
В большинстве экспериментов, в которых применяли T30, наблюдалось снижение сигнала. T30 способствовал полному ингибированию (n=21) в записанном сигнале VSDI в базальном отделе переднего мозга крыс p14, это значение фактически включает меньшую часть случаев, при которых во время перфузии Т30 наблюдались незначительные или незначительно положительные эффекты (Badin et al., 2016).
Результаты и обсуждение
Обращаясь к Фиг. 27, 28 и 29, введение 4 мкМ Tri04 повторяет результаты, ранее наблюдавшиеся при применении 4 мкМ NBP14, тогда как 2 мкМ Tri04 в перфузионном растворе определяет значительное влияние на совокупную активность базального отдела переднего мозга.
Анализ модуляторных пептидомиметиков
На Фиг. 27А изображено, что пространственно-временнные карты демонстрируют восстановление активности базального отдела переднего мозга благодаря присутствию 2 мкМ Tri04 в перфузате, содержащем 2 мкМ Т30 (n=29). Конкретнее, 2 мкМ Tri04 определяет угасание ингибирующего влияния Т30 по сравнению с активностью, измеренной посредством прямой стимуляции базального отдела переднего мозга крысы.
На Фиг. 27B гистограммы, относящиеся к 3 периодам записи, показывают изменения вызванного отклика после применения Tri04, подтверждая, что совместная перфузия с 2 мкМ Tri04 способствует увеличению сетевой активности (n=29, p=0,06, двусторонний парный t-критерий), вызванному ингибированием вызванных T30 эффектов.
На Фиг. 28 изображено, что временные ряды откликов для трех условий записи (исходный, применение T30 к искусственной спинномозговой жидкости (aCSF) и совместное применение T30 и Tri04 к aCSF) показывают аналогичный профиль активации для записей T30 и T30+Tri04 в течение первых 100 мсек, в то время как более высокая активность в записях, сделанных в присутствии Tri04, обнаруживается впоследствии, подтверждая защитную роль Tri04 по сравнению с T30.
На Фиг. 29 изображены гистограммы, относящиеся к трем условиям записи. Совместная перфузия с 4 мкМ Tri04 в искусственной спинномозговой жидкости (aCSF), содержащей 2 мкМ T30, определяет значительный эффект, изменяющий активность T30. В частности, было обнаружено, что Tri04 защищает от вызванных T30 отклонений от исходной записи со значительным увеличением (n=20, p<0,05, двусторонний парный t-критерий) активности базального отдела переднего мозга по сравнению с записями в присутствии только Т30. Следовательно, Tri04 демонстрирует некоторую эффективность в блокировании токсических воздействий T30 на среднемасштабную активность сети.
Реферат
Изобретение относится к новым пептидам, их фармацевтическим композициям и применению для облегчения или профилактики нейродегенеративных заболеваний. 3 н. и 13 з.п. ф-лы, 29 ил., 3 табл., 7 пр.
Формула