Гетероциклические арилсульфоны, пригодные для лечения расстройств, которые отвечают на модулирование 5ht6 рецепторов - RU2451012C2
Код документа: RU2451012C2
Описание
Уровень техники
Настоящее изобретение относится к новым гетероциклическим соединениям. Эти соединения обладают ценными терапевтическими свойствами и пригодны, в частности, для лечения заболеваний, которые отвечают на модулирование серотонинового рецептора 5HT6.
Серотонин (5-гидрокситриптамин, 5HT), моноаминовый нейротрансмиттер и местный гормон, образуется путем гидроксилирования и декарбоксилирования триптофана. Наибольшая концентрация образуется в энтерохромаффинных клетках желудочно-кишечного тракта, остальное количество преимущественно находится в тромбоцитах и в центральной нервной системе (ЦНС). 5НТ задействован в большом количестве физиологических и патофизиологических процессов. На периферии он вызывает сокращение ряда гладких мышц и вызывает эндотелийзависимую вазодилатацию. В ЦНС, как предполагают, он вовлечен в широкий диапазон функций, включая контроль аппетита, настроения, тревожности, галлюцинаций, сна, рвоты и болевой чувствительности.
Нейроны, которые секретируют 5НТ, обозначаются как серотонинергические. Функция 5НТ опосредуется через его взаимодействие со специфическими (серотонинергическими) нейронами. До настоящего времени было идентифицировано семь типов рецепторов 5НТ: 5HT1 (с подтипами 5HT1A, 5HT1B, 5HT1D, 5HT1E и 5HT1F), 5HT2 (с подтипами 5HT2A, 5HT2B и 5HT1C), 5HT3, 5HT4, 5HT5 (с подтипами 5HT1A и 5HT1B), 5HT6 и 5HT7. Большинство из этих рецепторов сопряжено с G-белками, которые воздействуют на активность либо аденилатциклазы, либо фосфолипазы Cγ. Человеческие 5HT6 рецепторы позитивно сопряжены с аденилатциклазой. Они распространены по лимбической, стриарной и кортикальной областям головного мозга и демонстрируют высокое сродство к антипсихотическим средствам.
Модулирование 5HT6 рецепторов подходящими веществами, как ожидается, корректирует некоторые расстройства, включая когнитивные дисфункции, такие как дефицит памяти, познавательной способности и обучения, в частности связанное с болезнью Альцгеймера возрастное когнитивное снижение и легкое когнитивное нарушение, синдром дефицита внимания/гиперактивности, расстройства личности, такие как шизофрения, в частности когнитивные дефициты, связанные с шизофренией, аффективные расстройства, такие как депрессия, тревожность и обсессивно-компульсивные расстройства, двигательные или моторные расстройства, такие как болезнь Паркинсона и эпилепсия, мигрень, расстройства сна (включая нарушение циркадного ритма), расстройства питания, такие как анорексия и булимия, некоторые желудочно-кишечные расстройства, такие как синдром раздраженной кишки, заболевания, связанные с нейродегенерацией, такие как удар, спинномозговая травма, травма головы или повреждения головы, такие как гидроцефалия, лекарственная зависимость и ожирение.
Другим нейротрансмиттером, задействованным в ЦНС, является допамин. Расстройства допаминергической трансмиттерной системы приводят к заболеваниям центральной нервной системы, которые включают, например, шизофрению, депрессию и болезнь Паркинсона. Эти заболевания и другие лечатся лекарственными средствами, которые взаимодействуют с допаминовыми рецепторами.
Допаминовые рецепторы подразделяются на два семейства. С одной стороны, существует группа D2, включающая D2, D3 и D4 рецепторы, и, с другой стороны, группа D1, включающая D1 и D5 рецепторы. В то время как D1 и D2 рецепторы широко распространены, D3 рецепторы экспрессируются региоселективно. Таким образом, эти рецепторы предпочтительно обнаруживаются в лимбической системе и проецируемых областях мезолимбической допаминовой системы, особенно в прилегающем ядре, но также и в других областях, таких как олива. За счет своей сравнительно региоселективной экспрессии рецепторы D3 рассматриваются в качестве мишени, имеющей немногие побочные эффекты, и предполагается, что в то время как избирательный D3 лиганд имеет свойства известных антипсихотических средств, он не будет иметь их неврологических побочных эффектов, опосредованных допаминовым рецептором D2 (P.Sokoloff et al., Localization and Function of the D3 Dopamine Receptor, Arzneim. Forsch./Drug Res. 42(1), 224 (1992); P.Sokoloff et al. Molecular Cloning and Characterization of a Novel Dopamine Receptor (D3) as a Target for Neuroleptics, Nature, 347, 146 (1990)).
Соединения, обладающие сродством к допаминовому D3 рецептору, были описаны в уровне техники в различных источниках, например в WO 95/04713, WO 96/23760, WO 97/45503, WO 99/58499 и в неопубликованной международной патентной заявке PCT/EP 2005/011106.
Соединения, обладающие сродством к 5HT6 рецептору, также были описаны в прототипах, например в WO 2005/037830, WO 2005/026125, WO 00/05225 и WO 98/27081. Тем не менее, их сродство и избирательность по отношению к 5HT6 рецептору или их фармакологический профиль не является удовлетворительным.
Задачей настоящего изобретения является создание соединений, которые обладают высоким сродством и избирательностью в отношении 5HT6 рецепторов и, необязательно, высоким сродством и избирательностью (в частности, относительно D2) по отношению к допаминовому рецептору D3, тем самым позволяя лечить расстройства, связанные с или восприимчивые к 5HT6 рецепторам. Соединения, обладающие сродством к обоим рецепторам, как ожидается, будут пригодны для лечения расстройств, связанных с или восприимчивых к обоим, 5HT6 рецептору и D3 рецептору, тем самым позволяя лечить более одного проявления соответствующего расстройства.
Эти соединения также будут обладать хорошим фармакологическим профилем, например хорошим соотношением концентраций в головном мозге и в плазме, хорошей биодоступностью, хорошей метаболической стабильностью или сниженным ингибированием митохондриального дыхания.
Сущность изобретения
Изобретение основывается на задаче обеспечения соединениями, которые действуют в качестве 5HT6 рецепторных лигандов. Поставленная задача неожиданно достигается посредством соединений формулы I

где
n имеет значение 0, 1 или 2;
G представляет собой CH2 или CHR3;
R1 представляет собой Н, C1-C6-алкил, C1-C6-алкил, замещенный C3-C6-циклоалкилом, C1-C6-гидроксиалкил, фторированный C1-C6-алкил, C3-C6-циклоалкил, фторированный C3-C6-циклоалкил, C3-C6-алкенил, фторированный C3-C6-алкенил, формил, ацетил, пропионил или бензил;
R2, R3 и R4 независимо друг от друга представляют собой H, метил, фторметил, дифторметил или трифторметил;
A представляет собой 1,4-фенилен или 1,3-фенилен, который необязательно замещен одним, двумя, тремя или четырьмя заместителями, выбранными из галогена, C1-C4-алкила, C1-C4-алкокси, фторированного C1-C4-алкила и фторированного C1-C4-алкокси;
E представляет собой NR5 или CH2, где R5 представляет собой Н или C1-C3-алкил;
Ar представляет собой радикал формулы A, B, C, D, E, F или G
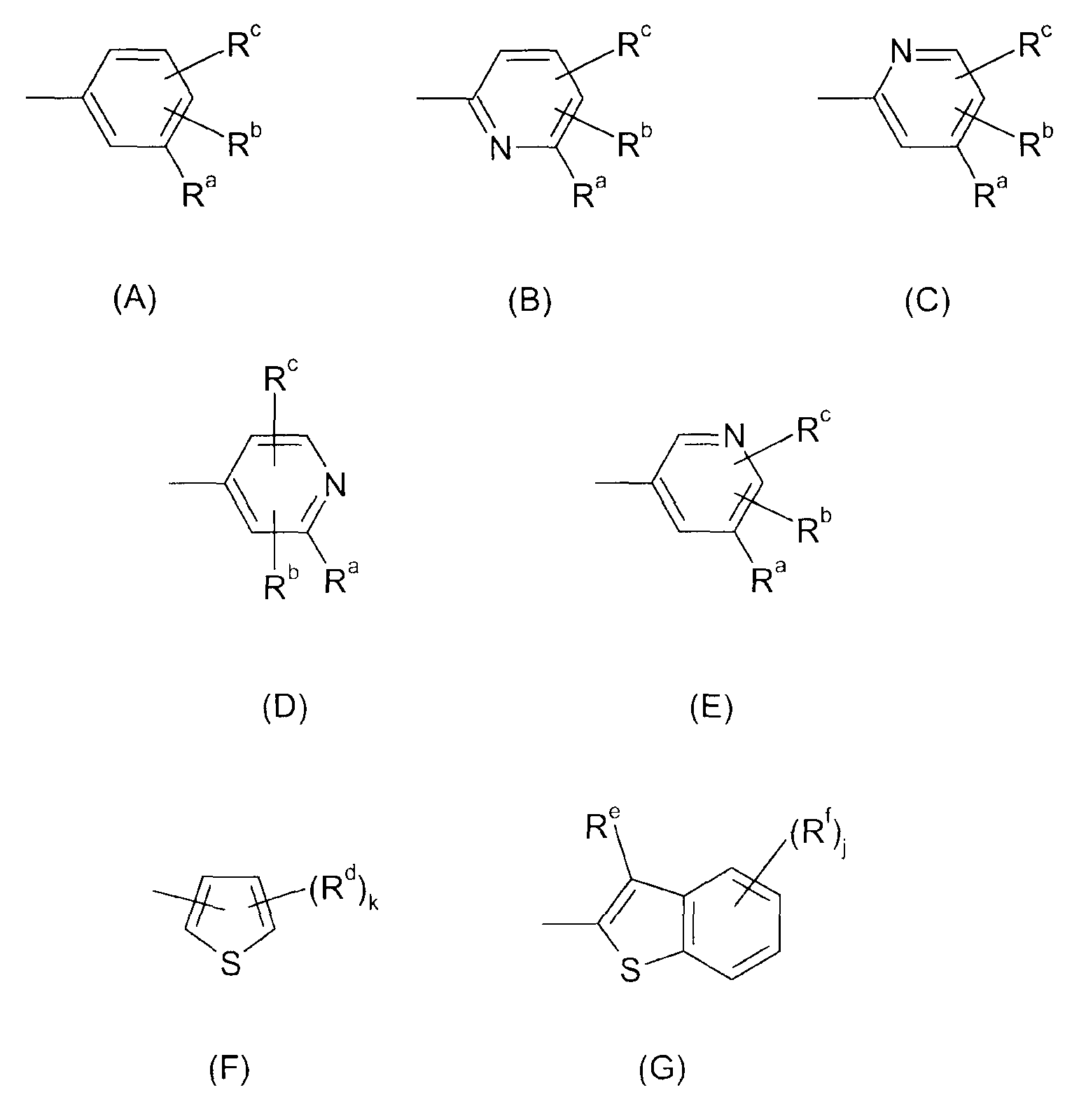
где
Ra представляет собой галоген, гидроксил, C1-C6-алкил, фторированный C1-C6-алкил, C1-C6-гидроксиалкил, C1-C6-алкокси-C1-C6-алкил, C2-C6-алкенил, фторированный C2-C6-алкенил, C3-C6-циклоалкил, фторированный C3-C6-циклоалкил, C1-C6-алкокси, C1-C6-гидроксиалкокси, C1-C6-алкокси-C1-C6-алкокси, фторированный C1-C6-алкокси, C1-C6-алкилтио, фторированный C1-C6-алкилтио, C1-C6-алкилсульфинил, фторированный C1-C6-алкилсульфинил, C1-C6-алкилсульфонил, фторированный C1-C6-алкилсульфонил, фенилсульфонил, пиридилсульфонил, бензилокси, фенокси, фенил, где фенильный и пиридильный радикал в пяти последних упомянутых радикалах может быть незамещенным или может нести от 1 до 3 заместителей, выбранных из C1-C4-алкила, фторированного C1-C4-алкила и галогена, CN, нитро, C1-C6-алкилкарбонила, фторированного C1-C6-алкилкарбонила, C1-C6-алкилкарбониламино, фторированного C1-C6-алкилкарбониламино, карбокси, NH-C(O)-NR6R7, NR6R7, NR6R7-C1-C6-алкилена, O-NR6R7, где R6 и R7 независимо друг от друга представляют собой H, C1-C4-алкил, фторированный C1-C4-алкил или C1-C4-алкокси, или могут образовывать вместе с N 4-, 5- или 6-членное насыщенное или ненасыщенное кольцо, R9-CO-NR6-C1-C6-алкилен, где R6 определен выше и R9 представляет собой C1-C4-алкил или фенил, где фенильный радикал может быть незамещенным или может нести от 1 до 3 заместителей, выбранных из C1-C4-алкила, фторированного C1-C4-алкила и галогена, CH2-пиридил, где пиридильный радикал может быть незамещенным или может нести от 1 до 3 заместителей, выбранных из C1-C4-алкила, фторированного C1-C4-алкила и галогена, или представляет собой насыщенное или ненасыщенное ароматическое или неароматическое 3-7-членное гетероциклическое кольцо, содержащее в качестве членов кольца 1, 2, 3 или 4 гетероатома, выбранных из N, O и S, и/или 1, 2 или 3 содержащие гетероатом группы, выбранные из NR8, где R8 представляет собой Н, C1-C4-алкил, фторированный C1-C4-алкил, C1-C4-алкилкарбонил или фторированный C1-C4-алкилкарбонил, SO, SO2 и CO, и где гетероциклическое кольцо может нести 1, 2 или 3 заместителя, выбранных из гидрокси, галогена, C1-C6-алкила, фторированного C1-C6-алкила, C1-C6-алкокси, фторированного C1-C6-алкокси, C1-C6-алкилтио, фторированного C1-C6-алкилтио, NR6R7-C1-C6-алкилена, где R6 и R7 определены выше, карбоксила и C1-C4-алкилоксикарбонила;
Rb и Rc независимо друг от друга представляют собой H, галоген, CH3, OCH3, CH2F, OCH2F, CHF2, OCHF2, CF3, OCF3, CH2CH2F, OCH2CH2F, CH2CHF2, OCH2CHF2, CH2CF3 или OCH2CF3;
Rd определен как Ra;
Re представляет собой Н или определен как Ra;
Rf определен как Ra;
k имеет значение 0, 1, 2 или 3; и
j имеет значение 0, 1, 2, 3 или 4;
при условии, что Ra не является F, CH2F, CHF2, CF3 или OCF3, если A представляет собой 1,4-фенилен, Ar представляет собой радикал формулы (A) и Rb и Rc представляют собой Н или галоген;
за исключением соединений, где R1 представляет собой пропил, G представляет собой CH2, n имеет значение 1, A представляет собой 1,4-фенилен, E представляет собой NH, Ar представляет собой радикал формулы (F) и Rd представляет собой галоген, C1-C6-алкил, C2-C6-алкенил или 5-членное гетероароматическое кольцо;
и их физиологически приемлемые кислотно-аддитивные соли.
Настоящее изобретение, таким образом, относится к соединениям общей формулы I и к их физиологически приемлемым кислотно-аддитивным солям.
В конкретном воплощении соединений формулы I Ar представляет собой радикал формулы (A), (B), (C), (D) или (E), где заместители имеют следующие значения:
Ra представляет собой галоген, C1-C6-алкил, фторированный C1-C6-алкил, C1-C6-гидроксиалкил, C1-C6-алкокси-C1-C6-алкил, C2-C6-алкенил, фторированный C2-C6-алкенил, C3-C6-циклоалкил, фторированный C3-C6-циклоалкил, C1-C6-алкокси, C1-C6-гидроксиалкокси, C1-C6-алкокси-C1-C6-алкокси, фторированный C1-C6-алкокси, C1-C6-алкилтио, фторированный C1-C6-алкилтио, C1-C6-алкилсульфинил, фторированный C1-C6-алкилсульфинил, C1-C6-алкилсульфонил, фторированный C1-C6-алкилсульфонил, фенилсульфонил, бензилокси, фенокси, где фенильный радикал в трех последних упомянутых радикалах может быть незамещенным или может нести от 1 до 3 заместителей, выбранных из C1-C4-алкила, фторированного C1-C4-алкила и галогена, CN, нитро, C1-C6-алкилкарбонила, фторированного C1-C6-алкилкарбонила, C1-C6-алкилкарбониламино, фторированного C1-C6-алкилкарбониламино, карбокси, NH-C(O)-NR6R7, NR6R7, NR6R7-C1-C6-алкилена, O-NR6R7, где R6 и R7 независимо друг от друга представляют собой H, C1-C4-алкил, фторированный C1-C4-алкил или C1-C4-алкокси, или могут образовывать вместе с N 4-, 5- или 6-членное насыщенное или ненасыщенное кольцо, или представляет собой насыщенное или ненасыщенное 3-7-членное гетероциклическое кольцо, включающее в качестве членов кольца 1, 2, 3 или 4 гетероатома, выбранных из N, O и S, и/или 1, 2 или 3 содержащие гетероатом группы, выбранные из NR8, где R8 представляет собой Н, C1-C4-алкил, фторированный C1-C4-алкил, C1-C4-алкилкарбонил или фторированный C1-C4-алкилкарбонил, SO, SO2 и CO, и где гетероциклическое кольцо может нести 1, 2 или 3 заместителя, выбранных из гидрокси, галогена, C1-C6-алкила, фторированного C1-C6-алкила и C1-C6-алкокси; и
Rb и Rc независимо друг от друга представляют собой H, галоген, CH3, OCH3, CHF2, OCHF2, CF3 или OCF3;
при условии, что Ra не является F, CH2F, CHF2, CF3 или OCF3, если A представляет собой 1,4-фенилен и Rb и Rc представляют собой Н или галоген;
и их физиологически приемлемые кислотно-аддитивные соли.
Настоящее изобретение также относится к фармацевтической композиции, которая содержит, по меньшей мере, одно соединение формулы I и/или, по меньшей мере, одну физиологически приемлемую кислотно-аддитивную соль формулы I, причем вместе с соответствующими физиологически приемлемыми носителями и/или вспомогательными субстанциями.
Настоящее изобретение также относится к способу лечения расстройств, которые отвечают на воздействие антагонистов 5HT6 рецепторов или агонистов 5HT6, указанный способ включает введение эффективного количества, по меньшей мере, одного соединения формулы I

где
n имеет значение 0, 1 или 2;
G представляет собой CH2 или CHR3;
R1 представляет собой Н, C1-C6-алкил, C1-C6-алкил, замещенный C3-C6-циклоалкилом, C1-C6-гидроксиалкил, фторированный C1-C6-алкил, C3-C6-циклоалкил, фторированный C3-C6-циклоалкил, C3-C6-алкенил, фторированный C3-C6-алкенил, формил, ацетил, пропионил или бензил;
R2, R3 и R4 независимо друг от друга представляют собой H, метил, фторметил, дифторметил или трифторметил;
A представляет собой 1,4-фенилен или 1,3-фенилен, который необязательно замещен одним, двумя, тремя или четырьмя заместителями, выбранными из галогена, C1-C4-алкила, C1-C4-алкокси, фторированного C1-C4-алкила и фторированного C1-C4-алкокси;
E представляет собой NR5 или CH2, где R5 представляет собой Н или C1-C3-алкил;
Ar представляет собой радикал формулы A, B, C, D, E, F или G

где
Ra представляет собой галоген, гидрокси, C1-C6-алкил, фторированный C1-C6-алкил, C1-C6-гидроксиалкил, C1-C6-алкокси-C1-C6-алкил, C2-C6-алкенил, фторированный C2-C6-алкенил, C3-C6-циклоалкил, фторированный C3-C6-циклоалкил, C1-C6-алкокси, C1-C6-гидроксиалкокси, C1-C6-алкокси-C1-C6-алкокси, фторированный C1-C6-алкокси, C1-C6-алкилтио, фторированный C1-C6-алкилтио, C1-C6-алкилсульфинил, фторированный C1-C6-алкилсульфинил, C1-C6-алкилсульфонил, фторированный C1-C6-алкилсульфонил, фенилсульфонил, пиридилсульфонил, бензилокси, фенокси, фенил, где фенильный и пиридильный радикал в пяти последних упомянутых радикалах может быть незамещенным или может нести от 1 до 3 заместителей, выбранных из C1-C4-алкила, фторированного C1-C4-алкила и галогена, CN, нитро, C1-C6-алкилкарбонила, фторированного C1-C6-алкилкарбонила, C1-C6-алкилкарбониламино, фторированного C1-C6-алкилкарбониламино, карбокси, NH-C(O)-NR6R7, NR6R7, NR6R7-C1-C6-алкилена, O-NR6R7, где R6 и R7 независимо друг от друга представляют собой H, C1-C4-алкил, фторированный C1-C4-алкил или C1-C4-алкокси, или могут образовывать вместе с N 4-, 5- или 6-членное насыщенное или ненасыщенное кольцо, R9-CO-NR6-C1-C6-алкилен, где R6 определен выше и R9 представляет собой C1-C4-алкил или фенил, где фенильный радикал может быть незамещенным или может нести от 1 до 3 заместителей, выбранных из C1-C4-алкила, фторированного C1-C4-алкила и галогена, CH2-пиридил, где пиридильный радикал может быть незамещенным или может нести от 1 до 3 заместителей, выбранных из C1-C4-алкила, фторированного C1-C4-алкила и галогена, или представляет собой насыщенное или ненасыщенное ароматическое или неароматическое 3-7-членное гетероциклическое кольцо, включающее в качестве членов кольца 1, 2, 3 или 4 гетероатома, выбранных из N, O и S, и/или 1, 2 или 3 содержащие гетероатом группы, выбранные из NR8, где R8 представляет собой Н, C1-C4-алкил, фторированный C1-C4-алкил, C1-C4-алкилкарбонил или фторированный C1-C4-алкилкарбонил, SO, SO2 и CO, и где гетероциклическое кольцо может нести 1, 2 или 3 заместителя, выбранных из гидрокси, галогена, C1-C6-алкила, фторированного C1-C6-алкила, C1-C6-алкокси, фторированного C1-C6-алкокси, C1-C6-алкилтио, фторированного C1-C6-алкилтио, NR6R7-C1-C6-алкилена, где R6 и R7 определены выше, карбоксила и C1-C4-алкилоксикарбонила;
Rb и Rc независимо друг от друга представляют собой H, галоген, CH3, OCH3, CH2F, OCH2F, CHF2, OCHF2, CF3, OCF3, CH2CH2F, OCH2CH2F, CH2CHF2, OCH2CHF2, CH2CF3 или OCH2CF3;
Rd определен как Ra;
Re представляет собой Н или определен как Ra;
Rf определен как Ra;
k имеет значение 0, 1, 2 или 3; и
j имеет значение 0, 1, 2, 3 или 4;
и/или, по меньшей мере, одну физиологически приемлемую кислотно-аддитивную соль формулы I субъекту, нуждающемуся в нем.
Настоящее изобретение, кроме того, относится к применению соединения, как определено для указанного выше способа и/или его физиологически приемлемой кислотно-аддитивной соли, для получения фармацевтической композиции для лечения медицинского расстройства, восприимчивого к лечению с помощью лиганда 5HT6 рецептора.
В конкретном воплощении соединение, применяемое в соответствии с изобретением или в способе по изобретению, определено выше, однако с приведенными выше условиями.
В конкретном воплощении применения и способе по изобретению в соединениях формулы I Ar представляет собой радикал формулы (A), (B), (C), (D) или (E), где заместители имеют следующие значения:
R1 представляет собой Н, C1-C6-алкил, C1-C6-алкил, замещенный C3-C6-циклоалкилом, C1-C6-гидроксиалкил, фторированный C1-C6-алкил, C3-C6-циклоалкил, фторированный C3-C6-циклоалкил, C3-C6-алкенил, фторированный C3-C6-алкенил, формил, ацетил или пропионил;
Ra представляет собой галоген, C1-C6-алкил, фторированный C1-C6-алкил, C1-C6-гидроксиалкил, C1-C6-алкокси-C1-C6-алкил, C2-C6-алкенил, фторированный C2-C6-алкенил, C3-C6-циклоалкил, фторированный C3-C6-циклоалкил, C1-C6-алкокси, C1-C6-гидроксиалкокси, C1-C6-алкокси-C1-C6-алкокси, фторированный C1-C6-алкокси, C1-C6-алкилтио, фторированный C1-C6-алкилтио, C1-C6-алкилсульфинил, фторированный C1-C6-алкилсульфинил, C1-C6-алкилсульфонил, фторированный C1-C6-алкилсульфонил, фенилсульфонил, бензилокси, фенокси, где фенильный радикал в трех последних упомянутых радикалах может быть незамещенным или может нести от 1 до 3 заместителей, выбранных из C1-C4-алкила, фторированного C1-C4-алкила и галогена, CN, нитро, C1-C6-алкилкарбонила, фторированного C1-C6-алкилкарбонила, C1-C6-алкилкарбониламино, фторированного C1-C6-алкилкарбониламино, карбокси, NH-C(O)-NR6R7, NR6R7, NR6R7-C1-C6-алкилена, O-NR6R7, где R6 и R7 независимо друг от друга представляют собой H, C1-C4-алкил, фторированный C1-C4-алкил или C1-C4-алкокси, или могут образовывать вместе с N 4-, 5- или 6-членное насыщенное или ненасыщенное кольцо, или представляет собой насыщенное или ненасыщенное 3-7-членное гетероциклическое кольцо, включающее в качестве членов кольца 1, 2, 3 или 4 гетероатома, выбранных из N, O и S, и/или 1, 2 или 3 содержащие гетероатом группы, выбранные из NR8, где R8 представляет собой Н, C1-C4-алкил, фторированный C1-C4-алкил, C1-C4-алкилкарбонил или фторированный C1-C4-алкилкарбонил, SO, SO2 и CO, и где гетероциклическое кольцо может нести 1, 2 или 3 заместителя, выбранных из гидрокси, галогена, C1-C6-алкила, фторированного C1-C6-алкила и C1-C6-алкокси; и
Rb и Rc независимо друг от друга представляют собой H, галоген, CH3, OCH3, CHF2, OCHF2, CF3 или OCF3;
при условии, что Ra не является F, CH2F, CHF2, CF3 или OCF3, если A представляет собой 1,4-фенилен и Rb и Rc представляют собой Н или галоген.
Подробное описание изобретения
Последующие приведенные замечания касательно предпочтительных аспектов изобретения, например предпочтительных значений переменных соединения I, предпочтительных соединений I и предпочтительных воплощений способа или применения согласно этому изобретению, применимы в каждом случае к ним самим или их комбинациям.
Заболевания, чувствительные к воздействию антагонистов или агонистов 5HT6 рецепторов, включают, в частности, расстройства и заболевания центральной нервной системы, в частности когнитивные дисфункции, такие как дефицит памяти, познавательной способности и обучения, в частности связанное с болезнью Альцгеймера возрастное когнитивное снижение и легкое когнитивное нарушение, синдром дефицита внимания/гиперактивности, расстройства личности, такие как шизофрения, в частности когнитивные дефициты, связанные с шизофренией, аффективные расстройства, такие как депрессия, биполярное расстройство, тревожность и обсессивно-компульсивные расстройства, двигательные или моторные расстройства, такие как болезнь Паркинсона и эпилепсия, мигрень, расстройства сна (включая нарушение циркадного ритма), расстройства питания, такие как анорексия и булимия, некоторые желудочно-кишечные расстройства, такие как синдром раздраженной кишки, заболевания, связанные с нейродегенерацией, такие как удар, спинномозговая травма, травма головы или повреждения головы, такие как гидроцефалия, лекарственная зависимость и ожирение.
В соответствии с изобретением, по меньшей мере, одно соединение общей формулы I, имеющее значения, первоначально упомянутые, применяется для лечения упомянутых выше симптомов. Соединения формулы I данной структуры могут существовать в различных пространственных расположениях, например, если они обладают одним или более центрами асимметрии, полизамещенными кольцами или двойными связями или как различные таутомеры, также возможно использовать энантиомерные смеси, в виде конкретных рацематов, диастереомерных смесей и таутомерных смесей, тем не менее предпочтительны соответствующие особенно чистые энантиомеры, диастереомеры и таутомеры соединений формулы I и/или их солей.
В особенности, атом углерода кольца, содержащего азот, несущего группу A, может иметь (S)- или (R)-конфигурацию. Тем не менее, (S)-конфигурация является предпочтительной.
Более того, радикал A может быть в цис- или трансположении к любому из заместителей R2, R3 или R4 (если, по меньшей мере, один из них не представляет собой водород). Тем не менее, трансположение является предпочтительным.
Аналогично возможно применять физиологически приемлемые соли соединений формулы I, в особенности кислотно-аддитивные соли с физиологически приемлемыми кислотами. Примерами пригодных физиологически приемлемых органических и неорганических кислот являются соляная кислота, бромистоводородная кислота, фосфорная кислота, серная кислота, C1-C4-алкилсульфоновые кислоты, такие как метансульфоновая кислота, ароматические сульфоновые кислоты, такие как бензолсульфоновая кислота и толуолсульфоновая кислота, щавелевая кислота, малеиновая кислота, фумаровая кислота, молочная кислота, винная кислота, адипиновая и бензойная кислота. Другие пригодные для использования кислоты описаны в Fortschritte der Arzneimittelforschung [Advances in drug research], Volume 10, pages 224 ff., Birkhäuser Verlag, Basel and Stuttgart, 1966.
Органические остатки, упомянутые в указанных выше определениях, представляют собой переменные, аналогичные термину «галоген» - общие термины для индивидуальных определений индивидуальных членов группы. Префикс Cn-Cm обозначает в каждом случае возможное число атомов углерода в группе.
Термин «галоген» означает в каждом случае фтор, бром, хлор или йод, в особенности фтор, хлор или бром.
C1-C4 алкил представляет собой алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 4 атомов углерода. Примерами алкильной группы являются метил, этил, н-пропил, изо-пропил, н-бутил, 2-бутил, изо-бутил или трет-бутил. C1-C2 алкил представляет собой метил или этил, C1-C3 алкил представляет собой, кроме того, н-пропил или изопропил.
C1-C6 алкил представляет собой алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 6 атомов углерода. Примеры включают C1-C4 алкил как упомянутую выше и также пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 2,2-диметилпропил, 1-этилпропил, гексил, 1,1-диметилпропил, 1,2-диметилпропил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,2-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1-этил-1-метилпропил и 1-этил-2-метилпропил.
Фторированный C1-C6 алкил представляет собой алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 6, в особенности от 1 до 4 атомов углерода (= фторированный C1-C4 алкил), в особенности от 1 до 3 атомов углерода (= фторированный C1-C3 алкил), где, по меньшей мере, один, например, 1, 2, 3, 4 или все атомы водорода замещены атомом фтора, например, так как во фторметиле, дифторметиле, трифторметиле, (R)-1-фторэтиле, (S)-1-фторэтиле, 2-фторэтиле, 1,1-дифторэтиле, 2,2-дифторэтиле, 2,2,2-трифторэтиле, 1,1,2,2-тетрафторэтиле, (R)-1-фторпропиле, (S)-1-фторпропиле, 2-фторпропиле, 3-фторпропиле, 1,1-дифторпропиле, 2,2-дифторпропиле, 3,3-дифторпропиле, 3,3,3-трифторпропиле, (R)-2-фтор-1-метилэтиле, (S)-2-фтор-1-метилэтиле, (R)-2,2-дифтор-1-метилэтиле, (S)-2,2-дифтор-1-метилэтиле, (R)-1,2-дифтор-1-метилэтиле, (S)-1,2-дифтор-1-метилэтиле, (R)-2,2,2-трифтор-1-метилэтиле, (S)-2,2,2-трифтор-1-метилэтиле, 2-фтор-1-(фторметил)этиле, 1-(дифторметил)-2,2-дифторэтиле, 1-(трифторметил)-2,2,2-трифторэтиле, 1-(трифторметил)-1,2,2,2-тетрафторэтиле, (R)-1-фторбутиле, (S)-1-фторбутиле, 2-фторбутиле, 3-фторбутиле, 4-фторбутиле, 1,1-дифторбутиле, 2,2-дифторбутиле, 3,3-дифторбутиле, 4,4-дифторбутиле, 4,4,4-трифторбутиле и им подобные.
Разветвленный C3-C6 алкил представляет собой алкил, имеющий 3-6 атомов углерода, по меньшей мере, один из которых является вторичным или третичным атомом углерода. Примерами являются изопропил, трет-бутил, 2-бутил, изобутил, 2-пентил, 2-гексил, 3-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 1-метил-1-этилпропил.
Фторированный разветвленный C3-C6 алкил представляет собой алкил, имеющий 3-6 атомов углерода, по меньшей мере, один является вторичным или третичным атомом углерода, где, по меньшей мере, один, например, 1, 2, 3, 4 или все атомы водорода замещены атомом фтора.
C1-C6 алкокси представляет собой алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 6, в особенности от 1 до 4 атомов углерода (= C1-C4 алкокси), которая связана с оставшейся молекулой через атом кислорода. Примеры включают метокси, этокси, н-пропокси, изопропокси, н-бутокси, 2-бутокси, изо-бутокси, трет-бутокси, пентилокси, 1-метилбутокси, 2-метилбутокси, 3-метилбутокси, 2,2-диметилпропокси, 1-этилпропокси, гексилокси, 1,1-диметилпропокси, 1,2-диметилпропокси, 1-метилпентилокси, 2-метилпентилокси, 3-метилпентилокси, 4-метилпентилокси, 1,1-диметилбутилокси, 1,2-диметилбутилокси, 1,3-диметилбутилокси, 2,2-диметилбутилокси, 2,3-диметилбутилокси, 3,3-диметилбутилокси, 1-этилбутилокси, 2-этилбутилокси, 1,1,2-триметилпропокси, 1,2,2-триметилпропокси, 1-этил-1-метилпропокси и 1-этил-2-метилпропокси.
Фторированный C1-C6 алкокси представляет собой алкоксигруппу с прямой или разветвленной цепью, имеющую от 1 до 6, в особенности от 1 до 4 атомов углерода (= фторированный C1-C4 алкокси), где, по меньшей мере, один, например, 1, 2, 3, 4 или все атомы водорода замещены атомами фтора, например, так как в фторметокси, дифторметокси, трифторметокси, (R)-1-фторэтокси, (S)-1-фторэтокси, 2-фторэтокси, 1,1-дифторэтокси, 2,2-дифторэтокси, 2,2,2-трифторэтокси, 1,1,2,2-тетрафторэтокси, (R)-1-фторпропокси, (S)-1-фторпропокси, (R)-2-фторпропокси, (S)-2-фторпропокси, 3-фторпропокси, 1,1-дифторпропокси, 2,2-дифторпропокси, 3,3-дифторпропокси, 3,3,3-трифторпропокси, (R)-2-фтор-1-метилэтокси, (S)-2-фтор-1-метилэтокси, (R)-2,2-дифтор-1-метилэтокси, (S)-2,2-дифтор-1-метилэтокси, (R)-1,2-дифтор-1-метилэтокси, (S)-1,2-дифтор-1-метилэтокси, (R)-2,2,2-трифтор-1-метилэтокси, (S)-2,2,2-трифтор-1-метилэтокси, 2-фтор-1-(фторметил)этокси, 1-(дифторметил)-2,2-дифторэтокси, (R)-1-фторбутокси, (S)-1-фторбутокси, 2-фторбутокси, 3-фторбутокси, 4-фторбутокси, 1,1-дифторбутокси, 2,2-дифторбутокси, 3,3-дифторбутокси, 4,4-дифторбутокси, 4,4,4-трифторбутокси и им подобные.
C1-C6 гидроксиалкил представляет собой алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 6, в особенности от 1 до 4 атомов углерода (= C1-C4 гидроксиалкил), в особенности от 1 до 3 атомов углерода (= C1-C3 гидроксиалкил), где один из атомов водорода замещен гидроксигруппой, например, так как в 2-гидроксиэтиле или 3-гидроксипропиле.
C1-C6-алкокси-C1-C6-алкил представляет собой алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 6, в особенности от 1 до 4 атомов углерода, в особенности от 1 до 3 атомов углерода, где один из атомов водорода замещен C1-C6-алкоксигруппой, например, так как в метоксиметиле, 2-метоксиэтиле, этоксиметиле, 3-метоксипропиле, 3-этоксипропиле и им подобные.
C1-C6-алкокси-C1-C6-алкокси представляет собой алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 6, в особенности от 1 до 4 атомов углерода, в особенности от 1 до 3 атомов углерода, где один из атомов водорода замещен C1-C6-алкоксигруппой, например, так как в 2-метоксиэтокси, этоксиметокси, 2-этоксиэтокси, 3-метоксипропокси, 3-этоксипропокси и им подобные.
C1-C6-алкилкарбонил представляет собой алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 6, в особенности от 1 до 4 атомов углерода (= C1-C4 алкилкарбонил), в особенности от 1 до 3 атомов углерода (= фторированный C1-C3 алкилкарбонил), где один из атомов водорода замещен карбонильной группой (CO), например, так как в ацетиле и пропиониле.
Фторированный C1-C6-алкилкарбонил представляет собой алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 6, в особенности от 1 до 4 атомов углерода (= фторированный C1-C4 алкилкарбонил), в особенности от 1 до 3 атомов углерода (= фторированный C1-C3 алкилкарбонил), где один из атомов водорода замещен карбонильной группой (CO) и где, по меньшей мере, один из оставшихся атомов водорода, например, 1, 2, 3 или 4 атома водорода замещены атомом фтора, например, так как в трифторацетиле и 3,3,3-трифторпропиониле.
C1-C6-алкилкарбониламино представляет собой алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 6, в особенности от 1 до 4 атомов углерода (= C1-C4 алкилкарбониламино), в особенности от 1 до 3 атомов углерода (= C1-C4 алкилкарбониламино), где один из атомов водорода замещен карбониламиногруппой (CO-NH-), например, так как в ацетамидо (ацетиламино) (CH3CONH-) и пропионамидо (CH3CH2CONH-).
Фторированный C1-C6-алкилкарбониламино представляет собой алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 6, в особенности от 1 до 4 атомов углерода (= фторированный C1-C4 алкилкарбониламино), в особенности от 1 до 3 атомов углерода (= фторированный C1-C4 алкилкарбониламино), где один из атомов водорода замещен карбониламиногруппой (CO-NH-) и где, по меньшей мере, один из оставшихся атомов водорода, например, 1, 2, 3 или 4 атома водорода замещены атомом фтора, например, так как в трифторацетиламино и 3,3,3-трифторпропиониламино.
C1-C6 алкилтио (также определенный как C1-C6-алкилсульфанил) (или C1-C6-алкилсульфинил или C1-C6-алкилсульфонил, соответственно) относится к алкильным группам с прямой или разветвленной цепью, имеющим от 1 до 6 атомов углерода, например от 1 до 4 атомов углерода, которые связаны с оставшейся молекулой через атом серы (или S(O)O в случае алкилсульфинила или S(O)2O в случае алкилсульфонила, соответственно), по любой связи в алкильной группе. Примеры для C1-C4-алкилтио включают метилтио, этилтио, пропилтио, изопропилтио и н-бутилтио. Примеры для C1-C4-алкилсульфинила включают метилсульфинил, этилсульфинил, пропилсульфинил, изопропилсульфинил и н-бутилсульфинил. Примеры для C1-C4-алкилсульфонила включают метилсульфонил, этилсульфонил, пропилсульфонил, изопропилсульфонил и н-бутилсульфонил.
Фторированный C1-C6 алкилтио (также определенный как фторированный C1-C6-алкилсульфанил) представляет собой алкилтиогруппу с прямой или разветвленной цепью, имеющую от 1 до 6, в особенности от 1 до 4 атомов углерода, где, по меньшей мере, один, например, 1, 2, 3, 4 или все атомы водорода замещены атомами фтора. Фторированный C1-C6 алкилсульфинил представляет собой алкилсульфинильную группу с прямой или разветвленной цепью, имеющую от 1 до 6, в особенности от 1 до 4 атомов углерода, где, по меньшей мере, один, например, 1, 2, 3, 4 или все атомы водорода замещены атомами фтора. Фторированный C1-C6 алкилсульфонил представляет собой алкилсульфонильную группу с прямой или разветвленной цепью, имеющую от 1 до 6, в особенности от 1 до 4 атомов углерода, где, по меньшей мере, один, например, 1, 2, 3, 4 или все атомы водорода замещены атомами фтора.
C3-C6 циклоалкил представляет собой циклоалифатический радикал, имеющий от 3 до 6 атомов С, такой как циклопропил, циклобутил, циклопентил и циклогексил. Циклоалкильный радикал может быть незамещенным или может иметь 1, 2, 3 или 4 C1-C4 алкильных радикалов, предпочтительно метильный радикал. Один алкильный радикал предпочтительно расположен в 1-положении циклоалкильного радикала, например, так как в 1-метилциклопропиле или 1-метилциклобутиле.
Фторированный C3-C6 циклоалкил представляет собой циклоалифатический радикал, имеющий от 3 до 6 атомов С, такой как циклопропил, циклобутил, циклопентил и циклогексил, где, по меньшей мере, один, например, 1, 2, 3, 4 или все атомы водорода замещены атомами фтора, например, так как в 1-фторциклопропиле, 2-фторциклопропиле, (S)- и (R)-2,2-дифторциклопропиле, 1,2-дифторциклопропиле, 2,3-дифторциклопропиле, пентафторциклопропиле, 1-фторциклобутиле, 2-фторциклобутиле, 3-фторциклобутиле, 2,2-дифторциклобутиле, 3,3-дифторциклобутиле, 1,2-дифторциклобутиле, 1,3-дифторциклобутиле, 2,3-дифторциклобутиле, 2,4-дифторциклобутиле или 1,2,2-трифторциклобутиле.
C2-C6-алкенил представляет собой отдельный ненасыщенный углеводородный радикал, имеющий 2, 3, 4, 5 или 6 атомов С, например винил, аллил (2-пропен-1-ил), 1-пропен-1-ил, 2-пропен-2-ил, металлил (2-метилпроп-2-ен-1-ил) и им подобные. C3-C6-алкенил представляет собой, в особенности, аллил, 1-метилпроп-2-ен-1-ил, 2-бутен-1-ил, 3-бутен-1-ил, металлил, 2-пентен-1-ил, 3-пентен-1-ил, 4-пентен-1-ил, 1-метилбут-2-ен-1-ил или 2-этилпроп-2-ен-1-ил.
Фторированный C2-C6-алкенил представляет собой отдельный ненасыщенный углеводородный радикал, имеющий 2, 3, 4, 5 или 6 атомов С, где, по меньшей мере, один, например, 1, 2, 3, 4 или все атомы водорода замещены атомами фтора, например, так как в 1-фторвиниле, 2-фторвиниле, 2,2-фторвиниле, 3,3,3-фторпропениле, 1,1-дифтор-2-пропениле, 1-фтор-2-пропениле и им подобные.
C1-C6-алкилен представляет собой углеводородную мостиковую группу, имеющую 1, 2, 3, 4, 5 или 6 атомов углерода, подобную метилену, этилену, 1,2- и 1,3-пропилену, 1,4-бутилену и им подобные.
Примеры имеющих 5 или 6 членов гетероароматических радикалов включают 2-, 3- или 4-пиридил, 2-, 4- или 5-пиримидинил, пиразинил, 3- или 4-пиридазинил, 2- или 3-тиенил, 2- или 3-фурил, 2- или 3-пирролил, 2-, 3- или 5-оксазолил, 3-, 4- или 5-изоксазолил, 2-, 3- или 5-тиазолил, 3-, 4- или 5-изотиазолил, 3-, 4- или 5-пиразолил, 2-, 4- или 5-имидазолил, 2- или 5-[1,3,4]оксадиазолил, 4- или 5-[1,2,3]оксадиазолил, 3- или 5-[1,2,4]оксадиазолил, 2- или 5-[1,3,4]тиадиазолил, 2- или 5-[1,3,4]тиадиазолил, 4- или 5-[1,2,3]тиадиазолил, 3- или 5-[1,2,4]тиадиазолил, 1H-, 2H- или 3H-1,2,3-триазол-4-ил, 2H-триазол-3-ил, 1H-, 2H- или 4H-1,2,4-триазолил и 1H- или 2H-тетразолил, которые могут быть незамещенным или которые могут нести 1, 2 или 3 упомянутых выше радикалов Ra.
Примеры фенильного кольца, конденсированного с насыщенным или ненасыщенным имеющим 5 или 6 членов карбоциклическим или гетероциклическим кольцом, включают инденил, инданил, нафтил, 1,2- или 2,3-дигидронафтил, тетралин, бензофуранил, 2,3-дигидробензофуранил, бензотиенил, индолил, индазолил, бензимидазолил, бензоксатиазолил, бензоксадиазолил, бензотиадиазолил, бензоксазинил, дигидробензоксазинил, хинолинил, изохинолинил, тетрагидроизохинолинил, хроменил, хроманил и им подобные, которые могут быть незамещенными и или которые могут нести 1, 2 или 3 упомянутых выше радикалов Ra. Указанная конденсированная система может быть связана с остатком молекулы (более точно с сульфонильной группой) через атомы углерода фенильного остатка или через атомы (C- или N-атомы) кольца, конденсированного с фенилом.
Примеры для насыщенных или ненасыщенных 3-7-членных гетероциклических колец (как радикалов Ra) включают насыщенные или ненасыщенные ароматические или неароматические гетероциклические кольца. Примеры, таким образом, включают, помимо определенных выше, 5- или 6-членных гетероароматических радикалов, азиридил, диазиридинил, оксиранил, азетидинил, азетинил, ди- и тетрагидрофуранил, пирролинил, пирролидинил, оксопирролидинил, пиразолинил, пиразолидинил, имидазолинил, имидазолидинил, оксазолинил, оксазолидинил, оксо-оксазолидинил, изоксазолинил, изоксазолидинил, пиперидинил, пиперазинил, морфолинил, тиоморфолинил, оксотиоморфолинил, диоксотиоморфолинил и им подобные.
Если R6 и R7образуют вместе с N 4-, 5- или 6-членное кольцо, то примеры для указанного типа радикала включают, помимо определенных выше, 5- или 6-членных гетероароматических радикалов, содержащих, по меньшей мере, один атом N в качестве члена кольца, азетидинил, азетинил, пирролинил, пирролидинил, пиразолинил, пиразолидинил, имидазолинил, имидазолидинил, оксазолинил, оксазолидинил, пиперидинил, пиперазинил, морфолинил и им подобные.
В соединениях формулы I n предпочтительно имеет значение 0 или 1; то есть содержащее азот кольцо представляет собой азетидинильную группу или пирролидинильную группу; и, в особенности, n имеет значение 1, что означает, что в особенно предпочтительном воплощении содержащее азот кольцо представляет собой пирролидинильное кольцо.
Предпочтительно, радикал R1 выбран из H, C1-C4-алкила, C1-C4-алкила, который замещен C3-C6-циклоалкилом или гидрокси, фторированного C1-C4-алкила, C2-C4-алкенила и бензила. Более предпочтительно является выбранным из H, пропила, циклопропилметилена, фторированного этила, например 2-фторэтила, фторированного пропила, например 3-фторпропила, гидроксипропила, например 3-гидроксипропила, пропионила, аллила и бензила. Более предпочтительно, R1 выбран из H, пропила, этила, метила, циклопропилметилена, 2-фторэтила, 3-фторпропила, 3-гидроксипропила, аллила и бензила. Даже более предпочтительно, R1 выбран из H, пропила, циклопропилметилена, 2-фторэтила, 3-фторпропила, 3-гидроксипропила, аллила или бензила. В особенно предпочтительном воплощении, R1 представляет собой Н, н-пропил или аллил, в особенности H или н-пропил, в особенности H.
Предпочтительно, R2, R3 и R4 представляют собой Н, CH3 или CH2F и более предпочтительно H.
Если группа A является замещенной, предпочтительные заместители выбраны из галогена, в особенности фтора, метила, дифторметила, трифторметила, метокси, дифторметокси и трифторметокси. Более предпочтительные заместители выбраны из галогена, в особенности фтора и метокси. Конкретно, заместитель представляет собой метокси. Примеры включают 2-фтор-1,4-фенилен, 3-фтор-1,4-фенилен, 2-фтор-1,3-фенилен, 4-фтор-1,3-фенилен, 2-метокси-1,4-фенилен, 3-метокси-1,4-фенилен, 2-метокси-1,3-фенилен и 3-метокси-1,3-фенилен. В конкретном воплощении, А представляет собой незамещенный 1,4-фенилен или незамещенный 1,3-фенилен. Более конкретно, А представляет собой 1,3-пиридилен, в особенности незамещенный 1,3-пиридилен.
Группа E предпочтительно представляет собой NR5, более предпочтительно NH или NCH3, в особенности NH.
В одном из предпочтительных воплощений изобретения Ar представляет собой радикал формулы (A), (B), (C), (D) или (E). Особенно предпочтительным является радикал (A). Среди пиридильных радикалов (B)-(E) предпочтительными являются радикалы (C) и (E).
В этих Ar радикалах (A)-(E) Ra предпочтительно выбран из группы, состоящей из галогена, C1-C6-алкила, фторированного C1-C6-алкила, C1-C6-гидроксиалкила, C1-C6-алкокси-C1-C6-алкила, C2-C6-алкенила, C3-C6-циклоалкила, фторированного C3-C6-циклоалкила, C1-C6-алкокси, C1-C6-алкокси-C1-C6-алкокси, фторированного C1-C6-алкокси, фторированного C1-C6-алкилтио, C1-C6-алкилсульфонила, фенилсульфонила, бензилокси, фенокси, CN, нитро, ацетила, трифторацетила, ацетамидо, карбокси, NH-C(O)-NH2, NR6R7, NR6R7-C1-C6-алкилена, O-NR6R7, где R6 и R7 независимо друг от друга представляют собой H, C1-C4-алкил, фторированный C1-C4-алкил или C1-C4-алкокси, и насыщенное или ненасыщенное ароматическое или неароматическое 3-7-членное гетероциклическое кольцо, включающее в качестве членов кольца 1, 2, 3 или 4 гетероатома, выбранных из N, O и S, и/или 1, 2 или 3 содержащие гетероатом группы, выбранные из NR8, где R8 определен выше и предпочтительно представляет собой H или C1-C4-алкил, такой как метил, SO, SO2 и CO, и где 3-7-членное гетероциклическое кольцо может нести 1, 2 или 3 заместителя, выбранных из гидрокси, галогена, C1-C6-алкила, фторированного C1-C6-алкила и C1-C6-алкокси.
Предпочтительно, насыщенное или ненасыщенное ароматическое или неароматическое 3-7-членное гетероциклическое кольцо выбрано из азетидин-1-ила, 2-метилазетидинила, 3-метоксиазетидинила, 3-гидроксиазетидинила, 3-фторазетидинила, 2,2-дифторазетидин-1-ила, пирролидин-1-ила, пирролидин-2-ила, пирролидин-3-ила, 2- и 3-фторпирролидин-1-ила, 2,2-дифторпирролидин-1-ила, 3,3-дифторпирролидин-1-ила, 2- и 3-метилпирролидин-1-ила, 1-метилпирролидин-2-ила, 2,2-диметилпирролидин-1-ила, 3,3-диметилпирролидин-1-ила, 2-оксо-пирролидин-1-ила, 2- и 3-трифторметилпирролидин-1-ила, 2-оксо-оксазолидин-1-ила, пиперидин-1-ила, 2-метилпиперидин-1-ила, 2-фторпиперидин-1-ила, 2,2-дифторпиперидин-1-ила, пиперазин-1-ила, 4-метилпиперазин-1-ила, морфолин-4-ила, тиоморфолин-4-ила, 1-оксотиоморфолин-4-ила, 1,1-диоксотиоморфолин-4-ила, пиррол-1-ила, пиррол-2-ила, пиррол-3-ила, 1-метилпиррол-2-ила, 1-метилпиррол-3-ила, фуран-2-ила, фуран-3-ила, тиофен-2-ила, тиофен-3-ила, 5-пропилтиофен-2-ила, пиразол-1-ила, пиразол-3-ила, пиразол-4-ила, 1-метилпиразол-4-ила, 4-фторпиразол-1-ила, имидазол-1-ила, имидазол-2-ила, 1-метилимидазол-2-ила, оксазол-2-ила, оксазол-4-ила, оксазол-5-ила, изоксазол-3-ила, изоксазол-4-ила, изоксазол-5-ила, тиазол-2-ила, тиазол-4-ила, тиазол-5-ила, 2-метилтиазол-4-ила, 2-метилтиазол-5-ила, [1,2,3]триазол-1-ила, [1,2,4]триазол-1-ила, [1,2,3]триазол-2-ила, [1,2,4]триазол-3-ила, [1,2,4]триазол-4-ила, 4-метил-[1,2,4]триазол-3-ила, 2-метил-[1,2,3]триазол-4-ила, [1,3,4]-оксадиазол-2-ила, [1,2,4]-оксадиазол-3-ила, [1,2,4]-оксадиазол-5-ила, [1,2,3]-оксадиазол-5-ила, [1,3,4]-оксадиазол-2-ила, 5-метил-[1,3,4]-оксадиазол-2-ила, 5-метил-[1,2,4]-оксадиазол-3-ила, [1,2,3]тиадиазол-4-ила, тетразол-1-ила, тетразол-5-ила, 2-метилтетразол-5-ила, 1-метилтетразол-5-ила, фуразан-3-ила, пирид-2-ила, пирид-3-ила, пирид-4-ила, пиримидин-2-ила, пиримидин-4-ила, пиримидин-5-ила и 2-метилпиримидин-4-ила.
Более предпочтительно, насыщенное или ненасыщенное 3-7-членное гетероциклическое кольцо выбрано из содержащих азот колец, таких как азетидин-1-ил, 2-метилазетидинил, 3-метоксиазетидинил, 3-гидроксиазетидинил, 3-фторазетидинил, 2,2-дифторазетидин-1-ил, пирролидин-1-ил, пирролидин-2-ил, пирролидин-3-ил, 2- и 3-фторпирролидин-1-ил, 2,2-дифторпирролидин-1-ил, 3,3-дифторпирролидин-1-ил, 2- и 3-метилпирролидин-1-ил, 1-метилпирролидин-2-ил, 2,2-диметилпирролидин-1-ил, 3,3-диметилпирролидин-1-ил, 2-оксо-пирролидин-1-ил, 2- и 3-трифторметилпирролидин-1-ил, 2-оксо-оксазолидин-1-ил, пиперидин-1-ил, 2-метилпиперидин-1-ил, 2-фторпиперидин-1-ил, 2,2-дифторпиперидин-1-ил, пиперазин-1-ил, 4-метилпиперазин-1-ил, морфолин-4-ил, тиоморфолин-4-ил, 1-оксотиоморфолин-4-ил, 1,1-диоксотиоморфолин-4-ил, пиррол-1-ил, пиррол-2-ил, пиррол-3-ил, 1-метилпиррол-2-ил, 1-метилпиррол-3-ил, пиразол-1-ил, пиразол-3-ил, пиразол-4-ил, 1-метилпиразол-4-ил, 4-фторпиразол-1-ил, имидазол-1-ил, имидазол-2-ил, 1-метилимидазол-2-ил, оксазол-2-ил, оксазол-4-ил, оксазол-5-ил, изоксазол-3-ил, изоксазол-4-ил, изоксазол-5-ил, тиазол-2-ил, тиазол-4-ил, тиазол-5-ил, 2-метилтиазол-4-ил, 2-метилтиазол-5-ил, [1,2,3]триазол-1-ил, [1,2,4]триазол-1-ил, [1,2,3]триазол-2-ил, [1,2,4]триазол-3-ил, [1,2,4]триазол-4-ил, 4-метил-[1,2,4]триазол-3-ил, 2-метил-[1,2,3]триазол-4-ил, [1,3,4]-оксадиазол-2-ил, [1,2,4]-оксадиазол-3-ил, [1,2,4]-оксадиазол-5-ил, [1,2,3]-оксадиазол-5-ил, [1,3,4]-оксадиазол-2-ил, 5-метил-[1,3,4]-оксадиазол-2-ил, 5-метил-[1,2,4]-оксадиазол-3-ил, [1,2,3]тиадиазол-4-ил, тетразол-1-ил, тетразол-5-ил, 2-метилтетразол-5-ил, 1-метилтетразол-5-ил, фуразан-3-ил, пирид-2-ил, пирид-3-ил, пирид-4-ил, пиримидин-2-ил, пиримидин-4-ил, пиримидин-5-ил и 2-метилпиримидин-4-ил.
Даже более предпочтительно, насыщенное или ненасыщенное 3-7-членное гетероциклическое кольцо выбрано из содержащих азот колец, которые связаны с фенильным или пиридильным кольцом группы Ar через их атом азота, такое как азетидин-1-ил, 2-метилазетидин-1-ил, 3-метоксиазетидин-1-ил, 3-гидроксиазетидин-1-ил, 3-фторазетидин-1-ил, 2,2-дифторазетидин-1-ил, пирролидин-1-ил, 2- и 3-фторпирролидин-1-ил, 2,2-дифторпирролидин-1-ил, 3,3-дифторпирролидин-1-ил, 2- и 3-метилпирролидин-1-ил, 2,2-диметилпирролидин-1-ил, 3,3-диметилпирролидин-1-ил, 2-оксо-пирролидин-1-ил, 2- и 3-трифторметилпирролидин-1-ил, 2-оксо-оксазолидин-1-ил, пиперидин-1-ил, 2-метилпиперидин-1-ил, 2-фторпиперидин-1-ил, 2,2-дифторпиперидин-1-ил, пиперазин-1-ил, 4-метилпиперазин-1-ил, морфолин-4-ил, тиоморфолин-4-ил, 1-оксотиоморфолин-4-ил, 1,1-диоксотиоморфолин-4-ил, пиррол-1-ил, пиразол-1-ил, 4-фторпиразол-1-ил, имидазол-1-ил, [1,2,3]триазол-1-ил, [1,2,4]триазол-1-ил, [1,2,3]триазол-2-ил, [1,2,4]триазол-3-ил, [1,2,4]триазол-4-ил, 4-метил-[1,2,4]триазол-3-ил, 2-метил-[1,2,3]триазол-4-ил, тетразол-1-ил и тетразол-2-ил.
В альтернативном даже более предпочтительном воплощении, насыщенное или ненасыщенное 3-7-членное гетероциклическое кольцо выбрано из 5- или 6-членных, предпочтительно 5-членного, азотсодержащих гетероароматических колец, связанных через атом углерода, таких как пиррол-2-ил, пиррол-3-ил, 1-метилпиррол-2-ил, 1-метилпиррол-3-ил, пиразол-3-ил, пиразол-4-ил, 1-метилпиразол-4-ил, имидазол-2-ил, 1-метилимидазол-2-ил, оксазол-2-ил, оксазол-4-ил, оксазол-5-ил, изоксазол-3-ил, изоксазол-4-ил, изоксазол-5-ил, тиазол-2-ил, тиазол-4-ил, тиазол-5-ил, 2-метилтиазол-4-ил, 2-метилтиазол-5-ил, [1,2,3]триазол-2-ил, [1,2,4]триазол-3-ил, [1,2,4]триазол-4-ил, 4-метил-[1,2,4]триазол-3-ил, 2-метил-[1,2,3]триазол-4-ил, [1,3,4]-оксадиазол-2-ил, [1,2,4]-оксадиазол-3-ил, [1,2,4]-оксадиазол-5-ил, [1,2,3]-оксадиазол-5-ил, [1,3,4]-оксадиазол-2-ил, 5-метил-[1,3,4]-оксадиазол-2-ил, 5-метил-[1,2,4]-оксадиазол-3-ил, [1,2,3]тиадиазол-4-ил, тетразол-5-ил, 2-метилтетразол-5-ил, 1-метилтетразол-5-ил, фуразан-3-ил, пирид-2-ил, пирид-3-ил, пирид-4-ил, пиримидин-2-ил, пиримидин-4-ил, пиримидин-5-ил и 2-метилпиримидин-4-ил.
Гетероциклическое кольцо является незамещенным или замещенным одним заместителем, который предпочтительно выбран из галогена, C1-C4-алкила, фторированного C1-C4-алкила, C1-C4-алкокси и фторированного C1-C4-алкокси, в особенности из галогена, в особенности фтора, C1-C4-алкила, в особенности метила и фторированного C1-C4-алкила, в особенности фторированного метила.
В предпочтительном воплощении Ra выбран из группы, состоящей из галогена, C1-C6-алкила, C1-C6-гидроксиалкила, фторированного C1-C4-алкила, C1-C4-алкокси, фторированного C1-C4-алкокси, C1-C4-алкокси-C1-C4-алкокси, C2-C4-алкенила, фторированного C2-C4-алкенила, NR6R7, ONR6R7, C1-C6-алкилен-NR6R7, где R6 и R7 независимо друг от друга представляют собой H, C1-C4-алкил или C1-C4-алкокси, уреидо (NHCONH2), C3-C6-циклоалкил, фторированный C3-C6-циклоалкил, ацетил, карбоксил, гидрокси, циано, нитро, бензокси, метилсульфанил, фторметилсульфанил, дифторметилсульфанил, трифторметилсульфанил, метилсульфонил и одно из упомянутых выше насыщенных или ненасыщенных 3-7-членных гетероциклических колец, в частности азетидин-1-ил, 2-метилазетидинил, 3-метоксиазетидинил, 3-гидроксиазетидинил, 3-фторазетидинил, 2,2-дифторазетидин-1-ил, пирролидин-1-ил, пирролидин-2-ил, пирролидин-3-ил, 2- и 3-фторпирролидин-1-ил, 2,2-дифторпирролидин-1-ил, 3,3-дифторпирролидин-1-ил, 2- и 3-метилпирролидин-1-ил, 1-метилпирролидин-2-ил, 2,2-диметилпирролидин-1-ил, 3,3-диметилпирролидин-1-ил, 2-оксо-пирролидин-1-ил, 2- и 3-трифторметилпирролидин-1-ил, 2-оксо-оксазолидин-1-ил, пиперидин-1-ил, 2-метилпиперидин-1-ил, 2-фторпиперидин-1-ил, 2,2-дифторпиперидин-1-ил, пиперазин-1-ил, 4-метилпиперазин-1-ил, морфолин-4-ил, тиоморфолин-4-ил, 1-оксотиоморфолин-4-ил, 1,1-диоксотиоморфолин-4-ил, пиррол-1-ил, пиррол-2-ил, пиррол-3-ил, 1-метилпиррол-2-ил, 1-метилпиррол-3-ил, пиразол-1-ил, пиразол-3-ил, пиразол-4-ил, 1-метилпиразол-4-ил, 4-фторпиразол-1-ил, имидазол-1-ил, имидазол-2-ил, 1-метилимидазол-2-ил, оксазол-2-ил, оксазол-4-ил, оксазол-5-ил, изоксазол-3-ил, изоксазол-4-ил, изоксазол-5-ил, тиазол-2-ил, тиазол-4-ил, тиазол-5-ил, 2-метилтиазол-4-ил, 2-метилтиазол-5-ил, [1,2,3]триазол-1-ил, [1,2,4]триазол-1-ил, [1,2,3]триазол-2-ил, [1,2,4]триазол-3-ил, [1,2,4]триазол-4-ил, 4-метил-[1,2,4]триазол-3-ил, 2-метил-[1,2,3]триазол-4-ил, [1,3,4]-оксадиазол-2-ил, [1,2,4]-оксадиазол-3-ил, [1,2,4]-оксадиазол-5-ил, [1,2,3]-оксадиазол-5-ил, [1,3,4]-оксадиазол-2-ил, 5-метил-[1,3,4]-оксадиазол-2-ил, 5-метил-[1,2,4]-оксадиазол-3-ил, [1,2,3]тиадиазол-4-ил, тетразол-1-ил, тетразол-5-ил, 2-метилтетразол-5-ил, 1-метилтетразол-5-ил, фуразан-3-ил, пирид-2-ил, пирид-3-ил, пирид-4-ил, пиримидин-2-ил, пиримидин-4-ил, пиримидин-5-ил и 2-метилпиримидин-4-ил.
В более предпочтительном воплощении Ra выбран из группы, состоящей из галогена, C1-C6-алкила, фторированного C1-C4-алкила, C1-C4-алкокси, OCF3, OCHF2, OCH2F, 2-фторэтокси, 2,2-дифторэтокси, 2,2,2-трифторэтокси, 1,1,2,2-тетрафторэтокси, 1,1,2,2,2-пентафторэтокси, C2-C4-алкенила, C3-C6-циклоалкила, фторированного C3-C6-циклоалкила, уреидо, ацетила, ацетиламино, карбоксила, гидрокси, циано, нитро, бензокси, трифторметилсульфанила, метилсульфонила, азетидин-1-ила, 2-метилазетидинила, 3-метоксиазетидинила, 3-гидроксиазетидинила, 3-фторазетидинила, 2,2-дифторазетидин-1-ила, пирролидин-1-ила, пирролидин-2-ила, пирролидин-3-ила, 2- и 3-фторпирролидин-1-ила, 2,2-дифторпирролидин-1-ила, 3,3-дифторпирролидин-1-ила, 2- и 3-метилпирролидин-1-ила, 1-метилпирролидин-2-ила, 2,2-диметилпирролидин-1-ила, 3,3-диметилпирролидин-1-ила, 2-оксо-пирролидин-1-ила, 2- и 3-трифторметилпирролидин-1-ила, 2-оксо-оксазолидин-1-ила, пиперидин-1-ила, 2-метилпиперидин-1-ила, 2-фторпиперидин-1-ила, 2,2-дифторпиперидин-1-ила, пиперазин-1-ила, 4-метилпиперазин-1-ила, морфолин-4-ила, тиоморфолин-4-ила, 1-оксотиоморфолин-4-ила, 1,1-диоксотиоморфолин-4-ила, пиррол-1-ила, пиррол-2-ила, пиррол-3-ила, 1-метилпиррол-2-ила, 1-метилпиррол-3-ила, пиразол-1-ила, пиразол-3-ила, пиразол-4-ила, 1-метилпиразол-4-ила, 4-фторпиразол-1-ила, имидазол-1-ила, имидазол-2-ила, 1-метилимидазол-2-ила, оксазол-2-ила, оксазол-4-ил, оксазол-5-ила, изоксазол-3-ила, изоксазол-4-ила, изоксазол-5-ила, тиазол-2-ила, тиазол-4-ила, тиазол-5-ила, 2-метилтиазол-4-ила, 2-метилтиазол-5-ила, [1,2,3]триазол-1-ила, [1,2,4]триазол-1-ила, [1,2,3]триазол-2-ила, [1,2,4]триазол-3-ила, [1,2,4]триазол-4-ила, 4-метил-[1,2,4]триазол-3-ила, 2-метил-[1,2,3]триазол-4-ила, [1,3,4]-оксадиазол-2-ила, [1,2,4]-оксадиазол-3-ила, [1,2,4]-оксадиазол-5-ила, [1,2,3]-оксадиазол-5-ила, [1,3,4]-оксадиазол-2-ила, 5-метил-[1,3,4]-оксадиазол-2-ила, 5-метил-[1,2,4]-оксадиазол-3-ила, [1,2,3]тиадиазол-4-ила, тетразол-1-ила, тетразол-5-ила, 2-метилтетразол-5-ила, 1-метилтетразол-5-ила, фуразан-3-ила, пирид-2-ила, пирид-3-ила, пирид-4-ила, пиримидин-2-ила, пиримидин-4-ила, пиримидин-5-ила и 2-метилпиримидин-4-ила.
В альтернативном предпочтительном воплощении Ra имеет формулу Ra'
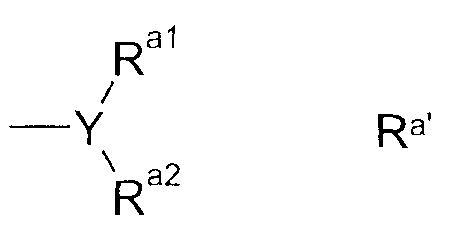
где
Y представляет собой N, CH или CF,
Ra1 и Ra2 независимо друг от друга выбраны из C1-C2-алкила, в особенности метила, фторированного C1-C2-алкила, в особенности фторметила, дифторметила или трифторметила, при условии, что для Y, имеющего значение CH или CF, один из радикалов Ra1 или Ra2 может также быть водородом или фтором, или
Ra1 и Ra2 образуют радикал (CH2)m, где 1 или 2 атома водорода могут быть замещены фтором и где m имеет значение 2, 3 или 4, в особенности CH2-CH2, CHF-CH2, CF2-CH2, CH2-CH2-CH2, CHF-CH2-CH2, CF2-CH2-CH2, CH2-CHF-CH2, CH2-CF2-CH2.
В случае, когда Ra1 и Ra2 отличаются друг от друга, радикал упомянутой выше формулы Ra' может иметь или (R)-, или (S)-конфигурацию по отношению к Y-остатку.
Примеры для предпочтительных радикалов формулы Ra' включают изопропил, (R)-1-фторэтил, (S)-1-фторэтил, 2-фторэтил, 1,1-дифторэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, (R)-1-фторпропил, (S)-1-фторпропил, 2-фторпропил, 3-фторпропил, 1,1-дифторпропил, 2,2-дифторпропил, 3,3-дифторпропил, 3,3,3-трифторпропил, циклопропил, циклобутил, 1-фторциклопропил, (S)- и (R)-2,2-дифторциклопропил и 2-фторциклопропил.
Среди радикалов формулы Ra' предпочтительными являются те, которые содержат 1, 2, 3 или 4, в особенности 1, 2 или 3, атома фтора.
Rb и Rc независимо друг от друга представляют собой H, галоген, CH3, OCH3, CH2F, OCH2F, CHF2, OCHF2, CF3, OCF3, CH2CH2F, OCH2CH2F, CH2CHF2, OCH2CHF2, CH2CF3 или OCH2CF3. Если оба Rb и Rc отличны от H, предпочтительным является то, что один из Rb и Rc выбран из галогена и другой выбран из галогена, CH3, OCH3, CH2F, OCH2F, CHF2, OCHF2, CF3, OCF3, CH2CH2F, OCH2CH2F, CH2CHF2, OCH2CHF2, CH2CF3 и OCH2CF3, в особенности из CH3, OCH3, CH2F, OCH2F, CHF2, OCHF2, CF3, OCF3, CH2CH2F и OCH2CH2F.
Предпочтительные примеры для Ar, где Ar представляет собой радикал формулы (A), (B), (C), (D) или (E), в особенности являются следующими: 3-метилфенил, 3-этилфенил, 3-пропилфенил, 3-изопропилфенил, 3-втор-бутилфенил, 3-изобутилфенил, 3-трет-бутилфенил, 3-(1,1-диметилпропил)фенил, 3-винилфенил, 3-изопропенилфенил, 3-фторфенил, 3-хлорфенил, 3-бромфенил, 3-йодфенил, 3-(фторметил)фенил, 3-(дифторметил)фенил, 3-(трифторметил)фенил, 3,5-бис(трифторметил)фенил, 3-(1-фторэтил)фенил, 3-((S)-1-фторэтил)фенил, 3-((R)-1-фторэтил)фенил, 3-(2-фторэтил)фенил, 3-(1,1-дифторэтил)фенил, 3-(2,2-дифторэтил)фенил, 3-(2,2,2-трифторэтил)фенил, 3-(3-фторпропил)фенил, 3-(2-фторпропил)фенил, 3-((S)-2-фторпропил)фенил, 3-((R)-2-фторпропил)фенил, 3-(3,3-дифторпропил)фенил, 3-(3,3,3-трифторпропил)фенил, 3-(1-фтор-1-метилэтил)фенил, 3-(2-фтор-1-метилэтил)фенил, 3-((S)-2-фтор-1-метилэтил)фенил, 3-((R)-2-фтор-1-метилэтил)фенил, 3-(2,2-дифтор-1-метилэтил)фенил, 3-((S)-2,2-дифтор-1-метилэтил)фенил, 3-((R)-2,2-дифтор-1-метилэтил)фенил, 3-(2,2,2-трифтор-1-метилэтил)фенил, 3-((S)-2,2,2-трифтор-1-метилэтил)фенил, 3-((R)-2,2,2-трифтор-1-метилэтил)фенил, 3-(2-фтор-1-фторметилэтил)фенил, 3-(1-дифторметил-2,2-дифторэтил)фенил, 3-(1,1-диметил-2-фторэтил)фенил, 3-метоксифенил, 3-этоксифенил, 3-пропоксифенил, 3-изопропоксифенил, 3-бутоксифенил, 3-(фторметокси)фенил, 3-(дифторметокси)фенил, 3-(трифторметокси)фенил, 3-(2-фторэтокси)фенил, 3-(2,2-дифторэтокси)фенил, 3-(2,2,2-трифторэтокси)фенил, 3-(1,1,2,2-тетрафторэтокси)фенил, 3-циклопропилфенил, 3-циклобутилфенил, 3-циклопентилфенил, 3-(2,2-дифторциклопропил)фенил, 3,4-дифторфенил, 3,5-дихлорфенил, 2,3-дихлорфенил, 2,5-дихлорфенил, 4-бром-3-фторфенил, 3-бром-2-фторфенил, 2-бром-3-фторфенил, 3-хлор-4-фторфенил, 3-бром-2,5-дифторфенил, 4-бром-2,5-дифторфенил, 5-бром-2,4-дифторфенил, 3-бром-2,4-дифторфенил, 4-хлор-3-(трифторметил)фенил, 2-хлор-5-(трифторметил)фенил, 2-фтор-5-(трифторметил)фенил, 4-фтор-3-(трифторметил)фенил, 3-фтор-5-(трифторметил)фенил, 4-бром-3-(трифторметил)фенил, 3-бром-5-(трифторметил)фенил, 2-бром-5-(трифторметил)фенил, 5-бром-2-метоксифенил, 3-бром-4-метоксифенил, 3-бром-4-(трифторметокси)фенил, 3,5-дибром-4-(2-фторэтокси)фенил, 2-фтор-3-изопропилфенил, 4-фтор-3-изопропилфенил, 3-(1-гидрокси-1-метилэтил)фенил, 3-(2-гидрокси-2-метилпропил)фенил, 3-ацетилфенил, 3-ацетиламинофенил, 3-карбоксифенил, 3-цианофенил, 3-нитрофенил, 3-гидроксифенил, 3-(O-бензил)фенил, 3-(2-метоксиэтокси)фенил, 3-(CH2-N(CH3)2)фенил, 3-(NH-CO-NH2)фенил, 3-(метилсульфанил)фенил, 3-(фторметилсульфанил)фенил, 3-(дифторметилсульфанил)фенил, 3-(трифторметилсульфанил)фенил, 3-(метилсульфонил)фенил, 3-(N-метокси-N-метиламино)фенил, 3-(метоксиамино)фенил, 3-(этоксиамино)фенил, 3-(N-метиламиноокси)фенил, 3-(N,N-диметиламиноокси)фенил, 3-цианофенил, 2,5-диметилфенил, 2,5-ди-(трифторметил)фенил, 3,5-ди-(трифторметил)фенил, 2,5-диметоксифенил, 2-метокси-5-метилфенил, 2-метокси-5-(трифторметил)фенил, 3-(азетидин-1-ил)фенил, 3-(2-метилазетидин-1-ил)фенил, 3-((S)-2-метилазетидин-1-ил)фенил, 3-((R)-2-метилазетидин-1-ил)фенил, 3-(3-фторазетидин-1-ил)фенил, 3-(2,2-дифторазетидин-1-ил)фенил, 3-(3-метоксиазетидин-1-ил)фенил, 3-(3-гидроксиазетидин-1-ил)фенил, 3-(пирролидин-1-ил)фенил, 3-(пирролидин-2-ил)фенил, 3-((S)-пирролидин-2-ил)фенил, 3-((R)-пирролидин-2-ил)фенил, 3-(пирролидин-3-ил)фенил, 3-((S)-пирролидин-3-ил)фенил, 3-((R)-пирролидин-3-ил)фенил, 3-(пирролидин-1-ил)-5-(трифторметил)фенил, 5-(пирролидин-1-ил)-2-метоксифенил, 3-(пирролидин-1-ил)-4-метоксифенил, 5-(пирролидин-1-ил)-2,4-дифторфенил, 3-(пирролидин-1-ил)-2,4-дифторфенил, 3-(2-фторпирролидин-1-ил)фенил, 3-((S)-2-фторпирролидин-1-ил)фенил, 3-((R)-2-фторпирролидин-1-ил)фенил, 3-(3-фторпирролидин-1-ил)фенил, 3-((S)-3-фторпирролидин-1-ил)фенил, 3-((R)-3-фторпирролидин-1-ил)фенил, 3-(2,2-дифторпирролидин-1-ил)фенил, 3-(3,3-дифторпирролидин-1-ил)фенил, 3-(2-метилпирролидин-1-ил)фенил, 3-((S)-2-метилпирролидин-1-ил)фенил, 3-((R)-2-метилпирролидин-1-ил)фенил, 3-(3-метилпирролидин-1-ил)фенил, 3-((S)-3-метилпирролидин-1-ил)фенил, 3-((R)-3-метилпирролидин-1-ил)фенил, 3-(1-метилпирролидин-2-ил)фенил, 3-((S)-1-метилпирролидин-2-ил)фенил, 3-((R)-1-метилпирролидин-2-ил)фенил, 3-(1-метилпирролидин-3-ил)фенил, 3-((S)-1-метилпирролидин-3-ил)фенил, 3-((R)-1-метилпирролидин-3-ил)фенил, 3-(2,2-диметилпирролидин-1-ил)фенил, 3-(3,3-диметилпирролидин-1-ил)фенил, 3-(2-трифторметилпирролидин-1-ил)фенил, 3-((S)-2-трифторметилпирролидин-1-ил)фенил, 3-((R)-2-трифторметилпирролидин-1-ил)фенил, 3-(3-трифторметилпирролидин-1-ил)фенил, 3-((S)-3-трифторметилпирролидин-1-ил)фенил, 3-((R)-3-трифторметилпирролидин-1-ил)фенил, 3-(2-оксопирролидин-1-ил)фенил, 3-(2-оксо-оксазолидин-3-ил)фенил, 3-(пиперидин-1-ил)фенил, 3-(2-метилпиперидин-1-ил)фенил, 3-((S)-2-метилпиперидин-1-ил)фенил, 3-((R)-2-метилпиперидин-1-ил)фенил, 3-(2-фторпиперидин-1-ил)фенил, 3-((S)-2-фторпиперидин-1-ил)фенил, 3-((R)-2-фторпиперидин-1-ил)фенил, 3-(2,2-дифторпиперидин-1-ил)фенил, 3-(пиперазин-1-ил)фенил, 3-(4-метилпиперазин-1-ил)фенил, 3-(морфолин-4-ил)фенил, 3-(морфолин-4-ил)-5-(трифторметил)фенил, 5-(морфолин-4-ил)-2-метоксифенил, 3-(морфолин-4-ил)-4-метоксифенил, 5-(морфолин-4-ил)-2,4-дифторфенил, 3-(морфолин-4-ил)-2,4-дифторфенил, 3-(тиоморфолин-4-ил)фенил, 3-(1-оксотиоморфолин-4-ил)фенил, 3-(1,1-диоксотиоморфолин-4-ил)фенил, 3-(пиррол-1-ил)фенил, 3-(пиррол-2-ил)фенил, 3-(пиррол-3-ил)фенил, 3-(1-метилпиррол-2-ил)фенил, 3-(1-метилпиррол-3-ил)фенил, 3-(фуран-2-ил)фенил, 3-(фуран-3-ил)фенил, 3-(тиофен-2-ил)фенил, 3-(тиофен-3-ил)фенил, 3-(5-пропилтиен-2-ил)фенил, 3-(пиразол-1-ил)фенил, 3-(пиразол-3-ил)фенил, 3-(пиразол-4-ил)фенил, 3-(1-метил-1H-пиразол-4-ил)фенил, 3-(1-этил-1H-пиразол-4-ил)фенил, 3-(1-метил-1H-пиразол-5-ил)фенил, 3-(4-фторпиразол-1-ил)фенил, 3-(1H-имидазол-2-ил)фенил, 3-(имидазол-1-ил)фенил, 3-(1-метилимидазол-2-ил)фенил, 3-(оксазол-2-ил)фенил, 3-(оксазол-4-ил)фенил, 3-(оксазол-5-ил)фенил, 4-фтор-3-(оксазол-4-ил)фенил, 3-(изоксазол-3-ил)фенил, 3-(изоксазол-4-ил)фенил, 3-(изоксазол-5-ил)фенил, 3-(тиазол-2-ил)фенил, 3-(тиазол-4-ил)фенил, 3-(тиазол-5-ил)фенил, 3-(2-метилтиазол-4-ил)фенил, 3-(2-метилтиазол-5-ил)фенил, 3-([1,2,3]-триазол-1-ил)фенил, 3-([1,2,4]-триазол-1-ил)фенил, 3-([1,2,3]-триазол-2-ил)фенил, 3-(4H-[1,2,4]-триазол-3-ил)фенил, 3-([1,2,4]-триазол-4-ил)фенил, 3-(2H-[1,2,3]-триазол-4-ил)фенил, 3-(4-метил-4H-[1,2,4]-триазол-3-ил)фенил, 3-(2-метил-2H-[1,2,3]-триазол-4-ил)фенил, 3-([1,3,4]-оксадиазол-2-ил)фенил, 3-(5-метил-[1,3,4]-оксадиазол-2-ил)фенил, 3-([1,2,4]-оксадиазол-3-ил)фенил, 3-(5-метил-[1,2,4]-оксадиазол-3-ил)фенил, 3-([1,2,4]-оксадиазол-5-ил)фенил, 3-([1,2,3]-оксадиазол-4-ил)фенил, 3-([1,2,3]-оксадиазол-5-ил)фенил, 3-([1,2,3]-тиадиазол-4-ил)фенил, 3-(1H-тетразол-5-ил)фенил, 3-(тетразол-1-ил)фенил, 3-(2-метил-2H-тетразол-5-ил)фенил, 3-(1-метил-1H-тетразол-5-ил)фенил, 3-фуразан-3-ил-фенил, 3-(пирид-2-ил)фенил, 3-(пирид-3-ил)фенил, 3-(пирид-4-ил)фенил, 3-(пиримидин-2-ил)фенил, 3-(пиримидин-4-ил)фенил, 3-(2-метилпиримидин-4-ил)фенил, 3-(пиримидин-5-ил)фенил, 5-бромпиридин-3-ил, 3-бром-2-хлорпиридин-5-ил, 4-метилпиридин-2-ил, 6-метилпиридин-2-ил, 4-(трифторметил)пиридин-2-ил, 6-(трифторметил)пиридин-2-ил, 5-(трифторметил)пиридин-3-ил, 5-(пирролидин-1-ил)пиридин-3-ил, 3-(пирролидин-1-ил)-2-хлорпиридин-5-ил и 3-(морфолин-4-ил)-2-хлорпиридин-5-ил.
В альтернативном предпочтительном воплощении Ar представляет собой группу формул (F) или (G), (F) является особено предпочтительной.
В соединениях формулы I, где Ar представляет собой радикал (F), Rd предпочтительно выбран из галогена, гидроксила, C1-C4-алкила, фторированного C1-C4-алкила, C1-C4-алкилсульфонила, фторированного C1-C4-алкилсульфонила, фенилсульфонила, пиридилсульфонила, фенила, где фенильный и пиридильный радикал в трех последних упомянутых радикалах может быть незамещенным или может нести от 1 до 3 заместителей, выбранных из C1-C4-алкила, фторированного C1-C4-алкила и галогена, R9-CO-NR6-C1-C2-алкилена, CH2-пиридила, где пиридильный радикал может быть незамещенным или может нести от 1 до 3 заместителей, выбранных из C1-C4-алкила, фторированного C1-C4-алкила и галогена, и насыщенного, частично ненасыщенного или ароматического 5- или 6-членного гетероциклического кольца, включающего в качестве членов кольца 1, 2 или 3 гетероатома, выбранных из N, O и S, и/или 1, 2 или 3 содержащие гетероатом группы, выбранные из NR8, где R8 представляет собой Н, C1-C4-алкил, фторированный C1-C4-алкил, C1-C4-алкилкарбонил или фторированный C1-C4-алкилкарбонил, и где гетероциклическое кольцо может нести 1, 2 или 3 заместителя, выбранных из гидрокси, галогена, C1-C6-алкила, фторированного C1-C6-алкила, C1-C6-алкокси, фторированного C1-C6-алкокси, C1-C6-алкилтио, фторированного C1-C6-алкилтио, NR6R7-C1-C6-алкилена, карбоксила и C1-C4-алкилоксикарбонила, где R6, R7и R9 определены выше.
Более предпочтительно, Rd выбран из галогена, C1-C4-алкила, фторированного C1-C4-алкила, C1-C4-алкилсульфонила, фторированного C1-C4-алкилсульфонила, фенилсульфонила, где фенильный радикал может быть незамещенным или может нести от 1 до 3 заместителей, выбранных из C1-C4-алкила, фторированного C1-C4-алкила и галогена, и 5- или 6-членного гетероароматического кольца, включающего в качестве членов кольца один атом азота или одну группу NR8, где R8 представляет собой Н или C1-C4-алкил, и необязательно один или два дополнительных гетероатома, выбранных из N, O, S, и где гетероароматическое кольцо может нести 1, 2 или 3 заместителя, выбранных из галогена, C1-C6-алкила, фторированного C1-C6-алкила, C1-C6-алкокси, фторированного C1-C6-алкокси, C1-C6-алкилтио и фторированного C1-C6-алкилтио.
Даже более предпочтительно, Rd выбран из галогена, C1-C4-алкила, фторированного C1-C4-алкила, фенилсульфонила, где фенильный радикал может быть незамещенным или может нести от 1 до 3 заместителей, выбранных из C1-C4-алкила, фторированного C1-C4-алкила и галогена, и 5- или 6-членного гетероароматического кольца, включающего в качестве членов кольца один атом азота или одну группу NR8, где R8 представляет собой Н или C1-C4-алкил, и необязательно один или два дополнительных гетероатома, выбранных из N, O, S, и где гетероароматическое кольцо может нести 1, 2 или 3 заместителя, выбранных из галогена, C1-C6-алкила, фторированного C1-C6-алкила, C1-C6-алкокси, фторированного C1-C6-алкокси, C1-C6-алкилтио и фторированного C1-C6-алкилтио.
5-членный гетероароматический радикал может быть связан через кольцевой атом углерода или кольцевой атом азота.
5- или 6-членный гетероароматический радикал предпочтительно выбран из оксазолила, изоксазолила, тиазолила, изотиазолила, оксадиазолила, тиадиазолила, пиридила и пиримидила. В случае, когда гетероароматический радикал является замещенным, он предпочтительно несет один заместитель, который предпочтительно выбран из галогена, C1-C6-алкила, фторированного C1-C6-алкила, C1-C6-алкокси, фторированного C1-C6-алкокси, C1-C6-алкилтио и фторированного C1-C6-алкилтио и более предпочтительно из F, CH3, CH2F, CHF2, CF3, OCH3, OCH2F, OCHF2, OCF3, SCH3, SCH2F, SCHF2 и SCF3.
k предпочтительно имеет значение 0, 1 или 2, более предпочтительно 0 или 1, в особенности 1.
Тиенильный радикал (F) может быть связан с сульфонильной группой SO2 через его 2- или 3-положение, 2-положение (= атом С смежный с атомом S кольца (S=1-положение)) является предпочтительным. Если тиенильный радикал несет один радикал Rd, указанный радикал предпочтительно присоединен по 4- или 5-положению, более предпочтительно по 5-положению (относительно 2- или 3-положения атома кольца, связанного с сульфонильной группой). Если тиенильный радикал несет два радикала Rd, указанные радикалы предпочтительно присоединены по 4- или 5-положению.
В особенности предпочтительные Ar радикалы формулы (F) выбраны из тиен-2-ила, тиен-3-ила, 3-хлортиен-2-ила, 4-хлортиен-2-ила, 5-хлортиен-2-ила, 3-бромтиен-2-ила, 4-бромтиен-2-ила, 5-бромтиен-2-ила, 4,5-дихлортиен-2-ила, 4,5-дибромтиен-2-ила, 4-бром-5-хлортиен-2-ила, 3-бром-5-хлортиен-2-ила, 5-метилтиен-2-ила, 5-этилтиен-2-ила, 5-пропилтиен-2-ила, 5-трифторметилтиен-2-ила, 5-фенилтиен-2-ила, 5-(пирид-2-ил)тиен-2-ила, 5-(фенилсульфонил)тиен-2-ила, 4-(фенилсульфонил)тиен-2-ила, 5-(пирид-2-илсульфонил)тиен-2-ила, 5-(3-хлор-5-трифторпирид-2-илсульфонил)тиен-2-ила, 5-(бензоиламинометил)тиен-2-ила, 5-((4-хлорбензоил)аминометил)тиен-2-ила, 5-(ацетиламинометил)тиен-2-ила, 5-(пиразол-1-ил)тиен-2-ила, 5-(пиразол-3-ил)тиен-2-ила, 5-(пиразол-4-ил)тиен-2-ила, 5-(пиразол-5-ил)тиен-2-ила, 5-(4-фторпиразол-1-ил)тиен-2-ила, 5-(1-метил-5-трифторметил-(1H)-пиразол-3-ил)тиен-2-ила, 5-(1-метил-3-трифторметил-(1H)-пиразол-5-ил)тиен-2-ила, 5-(4-карбокси-1-метил-5-метилтио-(1H)-пиразол-3-ил)тиен-2-ила, 5-(4-аминометил-1-метил-5-метилтио-(1H)-пиразол-3-ил)тиен-2-ила, 5-(изоксазол-3-ил)тиен-2-ила, 5-(изоксазол-4-ил)тиен-2-ила, 5-(изоксазол-5-ил)тиен-2-ила, 5-(5-трифторметилизоксазол-3-ил)тиен-2-ила, 5-(оксазол-2-ил)тиен-2-ила, 5-(оксазол-4-ил)тиен-2-ила, 5-(оксазол-5-ил)тиен-2-ила, 5-(2-метилоксазол-4-ил)тиен-2-ила, 5-(2-метилоксазол-5-ил)тиен-2-ила, 5-(изотиазол-3-ил)тиен-2-ила, 5-(изотиазол-4-ил)тиен-2-ила, 5-(изотиазол-5-ил)тиен-2-ила, 5-(5-трифторметилизотиазол-3-ил)тиен-2-ила, 5-(тиазол-2-ил)тиен-2-ила, 5-(тиазол-4-ил)тиен-2-ила, 5-(тиазол-5-ил)тиен-2-ила, 5-(2-метилтиазол-4-ил)тиен-2-ила, 5-(2-метилтиазол-5-ил)тиен-2-ила, 5-([1,2,3]-оксадиазол-4-ил)тиен-2-ила, 5-([1,2,3]-тиадиазол-4-ил)тиен-2-ила, 5-(пиримидин-2-ил)тиен-2-ила, 5-(пиримидин-4-ил)тиен-2-ила, 5-(пиримидин-5-ил)тиен-2-ила, 5-(2-метилтиопиримидин-4-ил)тиен-2-ила, 5-([1,3]-диоксолан-2-ил)тиен-2-ила, 3-([1,3]-диоксолан-2-ил)тиен-2-ила, 5-((3-хлор-5-(трифторметил)пиридин-2-ил)метил)тиен-2-ила, 5-[3-хлор-5-(трифторметил)пирид-2-илсульфонил]тиен-2-ила, 2-хлортиен-3-ила, 4-хлортиен-3-ила, 5-хлортиен-3-ила, 2-бромтиен-3-ила, 4-бромтиен-3-ила, 5-бромтиен-3-ила, 2,5-дихлортиен-3-ила, 2,5-дибромтиен-3-ила, 2,4,5-трихлортиен-3-ила, 4-бром-2,5-дихлортиен-3-ила, 2-хлор-5-метилсульфонилтиен-3-ила, 2,5-диметилтиен-3-ила, 4-гидрокситиен-3-ила, 2-фенилтиен-3-ила, 4-фенил-5-(трифторметил)тиен-3-ила и 2-метоксикарбонил-4-фенил-5-(трифторметил)тиен-3-ила.
В соединениях формулы I, где Ar представляет собой радикал (G), Re предпочтительно выбран из H, галогена, C1-C4-алкила и фторированного C1-C4-алкила, более предпочтительно из галогена, C1-C4-алкила и фторированного C1-C4-алкила и более предпочтительно из C1-C4-алкила, в особенности CH3.
Rf предпочтительно выбран из галогена, C1-C4-алкила и фторированного C1-C4-алкила, более предпочтительно из галогена, в особенности хлора.
j предпочтительно имеет значение 0 или 1, в особенности 1. В случае, когда j имеет значение 1, Rf предпочтительно присоединен по 4- или в особенности по 5-положению (относительно 3-положения Re).
В соединениях формулы I, где Ar представляет собой радикал (G), n, как правило, имеет значение 0.
В особенности предпочтительные Ar радикалы формулы (G) выбраны из бензо[b]тиофен-2-ила, бензо[b]тиофен-3-ила, 3-метилбензо[b]тиофен-2-ила, 5-метилбензо[b]тиофен-2-ила, 5-фтор-3-метилбензо[b]тиофен-2-ила, 5-хлор-3-метилбензо[b]тиофен-2-ила и 5-бром-3-метилбензо[b]тиофен-2-ила.
В одном из предпочтительных воплощений А представляет собой 1,3-фенилен. В указанном случае радикалы R1, R2, R3, R4, E и Ar с его переменными Ra, Rb, Rc Rd, Re и Rf имеют указанные выше общие или предпочтительные значения.
В альтернативном предпочтительном воплощении A представляет собой 1,4-фенилен. В указанном случае радикалы R1, R2, R3, R4, E и Ar с его переменными Ra, Rb, Rc, Rd, Re и Rf имеют указанные выше общие или предпочтительные значения. Тем не менее, Ra в указанном случае предпочтительно выбран из группы, состоящей из C1-C6-алкила, C1-C6-гидроксиалкила, C1-C6-алкокси-C1-C6-алкила, C2-C6-алкенила, фторированного C2-C6-алкенила, C3-C6-циклоалкила, фторированного C3-C6-циклоалкила, C1-C6-алкокси, C1-C6-гидроксиалкокси, C1-C6-алкокси-C1-C6-алкокси, C1-C6-алкилтио, фторированного C1-C6-алкилтио, C1-C6-алкилсульфинила, фторированного C1-C6-алкилсульфинила, C1-C6-алкилсульфонила, фторированного C1-C6-алкилсульфонила, фенилсульфонила, бензилокси, фенокси, где фенильный радикал в трех последних упомянутых радикалах может быть незамещенным или может нести от 1 до 3 заместителей, выбранных из C1-C4-алкила, фторированного C1-C4-алкила и галогена, CN, нитро, C1-C6-алкилкарбонила, фторированного C1-C6-алкилкарбонила, C1-C6-алкилкарбониламино, фторированного C1-C6-алкилкарбониламино, карбокси, NH-C(O)-NR6R7, NR6R7, NR6R7-C1-C6-алкилена, O-NR6R7, где R6 и R7 независимо друг от друга представляют собой H, C1-C4-алкил, фторированный C1-C4-алкил или C1-C4-алкокси, или могут образовывать вместе с N 4-, 5- или 6-членное насыщенное или ненасыщенное кольцо, или представляет собой насыщенное или ненасыщенное 3-7-членное гетероциклическое кольцо, включающее в качестве членов кольца 1, 2, 3 или 4 гетероатома, выбранных из N, O и S, и/или 1, 2 или 3 содержащие гетероатом группы, выбранные из NR8, где R8 определен выше, SO, SO2 и CO, и где гетероциклическое кольцо может нести 1, 2 или 3 заместителя, выбранных из гидрокси, галогена, C1-C6-алкила, фторированного C1-C6-алкила и C1-C6-алкокси. Более предпочтительно, Ra в указанном случае выбран из группы, состоящей из C1-C6-алкила, C1-C6-гидроксиалкила, C1-C4-алкокси, C1-C4-алкокси-C1-C4-алкокси, C2-C4-алкенила, фторированного C2-C4-алкенила, NR6R7, ONR6R7, C1-C6-алкилен-NR6R7, где R6 и R7 независимо друг от друга представляют собой H, C1-C4-алкил или C1-C4-алкокси, уреидо (NHCONH2), C3-C6-циклоалкил, фторированный C3-C6-циклоалкил, ацетил, карбоксил, гидрокси, циано, нитро, бензокси, метилсульфанил, фторметилсульфанил, дифторметилсульфанил, трифторметилсульфанил, метилсульфонил и одно из упомянутых выше насыщенных или ненасыщенных 3-7-членных гетероциклических колец, в частности азетидин-1-ил, 2-метилазетидинил, 3-метоксиазетидинил, 3-гидроксиазетидинил, 3-фторазетидинил, 2,2-дифторазетидин-1-ил, пирролидин-1-ил, пирролидин-2-ил, пирролидин-3-ил, 2- и 3-фторпирролидин-1-ил, 2,2-дифторпирролидин-1-ил, 3,3-дифторпирролидин-1-ил, 2- и 3-метилпирролидин-1-ил, 1-метилпирролидин-2-ил, 2,2-диметилпирролидин-1-ил, 3,3-диметилпирролидин-1-ил, 2-оксопирролидин-1-ил, 2- и 3-трифторметилпирролидин-1-ил, 2-оксооксазолидин-1-ил, пиперидин-1-ил, 2-метилпиперидин-1-ил, 3-(2-фторпиперидин-1-ил)фенил, 3-((S)-2-фторпиперидин-1-ил)фенил, 3-((R)-2-фторпиперидин-1-ил)фенил, 3-(2,2-дифторпиперидин-1-ил)фенил, пиперазин-1-ил, 4-метилпиперазин-1-ил, морфолин-4-ил, тиоморфолин-4-ил, 1-оксотиоморфолин-4-ил, 1,1-диоксотиоморфолин-4-ил, пиррол-1-ил, пиррол-2-ил, пиррол-3-ил, 1-метилпиррол-2-ил, 1-метилпиррол-3-ил, пиразол-1-ил, пиразол-3-ил, пиразол-4-ил, 1-метилпиразол-4-ил, 4-фторпиразол-1-ил, имидазол-1-ил, имидазол-2-ил, 1-метилимидазол-2-ил, оксазол-2-ил, оксазол-4-ил, оксазол-5-ил, изоксазол-3-ил, изоксазол-4-ил, изоксазол-5-ил, тиазол-2-ил, тиазол-4-ил, тиазол-5-ил, 2-метилтиазол-4-ил, 2-метилтиазол-5-ил, [1,2,3]триазол-1-ил, [1,2,4]триазол-1-ил, [1,2,3]триазол-2-ил, [1,2,4]триазол-3-ил, [1,2,4]триазол-4-ил, 4-метил-[1,2,4]триазол-3-ил, 2-метил-[1,2,3]триазол-4-ил, [1,3,4]-оксадиазол-2-ил, [1,2,4]-оксадиазол-3-ил, [1,2,4]-оксадиазол-5-ил, [1,2,3]-оксадиазол-5-ил, [1,3,4]-оксадиазол-2-ил, 5-метил-[1,3,4]-оксадиазол-2-ил, 5-метил-[1,2,4]-оксадиазол-3-ил, [1,2,3]тиадиазол-4-ил, тетразол-1-ил, тетразол-5-ил, 2-метилтетразол-5-ил, 1-метилтетразол-5-ил, фуразан-3-ил, пирид-2-ил, пирид-3-ил, пирид-4-ил, пиримидин-2-ил, пиримидин-4-ил, пиримидин-5-ил и 2-метилпиримидин-4-ил.
Даже более предпочтительно, Ra в указанном случае выбран из группы, состоящей из C1-C6-алкила, C1-C4-алкокси, C2-C4-алкенила, C3-C6-циклоалкила, фторированного C3-C6-циклоалкила, уреидо, ацетила, ацетиламино, карбоксила, гидрокси, циано, нитро, бензокси, трифторметилсульфанила, метилсульфонила, азетидин-1-ила, 2-метилазетидинила, 3-метоксиазетидинила, 3-гидроксиазетидинила, 3-фторазетидинила, 2,2-дифторазетидин-1-ила, пирролидин-1-ила, пирролидин-2-ила, пирролидин-3-ила, 2- и 3-фторпирролидин-1-ила, 2,2-дифторпирролидин-1-ила, 3,3-дифторпирролидин-1-ила, 2- и 3-метилпирролидин-1-ила, 1-метилпирролидин-2-ила, 2,2-диметилпирролидин-1-ила, 3,3-диметилпирролидин-1-ила, 2-оксопирролидин-1-ила, 2- и 3-трифторметилпирролидин-1-ила, 2-оксооксазолидин-1-ила, пиперидин-1-ила, 2-метилпиперидин-1-ила, 3-(2-фторпиперидин-1-ил)фенила, 3-((S)-2-фторпиперидин-1-ил)фенила, 3-((R)-2-фторпиперидин-1-ил)фенила, 3-(2,2-дифторпиперидин-1-ил)фенила, пиперазин-1-ила, 4-метилпиперазин-1-ила, морфолин-4-ила, тиоморфолин-4-ила, 1-оксотиоморфолин-4-ила, 1,1-диоксотиоморфолин-4-ила, пиррол-1-ила, пиррол-2-ила, пиррол-3-ила, 1-метилпиррол-2-ила, 1-метилпиррол-3-ила, пиразол-1-ила, пиразол-3-ила, пиразол-4-ила, 1-метилпиразол-4-ила, 4-фторпиразол-1-ила, имидазол-1-ила, имидазол-2-ила, 1-метилимидазол-2-ила, оксазол-2-ила, оксазол-4-ила, оксазол-5-ила, изоксазол-3-ила, изоксазол-4-ила, изоксазол-5-ила, тиазол-2-ила, тиазол-4-ила, тиазол-5-ила, 2-метилтиазол-4-ила, 2-метилтиазол-5-ила, [1,2,3]триазол-1-ила, [1,2,4]триазол-1-ила, [1,2,3]триазол-2-ила, [1,2,4]триазол-3-ила, [1,2,4]триазол-4-ила, 4-метил-[1,2,4]триазол-3-ила, 2-метил-[1,2,3]триазол-4-ила, [1,3,4]-оксадиазол-2-ила, [1,2,4]-оксадиазол-3-ила, [1,2,4]-оксадиазол-5-ила, [1,2,3]-оксадиазол-5-ила, [1,3,4]-оксадиазол-2-ила, 5-метил-[1,3,4]-оксадиазол-2-ила, 5-метил-[1,2,4]-оксадиазол-3-ила, [1,2,3]тиадиазол-4-ила, тетразол-1-ила, тетразол-5-ила, 2-метилтетразол-5-ила, 1-метилтетразол-5-ила, фуразан-3-ила, пирид-2-ила, пирид-3-ила, пирид-4-ила, 4-метилпиридин-2-ила, 6-метилпиридин-2-ила, 5-бромпиридин-2-ила, пиримидин-2-ила, пиримидин-4-ила, пиримидин-5-ила и 2-метилпиримидин-4-ила.
В указанном случае, то есть, если A представляет собой 1,4-фенилен, предпочтительными примерами для Ar, в частности, являются следующие: 3-метилфенил, 3-этилфенил, 3-пропилфенил, 3-изопропилфенил, 3-втор-бутилфенил, 3-изобутилфенил, 3-трет-бутилфенил, 3-(1,1-диметилпропил)фенил, 3-винилфенил, 3-изопропенилфенил, 3-метоксифенил, 3-этоксифенил, 3-пропоксифенил, 3-изопропоксифенил, 3-бутоксифенил, 3-циклопропилфенил, 3-циклобутилфенил, 3-циклопентилфенил, 3-(2,2-дифторциклопропил)фенил, 3-(1-гидрокси-1-метилэтил)фенил, 3-(2-гидрокси-2-метилпропил)фенил, 3-(цианофенил), 2,5-диметилфенил, 2,5-ди(трифторметил)фенил, 3,5-ди(трифторметил)фенил, 2,5-диметоксифенил, 2-метокси-5-метилфенил, 2-метокси-5-(трифторметил)фенил, 3-ацетилфенил, 3-ацетиламинофенил, 3-карбоксифенил, 3-цианофенил, 3-нитрофенил, 3-гидроксифенил, 3-(O-бензил)фенил, 3-(2-метоксиэтокси)фенил, 3-(CH2-N(CH3)2)фенил, 3-(NH-CO-NH2)фенил, 3-(метилсульфанил)фенил, 3-(фторметилсульфанил)фенил, 3-(дифторметилсульфанил)фенил, 3-(трифторметилсульфанил)фенил, 3-(метилсульфонил)фенил, 3-(N-метокси-N-метиламино)фенил, 3-(метоксиамино)фенил, 3-(этоксиамино)фенил, 3-(N-метиламиноокси)фенил, 3-(N,N-диметиламиноокси)фенил, 3-(азетидин-1-ил)фенил, 3-(2-метилазетидин-1-ил)фенил, 3-((S)-2-метилазетидин-1-ил)фенил, 3-((R)-2-метилазетидин-1-ил)фенил, 3-(3-фторазетидин-1-ил)фенил, 3-(2,2-дифторазетидин-1-ил)фенил, 3-(3-метоксиазетидин-1-ил)фенил, 3-(3-гидроксиазетидин-1-ил)фенил, 3-(пирролидин-1-ил)фенил, 3-(пирролидин-2-ил)фенил, 3-((S)-пирролидин-2-ил)фенил, 3-((R)-пирролидин-2-ил)фенил, 3-(пирролидин-3-ил)фенил, 3-((S)-пирролидин-3-ил)фенил, 3-((R)-пирролидин-3-ил)фенил, 3-(пирролидин-1-ил)-5-(трифторметил)фенил, 5-(пирролидин-1-ил)-2-метоксифенил, 3-(пирролидин-1-ил)-4-метоксифенил, 5-(пирролидин-1-ил)-2,4-дифторфенил, 3-(пирролидин-1-ил)-2,4-дифторфенил, 3-(2-фторпирролидин-1-ил)фенил, 3-((S)-2-фторпирролидин-1-ил)фенил, 3-((R)-2-фторпирролидин-1-ил)фенил, 3-(3-фторпирролидин-1-ил)фенил, 3-((S)-3-фторпирролидин-1-ил)фенил, 3-((R)-3-фторпирролидин-1-ил)фенил, 3-(2,2-дифторпирролидин-1-ил)фенил, 3-(3,3-дифторпирролидин-1-ил)фенил, 3-(2-метилпирролидин-1-ил)фенил, 3-((S)-2-метилпирролидин-1-ил)фенил, 3-((R)-2-метилпирролидин-1-ил)фенил, 3-(3-метилпирролидин-1-ил)фенил, 3-((S)-3-метилпирролидин-1-ил)фенил, 3-((R)-3-метилпирролидин-1-ил)фенил, 3-(1-метилпирролидин-2-ил)фенил, 3-((S)-1-метилпирролидин-2-ил)фенил, 3-((R)-1-метилпирролидин-2-ил)фенил, 3-(1-метилпирролидин-3-ил)фенил, 3-((S)-1-метилпирролидин-3-ил)фенил, 3-((R)-1-метилпирролидин-3-ил)фенил, 3-(2,2-диметилпирролидин-1-ил)фенил, 3-(3,3-диметилпирролидин-1-ил)фенил, 3-(2-трифторметилпирролидин-1-ил)фенил, 3-((S)-2-трифторметилпирролидин-1-ил)фенил, 3-((R)-2-трифторметилпирролидин-1-ил)фенил, 3-(3-трифторметилпирролидин-1-ил)фенил, 3-((S)-3-трифторметилпирролидин-1-ил)фенил, 3-((R)-3-трифторметилпирролидин-1-ил)фенил, 3-(2-оксопирролидин-1-ил)фенил, 3-(2-оксооксазолидин-3-ил)фенил, 3-(пиперидин-1-ил)фенил, 3-(2-метилпиперидин-1-ил)фенил, 3-((S)-2-метилпиперидин-1-ил)фенил, 3-((R)-2-метилпиперидин-1-ил)фенил, 3-(2-фторпиперидин-1-ил)фенил, 3-((S)-2-фторпиперидин-1-ил)фенил, 3-((R)-2-фторпиперидин-1-ил)фенил, 3-(2,2-дифторпиперидин-1-ил)фенил, 3-(пиперазин-1-ил)фенил, 3-(4-метилпиперазин-1-ил)фенил, 3-(морфолин-4-ил)фенил, 3-(морфолин-4-ил)-5-(трифторметил)фенил, 5-(морфолин-4-ил)-2-метоксифенил, 3-(морфолин-4-ил)-4-метоксифенил, 5-(морфолин-4-ил)-2,4-дифторфенил, 3-(морфолин-4-ил)-2,4-дифторфенил, 3-(тиоморфолин-4-ил)фенил, 3-(1-оксотиоморфолин-4-ил)фенил, 3-(1,1-диоксотиоморфолин-4-ил)фенил, 3-(пиррол-1-ил)фенил, 3-(пиррол-2-ил)фенил, 3-(пиррол-3-ил)фенил, 3-(1-метилпиррол-2-ил)фенил, 3-(1-метилпиррол-3-ил)фенил, 3-(фуран-2-ил)фенил, 3-(фуран-3-ил)фенил, 3-(тиофен-2-ил)фенил, 3-(тиофен-3-ил)фенил, 3-(5-пропилтиен-2-ил)фенил, 3-(пиразол-1-ил)фенил, 3-(пиразол-3-ил)фенил, 3-(пиразол-4-ил)фенил, 3-(1-метил-1H-пиразол-4-ил)фенил, 3-(1-этил-1H-пиразол-4-ил)фенил, 3-(1-метил-1H-пиразол-5-ил)фенил, 3-(4-фторпиразол-1-ил)фенил, 3-(1H-имидазол-2-ил)фенил, 3-(имидазол-1-ил)фенил, 3-(1-метилимидазол-2-ил)фенил, 3-(оксазол-2-ил)фенил, 3-(оксазол-4-ил)фенил, 3-(оксазол-5-ил)фенил, 4-фтор-3-(оксазол-4-ил)фенил, 3-(изоксазол-3-ил)фенил, 3-(изоксазол-4-ил)фенил, 3-(изоксазол-5-ил)фенил, 3-(тиазол-2-ил)фенил, 3-(тиазол-4-ил)фенил, 3-(тиазол-5-ил)фенил, 3-(2-метилтиазол-4-ил)фенил, 3-(2-метилтиазол-5-ил)фенил, 3-([1,2,3]-триазол-1-ил)фенил, 3-([1,2,4]-триазол-1-ил)фенил, 3-([1,2,3]-триазол-2-ил)фенил, 3-(4H-[1,2,4]-триазол-3-ил)фенил, 3-([1,2,4]-триазол-4-ил)фенил, 3-(2H-[1,2,3]-триазол-4-ил)фенил, 3-(4-метил-4H-[1,2,4]-триазол-3-ил)фенил, 3-(2-метил-2H-[1,2,3]-триазол-4-ил)фенил, 3-([1,3,4]-оксадиазол-2-ил)фенил, 3-(5-метил-[1,3,4]-оксадиазол-2-ил)фенил, 3-([1,2,4]-оксадиазол-3-ил)фенил, 3-(5-метил-[1,2,4]-оксадиазол-3-ил)фенил, 3-([1,2,4]-оксадиазол-5-ил)фенил, 3-([1,2,3]-оксадиазол-4-ил)фенил, 3-([1,2,3]-оксадиазол-5-ил)фенил, 3-([1,2,3]-тиадиазол-4-ил)фенил, 3-(1H-тетразол-5-ил)фенил, 3-(тетразол-1-ил)фенил, 3-(2-метил-2H-тетразол-5-ил)фенил, 3-(1-метил-1H-тетразол-5-ил)фенил, 3-фуразан-3-ил-фенил, 3-(пирид-2-ил)фенил, 3-(пирид-3-ил)фенил, 3-(пирид-4-ил)фенил, 3-(пиримидин-2-ил)фенил, 3-(пиримидин-4-ил)фенил, 3-(2-метилпиримидин-4-ил)фенил, 3-(пиримидин-5-ил)фенил, 5-бромпиридин-3-ил, 3-бром-2-хлорпиридин-5-ил, 4-метилпиридин-2-ил, 6-метилпиридин-2-ил, 4-(трифторметил)пиридин-2-ил, 6-(трифторметил)пиридин-2-ил, 5-(трифторметил)пиридин-3-ил, 5-(пирролидин-1-ил)пиридин-3-ил, 3-(пирролидин-1-ил)-2-хлорпиридин-5-ил и 3-(морфолин-4-ил)-2-хлорпиридин-5-ил.
В особенности предпочтительными соединениями формулы I являются те, которые имеют формулы I.а, I.b, I.c, I.d, I.e, I.f, I.g, I.h, I.i, I.k, I.l, I.m, I.n, I.o, I.p, I.q, I.r, I.s и I.t, где R1 и Ar имеют определенные выше значения. Предпочтительными значениями R1 и Ar являются те, которые определены выше.




Примеры предпочтительных соединений, которые представлены формулами I.q, I.r, I.s и I.t, перечислены в нижеследующих таблицах с 1 по:
Таблица 1
Соединения формулы I.q, в которых R4 представляет собой метил и комбинация из R1 и Ar для соединения соответствует в каждом случае одной строке в таблице A
Таблица 2
Соединения формулы I.q, в которых R4 представляет собой фторметил и комбинация из R1 и Ar для соединения соответствует в каждом случае одной строке в таблице A
Таблица 3
Соединения формулы I.q, в которых R4 представляет собой дифторметил и комбинация из R1 и Ar для соединения соответствует в каждом случае одной строке в таблице A
Таблица 4
Соединения формулы I.q, в которых R4 представляет собой трифторметил и комбинация из R1 и Ar для соединения соответствует в каждом случае одной строке в таблице A
Таблица 5
Соединения формулы I.r, в которых R4 представляет собой метил и комбинация из R1 и Ar для соединения соответствует в каждом случае одной строке в таблице A
Таблица 6
Соединения формулы I.r, в которых R4 представляет собой фторметил и комбинация из R1 и Ar для соединения соответствует в каждом случае одной строке в таблице A
Таблица 7
Соединения формулы I.r, в которых R4 представляет собой дифторметил и комбинация из R1 и Ar для соединения соответствует в каждом случае одной строке в таблице A
Таблица 8
Соединения формулы I.r, в которых R4 представляет собой трифторметил и комбинация из R1 и Ar для соединения соответствует в каждом случае одной строке в таблице A
Таблица 9
Соединения формулы I.s, в которых R3 представляет собой метил и комбинация из R1 и Ar для соединения соответствует в каждом случае одной строке в таблице A
Таблица 10
Соединения формулы I.s, в которых R3 представляет собой фторметил и комбинация из R1 и Ar для соединения соответствует в каждом случае одной строке в таблице A
Таблица 11
Соединения формулы I.s, в которых R3 представляет собой дифторметил и комбинация из R1 и Ar для соединения соответствует в каждом случае одной строке в таблице A
Таблица 12
Соединения формулы I.r, в которых R3 представляет собой трифторметил и комбинация из R1 и Ar для соединения соответствует в каждом случае одной строке в таблице A
Таблица 13
Соединения формулы I.t, в которых R3 представляет собой метил и комбинация из R1 и Ar для соединения соответствует в каждом случае одной строке в таблице A
Таблица 14
Соединения формулы I.t, в которых R3 представляет собой фторметил и комбинация из R1 и Ar для соединения соответствует в каждом случае одной строке в таблице A
Таблица 15
Соединения формулы I.t, в которых R3 представляет собой дифторметил и комбинация из R1 и Ar для соединения соответствует в каждом случае одной строке в таблице A
Таблица 16
Соединения формулы I.t, в которых R3 представляет собой трифторметил и комбинация из R1 и Ar для соединения соответствует в каждом случае одной строке в таблице A
Примеры предпочтительных соединений, которые представлены формулами I.а, I.b, I.c, I.d, I.e, I.f, I.g, I.h, I.i, I.k, I.l, I.m, I.n, I.o, I.p, I.q, I.r, I.s и I.t представляют собой индивидуальные соединения, перечисленные выше, где переменные Ar и R1 имеют значения, данные в одной строке в таблице A.
Соединения формулы I по настоящему изобретению могут быть синтезированы, как описано в синтетических путях A, B и C, представленных ниже.
Схема 1


На схеме 1 A, Ar, G, n, R2 и R4 определены выше. R' представляет собой или R1 или предшественник R1.
Путь A
В случае направления синтеза через путь A, аминосоединение (II-1) взаимодействует с подходящим производным сульфоновой кислоты, что дает сульфонамид (I-1) (E=NH). Подходящей производной сульфоновой кислоты является, например, сульфонилхлорид Ar-SO2Cl. Реакцию сульфонирования предпочтительно проводят в присутствии основания в соответствии со стандартными методиками. В реакции, представленной на указанной выше схеме 1, сульфонирование проводят в реакционных условиях, которые являются обычными для получения арилсульфонамидных соединений или арилсульфоновых сложных эфиров, соответственно, и которые описаны, например, у J. March, Advanced Organic Chemistry, 3rd edition, John Wiley & Sons, New York, 1985, page 444ff и в уровне техники, приведенном там, European J. Org. Chem. 2002 (13), pp.2094-2108, Tetrahedron 2001, 57 (27), pp.5885-5895, Bioorganic и Medicinal Chemistry Letters, 2000, 10(8), pp.835-838 и Synthesis 2000 (1), pp.103-108. Реакцию обычно проводят в инертном растворителе, например в эфире, таком как диэтиловый эфир, диизопропиловый эфир, метил трет-бутиловый эфир или тетрагидрофуран, в углеводороде, таком как дихлорметан, в алифатическом или циклоалифатическом углеводороде, таком как пентан, гексан или циклогексан, или в ароматическом углеводороде, таком как толуол, ксилол, кумол и им подобные, или в смеси упомянутых выше растворителей. Реакцию с Cl-SO2-Ar обычно проводят в присутствии вспомогательного основания. Подходящими основаниями являются неорганические основания, такие как карбонат натрия или карбонат калия, или гидрокарбонат натрия или гидрокарбонат калия и органические основания, например триалкиламины, такие как триэтиламин, или пиридиновые соединения, такие как пиридин, лутидин и им подобные. Последние соединения могут в то же самое время служить как растворители. Вспомогательное основание обычно применяют в, по меньшей мере, эквимолярных количествах исходя из аминового соединения (II-1).
До реакции сульфонирования радикал NH2 может быть превращен в NR5' группу, в которой R5' имеет значения, отличные от водорода, которые являются специфическими для R5 (не показано на схеме 1).
Если в полученном сульфонамиде (I'-1) R' не представляет собой желаемый радикал R1, но является его предшественником, соединение может быть модифицировано, как описано ниже, чтобы получить желаемый заместитель R1. Предшественник представляет собой радикал, который может быть легко удален и заменен желаемой группой R1 или который может быть модифицирован, что дает R1. Предшественник может также быть N-защитной группой.
Если R' представляет собой аллил, аллильная группа может быть отщеплена, чтобы получить соединение, где R' представляет собой водород. Отщепление аллильной группы достигается, например, путем взаимодействия соединения (I'-1) [R'=аллил] с аллилзахватывающим агентом, таким как меркаптобензойная кислота или 1,3-диметилбарбитуровая кислота, в присутствии каталитического количества палладиевых(0) соединений или палладиевых соединений, которые в состоянии образовывать палладиевое(0) соединение в реакционных условиях, например дихлорид палладия, тетракис(трифенилфосфин)палладия(0) или трис(дибензилиденацетон)дипалладия(0), преимущественно в комбинации с фосфиновыми лигандами, например триарилфосфинами, такими как трифенилфосфин, триалкилфосфинами, такими как трибутилфосфин, и циклоалкилфосфинами, такими как трициклогексилфосфин, и, в особенности, с фосфинхелатными лигандами, такими как 2,2'-бис(дифенилфосфино)-1,1'-бинафтил или 1,4-бис(дифенилфосфино)бутан, используя способы, известные из уровня техники (в отношении отщепления N-аллила в присутствии меркаптобензойной кислоты, см. WO 94/24088; в отношении отщепления в присутствии 1,3-диметилбарбитуровой кислоты, см. J. Am. Chem. Soc. 2001, 123 (28), pp.6801-6808 и J. Org. Chem. 2002, 67(11), pp.3718-3723). Альтернативно, отщепление N-аллила может также быть эффективным при взаимодействии в присутствии родиевых соединений, таких как трис(трифенилфосфин)хлорродия(I), используя способы, известные из уровня техники (см. J. Chem. Soc., Perkin Transaction I: Organic and Bio-Organic Chemistry 1999 (21), pp.3089-3104 и Tetrahedron Asymmetry 1997, 8(20), pp.3387-3391).
Если R' представляет собой бензил, указанный заместитель может также быть отщеплен, чтобы получить соединение (I'-1), где R' представляет собой Н. Условия реакции для отщепления известны среднему специалисту. Как правило, бензильную группу удаляют с помощью реакции гидрогенизации в присутствии подходящего Pd катализатора, такого как Pd на угле или гидроксид палладия.
R' может также быть защитной группой. Защитная группа может быть удалена, чтобы получить на выходе соединение (I'-1), где R' представляет собой Н. Подходящие защитные группы известны среднему специалисту и, например, выбраны из трет-бутоксикарбонила (boc), бензилоксикарбонила (Cbz), 9-флуоренилметоксикарбонила (Fmoc), трифенилметила (Trt) и нитробензолсульфенила (Nps). Предпочтительной защитной группой является boc. Защитные группы могут быть удалены известными способами, такими как обработка защищенного амина кислотой, например галогеновой кислотой, такой как HCl или HBr, или трифторуксусной кислотой, или путем гидрогенизации, необязательно в присутствии Pd катализатора.
Полученное соединение, где R' представляет собой Н, может затем взаимодействовать известным способом, в смысле алкилирования, с соединением R1-X. В указанном соединении R1 представляет собой C1-C4-алкил, C3-C6-циклоалкил, C1-C4-галогеналкил, C1-C4-алкокси-C1-C4-алкил или C3-C6-циклоалкил-C1-C4-алкил и X представляет собой нуклеофильно замещаемую уходящую группу, например галогеновую, трифторацетатную, алкилсульфонатную, арилсульфонатную, алкилсульфатную и им подобные. Условия реакции, которые являются обязательными для алкилирования, в достаточной мере раскрыты, например, в Bioorganic and Medicinal Chemistry Lett. 2002, 12(7), pp.2443-2446 и также 2002, 12(5), pp.1917-1919.
Алкилирование может также быть достигнуто, в смысле восстановительного аминирования, путем взаимодействия соединения (I'-1), где R'=H, с подходящим кетоном или альдегидом в присутствии агента восстановления, например в присутствии боргидрида, такого как боргидрид натрия, цианоборгидрид натрия или триацетоксиборгидрид натрия. Средний специалист знаком с условиями реакции, которые являются обязательными для восстановительного аминирования, например, из Bioorganic and Medicinal Chemistry Lett. 2002, 12(5), pp.795-798 и 12(7), pp.1269-1273.
В случае, если R' представляет собой водород, полученный сульфонамид (I'-1) может в дальнейшем взаимодействовать с ацилгалогенидом, чтобы получить соединение формулы I, где R1 представляет собой C1-C3-алкилкарбонил. Карбонильная группа в этих соединениях может быть восстановлена дибораном, чтобы получить соединения общей формулы I, где R1 представляет собой C2-C4-алкил. Карбонильная группа может также подвергнута взаимодействию с фторирующим агентом, чтобы получить соединение формулы I, где R1 представляет собой 1,1-дифторалкил. Ацилирование и восстановление могут быть осуществлены обычными способами, которые рассмотрены у Jerry March, Advanced Organic Chemistry, 3rd ed. J. Wiley & Sons, New York, 1985, p.370 и 373 (acylation) and p.1099 f. и в приведенном уровне техники в указанной публикации (в отношении ацилирования, см. также Synth. Commun. 1986, 16, p.267, и в отношении восстановления, см. также J. Heterocycl. Chem. 1979, 16, p.1525).
Путь B
В случае направления синтеза через путь B бромзамещенное соединение (II-2) взаимодействует с подходящим сульфонамидом ArSO2NHR5, что дает сульфонамид (I'-1). Реакцию в целом проводят в условиях активации, например в условиях микроволнового облучения. Pd, в особенности Pd(0) или Cu катализаторы могут также быть использованы для связывания (см., например, Org. Lett. 2000, 2, 1101; J. Am. Chem. Soc. 2002, 124, 6043; Org. Lett. 2003, 5, 4373; Tetrahedron Lett. 2003, 44, 3385). Примерами подходящих Pd(0) катализаторов являются тетракис(трифенилфосфин)палладия(0) и Pd2(dba)3 (трис(дибензилиденацетон)дипалладия(0)), которые обычно используют в присутствии три(замещенного)фосфина, например триарилфосфина, такого как трифенилфосфин, тритолилфосфина или ксантфоса, три(цикло)алкилфосфина, такого как трис-н-бутилфосфин, трис(трет-бутил)фосфин или трис(циклогексилфосфин). Указанное направление является в особенности полезным в случаях, когда соответствующий сульфонилхлорид не пригоден.
Альтернативно, бромистый заместитель может быть заменен аминозаместителем, например, путем взаимодействия с бензофенонимином или с бис(триметилсилил)амидом лития в присутствии соединения палладия(0), такого как трис(дибензилиденацетон)дипалладий(0) в присутствии три(замещенного)фосфина, например триарилфосфина, такого как трифенилфосфин или тритолилфосфин, три(цикло)алкилфосфина, такого как трис-н-бутилфосфин, трис(трет-бутил)фосфин или трис(циклогексилфосфин), предпочтительно в присутствии основания, такого как гидрид натрия, в соответствии со способом, описанным в, например, J. Org. Chem., 68 (2993), pp.8274-8276 или J. Org. Chem. 2000, 65, 2612. Полученное аминосоединение может затем быть подвергнуто реакции сульфонирования через путь A.
Путь C
В случае направления синтеза через путь C соединение (II-3) взаимодействует с меркаптосоединением HS-Ar в присутствии основания, такого как гидрид натрия или алкоксид натрия, или с солью щелочного металла, таким образом получая на выходе тиоэфирное соединение. Тиоэфирный остаток затем окисляют до сульфонового остатка, например, оксоном, чтобы получить на выходе сульфон (I'-2).
Заместитель Ar может варьироваться или путем использования разных сульфонилхлоридов, или путем модифицирования заместителей группы Ar после образования сульфонамида (I'-1) или сульфона (I'-2) известными способами. Например, бромный заместитель Ar группы может быть заменен N-связанной пирролидинильной группой в соответствии с методикой, описанной в Tetrahedron Asym. 1999, 10, 1831. Указанное Pd-опосредованное связывание в целом применимо ко всем содержащим азот гетероциклам, таким как азетидинил, пиразолидинил, имидазолидинил, пиперидинил, пиперазинил, морфолинил и им подобные. Реакция также применима к гетероциклическим соединениям, содержащим один или большее число заместителей, таких как галоген, алкил или фторированный алкил. Бромный заместитель Ar группы может, кроме того, быть заменен изопропенильной группой в соответствии с методикой конденсации по Штилле (Stille), где бромное соединение взаимодействует с алкенилтрибутилоловом в присутствии подходящего Pd катализатора связывания, например тетракистрифенилфосфин палладия(0) (см., например, Tetrahedron, 2003, 59(34), 6545 и Bioorg. Med. Chem. 1999, 7(5), 665). Изопропенильная группа может затем быть превращена в изопропильную группу с помощью известных способов гидрогенизации.
Соединения формулы (II) (II-1, II-2 и II-3) могут быть синтезированы, как показано ниже.
1. Синтез соединений формулы (II-1)
Схема 2

На схеме 2, A, G, n и R' определены выше.
Превращение кислоты (III) в ее метиловый эфир (IV) выполняют с помощью обычных способов, например, как описано в Jerry March, Advanced Organic Chemistry, John Wiley, 3rd edition, page 348ff. Например, кислоту превращают в соответствующий хлорангидрид, например, путем взаимодействия ее с SOCl2. Хлорангидрид затем превращают в сложный эфир с помощью реакции с метанолом.
Восстановление на стадии (ii) соответственно проводят в обычных условиях для превращения эфиров карбоновых кислот в спирты. Подходящие условия реакции и агенты восстановления описаны, например, у Jerry March, Advanced Organic Chemistry, John Wiley, 3rd edition, page 1093ff. Типичными агентами восстановления являются гидриды металлов и гидридные комплексы. Примеры подходящих гидридов металлов включают BH3, 9-BBN, AlH3 и AlH(i-Bu)2 (DIBAL-H), соответственно, в присутствии комплексообразующих растворителей, таких как тетрагидрофуран и диэтиловый эфир. Гидридными комплексами являются, например, NaBH4, LiAlH4 и LiAlH(OR)3, где R представляет собой C1-C4-алкил, такой как метил, этил, изобутил или трет-бутил. Предпочтительным агентом восстановления является LiAlH4. Восстановление соответственно проводят в комплексных растворителях, таких как простые эфиры с открытой цепью и циклические простые эфиры, например тетрагидрофуран, диэтиловый эфир, дипропиловый эфир, диизопропиловый эфир, дибутиловый эфир и метилбутиловый эфир. Предпочтительным растворителем является тетрагидрофуран.
На стадии мезилирования (iii) спиртовую функциональность превращают в более подходящую уходящую группу. Мезилирование выполняют в обычных условиях, например, путем взаимодействия спирта с метансульфонилхлоридом в присутствии основания. Подходящими основаниями являются, среди других, алкиламины, такие как диэтиламин, триэтиламин и этилдиизопропиламин. На указанной стадии другие функциональности, представляющие собой пригодные уходящие группы, такие как трифторацетат, другие алкилсульфонаты, арилсульфонаты, например тозилаты, алкилсульфонаты и подобный тозилат, могут быть введены вместо метансульфонильной группы.
На стадии циклизации (iv) соединение (VI) или подходящее его производное взаимодействует с первичным амином NH2R'. В случае если первичный амин представляет собой жидкость, он может также быть использован как растворитель, делая ненужным дополнительный растворитель. Если амин является вязким или твердым веществом, реакцию преимущественно проводят в подходящем растворителе.
Реакцию на стадии (v) проводят в реакционных условиях, которые являются обычными для реакции нитрования на ароматическом радикале и которые описаны, например, у Jerry March, Advanced Organic Chemistry, John Wiley, 3rd edition, page 468ff, Tetrahedron 1999, 55(33), pp.10243-10252, J. Med. Chem. 1997, 40(22), pp.3679-3686 и Synthetic Communications, 1993, 23(5), pp.591-599. Например, соединение (VII) взаимодействует с концентрированной азотной кислотой или нитратом, таким как нитрат калия или натрия, в присутствии концентрированной серной кислоты. Полученный продукт (VIII) может находиться в виде разных региоизомеров (например, орто, мета или пара), если А представляет собой фенил или шестичленный гетероарил. В случае, когда A представляет собой фенил или шестичленный гетероарил, пара-нитросоединение в целом преобладает. Тем не менее, некоторое количество орто-продукта может также быть получено, тогда как мета-продукт не образуется совсем или только в ничтожных количествах. Путем разделения орто- и пара-продуктов, соединения формулы I, где А представляет собой 1,4-связанный фенил, являются доступными через реакционный путь, показанный на схеме 2.
На стадии (vi), нитрогруппу в соединении формулы (VIII) восстанавливают до NH2 группы. Впоследствии NH2 группа может быть превращена в -NR5' группу, в которой R5' имеет значения, отличные от водорода, которые определены для R5. Условия реакции, которые являются обязательными для стадии (vi), соответствуют обычным условиям для восстановления ароматических нитрогрупп, которые широко описаны в уровне техники (см., например, J. March, Advanced Organic Chemistry, 3rd ed., J. Wiley & Sons, New-York, 1985, p.1183 и приведенный уровень техники в указанной ссылке). Восстановление достигается, например, путем взаимодействия нитросоединения VII с металлом, таким как железо, цинк или олово, в кислотных условиях реакции, то есть используя образующийся водород или используя гидридный комплекс, такой как литий алюминий гидрид или боргидрид натрия, предпочтительно в присутствии соединений переходного металла никеля или кобальта, такого как NiCl2(P(фенил)3)2 или CoCl2(см. Ono et al. Chem. Ind. (London), 1983 p.480) или используя NaBH2S3 (см. Lalancette et al. Can. J. Chem. 49, 1971, p.2990), с имеющейся воможностью к осуществлению указанных восстановлений, в зависимости от данного реагента, в субстанции или в растворителе или разбавителе. Альтернативно, восстановление может быть проведено в присутствии водорода в присутствии катализатора переходного металла, например, используя водород в присутствии катализаторов на основе платины, палладия, никеля, рутения или родия. Катализаторы могут содержать переходный металл в атомарной форме или в форме комплексного соединения из соли или оксида переходного металла с возможностью модификации активности, чтобы использовать обычные солиганды, например органические фосфиновые соединения, такие как трифенилфосфин, трициклогексилфосфин или три-н-бутилфосфины или фосфиты. Катализатор обычно применяют в количествах от 0,001 до 1 моль на моль нитросоединения в расчете на металл в катализаторе. В предпочтительном варианте восстановление является эффективным при использовании хлорида олова(II) по аналогии со способами, описанными в Bioorganic and Medicinal Chemistry Letters, 2002, 12(15), pp.1917-1919 и J. Med. Chem. 2002, 45(21), pp.4679-4688. Реакцию соединения формулы VII с хлоридом олова(II) предпочтительно проводят в инертном органическом растворителе, предпочтительно спирте, таком как метанол, этанол, изопропанол или бутанол.
Для соединений, где n имеет значение 1 и А представляет собой фенилен (то есть формула (I) представляет собой N-(пирролидин-3-ил)фенилсульфонамид), исходное соединение (III) является, например, коммерчески доступной (S) или (R) фенилянтарной кислотой или ее рацемической смесью. Исходя из энантиомерно чистого (S)- или (R)-соединения (III) может быть получен чистый (S)- или (R):
а) (S) изомер

На стадии (i), коммерчески доступную (S)-фенилянтарную кислоту (II-S) превращают в метиловый эфир (III); его восстанавливают до спирта (IV), который взаимодействует с метилсульфонилхлоридом. Циклизация с первичным амином дает фенилпирролидин (VI). Фенильную группу вначале нитруют, затем нитрогруппу восстанавливают до аминогруппы, которая взаимодействует с сульфонилхлоридом, что дает желаемый сульфониламид (I'-S).
b) (R)-изомер
(R)-изомер может быть получен аналогичным способом исходя из коммерчески доступной (R)-фенилянтарной кислоты (III-R):

c) Изомерные смеси
Изомерные смеси соединений формул I'-S и I'-R могут быть получены исходя из рацемического соединения формулы III или из смеси соединений формул III-S и III-R.
Среднему специалисту понятно, что синтез, описанный на схеме 2, также пригоден для получения соединений формулы (II) и, следовательно, для соединений формулы (I), где R2, R3 и R4 отличны от H, например, исходя из соответствующим образом замещенного соединения формулы (III). Аналогичный подход к синтезу энантиомерно чистого соединения формулы (I), которое может быть синтезировано исходя из соответствующего энантиомера (III).
2. Синтез соединений формулы (II-2)
Соединения формулы (II-2) могут быть синтезированы путем выполнения на стадии (v) схемы 2 реакции галогенирования вместо реакции нитрования. Реакции галогенирования арильных и гетероарильных групп являются широко распространенными стандартными способами и, например, рассмотрены в Jerry March, Advanced Organic Chemistry, John Wiley, 3rd edition page 476 ff.
3. Синтез соединений формулы (II-3)
Синтез указанных соединений также соответствует стандартным реакционным способам и может быть выполнен путем моногалогенирования метильной группы метилзамещенного арила или гетероарильного соединения.
4. Синтез энантиомерно чистого соединения формулы I
В дополнение к способу, описанному в п.1, энантиомерно чистые соединения формулы (I) могут также быть получены путем применения стандартных методик разделения их до подходящих предшественников. Например, соединение формулы VIII (см. схему 2 выше) или соединения формулы (II-2) или (II-3) (см. схему 1 выше), где R' представляет собой подходящую защитную группу, такую как бензил, могут взаимодействовать с винной кислотой или ее производным (например, диэтилтартратом, дипропилтартратом, диизопропилтартратом и т.д.), что дает две диастереомерные соли. Они могут быть разделены обычным способом, например путем экстрагирования или хроматографическими способами или предпочтительно путем фракционной кристаллизации. Таким образом, разделенные диастереомерные соли затем превращают в энантиомерно чистые соединения формул VIII, II-2 или II-3 путем взаимодействия солей с подходящим основанием, что дает S- или R-энантиомерные соединения формул VIII, II-2 или II-3. Подходящими основаниями являются, например, гидроксиды щелочных металлов, такие как гидроксид калия и гидроксид натрия, гидроксиды щелочноземельных металлов, такие как гидроксид магния и гидроксид кальция, карбонаты щелочных металлов, такие как карбонат натрия и карбонат калия, карбонаты щелочноземельных металлов, такие как карбонат магния и карбонат кальция, оксиды щелочных металлов, такие как оксид натрия и оксид калия и оксиды щелочноземельных металлов, такие как оксид магния и оксид кальция; органические основания, такие как алкоголяты, например метилат натрия, этилат натрия или трет-бутилат натрия, амины, такие как диметиламин, триметиламин, диэтиламин, триэтиламин, дипропиламин, трипропиламин, диизопропиламин, диизопропилэтиламин и им подобные, и содержащие азот основные гетероциклические соединения, такие как пиридин, пиколин и лутидин.
5. Специфические синтезы
5.1. Синтез соединений, где n имеет значение 1 (пирролидинилсульфоновые производные)
5.1.1
Схема 3

На схеме 3 A и R3 определены выше.
Пирролидиновое кольцо является также доступным с помощью [3+2] биполярного циклоприсоединения нестабильного азометинового илида к 1-алкениларилу или гетероарильному производному (IX) (например, винилбензол, R3=H). Указанная методика в целом описана в J. Org. Chem. 1987, 52, 235. Предшественник илида, амин N(CH2Rb)(CH2SiMe3)(CH2OCH3) (X), является коммерчески доступным или может быть синтезирован из NH2(CH2Rb), Me3SiCH2Cl и HCHO в присутствии метанола.
1-Алкенил-(гетеро)ароматическое соединение (IX) может быть синтезировано, например, путем конденсации по Штилле галогенобензола, например, бромбензола с соответствующим алкенилтрибутилоловом, таким как винил или изобутенилтрибутилолово, в присутствии подходящего Pd катализатора конденсации, например тетракистрифенилфосфин палладия(0) (см., например, Tetrahedron, 2003, 59(34), 6545 и Bioorg. Med. Chem. 1999, 7(5), 665). Выбирая специальный изомер по Штилле (например, цис- или транс-изобутенилтрибутилолово), соответствующий цис- или транс-алкилфенилпирролидин может быть получен селективно.
Альтернативно, 1-алкенил-(гетеро)ароматическое соединение (IX) может быть синтезировано с помощью реакции по Виттигу (Wittig) арилальдегида с реагентом Виттига, таким как PPh3=CHR (R представляет собой Н или C1-C3-алкил). Условия для реакции по Виттигу хорошо известны среднему специалисту и, например, рассмотрены в Jerry March, Advanced Organic Chemistry, John Wiley, 3rd edition, page 845 ff.
Преимущественно 1-(гетеро)алкенилароматическое соединение (IX), кроме того, содержит нитрогруппу или другой галогеновый заместитель (X=NO2 или галоген). В указанном случае последующие реакционные стадии могут быть проведены, как описано, через путь A или B. Если X=H, кольцо A может быть вначале подвергнуто нитрованию, как описано на схеме 2, стадия (v), и затем подвергнуто реакции по схеме 2, стадия (vi), и по схеме 1, путь A; или кольцо A может быть галогенировано и затем подвергнуто методикам пути B.
Группа CH2Rb предшественника амина преимущественно соответствует или желаемой группе R1 конечного соединения I, или является альтернативно отщепляемой группой, такой как бензил, которая может быть удалена, что дает N-незамещенный пирролидин. Последний может впоследствии быть функционализирован, как описано выше (см. путь A).
Синтез гетероарилпирролидинов, например, описан в Chem. Pharm. Bull., 1985, 33, 2762-66; J. Heterocyclic Chemistry, 1996, 1995-2005; J. Heterocyclic Chemistry, 2001, 38, 1039-1044; Tetrahedron Letters, 1992, 33, 44, 6607-10; Heterocycles, 1998, 48, 12, 2535-2541 для A является пиридиленом. Синтез винилзамещенного тиофена и тиазола, например, описан в Bioorg. Med. Chem. 1999, 7(5), 665.
5.1.2
Схема 4

Фенилпирролидины могут также быть получены с помощью [3+2] биполярного циклоприсоединения нестабильного азометинового илида к 1-алкинилбензолу (XII) (см., например, Tetrahedron 1996, 52, 59). Полученный пирролин (XIII) или конечный продукт (I') затем гидрируют до соответствующего пирролидина (XI). Если гидрогенизацию проводят в хиральных условиях, например, путем использования хиральных катализаторов, могут быть получены энантиомерно чистые фенилпирролидиновые соединения. Хиральные катализаторы гидрогенизации хорошо известны среднему специалисту.
Последующие превращения в желаемый сульфонамид могут быть проведены, как описано через путь A или B.
5.1.3
Альтернативно, гетероарилпирролидинильные соединения могут быть получены из гетероарильных галогенидов, которые подвергают Pd-опосредованному перекрестному связыванию с цинкорганическим пирролидиновым соединением. Указанный способ описан в дальнейшем в деталях ниже через путь F. В указанной альтернативе также гетероарильный галогенид преимущественно содержит нитрогруппу. В указанном случае превращение в желаемые сульфонамиды может быть проведено, как описано через путь A. Альтернативно, гетероарильный галогенид содержит атом галоген. В указанном случае превращение в желаемые сульфонамиды может быть достигнуто, как описано через путь B.
5.1.4
Соединения формулы I, где n имеет значение 1, G представляет собой CH2, А представляет собой 1,3-связанный арилен или гетероарилен и E представляет собой NH, могут быть получены аналогичным путем по сравнению с получением 1,4-связанного соединения из 3-аминоарила или гетероарилпирролидина, который взаимодействует с подходящим сульфонилхлоридом. Преимущественно, N-атом пирролидинового кольца защищают с помощью основанной на уретане защитной группы, подобной карбометокси (-COOCH3), бензилоксикарбонилу (cbz) и трет-бутилоксикарбонилу (boc). Указанная группа может быть замещена на желаемый заместитель R1 путем обработки соединения кислотой, такой как соляная кислота, таким образом удаляя кислотную группу и затем вводя желаемый заместитель, как описано через путь A.
3-аминоарил или гетероарилпирролидин может быть получен с помощью реакции по Хеку (Heck), где защищенный пирролин взаимодействует с 1-йод-3-нитробензолом или соответствующим пиридином (2-йод-4-нитропиридин или 3-йод-5-нитропиридин) в типичных условиях реакции по Хеку. Каталитическая гидрогенизация пирролиновой двойной связи и восстановление нитрогруппы в соответствии с методикой, описанной на схеме 2, дает на выходе желаемый продукт.
N-защищенный пирролин может быть получен путем взаимодействия коммерчески доступного пирролина с желаемой защитной группой, например с хлорметилфумаратом, бензилхлоридом, Cbz-ангидридом или Boc-ангидридом.
Пирролин может быть синтезирован по реакции обмена N-защищенного диаллиламина в присутствии катализатора обмена, например катализатора Груббса (Grubbs).
5.2. Синтез N-(азетидин-3-ил)сульфонамидов
Соединения формулы I, где n имеет значение 0 (азетидиновые соединения), могут быть синтезированы следующим образом.
Схема 5

На схеме 5 Ar и R1 определены выше. X и Y независимо друг от друга представляют собой CH или N.
Исходя из 1-бензгидрилазетидин-3-ола опосредованное Pd снятие защиты с амина (Tetrahedron 2002, 58, 9865-9870), образование карбамата и последующее галогенирование обеспечивают получение промежуточного соединения, которое подвергают вводу Zn (Tetrahedron 1987, 43, 2203-2212; J. Org. Chem. 1988, 53, 2390-2392). Таким образом полученные цинкорганические остатки могут взаимодействовать с подходящим 2-галоген-нитрокольцом (Synlett 1998, 4, 379-380; J. Am. Chem. Soc. 2003, 125, 12527-12530), что дает нитроарилазетидиновое ядро. Если использовать 2-галоген-галогеновое кольцо, имеется также возможность осуществить прямое связывание между арилазетидингалогенидом и подходящими сульфонамидами (Org. Lett. 2000, 2, 1101-1104; J. Am. Chem. Soc. 2002, 124, 6043-6048; Org. Lett. 2003, 5, 4373-4376; Tetrahedron Lett. 2003, 44, 3385-3386). Амин может быть регенерирован путем отщепления карбамата (например, с помощью трифторуксусной кислоты в случае Boc карбамата) и впоследствии превращен в амид с помощью реакции с подходящим ацилхлоридом. Нитрогруппа может быть восстановлена до амина через хлорангидрид олова или каталитической гидрогенизацией (например, Pd-C) и затем превращена в желаемый сульфонамид с помощью реакции с подходящим сульфонилхлоридом в присутствии основания, такого как пиридин. Окончательное восстановление амида через гидроборирование дает конечные соединения.
Несомненно, реакцию также применяют к соединениям, где (гетеро)ароматическое кольцо, связанное с азетидиновой группой, представляет собой имеющий 5-членный гетероциклический радикал, например, тиенил.
5.3. Синтез N-(пиперидин-3-ил)сульфонамидов
Кроме того, описанный выше синтез (пути A, B и C), соединений формулы I, где n имеет значение 2 и E представляет собой NR5(пиперидин-3-илсульфонамиды), может быть осуществлен исходя из коммерчески доступных 3-арил или 3-гетероарилпиперидинов. Эти исходные соединения могут затем быть превращены в аминозамещенное или галогенированное производное и затем быть подвергнуты синтезу по пути A или B.
Среднему специалисту легко будет понятно, что соединения формулы I могут также быть получены из структурных аналогов соединений посредством взаимопревращений функциональной группы. В особенности N-связанные радикалы Ra могут быть введены в соединения формулы I путем взаимодействия соответствующего галогенового соединения, то есть соединения формулы I, которое вместо Ra содержит атом галогена, в особенности атом брома или йода, с первичным или вторичным амином в присутствии основания, предпочтительно также в присутствии палладиевого катализатора согласно реакции Вухвард-Хартвига (Buchwald-Hartwig).
Если иное не указано, описанные выше реакции в целом проводят в растворителе в интервалах температур между комнатной температурой и температурой кипения используемого растворителя. Альтернативно, энергия активации, которая требуется для реакции, может быть введена в реакционную смесь, используя микроволное излучение, то есть то, что, оказалось, имело значение, в частности, в случае реакций, катализируемых переходными металлами (в отношении реакции, используя микроволное излучение, см. Tetrahedron 2001, 57, p.9199 ff. p.9225 ff., и также в общем способе, "Microwaves in Organic Synthesis", André Loupy (Ed.), Wiley-VCH 2002.
Сульфонилхлориды Cl-SO2-Ar являются или коммерчески доступными или могут быть получены в соответствии со стандартными синтетическими способами. Сульфонилхлориды, содержащие фторированный радикал Ra, могут быть получены с помощью разных путей синтеза, например, путем взаимодействия подходящего гидрокси или оксопредшественника (например, соединения Cl-SO2-Ar, несущего гидрокси или оксозамещенный радикал) с реагентами фторирования, подобными DAST трифторид(диэтиламиносеры), морфолин-DAST, деоксофтор трифторид(бис(2-метоксиэтил)аминосеры), реагент Ишикавы (Ishikawa) (N,N-диэтил-(1,1,2,3,3,3-гексафторпропил)амин; Journal of Fluorine Chemistry, 1989, 43, 371-377). Более традиционно, гидроксигруппу ароматического соединения, которая содержит гидроксизамещенной радикал, но не хлорсульфонильную группу, превращают в уходящую группу, которую затем заменяют ионом фторида (J. Org. Chem., 1994, 59, 2898-22901; Tetrahedron Letters, 1998, 7305-6; J. Org. Chem., 1998, 63, 9587-9589, Synthesis, 1987, 920-21)). Последующее прямое хлорсульфонилирование хлорсульфоновой кислотой (Heterocycles, 2001, 55, 9, 1789-1803; J. Org. Chem., 2000, 65, 1399-1406) или 2-стадийным синтезом по получению вначале производных сульфоновой кислоты, которые затем превращают в сульфонилхлориды с помощью например, хлорсульфоновой кислоты, пентахлоридом фосфора (Eur. J. Med. Chem., 2002, 36, 809-828) и им подобным, дает на выходе желаемый сульфонилхлорид (Tetrahedron Letters, 1991, 33, 50, 7787-7788)). Сульфонилхлориды могут также быть получены путем диазотирования подходящего предшественника амина Ar-NH2 нитритом натрия в кислотных условиях и реакцией с диоксидом серы в уксусной кислоте (схема (iii); J. Org. Chem., 1960, 25, 1824-26); путем окисления подходящих гетероарилтиолов HS-Ar или гетероарилбензилтиоэфиров C6H5-CH2-S-Ar хлором (Synthesis, 1998, 36-38; J. Am. Chem. Soc., 1950, 74, 4890-92) непосредственно с соответствующими сульфонилхлоридами. Дальнейшее известно среднему специалисту или может быть получено обычными способами.
Кислотно-аддитивные соли соединений формулы I получают обычным способом путем смешивания свободного основания с соответствующей кислотой, если требуется, в растворе органического растворителя, например низшего спирта, такого как метанол, этанол или пропанол, эфира, такого как метил трет-бутиловый эфир или диизопропиловый эфир, кетона, такого как ацетон или метилэтилкетон или сложный эфир, такой как этилацетат.
Соединения по изобретению формулы I обладают неожиданно высоким сродством к 5HT6 рецепторам. Соединения формулы I, в которых A является 1,3-фениленом, 2,4-пиридиленом или 3,5-пиридиленом и, в частности, 1,3-фениленом, являются, кроме того, высокоселективными лигандами допаминовых 5HT6 рецепторов, которые за счет их низкого сродства к другим рецепторам, таким как D1 рецепторы, D5 рецепторы, D4 рецепторы, α1-адренергические и/или α2-адренергические рецепторы, мускариновые рецепторы, гистаминовые рецепторы, опиатные рецепторы и, в особенности, допаминовые D2 рецепторы, вызывают меньше побочных эффектов, чем другие, менее избирательные лиганды 5HT6. Соединения формулы I, в которых А является 1,4-фениленом, демонстрируют высокое сродство к 5HT6 рецепторам и, необязательно, также к допаминовым D3 рецепторам. Из-за их низкого сродства к другим рецепторам, таким как D1 рецепторы, D5 рецепторы, D4 рецепторы, α1-адренергические и/или α2-адренергические рецепторы, мускариновые рецепторы, гистаминовые рецепторы, опиатные рецепторы и, в особенности, допаминовые D2 рецепторы, вызывают меньше побочных эффектов, чем другие, менее избирательные соединения, такие как классические нейролептики, которые являются антагонистами D2 рецепторов.
Соединение изобретения может быть агонистом допаминовых 5HT6 рецепторов, включая частичную агонистическую активность, или антагонистом допаминовых 5HT6 рецепторов, включая обратную агонистическую активность.
Высокое сродство соединений согласно данному изобретению к 5HT6 рецепторам отражается в очень низких константах связывания рецептора in vitro (Ki(5HT6) значения), которые, как правило, менее чем 50 нМ (нмоль/л), предпочтительно менее чем 10 нМ и, в особенности, менее чем 5 нМ. Вытеснение3H-LSD может, например, быть использовано в исследованиях связывания рецептора для определения сродства связывания с 5-HT6 рецепторами и [125I]-йодосульприд для определения сродства связывания с допаминовыми D3 рецепторами.
Избирательность D3/D2 соединений согласно данному изобретению, которые также имеют высокое сродство к допаминовым D3 рецепторам, т.е. отношение Ki(D2)/Ki(D3) констант связывания рецептора, является, как правило, по меньшей мере, 25, предпочтительно, по меньшей мере, 50, еще лучше, по меньшей мере, 100. Вытеснение [3H]SCH23390 или [125I]спиперона может быть использовано, например, для проведения исследований связывания рецепторов D1, D2 и D4.
За счет их профиля связывания эти соединения могут быть использованы для лечения заболеваний, которые восприимчивы к лигандам 5HT6 рецепторов и, необязательно, к лигандам допаминовых D3 рецепторов (или которые чувствительны к лечению лигандами 5HT6 рецепторами, и необязательно, лигандами допаминовых D3 рецепторов), т.е. они являются эффективными в лечении таких медицинских расстройств или заболеваний, при которых оказание воздействия на (модулирование) 5HT6 рецепторы и необязательно на (модулирование) допаминовые D3 рецепторы, приводит к улучшению клинической картины или к излечению заболевания. Примерами этих заболеваний являются расстройства или заболевания центральной нервной системы.
Под расстройствами или заболеваниями центральной нервной системы понимают существенные расстройства, которые поражают спинной мозг и, в особенности, головной мозг. В понимании данного изобретения термин «расстройство» обозначает нарушения и/или аномалии, которые, как правило, рассматриваются в качестве патологических состояний или функционирования и которые могут проявляться в виде частных признаков, симптомов и/или нарушений. В то время как лечение согласно данному изобретению может быть направлено на конкретные расстройства, т.е. аномалии или патологические состояния, также возможно для нескольких аномалий, которые могут иметь причинно-следственные связи друг с другом, быть собранными в систему, т.е. синдромы, которые могут лечиться в соответствии с настоящим изобретением.
Расстройства, которые могут лечиться в соответствии с настоящим изобретением, являются, в частности, расстройствами, восприимчивыми к модулированию 5HT6 рецепторов. Они включают когнитивные дисфункции, такие как дефицит памяти, познавательной способности и обучения, в частности, связанное с болезнью Альцгеймера, возрастное когнитивное снижение и легкое когнитивное нарушение, синдром дефицита внимания/гиперактивности, расстройства личности, такие как шизофрения, в частности когнитивные дефициты, связанные с шизофренией, аффективные расстройства, такие как депрессия, тревожность и обсессивно-компульсивные расстройства, двигательные или моторные расстройства, такие как болезнь Паркинсона и эпилепсия, мигрень, расстройства сна (включая нарушение циркадного ритма), расстройства питания, такие как анорексия и булимия, некоторые желудочно-кишечные расстройства, такие как синдром раздраженной кишки, заболевания, связанные с нейродегенерацией, такие как удар, спинно-мозговая травма, травма головы или повреждения головы, такие как гидроцефалия, лекарственная зависимость и ожирение.
Аддиктивные заболевания включают психические расстройства и нарушения поведения, которые вызваны злоупотреблением психотропными веществами, такими как медикаменты или наркотики, и также другие аддиктивные заболевания, такие как пристрастие к играм (неклассифицированные импульсивные расстройства контроля). Примерами вызывающих зависимость веществ являются опиоиды (например, морфин, героин и кодеин), кокаин; никотин; алкоголь; вещества, которые взаимодействуют с комплексом ГАМК/хлорный канал, седативные средства, снотворные средства и транквилизаторы, например бензодиазепины; ЛСД; каннабиноиды; психомоторные стимуляторы, такие как 3,4-метилендиокси-N-метиламфетамин (экстази); амфетамин и амфетаминоподобные вещества, такие как метилфенидат и другие стимуляторы, включая кофеин. Вызывающими зависимость веществами, которые особенно подлежат рассмотрению, являются опиоиды, кокаин, амфетамин или амфетаминоподобные вещества, никотин и алкоголь.
Касательно лечения аддиктивных заболеваний, особое предпочтение отдается тем соединениям согласно данному изобретению по формуле I, которые сами не обладают каким-либо психотропным действием. Это также можно наблюдать в тесте с использованием крыс, которые после введения соединений, которые могут применяться согласно данному изобретению, уменьшают самостоятельное введение психотропных веществ, например кокаина.
Соединения формулы I, обладающие высоким сродством к 5HT6 рецепторам, так же как и к допаминовым D3 рецепторам, могут успешно применяться в лечении расстройств, предпочтительно расстройств ЦНС, чувствительных и к допаминергическим и серотонинергическим воздействиям. В то время как 5HT6 рецепторы больше связаны с когнитивными функциями, допаминовые D3 рецепторы связаны с продуктивными симптомами, такими как мания, галлюцинация, спутанное мышление, спутанная речь, спутанное, ажитированное или кататоническое поведение, и с негативными симптомами, такими как потеря чувствительности, нарушение речи, потеря мотивации, апатия, дефицит внимания и уход от общества. Таким образом, соединения формулы I, обладающие высоким сродством к 5HT6 рецепторам, так же как и к допаминовым D3 рецепторам, могут успешно применяться в лечении расстройств, таких как болезнь Альцгеймера и, в особенности, шизофрения, которая характеризуется нарушениями когнитивных функций, так же как и продуктивными и негативными симптомами.
Согласно другому аспекту настоящего изобретения соединения согласно данному изобретению пригодны для лечения расстройств, причины которых могут, по меньшей мере, частично объясняться аномальной активностью 5HT6 рецепторов.
Согласно другому аспекту настоящего изобретения лечение направлено, в частности, на те расстройства, на которые можно повлиять посредством подходящего медикаментозного лечения посредством связывания предпочтительно экзогенно введенных связывающих агентов (лигандов) с 5HT6 рецепторами.
Заболевания, которые могут лечиться соединениями согласно этому изобретению, часто характеризуются прогрессирующим развитием, т.е. вышеописанные состояния меняются со временем; как правило, тяжесть возрастает и патологические состояния могут объединяться друг с другом или другие патологические состояния могут развиваться в дополнение к тем, которые уже существуют.
Соединения согласно данному изобретению могут применяться для лечения большого количества признаков, симптомов и/или дисфункций, которые связаны с расстройствами центральной нервной системы и, в частности, вышеперечисленными состояниями. Эти признаки, симптомы и/или дисфункции включают, например, нарушенное отношение к реальности, недостаток понимания и способности соблюдать обычные социальные нормы или потребности, возникающие в жизни, изменения темперамента, изменения в личных побуждениях, таких как голод, сон, жажда и т.д., и в настроении, расстройства способности наблюдать и обобщать, изменения личности, в частности эмоциональная лабильность, галлюцинации, расстройства эго, растерянность, амбивалентность, аутизм, деперсонализация и ложные ощущения, бредовые идеи, речь нараспев, отсутствие совместных рефлекторных движений, семенящая походка, согнутое положение туловища и конечностей, тремор, скудность мимики, монотонная речь, депрессии, апатия, затрудненная спонтанность и решительность, обедненная способность к ассоциациям, тревожность, нервная ажиатация, заикание, социофобия, панические расстройства, симптомы отмены в сочетании с зависимостью, маниакальные синдромы, состояния возбуждения и замешательства, дисфория, дискинетические синдромы и тики, например, хорея Гентингтона и синдром Жилль де ла Туретта, синдром головокружения, например периферическое позиционное, ротационное и осциляторное головокружение, меланхолия, истерия, ипохондрия и т.п.
В понимании изобретения лечение также включает превентивное воздействие (профилактику), в частности профилактику рецидива или фазовую профилактику, так же как и лечение острых или хронических признаков, симптомов и/или дисфункций. Лечение может быть ориентировано симптоматически, например, в виде подавления симптомов. Оно может проводиться в течение короткого периода, быть ориентировано на средние сроки или может быть долгосрочным лечением, например, в контексте поддерживающей терапии.
Соединения по настоящему изобретению предпочтительно пригодны для лечения заболеваний центральной нервной системы, более предпочтительно для лечения когнитивных дисфункций и, в особенности, для лечения когнитивных дисфункций, связанных с шизофренией или болезнью Альцгеймера.
В контексте лечения применение согласно данному изобретению желательных соединений включает способ. В этом способе эффективное количество одного или более соединений, как правило, приготовленных в соответствии с фармацевтической и ветеринарной практикой, вводится субъекту, которому проводится лечение, предпочтительно млекопитающему, в особенности человеку, домашнему скоту или домашнему животному. Показано ли такое лечение и в какой форме оно должно проводиться, зависит от конкретного случая и является предметом медицинской оценки (диагностики), которая учитывает признаки, симптомы и/или дисфункции, которые присутствуют, риски развития конкретных признаков, симптомов и/или дисфункций и другие факторы.
Как правило, лечение осуществляется посредством однократного или повторяющегося ежедневного введения, где индивидууму, проходящему лечение, проводится соответствующее совместное или попеременное введение с другими активными соединениями или препаратами, содержащими активное соединение, так чтобы суточная доза составляла предпочтительно от около 0,1 до 1000 мг/кг массы тела в случае перорального введения или от около 0,1 до 100 мг/кг массы тела в случае парентерального введения.
Это изобретение также относится к получению фармацевтических композиций для лечения индивидуума, предпочтительно млекопитающего, в особенности человека, домашнего скота или домашнего животного. Так, лиганды обычно вводятся в виде фармацевтических композиций, которые содержат фармацевтически приемлемый наполнитель вместе с, по меньшей мере, одним соединением согласно этому изобретению и, где необходимо, другими активными соединениями. Эти композиции могут, например, быть введены перорально, ректально, чрезкожно, подкожно, внутривенно, внутримышечно или интраназально.
Примерами подходящих фармацевтических препаратов являются твердые лекарственные формы, такие как порошки, гранулы, таблетки, в частности таблетки с пленочным покрытием, пластинки, пакетики, облатки, покрытые сахаром таблетки, капсулы, такие как твердые желатиновые капсулы и мягкие желатиновые капсулы, суппозитории или вагинальные лекарственные формы, полутвердые лекарственные формы, такие как мази, кремы, гидрогели, пасты или пластыри, и также жидкие лекарственные формы, такие как растворы, эмульсии, в частности эмульсии «масло-в-воде», суспензии, например лосьоны, препараты для инъекций и препараты для инфузии, и глазные капли и ушные капли. Имплантируемые высвобождающие препарат устройства также могут применяться для введения ингибиторов согласно данному изобретению. Кроме того, также возможно применять липосомы и микросферы.
При производстве композиций соединения согласно данному изобретению при необходимости смешивают или разбавляют одним или более наполнителями. Наполнители могут быть твердыми, полутвердыми или жидкими веществами, которые служат в качестве наполнителей, носителей или среды для активного соединения.
Подходящие наполнители перечислены в специальной медицинской литературе. Кроме того, препараты могут содержать фармацевтически подходящие носители или традиционные вспомогательные вещества, такие как смазки; смачивающие агенты; эмульгирующие и суспендирующие агенты; консерванты; антиоксиданты; средства от раздражения; хелатирующие агенты; дополнительные оболочки; стабилизаторы эмульсий; пленкообразующие средства; гельобразующие средства; маскирующие запах агенты; корректоры вкуса; камедь; гидроколлоиды; растворители; средства, повышающие растворимость; нейтрализующие агенты; ускорители диффузии; пигменты; соединения четвертичного аммония; пережиривающие агенты; сырье для мазей, кремов и масел; производные силикона; дезинтеграторы; стабилизаторы; стерилизаторы; основы суппозиториев; вспомогательные вещества для таблеток, такие как связывающие вещества, наполнители, смазки, дезинтегранты или оболочки; пропелленты; подсушивающие агенты; придающие непрозрачность вещества; загустители; воски; пластификаторы и светлые минеральные масла. Приготовление, таким образом, основано на знаниях специалистов, как это описано, например, в Fiedler, H.P., Lexikon der Hilfsstoffe für Pharmazie, Kosmetik und angrenzende Gebiete [Encyclopedia of auxiliary substances for pharmacy, cosmetics and related fields], 4th edition, Aulendorf: ECV-Editio-Kantor-Verlag, 1996.
Также было обнаружено, что расстройства, восприимчивые и к допаминергическим и к серотонинергическим воздействиям, могут также лечиться комбинированным применением лиганда допаминовых D3 рецепторов и лигандом 5HT6 рецепторов. Эта комбинация неожиданно не продемонстрировала побочных эффектов.
Соответственно, дальнейший аспект изобретения относится к фармацевтической композиции, содержащей, по меньшей мере, одно соединение, имеющее сродство к допаминовым D3 рецепторам и, по меньшей мере, одно соединение, имеющее сродство к 5HT6 рецепторам, и необязательно, по меньшей мере, один физиологически приемлемый носитель и/или вспомогательное вещество.
Данное изобретение также относится к применению, по меньшей мере, одного соединения, имеющего сродство к допаминовым D3 рецепторам, вместе, по меньшей мере, с одним соединением, имеющим сродство к 5HT6 рецепторам или фармацевтической композиции, как описано выше для приготовления лекарственного средства для лечения заболевания центральной нервной системы.
Соединения для применения согласно данному изобретению или в вышеприведенной композиции, обладающие сродством к допаминовым D3 рецепторам, предпочтительно не имеют вовсе или имеют несущественную активность в отношении 5HT6 рецепторов и, наоборот. Предпочтительно, соединения, имеющие сродство к допаминовым D3 рецепторам, обладают константой связывания Ki с допаминовыми D3 рецепторами на уровне почти 150 нМ и соединение, имеющее сродство к 5HT6 рецепторам, имеет константу связывания Ki к 5HT6 рецепторам на уровне почти 150 нМ. Более предпочтительно, соединение, имеющее сродство к допаминовым D3 рецепторам, обладает избирательностью к D3 допаминовым рецепторам по сравнению с 5HT6 рецепторами Ki(5HT6)/Ki(D3), по меньшей мере, 10; более предпочтительно, по меньшей мере, 25; и в особенности, по меньшей мере, 50; и соединение, имеющее сродство к 5HT6 допаминовым рецепторам, обладает селективностью к 5HT6 рецепторам по сравнению с допаминовыми D3 рецепторами Ki(D3)/Ki(5HT6), по меньшей мере, 10, более предпочтительно, по меньшей мере, 25, и в особенности, по меньшей мере, 50.
Соединения, обладающие сродством к допаминовым D3 рецепторам, хорошо известны и описаны, например, в следующих публикациях: WO 2006/058753, WO 2006/040176, WO 2006/040177, WO 2006/040178, WO 2006/040179, WO 2006/0040180, WO 2006/008592, WO 2006/015842, WO 2005/058328, WO 2004/89905, WO 2004/108706, WO 2004/080981, WO 2004/069830, WO 01/72306, WO 00/67847, WO 00/42038, WO 99/09015, WO 99/02503, WO 97/25324, WO 96/002519, содержание которых включено в данное описание во всей полноте посредством ссылки.
Предпочтительные соединения, имеющие сродство к допаминовым D3 рецепторам, являются антагонистами допаминовых D3 рецепторов.
Соединения, обладающие сродством к 5HT6 рецепторам, хорошо известны и описаны, например, в следующих публикациях: WO 2006/081322, WO 2005/040124, WO 2003/080580, WO 2002/032863, WO 00/05225, WO 98/27081 и S.-H. Zhao et al., Bioorganic and Medicinal Chemistry Letters 2007, содержание которых включено в данное описание во всей полноте посредством ссылки.
Предпочтительные соединения, имеющие сродство к допаминовым 5HT6 рецепторам, являются антагонистами допаминовых 5HT6 рецепторов.
Неожиданно комбинация соединений, обладающих сродством к допаминовым D3 рецепторам и, по меньшей мере, одного соединения, обладающего сродством к 5HT6 рецепторам, не имеет каких-либо побочных эффектов. Это может быть доказано посредством исследования (микродиализного исследования), описанного в примерах. В частности, сродство связывания с одним или другим рецептором не снижается.
Кроме того, было обнаружено, что лечение расстройств, которые восприимчивы и к допаминергическим, и серотонинергическим воздействиям, может также проводиться путем применения соединений, которые обладают сродством и к допаминовым D3 рецепторам, и к 5HT6 рецепторам.
Таким образом, изобретение, кроме того, относится к применению, по меньшей мере, одного соединения, которое имеет сродство к обоим как допаминовому D3 рецептору, так и к 5HT6 рецептору для получения лекарственного средства для лечения расстройства центральной нервной системы, за исключением соединений формулы

где Ar является замещенным или незамещенным арилом или гетероарильным кольцом;
А представляет собой 3-7-членное замещенное или незамещенное циклоалкильное или гетероциклическое кольцо;
Hc является замещенным или незамещенным содержащим азот гетероциклическим или гетероарильным кольцом;
Q представляет собой C-K или N, где K представляет собой Н, низший алкил, галоген или циано;
Z представляет собой O, S или NR, где R представляет собой Н или низший алкил;
J представляет собой цепь, имеющую от 0 до 8 звеньев, выбранных из незамещенного или замещенного метилена; NR8, O и S, где R8 представляет собой Н или незамещенный или замещенный низший алкил, циклоалкил, гетероциклил, аралкил, гетероаралкил, арил или гетероарил.
Предпочтительно, соединение имеет антагонистическую активность комбинированного допамина D3/5HT6.
Изобретение также относится к применению, по меньшей мере, одного соединения, которое представляет собой антагонист допаминового D3 рецептора и также имеет сродство к 5HT6 рецептору для получения лекарственного средства для лечения расстройства центральной нервной системы.
Предпочтительно, соединение имеет антагонистическую активность 5HT6 рецептора. Предпочтительно, соединение имеет антагонистическую активность комбинированного допамина D3/5HT6.
Соединения, имеющие эти “смешанные” сродства, являются, например, соединениями, описанными в WO 2006/040182.
Среди соединений формулы I, описанных в WO 2006/040182, предпочтительными являются данные соединения, где
- R1 представляет собой Н, n имеет значение 1, А представляет собой необязательно замещенный 1,4-фенилен, E представляет собой NH и Ar представляет собой фенил, содержащий в 4-положении (относительно 1-положения SO2 группы) заместитель Ra и необязательно 1 или 2 дополнительных заместителя Ra, где заместитель Ra, связанный по 4-положению, предпочтительно представляет собой радикал Ra' и, в особенности, выбран из изопропила или фторированного изопропила, такого как 1-метил-2-фтор-1-этил, 1-метил-2,2-дифтор-1-этил или 1-метил-2,2,2-трифтор-1-этил; или
- R1 не представляет собой H и, в особенности, представляет собой н-пропил, n имеет значение 0, А представляет собой необязательно замещенный 1,4-фенилен и Ar представляет собой фенил, содержащий по 4-положению (относительно 1-положения SO2 группы) заместитель Ra и необязательно 1 или 2 дополнительных заместителя Ra; или
- R1 не представляет собой H и, в особенности, представляет собой н-пропил, n имеет значение 1, А представляет собой необязательно замещенный 1,2-фенилен и Ar представляет собой фенил, содержащий, по меньшей мере, один заместитель Ra.
Более предпочтительными соединениями являются те, которые описаны в настоящем описании как соединения формулы I, предпочтение отдается тем соединениям, которые описаны в настоящем описании как предпочтительные.
В особенности, в соединениях по изобретению, имеющих смешанную активность, R1 не является H. Предпочтительно, R1 выбран из C1-C4-алкила, в частности метила, этила или в особенности пропила, фторированного C1-C4-алкила, в особенности 3-фторпропила или 2-фторпропила, C3-C4-алкенила, в особенности аллила, циклопропилметила или бензила. В особенности предпочтительно R1представляет собой пропил.
G предпочтительно представляет собой CH2 и n имеет значение предпочтительно 1.
А представляет собой предпочтительно 1,4-фенилен, в особенности незамещенный 1,4-фенилен.
E предпочтительно представляет собой NH.
Ar предпочтительно представляет собой группу (A) или (F).
Ra представляет собой предпочтительно галоген, C1-C4-алкил, фторированный C1-C4-алкил, C1-C4-алкокси, фторированный C1-C4-алкокси или имеющее 5- или 6-членное ненасыщенное или насыщенное гетероциклическое кольцо. Rb и Rc предпочтительно выбраны из H, галогена и C1-C4-галогеналкокси.
Rd предпочтительно представляет собой галоген, C1-C4-алкил, фторированный C1-C4-алкил или имеющее 5- или 6-членное гетероарильное кольцо, которое является незамещенным или содержит один заместитель, выбранный из C1-C4-алкила и фторированного C1-C4-алкила. Предпочтительные 6-членные гетероарильные кольца содержат один или два атома азота (в особенности предпочтительным является пиридил и пиримидил) и, в особенности, один атом азота. Предпочтительные 5-членные гетероарильные кольца содержат один атом азота и необязательно один или два дополнительных гетероатома, выбранных из N, O и S.
k предпочтительно имеет значение 0 или в особенности 1.
Соединение, имеющее “смешанное” сродство к обоим, как допаминовому D3 рецептору, так и к 5HT6 рецептору, предпочтительно имеет константу связывания Ki к допаминовому D3 рецептору вплоть до 150 нМ и к 5HT6 рецептору вплоть до 150 нМ. Более предпочтительно, соединение, имеющее сродство к допаминовому D3 рецептору и 5HT6 рецептору, имеет константу связывания Ki к допаминовому D3 рецептору вплоть до 100 нМ и к 5HT6 рецептору вплоть до 100 нМ. Даже более предпочтительно, соединение, имеющее сродство к допаминовому D3 рецептору и 5HT6 рецептору, имеет константу связывания Ki к допаминовому D3 рецептору вплоть до 50 нМ и к 5HT6 рецептору вплоть до 50 нМ.
Нарушения, имеющие как допаминергическое, так и серотонинергическое воздействие, являются нарушениями, которые отвечают на модуляцию допаминового D3 рецептора и 5HT6 рецептора. Нарушения, и допаминергическое и серотонинергическое воздействие, находятся в специфических познавательных дисфункциях и специфично познавательных дисфункциях, связанных с болезнью Альцгеймера и шизофренией.
Следующие примеры служат для объяснения изобретения без его ограничения.
Соединения характеризуют или через протонный ЯМР-спектр в d6-диметилсульфоксиде или d-хлороформе, если иное не установлено, на 400 МГц или 500 МГц ЯМР приборе (Bruker AVANCE) или с помощью масс-спектрометрии, в целом регистрируют через HPLC-MS в быстром градиенте на C18-материале (способ электроспрейной ионизации (ESI)) или температуру плавления.
Спектральные свойства ядерного магнитного резонанса (ЯМР) относятся к химическим сдвигам (δ), выраженным в частях на миллион (ppm, ч./млн). Относительная область сдвигов в1H ЯМР спектре соответствует числу атомов водорода для особенно функционального типа в молекуле. Природа сдвига в отношении мультиплетности обозначена как синглет (с), уширенный синглет (ушир.с), дуплет (д), уширенный дуплет (ушир.д), триплет (т), уширенный триплет (ушир.т), квартет (кв), квинтет (квинт) и мультиплет (м).
Примеры получения:
I. Получение промежуточных соединений
а. Получение сульфонилхлоридов
а.1 3-Бром-4-трифторметоксибензолсульфонилхлорид
2,0 г 1-бром-2-(трифторметокси)бензола (8,3 ммоль) растворяют в 30 мл дихлорметана. При температуре 0-5°C добавляют по каплям 1,06 г хлорсульфоновой кислоты (9,13 ммоль), растворенной в 3 мл дихлорметана. Реакционную смесь перемешивают в течение 30 минут при комнатной температуре. Добавляют дополнительное количество 5,5 экв хлорсульфоновой кислоты в дихлорметане, чтобы довести реакцию до завершения. Последующая стандартная обработка и хроматография на силикагеле в смеси н-гептан-дихлорметан (6:4) в качестве элюента дает 2,19 г указанного в заголовке соединения.
1H-ЯМР (CDCl3, 400 МГц): δ [ч./млн] 8,3 (д, 1H), 8,05 (дд, 1H), 7,5 (дд, 1H).
b. Получение 3-(3-аминофенил)пирролидинов
b.1 1-(Метоксикарбонил)-3-(3-аминофенил)пирролидин
b.1.1. 1-(Метоксикарбонил)пирролин
В колбу объемом 5 л, оборудованную механической мешалкой и термопарой, загружают 500 г порошкообразного карбоната калия, 2,5 л дихлорметана и начинают перемешивание. Полученную суспензию охлаждают до температуры 0°C. Медленно загружают 300 г диаллиламина. Происходит незначительная экзотермическая реакция. Затем в делительную воронку загружают 292,95 г метилхлорформиата в 500 мл CH2Cl2 и раствор медленно добавляют к амину в течение периода более часа. Температуру реакции поддерживают ниже 10°C. Затем реакционной смеси дают возможность нагреться до комнатной температуры в течение ночи. После фильтрования реакционной смеси через плотный слой целита фильтровальную лепешку промывают дихлорметаном. Раствор дихлорметана промывают водой и сушат над MgSO4. Концентрирование в вакууме дает на выходе продукт в виде масла желтого цвета. Дальнейшую очистку выполняют путем вакуумной отгонки. При давлении приблизительно 10-12 мм рт.ст. три фракции собирают в интервалах температур 50-61°C, 61-85°C и 85-90°C. Вторую и третью фракции идентифицируют с помощью ЯМР на наличие желаемого N-защищенного диаллиламина.
Полученный N-карбометоксидиаллиламин (400 г) растворяют в 1,5 л дихлорметана, раствор продувают азотом в течение 10 минут путем барботирования азота через перемешиваемый раствор. В колбу объемом 5 л, оборудованную механической мешалкой и делительной воронкой, загружают катализатор Граббса (Grubb's) (бис(трициклогексилфосфин)стиролрутенийдихлорид (3 г, 3,9 ммоль) при постоянном продувании. Добавляют дихлорметан и полученный темного цвета раствор перемешивают при комнатной температуре, барботируя азот в течение 10 минут. К раствору катализатора добавляют раствор N-карбометоксидиаллиламина в течение 2 часов. После завершения добавления раствор перемешивают при комнатной температуре в течение 2,5 дней. Затем реакционную смесь концентрируют до получения масла, которое затем очищают путем вакуумной отгонки. Желаемый продукт получают в виде прозрачной бесцветной жидкости, кипящей при температуре приблизительно 90°C (10 мм рт.ст.). Значение ЯМР согласуется с ожидаемой структурой.
1H-ЯМР (CDCl3): δ [ч./млн] 5,8-5,75 (м, 2Н), 4,1 (м, 2Н), 4,13 (м, 2Н), 3,72 (с, 3H).
b.1.2. 1-(Метоксикарбонил)-3-(3-аминофенил)пирролидин
3-горлую колбу продувают азотом в течение 10 минут. В колбу загружают ацетат палладия и три-o-толилфосфин в слабом токе азота. Безводный диметилформамид предварительно продувают азотом путем барботирования через него азота в течение несколько минут и затем загружают Pd(OAc)2 катализатор и фосфин, продолжая продувать через колбу азот. Последовательно в колбу загружают также диизипропилэтиламин, пирролин, полученный в примере b.1.1, 1-йод-3-нитробензол и карбонат серебра(II). Реакционную смесь перемешивают и нагревают в атмосфере азота до температуры 100°C в течение 6 часов. Приблизительно через 9 часов реакция завершается (тсх анализ). После охлаждения реакционной смеси до комнатной температуры в течение ночи ее гасят 10% раствором карбоната натрия и трижды экстрагируют MTBE (метил трет-бутиловый эфир). Комбинированные органические фазы сушат над MgSO4 и концентрируют. Избыток олефина удаляют путем вакуумной отгонки. Остаток темного цвета растворяют в MTBE, загружают на колонку с силикагелем и хроматографируют смесью MTBE:гептан, градиент от 1:9 до 2:8.
Затем 2,05 г элюированного пирролинового продукта суспендируют порциями в 95 мл метанола и гидрируют, используя 0,14 г катализатора Вилькинсона (RhCl(PPh3)3; 2% моль) при комнатной температуре и 40 пси (1 пси = 0,069 бар) давлении водорода, чтобы получить на выходе 1-(метоксикарбонил)-3-(3-нитрофенил)пирролидин.
Продукт затем подвергают кислотной обработке (HCl в метаноле, TFA), чтобы получить на выходе указанное в заголовке соединение.
CI-MC: 221,2 [M+H]+
c. Получение энантиомерно чистых предшественников
c.1 (S)- и (R)-1-Бензил-3-(3-нитрофенил)пирролидин
3-нитростирол взаимодействует с 2,5 мольными эквивалентами бензил метоксиметилтриметилсилилметил амина в дихлорметане в присутствии трифторуксусной кислоты.
К 54 г гидрохлорида рацемического 1-бензил-3-(3-нитрофенил)пирролидина (48 свободного основания), растворенного в этаноле, добавляют 1 мольный эквивалент L-винной кислоты. Выпавший в осадок татрат выделяют и перекристаллизовывают четырежды из метанола. Таким образом, очищенную соль выделяют, растворяют и превращают в свободный пирролидин. Получают 24,9 г (S)-1-бензил-3-(3-нитрофенил)пирролидина, имеющего >99%ee.
Комбинированные фильтраты указанного выше процесса разделения концентрируют, нейтрализуют и подвергают указанной выше обработке, при этом используя D-винную кислоту вместо L-формы. Получают 17,5 г (R)-1-бензил-3-(3-нитрофенил)пирролидина, имеющего >99%ee.
II. Получение соединений формулы I
Пример 1
3-Трифторметокси-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамид и его гидрохлорид
1.1. Диметиловый эфир (S)-2-фенилянтарной кислоты
5 г (S)-2-фенилянтарной кислоты (25,75 ммоль) растворяют в 50 мл метанола. При температуре 4°C добавляют по каплям 4,7 мл тионилхлорида (64,37 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 2-х часов, растворители упаривают при пониженном давлении. Оставшийся остаток растворяют в диэтиловом эфире, промывают один раз насыщенным водным раствором NaHCO3, повторно экстрагируют диэтиловым эфиром и комбинированные органические слои сушат над сульфатом магния, фильтруют и упаривают досуха, чтобы получить на выходе 5,8 г желаемого продукта.
ESI-MC: 223,1 [M+H]+
1.2. (S)-2-Фенилбутан-1,4-диол
2,54 г литийалюминийгидрида (66,95 ммоль) суспендируют при охлаждении льдом в 25 мл тетрагидрофурана. Медленно добавляют 5,8 г диметилового эфира (S)-2-фенилянтарной кислоты (25,75 ммоль), растворенного в 25 мл тетрагидрофурана при температуре 5-10°C. Перемешивание продолжают в течение 15 минут и затем добавляют по каплям 15 мл смеси тетрагидрофуран/вода (1:1). Значение рН суспензии доводят до 3-4 с помощью концентрированной соляной кислоты, фильтруют и фильтр промывают дихлорметаном. Фильтрат упаривают досуха, переносят в диэтиловый эфир, промывают насыщенным раствором гидрокарбоната натрия, повторно экстрагируют диэтиловым эфиром и комбинированные органические слои сушат над сульфатом магния, фильтруют и растворитель упаривают при пониженном давлении, чтобы получить на выходе 4,2 г диола.
ESI-MC: 189,1 [M+Na]+
1H-ЯМР (CDCl3): δ [ч./млн] 7,25-7,4 (м, 2Н), 7,15-7,3 (м, 3H), 4,2-4,35 (м, 2Н), 3,2 (м, 1H), 3,1 (м, 1H), 2,1-2,3 (м, 3H).
1.3. (S)-4-метансульфонилокси-3-фенилбутиловый эфир метансульфоновой кислоты
4,19 г (S)-2-фенилбутан-1,4-диола (25,21 ммоль) растворяют в 50 мл дихлорметана. Добавляют 10,53 мл триэтиламина (75,6 ммоль) и, при охлаждении льдом, 5 мл метансульфонилхлорида (64,34 ммоль). Перемешивание продолжают в течение 15 минут и затем добавляют 40 мл воды. Органическую фазу отделяют и водную фазу экстрагируют дихлорметаном. Комбинированные органические слои сушат над сульфатом магния, фильтруют и растворитель упаривают при пониженном давлении, чтобы получить на выходе 8,37 г продукта.
1.4. (S)-3-Фенил-1-пропилпирролидин
2,0 г (S)-4-метансульфонилокси-3-фенилбутилового эфира метансульфоновой кислоты (5,51 ммоль) растворяют в 5 мл н-пропиламина (60,82 ммоль). Реакционную смесь перемешивают в течение 15 часов при комнатной температуре, добавляют диэтиловый эфир, органическую фазу промывают дважды водой. Водную фазу повторно экстрагируют один раз диэтиловым эфиром, органические слои комбинируют, сушат над сульфатом магния, фильтруют и растворитель упаривают при пониженном давлении, чтобы получить на выходе 1,09 г продукта.
ESI-MC: 190,1 [M+H]+
1.5. (S)-3-(4-Нитрофенил)-1-пропилпирролидин
0,3 г (S)-3-Фенил-1-пропилпирролидина (1,48 ммоль) растворяют в 2 мл концентрированной серной кислоты в атмосфере аргона и охлаждении льдом. Добавляют небольшими порциями 165,16 мг нитрата калия (1,63 ммоль). Реакционную смесь перемешивают в течение 15 минут при охлаждении льдом, в течение 15 часов при комнатной температуре и выливают на размельченный лед. Водный раствор подщелачивают с помощью 25% раствора гидроксида натрия, экстрагируют трижды диэтиловым эфиром, водную фазу повторно экстрагируют один раз диэтиловым эфиром, органические слои комбинируют, сушат над сульфатом магния, фильтруют и растворитель упаривают при пониженном давлении, чтобы получить на выходе 0,326 г масло коричневатого цвета. Вторая реакция дает на выходе другие 0,919 г желаемого продукта.
ESI-MC: 235,1 [M+H]+
1H-ЯМР (CDCl3): δ [ч./млн] 8,15 (д, 2Н), 7,45 (д, 2Н), 3,4-3,5 (м, 1H), 2,9-3,0 (м, 1H), 2,75 (м, 1H), 2,3-2,6 (м, 4H), 1,8-1,9 (м, 1H), 1,5-1,65 (м, 3H), 0,95 (м, 3H).
1.6. (S)-3-(4-Аминофенил)-1-пропилпирролидин
0,907 г (S)-3-(4-Нитрофенил)-1-пропилпирролидина (3,59 ммоль) растворяют в 20 мл метанола, добавляют 7,0 г дихлорида олова (31,02 ммоль) и реакционную смесь перемешивают при температуре кипения с обратным холодильником в течение часа. Метанол упаривают, добавляют 60 мл 1 N гидроксида натрия и дихлорметана и фазы разделяют после экстенсивного перемешивания. Водную фазу экстрагируют дважды дихлорметаном, органические слои комбинируют, сушат над сульфатом магния, фильтруют и растворитель упаривают при пониженном давлении, чтобы получить на выходе 0,744 г сырого аминосоединения.
ESI-MC: 205,2 [M+H]+
1H-ЯМР (ДМСО-d6): δ [ч./млн] 6,9 (д, 2Н), 6,45 (д, 2Н), 4,7 (ушир.с, 2Н), 3,1 (м, 1H), 2,85 (м, 1H), 2,65 (м, 1H), 2,55 (м, 1H), 2,25-2,45 (м, 3H), 2,1 (м, 1H), 1,65 (м, 1H), 1,4-1,5 (м, 2Н), 0,85 (м, 3H).
1.7. 3-Трифторметокси-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамид и его гидрохлорид
0,4 г (S)-3-(4-аминофенил)-1-пропилпирролидина (1,96 ммоль) и 0,455 г коммерчески доступного 3-трифторметоксифенилсульфонилхлорида (1,86 ммоль) растворяют в 15 мл тетрагидрофурана. Добавляют 0,82 мл триэтиламина (5,87 ммоль) и реакционную смесь перемешивают в течение 15 часов при комнатной температуре. Растворители упаривают при пониженном давлении, остаток обрабатывают водой и рН доводят до щелочного значения с помощью раствора гидроксида натрия. Водный слой экстрагируют трижды диэтиловым эфиром, органические слои комбинируют, сушат над сульфатом магния, фильтруют и растворитель упаривают при пониженном давлении. Сырой продукт очищают с помощью хроматографии на силикагеле со смесью этилацетат/метанол (2,5-3%) в виде элюента, получая на выходе 0,225 г очищенного продукта.
ESI-MC: 429,15 [M+H]+
1H-ЯМР (CDCl3, 400 МГц): δ [ч./млн] 7,7 (д, 1H), 7,55 (с, 1H), 7,5 (т, 1H), 7,4 (д, 1H), 7,15 (д, 2Н), 6,95 (д, 2Н), 5,3 (ушир.с, 1H), 3,3 (м, 1H), 3,05 (м, 1H), 2,85 (м, 1H), 2,65 (м, 1H), 2,5 (м, 1H), 2,45 (м, 2Н), 2,3 (м, 1H), 1,8 (м, 1H), 1,55 (м, 2Н), 0,9 (т, 3H).
Указанный продукт растворяют в 15 мл диэтилового эфира и 1 мл дихлорметана, добавляют 0,61 мл 1 N HCl в диэтиловом эфире и после образования осадка суспензию упаривают при пониженном давлении, чтобы получить на выходе 0,235 г осадка белого цвета.
Пример 2
4-Бром-3-фтор-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамид
0,289 г желаемого продукта получают, следуя методике синтеза, аналогичной той, которая описана для получения 3-трифторметокси-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамида, используя коммерчески доступный 4-бром-3-фторбензолсульфонилхлорид.
ESI-MC: 441,0/443,0 [M+H]+
1H-ЯМР (CDCl3): δ [ч./млн] 7,65 (м, 1H), 7,5 (м, 1H), 7,4 (м, 1H), 7,15 (д, 2Н), 7,0 (д, 2Н), 3,3 (м, 1H), 3,0 (м, 1H), 2,8 (м, 1H), 2,65 (м, 1H), 2,35-2,5 (м, 3H), 2,3 (м, 1H), 1,8 (м, 1H), 1,5 (м, 2Н), 0,9 (м, 3H).
Пример 3
4-Бром-3,6-дифтор-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамид
0,131 г желаемого продукта получают, следуя методике синтеза, аналогичной той, которая описана для получения 3-трифторметокси-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамида, используя коммерчески доступный 4-бром-3,6-дифторбензолсульфонилхлорид.
ESI-MC: 459,0/461,0 [M+H]+
1H-ЯМР (CDCl3): δ [ч./млн] 7,55 (м, 1H), 7,4 (м, 1H), 7,15 (д, 2Н), 7,0 (д, 2Н), 4,7 (очень шир.с, 2Н), 3,3 (м, 1H), 3,0 (м, 1H), 2,85 (м, 1H), 2,7 (м, 1H), 2,4-2,6 (м, 3H), 2,25 (м, 1H), 1,8 (м, 1H), 1,55 (м, 2Н), 0,85 (м, 3H).
Пример 4
3-Трифторметил-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамид
0,11 г желаемого продукта получают, следуя методике синтеза, аналогичной той, которая описана для получения 3-трифторметокси-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамида, используя коммерчески доступный 3-трифторметилбензолсульфонилхлорид.
ESI-MC: 427,2 [M+H]+
Пример 5
Гидрохлорид 3,4-дифтор-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамида
ESI-MC: 381,2 [M+H]+
1H-ЯМР (ДМСО-d6, 400 МГц): δ [ч./млн] 11,25 (ушир.д, 1H), 10,55 (м, 1H), 7,85 (т, 1H), 7,65 (м, 2Н), 7,3 (д, 1H), 7,25 (д, 1H), 7,1 (м, 2Н), 3,2-3,8 (м, 5H), 2,9-3,15 (м, 2Н), 2,3 (м, 1H), 1,95 (м, 1H), 1,7 (м, 2Н), 0,9 (т, 3H).
Пример 6
N-(3-Пирролидин-3-илфенил)-3-трифторметоксибензолсульфонамид
6.1. Метиловый эфир 3-[3-(3-Трифторметоксибензолсульфониламино)фенил]пирролидин-1-карбоновой кислоты
Указанное соединение получают, следуя методике синтеза, аналогичной той, которая описана для получения 3-трифторметокси-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамида путем взаимодействия 1-(метоксикарбонил)-3-(3-аминофенил)пирролидина, полученного, как описано в примере b.1, с коммерчески доступным 3-трифторметоксибензолсульфонилхлоридом.
ESI-MC: 445,1 [M+H]+
6.2. N-(3-Пирролидин-3-илфенил)-3-трифторметоксибензолсульфонамид
Метиловый эфир 3-[3-(3-трифторметоксибензолсульфониламино)фенил]пирролидин-1-карбоновой кислоты (0,105 г; 0,24 ммоль) растворяют в 2,5 мл этанола и добавляют 0,9 мл концентрированной HCl. Реакционную смесь нагревают в системе микроволнового облучения (CEM) при температуре 90-150°C в течение нескольких часов, пока не вступит в реакцию исходный продукт. Смесь затем концентрируют в вакууме и кислотную водную фазу экстрагируют дважды диэтиловым эфиром. Значение рН водной фазы доводят до 9 с помощью 1 N водного раствора NaOH, экстрагируют трижды диэтиловым эфиром и комбинированные органические слои сушат над сульфатом натрия, фильтруют и растворитель упаривают досуха, чтобы получить на выходе 45 мг продукта.
ESI-MC: 387,15 [M+H]+.
Пример 7
N-((S)-3-Пирролидин-3-илфенил)-3-трифторметоксибензолсульфонамид
7.1. (S)-1-Бензил-3-(3-аминофенил)пирролидин
(S)-1-Бензил-3-(3-нитрофенил)пирролидин (1 г, 3,54 ммоль) растворяют в метаноле, добавляют 4,5 г дихлорида олова(II) (19,94 ммоль) и реакционную смесь перемешивают в течение 1,5 часов при температуре кипения с обратным холодильником. Когда исходный продукт вступит в реакцию, растворитель упаривают при пониженном давлении и остаток обрабатывают смесью 1 N водного раствора NaOH/этилацетат и фильтруют через целит. Фазы разделяют, водную фазу экстрагируют этилацетатом и комбинированные органические слои сушат над сульфатом магния, фильтруют и упаривают досуха, чтобы получить на выходе 0,75 г масла желтоватого цвета.
7.2. N-[3-((S)-1-Бензилпирролидин-3-ил)фенил]-3-трифторметоксибензолсульфонамид
(S)-1-Бензил-3-(3-аминофенил)пирролидин (0,4 г, 1,59 ммоль) и коммерчески доступный 3-трифторметоксибензолсульфонилхлорид (0,39 г, 1,5 ммоль) растворяют в 30 мл тетрагидрофурана. Добавляют 0,66 мл триэтиламина (3,75 ммоль) и смесь перемешивают в течение 16 часов при комнатной температуре. Растворитель упаривают при пониженном давлении и остаток обрабатывают смесью вода/диэтиловый эфир. После доведения рН водной фазы до щелочного значения с помощью 1 N водного раствора NaOH, водный слой экстрагируют диэтиловым эфиром и комбинированные органические слои сушат над сульфатом магния, фильтруют и упаривают. Продукт очищают с помощью хроматографии на силикагеле, используя полуавтоматическую хроматографическую систему Isco Companion, чтобы получить на выходе 0,512 г желаемого соединения.
ESI-MC: 477,1 [M+H]+
7.3. N-((S)-3-Пирролидин-3-илфенил)-3-трифторметоксибензолсульфонамид
N-[3-((S)-1-Бензилпирролидин-3-ил)фенил]-3-трифторметоксибензолсульфонамид (0,5 г, 1,05 ммоль) растворяют в ледяной уксусной кислоте и добавляют 10% Pd на угле в атмосфере азота. Реакционную смесь затем гидрируют в течение 5 часов при температуре 70°C. Затем катализатор удаляют фильтрованием через целит. Фильтрат концентрируют при пониженном давлении. Остаток обрабатывают водой и рН доводят до щелочного значения с помощью 1 N водного раствора NaOH. Водный слой экстрагируют дважды этилацетатом и один раз дихлорметаном, после чего комбинированные органические слои сушат над сульфатом магния, фильтруют и упаривают. Оставшееся белого цвета твердое вещество растирают в порошок с 10 мл диэтилового эфира и осадок фильтруют и сушат, чтобы получить на выходе 0,18 г указанного в заголовке соединения.
ESI-MC: 387,0 [M+H]+
1H-ЯМР (ДМСО): δ [ч./млн] 7,75 (д, 1H), 7,6 (м, 2Н), 7,5 (д, 1H), 7,0 (т, 1H), 6,85 (с, 1H), 6,8 (д, 1H), 6,7 (д, 1H), 3,3 (м, 1H), 3,0-3,2 (м, 3H), 2,7 (м, 1H), 2,1 (м, 1H), 1,7 (м, 1H).
Пример 8
N-[4-Метокси-3-(1-пропилпирролидин-3-ил)фенил]-3-трифторметоксибензолсульфонамид
8.1. 1-[3-(2-Метоксифенил)пирролидин-1-ил]пропан-1-он
Коммерчески доступный 3-(2-метоксифенил)пирролидин (1,64 г, 9,25 ммоль) растворяют в 50 мл тетрагидрофурана, добавляют 1,873 г триэтиламина (18,51 ммоль) и после охлаждения до температуры 0-5°C добавляют по каплям 1,325 г ангидрида пропионовой кислоты (10,18 ммоль), растворенного в некотором количестве тетрагидрофурана. После перемешивания в течение 30 минут исходный продукт вступает в реакцию, после чего добавляют 2 мл 7 N аммиака в метаноле. После перемешивания при комнатной температуре в течение 10 минут растворители упаривают при пониженном давлении, остаток обрабатывают диэтиловым эфиром, промывают один раз насыщенным водным раствором бикарбоната натрия, сушат над сульфатом магния, фильтруют и растворитель упаривают еще раз, чтобы получить на выходе 2,2 г желаемого продукта.
ESI-MC: 234,1 [M+H]+
8.2. 1-[3-(2-Метокси-5-нитрофенил)пирролидин-1-ил]пропан-1-он
1-[3-(2-Метоксифенил)пирролидин-1-ил]пропан-1-он (0,7 г; 3 ммоль) растворяют в 10 мл нитрометана. В интервале температур от -5°C до -10°C добавляют смесь 0,290 г азотной кислоты, 0,5 г воды и 5,52 г серной кислоты в пределах 25 минут и реакционную смесь перемешивают в течение еще часа при пониженной температуре и 16 часов при комнатной температуре. Добавляют лед, значение рН реакционной смеси доводят до щелочного с помощью 50% водного раствора NaOH и водную фазу экстрагируют дважды диэтиловым эфиром. Органические слои комбинируют, сушат над сульфатом магния, фильтруют и растворитель упаривают при пониженном давлении, чтобы получить на выходе 0,85 г желаемого продукта в виде смеси изомеров и небольшого количества динитропроизводного, которое используют на следующей стадии без дополнительной очистки.
ESI-MC: 279,1 [M+H]+
8.3. 1-[3-(2-Метокси-5-аминофенил)пирролидин-1-ил]пропан-1-он
1-[3-(2-Метокси-5-нитрофенил)пирролидин-1-ил]пропан-1-он (0,85 г; 3,05 ммоль) растворяют в 50 мл метанола. Добавляют 3,65 г дихлорида олова (16,18 ммоль) и реакционную смесь перемешивают в течение 2 часов при кипении с обратным холодильником. Когда исходный продукт вступает в реакцию, растворитель упаривают при пониженном давлении и остаток обрабатывают смесью 1 N водного раствора NaOH/этилацетат и фильтруют. Фазы разделяют, водную фазу экстрагируют этилацетатом и комбинированные органические слои сушат над сульфатом магния, фильтруют и упаривают досуха, чтобы получить на выходе 0,44 г сырого продукта, который используют на следующей стадии без дополнительной очистки.
ESI-MC: 249,1 [M+H]+
8.4. N-[4-Метокси-3-(1-пропионилпирролидин-3-ил)фенил]-3-трифторметоксибензолсульфонамид
1-[3-(2-Метокси-5-аминофенил)пирролидин-1-ил]пропан-1-он (0,44 г, 1,77 ммоль) и коммерчески доступный 3-трифторметоксибензолсульфонилхлорид (0,23 г, 0,89 ммоль) взаимодействуют, как описано выше, чтобы получить на выходе, после очистки с помощью хроматографии на силикагеле, используя прибор ISCO Companion, 0,198 г желаемого соединения.
ESI-MC: 473,1 [M+H]+
8.5. N-[4-Метокси-3-(1-пропилпирролидин-3-ил)фенил]-3-трифторметоксибензолсульфонамид
N-[4-Метокси-3-(1-пропионилпирролидин-3-ил)фенил]-3-трифторметоксибензолсульфонамид (0,19 г, 0,4 ммоль) растворяют в 15 мл тетрагидрофурана и добавляют по каплям 2 мл 1 M борантетрагидрофуранового комплекса в тетрагидрофуране. Реакционную смесь нагревают до температуры кипения с обратным холодильником в течение 30 минут, добавляют 2 мл 2 N водного раствора соляной кислоты и смесь нагревают при температуре кипения с обратным холодильником еще раз в течение 3 часов. После перемешивания в течение 16 часов при комнатной температуре растворитель упаривают, остаток обрабатывают водой и рН доводят до щелочного значения с помощью 1 N водного раствора NaOH. Водный слой экстрагируют дважды диэтиловым эфиром, комбинированные органические слои сушат над сульфатом магния, фильтруют и растворитель упаривают. Сырой продукт хроматографируют на chromabond колонке, используя 0-5% смесь дихлорметан/метанол в виде элюента, чтобы получить на выходе 0,077 мг указанного в заголовке соединения.
ESI-MC: 459,1 [M+H]+
1H-ЯМР (CDCl3): δ [ч./млн] 7,65 (д, 1H), 7,5 (с, 1H), 7,45 (т, 1H), 7,35 (д, 1H), 6,95 (д, 1H), 6,85 (с, 1H), 6,7 (д, 1H), 6,5 (ушир.с, 1H), 3,8 (с, 3H), 3,6 (м, 1H), 2,9 (м, 1H), 2,75 (м, 1H), 2,65 (м, 1H), 2,3-2,5 (несколько м, 3H), 2,15 (м, 1H), 1,65 (м, 1H), 1,5 (м, 2Н), 0,9 (т, 3H).
Пример 9
(3-Азетидин-3-илфенил)амид 5-хлор-3-метилбензо[b]тиофен-2-сульфоновой кислоты
Следуя методике, аналогичной той, которая описана для получения соединения по примеру 1.7, трет-бутил-3-(3-аминофенил)азетидин-1-карбоксилат (100 мг, 0,40 ммоль) связывают с 5-хлор-3-метилбензо[b]тиофен-2-сульфонилхлоридом (118 мг, 0,42 ммоль), что дает трет-бутил-3-(3-(5-хлор-3-метилбензо[b]тиофен-2-сульфонамидо)фенил)азетидин-1-карбоксилат (140 мг, 71%).
ESI-MC: 437,0 [M+H]+
трет-Бутил-3-(3-(5-хлор-3-метилбензо[b]тиофен-2-сульфонамидо)фенил)азетидин-1-карбоксилат (140 мг, 0,28 ммоль) перемешивают в муравьиной кислоте (3 мл) при температуре 0°C в течение 3 часов. Раствор концентрируют, растворяют в воде, добавляют концентрированную HCl и раствор концентрируют лиофилизацией, что дает указанное в заголовке соединение (113 мг, 93%) в виде пены белого цвета.
ESI-MC: 393,0 [M+H]+.
Соединения по примерам с 10 по 32 получают, следуя аналогичной методики.
Пример 10
N-(3-Азетидин-3-илфенил)-3-(2-метилтиазол-4-ил)бензолсульфонамид
ESI-MC: 386,1 [M+H]+
Пример 11
N-(4-Азетидин-3-илфенил)-3-трифторметилбензолсульфонамид
ESI-MC: 357,1 [M+H]+
Пример 12
(3-Азетидин-3-илфенил)амид тиофен-2-сульфоновой кислоты
ESI-MC: 294,9 [M+H]+
1H ЯМР (400 МГц, ДМСО): δ (ч./млн) 3,82 (м, 2Н), 3,92 (м, 1H), 4,04 (м, 2Н), 6,87 (д, 1H), 6,91 (д, 1H), 6,95 (с, 1H), 7,00 (т, 1H), 7,13 (т, 1H), 7,41 (д, 1H), 7,68 (д, 1H).
Пример 13
N-(3-Азетидин-3-илфенил)-3,5-бис-трифторметилбензолсульфонамид
ESI-MC: 425,0 [M+H]+
1H ЯМР (400 МГц, ДМСО): δ (ч./млн) 3,93 (м, 3H), 4,15 (м, 2Н), 6,71 (д, 1H), 6,78 (д, 1H), 6,87 (с, 1H), 7,04 (т, 1H), 8,17 (с, 1H), 8,20 (с, 1H).
Пример 14
N-(3-Азетидин-3-илфенил)-2,5-диметоксибензолсульфонамид
ESI-MC: 349,0 [M+H]+
1H ЯМР (400 МГц, ДМСО): δ (ч./млн) 3,78 (м, 2Н), 3,70 (м, 3H), 3,91 (м, 3H), 6,94 (т, 2Н), 7,02 (с, 1H), 7,09 (м, 1H), 7,11 (д, 1H), 7,17 (т, 1H), 7,23 (д, 1H).
Пример 15
N-(3-Азетидин-3-илфенил)-3-фторбензолсульфонамид
ESI-MC: 306,9 [M+H]+
1H ЯМР (400 МГц, ДМСО): δ (ч./млн) 3,81 (м, 2Н), 3,91 (м, 1H), 4,04 (м, 2Н), 6,87 (д, 1H), 6,94 (с, 1H), 7,12 (т, 1H), 7,36 (т, 1H), 7,47 (д, 1H), 7,49 (м, 1H), 7,56 (м, 1H).
Пример 16
(3-Азетидин-3-илфенил)амид 2,5-дихлортиофен-3-сульфоновой кислоты
ESI-MC: 362,9 [M+H]+
1H ЯМР (400 МГц, ДМСО): δ (ч./млн) 3,93 (м, 3H), 4,14 (м, 2Н), 6,71 (д, 1H), 6,81 (д, 1H), 6,85 (с, 1H), 7,06 (т, 1H), 7,10 (с, 1H).
Пример 17
N-(3-Азетидин-3-илфенил)-3-хлорбензолсульфонамид
ESI-MC: 322,9 [M+H]+
1H ЯМР (400 МГц, ДМСО): δ (ч./млн) 3,86 (м, 2Н), 3,94 (м, 1H), 4,07 (м, 2Н), 6,87 (т, 2Н), 6,94 (с, 1H), 7,13 (т, 1H), 7,52 (т, 1H), 7,57 (д, 1H), 7,72 (м, 2Н).
Пример 18
N-(3-Азетидин-3-илфенил)-3,5-дихлорбензолсульфонамид
ESI-MC: 356,9 [M+H]+
1H ЯМР (400 МГц, ДМСО): δ (ч./млн) 3,90 (м, 3H), 4,11 (м, 2Н), 6,66 (д, 1H), 6,76 (д, 1H), 6,82 (с, 1H), 7,03 (т, 1H), 7,62 (м, 2Н).
Пример 19
N-(3-Азетидин-3-илфенил)-3-метилбензолсульфонамид
ESI-MC: 303,0 [M+H]+
1H ЯМР (400 МГц, ДМСО): δ (ч./млн) 2,31 (с, 3H), 3,78 (м, 2Н), 3,93 (м, 3H), 6,93 (д, 1H), 6,96 (д, 1H), 7,00 (с, 1H), 7,17 (т, 1H), 7,38 (м, 2Н), 7,54 (м, 1H), 7,57 (с, 1H).
Пример 20
N-(3-Азетидин-3-илфенил)-5-бром-2-метоксибензолсульфонамид
ESI-MC: 399,0 [M+H]+
1H ЯМР (400 МГц, ДМСО): δ (ч./млн) 3,78 (м, 2Н), 3,85 (с, 3H), 3,91 (м, 3H), 6,95 (д, 1H), 6,97 (д, 1H), 7,02 (с, 1H), 7,13 (д, 1H), 7,18 (т, 1H), 7,71 (д, 1H), 7,80 (с, 1H).
Пример 21
(3-Азетидин-3-илфенил)амид 5-бензолсульфонилтиофен-2-сульфоновой кислоты
ESI-MC: 435,0 [M+H]+
1H ЯМР (400 МГц, ДМСО): δ (ч./млн) 3,91 (м, 3H), 4,14 (м, 2Н), 6,66 (д, 1H), 6,80 (с, 1H), 6,81 (д, 1H), 7,00 (д, 1H), 7,18 (т, 1H), 7,71 (д, 1H), 7,80 (с, 1H).
Пример 22
N-(3-Азетидин-3-илфенил)-2-метокси-5-метилбензолсульфонамид
ESI-MC: 333,0 [M+H]+
1H ЯМР (400 МГц, ДМСО): δ (ч./млн) 1,78 (м, 3H), 2,20 (с, 3H), 3,81 (м, 3H), 4,14 (м, 2Н), 6,75 (д, 1H), 6,80 (с, 1H), 6,81 (д, 1H), 7,00 (д, 1H), 7,18 (т, 1H), 7,71 (д, 1H), 7,80 (с, 1H).
Пример 23
(3-Азетидин-3-илфенил)амид 5-(2-метилсульфанилпиримидин-4-ил)тиофен-2-сульфоновой кислоты
ESI-MC: 417,1 [M-H]+
1H ЯМР (400 МГц, ДМСО): δ (ч./млн) 3,85 (с, 3H), 3,91 (м, 3H), 4,10 (м, 2Н), 6,70 (д, 1H), 6,89 (м, 2Н), 7,04 (д, 1H), 7,36 (д, 1H), 7,58 (д, 1H), 7,83 (с, 1H), 8,58 (м, 1H).
Пример 24
N-(3-Азетидин-3-илфенил)-3-цианобензолсульфонамид
ESI-MC: 313,9 [M+H]+
Пример 25
N-(3-Азетидин-3-илфенил)-3-метоксибензолсульфонамид
ESI-MC: 319,0 [M+H]+
Пример 26
(4-Азетидин-3-илфенил)амид 5-хлор-3-метилбензо[b]тиофен-2-сульфоновой кислоты
ESI-MC: 393,3 [M+H]+
Пример 27
N-(4-Азетидин-3-илфенил)-4-фтор-3-оксазол-4-илбензолсульфонамид
ESI-MC: 374,1 [M+H]+
Пример 28
N-(4-Азетидин-3-илфенил)-4-фтор-3-оксазол-5-илбензолсульфонамид
ESI-MC: 374,1 [M+H]+
Пример 29
N-(3-Азетидин-3-илфенил)-3-дифторметоксибензолсульфонамид
ESI-MC: 355,1 [M+H]+
Пример 30
N-(4-Азетидин-3-илфенил)-3-дифторметоксибензолсульфонамид
ESI-MC: 355,1 [M+H]+
Пример 31
N-(3-Азетидин-3-илфенил)-3-трифторметилбензолсульфонамид
ESI-MC: 357,1 [M+H]+
Пример 32
N-(3-Азетидин-3-илфенил)-3-трифторметоксибензолсульфонамид
ESI-MC: 373,1 [M+H]+
Пример 33
(4-Азетидин-3-илфенил)метиламид 5-хлор-3-метилбензо[b]тиофен-2-сульфоновой кислоты
трет-Бутил-3-(4-(5-хлор-3-метилбензо[b]тиофен-2-сульфонамидо)фенил)азетидин-1-карбоксилат (216 мг, 0,44 ммоль) перемешивают в ТГФ (5 мл) и добавляют NaH (25 мг, 0,53 ммоль). После перемешивания при комнатной температуре в течение 15 минут добавляют метилиодид (0,028 мл, 0,44 ммоль) и перемешивание продолжают в течение 116 часов. Раствор концентрируют в вакууме, растворяют в воде (pH 11) и экстрагируют EtOAc. Органические экстракты сушат (MgSO4), фильтруют и концентрируют, что дает трет-бутил-3-(4-(5-хлор-N,3-диметилбензо[b]тиофен-2-сульфонамидо)фенил)азетидин-1-карбоксилат (=исходное соединение, метилированное по амидо-N) (185 мг, 83%).
ESI-MC: 508,1 [M+H]+
трет-Бутил-3-(4-(5-хлор-N,3-диметилбензо[b]тиофен-2-сульфонамидо)фенил)азетидин-1-карбоксилат (185 мг, 0,36 ммоль) перемешивают в муравьиной кислоте (3 мл) при температуре 0°C в течение 3,5 часов. Раствор концентрируют, растворяют в воде, добавляют концентрированную HCl и раствор концентрируют лиофилизацией, что дает указанное в заголовке соединение (144 мг, 87%) в виде пены белого цвета.
ESI-MC: 408,1 [M+H]+
Пример 34
3-((S)-2,2-Дифтор-1-метилэтил)-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамид
Следуя методике, аналогичной той, которая описана для получения соединения по примеру 1.7, (S)-3-(4-аминофенил)-1-пропилпирролидин связывают с (S)-3-(1,1-дифторпропан-2-ил)бензол-1-сульфонилхлоридом, что дает указанное в заголовке соединение.
ESI-MC: 424,1 [M+H]+
Соединения по примерам с 35 по 58 получают, следуя аналогичной методики.
Пример 35
[4-((S)-1-пропилпирролидин-3-ил)фенил]амид 5-изоксазол-5-илтиофен-2-сульфоновой кислоты
ESI-MC: 418,1 [M+H]+
Пример 36
[4-((S)-1-пропилпирролидин-3-ил)фенил]амид 5-изоксазол-3-илтиофен-2-сульфоновой кислоты
ESI-MC: 418,1 [M+H]+
Пример 37
[4-((S)-1-пропилпирролидин-3-ил)фенил]амид 5-оксазол-5-ил-тиофен-2-сульфоновой кислоты
ESI-MC: 418,1 [M+H]+
Пример 38
3-((S)-2-Метилпирролидин-1-ил)-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамид
ESI-MC: 428,1 [M+H]+
Пример 39
[4-(1-пропилазетидин-3-ил)фенил]амид тиофен-2-сульфоновой кислоты
Следуя методике, аналогичной той, которая описана для получения соединения по примеру 1.7, 4-(1-пропилазетидин-3-ил)анилин связывают с тиофен-2-сульфонилхлоридом, что дает указанное в заголовке соединение.
ESI-MC: 337,0 [M+H]+
1H ЯМР (400 МГц, ДМСО): δ (ч./млн) 0,88 (т, 3H), 1,45 (м, 2Н), 3,11 (м, 2Н), 3,97 (м, 3H), 4,22 (м, 1H), 4,35 (м, 1H), 7,11 (м, 3H), 7,29 (м, 2Н), 7,54 (м, 1H), 7,84 (м, 1H).
Пример 40
2,5-Дихлор-N-[4-(1-пропилазетидин-3-ил)фенил]бензолсульфонамид
ESI-MC: 400,8 [M+H]+
Пример 41
N-[4-(1-Пропилазетидин-3-ил)фенил]-3-трифторметилбензолсульфонамид
ESI-MC: 400,8 [M+H]+
Пример 42
N-[4-(1-Пропилазетидин-3-ил)фенил]-3,5-бис-трифторметилбензолсульфонамид
ESI-MC: 467,1 [M+H]+
Пример 43
2,5-Диметил-N-[4-(1-пропилазетидин-3-ил)фенил]бензолсульфонамид
ESI-MC: 359,1 [M+H]+
Пример 44
3-Хлор-4-фтор-N-[4-(1-пропилазетидин-3-ил)фенил]бензолсульфонамид
ESI-MC: 383,0 [M+H]+
Пример 45
3-Фтор-N-[4-(1-пропилазетидин-3-ил)фенил]бензолсульфонамид
ESI-ESI-MC: 349,0 [M+H]+ 349,1
Пример 46
[4-(1-пропилазетидин-3-ил)фенил]амид 2,5-дихлортиофен-3-сульфоновой кислоты
ESI-MC: 404,9 [M+H]+
Пример 47
[4-(1-пропилазетидин-3-ил)фенил]амид 5-хлортиофен-2-сульфоновой кислоты
ESI-MC: 370,9 [M+H]+
Пример 48
3-Хлор-N-[4-(1-пропилазетидин-3-ил)фенил]бензолсульфонамид
ESI-MC: 365,1 [M+H]+
Пример 49
3,5-Дихлор-N-[4-(1-пропилазетидин-3-ил)фенил]бензолсульфонамид
ESI-MC: 400,8 [M+H]+
Пример 50
3-Метил-N-[4-(1-пропилазетидин-3-ил)фенил]бензолсульфонамид
ESI-MC: 345,1 [M+H]+
Пример 51
2,3-Дихлор-N-[4-(1-пропилазетидин-3-ил)фенил]бензолсульфонамид
ESI-MC: 400,8 [M+H]+
Пример 52
3-Бром-N-[4-(1-пропилазетидин-3-ил)фенил]бензолсульфонамид
ESI-MC: 410,9 [M+H]+
Пример 53
[4-(1-пропилазетидин-3-ил)фенил]амид 5-изоксазол-3-илтиофен-2-сульфоновой кислоты
ESI-MC: 404.0 [M+H]+
Пример 54
3,4-Дифтор-N-[4-(1-пропилазетидин-3-ил)фенил]бензолсульфонамид
ESI-MC: 367,0 [M+H]+
Пример 55
3-Циано-N-[4-(1-пропилазетидин-3-ил)фенил]бензолсульфонамид
ESI-MC: 356,3 [M+H]+
Пример 56
4-Фтор-3-оксазол-4-ил-N-[4-(1-пропилазетидин-3-ил)фенил]бензолсульфонамид
ESI-MC: 416,1 [M+H]+
Пример 57
4-Фтор-3-оксазол-4-ил-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамид
ESI-MC: 430,1 [M+H]+
Пример 58
4-Фтор-3-оксазол-5-ил-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамид
ESI-MC: 430,1 [M+H]+
Пример 59
Гидрохлорид [4-((S)-1-пропилпирролидин-3-ил)фенил]амида 5-бромтиофен-2-сульфоновой кислоты
59.1. Диметиловый эфир (S)-2-фенилянтарной кислоты
5 г (S)-2-Фенилянтарной кислоты (25,75 ммоль) растворяют в 50 мл метанола. При температуре 4°C добавляют по каплям 4,7 мл тионилхлорида (64,37 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 2-х часов, растворители упаривают при пониженном давлении. Оставшийся остаток растворяют в диэтиловом эфире, промывают один раз насыщенным водным раствором NaHCO3, повторно экстрагируют диэтиловым эфиром и комбинированные органические слои сушат над сульфатом магния, фильтруют и упаривают досуха, чтобы получить на выходе 5,8 г желаемого продукта.
ESI-MC: 223,1 [M+H]+
59.2. (S)-2-Фенилбутан-1,4-диол
2,54 г литийалюминийгидрида (66,95 ммоль) суспендируют при охлаждении льдом в 25 мл тетрагидрофурана. Медленно добавляют 5,8 г (S)-2-фенилянтарной кислоты диметилового эфира (25,75 ммоль), растворенного в 25 мл тетрагидрофурана при температуре 5-10°C. Перемешивание продолжают в течение 15 минут и затем добавляют по каплям 15 мл смеси тетрагидрофуран/вода (1:1). Значение рН суспензии доводят до 3-4 с помощью концентрированной соляной кислоты, фильтруют и фильтр промывают дихлорметаном. Фильтрат упаривают досуха, переносят в диэтиловый эфир, промывают насыщенным раствором гидрокарбоната натрия, повторно экстрагируют диэтиловым эфиром и комбинированные органические слои сушат над сульфатом магния, фильтруют и растворитель упаривают при пониженном давлении, чтобы получить на выходе 4,2 г диола.
ESI-MC: 189,1 [M+Na]+
1H-ЯМР (CDCl3): δ [ч./млн] 7,25-7,4 (м, 2Н), 7,15-7,3 (м, 3H), 4,2-4,35 (м, 2Н), 3,2 (м, 1H), 3,1 (м, 1H), 2,1-2,3 (м, 3H).
59.3. (S)-4-метансульфонилокси-3-фенилбутиловый эфир метансульфоновой кислоты
4,19 г (S)-2-Фенилбутан-1,4-диола (25,21 ммоль) растворяют в 50 мл дихлорметана. Добавляют 10,53 мл триэтиламина (75,6 ммоль) и, при охлаждении льдом, 5 мл метансульфонилхлорида (64,34 ммоль). Перемешивание продолжают в течение 15 минут и затем добавляют 40 мл воды. Органическую фазу отделяют и водную фазу экстрагируют дихлорметаном. Комбинированные органические слои сушат над сульфатом магния, фильтруют и растворитель упаривают при пониженном давлении, чтобы получить на выходе 8,37 г продукта.
59.4. (S)-3-Фенил-1-пропилпирролидин
2,0 г (S)-4-метансульфонилокси-3-фенилбутилового эфира метансульфоновой кислоты (5,51 ммоль) растворяют в 5 мл н-пропиламина (60,82 ммоль). Реакционную смесь перемешивают в течение 15 часов при комнатной температуре, добавляют диэтиловый эфир, органическую фазу промывают дважды водой. Водную фазу повторно экстрагируют один раз диэтиловым эфиром, органические слои комбинируют, сушат над сульфатом магния, фильтруют и растворитель упаривают при пониженном давлении, чтобы получить на выходе 1,09 г продукта.
ESI-MC: 190,1 [M+H]+
59.5. (S)-3-(4-Нитрофенил)-1-пропилпирролидин
0,3 г (S)-3-фенил-1-пропилпирролидина (1,48 ммоль) растворяют в 2 мл концентрированной серной кислоты в атмосфере аргона и охлаждении льдом. Добавляют небольшими порциями 165,16 мг нитрата калия (1,63 ммоль). Реакционную смесь перемешивают в течение 15 минут при охлаждении льдом, в течение 15 часов при комнатной температуре и выливают на размельченный лед. Водный раствор подщелачивают с помощью 25% раствора гидроксида натрия, экстрагируют трижды диэтиловым эфиром, водную фазу повторно экстрагируют один раз диэтиловым эфиром, органические слои комбинируют, сушат над сульфатом магния, фильтруют и растворитель упаривают при пониженном давлении, чтобы получить на выходе 0,326 г масла коричневатого цвета. Вторая реакция дает на выходе дополнительные 0,919 г желаемого продукта.
ESI-MC: 235,1 [M+H]+
1H-ЯМР (CDCl3): δ [ч./млн] 8,15 (д, 2Н), 7,45 (д, 2Н), 3,4-3,5 (м, 1H), 2,9-3,0 (м, 1H), 2,75 (м, 1H), 2,3-2,6 (м, 4H), 1,8-1,9 (м, 1H), 1,5-1,65 (м, 3H), 0,95 (м, 3H).
59.6. (S)-3-(4-Аминофенил)-1-пропилпирролидин
0,907 г (S)-3-(4-Нитрофенил)-1-пропилпирролидина (3,59 ммоль) растворяют в 20 мл метанола, добавляют 7,0 г дихлорида олова (31,02 ммоль) и реакционную смесь перемешивают при температуре кипения с обратным холодильником в течение часа. Метанол упаривают, добавляют 60 мл 1 N гидроксида натрия и дихлорметан и фазы разделяют после экстенсивного перемешивания. Водную фазу экстрагируют дважды дихлорметаном, органические слои комбинируют, сушат над сульфатом магния, фильтруют и растворитель упаривают при пониженном давлении, чтобы получить на выходе 0,744 г сырого аминосоединения.
ESI-MC: 205,2 [M+H]+
1H-ЯМР (ДМСО-d6): δ [ч./млн] 6,9 (д, 2Н), 6,45 (д, 2Н), 4,7 (ушир.с, 2Н), 3,1 (м, 1H), 2,85 (м, 1H), 2,65 (м, 1H), 2,55 (м, 1H), 2,25-2,45 (м, 3H), 2,1 (м, 1H), 1,65 (м, 1H), 1,4-1,5 (м, 2Н), 0,85 (м, 3H).
59.7. Гидрохлорид [4-((S)-1-пропилпирролидин-3-ил)фенил]амид 5-бромтиофен-2-сульфоновой кислоты
400 мг гидрохлорида (S)-3-(4-аминофенил)-1-пропилпирролидина (1,66 ммоль) и 435 мг (0,33 ммоль) 5-бромтиофен-2-сульфонилхлорида (1,66 ммоль) растворяют в 15 мл тетрагидрофурана. Добавляют 1,2 мл триэтиламина (8,3 ммоль) и реакционную смесь перемешивают в течение 15 часов при комнатной температуре. Растворители упаривают при пониженном давлении, остаток обрабатывают водой и рН доводят до щелочного значения с помощью раствора гидроксида натрия. Водный слой экстрагируют трижды диэтиловым эфиром, органические слои комбинируют, сушат над сульфатом магния, фильтруют и растворитель упаривают при пониженном давлении. Сырой продукт очищают с помощью хроматографии на силикагеле со смесью этилдихлорметан/метанол (0-6%) в виде элюента, получая на выходе 45 мг очищенного продукта. Указанный продукт растворяют в 10 мл диэтилового эфира и добавляют 0,055 мл 1 N HCl в диэтиловом эфире и после образования осадка суспензию упаривают при пониженном давлении, чтобы получить на выходе 50 мг осадка белого цвета.
ESI-MC: 431,0 [M+H]+
1H-ЯМР (ДМСО): δ [ч./млн] 11,2 и 11,0 (2с, ушир., 1H), 10,65 (м, 1H), 7,2-7,4 (несколько м, 4H), 7,1 (м, 2Н), 3,0-3,8 (несколько м, 7H), 2,3 (м, 1H), 1,85-2,0 (м, 1H), 1,7 (м, 2Н), 0,9 (м, 3H).
Пример 60
[4-((S)-1-пропилпирролидин-3-ил)фенил]амид 5-пропилтиофен-2-сульфоновой кислоты
Указанный в заголовке продукт получают, следуя методике синтеза, аналогичной той, которая описана для получения соединения по примеру 59, используя 5-пропилтиофен-2-сульфонилхлорид, который, в свою очередь, получают из коммерчески доступного 2-пропилтиофена через реакцию с хлорсульфоновой кислотой.
ESI-MC: 393,1 [M+H]+
1H-ЯМР (CDCl3, 400 МГц): δ [ч./млн] 7,3 (д, 1H), 7,2 (д, 2Н), 7,05 (д, 2Н), 6,65 (д, 1H), 3,35 (м, 1H), 3,1 (м, 1H), 2,9 (м, 1H), 2,75 (м, 3H), 2,5 (м, 3H), 2,3 (м, 1H), 1,85 (м, 1H), 1,5-1,7 (м, 4H), 0,9 (м, 6H).
Пример 61
Гидрохлорид 3-бром-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]-4-трифторметоксибензолсульфонамида
Указанный в заголовке продукт получают, следуя методике синтеза, аналогичной той, которая описана для получения соединения по примеру 59, используя коммерчески доступный 3-бром-4-трифторметоксибензолсульфонилхлорид.
ESI-MC: 507,05/509,05 [M+H]+
1H-ЯМР (ДМСО-d6, 400 МГц): δ [ч./млн] 11,1-11,4 (ушир., 1H), 10,6 (ушир., 1H), 8,15 (с, 1H), 7,9 (д, 1H), 7,7 (д, 1H), 7,35 (д, 1H), 7,3 (д, 1H), 7,1 (д, 2Н), 3,2-3,8 (несколько м, 4H), 2,95-3,15 (несколько м, 3H), 2,8 (м, 1H), 1,95 (м, 1H), 1,7 (м, 2Н), 0,9 (т, 3H).
Пример 62
[4-((S)-1-пропилпирролидин-3-ил)фенил]амид 5-хлортиофен-2-сульфоновой кислоты
Указанный в заголовке продукт получают, следуя методике синтеза, аналогичной той, которая описана для получения соединения по примеру 59, используя коммерчески доступный 5-хлортиофен-2-сульфонилхлорид.
ESI-MC: 385,0 [M+H]+
1H-ЯМР (CDCl3, 400 МГц): δ [ч./млн] 7,25 (д, 1H), 7,2 (д, 2Н), 7,0 (д, 2Н), 6,8 (д, 1H), 5,1 (ушир.с, 1H), 3,3 (м, 1H), 3,05 (м, 1H), 2,85 (м, 1H), 2,7 (м, 1H), 2,4-2,6 (несколько м, 3H), 2,3 (м, 1H), 1,8 (м, 1H), 1,55 (м, 2Н), 0,9 (т, 3H).
Пример 63
Гидрохлорид N-(3-пиперидин-3-илфенил)-3-трифторметоксибензолсульфонамида
ESI-MC: 401,0 [M+H]+
1H-ЯМР (ДМСО-d6, 400 МГц): δ [ч./млн] 10,55 (ушир., 1H), 9,35 (ушир., 1H), 9,2 (ушир., 1H), 7,8 (д, 1H), 7,7 (м, 1H), 7,65 (м, 2Н), 7,2 (т, 1H), 7,0 (м, 3H), 3,25 (м, 1H), 3,2 (м, 1H), 2,8-3,0 (м, 3H), 1,7-1,9 (м, 3H), 1,5-1,65 (м, 1H).
Пример 64
Гидрохлорид 3-циано-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамида
Указанный в заголовке продукт получают, следуя методике синтеза, аналогичной той, которая описана для получения соединения по примеру 59, используя коммерчески доступный 3-цианобензолсульфонилхлорид.
ESI-MC: 370,4 [M+H]+
1H-ЯМР (ДМСО-d6, 400 МГц): δ [ч./млн] 10,8 (ушир., 2Н), 8,2 (с, 1H), 8,1 (д, 1H), 8,05 (д, 1H), 7,8 (т, 1H), 7,25 (д, 2Н), 7,1 (д, 2Н), 3,0-3,8 (несколько м, 7H), 2,3 (м, 1H), 1,95 (м, 1H), 1,7 (м, 2Н), 0,9 (т, 3H).
Пример 65
N-[3-((S)-1-Бензилпирролидин-3-ил)фенил]-3-трифторметилбензолсульфонамид
Указанный в заголовке продукт получают, следуя методике синтеза, аналогичной той, которая описана для получения соединения по примеру 59, используя коммерчески доступный 3-трифторметилбензолсульфонилхлорид.
ESI-MC: 461,1 [M+H]+
1H-ЯМР (CDCl3, 400 МГц): δ [ч./млн] 8,0 (с, 1H), 7,9 (д, 1H), 7,75 (д, 1H), 7,55 (т, 1H), 7,2-7,4 (несколько м, 6H), 7,15 (м, 1H), 7,05 (д, 1H), 6,95 (с, 1H), 6,9 (д, 1H), 3,65 (с, 2Н), 3,25 (м, 1H), 2,95 (м, 1H), 2,75 (м, 2Н), 2,45 (м, 1H), 2,25 (м, 1H), 1,75 (м, 1H).
Пример 66
Гидрохлорид [4-((S)-1-пропилпирролидин-3-ил)фенил]амид 5-пиридин-2-илтиофен-2-сульфоновой кислоты
Указанный в заголовке продукт получают, следуя методике синтеза, аналогичной той, которая описана для получения соединения по примеру 59, используя коммерчески доступный 5-пиридин-2-илтиофен-2-сульфонилхлорид.
ESI-MC: 428,1 [M+H]+
1H-ЯМР (ДМСО-d6, 400 МГц): δ [ч./млн] 10,8-11,2 (ушир., 1H), 10,6 (м, 1H), 8,55 (д, 1H), 8,0 (д, 1H), 7,9 (т, 1H), 7,8 (д, 1H), 7,6 (д, 1H), 7,3-7,4 (м, 2Н), 7,3 (д, 1H), 7,15 (м, 2Н), 3,8 (м, 1H), 3,65 (м, 1H), 3,6 (м, 1H), 3,3-3,5 (м, 1H), 3,25 (м, 1H), 3,0-3,15 (м, 2Н), 2,35 (м, 1H), 2,0 (м, 1H), 1,7 (м, 2Н), 0,9 (т, 3H).
Пример 67
N-[3-((S)-Пирролидин-3-ил)фенил]-3-трифторметилбензолсульфонамид
Раствор N-[3-((S)-1-бензилпирролидин-3-ил)фенил]-3-трифторметилбензолсульфонамида (620 мг, 1,34 ммоль) (пример 65) в метаноле (30 мл) гидрируют, используя реактор гидрогенизации ThalesNano H-Cube®, применяя каталитический картридж с 10% палладия-на-угле. После концентрирования раствора при пониженном давлении сырой продукт очищают с помощью хроматографии на силикагеле со смесью этилацетат/метанол (1:1; 0:1) в виде элюента, получая на выходе 328 мг очищенного продукта.
ESI-MC: 371,0 [M+H]+
1H-ЯМР (MeOD, 400 МГц): δ [ч./млн] 7,9 (м, 2Н), 7,7 (м, 1H), 7,55 (м, 1H), 7,0 (м, 1H), 6,7-6,85 (м, 3H), 3,2-3,3 (м, 2Н), 3,05-3,15 (м, 2Н), 3,0 (м, 1H), 2,7 (м, 1H), 2,1 (м, 1H), 1,7 (м, 1H).
Пример 68
Гидрохлорид [4-((S)-1-аллилпирролидин-3-ил)фенил]амид 5-пиридин-2-илтиофен-2-сульфоновой кислоты
Указанный в заголовке продукт получают, следуя методике синтеза, аналогичной той, которая описана для получения гидрохлорида [4-((S)-1-пропилпирролидин-3-ил)фенил]амида 5-бромтиофен-2-сульфоновой кислоты (пример 59), используя коммерчески доступный 5-пиридин-2-илтиофен-2-сульфонилхлорид и 4-((S)-1-аллилпирролидин-3-ил)фениламин.
ESI-MC: 426,1 [M+H]+
Пример 69
Гидрохлорид ((S)-4-пирролидин-3-илфенил)амид 5-пиридин-2-илтиофен-2-сульфоновой кислоты
36 мг Pd2(dba)3 (0,04 ммоль) и 24 мг 1,4-бис-(дифенилфосфино)бутана (0,06 ммоль) растворяют в 10 мл тетрагидрофурана. После перемешивания в течение 20 минут добавляют [4-((S)-1-аллилпирролидин-3-ил)фенил]амид 5-пиридин-2-илтиофен-2-сульфоновой кислоты (235 мг, 0,55 ммоль) (пример 68) и 2-меркаптобензойную кислоту (160 мг, 1,04 ммоль), каждый в виде раствора в 3 мл тетрагидрофурана. Реакционную смесь перемешивают в течение 20 часов при комнатной температуре. Растворители упаривают при пониженном давлении, остаток растворяют в этилацетате и экстрагируют 0,5 N HCl. рН водной фазы доводят до щелочного значения с помощью раствора гидроксида натрия и затем экстрагируют трижды дихлорметаном. Органические слои комбинируют, сушат над сульфатом магния, фильтруют и растворитель упаривают при пониженном давлении. Сырой продукт очищают с помощью хроматографии (Chromabond-C18) со смесью H2O/ацетонитрил (95:5; 0:100; 95:5)/0,1% уксусной кислоты в виде элюента. К раствору таким образом полученного масла в 2-пропаноле добавляют HCl в диэтиловом эфире. Образованное твердое вещество отфильтровывают и сушат в вакуумной печи, чтобы получить 8 мг указанного в заголовке соединения.
ESI-MC: 386,0 [M+H]+
1H-ЯМР (ДМСО-d6, 400 МГц): δ [ч./млн] 8,5 (д, 1H), 7,95 (д, 1H), 7,85 (т, 1H), 7,7 (д, 1H), 7,4 (д, 1H), 7,3 (м, 1H), 7,1 (д, 2Н), 7,0 (д, 2Н), 3,4 (м, 1H), 3,2-3,3 (м, 2Н), 3,1 (м, 1H), 2,85 (м, 1H), 2,2 (м, 1H), 1,7-1,85 (м, 1H).
Пример 70
3-Бром-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамид
Указанный в заголовке продукт получают, следуя методике синтеза, аналогичной той, которая описана для получения соединения по примеру 59, используя коммерчески доступный 3-бромбензолсульфонилхлорид.
ESI-MC: 423,0/425,0 [M+H]+
Пример 71
N-[4-((S)-1-Пропилпирролидин-3-ил)фенил]-3-пирролидин-1-илбензолсульфонамид
0,4 г 3-Бром-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамида (0,94 ммоль), 0,156 мл пирролидина (1,89 ммоль), 160 мг трет-бутилата натрия ((1,66 ммоль) и 540 мг сульфата натрия растворяют в 15 мл тетрагидрофурана и нагревают до температуры 50°C. Добавляют 120 мг 2,2'-бис(дифенилфосфино)-1,1'-бинафталина (0,19 ммоль) и 85 мг три(дибензилиденацетон)дипалладия(0) (0,09 ммоль) и реакционную смесь перемешивают в течение 4 часов при температуре кипения с обратным холодильником. После обработки частично вступивший в реакцию исходный продукт взаимодействует еще раз в тех же самых условиях реакции до полного завершения реакции. Растворители упаривают при пониженном давлении, остаток обрабатывают дихлорметаном и водой, органические слои сушат над сульфатом магния, фильтруют и растворитель упаривают при пониженном давлении. Сырой продукт очищают с помощью хроматографии на силикагеле со смесью дихлорметан/метанол (0-20%) в виде элюента, используя полуавтоматический прибор ISCO Companion, получая на выходе 0,309 г очищенного продукта.
ESI-MC: 414,1 [M+H]+
1H-ЯМР (CDCl3, 400 МГц): δ [ч./млн] 7,2 (м, 1H), 7,15 (д, 2Н), 7,0 (м, 3H), 6,8 (с, 1H), 6,65 (д, 1H), 3,3 (м, 1H), 3,2 (м, 4H), 3,0 (м, 1H), 2,8 (м, 1H), 2,6 (м, 1H), 2,3-2,5 (несколько м, 3H), 2,25 (м, 1H), 2,0 (м, 4H), 1,75 (м, 1H), 1,5 (м, 2Н), 0,9 (т, 3H).
Пример 72
Гидрохлорид 3-(2-метилпирролидин-1-ил)-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамида
0,023 г желаемого продукта получают, следуя методике синтеза, аналогичной той, которая описана для получения соединения по примеру 71.
ESI-MC: 428,2/443,0 [M+H]+
1H-ЯМР (ДМСО-d6): δ [ч./млн] 10,8-11,2 (ушир., 1H), 10,2 (м, 1H), 7,2-7,35 (несколько м, 3H), 7,1 (м, 2Н), 6,95 (д, 1H), 6,8 (с, 1H), 6,7 (д, 1H), 2,9-3,9 (несколько м, 8H), 2,3 (м, 1H), 1,8-2,1 (несколько м, 4H), 1,6-1,75 (несколько м, 3H), 1,0 (д, 3H), 0,9 (т, 3H).
Пример 73
Гидрохлорид [4-((S)-1-пропилпирролидин-3-ил)фенил]амид 5-пиразол-1-илтиофен-2-сульфоновой кислоты
0,2 г [4-((S)-1-пропилпирролидин-3-ил)фенил]амида 5-бромтиофен-2-сульфоновой кислоты (0,47 ммоль), 0,038 г пиразола (0,56 ммоль), 0,005 г Cu2O (0,03 ммоль), 0,015 г салицилальдоксима (0,11 ммоль) и 0,3 г карбоната цезия (0,93 ммоль) растворяют в 3 мл ацетонитрила и нагревают в системе микроволнового облучения (СЕМ) при температуре 120°C в течение 4 часов. Реакционную смесь фильтруют через целит, фильтрат упаривают при пониженном давлении, остаток обрабатывают дихлорметаном и водой и органические слой промывают насыщенным водным раствором хлорида натрия. Органическую фазу упаривают при пониженном давлении и сырой продукт очищают с помощью препаративной HPLC, получая на выходе 0,02 г очищенного продукта.
ESI-MC: 417,1 [M+H]+
1H-ЯМР (ДМСО-d6, 400 МГц): δ [ч./млн] 10,65-11,0 (ушир., 1H), 10,55 (с, 1H), 8,55 (с, 1H), 7,8 (с, 1H), 7,5 (с, 1H), 7,35 (д, 2Н), 7,3 (м, 1H), 7,15 (д, 2Н), 6,6 (с, 1H), 2,9-3,85 (несколько м, 7H), 2,3-2,4 (м, 1H), 1,85-2,1 (м, 1H), 1,6-1,75 (м, 2Н), 0,9 (т, 3H).
Пример 74
Гидрохлорид [4-((S)-1-пропилпирролидин-3-ил)фенил]амид 4,5-дихлортиофен-2-сульфоновой кислоты
Указанный в заголовке продукт получают, следуя методике синтеза, аналогичной той, которая описана для получения соединения по примеру 59, используя коммерчески доступный 4,5-дихлортиофен-2-сульфонилхлорид.
ESI-MC: 419/421 [M+H]+
1H-ЯМР (ДМСО-d6, 400 МГц): δ [ч./млн] 10,9-11,2 (ушир., 1H), 10,8 (с, 1H), 7,7 (с, 1H), 7,4 (д, 1H), 7,3 (д, 1H), 7,2 (д, 2Н), 3,8 (м, 1H), 3,2-3,7 (несколько м, 3H), 2,95-3,2 (м, 3H), 2,35 (м, 1H), 1,9-2,1 (м, 1H), 1,6-1,8 (м, 2Н), 0,9 (т, 3H).
Пример 75
Гидрохлорид [4-((S)-1-пропилпирролидин-3-ил)фенил]амид 5-[1,2,3]тиадиазол-4-илтиофен-2-сульфоновой кислоты
Указанный в заголовке продукт получают, следуя методике синтеза, аналогичной той, которая описана для получения соединения по примеру 59, используя коммерчески доступный 5-[1,2,3]тиадиазол-4-илтиофен-2-сульфонилхлорид.
ESI-MC: 435,1 [M+H]+
1H-ЯМР (ДМСО-d6, 400 МГц): δ [ч./млн] 10,55-10,85 (ушир., 1H), 10,6 (с, 1H), 9,7 (с, 1H), 7,8 (д, 1H), 7,65 (д, 1H), 7,3-7,4 (м, 2Н), 7,2 (д, 2Н), 3,2-3,8 (несколько м, 4H), 2,95-3,2 (м, 3H), 2,35 (м, 1H), 1,85-2,1 (м, 1H), 1,6-1,75 (м, 2Н), 0,9 (т, 3H).
Пример 76
Гидрохлорид [4-((S)-1-пропилпирролидин-3-ил)фенил]амид 5-трифторметилтиофен-2-сульфоновой кислоты
5-Трифторметилтиофен-2-сульфонилхлорид получают из коммерчески доступного 2-трифторметилтиофена через реакцию с хлорсульфоновой кислотой в дихлорметане и последующей хроматографией на колонке с силикагелем (1H-ЯМР сульфонилхлорида (CDCl3, 400 МГц): δ [ч./млн] 7,9 (1H, д), 7,5 (1H, д)).
ESI-MC: 419,1 [M+H]+
1H-ЯМР (ДМСО-d6, 400 МГц): δ [ч./млн] 10,8-11,1 (ушир., 2Н), 7,8 (д, 1H), 7,65 (д, 1H), 7,25-7,4 (ушир.м, 2Н), 7,1-7,2 (д, 2Н), 3,2-3,9 (несколько м, 4H), 2,9-3,2 (м, 3H), 2,35 (м, 1H), 1,85-2,1 (м, 1H), 1,6-1,8 (м, 2Н), 0,95 (т, 3H).
Пример 77
Гидрохлорид N-[3-((S)-1-метилпирролидин-3-ил)фенил]-3-трифторметилбензолсульфонамида
Продукт получают после восстановительного аминирования N-[3-((S)-пирролидин-3-ил)фенил]-3-трифторметилбензолсульфонамида (из примера 67) с помощью формальдегида и триацетоксиборгидрида натрия в дихлорметане в присутствии уксусной кислоты.
ESI-MC: 385,0 [M+H]+
1H-ЯМР (ДМСО-d6, 400 МГц): δ [ч./млн] 10,5-11,0 (ушир., 2Н), 7,9-8,1 (м, 3H), 7,8 (м, 1H), 7,25 (м, 1H), 7,1 (м, 1H), 7,1 (с, 1H), 6,95 (д, 1H), 3,0-3,8 (м, 5H), 2,85 (с, 3H), 2,3 (м, 1H), 1,85-2,05 (м, 1H).
Пример 78
[4-((S)-1-Пропилпирролидин-3-ил)фенил]амид 5-(2-метилтиазол-4-ил)тиофен-2-сульфоновой кислоты
Указанный в заголовке продукт получают, следуя методике синтеза, аналогичной той, которая описана для получения соединения по примеру 59, используя коммерчески доступный 5-(2-метилтиазол-4-ил)тиофен-2-сульфонилхлорид.
ESI-MC: 448,1 [M+H]+
1H-ЯМР (ДМСО-d6, 400 МГц): δ [ч./млн] 9,7-11,0 (ушир., 1H), 8,0 (с, 1H), 7,5 (д, 1H), 7,45 (д, 1H), 7,2 (д, 2Н), 7,1 (д, 2Н), 3,25 (м, 1H), 2,84 (м, 1H), 2,7 (с, 3H), 2,6-2,7 (м, 2Н), 2,3-2,5 (м, 3H), 2,1-2,2 (м, 1H), 1,6-1,7 (м, 1H), 1,4-1,5 (м, 2Н), 0,8-0,9 (т, 3H).
Пример 79
N-[3-((S)-пирролидин-3-ил)фенил]-2-фтор-5-трифторметилбензолсульфонамид
Продукт получают, как описано для синтеза N-[3-((S)-пирролидин-3-ил)фенил]-3-трифторметилбензолсульфонамида (пример 67). Снятие защиты с N-бензильного производного достигается через гидрогенизацию в H-cube™.
ESI-MC: 389,1 [M+H]+
Пример 80
N-[3-((S)-пирролидин-3-ил)фенил]-3-фтор-5-трифторметилбензолсульфонамид
Продукт получают, как описано для синтеза N-[3-((S)-пирролидин-3-ил)фенил]-3-трифторметилбензолсульфонамида (пример 67). Снятие защиты с N-бензильного производного достигается через гидрогенизацию в H-cube™.
ESI-MC: 389,0 [M+H]+
1H-ЯМР (ДМСО-d6, 400 МГц): δ [ч./млн] 7,8 (с, 1H), 7,7-7,8 (м, 2Н), 6,95 (т, 1H), 6,8 (с, 1H), 6,75 (д, 1H), 6,6 (д, 1H), 5,8 (очень широкий, 2Н), 3,45 (м, 1H), 3,3 (м, 1H), 3,1-3,25 (м, 2Н), 2,85 (м, 1H), 2,2 (м, 1H), 1,75 (м, 1H).
Пример 81
N-[3-((S)-пирролидин-3-ил)фенил]-4-фтор-5-трифторметилбензолсульфонамид
Продукт получают, как описано для синтеза N-[3-((S)-пирролидин-3-ил)фенил]-3-трифторметилбензолсульфонамида (пример 67). Снятие защиты с N-бензильного производного достигается через гидрогенизацию в H-cube™.
ESI-MC: 389,0 [M+H]+
1H-ЯМР (ДМСО-d6, 400 МГц): δ [ч./млн] 8,05 (м, 1H), 8,0 (м, 1H), 7,6 (т, 1H), 7,0 (м, 2Н), 6,85 (с, 1H), 6,8 (д, 1H), 6,7 (д, 1H), 5,8 (очень широкий, 2Н), 3,4 (м, 1H), 3,2 (м, 2Н), 3,1 (м, 1H), 2,85 (м, 1H), 2,2 (м, 1H), 1,75 (м, 1H).
Пример 82
N-[3-((S)-пирролидин-3-ил)фенил]-2-метокси-5-трифторметилбензолсульфонамид
Продукт получают, как описано для синтеза N-[3-((S)-пирролидин-3-ил)фенил]-3-трифторметилбензолсульфонамида (пример 67). Снятие защиты с N-бензильного производного достигается через гидрогенизацию в H-cube™.
ESI-MC: 401,1 [M+H]+
1H-ЯМР (ДМСО-d6, 400 МГц): δ [ч./млн] 8,0 (с, 1H), 7,9 (м, 1H), 7,35 (д, 1H), 7,1 (м, 1H), 7,0 (м, 1H), 6,85-6,95 (м, 2Н), 3,9 (с, 3H), 3,0-3,4 (несколько м, 4H), 2,65 (м, 1H), 2,1 (м, 1H), 1,6 (м, 1H).
Пример 83
3,5-Дибром-4-(2-фторэтокси)-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамид
Соответствующий сульфонилхлорид получают из коммерчески доступного 2,6-дибромфенола через реакцию с 1-бром-2-фторэтаном и карбонатом цезия и последующего образования сульфонилхлорида через реакцию с хлорсульфоновой кислотой (1H-ЯМР (CDCl3, 400 МГц) 3,5-дибром-4(2-фторэтокси)фенилсульфонилхлорида: δ [ч./млн] 8,2 (с, 2Н), 4,9 (м, 1H), 4,8 (м, 1H), 4,45 (м, 1H), 4,4 (м, 1H)).
ESI-MC: 565,0 [M+H]+
1H-ЯМР (CDCl3, 400 МГц): δ [ч./млн] 7,85 (с, 2Н), 7,2 (д, 2Н), 7,0 (д, 2Н), 4,85 (м, 1H), 4,7 (м, 1H), 4,35 (м, 1H), 4,25 (м, 1H), 3,35 (м, 1H), 3,1 (м, 1H), 2,9 (м, 1H), 2,8 (м, 1H), 2,45-2,6 (м, 3H), 2,3 (м, 1H), 1,85 (м, 1H), 1,6 (м, 2Н), 0,95 (т, 3H).
Пример 84
Гидрохлорид 3-дифторметокси-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамида
Указанный в заголовке продукт получают, следуя методике синтеза, аналогичной той, которая описана для получения соединения по примеру 59, используя коммерчески доступный 3-дифторметоксибензолсульфонилхлорид.
ESI-MC: 411,5 [M+H]+
1H-ЯМР (ДМСО-d6, 400 МГц): δ [ч./млн] 10,2-11,1 (очень широкий, 2Н), 7,65 (м, 2Н), 7,5 (с, 1H), 7,45 (м, 1H), 7,25 (м, 2Н), 7,1 (м, 2Н), 3,1-3,8 (м, 5H), 3,1 (м, 2Н), 2,3 (м, 1H), 1,9-2,0 (м, 1H), 1,6-1,75 (м, 2Н), 0,9 (т, 3H).
Пример 85
5-Бром-2,4-дифтор-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамид
Указанный в заголовке продукт получают, следуя методике синтеза, аналогичной той, которая описана для получения соединения по примеру 59, используя коммерчески доступный 5-бром-2,4-дифторбензолсульфонилхлорид.
ESI-MC: 459,0/461,0 [M+H]+
1H-ЯМР (ДМСО-d6, 400 МГц): δ [ч./млн] 10,9 (очень широкий), 8,1 (т, 1H), 7,75 (т, 1H), 7,3 (д, 2Н), 7,1 (д, 2Н), 3,15-3,8 (м, 5H), 3,1 (м, 2Н), 2,35 (м, 1H), 1,9-2,0 (м, 1H), 1,6-1,75 (м, 2Н), 0,9 (т, 3H).
Пример 86
Гидрохлорид 3-бром-2,4-дифтор-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамида
Указанный в заголовке продукт получают, следуя методике синтеза, аналогичной той, которая описана для получения соединения по примеру 59, используя коммерчески доступный 3-бром-2,4-дифторбензолсульфонилхлорид.
ESI-MC: 459,4/461,4 [M+H]+
1H-ЯМР (ДМСО-d6, 400 МГц): δ [ч./млн] 10,9 (очень широкий), 7,9 (кв., 1H), 7,45 (т, 1H), 7,3 (д, 2Н), 7,1 (д, 2Н), 3,15-3,8 (м, 5H), 3,1 (м, 2Н), 2,3 (м, 1H), 1,9-2,0 (м, 1H), 1,6-1,75 (м, 2Н), 0,9 (т, 3H).
Пример 87
Гидрохлорид N-[4-((S)-1-пропилпирролидин-3-ил)фенил]-3,5-бис-трифторметилбензолсульфонамида
Указанный в заголовке продукт получают, следуя методике синтеза, аналогичной той, которая описана для получения соединения по примеру 59, используя коммерчески доступный 3,5-бис-трифторметоксибензолсульфонилхлорид.
ESI-MC: 481,1 [M+H]+
1H-ЯМР (ДМСО-d6, 400 МГц): δ [ч./млн] 10,8 (очень широкий), 8,5 (с, 1H), 8,25 (с, 2Н), 7,3 (д, 2Н), 7,1 (д, 2Н), 3,15-3,7 (м, 5H), 3,1 (м, 2Н), 2,3 (м, 1H), 1,9-2,0 (м, 1H), 1,6-1,75 (м, 2Н), 0,9 (т, 3H).
Пример 88
Гидрохлорид 3-бром-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]-5-трифторметилбензолсульфонамида
Указанный в заголовке продукт получают, следуя методике синтеза, аналогичной той, которая описана для получения соединения по примеру 59, используя коммерчески доступный 3-бром-5-трифторметилбензолсульфонилхлорид.
1H-ЯМР (ДМСО-d6, 400 МГц): δ [ч./млн] 10,7 (очень широкий), 8,3 (с, 1H), 8,15 (с, 1H), 7,95 (с, 1H), 7,3 (д, 2Н), 7,1 (д, 2Н), 3,15-3,7 (м, 5H), 3,1 (м, 2Н), 2,25-2,4 (м, 1H), 1,85-2,05 (м, 1H), 1,6-1,75 (м, 2Н), 0,9 (т, 3H).
Пример 89
Гидрохлорид N-[4-((S)-1-пропилпирролидин-3-ил)фенил]-2,5-бис-трифторметилбензолсульфонамид
Указанный в заголовке продукт получают, следуя методике синтеза, аналогичной той, которая описана для получения соединения по примеру 59, используя коммерчески доступный 2,5-бис-трифторметилбензолсульфонилхлорид.
ESI-MC: 481,1 [M+H]+
1H-ЯМР (DMSO-d6, 400 МГц): δ [ч./млн] 10,5-11,0 (очень широкий), 8,35 (с, 1H), 8,25 (с, 2Н), 7,3 (ушир., 2Н), 7,1 (д, 2Н), 3,2-3,8 (м, 4H), 2,9-3,1 (м, 3H), 2,25-2,4 (м, 1H), 1,8-2,05 (м, 1H), 1,6-1,75 (м, 2Н), 0,9 (т, 3H).
Пример 90
Гидрохлорид [4-((S)-1-пропилпирролидин-3-ил)фенил]амид 5-метилтиофен-2-сульфоновой кислоты
Указанный в заголовке продукт получают, следуя методике синтеза, аналогичной той, которая описана для получения соединения по примеру 59, используя коммерчески доступный 5-метилтиофен-2-сульфонилхлорид.
ESI-MC: 365,1 [M+H]+
1H-ЯМР (ДМСО-d6, 400 МГц): δ [ч./млн] 11,1-11,2 (очень широкий), 10,85-11,0 (очень широкий), 10,4 (м, 1H), 7,4 (д, 1H), 7,3 (д, 1H), 7,25 (д, 1H), 7,1 (д, 2Н), 6,8 (с, 1H), 3,2-3,8 (м, 4H), 2,95-3,2 (м, 3H), 2,45 (с, 3H), 2,25-2,4 (м, 1H), 1,85-2,1 (м, 1H), 1,6-1,75 (м, 2Н), 0,9 (т, 3H).
Пример 91
2-Метокси-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]-5-трифторметилбензолсульфонамид
Указанный в заголовке продукт получают, следуя методике синтеза, аналогичной той, которая описана для получения соединения по примеру 59, используя коммерчески доступный 2-метокси-5-трифторметилбензолсульфонилхлорид.
ESI-MC: 443,1 [M+H]+
1H-ЯМР (ДМСО-d6, 400 МГц): δ [ч./млн] 10,9 (очень широкий), 10,25 (очень широкий), 7,95 (м, 2Н), 7,4 (д, 1H), 7,3 (д, 2Н), 7,1 (д, 2Н), 3,95 (с, 3H), 2,9-3,8 (несколько м, 7H), 2,25-2,35 (м, 1H), 1,8-2,0 (м, 1H), 1,6-1,75 (м, 2Н), 0,9 (т, 3H).
Пример 92
N-((R)-3-Пирролидин-3-илфенил)-3-трифторметилбензолсульфонамид
Продукт получают, как описано для синтеза N-[3-((S)-пирролидин-3-ил)фенил]-3-трифторметилбензолсульфонамида (пример 67). Снятие защиты с N-бензильного производного достигается через гидрогенизацию в H-cube™.
ESI-MC: 371,1 [M+H]+
1H-ЯМР (ДМСО-d6, 400 МГц): δ [ч./млн] 8,0 (м, 2Н), 7,85 (д, 1H), 7,7 (м, 1H), 7,0 (т, 1H), 6,85 (с, 1H), 6,8 (д, 1H), 6,7 (д, 1H), 3,35 (м, 1H), 3,0-3,2 (м, 3H), 2,75 (м, 1H), 2,05-2,2 (м, 1H), 1,6-1,75 (м, 1H).
Пример 93
3-(2-Метилтиазол-4-ил)-N-((S)-3-пирролидин-3-илфенил)бензолсульфонамид
Продукт получают, как описано для синтеза N-[3-((S)-пирролидин-3-ил)фенил]-3-трифторметилбензолсульфонамида (пример 67). Снятие защиты с N-бензильного производного достигается через гидрогенизацию аммонийформиатом и 10% Pd/C.
ESI-MC: 400,1 [M+H]+
1H-ЯМР (ДМСО-d6, 400 МГц): δ [ч./млн] 8,4 (с, 1H), 8,1 (д, 1H), 8,0 (с, 1H), 7,65 (д, 1H), 7,55 (т, 1H), 7,1 (т, 1H), 7,0 (с, 1H), 6,8-6,9 (м, 2), 3,2 (м, 1H), 2,85-3,1 (м, 3H), 2,7 (с, 3H), 2,55 (м, 1H), 2,0-2,1 (м, 1H), 1,5-1,65 (м, 1H).
Пример 94
Гидрохлорид N-[4-((3S,5R)-5-метил-1-пропилпирролидин-3-ил)фенил]-3-трифторметилбензолсульфонамида
Продукт получают через следующие промежуточные соединения:

94.1. 1-трет-Бутиловый эфир 2-метиловый эфир (2S,4S)-4-фенилпирролидин-1,2-дикарбоновой кислоты
4,48 г коммерчески доступную (2S,4S)-Boc-4-фенилпирролидин-2-карбоновую кислоту (15,37 ммоль) растворяют в 50 мл диметилформамида. Добавляют 2,59 г карбоната калия (18,76 ммоль) и 2,66 г метилиодида (18,76 ммоль) и реакционную смесь перемешивают в течение 48 часов при комнатной температуре. Стандартная обработка этилацетатом дает на выходе 5,3 г продукта.
ESI-MC: 206,1 (-Boc), 250,1 (-tBu) [M+H]+
1H-ЯМР (CDCl3, 400 МГц): δ [ч./млн] 7,2-7,35 (м, 5H), 4,4-4,55 (м, 1H), 3,9-4,1 (м, 1H), 3,75 (с, 3H), 3,55 (м, 1H), 3,4 (м, 1H), 2,35 (м, 2Н), 1,45 (м, 9H).
94.2. трет-Бутиловый эфир (2S,4S)-2-гидроксиметил-4-фенилпирролидин-1-карбоновой кислоты
4,2 г 1-трет- Бутиловый эфир 2-метилового эфира (2S,4S)-4-фенилпирролидин-1,2-дикарбоновой кислоты (13,75 ммоль) в 30 мл тетрагидрофурана медленно добавляют к суспензии 0,27 г литийалюминийгидрида в 50 мл тетрагидрофурана. Перемешивание продолжают в течение 5 часов при температуре 0-5°C и в течение 14 часов при комнатной температуре. Для обработки к реакционной смеси медленно добавляют смесь тетрагидрофуран/вода (1:1) при температуре 0°C. Затем растворитель упаривают при пониженном давлении, добавляют воду и pH доводят приблизительно до значения 5 с помощью 20% водного раствора лимонной кислоты. Водную фазу экстрагируют четырежды этилацетатом, органические слои комбинируют, сушат над сульфатом магния, фильтруют и растворитель удаляют при пониженном давлении, чтобы получить на выходе 3,85 г продукта.
ESI-MC: 222,1 (-tBu) [M+H]+
1H-ЯМР (CDCl3, 400 МГц): δ [ч./млн] 7,2-7,4 (м, 5H), 4,15 (м, 1H), 3,65-3,8 (м, 3H), 3,35-3,5 (м, 2Н), 3,1 (ушир., 1H), 2,15 (м, 1H), 2,05 (м, 1H), 1,5 (с, 9H).
94.3. трет-Бутиловый эфир (2S,4S)-2-метансульфонилоксиметил-4-фенилпирролидин-1-карбоновой кислоты
К 2,5 г трет-бутилового эфира (2S,4S)-2-гидроксиметил-4-фенилпирролидин-1-карбоновой кислоты (9,01 ммоль) в 70 мл дихлорметана добавляют 1,92 г триэтиламина (18,02 ммоль) и 1,03 г метансульфонилхлорида (9,01 ммоль), растворенного в 5 мл дихлорметана. Реакционную смесь перемешивают в течение 16 часов при комнатной температуре и получают на выходе 3,4 г продукта после стандартной обработки.
ESI-MC: 300,1 (-tBu) [M+H]+
94.4. трет-Бутиловый эфир (2R,4S)-2-метил-4-фенилпирролидин-1-карбоновой кислоты
3,4 г трет-бутилового эфира (2S,4S)-2-метансульфонилоксиметил-4-фенилпирролидин-1-карбоновой кислоты (9,56 ммоль) растворяют в 50 мл тетрагидрофурана. После добавления 15,1 мл литийдиметиламиноборгидрида (14,34 ммоль; 1 M в тетрагидрофуране) добавляют 1,93 мл триэтилборана (1M в тетрагидрофуране) и реакционную смесь перемешивают при температуре кипения с обратным холодильником в течение 20 минут. Стандартная обработка дает 2,7 г сырого продукта, который очищают с помощью хроматографии на силикагеле, используя ISCO Companion прибор, получая на выходе 1,69 г очищенного продукта.
ESI-MC: 206,1 (-tBu) [M+H]+
1H-ЯМР (ДМСО-d6, 400 МГц): δ [ч./млн] 7,2-7,35 (м, 5H), 3,9-4,0 (м, 1H), 3,7 (м, 1H), 3,5 (м, 1H), 3,15 (м, 1H), 2,3 (д, 3H), 2,15 (м, 1H), 1,9 (м, 1H), 1,4 (с, 9H).
94.5. (2R,4S)-2-Метил-4-фенилпирролидин
1,68 г трет-Бутилового эфира (2R,4S)-2-метил-4-фенилпирролидин-1-карбоновой кислоты (6,42 ммоль) растворяют в 40 мл дихлорметана и добавляют по каплям 19,2 мл (38,56 ммоль) 2 N HCl в диэтиловом эфире. После перемешивания при комнатной температуре в течение 16 часов, растворители упаривают, остаток растворяют в воде, значение pH доводят до pH 9 с помощью водного раствора гидроксида натрия и водную фазу экстрагируют трижды этилацетатом. Органические фазы комбинируют, сушат над сульфатом магния, фильтруют и упаривают досуха при пониженном давлении, чтобы получить на выходе 1,05 г продукта.
ESI-MC: 162,2 [M+H]+
94.6. (2R,4S)-2-метил-4-фенил-1-пропилпирролидин
1,05 г (2R,4S)-2-Метил-4-фенилпирролидина (6,51 ммоль) растворяют в 30 мл дихлорметана, 0,58 г уксусной кислоты, 0,56 г пропионового альдегида (9,76 ммоль) и медленно добавляют порциями 2,07 г триацетоксиборгидрида натрия (9,76 ммоль). После перемешивания при комнатной температуре в течение 90 минут растворитель упаривают, добавляют воду и значение pH доводят до 6. Водную фазу экстрагируют трижды этилацетатом, органические фазы комбинируют, сушат над сульфатом магния, фильтруют и упаривают досуха при пониженном давлении, чтобы получить на выходе 1,48 г продукта.
ESI-MC: 204,1 [M+H]+
Нитрование с последующим восстановлением нитрогруппы с помощью дихлорида олова и связывания анилина с 3-трифторметилфенилсульфонилхлоридом выполняют, как уже описано для соединений по другим примерам, чтобы получить на выходе 0,088 г гидрохлорида N-[4-((3S,5R)-5-метил-1-пропилпирролидин-3-ил)фенил]-3-трифторметилбензолсульфонамида.
ESI-MC: 427,1 [M+H]+
1H-ЯМР (ДМСО-d6, 400 МГц): δ [ч./млн] 10,65 (ушир., 1H), 10,5 (1H), 7,95-8,1 (м, 3H), 7,8 (т, 1H), 7,25 (д, 2Н), 7,15 (д, 2Н), 3,8 (м, 1H), 3,65 (м, 1H), 3,5 (м, 1H), 3,25 (м, 1H), 3,0 (м, 1H), 2,95 (м, 1H), 2,2 (м, 1H), 2,1 (м, 1H), 1,7 (м, 2Н), 1,4 (д, 3H), 0,9 (т, 3H).
Пример 95
N-[4-(транс-4-Фторметил-1-пропилпирролидин-3-ил)фенил]-3-трифторметилбензолсульфонамид
Продукт получают через следующие промежуточные соединения:

95.1. трет-Бутиловый эфир транс-3-фторметил-4-фенилпирролидин-1-карбоновой кислоты
1,5 г трет-бутилового эфира транс-3-гидроксиметил-4-фенилпирролидин-1-карбоновой кислоты (5,41 ммоль) растворяют в 20 мл дихлорметана и добавляют 1,31 г диэтиламиносульфуртрифторида (DAST, 8,1 ммоль) в 2 мл дихлорметана при температуре 0°C. Реакционную смесь перемешивают в течение 72 часов при комнатной температуре, затем добавляют дихлорметан и воду, органическую фазу отделяют, сушат над сульфатом магния, фильтруют и упаривают досуха, чтобы получить на выходе 1,7 г масла светло-желтоватого цвета. Сырой продукт очищают с помощью хроматографии на силикагеле, используя смесь н-гептан/этилацетат (6:4) в виде элюента, чтобы получить на выходе 1,08 г продукта.
ESI-MC: 224,1 (-Boc) [M+H]+
1H-ЯМР (CDCl3, 400 МГц): δ [ч./млн] 7,2-7,4 (м, 5H), 4,45 (м, 0,5H), 4,35 (м, 1H), 4,25 (м, 0,5H), 3,9 (м, 1H), 3,8 (м, 1H), 3,3-3,5 (м, 2Н), 3,2 (м, 1H), 2,5-2,7 (м, 1H), 1,45 (с, 9H).
95.2 транс-3-Фторметил-4-фенилпирролидин
ESI-MC: 180,1 [M+H]+
95.3 транс-3-Фторметил-4-фенил-1-пропилпирролидин
ESI-MC: 222,1 [M+H]+
95.4 транс-3-Фторметил-4-(4-нитрофенил)-1-пропилпирролидин
ESI-MC: 267,1 [M+H]+
95.5 транс-3-Фторметил-4-(4-аминофенил)-1-пропилпирролидин
ESI-MC: 237,1 [M+H]+
Связывание транс-3-фторметил-4-(4-аминофенил)-1-пропилпирролидина с 3-трифторметилфенилсульфонилхлоридом, используя способы, ранее описанные для других примеров, дает на выходе 0,155 г N-[4-(транс-4-фторметил-1-пропилпирролидин-3-ил)фенил]-3-трифторметилбензолсульфонамида.
ESI-MC: 445,1 [M+H]+
1H-ЯМР (ДМСО-d6, 400 МГц): δ [ч./млн] 10,6 (ушир., 1H), 8,0-8,1 (м, 2Н), 7,95 (с, 1H), 7,8 (т, 1H), 7,25 (д, 2Н), 7,05 (д, 2Н), 4,4 (м, 1H), 4,3 (м, 1H), 3,3 (м, 1H), 3,2 (м, 1H), 3,1 (м, 1H), 2,9 (м, 2Н), 2,75 (м, 2Н), 2,55 (м, 1H), 1,5-1,6 (м, 2Н), 0,9 (т, 3H).
Пример 96
Гидрохлорид 3-(5-метил-[1,3,4]оксадиазол-2-ил)-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамида
0,047 г желаемого продукта получают, следуя методике синтеза, аналогичной той, которая описана для получения 3-трифторметокси-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамида (пример 1), используя коммерчески доступный 3-(5-метил-[1,3,4]оксадиазол-2-ил)бензолсульфонилхлорид.
ESI-MC: 427,0 [M+H]+
1H-ЯМР (CDCl3, 400 МГц): δ [ч./млн] 8,4 (с, 1H), 8,2 (д, 1H), 7,9 (д, 1H), 7,55 (т, 1H), 7,15 (д, 2Н), 7,0 (д, 2Н), 3,35 (м, 1H), 3,1 (м, 1H), 2,9 (м, 1H), 2,8 (м, 1H), 2,6 (с, 3H), 2,55 (м, 3H), 2,3 (м, 1H), 1,85 (м, 1H), 1,6 (м, 2Н), 0,95 (т, 3H).
Пример 97
3-Фтор-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамид трифторацетат
0,0065 г желаемого продукта получают, следуя методике синтеза, аналогичной той, которая описана для получения 3-трифторметокси-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамида (пример 1), используя коммерчески доступный 3-фторбензолсульфонилхлорид.
ESI-MC: 363,1 [M+H]+
Пример 98
3-Хлор-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамид
0,118 г желаемого продукта получают, следуя методике синтеза, аналогичной той, которая описана для получения 3-трифторметокси-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамида, используя коммерчески доступный 3-хлорбензолсульфонилхлорид.
ESI-MC: 379,1 [M+H]+
1H-ЯМР (CDCl3, 400 МГц): δ [ч./млн] 7,75 (с, 1H), 7,6 (д, 1H), 7,5 (д, 1H), 7,35 (т, 1H), 7,15 (д, 2Н), 7,0 (д, 2Н), 3,3 (м, 1H), 3,0 (м, 1H), 2,8 (м, 1H), 2,7 (м, 1H), 2,4-2,55 (м, 3H), 2,3 (м, 1H), 1,8 (м, 1H), 1,55 (м, 2Н), 0,95 (т, 3H).
Пример 99
3-(2-Метилтиазол-4-ил)-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамид
0,113 г желаемого продукта получают, следуя методике синтеза, аналогичной той, которая описана для получения 3-трифторметокси-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамида (пример 1), используя коммерчески доступный 3-(2-метилтиазол-4-ил)бензолсульфонилхлорид.
ESI-MC: 442,0 [M+H]+
1H-ЯМР (CDCl3, 400 МГц): δ [ч./млн] 8,4 (с, 1H), 8,05 (д, 1H), 7,7 (д, 1H), 7,4 (м, 2Н), 7,15 (д, 2Н), 7,05 (д, 2Н), 3,55 (м, 2Н), 3,2-3,5 (ушир.м, 2Н), 2,9-3,0 (м, 3H), 2,7 (с, 3H), 2,35 (м, 1H), 2,0-2,1 (м, 1H), 1,75-1,9 (м, 2Н), 0,95 (т, 3H).
Пример 100
N-[4-((S)-1-Аллилпирролидин-3-ил)фенил]-3-трифторметилбензолсульфонамид
0,01 г желаемого продукта получают, следуя методике синтеза, аналогичной той, которая описана для получения 3-трифторметокси-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамида (пример 1), используя коммерчески доступный 3-трифторметилбензолсульфонилхлорид.
ESI-MC: 411,1 [M+H]+
1H-ЯМР (CDCl3, 400 МГц): δ [ч./млн] 7,95 (с, 1H), 7,9 (д, 1H), 7,8 (д, 1H), 7,6 (т, 1H), 7,15 (д, 2Н), 6,95 (д, 2Н), 5,9 (м, 1H), 5,2 (д, 1H), 5,1 (д, 1H), 3,3 (м, 1H), 3,1-3,2 (м, 2Н), 3,0 (м, 1H), 2,8 (м, 1H), 2,65 (м, 1H), 2,45 (м, 1H), 2,3 (м, 1H), 1,8 (м, 1H).
Пример 101
N-((S)-4-Пирролидин-3-илфенил)-3-трифторметилбензолсульфонамид
0,071 г трис-(дибензилиденацетон)дипалладия(0) (0,08 ммоль) и 0,033 г 1,3-бис-(дифенилфосфино)бутана (0,08 ммоль) растворяют в 20 мл тетрагидрофурана и перемешивают в течение 30 минут. К полученному раствору добавляют 0,32 г N-[4-((S)-1-аллилпирролидин-3-ил)фенил]-3-трифторметилбензолсульфонамида (0,78 ммоль), растворенного в 5 мл тетрагидрофурана, а затем 0,129 г 2-меркаптобензойной кислоты (0,84 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 72 часов, растворитель упаривают и добавляют дихлорметан и 1 N водный раствор соляной кислоты. Значение рН водной фазы доводят до основного, экстрагируют дихлорметаном и комбинированные органические слои промывают водным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют и упаривают досуха при пониженном давлении. Сырой продукт очищают с помощью хроматографии на силикагеле, используя ISCO Companion прибор, чтобы получить на выходе 0,01 г продукта.
ESI-MC: 371,1 [M+H]+
1H-ЯМР (ДМСО-d6, 400 МГц): δ [ч./млн] 8,0 (д, 1H), 7,95 (с, 1H), 7,8 (д, 1H), 7,7 (т, 1H), 6,95 (д, 2Н), 6,85 (д, 2Н), 3,3 (м, 1H), 3,05-3,2 (м, 2Н), 3,0 (м, 1H), 2,7 (м, 1H), 2,1 (м, 1H), 1,7 (м, 1H).
Пример 102
4-Фтор-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]-3-трифторметилбензолсульфонамид
0,253 г желаемого продукта получают, следуя методике синтеза, аналогичной той, которая описана для получения 3-трифторметокси-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамида (пример 1), используя коммерчески доступный 3-трифторметил-4-фторбензолсульфонилхлорид.
ESI-MC: 431,2 [M+H]+
1H-ЯМР (ДМСО-d6, 400 МГц): δ [ч./млн] 10,5 (ушир., 1H), 8,1 (м, 1H), 8,05 (д, 1H), 7,75 (т, 1H), 7,25 (д, 2Н), 7,05 (д, 2Н), 3,2-3,6 (м, 5H), 3,0 (м, 2Н), 2,3 (м, 1H), 1,9 (м, 1H), 1,65 (м, 2Н), 0,9 (т, 3H).
Пример 103
Гидрохлорид 3-фтор-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]-5-трифторметилбензолсульфонамида
0,080 г желаемого продукта получают, следуя методике синтеза, аналогичной той, которая описана для получения 3-трифторметокси-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамида (пример 1), используя коммерчески доступный 3-фтор-5-трифторметилбензолсульфонилхлорид.
ESI-MC: 431,4 [M+H]+
1H-ЯМР (ДМСО-d6, 400 МГц): δ [ч./млн] 10,55 (ушир.), 8,1 (д, 1H), 7,9 (д, 1H), 7,8 (с, 1H), 7,3 (д, 2Н), 7,1 (д, 2Н), 3,2-3,6 (м, 5H), 3,1 (м, 2Н), 2,3 (м, 1H), 1,95 (м, 1H), 1,7 (м, 2Н), 0,9 (т, 3H).
Пример 104
2-Фтор-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]-5-трифторметилбензолсульфонамид
0,103 г желаемого продукта получают, следуя методике синтеза, аналогичной той, которая описана для получения 3-трифторметокси-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамида (пример 1), используя коммерчески доступный 2-фтор-5-трифторметилбензолсульфонилхлорид.
ESI-MC: 431,1 [M+H]+
1H-ЯМР (ДМСО-d6, 400 МГц): δ [ч./млн] 10,7 (очень широкий, 1H), 8,1 (м, 1H), 8,05 (д, 1H), 7,7 (т, 1H), 7,25 (д, 2Н), 7,05 (д, 2Н), 3,1-3,6 (м, 5H), 2,9-3,0 (м, 2Н), 2,3 (м, 1H), 1,85 (м, 1H), 1,6 (м, 2Н), 0,9 (т, 3H).
Пример 105
3-Морфолин-4-ил-N-[4-((S)-1-пропилпирролидин-3-ил)фенил]бензолсульфонамид
0,033 г желаемого продукта получают, следуя методике синтеза, аналогичной той, которая описана для получения N-[4-((S)-1-пропилпирролидин-3-ил)фенил]-3-пирролидин-1-илбензолсульфонамида (пример 71), используя морфолин в качестве амина.
ESI-MC: 430,5 [M+H]+
1H-ЯМР (CDCl3, 400 МГц): δ [ч./млн] 7,2-7,35 (м, 2Н), 7,1-7,2 (м, 3H), 6,95-7,05 (м, 3H), 3,8 (т, 4H), 3,3 (м, 1H), 3,1 (т, 4H), 3,05 (м, 1H), 2,85 (м, 1H), 2,7 (м, 1H), 2,4-2,6 (м, 3H), 2,3 (м, 1H), 1,8 (м, 1H), 1,55 (м, 2Н), 0,95 (т, 3H).
Пример 106
Гидрохлорид N-[4-(цис-2-метил-1-пропилпирролидин-3-ил)фенил]-3-трифторметилбензолсульфонамида
0,015 г продукта получают, как описано для синтеза N-[4-((3S,5R)-5-метил-1-пропилпирролидин-3-ил)фенил]-3-трифторметилбензолсульфонамида (пример 94) из коммерчески доступной Boc-цис-3-фенилпирролидин-2-карбоновой кислоты:
106.1. 1-трет-Бутиловый эфир 2-метиловый эфир цис-3-фенилпирролидин-1,2-дикарбоновой кислоты
ESI-MC: 206,1 (-Boc), 250,1 (-tBu) [M+H]+
106.2. трет-Бутиловый эфир цис-2-гидроксиметил-3-фенилпирролидин-1-карбоновой кислоты
ESI-MC: 222,1 (-tBu) [M+H]+
106.3. трет-Бутиловый эфир цис-2-метансульфонилоксиметил-3-фенилпирролидин-1-карбоновой кислоты
ESI-MC: 256,2 (-Boc), 299,9 (-tBu) [M+H]+
106.4. трет-Бутиловый эфир цис-2-метил-3-фенилпирролидин-1-карбоновой кислоты
ESI-MC: 206,1 (-tBu) [M+H]+
106.5. цис-2-Метил-3-фенилпирролидин
ESI-MC: 162,1 [M+H]+
106.6. цис-2-Метил-3-фенил-1-пропилпирролидин
ESI-MC: 204,1 [M+H]+
106.7. цис-2-Метил-3-(4-нитро)фенил-1-пропилпирролидин
ESI-MC: 249,1 [M+H]+
106.8. цис-2-Метил-3-(4-амино)фенил-1-пропилпирролидин
ESI-MC: 219,1 [M+H]+
Связывание анилина с 3-трифторметилфенилсульфонилхлоридом выполняют, как уже описано для соединений по другим примерам, чтобы получить на выходе 0,015 г конечного продукта.
ESI-MC: 427,1 [M+H]+
1H-ЯМР (ДМСО-d6, 400 МГц): δ [ч./млн] 10,3 (очень шир.), 8,0 (д, 1H), 7,95 (д, 1H), 7,85 (с, 1H), 7,75 (т, 1H), 7,15 (д, 2Н), 7,0 (д, 2Н), 3,8 (м, 1H), 3,65 (м, 1H), 3,3-3,6 (м, 2Н), 3,1 (м, 1H), 2,9 (м, 1H), 2,2 (м, 2Н), 1,65 (м, 2Н), 0,85 (т, 3H), 0,7 (д, 3H).
Пример 107
Гидрохлорид N-[4-((3S,5S)-5-метил-1-пропилпирролидин-3-ил)фенил]-3-трифторметилбензолсульфонамида
0,053 г продукта получают, как описано для синтеза N-[4-((3S,5R)-5-метил-1-пропилпирролидин-3-ил)фенил]-3-трифторметилбензолсульфонамида (пример 94) из коммерчески доступной (2R,4S)-Boc-4-фенилпирролидин-2-карбоновой кислоты:
107.1. 1-трет-Бутиловый эфир 2-метиловый эфир (2R,4S)-4-фенилпирролидин-1,2-дикарбоновой кислоты
ESI-MC: 206,0 (-Boc), 250,0 (-tBu) [M+H]+
107.2. трет-Бутиловый эфир (2R,4S)-2-гидроксиметил-4-фенилпирролидин-1-карбоновой кислоты
ESI-MC: 222,1 (-tBu) [M+H]+
107.3. трет-Бутиловый эфир (2R,4S)-2-метансульфонилоксиметил-4-фенилпирролидин-1-карбоновой кислоты
ESI-MC: 256,1 (-Boc), 300,1 (-tBu) [M+H]+
107.4. трет-Бутиловый эфир (2S,4S)-2-метил-4-фенилпирролидин-1-карбоновой кислоты
ESI-MC: 206,1 (-tBu) [M+H]+
107.5. (2S,4S)-2-Метил-4-фенилпирролидин
ESI-MC: 162,1 [M+H]+
107.6. (2R,4S)-2-Метил-4-фенил-1-пропилпирролидин
ESI-MC: 204,1 [M+H]+
107.7. (2S,4S)-2-Метил-4-(4-нитро)фенил-1-пропилпирролидин
ESI-MC: 249,1 [M+H]+
107.8. (2S,4S)-Метил-4-(4-амино)фенил-1-пропилпирролидин
ESI-MC: 219,1 [M+H]+
Связывание анилина с 3-трифторметилфенилсульфонилхлоридом выполняют, как уже описано для соединений по другим примерам, чтобы получить на выходе 0,053 г конечного продукта.
ESI-MC: 427,1 [M+H]+
1H-ЯМР (ДМСО-d6, 400 МГц): δ [ч./млн] 10,6 (очень шир.), 8,05 (м, 1H), 8,0 (м, 2Н), 7,8 (м, 1H), 7,3 (м, 2Н), 7,05 (м, 2Н), 3,3-3,6 (м, 4H), 3,2 (ушир., 1H), 2,9 (ушир., 1H), 2,4 (ушир., 1H), 1,75 (ушир., 2Н), 1,65 (ушир., 1H), 1,4 (ушир., 3H), 0,9 (ушир., 3H).
III. Примеры галеновых лекарственных форм
A) Таблетки
Таблетки нижеприведенного состава прессуют с помощью таблеточного пресса по традиционной методике:
40 мг вещества из примера 8
120 мг кукурузного крахмала
13,5 мг желатина
45 мг лактозы
2,25 мг Aerosil® (химически чистая кремниевая кислота в субмикроскопически мелкодисперсном виде)
6,75 мг картофельного крахмала (в виде 6% пасты)
B) Покрытые сахаром таблетки
20 мг вещества из примера 8
60 мг ядро композиции
70 мг осахаривающей композиции
Ядро композиции состоит из 9 частей кукурузного крахмала, 3 частей лактозы и 1 части 60:40 винилпирролидон/винилацетат сополимера. Осахаривающая композиция состоит из 5 частей тростникового сахара, 2 частей кукурузного крахмала, 2 частей карбоната кальция и 1 части талька. Покрытые сахаром таблетки, которые были приготовлены этим способом, затем покрывают устойчивой к желудочному соку оболочкой.
IV. Биологические исследования
Исследования связывания рецептора
Тестируемое вещество было растворено в метанол/Chremophor® (BASF-AG) или в диметилсульфоксиде и затем разбавлено водой до желаемой концентрации.
Человеческий 5HT6 рецептор
Характеристика соединений настоящего изобретения по отношению к человеческому 5-HT6 рецептору в исследовании связывания и функциональном исследовании аденилилциклазы.
Соединения доводят в растворе до концентрации 10-2 M или 10-3 M в ДМСО. Дальнейшие разбавления были проведены в буфере инкубации.
Исследования связывания
Методика исследования связывания основана на способе Monsma et al. (1993) Mol. Pharmacol. 43: 320-327. Реакцию связывания проводили в общем объеме 0,250 мл в течение 60 мин при 37°C. Мембраны из клеток HEK-293, стабильно экспрессирующие человеческие 5-HT6 рецепторы, инкубируют 2 нМ3H-LSD в присутствии или в отсутствие различных концентраций тестируемого соединения в течение 60 мин при 37°C. Неспецифическое связывание определяют с помощью 100 мкМ серотонина (5-HT). Исследования проводят дважды. Связанный и свободный радиолиганд отделяют фильтрацией и связанную радиоактивность определяют с помощью сцинтилляционного счетчика.
Оценка
Специфическое связывание лиганда с рецепторами было определено как разница между общим связыванием и неспецифическим связыванием, определенным в присутствии избытка немеченого 5-HT. Результаты выражают в виде процента контрольного специфического связывания, полученного в присутствии соединения. Значения IC50(концентрация, вызывающая половину от максимального ингибирования контрольного специфического связывания) и коэффициенты Хилла (nH) определяют с помощью нелинейного регрессионного анализа конкурирующих кривых с использованием уравнения Хилла апроксимации кривой.
Константы ингибирования (Ki) подсчитывают по уравнению Cheng Prusoff (Ki=IC50/(1+(L/KD)), где L = концентрация радиолиганда в исследовании, а KD = сродство радиолиганда к рецептору).
Функциональное исследование аденилилциклазы
Мембраны человеческих клеток линии Hela, стабильно экспрессирующих человеческие 5-HT6 рецепторы, инкубируют в течение 20 мин при 37°C в HBSS, 1 мМ MgCl2, 1 мМ CaCl2, 100 мМ IBMX, pH 7,4 в присутствии и в отсутствие тестируемых соединений. Для агонистического действия соединения инкубируют сами по себе. Для антагонистических эффектов ингибирование повышения цАМФ, вызванного 0,3 мкМ серотонина (5-HT), было определено.
Оценка: накопление цАМФ определяли с помощью количественного анализа EIA.
Допаминовый D3 рецептор
Исследуемая смесь (0,250 мл) состоит из мембран, полученных из ~106 клеток HEK-293, имевших стабильно экспрессированные человеческие допаминовые D3 рецепторы, 0,1 нМ [125I]-йодосульприда и инкубационного буфера (для общего связывания) или, кроме того, тестируемое вещество (кривая ингибирования) или 1 мкМ спиперона (неспецифическое связывание). Каждое исследование смеси проводят трижды.
Инкубационный буфер содержал 50 мМ трис, 120 мМ NaCl, 5 мМ KCl, 2 мМ CaCl2, 2 мМ MgCl2 и 0,1% бычьего сывороточного альбумина, 10 мкМ хинолона и 0,1% аскорбиновой кислоты (каждый день получаемой свежей). Буфер доводили до pH 7,4 добавлением HCl.
Допаминовый D2L рецептор
Смесь исследования (1 мл) состояла из мембран, полученных из ~106 клеток HEK-293, имеющих стабильно экспрессируемые человеческие допаминовые D2L рецепторы (длинная изоформа) и 0,01 нМ [125I]йодспиперона и инкубационного буфера (общее связывание) или, в дополнение, тестируемое вещество (кривая ингибирования) или 1 мкМ галогенперидол (неспецифическое связывание). Каждое исследование смеси проводят трижды.
Инкубационный буфер содержал 50 мМ трис, 120 мМ NaCl, 5 мМ KCl, 2 мМ CaCl2, 2 мМ MgCl2 и 0,1% бычьего сывороточного альбумина. Буфер доводили до pH 7,4 добавлением HCl.
Измерения и анализ
После инкубирования при 25°C в течение 60 минут смеси, которые исследуют, фильтровали через стекловолоконный фильтр Whatman GF/B в условиях вакуума с помощью клеточного комбайна. Фильтры переносили во флаконы сцинтилляции с помощью системы переноса фильтров. После добавления 4 мл Ultima Gold® (Packard) образцы встряхивали в течение 1 часа и затем измеряли радиоактивность в счетчике Beta-Counter (Packard, Tricarb 2000 или 2200CA). Значения cpm затем преобразовывали в dpm, используя стандартные ряды для пересчета и программу, поставляемую с прибором.
Кривые ингибирования анализировали с помощью повторного нелинейного регрессионного анализа с использованием Statistical Analysis System (SAS), схожей с программой “LIGAND”, описанной Munson и Rodbard.
Результаты исследований связывания рецептора выражали в виде констант связывания рецептора Ki(5HT6), Ki(D3) и Ki(D2), соответственно, как это описано ранее и приведено в таблице 6.
В этих тестах соединения по изобретению демонстрируют очень хорошее сродство к 5HT6рецептору (<50 нМ, или <10 нМ, часто <5 нМ). Некоторые из этих соединений, в частности, имеющие как 1,4-фенилен, как группу А, также демонстрируют очень хорошее сродство к D3 рецептору (<50 нМ, или <10 нМ, часто <5 нМ) и связываются избирательно с D3 рецептором, по сравнению со сродством к D2 рецептору.
Результаты тестов связывания приведены в таблице 6.
Пояснение
Исследование тестирования совместимости лигандов допаминовых D3 и 5HT6 рецепторов
Микродиализные исследования
Усиление холинергической функции, по широко распространенному мнению, улучшает когнитивные функции, увеличение коркового содержания внеклеточного ацетилхолина (ACh) может рассматриваться как биохимический маркер потенциальных прокогнитивных эффектов.
Таким образом, были произведены микродиализные исследования у свободно перемещающихся крыс. Были изучены эффекты лигандов 5-HT6 рецепторов, селективных D3лигандов или их комбинации на высвобождение ацетилхолина в медиальной предлобной коре и в гиппокампе: одна направляющая канюля была имплантирована в медиальную предлобную кору (AP=2,5; ML=0,6; DV=-0,2), вторая - в гиппокамп (AP=-5,5; ML=4,5; DV=-4,5). Через 5-7 дней после операции 2 микродиализных зонда (CMA/12, длина мембраны 3 мм) были медленно опущены до конечного положения. В день эксперимента тестируемое соединение или его носитель (2 мл/кг) вводили интраперитонеально. Микродиализатные фракции (шесть 20-минутных фракций перед и шесть фракций после введения соединения) были проанализированы на наличие ацетилхолина с помощью высокоэффективной жидкостной хроматографии в комбинации с электрохимическим определением (описание методов см. в Fox et al., J. Phamacol. Exp. Ther. 2005, 313, 176-190 и детальное описание ниже).
Лиганды 5-HT6 рецепторов и селективные лиганды D3 рецепторов увеличивали дозозависимым образом внеклеточные уровни ACh в медиальной предлобной коре и в гиппокампе. Комбинирование лигандов 5-HT6 рецепторов и лигандов D3рецепторов приводило, по меньшей мере, к аддитивному эффекту обоих вышеперечисленных агентов в медиальной предлобной коре и в гиппокампе, предполагая, что их комбинация может обеспечить терапевтическую пользу при расстройствах ЦНС, которые характеризуются нарушением когнитивных функций, включая деменцию и шизофрению.
Более того, лиганды смешанных D3/5-HT6 рецепторов также увеличивают микродиализатные уровни ACh в медиальной предлобной коре и в гиппокампе. Основываясь на сравнении доз, соединения, комбинирующие D3/5-HT6 внутри молекулы, являются более мощными в увеличении корковой холинергической функции по сравнению с «чистыми» антагонистами D3 рецепторов.
Микродиализные эксперименты
Операция
Для профилактики боли перед операцией вводили Rimadyl® (3 мг/кг, интраперитонеально). Самцов крысы линии Sprague-Dawley (массой 290-320 г) обезболивали пентобарбиталом (60 мг/кг, интраперитонеально, Narcoren®, Rhone-Merieux GmbH, France) и помещали в стереотаксическую рамку KOPF и имплантировали две микродиализные направляющие канюли (CMA/12, Axel Semrau GmbH, Germany) в выбранные области головного мозга того же животного: одну направляющую канюлю имплантировали в медиальную предлобную кору (AP=2,5; ML=0,6; DV=-0,2), а вторую - в гиппокамп (AP=-5,5; ML=4,5; DV=-4.5). Направляющую канюлю прикрепляли зубным цементом (Technovit powder, Product №5071, Technovit polymerization starter fluid, Product №2060, Kulzer GmbH, Germany) и 4 якорными шурупами к черепу. Крысам давали восстановиться после операции в течение 5-7 дней. За день до эксперимента каждое животное переносили в систему, допускающую свободное перемещение (CMA/120 Axel Semrau GmbH, Germany, состоящее из пластикового резервуара, проволочного крепления, противовеса, вертлюжного соединения, соединяющего вход/выход зонда с перфузионным насосом). Затем микродиализный зонд CMA/12 (длина мембраны 3 мм) медленно опускали до конечного положения. Зонд перфузировали раствором Рингера (147 мМ NaCl, 4,0 мМ KCl и 2,4 мМ CaCl2, содержащим 1 мкМ неостигмина), в течение примерно одного часа (CMA/102 микродиализный насос, Axel Semrau GmbH, Germany; 1,5 мкл/мин). Зонд перфузировали снова через 24 часа, по меньшей мере, за 1 час до сбора каждые 20 минут микродиализатных фракций. Шесть фракций перед и шесть фракций после интраперитонеального введения тестируемого соединения или носителя были анализированы на уровни микродиализатного ацетилхолина посредством ВЭЖХ с электрохимическим определением.
Исследование уровней микродиализатного ацетилхолина
10 мкл каждой микродиализатной фракции инъецировали в колонку обратной фазы (MF-8908 Acetylcholine SepStik Kit; микроколонка, размер частиц 10 мкм, 530×1,0 мм, сопряженная с иммобилизованным ферментным реактором 50×1,0 мм, размер частиц 10 мкм, содержащий ацетилхолинэстеразу и холиноксидазу; BAS, U.S.A.) с помощью охлажденного автоматического пробоотборника (HTC PAL сдвоенная инжекторная пробоотборная система, Axel Semrau, Germany). Подвижная фаза состояла из 50 ммоль/л Na2HPO4 (pH 8,5) и 5 мл/л Kathon. Скорость потока была 0,14 мл/мин (Rheos Flux pump, Axel Semrau GmbH, Germany), и время обработки образца было менее 15 минут. Ацетилхолин и холин измеряли посредством электрохимического детектора (LC-4C, BAS, U.S.A.) с платиновым рабочим электродом, установленным на + 500 мВ по сравнению с Ag/AgCl эталонным электродом. Систему калибровали стандартными растворами (ацетилхолин, холин), содержащими 1 пмоль/10 мкл инъекции. Ацетилхолин идентифицировали по его периоду удержания и пиковой высоте с методом внешнего стандарта, используя программное обеспечение для хроматографии (Chrom Perfect®, version 4.4.22, Justice Laboratory Software, U.S.A.).
Данные микродиализа (область под кривой 0-120 мин) оценивали на достоверность с помощью однофакторного дисперсионного анализа (ANOVA), затем с помощью post hoc теста с двуточечным сравнением по Dunnett с использованием программы GraphPad Prism v 4.0.
Реферат
Изобретение относится к новым соединениям формулы (I) ! ! где n равно 0, 1, 2; G означает СН2, CHR3; R1 означает Н, C1-С6-алкил, С3-С6-алкенил, -CH2Ph; R2, R3, R4 независимо друг от друга означают Н, СН3, -CH2F, -CHF2, CF3; А означает 1,4-Ph, 1,3-Ph, который необязательно замещен 1-4 заместителями, выбранными из галогена, C1-С4-алкила, С1-С4-алкокси, фторированного С1-С4-алкила и фторированного С1-С4-алкокси; Е означает NR5, где R5 означает Н, C1-С3-алкил; Ar означает радикал формулы A, F и G ! ! где Ra означает галоген, C1-С6-алкил, фторированный C1-С6-алкил, C1-С6-алкокси, фторированный C1-С6-алкокси, фенилсульфонил, CN, -NR6R7, где R6 и R7 образуют вместе с атомом N 5- или 6-членное насыщенное кольцо, или представляет собой 5-членное насыщенное или ненасыщенное ароматическое или неароматическое гетероциклическое кольцо, включающее в качестве членов кольца 1, 2 или 3 гетероатома, выбранных из N, О и S, и где гетероциклическое кольцо может нести 1, 2 или 3 заместителя, выбранных из галогена и C1-С6-алкила, или представляет собой 6-членное насыщенное гетероциклическое кольцо, включающее в качестве кольцевых членов один N и один О; Rb и Rc независимо друг от друга означают Н, галоген, СН3, ОСН3, CH2F, OCH2F, CHF2, OCHF2, CF3, OCF3, CH2CH2F, OCH2CH2F, CH2CHF2, OCH2CHF2, CH2CF3 или OCH2CF3; Rd означает как Ra или означает 5- или 6-членное гетероароматическое кольцо, включающее в качестве членов кольца 1, 2 или 3 гетероатома, выбранных из N, О и S, и где гетероароматическое кольцо может нести 1 заместитель, выбранный из C1-С6-алкила и C1-С6-алкилтио; Re означает Н или определен как Ra; Rf определен как Ra; k равно 0, 1, 2, 3; j равно 0, 1, 2, 3, 4; при условии, что Ra не означает F, CH2F, CHF2, CF3, OCF3, если А означает 1,4-Ph, Ar означает радикал формулы (А) и Rb и Rc означают Н, галоген; за исключением
Формула
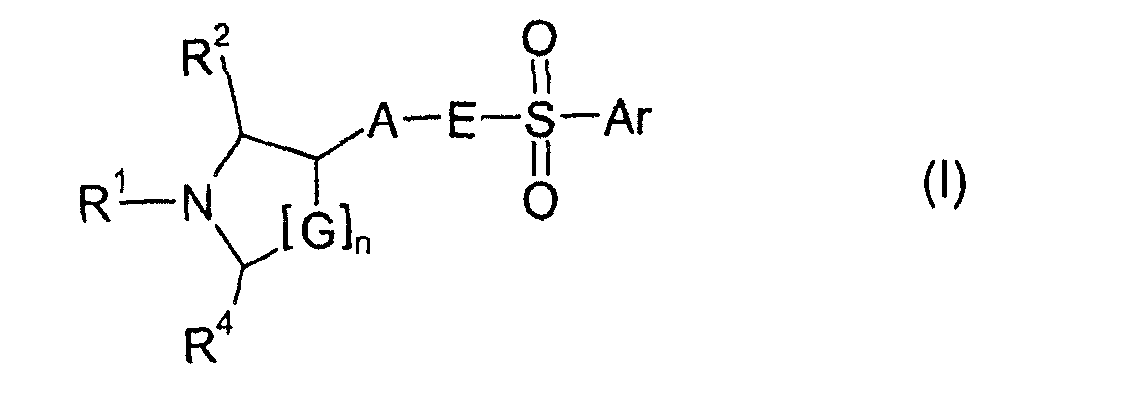
где
n имеет значение 0, 1 или 2;
G представляет собой СН2 или CHR3;
R1 представляет собой Н, C1-С6-алкил, C3-С6-алкенил или бензил;
R2, R3 и R4 независимо друг от друга представляют собой Н, метил, фторметил, дифторметил или трифторметил;
А представляет собой 1,4-фенилен или 1,3-фенилен, который необязательно замещен одним, двумя, тремя или четырьмя заместителями, выбранными из галогена, C1-С4-алкила, C1-С4-алкокси, фторированного C1-С4-алкила и фторированного C1-С4-алкокси;
Е представляет собой NR5, где R5 представляет собой Н или C1-С3-алкил;
Ar представляет собой радикал формулы A, F и G


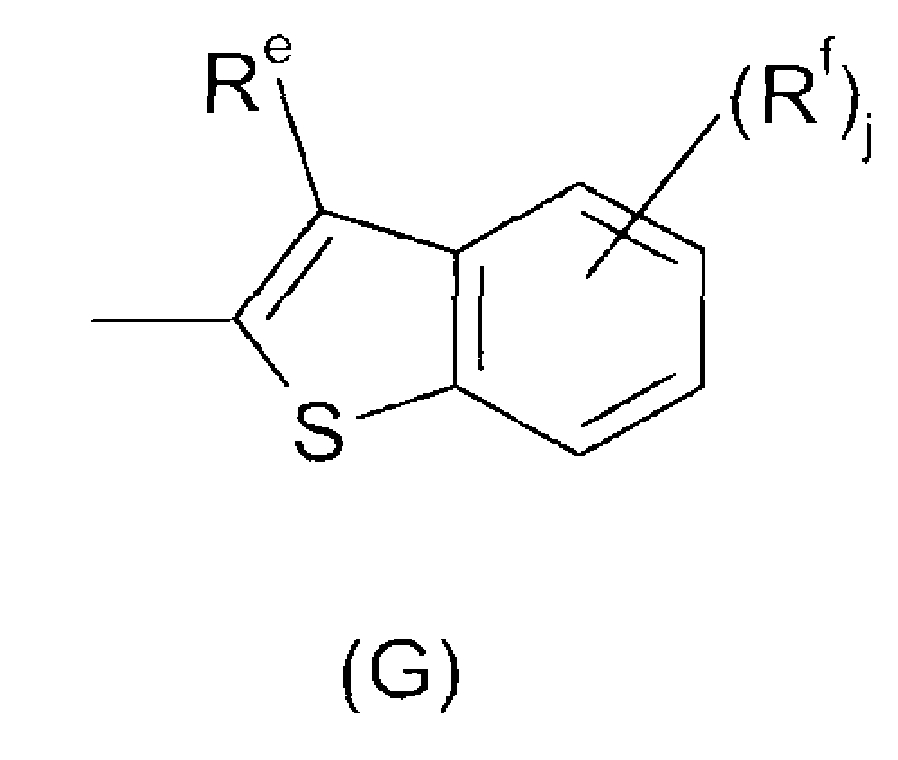
где
Ra представляет собой галоген, C1-С6-алкил, фторированный C1-С6-алкил, C1-С6-алкокси, фторированный C1-С6-алкокси, фенилсульфонил, CN, -NR6R7, где R6 и R7 образуют вместе с атомом N 5- или 6-членное насыщенное кольцо, или представляет собой 5-членное насыщенное или ненасыщенное ароматическое или неароматическое гетероциклическое кольцо, включающее в качестве членов кольца 1, 2 или 3 гетероатома, выбранных из N, О и S, и где гетероциклическое кольцо может нести 1, 2 или 3 заместителя, выбранных из галогена и C1-С6-алкила, или представляет собой 6-членное насыщенное гетероциклическое кольцо, включающее в качестве кольцевых членов один атом азота и один атом кислорода;
Rb и Rc независимо друг от друга представляют собой Н, галоген, СН3, ОСН3, CH2F, OCH2F, CHF2, OCHF2, CF3, OCF3, CH2CH2F, OCH2CH2F, CH2CHF2, OCH2CHF2, CH2CF3 или OCH2CF3;
Rd определен как Ra или представляет собой 5- или 6-членное гетероароматическое кольцо, включающее в качестве членов кольца 1, 2 или 3 гетероатома, выбранных из N, О и S, и где гетероароматическое кольцо может нести 1 заместитель, выбранный из C1-С6-алкила и C1-С6-алкилтио;
Re представляет собой Н или определен как Ra;
Rf определен как Ra;
k имеет значение 0, 1, 2 или 3; и
j имеет значение 0, 1, 2, 3 или 4;
при условии, что Ra не является F, CH2F, CHF2, CF3 или OCF3, если А представляет собой 1,4-фенилен, Ar представляет собой радикал формулы (А) и Rb и Rc представляют собой Н или галоген;
за исключением соединений, где R1 представляет собой пропил, G представляет собой СН2, n имеет значение 1, А представляет собой 1,4-фенилен, Е представляет собой NH, Ar представляет собой радикал формулы (F) и Rd представляет собой галоген, C1-С6-алкил, C2-С6-алкенил или 5-членное гетероароматическое кольцо;
и его физиологически приемлемые кислотно-аддитивные соли.
R1 представляет собой Н, C1-С6-алкил или C3-С6-алкенил;
Ar представляет собой радикал формулы А;
Ra представляет собой галоген, C1-С6-алкил, фторированный C1-С6-алкил, C1-С6-алкокси, фторированный C1-С6-алкокси, фенилсульфонил, CN, -NR6R7, где R6 и R7 образуют вместе с атомом N 5- или 6-членное насыщенное кольцо, или представляет собой насыщенное или ненасыщенное 5-членное гетероциклическое кольцо, включающее в качестве членов кольца 1, 2 или 3 гетероатома, выбранных из N, О и S, и где гетероциклическое кольцо может нести 1, 2 или 3 заместителя, выбранных из галогена и C1-С6-алкила, или представляет собой 6-членное насыщенное гетероциклическое кольцо, включающее в качестве кольцевого члена один атом азота и один атом кислорода; и
Rb и Rc независимо друг от друга представляют собой Н, галоген, СН3, ОСН3, CHF2, OCHF2, CF3 или OCF3;
при условии, что Ra не является F, CH2F, CHF2, CF3 или OCF3, если А представляет собой 1,4-фенилен и Rb и Rc представляют собой Н или галоген;
и их физиологически приемлемые кислотно-аддитивные соли.

где
Y представляет собой N, СН или CF,
где в случае, когда Y представляет собой СН или CF, Ra1 и Ra2 независимо друг от друга выбраны из C1-С2-алкила, фторированного C1-С2-алкила и C1-С2-алкокси, или один из радикалов Ra1 или Ra2 может также быть водородом или фтором или
где в случае, когда Y представляет собой N, Ra1 и Ra2 вместе образуют радикал (CH2)m, где 1 из атомов водорода может быть заменен C1-C2-алкилом, где один СН2 остаток может быть заменен О, и где m имеет значение 4 или 5.
Документы, цитированные в отчёте о поиске
Лечение поражения центральной нервной системы, вызванного вич, с помощью vx-478, изолированно либо в комбинации с azt или зтс

Комментарии