Гетероциклические производные и их применение - RU2734390C2
Код документа: RU2734390C2
Описание
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к новым гетероциклическим соединениям, их применению для профилактики или лечения заболеваний, связанных с активацией белков ПСАТ, в частности белка ПСАТ3, и фармацевтическим композициям, содержащим их.
УРОВЕНЬ ТЕХНИКИ
Белки переносчики сигнала и активаторы транскрипции (ПСАТ) представляют собой факторы транскрипции, которые передают сигналы из различных внеклеточных цитокинов и факторов роста в ядра. В настоящее время известно семь (7) подтипов белков ПСАТ (т.е. ПСАТ1, ПСАТ2, ПСАТ3, ПСАТ4, ПСАТ5a, ПСАТ5b и ПСАТ6), и в общем они состоят из около 750-850 аминокислот. Кроме того, каждый подтип белков ПСАТ содержит несколько консервативных доменов, которые играют важную роль в демонстрации функции белков ПСАТ. В частности, были описаны пять (5) доменов от N-конца до C-конца белков ПСАТ, включая спиральный-спиральный домен, ДНК-связывающий домен, линкерный домен, SH2 домен и трансактивирующий домен (ТАД)). Кроме того, рентгеновская кристаллическая структура ПСАТ1, ПСАТ3, ПСАТ4 и ПСАТ5 были описаны в 1998 (Becker S et al., Nature, 1998, 394; Vinkemeier U et al., Science, 1998, 279; Chen X et al., Cell, 1998, 93; D. Neculai et al., J. Biol. Chem., 2005, 280). В общем, рецепторы, с которыми связываются цитокины и факторы роста, подразделяются на класс I и класс II. ИЛ-2, ИЛ-3, ИЛ-5, ИЛ-6, ИЛ-12, Г-КСФ, ГМ-КСФ, ФИЛ, тромбопоэтин и т.д. связываются с рецепторами I класса, а ИФН-α, ИФН-γ, ИЛ-10, и т.д. связываются с рецепторами класса II (Schindler C et al., Annu. Rev. Biochem., 1995, 64; Novick D et al., Cell, 1994, 77; Ho AS et al., Proc. Natl. Acad. Sci., 1993, 90). Среди них, рецепторы цитокина, вовлеченные в активацию белков ПСАТ, могут быть классифицированы в зависимости от структурных форм внеклеточных доменов на семейство gp-130, семейство ИЛ-2, семейство фактора роста, семейство интерферона и семейство рецептора тирозинкиназы. Семейство цитокинов интерлейкина-6 являются типовыми многофункциональными цитокинами, которые медиируют различные физиологические действия. Когда цитокин интерлейкин-6 связывается с рецептором ИЛ-6, который присутствует на поверхности мембраны клетки, он привлекает рецептор gp-130 с образованием комплекса рецептора ИЛ-6-gp-130. В то же время JAK киназы (JAK1, JAK2, JAK3 и Tyk2) в цитоплазме привлекаются в цитоплазматическую область gp130 для того, чтобы быть фосфорилированными и активированными. Следовательно, латентные цитоплазматические белки ПСАТ привлекаются к рецептору, фосфорилируются JAK киназами и активируются. Тирозин-705, расположенный рядом с SH2 доменом, расположенным на C-конце белков ПСАТ, фосфорилируется, и активированный тирозин-705 каждого мономера белка ПСАТ связывается с SH2 доменом или другим мономером в обратном порядке, тем самым образуя гомо- или гетеродимер. Димеры транслокализуются в ядре и связываются со специфическим промотором связывания ДНК для того, чтобы способствовать транскрипции. В процессе транскрипции образуются различные белки (Myc, Циклин D1/D2, Bcl-xL, Mcl, сурвивин, ФРЭС, ФИГ-1, иммунные супрессоры и т.д.), связанные с пролиферацией, выживанием, ангиогенезом и иммунной инвазией (Stark et al., Annu. Rev. Biochem., 1997, 67; Levy et al., Nat. Rev. Mol. Cell Biol., 2002, 3).
В частности известно, что белок ПСАТ3 играет важную роль в острой воспалительной реакции и пути трансдукции сигнала ИЛ-6 и ЭФР (Akira et al., Cell, 1994, 76; Zhong et al., Science, 1994, 264). Согласно недавнему клиническому отчету, белок ПСАТ3 постоянно активирован у пациентов с солидными опухолями, расположенными в предстательной железе, желудке, молочной железе, легком, поджелудочной железе, почках, матке, яичниках, голове и шее, и т.д., а также с хроническим лейкозом, множественной миеломой и т.д. Кроме того, было описано, что степень выживания группы пациентов с активированным ПСАТ3 намного ниже, чем в группе пациентов и инактивированным ПСАТ3 (Masuda et al., Cancer Res., 2002, 62; Benekli et al., Blood, 2002, 99; Yuichi et al., Int. J. Oncology, 2007, 30). В то же время ПСАТ3 идентифицирован как жизненно необходимый фактор для роста и сохранения стволовых клеток эмбрионов мышей в исследовании с применением модели мышей с нокаутированным ПСАТ3. Также исследование с применением модели тканеспецифических ПСАТ3-дефицитных мышей показало, что ПСАТ3 играет важную роль в росте, апоптозе и подвижности клеток в тканеспецифической форме (Akira et al., Oncogene 2000, 19). Более того, так как апоптоз, вызванный антисмысловым ПСАТ3, наблюдается в различных колониях раковых клеток, считается, что ПСАТ3 является многообещающей новой целью для противоракового лечения. ПСАТ3 также считается потенциальной целью при лечении пациентов с диабетом, заболеваниями, связанными с иммунитетом, гепатитом C, дегенерацией желтого пятна, заражением папилломавирусом человека, неходжкинской лимфомой, туберкулезом и т.д. В то же время идентифицированные недавно клетки Th17 были описаны во множестве недавних статей, относящихся к различным аутоиммунным заболеваниям (Jacek Tabarkiewicz et al., Arch. Immunol. Ther. Exp., 2015, 11). На основе этих докладов, контроль дифференциации и функционирования клеток Th17 считается хорошей целью для лечения связанных с ними заболеваний. В частности, так как ПСАТ3-зависимые трансдукции сигнала ИЛ-6 и ИЛ-23 известны как важные факторы в дифференциации клеток Th17 (Xuexian O. Yang et al., J. Biol. Chem., 2007, 282; Harris T J et al., J. Immunol., 2007, 179), ингибирование функции ПСАТ3 предположительно является эффективным для лечения заболеваний, связанных с клетками Th17, таких как системная красная волчанка, увеит, ревматоидный артрит, аутоиммунное заболевание щитовидной железы, воспаление толстого кишечника, псориаз и псориазный артрит (Jacek Tabarkiewicz et al., Arch. Immunol. Ther. Exp., 2015, 11).
Недавно ИЛ-6 и ИЛ-23 антитела проходили клинические исследования при лечении артрита и псориаза, связанных с клетками Th17 и показали клиническую эффективность (Nishimoto N. et al., Arthritis Rheum., 2004, 50; Gerald G. et al., N. Engl. J. Med., 2007, 356). Также подтверждается, что ингибирование трансдукции сигнала ПСАТ3 является эффективным терапевтическим способом для таких заболеваний.
Наоборот, имея внутриклеточные ответные пути идентичных цитокинов и факторов роста такие же, как для ПСАТ3, ПСАТ1 повышает воспаление и врожденный и приобретенный иммунитет для того, чтобы ингибировать пролиферацию раковых клеток или вызывать апоптозные реакции, в отличие от ПСАТ3 (Valeria Poli et al., Review,Landes Bioscience, 2009).
Для разработки ингибиторов ПСАТ3 рассматривают следующие способы: i) ингибирование фосфорилирования белка ПСАТ3 ИЛ-6/gp-130/JAK киназой, ii) ингибирование димеризации активированных белков ПСАТ3, и iii) ингибирование связывания димера ПСАТ3 с ДНК ядра. Низкомолекулярные ингибиторы ПСАТ3 в настоящее время разрабатываются. В частности, OPB-31121 и OPB-51602 проходят клинические исследования на пациентах с солидными опухолями или раками крови в Otsuka Pharmaceutical Co., Ltd. Кроме того, S3I-201 (Siddiquee et al., Proc. Natl. Acad. Sci., 2007, 104), S3I-M2001 (Siddiquee et al., Chem. Biol., 2007, 2), LLL-12 (Lin et al., Neoplasia, 2010, 12), Статтик (Schust et al., Chem. Biol. 2006, 13), STA-21 (Song et al., Proc. Natl. Acad. Sci., 2005, 102), SF-1-066 (Zhang et al., Biochem. Pharm., 2010, 79) и STX-0119 (Matsuno et al., ACS Med. Chem. Lett., 2010, 1) и т.д. были описаны как эффективные в эксперименте с ингибированием роста раковых клеток и в животной модели (модель ксенотрансплантата in vivo). Более того, хотя изучали пептидные соединения, имитирующие последовательность аминокислот pY-705 (ПСАТ3), расположенную рядом с местом связывания с SH2 доменом последовательности аминокислот рецептора gp-130, с которым связываются JAK киназы (Coleman et al., J. Med. Chem., 2005, 48), развитие пептидных соединений не было успешным из-за проблем, таких как растворимость и проницаемость мембраны.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Следовательно, объектом данного изобретения является получение новых гетероциклических производных для ингибирования активации белка ПСАТ3.
Другим объектом данного изобретения является применение гетероциклических производных для профилактики или лечения заболеваний, связанных с активацией белка ПСАТ3.
В соответствии с одним аспектом данного изобретения, представлено соединение, выбранное из группы, включающей гетероциклическое производное, представленное формулой (I) и его фармацевтически приемлемая соль и его стереоизомер:
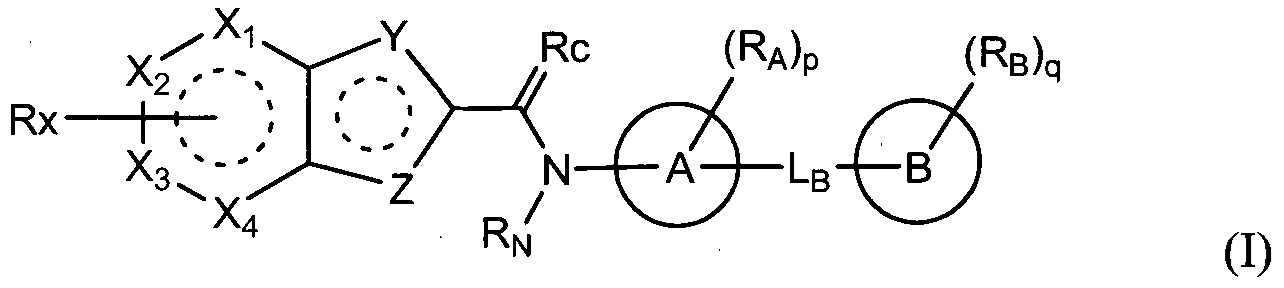
где
один из X1, X2, X3 и X4 является -C(-Rx)=, и каждый другой независимо является -C(-Rx')= или -N=;
один из Y и Z является -S- или -NH-, и другой является -CH= или -N=;
Rx является
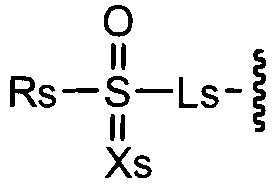
Xs является =O или =NH;
Ls является -C(-Rs')(-Rs'')- или -N(-Rs')-;
Rs является C1-6алкилом, галоC1-6алкилом, C1-6алкокси-C1-6алкилом, C1-6алкилкарбонил-C1-6алкилом, C2-7алкенилом, амино, аминоC1-6алкилом или 5-10-членным гетероциклилом, или Rs соединен с Rs' с образованием цепи;
Rs' и Rs'' каждый независимо является водородом, галогеном, C1-6алкилом, карбамоил-C1-6алкилом, C1-6алкиламино-C1-6алкилом или диC1-6алкиламино-C1-6алкилом, или Rs' и Rs'' соединены вместе с образованием цепи, или Rs' соединен с Rs с образованием цепи;
Rx' каждый независимо является водородом, галогеном, нитро, амино, C1-6алкокси, галоC1-6алкокси или C1-6алкилсульфонилом;
A и B каждый независимо является моноциклически или бициклически насыщенным или ненасыщенным C3-10карбоциклом или 5-12-членным гетероциклом;
Rc является =O, =NH, =N(-C1-6алкилом) или =N(-OH);
RN является водородом или C1-6алкилом, или RNсоединен с RA с образованием цепи;
LB является -[C(-RL)(-RL')]m-, -[C(-RL)(-RL')]n-O-, -O-, -NH-, -N(C1-6алкилом)-, -S(=O)2-, -C(=O)- или -C(=CH2)-, где m равно целому числу от 0 до 3, n равно целому числу от 1 до 3, RL и RL' каждый независимо является водородом, гидрокси, галогеном или C1-6алкилом, или RL и RL' соединены вместе с образованием цепи;
RA является водородом, галогеном, циано, C1-6алкилом, галоC1-6алкилом, цианоC1-6алкилом, C1-6алкилкарбонилом, C1-6алкокси, галоC1-6алкокси, цианоC1-6алкокси, C1-6алкиламино, диC1-6алкиламино, C1-6алкилтио, C1-6алкиламинокарбонилом, диC1-6алкиламинокарбонилом, C2-8алкинилом, C1-6алкоксикарбониламино-C1-6алкокси, аминоC1-6алкокси или 3-6-членным гетероциклилом, или RA соединен с RN с образованием цепи;
RB является водородом, галогеном, гидрокси, циано, нитро, амино, оксо, аминосульфонилом, сульфониламидо, C1-6алкиламино, C1-6алкилом, галоC1-6алкилом, цианоC1-6алкилом, C1-6алкокси, галоC1-6алкокси, цианоC1-6алкокси, C3-8циклоалкилокси, C2-8алкенилом, C2-8алкенилокси, C2-8алкинилом, C2-8алкинилокси, C1-6алкиламино-C1-6алкокси, диC1-6алкиламино-C1-6алкокси, C1-6алкоксикарбонилом, карбамоилом, карбамоил-C1-6алкокси, C1-6алкилтио, C1-6алкилсульфинилом, C1-6алкилсульфонилом, 5-10-членным гетероциклилом, 5-10-членным гетероциклил-C1-6алкилом, 5-10-членным гетероциклил-C1-6алкокси или 5-10-членным гетероциклилокси;
p равно целому числу от 0 до 4, и, если p равно 2 или больше, RA группы являются одинаковыми или отличаются друг от друга;
q равно целому числу от 0 до 4, и, если q равно 2 или больше, RB группы являются одинаковыми или отличаются друг от друга; и
каждая из указанных цепей независимо является насыщенной или ненасыщенной C2-10углеводородной цепью, не содержащей или содержащей, по крайней мере, одну гетерогруппу, выбранную из группы, включающей -O-, -NH-, -N=, -S-, -S(=O)- и -S(=O)2- в цепи, и не замещенной или замещенной, по крайней мере, одним заместителем, выбранным из группы, включающей галоген, C1-6алкил и C1-6алкокси; и
каждая из указанных гетероциклических и гетероциклильных групп независимо содержит, по крайней мере, одну гетерогруппы, выбранную из группы, включающей -O-, -NH-, -N=, -S-, -S(=O)- and -S(=O)2-.
В соответствии с другим аспектом данного изобретения, представлено применение соединения, выбранного из группы, включающей гетероциклическое производное, представленное формулой (I) выше, и его фармацевтически приемлемую соль или и его стереоизомер, для производства лекарственного средства для профилактики или лечения заболеваний, связанных с активацией белка ПСАТ3.
В соответствии с другим аспектом данного изобретения, представлена фармацевтическая композиция для профилактики или лечения заболеваний, связанных с активацией белка ПСАТ3, содержащая соединение, выбранное из группы, включающей гетероциклическое производное, представленное формулой (I) выше, и его фармацевтически приемлемую соль или и его стереоизомер в качестве активных ингредиентов.
В соответствии с еще одним аспектом данного изобретения, представлен способ профилактики или лечения заболеваний, связанных с активацией белка ПСАТ3 у млекопитающих, который включает введение соединения, выбранного из группы, включающей гетероциклическое производное, представленное формулой (I) выше, и его фармацевтически приемлемую соль или и его стереоизомер, млекопитающему.
Гетероциклическое производное, представленное формулой (I) выше, и его фармацевтически приемлемую соль или и его стереоизомер, обладают превосходным ингибирующим действием на активацию белка ПСАТ3, и поэтому может применяться для профилактики или лечения заболеваний, связанных с активацией белка ПСАТ3.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение может быть далее подробно описано ниже.
В описании данного изобретения, термин ʺгалогенʺ относится к фтору, хлору, брому или йоду, если не указано иначе.
Термин ʺалкилʺ относится к линейной или разветвленной углеводородной части, если не указано иначе.
Термины ʺгалоалкил", "галоалкокси", "галофенилʺ и т.д., соответственно относящиеся к алкилу, алкокси и фенилу, замещенному, по крайней мере, одним галогеном.
Термин ʺкарбоциклʺ относится к ароматическому или не ароматическому углеводородному кольцу, которое может быть насыщенным или ненасыщенным, и моноциклическому или полициклическому радикалу. Термин ʺкарбоциклилʺ относится к радикалу ʺкарбоциклʺ и применяется как термин, включающий ʺциклоалкилʺ и ʺарилʺ. Термин ʺциклоалкилʺ относится к насыщенному углеводородному радикалу, который может быть моноциклическим или полициклическим. Термин ʺарилʺ относится к ароматическому углеводородному кольцу, которое может быть моноциклическим или полициклическим.
Термины ʺкарбоцикл", "карбоциклил", "циклоалкилʺ и ʺарилʺ может относиться к, например, моноциклу или полициклу, содержащему от 3 до 20 атомов углерода, и обозначенному как ʺC3-20 карбоциклʺ, ʺC3-20 карбоциклилʺ, ʺC3-20 циклоалкилʺ и ʺC3-20 арилʺ, соответственно.
Термин ʺгетероциклʺ относится к ароматическому или не ароматическому кольцу, содержащему, по крайней мере, один гетероатом, который может быть насыщенным или ненасыщенным, и моноциклу или полициклу. Термин ʺгетероциклилʺ относится к радикалу ʺгетероциклʺ, который применяют как термин, включающий ʺгетероциклоалкилʺ и ʺгетероарилʺ. Термин ʺгетероциклоалкилʺ относится к насыщенному кольцевому радикалу, содержащему, по крайней мере, один гетероатом, который может быть моноциклическим или полициклическим. Термин ʺгетероарилʺ относится к ароматическому кольцевому радикалу, содержащему, по крайней мере, один гетероатом, который может быть моноциклическим или полициклическим.
Термин ʺгетероатомʺ может быть выбран из N, O и S.
Термины ʺгетероцикл", "гетероциклил", "гетероциклоалкилʺ и ʺгетероарилʺ могут относиться к, например, моно- или полициклу, содержащему от 3 до 20 гетероатомов и/или атомов углерода, и обозначенному как ʺ3-20-членный гетероциклʺ, ʺ3-20-членный гетероциклилʺ, ʺ3-20-членный гетероциклоалкилʺ и ʺ3-20-членный гетероарилʺ.
Термин ʺцепьʺ относится к насыщенной или ненасыщенной C2-10углеводородной цепи, не содержащей никакие гетероатомы в цепи, например, этилену, пропилену, бутилену и -CH2-CH=CH-; или насыщенной или ненасыщенной C2-10углеводородной цепи, содержащей, по крайней мере, одну гетерогруппу, выбранную из группы, включающей -O-, -NH-, -N=, -S-, -S(=O)- и -S(=O)2- в цепи, например, -CH2-O-CH2-, -CH2-O-CH2-O-CH2-, -CH2-CH=CH-NH- и -CH2-CH2-S(=O)2-CH2-O-, если не указано иначе. Цепь может быть замещена, по крайней мере, одним заместителем, выбранным из группы, включающей галоген, C1-6алкил и C1-6алкокси.
В соответствии с одним аспектом данного изобретения, представлено соединение, выбранное из группы, включающей гетероциклическое производное, представленное формулой (I), и его фармацевтически приемлемую соль и его стереоизомер:

где
один из X1, X2, X3 и X4 является -C(-Rx)=, и другие каждый независимо является -C(-Rx')= или -N=;
один из Y и Z является -S-или -NH-, и другой является -CH= или -N=;
Rx является

Xs является =O или =NH;
Ls является -C(-Rs')(-Rs'')- или -N(-Rs')-;
Rs является C1-6алкилом, галоC1-6алкилом, C1-6алкокси-C1-6алкилом, C1-6алкилкарбонил-C1-6алкилом, C2-7алкенилом, амино, аминоC1-6алкилом или 5-10-членным гетероциклилом, или Rs соединен с Rs' с образованием цепи;
Rs' и Rs'' каждый независимо является водородом, галогеном, C1-6алкилом, карбамоил-C1-6алкилом, C1-6алкиламино-C1-6алкилом или диC1-6алкиламино-C1-6алкилом, или Rs' и Rs'' соединены вместе с образованием цепи, или Rs' соединен с Rs с образованием цепи;
Rx' каждый независимо является водородом, галогеном, нитро, амино, C1-6алкокси, галоC1-6алкокси или C1-6алкилсульфонилом;
A и B каждый независимо является моноциклически или бициклически насыщенным или ненасыщенным C3-10карбоциклом или 5-12-членным гетероциклом;
Rc является =O, =NH, =N(-C1-6алкилом) или =N(-OH);
RNявляется водородом или C1-6алкилом, или RNсоединен с RA с образованием цепи;
LB является -[C(-RL)(-RL')]m-, -[C(-RL)(-RL')]n-O-, -O-, -NH-, -N(C1-6алкилом)-, -S(=O)2-, -C(=O)- или -C(=CH2)-, где m равно целому числу от 0 до 3, n равно целому числу от 1 до 3, RL и RL' каждый независимо является водородом, гидрокси, галогеном или C1-6алкилом, или RL и RL' соединены вместе с образованием цепи;
RA является водородом, галогеном, циано, C1-6алкилом, галоC1-6алкилом, цианоC1-6алкилом, C1-6алкилкарбонилом, C1-6алкокси, галоC1-6алкокси, цианоC1-6алкокси, C1-6алкиламино, диC1-6алкиламино, C1-6алкилтио, C1-6алкиламинокарбонилом, диC1-6алкиламинокарбонилом, C2-8алкинилом, C1-6алкоксикарбониламино-C1-6алкокси, аминоC1-6алкокси или 3-6-членным гетероциклилом, или RA соединен с RN с образованием цепи;
RB является водородом, галогеном, гидрокси, циано, нитро, амино, оксо, аминосульфонилом, сульфониламидо, C1-6алкиламино, C1-6алкилом, галоC1-6алкилом, цианоC1-6алкилом, C1-6алкокси, галоC1-6алкокси, цианоC1-6алкокси, C3-8циклоалкилокси, C2-8алкенилом, C2-8алкенилокси, C2-8алкинилом, C2-8алкинилокси, C1-6алкиламино-C1-6алкокси, диC1-6алкиламино-C1-6алкокси, C1-6алкоксикарбонилом, карбамоилом, карбамоил-C1-6алкокси, C1-6алкилтио, C1-6алкилсульфинилом, C1-6алкилсульфонилом, 5-10-членным гетероциклилом, 5-10-членным гетероциклил-C1-6алкилом, 5-10-членным гетероциклил-C1-6алкокси или 5-10-членным гетероциклилокси;
p равно целому числу от 0 до 4, и, если p равно 2 или выше, RA группы являются одинаковыми или отличаются друг от друга;
q равно целому числу от 0 до 4, и, если q равно 2 или выше, RB группы являются одинаковыми или отличаются друг от друга; и
каждая из указанных цепей независимо является насыщенной или ненасыщенной C2-10углеводородной цепью, не содержащей или содержащей, по крайней мере, одну гетерогруппу, выбранную из группы, включающей -O-, -NH-, -N=, -S-, -S(=O)- и -S(=O)2- в цепи, и не замещенной или замещенной, по крайней мере, одним заместителем, выбранным из группы, включающей галоген, C1-6алкил и C1-6алкокси; и
каждая из указанных гетероциклических и гетероциклильных групп независимо содержит, по крайней мере, одну гетерогруппу, выбранную из группы, включающей -O-, -NH-, -N=, -S-, -S(=O)- и -S(=O)2-.
В предпочтительном варианте соединения формулы (I),
один из X2 и X3 является -C(-Rx)=, и другой является -C(-Rx')= или -N=;
X1 и X4 каждый независимо является -C(-Rx')= или -N=;
один из Y и Z является -S- или -NH-, и другой является -CH=;
Rx и Rx' являются одинаковыми, такими, как определены в формуле (I); и
Rc, RN, A, B, LB, RA, RB, p и q являются одинаковыми, такими, как определены в формуле (I).
В предпочтительном варианте соединения формулы (I),
один из X2 и X3 является -C(-Rx)=, и другой является -C(-Rx')= или -N=;
X1 и X4 каждый независимо является -C(-Rx')= или -N=;
один из Y и Z является -S- или -NH-, и другой является -CH=;
Rx является

Xs является =O или =NH;
Ls является -C(-Rs')(-Rs'')- или -N(-Rs')-;
Rs является C1-6алкилом, галоC1-6алкилом, C1-6алкокси-C1-6алкилом или 5-6-членным гетероциклилом, или Rs соединен с Rs' с образованием цепи;
Rs' иRs'' каждый независимо является водородом, галогеном или C1-6алкилом, или Rs' и Rs'' соединены вместе с образованием цепи, или Rs' соединен с Rs с образованием цепи;
Rx' каждый независимо является водородом или галогеном;
каждая из указанных цепей независимо является насыщенной или ненасыщенной C2-7 углеводородной цепью, не содержащей или содержащей, по крайней мере, один гетероатом, выбранный из группы, включающей O, N и S; и
Rc, RN, A, B, LB, RA, RB, p и q являются одинаковыми, такими, как определены в формуле (I).
В предпочтительном варианте соединения формулы (I),
один из X2 и X3 является -C(-Rx)=, и другой является -C(-Rx')= или -N=;
X1 и X4 каждый независимо является -C(-Rx')= или -N=;
один из Y и Z является -S- или -NH-, и другой является -CH=;
Rx является

Xs является =O или =NH;
Ls является -C(-Rs')(-Rs'')- или -N(-Rs')-;
Rs является C1-6алкилом, галоC1-6алкилом, C1-6алкокси-C1-6алкилом или 5-6-членным гетероциклилом, или Rs соединен с Rs' с образованием цепи;
Rs' и Rs'' каждый независимо является водородом, галогеном или C1-6алкилом, или Rs' и Rs'' соединены вместе с образованием цепи, или Rs' соединен с Rs с образованием цепи;
Rx' каждый независимо является водородом или галогеном;
каждая из указанных цепей независимо является насыщенной или ненасыщенной C2-7 углеводородной цепью, не содержащей или содержащей, по крайней мере, один гетероатом, выбранный из группы, включающей O, N и S;
Rc и RN являются одинаковыми, такими, как определены в формуле (I);
A является бензолом или 5-10-членным гетероарилом, содержащим от 1 до 3 атомов азота;
B является моноциклически или бициклически насыщенным или ненасыщенным C6-10карбоциклом или 5-10-членным гетероциклом;
LB является -[C(-RL)(-RL')]m-, -O-, -NH- или -N(C1-6алкилом)-, где m равно 0 или 1, RL и RL' каждый независимо является водородом, гидрокси, галогеном или C1-6алкилом, или RL и RL' связаны вместе с образованием C2-5алкилена;
RA является галогеном, C1-6алкоксикарбониламино-C1-6алкокси, аминоC1-6алкокси или 3-6-членным гетероциклилом;
RB является галогеном, C1-6алкилом, C1-6алкокси, галоC1-6алкилокси, C2-6алкенилокси, C2-6алкинилокси, C1-6алкоксикарбонилом, C3-10карбоциклилокси или 3-10-членным гетероциклил-C1-3алкокси; и
каждая из указанных гетероарильных, гетероциклических и гетероциклильных частей независимо содержит от 1 до 3 гетероатомов, выбранных из группы, включающей O, N и S.
В предпочтительном варианте соединения формулы (I),
X1 и X4 являются -CH=;
X2 является -C(-Rx)=;
X3 является -N= или -C(-Rx')-;
Y является -C=;
Z является -S-;
Rx является

Ls является -C(-CH3)(-CH3)-;
Rs является C1-6алкилом, галоC1-6алкилом, C1-6алкоксиC1-6алкилом, C1-6алкилкарбонилC1-6алкилом, C2-7алкенилом, амино, аминоC1-6алкилом или 5-10-членным гетероциклилом, содержащим от 1 до 3 гетероатомов, выбранных из группы, включающей O, N и S;
Rx' является водородом, галогеном, нитро, амино, C1-6алкокси, галоC1-6алкокси или C1-6алкилсульфонилом;
Rc является =O;
RN является водородом; и
A, B, LB, RA, RB, p и q являются одинаковыми, такими, как определены в формуле (I).
В предпочтительном варианте соединения формулы (I),
X1, X3 и X4 являются -CH=;
X2 является -C(-Rx)=;
Y является -C=;
Z является -S-;
Rx является

Ls является -C(-Rs')(-Rs'')-;
Xs является =O или =NH;
Rs является C1-6алкилом, галоC1-6алкилом, C1-6алкокси-C1-6алкилом, C1-6алкилкарбонил-C1-6алкилом, C2-7алкенилом, амино, аминоC1-6алкилом или 5-10-членным гетероциклилом, содержащим от 1 до 3 гетероатомов, выбранных из группы, включающей O, N и S;
Rs' и Rs'' каждый независимо является водородом, галогеном, C1-6алкилом, карбамоилC1-6алкилом, C1-6алкиламино-C1-6алкилом или диC1-6алкиламино-C1-6алкилом, или Rs' и Rs'' соединены вместе с образованием цепи, где цепь является насыщенной или ненасыщенной C2-10углеводородной цепью, не содержащей или содержащей, по крайней мере, одну гетерогруппу, выбранную из группы, включающей -O-, -NH-, -N=, -S-, -S(=O)- и -S(=O)2- в цепи и не замещенной или замещенной, по крайней мере, одним заместителем, выбранным из группы, включающей галоген, C1-6алкил и C1-6алкокси;
Rc является =O;
RN является водородом; и
A, B, LB, RA, RB, p и q являются одинаковыми, такими, как определены в формуле (I).
В предпочтительном варианте соединения формулы (I),
X1, X3 и X4 являются -CH=;
X2 является -C(-Rx)=;
Y является-C=;
Z является -S-;
Rx является таким же, как определен выше в формуле (I);
Rc является =O;
RN является водородом; и
A, B, LB, RA, RB, p и q являются одинаковыми, такими, как определены в формуле (I).
В предпочтительном варианте соединения формулы (I),
X1, X2 и X4 являются -CH=;
X3 является -C(-Rx)=;
Y является-C=;
Z является -S- или -NH-;
Rx является

Xs является =O;
Ls является -C(-CH3)(-CH3)-;
Rs является метилом;
Rc является =O;
RN является водородом; и
A, B, LB, RA, RB, p и q являются одинаковыми, такими, как определены в формуле (I).
В предпочтительном варианте соединения формулы (I), если A является 5-членным гетероциклом, m равно целому числу от 1 до 3. 5-членным гетероциклом предпочтительно является 5-членное ароматическое кольцо, не замещенное или замещенное, по крайней мере, одним заместителем, выбранным из группы, включающей галоген, C1-10алкил и галоC1-10алкил. 5-членный гетероцикл содержит, по крайней мере, один гетероатом, выбранный из группы, включающей N, S и O.
Предпочтительные примеры соединений в соответствии с данным изобретением перечислены ниже, и его фармацевтически приемлемая соль и его стереоизомер также включены в объем данного изобретения:
1) N-(3-хлор-5-(2-(3-этокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
2) N-(3-хлор-5-(2-(3-пропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
3) N-(3-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
4) N-(3-бром-5-(2-(3-(1,1,2,2-тетрафторэтокси)-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
5) N-(3-хлор-5-(2-(3-(1,1,2,2-тетрафторэтокси)-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
6) N-(3-метокси-5-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
7) N-(3-хлор-5-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
8) N-(3-хлор-5-(2-(3-(2-морфолиноэтокси)-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
9) N-(3-бром-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
10) N-(3-(2-(3-(бут-2-ин-1-илокси)-5-(трифторметокси)фенил)пропан-2-ил)-5-хлорфенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
11) N-(3-хлор-5-(2-(3-изобутокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
12) N-(3-хлор-5-(2-(3-(2,2,2-трифторэтокси)-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
13) N-(3-хлор-5-(2-(3-(2,2-дифторэтокси)-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
14) N-(3-(2-(3-(аллилокси)-5-(трифторметокси)фенил)пропан-2-ил)-5-хлорфенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
15) N-(3-хлор-5-(2-(3-циклопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
16) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-((метилсульфонил)метил)бензо[b]тиофен-2-карбоксамид;
17) N-(3-хлор-5-(2-(4-метоксифенил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
18) N-(3-хлор-5-(2-(4-фторфенил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
19) N-(3-хлор-5-(2-(4-фторфенил)пропан-2-ил)фенил)-6-фтор-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
20) N-(3-бром-5-(2-(4-фторфенил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
21) N-(3-хлор-5-(2-(4-хлорфенил)пропан-2-ил)фенил)-5-((метилсульфонил)метил)бензо[b]тиофен-2-карбоксамид;
22) N-(3-хлор-5-(2-(4-хлорфенил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
23) 6-хлор-N-(3-хлор-5-(2-(4-хлорфенил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
24) N-(3-хлор-5-(2-(4-хлорфенил)пропан-2-ил)фенил)-5-(((трифторметил)сульфонил)метил)бензо[b]тиофен-2-карбоксамид;
25) N-(3-хлор-5-(2-(4-хлорфенил)пропан-2-ил)фенил)-5-(фтор(метилсульфонил)метил)бензо[b]тиофен-2-карбоксамид;
26) N-(3-хлор-5-(2-(4-хлорфенил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)тиено[2,3-c]пиридин-2-карбоксамид;
27) N-(3-хлор-5-(2-(5-хлортиофен-2-ил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
28) N-(3-хлор-5-(2-(5-изопропилтиофен-2-ил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
29) N-(3-хлор-5-(2-(5-метокситиофен-2-ил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
30) N-(3-хлор-5-(2-(2-метокситиофен-3-ил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
31) N-(3-хлор-5-(2-(1-метил-1H-пиррол-2-ил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
32) N-(3-хлор-5-(2-(4-метилтиофен-2-ил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
33) N-(3-хлор-5-(2-(4-хлорфенил)пропан-2-ил)фенил)-5-(1-(метилсульфонил)циклопропил)бензо[b]тиофен-2-карбоксамид;
34) N-(3-хлор-5-(2-(4-хлорфенил)пропан-2-ил)фенил)-5-(4-(метилсульфонил)тетрагидро-2H-пиран-4-ил)бензо[b]тиофен-2-карбоксамид;
35) N-(3-хлор-5-(2-(4-хлорфенил)пропан-2-ил)фенил)-6-(2-(метилсульфонил)пропан-2-ил)-1H-индол-2-карбоксамид;
36) N-(3-хлор-5-(2-(4-хлорфенил)пропан-2-ил)фенил)-5-((S-метилсульфонимидоил)метил)бензо[b]тиофен-2-карбоксамид;
37) N-(3-хлор-5-(4-(трифторметокси)фенокси)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
38) N-(3-хлор-5-(4-(трифторметил)фенокси)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
39) N-(3-бром-5-(4-хлорфенокси)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
40) N-(3-хлор-5-(4-хлорфенокси)фенил)-6-(2-(метилсульфонил)пропан-2-ил)-1H-индол-2-карбоксамид;
41) N-(3-хлор-5-(4-хлорфенокси)фенил)-5-((метилсульфонил)метил)бензо[b]тиофен-2-карбоксамид;
42) N-(3-хлор-5-(4-хлорфенокси)фенил)-5-(((трифторметил)сульфонил)метил)бензо[b]тиофен-2-карбоксамид;
43) N-(3-хлор-5-(4-фторфенокси)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
44) N-(3-хлор-5-(4-хлорфенокси)фенил)-6-фтор-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
45) 6-хлор-N-(3-хлор-5-(4-хлорфенокси)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
46) N-(3-(4-хлорфенокси)-5-метоксифенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
47) N-(3-хлор-5-(3-хлор-5-фторфенокси)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
48) N-(3-хлор-5-(3-(трифторметокси)фенокси)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
49) N-(3-хлор-5-(4-хлорфенокси)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
50) N-(3-хлор-5-(4-хлорфенокси)фенил)-5-(2-(метилсульфонил)пропан-2-ил)тиено[2,3-c]пиридин-2-карбоксамид;
51) N-(3-хлор-5-(3-хлор-4-фторфенокси)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
52) N-(3-хлор-5-(3,4-дифторфенокси)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
53) N-(3-хлор-5-(3-фтор-5-метоксифенокси)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
54) N-(3-хлор-5-(4-хлор-3-фторфенокси)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
55) N-(3-хлор-5-(2-(3-хлор-5-метоксифенил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
56) N-(3-хлор-5-(4-хлорфенокси)фенил)-5-(4-(метилсульфонил)тетрагидро-2H-пиран-4-ил)бензо[b]тиофен-2-карбоксамид;
57) N-(3-хлор-5-(4-хлорфенокси)фенил)-5-(2-((2-метоксиэтил)сульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
58) N-(3-хлор-5-(4-хлорфенокси)фенил)-6-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
59) N-(3-(азетидин-1-ил)-5-(4-хлорфенокси)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
60) N-(3-хлор-5-((6-хлорпиридин-3-ил)окси)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
61) N-(3-хлор-5-((5-хлорпиридин-2-ил)окси)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
62) N-(2-хлор-6-(3,5-дихлорфенокси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
63) N-(6-хлор-4-(4-хлорфенокси)пиридин-2-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
64) N-(2-хлор-6-(4-хлорфенокси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
65) N-(2-хлор-6-((6-хлорпиридин-3-ил)окси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
66) N-(4-хлор-6-(4-хлорфенокси)пиридин-2-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
67) N-(2-хлор-6-(4-(трифторметил)фенокси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
68) N-(2-хлор-6-(4-фторфенокси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
69) N-(2-бром-6-(4-хлорфенокси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
70) N-(2-хлор-6-(3-хлор-5-метоксифенокси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
71) N-(2-хлор-6-(3-хлор-4-фторфенокси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
72) N-(2-хлор-6-(4-хлор-3-фторфенокси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
73) N-(2-хлор-6-(4-хлорфенокси)пиридин-4-ил)-5-(1,1-диоксидотетрагидротиофен-2-ил)бензо[b]тиофен-2-карбоксамид;
74) N-(2-хлор-6-(4-хлорфенокси)пиридин-4-ил)-5-(1,1-диоксидотетрагидро-2H-тиопиран-2-ил)бензо[b]тиофен-2-карбоксамид;
75) N-(2-хлор-6-(4-хлорфенокси)пиримидин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
76) N-(6-хлор-2-(4-хлорфенокси)пиримидин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
77) N-(2-(4-хлорфенокси)-6-фторпиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
78) N-(2-(бицикло[2.2.1]гепт-5-ен-2-илокси)-6-хлорпиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
79) N-(2-хлор-6-(3,4-дифторфенокси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
80) N-(2-хлор-6-(3-хлорфенокси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
81) N-(2-хлор-6-(3-(трифторметокси)фенокси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
82) N-(2-хлор-6-(3,4-дихлорфенокси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
83) N-(2-хлор-6-(4-хлор-2-фторфенокси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
84) N-(2-хлор-6-(4-(трифторметокси)фенокси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
85) N-(2-хлор-6-((5-хлорпиридин-2-ил)окси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
86) N-(2-хлор-6-((4-хлорбензил)окси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
87) N-(3-хлор-5-(2-(3-(проп-1-ин-1-ил)-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
88) N-(1-(трет-бутил)-3-(2-(4-хлорфенил)пропан-2-ил)-1H-пиразол-5-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
89) N-(3-(2-(4-хлорфенил)пропан-2-ил)-1H-пиразол-5-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
90) N-(2-хлор-6-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
91) N-(4-хлор-6-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-2-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
92) N-(3-хлор-5-((2,2,6,6-тетраметилпиперидин-4-ил)окси)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
93) трет-бутил (2-(3-(4-хлорфенокси)-5-(5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамидо)фенокси)этил)карбамат;
94) N-(3-(2-аминоэтокси)-5-(4-хлорфенокси)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
95) N-(5-хлор-2',4'-дифтор-[1,1'-бифенил]-3-ил)-5-((метилсульфонил)метил)бензо[b]тиофен-2-карбоксамид;
96) (8-хлор-6-(4-хлорфенокси)-2,3-дигидро-4H-бензо[b][1,4]оксазин-4-ил)(5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-ил)метанон;
97) N-(3-хлор-5-(1-(4-хлорфенил)циклопропил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
98) N-(3-хлор-5-((2,4-дифторфенил)(метил)амино)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
99) N-(3-хлор-5-((4-хлорфенил)(метил)амино)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
100) N-(2-хлор-6-((4-хлорфенил)(метил)амино)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
101) N-(2-хлор-6-((4-хлорциклогекс-3-ен-1-ил)окси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
102) N-(2-хлор-6-((октагидроиндолизин-7-ил)окси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
103) 2,2,2-трифторацетат N-(3-хлор-5-(4-хлорфенокси)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксимидамида;
104) N-(2-хлор-6-(гексагидропирроло[1,2-a]пиразин-2(1H)-ил)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
105) N-(2-(4-(трет-бутил)пиперидин-1-ил)-6-хлорпиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
106) N-(2-хлор-6-(октагидро-2H-пиридо[1,2-a]пиразин-2-ил)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
107) N-(2-хлор-6-(7-этил-2,7-диазаспиро[4.4]нонан-2-ил)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
108) N-(2-хлор-6-(октагидроизохинолин-2(1H)-ил)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
109) N-(2-хлор-6-((5-метилтиазол-2-ил)окси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
110) N-(2-хлор-6-((1-метил-1H-пиразол-5-ил)окси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
111) N-(2-хлор-6-((1,3,5-триметил-1H-пиразол-4-ил)окси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
112) N-(2-хлор-6-((1-метил-1H-пиразол-4-ил)окси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
113) N-(2-хлор-6-((3,5-диметилизоксазол-4-ил)окси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
114) N-(2-хлор-6-((5-метилтиофен-3-ил)окси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
115) N-(2-хлор-6-((2-метилтиофен-3-ил)окси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
116) N-(2-хлор-6-((4,5-диметилизоксазол-3-ил)окси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
117) N-(2-хлор-6-((5-(трифторметил)тиофен-3-ил)окси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
118) метил 3-((6-хлор-4-(5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамидо)пиридин-2-ил)окси)изоксазол-5-карбоксилат;
119) N-(2-хлор-6-((4-метилтиазол-2-ил)окси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид;
120) N-(2-хлор-6-((5-метилтиофен-2-ил)окси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид; и
121) N-(2-хлор-6-((2-хлортиофен-3-ил)окси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид.
Перечисленные выше наименования соединений описаны в соответствии с номенклатурным методом, представленным программным обеспечением ChemBioDraw Ultra (версия 13.0.0.3015) от PerkinElmer.
В данном изобретении представлена фармацевтически приемлемая соль гетероциклического производного, представленного формулой (I) выше. Фармацевтически приемлемая соль должна быть низкотоксичной для человека, и не должна оказывать отрицательное воздействие на биологическую активность и физико-химические свойства исходных соединений. Примеры фармацевтически приемлемой соли могут включать кислотно-аддитивную соль между фармацевтически приемлемой свободной кислотой и основным соединением, представленным формулой (I), соль щелочного металла (соль натрия, и т.д.) и соль щелочноземельного металла (соль калия и т.д.), органическую основно-аддитивную соль между органическим основанием и карбоновой кислотой, представленной формулой (I), аддитивную соль аминокислоты, и т.д.
Примеры подходящей формы солей в соответствии с данным изобретением могут включать соль с неорганической кислотой или органической кислотой, где неорганическая кислота может быть соляной кислотой, серной кислотой, азотной кислотой, фосфорной кислотой, хлорной кислотой, бромистой кислотой и т.д., и органической кислотой может быть уксусная кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, фумаровая кислота, малеиновая кислота, малоновая кислота, фталевая кислота, янтарная кислота, молочная кислота, лимонная кислота, глюконовая кислота, винная кислота, салициловая кислота, яблочная кислота, щавелевая кислота, бензойная кислота, эмбоновая кислота, аспарагиновая кислота, глутаминовая кислота и т.д. Органическое основание, которое может применяться для получения аддитивной соли с органическим основанием, может включать трис(гидроксиметил)метиламин, дициклогексиламин, и т.д. Аминокислоты, которые могут применяться для получения аддитивного основания с аминокислотой, могут включать природные аминокислоты, такие как аланин и глицин.
Соли могут быть получены с применением обычного способа. Например, соли могут быть получены растворением соединения, представленного формулой (I), в смешиваемом с водой растворителе, таком как метанол, этанол, ацетон и 1,4-диоксан, добавлением свободной кислоты или свободного основания с последующей кристаллизацией полученной смеси.
Дополнительно, соединения в соответствии с данным изобретением могут иметь хиральный углеродный центр и, следовательно, могут присутствовать в форме R или S изомера, рацемического соединения, отдельного энантиомера или смеси, отдельного диастереомера или смеси, и все такие стереоизомеры и их смеси могут быть включены в объем данного изобретения.
Дополнительно, соединения в соответствии с данным изобретением могут включать гидрат или сольват гетероциклического производного, представленного формулой (I). Гидрат или сольват может быть получен с применением известного способа, и они, предпочтительно, являются не токсичными и водорастворимыми и, в частности, они предпочтительно представляют собой гидрат или сольват, содержащий 1-5 молекул спиртового растворителя (особенно, этанола и т.д.), связанного с ним.
В данном изобретении также представлено применение соединения, выбранного из группы, включающей гетероциклическое производное, представленное формулой (I) выше, и его фармацевтически приемлемую соль или и его стереоизомер, для производства лекарственного средства для профилактики или лечения заболеваний, связанных с активацией белка ПСАТ3.
Далее, в данном изобретении представлен способ профилактики или лечения заболеваний, связанных с активацией белка ПСАТ3, у млекопитающего, который включает введение соединения, выбранного из группы, включающей гетероциклическое производное, представленное формулой (I) выше, и его фармацевтически приемлемую соль или и его стереоизомер, млекопитающему.
Далее, в данном изобретении представлена фармацевтическая композиция для профилактики или лечения заболеваний, связанных с активацией белка ПСАТ3, содержащая соединение, выбранное из группы, включающей гетероциклическое производное, представленное формулой (I) выше, и его фармацевтически приемлемую соль или и его стереоизомер, в качестве активных ингредиентов.
В частности, заболевания, связанные с активацией белка ПСАТ3, выбирают из группы, включающей солидные раки, гемобламтозы или раки крови, радио- или химиорезистентные раки, метастатические раки, воспалительные заболевания, иммунологические заболевания, диабеты, дегенерацию желтого пятна, заражение папилломавирусом человека и туберкулез.
Более конкретно, заболевания, связанные с активацией белка ПСАТ3, выбирают из группы, включающей рак молочной железы, рак легкого, рак желудка, рак предстательной железы, рак матки, рак яичника, рак почки, рак поджелудочной железы, рак печени, рак толстой кишки, рак кожи, рак головы и шеи, рак щитовидной железы, остеосаркому, острый или хронический лейкоз, множественную миелому, лимфому В- или Т-клеток, неходжкинскую лимфому, аутоиммунные заболевания, включающие ревматоидный артрит, псориаз, гепатит, воспалительное заболевание кишечника, болезнь Крона, диабет, дегенерацию желтого пятна, папилломавирус человека и туберкулез.
В частности, гетероциклическое производное, представленное формулой (I) выше, или его фармацевтически приемлемая соль или его стереоизомер обладает превосходным ингибирующим действием на активацию белка ПСАТ3 и, следовательно, в данном изобретении также представлена композиция для ингибирования белка ПСАТ3, включающая его в качестве активного ингредиента.
Фармацевтическая композиция в соответствии с данным изобретением, в дополнение к гетероциклическому производному, представленному формулой (I) выше, его фармацевтически приемлемой соли и его стереоизомеру, также может включать, в качестве активных ингредиентов, общепринятые и не токсичные фармацевтически приемлемые добавки, например, носитель, наполнитель, разбавитель, адъювант и т.д., составленные в препарат с применением обычного способа.
Фармацевтическая композиция в соответствии с данным изобретением может быть составлена в различные лекарственные формы для перорального введения, такие как таблетки, пилюли, порошки, капсулы, сиропы или эмульсии, или для парентерального введения, такие как внутримышечные, внутривенные или подкожные инъекции, и т.д., и, предпочтительно, в форме препарата для перорального введения.
Примеры добавок, применяемых в фармацевтической композиции в соответствии с данным изобретением, могут включать подсластители, связующие агенты, растворители, добавки для солюбилизации, смачивающие агенты, эмульгаторы, изотонические агенты, абсорбенты, разрыхляющие агенты, антиоксиданты, консерванты, смазывающие агенты, наполнители, вкусовые добавки и т.д. Например, они могут включать лактозу, декстрозу, сахарозу, маннит, сорбит, целлюлозу, глицин, двуокись кремния, тальк, стеариновую кислоту, стеарин, стеарат магния, алюмосиликат магния, крахмал, желатин, трагакант, альгиновую кислоту, альгинат натрия, метилцеллюлозу, карбоксиметилцеллюлозу натрия, агар, воду, этанол, полиэтиленгликоль, поливинилпирролидон, хлорид натрия, хлорид кальция, эссенцию апельсина, эссенцию земляники, ароматизатор с запахом ванили и т.д.
Фармацевтическая композиция в соответствии с данным изобретением может быть составлена в препарат для перорального введения добавлением добавок к активным ингредиентам, где добавки могут включать целлюлозу, силикат кальция, кукурузный крахмал, лактозу, сахарозу, декстрозу, фосфат кальция, стеариновую кислоту, стеарат магния, стеарат кальция, желатин, тальк, поверхностно-активные вещества, суспендирующие агенты, эмульгаторы, разбавители и т.д.
Фармацевтическая композиция в соответствии с данным изобретением может быть составлена в препарат для инъекций добавлением добавок к активным ингредиентам, например, воды, физиологического раствора, раствора глюкозы, аналога водного раствора глюкозы, спирта, гликоля, простого эфира, масла, жирной кислоты, сложного эфира жирной кислоты, глицерида, поверхностно-активных веществ, суспендирующих агентов, эмульгаторов и т.д.
Соединение в соответствии с данным изобретением может вводиться предпочтительно в количестве от 0,1 до 2000 мг/сутки в расчете на взрослого человека с массой тела 70кг. Соединение в соответствии с данным изобретением может вводиться один раз в сутки и несколькими разделенными дозами. Доза соединения в соответствии с данным изобретением в значительной степени зависит от состояния здоровья, возраста, массы тела, пола пациента, способа введения, тяжести заболевания и т.д., и объем данного изобретения не ограничен предлагаемыми здесь дозами.
Пример
Далее данное изобретение более подробно описано в представленных ниже примерах, но они представлены только в целях иллюстрации, и данное изобретение ими не ограничено.
Определение аббревиатур, применяемых в представленных ниже примерах, следующее:
Таблица 1
Промежуточное соединение 1) Синтез 6-фтор-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоновой кислоты
(a) Синтез 1-(бромметил)-2,4-дифтор-5-метилбензола
Параформальдегид (247,0 мг, 7,81 ммоль) растворяют в 33% растворе HBr в AcOH (4,0 мл) и добавляют 2,4-дифтор-1-метилбензол (1,0 г, 7,81 ммоль) и ZnBr2 (880,0 мг, 3,91 ммоль). Реакционную смесь перемешивают при 120°C в течение 4 часов, охлаждают до комнатной температуры, добавляют насыщ. NaHCO3 и экстрагируют EtOAc. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:EtOAc=9:1) с получением 1-(бромметил)-2,4-дифтор-5-метилбензола (1,1 г, 64%) в виде бесцветной жидкости.
1H-ЯМР (400 МГц, CDCl3): δ 7,20 (т, 1H, J=8,4 Гц), 6,77 (т, 1H, J=9,5 Гц), 4,46 (с, 2H), 2,24 (с, 3H)
(b) Синтез 1,5-дифтор-2-метил-4-((метилсульфонил)метил)бензола
1-(Бромметил)-2,4-дифтор-5-метилбензол (260,0 мг, 1,18 ммоль) растворяют в безводном EtOH (6,0 мл) и добавляют метансульфинат натрия (120,0 мг, 1,18 ммоль). Реакционную смесь кипятят с обратным холодильником в течение 2 часов, охлаждают до комнатной температуры и концентрируют при пониженном давлении. Остаток перекристаллизовывают с Et2O с получением 1,5-дифтор-2-метил-4-((метилсульфонил)метил)бензола (160,0 мг, 61%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3): δ 7,32 (т, 1H, J=8,3 Гц), 6,86 (т, 1H, J=9,5 Гц), 4,24 (с, 2H), 2,82 (с, 3H), 2,27 (с, 3H)
(c) Синтез 1,5-дифтор-2-метил-4-(2-(метилсульфонил)пропан-2-ил)бензола
1,5-Дифтор-2-метил-4-((метилсульфонил)метил)бензол (3,4 г, 15,40 ммоль) растворяют в безводном ДМФ (22,4 мл) и добавляют NaOt-Bu (3,7 г, 38,60 ммоль) и CH3I (4,8 мл, 77,20 ммоль) при 0°C. Реакционную смесь перемешивают при 0°C, добавляют H2O и экстрагируют EtOAc. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:EtOAc=4:1) с получением 1,5-дифтор-2-метил-4-(2-(метилсульфонил)пропан-2-ил)бензола (370,0 мг, 10%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3): δ 7,38 (т, 1H, J=9,2 Гц), 6,75 (т, 1H, J=9,2 Гц), 2,70-2,81 (м, 3H), 1,90 (с, 3H), 1,74 (д, 6H, J=7,2 Гц)
(d) Синтез 1-(бромметил)-2,4-дифтор-5-(2-(метилсульфонил)пропан-2-ил)бензола
1,5-Дифтор-2-метил-4-(2-(метилсульфонил)пропан-2-ил)бензол (370,0 мг, 1,49 ммоль) растворяют в безводном 1,2-дихлорэтане (15,0 мл) и добавляют N-бромсукцинимид (265,0 мг, 1,49 ммоль) и AIBN (25,0 мг, 0,15 ммоль). Реакционную смесь кипятят с обратным холодильником при 100°C в течение 15 часов, охлаждают до комнатной температуры, добавляют H2O was added и экстрагируют CH2Cl2. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (n-Hex:EtOAc=4:1) с получением 1-(бромметил)-2,4-дифтор-5-(2-(метилсульфонил)пропан-2-ил)бензола (367,0 мг, 66%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3): δ 7,60 (т, 1H, J=8,5Гц), 6,88 (дд, 1H, J=12,4, 9,2 Гц), 4,28 (с, 2H), 2,74 (с, 3H), 1,93 (д, 6H, J=2,6 Гц)
(e) Синтез 2,4-дифтор-5-(2-(метилсульфонил)пропан-2-ил)бензальдегида
1-(Бромметил)-2,4-дифтор-5-(2-(метилсульфонил)пропан-2-ил)бензол (367,0 мг, 1,12 ммоль) растворяют в безводном CH3CN (11,0 мл) и добавляют 4-метилморфолин N-оксид (263,0 мг, 2,24 ммоль) и молекулярные сита (1,0 г). Реакционную смесь перемешивают при комнатной температуре в течение 90 минут, добавляют H2O и экстрагируют EtOAc. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток перекристаллизовывают с CH2Cl2 и n-Hex с получением 2,4-дифтор-5-(2-(метилсульфонил)пропан-2-ил)бензальдегида (200,0 мг, 66%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3): δ 10,16 (с, 1H), 8,07 (т, 1H, J=8,6 Гц), 7,56 (дд, 1H, J=12,6, 10,6 Гц), 2,90 (с, 3H), 1,87 (д, 6H, J=2,5 Гц)
(f) Синтез метил 6-фтор-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксилата
2,4-Дифтор-5-(2-(метилсульфонил)пропан-2-ил)бензальдегид (170,0 мг, 0,65 ммоль) растворяют в безводном ДМФ (11,0 мл) и добавляют метил 2-меркаптоацетат (58,0 мкл, 0,65 ммоль) и K2CO3 (179,6 мг, 1,30 ммоль). Реакционную смесь перемешивают при 80°C в течение 5 часов, охлаждают до комнатной температуры, добавляют H2O и экстрагируют EtOAc. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:EtOAc=1:1) с получением метил 6-фтор-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксилата (165,0 мг, 77%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3): δ 8,08 (д, 1H, J=7,6 Гц), 8,03 (с, 1H), 7,60 (д, 1H, J=12,8 Гц), 3,96 (с, 3H), 2,77 (с, 3H), 2,00 (д, 6H, J=2,6 Гц)
(g) Синтез 6-фтор-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоновой кислоты
Метил 6-фтор-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксилат (165,0 мг, 0,50 ммоль) растворяют в ТГФ (3,4 мл) и добавляют H2O (1,6 мл) и LiOH·H2O (210,0 мг, 4,99 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа, добавляют H2O и экстрагируют EtOAc. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток перекристаллизовывают с CH2Cl2 и n-Hex с получением 6-фтор-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоновой кислоты (150,0 мг, колич.) в виде белого твердого вещества.
ЖХ/МС ИЭР (-): 315 (M-1)
Промежуточное соединение 2) Синтез 5-((метилсульфонил)метил)бензо[b]тиофен-2-карбоновой кислоты
(a) Синтез метил 5-метилбензо[b]тиофен-2-карбоксилата
Методику синтеза промежуточного соединения 1-f повторяют, за исключением применения 2-фтор-5-метилбензальдегида (300,0 мг, 2,17 ммоль) в качестве исходного материала с получением метил 5-метилбензо[b]тиофен-2-карбоксилата (164,0 мг, 37%).
ЖХ/МС (ИЭР+): 207 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,99 (с, 1H), 7,29 (д, 1H, J=8,4 Гц), 7,67 (с, 1H), 7,30 (дд, 1H, J=8,3, 1,3 Гц), 3,94 (с, 3H), 2,48 (с, 3H)
(b) Синтез метил 5-(бромметил)бензо[b]тиофен-2-карбоксилата
Методику синтеза промежуточного соединения 1-d повторяют, за исключением применения метил 5-метилбензо[b]тиофен-2-карбоксилата (100,0 мг, 0,49 ммоль) в качестве исходного материала с получением метил 5-(бромметил)бензо[b]тиофен-2-карбоксилата (46,5 мг, 34%).
1H-ЯМР (400 МГц, CDCl3): δ 8,04 (с, 1H), 7,89 (с, 1H), 7,85 (д, 1H, J=8,4 Гц), 7,50 (д, 1H, J=8,5 Гц), 4,63 (с, 2H), 3,95 (с, 3H)
(c) Синтез метил 5-((метилсульфонил)метил)бензо[b]тиофен-2-карбоксилата
Методику синтеза промежуточного соединения 1-b повторяют, за исключением применения метил 5-(бромметил)бензо[b]тиофен-2-карбоксилата (45,0 мг, 0,16 ммоль) в качестве исходного материала с получением метил 5-((метилсульфонил)метил)бензо[b]тиофен-2-карбоксилата (45,0 мг, колич.).
ЖХ/МС (ИЭР+): 285 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 8,07 (с, 1H), 7,91-7,93 (м, 2H), 7,51 (д, 1H, J=8,4 Гц), 4,37 (с, 2H), 3,96 (с, 3H), 2,80 (с, 3H)
(d) Синтез 5-((метилсульфонил)метил)бензо[b]тиофен-2-карбоновой кислоты
Методику синтеза промежуточного соединения 1-g повторяют, за исключением применения метил 5-((метилсульфонил)метил)бензо[b]тиофен-2-карбоксилата (45,0 мг, 0,16 ммоль) в качестве исходного материала с получением 5-((метилсульфонил)метил)бензо[b]тиофен-2-карбоновой кислоты (39,3 мг, 90%).
1H-ЯМР (400 МГц, ДМСО-d6): δ 13,50 (шс, 1H), 8,15 (с, 1H), 8,08 (д, 1H, J=8,5 Гц), 8,03 (с, 1H), 7,53 (д, 1H, J=8,5 Гц), 4,62 (с, 2H), 2,94 (с, 3H)
Промежуточное соединение 3) Синтез 5-(((трифторметил)сульфонил)метил)бензо[b]тиофен-2-карбоновой кислоты
(a) Синтез метил 5-(((трифторметил)сульфонил)метил)бензо[b]тиофен-2-карбоксилата
Метил 5-(бромметил)бензо[b]тиофен-2-карбоксилат (263,0 мг, 0,92 ммоль) и трифлинат натрия (216,0 мг, 1,38 ммоль) растворяют в пропионитриле (4,6 мл). Реакционную смесь кипятят с обратным холодильником в течение 16 часов и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:EtOAc=4:1) с получением метил 5-(((трифторметил)сульфонил)метил)бензо[b]тиофен-2-карбоксилата (171,8 мг, 55%) в виде белого твердого вещества.
ЖХ/МС (ИЭР+): 339 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 8,08 (с, 1H), 7,94-7,96 (м, 2H), 7,49 (дд, 1H, J=8,5, 1,6 Гц), 4,61 (с, 2H), 3,97 (с, 3H)
(b) Синтез 5-(((трифторметил)сульфонил)метил)бензо[b]тиофен-2-карбоновой кислоты
Методику синтеза промежуточного соединения 1-g повторяют за исключением применения метил 5-(((трифторметил)сульфонил)метил)бензо[b]тиофен-2-карбоксилата (210,0 мг, 0,62 ммоль) в качестве исходного материала с получением 5-(((трифторметил)сульфонил)метил)бензо[b]тиофен-2-карбоновой кислоты (151,8 мг) без очистки.
1H-ЯМР (400 МГц, ДМСО-d6): δ 13,62 (шс, 1H), 8,20 (с, 1H), 8,15 (д, 1H, J=8,5 Гц), 8,12 (с, 1H), 7,58 (дд, 1H, J=8,5, 1,6 Гц), 5,41 (с, 2H)
Промежуточное соединение 4) Синтез 5-(фтор(метилсульфонил)метил)бензо[b]тиофен-2-карбоновой кислоты
(a) Синтез 2-метил-4-((метилсульфонил)метил)-1-нитробензола
Методику синтеза промежуточного соединения 1-b повторяют, за исключением применения 4-(бромметил)-2-метил-1-нитробензола (2,0 г, 8,69 ммоль) в качестве исходного материала с получением 2-метил-4-((метилсульфонил)метил)-1-нитробензола (1,7 г, 86%).
1H-ЯМР (400 МГц, CDCl3): δ 8,02 (д, 1H, J=8,1 Гц), 7,40-7,42 (м, 2H), 4,29 (с, 2H), 2,86 (с, 3H), 2,64 (с, 3H)
(b) Синтез 4-(фтор(метилсульфонил)метил)-2-метил-1-нитробензола
2-Метил-4-((метилсульфонил)метил)-1-нитробензол (760,0 мг, 3,32 ммоль) и сульфонамид N-фтор-N-(фенилсульфонил)бензола (2,1 г, 6,64 ммоль) растворяют в безводном ТГФ (16,6 мл) и 1,6 M раствор n-BuLi в n-Hex (4,2 мл, 6,64 ммоль) медленно добавляют по каплям при -78°C. Реакционную смесь перемешивают в течение 9 часов, добавляют H2O при комнатной температуре и экстрагируют EtOAc. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:EtOAc=1:1) с получением 4-(фтор(метилсульфонил)метил)-2-метил-1-нитробензола (175,0 мг, 21%) в виде коричневого твердого вещества.
1H-ЯМР (400 МГц, CDCl3): δ 8,05 (д, 1H, J=8,9 Гц), 7,94 (м, 1H), 7,54 (м, 1H), 6,09 (д, 1H, J=46,8 Гц), 3,04 (д, 3H, J=1,6 Гц), 2,65 (с, 3H)
(c) Синтез 2-(бромметил)-4-(фтор(метилсульфонил)метил)-1-нитробензола
Методику синтеза промежуточного соединения 1-d повторяют, за исключением применения 4-(фтор(метилсульфонил)метил)-2-метил-1-нитробензола (168,0 мг, 0,68 ммоль) в качестве исходного материала с получением 2-(бромметил)-4-(фтор(метилсульфонил)метил)-1-нитробензола (129,5 мг).
1H-ЯМР (400 МГц, CDCl3): δ 8,05 (д, 1H, J=8,9 Гц), 7,95 (м, 1H), 7,93 (м, 1H), 6,10 (д, 1H, J=46,8 Гц), 4,84 (с, 2H), 2,65 (с, 3H)
(d) Синтез 5-(фтор(метилсульфонил)метил)-2-нитробензальдегида
Методику синтеза промежуточного соединения 1-e повторяют, за исключением применения 2-(бромметил)-4-(фтор(метилсульфонил)метил)-1-нитробензола (127,0 мг) в качестве исходного материала с получением 5-(фтор(метилсульфонил)метил)-2-нитробензальдегида (13,5 мг, выход за 2 стадии: 8%).
1H-ЯМР (400 МГц, CDCl3): δ 10,44 (с, 1H), 8,23 (д, 1H, J=8,5 Гц), 8,13 (д, 1H, J=1,9 Гц), 7,97 (дд, 1H, J=8,5, 2,0 Гц), 6,21 (д, 1H, J=47,0 Гц), 3,10 (д, 3H, J=1,7 Гц)
(e) Синтез метил 5-(фтор(метилсульфонил)метил)бензо[b]тиофен-2-карбоксилата
Методику синтеза промежуточного соединения 1-f повторяют, за исключением применения 5-(фтор(метилсульфонил)метил)-2-нитробензальдегида (10,0 мг, 0,04 ммоль) в качестве исходного материала с получением метил 5-(фтор(метилсульфонил)метил)бензо[b]тиофен-2-карбоксилата (11,0 мг, колич.).
ЖХ/МС (ИЭР+): 303 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 8,11 (с, 1H), 8,08 (с, 1H), 7,98 (д, 1H, J=8,6 Гц), 7,63 (дд, 1H, J=8,5, 1,6 Гц), 6,17 (д, 1H, J=46,2 Гц), 3,97 (с, 3H), 3,02 (д, 3H, J=1,4 Гц)
(f) Синтез 5-(фтор(метилсульфонил)метил)бензо[b]тиофен-2-карбоновой кислоты
Методику синтеза промежуточного соединения 1-g повторяют, за исключением применения метил 5-(фтор(метилсульфонил)метил)бензо[b]тиофен-2-карбоксилата (11,0 мг, 0,04 ммоль) в качестве исходного материала с получением 5-(фтор(метилсульфонил)метил)бензо[b]тиофен-2-карбоновой кислоты (6,7 мг, 64%).
1H-ЯМР (400 МГц, ДМСО-d6): δ 8,23 (с, 1H), 8,17-8,20 (м, 2H), 7,59 (дд, 1H, J=8,5, 1,6 Гц), 6,93 (д, 1H, J=45,2 Гц), 3,19 (д, 3H, J=1,2 Гц)
Промежуточное соединение 5) Синтез 5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоновой кислоты
(a) Синтез 2-метил-4-(2-(метилсульфонил)пропан-2-ил)-1-нитробензола
Методику синтеза промежуточного соединения 1-c повторяют, за исключением применения 2-метил-4-((метилсульфонил)метил)-1-нитробензола (500,0 мг, 2,18 ммоль) в качестве исходного материала с получением 2-метил-4-(2-(метилсульфонил)пропан-2-ил)-1-нитробензола (308,0 мг, 55%).
1H-ЯМР (400 МГц, CDCl3): δ 8,00 (д, 1H, J=9,2 Гц), 7,62-7,63 (м, 2H), 2,65 (с, 3H), 2,61 (с, 3H), 1,88 (с, 6H)
(b) Синтез 2-(бромметил)-4-(2-(метилсульфонил)пропан-2-ил)-1-нитробензола
Методику синтеза промежуточного соединения 1-d повторяют, за исключением применения 2-метил-4-(2-(метилсульфонил)пропан-2-ил)-1-нитробензола (270,0 мг, 1,05 ммоль) в качестве исходного материала с получением 2-(бромметил)-4-(2-(метилсульфонил)пропан-2-ил)-1-нитробензола (272,0 мг).
1H-ЯМР (400 МГц, CDCl3): δ 8,07 (д, 1H, J=8,7 Гц), 7,84 (д, 1H, J=2,2 Гц), 7,77 (дд, 1H, J=8,7, 2,2 Гц), 4,86 (с, 2H), 2,63 (с, 3H), 1,91 (с, 6H)
(c) Синтез 5-(2-(метилсульфонил)пропан-2-ил)-2-нитробензальдегида
Методику синтеза промежуточного соединения 1-e повторяют, за исключением применения 2-(бромметил)-4-(2-(метилсульфонил)пропан-2-ил)-1-нитробензола (270,0 мг) в качестве исходного материала с получением 5-(2-(метилсульфонил)пропан-2-ил)-2-нитробензальдегида (139,0 мг, выход за 2 стадии: 49%).
ЖХ/МС (ИЭР+): 272 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 10,46 (с, 1H), 8,10-8,18 (м, 3H), 2,66 (с, 3H), 1,93 (с, 6H)
(d) Синтез метил 5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксилата
Методику синтеза промежуточного соединения 1-f повторяют, за исключением применения 5-(2-(метилсульфонил)пропан-2-ил)-2-нитробензальдегида (137,0 мг, 0,51 ммоль) в качестве исходного материала с получением метил 5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксилата (140,0 мг, 89%).
1H-ЯМР (400 МГц, CDCl3): δ 8,12 (д, 1H, J=1,8 Гц), 8,08 (с, 1H), 7,90 (д, 1H, J=8,7 Гц), 7,79 (дд, 1H, J=8,7, 1,9 Гц), 3,96 (с, 3H), 2,55 (с, 3H), 1,93 (с, 6H)
(e) Синтез 5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоновой кислоты
Методику синтеза промежуточного соединения 1-g повторяют, за исключением применения метил 5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксилата (155,0 мг, 0,50 ммоль) в качестве исходного материала с получением 5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоновой кислоты (115,0 мг, 78%).
1H-ЯМР (400 МГц, ДМСО-d6): δ 13,55 (шс, 1H), 8,25 (с, 1H), 8,14 (с, 1H), 8,07 (д, 1H, J=8,7 Гц), 7,76 (дд, 1H, J=8,8, 1,7 Гц), 2,73 (с, 3H), 1,83 (с, 6H)
Промежуточное соединение 6) Синтез 5-(1-(метилсульфонил)циклопропил)бензо[b]тиофен-2-карбоновой кислоты
(a) Синтез 2-метил-4-(1-(метилсульфонил)циклопропил)-1-нитробензола
2-Метил-4-((метилсульфонил)метил)-1-нитробензол (500,0 мг, 2,18 ммоль), 1,2-дибромэтан (0,3 мл, 3,27 ммоль) и бромид тетра-н-бутиламмония (70,3 мг, 0,22 ммоль) растворяют в толуоле (22,0 мл) и медленно добавляют 10N водный раствор NaOH (0,7 мл, 6,54 ммоль). Реакционную смесь нагревают при 40°C в течение 16 часов, добавляют H2O и экстрагируют EtOAc. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:EtOAc=4:1) с получением 2-метил-4-(1-(метилсульфонил)циклопропил)-1-нитробензола (92,0 мг, 17%) в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3): δ 8,00 (д, 1H, J=8,4 Гц), 7,58 (м, 1H), 7,53 (м, 1H), 2,79 (с, 3H), 2,62 (с, 3H), 1,89-1,92 (м, 2H), 1,30-1,33 (м, 2H)
(b) Синтез 2-(бромметил)-4-(1-(метилсульфонил)циклопропил)-1-нитробензола
Методику синтеза промежуточного соединения 1-d повторяют, за исключением применения 2-метил-4-(1-(метилсульфонил)циклопропил)-1-нитробензола (95,0 мг, 0,37 ммоль) в качестве исходного материала с получением 2-(бромметил)-4-(1-(метилсульфонил)циклопропил)-1-нитробензола (102,0 мг).
1H-ЯМР (400 МГц, CDCl3): δ 8,05 (д, 1H, J=8,4 Гц), 7,79 (д, 1H, J=2,0 Гц), 7,69 (дд, 1H, J=8,4, 2,0 Гц), 4,83 (с, 2H), 2,80 (с, 3H), 1,90-1,95 (м, 2H), 1,34-1,37 (м, 2H)
(c) Синтез 5-(1-(метилсульфонил)циклопропил)-2-нитробензальдегида
Методику синтеза промежуточного соединения 1-e повторяют, за исключением применения 2-(бромметил)-4-(1-(метилсульфонил)циклопропил)-1-нитробензола (100,0 мг) в качестве исходного материала с получением 5-(1-(метилсульфонил)циклопропил)-2-нитробензальдегида (40,6 мг, выход за 2 стадии: 41%).
ЖХ/МС (ИЭР+): 270 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 10,43 (с, 1H), 8,16 (д, 1H, J=8,2 Гц), 8,03-8,07 (м, 2H), 2,80 (с, 3H), 1,96-1,99 (м, 2H), 1,35-1,39 (м, 2H)
(d) Синтез метил 5-(1-(метилсульфонил)циклопропил)бензо[b]тиофен-2-карбоксилата
Методику синтеза промежуточного соединения 1-f повторяют, за исключением применения 5-(1-(метилсульфонил)циклопропил)-2-нитробензальдегида (40,0 мг, 0,15 ммоль) в качестве исходного материала с получением метил 5-(1-(метилсульфонил)циклопропил)бензо[b]тиофен-2-карбоксилата (35,9 мг, 78%).
ЖХ/МС (ИЭР+): 311 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 8,04-8,07 (м, 2H), 7,88 (м, 1H), 7,67 (м, 1H), 3,96 (с, 3H), 2,77 (с, 3H), 1,90-1,91 (м, 2H), 1,34-1,36 (м, 2H)
(e) Синтез 5-(1-(метилсульфонил)циклопропил)бензо[b]тиофен-2-карбоновой кислоты
Методику синтеза промежуточного соединения 1-g повторяют, за исключением применения метил 5-(1-(метилсульфонил)циклопропил)бензо[b]тиофен-2-карбоксилата (33,0 мг, 0,11 ммоль) в качестве исходного материала с получением 5-(1-(метилсульфонил)циклопропил)бензо[b]тиофен-2-карбоновой кислоты (21,9 мг, 70%).
ЖХ/МС ИЭР (+): 297 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 13,57 (шс, 1H), 8,19 (с, 1H), 8,10 (с, 1H), 8,07 (д, 1H, J=8,5 Гц), 7,67 (д, 1H, J=8,9 Гц), 2,88 (с, 3H), 1,67-1,70 (м, 2H), 1,35-1,38 (м, 2H)
Промежуточное соединение 7) Синтез 6-хлор-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоновой кислоты
(a) Синтез 1-(2-хлор-4-фтор-5-метилфенил)этан-1-она
AlCl3 (5,8 г, 43,3 ммоль) растворяют в 1,2-дихлорэтане (34,6 мл) и ацетилхлориде (3,1 мл, 43,3 ммоль) добавляют по каплям при 0°C. Добавляют 4-хлор-2-фтор-1-метилбензол (5,0 г, 34,6 ммоль). Реакционную смесь перемешивают при 0°C в течение 1 часа и затем при 60°C в течение 16 часов. 1N HCl водный раствор добавляют по каплям, и реакционную смесь экстрагируют EtOAc. Органический экстракт промывают насыщ. водным раствором NaHCO3 и насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:EtOAc=9:1) с получением 1-(2-хлор-4-фтор-5-метилфенил)этан-1-она (4,9 г, 75%) в виде желтого масла.
ЖХ/МС ИЭР (+): 187 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,48 (д, 1H, J=8,1 Гц), 7,10 (д, 1H, J=9,1 Гц), 2,64 (с, 3H), 2,27 (с, 3H)
(b) Синтез 2-(2-хлор-4-фтор-5-метилфенил)пропан-2-ола
1-(2-Хлор-4-фтор-5-метилфенил)этан-1-он (4,9 г, 26,00 ммоль) растворяют в ТГФ (260,0 мл) и 3,0 M раствор бромида метилмагния в Et2O (26,0 мл) добавляют по каплям при -8°C. Реакционную смесь перемешивают в течение 16 часов, 1N водный раствор HCl добавляют по каплям при 0°C для того, чтобы погасить реакцию, и экстрагируют EtOAc. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (амин силикагель, n-Hex:EtOAc=2:1) с получением 2-(2-хлор-4-фтор-5-метилфенил)пропан-2-ола (4,3 г, 82%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3): δ 7,50 (д, 1H, J=8,4 Гц), 7,04 (д, 1H, J=9,1 Гц), 2,44 (с, 1H), 2,25 (д, 3H, J=1,7 Гц), 1,70 (с, 6H)
(c) Синтез 2-(2-хлор-4-фтор-5-метилфенил)пропан-2-тиола
2-(2-Хлор-4-фтор-5-метилфенил)пропан-2-ол (4,3 г, 21,40 ммоль) и Реагент Лавессона (5,2 г, 12,80 ммоль) растворяют в толуоле (107,0 мл) и добавляют H2O (0,5 мл). Реакционную смесь перемешивают при 50°C в течение 16 часов, добавляют H2O и экстрагируют EtOAc. Органический экстракт промывают насыщ. водным раствором NaHCO3, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:ДХМ=4:1) с получением 2-(2-хлор-4-фтор-5-метилфенил)пропан-2-тиола (2,7 г, 59%) в виде бледно-желтого масла.
1H-ЯМР (400 МГц, CDCl3): δ 7,31 (д, 1H, J=8,1 Гц), 7,08 (д, 1H, J=9,1 Гц), 2,89 (с, 1H), 2,24 (с, 3H), 1,92 (с, 6H)
(d) Синтез (2-(2-хлор-4-фтор-5-метилфенил)пропан-2-ил)(метил)сульфана
NaOH (357,0 мг, 8,92 ммоль) растворяют в EtOH (34,3 мл) и диметилсульфат (1,0 мл, 10,29 ммоль) добавляют по каплям. Добавляют 2-(2-хлор-4-фтор-5-метилфенил)пропан-2-тиол (1,5 г, 6,86 ммоль), и реакционную смесь перемешивают при комнатной температуре в течение 2 часов, добавляют H2O и экстрагируют EtOAc. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:ДХМ=6:1) с получением (2-(2-хлор-4-фтор-5-метилфенил)пропан-2-ил)(метил)сульфана (1,5 г, 93%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3): δ 7,27 (д, 1H, J=7,7 Гц), 7,08 (д, 1H, J=9,2 Гц), 2,25 (д, 3H, J=1,7 Гц), 1,81-1,83 (м, 9H)
(e) Синтез 1-хлор-5-фтор-4-метил-2-(2-(метилсульфонил)пропан-2-ил)бензола
(2-(2-Хлор-4-фтор-5-метилфенил)пропан-2-ил)(метил)сульфан (1,5 г, 6,36 ммоль) растворяют в AcOH (31,8 мл) и 35% масс. водного раствора H2O2 (6,4 мл) добавляют по каплям. Реакционную смесь перемешивают при комнатной температуре в течение 16 часов, добавляют H2O и экстрагируют EtOAc. Органический экстракт промывают насыщ. водным раствором NaHCO3 и насыщенным раствором соли, сушат над безводным Na2SO и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (амин силикагель, n-Hex:EtOAc=4:1) с получением 1-хлор-5-фтор-4-метил-2-(2-(метилсульфонил)пропан-2-ил)бензола (1,6 г, 95%) в виде белого твердого вещества.
ЖХ/МС ИЭР (+): 265 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,55 (д, 1H, J=8,1 Гц), 7,09 (д, 1H, J=9,0 Гц), 2,76 (с, 3H), 2,27 (с, 3H), 2,03 (с, 6H)
(f) Синтез 1-(бромметил)-4-хлор-2-фтор-5-(2-(метилсульфонил)пропан-2-ил)бензола
Методику синтеза промежуточного соединения 1-d повторяют, за исключением применения 1-хлор-5-фтор-4-метил-2-(2-(метилсульфонил)пропан-2-ил)бензола (1,7 г, 6,35 ммоль) в качестве исходного материала с получением 1-(бромметил)-4-хлор-2-фтор-5-(2-(метилсульфонил)пропан-2-ил)бензола (2,2 г).
ЖХ/МС ИЭР (+): 343 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,77 (д, 1H, J=7,9 Гц), 7,18 (д, 1H, J=9,1 Гц), 4,47 (с, 2H), 2,77 (с, 3H), 2,06 (с, 6H)
(g) Синтез 4-хлор-2-фтор-5-(2-(метилсульфонил)пропан-2-ил)бензальдегида
Методику синтеза промежуточного соединения 1-e повторяют, за исключением применения 1-(бромметил)-4-хлор-2-фтор-5-(2-(метилсульфонил)пропан-2-ил)бензола (2,2 г) в качестве исходного материала с получением 4-хлор-2-фтор-5-(2-(метилсульфонил)пропан-2-ил)бензальдегида (1,0 г, выход за 2 стадии: 57%).
1H-ЯМР (400 МГц, CDCl3): δ 10,29 (с, 1H), 8,22 (д, 1H, J=7,4 Гц), 7,34 (д, 1H, J=9,6 Гц), 2,78 (с, 3H), 2,09 (с, 6H)
(h) Синтез метил 6-хлор-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксилата
Методику синтеза промежуточного соединения 1-f повторяют, за исключением применения 4-хлор-2-фтор-5-(2-(метилсульфонил)пропан-2-ил)бензальдегида (1,0 г, 3,59 ммоль) в качестве исходного материала с получением метил 6-хлор-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксилата (1,1 г, 91%).
1H-ЯМР (400 МГц, CDCl3): δ 8,27 (с, 1H), 8,03 (с, 1H), 7,94 (с, 1H), 3,96 (с, 3H), 2,79 (с, 3H), 2,14 (с, 6H)
(i) Синтез 6-хлор-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоновой кислоты
Методику синтеза промежуточного соединения 1-g повторяют, за исключением применения метил 6-хлор-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксилата (1,1 г, 3,26 ммоль) в качестве исходного материала с получением 6-хлор-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоновой кислоты (998,0 мг, 92%).
1H-ЯМР (400 МГц, ДМСО-d6): δ 13,67 (шс, 1H), 8,44 (с, 1H), 8,26 (с, 1H), 8,14 (с, 1H), 2,88 (с, 3H), 2,04 (с, 6H)
Промежуточное соединение 8) Синтез 5-(2-(метилсульфонил)пропан-2-ил)тиено[2,3-c]пиридин-2-карбоновой кислоты
(a) Синтез 2-(бромметил)-4-метил-5-нитропиридина
Методику синтеза промежуточного соединения 1-d повторяют, за исключением применения 2,4-диметил-5-нитропиридина (2,5 г, 16,43 ммоль) в качестве исходного материала с получением 2-(бромметил)-4-метил-5-нитропиридина (1,1 г, 28%).
ЖХ/МС ИЭР (+): 231 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 9,11 (с, 1H), 7,74 (с, 1H), 4,75 (с, 2H), 2,59 (с, 3H)
(b) Синтез 4-метил-2-((метилсульфонил)метил)-5-нитропиридина
Методику синтеза промежуточного соединения 1-b повторяют, за исключением применения 2-(бромметил)-4-метил-5-нитропиридина (1,1 г, 4,76 ммоль) в качестве исходного материала с получением 4-метил-2-((метилсульфонил)метил)-5-нитропиридина (980,0 мг, 89%).
ЖХ/МС ИЭР (+): 231 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 9,15 (с, 1H) 7,50 (с, 1H), 4,46 (с, 2H), 2,98 (с, 3H), 2,69 (с, 3H)
(c) Синтез 4-метил-2-(2-(метилсульфонил)пропан-2-ил)-5-нитропиридина
4-Метил-2-((метилсульфонил)метил)-5-нитропиридин (980,0 мг, 4,25 ммоль) растворяют в безводном ДМФ (21,2 мл) и добавляют 60% масс. NaH (426,0 мг, 10,64 ммоль) и CH3I (0,8 мл, 12,75 ммоль) при 0°C. Реакционную смесь перемешивают при комнатной температуре в течение 16 часов, добавляют H2O при 0°C и экстрагируют EtOAc. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:EtOAc=2:1) с получением 4-метил-2-(2-(метилсульфонил)пропан-2-ил)-5-нитропиридина (290,0 мг, 26%) в виде белого твердого вещества.
ЖХ/МС ИЭР (+): 259 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 9,14 (с, 1H) 7,65 (с, 1H), 2,82 (с, 3H), 2,69 (с, 3H), 1,92 (с, 6H)
(d) Синтез (E)-N,N-диметил-2-(2-(2-(метилсульфонил)пропан-2-ил)-5-нитропиридин-4-ил)этен-1-амина
4-Метил-2-(2-(метилсульфонил)пропан-2-ил)-5-нитропиридин (250,0 мг, 0,97 ммоль) растворяют в безводном ДМФ (1,2 мл) и добавляют диметилацеталь N,N-диметилформамида (1,3 мл, 9,68 ммоль). Реакционную смесь перемешивают в течение 1 часа, добавляют H2O и экстрагируют EtOAc. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:EtOAc=1:1) с получением (E)-N,N-диметил-2-(2-(2-(метилсульфонил)пропан-2-ил)-5-нитропиридин-4-ил)этен-1-амина (250,0 мг, 82%) в виде красного твердого вещества.
1H-ЯМР (400 МГц, CDCl3): δ 8,93 (с, 1H) 7,58 (с, 1H), 7,35 (д, 1H, J=13,2 Гц), 5,98 (д, 1H, J=13,2 Гц), 3,05 (с, 6H), 2,95 (с, 3H), 1,87 (с, 6H)
(e) Синтез 2-(2-(метилсульфонил)пропан-2-ил)-5-нитроизоникотинальдегида
(E)-N,N-диметил-2-(2-(2-(метилсульфонил)пропан-2-ил)-5-нитропиридин-4-ил)этен-1-амин (250,0 мг, 0,80 ммоль) растворяют в ТГФ (4,0 мл) и добавляют H2O (4,0 мл) и метапериодат натрия (512,0 мг, 2,39 ммоль). Реакционную смесь перемешивают при 40°C в течение 5 часов, добавляют H2O и экстрагируют EtOAc. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:EtOAc=1:1) с получением 2-(2-(метилсульфонил)пропан-2-ил)-5-нитроизоникотинальдегида (130,0 мг, 60%) в виде желтого твердого вещества.
ЖХ/МС ИЭР (+): 273 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 10,55 (с, 1H) 9,41 (с, 1H), 8,06 (с, 1H), 2,87 (с, 3H), 1,95 (с, 6H)
(f) Синтез метил 5-(2-(метилсульфонил)пропан-2-ил)тиено[2,3-c]пиридин-2-карбоксилата
Методику синтеза промежуточного соединения 1-f повторяют, за исключением применения 2-(2-(метилсульфонил)пропан-2-ил)-5-нитроизоникотинальдегида (130,0 мг, 0,48 ммоль) в качестве исходного материала с получением метил 5-(2-(метилсульфонил)пропан-2-ил)тиено[2,3-c]пиридин-2-карбоксилата (110,0 мг, 74%).
ЖХ/МС ИЭР (+): 314 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 9,16 (с, 1H) 8,10 (с, 1H), 8,07 (с, 1H), 4,00 (с, 3H), 2,82 (с, 3H), 1,98 (с, 6H)
(g) Синтез 5-(2-(метилсульфонил)пропан-2-ил)тиено[2,3-c]пиридин-2-карбоновой кислоты
Методику синтеза промежуточного соединения 1-g повторяют, за исключением применения метил 5-(2-(метилсульфонил)пропан-2-ил)тиено[2,3-c]пиридин-2-карбоксилата (110,0 мг, 7,64 ммоль) в качестве исходного материала с получением 5-(2-(метилсульфонил)пропан-2-ил)тиено[2,3-c]пиридин-2-карбоновой кислоты (100,0 мг, 95%).
ЖХ/МС ИЭР (+): 300 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 9,37 (с, 1H) 8,28 (с, 1H), 8,16 (с, 1H), 2,86 (с, 3H), 1,86 (с, 6H)
Промежуточное соединение 9) Синтез 6-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоновой кислоты
(a) Синтез 2-фтор-1-метил-4-((метилсульфонил)метил)бензола
Методику синтеза промежуточного соединения 1-b повторяют, за исключением применения 4-(бромметил)-2-фтор-1-метилбензола (1,0 г, 4,92 ммоль) в качестве исходного материала с получением 2-фтор-1-метил-4-((метилсульфонил)метил)бензола (813,0 мг, 82%).
1H-ЯМР (400 МГц, CDCl3): δ 7,23 (т, 1H, J=8,1 Гц), 7,07-7,10 (м, 2H), 4,20 (с, 2H), 2,78 (с, 3H), 2,29 (с, 3H)
(b) Синтез 2-фтор-1-метил-4-(2-(метилсульфонил)пропан-2-ил)бензола
Методику синтеза промежуточного соединения 1-c повторяют, за исключением применения 2-фтор-1-метил-4-((метилсульфонил)метил)бензола (813,0 мг, 4,02 ммоль) в качестве исходного материала с получением 2-фтор-1-метил-4-(2-(метилсульфонил)пропан-2-ил)бензола (620 мг, 67%).
1H-ЯМР (400 МГц, CDCl3): δ 7,26-7,32 (м, 2H), 7,21 (т, 1H, J=8,4 Гц), 2,54 (с, 3H), 2,28 (с, 3H), 1,82 (с, 6H)
(c) Синтез 1-(бромметил)-2-фтор-4-(2-(метилсульфонил)пропан-2-ил)бензола
Методику синтеза промежуточного соединения 1-d повторяют, за исключением применения 2-фтор-1-метил-4-(2-(метилсульфонил)пропан-2-ил)бензола (620,0 мг, 2,69 ммоль) с получением 1-(бромметил)-2-фтор-4-(2-(метилсульфонил)пропан-2-ил)бензола (680,0 мг, 79%).
1H-ЯМР (400 МГц, CDCl3): δ 7,35-7,46 (м, 3H), 4,51 (с, 2H), 2,58 (с, 3H), 1,84 (с, 6H)
(d) Синтез 2-фтор-4-(2-(метилсульфонил)пропан-2-ил)бензальдегида
Методику синтеза промежуточного соединения 1-e повторяют, за исключением применения 1-(бромметил)-2-фтор-4-(2-(метилсульфонил)пропан-2-ил)бензола (650,0 мг, 2,10 ммоль) в качестве исходного материала с получением 2-фтор-4-(2-(метилсульфонил)пропан-2-ил)бензальдегида (330,0 мг, 64%).
1H-ЯМР (400 МГц, CDCl3): δ 10,23 (с, 1H), 7,88 (т, 1H, J=8,3 Гц), 7,60-7,64 (м, 2H), 2,78 (с, 3H), 1,78 (с, 6H)
(e) Синтез метил 6-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксилата
Методику синтеза промежуточного соединения 1-f повторяют, за исключением применения 2-фтор-4-(2-(метилсульфонил)пропан-2-ил)бензальдегида (350,0 мг, 1,43 ммоль) в качестве исходного материала с получением метил 6-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксилата (265,0 мг, 59%).
1H-ЯМР (400 МГц, CDCl3): δ 8,33 (с, 1H), 8,22 (с, 1H), 8,04 (д, 1H, J=8,6 Гц), 7,73 (дд, 1H, J=8,6, 1,7 Гц), 3,90 (с, 3H), 2,74 (с, 3H), 1,84 (с, 6H)
(f) Синтез 6-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоновой кислоты
Методику синтеза промежуточного соединения 1-g повторяют, за исключением применения метил 6-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксилата (265,0 мг, 0,85 ммоль) в качестве исходного материала с получением 6-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоновой кислоты (230,0 мг, 91%).
ЖХ/МС ИЭР (-): 297 (M-1)
Промежуточное соединение 10) Синтез 5-(4-(метилсульфонил)тетрагидро-2H-пиран-4-ил)бензо[b]тиофен-2-карбоновой кислоты
(a) Синтез 4-(4-фтор-3-метилфенил)тетрагидро-2H-пиран-4-ола
4-Бром-1-фтор-2-метилбензол (1,0 г, 5,29 ммоль) растворяют в безводном ТГФ (26,0 мл) и добавляют 1,6 M раствор n-BuLi в ТГФ (3,5 мл, 5,55 ммоль) и тетрагидро-4H-пиран-4-он (556,0 мг, 5,55 ммоль) при -78°C. Реакционную смесь перемешивают при 0°C в течение 2 часов, добавляют H2O и экстрагируют EtOAc. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:EtOAc=1:1) с получением 4-(4-фтор-3-метилфенил)тетрагидро-2H-пиран-4-ола (800,0 мг, 72%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3): δ 7,31 (дд, 1H, J=7,3, 2,2 Гц), 7,26 (м, 1H), 6,99 (т, 1H, J=8,9 Гц), 3,84-3,98 (м, 4H), 2,29 (с, 3H), 2,08-2,18 (м, 2H), 1,65-1,69 (м, 3H)
(b) Синтез 4-(4-фтор-3-метилфенил)тетрагидро-2H-пиран-4-тиола
Методику синтеза промежуточного соединения 7-c повторяют, за исключением применения 4-(4-фтор-3-метилфенил)тетрагидро-2H-пиран-4-ола (800,0 мг, 3,80 ммоль) в качестве исходного материала с получением 4-(4-фтор-3-метилфенил)тетрагидро-2H-пиран-4-тиола (450,0 мг, 52%).
1H-ЯМР (400 МГц, ДМСО-d6): δ, 7,40 (дд, 1H, J=7,4, 2,4 Гц), 7,32 (м, 1H), 7,10 (т, 1H, J=8,9 Гц), 3,76-3,82 (м, 2H), 3,65-3,69 (м, 2H), 3,26 (с, 1H), 2,24 (с, 3H), 2,08-2,18 (м, 4H)
(c) Синтез 4-(4-фтор-3-метилфенил)-4-(метилтио)тетрагидро-2H-пирана
Методику синтеза промежуточного соединения 7-d повторяют, за исключением применения 4-(4-фтор-3-метилфенил)тетрагидро-2H-пиран-4-тиола (450,0 г, 1,99 ммоль) в качестве исходного материала с получением 4-(4-фтор-3-метилфенил)-4-(метилтио)тетрагидро-2H-пирана (300,0 мг, 63%).
1H-ЯМР (400 МГц, ДМСО-d6): δ 7,33 (д, 1H, J=7,4 Гц), 7,25 (м, 1H), 7,09 (т, 1H, J=9,0 Гц), 3,77-3,82 (м, 2H), 3,57-3,62 (м, 2H), 2,24 (с, 3H), 2,04-2,12 (м, 4H), 1,60 (с, 3H)
(d) Синтез 4-(4-фтор-3-метилфенил)-4-(метилсульфонил)тетрагидро-2H-пирана
Методику синтеза промежуточного соединения 7-e повторяют, за исключением применения 4-(4-фтор-3-метилфенил)-4-(метилтио)тетрагидро-2H-пирана (300,0 мг, 1,25 ммоль) в качестве исходного материала с получением 4-(4-фтор-3-метилфенил)-4-(метилсульфонил)тетрагидро-2H-пирана (300,0 мг, 89%).
1H-ЯМР (400 МГц, CDCl3): δ 7,39 (дд, 1H, J=7,0, 2,4 Гц), 7,33 (м, 1H), 7,10 (т, 1H, J=8,8 Гц), 3,98-4,02 (м, 2H), 3,40 (т, 2H, J=11,7 Гц), 2,55-2,63 (м, 2H), 2,42-2,47 (м, 5H), 2,33 (с, 3H)
(e) Синтез 4-(3-(бромметил)-4-фторфенил)-4-(метилсульфонил)тетрагидро-2H-пирана
Методику синтеза промежуточного соединения 1-d повторяют, за исключением применения 4-(4-фтор-3-метилфенил)-4-(метилсульфонил)тетрагидро-2H-пирана (300,0 мг, 1,10 ммоль) в качестве исходного материала с получением 4-(3-(бромметил)-4-фторфенил)-4-(метилсульфонил)тетрагидро-2H-пирана (340,0 мг, 88%).
1H-ЯМР (400 МГц, CDCl3): δ 7,59 (дд, 1H, J=6,9, 2,6 Гц), 7,50 (м, 1H), 7,19 (т, 1H, J=8,9 Гц), 4,54 (с, 2H), 3,98-4,02 (м, 2H), 3,36-3,42 (м, 2H), 2,55-2,65 (м, 2H), 2,42-2,50 (м, 5H)
(f) Синтез 2-фтор-5-(4-(метилсульфонил)тетрагидро-2H-пиран-4-ил)бензальдегида
Методику синтеза промежуточного соединения 1-e повторяют, за исключением применения 4-(3-(бромметил)-4-фторфенил)-4-(метилсульфонил)тетрагидро-2H-пирана (350,0 мг, 1,00 ммоль) в качестве исходного материала с получением 2-фтор-5-(4-(метилсульфонил)тетрагидро-2H-пиран-4-ил)бензальдегида (220,0 мг, 76%).
ЖХ/МС ИЭР (-): 285 (M-1)
(g) Синтез метил 5-(4-(метилсульфонил)тетрагидро-2H-пиран-4-ил)бензо[b]тиофен-2-карбоксилата
Методику синтеза промежуточного соединения 1-f повторяют, за исключением применения 2-фтор-5-(4-(метилсульфонил)тетрагидро-2H-пиран-4-ил)бензальдегида (110,0 мг, 0,38 ммоль) в качестве исходного материала с получением метил 5-(4-(метилсульфонил)тетрагидро-2H-пиран-4-ил)бензо[b]тиофен-2-карбоксилата (124,0 мг, 91%).
1H-ЯМР (400 МГц, CDCl3): δ, 8,06-8,09 (м, 2H), 7,97 (д, 1H, J=8,7 Гц), 7,66 (дд, 1H, J=8,7, 1,9 Гц), 4,03-4,06 (м, 2H), 3,97 (с, 3H), 3,43 (т, 2H, J=11,6 Гц), 2,56-2,72 (м, 4H), 2,49 (с, 3H)
(h) Синтез 5-(4-(метилсульфонил)тетрагидро-2H-пиран-4-ил)бензо[b]тиофен-2-карбоновой кислоты
Методику синтеза промежуточного соединения 1-g повторяют, за исключением применения метил 5-(4-(метилсульфонил)тетрагидро-2H-пиран-4-ил)бензо[b]тиофен-2-карбоксилата (124,0 мг, 0,35 ммоль) в качестве исходного материала с получением 5-(4-(метилсульфонил)тетрагидро-2H-пиран-4-ил)бензо[b]тиофен-2-карбоновой кислоты (104,0 мг, 87%).
ЖХ/МС ИЭР (-): 339 (M-1)
Промежуточное соединение 11) Синтез 6-(2-(метилсульфонил)пропан-2-ил)-1H-индол-2-карбоновой кислоты
(a) Синтез 2-(3-бром-4-метилфенил)пропан-2-ола
Методику синтеза промежуточного соединения 7-b повторяют, за исключением применения 1-(3-бром-4-метилфенил)этан-1-она (1,0 г, 4,69 ммоль) в качестве исходного материала с получением 2-(3-бром-4-метилфенил)пропан-2-ола (1,0 г, 96%).
1H-ЯМР (400 МГц, CDCl3): δ 7,67 (д, 1H, J=1,8 Гц), 7,31 (дд, 1H, J=7,9, 1,8 Гц), 7,20 (д, 1H, J=7,9 Гц), 2,38 (с, 3H), 1,70 (с, 1H), 1,56 (с, 6H)
(b) Синтез 2-(3-бром-4-метилфенил)пропан-2-тиола
Методику синтеза промежуточного соединения 7-c повторяют за исключением применения 2-(3-бром-4-метилфенил)пропан-2-ола (1,0 г, 4,50 ммоль) в качестве исходного материала с получением 2-(3-бром-4-метилфенил)пропан-2-тиола (1,0 г, 92%).
1H-ЯМР (400 МГц, CDCl3): δ 7,71 (с, 1H), 7,40 (д, 1H, J=8,0 Гц), 7,18 (д, 1H, J=8,0 Гц), 2,37 (с, 3H), 2,24 (с, 1H), 1,79 (с, 6H)
(c) Синтез (2-(3-бром-4-метилфенил)пропан-2-ил)(метил)сульфана
Методику синтеза промежуточного соединения 7-d повторяют, за исключением применения 2-(3-бром-4-метилфенил)пропан-2-тиола (1,0 г, 4,08 ммоль) в качестве исходного материала с получением (2-(3-бром-4-метилфенил)пропан-2-ил)(метил)сульфана (872,7 мг, 83%).
1H-ЯМР (400 МГц, CDCl3): δ 7,65 (д, 1H, J=2,0 Гц), 7,36 (дд, 1H, J=8,0, 2,0 Гц), 7,18 (д, 1H, J=8,0 Гц), 2,37 (с, 3H), 1,79 (с, 3H), 1,66 (с, 6H)
(d) Синтез 2-бром-1-метил-4-(2-(метилсульфонил)пропан-2-ил)бензола
Методику синтеза промежуточного соединения 7-e повторяют, за исключением применения (2-(3-бром-4-метилфенил)пропан-2-ил)(метил)сульфана (871,0 мг, 3,36 ммоль) в качестве исходного материала с получением 2-бром-1-метил-4-(2-(метилсульфонил)пропан-2-ил)бензола (973,7 мг, колич.).
1H-ЯМР (400 МГц, CDCl3): δ 7,76 (с, 1H), 7,51 (д, 1H, J=8,1 Гц), 7,27 (д, 1H, J=8,1 Гц), 2,56 (с, 3H), 2,41 (с, 3H), 1,82 (с, 6H)
(e) Синтез 2-бром-1-(бромметил)-4-(2-(метилсульфонил)пропан-2-ил)бензола
Методику синтеза промежуточного соединения 1-d повторяют, за исключением применения 2-бром-1-метил-4-(2-(метилсульфонил)пропан-2-ил)бензола (972,0 мг, 3,34 ммоль) в качестве исходного материала с получением 2-бром-1-(бромметил)-4-(2-(метилсульфонил)пропан-2-ил)бензола (894,4 мг, 72%).
1H-ЯМР (400 МГц, CDCl3): δ 7,82 (д, 1H, J=2,0 Гц), 7,61 (дд, 1H, J=8,2, 2,0 Гц), 7,50 (д, 1H, J=8,2 Гц), 4,59 (с, 2H), 2,59 (с, 3H), 1,84 (с, 6H)
(f) Синтез 2-бром-4-(2-(метилсульфонил)пропан-2-ил)бензальдегида
Методику синтеза промежуточного соединения 1-e повторяют, за исключением применения 2-бром-1-(бромметил)-4-(2-(метилсульфонил)пропан-2-ил)бензола (890,0 мг, 2,41 ммоль) в качестве исходного материала с получением 2-бром-4-(2-(метилсульфонил)пропан-2-ил)бензальдегида (475,9 мг, 65%).
1H-ЯМР (400 МГц, CDCl3): δ 10,36 (с, 1H), 7,94 (д, 1H, J=8,3 Гц), 7,92 (д, 1H, J=1,8 Гц), 7,74 (дд, 1H, J=8,3, 1,2 Гц), 2,62 (с, 3H), 1,88 (с, 6H)
(g) Синтез метил (Z)-2-(((бензилокси)карбонил)амино)-3-(2-бром-4-(2-(метилсульфонил)пропан-2-ил)фенил)акрилата
2-Бром-4-(2-(метилсульфонил)пропан-2-ил)бензальдегид (441,0 мг, 1,45 ммоль), метил 2-(((бензилокси)карбонил)амино)-2-(диметоксифосфорил)ацетат (622,0 мг, 1,88 ммоль) и ДБУ (330,0 мг, 2,17 ммоль) растворяют в CH2Cl2 (14,5 мл). Реакционную смесь перемешивают при комнатной температуре в течение 30 минут, добавляют H2O и экстрагируют CH2Cl2. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (амин силикагель, n-Hex:EtOAc=1:1) с получением метил (Z)-2-(((бензилокси)карбонил)амино)-3-(2-бром-4-(2-(метилсульфонил)пропан-2-ил)фенил)акрилата (570,0 мг, 77%).
ЖХ/МС ИЭР (+): 510 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,82 (с, 1H), 7,51 (с, 2H), 7,32-7,37 (м, 4H), 7,26-7,29 (м, 2H), 6,55 (шс, 1H), 5,04 (с, 2H), 3,87 (с, 3H), 2,53 (с, 3H), 1,82 (с, 6H)
(h) Синтез метил 6-(2-(метилсульфонил)пропан-2-ил)-1H-индол-2-карбоксилата
Метил (Z)-2-(((бензилокси)карбонил)амино)-3-(2-бром-4-(2-(метилсульфонил)пропан-2-ил)фенил)акрилат (570,0 мг, 1,12 ммоль), CuI (42,5 мг, 0,22 ммоль), L-пролин (51,4 мг, 0,45 ммоль) и K2CO3 (463,0 мг, 3,35 ммоль) растворяют в 1,4-диоксане (5,6 мл). Реакционную смесь перемешивают при 100°C в течение 2 дней, добавляют H2O и экстрагируют EtOAc. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (амин силикагель, n-Hex:EtOAc=1:1) с получением метил 6-(2-(метилсульфонил)пропан-2-ил)-1H-индол-2-карбоксилата (227,0 мг, 69%).
1H-ЯМР (400 МГц, ДМСО-d6): δ 12,02 (с, 1H), 7,67-7,69 (м, 2H), 7,37 (дд, 1H, J=8,6, 1,8 Гц), 7,16 (д, 1H, J=1,5 Гц), 3,88 (с, 3H), 2,68 (с, 3H), 1,80 (с, 6H)
(i) Синтез гидрохлорида 6-(2-(метилсульфонил)пропан-2-ил)-1H-индол-2-карбоновой кислоты
Методику синтеза промежуточного соединения 1-g повторяют, за исключением применения метил 6-(2-(метилсульфонил)пропан-2-ил)-1H-индол-2-карбоксилата (227,0 мг, 0,77 ммоль) в качестве исходного материала с получением гидрохлорида 6-(2-(метилсульфонил)пропан-2-ил)-1H-индол-2-карбоновой кислоты (170,0 мг, 79%).
1H-ЯМР (400 МГц, ДМСО-d6): δ 13,02 (шс, 1H), 11,82 (с, 1H), 7,64-7,67 (м, 2H), 7,35 (дд, 1H, J=8,8, 1,6 Гц), 7,07 (д, 1H, J=1,6 Гц), 2,67 (с, 3H), 1,80 (с, 6H)
Промежуточное соединение 12) Синтез 5-(2-((2-метоксиэтил)сульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоновой кислоты
(a) Синтез 2-(4-фтор-3-метилфенил)пропан-2-ола
Методику синтеза промежуточного соединения 7-b повторяют, за исключением применения 1-(4-фтор-3-метилфенил)этан-1-она (1,0 г, 6,57 ммоль) в качестве исходного материала с получением 2-(4-фтор-3-метилфенил)пропан-2-ола (872,0 мг, 79%).
1H-ЯМР (400 МГц, CDCl3): δ 7,31 (дд, 1H, J=7,4, 2,1 Гц), 7,25 (м, 1H), 6,95 (т, 1H, J=8,9 Гц), 2,28 (с, 3H), 1,71 (с, 1H), 1,57 (с, 6H)
(b) Синтез 2-(4-фтор-3-метилфенил)пропан-2-тиола
Методику синтеза промежуточного соединения 7-c повторяют, за исключением применения 2-(4-фтор-3-метилфенил)пропан-2-ола (872,0 мг, 5,18 ммоль) в качестве исходного материала с получением 2-(4-фтор-3-метилфенил)пропан-2-тиола (955,0 мг, 85%).
1H-ЯМР (400 МГц, CDCl3): δ 7,37 (дд, 1H, J=7,1, 2,3 Гц), 7,32 (м, 1H), 6,93 (т, 1H, J=8,9 Гц), 2,28 (с, 3H), 2,24 (с, 1H), 1,81 (с, 6H)
(c) Синтез (2-(4-фтор-3-метилфенил)пропан-2-ил)(2-метоксиэтил)сульфана
2-(4-Фтор-3-метилфенил)пропан-2-тиол (400,0 мг, 2,17 ммоль) растворяют в безводном ДМФ(16,3 мл) и добавляют 1-бром-2-метоксиэтан (392,0 мг, 2,82 ммоль) и Cs2CO3 (1,4 г, 4,34 ммоль). Реакционную смесь перемешивают при 70°C в течение 5 часов, охлаждают до комнатной температуры, добавляют H2O и экстрагируют EtOAc. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:EtOAc=9:1) с получением (2-(4-фтор-3-метилфенил)пропан-2-ил)(2-метоксиэтил)сульфана (420,0 мг, 80%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3): δ 7,34 (дд, 1H, J=7,4, 2,3 Гц), 7,29 (м, 1H), 6,92 (т, 1H, J=8,9 Гц), 3,32 (т, 2H, J=6,7 Гц), 3,26 (с, 3H), 2,43 (т, 2H, J=6,7 Гц), 2,27 (с, 3H), 1,68 (с, 6H)
(d) Синтез 1-фтор-4-(2-((2-метоксиэтил)сульфонил)пропан-2-ил)-2-метилбензола
Методику синтеза промежуточного соединения 7-e повторяют, за исключением применения (2-(4-фтор-3-метилфенил)пропан-2-ил)(2-метоксиэтил)сульфана (420,0 мг, 1,73 ммоль) в качестве исходного материала с получением 1-фтор-4-(2-((2-метоксиэтил)сульфонил)пропан-2-ил)-2-метилбензола (410,0 мг, 86%).
1H-ЯМР (400 МГц, CDCl3): δ 7,32-7,40 (м, 2H), 7,02 (т, 1H, J=8,9 Гц), 3,64 (т, 2H, J=6,7 Гц), 3,29 (с, 3H), 2,91 (т, 2H, J=6,7 Гц), 2,30 (с, 3H), 1,82 (с, 6H)
(e) Синтез 2-(бромметил)-1-фтор-4-(2-((2-метоксиэтил)сульфонил)пропан-2-ил)бензола
Методику синтеза промежуточного соединения 1-d повторяют, за исключением применения 1-фтор-4-(2-((2-метоксиэтил)сульфонил)пропан-2-ил)-2-метилбензола (410,0 мг, 1,49 ммоль) в качестве исходного материала to с получением 2-(бромметил)-1-фтор-4-(2-((2-метоксиэтил)сульфонил)пропан-2-ил)бензола (40,0 мг, 8%).
1H-ЯМР (400 МГц, CDCl3): δ 7,65 (дд, 1H, J=7,0, 2,6 Гц), 7,58 (м, 1H), 7,10 (т, 1H, J=9,0 Гц), 4,52 (с, 2H), 3,64 (т, 2H, J=6,5 Гц), 3,29 (с, 3H), 2,93 (т, 2H, J=6,5 Гц), 1,84 (с, 6H)
(f) Синтез 2-фтор-5-(2-((2-метоксиэтил)сульфонил)пропан-2-ил)бензальдегида
Методику синтеза промежуточного соединения 1-e повторяют, за исключением применения 2-(бромметил)-1-фтор-4-(2-((2-метоксиэтил)сульфонил)пропан-2-ил)бензола (60,0 мг, 0,17 ммоль) в качестве исходного материала с получением 2-фтор-5-(2-((2-метоксиэтил)сульфонил)пропан-2-ил)бензальдегида (36,0 мг, 74%).
1H-ЯМР (400 МГц, CDCl3): δ 10,30 (с, 1H), 7,99 (дд, 1H, J=6,4, 2,7 Гц), 7,93 (м, 1H), 7,17 (т, 1H, J=9,2 Гц), 3,62 (т, 2H, J=6,4 Гц), 3,23 (с, 3H), 2,87 (т, 2H, J=6,4 Гц), 1,80 (с, 6H)
(g) Синтез метил 5-(2-((2-метоксиэтил)сульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксилата
Методику синтеза промежуточного соединения 1-f повторяют, за исключением применения 2-фтор-5-(2-((2-метоксиэтил)сульфонил)пропан-2-ил)бензальдегида (36,0 мг, 0,13 ммоль) в качестве исходного материала с получением метил 5-(2-((2-метоксиэтил)сульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксилата (30,0 мг, 67%).
1H-ЯМР (400 МГц, CDCl3): δ 8,10 (с, 1H), 8,07 (с, 1H), 7,90 (д, 1H, J=8,7 Гц), 7,78 (дд, 1H, J=8,7, 2,0 Гц), 3,96 (с, 3H), 3,63 (т, 2H, J=6,4 Гц), 3,25 (с, 3H), 2,91 (т, 2H, J=6,4 Гц), 1,93 (с, 6H)
(h) Синтез 5-(2-((2-метоксиэтил)сульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоновой кислоты
Методику синтеза промежуточного соединения 1-g повторяют, за исключением применения метил 5-(2-((2-метоксиэтил)сульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксилата (30,0 мг, 0,08 ммоль) в качестве исходного материала с получением 5-(2-((2-метоксиэтил)сульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоновой кислоты (27,0 мг, 94%).
ЖХ/МС ИЭР (-): 341 (M-1)
Промежуточное соединение 13) Синтез 5-((S-метилсульфонимидоил)метил)бензо[b]тиофен-2-карбоновой кислоты
(a) Синтез (4-фтор-3-метилбензил)(метил)сульфана
4-(Бромметил)-1-фтор-2-метилбензол (1,0 г, 4,92 ммоль) и метантиолат натрия (380,0 мг, 5,42 ммоль) растворяют в ДМФ (24,6 мл). Реакционную смесь перемешивают при комнатной температуре в течение 16 часов, добавляют H2O и экстрагируют EtOAc. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:CH2Cl2=4:1) с получением (4-фтор-3-метилбензил)(метил)сульфана (709,0 мг, 85%) в виде бесцветной жидкости.
1H-ЯМР (400 МГц, CDCl3): δ 7,12 (д, 1H, J=7,3 Гц), 7,06 (м, 1H), 6,93 (м, 1H), 3,61 (с, 2H), 2,26 (с, 3H), 1,99 (с, 3H)
(b) Синтез (E)-N-((4-фтор-3-метилбензил)(метил)-λ4-сульфанилиден)-4-нитробензолсульфонамида
(4-Фтор-3-метилбензил)(метил)сульфан (600,0 мг, 3,52 ммоль), 4-нитробензолсульфонамид (869,0 мг, 4,39 ммоль) и (диацетоксийод)бензол (1,7 г, 5,37 ммоль) растворяют в CH3CN (35,8 мл). Реакционную смесь перемешивают при 90°C в течение 16 часов, охлаждают до комнатной температуры и концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с обращенной фазой (C18-силикагель, CH3CN:H2O) с получением (E)-N-((4-фтор-3-метилбензил)(метил)-λ4-сульфанилиден)-4-нитробензолсульфонамида (606,0 мг, 46%).
ЖХ/МС ИЭР (+): 371 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 8,18 (д, 2H, J=8,9 Гц), 7,88 (д, 2H, J=8,9 Гц), 7,01-7,05 (м, 2H), 6,91 (м, 1H), 4,16 (д, 1H, J=12,8 Гц), 4,07 (д, 1H, J=12,8 Гц), 2,66 (с, 3H), 2,20 (д, 3H, J=1,9 Гц)
(c) Синтез сульфонамида N-((4-фтор-3-метилбензил)(метил)(оксо)-λ6-сульфанилиден)-4-нитробензола
Сульфонамид (E)-N-((4-фтор-3-метилбензил)(метил)-λ4-сульфанилиден)-4-нитробензола (600,0 мг, 1,62 ммоль), RuCl3·H2O (36,5 мг, 0,16 ммоль) и NaIO4 (520,0 мг, 2,43 ммоль) растворяют в смеси CH2Cl2/H2O (16,3 мл, 10/3 об./об.). Реакционную смесь перемешивают при комнатной температуре в течение 16 часов, добавляют H2O и экстрагируют CH2Cl2. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (амин силикагель, n-Hex:EtOAc=1:2) с получением сульфонамида N-((4-фтор-3-метилбензил)(метил)(оксо)-λ6-сульфанилиден)-4-нитробензола (546,0 мг, 87%).
1H-ЯМР (400 МГц, CDCl3): δ 8,32 (д, 2H, J=9,0 Гц), 8,14 (д, 2H, J=9,0 Гц), 7,30 (дд, 1H, J=6,9, 1,9 Гц), 7,25 (м, 1H), 7,08 (м, 1H), 4,69 (с, 2H), 3,09 (с, 3H), 2,31 (д, 3H, J=1,8 Гц)
(d) Синтез сульфонамида N-((3-(бромметил)-4-фторбензил)(метил)(оксо)-λ6-сульфанилиден)-4-нитробензола
Методику синтеза промежуточного соединения 1-d повторяют, за исключением применения сульфонамида N-((4-фтор-3-метилбензил)(метил)(оксо)-λ6-сульфанилиден)-4-нитробензола (546,0 мг, 1,41 ммоль) в качестве исходного материала с получением сульфонамида N-((3-(бромметил)-4-фторбензил)(метил)(оксо)-λ6-сульфанилиден)-4-нитробензола (657,0 мг, колич.).
1H-ЯМР (400 МГц, CDCl3): δ 8,32 (д, 2H, J=9,0 Гц), 8,13 (д, 2H, J=9,0 Гц), 7,52 (м, 1H), 7,43 (м, 1H), 7,17 (м, 1H), 4,72 (с, 2H), 4,51 (с, 2H), 3,13 (с, 3H)
(e) Синтез N-((4-фтор-3-формилбензил)(метил)(оксо)-λ6-сульфанилиден)-4-нитробензол сульфонамид
Методику синтеза промежуточного соединения 1-e повторяют, за исключением применения сульфонамида N-((3-(бромметил)-4-фторбензил)(метил)(оксо)-λ6-сульфанилиден)-4-нитробензола (657,0 мг, 1,41 ммоль) в качестве исходного материала с получением сульфонамида N-((4-фтор-3-формилбензил)(метил)(оксо)-λ6-сульфанилиден)-4-нитробензола (357,7 мг, 63%).
1H-ЯМР (400 МГц, CDCl3): δ 10,38 (с, 1H), 8,33 (д, 2H, J=8,8 Гц), 8,14 (д, 2H, J=8,8 Гц), 7,92 (дд, 1H, J=6,2, 2,4 Гц), 7,82-7,86 (м, 1H), 7,34 (м, 1H), 4,75-4,83 (м, 2H), 3,14 (с, 3H)
(f) Синтез метил 5-((S-метилсульфонимидоил)метил)бензо[b]тиофен-2-карбоксилата
Методику синтеза промежуточного соединения 1-f повторяют, за исключением применения сульфонамида N-((4-фтор-3-формилбензил)(метил)(оксо)-λ6-сульфанилиден)-4-нитробензола (306,0 мг, 0,77 ммоль) в качестве исходного материала с получением метил 5-((S-метилсульфонимидоил)метил)бензо[b]тиофен-2-карбоксилата (139,0 мг, 65%).
ЖХ/МС ИЭР (+): 284 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 8,08 (с, 1H), 7,91-7,93 (м, 2H), 7,51 (дд, 1H, J=8,5, 1,7 Гц), 4,52 (д, 1H, J=13,1 Гц), 4,36 (д, 1H, J=13,1 Гц), 3,97 (с, 3H), 3,77 (с, 1H), 2,97 (с, 3H)
(g) Синтез 5-((S-метилсульфонимидоил)метил)бензо[b]тиофен-2-карбоновой кислоты
Методику синтеза промежуточного соединения 1-g повторяют, за исключением применения метил 5-((S-метилсульфонимидоил)метил)бензо[b]тиофен-2-карбоксилата (137,0 мг, 0,48 ммоль) в качестве исходного материала с получением 5-((S-метилсульфонимидоил)метил)бензо[b]тиофен-2-карбоновой кислоты (93,4 мг, 46%).
ЖХ/МС ИЭР (+): 270 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 8,13 (с, 1H), 8,06 (д, 1H, J=8,3 Гц), 8,04 (с, 1H), 7,57 (дд, 1H, J=8,4, 1,4 Гц), 4,55-4,57 (м, 3H), 2,86 (д, 3H, J=3,5 Гц)
Промежуточное соединение 14) Синтез 5-(1,1-диоксидотетрагидротиофен-2-ил)бензо[b]тиофен-2-карбоновой кислоты
(a) Синтез метил 5-(1,1-диоксидотетрагидротиофен-2-ил)бензо[b]тиофен-2-карбоксилата
1,1-Диоксид тетрагидротиофена (124,0 мг, 1,03 ммоль) растворяют в безводном ТГФ (7,3 мл) и добавляют по каплям 1 M раствор бис(триметилсилил)амида лития в ТГФ (1,5 мл, 1,55 ммоль) при -20°C. Реакционную смесь перемешивают при комнатной температуре в течение 30 минут и добавляют ZnCl2 (211,0 мг, 1,55 ммоль) при -20°C. Реакционную смесь медленно нагревают до комнатной температуры, добавляют метил 5-бромбензо[b]тиофен-2-карбоксилат (200,0 мг, 0,74 ммоль), Pd(OAc)2 (8,3 мг, 0,04 ммоль) и XPhos (35,2 мг, 0,07 ммоль) и перемешивают при 65°C в течение 5 часов. Реакционную смесь охлаждают до комнатной температуры, добавляют H2O и экстрагируют EtOAc. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:EtOAc=9:1) с получением метил 5-(1,1-диоксидотетрагидротиофен-2-ил)бензо[b]тиофен-2-карбоксилата (60,0 мг, 26%) в виде беловатого твердого вещества.
1H-ЯМР (400 МГц, CDCl3): δ 8,06 (с, 1H), 7,89-7,91 (м, 2H), 7,49 (дд, 1H, J=8,4, 2,0 Гц), 4,30 (м, 1H), 3,95 (с, 3H), 2,95-3,35 (м, 3H), 2,22-2,58 (м, 3H)
(b) Синтез 5-(1,1-диоксидотетрагидротиофен-2-ил)бензо[b]тиофен-2-карбоновой кислоты
Методику синтеза промежуточного соединения 1-g повторяют, за исключением применения метил 5-(1,1-диоксидотетрагидротиофен-2-ил)бензо[b]тиофен-2-карбоксилата (70,0 мг, 0,23 ммоль) в качестве исходного материала с получением 5-(1,1-диоксидотетрагидротиофен-2-ил)бензо[b]тиофен-2-карбоновой кислоты (60,0 мг, 90%) в виде белого твердого вещества.
ЖХ/МС ИЭР (-): 295 (M-1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 13,55 (с, 1H), 8,13 (с, 1H), 8,08 (д, 1H, J=8,5 Гц), 8,02 (с, 1H), 7,51 (д, 1H, J=8,4 Гц), 4,50 (м, 1H), 3,17-3,36 (м, 2H), 2,38-2,46 (м, 2H), 2,13-2,28 (м, 2H)
Промежуточное соединение 15) Синтез 5-(1,1-диоксидотетрагидро-2H-тиопиран-2-ил)бензо[b]тиофен-2-карбоновой кислоты
(a) Синтез метил 5-(1,1-диоксидотетрагидро-2H-тиопиран-2-ил)бензо[b]тиофен-2-карбоксилата
Методику синтеза промежуточного соединения 14-a повторяют, за исключением применения метил 5-бромбензо[b]тиофен-2-карбоксилата (95,0 мг, 0,35 ммоль) и 1,1-диоксида тетрагидро-2H-тиопирана (66,0 мг, 0,49 ммоль) в качестве исходного материала с получением метил 5-(1,1-диоксидотетрагидро-2H-тиопиран-2-ил)бензо[b]тиофен-2-карбоксилата (26,0 мг, 23%) в виде беловатого твердого вещества.
1H-ЯМР (400 МГц, CDCl3): δ 8,06 (с, 1H), 7,95 (с, 1H), 7,89 (д, 1H, J=8,5 Гц), 7,53 (д, 1H, J=8,5 Гц), 4,15 (м, 1H), 3,95 (с, 3H), 3,09-3,29 (м, 2H), 1,56-2,59 (м, 6H)
(b) Синтез 5-(1,1-диоксидотетрагидро-2H-тиопиран-2-ил)бензо[b]тиофен-2-карбоновой кислоты
Методику синтеза промежуточного соединения 1-g повторяют, за исключением применения метил 5-(1,1-диоксидотетрагидро-2H-тиопиран-2-ил)бензо[b]тиофен-2-карбоксилата (26,0 мг, 0,08 ммоль) в качестве исходного материала с получением 5-(1,1-диоксидотетрагидро-2H-тиопиран-2-ил)бензо[b]тиофен-2-карбоновой кислоты (22,0 мг, 88%) в виде белого твердого вещества.
ЖХ/МС ИЭР (-): 309 (M-1)
Пример 1) Синтез N-(3-хлор-5-(2-(3-этокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида
(a) Синтез 3-хлор-5-нитробензоилхлорида
3-Хлор-5-нитробензойную кислоту (5,0 г, 24,81 ммоль) растворяют в SOCl2 (10,0 мл, 137,00 ммоль) и добавляют каталитическое количество безводного ДМФ. Реакционную смесь кипятят с обратным холодильником при 110°C в течение 2 часов и концентрируют при пониженном давлении с получением 3-хлор-5-нитробензоилхлорида (5,3 г, колич.) в виде желтой жидкости без очистки.
(b) Синтез (3-хлор-5-нитрофенил)(3-метокси-5-(трифторметокси)фенил)метанона
3-Хлор-5-нитробензоилхлорид (5,0 г, 22,70 ммоль) растворяют в безводном Et2O (230,0 мл) и добавляют (3-метокси-5-(трифторметокси)фенил)бороновую кислоту (5,4 г, 22,70 ммоль), Pd(dba)2 (1,3 г, 2,27 ммоль), PPh3 (1,2 г, 4,54 ммоль) и тиофен-2-карбоксилат меди (4,3 г, 22,70 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 15 часов, фильтруют через Целит и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (амин силикагель, n-Hex:EtOAc=9:1) с получением (3-хлор-5-нитрофенил)(3-метокси-5-(трифторметокси)фенил)метанона (4,2 г, 41%) в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3): δ 8,49 (с, 1H), 8,46 (с, 1H), 8,10 (с, 1H), 7,26 (с, 1H), 7,18 (с, 1H), 7,05 (с, 1H), 3,90 (с, 3H)
(c) Синтез 1-хлор-3-(дихлор(3-метокси-5-(трифторметокси)фенил)метил)-5-нитробензола
(3-Хлор-5-нитрофенил)(3-метокси-5-(трифторметокси)фенил)метанон (4,0 г, 10,65 ммоль) растворяют в 1,2-дибромэтане (106,0 мл) и добавляют PCl5 (11,1 г, 53,24 ммоль). Реакционную смесь перемешивают при 110°C в течение 24 часов и охлаждают до комнатной температуры. Реакционную смесь выливают в a раствор NaHCO3 в ледяной воде, энергично перемешивают и экстрагируют CH2Cl2. Органический экстракт сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (амин силикагель, n-Hex:EtOAc=20:1) с получением 1-хлор-3-(дихлор(3-метокси-5-(трифторметокси)фенил)метил)-5-нитробензола (1,4 г, 30%) в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3): δ 8,37 (с, 1H), 8,24 (с, 1H), 7,91 (с, 1H), 7,08 (с, 1H), 7,05 (с, 1H), 6,81 (с, 1H), 3,84 (с, 3H)
(d) Синтез 1-хлор-3-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)-5-нитробензола
1M раствор TiCl4 в CH2Cl2 (0,6 мл, 0,63 ммоль) добавляют в 1,2 M раствор диметилцинка в толуоле (7,8 мл, 9,41 ммоль) при -40°C и перемешивают в течение 1 часа. 1-Хлор-3-(дихлор(3-метокси-5-(трифторметокси)фенил)метил)-5-нитробензол (1,4 г, 3,14 ммоль) в CH2Cl2 (11,4 мл) медленно добавляют по каплям при -40°C, и реакционную смесь нагревают до 0°C и перемешивают в течение 18 часов. Добавляют H2O, и реакционную смесь экстрагируют CH2Cl2. Органический экстракт сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (амин силикагель, n-Hex:EtOAc=9:1) с получением 1-хлор-3-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)-5-нитробензола (750,0 мг, 61%) в виде желтого твердого вещества.
1H-ЯМР (400 МГц, CDCl3): δ 8,07 (с, 1H), 8,00 (с, 1H), 7,48 (с, 1H), 6,62-6,65 (м, 3H), 3,78 (с, 3H), 1,70 (с, 6H)
(e) Синтез 3-(2-(3-хлор-5-нитрофенил)пропан-2-ил)-5-(трифторметокси)фенола
1-Хлор-3-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)-5-нитробензол (450,0 мг, 1,15 ммоль) растворяют в безводном CH2Cl2 (8,0 мл) и 1 M раствор BBr3 в CH2Cl2 (3,5 мл, 3,46 ммоль) медленно добавляют по каплям при 0°C. Реакционную смесь перемешивают при комнатной температуре в течение 8 часов, добавляют H2O при 0°C и экстрагируют CH2Cl2. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:EtOAc=3:1) с получением 3-(2-(3-хлор-5-нитрофенил)пропан-2-ил)-5-(трифторметокси)фенола (380,0 мг, 88%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3): δ 8,07 (с, 1H), 8,00 (с, 1H), 7,48 (с, 1H), 6,64 (с, 1H), 6,61 (с, 1H), 6,55 (с, 1H), 5,00 (с, 1H), 1,69 (с, 6H)
(f) Синтез 1-хлор-3-(2-(3-этокси-5-(трифторметокси)фенил)пропан-2-ил)-5-нитробензола
3-(2-(3-Хлор-5-нитрофенил)пропан-2-ил)-5-(трифторметокси)фенол (370,0 мг, 0,98 ммоль) растворяют в безводном ДМФ (9,8 мл) и добавляют K2CO3 (406,0 мг, 2,94 ммоль) и йодэтан (158,0 мл, 1,97 ммоль). Реакционную смесь перемешивают при 40°C for 15 часов, добавляют H2O и экстрагируют EtOAc. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:EtOAc=9:1) с получением 1-хлор-3-(2-(3-этокси-5-(трифторметокси)фенил)пропан-2-ил)-5-нитробензола (386,0 мг, 97%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3): δ 8,07 (с, 1H), 8,00 (с, 1H), 7,48 (с, 1H), 6,60-6,63 (м, 3H), 3,98 (кв, 2H, J=7,0 Гц), 1,69 (с, 6H), 1,40 (т, 3H, J=7,0 Гц)
(g) Синтез 3-хлор-5-(2-(3-этокси-5-(трифторметокси)фенил)пропан-2-ил)анилина
1-Хлор-3-(2-(3-этокси-5-(трифторметокси)фенил)пропан-2-ил)-5-нитробензол (380,0 мг, 0,94 ммоль) растворяют в смеси MeOH/H2O (10,0 мл, 9/1 об./об.) и добавляют Zn (616,0 мг, 9,43 ммоль) и NH4Cl (504,0 мг, 9,43 ммоль) при комнатной температуре. Реакционную смесь обрабатывают ультразвуком при 40°C в течение 40 минут, охлаждают до комнатной температуры, фильтруют через Целит и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (амин силикагель, n-Hex:EtOAc=1:1) с получением 3-хлор-5-(2-(3-этокси-5-(трифторметокси)фенил)пропан-2-ил)анилина (350,0 мг, 98%) в виде белого твердого вещества.
ЖХ/МС ИЭР (+): 374 (M+H1)
(h) Синтез N-(3-хлор-5-(2-(3-этокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида
5-(2-(Метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоновую кислоту (38,8 мг, 0,13 ммоль), 3-хлор-5-(2-(3-этокси-5-(трифторметокси)фенил)пропан-2-ил)анилин (48,6 мг, 0,13 ммоль) и ГАТУ (53,0 мг, 0,14 ммоль) растворяют в безводном ДМФ (1,3 мл) и добавляют ДИПЭА (44,0 мкл, 0,24 ммоль). Реакционную смесь перемешивают при 40°C в течение 3 часов, добавляют H2O и экстрагируют CH2Cl2. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с обращенной фазой (C18-силикагель, 0,1% муравьиной кислоты в CH3CN:0,1% муравьиной кислоты в H2O) с получением N-(3-хлор-5-(2-(3-этокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида (35,0 мг, 41%) в виде белого твердого вещества.
ЖХ/МС ИЭР (+): 654 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,65 (с, 1H), 8,34 (с, 1H), 8,20 (с, 1H), 8,09 (д, 1H, J=8,8 Гц), 7,88 (с, 1H), 7,74 (д, 1H, J=8,8 Гц), 7,52 (с, 1H), 7,04 (с, 1H), 6,77 (с, 2H), 6,72 (с, 1H), 4,01 (кв, 2H, J=6,9 Гц), 2,73 (с, 3H), 1,84 (с, 6H), 1,64 (с, 6H), 1,29 (т, 3H, J=6,9 Гц)
Соединения из Примеров 2-16 синтезируют с применением способа синтеза, описанного в примере 1, и данные этих соединений перечислены ниже.
Таблица 2
Пример 17) Синтез N-(3-хлор-5-(2-(4-метоксифенил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида
(a) Синтез 1-хлор-3-(2-(4-метоксифенил)пропан-2-ил)-5-нитробензола
1-(2-Бромпропан-2-ил)-3-хлор-5-нитробензол (30,0 мг, 0,11 ммоль) и анизол (0,1 мл, 1,07 ммоль) растворяют в 1,2-дихлорэтане (1,1 мл) и добавляют AlCl3 (44,0 мг, 0,33 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 12 часов, H2O добавляют и экстрагируют CH2Cl2. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:EtOAc=9:1) с получением 1-хлор-3-(2-(4-метоксифенил)пропан-2-ил)-5-нитробензола (40,0 мг, 90%) в виде желтого твердого вещества.
1H-ЯМР (400 МГц, CDCl3): δ 8,03 (с, 1H), 8,01 (с, 1H), 7,49 (с, 1H), 7,11 (д, 2H, J=8,4 Гц), 6,84 (д, 2H, J=8,6 Гц), 3,81 (с, 3H), 1,70 (с, 6H)
(b) Синтез 3-хлор-5-(2-(4-метоксифенил)пропан-2-ил)анилина
Методику синтеза из примера 1-g повторяют, за исключением применения 1-хлор-3-(2-(4-метоксифенил)пропан-2-ил)-5-нитробензола (84,2 мг, 0,24 ммоль) в качестве исходного материала с получением 3-хлор-5-(2-(4-метоксифенил)пропан-2-ил)анилина (20,0 мг, 56%).
ЖХ/МС ИЭР (+): 276 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,14 (д, 2H, J=8,4 Гц), 6,81 (д, 2H, J=8,6 Гц), 6,64 (с, 1H), 6,49 (с, 1H), 6,36 (с, 1H), 3,79 (с, 3H), 3,62 (с, 2H), 1,59 (с, 6H)
(c) Синтез N-(3-хлор-5-(2-(4-метоксифенил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида
Методику синтеза из примера 1-h повторяют, за исключением применения 3-хлор-5-(2-(4-метоксифенил)пропан-2-ил)анилина (81,0 мг, 0,27 ммоль) в качестве исходного материала с получением N-(3-хлор-5-(2-(4-метоксифенил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида (40,0 мг, 27%).
ЖХ/МС ИЭР (+): 556 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,64 (с, 1H), 8,36 (с, 1H), 8,20 (с, 1H), 8,10 (д, 1H, J=8,4 Гц), 7,87 (с, 1H), 7,75 (дд, 1H, J=8,4, 1,6 Гц), 7,54 (с, 1H), 7,17 (д, 2H, J=8,8 Гц), 7,00 (с, 1H), 6,88 (д, 2H, J=8,8 Гц), 3,74 (с, 3H), 2,74 (с, 3H), 1,86 (с, 6H), 1,64 (с, 6H)
Соединения из примеров с 18 до 36 синтезируют с применением способа синтеза, описанного в примере 17 и данные этих соединений перечислены ниже.
Таблица 3
Пример 37) Синтез N-(3-хлор-5-(4-(трифторметокси)фенокси)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида
(a) Синтез 1-хлор-3-нитро-5-(4-(трифторметокси)фенокси)бензола
1-Бром-3-хлор-5-нитробензол (200,0 мг, 0,84 ммоль), 4-(трифторметокси)фенол (220,0 мг, 1,69 ммоль), CuI (80,6 мг, 0,42 ммоль), N,N-диметилглицин (87,2 мг, 0,42 ммоль) и Cs2CO3 (826,9 мг, 2,53 ммоль) растворяют в безводном 1,4-диоксане (5,0 мл). Реакционную смесь перемешивают при 120°C в течение 15 часов, охлаждают до комнатной температуры, добавляют H2O и экстрагируют EtOAc. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex) с получением 1-хлор-3-нитро-5-(4-(трифторметокси)фенокси)бензола (160,0 мг, 61%) в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3): δ 7,95 (с, 1H), 7,65 (с, 1H), 7,26-7,30 (м, 3H), 7,09 (д, 2H, J=8,8 Гц)
(b) Синтез 3-хлор-5-(4-(трифторметокси)фенокси)анилина
Методику синтеза из примера 1-g повторяют, за исключением применения 1-хлор-3-нитро-5-(4-(трифторметокси)фенокси)бензола (160,0 мг, 0,52 ммоль) в качестве исходного материала с получением 3-хлор-5-(4-(трифторметокси)фенокси)анилина (130,0 мг, 79%) в виде беловатого масла.
ЖХ/МС ИЭР (+): 304 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,31 (д, 2H, J=8,7 Гц), 6,95 (д, 2H, J=8,7 Гц), 6,41 (с, 1H), 6,34 (с, 1H), 6,16 (с, 1H), 3,76 (шс, 2H)
(c) Синтез N-(3-хлор-5-(4-(трифторметокси)фенокси)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида
Методику синтеза из примера 1-h повторяют, за исключением применения 3-хлор-5-(4-(трифторметокси)фенокси)анилина (130,0 мг, 0,42 ммоль) и 5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоновой кислоты (150,0 мг, 0,55 ммоль) в качестве исходных материалов, с получением N-(3-хлор-5-(4-(трифторметокси)фенокси)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида (75,0 мг, 47%) в виде белого твердого вещества.
ЖХ/МС ИЭР (+): 584 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,74 (шс, 1H), 8,34 (с, 1H), 8,21 (с, 1H), 8,09 (д, 1H, J=8,7 Гц), 7,79 (с, 1H), 7,74 (д, 1H, J=8,7 Гц), 7,46 (д, 2H, J=8,7 Гц), 7,40 (т, 1H, J=1,8 Гц), 7,26 (д, 2H, J=8,9 Гц), 6,96 (т, 1H, J=1,8 Гц), 2,73(с, 3H), 1,85 (с, 6H)
Соединения из примеров от 38 до 61 синтезируют с применением способа синтеза, описанного в примере 37, и данные этих соединений перечислены ниже.
Таблица 4
Пример 62) Синтез N-(2-хлор-6-(3,5-дихлорфенокси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид
(a) Синтез 2-хлор-6-(3,5-дихлорфенокси)пиридин-4-амина
2,6-дихлорпиридин-4-амин (200,0 мг, 1,22 ммоль) и 3,5-дихлорфенол (400,0 мг, 2,45 ммоль) растворяют в сульфолане (6,1 мл) и добавляют K2CO3 (339,0 мг, 2,45 ммоль). Реакционную смесь перемешивают при 160°C в течение 16 часов, охлаждают до комнатной температуры, H2O добавляют и экстрагируют EtOAc. Органический экстракт промывают водным раствором 1N NaOH и насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с обращенной фазой (C18-силикагель, 0,1% муравьиной кислоты в CH3CN:0,1% муравьиной кислоты в H2O) с получением 2-хлор-6-(3,5-дихлорфенокси)пиридин-4-амина (121,0 мг, 34%) в виде белого твердого вещества.
ЖХ/МС ИЭР (+): 289 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 7,46 (с, 1H), 7,24 (д, 2H, J=1,8 Гц), 6,63 (шс, 2H), 6,35 (д, 1H, J=1,6 Гц), 6,00 (д, 1H, J=1,6 Гц)
(b) Синтез N-(2-хлор-6-(3,5-дихлорфенокси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида
5-(2-(Метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоновую кислоту (50,0 мг, 0,16 ммоль) растворяют в CH2Cl2 (1,6 мл) и добавляют ДМФ (1,2 мкл, 0,01 ммоль) и (COCl)2 (16,1 мкл, 0,18 ммоль). Реакционную смесь перемешивают при 25°C в течение 2 часов и концентрируют при пониженном давлении с получением хлорида 5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбонила. К остатку добавляют 2-хлор-6-(3,5-дихлорфенокси)пиридин-4-амин (50,9 мг, 0,17 ммоль) и пиридин (550,0 мкл), перемешивают при 30°C в течение 16 часов и концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с обращенной фазой (C18-силикагель, 0,1% муравьиной кислоты в CH3CN:0,1% муравьиной кислоты в H2O) с получением N-(2-хлор-6-(3,5-дихлорфенокси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида (62,0 мг, 65%) в виде белого твердого вещества.
ЖХ/МС ИЭР (+): 569 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 11,14 (шс, 1H), 8,42 (с, 1H), 8,26 (д, 1H, J=2,8 Гц), 8,13 (д, 1H, J=8,7 Гц), 7,77 (дд, 1H, J=8,7, 1,8 Гц), 7,71 (д, 1H, J=1,3 Гц), 7,56 (т, 1H, J=1,8 Гц), 7,44 (д, 2H, J=1,8 Гц), 7,39 (д, 1H, J=1,4 Гц), 2,74 (с, 3H), 1,86 (с, 6H)
Соединения из примеров от 63 до 86 синтезируют с применением способа синтеза, описанного в примере 62, и данные этих соединений перечислены ниже.
Таблица 5
Пример 87) Синтез N-(3-хлор-5-(2-(3-(проп-1-ин-1-ил)-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида
(a) Синтез трифторметансульфоната 3-(2-(3-хлор-5-нитрофенил)пропан-2-ил)-5-(трифторметокси)фенила
3-(2-(3-Хлор-5-нитрофенил)пропан-2-ил)-5-(трифторметокси)фенол (100,0 мг, 0,27 ммоль) растворяют в CH2Cl2 (2,7 мл) и медленно добавляют по каплям пиридин (109,0 мкл, 1,35 ммоль) и Tf2O (45,0 мкл, 0,27 ммоль) при 0°C. Реакционную смесь перемешивают при 0°C в течение 2 часов, добавляют H2O и экстрагируют CH2Cl2. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:EtOAc=9:1) с получением трифторметансульфоната 3-(2-(3-хлор-5-нитрофенил)пропан-2-ил)-5-(трифторметокси)фенила (120,0 мг, 88%) в виде бесцветной жидкости.
1H-ЯМР (400 МГц, CDCl3): δ 8,13 (т, 1H, J=1,9 Гц), 7,99 (т, 1H, J=1,9 Гц), 7,45 (т, 1H, J=1,8 Гц), 7,08-7,10 (м, 2H), 7,04 (т, 1H, J=1,9 Гц), 1,75 (с, 6H)
(b) Синтез 1-хлор-3-нитро-5-(2-(3-(проп-1-ин-1-ил)-5-(трифторметокси)фенил)пропан-2-ил)бензола
Трифторметансульфонат 3-(2-(3-хлор-5-нитрофенил)пропан-2-ил)-5-(трифторметокси)фенила (280,0 мг, 0,55 ммоль) растворяют в безводном ДМФ (5,5 мл) добавляют и 1-(триметилсилил)-1-пропин (123,0 мкл, 0,83 ммоль), Pd(PPh3)4 (64,0 мг, 0,06 ммоль), CuI (21,0 мг, 0,11 ммоль) и ДИПЭА (480,0 мкл, 2,75 ммоль) при комнатной температуре. Реакционную смесь перемешивают при 90°C в течение 15 часов, охлаждают до комнатной температуры, добавляют H2O и экстрагируют CH2Cl2. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:CH2Cl2=4:1) с получением 1-хлор-3-нитро-5-(2-(3-(проп-1-ин-1-ил)-5-(трифторметокси)фенил)пропан-2-ил)бензола (120,0 мг, 55%) в виде бесцветной жидкости.
1H-ЯМР (400 МГц, CDCl3): δ 8,08 (т, 1H, J=1,9 Гц), 7,99 (т, 1H, J=1,9 Гц), 7,46 (т, 1H, J=1,8 Гц), 7,11-7,13 (м, 2H), 6,94 (с, 1H), 2,04 (с, 3H), 1,70 (с, 6H)
(c) Синтез 3-хлор-5-(2-(3-(проп-1-ин-1-ил)-5-(трифторметокси)фенил)пропан-2-ил)анилина
Методику синтеза из примера 1-g повторяют, за исключением применения 1-хлор-3-нитро-5-(2-(3-(проп-1-ин-1-ил)-5-(трифторметокси)фенил)пропан-2-ил)бензола (120,0 мг, 0,32 ммоль) в качестве исходного материала с получением 3-хлор-5-(2-(3-(проп-1-ин-1-ил)-5-(трифторметокси)фенил)пропан-2-ил)анилина (93,0 мг, 84%).
ЖХ/МС ИЭР (+): 368 (M+1)
(d) Синтез N-(3-хлор-5-(2-(3-(проп-1-ин-1-ил)-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида
Методику синтеза из примера 1-h повторяют, за исключением применения 3-хлор-5-(2-(3-(проп-1-ин-1-ил)-5-(трифторметокси)фенил)пропан-2-ил)анилина (55,0 мг, 0,15 ммоль) в качестве исходного материала с получением N-(3-хлор-5-(2-(3-(проп-1-ин-1-ил)-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида (23,5 мг, 33%).
ЖХ/МС ИЭР (+): 648 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,65 (с, 1H), 8,34 (с, 1H), 8,20 (с, 1H), 8,10 (д, 1H, J=8,8 Гц), 7,90 (с, 1H), 7,74 (д, 1H, J=8,8 Гц), 7,50 (с, 1H), 7,19-7,22 (м, 3H), 7,07 (с, 1H), 2,73 (с, 3H), 2,03 (с, 3H), 1,85 (с, 6H), 1,65 (с, 6H)
Пример 88) Синтез N-(1-(трет-бутил)-3-(2-(4-хлорфенил)пропан-2-ил)-1H-пиразол-5-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида
(a) Синтез 4-(4-хлорфенил)-4-метил-3-оксопентаннитрила
2-(4-Хлорфенил)-2-метилпропановую кислоту (500,0 мг, 2,52 ммоль) растворяют в ТГФ (10,0 мл), добавляют карбонилдиимидазол (490,0 мг, 3,02 ммоль) и перемешивают в течение 2 часов. В реакционную смесь добавляют раствор, полученный растворением CH3CN (0,2 мл, 8,31 ммоль) в ТГФ (10,0 мл), медленным по каплям добавлением 1,6 M раствора n-BuLi в ТГФ (4,7 мл, 7,56 ммоль) при -78°C и перемешиванием в течение 1 часа. Полученную смесь перемешивают при -78°C в течение 2 часов, добавляют H2O и экстрагируют EtOAc. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:CH2Cl2=1:2) с получением 4-(4-хлорфенил)-4-метил-3-оксопентаннитрила (333,0 мг, 59%) в виде беловатого масла.
ЖХ/МС ИЭР (-): 220 (M-1)
1H-ЯМР (400 МГц, CDCl3): δ 7,38 (д, 2H, J=8,4 Гц), 7,19 (д, 2H, J=8,8 Гц), 3,30 (с, 2H), 1,53 (с, 6H)
(b) Синтез 1-(трет-бутил)-3-(2-(4-хлорфенил)пропан-2-ил)-1H-пиразолe-5-амина
Хлорид трет-бутилгидразина (463,0 мг, 3,72 ммоль) растворяют в EtOH (1,9 мл) и добавляют NaOH (119,0 г, 2,97 ммоль). В реакционную смесь по каплям добавляют 4-(4-хлорфенил)-4-метил-3-оксопентаннитрил (330,0 мг, 1,49 ммоль) в EtOH (1,0 мл). Реакционную смесь перемешивают при 80°C в течение 12 часов, добавляют H2O и экстрагируют EtOAc. Органический экстракт сушат над Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (амин силикагель, n-Hex:EtOAc=1:1) с получением 1-(трет-бутил)-3-(2-(4-хлорфенил)пропан-2-ил)-1H-пиразол-5-амина (130,0 мг, 30%) в виде белого твердого вещества.
ЖХ/МС ИЭР (+): 292 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,25 (д, 2H, J=9,2 Гц), 7,19 (д, 2H, J=8,8 Гц), 5,24 (с, 1H), 3,41 (с, 2H), 1,62 (с, 9H), 1,59 (с, 6H)
(c) Синтез N-(1-(трет-бутил)-3-(2-(4-хлорфенил)пропан-2-ил)-1H-пиразол-5-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида
Методику синтеза из примера 1-h повторяют, за исключением применения 1-(трет-бутил)-3-(2-(4-хлорфенил)пропан-2-ил)-1H-пиразол-5-амина (100,0 мг, 0,34 ммоль) в качестве исходного материала с получением N-(1-(трет-бутил)-3-(2-(4-хлорфенил)пропан-2-ил)-1H-пиразол-5-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида (78,0 мг, 40%).
ЖХ/МС ИЭР (+): 572 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,35 (с, 1H), 8,27 (с, 1H), 8,26 (с, 1H), 8,10 (д, 1H, J=8,8 Гц), 7,76 (д, 1H, J=8,8 Гц), 7,30-7,35 (м, 4H), 6,08 (с, 1H), 2,74 (с, 3H), 1,85 (с, 6H), 1,63 (с, 6H), 1,57 (с, 9H).
Пример 89) Синтез N-(3-(2-(4-хлорфенил)пропан-2-ил)-1H-пиразол-5-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида
N-(1-(трет-бутил)-3-(2-(4-хлорфенил)пропан-2-ил)-1H-пиразол-5-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид (30,0 мг, 0,05 ммоль) растворяют в муравьиной кислоте (4,0 мл). Реакционную смесь перемешивают при 80°C в течение 12 часов и концентрируют при пониженном давлении, подщелачивают насыщ. водным раствором NaHCO3 (pH=9) и экстрагируют EtOAc. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с обращенной фазой (C18-силикагель, 0,1% муравьиной кислоты в CH3CN:0,1% муравьиной кислоты в H2O) с получением N-(3-(2-(4-хлорфенил)пропан-2-ил)-1H-пиразол-5-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида (17,0 мг, 67%) в виде белого твердого вещества.
ЖХ/МС ИЭР (+): 516 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 12,30 (с, 1H), 11,23 (с, 1H), 8,44 (с, 1H), 8,13 (с, 1H), 8,09 (д, 1H, J=8,8 Гц), 7,74 (д, 1H, J=8,8 Гц), 7,38 (д, 2H, J=8,4 Гц), 7,29 (д, 2H, J=8,4 Гц), 6,50 (с, 1H), 2,74 (с, 3H), 1,86 (с, 6H), 1,67 (с, 6H)
Пример 90 и пример 91) Синтез N-(2-хлор-6-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида и N-(4-хлор-6-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-2-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида
(a) Синтез 4,6-дихлор-N-метокси-N-метилизоникотинамида
4,6-Дихлоризоникотиновую кислоту (3,0 г, 15,6 ммоль) растворяют в безводном CH2Cl2 (100,0 мл) и (COCl)2 (2,1 мл, 23,40 ммоль) и по каплям добавляют безводный ДМФ в каталитическом количестве, затем перемешивают при 0°C в течение 1 часа. Реакционную смесь сушат при пониженном давлении в течение 1 часа, остаток растворяют в безводном CH2Cl2 (100,0 мл) и N,O-диметилгидроксиамине (4,6 г, 46,80 ммоль) и добавляют пиридин (7,5 мл, 93,60 ммоль) при 0°C. Реакционную смесь перемешивают при 0°C в течение 1 часа, добавляют H2O и экстрагируют CH2Cl2. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (амин силикагель, n-Hex:EtOAc=1:4) с получением 4,6-дихлор-N-метокси-N-метилизоникотинамида (3,5 г, 83%) в виде белого твердого вещества.
ЖХ/МС ИЭР (+): 235 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,56 (шс, 1H), 7,44 (с, 1H), 3,80 (с, 3H), 3,36 (с, 3H)
(b) Синтез (4,6-дихлорпиридин-2-ил)(3-метокси-5-(трифторметокси)фенил)метанона
1-Бром-3-метокси-5-(трифторметокси)бензол (5,0 г, 18,45 ммоль) растворяют в ТГФ (90,0 мл), 1,7M раствор трет-BuLi в пентане (11,4 мл, 19,30 ммоль) добавляют по каплям при -78°C и перемешивают в течение 1 часа. Медленно добавляют 4,6-дихлор-N-метокси-N-метилизоникотинамид (3,5 г, 14,88 ммоль) в ТГФ (10,0 мл) и реакционную смесь перемешивают при 0°C в течение 2 часов, добавляют H2O и экстрагируют EtOAc. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:CH2Cl2=1:10) с получением (4,6-дихлорпиридин-2-ил)(3-метокси-5-(трифторметокси)фенил)метанона (2,4 г, 44%) в виде желтого твердого вещества.
ЖХ/МС ИЭР (+): 366 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 8,00 (с, 1H), 7,63 (с, 1H), 7,61 (с, 1H), 7,59 (с, 1H), 7,01 (с, 1H), 3,89 (с, 3H)
(c) Синтез 2,4-дихлор-6-(дихлор(3-метокси-5-(трифторметокси)фенил)метил)пиридин
Методику синтеза из примера 1-c повторяют, за исключением применения (4,6-дихлорпиридин-2-ил)(3-метокси-5-(трифторметокси)фенил)метанона (2,4 г, 6,55 ммоль) в качестве исходного материала с получением 2,4-дихлор-6-(дихлор(3-метокси-5-(трифторметокси)фенил)метил)пиридина (2,1 г, 76%).
ЖХ/МС ИЭР (+): 420 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,76 (с, 1H), 7,37 (с, 1H), 7,13 (с, 1H), 7,06 (с, 1H), 6,77 (с, 1H), 3,84 (с, 3H)
(d) Синтез 2,4-дихлор-6-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридина
Методику синтеза из примера 1-d повторяют, за исключением применения 2,4-дихлор-6-(дихлор(3-метокси-5-(трифторметокси)фенил)метил)пиридина (2,1 г, 4,98 ммоль) в качестве исходного материала с получением 2,4-дихлор-6-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридина (1,3 г, 69%) в виде беловатого масла.
ЖХ/МС ИЭР (+): 380 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,19 (с, 1H), 6,94 (с, 1H), 6,73 (с, 1H), 6,70 (с, 1H), 6,62 (с, 1H), 3,79 (с, 3H), 1,69 (с, 6H)
(e) Синтез 2-хлор-6-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-4-амина и (f) синтез 4-хлор-6-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-2-амина
2,4-дихлор-6-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин (50,0 мг, 0,13 ммоль), NaN3 (17,0 мг, 0,26 ммоль), Cu2O (18,7 мг, 0,131 ммоль) и L-пролин (19,5 мг, 0,17 ммоль) растворяют в безводном ДМСО (1,0 мл). Реакционную смесь перемешивают при 100°C в течение 12 часов, охлаждают до комнатной температуры, добавляют H2O и экстрагируют EtOAc. Органический экстракт сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (амин силикагель, n-Hex:EtOAc=9:1) с получением 2-хлор-6-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-4-амина (14,0 мг, 30%) и 4-хлор-6-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-2-амина (4,0 мг, 8%) в виде беловатого масла.
(e) ЖХ/МС ИЭР (+): 361 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 6,74 (с, 1H), 6,72 (с, 1H), 6,96 (с, 1H), 6,37 (д, 1H, J=1,2 Гц), 6,14 (д, 1H, J=1,2 Гц), 4,13 (шс, 2H), 3,76 (с, 3H), 1,64 (с, 6H)
(f) ЖХ/МС ИЭР (+): 361 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 6,72 (с, 1H), 6,71 (с, 1H), 6,59 (с, 1H), 6,48 (с, 1H), 6,32 (с, 1H), 4,43 (шс, 2H), 3,77 (с, 3H), 1,62 (с, 6H)
(g) Синтез N-(2-хлор-6-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида
Методику синтеза из примера 1-h повторяют, за исключением применения 2-хлор-6-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-4-амина (38,0 мг, 0,11 ммоль) в качестве исходного материала с получением N-(2-хлор-6-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида (20,0 мг, 30%) в виде белого твердого вещества.
ЖХ/МС ИЭР (+): 641 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,99 (с, 1H), 8,39 (с, 1H), 8,24 (с, 1H), 8,13 (д, 1H, J=8,8 Гц), 7,89 (с, 1H), 7,77 (д, 1H, J=8,8 Гц), 7,56 (с, 1H), 6,84 (с, 1H), 6,83 (с, 1H), 6,77 (с, 1H), 3,79 (с, 3H), 2,75 (с, 3H), 1,86 (с, 6H), 1,68 (с, 6H)
(h) Синтез N-(4-хлор-6-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-2-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида
Методику синтеза из примера 1-h повторяют, за исключением применения 4-хлор-6-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-2-амина (20,0 мг, 0,06 ммоль) в качестве исходного материала с получением N-(4-хлор-6-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-2-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида (12,0 мг, 34%) в виде белого твердого вещества.
ЖХ/МС ИЭР (+): 641 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 11,16 (с, 1H), 8,64 (с, 1H), 8,19 (с, 1H), 8,11 (д, 1H, J=8,8 Гц), 8,09 (д, 1H, J=2,0 Гц), 7,77 (дд, 1H, J=8,8, 2,0 Гц), 7,20 (с, 1H), 6,86 (с, 1H), 6,79-6,81 (м, 2H), 3,78 (с, 3H), 2,76 (с, 3H), 1,86 (с, 6H), 1,74 (с, 6H)
Пример 92) Синтез N-(3-хлор-5-((2,2,6,6-тетраметилпиперидин-4-ил)окси)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида
(a) Синтез 4-(3-бром-5-хлорфенокси)-2,2,6,6-тетраметилпиперидина
1-Бром-3-хлор-5-нитробензол (200,0 мг, 0,42 ммоль) растворяют в безводном ДМФ (2,1 мл) и 2,2,6,6-тетраметилпиперидин-4-оле (66,0 мг, 0,42 ммоль) и добавляют 60% масс. NaH (50,4 мг, 1,26 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 2 часов, добавляют H2O и экстрагируют EtOAc. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:EtOAc=9:1) с получением 4-(3-бром-5-хлорфенокси)-2,2,6,6-тетраметилпиперидина (160,0 мг, 54%) в виде беловатого масла.
ЖХ/МС ИЭР (+): 346 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,09 (с, 1H), 6,93 (с, 1H), 6,81 (с, 1H), 4,60 (м, 1H), 2,02-2,06 (м, 2H), 1,20-1,30 (м, 14H)
(b) Синтез 3-хлор-5-((2,2,6,6-тетраметилпиперидин-4-ил)окси)анилина
Методику синтеза из примера 91-e повторяют, за исключением применения 4-(3-бром-5-хлорфенокси)-2,2,6,6-тетраметилпиперидина (34,0 мг, 0,10 ммоль) в качестве исходного материала с получением 3-хлор-5-((2,2,6,6-тетраметилпиперидин-4-ил)окси)анилина (16,0 мг, 58%).
ЖХ/МС ИЭР (+): 283 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 6,31 (с, 1H), 6,29 (с, 1H), 6,10 (с, 1H), 4,58 (м, 1H), 3,70 (шс, 2H), 2,03-2,05 (м, 2H), 1,18-1,23 (м, 14H)
(c) Синтез N-(3-хлор-5-((2,2,6,6-тетраметилпиперидин-4-ил)окси)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида
Методику синтеза из примера 1-h повторяют, за исключением применения 3-хлор-5-((2,2,6,6-тетраметилпиперидин-4-ил)окси)анилина (16,0 мг, 0,06 ммоль) в качестве исходного материала с получением N-(3-хлор-5-((2,2,6,6-тетраметилпиперидин-4-ил)окси)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида (9,0 мг, 28%) в виде белого твердого вещества.
ЖХ/МС ИЭР (+): 563 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,53 (с, 1H), 8,28 (с, 1H), 8,16 (с, 1H), 8,03 (д, 1H, J=8,8 Гц), 7,68 (дд, 1H, J=8,8, 2,0 Гц), 7,41 (с, 1H), 7,33 (с, 1H), 6,73 (с, 1H), 4,66-4,71 (м, 1H), 1,88 (дд, 2H, J=12,4, 4,0 Гц), 1,79 (с, 6H), 1,14 (с, 6H), 1,07-1,10 (м, 2H), 1,02 (с, 6H)
Пример 93) Синтез трет-бутил (2-(3-(4-хлорфенокси)-5-(5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамидо)фенокси)этил)карбамата
(a) Синтез 1-(4-хлорфенокси)-3-метокси-5-нитробензола
Методику синтеза из примера 40-a повторяют, за исключением применения 1-бром-3-метокси-5-нитробензола (500,0 мг, 1,71 ммоль) в качестве исходного материала с получением 1-(4-хлорфенокси)-3-метокси-5-нитробензола (400,0 мг, 66%).
ЖХ/МС ИЭР (+): 280 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,48 (т, 1H, J=2,2 Гц), 7,37 (т, 1H, J=2,1 Гц), 7,36 (д, 2H, J=8,8 Гц), 7,00 (д, 2H, J=8,9 Гц), 6,83 (т, 1H, J=2,1 Гц), 3,87 (с, 3H)
(b) Синтез 3-(4-хлорфенокси)-5-нитрофенола
Методику синтеза из примера 1-e повторяют, за исключением применения 1-(4-хлорфенокси)-3-метокси-5-нитробензола (396,0 мг, 1,42 ммоль) в качестве исходного материала с получением 3-(4-хлорфенокси)-5-нитрофенола (307,0 мг, 82%).
ЖХ/МС ИЭР (+): 266 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,39 (т, 1H, J=2,2 Гц), 7,35 (д, 2H, J=8,9 Гц), 7,33 (т, 1H, J=2,1 Гц), 6,98 (д, 2H, J=8,9 Гц), 6,74 (т, 1H, J=2,2 Гц)
(c) Синтез трет-бутил (2-(3-(4-хлорфенокси)-5-нитрофенокси)этил)карбамата
3-(4-Хлорфенокси)-5-нитрофенол (297,0 мг, 1,11 ммоль) растворяют в безводном ДМФ (10,0 мл), добавляют K2CO3 (231,0 мг, 1,68 ммоль), перемешивают при комнатной температуре в течение 10 минут и добавляют трет-бутил (2-бромэтил)карбамат (300,0 мг, 1,34 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 16 часов, добавляют H2O и экстрагируют EtOAc. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:EtOAc=6:1) с получением трет-бутил (2-(3-(4-хлорфенокси)-5-нитрофенокси)этил)карбамата (435,0 мг, 95%).
ЖХ/МС ИЭР (+): 409 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,44 (т, 1H, J=2,1 Гц), 7,37 (т, 1H, J=2,1 Гц), 7,36 (д, 2H, J=8,9 Гц), 6,98 (д, 2H, J=8,9 Гц), 6,79 (т, 1H, J=2,2 Гц), 4,90 (шс, 1H), 4,04 (т, 2H, J=5,1 Гц), 3,51-3,55 (м, 2H), 1,43 (с, 9H)
(d) Синтез трет-бутил (2-(3-амино-5-(4-хлорфенокси)фенокси)этил)карбамата
Методику синтеза из примера 1-g повторяют, за исключением применения трет-бутил (2-(3-(4-хлорфенокси)-5-нитрофенокси)этил)карбамата (425,0 мг, 1,04 ммоль) в качестве исходного материала с получением трет-бутил (2-(3-амино-5-(4-хлорфенокси)фенокси)этил)карбамата (360,0 мг, 92%).
ЖХ/МС ИЭР (+): 379 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,28 (д, 2H, J=8,9 Гц), 6,96 (д, 2H, J=8,9 Гц), 5,98 (т, 1H, J=2,0 Гц), 5,91-5,94 (м, 2H), 3,92 (т, 2H, J=5,0 Гц), 3,73 (шс, 2H), 3,46-3,50 (м, 2H), 1,44 (с, 9H)
(e) Синтез трет-бутил(2-(3-(4-хлорфенокси)-5-(5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамидо)фенокси)этил)карбамата
Методику синтеза из примера 1-h повторяют, за исключением применения трет-бутил (2-(3-амино-5-(4-хлорфенокси)фенокси)этил)карбамата (211,0 мг, 0,56 ммоль) в качестве исходного материала с получением трет-бутил (2-(3-(4-хлорфенокси)-5-(5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамидо)фенокси)этил)карбамата (360,0 мг, 98%) в виде белого твердого вещества.
ЖХ/МС ИЭР (+): 682 (M+Na)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,53 (шс, 1H), 8,33 (с, 1H), 8,19 (с, 1H), 8,08 (д, 1H, J=8,7 Гц), 7,73 (д, 1H, J=8,7 Гц), 7,47 (д, 2H, J=8,7 Гц), 7,29 (с, 1H), 7,12 (д, 2H, J=8,9 Гц), 7,02-7,04 (м, 2H), 6,44 (с, 1H), 3,94-3,97 (м, 2H), 3,28-3,32 (м, 2H), 2,73 (с, 3H), 1,85 (с, 6H), 1,38 (с, 9H)
Пример 94) Синтез N-(3-(2-аминоэтокси)-5-(4-хлорфенокси)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида
трет-Бутил (2-(3-(4-хлорфенокси)-5-(5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамидо)фенокси)этил)карбамат (187,0 мг, 0,28 ммоль) растворяют в безводном CH2Cl2 (3,0 мл) и добавляют ТФК (220,0 мкл, 2,84 ммоль) при 0°C. Реакционную смесь перемешивают при комнатной температуре в течение 5 часов, добавляют насыщ. NaHCO3 и экстрагируют CH2Cl2. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (амин силикагель, CH2Cl2:MeOH=20:1) с получением N-(3-(2-аминоэтокси)-5-(4-хлорфенокси)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида (81,0 мг, 51%) в виде белого твердого вещества.
ЖХ/МС ИЭР (+): 559 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,54 (шс, 1H), 8,35 (с, 1H), 8,20 (с, 1H), 8,09 (д, 1H, J=8,7 Гц), 7,74 (д, 1H, J=8,7 Гц), 7,50 (д, 2H, J=8,7 Гц), 7,32 (с, 1H), 7,12 (д, 2H, J=8,9 Гц), 7,04 (с, 1H), 6,42 (с, 1H), 3,90-3,94(т, 2H, J=5,6 Гц), 2,87-2,90 (т, 2H, J=5,6 Гц), 2,51 (с, 3H), 2,00 (шс, 2H), 1,85 (с, 6H)
Пример 95) Синтез N-(5-хлор-2',4'-дифтор-[1,1'-бифенил]-3-ил)-5-((метилсульфонил)метил)бензо[b]тиофен-2-карбоксамида
(a) Синтез 3'-хлор-2,4-дифтор-5'-нитро-1,1'-бифенила
1-Бром-3-хлор-5-нитробензол (1,0 г, 4,23 ммоль), (2,4-дифторфенил)бороновую кислоту (0,7 г, 4,23 ммоль), Pd(PPh3)4 (490,0 мг, 0,42 ммоль) и Na2CO3 (1,4 г, 12,70 ммоль) добавляют в смесь ДМЭ/H2O (42,0 мл, 4/1 об./об.). Реакционную смесь перемешивают при 90°C в течение 3 часов, добавляют H2O и экстрагируют EtOAc. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:EtOAc=9:1) с получением 3'-хлор-2,4-дифтор-5'-нитро-1,1'-бифенила (1,1 г, 96%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3): δ 8,27 (с, 1H), 8,23 (с, 1H), 7,83 (с, 1H), 7,26-7,46 (м, 1H), 6,98-7,03 (м, 2H)
(b) Синтез 5-хлор-2',4'-дифтор-[1,1'-бифенил]-3-амина
Методику синтеза из примера 1-g повторяют, за исключением применения 3'-хлор-2,4-дифтор-5'-нитро-1,1'-бифенила (1,1 г, 4,08 ммоль) в качестве исходного материала с получением 5-хлор-2',4'-дифтор-[1,1'-бифенил]-3-амина (830,0 мг, 85%).
1H-ЯМР (400 МГц, CDCl3): δ 7,33-7,37 (м, 1H), 6,85-6,93 (м, 3H), 6,68 (м, 2H), 3,81 (шс, 2H)
(c) Синтез N-(5-хлор-2',4'-дифтор-[1,1'-бифенил]-3-ил)-5-((метилсульфонил)метил)бензо[b]тиофен-2-карбоксамида
Методику синтеза из примера 1-h повторяют, за исключением применения 5-хлор-2',4'-дифтор-[1,1'-бифенил]-3-амина (40,0 мг, 0,17 ммоль) в качестве исходного материала с получением N-(5-хлор-2',4'-дифтор-[1,1'-бифенил]-3-ил)-5-((метилсульфонил)метил)бензо[b]тиофен-2-карбоксамида (30,8 мг, 41%).
ЖХ/МС ИЭР (+): 492 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,76 (с, 1H), 8,40 (с, 1H), 8,11 (д, 1H, J=8,4 Гц), 8,06 (с, 1H), 8,00 (м, 1H), 7,91 (м, 1H), 7,66 (м, 1H), 7,54 (д, 1H, J=8,4 Гц), 7,43 (м, 1H), 7,37 (м, 1H), 7,25 (м, 1H), 4,65 (с, 2H), 2,94 (с, 3H)
Пример 96) Синтез (8-хлор-6-(4-хлорфенокси)-2,3-дигидро-4H-бензо[b][1,4]оксазин-4-ил)(5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-ил)метанона
(a) Синтез 6-бром-8-хлор-3,4-дигидро-2H-бензо[b][1,4]оксазина
2-Амино-4-бром-6-хлорфенол (100,0 мг, 0,45 ммоль), дибромэтан (0,1 мл, 1,12 ммоль) и K2CO3(186,0 мг, 1,35 ммоль) растворяют в безводном ДМФ (1,5 мл). Реакционную смесь перемешивают при 125°C в течение 15 часов, добавляют H2O и экстрагируют EtOAc. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:EtOAc=3:1) с получением 6-бром-8-хлор-3,4-дигидро-2H-бензо[b][1,4]оксазина (70,0 мг, 63%) в виде белого твердого вещества.
ЖХ/МС ИЭР (+): 248 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 6,84 (с, 1H), 6,61 (с, 1H), 4,31-4,33 (м, 2H), 3,42-3,45 (м, 2H), 3,97 (шс, 1H)
(b) Синтез 8-хлор-6-(4-хлорфенокси)-3,4-дигидро-2H-бензо[b][1,4]оксазина
6-Бром-8-хлор-3,4-дигидро-2H-бензо[b][1,4]оксазин (60,0 мг, 0,24 ммоль), 4-хлорфенол (62 мг, 0,48 ммоль), CuI (23,0 мг, 0,12 ммоль), N,N-диметилглицин (24,9 мг, 0,24 ммоль) и Cs2CO3 (236,0 мг, 0,72 ммоль) добавляют к безводному 1,4-диоксану (2,4 мл). Реакционную смесь перемешивают при 120°C в течение 15 часов, добавляют H2O и экстрагируют EtOAc. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (амин силикагель, n-Hex:EtOAc=9:1) с получением 8-хлор-6-(4-хлорфенокси)-3,4-дигидро-2H-бензо[b][1,4]оксазина (42,0 мг, 42%).
ЖХ/МС ИЭР (+): 296 (M+1)
(c) Синтез (8-хлор-6-(4-хлорфенокси)-2,3-дигидро-4H-бензо[b][1,4]оксазин-4-ил)(5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-ил)метанона
Методику синтеза из примера 1-h повторяют, за исключением применения 8-хлор-6-(4-хлорфенокси)-3,4-дигидро-2H-бензо[b][1,4]оксазина (20,0 мг, 0,07 ммоль) в качестве исходного материала с получением (8-хлор-6-(4-хлорфенокси)-2,3-дигидро-4H-бензо[b][1,4]оксазин-4-ил)(5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-ил)метанона (13,0 мг, 33%) в виде белого твердого вещества.
ЖХ/МС ИЭР (+): 576 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 8,20 (с, 1H), 8,07 (д, 1H, J=8,6 Гц), 7,88 (с, 1H), 7,75 (д, 1H, J=8,7 Гц), 7,02-7,09 (м, 4H), 6,79 (д, 2H, J=8,3 Гц), 4,46-4,51 (м, 2H), 4,10-4,16 (м, 2H), 2,74 (с, 3H), 1,84 (с, 6H)
Пример 97) Синтез N-(3-хлор-5-(1-(4-хлорфенил)циклопропил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида
(a) Синтез (3-хлор-5-нитрофенил)(4-хлорфенил)метанона
3-Хлор-5-нитробензойную кислоту (2,0 г, 9,92 ммоль) и ДМФ (0,1 мл, 0,99 ммоль) растворяют в SOCl2 (3,6 мл, 49,60 ммоль). Реакционную смесь перемешивают при 80°C в течение 3 часов и концентрируют при пониженном давлении с получением хлорида 3-хлор-5-нитробензоила. Остаток растворяют в хлорбензоле (20,0 мл), добавляют AlCl3 (4,0 г, 29,80 ммоль) при 0°C и перемешивают при 50°C в течение 5 часов. H2O добавляют при 0°C, и реакционную смесь экстрагируют EtOAc. Органический экстракт промывают насыщ. водным раствором NaHCO3 и насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:ДХМ=4:1) с получением (3-хлор-5-нитрофенил)(4-хлорфенил)метанона (2,8 г, 96%) в виде желтого твердого вещества.
1H-ЯМР (400 МГц, CDCl3): δ 8,46 (м, 1H), 8,44 (м, 1H), 8,08 (м, 1H), 7,75 (д, 2H, J=8,5 Гц), 7,54 (д, 2H, J=8,5 Гц)
(b) Синтез 1-хлор-3-(1-(4-хлорфенил)винил)-5-нитробензола
Бром(метил)трифенилфосфоран (5,3 г, 19,10 ммоль) растворяют в ТГФ (25,0 мл), 1,6 M раствор n-BuLi в n-Hex (12,0 мл, 19,10 ммоль) добавляют по каплям при 0°C и перемешивают в течение 30 минут. Реакционную смесь медленно добавляют к раствору (3-хлор-5-нитрофенил)(4-хлорфенил)метанона (2,8 г, 9,56 ммоль) в ТГФ (8,0 мл) при 0°C. Реакционную смесь перемешивают при комнатной температуре в течение 12 часов, добавляют H2O и экстрагируют EtOAc. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:ДХМ=4:1) с получением 1-хлор-3-(1-(4-хлорфенил)винил)-5-нитробензола (1,8 г, 65%) в виде цветного твердого вещества.
1H-ЯМР (400 МГц, CDCl3): δ 8,18 (м, 1H), 8,07 (м, 1H), 7,61 (м, 1H), 7,36 (д, 2H, J=8,4 Гц), 7,22 (д, 2H, J=8,4 Гц), 5,63 (с, 1H), 5,60 (с, 1H)
(c) Синтез 1-хлор-3-(2,2-дибром-1-(4-хлорфенил)циклопропил)-5-нитробензола
1-Хлор-3-(1-(4-хлорфенил)винил)-5-нитробензол (1,8 г, 6,19 ммоль), CHBr3 (735,0 мкл, 8,42 ммоль) и хлорида бензилтриэтиламмония (254,0 мг, 1,11 ммоль) растворяют в 1,2-дихлорэтане (6,2 мл) и добавляют NaOH (9,4 г, 235,0 ммоль) в H2O (9,4 мл). Реакционную смесь перемешивают при 40°C в течение 16 часов, добавляют H2O и экстрагируют EtOAc. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:ДХМ=4:1) с получением 1-хлор-3-(2,2-дибром-1-(4-хлорфенил)циклопропил)-5-нитробензола (2,2 г, 75%) в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3): δ 8,22 (с, 1H), 8,11 (с, 1H), 7,79 (с, 1H), 7,44 (д, 2H, J=8,4 Гц), 7,35 (д, 2H, J=8,4 Гц), 2,50-2,55 (м, 2H)
(d) Синтез 3-хлор-5-(1-(4-хлорфенил)циклопропил)анилина
Методику синтеза из примера 1-g повторяют, за исключением применения 1-хлор-3-(2,2-дибром-1-(4-хлорфенил)циклопропил)-5-нитробензола (2,2 г, 4,61 ммоль) в качестве исходного материала с получением 3-хлор-5-(1-(4-хлорфенил)циклопропил)анилина (1,2 г, 95%) в виде желтого масла.
ЖХ/МС ИЭР (+): 278 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,24 (д, 2H, J=8,4 Гц), 7,15 (д, 2H, J=8,4 Гц), 6,56 (с, 1H), 6,50 (с, 1H), 6,35 (с, 1H), 3,66 (шс, 2H), 1,20-1,28 (м, 4H)
(e) Синтез N-(3-хлор-5-(1-(4-хлорфенил)циклопропил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида
Методику синтеза из примера 1-h повторяют, за исключением применения 3-хлор-5-(1-(4-хлорфенил)циклопропил)анилина (46,7 мг, 0,17 ммоль) в качестве исходного материала с получением N-(3-хлор-5-(1-(4-хлорфенил)циклопропил)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида (44,1 мг, 47%).
ЖХ/МС ИЭР (+): 558 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,64 (с, 1H), 8,34 (с, 1H), 8,20 (с, 1H), 8,10 (д, 1H, J=8,7 Гц), 7,84 (м, 1H), 7,74 (дд, 1H, J=8,7, 1,8 Гц), 7,54 (м, 1H), 7,38 (д, 2H, J=8,6 Гц), 7,29 (д, 2H, J=8,6 Гц), 7,02 (м, 1H), 2,73 (с, 3H), 1,85 (с, 6H), 1,30-1,32 (м, 4H)
Пример 98) Синтез N-(3-хлор-5-((2,4-дифторфенил)(метил)амино)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида
(a) Синтез N-(3-хлор-5-нитрофенил)-2,4-дифторанилина
1-Бром-3-хлор-5-нитробензол (100,0 мг, 0,42 ммоль), 2,4-дифторанилин (35,6 мкл, 0,35 ммоль), Pd2(dba)3·CHCl3 (18,3 мг, 0,02 ммоль), BINAP (21,9 мг, 0,04 ммоль) и NaOt-Bu (47,5 мг, 0,49 ммоль) добавляют в безводный толуол (3,5 мл). Реакционную смесь подвергают взаимодействию при 110°C в течение 30 минут при облучении микроволнами при 150 Вт. Реакционную смесь охлаждают до комнатной температуры, добавляют H2O и экстрагируют EtOAc. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:EtOAc=9:1) с получением N-(3-хлор-5-нитрофенил)-2,4-дифторанилина (76,6 мг, 76%) в виде желтого твердого вещества.
ЖХ/МС ИЭР (+): 285 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,68 (с, 1H), 7,58 (с, 1H), 7,31 (м, 1H), 7,11 (с, 1H), 6,91-7,00 (м, 2H), 5,79 (с, 1H)
(b) Синтез N-(3-хлор-5-нитрофенил)-2,4-дифтор-N-метиланилина
N-(3-хлор-5-нитрофенил)-2,4-дифторанилин (167,1 мг, 0,59 ммоль) растворяют в ДМФ (6,0 мл) и добавляют 60% масс. NaH (35,2 мг, 0,88 ммоль) и CH3I (73,1 мкл, 1,17 ммоль) при 0°C. Реакционную смесь перемешивают при комнатной температуре в течение 1 часа, добавляют H2O и экстрагируют EtOAc. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:EtOAc=9:1) с получением N-(3-хлор-5-нитрофенил)-2,4-дифтор-N-метиланилина (172,4 мг, 98%) в виде желтого твердого вещества.
1H-ЯМР (400 МГц, CDCl3): δ 7,58 (с, 1H), 7,34 (с, 1H), 7,27 (м, 1H), 6,97-7,02 (м, 2H), 6,82 (с, 1H), 3,31 (с, 3H)
(c) Синтез 5-хлор-N1-(2,4-дифторфенил)-N1-метилбензол-1,3-диамина
Методику синтеза из примера 1-g повторяют, за исключением применения N-(3-хлор-5-нитрофенил)-2,4-дифтор-N-метиланилина (172,4 мг, 0,58 ммоль) в качестве исходного материала с получением 5-хлор-N1-(2,4-дифторфенил)-N1-метилбензол-1,3-диамина (148,4 мг, 96%) в виде красного масла.
1H-ЯМР (400 МГц, CDCl3): δ 7,22 (м, 1H), 6,87-6,94 (м, 2H), 6,14 (с, 1H), 6,06 (с, 1H), 5,79 (с, 1H), 3,60 (шс, 2H), 3,18 (с, 3H)
(d) Синтез N-(3-хлор-5-((2,4-дифторфенил)(метил)амино)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида
Методику синтеза из примера 1-h повторяют, за исключением применения 5-хлор-N1-(2,4-дифторфенил)-N1-метилбензол-1,3-диамина (35,6 мг, 0,13 ммоль) в качестве исходного материала с получением N-(3-хлор-5-((2,4-дифторфенил)(метил)амино)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида (57,2 мг, 79%) в виде белого твердого вещества.
ЖХ/МС ИЭР (+): 549 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,45 (с, 1H), 8,31 (с, 1H), 8,19 (с, 1H), 8,08 (д, 1H, J=8,7 Гц), 7,73 (м, 1H), 7,41-7,53 (м, 3H), 7,21 (м, 1H), 6,93 (с, 1H), 6,48 (с, 1H), 3,23 (с, 3H), 2,72 (с, 3H), 1,84 (с, 6H)
Соединения из Примера 99 и примера 100 синтезируют с применением способа синтеза, описанного в примере 98, данные этих соединений перечислены ниже.
Таблица 6
Пример 101) Синтез N-(2-хлор-6-((4-хлорциклогекс-3-ен-1-ил)окси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида
(a) Синтез 4-амино-6-хлорпиридин-2-ола
2,6-дихлорпиридин-4-амин (1,0 г, 6,13 ммоль) растворяют в трет-BuOH (30,7 мл) и добавляют KOH (516,0 мг, 9,20 ммоль). Реакционную смесь перемешивают при 150°C в течение 15 часов, добавляют H2O и экстрагируют EtOAc. Водный слой подкисляют 1N водным раствором HCl и затем экстрагируют EtOAc. Органический экстракт сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, MeOH:EtOAc=1:10) с получением 4-амино-6-хлорпиридин-2-ола (120,0 мг, 14%) в виде беловатого твердого вещества.
ЖХ/МС ИЭР (+): 145 (M+1)
(b) Синтез бензоата 4-хлорциклогекс-3-ен-1-ила
Бензоат 4-оксоциклогексила (1,1 г, 4,76 ммоль) растворяют в толуоле (55,0 мл) и добавляют PCl5 (1,3 г, 6,05 ммоль) при -40°C. Реакционную смесь перемешивают при комнатной температуре в течение 2 часов, добавляют H2O и экстрагируют EtOAc. Органический экстракт сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:EtOAc=1:4) с получением бензоата 4-хлорциклогекс-3-ен-1-ила (850,0 мг, 65%) в виде беловатого масла.
1H-ЯМР (400 МГц, CDCl3): δ 8,03 (д, 2H, J=8,0 Гц), 7,57 (т, 1H, J=7,6 Гц), 7,44 (т, 2H, J=7,6 Гц), 5,76 (м, 1H), 5,31 (м, 1H), 2,34-2,61 (м, 4H), 2,05-2,10 (м, 2H)
(c) Синтез 4-хлорциклогекс-3-ен-1-ола
Бензоат 4-хлорциклогекс-3-ен-1-ила (400,0 мг, 1,69 ммоль) растворяют в MeOH (8,4 мл) и добавляют 0,5 M раствор NaOMe в MeOH (3,8 мл, 1,86 ммоль) при 0°C. Реакционную смесь перемешивают в течение 2 часов, добавляют буферный раствор NaHSO4 и NaH2PO4 и экстрагируют CH2Cl2. Органический экстракт сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:EtOAc=1:1) с получением 4-хлорциклогекс-3-ен-1-ола (90,0 мг, 40%) в виде беловатого масла.
1H-ЯМР (400 МГц, CDCl3): δ 5,69 (м, 1H), 4,01 (м, 1H), 2,41-2,45 (м, 3H), 2,14 (м, 1H), 1,82-1,92 (м, 2H)
(d) Синтез 2-хлор-6-((4-хлорциклогекс-3-ен-1-ил)окси)пиридин-4-амина
4-Амино-6-хлорпиридин-2-ол (80,0 мг, 0,55 ммоль) растворяют в ТГФ (2,0 мл) и добавляют 2-4-хлорциклогекс-3-ен-1-ол (81,0 мг, 0,61 ммоль), 2,2 M раствор ДЭАД в толуоле (377,0 мкл, 0,83 ммоль) и PPh3 (189,0 мг, 0,72 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 15 часов и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, n-Hex:EtOAc=1:2) с получением 2-хлор-6-((4-хлорциклогекс-3-ен-1-ил)окси)пиридин-4-амина (51,0 мг, 36%) в виде желтого масла.
ЖХ/МС ИЭР (+): 259 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 6,21 (с, 1H), 5,82 (с, 1H), 5,72 (м, 1H), 5,27 (м, 1H), 4,14 (с, 2H), 2,43-2,51 (м, 4H), 1,98-2,02 (м, 2H)
(e) Синтез N-(2-хлор-6-((4-хлорциклогекс-3-ен-1-ил)окси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида
Методику синтеза из примера 67-b повторяют, за исключением применения 2-хлор-6-((4-хлорциклогекс-3-ен-1-ил)окси)пиридин-4-амина (40,0 мг, 0,15ммоль) в качестве исходного материала с получением N-(2-хлор-6-((4-хлорциклогекс-3-ен-1-ил)окси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида (35,0 мг, 42%).
ЖХ/МС ИЭР (+): 539 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,96 (с, 1H), 8,40 (с, 1H), 8,26 (с, 1H), 8,13 (д, 1H, J=8,8 Гц), 7,78 (д, 1H, J=8,8 Гц), 7,46 (с, 1H), 7,24 (с, 1H), 5,81 (м, 1H), 5,21 (м, 1H), 2,75 (с, 3H), 2,43-2,68 (м, 4H), 2,01-2,03 (м, 2H)
Пример 102) Синтез N-(2-хлор-6-((октагидроиндолизин-7-ил)окси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида
(a) Синтез октагидроиндолизин-7-ола
Гексагидроиндолизин-7(1H)-он (220,0 мг, 1,58 ммоль) растворяют в ТГФ (12,5 мл) и туда добавляют 1,0 M LiAlH4 в ТГФ (3,95 мл, 3,95 ммоль) при комнатной температуре. Смесь перемешивают при 80°C в течение 30 мин и добавляют воду при 0°C. Полученную реакционную смесь фильтруют через Целит и экстрагируют CH2Cl2. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют и выпаривают с получением октагидроиндолизин-7-ола (220,0 мг, 99%) в виде бесцветной жидкости.
ЖХ/МС ИЭР (+): 142 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 4,63-4,64 (м, 1H), 2,86-2,93 (м, 2H), 1,86-1,97 (м, 3H), 1,56-1,79 (м, 5H), 1,25-1,40 (м, 2H), 0,98-1,07 (м, 1H)
(b) Синтез 2-хлор-6-((октагидроиндолизин-7-ил)окси)пиридин-4-амина
Октагидроиндолизин-7-ол (200,0 мг, 1,42 ммоль) и 2,6-дихлорпиридин-4-амин (462,0 мг, 2,83 ммоль) растворяют в сульфолане (7,0 мл) и туда добавляют 60% масс. NaH (113,0 мг, 2,83 ммоль) при комнатной температуре. Смесь перемешивают при 160°C в течение 1 часа и экстрагируют EtOAc. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с обращенной фазой (C18-силикагель, 0,1% муравьиной кислоты в CH3CN: 0,1% муравьиной кислоты в H2O) с получением 2-хлор-6-((октагидроиндолизин-7-ил)окси)пиридин-4-амина (200,0 мг, 52%) в виде бесцветной жидкости.
ЖХ/МС ИЭР (+): 268 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 6,28 (с, 2H), 6,18 (д, 1H, J=1,6 Гц), 5,74-5,76 (м, 1H), 4,72-4,80 (м, 1H), 2,89-3,01 (м, 2H), 2,12-2,16 (м, 1H), 1,86-2,06 (м, 4H), 1,62-1,83 (м, 3H), 1,47-1,56 (м, 1H), 1,27-1,37 (м, 1H), 1,15-1,27 (м, 1H)
(c) Синтез N-(2-хлор-6-((октагидроиндолизин-7-ил)окси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида
Методику синтеза из примера 62-b повторяют, за исключением применения 2-хлор-6-((октагидроиндолизин-7-ил)окси)пиридин-4-амина (50,0 мг, 0,19 ммоль) в качестве исходного материала с получением N-(2-хлор-6-((октагидроиндолизин-7-ил)окси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида (11,1 мг, 10%)
ЖХ/МС ИЭР (+): 548 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,95 (с, 1H), 8,40 (с, 1H), 8,26 (д, 1H, J=1,6 Гц), 8,12-8,16 (м, 1H), 7,78 (дд, 1H, J=8,8, 1,6 Гц), 7,45 (д, 1H, J=1,6 Гц), 7,20 (д, 1H, J=1,2 Гц), 4,88-4,94 (м, 1H), 2,94-3,08 (м, 2H), 2,75 (с, 3H), 2,22-2,26 (м, 1H), 1,95-1,96 (м, 4H), 1,79-1,90 (м, 6H), 1,60-1,76 (м, 3H), 1,23-1,42 (м, 3H)
Пример 103) Синтез 2,2,2-трифторацетата N-(3-хлор-5-(4-хлорфенокси)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксимидамида
(a) Синтез 5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида
5-(2-(Метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоновую кислоту (111,0 мг, 0,37 ммоль) растворяют в CH2Cl2 (3,6 мл) и (COCl)2 (50,8 мг, 0,40 ммоль) и по каплям добавляют ДМФ (кат.). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа и концентрируют при пониженном давлении с получением хлорида 5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбонила. Остаток растворяют в 1,4-диоксане (3,7 мл) и по каплям добавляют 2N раствор NH3 в MeOH (1,8 мл). Реакционную смесь перемешивают при комнатной температуре в течение 40 минут, концентрируют при пониженном давлении. Остаток очищают хроматографией с обращенной фазой (C18-силикагель, CH3CN:H2O) с получением 5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида (110,0 мг, колич.).
ЖХ/МС ИЭР (+): 298 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 8,26 (шс, 1H), 8,11 (д, 1H, J=1,7 Гц), 8,08 (с, 1H), 8,04 (д, 1H, J=8,7 Гц), 7,70 (дд, 1H, J=8,7, 2,0 Гц), 7,66 (шс, 1H), 2,71 (с, 3H), 1,83 (с, 6H)
(b) Синтез этил 5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбимидата
5-(2-(Метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамид (85,0 мг, 0,29 ммоль) растворяют в CH2Cl2 (6,0 мл) и по каплям добавляют 1,0 M раствор тетрафторбората триэтилоксония в CH2Cl2 (109,0 мл, 0,57 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 16 часов и экстрагируют CH2Cl2. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (амин силикагель, CH2Cl2:MeOH=9:1) с получением этил 5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбимидата (63,9 мг, 69%).
ЖХ/МС ИЭР (+): 326 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 9,15 (с, 1H), 8,17 (с, 1H), 8,12 (д, 1H, J=1,5 Гц), 8,03 (д, 1H, J=8,7 Гц), 7,70 (дд, 1H, J=8,9, 1,8 Гц), 4,27 (кв, 2H, J=7,1 Гц), 2,72 (с, 3H), 1,83 (с, 6H), 1,33 (т, 3H, J=7,1 Гц)
(c) Синтез 2,2,2-трифторацетата N-(3-хлор-5-(4-хлорфенокси)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксимидамида
Этил 5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбимидат (63,9 мг, 0,20 ммоль) и 3-хлор-5-(4-хлорфенокси)анилин (59,9 мг, 0,24 ммоль) растворяют в ДМФ (0,4 мл) и по каплям добавляют триэтиламин (19,9 мг, 0,20 ммоль). Реакционную смесь перемешивают при 60°C в течение 16 часов и затем при 100°C в течение 16 часов. Реакционную смесь очищают хроматографией на колонке с обращенной фазой (C18-силикагель, 0,1% муравьиной кислоты в CH3CN: 0,1% муравьиной кислоты в H2O) с получением 2,2,2-трифторацетата N-(3-хлор-5-(4-хлорфенокси)фенил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксимидамида (2,4 мг, 2%) в виде белого твердого вещества.
ЖХ/МС ИЭР (+): 533 (M+1), свободная форма
1H-ЯМР (400 МГц, ДМСО-d6): δ 11,79 (шс, 2H), 8,31 (с, 1H), 8,26 (с, 1H), 8,18 (д, 1H, J=7,3 Гц), 7,80 (д, 1H, J=8,6 Гц), 7,49 (д, 2H, J=7,7 Гц), 7,26 (шс, 1H), 7,18 (д, 2H, J=8,4 Гц), 7,14 (шс, 1H), 6,96 (шс, 1H), 2,75 (с, 3H), 1,86 (с, 6H)
Пример 104) Синтез N-(2-хлор-6-(гексагидропирролo[1,2-a]пиразин-2(1H)-ил)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида
(a) Синтез 2-хлор-6-(гексагидропирролo[1,2-a]пиразин-2(1H)-ил)пиридин-4-амина
2,6-дихлорпиридин-4-амин (50,0 мг, 0,31 ммоль) и октагидропирролo[1,2-a]пиразин (77,6 мг, 0,61 ммоль) растворяют в сульфолане (0,5 мл), затем нагревают при 150°C в течение ночи. Добавляют еще октагидропирролo[1,2-a]пиразин (100,0 мг, 0,80 ммоль). Реакционную смесь перемешивают при 150°C в течение еще 1 дня и затем охлаждают до комнатной температуры и экстрагируют EtOAc. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4, концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (силикагель, CH2Cl2:MeOH=7:1) с получением 2-хлор-6-(гексагидропирролo[1,2-a]пиразин-2(1H)-ил)пиридин-4-амина (66,0 мг, 85%) в виде светло-желтого аморфного вещества.
1H-ЯМР (400 МГц, CDCl3): δ 6,00 (с, 1H), 5,71 (с, 1H) 4,31 (д, 1H, J=11,9 Гц), 4,07 (д, 1H, J=12,2 Гц), 4,02 (с, 2H), 3,11-3,15 (м, 2H), 2,94-3,01 (м, 1H), 2,57-2,63 (м, 1H), 2,28-2,31 (м, 1H), 2,15-2,19 (м, 1H), 2,03-2,08 (м, 2H), 1,77-1,83 (м, 2H), 1,47-1,50 (м, 1H)
(b) Синтез N-(2-хлор-6-(гексагидропирролo[1,2-a]пиразин-2(1H)-ил)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида
Методику синтеза из примера 62-b повторяют, за исключением применения 2-хлор-6-(гексагидропирролo[1,2-a]пиразин-2(1H)-ил)пиридин-4-амина (62,0 мг, 0,25 ммоль) с получением N-(2-хлор-6-(гексагидропирролo[1,2-a]пиразин-2(1H)-ил)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида (28,4 мг, 22%).
ЖХ/МС ИЭР (+): 533 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,73 (с, 1H), 8,39 (с, 1H), 8,22 (м, 1H), 8,12 (д, 1H, J=8,7 Гц), 7,76 (дд, 1H, J=8,7, 1,8 Гц), 7,22 (с, 1H), 7,13 (с, 1H), 4,23 (д, 1H, J=11,1 Гц), 4,08 (д, 1H, J=12,4 Гц), 3,00-3,09 (м, 2H), 2,87-2,94 (м, 1H), 2,74 (с, 3H), 2,55-2,60 (м, 1H), 2,03-2,16 (м, 2H), 1,86-1,97 (м, 8H), 1,66-1,76 (м, 2H), 1,33-1,43 (м, 1H)
Соединения из примеров от 105 до 108 синтезируют с применением способа синтеза, описанного в примере 104, данные этих соединений перечислены ниже.
Таблица 7
Пример 109) Синтез N-(2-хлор-6-((5-метилтиазол-2-ил)окси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида
(a) Синтез 4-бром-2,6-дихлорпиридин 1-оксида
4-Бром-2,6-дихлорпиридин (5,0 г, 22,04 ммоль) растворяют в ТФК (23,8 мл, 309,00 ммоль) и добавляют H2O2 (4,8 мл, 55,10 ммоль) при комнатной температуре. Смесь кипятят с обратным холодильником при перемешивании при 100°C в течение 14 часов, затем охлаждают до комнатной температуры и фильтруют. Фильтрат экстрагируют EtOAc. Органический экстракт промывают 1N NaOH, сушат с безводным Na2SO4, фильтруют и выпаривают с получением 1-оксида 4-бром-2,6-дихлорпиридина (2,7 г, 49%) в виде желтого твердого вещества.
ЖХ/МС ИЭР (+): 244 (M+1)
1H-ЯМР(400 МГц, CDCl3): δ 7,61 (с, 2H)
(b) Синтез 1-оксида 4-бром-2-хлор-6-((5-метилтиазол-2-ил)окси)пиридина
1-Оксид 4-бром-2,6-дихлорпиридина (112,0 мг, 0,46 ммоль) растворяют в ДМФ (4,0 мл) и 5-метилтиазол-2-оле (53,0 мг, 0,46 ммоль), добавляют Cs2CO3 (300,0 мг, 0,92 ммоль) при комнатной температуре. Смесь перемешивают при 40°C for 2 часов. Реакционную смесь очищают хроматографией на колонке с обращенной фазой (C18-силикагель, 0,1% муравьиной кислоты в CH3CN:0,1% муравьиной кислоты в H2O) с получением 1-оксида 4-бром-2-хлор-6-((5-метилтиазол-2-ил)окси)пиридина (50,0 мг, 33%) в виде желтого твердого вещества.
ЖХ/МС ИЭР (+): 321 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,72 (д, 1H, J=2,8 Гц), 7,67 (д, 1H, J=2,8 Гц), 6,77-6,78 (м, 1H), 2,02 (д, 3H, J=1,6 Гц)
(c) Синтез 2-((4-бром-6-хлорпиридин-2-ил)окси)-5-метилтиазола
1-Оксид 4-бром-2-хлор-6-((5-метилтиазол-2-ил)окси)пиридина (40,0 мг, 0,12 ммоль) растворяют в CHCl3 (1,2 мл) и туда добавляют PCl3 (33,0 мкл, 0,37 ммоль) при 0°C. Смесь перемешивают при комнатной температуре в течение 6 часов и экстрагируют EtOAc. Органический экстракт промывают 1N NaOH и насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют и выпаривают с получением 2-((4-бром-6-хлорпиридин-2-ил)окси)-5-метилтиазола (35,0 мг, 92%) в виде твердого вещества цвета слоновой кости.
ЖХ/МС ИЭР (+): 305 (M+1)
1H-ЯМР(400 МГц, CDCl3): δ 8,48 (с, 1H), 7,40 (с, 1H), 7,37 (с, 1H), 2,21 (с, 3H)
(d) Синтез 2-хлор-6-((5-метилтиазол-2-ил)окси)пиридин-4-амина
2-((4-Бром-6-хлорпиридин-2-ил)окси)-5-метилтиазол (30,0 мг, 0,10 ммоль) растворяют в ДМСО (1,0 мл) и добавляют Cu2O (16,9 мг, 0,12 ммоль), азид натрия (12,8 мг, 0,20 ммоль) при комнатной температуре. Смесь перемешивают при 100°C в течение 1 часа и экстрагируют EtOAc. Органический экстракт промывают насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с обращенной фазой (C18-силикагель, 0,1% муравьиной кислоты в CH3CN: 0,1% муравьиной кислоты в H2O) с получением 2-хлор-6-((5-метилтиазол-2-ил)окси)пиридин-4-амина (4,0 мг, 16%) в виде беловатого твердого вещества.
ЖХ/МС ИЭР (+): 242 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,48 (д, 1H, J=1,6 Гц), 7,38 (д, 1H, J=1,2 Гц), 6,42 (д, 1H, J=1,6 Гц), 6,44 (шс, 2H), 2,18 (д, 3H, J=1,2 Гц)
(e) Синтез N-(2-хлор-6-((5-метилтиазол-2-ил)окси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида
Методику синтеза из примера 62-b повторяют, за исключением применения 2-хлор-6-((5-метилтиазол-2-ил)окси)пиридин-4-амина (4,0 мг, 0,02 ммоль) с получением N-(2-хлор-6-((5-метилтиазол-2-ил)окси)пиридин-4-ил)-5-(2-(метилсульфонил)пропан-2-ил)бензо[b]тиофен-2-карбоксамида (1,1 мг, 13%) в виде белого твердого вещества.
ЖХ/МС ИЭР (+): 522 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 11,33 (шс, 1H), 8,49 (с, 2H), 8,24 (с, 1H), 8,12 (д, 1H, J=8,8 Гц), 8,00 (д, 1H, J=1,2 Гц), 7,77 (дд, 1H, J=8,8, 1,6 Гц), 7,48 (д, 1H, J=1,2 Гц), 2,74 (с, 3H), 2,22 (д, 3H, J=0,8 Гц), 1,86 (с, 6H)
Соединения из примера от 110 до 121 синтезируют с применением способа синтеза, описанного в примере 109, данные этих соединений перечислены ниже.
Таблица 8
Экспериментальные примеры
Эксперименты проводят, как показано ниже, для соединений, полученных в представленных выше примерах.
Экспериментальный пример 1) Эксперимент для проверки ингибирования активности ПСАТ3 и ПСАТ1 через анализ гена-репортера
1-1) Эксперимент для проверки ингибирования активности ПСАТ3
Колонию клеток рака предстательной железы человека (колония стабильных клеток LNCaP; плазмид pПСАТ3-TA-luc), которые содержат стабильно действующий промотор ПСАТ3, культивируют в среде RPMI1640 (каталожный № 11875, Life Technologies), содержащей 10% фетальной бычьей сыворотки (ФБС) (каталожный № SH30396, Thermo Scientific) и 150 мкг/мл раствора G-418 (Каталожный № 04 727 894 001, Roche). Анализ гена-репортера с применением колонии стабильных клеток LNCaP проводят в среде RPMI1640, содержащей 3% ДЦК-ФБС без раствора G-418. Стабильные клетки LNCaP помещают в два (2) белых 96-луночных планшета в количестве 30000 клеток/50 мкл в каждой лунке. Клетки культивируют при 37°C под 5% CO2 в течение 24 часов и затем обрабатывают соединениями, перечисленными в примерах, которые разводят в различных концентрациях. Затем в каждую лунку добавляют ИЛ-6 в конечной концентрации 10 нг/мл. После завершения обработки соединениями и ИЛ-6, клетки культивируют при 37°C под 5% CO2 в течение 24 часов. Планшеты рассматривают в микроскоп, и исследуют и записывают осаждение лекарственного и конкретные данные.
Анализ люциферазы и анализ жизнеспособности клеток проводят, соответственно, в одном из двух планшетов. Для анализа люциферазы, жидкую среду в 96-луночном планшете удаляют и затем в каждую лунку добавляют 20 мкл буфера для лизиса пассивных клеток. После встряхивания планшета в течение 30 минут, активность люциферазы в каждой лунке измеряют в микропланшетном ридере PHERAstar™ (BMG LABTECH) с применением системы анализа люциферазы (каталожный № E1501, Promega). Для анализа жизнеспособности клеток 96-лунойчный планшет выдерживают при комнатной температуре в течение 30 минут, добавляют 20 мкл/лунку раствора CellTiter-Glo (каталожный № G7573, Promega) и встряхивают в течение 10 минут для измерения цитотоксичности, вызванной соединениями, перечисленными в примерах, с применением микропланшетного ридера PHERAstar™ (BMG LABTECH). Лунки без 0,1% ДМСО и стимулирования применяют в качестве отрицательного контроля, и лунки с 0,1% ДМСО и стимулированием применяют в качестве положительного контроля.
1-2) Эксперимент для проверки ингибирования активности ПСАТ1
Колонию клеток остеосаркомы человека (колония стабильных клеток U2OS; pGL4-ПСАТ1-TA-luc), которые содержат стабильно действующий промотор ПСАТ1, культивируют в среде McCoy 5'A (каталожный № 16600, Life Technologies), содержащей 10% ФБС (каталожный № SH30396, Thermo Scientific) и 1000 мкг/мл раствора G418 (каталожный № 04 727 894 001, Roche). Анализ гена-репортера проводят с применением колонии стабильных клеток U2OS проводят в среде McCoy 5'A, содержащей 10% ФБС без раствора G-418. Стабильные клетки U2OS помещают в два (2) белых 96-луночных планшета в количестве 25000 клеток/50 мкл в каждой лунке. Клетки культивируют при 37°C под 5% CO2 в течение 24 часов и затем обрабатывают соединениями, перечисленными в примерах, которые разводят в различных концентрациях. Затем в каждую лунку добавляют ИФН-γ в конечной концентрации 50 нг/мл. После завершения обработки соединениями и ИФН-γ, клетки культивируют при 37°C под 5% CO2 в течение 8 часов. Планшеты рассматривают в микроскоп, и исследуют и записывают осаждение лекарственного средства и конкретные данные.
Анализ люциферазы и анализ жизнеспособности клеток проводят, соответственно, в одном из двух планшетов. Для анализа люциферазы, жидкую среду в 96-луночном планшете удаляют и затем в каждую лунку добавляют 20 мкл буфера для лизиса пассивных клеток. После встряхивания планшета в течение 30 минут, активность люциферазы в каждой лунке измеряют в микропланшетном ридере PHERAstar™ (BMG LABTECH) с применением системы анализа люциферазы (каталожный № E1501, Promega). Для анализа жизнеспособности клеток 96-лунойчный планшет выдерживают при комнатной температуре в течение 30 минут, добавляют 20 мкл/лунку раствора CellTiter-Glo (каталожный № G7573, Promega) и встряхивают в течение 10 минут для измерения цитотоксичности, вызванной соединениями, перечисленными в примерах, с применением микропланшетного ридера PHERAstar™ (BMG LABTECH). Лунки без 0,1% ДМСО и стимулирования применяют в качестве отрицательного контроля, и лунки с 0,1% ДМСО и стимулированием применяют в качестве положительного контроля.
Результаты оценки ингибирующего действия соединений, перечисленных в примерах, на димеризацию ПСАТ3 и ПСАТ1, полученной в анализах гена-репортера ПСАТ3 и ПСАТ1, показаны в таблице 9 ниже.
Таблица 9
Как показано в таблице 9, соединения в соответствии с данным изобретением демонстрируют превосходное ингибирующее действие на активность белка ПСАТ3, но показывает практическое отсутствие ингибирующего действия на активность белка ПСАТ1.
Экспериментальный пример 2) Анализ ингибирования роста клеток
Ингибирующее действие соединений в соответствии с данным изобретением на рост раковых клеток оценивают, как показано ниже. Колонии раковых клеток, включающие колонии клеток рака предстательной железы (LNCaP, DU-145), колонию клеток рака желудка (NCI-N87) и колонии клеток рака молочной железы (MDA-MB-468) культивируют по протоколу, предложенному каждым поставщиком. Среду с добавлением 10 нг/мл ИЛ-6 применяют для LNCaP, колонии клеток рака предстательной железы, при обработке лекарственным средством. Каждый тип клеток, применяемых в экспериментах, субкультивируют в 96-луночном планшете с подсчетом точного количества клеток с помощью цитометра с визуализацией Tali™ (Life Technologies). В 96-луночном планшете, DU-145 применяют в количестве 3000 клеток/лунку; NCI-N87 применяют в количестве 5000 клеток/лунку; и LNCaP и MDA-MB-468 применяют в количестве 10000 клеток/лунку. Клетки обрабатывают соединениями, перечисленными в примерах, которые разводят в различных концентрациях. После завершения обработки соединениями, клетки LNCaP, DU-145, NCI-N87 культивируют при 37°C под 5% CO2 в течение 96 часов и клетки MDA-MB-468 культивируют при 37°C на воздухе в течение 96 часов. Затем клетки рассматривают в микроскоп и исследуют и записывают осаждение лекарственного средства и конкретные данные. Затем 96-луночный планшет выдерживают при комнатной температуре в течение 30 минут, добавляют 20 мкл/лунку раствора CellTiter-Glo (каталожный № G7573, Promega) и встряхивают в течение 10 минут, затем измеряют с помощью микропланшетного ридера PHERAstar™ (BMG LABTECH) в соответствии с общим протоколом люминометра, представленным поставщиком. Лунки, в которые была добавлена только культуральная жидкость, без добавления клеток, используют в качестве негативного контроля, а лунки, в которые добавлена культуральная жидкость, содержащая 0,1% ДМСО вместо соединений, перечисленных в примерах, используют в качестве положительного контроля.
Результаты ингибирующего действия соединений, полученных в примерах, на рост раковых клеток представлены в таблицах 10-13 ниже.
Таблица 10
Таблица 11
Таблица 12
Таблица 13
Как показано в таблицах 10-13, соединения в соответствии с данным изобретением демонстрируют превосходное ингибирующее действие на рост различных типов раковых клеток.
Реферат
Изобретение относится к новым соединениям, представленным формулой (I), и их фармацевтически приемлемым солям, а также к фармацевтическим композициям на их основе, применению и способу лечения. Технический результат: получены новые соединения, обладающие ингибирующим действием на активацию белка ПСАТ3, которые могут применяться для профилактики или лечения заболеваний, связанных с активацией белка ПСАТ3. 4 н. и 9 з.п. ф-лы, 13 табл., 123 пр.
Формула
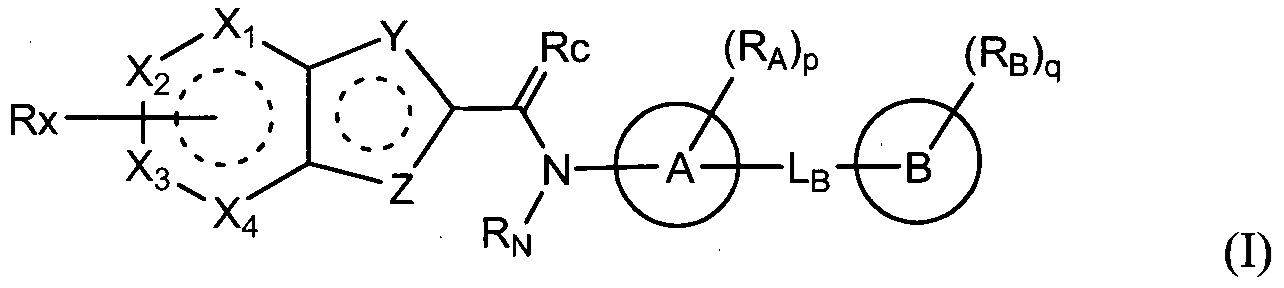






Комментарии