Производные флавонов, ксантонов и кумаринов и фармацевтическая композиция на их основе - RU2252221C2
Код документа: RU2252221C2
Описание
Развитие резистентности новообразований ко многим лекарственным средствам представляет собой постоянно усложняющуюся проблему в области лечения рака. В последние десятилетия выяснены несколько механизмов резистентности опухолевых клеток к лекарственным средствам. Показано, что медиатором одного из типов резистентности ко многим лекарственным средствам (РМЛ, англ. аббревиатура MDR) является энергозависимый связанный с мембраной Р-гликопротеин (PGP), названный насосом оттока (Biochem. Biophys. Acta, 455, 152, 1976). PGP является членом АТФ-связывающей группы с низкой специфичностью к субстратам (Nature, 323. 448, 1986). Отток, медиатором которого является PGP, обуславливает удаление из клеток широкого диапазона разнообразных цитостатических лекарственных средств, таких как антрациклины, эпиподофиллотоксины, актиномицин D, алкалоиды барвинка, колхицины и таксол. В последние несколько лет было показано, что различные вещества ингибируют отток лекарственных веществ из клеток, медиатором которого является PGP, и, таким образом, восстанавливают их чувствительность к химиотерапевтическим агентам (Pharmacol. Rev 42, 155, 1990). К таким веществам относятся блокаторы ионных каналов, такие как верапамил (Cancer Res. 41, 1967, 1981), амиодарон (Cancer Res. 46, 825, 1986), пропафенон (Proc. Am. Assoc. Cancer Res. 34, 321, 1993), дигидропиридины (Cancer Res. 43, 2267, 1983), фенотиазины (Mol. Pharmacol. 35, 105, 1989). Предварительные результаты, полученные при клинических испытаниях, явно показывают, что модулирование РМЛ может быть перспективным подходом к лечению гематологических злокачественных расстройств, однако серьезные побочные эффекты (воздействие на сердце, подавление иммунитета и нефротоксичность) часто препятствуют применению оптимальных доз модуляторов (Cancer 72, 3553, 1993). Поэтому ощущается настоятельная необходимость в специально разработанных высокоэффективных модуляторах с ограниченным побочным действием.
Настоящее изобретение относится к новому классу соединений, аналогичных по структуре природным и синтетическим флавоноидам, и к фармацевтическому применению таких соединений.
Таким образом, в соответствии с одним аспектом настоящего изобретения предлагается соединение Формулы (I):

или его фармацевтически приемлемая соль либо сольват, в котором:
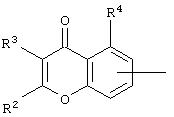
R и R1 одинаковы или различны и каждый из них представляет собой низший C1-С6 алкил или карбоциклическую группу, содержащую в циклической структуре от 5 до 10 атомов, причем упомянутые атомы в циклической структуре образуют один или два цикла, где цикл или каждый из циклов содержит 5 или 6 атомов, или
R и R1 в сочетании с атомом азота, к которому они присоединены, образуют гетероциклическую группу, состоящую из 4-8 членов, которая может содержать один или несколько дополнительных гетероатомов, выбранных из группы, состоящей из N, О и S, причем упомянутая гетероциклическая группа факультативно замещена низшим C1-C4 алкилом или бензилом;
Z представляет собой

где
R2 и R3 независимо друг от друга выбраны из следующих групп:
(i) водород, (ii) замещенная или незамещенная, предпочтительно ароматическая, карбоциклическая или гетероциклическая группа, содержащая в циклической структуре от 5 до 10 атомов, причем упомянутые атомы в циклической структуре образуют один или два цикла, где цикл или каждый из циклов содержит 5 или 6 атомов, любые гетероатомы выбраны из группы, состоящей из N, О и S, а любые заместители выбраны независимо друг от друга из группы, в которую входят:
(а) Сl, (b) Вr, (с) F, (d) ОН, (е) NО2, (f) СF2, (g) низший C1-C4 алкил (в частности, СН3), (h) SСН3, (i) NНСОСН3, (j) N(R6)(R8), где R6 и R8одинаковы или различны и каждый из них представляет собой Н или низший C1-C4 алкил, (k) OR10, где R10 представляет собой Н или насыщенный или ненасыщенный низший C1-C6 алкил, который может быть незамещенным или замещенным группой NRR1, где R и R1 соответствуют вышеприведенному определению, и (1) OCOR11, где R11 представляет собой Н или низший C1-C4алкил, (iii) Cl, (iv) Br, (v) F, (vi) ОН, (vii) NО2, (viii) насыщенный или ненасыщенный низший углеводородный радикал C1-C6 нормального или разветвленного строения, который может быть незамещенным или замещенным одним, двумя или тремя заместителями, выбранными из Cl, Br, F, OMe, NO2 и СF3, (ix) NHCOCH3, (х) N(R6)(R8), (xi) SR10, (xii) OR10 и (xiii) OCOR11, где R6, R8, R10 и R11 соответствуют вышеприведенным определениям;
или
R2 и R3 в сочетании с атомами углерода, к которым они присоединены, образуют карбоциклическую или гетероциклическую группу, содержащую 5 или 6 атомов, в которой любой гетероатом выбран из группы, состоящей из N, О и S, причем упомянутая карбоциклическая или гетероциклическая группа может быть насыщенной или ненасыщенной и незамещенной или замещенной одним или несколькими заместителями, выбранными из группы, в которую входят Cl, Br, F, ОН, NO2, СF3, низший С1 -С4 алкил, SСН3, NНСОСН3, N(R6)(R8), OR10 и OCOR11, где R6, R8, R10 и R11 соответствуют вышеприведенным определениям; и
R4 - водород или OR10, где R10 соответствует вышеприведенному определению,
либо

где R5 представляет собой водород или низший углеводородный радикал C1-С6 нормального или разветвленного строения, который может быть незамещенным или замещенным одним, двумя или тремя заместителями, выбранными из Cl, Br, F, ОМе, NО2 и СF3, при условии, что если группа Z представляет собой

то оба заместителя R и R1 не могут быть метилами или R и R1 в сочетании с атомом азота, к которому они присоединены, не могут образовывать группы

Кроме того, в соответствии с одним из аспектов настоящего изобретения предлагаются соединения, имеющие структуру (IA’):

где:
R2 и R3 независимо друг от друга выбраны из следующих групп:
(i) водород, (ii) замещенная или незамещенная, предпочтительно ароматическая, карбоциклическая или гетероциклическая группа, содержащая в циклической структуре от 5 до 10 атомов, причем упомянутые атомы в циклической структуре образуют один или два цикла, где цикл или каждый из циклов содержит 5 или 6 атомов, любые гетероатомы выбраны из группы, состоящей из N, О и S, а любые заместители выбраны независимо друг от друга из группы, в которую входят: Cl, Br, F, ОН, NО2, СF3, низший С1-С4 алкил (в частности, СН3), SСН3, NНСОСН3, N(R6)(R8), OR10 и OCOR11, где R6, R8, R10 и R11 одинаковы или различны и каждый из них представляет собой водород или низший C1-C4алкил, (iii) Cl, (iv) Br, (v) F, (vi) ОН, (vii) NO2, (viii) насыщенный или ненасыщенный низший углеводородный радикал С1-С6 нормального или разветвленного строения, который может быть незамещенным или замещенным одним, двумя или тремя заместителями, выбранными из Cl, Br, F, ОМе, NО3 и СF3, (ix) NHCOCH3, (х) N(R6)(R8), (xi) SR10, (xii) OR10 и (xiii) OCOR11, где R6, R8, R10 и R11 соответствуют вышеприведенным определениям;
или
R2 и R3 в сочетании с атомами углерода, к которым они присоединены, образуют карбоциклическую или гетероциклическую группу, содержащую 5 или 6 атомов, в которой любой гетероатом выбран из группы, состоящей из N, О и S, причем упомянутая карбоциклическая или гетероциклическая группа может быть насыщенной или ненасыщенной и незамещенной или замещенной одним или несколькими заместителями, выбранными из группы, в которую входят Cl, Br, F, ОН, NO2, СF3, низший C1-C4 алкил, SСН3, NНСОСН3, N(R6)(R8), OR10 и OCOR11, где R6, R8, R10 и R11 соответствуют вышеприведенным определениям; и
R4 - водород или OR10, где R10 соответствует вышеприведенному определению.
Предпочтительную группу составляют соединения, в которых R, R1 и R4соответствуют вышеприведенным определениям, относящимся к формуле (IA’), и
R2 и R3 независимо друг от друга выбраны из группы, в которую входят: (i) водород, (ii) замещенная или незамещенная, предпочтительно ароматическая, карбоциклическая или гетероциклическая группа, содержащая в циклической структуре от 5 до 10 атомов, причем упомянутые атомы в циклической структуре образуют один или два цикла, где цикл или каждый из циклов содержит 5 или 6 атомов, любые гетероатомы выбраны из группы, состоящей из N, О и S, а любые заместители выбраны независимо друг от друга из группы, в которую входят:
(а) Сl, (b) Вr, (с) F, (d) ОН, (е) NO2, (f) СF3, (g) низший C1-C4 алкил (в частности, СН3), (h) SСН3, (i) NНСОСН3, (j) N(R6 )(R8), где R6 и R8одинаковы или различны и каждый из них представляет собой Н или низший C1-C4 алкил, (k) OR10, где R10 представляет собой Н или насыщенный или ненасыщенный низший С1-С6 алкил, который может быть незамещенным или замещенным группой NRR1, где R и R1 соответствуют вышеприведенному определению, и (1) OCOR11, где R11 представляет собой Н или низший C1-C4алкил, (iii) Cl, (iv) Br, (v) F, (vi) ОН, (vii) NО3, (viii) насыщенный или ненасыщенный низший углеводородный радикал C1-С6 нормального или разветвленного строения, который может быть незамещенным или замещенным одним, двумя или тремя заместителями, выбранными из Cl, Br, F, OMe, NO2 и СF3, (ix) NНСОСН3, (х) N(R6)(R8), (xi) SR10, (xii) OR10 и (xiii) OCOR11, где R6, R8, R10 и R11 соответствуют вышеприведенным определениям, относящимся к Формуле (I).
В пределах этой группы каждый из заместителей R2 и R3 может быть атомом водорода. Другую предпочтительную группу составляют соединения, в которых один из заместителей R1 и R2 - водород, а второй выбран из группы, в которую входят: (i) замещенная или незамещенная, предпочтительно ароматическая, карбоциклическая или гетероциклическая группа, содержащая в циклической структуре от 5 до 10 атомов, причем упомянутые атомы в циклической структуре образуют один или два цикла, где цикл или каждый из циклов содержит 5 или 6 атомов, любые гетероатомы выбраны из группы, состоящей из N, О и S, а любые заместители выбраны независимо друг от друга из группы, в которую входят: Cl, Br, F, ОН, NO2, СF3, низший C1-C4 алкил (в частности, СН3), SСН3, NНСОСН3, N(R6)(R8), OR10 и OCOR11, где R6, R8, R10 и R11 одинаковы или различны и каждый из них представляет собой водород или низший C1-C4алкил,
(ii) Cl, (iii) Br, (iv) F, (v) ОН, (vi) NО3, (vii) насыщенный или ненасыщенный низший углеводородный радикал С1-С6 нормального или разветвленного строения, который может быть незамещенным или замещенным одним, двумя или тремя заместителями, выбранными из Cl, Br, F, OMe, NO2 и СF3, (viii) NНСОСН3, (ix) N(R6)(R8), (x) SR10, (xi) OR10 и (xii)OCOR11, где R6, R8, R10 и R11 соответствуют вышеприведенным определениям, относящимся к Формуле (I).
В пределах этой предпочтительной группы соединений дальнейшее предпочтение отдается соединениям, в которых R2 - водород, а R3 выбран из группы, в которую входят: (i) замещенная или незамещенная, предпочтительно ароматическая, карбоциклическая или гетероциклическая группа, содержащая в циклической структуре от 5 до 10 атомов, причем упомянутые атомы в циклической структуре образуют один или два цикла, где цикл или каждый из циклов содержит 5 или 6 атомов, любые гетероатомы выбраны из группы, состоящей из N, О и S, а любые заместители выбраны независимо друг от друга из группы, в которую входят:
Cl, Br, F, ОН, NО3, СF3, низший C1-C4 алкил (в частности, СН3), SСН3, NНСОСН3, N(R6)(R8), OR10 и OCOR11, где R6, R8, R10 и R11 одинаковы или различны и каждый из них представляет собой водород или низший C1-C4алкил,
(ii) Cl, (iii) Br, (iv) F, (v) ОН, (vi) NO2, (vii) насыщенный или ненасыщенный низший углеводородный радикал С1-С6 нормального или разветвленного строения, который может быть незамещенным или замещенным одним, двумя или тремя заместителями, выбранными из Cl, Br, F, OMe, NO2 и СF3, (viii) NHCOCH3, (ix) N(R6 )(R8), (x) SR10, (xi) OR10 и (xii)OCOR11, где R6, R8, R10 и Rl1 соответствуют вышеприведенным определениям, относящимся к Формуле (I).
Еще одну предпочтительную группу составляют соединения, в которых R3 - водород, а R2 выбран из группы, в которую входят: (i) замещенная или незамещенная, предпочтительно ароматическая, карбоциклическая или гетероциклическая группа, содержащая в циклической структуре от 5 до 10 атомов, причем упомянутые атомы в циклической структуре образуют один или два цикла, где цикл или каждый из циклов содержит 5 или 6 атомов, любые гетероатомы выбраны из группы, состоящей из N, О и S, а любые заместители выбраны независимо друг от друга из группы, в которую входят:
Cl, Br, F, ОН, NO2, СF3, низший С1-С4 алкил (в частности, СН3), SСН3, NНСОСН3, N(R6)(R8), OR10 и OCOR11, где R6, R8, R10 и R11 одинаковы или различны и каждый из них представляет собой водород или низший С1-С4алкил,
(ii) Cl, (iii) Br, (iv) F, (v) OH, (vi) NО3, (vii) насыщенный или ненасыщенный низший углеводородный радикал С1-С6 нормального или разветвленного строения, который может быть незамещенным или замещенным одним, двумя или тремя заместителями, выбранными из Cl, Br, F, OMe, NO2 и СF3, (viii) NНСОСН3, (ix) N(R6)(R8), (x) SR10, (xi) OR10 и (xii) OCOR11, где R6, R8, R10 и R11 соответствуют вышеприведенным определениям, относящимся к Формуле (I).
Еще одним предпочтительным вариантом осуществления настоящего изобретения являются соединения, в которых R2 - замещенная или незамещенная, предпочтительно ароматическая, карбоциклическая или гетероциклическая группа, содержащая в циклической структуре от 5 до 10 атомов, причем упомянутые атомы в циклической структуре образуют один или два цикла, где цикл или каждый из циклов содержит 5 или 6 атомов, любые гетероатомы выбраны из группы, состоящей из N, О и S, а любые заместители выбраны независимо друг от друга из группы, в которую входят Cl, Br, F, ОН, NO2, СF3, низший С1-С4 алкил (в частности, СН3), SСН3, NНСОСН3, N(R6)(R8), OR10 и OCOR11, где R6, R8, R10 и R11 соответствуют определениям, относящимся к Формуле (I). В этих соединениях R3 предпочтительно выбран из группы, в которую входят Н, Cl, Br, F, ОН, NO2, насыщенный или ненасыщенный низший углеводородный радикал C1-С6 нормального или разветвленного строения, который может быть незамещенным или замещенным одним, двумя или тремя заместителями, выбранными из Cl, Br, F, ОМе, NO2, СF3, NНСОСН3, N(R6)(R8), OR10 и OCOR11, где R6, R8, R10 и R11 соответствуют определениям, относящимся к Формуле (I).
В альтернативном варианте R3 может быть замещенной или незамещенной, предпочтительно ароматической, карбоциклической или гетероциклической группой, содержащей в циклической структуре от 5 до 10 атомов, причем упомянутые атомы в циклической структуре образуют один или два цикла, где цикл или каждый из циклов содержит 5 или 6 атомов, любые гетероатомы выбраны из группы, состоящей из N, О и S, а любые заместители выбраны независимо друг от друга из группы, в которую входят: Cl, Br, F, ОН, NO2, СF3 , низший C1-C4 алкил (в частности, СН3), SСН3, NНСОСН3, N(R6)(R8), OR10 и OCOR11, где R6, R8, R10 и R11 соответствуют определениям, относящимся к Формуле (I).
В этих соединениях R3 предпочтительно выбран из группы, в которую входят Н, Cl, Br, F, ОН, NО3, насыщенный или ненасыщенный низший углеводородный радикал С1-С6 нормального или разветвленного строения, который может быть незамещенным или замещенным одним, двумя или тремя заместителями, выбранными из Cl, Br, F, ОМе, NO2, СF3, NНСОСН3, N(R6)(R8), OR10 и OCOR11, где R6, R8, R10 и R11 соответствуют определениям, относящимся к Формуле (I).
В соединениях, где R2 и/или R3 - замещенная карбоциклическая или гетероциклическая группа, заместители при этой карбоциклической или гетероциклической группе предпочтительно выбраны из группы, состоящей из ОН и OR10, где R10 соответствует определению, относящемуся к Формуле (I).
Особо предпочтительной карбоциклической группой является фенил или фенил, замещенный одной, двумя или тремя группами ОН или OR10. В этих соединениях предпочтительными группами R10 являются метил или группа

Предпочтение отдается также соединениям, в которых один из заместителей R2 или R3 - водород или низший углеводородный радикал С1-С6нормального или разветвленного строения, особое предпочтение отдается метилу.
Настоящим изобретением предлагается также соединение Формулы (I), имеющее структуру (IA’’)

в которых R, R1 и R4 соответствуют определениям, относящимся к Формуле (I), а R2 и R3 в сочетании образуют Цикл Q, причем Цикл Q - карбоциклическая или гетероциклическая группа, содержащая в циклической структуре 5 или 6 атомов, где любой гетероатом выбран из группы, состоящей из N, О и S, при этом упомянутая карбоциклическая или гетероциклическая группа является насыщенной или ненасыщенной и может быть незамещенной или замещенной одним или несколькими заместителями, выбранными из группы, в которую входят Cl, Br, F, ОН, NO2, СF3, низший С1-С4 алкил, SСН3, NНСОСН3, N(R6)(R8), OR10 и OCOR11, где R6, R8, R10 и R11 соответствуют определениям, относящимся к Формуле (I).
В этих соединениях Цикл Q предпочтительно представляет собой карбоциклическую или гетероциклическую ароматическую группу, в которой любой гетероатом выбран из группы, состоящей из N, О и S, при этом упомянутая группа является незамещенной или замещенной одним или несколькими заместителями, выбранными из группы, в которую входят Cl, Br, F, ОН, NО3, СF3, низший C1-C4 алкил, SСН3, NНСОСН3, N(R6)(R8 ), OR10 и OCOR11, где R6, R8, R10 и R11 соответствуют определениям, относящимся к Формуле (I). Особо предпочтительными являются соединения, где Цикл Q - бензольный или пиридиновый цикл.
Заместитель Z может быть присоединен к любому положению ароматического цикла. Таким образом, вышеописанные соединения Формул (IA’) или (IA’’) охватывают соединения, имеющие структуры (IА)х, (IА)у и (IA)z:

где R, R1, R2, R3 и R4 соответствуют вышеприведенным определениям. В вышеописанных соединениях Формул (IA’) или (IA’’) R4предпочтительно представляет собой Н, ОН или ОСН3.
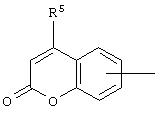
Кроме того, изобретение предлагает соединения Формулы (I), имеющие структуру (IB):

где R и R1 соответствуют определениям, относящимся к Формуле (I), a R5представляет собой Н или низший углеводородный радикал C1-С6нормального или разветвленного строения, который может быть незамещенным или замещенным одним, двумя или тремя заместителями, выбранными из Cl, Br, F, OMe, NO2 и СF3. В предпочтительном варианте осуществления изобретения R5 - Н или метил.
В вышеописанных соединениях Формулы (IB) заместитель Z может быть присоединен к любому положению ароматического цикла. Таким образом, вышеописанные соединения Формулы (IB) охватывают соединения, имеющие структуры (IB)w, (IB)x, (IВ)у и (IA)z:

где R, R1и R5 соответствуют определениям, относящимся к Формуле (I).
В соединениях Формул (I), (IA’), (IA’’) и (IB) заместители R и R1одинаковы или различны, и предпочтительно каждый из них представляет собой С1-С4 алкил или C5-C8 циклоалкил. В пределах этой группы соединений заместители R и R1 предпочтительно выбраны независимо друг от друга из группы, в которую входят метил, этил, пропил, циклопропил и циклогексил.
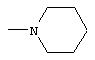
В предпочтительной группе соединений заместители R и R’ в сочетании с атомом азота, к которому они присоединены, образуют гетероциклическую группу, состоящую из 4-8 членов. Среди этих соединений предпочтение отдается тем, в которых R и R1 в сочетании с атомом азота, к которому они присоединены, образуют пирролидиновую, пиперидиновую, пиперазиновую, N-метилпиперазиновую, N-бензилпиперазиновую или морфолиновую группу.
Имеется в виду, что соединения Формулы (I) содержат основную аминную функциональную группу и поэтому могут быть превращены в соли кислот с фрамацевтически приемлемыми кислотами, например, с хлористоводородной и фосфорной кислотами. Такие соли также включены в объем настоящего изобретения.
Соединения Формулы (I) могут быть успешно получены способом, включающим следующие стадии:
(i) проведение реакции гидроксильного производного Z-OH с пропаргилбромидом с получением алкина Z-OCH2C≡ H и
(ii) проведение реакции алкина Z-ОСН2С≡ Н с амином HNRR1. Такой способ является еще одним аспектом настоящего изобретения.
Далее настоящее изобретение предлагает соединение Формулы (I) в соответствии с вышеприведенным определением для применения в качестве модулятора резистентности ко многим лекарственным средствам в химиотерапии рака или в качестве антипролиферативного лекарственного средства. В частности, соединения Формулы (I) особенно эффективны для модулирования резистентности ко многим лекарственным средствам, медиатором которой является Р-гликопротеин.
Кроме того, настоящее изобретение предлагает применение соединения Формулы (I)
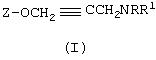
или его фармацевтически приемлемой соли либо сольвата, где:
R и R1 одинаковы или различны и каждый из них представляет собой низший C1-С6 алкил или карбоциклическую группу, содержащую в циклической структуре от 5 до 10 атомов, причем упомянутые атомы в циклической структуре образуют один или два цикла, где цикл или каждый из циклов содержит 5 или 6 атомов, или
R и R1 в сочетании с атомом азота, к которому они присоединены, образуют гетероциклическую группу, состоящую из 4-8 членов, которая может содержать один или несколько дополнительных гетероатомов, выбранных из группы, состоящей из N, О и S, причем упомянутая гетероциклическая группа факультативно замещена низшим C1-C4 алкилом или бензилом;
Z представляет собой

где
R2 и R3 независимо друг от друга выбраны из следующих групп:
(i) водород, (ii) замещенная или незамещенная, предпочтительно ароматическая, карбоциклическая или гетероциклическая группа, содержащая в циклической структуре от 5 до 10 атомов, причем упомянутые атомы в циклической структуре образуют один или два цикла, где цикл или каждый из циклов содержит 5 или 6 атомов, любые гетероатомы выбраны из группы, состоящей из N, О и S, а любые заместители выбраны независимо друг от друга из группы, в которую входят:
(а) Сl, (b) Вr, (с) F, (d) ОН, (е) NО2, (f) СF3, (g) низший С1-С4 алкил (в частности, СН3), (h) SСН3, (i) NНСОСН3, (j) N(R6)(R8), где R6 и R8одинаковы или различны и каждый из них представляет собой Н или низший С1-С4 алкил, (k) OR10, где R10 представляет собой Н или насыщенный или ненасыщенный низший C1-C6 алкил, который может быть незамещенным или замещенным группой NRR1, где R и R1 соответствуют вышеприведенному определению, и (1) OCOR11, где R11 представляет собой Н или низший С1-С4алкил,
(iii) Cl, (iv) Br, (v) F, (vi) ОН, (vii) NО2, (viii) насыщенный или ненасыщенный низший углеводородный радикал С1-С6 нормального или разветвленного строения, который может быть незамещенным или замещенным одним, двумя или тремя заместителями, выбранными из Cl, Br, F, ОМе, NО2 и СF3, (ix) NНСОСН3, (х) N(R6)(R8), (xi) SR10, (xii) OR10 и (xiii) OCOR11, где R6, R8, R10 и R11 соответствуют вышеприведенным определениям;
или
R2 и R3 в сочетании с атомами углерода, к которым они присоединены, образуют карбоциклическую или гетероциклическую группу, содержащую 5 атомов или 6 атомов, в которой любой гетероатом выбран из группы, состоящей из N, О и S, причем упомянутая карбоциклическая или гетероциклическая группа может быть насыщенной или ненасыщенной и незамещенной или замещенной одним или несколькими заместителями, выбранными из группы, в которую входят Cl, Br, F, ОН, NО3, СF3, низший С1-С4 алкил, SСН3, NНСОСН3, N(R6 )(R8), OR10 и OCOR11, где R6, R8, R10 и R11 соответствуют вышеприведенным определениям; и
R4 - водород или OR10, где R10 соответствует вышеприведенному определению,
или

где R5 представляет собой водород или низший углеводородный радикал C1-С6 нормального или разветвленного строения, который может быть незамещенным или замещенным одним, двумя или тремя заместителями, выбранными из Cl, Br, F, ОМе, NО3 и СF3, при производстве лекарственного средства для лечения или профилактики новообразований, в частности, новообразований, локализованных в матке, яичниках или молочной железе. Кроме того, эти соединения Формулы (I) могут быть особенно эффективными при производстве лекарственного средства для поражения раковых клеток, устойчивых к паклитакселу и доцетакселу.
Соединения Формулы (I) могут быть также успешно применены в качестве антипролиферативных лекарственных средств в комбинированных схемах терапии, включающих совместное применение соединения Формулы (I) с одним или несколькими противоопухолевыми или цитостатическими агентами, такими как паклитаксел или доцетаксел. Комбинированная терапия может включать одновременное или последовательное применение соединения Формулы (I) с одним или несколькими противоопухолевыми или цитостатическими агентами, в том числе с антрациклинами, эпиподофиллотоксинами, актиномицином D, алкалоидами барвинка, колхицинами, паклитакселом или доцетакселом. Такая комбинированная терапия является еще одним аспектом настоящего изобретения.
Соединения в соответствии с настоящим изобретением могут быть полезны также при приготовлении лекарственных средств для лечения или профилактики расстройств, возникающих в климактерическом периоде, и остеопороза.
Далее настоящее изобретение предлагает фармацевтическую композицию, содержащую одно или несколько соединений Формулы (I) в сочетании с одной или несколькими фармацевтически приемлемыми добавками. Такая композиция может также содержать один или несколько противоопухолевых или цитостатических агентов, таких как паклитаксел или доцетаксел.
Ниже изобретение описано с помощью иллюстративных примеров со ссылками на прилагаемые формулы.
ПРИМЕРЫ
Пример 1. Общие условия получения пропинилоксипроизводных
Смесь гидроксипроизводного (0,01 моль), К2СО3 (0,02 моль), KI (0,001 моль), пропаргилбромида (0,015 моль) и ацетона (100 мл) кипятили с обратным холодильником в течение 10 ч и фильтровали в горячем состоянии. Выпаривали растворитель и кристаллизовали осадок из соответствующего растворителя.
Пример 2. Получение 7-пропинилокси-4’-метоксиизофлавона
Смесь 7-гидрокси-4’-метоксиизофлавона (2,68 г, 0,01 моль), К2СО3 (2,8 г, 0,02 моль), KI (0,166 г, 0,001 моль), пропаргилбромида (1,78 г, 0,015 моль) и ацетона (100 мл) кипятили с обратным холодильником в течение 10 ч и фильтровали в горячем состоянии. Выпаривали растворитель и кристаллизовали осадок из толуола. Получено 2,75 г продукта со следующими характеристиками: т.пл. 145-146° С;1Н ЯМР (СDСl3) δ : 2,6 (m, 1H), 3,83 (s, 3Н), 4,8 (s, 2H), 6,93-8,27 (m, 8H).
Пример 3. Получение 7-пропинилоксиизофлавона
Смесь 7-гидроксиизофлавона (2,38 г, 0,01 моль), К2СО3 (2,8 г, 0,02 моль), KI (0,166 г, 0,001 моль), пропаргилбромида (1,78 г, 0,015 моль) и ацетона (100 мл) кипятили с обратным холодильником в течение 10 ч и фильтровали в горячем состоянии. Выпаривали растворитель и кристаллизовали осадок из толуола. Получено 2,1 г продукта со следующими характеристиками: т.пл. 130-131°С;1Н ЯМР (СDСl3) δ : 2,6 (m, 1H), 4,8 (s, 2H), 6,99-8,28 (m, 7H).
Пример 4. Получение 7-пропинилокси-2-метил-4’-метоксиизофлавона
Смесь 7-гидрокси-2-метил-4’-метоксиизофлавона (2,82 г, 0,01 моль), К2СО3 (2,8 г, 0,02 моль), KI (0,166 г, 0,001 моль), пропаргилбромида (1,78 г, 0,015 моль) и ацетона (100 мл) кипятили с обратным холодильником в течение 10 ч и фильтровали в горячем состоянии. Выпаривали растворитель и кристаллизовали осадок из толуола. Получено 2,24 г продукта со следующими характеристиками: т.пл. 139-140° С;1H ЯМР (СDСl3) δ : 2,29 (s, 3Н), 2,6 (m, 1H), 3,85 (s, 3Н), 4,75 (s, 2H), 6,93-8, 17 (m, 7H).
Пример 5. Получение 7-пропинилокси-5-гидрокси-4’-метоксиизофлавона
Смесь 5,7-дигидрокси-4’-метоксиизофлавона (2,84 г, 0,01 моль), К2СО3(2,8 г, 0,02 моль), KI (0,166 г, 0,001 моль), пропаргилбромида (1,78 г, 0,015 моль) и ацетона (100 мл) кипятили с обратным холодильником в течение 10 ч и фильтровали в горячем состоянии. Выпаривали растворитель и кристаллизовали осадок из толуола. Получено 2,25 г продукта со следующими характеристиками: т.пл. 174-176° С;1Н ЯМР (СDСl3) δ : 2,6 (m, 1H), 3,86 (s, 3Н), 4,8 (s, 2H), 6,47-7,91 (m, 7H), 12,90 (s, 1H).
Пример 6. Получение 7,4’-дипропинилоксиизофлавона
Смесь 5,7-дигидрокси-4’-метоксиизофлавона (2,54 г, 0, 01 моль), К2СО3(2,8 г, 0,02 моль), KI (0,166 г, 0,001 моль), пропаргилбромида (1,72 г, 0,015 моль) и ацетона (100 мл) кипятили с обратным холодильником в течение 10 ч и фильтровали в горячем состоянии. Выпаривали растворитель и кристаллизовали осадок из толуола. Получено 2,31 г продукта со следующими характеристиками: т.пл. 162-163° С;1Н ЯМР (СDСl3) δ : 2,44 (m, 1H, СН), 2,57 (m, 1H), 4,54 (s, 2H), 4,56 (s, 2H), 6,85-8,08 (m, 8H).
Пример 7. Получение 1-пропинилоксиксантен-9-она
Смесь 3-гидроксиксантен-9-она (2,12 г, 0,01 моль), К2СО3 (2,8 г, 0,02 моль), KI (0,166 г, 0,001 моль), пропаргилбромида (1,78 г, 0,015 моль) и ацетона (100 мл) кипятили с обратным холодильником в течение 10 ч и фильтровали в горячем состоянии. Выпаривали растворитель и кристаллизовали осадок из толуола. Получено 2,0 г продукта со следующими характеристиками: т.пл. 168-169° С;1H ЯМР (СDСl3) δ : 2,56 (m, 1H), 4,94 (s,2H), 6,95-8,33 (m, 7Н).
Пример 8. Получение 2-пропинилоксиксантен-9-она
Смесь 2-гидроксиксантен-9-она (2,12 г, 0,01 моль), К2СО3 (2,8 г, 0,02 моль), KI (0,166 г, 0,001 моль), пропаргилбромида (1,78 г, 0,015 моль) и ацетона (100 мл) кипятили с обратным холодильником в течение 10 ч и фильтровали в горячем состоянии. Выпаривали растворитель и кристаллизовали осадок из толуола. Получено 2,25 г продукта со следующими характеристиками: т.пл. 153-154° С;1Н ЯМР (СDСl3) δ : 2,58 (m, 1H), 4,8 (s, 2Н), 7,35-8,38 (m, 7H).
Пример 9. Получение 3-пропинилоксиксантен-9-она
Смесь 3-гидроксиксантен-9-она (2,12 г, 0,01 моль), К2СО3 (2,8 г, 0,02 моль), KI (0,166 г, 0,001 моль), пропаргилбромида (1,78 г, 0,015 моль) и ацетона (100 мл) кипятили с обратным холодильником в течение 10 ч и фильтровали в горячем состоянии. Выпаривали растворитель и кристаллизовали осадок из толуола. Получено 2,25 г продукта со следующими характеристиками: т.пл. 142-144° С;1Н ЯМР (СDСl3) δ : 2,61 (m, 1H), 4,84 (s, 2Н), 6,98-8,38 (m, 7H).
Пример 10. Получение 7-пропинилоксифлавона
Смесь 7-гидроксифлавона (2,38 г, 0,01 моль), К2СО3 (2,8 г, 0,02 моль), KI (0,166 г, 0,001 моль), пропаргилбромида (1,78 г, 0,015 моль) и ацетона (100 мл) кипятили с обратным холодильником в течение 10 ч и фильтровали в горячем состоянии. Выпаривали растворитель и кристаллизовали осадок из толуола. Получено 2,58 г продукта со следующими характеристиками: т.пл. 199-200° С;1H ЯМР (СDСl3) δ : 2,6 (m, 1H), 4,8 (s, 2H), 6,75-8,18 (m, 9H).
Пример 11. Получение 7-пропинилокси-3-метилфлавона
Смесь 7-гидрокси-3-метилфлавона (2,52 г, 0,01 моль), К2СО3 (2,8 г, 0,02 моль), KI (0,166 г, 0,001 моль), пропаргилбромида (1,78 г, 0,015 моль) и ацетона (100 мл) кипятили с обратным холодильником в течение 10 ч и фильтровали в горячем состоянии. Выпаривали растворитель и кристаллизовали осадок из толуола. Получено 2,32 г продукта со следующими характеристиками: т.пл. 179-180° С;1H ЯМР (СDСl3) δ : 2,15 (s, 3H), 2,69 (m, 1H), 4,8 (s, 2H), 6,95-8,25 (m, 8H).
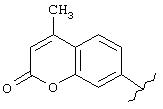
Пример 12. Получение 7-пропинилокси-4-метилкумарина
Смесь 7-гидрокси-4-метилкумарина (1,76 г, 0,01 моль), К2СО3 (2,8 г, 0,02 моль), KI (0,166 г, 0,001 моль), пропаргилбромида (1,78 г, 0,015 моль) и ацетона (100 мл) кипятили с обратным холодильником в течение 10 ч и фильтровали в горячем состоянии. Выпаривали растворитель и кристаллизовали осадок из толуола. Получено 1,93 г продукта со следующими характеристиками: т.пл. 140-141° С;1Н ЯМР (СDСl3) δ : 2,4 (s), 2,69 (m), 4,8 (s, 2H), 6,15-7,58 (m, 4H).
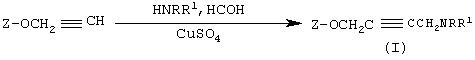
Пример 13. Общие условия получения аминопропинилоксипроизводных

Раствор формальдегида (0,5 мл), выбранного амина (6 ммоль) и CuSO4(0,1 г) в ЕtOН/Н2О (20 мл) добавляли к раствору пропинилоксипроизводного (4,6 ммоль) в ЕtOН/Н2О (20 мл). Добавляли Н2SO4 до рН 8 и кипятили смесь с обратным холодильником в течение 24 ч. Добавляли NН3 (30 мл) и экстрагировали смесь диэтиловым эфиром. После выпаривания растворителя остаток очищали флеш-хроматографией (элюент толуол:ацетон, 4:1) и кристаллизовали из соответствующего растворителя.
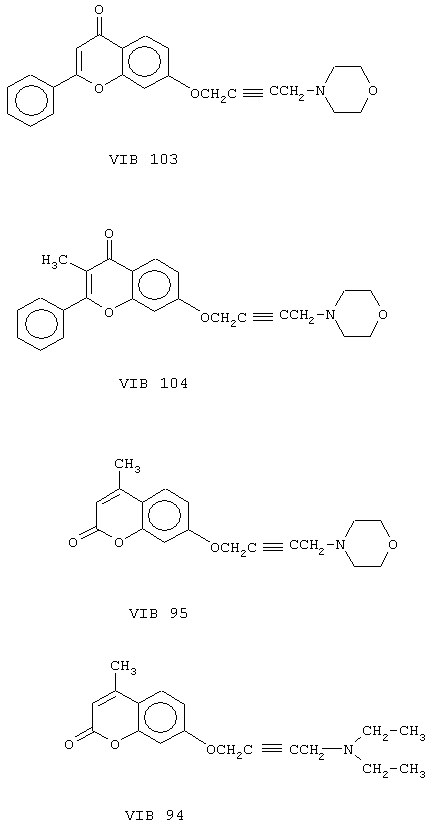
Пример 14. 7-(4-пиперидинбут-2-ин)-окси-4’-метоксиизофлавон (см. прилагаемую формулу VI В 15)
Раствор формальдегида (1 мл), пиперидина (0,85 г, 0,01 моль) и CuSO4(0,2 г) в ЕtOН/Н2О (40 мл) добавляли к раствору пропинилоксипроизводного (3,08 г, 0, 01 моль) в ЕtOН/Н2О (40 мл). Добавляли Н2SO4 до рН 8 и кипятили смесь с обратным холодильником в течение 24 ч. Добавляли NН3 (60 мл) и экстрагировали смесь диэтиловым эфиром. После выпаривания растворителя остаток очищали флеш-хроматографией (элюент толуол: ацетон, 4:1) и кристаллизовали из лигроина. Получено 1,63 г продукта со следующими характеристиками: т.пл. 95-97° С;1Н ЯМР δ : 1,73-1,98 (m, 2H), 1,52-1,68, (q, 4Н), 2,4-2,55 (t, 4H), 3,3 (s, 2H), 3,85 (s, 3H), 4,85 (s, 2H), 6,9-8,25 (m, 8H).
Пример 15. 7-(4-морфолинбут-2-ин)-окси-4’-метоксиизофлавон (см. прилагаемую формулу VI В 17)
Раствор формальдегида (1 мл), морфолина (0,87 г, 0,01 моль) и CuSO4(0, 2 г) в ЕtOН/Н2О (40 мл) добавляли к раствору пропинилоксипроизводного (3,08 г, 0,01 моль) в ЕtOН/Н2О (40 мл). Добавляли H2SO4 до рН 8 и кипятили смесь с обратным холодильником в течение 24 ч. Добавляли NН3 (60 мл) и экстрагировали смесь диэтиловым эфиром. После выпаривания растворителя остаток очищали флеш-хроматографией (элюент толуол:ацетон, 4:1) и кристаллизовали из лигроина. Получено 1,62 г продукта со следующими характеристиками: т.пл. 98-100° С;1Н ЯМР δ : 2,43-2,61 (m, 4H), 3,3 (s, 2H), 3,6-3, 78 (m, 4H), 3,78 (s, 3H), 4,75 (s, 2H), 6,9-8,3 (m, 8H).
Пример 16. 7-[4-(4-бензил-пиперазин-1-ил)бут-2-ин]-окси-4’-метокси-изофлавон (см. прилагаемую формулу VI В 16)
Раствор формальдегида (1 мл), бензилпиперазина (1,76 г, 0,01 моль) и CuS04 (0,2 г) в ЕtOН/Н2О (40 мл) добавляли к раствору пропинилоксипроизводного (3,08 г, 0,01 моль) в ЕtOН/Н2О (40 мл). Добавляли Н2SO4 до рН 8 и кипятили смесь с обратным холодильником в течение 24 ч. Добавляли NН3 (60 мл) и экстрагировали смесь диэтиловым эфиром. После выпаривания растворителя остаток очищали флеш-хроматографией (элюент толуол:ацетон, 4:1) и кристаллизовали из лигроина. Получено 1,1 г продукта со следующими характеристиками: т.пл. 98-100° С;1Н ЯМР δ : 2,45-2,65 (m, 8H), 3,35 (s, 2H), 3,52 (s, 2H), 3,85 (s, 3H), 4,85 (s, 2H), 6,95-8,27 (m, 13 Н).
Пример 17. 7-(4-пирролидинбут-2-ин)-окси-4’-метоксиизофлавон (см. прилагаемую формулу VI В 91)
Раствор формальдегида (1 мл), пирролидина (0,71 г, 0,01 моль) и CuSO4(0,2 г) в ЕtOН/Н2О (40 мл) добавляли к раствору пропинилоксипроизводного (3,08 г, 0,01 моль) в ЕtOН/Н2О (40 мл). Добавляли H2SO4 до рН 8 и кипятили смесь с обратным холодильником в течение 24 ч. Добавляли NН3 (60 мл) и экстрагировали смесь диэтиловым эфиром. После выпаривания растворителя остаток очищали флеш-хроматографией (элюент толуол:ацетон, 4:1) и кристаллизовали из лигроина. Получено 0,8 г продукта со следующими характеристиками: т.пл. 111-112° С;1Н ЯМР δ : 1,68-1,83 (m, 4H), 2,6-2,65 (m, 4H), 3,5 (m, 2H), 3,85 (s, 3H), 4,83 (m, 2H), 6,96-8,26 (m, 8H).
Пример 18. 7-(4-диэтиламинобут-2-ин)-окси-4’-метоксиизофлавон (см. прилагаемую формулу VI В 90)
Раствор формальдегида (1 мл), диэтиламина (0,73 г, 0,01 моль) и СuSO4(0,2 г) в ЕtOН/Н2О (40 мл) добавляли к раствору пропинилоксипроизводного (3,08 г, 0,01 моль) в ЕtOН/Н2О (40 мл). Добавляли H2SO4 до рН 8 и кипятили смесь с обратным холодильником в течение 24 ч. Добавляли NН3 (60 мл) и экстрагировали смесь диэтиловым эфиром. После выпаривания растворителя остаток очищали флеш-хроматографией (элюент толуол: ацетон, 4:1) и кристаллизовали из лигроина. Получено 1,2 г продукта со следующими характеристиками: т.пл. 73-75° С;1Н ЯМР δ : 1 (t, 6Н), 2,5 (q, 4H), 3,49 (s, 2H), 3,85 (s, 3Н), 4,85 (s, 2H), 6,95-8,28 (m, 8H).
Пример 19. 7-(4-диэтиламинобут-2-ин)-оксиизофлавон (см. прилагаемую формулу VI В 92)
Раствор формальдегида (1 мл), диэтиламина (0,73 г, 0,01 моль) и CuSO4 (0,2 г) в ЕtOН/Н2О (40 мл) добавляли к раствору пропинилоксипроизводного (2,94 г, 0,01 моль) в ЕtOН/Н2О (40 мл). Добавляли H2SO4 до рН 8 и кипятили смесь с обратным холодильником в течение 24 ч. Добавляли NH3 (60 мл) и экстрагировали смесь диэтиловым эфиром. После выпаривания растворителя остаток очищали флеш-хроматографией (элюент толуол:ацетон, 4:1) и кристаллизовали из лигроина. Получено 0,62 г продукта со следующими характеристиками: т.пл. 79-80° С;1Н ЯМР δ : 1,03 (t, 6H), 2,5 (q,4H), 3,49 (s, 2H), 4,84 (s, 2H), 7,0-8,26 (m, 9H).
Пример 20. 7-(4-морфолинбут-2-ин)-оксиизофлавон (см. прилагаемую формулу VI В 93)
Раствор формальдегида (1 мл), морфолина (0,87 г, 0,01 моль) и CuSO4(0,2 г) в ЕtOН/Н2О (40 мл) добавляли к раствору пропинилоксипроизводного (2, 94 г, 0,01 моль) в ЕtOН/Н2О (40 мл). Добавляли H2SO4 до рН 8 и кипятили смесь с обратным холодильником в течение 24 ч. Добавляли NH3 (60 мл) и экстрагировали смесь диэтиловым эфиром. После выпаривания растворителя остаток очищали флеш-хроматографией (элюент толуол: ацетон, 4:1) и кристаллизовали из лигроина. Получено 1,5 г продукта со следующими характеристиками: т.пл. 104-105° С;1Н ЯМР δ : 2,5-2,6 (m, 4H), 3,35 (s, 2H), 3,75 (m, 4H), 4,85 (m, 2H), 6,95-8,22 (m, 9H).
Пример 21. 7-(4-морфолинбут-2-ин)-окси-2-метил-4’-метоксиизофлавон (см. прилагаемую формулу VIВ 105)
Раствор формальдегида (1 мл), морфолина (0,87 г, 0,01 моль) и CuSO4 (0,2 г) в ЕtOН/Н2О (40 мл) добавляли к раствору пропинилоксипроизводного (3,2 г, 0,01 моль) в ЕtOН/Н2О (40 мл). Добавляли H2SO4 до рН 8 и кипятили смесь с обратным холодильником в течение 24 ч. Добавляли NН3 (60 мл) и экстрагировали смесь диэтиловым эфиром. После выпаривания растворителя остаток очищали флеш-хроматографией (элюент толуол:ацетон, 4:1) и кристаллизовали из лигроина. Получено 1,2 г продукта со следующими характеристиками: т.пл. 136-139° С;1H ЯМР δ : 2,15 (s, 3Н), 2,5-2,6 (m, 4H), 3,35 (s, 2H), 3,7 (m, 4H), 4, 7 (m, 2H), 6,95-8,25 (m, 8H).
Пример 22. 7-(4-морфолинбут-2-ин)-окси-5-гидрокси-4’-метоксиизофлавон (см. прилагаемую формулу VIB 102)
Раствор формальдегида (1 мл), морфолина (0,87 г, 0,01 моль) и CuSO4(0,2 г) в EtOH/Н2О (40 мл) добавляли к раствору пропинилоксипроизводного (3,2 г, 0,01 моль) в EtOH/Н2О (40 мл). Добавляли H2SO4 до рН 8 и кипятили смесь с обратным холодильником в течение 24 ч. Добавляли NН3 (60 мл) и экстрагировали смесь диэтиловым эфиром. После выпаривания растворителя остаток очищали флеш-хроматографией (элюент толуол:ацетон, 4:1) и кристаллизовали из лигроина. Получено 0,84 г продукта со следующими характеристиками: масло, т.пл. хлористоводородной соли 120-123° С (кристаллизовано из метанола с эфиром);1H ЯМР δ : 2,3 (m, 4H), 3,3 (s, 2H), 3,7 (m, 4H), 3,85 (s, 3Н), 4,85 (m, 2H), 6,48-7,90 (m, 7H), 12,85 (s, 1H).
Пример 23. 4,7’-бис(4-морфолинилбут-2-инилокси)изофлавон (см. прилагаемую формулу VIB 97)
Раствор формальдегида (1 мл), морфолина (0,87 г, 0,01 моль) и CuSO4(0,2 г) в ЕtOН/Н2О (40 мл) добавляли к раствору пропинилоксипроизводного (3,2 г, 0,01 моль) в ЕtOН/Н2О (40 мл). Добавляли Н2SO4 до рН 8 и кипятили смесь с обратным холодильником в течение 24 ч. Добавляли NН3 (60 мл) и экстрагировали смесь диэтиловым эфиром. После выпаривания растворителя остаток очищали флеш-хроматографией (элюент толуол:ацетон, 4:1) и кристаллизовали из лигроина. Получено 1,06 г продукта со следующими характеристиками: т.пл. 158-159° С;1H ЯМР δ : 2,55 (m, 8H), 3,34 (s, 4H), 3,74 (m, 8H), 4,7 (s, 2H), 4,85 (s, 2H), 6,98-8,26 (m, 8H).
Пример 24. 7-(4-морфолинбут-2-ин)-оксифлавон (см. прилагаемую формулу VI В 103)
Раствор формальдегида (1 мл), морфолина (0,87 г, 0,01 моль) и CuSO4(0,2 г) в ЕtOН/Н2О (40 мл) добавляли к раствору пропинилоксипроизводного (2,94 г, 0,01 моль) в ЕtOН/Н2О (40 мл). Добавляли H2SO4 до рН 8 и кипятили смесь с обратным холодильником в течение 24 ч. Добавляли NН3 (60 мл) и экстрагировали смесь диэтиловым эфиром. После выпаривания растворителя остаток очищали флеш-хроматографией (элюент толуол:ацетон, 4:1) и кристаллизовали из лигроина. Получено 0,75 г продукта со следующими характеристиками: т.пл. 126-127° С;1Н ЯМР δ : 2,56 (m, 4H), 3,35 (s, 2H), 3,7 (m, 4H), 4,86 (m, 2H), 6,79-8,2 (m, 9H). Масс-спектр: m/z 374 (М+, 14,38), 238 (100), 137 (82,79).
Пример 25. 7-(4-морфолинбут-2-ин)-окси-3-метилфлавон (см. прилагаемую формулу VI В 104)
Раствор формальдегида (1 мл), морфолина (0,87 г, 0,01 моль) и CuSO4(0,2 г) в ЕtOН/Н2 О (40 мл) добавляли к раствору пропинилоксипроизводного (3,09 г, 0,01 моль) в ЕtOН/Н2О (40 мл). Добавляли Н2SO4 до рН 8 и кипятили смесь с обратным холодильником в течение 24 ч. Добавляли NH3 (60 мл) и экстрагировали смесь диэтиловым эфиром. После выпаривания растворителя остаток очищали флеш-хроматографией (элюент толуол:ацетон, 4:1) и кристаллизовали из лигроина. Получено 0,78 г продукта со следующими характеристиками: т.пл. 139-140° С;1Н ЯМР δ : 2,13 (s, 3Н), 2,6 (m, 4H), 3,35 (m, 2H), 3,8 (m, 4H), 4,03 (s, 2H), 6,85-8,10 (m, 8H).
Пример 26. 7-(4-морфолинбут-2-ин)-окси-4-метилкумарин (см. прилагаемую формулу VI В 95)
Раствор формальдегида (1 мл), морфолина (0,87 г, 0, 01 моль) и CuSO4 (0,2 г) в ЕtOН/Н2О (40 мл) добавляли к раствору пропинилоксипроизводного (2,14 г, 0,01 моль) в ЕtOН/Н2О (40 мл). Добавляли Н2SO4 до рН 8 и кипятили смесь с обратным холодильником в течение 24 ч. Добавляли NH3 (60 мл) и экстрагировали смесь диэтиловым эфиром. После выпаривания растворителя остаток очищали флеш-хроматографией (элюент толуол: ацетон, 4:1) и кристаллизовали из лигроина. Получено 1,9 г продукта со следующими характеристиками: т.пл. 125-126° С;1Н ЯМР δ : 2,4 (s, 3Н), 2,52 (m, 4H), 3,3 (m, 2H), 3,7 (m, 4H), 4,78 (m, 2H), 6,16-7,54 (m, 4H).
Пример 27. 7-(4-диэтиламинобут-2-ин)-окси-4-метилкумарин (см. прилагаемую формулу VI В 94)
Раствор формальдегида (1 мл), диэтиламина (0,73 г, 0,01 моль) и CuSO4(0,2 г) в ЕtOН/Н2О (40 мл) добавляли к раствору пропинилоксипроизводного (2,14 г, 0,01 моль) в ЕtOН/Н2О (40 мл). Добавляли H2SO4 до рН 8 и кипятили смесь с обратным холодильником в течение 24 ч. Добавляли NН3 (60 мл) и экстрагировали смесь диэтиловым эфиром. После выпаривания растворителя остаток очищали флеш-хроматографией (элюент толуол: ацетон, 4:1) и кристаллизовали из лигроина. Получено 1,9 г продукта со следующими характеристиками: т.пл. 108-110° С;1Н ЯМР δ : 1,04 (t, 6H), 2,42 (s, 2H), 2,5 (q, 4Н), 3,7 (m, 2H), 4,8 (m, 2H), 6,18-7,57 (m, 4H).
Пример 28. 1-(4-морфолинбут-2-ин)-оксиксантон (см. прилагаемую формулу VI В 99)
Раствор формальдегида (1 мл), морфолина (0,87 г, 0,01 моль) и CuSO4 (0,2 г) в ЕtOН/Н2О (40 мл) добавляли к раствору пропинилоксипроизводного (2,5 г, 0,01 моль) в ЕtOН/Н2О (40 мл). Добавляли H2SO4 до рН 8 и кипятили смесь с обратным холодильником в течение 24 ч. Добавляли NН3 (60 мл) и экстрагировали смесь диэтиловым эфиром. После выпаривания растворителя остаток очищали флеш-хроматографией (элюент толуол:ацетон, 4:1) и кристаллизовали из лигроина. Получено 1,8 г продукта со следующими характеристиками: т.пл. 98-101° С;1Н ЯМР δ : 2,53 (m, 4H), 3,34 (m, 2H), 3,73 (m, 4H), 4,98 (m, 2H), 6,98-8,33 (m, 7H).
Пример 29. 1-(4-диэтиламинобут-2-ин)-оксиксантон (см. прилагаемую формулу VI В 98)
Раствор формальдегида (1 мл), диэтиламина (0,73 г, 0,01 моль) и CuSO4(0,2 г) в ЕtOН/Н2О (40 мл) добавляли к раствору пропинилоксипроизводного (2,5 г, 0,01 моль) в ЕtOН/Н2О (40 мл). Добавляли H2SO4 до рН 8 и кипятили смесь с обратным холодильником в течение 24 ч. Добавляли NH3 (60 мл) и экстрагировали смесь диэтиловым эфиром. После выпаривания растворителя остаток очищали флеш-хроматографией (элюент толуол:ацетон, 4:1) и кристаллизовали из лигроина. Получено 0,64 г продукта со следующими характеристиками: т.пл. 70-72° С;1Н ЯМР δ : 1,02 (t, 6H), 2,5 (q, 4H), 3,45 (m, 2H), 4,96 (m, 2H), 6,98-8, 33 (m, 7H).
Пример 30. 2-(4-морфолинбут-2-ин)-оксиксантон (см. прилагаемую формулу VI В 101)
Раствор формальдегида (1 мл), морфолина (0,87 г, 0,01 моль) и CuSO4(0,2 г) в ЕtOН/Н2О (40 мл) добавляли к раствору пропинилоксипроизводного (2,5 г, 0,01 моль) в ЕtOН/Н2О (40 мл). Добавляли Н2SО4 до рН 8 и кипятили смесь с обратным холодильником в течение 24 ч. Добавляли NН3 (60 мл) и экстрагировали смесь диэтиловым эфиром. После выпаривания растворителя остаток очищали флеш-хроматографией (элюент толуол:ацетон, 4:1) и кристаллизовали из лигроина. Получено 1,8 г продукта со следующими характеристиками: т.пл. 105-106° С;1Н ЯМР δ : 2,53 (m, 4H), 3,33 (m, 2H), 3,7 (m, 4H), 4,84 (m, 2H), 7,39-7,83 (m, 7H).
Пример 31. 2-(4-диэтиламинобут-2-ин)-оксиксантон (см. прилагаемую формулу VI В 100)
Раствор формальдегида (1 мл), диэтиламина (0,73 г, 0,01 моль) и CuSO4(0,2 г) в ЕtOН/Н2О (40 мл) добавляли к раствору пропинилоксипроизводного (2,5 г, 0,01 моль) в ЕtOН/Н2О (40 мл). Добавляли H2SO4 до рН 8 и кипятили смесь с обратным холодильником в течение 24 ч. Добавляли NН3 (60 мл) и экстрагировали смесь диэтиловым эфиром. После выпаривания растворителя остаток очищали флеш-хроматографией (элюент толуол: ацетон, 4:1) и кристаллизовали из лигроина. Получено 0,64 г продукта со следующими характеристиками: т.пл. 66-68° С;1Н ЯМР δ : 1,08 (t, 6H), 2,54 (q, 4H), 3,5 (m, 2H), 4,86 (m, 2H), 7,35-8,38 (m, 7H).
Пример 32. 3-(4-морфолинбут-2-ин)-оксиксантон (см. прилагаемую формулу VI В 96)
Раствор формальдегида (1 мл), морфолина (0,87 г, 0,01 моль) и CuSO4(0,2 г) в ЕtOН/Н2О (40 мл) добавляли к раствору пропинилоксипроизводного (2,5 г, 0,01 моль) в ЕtOН/Н2О (40 мл). Добавляли H2SO4 до рН 8 и кипятили смесь с обратным холодильником в течение 24 ч. Добавляли NН3 (60 мл) и экстрагировали смесь диэтиловым эфиром. После выпаривания растворителя остаток очищали флеш-хроматографией (элюент толуол: ацетон, 4:1) и кристаллизовали из лигроина. Получено 1,5 г продукта со следующими характеристиками: т.пл. 126-128° С;1H ЯМР δ : 2,56 (m, 4H), 3,4 (m, 2H), 3,7 (m, 4H), 4,86 (m, 2H), 6,97-8,37 (m, 7H).
БИОЛОГИЧЕСКИЕ ИСПЫТАНИЯ
Соединения VIВ 16, VIВ 94, VIВ 99 и VIВ 100 были испытаны с целью определения их цитотоксичности в отношении устойчивых к лекарственным средствам раковых клеток как по отдельности, так и в сочетании с паклитакселом. Ниже представлены результаты этих исследований.
При испытаниях этих соединений в отдельности было обнаружено, что они обладают сравнительно низкой цитотоксичностью (IС50>30 мкМ) в отношении устойчивых к лекарственным средствам раковых клеток.
Затем соединения испытывали в сочетании с паклитакселом для определения цитостатической активности в отношении стойких к лекарственным средствам клеток рака молочной железы MDA-435/LCC6-MDR. В этих экспериментах упомянутые соединения применяли в сочетании с паклитакселом, концентрация паклитаксела составляла 1 мкМ. При применении паклитаксела совместно с каждым из соединений его IC50понижается в 2-4 раза, т.е. с 426 до 210-110 нМ, по сравнению с применением индивидуального паклитаксела. Следовательно, в присутствии этих соединений паклитаксел может проявить свою высокую ингибирующую активность в отношении устойчивых к лекарственным средствам раковых клеток.

Методика эксперимента
Испытания заключались в одновременной обработке клеток МDA-435/LCC-MDR паклитакселом в присутствии или отсутствии испытываемых соединений (1 мкМ) in vitro в течение 72 ч. Оценку цитотоксичности, т.е. ингибирования роста клеток, производили в соответствии с методикой Скехана и др. (Skehan et al.), описанной в J. Nat. Cancer Inst. 82, 1107, 1990.
Вкратце методику можно описать следующим образом. Клетки высевали в 96-луночную чашку Петри в количестве 400-1200 клеток на лунку и перед введением лекарственного средства инкубировали при 37° С в течение 15-18 ч для обеспечения прикрепления культуры к лунке. Испытываемые соединения растворяли в 100%-ном диметилсульфоксиде и затем разбавляли средой RPMI-1640, содержащей 10 мМ HEPES (N-2-гидроксиэтилпиперазин-N’-2-гидрокси-пропансульфокислоты). После 72 ч инкубации в каждую лунку добавляли 100 мкл 50%-ной трихлоруксусной кислоты, охлажденной льдом, и инкубировали в течение 1 ч при 4° С. Затем чашки промывали 5 раз водопроводной водой для удаления трихлоруксусной кислоты, низкомолекулярных продуктов метаболизма и сывороточных протеинов. Добавляли в каждую лунку 50 мкл сульфородамина В (0,4%). После 5-минутной инкубации при комнатной температуре чашки промывали 5 раз 0, 1%-ной уксусной кислотой и сушили на воздухе. Связанный краситель растворяли трис(гидроксиметил)-метиламинометаном (TRIS) (основание, 10 мМ, рН 10,5) в течение 5 мин на вращательном приборе для встряхивания. Оптическую плотность измеряли на длине волны 570 нм.




Активность соединений настоящего изобретения в отношении чувствительных клеток аденокарциномы яичников (2008)
Реферат
Изобретение относится к новым производным флавонов, ксантонов и кумаринов формулы 1:

или их фармацевтически приемлемым солям либо сольватам, где
R и R1 одинаковы или различны и каждый из них представляет собой низший C1-C6 алкил или же R и R1 в сочетании с атомом азота, к которому они присоединены, образуют гетероциклическую группу, состоящую из 4-8 членов, которая может содержать один или несколько дополнительных гетероатомов, выбранных из группы, состоящей из N и О, причем упомянутая гетероциклическая группа факультативно замещена бензилом; Z представляет собой
(A)

где R2 и R3 независимо друг от друга выбраны из следующих групп: (i) водород, (ii) замещенная или незамещенная ароматическая группа, содержащая в циклической структуре от 5 до 10 атомов углерода, причем заместители при этой группе выбраны независимо друг от друга из группы, состоящей из низшего C1-C4 алкила и OR10, где R10 представляет собой водород, насыщенный или ненасыщенный низший C1-C6 алкил или

и (iii) углеводородный радикал C1-C6нормального или разветвленного строения; или R2 и R3 в сочетании с атомами углерода, к которым они присоединены, образуют карбоциклическую группу, содержащую 5 или 6 атомов; и R4 представляет собой водород или место присоединения группы –OCH2-C≡CCH2NRR1, либо
(В)
где R5 представляет собой водород или низший углеводородный радикал C1 -C6 нормального или разветвленного строения, при условии, что если группа Z представляет собой

то оба заместителя R и R1 не могут быть метилами или R и R1 в сочетании с атомом азота, к которому они присоединены, не могут образовывать группы


Изобретение также относится к компоненту лекарственного средства для лечения и профилактики новообразований и фармацевтической композиции на основе соединений формулы 1, обладающей пролиферативной активностью. Эти соединения обладают антипролиферативными свойствами и полезны в качестве модуляторов резистентности ко многим лекарственным средствам в химиотерапии рака. Соединения могут быть полезны также при производстве лекарственных средств для лечения или профилактики новобразований, расстройств, возникающих в климактерическом периоде, и остеопороза. Технический результат - получение новых соединений, обладающих ценным биологически активным действием. 3 с. и 28 з.п. ф-лы, 2 табл.
Формула

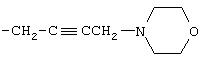























Комментарии