Азуленовое производное, фармацевтическая композиция на его основе и способ лечения диабета - RU2295522C2
Код документа: RU2295522C2
Описание
Область техники
Настоящее изобретение относится к азуленовым производным определенной химической формулы и их солям. Конкретнее настоящее изобретение относится к азуленовым производным, которые эффективно лечат или предупреждают диабет, такой как инсулинозависимый диабет (диабет типа 1) и инсулинонезависимый диабет (диабет типа 2), а также различные связанные с диабетом заболевания, такие как инсулинорезистентные болезни и ожирение, например, в качестве фармацевтических средств, в частности в качестве ингибиторов котранспортера Na+-глюкозы, и к их солям.
Предпосылки создания изобретения
В последние годы потребовался фармацевтический препарат для ингибирования котранспортера Na+-глюкозы (SGLT) в кишечнике и почках для реабсорбции глюкозы (ингибитор котранспортера Na+ -глюкозы) как противодиабетическое средство для быстрой нормализации гипергликемии и улучшения энергобаланса в организме. Ожидается, что такой ингибитор котранспортера Na+-глюкозы будет превосходным фармацевтическим препаратом для лечения или предупреждения диабета, такого как инсулинозависимый диабет (диабет типа 1) и инсулинонезависимый диабет (диабет типа 2), а также различных связанных с диабетом заболеваний, таких как инсулинорезистентные болезни и ожирение.
В качестве соединений, используемых в качестве ингибитора котранспортера Na+-глюкозы, известны, например, флоридзин, описанный Welch C.A. et al. (J. Natr., 1989, 119(11), 1698), и синтетический О-гликозид, описанный Hongu M. et al. (Chem. Pharm. Bull., 1998, 46(1), 22) и в JP-A-11-21243. Сообщается, что указанные соединения выводят с мочой избыточную глюкозу крови и снижают уровень глюкозы в крови, ингибируя котранспортер Na+-глюкозы в почках.
Однако, так как любое из указанных соединений представляет собой О-гликозид, содержащий О-глюкозидную связь, образованную между глюкозой и агликоновой группой, существует проблема, что при пероральном приеме гипогликемическое действие исчезает из-за гидролиза О-глюкозидной связи глюкозидазой или подобным ферментом в тонкой кишке.
Известно, что флоретин - агликоновая группа флоридзина - хорошо ингибирует транспортер, облегчающий диффузию глюкозы. Например, сообщается, что концентрация глюкозы в мозге уменьшается, когда в вену крысы вводят флоретин (см., например, Stroke, 1983, 14, 388). Также известно, что флоретин ингибирует транспортер витамина С (Wang Y. et al., Biochem. Biophys. Res. Commun., 2000, 267, 488-494).
Поэтому делаются попытки использовать в качестве ингибитора котранспортера Na+-глюкозы С-гликозид, полученный заменой кислорода в глюкозидной связи О-гликозида на углерод.
Например, в JP-A-2001-288178 (далее называемой "патентный документ 1") указывается, что соединение приведенной далее формулы обладает действием ингибитора котранспортера Na+-глюкозы и пригодно в качестве лечебного средства или профилактического средства в случае диабета и как гипогликемическое средство.

где R1 представляет Н, ОН, низшую алкильную группу, -О-(низшую алкильную группу) или подобную группу, R2 представляет Н, -СОО-(низшую алкильную группу) или подобную группу, R5 представляет -СН2ОН, -СН2ОСОО-(низшую алкильную группу) или подобную группу, А представляет пиридин, фуран, тиофен, хинолин, индол или подобный гетероцикл, n равно 0, 1, 2 или 3, и m равно 0 или 1 (для более детального определения символов приведенной выше формулы см. патентный документ 1).
Кроме того, в описании WO 01/27128 (далее называемом "патентный документ 2") указывается, что в качестве ингибитора котранспортера Na+-глюкозы для лечения ожирения или диабета типа 2 можно использовать соединение формулы

где R1, R2 и R2а представляют по отдельности атом водорода, OH, OR5, алкил, CF3, OCHF2, OCHF3 или подобную группу, R3 и R4 представляют по отдельности атом водорода, OH, OR5а , -О-арил, -О-СН2-арил, алкил, циклоалкил, CF3 или подобную группу, А представляет О, S, NH или (CH2)n, и n равно 0, 1, 2 или 3 (для более детального определения символов приведенной выше формулы см. патентный документ 2).
Как пояснялось выше, С-гликозид пригоден до некоторой степени для лечения диабета из-за ингибирования котранспортера Na+-глюкозы. Однако из-за возрастания в последнее время частоты случаев диабета, который является заболеванием, связанным с образом жизни, и который даже можно назвать национальной болезнью, для клинической практики лечения диабета или подобных заболеваний все в большей степени требуется соединение химического строения, отличающегося от строения известных соединений, и оказывающее более быстрое и более существенное действие ингибитора котранспортера Na+-глюкозы.
Описание изобретения
Авторы настоящего изобретения провели интенсивные исследования, касающиеся соединения с бензольным циклом, непосредственно связанным с глюкозным остатком, и обладающего действием ингибитора котранспортера Na+ -глюкозы. В результате авторы обнаружили, что соединение (производное азулена), содержащее азуленовый цикл, связанный с бензольным циклом непосредственно или через низший алкилен (-А-), который может быть замещен атомом галогена, причем бензольный цикл непосредственно связан с глюкозным остатком, отображаемое приведенной далее формулой (I), обладает существенным действием ингибитора котранспортера Na+-глюкозы. Конкретно настоящее изобретение относится к соединению приведенной далее формулы (I) и его соли (называемым далее "соединение настоящего изобретения"). Соединение настоящего изобретения можно подходящим образом использовать в качестве ингибитора котранспортера Na+-глюкозы, используя указанное соединение в качестве активного ингредиента, в частности в качестве лечебного средства и/или профилактического средства в случае диабета.
Химическая формула соединения настоящего изобретения отличается от формул в патентных документах 1 и 2 тем, что соединение настоящего изобретения, например, содержит азуленовый цикл.

где R1-R4 представляют по отдельности атом водорода, необязательно замещенный низший алкил, -С(=О)-(необязательно замещенный низший алкил) или -(необязательно замещенный низший алкилен)(необязательно замещенный арил),
R5-R12 представляют, по отдельности, атом водорода, необязательно замещенный низший алкил, атом галогена, -ОН, -О-(необязательно замещенный низший алкил), -(необязательно замещенный низший алкилен)-ОН, -(необязательно замещенный низший алкилен)-О-(необязательно замещенный низший алкил), -О-(необязательно замещенный низший алкилен)-О-(необязательно замещенный низший алкил), -О-(необязательно замещенный низший алкилен)-(необязательно замещенный арил), -(необязательно замещенный низший алкилен)-О-С(=О)-(необязательно замещенный низший алкил), -СООН, нитро, циано, амино, замещенный амино или -С(=О)-О-(необязательно замещенный низший алкил), и
А представляет связь или необязательно замещенный низший алкилен,
где -А- может присоединяться в любом положении 1-8 азуленового цикла, и любые две группы из числа R5, R6 и R7 могут образовывать бензольный цикл вместе с соседними атомами углерода.
Термин "необязательно замещенный", используемый для определения групп, представленных R1-R4, R5-R12 и А, указывает, что представляющие интерес группы могут быть или незамещенными или замещены атомом галогена, -ОН, (низший алкилен)-ОН, -СООН, -С(=О)-О-(низшим алкилом), нитро, циано, амино или замещенным амино. Атом галогена, -ОН и -СООН предпочтительны в качестве заместителя.
Необязательно замещенный низший алкил, -С(=О)-(необязательно замещенный низший алкил) и -(необязательно замещенный низший алкилен)-(необязательно замещенный арил), представленные R1-R4 в приведенной выше формуле (I), представляют собой, предпочтительно, низший алкил, -С(=О)-(низший алкил) и -(низший алкилен)арил, соответственно. Необязательно замещенный низший алкил, -О-(необязательно замещенный низший алкил), -(необязательно замещенный низший алкилен)-ОН, (необязательно замещенный низший алкилен)-О-(необязательно замещенный низший алкил), -О-(необязательно замещенный низший алкилен)-О-(необязательно замещенный низший алкил), -О-(необязательно замещенный низший алкилен)-(необязательно замещенный арил), -(необязательно замещенный низший алкилен)-О-С(=О)-(необязательно замещенный низший алкил) и -С(=О)-О-(необязательно замещенный низший алкил), представленные R5-R12 в формуле (I), представляют собой, предпочтительно, низший алкил, -О-(низший алкил), -(низший алкилен)-ОН, -(низший алкилен)-О-(низший алкил), -О-(низший алкилен)-О-(низший алкил), -О-(низший алкилен)арил, -(низший алкилен)-О-С(=О)-(низший алкил) и -С(=О)-О-(низший алкил) соответственно. Необязательно замещенный низший алкилен, представленный А в приведенной выше формуле (I), представляет собой, предпочтительно, низший алкилен или галогензамещенный низший алкилен.
В соединении настоящего изобретения группа, представленная А в приведенной выше формуле (I), представляет собой, предпочтительно, низший алкилен и особенно предпочтительно - метилен.
Группы R1-R4 в приведенной выше формуле (I) представляют собой, предпочтительно, атомы водорода.
Азуленовое производное приведенной выше формулы (I) может представлять собой, предпочтительно, любое из соединений, выбранных из группы, в которую входят 1,5-ангидро-1-[3-(азулен-2-илметил)фенил]гексит, 1,5-ангидро-1-[5-(азулен-2-илметил)-2-метоксифенил]гексит, 1, 5-ангидро-1-[3-(азулен-2-илметил)-5-метоксифенил]гексит, 1,5-ангидро-1-[3-(азулен-2-илметил)-4-метоксифенил]гексит, 1,5-ангидро-1-[5-(азулен-2-илметил)-2-этоксифенил]гексит, 1, 5-ангидро-1-[5-(азулен-2-илметил)-2-метилфенил]гексит, 1,5-ангидро-1-[5-(азулен-2-илметил)-2-гидроксифенил]гексит, 1,5-ангидро-1-[5-(азулен-2-илметил)-2-фторфенил]гексит, 1, 5-ангидро-1-[5-(азулен-2-илметил)-2,4-диметоксифенил]гексит и 1,5-ангидро-1-[4-(азулен-2-илметил)-1-метокси-2-нафтил]гексит.
Настоящее изобретение также относится к фармацевтической композиции, содержащей вышеуказанное азуленовое производное или его соль в качестве активного ингредиента и фармацевтически приемлемые адъюванты.
Фармацевтическая композиция настоящего изобретения эффективно применима для ингибирования котранспортера Na+-глюкозы или профилактического средства или лечебного средства в случае диабета и осложнений диабета.
Настоящее изобретение также относится к применению вышеуказанного азуленового производного или его соли для получения ингибитора котранспортера Na+-глюкозы или профилактического и/или лечебного средства в случае диабета и осложнений диабета.
Настоящее изобретение также относится к способу лечения диабета и осложнений диабета, включающему введение пациенту эффективного количества вышеуказанного азуленового производного или его соли.
В определении формул в данном описании определение "низший" относится к линейной или разветвленной углеродной цепи с 1-6 атомами углерода, если не указано иное. Соответственно примеры "низшего алкила" включают линейные или разветвленные алкилы с 1-6 атомами углерода, такие как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, гексил и изогексил. Из них предпочтительными являются алкилы с 1-3 атомами углерода, причем особенно предпочтительны метил и этил.
В качестве "низшего алкилена" кроме метилена, этилена, пропилена и бутилена можно использовать разветвленный алкилен. Из них предпочтительными являются метилен и этилен, причем особенно предпочтителен метилен.
В качестве "атома галогена" может быть задан атом фтора, атом хлора, атом брома или атом иода, причем особенно предпочтительны атом хлора и атом брома. В качестве "галогензамещенного низшего алкила" или "галогензамещенного низшего алкилена" может быть задан низший алкил или низший алкилен, замещенный вышеуказанным атомом галогена, причем особенно предпочтительными являются низший алкил или низший алкилен, замещенные одним или несколькими атомами фтора.
Термин "арил" относится к моноциклической-трициклической ароматической углеводородной группе с 6-14 атомами углерода. Примерами арила являются фенил, нафтил, антранил и фенантрил, причем особенно предпочтительны фенил и нафтил. В качестве группы "-(низший алкилен)-арил" предпочтительными являются бензил и фенетил.
В качестве "замещенного амина" может быть задана аминогруппа, в которой один или два атома водорода замещены низшим алкилом, ацилом, карбамоилом или карбаматом (NH2-C(=O)-O-). В качестве "ацила" могут быть заданы формил, ацетил, пропионил, бутирил, валерил, пивалоил или подобные группы, причем особенно предпочтителен ацетил.
-А- в приведенной выше формуле (I) может связываться с любым из положений 1-8 азуленового цикла.
Соединение настоящего изобретения включает смесь различных стереоизомеров или отдельные стереоизомеры, такие как таутомер и оптический изомер.
Соединение настоящего изобретения может образовывать соль присоединения кислоты или в зависимости от типа заместителя соль присоединения основания. Конкретными примерами таких солей являются соль присоединения, образованная с минеральной кислотой, такой как хлороводородная кислота, бромоводородная кислота, иодоводородная кислота, серная кислота, азотная кислота и фосфорная кислота; с органической кислотой, такой как муравьиная кислота, уксусная кислота, пропионовая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота, винная кислота, лимонная кислота, метансульфоновая кислота и этансульфоновая кислота; с кислой аминокислотой, такой как аспарагиновая кислота и глутаминовая кислота; соль неорганического основания, такого как натрий, калий, магний, кальций и алюминий; органического основания, такого как метиламин, этиламин и этаноламин; основной аминокислоты, такой как лизин и орнитин; и аммонийные соли.
Соединение настоящего изобретения также включает гидраты и различные фармацевтически приемлемые сольваты и полиморфы.
Соединение настоящего изобретения не следует ограничивать соединениями, описанными далее в примерах, но они включают в себя все соединения приведенной выше формулы (I) (азуленовые производные) и их фармацевтически приемлемые соли.
Кроме того, соединение настоящего изобретения может включать любое пролекарство, которое в организме в результате метаболизма превращается в любое соединение из числа соединений приведенной выше формулы (I) или его соли. В качестве группы, образующей пролекарство соединения настоящего изобретения, может быть задана группа, описанная в Prog. Med., 5:2157-2161 (1985), или группа, описанная в "Development of Pharmaceuticals", vol.7, Molecular Design, 163-198 (Hirokawa Shoten, 1990). Поэтому указанные работы включены в данное описание в качестве ссылок.
Соединение настоящего изобретения или его фармацевтически приемлемую соль можно получить разными известными методами синтеза с использованием особенностей, основанных на типе его основной структуры или заместителя. В таком случае, с точки зрения метода получения, эффективной может быть замена функциональной группы на подходящую защищенную группу, конкретно на группу, которую можно легко превратить в функциональную группу на стадии получения исходного вещества или промежуточного соединения в зависимости от типа функциональной группы. Следуя по такому пути, для получения целевого соединения защитную группу необязательно удаляют. Примерами таких функциональных групп являются гидроксильная группа и карбоксильная группа. Примерами защитных групп для указанных функциональных групп являются защитные группы, описанные в Green and Wuts, "Protective Groups in Organic Synthesis", Second Edition. Такие группы можно использовать соответственно согласно условиям реакции.
Препаративные примеры
Далее будут описываться типичные способы получения соединения настоящего изобретения
Препаративный пример 1
Способ препаративного примера 1 включает введение азулена (1) в реакцию Фриделя-Крафтса с последующим восстановлением с получением соединения (2), введение соединения (2) во взаимодействие с соединением (3) по реакции присоединения с получением соединения (4), восстанавление соединения (4) с получением соединения (I) и удаление защитной группы из соединения (I) с получением соединения (I'), как показано на схеме, приведенной далее.

В приведенных формулах R1-R12 и А имеют значения, указанные выше.
Реакцию Фриделя-Крафтса осуществляют в присутствии подходящей кислоты Льюиса в отсутствие растворителя или в подходящем растворителе. Характерными примерами кислоты Льюиса являются хлорид алюминия, трихлорид бора, хлорид цинка, хлорид ванадия, хлорид железа и хлорид олова. Характерными примерами растворителя являются простые эфиры, такие как диэтиловый эфир и тетрагидрофуран; галогеналкилы, такие как хлороформ, дихлорметан и 1,2-дихлорэтан; диметилформамид, диметилсульфоксид и смеси указанных растворителей. Растворитель выбирают соответственно согласно типу реагирующих веществ или условиям реакции. Температура реакции составляет примерно 20°С-180°С и, предпочтительно, примерно 20°С-40°С, хотя она изменяется согласно типу исходных веществ, условиям реакции или подобным факторам, однако, в вышеуказанных пределах.
Последующую реакцию восстановления осуществляют в присутствии подходящего восстановителя и кислотного катализатора в подходящем растворителе. Характерными примерами восстановителя являются боргидрид натрия, цианоборгидрид натрия и алюмогидрид лития. Характерными примерами кислоты являются комплекс трифторида бора с диэтиловым эфиром, трифторуксусная кислота и трифторметансульфоновая кислота. Характерными примерами растворителя являются простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диглим; галогеналкилы, такие как хлороформ, дихлорметан и 1,2-дихлорэтан; и смеси указанных растворителей. Растворитель выбирают соответственно согласно типу реагирующих веществ или условиям реакции. Температура реакции составляет примерно 0-180°С и, предпочтительно, примерно 0°С-60°С, хотя она изменяется согласно типу исходных веществ, условиям реакции или подобным факторам, однако, в вышеуказанных пределах.
Последующую реакцию присоединения соединения (2) к соединению (3) осуществляют в присутствии алкиллитиевого реагента, такого как н-бутиллитий, втор-бутиллитий или трет-бутиллитий, в подходящем растворителе. Характерными примерами растворителя являются простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диглим. Растворитель выбирают соответственно согласно типу реагирующих веществ или условиям реакции. Температура реакции составляет примерно от -100 до 180°С и, предпочтительно, примерно от -80 до 30°С, хотя она изменяется согласно типу исходных веществ, условиям реакции или подобным факторам, однако, в вышеуказанных пределах. Соединение (4) также можно получить взаимодействием соединения (2) с реактивом Гриньяра, полученным с использованием металлического реагента, такого как магний, в подходящем растворителе. Характерными примерами растворителя являются простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диглим. Растворитель выбирают соответственно согласно типу реагирующих веществ или условиям реакции. Температура реакции составляет примерно 20-180°С и, предпочтительно, примерно 20-80°С, хотя она изменяется согласно типу исходных веществ, условиям реакции или подобным факторам, однако в вышеуказанных пределах.
Последующую реакцию восстановления осуществляют в присутствии подходящего восстановителя и кислотного катализатора в подходящем растворителе. Характерными примерами восстановителя являются триэтилсилан, триизопропилсилан и трет-бутилдиметилсилан. Характерными примерами кислотного катализатора являются комплекс трифторида бора с диэтиловым эфиром, трифторуксусная кислота и триметилсилилтрифторметансульфонат. Характерными примерами растворителя являются галогеналкилы, такие как хлороформ, дихлорметан и 1,2-дихлорэтан; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диглим; ацетонитрил и смеси указанных растворителей. Растворитель выбирают соответственно согласно типу реагирующих веществ или условиям реакции. Температура реакции составляет примерно от -100 до 180°С и предпочтительно примерно от -40 до 20°С, хотя она изменяется согласно типу исходных веществ, условиям реакции или подобным факторам, однако в вышеуказанных пределах.
Удаление защитной группы осуществляют в присутствии металлического катализатора, такого как палладий/уголь, гидроксид палладия или платина/уголь, в подходящем растворителе в атмосфере водорода или в присутствии кислоты Льюиса в подходящем растворителе. Характерными примерами кислоты Льюиса являются трихлорид бора, трибромид бора и трихлорид алюминия. Характерными примерами растворителя являются простые эфиры, такие как тетрагидрофуран и диоксан; сложные эфиры, такие как этилацетат; спирты, такие как метанол и этанол; ацетонитрил и смеси указанных растворителей. Растворитель выбирают соответственно согласно типу реагирующих веществ или условиям реакции. Температура реакции составляет примерно от -100 до 180°С и, предпочтительно примерно от -80 до 30°С, хотя она изменяется согласно типу исходных веществ, условиям реакции или подобным факторам, однако в вышеуказанных пределах.
Препаративный пример 2
Способ препаративного примера 2 включает взаимодействие соединения (3) с соединением (5) с получением соединения (6), восстановление соединения (6) с получением соединения (7), галогенирование соединения (7) с получением соединения (7'), взаимодействие соединения (7') с азуленовым производным (8) с получением соединения (I) и удаление защитной группы из соединения (I) с получением соединения (I'), как показано на схеме, приведенной далее.

В приведенных формулах Х представляет галоген, B(OR13)3, где R13 представляет собой Н или низший алкил, или SnR143, где R14 представляет собой низший алкил.
Взаимодействие соединения (3) с соединением (5) осуществляют так же, как взаимодействие соединения (2) с соединением (3) в препаративном примере 1.
Последующую реакцию восстановления для получения соединения (7) осуществляют так же, как реакцию восстановления соединения (4) в препаративном примере 1. Последующее галогенирование соединения (7) для получения соединения (7') осуществляют в присутствии подходящего галогенирующего агента в подходящем растворителе. Характерными примерами галогенирующего агента являются N-бромсукцинимид, бром, бромоводород. Характерными примерами растворителя являются галогеналкилы, такие как метиленхлорид, хлороформ и четыреххлористый углерод; сложные эфиры, такие как этилацетат; простые эфиры, такие как тетрагидрофуран и диоксан; диметилсульфоксид, уксусная кислота, вода и смеси указанных растворителей. Растворитель выбирают соответственно согласно типу реагирующих веществ или условиям реакции. Температура реакции составляет примерно от -100 до 180°С и, предпочтительно, примерно 0-100°С, хотя она изменяется согласно типу исходных веществ, условиям реакции или подобным факторам, однако в вышеуказанных пределах.
Последующее взаимодействие соединения (7') с соединением (8) осуществляют в присутствии подходящего палладиевого катализатора или в присутствии подходящего палладиевого катализатора и подходящего фосфина в подходящем растворителе. Характерными примерами катализатора являются тетракистрифенилфосфинпалладий(0), ацетат палладия, бистрифенилфосфиндихлорпалладий(II), 1,2-бис(дифенилфосфиноэтан)дихлорпалладий(II), 1, 1'-бис(дифенилфосфиноферроцен)дихлорпалладий(II) и трис(дибензилиденацетон)дипалладий(0). Характерными примерами фосфина являются трифурилфосфин, 2-(дициклогексилфосфино)бифенил и три(трет-бутил)фосфин. Характерными примерами растворителя являются простые эфиры, такие как тетрагидрофуран, диоксан и диглим; спирты, такие как метанол, этанол и изопропанол; бензол, толуол, вода и смеси указанных растворителей. Растворитель выбирают соответственно согласно типу реагирующих веществ или условиям реакции. Температура реакции составляет примерно от -100 до 180°С и, предпочтительно, примерно 0-100°С, хотя она изменяется согласно типу исходных веществ, условиям реакции или подобным факторам, однако в вышеуказанных пределах.
Такую реакцию можно осуществить взаимодействием соединения (7') с металлом в подходящем растворителе с получением металлосодержащего реагента с последующим взаимодействием полученного реагента с соединением (8) в присутствии палладиевого катализатора. Характерными примерами металла являются медь, цинк, железо и магний. Палладиевый катализатор, растворитель и температура реакции такие же, какие указаны выше.
Удаление защитной группы осуществляют в присутствии подходящего основания в подходящем растворителе. Характерными примерами основания являются гидроксид натрия, гидроксид калия, метоксид натрия и этоксид натрия. Характерными примерами растворителя являются простые эфиры, такие как тетрагидрофуран, диоксан и диглим; спирты, такие как метанол, этанол и изопропанол; ацетонитрил, вода и смеси указанных растворителей. Растворитель выбирают соответственно согласно типу реагирующих веществ или условиям реакции. Температура реакции составляет примерно от -100 до 180°С и, предпочтительно, примерно 0-100°С, хотя она изменяется согласно типу исходных веществ, условиям реакции или подобным факторам, однако в вышеуказанных пределах.
Удаление защитной группы также осуществляют в присутствии кислоты Льюиса в подходящем растворителе. Характерными примерами кислоты Льюиса являются трихлорид бора, трибромид бора и трихлорид алюминия. Характерными примерами растворителя являются простые эфиры, такие как тетрагидрофуран и диоксан; сложные эфиры, такие как этилацетат; спирты, такие как метанол и этанол; ацетонитрил и смеси указанных растворителей. Растворитель выбирают соответственно согласно типу реагирующих веществ или условиям реакции. Температура реакции составляет примерно от -100 до 180°С и, предпочтительно, примерно от -80 до 60°С, хотя она изменяется согласно типу исходных веществ, условиям реакции или подобным факторам, однако в вышеуказанных пределах.
Препаративный пример 3
Способ препаративного примера 3 включает введение защитной группы в спиртовое производное (9), взаимодействие защищенного производного (9) с соединением (3) с получением соединения (10), восстановление соединения (10) и удаление из него защитной группы с получением соединения (11), галогенирование соединения (11) с получением соединения (7'), взаимодействие соединения (7') с азуленовым производным (8) с получением соединения (I) и удаление защитной группы из соединения (I) с получением соединения (I'), как показано на схеме, приведенной далее.

В приведенных формулах Р представляет защитную группу и Х представляет галоген, B(OR13), где R13 представляет собой Н или низший алкил, или SnR143, где R14 представляет собой низший алкил.
Спиртовое производное (9) защищают подходящей защитной группой, такой как трет-бутилдиметилсилильная группа, трет-бутилдифенилсилильная группа и тетрагидропиранильная группа, согласно обычному способу. Последующее взаимодействие с соединением (3) осуществляют так же, как взаимодействие соединения (2) с соединением (3) в препаративном примере 1.
Последующую реакцию восстановления осуществляют так же, как реакцию восстановления соединения (4) в препаративном примере 1. Последующее удаление защитной группы осуществляют в присутствии подходящего катализатора в подходящем растворителе. Характерными примерами катализатора являются фторид тетрабутиламмония, комплекс трифторида бора с диэтиловым эфиром, фтороводород, уксусная кислота и п-толуолсульфоновая кислота. Характерными примерами растворителя являются простые эфиры, такие как тетрагидрофуран и диоксан; спирты, такие как метанол и этанол; вода и смеси указанных растворителей. Растворитель выбирают соответственно согласно типу реагирующих веществ или условиям реакции. Температура реакции составляет примерно от -100 до 180°С и, предпочтительно, примерно 20-80°С, хотя она изменяется согласно типу исходных веществ, условиям реакции или подобным факторам, однако в вышеуказанных пределах.
Последующее галогенирование осуществляют в присутствии подходящего галогенирующего агента и трифенилфосфина в подходящем растворителе. Характерными примерами галогенирующего агента являются N-бромсукцинимид, бром, четырехбромистый углерод и бромид меди(II). Характерными примерами растворителя являются галогеналкилы, такие как метиленхлорид, хлороформ и четыреххлористый углерод; сложные эфиры, такие как этилацетат; простые эфиры, такие как тетрагидрофуран и диоксан; бензол, толуол, диметилсульфоксид, уксусная кислота, вода и смеси указанных растворителей. Растворитель выбирают соответственно согласно типу реагирующих веществ или условиям реакции. Температура реакции составляет примерно от -100 до 180°С и, предпочтительно, примерно 0-100°С, хотя она изменяется согласно типу исходных веществ, условиям реакции или подобным факторам, однако в вышеуказанных пределах.
Последующее взаимодействие соединения (7') с соединением (8) и удаление защитной группы осуществляют так же, как в препаративном примере 2.
Препаративный пример 4
Способ препаративного примера 4 включает взаимодействие бромбензольного производного (12) с соединением (3) с получением соединения (13), восстановление соединения (13) с получением соединения (14), превращение соединения (14) в производное триалкилолова (15), взаимодействие производного (15) с азуленовым производным (16) с получением соединения (I) и удаление из соединения (I) защитной группы с получением соединения (I'), как показано на схеме, приведенной далее.


В приведенных формулах Y представляет галоген и R15 представляет низший алкил.
Взаимодействие бромбензольного производного (12) с соединением (3) осуществляют так же, как взаимодействие соединения (2) с соединением (3) в препаративном примере 1.
Последующую реакцию восстановления осуществляют так же, как реакцию восстановления соединения (4) в препаративном примере 1. Последующую конверсию в производное триалкилолова осуществляют в присутствии гексаалкилдиолова и подходящего палладиевого катализатора в подходящем растворителе. Характерными примерами палладиевого катализатора являются тетракистрифенилфосфинпалладий(0), ацетат палладия, бистрифенилфосфиндихлорпалладий(II), 1,2-бис(дифенилфосфиноэтан)дихлорпалладий(II) и 1,1'-бис(дифенилфосфиноферроцен)дихлорпалладий(II). Характерными примерами растворителя являются простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, диоксан и диглим; спирты, такие как метанол, этанол и изопропанол; бензол, толуол, вода и смеси указанных растворителей. Растворитель выбирают соответственно согласно типу реагирующих веществ или условиям реакции. Температура реакции составляет примерно от -100 до 180°С и, предпочтительно, примерно 0-100°С, хотя она изменяется согласно типу исходных веществ, условиям реакции или подобным факторам, однако в вышеуказанных пределах.
Последующее взаимодействие с азуленовым производным (16) осуществляют в присутствии подходящего палладиевого катализатора или в присутствии подходящего палладиевого катализатора и подходящего фосфина в подходящем растворителе. Характерными примерами катализатора являются тетракистрифенилфосфинпалладий(0), ацетат палладия, бистрифенилфосфиндихлорпалладий(II), 1,2-бис(дифенилфосфиноэтан)дихлорпалладий(II), 1, 1'-бис(дифенилфосфиноферроцен)дихлорпалладий(II) и трис(дибензилиденацетон)дипалладий(0). Характерными примерами фосфина являются трифурилфосфин, 2-(дициклогексилфосфино)бифенил и три(трет-бутил)фосфин. Характерными примерами растворителя являются простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, диоксан и диглим; спирты, такие как метанол, этанол и изопропанол; бензол, толуол, вода и смеси указанных растворителей. Растворитель выбирают соответственно согласно типу реагирующих веществ или условиям реакции. Температура реакции составляет примерно от -100 до 180°С и, предпочтительно, примерно 0-100°С, хотя она изменяется согласно типу исходных веществ, условиям реакции или подобным факторам, однако в вышеуказанных пределах. Удаление защитной группы осуществляют так же, как в препаративном примере 2.
Препаративный пример 5
Способ препаративного примера 5 включает бромирование производного фенилуксусной кислоты (17) с получением соединения (18), превращение соединения (18) в фенилацетоновое производное (19), циклизацию производного (19) с соединением (20) с получением соединения (2), взаимодействие соединения (2) с соединением (3) с получением соединения (4), восстановление соединения (4) с получением соединения (I) и удаление из соединения (I) защитной группы с получением соединения (I'), как показано на схеме, приведенной далее.

Бромирование производного фенилуксусной кислоты (17) осуществляют в присутствии подходящего агента бромирования в подходящем растворителе. Характерными примерами бромирующего агента являются N-бромсукцинимид, бром, бромоводород. Характерными примерами растворителя являются галогеналкилы, такие как метиленхлорид, хлороформ и четыреххлористый углерод; сложные эфиры, такие как этилацетат; простые эфиры, такие как тетрагидрофуран и диоксан; диметилсульфоксид, уксусная кислота, вода и смеси указанных растворителей. Растворитель выбирают соответственно согласно типу реагирующих веществ или условиям реакции. Температура реакции составляет примерно от -100 до 180°С и, предпочтительно, примерно 0-100°С, хотя она изменяется согласно типу исходных веществ, условиям реакции или подобным факторам, однако в вышеуказанных пределах.
Последующую дериватизацию в фенилацетоновое производное (19) осуществляют в присутствии подходящего основания в подходящем растворителе. Характерными примерами основания являются ацетат натрия, ацетат калия и пиридин. Характерным примером растворителя является уксусный ангидрид. Температура реакции составляет примерно от -100 до 180°С и, предпочтительно, примерно 30-150°С, хотя она изменяется согласно типу исходных веществ, условиям реакции или подобным факторам, однако в вышеуказанных пределах.
Последующую реакцию циклизации осуществляют взаимодействием соединения (19) с подходящим амином в присутствии подходящего дегидратирующего агента в подходящем растворителе и с последующим взаимодействием смеси с соединением (20) в подходящем растворителе. Характерными примерами амина являются морфолин, пирролидин, N-метилпиперазин, диэтиламин, диизопропиламин. Характерными примерами дегидратирующего агента являются сульфат магния и сульфат натрия. Характерными примерами растворителя являются простые эфиры, такие как тетрагидрофуран, диоксан и диэтиловый эфир; галогеналкилы, такие как метиленхлорид, хлороформ и четыреххлористый углерод; сложные эфиры, такие как этилацетат; спирты, такие как метанол, этанол и изопропанол; бензол, толуол, ацетонитрил, вода и смеси указанных растворителей. Растворитель выбирают соответственно согласно типу реагирующих веществ или условиям реакции. Температура реакции составляет примерно от -100 до 180°С и, предпочтительно, примерно 20-120° С, хотя она изменяется согласно типу исходных веществ, условиям реакции или подобным факторам, однако в вышеуказанных пределах.
Последующую реакцию присоединения к соединению (3) и восстановление осуществляют так же, как реакцию присоединения и восстановление в препаративном примере 1.
Удаление защитной группы осуществляют так же, как в препаративном примере 2.
Наилучший способ осуществления изобретения
Примеры
Соединение настоящего изобретения далее будет описываться подробнее с помощью примеров. Так как исходные соединения для получения соединения настоящего изобретения включают новые соединения, способы получения таких соединений также будут описываться в ссылочных примерах.
Ссылочный пример 1
Хлорид алюминия (1,87 г) добавляют при 0°С к раствору 1-метилазулена (2 г) в метиленхлориде (20 мл) и смесь перемешивают в течение 15 минут. Затем к реакционной смеси при 0°С добавляют по каплям раствор 3-бромбензоилхлорида (1,86 мл) в метиленхлориде (5 мл) и смесь перемешивают в течение одного часа. Реакционную смесь добавляют к 10% соляной кислоте, охлаждаемой льдом, и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. После фильтрации фильтрат концентрируют. Остаток очищают колоночной хроматографией на силикагеле (н-гексан-этилацетат) и получают (3-бромфенил)(3-метилазулен-1-ил)метанон (1,2 г).
Ссылочный пример 2
Комплекс трифторида бора с диэтиловым эфиром (1,17 мл) при 0°С добавляют к раствору (3-бромфенил)(3-метилазулен-1-ил)метанона (0,5 г) в смеси диглим-эфир (соотношение 1:1, 2,0 мл) и смесь перемешивают в течение 20 минут. Затем к реакционной смеси добавляют боргидрид натрия (0,68 г) и смесь перемешивают при комнатной температуре в течение одного часа. Реакционную смесь добавляют к воде, охлаждаемой льдом, и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. После фильтрации фильтрат концентрируют. Остаток очищают колоночной хроматографией на силикагеле (н-гексан-эфир), и получают 1-(3-бромбензил)-3-метилазулен (0,21 г).
Ссылочный пример 3
К раствору 1-(3-бромбензил)-3-метилазулена (1,2 г) в ТГФ (8,0 мл) при -78°С добавляют по каплям 1,6 М раствор н-бутиллития в гексане (2,44 мл) и смесь перемешивают в течение одного часа. Затем к реакционной смеси добавляют по каплям раствор 2,3,4, 6-тетра-О-бензил-D-(+)-глюконо-1,5-лактона (2,08 г) в ТГФ (8,0 мл) и смесь перемешивают в течение одного часа. К реакционной смеси добавляют насыщенный водный раствор хлорида аммония и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. После фильтрации фильтрат концентрируют. Остаток очищают колоночной хроматографией на силикагеле (н-гексан-этилацетат), и получают 2,3,4,6-тетра-О-бензил-1-С-[3-[(3-метилазулен-1-ил)метил]фенил]-D-глюкопиранозу (1,74 г).
Соединения ссылочных примеров 4, 5 и 6 получают соответственно такими же способами, как в ссылочных примерах 1, 2 и 3.
Ссылочный пример 7
К раствору 3-бром-4-этокситолуола (3,6 г) в ТГФ (50 мл) при -78°С добавляют по каплям 1,6 М раствор н-бутиллития в гексане (11 мл) и смесь перемешивают в течение 15 минут. Затем к реакционной смеси добавляют по каплям раствор 2,3,4, 6-тетра-О-бензил-D-(+)-глюконо-1,5-лактона (7,6 г) в ТГФ (10 мл) и смесь перемешивают в течение 2,5 часов. К реакционной смеси добавляют насыщенный водный раствор хлорида аммония и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. После фильтрации фильтрат концентрируют. Полученное выпавшее в осадок вещество выделяют фильтрацией и получают 2,3,4,6-тетра-О-бензил-1-С-(2-этокси-5-метилфенил)-D-глюкопиранозу (3,53 г).
Ссылочный пример 8
К раствору 2,3,4, 6-тетра-О-бензил-1-С-(2-этокси-5-метилфенил)-D-глюкопиранозы (3,5 г) при -50°С добавляют по каплям комплекс трифторида бора с диэтиловым эфиром (0,6 мл) и триэтилсилан (1,7 мл) и смесь перемешивают в течение двух часов. К реакционной смеси добавляют насыщенный водный раствор карбоната калия и смесь экстрагируют хлороформом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. После фильтрации фильтрат концентрируют. Остаток очищают колоночной хроматографией на силикагеле (гексан-этилацетат) и получают (1S)-1,5-ангидро-2,3,4, 6-тетра-О-бензил-1-(2-этокси-5-метилфенил)-D-глюцит (3,4 г).
Ссылочный пример 9
К раствору (1S)-1,5-ангидро-2,3,4,6-тетра-О-бензил-1-(2-этокси-5-метилфенил)-D-глюцита (3,4 г) в метиленхлориде (50 мл) при -78°С добавляют по каплям 1,0 М раствор трихлорида бора в метиленхлориде (31,0 мл) и смесь перемешивают в течение 30 минут. К реакционной смеси добавляют метанол (10 мл), смесь перемешивают в течение 10 минут и концентрируют. Остаток растворяют в пиридине (20 мл) и к раствору добавляют уксусный ангидрид (10 мл) с последующим перемешиванием в течение 12 часов при комнатной температуре. Реакционную смесь разбавляют этилацетатом. Разбавленный продукт промывают в указанном порядке 10% соляной кислотой, насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли и сушат над безводным сульфатом натрия. После фильтрации фильтрат концентрируют. Остаток очищают колоночной хроматографией на силикагеле (н-гексан-этилацетат) и получают (1S)-2,3,4,6-тетра-О-ацетил-1,5-ангидро-1-(2-этокси-5-метилфенил)-D-глюцит (1,3 г).
Ссылочный пример 10
К раствору (1S)-2,3,4,6-тетра-О-ацетил-1, 5-ангидро-1-(2-этокси-5-метилфенил)-D-глюцита (3,7 г) в четыреххлористом углероде (30,0 мл) добавляют N-бромсукцинимид (1,7 г) и пероксид бензоила (0,1 г) и смесь кипятят с обратным холодильником в течение одного часа. Реакционную смесь разбавляют хлороформом и разбавленный продукт промывают в указанном порядке насыщенным водным раствором гидрокарбоната натрия, насыщенным водным раствором тиосульфата натрия и насыщенным раствором соли, и сушат над безводным сульфатом натрия. После фильтрации фильтрат концентрируют. Полученное выпавшее в осадок вещество выделяют фильтрацией и получают (1S)-2,3,4,6-тетра-О-ацетил-1,5-ангидро-1-[5-(бромметил)-2-этоксифенил]-D-глюцит (1,4 г).
Ссылочный пример 11
К суспензии металлического магния (0,22 г) в ТГФ (5,0 мл) в атмосфере аргона добавляют каталитическое количество иода. Затем к смеси добавляют по каплям раствор соединения в ТГФ (5,0 мл) и затем смесь кипятят с обратным холодильником в течение одного часа. Затем полученный таким образом реактив Гриньяра при 0°С добавляют по каплям к раствору 3-бром-4-метилбензальдегиддиметилацеталя (2,45 г) в ТГФ (5,0 мл), и смесь перемешивают в течение одного часа. К реакционной смеси добавляют водный раствор хлорида аммония и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. После фильтрации фильтрат концентрируют. Остаток очищают колоночной хроматографией на силикагеле (н-гексан-этилацетат) и получают 2,3,4, 6-тетра-О-бензил-1-С-[5-(диметоксиметил)-2-метилфенил]-D-глюкопиранозу (2,4 г).
Ссылочный пример 12
К раствору 2,3,4, 6-тетра-О-бензил-1-С-[5-(диметоксиметил)-2-метилфенил]-D-глюкопиранозы (2,4 г) в смеси ацетон-вода (соотношение 5:1, 12 мл) при комнатной температуре добавляют по каплям сульфаминовую кислоту (0,4 г) и хлорит натрия (0,4 г) и смесь перемешивают в течение трех часов. Из реакционной смеси выпаривают ацетон и добавляют воду. Смесь экстрагируют этилацетатом. Органический слой промывают в указанном порядке водой и насыщенным раствором соли и сушат над безводным сульфатом натрия. После фильтрации фильтрат концентрируют и получают 4-метил-3-[(3R,4S,5R,6R)-3,4, 5-трис(бензилокси)-6-[(бензилокси)метил]-2-гидрокситетрагидро-2Н-пиран-2-ил]бензойную кислоту (1,5 г).
Соединение ссылочного примера 13 получают таким же способом, как в ссылочном примере 8.
Ссылочный пример 14
К раствору 4-метил-3-[(2S,3S,4R,5R,6R)-3,4,5-трис(бензилокси)-6-[(бензилокси)метил]тетрагидро-2Н-пиран-2-ил]бензойной кислоты (1,5 г) в ДМФА (10 мл) при комнатной температуре добавляют метилиодид (0,17 мл) и карбонат калия (0,4 г) и смесь перемешивают в течение трех часов. Нерастворимое вещество отделяют фильтрацией и фильтрат разбавляют этилацетатом. Разбавленный продукт промывают в указанном порядке водой и насыщенным раствором соли и сушат над безводным сульфатом натрия. После фильтрации фильтрат концентрируют. Остаток очищают колоночной хроматографией на силикагеле (н-гексан-этилацетат) и получают метил-4-метил-3-[(2S,3S,4R,5R,6R)-3,4,5-трис(бензилокси)-6-[(бензилокси)метил]тетрагидро-2Н-пиран-2-ил]бензоат (1,3 г).
Ссылочный пример 15
К раствору метил-4-метил-3-[(2S,3S,4R,5R,6R)-3,4,5-трис(бензилокси)-6-[(бензилокси)метил]тетрагидро-2Н-пиран-2-ил]бензоата (1,3 г) в ТГФ (10 мл) при 0°С добавляют алюмогидрид лития (73 мг) и смесь перемешивают в течение одного часа. Реакционную смесь выливают в воду, охлаждаемую льдом, и нерастворимое вещество отделяют фильтрацией. Фильтрат экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. После фильтрации фильтрат концентрируют. Остаток очищают колоночной хроматографией на силикагеле (н-гексан-этилацетат) и получают (1S)-1,5-ангидро-2,3,4,6-тетра-О-бензил-1-[5-(гидроксиметил)-2-метилфенил]-D-глюцит (1,0 г).
Ссылочный пример 16
К раствору (1S)-1,5-ангидро-2,3,4,6-тетра-О-бензил-1-[5-(гидроксиметил)-2-метилфенил]-D-глюцита (1,0 г) в метиленхлориде (10 мл) при комнатной температуре добавляют четырехбромистый углерод (0,62 г) и трифенилфосфин (0,49 г) и смесь перемешивают в течение одного часа. Реакционную смесь концентрируют, остаток очищают колоночной хроматографией на силикагеле (н-гексан-этилацетат) и получают (1S)-1,5-ангидро-2,3,4,6-тетра-О-бензил-1-[5-(бромметил)-2-метилфенил]-D-глюцит (0,8 г).
Соединения ссылочных примеров 17 и 18 получают соответственно такими же способами, как в ссылочных примерах 1 и 2.
Ссылочный пример 19
К раствору (1S)-1,5-ангидро-2,3,4,6-тетра-О-бензил-1-[3-бром-5-(метоксиметил)фенил]-D-глюцита (7,8 г) в ТГФ (5,0 мл) при -78°С добавляют по каплям 1,6 М раствор н-бутиллития в н-гексане (14,0 мл) и смесь перемешивают в течение 30 минут. К реакционной смеси добавляют по каплям ДМФА (1,0 мл) и смесь перемешивают в течение четырех часов. К реакционной смеси добавляют насыщенный водный раствор хлорида аммония и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. После фильтрации фильтрат концентрируют. Остаток очищают колоночной хроматографией на силикагеле (н-гексан-этилацетат) и получают 3-метоксиметил-5-[(2S,3S,4R,5R,6R)-3,4, 5-трис(бензилокси)-6-[(бензилокси)метил]тетрагидро-2Н-пиран-2-ил]бензальдегид (2,6 г).
Ссылочный пример 20
К раствору 3-метоксиметил-5-[(2S,3S,4R,5R,6R)-3,4, 5-трис(бензилокси)-6-[(бензилокси)метил]тетрагидро-2Н-пиран-2-ил]бензальдегида (2,6 г) в смеси 1:1 метанола и ТГФ (10 мл) добавляют боргидрид натрия (0,15 г) и смесь перемешивают в течение одного часа. К реакционной смеси добавляют ацетон (5,0 мл) и смесь перемешивают в течение 10 минут. К реакционной смеси добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. После фильтрации фильтрат концентрируют. Остаток очищают колоночной хроматографией на силикагеле (н-гексан-этилацетат) и получают (1S)-1,5-ангидро-2,3,4,6-тетра-О-бензил-1-[3-(гидроксиметил)-5-(метоксиметил)фенил]-D-глюцит (2,1 г).
Соединения ссылочных примеров 21, 22 и 23 получают соответственно такими же способами, как в ссылочных примерах 6, 11 и примере 1.
Ссылочный пример 24
К раствору (1S)-1,5-ангидро-2,3,4, 6-тетра-О-бензил-1-[3-([[трет-бутил(дифенил)силил]окси]метил)фенил]-D-глюцита (1,7 г) в ТГФ (10,0 мл) при комнатной температуре добавляют 1,0 М раствор фторида тетрабутиламмония в ТГФ (3,8 мл) и смесь перемешивают в течение двух часов. Затем к реакционной смеси добавляют 10% водный раствор гидроксида натрия (3,0 мл) и смесь кипятят с обратным холодильником при перемешивании в течение одного часа. К реакционной смеси добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. После фильтрации фильтрат концентрируют. Остаток очищают колоночной хроматографией на силикагеле (н-гексан-этилацетат) и получают (1S)-1,5-ангидро-2,3,4,6-тетра-О-бензил-1-[3-(гидроксиметил)фенил]-D-глюцит (0,7 г).
Соединение ссылочного примера 25 получают таким же способом, как в ссылочном примере 16.
Ссылочный пример 26
К раствору 5-бром-2-метоксибензилового спитра (10, 0 г) в ДМФА (100 мл) при охлаждении льдом добавляют имидазол (3,45 г) и трет-бутилдиметилхлорсилан (17,6 г) и смесь перемешивают в течение двух часов. Реакционную смесь добавляют к воде, охлаждаемой льдом, и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. После фильтрации фильтрат концентрируют. Остаток очищают колоночной хроматографией на силикагеле (н-гексан-этилацетат) и получают [(5-бром-2-метоксибензил)окси](трет-бутил)диметилсилан (15,2 г).
Соединения ссылочных примеров 27, 28, 29, 30 и 31 получают соответственно такими же способами, как в ссылочном примере 3, примере 1, ссылочном примере 16, ссылочном примере 11 и примере 1.
Ссылочный пример 32
К раствору (1S)-1,5-ангидро-2,3,4,6-тетра-О-бензил-1-(3-бромфенил)-D-глюцита (5,0 г) в толуоле (8,0 мл) в атмосфере аргона добавляют гексабутилдиолово (10,0 г) и тетракистрифенилфосфинпалладий(0) (0,24 г) и смесь кипятят с обратным холодильником при перемешивании в течение 17 часов. Реакционную смесь концентрируют. Остаток очищают колоночной хроматографией на силикагеле (н-гексан-этилацетат) и получают (1S)-1,5-ангидро-2,3,4,6-тетра-О-бензил-1-[3-(трибутилстаннил)фенил]-D-глюцит (4,0 г).
Ссылочный пример 33
К раствору (1S)-1,5-ангидро-2,3,4, 6-тетра-О-бензил-1-[3-(гидроксиметил)фенил]-D-глюцита (6,8 г), полученного в ссылочном примере 24, в хлороформе (100 мл) добавляют диоксид марганца (20,4 г) и смесь кипятят с обратным холодильником при перемешивании в течение 1,5 часов. После отделения нерастворимого вещества от реакционной смеси фильтрацией через целит при комнатной температуре фильтрат концентрируют. Остаток очищают колоночной хроматографией на силикагеле (н-гексан-этилацетат) и получают 3-[(2S,3S,4R,5R,6R)-3,4,5-трис(бензилокси)-6-[(бензилокси)метил]тетрагидро-2Н-пиран-2-ил]бензальдегид (6,8 г).
Ссылочный пример 34
К раствору бромида метилтрифенилфосфония (11,6 г) в ТГФ (100 мл) при комнатной температуре добавляют трет-бутоксид калия (3,6 г) и смесь перемешивают в течение 10 минут. Добавляют по каплям раствор 3-[(2S,3S,4R,5R,6R)-3,4,5-трис(бензилокси)-6-[(бензилокси)метил]тетрагидро-2Н-пиран-2-ил]бензальдегида (6,8 г) в ТГФ (10 мл) и смесь перемешивают в течение одного часа при комнатной температуре. К реакционной смеси добавляют насыщенный водный раствор хлорида аммония и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. После фильтрации фильтрат концентрируют. Остаток очищают колоночной хроматографией на силикагеле (н-гексан-этилацетат) и получают (1S)-1,5-ангидро-2,3,4, 6-тетра-О-бензил-1-(3-винилфенил)-D-глюцит (6,8 г).
Соединения ссылочных примеров 35, 36, 37, 38, 39 и 40 получают соответственно такими же способами, как в ссылочном примере 26, ссылочном примере 3, примере 1, ссылочном примере 16, ссылочном примере 3 и примере 1.
Ссылочный пример 41
К раствору (1S)-1,5-ангидро-2,3,4, 6-тетра-О-бензил-1-(3-бром-5-метоксифенил)-D-глюцита (10,0 г) в смеси ТГФ-метанол (соотношение 1:1, 100 мл) добавляют 5% палладий/уголь (1 г). Затем к смеси добавляют две капли 1 М соляной кислоты и затем смесь перемешивают в течение 30 минут в атмосфере водорода. После фильтрации реакционной смеси фильтрат концентрируют. Остаток очищают колоночной хроматографией на силикагеле (хлороформ-метанол), и получают (1S)-1,5-ангидро-1-(3-бром-2-метоксифенил)-D-глюцит (2,9 г).
Соединения ссылочных примеров 42, 43, 44, 45 и 46 получают соответственно такими же способами, как в примере 37, ссылочном примере 32, ссылочном примере 41, примере 37 и ссылочном примере 32.
Ссылочный пример 47
К раствору 2,3,4, 6-тетра-О-бензил-1-О-(трифторацетил)-a-D-глюкопиранозы (20,0 г) в метиленхлориде (100 мл) добавляют 1-бром-2,4-диметоксибензол (9,1 мл) и смесь перемешивают в течение 10 минут. К реакционной смеси добавляют комплекс трифторида бора с диэтиловым эфиром (3,9 мл) и смесь перемешивают при комнатной температуре в течение 12 часов. К реакционной смеси добавляют воду и смесь экстрагируют метиленхлоридом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. После фильтрации фильтрат концентрируют. Остаток очищают колоночной хроматографией на силикагеле (н-гексан-этилацетат) и получают (1S)-1,5-ангидро-2,3,4,6-тетра-О-бензил-1-(5-бром-2,4-диметоксифенил)-D-глюцит (17,0 г).
Соединение ссылочного примера 48 получают таким же способом, как в ссылочном примере 41.
Ссылочный пример 49
К раствору (1S)-1,5-ангидро-1-(5-бром-2,4-диметоксифенил)-D-глюцита (1,35 г) в метиленхлориде (15 мл) при 0°С добавляют диизопропилэтиламин (2,98 г) и хлорметилметиловый эфир (1,3 мл) и смесь перемешивают при комнатной температуре в течение 12 часов. Реакционную смесь добавляют к воде, охлаждаемой льдом, и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. После фильтрации фильтрат концентрируют. Остаток очищают колоночной хроматографией на силикагеле (н-гексан-этилацетат) и получают (1S)-1,5-ангидро-1-(5-бром-2,4-диметоксифенил)-2,3,4,6-тетракис-О-(метоксиметил)-D-глюцит (0,7 г).
Соединение ссылочного примера 50 получают таким же способом, как в ссылочном примере 32.
Ссылочный пример 51
К раствору 6-изопропилазулен-2-карбальдегида (1,4 г) в метаноле (30 мл) при 0°С добавляют боргидрид натрия (0,26 г) и смесь перемешивают в течение одного часа. К реакционной смеси добавляют ацетон и смесь перемешивают в течение 15 минут. Реакционную смесь концентрируют. Остаток очищают колоночной хроматографией на силикагеле (н-гексан-этилацетат) и получают (6-изопропилазулен-2-ил)метанол (1,15 г).
Ссылочный пример 52
К раствору (6-изопропилазулен-2-ил)метанола (0,5 г) в четыреххлористом углероде (10,0 мл) добавляют трифенилфосфин (0,66 г) и смесь кипятят с обратным холодильником в течение 15 часов. Реакционную смесь концентрируют. Остаток очищают колоночной хроматографией на силикагеле (н-гексан-диэтиловый эфир) и получают 2-(хлорметил)-6-изопропилазулен (0,38 г).
Соединение ссылочного примера 53 получают таким же способом, как в ссылочном примере 52.
Ссылочный пример 54
К раствору метил-2-хлоразулен-1-карбоксилата (11,38 г) и гексаметилдиолова (35,9 г) в 1, 4-диоксане (272 мл) при команатной температуре добавляют [1,2-бис(дифенилфосфино)этан]дихлорпалладий(II) (1,48 г) и смесь нагревают при 60°С и перемешивают в течение 38 часов. После выпаривания растворителя при пониженном давлении полученный остаток очищают колоночной хроматографией на силикагеле (гексан - эфир - ацетат) и получают метил-2-(трибутилстаннил)азулен-1-карбоксилат (12,36 г).
Ссылочный пример 55
К суспензии 1,2,3,4,6-пента-О-ацетил-b-D-глюкопиранозы (6,41 г), 1,2-диэтокси-4-метилбензола (2,47 г) и трифторацетата серебра (3,63 г) в 1, 2-дихлорэтане (70 мл) при 0°С добавляют 1,0 М раствор тетрахлорида олова в дихлорметане (16,5 мл) и смесь перемешивают при той же температуре в течение одного часа. После нагревания до комнатной температуры и перемешивания в течение 15 часов к смеси добавляют насыщенный водный раствор бикарбоната натрия. Реакционную смесь фильтруют через целит и фильтрат экстрагируют хлороформом. Органический слой промывают водой и насыщенным раствором соли и сушат над безводным сульфатом натрия. После фильтрации растворитель выпаривают при пониженном давлении. К полученному остатку добавляют метанол (200 мл) и каталитическое количество метоксида натрия и смесь перемешивают при комнатной температуре в течение ночи. Растворитель выпаривают при пониженном давлении и полученный остаток очищают колоночной хроматографией на силикагеле (хлороформ-метанол). К полученному остатку добавляют пиридин (30 мл), уксусный ангидрид (5 мл) и каталитическое количество 4-диметиламинопиридина и смесь перемешивают при комнатной температуре в течение двух суток. К реакционной смеси добавляют толуол и выпаривают растворитель при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (этилацетат - н-гексан) и получают (1S)-2,3,4,6-тетра-О-ацетил-1,5-ангидро-1-(2,3-диэтокси-5-метилфенил)-D-глюцит (2,51 г).
Ссылочный пример 56
Суспензию (1S)-2,3,4,6-тетра-О-ацетил-1,5-ангидро-1-(2,3-диэтокси-5-метилфенил)-D-глюцита (500 мг) и N-бромсукцинимида (209 мг) в четыреххлористом углероде (10 мл) кипятят с обратным холодильником и добавляют 2, 2'-азобис(изобутиронитрил) (80 мг). Смесь перемешивают в течение 30 минут при кипячении с обратным холодильником и реакционную смесь оставляют охлаждаться до комнатной температуры. После выпаривания растворителя при пониженном давлении полученный остаток очищают колоночной хроматографией на силикагеле (этилацетат - н-гексан) и получают (1S)-2,3,4,6-тетра-О-ацетил-1,5-ангидро-1-[5-(бромметил)-2, 3-диэтоксифенил]-D-глюцит (464 мг).
Соединения ссылочных примеров 57 и 58 получают соответственно такими же способами, как в ссылочных примерах 55 и 56.
Ссылочный пример 59
К суспензии трет-бутоксида калия (625 мг) в ТГФ (11 мл) при -78°С добавляют 1,56 М раствор н-бутиллития в н-гексане (3,57 мл) и 2-фтортолуол (0,66 мл) в указанном порядке и смесь перемешивают при той же температуре в течение 1,5 часов. К реакционной смеси добавляют по каплям раствор 2,3,4,6-тетра-О-бензил-D-(+)-глюконо-1,5-лактона (3,00 г) в ТГФ (10 мл) и смесь перемешивают при той же температуре в течение 30 минут. После добавления 1 М соляной кислоты смесь нагревают до комнатной температуры. Реакционную смесь экстрагируют диэтиловым эфиром. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. После фильтрации растворитель выпаривают при пониженном давлении. Фильтрат концентрируют и остаток сушат до твердого состояния. Полученный остаток растворяют в дихлорэтане (5 мл) и ацетонитриле (25 мл). К раствору при -30°С добавляют триизопропилсилан (2,27 мл) и комплекс трифторида бора с диэтиловым эфиром (0,85 мл). После перемешивания при той же температуре в течение 30 минут к реакционной смеси добавляют насыщенный водный раствор бикарбоната натрия. Смесь экстрагируют диэтиловым эфиром. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. После фильтрации растворитель выпаривают при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (этилацетат-н-гексан), и получают (1S)-1,5-ангидро-2,3,4,6-тетра-О-бензил-1-(2-фтор-3-метилфенил)-D-глюцит (559 мг).
Ссылочный пример 60
Суспензию (1S)-1,5-ангидро-2,3,4,6-тетра-О-бензил-1-(2-фтор-3-метилфенил)-D-глюцита (550 мг) и 20% гидроксида палладия на угле (300 мг) в смеси ТГФ (10 мл) - метанол (5 мл) перемешивают в атмосфере водорода (1 атм) в течение 2,5 суток. Реакционную смесь фильтруют через целит и фильтрат концентрируют. К полученному остатку добавляют пиридин (5 мл), уксусный ангидрид (2 мл) и каталитическое количество 4-диметиламинопиридина, и смесь перемешивают при комнатной температуре в течение одного часа. После выпаривания растворителя при пониженном давлении оставшийся растворитель выпаривают вместе с толуолом и остаток растворяют в диэтиловом эфире. Полученный раствор промывают 1 М соляной кислотой и насыщенным раствором соли и сушат над безводным сульфатом натрия. После фильтрации фильтрат концентрируют при пониженном давлении и получают (1S)-2,3,4,6-тетра-О-ацетил-1,5-ангидро-1-(2-фтор-3-метилфенил)-D-глюцит (335 мг).
Соединения ссылочных примеров 61, 62, 63, 64 и 65 получают соответственно такими же способами, как в ссылочных примерах 56, 55, 56, 55 и 56.
Ссылочный пример 66
К раствору 3-бром-4-гидроксифенилуксуной кислоты (28,5 г) в уксусном ангидриде (100 мл) добавляют ацетат натрия (50,5 г) и смесь кипятят с обратным холодильником в течение 21 часа. После охлаждения до комнатной температуры к реакционной смеси добавляют 20% водный раствор гидроксида натрия для доведения рН до 11. Смесь кипятят с обратным холодильником в течение одного часа. После охлаждения до комнатной температуры к реакционной смеси добавляют 10% соляную кислоту для доведения рН до 6. Смесь экстрагируют этилацетатом. Органический слой промывают водой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и сушат над безводным сульфатом натрия. После фильтрации растворитель выпаривают при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (этилацетат - н-гексан) и получают 1-(3-бром-4-гидроксифенил)ацетон (22,2 г).
Ссылочный пример 67
К раствору 1-(3-бром-4-гидроксифенил)ацетона (4,0 г) в ДМФА (40 мл) добавляют карбонат калия (2,7 г) и бензилбромид (2,3 мл) и смесь перемешивают при комнатной температуре в течение шести часов. Реакционную смесь выливают в воду и смесь экстрагируют этилацетатом. Органический слой промывают водой и насыщенным раствором соли и сушат над безводным сульфатом натрия. После фильтрации растворитель выпаривают при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (этилацетат-н-гексан) и получают 1-[4-(бензилокси)-3-бромфенил]ацетон (3,65 г).
Ссылочный пример 68
К раствору 1-[4-(бензилокси)-3-бромфенил]ацетона (3,65 г) в диэтиловом эфире (30 мл) добавляют пирролидин (1,9 мл) и сульфат магния (2,74 г) и смесь перемешивают при комнатной температуре в течение 12 часов. После фильтрации растворитель выпаривают при пониженном давлении. Полученный остаток сушат при пониженном давлении и растворяют в этаноле (30 мл). К раствору добавляют 2Н-циклогепта[b]фуран-2-он (0,5 г), и смесь кипятят с обратным холодильником в течение восьми часов. Реакционную смесь концентрируют. Полученный остаток очищают колоночной хроматографией на силикагеле (этилацетат-н-гексан) и получают 2-[4-(бензилокси)-3-бромбензил]азулен (0,84 г).
Ссылочный пример 69
К раствору 2-[4-(бензилокси)-3-бромбензил]азулена (0,17 г) в ТГФ (3,0 мл) при -55°С добавляют по каплям 1,6 М раствор н-бутиллития в н-гексане (0,32 мл) и смесь перемешивают при той же температуре в течение 10 минут. К реакционной смеси добавляют по каплям раствор 2,3,4,6-тетра-О-бензилглюконо-1,5-лактона (0,12 г) в ТГФ (3,0 мл) и смесь перемешивают при той же температуре в течение 30 минут. К реакционной смеси добавляют насыщенный водный раствор хлорида аммония и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. После фильтрации растворитель выпаривают при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (этилацетат - н-гексан) и получают 1-С-[5-(азулен-2-илметил)-2-(бензилокси)фенил]-2,3,4,6-тетра-О-бензил-D-глюкопиранозу (0,9 г).
Пример 1
К раствору 2,3,4,6-тетра-О-бензил-1-С-[3-[(3-метилазулен-1-ил)метил]фенил]-D-глюкопиранозы (2,3 г) в ацетонитриле (40 мл) при -40°С добавляют по каплям комплекс трифторида бора с диэтиловым эфиром (0,39 мл) и триизопропилсилан (1,23 мл) и смесь перемешивают в течение двух часов. К реакционной смеси добавляют насыщенный водный раствор карбоната калия и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. После фильтрации фильтрат концентрируют. Остаток очищают колоночной хроматографией на силикагеле (н-гексан-этилацетат) и получают (1S)-1,5-ангидро-2,3,4,6-тетра-О-бензил-1-[3-[(3-метилазулен-1-ил)метил]фенил]-D-глюцит (1,47 г).
Пример 2
К раствору (1S)-1,5-ангидро-2,3,4,6-тетра-О-бензил-1-[3-[(3-метилазулен-1-ил)метил]фенил]-D-глюцита (0,76 г) в метиленхлориде (20 мл) при -78°С добавляют по каплям 1 М раствор трибромида бора в н-гептане (20 мл) и смесь перемешивают в течение 30 минут. К реакционной смеси добавляют смесь метиленхлорид - толуол (соотношение 2:1, 60 мл) и затем к смеси добавляют метанол (6 мл). Реакционную смесь охлаждают до комнатной температуры и концентрируют до половины объема, затем к смеси добавляют метанол (25 мл) и смесь концентрируют. Данную операцию повторяют три раза. Остаток, полученный концентрированием, очищают колоночной хроматографией на силикагеле (хлороформ-метанол) и получают (1S)-1,5-ангидро-1-[3-[(3-метилазулен-1-ил)метил]фенил]-D-глюцит (0,068 г).
Соединения примеров 3 и 4 получают соответственно такими же способами, как в примерах 1 и 2.
Пример 5
К суспензии порошка цинка (0,17 г) в ТГФ (5,0 мл) в атмосфере аргона добавляют две капли 1,2-дибромэтана и смесь кипятят с обратным холодильником в течение пяти минут. После охлаждения до комнатной температуры к реакционной смеси добавляют две капли хлортриметилсилана. Смесь перемешивают в течение 15 минут. Затем к реакционной смеси добавляют (1S)-2,3,4,6-тетра-О-ацетил-1,5-ангидро-1-[5-(бромэтил)-2-этоксифенил]-D-глюцит (1,4 г) и смесь кипятят с обратным холодильником в течение одного часа. После охлаждения до комнатной температуры к реакционной смеси добавляют тетракистрифенилфосфинпалладий(0) (0,27 г) и метил-2-хлоразулен-1-карбоксилат (0, 28 г). Смесь кипятят с обратным холодильником в течение шести часов. После охлаждения до комнатной температуры смесь выливают в 10% соляную кислоту при охлаждении льдом. Смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. После фильтрации фильтрат концентрируют. Остаток очищают колоночной хроматографией на силикагеле (н-гексан-этилацетат) и получают метил-2-(4-этокси-3-[(2S,3S,4R,5R,6R)-3,4,5-трис(ацетилокси)-6-[(ацетилокси)метил]тетрагидро-2Н-пиран-2-ил]бензил)азулен-1-карбоксилат (0,58 г).
Пример 6
К раствору метил-2-(4-этокси-3-[(2S,3S,4R,5R,6R)-3,4, 5-трис(ацетилокси)-6-[(ацетилокси)метил]тетрагидро-2Н-пиран-2-ил]бензил)азулен-1-карбоксилата (0,58 г) в метаноле (5,0 мл) при комнатной температуре добавляют по каплям 10% водный раствор гидроксида натрия (5,0 мл). Смесь перемешивают в течение 30 минут и затем кипятят с обратным холодильником в течение шести часов. После охлаждения льдом реакционную смесь нейтрализуют, добавляя 10% соляную кислоту. Нейтрализованный продукт экстрагируют хлороформом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. После фильтрации фильтрат концентрируют. Остаток очищают колоночной хроматографией на силикагеле (хлороформ-метанол) и получают 2-(4-этокси-3-[(2S,3R,4R,5S,6R)-3,4, 5-трис(ацетилокси)-6-[(ацетилокси)метил]тетрагидро-2Н-пиран-2-ил]бензил)азулен-1-карбоновую кислоту (0,4 г).
Пример 7
К суспензии 2-(4-этокси-3-[(2S,3R,4R,5S,6R)-3,4,5-трис(ацетилокси)-6-[(ацетилокси)метил]тетрагидро-2Н-пиран-2-ил]бензил)азулен-1-карбоновой кислоты (0,36 г) в бензоле (10 мл) добавляют моногидрат п-толуолсульфоновой кислоты (40 мг) и смесь кипятят с обратным холодильником в течение 15 минут. Реакционную смесь концентрируют. Остаток очищают колоночной хроматографией на силикагеле (хлороформ-метанол) и получают (1S)-1,5-ангидро-1-[5-(азулен-2-илметил)-2-этоксифенил]-D-глюцит (203 мг).
Соединение примера 8 получают таким же способом, как в примере 5.
Пример 9
К раствору метил-2-(4-метил-3-[(2S,3S,4R,5R,6R)-3,4, 5-трис(бензилокси)-6-[(бензилокси)метил]тетрагидро-2Н-пиран-2-ил]бензил)азулен-1-карбоксилата (0,39 г) в метиленхлориде (10 мл) при -78°С добавляют по каплям 1,0 М раствор трихлорида бора в метиленхлориде (3,0 мл) и смесь перемешивают в течение 15 минут. К реакционной смеси добавляют метанол (10 мл), смесь перемешивают в течение 10 минут и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (хлороформ-метанол) и получают метил-2-(4-метил-3-[(2S,3R,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2Н-пиран-2-ил]бензил)азулен-1-карбоксилат (0,08 г).
Соединения примеров 10 и 11 получают, соответственно, такими же способоами, как в примерах 6 и 7.
Пример 12
К раствору метил-2-(4-метил-3-[(2S,3S,4R,5R,6R)-3,4,5-трис(бензилокси)-6-[(бензилокси)метил]тетрагидро-2Н-пиран-2-ил]бензил)азулен-1-карбоксилата (0,39 г) в метиленхлориде (10 мл) при -78°С добавляют по каплям 1,0 М раствор трихлорида бора в метиленхлориде (3,0 мл) и смесь перемешивают в течение 15 минут. К реакционной смеси добавляют метанол (10,0 мл), смесь перемешивают в течение 10 минут и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (хлороформ-метанол) и получают метил-3-бензил-2-(4-метил-3-[(2S,3R,4R,5S,6R)-3,4, 5-тригидрокси-6-(гидроксиметил)тетрагидро-2Н-пиран-2-ил]бензил)азулен-1-карбоксилат (0,06 г).
Соединения примеров 13, 14, 15 и 16 получают соответственно такими же способами, как в примерах 6, 7, 5 и 9.
Пример 17
К раствору метил-2-[3-(хлорметил)-5-[(2S,3R,4R,5S,6R)-3,4, 5-тригидрокси-6-(гидроксиметил)тетрагидро-2Н-пиран-2-ил]бензил)азулен-1-карбоксилата (0,06 г) в метаноле (3,0 мл) при комнатной температуре добавляют 28% раствор метоксида натрия в метаноле (0,5 мл). Смесь перемешивают в течение одного часа. Затем к реакционной смеси добавляют 10% водный раствор гидроксида натрия (3,0 мл) и смесь кипятят с обратным холодильником в течение одного часа. После охлаждения до комнатной температуры реакционную смесь нейтрализуют, добавляя 10% соляную кислоту, и экстрагируют хлороформом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. После фильтрации фильтрат концентрируют. Остаток очищают колоночной хроматографией на силикагеле (хлороформ-метанол) и получают (1S)-1, 5-ангидро-1-[3-(азулен-2-илметил)-5-(метоксиметил)фенил]-D-глюцит (0,02 г).
Соединения примеров 18, 19, 20, 21 и 22 получают соответственно такими же способами, как в примерах 5, 9, 6, 7 и 5.
Соединения примеров 23, 24, 25, 26 и 27 получают соответственно такими же способами, как в примерах 2, 6, 7, 5 и 6.
Соединения примеров 28, 29, 30, 31 и 32 получают соответственно такими же способами, как в примерах 7, 5, 9, 6 и 7.
Пример 33
К раствору (1S)-1,5-ангидро-2,3,4, 6-тетра-О-бензил-1-[3-(трибутилстаннил)фенил]-D-глюцита (0,5 г) и метил-2-хлоразулен-1-карбоксилата (0,1 г) в 1,4-диоксане (3,0 мл) добавляют карбонат калия (0,15 г) и бис(трифенилфосфин)дихлорпалладий(II) (0,04 г) и смесь кипятят с обратным холодильником в течение 15 часов. Реакционную смесь концентрируют. Остаток очищают колоночной хроматографией на силикагеле (н-гексан-этилацетат) и получают метил-2-(3-[(2S,3S,4R,5R,6R)-3,4,5-трис(бензилокси)-6-[(бензилокси)метил]тетрагидро-2Н-пиран-2-ил]фенил)азулен-1-карбоксилат (0,25 г).
Соединения примеров 34, 35 и 36 получают соответственно такими же способами, как в примерах 2, 6 и 7.
Пример 37
К раствору (1S)-1, 5-ангидро-1-[3-(азулен-2-илметил)фенил]-D-глюцита (0,24 г) в пиридине (5,0 мл) при комнатной температуре добавляют уксусный ангидрид (0,3 мл) и смесь перемешивают в течение 15 часов. Реакционную смесь разбавляют этилацетатом. Разбавленный раствор промывают в указанном порядке 10% соляной кислотой, насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли и сушат над безводным сульфатом натрия. После фильтрации фильтрат концентрируют. Остаток очищают колоночной хроматографией на силикагеле (н-гексан-этилацетат) и получают (1S)-2,3,4,6-тетра-О-ацетил-1, 5-ангидро-1-[3-(азулен-2-илметил)фенил]-D-глюцит (0,34 г).
Пример 38
К раствору (1S)-2,3,4,6-тетра-О-ацетил-1, 5-ангидро-1-[3-(азулен-2-илметил)фенил]-D-глюцита (0,20 г) в метиленхлориде (20 мл) при 0°С добавляют хлорид алюминия (0,24 г), и смесь перемешивают в течение 30 минут. Затем к реакционной смеси при 0°С добавляют по каплям уксусный ангидрид (0,17 мл) и смесь кипятят с обратным холодильником при перемешивании в течение 30 минут и еще 16 часов. Реакционную смесь при охлаждении льдом добавляют к 10% соляной кислоте и экстрагируют этилацетатом. Органический слой промывают в указанном порядке насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли и сушат над безводным сульфатом натрия. После фильтрации фильтрат концентрируют. Остаток очищают колоночной хроматографией на силикагеле (н-гексан-этилацетат) и получают (2S,3S,4R,5R, 6R)-2-[3-[(1-ацетилазулен-2-ил)метил]фенил]-6-[(ацетилокси)метил]тетрагидро-2Н-пиран-3,4,5-триилтриацетат (0,09 г).
Пример 39
К раствору (2S,3S,4R, 5R,6R)-2-[3-[(1-ацетилазулен-2-ил)метил]фенил]-6-[(ацетилокси)метил]тетрагидро-2Н-пиран-3,4,5-триилтриацетата (0,09 г) в смеси ТГФ-метанол (соотношение 1:1, 6,0 мл) при 0°С добавляют метоксид натрия (16 мг) и смесь перемешивают в течение двух часов. После нейтрализации катионообменной смолой реакционную смесь при охлаждении льдом добавляют к 10% соляной кислоте. После фильтрации фильтрат концентрируют. Остаток очищают колоночной хроматографией на силикагеле (хлороформ-метанол), и получают 1-(2-[3-[(2S,3R,4R,5S,6R)-3,4, 5-тригидрокси-6-(гидроксиметил)тетрагидро-2Н-пиран-2-ил]бензил]азулен-1-ил)этанон (0,06 г).
Соединения примеров 40 и 41 получают соответственно такими же способами, как в ссылочном примере 2 и примере 39.
Пример 42
К (1S)-1,5-ангидро-2,3,4,6-тетра-О-бензил-1-(3-винилфенил)-D-глюциту (1,0 г) добавляют раствор 9-борабицикло[3.3.1]нонана в ТГФ (8,0 мл), и смесь кипятят с обратным холодильником в течение четырех часов. Затем к реакционной смеси добавляют 3 М водный раствор фосфата калия (1,3 мл) и ДМФА (12 мл). Затем к смеси добавляют метил-2-хлоразулен-1-карбоксилат (0,35 г) и 1,1'-дифенилфосфиноферроцендихлорпалладий(II) (0,12 г) и затем смесь перемешивают при 50°С в течение двух часов. После охлаждения до комнатной температуры реакционную смесь выливают в воду, охлаждаемую льдом, и экстрагируют этилацетатом. Органический слой промывают в указанном порядке насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли и сушат над безводным сульфатом натрия. Реакционную смесь концентрируют. Остаток очищают колоночной хроматографией на силикагеле (н-гексан-этилацетат) и получают 2-[2-(3-[(2S,3S,4R,5R,6R)-3,4,5-трис(бензилокси)-6-[(бензилокси)метил]тетрагидро-2Н-пиран-2-ил]фенил)этил]азулен-1-карбоксилат (0,88 г).
Соединения примеров 43, 44, 45, 46, 47 и 48 получают соответственно такими же способами, как в примерах 2, 6, 7, 5, 2 и 6.
Соединения примеров 49, 50, 51, 52, 53 и 54 получают соответственно такими же способами, как в примерах 7, 33, 39, 2, 6 и 7.
Соединения примеров 55, 56, 57, 58 и 59 получают соответственно такими же способами, как в примерах 33, 39, 33, 39 и 33.
Пример 60
К раствору (1S)-1,5-ангидро-1-[5-(азулен-2-илметил)-2,4-диметоксифенил]-2,3,4,6-тетракис-О-(метоксиметил)-D-глюцита (0,09 г) в метаноле (2,0 мл) добавляют 10% соляную кислоту (0,5 мл) и смесь кипятят с обратным холодильником в течение 30 минут. Реакционную смесь выливают в воду, охлаждаемую льдом, и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. После фильтрации фильтрат концентрируют. Остаток очищают колоночной хроматографией на силикагеле (хлороформ-метанол) и получают (1S)-1, 5-ангидро-1-[5-(азулен-2-илметил)-2,4-диметоксифенил]-D-глюцит (0,02 г).
Пример 61
К суспензии метил-2-(трибутилстаннил)азулен-1-карбоксилата (0, 25 г), трис(дибензилиденацетон)дипалладия(0) (0,05 г), 2-(дициклогексилфосфино)бифенила (0,05 г), фторида калия (0,09 г) и карбоната цезия (0,35 г) в 1,4-диоксане (20,0 мл) добавляют (1S)-2,3,4, 6-тетра-О-ацетил-1,5-ангидро-1-[4-(бромметил)-1-метокси-2-нафтил]-D-глюцит (0,62 г). Смесь перемешивают при 60°С в течение восьми часов и при 85°С еще в течение 14 часов. Нерастворимые вещества удаляют фильтрацией и фильтрат упаривают для удаления растворителя. Остаток очищают колоночной хроматографией на силикагеле и получают метил-2-[(4-метокси-3-[(2S,3S,4R,5R,6R)-3,4, 5-трис(ацетилокси)-6-[(ацетилокси)метил]тетрагидро-2Н-пиран-2-ил]-1-нафтил)метил]азулен-1-карбоксилат (0,34 г).
Соединение примера 62 получают таким же способом, как в примере 39.
Пример 63
К раствору метил-2-[3-[(1S)-1,5-ангидро-D-глюцит-1-ил]-4-метокси-1-нафтил]метилазулен-1-карбоксилата (0,23 г) в метаноле (8,0 мл) добавляют по каплям 1 М водный раствор гидроксида натрия (12 мл) и смесь кипятят с обратным холодильником в течение трех часов. К реакционной смеси при охлаждении льдом добавляют 1 М соляную кислоту (12 мл) и выпаривают растворитель. Полученный остаток суспендируют в ацетонитриле (15 мл). К суспензии добавляют по каплям 4 М раствор хлороводорода в 1,4-диоксане (0,4 мл) и смесь кипятят с обратным холодильником в течение 15 минут. Нерастворимое вещество удаляют фильтрацией и растворитель выпаривают. Полученный остаток очищают колоночной хроматографией на силикагеле и колоночной хроматографией на обращенной фазе в указанном порядке и получают (1S)-1,5-ангидро-1-[4-(азулен-2-илметил)-1-метокси-2-нафтил]-D-глюцит (0,08 г).
Соединения примеров 64, 65 и 66 получают соответственно такими же способами, как в примерах 61, 39 и 63.
Пример 67
К раствору (1S)-2,3,4,6-тетра-О-ацетил-1, 5-ангидро-1-[5-(бромметил)-2-этокси-3-метоксифенил]-D-глюцита (327 мг) и метил-2-(трибутилстаннил)азулен-1-карбоксилата (180 мг) в 1,4-диоксане (10 мл) добавляют трис(дибензилиденацетон)дипалладий(0) (17 мг), 2-(дициклогексилфосфино)бифенил (22 мг), фторид калия (44 мг) и карбонат цезия (247 мг). Смесь энергично перемешивают при 90°С в течение 14 часов. К реакционной смеси добавляют 1 М соляную кислоту и смесь экстрагируют диэтиловым эфиром. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. После фильтрации фильтрат концентрируют при пониженном давлении. Полученный остаток растворяют в ТГФ (4 мл) и МеОН (2 мл) и к реакционной смеси при комнатной температуре добавляют 1 М водный раствор гидроксида натрия (0,5 мл). После перемешивания в течение 30 минут к реакционной смеси добавляют еще 1 М водный раствор гидроксида натрия (0,5 мл). Смесь перемешивают в течение 30 минут. Выпаривают растворитель при пониженном давлении и полученный остаток очищают колоночной хроматографией на силикагеле (хлороформ-метанол). К полученному остатку (133 мг) добавляют метанол (2,5 мл) и 10% водный раствор гидроксида натрия (2,5 мл) и смесь кипятят с обратным холодильником в течение одного часа. После выпаривания растворителя при пониженном давлении добавляют этанол. Смесь фильтруют. Фильтрат концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (хлороформ-метанол) и получают 2-[4-этокси-3-метокси-5-[(2S,3R,4R,5S,6R)-3,4, 5-тригидрокси-6-(гидроксиметил)тетрагидро-2Н-пиран-2-ил]бензил]азулен-1-карбоновую кислоту (51 мг).
Пример 68
К 2-[4-этокси-3-метокси-5-[(2S,3R,4R, 5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2Н-пиран-2-ил]бензил]азулен-1-карбоновой кислоте (50 мг) добавляют ацетонитрил (5 мл) и 4 М раствор хлороводорода в этилацетате (0,02 мл) и смесь кипятят с обратным холодильником в течение 10 минут. К реакционной смеси добавляют еще 4 М раствор хлороводорода в этилацетате (0,02 мл) и смесь кипятят с обратным холодильником в течение 30 минут. Реакционную смесь концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (хлороформ-метанол) и получают (1S)-1, 5-ангидро-1-[5-(азулен-2-илметил)-2-этокси-3-метоксифенил]-D-глюцит (42 мг).
Соединения примеров 69, 70 и 71 получают соответственно такими же способами, как в примерах 61, 39 и 63.
Пример 72
К раствору (1S)-2,3,4,6-тетра-О-ацетил-1,5-ангидро-1-[3-(бромметил)-2-фторфенил]-D-глюцита (198 мг) и метил-2-(трибутилстаннил)азулен-1-карбоксилата (180 мг) в 1,4-диоксане (10 мл) добавляют трис(дибензилиденацетон)дипалладий(0) (17 мг), 2-(дициклогексилфосфино)бифенил (22 мг), фторид калия (44 мг) и карбонат цезия (247 мг) и смесь энергично перемешивают при 90°С в течение 15 часов. Реакционную смесь фильтруют через целит и фильтрат концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (этилацетат - н-гексан). Полученный остаток растворяют в смеси ТГФ-метанол (соотношение 1:1, 6,0 мл). К раствору добавляют метоксид натрия (30 мг) и полученную смесь перемешивают при комнатной температуре в течение ночи. Выпаривают растворитель при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (хлороформ-метанол) и получают метил-2-[2-фтор-3-[(2S,3R,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2Н-пиран-2-ил]бензил]азулен-1-карбоксилат (19 мг).
Пример 73
К раствору метил-2-[2-фтор-3-[(2S,3R,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2Н-пиран-2-ил]бензил]азулен-1-карбоксилата (19 мг) в метаноле (2 мл) добавляют 10% водный раствор гидроксида натрия (2 мл). Смесь кипятят с обратным холодильником в течение 2 часов. Реакционную смесь нейтрализуют, добавляя 4 М раствор хлороводорода в этилацетате, и выпаривают растворитель при пониженном давлении. К полученному остатку добавляют ацетонитрил (5 мл) и 4 М раствор хлороводорода в этилацетате (1 мл) и смесь кипятят с обратным холодильником в течение 30 минут. Выпаривают растворитель при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (хлороформ-метанол) и получают (1S)-1,5-ангидро-1-[3-(азулен-2-илметил)-2-фторфенил]-D-глюцит (10 мг).
Соединение примера 74 получают таким же, способом, как в ссылочном примере 8.
Пример 75
К раствору (1S)-1, 5-ангидро-1-[5-(азулен-2-илметил)-2-(бензилокси)фенил]-2,3,4,6-тетра-О-бензил-D-глюцита (0,07 г) в метиленхлориде (5 мл) добавляют хлорид алюминия (0,12 г) и анизол (4,0 мл) и смесь перемешивают при комнатной температуре в течение двух часов. Реакционную смесь выливают в воду, охлаждаемую льдом, и экстрагируют этилацетатом. Органический слой промывают крепким рассолом и сушат над безводным сульфтом натрия. После фильтрации фильтрат концентрируют. Остаток очищают колоночной хроматографией на силикагеле (хлороформ-метанол) и получают (1S)-1, 5-ангидро-1-[5-(азулен-2-илметил)-2-гидроксифенил]-D-глюцит (0,01 г).
Структурные формулы и физико-химические свойства соединений ссылочных примеров и примеров собраны в таблицах 1-22 в конце данного описания.
В таблицах могут применяться аббревиатуры, указанные далее.
С.п. относится к номеру ссылочного примера, Пр. относится к номеру примера, "Структура" относится к структурной формуле, Ас обозначает ацетильную группу, Bn обозначает бензильную группу, Bu обозначает бутильную группу, "Данные" относится к полученным свойствам, ЯМР обозначает спектр ядерного магнитного резонанса (внутренний стандарт ТМС), и МС относится к величине, полученной при масс-спектрометрическом анализе.
Соединения, перечисленные в табл.23, можно легко получить такими же способами, как в примерах и препаративных примерах, или способом с небольшими модификациями, очевидными для специалистов в данной области техники. Табл.23 приводится после таблиц 1-22.
Промышленная применимость
Так как производное азулена и его соль (соединения настоящего изобретения) обладают действием ингибитора котранспортера Na+-глюкозы и снижения уровня глюкозы в крови, указанные соединения пригодны для лечения или предупреждения инсулинзависимого диабета (диабета типа 1), инсулиннезависимого диабета (диабета типа 2), инсулинорезистентных болезней и ожирения, например, как фармацевтические средства, в частности, как ингибиторы котранспортера Na+-глюкозы.
Существенное действие ингибирования котранспортера Na+-глюкозы и снижения уровня глюкозы в крови соединения настоящего изобретения подтверждаются в приведенных далее фармакологических испытаниях (примеры испытаний 1 и 2).
Пример испытания 1
[Ингибирование активности человеческого котранспортера Na+-глюкозы (человеческого SGLT2)]
(1) Получение экспрессирующего вектора человеческого SGLT2
Во-первых, осуществляют обратную транскрипцию одноцепочечной кДНК из полной РНК, происходящей из почки человека (изготовитель BD Biosciences Clontech), с использованием Superscript II (изготовитель Invitrogen Corporation) и случайного гексамера. Во-вторых, с использованием кДНК в качестве матрицы методом ПЦР с использованием ДНК-полимеразы Pyrobest (изготовитель Takara Bio Inc.) амплифицируют фрагмент ДНК, кодирующий человеческий SGLT2 (Wells R.G. et al., Am. J. Physiol., 1992, 263(3), F459). Иными словами, сайт Hind III и сайт EcoRI встраивают соответственно в 5'-область и 3'-область фрагмента ДНК с использованием праймеров.
Амплифицированный фрагмент клонируют в вектор pCR2.1-Topo с использованием набора Topo ТА Cloning Kit (изготовитель Invitrogen Corporation) и клонированный вектор трансфицируют в компетентную клетку Escherichia coli JM109. Устойчивые к ампициллину клоны культивируют в среде LB, содержащей ампициллин (100 мг/л). Очищают плазмиду из культивированной Escherichia coli с использованием метода Hanahan (см. Maniatis et al., "Molecular Cloning"). Получают фрагмент ДНК, кодирующий человеческий SGLT2, расщеплением плазмиды Hind III/EcoRI и лигируют и клонируют в тот же сайт экспрессирующего вектора pcDNA 3.1 (изготовитель Invitrogen Corporation) с использованием ДНК-лигазы (изготовитель Roche Diagnostics). Лигированный клон трансфицируют в компетентную клетку Escherichia coli JM109 тем же способом, какой описан выше, и культивируют в среде LB, содержащей ампициллин, и с использованием метода Hanahan получают экспрессирующий вектор человеческого SGLT2.
(2) Получение клеток, экспрессирующих человеческий SGLT2
Экспрессирующий вектор человеческого SGLT2 трансфицируют в клетки СНО-К1 с использованием липофектамина 2000 (изготовитель Invitrogen Corporation). Клетки культивируют в среде Гама F12 (изготовитель Nissui Pharmaceutical Co., Ltd.), содержащей пенициллин (50 МЕ/мл, изготовитель Danippon Pharmaceutical Co., Ltd.), стрептомицин (50 мкг/мл, изготовитель Danippon Pharmaceutical Co., Ltd.), генетицин (40 мкг/мл, изготовитель Invitrogen Corporation) и 10% фетальной телячьей сыворотки, в присутствии 5% СО2 при 37оС в течение двух недель и получают клоны, устойчивые к генетицину. Получают клетки, устойчиво экспрессирующие человеческий SGLT2, которые проявляют натрийзависимое поглощение метил-a-D-глюкопиранозида (см. следующие разделы о способе измерения поглощения a-D-глюкопиранозида).
(3) Ингибирование поглощения a-D-глюкопиранозида
После удаления среды клеток СНО, устойчиво экспрессирующих человеческий SGLT2, добавляют буферный раствор для предварительной обработки (буферный раствор, рН 7,4, содержащий хлорид холина (140 мМ), хлорид калия (2 мМ), хлорид кальция (1 мМ), хлорид магния (1 мМ), 2-[4-(2-гидроксиэтил)-1-пиперазинил]этансульфоновую кислоту (10 мМ) и трис(гидроксиметил)аминометан (5 мМ)) в количестве 100 мкл на лунку и инкубируют при 37°С в течение 20 минут.
Смешивают 11 мкл метил-a-D-(U-14С)глюкопиранозида (изготовитель Amersham Pharmacia Biotech) с 1000 мкл буферного раствора для поглощения, содержащего испытываемое соединение (буферный раствор, рН 7,4, содержащий хлорид натрия (140 мМ), хлорид калия (2 мМ), хлорид кальция (1 мМ), хлорид магния (1 мМ), метил-a-D-глюкопиранозид (50 мкМ), 2-[4-(2-гидроксиэтил)-1-пиперазинил]этансульфоновую кислоту (10 мМ) и трис(гидроксиметил)аминометан (5 мМ)), и получают буферный раствор для поглощения. Получают буферный раствор для поглощения без испытываемого соединения для контрольной группы. Также получают буферный раствор для базисного поглощения без испытываемого соединения, содержащий хлорид холина (140 мМ) вместо хлорида натрия, для измерения базисного поглощения.
После удаления буферного раствора для предварительной обработки добавляют буферный раствор для поглощения (25 мкл на лунку) и инкубируют при 37°С в течение двух часов. После удаления буферного раствора для поглощения добавляют буферный раствор для промывки (буферный раствор, рН 7,4, содержащий хлорид холина (140 мМ), хлорид калия (2 мМ), хлорид кальция (1 мМ), хлорид магния (1 мМ), метил-a-D-глюкопиранозид (10 мкМ), 2-[4-(2-гидроксиэтил)-1-пиперазинил]этансульфоновую кислоту (10 мМ) и трис(гидроксиметил)аминометан (5 мМ)) (200 мкл на лунку). Смесь сразу же удаляют. Указанную операцию промывки осуществляют еще раз. Добавляют 0,5% раствор лаурилсульфата натрия (25 мкл на лунку) для солюбилизации клеток. К солюбилизированным клеткам добавляют 75 мкл Микросцинта 40 (изготовитель Perkin Elmer, Inc.) и измеряют радиоактивность с использованием микросцинтилляционного счетчика TopCount (изготовитель Perkin Elmer, Inc.). Величину, полученную путем вычитания величины базисного поглощения из величины поглощения контрольной группы, принимают за 100%. Концентрацию для ингибирования на 50% полученной выше величины (величину IC50) вычисляют из кривой зависимости ингибирования от концентрации с использованием метода наименьших квадратов. В результате соединение настоящего изобретения показывает сильное действие ингибитора котранспортера Na+-глюкозы. Величины IC50 типичных соединений настоящего изобретения приводятся в табл.24.
Пример испытаний 2
[Испытание на подтверждение гипогликемической активности]
Используют мышей Fed KK-Ay (CLEA Japan, Inc., самцы). Испытываемое соединение суспендируют в 0,5% растворе метилцеллюлозы до концентрации 3 мг/10 мл. Измеряют массу каждой мыши. Суспензию испытываемого соединения вводят мышам насильственно перорально в дозе 10 мл/кг. Мышам контрольной группы вводят только 0,5% раствор метилцеллюлозы. Каждая группа состоит из шести мышей. Кровь из хвостовой вены берут непосредственно перед введением соединения и через один, два, четыре и восемь часов после введения соединения. Уровень глюкозы в крови измеряют с использованием теста CII Wako на глюкозу (изготовитель Wako Pure Chemical Industries, Ltd.). Интенсивность гипогликемической активности определяют, вычисляя площадь под кривой зависимости концентрации глюкозы в крови от времени (AUC) с использованием трапецеидального метода при концентрации глюкозы в 0-8 часов после введения соединения и вычисляя степень (%) снижения AUC в группе, которой вводили соединение, от AUC в контрольной группе.
В результате соединение настоящего изобретения обнаруживает сильную гипогликемическую активность. Гипогликемическая активность типичных соединений настоящего изобретени приводится в табл.25
Фармацевтическую композицию, содержащую одно или несколько соединений настоящего изобретения и их фармацевтически приемлемые соли, получают в виде таблеток, порошков, мелких гранул, гранул, капсул, пилюль, жидкостей, инъекций, суппозиториев, мазей, пластырей или подобных форм с использованием носителя, наполнителя или других добавок, обычно используемых для фармацевтических препаратов, и вводят перорально или неперорально.
Количество соединения настоящего изобретения, которое вводят клинически в организм человека, определяют соответственно с учетом симптомов, массы, возраста, пола и подобных особенностей пациента, которому вводят соединение, в интервале 0,1-500 мг в сутки в случае перорального введения или в интервале 0, 01-100 мг в сутки в случае неперорального введения один или несколько раз в сутки. Так как вводимое количество изменяется в соответствии с разными условиями, для введения достаточным может оказаться меньшее количество соединения, чем количество, указанное выше.
В качестве твердой композиции для перорального введения соединения настоящего изобретения используют таблетки, порошки, гранулы или подобные формы. В такой твердой композиции одно или несколько активных веществ смешивают с по меньшей мере одним инертным разбавителем, таким как лактоза, маннит, глюкоза, гидроксипропилцеллюлоза, микрокристаллическая целлюлоза, крахмал, поливинилпирролидон или алюмометасиликат магния. Композиция кроме инертного разбавителя может содержать другие добавки, такие как смазывающее вещество, такое как стеарат магния, дезинтегратор, такой как кальцийкарбоксиметилцеллюлоза, и солюбилизатор, такой как глутаминовая кислота и аспарагиновая кислота, какие обычно используют. На таблетку или пилюлю необязательно может быть нанесена пленка глюкозы или вещества, растворимого в желудке или кишечнике, такого как сахароза, желатин, гидроксипропилцеллюлоза или фталат гидроксипропилцеллюлозы.
Жидкая композиция для перорального введения включает в себя фармацевтически приемлемые препараты, такие как эмульсионные препараты, растворы, суспензии, сиропы, эликсиры и подобные препараты, и содержит обычно используемый инертный разбавитель, такой как дистиллированная вода и этиловый спирт. Композиция может содержать кроме разбавителя адъюванты, такие как солюбилизатор, увлажняющее вещество и суспендирующий агент, подслащивающее вещество, корригент, отдушка и консервант.
Инъекция для неперорального введения включает стерилизованный водный или неводный раствор, суспензию и эмульсию. Примерами разбавителей для водного раствора или суспензии являются дистиллированная вода и физиологический раствор для инъекции. Примерами разбавителей для неводного раствора или суспензии являются пропиленгликоль, полиэтиленгликоль и растительные масла, такие как оливковое масло; спирты, такие как этиловый спирт; и Полисольват 80 (торговое наименование). Такая композиция также может содержать добавки, такие как вещество для регулировки изотоничности, консервант, увлажняющее вещество, эмульгатор, диспергатор, стабилизатор (например, лактозу) и солюбилизатор. Такие соединения стерилизуют, например, фильтрацией через фильтр, задерживающий бактерии, добавлением дезинфицирующего агента или облучением. Такие соединения можно использовать, получая стерильную твердую композицию и растворяя композицию в стерилизованной воде или растворе для инъекции перед применением.
Таблица 23

Реферат
Настоящее изобретение относится к азуленовому производному формулы (I) или его соли:

где R1-R4 представляют по отдельности атом водорода, -(низший алкилен)-O-(низший алкил), -С(=O)-(необязательно замещенный низший алкил) или -(необязательно замещенный низший алкилен)-(необязательно замещенный арил), R5-R12 представляют по отдельности атом водорода, необязательно замещенный низший алкил, атом галогена, -ОН, -O-(необязательно замещенный низший алкил), -(необязательно замещенный низший алкилен)-O-(необязательно замещенный низший алкил), O-(необязательно замещенный низший алкилен)-(необязательно замещенный арил), -СООН, или -С(=O)-O-(необязательно замещенный низший алкил), и А представляет связь или необязательно замещенный низший алкилен, где -А- может быть связана с любым положением 1-8 азуленового цикла, и любые две группы из числа R5, R6 и R7 могут образовывать бензольный цикл вместе с соседними атомами углерода, а также изобретение относится к фармацевтической композиции на основе этих соединений, представляющей собой ингибитор котранспортера Na+-глюкозы, и способу лечения диабета, такого как инсулинозависимый диабет (диабет типа 1) и инсулинонезависимый диабет (диабет типа 2). 3 н. и 4 з.п. ф-лы, 25 табл.
Формула



Документы, цитированные в отчёте о поиске
Инозитолгликаны с инсулиноподобным действием, способ их получения, фармацевтическая композиция и способ ее получения































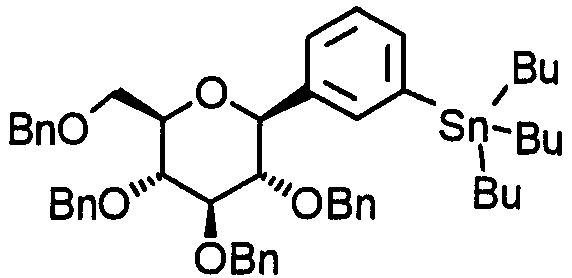



















































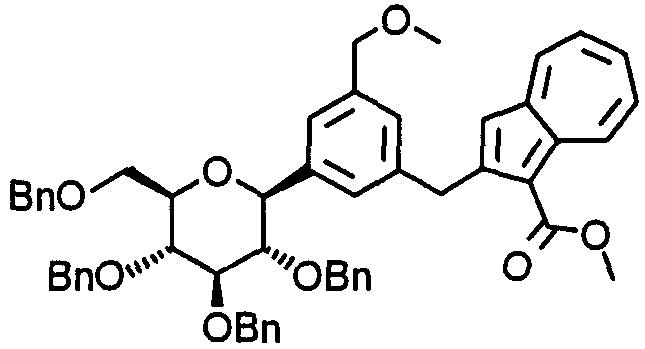










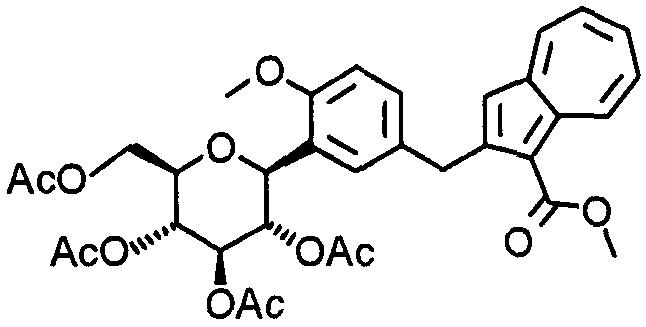











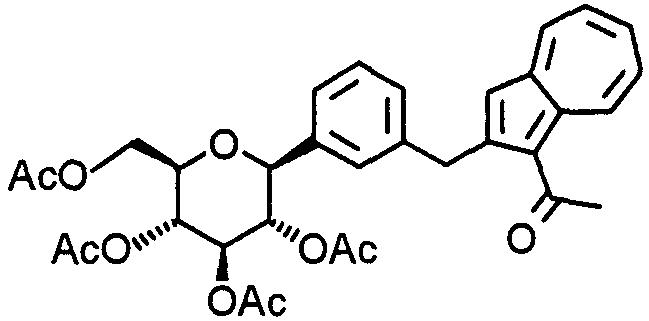


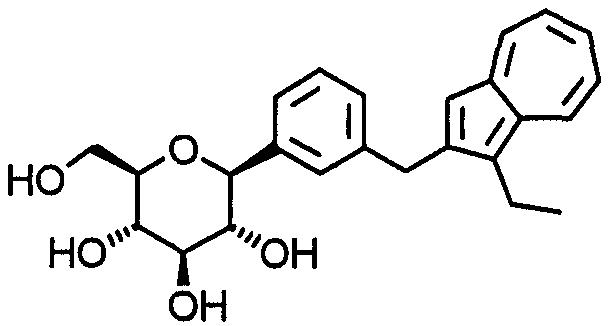
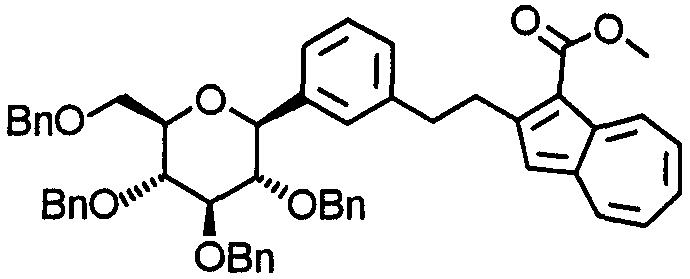



















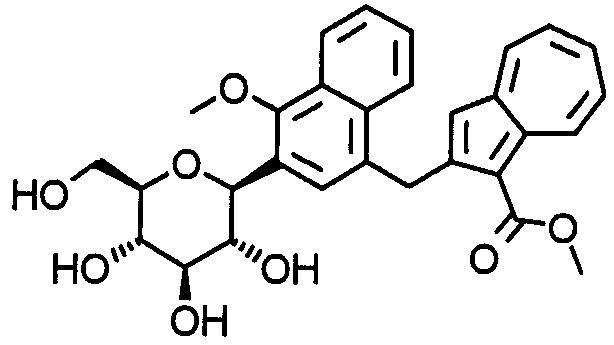

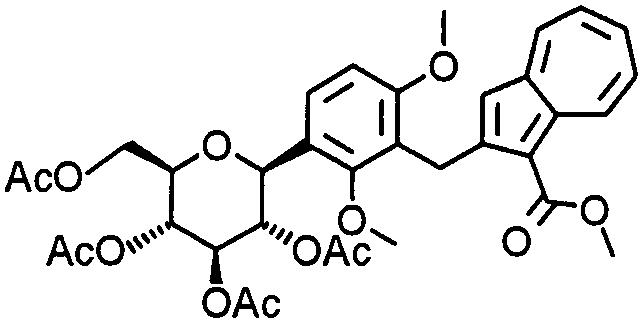












Комментарии