Cry1d для борьбы с хлопковой совкой - RU2685927C2
Код документа: RU2685927C2
Чертежи





















Описание
Перекрестная ссылка
Настоящая заявка испрашивает приоритет предварительной заявки на патент США 61/968,703 от 21 марта 2014. Описание указанной заявки включено в настоящий документ полностью.
Уровень техники
Cry1Da является известным дельта-эндотоксином, продуцируемым некоторыми видами Bacillus thuringiensis, впервые он был описан в патенте US 5,691,308. Позднее в двух независимых рецензированных статьях (Karim et al. (2000) и Frankenhuyzen (2009)) сообщалось, что он неактивен в отношении хлопковой совки (CEW). Поэтому следующие удивительные и неожиданные наблюдения прямо опровергают эти опубликованные результаты и четко показывают, что Cry1Da имеет хорошую инсектицидную активность от гусениц CEW, если растения экспрессируют этот ген.
Сущность изобретения
Настоящее изобретение относится частично к удивительному открытию, что Cry1Da активен против гусениц хлопковой совки (CEW), Helicoverpa zea (Boddie). Биотесты на листьях и рыльцах с использованием трансгенной кукурузы, экспрессирующей полноразмерные, укороченные и химерные варианты Cry1Da, продемонстрировали хорошую инсектицидную защиту от ущерба от гусениц CEW. Кроме того, удивительным было, что защита от гусениц CEW, пожирающих кукурузные рыльца, оказалась лучше у трансгенных растений, экспрессирующих укороченный Cry1Da, чем у промышленных растений, продуцирующих Cry1Fa.
Хлопковая совка (CEW) является насекомым-вредителем, плохо поддающимся сдерживанию белками Bacillus thuringiensis (Bt), и здесь впервые описываются наблюдения, что трансгенная кукуруза, экспрессирующая Cry1Da, обнаруживает биологическую активность для защиты кукурузных рылец от ущерба, вызванного пожиранием этими насекомыми. Взрослые самки CEW типично откладывают свои яйца на рыльцах кукурузы, и только что вылупившиеся гусеницы питаются на кукурузных рыльцах, прежде чем войти в початок. Таким образом, наличие инсектицидной защитной активности, локализованной в тканях рыльцев кукурузы обеспечит значительный защитный эффект от ущерба от пожирания, вызванного этим важным вредителем кукурузы.
Краткое описание чертежей
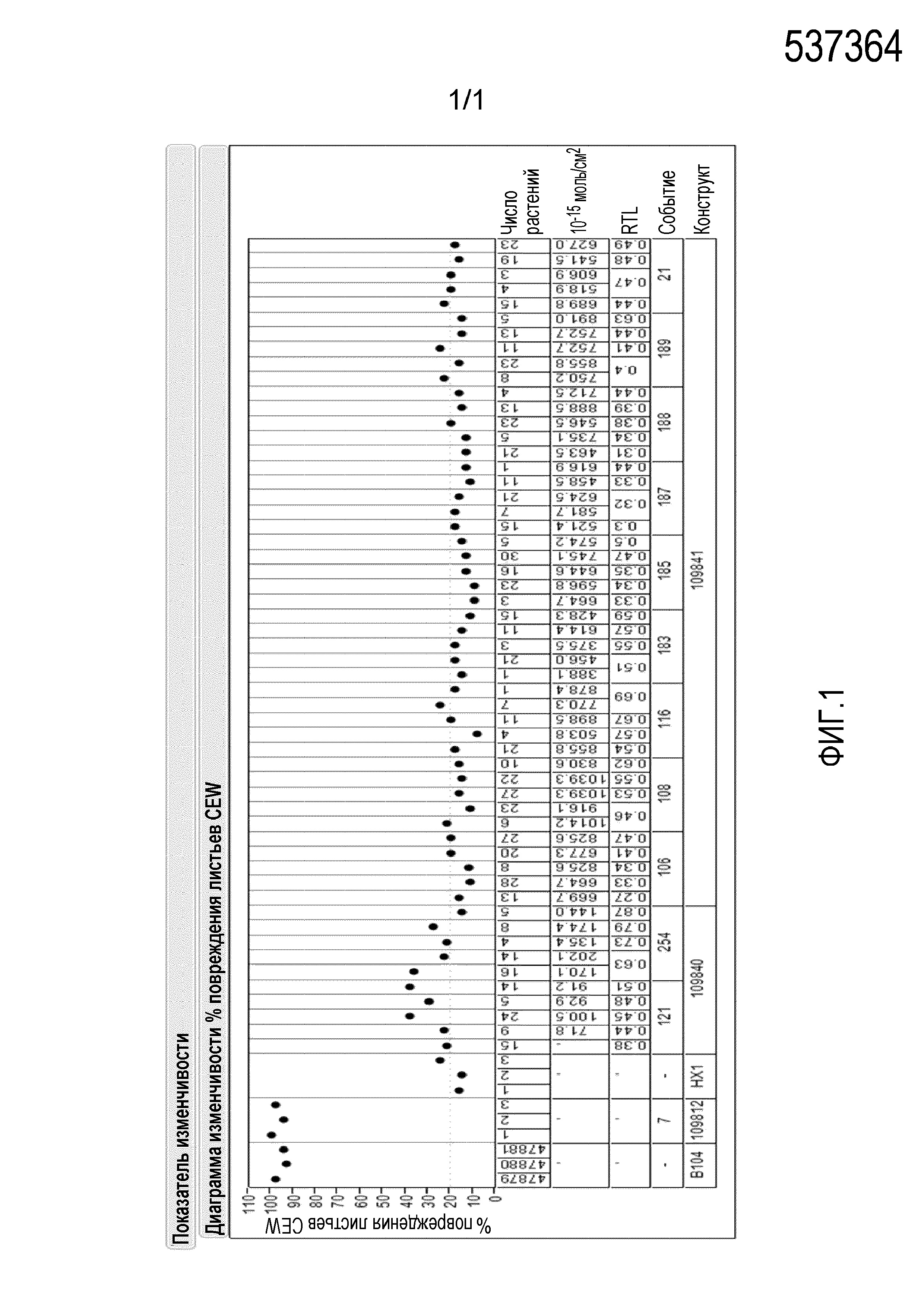
Фигура 1: Процент активности в отношении повреждения зараженных гусеницами CEW листьев нетрансформированной кукурузы (B-104), трансгенной кукурузы, экспрессирующей YFP (109812), кукурузы Herculex1™ (HX1) или трансгенной кукурузы T-1, экспрессирующей полноразмерный Cry1Da (109840) или укороченный Cry1Da (109841).
Краткое описание последовательностей
SEQ ID NO:1 является фрагментом ДНК, содержащим DIG-911 кодирующую последовательность (CDS).
SEQ ID NO:2 является аминокислотной последовательностью для белка DIG-911 (химерный инсектицидный токсин Cry1Da2/Cry1Ab, который состоит из сегмента эндотоксина Cry1Da (аминокислоты 1-594, как описано в GENBANK, номер доступа 176415.1, и в патенте US 5,691,308) и сегмента протоксина, производного от Cry1Ab (DIG-911, аминокислоты 595-1139), по существу такого же, какой описан в GENBANK, номер доступа AFK79795.1).
SEQ ID NO:3 является фрагментом ДНК, имеющим DIG-180 кодирующую последовательность (CDS).
SEQ ID NO:4 является белком DIG-180 (Cry1Fa2).
SEQ ID NO:5 является вектором-вставкой pDAB109825 Gateway® (INVITROGEN), содержащим оптимизированную для кукурузы кодирующую последовательность (SEQ ID NO:5), которая кодирует инсектицидный белковый эндотоксин Cry1Da2 (SEQ ID NO:6).
SEQ ID NO:6 является инсектицидным белковым эндотоксином Cry1Da2.
SEQ ID NO:7 является праймером для AAD-1; смотри таблицу 2.
SEQ ID NO:8 является праймером для AAD-1
SEQ ID NO:9 является зондом для AAD-1.
SEQ ID NO:10 является праймером для гена устойчивости к спектиномицину ген.
SEQ ID NO:11 является праймером для гена устойчивости к спектиномицину
SEQ ID NO:12 является зондом для гена устойчивости к спектиномицину.
SEQ ID NO:13 является праймером для гена инвертазы кукурузы.
SEQ ID NO:14 является праймером для гена инвертазы кукурузы.
SEQ ID NO:15 является зондом для гена инвертазы кукурузы.
Подробное описание
Настоящее изобретение относится частично к удивительному открытию, что Cry1Da активен против гусениц хлопковой совки (CEW), Helicoverpa zea (Boddie). Биопробы, полученные из пищевых биотестов in vitro, показали, что химерный протоксин Cry1Da/Cry1Ab приводит к существенному ингибированию роста и к смертности гусениц CEW. Инсектицидный белок или токсин Cry1Da означает любой инсектицидный белок, содержащий внутренний токсин, определенный в SEQ ID NO:6, или его варианты. Такие варианты имеют по меньшей мере 95%-ную идентичность последовательности с SEQ ID NO:6, предпочтительно 99%-ную идентичность последовательности с SEQ ID NO:6.
Биотесты на листьях и рыльцах с использованием трансгенной кукурузы, экспрессирующей укороченную версию Cry1Da, продемонстрировали хорошую инсектицидную защиту от ущерба от гусениц CEW. Сравнимая защита листьев от пожирания гусеницами совки наблюдалась как на растениях трансгенной кукурузы, экспрессирующих укороченный Cry1Da, так и на промышленном продукте Herculex® I (HX1), экспрессирующем Cry1Fa.
Неожиданно было найдено, что защита от гусениц CEW, поедающих кукурузные рыльца, лучше у трансгенных растений, экспрессирующих укороченный Cry1Da, чем у растений HX1. Насекомые, питающиеся тканями рыльцев трансгенной кукурузы, экспрессирующей укороченный Cry1Da, имели численно более высокую смертность (~25%), чем наблюдалось у насекомых, питающихся тканями рыльцев кукурузы HX1 (<10%).
CEW является насекомым-вредителем, с которым плохо справляется белок Bacillus thuringiensis (Bt), и здесь впервые описываются наблюдения, что трансгенная кукуруза, экспрессирующая Cry1Da, демонстрирует биологическую активность в отношении защиты кукурузных рылец от ущерба, вызванного пожиранием этими насекомымы. Взрослые самки CEW типично откладывают свои яйца на рыльцах кукурузы, и только что отродившиеся гусеницы питаются на кукурузных рыльцах, прежде чем войти в початок. Таким образом, наличие инсектицидной защитной активности, локализованной в тканях рыльцев кукурузы, обеспечит значительный защитный эффект от ущерба от пожирания, вызванного этим важным вредителем кукурузы. Варианты осуществления настоящего изобретения включают в себя применение белков Cry1Da в географических районах, включающих зоны выращивания сои и кукурузы, где присутствие CEW создает проблемы.
Данные, представленные в настоящем документе, демонстрируют, что Cry1Da является лучшим белком для борьбы с CEW посредством тканей рыльцев, чем Herculex 1®. Термин "борьба" и "бороться", как он используется здесь, включает ингибирование роста и/или смертность.
В настоящем документе показано, что химерный протоксин Cry1Da/Cry1Ab обладает инсектицидной активностью от H. zea, согласно пищевым биотестам на насекомых. Когда в трансгенной кукурузе экспрессировалась укороченная форма Cry1Da, она защищала растения от повреждения листьев и рыльцев, вызванного их пожиранием CEW или совкой травяной (FAW), Spodoptera frugiperda. Эти результаты являются удивительными, так как ранее сообщалось, что Cry1Da неактивен против CEW (Karim, 2000), а активен только против FAW (Van Frankenhuyzen, 2009). Инсектицидный белок Cry1Da сам по себе известен, однако, настоящее изобретение является новым и неожиданным применением Cry1Da для предотвращения серьезного ущерба растениям от CEW, особенно хлебным злакам.
Helicoverpa zea имеет многоядную особенность питания гусениц. Они питаются предпочтительно на репродуктивных структурах и богатых азотом растущих тканях, таких, как кукурузные рыльца, початки, стержень и метелка кукурузного початка, коробочки и почки хлопчатника, а также соевые стручки. Это очень серьезный вредитель сельскохозяйственных культур, так как поврежденность растений напрямую влияет на урожайность. Помимо кукурузы, Cry1Da полезен для борьбы с этим видом насекомых в высокотоварных культурах, таких, как хлопок и соя, а также для овощей, как томаты.
Управление устойчивостью насекомых к пестицидам (IRM) описывает методы агротехники, применяющиеся для снижения потенциала насекомых-вредителей становиться устойчивыми к пестицидам. IRM имеет большое значение для использования токсинов Cry в главных сельскохозяйственных культурах, так как устойчивость насекомых создает многочисленные угрозы для применения токсинов Cry в трансгенных культурах. Особые стратегии IRM, такие, как высокая доза и организация структурированных убежищ (рефугий), способны снизить вероятность того, что насекомые выработают устойчивость к определенным токсинам Cry. Эффективные методы IRM могут снизить риск развития устойчивости.
На веб-сайте Управления по охране окружающей среды США (epa.gov/oppbppd1/biopesticides/pips/bt_corn_refuge_2006.htm) опубликованы следующие требования к обеспечению убежищ из растений, не несущих токсина Cry, для применения с трансгенными культурами, продуцирующими единственный токсин Cry, активный против обсуждаемых вредителей:
"Конкретные структурные требования для зерновых, защищенных от зернового точильщика белком Bt (Cry1Ab или Cry1F), следующие:
- Структурированные убежища:
20% убежищ из кукурузы, не имеющей Bt-защиты от чешуекрылых, в кукурузном поясе;
50% убежищ, не имеющих Bt-защиты от чешуекрылых, в хлопковом поясе
- Блоки:
внутренние (т.е., в пределах поля Bt)
внешние (т.е., отдельные поля в пределах полумили (по возможности четверти мили) от поля Bt, чтобы максимально увеличить случайное скрещивание)
- Внутриполевые полосы:
полосы должны иметь ширину по меньшей мере 4 ряда (предпочтительно 6 рядов), чтобы снизить эффекты от перемещения гусениц".
Кроме того, Национальная ассоциация кукурузоводов на своем веб-сайте (ncga.com/insect-resistance-management-fact-sheet-bt-corn) также дает похожие рекомендации относительно требованиям к убежищам. Например:
"Требования к IRM в отношении зернового точильщика:
- засевать по меньшей мере 20% площадей посева кукурузы под гибриды-убежища,
- в зонах выращивания хлопка убежища должны составлять 50%,
- культуры необходимо выращивать в пределах полумили от убежищ-гибридов,
- убежища можно засаживать в виде полос внутри Bt-поля; полосы убежищ должны иметь ширину по меньшей мере 4 ряда,
- убежища разрешается обрабатывать обычными пестицидами, только если достигнуты экономические пороги в отношении целевых насекомых,
- на выращиваемых в убежищах культурах нельзя применять распыляемые инсектициды на основе Bt,
- подходящие убежища следует организовать на каждой ферме с Bt-кукурузой".
Существуют различные пути обеспечения IRM эффектов в убежище, включая различные геометрические рисунки плантаций на полях (как упомянутые выше) и использование фасованных в мешках семенных смесей, как обсуждалось, кроме того, Roush et al. (см. выше) и в патенте US 6,551,962.
Инсектицидные токсины и варианты, активные против насекомых
Помимо конкретно проиллюстрированных генов и белков, осуждаемых здесь, включены также инсектицидно активные варианты. Под термином "вариант" авторы заявки подразумевают фрагменты, определенные делеционные и инсерционные мутанты и некоторые рекомбинантные белки. Белок Cry1Da является классическим трехдоменным Cry-токсином. В качестве предисловия к описанию вариантов инсектицидного токсина Cry1Da, являющихся частью изобретения, будет полезно кратко остановиться на архитектуре трехдоменных токсинов Cry вообще и инсектицидного токсина Cry1Da.
Большинство молекул кристаллического белка дельта-эндотоксина Bacillus thuringiensis состоит из двух функциональных сегментов. Первым сегментом является устойчивый к протеазе внутренний токсин (эндотоксин), который соответствует примерно первой половине молекулы белка. Полная молекула протоксина размером ~130 кДа быстро перерабатывается в резистентный внутренний сегмент протеазами в брюхе насекомого. Сегмент, который удаляется в результате этой обработки, будет называться здесь "сегментом протоксина". По-видимому, сегмент протоксина участвует в образовании кристалла токсина (Arvidson et al., (1989). Таким образом, сегмент протоксина может передать токсину частичную специфичность к насекомому, в результате ограничения доступность центра насекомому, уменьшения обработки протеазой молекулы токсина (Haider et al., (1986) или в результате снижения растворимости токсина (Aronson et al., (1991). Bt-токсины даже в пределах определенного класса могут несколько различаться по длине и точному месту перехода от участка эндотоксина к участку протоксина. Переход от участка эндотоксина к участку протоксина типично имеет место на длине примерно 50-60% от длины полноразмерного токсина.
Трехмерные кристаллические структуры были определены для Cry1Aa1, Cry2Aa1, Cry3Aa1, Cry3Bb1, Cry4Aa, Cry4Ba и Cry8Ea1. Эти структуры для эндотоксинов удивительно похожи и состоят из трех разных доменов (проанализированных Maagd et al., 2003).
Варианты инсектицидного токсина, создаваемые путем удаления, замещениями или добавлениями ограниченного числа аминокислот
Удаления, замещения и добавления аминокислот для иллюстрируемых аминокислотных последовательностей можно легко осуществить последовательно, а эффекты таких изменений на инсектицидную активность можно проверить биотестами. При условии ограниченности числа изменений такое тестирование не влечет проведения чрезмерного количества опытов. Изобретение охватывает инсектицидно активные варианты эндотоксина, в котором было сделано до 10, до 15 или до 20 добавлений, удалений или замещений аминокислот.
Сюда относятся инсектицидно активные варианты Cry1Da, в том числе те, у которых сегмент эндотоксина по меньшей мере на 95%, 96%, 97%, 98%, или 99% идентичен представленной здесь аминокислотной последовательности. Включены также близкие активные белки, имеющие по меньшей мере 90%, 91%, 92%, 93%, или 94% идентичности с показанной последовательностью.
Согласно официальной номенклатуре, номенклатура Cry и Bt основана на границах приблизительно 95% (например, для Cry1Da), 78% (для Cry1D) и 45% (для Cry1) идентичности последовательностей, как указано в "Revision of the Nomenclature for the Bacillus thuringiensis Pesticidal Crystal Proteins," N. Crickmore, D.R. Zeigler, J. Feitelson, E. Schnepf, J. Van Rie, D. Lereclus, J. Baum, D.H. Dean. Microbiology and Molecular Biology Reviews (1998) Vol 62: 807 813.
Варианты могут быть получены путем случайных мутаций, или они могут быть сконструированы. В случае сконструированных мутантов имеется большая вероятность образования вариантов с активностью, близкой к активности нативного токсина, когда идентичность по аминокислотам сохраняется в критических областях токсина, отвечающих за биологическую активность или вовлеченных в определение трехмерной конфигурации, которая в конечном счета ответственная за биологическую активность. Высокая вероятность сохранения активности будет иметься также в случае консервативных замещений. Аминокислоты можно разделить на следующие классы: неполярные, незаряженные полярные, основные и кислотные. Наименее вероятно, что консервативные замещения, при которых аминокислоту одного класса замещают другой аминокислотой этого же типа, существенно изменят биологическую активность варианта. Ниже перечисляются примеры аминокислоты, принадлежащих каждому классу.
В некоторых случаях можно также осуществить неконсервативные замещения. Важно, что эти замещения не должны значительно снижать биологическую активность по сравнению с биологической активностью токсина. Варианты включают в себя полипептиды, которые отличаются аминокислотной последовательностью вследствие мутагенеза. Варианты белков, охватываемые настоящим изобретением, являются биологически активными, то есть они сохраняют желаемую биологическую активность нативного белка, то есть, сохраняют пестицидную активность.
Варианты белков могут быть также сконструированы так, чтобы отличаться на уровне последовательностей, но сохранять ту же или в близкую общую, по существу трехмерную, структуру, поверхностное распределение зарядов и т.д. Смотри, например, патент US 7058515; Larson et al., (2002); Stemmer (1994a, 1994b, 1995); и Crameri et al., (1996a, 1996b, 1997).
Нуклеиновые кислоты
В одном аспекте настоящее изобретение относится к изолированным нуклеиновым кислотам, кодирующим инсектицидные токсины Cry1Da. Сюда включает в себя новое применение нуклеиновых кислот, кодирующих SEQ ID NO:2, SEQ ID NO:4, и SEQ ID NO:6, и их комплементы, а также другие нуклеиновые кислоты, которые кодируют инсектицидно активные варианты. Под "изолированными" авторы заявки понимают, что молекулы нуклеиновой кислоты были удалены из их естественного окружения и были искусственно помещены в другую среду. Из-за избыточности генетического кода описываемые здесь аминокислотные последовательности могут кодироваться множеством разных последовательностей ДНК. Специалист в данной области вполне способен создавать эти альтернативные последовательности ДНК, кодирующие те же или по существу те же токсины.
Кодирующие последовательности согласно настоящему изобретению могут быть функционально связаны с гетерологичным промотором, в том числе промотором, не являющимся Bt. Такие последовательности могут быть включены в экспрессионные конструкты, трансформирующие кассеты и экспрессионные кассеты, включая, например, те, которые могут воспроизводимо присутствовать в геноме растения.
Синтез генов
Гены, кодирующие описываемые здесь улучшенные Cry-белки, могут быть получены разными способами, хорошо известными в данной области. Например, синтезированные генные сегменты и синтезированные гены можно получить с помощью химии сложных триэфирфосфитов и фосфорамидитов (Caruthers et al, 1987), имеются коммерческие производители, предлагающие осуществлять генный синтез по заказу. Полноразмерные гены могут быть собраны большим числом способов, в том числе, например, сшиванием рестрикционных фрагментов или посредством совокупности полимеразных цепных реакций (ПЦР) перекрывающихся олигонуклеотидов (Stewart и Burgin, 2005). Кроме того, делеции терминального гена можно осуществить путем ПЦР-амплификации, используя сайт-специфичные концевые олигонуклеотиды.
Нуклеиновые кислоты, кодирующие инсектицидные токсины Cry1Da, можно сконструировать искусственно, например, способами, практикующимися в настоящее время всеми коммерческим поставщиками (смотри, например, патент US 7482119 B2). Эти гены, или их участки или варианты, также могут быть сконструированы искусственно, например, с применением генного синтезатора и способов генной инженерии, описанных, например, в патенте US 5380831. Альтернативно, вариации синтезированных или натуральных генов можно легко сконструировать, используя стандартные методы молекулярной биологии для получения точечных мутаций. Фрагменты этих генов можно также получить, используя имеющиеся в продаже экзонуклеазы или эндонуклеазы в соответствии со стандартными процедурами. Например, можно использовать ферменты, такие как Bal31, или сайт-специфический мутагенез для систематического отсечения нуклеотидов от концов этих генов. Равным образом, фрагменты генов, которые кодируют активные фрагменты токсина, можно получить, используя разнообразные рестрикционные ферменты.
При заданной аминокислотной последовательности для инсектицидного токсина Cry1Da, кодирующую последовательность можно сконструировать путем обратной трансляции аминокислотной последовательности, используя кодоны, предпочитаемые намеченным хозяином, и затем очищая последовательность с использованием альтернативных кодонов, чтобы удалить последовательности, которые могли бы вызвать проблемы, и дать периодические терминирующие кодоны, чтобы удалить длинные открытые кодирующие последовательности в некодирующих рамках считывания.
Количественная оценка идентичности последовательностей
Чтобы определить процентную долю идентичности двух аминокислотных последовательностей или двух последовательностей нуклеиновых кислот, последовательности выравнивают в целях оптимального сравнения. Процент идентичности двух последовательностей является функцией числа идентичных позиций, разделяемых последовательностями (т.е., процент идентичности=число идентичных позиций/полное число позиций (например, перекрывающиеся позиции) x 100). В одном варианте осуществления обе последовательности имеют одинаковую длину. Процент идентичности между двумя последовательности можно определить, используя методы, близкие описываемым ниже, с разрешением или без разрешения пропусков (гэпов). При расчете процента идентичности обычно подсчитывают точные соответствия.
Определение процента идентичности между двумя последовательностями можно осуществить, используя математический алгоритм. Одним неограничивающим примером такого алгоритма является алгоритм, разработанный Altschul et al. (1990) и Karlin и Altschul (1990) и модифицированный Karlin и Altschul (1993), который введен в программы BLASTN и BLASTX. Поиск с использованием программы BLAST удобно использовать для идентификации последовательностей, гомологичных (близких) запрашиваемой последовательности, в базах данных нуклеиновых кислот или белков. Поиски по BLASTN можно провести (количество баллов=100, длина слова=12) для идентификации нуклеотидных последовательностей, гомологичных молекулам нуклеиновых кислот согласно изобретению. Поиски по BLASTX можно провести (количество баллов=50, длина слова=3) для идентификации аминокислотной последовательности, гомологичной молекулам инсектицидного белка согласно изобретению.
В целях сравнения можно использовать программу Gapped BLAST (Altschul et al., (1997)) для получения выравниваний с учетом пропусков. Альтернативно, можно использовать программу PSI-Blast, чтобы осуществить итерационный перебор, который обнаруживает соотношение расхождений между молекулами (Altschul et al.), (1997). При использовании программ BLAST, Gapped BLAST, и PSI-Blast можно использовать значения параметров по умолчанию соответствующих программ. Смотри www.ncbi.nlm.nih.gov.
Одним неограничивающим примером математического алгоритма, использующегося для сравнения последовательностей, является алгоритм ClustalW (Thompson et al., (1994)). ClustalW сравнивает последовательности и выравнивает всю последовательность аминокислот или ДНК, таким образом, он дает информацию о сохранении всей аминокислотной последовательности или нуклеотидной последовательности. Алгоритм ClustalW используется в нескольких имеющихся в продаже пакетах программ для анализа ДНК/аминокислот, таких, как модуль ALIGNX в пакете программ Vector NTI (Invitrogen, Inc., Carlsbad, CA). При выравнивании аминокислотных последовательностей с помощью ALIGNX удобно использовать стандартные настройки со штрафом за внесение пропуска 10, штрафом за продолжение пропуска 0,1 и с матрицей сравнения blosum63mt2, чтобы оценить процент близости аминокислот (консенсус) или идентичность между двумя последовательностями. При выравнивании последовательностей ДНК с использованием модуля ALIGNX удобно использовать стандартные настройки со штрафом за внесение пропуска 15, штрафом за продолжение пропуска 6,6 и матрицей сравнения swgapdnamt, чтобы оценить процент идентичности между двумя последовательностями.
Другим неограничивающим примером математического алгоритма, используемого для сравнения последовательностей, является алгоритм, разработанный Myers и Miller (1988). Такой алгоритм встроен в программу wSTRETCHER, являющейся частью пакета программ выравнивания последовательностей wEMBOSS (доступна по адресу http://emboss.sourceforge.net/). Программа wSTRETCHER рассчитывает оптимальное глобальное выравнивание двух последовательностей, используя модификацию классического алгоритма динамического программирования, который использует линейное пространство. Подстановочная матрица, штраф за внесение пропуска и штраф за продолжение пропуска, используемые для расчета выравнивания, можно задавать индивидуально. При применении программы wSTRETCHER для сравнения нуклеотидных последовательностей можно использовать штраф за внесение пропуска 16 и штраф за продолжение пропуска 4, а также файл оценочной матрицы EDNAFULL. При сравнении аминокислотных последовательностей можно использовать штраф за внесение пропуска 12 и штраф за продолжение пропуска 2, а также файл оценочной матрицы EBLOSUM62.
Следующим неограничивающим примером математического алгоритма, используемого для сравнения последовательностей, является алгоритм, разработанный Needleman и Wunsch (1970), который встроен в пакет программ для выравнивания последовательностей GAP, версия 10, и в программу wNEEDLE (http://emboss.sourceforge.net/). Пакет GAP, версия 10, можно использовать для определения идентичности или близости последовательностей, используя следующие параметры: для нуклеотидной последовательности процент идентичности и процент близости находят, используя штраф за открытие пропуска 50, штраф за продолжение пропуска 3 и оценочную матрицу nwsgapdna.cmp. Для сравнения аминокислотных последовательностей % идентичности или % близости определяют, используя штраф за открытие пропуска 8, штраф за продолжение пропуска 2 и оценочную матрицу BLOSUM62.
Программа wNEEDLE считывает две входные последовательности, находит оптимальное выравнивание (включая пропуски) по всей их длине и записывает в файл оптимальное глобальное выравнивание последовательностей. Алгоритм анализирует все возможные выравнивания и выбирает наилучшее, используя оценочную матрицу, содержащую значения для всех возможных остатков или соответствий нуклеотидов. wNEEDLE находит выравнивание с максимально возможным число баллов, где число баллов выравнивания равно сумме соответствий, взятых из оценочной матрицы, минус штрафы, возникающие при открытии и продолжении пропусков в выровненных последовательностях. Подстановочная матрица и штрафы за открытие и продолжение пропуска задаются пользователем. При сравнении аминокислотных последовательностей по умолчанию используются штраф за внесение пропуска 10, штраф за продолжение пропуска 0,5 и матрица сравнения EBLOSUM62. При сравнении последовательностей ДНК программой wNEEDLE используют штраф за внесение пропуска 10, штраф за продолжение пропуска 0,5 и матрицу сравнения EDNAFULL.
Можно также использовать эквивалентные программы. Под "эквивалентной программой" понимается любая программа сравнения последовательностей, которая для любых двух анализируемых последовательностей генерирует выравнивание, имеющее такие же соответствия нуклеотидных или аминокислотных остатков и такой же процент идентичности последовательности, как в соответствующих выравниваниях, сгенерированных программами ALIGNX, wNEEDLE или wSTRETCHER. Процент идентичности представляет собой процентную долю идентичных соответствий между двумя последовательностями на указанной выровненной области (включая любые пропуски по длине), а процент близости является процентной долей соответствий между двумя последовательности на указанной выровненной области (включая любые пропуски по длине).
Выравнивание можно также осуществить вручную путем проверки.
Рекомбинантные хозяева
Гены по настоящему изобретению, кодирущие инсектицидный токсин, могут быть введены в самые разные бактерии-хозяева или растения-хозяева. Экспрессия гена инсектицидного токсина приводит, прямо или косвенно, к внутриклеточному продуцированию и сохранению пестицидного белка. С подходящими бактериями-хозяевами, например, Pseudomonas, бактерии можно внести в среду вредителя, где они будут пролиферировать и попадать в организм. Результатом является сдерживание вредителя. Альтернативно, бактерии, приютившие ген инсектицидного токсина, могут быть обработаны в условиях, продлевающих активность токсина и стабилизирующих клетку. Обработанную клетку, которая сохраняет токсичную активность, можно затем внести в среду целевого вредителя. Нерегенерируемые/нетотипотентные растительные клетки от растений по настоящему изобретению (содержащие по меньшей мере один ген токсина Cry), также являются частью настоящего изобретения.
Когда ген Bt-токсина вводят через подходящий вектор в микроб-хозяин и указанного хозяина вносят в среду живым, важно, чтобы использовались определенные микроорганизмы-хозяева. Выбирают микроорганизмы-хозяева, которые известны как занимающие "фитосферу" (филлоплан, филлосфера, ризосфера и/или ризоплан) одной или более представляющих интерес культур. Эти микроорганизмы выбирают так, чтобы они были способны успешно бороться в конкретной среде (зерновые и другие места обитания насекомого) с дикими местными микроорганизмами, обеспечивали стабильное поддержание и экспрессию гена, экспрессирующего полипептидный пестицид, и, желательно, обеспечивали улучшенную защиту пестицида от экологической деградации и инактивации.
Известно большое число микроорганизмов, которые обитают на филлоплане (поверхность листьев растений) и/или ризосфере (почва, окружающая корни растений) самых разных промышленных культур. Эти микроорганизмы включают бактерии, водоросли и грибки. Особый интерес представляют такие микроорганизмы, как бактерии, например, рода Pseudomonas, Erwinia, Serratia, Klebsiella, Xanthomonas, Streptomyces, Rhizobium, Sinorhizobium, Rhodopseudomonas, Methylophilius, Agrobacterium, Acetobacter, Lactobacillus, Arthrobacter, Azotobacter, Leuconostoc и Alcaligenes; грибки, в частности, дрожжевые, например, рода Saccharomyces, Cryptococcus, Kluyveromyces, Sporobolomyces, Rhodotorula и Aureobasidium. Особый интерес представляют такие фитосферные виды бактерий как Pseudomonas syringae, Pseudomonas fluorescens, Serratia marcescens, Acetobacter xylinum, Agrobacterium tumefaciens, Agrobacterium radiobacter, Rhodopseudomonas spheroides, Xanthomonas campestris, Sinorhizobium meliloti (прежде Rhizobium meliloti), Alcaligenes eutrophus и Azotobacter vinelandii; и фитосферные виды дрожжей, такие, как Rhodotorula rubra, R. glutinis, R. marina, R. aurantiaca, Cryptococcus albidus, C. diffluens, C. laurentii, Saccharomyces rosei, S. pretoriensis, S. cerevisiae, Sporobolomyces roseus, S. odorus, Kluyveromyces veronae, и Aureobasidium pollulans. Особый интерес представляют пигментированные микроорганизмы.
Методы борьбы с насекомыми-вредителями
Когда насекомое вступает в контакт с эффективным количеством токсина, доставляемое через экспрессию трансгенного растения, приготовленные белковые смеси, распыляемые белковые смеси, приманку или другую систему доставки, результатом типично является смерть насекомого, или насекомые больше не кормятся на источнике, который делает токсины доступными для насекомых.
Обсуждаемые белковые токсины могут быть "нанесены" или приведены в контакт с целевыми насекомыми различными способами. Например, можно использовать хорошо известные в данной области трансгенные растения (в которых белок продуцирован и присутствует в растении). Экспрессии генов токсинов можно достичь также избирательно в особых тканях растений, таких, как корни, листья и т.д. Это можно осуществить, например, с помощью применения тканеспецифичных промоторов. Другим хорошо известным примером является нанесение распылением. Рассматриваемые белки могут быть надлежащим образом приготовлены в виде препарата, подходящего для желаемого конечного применения, и затем распылены (или нанесены иным способом) на растение и/или вокруг/вблизи защищаемого растения (до обнаружения инвазии, после обнаружения целевых насекомых, до и после и т.п.). Можно также использовать приманку в гранулах, что также известно в данной области.
Трансгенные растения
Рассматриваемые белки можно использовать для защиты практически всех типов растений от повреждений, причиняемых насекомыми-вредителями. Примерами некоторых из таких растений являются кукуруза, подсолнечник, соя, хлопок, канола, рис, сорго, пшеница, ячмень, овощи, декоративные растения, перец (включая жгучие перцы), сахарная свекла, фрукты и травяной покров. Методы трансформации растений хорошо известны в данной области, иллюстративные способы трансформирования описываются в примерах.
Один предпочтительный вариант осуществления настоящего изобретения заключается в трансформации растений генами, кодирующими инсектицидный белок по изобретению или его варианты. Трансформированные растения стойки к атакам целевого насекомого-вредителя благодаря присутствию контролируемых количеств инсектицидного белка по изобретению или его вариантов в клетках трансформированного растения. Вводя генетический материал, который кодирует инсектицидные свойства инсектицидных Bt токсинов в геном растения, поедаемого конкретным насекомым-вредителем, взрослые насекомые или личинки умрут после употребления пищевого растения. Было трансформировано большое число однодольных и двудольных растений. Коммерческий интерес представляют трансгенные сельскохозяйственные культуры, а также фрукты и овощи. Такие культуры включают в себя, без ограничений, кукурузу, рис, сою, канолу, подсолнечник, люцерну, сорго, пшеницу, хлопок, арахис, помидоры, картофель т.п. Существует несколько методов для введения генетического материала в клетки растений и для получения растений, которые стабильно сохраняют и экспрессируют введенный ген. Такие методы включают ускоренное введение генетического материала, нанесенного на микрочастицы, прямо в клетку (патенты US 4945050 и US 5141131). Растения могут быть трансформированы с использованием агробактериальной технологии, смотри, например, патенты US 5177010, US 5104310, Европейские патентные заявки 0131624B1, 120516, 159418B1, 176112, патенты СШа US 5149645, US 5469976, US 5464763, US 4940838, US 4693976, Европейские патентные заявки 116718, 290799, 320500, 604662, 627752, 0267159, 0292435, и патенты US 5231019, US 5463174, US 4762785, US 5004863 и US 5159135. Другие методы трансформации включают технологию WHISKERS™ (смотри US 5302523 и US 5464765). Для трансформации растений использовался также метод электропорации (смотри WO 87/06614, US 5472869, US 5384253, WO 9209696 и WO 9321335). Все эти патенты и публикации, относящиеся в трансформации, введены в настоящий документ ссылкой. Помимо многочисленных технологий трансформации растений, можно варьировать также тип ткани, которая контактирует с чужеродными генами. Такие ткани включают, без ограничений, эмбриогенные ткани, ткани каллуса типа I и II, гипокотиль, меристему и т.д. Почти все растительные ткани можно трансформировать во время дедифференцировки, используя подходящие методы, известные специалисту.
Гены, кодирующие инсектицидные токсины Cry1Da, можно вставить в растительные клетки, используя различные методы, хорошо известные в уровне техники, описанном выше. Например, доступно большое число клонирующих векторов, содержащих маркер, который позволяет осуществить селекцию трансформированных микробных клеток, и систем репликации, функционирующих в Escherichia coli, для получения и модификации чужеродных генов для вставки в высшие растения. Такие манипуляции могут включать, например, введение мутаций, отсечения, присоединения или замещения, какие желательны для намеченного применения. Векторы содержат, например, последовательность pBR322, последовательность pUC, последовательность M13mp, pACYC184 и т.д. Соответственно, последовательность, кодирующая белок Cry или варианты, может быть вставлена в вектор на подходящем сайте рестрикции. Полученная плазмида используется для трансформации E. coli, клетки которой культивируют в подходящей питательной среде, затем собирают и подвергают лизису, чтобы собрать подходящие для работы количества плазмиды. В качестве аналитических методов обычно применяют анализ последовательностей, анализ рестрикционного фрагмента, электрофорез и другие биохимические и биомолекулярные способы анализа. После каждой манипуляции использованную ДНК-последовательность можно отщепить и соединить со следующей последовательностью ДНК. Каждую обработанную последовательность ДНК можно клонировать в одну и ту же или разные плазмиды.
Использование векторов, содержащих T-ДНК, для трансформации растительных клеток, интенсивно исследовалось и достаточно подробно описано в европейской патентной заявке EP 120516; в работах Lee и Gelvin (2008), Fraley et al., (1986), и An et al., (1985), и хорошо зарекомендовало себя на практике.
После того как вставленная ДНК была интегрирована в геном растения, она является относительно стабильной по всех следующих поколениях. Вектор, использовавшийся для трансформации растительной клетки, обычно содержит селектируемый ген-маркер, кодирующий белок, который придает клеткам трансформированного растения стойкость к гербициду или антибиотику, такому, наряду с прочими, как биалафос, канамицин, G418, блеомицин или гидромицин. Используемый самостоятельно селектируемый гель-маркер должен, соответственно, позволять селекцию трансформированных клеток, тогда как рост клеток, которые не содержат ДНК-вставки, подавляется селективным соединением.
Для вставки ДНК в клетку растения-хозяина известно большое число методов. Сюда относятся трансформация с T-ДНК, обеспечиваемая Agrobacterium tumefaciens или Agrobacterium rhizogenes в качестве агента трансформации. Кроме того, можно применять слияние протопластов растений с липосомами, содержащими необходимую ДНК, прямое введение ДНК, трансформацию биолистикой (бомбардировка микрочастицами) или электропорацию, а также другие возможные способы.
В одном предпочтительном варианте осуществления настоящего изобретения растения будут трансформированы генами, у которых частота использования кодона белок-кодирующей области была оптимизирована для растения. Смотри, например, патент US 5380831, введенный в настоящий документ ссылкой. Кроме того, предпочтительно будут использоваться растения, кодирующие укороченный токсин. Укороченный токсин типично кодирует от примерно 55% до примерно 80% полноразмерного токсина. Способы создания синтетических генов Bt для применения в растениях в данной области известны (Stewart 2007).
Независимо от метода трансформации, ген предпочтительно вводят в вектор переноса гена, подходящий для экспрессии генов инсектицидного токсина Bt и вариантов в растительную клетку путем включения в вектор растительного промотора. Помимо растительных промоторов, для экспрессии чужеродных генов можно с эффективностью использовать в растительных клетках промоторы из самых разных источников. Например, можно использовать промоторы бактериального происхождения, такие, как промотор октопин синтазы, промотор нопалин синтазы, промотор маннопин синтазы; промоторы вирусного происхождения, такие, как промоторы 35S и 19S вируса мозаики цветной капусты, и т.д. Растительные промоторы включают, без ограничений, малую субъединицу (ssu) рибулозо-1,6-бисфосфат (RUBP) карбоксилазы, промотор бета-конглицинина, промотор фазеолина, промотор ADH (алкогольдегидрогеназы), хитшоковые промоторы, промотор ADF (фактора деполимеризации актина) и тканеспецифичные промоторы. Промоторы могут также содержать определенные энхансерные элементы последовательностей, которые могут улучшить эффективность транскрипции. Типичные энхансеры включают, без ограничений, ADH1-интрон 1 и ADH1-интрон 6. Можно использовать конститутивные промоторы. Конститутивные промоторы направляют непрерывную экспрессию генов в клетки почти всех типов и почти непрерывно (например, актин, убиквитин, CaMV 35S). Тканеспецифичные промоторы ответственны за экспрессию гена в клетках или тканях особого типа, таких, как листья или семена (например, зеин, олеозин, напин, ACP (ацил-несущий белок)), эти промоторы также можно использовать. Можно также использовать промоторы, которые активны в течение определенной стадии развития растения, а также те, которые активны в определенных тканях и органах растения. Примеры таких промоторов включают, без ограничений, промоторы, специфичные к корням, пыльце, зародышам, к кукурузным рыльцам, хлопковым волокнам, эндосперму семени, флоэме и т.д.
В некоторых случаях может быть желательным использовать индуцируемый промотор. Индуцируемый промотор ответственен за экспрессию генов в ответ на специфический сигнал, такой, как физический стимул (например, гены белка температурного шока (хитшоковые гены)), свет (например, RUBP карбоксилаза), гормон (например, глюкокортикоид), антибиотик (например, тетрациклин), метаболиты и стресс (например, засуха). Можно использовать и другие желательные элементы транскрипции и трансляции, которые действуют в растениях, такие, как нетранслируемая лидерная 5'-концевая последовательность, последовательности, терминирующие транскрипцию РНК, и сигнальные последовательности полиаденилирования. В уровне техники известно множество растений-специфичных векторов переноса гена.
Трансгенные зерновые культуры, отличающиеся признаком устойчивости к насекомым (IR), преобладают среди посевов кукурузы и хлопчатника во всей Северной Америке, и их применение расширяется во всем мире. Коммерческие трансгенные зерновые культуры, сочетающие признак IR и признак переносимости гербицидов (HT), были разработаны несколькими компаниями, производящими семена. Эти культуры имеют комбинации признаков IR, приданных им инсектицидными Bt-белками, и признаков HT, таких, как устойчивость к ингибиторам ацетолактатной синтазы (ALS), таким как сульфонилмочевины, имидазолиноны, тиазолопиримидин, сульфонанилиды и т.д., ингибиторам синтетазы глутамина (GS), такие, как биалафос, глюфосинат и т.д., ингибиторам 4-гидроксифенилпируват диоксигеназы (HPPD), таким, как мезотрион, изоксафлютол и т.д., ингибиторам 5-энолпирувилшикимат-3-фосфат синтазы (EPSPS), как глифосфат и т.д., и ингибиторам ацетил кoэнзим A карбоксилазы (ACCase), таким как галоксифоп, квизалофоп, диклофоп и т.д. Известны и другие примеры, в которых трансгенные белки обеспечивают растениям устойчивость к таким химическим классам гербицидов, как гербициды на основе фенокси-кислот и на основе пиридилоксиацетата ауксина (смотри WO 2007/053482 A2), или гербициды на основе фенокси-кислот и на основе арилоксифеноксипропионатов (смотри WO 2005107437 A2, A3). Способность справляться с несколькими проблемами, вызываемыми вредителями, благодаря признаку IR является важной концепцией совершенствования коммерческого продукта, и преимущества этой концепции усиливаются, если в одном растении сочетаются способность справляться с насекомыми и способность справляться с сорняками. Дальше, повышения ценности можно достичь благодаря сочетанию в одном растении признаков IR, придаваемых инсектицидным белком Bt, например, согласно настоящему изобретению, и одного или нескольких дополнительных признаков HT, какие упоминались выше, плюс один или более дополнительных входных признаков (например, устойчивость к другим насекомым, придаваемая белками, производными от Bt, или другими инсектицидными белками, устойчивость к насекомым, придаваемая такими механизмами, как RNAi и др., устойчивость к болезням, устойчивость к стрессу, улучшенная эффективность использования азота и т.д.), или выходных признаков (например, высокое содержание масел, благоприятный состав масла, улучшение питательных свойств и т.п.). Такие комбинации могут быть получены либо обычной селекцией (селекционный стек) или совместно как новое трансформационное событие, включающее одновременное введение нескольких генов (молекулярный стек). Преимущества включают в себя способность справляться с насекомыми-вредителями и улучшенную борьбу с сорняками в сельскохозяйственных культурах, что обеспечивает вторичную выгоду для производителей и/или потребителей. Таким образом, настоящее изобретение может применяться в комбинации с другими признаками, чтобы обеспечить полный агротехнический набор улучшенных качеств зерновых культур со способностью гибко и экономически эффективно справиться с любым числом агрономических проблем.
Все патенты, патентные заявки, предварительные заявки и публикации, на которые приводятся ссылки или которые цитируются в настоящем документе, введены в него ссылкой в той степени полноты, в какой они не противоречат явно описанным идеям настоящего изобретения.
Если конкретно не указано или не подразумевается иное, использование единственного числа означает здесь "по меньшей мере один".
Ниже приводятся примеры, иллюстрирующие процедуры для осуществления изобретения. Эти примеры не должны рассматриваться как огранивающие. Все процентные данные являются весовыми процентами, а все пропорции в смесях растворителей проведены по объему, если не указано иное. Все температуры приведены в градусах Цельсия.
Пример 1. Конструкции плазмид, кодирующих DIG-911 и DIG-180, и экспрессия в бактериях-хозяевах
Белок DIG-911 (химерный инсектицидный токсин Cry1Da2/Cry1Ab; SEQ ID NO:2) состоит из сегмента эндотоксина Cry1Da (аминокислоты 1-594, как описано в GENBANK, номер доступа 176415.1, и патенте US 5,691,308) и сегмента протоксина, производного от Cry1Ab (DIG-911, аминокислоты 595-1139), по существу такого, какой описан в GENBANK, номер доступа AFK79795.1). Использование сегмента эндотоксина Cry1Da в комбинациях с другими инсектицидными токсинами Cry или Vip было описано ранее в публикации заявок на патент США под номерами 2013/0007923, 2012/0331590, 2012/0331589 и 2012/0317681, но использование инсектицидного белка Cry1Da для борьбы с хлопковой совкой (CEW; Helicoverpa zea (Boddie)) не предполагалось.
Если не указано иное, биомолекулярные и биохимические манипуляции, описываемые в этом и последующих примерах, осуществляли по стандартным методикам, какие описаны, например, в публикациях Sambrook et al., ред. (1989 и более поздние издания, Molecular Cloning: A Laboratory Manual, 2nd ed.; Cold Spring Harbor Laboratory Press, Plainview, N.Y.); Ausubel et al., ред. (1995 и более поздние издания), Current Protocols in Molecular Biology. Greene Publishing and Wiley-Interscience, New York); и Harlow & Lane, ред. (1988 и более поздние издания, Antibodies: A Laboratory Manual. Cold Spring Harbor Laboratories, Cold Spring Harbor, NY). Стандартные способы клонирования применяли для конструкции экспрессионных плазмид Pseudomonas fluorescens (Pf), разработанных для получения белков DIG-911 и DIG-180 (т.е., Cry1Fa2; SEQ ID NO:4). Плазмидные препараты получали, используя набор Nucleospin Plasmid (Macherey-Nagel Inc, Bethlehem, PA) следуя инструкциям поставщика по выделению малокопийных плазмид.
Основная стратегия клонирования включала субклонирование фрагмента ДНК, содержащего кодирующую последовательность DIG-911 или DIG-180 (CDS), в соответствии с SEQ ID NO:1 и SEQ ID NO:3, в pDOW1169 на сайтах рестрикции SpeI или XbaI, и XhoI или SalI, соответственно, в результате чего DIG-911 и DIG-180 CDS были переданы под контроль экспрессии промотору Ptac и терминатору rrnBT1T2 от плазмиды pKK223-3 (PL Pharmacia, Milwaukee, WI). Плазмида pDOW1169 представляет собой среднекопийную плазмиду с точкой начала репликации RSF1010 и геном pyrF (патент US 7,618,799). Фрагменты ДНК, содержащие кодирующую белок область последовательности, могут быть клонированы в pDOW1169 ДНК в сайте рестрикции за рибосомосвязывающим сайтом, присутствующим в последовательности pDOW1169, или, альтернативно, можно ввести отдельный рибосомосвязывающий сайт как последовательность, находящуюся на фрагменте кодирующей области до белок-кодирующей области. ДНК экспрессионной плазмиды pDOW2848 (DIG-911) превращали электропорацией в клетки DC454 (штамм P. fluorescens, близкий к дикому штамму, имеющий мутации ΔpyrF и lsc::lacIQI), а pDAB1817 ДНК (DIG-180) превращали в клетки MB214). Трансформированные клетки оставляли для восстановления в гидролизатной среде SOC-Soy, а затем высевали на чашки в селективные питательные среды (M9 глюкозный агар без урацила или на среду LB, содержащую тетрациклин в подходящих концентрациях; Sambrook et al., см. выше). Детали относительно микробиологических манипуляций с P. fluorescens можно найти в публикации Squires et al. (2004), патентах US 7,985,564, US 7,681,799 и заявке US 2008/0058262, введенных в настоящий документ ссылкой. Рекомбинантные колонии идентифицировали по характеру расщепления рестриктазами плазмидной ДНК в минипрепаратах.
Анализ роста и экспрессии во встряхиваемых колбах.
Получение белков DIG-911 и DIG-180 для характеризации и для биопроб насекомых осуществляли методом выращивания штамма DPf150 (содержащих плазмиду pDOW2848) или штамма Dpf129 (содержащих плазмиду pDAB1817) P. fluorescens во встряхиваемых колбах. Посевные культуры, выращенные в среде M9, дополненной 1% глюкозы и микроэлементами, использовали для инокуляции 50 мл определенной минимальной среды с 5% глицерина (Teknova Cat. # 3D7426, Hollister, CA). Экспрессию генов DIG-911 или DIG-180 через промотор Ptac инициировали добавлением изопропил-β-D-1-тиогалактопиранозида (IPTG) после начальной инкубации в течение 24 часов при 30° с встряхиванием. Культуры отбирали в момент инициирования и в разные моменты времени после инициирования. Плотность клеток измеряли по оптической плотности на 600 нм (OD600). Можно также использовать другие культуральные среды, подходящие для роста Pseudomonas fluorescens, например, какие описаны Huang et al. (2007, Prot).
Фракционирование клеток и SDS-PAGE анализ образцов во встряхиваемой колбе
В каждый момент отбора проб 2 мл аликвоты центрифугировали при 14000g пять минут, и гранулы клеток хранили при -80°C. Для экстракции белка гранулы оттаивали и суспендировали в 0,5 мл фосфатного буфера с pH 7,2. Клетки лизировали путем обработки ультразвуком, применяя ультразвуковой дезинтегратор Branson 250 (Branson Ultrasonics, Danbury CT) и используя микронаконечник диаметром 1/8 дюйма (0,3 см) с постоянным выходом 20 единиц. Использовали два импульса по 45 секунд, а в промежутке между импульсами образец несколько минут охлаждали на льду. После фракционирования лизата центрифугированием в микроцентрифуге в течение 5 минут на 14000 об/мин, супернатант (растворимая фракция) удаляли, а гранулы (нерастворимая фракция) суспендировали в 0,5 мл фосфатного буфера.
Образцы смешивали в отношении 1:3 с 4X буфера для образцов Laemmli, содержащего β-меркаптоэтанол (Sambrook et al., см. выше) и кипятили 5 минут перед нанесением на полиакриламидный гель Novex® 4-20% Tris Glycine SDS (Invitrogen, Carlsbad, CA). Электрофорез проводили в подвижном буфере Tris Glycine Novex® (Invitrogen). Гели окрашивали биологически безопасным красителем кумасси в соответствии с протоколом производителя (Bio-Rad Inc., Hercules, CA).
Приготовление телец включений
Получение телец включений белка Cry (IB) осуществляли на клетках от ферментации P. fluorescens, которые продуцировали нерастворимый инсектицидный белок Bt, как показано методами SDS-PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия) и MALDI-MS (Матрично-активированная лазерная десорбция/ионизация+масс-спектрометрия). Гранулы с ферментированной P. fluorescens оттаивали в водяной бане при 37°C. Клетки повторно суспендировали в 25% (вес/об.) лизирующего буфера (50 мМ Tris, pH 7,5, 200 мМ NaCl, 20 мМ EDTA динатриевая соль (этилендиаминтетрауксусная кислота), 1% Triton X-100 и 5 мМ дитиотреитол (DTT); непосредственно перед использованием добавляли 5 мл/л коктейля ингибиторов бактериальной протеазы (P8465 Sigma-Aldrich, St. Louis, MO). Однородную суспензию получали, используя ручной гомогенизатор на самой низкой установке (Tissue Tearor™, BioSpec Products, Inc., Bartlesville, OK). В суспензию клеток добавляли лизоцим из белка куриных яиц (25 мг, Sigma L7651), помешивая металлической лопаточкой, и суспензию инкубировали при комнатной температуре один час. Суспензию охлаждали на льду в течение 15 минут, затем разрушали ультразвуком, используя ультразвуковой дезинтегратор Branson 250 (две одноминутных сессии при 50%-ной нагрузке, выход 30%). Лизис клеток проверяли на микроскопе. При необходимости добавляли еще 25 мг лизоцима, и инкубирование и обработку ультразвуком повторяли. Если лизис клеток подтверждался в микроскоп, лизат центрифугировали при 11500g в течение 25 минут (4°), чтобы образовать гранулу IB, а супернатант выбрасывали. Гранулы IB повторно суспендировали в 100 мл лизирующего буфера, гомогенизировали ручным миксером и центрифугировали, как описано выше. Гранулы IB повторно промывали вторичной суспензией (в 50 мл лизирующего буфера); гомогенизацию, обработку ультразвуком и центрифугирование повторяли до тех пор, пока супернанант не становился бесцветным, а гранулы IB становились твердыми и принимали грязно-белый оттенок. Для окончательной промывки гранулы IB ресуспендировали в пропущенной через стерилизующий фильтр (0,22 мкм) дистиллированной воде, содержащей 2 мМ EDTA, и центрифугировали.
Солюбилизация телец включений
Шесть мл суспензии телец включений из Pf изолятов DPf150 или Dpf129 (содержащих примерно 30 мг/мл белка DIG-911 или DIG-180) центрифугировали на максимальной установке микроцентрифуги (приблизительно 14000g), чтобы гранулировать включения. Супернатант промежуточного буфера удаляли и заменяли на 25 мл натрийкарбонатного буфера, 100 мМ, pH11, в конической пробирке на 50 мл. Тельца включения ресуспендировали, используя пипетку, и потряхивали, чтобы тщательно перемешать. Пробирку помещали на ночь на медленно качающуюся платформу при 4°С, чтобы экстрагировать целевой белок. Экстракт центрифугировали при 30000g в течение 30 мин при 4°C, и полученный супернатант сгущали в 5 раз, используя центробежное фильтровальное устройство Amicon Ultra-15 из регенерированной целлюлозы (отсечение по молекулярной массе 30000; Millipore). Затем буфер для образца заменяли на 10 мМ буфера CAPS (3-(циклогексамино)1-пропансульфоновая кислота) pH10, используя одноразовые колонки PD-10 (GE Healthcare, Piscataway, NJ).
SDS-PAGE анализ и количественное определение белка в препаратах IB осуществляли, оттаивая 1 мл аликвоты гранул IB и разбавляя в отношении 1:20 дистиллированной водой, пропущенной через стерилизационный фильтр. Затем разбавленный образец кипятили с 4X восстанавливающего буфера (250 мМ Tris, pH 6,8, 40% глицерин (об./об.), 0,4% Бромфенол Синий (вес/об.), 8% SDS (вес/об.) и 8% β-меркаптоэтанол (об./об.)) и помещали на гелевую систему Novex® 4-20% трис-глицина, 12+2 лунки с гелем (Invitrogen), работающую с 1X буфера трис-глицин/SDS (Bio-Rad). Гель-электрофорез проводили в течение примерно 60 мин под напряжением 200В, затем гель окрашивали Кумасси Синим (50% G-250/50% R-250 в 45%-ном метаноле, 10% уксусная кислота), и обесцвечивали смесью 7% уксусной кислоты и 5% метанола в дистиллированной воде. Количественное определение целевых полос осуществляли, сравнивая денситометрические значения для полос образцов бычьего сывороточного альбумина (BSA), подвергавшихся электрофорезу на том же геле, чтобы получить стандартную кривую. Концентрированный экстракт готовили для электрофореза путем разбавления в отношении 1:50 в буфере для образца NuPAGE® LDS (Invitrogen), содержащем 5 мМ дитиотреитола в качестве восстановителя, и грели при 95° в течение 4 минут. Образец помещали в виде дублированных дорожек на 4-12% гель NuPAGE® рядом с пятью BSA-стандартами в диапазоне от 0,2 до 2 мг на дорожку (для получения калибровочной кривой). Прикладывали напряжение 200В, используя подвижный буфер MOPS SDS (Invitrogen), пока краситель-свидетель не достигнет дна геля. Гель окрашивали 0,2% Кумасси Синего G-250 в 45% метанола, 10% уксусной кислоты и обесцвечивали, сначала кратковременно 45% метанола, 10% уксусной кислоты, а затем полностью, с 7% уксусной кислоты, 5% метанола до тех пор, пока фон не обесцветится. После обесцвечивания гель сканировали на приборе Bio-Rad Fluor-S MultiImager. Использовали встроенную в прибор программу Quantity One, версия 4.5.2, для получения объемов окрашенных полос белка за вычетом фона и для получения кривой, калиброванной по BSA, которую использовали для расчета концентрации белка DIG-911 или DIG-180 в маточном растворе.
Пример 2. Активность инсектицидных токсинов DIG-911 и DIG-180, продуцированных в Pseudomonas fluorescens, против гусениц CEW
Приготовление образцов и биотесты
Препараты телец включений в 10 мМ буфера CAPS pH10 разбавляли в том же буфере, чтобы получить дозу 3000, 1000, 333,3, 111,1, 37,0, 12,3 или 4,1 нг/см2 целевого белка Cry1Da. Все биопробы содержали контрольные обработки, состоящие из 10 мМ буфера CAPS pH10 или воды, которые служили фоновым режимом для проверки смертности или ингибирования роста.
Концентрации белка в буфере биотестов оценивали методом гель-электрофореза, используя BSA для получения калибровочной кривой для гель-денситометрии, которую измеряли с помощью системы формирования изображения BioRad (Fluor-S MultiImager с программой Quantity One, версия 4.5.2). Белки в гелевой матрице окрашивали красителем на основе Кумасси Синего и обесцвечивали перед считыванием.
Гусеницы CEW вылуплялись из яиц, полученных из колонии, поддерживаемой коммерческим инсектарием (Benzon Research Inc., Carlisle, PA). Биотесты проводили в 128-луночных пластмассовых планшетах, специально разработанных для биотестов на насекомых (C-D International, Pitman, NJ). Каждая лунка содержала 1,5 мл рацион для многовидовых чешуекрылых (Southland Products, Lake Village, AR). Пипеткой наносили 40 мкл аликвоты образца белка на 1,5 см2 поверхности пищи в каждой лунке (26,7 мкл/см2). Концентрацию пищи рассчитывали как количество (нг) инсектицидного белкового токсина на квадратный сантиметр (см2) площади поверхности лунки. Обработанные планшеты держали в вытяжном шкафу до тех пор, пока жидкость не испарится с поверхности пищи или не будет поглощена внутрь нее.
В пределах 24-48 часов после вылупления отдельные гусеницы подхватывали увлажненной верблюжьей волосяной кисточкой и сажали на обработанную пищу из расчете одна гусеница на лунку. Затем инвазированные лунки закрывали липкими листами прозрачного пластика, имеющими отверстия для возможности газообмена (C-D International). Планшеты для биотестов держали в течение 5 дней в контролируемых внешних условиях (28°С, отн. влажность ок. 60%, 16:8 (свет:темнота)), после чего записывали полное число насекомых, подвергнутых действию каждого образца белка, число живых и мертвых насекомых и вес выживших насекомых. Для каждой обработки рассчитывали процент смертности и процент ингибирования роста. Ингибирование роста (GI) рассчитывали следующим образом:
GI=[1 - (TWIT/TNIT)/(TWIBC/TNIBC)]
где
- TWIT есть суммарный вес насекомых в обработке,
- TNIT есть полное число насекомых в обработке
- TWIBC есть суммарный вес насекомых в фоновом режиме (контрольный буфер), и
- TNIBC есть полное число насекомых в фоновом режиме (контрольный буфер).
Данные по смертности и ингибированию роста анализировали с помощью номинальной логистической регрессии (P<0,05). Параметр GI50 был определен как концентрация инсектицидного белкового токсина в пище, при которой величина GI составляла 50%, а LC50 (50%-на летальная концентрация) записывалась как концентрация в пище инсектицидного белкового токсина, при которой 50% испытуемых насекомых было убито. Статистический анализ (односторонний анализ ANOVA) осуществляли, используя программу JMP® Pro (версия 9.0.3; SAS, Cary, NC). В таблице 1 приведены активности белков DIG-911 и DIG-180, согласно измерениям в пищевых биотестах.
Таблица 1. Активности белков DIG-911 и Cry1Fa в пищевых биотестах в отношении новорожденных гусениц хлопковой совки (CEW)
*CI=доверительный интервал
Данные в таблице 1 подтверждают удивительное открытие, что белок DIG-911, содержащий сегмент эндотоксина Cry1Da, проявляет активность как в отношении смертности, так и в отношении ингибирования роста гусениц хлопковой совки (CEW). Этот результат противоречит результатам, опубликованным другими авторами, что белок Cry1Da неактивен против хлопковой совки (см. Karim et al. (2000) Pesticide Biochemistry and Physiology 67(3):198-216; и Frankenhuyzen (2009), Journal of Invertebrate Pathology. 101:1-16).
Пример 3. Конструирование векторов трансформации растений
Входящие векторы Gateway® (INVITROGEN) конструировали стандартными способами молекулярного клонирования. Входящий вектор pDAB109825 содержит оптимизированную для кукурузы кодирующую последовательность (SEQ ID NO:5), которая кодирует инсектицидный белок-эндотоксин Cry1Da2 (SEQ ID NO:6). Входящий вектор pDAB109840 содержит оптимизированную для кукурузы кодирующую последовательность, которая кодирует полноразмерный инсектицидный белок Cry1Da2. Экспрессия растением кодирующей последовательности эндотоксина Cry1Da2 находится под контролем копии промотора убиквитина-1 кукурузы с ассоциированным интрон-1 (патент US 5,510,474). Фрагмент, содержащий 3'UTR из 5-гена пероксидазы кукурузы 5 (ZmPer5 3'UTR; патент US 6,699,984), использовали для окончания транскрипции Cry1Da2 mRNA. Вектор трансформации/экспрессии (pDAB109841) для агробактериальной трансформации зародышей кукурузы был сконструирован посредством стандартных способов клонирования и реакций рекомбинации Gateway®, использующих описанные выше типичные бинарный вектор назначения (pDAB109805) и входящий вектор pDAB109825. Бинарный вектор назначения pDAB109805 содержит кодирующую область устойчивого к гербицидам белка AAD-1 (патент US 7,838,733, и Wright et al. (2010) Proc. Natl. Acad. Sci. USA 107:20240-20245) под контролем экспрессии копии промотора палочковидного вируса сахарного тростника (SCBV; по существу такой, как описано в патенте US 6,093,569). Синтетическая последовательность 5'UTR, состоящая из последовательностей гена оболочечного белка вируса полосатости кукурузы (MSV) 5'UTR и интрон-6 гена 1-алкогольдегидрогеназы кукурузы (ADH1), находилась между 3'-концом сегмента промотора SCBV и инициирующим кодоном кодирующей области AAD-1. Фрагмент, содержащий 3'UTR из гена липазы кукурузы (смотри выше), использовали для окончания транскрипции AAD-1 mRNA.
Бинарный вектор отрицательного контроля (pDAB101556) содержал область, кодирующую ген-маркер желтого флуоресцентного белка (YFP) (Shagin et al. (2004) Molecular Biology and Evolution 21:841-850) в условиях контроля экспрессии копии промотора убиквитина-1 кукурузы посредством интрон-1 (смотри выше), и фрагмент, содержащий 3'UTR гена пероксидазы-5 кукурузы (ZmPer5 3'UTR; патент US 6,699,984). Кроме того, pDAB101556 содержит кодирующую область устойчивого к гербицидам белка AAD-1 (см. выше) под контролем экспрессии второй копии промотора убиквитина-1 кукурузы посредством интрона-1 (см. выше) и 3'UTR из гена липазы кукурузы (см. выше).
Пример 4. Агробактериальная трансформация кукурузы
Агробактериальную трансформацию применяли для стабильной интеграции кодирующей области эндотоксина Cry1Da2 в геном растения, чтобы таким образом создать трансгенные клетки, ткани и растения кукурузы, которые продуцируют полноразмерный или укороченный инсектицидный белок Cry1Da2. Способы трансформации кукурузы, использующие сверхбинарные и бинарные векторы трансформации, в данной области известны и описаны, например, в международной PCT-публикации WO2010/120452. Трансформированные ткани выбирали за из способность расти на среде, содержащей галоксифоп-Р-метил.
Инициирование агробактериальной культуры
Маточные растворы в глицерине исследуемых векторов поставлялись в штамме-хозяине Agrobacterium tumefasiens DAt13192 (WO 2012/016222A2). Культуры Agrobacterium высеивали штрихом из глицериновых растворов на AB-минимальную среду (Watson, et al., (1975) J. Bacteriology 123:255-264), содержащую подходящие антибиотики, и инкубировали при 20°C в темноте в течение 3 дней. Затем культуры наносили штрихом на пластину среды YEP (г/л: экстракт дрожжей - 10; пептон - 10; NaCl - 5) с антибиотиками и инкубировали при 20°C в темноте в течение 1-3 дней.
В день проведения эксперимента готовили смесь среды для инокуляции и ацетосирингона (Frame et al. (2011) Methods in Molecular Biology 710:327-341) в объеме, подходящем для числа конструктов в эксперименте, и вносили пипеткой в стерильную одноразовую колбу на 250 мл. Среда для инокуляции содержит: 2,2 г/л минеральных солей (MS); модифицированные MS витамины (Frame et al., ibid.) 68,4 г/л сахарозы, 36 г/л глюкозы, 115 мг/л L-пролина и 100 мг/л мио-инозитола; pH=5,4). Ацетосирингон добавляли в колбу, содержащую среду для инокуляции в конечной концентрации 200 мкм, из маточного раствора 1М в 100%-ном диметилсульфоксиде.
Для каждого конструкта 1 прививочную петлю для посева Agrobacterium с пластинки YEP суспендировали в 15 мл смеси среды для инокуляции с ацетосирингоном в стерильной одноразовой центрифужной пробирке на 50 мл, и измеряли оптическую плотность раствора на длине волны 550 нм (OD550), используя спектрофотометр. Затем суспензию разбавляли до OD550 0,3-0,4 дополнительной смесью среды для инокуляции с ацетосирингоном. Затем пробирку с суспензией Agrobacterium располагали горизонтально на шейкере с платформой, установленном на примерно 75 об/мин, при комнатной температуре и встряхивали 1-4 часа перед использованием.
Стерилизация початков и выделение зародышей
Початки Zea mays имбредной линии B104 (Hallauer, et al. (1997) Crop Science 37:1405-1406) выращивали в теплице и собирали через 10-12 дней после опыления. Собранные початки очищали от оберток и стерилизовали на поверхности, погружая в 20%-ный раствор покупного отбеливателя (бактерицидный отбеливатель Ultra Clorox®, 6,15% гипохлорита натрия; с двумя каплями TWEEN 20) на 20 минут, с последующим трехкратным промыванием в стерильной деионизированной воде в вытяжном шкафу с ламинарным потоком. Незрелые зиготные зародыши (длиной 1,8-2,2 мм) асептически вырезали из каждого початка и помещали в одну или несколько центрифужных микропробирок, содержащих 2,0 мл суспензии Agrobacterium, в которую было добавлено 2 мкл 10%-ного ПАВа BREAK-THRU® S233 (Evonik Industries; Эссен, Германия).
Сокультивирование Agrobacterium
После выделения зародыши помещали на 5 минут на качалку с платформой. Затем содержимое пробирки выливали на планшет со средой для сокультивирования, которая содержит 4,33 г/л MS солей, модифицированные MS витамины, 30 г/л сахарозы, 700 мг/л L-пролина, 3,3 мг/л Dicamba в KOH (3,6-дихлор-о-анисовая кислота или 3,6-дихлор-2-метоксибензойная кислота), 100 мг/л мио-инозитола, 100 мг/л ферментативного гидролизата казеина, 15 мг/л AgNO3, 200 мкм ацетосирингона в DMSO и 3 г/л агара (SIGMA-ALDRICH, проверенная культура растительных клеток) при pH 5,8. Жидкую суспензию Agrobacterium удаляли стерильной одноразовой пипеткой без градуировки и планшет для сокультивирования, содержащий зародыши, помещали в глубину полуоткрытого вытяжного шкафа с ламинарным потоком на 30 минут, после чего зародыши с помощью микроскопа ориентировали щитком вверх, используя стерильный пинцет. Планшет возвращали внутрь полуоткрытого вытяжного шкафа с ламинарным потоком еще на 15 мин. Затем планшет закрывали, герметизировали медицинской лентой 3M™ Micropore™, и помещали в инкубатор при 25°C при постоянном освещении интенсивностью около 60 мкЭ/(м2 с).
Отбор каллуса и регенерация трансгенных событий
После периода сокультивирования зародыши переносили в среду покоя, которая состояла из 4,33 г/л MS солей, модифицированных MS витаминов, 30 г/л сахарозы, 700 мг/л L-пролина, 3,3 мг/л Dicamba в KOH, 100 мг/л мио-инозитола, 100 мг/л ферментативного гидролизата казеина, 15 мг/л AgNO3, 0,5 г/л MES (2-(N-морфолино)этансульфоновой кислоты моногидрат; Phytotechnologies labr.; Lenexa, KS), 250 мг/л цефотаксима и 7,0 г/л агара; pH=5,8. На каждый планшет перемещали не более 36 зародышей. Планшеты оборачивали лентой Micropore™ и инкубировали 7-10 дней при 27°C при постоянном освещении интенсивностью примерно 50 мкЭ/(м2·с). Зародыши с каллусом (<18 на планшет) переносили затем на среду отбора I, которая состояла из среды покоя (смотри выше), но содержала всего 6,5 г/л агара с 100 нМ галоксифоп-Р-метила (0,0362 мг/л). Планшеты оборачивали пленкой Micropore™ и инкубировали 7 дней при 27°C при постоянном освещении интенсивностью примерно 50 мкЭ/(м2·с). Затем разросшийся каллус (<12 на планшет) переносили в среду отбора II, которая состояла из среды покоя (см выше), но содержала всего 6,5 г/л агара, с 500 нМ галоксифоп-Р-метила (0,181 мг/л). Планшеты оборачивали пленкой и инкубировали в течение 14 дней при 27°C при постоянном освещении интенсивностью примерно 50 мкЭ/(м2·с).
На этой стадии устойчивый каллус (<9 на планшет) переносили в среду предварительной регенерации. Среда предварительной регенерации содержит 4,33 г/л MS солей, модифицированные MS витамины, 45 г/л сахарозы, 350 мг/л L-пролина, 100 мг/л мио-инотизола, 50 мг/л ферментативного гидролизата казеина, 1,0 мг/л AgNO3, 0,5 г/л MES, 0,5 мг/л нафталинуксусной кислоты в NaOH, 2,5 мг/л абсцизовой кислоты в этаноле; 1 мг/л 6-бензиламинопурина, 250 мг/л цефотаксима, 5,5 г/л агара и 500 нМ галоксифоп-Р-метила (0,181 мг/л), pH=5,8. Пласшеты оборачивали пленкой и инкубировали 7 дней при 27°C при постоянном освещении интенсивностью приблизительно 50 мкЭ/(м2·с). Затем регенерированный каллус (<6 на планшет) переносили в среду регенерации в планшеты Phytatrays™ (Sigma-Aldrich) и инкубировали при 28°C в условиях "16 часов свет+8 часов темноты в сутки, интенсивность освещения примерно 150 мкЭ/(м2·с)" в течение 14 дней или до образования побегов. Среда регенерации содержит 4,33 г/л MS солей, модифицированные MS витамины, 60 г/л сахарозы, 0,50 г/л MES, 125 мг/л цефотаксима, 5,5 г/л агара и 500 нМ галоксифоп-Р-метила (0,181 мг/л), pH=5,8. Затем выделяли небольшие побеги с первичными корнями и без отбора переносили в среду вытягивания (т.е., среда регенерации без галоксифоп-Р-метила и с 30 г/л сахарозы вместо 60 г/л сахарозы) для дальнейшего роста. Укорененную рассаду длиной около 6 см или выше пересаживали в почву и переносили в ростовую камеру для закаливания.
Перенос T0 растений в теплицу и укоренение для анализа и получения семян
Трансформированные растительные ткани, отобранные по их способности расти на среде, содержащей галоксифоп, пересаживали из планшетов Phytatrays™ в горшочки (T.O. Plastics, средний внутренний диаметр 3,5" (9 см)), наполненные средой для выращивания (ProMix BX; Premier Tech Horticulture), накрытой крышками для увлажнения HUMIDOME (Arco Plastics Ltd.), и затем закаливали в теплице (28°C днем/24°C ночью, световой период 16 часов, отн. влажность 50-70%, интенсивность освещения 200 мкЭ/(м2·с)). Когда растения достигали стадии V3-V4, их пересаживали в почвенную смесь Sunshine Custom Blend 160 и растили до цветения в теплице (тип световой экспозиции: фото или ассимиляция; верхний предел света: 1200 PAR; 16-часовой световой день; 27°C днем/24°C ночью). Предположительно мутагенную рассаду анализировали в отношении числа копий трансгена путем количественного ПЦР-анализа в реальном времени, используя праймеры, разработанные для детектирования относительного числа копий трансгенов, и события, имеющие всего одну или две копии интегрированного гена Cry1Da2, пересаживали в горшки объемом 5 галлонов (19 л). Наблюдения проводили периодически, чтобы отследить любые аномальные фенотипы. Растения поколения T1 получали путем самоопыления рыльцев трансгенных растений T0 пыльцой, собранной с растений T0, и последующим выращиванием полученных семян. Семена T1 от события 109841[3]-106 выращивали и отбирали путем опрыскивания растений квизалофопом, оставляя выжившие растения до стадии репродукции, чтобы получить рыльца для биотестов на хлопковую совку и для вестерн-блоттинга.
Растения трансгенной кукурузы получали аналогично путем трансформации бинарным вектором pDAB101556, несущим кассету экспрессии гена желтого флуоресцентного белка.
Пример 5. Молекулярный и биохимический анализ тканей трансгенной кукурузы
Гидролизный зонд qPCR для анализа числа копий
Молекулярный анализ применяли для скрининга простых событий с малым числом копий. Ткань листьев собирали с укоренившихся, предположительно трансгенных, растений перед пересадкой в почву. ДНК экстрагировали посредством набора QIAGEN MagAttract™, используя робот для автоматической экстракции Biosprint96 (QIAGEN) и протоколы, рекомендованные поставщиком. Анализ числа копий интегрированного трансгена проводили, используя анализ с помощью гидролизных зондов, специфических для гена AAD-1. Кроме того, загрязнение непреднамеренной интеграцией плазмидного скелета бинарного вектора детектировали анализом с гидролизными зондами, специфичными для стойкого к спектиномицину (Spec) гену, находящемуся на скелете бинарного вектора. Анализ с гидролизными зондами для инвертазы генов эндогенной кукурузы (GenBank™, номер доступа U16123) был разработан в качестве внутреннего эталона. В таблице 2 приводятся олигонуклеотидные последовательности компонентов анализа с гидролизными зондами (синтезированными Integrated DNA Technologies, Coralville, IA & Applied Biosystems, Foster City,CA). Дуплексные ПЦР-реакции с гидролизными зондами устанавливали, в соответствии с таблицей 3, с примерно 10 нг ДНК, условия опыта представлены в таблице 4.
Таблица 2. Список прямых и обратных нуклеотидных праймеров и флуоресцентных зондов, использованных для определения числа копий трансгенов и относительной экспрессии
*Флуоресцентные метки: FAM=6-карбокси-флуоресцеин амидит; HEX=гексахлорофлуоресцеин; MGB & VIC="Minor Groove Binder (белок, связывающийся с малой бороздой)"; VIC® фирменная флуоресцентная метка от INVITROGEN.
Таблица 3. Смесь гидролизных зондов для ПЦР для анализа числа копий трансгенов ДНК
Таблица 4. Условия в термоциклере для ПЦР-амплификации с гидролизными зондами
Для амплификации готовили смесь мастер-микс зондов LIGHTCYCLER®480 (Roche Applied Science, Indianopolis, IN) в конечной концентрации 1X в 10 мкл объемной мультиплексной реакции, 0,4 мкМ каждого праймера и 0,2 мкм каждого зонда. Флуоресцентный компонент FAM (6-карбокси-флуоросцеин амидит) возбуждали на 465 нм и флуоресценцию измеряли на 510 нм; соответствующие значения для флуоресцентного компонента HEX (гесахлорфлуоресцеин) составляли 533 нм и 580 нм. Уровень флуоресценции, полученный при каждой реакции, анализировали на ПЦР-системе реального времени Roche Lightcycler®480 с соответствии с рекомендациями производителя. Число копий трансгена определяли путем сравнения выдаваемых системой Lightcycler®480 значений целевой ген/контроль для неизвестных образцов со значениями целевой ген/контроль для известных стандартных чисел копий (причем 1-Copy относится к гемизиготным растениям, 2-Copy относится к гомозиготным растениям).
Баллы Cp, т.е., точка, в которой сигнал флуоресценции пересечет фоновый порог, определяли посредством алгоритма подбора точек (программа Lightcycler®, выпуск 1.5), использовали модуль Relative Quant для осуществления анализа ПЦР-данных в реальном времени.
Программа Fit Points Algorithm в системе Lightcycler® выдает график, на котором показана зависимость логарифма входной концентрации матричной ДНК от измеренных значений Cp. Наклон кривой является желательным параметром сравнения; таким образом, за начальный логарифм входящего числа может быть взята любая начальная точка на кривой, с той оговоркой, что произвольные значения концентрации, используемые для входной матричной ДНК, характеризуют фактические последовательное разведение. Например, для 10-кратного последовательного разведения фактические входные концентрации могут быть равны 1000, 100, 10 и т.д., и для этих точек программа LC480 Fit Points Algorithm наносит на график точки 3, 2, 1 и т.д. в качестве логарифмов входных значений. Наилучшее соответствие с этой линией (log(input) vs Cp), полученное с использованием линейной регрессии, используют затем, чтобы оценить наклон (m) из уравнения вида y=mx+b. Имеется обратная зависимость между исходным количеством матричной ДНК и значением Cp, поэтому наклон (m) всегда отрицательный.
Идеальная (т.е., эффективная на 100%) ПЦР-реакция удваивает суммарную концентрацию темплата за каждый цикл. Эффективность ПЦР (Eff) рассчитывают как Eff=10exp(-1/m). Таким образом, для идеально эффективной реакции (эффективность которой определена как равная 2,00) наклон (m) на графике log(input) vs Cp будет составлять -3,3219.
Другими словами, эффективная на 100% ПЦР-реакция определена как: 2,0=10exp(-1/-3,3219). Программа LC480 Fit Points Algorithm выдает значение эффективности, рассчитанное по первой формуле. Так, реакция, эффективная на 99%, имеет значение Eff 1,99, а не 0,99. Чтобы выразить это как процент эффективности, из указанного значения вычитают 1 и умножают на 100. Иначе говоря, %Eff=[(10exp(-1/m)-1)] x 100.
Детектирование продуцируемого растением укороченного белка Cry1Da2
Белки экстрагировали из 200-240 мг рыльцев кукурузы (собранных с неопыленных початков) в 0,6 мл PBST (PBS-буфер, содержащий 0,05% Tween 20). Добавляли стальные шарики диаметром 2 мм, пробирки закрывали и закрепляли в мельнице Geno/Grinder (Certiprep; Metuchen, NJ), после чего трясли 5 мин на 1500 об/мин. Пробирки центрифуговали на 4000 об/мин в течение 7 мин при 4°C, и супернатанты, содержащие растворенные белки, хранили при -80°C до применения.
Суммарные концентрации белка определяли, используя набор для определения белка PIERCE 660 нм (Thermo Scientific; Rockford, IL) и следуя инструкциям поставщика. Иммуноблот-анализы белка проводили с использованием поликлональных антител, полученных от кроликов с применением стандартных процедур (смотри, например, Harlow, E., Lane, D.P. (1988) Antibodies: A Laboratory Manual. Cold Springs Harbor Laboratories, Cold Spring Harbor, NY, и обновленные версии). Готовили образцы и белки отделяли электрофорезом через гели NuPAGE 4-12% Bis-Tris в подвижном буфере MES в соответствии с протоколом, предложенным производителем для денатурирующего электрофореза (Invitrogen). Белки переносили на нитроцеллюлозную мембрану на 80 мин при напряжении 30В в трансфер-буфере NUPAGE. Блоты блокировали на 1 час при комнатной температуре в смеси 5% молоко/PBST (PBS с 0,05% Tween-20), после чего зондировали первичным антителом (специфичным для эндотоксина-белка Cry1Da) и затем вторичными антителами в течение одного часа каждый при комнатной температуре в блокирующем растворе, с промежуточной промывкой между каждым антителом в течение 15 минут в PBST. Блоты проявляли, используя блоттинг-субстрат ECL Western blotting от PIERCE в соответствии с протоколом производителя (Thermo Fisher Scientific, Rockford, IL). Присутствие укороченных белков Cry1Da было подтверждено в экстрактах из двойной выборки тканей рыльцев растений кукурузы, генерированных из события 109841[3]-106 (растения 109841[3]-106.AJ001.008, 109841[3]-106.AJ001.013, 109841[3]-106.AJ001.020, 109841[3]-106.AJ001.027 и 109841[3]-106.AJ001.028). Типично детектировали две полосы, одна с подвижностью, соответствующей примерно 65 кДа, что соответствует размеру молекулы белка Cry1Da2, кодированного конструктом pDAB109841, а вторая полоса имела подвижность, соответствующую несколько меньшим белкам, чем 65 кДа. Эти более мелкие белки могут соответствовать продуктам, остающимся после отщепления аминокислот 1-28 от N-конца белкового эндотоксина Cry1Da (Часто детектируется процессинг нескольких N-терминальных аминокислот от белков Cry1). Такие полосы не были видны в экстрактах рыльцев от нетрансгенных растений B104.
Таблица 5. Анализ T1 растений на относительный уровень транскриптов РНК (RTL) и экспрессию белка
*Измерения проводились посредством вестерн-блоттинга, результаты оценивали количественно методом ЖХ/МС/МС, известным в данной области.
Пример 6. Биопробы тканей трансгенной кукурузы
Биопробы листьев T1-кукурузы со стадии V5
Планшеты для биоанализа (32-лунки на планшет, C-D International) частично заполняли 2%-ным раствором агара, и агару давали застыть. Из каждого растения отбирали две части листа (площадью примерно один квадратный дюйм) и помещали каждый в отдельную лунку 32-луночного планшета. В каждую лунку помещали 10 новорожденных гусениц Helicoverpa zea (CEW) (примерно через 24-48 ч после вылупления). Планшеты закрывали перфорированными липкими крышками, чтобы позволить вентиляцию во время теста, и помещали в условия: 28°C, отн. влажность 40%, 16 часов свет/8 часов темнота. Через три дня для каждого куска листа определяли простой процентный показатель площади повреждения листа. Оценки повреждений усредняли для каждого теста.
Биотесты на повреждение рыльцев хлопковой совкой
Собирали неопыленные початки, измеряли их длину и початки хранили при 4°C до использования для биотестов. Около 10 мл 2%-ного агара в воде помещали на дно каждой лунки (площадью около 1 кв.дюйма) 32-луночного планшета для биотестов, чтобы подавать влагу к рыльцам и гусеницам хлопковой совки. Пять пучков рыльцев (длиной примерно 10 см) скармливали двум новорожденным совкам в каждой лунке. Каждое событие тестировали в четырех повторах (лунках) в полностью рандомизированном формате. После заражения насекомым планшеты закрывали перфорированной липкой крышкой, позволяющей вентиляцию во время теста. Планшеты помещали в условия 28°C, отн. влажность 60%, 16 часов свет/8 часов темнота. Через 3 дня после заражения регистрировали процент повреждения рыльцев путем визуальной оценки количества экскрементов на тканях рыльцев. Записывали число живых, мертвых и пропавших насекомых на событие и рассчитывали процент смертности гусениц.
Активность продуцируемого растением Cry1Da в отношении гусениц CEW
Иммуно-блоттинг обнаружил белковый эндотоксин Cry1Da в рыльцах початков T1 трансгенных растений pDAB109841, при этом рыльца обеспечивали отличную защиту от повреждений в результате поедания гусеницами H. zea, имея всего 4,6% повреждения рыльцев в биотестах (таблица 6). Рыльца из отрицательного контроля (растения трансгенной кукурузы) продуцировали неинсектицидный желтый флуоресцентный белок (YFP; конструкт pDAB101556), а нетрансгенные B104 растения обнаружили среднее повреждение рыльцев гусеницами H. zea на уровне 90-95%. Кроме того, смертность гусениц, кормившихся на рыльцах от растений, продуцирующих белковый эндотоксин Cry1Da, составила 26,8%, тогда как на образцах растений отрицательного контроля никакой смертности гусениц не наблюдалось. Конструкт Cry1Da дал отличную защиту листьев образцов стадии V5, причем трансгенные растения pDAB109851 имели от 12% до 25% листьев, поврежденных H. zea (таблица 6), тогда как растения отрицательного контроля (B104 и продуцирующие YFP) обнаружили почти 100%-ное повреждение листьев. Результаты биотестов как на рыльцах, так и на листьях продемонстрировали, что белковый эндотоксин Cry1Da является очень эффективным в отношении защиты кукурузных растений от повреждения гусеницами H. zea.
Таблица 6. Результаты биотестов с новорожденными гусеницами H.zea на образцах, взятых от растений, продуцирующих эндотоксин Cry1Da, в сравнении с растениями отрицательного контроля. Средние в столбцах были разделены посредством HSD-теста Тьюки-Крамера.
* Среднее по 4 параллельным опытам
** NA=не применимо
*** Уровни, не соединенные одинаковой буквой в столбце, значительно различаются.
Таблица 7 показывает процент смертности, процент повреждения листьев и процент повреждения рыльцев насекомым H. zea. Степень повреждения листьев оценивали визуально по количеству экскрементов насекомых на тканях. Процентную долю поврежденных листьев оценивали визуально по кормовой площади личинок на 1 квадратный дюйм кусочка листа. Кукуруза разновидности B104 и конструкт 101556 (или конструкт 109812 для определения повреждения листьев), использовавшиеся в качестве отрицательного контроля, были получены из гибридного культурного сорта растения и контрольного желтого флуоресцентного белка (YFP), соответственно, а HX1 обозначает коммерческий гибрид Herculex® I, экспрессирующий белок Cry1Fa. Конструкт 109841 представлял собой T1-кукурузу, экспрессирующую укороченную версию Cry1Da. Данные анализировали посредством ANOVA и методом разделения средних Тьюки-Крамера.
Таблица 7. Процент смертности, процент повреждения листьев и процент повреждения рыльцев насекомым H. zea
*SEM=среднеквадратичное отклонение. Буквы в скобках означают статистические уровни. Уровни, не соединенные одинаковой буквой, значительно различаются (P<0,05).
**Конструкт 109812 использовался как отрицательный контроль YFP для биотестов на повреждение листьев.
Пример 7. Эффективность белкового эндотоксина Cry1Da против CEW в полевых условиях
Семена от восьми T1 pDAB109841 трансгенных событий B104 были испытаны в полевых условиях на опытных делянках полевой станции Dow AgroSciences, Фаулер, Индиана. Эти события были проанализированы молекулярными методами, какие описаны выше, и было найдено, что они представляли собой однокопийные события, не имеющие детектируемых последовательностей скелета бинарного вектора. Все события тестировали как разделение T1 растений 1:1 (гемизиготный:нуль) для события интеграции Cry1Da/AAD1. Отрицательными контролями были нетрансгенные растения B104 (нуль).
Опытные делянки имели один ряд длиной 20 футов (6,1 м) на каждый тестируемый вид насекомых. Обработки высаживали в виде рандомизированного полноблочного плана с 4 повторениями. Экспериментальные точки входа обрабатывали на стадии развития V2 гербицидом Assure® II (DuPont™ Crop Protection, Wilmington, DE) на уровне 184 г кислотных эквивалентов на гектар (ae/ha)+1% COC, чтобы удалить нулевые растения. Assure® II содержит активный ингредиент (ai) хизалофоп-Р-этил (этил(R)-2-4-[4-6-хлорохиноксалин-2-ил-окси)-фенокси]пропионат). Коммерческий продукт содержит 0,88 ф активного ингредиента на галлон (105,4 г/л) и 1,0 об.% концентрата растительного масла (COC). COC представляет собой эмульгирующееся очищенное парафиновое масло, содержащее около 85% парафинового масла и около 15% эмульгаторов. Подсчеты густоты стояния производили через 2 недели после обработки. Для определения ущерба от насекомых оценивали пять растений на делянку.
Яйца хлопковой совки (CEW; Helicoverpa zea Boddie) поставлялись фирмой Benzon Research. Для оценки эффективности против CEW каждое растение получало 5 гусениц CEW во второй возрастной стадии на рыльце початка (21 августа 2012) во время цветения (основная стадия роста #6). Четвертого сентября 2012 початки были исследованы на наличие живых личинок и повреждение от поедания, определенное в соответствии с критериями, перечисленными в таблице 8.
Таблица 8. Критерии оценки ущерба от хлопковой совки
Для оценки уровня белка Cry1Da в листьях для каждого события использовали количественный иммуносорбентный ферментный анализ (ELISA) с применением стандартных протоколов. Тесты ELISA проводили, применяя многократное разбавление экстрактов растений и используя по существу те же реагенты и инструкции, какие предусмотрены поставщиками наборов ELISA. Использовали описанные выше антитела к Cry1Da.
Таблица 9. Результаты аналитических тестов и пищевых тестов на насекомых на растениях, выращенных в поле. Средние значения были разделены посредством HSD теста Тьюки-Крамера.
* Уровни, не соединенные одинаковой буквой, существенно различаются
** N/A=не применимо
Имелся широкий диапазон уровней накопления Cry1Da, от 67 нг/см2 до 135 нг/см2. Все протестированные события pDAB109841 дали статистически близкий уровень защиты от CEW, как для уровня потребления зерен, так и уровня поражения початка, независимо от уровня продуцирования Cry1Da.
Ссылки
Frankenhuyzen, K. 2009. Minireview: Insecticidal activity of Bacillus thuringiensis crystal proteins. Journal of Invertebrate Pathology. 101:1-16.
Karim S., Ridzuddin, S., Gould, F., Dean, D.H. 2000. Determination of Receptor Binding Properties of Bacillus thuringiensis δ-Endotoxins to Cotton Bollworm (Helicoverpa zea) and Pink Bollworm (Pectinophora gossypiella) Midgut Brush Border Membrane Vesicles. Pesticide Biochemistry and Physiology 67(3):198-216.
Höfte, H., P. Soetaert, S. Jansens, and M. Peferoen. 1990. Nucleotide sequence and deduced amino acid sequence of a new Lepidoptera-specific crystal protein gene from Bacillus thuringiensis. Nucl. Acids Res. 18:5545.
Payne, J., A.J. Sick. 1997. US Patent No. 5,691,308.
Реферат
Изобретение относится к области биохимии, в частности к способу борьбы с повреждением растений хлопковой совкой, а также к способу борьбы с насекомым хлопковая совка, предусматривающим предоставление инсектицидного белка Cry1Da указанной хлопковой совке. Также раскрыта совокупность растений для борьбы с хлопковой совкой в поле, содержащая растения, не содержащие белок Bacillus thuringiensis, в указанном поле и растения, экспрессирующие инсектицидный белок Cry1Da, а также смесь семян для борьбы с хлопковой совкой, содержащая семена, полученные от растений, не содержащих белок Bacillus thuringiensis, и совокупность семян, способных экспрессировать инсектицидный белок Cry1Da. Изобретение позволяет эффективно предотвращать повреждение растений хлопковой совкой. 6 н. и 4 з.п. ф-лы, 1 ил., 9 табл., 7 пр.
Формула
Документы, цитированные в отчёте о поиске
Способы трансформации растений для экспрессии дельта-эндотоксинов bacillus thuringiensis

Комментарии