Способ - RU2621681C2
Код документа: RU2621681C2
Описание
Настоящее изобретение относится к способу получения соединений железа с гидроксипиронами и к соединениям и композициям, которые можно получать этим способом.
Патенты США 6,339,080 и 6,635,631 описывают образование комплексов трехвалентного железа и 3-гидрокси-4-пиронов, в которых карбоновая кислота используется в качестве противоиона.
ЕР 0159194 раскрывает нейтральные (т.е. с уравновешенным зарядом) комплексы трехвалентного железа, содержащие конкретные комбинации лигандов, выбранных из 3-гидроксипиронов, 3-гидроксипиридонов и конкретных монокарбоновых кислот. Для получения нейтральных (т.е. с уравновешенным зарядом) комплексов трехвалентного железа ЕР 0159194 описывает взаимодействие этанольного раствора хлорида трехвалентного железа с раствором гидроксипиронового лиганда в хлороформе с последующим регулированием pH твердым карбонатом натрия.
Патенты GB 2128998 и 2157563 и ЕР 0107458 описывают способ получения нейтральных (т.е. с уравновешенным зарядом) комплексов железа (III) с мальтолом, способ включает смешивание мальтола в хлороформе с 1М раствором хлорида трехвалентного железа в этаноле для получения в смеси молярного соотношения мальтол:железо 3:1. Через 5 минут при 20°С к раствору добавляют 10-молярный избыток твердого карбоната натрия и смесь перемешивают в течение 10 минут. Затем смесь фильтруют и растворитель испаряют, получая нейтральный комплекс, содержащий мальтол и катион трехвалентного железа в соотношении 3:1. Перекристаллизация этого 3:1 комплекса из этанола дает чистый нейтральный комплекс трехвалентного железа.
Патент GB 2136806 описывает получение комплекса железа и гидроксипиридона с использованием лиофильной сушки и органических растворителей.
WO 03/097627 описывает способ получения соединения железа с гидроксипироном при взаимодействии соли трехвалентного железа карбоновой кислоты и гидроксипирона в водном растворе при pH больше 7.
Нурчи (Nurchi) с соавт. (Journal of Inorganic Biochemistry, 104, 2010, 560-569) описывает синтез хелата трехвалентного железа и койевой кислоты (1:3), который очень хорошо растворим в растворе и поэтому не осаждается.
Баттерман (Batterman) с соавт. (American Journal of the Medical Sciences, 1947, 214(3), 268-271) раскрывает применение коллоидного гидроксида железа для лечения гипохромной анемии.
Хикмат (Hikmat) с соавт. (Blood (ASH Annual Meeting Abstracts) 2004 104: Abstract 3681) описывает применение сахарата гидроксида трехвалентного железа для терапии железодефицитной анемии.
Герард (Gerard) с соавт. (J. Chem. Research (S), 1980, page 314) описывает комплексы железа (III) с мальтолом (3-гидрокси-2-метил-4-пироном), в том числе гидроксо-комплексы, в кислой среде.
Хлорид трехвалентного железа используют в качестве исходного вещества для синтеза три(мальтол)железа (см. Y Kidani, R Salto and Hisashi Koike 1970 Annual report of College of Pharmacy 1970).
Хлорид трехвалентного железа представляет собой перспективное исходное вещество, так как он является дешевым, стабильным и легко доступным. Однако попытки усовершенствовать синтез три(мальтол)железа затрудняются тем, что хлорид трехвалентного железа имеет максимальную растворимость при кислых значениях pH, тогда как мальтол имеет максимальную растворимость при щелочных значениях pH.
В публикации [S A Mukha et al., Chemistry of Sustainable Development 15, (2007) 448-458] описано применение органических растворителей для решения основной проблемы несовместимости хлорида трехвалентного железа и мальтола в водной среде.
Указанный способ, использующий органические растворители, при применении в промышленных масштабах рассматривался бы контролирующими органами как неблагоприятный. Кроме того, этот способ был бы чрезвычайно дорогим, использующим процедуры выпаривания, и потребовалась бы система мер для получения воспроизводимых партий продукта, который можно было бы производить в соответствии со стандартами GMP (Good Manufacturing Process).
Вышеуказанные способы для получения нейтральных комплексов гидроксипирона с трехвалентным железом имеют несколько недостатков. Первый из них состоит в том, что способ требует применения органических растворителей. Органические растворители являются дорогими, токсичными и горючими веществами. Кроме того, органические остатки, получаемые в результате осуществления способа, приходится утилизировать, что требует дополнительных расходов и мер безопасности.
Сохраняется потребность в новых дополнительных способах получения соединений железа с гидроксипиронами, например, соединений железа с гидроксипиронами, имеющими фармацевтическую чистоту, в способах, которые решают или сокращают некоторые или все вышеупомянутые проблемы, связанные с известными способами для получения нейтральных (т.е. с уравновешенным зарядом) комплексов трехвалентного железа с гидроксипироном. В частности, существует потребность в том, чтобы отказаться от применения органических растворителей в способе и/или исключить существовавшие ранее примеси и/или увеличить выход соединения трехвалентного железа и гидроксипирона и/или уменьшить общее количество растворителя, необходимого для реакции.
Первый объект изобретения относится к способу получения соединения железа с гидроксипироном, включающему взаимодействие гидроксипирона с некарбоксилатной солью железа в водном растворе и осаждение соединения железа с гидроксипироном из водного раствора и/или, преимущественно необязательно, водный раствор имеет pH больше 7, предпочтительно, конечный pH составляет больше 7.
Второй объект изобретения относится к способу получения соединения железа с гидроксипироном, включающему взаимодействие гидроксипирона с некарбоксилатной солью железа в водном растворе с pH больше 7 и осаждение гидроксипиронжелеза из водного раствора, причем, необязательно, способ не включает применение органического растворителя и/или раствор не содержит буфера.
Третий объект изобретения относится к способу получения соединения железа с гидроксипироном, включающему взаимодействие гидроксипирона в водном щелочном растворе с некарбоксилатной солью железа, или смесью гидроксипирона и некарбоксилатной соли железа, где соль или смесь добавляют к водному щелочному раствору, и необязательно осаждение гидроксипиронжелеза из водного щелочного раствора.
Четвертый объект изобретения относится к способу получения соединения железа с гидроксипироном, включающему взаимодействие водного раствора гидроксипирона при температуре от более 40°С до 100°C с некарбоксилатной солью железа и необязательно добавление дополнительного количества гидроксипирона и/или, необязательно, осаждение гидроксипиронжелеза из водного раствора.
Пятый объект изобретения относится к способу получения соединения железа с гидроксипироном, включающему взаимодействие водного раствора гидроксипирона, имеющего температуру в интервале от более 40°С до 100°C с некарбоксилатной солью железа, необязательно охлаждение, и взаимодействие раствора с водным щелочным раствором, содержащим гидроксипирон, и, необязательно, осаждение гидроксипиронжелеза из водного щелочного раствора.
Еще один объект изобретения относится к способу получения соединения железа с гидроксипироном, включающему взаимодействие гидроксипирона в водном щелочном растворе с некарбоксилатной солью железа и осаждение соединения железа с гидроксипироном из водного раствора, имеющего уровень pH больше 7, или ниже 7 или равный 7, такой, как указано здесь. Возможно при pH ниже 7 или равном 7, таком, как указано здесь, раствор не содержит буфера, такого, как указано здесь и/или молярное соотношение гидроксипирона и используемой соли железа больше, чем 3:1, такое, например, как 3,1:1; 3,5:1; 4:1 или больше.
Шестой объект изобретения относится к фармацевтической композиции, содержащей соединение железа с гидроксипироном и гидроксид железа. Эта фармацевтическая композиция, как правило, пригодна для введения субъекту, такому как млекопитающее, например, такому как человек. Путь введения обычно пероральный.
Настоящее изобретение относится к способам, в которых соединение железа с гидроксипироном, такое как три(мальтол)железо, можно осаждать из водного раствора или водного щелочного раствора. Кроме того, некарбоксилатное соединение железа в качестве исходного вещества может давать натриевую или калиевую соль, обладающую высокой растворимостью, что позволяет легко удалять их из конечного продукта в водной среде. Натриевая или калиевая соль может к тому же быть нетоксичной, например, хлорид.
Способ по изобретению может не допустить образования черных отложений и смол, состоящих из полимеров хлорид трехвалентного железа / гидроксид трехвалентного железа, а. также не окрашенных в красный цвет осадков и смешанных гидрокси и хлоридов железа, таких, например, как Fe(OH)2 (Мальтол) и Fe(ОН) (Мальтол)2.
В одном варианте осуществления изобретение относится к способу получения соединения железа с гидроксипироном, в котором гидроксид железа, такой как гидроксид трехвалентного железа, содержится в количестве меньшем или равном около 10 мас.%, считая на массу соединения железа с гидроксипироном, таком как количество, меньшее или равное около 5 мас.%, например, около 2 мас.%.
В одном варианте осуществления изобретения, соединение железа с гидроксипироном представляет собой фармацевтически чистое соединение. Например, соединение железа с гидроксипироном может иметь чистоту, которая больше или равна около 95, 96, 97, 98, 99 или 99,5%. Предпочтительно, когда соединение железа с гидроксипироном, осажденное или осажденное и выделенное, и необязательно высушенное имеет чистоту больше или равную около 95, 96, 97, 98, 99 или 99,5%, предпочтительно без дополнительной очистки.
Термин «осаждение», используемый здесь, включает активную стадию инициирования осаждения гидроксипиронжелеза, например, повышением pH водного раствора до уровня больше 7 и/или добавлением гидроксипирона. Однако специалисту в данной области понятно, что соединение железа с гидроксипироном может осаждаться самопроизвольно, если условия реакции подходящие, и в таком случае нет необходимости осуществлять дополнительные стадии. Например, растворимость гидроксипиронжелеза в водном растворе может быть меньше растворимости реактантов, что является причиной его осаждения при смешивании реактантов. Следовательно, термин «осаждение» также включает пассивный вариант осуществления изобретения, допускающий возможность осаждения гидроксипиронжелеза.
В одном варианте осуществления изобретения стадия осаждения включает повышение уровня pH водного раствора от уровня pH меньше 7, такого как от 3 до 6 или 4-5 до pH больше 7, такого, как указано в данном документе, и/или прибавление дополнительного количества гидроксипирона к водному раствору, содержащему соль железа и гидроксипирон. Дополнительное количество гидроксипирона может быть, например, достаточным для получения молярного соотношения соли железа к гидроксипирону приблизительно 1:3 или больше. Поэтому количество дополнительно прибавленного гидроксипирона может быть по меньшей мере эквивалентным молярному количеству соли железа, например, может быть равным по меньшей мере 1- или 2-кратному молярному количеству соли железа.
В качестве варианта стадия осаждения включает объединение соли железа и гидроксипирона в молярном соотношении около 1:3 или больше в водном растворе при pH больше 7, таком как указано выше. Водный раствор обычно содержит по меньшей мере 60% (об/об) воды в качестве растворителя в таком варианте осуществления изобретения, например, от 70 до 100% (об/об), например около 100% (об/об).
В одном варианте осуществления изобретения стадия осаждения включает объединение соли железа и гидроксипирона в водном растворе при pH больше 7, причем этот водный раствор содержит по меньшей мере 60% (об/об) воды в качестве растворителя, например, от 70 до 100% (об/об), например около 100% (об/об).
В еще одном варианте осуществления изобретения стадия осаждения гидроксипиронжелеза включает комбинирование соли железа и гидроксипирона.
Термин «осадок» включает твердую фазу гидроксипиронжелеза, которую можно отличить и отделить от жидкой водной фазы или раствора. Твердая фаза может быть аморфной или кристаллической или их смесью. Обычно гидроксипиронжелезо образуется в виде бордово-красного твердого вещества.
В одном варианте осуществления изобретения, осажденное соединение железа с гидроксипироном отделяют и выделяют из раствора, который возможно не содержит органический растворитель, как указано в данном документе. Отделение и выделение можно осуществлять любыми подходящими методами, известными в данной области техники, например, фильтрованием, например, фильтрованием при атмосферном или пониженном давлении (например, меньше 1 бар) или в вакууме, или центрифугированием или декантацией. Подразумевается, что термин «вакуум», используемый здесь, включает давления от, например, 100 нПа до 100 кПа, в частности от 100 мПа до 3 кПа или от 3 кПа до 70, 80 или 90 кПа.
Термин «водный раствор» включает растворы, в которых растворитель содержит воду. Раствор, обычно состоящий в основном из воды, содержит больше 30%, 40%, 50%, 60% (об/об) воды или больше 70%, 80% или 90% (об/об) воды, например, от 60 до 100% (об/об) воды или от 80 до 98% (об/об) воды, например, от 85 до 95% (об/об) воды, считая на общий объем растворителя или раствора. В одном варианте осуществления изобретения растворитель водного раствора содержит воду или представляет собой воду. Вода может быть дистиллированной водой.
В одном варианте осуществления изобретения водный раствор, в котором реакция имеет место и из которого происходит осаждение, является одним и тем же водным раствором. Обычно способ по изобретению не включает удаление растворителя из водного раствора, например, испарением на роторном испарителе, и замену еще одним растворителем, например, органическим растворителем.
В одном варианте осуществления изобретения растворитель водного раствора не удаляют при пониженном давлении или не выпаривают. В еще одном варианте осуществления изобретения водный раствор не лиофилизируют.
В одном варианте осуществления изобретения, водный раствор может содержать другие растворители, кроме воды, при условии, что они не влияют на способность гидроксипиронжелеза осаждаться из водного раствора. Например, водный раствор может содержать спирт, такой как этанол. Количество неводного растворителя может быть меньше чем 20% (об/об), например, меньше 10% (об/об).
В одном варианте осуществления изобретения концентрация гидроксипирона, такого как мальтол, в водном растворе составляет больше 0,03 М, такая как от 0,04 до 2 М, например, от более 0,08 до 1,5 или 1 М. Концентрации соли железа и гидроксипирона могут быть такими, которые обеспечивают молярное соотношение железа и гидроксипирона в интервале от около 5:1 до около 1:5, например, от около 3:1 до около 1:3. Например, молярное соотношение железа и гидроксипирона в водном растворе может составлять около 1:3 или больше, например около 1:3. Молярная концентрация соли железа может быть больше или меньше молярной концентрации гидроксипирона, но обычно меньше.
Обычно используемые водные растворы практически не содержат органических растворителей, таких, например, как спирты, такие как метанол и этанол, а также кетоны, такие как ацетон, и галогенсодержащие растворители, такие как хлороформ или дихлорметан, или сложные эфиры, например, этилацетат. Подразумевается, что термин «практически не содержит» означает, что водный раствор содержит меньше 10% (об/об), предпочтительно меньше 5%, более предпочтительно меньше 1%, наиболее предпочтительно - практически 0% органического растворителя по объему по отношению к общему объему водного раствора.
В одном варианте осуществления изобретения, способ не включает применения органического растворителя, такого, как указано выше. Например, можно не использовать никакого органического растворителя для получения соединения железа с гидроксипироном, а также, для выделения и/или очищения соединения железа с гидроксипироном.
Водный раствор в способах по изобретению также обычно практически не содержит буферов, таких как цитрат, ацетат, глицин, морфолинпропансульфонат (MOPS) и т.п. Термин «практически не содержит» такой же по значению, как это определено выше. В одном варианте осуществления изобретения водный раствор не содержит буфера и способ осуществляют в отсутствие буфера.
В способах по изобретению гидроксипиронжелезо, как указано здесь, такое как три(гидроксипирон)трехвалентного железа, преимущественно получают в количестве более 5 г, например, более 10 г, 50 г, 100 г или 1 кг, например, в количестве от 10 г или 100 г до 10 кг, или 50 г, или 500 г - 5 кг.
В одном варианте осуществления изобретения способ включает взаимодействие гидроксипирона с некарбоксилатной солью железа в водном щелочном растворе. Подразумевается, что термин "водный щелочной раствор» обозначает водный раствор, такой как указано в данном документе, который имеет первоначальный и/или конечный pH больше 7.
Термин «первоначальный pH» обычно относится к pH раствора до добавления соли железа или ее раствора, а также гидроксипирона. Термин «конечный pH», как правило, относится к pH раствора после добавления соли железа или ее раствора, или смеси, включающей соль железа и гидроксипирон, и образования гидроксипиронжелеза. Водный щелочной раствор обычно содержит основание, такое, как указано в данном документе.
Обычно раствор не забуферен, поэтому pH раствора может отклоняться от первоначального уровня во время осуществления способа, хотя в одном варианте осуществления изобретения это может быть. Обычно как первоначальный, так и конечный pH больше 7, такой, как указано выше, хотя pH может уменьшаться ниже 7 во время по меньшей мере частичного протекания реакции. В таком случае можно довести pH до уровня выше 7 для того, чтобы осадить гидроксипиронжелезо из водного раствора.
В одном варианте осуществления изобретения pH водного раствора составляет больше примерно 3, 4, 5, 6, 7, 8, 9 или 10 в течение всей реакции. Например, pH водного раствора предпочтительно больше, чем примерно 7 в течение реакции.
В одном варианте осуществления изобретения уровень pH водного раствора не регулируют, например, добавлением основания, например, гидроксида натрия или карбоната натрия, после объединения соли железа и гидроксипирона.
В одном варианте осуществления изобретения, некарбоксилатная соль железа и гидроксипирон подвергают взаимодействию в водном растворе при pH больше 7. Этот водный раствор и все водные растворы, обсуждаемые здесь, предпочтительно готовят, используя деионизированную или дистиллированную воду. Особенно предпочтительно, если растворы получают, используя дистиллированную воду.
Водный раствор, в котором происходит реакция между солью железа и гидроксипироном, предпочтительно имеет первоначальный и/или конечный pH больше, чем около 7,2; 8 или предпочтительно больше чем около 9, более предпочтительно, если первоначальный и/или конечный pH больше, чем около 10. В одном варианте осуществления изобретения первоначальный и/или конечный pH раствора составляет от около 7,1 до около 14 или от 7,1 до 10, 11 или 12, более предпочтительно от около 7,3, 7,5 или около 9,1 до около 13, особенно предпочтительно от около 10 до около 13, такой как во время осуществления способа.
В одном варианте осуществления изобретения pH водного раствора больше 7 и меньше 11 или 10, например, около 7,2-9, такой как 7,4-8. Это может служить для ограничения образования гидроксида трехвалентного железа.
Уровень pH водного раствора, из которого осаждается гидроксипиронжелезо может быть таким, как указано выше, например, больше 7 до около 9, 10 или 11, например, от около 7,2 до 9 или 7,4-8, или больше 8 или 9. Уровень pH водного раствора, из которого осаждается гидроксипиронжелезо, необязательно может быть больше 7 и меньше 10 или 11. В соответствии с другим вариантом pH водного раствора, из которого осаждается гидроксипиронжелезо, может быть меньше или равен 7, например, 5-7 или от 5,5 до 6. Это может быть особенно подходящим для тех случаев, когда молярное соотношение гидроксипирона к используемой соли железа больше 3:1, составляя 3,1:1 или больше, 3,5:1 или больше или 4:1 или больше, например, от 3,5:1 или 4:1 вплоть до 10:1.
Как описано выше, pH водного раствора может понизиться до около 7 во время по меньшей мере частичной реакции между гидроксипироном и солью железа. В одном варианте осуществления способа по изобретению первоначальный pH водного раствора меньше 7 или равен примерно 7. Например, первоначальный pH раствора может составлять от около 3 до около 7, например, от около 4 до около 6 или от около 6 до около 7. Затем pH может увеличиться до более чем 7, как указано выше. Увеличение уровня pH можно достичь, например, добавлением раствора к щелочному раствору, такому как раствор с pH больше 7, например, от 8 до 11 или больше, чем 9-10. Такой раствор может содержать гидроксипирон. В качестве альтернативы к раствору для увеличения pH можно прибавить дополнительные количества основания.
В одном варианте осуществления изобретения, pH водного раствора не снижается ниже 2, 3, 4, 5 или 6 во время реакции. Например, pH водного раствора может быть в интервале от 2 до 13, таком как 4-11, например, 5-10 или 6-9 во время реакции.
Любой из вышеуказанных уровней pH можно получить, используя водный раствор, содержащий подходящее основание в определенной концентрации. Под «подходящим основанием» подразумевается любое основание, которое не образует комплекс с катионом железа в условиях реакции или иным образом не препятствует реакции между солью железа и гидроксипироном. Водный раствор может содержать одно основание или смесь двух или нескольких оснований.
Уровень pH можно измерять любым из средств, известным специалисту в данной области. Это средство может включать любой из имеющихся в продаже электронных pH-метров или универсальную индикаторную бумагу.
Предпочтительно, если основание растворимо в воде при комнатной температуре (например, при температуре от 0 до 40°С) в той степени, которая способна обеспечить необходимый уровень pH.
Примеры оснований, подходящих для применения в настоящем изобретении, включают: гидроксиды, например, основания, выбранные из группы, состоящей из: гидроксидов щелочных металлов, таких как гидроксиды натрия и калия, гидроксид аммония; и гидрокарбонаты или карбонаты натрия или калия.
Основание может быть выбрано из группы, состоящей из гидроксидов щелочных металлов и их смесей. В одном варианте осуществления изобретения основание выбирают из гидроксида натрия или гидроксида калия и их смесей, или гидроксида натрия.
Количество основания в водном растворе может надлежащим образом колебаться в интервале от 0,1 до 50% (мас./об) водного раствора. Предпочтительно однако, если количество основания в водном растворе изменяется от 5% до 40% (мас./об) водного раствора. В одном варианте осуществления изобретения количество основания, такого как гидроксид щелочного металла, в водном растворе составляет от около 10 до около 20% (мас./об), например, около 15 (мас./об).
В одном варианте осуществления изобретения молярное соотношение гидроксипирона и соли железа в водном растворе составляет по меньшей мере 3:1. Предпочтительно, если относительное молярное соотношение может составлять от 3:1 до 5:1. Однако в особенно предпочтительном варианте осуществления настоящего изобретения молярное соотношение гидроксипирона и соли железа составляет от 3,1:1 до 3,5:1.
В одном варианте осуществления изобретения используемое молярное соотношение гидроксипирона и соли железа составляет больше 3:1, например, около 4:1 или выше. Желательно обеспечить такой избыток гидроксипирона, который является непрореагировавшим с железом, в растворе и полученной композиции. К тому же, например, использование молярного соотношения гидроксипирона, такого как мальтол, к соли железа больше 3:1, например, около 4:1 или больше, может уменьшить образование гидроксида железа и/или снизить уровень pH, при котором осаждение гидроксипиронжелеза, такого как три(гидроксипирон) трехвалентного железа, например, три(мальтол) трехвалентного железа, может происходить, например, при pH ниже, чем около 7, например, при pH от 5 до 7 или около 5,5-6. Понижение уровня pH, как указано ранее, может также не допустить образования гидроксида железа или уменьшить его.
Специалист в данной области техники понимает, что pH и растворимость конкретных соединений железа с гидроксипиронами в водном растворе также определяется природой образующихся соединений железа. Следовательно, относительное молярное отношение гидроксипирона к соли железа может быть немного меньше, чем 3:1 при более высоких уровнях pH (например, больше 10) или в случае комплексов, которые менее растворимы в водных растворах с целью получить приемлемые выходы соединений железа с гидроксипиронами.
В одном варианте осуществления изобретения водный раствор с pH, указанным выше, получают путем добавления некоторого количества основания к воде, предпочтительно к деионизированной или дистиллированной воде. Концентрация основания определяет уровень pH, а количество основания, необходимое для обеспечения конкретного уровня pH, может быть рассчитано с учетом этого.
Соль железа и/или гидроксипирон в твердом виде можно добавлять к водному раствору при pH, указанном выше. В качестве варианта соль железа и гидроксипирон можно добавлять по отдельности в любом порядке или одновременно к водному раствору, который не содержит соль железа или гидроксипирон, в отдельные водные растворы, такие как указано в данном документе.
Настоящее изобретение подтверждает, что путь, в котором соль железа и гидроксипирон объединяют, может избежать образования нежелательных побочных продуктов, таких как продукты, описанные выше. Обычно соль железа добавляют в твердом виде к водному раствору, содержащему гидроксипирон. Однако соль железа можно добавлять к гидроксипирону в виде водного раствора соли железа. Для соли железа pH водного раствора обычно меньше 7. Для солей трехвалентного железа, например, pH водного раствора обычно составляет от 1 до 4. Для солей двухвалентного железа, например, pH водного раствора обычно составляет от 3 до 6. Этот интервал pH может способствовать стабилизации ионов железа в отношении гидролиза и других форм разложения. Как правило, свежеприготовленные растворы солей железа предпочтительны, если надо использовать растворы соли железа.
В одном варианте осуществления изобретения, свежеприготовленный раствор соли железа представляет собой раствор, который используют в течение примерно 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 часов после приготовления или меньше, например, в течение примерно 30 минут, 20 минут или 10 минут.
В еще одном варианте осуществления изобретения, соль железа добавляют к водному раствору, содержащему гидроксипирон, в течение периода времени от примерно 5 минут до 20 часов, такого как от 10 минут до 10 часов, например, от 30 минут до 5 часов или 1-2 часа. Например, водный раствор соли железа может быть добавлен к гидроксипирону по каплям в течение любого из вышеуказанных периодов времени.
Реакцию гидроксипирона с некарбоксилатной солью железа можно проводить при температурах окружающей среды, например при температуре от 5 до 35°С. В одном варианте осуществления изобретения, способ осуществляют при температуре выше температуры окружающей среды. Например, водный раствор может иметь температуру выше 40°С, например, выше 50°С или 60°С, или 70°С, или 80°С, или 90°С, например, от 40 до 100°С, такую как от 50 до 90°С или от 60 до 80°С. Следовательно, способ можно осуществлять при этих температурах.
Было обнаружено, что гидроксипироны преимущественно стабильны при этих более высоких температурах, при которых растворимость увеличивается. Поэтому можно использовать более высокие концентрации гидроксипиронов, которые приводят к получению осажденного продукта, такого как продукт присоединения соли железа, необязательно с последующим охлаждением до температуры окружающей среды.
В одном варианте осуществления изобретения способ включает взаимодействие гидроксипирона с некарбоксилатной солью железа при температуре выше, чем около 40°С, например, выше, чем около 50°С, или около 60°С, или 70°С, или 80°С, или 90°С, или при такой, как указано выше. При этих температурах водный раствор может иметь уровень pH от около 6 до около 8, такой как около 7, или pH больше 7, как указано выше.
Некарбоксилатную соль железа обычно добавляют к гидроксипирону способами по изобретению. Гидроксипирон обычно находится в водном щелочном растворе, как указано в данном документе, но он может находиться и при pH меньше 7 или равном 7, например от 3 до 7, по меньшей мере первоначально.
В одном варианте осуществления изобретения некарбоксилатную соль железа добавляют к гидроксипирону, например, в водном растворе, как указано выше. Например, гидроксипирон может находиться в водном растворе, таком как водный щелочной раствор, к которому добавляют некарбоксилатную соль. В качестве варианта гидроксипирон может быть объединен с водным раствором, таким как вода, который необязательно является щелочным, раствор нагревают, например, до температуры, указанной выше, и некарбоксилатную соль объединяют с нагретым раствором. Полученный раствор можно объединить с отдельным водным щелочным раствором, содержащим гидроксипирон. Например, нагретый раствор может быть добавлен к водному щелочному раствору, содержащему гидроксипирон.
Соль железа и гидроксипирон можно объединить с водным раствором, таким, как указано выше, до нагревания, например, до температуры выше 60°С, и затем объединить с отдельным водным щелочным раствором, содержащим гидроксипирон. Водный щелочной раствор может иметь любой pH, как указано выше.
Затем pH раствора можно довести до уровня больше 7, чтобы осадить гидроксипиронжелезо и/или можно прибавить дополнительное количество гидроксипирона, как описано выше.
Так, в одном варианте осуществления изобретения (1:1) и/или (1:2) комплекс железа с гидроксипироном, который представляет собой соединение моногидроксипиронжелезо, ди(гидроксипирон)железо или их смесь, образуется при pH меньше 7 или около 7 реакцией гидроксипирона и соли железа. Молярное соотношение железа и гидроксипирона может составлять от примерно 1:1 до 1:2. Затем pH раствора может быть доведен до уровня больше 7, для того, чтобы осадить гидроксипиронжелезо. В качестве варианта или дополнительно водный раствор, содержащий 1:1 и/или 1:2 комплекс гидроксипиронжелезо, может быть подвергнут взаимодействию с дополнительным количеством производного гидроксипирона, как описано выше, которое достаточно для образования 1:3 комплекса железа с гидроксипироном.
Таким образом, способ по изобретению может включать первую стадию образования моно- или дигидроксипироновых комплексов с железом или их смеси путем взаимодействия соли железа с гидроксипироном, причем соотношение молярной концентрации соли железа и гидроксипирона больше 1:3, например, 1:1, 2:1, 3:1 или 5:1, и вторую стадию образования соединения железа с гидроксипироном путем прибавления дополнительного количества гидроксипирона и/или доведения pH до уровня pH больше 7, такого, как указано здесь. Дополнительное количество гидроксипирона может представлять собой любое количество, достаточное для образования три(гидроксипирон)железа или 1:3 комплекса железа с гидроксипироном, такого как указано здесь. Нет необходимости выделять «промежуточный» комплекс моно- или дигидроксипиронжелезо, хотя это можно было бы сделать и завершить реакцию на более поздней стадии.
В одном варианте осуществления изобретения моногидроксипиронжелезо, дигидроксипиронжелезо или их смесь образуются путем взаимодействия гидроксипирона с некарбоксилатной солью при начальном pH меньше 7 и/или прибавляют дополнительное количество производного гидроксипирона к водному раствору и/или увеличивают pH до уровня больше 7.
В одном варианте осуществления изобретения гидроксипирон и некарбоксилатная соль железа взаимодействуют в водном растворе, имеющем pH в интервале, например, 3-7, например 4-5. Затем pH раствора увеличивают до уровня больше 7, например, 7,2-9 или 7,4-8, для того, чтобы осадить из раствора соединение железа с гидроксипироном, такое как три(гидроксипирон) трехвалентного железа. Используемое молярное соотношение гидроксипирона и некарбоксилатной соли железа предпочтительно больше чем 3:1 или равно 3:1, например, от 5:1 до 3,1:1, такое как около 4:1 или больше. Весь гидропирон может быть использован первоначально при низком pH или часть его может быть объединена позже, например до, во время или после увеличения pH.
При pH 3-7 гидроксипирон и некарбоксилатная соль могут взаимодействовать, образуя преимущественно "протонированные" комплексы, т.е. положительно заряженные комплексы гидроксипирона с железом, в которых молярное соотношение железа и гидроксипирона составляет 1:1 или 1:2. Они обладают относительно высокой растворимостью в водном растворе по сравнению с нейтральными 1:3 комплексами. Увеличение pH может увеличивать количество нейтрального комплекса с низкой растворимостью и этот комплекс может выпадать в осадок.
Подразумевается, что термин «некарбоксилатная соль железа» относится к солям железа, таким как соли двухвалентного и трехвалентного железа, которые не содержат карбоксилатных анионов, например, анионов описанных в WO 03/097627. Некарбоксилатные соли железа, следовательно, обычно включают соли железа и неорганических анионов, таких как хлорид, нитрат и сульфат. Водный раствор некарбоксилатной соли железа обычно имеет pH меньше 7, например, от 0 до 6, от 1 до 5, от 2 до 4 или около 3. Растворимость соли железа в воде при 20°С обычно составляет по меньшей мере 20 г / 100 мл воды, например, по меньшей мере 40 г / 100 мл воды.
В одном варианте осуществления изобретения некарбоксилатная соль железа находится в виде твердого вещества, например в виде порошка, или в виде водного раствора соли, где водный раствор такой, как указано выше. Водный раствор соли железа обычно имеет pH меньше 7, такой как от 0 до 7, от 1 до 6, от 2 до 5 или от 3 до 4. Твердое вещество или раствор могут быть объединены с гидроксипироном или добавлены к гидроксипирону, например, в водном растворе или в щелочном водном растворе на одной или на нескольких стадиях. Например, может быть добавлена порция соли железа с последующим добавлением основания для регулирования pH и необязательно дополнительной порции соли железа.
Некарбоксилатная соль железа и соединение железа и гидроксипирона могут независимо быть фармацевтически приемлемыми или нетоксичными.
Соли железа по изобретению обычно включают неорганические анионы, то есть анионы, которые не содержат углерод и водород. В одном варианте осуществления изобретения, некарбоксилатную соль железа выбирают из двухвалентного или трехвалентного железа или их смесей, таких, например, как хлорид трехвалентного железа, сульфат трехвалентного железа, нитрат трехвалентного железа, хлорид двухвалентного железа, нитрат двухвалентного железа, сульфат двухвалентного железа, такой как гептагидрат сульфата двухвалентного железа, или их смеси. Соль может представлять собой гидрат или быть безводной. Например, хлорид трехвалентного железа может быть в виде гексагидрата, а хлорид двухвалентного железа, в виде тетрагидрата.
Соединения железа с гидроксипироном, полученные способом по изобретению, предпочтительно представляют собой нейтральные комплексы, содержащие катионы железа и анионы гидроксипирона и без дополнительных анионов, уравновешивающих заряд, таких как гидроксид или хлорид. В одном варианте осуществления изобретения, соединение железа с гидроксипироном представляет собой три(гидроксипирон)железо, т.е. Fe(гидроксипирон)3, такой как три(гидроксипирон) трехвалентного железа.
Показано, что соли трехвалентного железа могут окисляться in situ в способах по изобретению и давать соединения трехвалентного железа с гидроксипироном.
В одном варианте осуществления изобретения соединение трехвалентного железа с гидроксипироном, полученное способом по изобретению, представляет собой три(гидроксипирон) трехвалентного железа, где гидроксипирон такой, как указано здесь, например, три(мальтол) трехвалентного железа или три(этилмальтол) трехвалентного железа.
Подразумевается, что термин «нейтральный комплекс» означает, что положительный заряд на катионе железа уравновешивается отрицательным зарядом на лигандах в комплексе. Следовательно, общий заряд комплекса железа с гидропироном равен нулю. Так как имеется внутреннее уравновешивание зарядов между катионом железа и лигандами гидроксипирона, нет необходимости в любых дополнительных нековалентно связанных анионах, таких как хлорид, чтобы уравновесить любой заряд, оставшийся на катионе железа.
Соединение железа с гидроксипироном содержит железо в степени окисления (Fe3+).
В одном варианте осуществления изобретения соединение железа с гидроксипироном, такое как три(гидроксипирон)железо, полученное способом, имеет растворимость в воде или водном растворе при 25°С меньше, чем около 20 г / 100 мл водного раствора или воды, например, меньше, чем около 10 г / 100 мл водного раствора или воды, например, меньше, чем около 5 г / 100 мл водного раствора или воды. Например, растворимость соединения гидроксипирона и железа может составлять от около 1 г / 100 мл водного раствора или воды до около 7 г / 100 мл воды, например, около 3-5 г / 100 мл воды или около 3,5-4 г / 100 мл водного раствора или воды при 25°С. Например, максимальная растворимость три(мальтол)железа в воде составляет около 3,5 г / 100 мл воды при около 25°С.
Когда железо находится в трехвалентном состоянии, нейтральный комплекс железа с гидроксипироном содержит гидроксипирон и трехвалентное железо в стехиометрическом отношении 3:1 (гидроксипирон:трехвалентное железо). Нейтральный комплекс трехвалентного железа с гидроксипироном содержит три одноосновных бидентатных гидроксипироновых лигандов, ковалентно связанных с ионом трехвалентного железа. Гидроксипироновый лиганд представляет собой бидентатный и одноосновный лиганд. Однозарядный гидроксипироновый лиганд содержит –О- группу вместо -ОН группы, присутствующей в нейтральном гидроксипироновым лиганде.
Гидроксипироновые лиганды в соединениях железа с гидроксипиронами могут быть одинаковыми или разными. В предпочтительном варианте осуществления изобретения все гидроксипироновые лиганды одинаковые.
Предпочтительно, если соединение железа с гидроксипиронами совсем не содержит или практически не содержит заряженных комплексов трехвалентного железа с гидроксипиронами и нейтральных комплексов трехвалентного железа со смешанными лигандами, содержащими ковалентно связанные карбоксилатные лиганды.
Подразумевается, что термин «заряженные комплексы трехвалентного железа с гидроксипироном» обозначает комплексы трехвалентного железа с гидроксипироном, в которых стехиометрическое отношение гидроксипирона к трехвалентному железу составляет 2:1 или 1:1, так что заряд на катионе железа внутренне не уравновешен зарядом на гидроксипироновом лиганде. Общий заряд на комплексе может составлять +1 или +2 и по меньшей мере один противоион, такой, например, как хлорид, требуется для того, чтобы уравновесить заряд.
«Практически не содержат» означает, что заряженные комплексы трехвалентного железа или нейтральные комплексы трехвалентного железа со смешанными лигандами, содержащие карбоксилатные лиганды, включают меньше 10 мас.% общей массы частиц железа в конечной композиции, считая на композицию, и предпочтительно меньше 5%, например, меньше 2 мас.% или 1 мас.% или около 0 мас.%.
Когда соединение железа и гидроксипирона имеет один или несколько хиральных центров, соединение железа и гидроксипирона может быть получено или в виде чистого энантиомера или диастереоизомера, или в виде рацемической смеси или смеси, обогащенной одним из энантиомеров или диастереоизомеров. Смесь энантиомеров или диастереоизомеров можно разделять и очищать с помощью любых известных в данной области техники способов. Однако смесь оптических изомеров обычно не разделяют и не очищают.
Предпочтительно, если гидроксипирон, используемый в способе по настоящему изобретению, представляет собой гидрокси-4-пирон. Особенно предпочтительно, если гидрокси-4-пирон представляет собой 3-гидрокси-4-пирон или 3-гидрокси-4-пирон, в котором один или несколько атомов водорода, присоединенных к атомам углерода кольца, замещены алифатической углеводородной группой, содержащей 1-6 атомов углерода.
Замещенные 3-гидрокси-4-пироны могут содержать алифатические углеводородные группы более чем одного типа. Однако, обычно предпочтительно, если имеется замещение одной алифатической углеводородной группой, а не двумя или тремя такими группами.
В качестве варианта гидроксипироновый лиганд может представлять собой 5-гидроксипирон, такой как койевая кислота (5-гидрокси-2-(гидроксиметил)-4-пирон). В дополнительном варианте осуществления изобретения гидроксипирон, используемый в способе по настоящему изобретению, может содержать смеси гидроксипироновых лигандов, упомянутых выше.
В одном варианте осуществления изобретения гидроксипирон не содержит гидроксиметильного, гидроксиэтильного или гидроксиалкильного заместителя, где алкил представляет собой предпочтительно C1-C10, например C1-C6. В одном варианте осуществления изобретения гидроксипирон не содержит койевой кислоты и не состоит из койевой кислоты.
Термин «алифатическая углеводородная группа», используемый здесь, включает как ациклические, так и циклические группы, которые могут быть ненасыщенными или насыщенными, ациклические группы, имеющие разветвленную цепь или предпочтительно линейную цепь. Особенно предпочтительными являются группы, содержащие от 1 до 4 атомов углерода, более предпочтительны группы, содержащие от 1 до 3 атомов углерода. Насыщенные алифатические углеводородные группы являются предпочтительными, они представляют собой или циклические группы, такие как циклоалкильные группы, циклопропил и особенно циклогексил, или более предпочтительны ациклические группы, такие как метил, этил, н-пропил и изопропил. Метил и этил особенно предпочтительны.
Замещение в положении 2 или 6 представляет особый интерес, хотя, когда кольцо замещено большими алифатическими углеводородными группами, имеется преимущество, которое состоит в том, что исключается замещение на атоме углерода в альфа-положении к системе. Эта система участвует в образовании комплекса с железом и ее близость к одной из больших алифатических углеводородных групп может привести к стерическим эффектам, которые ингибируют образование комплекса.
Предпочтительные гидроксипироновые лиганды в комплексах по настоящему изобретению имеют формулу (I), особый интерес представляют конкретные гидроксипироны формул (II) и (III):
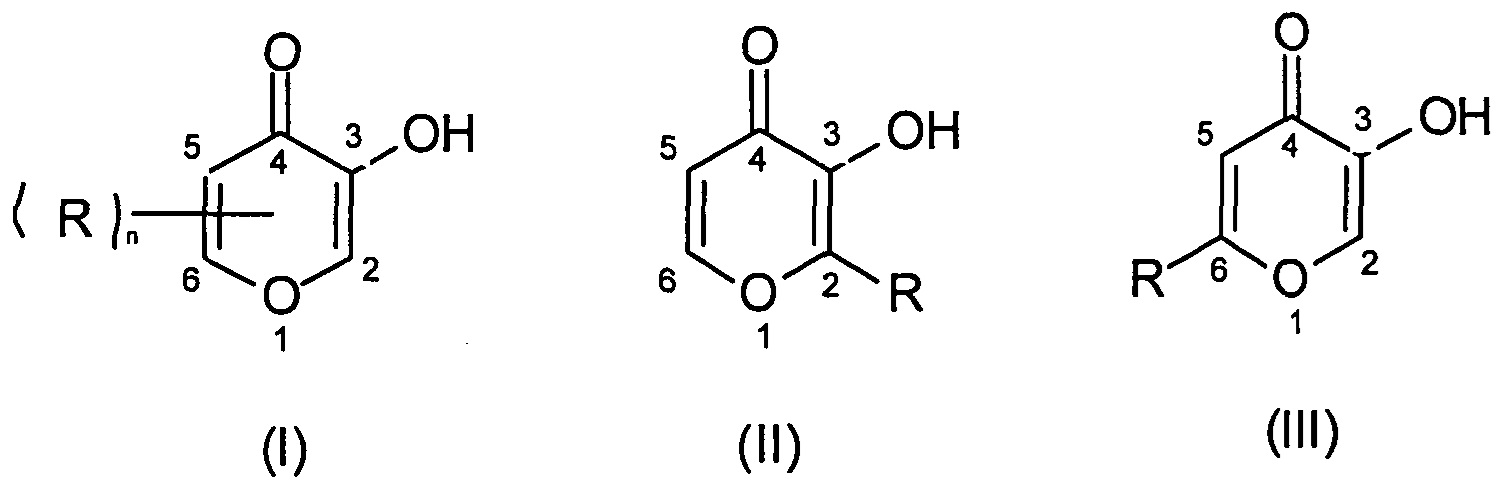
в которых R обозначает циклоалкильную или алкильную группу, например, метальную, этильную, н-пропильную, изопропильную или бутильную, а n равно 0, 1, 2 или 3 (причем кольцо не замещено алкильной группой, когда n равно 0).
Из указанных соединений наибольший интерес представляет 3-гидрокси-2-метил-4-пирон (мальтол; II, R=Me), хотя и 3-гидрокси-4-пирон (пиромекониевая кислота; I, n=0), 3-гидрокси-6-метил-4-пирон (изомальтол, III, R=Me) и особенно 2-этил-3-гидрокси-4-пирон (этилмальтол; II, R=Et) также исключительно интересны. Для удобства соединение 3-гидрокси-2-метил-4-пирон называют «мальтол» в данном документе.
В одном варианте осуществления настоящего изобретения гидрокси-4-пирон выбран из мальтола, этилмальтола и их смесей. Мальтол является наиболее предпочтительным и предпочтительным соединением железа и гидроксипирона по изобретению является три(мальтол) трехвалентного железа.
Некоторые гидроксипироны, такие как мальтол, имеются в продаже. Среди других гидроксипиронов удобным исходным веществом во многих примерах является 3-гидрокси-4-пирон, который легко можно получать декарбоксилированием 2,6-дикарбокси-3-гидрокси-4-пирона (мекониевой кислоты). Например, 3-гидрокси-4-пирон можно подвергать взаимодействию с альдегидом для введения 1-гидроксиалкильной группы в положение 2, эту группу затем восстанавливают, получая 2-аллил-3-гидрокси-4-пирон. Другие препаративные способы описаны в статье (Spielman, Freifelder, J. Am. Chem. Soc. Vol.69, page 2908 (1947).
Специалисту в данной области понятно, что указанные способы не являются единственными путями к этим производным гидроксипиронов и можно в равной мере использовать различные альтернативные способы, известные из уровня техники.
В одном варианте осуществления изобретения осажденный комплекс гидроксипиронжелезо, который можно получать способом по изобретению, является фармацевтически чистым и не требует дополнительной очистки. Осажденное гидроксипиронжелезо можно отделить и высушить, как описано ниже, но его не очищают таким способом, как кристаллизация. Например, чистота осажденного гидроксипиронжелеза может быть больше или равной примерно 95, 96, 97, 98, 99 или 99,5%.
В одном варианте осуществления изобретения выделенный или отделенный осадок, содержащий гидроксипиронжелезо, включает гидроксид железа, такой как Fe(ОН)3, в количестве, например, меньше, чем около 3, 2, 1 или 0,1 мас.%. Например, выделенное или отделенное гидроксипиронжелезо может содержать гидроксид железа в количестве от 0,01 до 3% (мас.), например, от 0,1 до 2,5% (мас.), предпочтительно от 1 до 2% (мас.).
В одном варианте осуществления изобретения соединение железа с гидроксипироном представляет собой три(гидроксипирон)железо, такое как три(гидроксипирон) трехвалентного железа, например, три(мальтол)трехвалентного железа.
В одном варианте осуществления изобретения соединение железа с гидроксипироном осаждают из водного раствора с образованием суспензии, содержащей осадок и водный раствор, осадок отделяют и выделяют из суспензии и необязательно сушат. Условия сушки могут быть такими, как описано ниже.
Образовавшееся соединение железа с гидроксипироном обычно выделяют в виде осадка и необязательно сушат при атмосферном давлении, например, при 80°С или выше, например, в печи; или сушат в вакууме, причем температура может быть ниже 80°С, например, 40°С или меньше. Выделенный осадок можно, кроме того, сушить в печи.
В одном варианте осуществления изобретения, выход гидроксипиронжелеза больше 50%, например, больше 60%, 70%, 80%, 90% или 95%, считая на исходные вещества.
Растворимость соединения железа с гидроксипироном, такого как три(гидроксипирон)железо, в водном растворе или в водном щелочном растворе обычно такая, что оно осаждается из раствора при pH больше 7. Не все количество образовавшегося комплекса три(гидроксипирон)железа может осаждаться, хотя обычно более 50% образовавшегося или имеющегося гидроксипиронжелеза осаждается. Обычно виды гидроксипиронжелеза, образованного и осажденного, представляют собой виды три(гидроксипирон)железа, которые обеспечивают более 50% образовавшихся соединений железа с гидроксипироном.
В одном варианте осуществления изобретения от около 40 до около 98%, например, от около 70-90% (мол.) теоретического количества соединений железа осаждается. Осадок может быть выделен или собран путем отделения твердого вещества, выпавшего в осадок из раствора, или суспензии, содержащей водный раствор, или жидкости, с помощью методов, известных в данной области техники, таких как фильтрование, центрифугирование и декантация, необязательно в вакууме.
Осаждение соединения железа с гидроксипироном можно увеличивать, охлаждая реакционную смесь, используя, например, холодную воду или лед и баню с холодной водой для охлаждения раствора до температуры от 0°С до 10°С.
В одном варианте осуществления изобретения осажденный и выделенный комплекс гидроксипирона и железа, такой как комплекс три(гидроксипирон) трехвалентного железа необязательно промывают осадителем, таким как вода, и сушат, например, в вакууме. Сушка позволяет выделять гидроксипиронжелезо в виде твердого вещества и его можно превратить в порошок. Содержание воды в высушенном порошке соединения железа и гидроксипирона обычно составляет меньше 10% (мас.), например, от 1 до 5% (мас.). Никакой дополнительной очистки обычно можно не проводить. Таким образом, настоящее изобретение обеспечивает получение полезного, фармацевтически приемлемого продукта, не требующего дополнительной очистки, например, упаривания и перекристаллизации, или применения органических растворителей.
Надосадочная жидкость может включать, например, соли, не содержащие железо, такие как хлориды натрия или калия в количестве до 100% (моль) от теоретического максимума, и соединения железа с гидроксипироном с различными молярными соотношениями железо:гидроксипирон, такими как 1:1 или 1:2. Жидкость над осадком можно отделять от твердых веществ любым подходящим способом, например, фильтрованием, и сушить, например, при 80°С, предпочтительно до постоянной массы.
Соединения железа с гидроксипироном необязательно сушить, как описано здесь, а их можно очищать дополнительно и выделять в виде по существу чистых продуктов способами, известными в данной области техники, такими, например, как перекристаллизация. Перекристаллизацию можно проводить, используя такие растворители, как, например, вода, спирт, такой как этанол, водно-спиртовые смеси или смеси водных растворителей, содержащих простой эфир, например, диэтиловый эфир или тетрагидрофуран. Однако обычно соединение железа с гидроксипироном не очищают после выделения в виде осадка, а необязательно сушат.
Один объект изобретения относится к фармацевтической композиции, содержащей соединение железа с гидроксипироном и гидроксид железа, такой как гидроксид трехвалентного железа или Fe(ОН)3.
В одном варианте осуществления изобретения гидроксид железа не является терапевтическим средством или фармацевтически неактивен, например, гидроксид железа может быть инертным. В предпочтительном варианте осуществления изобретения гидроксид железа находится в композиции в виде твердого вещества (т.е. не в виде жидкости или коллоида). Предпочтительно, когда гидроксид железа не является терапевтическим средством или фармацевтически неактивен и представляет собой твердое вещество.
Гидроксид железа предпочтительно содержится в качестве фармацевтического эксципиента. Например, гидроксид железа, такой как гидроксид трехвалентного железа может обеспечивать стабильный цвет композиции, а именно красный, розовый или коричневый или их оттенки в той же области спектра. Подразумевается, что выражение «стабильный цвет» означает, что композиция по существу не изменяет цвет при выдерживании при температуре и влажности окружающей среды в течение некоторого периода времени, например, в течение 1 дня, 1 недели или 1 месяца.
В одном варианте осуществления изобретения композиция содержит вкусовую добавку, такую как непрореагировавший гидроксипирон, например, мальтол, который является свободным (не связанным в комплекс). Непрогеагировавший гидроксипирон может быть вкусовой добавкой. Применение непрореагировавшего гидроксипирона может обеспечить полезную интенсификацию вкуса (например, придать вкус карамели) соединению железа с гидроксипироном. Например, три(мальтол)железо имеет слабый металлический привкус, но также имеет и карамельный вкус. Соли железа, такие как хлорид трехвалентного железа, имеют вяжущий вкус и могут быть неприемлемы для перорального введения только по этой причине.
В одном варианте осуществления изобретения гидроксид железа не содержит коллоидного железа, такого как коллоидный гидроксид железа и/или форму гидроксида железа, защищенную сахаром, такую как сахарат гидроксида трехвалентного железа.
Подразумевается, что термином «фармацевтическая композиция» обозначают композицию, которая подходит для введения субъекту. В термин «субъект» авторы изобретения включают животное, такое как млекопитающее, например, человека.
Соединение железа с гидроксипироном может быть таким, как определено в любом из указанных выше вариантах осуществления изобретения. В одном варианте осуществления изобретения соединение железа с гидроксипироном представляет собой три(гидроксипирон)железо, такое, например, как три(мальтол)железо или три(этилмальтол)железо (III).
Соединение железа с гидроксипироном, такое как три(гидроксипирон)железо (III), может содержаться в композиции в количестве по меньшей мере около 40 мас.%, считая на массу композиции, таком как по меньшей мере около 50, 60, 70, 80, 90 или 95 мас.%, и может быть фармацевтически чистым, как указано в данном документе. Например, the iron гидроксипиронжелезо, как указано здесь, может содержаться в количестве от около 40 до около 99 мас.%, например, от около 60 до около 98 мас.% или от около 70 до около 95 мас.%.
Композиция необязательно дополнительно содержит производное гидроксипирона, такое как мальтол, этилмальтол и их смеси и/или карбоновую кислоту, такую как, например, лимонная кислота. Кроме того, композиция может содержать соль неорганического аниона и металла (не железа), например, хлорид натрия или калия. Эти необязательные компоненты могут присутствовать независимо в количестве меньше 10 мас.%, например, в количестве меньше 5 мас.% или около 5 мас.% или около 2 мас.%. Например, гидроксипирон и/или соль (которая не является солью железа) могут содержаться в композиции в количестве от 0,01 до 2 мас.%, например, от 0,1 до 1 мас.%.
В одном варианте осуществления изобретения композиция находится в твердой форме, например, в виде порошка, капсулы или таблетки. В одном варианте осуществления изобретения композиция не является смолой.
Обычно гидроксид железа, такой как гидроксид трехвалентного железа, содержится в композиции в количестве меньшем или равном 10 мас.%, в расчете на массу композиции например, в количестве меньшем или равном около 5 мас.% или около 2 мас.%. Например, количество гидроксида железа в композиции может составлять от 0,01 до 2 мас.%, например от 0,1 до 1 мас.%.
Композиция может быть получена способами по настоящему изобретению или например, смешиванием соединения железа с гидроксипироном с гидроксидом железа.
Дополнительный объект настоящего изобретения относится к фармацевтической композиции по изобретению вместе с фармацевтически приемлемым разбавителем или носителем.
Композиции по настоящему изобретению могут дополнительно содержать одну или несколько карбоновых кислот. Кислота может быть выбрана из любых карбоновых кислот, описанных в WO 03/097627, и является фармацевтически приемлемой и подходит для применения в медицине.
Кислота может быть добавлена для того, чтобы оптимизировать эффективность буферизации композиций железа по настоящему изобретению в водном растворе и/или in vivo.
Молярное соотношение карбоновой кислоты и соединения железа с гидроксипироном в композиции по изобретению составляет предпочтительно от 30:1 до 1:30, более предпочтительно от 10:1 до 1:10.
Термин «фармацевтически приемлемый», по мнению авторов, обычно означает, что носители должны быть «приемлемыми» в смысле их совместимости с активным ингредиентом (соединением железа с гидроксипироном) и не наносить вред реципиенту.
Композиции могут быть в твердой форме, такой как порошок, капсула или таблетка, или в жидкой форме. Подходящие твердые разбавители и носители включают крахмал, декстрин и стеарат магния. Также могут использоваться стабилизирующие и суспендирующие агенты, такие, как метилцеллюлоза и повидон и другие таблетирующие средства, такие как лактоза, и агенты для повышения текучести, такие как Aerosil 2000™.
Особенно полезными разбавителями и носителями являются увлажняющие вещества или поверхностно-активные вещества (ПАВ), предпочтительно неионогенные или ионогенные ПАВ. Примеры подходящих неионогенных ПАВ включают полиоксил-10-олеиловый простой эфир и полисорбаты. Примером подходящего ионогенного ПАВ является натрийлаурилсульфат.
Жидкие носители могут быть стерильными и апирогенными: примерами являются физиологический раствор и вода.
Соединения железа с гидроксипиронами и композиции по настоящему изобретению обеспечивают конкретные преимущества рецептур комплексов железа. Жидкие рецептуры соединений железа особенно подходят для перорального и парентерального введения. Для таких видов применения растворимость некоторых известных комплексов железа является неудовлетворительной.
Соединения железа с гидроксипиронами и композиции по настоящему изобретению могут быть приготовлены с физиологически приемлемым разбавителем или носителем для применения в качестве фармацевтических препаратов для ветеринарии или лечения людей человека множеством способов. Однако обычно предпочтительны композиции, в которых разбавитель или носитель не является нестерильным раствором в воде и/или органическим растворителем. Таким образом, комплексы железа можно применять в виде водной, масляной или эмульгированной композиции, содержащей жидкий разбавитель, которую однако обычно применяют для парентерального введения, и поэтому может быть подходящей стерильная и апирогенная композиция. Одной из форм композиции, представляющей особый интерес, является форма в виде стерильного раствора для инъекций. Однако пероральное введение обычно является предпочтительным для лечения железодефицитной анемии у человека, и композиции по настоящему изобретению можно вводить таким путем.
Для перорального введения людям обычно используют композиции, включающие твердый носитель, например, крахмал, лактозу, декстрин или стеарат магния. Таким твердым композициям удобно придавать форму, например, изготавливать в форме таблеток, капсул (включая спансулы) и т.п. Однако жидкие препараты особенно подходят для перорального введения пациентам, у которых имеются затруднения при глотании твердых лекарственных форм. Такие затруднения являются обычными для пациентов, страдающих анемией, связанной с артритом.
Можно также рассматривать другие формы введения, кроме инъекций или перорального пути введения, например, применение суппозиториев.
В фармацевтической композиции может содержаться более одного соединения железа с гидроксипироном, полученного способом по настоящему изобретению, и в нее могут быть также включены другие активные соединения. Типичные добавки включают соединения, способные облегчать лечение анемии, такие как фолиевая кислота. Источник цинка можно также включить.
Предпочтительно вышеуказанные композиции подходят для применения в медицине.
Композиции по настоящему изобретению особенно подходят для тяжелых видов анемии, возникающих из-за нарушений, связанных с кровотечениями, особенно в желудочно-кишечном тракте. Многие из пациентов с такими заболеваниями не переносят стандартных препаратов двухвалентного железа против анемии. В таких случаях препараты двухвалентного железа противопоказаны или пациентов предупреждают о противопоказаниях. Кроме того, пациентов, которым необходимо переливать кровь, или клинических больных, получающих внутривенные инъекции, можно лечить на амбулаторной основе, что экономит существенные затраты на лечение.
Фармацевтические композиции по изобретению могут быть использованы в способе лечения субъекта для повышения содержания железа в кровотоке субъекта и/или для профилактики и/или лечения анемии, такой как железодефицитная анемия, который включает введение указанному субъекту эффективного количества композиции, как указано ранее.
Соединения железа с гидроксипиронами и композиции, которые можно получать способом по настоящему изобретению, можно также использовать в видах лечения, описанных в WO 2009/138761.
Указание или обсуждение в настоящем описании документа, явно опубликованного ранее, не следует обязательно считать подтверждением того, что этот документ является частью существующего уровня техники или представляет собой общеизвестные знания.
Следующие ниже неограничивающие примеры иллюстрируют изобретение и никаким образом не ограничивают объем изобретения. В примерах и в описании настоящей заявки все количества в процентах, части и соотношения являются массовыми, если не указано иное. Средние молекулярные массы рассчитаны по массе, если не указано иное. Следует принимать во внимание, что различные количества (в процентах) различных компонентов, которые содержатся в продуктах по изобретению, включая любые необязательные компоненты, добавляют до 100%.
Примеры
Хлорид трехвалентного железа, используют в примерах или в виде свежеприготовленного раствора, или в виде твердого вещества.
Сравнительный пример 1
Получение комплекса три(мальтол)железо из чистого мальтола.
Мальтол растворяют в водном растворе хлорида трехвалентного железа и при добавлении гидроксида натрия осаждают комплекс три(мальтол)железо.
Точно измеренную массу гранул гексагидрата хлорида трехвалентного железа (330 г) растворяют в дистиллированной воде, получая раствор с pH 0,6. К полученному раствору добавляют эквимолярное количество мальтола (всего 490 г, первоначально 250 г) и дают раствориться при непрерывном перемешивании. Установлено, что pH полученного раствора равен нулю и этот раствор имеет бордово-красный цвет. Показано спектроскопически, что первоначальный раствор представляет собой в основном смесь 1:1 комплекса Fe/мальтол с небольшим количеством 1:2 компонента. Добавляют остальной мальтол. После перемешивания в течение 1 часа к раствору добавляют по каплям гидроксид натрия (147 г NaOH в 750 мл воды) до достижения pH 8,3. Раствор и осадок имеют красный цвет. Осадок выделяют с помощью воронки Бюхнера в вакууме. Осадок сушат при 40°С в вакууме.
Мальтол только слабо растворим в водной кислой реакционной среде. После перемешивания в течение часа следы нерастворенного мальтола видимы на поверхности раствора хлорид трехвалентного железа/мальтол, на стенках реакционного сосуда и на мешалке. При добавлении гидроксида натрия, комки коричнево-черного вещества появляются на стенках реакционного сосуда и на мешалке, которые, по-видимому, добавляются к примесям в целевом продукте.
Попытка нагреть раствор хлорида трехвалентного железа/мальтол для того, чтобы способствовать растворению мальтола в растворе хлорида трехвалентного железа, привела в результате к жженому, не отвечающему техническим требованиям, окрашенному образцу соединения железа с мальтолом. Этот способ также дает два побочных продукта, а именно Fe(OH)2 (Мальтол) и Fe(ОН) (Мальтол)2, на образование которых расходуется дорогой мальтол.
Раствор гидроксида натрия приходится добавлять чрезвычайно медленно, чтобы предотвратить «осмоление» и образование нежелательных сгустков на дне реакционного сосуда.
Этим способом получают соединение три(мальтол)железо с выходом примерно 78%.
Когда мальтол добавляют к раствору хлорида трехвалентного железа с низким уровнем pH, не происходит образования три(мальтол)железа, а образуется гидроксид трехвалентного железа с мономальтолжелезом и небольшой долей ди(мальтол)железа Нейтрализацию заряда этих комплексов осуществляет или гидроксильная функциональная группа, или хлорид-анион. Добавление мальтола также приводит к образованию черных отложений и смол, состоящих из полимеров хлорид трехвалентного железа/гидроксид трехвалентного железа. Указанные черные отложения получаются в том случае, если растворы нагревают. Поэтому указанным способом невозможно получить правильную стехиометрию для образования три(мальтол)железа и изготовить фармацевтически приемлемый продукт.
Добавление мальтола к водному раствору хлорида трехвалентного или двухвалентного железа, как полагают, является непригодным к использованию для широкомасштабных и производственных целей и в примерах 2-4 исследовано добавление хлоридов железа к мальтолу в растворе.
Проблемы работы в водной среде
Хлорид трехвалентного железа в виде гидратированного иона в водном растворе является сильной кислотой Льюиса с Ka 7×10-3, и хлорид двухвалентного железа, в виде гидратированного иона в водном растворе также является сильной кислотой Льюиса с Ka 5×10-9. В нужном интервале для использования хлоридов железа в качестве исходных веществ для синтеза три(мальтол)железа, хлорид трехвалентного железа, в водном растворе имеет уровень pH в интервале от 1 до 3, и хлорид двухвалентного железа имеет уровень pH в интервале от 3 до 5. Кроме того, имеющиеся в продаже растворы хлоридов железа имеют pH приблизительно 1, так как они стабилизированы добавлением соляной кислоты, чтобы предотвратить осаждение гидроксида железа.
В настоящем изобретении подтверждается, что мальтол практически не растворим при этих низких уровнях pH и имеет ограниченную растворимость при растворении в воде в интервале pH 6-8. Максимальная растворимость в воде составляет 1 г / 100 мл при 20°С. Однако растворимость мальтола может быть увеличена до 10 г / 100 мл путем нагревания до температур, близких к температурам кипения. Мальтол стабилен в водных растворах при этих температурах, и это свойство используют в примере 4 для синтеза три(мальтол)железа. При низких уровнях pH три(мальтол)железо не является предпочтительным продуктом из-за диспропорционирования.
Для получения значительных количеств три(мальтол)железа, используя стехиометрическое отношение соли железа к гидроксипирону, равное 1:3, конечный pH раствора должен превышать 7, так как при более низком pH существуют ди(мальтол)железо и моно(мальтол)железо. Поэтому изучали два способа повышения pH: (1) с помощью карбоната натрия 2) с помощью гидроксида натрия. Другие гидроксиды щелочных металлов такие как гидроксид калия, могли бы использоваться. Было показано, что нейтрализация карбонатом натрия менее предпочтительна из-за образования CO2.
Настоящее исследование привело к усовершенствованному синтезу три(мальтол)железа.
Пример 2
Мальтол растворяют в водном растворе гидроксида натрия и мальтолжелезо осаждают, добавляя хлорид трехвалентного железа.
Ввиду некоторых трудностей, проявившихся в примере 1, и того факта, что мальтол хорошо растворим в водном растворе гидроксида щелочного металла, было решено изменить методику.
Первоначальная работа, в которой использовали этот способ получения, показала, что достигается выход 90%. Различные рабочие параметры были затем оптимизированы и в следующей ниже методике излагается окончательный вариант способа, который был выбран. При этом достигается выход 95%.
Точно измеренную массу таблеток гидроксида натрия (20 г) растворяют в дистиллированной воде, получая раствор с pH 13,50. К полученному водному раствору NaOH добавляют эквимолярное количество мальтола (63 г) и получают прозрачный раствор желтого цвета с pH 11,6. Практически сразу же к этому раствору медленно добавляют стехиометрическое количество хлорида трехвалентного железа (45 г), получая pH 7,1, и образуется осадок красного цвета, который затем выделяют на воронке Бюхнера в вакууме. Затем осадок сушат при 40°С в вакууме.
Добавление раствора мальтола в гидроксиде натрия к хлориду трехвалентного железа, как в способе 1, не является предпочтительным, так как оно дает не отвечающий техническим требованиям продукт, смолы и черный осадок.
Мальтол хорошо растворим в водных растворах гидроксидов щелочного металла и дает желтый раствор. Концентрация раствора гидроксида предпочтительно не превышает 20%.
Этот способ является выгодным, так как делает возможным получение только одного побочного продукта, а именно гидроксида трехвалентного железа Fe(ОН)3, на образование которого расходуется некоторая часть железа, предназначенного для образования комплекса с мальтолом. Это не легко измерить в присутствии мальтолжелеза, и поэтому следующий ниже способ используют для измерения гидроксида трехвалентного железа.
Fe(OH)3 не растворяется в этаноле и поэтому продукт мальтолжелезо растворяют в этаноле. Показано, что небольшие количества Fe(ОН)3 могут присутствовать в партиях мальтолжелеза, синтезированных в соответствии с примером 2.
Принимая во внимание предельные величины из описания в одном варианте осуществления изобретения, количество Fe(ОН)3, содержащегося в активном веществе, не может превышать 2 мас.% Учитывая его известные инертные характеристики, уровень этого соединения надлежащим образом регулируется, и окончательное описание, включающее регулируемый гидроксид трехвалентного железа, должно быть приемлемым.
Материальный баланс для мальтола и железа составил 99%.
Используя этот способ получения, получают мальтолжелезо с выходом 95%.
Пример 3
Мальтол растворяют в водном растворе карбоната натрия и после добавления хлорида трехвалентного железа осаждают мальтолжелезо.
Точно измеренную массу карбоната натрия (Na2CO3) (53 г) растворяют в дистиллированной воде, получая раствор с pH=11,5. Эквимолярное количество мальтола (65 г) добавляют к этому водному щелочному раствору, получая густой кремообразный окрашенный раствор с pH=9,9. К этому раствору добавляют по каплям стехиометрическое количество раствора хлорида трехвалентного железа до pH 8,00. Добавляют дополнительно 15 г Na2CO3 к этому раствору, увеличивая pH до 9,00. Затем добавляют остаток раствора хлорида трехвалентного железа, получая раствор с pH=8,77 и появляется осадок, окрашенный в красный цвет.
Осадок выделяют, используя воронку Бюхнера в вакууме. Затем осадок сушат при 40°С в вакууме. Выделение CO2 во время реакции делает рассматриваемый способ менее желательным из-за образования пены на поверхности. Конечный продукт представляет собой гелеобразное твердое вещество (когда находится во влажном состоянии), и, следовательно, на удаление влаги во время сушки может потребоваться много времени. Способ, возможно, не является предпочтительным, но полученное соединение три(мальтол)железо может соответствовать требованиям.
Пример 4
Мальтол растворяют в воде и нагревают почти до температуры кипения и добавляют хлорид трехвалентного или двухвалентного железа, получая смесь 1:1/1:2 комплексов трехвалентного железа с мальтолом. Раствору дают охладиться и добавляют к мальтолу, растворенному в гидроксиде натрия.
Стадия 1
В зависимости от требуемого размера партии, хлорид трехвалентного железа медленно добавляют к раствору мальтола в воде при pH 6-7. Растворимость мальтола сильно увеличивается до 10 г / 100 мл при нагревании до температур выше 60°С. Добавление хлорида трехвалентного железа или хлорида двухвалентного железа, мониторинг pH раствора и поддерживание pH>3 дает главным образом ди(мальтол)железо, но очень немного три(мальтол)железа. При pH больше 3, гидроксид трехвалентного железа, по-видимому, не образуется. Продукты мономальтолжелезо и ди(мальтол)железо с гидрокси- или хлорид-анионами, обеспечивающими нейтрализацию заряда, хорошо растворимы и концентрированный раствор с концентрацией, превышающей 30 г/100 мл, может быть получен. Чтобы получить правильную стехиометрию для образования три(мальтол)железа, требуется дополнительное количество мальтола и необходимо корректировать pH до уровней выше 7.
Безводный хлорид двухвалентного или трехвалентного железа или 126 г или 162 г, соответственно, в 200 мл воды можно прибавить к литру воды, содержащей 120 г мальтола. Это соотношение железа и мальтола не обеспечивает достаточного количества мальтола для получения значительных количеств три(мальтол)железа, которое не осаждается на этой стадии.
Стадия 2
Мальтол в щелочном растворе описан как изложено выше. Так как растворы мальтола до 20% в растворе гидроксида натрия имеют pH около 11,6, смешивание этого раствора с растворами мономальтол/димальтол железа из стадии 1 дает осадок три(мальтол)железа, который имеет бордово-красный цвет и высокую чистоту, как определено УФ спектроскопией. Фильтрат дает продукт, который соответствует стандартам GMP (Good Manufacturing Process). Хлорид натрия, который генерируется в этом способе, обнаруживают в надосадочной жидкости, так как его растворимость намного выше (35 г / 100 мл) растворимости три(мальтол)железа. Небольшие количества хлорида натрия в три(мальтол)железе можно уменьшить промыванием в воде, если требуется.
Неожиданная дополнительная особенность исследования явилась результатом работы по хлориду двухвалентного железа. Хлорид двухвалентного железа может быть замещен на стадии 1 с образованием ди(мальтол)железа, так как было показано, что мальтол автоокисляет двухвалентное железо в трехвалентное во время процесса комплексообразования. Один аспект настоящей работы, который рассматривается как потенциально очень полезный, если требуются партии большего размера, обусловлен тем, что хлорид двухвалентного железа является более слабой кислотой Льюиса, чем хлорид трехвалентного железа, и pH исходного раствора больше 3. Поэтому риск образования гидроксида трехвалентного железа в этом случае ниже, чем в случае применения хлорида трехвалентного железа в более высоких концентрациях.
Хлориды двухвалентного и трехвалентного железа в растворе или в виде твердого вещества можно добавлять к щелочному раствору мальтола в растворе гидроксида натрия, объединяя стадии 1 и 2. Обеспечивая небольшой избыток мальтола до примерно 10% получают осадок три(мальтол)железа с небольшим количеством мальтола. Такой препарат был бы удовлетворительным в качестве продукта - три(мальтол)железа, соответствующего стандартам GMP.
Реферат
Изобретение относится к новому способу получения соединения три(гидроксипирон) трехвалентного железа, включающему взаимодействие гидроксипирона с некарбоксилатной солью железа в водном растворе и осаждение соединения тригидроксипирон трехвалентного железа из водного раствора, имеющего рН больше 7, в котором гидроксипирон находится в водном растворе, содержащем основание, к которому добавляют некарбоксилатную соль, или в котором гидроксипирон добавляют к воде, воду нагревают, некарбоксилатную соль добавляют к нагретой воде и полученный раствор объединяют с водным щелочным раствором, содержащим гидроксипирон, и в котором гидроксипирон выбирают из мальтола, этилмальтола и их смесей. Технический результат: способ позволяет отказаться от применения органических растворителей в способе, и/или исключить существовавшие ранее примеси, и/или увеличить выход соединения трехвалентного железа и гидроксипирона, и/или уменьшить общее количество растворителя, необходимого для реакции. 12 з.п. ф-лы, 4 пр.
Формула
Документы, цитированные в отчёте о поиске
Комплекс железа

Комментарии