Производные арилциклоалкиламинов, нейропротектор (варианты), вещество, обладающее сочетанным нейропротекторным, анальгетическим и антидепрессивным действием, фармацевтические композиции на его основе - RU2637928C2
Код документа: RU2637928C2
Описание
Изобретение относится к области фармацевтической химии, а именно, к новым органическим соединениям, проявляющим нейропротективные свойства, фармацевтическим композициям на их основе, обладающим нейропротекторными свойствами для лечения нейродегенеративных заболеваний, депрессии и боли.
Точнее, изобретение относится к производным арилциклоалкиламинов, а именно к солям и гидратам производных арилциклоалкиламинов общей формулы (I):

где R1, R2: Н, линейный или разветвленный алкил (C1÷C4), линейный или разветвленный алкокси (C1÷C4), галоген;
Y: -СН2-O-СН2-, -(СН2)n-, где n: 1-3;
X: -CO-NH-(CH2)6-, -CO-(CH2)k-, -CH2-NH-(CH2)6-, -CH(CH3)-NH-(CH2)6-, -(CO)p-(CHR5)m-(CH2)n-, где p, m, n: 0, 1, k: 4-7, R5: H, линейный алкил C1-C5;
R3, R4: H, линейный алкил C1-C4, -CH2-C≡CH, -(CH2)2-O-(CH2)2-NH2, циклопропил, циклопропилметил; 4-пиридинил, аминокислотный остаток ациклической или ароматической протоионогенной α-аминокислоты, пролина, γ-аминомасляной кислоты, ε-аминокапроновой кислоты, β-аланина; -CHR6-CH2-O-R7, где R6: Н или линейный или разветвленный алкил С1-С4, бензил, R7: Н, линейный алкил С1-С4, R3, R4 вместе с азотом, к которому присоединены, образуют пирролидиновый, 2-(гидроксиметил)пиролидиновый, 4-аминопиридиниевый цикл; G: низкомолекулярная (С1-С4) карбоновая или минеральная кислота или вода.
Нейродегенеративные заболевания представляют собой заболевания, затрагивающие головной и спинной мозг, периферическую и автономную нервные системы, нервно-мышечную функцию и мышцы. В частности, к нейродегенеративным заболеваниям относят эпилепсию, болезнь Паркинсона, цереброваскулярные заболевания, инсульт, болезнь Альцгеймера и другие деменции, рассеянный склероз, мигрень, травму головного мозга и т.д. Эта группа заболеваний являются широко распространенной, резко ухудшающей качество и продолжительность жизни пациентов. [WHO Press. Neurological disorders: public health challenges, 2007; Neurological and Psychiatric Disorders. Ed. Frank I. Tarazi and John A. Schetz, Humana Press Inc., 2005].
Развитие нейродегенеративного заболевания в каждом конкретном случае имеет свои особенности. Однако во всех случаях заболевание связано с повреждением и апоптозом клеток нервной ткани, гиперактивацией нейронов, нарушением синаптической передачи, функциональной активности нейромедиаторов и ферментных систем и приводит к ухудшению функционирования как нервной системы в целом, так и других систем и органов.
Применение для лечения этой группы заболеваний нейропротективных средств направлено на снижение повреждений нейронов головного мозга, а также на уменьшение патофизиологических и биохимических нарушений в нервной клетке [Pierre Sokoloff.. Levomilnacipran drug for functional rehabilitation after an acute neurological stroke, WO 2013014263 A1; Stacey E. Seidl and Judith A. Potashkin. The promice of neuroprotective agents in Parkinson disease. Front Neurol. 2011. 2, Art. 68]. Лечение каждого из заболеваний этой группы достаточно специфично.
Так, наиболее распространенным препаратом для терапии болезни Паркинсона является леводопа [Merims D, Giladi N. "Dopamine dysregulation syndrome, addiction and behavioral changes in Parkinson's disease". Parkinsonism Relat Disord. 2008, 14 (4): 273-280]. Леводопа проникает через гематоэнцефалический барьер, является источником дофамина. Однако леводопа подвергается декарбоксилированию и метилированию в периферических тканях, что значительно снижает ее уровень в головном мозге. Поэтому в клинике применяются препараты подавляющие активность ДОФА-декарбоксилазы и ингибиторы катехоламин-О-метилтрансферразы, ключевого фермента в биохимическом превращении катехоламинов - Синемет, Мадопар, Толкапон, Энтакапон [Goldenberg MM. "Medical management of Parkinson's disease". P&T, 2008, 33(10): 590-606].
Недостатком применения леводопы является развитие леводопа-индуцированной дискинезии, а также то, что ее использование не подавляет весь комплекс симптомов болезни Паркинсона [Е. Manfred; P. Riederer, D. Scheller. Mechanisms underlying and medical management of L-Dope-associated motor complications. J. of Neural Transmission, December 2011, 118 (12): 1659-1660; Cenci MA. Presynaptic Mechanisms of 1-DOPA-Induced Dyskinesia: The Findings, the Debate, and the Therapeutic Implications. Front Neurol, 2014, 5: 242; Heky MA et al. SydneyMulticenter Study of Parkinson disease: non-L-dopa-responsive problems dominate at 15 years. Movement Disorders, 2005, 20: 190-199]. Компенсацию дефицита дофамина при болезни Паркинсона также обеспечивают дофаминовые агонисты: Адартрель, Мирапекс [Kvernmo Т,

Течение эпилепсии в значительной мере обусловлено повышением активности глутаматергической системы, нарушением активности ГАМК-ергической системы головного мозга. Это объясняет использование антиконвульсантов, снижающих активность глутаматергической системы, соединений, повышающих активность ГАМК-ергической системы мозга и потенциал-зависимых натриевых и кальциевых каналов, ограничивая тем самым проведение нервного импульса, таких, как Вальпроат, Фенитоин, Фенобарбитал, Бензодиазепины, Вигабатрин, Габапентин, Карбамазепин [Meldrum BS, Rogawski MA. Molecular targets for antiepileptic drug development. Neurotherapeutics. 2007; 4:18-61]. Однако тормозное действие препаратов на центральную нервную систему приводит к сонливости, астении, головокружению, снижению памяти, ослаблению когнитивных функций (Болдырева С.Р., Ермаков А.Ю. Побочные действия антиэпилептических препаратов. Медицинский Совет. 2008. №9-10).
При терапии эпилепсии используют препараты, увеличивающие активность ГАМК-ергической системы головного мозга, снижающие активность глутаматергической системы. Терапия направлена на подавление судорог, формирование устойчивой ремиссии, однако терапевтическое воздействие на ГАМК-ергическую систему не устраняет, а даже усугубляет многие проявления болезни, например, усиливает депрессию, нарушает когнитивную функцию, вызывает суицидальный синдром [J. Christensen et al. Prenatal Valproate Exposure and Risk of Autism Spectrum Disorders and Childhood Autism JAMA. 2013; 309(16):1696-1703].
Известно использование для лечения нейродегенеративных заболеваний ингибиторов ацетилхолинестеразы (Ache), в частности - Допенезила [Birks J, Harvey RJ (2006). Birks, Jacqueline, ed. "Donepezil for dementia due to Alzheimer's disease". Cochrane Database Syst Rev, 2006, (1): CD001190; S.J. Shimshok et all, Isatin derivatives as acetylcholinesterase inhibitors and analgesics. US 6100276; N. Shakya et all, Substituted carbamic acid quinolin-6-yl esters useful as acetylcholinesterase inhibitors. UD 7655801; S.R. McHardlt et all, oximes for treatment of peripheral and central nervous system explore to acetylcholinesterase inhibitors. US 8653108]. Однако эти препараты не эффективны при лечении деменции у больных на поздней стадии заболевания. Побочные эффекты и невысокая терапевтическая эффективность ингибиторов Ache ограничивают их применение.
Гиперактивация глутаматергической системы, характерная для нейродегенеративных заболеваний (деменция, болезнь Паркинсона (БП), болезнь Альцгеймера (БА), инсульт, рассеянный склероз, шизофрения, эпилепсия и т.п.), приводит к нарушению синаптической пластичности, дисфункции нейронов, деполяризации мембран клеток и т.д, что в итоге усиливает нейродегенерацию и нарушение когнитивных функций [Zukin, S.R. and Javitt, D.C. The NMDA-PCP theory of schizophrenia: implications of receptor interactions. Biol. Psychiatry 27: 91A, 1990; A. Lau, M. Tymianski. Glutamate receptors, neurotoxicity and neurodegeneration. Eur. J. Physiol, 460, 525-542, 2010; Choi, D.W. and Rothman, S.M. The role of glutamate neurotoxicity in hypoxic-ischemic neuronal death. Annu Rev Neurosci. 13: 171-182, 1990]. Сказанное объясняет использование антагонистов НМДА-рецепторов при лечении нейродегенеративных заболеваний [Crosby, N.J. et all, (2003). Clarke, Carl E. ed. "Amantadine in Parkinson's disease". Cochrane Database of Systematic Reviews] и мемантина [Arsland, D. et all, E. Jul. Memantine in patients with Parkinson's disease dementia or dementia with Lewy bodies: a double-blind, placebo-controlled, multicentre tria. Lancet neurology 8 (7): 613-8, 2009; Reisberg B. et all, Memantine Study Group.Memantine in moderate-to-severe Alzheimer's disease. New Engl. J. Med. 348(14): 1333-41, 2003].
Побочными действиями известных НМДА-антагонистов являются головокружение, тошнота, головная боль узкий тепапевтический интевал, что делают целесообразной разработку более безопасных и эффективных веществ с указанным механизмом действия [D.J. Liotta et all, NMDA receptor antagonists for neuroprotection. US 9079852; A. Adejare, Non competitive NMDA receptor antagonists. US 8703799; H. Furukawa, Phenylethanolamine-based NMDA receptor antagonists. US 8648198; R.J. Deorazio et all, Cyclohexylamine derivative as subtype selective NMDA receptor antagonist. US 6919377].
Таким образом, недостатками препаратов, используемых при лечении нейродегенеративных заболеваний, являются их невысокая эффективность, многочисленные побочные эффекты, связанные с появлением нейромедиаторного дисбаланса в центральной нервной системе и действием препаратов на вегетативную нервную систему.
В этой связи вызывают интерес производные арилциклоаминов, незначительное изменение химической структуры которых приводит к существенному изменению спектра их биологической активности. Так, арилциклоалканполиалкиламины и их фармацевтически приемлемые соли общей формулы:
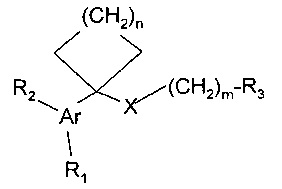
где Ar: арил; R1, R2: H, ОН, низший алкил, циклоалкил, алкокси, нитрогруппа, тиогруппа или галоген; X: нуль, эфир, тиоамид, тиокетон, тиоэфир; R3: морфолин; n: 2-5; m: 0-5, предложены в качестве антипсихотических, антиамнезических и антиишемических агентов [US 5086054]. Активность этой группы веществ обусловлена способностью минимизировать дисфункцию сигма-рецепторов ЦНС.
Аминопроизводные 1-фенилциклоалкил карбоновой кислоты [S.N. Calderon et all, J. Med. Chem. 1991, 3159-3164] проявляют антиконвульсантную активность, производные 1-фенилциклоалкил карбоновой кислоты предложены для лечения БА и рассеянного склероза [US 2015/0065567 А1].
В работе И.М. Федоровой [И.М. Федорова и др. Ж. эволюц. биохим. и физиол., 44, №6, 556-562, 2008] описано производное арилциклоалкиламинов следующей формулы:
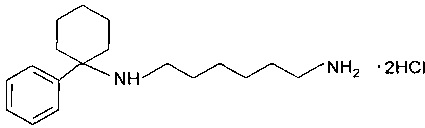
Соединение изучено in vitro в качестве блокатора NMDA и АМРА рецепторов. Однако данных о нейропротективным воздействии данного соединения на организм in vivo в проанализированной литературе не выявлено. Вместе с тем, проведенные сравнительные эксперименты показали, что нейропротективный эффект при использовании данного соединения невысокий.
Наиболее близкими к заявляемым веществам являются арилциклоамины общих формул А и С [US 7132551]:

где X: С(R3)2, О, S, SO, SO2, NR2, NC(O)R7, NC(O)OR2, NS(O)2R7, C=O; Z: C(R3)2, C(O), O, NR, NC(O)OR, S, SO, SO2; m: 1-5; n: 1-2; p: 0-3; у: 0-2; R: H, алкил, циклоалкил, арил, гетероарил, аралкил, гетероаралкил; R1: Н, алкил, арил, гетероарил, аралкил, гетероаралкил; R, R1 могут соединяться ковалентной связью; R2: Н, алкил, фторалкил, арил, гетероарил, циклоалкил; R4: Н, алкил, циклоалкил, арил, гетероарил, алкенил, OR; R5, R6: Н, алкил, (СН2)pY, арил, гетероарил, F, OR2 и OC(O)R2, или CR5R6 равен С(О); R7: алкил, циклоалкил, арил, гетероарил, аралкил, гетероаралкил; R8, R9: Н, алкил, (CH2)pY, арил, гетероарил, F, OR2 и OC(O)R2, или CR8R9 равен С(О); Y: OR2, N(R2)2, SR2, S(O)R2, S(O)2R2, P(O)(OR2)2; любые R2могут быть ковалентно связаны; R4 и R5, R4 и R6, R8 и R9 могут быть ковалентно связаны; А и С являются стереоизомеров. В веществе общей формулы A R3: Н, алкил, арил, OR2, OC(O)R2, CH2OR2 или CO2R2, любые R3 могут быть ковалентно связаны мостиком, состоящим из 1-4 атомов углерода. В веществе общей формулы С, R3: Н, алкил, арил, OR2, OC(O)R2, CH2OR2 или CO2R2.
Данные вещества действуют как лиганды рецепторов и транспортеров моноаминов, ингибируют обратный захват моноаминов, усиливают двигательную активность экспериментальных животных. Однако вещества мало перспективны для лечения нейродегенеративных заболеваний, для которых характерны и нарушения глутаматной или холинергической систем (паркинсонизм, деменция, депрессия). Влияние веществ на функции других нейромедиаторов и рецепторов ЦНС не подтверждены.
Технической задачей, решаемой авторами, являлось создание новых органических веществ, проявляющих нейропротективную активность, а также фармацевтических композиций для лечения нейродегенеративных заболеваний и сопутствующих заболеваний.
Технический результат в отношении новых соединений, обладающих нейропродуктивным действием, был достигнут путем получения производных арилциклоалкиламинов общей формулы (I)

где R1, R2: H, линейный или разветвленный алкил (С1÷C4) линейный или разветвленный алкокси (С1÷C4), галоген;
Y: -СН2-O-СН2-, -(СН2)n-, где n: 1-3;
X: -CO-NH-(CH2)6-, -CO-(CH2)k-, -CH2-NH-(CH2)6-, -CH(CH3)-NH-(CH2)6-, -(CO)p-(CHR5)m-(CH2)n-, где p, m, n: 0, 1, k: 4-7, R5: H, линейный алкил С1-С5;
R3, R4: H, линейный алкил C1-C4, -CH2-C≡CH, -(CH2)2-O-(CH2)2-NH2, циклопропил, циклопропилметил; 4-пиридинил, аминокислотный остаток ациклической или ароматической протоионогенной α-аминокислоты, пролина, γ-аминомасляной кислоты, ε-аминокапроновой кислоты, β-аланина; -CHR6-CH2-O-R7, где R6: Н или линейный или разветвленный алкил С1-С4, бензил, R7: Н, линейный алкил C1-C4, R3, R4 вместе с азотом, к которому присоединены, образуют пирролидиновый, 2-(гидроксиметил)пиролидиновый, 4-аминопиридиниевый цикл; G: (С1-С4) карбоновая или минеральная кислота или вода.
В качестве α-аминокислоты производные арилциклоалкиламинов общей формулы (I) и (II) могут содержать остатки ациклической или ароматической протеиногенной α-аминокислоты, такие, как L-аланин, L-аспарагиновая кислота, L-глутамин, L-глицин, L-лейцин, L-тирозин, L-фенилаланин, L-тирозин и т.п.
В качестве (С1-С4) карбоновой кислоты производные арилциклоалкиламинов общей формулы (I) и (II) могут содержать уксусную, фумаровую, янтарную, винную, яблочную, малеиновую кислоты, а в качестве минеральной - соляную, фосфорную, серную и т.п. кислоты.
Синтез производных арилциклоалкиламинов проводится стандартными методами органического синтеза с использованием коммерчески доступных реагентов. Степень завершения реакций контролировали методом ТСХ на пластинах Merck "TLC Silica gel 60 F254" в системах элюентов: бензол-метанол (20:1); этилацетат-триэтиламин (100:1); гексан-бензол (2:1); гексан-этилацетат (4:1); этилацетат-бензол (1:10); гептан-этилацетат (1:3); гептан-ацетон (25:1).
Подлинность производных арилциклоалкиламинов общей формулы (I) подтверждена методами ЯМР-спектроскопии и масс-спектрометрии. Спектры ЯМР1Н и13С записаны на приборе Bruker DPX 300 (Германия) (300 и 75 МГц, соответственно) для растворов в CDCl3, DMSO-d6 или D2O, внутренние стандарты - сигналы остаточных протонов для1Н (7,26 м. д., 2,50 м. д. и 4,70 м. д., соответственно) и сигналы атомов углерода растворителя для13С (77,16 м. д. и 40,52 м.д.). Константы спин-спинового взаимодействия (J) в протонных спектрах измеряли в приближении первого порядка. Масс-спектры измерены на приборе Bruker AmaZon (Германия), ионизация по методу электроспрей. Температуры плавления определяли на приборе ПТП-М (Россия). Чистота веществ определена методом ЯМР1Н и ОФ ВЭЖХ. Содержание основного вещества составляло не менее 98%.
Производные арилциклоалкиламинов общей формулы (I), как показали проведенные эксперименты, проявляют нейропротективную активность, т.е. являются нейропротекторами.
Проведенные исследования показали, что в качестве нейропротектора, как вариант, наряду с соединением общей формулы (I) могут выступать более простые по структуре производные арилциклоалкиламинов общей формулы (II)

где Y: -СН2-O-СН2-, -(СН2)2-; X: -NH-(CH2)6NH2.
Данные соединения в литературе не описаны. Возможность рассмотрения соединений общей формулы (I) и (II) в качестве вариантов данной группы изобретений обусловлено наличием в их структуре общих функциональных групп, сочетание которых, по-видимому, обеспечивает их нейропротективную, антиамне-стическую и анальгетическую активность при действии на организм.
Дальнейшие проведенные фармако-биологические исследования in vivo на экспериментальных моделях показали, что соединения общей формулы (I) и (II) обладают не только нейропротективным воздействием на организм, но и воздействуют на сопутствующие негативные эффекты заболевания, то есть обладают воздействием, включающим нейропротективную, антидепрессантной и анальгетическую активность.
Соединения могут использоваться в качестве активного начала как самостоятельно, так и в смеси с другими биологически активными веществами. При этом в композицию могут дополнительно входить вспомогательные вещества, влияющие на физико-химические свойства используемых композиций.
В качестве дополнительных физиологически активных веществ могут быть использованы леводопа, пальмитоилэтаноламид, расагилин, рисперидон, толоксатон, кветиапин, гамма-аминомасляная кислота (ГАМК), натрия вальпроат, амитриптилин, кломепрамин, флуоксетин, пароксетин, сертралин, адреномиметики, например фенилэфрин, адреналин и т.п.
В качестве вспомогательных веществ в составе композиций для энтерального применения используют фармацевтически инертные вещества, улучшающие условия получения, хранения или применения фармацевтической композиции, такие как растворители, наполнители, связующие, разрыхлители, скользяще-смазывающие вещества, пленкообразователи, пигменты, вкусовые добавки, пластификаторы, пролонгирующие вещества, ароматизаторы, стабилизаторы, консерванты и т.п.
Например, в качестве наполнителей композиции может содержать вещества из группы, в которую входят сахара и их производные, соли магния, кросповидон, коповидоны, сахарин и его соли, соли натрия, соли калия, лимонная кислота и ее соли, янтарная кислота, тартаровая кислота или ее соли, протеиногенные аминокислоты и их производные, а в качестве связующих - сахарозу, эфиры целлюлозы, поливинилпирролидон, желатин, альгиновую кислоту или ее соли, шеллак, гуммиарабик, поливиниловый спирт, метакриловую кислоту и ее сополимеры, натрий карбоксиметилцеллюлозу.
В качестве разрыхлителей в композицию может натрий кроскармеллоза, крахмал кукурузный, крахмал кукурузный прежелатинизированный, кросповидон, кальциевая соль кроскармеллозы; в качестве скользящих-смазывающих веществ - натрий стеарилфумарат, кальция стеарат, магния стеарилфумарат, кальция стеарилфумарат, стеариновая кислота, коллоидная двуокись кремния, воск; в качестве пигмента - титана диоксид, тальк, соли железа, красители, каолин, в качестве пластификатора полисорбаты, глицерин и его эфиры, полиэтиленгликоль, пропиленгликоль, дибутилфталат, триэтилцитрат, триацетин, повидон, минеральные масла, растительные масла; в качестве ароматизирующих веществ - эфирные масла мяты, лимона, апельсина и т.п.
Фармацевтические композиции могут быть использованы для энтерального введения в виде таблеток, таблеток, покрытых оболочкой, капсул, драже, суспензий, растворов, порошков, порошков для приготовления растворов и пр., а для парентерального введения в виде растворов, порошков для приготовления растворов для парентерального введения, эмульсий, суспензий и т.п.
При выполнении композиции в форме таблетки, покрытой оболочкой, или в форме драже, в качестве покрытия используют эфиры целлюлозы, натрий карбоксиметилцеллюлоза и ее производные, повидоны, коповидоны, метакриловая кислота и ее сополимеры, сахароза, готовые смеси для покрытия, содержащие в составе целлюлозу и ее эфиры, повидоны, сополимеры винилпирролидона с винилацетатом, шеллак, желатин, ксантановая камедь, гуммиарабик, альгиновая кислота и ее соли.
Композиции для парентерального введения могут быть получены в виде порошка, например, лиофильзованного порошка, для приготовления раствора для парентерального введения (раствор для инъекций или инфузий), В состав таких композиций могут входить вспомогательные вещества, обеспечивающие пористость и форму порошка, улучшающего его растворимость и обеспечивающие стабильность при хранении, например аргинин, глицин или его эфиры, лимонная кислота и ее соли, янтарная кислота и ее соли, полиолы, бензойная кислота и ее соли, аскорбиновая кислота и т.п.
Разведение композиций, представляющих собой порошок, с целью получения растворов для парентерального, проводится непосредственно перед введением, для чего используются стерильные апирогенные растворители - вода, физраствор, маннитола раствор для инфузий 15%, раствор глюкозы, раствор магния сульфата, раствор Рингера, растворы аминокислот для парентерального питания и т.п. Разведение порошков для энтерального введения проводится водой.
Композиции для парентерального введения могут быть получены в виде раствора, содержащего в качестве физиологически активного вещества производные арилциклоалкиламинов общей формулы (I), или их смеси с одним или более других физиологически активных веществ. В качестве вспомогательных веществ такие композиции содержат воду и, например, декстрозу, хлорид натрия, смесь декстрозы и хлорида натрия, лимонную кислоту и ее соли, янтарную кислоту и ее соли, соли магния, вспомогательный растворитель, например, полиэтиленгликоль, хелатирующий агент, например, натриевую соль этилендиаминтетрауксусной кислоты, солюбилизатор, например, циклодекстрин, маннитол, консервант, например, нипагин, нипазол, соли бензойной кислоты, антиоксидант, например, аскорбиновую кислоту, натрия метабисульфит и т.п.
Физиологически активные вещества в составе фармацевтических композиций проявляют эффективность в широком интервале доз, и вводятся в терапевтически эффективном количестве с учетом данных о пациенте, способе введения композиции, курсе введения и т.п. Суточная доза может быть введена в виде однократной дозы или в виде раздельных доз.
Лечение нейродегенеративных заболеваний с помощью заявляемых композиции, как правило, проводят путем энтерального или парентерального введения лекарственного средства.
Энтерально средство вводят в организм физиологически активного вещества в виде таблеток, таблеток, покрытых оболочкой, драже, капсул, раствора, порошков или гранул при содержании производных арилциклоалкиламинов от 0,001 до 0,100 г в одной дозе. При этом при введении их с другими физиологически активными веществами содержание производных арилциклоалкиламинов во вводимой дозе должно составлять не менее 0,001 г. Курс применения таких фармацевтических композиций может составлять от нескольких недель до нескольких месяцев и более.
Парентерально лечение осуществляют в виде инъекций или инфузий при суточной дозе от 0,005 г до 0,100 г и содержании активного вещества от 0,001 до 0,05 г на одну дозу. Разведение композиций апирогенными растворителями с целью получения растворов для внутривенных инъекций и/или инфузий проводится непосредственно перед введением. Полученный раствор вводят внутривенно инъекционно или путем внутривенной капельной инфузий, внутримышечно, подкожно. Курс парентерального применения фармацевтических композиций может быть от нескольких суток до нескольких месяцев и более.
Проведенные испытания показали, что заявляемые соединения перспективны для лечения таких заболеваний, как болезнь Паркинсона, деменция, инсульт, болезнь Альцгеймера, эпилепсия, шизофрения.
Примеры промышленного применения заявляемой группы изобретений представлены ниже. Сводные данные об отражении в примерах синтеза и использования отдельных соединений, имеющих различные функциональные группы, соответствующие формулам (I) и (I1), приведены в таблице 1.
Пример 1. Синтез 2-(диметиламино)-1-(1-фенилциклопентил)этан-1-он гидрохлорида

1-Фенилциклопентан-1-карбонитрил.
К кипящей суспензии гидрида натрия (10,6 г, 0,44 моль) в тетрагидрофуране (500 мл) при перемешивании, в течение 1,5 час, прикапывают смесь бензилцианида (23,43 г, 0,2 моль) и 1,4-дибромбутана (45,34 г, 0,21 моль). Смесь кипятят 18 час, охлаждают льдом, прикапывают воду (60 мл). Фазы разделяют, органическую фазу упаривают в вакууме, при температуре 50°C. Остаток растворяют в 250 мл гептана, промывают водой (3×50 мл), насыщенным раствором NaCl (25 мл), сушат над MgSO4, фильтруют и упаривают в вакууме при температуре 45°C. Остаток перегоняют в вакууме, собирают фракцию с Ткип.=113-117°C (5-6 мм.рт.ст.). Получают 1-фенилциклопентан-1-карбонитрил в виде бесцветного масла, 26,4 г (77%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,90-2,16 (6Н, м., c-C5H8); 2,46-2,56 (2Н, м., c-C5H8); 7,30-7,49 (5Н, м., Ph).
1-(1-Фенилциклопентил)этан-1-он.
К раствору 1-фенилциклопентан-1-карбонитрила (26,40 г, 0,154 моль) в 150 мл бензола прибавляют хлорид меди (I) (0,6 г, 0,006 моль), при температуре 60°C и перемешивании по каплям прибавляют раствор метилмагний йодида (0,31 моль) в диэтиловом эфире (103 мл), эфир отгоняют, остаток кипятят 18 час. Охлаждают реакционную смесь льдом с солью, при перемешивании прибавляют 900 мл 5% соляной кислоты, кипятят в течение 2 час, охлаждают. Фазы разделяют, водную фазу экстрагируют бензолом (3×75 мл), Экстракт промывают насыщенным раствором NaHCO3 (2×150 мл), насыщенным раствором NaCl (100 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 50°С. Остаток перегоняют в вакууме, собирают фракцию с Ткип.=93-98°С (5-6 мм.рт.ст.). Получают 1-(1-фенилцикло-пентил)этан-1-он в виде светло-желтого масла, 26,09 г (90%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,60-1,78 (4Н, м., c-C5H8); 1,86-1,98 (2Н, м., c-C5H8); 2,45-2,55 (2Н, м., c-C5H8); 1,95 (3Н, с., COCH3); 7,22-7,39 (5Н, м., Ph).
2-Бром-1-(1-фенилциклопентил)этан-1-он.
К раствору 1-(1-фенилциклопентил)этан-1-она (9,41 г, 0,05 моль) в 50 мл метанола при перемешивании и охлаждении прибавляют бром (8,0 г, 0,05 моль), перемешивают 2 час при комнатной температуре, прибавляют 30 мл воды. Смесь оставляют на 12 час, разбавляют 100 мл воды, экстрагируют хлористым метиленом (4×20 мл). Экстракт промывают насыщенным раствором NaHCO3 (2×25 мл), насыщенным раствором NaCl (25 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 50°C. Получают 2-бром-1-(1-фенилциклопентил)этан-1-он в виде желтого масла, 12,15 г (91%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,68-1,81 (4Н, м., c-C5H8); 1,93-2,05 (2Н, м., c-C5H8); 2,50-2,58 (2Н, м., c-C5H8); 3,90 (2Н, с., COCH2Br); 7,25-7,39 (5Н, м., Ph).
2-(Диметиламино)-1-(1-фенилциклопентил)этан-1-он гидрохлорид
В толстостенный реактор для работы под давлением помещают 2-бром-1-(1-фенилциклопентил)этан-1-он (10,7 г, 0,04 моль), диметиламин гидрохлорид (13,1 г, 0,16 моль) и 100 мл метанола, быстро прибавляют K2CO3 (45 г, 0,32 моль), реактор плотно закрывают, перемешивают 12 час при комнатной температуре. Содержимое переносят в колбу, упаривают в вакууме, при температуре 45°С. Остаток растворяют в 250 мл воды, прибавляют 50 мл 10% раствора KOH, экстрагируют бензолом (3×50 мл). Бензольный экстракт промывают водой (3×50 мл), экстрагируют 10% соляной кислотой (3×25 мл). Водный экстракт упаривают в вакууме, при температуре 45°С. Остаток обрабатывают кипящим диэтиловым эфиром (3×25 мл), высушивают в вакууме, при температуре 50°С, перекристаллизовывают из пропан-2-ола. Получают 2-(диметиламино)-1-(1-фенилциклопентил)этан-1-он гидрохлорид (бесцветные кристаллы), 7,82 г (73%), Тпл=142,9°С. Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,60-1,82 (4Н, м.); 1,90-2,06 (2Н, м., c-C5H8); 2,35-2,44 (2Н, м., с-С5Н8); 2,79 (3Н, с); 2,81 (3Н, с) (+NH(CH3)2); 3,92 (2Н, д., J=3,6, COCH2N+Н(CH3)2); 7,14-7,41 (5Н, м., Ph); 12,40 (1Н, ш.с.,+NH(CH3)2). Спектр ЯМР1Н (D2O), δ, м.д. (J, Гц): 1,45-1,67 (4Н, м.); 1,85-2,00 (2Н, м.); 2,22-2,38 (2Н, м.) (c-C5H8); 2,57 (6Н, с,+NH(CH3)2); 4,01 (2Н, с, COCH2N+Н(СН3)2); 7,19-7,38 (5Н, м., Ph). Спектр ЯМР13С (CDCl3), δ, м.д.: 23,9 (С-3, 4 c-C5H8); 34,6 (С-2, 5 c-C5H8); 43,0 (N(CH3)2); 59,2 (COCH2N); 64,9 (С-1 c-C5H8); 127,2 (С-3, 5 Ph); 128,4 (С-4 Ph); 129,8 (С-2, 6 Ph); 140,5 (С-1 Ph); 203,1 (СО). Масс-спектр: MH+ найдено - 232,10, МН+ вычислено - 232,17.
Пример 2. Синтез 2-(диметиламино)-1-(1-фенилциклогексил)этан-1-он гидрохлорида

1-Фенилциклогексан-1-карбонитрил
К кипящей суспензии гидрида натрия (10,6 г, 0,44 моль) в тетрагидрофуране (500 мл) при перемешивании в течение 1,5 час прикапывают смесь бензилцианида (23,43 г, 0,2 моль) и 1,5-дибромпентана (48,30 г, 0,21 моль), кипятят 15 час, охлаждают льдом, прикапывают воду (60 мл). Фазы разделяют, органическую фазу упаривают в вакууме, при температуре 50°С. Остаток растворяют в 250 мл гептана, промывают водой (3×50 мл), насыщенным раствором NaCl (25 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 50°С. Остаток перегоняют в вакууме, собирают фракцию с Ткип.=124-130°С (5-мм.рт.ст.). Получают 1-фенилциклогексан-1-карбонитрил в виде светло-желтого масла, 23,29 г (63%). Спектр ЯМР1H (CDCl3), δ, м.д. (J, Гц): 1,20-1,37 (1Н, м., c-C6H10); 1,74-1,93 (7Н, м., с-С6Н10); 2,12-2,23 (2Н, м., с-С6Н10); 7,30-7,45 (3Н, м., Ph); 7,48-7,56 (2Н, м., Ph).
1-(1-Фенилциклогексил)этан-1-он
К раствору 1-фенилциклогексан-1-карбонитрила (9,26 г, 0,05 моль) в 50 мл бензола прибавляют хлорид меди (I) (0,2 г, 0,002 моль), при температуре 60°С и перемешивании по каплям, прибавляют раствор метилмагний йодида (0,1 моль) в диэтиловом эфире (35 мл, 3М раствор), эфир отгоняют, остаток кипятят 12 час. Реакционную смесь охлаждают льдом с солью, прибавляют 300 мл 5% соляной кислоты, кипятят в течение 2 час, охлаждают. Фазы разделяют, водную фазу экстрагируют бензолом (3×25 мл), экстракт объединяют с органической фазой, промывают насыщенным раствором NaHCO3 (2×50 мл), насыщенным раствором NaCl (30 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 50°С. Получают 1-(1-фенилциклогексил)этан-1-он в виде светло-желтого масла, 9,91 г (98%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,27-1,38 (1Н, м., c-C6H10); 1,43-1,71 (5Н,м., с-С6Н10); 1,78-1,95 (2Н, м., c-C6H10); 2,28-2,41 (2Н, м., с-С6Н10); 1,91 (3Н, с., COCH3); 7,22-7,39 (5Н, м., Ph).
2-Бром-1-(1-фенилциклогексил)этан-1-он
К раствору 1-(1-фенилциклогексил)этан-1-она (10,1 г, 0,05 моль) в 50 мл метанола при перемешивании и охлаждении прибавляют бром (8,0 г, 0,05 моль). Перемешивают при комнатной температуре 2 час, прибавляют 30 мл воды. Смесь оставляют на 12 час, разбавляют 100 мл воды, экстрагируют хлористым метиленом (4×20 мл). Экстракт промывают насыщенным раствором NaHCO3 (2×25 мл), насыщенным раствором NaCl (25 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 40°С. Получают 2-бром-1-(1-фенилциклогексил)этан-1-он в виде желтого масла, 13,50 г (96%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,20-1,43 (1Н, м., c-C6H10); 1,45-1,73 (5H, м., с-С6Н10); 1,75-2,02 (2Н, м., с-С6Н10); 2,25-2,42 (2Н, м., c-C6H10); 3,88 (2Н, с., COCH2Br); 7,23-7,42 (5Н, м., Ph).
2-(Диметиламино)-1-(1-фенилциклогексил)этан-1-он гидрохлорид
В толстостенный реактор для работы под давлением помещают 2-бром-1-(1-фенилциклогексил)этан-1-он (11,2 г, 0,04 моль), диметиламина гидрохлорид (13,1 г, 0,16 моль) и 100 мл метанола, быстро прибавляют K2CO3 (45 г, 0,32 моль), плотно закрывают. Суспензию перемешивают 12 час при комнатной температуре, переносят в колбу, упаривают в вакууме, при температуре 50°С. Остаток растворяют в 250 мл воды, прибавляют 50 мл 10% раствора KOH, экстрагируют бензолом (3×50 мл). Органический экстракт промывают водой (3×50 мл), экстрагируют 10% соляной кислотой (3×25 мл). Водный экстракт упаривают в вакууме, при температуре 45°С. Остаток перекристаллизовывают из пропан-2-ола. Получают 2-(диметиламино)-1-(1-фенилциклогексил)этан-1-он гидрохлорид в виде бесцветных игольчатых кристаллов, 8,90 г (79%), Тпл=143,1°С. Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,31-1,71 (6Н, м.); 1,84-1,97 (2Н, м., c-C6H10); 2,25-2,36 (2Н, м. с-С6Н10); 2,77 (3Н, с); 2,78 (3Н, с) (+NH(CH3)2); 3,86 (2Н, с, COCH2N+Н(CH3)2); 7,20-7,42 (5Н, м., Ph); 12,36 (1Н, ш.с.,+NH(CH3)2). Спектр ЯМР13С (CDCl3), δ, м.д.: 23,0 (С-3, 5 с-С6Н10); 25,7 (С-4 с-С6Н10); 32,8 (С-2, 6 с-С6Н10); 43,4 (N(CH3)2); 55,8 (COCH2N); 60,2 (С-1 с-С6Н10); 127,0 (С-3, 5 Ph); 128,1 (С-4 Ph); 129,7 (С-2, 6 Ph); 139,7 (С-1 Ph); 203,6 (CO). Масс-спектр: МН+ найдено - 246,14, МН+ вычислено - 246,19.
Пример 3. Синтез 2-(диэтиламино)-1-(1-фенилциклопентил)этан-1-он гидрохлорида

В колбе с обратным холодильником, защищенным от влаги, смешивают 2-бром-1-(1-фенилциклопентил)этан-1-он (8,00 г, 0,03 моль), полученный по примеру 1, диэтиламин (3,3 г, 0,045 моль) и K2CO3 (6,22 г, 0,045 моль) в 20 мл метанола. Суспензию перемешивают 12 час при комнатной температуре, упаривают в вакууме, при температуре 45°С. Остаток растворяют в 50 мл воды, прибавляют 10 мл 20% раствора KOH, экстрагируют диэтиловым эфиром (3×25 мл). Экстракт промывают водой (3×25 мл), экстрагируют 10% соляной кислотой (3×25 мл). Водный экстракт упаривают в вакууме, при температуре 50°С. Остаток кристаллизуют в смеси пропан-2-ола и н-гептана (1:3), высушивают в вакууме при температуре 50°С Получают 2-(диэтиламино)-1-(1-фенилциклопентил)этан-1-он гидрохлорид в виде бесцветных кристаллов, 4,19 г (47%), Тпл=148,5°C. Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,13 (6Н, тр, J=7,3, N+H(CH2CH3)2); 1,54-1,83 (4Н, м.); 1,88-2,07 (2Н, м.); 2,40-2,54 (2Н, м.) (c-C5H8); 3,23 (4Н, кв, J=7,3, N+H(CH2CH3)2); 3,90 (2Н, д., J=2,9, COCH2N+H(C2H5)2); 7,21-7,44 (5Н, м., Ph); 12,15 (1Н, ш.с,+NH(C2H5)2). Спектр ЯМР13С (CDCl3), δ, м.д.: 10,1 (N+H(CH2CH3)2); 23,7 (С-3, 4 с-C5H8); 34,5 (С-2, 5 c-C5H8); 48,8 ((N+Н(СН2СН3)2); 51,1 (COCH2N); 65,1 (С-1 c-C5H8); 127,1 (С-3, 5 Ph); 128,4 (С-4 Ph); 129,7 (С-2, 6 Ph); 140,5 (C-1 Ph); 203,7 (CO). Масс-спектр: МН+ найдено - 260,16, МН+ вычислено - 260,20.
Пример 4. Синтез 2-(диэтиламино)-1-(1-фенилциклопентил)этан-1-он фосфата

2-(Диэтиламино)-1-(1-фенилциклопентил)этан-1-он гидрохлорид (1,05 г, 3,4 ммоль), полученный по примеру 3, растворяют в 10 мл воды, прибавляют 10 мл 20% раствора KOH, экстрагируют диэтиловым эфиром (3×15 мл), экстракт промывают водой (3×25 мл), эфирный раствор сушат над K2CO3, фильтруют, упаривают в вакууме, при температуре 50°С. Получают 2-(диэтиламино)-1-(1-фенилциклопентил)этан-1-он в виде желтого масла, 0,87 г (100%). Масло растворяют в 10 мл диэтилового эфира, прибавляют смесь 10 мл диэтилового эфира с фосфорной кислотой (85%, 0,39 г, 3,4 ммоль). Упаривают в вакууме, при температуре 45°С. Остаток растворяют в 5 мл ацетона, осаждают 20 мл диэтилового эфира, осадок фильтруют, промывают эфиром (2×10 мл), высушивают в вакууме при температуре 50°С. Получают 2-(диэтиламино)-1-(1-фенилциклопентил)этан-1-он фосфат в виде бесцветных кристаллов, 1,12 г (92%), Тпл=126-128°С. Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 0,92 (6Н, тр, J=6, N+H(СН2СН3)2); 1,54-1,75 (4Н, м.); 1,88-2,07 (2Н, м.); 2,40-2,54 (2Н, м.) (c-C5H8); 2,81 (4Н, кв, J=6, N+H(CH2CH3)2); 3,64 (2Н, с, COCH2N+H(C2H5)2); 7,21-7,44 (5Н, м., Ph); 11,09 (3Н, ш.с,+NH(C2H5)2)
Пример 5. Синтез 2-(диэтиламино)-1-(1-фенилциклопентил)этан-1-он сульфата

2-(Диэтиламино)-1-(1-фенилциклопентил)этан-1-он гидрохлорид (1,05 г, 3,4 ммоль), полученный по примеру 3, растворяют в 10 мл воды, прибавляют 10 мл 20% раствора KOH, экстрагируют диэтиловым эфиром (3×15 мл), экстракт промывают водой (3×25 мл), эфирный раствор сушат над безводным K2CO3, фильтруют, упаривают в вакууме, при температуре 50°С. Получают 2-(диэтиламино)-1-(1-фенилциклопентил)этан-1-он в виде желтого масла, 0,87 г (100%). Масло растворяют в 10 мл диэтилового эфира, прибавляют смесь 10 мл диэтилового эфира с серной кислотой (98%, 0,17 г, 1,7 ммоль). Упаривают в вакууме, при температуре 45°С. Получают 2-(диэтиламино)-1-(1-фенилциклопентил)этан-1-он сульфат, 1,21 г (100%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,05 (6Н, тр, J=7,1, N+H(CH2CH3)2); 1,54-1,75 (4Н, м.); 1,88-2,07 (2Н, м.); 2,40-2,54 (2Н, м.) (c-C5H8); 3,26 (4Н, кв, J=7,4, N+H(CH2CH3)2); 4,14 (2Н, с, COCH2N+H(C2H5)2); 7,21-7,44 (5Н, м., Ph); 9,64 (1Н, ш.с.,+NH(C2H5)2).
Пример 6. Синтез 2-(диэтиламино)-1-(1-фенилциклопентил)этан-1-он метансульфоната

2-(Диэтиламино)-1-(1-фенилциклопентил)этан-1-он гидрохлорид, полученный по примеру №3, (1,0 г, 3,4 ммоль) растворяют в 10 мл воды, прибавляют 10 мл 20% раствор KOH, экстрагируют диэтиловым эфиром (3×15 мл), экстракт промывают водой (3×25 мл), эфирный раствор сушат над безводным K2CO3, фильтруют, упаривают в вакууме, при температуре 45°С. Получают 2-(диэтиламино)-1-(1-фенилциклопентил)этан-1-он в виде желтого масла, 0,87 г (100%). Масло растворяют в 10 мл диэтилового эфира, прибавляют смесь 10 мл диэтилового эфира с метансульфоновой кислотой (0,324 г, 3,4 ммоль), упаривают в вакууме, при температуре 50°С. Получают 2-(диэтиламино)-1-(1-фенилциклопентил)этан-1-он метансульфонат, 1,20 г (100%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,08 (6Н, т., J=7,4, N+H(CH2CH3)2); 1,54-1,75 (4Н, м.); 1,88-2,07 (2Н, м.); 2,40-2,54 (2Н, м., c-C5H8); 2,76 (3Н, с., CH3SO2); 3,10-3,30 (4Н, м., N+Н(СН2СН3)2); 3,96 (2Н, д., J=3,7, COCH2N+H(C2H5)2); 7,21-7,44 (5Н, м., Ph); 10,44 (1Н, ш.с.,+NH(С2Н5)2)
Пример 7. Пример 7. Синтез 2-(диэтиламино)-1-(1-фенилцикло-пентил)этан-1-он фумарата
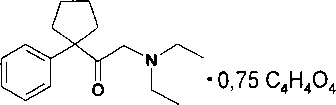
2-(Диэтиламино)-1-(1-фенилциклопентил)этан-1-он гидрохлорид (1,0 г, 3,4 ммоль), полученный по примеру 3, растворяют в 10 мл воды и прибавляют 10 мл 20% раствора KOH, экстрагируют диэтиловым эфиром (3×15 мл), экстракт промывают водой (3×25 мл), эфирный раствор сушат над безводным K2CO3, фильтруют, упаривают в вакууме, при температуре 45°С. Получают 2-(диэтиламино)-1-(1-фенилциклопентил)этан-1-он в виде желтого масла, 0,87 г (100%), который растворяют в 10 мл метанола, прибавляют раствор 0,39 г (3,4 моль) фумаровой кислоты в 30 мл метанола. Упаривают в вакууме, при температуре 50°С. Остаток, в виде желтого медленно кристаллизующегося масла, которое обрабатывают нагретым до кипения диэтиловым эфиром (3×20 мл). Осадок фильтруют, сушат в вакууме, при температуре 45°С. Получают 2-(диэтиламино)-1-(1-фенилциклопентил)этан-1-он фумарат в виде порошка, 0,8 г, Тпл=100,0-101,5°С. Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 0,96 (6Н, т., J=7,5, N+H(CH2CH3)2); 1,85-2,03 (2Н, м.); 2,37-2,55 (2Н, м.); 2,73- 2,88 (2Н, м.) (с-C4H6); 2,99 (4Н, п., J=7,0, N+H(CH2CH3)2); 3,76 (2Н, с., COCH2N+H(C2H5)2); 6,77 (1,45Н, c., =CHCO2H); 7,17-7,44 (5Н, м., Ph); 12,50 (1,49Н, ш.с.,+NH(C2H5)2 и =CHCO2H). Спектр ЯМР13С (CDCl3), δ, м.д.: 10,8 (N+H(CH2CH3)2); 16,7 (С-3 с-C4H6); 31,1 (С-2, 4 с-C4H6); 47,5 ((N+H(CH2CH3)2); 53,5 (COCH2N); 58,6 (С-1 с-C4H6); 126,6 (С-3, 5 Ph); 127,6 (С-4 Ph); 129,4 (С-2, 6 Ph); 135,6 (=CHCO2H); 142,4 (С-1 Ph); 170,8 (=CHCO2H); 206,4 (СО).
Пример 8. Синтез 2-(дибутиламино)-1-(1-фенилциклопентил)этан-1-он гидрохлорида

В колбе с обратным холодильником, защищенным от влаги, смешивают 2-бром-1-(1-фенилциклопентил)этан-1-он (8,00 г, 0,03 моль), полученный по примеру 1, дибутиламин (5,82 г, 0,045 моль) и K2CO3 (6,22 г, 0,045 моль) в 20 мл метанола, перемешивают 12 час при комнатной температуре. Упаривают в вакууме, при температуре 40°С. Остаток растворяют в 50 мл воды, прибавляют 10 мл 20% раствора KOH, экстрагируют диэтиловым эфиром (3×25 мл). Экстракт промывают водой (3×25 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 35°С. Остаток хроматографируют (сорбент силикагель 40-63 мкм, элюент - смесь бензол : метанол (20:1)). Фракции, содержащие 2-(дибутиламино)-1-(1-фенилциклопентил)этан-1-он, экстрагируют 10% соляной кислотой (3×25 мл), экстракт упаривают в вакууме при температуре 40°С. Остаток обрабатывают нагретым до кипения диэтиловым эфиром (3×25 мл), высушивают в вакууме при температуре 50°С. Получают 2-(дибутиламино)-1-(1-фенилциклопентил)этан-1-он гидрохлорид в виде бесцветного порошка, 1,48 г (14%), Тпл=117,0°С. Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 0,83 (6Н, тр, J=6,9, N+H(CH2CH2CH2CH3)2); 1,05-1,36 (6Н, м.); 1,54-1,88 (6Н, м.) (c-C5H8 и N+Н(CH2CH2CH2CH3)2); 1,91-2,08 (2Н, м., c-C5H8); 2,41-2,58 (2Н, м., c-C5H8); 2,99-3,18 (4Н, м., N+H(CH2CH2CH2CH3)2); 3,91 (2Н, с., COCH2N+H(Bu)2); 7,20-7,42 (5Н, м., Ph); 12,24 (1Н, ш.с.,+NH(Bu)2). Спектр ЯМР1Н (D2O), δ, м.д. (J, Гц): 0,66 (6Н, тр, J=7,3, N+H(CH2CH2CH2CH3)2); 0,97-1,11 (4Н, секст, J=7,3, N+H(CH2CH2CH2CH3)2); 1,11-1,26 (4Н, м., N+H(CH2CH2CH2CH3)2); 1,44-1,62 (4H, м., c-C5H8); 1,82-1,99 (2Н, м., c-C5H8); 2,27-2,41 (2Н, м., c-C5H8); 2,78 (4Н, тр, J=8,4, N+H(CH2CH2CH2CH3)2); 4,00 (2Н, с., COCH2N+H(Bu)2); 7,19-7,36 (5Н, м., Ph). Спектр ЯМР13С (CDCl3), δ, м.д.: 13,8 (N+H(CH2CH2CH2CH3)2); 20,3 (N+H(CH2CH2CH2CH3)2); 23,6 (С-3, 4 c-C5H8); 26,7 (N+H(CH2CH2CH2CH3)2); 34,3 (С-2, 5 c-C5H8); 51,6 (COCH2N); 54,1 (N+Н(CH2CH2CH2CH3)2); 65,4 (С-1 c-C5H8); 127,2 (С-3, 5 Ph); 128,5 (С-4 Ph); 129,8 (С-2, 6 Ph); 140,3 (С-1 Ph); 204,0 (CO). Масс-спектр: МН+ найдено - 316,23, МН+ вычислено - 316,26.
Пример 9. Синтез 2-(1-метоксипропан-2-иламино)-1-(1-фенилцикло-пентил)этан-1-он гидрохлорида

В колбе с обратным холодильником, защищенным от влаги, смешивают 2-бром-1-(1-фенилциклопентил)этан-1-он (8,00 г, 0,03 моль), полученный по примеру 1, 1-метоксипропан-2-амин (4,00 г, 0,045 моль) и K2CO3 (6,22 г, 45 ммоль) в 20 мл метанола. Суспензию оставляют при комнатной температуре на 12 час, упаривают в вакууме при температуре 40°С, остаток растворяют в 50 мл воды, прибавляют 10 мл 20% раствора KOH, экстрагируют диэтиловым эфиром (3×25 мл), экстракт промывают водой (3%25 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 50°С. Остаток хроматографируют (сорбент силикагель 40-60 мкм, элюент - градиент от этил ацетата до смеси этилацетат: триэтиламин 100:1). Фракции, содержащие продукт, объединяют, упаривают в вакууме, при температуре 40°С. Остаток растворяют в 30 мл этил ацетата, экстрагируют 10% соляной кислотой (3×25 мл). Экстракт упаривают в вакууме при температуре 50°С. Остаток обрабатывают нагретым до кипения диэтиловым эфиром (3×25 мл), высушивают в вакууме при температуре 50°С. Получают 2-((1-метоксипропан-2-ил)амино)-1-(1-фенилциклопентил)этан-1-он гидрохлорид в виде порошка, 3,92 г (42%), Тпл=106,0-106,5°С. Спектр ЯМР1H (CDCl3), δ, м.д. (J, Гц): 1,18 (3Н, д., J=9,0, СН(СН3)CH2OCH3); 1,73 (4Н, ш.с.); 1,91-2,15 (2Н, м.); 2,46-2,67 (2Н, м.) (c-C5H8); 3,26 (3Н, с., OCH3); 3,15-3,47 (1Н, м., CH); 3,60 (1Н, д.д., J=12,0, J=3,0) и 3,64 (1Н, д.д., J=12,0, J=7,5) (СН(СН3)CH2OCH3); 3,74 (1Н, д.т., J=18,0, J=6,0) и 4,01 (1H, д.т., J=18,0, J=6,0) (COCH2N); 7,25-7,43 (5Н, м., Ph); 8,94 (1Н, ш.с.); 10,07 (1Н, ш.с.) (N+H2). Спектр ЯМР1Н (D2O), δ, м.д. (J, Гц): 1,03 (3Н, д., J=9,0, СН(CH3)CH2OCH3); 1,53-1,74 (4Н, м.); 1,94-2,11 (2Н, м.); 2,33-2,47 (2Н, м.) (c-C5H8); 3,21 (3Н, с, OCH3); 3,22-3,48 (3Н, м., CH(СН3)CH2OCH3); 3,94 (2Н, с., COCH2N); 7,28-7,45 (5Н, м., Ph). Спектр ЯМР13С (CDCl3); δ, м.д.: 13,8 (СН(СН3)СН2ОСН3); 24,0 и 24,1 (С-3, 4 c-C5H8); 34,9 и 35,2 (С-2, 5 c-C5H8); 49,0 (CH); 54,3 (COCH2N); 59,2 (OCH3); 64,1 (С-1 c-C5H8); 73,2 (СН(СН3)CH2O); 127,5 (С-3, 5 Ph); 128,1 (С-4 Ph); 129,6 (С-2, 6 Ph); 141,3 (С-1 Ph); 203,7 (CO). Масс-спектр: МН+ найдено - 276,13, МН+ вычислено - 276,20.
Пример 10. Синтез 2-(Диэтиламино)-1-(1-(2-фторофенил)циклопентил)-этан-1-он гидрохлорида

1-(2-Фторофенил)-циклопентан-1-карбонитрил.
К кипящей суспензии гидрида натрия (5,30 г, 0,22 моль) в тетрагидрофуране (250 мл) при перемешивании в течение 1,5 час прикапывают смесь 2-(2-фторофенил)ацетонитрила (13,51 г, 0,1 моль) и дибромбутана (23,75 г, 0,11 моль), кипятят 12 час, охлаждают льдом, при перемешивании прикапывают воду (50 мл). Фазы разделяют. Органическую фазу упаривают в вакууме, при температуре 40°С, остаток растворяют в 150 мл гептана, промывают водой (3×30 мл), насыщенным раствором NaCl (30 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 50°С. Остаток перегоняют в вакууме, собирают фракцию с Ткип.=110-115°С (5-6 мм.рт.ст.). Получают 1-(2-фторофенил)-циклопентан-1-карбонитрил в виде бесцветного масла, 15,52 г (82%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,85-2,25 (6Н, м.); 2,47-2,65 (2Н, м.) (с-C5H8); 7,07-7,23 (2Н, м., 3,4-C6H4); 7,29-7,40 (1Н, м., 6-C6H4); 7,46 (1Н, т.д., J1=7,5, J2 0,5, 5-С6Н4).
1-(1-(2-Фторофенил)циклопентил)этан-1-он.
К раствору 1-(2-фторофенил)циклопентан-1-карбонитрила (15,5 г, 0,082 моль) в 150 мл бензола при перемешивании прибавляют хлорид меди (I) (0,4 г, 0,004 моль), раствор метилмагний йодида (0,165 моль) в диэтиловом эфире (150 мл, 1,1 М раствор). Эфир отгоняют, остаток кипятят 6 час. Реакционную смесь охлаждают льдом с солью, при перемешивании прибавляют 150 мл 15% соляной кислоты, далее кипятят в течение 2 час, охлаждают. Фазы разделяют, водную фазу экстрагируют бензолом (3×75 мл), экстракты объединяют, промывают насыщенным раствором NaHCO3 (2×50 мл), насыщенным раствором NaCl (50 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 50°С. Остаток перегоняют в вакууме, собирают фракцию с Ткип.=110-115°С (5-6 мм.рт.ст.). Получают 1-(1-(2-фторофенил)циклопентил)этан-1-он в виде светло-коричневого масла, 8,63 г (51%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,63-1,80 (4Н, м.); 1,86-2,04 (2Н, м.); 2,36-2,50 (2Н, м.) (c-C5H8); 1,96 (3Н, с., СОСН3); 6,98-7,08 (1Н, м., 6-C6H4); 7,15 (1Н, т.д., J1=7,5, J2=0,5, 5-C6H4); 7,21-7,32 (1Н, м., 3-C6H4); 7,39 (1Н, т.д., J1=7,5, J2=0,5, 4-C6H4).
2-Бром-1-(1-(2-фторофенил)циклопентил)этан-1-он
К раствору 1-(1-(2-фторофенил)циклопентил)этан-1-она (4,20 г, 0,02 моль) в 20 мл метанола при перемешивании и охлаждении водой прибавляют бром (3,25 г, 0,02 моль), перемешивают при комнатной температуре 2 час, прибавляют 10 мл воды, оставляют на 12 час. Смесь разбавляют 40 мл воды, экстрагируют хлористым метиленом (4×15 мл). Экстракт промывают насыщенным раствором NaHCO3 (2×20 мл), насыщенным раствором NaCl (20 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 40°С. Получают 2-бром-1-(1-(2-фторофенил)циклопентил)этан-1-он в виде желтого масла, 5,42 г (95%). Спектр ЯМР1H (CDCl3), δ, м.д. (J, Гц): 1,66-1,86 (4Н, м.); 1,95-2,09 (2Н, м.); 2,43-2,57 (2Н, м.) (c-C5H8); 3,90 (2Н, с, COCH2Br); 7,03-7,13 (1Н, м., 6-С6Н4); 7,20 (1Н, т.д., J1=7,5, J2=0,5, 5-C6H4); 7,26-7,38 (1Н, м., 3-С6Н4); 7,42 (1Н, т.д., J1=7,5, J2=0,5,4-C6H4).
2-(Диэтиламино)-1-(1-(2-фторофенил)циклопентил)этан-1-он гидрохлорид
В колбе с обратным холодильником, защищенным от влаги, смешивают 2-бром-1-(1-(2-фторофенил)циклопентил)этан-1-он (5,00 г, 17 ммоль) и диэтиламин (12,82 г, 0,175 моль) в 20 мл пропан-2-ола, Перемешивают при комнатной температуре 12 час. Упаривают в вакууме, при температуре 40°С. К остатку прибавляют 11 мл 10% раствора KOH, упаривают. Остаток растворяют в 20 мл воды, прибавляют 5 мл 10% раствора KOH, экстрагируют диэтиловым эфиром (3×15 мл). Экстракт промывают водой (3×15 мл), упаривают в вакууме, при температуре 40°С. Остаток хроматографируют (сорбент силикагель 40-60 мкм, элюент - градиент от этил ацетата до смеси этил ацетат : триэтиламин (100:1)). Фракции, содержащие продукт, упаривают в вакууме, при температуре 40°С. Остаток растворяют в 20 мл этилацетата, экстрагируют 10% соляной кислотой (3×25 мл). Водный экстракт упаривают в вакууме при температуре 40°С. Остаток обрабатывают нагретым до кипения диэтиловым эфиром (3×25 мл), высушивают в вакууме при температуре 50°С. Получают 2-(диэтиламино)-1-(1-(2-фторофенил)циклопентил)этан-1-он гидрохлорид в виде светло-коричневого порошка, 2,09 г (38%), Тпл=126,0-126,5°С. Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,33 (6Н, т., J=7,5, N+H(CH2CH3)2); 1,74 (4Н, ш.с.); 1,90-2,07 (2Н, м.); 2,29-2,45 (2Н, м.) (c-C5H8); 3,25-3,49 (4Н, м., N+H(CH2CH3)2); 3,86 (2Н, д., J=3,0, COCH2N+Н(СН3)2); 7,04-7,10 (1Н, м.); 7,15-7,27 (1Н, м.); 7,28-7,41 (2Н, м.) (C6H4); 12,28 (1Н, ш.с.,+NH(C2H5)2). Спектр ЯМР13С (CDCl3), δ, м.д.: 10,4 (N+Н(СН2СН3)2); 24,5 (С-3, 4 c-C5H8); 35,1 (С-2, 5 c-C5H8); 48,8 ((N+H(CH2CH3)2); 51,6 (COCH2N); 61,2 (С-1 c-C5H8); 116,6 (д.,2JCF=21,1, С-3 C6H4); 125,7 (С-5 C6H4); 128,0 (д.,3JCF=3,8, С-4 С6Н4); 129,1 (д.,2JCF=13,6, С-1 С6Н4); 130,6 (д.,3JCF=9,1, С-6 C6H4); 160,8 (д.,1JCF=244,5, С-2 С6Н4); 203,4 (СО). Масс-спектр: МН+ найдено - 278,13, MH+ вычислено - 278,19.
Пример 11. Синтез 2-(диэтиламино)-1-(1-фенилциклобутил)этан-1-он гидрохлорида

1-Фенилциклобутан-1-карбонитрил
К суспензии гидрида натрия (10,6 г, 0,44 моль) в диметилсульфоксиде (200 мл) при перемешивании прикапывают раствор бензилцианида (23,43 г, 0,2 моль) и 1,3-дибромпропана (44,4 г, 0,22 моль) в 100 мл диэтилового эфира. Смесь перемешивают 1 час при 20°С, прибавляют 30 мл пропан-2-ола и 1000 мл воды, экстрагируют диэтиловым эфиром (3×100 мл). Экстракт промывают водой (70 мл), насыщенным раствором NaHCO3 (70 мл), насыщенным раствором NaCl (70 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 45°С. Остаток перегоняют в вакууме. Ткип.=100-106°С (5-6 мм.рт.ст.). Получают 1-фенилциклобутан-1-карбонитрил в виде бесцветного масла, 17,00 г (54%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 2,04-2,15 (1Н, м.); 2,36-2,54 (1H, м.); 2,59-2,73 (2Н, м.); 2,79-2,92 (2Н, м.) (с-C4H6); 7,30-7,50 (5Н, м., Ph).
1-(1-Фенилциклобутил)этан-1-он.
К раствору 1-фенилциклобутан-1-карбонитрила (15,7 г, 0,10 моль) в 200 мл бензола при перемешивании прибавляют хлорид меди (I) (0,4 г, 4 ммоль), раствор метилмагний йодида (0,2 моль) в диэтиловом эфире (200 мл, 1М раствор). Диэтиловый эфир отгоняют, остаток кипятят 8 час, Реакционную смесь охлаждают льдом с солью, при перемешивании прибавляют 200 мл 15% соляной кислоты, затем кипятят в течение 2 час, охлаждают. Фазы разделяют, водную фазу экстрагируют бензолом (3×50 мл), экстракт объединяют с органической фазой, промывают насыщенным раствором NaHCO3(2×50 мл), насыщенным раствором NaCl (50 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 45°С. Остаток перегоняют в вакууме, собирают фракцию с Ткип.=95-100°С (5-6 мм.рт.ст.). Получают 1-(1-фенилциклобутил)этан-1-он в виде светло-желтого масла, 8,90 г (51%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,83-2,03 (2Н, м.); 2,39-2,53 (2Н, м.); 2,71-2,84 (2Н, м.) (с-С4Н6); 1,94 (3Н, с, СОСН3); 7,23-7,44 (5Н, м., Ph).
2-Бром-1-(1-фенилциклобутил)этан-1-он
К раствору 1-(1-фенилциклобутил)этан-1-она (4,4 г, 0,025 моль) в 25 мл метанола при перемешивании и охлаждении водой прибавляют бром (4,0 г, 0,025 моль), перемешивают при комнатной температуре 1 час. Прибавляют 10 мл воды, оставляют смесь на 12 час, разбавляют 50 мл воды, экстрагируют хлористым метиленом (4×20 мл). Экстракт промывают насыщенным раствором NaHCO3 (2×25 мл), насыщенным раствором NaCl (25 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 40°С. Получают 2-бром-1-(1-фенилциклобутил)этан-1-он в виде желтого масла, 6,20 г (98%). Спектр ЯМР 1H (CDCl3), δ, м.д. (J, Гц): 1,85-2,11 (2Н, м.); 2,45-2,57 (2Н, м.); 2,80-2,92 (2Н, м.) (с-С4Н6); 3,88 (2Н, с., COCH2Br); 7,23-7,45 (5Н, м., Ph).
2-(Диэтиламино)-1-(1-фенилциклобутил)этан-1-он гидрохлорид.
В колбе с обратным холодильником, защищенным от влаги, в 20 мл пропан-2-ола смешивают 2-бром-1-(1-фенилциклобутил)этан-1-он (5,06 г, 0,02 моль) и диэтиламин (14,63 г, 0,20 моль), оставляют при комнатной температуре на 12 час. Упаривают в вакууме при температуре 50°С, к остатку прибавляют 11 мл 10% раствора KOH, упаривают в вакууме. Остаток растворяют в 20 мл воды, прибавляют 5 мл 10% раствора KOH, экстрагируют диэтиловым эфиром (3×15 мл). Эфирный экстракт промывают водой (3×15 мл), экстрагируют 10% соляной кислотой (3×25 мл). Водные экстракте упаривают в вакууме при температуре 50°С. Остаток перекристаллизовывают из смеси пропан-2-ол : н-гептан 1:3. Получают 2-(диэтиламино)-1-(1-фенилциклобутил)этан-1-он гидрохлорид в виде кристаллов, 3,77 г (67%), Тпл=133,0-133,5°С. Спектр ЯМР1Н (CDCl3), δ, м. д. (J, Гц): 1,12 (6Н, т., J=7,5, N+H(СН2СН3)2); 1,80-1,98 (2Н, м.); 2,37-2,59 (2Н, м.); 2,68-2,83 (2Н, м.) (с-C4H6); 3,22 (4Н, п., J=6,8, N+H(СН2СН3)2); 3,86 (2Н, д., J=3,0, COCH2N+H(C2H5)2); 7,15-7,39 (5Н, м., Ph); 12,05 (1Н, ш.с.,+NH(C2H5)2). Спектр ЯМР13С (CDCl3), δ, м.д.: 10,2 (N+H(CH2CH3)2); 16,6 (С-3 с-C4H6); 30,8 (С-2, 4 c-С4Н6); 48,8 ((N+H(CH2CH3)2); 50,3 (COCH2N); 58,7 (С-1 c-С4Н6); 126,4 (С-3, 5 Ph); 128,3 (С-4 Ph); 129,9 (С-2, 6 Ph); 140,9 (С-1 Ph); 203,2 (СО). Масс-спектр: МН+ найдено - 246,12, МН+ вычислено - 246,19.
Пример 12. Синтез 2-(диэтиламино)-1-(1-(4-метилфенил)-циклопентил)этан-1-он гидрохлорида

1-(4-Метилфенил)циклопентан-1-карбонитрил
К кипящей суспензии гидрида натрия (5,28 г, 0,22 моль) в тетрагидрофуране (250 мл) при перемешивании в течение 1,5 час прикапывают смесь 2-(4-метилфенил)ацетонитрила (3,12 г, 0,1 моль) и 1,4-дибромбутана (23,75 г, 0,11 моль), кипятят 10 час. К охлаждаемой льдом смеси при перемешивании прикапывают воду (50 мл). Фазы разделяют, органическую фазу упаривают в вакууме, при температуре 40°С. Остаток растворяют в 150 мл гептана, промывают водой (3×30 мл), насыщенным раствором NaCl (30 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 40°С. Остаток перегоняют в вакууме, собирают фракцию с Ткип.=125-128°С (5-6 мм.рт.ст.). Получают 1-(4-метилфенил)циклопентан-1-карбонитрил в виде бесцветного масла, 13,90 г (75%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,88-2,16 (6Н, м.); 2,43-2,56 (2Н, м.) (c-C5H8); 2,37 (3Н, с, 4-СН3); 7,21 (2Н, д., J=9,0, 3,5-C6H4); 7,37 (2Н, д., J=9,0, 2,6-C6H4).
1-(4-метилфенил)циклопентилэтан-1-он
К раствору (4-метилфенил)циклопентан-1-карбонитрила (9,26 г, 0,05 моль) в 50 мл бензола при перемешивании прибавляют хлорид меди (I) (0,2 г, 0,002 моль), при температуре 60°С, в течение 10 мин, прибавляют раствор метилмагний йодида (0,105 моль) в диэтиловом эфире (35 мл 3М раствора). Диэтиловый эфир отгоняют, смесь кипятят 12 час. Реакционную смесь охлаждают льдом с солью, прибавляют 300 мл 5% соляной кислоты, далее кипятят в течение 2 час, охлаждают. Фазы разделяют, водную фазу экстрагируют бензолом (3×25 мл). Экстракты промывают насыщенным раствором NaHCO3 (2×50 мл), насыщенным раствором NaCl (30 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 50°С. Получают 1-(4-метилфенил)циклопентилэтан-1-он в виде желтого масла, 9,90 г (98%) Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,60-1,78 (4Н, м.); 1,85-2,00 (2Н, м.); 2,43-2,55 (2Н, м.) (c-C5H8); 1,95 (3Н, с, СОСН3); 2,35 (3Н, с, 4-СН3); 7,15 (2Н, д., J=9,0, 3,5-C6H4); 7,20 (2Н, д., J=9,0, 2,6-C6H4).
2-Бром-1-(1-(4-метилфенил)циклопентил)этан-1-он
К раствору 1-(4-метилфенил)циклопентилэтан-1-она (4,05 г, 0,02 моль) в 20 мл метанола при перемешивании и охлаждении водой прибавляют бром (3,25 г, 0,02 моль), перемешивают при комнатной температуре 0,5 час. Прибавляют 10 мл воды, оставляют смесь на 2 час, разбавляют 40 мл воды, экстрагируют хлористым метиленом (4×15 мл). Экстракт промывают насыщенным раствором NaHCO3 (2×20 мл), насыщенным раствором NaCl (20 мл), сушат над MgSO4, фильтруют, упаривают в вакууме при температуре 40°С. Получают 2-бром-1-(1-(4-метилфенил)циклопентил)этан-1-он в виде красно-коричневого масла, 5,34 г (95%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,69-1,80 (4Н, м.); 1,92-2,05 (2Н, м.); 2,45-2,58 (2Н, м.) (c-C5H8); 2,35 (3Н, с, СН3); 3,90 (2Н, с, COCH2Br); 7,17 (4Н, с, C6H4).
2-(Диэтиламино)-1-(1-(4-метилфенил)-циклопентил)этан-1-он гидрохлорид.
В колбе с обратным холодильником, защищенным от влаги, в 20 мл пропан-2-ола смешивают 2-бром-1-(1-(4-метилфенил)циклопентил)этан-1-он (5,30 г, 0,019 моль) и диэтиламин (12,82 г, 0,17 моль), перемешивают при комнатной температуре 12 час. Упаривают в вакууме при температуре 50°С, к остатку прибавляют 11 мл 10% раствора KOH, упаривают. Остаток растворяют в 20 мл воды, прибавляют 5 мл 10% раствора KOH, экстрагируют диэтиловым эфиром (3×15 мл). Экстракт промывают водой (3×15 мл), экстрагируют 10% соляной кислотой (3×25 мл). Водный экстракт упаривают в вакууме при температуре 50°С. Остаток обрабатывают нагретым до кипения диэтиловым эфиром (3×25 мл), упаривают в вакууме, при температуре 50°С. Получают 2-(диэтиламино)-1-(1-(4-метилфенил)-циклопентил)этан-1-он гидрохлорид в виде порошка бежевого цвета, 3,20 г (55%). Тпл>170°С (с разложением). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,12 (6Н, тр, J=7,5, N+H(CH2CH3)2); 1,54-1,80 (4Н, м.); 1,86-2,03 (2Н, м.); 2,35-2,51 (2Н, м.) (c-C5H8); 2,29 (3Н, с, 4-СН3); 3,20 (4Н, п., J=7,0, N+H(CH2CH3)2); 3,86 (2Н, д., J=3,0, COCH2N+Н(CH3)2); 7,03-7,19 (4Н, м., C6H4); 12,08 (1Н, ш.с.,+NH(С2Н5)2). Спектр ЯМР13С (CDCl3), δ, м.д.: 10,3 (N+H(CH2CH3)2); 21,3 (4-СН3); 23.7 (С-3, 4 c-C5H8); 34,6 (С-2, 5 с-С5Н8); 48,8 ((N+H(CH2CH3)2); 50,9 (COCH2N); 64.8 (С-1 c-C5H8); 127,0 (С-2, 6 Ph); 130,5 (С-3, 5 Ph); 137,5 (С-4 Ph); 138,3 (С-1 Ph); 204,1 (СО). Масс-спектр: МН+ найдено - 274,14, МН+ вычислено - 274,22.
Пример 13. Синтез 2-((2-гидроксиэтил)амино)-1-(1-фенилцикло-пентил)этан-1-он гидрохлорида

2-(2-Гидроксиэтил)амино)-1-(1-фенилциклопентил)этан-1-он гидрохлорид.
В колбе с обратным холодильником, защищенным от влаги, в 20 мл пропан-2-ола смешивают 2-бром-1-(1-фенилциклопентил)этан-1-он (5,34 г, 0,02 моль), полученный по примеру 1, этаноламин (4,89 г, 0,08 моль), перемешивают 12 час при комнатной температуре, упаривают в вакууме, при температуре 50°С, прибавляют 11 мл 10% раствора KOH, упаривают. Остаток растворяют в 20 мл воды, прибавляют 5 мл 10% раствора KOH, экстрагируют диэтиловым эфиром (3×15 мл). Экстракт промывают водой (3×15 мл), экстрагируют 10% соляной кислотой (3×25 мл). Водный экстракт упаривают в вакууме, при температуре 45°С. Остаток обрабатывают нагретым до кипения диэтиловым эфиром (3×25 мл), сушат в вакууме при температуре 50°С. Получают 2-(2-гидроксиэтил)амино)-1-(1-фенилциклопентил)этан-1-он гидрохлорид в виде светло-бежевого порошка, 4,03 г (71%), Тпл=170,5-171,0°С. Спектр ЯМР1Н (DMSO), δ, м.д. (J, Гц): 1,64 (4Н, ш.с); 1,79-1,98 (2Н, м.); 2,37-2,56 (2Н, м.) (c-C5H8); 2,85 (2Н, ш.с., COCH2N); 3,62-3,77 (4Н, м., NCH2CH2OH); 4,58 (1Н, ш.с, ОН); 7,13-7,32 (5Н, м., Ph); 9,22 (2Н, ш.с., N+H2). Спектр ЯМР1Н (D2O), δ, м.д. (J, Гц): 1,51-1,74 (4Н, м.); 1,94-2,09 (2Н, м.); 2,32-2,45 (2Н, м.) (c-C5H8); 2,94 (2Н, т., J=4,5, N+H2CH2); 3,66 (2Н, т., J=4,5, CH2OH); 3,97 (2Н, с., COCH2N); 7,27-7,44 (5Н, м., Ph). Спектр ЯМР13С (DMSO), δ, м.д.: 24,0 (С-3, 4 c-C5H8); 35,1 (С-2, 5 c-C5H8); 50,2 (N+H2CH2); 51,7 (COCH2N); 57,5 (CH2OH); 64,0 (С-1 c-C5H8); 127,5 (С-3, 5 Ph); 128,0 (С-4 Ph); 129,5 (С-2, 6 Ph); 141,3 (С-1 Ph); 203,7 (СО). Масс-спектр: МН+ найдено - 248,09, МН+ вычислено - 248,17.
Пример 14. Синтез 2-(диэтиламино)-1-(1-фенилциклогептил)этан-1-он гидрохлорида

1-Фенилциклогептан-1-карбонитрил
К кипящей суспензии гидрида натрия (3,6 г, 0,15 моль) в тетрагидрофуране (500 мл) при перемешивании в течение 1,5 час прикапывают смесь бензилцианида (7,81 г, 0,07 моль) и 1,6-дибромгексана (16,10 г, 0,07 моль), кипятят 24 час. К охлаждаемой льдом смеси при перемешивании прикапывают воду (60 мл). Фазы разделяют, органическую фазу упаривают в вакууме, при температуре 40°С. Остаток растворяют в 250 мл гептана, промывают водой (3×50 мл), насыщенным раствором NaCl (30 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 50°С. Остаток перегоняют в вакууме, собирают фракцию с Ткип.=138-145°С (5-6 мм.рт.ст.). Получают 1-фенилциклогептан-1-карбонитрил в виде бесцветного масла, 2,66 г (20%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,60-1,80 (2Н, м.); 1,80-1,97 (6Н, м.); 1,97-2,14 (2Н, м.); 2,16-2,33 (2Н, м.) (с-C7H12); 7,31 (1Н, т., J=7,5, 4-Ph); 7,39 (2Н, т., J=7,5, 3,5-Ph); 7,52 (2Н, д., J=5,0, 2,6-Ph).
1-(1-Фенилциклогептил)этан-1-он.
К раствору 1-фенилциклогептан-1-карбонитрила (2,65 г, 13,3 ммоль) в 30 мл бензола прибавляют хлорид меди (I) (0,05 г, 0,5 ммоль), при температуре 60°С и перемешивании, по каплям, прибавляют раствор метилмагний йодида (26,6 ммоль) в диэтиловом эфире (25 мл, 1,1М раствор). Эфир отгоняют, смесь кипятят 10 час, охлаждают льдом с солью, прибавляют 30 мл 15% соляной кислоты, кипятят в течение 2 час, охлаждают. Фазы разделяют, водную фазу экстрагируют бензолом (3×20 мл). Экстракт промывают насыщенным раствором NaHCO3 (2×20 мл), насыщенным раствором NaCl (20 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 50°С. Остаток хроматографируют (сорбент силикагель 40-60 мкм, элюент - смесь гексан : бензол 2:1). Фракции, содержащие продукт, объединяют, упаривают в вакууме, при температуре 50°С. Получают 1-(1-фенилцикло-гептил)этан-1-он в виде желтого масла, 1,79 г (62%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,50-1,95 (8Н, м.); 1,98-2,11 (2Н, м.); 2,26-2,38 (2Н, м.) (С-С7Н12); 1,87 (3Н, с, СОСН3); 7,20-7,53 (5Н, м., Ph).
2-бром-1-(1-фенилциклогептил)этан-1-он.
К раствору 1-(1-фенилциклогептил)этан-1-она (1,75 г, 8,1 ммоль) в 10 мл метанола при перемешивании и охлаждении водой прибавляют бром (1,29 г, 8,1 ммоль), перемешивают при комнатной температуре 2 час. Прибавляют 10 мл воды, оставляют смесь на 12 час, разбавляют 10 мл воды, экстрагируют хлористым метиленом (4×10 мл). Экстракт промывают насыщенным раствором NaHCO3 (2×15 мл), насыщенным раствором NaCl (15 мл), сушат над MgSO4, фильтруют, упаривают в вакууме при температуре 50°С. Получают 2-бром-1-(1-фенилциклогептил)этан-1-он в виде красного масла, 2,29 г (96%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,48-1,78 (6Н, м.); 1,55-1,98 (2Н, м.); 2,03-2,15 (2Н, м.); 2,30-2,44 (2Н, м.) (с-С7Н12); 3,81 (2Н, с, COCH2Br); 7,20-7,54 (5Н, м., Ph).
2-(Диэтиламино)-1-(1-фенилциклогептил)этан-1-он гидрохлорид.
В колбе с обратным холодильником, защищенным от влаги, в 10 мл пропан-2-ола смешивают 2-бром-1-(1-фенилциклогептил)этан-1-он (2,25 г, 7,6 ммоль) и диэтиламин (5,56 г, 76 ммоль), оставляют при комнатной температуре и перемешивании на 12 час. Упаривают в вакууме, при температуре 50°С. К остатку прибавляют 5 мл 10% раствора KOH, упаривают. Остаток растворяют в 20 мл воды, прибавляют 5 мл 10% раствора KOH, экстрагируют диэтиловым эфиром (3×15 мл). Экстракт промывают водой (3×15 мл), экстрагируют 10% соляной кислотой (3×25 мл). Водный экстракт упаривают в вакууме при температуре 45°С. Остаток обрабатывают нагретым до кипения диэтиловым эфиром, сушат в вакууме при температуре 50°С. Получают 2-(диэтиламино)-1-(1-фенилциклогептил)этан-1-он гидрохлорид в виде бледно-желтого порошка, 1,60 г (65%), Тпл=144,0-145,0°С. Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,18 (6Н, тр, J=7,5, N+H(CH2CH3)2); 1,49-1,74 (8Н, м.); 2,04-2,19 (2Н, м.); 2,25-2,40 (2Н, м.) (с-С7Н12); 3,27 (4Н, п., J=6,8, N+H(CH2CH3)2); 3,79 (2Н, д., J=2,9, COCH2N+H(C2H5)2); 7,18-7,44 (5Н, м., Ph); 12,18 (1Н, ш.с,+NH(C2H5)2). Спектр ЯМР13С (CDCl3), δ, м.д.: 10,4 (N+H(СН2СН3)2); 23,7 (С-3, 6 с-С7Н12); 30,1 (С-4, 5 с-С7Н12); 35,1 (С-2, 7 с-С7Н12); 48,9 ((N+H(СН2СН3)2); 51,1 (COCH2N); 59,9 (С-1 с-С7Н12); 126,6 (C-2, 6 Ph); 128,3 (С-4 Ph); 130,0 (С-3, 5 Ph); 141,6 (С-1 Ph); 204,7 (СО). Масс-спектр: МН+ найдено - 288,18 МН+ вычислено - 288,23.
Пример 15. Синтез 2-(морфолино)-1-(1-фенилциклопентил)этан-1-он гидрохлорида

В колбе с обратным холодильником, защищенным от влаги, в 10 мл пропан-2-ола смешивают 2-бром-1-(1-фенилциклопентил)этан-1-он (2,67 г, 0,01 моль), полученный по примеру 1, морфолин (3,48 г, 0,04 моль), перемешивают при комнатной температуре 12 час. Смесь упаривают в вакууме, при температуре 40°С, к остатку прибавляют 5 мл 10% раствора KOH, упаривают. Остаток растворяют в 20 мл воды, прибавляют 5 мл 10% раствора KOH, экстрагируют диэтиловым эфиром (3×15 мл). Экстракт промывают водой (3×15 мл), экстрагируют 10% соляной кислотой (3×15 мл). Водный экстракт упаривают в вакууме при температуре 45°С. Остаток обрабатывают нагретым до кипения диэтиловым эфиром, сушат в вакууме при температуре 50°С. Получают 2-(морфолино)-1-(1-фенилциклопентил)этан-1-он гидрохлорид в виде бесцветного порошка, 1,48 г (48%). Тпл (с разложением) >170°С. Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,66-1,87 (4Н, м.); 1,93-2,10 (2Н, м.); 2,41-2,59 (2Н, м.) (c-C5H8); 3,05-3,24 (2Н, м.) и 3,26-3,47 (2Н, м.) (3, 5 - CH2 morpholine); 3,81 (2Н, д., J=3,0, COCH2N+H); 3,88 (2Н, д. д., J=13,5, J=3,0) и 4.23 (2Н, т., J=13,5) (2, 6 - CH2 morpholine); 7,20-7,46 (5Н, м., Ph); 13,16 (1Н, ш.с.,+NH). Спектр ЯМР13С (CDCl3); δ, м.д.: 24,0 (С-3, 4 c-C5H8); 34,7 (С-2, 5 c-C5H8); 51,2 (С-3, 5 morpholine); 58,2 (COCH2N); 64,2 (С-2, 6 morpholine); 65,2 (С-1 c-C5H8); 127,2 (С-3, 5 Ph); 128,5 (С-4 Ph); 129,9 (С-2, 6 Ph); 140,5 (С-1 Ph); 202,7 (СО). Масс-спектр: МН+ найдено - 274,11, МН+ вычислено - 274,18.
Пример 16. Синтез 2-(пиперидин-1-ил)-1-(1-фенилциклопентил)этан-1-он гидрохлорида

В колбе с обратным холодильником, защищенным от влаги, в 10 мл пропан-2-ола смешивают 2-бром-1-(1-фенилциклопентил)этан-1-он (2,67 г, 0,01 моль), полученный по примеру 1, и пиперидин (3,41 г, 0,04 моль), оставляют при комнатной температуре и перемешивании на 12 час. Упаривают в вакууме, при температуре 40°С, прибавляют 5 мл 10% раствора KOH, растворитель отгоняют. Остаток растворяют в 20 мл воды, прибавляют 5 мл 10% раствора KOH, экстрагируют диэтиловым эфиром (3×15 мл). Экстракт промывают водой (3×15 мл), экстрагируют 10% соляной кислотой (3×15 мл). Водный экстракт упаривают в вакууме, при температуре 50°С. Остаток обрабатывают нагретым до кипения диэтиловым эфиром (3×25 мл), сушат в вакууме при температуре 40°С. Получают 2-(пиперидин-1-ил)-1-(1-фенилциклопентил)этан-1-он гидрохлорид в виде бесцветного порошка, 2,06 г (67%), Тпл=173,5-174,0°C. Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,29-1,47 (1H м.); 1,61-1,91 (7Н, м.); 1,93-2,10 (2Н, м.); 2,11-2,32 (2Н, м.), 2,39-2,56 (2Н, м.) (3-5 - СН2 - N(CH2)5, и c-C5H8); 3,05-3,16 (2Н, м.) и 3,16-3,33 (2Н, м.) (2, 6 - СН2 - N(CH2)5); 3,78 (2Н, д., J=3,0, COCH2N+H); 7,20-7,44 (5Н, м., Ph); 12,18 (1Н, ш.с.,+NH). Спектр ЯМР13С (CDCl3), δ, м.д.: 22,0 (С-4 N(CH2)5); 23,3 (С-3, 5 N(CH2)5); 23,9 (С-3, 4 c-C5H8); 34,6 (С-2, 5 c-C5H8); 52,4 (С-2, 6 N(CH2)5); 58,3 (COCH2N); 65,2 (С-1 c-C5H8); 127,1 (С-3, 5 Ph); 128,4 (С-4 Ph); 129,8 (С-2, 6 Ph); 140,5 (С-1 Ph); 203,1 (СО). Масс-спектр: МН+ найдено - 272,15, МН+ вычислено - 272,20.
Пример 17. Синтез 2-пирролидинил-1-(1-фенилциклопентил)этан-1-он гидрохлорида

В колбе с обратным холодильником, защищенным от влаги, в 10 мл пропан-2-ола смешивают 2-бром-1-(1-фенилциклопентил)этан-1-он (2,67 г, 0,01 моль), полученный по примеру 1, пирролидин (2,84 г, 0,04 моль). Раствор оставляют при комнатной температуре и перемешивании на 12 час, Упаривают в вакууме, при температуре 40°С. К остатку прибавляют 5 мл 10% раствора KOH, упаривают в вакууме досуха. Остаток растворяют в 20 мл воды, прибавляют 5 мл 10% раствора KOH, экстрагируют диэтиловым эфиром (3×15 мл). Экстракт промывают водой (3×15 мл), экстрагируют 10% соляной кислотой (3×15 мл). Водный экстракт упаривают в вакууме, при температуре 45°С. Остаток обрабатывают нагретым до кипения диэтиловым эфиром, сушат. Получают 2-пирролидинил-1-(1-фенилциклопентил)этан-1-он гидрохлорид в виде бесцветного порошка, 1,62 г (55%), Тпл (с разложением) >195°С. Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,61-1,84 (4Н, м.); 1,93-2,06 (2Н, м.); 2,40-2,54 (2Н, м.) (c-C5H8); 2,06-2,16 (4Н, м., 3, 4 - CH2 - N(СН2)4); 2,81-2,98 (2Н, м.) и 3,56-3,70 (2Н, м.) (2, 5 - СН2 - N(CH2)4); 3,92 (2Н, д., J=3,0, COCH2N+H); 7,21-7,44 (5Н, м., Ph); 12,52 (1Н, ш.с.,+NH). Спектр ЯМР1Н (D2O), δ, м.д. (J, Гц): 1,52-1,74 (4Н, м.); 1,94-2,06 (2Н, м.); 2,31-2,43 (2Н, м.) (с-C5H8); 1,90 (4Н, ш.с., 3, 4 - СН2 - N(СН2)4; 2,68 (2Н, ш.с.) и 3,49 (2Н, ш.с.) (2, 5 - CH2 - N(CH2)4); 4,14 (2Н, с., COCH2N+H); 7,28-7,44 (5Н, м., Ph). Спектр ЯМР13С (CDCl3); δ, м.д.: 24,0 (С-3, 4 c-C5H8); 24,5 (С-3, 4 N(CH2)4); 34,8 (С-2, 5 c-C5H8); 53,7 (С-2, 5 N(CH2)4); 56,6 (COCH2N); 64,6 (С-1 c-C5H8); 127,2 (С-3, 5 Ph); 128,2 (С-4 Ph); 129,8 (С-2, 6 Ph); 140,8 (С-1 Ph); 203,1 (СО). Масс-спектр: МН+ найдено - 258,12, МН+ вычислено - 258,19.
Пример 18. Синтез 2-(диэтиламино)-1-(1-(3,4-диметоксифенил)циклопентил)этан-1-он гидрохлорида

1-(3,4-Диметоксифенил)циклопентан-1-карбонитрил.
К кипящей суспензии гидрида натрия (5,30 г, 0,22 моль) в тетрагидрофуране (250 мл), при перемешивании прикапывают смесь 2-(3,4-диметоксифенил)ацетонитрила (17,7 г, 0,10 моль) и 1,4-дибромбутана (21,70 г, 0,10 моль), кипятят 10 час. К охлаждаемой льдом смеси при перемешивании прикапывают воду (50 мл). Фазы разделяют, органическую фазу упаривают в вакууме, при температуре 50°С. Остаток растворяют в 150 мл гептана, промывают водой (3×30 мл), насыщенным раствором NaCl (50 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 50°С. Остаток хроматографируют (сорбент силикагель 40-60 мкм, элюент - смесь гексан : этилацетат 4:1). Фракции, содержащие продукт, объединяют, упаривают в вакууме, при температуре 40°С. Получают 1-(3,4-диметоксифенил)циклопентан-1-карбонитрил в виде бесцветного масла, 19,66 г (85%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,85-2,12 (6Н, м.); 2,38-2,51 (2Н, м.) (с-С5Н8); 3,87 (3Н, с.) и 3,90 (3Н, с.) (СН3О); 6,84 (1Н, д., J=9,0, 6-С6Н4); 6,93-7,01 (2Н, м., 2,5-C6H4).
1-(3,4-Диметоксифенил)циклопентилэтан-1-он.
К раствору 1-(3,4-диметоксифенил)циклопентиан-1-карбонитрила (18,5 г, 0,08 моль) в 200 мл бензола при перемешивании прибавляют хлорид меди (I) (0,2 г, 2 ммоль), раствор метилмагний йодида (0,16 моль) в диэтиловом эфире (150 мл, 1,06 М раствор), эфир отгоняют, остаток кипятят 9 час. Реакционную смесь охлаждают льдом с солью, при перемешивании прибавляют 150 мл 15% соляной кислоты, кипятят в течение 2 час, охлаждают. Фазы разделяют, водную фазу экстрагируют бензолом (3×50 мл). Экстракты промывают насыщенным раствором NaHCO3 (2×50 мл), насыщенным раствором NaCl (50 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 40°С. Остаток хроматографируют (сорбент силикагель 40-60 мкм, элюент - смесь гексан : этил ацетат 4:1). Фракции, содержащие продукт, объединяют, упаривают в вакууме, при температуре 40°С. Получают 1-(3,4-диметоксифенил)циклопентилэтан-1-он в виде желтого масла, 14,30 г (72%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,55-1,76 (4Н, м.); 1,78-1,94 (2Н, м.); 2,38-2,49 (2Н, м.) (c-C5H8); 1,93 (3Н, с, СОСН3); 3,84 (3Н, с.) и 3,85 (3Н, с.) (СН3О); 6,65-6,74 (1Н, м., 6-C6H4); 6,75-6,88 (2Н, м., 2,5-C6H4).
1-(1-(3,4-Диметоксифенил)-циклопентил)-2-иодоэтан-1-он
Смесь 1-(3,4-диметоксифенил)циклопентилэтан-1-она (1 г, 4 ммоль), оксида меди (II) (0,64 г, 8 ммоль) и йода кристаллического (1 г, 4 ммоль) в 15 мл абсолютного метанола кипятят 5 час. Охлажденную реакционную смесь фильтруют, осадок промывают метанолом (5 мл), упаривают в вакууме, при температуре 45°С, остаток растворяют в 50 мл этилацетата, промывают водой (25 мл), 2% раствором NaHSO3 (25 мл), насыщенным раствором NaHCO3 (25 мл), насыщенным раствором NaCl (25 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 40°С. Получают 1-(1-(3,4-диметоксифенил)-циклопентил)-2-иодоэтан-1-он виде желтого масла, 1,37 г (91%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,72-1,80 (4Н, м.); 1,86-2,03 (2Н, м.); 2,44-2,58 (2Н, м.) (c-C5H8); 3,80 (2Н, с, COCH2I); 3,86 (3Н, с.) и 3,87 (3Н, с.) (СН3О); 6,64-6,77 (1Н, м., 6-C6H4); 6,79-6,91 (2Н, м., 2,5-C6H4).
2-(Диэтиламино)-1-(1-(3,4-диметоксифенил)циклопентил)этан-1-он гидрохлорид.
В колбе с обратным холодильником, защищенным от влаги, смешивают 1-(1-(3,4-диметоксифенил)циклопентил)-2-йодоэтан-1-он (1,30 г, 3,5 ммоль), диэтиламин (0,42 г, 5,8 ммоль) и K2CO3 (0,80 г, 5,8 ммоль) в 5 мл метанола, перемешивают 12 час при температуре 20°С. Упаривают в вакууме, при температуре 40°С, остаток растворяют в 10 мл воды, прибавляют 5 мл 20% раствора KOH, экстрагируют диэтиловым эфиром (3×15 мл). Экстракт сушат над K2CO3, фильтруют, упаривают в вакууме, при температуре 50°С. Остаток хроматографируют (сорбент силикагель 40-60 мкм, элюент - градиент от этил ацетата до смеси этилацетат : триэтиламин 20:1). Фракции, содержащие продукт, объединяют, упаривают в вакууме, при температуре 40°С. К остатку прибавляют 10% раствор соляной кислоты (30 мл), отгоняют растворитель. Остаток обрабатывают нагретым до кипения диэтиловым эфиром (3×10 мл), сушат в вакууме при температуре 50°С. Получают 2-(диэтиламино)-1-(1-(3,4-диметоксифенил)циклопентил)этан-1-он гидрохлорид в виде бесцветных кристаллов, 0,27 г (25%), Тпл=142,0-145,0°С. Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,17 (6Н, т., J=7,2, N+H(CH2CH3)2); 1,55-1,84 (4Н, м.); 1,89-2,04 (2Н, м.); 2,38-2,51 (2Н, м.) (c-C5H8); 3,25 (4Н, п., J=6,3, N+H(СН2СН3)2); 3,85 (3Н, с.) и 3,87 (3Н, с.) (СН3О); 3,94 (2Н, д., J=3,0, COCH2N+Н); 6,66-6,97 (3Н, м., C6H3(OCH3)2); 12,13 (1Н, ш.с,+NH(C2H5)2). Спектр ЯМР1Н (D2O), δ, м.д. (J, Гц): 0,93 (6Н, т., J=7,5, N+H(СН2СН3);); 1,46-1,67 (4Н, м.); 1,82-1,97 (2Н, м.); 2,29-2,43 (2Н, м.) (с-С5Н8); 2,94 (4Н, кв., J=8,0, N+Н(СН2СН3)2); 3,75 (6Н, с, СН3О × 2); 4,02 (2Н, с, COCH2N+H); 6,73-6,99 (3Н, м., C6H3(ОСН3)2). Спектр ЯМР13С (CDCl3), δ, м.д.: 10,3 (N+H(CH2CH3)2); 23,7 (С-3, 4 c-C5H8); 34,6 (С-2, 5 c-C5H8); 48,8 ((N+H(СН2СН3)2); 50,8 (COCH2N); 56,3 и 56,5 (СН3О × 2); 64,7 (С-1 c-C5H8); 110,4 (С-2 С6Н3(ОСН3)2); 112,1 (С-5 С6Н3(ОСН3)2); 119,5 (С-6 С6Н3(ОСН3)2); 132,8 (С-1 С6Н3(ОСН3)2); 149,3 (С-3 С6Н3(ОСН3)2); 150,0 (С-4 C6H3(ОСН3)2); 204,2 (СО). Масс-спектр: МН+ найдено - 320,18, МН+ вычислено - 320,22.
Пример 19. Синтез 2-((2-метоксиэтил)амино)-1-(1-фенилцикло-пентил)этан-1-он гидрохлорида
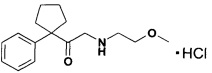
В колбе с обратным холодильником, защищенным от влаги, в 10 мл пропан-2-ола смешивают 2-бром-1-(1-фенилциклопентил)этан-1-он (2,67 г, 0,01 моль), полученный по примеру 1, 2-метоксиэтиламин (3,00 г, 0,04 моль), перемешивают при температуре 20°С 12 час. Упаривают в вакууме при температуре 40°С, прибавляют 5 мл 10% раствора KOH, упаривают. Остаток растворяют в 20 мл воды, прибавляют 5 мл 10% раствора KOH, экстрагируют диэтиловым эфиром (3×15 мл), промывают водой (3×15 мл), экстрагируют 10% соляной кислотой (3×15 мл). Водный экстракт упаривают вакууме, при температуре 45°С. Остаток растворяют в 4 мл ацетона, высаживают 20 мл диэтилового эфира, осадок отфильтровывают, промывают эфиром (2×5 мл), сушат в вакууме при температуре 50°С. Получают 2-(2-метоксиэтиламино)-1-(1-фенилциклопентил)этан-1-он гидрохлорид в виде бесцветного порошка, 1,62 г (54%), Тпл=112-115°С. Спектр ЯМР1Н (D2O), δ, м.д. (J, Гц): 1,38-1,67 (4Н, м., c-C5H8); 1,78-2,05 (2Н, м., c-C5H8); 2,23-2,42 (2Н, м., c-C5H8); 2,89-3.01 (2Н, м., NH2+CH2CH2OCH3); 3.26 (1Н, с, СН2СН2ОСН3); 3,40-3,57 (2Н, м. NH2+CH2CH2OCH3) и 3,97 (2Н, с, COCH2N+H); 7,20-7,44 (5Н, м., Ph). Спектр ЯМР13С (D2O), δ, м.д.: 23,6 (С-3, 4 с-C5H8); 34,6 (С-2, 5 c-C5H8); 46,7 (NH2+CH2CH2OCH3); 51,7 (COCH2NH2+); 58.7 (NH2+CH2CH2OCH3); 64,1 (С-1 c-C5H8); 67.0 (NH2+CH2CH2OCH3) 127,7 (С-3, 5 Ph); 128,3 (C-4 Ph); 129,7 (С-2, 6 Ph); 140,8 (C-1 Ph); 206,2 (CO).
Пример 20. Синтез 2-((2-бутоксиэтил)амино)-1-(1-фенилциклопентил)этан-1-он гидрохлорида

В колбе с обратным холодильником, защищенным от влаги, смешивают 2-бром-1-(1-фенилциклопентил)этан-1-он (1,00 г, 3,7 ммоль), полученный по примеру 1, 2-бутоксиэтиламин (1,30 г, 11 ммоль) с 10 мл пропан-2-ола, перемешивают 12 час при комнатной температуре, упаривают в вакууме при температуре 45°С, прибавляют 5 мл 10% раствора KOH, упаривают, растворяют в 20 мл воды, прибавляют 5 мл 10% раствора KOH, экстрагируют эфиром (3×15 мл). Экстракт промывают водой (3×15 мл), сушат над K2CO3, фильтруют, упаривают в вакууме, при температуре 50°С. Остаток хроматографируют (сорбент силикагель 40-60 мкм, элюент - смесь гексан : этилацетат 4:1). Фракции, содержащие продукт, упаривают в вакууме, при температуре 50°С, с добавлением 1 мл 35% соляной кислоты. 2-(2-бутоксиэтиламино)-1-(1-фенилциклопентил)этан-1-он гидрохлорид получают в виде желтоватого масла, 0,64 г (57%). ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 0,92 (3Н, тр, J=7,4, N+H2CH2CH2OCH2CH2CH2CH3); 1,22-1.36 (2Н, м, N+H2CH2CH2OCH2CH2CH2CH3); 1,37-1.55 (2Н, м, N+H2CH2CH2OCH2CH2CH2CH3); 1,64-1,86 (4Н, м.); 1,90-2,11 (2Н, м.); 2,46-2,64 (2Н, м.) (c-C5H8); 3,07-3,21 (2Н, м., N+H2CH2CH2OCH2CH2CH2CH3); 3,39 (2Н, т., J=6,3, N+H2CH2CH2OCH2CH2CH2CH3); 3,68-3,82 (2Н, м., N+H2CH2CH2OCH2CH2CH2CH3) 3,95 (2Н, м., COCH2N+H2); 7,21-7,45 (5Н, м., Ph); 9,05 (2Н, ш.с., N+H2CH2CH2OCH2CH2CH2CH3). Спектр ЯМР13С (CDCl3), δ, м.д.: 14,3 (N+H2CH2CH2OCH2CH2CH2CH3); 19,6 (N+H2CH2CH2OCH2CH2-CH2CH3); 24,2 (С-3, 4 c-C5H8); 31,9 (N+H2CH2CH2OCH2CH2CH2CH3); 35,2 (С-2, 5 c-C5H8); 47,7 (N+Н2СН2СН2ОСН2СН2СН2СН3); 51,8 (COCH2NH2+); 63,9 (С-1 c-C5H8); 65,9 (NH2+CH2CH2OCH2CH2CH2CH3); 71,7(NH2+CH2CH2OCH2-CH2CH2CH3); 127,5 (С-3, 5 Ph); 128,3 (C-4 Ph); 129,7 (С-2, 6 Ph); 141,0 (C-l Ph); 203,57 (CO).
Пример 21. Синтез 2-(этил(проп-2-ин-1-ил)амино)-1-(1-фенилциклопентил)этан-1-он гидрохлорида

N-Этилпроп-2-инил-1-амин.
В двугорлой колбе с обратным холодильником, капельной воронкой, к раствору этиламина (70% раствор в воде, 0,1 моль, 6,43 г) в 40 мл диэтилового эфира прикапывают раствор пропаргил бромида (80% раствор в толуоле, 0,05 моль, 7,4 г) в 10 мл диэтилового эфира в течение 20 мин, перемешивают 4 час. Прибавляют 4 г KOH, перемешивают 1 час, органическую фазу отделяют, перегоняют при атмосферном давлении. Собирают фракцию с Тпл=80-102°С. Получают N-этилпроп-2-инил-1-амин в виде бесцветной жидкости, 2,5 г (60%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,12 (3Н, т, J=7,2, CH3CH2NHCH2C≡CH); 1,33 (1Н, ш.с, CH3CH2NHCH2C≡CH); 2,21 (1Н, т, J=2,2, CH3CH2NHCH2C≡CH); 2,73 (2Н, кв., J=7,2, CH3CH2NHCH2C≡CH); 3,43 (2Н, д, J=2,2, CH3CH2NHCH2C≡CH).
2-(Этил(проп-2-инил)амино)-1-(1-фенилциклопентил)этан-1-он гидрохлорид
В колбе с обратным холодильником, защищенным от влаги, в 10 мл пропан-2-ола смешивают 2-бром-1-(1-фенилциклопентил)этан-1-он (2,67 г, 10 ммоль), полученный по примеру 1, N-этилпроп-2-иниламин (2,49 г, 30 моль), оставляют при комнатной температуре и перемешивании на 12 час .Растворитель отгоняют в вакууме, при температуре 40°С. К остатку прибавляют 5 мл 10% раствора KOH, упаривают. Остаток растворяют в 20 мл воды, прибавляют 5 мл 10% раствора KOH, экстрагируют диэтиловым эфиром (3×15 мл). Экстракт промывают водой (3×15 мл), сушат над K2CO3, фильтруют, упаривают в вакууме, при температуре 40°С. Остаток хроматографируют (сорбент силикагель 40-60 мкм, элюент - смесь гексан : этилацетат 4:1). Фракции, содержащие продукт, упаривают в вакууме, при температуре 40°С, с добавлением 1 мл 35% соляной кислоты. Получают продукт в виде светло-желтого масла, кристаллизуют кипячением в 20 мл диэтилового эфира. Осадок фильтруют, сушат в вакууме, при температуре 45°С. Получают 2-(этил(проп-2-инил)амино)-1-(1-фенилциклопентил)этан-1-он гидрохлорид в виде бесцветных кристаллов, 1,1 г (57%), Тпл=132-134°С. Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,21 (3Н, тр, J=7,4, CH3CH2N+HCH2C≡CH); 1,64-1,86 (4Н, м.), 1,90-2,13 (2Н, м.); 2,45 (1Н, тр, J=2,2, CH3CH2N+HCH2C≡CH) 2,47-2,64 (2Н, м.) (с-С5Н8); 3,10-3,30 (2Н, м., CH3CH2N+HCH2C≡CH); 3,81-4,21 (4Н, м., CH3CH2N+HCH2C≡CH и COCH2NH+); 7,21-7,45 (5Н, м., Ph); 12,8 (1Н, ш.с, CH3CH2N+HCH2C≡CH). Спектр ЯМР1Н (D2O), δ, м.д. (7, Гц): 1,13 (3Н, тр, J=7,4, CH3CH2N+HCH2C≡CH); 1,56-1,81 (4Н, м.); 1,98-2,19 (2Н, м.); 2.35-2.57 (2Н, м.) (c-C5H8); 2,92 (1H, тр, J=2,4, CH3CH2N+HCH2C≡CH); 3,17 (2Н, кв., J=7,4, CH3CH2N+HCH2C≡CH); 3,92 (2Н, д., J=2,4, CH3CH2N+НСН2С≡CH); 3,81 (2Н, с, COCH2NH+); 7,30-7,55 (5Н, м., Ph). Спектр ЯМР13С (D2O), δ, м.д.: 8.9 (CH3CH2N+HCH2C≡CH); 23,3 (С-3, 4 c-С5Н8); 34,3 (С-2, 5 c-C5H8); 43,2 (CH3CH2N+НСН2С≡CH); 50,6 (CH3CH2N+HCH2C≡CH); 57,4 (COCH2NH+); 64,5 (С-1 c-C5H8); 71,1 (CH3CH2N+HCH2C≡СН); 80,6 (CH3CH2N+НСН2С≡СН); 127,8 (С-3, 5 Ph); 128,5 (С-4 Ph); 129,8 (С-2, 6 Ph); 140,3 (С-1 Ph); 205,5 (СО).
Пример 22. Синтез (S) 2-(2-(гидроксиметил)пиролидин-1-ил)-1-(1-фенилциклопентил)этан-1-он гидрохлорида

В колбе с обратным холодильником, защищенным от влаги, в 10 мл пропан-2-ола смешивают 2-бром-1-(1-фенилциклопентил)этан-1-он (1,0 г, 3,7 ммоль), полученный по примеру 1, (S) пирролидин-2-илметанол гидрохлорид (1,03 г, 7,5 ммоль) и безводный K2CO3 (2,07 г, 15 ммоль). Раствор оставляют при комнатной температуре и перемешивании на 12 час, упаривают в вакууме, при температуре 45°С, прибавляют 5 мл 10% раствора KOH, упаривают. Остаток растворяют в 20 мл воды, прибавляют 5 мл 10% раствора KOH, экстрагируют эфиром (3×15 мл). Экстракт промывают водой (3×15 мл), сушат над безводным K2CO3, фильтруют, упаривают в вакууме, при температуре 45°С. Остаток хроматографируют (сорбент силикагель 40-60 мкм, элюент - этил ацетат). Фракции, содержащие продукт, упаривают в вакууме при температуре 40°C с добавлением 1 мл концентрированной соляной кислоты. Остаток растворяют в 5 мл ацетона, осаждают 20 мл диэтилового эфира, осадок отфильтровывают, сушат в вакууме при температуре 50°С. Получают (S)-2-(2-(гидроксиметил)пиролидин-1-ил)-1-(1-фенилциклопентил)этан-1-он гидрохлорид в виде бесцветных кристаллов, 0,63 г (52%), Тпл=113-116°С. Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,60-2,31 (6Н, м.); 2,35-2,44 (2Н, м., c-C5H8); 2,90-3,10 (1Н, м., пирролидин); 3,49-3,67 (2Н, м., пирролидин); 3,67-3,93 (2Н, м., CH2OH); 4,01-4,27 (2Н, м., COCH2N+H); 4,61 (1Н, ш.c., CH2OH); 7,20-7,41 (5Н, м., Ph); 11,53 (1Н, ш.с,+NH). Спектр ЯМР1Н (D2O), δ, м.д. (J, Гц): 1,50-1,75 (5Н, м.); 1,85-2,15 (5Н, м.); 2,31-2,46 (2Н, м.) (c-C5H8); 2,71-2,86 (1Н, м., пирролидин); 3,25-3,77 (4Н, м., CH2OH); 4,05-4,44 (2Н, АВ-система., J1=17,8 J2=63,1 COCH2N+H); 7,25-7,45 (5Н, м., Ph). Спектр ЯМР13С (D2O), δ, м.д.: 22,3 (пирролидин); 23,3 (С-3, 4 с-C5H8); 26,0 (пирролидин); 34,5 (С-2, 5 c-C5H8); 56,7 (пирролидин); 60,0 (COCH2N+); 60,3 (пирролидин); 64,3 (С-1 c-C5H8); 70,3 (пирролидин); 127,8 (С-3, 5 Ph); 128,1 (С-4 Ph); 129,87 (С-2, 6 Ph); 140,5 (С-1 Ph); 205,9 (СО).
Пример 23. Синтез (S) 2-(1-гидрокси-4-метилпентан-2-ил)амино)-1-(1-фенилциклопентил)этан-1-он гидрохлорида

К раствору гидрохлорида L-лейцинола (1,84 г, 11 ммоль) в 50 мл N,N-диметилформамида прибавляют K2CO3 (4,2 г, 0,0304 моль), 15 мин перемешивают, прибавляют 2-бром-1-(1-фенил-циклопентил)этан-1-он (2,0 г, 7,5 ммоль), полученный по примеру 1, оставляют при комнатной температуре и перемешивании на 12 час. Упаривают в вакууме, при температуре 40°С, прибавляют трет-бутилметиловый эфир (100 мл), промывают водой (3×50 мл), экстрагируют 5% соляной кислотой (3×50 мл). Экстракт упаривают в вакууме, при температуре 45°С. Остаток растворяют в пропан-2-оле, прибавляют трет-бутилметиловый эфир (200 мл), осадок отделяют, сушат в вакууме при температуре 50°С. Получают (S) 2-(1-гидрокси-4-метилпентан-2-иламино)-1-(1-фенилцикло-пентил)этан-1-он гидрохлорид виде бесцветных кристаллов, 0,6 г (23%). Спектр1Н-ЯМР (300 МГц, DMSO-d6), δ, м.д. (J, Гц): 0,84 (6Н, д.д., J1=6,2, J2=2,4); 1,36-1,15 (3Н, м.); 1,49-1,36 (1Н, м.); 1,82-1,55 (4Н, м.); 2,23-2,08 (4Н, м.); 2,43 (1Н, д., J=12,2); 3,03-2,89 (1Н, м.); 3,53 (2Н, ш.с); 3,78 (2Н, м.); 6,44 (1Н, с); 7,57-7,12 (5Н, м.); 8,7 (1Н, д., J=11); 9,7 (1Н, д., J=11). Спектр13С-ЯМР (75 МГц, DMSO-d6), δ, м.д.: 23,45; 24,11 (С-3, 4 c-C5H8); 24,26; 24,44; 32,85; 33,05 (С-2, 5 c-C5H8); 38,12; 47,96; 52,13 (COCH2N); 59,36; 61,82 (С-1 c-C5H8); 96,04; 127,18 (С-3, 5 Ph); 128,45 (С-4 Ph); 129,6 (С-2, 6 Ph); 143,4 (С-1 Ph); 203,7 (СО).
Пример 24. Синтез (S) 2-((1-гидрокси-3-фенилпроп-2-ил)амино)-1-(1-фенилциклопентил)этанон гидрохлорида

К раствору гидрохлорида (S) 2-амино-3-фенилпрорпан-1-ола (1,51 г, 0,01 моль) в 50 мл N,N-диметилформамида прибавляют безводный K2CO3 (4,2 г, 0,0304 моль), перемешивают 15 мин, прибавляют 2-бром-1-(1-фенилциклопентил)этан-1-он (2,6 г, 0,01 моль), полученный по примеру 1, оставляют при комнатной температуре и перемешивании на 12 час. Упаривают в вакууме, при температуре 40°С, прибавляют трет-бутилметиловый эфир (100 мл), промывают водой (3×50 мл). Органическую фазу экстрагируют 5% соляной кислотой (3×50 мл). Экстракт упаривают в вакууме, при температуре 40°С. Остаток растворяют в пропан-2-оле, прибавляют терт-бутилметиловый эфир (200 мл), осадок отделяют, сушат в вакууме при температуре 40°С. Получают (S) 2-(1-гидрокси-3-фенилпропан-2-иламино)-1-(1-фенилциклопентил)этанон гидрохлорид виде бесцветных кристаллов, 0,78 г (21%). Спектр ЯМР1Н (D2O), δ, м.д. (J, Гц): 1,38-1,67 (4Н, м., c-C5H8); 1,78-2,05 (2Н, м., c-C5H8); 2,23-2,42 (2Н, м., c-C5H8); 3,25-3,41 (2Н, м., PhCH2); 3,85-3,99 (1Н, м., NHCH); 4,05-4,44 (2Н, м., СН2ОН); 4,55 (2Н, с, COCH2N+H); 7,20-7,54 (10Н, м., Ph, Ph). Спектр ЯМР13С (D2O), δ, м.д.: 23,6 (С-3, 4 c-C5H8); 34,6 (С-2, 5 c-C5H8); 35,5 (PhCH2); 58,1 (COCH2NH2+); 60,1 (NHCH); 63,1 (С-1 c-C5H8); 65,3 (СН2ОН); 126,1 (С-4 PhCH2); 127,5 (С-3, 5 Ph); 128,4 (С-4 Ph); 128,8 (С-3, 5 PhCH2); 129,8 (С-2, 6 Ph); 132,4 (С-2, 6 PhCH2); 138,2 (С-1 PhCH2); 140,8 (С-1 Ph); 207,2 (СО).
Пример 25. Синтез 2-(циклопропиламино)-1-(1-(2-фторофенил)-циклопентил)этан-1-он гидрохлорида

В колбе с обратным холодильником, защищенным от влаги, в 10 мл бензола смешивают 2-бром-1-(1-(2-фторофенил)циклопентил)этан-1-он (1,43 г, 5 ммоль), полученный по примеру 10, циклопропиламин (0,86 г, 0,015 ммоль), кипятят в течение 3 час. Растворитель отгоняют в вакууме, при температуре 50°С, прибавляют 11 мл 10% раствора KOH, отгоняют растворитель. Остаток растворяют в 20 мл воды, прибавляют 5 мл 10% раствора KOH, экстрагируют диэтиловым эфиром (3×15 мл). Экстракт промывают водой (3×15 мл), упаривают в вакууме при температуре 40°С. Остаток хроматографируют (сорбент - силикагель 40-60 мкм, элюент - градиент от этилацетата до смеси этил ацетат : триэтиламин 100:1). Фракции, содержащие продукт, объединяют, упаривают в вакууме, при температуре 40°С.Остаток растворяют в этил ацетате, экстрагируют 10% соляной кислотой (3×25 мл). Экстракт упаривают в вакууме, при температуре 40°С. Остаток обрабатывают нагретым до кипения диэтиловым эфиром (3×25 мл), высушивают в вакууме, при температуре 50°С. Получают 2-(циклопропиламино)-1-(1-(2-фторофенил)циклопентил)этан-1-он гидрохлорид в виде порошка белого цвета, 0,83 г (56%), Тпл=105,0-108,5°С.Спектр ЯМР1Н (D2O), δ, м.д. (J, Гц): 0,70-0,85 (4Н, м, с-С3Н5); 1,60-1,75 (4Н, м., (c-C5H8)); 1,95-2,10 (2Н, м., (c-C5H8)); 2,35-2,45 (2Н, м., (с-С5Н8)); 2,52-2,62 (1Н, м, с-С3Н5), 4,10 (2Н, с, COCH2N); 7,15-7,25 (1Н, м., 6-C6H4); 7,33 (1Н, т.д., J1-7,6, J2=1,2, 5-C6H4); 7,42-7,50 (1Н, м., 3-С6Н4); 7,59 (1Н, т.д., J1-7,9, J2=1,6, 4-C6H4). Спектр ЯМР13С (D2O), δ, м.д.: 2,9 (С-2, 3, c-С3Н5); 23,6 (С-3, 4 c-C5H8); 29,8 (С-1, c-С3Н5); 34,2 (С-2, 5 c-C5H8); 52,6 (NCH2); 60,0 (С-1 c-C5H8); 116,2 (д.,2JCF-22,0, С-3 C6H4); 124,9 (С-5,4JCF-1,0, C6H4); 128,2 (д.,3JCF-2,9, С-4 C6H4); 128,5 (д.,3JCF-13,9, С-6 C6H4); 130,2 (д.,2JCF-8,8, С-1 С6Н4); 161,0 (д.,1JCF-244,3, С-2 C6H4); 206,1 (СО).
Пример 26. Синтез 2-(циклопропил(циклопропилметил)амино)-1-(1-(2-фторофенил)циклопентил)этан-1-он гидрохлорида

В колбе с обратным холодильником, защищенным от влаги, смешивают 2-бром-1-(1-(2-фторофенил)циклопентил)этан-1-он (1,43 г, 0,005 моль), полученный по примеру 10, и N-(циклопропилметил)циклопропиламин (1,1 г, 0,01 моль) в 10 мл бензола, кипятят в течение 3 час. Упаривают в вакууме, при температуре 45°С. К остатку прибавляют 11 мл 10% раствора KOH, упаривают, растворяют в 20 мл воды, прибавляют 5 мл 10% раствора KOH, экстрагируют диэтиловым эфиром (3×15 мл). Экстракт промывают водой (3×15 мл), упаривают в вакууме при температуре 40°С. Остаток хроматографируют (сорбент силикагель 40-60 мкм, элюент - градиент от этилацетата до смеси этил ацетат: триэтиламин 100:1). Фракции, содержащие продукт, объединяют, упаривают в вакууме, при температуре 40°С. Остаток растворяют в этилацетате, экстрагируют 10% соляной кислотой (3×25 мл). Экстракт упаривают в вакууме, при температуре 50°С. Остаток обрабатывают кипящим диэтиловым эфиром (3×25 мл), высушивают в вакууме при температуре 50°С. Получают 2-(циклопропил(циклопропилметил)-амино)-1-(1-(2-фторофенил)цикло-пентил)этан-1-он гидрохлорид в виде светло-желтого масла, 0,87 г (49%). Спектр ЯМР1Н (D2O), δ, м.д. (J, Гц): 0,20-0,40 (2Н, м, c-С3Н5); 0,55-0,75 (2Н, м, c-С3Н5); 0,80-1,0 (4Н, м, c-С3Н5); 1,45-1,64 (2Н, м, с-С3Н5); 1,64-1,80 (4Н, м.); 1,95-2,15 (2Н, м., (c-C5H8)); 2,25-2,45 (2Н, м., (с-C5H8)); 2,75- -3,25 (5Н, м, c-С3Н5 и CH2(c-С3Н5)), 4,10-4,35 (2Н, м., COCH2N); 7,10-7,20 (1Н, м., 6-С6Н4); 7,28 (1Н, т.д., J1=7,6, J2=1,2, S-C6H4); 7,35-7,45 (1Н, м., 3-С6Н4); 7,53 (1Н, т.д., J1=7,5, J2=1,7, 4-C6H4). Спектр ЯМР13С (D2O), δ, м.д.: 3,4 (С-2, 3, c-С3Н5); 4,8 (С-1, 3, СН2-c-С3Н5); 5,0 (С-2, 3, СН2-c-С3Н5); 23,5 (С-3, 4 c-C5H8); 48,7 (С-1, c-С3Н5); 34,2 (С-2, 5 c-C5H8); 52,6 (NCH2); 59,6 (СН2-c-С3Н5); 60,3 (С-1 с-C5H8); 116,1 (д.,2JCF=21,3, С-3 C6H4); 125,2 (С-5,4JCF=1,0 С6Н4); 128,2 (д.,3JCF-2,5, С-4 C6H4); 128,5 (д.,3JCF=13,9, С-6 C6H4); 130,3 (д.,2JCF=8,0, С-1 C6H4); 160,4 (д.,1JCF=243,5, С-2 С6Н4); 205,4 (СО).
Пример 27. Синтез 1-(4-(-хлорфенил)тетрагидро-2H-пиран-4-ил)-2-(циклопропиламино)пентан-1-он гидрохлорида
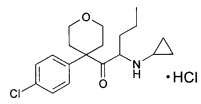
4-(4-хлорфенил)тетрагидро-2H-пиран-4-карбонитрил.
В колбе с обратным холодильником, защищенным от влаги, к раствору 2-(4-хлорбензил)ацетонитрила (30.25 г, 0,2582 моль) в диметилсульфоксиде (250 мл), при перемешивании прибавляют порциями гидрид натрия (13,08 г, 0,545 моль) и раствор бис(2-хлорэтилового) эфира (40,85 г, 0,286 моль) в диметилсульфоксиде (50 мл), перемешивают 15 час. Смесь охлаждают льдом, при перемешивании прикапывают воду (500 мл), экстрагируют этилацетатом (3×200 мл). Экстракт промывают водой (200 мл), насыщенным раствором хлорида аммония (200 мл), водой (200 мл), насыщенным раствором NaHCO3 (200 мл), водой (200 мл), насыщенным раствором NaCl (200 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 40°С. Остаток перегоняют, собирают фракцию при 135-140°С (2 мм.рт.ст.). Получают 4-(4-хлорфенил)тетрагидро-2H-пиран-4-карбонитрил в виде бесцветного масла, 32,1 г (67%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,95-2,20 (4Н, м., c-C4H8O), 3,85-3,95 (2Н, м., с-C4H8O); 4,00-4,15 (2Н, м., с-C4H8O); 7,35-7,50 (4Н, м., C6H4)
1-(4-(4-Хлорфенил)тетрагидро-2H-пиран-4-ил)пентан-1-он.
К раствору 4-(4-хлорфенил)тетрагидро-2H-пиран-4-карбонитрила (10,00 г, 0,045 моль) в 200 мл бензола при перемешивании прибавляют хлорид меди (I) (0,40 г, 0,004 моль), раствор н-бутилмагний йодида (0,113 моль) в диэтиловом эфире (150 мл, 0,75 М раствор), эфир отгоняют, остаток кипятят 18 час. Реакционная смесь охлаждают льдом с солью, прибавляют 150 мл 15% соляной кислоты, кипятят в течение 2 час, охлаждают. Фазы разделяют, водную фазу экстрагируют бензолом (3×50 мл). Экстракты промывают насыщенным раствором NaHCO3 (2×50 мл), насыщенным раствором NaCl (50 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 40°С. Остаток хроматографируют (сорбент силикагель 40-60 мкм, элюент - смесь этил ацетат : бензол 1:10). Фракции, содержащие продукт, объединяют, упаривают в вакууме при температуре 40°С. Получают 1-(4-(4-хлорфенил)тетрагидро-2Я-пиран-4-ил)пентан-1-он в виде светло-желтого масла, 10,20 г (80%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 0,74 (3Н, т., J=8, CH3CH2CH2CH2); 0,95-1,15 (2Н, м., СН3СН2СН2СН2); 1,3-1,42 (2Н, м., СН3СН2СН2СН2); 1,95-2,05 (2Н, м, с-C4H8O); 2,17 (2Н, т., J=8, СН3СН2СН2СН2); 2,35-2,45 (2Н, м., с-C4H8O); 3,50-3,65 (2Н, м., с-C4H8O); 3,75-3,90 (2Н, м., с-C4H8O); 7,21 (2Н, д., J=8, C4H6); 7,33 (2Н, д., J=8, С4Н6).
2-Бром-1-(4-(4-хлорфенил)тетрагидро-2H-пиран-4-ил)пентан-1-он
К раствору 1-(4-(4-хлорфенил)тетрагидро-2H-пиран-4-ил)пентан-1-она (1,4 г, 0,005 моль) в 20 мл тетрахлорметана при перемешивании прибавляют бром (0,8 г, 0,005 моль), перемешивают при 40°С в течение 2 час, упаривают в вакууме, при температуре 45°С. Получают 2-бром-1-(4-(4-хлорфенил)тетрагидро-2H-пиран-4-ил)пентан-1-он в виде желтого порошка, 1,74 г (100%). Спектр ЯМР1H (CDCl3), δ, м.д. (J, Гц): 0,64 (3Н, т., J=7,4, CH3CH2CH2CHBr); 0,95-1,12 (2Н, м., CH3CH2CH2CHBr); 1,27-1,47 (1Н, м., CH3CH2CH2CHBr); 1,95-2,05 (2Н, м, c-C4H8O); 2,20-2,40 (1Н, м., CH3CH2CH2CHBr); 2,45-2,55 (2Н, м., c-C4H8O); 3,65-4,00 (4Н, м., с-C4H8O); 4,1-4,21 (1Н, м., CH3CH2CH2CHBr); 7,25 (2Н, д., J=8,7, С4Н6); 7,39 (2Н, д., J=8,7, С4Н6).
1-(4-(-Хлорфенил)тетрагидро-2H-пиран-4-ил)-2-(циклопропиламино)пентан-1-он гидрохлорид
В колбе с обратным холодильником, защищенным от влаги, в 10 мл бензола смешивают 2-бром-1-(4-(4-хлорфенил)тетрагидро-2H-пиран-4-ил)пентан-1-он (1,74 г, 5 ммоль), циклопропиламин (0,85 г, 15 ммоль), кипятят, перемешивают 24 час. Упаривают в вакууме, при температуре 45°С. К остатку прибавляют 11 мл 10% раствора KOH, растворитель отгоняют. Остаток растворяют в 20 мл воды, прибавляют 5 мл 10% раствора KOH, экстрагируют диэтиловым эфиром (3×15 мл). Экстракт промывают водой (3×15 мл), упаривают в вакууме, при температуре 45°С. Остаток хроматографируют (сорбент силикагель 40-60 мкм, градиент от гептана до смеси гептан: этилацетат 3:1). Фракции, содержащие продукт, объединяют, упаривают в вакууме, при температуре не более 50°С. Остаток растворяют в этилацетате, экстрагируют 10% соляной кислотой (3×25 мл), экстракт упаривают в вакууме, при температуре 40°С. Получают 1-(4-(-хлорфенил)тетрагидро-2H-пиран-4-ил)-2-(циклопропиламино)пентан-1-он гидрохлорид в виде белого порошка, 0,71 г (40%). Спектр ЯМР1Н (DMSO-d6), δ, м.д. (J, Гц): 0,35-1,75 (9Н, м., CH3CH2CH2CHN и С-С3Н5); 1,60-1,71 (1Н, м., с-С3Н5); 2,0-2,49 (6Н, м, CH3CH2CH2CHN и c-C4H8O); 4,49 (1Н, ш.с, CH3CH2CH2CHN); 7,45-7.52 (4Н, м., C4H6); 9,39 (1Н, ш.с, NH2+), 9,68 (1Н, ш.с, NH2+). Спектр ЯМР13С (DMSO-d6), δ, м.д.: 3,3 (С-2, c-С3Н5); 4,2 (С-3, c-С3Н5); 13,7 (NCHCH2CH2CH3); 16,7 6 (NCHCH2CH2CH3); 29,3 (С-1, c-С3Н5); 31,5 (С-1,4 с-C4H8O); 33,8 (NCHCH2CH2CH3); 53,1 (С-1 c-C4H8O); 65,6 (NCHCH2CH2CH3); 64,0 (С-2,3 с-C4H8O); 129,4 (С-3,5 C6H4); 130,2 (С-2,6 C6H4); 133,1 (С-4 C6H4); 137,3 (С-1 С6Н4); 206,5 (СО).
Пример 28. Синтез 2-((2-гидроксиэтил)амино)-1-(1-фенилциклогексил)гептан-1-он гидрохлорида

1-(1-Фенилциклогексил)-гептан-1-он.
К раствору 1-фенилциклогексан-1-карбонитрила (8,34 г, 0,0456 моль), полученный по примеру 2, в 200 мл бензола при перемешивании прибавляют хлорид меди (I) (0,40 г, 0,004 моль), по каплям, прибавляют раствор н-гексилмагний йодида (0,113 моль) в диэтиловом эфире (150 мл, 0,75 М раствор), эфир отгоняют, остаток кипятят 18 час. Смесь охлаждают льдом с солью, при перемешивании прибавляют 150 мл 15% соляной кислоты, далее кипятят в течение 2 час, охлаждают. Фазы разделяют, водную фазу экстрагируют бензолом (3×50 мл). Экстракт промывают насыщенным раствором NaHCO3 (2×50 мл), насыщенным раствором NaCl (50 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 45°С. Остаток перегоняют в вакууме, собирают фракцию с Ткип.=165-175°С (2 мм.рт.ст.). Получают 1-(1-фенилциклогексил)-гептан-1-он в виде светло-желтого масла. Масса составляет 4,68 г (38%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 0,82 (3Н, т., J=8,3, СН3СН2СН2СН2СН2СН2); 1,0-2,0 (16Н, м., CH3CH2CH2CH2CH2CH2 и c-C6H10); 2,21 (2Н, т., J=7,4, СН3СН2СН2СН2СН2СН2); 2,35-2,45 (2Н, м., с-С6Н10); 7,20-7,50 (5Н, м., Ph).
2-Бром-1-(1-фенилциклогексил)гептан-1-он.
К раствору 1-(1-фенилциклогексил)гептан-1-она (1,36 г, 5 ммоль) в 20 мл тетрахлорметана при перемешивании прибавляют бром (0,8 г, 5 ммоль), перемешивают при 50°С в течение 2 час, упаривают в вакууме, при температуре 50°С. Получают 2-бром-1-(1-фенилциклогексил)гептан-1-он в виде желтого порошка, 1,56 г (89%). Спектр ЯМР1Н (DMSO-d6), 8, м.д. (J, Гц): 0,77 (3Н, т., J=8,4, CH3CH2CH2CH2CH2CHBr); 0,9-2,0 (10Н, м., CH3CH2CH2CH2CH2CHBr и с-С6Н10); 2,21-2,45 (4Н, м., CH3CH2CH2CH2CH2CHBr и c-C6H10); 4,25-4,35 (1Н, м., CH3CH2CH2CH2CH2CHBr); 7,20-7,45 (5Н, м., Ph)
2-((2-Гидроксиэтил)амино)1-(1-фенилциклогексил)гептан-1-он гидрохлорид
В колбе с обратным холодильником, в 10 мл пропан-2-ола, смешивают 2-бром-1-(1-фенилциклогексил)гептан-1-он (1,34 г, 3,8 ммоль) и этаноламин (0,93 г, 15 ммоль), кипятят при перемешивании в течение 24 час, упаривают в вакууме, при температуре 45°С. К остатку прибавляют 11 мл 10% раствора KOH, экстрагируют этилацетатом (3×30 мл). Экстракт промывают водой (3×15 мл), упаривают в вакууме при температуре 40°С. Остаток хроматографируют (сорбент силикагель 40-60 мкм, градиент от гептана до смеси гептан : этилацетат 1:3). Фракции, содержащие продукт, объединяют, упаривают в вакууме, при температуре 40°С. Остаток растворяют в этилацетате, экстрагирую 10% соляной кислотой (3×25 мл). Водный экстракт упаривают в вакууме, при температуре 50°С. Получают 2-((2-гидроксиэтил)амино)1-(1-фенилциклогексил)гептан-1-он гидрохлорид в виде белого порошка, 0,47 г (34%). Спектр ЯМР1Н (DMSO-d6), δ, м.д. (J, Гц): 0,5-1,65 (15Н, м., CH3CH2CH2CH2CH2CHN и с-С6Н10); 2,49-1,95 (4Н, м., CH3CH2CH2CH2CH2CHN и с-С6Н10); 2,65 (2Н, ш.с, NH2+CH2CH2OH); 3,59 (2Н, т., J=4,4, NH2+CH2CH2OH); 4,46 (1Н, ш.с, CH3CH2CH2CH2CH2CHN); 5,24 (1Н, ш.с, NH2+CH2CH2OH), 7,20-7,50 (5Н, м., Ph), 8,79 (1Н, ш.с, NH2+), 9,20 (1Н, ш.с, NH2+). Спектр ЯМР13С (DMSO-d6), δ, м.д.: 14,2 (NCHCH2CH2CH2CH2CH3); 22,1 (NCHCH2CH2CH2CH2CH3); 22,4 (С-3,5, с-С6Н10); 22,9 (NCHCH2CH2CH2CH2CH3); 26,6 (С-4, с-С6Н10); 29,6 (NCHCH2CH2CH2-CH2CH3); 31,2 (NCHCH2CH2CH2CH2CH3); 31,3 (С-2, 6, с-С6Н10); 48,7 (СН2СН2ОН); 55,1 (С-1, с-С6Н10); 56,8 (NCHCH2CH2CH2CH2CH3); 62,1 (СН2СН2ОН); 16,7 6 (NCHCH2CH2CH3); 31,5 (С-1,4 c-C6H10); 33,8 (NCHCH2CH2CH3); 53,1 (С-1 с-С6Н10); 65,6 (NCHCH2CH2CH3); 127,9 (С-3,5 Ph); 128,1 (С-2,6 Ph); 129,4 (С-4 Ph); 138,9 (С-1 Ph); 207,7 (СО).
Пример 29. Синтез 2-(диэтиламино)-1-(1-(3-метоксифенил)цикло-пентил)этан-1-он гидрохлорида

1-(3-Метоксифенил)циклопентан-1-карбонитрил.
К кипящей суспензии гидрида натрия (1,54 г, 0,064 моль) в тетрагидрофуране (70 мл) при перемешивании прикапывают 2-(3-метоксифенил)ацетонитрил (4,3 г, 0,029 моль) и 1,4-дибромбутан (3,66 мл, 6,62 г, 0,031 моль), кипятят 11 час. К охлаждаемой льдом смеси, при перемешивании, прикапывают воду (20 мл), фазы разделяют. Органическую фазу упаривают, при температуре 40°С. Остаток растворяют в 50 мл гептана, промывают водой (3×20 мл), насыщенным раствором NaCl, сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 40°С. Остаток хроматографируют (сорбент силикагель 40-60 мкм, элюент-смесь н-гептан : ацетон 25:1), фракции содержащие продукт, объединяют, упаривают в вакууме при температуре 45°С. Получают 1-(3-метоксифенил)циклопентан-1-карбонитрил получают в виде бесцветного масла, 4,65 г (79%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,81-2,11 (6Н, м., c-C5H8); 2,41-2,55 (2Н, м.) (c-C5H8); 3,87 (3Н, c.СН3О); 6,71-6,85 (1Н, м., 4-C6H4); 6,95-7,15 (2Н, м., 2,6-С6Н4); 7,20-7,35 (1Н, м., 5-С6Н4).
1-(1-(-3-метоксифенил)циклопентил)этан-1-он
К раствору 1-(3-метоксифенил)циклопентан-1-карбонитрила (4,62 г, 0,023 моль) в 50 мл бензола прибавляют хлорид меди (I) (0,11 г, 0,001 моль), при температуре 60°С и перемешивании, в течение 10 мин, прибавляют раствор метилмагний йодида (0,046 моль) в диэтиловом эфире (46 мл 1М раствора). Эфир отгоняют, остаток кипятят 18 час. Реакционную смесь охлаждают льдом с солью, при перемешивании прибавляют 50 мл 5% соляной кислоты, кипятят в течение 2 час, охлаждают. Фазы разделяют, водную фазу экстрагируют бензолом (3×25 мл). Экстракты объединяют с органической фазой, промывают насыщенным раствором NaHCO3 (2×25 мл), насыщенным раствором NaCl (25 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 40°С. Остаток хроматографируют (сорбент силикагель 40-60 мкм, элюент-смесь этилацет : гептан, 1:1), фракции, содержащие продукт, объединяют, упаривают в вакууме при температуре 40°С. Получают 1-(1-(-3-метоксифенил)циклопентил)этан-1-он в виде светло-желтого масла, 4,82 г (96%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,55-1,78 (4Н, м., c-C5H8); 1,78-1,95 (2Н, м., c-C5H8); 2,38-2,55 (2Н, м., c-C5H8); 2,33 (3Н, с, СОСН3); 3,74 (3Н, с, СН3О); 6,81-7,05 (1Н, м., 4-C6H4); 7,00-7,15 (2Н, м., 2,6-С6Н4); 7,20-7,35 (1Н, м., 5-С6Н4).
2-Йодо-1-(1-(3-метоксифенил)циклопентил)этан-1-он.
Смесь 1-(1-(3-метоксифенил)циклопентил)этан-1-она (0,87 г, 4 ммоль), растертого оксида меди (II) (0,64 г, 8 ммоль) и йода кристаллического (1 г, 4 ммоль) в 15 мл абсолютного метанола кипятят 5 час, охлаждают, фильтруют, осадок промывают метанолом (5 мл). Фильтрат и промывные жидкости объединяют, упаривают в вакууме, при температуре 45°С. Остаток растворяют в 50 мл этилацетата, промывают водой (25 мл), 2% раствором NaHSO3 (25 мл), насыщенным раствором NaHCO3 (25 мл), насыщенным раствором NaCl (25 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 40°С. Получают 2-йодо-1-(1-(3-метоксифенил)-циклопентил)этан-1-он в виде желтого масла, темнеющего со временем, 1,11 г (80%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,74-1,84 (4Н, м.); 1,86-2,05 (2Н, м.); 2,46-2,59 (2Н, м.) (c-C5H8); 3,95 (2Н, с, COCH2I); 3,83 (3Н, с, СН3О); 6,70-6,85 (1Н, м., 4-C6H4); 6,95-7,15 (2Н, м., 2,6-C6H4); 7,20-7,35 (1Н, м., 5-C6H4).
2-(Диэтиламино)-1-(1-(3-метоксифенил)циклопентил)этан-1-он гидрохлорид.
В колбе с обратным холодильником, защищенным от влаги, смешивают 2-йодо-1-(1-(3-метоксифенил)циклопентил)этан-1-он (1,0 г, 2,9 ммоль), диэтиламин (0,85 г, 11,6 ммоль) в 5 мл метанола, перемешивают 12 час при температуре 25°С. Смесь упаривают в вакууме, при температуре 40°С, остаток растворяют в 50 мл воды, прибавляют 10 мл 20% раствора KOH, экстрагируют диэтиловым эфиром (3×10 мл). Экстракт промывают водой (3×10 мл), экстрагируют 10% соляной кислотой (3×5 мл), водный экстракт упаривают в вакууме при температуре 50°С. Остаток обрабатывают нагретым до кипения диэтиловым эфиром (3×5 мл), осадок отделяют, сушат в вакууме при температуре 50°С. Получают 2-(диэтиламино)-1-(1-(3-метоксифенил)циклопентил)этан-1-он гидрохлорид в виде бесцветного порошка, 0,70 г (74%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,27 (6Н, т., J=7,23, N+H(CH2CH3)2); 1,55-1,85 (4Н, м., c-C5H8); 1,89-2,04 (2Н, м., c-C5H8); 2,38-2,51 (2Н, м., c-C5H8); 3,26 (4Н, м., N+H(CH2CH3)2); 3,85 (3Н, с, СН3О); 4,54 (2Н, д., J=3,0, COCH2N+H); 7,00-7,15 (1Н, м., 4-C6H4); 7,25-7,35 (2Н, м., 2,6-С6Н4); 7,40-7,55 (1H м., 5-С6Н4); 12,25 (1Н, ш.с,+NH(C2H5)2). Спектр ЯМР13С (CDCl3), δ, м.д.: 9,3 (N+H(СН2СН3)2); 23,8 (С-3, 4 c-C5H8); 34,7 (С-2, 5 c-C5H8); 48,9 ((N+H(СН2СН3)2); 51,8 (COCH2N); 55,3 (СН3О); 64,7 (С-1 с-С5Н8); 110,4 (С-2 C6H3(ОСН3)2); 117,1 (С-4 С6Н3(ОСН3)2); 119,5 (С-6 C6H3(ОСН3)2); 129,8 (С-5 С6Н3(ОСН3)2); 149,3 (С-1 C6H3(ОСН3)2); 158,0 (С-3 C6H3(ОСН3)2); 214,3 (СО).
Пример 30. Синтез 1-(1-(2-бром-5-метоксифенил)циклопентил)-2-(диэтиламино)этан-1-он гидрохлорида

К раствору 2-(диэтиламино)-1-(1-(3-метоксифенил)циклопентил)этан-1-он гидрохлорида (0,5 г, 1,53 ммоль), полученному по примеру 29, в 5 мл уксусной кислоты при комнатной температуре прибавляют раствор брома (0,25 г, 1,56 ммоль) в 1 мл уксусной кислоты, перемешивают 2 час, упаривают в вакууме. Остаток растворяют в 10 мл воды, прибавляют 10 мл 20% раствора KOH, экстрагируют диэтиловым эфиром (3×10 мл). Эфирный экстракт промывают водой, экстрагируют 10% соляной кислотой (3×25 мл). Водный экстракт упаривают в вакууме, при температуре 50°С. Остаток обрабатывают нагретым до кипения диэтиловым эфиром (3×5 мл), сушат в вакууме при температуре 50°С. Получают 1-(1-(2-бром-5-метоксифенил)циклопентил)-2-(диэтиламино)этан-1-он гидрохлорид в виде бесцветного порошка, 0,14 г (20%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,31 (6Н, т., J=7,25, N+H(CH2CH3)2); 1,55-1,85 (4Н, м., c-C5H8); 1,89-2,04 (2Н, м., c-C5H8); 2,38-2,51 (2Н, м., c-C5H8); 3,26 (4Н, м., N+H(СН2СН3)2); 3,88 (3Н, с, СН3О); 4,54 (2Н, с, COCH2N+H); 6,45-7,25 (2Н, м., 4, 6-C6H4); 7,40-7,55 (1Н, м., 3-С6Н4), 12,00 (1Н, ш.с,+NH(C2H5)2). Спектр ЯМР13С (CDCl3), δ, м.д.: 9,4 (N+Н(CH2CH3)2); 24,8 (С-3, 4 c-C5H8); 34,6 (С-2, 5 c-C5H8); 49,9 ((N+H(СН2СН3)2); 51,7 (COCH2N); 55,5 (СН3О); 64,7 (С-1 c-C5H8); 111,3 (С-6 C6H4OCH3); 114,2 (С-2 C6H4OCH3); 117,4 (С-4 С6Н4ОСН3); 128,8 (С-3 C6H4OCH3); 149,3 (С-1 С6Н4ОСН3); 158,6 (С-5 С6Н4ОСН3); 210,3 (СО).
Пример 31. Синтез 3-(диметиламино)-1-(1-фенилциклопентил)пропан-1-он гидрохлорида

В колбе с обратным холодильником, в 7 мл бутан-1-ола смешивают 1-(1-фенилциклопентил)этан-1-он (1,9 г, 0,01 моль), полученный по примеру 1, диметиламина гидрохлорид (1,22 г, 0,015 моль) и параформа (0,42 г, 0,014 моль), кипятят 1 час, прибавляют параформ (0,42 г, 0,014 моль), кипятят 5 час. Смесь охлаждают, экстрагируют 5% соляной кислотой (3×20 мл), экстракт промывают диэтиловым эфиром (20 мл). Водную фазу охлаждают до 0°С, прибавляют 20% раствор KOH до рН~12-13, экстрагируют диэтиловым эфиром (3×50 мл). Экстракт сушат над K2CO3, фильтруют, упаривают в вакууме, при температуре 45°С. Остаток хроматографируют (сорбент силикагель 40-60 мкм, градиент от этилацетата к смеси этилацетат : триэтиламин 100:1). Фракции, содержащие продукт объединяют, упаривают в вакууме, при температуре 40°С. К остатку прибавляют 10% раствор соляной кислоты (25 мл), растворитель отгоняют в вакууме. Остаток обрабатывают нагретым до кипения диэтиловым эфиром (3×15 мл), высушивают в вакууме при температуре 50°С. Получают 3-(диметиламино)-1-(1-фенилциклопентил)пропан-1-он гидрохлорид в виде светло-бежевых кристаллов, 1,10 г (39%), Тпл=175,5-176,0°С. Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,57-1,83 (4Н, м.); 1,89-2,06 (2Н, м.); 2,46-2,64 (2Н, м.) (c-C5H8); 2,57 (3Н, с.) и 2,59 (3Н, с.) (N+H(СН3)2); 2,96 (2Н, т., J=6,0, СОСН2СН2); 3,13 (2Н, кв., J=6,0, CH2CH2N+H(СН3)2); 7,21-7,43 (5Н, м., Ph); 12,42 (1Н, ш.с,+NH(CH3)2). Спектр ЯМР13С (CDCl3), δ, м.д.: 24,0 (С-3, 4 c-C5H8); 32,7 (COCH2); 34,8 (С-2, 5 c-C5H8); 43,2 (NH(СН3)2); 53,2 (CH2N+H); 65,7 (С-1 с-С5Н8); 127,4 (С-3, 5 Ph); 128,1 (С-4 Ph); 129,5 (С-2, 6 Ph); 140,0 (С-1 Ph); 207,9 (СО). Масс-спектр: МН+ найдено - 246,13, МН+ вычислено -246,19.
Пример 32. Синтез 3-(диэтиламино)-1-(1-фенилциклопентил)пропан-1-он гидрохлорида

Смесь 1-(1-фенилциклопентил)этан-1-она (1,90 г, 0,01 моль), полученного по примеру 1, диэтиламина (1,6 мл, 1,10 г, 0,015 моль), n-толуолсульфокислоты моногидрата (3,04 г, 0,016 моль) и 5 мл формалина (0,07 моль) в 40 мл толуола кипятят с отгонкой воды (насадка Дина-Старка) до исчезновения исходного кетона (контроль методом ТСХ). Смесь охлаждают, экстрагируют 5% соляной кислотой (3×20 мл). Экстракт промывают диэтиловым эфиром (20 мл), охлаждают до 0°С, прибавляют 20% раствор KOH до рН-12-13, экстрагируют эфиром (3×50 мл). Экстракт сушат над K2CO3, фильтруют, упаривают в вакууме, при температуре 40°С. Остаток хроматографируют (сорбент силикагель 40-60 мкм, элюент - градиент от этилацетата к смеси этилацетат : триэтиламин 100:1). Фракции, содержащие продукт, упаривают в вакууме, при температуре 40°С, прибавляют 10% раствор соляной кислоты (25 мл), упаривают. Остаток обрабатывают нагретым до кипения диэтиловым эфиром (3×15 мл), высушивают в вакууме при температуре 50°С. Получают 3-(диэтиламино)-1-(1-фенилциклопентил)пропан-1-он гидрохлорид в виде бесцветных кристаллов, 1,80 г (58%), Тпл=102,0-104,0°С. Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,22 (6Н, тр, J=6,0, N+H(СН2СН3)2); 1,55-1,81 (4Н, м.); 1,89-2,04 (2Н, м.); 2,47-2,62 (2Н, м.) (c-C5H8); 2,85 (4Н, м., N+Н(СН2СН3)2); 2,94-3,13 (4Н, м., СО CH2CH2N+H(C2H5)2); 7,21-7,38 (5Н, м., Ph); 12,06 (1Н, ш.с.,+NH(C2H5)2). Спектр ЯМР13С (CDCl3), δ, м.д.: 8,7 (N+H(CH2CH3)2); 23,9 (С-3, 4 c-C5H8); 32,2 (СОСН2); 34,7 (С-2, 5 c-C5H8); 46,8 ((N+H(CH2CH3)2); 47,3 (CH2N+HEt2); 65,9 (С-1 c-C5H8); 127,4 (С-2, 6 Ph); 127,8 (С-4 Ph); 129,4 (С-3, 5 Ph); 142,1 (С-1 Ph); 208,1 (СО). Масс-спектр: МН+ найдено - 274,13, МН+ вычислено - 274,22.
Пример 33. Синтез 3-(морфолино)-1-(1-фенилциклобутил)пропан-1-он гидрохлорида

Смесь 1-(1-фенилциклобутил)этан-1-она (4,4 г, 0,025 моль), полученного по примеру 11, морфолина (3,3 мл, 3,27 г, 0,038 моль), n-толуолсульфокислоты моногидрата (7,61 г, 0,04 моль) и 12,5 мл формалина (0,175 моль) в 100 мл толуола, кипятят с отгонкой воды (насадка Дина-Старка) до исчезновения исходного кетона (контроль методом ТСХ). Смесь охлаждают, экстрагируют 5% соляной кислотой (3×50 мл), экстракт промывают диэтиловым эфиром (50 мл), охлаждают до температуры 0°С, прибавляют 20% раствор KOH до рН~12-13, экстрагируют диэтиловым эфиром (3×50 мл). Экстракт сушат над K2CO3, фильтруют, упаривают в вакууме, при температуре 50°С. Остаток хроматографируют (сорбент силикагель 40-60 мкм, градиент от этилацетата до смеси этилацетат : триэтиламин 100:1). Фракции, содержащие продукт, объединяют, упаривают в вакууме, при температуре 40°С. К остатку прибавляют 10% соляную кислоту (50 мл), растворитель отгоняют в вакууме. Остаток обрабатывают нагретым до кипения диэтиловым эфиром (3×15 мл), сушат в вакууме при температуре 50°С. Получают 3-(морфолино)-1-(1-фенилциклобутил)пропан-1-он гидрохлорид в виде бесцветных кристаллов, 2,48 г (32%), Тпл=186°С. Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,89 (2Н, п., J=8,3); 2,44-2,59 (2Н, м.); 2,62-2,74 (2Н, м.) (c-C4H6); 2,74-2,90 (2Н, м.); 2,98-3,11 (4Н, м.) и 3,11-3,22 (2Н, м.) (3, 5-CH2 morpholine и COCH2CH2N); 3,84 (2Н, д. д., J=12,0, J=3,0) и 4,12 (2Н, т., J=12,0) (2, 6-СН2 morpholine); 7,19-7,45 (5Н, м., Ph); 13,04 (1Н, ш.с.,+NH). Спектр ЯМР13С (CDCl3), δ, м.д.: 16,5 (С-3 с-С4Н6); 31,0 (COCH2); 31,2 (С-2, 4 с-С4Н6); 52,3 (С-3, 5 morpholine); 52,7 (COCH2CH2N); 59,4 (С-1 c-С4Н6); 63,8 (С-2, 6 morpholine); 126,8 (С-2, 6 Ph); 127,3 (С-4 Ph); 129,5 (С-3, 5 Ph); 142,3 (С-1 Ph); 207,6 (СО). Масс-спектр: МН+ найдено - 274,12, MH+ вычислено - 274,18.
Пример 34. Синтез 3-(Пирролидинил)-1-(1-(2-фторофенил)цикло-пентил)пропан-1-она гидрохлорида

Смесь 1-(1-(2-фторофенил)циклопентил)этан-1-она (4,20 г, 0,02 моль), полученного по примеру 10, пирролидина (2,5 мл, 2,13 г, 0,03 моль), n-толуолсульфокислоты моногидрата (5,71 г, 0,03 моль), 10 мл формалина (0,14 моль) в 75 мл толуола кипятят с отгонкой воды (насадка Дина-Старка) до исчезновения исходного кетона (контроль методом ТСХ). Смесь охлаждают, экстрагируют 5% соляной кислотой (3% 25 мл), экстракт промывают диэтиловым эфиром (25 мл), охлаждают до температуры 0°С, прибавляют 20% раствора KOH до рН~12-13, экстрагируют диэтиловым эфиром (3×25 мл). Экстракт сушат над K2CO3, фильтруют, упаривают в вакууме, при температуре 45°С. Остаток хроматографируют (сорбент силикагель 40-60 мкм, градиент от этилацетата до смеси этилацетат : триэтиламин 100:1). Фракции, содержащие продукт, объединяют, упаривают в вакууме, при температуре 50°С. К остатку прибавляют 10% соляную кислоту (30 мл), упаривают. Остаток обрабатывают нагретым до кипения диэтиловым эфиром (3×15 мл), сушат в вакууме при температуре 50°С. Получают 3-(пирролидинил)-1-(1-(2-фторофенил)циклопентил)пропан-1-он гидрохлорид в виде бесцветных кристаллов, 2,61 г (40%), Тпл=147,5-148,0°C. Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,70 (4Н, ш.с.); 2,09-2,24 (2Н, м.); 2,31-2.49 (2Н, м.) (c-C5H8); 1,87-2,07 (4Н, м., 3, 4-СН2-N(CH2)4); 2,64-2,81 (2Н, м., 2, 5-СН2-N(CH2)4); 2,95 (2Н, т., J=7,0, COCH2); 3,27 (2Н, кв., J=6,6, CH2N+H); 3.50-3,63 (2Н, м., 2, 5-СН2-N(СН2)4); 6,96-7,09 (1Н, м.); 7,13-7,24 (1Н, м.); 7,24-7,34 (1Н, м.); 7,36-7,47 (1Н, м.) (C6H4F); 12,35 (1Н, ш.с.,+NH(СН2)4). Спектр ЯМР13С (CDCl3), δ, м.д.: 23,7 (С-3, 4 c-C5H8); 24,6 (С-3, 4 N(CH2)4); 34,6 (СОСН2); 35,0 (С-2, 5 c-C5H8); 50,4 (CH2N+H); 54,0 (С-2, 5 N(CH2)4); 61,9 (С-1 c-C5H8); 116,3 (д.,2JCF=21,9, С-3 C6H4); 125,2 (С-5,4JCF=3,0, C6H4); 128,3 (д.,3JCF=4,5, С-4 С6Н4); 129,7 (д.,3JCF=7,5, С-6 C6H4); 130,6 (д.,2JCF=14,3, С-1 C6H4); 161,0 (д.,1JCF=245,3, С-2 C6H4); 207,6 (СО). Масс-спектр: МН+ найдено - 290,14, МН+ вычислено - 290,19.
Пример 35. Синтез 3-(диэтиламино)-1-(1-(3,4-диметоксифенил)-циклопентил)пропан-1-он гидрохлорида

Смесь 1-(1-(3,4-диметоксифенил)циклопентил)этан-1-она (4,97 г, 0,02 моль), полученного по примеру 18, диэтиламина (3,1 мл, 2,19 г, 0,03 моль), n-толуолсульфокислоты моногидрата (5,71 г, 0,03 моль) и 10 мл формалина (0,14 моль) в 75 мл толуола кипятят с отгонкой воды (насадка Дина-Старка) до исчезновения исходного кетона (контроль методом ТСХ). Смесь охлаждают, экстрагируют 5% соляной кислотой (3×25 мл), экстракт промывают диэтиловым эфиром (25 мл). Водную фазу охлаждают до температуры 0°С, прибавляют 20% раствор KOH до рН~12-13, экстрагируют диэтиловым эфиром (3×25 мл). Экстракт сушат над K2CO3, фильтруют, упаривают в вакууме, при температуре 40°С. Остаток хроматографируют (сорбент силикагель 40-60 мкм, градиент от этилацетата к смеси этилацетат : триэтиламин 100:1). Фракции, содержащие продукт, объединяют, упаривают в вакууме, при температуре 40°С. К остатку прибавляют 10% раствор соляной кислоты (30 мл), отгоняют растворитель в вакууме, при температуре 45°С. Остаток обрабатывают нагретым до кипения диэтиловым эфиром (3×15 мл), высушивают в вакууме при температуре 50°С. Получают 3-(диэтиламино)-1-(1-(3,4-диметоксифенил)циклопентил)пропан-1-он гидрохлорид в виде бесцветных кристаллов, 0,81 г (11%), Тпл=119,0-120,0°C. Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,25 (6Н, т., J=7,5, N+H(CH2CH3)2); 1,53 -1,81 (4Н, м.); 1,85-2,09 (2Н, м.); 2,45-2,64 (2Н, м.) (c-C5H8); 2,76-3,03 (4Н, м., COCH2CH2N+H); 3,05 (4Н, ш.с., N+H(СН2СН3)2); 3,85 (3Н, с.) и 3,87 (3Н, с.) (СН3О×2); 6,56-7,00 (3Н, м., C6H3(OCH3)2); 12,04 (1Н, ш.с.,+NH(C2H5)2). Спектр ЯМР1Н (D2O), δ, м.д. (J, Гц): 1,00 (6Н, т., J=7,5, N+H(CH2CH3)2); 1,39-1,64 (4Н, м.); 1,73-1,90 (2Н, м.); 2,25-2,39 (2Н, м.) (c-C5H8); 2,63-2,91 (6Н, м., N+H(CH2CH3)2 и СОСН2СН2); 3,06 (2Н, т., J=6,0, N+HCH2CH2); 3,72 (3Н, с.) и 3,74 (3Н, с.) (СН3О×2); 6,64-7,03 (3Н, м., С6Н3(ОСН3)2). Спектр ЯМР13С (CDCl3), δ, м.д.: 8,7 (N+H(CH2CH3)2); 23,9 (С-3, 4 c-C5H8); 32,2 (СОСН2); 34,7 (С-2, 5 c-C5H8); 46,7 ((N+H(CH2CH3)2); 47,5 (CH2N+H); 56,3 и 56,5 (CH3O×2); 65,3 (C-1 c-C5H8); 110,7 (С-2 С6Н3(ОСН3)2); 111,8 (C-5 С6Н3(ОСН3)2); 119,8 (C-6 C6H3(ОСН3)2); 134,4 (С-1 С6Н3(ОСН3)2); 148,7 (С-3 C6H3(ОСН3)2); 149,5 (С-4 С6Н3(ОСН3)2); 208,4 (СО). Масс-спектр: МН+ найдено - 334,20, МН+ вычислено - 334,24.
Пример 36. Синтез 6-амино-N-(1-(4-(4-хлорфенил)тетрагидро-2H-пиран-4-ил)пентил)гексанамид гидрохлорида

4-(4-Хлорфенил)тетрагидро-2Н-пиран-4-ил)пентан-1-амин гидрохлорид.
В колбе с обратным холодильником, кипятят при перемешивании раствор 1-(4-(4-хлорфенил)тетрагидро-2H-пиран-4-ил)пентан-1-она (2,80 г, 0,01 моль), полученного по примеру 27, и формиата аммония (3,2 г, 0,05 моль) в муравьиной кислоте (2 мл) в течение 48 час. Смесь разбавляют водой, экстрагируют хлористым метиленом (3×30 мл). Экстракт промывают водой (2×10 мл), упаривают в вакууме при температуре 40°С. Остаток кипятят в 35% соляной кислоте (10 мл) в течение 2 час, разбавляют водой (20 мл), экстрагируют хлористым метиленом (2×10 мл). Водную фазу упаривают в вакууме, при температуре 35°С. Получают 4-(4-хлорфенил)тетрагидро-2H-пиран-4-ил)пентан-1-амин гидрохлорид в виде бесцветного порошка, 0,65 г (16%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 0,81 (3Н, т., J=8, CH3CH2CH2CH2CHNH3+); 1,0-1,50 (4Н, м., CH3CH2CH2CH2CHNH3+); 1,6-2,55 (6Н, м., CH3CH2CH2CH2CHNH3+ и с-C4H8O); 3.10 (1Н, ш.с., CH3CH2CH2CH2CHNH3+); 3,75-3,50 (2Н, м., c-C4H8O); 3,77-4,00 (2Н, м., с-C4H8O); 7,35-7,45 (4Н, м., С6Н4); 8,20 (3Н, ш.с., CH3CH2CH2CH2CHNH3+).
трет-Бутил (6-((1-(4-(4-хлорфенил)тетрагидро-2H-пиран-4-ил)-пентил)амино)-6-оксогексил)карбамат
К раствору 6-((трет-бутоксикарбонил)амино)гексановой кислоты (0,43 г, 1,88 ммоль) и триэтиламина (0,19 г, 1,88 ммоль) в N,N-диметилформамиде (5 мл) при (-)5°С, прибавляют изо-бутилхлорформиат (0,26 г, 1,88 ммоль), перемешивают в течение 1 час, прибавляют раствор 4-(4-хлорфенил)тетрагидро-2H-пиран-4-ил)пентан-1-амин гидрохлорида (0,5 г, 1,57 моль) и триэтиламина (0,19 г, 1,88 моль) в N,N-диметилформамиде (5 мл), перемешивают 2 час, разбавляют водой, экстрагируют этилацетатам (3×30 мл). Экстракт промывают водой (2×10 мл), насыщенным раствором NaHCO3 (2×10 мл), насыщенным раствором NaCl (2×10 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 40°С. Остаток хроматографируют (сорбент силикагель 40-60 мкм, элюент-градиент от гептана до смеси гептан : этилацетат 1:3). Фракции, содержащие продукт, объединяют, упаривают в вакууме, при температуре 40°С. Получают трет-бутил (6-((1-(4-(4-хлорфенил)тетрагидро-2H-пиран-4-ил)-пентил)амино)-6-оксогексил)карбамат в виде белого порошка, 0,51 г (65%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 0,79 (3Н, т., J=6,9, CH3CH2CH2CH2CHNH); 1,0-1,75 (19Н, м., CH3CH2CH2CH2CHNH, (СН3)3С и OCCH2CH2CH2CH2CH2NH); 1,78-2,35 (6Н, м., OCCH2CH2CH2CH2CH2NH и с-C4H8O); 3,05-3,15 (2Н, м., OCCH2CH2CH2CH2CH2NH); 3,25-3,50 (2Н, м., c-C4H8O); 3,70-3,95 (2Н, м., с-C4H8O); 4,00-4,15 (1Н, м, CH3CH2CH2CH2CHNH); 4.63 (1Н, ш.с., OCCH2CH2CH2CH2CH2NH); 4,86 (1Н, д, J=10,2, CH3CH2CH2CH2CHNH); 7,21 (2Н, д., J=8,7, C6H4); 7,37 (2Н, д., J=8,7, C6H4).
6-Амино-N-(1-(4-(4-хлорфенил)тетрагидро-2H-пиран-4-ил)пентил)гексанамид гидрохлорид.
К раствору трет-бутил (6-((1-(4-(4-хлорфенид)тетрагидро-2H-пиран-4-ил)пентил)амино)-6-оксогексил)карбамата (0,45 г, 0,91 ммоль) в пропан-2-оле (3 мл) прибавляют 35% соляную кислоту (0,5 мл), перемешивают 1,5 час, упаривают в вакууме при температуре 40°С. Получают 6-амино-N-(1-(4-(4-хлорфенил)тетрагидро-2H-пиран-4-ил)пентил)гексанамид гидрохлорид в виде белого порошка, 0,39 г (100%). Спектр ЯМР1Н (D2O), δ, м.д. (J, Гц): 0,74 (3Н, т., J=6,6, CH3CH2CH2CH2CHNH); 0,95-1,25 (4Н, м., СН3СН2-CH2CH2CHNH); 1,75-1,55 (4Н, м., OCCH2CH2CH2CH2CH2NH3+); 1,58-1,78 (4Н, м., OCCH2CH2CH2CH2CH2NH3+ и CH3CH2CH2CH2CHNH); 1,80-2,00 (2Н, м., ОССН2СН2СН2 CH2CH2NH3+); 2,25-2,50 (4Н, м., c-C4H8O); 3,02 (2Н, т., J=7,6 OCCH2CH2CH2CH2CH2NH3+); 3,25-3,50 (2Н, м., с-C4H8O); 3,70-3,95 (3Н, м., CH3CH2CH2CH2CHNH и c-C4H8O); 7,36 (2Н, д., J=8,7, C6H4); 7,42 (2Н, д., J=8,7, С6Н4). Спектр ЯМР13С (D2O), δ, м.д.: 13,2 (NCHCH2CH2CH2CH3); 21,5 (NCHCH2CH2CH2CH3); 25,4 (OCCH2CH2CH2CH2-CH2NH3+); 26,5 (OCCH2CH2CH2CH2CH2NH3+); 27,2 (OCCH2CH2CH2CH2-CH2NH3+); 27,9 (NCHCH2CH2CH2CH3); 31,1 (NCHCH2CH2CH2CH3); 32,9 (C-2,5 c-C4H8O); 35,6 (OCCH2CH2CH2CH2CH2NH3+); 39,3 (С-1 c-C4H8O); 44,0 (OCCH2CH2CH2CH2CH2NH3+); 57,8 (NCHCH2CH2CH2CH3); 64,1 (C-3,4 c-C4H8O); (OCCH2 CH2CH2CH2CH2NH3+); (NCHCH2CH2CH2CH3); 64,1 (C-2,3 с-C4H8O); 128,4 (C-3,5 C6H4); 130,1 (С-2,6 C6H4); 131,9 (С-4 C6H4); 139,1 (С-1 C6H4); 176,6 (СО).
Пример 37. Синтез 6-амино-N-(1-(1-фенилциклопентил)этил)гексанамид гидрохлорида

1-(1-Фенилциклопентил)этан-1-амин гидрохлорид.
В колбе с обратным холодильником кипятят в течение 10 час раствор 1-(1-фенилциклопентил)этан-1-она (4,3 г, 0,0228 ммоль), полученного по примеру 1, с формиатом аммония (6,3 г 0,1 моль) в муравьиной кислоте (4 мл). Смесь выливают в воду (100 мл), осадок фильтруют, промывают водой. К осадку прибавляют 35% соляную кислоту (10 мл), кипятят до растворения осадка, разбавляют водой (20 мл), экстрагируют этилацетатом (2×10 мл). Экстракт упаривают в вакууме, при температуре 40°С. Получают 1-(1-фенилциклопентил)этан-1-амин гидрохлорид в виде белого порошка, 2,9 г (70%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,21 (3Н, д., J=6,7, CH3CHNH3+), 1,5-2,5 (8Н, м., c-C5H8); 3,54 (1Н, м., CH3CHNH); 7,25-7,45 (5Н, м., Ph); 8,2 (3Н, ш.с., CH3CHNH3+).
трет-Бутил (6-оксо-6((1-(1-фенилциклопентил)этил)амино)гексил)-карбамат.
К раствору 6-((трет-бутоксикарбонил)амино)гексановой кислоты (2,31 г, 0,01 моль) и триэтиламина (1,12 г, 0,011 моль) в хлористом метилене (20 мл) при (-)5°С прибавляют изо-бутилхлорформиат (1,52 г, 0,011 моль), перемешивают при комнатной температуре 1 час. Прибавляют раствор 1-(1-фенилциклопентил)этан-1-амин гидрохлорида (2,25 г, 0,01 моль) и триэтиламина (1,12 г, 11 ммоль) в хлористом метилене (20 мл), перемешивают 2 час. Разбавляют водой, экстрагируют дихлорметаном (3×50 мл). Экстракт промывают водой (2×10 мл), насыщенным раствором NaHCO3 (2×10 мл), насыщенным раствором NaCl (2×10 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 40°С. Остаток хроматографируют (сорбент силикагель 40-60 мкм, элюент-градиент от гептана до смеси гептан : этилацетат 1:3). Фракции, содержащие продукт, объединяют, упаривают в вакууме, при температуре 45°С. Получают трет-бутил (6-оксо-6((1-(1-фенилциклопентил)этил)амино)-гексил)карбамат в виде белого порошка, 3,47 г (86%). Спектр ЯМР1Н (DMSO-d6), δ, м.д. (J, Гц): 0,73 (3Н, д., J=6,7, CH3CHNH); 1,25-2,00 (23Н, м., c-C5H8, (СН3)3С и OCCH2CH2CH2CH2CH2NH); 2,05-2,25 (2Н, м., OCCH2CH2CH2CH2CH2NH); 2,89 (2Н, м., OCCH2CH2CH2CH2CH2NH); 4,10-4,22 (1Н, м., CH3CHNH); 6,75 (1Н, м., OCCH2CH2CH2CH2CH2NH); 7,20 (1Н, м., CH3CHNH); 7,25-7,35 (5Н, м., Ph).
6-Амино-N-(1-(1-фенилциклопентил)этил)гексанамид гидрохлорид.
К раствору трет-бутил (6-оксо-6((1-(1-фенилциклопентил)этил)амино)-гексил)карбамата (3,0 г, 7,45 ммоль) в пропан-2-оле (20 мл) прибавляют 35% соляную кислоту (1 мл), выдерживают 1,5 час, упаривают в вакууме, при температуре 45°С. Получают 6-амино-N-(1-(1-фенилциклопентил)этилгексанамид гидрохлорид в виде белого порошка, 2,0 г (79%). Спектр ЯМР1Н (D2O), δ, м.д. (J, Гц): 0,92 (3Н, д., J=6,7, CH3CHNH); 1,25-2,10 (14Н, м., c-C5H8, и OCCH2CH2CH2CH2CH2NH3+); 2,15-2,25 (2Н, м., OCCH2CH2CH2CH2CH2NH3+); 2,99 (2Н, т., J=7,6, OCCH2CH2CH2CH2CH2NH3+); 4,12-4,20 (1Н, м., CH3CHNH); 7,25-7,45 (5Н, м., Ph). Спектр ЯМР13С (D2O), δ, м.д.: 16,3 (CH3CHNH); 22,8 (OCCH2CH2CH2CH2CH2NH3+); 25,0 (OCCH2CH2CH2CH2CH2NH3+); 25,3 (С-3, 4 с-C5H8); 2,6,48 (OCCH2CH2CH2CH2CH2NH3+); 34,6 (С-2, 5 c-C5H8); 35,7 (OCCH2CH2CH2CH2CH2NH3+); 39,3 (OCCH2CH2CH2CH2CH2NH3+); 50,7 (С-1 с-C5H8); 55,3 (CH3CHNH); 126,2 (С-3, 5 Ph); 128,1 (С-4 Ph); 128,2 (С-2, 6 Ph); 144,4 (С-1 Ph); 175,22 (OCCH2CH2CH2CH2CH2NH3+).
Пример 38. Синтез 6-амино-N-((1-фенилциклопентил)метил)гексанамид гидрохлорида

1-(1-Фенилциклопентил)метанамин гидрохлорид.
К раствору 1-фенилциклопентан-1-карбонитрила (1,71 г, 0,01 моль), полученного по примеру 1, с ди-трет-бутил дикарбонатом (4,37 г, 0,02 моль) и NiCl2*6H2O (0,24 г, 1 ммоль) в метаноле (75 мл) при 0°С, порциями присыпают NaBH4 (2,65 г, 0,07 моль) таким образом, чтобы температура не поднималась выше 5°С, перемешивают 5 час при комнатной температуре, упаривают в вакууме, при температуре 40°С. Остаток растворяют в этилацетате (50 мл), промывают водой (3×20 мл), насыщенным раствором хлористого аммония (3×20 мл), насыщенным раствором NaHCO3 (3×20 мл), насыщенным раствором NaCl (3×20 мл), сушат над Na2SO4, фильтруют, упаривают в вакууме, при температуре 45°С. К остатку прибавляют 35% соляную кислоту (10 мл), перемешивают при 40°С до полного растворения осадка, разбавляют водой (20 мл), экстрагируют диэтиловым эфиром. Водную фазу упаривают в вакууме при температуре 40°С. Получают 1-(1-фенилциклопентил)метанамин гидрохлорид в виде бесцветного порошка, 1,8 г (85%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,5-1,90 (4Н, м., c-C5H8); 1,95-2,15 (4Н, м., c-C5H8); 3,02 (2Н, с., CH2NH3+); 7,20-7,38 (5Н, Ph); 7.79 (3Н, ш.с., CH2NH3+)
трет-Бутил (6-оксо-6((1-(1-фенилциклопентил)метил)амино)гексил)-карбамат.
К раствору 6-((трет-бутоксикарбонил)амино)гексановой кислоты (2,31 г, 0,01 моль) и триэтиламина (1,12 г, 0,011 моль) в хлористом метилене (20 мл) при температуре (-)5°С прибавляют изо-бутилхлорформиат (1,52 г, 0,011 моль), перемешивают при комнатной температуре 1 час, прибавляют раствор 1-(1-фенилциклопентил)этан-1-амин гидрохлорида (2,25 г, 0,01 моль) и триэтиламина (1,12 г, 11 ммоль) в хлористом метилене (20 мл). Смесь перемешивают 2 час, разбавляют водой, экстрагируют хлористым метиленом (3×50 мл). Экстракт промывают водой (2×10 мл), насыщенным раствором NaHCO3 (2×10 мл), насыщенным раствором NaCl (2×10 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 40°С. Остаток хроматографируют (сорбент силикагель 40-60 мкм, элюент-градиент от гептана до смеси гептан : этилацетат 1:3). Фракции, содержащие продукт, объединяют, упаривают в вакууме, при температуре 40°С. Получают трет-бутил (6-оксо-6((1-(1-фенилциклопентил)метил)амино)гексил)карбамат в виде белого порошка, 3,47 г (86%). Спектр ЯМР1Н (DMSO-d6), δ, м.д. (J, Гц): 1,25-2,00 (23Н, м., c-C5H8, (CH3)3C и OCCH2CH2CH2CH2CH2NH); 2,05-2,25 (2Н, м., OCCH2CH2CH2CH2CH2NH); 2,89 (2Н, м., OCCH2CH2CH2CH2CH2NH); 3,43 (2Н, д., J=6,11, CH2NH); 6,75 (1Н, ш.с., OCCH2CH2CH2CH2CH2NH); 5,20 (1Н, м., CH2NH); 7,25-7,35 (5Н, м., Ph).
6-Амино-N-((1-фенилциклопентил)метил)гексанамид гидрохлорид.
К раствору mpem-бутил (6-оксо-6-(((1-фенилциклопентил)метил)амино)-гексил)карбамата (2,91 г, 7,5 ммоль) в пропан-2-оле (20 мл) прибавляют 35% соляную кислоту (1 мл), перемешивают в течение 1,5 час. Упаривают в вакууме, при температуре 40°С. Получают 6-амино-N-((1-фенилциклопентил)метил)гексанамид гидрохлорид в виде белого порошка, 2,1 г (86%). Спектр ЯМР1Н (D2O), δ, м.д. (J, Гц): Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,25-2,10 (14Н, м., c-C5H8, и OCCH2CH2CH2CH2CH2NH3+); 2,07 (2Н, т., J=7,4, OCCH2CH2CH2CH2CH2NH3+); 2,93 (2Н, т., J=7,7, OCCH2CH2CH2CH2CH2NH3+); 3,3 (1Н, с., CH2NH); 7,15-7,35 (5Н, м., Ph). Спектр ЯМР13С (D2O), δ, м.д.: 22,9 (OCCH2CH2CH2CH2CH2NH3+); 24,9 (OCCH2CH2CH2CH2CH2NH3+); 25,1 (С-3, 4 с-C5H8); 26,4 (ОССН2СН2СН2-CH2CH2NH3+); 35,3 (С-2, 5 c-C5H8); 35,4 (OCCH2CH2CH2CH2CH2NH3+); 39,2 (OCCH2CH2CH2CH2CH2NH3+); 47,9 (С-1 с-C5H8); 51,7 (CH2NH); 126,2 (С-3, 5 Ph); 127,1 (С-4 Ph); 128,3 (С-2, 6 Ph); 146,6 (С-1 Ph); 176,0 (OCCH2CH2CH2CH2CH2NH3+).
Пример 39. Синтез 6-амино-N-(4-(3,4-диметоксифенил)тетрагидро-2H-пиран-4-ил)гексанамид гидрохлорида

4-(3,4-диметоксифенил)тетрагидро-2H-пиран-4-карбоксамид.
В колбе с обратным холодильником кипятят в течение 4 час, при перемешивании, раствор 4-(3,4-диметоксифенил)тетрагидро-2H-пиран-4-карбонитрила (4,7 г, 0,019 моль), полученного по примеру 18, гидроксида калия (3,76 г, 0,067 моль) в изопропиловом спирте (60 мл), упаривают в вакууме, при температуре 45°С. Остаток растворяют в воде (200 мл), экстрагируют хлористым метиленом (3×70 мл). Экстракт промывают водой, сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 50°С. Остаток кристаллизуют из гептана (50 мл), сушат в вакууме при температуре 50°С. Получают 4-(3,4-диметоксифенил)тетрагидро-2Н-пиран-4-карбоксамид в виде игольчатых кристаллов, 3,0 г (63%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 2,05-2,25 (2Н, м., с-C4H8O), 2,30-2,45 (2Н, м., c-C4H8O); 3,75-3,85 (4Н, м., с-С4Н8О); 3,89 (3Н, с., СН3О); 3,91 (3Н, с., СН3О); 5,22 (1Н, ш.с., NH2); 5,35 (1Н, ш.с., NH2); 6,85-7,10 (3Н, м., С6Н3).
Метил (4-(3,4-диметоксифенил)тетрагидро-2Н-пиран-4-ил)карбамат.
В колбе с обратным холодильником, к раствору 4-(3,4-диметоксифенил)тетрагидро-2Н-пиран-4-карбоксамид (2,21 г, 8,3 моль) в метаноле (13 мл), при перемешивании прибавляют N-бромсукцинимид (1,48 г, 8,3 моль) и 1,8-диазабицикло[5,4,0]ундец-7-ен (2.92 г, 0,0192 моль), кипят 1,5 час. Упаривают в вакууме, при температуре 45°С. Остаток растворяют в этилацетате (100 мл), промывают водой (2×25 мл), 0,35М Н3РО4 (2×20 мл), раствором КОН (1М), (2×25 мл), водой (2×25 мл), насыщенным раствором NaCl (25 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 45°С. Получают метил (4-(3,4-диметоксифенил)тетрагидро-2Н-пиран-4-ил)-карбамат в виде светло-желтого масла, 1,59 г (65%), Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 2,05-2,35 (4Н, м., с-С4Н8О); 3,61 (3Н, с., CH3OCNH); 3,70-3,85 (2Н, м., с-С4Н8О); 3,87-3,95 (8Н, м., c-C4H8O и СН3О); 5,03 (1Н, с., CH3OCNH); 6,85-7,10 (3Н, м., С6Н3).
4-(3,4-Диметоксифенил)тетрагидро-2Н-пиран-4-амина гидрохлорид.
В колбе с обратным холодильником кипятят в течение 3,5 час раствор метил (4-(3,4-диметоксифенил)тетрагидро-2Н-пиран-4-ил)карбамата (1,49 г, 5 ммоль) с гидроксидом калия (1,43 г, 0,0255 моль) в смеси вода (2,5 мл):этанол (10 мл). Упаривают в вакууме при температуре 40°С, к остатку прибавляют 35% соляную кислоту (3,18 г, 0,0305 моль) и 10 мл воды. Смесь перемешивают в течение 15 мин, прибавляют КОН (2,35 г, 0,0419 моль), экстрагируют трет-бутилметиловым эфиром (2×25 мл). Экстракт сушат над К2СО3, фильтруют, упаривают в вакууме, при температуре 40°С, прибавляют пропан-2-ол (20 мл) и 35% соляную кислоту (0,55 г, 5,3 ммоль). Осадок отделяют, промывают пропан-2-олом (2×2 мл), сушат в вакууме при температуре 50°С. Получают 4-(3,4-диметоксифенил)тетрагидро-2Н-пиран-4-амина гидрохлорид в виде порошка белого цвета, 0,46 г (34%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 2,05-2,25 (2Н, м., с-C4H8O); 2,50-2,70 (2Н, м., с-C4H8O); 3,30-3,60 (2Н, м., с-C4H8O); 3,78 (6Н, м., CH3O); 3,87-3,95 (2Н, м., с-C4H8O); 7,05-7,35 (3Н, м., С6Н3).
трет-Бутил(6-((4-(3,4-диметоксифенил)тетрагидро-2Н-пиран-4-ил)-амино)-6-оксогексил)карбамата.
К раствору 6-((трет-бутоксикарбонил)амино)гексановой кислоты (0,33 г, 0,00146 моль) и триэтиламина (0,15 г, 1,46 ммоль) в тетрагидрофуране (5 мл) при температуре (-)5°С прибавляют изо-бутилхлорформиат (0,20 г, 1,46 ммоль), перемешивают при температуре 20°С 1 час, прибавляют раствор 4-(3,4-диметоксифенил)тетрагидро-2H-пиран-4-амина гидрохлорида (0,40 г, 1,46 ммоль) и триэтиламина (0,16 г, 1,46 ммоль) в тетрагидрофуране (6 мл). Смесь перемешивают 2 час, разбавляют водой, экстрагируют этилацетатам (3×30 мл). Экстракт промывают водой (2×10 мл), насыщенным раствором NaHCO3 (2×10 мл), насыщенным раствором NaCl (2×10 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 40°С. Остаток хроматографируют (сорбент силикагель 40-60 мкм, элюент - градиент от гептана до этилацетата). Фракции, содержащие продукт, объединяют, упаривают в вакууме при температуре 45°С. Получают (6-((4-(3,4-диметоксифенил)тетрагидро-2H-пиран-4-ил)амино)-6-оксогексил)карбамат в виде белого порошка, 0,18 г (27%). Спектр ЯМР1Н (DMSO-d6), δ, м.д. (J, Гц): 1,30-1,40 (2Н, м., OCCH2CH2CH2CH2CH2NH); 1,41-1,58 (11Н, м., HNOCCH2CH2CH2CH2CH2NH и (СН3)3С); 1,60-1,80 (2Н, м., HNOCCH2CH2CH2CH2CH2NH); 2,05-2,25 (4Н, м., HNOCCH2CH2CH2CH2-CH2NH и с-C4H8O); 2,35-2,45 (2Н, м., с-C4H8O); 3,05-3,20 (2Н, м., HNOCCH2CH2CH2CH2CH2NH); 3,65-3,80 (2Н, м., с-C4H8O); 3,80-3,95 (8Н, м., с-C4H8O и CH3O), 4,59 (1Н, ш.с., HNOCCH2CH2CH2CH2CH2N); 5,71 (1Н, ш.с., HNOCCH2CH2CH2CH2CH2NH); 6,80-7,00 (3Н, м., С6Н3).
6-Амино-N-(4-(3,4-диметоксифенил)тетрагидро-2Н-пиран-4-ил)-гексанамид гидрохлорид.
К раствору трет-бутил (6-((4-(3,4-диметоксифенил)тетрагидро-2Н-пиран-4-ил)амино)-6-оксогексил)карбамата (0,16 г, 0,36 ммоль) в пропан-2-оле (3 мл) прибавляют 35% соляную кислоту (0,1 г, 1 ммоль), выдерживают 1,5 час. Упаривают в вакууме, при температуре 50°С. Получают 6-амино-N-(4-(3,4-диметоксифенил)тетрагидро-2H-пиран-4-ил)гексанамид гидрохлорид в виде белого порошка, 0,12 г (86%). Спектр ЯМР1Н (D2O), δ, м.д. (J, Гц): 1,15-1,35 (2Н, м., OCCH2CH2CH2CH2CH2NH3+); 1,41-1,60 (4Н, м., HNOCCH2CH2CH2CH2CH2NH3+); 1,95-2,05 (2Н, м., HNOCCH2CH2CH2CH2CH2NH3+); 2,18-2,25 (4Н, м., с-C4H8O); 2,87 (2Н, т., J=6,8, HNOCCH2CH2CH2CH2CH2NH3+); 3,60-4,00 (10Н, м., с-C4H8O и СН3); 6,85-7,00 (3Н, м., С6Н3). Спектр ЯМР13С (D2O), δ, м.д.: 23,7 (OCCH2CH2CH2CH2CH2NH3+); 4,9 (ОССН2СН2СН2СН2 CH2NH3+); 25,2 (OCCH2CH2CH2CH2CH2NH3+); 26,4 (OCCH2CH2CH2CH2CH2NH3+); 35,1 (OCCH2CH2CH2CH2CH2NH3+); 36,0 (OCCH2CH2CH2CH2CH2NH3+); 39,2(C-2, 5c-C4H8O); 55,3 (C-1 c-C4H8O); 55,7 (CH3O); 63,6 (C-3, 4c-C4H8O); 109,1 (C-5, C6H3); 111,6 (C-2, C6H3); 117,9 (C-6, C6H3); 138,9 (C-1, C6H3); 147,0 (C-4, C6H3); 148,0 (C-3, C6H3); 176,3 (OCCH2CH2CH2CH2CH2NH3+).
Пример 40. Синтез 6-амино-N-(4-фенилтетрагидро-2H-пиран-4-ил)гексанамид гидрохлорида

4-Фенилтетрагидро-2Н-пиран-4-карбонитрил.
В колбе с обратным холодильником, защищенным от влаги, к раствору бензилцианида (30,25 г, 0,258 моль) в диметилсульфоксиде (250 мл), при перемешивании прибавляют порциями гидрид натрия (13,1 г, 0,545 моль) и раствор бис(2-хлорэтилового) эфира (40,82 г, 0,286 моль) в диметилсульфоксиде (100 мл), перемешивают в течение 15 час. Смесь охлаждают льдом, при перемешивании прикапывают воду (500 мл), экстрагируют этилацетатом (3×300 мл). Экстракт промывают водой (200 мл), насыщенным раствором хлорида аммония (200 мл), водой (200 мл), насыщенным раствором NaHCO3 (200 мл), водой (200 мл), насыщенным раствором NaCl (200 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 45°С. Остаток перегоняют в вакууме, собирают фракцию с Ткип.=135-140°С (2 мм. рт.ст.). Получают 4-фенил-тетрагидро-2H-пиран-4-карбонитрил в виде бесцветного масла, 32,1 г (65%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 2,00-2,25 (4Н, м., с-C4H8O), 3,85-3,95 (2Н, м., c-C4H8O, CH3O-); 4,00-4,20 (2Н, м., с-C4H8O); 7,30-7,60 (5Н, м., Ph).
4-Фенилтетрагидро-2Н-пиран-4-карбоксамид.
В колбе с обратным холодильником, кипятят при перемешивании, течение 6 час, раствор 4-фенилтетрагидро-2H-пиран-4-карбонитрила (16,20 г, 0,087 моль) и КОН (14,85 г, 0,265 моль) в пропан-2-оле (360 мл). Смесь упаривают в вакууме, при температуре 40°С, остаток промывают водой (1000 мл), осадок отфильтровывают, промывают водой (2×100 мл), гексаном (2×50 мл), сушат в вакууме при температуре 50°С. Получают 4-фенилтетрагидро-2H-пиран-4-карбоксамид в виде игольчатых кристаллов, 12,0 г (68%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 2,05-2,25 (2Н, м., с-C4H8O), 2,30-2,45 (2Н, м., с-C4H8O); 3,75-3,85 (4Н, м., с-C4H8O); 5,0-5,6 (2Н, ш.с., NH2); 7,3-7,50 (5Н, м., Ph).
Метил (4-фенилтетрагидро-2Н-пиран-4-ил)карбамат.
В колбу с обратным холодильником, к раствору 4-фенилтетрагидро-2H-пиран-4-карбоксамида (11.96 г, 0,0583 моль) в метаноле (130 мл), при перемешивании, прибавляют N-бромсукцинимид (13,48 г, 0,076 моль) и 1,8-диазабицикло[5.4.0]ундец-7-ен (20.4 г, 0.134 моль), кипят 1,5 час. Упаривают в вакууме, при температуре 45°С, остаток растворяют в этилацетате (500 мл), промывают водой (2×150 мл), 0,35 М фосфорной кислотой (2×150 мл), 1 М раствором КОН (2×150 мл), водой (2×150 мл), насыщенным раствором NaCl (150 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 45°С. Получают метил (4-фенилтетрагидро-2H-пиран-4-ил)карбамат в виде белого порошка, 9,96 г (73%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 2,05-2,35 (4Н, м., с-C4H8O); 3,60 (3Н, с., CH3OCNH); 3,70-3,85 (4Н, м., с-C4H8O); 5,36 (1Н, с., CH3OCNH); 7,3-7,50 (5Н, м., Ph).
4-Фенилтетрагидро-2Н-пиран-4-амин гидрохлорид.
В колбе с обратным холодильником, кипятят в течение 3,5 час раствор метил (4-фенилтетрагидро-2H-пиран-4-ил)карбамата (5,0 г, 0,0213 моль) и КОН (6,0 г, 0,107 моль) в 55 мл смеси вода : этанол (1:10). Упаривают в вакууме при температуре 40°С, прибавляют 35% соляную кислоту (30 г, 0,288 моль) и 50 мл воды, перемешивают 15 мин, прибавляют КОН (20 г, 0,357 моль), экстрагируют трет-бутилметиловым эфиром (3×50 мл), сушат над К2СО3, фильтруют, упаривают в вакууме, при температуре 50°С. К остатку прибавляют пропан-2-ол (20 мл) и 35% соляную кислоту (2,3 г, 0,022 моль), осадок отфильтровывают, промывают пропан-2-олом (2×5 мл), сушат в вакууме. Получают 4-фенилтетрагидро-2H-пиран-4-амин гидрохлорид в виде порошка белого цвета, 3,25 г (71%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 2,10-2,15 (2Н, м., с-C4H8O); 2,25-2,45 (2Н, м., с-C4H8O); 3,40-3,50 (2Н, м., с-C4H8O); 3,85-3,95 (2Н, м., с-C4H8O); 7,35-7,50 (3Н, м., Ph), 7,66 (1Н, д., J=7,6, Ph); 8,68 (3Н, ш.с., NH3+).
трет-Бутил(6-оксо-6-((4-фенилтетрагидро-2Н-пиран-4-ил)амино)-гексил)карбамат.
К раствору 6-((трет-бутоксикарбонил)амино)гексановой кислоты (2,56 г, 11 ммоль) и триэтиламина (1,03 г, 0,0102 моль) в хлористом метилене (20 мл) при температуре (-) 5°С, прибавляют изо-бутилхлорформиат (1,26 г, 9,2 ммоль), перемешивают при комнатной температуре 1 час, прибавляют раствор 4-фенилтетрагидро-2Н-пиран-4-амина гидрохлорида (1,97 г, 9,2 ммоль) и триэтиламина (0,93 г, 9,2 ммоль) в диметилформамиде (20 мл). Смесь перемешивают 2 час, разбавляют водой, экстрагируют этилацетатам (3×100 мл). Экстракт промывают водой (2×100 мл), насыщенным раствором NaHCO3 (2×100 мл), насыщенным раствором NaCl (2×100 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 40°С. Остаток хроматографируют (сорбент - силикагель 40-60 мкм, элюент - градиент от гептана до этилацетата). Фракции, содержащие продукт, объединяют, упаривают в вакууме, при температуре 40°С. Получают трет-бутил(6-оксо-6-((4-фенилтетрагидро-2H-пиран-4-ил)амино)гексил)карбамат в виде белого порошка, 3,05 г (85%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,30-1,40 (2Н, м., OCCH2CH2CH2CH2CH2NH); 1,41-1,58 (11Н, м., HNOCCH2CH2CH2CH2CH2NH и (СН3)3С); 1,60-1,70 (2Н, м., HNOCCH2CH2-CH2CH2CH2NH); 2,05-2,25 (4Н, м., HNOCCH2CH2CH2CH2CH2NH и с-C4H8O); 2,35-2,45 (2Н, м., с-C4H8O); 3,05-3,20 (2Н, м., HNOCCH2CH2CH2-CH2CH2NH); 3,70-3,80 (2Н, м., с-C4H8O); 3,80-3,95 (2Н, м., с-C4H8O), 4,56 (1Н, ш.с., HNOCCH2CH2CH2CH2CH2N); 5,74 (1Н, ш.с., HNOCCH2CH2CH2-CH2CH2NH); 7,25-7,50 (5Н, м., Ph).
6-Амино-N-(4-фенилтетрагидро-2Н-пиран-4-ил)гексанамид гидрохлорид.
К раствору трет-бутил(6-оксо-6-((4-фенилтетрагидро-2H-пиран-4-ил)амино)гексил)карбамата (3,02 г, 7,7 ммоль) в 1,4-диоксане (10 мл) прибавляют раствор метансульфокислоты (1,12 г, 11,6 ммоль) в 1 мл хлористого метилена, выдерживают 15 час. Смесь упаривают в вакууме, при температуре 45°С, прибавляют раствор КОН (5 г, 0,0893 моль) в воде (20 мл), экстрагируют хлористым метиленом (3×50 мл). Экстракт промывают водой (2×50 мл), сушат над K2CO3, фильтруют, упаривают в вакууме, при температуре 50°С. Остаток растворяют в пропан-2-оле (10 мл), прибавляют соляную кислоту (0,8 г, 7,7 моль), упаривают в вакууме, при температуре 45°С. Получают 6-амино-N-(4-фенилтетрагидро-2H-пиран-4-ил)гексанамида гидрохлорид в виде кристаллизующегося масла, 1,88 г (74%). Спектр ЯМР1H (D2O), δ, м.д. (J, Гц): 1,15-1,35 (2Н, м., OCCH2CH2CH2CH2CH2NH3+); 1,41-1,60 (4Н, м., HNOCCH2CH2CH2CH2CH2NH3+); 1,95-2,05 (2Н, м., HNOCCH2CH2CH2-CH2CH2NH3+); 2,18-2,25 (4Н, м., с-C4H8O); 2,88 (2Н, т., J=4, HNOCCH2CH2-CH2CH2CH2NH3+); 3,60-4,00 (4Н, м., c-C4H8O); 7,20-7,40 (3Н, м., Ph). Спектр ЯМР13С (D2O), δ, м.д.: 24,8 (OCCH2CH2CH2CH2CH2NH3+); 25,2 (OCCH2CH2CH2CH2CH2NH3+); 26,4 (OCCH2CH2CH2CH2CH2NH3+); 35,1 (OCCH2CH2CH2CH2CH2NH3+); 35,9 (C-2,5, c-C4H8O); 39,3 (OCCH2CH2-CH2CH2CH2NH3+); 55,5 (C-1, c-C4H8O); 63,6 (C-3, 4, c-C4H8O); 125,0 (C-4, Ph); 127,2 (C-2, 6, Ph); 128,7 (C-3, 5, Ph); 145,5 (C-1, Ph); 176,3 (OCCH2CH2-CH2CH2CH2NH3+).
Пример 41. Синтез N-(2-(2-аминоэтокси)этил)-1-фенилциклогексан-амин дигидрохлорида

1-Фенилциклогексан-1-карбоксамид.
В колбе с обратным холодильником, кипятят раствор 1-фенил-циклогексанкарбонитрила (21,3 г, 0,12 моль), полученного по примеру 2, и серной кислоты (11,8 г, 0,12 моль) в трифторуксусной кислоте (45 мл) в течение 12 час. Смесь выливают в воду со льдом (200 мл), экстрагируют хлористым метиленом (3×150 мл). Экстракт промывают водой (2×100 мл), насыщенным раствором NaHCO3 (2×100 мл), водой (2×100 мл), насыщенным раствором NaCl (100 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 40°С. Остаток перекристаллизовывают из гексана (100 мл), фильтруют, промывают гексаном (2×10 мл), сушат в вакууме, при температуре 50°С. Получают 1-фенилциклогексан-1-карбоксамид в виде белого порошка, 16,5 г (67%). Спектр ЯМР1Н (DMSO-d6), δ, м.д. (J, Гц): 1,2-1,45 (4Н, м., с-С6Н10); 1,6-1,8 (2Н, м., с-С6Н10); 1,95-2,05 (2Н, м., с-С6Н10); 2,2-2,35 (2Н, м., с-С6Н10); 6,85 (2Н, уш. д., J=5,9, CONH2); 7,1-7,8 (5Н, м., Ph).
1-Фенилциклогексан-1-амин гидрохлорид.
В колбе, к раствору КОН (34,2 г, 0,611 моль) в воде (170 мл), при температуре (-) 15°С прикапывают бром (3,5 мл, 10,7 г, 0,067 моль), прибавляют 1-фенилциклогексан-1-карбоксамид (12,3 г, 0,061 моль), перемешивают при 10°С 2 час. Экстрагируют диэтиловым эфиром (3×75 мл). Экстракт промывают водой (20 мл), упаривают в вакууме, при температуре 40°С, прибавляют 35% соляную кислоту (50 мл), кипятят с обратным холодильником 1 час, упаривают в вакууме, при температуре 40°С. Получают 1-фенилциклогексан-1-амин гидрохлорид в виде белого порошка, 10,0 г (77%). Спектр ЯМР1Н (DMSO-d6), δ, м.д. (J, Гц): 1,2-1,45 (4Н, м., с-С6Н10); 1,6-1,8 (2Н, м., с-С6Н10); 1,95-2,05 (2Н, м., с-С6Н10); 2,2-2,35 (2Н, м., с-С6Н10), 7,1-7,8 (5Н, м., Ph); 8,55 (3Н, ш.с., NH3+).
2-(2-(2-((1-Фенилциклогексил)амино)этокси)этил)изоиндолин-1,3-дион гидрохлорид.
В колбе с обратным холодильником нагревают в течение 12 час при температуре 100°С раствор 1-фенилциклогексан-1-амин гидрохлорида (10,5 г, 0,05 моль) с 2-(2-(2-хлоэтокси)этил)изоиндолин-1,3-дионом (12,68 г, 0,05 моль) и К2СО3 (13,8 г, 0,1 моль) в диметилформамиде (80 мл). Смесь разбавляют водой (200 мл), экстрагируют эти л ацетатом (3×80 мл), Экстракт промывают водой (2×50 мл), упаривают в вакууме, при температуре 40°С. К остатку прибавляют соляную кислоту (5,2 г, 0,05 моль), упаривают в вакууме. Остаток кристаллизуют из смеси ацетон: диэтиловый эфир (2:1), фильтруют, промывают эфиром (50 мл), сушат в вакууме при температуре 50°С. Получают 2-(2-(2-((1-фенилциклогексил)амино)этокси)этил)изоиндолин-1,3-дион гидрохлорид в виде белого порошка, 10,08 г (47%). Спектр ЯМР1Н (DMSO-d6), δ, м.д. (J, Гц): 1,40-1,65 (6Н, м., с-С6Н10); 1,70-2,10 (4Н, м., с-С6Н10); 2,70-2,95 (4Н, м., PhthNCH2CH2OCH2CH2NH2+); 3,55-4,05 (4Н, м., PhthNCH2CH2OCH2CH2NH2+), 7,20-7,50 (5Н, м., Ph); 7,75-7,95 (4Н, м., PhthNCH2CH2OCH2CH2NH2+); 9,52 (2Н, ш.с., PhthNCH2CH2OCH2CH2NH2+).
N-(2-(2-Аминоэтокси)этил)-1-фенилциклогексанамин дигидрохлорид.
В колбе с обратным холодильником кипятят суспензию 2-(2-(2-((1-фенилциклогексил)амино)этокси)этил)изоиндолин-1,3-дион гидрохлорида (8,58 г, 0,02 моль) с гидразин гидратом (1,0 г, 0,02 моль) в пропан-2-оле (40 мл) в течение 2 час, прибавляют 35% соляную кислоту (5 мл) и воду (40 мл), кипятят 1 час. Смесь охлаждают, фильтруют, осадок промывают на фильтре водой (3×50 мл). Фильтрат и промывные жидкости объединяют, упаривают в вакууме, при температуре 40°С. Остаток кипятят в ацетоне (100 мл) в течение 30 мин, фильтруют, промывают на фильтре ацетоном (2×20 мл), сушат в вакууме. Получают N-(2-(2-аминоэтокси)этил)-1-фенилциклогексанамин дигидрохлорид в виде белого порошка, 4,61 г (75%). Спектр ЯМР1Н (DMSO-d6), δ, м.д. (J, Гц): 1,40-1,65 (6Н, м., с-С6Н10); 2,25-2,35 (2Н, м., с-С6Н10); 2,45-2,55 (2Н, м., с-С6Н10); 3,45-3,55 (4Н, м., NH2+CH2CH2OCH2CH2NH3+); 4,15-4,35 (4Н, м., NH2+CH2CH2OCH2-CH2NH3+); 7,20-7,50 (5Н, м., Ph); 10,22 (5Н, ш.с., NH2+CH2CH2OCH2CH2NH3+). Спектр ЯМР13С (DMSO-d6), δ, м.д.: 22,4 (С-3,5, с-С6Н10); 26,7 (С-4, с-С6Н10); 33,8 (С-2,6, с-С6Н10); 41,6 (H2+NCH2CH2OCH2CH2NH3+); 41,9 (H2+NCH2CH2OCH2CH2NH3+); 57,6 (C-1, с-С6Н10); 72,5 (Н2+NCH2CH2OCH2-CH2NH3+); 73,7 (Н2+NCH2CH2OCH2CH2NH3+); 124,6 (С-4, Ph); 128,2 (С-3,5, Ph); 129,6 (С-2,6, Ph); 133,2 (C-1, Ph).
Пример 42. Синтез N1-((1-фенилциклопентил)метил)гексан-1,6-диамин дигидрохлорида

2-(5-(((1-Фенилциклопентил)метил)амино)гексил)изоиндолин-1,3-дион гидрохлорид.
В колбе с обратным холодильником, нагревают в течение 12 час, при 100°С, раствор 1-(1-фенилциклопентил)метанамин гидрохлорид (0,95 г, 4,7 ммоль), полученный по примеру 38, 2-(6-бромгексил)изоиндолин-1,3-диона (1,41 г, 4,7 ммоль) и K2CO3 (1,30 г, 9,4 ммоль) в диметилформамиде (20 мл). Смесь разбавляют водой (100 мл), экстрагируют этилацетатом (3×30 мл), органическую фазу промывают водой (2×50 мл), упаривают в вакууме, прибавляют 35% соляную кислоту (2,6 г, 25 ммоль), упаривают в вакууме. Остаток кристаллизуют из смеси ацетон : диэтиловый эфир (4:3), осадок фильтруют, промывают эфиром (20 мл), сушат в вакууме. Получают 2-(5-(((1-фенилциклопентил)метил)амино)-гексил)изоиндолин-1,3-дион гидрохлорид в виде белого, порошка, 1,31 г, (69%). Спектр ЯМР1Н (DMSO-d6), δ, м.д. (J, Гц): 0,96-1,41 (4Н, м., PhthNCH2CH2CH2CH2CH2CH2NH2+); 1,45-1,65 (6Н, м., с-С5Н8); 1,7-1,95 (2Н, м., PhthNCH2CH2CH2CH2CH2CH2NH2+); 2,3-2,45 (6Н, м., с-С5Н8 и PhthNCH2CH2CH2CH2CH2CH2NH2+); 2,75 (2Н, с., с-C5H8CH2); 3,56 (2Н, т., J=7,9, PhthNCH2CH2CH2CH2CH2CH2NH2+); 7,30-7,7 (5Н, м., Ph); 7,80-7,95 (4Н, м., PhthNCH2CH2CH2CH2CH2CH2NH2+); 9,52 (2Н, ш.с., PhthNCH2CH2CH2CH2CH2CH2NH2+).
N1-((1-Фенилциклопентил)метил)гексан-1,6-диамин дигидрохлорид.
В колбе с обратным холодильником кипятят в течение 2 час суспензию 2-(5-(((1 -фенилциклопентил)метил)амино)-гексил)изоиндолин-1,3-дион гидрохлорида (1,0 г, 2,47 ммоль) и гидразин гидрата (0,12 г, 2,47 ммоль) в 2-пропаноле (10 мл), прибавляют 35% соляную кислоту (5 мл) и воду (45 мл), кипятят 1 час. Смесь охлаждают, фильтруют, осадок промывают на фильтре водой (3×10 мл). Фильтрат упаривают в вакууме, остаток кипятят в ацетоне (20 мл) в течение 30 мин, фильтруют, промывают ацетоном (2×10 мл), сушат в вакууме. Получают N1-((1-фенилциклопентил)метил)гексан-1,6-диамин дигидрохлорид в виде белого порошка, 0,61 г (71%). Спектр ЯМР1Н (DMSO-d6), δ, м.д. (J, Гц): 0,95-1,41 (4Н, м., H3+NCH2CH2CH2CH2CH2CH2NH2+); 1,45-1,65 (6Н, м., с-С5Н8); 1.7-1,95 (2Н, м., Н3+NCH2CH2CH2CH2CH2CH2NH2+); 2,3-2,45 (6Н, м., с-С5Н8 и H3+NCH2-CH2CH2CH2CH2CH2NH2+); 2,65-2,75 (2Н, м., H3+NCH2CH2CH2-CH2CH2CH2NH2+); 3,75 (2Н, c., с-C5H8CH2); 7,3-7,7 (5Н, м, Ph); 10,50 (2Н, ш.c., H3+NCH2CH2CH2CH2CH2CH2NH2+). Спектр ЯМР13С (DMSO-d6), δ, м.д.: 22,5 (С-3,4, с-С5Н8); 23,8 (Н2+NCH2CH2CH2CH2CH2CH2NH3+); 25,1 (H2+NCH2-CH2CH2CH2CH2CH2NH3+); 26,5 (H2+NCH2CH2CH2CH2CH2CH2NH3+); 31,4 (H2+NCH2CH2CH2CH2CH2CH2NH3+); 37,2 (C-2,5, c-C5H8); 40,8 (Н2+NCH2CH2-CH2CH2CH2CH2NH3+); 41,2 (C-1, c-C5H8); 43,4 (H2+NCH2CH2CH2-CH2CH2CH2NH3+); 56,9 (CH2-c-C5H8); 124,7 (C-4, Ph); 128,5 (C-3,5, Ph); 129,9 (C-2,6, Ph); 134,2 (C-1, Ph).
Пример 43. Синтез N1-(1-(1-фенилциклопентил)этил)гексан-1,6-диамин дигидрохлорида

2-(6-((1-(1-Фенилциклопентил)этил)амино)гексил)изоиндолин-1,3-дион гидрохлорид.
В колбе с обратным холодильником нагревают в течение 12 час, при 100°С, раствор 1-(1-фенилциклопентил)этан-1-амин гидрохлорида (2 г, 8,9 ммоль), полученный по примеру 37, 2-(6-бромгексил)изоиндолин-1,3-дионом (2,67 г, 8,9 ммоль) и K2CO3 (2,46 г, 17,8 ммоль) в диметилформамиде (40 мл). Смесь разбавляют водой (200 мл), экстрагируют этилацетатом (3×30 мл), экстракт промывают водой (2×50 мл), упаривают в вакууме при температуре 45°С.К остатку прибавляют 35% соляную кислоту (2,6 г, 25 ммоль), упаривают в вакууме. Остаток кристаллизуют из смеси ацетон : диэтиловый эфир (1:1), осадок фильтруют, промывают эфиром (20 мл), сушат в вакууме. Получают 2-(6-((1-(1-фенилциклопентил)этил)амино)гексил)изоиндолин-1,3-дион гидрохлорид в виде белого порошка, 1,34 г (36%). Спектр ЯМР1Н (DMSO-d6), δ, м.д. (J, Гц): 0,95-1,40 (7Н, м., PhthNCH2CH2CH2CH2CH2CH2NH2+, CHCH3); 1,45-1,65 (6Н, м., с-С5Н8); 1,7-1,95 (2Н, м., PhthNCH2CH2CH2CH2-CH2CH2NH2+); 2,3-2,5 (6Н, м., с-С5Н8 и PhthNCH2CH2CH2CH2CH2CH2NH2+); 2,93 (1Н, м., СНСН3); 3,55 (2Н, т., J=7,7, PhthNCH2CH2CH2CH2CH2CH2NH2+); 7,3-7,7 (5Н, м., Ph); 7,80-7,98 (4Н, м., PhthNCH2CH2CH2CH2CH2CH2NH2+); 9,66 (2Н, ш.с., PhthNCH2CH2CH2CH2CH2CH2NH2+).
N1-(1-(1-фенилциклопентил)этил)гексан-1,6-диамин дигидрохлорид.
В колбе с обратным холодильником в течение 2 час кипятят суспензию 2-(6-((1-фенилциклопентил)амино)гексил)-изоиндолин-1,3-дион гидрохлорида (0,84 г, 2 ммоль) и гидразин гидрата (0,1 г, 2 ммоль) в пропан-2-оле (10 мл), прибавляют 35% соляную кислоту (5 мл) и воду (45 мл), кипятят 1 час. Смесь охлаждают, фильтруют, осадок промывают на фильтре водой (3×10 мл). Фильтрат упаривают в вакууме, остаток в течение 30 мин кипятят в ацетоне (20 мл), фильтруют, промывают ацетоном (2×10 мл), сушат в вакууме. Получают N1-(1-(1-фенилциклопентил)этил)гексан-1,6-диамин дигидрохлорид в виде белого порошка, 0,47 г (65%). Спектр ЯМР1H (DMSO-d6), δ, м.д. (J, Гц): 0,95-1,40 (7Н, м., H3+NCH2CH2CH2CH2CH2CH2NH2+, СНСН3); 1,45-1,65 (8Н, м., с-С5Н8, H3+NCH2CH2CH2CH2CH2CH2NH2+); 2,3-2,5 (6Н, м., с-С5Н8 и Н3+NCH2CH2-CH2CH2CH2CH2NH2+); 2,65-2,75 (2Н, м., H3+NCH2CH2CH2CH2CH2CH2NH2+); 3,95 (1H, м., СНСН3); 7,3-7,7 (5Н, м., Ph); 8,57 (5Н, ш.с., Н3+NCH2CH2-CH2CH2CH2CH2CH2NH2+). Спектр ЯМР13С (DMSO-d6), δ, м.д.: 13,7 (СНСН3); 22,5 (С-3,4, с-С5Н8); 23,8 (H2+NCH2CH2CH2CH2CH2CH2NH3+); 24,4 (H2+NCH2-CH2CH2CH2CH2CH2NH3+); 26,2 (H2+NCH2CH2CH2CH2CH2CH2NH3+); 31,5 (Н2+NCH2CH2CH2CH2CH2CH2NH3+); 37,2 (C-2,5, c-C5H8); 40,8 (Н2+NCH2CH2-CH2CH2CH2CH2NH3+); 43,4 (H2+CH2CH2CH2CH2CH2CH2NH3+); 62,3 (CHCH3); 66,5 (C-1, c-C5H8); 124,8 (C-4, Ph); 127,5 (C-3,5, Ph); 129,9 (C-2,6, Ph); 134,4 (C-1, Ph).
Пример 44. Синтез N-(6-аминогексил)-1-фенилциклопентане-1-карбоксамид гидрохлорида

1-Фенилциклопентан-1-карбоновая кислота.
В колбе с обратным холодильником кипятят в течение 6 час раствор 1-фенилциклопентилкарбонитрил (8,5 г, 0,05 моль), полученного по примеру 1, и гидроксида калия (11,0 г, 0,2 моль) в этиленгликоле (30 мл). Смесь разбавляют водой (25 мл), экстрагируют этилацетатом (3×25 мл), к водной фазе прибавляют 35% соляную кислоту (25 мл), экстрагируют этилацетатом (3×40 мл). Экстракт промывают водой (50 мл), насыщенным раствором NaCl (50 мл), сушат MgSO4, фильтруют, упаривают в вакууме, при температуре 45°С. Получают 1-фенилциклопентан-1-карбоновую кислоту в виде кристаллизующегося масла, 6,2 г (65%). Спектр ЯМР1H (CDCl3), δ, м.д. (J, Гц): 1,65-1,85 (4Н, м., с-С5Н8); 1,95-2,06 (2Н, м., с-С5Н8); 2,55-2,85 (2Н, м., с-С5Н8); 7,20-7,50 (5Н, м., Ph).
Бензил (6-(фенилциклопентан-1-карбоксамидо)гексил)карбамат.
В колбе с обратным холодильником в течение 1 час кипятят 1-фенилциклопентан-1-карбоновую кислоту (2,25 г, 0,0158 моль), хлористый тионил (5,7 г, 0,048 моль) в бензоле (15 мл) с 1 каплей диметилформамида, избыток хлористого тионила отгоняют в вакууме. Полученный хлорангидрид 1-фенилциклопентан-1-карбоновой кислоты используют далее без очистки.
К раствору бензил (б-аминогексил)карбамата (1,88 г, 0,009 моль) и N-метилморфолина (1,37 г, 0,0135 моль) в бензоле (30 мл) при температуре 0°С прикапывают раствор хлорангидрида 1-фенилциклопентан-1-карбоновой кислоты в бензоле (15 мл). Смесь перемешивают в течение 2 час при комнатной температуре, разбавляют бензолом (20 мл), органическую фазу промывают насыщенным раствором хлористого аммония (2×30 мл), водой (2×30 мл), насыщенным раствором NaHCO3 (2×30 мл), насыщенным раствором NaCl (2×30 мл), сушат над Na2SO4, фильтруют, упаривают в вакууме, при температуре 45°С. Остаток хроматографируют (сорбент силикагель 40-60 мкм, градиент от гептана до смеси гептан: этилацетат 1:1). Фракции, содержащие продукт, объединяют, упаривают в вакууме, при температуре 45°С. Получают бензил (6-(фенилциклопентан-1-карбоксамидо)гексил)карбамат в виде кристаллизующегося масла, 3.07 г (81%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 0,94-1,47 (8Н, м., HNCH2CH2CH2CH2CH2CH2NHCO2CH2Ph); 1,55-1,70 (2Н, м. с-С5Н8); 1,71-1,85 (2Н, м., с-С5Н8); 1,89-2,07 (2Н, м., с-С5Н8); 2,31-2,52 (2Н, м., с-С5Н8); 2,95-3,17 (4Н, м., HNCH2CH2CH2CH2CH2CH2NHCO2-CH2Ph); 4,71 (1H, ш.с., HNCH2CH2CH2CH2CH2CH2NHCO2CH2Ph); 5,10 (2Н, с., HNCH2CH2CH2CH2CH2CH2NHCO2CH2Ph); 5,23 (1Н, ш.с., HNCH2CH2CH2-CH2CH2CH2NHCO2CH2Ph); 7,12-7,41 (10Н, м., Ph, Ph).
N-(6-Аминогексил)-1-фенилциклопентане-1-карбоксамид гидрохлорид.
В колбе с обратным холодильником в токе сухого аргона нагревают при температуре 40°С в течение 2 час раствор бензил (6-(фенилциклопентан-1 -карбоксамидо)гексил)карбамата (2,66 г, 6,3 ммоль), муравьиной кислоты (2 мл) и палладия на угле (200 мг) в метаноле (30 мл). Смесь фильтруют через целит (Celite® 503), осадок промывают водой (2×10 мл). Фильтрат и промывные жидкости объединяют, упаривают в вакууме, при температуре 40°С. К остатку прибавляют раствор гидроксида натрия (2 г) в воде (25 мл), экстрагируют хлористым метиленом (3×30 мл), экстракты промывают водой (1×30 мл), сушат над К2СО3, фильтруют. Осадок промывают хлористым метиленом (2×10 мл). Фильтрат упаривают в вакууме, при температуре 40°С. К остатку прибавляют 35% соляную кислоту (1 г), отгоняют растворитель в вакууме при температуре 50°С. Получают N-(6-аминогексил)-1-фенилциклопентане-1-карбоксамид гидрохлорид в виде кристаллизующегося масла, 1,48 г (72%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,08-1,45 (6Н, м., с-С5Н8 и HNCH2CH2CH2CH2CH2CH2NH3+); 1,53-1,90 (6Н, м., HNCH2CH2CH2CH2CH2CH2NH3+); 1,93-2,19 (2Н, м., с-С5Н8); 2,37-2,58 (2Н, м., с-С5Н8); 2,80-3,00 (2Н, м., HNCH2CH2CH2CH2CH2CH2NH3+); 3.03-3.20 (2Н, м., HNCH2CH2CH2CH2CH2CH2NH3+); 6,28 (1Н, ш.с., HNCH2CH2CH2CH2CH2CH2NH3+); 7,21-7,27 (1Н, м., Ph); 7,29-7,40 (4Н, м., Ph); 8,19 (3Н, ш.с., HNCH2CH2CH2CH2CH2CH2NH3+). Спектр ЯМР13С (D2O), δ, м.д.: 23,7 (С-3,4, с-С5Н8); 25,6 (HNCH2CH2CH2CH2CH2CH2NH3+); 25,9 (HNCH2CH2CH2CH2CH2CH2NH3+); 27,2 (HNCH2CH2CH2CH2CH2CH2NH3+); 28,8 (HNCH2CH2CH2CH2CH2CH2NH3+); 36,6 HNCH2CH2CH2CH2CH2CH2NH3+); 39,7 (HNCH2CH2CH2CH2CH2CH2NH3+); 39,9 (C-2, 5, c-C5H8); 59,2 (C-1, c-C5H8); 126,9 (C-4, Ph); 127,1 (C-2,6, Ph); 128,7 (C-3, 5, Ph); 143,5 (C-1, Ph); 177,2 (CO).
Пример 45. Синтез N-(6-аминогексил)-1-(2-метилфенил)циклопентане-1-карбоксамид гидрохлорида

1-(2-Метилфенил)циклопентан-1-карбонитрил.
К кипящей суспензии гидрида натрия (10,6 г, 0,44 моль) в тетрагидрофуране (500 мл) при перемешивании прикапывают смесь 2-(2-метилфенил)ацетонитрила (26,24 г, 0,2 моль) и дибромбутана (45,34 г, 0,21 моль), кипятят 18 час. Реакционную смесь охлаждают льдом и при перемешивании прикапывают воду (60 мл). Фазы разделяют, органическую фазу упаривают.Остаток растворяют в 250 мл гептана, промывают водой (3×50 мл), насыщенным раствором NaCl, сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 40°С. Остаток перегоняют в вакууме, собирают фракцию с Ткип.=113-117°С (5-6 мм. рт.ст.). Получают 1-(2-метилфенил)циклопентан-1-карбонитрил в виде бесцветного масла, 26,66 г (72%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,80-2,16 (6Н, м., с-С5Н8); 2,60-2,75 (5Н, м., СН3 и с-С5Н8); 7,20-7,49 (4Н, м., С6Н4).
1-(2-метилфенил)циклопентан-1-карбоновая кислота.
В колбе с обратным холодильником, кипятят в течение 6 час раствор 1-(2-метилфенил)циклопентан-1-карбонитрила (3,2 г, 17,3 ммоль) и КОН (3,9 г, 69 ммоль) в этиленгликоле (20 мл). Смесь разбавляют водой (25 мл), экстрагируют этилацетатом (3×25 мл). Водный слой подкисляют 35% соляной кислотой (15 мл), экстрагируют этилацетатом (3×25 мл). Экстракт промывают водой (1×50 мл), насыщенным раствором NaCl (1×50 мл), сушат над MgSO4, фильтруют. Фильтрат и промывные жидкости объединяют, упаривают в вакууме, при температуре 40°С. Получают 1-(2-метилфенил)циклопентан-1-карбоновую кислоту в виде кристаллизующегося масла, 2,3 г (65%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,70-2,05 (4Н, м. с-С5Н8); 2,10-2,25 (2Н, м., с-С5Н8); 2,35 (3Н, с., СН3); 2,55-2,75 (2Н, м., с-С5Н8); 7,15-7,25 (3Н, м., С6Н4); 7,30-7,45 (1H, м., C6H4).
Бензил (6-(1-(2-метилфенил)циклопентан-1-карбоксамидо)гексил)-карбамат.
В колбе с обратным холодильником кипятят течение 1 час 1-(2-метилфенил)циклопентан-1 -карбоновую кислоту (1,91 г, 9,4 ммоль), хлористый тионил (3,4 г, 28,2 ммоль) с 1 каплей диметилформамида в бензоле (10 мл), избыток хлористого тионила отгоняют в вакууме. Хлорангидрид 1-(2-метилфенил)циклопентан-1-карбоновой кислоты используют далее без очистки.
К раствору бензил (б-аминогексил)карбамата (2,35 г, 9,4 ммоль) и N-метилморфолина (1,43 г, 14,1 ммоль) в бензоле (30 мл) при температуре 0°С прикапывают раствор хлорангидрида 1-(2-метилфенил)циклопентан-1-карбоновой кислоты (9,4 ммоль) в бензоле (20 мл), перемешивают в течение 2 час при комнатной температуре. Смесь разбавляют бензолом (20 мл), органический слой промывают насыщенным раствором хлористого аммония (2×30 мл), водой (2×30 мл), насыщенным раствором NaHCO3 (2×30 мл), насыщенным раствором NaCl (2×30 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 40°С. Остаток хроматографируют (силикагель 40-60 мкм, градиент от гептана до смеси гептан: этилацетат 1:1). Фракции, содержащие продукт, объединяют и упаривают в вакууме. Получают бензил (6-(1-(2-метилфенил)циклопентан-1-карбоксамидо)-гексил)карбамат в виде кристаллизующегося масла, 3,24 г (82%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 0,98-1,51 (8Н, м., HNCH2CH2CH2CH2CH2CH2NHCO2CH2Ph); 1,54-1,70 (2Н, м. с-С5Н8); 1,74-1,90 (2Н, м., с-С5Н8); 2,04 (3Н, с., СН3); 2,37-2,55 (2Н, м., с-С5Н8); 2,94-3,20 (4Н, м., HNCH2CH2CH2CH2CH2CH2NHCO2CH2Ph); 4,76 (1Н, ш.с., HNCH2CH2 CH2CH2CH2CH2NHCO2CH2Ph); 5,06 (3Н, ш.с., HNCH2CH2CH2CH2CH2NHCO2CH2Ph); 7,12-7,21 (3Н, м., С6Н4); 7,29-7,40 (6Н, м., С6Н4, Ph).
N-(6-Аминогексил)-1-(2-метилфенил)циклопентане-1-карбоксамид гидрохлорид.
В колбе с обратным холодильником под аргоном нагревают при 40°С, в течение 2 час, раствор бензил (6-(1-(2-метилфенил)циклопентан-1-карбоксамидо)гексил)карбамат (2,75 г, 6,3 ммоль), муравьиной кислоты (2 мл) и палладия на угле (200 мг) в метаноле (25 мл). Смесь фильтруют через целит (Celite® 503), промывают водой (2×10 мл). Маточный раствор упаривают в вакууме, к остатку прибавляют раствор NaOH (2 г) в воде (25 мл), экстрагируют хлористым метиленом (3×30 мл), экстракт промывают водой (1×30 мл), сушат над K2CO3, упаривают. К остатку прибавляют 35% соляную кислоту (1 г), упаривают в вакууме. Получают N-(6-аминогексил)-1-(2-метилфенил)циклопентане-1-карбоксамид гидрохлорид в виде кристаллизующегося масла, 1,44 г (67%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,06-1,55 (6Н, м., с-С5Н8 и HNCH2CH2CH2CH2CH2CH2NH3+); 1,50-1,85 (6Н, м., HNCH2CH2CH2CH2CH2CH2NH3+); 1,91-2,07 (2Н, м., с-С5Н8); 2,21 (3Н, с., СН3); 2,35-2,53 (2Н, м., с-С5Н8); 2,89-3,00 (2Н, м., HNCH2CH2CH2CH2CH2CH2NH3+); 3.05-3.16 (2Н, м., HNCH2CH2CH2CH2CH2CH2NH3+); 5,25 (1Н, ш.с., HNCH2CH2CH2CH2CH2CH2NH3+); 7,12-7,23 (3Н, м., С6Н4); 7,32-7,40 (1Н, м., C6H4); 8,26 (3Н, ш.с., HNCH2CH2CH2CH2CH2CH2NH3+). Спектр ЯМР13С (D2O), δ, м.д.: 20,9 (СН3); 25,0 (С-3,4, с-С5Н8); 25,9 (HNCH2CH2CH2CH2CH2CH2NH3+); 26,0 (HNCH2CH2CH2CH2CH2CH2NH3+); 27,3 (HNCH2CH2CH2CH2CH2CH2NH3+); 29,1 (HNCH2CH2CH2CH2CH2CH2NH3+); 37,0 (HNCH2CH2CH2CH2CH2CH2NH3+); 39,6 (HNCH2CH2CH2CH2CH2CH2NH3+); 39,8 (C-2, 5, c-C5H8); 58,5 (C-1, c-C5H8); 125,6 (C-6, C6H4); 126,0 (C-5, C6H4); 127,3 (C-4, C6H4); 132,2 (C-3, C6H4); 137,6 (C-2, C6H4); 142,3 (C-1, C6H4); 177,7 (CO).
Пример 46. Синтез 2-амино-1-(1-фенилциклопентил)этан-1-он гидробромида

2-(2-Оксо-2-(1-фенилциклопентил)этил)изоиндолин-1,3-дион.
К суспензии фталимида калия (16 г, 0,086 моль) в 90 мл диметилформамида при перемешивании, при температуре 60°С, прибавляют 2-бром-1-(1-фенилциклопентил)этан-1-он (23 г, 0,086 моль), полученный по примеру 1, перемешивают 1 час. Смесь выливают в 500 мл воды, осадок фильтруют, промывают 50 мл воды, сушат в вакууме при 50°С. Получают 2-(2-оксо-2-(1-фенилциклопентил)этил)изоиндолин-1,3-дион в виде белого порошка, 24,4 г (85%). Спектр ЯМР1Н (DMSO-d6), δ, м.д. (J, Гц): 1,36 (9Н, с., t-Bu), 1,5-1,75 (4Н, м., с-С5Н8), 1,85-2,15 (2Н, м., с-С5Н8), 2,52-2,60 (2Н, м., с-С5Н8), 4,30 (2Н, с., PhthNCH2), 7,30-7,45 (5Н, м., Ph), 7,80 - (4Н, м., PhthN).
2-Амино-1-(1-фенилциклопентил)этан-1-он гидробромид.
В колбе, 2-(2-оксо-2-(1-фенилциклопентил)этил)изоиндолин-1,3-дион (24 г, 0,072 моль) кипятят в течение 8 час, с обратным холодильником, в смеси уксусной кислоты (250 мл) с 48% раствором бромоводородной кислоты (100 мл). Смесь охлаждают, растворитель упаривают в вакууме, остаток растворяют в 150 мл воды, осадок отфильтровывают, водный раствор экстрагируют 100 мл этилацетата. Водную фазу упаривают в вакууме, к остатку прибавляют 150 мл 1-пропанола, упаривают. Остаток обрабатывают 250 мл метил-трет-бутиловым эфиром. Осадок отделяют, промывают 100 мл метил-трет-бутилового эфира, сушат в вакууме при температуре 50°С. Получают 2-амино-1-(1-фенилциклопентил)этан-1-он гидробромид в виде белого порошка, 16,0 г (78%). Спектр ЯМР1Н (DMSO-d6), δ, м.д. (J, Гц): 1,5-1,7 (4Н, м, с-С5Н8); 1,8-1,95 (2Н, м., с-С5Н8); 2,45-2,55 (2Н, м., с-С5Н8, под остаточным сигналом от DMSO-d6); 3,74 (2Н, с., COCH2NH3+); 7,25-7,45 (5Н, м., Ph); 7,99 (3Н, ш.с., COCH2NH3+).
Пример 47. Синтез 2-амино-N-(2-оксо-2-(1-фенилциклопентил)этил)ацетамид гидрохлорида

трет-Бутил (2-оксо-2-((2-оксо-2-(1-фенилциклопентил)этил)амино)-этил)карбамат.
К охлажденному до (-)10°С раствору Вос-глицина (1,4 г, 8 ммоль) и триэтиламина (0,81 г, 8 ммоль) в 30 мл тетрагидрофурана прибавляют изо-бутилхлорформиат (1,1 г, 8 ммоль), перемешивают 20 мин, прибавляют суспензию 2-амино-1-(1-фенилциклопентил)этан-1-он гидробромида (2,0 г, 7 ммоль), полученный по примеру 46, и триэтиламина (0,71 г, 7 ммоль) в 20 мл тетрагидрофурана, перемешивают при комнатной температуре 2 час. Смесь выливают в 50 мл воды, экстрагируют этилацетатом (3×40 мл). Экстракт промывают 4% раствором фосфорной кислоты (2×40 мл), водой (40 мл), 10% раствором NaHCO3 (2×40 мл), 35% раствором NaCl (2×40 мл), сушат над Na2SO4, фильтруют, упаривают в вакууме. Остаток перекристаллизовывают из 50 мл гептана, сушат в вакууме при температуре 50°С. Получают трет-бутл (2-оксо-2-((2-оксо-2-(1-фенилциклопентил)этил)-амино)этил)карбамат в виде белого порошка, 1,71 г (68%). Спектр ЯМР1Н (DMSO-d6), δ, м.д. (J, Гц): 1,36 (9Н, с., t-Bu); 1,5-1,7 (4Н, м., с-С5Н8); 1,8-1,95 (2Н, м., с-С5Н8); 2,45-2,55 (2Н, м., с-С5Н8, под остаточным сигналом от DMSO-d6); 3,51 (2Н, д., J=6,11, CH2NHboc); 3,82 (2Н, д., J=5,38, COCH2NH); 6,94 (1Н, т., J=6,11, CH2NHboc); 7,2-7,4 (5Н, м., Ph); 7,79 (1Н, т., J=5,38, COCH2NH).
2-Амино-N-(2-оксо-2-(1-фенилциклопентил)этил)ацетамид гидрохлорида гидрохлорид.
К раствору трет-бутип (2-оксо-2-((2-оксо-2-(1-фенилциклопентил)-этил)амино)этил)-карбамата (1,68 г, 4,7 ммоль) в 5 мл диоксана при комнатной температуре прибавляют 6 мл 4 М раствора хлороводорода в диоксане, перемешивают 3 час, упаривают в вакууме, остаток растирают с 20 мл диэтилового эфира, осадок фильтруют, промывают 40 мл эфира, сушат в вакууме при температуре 50°С. Получают 2-амино-N-(2-оксо-2-(1-фенилциклопентил)этил)ацетамид гидрохлорид в виде белого гигроскопичного порошка, 1,31 г (95%). Спектр ЯМР1Н (D2O), δ, м.д. (J, Гц): 1,60-1,75 (4Н, м., с-С5Н8); 1,95-2,10 (2Н, м., с-С5Н8); 2,45-2,50 (2Н, м., с-С5Н8); 3,83 (2Н, с., COCH2NH); 4,10 (2Н, с., CH2NH3+); 7,30-7,50 (5Н, м., Ph). Спектр ЯМР13С (D2O), δ, м.д.: 23,01 (С-3, 4 с-С5Н8); 34,50 (С-2, 5 с-С5Н8); 40,30 (COCH2N, NHOCCH2NH3+); 63,85 (C-1 с-С5Н8); 127,23 (С-3, 5 Ph); 127,54 (С-4 Ph); 129,8 (С-2, 6 Ph); 141,61 (C-1 Ph); 167,21 (NHOCCH2NH3+); 210,43 (COCH2N).
Пример 48. Синтез (S) 2-амино-4-метил-N-(2-оксо-2-(1-фенилциклопентил)этил)пентанамид гидрохлорида

(S) трет-Бутил (4-метил-1-оксо-1-((2-оксо-2-(1-фенилциклопентил)-этил)амино)пентан-2-ил)карбамат.
К раствору бок-L-лейцина (1,85 г, 8 ммоль) и триэтиламина (0,81 г, 8 ммоль) в 30 мл тетрагидрофурана, охлажденному до температуры (-)10°С, прибавляют изо-бутилхлорформиат (1,1 г, 8 ммоль), перемешивают 20 мин, прибавляют суспензию 2-амино-1-(1-фенилциклопентил)этан-1-он гидробромида (2,0 г, 7 ммоль), полученного по примеру 46, и триэтиламина (0,71 г, 7 ммоль) в 20 мл тетрагидрофурана, перемешивают при комнатной температуре 2 час. Смесь выливают в 50 мл воды, экстрагируют этилацетатом (3×40 мл). Экстракт промывают 4% фосфорной кислотой (2×40 мл), водой (40 мл), 10% раствором NaHCO3 (2×40 мл), 35% раствором NaCl (2×40 мл), сушат над Na2SO4, фильтруют. Осадок промывают этилацетатом (2×30 мл). Фильтрат упаривают в вакууме, при температуре 45°С. Остаток хроматографируют (силикагель 40-60 мкм, градиент от гептана до смеси гептан: этилацетат 1:1). Фракции, содержащие продукт, концентрируют в вакууме. Получают трет-бутил (S) (4-метил-1-оксо-1-((2-оксо-2-(1-фенилциклопентил)этил)амино)-пентан-2-ил)карбамат в виде белого порошка, 2,36 г (81%). Спектр ЯМР1Н (DMSO-d6), δ, м.д. (J, Гц): 0,84 (3Н, д., J=6,85, СН3СН3СНСН2); 0,87 (3Н, д., J=6,60, СН3СН3СНСН2); 1,3-1,45 (10Н, с., t-Bu, СН3СН3СНСН2); 1,55-1,71 (6Н, м., с-С5Н8, СН3СН2СНСН2); 1,8-1,95 (2Н, м., с-С5Н8); 2,45-2,55 (2Н, м., с-С5Н8, под остаточным сигналом от DMSO-d6); 3,70-3,90 (2Н, м., COCH2NH); 3,95 (1H, м., CHNHboc); 6,83 (1Н, д., J=8,56, CHNHboc); 7,2-7,4 (5Н, м., Ph); 7,78 (1H, т., J=5,38, COCH2NH).
(S) 2-Амино-4-метил-N-(2-оксо-2-(1-фенилциклопентил)этил)пентанамид гидрохлорид.
К раствору (S) трет-бутил (4-метил-1-оксо-1-((2-оксо-2-(1-фенилцикло-пентил)этил)амино)пентан-2-ил)карбамата (2,75 г, 6,6 ммоль) в 10 мл диоксана при комнатной температуре прибавляют 8 мл 4 М раствора хлороводорода в диоксане, перемешивают 3 час, упаривают в вакууме, остаток растирают с 20 мл диэтилового эфира, осадок фильтруют, промывают 40 мл эфира, сушат в вакууме при температуре 50°С. Получают (S) 2-амино-4-метил-N-(2-оксо-2-(1-фенилциклопентил)этил)пентанамид гидрохлорид в виде белого гигроскопичного порошка, 1,75 г (75%). Спектр ЯМР1H (D2O), δ, м.д. (J, Гц): 0,94 (3Н, д., J=5,87, СН3СН3СНСН2); 0,96 (3Н, д., J=5,38, СН3СН3СНСН2); 1,55-1,80 (7Н, м., с-С5Н8, СН3СН2СНСН2); 1,95-2,10 (2Н, м., с-С5Н8); 2,40-2,50 (2Н, м., с-С5Н8); 3,95-4,20 (3Н, м., COCH2NH, CHNH3+); 7,30-7,50 (5Н, м., Ph). Спектр ЯМР13С (D2O), δ, м.д.: 21,31 (NHOCCHNH3+CH2CH(CH3)2); 21,49 (NHOCCHNH3+СН2СН(СН3)2); 23,03 (С-3, 4 с-С5Н8); 34,52 (С-2, 5 с-С5Н8); 39,91 (NHO CCHNH3+CH2CH(CH3)2); 45,45 (COCH2N); 51,91 (NHOCCHNH3+СН2СН(СН3)2); 63,89 (C-1 с-С5Н8); 127,22 (С-3, 5 Ph); 127,56 (С-4 Ph); 129,11 (C-2, 6 Ph); 141,61 (C-1 Ph); 170,56 (NHOCCHNH3+CH2CH(CH3)2); 209,92 (COCH2N).
Пример 49. Синтез (S) 2-амино-N-(2-оксо-2-(1-фенилциклопентил)этил)-3-фенилпропанамид гидрохлорида

(S) трет-Бут ил (1-оксо-1-((2-оксо-2-(1-фенилцикпопентил)этил)-амино)-3-фенилпропан-2-ил)карбамат.
К раствору бок-L-фенилаланина (2,12 г, 8 ммоль) и триэтиламина (0,81 г, 8 ммоль) в 30 мл тетрагидрофурана при температуре (-)10°С, прибавляют изо-бутилхлорформиат (1,1 г, 8 ммоль), перемешивают 20 мин, прибавляют суспензию 2-амино-1-(1-фенилциклопентил)этан-1-он гидробромида (2,0 г, 7 ммоль), полученный по примеру 46, триэтиламина (0,71 г, 7 ммоль) в 20 мл тетрагидрофурана, перемешивают при комнатной температуре 2 час. Смесь выливают в 50 мл воды, экстрагируют этилацетатом (3×40 мл). Экстракт промывают 4% раствором фосфорной кислоты (2×40 мл), водой (40 мл), 10% раствором NaHCO3 (2×40 мл), 35% раствором NaCl (2×40 мл), сушат над Na2SO4, фильтруют, упаривают в вакууме. Остаток хроматографируют (силикагель 40-60 мкм, градиент от гептана до смеси гептан : этилацетат 1:1). Фракции, содержащие продукт, концентрируют в вакууме. Получают (S)трет-бутил (1-оксо-1-((2-оксо-2-(1-фенилциклопентил)этил)амино)-3-фенилпропан-2-ил)карбамат в виде белого порошка, 2,86 г (91%). Спектр ЯМР1Н (DMSO-d6), δ, м.д. (J, Гц): 1,27 (9Н, с., t-Bu); 1,5-1,7 (4Н, м., с-С5Н8); 1,8-1,95 (2Н, м., с-С5Н8); 2,45-2,55 (2Н, м., с-С5Н8, под остаточным сигналом от DMSO-d6); 2,65-3,0 (2Н, м., CH2Ph); 3,75-3,95 (2Н, м., COCH2NH); 4,1-4,2 (1Н, м., CHNHboc); 6,87 (1Н, д., J=8,80, CHNHboc); 7,1-7,45 (10Н, м., Ph, Ph); 7,96 (1H, т., J=5,38, COCH2NH).
(S) 2-Амино-N-(2-оксо-2-(1-фенилцикпопентил)этил)-3-фенилпропанамид гидрохлорид.
К раствору (S) трет-бутил (1-оксо-1-((2-оксо-2-(1-фенилциклопентил)-этил)амино)-3-фенилпропан-2-ил)карбамата (2,76 г, 4,7 ммоль) в 5 мл диоксана при комнатной температуре прибавляют 8 мл 4М раствора хлороводорода в диоксане, перемешивают 3 час. Растворитель упаривают в вакууме, остаток растирают с 20 мл диэтилового эфира, фильтруют, промывают 40 мл эфира, сушат в вакууме при температуре 50°С. Получают (S) 2-амино-N-(2-оксо-2-(1-фенилциклопентил)этил)-3-фенилпропанамид гидрохлорид в виде белого гигроскопичного порошка, 1,33 г (56%). Спектр ЯМР1Н (DMSO-d6), δ, м.д. (J, Гц): 1,50-1,70 (4Н, м., с-С5Н8); 1,82-1,97 (2Н, м., с-С5Н8); 2,45-2,55 (2Н, м., с-С5Н8, под остаточным сигналом от DMSO-d6); 2,95-3,20 (2Н, м., CH2Ph); 3,75-3,95 (2Н, м., COCH2NH); 4.07 (1Н, ш.с., CHNH3+); 7,15-7,45 (10Н, м., Ph, Ph); 8,30 (3Н, ш.с., CHNH3+); 8,78 (1H, т., J=5,38, COCH2NH). Спектр ЯМР1H (D2O), δ, м.д. (J, Гц): 1,53-1,74 (4Н, м., с-С5Н8); 1,90-2,10 (2Н, м., с-С5Н8); 2,30-2,45 (2Н, м., с-С5Н8); 3,05-3,25 (2Н, м., CH2Ph); 3,90-4,05 (2Н, м., COCH2NH); 4,25 (1H, т., J=6,85, CHNH3+); 7,20-7,45 (10Н, м., Ph, Ph'). Спектр ЯМР13С (D2O), δ, м.д.: 23,03 (С-3, 4 с-С5Н8); 34,50 (С-2, 5 с-С5Н8); 36,88 (NHOCCHNH3+CH2); 45,29 (COCH2N); 54,34(NHOCCHNH3+CH2); 63,84 (C-1 c-C5H8); 127,19 (C-3, 5 Ph); 127,24 (C-3, 5 Ph'); 127,55 (C-4 Ph); 127,96 (C-4 Ph'); 129,09 (C-3, 5 Ph'); 129,36 (C-2, 6 Ph); 133,69 (C-1 Ph'); 141,49 (C-1 Ph); 169,07 (NHOCCHNH3+CH2); 209,46 (COCH2N).
Пример 50. Синтез (S) N-(2-оксо-2-(1-фенилциклопентил)этил)пирролидин-2-карбоксамид гидрохлорида

(S) трет-Бутил 2-((2-оксо-2-(1-фенилциклопентил)этил)карбомаил)-пирролидин-1-карбксилат.
К раствору Бос-L-пролина (1,72 г, 8 ммоль) и триэтиламина (0,81 г, 8 ммоль) в 30 мл тетрагидрофурана при температуре (-)10°С, прибавляют изо-бутилхлорформиат (1,1 г, 8 ммоль), перемешивают 20 мин, прибавляют суспензию 2-амино-1-(1-фенилциклопентил)этан-1-он гидробромида (2,0 г, 7 ммоль), полученного по примеру 46, и триэтиламина (0,71 г, 7 ммоль) в 20 мл тетрагидрофурана, перемешивают 2 час при комнатной температуре. Смесь выливают в 50 мл воды, экстрагируют этилацетатом (3×40 мл). Экстракт промывают 4% раствором H3PO4 (2×40 мл), водой (40 мл), 10% раствором NaHCO3 (2×40 мл), 35% раствором NaCl (2×40 мл), сушат над Na2SO4, фильтруют, упаривают в вакууме. Остаток перекристаллизовывают из 50 мл гептана, сушат в вакууме при температуре 50°С. Получают (S) трет-бутил 2-((2-оксо-2-(1-фенилциклопентил)этил)-карбомаил)пирролидин-1-карбксилат в виде белого порошка, 1,84 г (67%). Спектр ЯМР1H (DMSO-d6), δ, м.д. (J, Гц): 1,29 (5,7Н, с., t-Bu); 1,37 (3,3Н, с., t-Bu) - затрудненное вращение, 1,5-1,7 (4Н, м., с-С5Н8); 1,7-2,25 (6Н, м., с-С5Н8, пролин); 2,45-2,55 (2Н, м., с-С5Н8, под остаточным сигналом от DMSO-d6); 3,15-3,40 (2Н, м., пролин); 3,70-3,90 (2Н, м., COCH2NH); 4,00-4,15 (1Н, м., полин); 7,25-7,40 (5Н, м., Ph); 7,80 - (1Н, м., COCH2NH).
(S) N-(2-Оксо-2-(1-фенилциклопентил)этил)пирролидин-2-карбрксамид гидрохлорид.
К раствору (S) трет-бутил 2-((2-оксо-2-(1-фенилциклопентил)этил)-карбомаил)пирролидин-1-карбксилата (1,54 г, 3,85 ммоль) в 17 мл диоксана при температуре 20°С прибавляют 5 мл 4М раствора хлороводорода в диоксане, перемешивают 3 час, упаривают в вакууме, остаток растирают с 20 мл диэтилового эфира, фильтруют, промывают 40 мл диэтилового эфира, сушат в вакууме при температуре 50°С. Получают (S) N-(2-оксо-2-(1-фенилциклопентил)-этил)пирролидин-2-карбрксамид гидрохлорид в виде белого гигроскопичного порошка, 1,07 г (82%). Спектр ЯМР1Н (D2O), δ, м.д. (J, Гц): 1,55-1,75 (4Н, м., с-С5Н8); 1,95-2,15 (6Н, м., с-С5Н8, пирролидин); 2,35-2,50 (3Н, м., с-С5Н8, пирролидин); 3,30-3,45 (2Н, м., пирролидин); 3,95-4,18 (2Н, м., COCH2NH); 4,35-4,45 (1H, м., пирролидин); 7,32-7,48 (5Н, м., Ph). Спектр ЯМР13С (D2O), δ, м.д.: 23,07 (С-3, 4 с-С5Н8); 23,73 (С-2, пирролидин); 29,83 (С-3, пирролидин); 34,54 (С-2, 5 с-С5Н8); 45,73 (COCH2N); 46,56(С-4, пирролидин); 63,87 (С-1 с-С5Н8); 66,62 (С-1, пирролидин); 127,25 (С-3, 5 Ph); 127,58 (С-4 Ph); 129,12 (С-2, 6 Ph); 141,66 (C-1 Ph); 169,91 (NHOC); 210,08 (COCH2N).
Пример 51. Синтез 3-амино-N-(2-оксо-2-(1-фенилциклопентил)этил)-пропанамид гидрохлорида
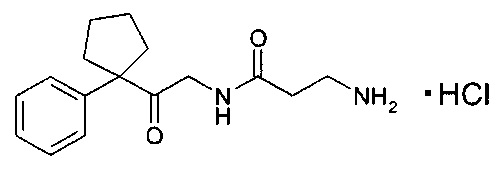
трет-Бутил (3-оксо-3-((2-оксо-2-(1-фенилциклопентил)этил)амино)-пропил)карбамат.
К раствору бос-β-аланина (1,51 г, 8 ммоль) и триэтиламина (0,81 г, 8 ммоль) в 30 мл тетрагидрофурана при температуре (-)10°С, прибавляют изо-бутилхлорформиат (1,1 г, 8 ммоль), перемешивают 20 мин, прибавляют суспензию 2-амино-1-(1-фенилциклопентил)этан-1-он гидробромида (2,0 г, 7 ммоль), полученного по примеру 46, и триэтиламина (0,71 г, 7 ммоль) в 20 мл тетрагидрофурана, перемешивают при комнатной температуре 2 час. Реакционную смесь выливают в 50 воды, экстрагируют этилацетатом (3×40 мл). Экстракт промывают 4% раствором H3PO4 (2×40 мл), водой (40 мл), 10% раствором NaHCO3 (2×40 мл), 35% раствором NaCl (2×40 мл), сушат над Na2SO4, фильтруют, упаривают в вакууме. Остаток перекристаллизовывают из 50 мл гептана, сушат в вакууме при температуре 50°С. Получают трет-бутил (3-оксо-3-((2-оксо-2-(1-фенилциклопентил)-этил)амино)пропил)карбамат в виде белого порошка, 1,96 г (77%). Спектр ЯМР1Н (DMSO-d6), δ, м.д. (J, Гц): 1,37 (9Н, с., t-Bu); 1,5-1,7 (4Н, м., с-С5Н8); 1,8-1,95 (2Н, м., с-С5Н8); 2,25 (2Н, т., J=7,34, COCH2CH2NHboc); 2,45-2,55 (2Н, м., с-С5Н8, под остаточным сигналом от DMSO-d6), 3,09 (2Н, д.д., J1=6,60, J2=13,45, COCH2CH2NHboc); 3,81 (2Н, д., J=5,38, COCH2NH); 6,67 (1Н, т., J=6,60, CH2NHboc); 7,25-7,42 (5H, м., Ph); 7,93 (1H, т., J=5,38, COCH2NH).
3-Амино-N-(2-оксо-2-(1-фенилциклопентил)этил)пропанамид гидрохлорид.
К раствору трет-бутил(3-оксо-3-((2-оксо-2-(1-фенилциклопентил)-этил)амино)пропил)карбамата (1,68 г, 4,7 ммоль) в 5 мл диоксана при комнатной температуре прибавляют 6 мл 4 М раствора хлороводорода в диоксане, перемешивают 3 час. Растворитель упаривают в вакууме, остаток растирают с 20 мл диэтилового эфира, осадок фильтруют, промывают 40 мл эфира, сушат в вакууме при температуре 50°С. Получают 3-амино-N-(2-оксо-2-(1-фенилциклопентил)этил)пропанамид гидрохлорид в виде белого гигроскопичного порошка, 1,31 г (95%). Спектр ЯМР1Н (D2O), δ, м.д. (J, Гц): 1,60-1,80 (4Н, м., с-С5Н8); 1,95-2,15 (2Н, м., с-С5Н8); 2,35-2,55 (2Н, м., с-С5Н8); 2,69 (2Н, т., J=6,60, COCH2CH2NH3+); 2,23 (2Н, т., J=6,60, COCH2CH2NH3+); 4,01 (2Н, с., COCH2NH); 7,30-7,47 (5Н, м., Ph). Спектр ЯМР13С (D2O), δ, м.д.: 23,06 (С-3, 4 с-С5Н8); 31,78 (NHCOCH2CH2NH3+); 34,55 (C-2, 5 с-С5Н8); 35,66 (NHCOCH2CH2NH3+); 45,60 (COCH2N); 63,88 (C-1 c-C5H8); 127,23 (C-3, 5 Ph); 127,52 (C-4 Ph); 129,07 (C-2, 6 Ph); 141,71 (C-1 Ph); 172,31 (NHCOCH2CH2NH3+); 210,71 (COCH2N).
Пример 52. Синтез 4-амино-N-(2-оксо-2-(1-фенилциклопентил)этил)бутанамид гидрохлорида

трет-Бутил (4-оксо-4-((2-оксо-2-(1-фенилциклопентил)этил)амино)-бутил)карбамат.
К раствору бок-γ-аминомаслянной кислоты (1,63 г, 8 ммоль) и триэтиламина (0,81 г, 8 ммоль) в 30 мл тетрагидрофурана при температуре (-)10°С, прибавляют изо-бутилхлорформиат (1,1 г, 8 ммоль), перемешивают 20 мин, прибавляют суспензию 2-амино-1-(1-фенилциклопентил)этан-1-он гидробромида (2,0 г, 7 ммоль), полученного по примеру 46, и триэтиламина (0,71 г, 7 ммоль) в 20 мл тетрагидрофурана, перемешивают при комнатной температуре 2 час. Смесь выливают в 50 мл воды, экстрагируют этилацетатом (3×40 мл). Экстракт промывают 4% раствором H3PO4 (2×40 мл), водой (40 мл), 10% раствором NaHCO3 (2×40 мл), 35% раствором NaCl (2×40 мл), сушат над Na2SO4, фильтруют, упаривают в вакууме. Остаток хроматографируют (силикагель 40-60 мкм, градиент от гептана до смеси гептан: этилацетат 1:1). Фракции, содержащие продукт, концентрируют в вакууме. Получают трет-бутил (4-оксо-4-((2-оксо-2-(1-фенилциклопентил)этил)амино)бутил)карбамат в виде белого порошка, 2,1 г (77%). Спектр ЯМР1Н (DMSO-d6), δ, м.д. (J, гц): 1,38 (9Н, с., t-Bu); 1,5-1,7 (6Н, м., с-С5Н8, COCH2CH2CH2NHboc); 1,8-1,95 (2Н, м., с-С5Н8); 2,07 (2Н, т., J=7,58, COCH2CH2CH2NHboc); 2,45-2,55 (2Н, м., с-С5Н8, под остаточным сигналом от DMSO-d6); 2,90 (2Н, д.д., J1=6,85, J2=13,20, COCH2CH2NHboc); 3,81 (2Н, д., J=5,38, COCH2NH); 6,78 (1Н, т., J=6,85, CH2NHboc); 7,25-7,45 (5Н, м., Ph); 7,86 (1Н, т., J=5,38, COCH2NH).
4-Амино-N-(2-оксо-2-(1-фенилциклопентил)этил)бутанамид гидрохлорид.
К раствору трет-бутил (4-оксо-4-((2-оксо-2-(1-фенилциклопентил)-этил)амино)бутил)карбамата (2,0 г, 5,15 ммоль) в 5 мл диоксана при комнатной температуре прибавляют 7 мл 4 М раствора хлороводорода в диоксане, перемешивают 3 час. Растворитель упаривают в вакууме, остаток растирают с 20 мл диэтилового эфира, осадок фильтруют, промывают 40 мл эфира, сушат в вакууме при температуре 50°С. Получают 4-амино-N-(2-оксо-2-(1-фенилциклопентил)этил)бутанамид гидрохлорид в виде белого гигроскопичного порошка, 1,56 г (93%). Спектр ЯМР1Н (D2O), δ, м.д. (J, Гц): 1,55-1,73 (4Н, м., с-С5Н8); 1,85-1,95 (2Н, м., COCH2CH2CH2NH3+); 1,96-2,05 (2Н, м., с-С5Н8); 2,32-2,48 (4Н, м., COCH2CH2CH2NH3+, с-С5Н8); 2,95-3,05 (2Н, м., с-COCH2CH2CH2NH3+); 3,97 (2Н, с., COCH2NH); 7,30-7,45 (5Н, м., Ph). Спектр ЯМР13С (D2O), δ, м.д.: 22,90 (NHCOCH2CH2CH2NH3+); 23,05 (С-3, 4 с-С5Н8); 32,11 (NHCOCH2CH2CH2NH3+); 34,51 (С-2, 5 с-С5Н8); 38,82 (COCH2N); 63,90 (С-1 с-С5Н8); 127,23 (С-3, 5 Ph); 127,50 (С-4 Ph); 129,05 (С-2, 6 Ph); 141,72 (C-1 Ph); 175,09 (NHCOCH2CH2CH2NH3+); 210,80 (COCH2N).
Пример 53. Синтез (S) 2-амино-3-(4-гидроксифенил)-N-(2-оксо-2-(1-фенилциклопентил)этил)пропанамид гидрохлорида

трет-Бутил (3-(4-гидроксифенил)-1-оксо-1-((2-оксо-2-(1-фенилцикло-пентил)этил)амино)пропан-2-ил)карбамат.
К раствору бок-L-тирозина (2,25 г, 8 ммоль) и триэтиламинам (0,81 г, 8 ммоль) в 30 мл тетрагидрофурана, охлажденному до температуры (-)10°С, прибавляют изо-бутилхлорформиат (1,1 г, 8 ммоль), перемешивают 20 мин, прибавляют суспензию 2-амино-1-(1-фенилциклопентил)этан-1-он гидробромида (2,0 г, 7 ммоль), полученного по примеру 46, с триэтиламином (0,71 г, 7 ммоль) в 20 мл тетрагидрофурана, перемешивают при комнатной 2 час. Смесь выливают в 50 мл воды, экстрагируют этилацетатом (3×40 мл). Экстракт промывают 4% раствором Н3РО4 (2×40 мл), водой (40 мл), 10% раствором NaHCO3 (2×40 мл), насыщенным раствором NaCl (2×40 мл), сушат над Na2SO4, фильтруют и упаривают в вакууме. Остаток хроматографируют (силикагель 40-60 мкм, градиент от гептана до смеси гептан: этилацетат 1:1). Фракции, содержащие продукт, концентрируют в вакууме. Получают (S) трет-бутил (3-(4-гидроксифенил)-1-оксо-1-((2-оксо-2-(1-фенилцикло-пентил)-этил)амино)пропан-2-ил)карбамат в виде белого порошка, 2,1 г (65%). Спектр ЯМР1Н (DMSO-d6), δ, м.д. (J, Гц): 1,30 (9Н, с., t-Bu); 1,5-1,7 (4Н, м., с-С5Н8); 1,8-1,95 (2Н, м., с-С5Н8); 2,45-2,55 (2Н, м., с-С5Н8, под остаточным сигналом от DMSO-d6); 2,56-2,91 (2Н, м., CH2C6H4OH); 3,75-4.03 (2Н, м., COCH2NH); 4,05-4,12 (1H, м., CHNHboc); 6,64 (2Н, д., J=8,31, C6H4OH); 6,78 (1Н, д., J=8,80, CHNHboc); 7,02 (2Н, д., J=8,31, С6Н4ОН); 7,2-7,4 (5Н, м., Ph); 7,92 (1H, т., J=5,38, COCH2NH); 9,14 (1H, с., C6H4OH).
(S) 2-Амино-3-(4-гидроксифенил)-N-(2-оксо-2-(1-фенилциклопентил)-этил)пропанамид гидрохлорид.
К раствору (S) трет-бутил (3-(4-гидроксифенил)-1-оксо-1-((2-оксо-2-(1-фенилциклопентил)этил)амино)пропан-2-ил)карбамата (0,73 г, 1,56 ммоль) в 2 мл диоксана при комнатной температуре прибавляют 2 мл 4 М раствора хлороводорода в диоксане, перемешивают 3 час. Растворитель упаривают в вакууме, остаток растирают с 10 мл диэтилового эфира, осадок фильтруют, промывают 20 мл эфира, сушат в вакууме при температуре 50°С. Получают (S) 2-амино-3-(4-гидроксифенил)-N-(2-оксо-2-(1-фенилциклопентил)этил)-пропанамид гидрохлорид в виде белого гигроскопичного порошка, 0,57 г (91%). Спектр ЯМР1H (D2O), δ, м.д. (J, Гц): 1,50-1,70 (4Н, м., с-С5Н8); 1,85-2,00 (2Н, м., с-С5Н8); 2,25-2,45 (2Н, м., с-С5Н8); 3,00-3,15 (2Н, м., CH2C6H4OH); 3,85-4.05 (2Н, м., COCH2NH); 4,20 (1H, т., J=6,85 CHNH3+); 6,82 (2Н, д., J=8,56, С6Н4ОН); 7,08 (2Н, д., J=8,56, C6H4OH); 7,25-7,45 (5Н, м., Ph). Спектр ЯМР13С (D2O), δ, м.д.: 23.05 (С-3, 4 с-С5Н8); 34.46 (С-2, 5 с-С5Н8); 36.10(NHCOCHNH3+CH2); 4.41 (NHCOCHNH3+CH2); 63.83 (C-1 с-С5Н8); 115.79 (С-3, 5 С6Н4ОН); 125.38 (С-1 C6H4OH); 127.15 (С-3, 5 Ph); 127.53 (С-4 Ph); 129.08 (С-2, 6 Ph); 130.79 (С-2, 6 C6H4OH); 141.49 (C-1 Ph); 155.17 (С-4 C6H4OH); 169.13 (NHCOCHNH3+CH2); 209.26 (COCH2N).
Пример 54. Синтез 4-амино-1-(2-оксо-2-(1-фенилциклопентил)этил)пиридин-1-иум бромида гидрата

4-Амино-1-(2-оксо-2-(1-фенилциклопентил)этил)пиридин-1-иум бромид гидрат.
К раствору 4-аминопиридина (0,47 г, 5 ммоль) в 50 мл бензола прибавляют 2-бром-1-(1-фенилциклопентил)этан-1-он (1,34 г, 5 ммоль), полученный по примеру 1, кипятят 1,5 час. Смесь охлаждают до комнатной температуры, осадок отфильтровывают, промывают 50 мл диэтилового эфира, растворяют в 10 мл воды. Раствор упаривают в вакууме при температуре 40°С. Получают 4-амино-1-(2-оксо-2-(1-фенилциклопентил)этил)пиридин-1-иум бромид гидрат в виде светло-кремового порошка, 1,0 г (55%). Спектр ЯМР1Н (D2O), δ, м.д. (J, Гц): 1,60-1,83 (4Н, м., с-С5Н8); 2,05-2,20 (2Н, м., с-С5Н8); 2,45-2,55 (2Н, м., с-С5Н8); 4,70-4,80 (2Н, м., СОСН2Ру, под остаточным сигналом воды в D2O); 6,78 (2Н, д., J=7,58, Ру); 7,40-7,55 (7Н, м., Ph, Ру). Спектр ЯМР13С (D2O), δ, м.д.: 22,94 (С-3, 4 с-С5Н8); 34,04 (С-2, 5 с-С5Н8); 64,03 (COCH2N, С-1 с-С5Н8); 109,57 (С-2,4 Ру); 127,36 (С-3, 5 Ph); 127,99 (С-4 Ph); 129,41 (С-2, 6 Ph); 140,36 (C-1 Ph); 143,20 (С-1,5 Ру); 158,95 (С-3 Ру); 207,04 (COCH2N).
Пример 55. Синтез 1-Фенил-N-(пиридин-4-ил)циклопентан-1-карбоксамид полугидрата

1-Фенил-N-(пиридин-4-ил)циклопентан-1-карбоксамид полугидрат.
В колбе с обратным холодильником кипятят в течение 1 час 1-фенилциклопентан-1-карбоновую кислоту (2,1 г, 10,6 ммоль), полученную по примеру 44, и хлористый тионил (5,7 г, 48 ммоль) в бензоле (15 мл) с 1 каплей диметилформамида, избыток хлористого тионила отгоняют в вакууме. Полученный хлорангидрид 1-фенилциклопентан-1-карбоновой кислоты используют далее без очистки.
К раствору 4-аминопиридина (1,0 г, 10,6 ммоль) в 160 мл диэтилового эфира прибавляют хлорангидрид 1-фенилциклопентан-1-карбоновой кислоты в 10 мл диэтилового эфира, перемешивают при комнатной температуре в течение 24 час. Осадок отфильтровывают, промывают 50 мл диэтилового эфира, суспендируют в 50 мл 10% раствора NaHCO3, экстрагируют хлористым метиленом (3×30 мл). Экстракт промывают водой, сушат над K2CO3, фильтруют, упаривают в вакууме, при температуре при температуре 50°С. Остаток хроматографируют (силикагель 40-60 мкм, градиент от гептана до этилацетата). Фракции, содержащие продукт, объединяют, добавляют 10 мл воды. Раствор упаривают в вакууме. Получают 1-фенил-N-(пиридин-4-ил)-циклопентан-1-карбоксамид полугидрат в виде светло кремового порошка, 0,90 г (31%). Спектр ЯМР1Н (DMSO-d6), δ, м.д. (J, Гц): 1,55-1,75 (4Н, м., с-С5Н8); 1,85-2,05 (2Н, м., с-С5Н8); 2,55-2,70 (2Н, м., с-С5Н8); 7,20-7,27 (1Н, с., Ph); 7,30-7,45 (4Н, с., Ph); 7,62 (2Н, д., J=6,36, Ру); 8,37 (2Н, д., J=6,36, Ру); 9,53 (1Н, с., COCH2NH). Спектр ЯМР13С (DMSO-d6), δ, м.д.: 23,74 (С-3, 4 с-С5Н8); 36,28 (С-2, 5 с-С5Н8); 60,93 (С-1 с-С5Н8); 114,20 (С-2,4 Ру); 126,81(С-3, 5 Ph); 127,10 (С-4 Ph); 128,88 (С-2, 6 Ph); 143,86 (C-1 Ph); 146,53 (С-1,5 Ру); 150,57 (С-3 Ру); 175,14 (CONH).
Пример 56. Синтез (S) 2-амино-3-(1H-индол-3-ил)-N-((1-фенилциклопентил)метил)пропанамид гидрохлорида

(S) трет-Бутил(3-(1Н-идол-3-ил)-1-оксо-(((1-фенилциклопентил)-метил)амино)-пропан-2-ил)карбамат.
К раствору бос-L-триптофана (0,47 г, 1,55 ммоль) и триэтиламина (0,16 г, 1,55 ммоль) в 6 мл тетрагидрофурана, охлажденному до температуры (-)10°С, прибавляют изо-бутилхлорформиат (0,21 г, 1,55 ммоль), перемешивают 20 мин, прибавляют суспензию 1-(1-фенилциклопентил)метанамин гидрохлорида (0,33 г, 1,55 ммоль), полученного по примеру 38, и триэтиламина (0,16 г, 1,55 ммоль) в 6 мл тетрагидрофурана, перемешивают 2 час. Смесь выливают в 20 мл воды, экстрагируют этилацетатом (3×15 мл). Экстракт промывают 4% раствором Н3РО4 (2×15 мл), водой (15 мл), 10% раствором NaHCO3(2×15 мл), 35% раствором NaCl (2×15 мл). Сушат над Na2SO4, фильтруют, упаривают в вакууме. Получают (S) трет-бутил(3-(1Н-идол-3-ил)-1-оксо-(((1-фенилциклопентил)метил)амино)пропан-2-ил)-карбамат в виде стеклующегося масла, 0,59 г (85%). Спектр ЯМР1Н (DMSO-d6), δ, м.д. (7, Гц): 1,31 (9Н, с., t-Bu); 1,45-2,00 (8Н, м., с-С5Н8); 2,71-3,55 (6Н, м., CH2Ind, CH2NH); 4,12-4,23 (1Н, м., CHNHboc); 6,72 (1H, д., J=7,82, CHNHboc); 6,97 (1H, м., Ind); 7,00-7,35 (9Н, м., Ph, Ind); 7,53 (1Н, д., J=7,09, CH2NH); 10,75 (1Н, c., NH Ind).
(S) 2-Амино-3-(1Н-индол-3-ил)-N-((1-фенилциклопентил)метил)-пропанамид гидрохлорид.
(S) трет-бутил (3-(1Н-идол-3-ил)-1-оксо-(((1-фенилциклопентил)-метил)-амино)пропан-2-ил)карбамат. (0,55 г, 1,23 ммоль) растворяют при комнатной температуре в 5 мл муравьиной кислоты, перемешивают 3 час. Раствор упаривают в вакууме, при температуре 25°С, остаток растворяют в 35 мл хлористого метилена, промывают 10% раствором NaHCO3(2×10 мл), сушат над К2СО3, фильтруют, упаривают в вакууме, при температуре 25°С. Остаток растворяют в 35 мл диэтилового эфира, прибавляют 1 мл 4М раствора хлороводорода в диоксане, осадок фильтруют, промывают 35 мл эфира, сушат в вакууме при температуре 45 °С. Получают (S) 2-амино-3-(1H-индол-3-ил)-N-((1-фенилциклопентил)-метил)пропанамид гидрохлорид в виде кремового гигроскопичного порошка, 0,33 г (67%). Спектр ЯМР1Н (D2O), δ, м.д. (J, Гц): 1,00-1,65 (8Н, м., с-С5Н8); 3,08 (2Н, д., J=7.58, CH2NH); 3,09 (2Н, АВ, J1=231,08, J2=13.45, CH2Ind); 3,99 (1H, т., J=7,83, CHNH3+) 6,72 (1H, д., J=7,82, CHNHboc); 6,63-6,73 (2Н, м., Ind); 6,95-7,15 (6Н, м., Ph, Ind); 7,35-7,45 (2Н, м., Ind). Спектр ЯМР,13С (D2O), δ, м.д.: 22,7 (С-3,4, с-С5Н8); 33,7 (CH2Ind); 35,7 (С-2,5, с-С5Н8); 48,2 (C-1, с-С5Н8); 51,0 (CH2NH); 53,7 (CHNH3+); 106,6 (C2-Ind); 112,0 (C7-Ind); 118,2 (C4-Ind); 119,5 (C5-Ind); 122,1 (C6-Ind); 124,9 (C-4, Ph); 126,2 (C1-Ind); 126,6 (C3-Ind); 126,9 (C-3,5, Ph); 128,3 (C-2,6, Ph); 136,3 (C8-Ind); 146,2 (C-1, Ph); 169,1 (CONH).
Пример 57. Синтез 6-Амино-N-((1-(4-этилфенил)циклопентил)метил)-гексанамид гидрохлорида

1-(4-Этилфенил)циклопентан-1-карбонитрил.
К кипящей суспензии гидрида натрия (0,58 г, 0,024 моль) в тетрагидрофуране (40 мл) при перемешивании прикапывают смесь 2-(4-этилфенил)ацетонитирила (1,6 г, 0,011 моль) и 1,4-дибромбутана (2,58 г, 0,011 моль) в 10 мл тетрагидрофурана. Смесь кипятят 10 час, охлаждают льдом, прикапывают воду (10 мл). Фазы разделяют, органическую фазу упаривают в вакууме, при температуре 40°С. Остаток хроматографируют (силикагель 40-60 мкм, гептан : этилацетат, 10:1). Фракции, содержащие продукт, упаривают. Получают 1-(4-этилфенил)циклопентан-1-карбонитрил в виде желтого масла, 1,60 г (72%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,27 (3Н, т., J=7,58, CH3CH2-); 1,80-2,20 (6Н, м., с-С5Н8); 2,46-2,55 (2Н, м., с-С5Н8); 2,67 (2Н, кв., J1=7,58, J2=15,16, CH3CH2-); 7,23 (2Н, д., J=8,31, С6Н4); 7,40 (2Н, д., J=8,31, С6Н4).
(1-(4-Этилфенил)циклопентил)метанамин гидрохлорид.
К раствору 1-(4-этилфенил)циклопентан-1-карбонитрила (1,60 г, 8 ммоль), с ди-трет-бутил дикарбонатом (3,5 г, 16 ммоль) и NiCl2*6H2O (0,20 г, 0,8 ммоль) в метаноле (60 мл) при 0°С, порциями присыпают NaBH4 (2,1 г, 56 ммоль) так, чтобы температура не поднималась выше 5°С, перемешивают 5 час, упаривают в вакууме, при температуре 45°С. Остаток растворяют в этилацетате (50 мл), промывают водой (3×20 мл), насыщенным раствором хлористого аммония (3×20 мл), насыщенным раствором NaHCO3 (3×20 мл), насыщенным раствором NaCl (3×20 мл), сушат над Na2SO4, фильтруют, упаривают в вакууме, при температуре 40°С. К остатку прибавляют 35% соляную кислоту (10 мл), перемешивают при 40°С до растворения осадка, разбавляют водой (20 мл), экстрагируют диэтиловым эфиром. Водную фазу упаривают в вакууме при температуре 40°С. Получают (1-(4-этилфенил)циклопентил)метанамин гидрохлорид в виде бесцветного порошка, 0,82 г (43%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,22 (3Н, т., J=7,58, CH3CH2-); 1,5-1,8 (4Н, м., с-С5Н8); 1,9-2,2 (4Н, м., с-С5Н8); 2,62 (2Н, д., J1=7,58, J2=15,16, СН3СН2-); 3,00 (2Н, кв., J1=3,38, J2=11,00, CH2NH3+); 7,15 (2Н, д., J=8,31, С6Н4); 7,26 (2Н, д., J=8,31, С6Н4).; 7,81 (3Н, ш.с., CH2NH3±).
трет-Бутил (6-оксо-6((1-(4-этилфенил)циклопентил)метил)амино)-6-оксагексил)карбамат гидрохлорид.
К раствору 6-((трет-бутоксикарбонил)амино)гексановой кислоты (0,48 г, 2,09 ммоль) и триэтиламина (0,21 г, 2,09 ммоль) в хлористом метилене (5 мл) при температуре (-)5°С прибавляют изо-бутилхлорформиат (0,28 г, 2,09 ммоль), перемешивают 1 час, прибавляют раствор (1-(4-этилфенил)циклопентил)метанамин гидрохлорида (0,50 г, 2,09 ммоль) и триэтиламина (0,21 г, 2,09 ммоль) в хлористом метилене (5 мл), перемешивают 2 час, разбавляют водой, экстрагируют хлористым метиленом (3×10 мл). Экстракт промывают водой (2×5 мл), насыщенным раствором NaHCO3 (2×5 мл), насыщенным раствором NaCl (2×5 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 35°С. Остаток перекристаллизовывают из гексана (20 мл), сушат в вакууме при температуре 50°С. Получают трет-бутил (6-оксо-6((1-(4-этилфенил)циклопентил)метил)-амино)-6-оксагексил)карбамат в виде белого порошка, 0,60 г (69%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,25 (3Н, т., J=7,58, СН3СН2-); 1,25-2,00 (23Н, м., с-С5Н8, (СН3)3С и OCCH2CH2CH2CH2CH2NH); 2,06 (2Н, т., J=7,58, OCCH2CH2CH2CH2CH2NH); 2,64 (2Н, д., J1=7,58, J2=15,16, СН3СН2-); 3,00-3,15 (2Н, м., OCCH2CH2CH2CH2CH2NH); 3,39 (2Н, д., J1=6,11, CH2NH); 4,56 (1Н, ш.с., OCCH2CH2CH2CH2CH2NH); 5,09 (1Н, ш.с., CH2NH); 7,18 (4Н, с., C6H4).
6-Амино-N-((1-(4-этилфенил)циклопентил)метил)гексанамид гидрохлорид.
К раствору трет-бутил (6-оксо-6((1-(4-этилфенил)циклопентил)метил)-амино)-6-оксагексил)карбамата (0,60 г, 1,4 ммоль) в диоксане (4 мл) прибавляют 4М раствор хлороводорода в диоксане (2 мл), перемешивают в течение 6 час. Упаривают в вакууме, при температуре 45°С. Получают 6-амино-N-((1-(4-этилфенил)циклопентил)метил)гексанамид гидрохлорид в виде бесцветного масла, 0,43 г (84%). Спектр ЯМР1Н (D2O), δ, м.д. (J, Гц): 1,00 (3Н, т., J=7,58, СН3СН2-); 1,20-2,0 (14Н, м., с-С5Н8, и OCCH2CH2CH2CH2CH2NH3+); 2,07 (2Н, т., J=7,34, OCCH2CH2CH2CH2CH2NH3+); 2,38 (2Н, д., J1=7,58, J2=15,16, СН3СН2-); 2,95 (2Н, т., J=7,71, OCCH2CH2CH2CH2CH2NH3+); 3,24 (1H, с., CH2NH); 6,94 (2Н, д., J=8,07, С6Н4); 7,08 (2Н, д., J=8,07, С6Н4). Спектр ЯМР13С (D2O), δ, м.д.: 15,4 (СН3СН2-); 23,5 (OCCH2CH2CH2CH2CH2NH3+); 25,1 (OCCH2CH2CH2CH2CH2NH3+); 25,2 (С-3, 4 с-С5Н8); 26,6 (OCCH2CH2CH2CH2CH2NH3+); 28,1 (СН3СН2-); 35,5 (С-2, 5 с-С5Н8); 35,7 (OCCH2CH2CH2CH2CH2NH3+); 39,4 (OCCH2CH2CH2CH2CH2NH3+); 48,1 (C-1 с-С5Н8); 51,4 (CH2NH); 126,9 (С-3 С6Н4); 127,6 (С-2 С6Н4); 141,6 (С-4 C6H4); 144,0 (С-1 С6Н4); 175,5 (OCCH2CH2CH2CH2CH2NH3+).
Пример 58. Синтез 6-Амино-N-((1-(4-этилфенил)циклопентил)метил)-гексанамид ацетата

К раствор 6-амино-N-((1-(4-этилфенил)циклопентил)метил)гексанамид гидрохлорида (0,42 г, 1,2 ммоль) в воде (5 мл) добавляют КОН (0,56 г, 10 ммоль). Экстрагируют эфиром (3×10 мл). Экстракт промывают насыщенным раствором NaCl (2×5 мл), сушат над K2CO3, фильтруют. К фильтрату добавляют уксусную кислоту (80 мг, 1,3 ммоль). Упаривают в вакууме, при температуре 40°С. Остаток затирают с эфиром, фильтруют, промывают эфиром, сушат в вакууме при температуре 50°С Получают 6-амино-N-((1-(4-этилфенил)циклопентил)метил)-гексанамид ацетат в виде белого порошка, 94 мг (21%). Спектр ЯМР1Н (D2O), δ, м.д. (J, Гц): 1,06 (3Н, т., J=7,58, СН3СН2-); 1,10-2, 0 (14Н, м., с-С5Н8, и OCCH2CH2CH2CH2CH2NH3+); 1,88 (3Н, с., CH3CO2H); 2,04 (2Н, т., J=7,34, OCCH2CH2CH2CH2CH2NH3+); 2,48 (2Н, д., J1=7,58, J2=15,16, CH3CH2-); 2,90 (2Н, т., J=7,82, OCCH2CH2CH2CH2CH2NH3+); 3,26 (1Н, с., CH2NH); 7,07 (2Н, д., J=8,31, С6Н4); 7,15 (2Н, д., J=8,31, С6Н4). Спектр ЯМР13С (D2O), δ, м.д.: 15,2 (СН3СН2-); 23,0 (OCCH2CH2CH2CH2CH2NH3+); 23,2 (CH3CO2H); 24,9 (OCCH2CH2CH2CH2CH2NH3+); 25,1 (С-3, 4 с-С5Н8); 26,4 (ОССН2СН2СН2-CH2CH2NH3+); 27,8 (СН3СН2-); 35,3 (С-2, 5 с-С5Н8); 35,4 (ОССН2СН2СН2-CH2CH2NH3+); 39,2 (OCCH2CH2CH2CH2CH2NH3+); 48,0 (C-1 с-С5Н8); 51,4 (CH2NH); 127,1 (С-3 С6Н4); 127,6 (С-2 С6Н4); 142,3 (С-4 C6H4); 143,8 (С-1 С6Н4); 176,0 (OCCH2CH2CH2CH2CH2NH3+); 181,2 (CH3CO2H).
Пример 59. Синтез 6-амино-N-((1-(4-трет-бутилфенил)циклопентил)-метил)гексанамид гидрохлорида

1-(4-трет-Бутилфенил)циклопентан-1-карбонитрил.
К кипящей суспензии гидрида натрия (1,1 г, 0,044 моль) в тетрагидрофуране (80 мл) при перемешивании, в течение 0,5 час, прикапывают смесь 2-(4-трет-бутилфенил)ацетонитирила (3,5 г, 0,02 моль) и 1,4-дибромбутана (4,58 г, 0,021 моль) в 20 мл тетрагидрофурана. Смесь кипятят 10 час, охлаждают льдом, прикапывают воду (20 мл). Фазы разделяют, органическую фазу упаривают в вакууме, при температуре 40°С. Остаток хроматографируют (силикагель 40-60 мкм, гептан : этилацетата, 10:1). Фракции, содержащие продукт, объединяют, упаривают. Получают 1-(4-трет-бутилфенил)циклопентан-1-карбонитрил в виде желтого масла, 2,60 г (56%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,34 (9Н, с., (CH3)3С-); 1,80-2,20 (6Н, м., с-С5Н8); 2,46-2,55 (2Н, м., с-С5Н8); 7,41 (4Н, с., С6Н4).
(1-(4-трет-бутилфенил)циклопентил)метанамин гидрохлорид.
К раствору 1-(4-трет-бутилфенил)циклопентан-1-карбонитрил (2,60 г, 11,4 ммоль), с ди-трет-бутил дикарбонатом (5 г, 22,9 ммоль) и NiCl2*6H2O (0,27 г, 1,1 ммоль) в метаноле (90 мл) при 0°С, порциями присыпают NaBH4 (3,0 г, 80 ммоль) так, чтобы температура не поднималась выше 5 с., перемешивают 5 час при комнатной температуре, упаривают в вакууме, при температуре 40°С. Остаток растворяют в этилацетате (100 мл), промывают водой (3×20 мл), насыщенным раствором хлористого аммония (3×20 мл), насыщенным раствором NaHCO3 (3×20 мл), насыщенным раствором NaCl (3×20 мл), сушат над Na2SO4, фильтруют, упаривают в вакууме, при температуре 40°С. К остатку прибавляют 35% соляную кислоту (20 мл), перемешивают при 40°С до полного растворения осадка, разбавляют водой (20 мл), экстрагируют диэтиловым эфиром. Водную фазу упаривают в вакууме при температуре 40°С. Получают (1-(4-трет-бутилфенил)циклопентил)метанамин гидрохлорид в виде бесцветного порошка, 1,49 г (49%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,31 (9Н, с., (СН3)3-); 1,5-1,8 (4Н, м., с-С5Н8); 1,9-2,2 (4Н, м., с-С5Н8); 3,02 (2Н, ш.с., CH2NH3+); 7,25 (2Н, д., J=8,31, С6Н4); 7,34 (2Н, д., J=8,31, С6Н4).; 7,83 (3Н, ш.с., CH2NH3±).
трет-Бутил (6-оксо-6((1-(4-трет-бутилфенил)циклопентил)метил-амино)-6-оксагексил)карбамат.
К раствору 6-((трет-бутоксикарбонил)амино)гексановой кислоты (0,48 г, 2,09 ммоль) и триэтиламина (0,21 г, 2,09 ммоль) в хлористом метилене (5 мл) при температуре (-)5°С прибавляют изо-бутилхлорформиат (0,28 г, 2,09 ммоль), перемешивают при комнатной температуре 1 час, прибавляют раствор (1-(4-трет-бутилфенил)циклопентил)метанамин гидрохлорид (0,56 г, 2,09 ммоль) и триэтиламина (0,21 г, 2,09 ммоль) в хлористом метилене (5 мл). Смесь перемешивают 2 час, разбавляют водой, экстрагируют хлористым метиленом (3×10 мл). Экстракт промывают водой (2×5 мл), насыщенным раствором NaHCO3 (2×5 мл), насыщенным раствором NaCl (2×5 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 40°С. Остаток перекристаллизовывают из гексана (20 мл), сушат в вакууме при температуре 50°С. Получают трет-бутил (6-оксо-6((1-(4-трет-бутилфенил)циклопентил)метиламино)-6-оксагексил)карбамат в виде белого порошка, 0,66 г (71%). Спектр ЯМР1Н (CDCl3), δ, м.д. (J, Гц): 1,20-2,00 (32Н, м., с-С5Н8, (CH3)3C, (CH3)3С и OCCH2CH2CH2CH2CH2NH); 2,07 (2Н, т., J=7,34, OCCH2CH2CH2CH2CH2NH); 3,08 (2Н, т., J=6,36, OCCH2CH2CH2CH2CH2NH); 3,38 (2Н, д., J1=6,11, CH2NH); 4,54 (1Н, ш.с., OCCH2CH2CH2CH2CH2NH); 5,12 (1H, ш.с., CH2NH); 7,19 (2H, д., J=8,56, C6H4); 7,35 (2H, д., J=8,56, C6H4).
6-Амино-N-((1-(4-трет-бутилфенил)циклопентил)метил)гексанамид гидрохлорид.
К раствору трет-бутил (6-оксо-6((1-(4-трет-бутилфенил)цикло-пентил)метиламино)-6-оксагексил)карбамата (0,66 г, 1,5 ммоль) в диоксане (4 мл) прибавляют 4 М раствор хлороводорода в диоксане (2 мл), перемешивают в течение 6 час. Упаривают в вакууме, при температуре 45°С. Получают 6-амино-N-((1-(4-трет-бутилфенил)циклопентил)-метил)гексанамид гидрохлорид в виде бесцветного масла, 0,57 г (100%). Спектр ЯМР1Н (D2O), δ, м.д. (J, Гц): 1,06 (9Н, с., (СН3)3С-); 1,20-2,0 (14Н, м., с-С5Н8, и OCCH2CH2CH2CH2CH2NH3+); 2,07 (2Н, т., J=7,34, OCCH2CH2CH2CH2CH2NH3+); 2,97 (2Н, т., J=7,83, OCCH2CH2CH2CH2CH2NH3+); 3,26 (2Н, с., CH2NH); 7,11 (4Н, с., С6Н4). Спектр ЯМР13С (D2O), δ, м.д.: 23,6 (OCCH2CH2CH2CH2CH2NH3+); 25,2 (OCCH2CH2CH2CH2CH2NH3+); 25,6 (С-3, 4 с-С5Н8); 26,6 (OCCH2CH2CH2CH2CH2NH3+); 31,2 ((СН3)3С-); 33,9 ((СН3)3С-); 35,4 (С-2, 5 с-С5Н8); 35,7 (OCCH2CH2CH2CH2CH2NH3+); 39,4 (OCCH2CH2CH2CH2CH2NH3+); 48,1 (С-1 с-С5Н8); 51,3 (CH2NH); 124,5 (С-3 С6Н4); 126,6 (С-2 С6Н4); 143,9 (С-4 С6Н4); 148,3 (С-1 C6H4); 175,5 (OCCH2CH2CH2CH2CH2NH3+).
Пример 60. Синтез 6-амино-N-((1-(4-трет-бутилфенил)циклопентил)-метил)гексанамид ацетата
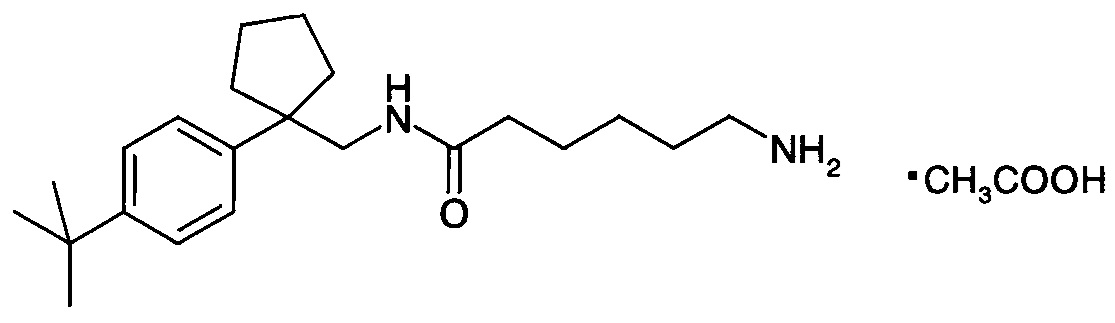
К раствор 6-амино-N-((1-(4-трет-бутилфенил)циклопентил)-метил)-гексанамид гидрохлорида (0,54 г, 1,4 ммоль) в воде (5 мл) добавляют КОН (0,56 г, 10 ммоль). Экстрагируют диэтиловым эфиром (3×10 мл). Экстракт промывают насыщенным раствором NaCl (2×5 мл), сушат над К2СО3, фильтруют. К фильтрату добавляют уксусную кислоту (90 мг, 1,5 ммоль). Упаривают в вакууме, при температуре 45°С. Остаток затирают с эфиром, фильтруют, промывают эфиром, сушат в вакууме при температуре 50°С Получают 6-амино-N-((1-(4-трет-бутилфенил)циклопентил)-метил)гексанамид ацетат в виде белого порошка, 0,27 г (47%). Спектр ЯМР1Н (D2O), δ, м. д. (J, Гц): 1,10 (9Н, с., (СН3)3С-); 1,20-1,80 (14Н, м., с-С5Н8, и OCCH2CH2CH2CH2CH2NH3+); 1,88 (3Н, с., CH3CO2H); 2,04 (2Н, т., J=7,58, OCCH2CH2CH2CH2CH2NH3+); 2,92 (2Н, т., J=7,58, OCCH2CH2CH2CH2CH2NH3+); 3,26 (2Н, с., CH2NH); 7,13 (2Н, д., J=7,58, С6Н4); 7,20 (2Н, д., J=7,58, С6Н4). Спектр ЯМР13С (D2O), δ, м. д.: 23,1 (ОССН2СН2СН2СН2-CH2NH3+); 23,2 (CH3CO2H); 25,0 (OCCH2CH2CH2CH2CH2NH3+); 25,3 (С-3, 4 с-С5Н8); 26,5 (OCCH2CH2CH2CH2CH2NH3+); 30,9 ((СН3)3С-); 33,8 ((СН3)3С-); 35,3 (С-2, 5 c-С5Н8); 35,5 (OCCH2CH2CH2CH2CH2NH3+); 39,2 (OCCH2CH2CH2CH2CH2NH3+); 48,0 (С-1 с-С5Н8); 51,2 (CH2NH); 125,0 (С-3 C6H4); 126,7 (С-2 C6H4; 143,7 (С-4 С6Н4); 148,7 (С-1 C6H4); 175,8 (OCCH2CH2CH2CH2CH2NH3+); 181,1 (CH3CO2H).
Пример 61. Синтез 6-амино-N-((1-(4-бутоксифенил)циклопентил)-метил)гексанамид гидрохлорида

К кипящей суспензии гидрида натрия (0,6 г, 0,026 моль) в тетрагидрофуране (40 мл) при перемешивании, в течение 0,5 час, прикапывают смесь 2-(4-бутоксифенил)ацетонитирила (2,2 г, 0,012 моль) и 1,4-дибромбутана (2,64 г, 0,012 моль) в 10 мл тетрагидрофурана, кипятят в течение 10 час, охлаждают льдом, прикапывают воду (10 мл). Фазы разделяют, органическую фазу упаривают в вакууме, при температуре 50°С. Остаток хроматографируют (силикагель 40-60 мкм, гептан : этилацетат 10:1). Фракции, содержащие продукт, упаривают. Получают
1-(4-бутоксифенил)циклопентан-1-карбонитрил в виде желтого масла, 1,4 г (50%). Спектр ЯМР1H (CDCl3), δ, м. д. (J, Гц): 0,99 (3Н, т., J=7,34, CH3CH2CH2CH2O-); 1,4-1,6 (2Н, м., CH3CH2CH2CH2O-); 1,7-1,8 (2Н, м., CH3CH2CH2CH2O-); 1,80-2,2 (6Н, м., с-С5Н8); 2,45-2,60 (2Н, м., с-С5Н8); 3,97 (3Н, т., J=6,36, CH3CH2CH2CH2O-); 6,90 (2Н, д., J=8,80, С6Н4); 7,36 (2Н, д., J=6,80, С6Н4).
(1-(4-Бутоксифенил)циклопентил)метанамин гидрохлорид.
К раствору 1-(4-бутоксифенил)циклопентан-1-карбонитрил (1,40 г, 4,1 ммоль), с ди-трет-бутил дикарбонатом (1,8 г, 8,2 ммоль) и NiCl2*6H2O (0,1 г, 0,4 ммоль) в метаноле (30 мл) при 0°С порциями присыпают NaBH4 (2,1 г, 56 ммоль) так, чтобы температура не поднималась выше 5°С, перемешивают 5 час при комнатной температуре, упаривают в вакууме, при температуре 45°С. Остаток растворяют в этилацетате (50 мл), промывают водой (3×20 мл), насыщенным раствором хлористого аммония (3×20 мл), насыщенным раствором NaHCO3 (3×20 мл), насыщенным раствором NaCl (3×20 мл), сушат над Na2SO4, фильтруют, упаривают в вакууме, при температуре 40°С. К остатку прибавляют 35% соляную кислоту (10 мл), перемешивают при 40°С до полного растворения осадка, разбавляют водой (20 мл), экстрагируют диэтиловым эфиром (3×20 мл). Водную фазу упаривают в вакууме при температуре 40°С. Получают (1-(4-бутоксифенил)циклопентил)метанамин гидрохлорид в виде бесцветного порошка, 0,70 г (61%). Спектр ЯМР1Н (CDCl3), δ, м. д. (J, Гц): 0,99 (3Н, т., J=7,34, CH3CH2CH2CH2O-); 1,4-1,6 (2Н, м., CH3CH2CH2CH2O-); 1,5-1,8 (6Н, м., с-С5Н8, CH3CH2CH2CH2O-); 1,9-2,2 (4Н, м., с-С5Н8); 3,00 (2Н, ш.с., CH2NH3+); 3,95 (3Н, т., J=6,36, CH3CH2CH2CH2O-); 6,87 (2H, д., J=8,56, С6Н4); 7,25 (2Н, д., J=8,56, С6Н4); 7,82 (3Н, ш. с., CH2NH3+).
трет-Бутил (6-оксо-6((1-(4-бутоксифенил)циклопентил)метил-амино)-6-оксагексил)карбамат.
К раствору 6-((трет-бутоксикарбонил)амино)гексановой кислоты (0,48 г, 2,09 ммоль) и триэтиламина (0,21 г, 2,09 ммоль) в хлористом метилене (5 мл) при температуре (-)5°С прибавляют изо-бутилхлорформиат (0,28 г, 2,09 ммоль), перемешивают 1 час, прибавляют раствор триэтиламина (0,21 г, 2,09 ммоль) и (1-(4-бутоксифенил)циклопентил)метанамин гидрохлорида (0,59 г, 2,09 ммоль) в хлористом метилене (5 мл). Смесь перемешивают 2 час, разбавляют водой, экстрагируют хлористым метиленом (3×10 мл). Экстракт промывают водой (2×5 мл), насыщенным раствором NaHCO3 (2×5 мл), насыщенным раствором NaCl (2×5 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 40°С. Остаток перекристаллизовывают из гексана (20 мл), сушат в вакууме при температуре 50°С. Получают трет-бутил (6-оксо-6((1-(4-бутоксифенил)-циклопентил)метиламино)-6-оксагексил)карбамат в виде белого порошка, 0,66 г (69%). Спектр ЯМР1Н (CDCl3), δ, м. д. (J, Гц): 0,99 (3Н, т., J=7,34, CH3CH2CH2CH2O-); 1,20-2,00 (27Н, м., с-С5Н8, (CH3)3С, (CH3CH2CH2CH2O- и OCCH2CH2CH2CH2CH2NH); 2,06 (2Н, т., J=7,34, ОССН2-CH2CH2CH2CH2NH); 3,08 (2Н, т., J=5,87, OCCH2CH2CH2CH2CH2NH); 3,38 (2Н, д., J=5,87, CH2NH); 3,96 (3Н, т., J=6,60, CH3CH2CH2CH2O-); 4,53 (1H, ш.с., OCCH2CH2CH2CH2CH2NH); 5,06 (1Н, ш.с., CH2NH); 6,88 (2Н, д., J=8,80, С6Н4); 7,17 (2Н, д., J=8,80, С6Н4).
6-Амино-N-((1-(4-бутоксифенил)циклопентил)метил)гексанамид гидрохлорид.
К раствору трет-бутил (6-оксо-6((1-(4-бутоксифенил)циклопентил)-метиламино)-6-оксагексил)карбамата (0,66 г, 1,4 ммоль) в диоксане (4 мл) прибавляют 4 М раствор хлороводорода в диоксане (2 мл), перемешивают в течение 6 час. Упаривают в вакууме, при температуре 45°С. Получают 6-амино-N-((1-(4-бутоксифенил)циклопентил)метил)гексанамид гидрохлорид в виде бесцветного масла, 0,57 г (100%). Спектр ЯМР1Н (D2O), δ, м. д. (J, Гц): 0,73 (3Н, т., J=7,34, CH3CH2CH2CH2O-); 1,20-2,0 (20Н, м., с-С5Н8, CH3CH2CH2CH2O- и OCCH2CH2CH2CH2CH2NH3+); 2,06 (2H, т., J=7,34, OCCH2CH2CH2CH2CH2NH3+); 2,92 (2Н, т., J=7,58 OCCH2CH2CH2CH2CH2NH3+); 3,20 (1H, с., CH2NH); 3,66 (3Н, т., J=6,36, CH3CH2CH2CH2O-); 6,63 (2Н, д., J=8,56, С6Н4); 7,05 (2Н, д., J=8,56, С6Н4). Спектр ЯМР13С (D2O), δ, м. д.: 13,6 (CH3CH2CH2CH2O-); 19,1 (CH3CH2CH2CH2O-); 23,4 (OCCH2CH2CH2CH2CH2NH3+); 25,2 (OCCH2CH2CH2CH2CH2NH3+); 25,6 (С-3, 4 с-С5Н8); 26,6 (OCCH2CH2CH2CH2CH2NH3+); 31,2 (CH3CH2CH2CH2O-); 35,5 (С-2, 5 с-С5Н8); 35,7 (OCCH2CH2CH2CH2CH2NH3+); 39,4 (OCCH2CH2CH2CH2CH2NH3+); 48,1 (С-1 с-С5Н8); 51,1 (CH2NH); 67,4 (CH3CH2CH2CH2O-); 114,1 (С-2 C6H4); 127,8 (С-3 С6Н4); 138,8 (С-1 С6Н4); 157,0 (С-4 С6Н4); 175,4 (OCCH2CH2CH2CH2CH2NH3+).
Пример 62. Синтез 6-амино-N-((1-(4-бутоксифенил)циклопентил)-метил)гексанамид ацетата

К раствор 6-амино-N-((1-(4-бутоксифенил)циклопентил)метил)-гексанамид гидрохлорида (0,53 г, 1,3 ммоль) в воде (5 мл) добавляют КОН (0,56 г, 10 ммоль). Экстрагируют диэтиловым эфиром (3×10 мл). Экстракт промывают насыщенным раствором NaCl (2×5 мл), сушат над К2СО3, фильтруют. К фильтрату добавляют уксусную кислоту (80 мг, 1,3 ммоль). Упаривают в вакууме, при температуре 35°С. Остаток затирают с эфиром, фильтруют, промывают эфиром, сушат в вакууме при температуре 50°С Получают 6-амино-N-((1-(4-бутоксифенил)циклопентил)метил)-гексанамид ацетат в виде в виде белого порошка, 0,27 г (47%). Спектр ЯМР1Н (D2O), δ, м. д. (J, Гц): 0,76 (3Н, т., J=7,58, CH3CH2CH2CH2O-); 1,20-1,80 (20Н, м., с-С5Н8, CH3CH2CH2CH2O- и OCCH2CH2CH2CH2CH2NH3+); 1,88 (CH3CO2H); 2,05 (2Н, т., J=7,58, OCCH2CH2CH2CH2CH2NH3+); 2,91 (2Н, т., J=7,82 OCCH2CH2CH2CH2CH2NH3+); 3,23 (1H, с., CH2NH); 3,77 (3Н, т., J=6,36, CH3CH2CH2CH2O-); 6,71 (2Н, д., J=8,80, С6Н4); 7,10 (2Н, д., J=8,80, С6Н4). Спектр ЯМР13С (D2O), δ, м. д.: 13,3 (CH3CH2CH2CH2O-); 18,8 (CH3CH2CH2CH2O-); 23,1 (CH3CO2H); 25,0 (OCCH2CH2CH2CH2CH2NH3+); 25,2 (OCCH2CH2CH2CH2CH2NH3+); 25,6 (С-3, 4 с-С5Н8); 26,5 (OCCH2CH2CH2-CH2CH2NH3+); 30,8 (СН3СН2СН2СН2О-); 35,4 (С-2, 5 с-С5Н8); 35,5 (OCCH2-CH2CH2CH2CH2NH3+); 39,2 (OCCH2CH2CH2CH2CH2NH3+); 47,9 (С-1 c-C5H8); 51,0 (CH2NH); 67,8 (CH3CH2CH2CH2O-); 114,1 (С-2 C6H4); 128,0 (С-3 C6H4); 138,9 (С-1 C6H4); 156,6 (С-4 C6H4); 175,8 (OCCH2CH2CH2CH2CH2NH3+); 180,9 (CH3CO2H).
Пример 63. Синтез 6-амино-N-((1-(4-изо-бутоксифенил)циклопентил)-метил)гексанамид гидрохлорида

К кипящей суспензии гидрида натрия (0,90 г, 0,037 моль) в тетрагидрофуране (60 мл) при перемешивании, в течение 0,5 час, прикапывают смесь 2-(4-изо-бутоксифенил)ацетонитирила (3,2 г, 0,017 моль) и 1,4-дибромбутана (3,83 г, 0,018 моль) в 10 мл тетрагидрофурана. Смесь кипятят 10 час, охлаждают льдом, прикапывают воду (10 мл). Фазы разделяют, органическую фазу упаривают в вакууме, при температуре 40°С. Остаток хроматографируют (силикагель 40-60 мкм, гептан : этилацетат, 10:1). Фракции, содержащие продукт, объединяют, упаривают. Получают
1-(4-изо-бутоксифенил)циклопентан-1-карбонитрил в виде желтого масла, 2,60 г (63%). Спектр ЯМР1Н (CDCl3), δ, м. д. (J, Гц): 1,04 (6Н, д., J=6,60, (CH3)2СНСН2О-); 1,80-2,2 (7Н, м., (СН3)2CHCH2O-), с-С5Н8); 2,45-2,60 (2Н, м., с-С5Н8); 3,73 (2Н, д., J=6,60, (СН3)2CHCH2O-)); 6,90 (2Н, д., J=8,56, С6Н4); 7,36 (2Н, д., J=6,56, С6Н4).
(1-(4-изо-Бутоксифенил)циклопентил)метанамин гидрохлорид.
К раствору 1-(4-изо-бутоксифенил)циклопентан-1-карбонитрил (2,60 г, 10,7 ммоль), с ди-трет-бутил дикарбонатом (4,7 г, 21,4 ммоль) и NiCl2*6H2O (0,25 г, 1 ммоль) в метаноле (80 мл) при 0°С, порциями прибавляют NaBH4 (2,8 г, 75 ммоль) так, чтобы температура не поднималась выше 5°С, перемешивают 5 час, упаривают в вакууме, при температуре 50°С. Остаток растворяют в этилацетате (50 мл), промывают водой (3×20 мл), насыщенным раствором хлористого аммония (3×20 мл), насыщенным раствором NaHCO3 (3×20 мл), насыщенным раствором NaCl (3×20 мл), сушат над Na2SO4, фильтруют, упаривают в вакууме, при температуре 40°С. К остатку прибавляют 35% соляную кислоту (10 мл), перемешивают при 40°С до полного растворения осадка, разбавляют водой (20 мл), экстрагируют диэтиловым эфиром (3×20 мл). Водную фазу упаривают в вакууме при температуре 40°С. Получают (1-(4-изо-бутоксифенил)циклопентил)-метанамин гидрохлорид в виде бесцветного порошка, 1,71 г (56%). Спектр ЯМР1Н (CDCl3), δ, м. д. (J, Гц): 1,00 (6Н, д., J=6,85, (CH3)2CHCH2O-); 1,5-1,8 (4Н, м., с-С5Н8,); 1,9-2,2 (5Н, м., с-С5Н8, (СН3)2CHCH2O-); 2,99 (2Н, ш.с., CH2NH3+); 3,69 (2Н, д., J=6,36, (СН3)2CHCH2O-); 6,84 (2Н, д., J=8,80, С6Н4); 7,23 (2Н, д., J=8,80, С6Н4); 7,82 (3Н, ш. с., CH2NH3+).
трет-Бутил (6-оксо-6((1-(4-изо-бутоксифенил)циклопентил)метил-амино)-6-оксагексил)карбамат.
К раствору 6-((трет-бутоксикарбонил)амино)гексановой кислоты (0,48 г, 2,09 ммоль) и триэтиламина (0,21 г, 2,09 ммоль) в хлористом метилене (5 мл) при температуре (-)5°С прибавляют изо-бутилхлорформиат (0,28 г, 2,09 ммоль), перемешивают при комнатной температуре 1 час, прибавляют раствор (1-(4-изо-бутоксифенил)циклопентил)метанамин гидрохлорида (0,59 г, 2,09 ммоль) и триэтиламина (0,21 г, 2,09 ммоль) в хлористом метилене (5 мл). Смесь перемешивают 2 час, разбавляют водой, экстрагируют хлористым метиленом (3×10 мл). Экстракт промывают водой (2×5 мл), насыщенным раствором NaHCO3 (2×5 мл), насыщенным раствором NaCl (2×5 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 40°С. Остаток перекристаллизовывают из гексана (20 мл), сушат в вакууме при температуре 50°С. Получают трет-бутил (6-оксо-6((1-(4-изо-бутоксифенил)циклопентил)метиламино)-6-оксагексил)карбамат в виде белого порошка, 0,65 г (68%). Спектр ЯМР1Н (CDCl3), δ, м. д. (J, Гц): 1,03 (6Н, д., J=6,60, (CH3)2СНСН2О-); 1,20-2,00 (24Н, м., с-С5Н8, (СН3)3С, (СН3)2CHCH2O- -и OCCH2CH2CH2CH2CH2NH); 2,05 (2Н, т., J=7,34, OCCH2CH2CH2CH2CH2NH); 3,08 (2Н, т., J=6,60, OCCH2CH2CH2CH2CH2NH); 3,37 (2Н, д., J=6,11, CH2NH); 3,72 (2Н, т., J=6,60, (СН3)2CHCH2O-); 4,54 (1H, ш.с., OCCH2CH2CH2CH2CH2NH); 5,07 (1H, ш.с., CH2NH); 6,87 (2H, д., J=8,80, C6H4); 7,17 (2H, д., J=8,80, C6H4).
6-Амино-N-((1-(4-изо-бутоксифенил)циклопентил)метил)гексанамид гидрохлорид.
К раствору трет-бутил (6-оксо-6((1-(4-изо-бутоксифенил)циклопентил)-метиламино)-6-оксагексил)карбамата (0,60 г, 1,4 ммоль) в диоксане (4 мл) прибавляют 4 М раствор хлороводорода в диоксане (2 мл), перемешивают в течение 6 час. Упаривают в вакууме, при температуре 40°С. Получают 6-амино-N-((1-(4-изо-бутоксифенил)циклопентил)метил)-гексанамид гидрохлорид в виде бесцветного масла, 0,56 г (100%). Спектр ЯМР1Н (D2O), δ, м. д. (J, Гц): 0,77 (6Н, д., J=6,60, (СН3)3CHCH2O-); 1,20-2,0 (15Н, м., с-С5Н8, (СН3)3CHCH2O- и OCCH2CH2CH2CH2CH2NH3+); 2,06 (2Н, т., J=7,34, OCCH2CH2CH2CH2CH2NH3+); 2,91 (2Н, т., J=7,60 OCCH2CH2CH2CH2CH2NH3+); 3,19 (2Н, с., CH2NH); 3,43 (2Н, д., J=6,60, (СН3)3CHCH2O-); 6,64 (2Н, д., J=8,80, С6Н4); 7,04 (2Н, д., J=8,80, С6Н4). Спектр ЯМР13С (D2O), δ, м. д.: 18,9 ((СН3)2CHCH2O-); 23,4 (ОССН2СН2-CH2CH2CH2NH3+); 25,1 (OCCH2CH2CH2CH2CH2NH3+); 25,6 (С-3, 4 с-С5Н8); 26,6 (OCCH2CH2CH2CH2CH2NH3+); 33,5 ((СН3)2CHCH2O-); 35,5 (С-2, 5 с-С5Н8); 35,7 (OCCH2CH2CH2CH2CH2NH3+); 39,4 (OCCH2CH2CH2CH2-CH2NH3+); 48,0 (С-1 с-С5Н8); 51,0 (CH2NH); 74,3 ((СН3)2CHCH2O-); 114,2 (С-2 C6H4); 127,9 (С-3 С6Н4); 138,8 (С-1 С6Н4); 157,0 (С-4 C6H4); 175,6 (OCCH2CH2CH2-CH2CH2NH3+).
Пример 64. Синтез 6-амино-N-((1-(4-изо-бутоксифенил)циклопентил)-метил)гексанамид ацетата

К раствору 6-амино-N-((1-(4-изо-бутоксифенил)циклопентил)метил)-гексанамид гидрохлорида (0,52 г, 1,3 ммоль) в воде (4 мл) добавляют КОН (0,56 г, 10 ммоль), экстрагируют эфиром (3×10 мл). Экстракт промывают насыщенным раствором NaCl (2×5 мл), сушат над К2СО3, фильтруют. К фильтрату добавляют уксусную кислоту (80 мг, 1,3 ммоль). Упаривают в вакууме, при температуре 45°С. Остаток затирают с эфиром, фильтруют, промывают эфиром, сушат в вакууме при температуре 50°С Получают 6-амино-N-((1-(4-изо-бутоксифенил)циклопентил)метил)-гексанамид ацетата в виде белого порошка, 0,35 г (64%). Спектр ЯМР1Н (D2O), δ, м. д. (J, Гц): 0,80 (6Н, д., J=6,60, (CH3)3СНСН2О-); 1,20-1,85 (15Н, м., с-С5Н8, (СН3)3CHCH2O- и OCCH2CH2CH2CH2CH2NH3+); 1,87 (CH3CO2H); 2,05 (2Н, т., J=7,58, OCCH2CH2CH2CH2CH2NH3+); 2,91 (2Н, т., J=7,58 ОССН2СН2СН2 CH2CH2NH3+); 3,23 (2Н, с., CH2NH); 3,53 (2Н, д., J=6,60, (СН3)3CHCH2O-); 6,72 (2Н, д., J=8,80, С6Н4); 7,09 (2Н, д., J=8,80, C6H4). Спектр ЯМР13С (D2O), δ, м. д.: 18,7 ((СН3)2CHCH2O-); 23,1 (CH3CO2H); 23,3 (OCCH2CH2CH2CH2CH2NH3+); 25,0 (OCCH2CH2CH2CH2CH2NH3+); 25,2 (С-3, 4 с-С5Н8); 26,5 (OCCH2CH2CH2CH2CH2NH3+); 27,7 ((СН3)2CHCH2O-); 35,4 (С-2, 5 с-С5Н8); 35,5 (OCCH2CH2CH2CH2CH2NH3+); 39,2 (OCCH2CH2CH2CH2-CH2NH3+); 48,0 (С-1 с-С5Н8); 51,0 (CH2NH); 74,5 ((СН3)2CHCH2O-); 114,2 (С-2 С6Н4); 128,0 (С-3 С6Н4); 138,9 (С-1 С6Н4); 156,8 (С-4 С6Н4); 175,8 (OCCH2CH2CH2CH2CH2NH3+); 181,1 (CH3CO2H).
Пример 65. Синтез N1-((4-фенилтетрагидро-2Н-пиран-4-ил)метил)гексан-1,6-диамин дигидрохлорида

К раствору 1-фенилтетрагидро-2H-пиран-4-ил-1-карбонитрила (3,74 г, 20 ммоль), полученного по примеру 40, с ди-трет-бутил дикарбонатом (8,74 г, 40 ммоль) и NiCl2⋅6H2O (0,56 г, 2 ммоль) в метаноле (75 мл) при 0°С, порциями присыпают NaBH4 (9,66 г, 0,25 моль) таким образом, чтобы температура не поднималась выше 5°С, перемешивают 5 час при комнатной температуре, упаривают в вакууме, при температуре 40°С. Остаток растворяют в этилацетате (150 мл), промывают водой (3×50 мл), насыщенным раствором хлористого аммония (2×40 мл), насыщенным раствором NaHCO3 (2×40 мл), насыщенным раствором NaCl (2×40 мл), сушат над Na2SO4, фильтруют, фильтрат упаривают в вакууме, при температуре 45°С. Остаток растворяют в 30 мл пропан-2-ола, прибавляют 35% соляную кислоту (10 мл), перемешивают при температуре 50°С в течение 1 час, упаривают в вакууме при температуре 45°С. Остаток диспергируют в 30 мл хлористого метилена, перемешивают в течение 30 мин. Осадок отделяют, промывают хлористым метиленом (2×10 мл), сушат в вакууме при температуре 50°С. Получают (4-фенилтетрагидро-2H-пиран-4-ил)метанамин гидрохлорид в виде белого порошка, 2,2 г (50%). Спектр ЯМР1Н (CDCl3), δ, м. д. (J, Гц): 1,85-2,00 (2Н, м., с-C4H8O); 2,10-2,20 (2Н, м., с-C4H8O); 3,00 (2Н, с., CH2NH3+); 3,30-3,40 (2Н, м., c-C4H8O); 3,65-3,75 (2Н, м., с-C4H8O); 7,25-7,50 (5Н, Ph); 7.94 (3Н, ш. с., CH2NH3+).
2-(6-(((4-Фенилтетрагидро-2Н-пиран-4-ил)метил)амино)гексил)-изоиндолин-1,3-дион гидрохлорид.
В колбе с обратным холодильником, нагревают в течение 12 час, при температуре 100°С, раствор (4-фенилтетрагидро-2H-пиран-4-ил)метанамин гидрохлорида (2,2 г, 10 ммоль), 2-(6-бромгексил)изоиндолин-1,3-диона (3,13 г, 10 ммоль) и К2СО3 (3,0 г, 22 ммоль) в диметилформамиде (40 мл). Смесь разбавляют водой (150 мл), экстрагируют этилацетатом (3×50 мл), органическую фазу промывают водой (2×100 мл), упаривают в вакууме. Остаток растворяют в 20 мл пропан-2-ола, прибавляют 35% соляную кислоту (10 мл), перемешивают 30 мин, упаривают в вакууме. Остаток промывают водой (2×100 мл), высушивают в вакууме, кристаллизуют из смеси ацетон : диэтиловый эфир (4:60), отделяют, промывают эфиром (20 мл), сушат в вакууме. Получают 2-(6-(((4-фенилтетрагидро-2Н-пиран-4-ил)метил)амино)гексил)-изоиндолин-1,3-дион гидрохлорид в виде белого, порошка, 2,33 г, (51%). Спектр ЯМР1Н (DMSO-d6), δ, м. д. (J, Гц): 1,10-1,25 (4Н, м., PhthNCH2CH2CH2CH2CH2CH2NH2+); 1,45-1,65 (4Н, м., PhthNCH2CH2CH2-CH2CH2CH2NH2+); 1,90-2,00 (2Н, м., с-C4H8O); 2,15-2,25 (2Н, м., с-C4H8O); 2,60-2,70 (2Н, м., PhthNCH2CH2CH2CH2-CH2CH2NH2+); 3,15 (2Н, с., CH2NH2+); 3,30-3,40 (2Н, м., PhthNCH2CH2CH2-CH2CH2CH2NH2+); 3,50-3,60 (2Н, м., с-C4H8O); 3,65-3,80 (2Н, м., с-C4H8O); 7,25-7,50 (5Н, м., Ph); 7,80-7,90 (4Н, м., PhthNCH2CH2CH2CH2CH2-CH2NH2+); 8,25 (2Н, ш. с., PhthNCH2CH2CH2CH2CH2CH2NH2+).
N1-((4-фенилтетрагидро-2Н-пиран-4-ил)метил)гексан-1,6-диамин дигидрохлорид.
В колбе с обратным холодильником кипятят в течение 2 час суспензию 2-(6-(((4-фенилтетрагидро-2H-пиран-4-ил)метил)амино)гексил)-изоиндолин-1,3-дион гидрохлорида (2,33 г, 5 ммоль) карбоната калия (1,38 г, 10 ммоль) и 50% гидразин гидрата (0,32 г, 5 ммоль) в пропан-2-оле (40 мл). Прибавляют 35% соляную кислоту (15 мл) и воду (80 мл), кипятят 1 час. Смесь охлаждают, фильтруют, осадок промывают водой (3×10 мл). Фильтрат упаривают в вакууме, остаток экстрагируют эфиром (3×30 мл), упаривают в вакууме. Остаток промывают этилацетатом (2×30 мл), сушат в вакууме. Получают N1-((4-фенилтетрагидро-2H-пиран-4-ил)метил)-гексан-1,6-диамин дигидрохлорид в виде белого порошка, 0,52 г (32%). Спектр ЯМР1Н (D2O), δ, м. д. (J, Гц): 1,15-1,35 (4Н, м., H3+NCH2CH2CH2CH2CH2-CH2NH2+); 1,45-1,65 (4Н, м., H3+NCH2CH2CH2CH2-CH2CH2NH2+); 1,85-1,95 (2Н, м., с-C4H8O); 2,30-2,40 (2Н, м., с-C4H8O); 2,80-2,95 (4Н, м., H3+NCH2CH2CH2CH2CH2CH2NH2+); 3,28 (2Н, с., CH2NH2+); 3,45-3,55 (2Н, м., с-C4H8O); 3,80-3,90 (2Н, м., с-C4H8O); 7,35-7,60 (5Н, м., Ph); Спектр ЯМР13С (D2O), δ, м. д.: 23,8 (H2+NCH2CH2CH2CH2CH2CH2NH3+); 25,1 (H2+NCH2-CH2CH2CH2CH2CH2NH3+); 26,4 (H2+NCH2CH2CH2CH2CH2CH2NH3+); 33,2 (С-2, 5, c-C4H8O); 33,7 (С-1, с-C4H8O); 39,3 (H2+NCH2CH2CH2CH2-CH2CH2NH3+); 48,4 (H2+NCH2CH2-CH2CH2CH2CH2NH3+); 51,2 (CH2NH2+); 63,5 (С-3, 4 c-C4H8O); 127,6 (С-2, 6, Ph); 128,1 (С-4, Ph); 129,6 (С-3,5, Ph); 139,0 (C1, Ph).
Пример 66. Синтез 6-амино-N-(4-фенилтетрагидро-2H-пиран-4-ил)-гексанамид фумарата

К раствору N1-((4-фенилтетрагидро-2H-пиран-4-ил)метил)-гексан-1,6-диамин дигидрохлорида (0,1 г, 0,3 ммоль), полученного по примеру 65, в воде (4 мл) добавляют КОН (0,56 г, 10 ммоль). Экстрагируют диэтиловым эфиром (3×10 мл). Экстракт промывают насыщенным раствором NaCl (2×5 мл), сушат над К2СО3, фильтруют. Фильтрат концентрируют до объема 10 мл, прибавляют раствор фумаровой кислоты в 15 мл диэтилового эфира (35 мг, 0,3 ммоль). Осадок отделяют, промывают эфиром (2×5 мл), сушат в вакууме при температуре 50°С Получают 6-амино-N-(4-фенилтетрагидро-2H-пиран-4-ил)гексанамид фумарат в виде белого порошка, 40 мг (35%). Спектр ЯМР1Н (D2O), δ, м. д. (J, Гц): 1,15-1,65 (8Н, м., H3+NCH2CH2CH2CH2CH2-CH2NH2+); 1,85-1,95 (2Н, м., с-C4H8O); 2,10-2,25 (2Н, м., с-C4H8O); 2,80-2,95 (2Н, т., J=7,34, H3+NCH2CH2CH2CH2CH2CH2NH2+); 3,25 (2Н, с., CH2NH2+); 3,45-3,55 (2Н, м., с-C4H8O); 3,80-3,90 (4Н, м., с-C4H8O, H3+NCH2CH2CH2CH2CH2CH2NH2+); 6,62 (2Н, с., HO2CCH=CHCO2H); 7,25-7,60 (5Н, м., Ph); Спектр ЯМР13С (D2O), δ, м. д.: 23,8 (H2+NCH2CH2CH2CH2CH2CH2NH3+); 25,2 (H2+NCH2-CH2CH2CH2CH2CH2NH3+); 26,4 (H2+NCH2CH2CH2CH2CH2CH2NH3+); 32,8 (С-2, 5, c-C4H8O); 33,7 (С-1, с-C4H8O); 39,3 (H2+NCH2CH2CH2CH2-CH2CH2NH3+); 48,4 (H2+NCH2CH2-CH2CH2CH2CH2NH3+); 51,9 (CH2NH2+); 63,2 (С-3, 4 с-C4H8O); 127,4 (С-2, 6, Ph); 128,1 (С-4, Ph); 128,7 (С-3,5, Ph); 134,8 (HO2CCH=CHCO2H); 139,0 (С-1, Ph); 172,1 (HO2CCH=CHCO2H).
Пример 67. Синтез 6-амино-N-(4-фенилтетрагидро-2H-пиран-4-ил)-гексанамид сукцианата

К раствору N1-((4-фенилтетрагидро-2H-пиран-4-ил)метил)-гексан-1,6-диамин дигидрохлорида (0,1 г, 0,3 ммоль), полученного по примеру 65, в воде (4 мл) добавляют КОН (0,56 г, 10 ммоль). Экстрагируют диэтиловым эфиром (3×10 мл). Экстракт промывают насыщенным раствором NaCl (2×5 мл), сушат над К2СО3, фильтруют. Маточник упаривают до объема 10 мл, прибавляют раствор янтарной кислоты в 15 мл эфира (35 мг, 0,3 ммоль). Осадок отделяют, кристаллизуют из смеси хлористый метилен : гексан 3:2, сушат в вакууме при температуре 50°С. Получают 6-амино-N-(4-фенилтетрагидро-2H-пиран-4-ил)гексанамид сукцинат в виде белого порошка, 20 г (18%). Спектр ЯМР1Н (D2O), δ, м. д. (J, Гц): 1,15-1,65 (8Н, м., Н3+NCH2CH2CH2CH2CH2-CH2NH2+); 1,85-1,95 (2Н, м., с-C4H8O); 2,30-2,40 (2Н, м., с-C4H8O); 2,48 (5,2Н, с., HO2CH2-CH2CO2H); 2,80-2,95 (2Н, т., J=7,58, H3+NCH2CH2CH2CH2CH2CH2NH2+); 3,26 (2Н, c., CH2NH2+); 3,45-3,55 (2Н, м., с-C4H8O); 3,80-3,90 (4Н, м., с-C4H8O, H3+NCH2CH2CH2CH2CH2-CH2NH2+); 7,25-7,60 (5Н, м., Ph); Спектр ЯМР13С (D2O), δ, м. д.: 24,4 (Н2+CH2CH2CH2CH2CH2CH2NH3+); 25,1 (H2+NCH2-CH2CH2CH2CH2CH2NH3+); 26,6 (H2+NCH2CH2CH2CH2CH2CH2NH3+); 31,6 (НО2ССН2СН2СО2Н); 32,8 (С-2, 5, с-C4H8O); 33,7 (С-1, с-C4H8O); 39,4 (H2+NCH2CH2CH2CH2-CH2CH2NH3+); 48,4 (H2+NCH2CH2-CH2CH2CH2CH2NH3+); 51,1 (CH2NH2+); 64,1 (С-3, 4 с-C4H8O); 126,6 (С-2, 6, Ph); 127,4 (С-4, Ph); 128,7 (С-3,5, Ph); 142,5 (С-1, Ph); 158,8 (НО2СН2СН2СО2Н).
Пример 68. Синтез 6-амино-N-(4-фенилтетрагидро-2H-пиран-4-ил)-гексанамид малеата

К раствору N1-((4-фенилтетрагидро-2H-пиран-4-ил)метил)-гексан-1,6-диамин дигидрохлорида (0,1 г, 0,3 ммоль), полученного по примеру 65, в воде (4 мл) добавляют КОН (0,56 г, 10 ммоль). Экстрагируют диэтиловым эфиром (3×10 мл). Экстракт промывают насыщенным раствором NaCl (2×5 мл), сушат над К2СО3, фильтруют. Фильтрат концентрируют до объема 10 мл, прибавляют раствор малеиновой кислоты в 15 мл диэтилового эфира (35 мг, 0,3 ммоль). Выпавшее масло отделяют, кристаллизуют из смеси хлористый метилен : гексан (10:1), сушат в вакууме при температуре 50°С Получают 6-амино-N-(4-фенилтетрагидро-2H-пиран-4-ил)гексанамид малеат в виде белого порошка, 20 мг (18%). Спектр ЯМР1Н (D2O), δ, м. д. (J, Гц): 1,15-1,35 (4Н, м., H3+NCH2CH2CH2CH2CH2-CH2NH2+); 1,45-1,65 (4Н, м., H3+NCH2CH2CH2CH2-CH2CH2NH2+); 1,85-1,95 (2Н, м., с-C4H8O); 2,30-2,40 (2Н, м., с-C4H8O); 2,80-2,95 (4Н, м., H3+NCH2CH2CH2CH2CH2CH2NH2+); 3,26 (2Н, с., CH2NH2+); 3,45-3,55 (2Н, м., с-C4H8O); 3,80-3,90 (2Н, м., с-C4H8O); 6,28 (3,4Н, с., HO2CCH=CHCO2H); 7,35-7,60 (5Н, м., Ph); Спектр ЯМР13С (D2O), δ, м. д.: 24,3 (Н2+CH2CH2CH2CH2CH2CH2NH3+); 25,1 (H2+NCH2-CH2CH2CH2CH2CH2NH3+); 26,4 (H2+NCH2CH2CH2CH2CH2CH2NH3+); 33,2 (С-2, 5, с-C4H8O); 33,7 (С-1, с-C4H8O); 39,3 (H2+NCH2CH2CH2CH2-CH2CH2NH3+); 48,4 (H2+NCH2CH2-CH2CH2CH2CH2NH3+); 58,2 (CH2NH2+); 63,5 (С-3, 4 с-C4H8O); 127,6 (С-2, 6, Ph); 128,1 (С-4, Ph); 129,6 (С-3,5, Ph); 134,4 (HO2CCH=CHCO2H); 139,0 (С-1, Ph); 171,0 (HO2CCH=CHCO2H).
Пример 69. Синтез 1-Фенилциклопентан-1-карбоксамид дигидрохлорида

В колбе с обратным холодильником, кипятят раствор 1-фенилциклопентилкарбонитрила (15 г, 0,088 моль), полученного по примеру 1, и серной кислоты (8,6 г, 0,088 моль) в трифторуксусной кислоте (20 мл) в течение 12. Смесь выливают в воду со льдом (100 мл), экстрагируют хлористым метиленом (3×80 мл), промывают водой (2×50 мл), насыщенным раствором NaHCO3 (2×50 мл), водой (2×50 мл) и насыщенным раствором NaCl (50 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 40°С. Остаток перекристаллизовывают из гексана (50 мл), фильтруют, промывают гексаном (2×10 мл), сушат в вакууме, при температуре 50°С. Получают 1-фенилциклопентан-1-карбоксамид в виде белого порошка, 9,97 г (60%). ЯМР1Н (DMSO-d6), δ, м. д. (J, Гц): 1,5-2,0 9 (6Н, м., с-С5Н8); 2,45-2,64 (2Н, м., с-С5Н8), 6,61 (2Н, уш. д., J=3, CONH2); 7,1-7,4 (5Н, м., Ph)
1-Фенилциклопентан-1-амин гидрохлорид.
В колбе, к раствору КОН (29,7 г, 0,53 моль) в воде (150 мл) при температуре (-) 14°С прикапывают бром (3,0 мл, 9,33 г, 0,0583 моль), прибавляют 1-фенилциклопентан-1-карбоксамид (10,0 г, 0,053 моль), перемешивают при 10°С 2 час. Экстрагируют эфиром (3×70 мл). Экстракт промывают водой (20 мл), упаривают в вакууме, при температуре 40°С, прибавляют 35% соляную кислоту (40 мл) и кипятят с обратным холодильником 1 час, упаривают в вакууме, при температуре 40°С. Получают 1-фенилциклопентан-1-амин гидрохлорид в виде белого порошка, 6,4 г (60%). ЯМР1Н (DMSO-d6), δ, м. д. (J, Гц): 1,5-2,0 9 (6Н, м., с-С5Н8); 2,45-2,64 (2Н, м., с-С5Н8); 7,1-7,4 (5Н, м., Ph); 8,55 (3Н, ш. с., NH3+).
2-(6-((1-Фенилциклопентил)амино)гексил)изоиндолин-1,3-дион гидрохлорид.
В колбе с обратным холодильником нагревают в течение 12 час при температуре 100°С раствор 1-фенилциклопентан-1-амин гидрохлорида (5 г, 0,025 моль) с 2-(6-бромгексил)изоиндолин-1,3-дионом (7,75 г, 0,025 моль и К2СО3 (6,9 г, 0,05 моль) в диметилформамиде (80 мл), разбавляют водой (200 мл), экстрагируют этилацетатом (3×80 мл). Экстракт промывают водой (2×50 мл), упаривают в вакууме при температуре 40°С, прибавляют соляную кислоту (5,2 г, 0,05 моль), упаривают в вакууме. Остаток кристаллизуют из смеси ацетон : диэтиловый эфир (10:3), фильтруют, промывают ацетоном, сушат в вакууме при температуре 50°С. Получают 2-(6-((1-фенилциклопентил)амино)гексил)изоиндолин-1,3-дион гидрохлорид в виде белого порошка, 9,3 г (42%). Спектр ЯМР1Н (DMSO-d6), δ, м. д. (J, Гц): 0,95-1,40 (4Н, м., PhthNCH2CH2CH2CH2CH2CH2NH2+); 1,45-1,65 (6Н, м., с-С5Н8); 1,7-1,95 (2Н, м., PhthNCH2CH2CH2CH2CH2CH2NH2+), 2,3-2,5 (6Н, м., с-С5Н8 и PhthNCH2CH2CH2CH2CH2CH2NH2+); 3,55 (2Н, т., J=7,8, PhthNCH2CH2CH2CH2CH2CH2NH2+), 7,3-7,5 (3Н, м., Ph); 7,6-7,7 (2Н, м., Ph); 7,8-7,95 (4Н, м., PhthNCH2CH2CH2CH2CH2CH2NH2+); 9,52 (2Н, ш. с., PhthNCH2CH2CH2CH2CH2CH2NH2+).
N1-(1-Фенилциклопентил)гексан-1,6-диамин дигидрохлорид.
В колбе с обратным холодильником кипятят суспензию 2-(6-((1-фенилциклопентил)амино)гексил)изоиндолин-1,3-дион гидрохлорида (6,0 г, 0,014 моль) с гидразин гидратом (0,78 г, 0,016 моль) в пропан-2-оле (30 мл) в течение 2 час, прибавляют 35% соляную кислоту (5 мл) и воду (45 мл), кипятят 1 час. Смесь охлаждают, фильтруют, промывают водой (3×30 мл). Фильтрат упаривают в вакууме, при температуре 40°С. Остаток кипятят в ацетоне (100 мл) в течение 30 мин, фильтруют, промывают ацетоном (2×20 мл), сушат в вакууме при температуре 50°С. Получают N1-(1-фенилциклопентил)гексан-1,6-диамин дигидрохлорид в виде белого порошка, 3,9 г (84%). Спектр ЯМР1Н (DMSO-d6), δ, м. д. (J, Гц): 0,95-1,40 (4Н, м., H3+NCH2CH2CH2CH2CH2CH2NH2+); 1,45-1,65 (6Н, м., с-С5Н8); 1.7-1,95 (2Н, м., H3+NCH2CH2CH2CH2CH2CH2NH2+), 2,3-2,5 (6Н, м., с-С5Н8 и H3+NCH2CH2CH2CH2CH2CH2NH2+); 2,65-2,75 (2Н, м., H3+NCH2CH2CH2CH2CH2CH2NH2+), 7,3-7,5 (3Н, м., Ph); 7,6-7,7 (2Н, м., Ph); 8,21 (3Н, м., H3+NCH2CH2CH2CH2CH2CH2NH2+); 9,57 (2Н, ш. c., H3+NCH2CH2CH2CH2CH2CH2NH2+). Спектр ЯМР13С (DMSO-d6), δ, м. д.: 22,4 (С-3,4, с-С5Н8); 23,7 (H2+NCH2CH2CH2CH2CH2CH2NH3+); 24,1 (H2+NCH2CH2CH2CH2CH2CH2NH3+); 26,1 (Н2+NCH2CH2CH2CH2CH2CH2NH3+); 31,5 (H2+NCH2 CH2CH2CH2CH2CH2NH3+); 37,2 (C-2,5, c-C5H8); 40,8 (H2+NCH2CH2CH2CH2CH2CH2NH3+); 43,4 (Н2+NCH2CH2CH2CH2CH2CH2NH3+); 66,2 (C-1, c-C5H8); 124,8 (C-4, Ph); 128,5 (C-3,5, Ph); 129,8 (C-2,6, Ph); 134,2 (C-1, Ph).
Пример 70. Синтез N1-(4-фенилтетрагидро-2Н-пиран-4-ил)гексан-1,6-диамин дигидрохлорида

В колбе с обратным холодильником нагревают раствор 4-фенилтетрагидро-2H-пиран-4-амина гидрохлорида (5,34 г, 0,025 моль), полученного по примеру 40, с 2-(6-бромгексил)изоиндолин-1,3-дионом (7,75 г, 0,025 моль) и K2CO3 (6,9 г, 0,05 моль) в диметилформамиде (40 мл) в течение 12 час при температуре 100°С, разбавляют водой (100 мл), экстрагируют этилацетатом (3×40 мл). Экстракт промывают водой (2×25 мл), упаривают в вакууме, при температуре 40°С, прибавляют соляную кислоту (2,1 г, 0,025 моль), упаривают в вакууме. Остаток кристаллизуют из смеси ацетон : диэтиловый эфир (5:2), фильтруют, сушат в вакууме при температуре 50°С. Получают 2-(6-((4-фенилтетрагидро-2H-пиран-4-ил)амино)гексил)изоиндолин-1,3-дион гидрохлорид в виде порошка, 5,44 г (49%). Спектр ЯМР1Н (DMSO-d6), δ, м. д. (J, Гц): 0,93-1,31 (4Н, м., PhthNCH2CH2CH2CH2CH2CH2NH2+); 1,33-1,75 (4H, м., PhthNCH2CH2CH2CH2CH2CH2NH2+); 2,25-2,45 (4Н, м., с-C4H8O); 2,52-2,81 (2Н, м., с-C4H8O); 3,12 (2Н, т., J=8,5, PhthNCH2CH2CH2CH2CH2CH2NH2+); 3,53 (2Н, т., J=7,4, PhthNCH2CH2CH2CH2CH2CH2NH2+), 3,81-3,95 (2Н, м., с-C4H8O); 7,31-7,52 (3Н, м., Ph); 7,61м, 7,73 (2Н, м., Ph); 7,82-7,95 (4Н, м., PhthNCH2CH2CH2CH2CH2CH2NH2+); 9,52 (2Н, ш. с., PhthNCH2CH2CH2CH2CH2CH2NH2+).
N1-(4-фенилтетрагидро-2Н-пиран-4-ил)гексан-1,6-диамин дигидрохлорид.
В колбе с обратным холодильником кипятят суспензию 2-(6-((4-фенилтетрагидро-2H-пиран-4-ил)амино)гексил)изоиндолин-1,3-дион гидрохлорида (5,0 г, 0,0113 моль) с гидразин гидратом (0,73 г, 0,0147 моль) в пропан-2-оле (20 мл) в течении 2 час, прибавляют 35% соляную кислоту (3 мл) и воду (25 мл), кипятят 1 час. Смесь охлаждают, фильтруют, промывают на фильтре водой (3×25 мл). Фильтрат и промывные жидкости объединяют, упаривают в вакууме, при температуре 40°С. Остаток кипятят в ацетоне (50 мл) в течении 30 мин, фильтруют, промывают на фильтре ацетоном (2×10 мл), сушат в вакууме при температуре 50°С. Получают N1-(4-фенилтетрагидро-2H-пиран-4-ил)гексан-1,6-диамин дигидрохлорид в виде белого порошка, 2,40 г (61%). Спектр ЯМР1Н (DMSO-d6), δ, м. д. (J, Гц): 0,94-1,35 (4Н, м., PhthNCH2CH2CH2CH2CH2CH2NH2+); 1,36-1,75 (4Н, м., PhthNCH2CH2CH2CH2CH2CH2NH2+); 2,24-2,45 (4Н, м., с-C4H8O); 2,51-2,81 (4Н, м., с-C4H8O и H3+NCH2CH2CH2CH2CH2CH2NH2+); 3,15 (2Н, т., J=8,5, H3+NCH2CH2CH2CH2CH2CH2NH2+); 3,83-4,05 (2Н, м., с-C4H8O); 7,30-7,75 (5Н, м., Ph); 8,21 (3Н, ш. с., H3+NCH2CH2CH2CH2CH2CH2NH2+); 9,73 (2Н, ш. с., H3+NCH2CH2CH2CH2CH2CH2NH2+).
Пример 71. Синтез N-(2-аминоэтил)пальмитамид гидрохлорида
CH3-(CH2)14-C(O)-NH-CH2-CH2-NH2⋅HCI
Смесь 31,2 г бутилового эфира пальмитиновой кислоты, 36 мл этилендиамина и 0,5 г хлористого аммония кипятят 14 часов. Смесь охлаждают, взбалтывают с 70 мл гексана, фильтруют, промывают гексаном, изопропанолом, осадок на фильтре кипятят со 100 мл изопропанола, горячий раствор фильтруют, выпавший из фильтрата осадок основания (2-аминоэтиламид пальмитиновой кислоты) еще раз кристаллизуют из изопропанола и переводят в HCI-соль путем добавления 35% HCI (4 мл) к раствору основания в изопропаноле. Полученную HCI-соль кристаллизуют из изопропанола. Выход хлоргидрата 2-аминоэтиламида пальмитиновой кислоты 4,6 г (14% в расчете на исходный бутиловый эфир пальмитиновой кислоты), т.пл. 138-140°С (лит. данные: т.пл. 141°С. Naudet М., et al., Bull. Soc. Chim. Fr., 1954, 1167-1172.). Найдено, %: С 64,65, H 11,17, N 8,22. C18H39ClN2O. Вычислено, %: С 64.40, Н 11.62, N 8.31. 1Н NMR (DMSO-d6) 8.18 (bs, 3Н, NH2HCl); 8.06 (m, 1Н, CONH); 3.32 (m, 2H, CH2N); 2.86 (t, 2H, CH2N); 2.08 (t, 2H, CH2CO); 1.50 (m, 2H, CH2); 1.23 (m, 24H, 12 CH2); 0.87 (t, 3Н, CH3).
Пример 72. Синтез 5-Амино-1-(1-фенилциклогексил)пентан-1-он гидрохлорида

Получение ((4-Бромпропокси)метил)бензола. При интенсивном перемешивании прибавляют к раствору гидроксида натрия (20 г, 0,5 моль) и триэтилбензил бромида (1 г) в 20 мл воды, бензиновый спирт (10,8 г, 0,1 моль) и 1,3-дибромпропан (44 г, 0,22 моль) в 20 мл дихлорметана одной порцией, перемешивают 2 часа, органический слой оделяют, и промывают водой (3×50 мл), сушат Na2SO4, фильтруют и упаривают в вакууме. Остаток фракционируют в вакууме, собирают фракцию кипящую при 75-80°С при 5 мм.Hg ст. Получают ((4-бромпропокси)метил)бензол 17,5 г (60%). Спектр ЯМР1Н (CDCl3), δ, м. д. (J, Гц): 1,89 (2Н, м., CH2CH2CH2Br); 3,25 (2Н, т., J=7,75, CH2CH2CH2Br); 3,51 (2Н, т., J=7,85, CH2CH2CH2Br); 4,81 (2Н, с., PhCH2O); 7,5 (5Н, м., Ph).
Получение 5-(Бензилокси)-1-(1-фенилциклогексил)пентан-1-она. К раствору диэтиламина (1,61 г, 22 ммоль) в 15 мл тетрагидрофурана при -70°С прибавляют 2,5М раствор н-бутиллития (8,8 мл, 22 ммоль), перемешивают 20 мин., а затем добавляют 1-(1-фенилциклогексил)этан-1-он (3,78 г, 20 ммоль), полученный по примеру 2 в 15 мл гексаметиленфосфоратриамида, перемешивают при -70°С 2 часа и прибавляют ((3-бромпропокси)метил)бензол (5,66 г, 22 ммоль) и оставляют перемешиваться еще 2 часа, после этого убирают охлаждение и оставляют перемешиваться при комнатной температуре еще на 10 часов. Реакционную смесь выливают в 100 мл воды и экстрагируют бензолом (3×30 мл), органическую фазу промывают 1М ростовом соляной кислоты (3×20 мл), водой (20 мл), насыщенным раствором хлорида натрия (3×20 мл), сушат Na2SO4, фильтруют и упаривают. Остаток хроматографируют (сорбентсиликагель 40-63 мкм, элюент - смесь гептан : этилацетат (10:3)), фракции содержащие продукт объединяют и упаривают. Получают 5-(бензилокси)-1-(1-фенилциклогексил)пентан-1-он 3,8 г (52%), в виде масла. Спектр ЯМР1Н (CDCl3), δ, м. д. (J, Гц): 1,43-1,55 (10Н, м., с-С6Н10, -СОСН2СН2СН2СН2-); 1,87 (2Н, м., с-С6Н10); 2,10 (2Н, м., с-С6Н10); 2,41 (2Н, т., J=8,15, -СОСН2СН2СН2СН2-); 3,45 (2Н, т., J=7,15, -СОСН2СН2СН2СН2-); 4,82 (2Н, с., CH2OPh); 7,10-7,40 (10Н, м., Ph, CH2OPh);
Получение 5-Бром-1-(1-фенилциклогексил)пентан-1-она. 5-(Бензилокси)-1-(1-фенилциклогексил)пентан-1-он (2,2 г, 6,3 ммоль) кипятят с интенсивным перемешиванием и отгонкой образующегося бензилбромида в 48% бромоводородной кислоте 20 мл 2 часа. После этого реакционную смесь разбавляют водой 50 мл, и экстрагируют бензолом (3×20 мл), сушат Na2SO4, фильтруют и упаривают. Остаток 5-бром-1-(1-фенилциклогексил)пентан-1-он 1,4 г (68%), в виде желтоватого масла используют в следующей стадии без анализа.
Получение 2-(5-Оксо-5-(1-фенилциклогексил)пентил)изоиндолин-1,3-диона. Нагревают при 80°С 5-бром-1-(1-фенилциклогексил)пентан-1-он (1,4 г, 4,3 ммоль) с фталимидом калия (0,8 г, 4,3 ммоль) в 10 мл диметилформамида 10 часов. Реакционную смесь разбавляют водой 50 мл и экстрагируют этилацетатом (3×20 мл),промывают водой (3×20 мл), сушат Na2SO4, фильтруют и упаривают. Получают 2-(5-оксо-5-(1-фенилциклогексил)пентил)изоиндолин-1,3-дион. 1,43 г (88%) в виде кристаллизующегося масла. Спектр ЯМР1Н (CDCl3), δ, м. д. (J, Гц): 1,43-1,55 (10Н, м., с-С6Н10, -COCH2CH2CH2CH2-); 1,86 (2Н, м., с-С6Н10); 2,15 (2Н, м., с-С6Н10); 2,45 (2Н, т., J=7,88, -СОСН2СН2СН2СН2-); 3,58 (2Н, т., J=7,65, -СОСН2СН2СН2СН2-); 7,10-7,40 (5Н, м., Ph); 7,78 (4Н, м., Phth).
Получение 5-Амино-1-(1-фенилциклогексил)пентан-1-он гидрохлорида. Кипятят с обратным холодильником 2-(5-оксо-5-(1-фенилциклогексил)пентил)изоиндолин-1,3-дион (1,43 г, 3,67 ммоль) в смеси 6 мл уксусной кислоты с 2 мл 48% бромоводородной кислоты 10 часов. После этого реакционную смесь упаривают в вакууме, растворяют в 50 мл дихлорметана, и промывают водой, 10% раствором NaHCO3, водой, сушат Na2SO4, фильтруют и упаривают в вакууме. Остаток хроматографируют (сорбент силикагель 40-63 мкм, элюент - смесь дихлорметана : 2-пропанола (2:1)), фракции содержащие продукт объединяют и упаривают с добавлением 2 мл концентрированной соляной кислоты. Остаток растворяют в воде 5 мл, фильтруют, замораживают и лиофилизуют. Получают, 5-амино-1-(1-фенилциклогексил)пентан-1-он гидрохлорид 0,46 г (45%). Спектр ЯМР1Н (CD3OD), δ, м. д. (J, Гц): 1,20-1,70 (10Н, м., с-С6Н10); 1,88 (2Н, м., COCH2CH2CH2CH2NH3+); 2,10-2,50 (4Н, м., с-С6Н10); 2,60-2,72 (2Н, м., COCH2CH2CH2CH2NH3+); 2,65 (2Н, д.т., J=7,25, 15,50, ,COCH2CH2CH2CH2NH3+); 7,20-7,40 (5Н, м., Ph). Спектр ЯМР13С (CD3OD), δ, м. д.: 20,5; 21,7; 27,1; 27,4; 34,6; 37,3; 40,5; 53,7; 129,6; 130,1; 130,9; 143,8; 213,4.
Пример 73. Синтез 5-Амино-1-(1-фенилциклопентил)октан-1-он гидрохлорида

Получение ((6-Бромгексокси)метил)бензола. При интенсивном перемешивании прибавляют к раствору гидроксида натрия (20 г, 0,5 моль) и триэтилбензил бромида (1 г) в 20 мл воды, бензиловый спирт (5,4 г, 0,05 моль) и 1,6-дибромгексан (48,8 г, 0,2 моль) в 20 мл дихлорметана одной порцией, перемешивают 2 часа, органический слой оделяют, и промывают водой (3×50 мл), сушат Na2SO4, фильтруют и упаривают в вакууме. Остаток фракционируют в вакууме, собирают фракцию кипящую при 150-155°С при 2 мм.Hg ст. Получают ((6-бромгексокси)метил)бензол 10,1 г (74%). Спектр ЯМР1Н (CDCl3), δ, м. д. (J, Гц): 1,20-1,55 (6Н, м, OCH2CH2CH2CH2CH2CH2Br); 1,81 (2Н, м., OCH2CH2CH2CH2CH2CH2Br); 3,21 (2Н, т., J=7,65, OCH2CH2CH2CH2CH2CH2Br); 3,54 (2Н, т., J=7,75, OCH2CH2CH2CH2CH2CH2Br); 4,82 (2Н, с., PhCH2O); 7,5 (5Н, м., Ph).
5-(Бензилокси)-1-(1-фенилциклопентил)октан-1-он. К раствору диэтиламина (1,61 г, 22 ммоль) в 15 мл тетрагидрофурана при (-)70°С прибавляют 2,5М раствор н-бутиллития(8,8 мл, 22 ммоль), перемешивают 20 мин., а затем добавляют 1-(1-фенилциклопентил)этан-1-он (3,78 г, 20 ммоль), полученный по примеру 2 в 15 мл гексаметиленфосфоратриамида, перемешивают при(-)70°С 2 часа и прибавляют ((6-бромгексокси)метил)бензол (5,96 г, 22 ммоль) и оставляют перемешиваться еще 2 часа, после этого убирают охлаждение и оставляют перемешиваться при комнатной температуре еще на 10 часов. Реакционную смесь выливают в 100 мл воды и экстрагируют бензолом (3×30 мл), органическую фазу промывают 1М ростовом соляной кислоты (3×20 мл), водой (20 мл), насыщенным раствором хлорида натрия (3×20 мл), сушат Na2SO4, фильтруют и упаривают. Остаток хроматографируют (сорбент силикагель 40-63 мкм, элюент - смесь гептан : этилацетат (10:3)), фракции содержащие продукт объединяют и упаривают. Получают 5-(бензилокси)-1-(1-фенилциклопентил)октан-1-он 3,3 г (45%), в виде масла. Спектр ЯМР1Н (CDCl3), δ, м. д. (J, Гц): 1,40-1,55 (14Н, м., с-С5Н8, -COCH2CH2CH2CH2CH2CH2CH2-); 195 (2Н, м., с-С5Н8); 2,15 (2Н, м., с-С5Н8); 2,40 (2Н, т., J=7,55, -СОСН2СН2СН2СН2СН2СН2СН2-); 3,44 (2Н, т., J=7,48, -COCH2CH2CH2CH2CH2CH2CH2-); 4,83 (2Н, с., CH2OPh); 7,10-7,40 (10Н, м., CH2OPh,Ph).
Получение 5-Бром-1-(1-фенилциклопентил)октан-1-она. 5-(Бензилокси)-1-(1-фенилциклопентил)октан-1-он (3,0 г, 7,9 ммоль) кипятят с интенсивным перемешиванием и отгонкой образующегося бензилбромида в 48% бромоводородной кислоте 20 мл 2 часа. После этого реакционную смесь разбавляют водой 50 мл, и экстрагируют бензолом (3×20 мл), сушат Na2SO4, фильтруют и упаривают. Остаток 5-бром-1-(1-фенилциклопентил)октан-1-он 1,6 г (55%), в виде желтоватого масла используют в следующей стадии без анализа
Получение 2-(5-Оксо-5-(1-фенилциклопентил)октил)изоиндолин-1,3-диона. Нагревают при 80°С 5-бром-1-(1-фенилциклопентил)октан-1-он (1,6 г, 4,3 ммоль) с фталимидом калия (0,8 г, 4,3 ммоль) в 10 мл диметилформамида 10 часов. Реакционную смесь разбавляют водой 50 мл и экстрагируют этил ацетатом (3×20 мл), промывают водой (3×20 мл), сушат Na2SO4, фильтруют и упаривают. Получают 2-(5-оксо-5-(1-фенилциклопентил)октил)изоиндолин-1,3-дион. 1,26 г (70%) в виде кристаллизующегося масла. Спектр ЯМР1Н (CDCl3), δ, м. д. (J, Гц): 1,30-1,55 (14Н, м, с-С5Н8, -COCH2CH2CH2CH2CH2CH2CH2-); 1,89 (2Н, м., c-С5Н8); 2,17 (2Н, м., с-С5Н8); 2,40 (2Н, т., J=7,25, -СОСН2СН2СН2СН2СН2СН2СН2-); 3,57 (2Н, т., J=7,66, -COCH2CH2CH2CH2CH2CH2CH2-); 7,10-7,40 (5Н, м., Ph); 7,78 (4Н, м., Phth).
Получение 5-Амино-1-(1-фенилциклопентил)октан-1-он гидрохлорид. Кипятят с обратным холодильником 2-(5-оксо-5-(1-фенилциклопентил)октил)изоиндолин-1,3-дион (1,2 г, 2,97 ммоль) в смеси 6 мл уксусной кислоты с 2 мл 48% бромоводородной кислоты 10 часов. После этого реакционную смесь упаривают в вакууме, растворяют в 50 мл дихлорметана, и промывают водой, 10% раствором NaHCO3, водой, сушат Na2SO4, фильтруют и упаривают в вакууме. Остаток хроматографируют (сорбент силикагель 40-63 мкм, элюент - смесь дихлорметана : 2-пропанола (2:1)), фракции содержащие продукт объединяют и упаривают с добавлением 2 мл концентрированной соляной кислоты. Остаток растворяют в воде 5 мл, фильтруют, замораживают и лиофилизуют. Получают, 5-амино-1-(1-фенилциклопентил)октан-1-он гидрохлорид 0,44 г (48%). Спектр ЯМР1Н (CD3OD), δ, м. д. (J, Гц): 1,05 (2Н, м., COCH2CH2CH2CH2CH2CH2CH2NH3+); 1,22 (2H, м., с-С5Н8); 1,26 (2Н, м., с-С5Н8); 1,38 (2Н, м., с-С5Н8); 1,50-1,80 (8Н, м., с-С5Н8, COCH2CH2CH2CH2CH2CH2CH2NH3+); 1,92 (2Н, м., COCH2CH2CH2CH2CH2CH2CH2NH3+); 2,30 (2Н, т., J=8,15, COCH2CH2CH2CH2CH2CH2CH2NH3+); 2,50 (2H, м., COCH2CH2CH2CH2CH2CH2CH2NH3+); 2,86 (2H, т., J=7,45, COCH2CH2CH2CH2CH2CH2CH2NH3+); 7,20-7,40 (5Н, м., Ph). Спектр ЯМР13С (CD3OD), δ, м. д.: 24,7; 24,8; 27,5; 28,6; 29,3; 29,7; 29,9; 35,5; 38,2; 40,9; 66,9; 128,1; 128,3; 129,9; 144,2; 213,7.
Пример 74. Синтез 5-Амино-1-(1-фенилциклопентил)гептан-1-он гидрохлорида
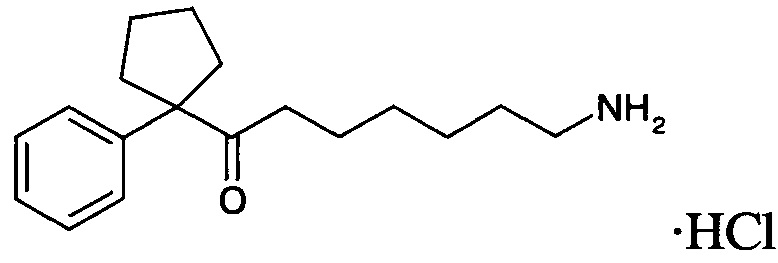
Получение ((5-Бромпентокси)метил)бензола. При интенсивном перемешивании прибавляют к раствору гидроксида натрия (20 г, 0,5 моль) и триэтилбензил бромида (1 г) в 20 мл воды, бензиновый спирт (10,8 г, 0,1 моль) и 1,5-дибромпентан (50 г, 0,22 моль) в 20 мл дихлорметана одной порцией, перемешивают 2 часа, органический слой оделяют, и промывают водой (3×50 мл), сушат Na2SO4, фильтруют и упаривают в вакууме. Остаток фракционируют в вакууме, собирают фракцию кипящую при 150-155°С при 2 мм.Hg ст. Получают ((5-бромпентокси)метил)бензол 17,5 г (68%). Спектр ЯМР1Н (CDCl3), δ, м. д. (J, Гц): 1,27 (2Н, м, OCH2CH2CH2CH2CH2Br); 1,50 (2Н, м, OCH2CH2CH2CH2CH2Br); 1,81 (2Н, м, OCH2CH2CH2CH2CH2Br); 3,27 (2Н, т., J=7,45, OCH2CH2CH2CH2CH2Br); 3,55 (2Н, т., J=7,25, OCH2CH2CH2CH2CH2Br); 4,85 (2Н, с., PhCH2O); 7,50 (5Н, м., Ph).
Получение 5-(Бензилокси)-1-(1-фенилциклопентил)гептан-1-она. К раствору диэтиламина (1,61 г, 22 ммоль) в 15 мл тетрагидрофурана при (-)70°С прибавляют 2,5М раствор н-бутиллития (8,8 мл, 22 ммоль), перемешивают 20 мин., а затем добавляют 1-(1-фенилциклопентил)этан-1-он (3,78 г, 20 ммоль), полученный по примеру 2 в 15 мл гексаметиленфосфоратриамида, перемешивают при (-)70°С 2 часа и прибавляют ((5-бромпентокси)метил)бензол (5,66 г, 22 ммоль) и оставляют перемешиваться еще 2 часа, после этого убирают охлаждение и оставляют перемешиваться при комнатной температуре еще на 10 часов. Реакционную смесь выливают в 100 мл воды и экстрагируют бензолом (3×30 мл), органическую фазу промывают 1М ростовом соляной кислоты (3×20 мл), водой (20 мл), насыщенным раствором хлорида натрия (3×20 мл), сушат Na2SO4, фильтруют и упаривают. Остаток хроматографируют (сорбент силикагель 40-63 мкм, элюент - смесь гептан : этилацетат (10:3)), фракции содержащие продукт объединяют и упаривают. Получают 5-(бензилокси)-1-(1-фенилциклопентил)гептан-1-он 2,3 г (31%), в виде масла. Спектр ЯМР1Н (CDCl3), δ, м. д. (J, Гц): 1,40-1,55 (12Н, м., с-С5Н8, -COCH2CH2CH2CH2CH2CH2-); 1,83 (2Н, м., с-С5Н8); 2,05 (2Н, м., с-С5Н8); 2,44 (2Н, т., J=7,67, -СОСН2СН2СН2СН2СН2СН2-); 3,46 (2Н, т., J=7,89, -COCH2CH2CH2CH2CH2CH2-); 4,84 (2Н, с., CH2OPh); 7,10-7,40 (10Н, м., Ph, CH2OPh).
Получение 5-Бром-1-(1-фенилциклопентил)гептан-1-она. 5-(Бензилокси)-1-(1-фенилциклопентил)гептан-1-он (2,3 г, 6,3 ммоль) кипятят с интенсивным перемешиванием и отгонкой образующегося бензил бромида в 48% бромоводородной кислоте 20 мл 2 часа. После этого реакционную смесь разбавляют водой 50 мл, и экстрагируют бензолом (3×20 мл), сушат Na2SO4, фильтруют и упаривают. Остаток 5-бром-1-(1-фенилциклопентил)гептан-1-он 1,6 г (75%), в виде желтоватого масла используют в следующей стадии без анализа
Получение 2-(5-Оксо-5-(1-фенилциклопентил)гептил)изоиндолин-1,3-диона. Нагревают при 80°С 5-бром-1-(1-фенилциклопентил)гептан-1-он (1,6 г, 4,3 ммоль) с фталимидом калия (0,8 г, 4,3 ммоль) в 10 мл диметилформамида 10 часов. Реакционную смесь разбавляют водой 50 мл и экстрагируют этил ацетатом (3×20 мл),промывают водой (3×20 мл), сушат Na2SO4, фильтруют и упаривают. Получают 2-(5-оксо-5-(1-фенилциклопентил)гептил)изоиндолин-1,3-дион. 1,35 г(78%) в виде кристаллизующегося масла. Спектр ЯМР1Н (CDCl3), δ, м. д. (J, Гц): 1,33 (4Н, м., -COCH2CH2CH2CH2CH2CH2-); 1,43-1,66 (8Н, м., с-С5Н8, -COCH2CH2CH2CH2CH2CH2-); 1,86 (2Н, м., с-С5Н8); 2,15 (2Н, м., с-С5Н8); 2,47 (2Н, т., J=7,89, -СОСН2СН2СН2СН2СН2СН2-); 3,55 (2Н, т., J=7,45, СОСН2СН2СН2СН2СН2СН2-); 7,10-7,40 (5Н, м., Ph); 7,78 (4Н, м., Phth).
Получение 5-Амино-1-(1-фенилциклопентил)гептан-1-он гидрохлорида. Кипятят с обратным холодильником 2-(5-оксо-5-(1-фенилциклопентил)гептил)изоиндолин-1,3-дион (1,0 г, 2,48 ммоль) в смеси 6 мл уксусной кислоты с 2 мл 48% бромоводородной кислоты 10 часов. После этого реакционную смесь упаривают в вакууме, растворяют в 50 мл дихлорметана, и промывают водой, 10% раствором NaHCO3, водой, сушат Na2SO4, фильтруют и упаривают в вакууме. Остаток хроматографируют (сорбент силикагель 40-63 мкм, элюент - смесь дихлорметана : 2-пропанола (2:1)), фракции содержащие продукт объединяют и упаривают с добавлением 2 мл концентрированной соляной кислоты. Остаток растворяют в воде 5 мл, фильтруют, замораживают и лиофилизуют. Получают, 5-амино-1-(1-фенилциклопентил)гептан-1-он гидрохлорид 0,27 г (35%). Спектр ЯМР1Н (CD3OD), δ, м. д. (J, Гц): 1,06 (2Н, м., COCH2CH2CH2CH2CH2CH2NH3+); 1,18 (2Н, м., с-С5Н8); 1,40 (2Н, м., COCH2CH2CH2CH2CH2CH2NH3+); 1,50-1,75 (6Н, м., с-С5Н8, COCH2CH2CH2CH2CH2CH2NH3+); 1,90 (2Н, м., COCH2CH2CH2CH2CH2CH2NH3+); 2,32 (2Н, т., J=7,33, COCH2CH2CH2CH2CH2CH2NH3+); 2,51 (2Н, м., с-С5Н8); 2,82 (2Н, т., J=7,25, COCH2CH2CH2CH2CH2CH2NH3+); 7,20-7,40 (5Н, м., Ph). Спектр ЯМР13С (CD3OD), δ, м. д.: 24,7; 25,2; 26,3; 27,4; 28,3; 29,5; 35,5; 38,1; 40,8; 66,9; 128,1; 128,3; 129,9; 144,2; 213,5.
Пример 75. Синтез 5-(Диэтиламино)-1-(1-фенилциклопентил)гептан-1-он гидрохлорида
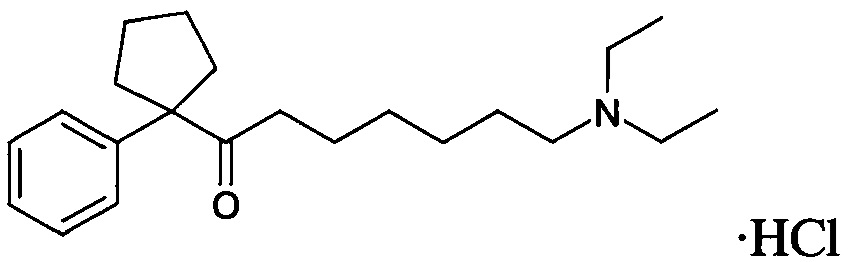
Получение 5-(Диэтиламино)-1-(1-фенилциююпентил)гептан-1-он гидрохлорида. Перемешивают при комнатной температуре смесь 5-бром-1-(1-фенилциклопентил)гептан-1-он (0,5 г, 1,48 ммоль) в смеси 5 мл диэтиламина 10 часов. После этого реакционную смесь упаривают в вакууме, растворяют в 50 мл дихлорметана, и промывают водой, 10% раствором NaHCO3, водой, сушат Na2SO4, фильтруют и упаривают в вакууме. Остаток хроматографируют (сорбент силикагель 40-63 мкм, элюент - смесь дихлорметана : 2-пропанола (2:1)), фракции содержащие продукт объединяют и упаривают с добавлением 2 мл концентрированной соляной кислоты. Остаток растворяют в воде 5 мл, фильтруют, замораживают и лиофилизуют. Получают, 5-(диэтиламино)-1-(1-фенилциклопентил)гептан-1-он гидрохлорид 0,38 г (70%). Спектр ЯМР1Н (CD3OD), δ, м. д. (J, Гц): 0,95-1,20 (4Н, м., с-C5H8, COCH2CH2CH2CH2CH2CH2NH3+); 1,30 (6Н, т., J=7,25, CH3CH2N); 1,35-2,00 (10Н, м., с-С5Н8, COCH2CH2CH2CH2CH2CH2NH3+); 2,33 (2Н, м., COCH2CH2CH2CH2CH2CH2NH3+); 2,51 (2Н, м., COCH2CH2CH2CH2CH2CH2NH3+); 3,00 (2Н, м., COCH2CH2CH2CH2CH2CH2NH3+); 3,19 (4Н, кв., J=7,25, CH3CH2N); 7,20-7,40 (5Н, м., Ph). Спектр ЯМР13С (CD3OD), δ, м. д.: 9,4; 24,6; 24,7; 24,8; 27,3; 29,4; 35,5; 38,0; 48,6; 53,1; 66,9; 128,1; 128,3; 129,9; 144,2; 213,5.
Пример 76. Синтез (S)-2-Амино-5-гуанидино-N-((1-фенилциклопентил) метил)пентанамиддигидрохлорида

Получение трет-Бутил (S)-(5-(3-нитрогуанидино)-1-оксо-1-(((1-фенилцикло-пентил)метил)амино)пент-2-ил)карбомата. К раствору N2-трет-бутоксикарбонил)-Nω-нитро-L-аргенина (1,51 г, 4,72 ммоль), 1-(1-фенилциклопентил)метанамин гидрохлорида (1,00 г, 4,72 ммоль), полученного по примеру 38 и триэтиламина (0,48 г, 4,72 ммоль) в 30 мл диметилформамида, охлажденному до температуры (-)5°С, прибавляют дициклогексилкарбодиимид (0,97 г, 4,72 ммоль), перемешивают 40 мин при (-)5°С, и оставляют перемешиваться при комнатной температуре 24 часа. Выпавший осадок дициклогексилмочевины отфильтровывают, маточный раствор выливают в 200 мл воды, выпавший осадок фильтруют, промывают на фильтре водой (3×50 мл), этилацетатом (3×50 мл), хлористым метиленом (3×50 мл), сушат при 100°С. Получают трет-бутил (S)-(5-(3-нитрогуанидино)-1-оксо-1-(((1-фенилциклопентил)-метил)амино)пент-2-ил)карбомат в виде белого порошка, 1,60 г (71%). Спектр ЯМР1H (DMSO-d6), δ, м. д. (J, Гц): 1,10-2,00 (23Н, м., HNCH2CH2CH2CH(NH)CONH, с-С5Н8, t-Bu); 3,11 (2Н, м., CH2N); 3,85 (1Н, м., HNCH2CH2CH2CH(NH)CONH); 6,78 (1Н, д., J=8,07., HNCH2CH2CH2CH(NH)CONH)); 7,10-7,30 (6Н, Ph, HNCH2CH2CH2CH2CH(NH)CONH); 7,5-8,5 (3Н, ш.с., NO2NHCNH, HNCH2CH2CH2CH2CH(NH)CONH).
Получение (S)-2-Амино-5-гуанидино-N-((1-фенилциклопенпгил)метил)пентанамид дигидрохлорида. К раствору трет-бутил (S)-(5-(3-нитрогуанидино)-1-оксо-1-(((1-фенилциклопентил)-метил)амино)пент-2-ил)карбомата (1,6 г, 3,35 ммоль) в 30 мл этанола при комнатной температуре прибавляют 1 г 10% палладия на угле и 2 мл муравьиной кислоты и реакционную смесь нагревают и перемешивают при 50°С 3 час, после этого фильтруют и упаривают в вакууме, остаток растворяют в 30 мл 2-пропанола добавляют 5 мл концентрированной соляной кислоты и реакционную смесь нагревают 3 часа при 50°С. Поле этого растворитель упаривают, остаток растворяют в 50 мл воды, экстрагируют этилацетатом (3×20 мл), водную фазу упаривают в вакууме. Получают ((S)-2-амино-5-гуанидино-N-((1-фенилциклопентил)метил)пентанамиддигидрохлорид в виде белого гигроскопичного порошка, 1,03 г (76%). Спектр ЯМР1Н (CD3OD), δ, м. д. (J, Гц): 1,40-1,45 (2Н, м., NCH2CH2CH2CH(NH2)CO); 1,60-2,10 (10Н, м., NCH2CH2CH2CH(NH2)CO, с-С5Н8); 3,14 (2Н, т., J=7,09, NCH2CH2CH2CH(NH2)CO); 3,53 (2Н, д.д., J=13,45, 205,65, NHCH2); 3,86 (2Н, т., J=6,36, NCH2CH2CH2CH(NH2)CO); 7,19 (1Н, м., 4H-Ph); 7,25-7,40 (4Н, м., 2, 3, 5, 6-H-Ph). Спектр ЯМР13С (CD3OD), δ, м. д.: 24,4 (NCH2CH2CH2CH(NH2)CO); 25,3 (С-3, 4 с-С5Н8); 29,9 (NCH2CH2CH2CH(NH2)CO); 36,5 (С-2, 5 с-С5Н8); 37,7 (С-1 с-C5H8); 41,9 (NCH2CH2CH2CH(NH2)CO); 53,2 (NCH2CH2CH2CH(NH2)CO); 53,9 (CH2NH); 127,3 (C-4, Ph); 128,3 (C-2,6, Ph); 129,4 (C-3,5 Ph); 147,7 (C-1, Ph); 158,7 (-NHC(NH)NH2); 170,1 (NCH2CH2CH2CH(NH2)CO).
Пример 77. Синтез (S)-2-Амино-N1-((1-фенилциклопентил)метил)пентандиамид гидрохлорида

Получение трет-Бутил (S)-(5-(3-нитрогуанидино)-1-оксо-1-(((1-фенилцикло-пентил)метил)амино)пент-2-ил)карбомата. К раствору (трет-бутоксикарбонил)-L-глютамин (1,16 г, 4,72 ммоль), 1-(1-фенилциклопентил)метанамин гидрохлорида (1,00 г, 4,72 ммоль), полученного по примеру 38 и триэтиламина (0,48 г, 4,72 ммоль) в 30 мл диметилформамида, охлажденному до температуры (-)5°С, прибавляют дициклогексилкарбодиимид (0,97 г, 4,72 ммоль), перемешивают 40 мин при (-)5°С, и оставляют перемешиваться при комнатной температуре 24 часа. Выпавший осадок дициклогексилмочевины отфильтровывают, маточный раствор выливают в 200 мл воды и экстрагируютэтилацетатом (3×50 мл). Экстракт промывают водой (3×50 мл), 1М раствором соляной кислоты(3×50 мл), водой (50 мл), насыщенным раствором NaHCO3 (2×150 мл), насыщенным раствором NaCl (100 мл), сушат над MgSO4, фильтруют, упаривают в вакууме. Остаток кристаллизуют из гептана. Получают трет-бутил (S)-(5-амино-1,5-диоксо-1-(((1-фенилциклопентил)метил)амино)пент-2-ил)карбомат в виде белого порошка, 1,60 г (84%). Спектр ЯМР1Н (DMSO-d6), δ, м. д. (J, Гц): 1,37 (9Н, с., t-Bu); 1,50-2,00 (12Н, м., H2NOCCH2CH2CH(NH)CONH, с-С5Н8); 3,25 (2Н, д.д.д., J=5,62, 13,45, 66,27, CH2N); 3,81 (1Н, м., H2NOCCH2CH2CH(NH)CONH); 6,72 (2Н, д., J=42,15, H2NOCCH2CH2CH(NH)CONH); 7,10-7,30 (7Н, Ph, H2NOCCH2CH2CH(NH)CONH).
Получение (S)-2-Амино-N1-((1-фенилциклопентил)метил)пентандиамид гидрохлорида. К раствору трет-бутил (S)-(5-амино-1,5-диоксо-1-(((1-фенилциклопентил)метил)амино)пент-2-ил)карбомата (1,60 г, 3,96 ммоль) в 30 мл 2-пропанола добавляют 5 мл концентрированной соляной кислоты и реакционную смесь нагревают 3 часа при 50°С. Поле этого растворитель упаривают, остаток растворяют в 50 мл воды, экстрагируют этилацетатом (3×20 мл), водную фазу упаривают в вакууме. Получают (S)-2-амино-N1-((1-фенилциклопентил)метил)пентандиамид гидрохлорида в виде белого гигроскопичного порошка, 0,34 г (25%). Спектр ЯМР1Н (CD3OD), δ, м. д. (J, Гц): 1,50-2,0 (10Н, м., COCH2CH2CH(NH2)CO, c-С5Н8); 2,10-2,30 (2Н, м., COCH2CH2CH(NH2)CO); 3,42 (2Н, д.д., J=13,45, 67,0, NCH2); 4,10 (1Н, д.д., J=4,16, 8,31, COCH2CH2CH(NH2)CO); 7,27 (1H, м., 4H-Ph); 7,29-7,40 (4Н, м., 2, 3, 5, 6-Н-Ph). Спектр ЯМР13С (CD3OD), δ, м. д.: 24,4 (С-3, 4 с-С5Н8); 27,1 (NH2OCCH2CH2CH(NH2)CO); 30,5 (NH2OCCH2CH2CH(NH2)CO); 36,6 (С-2, 5 с-С5Н8); 37,6 (C-1 с-С5Н8); 53,5 (NH2OCCH2CH2CH(NH2)CO); 58,1 (CH2NH); 127,3 (С-4, Ph); 128,3 (С-2,6, Ph); 129,5 (С-3,5 Ph); 147,9 (C-1, Ph); 174,9 (NH2OCCH2CH2CH(NH2)CO); 181,7 (NH2OCCH2CH2CH(NH2)CO).
Пример 78. Синтез (S)-2-Амино-N1-((1-фенилциклопентил)метил)сукцинамид гидрохлорида

Получение трет-Бутил (S)-(5-(3-нитрогуанидино)-1-оксо-1-(((1-фенилциклопентил)метил)амино)пент-2-ил)карбомат. К раствору N2-трет-бутоксикарбонил)-Nω-нитро-L-аргинина (1,51 г, 4,72 ммоль), 1-(1-фенилциклопентил)метанамин гидрохлорида (1,00 г, 4,72 ммоль), полученного по примеру 38 и триэтиламина (0,48 г, 4,72 ммоль) в 30 мл диметилформамида, охлажденному до температуры (-)5°С, прибавляют дициклогексилкарбодиимид (0,97 г, 4,72 ммоль), перемешивают 40 мин при (-)5°С, и оставляют перемешиваться при комнатной температуре 24 часа. Выпавший осадок дициклогексилмочевины отфильтровывают, маточный раствор выливают в 200 мл воды, выпавший осадок фильтруют, промывают на фильтре водой (3×50 мл), этилацетатом (3×50 мл), хлористым метиленом (3×50 мл), сушат при 100°С. Получают трет-бутил (S)-(5-(3-нитрогуанидино)-1-оксо-1-(((1-фенилциклопентил)-метил)амино)пент-2-ил)карбомат в виде белого порошка, 1,60 г (71%). Спектр ЯМР1Н (DMSO-d6), δ, м.д. (J, Гц): 1,10-2,00 (23Н, м., HNCH2CH2CH2CH(NH)CONH, с-С5Н8, t-Bu); 3,11 (2Н, м., CH2N); 3,85 (1H, м., HNCH2CH2CH2CH(NH)CONH); 6,78 (1H, д., J=8,07., HNCH2CH2CH2CH(NH)CONH)); 7,10-7,30 (6Н, Ph, HNCH2CH2CH2CH2CH(NH)CONH); 7,5-8,5 (3Н, ш.с., NO2NHCNH, HNCH2CH2CH2CH2CH(NH)CONH).
(S)-2-Амино-5-гуанидино-N-((1-фенилциклопентил)метил)пентанамиддигидрохлорид. К раствору трет-бутил (S)-(5-(3-нитрогуанидино)-1-оксо-1-(((1-фенилциклопентил)-метил)амино)пент-2-ил)карбомата (1,6 г, 3,35 ммоль) в 30 мл этанола при комнатной температуре прибавляют 1 г 10% палладия на угле и 2 мл муравьиной кислоты и реакционную смесь нагревают и перемешивают при 50°С 3 час, после этого фильтруют и упаривают в вакууме, остаток растворяют в 30 мл 2-пропанола добавляют 5 мл концентрированной соляной кислоты и реакционную смесь нагревают 3 часа при 50°С. Поле этого растворитель упаривают, остаток растворяют в 50 мл воды, экстрагируют этилацетатом (3×20 мл), водную фазу упаривают в вакууме. Получают ((S)-2-амино-5-гуанидино-N-((1-фенилциклопентил)метил)пентанамиддигидрохлорид в виде белого гигроскопичного порошка, 1,03 г (76%). Спектр ЯМР1Н (CD3OD), δ, м.д. (J, Гц): 1,40-1,45 (2Н, м., NCH2CH2CH2CH(NH2)CO); 1,60-2,10 (10Н, м., NCH2CH2CH2CH(NH2)CO, с-С5Н8); 3,14 (2Н, т., J=7,09, NCH2CH2CH2CH(NH2)CO); 3,53 (2Н, д.д., J=13,45, 205,65, NHCH2); 3,86 (2Н, т., J=6,36, NCH2CH2CH2CH(NH2)CO); 7,19 (1Н, м., 4H-Ph); 7,25-7,40 (4Н, м., 2, 3, 5, 6-Н-Ph). Спектр ЯМР13С (CD3OD), δ, м. д.: 24,4 (С-3, 4 с-С5Н8); 36,7 (NH2OCCH2CH(NH2)CO); 36,7 (С-2, 5 с-С5Н8); 37,6 (С-1 с-С5Н8); 51,2 (NH2OCCH2CH(NH2)CO); 53,3 (CH2NH); 127,4 (С-4, Ph); 128,3 (С-2,6, Ph); 129,5 (С-3,5 Ph); 147,8 (C-1, Ph); 169,6 (NH2OCCH2CH(NH2)CO); 173,6 (NH2OCCH2CH(NH2)CO).
Пример 79. Синтез (S)-3-Амино-4-оксо-4-(((1-фенилциклопентил)метил)амино)бутановая кислота гидрохлорида

Получение метил (S)-3-((трет-бутоксикарбонил)амино)-4-оксо-4-(((1-фенилцикло-пентил)метил)амино)бутаноат. К раствору (S)-2-((трет-бутоксикарбонил)амино)-4-метокси-4-оксобутановой кислоты (1,17 г, 4,72 ммоль) и триэтиламина (0,48 г, 4,72 ммоль) в 20 мл дихлорметана, охлажденному до температуры (-)10°С, прибавляют изо-бутилхлорформиат (0,64 г, 4,72 ммоль), перемешивают 20 мин, прибавляют раствор 1-(1-фенилциклопентил)метанамин гидрохлорида (1,00 г, 4,72 ммоль), полученного по примеру 38, и триэтиламина (0,48 г, 4,72 ммоль) в 20 мл дихлорметана, перемешивают 2 час. Смесь выливают в 20 мл воды, экстрагируют дихлорметаном (3×20 мл). Экстракт промывают 1М раствором соляной кислоты (2×20 мл), водой (20 мл), 10% раствором NaHCO3 (2×20 мл), 35% раствором NaCl (2×20 мл). Сушат над Na2SO4, фильтруют, упаривают в вакууме, остаток кристаллизуют из гептана. Получают метил (S)-3-((трет-бутоксикарбонил)амино)-4-оксо-4-(((1-фенилциклопентил)метил)амино)бутаноат в виде белого порошка, 1,60 г (84%).
Получение (S)-3-амино-4-оксо-4-(((1-фенилциклопентил)метил)амино)бутановой кислоты гидрохлорида. К раствору метил (S)-3-((трет-бутоксикарбонил)амино)-4-оксо-4-(((1-фенилциклопентил)метил)амино)бутаноат (1,60 г, 3,96 ммоль) в 30 мл этанола добавляют гидроксид натрия (2,75 г, 6,6 ммоль) и 2 мл воды. Реакционную смесь перемешиваю при 30°С в течении 10 часов. Упаривают в вакууме растворяют в 50 мл воды и экстрагируют этилацетатом (2×20 мл), водный слой зачисляют до рН~2 соляной кислотой и экстрагируют этилацетатом (3×20 мл). Органическую фазу упаривают в вакууме, растворяют в 30 мл 2-пропанола добавляют 5 мл концентрированной соляной кислоты и реакционную смесь нагревают 3 часа при 50°С. Поле этого растворитель упаривают, остаток растворяют в 50 мл воды, экстрагируют этилацетатом (3×20 мл), водную фазу упаривают в вакууме. Получают (S)-3-амино-4-оксо-4-(((1-фенилциклопентил)метил)амино)бутановую кислоту гидрохлорид в виде белого гигроскопичного порошка, 0,71 г (55%). Спектр ЯМР1H (CD3OD), δ, м. д. (J, Гц): 1,60-2,0 (8Н, м., с-С5Н8); 2,81 (2Н, м., COCH2CH(NH2)CO2H); 3,40 (2Н, с., NCH2); 4,12 (1Н, д.д., J=4,65, 6,34, COCH2CH(NH2)CO2H); 7,20 (1Н, м., 4H-Ph); 7,30-7,40 (4Н, м., 2, 3, 5, 6-Н-Ph). Спектр ЯМР13С (CD3OD), δ, м. д.: 24,5 (С-3, 4 с-С5Н8); 35,2 (HO2CCH2CH(NH2)CO); 36,6 (С-2, 5 с-С5Н8); 36,9 (С-1 с-С5Н8); 51,2 (HO2CCH2CH(NH2)CO); 53,3 (CH2NH); 127,2 (С-4, Ph); 128,3 (С-2,6, Ph); 129,4 (С-3,5 Ph); 148,1 (C-1, Ph); 171,2 (HO2CCH2CH(NH2)CO); 171,4 (HO2CCH2CH(NH2)CO);
Пример 80. Синтез (S)-4-Амино-5-оксо-5-(((1-фенилциклопентил)метил)амиино)пентановая кислота гидрохлорида.

Получение метил (S)-4-((трет-бутоксикарбонил)амино)-5-оксо-5-(((1-фенилцикло-пентил)метил)амино)пентаноата. К раствору (S)-2-((трет-бутоксикарбонил)амино)-5-метокси-5-оксопентановая кислота (1,23 г, 4,72 ммоль) и триэтиламина (0,48 г, 4,72 ммоль) в 20 мл дихлорметана, охлажденному до температуры (-)10°С, прибавляют изо-бутилхлорформиат (0,64 г, 4,72 ммоль), перемешивают 20 мин, прибавляют раствор 1-(1-фенилциклопентил)метанамин гидрохлорида (1,00 г, 4,72 ммоль), полученного по примеру 38, и триэтиламина (0,48 г, 4,72 ммоль) в 20 мл дихлорметана, перемешивают 2 час. Смесь выливают в 20 мл воды, экстрагируют дихлорметаном (3×20 мл). Экстракт промывают 1М раствором соляной кислоты (2×20 мл), водой (20 мл), 10% раствором NaHCO3 (2×20 мл), 35% раствором NaCl (2×20 мл). Сушат над Na2SO4, фильтруют, упаривают в вакууме, остаток кристаллизуют из гептана, метил (S)-4-((трет-бутоксикарбонил)амино)-5-оксо-5-(((1-фенилциклопентил)метил)амино)пентаноат в виде белого порошка, 1,50 г (76%). Спектр ЯМР1Н (DMSO-d6), δ, м. д. (J, Гц): 1,40 (9Н, t-Bu); 1,60-2,20 (12Н, м., CH3O2CCH2CH2CH(NH)CO, с-С5Н8); 3,25 (2Н, д.д.д., J=6,6, 13,2, 87,78, CH2N); 3,61 (3Н, с., CH3O2CCH2CH2CH(NH)CONH); 3,92 (1H, м., CH3O2CCH2CH2CH(NH)CONH); 6,19 (1Н, д., J=8,31, CH3O2CCH2CH2CH(NH)CONH); 7,03 (1H, т., J=5,14, CH3O2CCH2CH2CH(NH)CONH); 7,10-7,30 (5H, Ph).
Получение (S)-4-Амино-5-оксо-5-(((1-фенилциклопентил)метил)амино)пентановой кислоты гидрохлорида. К раствору метил(S)-4-((трет-бутоксикарбонил )амино)-5-оксо-5-(((1-фенилциклопентил)метил)амино)пентаноата (1,50 г, 3,96 ммоль) в 30 мл этанола добавляют гидроксид натрия (2,75 г, 6,6 ммоль) и 2 мл воды. Реакционную смесь перемешиваю при 30°С в течении 10 часов. Упаривают в вакууме растворяют в 50 мл воды и экстрагируют этилацетатом (2×20 мл), водный слой зачисляют до рН~2 соляной кислотой и экстрагируют этилацетатом (3×20 мл). Органическую фазу упаривают в вакууме, растворяют в 30 мл 2-пропанола добавляют 5 мл концентрированной соляной кислоты и реакционную смесь нагревают 3 часа при 50°С. Поле этого растворитель упаривают, остаток растворяют в 50 мл воды, экстрагируют этилацетатом (3×20 мл), водную фазу упаривают в вакууме. Получают (S)-4-амино-5-оксо-5-(((1-фенилциклопентил)метил)амино)пентановую кислоту гидрохлорид в виде белого гигроскопичного порошка, 0,99 г (81%). Спектр ЯМР1Н (CD3OD), δ, м. д. (J, Гц): 1,50-2,0 (10Н, м., с-С5Н8, COCH2CH2CH(NH2)CO2H); 2,10-2,30 (2Н, м., COCH2CH2CH(NH2)CO2H); 3,50 (2Н, д.д., J=13,45, 224,48, NHCH2); 4,10 (1H, т., J=5,87, COCH2CH2CH(NH2)CO2H); 7,17 (1H, м., 4H-Ph); 7,29-7,50 (4Н, м., 2, 3, 5, 6-Н-Ph). Спектр ЯМР13С (CD3OD), δ, м. д.: 24,5 (С-3, 4 с-С5Н8); 27,9 (HO2CCH2CH2CH(NH2)CO); 30,1 (HO2CCH2CH2CH(NH2)CO); 36,5 (С-2, 5 с-С5Н8); 37,5 (C-1 с-С5Н8); 53,2 (HO2CCH2CH2CH(NH2)CO); 53,7 (CH2NH); 127,4 (С-4, Ph); 128,3 (С-2,6, Ph); 129,5 (С-3,5 Ph); 147,6 (C-1, Ph); 169,8 (HO2CCH2CH2CH(NH2)CO); 175,8 (HO2CCH2CH2CH(NH2)CO).
Пример 81. Синтез (2S)-2,5-Диамино-N-(1-(1-фенилциклопентил)этил)пентанамид-дигидрохлорида.

Получение ди-трет-бутил ((4S)-5-оксо5-((1-(1-фенилциклопентил)этил)амиино)пентан-1,4-диил)дикарбомат. К раствору N2,N5-бис(трет-бутоксикарбонил)-L-орнитина (1,47 г, 4,43 ммоль) и триэтиламина (0,45 г, 4,43 ммоль) в 20 мл дихлорметана, охлажденному до температуры (-)10°С, прибавляют изо-бутилхлорформиат (0,61 г, 4,43 ммоль), перемешивают 20 мин, прибавляют раствор 1-(1-фенилциклопентил)этан-1-амин гидрохлорида (1,00 г, 4,43 ммоль), полученного по примеру 37, и триэтиламина (0,45 г, 4,43 ммоль) в 20 мл дихлорметана, перемешивают 2 час. Смесь выливают в 20 мл воды, экстрагируют дихлорметаном (3×20 мл). Экстракт промывают 1М раствором соляной кислоты (2×20 мл), водой (20 мл), 10% раствором NaHCO3 (2×20 мл), 35% раствором NaCl (2×20 мл). Сушат над Na2SO4, фильтруют, упаривают в вакууме, остаток кристаллизуют из гептана. Получают ди-трет-бутил ((4S)-5-оксо5-((1-(1-фенилциклопентил)этил)амино)пентан-1,4-диил)дикарбомат в виде белого порошка, 1,46 г (65%). Спектр ЯМР1Н (DMSO-d6), δ, м. д. (J, Гц): 0,81 (3Н, д.д., J=6,85, 9,29); 1,00-2,00 (32Н, м., HNCH2CH2CH2CH2CH(NH)CONH, с-С5Н8, t-Bu); 3,83 (1H, м., (CH3)CHN); 4,15 (1Н, м., HNCH2CH2CH2CH2CH(NH)CONH); 6,19 (1Н, т., J=5,38., HNCH2CH2CH2CH2CH(NH)CONH)); 6,35 (1Н, д.д., J=8,31, 56,00 HNCH2CH2CH2CH2CH(NH)CONH); 6,75 (1Н, д.д., J=10,51, 42,79, HNCH2CH2CH2CH2CH(NH)CONH); 7,10-7,30 (5H, Ph).
Получение (2S)-2,5-Диамино-N-(1-(1-фенилциклопентил)этил)пентанамид дигидрохлорида. К раствору ди-трет-бутил ((4S)-5-оксо5-((1-(1-фенилциклопентил)этил)амино)пентан-1,4-диил)дикарбомата (1,46 г, 2,88 ммоль) в 30 мл 2-пропанола добавляют 5 мл концентрированной соляной кислоты и реакционную смесь нагревают 3 часа при 50°С. Поле этого растворитель упаривают, остаток растворяют в 50 мл воды, экстрагируют этилацетатом (3×20 мл), водную фазу упаривают в вакууме. Получают (2S)-2,5-диамино-N-(1-(1-фенилциклопентил)этил)пентанамиддигидрохлорид в виде белого гигроскопичного порошка, 0,74 г (69%). Спектр ЯМР1H (CD3OD), δ, м. д. (J, Гц): 1,00 (3Н, д.д., J=6,85, 25,92, CH3CHNH); 1,40-2,10 (12Н, м., NCH2CH2CH2CH(NH2)CO, c-С5Н8); 2,95 (2Н, м., NCH2CH2CH2CH(NH2)CO); 3,93 (1Н, м., NCH2CH2CH2CH(NH2)CO); 4,35 (1Н, м., CH3CHNH); 7,22 (1H, м., 4H-Ph); 7,29-7,50 (4Н, м., 2, 3, 5, 6-Н-Ph). Спектр ЯМР13С (CD3OD), δ, м. д.: 17,50, 17,75 (CH(CH3)NH, диастереомеры); 23,83, 24,10, 24,28, 24.51 (С-3, 4 с-С5Н8, диастереомеры); 24,19 (H2NCH2CH2CH2CH(NH2)CO); 30,00 (H2NCH2CH2CH(NH2)CO); 33,39, 34,87, 36,27, 37,66 (С-2, 5 с-С5Н8, диастереомеры); 40,22 (H2NCCH2CH2CH(NH2)CO); 53,00, 53,08 (С-1 с-С5Н8, диастереомеры); 53,95, 54,01 (H2NCH2CH2CH2CH(NH2)CO, диастереомеры); 56,77, 57,10 (CH(CH3)NH, диастереомеры); 127,4 (С-4, Ph); 128,85, 128,98 (С-2,6, Ph, диастереомеры); 129,35, 129,39 (С-3,5 Ph, диастереомеры); 145,74, 146,04 (C-1, Ph, диастереомеры); 169,5 (H2NCH2CH2CH2CH(NH2)CO).
Пример 82. Синтез (2S)-2,6-Диамино-N-(1-(1-фенилциклопентил)этил)гексан-амид дигидрохлорида.

Получение ди-трет-бутил ((5S)-6-оксо-6-((1-(1-фенилциклопентил)этил)амино)гексан-1,5-диил)дикарбомат. К раствору N2,N6-бис(трет-бутоксикарбонил)-L-лизин (1,53 г, 4,43 ммоль) и триэтиламина (0,45 г, 4,43 ммоль) в 20 мл дихлорметана, охлажденному до температуры (-)10°С, прибавляют изо-бутилхлорформиат (0,61 г, 4,43 ммоль), перемешивают 20 мин, прибавляют раствор 1-(1-фенилциклопентил)этан-1-амин гидрохлорида (1,00 г, 4,43 ммоль), полученного по примеру 37, и триэтиламина (0,45 г, 4,43 ммоль) в 20 мл дихлорметана, перемешивают 2 час. Смесь выливают в 20 мл воды, экстрагируют дихлорметаном (3×20 мл). Экстракт промывают 1М раствором соляной кислоты (2×20 мл), водой (20 мл), 10% раствором NaHCO3 (2×20 мл), 35% раствором NaCl (2×20 мл). Сушат над Na2SO4, фильтруют, упаривают в вакууме, остаток кристаллизуют из гептана. Получают ди-трет-бутил ((5S)-6-оксо-6-((1-(1-фенилциклопентил)этил)амино)гексан-1,5-диил)дикарбомат в виде белого порошка, 1,56 г (68%). Спектр ЯМР1Н (DMSO-d6), δ, м. д. (J, Гц): 0,80 (3Н, д.д., J=6,6, 6,85); 1,00-2,00 (34Н, м., HNCH2CH2CH2CH2CH(NH)CONH, с-С5Н8; t-Bu); 3,92 (1Н, м., (CH3)CHN); 4,13 (1H, м., HNCH2CH2CH2CH2CH(NH)CONH); 6,12 (1H, т., J=4,16., HNCH2CH2CH2CH2CH(NH)CONH)); 6,43 (1H, д.д., J=7,83, 48,42 HNCH2CH2CH2CH2CH(NH)CONH); 6,77 (1H, д.д., J=9,54, 38,15, HNCH2CH2CH2CH2CH(NH)CONH); 7,10-7,30 (5H, Ph).
Получение (2S)-2,6-Диамино-N-(1-(1-фенилциклопентил)этил)гексанамид дигидрохлорида. К раствору ди-трет-бутил ((5S)-6-охо-6-((1-(1-фенилциклопентил)этил)амино)гексан-1,5-диил)дикарбомата (1,56 г, 3,01 ммоль) в 30 мл 2-пропанола добавляют 5 мл концентрированной соляной кислоты и реакционную смесь нагревают 3 часа при 50°С. Поле этого растворитель упаривают, остаток растворяют в 50 мл воды, экстрагируют этилацетатом (3×20 мл), водную фазу упаривают в вакууме. Получают (2S)-2,6-диамино-N-(1-(1-фенилциклопентил)этил)гексанамиддигидрохлорид в виде белого гигроскопичного порошка, 0,78 г (66%). Спектр ЯМР1Н (CD3OD), δ, м. д. (J, Гц): 1,00 (3Н, д.д., J=6,85, 35,21, CH3CHNH); 1,45-2,10 (14Н, м., HCH2CH2CH2CH2CH(NH2)СО, с-С5Н8); 2,97 (2Н, м., NCH2CH2CH2CH2CH(NH2)CO); 3,98 (1H, м., NCH2CH2CH2CH2CH(NH2)CO); 4,33 (1H, м., CH3CHNH); 7,22 (1H, м., 4-H-Ph); 7,29-7,40 (4Н, м., 2, 3, 5, 6-Н-Ph). Спектр ЯМР13С (CD3OD), δ, м. д.: 17,45, 17,72 (CH(CH3)NH, диастереомеры); 23,04, 23,08, 23,85, 24,60 (С-3, 4 с-С5Н8, диастереомеры); 24,19 (H2NCH2CH2CH2CH(NH2)CO); 24,20 (H2NCH2CH2CH2CH2CH(NH2)CO); 28,19 (H2NCH2CH2CH2CH2CH(NH2)CO); 32,46 (H2NCH2CH2CH2CH(NH2)CO); 33,39, 35,06, 36,01, 37,67 (С-2, 5 c-C5H8, диастереомеры); 40,42 (H2NCH2CH2CH2CH(NH2)CO); 52,93, 52,97 (C-1 с-С5Н8, диастереомеры); 53,29, 54,41 (H2NCH2CH2CH2CH2CH(NH2)CO, диастереомеры); 56,81, 57,10 (CH(CH3)NH, диастереомеры); 127,37 (С-4, Ph); 128,79, 128,98 (С-2,6, Ph, диастереомеры); 129,35 (С-3,5 Ph, диастереомеры); 145,78, 146,21 (C-1, Ph, диастереомеры); 169,71, 169,84 (H2NCH2CH2CH2CH2CH(NH2)CO, диастереомеры).
Пример 83. Синтез (2S,3R)-2-Амино-3-гидрокси-N-((1-фенилциклопентил)ме-тил)бутанамид гидрохлорида.

Получение трет-Бутил ((2S,3R)-3-гидрокси-1-оксо-1-((1-(1-фенил-циклопентил)этил)амино)бут-2-ил)карбомата. К раствору (трет-бутокси)-L-треонин (0,97 г, 4,43 ммоль) и триэтиламина (0,45 г, 4,43 ммоль) в 20 мл тертагидрофурана, охлажденному до температуры (-)10°С, прибавляют изо-бутилхлорформиат (0,61 г, 4,43 ммоль), перемешивают 20 мин, прибавляют раствор 1-(1-фенилциклопентил)этан-1-амин гидрохлорида (1,00 г, 4,43 ммоль), полученного по примеру 37, и триэтиламина (0,45 г, 4,43 ммоль) в 20 мл тетрогидрофурана, перемешивают 2 час. Смесь упаривают в вакууме, разбавляют в 20 мл воды, экстрагируют этилацетатом (3×20 мл). Экстракт промывают 1М раствором соляной кислоты (2×20 мл), водой (20 мл), 10% раствором NaHCO3 (2×20 мл), 35% раствором NaCl (2×20 мл). Сушат над Na2SO4, фильтруют, упаривают в вакууме, остаток кристаллизуют из гептана. Получают трет-бутил ((2S,3R)-3-гидрокси-1-оксо-1-((1-(1-фенилциклопентил)этил)амино)бут-2-ил)карбомат в виде белого порошка, 1,23 г (71%).
Получение (2S,3R)-2-Амино-3-гидрокси-N-((1-фенилциклопентил)метил)бутанамид гидрохлорида. К раствору ди-трет-бутил трет-бутил ((2S,3R)-3-гидрокси-1-оксо-1-((1-(1-фенилциклопентил)этил)амино)бут-2-ил)карбомата (1,43 г, 3,14 ммоль) в 30 мл 2-пропанола добавляют 5 мл концентрированной соляной кислоты и реакционную смесь нагревают 3 часа при 50°С. Поле этого растворитель упаривают, остаток растворяют в 50 мл воды, экстрагируют этилацетатом (3×20 мл), водную фазу упаривают в вакууме. Получают (2S,3R)-2-амино-3-гидрокси-N-((1-фенилциклопентил)метил)бутанамид гидрохлорид в виде белого гигроскопичного порошка, 0,90 г (91%). Спектр ЯМР1Н (CD3OD), δ, м. д. (J, Гц): 0,95 (3Н, д.д., J=6,85, 18,83, CH3CHNH); 1,25 (3Н, д.д., J=6,36, 26,90, CH3CH(OH)CH(NH2)CO); 1,40-2,15 (8Н, м., с-С5Н8); 3,72 (1H, д.д., J=6,11, 9,05, CH3CH(OH)CH(NH2)CO); 4,05 (1H, м., CH3CHNH); 4,30 (1H, м., CH3CH(OH)CH(NH2)CO); 7,22 (1Н, м., 4-H-Ph); 7,29-7,50 (4Н, м., 2, 3, 5, 6-Н-Ph). Спектр ЯМР13С (CD3OD), δ, м. д.: 17,60 (CH(CH3)NH); 19,90, 20,47 (CH3CH(OH)CH(NH2)CO, диастереомеры); 23,84, 24,00, 24,18, 24,31 (С-3, 4 с-С5Н8, диастереомеры); 33,84, 34,98, 36,90, 37,53 (С-2, 5 с-С5Н8, диастереомеры); 52,77, 52,80 (С-1 с-С5Н8, диастереомеры); 56,94, 57,00 (CH(CH3)NH, диастереомеры); 60,10, 60,15 (CH3CH(OH)CH(NH2)CO, диастереомеры); 67,42, 67,61 (CH3CH(OH)CH(NH2)CO, диастереомеры); 127,44 (С-4, Ph); 129,04 (С-2,6, Ph); 129,32 (С-3,5 Ph); 145,53 (C-1, Ph); 168,25 (CH3CH(OH)CH(NH2)CO).
Пример 84. Синтез (2,5)-2-Амино-3-гидрокси-N-(1-(1-фенилциклопентил)этил)пропанамид гидрохлорид.

Получение терт-Бутил ((2S)-3-гидрокси-1-оксо-1-((1-(1-фенил-циклопентил)этил)амино)проп-2-ил)карбомата. К раствору (трет-бутокси)-L-треонина (0,91 г, 4,43 ммоль) и триэтиламина (0,45 г, 4,43 ммоль) в 20 мл тертагидрофурана, охлажденному до температуры (-)10°С, прибавляют изо-бутилхлорформиат (0,61 г, 4,43 ммоль), перемешивают 20 мин, прибавляют раствор 1-(1-фенилциклопентил)этан-1-амин гидрохлорида (1,00 г, 4,43 ммоль), полученного по примеру 37, и триэтиламина (0,45 г, 4,43 ммоль) в 20 мл тетрогидрофурана, перемешивают 2 час. Смесь упаривают в вакууме, разбавляют в 20 мл воды, экстрагируют этилацетатом (3×20 мл). Экстракт промывают 1М раствором соляной кислоты (2×20 мл), водой (20 мл), 10% раствором NaHCO3 (2×20 мл), 35% раствором NaCl (2×20 мл). Сушат над Na2SO4, фильтруют, упаривают в вакууме, остаток кристаллизуют из гептана. Получают терт-бутил ((2S)-3-гидрокси-1-оксо-1-((1-(1-фенилциклопентил)этил)амино)проп-2-ил)карбомат в виде белого порошка, 1,43 г (86%).
Получение (2S)-2-Амино-3-гидрокси-N-(1-(1-фенилциклопентил)этил)пропанамид гидрохлорида. К раствору трет-бутил терт-бутил ((2S)-3-гидрокси-1-оксо-1-((1-(1-фенилциклопентил)этил)амино)проп-2-ил)карбомата (1,43 г, 3,81 ммоль) в 30 мл 2-пропанола добавляют 5 мл концентрированной соляной кислоты и реакционную смесь нагревают 3 часа при 50°С. Поле этого растворитель упаривают, остаток растворяют в 50 мл воды, экстрагируют этилацетатом (3×20 мл), водную фазу упаривают в вакууме. Получают (2S)-2-амино-3-гидрокси-N-(1-(1-фенилциклопентил)этил)пропанамид гидрохлорид в виде белого гигроскопичного порошка, 0,80 г (67%). Спектр ЯМР1Н (CD3OD), δ, м. д. (J, Гц): 0,94 (3Н, д.д., J=6,85, 18,83, CH3CHNH); 1,40-2,15 (8Н, м., с-С5Н8); 3,70-4.00 (3Н, м., CH3CHNH, CH2(ОН)СН(NH2)СО); 4,34 (1Н, м., CH2(OH)CH(NH2)CO); 7,22 (1Н, м., 4-H-Ph); 7,29-7,50 (4Н, м., 2, 3, 5, 6-Н-Ph). Спектр ЯМР13С (CD3OD), δ, м. д.: 17,44. 17,62 (CH(CH3)NH, диастереомеры); 23,91, 23,98, 24,26, 24,315 (С-3, 4 с-С5Н8, диастереомеры); 33,90, 35,02, 36,79, 37,55 (С-2, 5 с-С5Н8, диастереомеры); 52,43, 52,88 (С-1 с-С5Н8, диастереомеры); 56,29 (CH(CH3)NH); 57,10 (CH2(OH)CH(NH2)CO); 61,88, 62,06 (CH2(OH)CH(NH2)CO, диастереомеры); 127,41 (С-4, Ph); 129,02, 129,14 (С-2,6, Ph, диастереомеры); 129,24, 129,31 (С-3,5 Ph, диастереомеры); 145,52, 145,67 (C-1, Ph, диастереомеры); 167,01, 168,01 (CH2(OH)CH(NH2)CO, диастереомеры).
Пример 85. Синтез (2S,3S)-Амино-3-метил-N-(2-оксо-2-(1-фенилциклопентил)этил)пентанамид гидрохлорида.

Получение трет-Бутил ((2S,3S)-3-метил-1-оксо-1-((-2-оксо-2-(1-фенилциклопентил)этил)амино)пент-2-ил)карбомата. К раствору (терт-бутоксикарбонил)-L-изолейцина (1,17 г, 5,06 ммоль) и триэтиламина (0,51 г, 5,06 ммоль) в 20 мл тетрагидрофурана, охлажденному до температуры (-)10°С, прибавляют изо-бутилхлорформиат (0,61 г, 5,06 ммоль), перемешивают 20 мин, прибавляют раствор 2-амино-1-(1-фенилциклопентил)этан-1-он (1,44 г, 5,06 ммоль), полученного по примеру 46, и триэтиламина (0,51 г, 5,06 ммоль) в 20 мл тетрагидрофурана, перемешивают 2 час. Смесь упаривают в вакууме, разбавляют в 20 мл воды, экстрагируют этилацетатом (3×20 мл). Экстракт промывают 1М раствором соляной кислоты (2×20 мл), водой (20 мл), 10% раствором NaHCO3(2×20 мл), 35% раствором NaCl (2×20 мл). Сушат над Na2SO4, фильтруют, упаривают в вакууме, остаток кристаллизуют из гептана. Получают трет-бутил ((2S,3S)-3-метил-1-оксо-1-((2-оксо-2-(1-фенилциклопентил)этил)амино)пент-2-ил)карбомат в виде белого порошка, 0,85 г (45%). Спектр ЯМР1Н (DMSO-d6), δ, м. д. (J, Гц): 0,81 (3Н, д., J=6,85, CH3CH2CH(CH3)CH(NH)CONH); 0,83 (3Н, т., J=7,35, CH3CH2CH(CH3)CH(NH)CONH); 1,03 (1Н, м., CH3CH2CH(CH3)CH(NH)CONH); 1,37 (9Н, с., t-Bu); 1,50-2,50 (10Н, м., CH3CH2CH(CH3)CH(NH)CONH, с-С5Н8); 3,60-3,90 (3Н, м, CH3CH2CH(CH3)CH(NH)CONH, СН2СО); 5,85 (1H, д., J=9,29, CH3CH2CH(CH3)CH(NH)CONH); 7,10-7,30 (5Н, Ph); 7,69 (1Н, т., J=5,14, CH3CH2CH(CH3)CH(NH)CONH).
Получение (2S,3S)-2-Амино-3-метил-N-(2-оксо-2-(1-фенилциклопентил)этил)пентанамид гидрохлорид. К раствору трет-бутил ((2S,3S)-3-метил-1-оксо-1-((2-оксо-2-(1-фенилциклопентил)этил)амино)пент-2-ил)карбомат (0,45 г, 1,20 ммоль) в 30 мл 2-пропанола добавляют 5 мл концентрированной соляной кислоты и реакционную смесь нагревают 3 часа при 50°С. Поле этого растворитель упаривают, остаток растворяют в 50 мл воды, экстрагируют этилацетатом (3×20 мл), водную фазу упаривают в вакууме. Получают (2S,3S)-2-амино-3-метил-N-(2-оксо-2-(1-фенилциклопентил)этил)пентанамид гидрохлорид в виде белого гигроскопичного порошка, 0,25 г (67%). Спектр ЯМР1Н (DMSO-d6), δ, м. д. (J, Гц): 0,84 (3Н, т., J=7,34, CH3CH2CH(CH3)CH(NH2)CO); 0,89 (3Н, д., J=6,85, CH3CH2CH(CH3)CH(NH2)CO); 1,15 (1H, м., CH3CH2CH(CH3)CH(NH2)CO); 1,45-1,95 (8Н, м., CH3CH2CH(CH3)CH(NH2)CO, с-С5Н8); 2,55 (2Н, м., с-С5Н8); 3,64 (1H, д., J=3,42., CH3CH2CH(CH3)CH(NH2)CO); 3,78-4,00 (2Н, м., CH2NH); 7,20-7,45 (5Н, м., Ph); 8,22 (3Н, ш.с., CH3CH2CH(CH3)CH(NH3+)CO); 8,57 (1H, ш.с., CH2NH). Спектр ЯМР13С (CD3OD), δ, м. д.: 10,4 (CH3CH2CH(CH3)CH(NH2)CO); 13,6 (CH3CH2CH(CH3)CH(NH2)CO); 23,3 (CH3CH2CH(CH3)CH(NH2)CO); 24,2 (С-3, 4 с-С5Н8); 31,6 (CH(CH3)2CH(NH2)CO); 34,5 (CH3CH2CH(CH3)CH(NH2)CO); 36,6 (С-2, 5 с-С5Н8); 44,6 ((COCH2NH); 57,6 ((C-1 с-С5Н8); 63,6 (CH3CH2CH(CH3)CH(NH2)CO); 126,8 (C-4, Ph); 128,2 (C-2,6, Ph); 128,6 (C-3,5 Ph); 142,1 (C-1, Ph); 168,3 (COCH2NH); 206,2 (CH3CH2CH(CH3)CH(NH2)CO).
Пример 86. Синтез (S)-2-Амно-3-метил-N-(2-оксо-2-(1-фенилциклопентил)этил)бутанамид гидрохлорид.

Получение трет-Бутил (S)-(3-метил-1-оксо-1-((2-оксо-2-(1-фенилциклопентил)этил)амино)бут-2-ил)карбомата. К раствору (трет-бутоксикарбонил)-L-валина (0,76 г, 3,52 ммоль) и триэтиламина (0,36 г, 3,52 ммоль) в 20 мл тертагидрофурана, охлажденному до температуры (-)10°С, прибавляют изо-бутилхлорформиат (0,48 г, 3,52 ммоль), перемешивают 20 мин, прибавляют раствор 2-амино-1-(1-фенилциклопентил)этан-1-он гидробромид (1,00 г, 3,52 ммоль), полученного по примеру 46, и триэтиламина (0,36 г, 3,52 ммоль) в 20 мл тетрогидрофурана, перемешивают 2 час. Смесь упаривают в вакууме, разбавляют в 20 мл воды, экстрагируют этилацетатом (3×20 мл). Экстракт промывают 1М раствором соляной кислоты (2×20 мл), водой (20 мл), 10% раствором NaHCO3 (2×20 мл), 35% раствором NaCl (2×20 мл). Сушат над Na2SO4, фильтруют, упаривают в вакууме, остаток кристаллизуют из гептана. Получают трет-бутил (S)-(3-метил-1-оксо-1-((2-оксо-2-(1-фенилциклопентил)этил)амино)бут-2-ил)карбомат в виде белого порошка, 1,40 г (99%). Спектр ЯМР1Н (DMSO-d6), δ, м. д. (J, Гц): 0,80 (6Н, д.д., J=6,85, 19,07, (CH3)2CHCH(NH)CONH); 1,37 (9Н, с., t-Bu); 1,50-2,50 (9Н, м., (CH3)2CHCH(NH)CONH), с-С5Н8); 3,60-3,90 (3Н, м, (CH3)2CHCH(NH)CONH), CH2CO); 5,81 (1H, д., J=9,05, CH3CH2CH(CH3)CH(NH)CONH); 7,10-7,30 (5Н, Ph); 7,71 (1H, т., J=4,98, CH3CH2CH(CH3)CH(NH)CONH).
Получение (S)-2-Амно-3-метил-N-(2-оксо-2-(1-фенилциклопентил)этил)бутанамид гидрохлорида. К раствору трет-бутил (S)-(3-метил-1-оксо-1-((2-оксо-2-(1-фенилциклопентил)этил)амино)бут-2-ил)карбомат (1,40 г, 3,52 ммоль) в 30 мл 2-пропанола добавляют 5 мл концентрированной соляной кислоты и реакционную смесь нагревают 3 часа при 50°С. Поле этого растворитель упаривают, остаток растворяют в 50 мл воды, экстрагируют этилацетатом (3×20 мл), водную фазу упаривают в вакууме. Получают (S)-2-амно-3-метил-N-(2-оксо-2-(1-фенилциклопентил)этил)бутанамид гидрохлорид в виде белого гигроскопичного порошка, 0,76 г (65%). Спектр ЯМР1Н (CD3OD), δ, м. д. (J, Гц): 1,06 (6Н, д.д., J=1,96, 7,09, (СН3)СНСН(NH2)СО)); 1,60-1,75 (4Н, м., с-С5Н8); 1,95-2,05 (2Н, м., с-С5Н8); 2,10-2,25 (1Н, м., (CH3)CHCH(NH2)CO)); 2,50-2,60 (2Н, м., с-С5Н8); 3,70 (1H, д., J=5,62., (CH3)CHCH(NH2)CO)); 3,98 (2Н, д.д., J=18,34, 80,70, COCH2NH); 7,27 (1H, м., 4-H-Ph); 7,30-7,45 (4Н, м., 2, 3, 5, 6-Н-Ph). Спектр ЯМР13С (CD3OD), δ, м. д.: 18,6 (CH(CH3)2CH(NH2)CO); 24,7 (С-3, 4 с-С5Н8); 31,6 (CH(CH3)2CH(NH2)CO); 36,0 (С-2, 5 с-С5Н8); 46,1 ((COCH2NH); 59,9 ((С-1 с-С5Н8); 65,1 (CH(CH3)2CH(NH2)CO); 128,2 (С-4, Ph); 128,5 (С-2,6, Ph); 130,1 (С-3,5 Ph); 143,6 (C-1, Ph); 169,8 (COCH2NH); 207,8 (CH(CH3)2CH(NH2)CO).
Пример 87. Синтез (S)-2-Амино-N-(2-оксо-2-(1-фенилциклопентил)этил)пропанамид гидрохлорид.

Получение терт-Бутил (S)-(1-оксо-1-((2-оксо-2-(1-фенилциклопентил)этил)амино)проп-2-ил)карбомата. К раствору (трет-бутоксикарбонил)-L-аланин (0,67 г, 3,52 ммоль) и триэтиламина (0,36 г, 3,52 ммоль) в 20 мл тертагидрофурана, охлажденному до температуры (-)10°С, прибавляют изо-бутилхлорформиат (0,48 г, 3,52 ммоль), перемешивают 20 мин, прибавляют раствор 2-амино-1-(1-фенилциклопентил)этан-1-он гидробромид (1,00 г, 3,52 ммоль), полученного по примеру 46, и триэтиламина (0,36 г, 3,52 ммоль) в 20 мл тетрогидрофурана, перемешивают 2 час. Смесь упаривают в вакууме, разбавляют в 20 мл воды, экстрагируют этилацетатом (3×20 мл). Экстракт промывают 1М раствором соляной кислоты (2×20 мл), водой (20 мл), 10% раствором NaHCO3 (2×20 мл), 35% раствором NaCl (2×20 мл). Сушат над Na2SO4, фильтруют, упаривают в вакууме, остаток кристаллизуют из гептана. Получают трерт-бутил (S)-(1-оксо-1-((2-оксо-2-(1-фенилциклопентил)этил)амино)проп-2-ил)карбомат в виде белого порошка, 1,24 г (94%).
Получение (S)-2-Амино-N-(2-оксо-2-(1-фенилциклопентил)этил)пропанамид гидрохлорида. К раствору трерт-бутил (S)-(1-оксо-1-((2-оксо-2-(1-фенилциклопентил)этил)амино)проп-2-ил)карбомата (1,24 г, 3,31 ммоль) в 30 мл 2-пропанола добавляют 5 мл концентрированной соляной кислоты и реакционную смесь нагревают 3 часа при 50°С. Поле этого растворитель упаривают, остаток растворяют в 50 мл воды, экстрагируют этилацетатом (3×20 мл), водную фазу упаривают в вакууме. Получают (S)-2-амино-N-(2-оксо-2-(1-фенилциклопентил)этил)пропанамид гидрохлорид в виде белого гигроскопичного порошка, 0,81 г (79%). Спектр ЯМР1Н (CD3OD), δ, м. д. (J, Гц): 1,51 (3Н, д., J=7,09, (CH3)CH(NH2)CO)); 1,60-1,75 (4Н, м., с-С5Н8); 1,95-2,05 (2Н, м., с-С5Н8); 2,50-2,60 (2Н, м., с-С5Н8); 3,85-4,10 (3Н, м., (CH3)CH(NH2)CO), COCH2NH)); 7,27 (1Н, м., 4-H-Ph); 7,30-7,45 (4Н, м., 2, 3, 5, 6-H-Ph). Спектр ЯМР13С (CD3OD), δ, м. д.: 17,8 (CH3CH(NH2)CO); 24,7 (С-3, 4 с-С5Н8); 36,1 (С-2, 5 с-С5Н8); 46,2 ((COCH2NH); 50,3 ((С-1 с-С5Н8); 65,1 (CH3CH2(NH2)CO); 128,2 (С-4, Ph); 128,5 (С-2,6, Ph); 130,1 (С-3,5 Ph); 143,6 (C-1, Ph); 171,4 (COCH2NH); 207,9 (CH3CH2(NH2)CO); (CH3CH(NH2)CO);
Пример 88. Изучение активности производных арилциклоалкиламинов in vitro Исследование взаимодействия производных арилциклоалкиламинов с ферментами ацетилхолинстераза и бутирилхолинстераза, NMDA, АМРА-блокирующей активности
Ингибирование ацетилхолинестеразы (AChE), бутирилхолинестеразы (BChe, BuChe) определялось по общепринятой методологии [Silva D. [Silva D, et al, Synthesis, Pharmacological Assessment, and Molecular Modeling of Acetylcholinesterase/Butyrylcholinesterase Inhibitors: Effect against Amyloid-β-Induced Neurotoxicity. ACS Chemical Neuroscience 2013, 4(4), 547-565]].
Субстраты: ацетилтиохолин и бутирилтиохолин, хромоген - реагент Эллмана. Измерения проведены на планшетном ридере Infinite М200 (Tecan, Щвейцария) при температуре 37°С; длине волны детектирования 405 нм; плашка Greiner 96U Transparent; число вспышек (flashes) 5; число кинетических циклов 50.
Вычисляли значение константы полуингибирования, IC50, мкМ
Исследование NMDA, АМРА-блокирующей активности выполнены на нативных рецепторах нейронов переживающих срезов мозга крыс лини Вистар методом вибродиссоциации. Для работы с NMDA- и кальций-непроницаемыми АМРА-рецепторами использованы пирамидные нейроны поля СА1 гиппокампа, для работы с кальций-проницаемыми АМРА рецепторами - гигантские интернейроны стриатума. Активация NMDA рецепторов проведена L-аспартатом (100 мкМ), активацию АМРА рецепторов - каинатом (100 мкМ). Регистрация токов проведена методом фиксации потенциала в конфигурации «whole cell». Мембранный потенцияал составлял (-)80 мВ. Внеклеточный раствор содержал (мМ): NaCl 143; KCl 5; CaCl2 2,5; D-glucose 10; HEPES 10 (рН доведен до 7,4 0,1 М HCl). Пипеточный раствор (мМ): CsF 100; CsCl 40; NaCl 5; CaCl2 0,5; EGTA 5; HEPES 10 (рН доводился до 7,2 0,1 М CsOH). Раствор подавался перфузирующей системой RSC-200 (BioLogic Science Instr., France), обеспечивающей смену раствора не более чем за 50 мсек. Для записи ответов использован усилитель ЕРС 8 (HEKA Elektronik, Germany). Управление экспериментом проведено при помощи персонального компьютера. Блокирующее действие соединений установлено по способности ингибировать трансмембранный ток, поддерживающийся при аппликации агониста. Значения IC50 вычислены уравнению Хилла. Статистическая обработка проведена по программе Microcal Origin 6.0.



Все рассмотренные производные арилциклоалкиламинов являются блокаторами NMDA-рецепторов и фермента Buche.
Лучшие результаты найдены для соединений с сочетанной активностью комбинированной бокады NMDA-рецепторов и Buche, например соединения по примерам 2, 8, 14, 23, 28, 42-43, 51, 68, 69.
Их активность превышает активность препаратов сравнения - мемантин, допенезил и галантамин в виду комбинированного ингибирования NMDA-рецеторов и фермента BuChe.
Пример 89. Нейропротективная активность производных арилциклоалкил-аминов при введении нейротоксинов
Противосудорожная и нейропротективная активность при токсическом действии каината оценивалась по общепринятой методике (Wang Q, et all, Kainic acid-mediated excitotoxicity as a model for neurodegeneration. Mol. Neurobiol. 31(1-3):3-16, 2005).
Животные: крысы популяции Вистар, масса 250±20 г, возраст 12-14 недель (питомник Рапполово, РФ). Количество крыс в группе - 8 (n=8).
Введение препаратов: 1,0 мл раствора в воде д/и, внутрижелудочно (в/ж), жестким металлическим зондом, однократно, за 45 мин до введения каината. Контроль: аналогичто вводят 1 мл воды д/и.
Введение каиновой кислоты: 1 мл раствора в воде д/и, в/ж, 12 мг/кг.
Противосудорожное действие определено по уменьшению тяжести судорог в течение 4 час после введения каината, в баллах: 0 - отсутствие; 1 - подергивание отдельных мышц, "отряхивание мокрой собаки", 2 - клонус лап; 3 - сильный клонус лап со вставанием, потеря позы; 4 - клонико-тонические судороги; 5 - тонические судороги. При повторении судорог, их тяжесть увеличивается на 0,5 балла. Каинатную токсичность определена по летальности крыс в течение 2 недель после введения каината.


Лучшие результаты получены при использовании композиции леводопы с соединениями по примерам 23 и 42 и при использовании индивидуальных содинений по примерам 14, 3, 19
Антипсихотическое действие при шизофрении (атаксии), вызванной МК-801
МК-801 вызывает приступы шизофрении у крыс [


Технология выполнения исследования: Животные: крысы популяции Вистар, масса 250±20 г, возраст 12-14 недель (питомник Рапполово, РФ).
Количество крыс в группе - 10 (n=10). Введение препаратов: 1 мл раствора в воде д/и, в/ж, жестким металлическим зондом, однократно, за 45 мин до введения МК-801. Контроль: аналогично вводится 1 мл воды д/и.
Введение МК-801: 0,2 мл раствора МК-801 в воде д/и, внутримышечно (в/м), 0,45 мг/кг. Тяжесть атаксии в баллах: 0 - нет атаксии; 1 - некоординированные движения, гиперлокомоция; 2 - гиперлокомоция, стереотипия, падение на бок; 3 - полное нарушение антигравитационных рефлексов. Нейропротективное действие производных арилциклоалкиламинов и препаратов сравнения оценено по устранению тяжелой атаксии (2-3 балла), вызванной МК-801.



Производные арилциклоалкиламинов и их комбинации с пальмитоилэтаноламидом и леводопой проявляют дозозависимую антипсихотическую и нейропротективную активность, превышающую активность мемантина.
Противопаркинсоническая активность при галоперидоловой каталепсии.
Паркинсонизм индуцирован введением галоперидола в высокой дозе.
Животные: крысы популяции Вистар, масса 260±20 г, возраст 14-16 недель (питомник Рапполово, РФ). Количество крыс в группе - 10 (n=10).
Введение препаратов: 0,2 мл раствора производного арилциклоалкиламина в физрастворе вводят внутрибрющинно (в/бр), в течение 5 сут, последнее введение проводят за 30 мин до введения галоперидола.
Контроль: аналогично вводят 0,2 мл физраствора. Введение галоперидола: 0,2 мл раствора в физрастворе, в/бр, 1 мг/кг.
Определение противопаркинсонического действия: через 120 мин после введения галоперидола определена каталепсия (тест «Наклонная сетка») в баллах:
2 - иммобилизация от 50 до 80 сек, 1 - иммобилизация от 20 до 40 сек, 0 баллов - иммобилизация меньше 10 сек.
Ригидность - по симптому "горбатости", измеряемая по уменьшению расстояния от шеи до основания хвоста крысы, в баллах: 0 - отсутствие ригидности, 1 - уменьшение менее чем на 1,5 см, 2 - уменьшение на 1,5-2,5 см, 3 - уменьшение более чем на 2,5 см.
Через 180 мин измерена двигательная активность крыс (тест «Открытое поле», тестирование в течение 3 мин). Количественная оценка олигокинезии, в баллах:
0 - суммарное время ходьбы более 15 сек, вертикальных стоек более 7; 1 балл - суммарное время ходьбы 6-14 сек, вертикальных стоек 4-6; 2 суммарное время ходьбы 3-6 сек, вертикальных стоек 0-1; 3 - суммарное время ходьбы 0-2 сек, вертикальных стоек 0-1.

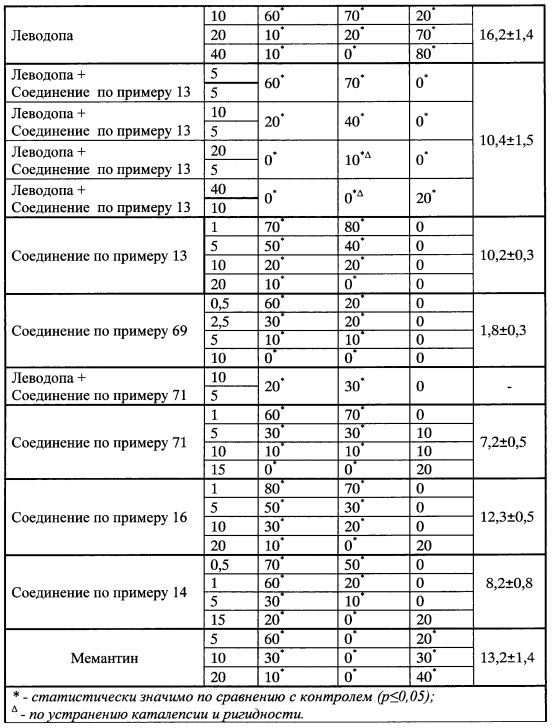
Производные арилциклоалкиламинов подавляют развитие паркинсонизма, вызванного токсической дозой галоперидола, превышая по активности препараты сравнения. Комбинация производных арилциклоалкиламинов с лево допой позволяет увеличить ее противопаркинсоническое действие и уменьшить побочные эффекты леводопы.
Противосудорожная активность при токсическом действии коразола
Коразол вызывает судороги, типичные для нейродегенеративных заболеваний. Устранение таких судорог расценивается как потенциальная активность препаратов, в частности, при болезни Паркинсона, эпилепсии и т.п.
Оценка противосудорожного действия выполнена следующим способом: препарт вводят внутригастрально, через 40 мин проводят инъекцию коразора, далее определяют снижение судорог на фоне введения препаратов по сравнению с контролем (нелеченные животные).
Определяют эффективную дозу соединения, устраняющую генерализованные коразоловые судороги.
Животные: крысы популяции Вистар, масса 260±20 г, возраст 14-16 недель (питомник Рапполово, РФ). Количество крыс в группе - 10 (n=10).
Введение препаратов: 1 мл раствора или суспензии вводят внутригастрально, однократно, за 40 мин до введения коразола. Контроль: аналогично вводят 1 мл воды д/и.
Введение коразола: в/бр, 0,2 мл раствора в воде, 65 мг/кг. Оценка степени тяжести коразоловых судорог, в баллах: 0 - отсутствие реакции; 1 - лицевые автоматизмы, подергивание ушей, подергивание отдельных мышц, 2 - клонус передних или задних лап, 3 - клонус задних лап со вставанием, потеря позы, 4 - сильный клонус передних и задних лап, прыжки с падением на бок, 5 - клонико-тонические судороги, 6 - тонические судороги. При повторении судорог их тяжесть увеличивается на 0,5 балла. Судороги регистрируются в течение 30 мин после введения коразола.
Таблица 6.
Противосудорожная активность производных арилциклоалкиламинов и комбинаций производных арилциклоалкиламинов с фенилэфрином,пальмитоилэтаноламидом и N-(2-аминоэтил)пальмитамид гидрохлоридом при токсическом действии коразола. Внутригастральное введение препаратов.

Таким образом, производные арилциклоалкиламинов подавляют развитие коразоловых судорог. Наибольшую эффективность среди соединений, изученных в тесте, проявляют производные арилциклоалкиламинов по примерам 9, 21, 42, 43. Ведение производные арилциклоалкиламинов в комбинации с фенилэфрином, пальмитоилэтаноламидом или N-(2-аминоэтил)пальмитамид гидрохлоридом позволяет снизить дозу производных арилциклоалкиламинов, устраняющую генерализованные коразоловые судороги.
Пример 90. Фармацевтические композиции
На основе вышеприведенных соединений в результате смешения ингредиентов в заданных количествах были составлены композиции, составы которых приведены в таблице 7.









Пример 91. Противопаркинсонические и нейропротективные свойства производных арилциклоалкиламинов
Эффективность лечения паркинсонизма при помощи фармацевтических композиций, содержащих производные арилциклоалкиламинов и комбинаций производных арилциклоалкиламинов с леводопой или расагилином изучены на модели ротенон-индуцированного паркинсонизма.
Известно [Jason R, Cannon, et all, A highly reproducible rotenone model of Parkinson's disease, Neurobiology of Disease 34, 279-290, 2009], что ротенон при хроническом введении вызывает у крыс симптомы паркинсонизма (каталепсия, атаксия, олигокинезия) вследствие развития дегенеративные изменения нейронов стриатума.
Исследование проводено по следующей технологии: пакринсонизм индуцировали подкожным введением ротенона.
Препараты вводят внутригастрально по лечебной схеме, определяют их влияние на развитие каталепсии, атаксии, олигокинезии крыс.
Животные: крысы популяции Вистар, масса 255±20 г, возраст 14-17 недель (питомник Рапполово, РФ). Количество крыс в группе - 10 (n=10).
Введение ротенона: За 90 мин до первого введения ротенона отбирают крыс с высокой локомоторной активностью (горизонтальная активность не менее 12 сек, вертикальная активность не менее 4 стоек). 0,2 мл раствора в смеси воде вводят один раз в день, в течение 25 сут, подкожно, в дозе 2,3 мг/кг.
Введение препаратов: 1,0 мл раствора в воде д/и вводят в/ж, жестким металлическим зондом, однократно за 45 мин до введения ротенона, один раз в день, в течение 25 сут. В контроле аналогично вводят 1 мл воды д/и.
Противопаркинсоническое действие определено по устранению экстрапирамидных нарушений (атаксии и каталепсии) и олигокинезии у крыс.
Каталепсия, тест «наклонная сетка», в баллах: 3 - иммобилизация от 80 до 120 сек; 2 - иммобилизация от 40 до 70 сек; 1 - иммобилизация от 20 до 35 сек; 0 - иммобилизация менее 20 сек. Атаксия, в баллах: 0 - нет атаксии; 1 - некоординированные движения, гиперлокомоция; 2 - гиперлокомоция, стереотипия, падение на бок; 3 - полное нарушение антигравитационных рефлексов. Олигокинезия (тест «Открытое поле», тестрирование в течение 3 мин), в баллах: 0 - суммарное время ходьбы более 12 сек, число вертикальных стоек более 3; 1 - суммарное время ходьбы 6-11 сек и число вертикальных стоек 1-3; 2 - суммарное время ходьбы 2-5 сек и число вертикальных стоек 0-1; 3 - суммарное время ходьбы 0-1 сек и число вертикальных стоек 0.
Неспецифическое нейропротективное действие определено по устранению летальности и потери массы крыс, эффективность лечебного действия - по уменьшению числа крыс с ротеноновым паркинсонизмом.
Статистическая обработка выполнена с помощью ENOVA.


Производные арилцикломинов подавляют развитие каталепсии, атаксии, олигокинезии, то есть развитие паркинсонизма, в то время как препарат сравнения, леводопа, устраняет экстрапирамидные расстройства и олигокинезию у крыс с паркинсонизмом только в дозах 20 и 40 мг/кг, вызывающих побочное возбуждающее действие на ЦНС. В отличие от леводопы, производные арилциклоалкиламинов устраняют экстрапирамидные расстройства и олигокинезию у крыс с паркинсонизмом и не вызывают побочного возбуждающего действия, характерного для леводопы и мемантина.
Комбинация леводопы и расагилина с производными арилциклоалкиламинов оказывает лечебный противопаркинсонический и нейропротективный эффект без развития выраженного возбуждающего действия на ЦНС. Эффект производных арилциклоалкиламинов усиливается в присутствии N-(2-аминоэтил)пальмитамид гидрохлорида. Применение производных арилциклоалкиламинов и их комбинации с леводопой или с N-(2-аминоэтил)пальмитамид гидрохлоридом перпективны для лечения паркинсонизма.
Пример 92. Активность производных арилциклоалкиламинов при болезни Альцгеймера (модель β-амилоидной амнезии)
Эксперименты выполнены, как описано в литературе [J.J. Miguel-Hidalgo et all. Neuroprotection by memantine against neurodegeneration induced by β-amyloid (1-40). Brain Research 958 (2002) 210-221; Shawn N. Whitehead at all. Interaction Between a Rat Model of Cerebral Ischemia and β-Amyloid Toxicity, Inflammatory Responses. Stroke January, 2005. p. 107-112; Morimoto K, et all, Co-injection of β-amyloid with ibotenic acid induces synergistic loss of rat hippocampal neurons. Neuroscience. 1998; 84: 479-87]. Изучение проводили по следующей технологии: амнезию альгеймеровского типа индуцируют интрацеребральным введением β-амилоида 1-40 (Аβ1-40, Bachem, US). Препараты вводят внутригастрально по лечебной схеме. Антиамнестическую активность подтверждают по сохранию пространственной памяти, неропротективную активность - по сохранению когнитивных функций, выживаемости нейронов мозга крыс.
Животные: крысы-самцы популяции Вистар, масса на начало эксперимента 262±20 г (питомник Рапполово, РФ). Количество крыс в группе - 14 (n=14).
Введение Aβ1-40: непосредственно перед использованием растворяют в 0,15 М ТРИС-буфере (рН 8,7), раствор фильтруют (мембранный фильтр RC, 0,22 мкм). Концентрация Aβ1-40 - 10 мкг/мкл. После анестезии хлоральгидратом (0,35 мг/кг), крыс помещают в стереотаксический аппарат, 5 мкл раствора Aβ1-40 вводят в асептических условиях путем инфузии (1,0 мкл/мин) в правую область гипокампа (СА1). Ложно оперированным крысам аналогично вводят физраствор.
Введение препаратов: 2 мл раствора препарата, внутригастрально, один раз в сутки, в течение 15 сут. Первое введение - через 30 мин после введения Aβ1-40. В контроле аналогично вводят 2 мл физраствора.
Получение срезов. На 15-е сут, 5 крыс выводят из эксперимента (пентобарбитала, 90 мг/кг, в/бр), проводят перфузию раствором 4% формальдегида и 0,05% глутарового альдегида в фосфатном буфере (рН 7,4), мозг выделяют и фиксируют в том же растворе. Получают парафиновые срезы толщиной 10 мкм.
Степень дегенерации нейронов количественно определяют после иммунной гистохимической реакции срезов с моноклональными антителами на GFAP (Thermo Fisher Scientific).
Исследование обучения и памяти выполнено в водном лабиринте Мориса со скрытой платформой [Rudi


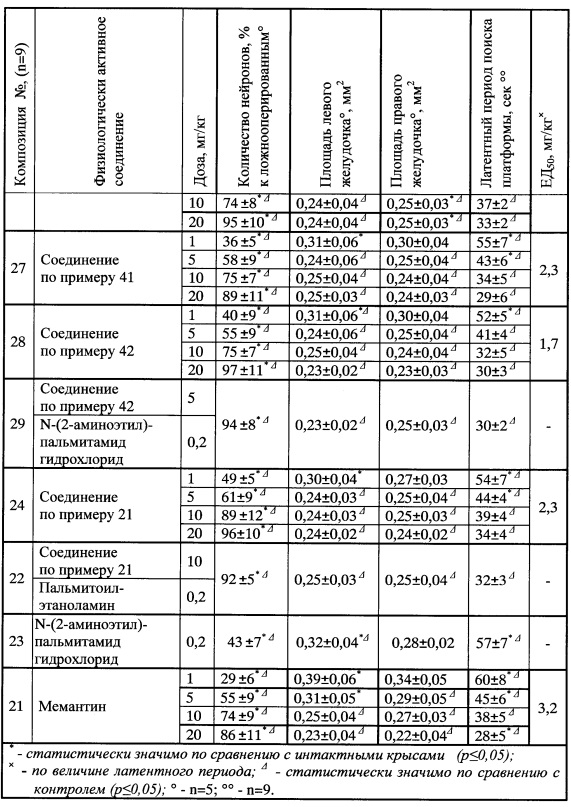
Антиамнестическая активность производных арилциклоалкиламинов при β-амилоидной амнезии, характерной для болезни Альцгеймера, превышает активность мемантина. Нейропротективная активность соединений сопоставима с активностью мемантина.
Применение производных арилциклоалкиламинов в комбинации с N-(2-аминоэтил)пальмитамид гидрохлоридом позволяет увеличить антиамнестиескую и нейропротективную активность фармацевтических композиций.
Пример 93. Антиэпилептическая активность производных арилциклоалкиламинов при эпилепсии
Использованы общепринятые методические подходы [Blanco М,М, et all, Assessment of seizure susceptibility in pilocarpine epileptic and nonepileptic Wistar rats and of seizure reinduction with pentylenetetrazole and electroshock models, - Epilepsia, 2009, 50(4): 824-831]. Исследования проводились по следующей схеме.
Технология выполнения исследования: у крыс вызывается эпилептический статус под действием пилокарпина, вводится коразол, индуцирующий судороги.
При данной фармакорезистентной эпилепсии препараты вводятся внутрижелудочно перед введением коразола. Антиэпилептическая активность препаратов определяется их способностью подавлять судороги.
Животные: крысы популяции Вистар, масса 255±27 г, возраст 12-14 недель (питомник Рапполово, РФ). Количество крыс в группе - 10 (n=10),
Пилокарпиновый эпилептический статус: вводятся: скополамина метилбромид, 1 мг/кг, в/бр; через 30 мин однократно - пилокарпина гидрохлорид, 320 мг/кг, в/бр; через 90 мин после начала эпилептического статуса - в/бр тиопентал натрия, 25 мг/кг. Фармакорезистентные коразоловые судороги у крыс с пилокарпиновой эпилепсией вызваны введением коразола, в/м, в дозе 45 мг/кг, через 30 сут. после пилокарпинового эпистатуса. Введение препаратов: 1 мл раствора или взвеси фармацевтической композиции в воде д/и вводят в/ж, жестким металлическим зондом, подостро: двукратно за 6 час и за 30 мин до введения коразола. Контрольная группа: аналогично вводят 1 мл воды д/и.
Судорожная активность по шкале Racine [Racine R.J. Modification of seizures activity by electrical stimulation: II Motor seizure. Electroencephalogr. Clin. Neurophysiol. 32, 1972]: 0 - отсутствие; лицевые автоматизмы, подергивание ушей и вибрисс; 1 - клонус лица и головы; 2 - клонические судороги передних конечностей; 3 - клонические судороги конечностей, реакция Штраубе и «дикий бег»; 4 - билатеральные клонические судороги передних конечностей совместно с потерей постуральной устойчивости; 5 - множественные билатеральные клонические судороги передних конечностей совместно с потерей постуральной устойчивости; 6 - прыжки; 7 - бег и прыжки; 8 - бег и прыжки вместе с последующими тоническими судорогами; 9 - множественные тонические судороги.


Производные арилциклоалкиламинов подавляют клонико-тонические и тонические клонико-тонических судорог у крыс с эпилепсией, резистентной к вальпроату натрия. Тяжесть судорог снижается от 5,5 балл (контроль) до 1,7-2,7 производными арилциклоалкиламинов, комбинация которых с вальпроатом натрия позволит повысить эффективность лечения эпилепсии вальпроатом и уменьшить побочные эффекты вальпроата, применяемого в клинике.
Пример 94. Антидепрессантная активность производных арилциклоалкиламинов
Антидепрессантивная активность изучена в повторном плавательном тесте Порсольта, как описано в литературе [Porsolt R.D. et all, Behavioural despair in rats: a new model sensitive to antidepressant treatments. Eur. J. Pharmacol. 47, p, 379-391, 1978; Detke M.J. et all. Acute and chronic antidepressant drug treatment in the rat forced swimming test model of depression. Exp. Clin. Psychopharmacol. 5(2):107-112.1997].
Препараты вводили по лечебной курсовой схеме в течение 15 сут, оценено их влияние на показатели депрессии, побочные эффекты антидепрессантов.
Животные: крысы популяции Вистар, масса 220±20 г, возраст 10-12 недель (питомник Рапполово, РФ). Количество крыс в группе 10 (n=10).
Введение препаратов: 2 мл раствора фармацевтической композиции в воде д/и вводят в/ж, жестким металлическим зондом, ежедневно, в течение 2 недель: первый раз через 1 час после первого плавания, на 7-е и 15-е сутки - за 40 мин до повторного плавания крысы.
В остальные дни - в то же время, что на 7-е и 15-е сутки эксперимента. Контроль: аналогично вводят 2 мл воды д/и.
Антидепрессантное действие: на 7 и 15 день теста установлено суммарное время иммобилизации крыс в течение 5 мин повторного плавания.
При депрессии этот показатель превышает 120 сек.
Побочныеэффекты определяют по наличию седации, изменению горизонтальной и вертикальной активности не менее чем в 1,5 раза по сравнению с интактными крысами (тест «Открытое поле»).



Таким образом, производные арилциклоалкиламинов не уступают по антидепрессантной активности амитриптилину и мемантину, но в отличие от них практически полностью лишены побочного седативного (амитриптилин, сертралин) и психостимулирующего (мемантин) действия.
Применение производных арилциклоалкиламинов в комбинации с антидепрессантами позволяет снизить побочные действия антидепрессантов и повысить эффективность лечения депрессии в клинике.
Пример 95. Анальгезирующая и противовоспалительная активность производных арилциклоалкиламинов
Исследования проведены по следующей схеме. Воспаление и боль вызывались у крыс воздействием формалина. Анальгетическая активность оценена в тесте отдергивания хвоста (tail-flick). Препарат вводится по лечебно-профилактической схеме перед индуцированием патологии. Эффективность определена по способности снижать препаратов воспаление и проявлять анальгетическое действие.
Животные: аутобрединговые крысы-самцы Вистар, масса 253±18 г (питомник Рапполово, РФ). После 2 недель акклиматизации, использованы крысы со средней локомоторной активностью (тест «Открытое поле»): время ходьбы 12-15 сек, вертикальных стоек 5-8 в течение 3 мин. Количество крыс в группе - 10.
Введение препаратов: 0,25 мл, в/бр или субплантарно (с/пл) около зоны поражения за 30 мин до введения формалина или термического воздействия.
Препараты вводятся в нарастающих дозах до получения максимальной анальгезии (латентный период рефлекса более 30 сек) при последних трех измерениях болевой чувствительности. В контрольной группе аналогично вводят физраствор.
Острая воспалительная реакция вызвана субплантарным (с/пл) введением 0,1 мл 3%-ного раствора формалина. Толщина задних стоп крысы измерена инструменально.
Выраженность воспалительной реакции и анальгезии оценены через 3 час после индукции воспаления: частота и продолжительность болевой реакции крыс (лизание пораженной конечности, воспалительная боль), продолжительность болевой реакции (сек) за 5 мин наблюдения в острую (0-5 мин) и тоническую фазы (15-60 мин), длительность лизания лапы с 15 по 60 мин.
Анальгезирующее действие, тест отдергивания хвоста (tail-flick).
Боль вызывалась погружением хвоста крысы в воду с температурой 52,0±0,1°С на глубину 4 см от кончика хвоста. Для оценки анальгезии использованы крысы с коротким латентным периодом рефлекса, 4-5 сек, за 15 мин перед введением веществ. Латентный период отдергивания хвоста определен за 15 мин до введения физраствора (интактные крысы), каждые 3 мин после раздражения, в течение 24 мин.
Статистическая значимость различий оценена по t-критерию Стьюдента.


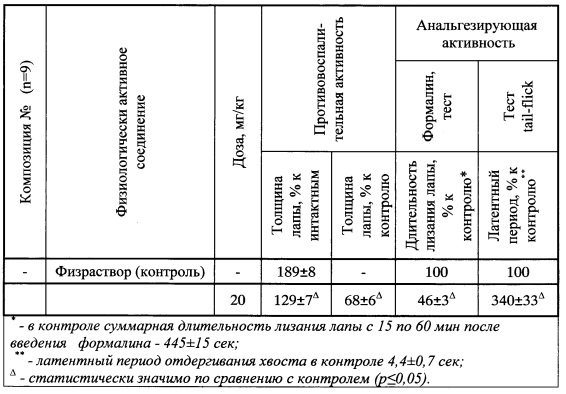
Эксперимент подтверждает противовоспалительную и анальгетическую активность производных арилциклоалкиламинов.
Пример 96. Безопасность и терапевтический индекс производных арилциклоалкиламинов
Безопасность и терапевтический индекс - важнейшие показатели безопасности и качества лекарственных средств. Для установления дозы соединений, вызывающей выраженные нарушения двигательной активности (тесты «открытое поле», «вращающийся стержень», «перевернутая сетка») определены моторные нарушения у крыс Вистар, вызванные в/бр введением препаратов. Оценка токсичности при в/м введении препаратов (изметение двигательной активности не менее чем в 1,5 раза, по сравнению с контролем, наличие тяжелой атаксии), определена доза, вызывающая статистически значимые моторные нарушения у 80% крыс (ТД80). В тесте коразоловых судорог определена доза, устраняющая генерализованные клонико-тонические коразоловые судороги у 80% крыс (ЕД80), в тесте коразолового киндлинга - доза, устраняющая генерализованные клонико-тонические коразоловые киндлинговые судороги у 80% киндлинговых крыс (ЕД80).


Проведенные фармако-биологические исследования показали высокую активность и безопасность применения производных арилциклоалкиламинов и комбинаций производных арилциклоалкиламинов с другими физиологически активными веществами при нейродегенеративных процессах, боли и депрессии.




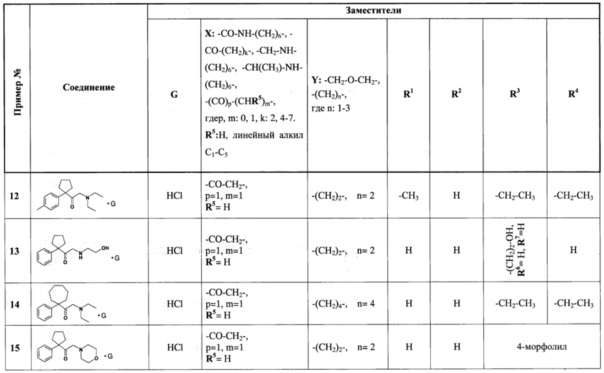
























Отражение функциональных групп производных арилциклоалкиламинов общей формулы (II) в примерах синтеза.

Реферат
Изобретение относится к новым арилциклоалкиламинам общей формулы (I), обладающим нейропротективным, анальгетическим и антидепрессивным действием. Соединения могут быть использованы для лечения нейродегенеративных заболеваний, боли и депрессии. Такими заболеваниями могут быть болезнь Паркинсона, деменция, инсульт, болезнь Альцгеймера, эпилепсия, шизофрения, депрессия. В общей формуле (I)R, Rозначают Н, линейный или разветвленный алкил (C-C), линейный или разветвленный алкокси (C-C), галоген; Y оначает -СН-O-СН-, -(СН)-, где n: 1-3; X означает -CO-NH-(CH)-, -CO-(CH)-, -CH-NH-(CH)-, -CH(CH)-NH-(CH)-, -(CO)-(CHR), где p, m-: 0, 1, k: 2, 4-7, R: H, линейный алкил C-C; R, Rпредставляют собойH, линейный алкил C-C, -CH-C≡CH, -(CH)-O-(CH)-NH, циклопропил, циклопропилметил; 4-пиридинил, аминокислотный остаток протеионогенной ациклической или ароматической α-аминокислоты, γ-аминомасляной кислоты, ε-аминокапроновой кислоты, β-аланина; -CHR-CH-O-R, где R: Н или линейный или разветвленный алкил C-C, бензил, R: Н, линейный алкил С-С, или R, Rвместе с азотом, к которому присоединены, образуют пирролидиновый, 2-(гидроксиметил) пиролидиновый, 4-аминопиридиниевый цикл; G представляет собой (С-С)карбоновую кислоту, метансульфоновую кислоту или минеральную кислоту или воду. В качестве остатка ациклической или ароматической α-аминокислоты они содержат остаток протеиногенной α-аминокислоты. В качестве (С-С)карбоновой кислоты они содержат не менее одного соединения из группы, включающей уксусную, фумаровую, янтарную, винную, яблочную и малеиновую кислоты. В качестве минеральной кислоты они содержат не менее одного соединения из группы, включающей соляную, фосфорную, серную кислоты. Предпочтительными соединениями являются производные арилциклоалкиламинов общей формулы (II), где Y: -СН-O-СН-, -(СН)-. Изобретение также относится к фармацевтической композиции, которая может представлять собой комбинацию производных арилциклоалкиламинов и, по крайней мере, одного вещества из группы, в которую входят леводопа, пальмитоилэтаноламид, N-(2-аминоэтил)пальмитамид гидрохлорид, расагилин, рисперидон, толоксатон, кветиапин, гамма-аминомасляная кислота, натрия вальпроат, амитриптилин, кломепрамин, флуоксетин, пароксетин, сертралин, фенилэфрин, дексаметазон, преднизолон. Композиция может быть выполнена в виде таблетки, капсулы, пеллеты, порошка для приготовления раствора для энтерального введения, раствора для парентерального введения, порошка для приготовления раствора для парентерального введения. 4 н. и 7 з.п. ф-лы, 13 табл., 96 пр.
Формула



Документы, цитированные в отчёте о поиске
Циклоалкиламины в качестве ингибиторов повторного поглощения моноамина
Циклоалкиламины в качестве ингибиторов повторного поглощения моноамина

Комментарии