Способ идентификации и характеризации функций, потенциально имеющихся в биологическом образце, содержащем нуклеиновые кислоты - RU2249045C2
Код документа: RU2249045C2
Чертежи




Описание
Область техники к которой относится изобретение
Изобретение относится к молекулярной биологии, и, в частности, предметом настоящего изобретения является способ, позволяющий идентифицировать функции, потенциально имеющиеся в биологическом образце, содержащем нуклеиновые кислоты, и характеризовать вышеуказанные функции путем экспрессии белка in vitro после транскрипции и трансляции фрагментов ДНК. Характеризацию функции согласно предлагаемому в изобретении способу можно осуществлять, например, путем биохимического анализа этой функции и, в случае необходимости, путем клонирования и/или секвенирования полинуклеотидной последовательности, соответствующей каждой из функций, возможно имеющихся в исследуемом образце.
Таким образом, способ согласно настоящему изобретению позволяет в особенности идентифицировать и выделять гены или белки, которых они кодируют, обладающие определенной или определяемой функцией.
Поиск новых генов и/или белков, которых они кодируют, представляет собой главную задачу многочисленных лабораторий молекулярной биологии. Действительно, генная и клеточная терапия или создание трансгенных животных и растений вселяют новые надежды в отношении здоровья, диагностики и питания человека или животных, однако, делают неизбежной идентификацию многочисленных генов и/или белковых активностей. Так, существуют многочисленные способы выделения и скрининга генов путем клонирования и экспрессии.
Один из этих способов, называемый геномным, состоит в секвенировании части или всего генома организма с последующим поиском в банках данных путем выявления гомологии с уже идентифицированными последовательностями, потенциально кодирующих последовательностей. После идентификации эти последовательности должны быть субклонированы и экспрессированы для подтверждения того, что они эффективно кодируют искомую функцию. Кроме значительного времени, необходимого для осуществления этого способа, он обладает тем недостатком, что с его помощью можно идентифицировать только функции, гомологичные уже известным, кодирующие последовательности которых уже имеются в базах данных.
Исследование белков является вторым возможным подходом к поиску представляющих интерес свойств. Этот подход заключается в экстракции белков, экспрессированных микроорганизмом, и их очистке. Каждую очищенную фракцию затем тестируют для определения того, какая из них обладает искомым свойством. Главный недостаток этого способа заключается в том, что он не позволяет выявить прямую связь между детектируемым свойством и геном, который контролирует экспрессию этого свойства. Вторым недостатком этого подхода является то, что он не позволяет детектировать свойства, которые не были индуцированы в исходном микроорганизме.
Третий способ детектирования экспрессированной микроорганизмом функции состоит в экспрессии путем клонирования. Этот способ включает экстракцию ДНК из исходного микроорганизма, фрагментацию и встраивание в экспрессирующий вектор, которым трансформируют клетки хозяина. Клетки хозяина выбирают по его способности экспрессировать гены исходного микроорганизма. Таким же образом вектор всегда выбирают по его совместимости с хозяином для экспрессии. Способ экспрессии путем клонирования используют в рамках поиска функции в микроорганизме, обладающем генетическими характеристиками, близкими к одному из существующих хозяев (тот же профиль использования кодонов, тот же процент GC, ...). В случае поиска функции исходя из большого числа микроорганизмов разного генетического происхождения способ экспрессии путем клонирования становится неприменимым, поскольку клетки хозяина более неспособны экспрессировать введенные гетерологичные гены.
Кроме того, способ экспрессии путем клонирования, как и другие способы уровня техники выделения и скрининга генов, обладает многочисленными недостатками, такими как:
- клеточная токсичность продуктов транскрипции и трансляции, которая может индуцировать генетическую рекомбинацию, предотвращающую появление токсичных продуктов в клетке;
- небольшая репрезентативность используемого банка;
- значительное время осуществления;
- незначительное соответствие между последовательностью клонированного гена и структурой используемого экспрессирующего вектора;
- широкий диапазон уровней экспрессии;
- проблемы с частотой использования кодонов;
- проблемы выделения, посттрансляционных модификаций;
- проблемы, возникающие за счет влияния физиологического состояния клетки на уровень экспрессии белков, когда осуществляют поиск белковой активности непосредственно в исходных клеточных экстрактах;
- большие трудности с автоматизацией.
Сущность изобретения
Целью настоящего изобретения являлось как раз преодоление этих недостатков путем разработки быстрого и эффективного способа идентификации функции, ассоциированной с полинуклеотидной последовательностью, содержащейся в биологическом образце, который включает нуклеиновые кислоты, и позволяющего выделять вышеуказанную последовательность.
Эта цель была достигнута благодаря способу идентификации характеризации функций, потенциально имеющихся в биологическом образце, содержащем нуклеиновые кислоты, включающему следующие стадии:
(a) получение фрагментов нуклеиновой кислоты из вышеуказанного образца;
(b) встраивание каждого из вышеуказанных фрагментов в векторную молекулу;
(c) выделение каждого, полученного на стадии (b) фрагмента, встроенного в векторную молекулу, или части каждой, полученной на стадии (b) конструкции, представляющей собой векторную молекулу с встроенным фрагментом;
(d) обработка in vitro каждого, выделенного на стадии (с) фрагмента, встроенного в векторную молекулу, или части каждой, выделенной на стадии (с) конструкции, представляющей собой векторную молекулу с встроенным фрагментом, для получения транскриптов;
(e) тестирование функции полученных на стадии (d) транскриптов или кодируемых ими белков, полученных трансляцией вышеуказанных транскриптов.
Способ согласно изобретению обладает определенными преимуществами, поскольку позволяет:
- тестировать свойства транскриптов, полученных на стадии (d), если они обладают полезными свойствами, например т РНК, рибозима; или
- тестировать свойства белков, кодируемых вышеуказанными транскриптами.
При тестировании функций белков, кодируемых полученными на стадии (d) транскриптами, способ согласно изобретению включает на стадии (е) обработку вышеуказанных транскриптов in vitro клеточным экстрактом, позволяющим осуществлять их трансляцию в белок, а затем тестирование функций вышеуказанных белков любым подходящим способом.
Под функцией в свете настоящего изобретения понимают свойство, которое может быть кодировано полинуклеотидной последовательностью. Этим свойством может быть, например, ферментативная активность или сродство, если вышеуказанная последовательность кодирует белок, или, например, эндонуклеазная активность, если вышеуказанная последовательность кодирует каталитическую мРНК.
Таким образом, способ согласно изобретению позволяет не только детектировать функцию, но и также характеризовать ее с биохимической точки зрения. Если функцией является, например, ферментативная активность, то речь может идти об анализе оптимальных условий функционирования (рН, температура, концентрация солей), кинетических параметрах (Vm, Km), параметрах ингибирования (Ki ). Если функцией является сродство, то речь может идти об определении Кd, или молекулы, обладающей наибольшим сродством к этому белку. Речь может идти еще об определении размера транслированного белка или мРНК-транскрипта и возможно о секвенировании соответствующего гена.
Под биологическим образцом понимают любой образец, который может содержать нуклеиновые кислоты, такой как образец почвы, растения, крови человека или животного, воды, микробной культуры, клеточный или вирусный образец, полученный путем биопсии образец, и т.д., однако, эти образцы могут также соответствовать продуктам амплификации (PCR (полимеразная цепная реакция), NASBA, и т.д.), геномной ДНК, синтетической ДНК, мРНК, или любому продукту на основе нуклеиновых кислот, происходящему от обычно используемых специалистом обработок.
Под векторной молекулой понимают одну или несколько полинуклеотидных последовательностей, включающих по крайней мере один промотор транскрипции для осуществления стадии (d) и, в случае необходимости, вещество, облегчающее выделение фрагмента на стадии (с). Предпочтительно этим веществом может быть одна или несколько молекул стрептавидина или биотина, полипирольной группы, антитела; однонитевая или двунитевая полинуклеотидная последовательность, вектор плазмидной ДНК, предпочтительно не включающий последовательностей, контролирующих экспрессию in vivo встроенного фрагмента, или любое другое соединение, позволяющие выделять на стадии (с) встроенный фрагмент.
Под выделением на стадии (с) понимают разделение группы полученных на стадии (b) фрагментов на подмножества, причем подмножество может представлять собой один или несколько фрагментов нуклеиновой кислоты.
Получение фрагментов нуклеиновых кислот на стадии (а) согласно предлагаемому в изобретении способу может включать операцию экстракции, если нуклеиновые кислоты непосредственно недоступны в биологическом образце, например, в случае нуклеиновых кислот, содержащихся в клетках, вирусах, крови, органических элементах, и т.д. В этом случае для получения фрагментов нуклеиновых кислот на стадии (а) включают операцию экстракции. Аналогично, если биологический образец представляет собой мРНК, для получения фрагментов нуклеиновых кислот на стадии (а) необходима стадия полимеразной цепной реакции с обратной транскриптазой.
Согласно предпочтительному варианту осуществления изобретения, векторная молекула включает две полинуклеотидные последовательности, каждая из которых включает по крайней мере один промотор транскрипции. С каждой из этих последовательностей соединен конец одного из фрагментов, полученных на стадии (а).
Согласно предпочтительному варианту осуществления изобретения промотор (промоторы) транскрипции, содержащийся в векторной молекуле, представляет (представляют) собой сильный промотор (промоторы), такие как промотор РНК-полимеразы фага Т7, SP6, Qβ или λ.
Таким образом, способ согласно изобретению позволяет идентифицировать полинуклеотидную последовательность и/или соответствующий белок, обладающую (-щий) функцией, на основе образца, содержащего нуклеиновые кислоты. Эта цель достигается согласно способу, включающему следующие стадии:
(a) получение фрагментов нуклеиновых кислот из вышеуказанного образца;
(b) встраивание каждого из вышеуказанных фрагментов в вектор с получением рекомбинантных векторов;
(c) выделение каждого рекомбинантного вектора или части этого рекомбинантного вектора любым подходящим способом;
(d) обработка in vitro рекомбинантного вектора или части рекомбинантного вектора, выделенного на стадии (с), для получения транскриптов;
(e) тестирование функции транскриптов, полученных на стадии (d), или кодируемых ими белков любым соответствующим способом после трансляции вышеуказанных транскриптов.
Под рекомбинантным вектором, в применении к вышеуказанному способу согласно изобретению, понимают вектор, например, плазмидный вектор, в который введен фрагмент, и под частью этого вектора понимают часть рекомбинантного вектора, содержащего полученный на стадии (а) фрагмент и элементы, необходимые для осуществления стадии (d) и, в случае необходимости, стадии (е).
Стадии способа согласно изобретению могут быть осуществлены последовательно, без перерыва, одним и тем же оператором, предпочтительно в автоматизированном устройстве, включающем каждую из стадий, или они могут быть реализованы периодически, в случае необходимости, разными операторами.
Вместе стадия (d) (транскрипция) и стадия (е) (трансляция) также были названы реакцией экспрессии белка in vitro, обозначаемой так же как реакция EPIV. Реакция EPIV может проводиться одновременно, что означает, что трансляция (стадия (е)) происходит одновременно с транскрипцией (стадия (d)), или может быть разделена на две разные стадии: (d) транскрипции и (е) трансляции.
Разделение стадий (d) и (е) позволяет оптимизировать выход продукта на каждой стадии и, таким образом, получать более значительные количества белков, что является полезным в случае ферментов с незначительной удельной активностью.
Это разделение позволяет также нормализовывать образование продуктов на стадии (е) и сравнивать различные экспрессированные функции.
Разделение транскрипции (стадия (d)) и трансляции (стадия (е)) также позволяет избежать проблем, связанных с разрушением ДНК-матрицы нуклеазами, если матрица получена путем PCR. В самом деле, компоненты реакции транскрипции меньше загрязнены нуклеазами по сравнению с экстрактами для трансляции.
Разделение позволяет, кроме того, использовать различные, в зависимости от происхождения отобранной путем скрининга ДНК, экстракты для трансляции. Действительно, трансляцию транскрипта на стадии (е) предпочтительно осуществлять с помощью экстрактов для трансляции одного и того же происхождения или происхождения, близкого к таковому биологического образца, который используют для осуществления способа согласно изобретению. Таким образом, удается привести в соответствие сигналы трансляции, присутствующие в транскриптах и узнаваемые клеточным экстрактом для обеспечения эффективной трансляции. В качестве примера можно указать использование экстракта для трансляции экстремофильного организма для скрининга банка ДНК одного и того же организма или другого экстремофильного организма (термофилы, галофилы, ацидофилы, и т.д.) или экстракта для трансляции эукариотных клеток для скрининга банка эукариотной ДНК. Соответствующие экстракты способны улучшать эффективность способа. Экстракты выбирают по их способности транслировать транскрипты на стадии (е).
Предлагаемый согласно изобретению способ обладает тем преимуществом, что в нем осуществлено соответствие между экспрессией транскриптов на стадии (d) и используемыми экстрактами для трансляции. Эти экстракты также характеризуются тем, что либо они не обладают искомым свойством, либо они им обладают, но его невозможно обнаружить в условиях теста, реализуемых для детектирования искомой функции. Речь идет, например, об использовании экстракта для трансляции, обладающего β -галактозидазной мезофильной активностью, позволяющей осуществлять трансляцию мРНК термофильной β-галактозидазы и детектировать активность этой последней при высокой температуре, при которой исчезает β-галактозидазная мезофильная активность.
В зависимости от генетического происхождения полученных на стадии (а) фрагментов, например, ДНК грамположительных или грамотрицательных микроорганизмов, эукариотов, вирусов и т.д., и тестируемой функции, следовательно, могут быть использованы различные экстракты для трансляции.
Наиболее предпочтительное осуществление способа согласно изобретению состоит в использовании на стадии (е) экстракта для трансляции, представляющего собой смесь нескольких экстрактов для трансляции. Речь может идти, например, об экстракте для трансляции из Е.coli, сверхпродуцирующей шаперон А, смешанном с экстрактом для трансляции из Е.coli, сверхпродуцирующей шаперон В. Предусматривается любой тип смеси, который соответствует вышеуказанным характеристикам. Таким же образом можно использовать экстракт для трансляции, в который добавлена одна или несколько тРНК, специфичных для одного или нескольких кодонов. Полученные таким образом экстракты для трансляции позволяют осуществлять трансляцию мРНК, включающую эти специфические кодоны, как, например, трансляцию содержащей амбер-кодон мРНК путем добавления в экстракт для трансляции одного или нескольких супрессорных тРНК.
На стадии (е) можно использовать универсальный экстракт для трансляции, независимо от происхождения образца, такой как, например, экстракт Е.coli и/или любой другой клеточный экстракт или любые другие клеточные экстракты, дополненные или нет представляющими интерес молекулами, такими как, например, указанные выше (тРНК, шаперон,...).
К экстракту для трансляции на стадии (е) можно также добавлять одно или несколько веществ, благоприятствующих более эффективному удалению или более эффективному созреванию экспрессированных белков, как, например, шапероны, детергенты, сульфобетаины, мембранные эктракты, и т.д.
Тестирование функции синтезированных на стадии (е) белков может быть осуществлено любым соответствующим способом, позволяющим, например, детектировать искомую ферментативную активность или искомые ферментативные активности. Этот вариант осуществления особенно применим тогда, когда ведут поиск ферментов с принципиально новыми (оригинальными) свойствами, как, например, термостабильные ферменты, активные при высокой температуре, в кислой среде, в среде с высокой концентрацией солей, и т.д., исходя из образца ДНК, происходящего от экстремофильного организма (экстремофильных организмов). Эти экстремофильные ферменты, часто активные в условиях, близких к физиологическим условиям штаммов, которые их продуцируют (температуры, содержание солей, рН, и т.д.), представляют собой инструменты, особенно представляющие интерес для многочисленных промышленных способов (агро-пищевая промышленность, промышленность по производству животных кормов, бумажная промышленность, промышленность детергентов, текстильная промышленность, и т.д.), где ими можно заменить их мезофильные гомологи.
Способ согласно изобретению обладает тем преимуществом, что с его помощью можно осуществлять:
- тестирование свойств транскриптов стадии (d), когда они обладают полезными свойствами типа тРНК, рибозима, или
- тестирование свойств белков, кодированных вышеуказанными транскриптами.
В случае рибозима, обладающего, например, эндонуклеазной активностью, эту активность можно детектировать путем использования нуклеотидной матрицы, содержащей на одном конце флуоресцентную группу и на другом конце группу-"тушитель". В случае расщепления матрицы рибозимом, флуоресцентная группа отделяется от группы-"тушителя", вследствие чего проявляется флуоресценция первой.
В случае тРНК можно использовать, например, полученную в результате реакции фракцию, потенциально содержащую эту тРНК, и вводить ее в реакцию трансляции in vitro, включающую мРНК гена-репортера, один из кодонов которого может быть считан только с помощью искомой тРНК. Если активность гена-репортера обнаружена, то это означает, что тРНК присутствовала в первоначальной фракции и что она сделала возможным осуществление трансляции in vitro мРНК гена-репортера.
В рамках выявления ферментативной активности специалистом может быть предусмотрен любой тип специфического субстрата для обнаружения присутствия или отсутствия искомой функции на стадии (е). Любая трансформация (любые трансформации) субстрата или субстратов с помощью искомой функции или искомых функций может быть обнаружена (могут быть обнаружены) любым, известным специалисту методом (флуориметрия, колориметрия, определение абсорбционной способности, вязкости и т.д.).
В случае выявления сродства можно использовать, например, в зависимости от искомого сродства: антиген-антитело, ДНК связывающий белок - ДНК, рецептор-лиганд, и т.д., тесты, такие, как фиксация меченого радиоактивным изотопом лиганда; иммунологическая детекция, включающая иммобилизацию антигена, его специфическая детекция с помощью искомого антитела и обнаружение этого искомого антитела благодаря антителу против антитела, связанному с репортерной активностью, которая может быть обнаружена, или детекция антигена путем использования козьего антитела, фиксированного на способном распознавать антиген носителе, причем антиген может быть обнаружен с помощью второго, кроличьего антитела (образование "сэндвича"), связанного непосредственно или нет с репортерной активностью (типа щелочной фосфатазы или пероксидазы).
Предпочтительный вариант осуществления способа состоит в тестировании, на стадии (е), параллельно или одновременно, различных свойств одной и той же функции или нескольких функций.
Таким образом, одно из преимуществ способа согласно изобретению состоит в том, что способ позволяет не только детектировать потенциально имеющиеся в биологическом образце функции, но также и проводить:
- количественную характеризацию, когда эти свойства позволяют это, как, например, в случае ферментативной активности или сродства (аффинности);
- биохимическую характеризацию, например, определить оптимальные условия функционирования, такие как температура, рН, концентрация солей, и т.д., а также определить молекулярную массу, провести секвенирование белка, или при необходимости, секвенирование соответствующей полинуклеотидной последовательности.
Другое преимущество способа согласно изобретению состоит в том, что способ совершенно не зависит от экспрессии белков in vivo. Клетки-хозяева, такие как микроорганизмы, если их используют, служат только для выделения и амплификации гетерологичных фрагментов. Следовательно, способ согласно изобретению позволяет избежать всех вышеуказанных проблем, связанных с методами экспрессии путем клонирования согласно уровню техники. В частности, способ согласно изобретению полезен при идентификации генов, экспрессирующих цитотоксичный белок. В этом случае, векторная молекула, в которой клонирован гетерологичный фрагмент на стадии (b), может представлять собой плазмидный вектор, предпочтительно не обеспечивающий экспрессию вышеуказанного фрагмента in vivo. В качестве примера таких векторов можно назвать pBR322 или pACYC184.
Фрагменты на стадии (а) способа согласно изобретению предпочтительно получают путем расщепления нуклеиновых кислот биологического образца или вышеуказанных полинуклеотидных продуктов PCR одной или несколькими эндонуклеазами. Фрагменты могут быть также получены путем механического воздействия на нуклеиновые кислоты, например, путем пропускания через иглу шприца, разрушения под давлением, или обработки ультразвуком, и т.д.
Согласно предпочтительному варианту осуществления способа, в случае, если нуклеиновые кислоты образца могут не требовать фрагментации, как, например, при анализе геномных банков, фрагменты на стадии (а) можно получить, например, путем экстракции и/или очистки и/или подготовки концов фрагментов для встраивания в векторные молекулы, например, для встраивания в плазмидный вектор.
В другом предпочтительном варианте осуществления способа, в случае, если образец происходит от прокариотического организма, получаемые на стадии (а) фрагменты имеют размер от одного до нескольких десятков т.п.н. (тысяч пар нуклеотидов), предпочтительно 1-40 т.п.н., наиболее предпочтительно 1-10 т.п.н. Получаемые на стадии (а) фрагменты предпочтительно имеют размер порядка 5 т.п.н. В самом деле, средний размер прокариотного гена составляет около 1000 пар оснований. Используя фрагменты размером 5000 пар оснований можно получать клоны, несущие полный ген совместно с сайтом связывания рибосом. В случае, если ДНК имеет эукариотическое происхождение, размер получаемых на стадии (а) фрагментов должен быть значительно больше, предпочтительно порядка от нескольких десятков до нескольких сотен тысяч пар нуклеотидов.
Следует отметить, что получаемые на стадии (а) фрагменты могут нести как неполный, так и полный оперон.
Биологический образец, из которого получают фрагменты на стадии (а), может происходить от одного или нескольких, одинаковых или разных прокариотных организмов или эукариотных клеток, или также вирусов. Речь может идти, например, об образце нуклеиновых кислот микроорганизма или смеси микроорганизмов, или об эукариотических клетках тканей или организмов, как одинаковых, так и разных. Однако, образец нуклеиновых кислот также может представлять собой последовательность или банк нуклеиновых кислот. Биологический образец может также представлять собой известные или неизвестные организмы и/или нуклеиновые кислоты. Образец также может представлять собой синтетические нуклеиновые кислоты.
В случае банка эукариотической ДНК, реакция транскрипции может быть дополнена реакцией сплайсинга и процессинга мРНК in vitro, используя, например, ядерный экстракт (3).
Способ согласно изобретению обеспечивает прямую связь между выявляемой на стадии (е) функцией и соответствующей полинуклеотидной последовательностью. Этот способ, следовательно, в особенности предназначен для обнаружения функций и идентификации соответствующих генов, исходя из геномной ДНК. Под геном понимают фрагмент или последовательность ДНК, определяющие биологическую функцию.
Как указано выше, согласно другому предпочтительному варианту осуществления способа согласно изобретению, векторная молекула, в которой клонированы фрагменты нуклеиновой кислоты на стадии (b), представляет собой плазмидный вектор. В этом случае, на стадии (b) способа согласно изобретению, каждый фрагмент встроен в вектор по сайту рестрикции или кассеты с использованием клонирования. Плазмидный вектор должен включать промотор для РНК-полимеразы с одной стороны сайта клонирования и необязательно терминатор для РНК-полимеразы с другой стороны. Под этим вектором также можно понимать вектор, включающий сайт клонирования, находящийся между двумя, одинаковыми или разными, промоторами для РНК-полимеразы, необязательно фланкированными с той и другой стороны соответствующим терминатором или соответствующими терминаторами для РНК-полимеразы. Использованные промоторы и терминаторы предпочтительно не способны функционировать в микроорганизме, который используют для выделения рекомбинантных векторов на стадии (с).
В случае, если вектор не включает промотор (промоторы) и/или необязательно терминатор (терминаторы) для РНК-полимеразы, или в случае, если промотор (промоторы) и необязательно терминатор (терминаторы) для РНК-полимеразы неадекватны для осуществления стадии (d), этот промотор (эти промоторы) и возможный терминатор (возможные терминаторы) могут быть встроены на стадии (с) способа согласно изобретению любым соответствующим методом. Предпочтительно это встраивание осуществляют путем полимеразной цепной реакции с набором праймеров, несущих последовательности промотора (промоторов) и терминатора (терминаторов).
Согласно другому предпочтительному варианту осуществления способа используют сильный промотор (промоторы) и необязательно сильный терминатор (терминаторы) такие, как, например, у бактериофага Т7.
В случае, если в качестве вектора используют плазмидный вектор, выделение рекомбинантного вектора на стадии (с) может быть осуществлено путем трансформации клеток-хозяев с помощью всего пула полученных на стадии (b) рекомбинантных векторов для создания банка клонов с последующей экстракцией рекомбинантного вектора или части рекомбинантного вектора, содержащегося в каждом клоне банка любым соответствующим способом.
Экстракция рекомбинантного вектора или части рекомбинантного вектора, фланкированной промотором (промоторами) и необязательно терминатором (терминаторами) для РНК-полимеразы, может быть осуществлена любым, известным специалисту способом, как, например, мини-выделение и, при необходимости, расщепление, или путем полимеразной цепной реакции. Другой предпочтительный способ заключается в проведении полимеразной цепной реакции с олигонуклеотидами, защищенными фосфортио-группами по 5'-концам от разрушения нуклеазами, особенно нуклеазами, содержащимися в среде для трансляции.
Как указано выше, разделение на стадии (с) может быть осуществлено любым физическим, механическим или химическим способом, таким как, например, простым предельным разведением совокупности фрагментов, встроенных в векторную молекулу на стадии (b). Однако, разделение также предпочтительно может быть осуществлено с использованием свойств специфического вещества, ген которого встроен в векторную молекулу, например в случае антител выделение фрагмента может быть основано на использовании сродства антиген-антитело, или в случае биотина, выделение может быть основано на использовании сродства биотин-стрептавидин, и т.д.
Согласно еще одному предпочтительному варианту осуществления способа, осуществляют выбор полученных на стадии (с) фрагментов или части фрагментов, встроенных в векторную молекулу, полученных на стадии (с). Для этого при проведении реакции EPIV для каждого из полученных на стадии (с) фрагментов или части фрагментов, встроенных в векторную молекулу, в реакционную смесь для трансляции стадии (е) вводят маркер белкового синтеза (биотинилированная тРНК, модифицированная аминокислота, и т.д.). Каждый продукт реакции EPIV затем анализируют, например, путем твердофазного иммуноферментного анализа (ELISA), на наличие экспрессированного белка. Определяют фрагменты или их части, встроенные в векторную молекулу, для которых реакция EPIV является отрицательной. Эти фрагменты не содержат открытой рамки считывания. Вследствие этой операции предварительного скрининга эти фрагменты исключаются из последующих скринингов в отношении идентификации активностей, связанных с белком. Такая операция предварительного скрининга позволяет получить выигрыш во времени и в реагентах в случае повторного и не одновременного для одного и того же банка скрининга.
Согласно еще одному предпочтительному варианту осуществления способ проводят полностью на твердом носителе типа микрогранул, мембран или титрационного микропланшета. В качестве носителей могут быть использованы стеклянные пластины, нитроцеллюлозные мембраны или любые другие известные специалисту носители. Встроенные в векторную молекулу фрагменты выделяли с использованием этого носителя или титрационного микропланшета и реагенты, позволяющие осуществлять способ согласно изобретению, наносили на этот носитель. Тестирование искомой функции или функций может быть проведено непосредственно на носителе после его промывки. В случае, если векторной молекулой является плазмидный вектор и если способ согласно изобретению осуществляли на носителе, колонии, трансформированные рекомбинантными векторами, переносили по отдельности на один и тот же носитель, и затем лизировали in situ (3) для высвобождения рекомбинантного вектора. Другой вариант осуществления того же типа состоит в том, что каждый рекомбинантный вектор или часть рекомбинантного вектора наносят по отдельности на один и тот же носитель. Затем можно наносить реагенты, позволяющие осуществлять реакцию EPIV на носителе, включающем ДНК, нанесенную согласно одному из вышеописанных способов. Тестирование функции можно осуществлять прямо на носителе после его промывки.
Предметом изобретения также являются:
- неизвестные полинуклеотидные последовательности, идентифицированные и селекционированные по способу согласно изобретению;
- содержащие эти полинуклеотидные последовательности фрагменты, встроенные в векторные молекулы;
- плазмидные векторы, содержащие эти последовательности; клетки-хозяева, трансформированные этими полинуклеотидными последовательностями или этими векторами; или
- белки, кодированные этими последовательностями.
Изобретение также относится к любому банку, образованному:
- полинуклеотидными последовательностями, выделенными по способу согласно изобретению;
- векторными молекулами, содержащими эти последовательности фрагментами;
- векторами, содержащими вышеуказанные последовательности;
- клетками-хозяевами, трансформированными одной из этих последовательностей или одним из этих векторов; или
- белками, кодированными вышеуказанными последовательностями.
Способ согласно изобретению, по отношению к способам уровня техники, обладает тем преимуществом, что он может быть автоматизирован. В случае, если векторной молекулой является плазмидный вектор, эта автоматизация может быть осуществлена следующим образом:
- каждый рекомбинантный вектор банка, полученного на стадии (b), может быть выращен на носителе, в лунке микропланшета, с помощью автоматического устройства (робота) типа Colony Picker;
- эта культура может быть использована на стадии плазмидной экстракции, проводимой с помощью автоматического устройства типа BioRobot 9600 (QIAGEN), или на стадии амплификации PCR, осуществляемой устройством типа MultiProbe (PACKARD), в автоматической термоячейке для проведения реакций типа РТС 200 или РТС 225 (автоматизированный, оборудованный роботами действующий механизм - MJ RESEARCH);
- очистка продуктов PCR может быть осуществлена с помощью автоматического устройства BioRobot 9600;
- реакция EPIV на стадиях (d) и (е) может быть полностью проведена с помощью автоматического устройства MultiProbe. Тестирование функций транскриптов, полученных на стадии (d), может быть осуществлена с использованием автоматического пипеттора, а считывание результатов может быть осуществлено с помощью соответствующего считывающего устройства. Если реакция транскрипции проводится отдельно от реакции трансляции, то возможная очистка мРНК может быть осуществлена с помощью BioRobot 9600;
- тестирование активности синтезированных белков на стадии (е) осуществляют с использованием автоматического пипеттора, а считывание результатов осуществляют с помощью соответствующего считывающего устройства (на основе спектрофотометрии, колориметрии, флуорометрии, и т.д., в зависимости от реализуемого теста) для считывания микропланшетов или любым другим соответствующим способом.
Следовательно, изобретение также относится к автоматизированному устройству для осуществления вышеописанных способов, включающему компоновку одного или нескольких носителей, роботов, автоматов и считывающих устройств, позволяющую при необходимости приготовить образец на стадии (а); осуществлять, в случае необходимости, стадию встраивания фрагментов в векторную молекулу на стадии (b); при необходимости, выделять вышеуказанные, клонированные в векторной молекуле фрагменты на стадии (с) и осуществлять стадии (d) и (е). Обеспечивая высокую частоту повторения способа согласно изобретению, или части способа согласно изобретению (стадии (d) и (е)), эта компоновка автоматов позволяет быстро проводить поиск функций, исходя из различных образцов нуклеиновых кислот.
В способе согласно изобретению может быть использован любой плазмидный вектор, обладающий вышеуказанными характеристиками. В качестве примера можно указать вектор, представленный на фиг.2 и сконструированный следующим образом:
- ori плазмидной репликации;
- сайт клонирования, находящийся между двумя идентичными промоторами, такими как промотор Т7, или любой другой сильный промотор, такой, как Qβ, T3, SP6, и т.д., возможно фланкированными, и тот и другой, терминатором транскрипции. Эти промоторы и терминатор, если он имеется, предпочтительно не функционируют в используемом для выделения рекомбинантных векторов микроорганизме. Такая конструкция позволяет транскрибировать фрагмент ДНК, встроенный в сайт для клонирования, каков бы ни был смысл его встраивания. Вероятность нахождения хорошего клона, следовательно, увеличивается вдвое. Средний размер прокариотного гена составляет примерно 1000 пар оснований. За счет использования фрагментов прокариотной ДНК размером примерно 5000 пар оснований для создания банка очень вероятным является получение клонов, несущих полные гены с присущим им сайтом связывания рибосом (RBS). В предложенной системе двойного промотора ген расположен примерно на 2000 оснований перед началом мРНК, что благоприятствует возможной эффективной экспрессией соответствующего белка по способу согласно изобретению (как показано в экспериментальной части для β -лактамазной активности);
- при необходимости, специфические последовательности одного и другого из терминаторов могут служить сайтами гибридизации при амплификации путем PCR включенного в вектор полинуклеотидного фрагмента;
- селектирующий ген, например ген тРНК (4), при необходимости, параллельно, ген устойчивости к антибиотику (или другой тип селектирующего гена) встроен в сайт для клонирования. Селекция с помощью антибиотика используется только для препаративной амплификации клонирующего вектора. Действительно при встраивании каждого из вышеуказанных фрагментов на стадии (b), фрагмент ДНК заменяет ген устойчивости. Эта система обладает тем преимуществом, что не зависит от селекции с помощью антибиотика, которая вызывает проблемы контаминации и деструкции антибиотика, и позволяет получать рекомбинантный вектор, не имеющий иной открытой рамки считывания, чем открытая рамка считывания, возможно введенная гетерологичным фрагментом. С другой стороны, эта система позволяет очень быстро оценивать содержание негативных клонов путем осуществления параллельного высевания аликвоты банка на минимальную среду и на среду, содержащую антибиотик для селекции.
Еще одно из преимуществ способа согласно изобретению состоит в том, что способ позволяет обнаруживать полинуклеотидные функции в отобранных образцах, характеризовать их и идентифицировать соответствующие нуклеотидные последовательности. Таким образом, способ согласно изобретению не требует выделения каждого микроорганизма, присутствующего в отобранном образце. Известно, что выделение содержащихся в отобранном образце микроорганизмов приводит к ограниченным результатам, поскольку при этом удается проанализировать только несколько процентов из всего разнообразия присутствующих микроогранизмов. Кроме того, способ согласно изобретению обеспечивает значительный выигрыш в отношении времени. Способ согласно изобретению обеспечивает наилучшие результаты, поскольку позволяет скринировать биоразнообразие порядка 100% в срок 5-10 дней, в то время как способы уровня техники позволяют анализировать порядка 5% биоразнообразия, присутствующего в отобранном образце в течение нескольких недель или даже нескольких месяцев, при этом же времени необходимо для скрининга этих штаммов с целью детектирования тестируемой белковой активности. Способ согласно изобретению также является полезным для поиска белковых активностей в патогенном микроорганизме или данной клетке. Геномный банк или банк кДНК может быть легко получен и подвергнут скринингу согласно предложенному способу. В случае банка кДНК векторная молекула включает последовательность, необходимую для инициации трансляции с учетом используемого на стадии (е) экстракта для трансляции. Помимо своей быстроты, способ согласно изобретению не зависит от физиологии конкретной клетки. Так, он позволяет детектировать белковые активности без необходимости решения проблем культивирования и физиологических состояний. Способ согласно изобретению позволяет тестировать непосредственно ген, исходя из определения функции организма. Он позволяет также находить функцию в организме, потенциально обладающем вышеуказанной функцией. Этот способ, благодаря своей быстроте и эффективности, позволяет осуществлять скрининг одной или нескольких функций большого числа организмов коллекции и, следовательно, оценивать ее микробиологическое биоразнообразие. Этот способ будет полезен при идентификации представляющих промышленный интерес белковых активностей, исходя из выделенных экстремофильных организмов или еще сырого образца, приготовленного из вышеуказанных организмов.
Наконец, способ согласно изобретению представляет интерес в области исследования генома. Вследствие своей концепции, он позволяет идентифицировать новые гены без осуществления секвенирования на первой стадии, так как он позволяет непосредственно переходить к детектированию функции, кодируемой соответствующей полинуклеотидной последовательностью. При применении к совокупности геномной ДНК организма, способ согласно изобретению позволяет получать характеристику всего фенотипа этого организма, вследствие чего для него вводят название "феномный".
Изобретение относится также к набору для осуществления вышеуказанного способа согласно изобретению. Этот набор включает:
- средства, необходимые для получения фрагментов нуклеиновых кислот;
- по крайней мере одну векторную молекулу;
- по крайней мере один агент полимеризации;
- необязательно, по крайней мере один клеточный экстракт для трансляции;
- средства, необходимые для тестирования одной или нескольких функций;
- буферы, необходимые для осуществления различных стадий.
Этот набор может быть упакован в одну или различные емкости.
Другие преимущества и характеристики изобретения следуют из нижеприводимых примеров осуществления изобретения, в которых ссылаются на прилагаемые чертежи.
Перечень фигур
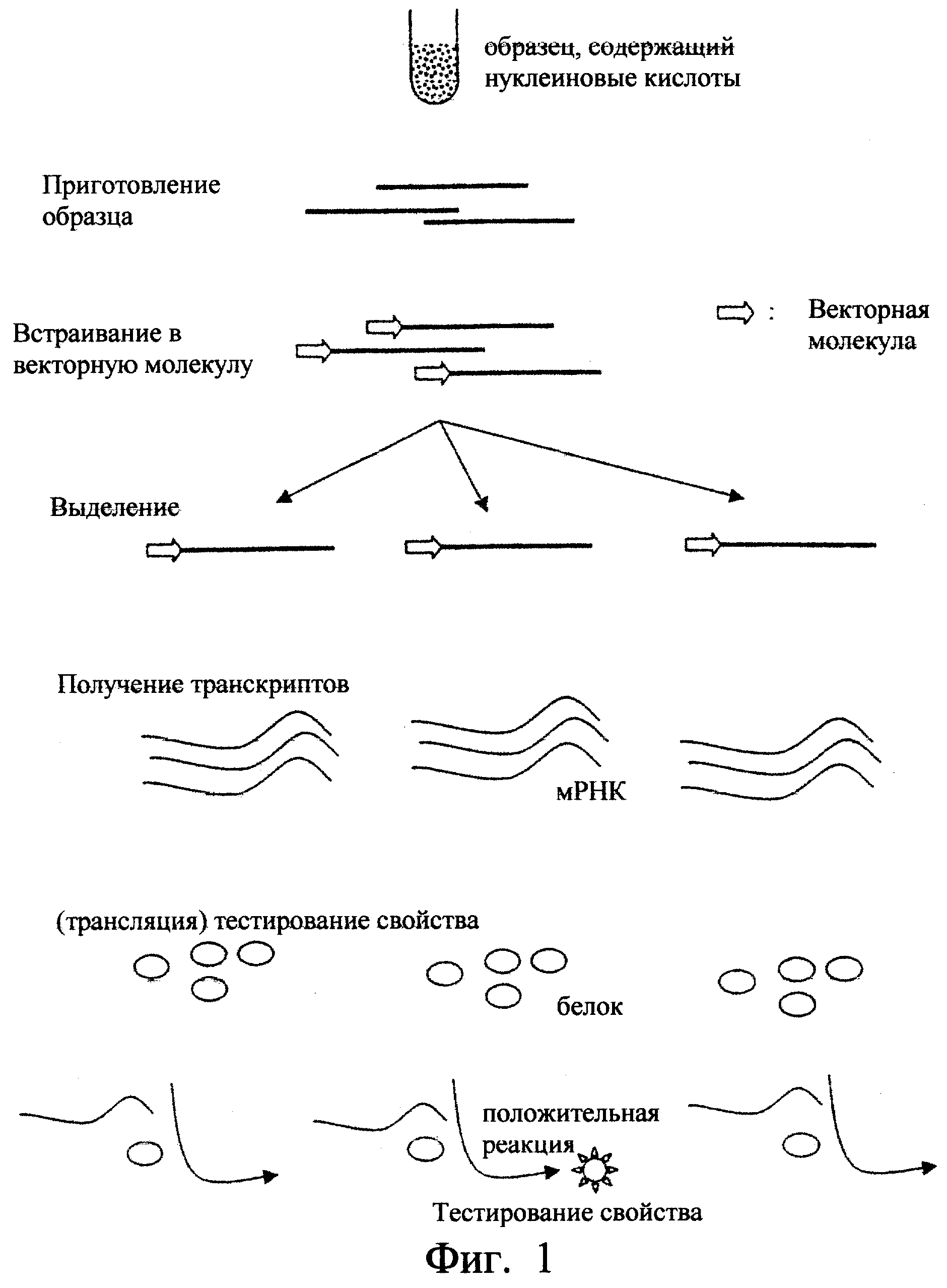
Фиг.1. Схематично показан пример осуществления способа согласно изобретению.
Фиг.2. Показан пример карты клонирующего вектора для конструирования банка.
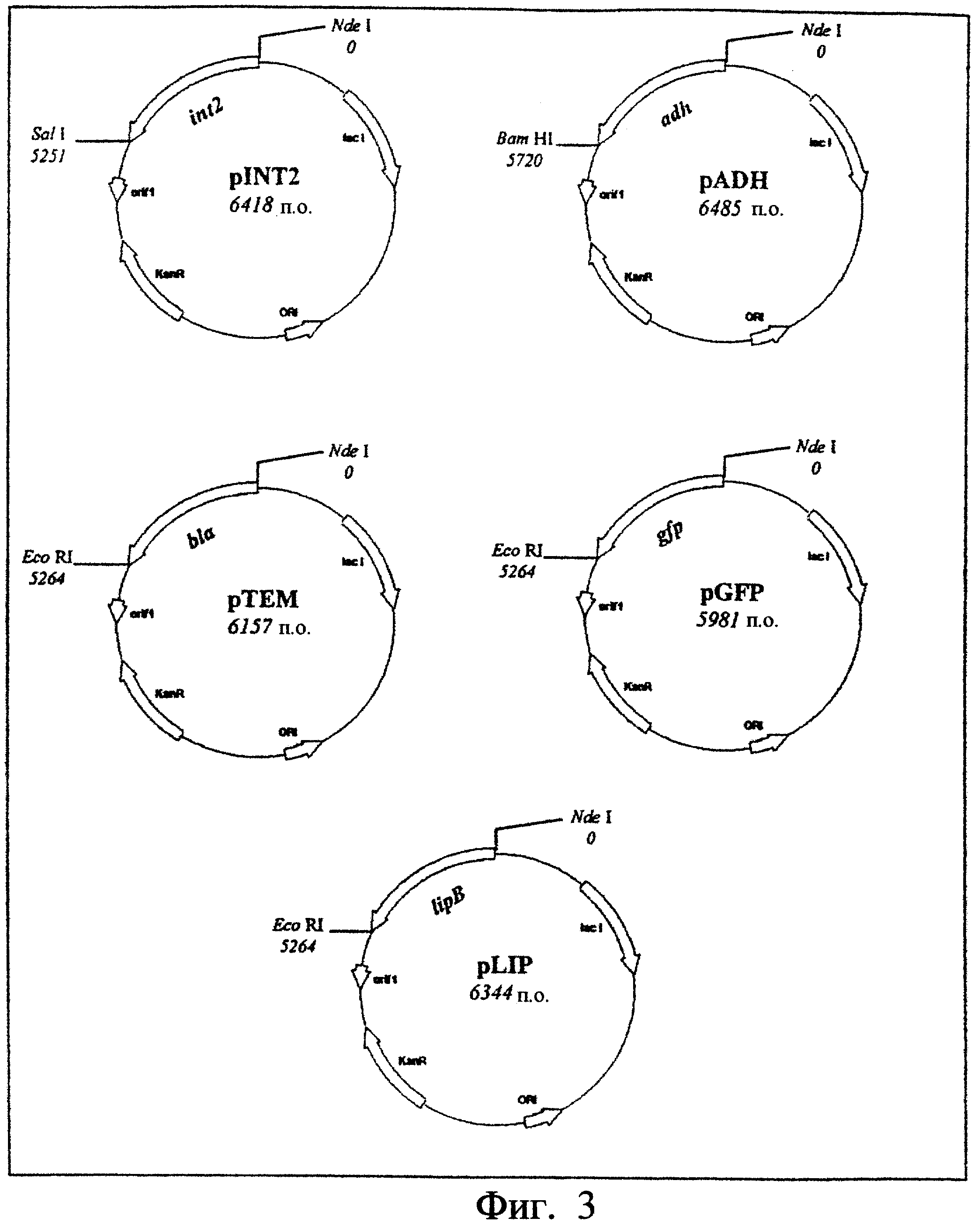
Фиг.3. Показаны карты плазмид pADH, pTEM, рЕТ26-Tfu2, pLIPet, pGFP.
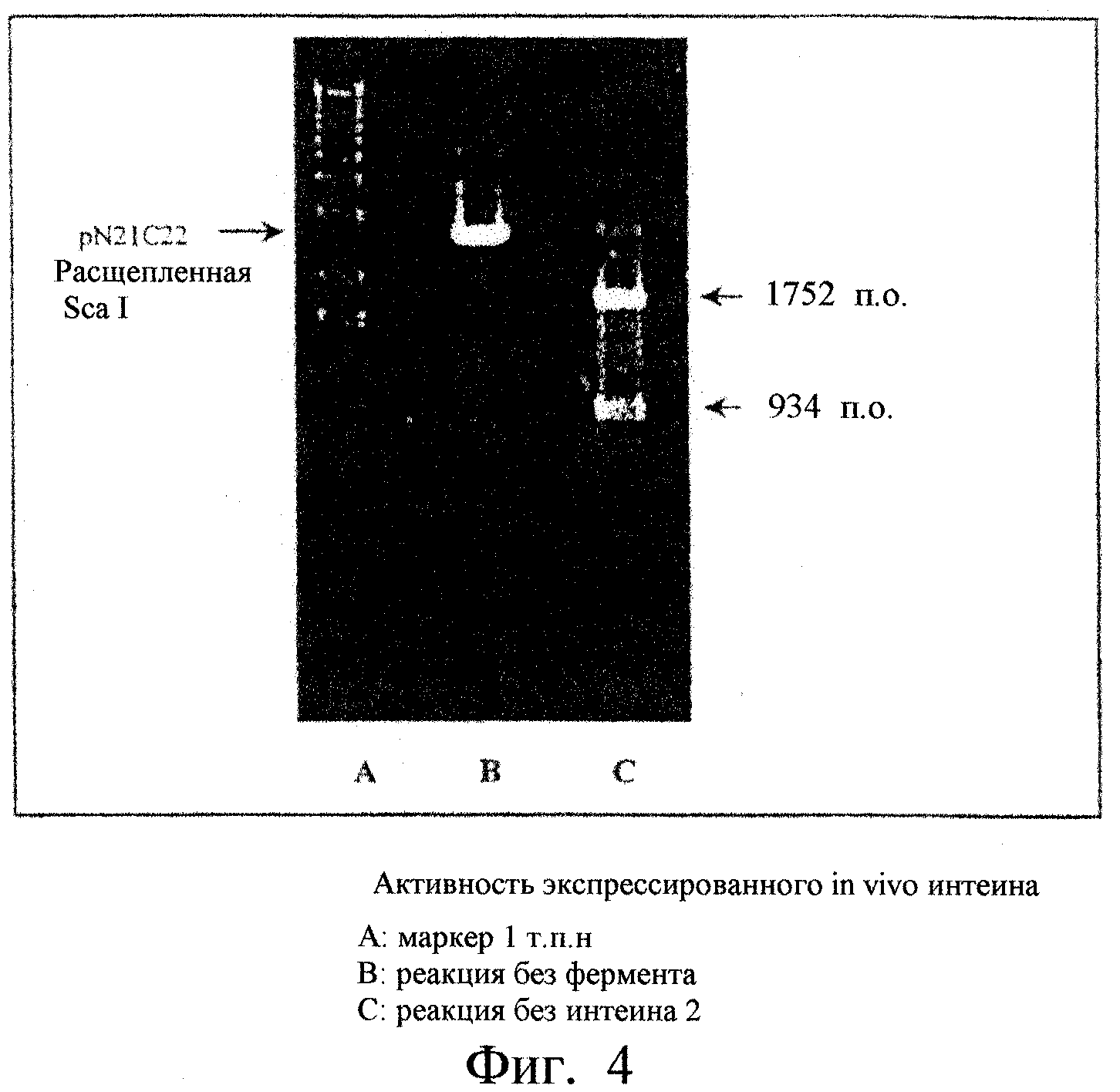
Фиг.4. Показана активность интеина 2 ДНК-полимеразы Thermococcus fumicolans (Tfu), полученного in vivo способом экспрессии путем клонирования: 1 - Маркеры (масштаб 1 т.п.н.), 2 - реакция без фермента, 3 - реакция с интеином 2.
Фиг.5. Показана активность GFP, полученного путем реакции EPIV (эмиссия флуоресценции вследствие выдержки под действием лучей с длиной волны примерно 400 нм) с экстрактами для мезофильной трансляции. Пробирка А: реакция EPIV с водой (контроль). Пробирка В: реакция EPIV с вектором pGFP.
Фиг.6. Показана активность интеина 2 Tfu ДНК-полимеразы, продуцированного путем реакции EPIV с экстрактом для трансляции мезофильного типа. 1 - Маркеры (масштаб 1 т.п.н.). 2 - Т- (реакция без фермента). 3 - контроль (реакция EPIV без ДНК). 4 - Т+ (реакция с интеином 2, синтезированным in vivo). 5 - опыт (реакция с интеином 2, синтезированным путем реакции EPIV (pET26-Tfu2)).
Фиг.7. Показано детектирование активности термофильного фермента, полученного при использовании экстракта для мезофильной трансляции и обладающего вышеуказанной активностью. Пробирка А: реакция EPIV с водой (контроль) инкубация при температуре 37°С. Пробирка В: реакция EPIV инкубация при температуре 37°С. Пробирка С: реакция EPIV с водой (контроль) инкубация при температуре 70°С, после центрифугитрования. Пробирка D: реакция EPIV инкубация при температуре 70°С, после центрифугирования.
Сведения, подтверждающие возможность осуществления изобретения
I - Материалы
1) Штаммы и плазмиды
Вектор рЕТ26b+ входит в семейство векторов рЕТ, описанное Studier и Moffatt (8) и выпускаемое в продажу фирмой NOVAGEN. Этот вектор позволяет экспрессировать гены под контролем промотора фага Т7. Вектор PINPOINT™ (PROMEGA) содержит ген cat (кодирующий хлорамфениколацетилтрансферазу) под контролем промотора РНК-полимеразы фага Т7. Вектор pHS2-22-21 сконструирован путем введения с помощью обратной полимеразной цепной реакции гена интеина 2 Tfu ДНК-полимеразы по полилинкерному сайту плазмиды pUC19. Вектор pHS2-22-21 соответствует pUC 19, содержащей homing- сайт (43 пары оснований) интеина или сайт, в который встроен ген интеина.
Штамм XLl-Blue [Tn10 proА+B+ lacIq


2) Реагенты
Ферменты для рестрикции и модификаций, перечисленные в таблице I, были использованы согласно рекомендациям поставщиков.
Используемые буферы описаны в таблице II.
II - Получение и тестирование плазмид
1) Конструкции
Плазмида pET26-Tfu2, представленная на фиг.3, была получена путем встряхивания гена интеина 2 Tfu ДНК-полимеразы (itfu2) (номер, под которым находится в банке генов: Z69882) между свитами рестрикции Nde I и Sal I вектора рЕТ26b+. Таким же образом плазмида pADH была получена путем встраивания гена алкогольдегидрогеназы (adh) Thermococcus hydrothermalis между сайтами рестрикции Nde I и Bam HI вектора рЕТ26b+ и плазмиды pADH, pTEM, pGFP и pLIP, представленные на фиг.3, были получены путем встраивания генов β-лактамазы ТЕМ-1 (blа) Escherichia coli (9), флуоресцирующего зеленым свечением белка (Green Fluorescent Proteine) (gfp) Aequorea victoria (6) и липазы В Candida antarctica (lipB) (номер, под которым находится в банке генов: Y14015), соответственно, между сайтами рестрикции Nde I и Eco RI вектора рЕТ26b+. Для каждого из этих четырех генов сайт рестрикции Nde I был перекрыт инициаторным кодоном трансляции ATG.
Каждая конструкция была подтверждена несколькими анализами профиля рестрикции. 200 мкл компетентных клеток XLl-Blue (1) трасформировали 10 нг каждой плазмиды путем теплового удара тока (2), трансформированные клетки высевали в виде монослоя на твердую среду LB (бульон Луриа), содержащую 60 мкг/мл канамицина и 12,5 мкг/мл тетрациклина. Плазмидную ДНК из трансформированных клонов выделяли с помощью хроматографии на колонке TIP100 (QIAGEN). ДНК осаждали изопропанолом и растворяли в 100 мкл буфера Т. Концентрацию плазмидных ДНК определяли спектрофотометрически при 260 нм. Чистоту плазмидной ДНК подтверждали путем электрофореза 0,2 мкл каждого вектора в 1% агарозном геле.
2) Тесты in vivo экспрессии - тестирование активности
- рТЕМ: 200 мкл компетентных клеток BL21 DЕ3 (pLysS) трансформировали 10 нг плазмиды рТЕМ путем теплового шока, трансформированные клетки высевали в виде монослоя на твердую среду LB (бульон Луриа), содержащую 60 мкг/мл канамицина, 20 мкг/мл хлорамфеникола, 32 мкг/мл изопропил-β -D-тиогалактозида (IPTG) и 100 мкг/мл ампициллина. После инкубации в течение ночи при температуре 37°С в чашке Петри можно было наблюдать рост многочисленных колоний, свидетельствующие о том, что ген ТЕМ-1 плазмиды рТЕМ экспрессируется, является функциональным и придает устойчивость к ампициллину.
- pGFP: 200 мкл компетентных клеток BL21 DL3 (pLysS) трансформировали 10 нг плазмиды рТЕМ путем теплового шока, трансформированные клетки высевали в виде монослоя на твердую среду LB (бульон Луриа), содержащую 60 мкг/мл канамицина, 20 мкг/мл хлорамфеникола и 32 мкг/мл изопропил-β-D-тиогалактозида. После инкубации в течение ночи при температуре 37°С в чашке Петри можно было наблюдать рост многочисленных колоний. Совокупность этих колоний реагировала на возбуждение ультрафиолетовыми лучами (с длиной волны примерно 400 нм), эметтируя зеленое флуоресцентное свечение, что подтверждает, что ген gfp плазмиды pGFP экспрессируется и является функциональным.
- pET26-Tfu2: 200 мкл компетентных клеток BL21 DE3 (pLysS) трансформировали 10 нг плазмиды pET26-Tfu2 путем теплового тока, трансформированные клетки высевали в виде монослоя на твердую среду LB (бульон Луриа), содержащую 60 мкг/мл канамицина и 20 мкг/мл хлорамфеникола. Трансформированные клоны с плотностью OD600 nm=0,5 индуцировали 0,5 мМ изопропил-β-D-тиогалактозидом в течение двух часов при температуре 37°С. После центрифугирования осадок бактерий суспендировали в 20 мМ натрийфосфатном буфере, рН 7,5 и клетки лизировали с помощью нескольких циклов замораживание/оттаивание. Интеин 2 очищали на колонке QFast-Flow с градиентной элюцией NaCl. Активность фермента тестировали следующим образом: 1 мкл элюированной фракции с наибольшей концентрацией чистого фермента разводили в сто раз. Один мкл разведения инкубировали в течение 15 минут при температуре 70°С вместе с 3 мкл буфера IT2 и 220 нг плазмиды рНS2-22-21, расщепленной Sca I, в конечном объеме 30 мкл. После рестрикции 15 мкл этой смеси анализировали с помощью электрофореза в 1% агарозном геле. После миграции и окрашивания этидиумбромидом гель смотрели под ультрафиолетом. Как показано на фиг.4, было обнаружено две полосы, 934 пары оснований и 1752 пары оснований соответственно, соответствующих рестриктированному вектору pHS2-22-21 (1 сайт Sca I), содержащему ген интеина 2. Ген itfu2 плазмиды pET26-Tfu2, следовательно, экспрессируется и его продукт, интеин 2, является активным.
- pADH: 200 мкл компетентных клеток BL21 DE3 (pLysS) трансформировали с помощью 10 нг ллазмиды pADH путем теплового тока, трансформированные клетки высевали в виде монослоя на твердую среду LB (бульон Луриа), содержащую 60 мкг/мл канамицина и 20 мкг/мл хлорамфеникола. Трансформированные клоны с плотностью OD600 nm=0,5 индуцировали 1 мМ изопропил-β-D-тиогалактозидом в течение трех часов при температуре 37°С. После центрифугирования осадок бактерий суспендировали в буфере, содержащем 50 мМ фосфата натрия и 10 мМ MgCl2, pH 8,0, и клетки лизировали в течение 30 минут на льду в присутствии 1 мг/мл лизоцима, 10 мкг/мл рибонуклеазы А и 100 мкг/мл дезоксирибонуклеазы I. Лизат центрифугировали, супернатант инкубировали в течение 30 минут при температуре 50°С и снова центрифугировали. В полученном супернатанте определяли ферментативную активность. Отрицательным контролем служили аналогичным образом обработанные клетки BL21 DЕ3 (pLysS), не содержащие плазмид. Алкогольдегидрогеназную активность определяли спектрофотометрически по кинетике восстановления никотинамид-аденин-динуклеотид-фосфата (NADP) до восстановленной формы никотинамид-аденин-динуклеотид-фосфата (NADPH) при длине волны 340 нм. Для этого 10 мкл анализируемого или контрольного супернатанта добавляли 500 мкл буфера TADH и 490 мкл воды и инкубировали при температуре 50°С в течение пяти минут. В этих условиях активность составила 15,6 ед. оптической плотности/мин/мл для анализируемого супернатанта и 0 ед. оптической плотности/мин/мл для контроля. Ген adh плазмиды pADH, следовательно, экспрессируется и его продукт, алкогольдегидрогеназа, является активным.
III - Опыты по экспрессии белка in vitro (EPIV) с экстрактом для трансляции, полученным из мезофильных штаммов (37°С)
4 мкг каждого вектора осаждали одной десятой объема 3М раствора ацетата натрия, рН 6,0, и двумя объемами абсолютного 100%-ного этанола. Осадки промывали 70%-ным этанолом для удаления следов солей. ДНК ресуспендировали в 4 мкл буфера Т.
ДНК инкубировали в течение двух часов при температуре 37°С в смеси для экспрессии белка in vitro, содержащей 0, 1 мМ каждой из 20 аминокислот, 20 мкл экстракта "S30 Premix" и 15 мкл "экстракта Т7 S30" (PROMEGA) в конечном объеме 50 мкл. Экстракты "330 Premix" и "экстракт Т7 330" содержат все элементы, необходимые для реакции транскрипции in vitro, "спаренной" с реакцией трансляции, а именно: Т7 РНК-полимеразы, цитидин-5'-трифосфат (СТР), уридин-5'-трифосфат (UTP), гуанозин-5'-трифосфат (GTP), аденозин-5'-трифосфат (АТР), тРНК, этилендиаминтетрауксусную кислоту (EDTA), фолиевую кислоту и соответствующие соли. Экстракт для трансляции был получен по методике, описанной Zubay (10) из штамма Escherichia coli В, дефицитного по эндопротеиназе OmpT и протеазе lon, что обеспечивает наилучшую стабильность экспрессированных in vitro белков.
Отрицательный контроль был получен путем инкубации стерильной воды вместо ДНК в смеси для транскрипции-трансляции. Положительный контроль был получен путем инкубации 2 мкг плазмиды PINPOINT™.
Продукты реакции EPIV хранили на льду до определения ферментативной активности каждого образца.
IV - Количественное определение активностей
1) Мезофильные ферменты
а) Активность GFP
На фиг.5 показана пробирка, содержащая продукт реакции EPIV с использованием в качестве матрицы вектора pGFP, и контрольная пробирка, облученная ультрафиолетом с длиной волны около 400 нм. Только одна пробирка, содержащая продукт реакции EPIV, с использованием в качестве матрицы плазмиды pGFP, испускала зеленое флуоресцентное свечение. Реакция EPIV, следовательно, позволила получить белок GFP, обладающий флуоресцентной активностью.
б) β-Лактамазная активность
β-лактамазную активность определяли спектрофотометрически по кинетике разрушения нитроцефина, хромогенного цефалоспорина, при длине волны 486 нм (5). Для этого, 5, 10 или 20 мкл продукта реакции EPIV с использованием в качестве матрицы вектора рТЕМ инкубировали в 1 мл буфера BETA в течение двух минут при температуре 37°С. Средняя активность продукта реакции EPIV с вектором рТЕМ составила 8,9 ед. оптической плотности/мин/мл экстракта и 0,6 ед. оптической плотности/мин/мл экстракта для продукта контрольной реакции EPIV. Реакция экспрессии белка in vitro, следовательно, позволяет синтезировать активную β-лактамазу, способную разрушать нитроцефин in vitro.
Контрольный вектор PINPOINT™ содержит ген bla под контролем своего эндогенного промотора. β-лактамазная активность продукта реакции EPIV с этим вектором составила 6 ед. оптической плотности/мин/мл экстракта. Следует отметить, что добавление ингибитора РНК-полимеразы Е. coli рифампицина в количестве 1 нг/мкл, существенно не улучшает экспрессию β-лактамазы in vitro с использованием вектора PINPOINT™ в качестве матрицы. Ген bla вектора PINPOINT™, расположенный на 2123 пары оснований до промотора Т7, следовательно, эффективно транскрибируется и транслируется. Это означает, что ген, расположенный на 2000 пар оснований до промотора Т7, эффективно транскрибируется и транслируется во время реакции EPIV.
2) Термофильные ферменты
а) Активность интеина 2
Продукт реакции EPIV, полученный с использованием в качестве матрицы вектора pET26-Tfu2, тестировали для определения возможности продуцирования активного интеина 2. Для этого, 5 мкл продукта реакции EPIV добавляли к 220 нг вектора рНS2-22-21, расщепленного Sca I, и 3 мкл буфера IT2, объем доводили до 30 мкл и инкубировали в течение 20 минут при температуре 70°С. В качестве отрицательного контроля вместо продукта реакции EPIV добавляли 5 мкл воды. Положительный контроль содержал 1 мкл очищенной фракции продуцированного in vitro интеина 2, разведенной в сто раз. Наконец, контроль на специфичность был осуществлен путем инкубации 5 мкл продукта реакции EPIV без ДНК.
После инкубации, продукты четырех опытов экстрагировали смесью фенол/хлороформ, осаждали абсолютным этанолом и промывали 70%-ным этанолом для удаления солей. Осадки растворяли в 10 мкл буфера Т, и 8 мкл анализировали с помощью электрофореза в 1% агарозном геле. Гель окрашивали этидиумбромидом и смотрели под ультрафиолетом для анализа профилей рестрикции. Появление полос с 934 и 1752 парами оснований на блоте 5 фиг.6, идентичных полосам блота 4 (положительный контроль), подтверждает эффективную в высокой степени экспрессию и ферментативную активность интеина 2. Более того, реакция EPIV является специфичной, поскольку в контроле (дорожка 3) соответствующая полоса не появляется.
б) Алкогольдегидрогеназная активность
Алкогольдегидрогеназную активность определяли спектрофотометрически по кинетике восстановления никотинамид-аденин-динуклеотид-фосфата (NADP) до восстановленной формы никотинамид-аденин-динуклеотид-фосфата (NADPH) при длине волны 340 нм. Для этого, 5, 10 или 15 мкл продукта реакции EPIV с вектором pADH в качестве матрицы, или без ДНК, инкубировали при температуре 50°С в течение пяти минут с 500 мкл буфера TADH в конечном объеме 1 мл. В этих условиях, средняя активность продукта реакции EPIV с вектором pADH в качестве матрицы составила 2,3 ед. оптической плотности/мин/мл экстракта и 0,32 ед. оптической плотности/мин/мл экстракта для контроля (реакция EPIV с водой). Алкогольдегидрогеназа (ADH) Thermococcus hydrothermalis (номер, под которым находится в банке генов: Y14015), следовательно, была экспрессирована в активной форме во время реакции EPIV.
3) Психрофильный фермент
Липазную активность определяли спектрофотометрически по кинетике разрушения хромогенного липида (резофуриновый эфир 1,2-O-дилаурил-рац.-глицеро-3-глутаровой кислоты) при длине волны 572 нм. Для этого, 5 мкл продукта реакции EPIV с вектором pLIP в качестве матрицы, или без ДНК инкубировали при температуре 70°С в течение пятнадцати минут в буфере для реакции в присутствии 100 мкг субстрата. В этих условиях, активность продукта реакции EPIV с вектором pLIP составила 0, 50 ед. оптической плотности/мин/мл экстракта и 0,04 ед. оптической плотности/мин/мл экстракта для контроля. Липаза В Candida antarctica (эукариотный организм), следовательно, была экспрессирована в активной форме во время реакции EPIV.
V - Использование экстракта для трансляции, обладающего мезофильной активностью, для детектирования термофильного свойства
Ген бета-галактозидазы Thermotoga neapolitana был встроен в вектор, содержащий промотор транскрипции бактериофага Т7. Таким образом полученный вектор был использован для реализации реакции EPIV с экстрактом для трансляции из штамма Е.coli, обладающей бета-галактозидазной активностью. Параллельно была осуществлена реакция EPIV без ДНК. При инкубации при температуре 37°С фракции каждого из продуктов реакции EPIV в присутствии Xgal в натрийфосфатном буфере (50 мМ, рН 7) в двух пробирках изменилась окраска на синюю за несколько минут (см. фиг.7, пробирки А и В). При инкубации фракции каждого из продуктов реакции EPIV в присутствии Xgal в тех же условиях, но при температуре 70°С, только в одной пробирке, соответствующей продукту реакции EPIV с плазмидой, кодирующей термофильную бета-галактозидазу, изменилась окраска на синюю (см. фиг.7, пробирки С и D: содержимое этих двух пробирок было подвергнуто центрифугированию для получения осадка белков из экстракта для мезофильной трансляции, которые выпали в осадок вследствие их тепловой денатурации во время тестирования активности при температуре 70°С). Мезофильную бета-галактозидазную активность более нельзя обнаружить при этой температуре (тепловая денатурация мезофильной бета-галактозидазы). Следовательно, можно использовать экстракт для трансляции, обладающий свойством, подобным искомому свойству, если это свойство нельзя детектировать в условиях детектирования искомого свойства.
VI - Экстракты для трансляции, приготовленные из экстремофильных организмов
Экстракты для трансляции из других организмов и, в особенности, экстремофильных организмов могут быть получены из клеток по одной из методик, описанных Zubay (1973) (10) или Pratt (1984) (7). Скорости центрифугирования, условия измельчения клеток и различные буферы для приготовления или реакции подбирают для каждого типа экстракта для трансляции путем систематических опытов. Используя ряд экстрактов для трансляции, становится возможным осуществлять трансляцию гена, каково бы ни было его генетическое происхождение: способ согласно изобретению, следовательно, позволяет достигать адекватности между системой для трансляции и экспрессией гена, кодирующего искомое свойство.
Литература
1. Hanahan D., (1985), Techniques for transformation of Escherichia coli, dans DNA cloning: a practical approach, Glover D.M. (Ed), IRL Press, Oxford vol I, 109-135.
2. Maniatis Т., Fristch E.F. et Sambrook J., (1982), Molecular cloning. A laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY.
3. Masson J.M., Meuris P., Grunstein M., Abelson J. et Miller H.J., (1987), Expression of a set of synthetic suppressor tRNAPhe genes in Saccharomyces cerevisiae, Proc. Natl. Acad. Sci. USA, 84, 6815-6819.
4. Normanly J., Masson J.-M., Kleina L.G., Abelson J. et Miller J.H., 1986, Construction of two Escherichia coli amber suppressor genes: tRNAPhe CUA and tRNACys CUA, Proc. Natl. Acad. Sci. USA, 83, 6548-6552.
5. O'Callaghan C.H., Morris A., Kirby S.M. et Shingler A.H., 1972, Novel method for detection of beta-lactamases by using a chromogenic cephalosporin substrate, Antimicrob. Agents Chemother., 1, 283-288.
6. Prasher D.C., Eckenrode V.K., Ward W.W., Prendergast F.G. et Cormier M.J., 1992, Primary structure of the Aequorea victoria green-fluorescent protein. Gene, 111, 229-233.
7. Pratt J.M., 1984, Coupled transcription-translation in prokaryotic cell-free systems. Transcription and Translation: A practical approach, Hames B.D. and Higgins S.J. Eds, JRL Press.
8. Studier F.W. et Moffatt B.A., 1986, Use of bacteriophage T7 RNA polymerase to direct selective high-level expression of cloned genes, J. Mol. Biol, 189, 113-130.
9. Sutcliffe J.G., 1978, Nucleotide sequence of the ampicillin resistance gene of Escherichia coil plasmid pBR322, Proc. Natl. Acad. Sci. USA, 75, 3737-3741.
10. Zubay G., 1973, In vitro synthesis of protein in microbial systems, Ann. Rev. Genet., 7, 267-287.









Реферат
Изобретение относится к области молекулярной биологии и может быть использовано в медицине и фармацевтической промышленности. Раскрыты способ идентификации определенных функций транскриптов или белков, кодируемых нуклеиновой кислотой, содержащейся в образце, и набор для его осуществления, включающий специфический плазмидный вектор. Указанный вектор включает область ori, ген тРНК и между двумя сильными промоторами, необязательно фланкированными терминаторами, сайт клонирования, в который может быть включен дополнительный селективный ген. Согласно предложенному способу в вектор встраивают фрагменты нуклеиновой кислоты, предварительно полученные из содержащего ее образца. Затем вектор обрабатывают in vitro для получения транскриптов. Указанные транскрипты применяют либо в процессах тестирования их функций, либо для получения кодируемых ими белков. Функции белков также тестируются. Набор для осуществления способа включает, соответственно, клеточный экстракт для трансляции, агент полимеризации, средства, необходимые для тестирования одной или нескольких функций белков или кодирующих их транскриптов, буферы, средства, необходимые для получения фрагментов нуклеиновой кислоты, и специфический вектор. Применение изобретения позволяет быстро и эффективно идентифицировать функцию, ассоциированную с полинуклеотидной последовательностью, содержащейся в биологическом образце, который включает нуклеиновые кислоты.. 3 н. и 24 з.п. ф-лы, 7 ил., 2 табл.

Комментарии