Тетрациклические соединения - RU2725140C2
Код документа: RU2725140C2
Описание
[Область изобретения]
Настоящее изобретение относится к тетрациклическим соединениям, их солям или сольватам. Более конкретно, настоящее изобретение относится к тетрациклическим соединениям и обеспечивает лекарственное средство, фармацевтические композиции, содержащие соединения, являющиеся ингибиторами ALK, и фармацевтические средства для профилактики или лечения заболеваний, включая рак, раковые метастазы, депрессию или нарушение познавательной функции, включающие такие соединения. Кроме того, настоящее изобретение относится к способу лечения заболеваний, включающему введение пациенту, который нуждается в лечении заболевания, соединений, описанных в настоящей заявке, их солей или сольватов в эффективном количестве для лечения заболеваний, и к применению тетрациклических соединений для получения фармацевтической композиции.
[Предпосылки изобретения]
Киназа Анапластической Лимфомы (ALK) представляет собой одну из рецепторных тирозиновых киназ, относящихся к семейству инсулиновых рецепторов (непатентные документы №№ 1 и 2).
Сообщалось о том, что, из-за изменения гена ALK (транслокация, точечная мутация и амплификация гена), аномальная активация ALK в результате вовлечена в онкогенез.
Например, при раке легкого ALK образует EML4-ALK в результате хромасомальной транслокации, что приводит к конститутивной активации тирозиновой киназы, и она приобретает онкогенную активность (непатентный документ 1). Кроме того, сообщалось о транслокации ALK при системной анапластической крупноклеточной лимфоме (ALCL) и воспалительных миофибробластных опухолях (IMT) (непатентные документы №№ 3 и 4) и раке пищевода (непатентный документ 5). Также было обнаружено, что активная точечная мутация (приблизительно 10%) или амплификация гена ALK вовлечены в онкогенез нейробластомы (непатентные документы №№ 6 и 7).
С другой стороны, также сообщалось о том, что в опухолях, активированных плейотрофином (PTN) или мидкином (MK) (непатентные документы №№ 8 и 9), они оба являются лигандами для ALK.
Кроме того, на основании исследования с использованием мышей с ALK-нокаутом было сделано предположение, что ингибитор ALK является полезным в качестве антидепрессанта или в качестве профилактического или терапевтического средства от нарушения познавательных функций (непатентный документ 10 и патентный документ 1).
Поэтому соединение, обладающее ингибиторной активностью в отношении ALK, будет чрезвычайно полезным для профилактики и лечения рака, депрессии и нарушения познавательной функции и т.п.
В то же время, в качестве вещества, ингибирующего ALK, известны некоторые соединения из числа ингибиторов одновременно нескольких киназ, которые обладают ингибиторной активностью в отношении ALK, как одной из их активностей. Например, в качестве ингибитора c-MET (мезенхимально-эпителиальный транзиционный фактор) и ALK сообщалось о PF02341066, имеющем 2-аминопиридиновую структуру (патентный документ 2, непатентные документы №№ 11 и 12). В качестве ингибитора для FAK, ZAP70, IGF-1R и ALK и т.п. сообщалось о NVP-TAE684, имеющем 2,4-диаминопиримидиновую структуру (патентный документ 3 и непатентный документ 13). Кроме того, были описаны 2,4-диаминопиримидины и 2,4-диаминохиназолины (патентный документ 4), пиридопиразины (патентный документ 5), пиразоло[3,4-C]изохинолины (патентный документ 6), тиазолы (патентный документ 7), трициклические соединения (патентный документ 8) и индазолы (патентный документ 9) и т.п.
Однако тетрациклические соединения по настоящему изобретению не были раскрыты ни в одном из документов, указанных выше.
В качестве тетрациклического соединения, демонстрирующего противоопухолевую активность, известны тетрациклические соединения, включающие карбазольную структуру, такие как эллиптицин.
Однако механизм их действия основан на взаимодействии с ДНК, вызывая клеточную токсичность (непатентный документ 15), и отсутствует какое-либо описание, касающееся активности ингибирования ALK тетрациклическими соединениями.
[Перечень документов]
[Патентный документ 1] WO 2007/023310 A2
[Патентный документ 2] WO 2006/021884 A2
[Патентный документ 3] WO 2004/080980 A1
[Патентный документ 4] WO 2009/008371 A1
[Патентный документ 5] WO 2007/130468 A2
[Патентный документ 6] WO 2005/009389 A2
[Патентный документ 7] WO 2005/097765 A1
[Патентный документ 8] WO 2008/021369 A2
[Патентный документ 9] WO 2009/013126 A1
[Непатентный документ 1] Proc Natl Acad Sci USA, Vol. 101, стр. 13306-13311, 2004
[Непатентный документ 2] Nature, Vol. 448, стр. 561-566, 2007
[Непатентный документ 3] Blood, Vol. 72, стр. 234-240, 1988
[Непатентный документ 4] Cancer Res, Vol. 59, стр. 2776-2780, 1999
[Непатентный документ 5] World J Gastroenterol, Vol. 12, стр. 7104-7112, 2006
[Непатентный документ 6] Nature, Vol. 455, стр. 930-935, 2008
[Непатентный документ 7] Nature, Vol. 455, стр. 971-974, 2008
[Непатентный документ 8] J Biol Chem, Vol. 276, стр. 16772-16779, 2001
[Непатентный документ 9] J Biol Chem, Vol. 277, стр. 35990-35999, 2002
[Непатентный документ 10] Neuropsychopharmacology, Vol. 33, стр. 685-700, 2008
[Непатентный документ 11] Proc Am Assoc Cancer Res (AACR) 2006, 47: Abst LB-271
[Непатентный документ 12] Proc Am Assoc Cancer Res (AACR) 2006, 47: Abst LB-273
[Непатентный документ 13] Proc Natl Acad Sci USA Vol. 104, стр. 270-275, 2007
[Непатентный документ 14] Current Organic Chemistry, Vol. 5, Issue No. 5, стр. 507-518, 2001
[Непатентный документ 15] Current Medicinal Chemistry: Anti-Cancer Agents, Vol. 4, Issue No. 2, стр. 149-172, 2004
[Краткое описание изобретения]
[Задачи, решаемые настоящим изобретением]
Настоящее изобретение направлено на обеспечение ALK-ингибирующих соединений, имеющих новую структуру. Кроме того, целью настоящего изобретения является обеспечение фармацевтических средств для профилактики или лечения, включающих ALK-ингибирующие соединения, которые являются эффективными для профилактики или лечения заболевания, сопровождаемого аномальностью ALK, например, рака, раковых метастазов, депрессии и нарушения познавательной функции.
[Средства для решения задач]
В результате глубоких исследований, осуществленных авторами настоящего изобретения, было обнаружено, что тетрациклические соединения, которые представлены следующей формулой (1), со структурой, явно отличающейся от других существующих фармацевтических соединений, обладают отличной ALK-ингибирующей активностью, являются полезными для лечения и профилактики заболеваний, включая рак, раковые метастазы, депрессию и нарушение познавательной функции, и обладают замечательной эффективностью против указанных заболеваний. Таким образом, было создано настоящее изобретение.
Таким образом, в соответствии с одним аспектом настоящего изобретения, обеспечиваются тетрациклические соединения, лекарственное средство и фармацевтическая композиция, содержащие такие соединения, и т.п., представленные ниже.
[1] Соединение или его соль или сольват, представленное формулой (I):

где
A1, A2, A3, A4, A7, A8, A9 и A10 все представляют собой C, или какой-либо один из A2, A3, A4, A7, A8 и A9 представляет собой N (при условии, что, когда он представляет собой N, для него не существует никакой группы заместителя), и остальные представляют собой C;
A5 выбран из NR5, O и S;
R1 и R10, каждый независимо, представляют собой [1] атом водорода, [2] цианогруппу, [3] атом галогена или [4] 4-10-членную гетероциклоалкильную группу, которая может быть замещена 4-10-членной гетероциклоалкильной группой(группами);
R2 выбран из группы, включающей:
(1) атом водорода,
(2) C1-8 алкильную группу,
(3) C2-8 алкенильную группу,
(4) C2-8 алкинильную группу,
(5) цианогруппу,
(6) атом галогена,
(7) (C1-8 алкил)m2-аминогруппу, которая может быть замещена C1-8 алкилсульфонильной группой(группами),
m2: 0~2, и
(8) нитрогруппу;
R3 выбран из группы, включающей:
(1) атом водорода,
(2) C1-8 алкильную группу, которая может быть замещена [1] атомом(атомами) галогена, [2] гидроксигруппой(группами) или [3] C1-8 алкоксигруппой(группами),
(3) C6-10 арильную группу,
(4) цианогруппу,
(5) C1-8 алканоильную группу, которая может быть замещена C6-10 арильной группой(группами),
(6) (C1-8алкил)m3a-аминокарбонильную группу, которая может быть замещена одной или несколькими группами R3A,
R3A: [1] C6-10 арильная группа, [2] C1-8 алкоксигруппа, [3] 5-14-членная гетероарильная группа или [4] C6-10 арилсульфонильная группа,
m3a: 0~2,
(7) гидроксикарбонильную группу,
(8) C1-8 алкоксикарбонильную группу, которая может быть замещена [1] гидроксигруппой(группами) или [2] C1-8 алкоксигруппой(группами),
(9) атом галогена,
(10) (C1-8 алкил)m3b-аминогруппу, которая может быть замещена C6-10 арильной группой(группами),
m3b: 0~2,
(11) C1-8 алкилкарбонил(C0-8 алкил)аминогруппу, которая может быть замещена [1] C6-10 арильной группой(группами) или [2] C6-10 арилоксигруппой(группами),
(12) C6-10 арилкарбонил(C0-8 алкил)аминогруппу, которая может быть замещена C1-8 алкильной группой(группами), которая может быть замещена атомом(атомами) галогена,
(13) (C1-8 алкил)m3c-аминокарбонил(C0-8 алкил)аминогруппу, которая может быть замещена C6-10 арильной группой(группами),
m3c: 0~2,
(14) нитрогруппу,
(15) гидроксигруппу,
(16) C1-8 алкоксигруппу, которая может быть замещена одной или несколькими группами R3B,
R3B: [1] гидроксигруппа, [2] C1-8 алкоксигруппа, [3] C6-10 арил(C0-8 алкил)аминокарбонильная группа, [4] (C1-8 алкил)m3d-аминогруппа или [5] атом галогена,
m3d: 0~2,
(17) 4-10-членную гетероциклоалкилоксигруппу,
(18) 5-14-членную гетероарилоксигруппу,
(19) (C1-8 алкил)m3e-аминокарбонилоксигруппу, которая может быть замещена C6-10 арильной группой(группами)
m3e: 0~2,
(20) 4-10-членную азотсодержащую гетероциклоалкилкарбонильную группу,
(21) C1-8 алкилсульфонилоксигруппу, которая может быть замещена атомом(атомами) галогена,
(22) C1-8 алкилтиогруппу,
(23) C1-8 алкилсульфонильную группу, которая может быть замещена C6-10 арильной группой(группами),
(24) 5-14-членную гетероарильную группу, которая может быть замещена C1-8 алкильной группой(группами), которая может быть замещена C1-8 алкоксигруппой(группами),
(25) C1-8 алкоксикарбонил(C0-8 алкил)аминогруппу, которая может быть замещена C1-8 алкоксигруппой(группами),
(26) C6-10 арилоксикарбонил(C0-8 алкил)аминогруппу, которая может быть замещена C1-8 алкильной группой(группами), которая может быть замещена атомом(атомами) галогена,
(27) C6-10 арил(C0-8 алкил)аминокарбонил(C0-8 алкил)аминогруппу, которая может быть замещена одной или несколькими группами R3C,
R3C: [1] C1-8 алкильная группа, которая может быть замещена атомом(атомами) галогена, или [2] C1-8 алкоксигруппа,
(28) C3-8 циклоалкил(C0-8 алкил)аминокарбонилоксигруппу и
(29) C6-10 арил(C0-8 алкил)аминокарбонилоксигруппу, которая может быть замещена заместителем(заместителями), выбранным из группы, включающей [1] C1-8 алкильную группу и [2] C1-8 алкоксигруппу;
R4 выбран из группы, включающей:
(1) атом водорода,
(2) C1-8 алкильную группу, которая может быть замещена атомом(атомами) галогена,
(3) C2-8 алкенильную группу,
(4) C2-8 алкинильную группу,
(5) C3-8 циклоалкильную группу,
(6) цианогруппу,
(7) аминокарбонильную группу,
(8) (C1-8 алкил)m4a-аминокарбонильную группу,
m4a: 1~2,
(9) гидроксикарбонильную группу,
(10) C1-8 алкоксикарбонильную группу,
(11) атом галогена,
(12) (C1-8 алкил)m4b-аминогруппу,
m4b: 0~2,
(13) гидроксигруппу и
(14) C1-8 алкоксигруппу, которая может быть замещена гидроксигруппой(группами);
R5 выбран из группы, включающей:
(1) атом водорода,
(2) C1-8 алкильную группу, которая может быть замещена одной или несколькими группами R5A,
R5A: [1] гидроксикарбонильная группау, [2] C1-8 алкоксикарбонильная группа, [3] гидроксигруппа, [4] C1-8 алкоксигруппа, [5] (C1-8 алкил)m5-аминогруппа, [6] C6-10 арильная группа или [7] C1-8 алкилтиогруппа,
m5: 0~2,
(3) C2-8 алкенильную группу,
(4) C2-8 алкинильную группу,
(5) C3-8 циклоалкильную группу и
(6) C1-8 алкилсульфонильную группу;
R6 и R6’, каждый независимо, выбраны из группы, включающей:
(1) C1-8 алкильную группу, которая может быть замещена атомом(атомами) галогена,
(2) C2-8 алкенильную группу и
(3) C2-8 алкинильную группу; или
R6 и R6’, взятые вместе с атомами углерода, с которыми они связаны, образуют:
(4) C3-8 циклоалкильную группу или
(5) 4-10-членную гетероциклоалкильную группу, которая может быть замещена C1-8алкилC6-10арилсульфонильной группой(группами), которая может быть замещена C1-8 алкильной группой(группами);
R7 выбран из группы, включающей:
(1) атом водорода,
(2) атом галогена,
(3) C1-8 алкоксигруппу, которая может быть замещена одной или несколькими группами R7A,
R7A: [1] (C1-8 алкил)m7a-аминогруппа, [2] гидрокси, [3] 4-10-членная гетероциклоалкильная группа, которая может быть замещена C1-8 алкильной группой(группами),
m7a: 0~2,
(4) C1-8 алкилсульфонильную группу,
(5) нитрогруппу и
(6) гидроксильную группу;
R8 выбран из группы, включающей:
(1) атом водорода,
(2) C1-8 алкильную группу, которая может быть замещена одной или несколькими группами R8A,
R8A: [1] 4-10-членная гетероциклоалкильная группа, которая может быть замещена одной или несколькими группами R8A1, [2] (C1-8 алкил)m8a-аминогруппа, которая может быть замещена атомом галогена, и [3] гидроксигруппа,
m8a: 0~2,
R8A1: [1] C1-8 алкильная группа, [2] C1-8 алкилсульфонильная группа, [3] (C1-8 алкил)m8b-аминосульфонильная группа, [4] оксогруппа, [5] C1-8 алкоксикарбонил или [6] C1-8 алкоксикарбонил(C0-8 алкил)аминосульфонил,
m8b: 0~2,
(3) C2-8 алкенильную группу,
(4) 4-10-членную гетероциклоалкильную группу, которая может быть замещена одной или несколькими группами R8B,
R8B:
<1> C1-8 алкильная группа, которая может быть замещена одной или несколькими группами R8B1,
<2> C2-8 алкенильная группа,
<3> C2-8 алкинильная группа,
<4> C3-8 циклоалкильная группа, которая может быть замещена [1] цианогруппой(группами) или [2] C1-8 алкильной группой(группами),
<5> 4-10-членная гетероциклоалкильная группа, которая может быть замещена одной или несколькими группами R8B2,
<6> C1-8 алкоксигруппа, которая может быть замещена заместителем(заместителями), выбранным из группы, включающей [1] C1-8 алкоксигруппу и [2] C3-8 циклоалкильную группу,
<7> C1-8 алкоксикарбонильная группа,
<8> C1-8 алкилсульфонильная группа,
<9> 5-14-членная гетероарилсульфонильная группа,
<10> оксогруппа,
<11> цианогруппа,
<12> C1-8 алканоильная группа, которая может быть замещена одной или несколькими группами R8B3,
<13> C3-8 циклоалкилкарбонильная группа,
<14> (C1-8 алкил)m8c-аминосульфонильная группа,
<15> C1-8 алкилсульфонил(C0-8 алкил)аминогруппа,
<16> (C1-8 алкил)m8d-аминогруппа, которая может быть замещена одной или несколькими группами R8B4,
<17> гидроксигруппа,
<18> (C1-8 алкил)m8e-аминокарбонильная группа или
<19> C1-8алкоксикарбонил(C0-8 алкил)аминогруппа,
m8c: 0~2,
m8d: 0~2,
m8e: 0~2,
R8B1: [1] C3-8 циклоалкильная группа, [2] гидроксигруппа, или [3] C1-8 алкоксигруппа(группы),
R8B2: [1] атом галогена, [2] C1-8 алкильная группа, [3] оксогруппа, [4] гидроксигруппа или [5] атом дейтерия,
R8B3: (C1-8 алкил)m8f-аминогруппа,
m8f: 0~2,
R8B4: [1] C3-8 циклоалкильная группа или [2] гидроксигруппа,
(5) 5-14-членную гетероарильную группу, которая может быть замещена C1-8 алкильной группой,
(6) (C1-8 алкил)m8g-аминокарбонильную группу, которая может быть замещена одной или несколькими группами R8C,
m8g: 0~2,
R8C: [1] гидроксигруппа, [2] (C1-8 алкил)m8h-аминогруппа, которая может быть замещена заместителем(заместителями), выбранным из группы, включающей <1> (C1-8 алкил)m8i-аминосульфонильную группу, <2> C1-8 алкилсульфонильную группу, <3> C1-8 алкоксикарбонильную группу и <4> C1-8 алкоксикарбонил(C0-8 алкил)аминосульфонильную группу, [3] C1-8 алкилсульфонильная группа или [4] C1-8 алкоксигруппа, которая может быть замещена гидроксигруппой,
m8h: 0~2,
m8i: 0~2,
(7) 4-10-членную гетероциклоалкил(C0-8 алкил)аминокарбонильную группу, которая может быть замещена оксогруппой(группами),
(8) 4-10-членную азотсодержащую гетероциклоалкилкарбонильную группу, которая может быть замещена одной или несколькими группами R8D,
R8D: [1] C1-8 алкильная группа, которая может быть замещена одной или несколькими группами R8D1, [2] гидроксигруппа, [3] C1-8 алкилсульфонильная группа или [4] C1-8 алкоксикарбонильная группа,
R8D1: [1] гидроксигруппа или [2] C1-8 алкоксигруппа,
(9) гидроксикарбонильную группу,
(10) C0-8алкокси(C0-8алкил)аминокарбонильную группу, которая может быть замещена гидроксигруппой(группами),
(11) атом галогена,
(12) (C1-8алкил)m8j-аминогруппу, которая может быть замещена одной или несколькими группами R8H,
m8j: 0~2,
R8H: [1] гидроксигруппа или [2] 4-10-членная гетероциклоалкильная группа,
(13) гидроксильную группу,
(14) C1-8 алкоксигруппу, которая может быть замещена одной или несколькими группами R8E,
R8E:
<1> гидроксигруппа,
<2> атом галогена,
<3> гидроксикарбонильная группа,
<4> C1-8 алкоксикарбонильная группа,
<5> 4-10-членная азотсодержащая гетероциклоалкилкарбонильная группа, которая может быть замещена одной или несколькими группами R8E1,
<6> (C1-8 алкил)m8k1-аминогруппа, которая может быть замещена одной или несколькими группами R8E2,
m8k1: 0~2,
<7> 4-10-членная гетероциклоалкильная группа, которая может быть замещена одной или несколькими группами R8E3,
<8> 5-14-членная гетероарильная группа,
<9> (C1-8 алкил)m8k2-аминокарбонильная группа, которая может быть замещена одной или несколькими группами R8E6,
m8k2: 0~2,
<10> C1-8 алкоксигруппа, которая может быть замещена одной или несколькими группами R8E7,
<11> C1-8 алкилтиогруппа,
<12> C1-8 алкилсульфинильная группа,
<13> C1-8 алкилсульфонильная группа,
R8E1:
<1> C1-8 алкоксикарбонильная группа,
<2> C1-8 алканоильная группа,
<3> C1-8 алкилсульфонильная группа,
<4> (C1-8 алкил)m8k3-аминосульфонильная группа,
m8k3: 0~2, или
<5> 4-10-членная гетероциклоалкильная группа,
R8E2:
<1> гидроксигруппа,
<2> C1-8 алкоксикарбонильная группа, которая может быть замещена атомом(атомами) галогена,
<3> C3-8 циклоалкильная группа, которая может быть замещена C1-8 алкильной группой(группами), которая может быть замещена гидроксигруппой(группами),
<4> C1-8 алканоильная группа, которая может быть замещена заместителем(заместителями), выбранным из группы, включающей [1] (C1-8 алкил)m8k4-аминогруппу и [2] атом(атомы) галогена,
m8k4: 0~2,
<5> (C1-8 алкил)m8k5-аминокарбонильная группа,
m8k5: 0~2,
<6> C1-8 алкилсульфонильная группа,
<7> 4-10-членная азотсодержащая гетероциклоалкилсульфонильная группа, которая может быть замещена C1-8 алкильной группой(группами),
<8> (C1-8алкил)m8k6-аминосульфонильная группа, которая может быть замещена C1-8алкоксикарбонильной группой(группами),
m8k6: 0~2, или
R8E3:
<1> C1-8 алкильная группа, которая может быть замещена заместителем(заместителями), выбранным из группы, включающей [1] гидроксигруппу и [2] C1-8 алкилкарбонилоксигруппу,
<2> C1-8 алкилкарбонилоксигруппа,
<3> гидроксигруппа,
<4> C3-8циклоалкильная группа,
<5> C1-8 алкоксигруппа,
<6> C1-8 алкоксикарбонильная группа,
<7> C1-8 алкилсульфонильная группа,
<8> (C1-8 алкил)m8k8-аминокарбонильная группа,
m8k8: 0~2,
<9> C1-8 алканоильная группа, которая может быть замещена гидроксигруппой(группами),
<10> оксогруппа или
<11> 4-10-членная гетероциклоалкильная группа, которая может быть замещена заместителем(заместителями), выбранным из группы, включающей [1] C1-8 алканоильную группу, [2] C1-8 алкоксикарбонильную группу и [3] C1-8 алкилсульфонильную группу,
R8E6:
<1> C2-8 алкенилкарбонилоксигруппа,
<2> гидроксигруппа,
<3> цианогруппа,
<4> (C1-8алкил)m8k9-аминогруппа, которая может быть замещена гидроксигруппой(группами),
m8k9: 0~2,
<5> C1-8 алкоксигруппа, которая может быть замещена гидроксигруппой(группами),
<6> C1-8 алкилкарбонилоксигруппа,
<7> 4-10-членная гетероциклоалкильная группа, которая может быть замещена C1-8 алкильной группой(группами), или
<8> 5-14-членная гетероарильная группа,
R8E7:
<1> гидроксигруппа или
<2> C1-8 алкоксигруппа, которая может быть замещена гидроксигруппой(группами),
(15) 4-10-членную гетероциклоалкилоксигруппу, которая может быть замещена одной или несколькими группами R8F,
R8F:
<1> C1-8 алкильная группа, которая может быть замещена одной или несколькими группами R8F1,
<2> C3-8циклоалкильная группа,
<3> C1-8 алканоильная группа, которая может быть замещена атомом(атомами) галогена,
<4> C1-8 алкилкарбонилоксигруппа,
<5> C1-8 алкоксикарбонильная группа,
<6> 4-10-членная гетероциклоалкильная группа, которая может быть замещена одной или несколькими группами R8F2,
<7> C1-8 алкилсульфонильная группа,
<8> гидроксигруппа или
[9] C6-10 арильная группа,
R8F1: [1] гидроксигруппа, [2] C1-8 алкоксигруппа или [3] атом галогена,
R8F2: [1] 4-10-членная гетероциклоалкильная группа, [2] C1-8 алкоксикарбонильная группа или [3] C1-8 алкилсульфонильная группа,
(16) 5-14-членную гетероарилоксигруппу,
(17) 4-10-членную гетероциклоалкилкарбонилоксигруппу,
(18) (C1-8 алкил)m8l1-аминосульфонилоксигруппу,
m8l1: 0~2,
(19) C1-8 алкилтиогруппу, которая может быть замещена [1] (C1-8алкил)m8l2-аминогруппой(группами), [2] гидроксигруппой(группами) или [3] гидроксикарбонильной группой(группами),
m8l2: 0~2,
(20) C1-8 алкилсульфонильную группу, которая может быть замещена одной или несколькими группами R8G,
R8G: [1] гидроксикарбонильная группа, [2] гидроксигруппа, или [3] (C1-8 алкил)m8l3-аминогруппа,
m8l3: 0~2,
(21) 4-10-членную азотсодержащую гетероциклоалкилсульфонилоксигруппу, которая может быть замещена C1-8 алкильной группой(группами),
(22) C2-8 алкенилоксигруппу и
(23) C1-8 алкилсульфонилоксигруппу, которая может быть замещена атомом(атомами) галогена;
R9 выбран из группы, включающей:
(1) атом водорода,
(2) C1-8 алкильную группу, которая может быть замещена одной или несколькими группами R9A,
R9A: [1] C3-8 циклоалкильная группа, [2] 4-10-членная гетероциклоалкильная группа, которая может быть замещена одной или несколькими группами R9A1, [3] гидроксигруппа, [4] C1-8 алкоксигруппа или [5] гидроксикарбонильная группа,
R9A1: [1] C1-8 алкильная группа, [2] C3-8 циклоалкильная группа или [3] 4-10-членная гетероциклоалкильная группа,
(3) C2-8 алкенильную группу, которая может быть замещена одной или несколькими группами R9B,
R9B: [1] (C1-8 алкил)m9a-аминогруппа, [2] 4-10-членная гетероциклоалкильная группа, которая может быть замещена одной или несколькими группами R9B1,
R9B1: [1] C3-8 циклоалкильная группа или [2] 4-10-членная гетероциклоалкильная группа,
m9a: 0~2,
(4) C2-8 алкинильную группу, которая может быть замещена одной или несколькими группами R9C,
R9C: [1] C1-8 алкоксигруппа, [2] (C1-8 алкил)m9b-аминогруппа, которая может быть замещена C6-10 арильной группой(группами), [3] 4-10-членная гетероциклоалкильная группа, которая может быть замещена одной или несколькими группами R9C1, [4] C3-8 циклоалкильная группа, [5] гидроксигруппа, [6] гидроксикарбонильная группа или [7] C1-8 алкилоксикарбонильная группа,
m9b: 0~2,
R9C1: [1] C3-8 циклоалкильная группа, [2] 4-10-членная гетероциклоалкильная группа или [3] оксогруппа,
(5) C3-8 циклоалкильную группу,
(6) 4-10-членную гетероциклоалкильную группу, которая может быть замещена одной или несколькими группами R9D,
R9D: [1] C1-8 алкильная группа, которая может быть замещена 4-10-членной гетероциклоалкильной группой(группами), [2] C3-8 циклоалкильная группа, [3] 4-10-членная гетероциклоалкильная группа или [4] C1-6 алкилсульфонильная группа, или [5] C1-8алкоксикарбонильная группа,
(7) C6-10 арильную группу, которая может быть замещена одной или несколькими группами R9E,
R9E: [1] атом галогена, [2] гидроксигруппа, [3] гидроксикарбонильная группа или [4] C1-8 алкильная группа, которая может быть замещена гидроксигруппой(группами), или [5] C1-8 алкоксигруппа,
(8) 5-14-членную гетероарильную группу, которая может быть замещена C1-8 алкильной группой(группами),
(9) цианогруппу,
(10) C1-8 алканоильную группу,
(11) 4-10-членную азотсодержащую гетероциклоалкилкарбонильную группу, которая может быть замещена C1-8 алкильной группой(группами),
(12) атом галогена,
(13) (C1-8 алкил)m9c-аминогруппу, которая может быть замещена одной или несколькими группами R9F,
m9c: 0~2,
(14) C1-8 алкилкарбонил(C0-8 алкил)аминогруппу, которая может быть замещена (C1-8 алкил)m9d-аминогруппой(группами),
m9d: 0~2,
(15) C1-8 алкилсульфонил(C0-8 алкил)аминогруппу,
(16) (C1-8 алкил)m9e-аминосульфонил(C0-8 алкил)аминогруппу,
m9e: 0~2,
(17) нитрогруппу,
(18) гидроксигруппу,
(19) C1-8 алкоксигруппу, которая может быть замещена одной или несколькими группами R9G,
R9G: [1] гидроксигруппа, [2] гидроксикарбонильная группа, [3] C6-10 арильная группа, которая может быть замещена C1-8 алкоксигруппой(группами), [4] (C1-8 алкил)m9g1-аминогруппа, [5] C1-8 алкоксигруппа, которая может быть замещена одной или несколькими группами R9G1, [6] 5-14-членная гетероарильная группа или [7] 4-10-членная гетероциклоалкилоксигруппа, которая может быть замещена C1-8 алкильной группой(группами),
m9g1: 0~2,
R9G1: [1] C1-8 алкоксигруппа или [2] гидроксикарбонильная группа,
(20) 4-10-членную гетероциклоалкилоксигруппу, которая может быть замещена [1] 4-10-членной гетероциклоалкильной группой(группами) или [2] C1-8 алкоксикарбонильной группой(группами),
(21) C1-8 алкилсульфонилоксигруппу, которая может быть замещена атомом(атомами) галогена,
(22) C1-8 алкилтиогруппу, которая может быть замещена (C1-8 алкил)m9f-аминогруппой(группами),
m9f: 0~2,
(23) C1-8 алкилсульфонильную группу, которая может быть замещена (C1-8 алкил)m9g-аминогруппой(группами),
m9g: 0~2,
(24) (C1-8 алкил)m9h-аминосульфонильную группу,
m9h: 0~2,
(25) 4-10-членную азотсодержащую гетероциклоалкилсульфонильную группу, которая может быть замещена C1-8 алкильной группой(группами), и
(26) гидроксикарбонильную группу.
[2] Соединение в соответствии с описанным выше пунктом [1] или его соль или сольват, где R3 представляет собой цианогруппу или атом галогена.
[3] Соединение в соответствии с описанным выше пунктом [1] или его соль или сольват, где A5 представляет собой NR5 и R5 представляет собой атом водорода.
[4] Соединение в соответствии с описанным выше пунктом [1] или его соль или сольват, где все из A1, A2, A3, A4, A7, A8, A9 и A10 представляют собой атом углерода.
[5] Соединение в соответствии с пунктом 1 или его соль или сольват, где:
A1, A2, A3, A4, A7, A8, A9 и A10 все представляют собой C, или какой-либо один из A2, A3, A4, A7, A8 и A9 представляет собой N (при условии, что, когда он представляет собой N, для него не существует никакой группы заместителя), и остальные представляют собой C;
A5 выбран из NR5, O и S;
R1 представляет собой [1] атом водорода, [2] цианогруппу или [3] атом галогена;
R2 выбран из группы, включающей:
(1) атом водорода,
(2) C1-8 алкильную группу,
(3) цианогруппу,
(4) атом галогена и
(5) (C1-8 алкил)m2-аминогруппу, которая может быть замещена C1-8 алкилсульфонильной группой(группами),
m2: 0~2;
R3 выбран из группы, включающей:
(1) атом водорода,
(2) C1-8 алкильную группу, которая может быть замещена атомом(атомами) галогена,
(3) цианогруппу,
(4) (C1-8 алкил)m3a-аминокарбонильную группу, которая может быть замещена одной или несколькими группами R3A,
R3A: [1] C6-10 арильная группа, [2] C1-8 алкоксигруппа, [3] 5-14-членная гетероарильная группа или [4] C6-10арилсульфонильная группа,
m3a: 0~2,
(5) гидроксикарбонильную группу,
(6) C1-8 алкоксикарбонильную группу, которая может быть замещена гидроксигруппой(группами),
(7) атом галогена,
(8) (C1-8 алкил)m3b-аминогруппу, которая может быть замещена C6-10 арильной группой(группами),
m3b: 0~2,
(9) C1-8 алкилкарбонил(C0-8 алкил)аминогруппу, которая может быть замещена [1] C6-10 арильной группой(группами) или [2] C6-10 арилоксигруппой(группами),
(10) C6-10 арилкарбонил(C0-8 алкил)аминогруппу, которая может быть замещена C1-8 алкильной группой(группами), которая может быть замещена атомом(атомами) галогена,
(11) нитрогруппу,
(12) гидроксигруппу,
(13) C1-8 алкоксигруппу, которая может быть замещена одной или несколькими группами R3B,
R3B: [1] гидроксигруппа, [2] C1-8 алкоксигруппа, [3] C6-10 арил(C0-8 алкил)аминокарбонильная группа, [4] (C1-8 алкил)m3d-аминогруппа или [5] атом галогена,
m3d: 0~2,
(14) 4-10-членную гетероциклоалкилоксигруппу,
(15) 5-14-членную гетероарилоксигруппу,
(16) (C1-8 алкил)m3e-аминокарбонилоксигруппу, которая может быть замещена C6-10 арильной группой(группами),
m3e: 0~2,
(17) 4-10-членную азотсодержащую гетероциклоалкилкарбонильную группу,
(18) C1-8 алкилтиогруппу,
(19) 5-14-членную гетероарильную группу, которая может быть замещена C1-8 алкильной группой(группами), которая может быть замещена C1-8 алкоксигруппой(группами),
(20) C1-8 алкоксикарбонил(C0-8 алкил)аминогруппу, которая может быть замещена C1-8 алкоксигруппой(группами),
(21) C6-10 арилоксикарбонил(C0-8 алкил)аминогруппу, которая может быть замещена C1-8 алкильной группой(группами), которая может быть замещена атомом(атомами) галогена,
(22) C6-10 арил(C0-8 алкил)аминокарбонил(C0-8 алкил)аминогруппу, которая может быть замещена C1-8 алкоксигруппой(группами),
(23) C3-8 циклоалкил(C0-8 алкил)аминокарбонилоксигруппу и
(24) C6-10 арил(C0-8 алкил)аминокарбонилоксигруппу, которая может быть замещена заместителем(заместителями), выбранным из группы, включающей [1] C1-8 алкильную группу и [2] C1-8 алкоксигруппу;
R4 выбран из группы, включающей:
(1) атом водорода,
(2) C1-8 алкильную группу, которая может быть замещена атомом(атомами) галогена,
(3) C3-8 циклоалкильную группу,
(4) цианогруппу,
(5) аминокарбонильную группу,
(6) гидроксикарбонильную группу,
(7) атом галогена,
(8) (C1-8 алкил)m4b-аминогруппу,
m4b: 0~2,
(9) гидроксигруппу и
(10) C1-8 алкоксигруппу, которая может быть замещена гидроксигруппой(группами);
R5 выбран из группы, включающей:
(1) атом водорода,
(2) C1-8 алкильную группу, которая может быть замещена одной или несколькими группами R5A,
R5A: [1] гидроксикарбонильная группа, [2] C1-8 алкоксикарбонильная группа, [3] гидроксигруппа, [4] C1-8 алкоксигруппа, [5] (C1-8 алкил)m5-аминогруппа или [6] C1-8 алкилтиогруппа,
m5: 0~2, и
(3) C1-8 алкилсульфонильную группу;
R6 и R6’, каждый независимо, представляют собой:
(1) C1-8 алкильную группу, или
R6 и R6’, взятые вместе с атомами углерода, с которыми они связаны, образуют,
(2) C3-8 циклоалкильную группу или
(3) 4-10-членную гетероциклоалкильную группу;
R7 выбран из группы, включающей:
(1) атом водорода,
(2) атом галогена и
(3) C1-8 алкоксигруппу, которая может быть замещена одной или несколькими группами R7A,
R7A: [1] (C1-8 алкил)m7a-аминогруппа или [2] гидроксигруппа,
m7a: 0~2;
R8 выбран из группы, включающей:
(1) атом водорода,
(2) C1-8 алкильную группу, которая может быть замещена одной или несколькими группами R8A,
R8A: [1] 4-10-членная гетероциклоалкильная группа, которая может быть замещена одной или несколькими группами R8A1, [2] (C1-8 алкил)m8a-аминогруппа, которая может быть замещена атомом галогена, и [3] гидроксигруппа,
m8a: 0~2,
R8A1: [1] C1-8 алкильная группа, [2] C1-8 алкилсульфонильная группа, [3] (C1-8 алкил)m8b-аминосульфонильная группа или [4] оксогруппа,
m8b: 0~2,
(3) C2-8 алкенильную группу,
(4) 4-10-членную гетероциклоалкильную группу, которая может быть замещена одной или несколькими группами R8B,
R8B:
<1> C1-8 алкильная группа, которая может быть замещена одной или несколькими группами R8B1,
<2> C2-8 алкинильная группа,
<3> C3-8 циклоалкильная группа, которая может быть замещена [1] цианогруппой(группами) или [2] C1-8 алкильной группой(группами),
<4> 4-10-членная гетероциклоалкильная группа, которая может быть замещена одной или несколькими группами R8B2,
<5> C1-8 алкоксигруппа, которая может быть замещена заместителем(заместителями), выбранным из группы, включающей [1] C1-8 алкоксигруппу и [2] C3-8 циклоалкильную группу,
<6> C1-8 алкилсульфонильная группа,
<7> оксогруппа,
<8> цианогруппа,
<9> C1-8 алканоильная группа, которая может быть замещена одной или несколькими группами R8B3,
<10> C3-8 циклоалкилкарбонильная группа,
<11> (C1-8 алкил)m8c-аминосульфонильная группа,
<12> C1-8 алкилсульфонил(C0-8 алкил)аминогруппа,
<13> (C1-8 алкил)m8d-аминогруппа, которая может быть замещена одной или несколькими группами R8B4,
<14> гидроксигруппа или
<15> (C1-8 алкил)m8e-аминокарбонильная группа,
m8c: 0~2,
m8d: 0~2,
m8e: 0~2,
R8B1: [1] C3-8 циклоалкильная группа, [2] гидроксигруппа или [3] C1-8 алкоксигруппа, которая может быть замещена C1-8 алкоксигруппой(группами),
R8B2: [1] атом галогена, [2] C1-8 алкильная группа, [3] оксогруппа или [4] гидроксигруппа,
R8B3: (C1-8 алкил)m8f-аминогруппа,
m8f: 0~2,
R8B4: [1] C3-8 циклоалкильная группа или [2] гидроксигруппа,
(5) 5-14-членную гетероарильную группу, которая может быть замещена C1-8 алкильной группой,
(6) (C1-8 алкил)m8g-аминокарбонильную группу, которая может быть замещена одной или несколькими группами R8C,
m8g: 0~2,
R8C: [1] гидроксигруппа, [2] (C1-8 алкил)m8h-аминогруппа, которая может быть замещена заместителем(заместителями), выбранным из группы, включающей <1> (C1-8 алкил)m8i-аминосульфонильную группу и <2> C1-8 алкилсульфонильную группу, или [3] C1-8 алкилсульфонильная группа,
m8h: 0~2,
m8i: 0~2,
(7) 4-10-членную гетероциклоалкил(C0-8 алкил)аминокарбонильную группу, которая может быть замещена оксогруппой(группами),
(8) 4-10-членную азотсодержащую гетероциклоалкилкарбонильную группу, которая может быть замещена одной или несколькими группами R8D,
R8D: [1] C1-8 алкильная группа, которая может быть замещена одной или несколькими группами R8D1, [2] гидроксигруппа или [3] C1-8 алкилсульфонильная группа,
R8D1: [1] гидроксигруппа или [2] C1-8 алкоксигруппа,
(9) гидроксикарбонильную группу,
(10) C0-8 алкокси(C0-8 алкил)аминокарбонильную группу, которая может быть замещена гидроксигруппой(группами),
(11) атом галогена,
(12) (C1-8 алкил)m8j-аминогруппу, которая может быть замещена 4-10-членной гетероциклоалкильной группой(группами),
m8j: 0~2,
(13) гидроксильную группу,
(14) C1-8 алкоксигруппу, которая может быть замещена одной или несколькими группами R8E,
R8E:
<1> гидроксигруппа,
<2> C1-8 алкоксикарбонильная группа,
<3> 4-10-членная азотсодержащая гетероциклоалкилкарбонильная группа, которая может быть замещена одной или несколькими группами R8E1,
<4> (C1-8 алкил)m8k1-аминогруппа, которая может быть замещена одной или несколькими группами R8E2,
m8k1: 0~2,
<5> 4-10-членная гетероциклоалкильная группа, которая может быть замещена одной или несколькими группами R8E3,
<6> 5-14-членная гетероарильная группа,
<7> (C1-8 алкил)m8k2-аминокарбонильная группа, которая может быть замещена одной или несколькими группами R8E6,
m8k2: 0~2,
<8> C1-8 алкоксигруппа, которая может быть замещена одной или несколькими группами R8E7,
<9> C1-8 алкилтиогруппа,
<10> C1-8 алкилсульфинильная группа или
<11> C1-8 алкилсульфонильная группа,
R8E1:
<1> C1-8 алкоксикарбонильная группа,
<2> C1-8 алканоильная группа,
<3> C1-8 алкилсульфонильная группа,
<4> (C1-8 алкил)m8k3-аминосульфонильная группа,
m8k3: 0~2, или
<5> 4-10-членная гетероциклоалкильная группа,
R8E2:
<1> гидроксигруппа,
<2> C1-8 алкоксикарбонильная группа,
<3> C3-8 циклоалкильная группа, которая может быть замещена C1-8 алкильной группой(группами), которая может быть замещена гидроксигруппой(группами),
<4> C1-8 алканоильная группа, которая может быть замещена заместителем(заместителями), выбранным из группы, включающей [1] (C1-8 алкил)m8k4-аминогруппу и [2] атом галогена,
m8k4: 0~2,
<5> (C1-8 алкил)m8k5-аминокарбонильная группа,
m8k5: 0~2,
<6> C1-8 алкилсульфонильная группа,
<7> 4-10-членная азотсодержащая гетероциклоалкилсульфонильная группа, которая может быть замещена C1-8 алкильной группой(группами),
<8> (C1-8 алкил)m8k6-аминосульфонильная группа,
m8k6: 0~2, или
R8E3:
<1> C1-8 алкильная группа, которая может быть замещена заместителем(заместителями), выбранным из группы, включающей [1] гидроксигруппу и [2] C1-8 алкилкарбонилоксигруппу,
<2> гидроксигруппа,
<3> C3-8циклоалкильная группа,
<4> C1-8 алкилсульфонильная группа,
<5> (C1-8 алкил)m8k8-аминокарбонильная группа,
m8k8: 0~2,
<6> C1-8 алканоильная группа, которая может быть замещена гидроксигруппой(группами),
<7> оксогруппа или
<8> 4-10-членная гетероциклоалкильная группа, которая может быть замещена заместителем(заместителями), выбранным из группы, включающей [1] C1-8 алканоильную группу и [2] C1-8 алкилсульфонильную группу,
R8E6:
<1> C2-8 алкенилкарбонилоксигруппа,
<2> гидроксигруппа,
<3> цианогруппа,
<4> (C1-8 алкил)m8k9-аминогруппа, которая может быть замещена гидроксигруппой(группами),
m8k9: 0~2,
<5> C1-8 алкоксигруппа, которая может быть замещена гидроксигруппой(группами),
<6> 4-10-членная гетероциклоалкильная группа, которая может быть замещена C1-8 алкильной группой(группами), или
<7> 5-14-членную гетероарильная группа,
R8E7:
<1> гидроксигруппа или
<2> C1-8 алкоксигруппа, которая может быть замещена гидроксигруппой(группами),
(15) 4-10-членную гетероциклоалкилоксигруппу, которая может быть замещена одной или несколькими группами R8F:
R8F:
<1> C1-8 алкильная группа, которая может быть замещена одной или несколькими группами R8F1,
<2> C3-8циклоалкильная группа,
<3> C1-8 алканоильная группа, которая может быть замещена атомом(атомами) галогена,
<4> C1-8 алкоксикарбонильная группа,
<5> 4-10-членная гетероциклоалкильная группа, которая может быть замещена одной или несколькими группами R8F2,
<6> C1-8 алкилсульфонильная группа или
<7> гидроксигруппа,
R8F1: [1] гидроксигруппа, [2] C1-8 алкоксигруппа или [3] атом галогена,
R8F2: [1] 4-10-членная гетероциклоалкильная группа, [2] C1-8 алкоксикарбонильная группа или [3] C1-8 алкилсульфонильная группа,
(16) 5-14-членную гетероарилоксигруппу,
(17) (C1-8 алкил)m8l1-аминосульфонилоксигруппу,
m8l1: 0~2,
(18) C1-8 алкилтиогруппу, которая может быть замещена (C1-8 алкил)m8l2-аминогруппой(группами),
m8l2: 0~2,
(19) C1-8 алкилсульфонильную группу, которая может быть замещена одной или несколькими группами R8G,
R8G: [1] гидроксикарбонильная группа, [2] гидроксигруппа или [3] (C1-8 алкил)m8l3-аминогруппа,
m8l3: 0~2,
(20) C2-8 алкенилоксигруппу и
(21) C1-8 алкилсульфонилоксигруппу, которая может быть замещена атомом(атомами) галогена;
R9 выбран из группы, включающей:
(1) атом водорода,
(2) C1-8 алкильную группу, которая может быть замещена одной или несколькими группами R9A,
R9A: [1] C3-8 циклоалкильная группа, [2] 4-10-членная гетероциклоалкильная группа, которая может быть замещена одной или несколькими группами R9A1, [3] гидроксигруппа или [4] C1-8 алкоксигруппа,
R9A1: [1] C1-8 алкильная группа, [2] C3-8 циклоалкильная группа или [3] 4-10-членная гетероциклоалкильная группа,
(3) C2-8 алкенильную группу,
(4) C2-8 алкинильную группу, которая может быть замещена одной или несколькими группами R9C,
R9C: [1] C1-8 алкоксигруппа, [2] (C1-8 алкил)m9b-аминогруппа, которая может быть замещена C6-10 арильной группой(группами), [3] 4-10-членная гетероциклоалкильная группа, которая может быть замещена одной или несколькими группами R9C1, [4] C3-8 циклоалкильная группа, [5] гидроксигруппа или [6] гидроксикарбонильная группа,
m9b: 0~2,
R9C1: [1] C3-8 циклоалкильная группа, [2] 4-10-членная гетероциклоалкильная группа или [3] оксогруппа,
(5) C3-8 циклоалкильную группу,
(6) 4-10-членную гетероциклоалкильную группу, которая может быть замещена одной или несколькими группами R9D,
R9D: [1] C1-8 алкильная группа, которая может быть замещена 4-10-членной гетероциклоалкильной группой(группами), [2] C3-8 циклоалкильная группа, [3] 4-10-членная гетероциклоалкильная группа или [4] C1-6 алкилсульфонильная группа,
(7) C6-10 арильную группу, которая может быть замещена одной или несколькими группами R9E,
R9E: [1] атом галогена, [2] гидроксигруппа, [3] гидроксикарбонильная группа или [4] C1-8 алкильная группа, которая может быть замещена гидроксигруппой(группами),
(8) 5-14-членную гетероарильную группу, которая может быть замещена C1-8 алкильной группой(группами),
(9) цианогруппу,
(10) C1-8 алканоильную группу,
(11) 4-10-членную азотсодержащую гетероциклоалкилкарбонильную группу, которая может быть замещена C1-8 алкильной группой(группами),
(12) атом галогена,
(13) (C1-8 алкил)m9c-аминогруппу,
m9c: 0~2,
(14) C1-8 алкилкарбонил(C0-8 алкил)аминогруппу, которая может быть замещена (C1-8 алкил)m9d-аминогруппой(группами),
m9d: 0~2,
(15) C1-8 алкилсульфонил(C0-8 алкил)аминогруппу,
(16) (C1-8 алкил)m9e-аминосульфонил(C0-8 алкил)аминогруппу,
m9e: 0~2,
(17) нитрогруппу,
(18) гидроксигруппу,
(19) C1-8 алкоксигруппу, которая может быть замещена одной или несколькими группами R9G,
R9G: [1] гидроксигруппа, [2] гидроксикарбонильная группа, [3] C6-10 арильная группа, которая может быть замещена C1-8 алкоксигруппой(группами), [4] (C1-8 алкил)m9g1-аминогруппа, [5] C1-8 алкоксигруппа, которая может быть замещена одной или несколькими группами R9G1 или [6] 5-14-членная гетероарильная группа,
m9g1: 0~2,
R9G1: [1] C1-8 алкоксигруппа или [2] гидроксикарбонильная группа,
(20) 4-10-членную гетероциклоалкилоксигруппу, которая может быть замещена 4-10-членной гетероциклоалкильной группой(группами),
(21) C1-8 алкилтиогруппу, которая может быть замещена (C1-8 алкил)m9f-аминогруппой(группами),
m9f: 0~2,
(22) C1-8 алкилсульфонильную группу, которая может быть замещена (C1-8 алкил)m9g-аминогруппой(группами),
m9g: 0~2,
(23) (C1-8 алкил)m9h-аминосульфонильную группу,
m9h: 0~2, и
(24) 4-10-членную азотсодержащую гетероциклоалкилсульфонильную группу, которая может быть замещена C1-8 алкильной группой(группами);
R10 представляет собой [1] атом водорода или [2] 4-10-членную гетероциклоалкильную группу, которая может быть замещена 4-10-членной гетероциклоалкильной группой(группами).
[6] Соединение в соответствии с пунктом 1 или соль или сольват, где указанное соединение выбрано из группы, включающей:
9-(4-изопропил-пиперазин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил;
6,6-диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-9-проп-1-инил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил;
9-циклопропилэтинил-6,6-диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил;
6,6-диметил-8-(1-оксетан-3-ил-пиперидин-4-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил;
9-бром-6,6-диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил;
9-бром-8-(4-циклопропил-пиперазин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил;
9-хлор-6,6-диметил-8-(4-морфолин-4-ил-пиперидин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил;
8-(4-циклобутил-пиперазин-1-ил)-6,6-диметил-11-оксо-9-проп-1-инил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил;
6,6,9-триметил-8-(4-морфолин-4-ил-пиперидин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил;
9-этил-6,6-диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил;
9-этил-6,6-диметил-8-(4-морфолин-4-ил-пиперидин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил;
9-этинил-6,6-диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил;
8-(4-циклобутил-пиперазин-1-ил)-9-этил-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил;
9-этинил-6,6-диметил-11-оксо-8-(4-пирролидин-1-ил-пиперидин-1-ил)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил;
6,6-диметил-11-оксо-8-(4-пирролидин-1-ил-пиперидин-1-ил)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил;
8-(4-циклобутил-пиперазин-1-ил)-9-этинил-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил;
8-(4-циклобутил-пиперазин-1-ил)-6,6-диметил-11-оксо-9-пропил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил;
8-(1-изопропил-пиперидин-4-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил;
8-(4-изопропил-пиперазин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил;
8-(4-циклобутил-пиперазин-1-ил)-9-циклопропил-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил;
8-(2-трет-бутиламино-этокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил;
9-этинил-8-(4-метансульфонил-пиперазин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил;
9-бром-8-(4-циклобутил-пиперазин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил;
6,6-диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-9-пропил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил; и
9-этинил-6,6-диметил-8-морфолин-4-ил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил.
[7] Лекарственное средство, содержащее в качестве активного ингредиента соединение в соответствии с любым из описанных выше пунктов [1]-[5] или его соль или сольват.
[8] Ингибитор ALK, содержащий в качестве активного ингредиента соединение в соответствии с любым из описанных выше пунктов [1]-[5] или его соль или сольват.
[9] Фармацевтическое средство для профилактики или лечения рака, раковых метастазов, депрессии или нарушения познавательной функции, содержащее в качестве активного ингредиента соединение в соответствии с любым из описанных выше пунктов [1]-[5] или его соль или сольват.
[10] Фармацевтическая композиция, содержащая соединение в соответствии с любым из описанных выше пунктов [1]-[5] или его соль или сольват и фармацевтически приемлемый носитель(носители).
[11] Способ лечения пациента, страдающего от заболевания, включающего рак, раковые метастазы, депрессию или нарушение познавательной функции, включающий введение пациенту, который нуждается в лечении заболевания, соединения, описанного выше в любом из пунктов [1]-[5], его соли или сольвата в количестве, эффективном для лечения заболевания.
[12] Применение соединения, описанного выше в любом из пунктов [1]-[5], его соли или сольвата для получения фармацевтического препарата.
[13] Применение в соответствии с описанным выше пунктом [11] для получения фармацевтической композиции для лечения или профилактики заболевания млекопитающих, включая человека, где заболевание связано с активностью ALK.
[Эффект настоящего изобретения]
Соединения по настоящему изобретению или их соли или сольваты обладают отличной активностью ингибирования ALK, отличной стабильностью в организмах и отличной растворимостью в воде, и поэтому являются полезными в качестве профилактического или терапевтического средства от пролиферативных расстройств (в частности, терапевтического средства). Кроме того, соединения по настоящему изобретению или их соли или сольваты являются полезными в качестве профилактического или терапевтического средства (в частности, терапевтического средства) от различных заболеваний, таких как рак, включая лейкоз (острый миелогенный лейкоз, хронический миелогенный лейкоз, острый лимфатический лейкоз, хронический лимфатический лейкоз и т.п.), злокачественную лимфому (лимфому Ходжкина, неходжкинскую лимфому и т.п.), опухоль головного мозга, нейробластому, глиоматоз, рак щитовидной железы, миелодиспластический синдром, рак головы и шеи, рак пищевода, рак желудка, рак толстой кишки, колоректальный рак, рак молочной железы, рак яичника, рак легкого, рак поджелудочной железы, рак печени, рак желчного пузыря, рак кожи, злокачественную меланому, рак почки, рак почечной лоханки-уретры, рак мочевого пузыря, рак матки, рак мужских половых желез, рак предстательной железы и т.п. Кроме того, соединения по настоящему изобретению являются полезными в качестве профилактического или терапевтического средства (в частности, терапевтического средства) от инфильтрации/метастазов солидных опухолей. И более того, соединения по настоящему изобретению являются полезными в качестве профилактического или терапевтического средства от других заболеваний, которые связаны с ALK, например, депрессии или нарушения познавательной функции.
Способ по настоящему изобретению включает стадию введения фармацевтически эффективного количества фармацевтической композиции, содержащей соединения по настоящему изобретению или их соли или сольваты, пациенту, который нуждается в таком лечении или страдает от таких заболеваний или состояний.
[Способ осуществления изобретения]
Далее будут описаны соединения по настоящему изобретению, способ их получения и фармацевтическое средство, включающее такие соединения.
(Определения)
В соответствии с настоящим изобретением, “атом галогена” означает атом фтора, атом хлора, атом брома, атом йода и т.п. В соответствии с настоящим изобретением, когда атом галогена представляет собой группу заместителя для ароматического углеродного кольца, ароматического гетероцикла и т.п., предпочтительный атом галогена включает атом фтора, атом хлора и атом брома. В соответствии с настоящим изобретением, когда атом галогена представляет собой группу заместителя для алкильной группы или группу, которая включает алкил в качестве, по меньшей мере, части этой группы (например, алкокси, алкенил, ненасыщенный карбоцикл, ненасыщенный гетероцикл и т.п.), предпочтительный атом галогена включает атом фтора. Конкретные примеры такой группы включают трифторметильную группу, пентафторэтильную группу, гептафторпропильную группу, нонафторбутильную группу, трифторметоксигруппу, пентафторэтоксигруппу, гептафторпропоксигруппу, нонафторбутоксигруппу, трифторацетильную группу, пентафторпропионильную группу, гептафторбутирильную группу и нонафторпентаноильную группу.
“C1-8 Алкильная группа” означает одновалентную группу, которая образована путем удаления какого-либо одного из атомов водорода из линейного или разветвленного алифатического углеводорода, содержащего от 1 до 8 атомов углерода. Конкретные примеры такой группы включают метильную группу, этильную группу, изопропильную группу, бутильную группу, н-бутильную группу, изобутильную группу, втор-бутильную группу, трет-бутильную группу, пентильную группу, изопентильную группу, 2,3-диметилпропильную группу, гексильную группу, 2,3-диметилгексильную группу, 1,1-диметилпентильную группу, гептильную группу и октильную группу. Предпочтительно представляет собой C1-6 алкильную группу, более предпочтительно C1-5 алкильную группу, еще более предпочтительно C1-4 алкильную группу, и еще более предпочтительно C1-3 алкильную группу.
“C1-8 Алкильная группа, которая может быть замещена” означает незамещенную C1-8 алкильную группу или C1-8 алкильную группу, в которой, по меньшей мере, один атом водорода в алкильной группе замещен определенным в настоящем описании заместителем(заместителями). Когда присутствуют две или более групп заместителей, каждая группа заместителя может иметь одинаковое или отличное друг от друга значение. Кроме того, алкильная группа может быть замещена циклической группой заместителя через спиро связь. Предпочтительно, она представляет собой C1-8 алкильную группу, которая может быть замещена 1-3 заместителями. Более предпочтительно, включает 1-3 заместителя для C1-6 алкильной группы и C1-4 алкильной группы, и от 1 до 2 заместителей для C1-3 алкильной группы.
“C2-8 Алкенильная группа” означает одновалентную группу, где, по меньшей мере, одна двойная связь (два смежных SP2 атома углерода) содержится в линейной или разветвленной алифатической углеводородной группе, содержащей от 1 до 8 атомов углерода. Конкретные примеры C2-8 алкенильной группы включают винильную группу, аллильную группу, 1-пропенильную группу, 2-пропенильную группу, 1-бутенильную группу, 2-бутенильную группу (включая как цис, так и транс), 3-бутенильную группу, пентенильную группу и гексенильную группу. Предпочтительно она представляет собой C2-6 алкенильную группу, более предпочтительно C2-5 алкенильную группу, еще более предпочтительно C2-4 алкенильную группу, и еще более предпочтительно C2-3 алкенильную группу.
“C2-8 Алкенильная группа, которая может быть замещена” означает незамещенную C2-8 алкенильную группу, описанную выше, или C2-8 алкенильную группу, в которой, по меньшей мере, один атом водорода в алкенильной группе замещен определенным в настоящем описании заместителем(заместителями). Когда присутствуют две или более групп заместителей, каждая группа заместителя может иметь одинаковое или отличное друг от друга значение. Кроме того, связанный простой связью атом углерода может быть замещен циклической группой заместителя через спиро связь. Предпочтительно, она представляет собой C2-8 алкенильную группу, которая может быть замещена 1-3 заместителями. Более предпочтительно, включает 1-3 заместителя для C2-6 алкенильной группы и C2-4 алкенильной группы, от 1 до 2 заместителей для C2-3 алкенильной группы.
“C2-8 Алкинильная группа” означает одновалентную группу, где, по меньшей мере, одна тройная связь (два смежных SP атома углерода) содержится в линейной или разветвленной алифатической углеводородной группе, содержащей от 1 до 8 атомов углерода. Конкретные примеры C2-8 алкинильной группы включают этинильную группу, 1-пропинильную группу, пропаргильную группу и 3-бутинильную группу. Предпочтительно она представляет собой C2-6 алкинильную группу, более предпочтительно C2-5 алкинильную группу, еще более предпочтительно C2-4 алкинильную группу, и еще более предпочтительно C2-3 алкинильную группу.
“C2-8 Алкинильная группа, которая может быть замещена” означает незамещенную C2-8 алкинильную группу, описанную выше, или C2-8 алкинильную группу, в которой, по меньшей мере, один атом водорода в алкинильной группе замещен определенным в настоящем описании заместителем(заместителями). Когда присутствуют две или более групп заместителей, каждая группа заместителя может иметь одинаковое или отличное друг от друга значение. Кроме того, связанный простой связью атом углерода может быть замещен циклической группой заместителя через спиро связь. Предпочтительно, она представляет собой C2-8 алкинильную группу, которая может быть замещена 1-3 заместителями. Более предпочтительно, включает 1-3 заместителя для C2-6 алкинильной группы и C2-4 алкинильной группы, и от 1 до 2 заместителе для C2-3 алкинильной группы.
“C3-8 Циклоалкильная группа” означает алифатическую углеводородную группу в циклической форме. Предпочтительно, она включает C3-6 циклоалкильную группу. Конкретные примеры такой группы включают циклопропильную группу, циклобутильную группу, циклопентильную группу, циклогексильную группу, циклогептильную группу и циклооктильную группу. Предпочтительно, она представляет собой C3-6 циклоалкильную группу.
“C3-8 Циклоалкильная группа, которая может быть замещена” означает незамещенную C3-8 циклоалкильную группу, описанную выше, или C3-8 циклоалкильную группу, в которой, по меньшей мере, один атом водорода замещен определенной в настоящей заявке группой(группами) заместителя. Когда присутствуют две или более групп заместителей, каждая группа заместителя может иметь одинаковое или отличное друг от друга значение. Кроме того, связанный простой связью атом углерода может быть замещен циклической группой заместителя через спиро связь. Предпочтительно, она представляет собой C3-8 циклоалкильную группу, которая может быть замещена 1-3 заместителями.
“4-10-Членная гетероциклоалкильная группа” означает насыщенную или частично ненасыщенную гетероциклическую группу, которая состоит из 4-10 образующих кольцо атомов и включает от 1 до 3 гетероатомов, которые выбраны из O, S и N. Гетероциклоалкильная группа может представлять собой гетероциклоалкильную группу моноциклического, бициклического или спироциклического типа. Конкретные примеры такой группы включают оксетанильную группу, тетрагидрофурильную группу, тетрагидротиенильную группу, тетрагидропиранильную группу, пирролидинoгруппу, пирролидинильную группу, пиперидинoгруппу, пиперидинильную группу, пиперазинoгруппу, пиперазинильную группу, морфолинoгруппу, морфолинильную группу, тетрагидротиопиранильную группу, тиоморфолинoгруппу, имидазолидинильную группу, 1,3-диоксоланильную группу, тетрагидропиранильную группу, 1,3-диоксанильную группу, 1,2,3,6-тетрагидропиридинильную группу, 1,4-диокса-8-аза-спиро[4.5]деканильную группу и 1-окса-8-аза-спиро[4.5]деканильную группу. Предпочтительно она представляет собой 4-8-членную гетероциклоалкильную группу, более предпочтительно 4-6-членную гетероциклоалкильную группу.
“4-10-Членная гетероциклоалкильная группа, которая может быть замещена” означает незамещенную 4-10-членную гетероциклоалкильную группу, описанную выше, или 4-10-членную гетероциклоалкильную группу, в которой, по меньшей мере, один атом водорода в гетероциклоалкильной группе замещен определенным в настоящем описании заместителем(заместителями). Когда присутствуют две или более групп заместителей, каждая группа заместителя может иметь одинаковое или отличное друг от друга значение. Кроме того, алкильная группа может быть замещена циклической группой заместителя через спиро связь. Предпочтительно, она представляет собой 4-10-членную гетероциклоалкильную группу, которая может быть замещена 1-4 заместителями. Более предпочтительно, включает от 1 до 4 заместителей для 4-8-членной гетероциклоалкильной группы и 1-3 заместителя для 4-6-членной гетероциклоалкильной группы. Когда заместитель представляет собой оксогруппу, 2 оксогруппы могут быть соединены с одним и тем же атомом серы. Когда образуется соль, 2 алкильные группы могут быть соединены с одним и тем же атомом азота.
“C6-10 Арильная группа” означает одновалентное ароматическое углеводородное кольцо. Конкретные примеры C6-10 арильной группы включают фенильную группу, 1-нафтильную группу и 2-нафтильную группу. Предпочтительно, она представляет собой C6 арильную группу или C10 арильную группу.
“C6-10 Арильная группа, которая может быть замещена” означает незамещенную C6-10 арильную группу, описанную выше, или C6-10 арильную группу, в которой, по меньшей мере, один атом водорода замещен определенной в настоящей заявке группой(группами) заместителя. Когда присутствуют две или более групп заместителей, каждая группа заместителя может иметь одинаковое или отличное друг от друга значение. Предпочтительно, она представляет собой C6-10 арильную группу, которая может быть замещена 1-3 заместителями.
“5-14-Членная гетероарильная группа” означает ароматическую циклическую группу, включающую один или несколько гетероатомов из числа 5-14 образующих кольцо атомов. Цикл может представлять собой моноциклическую или бициклическую гетероарильную группу, конденсированную с бензольным кольцом или моноциклическим гетероарильным кольцом. Конкретные примеры такой группы включают фурильную группу, тиенильную группу, пирролильную группу, имидазолильную группу, пиразолильную группу, тиазолильную группу, изотиазолильную группу, оксазолильную группу, изооксазолильную группу, оксадиазолильную группу, тиадиазолильную группу, триазолильную группу, тетразолильную группу, пиридильную группу, пиримидильную группу, пиридазинильную группу, пиразинильную группу, триазинильную группу, бензофуранильную группу, бензотиенильную группу, бензотиадиазолильную группу, бензотиазолильную группу, бензоксазолильную группу, бензоксадиазолильную группу, бензоимидазолильную группу, индолильную группу, изоиндолильную группу, индазолильную группу, хинолильную группу, изохинолильную группу, циннолинильную группу, хиназолинильную группу, хиноксалинильную группу, бензодиоксолильную группу, индолизинильную группу, имидазопиридильную группу и т.п. Предпочтительно, она представляет собой 5-6-членную гетероарильную группу.
“5-14-Членная гетероарильная группа, которая может быть замещена” означает незамещенную 5-14-членную кольцевую гетероарильную группу, описанную выше, или 5-14-членную кольцевую гетероарильную группу, в которой, по меньшей мере, один атом водорода в гетероарильной группе замещен определенным в настоящем описании заместителем(заместителями). Когда присутствуют две или более групп заместителей, каждая группа заместителя может иметь одинаковое или отличное друг от друга значение. Предпочтительно, она представляет собой 5-14-членную гетероарильную группу, которая может быть замещена 1-3 заместителями. Более предпочтительно, включает от 1 до 3 заместителей или от 1 до 2 заместителей для 5-6-членной гетероарильной группы.
“C1-8 Алканоильная группа” означает C1-8 алкил-C(O)- группу, и указанная C1-8 алкильная группа описана выше. Конкретные примеры такой группы включают ацетильную, пропионильную, бутирильную, изобутирильную, пентаноильную, трет-бутилкарбонильную и гексаноильную группу. Предпочтительно она представляет собой C1-6 алканоильную группу, и более предпочтительно C1-3 алканоильную группу.
“C1-8 Алканоильная группа, которая может быть замещена” означает незамещенную C1-8 алканоильную группу, описанную выше, или C1-8 алканоильную группу, в которой, по меньшей мере, один атом водорода в алканоильной группе замещен определенным в настоящем описании заместителем(заместителями). Когда присутствуют две или более групп заместителей, каждая группа заместителя может иметь одинаковое или отличное друг от друга значение. Предпочтительно, она представляет собой C1-8 алканоильную группу, которая может быть замещена 1-3 заместителями. Более предпочтительно, включает от 1 до 2 заместителей для C1-6 алканоильной группы и C1-3 алканоильной группы.
“C3-8 Циклоалкилкарбонильная группа” означает C3-8 циклоалкил-C(O)-группу, и указанная C3-8 циклоалкильная группа описана выше. Конкретные примеры такой группы включают циклопропилкарбонильную группу, циклобутилкарбонильную группу, циклопентилкарбонильную группу, циклогексилкарбонильную группу, циклогептилкарбонильную группу и циклооктилкарбонильную группу.
“4-10-Членная гетероциклоалкилкарбонильная группа” означает 4-10-членную гетероциклоалкил-CO- группу, и указанный 4-10-членный гетероциклоалкил описан выше.
“4-10-Членная гетероциклоалкилкарбонильная группа, которая может быть замещена” означает незамещенную 4-10-членную гетероциклоалкилкарбонильную группу, описанную выше, или 4-10-членную гетероциклоалкилкарбонильную группу, в которой, по меньшей мере, один атом водорода гетероциклоалкильной группы замещен определенным в настоящем описании заместителем(заместителями). Когда присутствуют две или более групп заместителей, каждая группа заместителя может иметь одинаковое или отличное друг от друга значение. Кроме того, гетероциклоалкильная группа может быть замещена циклической группой заместителя через спиро связь. Предпочтительно, она представляет собой 4-10-членную гетероциклоалкилкарбонильную группу, которая может быть замещена 1-3 заместителями.
“Аминокарбонильная группа, которая может быть замещена” означает незамещенную аминокарбонильную группу или аминокарбонильную группу, в которой один или два атома водорода по атому азота замещены определенным в настоящем описании заместителем(заместителями). Когда присутствуют две группы заместителя, каждая группа заместителя может иметь одинаковое или отличное друг от друга значение.
“C3-8 Циклоалкил(C0-8 алкил)аминокарбонилоксигруппа” означает C3-8 циклоалкил-NHC(O)O- группу или C3-8 циклоалкил-N(C1-8 алкил)C(O)O- группу, и указанная C3-8 циклоалкильная группа описана выше. Конкретные примеры такой группы включают циклопропиламинокарбонилоксигруппу, циклобутиламинокарбонилоксигруппу, циклопентиламинокарбонилоксигруппу, циклогексиламинокарбонилоксигруппу, циклопропил(N-метил)аминокарбонилоксигруппу и циклобутил(N-метил)аминокарбонилоксигруппу.
“(C1-8 Алкил)х-аминокарбонильная группа”, где x представляет собой символ, определенный в формуле изобретения, означает NH2C(O)- группу, (C1-8 алкил)NH-C(O)- группу, или (C1-8 алкил)2N-C(O)- группу. Конкретные примеры такой группы включают N-метил-аминокарбонильную группу, N-этил-аминокарбонильную группу, N-н-бутил-аминокарбонильную группу, N,N-диметил-аминокарбонильную группу.
“(C1-8 Алкил)х-аминокарбонильная группа, которая может быть замещена” означает незамещенную (C1-8 алкил)х-аминокарбонильную группу, описанную выше, или (C1-8 алкил)х-аминокарбонильную группу, в которой, по меньшей мере, один атом водорода по атому азота или в алкильной группе замещен определенным в настоящем описании заместителем(заместителями). Когда присутствует несколько групп заместителей, каждая группа заместителя может иметь одинаковое или отличное друг от друга значение.
“C6-10 Арил(C0-8 алкил)аминокарбонильная группа” означает C6-10 арил-NHC(O)- группу или C6-10 арил-N(C1-8 алкил)-C(O)- группу. Конкретные примеры такой группы включают фенил-NHC(O)- группу, или фенил-(N-метил)-аминокарбонильную группу, где C6-10 арильная группа и C1-8 алкил описаны выше. Конкретные примеры такой группы включают фениламинокарбониламиногруппу и фениламинокарбонил(N-метил)аминогруппу.
“4-10-Членная азотсодержащая гетероциклоалкилкарбонильная группа” означает карбонильную группу, с которой связана 4-10-членная азотсодержащая гетероциклоалкильная группа. В настоящей заявке 4-10-членная азотсодержащая гетероциклоалкильная группа (т.е. 4-10-членная гетероциклоалкильная группа, включающая атом(атомы) азота) означает гетероциклоалкильную группу, которая состоит из 4-10 образующих кольцо атомов и включает, по меньшей мере, один атом азота в качестве гетероатома. Предпочтительно, она связана с карбонильной группой через атом азота, который содержится в гетероциклоалкильном кольце. Конкретные примеры 4-10-членной азотсодержащей гетероциклоалкильной группы включают пирролидинильную группу, имидазолидинильную группу, морфолинoгруппу, тиоморфолиногруппу, пиперазинoгруппу и пиперидинoгруппу. Также как для 4-10-членной азотсодержащей гетероциклоалкилкарбонильной группы, ее примеры включают пирролидинoкарбонильную группу, пиперидинoкарбонильную группу, пиперазинoкарбонильную группу и морфолинoкарбонильную группу.
“4-10-Членная азотсодержащая гетероциклоалкилкарбонильная группа, которая может быть замещена” означает незамещенную 4-10-членную азотсодержащую гетероциклоалкилкарбонильную группу, описанную выше, или 4-10-членную гетероциклоалкилкарбонильную группу, в которой, по меньшей мере, один атом водорода гетероциклоалкильной группы замещен определенным в настоящем описании заместителем(заместителями). Когда присутствуют две или более групп заместителей, каждая группа заместителя может иметь одинаковое или отличное друг от друга значение. Кроме того, гетероциклоалкильная группа может быть замещена циклической группой заместителя через спиро связь. Предпочтительно, она представляет собой 4-10-членную азотсодержащую гетероциклоалкилкарбонильную группу, которая может быть замещена 1-3 заместителями.
“4-10-Членная гетероциклоалкил(C0-8 алкил)аминокарбонильная группа” означает 4-10-членную гетероциклоалкил NHC(O)- группу, или 4-10-членную гетероциклоалкил N(C1-8 алкил)-C(O)- группу. Конкретные примеры такой группы включают оксетан-3-иламидную группу и (1,1-диоксо-тетрагидро-тиофен-3-ил)-амидную группу.
“4-10-Членная гетероциклоалкил(C0-8 алкил)аминокарбонильная группа, которая может быть замещена одной или несколькими оксогруппами” означает незамещенную 4-10-членную гетероциклоалкиламинокарбонильную группу, описанную выше, или 4-10-членную гетероциклоалкиламинокарбонильную группу, в которой гетероциклоалкильная группа замещена, по меньшей мере, одной оксогруппой.
“C6-10 Арилсульфонильная группа” означает C6-10 арил-S(O)2- группу, и указанная C6-10 арильная группа описана выше. Конкретные примеры такой группы включают фенилсульфонильную группу.
“5-14-Членная гетероарилсульфонильная группа” означает 5-14-членную гетероарил-S(O)2- группу, и указанный 5-14-членный гетероарил описан выше. Конкретные примеры такой группы включают имидазол-сульфонильную группу.
“(C1-8 Алкил)х-аминогруппа”, где x представляет собой символ, определенный в формуле изобретения, означает аминогруппу, NH(C1-8 алкил) группу, или N(C1-8 алкил)2- группу. Конкретные примеры такой группы включают амино, метиламино, этиламино, бутиламино, изопропиламино, диметиламино и диэтиламино. Предпочтительно, она представляет собой C1-3 алкиламиногруппу.
“(C1-8 Алкил)х-аминогруппа, которая может быть замещена” означает незамещенную (C1-8 алкил)х-аминогруппу или аминогруппу, в которой один или два атома водорода по атому азота или в алкильной группе замещены определенным в настоящем описании заместителем(заместителями). Когда присутствуют две группы заместителя, каждая группа заместителя может иметь одинаковое или отличное друг от друга значение.
“C1-8 Алкилкарбонил(C0-8 алкил)аминогруппа” означает C1-8 алкил-C(O)-NH- группу или C1-8 алкил-C(O)-N(C1-8 алкил)- группу, и указанный C1-8 алкил описан выше. Конкретные примеры такой группы включают метилкарбониламиногруппу, этилкарбониламиногруппу, пропилкарбониламиногруппу и бутилкарбониламиногруппу.
“C1-8 Алкилкарбонил(C0-8 алкил)аминогруппа, которая может быть замещена” означает незамещенную C1-8 алкилкарбонил(C0-8 алкил)аминогруппу, описанную выше, или C1-8 алкилкарбонил(C0-8 алкил)аминогруппу, в которой, по меньшей мере, один атом водорода концевой алкильной группы замещен определенным в настоящем описании заместителем(заместителями). Когда присутствуют две или более групп заместителей, каждая группа заместителя может иметь одинаковое или отличное друг от друга значение. Кроме того, алкильная группа может быть замещена циклической группой заместителя через спиро связь. Предпочтительно, она представляет собой C1-8 алкилкарбонил(C0-8 алкил)аминогруппу, которая может быть замещена 1-3 заместителями.
“C6-10 Арилкарбонил(C0-8 алкил)аминогруппа” означает C6-10арил-C(O)-NH- группу или C6-10 арил-C(O)-N(C1-8 алкил)- группу, и указанные C6-10 арильная группа и C1-8 алкильная группа описаны выше. Конкретные примеры такой группы включают фенилкарбониламиногруппу.
“C6-10 Арилкарбонил(C0-8 алкил)аминогруппа, которая может быть замещена” означает незамещеную C6-10 арилкарбонил(C0-8 алкил)аминогруппу, описанную выше, или C6-10 арилкарбонил(C0-8 алкил)аминогруппу, в которой, по меньшей мере, один атом водорода арильной группы замещен определенным в настоящем описании заместителем(заместителями). Когда присутствуют две или более групп заместителей, каждая группа заместителя может иметь одинаковое или отличное друг от друга значение. Предпочтительно, она представляет собой C6-10 арилкарбонил(C0-8 алкил)аминогруппу, которая может быть замещена 1-3 заместителями.
“(C1-8 Алкил)х-аминокарбонил(C0-8 алкил)аминогруппа”, где x представляет собой символ, определенный в формуле изобретения, означает NH2C(O)NH- группу, (C1-8 алкил)NHC(O)NH- группу, NH2C(O)N(C1-8 алкил)- группу или (C1-8 алкил)NHC(O)N(C1-8 алкил)- группу, и указанный C1-8 алкил описан выше. Конкретные примеры такой группы включают аминокарбонил-(N-метил)амино и (N-метил)аминокарбонил-(N’-метил)амино.
“(C1-8 Алкил)х-аминокарбонил(C0-8 алкил)аминогруппа, которая может быть замещена” означает незамещенную (C1-8 алкил)х-аминокарбонил(C0-8 алкил)аминогруппу или (C1-8 алкил)х-аминокарбонил(C0-8 алкил)аминогруппу, в которой, по меньшей мере, один атом водорода по атому азота или в алкильной группе замещен определенным в настоящем описании заместителем. Предпочтительно, она представляет собой (C1-8 алкил)х-аминокарбонил(C0-8 алкил)аминогруппу, которая может быть замещена фенильной группой.
“C1-8 Алкилсульфониламиногруппа” означает C1-8 алкил-S(O)2-NH- группу, и указанная C1-6 алкильная группа описана выше. Конкретные примеры такой группы включают метилсульфониламиногруппу и этилсульфониламиногруппу.
“(C1-8 Алкил)x-аминосульфонил(C0-8 алкил)аминогруппа”, где x представляет собой символ, определенный в формуле изобретения, означает NH2S(O)2NH- группу, NH(C1-8 алкил)-S(O)2NH- группу или N(C1-8 алкил)2-S(O)2NH- группу, NH2S(O)2N(C1-8 алкил)- группу, NH(C1-8 алкил)-S(O)2(C1-8 алкил)N- группу или N(C1-8 алкил)2-S(O)2(C1-8 алкил)N- группу, и указанная C1-8 алкильная группа описана выше. Конкретные примеры такой группы включают метиламино-сульфониламиногруппу и диметиламино-сульфониламиногруппу.
“C1-8 Алкоксигруппа” означает C1-8 алкил-O- группу. Конкретные примеры такой группы включают метоксигруппу, этоксигруппу, 1-пропоксигруппу, 2-пропоксигруппу, н-бутоксигруппу, изобутоксигруппу, втор-бутоксигруппу, трет-бутоксигруппу, 1-пентилоксигруппу, 2-пентилоксигруппу, 3-пентилоксигруппу, 2-метил-1-бутилоксигруппу, 3-метил-1-бутилоксигруппу, 2-метил-2-бутилоксигруппу, 3-метил-2-бутилоксигруппу, 2,2-диметил-1-пропилоксигруппу, 1-гексилоксигруппу, 2-гексилоксигруппу, 3-гексилоксигруппу, 2-метил-1-пентилоксигруппу, 3-метил-1-пентилоксигруппу, 4-метил-1-пентилоксигруппу, 2-метил-2-пентилоксигруппу, 3-метил-2-пентилоксигруппу, 4-метил-2-пентилоксигруппу, 2-метил-3-пентилоксигруппу, 3-метил-3-пентилоксигруппу, 2,3-диметил-1-бутилоксигруппу, 3,3-диметил-1-бутилоксигруппу, 2,2-диметил-1-бутилоксигруппу, 2-этил-1-бутилоксигруппу, 3,3-диметил-2-бутилоксигруппу, 2,3-диметил-2-бутилоксигруппу и 1-метил-циклопропилметоксигруппу. Предпочтительно она представляет собой C1-6 алкоксигруппу, более предпочтительно C1-5 алкоксигруппу, еще более предпочтительно C1-4 алкоксигруппу, и еще более предпочтительно C1-3 алкоксигруппу.
“C1-8 Алкоксигруппа, которая может быть замещена” означает незамещенную C1-8 алкоксигруппу или C1-8 алкоксигруппу, в которой, по меньшей мере, один атом водорода алкильной группы замещен определенным в настоящем описании заместителем(заместителями). Когда присутствуют две или более групп заместителей, каждая группа заместителя может иметь одинаковое или отличное друг от друга значение. Кроме того, алкильная группа может быть замещена циклической группой заместителя через спиро связь. Предпочтительно, она представляет собой C1-8 алкоксигруппу, которая может быть замещена 1-3 заместителями. Более предпочтительно, включает 1-3 заместителя для C1-6 алкоксигруппы и C1-4 алкоксигруппы, и от 1 до 2 заместителей для C1-3 алкоксигруппы.
“C1-8 Алкоксикарбонильная группа” означает C1-8 алкил-O-C(O)- группу, и указанная C1-8 алкильная группа описана выше. Конкретные примеры такой группы включают метоксикарбонильную группу, этоксикарбонильную группу, н-пропоксикарбонильную группу и изопропоксикарбонильную группу. Предпочтительно она представляет собой C1-6 алкоксикарбонильную группу, и более предпочтительно C1-3 алкоксикарбонильную группу.
“C1-8 Алкоксикарбонильная группа, которая может быть замещена” означает незамещенную C1-8 алкоксикарбонильную группу, описанную выше, или C1-8 алкоксикарбонильную группу, в которой, по меньшей мере, один атом водорода замещен определенным в настоящем описании заместителем(заместителями). Когда присутствуют две или более групп заместителей, каждая группа заместителя может иметь одинаковое или отличное друг от друга значение. Кроме того, алкильная группа в алкоксикарбонильной группе может быть замещена циклической группой заместителя через спиро связь. Предпочтительно, она представляет собой C1-8 алкоксикарбонильную группу, которая может быть замещена 1-3 заместителями.
“C0-8 Алкокси(C0-8 алкил)аминокарбонильная группа” означает HO-NH-C(O)- группу, C1-8 алкил-NH-C(O)- группу, HO-N(C1-8 алкил)-C(O)- группу или C1-8 алкил-N(C1-8 алкил)-C(O)- группу и содержит C1-8 алкоксигруппу или C1-8 алкильную группу, описанные выше. Конкретные примеры такой группы включают метоксиаминокарбонильную группу, этоксиаминокарбонильную группу, н-пропоксиаминокарбонильную группу и изопропоксиаминокарбонильную группу. Предпочтительно она представляет собой C1-6 алкоксиаминокарбонильную группу, и более предпочтительно C1-3 алкоксиаминокарбонильную группу.
“C0-8 Алкокси(C0-8 алкил)аминокарбонильная группа, которая может быть замещена” означает незамещенную гидроксиаминокарбонильную группу, описанную выше, или C1-8 алкоксиаминокарбонильную группу, гидрокси(C1-8 алкил)аминокарбонильную группу или C1-8 алкокси(C1-8 алкил)аминокарбонильную группу, где, по меньшей мере, один атом водорода алкильной группы замещен определенным в настоящем описании заместителем(заместителями). Когда присутствуют две или более групп заместителей, каждая группа заместителя может иметь одинаковое или отличное друг от друга значение. Кроме того, алкильная группа может быть замещена циклической группой заместителя через спиро связь. Предпочтительно, она представляет собой C1-8 алкоксиаминокарбонильную группу, которая может быть замещена 1-3 заместителями.
“4-10-Членная гетероциклоалкилоксигруппа” означает 4-10-членную гетероциклоалкил-O- группу, и указанный 4-10-членный гетероциклоалкил описан выше.
“4-10-Членная гетероциклоалкилоксигруппа, которая может быть замещена” означает незамещенную 4-10-членную гетероциклоалкилоксигруппу, описанную выше, или 4-10-членную гетероциклоалкилоксигруппу, в которой, по меньшей мере, один атом водорода гетероциклоалкильной группы замещен определенным в настоящем описании заместителем(заместителями). Когда присутствуют две или более групп заместителей, каждая группа заместителя может иметь одинаковое или отличное друг от друга значение. Кроме того, гетероциклоалкильная группа может быть замещена циклической группой заместителя через спиро связь. Предпочтительно, она представляет собой 4-10-членную гетероциклоалкилоксигруппу, которая может быть замещена 1-3 заместителями.
“C6-10 Арилоксигруппа” означает C6-10 арил-O- группу, и указанная C6-10 арильная группа описана выше.
“5-14-Членная гетероарилоксигруппа” означает 5-14-членную гетероарил-O- группу, и указанный 5-14-членный гетероарил описан выше. Конкретные примеры такой группы включают пиримидинилоксигруппу.
“C1-8 Алкилкарбонилоксигруппа” означает C1-8 алкил-C(O)-O- группу, и указанный C1-8 алкил описан выше. Конкретные примеры такой группы включают метилкарбонилоксигруппу, этилкарбонилоксигруппу и пропилкарбонилоксигруппу.
“C2-8 Алкенилкарбонилоксигруппа” означает C2-8 алкенил-C(O)-O- группу, и указанный C2-8 алкенил описан выше. Конкретные примеры такой группы включают 2-метил-2-бутеноилокси группу.
“4-10-Членная гетероциклоалкилкарбонилоксигруппа” означает 4-10-членную гетероциклоалкил-C(O)-O- группу, и указанный 4-10-членную гетероциклоалкил описан выше.
“(C1-8 Алкил)х-аминокарбонилоксигруппа”, где x представляет собой символ, определенный в формуле изобретения, означает NH2C(O)-O- группу, NH(C1-8 алкил)-C(O)-O- группу или N(C1-8 алкил)2-C(O)-O- группу. Конкретные примеры такой группы включают метиламино-карбонилоксигруппу, этиламино-карбонилоксигруппу и пропиламино-карбонилоксигруппу.
“(C1-8 Алкил)х-аминокарбонилоксигруппа, которая может быть замещена” означает незамещенную (C1-8 алкил)х-аминокарбонилоксигруппу или (C1-8 алкил)х-аминокарбонилоксигруппу, в которой один или два атома водорода по атому азота или в алкильной группе замещены определенным в настоящем описании заместителем(заместителями). Когда присутствуют две группы заместителя, каждая группа заместителя может иметь одинаковое или отличное друг от друга значение.
“4-10-Членная азотсодержащая гетероциклоалкилсульфонильная группа” означает 4-10-членную азотсодержащую гетероциклоалкил-S(O)2- группу, описанную выше. Конкретные примеры такой группы включают морфолино-сульфонильную группу.
“4-10-Членная азотсодержащая гетероциклоалкилсульфонильная группа, которая может быть замещена” означает незамещенную 4-10-членную азотсодержащую гетероциклоалкилсульфонильную группу, описанную выше, или 4-10-членную азотсодержащую гетероциклоалкилсульфонилоксигруппу, в которой, по меньшей мере, один атом водорода в 4-10-членной азотсодержащей гетероциклоалкильной группе замещен определенным в настоящем описании заместителем(заместителями). Когда присутствуют две или более групп заместителей, каждая группа заместителя может иметь одинаковое или отличное друг от друга значение. Предпочтительно, она представляет собой 4-10-членный азотсодержащий гетероциклоалкилсульфонил, который может быть замещен 1-3 заместителями.
“4-10-Членная азотсодержащая гетероциклоалкилсульфонилоксигруппа” означает 4-10-членную азотсодержащую гетероциклоалкил-S(O)2-O- группу, описанную выше. Конкретные примеры такой группы включают морфолино-сульфонилоксигруппу и пиперидино-сульфонилоксигруппу.
“4-10-Членная азотсодержащая гетероциклоалкилсульфонилоксигруппа, которая может быть замещена” означает незамещенную 4-10-членную азотсодержащую гетероциклоалкилсульфонилоксигруппу, описанную выше, или 4-10-членную азотсодержащую гетероциклоалкилсульфонилоксигруппу, в которой, по меньшей мере, один атом водорода 4-10-членной азотсодержащей гетероциклоалкильной группы замещен определенным в настоящем описании заместителем(заместителями). Когда присутствуют две или более групп заместителей, каждая группа заместителя может иметь одинаковое или отличное друг от друга значение. Предпочтительно, она представляет собой 4-10-членный азотсодержащий гетероциклоалкилсульфонилокси, который может быть замещен 1-3 заместителями.
“C1-8 Алкилсульфонилоксигруппа” означает C1-8 алкил-S(O)2-O- группу, и указанный C1-8 алкил описан выше.
“C1-8 Алкилсульфонилоксигруппа, которая может быть замещена” означает незамещенную C1-8 алкилсульфонилоксигруппу, описанную выше, или C1-8 алкилсульфонилоксигруппу, в которой, по меньшей мере, один атом водорода алкильной группы замещен определенным в настоящем описании заместителем(заместителями). Когда присутствуют две или более групп заместителей, каждая группа заместителя может иметь одинаковое или отличное друг от друга значение. Кроме того, алкильная группа может быть замещена циклической группой заместителя через спиро связь. Предпочтительно, она представляет собой C1-8 алкилсульфонилоксигруппу, которая может быть замещена 1-3 заместителями. Конкретные примеры такой группы включают трифторметилсульфонилоксигруппу.
“(C1-8 Алкил)х-аминосульфонилоксигруппа”, где x представляет собой символ, определенный в формуле изобретения, означает NH2S(O)2- группу, N(C1-8 алкил)S(O)2- группу или N(C1-8 алкил)2S(O)2- группу. Конкретные примеры такой группы включают N-метиламиносульфонилоксигруппу.
“C1-8 Алкилтиогруппа” означает C1-8 алкил-S- группу, и указанная C1-8 алкильная группа описана выше. Примеры такой группы включают метилтио, этилтио, н-пропилтио, изопропилтио, н-бутилтио, втор-бутилтио, изобутилтио, трет-бутилтио, н-пентилтио, 3-метилбутилтио, 2-метилбутилтио, 1-метилбутилтио, 1-этилпропилтио, н-гексилтио, 4-метилпентилтио, 3-метилпентилтио, 2-метилпентилтио, 1-метилпентилтио, 3-этилбутилтио и 2-этилбутилтио и т.п. Предпочтительно она представляет собой C1-6 алкилтиогруппу, и более предпочтительно C1-3 алкилтиогруппу.
“C1-8 Алкилтиогруппа, которая может быть замещена” означает незамещенную C1-8 алкилтиогруппу или C1-8 алкилтиогруппу, в которой, по меньшей мере, один атом водорода алкильной группы замещен определенным в настоящем описании заместителем(заместителями). Когда присутствуют две или более групп заместителей, каждая группа заместителя может иметь одинаковое или отличное друг от друга значение. Кроме того, алкильная группа может быть замещена циклической группой заместителя через спиро связь. Предпочтительно, она представляет собой C1-8 алкилтиогруппу, которая может быть замещена 1-3 заместителями.
“C1-8 Алкилсульфонильная группа” означает C1-8 алкил-S(O)2- группу, и указанная C1-8 алкильная группа описана выше. Конкретные примеры такой группы включают метилсульфонильную группу, этилсульфонильную группу и н-пропилсульфонильную группу. Предпочтительно она представляет собой C1-6 алкилсульфонильную группу, и более предпочтительно C1-3 алкилсульфонильную группу.
“C1-8 Алкилсульфинильная группа” означает C1-8 алкил-S(O)- группу, и указанная C1-8 алкильная группа описана выше. Конкретные примеры такой группы включают метилсульфинильную группу, этилсульфинильную группу и н-пропилсульфинильную группу. Предпочтительно она представляет собой C1-6 алкилсульфинильную группу, и более предпочтительно C1-3 алкилсульфинильную группу.
“C1-8 Алкилсульфонильная группа, которая может быть замещена” означает незамещенную C1-8 алкилсульфонильную группу, описанную выше, или C1-8 алкилсульфонильную группу, в которой, по меньшей мере, один атом водорода алкильной группы замещен определенным в настоящем описании заместителем(заместителями). Когда присутствуют две или более групп заместителей, каждая группа заместителя может иметь одинаковое или отличное друг от друга значение. Предпочтительно, она представляет собой C1-8 алкилсульфонильную группу, которая может быть замещена 1-3 заместителями.
“C1-8 Алкилсульфинильная группа, которая может быть замещена” означает незамещенную C1-8 алкилсульфинильную группу, описанную выше, или C1-8 алкилсульфинильную группу, в которой, по меньшей мере, один атом водорода алкильной группы замещен определенным в настоящем описании заместителем(заместителями). Когда присутствуют две или более групп заместителей, каждая группа заместителя может иметь одинаковое или отличное друг от друга значение. Предпочтительно, она представляет собой C1-8 алкилсульфинильную группу, которая может быть замещена 1-3 заместителями.
“4-10-Членная гетероциклоалкилсульфонильная группа” означает 4-10-членную гетероциклоалкил-S(O)2- группу, и указанный 4-10-членный гетероциклоалкил описан выше.
“4-10-Членная гетероциклоалкилсульфонильная группа, которая может быть замещена” означает незамещенную 4-10-членную гетероциклоалкилсульфонильную группу, описанную выше, или 4-10-членную гетероциклоалкилсульфонильную группу, в которой, по меньшей мере, один атом водорода гетероциклоалкильной группы замещен определенным в настоящем описании заместителем(заместителями). Когда присутствуют две или более групп заместителей, каждая группа заместителя может иметь одинаковое или отличное друг от друга значение. Кроме того, гетероциклоалкильная группа может быть замещена циклической группой заместителя через спиро связь. Предпочтительно, она представляет собой 4-10-членную гетероциклоалкилсульфонильную группу, которая может быть замещена 1-3 заместителями.
“(C1-8 Алкил)х-аминосульфонильная группа”, где x представляет собой символ, определенный в формуле изобретения, означает NH2-S(O)2- группу, C1-8 алкиламино-S(O)2- группу или (C1-8 алкил)2амино-S(O)2- группу, и указанный C1-8 алкил описан выше. Конкретные примеры такой группы включают аминосульфонильную группу, метиламиносульфонильную группу и диметиламиносульфонильную группу.
“(C1-8 Алкил)х-аминосульфонильная группа, которая может быть замещена” означает незамещенную аминосульфонильную группу или (C1-8 алкил)x-аминосульфонильную группу, в которой один или два атом водорода по атому азота или в алкильной группе замещены определенным в настоящем описании заместителем(заместителями). Когда присутствуют две группы заместителя, каждая группа заместителя может иметь одинаковое или отличное друг от друга значение.
“C1-8 Алкоксикарбонил(C0-8 алкил)аминогруппа” означает C1-8 алкокси-C(O)-NH- группу или C1-8 алкокси-C(O)-N(C1-8 алкил)- группу, где указанные C1-8 алкоксигруппа и C1-8 алкил описаны выше. Конкретные примеры такой группы включают метоксикарбамоильную группу и N-этилкарбонил-N-метил-аминогруппу.
“C1-8 Алкоксикарбонил(C0-8 алкил)аминогруппа, которая может быть замещена” означает незамещенную C1-8 алкоксикарбонил(C0-8 алкил)аминогруппу, описанную выше, или C1-8 алкоксикарбонил(C0-8 алкил)аминогруппу, где, по меньшей мере, один атом водорода алкильной группы замещен определенным в настоящем описании заместителем(заместителями). Когда присутствуют две или более групп заместителей, каждая группа заместителя может иметь одинаковое или отличное друг от друга значение. Предпочтительно, она представляет собой C1-8 алкоксикарбонил(C0-8 алкил)аминогруппу, которая может быть замещена 1-3 заместителями.
“C1-8 Алкоксикарбонил(C0-8 алкил)аминосульфонильная группа” означает C1-8 алкокси-C(O)-NHS(O)2- группу или C1-8 алкокси-C(O)-N(C1-8 алкил)S(O)2- группу, где указанные C1-8 алкоксигруппа и C1-8 алкильная группа описаны выше. Конкретные примеры такой группы включают метоксикарбониламиносульфонильную группу и этоксикарбонил-N-метил-аминосульфонильную группу.
“C6-10 Арилоксикарбонил(C0-8 алкил)аминогруппа” означает C6-10 арил-O-C(O)-NH- группу или C6-10 арил-O-C(O)-N(C1-8 алкил)- группу, где указанные C6-10 арильная группа и C1-8 алкил описаны выше. Конкретные примеры такой группы включают фенилоксикарбониламиногруппу и N-метил-N-фенилоксикарбонил-аминогруппу.
“C6-10 Арилоксикарбонил(C0-8 алкил)аминогруппа, которая может быть замещена” означает незамещенную C6-10 арилоксикарбонил(C0-8 алкил)аминогруппу, описанную выше, или C6-10 арилоксикарбонил(C0-8 алкил)аминогруппу, в которой, по меньшей мере, один атом водорода арильной группы замещен определенным в настоящем описании заместителем(заместителями). Когда присутствуют две или более групп заместителей, каждая группа заместителя может иметь одинаковое или отличное друг от друга значение. Предпочтительно, она представляет собой C6-10 арилоксикарбонил(C0-8 алкил)аминогруппу, которая может быть замещена 1-3 заместителями.
“C6-10 Арил(C0-8 алкил)аминокарбонил(C0-8 алкил)аминогруппа” означает C6-10 арил-NHC(O)NH- группу, C6-10 арил-N(C1-8 алкил)-C(O)NH- группу, C6-10 арил-N(C1-8 алкил)-C(O)N(C1-8 алкил)- группу или C6-10 арил-NH-C(O)N(C1-8 алкил)- группу, где указанные C6-10 арильная группа и C1-8 алкил описаны выше. Конкретные примеры такой группы включают фениламинокарбониламиногруппу и фениламинокарбонил(N-метил)аминогруппу.
“C6-10 Арил(C0-8 алкил)аминокарбонил(C0-8 алкил)аминогруппа, которая может быть замещена” означает незамещенную C6-10 арил(C0-8 алкил)аминокарбонил(C0-8 алкил)аминогруппу, описанную выше, или C6-10 арил(C0-8 алкил)аминокарбонил(C0-8 алкил)аминогруппу, в которой, по меньшей мере, один атом водорода арильной группы замещен определенным в настоящем описании заместителем(заместителями). Когда присутствуют две или более групп заместителей, каждая группа заместителя может иметь одинаковое или отличное друг от друга значение. Предпочтительно, она представляет собой C6-10 арил(C0-8 алкил)аминокарбонил(C0-8 алкил)аминогруппу, которая может быть замещена 1-3 заместителями.
“C6-10 Арил(C0-8 алкил)аминокарбонилоксигруппа” означает C6-10 арил-NHC(O)-O- или C6-10 арил-N(C1-8 алкил)-C(O)-O- группу, где указанные C6-10 арильная группа и C1-8 алкил описаны выше. Конкретные примеры такой группы включают фениламинокарбонилоксигруппу и фениламинокарбонил(N-метил)аминокарбонилоксигруппу.
“C6-10 Арил(C0-8 алкил)аминокарбонилоксигруппа, которая может быть замещена” означает незамещенную C6-10 арил(C0-8 алкил)аминокарбонилоксигруппу, описанную выше, или C6-10 арил(C0-8 алкил)аминокарбонилоксигруппу, в которой, по меньшей мере, один атом водорода арильной группы замещен определенным в настоящем описании заместителем(заместителями). Когда присутствуют две или более групп заместителей, каждая группа заместителя может иметь одинаковое или отличное друг от друга значение. Предпочтительно, она представляет собой C6-10 арил(C0-8 алкил)аминокарбонилоксигруппу, которая может быть замещена 1-3 заместителями.
“C1-8 Алкилсульфонил(C0-8 алкил)аминогруппа” означает C1-8 алкил-S(O)2-NH- группу или C1-8 алкил-S(O)2-N(C1-8 алкил)- группу. Конкретные примеры такой группы включают метилсульфониламиногруппу и метилсульфонил-(N-метил)аминогруппу.
“C2-8 Алкенилоксигруппа” означает C2-8 алкенил-O- группу, где указанная C2-8 алкенильная группа описана выше. Конкретные примеры C2-8 алкенилоксигруппы включают винилоксигруппу и аллилоксигруппу.
Предпочтительно, все из A1, A2, A3, A4, A7, A8, A9 и A10 представляют собой C, или какой-либо один из A2, A4, A7 и A9 представляет собой N, а остальные представляют собой C (при условии, что, когда A2, A4, A7 или A9 представляет собой N, они не содержат группу заместителя R2, R4, R7 или R9). Более предпочтительно, все из них представляют собой C, или A4 представляет собой N, тогда как остальные представляют собой C, еще более предпочтительно, все из них представляют собой C, или A4, A7 и A9 представляет собой N, а остальные представляют собой C (при условии, что, когда A4, A7 или A9 представляет собой N, они не содержат группу заместителя R4, R7, R9).
A5 предпочтительно представляет собой NR5 или O, более предпочтительно NR5, еще более предпочтительно NH.
R1 предпочтительно представляет собой
[1] атом водорода,
[2] атом галогена,
и более предпочтительно
[1] атом водорода,
[2] атом фтора,
[3] атом хлора.
R10 предпочтительно представляет собой атом водорода.
R2 предпочтительно представляет собой
[1] атом водорода,
[2] C1-5 алкильную группу,
[3] циано,
[4] атом галогена,
и более предпочтительно
[1] атом водорода,
[2] C1-3 алкильную группу,
[3] атом фтора,
[4] атом хлора,
[5] атом брома.
И еще более предпочтительно
[1] атом водорода,
[2] атом галогена,
еще более предпочтительно
[1] атом водорода.
R4 предпочтительно представляет собой
[1] атом водорода,
[2] C1-5 алкильную группу, которая может быть замещена 1-11 атомом(атомами) галогена,
[3] C3-6 циклоалкильную группу,
[4] циано,
[5] атом галогена,
[6] (C1-3 алкил)m4b-аминогруппу (m4b: 0~2),
[7] гидрокси,
[8] C1-5 алкоксигруппу, которая может быть замещена 1-4 гидроксигруппами,
и более предпочтительно
[1] атом водорода,
[2] C1-3 алкильную группу, которая может быть замещена 1-7 атомом(атомами) галогена,
[3] C3-5 циклоалкильную группу,
[4] циано,
[5] атом фтора,
[6] атом брома,
[7] амино (C1-3 алкил)m4b-аминогруппу,
[8] гидрокси,
[9] C1-3 алкоксигруппу, которая может быть замещена 1-2 гидроксигруппами,
еще более предпочтительно
[1] атом водорода,
[2] C1-8 алкильную группу, которая может быть замещена, по меньшей мере, одним атомом галогена,
[3] C3-8 циклоалкильную группу,
[4] циано,
[5] атом галогена,
[6] гидрокси,
[7] C1-8 алкоксигруппу, которая может быть замещена гидроксигруппой,
еще более предпочтительно
[1] атом водорода,
[2] атом галогена.
R5 предпочтительно представляет собой
[1] атом водорода,
[2] C1-5 алкильную группу, которая может быть замещена 1-5 заместителями R5A,
[3] C1-5 алкилсульфонильную группу,
и более предпочтительно
[1] атом водорода,
[2] C1-3 алкильную группу, которая может быть замещена 1-3 заместителями R5A,
[3] C1-3 алкилсульфонильную группу.
Еще более предпочтительно
[1] атом водорода,
[2] C1-8 алкильную группу,
еще более предпочтительно
[1] атом водорода.
R5A предпочтительно представляет собой
[1] C1-5 алкоксикарбонильную группу,
[2] гидрокси,
[3] C1-5 алкоксигруппу,
[4] (C1-5 алкил)m5-аминогруппу (m5: 0-2),
[5] C6 арил,
[6] C1-5 алкилтиогруппу,
и более предпочтительно
[1] C1-3 алкоксикарбонильную группу,
[2] гидрокси,
[3] C1-3 алкоксигруппу,
[4] (C1-3 алкил)m5-аминогруппу (m5: 0-2),
[5] C1-3 алкилтиогруппу,
еще более предпочтительно
[1] гидрокси,
[2] C1-5 алкоксигруппу,
[3] (C1-5 алкил)m5-аминогруппу (m5: 0-2),
[4] C1-5 алкилтиогруппу.
R6 и R6' предпочтительно представляют собой
[1] C1-8 алкильную группу,
взятые вместе с атомами углерода, с которыми они связаны, образуют
[2] C3-8 циклоалкильную группу,
[3] 4-10-членную гетероциклоалкильную группу,
более предпочтительно
[1] C1-3 алкильную группу,
взятые вместе с атомами углерода, с которыми они связаны, образуют
[2] C3-6 циклоалкильную группу,
[3] 4-6-членную гетероциклоалкильную группу,
еще более предпочтительно
[1] метил,
взятые вместе с атомами углерода, с которыми они связаны, образуют
[2] циклопентан,
[3] тетрагидропиран,
[4] или пиперидин.
R7 предпочтительно представляет собой
[1] атом водорода,
[2] атом фтора,
[3] атом брома,
[4] атом хлора,
[5] C1-5 алкоксигруппу, которая может быть замещена 1-4 заместителями R7A,
и более предпочтительно
[1] атом водорода,
[2] атом галогена,
и еще более предпочтительно
[1] атом водорода,
[2] атом фтора,
[3] атом брома,
[4] атом хлора,
и еще более предпочтительно
[1] атом водорода.
R7A предпочтительно представляет собой
[1] (C1-5 алкил)m7-аминогруппу (m7: 0~2),
[2] гидрокси,
[3] 4-6-членную гетероциклоалкильную группу, которая может быть замещена C1-5 алкильной группой(группами), и более предпочтительно
[1] (C1-3 алкил)m7-аминогруппу (m7: 2),
[2] гидрокси,
[3] 4-6-членную гетероциклоалкильную группу, которая может быть замещена C1-3 алкильной группой(группами).
R3 предпочтительно представляет собой
[1] атом водорода,
[2] C1-5 алкильную группу, которая может быть замещена 1-11 атомом(атомами) галогена,
[3] циано,
[4] (C1-5 алкил)m3a-аминокарбонильную группу (m3a: 0~2), которая может быть замещена 1-5 заместителями R3A,
[5] гидроксикарбонил,
[6] C1-5 алкилкарбонильную группу, которая может быть замещена 1-4 гидроксигруппами,
[7] атом галогена,
[8] (C1-3 алкил)m3b-аминогруппу (m3b: 0~2), которая может быть замещена 1-2 C6 арильными группами,
[9] C1-5 алкилкарбонил(C0-3 алкил)аминогруппу, которая может быть замещена 1-2 C6 арильными группами или 1-2 C6 арилоксигруппами,
[10] C6 арилкарбонил(C0-3 алкил)аминогруппу, которая может быть замещена 1-5 C1-3 алкильными группами, которая может быть замещена 1-7 атомом(атомами) галогена,
[11] (C1-3 алкил)m3c-аминокарбонил(C0-3 алкил)аминогруппу (m3c: 0-1), которая может быть замещена C6 арилом,
[12] нитро,
[13] гидрокси,
[14] C1-5 алкоксигруппу, которая может быть замещена 1-4 заместителями R3B,
[15] 4-6-членную гетероциклоалкилоксигруппу,
[16] 6-членную гетероарилоксигруппу,
[17] (C1-5 алкил)m3e-аминокарбонилоксигруппу (m3e: 0~2), которая может быть замещена 1-3 C6 арильными группами,
[18] 4-6-членную азотсодержащую гетероциклоалкиламинокарбонильную группу,
[19] C1-5 алкилтиогруппу,
[20] 5-6-членную гетероарильную группу, которая может быть замещена 1-4 C1-5 алкильными группами, которая может быть замещена 1-3 C1-5 алкоксигруппами,
[21] C1-3 алкоксикарбонил(C0-3 алкил)аминогруппу, которая может быть замещена C1-3 алкоксигруппой,
[22] C6 арилоксикарбонил(C0-3 алкил)аминогруппу, которая может быть замещена 1-3 C1-3 алкильными группами, которая может быть замещена 1-9 атомом(атомами) галогена,
[23] C6 арилоксикарбонил(C0-3 алкил)аминокарбонил(C0-3 алкил)аминогруппу, которая может быть замещена 1-3 заместителями R3C,
[24] C3-6 циклоалкил(C0-3 алкил)аминокарбонилоксигруппу и
[25] C6 арил(C0-3 алкил)аминокарбонилоксигруппу, которая может быть замещена 1-3 заместителями, выбранными из группы, включающей C1-5 алкильную группу и C1-5 алкоксигруппу(группы).
R3 более предпочтительно представляет собой
[1] атом водорода,
[2] C1-3 алкильную группу, которая может быть замещена 1-7 атомом(атомами) галогена,
[3] циано,
[4] (C1-4 алкил)m3a-аминокарбонильную группу (m3a: 0~1), которая может быть замещена 1-4 заместителями R3A,
[5] гидроксикарбонил,
[6] атом галогена,
[7] C1-4 алкилкарбонил(C1-3 алкил)аминогруппу, которая может быть замещена 1-2 C6 арильными группами или 1-2 C6 арилоксигруппами,
[8] C6 арилкарбонил(C0-3 алкил)аминогруппу, которая может быть замещена C1-3 алкильной группой, которая может быть замещена 1-7 атомом(атомами) галогена,
[9] нитро,
[10] гидрокси,
[11] C1-4 алкоксигруппу, которая может быть замещена 1-3 заместителями R3B,
[12] 4-членную гетероциклоалкилоксигруппу,
[13] (C1-3 алкил)m3e-аминокарбонилоксигруппу (m3e: 1), которая может быть замещена C6 арильной группой(группами),
[14] 6-членную азотсодержащую гетероциклоалкиламинокарбонильную группу,
[15] C1-3 алкилтиогруппу,
[16] 5-членную гетероарильную группу, которая может быть замещена C1-5 алкильной группой, которая может быть замещена C1-3 алкоксигруппой,
[17] C6 арилоксикарбонил(C0-3 алкил)аминокарбонил(C0-3 алкил)аминогруппу, которая может быть замещена R3C заместителем,
[18] C6 циклоалкил(C0-2 алкил)аминокарбонилоксигруппу и
[19] C6 арил(C0-3 алкил)аминокарбонилоксигруппу, которая может быть замещена 1-2 заместителями, выбранными из группы, включающей C1-4 алкильную группу и C1-3 алкоксигруппу.
R3 еще более предпочтительно представляет собой
[1] атом водорода,
[2] циано,
[3] атом галогена,
еще более предпочтительно R3 представляет собой
[1] циано,
[2] атом галогена.
R3A предпочтительно представляет собой
[1] C6 арил,
[2] C1-5 алкоксигруппу,
[3] 5- или 6-членную гетероарильную группу,
[4] C6 арилсульфонил.
R3B предпочтительно представляет собой
[1] гидрокси,
[2] C1-5 алкоксигруппу,
[3] C6 арил(C0-3 алкил)аминокарбонильную группу,
[4] (C1-3 алкил)m3d-аминогруппу (m3d: 0~2),
[5] атом галогена,
более предпочтительно
[1] гидрокси,
[2] C1-5 алкоксигруппу.
R3C предпочтительно представляет собой
[1] C1-5 алкильную группу, которая может быть замещена 1-11 атомом(атомами) галогена,
[2] C1-5 алкоксигруппу,
более предпочтительно
[1] C1-4 алкильную группу, которая может быть замещена 1-9 атомом(атомами) галогена,
[2] C1-3 алкоксигруппу.
R8 предпочтительно представляет собой
[1] атом водорода,
[2] C1-5 алкильную группу, которая может быть замещена 1-5 заместителями R8A,
[3] C2-5 алкенильную группу,
[4] 4-6-членную гетероциклоалкильную группу, которая может быть замещена 1-4 заместителями R8B,
[5] 5-6-членную гетероарильную группу, которая может быть замещена 1-4 C1-8 алкильными группами,
[6] (C1-5 алкил)m8g-аминокарбонильную группу (m8g: 0~2), которая может быть замещена 1-3 заместителями R8C,
[7] 4-6-членную гетероциклоалкил(C0-3 алкил)аминокарбонильную группу, которая может быть замещена 1-2 оксогруппами,
[8] 4-6-членную азотсодержащую гетероциклоалкилкарбонильную группу, которая может быть замещена 1-4 заместителями R8D,
[9] гидроксикарбонил,
[10] C1-5 алкокси(C0-3 алкил)аминокарбонильную группу, которая может быть замещена 1-3 гидроксигруппами,
[11] атом галогена,
[12] (C1-5 алкил)m8j-аминогруппу (m8j: 0~2), которая может быть замещена 1-2 заместителями R8H,
[13] гидроксил,
[14] C1-5 алкоксигруппу, которая может быть замещена 1-4 заместителями R8E,
[15] 4-6-членную гетероциклоалкилоксигруппу, которая может быть замещена 1-5 заместителями R8F,
[16] 6-членную гетероарилоксигруппу,
[17] (C1-5 алкил)m8l1-аминосульфонилоксигруппу (m8l1: 0-2),
[18] C1-5 алкилтиогруппу, которая может быть замещена 1-4 заместителями R8I,
[19] C1-5 алкилсульфонильную группу, которая может быть замещена 1-4 заместителями R8G,
[20] 6-членную гетероциклоалкилсульфонильную группу, которая может быть замещена C1-3 алкильной группой,
[21] C2-5 алкенилоксигруппу и
[22] C1-3 алкилсульфонилоксигруппу, которая может быть замещена 1-7 атомом(атомами) галогена.
И более предпочтительно представляет собой
[1] атом водорода,
[2] C1-3 алкильную группу, которая может быть замещена 1-3 заместителями R8A,
[3] C2-4 алкенильную группу,
[4] 6-членную гетероциклоалкильную группу, которая может быть замещена 1-3 заместителями R8B,
[5] 5-6-членную гетероарильную группу, которая может быть замещена 1-2 C1-3 алкильными группами,
[6] (C1-3 алкил)m8g-аминокарбонильную группу (m8g: 0~2), которая может быть замещена 1-2 заместителями R8C,
[7] 4-6-членную гетероциклоалкил(C0-1 алкил)аминокарбонильную группу, которая может быть замещена 1-2 оксогруппами,
[8] 6-членную азотсодержащую гетероциклоалкилкарбонильную группу, которая может быть замещена 1-2 заместителями R8D,
[9] гидроксикарбонил,
[10] C1-3 алкокси(C0-3 алкил)аминокарбонильную группу, которая может быть замещена 1-2 гидроксигруппами,
[11] атом брома,
[12] (C1-3 алкил)m8j-аминогруппу (m8j: 0~2), которая может быть замещена 1-2 заместителями R8H,
[13] гидроксил,
[14] C1-5 алкоксигруппу, которая может быть замещена 1-3 заместителями R8E,
[15] 4-6-членную гетероциклоалкилоксигруппу, которая может быть замещена 1-3 заместителями R8F,
[16] 6-членную гетероарилоксигруппу,
[17] (C1-3 алкил)m8l1-аминосульфонилоксигруппу (m8l1: 0-2),
[18] C1-3 алкилтиогруппу, которая может быть замещена 1-2 заместителями R8I,
[19] C1-3 алкилсульфонильную группу, которая может быть замещена 1-2 заместителями R8G,
[20] 6-членную гетероциклоалкилсульфонильную группу, которая может быть замещена C1-3 алкильной группой,
[21] C2-3 алкенилоксигруппу и
[22] трифторметилсульфонилоксигруппу,
еще более предпочтительно
[1] атом водорода,
[2] C1-3 алкильную группу, которая может быть замещена 1-3 заместителями R8A,
[3] 6-членную гетероциклоалкильную группу, которая может быть замещена 1-3 заместителями R8B,
[4] 5-6-членную гетероарильную группу, которая может быть замещена 1-2 C1-3 алкильными группами,
[5] 4-6-членную гетероциклоалкил(C0-1алкил)аминокарбонильную группу, которая может быть замещена 1-2 оксогруппами,
[6] 6-членную азотсодержащую гетероциклоалкилкарбонильную группу, которая может быть замещена 1-2 заместителями R8D,
[7] (C1-3 алкил)m8j-аминогруппу (m8j: 0~2), которая может быть замещена 1-2 заместителями R8H,
[8] гидроксил,
[9] C1-5 алкоксигруппу, которая может быть замещена 1-3 заместителями R8E,
[10] 4-6-членную гетероциклоалкилоксигруппу, которая может быть замещена 1-3 заместителями R8F,
[11] 6-членную гетероарилоксигруппу,
[12] C1-3 алкилтиогруппу, которая может быть замещена 1-2 заместителями R8I,
[13] C1-3 алкилсульфонильную группу, которая может быть замещена 1-2 заместителями R8G и
[14] C2-3 алкенилоксигруппу,
более предпочтительно
[1] атом водорода,
[2] C1-3 алкильную группу, которая может быть замещена 1-3 заместителями R8A,
[3] 6-членную гетероциклоалкильную группу, которая может быть замещена 1-3 заместителями R8B,
[4] (C1-3 алкил)m8j-аминогруппу (m8j: 0~2), которая может быть замещена 1-2 заместителями R8H,
[5] C1-5 алкоксигруппу, которая может быть замещена 1-3 заместителями R8E, и
[6] 4-6-членную гетероциклоалкилоксигруппу, которая может быть замещена 1-3 заместителями R8F,
еще более предпочтительно
[1] 4-10-членную гетероциклоалкильную группу, которая может быть замещена одной или несколькими группами R8B, описанными ниже,
еще более предпочтительно
[1] 4-10-членную гетероциклоалкильную группу, которая может быть замещена, по меньшей мере, одним атомом галогена, C1-8 алкильной группой или оксо.
R8A предпочтительно представляет собой
[8A-1] 4-6-членную гетероциклоалкильную группу, которая может быть замещена 1-4 заместителями R8A1,
[8A-2] (C1-5 алкил)m8a-аминогруппу (m8a: 0~2), которая может быть замещена 1-11 атомом(атомами) галогена, и
[8A-3] гидрокси;
R8A более предпочтительно представляет собой
[8A-1] 6-членную гетероциклоалкильную группу, которая может быть замещена 1-2 заместителями R8A1,
[8A-2] (C1-3 алкил)m8a-аминогруппу (m8a: 0~2), которая может быть замещена 1-11 атомом(атомами) галогена, и
[8A-3] гидрокси;
R8A1 предпочтительно представляет собой
[8A1-1] C1-5 алкильную группу,
[8A1-2] C1-5 алкилсульфонильную группу,
[8A1-3] (C1-5 алкил)m8b-аминосульфонильную группу (m8b: 0~2), или
[8A1-4] оксогруппу,
более предпочтительно
[8A1-1] C1-3 алкильную группу,
[8A1-2] C1-3 алкилсульфонильную группу или
[8A1-3] (C1-3 алкил)m8b-аминосульфонильную группу (m8b: 0),
R8B предпочтительно представляет собой
[8B-1] C1-6 алкильную группу, которая может быть замещена 1-13 заместителями R8B1,
[8B-2] C2-6 алкинильную группу,
[8B-3] C3-6 циклоалкильную группу, которая может быть замещена [1] циано группой(группами) или [2] C1-6 алкильной группой(группами),
[8B-4] 4-6-членную гетероциклоалкильную группу, которая может быть замещена 1-10 заместителями R8B2,
[8B-5] C1-6 алкоксигруппу, которая может быть замещена 1-5 заместителями, выбранными из группы, включающей [1] C1-5 алкоксигруппу и [2] C3-6 циклоалкильную группу,
[8B-6] C1-5 алкоксикарбонильную группу,
[8B-7] C1-5 алкилсульфонильную группу,
[8B-8] 5-6-членную гетероарилсульфонильную группу,
[8B-9] циано,
[8B-10] C1-6 алканоильную группу, которая может быть замещена 1-2 заместителями R8B3,
[8B-11] C3-8 циклоалкилкарбонильную группу,
[8B-12] (C1-5 алкил)m8c-аминосульфонильную группу (m8c: 0-2),
[8B-13] C1-6 алкилсульфонил(C0-6 алкил)аминогруппу,
[8B-14] (C1-8 алкил)m8d-аминогруппу (m8d: 0-2), которая может быть замещена 1-3 заместителями R8B4,
[8B-15] гидрокси,
[8B-16] (C1-6 алкил)m8e-аминокарбонильную группу (m8e0-2) или
[8B-17] C1-4 алкоксикарбониламиногруппу,
более предпочтительно
[8B-1] C1-5 алкильную группу, которая может быть замещена 1-3 заместителями R8B1,
[8B-2] C2-5 алкинильную группу,
[8B-3] C3-5 циклоалкильную группу, которая может быть замещена [1] цианогруппой или [2] C1-6 алкильной группой,
[8B-4] 4-6-членную гетероциклоалкильную группу, которая может быть замещена 1-8 заместителями R8B2,
[8B-5] C1-5 алкоксигруппу, которая может быть замещена 1-2 заместителями, выбранными из группы, включающей [1] C1-3 алкоксигруппу и [2] C3-6 циклоалкильную группу,
[8B-6] C1-3 алкилсульфонильную группу,
[8B-7] циано,
[8B-8] C1-6 алканоильную группу, которая может быть замещена заместителем R8B3,
[8B-9] C3-5 циклоалкилкарбонильную группу,
[8B-10] (C1-3 алкил)m8c-аминосульфонильную группу (m8c: 1-2),
[8B-11] C1-3 алкилсульфонил(C0-3 алкил)аминогруппу,
[8B-12] (C1-5 алкил)m8d-аминогруппу (m8d:0-1), которая может быть замещена 1-2 заместителями R8B4,
[8B-13] гидрокси или
[8B-14] (C1-3 алкил)m8e-аминокарбонильную группу (m8e: 0-1).
R8B1 предпочтительно представляет собой
[8B1-1] C3-6 циклоалкильную группу,
[8B1-2] гидрокси,
[8B1-3] C1-8 алкоксигруппу, которая может быть замещена 1-2 C1-5 алкоксигруппами или
[8B1-4] циано,
более предпочтительно
[8B1-1] C3-5 циклоалкильную группу,
[8B1-2] гидрокси,
[8B1-3] C1-8 алкоксигруппу, которая может быть замещена 1 C1-3 алкоксигруппой или
[8B1-4] циано,
R8B2 предпочтительно представляет собой
[8B2-1] атом галогена,
[8B2-2] C1-6 алкильную группу,
[8B2-3] оксо,
[8B2-4] гидрокси или
[8B2-5] атом дейтерия,
более предпочтительно
[8B2-1] атом фтора,
[8B2-2] C1-3 алкильную группу,
[8B2-3] оксо или
[8B2-4] гидроксил.
R8B3 предпочтительно представляет собой
[8B3-1] (C1-6 алкил)m8f-аминогруппу (m8f: 0-2),
более предпочтительно
[8B3-1] (C1-3 алкил)m8f-аминогруппу (m8f: 2).
R8B4 предпочтительно представляет собой
[8B4-1] C3-6 циклоалкильную группу или
[8B4-2] гидрокси;
R8C предпочтительно представляет собой
[8C-1] гидроксил,
[8C-2] (C1-3 алкил)m8h-аминогруппу (m8h: 0-1), которая может быть замещена (C1-3 алкил)m8i-аминосульфонильной группой (m8i: 0-2),
[8C-3] C1-3 алкилсульфонильную группу;
R8D предпочтительно представляет собой
[8D-1] C1-6 алкильную группу, которая может быть замещена заместителем R8D1,
[8D-2] гидроксигруппу,
[8D-3] C1-3 алкилсульфонильную группу или
[8D-4] C1-4 алкоксикарбонильную группу;
R8D1 предпочтительно представляет собой
[8D1-1] гидроксигруппу или
[8D1-2] C1-3 алкоксигруппу;
R8H предпочтительно представляет собой
[8H-1] 4-6-членную гетероциклоалкильную группу;
R8E предпочтительно представляет собой
[8E-1] гидроксигруппу,
[8E-2] C1-8 алкоксигруппу, которая может быть замещена 1-2 заместителями R8E7,
[8E-3] C1-3 алкилсульфонильную группу,
[8E-4] C1-4 алкоксикарбонильную группу,
[8E-5] 4-6-членную азотсодержащую гетероциклоалкилкарбонильную группу, которая может быть замещена 1-2 заместителями R8E1,
[8E-6] (C1-5 алкил)m8k1-аминогруппу (m8k1: 0~2), которая может быть замещена заместителем R8E2,
[8E-7] 4-6-членную гетероциклоалкильную группу, которая может быть замещена 1-4 заместителями R8E3,
[8E-8] 5-6-членную гетероарильную группу,
[8E-9] (C1-6 алкил)m8k2-аминокарбонильную группу (m8k2: 0~2), которая может быть замещена 1-2 заместителями R8E6,
[8E-10] C1-5 алкоксигруппу, которая может быть замещена заместителем R8E7,
[8E-11] C1-3 алкилтиогруппу,
[8E-12] C1-3 алкилсульфинильную группу,
[8E-13] C1-5 алкилсульфонильную группу,
[8E-14] C1-3 алкилсульфонил(C0-8 алкил)аминогруппу,
[8E-15] 4-6-членную гетероциклоалкилсульфонил(C0-3 алкил)аминогруппу, которая может быть замещена 1-3 C1-5 алкильными группами;
более предпочтительно
[8E-1] (C1-3 алкил)m8k1-аминогруппу (m8k1: 2), которая может быть замещена одной или несколькими группами R8E2,
[8E-2] C1-8 алкоксигруппу, которая может быть замещена одной или несколькими группами R8E7,
[8E-3] C1-3 алкилсульфонильную группу,
[8E-4] (C1-5 алкил)m8k1-аминогруппу (m8k1: 0~2), которая может быть замещена заместителем R8E2,
[8E-5] 4-6-членную гетероциклоалкильную группу, которая может быть замещена 1-4 заместителями R8E3,
[8E-6] 4-6-членную гетероциклоалкилсульфониламиногруппу, которая может быть замещена 1-2 C1-3 алкильными группами;
R8E1 предпочтительно представляет собой
[8E1-1] C1-4 алкоксикарбонильную группу,
[8E1-2] C1-3 алканоильную группу,
[8E1-3] C1-5 алкилсульфонильную группу,
[8E1-4] (C1-3 алкил)m8k3-аминосульфонильную группу (m8k3: 0~2),
[8E1-5] 4-6-членную гетероциклоалкильную группу;
R8E2 предпочтительно представляет собой
[8E2-1] гидроксигруппу,
[8E2-2] C1-6 алкоксикарбонильную группу,
[8E2-3] C3-6 циклоалкильную группу, которая может быть замещена C1-8 алкильной группой, которая может быть замещена гидрокси,
[8E1-4] C1-5 алканоильную группу, которая может быть замещена 1-3 заместителями, выбранными из группы, включающей [1] (C1-3 алкил)m8k4-аминогруппу (m8k4: 0~2) и [2] атом галогена,
[8E2-5] (C1-3 алкил)m8k5-аминокарбонильную группу (m8k5: 0~2),
[8E2-6] C1-3 алкилсульфонильную группу,
[8E2-7] (C1-3 алкил)m8k6-аминосульфонильную группу (m8k6: 0-1), которая может быть замещена C1-4 алкоксикарбонильной группой;
более предпочтительно представляет собой
[8E2-1] гидроксигруппу.
R8E3 предпочтительно представляет собой
[8E3-1] C1-6 алкильную группу, которая может быть замещена 1-3 заместителями, выбранными из группы, включающей [1] гидроксигруппу или [2] C1-3 алкилкарбонилоксигруппу,
[8E3-2] C1-4 алкилкарбонилоксигруппу,
[8E3-3] гидроксигруппу,
[8E3-4] C3-5 циклоалкильную группу,
[8E3-5] C1-4 алкоксикарбонильную группу,
[8E3-6] C1-5 алкилсульфонильную группу,
[8E3-7] (C1-3 алкил)m8k8-аминокарбонильную группу (m8k8: 0~2),
[8E3-8] C1-3 алканоильную группу, которая может быть замещена гидроксигруппой,
[8E3-9] оксогруппу или
[8E3-10] 4-6-членную гетероциклоалкильную группу, которая может быть замещена 1-3 заместителями, выбранными из группы, включающей [1] C1-3 алканоильную группу, [2] C1-4 алкоксикарбонильную группу или [3] C1-3 алкилсульфонильную группу;
более предпочтительно
[8E3-1] (C1-3 алкил)m8k8-аминокарбонильную группу (m8k8: 0~2) или
[8E3-2] оксогруппу;
R8E4 предпочтительно представляет собой
[8E4-1] 4-6-членную гетероциклоалкильную группу,
[8E4-2] C1-3 алканоильную группу,
[8E4-3] C1-3 алкоксикарбонильную группу,
[8E4-4] C1-3 алкилсульфонильную группу,
[8E4-5] C1-3 алкиламиносульфонильную группу;
R8E6 предпочтительно представляет собой
[8E6-1] C2-3 алкенилкарбонилоксигруппу,
[8E6-2] гидроксигруппу,
[8E6-3] циано,
[8E6-4] (C1-3 алкил)m8k9-аминогруппу (m8k9: 0~2), которая может быть замещена 1-2 гидроксигруппами,
[8E6-5] C1-3 алкоксигруппу, которая может быть замещена гидроксигруппой,
[8E6-6] C1-4 алкилкарбонилоксигруппу,
[8E6-7] 4-6-членную гетероциклоалкильную группу, которая может быть замещена 1-3 C1-8 алкильными группами,
[8E6-8] 5-6-членную гетероарильную группу;
R8E7 предпочтительно представляет собой
[8E7-1] гидроксигруппу,
[8E7-2] C1-3 алкоксигруппу, которая может быть замещена гидроксигруппой;
R8F предпочтительно представляет собой
[8F-1] C1-5 алкильную группу, которая может быть замещена 1-3 заместителями R8F1,
[8F-2] C3-6 циклоалкильную группу,
[8F-3] C1-3 алканоильную группу, которая может быть замещена 1-7 атомом(атомами) галогена,
[8F-4] C1-5 алкилкарбонилоксигруппу,
[8F-5] C1-5 алкоксикарбонильную группу,
[8F-6] 4-6-членную гетероциклоалкильную группу, которая может быть замещена 1-3 заместителями R8F2,
[8F-7] C1-5 алкилсульфонильную группу или
[8F-8] гидроксигруппу;
более предпочтительно
[8F-1] C1-3 алкильную группу, которая может быть замещена заместителем R8F1,
[8F-2] C3-5 циклоалкильную группу,
[8F-3] 4-6-членную гетероциклоалкильную группу, которая может быть замещена заместителем R8F2,
[8F-4] C1-3 алкилсульфонильную группу;
R8F1 предпочтительно представляет собой
[8F1-1] гидроксигруппу,
[8F1-2] C1-5 алкоксигруппу или
[8F1-3] атом галогена;
R8F2 предпочтительно представляет собой
[8F2-1] 4-6-членную гетероциклоалкильную группу,
[8F2-2] C1-5 алкоксикарбонильную группу или
[8F2-3] C1-3 алкилсульфонильную группу;
R8G предпочтительно представляет собой
[8G-1] гидроксикарбонильную группу,
[8G-2] гидроксигруппу или
[8G-3] (C1-5 алкил)m8l3-аминогруппу (m8l3: 0~2),
R9 предпочтительно представляет собой
[1] атом водорода,
[2] C1-8 алкильную группу, которая может быть замещена 1-8 заместителями R9A,
[3] C2-6 алкенильную группу,
[4] C2-8 алкинильную группу, которая может быть замещена 1-6 заместителями R9C,
[5] C3-6 циклоалкильную группу,
[6] 4-6-членную гетероциклоалкильную группу, которая может быть замещена 1-5 заместителями R9D,
[7] C6 арильную группу, которая может быть замещена 1-2 заместителями R9E,
[8] 5-6-членную гетероарильную группу, которая может быть замещена 1-3 C1-5 алкильными группами,
[9] циано,
[10] C1-6 алканоильную группу,
[11] 4-6-членную азотсодержащую гетероциклоалкилкарбонильную группу, которая может быть замещена C1-5 алкильной группой,
[12] атом галогена,
[13] (C1-4 алкил)m9c-аминогруппу (m9c: 0~2), которая может быть замещена заместителем R9F,
[14] гидрокси,
[15] C1-6 алкоксигруппу, которая может быть замещена 1-5 заместителями R9G,
[16] 4-6-членную гетероциклоалкилоксигруппу, которая может быть замещена одной или двумя 4-6-членными гетероциклоалкильными группами,
[17] C1-5 алкилтиогруппу, которая может быть замещена (C1-3 алкил)m9f-аминогруппой(группами) (m9f: 0~2),
[18] C1-5 алкилсульфонильную группу, которая может быть замещена (C1-3 алкил)m9g-аминогруппой(группами) (m9g: 0~2),
[19] (C1-3 алкил)m9h-аминосульфонильную группу (m9h: 0~2),
[20] 4-6-членную азотсодержащую гетероциклоалкилсульфонильную группу, которая может быть замещена C1-3 алкильной группой;
более предпочтительно
[1] атом водорода,
[2] C1-6 алкильную группу, которая может быть замещена заместителем R9A,
[3] C2-5 алкенильную группу,
[4] C2-8 алкинильную группу, которая может быть замещена заместителем R9C,
[5] C3-6 циклоалкильную группу,
[6] 4-6-членную гетероциклоалкильную группу, которая может быть замещена заместителем R9D,
[7] 5-6-членную гетероарильную группу, которая может быть замещена C1-5 алкильной группой,
[8] циано,
[9] C1-3 алканоильную группу,
[10] атом галогена,
[11] (C1-4 алкил)m9b-n аминогруппу (m9b: 0),
[12] гидрокси,
[13] C1-6 алкоксигруппу, которая может быть замещена 1-3 заместителями R9G,
[14] 4-6-членную гетероциклоалкилоксигруппу, которая может быть замещена 4-6-членной гетероциклоалкильной группой;
еще более предпочтительно
[1] атом водорода,
[2] C1-8 алкильную группу, которая может быть замещена одним или несколькими заместителями R9A,
[3] C2-8 алкенильную группу, которая может быть замещена одним или несколькими заместителями R9B,
[4] C2-8 алкинильную группу, которая может быть замещена одним или несколькими заместителями R9C,
[5] C3-8 циклоалкильную группу,
[6] атом галогена;
еще более предпочтительно
[1] атом водорода,
[2] C1-8 алкильную группу, которая может быть замещена одним или несколькими заместителями R9A,
[3] C2-8 алкинильную группу, которая может быть замещена одним или несколькими заместителями R9C.
R9A предпочтительно представляет собой
[9A-1] C3-6 циклоалкильную группу,
[9A-2] 4-6-членную гетероциклоалкильную группу, которая может быть замещена 1-3 заместителями R9A1,
[9A-3] гидроксигруппу или
[9A-4] C1-6 алкоксигруппу;
более предпочтительно
[9A-1] 4-6-членную гетероциклоалкильную группу, которая может быть замещена заместителем R9A1,
[9A-2] гидроксигруппу или
[9A-3] C1-3 алкоксигруппу;
R9A1 предпочтительно представляет собой
[9A1-1] C1-5 алкильную группу,
[9A1-2] C3-5 циклоалкильную группу или
[9A1-3] 4-6-членную гетероциклоалкильную группу;
более предпочтительно
[9A1-1] C1-3 алкильную группу,
[9A1-2] C3 циклоалкильную группу или
[9A1-3] 4-членную гетероциклоалкильную группу;
R9C предпочтительно представляет собой
[9C-1] C1-8 алкоксигруппу,
[9C-2] (C1-5 алкил)m9b-аминогруппу (m9b: 0~2), которая может быть замещена 1-2 C6 арильными группами,
[9C-3] 4-6-членную гетероциклоалкильную группу, которая может быть замещена 1-3 заместителями R9C1,
[9C-4] C3-6 циклоалкильную группу,
[9C-5] гидроксигруппу или
[9C-6] гидроксикарбонильную группу;
более предпочтительно
[9C-1] C1-5 алкоксигруппу,
[9C-2] (C1-3 алкил)m9b-аминогруппу (m9b: 2), которая может быть замещена 1-2 C6 арильными группами,
[9C-3] 4-6-членную гетероциклоалкильную группу, которая может быть замещена 1-2 заместителями R9C1,
[9C-4] C3-5 циклоалкильную группу,
[9C-5] гидроксигруппу.
R9C1 предпочтительно представляет собой
[9C1-1] C3-5 циклоалкильную группу,
[9C1-2] 4-6-членную гетероциклоалкильную группу или
[9C1-3] оксогруппу;
более предпочтительно
[9C1-1] C3 циклоалкильную группу,
[9C1-2] 4-6-членную гетероциклоалкильную группу или
[9C1-3] оксогруппу;
R9D предпочтительно представляет собой
[9D-1] C1-5 алкильную группу, которая может быть замещена одной или двумя 4-6-членными гетероциклоалкильными группами,
[9D-2] C3-5 циклоалкильную группу,
[9D-3] 4-6-членную гетероциклоалкильную группу или
[9D-4] C1-3 алкилсульфонильную группу;
более предпочтительно
[9D-1] C1-5 алкильную группу, которая может быть замещена 4-6-членной гетероциклоалкильной группой,
[9D-2] 4-6-членную гетероциклоалкильную группу или
[9D-3] метилсульфонильную группу;
R9E предпочтительно представляет собой
[9E-1] атом галогена,
[9E-2] гидроксигруппу,
[9E-3] гидроксикарбонильную группу или
[9E-4] C1-3 алкильную группу, которая может быть замещена гидрокси;
R9F предпочтительно представляет собой
[9F-1] C1-3 алкилсульфонильную группу,
[9F-2] (C1-3 алкил)m9f1-аминосульфонильную группу (m9f1: 0~2) или
[9F-3] C1-3 алканоильную группу, которая может быть замещена (C1-3 алкил)m9f2-аминогруппой(группами) (m9f2: 0~2);
R9G предпочтительно представляет собой
[9G-1] гидроксигруппу,
[9G-2] гидроксикарбонильную группу,
[9G-3] C6 арильную группу, которая может быть замещена C1-3 алкоксигруппой(группами),
[9G-4] (C1-3 алкил)m9g1-аминогруппу (m9g1: 0~2),
[9G-5] C1-5 алкоксигруппу, которая может быть замещена 1-3 заместителями R9G1, или
[9G-6] 5-6-членную гетероарильную группу;
более предпочтительно
[9G-1] гидроксигруппу,
[9G-2] (C1-3 алкил)m9g1-аминогруппу (m9g1: 0~2),
[9G-3] C1-3 алкоксигруппу, которая может быть замещена заместителем R9G1, или
[9G-4] 5-6-членную гетероарильную группу;
R9G1 предпочтительно представляет собой
[9G1-1] C1-3 алкоксигруппу или
[9G1-2] гидроксикарбонильную группу.
Предпочтительно, A5 представляет собой NH, при этом остальные представляют собой C, R3 представляет собой цианогруппу, R6 и R6’представляют собой метил, R8 представляет собой (1) атом водорода, (2) C1-8 алкильную группу, которая может быть замещена одной или несколькими группами R8A, (3) C2-8 алкенильную группу, (4) 4-10-членную гетероциклоалкильную группу, которая может быть замещена одной или несколькими группами R8B, (5) 5-14-членную гетероарильную группу, которая может быть замещена C1-8 алкильной группой, (6) (C1-8 алкил)m8g-аминокарбонильную группу, которая может быть замещена одной или несколькими группами R8C, (7) 4-10-членную азотсодержащую гетероциклоалкилкарбонильную группу, которая может быть замещена одной или несколькими группами R8D, (8) гидроксикарбонильную группу, (9) C0-8 алкокси(C0-8 алкил)аминокарбонильную группу, которая может быть замещена одной или несколькими гидроксигруппой(группами), (10) атом галогена, (11) гидроксигруппу, (12) C1-8 алкоксигруппу, которая может быть замещена одной или несколькими группами R8E, (13) 4-10-членную гетероциклоалкилоксигруппу, которая может быть замещена одной или несколькими группами R8F, (14) аминосульфонилоксигруппу, которая может быть замещена одной или несколькими C1-8 алкильными группами, (15) C1-8 алкилтиогруппу, которая может быть замещена (C1-8 алкил)n-аминогруппой, или (16) C1-8 алкилсульфонильную группу, которая может быть замещена группой R8G, R9 представляет собой (1) атом водорода, (2) C1-8 алкильную группу, которая может быть замещена одной или несколькими группами R9A, (3) C2-8 алкенильную группу, которая может быть замещена одной или несколькими группами R9B, (4) C2-8 алкинильную группу, которая может быть замещена одной или несколькими группами R9C, (5) C3-8 циклоалкильную группу, (6) 4-10-членную гетероциклоалкильную группу, которая может быть замещена одной или несколькими группами R9D, (7) C6-10 арильную группу, которая может быть замещена одной или несколькими группами R9E, (8) 5-14-членную гетероарильную группу, которая может быть замещена C1-8 алкильной группой, (9) цианогруппу, (10) C1-8 алканоильную группу, (11) 4-10-членную азотсодержащую гетероциклоалкилкарбонильную группу, которая может быть замещена C1-8 алкильной группой, (12) атом галогена, (13) (C1-8 алкил)m9c-аминогруппу, которая может быть замещена одной или несколькими группами R9F, (14) C1-8 алкилсульфониламиногруппу, (15) нитрогруппу, (16) гидроксигруппу, (17) C1-8 алкоксигруппу, которая может быть замещена одной или несколькими группами R9G, (18) C1-8 алкилтиогруппу, которая может быть замещена (C1-8 алкил)m9f-аминогруппой, (19) C1-8 алкилсульфонильную группу, которая может быть замещена (C1-8 алкил)m9g-аминогруппой, (20) (C1-8 алкил)m9h-аминосульфонильную группу или (21) 4-10-членную азотсодержащую гетероциклоалкилсульфонильную группу, которая может быть замещена C1-8 алкильной группой, и R1, R2, R5, R7 и R10 имеют значения, определенные выше.
Более предпочтительно, A5 представляет собой NH, при этом остальные представляют собой C, R3 представляет собой цианогруппу, R6 и R6’ представляют собой метильные группы, R8 представляет собой (1) атом водорода, (2) C1-8 алкильную группу, которая может быть замещена одной или несколькими группами R8A, (3) 4-10-членную гетероциклоалкильную группу, которая может быть замещена одной или несколькими группами R8B, или (4) C1-8 алкоксигруппу, которая может быть замещена одной или несколькими группами R8E, R9 представляет собой (1) атом водорода, (2) C1-8 алкильную группу, которая может быть замещена одной или несколькими группами R9A, (3) C2-8 алкинильную группу, которая может быть замещена одной или несколькими группами R9C, (4) C3-8 циклоалкильную группу или (5) атом галогена, и R1, R2, R5, R7 и R10 представляют собой атом водорода.
В соответствии с настоящим изобретением, примеры солей соединений, которые представлены формулой (I), включают соль хлористоводородной кислоты, соль бромистоводородной кислоты, соль йодистоводородной кислоты, соль фосфорной кислоты, соль фосфоновой кислоты, соль серной кислоты, соль сульфоновой кислоты, такую как соль метансульфоновой кислоты, соль п-толуолсульфоновой кислоты и т.п., соль карбоновой кислоты, такую как соль уксусной кислоты, соль лимонной кислоты, соль яблочной кислоты, соль винной кислоты, соль янтарной кислоты, соль салициловой кислоты и т.п., или соль щелочного металла, такую как соль натрия, соль калия и т.п., соль щелочноземельнго металла, такую как соль магния, соль кальция и т.п., соль аммония, такую как соль аммония, соль алкиламмония, соль диалкиламмония и соль триалкиламмония, и соль тетраалкиламмония. Предпочтительно, соли представляют собой фармацевтически приемлемые соли. Эти соли получают путем приведения соединений, описанных выше, в контакт с кислотой или основанием, которое можно использовать для получения фармацевтического продукта.
В соответствии с настоящим изобретением, соединения, которые представлены формулой (I), или их соли могут быть в форме ангидрида или сольвата, такого как гидрат, и т.п. В настоящей заявке термин “сольват (d)” означает эффект, в результате которого молекулы или ионы растворенного вещества, содержащиеся в растворе, сильно притягивают находящиеся близко к ним молекулы растворителя с образованием большой группы молекул. Когда растворитель представляет собой воду, это называется “гидрат (d)”. Сольват может представлять собой либо гидрат, либо негидрат. Предпочтительно, сольваты представляют собой фармацевтически приемлемые сольваты. Для негидрата можно использовать спирт (например, метанол, этанол, н-пропанол), диметилформамид и т.п.
Соединения по настоящему изобретению и их соли могут присутствовать в некоторых таутомерных формах, например, в енольной и иминовой форме, кето и енаминовой форме, и в виде их смеси. В растворе таутомер присутствует в виде смеси таутомерных разновидностей. В случае твердой формы один тип таутомера обычно присутствует в преобладающем количестве. В этой связи, даже если описан только один тип таутомера, настоящее изобретение включает все типы таутомера соединений по настоящему изобретению.
Настоящее изобретение включает все типы стереоизомеров соединений по настоящему изобретению, которые представлены формулой (I) (например, энантиомер, диастереомер (включая цис и транс геометрический изомер)), рацемат такого изомера и их смесь. Например, соединения, имеющие формулу (I) по настоящему изобретению, могут содержать один или несколько асимметрических центров, и настоящее изобретение включает рацемическую смесь, диастереомерную смесь и энантиомер такого соединения.
Когда соединения по настоящему изобретению получают в свободной форме, их можно преобразовать в форму соли, гидрата или сольвата, которая может быть образована из соединения в соответствии со способом, хорошо известным из уровня техники.
Кроме того, когда соединения по настоящему изобретению получают в форме соли, гидрата или сольвата таких соединений, их можно преобразовать в свободную форму в соответствии со способом, хорошо известным из уровня техники.
Настоящее изобретение включают все изотопы соединений, которые представлены формулой (I). Изотопы соединений по настоящему изобретению означают соединения по настоящему изобретению, в которых, по меньшей мере, один атом замещен атомом с таким же атомным числом (т.е. числом протонов), но с другим массовым числом (сумма количества протонов и количества нейтронов). Пример изотопов, которые включены в соединения по настоящему изобретению, включает атом водорода, атом углерода, атом азота, атом кислорода, атом фосфора, атом серы, атом фтора, атом хлора и т.п., и включены2H,3H,13C,14C,15N,17O,18O,31P,32P,35S,18F,36Cl и т.п. В частности, радиоизотоп, который разлагается, испуская излучение, например3H и14C, является полезным для определения дистрибуции фармацевтического средства или соединения в живой ткани и т.п. С другой стороны, стабильный изотоп не разлагается и сохраняется почти в таком же количестве, не испуская радиоактивность, и поэтому является безопасным для использования. Изотопы соединений по настоящему изобретению можно преобразовать путем замещения химического реагента, используемого для синтеза, химическим реагентом, включающим соответствующий радиоизотоп, в соответствии со способом, хорошо известным из уровня техники.
Кроме того, соединения (I) по настоящему изобретению можно вводить в форме пролекарства. В настоящей заявке термин “пролекарство” относится к производным соединений, имеющим формулу (I), которые можно преобразовать в соединения, имеющие формулу (I), или их соли или сольваты после введения путем ферментативного или неферментативного разложения в физиологических условиях. Пролекарство может быть в неактивной форме при его введении пациенту. Однако в организме оно преобразовывается в соединение, имеющее формулу (I), и присутствует в организме в активной форме.
Например, пролекарство преобразуется в форму желаемого лекарственного средства при специфическом pH или при ферментативном воздействии. Традиционное пролекарство представляет собой соединение, содержащее гидролизуемый сложноэфирный остаток, который образует свободную кислоту в организме. Примеры такого гидролизуемого сложноэфирного остатка включают остаток, содержащий карбоксильную группу, в которой свободный водород (например, свободный водород в карбоксильной группе, когда Y в формуле (I) содержит карбоксильную группу) заменен C1-4 алкильной группой, C2-7 алканоилоксиметильной группой, 1-(алканоилокси)этильной группой, содержащей от 4 до 9 атомов углерода, 1-метил-1-(алканоилокси)этильной группой, содержащей от 5 до 10 атомов углерода, алкоксикарбонилоксиметильной группой, содержащей от 3 до 5 атомов углерода, 1-(алкоксикарбонилокси)этильной группой, содержащей от 4 до 7 атомов углерода, 1-метил-1-(алкоксикарбонилокси)этильной группой, содержащей от 5 до 8 атомов углерода, N-(алкоксикарбонил)аминометильной группой, содержащей от 3 до 9 атомов углерода, 1-(N-(алкоксикарбонил)амино)этильной группой, содержащей от 4 до 10 атомов углерода, 3-фталидильной группой, 4-кротонолактонильной группой, γ-бутиролактон-4-ильной группой, ди-N,N-(C1-2)алкиламино(C2-3)алкильной группой (например, N,N-диметиламиноэтильной группой), карбамоил(C1-2)алкильной группой, N,N-ди(C1-2)алкилкарбамоил-(C1-2)алкильной группой, пиперидинo(C2-3)алкильной группой, пирролидинo(C2-3)алкильной группой или морфолинo(C2-3)алкильной группой, но не ограничиваются этим.
Репрезентативный способ получения
Соединения, имеющие формулу (I), по настоящему изобретению можно получить, например, способом, описанным ниже. Однако способ получения соединений по настоящему изобретению не ограничивается этим. Кроме того, в зависимости от необходимости, порядок реакционных стадий, таких как введение группы заместителя и т.п., может меняться. Хотя соединения по настоящему изобретению являются новыми соединениями, которые не могут быть описаны в литературных источниках, их можно получить в соответствии с химическим способом, который хорошо известен из уровня техники. А также, что касается участвующих в реакции соединений, которые используют для получения, можно использовать коммерчески доступные соединения, или их можно получить в соответствии со способом, хорошо известным из уровня техники, в зависимости от необходимости.
В следующих схемах реакций, показывающих реакционную стадию, A1-A10 и R1-R10 имеют значения, определенные в формуле (I). PR1-PR10 имеют такие же значения, как R1-R10, которые определены в формуле (I), или представляют собой группу, которую можно преобразовать в R1-R10 в соответствии с модификацией или удалением защиты функциональной группы.
Другие символы, представленные в виде аббревиатур в следующих далее схемах реакций, имеют обычные значения, которые должны быть понятны специалистам в данной области.
PG представляет собой защитную группу (например, метил, этил, трет-бутил, бензил, замещенный бензил, ацетил, трет-бутоксикарбонил, бензилоксикарбонил, метансульфонил, трифторметансульфонил, триметилсилил, триэтилсилил, триизопропилсилил, трет-бутилдиметилсилил, тетрагидропиранил и т.п.). В способе получения, описанном ниже, когда определенная группа подвержена нежелательной химической модификации в условиях осуществления способа, получение можно осуществить с использованием таких приемов, как защита и удаление защиты функциональной группы и т.п.
Что касается используемых в настоящем изобретении способов выбора, присоединения и удаления защитной группы, они включают способы, описанные в “Protective Groups in Organic Synthesis” (Greene and Wuts, 4th edition, John Wiley & Sons 2007), и их можно использовать подходящим образом в соответствии с конкретными реакционными условиями.
LG представляет собой удаляемую группу, такую как фтор, хлор, бром, йод, метансульфонат, трифторметансульфонат и т.п., которую можно использовать для реакции, описанной выше.
Кроме того, символы, представленные в виде аббревиатур, которые обычно используют для описания общего способа синтеза и примеров, представленных ниже, и названия химических реагентов и растворителей, соответствующих химическим формулам, перечислены ниже.
9-BBN 9-борабицикло[3.3.1]нонан
AcOH уксусная кислота
BINAP 2,2’-бис(дифенилфосфино)-1,1’-бинафтил
BF3OEt2 этерат трифторида бора
t-BuOK трет-бутоксид калия
n-BuLi н-бутиллитий
t-BuONa трет-бутоксид натрия
CDI карбонилдиимидазол
CPME c-пентилметиловый эфир
DBU 1,8-диазабицикло[5.4.0]-7-ундецен
DCM дихлорметан
DEAD диэтил азодикарбоксилат
DDQ 2,3-дихлор-5,6-дициано-п-бензохинон
DIPEA N,N-диизопропилэтиламин
DMA N,N-диметилацетамид
DME диметоксиэтан
DMF N,N-диметилформамид
DMSO диметилсульфоксид
DPPF бис(дифенилфосфино)ферроцен
EDC гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида
EtOAc этилацетат
HOBt 1-гидроксибензотриазол
KHMDS калия гексаметилдисилазид
LDA диизопропиламид лития
LiHMDS гексаметилдисилазид лития
MeCN ацетонитрил
MeI метилйодид
MeOH метанол
MTBE трет-бутилметиловый эфир
NaHMDS гексаметилдисилазид натрия
NMP N-метилпирролидон
Pd2(dba)3 трис(дибензилиденацетон)дипалладий(0)
Pd(OAc)2 ацетат палладия
PdCl2(CH3CN)2 дихлор(бисацетонитрил)палладий(II)
PdCl2(PPh3)2 дихлорбис(трифенилфосфин)палладий(II)
Pd(PPh3)4 тетракис(трифенилфосфин)палладий(0)
P(t-Bu)3 три-трет-бутилфосфин
PPh3 трифенилфосфин
P(o-tol)3 три-o-толилфосфин
TEA триэтиламин
TEMPO 2,2,6,6-тетраметилпиперидин-1-оксил
TFA трифторуксусная кислота
TFAA трифторуксусный ангидрид
TFE трифторэтанол
THF тетрагидрофуран (ТГФ)
TMAD 1,1’-азобис (N,N-диметилформамид)
TMSCl триметилсилилхлорид
TMSI триметилсилилйодид
DavePhos 2-дициклогексилфосфино-2’-(N,N-диметиламино)бифенил
JohnPhos 2-(ди-трет-бутилфосфино)бифенил
c-Гексил JohnPhos 2-(дициклогексилфосфино)бифенил
S-Phos 2’,6’-диметокси-2-(дициклогексилфосфино)бифенил
X-Phos 2’,4’,6’-триизопропил-2-(дициклогексилфосфино)бифенил
t-БутилX-Phos 2’,4’,6’-триизопропил-2-(ди-трет-бутилфосфино)бифенил
Xantphos 4,5’-бис (дифенилфосфино)-9,9’-диметилксантен
Способ получения I
Это один из способов для получения соединений Формулы (I), в которой A5 представляет собой N и R5 представляет собой H.

Стадия I-1
Это стадия алкилирования циклического кетонового производного Ia. Эту стадию можно осуществить путем взаимодействия циклического кетонового производного Ia с агентом алкилирования, соответствующим R6 и R6’, в присутствии основания. Например, ее можно осуществить в соответствии со способом, описанным в Journal of the American Chemical Society, 115(23), 10628-36; 1993, и Organic Letters, 9(24), 5027-5029; 2007, и т.п. Реакцию осуществляют в растворителе в условиях температуры реакции от -20°C до температуры кипения растворителя, в присутствии или в отсутствие катализатора. Когда R6 и R6’представляют собой группы атомов, отличные от атома водорода, можно выбрать произвольный порядок реакций, и разделение и очистку можно осуществить на любой стадии, или реакцию можно осуществить непрерывным способом.
Что касается агента алкилирования, его примеры включают алкилгалогенид, такой как MeI, этилйодид, 2-йодпропан, 1,4-дибромбутан, 1,1’-оксибис(2-бромэтан) и т.п., диметилсульфат и сложный эфир сульфоновой кислоты, такой как метилметансульфонат, метилтозилат и метилтрифторметансульфонат. Предпочтительно, он представляет собой алкилгалогенид, такой как MeI и т.п. Что касается катализатора, его примеры включают межфазный катализатор, такой как тетрабутиламмонийхлорид и гидросульфат тетрабутиламмония. Предпочтительно, он представляет собой гидросульфат тетрабутиламмония. Что касается основания, его примеры включают неорганическое основание, такое как гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия, карбонат цезия, гидрид натрия, гидрид калия, гидрид кальция и т.п., или органическое основание, такое как t-BuOK, t-BuONa, пиридин, TEA, DIPEA, LDA, LiHMDS и n-BuLi. Предпочтительно, оно представляет собой гидроксид калия, трет-бутоксид калия или трет-бутоксид натрия. Что касается растворителя, его примеры включают толуол, ксилол, н-гексан, циклогексан, DMF, DMA, EtOAc, DMSO, дихлорметан, тетрахлорид углерода, ТГФ, диоксан, ацетонитрил, воду, метанол, этанол и их смесь. Предпочтительно, он представляет собой смесь растворителей вода-ТГФ или ТГФ.
Стадия I-2
Эта стадия представляет собой синтез карбазольного скелета Id в соответствии с методом Фишера. Эту стадию обычно осуществляют с использованием циклического кетона Ib в присутствии соединения гидразина Ic и кислоты в растворителе, или с использованием кислоты в качестве растворителя в условиях температуры реакции от 0°C до температуры кипения растворителя, и также ее можно осуществить в соответствии со способом, описанным в Journal of Heterocyclic Chemistry, 28(2), 321-3; 1991 и Bioorganic & Medicinal Chemistry Letters (2008), 18(24), 6479-6481. Кроме того, когда реакция протекает медленно, также можно использовать катализатор на основе хлорида цинка и т.п., в соответствии с реакционными условиями, раскрытыми в Organic Letters (2006), 8(3), 367-370. Реакция включает стадию получения фенилгидразона и стадию сигматропной перегруппировки. Разделение и очистку можно осуществить на любой стадии, или реакцию можно осуществить непрерывным способом. Кроме того, в соответствии со структурой арилгидразина, который представляет собой взаимодействующее вещество на этой реакционной стадии, может быть получена смесь изомера положения в качестве продукта реакции. Такие изомеры положения можно отделить друг от друга или использовать в виде смеси на следующей стадии реакций.
Что касается кислоты, используемой для реакции, ее примеры включают муравьиную кислоту, уксусную кислоту, метансульфоновую кислоту, п-толуолсульфоновую кислоту, бензолсульфоновую кислоту, TFA, хлористоводородную кислоту, серную кислоту и п-толуолсульфонат пиридиния. Предпочтительно, она представляет собой уксусную кислоту, серную кислоту или TFA. Что касается растворителя, его примеры включают толуол, ксилол, NMP, DMF, DMA, DMSO, сульфолан, диоксан, DME, TFE, диэтиленгликоль, триэтиленгликоль и их смесь.
Стадия I-3
Эта стадия представляет собой стадию окисления по бензилу в 11-положении карбазольного скелета Id. Эту стадию осуществляют путем нанесения окислителя на субстрат в растворителе, в присутствии или в отсутствие катализатора, в условиях температуры реакции от -20°C до температуры кипения растворителя. Что касается условий реакции, может быть рассмотрен способ, описанный в Journal of Medicinal Chemistry, 51(13), 3814-3824; 2008 и т.п.
Что касается окислителя и катализатора, используемых для реакции, можно использовать DDQ, перкислоту, такую как, mCPBA и т.п., церийаммонийнитрат(IV) (CAN), перманганат, такой как перманганат калия, перманганат бария и т.п., хлорит натрия, перекись водорода или N-гидроксифталимид и т.п., которые можно использовать отдельно или в сочетании друг с другом. Предпочтительно, он представляет собой DDQ или N-гидроксифталимид. Что касается растворителя, используемого для реакции, его примеры включают воду, трет-бутанол, ацетонитрил, ТГФ, дихлорметан, этилацетат и их смесь. Предпочтительно, он представляет собой ТГФ.
Способ получения II
Это иллюстративный способ получения β-кетоэфирного промежуточного соединения IIg, которое используют для построения скелета соединений, которые представлены формулой (I).

Стадия II-1, Стадия II-2
Это стадия алкилирования в α-положении сложного эфира карбоновой кислоты IIc или нитрила IIa. Эту стадию можно осуществить путем взаимодействия с агентом алкилирования, соответствующим R6 и R6’, в растворителе в условиях температуры реакции от -20°C до температуры кипения растворителя, в присутствии основания. Например, ее можно осуществить в соответствии со способом, описанным в J. Org. Chem., 2007, 72 (25), 9541-9549 и European Journal of Organic Chemistry (21), 3449-3462 и т.п. Реагенты и условия реакции аналогичны тем, которые описаны для Стадии I-1.
Стадия II-3
Эта стадия представляет собой стадию эфирного гидролиза сложного эфира карбоновой кислоты IId. Эту стадию можно осуществить путем гидролиза в водном растворителе при температуре реакции от 0°C до температуры кипения растворителя, в присутствии неорганического основания, например, в соответствии со способом, описанным в Tetrahedron Lett. 3529, 1977. Альтернативно, ее можно осуществить, например, в соответствии со способом, в котором гидролиз осуществляют в присутствии кислоты, в соответствии со способом, описанным в J. Am. Chem. Soc, 1977, 99, 2353. Что касается неорганического основания, его примеры включают гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия и карбонат цезия. Предпочтительно, оно представляет собой гидроксид натрия или гидроксид калия. Что касается растворителя, можно использовать воду, метанол, этанол, тетрагидрофуран, диоксан и т.п., которые можно использовать отдельно или в сочетании друг с другом. Предпочтительно, он представляет собой метанол, содержащий воду, или этанол, содержащий воду. Что касается кислоты, которую можно использовать для кислотного гидролиза, хлористоводородную кислоту, серную кислоту, трифторуксусную кислоту и метансульфоновую кислоту можно использовать отдельно в сочетании друг с другом. Предпочтительно, она представляет собой серную кислоту.
Стадия II-4, Стадия II-5
Это стадия непосредственного (гетеро)арилирования в α-положении сложного эфира карбоновой кислоты или нитрила. Эту стадию можно осуществить путем SNAr реакции, в которой сложный эфир карбоновой кислоты или нитрил подвергают взаимодействию с ароматическим соединением IIf, содержащим удаляемую группу, в присутствии основания. Это можно осуществить в соответствии со способом, описанным в J. Am. Chem. Soc. 2000, 122, 712-713. Альтернативно, эту реакцию также можно осуществить в соответствии со способом, в котором сложный эфир карбоновой кислоты или нитрил подвергают взаимодействию с ароматическим соединением IIf, содержащим удаляемую группу, в присутствии катализатора, лиганда и основания. Например, ее можно осуществить в соответствии со способом, описанным в Org. Lett, 2008, 10(8), 1545, J. Org. Chem. 2003, 68, 8003, и Angew. Chem. Int. Ed. 2003, 42, 5051 и т.п.
Что касается основания, используемого для реакции, можно использовать фосфат натрия, фосфат калия, карбонат натрия, карбонат калия, карбонат цезия, гидрид натрия, LiHMDS, NaHMDS, LDA, дициклогексиламид лития, 2,2,6,6-тетраметилпирролидид лития, KHMDS, t-BuONa, t-BuOK и т.п. Предпочтительно, оно представляет собой NaHMDS, KHMDS или t-BuONa. Что касается катализатора, лиганда или комплекса катализатор-лиганд, которые используют для реакции, можно использовать, например, ацетат палладия, Pd2(dba)3, π-аллилпалладийхлоридный димер, PdCl2(CH3CN)2, триалкилпроазафосфатран, {P(t-Bu)3PdBr}2, PPh3, P(o-tol)3, BINAP, DPPF, P(t-Bu)3, DavePhos, JohnPhos, c-Гексил JohnPhos, S-Phos, X-Phos, трет-БутилX-Phos, Xantphos, 4,5-бис[бис(3,5-бистрифторметилфенил)фосфанил]-9,9-диметил-9H-ксантен, соль 1,3-диаллилдигидроимидазолия и т.п. Предпочтительно используют триизобутилпроазафосфатран.
Стадия II-6
Это стадия гидролиза нитрила IIb до карбоновой кислоты. Эту стадию можно осуществить путем гидролиза в присутствии кислоты в условиях температуры реакции от 0°C до температуры кипения растворителя, и условия реакции включают условия, описанные, например, в Tetrahedron, 64(36), 8464-8475; 2008 и т.п. Для этой реакции кислоту как таковую можно использовать в качестве растворителя или разбавленную другим растворителем. Альтернативно, эту стадию можно осуществить путем гидролиза в присутствии неорганического основания, в условиях температуры реакции от 0°C до температуры кипения растворителя, и можно использовать условия реакции, описанные, например, в Bioorganic & Medicinal Chemistry Letters, 18(2), 749-754; 2008 и т.п.
Реакция включает гидролиз нитрила IIb до амида кислоты и дальнейшее преобразование в карбоновую кислоту. Разделение и очистку можно осуществить на любой стадии, или реакцию можно осуществить непрерывным способом.
Что касается кислоты, которую используют для реакции, ее примеры включают метансульфоновую кислоту, п-толуолсульфоновую кислоту, бензолсульфоновую кислоту, трифторуксусную кислоту, хлористоводородную кислоту и серную кислоту. Что касается растворителя, его примеры включают толуол, ксилол, диоксан, диметоксиэтан, диэтиленгликоль, триэтиленгликоль, TFE и т.п. и их смесь. Что касается неорганического основания, его примеры включают гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия и карбонат цезия.
Стадия II-7
Это стадия преобразования карбоновой кислоты IIe в β-кетоэфир. В соответствии с этой стадией, карбоновую кислоту как взаимодействующее вещество преобразуют в хлорангидрид кислоты, активный сложный эфир и т.п. путем воздействия активирующего агента в растворителе, в условиях температуры реакции от 0°C до температуры кипения растворителя. Затем хлорангидрид кислоты или активный сложный эфир подвергают взаимодействию с енолятом сложного моноэфира малоновой кислоты в условиях температуры реакции от 0°C до температуры кипения растворителя с получением целевого соединения через декарбоксилирование. Что касается условий реакции, можно использовать, например, способ, описанный в J. Chem. Soc. Perkin Trans. 1 1988, 2345-2352, и Synthesis 1993, 290-292. Что касается способа активации карбоновой кислоты, его примеры включают способ преобразования в хлорангидрид кислоты с использованием тионилхлорида, оксалилхлорида, оксихлорид фосфора и т.п., или способ преобразования в активный сложный эфир с использованием CDI. Предпочтительно используют тионилхлорид или CDI. Активированную карбоновую кислоту как таковую можно подвергнуть процедуре выделения и очистки, или ее можно далее использовать для следующей реакции. Что касается способа получения енолята сложного моноэфира малоновой кислоты, можно использовать сочетание магниевой соли, такой как хлорид магния и т.п., и сложного моноэфира малоновой кислоты (и его соли), либо реагента Гриньяра, такого как изопропилмагнийхлорид и т.п., и сложного моноэфира малоновой кислоты (и его соли) и т.п. Для улучшения выхода реакции можно также добавить в реакционную систему органическое основание, такое как TEA, DIPEA и т.п. Что касается растворителя, его примеры включают толуол, ксилол, MeCN, ТГФ, CPME, MTBE, NMP, DMF, DMA, DMSO, сульфолан, диоксан, DME и т.п. и их смесь. Предпочтительно, он представляет собой MeCN, ТГФ или DME.
Стадия II-8
Это стадия преобразования нитрила IIb в β-кетоэфир. Эту стадию можно осуществить при помощи так называемой реакции Blaise, в которой сложный эфир 2-галогенкарбоновой кислоты подвергают взаимодействию с нитрилом в присутствии активированного цинкового порошка в условиях температуры реакции от 0°C до температуры кипения растворителя, и можно использовать способ реакции, описанный, например, в SYNTHESIS 2004, No. 16, pp 2629-2632x. Что касается способа активации цинкового порошка, можно использовать способ, в котором заранее осуществляют кислотную промывку и сушку, или способ, в котором в реакционную систему включают каталитическое количество кислоты, такой как метансульфоновая кислота и т.п.
Способ получения III
Это иллюстративный способ получения соединения IIIh из промежуточного соединения IIg, которое получено в Способе получения II.
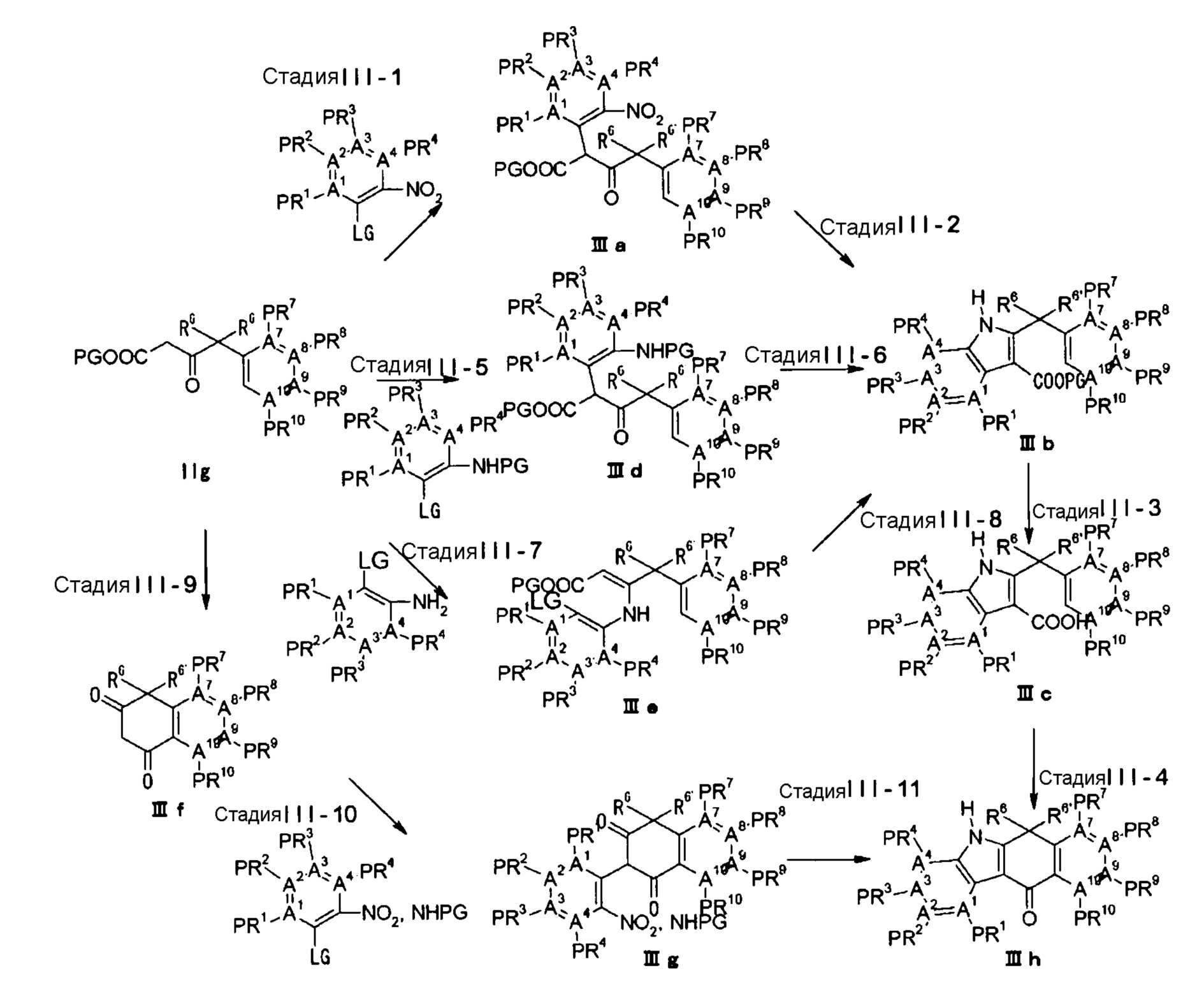
Стадия III-1
Эту стадию можно осуществить путем реакции нуклеофильного ароматического замещения, в которой ароматическое нитросоединение, содержащее удаляемую группу, подвергают взаимодействию с β-кетоэфиром IIg в присутствии основания, в условиях температуры реакции от 0°C до температуры кипения растворителя, и способ реакции включает способ, описанный, например, в Synlett, (5), 883-885; 2004, и Tetrahedron, 38(23), 3479-83; 1982.
Что касается основания, используемого для реакции, можно использовать фосфат натрия, фосфат калия, карбонат натрия, карбонат калия, карбонат цезия, гидрид натрия, LiHMDS, NaHMDS, LDA, дициклогексиламид лития, 2,2,6,6-тетраметилпирролидид лития, KHMDS, t-BuOK, t-BuONa и т.п. Предпочтительно, оно представляет собой карбонат калия, карбонат цезия, t-BuOK или t-BuONa. Что касается растворителя, его примеры включают толуол, ксилол, MeCN, ТГФ, CPME, MTBE, NMP, DMF, DMA, DMSO, сульфолан, диоксан, DME, ацетон, метилэтилкетон и их смесь. Предпочтительно, он представляет собой ТГФ, DMF, DMA, NMP или их смесь.
Кроме того, настоящую стадию также можно осуществить в присутствии катализатора и основания, как описано для Стадии III-5 или в Journal of Organic Chemistry, 72(14), 5337-5341; 2007.
Стадия III-2
Это стадия восстановительной циклизации с образованием индольного кольца после восстановления нитрогруппы. Эту реакцию можно осуществить путем взаимодействия β-кетоэфира IIIa с восстановителем в условиях температуры реакции от 0°C до температуры кипения растворителя для восстановления нитрогруппы. Что касается восстановителя, используемого для этой реакции, можно использовать условия, обычно используемые для восстановления нитрогруппы, например, железо, как проиллюстрировано в Syntjesis, (18), 2943-2952, 2008, цинк, как проиллюстрировано в Tetrahedron, 64(40), 9607-9618, 2008, хлорид титана(III), как проиллюстрировано в Organic & Biomolecular Chemistry, 3(2), 213-215, 2005, хлорид олова(II), как проиллюстрировано в Journal of Organic Chemistry, 58(19), 5209-5220, 1993, гидросульфит натрия, как проиллюстрировано в Gazzetta Chimica Italiana, 121(11), 499-504, 1991, и условия каталитического восстановления, как проиллюстрировано в Synlett, (17), 2689-2691, 2008 и т.п. Предпочтительно, восстановитель представляет собой железо или гидросульфит натрия.
Стадия III-3
Это стадия удаления сложноэфирной защитной группы сложного эфира индол-3-карбоновой кислоты IIIb. В качестве примера сложноэфирной защитной группы можно указать метильную группу, этильную группу, трет-бутильную группу, бензильную группуу, замещенную бензильную группу и т.п. Предпочтительно она представляет собой трет-бутил. Что касается способа удаления защиты, его примеры включают способ, описанный в “Protective Groups in Organic Synthesis” (Greene and Wuts, 4th edition, John Wiley & Sons 2007), и его можно подходящим образом использовать в соответствии с каждыми реакционными условиями. Когда сложноэфирная защитная группа представляет собой трет-бутил, в качестве условий удаления защиты можно использовать TMSI, TMSCl и BF3·OEt2. Что касается растворителя, его примеры включают толуол, ксилол, диэтиловый эфир, ТГФ, CPME, MTBE, NMP, DMF, DMA, DMSO, сульфолан, диоксан, DME, TFE и т.п. и их смесь. Предпочтительно, он представляет собой ТГФ или TFE.
Стадия III-4
Это стадия циклизации индол-3-карбоновой кислоты IIIc до карбазола на основе реакции Фриделя-Крафтса. В соответствии с этой реакцией получают смешанный ангидрид кислоты с использованием уксусного ангидрида, трифторуксусного ангидрида и т.п., или получают хлорангидрид кислоты с использованием тионилхлорида, оксалилхлорида, оксихлорида фосфор и т.п., что приводит к активации карбоновой кислоты. Предпочтительно используют уксусный ангидрид или трифторуксусный ангидрид. Реакцию осуществляют в отсутствие или в присутствии растворителя. Что касается растворителя, его примеры включают толуол, ксилол, диэтиловый эфир, ТГФ, CPME, MTBE, NMP, DMF, DMA, DMSO, сульфолан, диоксан, DME и т.п. и их смесь. Предпочтительно, он представляет собой ТГФ, DMF, DMA или DME. Кроме того, можно использовать органическое основание, такое как TEA, DIPEA, пиридин и т.п.
Затем, в условиях температуры реакции от 0°C до температуры кипения растворителя, осуществляют циклизацию без катализатора или с использованием кислоты Бренстеда или кислоты Льюиса в качестве катализатора (Heterocycles 1999, 51, 2127). Что касается катализатора на основе кислоты Льюиса, примеры включают хлорид алюминия, трифлат алюминия, трифлат висмута, трифлат иттербия и BF3·OEt2. Предпочтительно, он представляет собой BF3·OEt2. В зависимости от типа группы заместителя, реакцию также можно осуществить путем нанесения метансульфоновой кислоты-пентоксида фосфора (реагент Итона), полифосфорной кислоты и т.п. на сложный эфир индол-3-карбоновой кислоты IIIb, без прохождения Стадии III-3.
Стадия III-5, III-6
Эту стадию можно осуществить путем взаимодействия ароматического ациламидного соединения, содержащего удаляемую группу, с β-кетоэфиром IIg в присутствии основания, катализатора, и лиганда, в условиях температуры реакции от 0°C до температуры кипения растворителя, с последующим удалением ацильной защитной группы. Примеры включают способ, описанный в Journal of Organic Chemistry 2007, 72, 9329-9334, и Organic Letters 10(4), 625-628, 2008. Что касается металлического катализатора, можно использовать йодид меди(I) и ацетат палладия. Что касается лиганда, можно использовать (S)-пролин, три-трет-бутилфосфин, бис(трет-бутил)(2’-метил[1,1’-бифенил]-2-ил)фосфин и т.п. Что касается основания, которое используют для реакции, можно использовать фосфат натрия, фосфат калия, карбонат натрия, карбонат калия, карбонат цезия, гидрид натрия, LiHMDS, NaHMDS, LDA, дициклогексиламид лития, 2,2,6,6-тетраметилпирролидид лития, гексаметилдисилазид калия, t-BuONa, t-BuOK и т.п.
Стадия III-7, III-8
Это стадия взаимодействия ароматического аминосоединения с β-кетоэфиром IIg с образованием енаминового промежуточного соединения, с последующей каталитической циклизацией. Примеры включают способ, описанный в Journal of Organic Chemistry, 68(15), 6011-6019; 2003, и European Journal of Organic Chemistry, (24), 3977-3980; 2007.
Альтернативно, циклизацию можно осуществить на основе окислительного способа. Например, также можно использовать реакционные условия, описанные в Angewandte Chemie, International Edition, 47(38), 7230-7233; 2008.
Стадия III-9
Это стадия синтеза 1,3-дикетона на основе циклизации β-кетоэфира IIg. Что касается условий и реагентов для этой реакции, можно использовать способ, описанный в Bioorganic & Medicinal Chemistry Letters, 18(2), 568-570; 2008, где β-кетоэфир IIg подвергают взаимодействию в растворителе в присутствии катализатора на основе кислоты Бренстеда или катализатора на основе кислоты Льюиса, или способ с использованием агента конденсации, такого как метансульфоновая кислота-пентоксид фосфора (реагент Итона), полифосфорная кислота и т.п.
Стадия III-10, III-11
Эту стадию можно осуществить таким же способом, какой использовали на Стадии III-1 и III-2 или Стадии III-5 и III-6.
Способ получения IV
Иллюстративный способ получения соединения IIIh, где используют соединение формулы Iva в качестве исходного вещества.

Стадия IV-1, IV-3
Это стадия образования ди-замещенных индольных производных на основе реакции Соногашира, в которой концевой алкин подвергают взаимодействию с ароматическим аминовым производным IVa, содержащим удаляемую группу в орто положении, в присутствии основания и катализатора, с использованием или без каталитического количества медного реагента. Конкретные примеры включают способ, описанный в Organic Letters, 11(1), 221-224; 2009. Реакцию осуществляют в подходящем растворителе, в присутствии палладиевого катализатора и лиганда (или их комплекса), с использованием или без основания и медного катализатора. Пример медного катализатора, используемого для реакции, включает йодид меди. В качестве примера катализатора и лиганда (или их комплекса) можно указать ацетат палладия, Pd2(dba)3, π-аллилпалладийхлоридный димер, PdCl2(CH3CN)2, PdCl2(PPh3)2, триалкилпроазафосфатран, {P(t-Bu)3PdBr}2, PPh3, P(o-tol)3, BINAP, DPPF, P(t-Bu)3, DavePhos, JohnPhos, c-Гексил JohnPhos, S-Phos, X-Phos, трет-БутилX-Phos, Xantphos, 4,5-бис[бис(3,5-бистрифторметилфенил)фосфанил]-9,9-диметил-9H-ксантен, соль 1,3-диаллилдигидроимидазолия и т.п. Что касается основания, используемого для реакции, можно использовать фосфат натрия, фосфат калия, карбонат натрия, карбонат калия, карбонат цезия, TEA, DIPEA и т.п. Предпочтительно, оно представляет собой карбонат цезия, TEA или DIPEA.
Стадия IV-2
Эта стадия соответствует тандемной реакции Фриделя-Крафтса, в которой ацилирование в 3-положении ди-замещенного индольного производного IVb осуществляют в присутствии катализатора на основе кислоты Льюиса, в условиях температуры реакции от 0°C до температуры кипения растворителя, с последующей внутримолекулярной циклизацией. Что касается катализатора, используемого для реакции, его примеры включают хлорид алюминия, трифлат алюминия, трифлат висмута, трифлат иттербия и BF3·OEt2. Предпочтительно, он представляет собой хлорид алюминия.
Стадия IV-4
Эта стадия включает удаление защитной группы, представляющей собой сложный эфир карбоновой кислоты, содержащейся в ди-замещенном индольном производном IVc, и последующую внутримолекулярную циклизацию в 3-положении индола либо каталитическим, либо некаталитическим путем. Что касается способа удаления защиты, его примеры включают способ, описанный в “Protective Groups in Organic Synthesis” (Greene and Wuts, 4th edition, John Wiley & Sons 2007), и его можно подходящим образом использовать в соответствии с типом каждой защитной группы. Когда для реакции используют активированное индольное производное, циклизация осуществляется легче, поэтому реакцию можно осуществить некаталитическим путем. Кроме того, циклизацию также можно осуществить с использованием агента конденсации, такого как полифосфорная кислота, метансульфоновая кислота-пентоксид фосфора (реагент Итона) и т.п. Альтернативно, также возможен способ, когда карбоновую кислоту сначала преобразовывают в хлорангидрид карбоновой кислоты, смешанный ангидрид кислоты и т.п. в условиях, аналогичных тем, которые определены на Стадии III-4, и циклизацию осуществляют в условиях Фриделя-Крафтса, в присутствии катализатора на основе кислоты Льюиса. Что касается катализатора на основе кислоты Льюиса, используемого для реакции, его примеры включают хлорид алюминия, трифлат алюминия, трифлат висмута, трифлат иттербия и BF3·OEt2.
Способ получения V
Это один из способов построения скелета соединений, имеющих формулу (I), в которой A5 представляет собой O, S или NH.

Стадия V-1
Это стадия арилирования циклического кетонового производного Ib с использованием ароматического соединения Va, содержащего удаляемую группу. Реакцию осуществляют каталитически в присутствии основания с использованием сочетания катализатора на основе переходного металла и лиганда, и можно использовать, например, условия, описанные в J. Am. Chem. Soc. 2000, 122, 1360-1370, и Journal of Organic Chemistry (2003), 68(25), 9865-9866. Что касается основания, используемого для реакции, его примеры включают t-BuONa, t-BuOK, LiHMDS, NaHMDS, фосфат калия, карбонат натрия, карбонат калия и карбонат цезия. Что касается катализатора и лиганда (или комплекса катализатор-лиганд), можно использовать ацетат палладия, Pd2(dba)3, π-аллилпалладийхлоридный димер, PdCl2(CH3CN)2, PdCl2(PPh3)2, триалкилпроазафосфатран, {P(t-Bu)3PdBr}2, PPh3, P(o-tol)3, BINAP, DPPF, P(t-Bu)3, DavePhos, JohnPhos, c-Гексил JohnPhos, S-Phos, X-Phos, трет-БутилX-Phos, Xantphos, 4,5-бис[бис(3,5-бистрифторметилфенил)фосфанил]-9,9-диметил-9H-ксантен соль 1,3-диаллилдигидроимидазолия и т.п.
Стадия V-2
Это стадия удаления защитной группы. Когда A5 представляет собой O или S, в качестве защитной группы можно использовать трет-бутильную группу, бензильную группу и замещенную бензильную группу. Когда A5 представляет собой O, можно использовать трет-бутилдиметилсилильную группу и тетрагидропиранильную группу. Когда эта группа представляет собой NH, можно использовать трет-бутоксикарбонильную группу, бензилоксикарбонильную группу, метансульфонильную группу, трифторацетильную группу и т.п. Что касается способа удаления защиты, его примеры включают способ, описанный в “Protective Groups in Organic Synthesis” (Greene and Wuts, 4th edition, John Wiley & Sons 2007), и его можно подходящим образом использовать в соответствии с типом каждой защитной группы.
Стадия V-3
Это стадия циклизации циклического α-арилкетонового производного Vc с получением бензофуранового производного, бензотиофена или индола Vd. Реакцию можно осуществить в условиях с использованием катализатора на основе кислоты или дегидратирующих условий. Например, можно использовать условия реакции, описанные в Acta Pharmaceutica Hungarica (2003), 73(3), 171-178. Кроме того, в зависимости от типа защитной группы для гидроксильной группы, эту реакцию можно осуществить одновременно с удалением защиты Стадии V-2, как описано в Heterocycles, 26(7), 1863-71; 1987. Что касается условий дегидратации, можно использовать сочетание органического основания и ангидрида кислоты, такой как трифторметансульфоновая кислота, и т.п.
Стадия V-4
Это стадия окисления по бензилу в 11-положении тетрациклического соединения Vd. Эту стадию осуществляют путем нанесения окислителя на субстрат в растворителе, в присутствии или в отсутствие катализатора, в условиях температуры реакции от -20°C до температуры кипения растворителя. Что касается условий реакции, можно использовать способ, описанный в Journal of Medicinal Chemistry, 51(13), 3814-3824; 2008 и т.п.
Что касается окислителя и катализатора, используемых для реакции, можно использовать DDQ, перкислоту, такую как mCPBA и т.п., церийаммонийнитрат(IV) (CAN), перманганат, такой как перманганат калия, перманганат бария и т.п., хлорит натрия, перекись водорода, N-гидроксифталимид и т.п., которые можно использовать отдельно или в сочетании друг с другом. Что касается растворителя, используемого для реакции, его примеры включают воду, трет-бутанол, ацетонитрил, тетрагидрофуран, дихлорметан, этилацетат и их смесь.
Способ получения VI
Это иллюстративный способ построения скелета соединений, которые представлены формулой (I), в которой A5 представляет собой S.

Стадия VI-1
Это реакция создания бензотиофенового кольца на основе взаимодействия между илидом VIa, содержащим тиол в орто-положении, и ацилхлоридом VIb. Реакцию можно осуществить в присутствии основания, и условия включают, например, условия, описанные в Synthesis, (2), 155-7; 1988. Что касается основания, его примеры включают н-бутиллитий, метилат натрия и триэтиламин.
Стадия VI-2
Это реакция для синтеза ароматической карбоновой кислоты. Реакцию можно осуществить путем металлизации, такой как реакция присоединения лития или магния на основе обмена между галогеном и металлом в присутствии основания, с последующим карбоксилированием с использованием газообразного карбоната, сухого льда и т.п. Можно использовать условия реакции, описанные в Journal of Organic Chemistry (2008), 73(19), 7785-7788. Что касается основания, можно использовать н-бутиллитий, втор-бутиллитий, трет-бутиллитий, реагент Гриньяра и различные комплексы. Альтернативно, как описано в e-EROS Encyclopedia of Reagents for Organic Synthesis 2001 (электронная версия; http: //www3.interscience.wiley.com/cgi-bin/mrwhome/104554785/HOME), также можно использовать условия карбоксилирования с использованием катализатора на основе переходного металла.
Стадия VI-3
Эта стадия соответствует внутримолекулярной циклизации в 3-положении ди-замещенного бензотиофенового производного VId либо каталитическим, либо некаталитическим путем. Например, можно использовать условия реакции, описанные в Journal of the American Chemical Society, 130(23), 7286-7299; 2008. Реакцию можно осуществить с использованием агента конденсации, такого как полифосфорная кислота, метансульфоновая кислота-пентоксид фосфора (реагент Итона) и т.п. Альтернативно, также можно сначала осуществить преобразование карбоновой кислоты в хлорангидрид карбоновой кислоты, смешанный ангидрид кислоты и т.п., и циклизацию осуществляют в условиях Фриделя-Крафтса в присутствии катализатора на основе кислоты Льюиса. Что касается катализатора на основе кислоты Льюиса, используемого для реакции, его примеры включают хлорид алюминия, трифлат алюминия, трифлат висмута, трифлат иттербия и BF3·OEt2.
Способ получения VII Преобразование и модификация функциональных групп
Для функциональных групп PR1-PR10 в формуле (I) по настоящему изобретению, можно ввести различные группы заместителей на основе способа преобразования и модификации функциональной группы, который хорошо известен специалистам в данной области техники. Ниже описаны репрезентативные примеры преобразования функциональных групп. Кроме того, хотя представленная ниже схема реакций является специфической с той точки зрения, что примеры PR8 и PR9 представлены для тетрациклического соединения, которое уже сконструировано, ее также можно осуществить для промежуточного соединения в ходе любых стадий, описанных в Способах получения I-VI выше, или для конечного соединения. Кроме того, ее можно осуществить в любом положении замещения PR1-PR4 и R6-PR10.
В представленной ниже формуле Q1 и Q2 представляют собой любую группу заместителя, которая включена в PR1-PR4 и R6-PR10.

Стадия VII-1
Это стадия удаления защитной группы для ароматической гидроксильной группы. В качестве примера защитной группы можно указать метильную группу, трет-бутильную группу, бензильную группу, замещенную бензильную группу, трет-бутилдиметилсилильную группу, тетрагидропиранильную группу и т.п. Предпочтительно, она представляет собой метильную группу. Что касается способа удаления защиты, его примеры включают способ, описанный в “Protective Groups in Organic Synthesis” (Greene and Wuts, 4th edition, John Wiley & Sons 2007), и его можно подходящим образом использовать в соответствии с типом каждой защитной группы. Когда используют метильную группу в качестве защитной группы, для удаления защиты можно использовать различные реакционные условия селективным образом, в зависимости от реактивности. Примеры включают нагревание в присутствии соли пиридинхлористоводородной кислоты, нагревание в присутствии растворителя с додекантиолом и метилатом натрия и нагревание в присутствии растворителя с безводным галогенидом лития, трибромидом бора, TMSI и т.п.
Стадия VII-2
Это один из способов для введения группы заместителя на основе образования эфирной связи с ароматической гидроксильной группой. Для образования эфирной связи можно использовать реакцию Мицунобу, описанную в известной литературе (Mitsunobu, et. al., Synthesis, Vol. 1, page 1, 1981), или аналогичный способ. Конкретно, реакцию осуществляют в присутствии соединения фосфора и азосоединения, в растворителе, в условиях температуры реакции от -78°C до температуры кипения растворителя. Что касается соединения фосфора, его примеры включают PPh3 и три-н-бутилфосфин. Что касается азосоединения, его примеры включают DEAD, TMAD и диизопропилазодикарбоновую кислоту. Также, используя такие вещества в любом сочетании, можно получить целевое соединение.
Стадия VII-3
Это стадия осуществления трифторметансульфонилирования по ароматической гидроксильной группе. Реакцию осуществляют путем взаимодействия с участвующим в реакции реагентом, таким как трифторметансульфоновая кислота и т.п., в присутствии основания, с использованием или без растворителя, в условиях температуры реакции от -20°C до температуры кипения растворителя. Что касается основания, используемого для реакции, можно использовать TEA, DIPEA, пиридин, 2,6-лутидин, диметиламинопиридин и т.п. Предпочтительно используют пиридин без какого-либо растворителя. Полученный эфир трифторметансульфоновой кислоты VIId представляет собой хорошую удаляемую группу, и его можно использовать для различных дериватизаций.
Стадия VII-4
Это стадия получения сложного эфира сульфаминовой кислоты путем осуществления сульфамоилирования по ароматической гидроксильной группе. Реакцию осуществляют путем взаимодействия с участвующим в реакции реагентом, таким как сульфамоилхлорид и т.п., в присутствии основания, с использованием растворителя, в условиях температуры реакции от -20°C до температуры кипения растворителя. Что касается основания, используемого для реакции, можно использовать гидрид натрия, TEA, DIPEA, пиридин, 2,6-лутидин, диметиламинопиридин и т.п. Предпочтительно, оно представляет собой гидрид натрия. Полученный сложный эфир сульфаминовой кислоты VIIe представляет собой субстрат для перегруппировки тиаФриса Стадии VII-5, и его можно использовать для различных дериватизаций.
Стадия VII-5
Эта стадия соответствует перегруппировке сульфамоильной группы в соседнее положение в присутствии катализатора на основе кислоты Льюиса, в условиях температуры реакции от 0°C до температуры кипения растворителя, когда соседнее положение сложного эфира сульфаминовой кислоты является незамещенным (т.е. C-H), т.е. реакцию называют перегруппировкой тиаФриса. Что касается катализатора, используемого для реакции, можно использовать хлорид алюминия, трифлат алюминия, трифлат висмута, трифлат иттербия, BF3·OEt2 и т.п. Предпочтительно, он представляет собой хлорид алюминия.
Стадия VII-6
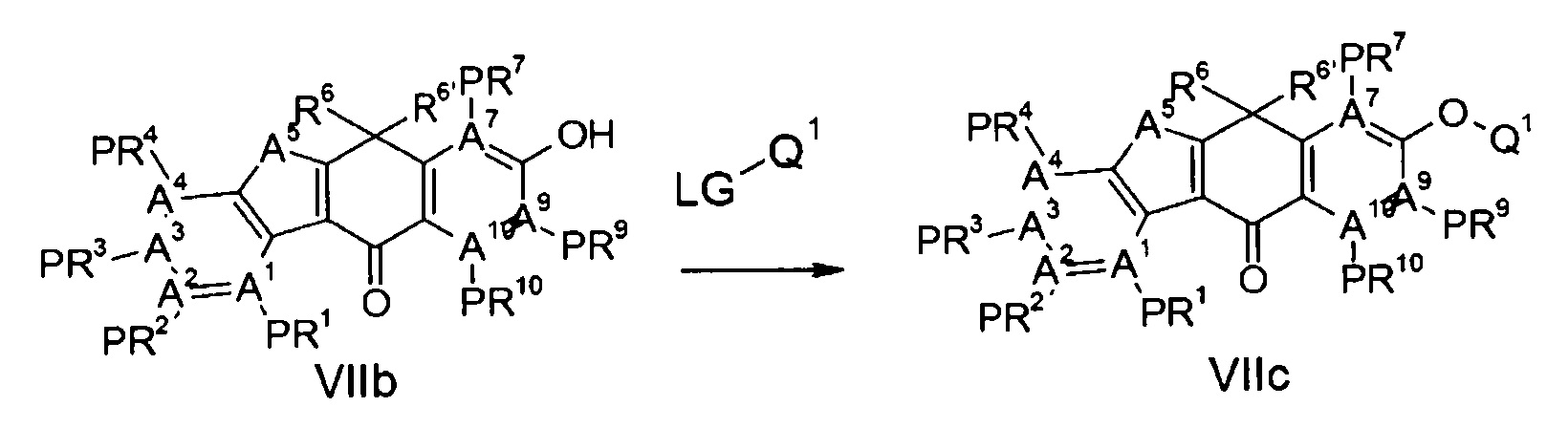
Это еще одна стадия введения группы заместителя на основе образования эфирной связи. В соответствии с этой стадией, реагент, содержащий подходящую удаляемую группу, такой как алкилгалогенид и т.п., подвергают нуклеофильной реакции с гидроксильной группой соединения VIIb в присутствии подходящего основания с образованием эфирной связи. Что касается основания, его примеры включают неорганическое основание, такое как карбонат натрия, карбонат калия, карбонат цезия, гидрид натрия, гидрид калия, гидрид кальция и т.п., или органическое основание, такое как пиридин, TEA, DIPEA и т.п.
Кроме того, с использованием арилгалогенида, арилбората и т.п. в качестве реагента, содержащего удаляемую группу, также достигается образование диариловой эфирной связи. Когда реактивность является недостаточной, можно использовать катализатор, такой как медный порошок, ацетат меди, йодид меди и т.п., или лиганд, такой как фенантролин, транс-1,2-циклогександиамин и т.п.
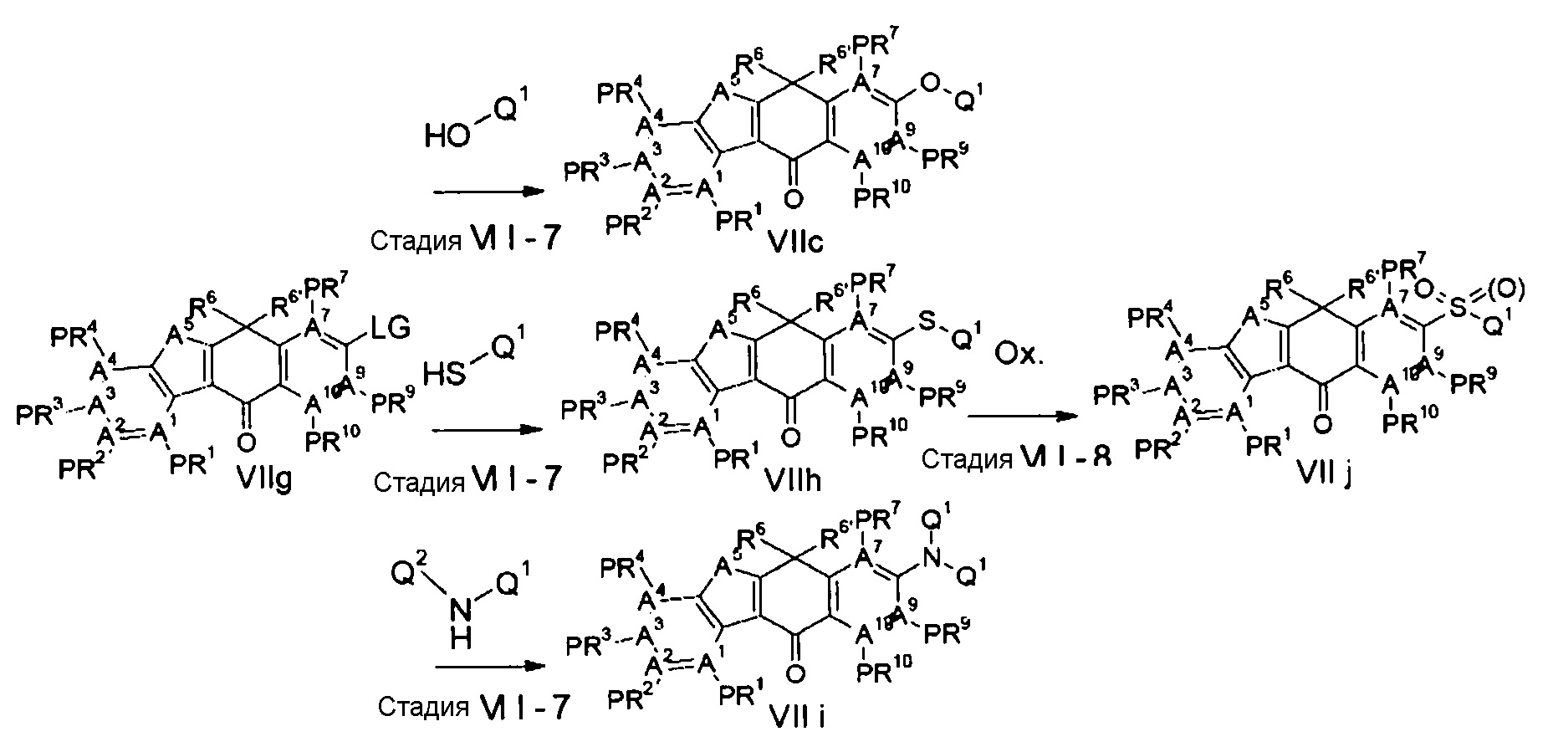
Стадия VII-7
Это реакция для образования связи между арилом и гетероатомом с использованием соединения VIIg, содержащего удаляемую группу. Реакцию осуществляют в подходящем растворителе, инертном к реакции, в присутствии основания. Что касается удаляемой группы LG, можно использовать галоген, трифлат и т.п. Что касается растворителя, его примеры включают толуол, ксилол, н-гексан, циклогексан, DMF, DMA, EtOAc, DMSO, NMP, ТГФ, DME, диоксан, ацетонитрил и т.п. и их смесь. Что касается основания, используемого для реакции, его примеры включают t-BuONa, t-BuOK, LiHMDS, NaHMDS, KHMDS, фосфат калия, карбонат натрия, карбонат калия и карбонат цезия. Эту стадию также можно осуществить с использованием катализатора и лиганда. Что касается катализатора и лиганда (или комплекса катализатор-лиганд), можно использовать, например, ацетат палладия, Pd2(dba)3, π-аллилпалладийхлоридный димер, PdCl2(CH3CN)2, PdCl2(PPh3)2, триалкилпроазафосфатран, {P(t-Bu)3PdBr}2, PPh3, P(o-tol)3, BINAP, DPPF, P(t-Bu)3, DavePhos, JohnPhos, c-Гексил JohnPhos, S-Phos, X-Phos, трет-БутилX-Phos, Xantphos, 4,5-бис[бис(3,5-бистрифторметилфенил)фосфанил]-9,9-диметил-9H-ксантен, соль 1,3-диаллилдигидроимидазолия и т.п.
Стадия VII-8
Когда продукт реакции Стадии VII-7 представляет собой тиоэфир VIIh, можно получить сульфоксидное или сульфоновое соединение VIIj путем окисления при помощи м-хлорпербензойной кислоты, оксона, TEMPO и т.п.
Стадия VII-9
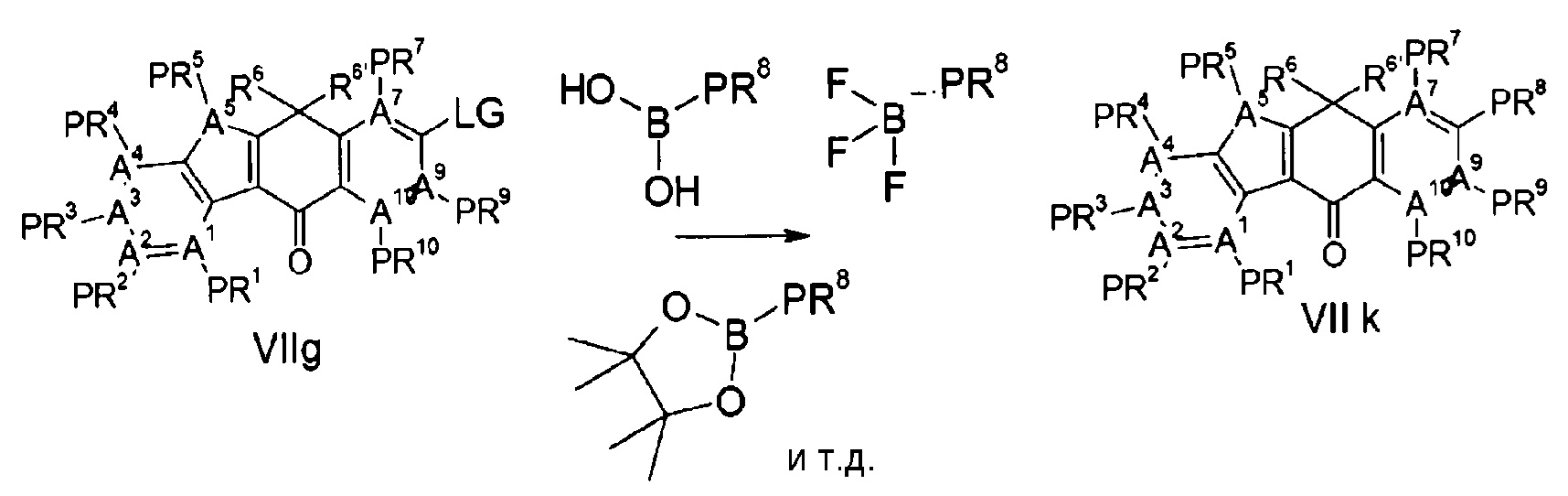
Это реакция для образования связи между арилом и SP2 углеродом или связи между арилом и SP3углеродом, в которой используют соединение VIIg, содержащее удаляемую группу. Реакцию осуществляют в подходящем растворителе, инертном к реакции, в присутствии основания. Что касается удаляемой группы LG, можно использовать галоген, трифлат и т.п. Что касается растворителя, его примеры включают толуол, ксилол, н-гексан, циклогексан, DMF, DMA, EtOAc, DMSO, NMP, ТГФ, DME, диоксан, ацетонитрил, воду, изопропанол и т.п. и их смесь. Что касается основания, используемого для реакции, его примеры включают t-BuONa, t-BuOK, LiHMDS, NaHMDS, KHMDS, фосфат калия, карбонат натрия, карбонат калия, карбонат цезия, TEA и DIPEA. Эту стадию также можно осуществить с использованием катализатора и лиганда. Что касается катализатора и лиганда (или комплекса катализатор-лиганд), можно использовать, например, ацетат палладия, Pd2(dba)3, π-аллилпалладийхлоридный димер, PdCl2(CH3CN)2, PdCl2(PPh3)2, триалкилпроазафосфатран, {P(t-Bu)3PdBr}2, PPh3, P(o-tol)3, BINAP, DPPF, P(t-Bu)3, DavePhos, JohnPhos, c-Гексил JohnPhos, S-Phos, X-Phos, трет-БутилX-Phos, Xantphos, 4,5-бис[бис(3,5-бистрифторметилфенил)фосфанил]-9,9-диметил-9H-ксантен, соль 1,3-диаллилдигидроимидазолия и т.п.

Стадия VII-10
Это реакция карбоксилирования с использованием соединения VIIg, содержащего удаляемую группу. Реакцию осуществляют путем взаимодействия с муравьиной кислотой (или ее синтетическим эквивалентом) в подходящем растворителе, инертном к реакции, в присутствии основания и катализатора. Что касается удаляемой группы LG, можно использовать галоген, трифлат и т.п. Растворитель и катализатор можно выбрать и использовать таким же образом, как на Стадии VII-9.
Стадия VII-11
Это реакция амидирования с использованием карбоновой кислоты VIIm. Конкретно, реакцию можно осуществить при помощи реакции конденсации с дегидратированием с использованием различных аминов, таких как аммиак, первичные амины, вторичные амины, гидразины, замещенные гидразины и т.п. Реакцию осуществляют в присутствии кислотного галогенирующего агента или дегидратирующего агента конденсации, в апротонном растворителе, в условиях температуры реакции от -20°C до температуры кипения растворителя, с использованием или без активного агента этерификации и основания.
Что касается кислотного галогенирующего агента, его примеры включают оксалилхлорид и тионилхлорид. Что касается дегидратирующего агента конденсации, его примеры включают 1,3-дициклогексилкарбодиимид (DCC), 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин (EEDQ), гексафторфосфат бром-трис(пирролидинo)-фосфония (PyBrOP), EDC и (бензотриазолилокси)трипирролидинo-фосфоний=гексафторфосфат (PyBOP). Что касается активного агента этерификации, его примеры включают HOBt, ди(N-сукцинимидил) карбонат и карбонилдиимидазол. Что касается основания, его примеры включают TEA, DIPEA и DBU. Что касается растворителя, его примеры включают DMF, DMA, DCM, ацетон, ТГФ, диоксан, DME, этилацетат, MeCN и их смесь.
Стадия VII-12

Это стадия образования связи между арилом и SP углеродом с использованием соединения VIIo, содержащего удаляемую группу. Реакцию осуществляют путем взаимодействия концевого алкина в подходящем растворителе, в присутствии основания и катализатора, с использованием или без каталитического количества медного реагента, и реакцию называют реакцией Соногашира. Реагенты и условия реакции такие же, которые описаны на Стадии IV-1 и Стадии IV-3. В качестве варианта реакции Соногашира примеры включают способ, раскрытый в Tetrahedron, 63(43), 10671-10683; 2007. Конкретно, при использовании вторичных аминов и т.п. в реакционной системе и при использовании пропаргилбромида в качестве алкина можно ввести пропаргиламин.
Стадия VII-13

Это реакция образования связи между арилом и CN с использованием соединения VIIo, содержащего удаляемую группу. Реакцию можно осуществить путем добавления источника CN- в подходящем растворителе, в присутствии медного, цинкового или палладиевого катализатора, с использованием или без лиганда, в соответствии с условиями реакции, описанными в Organic Letters, 10(23), 5325-5328; 2008, Tetrahedron Letters, 49(32), 4693-4694; 2008, и Bioorganic & Medicinal Chemistry, 16(13), 6489-6500; 2008. Что касается источника CN-, можно использовать цианид меди(I), цианид цинка(II), гексацианид железа(III), цианид натрия, цианид калия и т.п.
Синтез исходных веществ
Некоторые исходные вещества для настоящего изобретения представляют собой новые соединения, и их можно легко синтезировать таким же способом, как известные участвующие в реакции соединения, или в соответствии со способом, хорошо известным специалистам в данной области.
Выше описаны примеры способа получения соединений, имеющих формулу (I), в соответствии с настоящим изобретением. Однако выделение и очистку целевых соединений, которые описаны подробно на каждой стадии реакций, можно осуществить путем применения обычных способов химической обработки, таких как экстракция, концентрирование, удаление путем дистилляции, кристаллизация, фильтрование, перекристаллизация, различные виды хроматографии и т.п.
Фармацевтическое средство по настоящему изобретению
Фармацевтическая композиция по настоящему изобретению содержит фармацевтически приемлемый носитель, помимо соединения, которое выбирают как являющееся полезным для изобретения. В настоящем описании термин “фармацевтически приемлемый носитель” означает один или несколько типов подходящего твердого или жидкого носителя, разбавителя или инкапсулирующего вещества, которое является подходящим для введения млекопитающим. В настоящем описании термин “приемлемый” означает, что это вещество не вызывает никакой реакции для существенного снижения фармацевтической эффективности композиции в нормальных условиях для использования, и компоненты композиции и представляющее интерес соединение можно тщательно смешивать друг с другом. Фармацевтически приемлемый носитель должен иметь существенно высокую чистоту и существенно низкую токсичность, чтобы его можно было подходящим образом вводить субъекту, подлежащему лечению, предпочтительно животному, и более предпочтительно млекопитающему.
Что касается веществ, которые можно использовать в качестве фармацевтически приемлемого носителя, их примеры включают сахара, такие как лактоза, глюкоза, сахароза и т.п.; крахмал, такой как кукурузный крахмал, картофельный крахмал и т.п.; целлюлозу и производные целлюлозы, такие как натрийкарбоксиметилцеллюлоза, этилцеллюлоза, метилцеллюлоза и т.п.; порошок трагаканта; солод; желатин; тальк; твердое смазывающее вещество, такое как стеариновая кислота или стеарат магния и т.п.; сульфат кальция; растительные масла, такие как арахисовое масло, масло семян хлопчатника, кунжутное масло, оливковое масло, кукурузное масло, растительное масло, масло какао и т.п.; многоатомные спирты, такие как пропиленгликоль, глицерин, сорбит, маннит, полиэтиленгликоль и т.п.; альгиновую кислоту; эмульгатор, такой как TWEEN; увлажнитель, такой как лецитин и т.п.; краситель; отдушку; агент таблетирования; стабилизатор, антиоксидант; консервант; апирогенную воду; водный изотонический раствор и фосфатно-буферный раствор.
Когда фармацевтическую композицию по настоящему изобретению используют в качестве ингибитора ALK или терапевтического или профилактического средства от пролиферативного расстройства или используют против депрессии или нарушения познавательной функции, в качестве пути введения может рассматриваться пероральный, ректальный, парентеральный (внутривенный, внутримышечный, подкожный), интрацистернальный, интравагинальный, интраперитонеальный пути введения, введение в мочевой пузырь, местное введение (капли, порошок, мазь, гель или крем) или введение путем ингаляции (спрей для введения через рот или нос) и т.п. Что касается формы для введения, ее примеры включают таблетку, капсулу, гранулу, порошок, пилюлю, водный или неводный пероральный раствор и суспензию, и парентеральный раствор, которым заполняют контейнер, подходящий для деления на несколько малых доз. Кроме того, форму для введения можно модифицировать для различных путей введения, включая подкожный трансплантат, который обеспечивает контролируемое высвобождение лекарственного соединения.
Указанный выше препарат получают в соответствии со способом, хорошо известным из уровня техники, с использованием добавок, таких как наполнитель, смазывающее вещество (т.е. агент покрытия), связующее, разрыхлитель, стабилизатор, корригент для вкуса и запаха, разбавитель и т.п.
Что касается наполнителя, его примеры включают крахмал, такой как крахмал, картофельный крахмал, кукурузный крахмал, лактоза, кристаллическая целлюлоза и гидрофосфат кальция.
Что касается агента покрытия, его примеры включают этилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, шеллак, тальк, воск карнаубы и парафин.
Что касается связующего, его примеры включают поливинилпирролидон, Macrogol и соединения, описанные выше в качестве наполнителя.
Что касается разрыхлителя, его примеры включают соединения, описанные выше в качестве наполнителя, и химически модифицированный крахмал или целлюлозу, такие как натрий кроскармеллоза, натрийкарбоксиметилкрахмал и сшитый поливинилпирролидон.
Что касается стабилизатора, его примеры включают сложные эфиры параоксибензойной кислоты, такие как метилпарабен, пропилпарабен и т.п.; спирты, такие как хлорбутанол, бензиловый спирт, фенилэтиловый спирт и т.п.; бензалконийхлорид; фенолы, такие как фенол, крезол и т.п.; тимеросал; дегидроуксусную кислоту; и сорбиновую кислоту.
Что касается корригента для вкуса и запаха, его примеры включают подсластитель, агент, придающий кислый вкус, отдушку и т.п., которые обычно используют в данной области.
Кроме того, что касается растворителя для получения жидкого препарата, его примеры включают этанол, фенол, хлоркрезол, очищенную воду и дистиллированную воду.
Что касается поверхностно-активного вещества или эмульгатора, его примеры включают полисорбат 80, полиоксил 40 стеарат и лауромакроголь.
Когда фармацевтическую композицию по настоящему изобретению используют в качестве ингибитора ALK или терапевтического или профилактического средства от пролиферативного расстройства или используют против депрессии или нарушения познавательной функции, используемое количество соединений по настоящему изобретению или их солей или сольватов варьирует в зависимости от симптома, возраста, массы тела, относительного состояния здоровья субъекта, введения других лекарственных средств, способа введения и т.п. Например, количество, которое обычно является эффективным для пациента (т.е. теплокровного животного, в частности, человека), составляет, в расчете на эффективный компонент (т.е. соединение по настоящему изобретению, которое представлено формулой (I)), предпочтительно от 0,001 до 1000 мг на 1 кг массы тела в день, более предпочтительно от 0,01 до 300 мг на 1 кг массы тела в день в случае перорально вводимого средства, и суточная доза предпочтительно находится в пределах от 1 до 800 мг для взрослого пациента с нормальной массой тела. В случае парентерально вводимого средства, она предпочтительно составляет от 0,001 до 1000 мг на 1 кг массы тела в день, и более предпочтительно от 0,01 до 300 мг на 1 кг массы тела в день. Такую дозу предпочтительно вводить раз в день или разделенную на несколько доз, в зависимости от симптома субъекта, подлежащего лечению.
[Примеры]
Далее настоящее изобретение объясняется более подробно в свете следующих примеров. Однако настоящее изобретение не ограничивается этими примерами.
ЯМР-анализ
ЯМР-анализ осуществляли с использованием JNM-EX270 (270 МГц, изготовитель JEOL), JNM-GSX400 (400 МГц, изготовитель JEOL) или 400 MR (400 МГц, изготовитель Varian). ЯМР-данные выражали в м.д. (частей на миллион; δ), при этом их сравнивали с сигналом дейтерия, полученным от образца растворителя.
Масс-спектры
Измерение осуществляли с использованием JMS-DX303 или JMS-SX/SX102A (оба от компании-изготовителя JEOL).
Данные высокоэффективной жидкостной хроматографии-масс-спектроскопии (LC-MS, ЖХ/МС).
Измерение осуществляли с использованием Micromass (ZMD, изготовитель Micromass) с 996-600E устройством для градиентной высокоэффективной жидкостной хроматографии (изготовитель Waters) или Micromass (ZQ, изготовитель Micromass) с 2525 устройством для градиентной высокоэффективной жидкостной хроматографии (изготовитель Waters).
Одно из следующих условий, которые описаны в таблице 1 ниже, было взято в качестве условия для высокоэффективной жидкостной хроматографии.

Реакция в условиях микроволнового облучения
Реакцию осуществляли с использованием реакционного сосуда, закрываемого крышкой путем надавливания, вместе с ExplorerTM (изготовитель CEM Microwave Technology) или инициатором (изготовитель Biotage). Максимальное внешнее воздействие включает охлаждение реакционного сосуда воздухом во избежание повышения температуры, вызываемого микроволновым облучением.
Коммерчески доступные реагенты получали и использовали без какой-либо дополнительной очистки. Комнатная температура означает температуру в пределах около 20-25°C. Все неводные реакции осуществляли в безводном растворителе в атмосфере азота или аргона. Для концентрирования при пониженном давлении или удаления растворителя путем дистилляции использовали роторный испаритель.
Для получения соединений, когда существует возможность нежелательной побочной реакции, осуществляли защиту функциональной группы с использованием защитной группы с получением целевой молекулы, и защитную группу удаляли на более поздней стадии, если это желательно. Выбор, присоединение и удаление защитной группы осуществляли в соответствии со способом, описанным в литературе, например, [Greene and Wuts, “Protective Groups in Organic Synthesis” (4th edition, John Wiley & Sons 2007)].
[Пример 1]
Соединение A2
7-Метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-он

7-Метокси-3,4-дигидро-1H-нафталин-2-он (Соединение A1, 209 г, 1,18 моль), гидросульфат тетрабутиламмония (40 г, 0,118 моль) и метилйодид (162 г, 2,60 моль) суспендировали в ТГФ (500 мл) при комнатной температуре. При перемешивании к смеси добавляли 50% водный раствор гидроксида калия (400 г) в течение 5 минут. Смесь достигала температуры кипения с обратным холодильником в результате быстрого повышения внутренней температуры. Сразу после прекращения повышения внутренней температуры перемешивание продолжали в течение 45 минут. Реакционный раствор разбавляли дистиллированной водой (1 л) и экстрагировали два раза при помощи CPME (1,5 л). Объединенный органический слой промывали (дистиллированная вода 1 л×3), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный неочищенный продукт перекристаллизовывали из MeOH (1 л) и дистиллированной воды (500 мл) с получением указанного в заголовке соединения в виде бесцветных игольчатых кристаллов (177 г, 73%).
1H-ЯМР(400 МГц, CDCl3) δ: 1,43 (6 H, с), 2,65 (2 H, т, 12 Гц), 3,02 (2 H, т, 12 Гц), 3,79 (3 H, с), 6,74 (1 H, м), 6,87 (1 H, м), 7,24 (1 H, м).
ЖХ/МС: м/z 205 [М+H]
[Пример 2]
Соединение A3-1, Соединение A3-2
3-Бром-8-метокси-6,6-диметил-6,11-дигидро-5H-бензо[b]карбазол
1-Бром-8-метокси-6,6-диметил-6,11-дигидро-5H-бензо[b]карбазол

7-Метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-он (Соединение A2, 66,2 г, 324 ммоль) и 3-бромфенилгидразин в форме соли хлористоводородной кислоты (71,0 г, 318 ммоль) растворяли в AcOH (350 мл) и подвергали кипячению с обратным холодильником при перемешивании в течение 6 часов. Используемый в реакции растворитель удаляли путем перегонки при пониженном давлении с получением неочищенного продукта в виде смеси указанных в заголовке соединений A3-1 и A3-2.
[Пример 3]
Соединение A4
3-Бром-8-метокси-6,6-диметил-5,6-дигидробензо[b]карбазол-11-он

Неочищенный продукт, полученный, как описано выше, (т.е. смесь A3-1 и A3-2) растворяли в смеси растворителей ТГФ (450 мл) и дистиллированной воды (50 мл), добавляли один раз DDQ (115 г, 509 ммоль) и затем перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь разбавляли при помощи CPME 3 л и органический слой промывали три раза 0,5 н водным раствором гидроксида натрия (1 л) и два раза дистиллированной водой (1 л), в указанном порядке, и сушили над безводным сульфатом натрия. Органический слой концентрировали до 500 мл при пониженном давлении. Осажденный продукт собирали фильтрованием и промывали небольшим количеством CPME с получением указанного в заголовке соединения в виде желтого кристаллического вещества (48 г, 40%).
1H-ЯМР(400 МГц, DМSO-d6) δ: 1,73 (6 H, с), 3,90 (3 H, с), 7,06-7,09 (1 H, м), 7,32-7,38 (2 H, м), 7,65-7,66 (1 H, м), 8,09-8,17 (2 H, м), 12,32 (1 H, ушир. с).
ЖХ/МС: м/z 370, 372 [М+H]+
[Пример 4]
Соединение AA1
Метиловый эфир 4-метокси-2-(3-триметилсиланилпроп-2-инил)бензойной кислоты
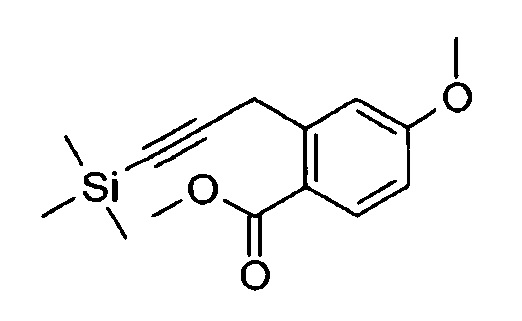
К ТГФ (16 мл) раствору метилового эфира 2-бромметил-4-метокси-бензойной кислоты (961 мг, 4,09 ммоль) добавляли трифенилфосфин (107 мг, 0,1 экв.), карбонат цезия (1,87 г, 1,4 экв.), йодид меди (59 мг, 0,076 экв.) и трис(дибензилиденацетон)дипалладий (86 мг, 0,023 экв.), дегазировали, продували газообразным азотом, добавляли триметилсилилацетилен (734 мкл, 1,3 экв.) и затем перемешивали в течение ночи при 55°C. К реакционному раствору добавляли насыщенный водный раствор хлорида аммония с последующим экстрагированием этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом магния. Осушитель удаляли фильтрованием и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (коричневое маслянистое вещество, 606 мг, 54%).
1H-ЯМР(400 МГц, CDCl3) δ: 7,93 (1 H, д, J=8,8 Гц), 7,33 (1 H, д, J=2,6 Гц), 6,78 (1 H, дд, J=8,8, 2,6 Гц), 4,09 (2 H, с), 3,86 (3 H, с), 3,84 (3 H, с), 0,14 (9 H, с).
ЖХ/МС: м/z 277 [М+H]+
ВЭЖХ время удерживания: 3,30 мин (условия анализа U)
[Пример 5]
Соединение AA2
Метиловый эфир 2-(1,1-диметил-3-триметилсиланилпроп-2-инил)-4-метокси-бензойной кислоты

К толуольному (4 мл) раствору метилового эфира 4-метокси-2-(3-триметилсиланил-проп-2-инил)-бензойной кислоты (Соединение AA1, 273 мг, 0,988 ммоль) добавляли бис(триметилсилил)амид натрия (2,1 мл, 1,9 М раствор, 4 экв.) и йодметан (308 мкл, 5 экв.) при -78°C. Температуре реакции давали повыситься до комнатной температуры, затем смесь перемешивали в течение 2 часов. К реакционному раствору добавляли насыщенный водный раствор хлорида аммония с последующим экстрагированием этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом магния. Осушитель удаляли фильтрованием и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (желтое маслянистое вещество, 226 мг, 75%).
1H-ЯМР(400 МГц, CDCl3) δ: 7,45 (1,0 H, д, J=8,4 Гц), 7,09 (1,1 H, д, J=2,6 Гц), 6,75 (1 H, м), 3,84 (3 H, с), 3,82 (3 H, с), 1,70 (6 H, с), 0,14 (9 H, с).
ЖХ/МС: м/z 305 [М+H]+
ВЭЖХ время удерживания: 3,38 мин (условия анализа U)
[Пример 6]
Соединение AA3
Метиловый эфир2-(1,1-диметилпроп-2-инил)-4-метокси-бензойной кислоты

К ТГФ (18 мл) раствору метилового эфира 2-(1,1-диметил-3-триметилсиланилпроп-2-инил)-4-метокси-бензойной кислоты (Соединение AA2, 912 мг, 3 ммоль) добавляли тетрабутиламмонийфторид (2,061 г, 2,6 экв.) и затем перемешивали в течение 3 часов при комнатной температуре. К реакционному раствору добавляли насыщенный водный раствор хлорида аммония с последующим экстрагированием этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом магния. Осушитель удаляли фильтрованием и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (желтое маслянистое вещество, 524 мг, 75%).
1H-ЯМР(400 МГц, CDCl3) δ: 7,44 (1 H, д, J=8,4 Гц), 7,05 (1 H, д, J=2,3 Гц), 6,76 (1 H, дд, J=8,4, 2,3 Гц, 3,84 (3 H, с), 3,82 (3 H, с), 1,73 (6 H, с)
ЖХ/МС: м/z 223 [М+H]+
ВЭЖХ время удерживания: 2,55 мин (условия анализа U)
[Пример 7]
Соединение AA4
Метиловый эфир 2-[1-(6-циано-1-метансульфонил-1H-индол-2-ил)-1-метилэтил]-4-метокси-бензойной кислоты

К DMF (2 мл) раствору метилового эфира 2-(1,1-диметилпроп-2-инил)-4-метокси-бензойной кислоты (Соединение AA3, 134 мг, 0,577 ммоль) и N-(2-бром-5-цианофенил)метансульфонамида (Соединение AA5, 167 мг, 1,05 экв.) добавляли йодид меди (9 мг, 0,08 экв.) и TEA (129 мкл, 1,6 экв.), дегазировали и продували газообразным азотом, добавляли дихлорбис(трифенилфосфин)палладий (20 мг, 0,05 экв.) и затем дегазировали и снова продували газообразным азотом. После перемешивания в течение 2 часов при 90°C, к реакционному раствору добавляли воду, экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом магния. Осушитель удаляли фильтрованием и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (белое твердое вещество, 152 мг, 62%).
1H-ЯМР(400 МГц, DМSO-d6) δ: 8,19 (1 H, дд, J=0,6, 0,6 Гц 7,84 (1 H, дд, J=8,0, 0,6 Гц), 7,67 (1 H, дд, J=8,0, 1,3 Гц), 7,13 (1 H, д, J=8,4 Гц), 6,99 (1 H, с), 6,96 (1 H, ушир. с), 6,85 (1 H, дд, J=8,4, 2,5 Гц), 3,78 (3 H, с), 3,12 (3 H, с), 3,09 (3 H, ушир. с), 1,89 (6 H, с).
ЖХ/МС: м/z 427 [М+H]+
ВЭЖХ время удерживания: 2,77 мин (условия анализа U)
[Пример 8]
Соединение AA5
N-(2-Бром-5-цианофенил)метансульфонамид

К смеси 3-амино-4-бром-бензонитрила (1,98 г, 10 ммоль), TEA (5,06 г, 50 ммоль) и метиленхлорида (50 мл) добавляли мезилхлорид (2,71 мл, 35 ммоль) при 0°C и смесь перемешивали при комнатной температуре в течение 30 минут. К реакционному раствору добавляли воду, затем экстрагировали дихлорметаном. Органический слой сушили над сульфатом натрия. Осушитель удаляли фильтрованием и к остаткам, полученным после концентрирования при пониженном давлении, добавляли тетрагидрофуран (100 мл), воду (400 мкл) и гидрид натрия (540 мг, 15,5 ммоль) и перемешивали при комнатной температуре в течение 16 часов. К реакционному раствору добавляли насыщенный водный раствор хлорида аммония (200 мл) с последующим экстрагированием этилацетатом. Органический слой сушили над сульфатом натрия. Осушитель удаляли фильтрованием и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением указанного в заголовке соединения (2,48 г, 90%).
1H-ЯМР(400 МГц, DМSO-d6) δ: 9,82 (1 H, с), 7,87 (1 H, д, J=4 Гц), 7,75 (1 H, д, J=8 Гц), 7,70 (1 H, дд, J=8 Гц, 4 Гц), 3,14 (3 H, с).
ВЭЖХ время удерживания: 1,63 мин (условия анализа U)
[Пример 9]
Соединение AA6
2-(1-Гидрокси-1-метилэтил)-1H-индол-6-карбонитрил
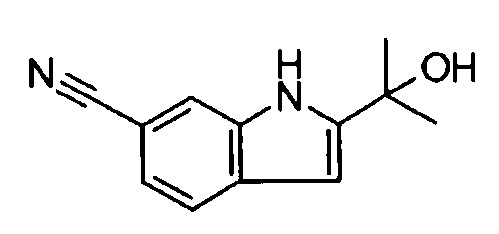
К N-(2-бром-5-цианофенил)метансульфонамиду (Соединение AA5, 230 мг, 1 ммоль), 3-метил-2-бутин-3-олу (0,15 мл, 1,5 ммоль), X-Phos (72 мг, 15% моль), PdCl2(CH3CN)2(13 мг, 5% моль) и карбонату цезия (390 мг, 2 ммоль) добавляли DMA (2 мл) и смесь перемешивали при 100°C в течение 3 часов. К реакционному раствору добавляли воду и 5 н раствор хлористоводородной кислоты и затем экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия. Осушитель удаляли фильтрованием и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением указанного в заголовке соединения (130 мг, 75%).
1H-ЯМР(400 МГц, CDCl3) δ: 8,76 (1 H, с), 7,68 (1 H, с), 7,60 (1 H, д, J=8 Гц), 7,32 (1 H, дд, J=8 Гц, 4 Гц), 6,37 (1 H, м), 1,93 (1 H, с), 1,70 (6 H, с).
ЖХ/МС: м/z 201 [М+H]+
ВЭЖХ время удерживания: 2,12 мин (условия анализа U)
[Пример 10]
Соединение A5-1
3-Бром-8-гидрокси-6,6-диметил-5,6-дигидробензо[b]карбазол-11-он

С использованием тех же условий, как в способе синтеза Соединения A6, синтезировали указанное в заголовке соединение, исходя из Соединения A4.
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,30 (1 H, с), 10,21 (1 H, с), 8,06-8,11 (1 H, м), 8,01-8,05 (1 H, м), 7,62-7,66 (1 H, м), 7,32-7,37 (1 H, м), 7,08-7,12 (1 H, м), 6,84-6,90 (1 H, м), 1,69 (6 H, с).
ЖХ/МС: м/z 356, 358 [М+H]+
ВЭЖХ время удерживания: 2,30 мин (условия анализа U)
[Пример 11]
Соединение A5-2
8-Метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

(Способ 1) 3-Бром-8-метокси-6,6-диметил-5,6-дигидробензо[b]карбазол-11-он (Соединение A4, 10,45 г, 28,2 ммоль) и цианид меди(I) (5,0 г, 50,2 ммоль) растворяли в NMP (100 мл) с последующим перемешиванием при 170°C в течение 17 часов. Реакционную смесь суспендировали в этилацетате (500 мл) и дистиллированной воде (200 мл). Нерастворимые вещества удаляли путем фильтрования через Целит и промывали два раза этилацетатом (300 мл×2). Органический слой промывали один раз водным раствором динатрий EDTA (200 мл) и два раза насыщенным солевым раствором (200 мл), в указанном порядке, и сушили над безводным сульфатом натрия. Органический слой концентрировали при пониженном давлении с получением продукта, который суспендировали и промывали небольшим количеством CPME с получением указанного в заголовке соединения в виде бесцветного кристаллического вещества (6,58 г, 73%).
(Способ 2) К ТГФ (5,6 мл) раствору метилового эфира 2-[1-(6-циано-1-метансульфонил-1H-индол-2-ил)-1-метилэтил]-4-метокси-бензойной кислоты (Соединение AA4, 138 мг, 0,324 ммоль) добавляли тетрабутиламмонийфторид (514 мг, 6 экв.) и смесь перемешивали при комнатной температуре в течение ночи. Затем к смеси добавляли 2 M водный раствор гидроксида натрия (5,6 мл), затем смесь перемешивали в течение 4 часов, добавляли 1 M HCl и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом магния. Осушитель удаляли фильтрованием и остатки, полученные после концентрирования при пониженном давлении, растворяли в этилацетате (10 мл) и добавляли раствор 4 M HCl и этилацетата (10 мл) с последующим перемешиванием при комнатной температуре в течение 30 минут. Остатки, полученные после концентрирования реакционного раствора при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (89,2 мг, 62%).
(Способ 3) К нитробензолу (5 мл) и хлориду алюминия (400 мг, 3 ммоль) добавляли 4-метоксибензоилхлорид (400 мг, 2,3 ммоль). После перемешивания в течение 30 минут при комнатной температуре добавляли 2-(1-гидрокси-1-метил-этил)-1H-индол-6-карбонитрил (Соединение AA6, 200 мг, 1 ммоль) с последующим перемешиванием при комнатной температуре в течение 3 часов. К реакционному раствору добавляли воду, затем смесь экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия. Осушитель удаляли фильтрованием и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением указанного в заголовке соединения (127 мг, 40%).
1H-ЯМР(400 МГц, DМSO-d6) δ: 1,71 (6 H, с), 3,89 (3 H, с), 7,07-7,09 (1 H, м), 7,34 (1 H, с), 7,58-7,60 (1 H, м), 7,99 (1 H, с), 8,14-8,16 (1 H, м), 8,30-8,32 (1 H, м), 12,32 (1 H, ушир. с).
ЖХ/МС: м/z 317 [М+H]+
ВЭЖХ время удерживания: 2,56 мин (условия анализа U)
[Пример 12]
Соединение A6
8-Гидрокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
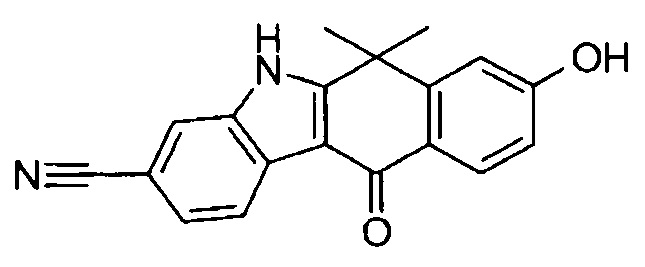
8-Метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил (Соединение A5-2, 6,58 г, 20,8 ммоль) растворяли в пиридине - соли хлористоводородной кислоты (25,0 г) и перемешивали при 170°C в течение 13 часов. Реакционную смесь распределяли между этилацетатом (400 мл) и дистиллированной водой (400 мл) и водный слой экстрагировали снова этилацетатом (400 мл). Объединенный органический слой промывали два раза дистиллированной водой (100 мл) и один раз насыщенным солевым раствором (100 мл), в указанном порядке, и сушили над безводным сульфатом натрия. Органический слой концентрировали при пониженном давлении с получением продукта, который суспендировали и промывали небольшим количеством CPME с получением указанного в заголовке соединения в виде бесцветного кристаллического вещества (5,91 г, 93%).
1H-ЯМР(400 МГц, DМSO-d6) δ: 1,73 (6 H, с), 6,87-6,90 (1 H, м), 7,11 (1 H, с), 7,57-7,59 (1 H, м), 7,97 (1 H, с), 8,04-8,06 (1H, м), 8,29-8,31 (1 H, м), 10,27 (1 H, с), 12,66 (1 H, ушир. с).
ЖХ/МС: м/z 303 [М+H]+
[Пример 13]
Соединение A7-1
трет-Бутиловый эфир 4-(3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)пиперидин-1-карбоновой кислоты

8-Гидрокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил (Соединение A6, 30 мг, 0,099 ммоль) растворяли в ТГФ (1 мл), добавляли трет-бутиловый эфир 4-гидрокси-пиперидин-1-карбоновой кислоты (40 мг, 2 экв.), трифенилфосфин (52 мг, 2 экв.) и диизопропилазодикарбоксилат (43 мкл, 2 экв.), в указанном порядке, и перемешивали при комнатной температуре в течение 4 часов. Реакционный раствор выливали в воду и затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Осушитель удаляли фильтрованием и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (37 мг, 76%).
1H-ЯМР(400 МГц, CDCl3) δ: 9,44 (1 H, с), 8,77 (1 H, д, J=7,8 Гц), 8,62 (1 H, д, J=8,2 Гц), 8,00 (1 H, с), 7,81 (1 H, д, J=8,2 Гц), 7,34 (1 H, с), 7,26 (1 H, д, J=7,8 Гц), 4,85-4,93 (1 H, м), 3,96-4,04 (2 H, м), 3,60-3,70 (2 H, м), 2,19-2,32 (2 H, м), 1,89-2,15 (8 H, м), 1,74 (9 H, с).
ЖХ/МС: м/z 430 [М+H]+
ВЭЖХ время удерживания: 4,09 мин (условия анализа W)
[Пример 14]
Соединение A7-2
6,6-Диметил-11-оксо-8-[2-(2-оксо-имидазолидин-1-ил)этокси]-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения A6 и 1-(2-гидрокси-этил)имидазолидин-2-она.
ЖХ/МС: m/z 415 [M+H]+
ВЭЖХ время удерживания: 2,96 мин (условия анализа W)
[Пример 15]
Соединение A7-3
трет-Бутиловый эфир [2-(3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)этил]карбаминовой кислоты

С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения A6 и трет-бутилового эфира (2-гидрокси-этил)карбаминовой кислоты.
ЖХ/МС: m/z 346 [M+H]+
ВЭЖХ время удерживания: 2,40 мин (условия анализа W)
[Пример 16]
Соединение A7-4
6,6-Диметил-8-(2-метилсульфанил-этокси)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
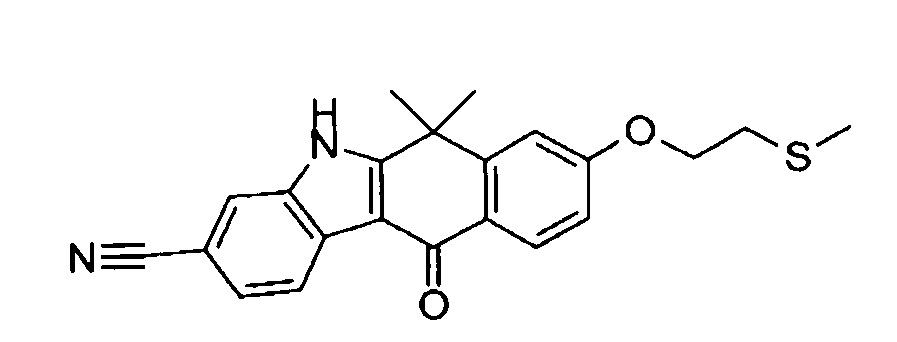
С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения A6 и 2-метилтиоэтанола.
ЖХ/МС: m/z 451 [M+H]+
ВЭЖХ время удерживания: 4,23 мин (условия анализа W)
[Пример 17]
Соединение A7-5
6,6-Диметил-8-(2-метилсульфанил-этокси)-5-(2-метилсульфанил-этил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

Указанное в заголовке соединение получали в виде побочного продукта синтеза Соединения A7-4.
ЖХ/МС: m/z 377 [M+H]+
ВЭЖХ время удерживания: 3,75 мин (условия анализа W)
[Пример 18]
Соединение A7-6
6,6-Диметил-11-оксо-8-(тетрагидро-пиран-4-илокси)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения A6 и тетрагидропиран-4-ола.
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,72 (1 H, ушир.с), 8,32 (1 H, д, 8,5 Гц), 8,15 (1 H, д, 8,5 Гц), 8,01 (1 H, с), 7,61 (1 H, д, 8, 5 Гц), 7,38 (1 H, с), 7,15 (1 H, д, 8,5 Гц), 4,86-4,81 (1 H, м), 3,93-3,88 (2 H, м), 3,58-3,52 (2 H, м), 2,06-2,00 (2 H, м), 1,85 (6 H, с), 1,69-1,60 (2 H, м).
ЖХ/МС: м/z 387 [М+H]+
ВЭЖХ время удерживания: 3,47 мин (условия анализа W)
[Пример 19]
Соединение A7-7
6,6-Диметил-11-оксо-8-(пиридин-4-илметокси)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения A6 и пиридин-4-ил-метанола.
ЖХ/МС: m/z 394 [M+H]+
ВЭЖХ время удерживания: 2,56 мин (условия анализа W)
[Пример 20]
Соединение A7-8
8-(2-Метоксиэтокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения A6 и 2-метоксиэтанола.
1H-ЯМР(400 МГц, DМSO-d6) δ: 11,69 (1 H, ушир. с), 8,27 (1 H, д, 7,9 Гц), 8,10 (1 H, д, 8,5 Гц), 7,95 (1 H, с), 7,55 (1 H, д, 7,9 Гц), 7,32 (1 H, д, 2,4 Гц), 7,05 (1 H, д, 8,5 Гц), 4,22 (2 H, т, 4,3 Гц), 3,67 (2 H, т, 4,3 Гц), 1,72 (6 H, с).
ЖХ/МС: м/z 361 [М+H]+
ВЭЖХ время удерживания: 3,38 мин (условия анализа W)
[Пример 21]
Соединение A7-9
8-[2-(2-Метоксиэтокси)этокси]-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения A6 и 2-(2-метоксиэтокси)этанола.
ЖХ/МС: m/z 405 [M+H]+
ВЭЖХ время удерживания: 3,32 мин (условия анализа W)
[Пример 22]
Соединение A7-10
6,6-Диметил-8-(3-метилоксетан-3-илметокси)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
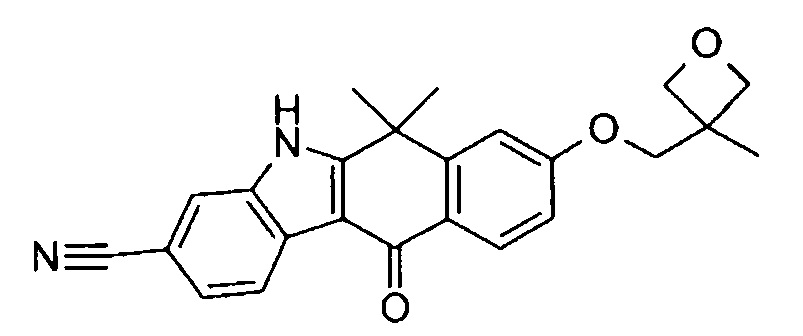
С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения A6 и 3-хлорметил-3-метилоксетана.
ЖХ/МС: m/z 387 [M+H]+
ВЭЖХ время удерживания: 2,23 мин (условия анализа S)
[Пример 23]
Соединение A7-11-1
трет-Бутиловый эфир [2-(3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)этил]этил-карбаминовой кислоты
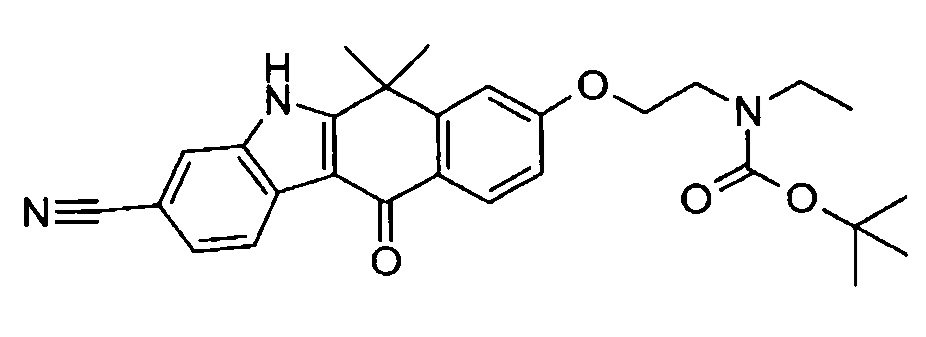
С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения A6 и трет-бутилового эфира этил-(2-гидрокси-этил)карбаминовой кислоты.
ЖХ/МС: m/z 474 [M+H]+
ВЭЖХ время удерживания: 2,93 мин (условия анализа U)
[Пример 24]
Соединение A7-11-2
8-(2-Этиламиноэтокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения A7-11-1.
ЖХ/МС: m/z 374 [M+H]+
ВЭЖХ время удерживания: 1,35 мин (условия анализа U)
[Пример 25]
Соединение A7-12
8-(2-Гидроксиэтокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения A6 и 2-бромэтанола.
ЖХ/МС: m/z 437 [M+H]+
ВЭЖХ время удерживания: 2,93 мин (условия анализа U)
[Пример 26]
Соединение A7-13-1
6,6-Диметил-11-оксо-8-(2-фенил-[1,3]диоксан-5-илокси)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения A6 и 2-фенил-[1,3]диоксан-5-ола.
ЖХ/МС: m/z 465 [M+H]+
ВЭЖХ время удерживания: 4,10 мин (условия анализа W)
[Пример 27]
Соединение A7-13-2
8-(2-Гидрокси-1-гидроксиметилэтокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

Безводный трихлорид железа (56 мг, 5 экв.) добавляли к суспензии 6,6-диметил-11-оксо-8-(2-фенил-[1,3]диоксан-5-илокси)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрила (Соединение A7-13-1, 13 мг, 0,028 ммоль) в дихлорметане (2 мл) и перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор добавляли в воду и затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Осушитель удаляли фильтрованием и остатки, полученные после концентрирования при пониженном давлении, очищали при помощи высокоэффективной жидкостной хроматографии с получением указанного в заголовке соединения (7 мг, 46%).
ЖХ/МС: m/z 377 [M+H]+
ВЭЖХ время удерживания: 2,70 мин (условия анализа W)
[Пример 28]
Соединение A7-14-1
8-((S)-2,2-Диметил-[1,3]диоксолан-4-илметокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения A6 и (R)-2,2-диметил-[1,3]диоксолaн-4-илметилового эфира толуол-4-сульфоновой кислоты.
ЖХ/МС: m/z 417 [M+H]+
ВЭЖХ время удерживания: 3,47 мин (условия анализа Y)
[Пример 29]
Соединение A7-14-2
8-((R)-2,3-Дигидрокси-пропокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

К раствору 8-(2,2-диметил-[1,3]диоксолaн-4-илметокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрила (Соединение A14-1, 30 мг, 0,07 ммоль) в ТГФ и воде (4:1, 1 мл) добавляли камфорсульфоновую кислоту (36 мг, 0,14 ммоль) при комнатной температуре. После перемешивания при комнатной температуре в течение 38 часов смесь экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия. Осушитель удаляли фильтрованием и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (дихлорметан/метанол) с получением указанного в заголовке соединения (белое твердое вещество, 28 мг, 72%).
1H-ЯМР(300 МГц, DМSO-d6) δ: 12,7 (с, 1 H), 8,31 (д, 1 H, J=8,01 Гц), 8,15 (д, 1H, J=8,77 Гц), 8,00 (с, 1 H), 7,60 (д, 1 H, J=8,01 Гц), 7,12 (с, 1 H), 7,09 (д, 1 H, J=8,77 Гц), 4,46 (м, 1 H), 4,15 (м, 3 H), 3,78 (м, 1 H), 1,76 (с, 6 H), 1,38 (с, 3 H), 1,32 (с, 3 H).
ЖХ/МС: м/z 377 [М+H]+
ВЭЖХ время удерживания: 1,80 мин (условия анализа U)
[Пример 30]
Соединение A7-14-3
8-((S)-2,2-Диметил-[1,3]диоксолaн-4-илметокси)-5,6,6-триметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-4, получали указанное в заголовке соединение в виде неочищенного продукта, исходя из Соединения A7-14-1.
[Пример 31]
Соединение A7-14-4
8-((R)-2,3-Дигидрокси-пропокси)-5,6,6-триметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-14-2, получали указанное в заголовке соединение, исходя из Соединения A7-14-3 (303 мг, 98%).
ЖХ/МС: m/z 484 [M+H]+
ВЭЖХ время удерживания: 2,08 мин (условия анализа D)
[Пример 32]
Соединение A7-15-1
8-[(4R,5S)-5-(Трет-бутил-диметил-силанилоксиметил)-2,2-диметил-[1,3]диоксолaн-4-илметокси]-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения A6 и [(4R,5R)-5-(трет-бутил-диметилсиланилоксиметил)-2,2-диметил-[1,3]диоксолан-4-ил]метанола.
ЖХ/МС: m/z 516 [M+H]+
ВЭЖХ время удерживания: 3,97 мин (условия анализа Y)
[Пример 33]
Соединение A7-15-2
6,6-Диметил-11-оксо-8-((2R,3R)-2,3,4-тригидрокси-бутокси)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-14-2, получали указанное в заголовке соединение, исходя из Соединения A7-15-1.
ЖХ/МС: m/z 407 [M+H]+
ВЭЖХ время удерживания: 1,73 мин (условия анализа U)
[Пример 34]
Соединение A7-16
6,6-Диметил-8-(1-метил-пиперидин-4-илокси)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения A6 и 1-метилпиперидин-4-ола.
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,75 (1 H, с), 8,32 (1 H, д, J=7,9 Гц), 8,14 (1 H, д, J=9, 8 Гц), 8,00 (1 H, с), 7,60 (1 H, д, J=7,9 Гц), 7,34 (1 H, с), 7,11 (1 H, д, J=9,1 Гц), 4,62 (1 H, м), 2,64 (2 H, м), 2,23 (2 H, м), 2,21 (с, 3 H), 1,99 (2 H, м), 1,77 (с, 6 H), 1,73 (2 H, м).
ЖХ/МС: м/z 400 [М+H]+
ВЭЖХ время удерживания: 1,42 мин (условия анализа S)
[Пример 35]
Соединение A7-17
8-(2-Диэтиламино-этокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

8-Гидрокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил (Соединение A6, 25 мг, 0,083 ммоль) растворяли в N,N-диметилацетамиде (1 мл), добавляли 2-хлорэтилдиэтиламин (16 мг, 1,1 экв.) и карбонат цезия (54 мг, 2 экв.), в указанном порядке, и перемешивали при 100°C в течение 4 часов. Реакционный раствор выливали в воду и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Осушитель удаляли фильтрованием и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на аминосиликагеле (этилацетат/гексан) с получением указанного в заголовке соединения (11 мг, 32%).
1H-ЯМР(400 МГц, DМSO-d6) δ: 8,32 (1 H, д, J=8,2 Гц), 8,15 (1 H, д, J=8,7 Гц), 8,01 (1 H, с), 7,61 (1 H, д, J=8,2 Гц), 7,35 (1 H, д, J=1,8 Гц), 7,09 (1 H, дд, J=8,7, 1,8 Гц), 4,19 (2 H, т, J=5,9 Гц), 2,83 (2 H, т, J=5,9 Гц), 2,58 (4 H, кв., J=7,0 Гц), 1,78 (6 H, с), 1,00 (6 H, т, J=7,0 Гц).
ЖХ/МС: м/z 402 [М+H]+
ВЭЖХ время удерживания: 2,52 мин (условия анализа W)
[Пример 36]
Соединение A7-18
N-[2-(3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)этил]ацетамид
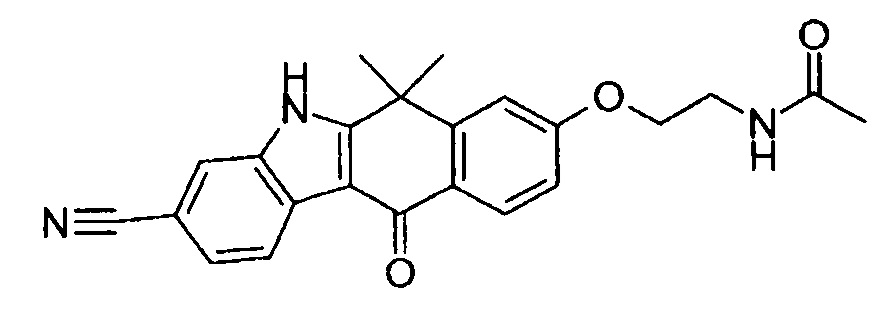
С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения A6 и 2-хлорэтилацетамида.
ЖХ/МС: m/z 388 [M+H]+
ВЭЖХ время удерживания: 2,91 мин (условия анализа W)
[Пример 37]
Соединение A7-19
Этиловый эфир [2-(3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)этил]карбаминовой кислоты

С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения A6 и этил-2-хлорэтилкарбамата.
ЖХ/МС: m/z 418 [M+H]+
ВЭЖХ время удерживания: 3,35 мин (условия анализа W)
[Пример 38]
Соединение A7-20
[2-(3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)этил]мочевина

С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения A6 и 2-хлорэтилмочевины.
ЖХ/МС: m/z 399 [M+H]+
ВЭЖХ время удерживания: 2,80 мин (условия анализа W)
[Пример 39]
Соединение A7-21
6,6-Диметил-8-(оксетан-3-илокси)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения A6 и оксетан-3-илового эфира толуол-4-сульфоновой кислоты.
ЖХ/МС: m/z 359 [M+H]+
ВЭЖХ время удерживания: 2,00 мин (условия анализа S)
[Пример 40]
Соединение A7-22
6,6-Диметил-11-оксо-8-(пиримидин-2-илокси)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения A6 и 2-бромпиримидина.
ЖХ/МС: m/z 381 [M+H]+
ВЭЖХ время удерживания: 2,00 мин (условия анализа S)
[Пример 41]
Соединение A7-23
(3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)этилацетатный сложный эфир

С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения A6 и этилового эфира 3-хлор-пропионовой кислоты.
ЖХ/МС: m/z 389 [M+H]+
ВЭЖХ время удерживания: 3,37 мин (условия анализа U)
[Пример 42]
Соединение A7-24
8-(2-Бром-этокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
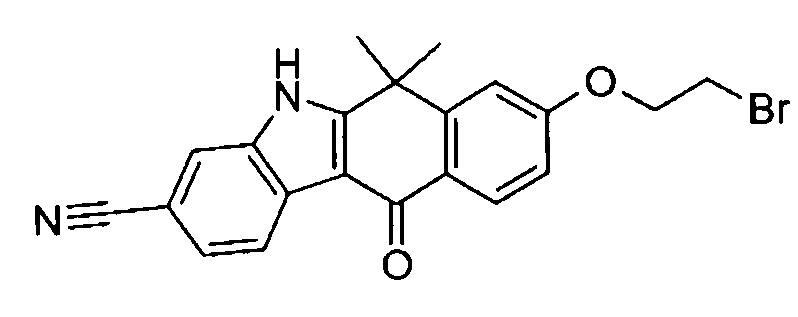
С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения A6 и 2-бромэтанола.
1H-ЯМР (270 МГц, DМSO-d6) δ: 12,75 (1 H, ушир. с), 8,32 (1 H, д, J=8,2 Гц), 8,17 (1 H, д, J=8,6 Гц), 8,01 (1 H, с), 7,61 (1 H, дд, J=8,2, 1,4 Гц), 7,40 (1 H, д, J=2,2 Гц), 7,12 (1 H, дд, J=8,6, 2,2 Гц), 4,50 (2 H, т, J=5,3 Гц), 3,88 (2 H, т, J=5,3 Гц), 1,77 (6 H, с).
ЖХ/МС: м/z 409, 411 [М+H]+
ВЭЖХ время удерживания: 2,48 мин (условия анализа S)
[Пример 43]
Соединение A7-25
6,6-Диметил-11-оксо-8-(пиперидин-4-илметокси)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил, соль хлористоводородной кислоты

В атмосфере азота к 3-циано-8-гидрокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-ону (Соединение A6, 85 мг, 0,28 ммоль) и трифенилфосфину (150 мг, 2 экв.) добавляли ТГФ (2 мл) и затем добавляли по каплям трет-бутиловый эфир 4-гидроксиметил-пиперидин-1-карбоновой кислоты (120 мг, 2 экв.) и 2,19 н раствор диэтилазодикарбоновой кислоты (0,26 мл, 2 экв.) в толуоле. Полученную смесь перемешивали при комнатной температуре в течение 12 часов в атмосфере азота. Остатки, полученные после концентрирования реакционного раствора при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/дихлорметан) с получением трет-бутилового эфира 4-(3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илоксиметил)пиперидин-1-карбоновой кислоты (белый порошок, 120 мг).
К полученному соединению добавляли раствор 4 н хлористоводородной кислоты и диоксана при охлаждении. После перемешивания при комнатной температуре в течение 2 часов растворитель удаляли под потоком азота. Затем остатки промывали диэтиловым эфиром и затем подвергали азеотропной перегонке с толуолом, с последующей сушкой в условиях вакуума и фильтрованием с получением указанного в заголовке соединения (79 мг).
ЖХ/МС: m/z 399 [M+H]+
ВЭЖХ время удерживания: 2,22 мин (условия анализа C)
[Пример 44]
Соединение A8-1
6,6-Диметил-11-оксо-8-(пиперидин-4-илокси)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

ТГФ (0,5 мл) и TFA (0,5 мл) добавляли к трет-бутиловому эфиру 4-(3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)пиперидин-1-карбоновой кислоты (Соединение A7-1, 35 мг, 0,072 ммоль) и смесь перемешивали при комнатной температуре вплоть до исчезновения Соединения A7-1. Реакционный раствор концентрировали при пониженном давлении и остаток подвергали обессоливанию с использованием анионообменника PL StratoSpheres (trademark) PL-HCO3 MP с получением указанного в заголовке соединения (37 мг, 76%).
1H-ЯМР (400 МГц, CD3OD) δ: 8,38 (1 H, д, J=7,9 Гц), 8,24 (1 H, д, J=8,5 Гц), 7,85 (1 H, с), 7,53 (1 H, д, J=7,9 Гц), 7,27 (1 H, с), 7,09 (1 H, д, J=8,5 Гц), 4,67-4,76 (1 H, м), 3,07-3,20 (2 H, м), 2,77-2,87 (2 H, м), 2,03-2,15 (2 H, м), 1,80 (6 H, с), 1,69-1,77 (2 H, м).
ЖХ/МС: м/z 386 [М+H]+
ВЭЖХ время удерживания: 2,51 мин (условия анализа W)
[Пример 45]
Соединение A8-2
8-(2-Амино-этокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения A7-3.
ЖХ/МС: m/z 346 [M+H]+
ВЭЖХ время удерживания: 2,40 мин (условия анализа W)
[Пример 46]
Соединение A8-3
8-(2-Метансульфонил-этокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-8, получали указанное в заголовке соединение, исходя из Соединения A7-5.
ЖХ/МС: m/z 409 [M+H]+
ВЭЖХ время удерживания: 3,13 мин (условия анализа W)
[Пример 47]
Соединение A8-4
8-(2-Метансульфинил-этокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

Указанное в заголовке соединение получали в виде побочного продукта синтеза Соединения A8-3.
ЖХ/МС: m/z 393 [M+H]+
ВЭЖХ время удерживания: 2,87 мин (условия анализа W)
[Пример 48]
Соединение A8-5
5,6,6-Триметил-11-оксо-8-(тетрагидро-пиран-4-илокси)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A10-1, получали указанное в заголовке соединение, исходя из Соединения A7-6.
ЖХ/МС: m/z 401 [M+H]+
ВЭЖХ время удерживания: 2,72 мин (условия анализа S)
[Пример 49]
Соединение A8-6-1
2-Бром-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
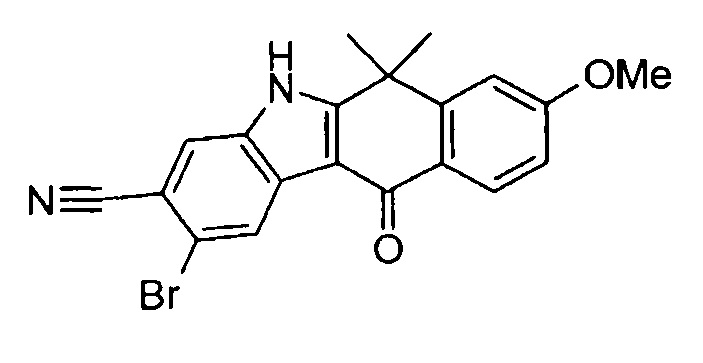
8-Метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил (Соединение A5-2, 50 мг, 0,158 ммоль) растворяли в CH3CN (1 мл), добавляли NBS (56 мг, 2 экв.) и перемешивали при 80°C в течение ночи. Реакционный раствор добавляли в воду и затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Осушитель удаляли фильтрованием и к остаткам, полученным после концентрирования при пониженном давлении, добавляли MeOH и твердое вещество, оставшееся после растворения, фильтровали с получением целевого соединения (желтый порошок, 20 мг, 38%).
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,92 (1 H, с), 8,50 (1 H, с), 8,16 (1 H, д, J=8,5 Гц), 8,14 (1 H, с), 7,36 (1 H, д, J=2,4 Гц), 7,11 (1 H, дд, J=8,5, 2,4 Гц), 3,92 (3H, с), 1,78 (6 H, с).
ЖХ/МС: м/z 395, 397 [М+H]+
ВЭЖХ время удерживания: 2,57 мин (условия анализа S)
[Пример 50]
Соединение A8-6-2
2-Бром-8-гидрокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A6, получали указанное в заголовке соединение, исходя из Соединения A8-6-1.
1H-ЯМР(400 МГц, DМSO-d6) δ: 8,46 (1 H, с), 8,10 (1 H, с), 8,05 (1 H, д, J=8,6 Гц), 7,13 (1 H, д, J=2,1 Гц), 6,89 (1 H, дд, J=8,5, 2,1 Гц), 1,71 (6 H, с).
ЖХ/МС: м/z 381, 383 [М+H]+
ВЭЖХ время удерживания: 2,10 мин (условия анализа S)
[Пример 51]
Соединение A8-6-3
2-Бром-8-(2-диэтиламино-этокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения A8-6-2.
1H-ЯМР(400 МГц, CD3OD) δ: 8,53 (1 H, д, J=0,5 Гц), 8,20 (1 H, д, J=8,7 Гц), 7,88 (1 H, д, J=0,5 Гц), 7,28 (1 H, д, J=2,3 Гц), 7,05 (1 H, дд, J=8,9, 2,5 Гц), 4,24 (2 H, т, J=5,7 Гц), 2,96 (2 H, т, J=5,7 Гц), 2,70 (4 H, кв., J=7,1 Гц), 1,79 (6 H, с), 1,12 (6 H, т, J=7,2 Гц).
ЖХ/МС: м/z 480, 482 [М+H]+
ВЭЖХ время удерживания: 1,73 мин (условия анализа S)
[Пример 52]
Соединение A8-7
(3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)уксусная кислота

(3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)этилацетатный сложный эфир (Соединение A7-23, 180 мг, 0,464 ммоль) и гидроксид калия (130 мг, 2,32 ммоль) растворяли в ТГФ (10 мл) и воде (1,8 мл) и перемешивали при 70°C в течение 2 часов. После охлаждения до комнатной температуры смесь экстрагировали дихлорметаном. Водный слой доводили до кислотного уровня с использованием 1 н раствора хлористоводородной кислоты, и осажденное твердое вещество фильтровали и промывали несколько раз водой с получением указанного в заголовке соединения (белое твердое вещество, 130 мг, 78%).
1H-ЯМР(300 МГц, DМSO) δ м.д. 13,09 (с, 1 H), 8,31 (д, 1 H, J=8,1 Гц), 8,11 (д, 1 H, J=8,4 Гц), 8,01 (с, 1 H), 7,58 (д, 1 H, J=7,8 Гц), 7,25 (д, 1 H, J=2,1 Гц), 6,97 (д, 1 H, J=8,4 Гц), 4,51 (с, 2 H), 1,73 (с, 6 H).
ЖХ/МС: м/z 361 [М+H]+
ВЭЖХ время удерживания: 2,97 мин (условия анализа U)
[Пример 53]
Соединение A8-8
6,6-Диметил-8-(2-морфолин-4-ил-этокси)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A8-17, получали указанное в заголовке соединение, исходя из Соединения A7-24 и морфолина.
1H-ЯМР(500 МГц, CD3OD+CDCl3) δ м.д. 8,4 (д, 1 H, J=8,2 Гц), 8,3 (д, 1 H, J=8,7 Гц), 7,8 (с, 1 H), 7,5 (дд, 1 H, J=1,1 Гц, J=8,2 Гц), 7,2 (д, 1 H, J=2,3 Гц), 7,0 (дд, 1 H, J=2,2 Гц, J=8,7 Гц), 4,2 (т, 2 H, J=5,3 Гц), 3,7 (т, 4 H, J=4,5 Гц), 2,9 (т, 2 H, J=5,3 Гц), 2,6 (т, 4 H, J=4,5 Гц), 1,8 (с, 6 H).
ЖХ/МС: м/z 416 [М+H]+
ВЭЖХ время удерживания: 2,40 мин (условия анализа U)
[Пример 54]
Соединение A8-9
8-[2-(1,1-Диоксотиоморфолинo)этокси]-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
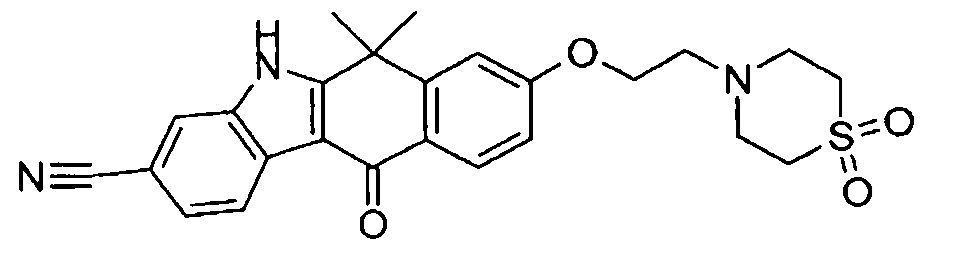
С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения A7-24 и тиоморфолин-1,1-диоксида.
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,72 (1 H, с), 8,31 (1 H, д, 8,5 Гц), 8,15 (1 H, д, 8,5 Гц), 8,00 (1 H, с), 7,60 (1 H, д, 8,5 Гц), 7,36 (1 H, д, 1,8 Гц), 7,10 (1 H, дд, 1,8, 8,5), 4,25 (2 H, т, 5,5 Гц), 3,06-3,33 (8 H, м), 2,97 (2 H, т, 5,5), 1,77 (6 H, с).
ЖХ/МС: м/z 464 [М+H]+
ВЭЖХ время удерживания: 2,70 мин (условия анализа W)
[Пример 55]
Соединение A8-10
8-(2-Трет-бутиламино-этокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения A7-24 и трет-бутиламина.
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,71 (1 H, с), 8,32 (1 H, д, 7,9 Гц), 8,15 (1 H, д, 9,1 Гц), 8,07 (1 д, 1,8 Гц), 7,60 (1 H, дд, 1,8, 7,9 Гц), 7,35 (1 H, д, 2,4 Гц), 7,09 (1 H, дд, 2,4, 9,1 Гц), 4,16 (2 H, т, 6,1 Гц), 2,91 (2 H, т, 6,1 Гц), 1,77 (6 H, с), 1,08 (9 H, с).
ЖХ/МС: м/z 402 [М+H]+
ВЭЖХ время удерживания: 2,55 мин (условия анализа W)
[Пример 56]
Соединение A8-11
8-(2-Втор-бутиламино-этокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A8-17, получали указанное в заголовке соединение, исходя из Соединения A7-24 и втор-бутиламина.
ЖХ/МС: m/z 402 [M+H]+
ВЭЖХ время удерживания: 1,88 мин (условия анализа U)
[Пример 57]
Соединение A8-12
8-[2-(2-Гидрокси-1,1-диметил-этиламино)этокси]-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A8-17, получали указанное в заголовке соединение, исходя из Соединения A7-24 и 2-амино-2-метил-пропан-1-ола.
1H-ЯМР(300 МГц, DМSO-d6) δ м.д. 12,65 (ушир. с, 1 H), 8,31 (д, 1 H, J=8,0 Гц), 8,15 (д, 1H, J=8,8 Гц), 7,99 (с, 1 H), 7,59 (д, 1 H, J=8,0 Гц), 7,34 (д, 1 H, J=2,3 Гц), 7,08 (дд, 1H, J=2,2 Гц, J=8,8 Гц), 4,58 (ушир. с, 1 H), 4,16 (т, 2 H, J=5,7 Гц), 3,20 (с, 2 H), 2,88 (т, 2H, J=5,7 Гц), 1,76 (с, 6 H), 0,97 (с, 6 H).
ЖХ/МС: м/z 418 [М+H]+
ВЭЖХ время удерживания: 2,47 мин (условия анализа U)
[Пример 58]
Соединение A8-13
8-[2-(4-Этил-пиперазин-1-ил)этокси]-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A8-17, получали указанное в заголовке соединение, исходя из Соединения A7-24 и 1-этил-пиперазина.
ЖХ/МС: m/z 443 [M+H]+
ВЭЖХ время удерживания: 1,68 мин (условия анализа U)
[Пример 59]
Соединение A8-14
8-(2-Имидазол-1-ил-этокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
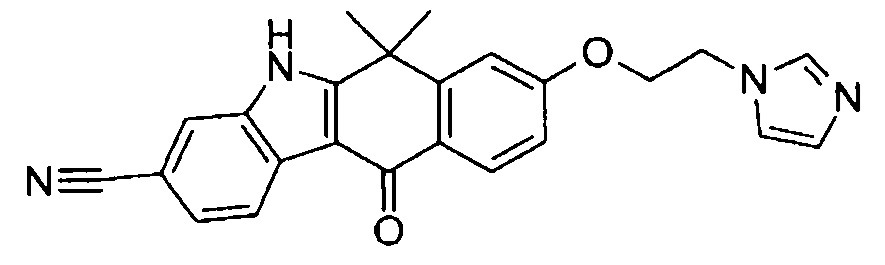
С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения A6 и 2-имидазол-1-ил-этанола.
1H-ЯМР(300 МГц, DМSO-d6) δ м.д. 12,71 (с, 1 H), 8,31 (д, 1 H, J=8,3 Гц), 8,14 (д, 1 H, J=8,8 Гц), 7,99 (с, 1 H), 7,73 (с, 1 H), 7,60 (д, 1 H, J=8,3 Гц), 7,34 (с, 1 H), 7,29 (с, 1 H), 7,09 (д, 1 H, J=8,8 Гц), 6,91 (с, 1 H), 4,20 (с, 4 H), 1,76 (с, 6 H).
ЖХ/МС: м/z 387 [М+H]+
ВЭЖХ время удерживания: 1,77 мин (условия анализа U)
[Пример 60]
Соединение A8-15
8-{2-[Бис-(2-гидрокси-этил)амино]этокси}-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

В соответствии со способом, аналогичным способу для синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения A7-24 и 2-(2-гидрокси-этиламино)этанола.
ЖХ/МС: m/z 434 [M+H]+
ВЭЖХ время удерживания: 2,40 мин (условия анализа U)
[Пример 61]
Соединение A8-16
Амид 1-[2-(3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)этил]пиперидин-4-карбоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения A8-17, получали указанное в заголовке соединение, исходя из Соединения A7-24 и амида пиперидин-4-карбоновой кислоты.
ЖХ/МС: m/z 457 [M+H]+
ВЭЖХ время удерживания: 1,28 мин (условия анализа S)
[Пример 62]
Соединение A8-17
6,6-Диметил-11-оксо-8-[2-(3-оксо-пиперазин-1-ил)этокси]-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

К DMF раствору (5 мл) 8-(2-бром-этокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрила (Соединение A7-24, 30 мг, 0,07 ммоль) добавляли пиперазин-2-он (44,9 мг, 0,35 ммоль) и N,N-диизопропилэтиламин (0,061 мл, 0,35 ммоль) при комнатной температуре и перемешивали при 80°C в течение 18 часов. После охлаждения до комнатной температуры смесь экстрагировали этилацетатом, промывали насыщенным солевым раствором. Органический слой сушили над сульфатом магния. Осушитель удаляли фильтрованием и остатки, полученные после концентрирования при пониженном давлении, очищали при помощи препаративной ТСХ (дихлорметан/метанол) с получением указанного в заголовке соединения (белое твердое вещество, 24 мг, 80%).
1H-ЯМР(300 МГц, DМSO-d6) δ м.д. 12,71 (с, 1 H), 8,32 (д, 1 H, J=8,4 Гц), 8,15 (д, 1 H, J=8,8 Гц), 8,00 (с, 1 H), 7,75 (с, 1 H), 7,60 (д, 1 H, J=8,4 Гц), 7,37 (д, 1 H, J=2,3 Гц), 7,09 (дд, 1 H, J=2,3 Гц, J=8,8 Гц), 4,27 (т, 2H, J=5,7 Гц), 3,19 (м, 2 H), 3,08(с, 2 H), 2,83 (т, 2 H, J=5,7 Гц), 2,70 (т, 2 H, J=5,7 Гц), 1,8(с, 6 H).
ЖХ/МС: м/z 429 [М+H]+
ВЭЖХ время удерживания: 1,29 мин (условия анализа S)
[Пример 63]
Соединение A8-18
[2-(3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)этил]амид морфолин-4-сульфоновой кислоты

Указанное в заголовке соединение получали в виде побочного продукта синтеза Соединения C1-2.
ЖХ/МС: m/z 495 [M+H]+
ВЭЖХ время удерживания: 2,00 мин (условия анализа S)
[Пример 64]
Соединение A8-19
[2-(3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)этил]амид4-метил-пиперазин-1-сульфоновой кислоты

Указанное в заголовке соединение получали в виде побочного продукта синтеза Соединения C1-4.
1H-ЯМР (300 МГц, DМSO-d6) δ: 1,77 (6 H, с), 2,16 (3 H, с), 2,34 (4 H, м), 3,08 (4 H, м), 3,35 (2 H, м), 4,19 (2 H, т, 5,34 Гц), 7,09 (1 H, дд, 8,77 Гц, 2,99 Гц), 7,37 (1 H, уш. с, 1,91 Гц), 7,59 (2 H, м), 8,01 (1 H, с), 8,16 (1 H, д, 8,40 Гц), 8,32 (1 H, д, 8,01 Гц), 12,7 (1 H, с).
ЖХ/МС: м/z 501 [М+H]+
ВЭЖХ время удерживания: 1,43 мин (условия анализа S)
[Пример 65]
Соединение A8-20
6,6-Диметил-8-(1-оксетан-3-ил-пиперидин-4-илметокси)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

6,6-Диметил-11-оксо-8-(пиперидин-4-илметокси)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил в форме соли хлористоводородной кислоты (Соединение A7-25, 30 мг, 0,075 ммоль) и оксетан-3-он (38 мг, 7 экв.) растворяли в уксусной кислоте (0,2 мл), ТГФ (1 мл) и метаноле (1 мл), добавляли цианоборогидрид натрия (33 мг, 7 экв.) при комнатной температуре и перемешивали в течение ночи. К реакционному раствору добавляли воду и затем экстрагировали этилацетатом. Раствор сушили над сульфатом натрия, и растворитель удаляли в условиях вакуума, и полученные остатки очищали при помощи препаративной ТСХ (хлороформ: 2 н раствор аммиака в метаноле = 9:1) с получением целевого соединения (15 мг).
ЖХ/МС: m/z 456 [M+H]+
ВЭЖХ время удерживания: 2,78 мин (условия анализа C)
[Пример 66]
Соединение A8-21
6,6-Диметил-8-[2-(1-оксетан-3-ил-пиперидин-4-ил)этокси]-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-25 и Соединения A8-20, получали указанное в заголовке соединение, исходя из Соединения A6 и трет-бутилового эфира 4-(2-гидрокси-этил)пиперидин-1-карбоновой кислоты (15 мг).
ЖХ/МС: m/z 470 [M+H]+
ВЭЖХ время удерживания: 2,85 мин (условия анализа C)
[Пример 67]
Соединение A9-1
N-[2-(3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)этил]метансульфонамид

Соль трифторуксусной кислоты 8-(2-амино-этокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрила (Соединение A8-2, 19 мг, 0,044 ммоль) суспендировали в дихлорметане (0,5 мл), добавляли диизопропилэтиламин (0,0157 мл, 2 экв.) и метансульфонилхлорид (0,0034 мл, 1 экв.) и затем перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор добавляли в воду и затем экстрагировали дихлорметаном. После промывки насыщенным солевым раствором органический слой сушили над сульфатом натрия. Осушитель удаляли фильтрованием и остатки, полученные после концентрирования при пониженном давлении, разделяли при помощи препаративной ТСХ на силикагеле (этилацетат 100%) с получением целевого соединения (5,5 мг, 29%).
1H-ЯМР(400 МГц, DМSO-d6) δ: 8,47 (1 H, д, J=8,2 Гц), 8,32 (1 H, д, J=8,7 Гц), 8,16 (1 H, с), 7,76 (1 H, д, J=8,2 Гц), 7,53-7,46 (2 H, м), 7,26 (1 H, д, J=8,7 Гц), 4,39-4,33 (2 H, м), 3,58-3,51 (2 H, м), 3,12 (3 H, с), 1,93 (6 H, с).
ЖХ/МС: м/z 424 [М+H]+
ВЭЖХ время удерживания: 3,10 мин (условия анализа W)
[Пример 68]
Соединение A9-2
N-[2-(3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)этил]-2,2,2-трифторацетамид
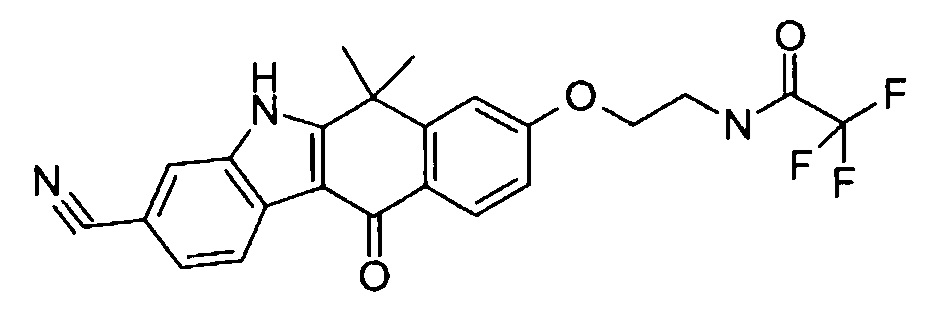
Указанное в заголовке соединение получали в виде побочного продукта синтеза Соединения A9-1.
ЖХ/МС: m/z 442 [M+H]+
ВЭЖХ время удерживания: 3,45 мин (условия анализа W)
[Пример 69]
Соединение A9-3-1
8-{2-(Трет-бутилоксикарбониламиносульфонил)амино-этокси}-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

Соль трифторуксусной кислоты 8-(2-амино-этокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрила (Соединение A8-2, 20 мг, 0,044 ммоль) растворяли в пиридине (0,5 мл), добавляли N-(трет-бутоксикарбонил)-N-[4-(диметилазаниумилиден)-1,4-дигидропиридин-1-илсульфонил]азанид (13,5 мг, 1 экв.) и затем перемешивали при комнатной температуре в течение 14 часов. Реакционный раствор добавляли в воду и затем экстрагировали этилацетатом. После промывки насыщенным солевым раствором органический слой сушили над сульфатом натрия. Осушитель удаляли фильтрованием и остатки, полученные после концентрирования при пониженном давлении, разделяли при помощи препаративной ТСХ на силикагеле (этилацетат) с получением указанного в заголовке соединения (16,1 мг, 68%).
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,74 (1 H, с), 10,94 (1 H, с), 8,33 (1 H, д, J=8,5 Гц), 8,16 (1 H, д, J=9,1 Гц), 8,02 (1 H, с), 7,84 (1 H, ушир. с), 7,62 (1 H, д, J=7,9 Гц), 7,36 (1 H, с), 7,10 (1 H, д, J=7,9 Гц), 4,24-4,18 (2 H, м), 1,78 (6 H, с), 1,32 (9 H, с).
ЖХ/МС: м/z 525 [М+H]+
ВЭЖХ время удерживания: 3,48 мин (условия анализа W)
[Пример 70]
Соединение A9-3-2
8-{2-(Метиламиносульфонил)амино-этокси}-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения A9-3-1.
ЖХ/МС: m/z 425 [M+H]+
ВЭЖХ время удерживания: 2,95 мин (условия анализа W)
[Пример 71]
Соединение A9-4
8-(1-Метансульфонил-пиперидин-4-илокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

В соответствии со способом, аналогичным способу синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения A8-1 и метансульфонилхлорида.
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,72 (1 H, с), 8,30 (1 H, д, J=8,5 Гц), 8,14 (1 H, д, J=8,5 Гц), 8,00 (1 H, с), 7,59 (1 H, д, J=7,9 Гц), 7,38 (1 H, с), 7,13 (1 H, д, J=8,5 Гц), 4,81 (1 H, с), 3,39-3,38 (2 H, м), 3,19-3,13 (2 H, м), 2,93 (3 H, с), 2,11-2,04 (2 H, м), 1,83-1,75 (8 H, м).
ЖХ/МС: м/z 464 [М+H]+
ВЭЖХ время удерживания: 3,41 мин (условия анализа U)
[Пример 72]
Соединение A9-5
8-[1-(2-Метокси-этил)пиперидин-4-илокси]-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A9-1, получали указанное в заголовке соединение, исходя из Соединения A8-1 и 1-бром-2-метокси-этана.
1H-ЯМР(400 МГц, CDCl3) δ: 8,48-8,53 (1 H, м), 8,32-8,38 (1 H, м), 7,74-7,77 (1 H, м), 7,50-7,55 (1 H, м), 7,07-7,10 (1 H, м), 6,95-7,00 (1 H, м), 4,43-4,51 (1 H, м), 3,53 (2 H, т, J=5,6 Гц), 3,36 (3 H, с), 2,77-2,87 (2 H, м), 2,62 (2 H, т, J=5,6 Гц), 2,35-2,47 (2 H, м), 2,02-2,12 (2 H, м), 1,78-1,95 (2 H, м), 1,82 (6 H, с).
ЖХ/МС: м/z 444 [М+H]+
ВЭЖХ время удерживания: 2,00 мин (условия анализа U)
[Пример 73]
Соединение A9-6-2
8-[1-(2-Гидрокси-этил)пиперидин-4-илокси]-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
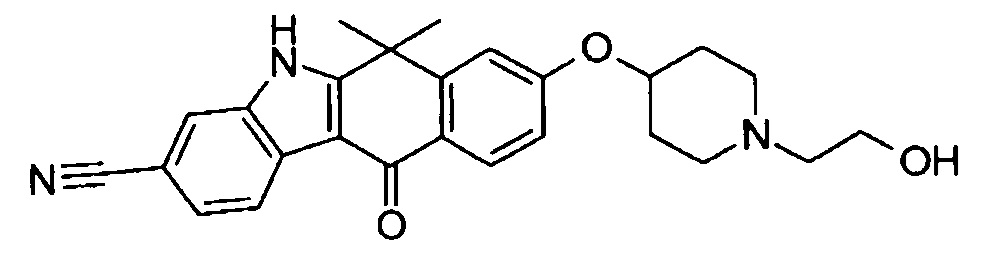
В соответствии со способом, аналогичным способу синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения A8-1 и (2-бромэтокси)-трет-бутилдиметилсилана, с последующей обработкой тетрабутиламмонийфторидом.
ЖХ/МС: m/z 430 [M+H]+
ВЭЖХ время удерживания: 1,45 мин (условия анализа S)
[Пример 74]
Соединение A9-7
8-[1-(2-Фтор-этил)пиперидин-4-илокси]-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

В соответствии со способом, аналогичным способу синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения A8-1 и 2-фторэтилового эфира метансульфоновой кислоты.
1H-ЯМР (300 МГц, DМSO-d6) δ: 1,67 (2 H, м), 1,76 (6 H, с), 2,01 (2 H, м), 2,37 (2 H, т, 11,0 Гц), 2,61 (1 H, т, 4,20 Гц), 2,70 (1 H, т, 4,58), 2,78 (2 H, м), 4,46 (1 H, т, 4,58 Гц), 4,62 (2 H, т, 5,34 Гц), 7,10 (1 H, дд, 9,16 Гц, 2,29 Гц), 7,34 (1 H, ушир. с, 1,53 Гц), 7,60 (1 H, дд, 8,40 Гц, 1,53 Гц), 7,99 (1 H, с), 8,13 (1 H, д, 8,39 Гц), 8,30 (1H, д, 8,39 Гц), 12,7 (1 H, с).
ЖХ/МС: м/z 432 [М+H]+
ВЭЖХ время удерживания: 1,52 мин (условия анализа S)
[Пример 75]
Соединение A9-8
8-(1-Ацетил-пиперидин-4-илокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

В соответствии со способом, аналогичным способу синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения A8-1 и ацетилхлорида.
ЖХ/МС: m/z 428 [M+H]+
ВЭЖХ время удерживания: 1,91 мин (условия анализа S)
[Пример 76]
Соединение A9-9
2-(3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)ацетамид

С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения A6 и 2-бром-ацетамида.
ЖХ/МС: m/z 360 [M+H]+
ВЭЖХ время удерживания: 2,83 мин (условия анализа U)
[Пример 77]
Соединение A9-10
2-(3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)-N-метил-ацетамид

(3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)уксусную кислоту (Соединение A8-7, 30 мг, 0,0838 ммоль), метиламин в форме соли хлористоводородной кислоты (28,1 мг, 0,417 ммоль), EDC (32 мг, 0,167 ммоль) и HOBT (0,023 мг, 0,167 ммоль) растворяли в DMF (1 мл) и добавляли диизопропилэтиламин (0,145 мл, 0,833 ммоль) при комнатной температуре. После перемешивания при комнатной температуре в течение 18 часов добавляли воду и осуществляли экстрагирование этилацетатом. После промывки насыщенным солевым раствором органический слой сушили над сульфатом магния. Осушитель удаляли фильтрованием и остатки, полученные после концентрирования при пониженном давлении, растворяли в дихлорметане, добавляли диэтиловый эфир и получали указанное в заголовке соединение в виде осажденного вещества (белое твердое вещество, 19,7 мг, 63%).
1H-ЯМР(300 МГц, DМСO) δ м.д. 12,73 (с, 1 H), 8,33 (д, 1 H, J=8,1 Гц), 8,17 (д, 1 H, J=8,7 Гц), 8,13 (с, 1 H), 8,00 (с, 1 H), 7,62 (д, 1 H, J=8,1 Гц), 7,39 (д, 1 H, J=2,4 Гц), 7,11 (дд, 1 H, J=8,7 Гц, 2,4 Гц), 4,64 (с, 2 H), 3,17 (д, 1 H, J=5,4 Гц), 2,69 (д, 1 H, J=4,5 Гц), 1,76 (с, 6 H).
ЖХ/МС: м/z 374 [М+H]+
ВЭЖХ время удерживания: 2,43 мин (условия анализа U)
[Пример 78]
Соединение A9-11
2-(3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)-N-(2,2-диметил-[1,3]диоксолан-4-илметил)ацетамид

С использованием тех же условий, как в способе синтеза Соединения A9-10, получали указанное в заголовке соединение, исходя из Соединения A8-7 и C-(2,2-диметил-[1,3]диоксолан-4-ил)метиламина.
ЖХ/МС: m/z 474 [M+H]+
ВЭЖХ время удерживания: 2,20 мин (условия анализа U)
[Пример 79]
Соединение A9-12
2-(3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)-N-(2,3-дигидрокси-пропил)ацетамид

С использованием тех же условий, как в способе синтеза Соединения A7-14-2, получали указанное в заголовке соединение, исходя из Соединения A9-11.
ЖХ/МС: m/z 434 [M+H]+
ВЭЖХ время удерживания: 1,72 мин (условия анализа U)
[Пример 80]
Соединение A9-13
2-[2-(3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)ацетиламино]этиловый эфир 2-метил-акриловой кислоты

С использованием тех же условий, как в способе синтеза Соединения A9-10, получали указанное в заголовке соединение, исходя из Соединения A8-7 и 2-амино-этилового эфира 2-метил-акриловой кислоты.
ЖХ/МС: m/z 472 [M+H]+
ВЭЖХ время удерживания: 3,30 мин (условия анализа U)
[Пример 81]
Соединение A9-14
2-(3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)-N-(2-гидрокси-этил)ацетамид

2-[2-(3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)ацетиламино]этиловый эфир 2-метил-акриловой кислоты (Соединение A9-13, 40 мг, 0,085 ммоль) растворяли в смеси растворителей метанола (2 мл) и воды (2 мл), добавляли гидроксид калия (48 мг, 0,85 ммоль) и затем перемешивали при комнатной температуре в течение 18 часов. После нейтрализации при помощи 1 н раствора хлористоводородной кислоты реакционный раствор концентрировали при пониженном давлении. Полученные остатки очищали на аминосиликагеле с получением указанного в заголовке соединения (белое твердое вещество, 8,9 мг, 26%).
1H-ЯМР(300 МГц, DМСO) δ м.д. 12,75 (с, 1 H), 8,32 (д, 1 H, J=8,1 Гц), 8,17-8,13 (м, 2 Гц), 7,99 (с, 1 H), 7,60 (д, 1 H, J=8,1 Гц), 7,38 (д, 1 H, J=1,8 Гц), 7,11 (дд, 1 H, J=2,1 Гц, 8,7 Гц), 4,72 (т, 1 H, J=5,7 Гц), 4,65 (с, 1H), 3,48 (дд, 2 H, J=12,0 Гц, 6,0 Гц), 3,26 (дд, 2 H, J=12,0 Гц, 6,0 Гц), 1,76 (с, 6 H).
ЖХ/МС: м/z 404 [М+H]+
ВЭЖХ время удерживания: 2,83 мин (условия анализа U)
[Пример 82]
Соединение A9-15-1
трет-Бутиловый эфир 4-[2-(3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)ацетил]пиперазин-1-карбоновой кислоты

(3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)уксусную кислоту (Соединение A8-7, 30 мг, 0,083 ммоль), трет-бутиловый эфир пиперазин-1-карбоновой кислоты (31 мг, 2 экв.) и HOBt (30 мг, 3 экв.) растворяли в 0,5 мл DMF, добавляли EDC (48 мг, 3 экв.) и перемешивали при комнатной температуре в течение ночи. Затем растворитель удаляли при пониженном давлении, и полученные остатки очищали при помощи препаративной ТСХ с получением указанного в заголовке соединения (20 мг).
ЖХ/МС: m/z 527, 471, 427[M-H]-
ВЭЖХ время удерживания: 2,77 мин (условия анализа C)
[Пример 83]
Соединение A9-15-2
6,6-Диметил-11-оксо-8-(2-оксо-2-пиперазин-1-ил-этокси)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил, соль хлористоводородной кислоты

К трет-бутиловому эфиру 4-[2-(3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)ацетил]пиперазин-1-карбоновой кислоты (Соединение A9-15-1, 20 мг) добавляли 4 н раствор хлористоводородной кислоты в диоксане (1 мл) и перемешивали на водяной бане при 10°C в течение 4 часов. К реакционному раствору добавляли воду, и осажденные вещества фильтровали и сушили с получением указанного в заголовке соединения (15 мг, белый порошок).
ЖХ/МС: m/z 429 [M+H]+
ВЭЖХ время удерживания: 0,81 мин (условия анализа I)
[Пример 84]
Соединение A9-16
2-(3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)-N-(2-циано-этил)ацетамид

(3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)уксусную кислоту (Соединение A8-7, 30 мг, 0,083 ммоль), 3-аминопропионитрил (12 мг, 2 экв.) и HOBt (30 мг, 3 экв.) растворяли в 0,5 мл DMF, добавляли EDC (48 мг, 3 экв.) и перемешивали при комнатной температуре в течение ночи. Затем растворитель удаляли при пониженном давлении, и полученные остатки очищали при помощи препаративной ТСХ с получением указанного в заголовке соединения (23 мг).
ЖХ/МС: m/z 411 [M+H]+
ВЭЖХ время удерживания: 2,27 мин (условия анализа C)
[Пример 85]
Соединение A9-17
2-(3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)-N-(2-циано-этил)-N-метил-ацетамид
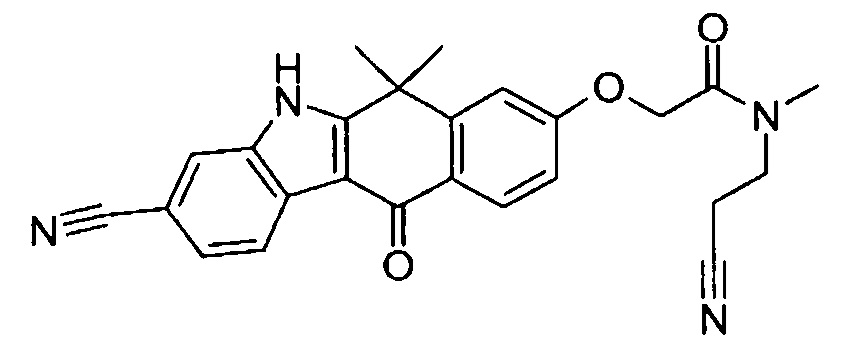
(3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)уксусную кислоту (Соединение A8-7, 30 мг, 0,083 ммоль), N-метил-3-аминопропионитрил (14 мг, 2 экв.) и HOBt (30 мг, 3 экв.) растворяли в 0,5 мл DMF, добавляли EDC (48 мг, 3 экв.) и перемешивали при комнатной температуре в течение ночи. Затем растворитель удаляли при пониженном давлении, и полученные остатки очищали при помощи препаративной ТСХ с получением указанного в заголовке соединения (7 мг).
ЖХ/МС: m/z 411 [M+H]+
ВЭЖХ время удерживания: 2,33 мин (условия анализа C)
[Пример 86]
Соединение A10
8-(Трет-бутил-диметил-силанилокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

DMF раствор 8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрила (Соединение A6, 100 мг, 0,331 ммоль), имидазола (67,5 мг, 3 экв.) и трет-бутилхлордиметилсилана (92,4 мг, 1,5 экв.) перемешивали в течение ночи при комнатной температуре. К реакционному раствору добавляли насыщенный водный раствор гидрокарбоната натрия с последующим экстрагированием трет-бутилметиловым эфиром. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Осушитель удаляли фильтрованием и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением целевого соединения (белое твердое вещество, 170 мг, 100%).
ЖХ/МС: m/z 417 [M+H]+
ВЭЖХ время удерживания: 3,38 мин (условия анализа S)
[Пример 87]
Соединение A10-1
8-Метокси-5,6,6-триметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

К ТГФ раствору трифенилфосфина (260 мг, 3 экв.) добавляли диизопропиловый эфир азодикарбоновой кислоты (0,195 мл, 3 экв.) и смесь перемешивали при комнатной температуре в течение 1 часа. Затем добавляли 8-(трет-бутилдиметилсиланилокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил (Соединение A10, 138 мг, 0,331 ммоль) и метанол (1 мл) и перемешивали в течение ночи. Реакционный раствор очищали при помощи ВЭЖХ с получением целевого соединения (44,8 мг, 41%).
1H-ЯМР(270 МГц, DМSO-d6) δ: 8,44 (1 H, д, J=8,1 Гц), 8,33 (1 H, с), 8,14 (1 H, д, J=8,7 Гц), 7,66 (1 H, дд, J=8,2, 1,1 Гц), 7,39 (1 H, д, J=2,3 Гц), 7,09 (1 H, дд, J=8,7, 2,3 Гц), 4,17 (3 H, с), 3,92 (3 H, с), 1,88 (6 H, с).
ЖХ/МС: м/z 331 [М+H]+
ВЭЖХ время удерживания: 2,35 мин (условия анализа S)
[Пример 88]
Соединение A10-2
8-(1-Метансульфонил-пиперидин-4-илокси)-5,6,6-триметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-4, получали указанное в заголовке соединение, исходя из Соединения A9-4.
ЖХ/МС: m/z 478 [M+H]+
ВЭЖХ время удерживания: 2,68 мин (условия анализа U)
[Пример 89]
Соединение B1
3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-иловый эфир трифторметансульфоновой кислоты

8-Гидрокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил (Соединение A6, 550 мг, 0,189 ммоль) растворяли в пиридине (18 мл), добавляли безводную трифторметансульфоновую кислоту (0,758 мл, 3 экв.) и перемешивали при комнатной температуре в течение 30 минут. Реакционный раствор добавляли в воду и затем экстрагировали дихлорметаном. Органический слой сушили над сульфатом магния. Осушитель удаляли фильтрованием и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением целевого соединения (белый порошок, 641 мг, 81%).
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,89 (1 H, ушир. с), 8,36 (1 H, д, J=8,8 Гц), 8,31 (1 H, дд, J=8,1, 0,7 Гц), 8,11 (1 H, д, J=2,3 Гц), 8,04 (1 H, дд, J=1,5, 0,7 Гц), 7,65-7,60 (2 H, м), 1,76 (6 H, с).
ЖХ/МС: м/z 435 [М+H]+
ВЭЖХ время удерживания: 3,10 мин (условия анализа U)
[Пример 90]
Соединение B2-1
8-(4-Изопропил-пиперазин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-иловый эфир трифторметансульфоновой кислоты (Соединение B1, 40 мг, 0,0921 ммоль) растворяли в NMP (1 мл) и добавляли 1-изопропилпиперазин (236 мг, 20 экв.). Смесь перемешивали при 120°C в течение 3 часов. После охлаждения до комнатной температуры осуществляли очистку при помощи ВЭЖХ с получением целевого соединения (белый порошок, 12,8 мг, 34%).
1H-ЯМР(270 МГц, DМSO-d6) δ: 8,30 (1 H, д, 8,1 Гц), 8,03 (1 H, д, 8,6 Гц), 7,98 (1 H, с), 7,56 (1 H, д, 8,6 Гц), 7,21 (1 H, с), 7,04 (1 H, д, 9,1 Гц), 3,40-3,37 (4 H, м), 2,73-2,65 (1 H, м), 2,61-2,58 (4 H, м), 1,75 (6 H, с), 1,02 (6 H, д, 6,6 Гц).
ЖХ/МС: м/z 413 [М+H]+
[Пример 91]
Соединение B2-2
8-[4-(2-Гидрокси-этил)пиперазин-1-ил]-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

В соответствии со способом, аналогичным способу синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения B1 и N-(2-гидроксиэтил)пиперазина.
1H-ЯМР(270 МГц, DМSO-d6) δ: 8,30 (1 H, д, 8,1 Гц), 8,03 (1 H, д, 8,7 Гц), 7,99 (1 H, с), 7,58 (1 H, д, 7,9 Гц), 7,21 (1 H, с), 7,04 (1 H, д, 8,7 Гц), 4,50-4,46 (1 H, ушир. м), 3,59-3,53 (2 H, м), 3,39-3,35 (4 H, м), 2,59-2,56 (4 H, м), 2,45 (2 H, т, 6,1 Гц), 1,76 (6 H, с).
ЖХ/МС: м/z 415 [М+H]+
ВЭЖХ время удерживания: 1,27 мин (условия анализа S)
[Пример 92]
Соединение B2-3
6,6-Диметил-8-морфолин-4-ил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения B1 и морфолина.
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,62 (1 H, ушир. с), 8,29 (1 H, д, 8,2 Гц), 8,04 (1 H, д, 9,0 Гц), 7,96 (1 H, с), 7,56 (1 H, д, 8,2 Гц), 7,22 (1 H, с), 7,04 (1 H, д, 9,0 Гц), 3,77-3,75 (4 H, м), 3,35-3,30 (4 H, м), 1,74 (6 H, с).
ЖХ/МС: м/z 372 [М+H]+
ВЭЖХ время удерживания: 2,45 мин (условия анализа U)
[Пример 93]
Соединение B2-4
6,6-Диметил-11-оксо-8-(4-пирролидин-1-ил-пиперидин-1-ил)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения B1 и 4-пирролидин-1-ил-пиперидина.
1H-ЯМР(270 МГц, ДМСO-д6) δ: 8,30 (1 H, д, 8,1 Гц), 8,01 (1 H, д, 8,7 Гц), 7,97 (1 H, с), 7,56 (1 H, д, 8,6 Гц), 7,20 (1 H, с), 3,94-3,90 (2 H, м), 3,30-3,28 (4 H, м), 2,95 (2 H, т, 11,8 Гц), 2,24-2,20 (1 H, м), 1,95-1,91 (2 H, м), 1,75 (6 H, с), 1,70-1,66 (4 H, м), 1,54-1,52 (2 H, м).
ЖХ/МС: м/z 439 [М+H]+
[Пример 94]
Соединение B2-5-1
трет-Бутиловый эфир 4-(3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-ил)пиперазин-1-карбоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения B1 и трет-бутилового эфира пиперазин-1-карбоновой кислоты.
ЖХ/МС: m/z 471 [M+H]+
ВЭЖХ время удерживания: 2,67 мин (условия анализа S)
[Пример 95]
Соединение B2-5-2
6,6-Диметил-11-оксо-8-пиперазин-1-ил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения B2-5-1.
1H-ЯМР(400 МГц, DМSO-d6) δ: 8,32 (1 H, д, 8,5 Гц), 8,03 (1 H, д, 9,1 Гц), 7,99 (1 H, с), 7,59 (1 H, дд, 8,2, 1,5 Гц), 7,20 (1 H, д, 2,4 Гц), 7,04 (1 H, дд, 8,8, 2,1 Гц), 3,32-3,30 (4 H, м), 2,88-2,87 (4 H, м), 1,77 (6 H, с).
ЖХ/МС: м/z 371 [М+H]+
[Пример 96]
Соединение B2-6
6,6-Диметил-11-оксо-8-пиперидин-1-ил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения B1 и пиперидина.
ЖХ/МС: m/z 370 [M+H]+
ВЭЖХ время удерживания: 2,40 мин (условия анализа U)
[Пример 97]
Соединение B2-7-1
8-(4-Гидрокси-пиперидин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения B1 и пиперидин-4-ола.
1H-ЯМР(270 МГц, DМSO-d6) δ: 8,30 (1 H, д, 8,1 Гц), 8,01 (1 H, д, 8,7 Гц), 7,97 (1 H, с), 7,56 (1 H, д, 7,7 Гц), 7,19 (1 H, с), 7,04 (1 H, д, 10,6 Гц), 4,76-4,71 (1 H, ушир. м), 3,81-3,75 (3 H, м), 3,08 (2 H, т, 10,2 Гц), 1,86-1,82 (2 H, м), 1,75 (6 H, с), 1,49-1,42 (2 H, м).
ЖХ/МС: м/z 386 [М+H]+
[Пример 98]
Соединение B2-7-2
6,6-Диметил-11-оксо-8-(4-оксо-пиперидин-1-ил)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
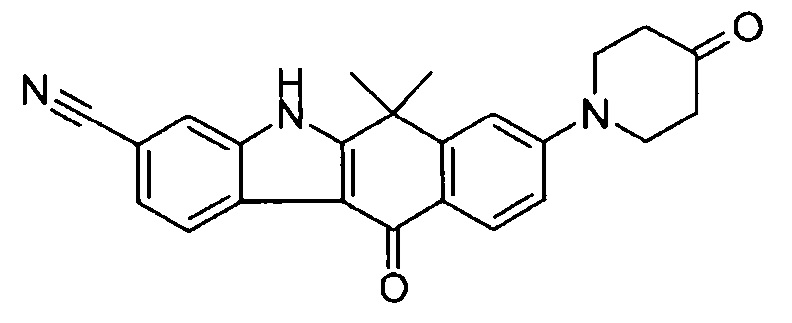
8-(4-Гидрокси-пиперидин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил (Соединение B2-7-1, 210 мг, 0,545 ммоль) растворяли в смеси растворителей DCM (2 мл) и DMF (0,6 мл), добавляли 1,1,1-триацетокси-1,1-дигидро-1,2-бензойодоксол-3(1H)-он (300 мг, 1,3 экв.) и смесь перемешивали при комнатной температуре в течение 2 часов. К реакционному раствору добавляли 0,25 моль/л водного раствора тиосульфата натрия, насыщенный раствор бикарбоната натрия и CPME с последующим перемешиванием при комнатной температуре в течение 1 часа. Реакционный раствор фильтровали, и фильтрат подвергали разделению жидкостей. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Осушитель удаляли фильтрованием и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением целевого соединения (желтовато-белый порошок, 109 мг, 52%).
ЖХ/МС: m/z 384 [M+H]+
ВЭЖХ время удерживания: 2,17 мин (условия анализа U)
[Пример 99]
Соединение B2-8
8-(4-Метансульфонил-пиперазин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения B1 и 1-метансульфонилпиперазина.
1H-ЯМР(270 МГц, DМSO-d6) δ: 12,66 (1 H, ушир. с), 8,31 (1 H, д, J=8,2 Гц), 8,06 (1 H, д, J=8,7 Гц), 7,99 (1 H, с), 7,59 (1 H, д, J=8,2 Гц), 7,30 (1 H, д, J=1,8 Гц), 7,09 (1 H, дд, J=8,7, 1,8 Гц), 3,53 (4 H, т, J=4,8 Гц), 3,27 (4 H, т, J=4,8 Гц), 2,94 (3 H, с), 1,77 (6 H, с).
ЖХ/МС: м/z 449 [М+H]+
ВЭЖХ время удерживания: 1,98 мин (условия анализа S)
[Пример 100]
Соединение B2-9
8-(3-Метансульфонил-пирролидин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения B1 и 3-метансульфонилпирролидина.
ЖХ/МС: m/z 434 [M+H]+
ВЭЖХ время удерживания: 1,83 мин (условия анализа S)
[Пример 101]
Соединение B2-10
8-(1,1-Диоксотиоморфолинo)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-иловый эфир трифторметансульфоновой кислоты (Соединение B1, 30 мг, 0,069 ммоль) растворяли в 1,4-диоксане (1 мл), добавляли тиоморфолин 1,1-диоксид (19 мг, 2 экв.), Pd2(dba)3 (6,3 мг, 0,1 экв.), BINAP (8,6 мг, 0,2 экв.) и K3PO4 (29 мг, 2 экв.) и перемешивали при 100°C в течение ночи. Реакционный раствор добавляли в воду и затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Осушитель удаляли фильтрованием и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением целевого соединения (белый порошок, 2,1 мг, 7%).
1H-ЯМР(270 МГц, DМSO-d6) δ: 8,29 (1 H, д, J=8,6 Гц), 8,07 (1 H, д, J=8,9 Гц), 8,00 (1 H, с), 7,55 (1 H, дд, J=8,5, 1,7 Гц), 7,34 (1 H, д, J=2,0 Гц), 7,15 (1 H, дд, J=9,1, 2,7 Гц), 4,01 (4 H, с), 3,16 (4 H, с), 1,77 (6 H, с).
ЖХ/МС: м/z 420 [М+H]+
ВЭЖХ время удерживания: 1,80 мин (условия анализа S)
[Пример 102]
Соединение B2-11
8-(4-Циклопентил-2-оксо-пиперазин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-10, получали указанное в заголовке соединение, исходя из Соединения B1 и 4-циклопентилпиперазин-2-она.
ЖХ/МС: m/z 453 [M+H]+
ВЭЖХ время удерживания: 1,30 мин (условия анализа S)
[Пример 103]
Соединение B2-12
6,6-Диметил-8-(4-морфолин-4-ил-пиперидин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения B1 и 4-пиперидин-4-илморфолина.
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,73 (1 H, с), 8,27-8,31 (1 H, м), 7,98-8,02 (1 H, м), 7,95-7,97 (1 H, м), 7,53-7,58 (1 H, м), 7,17-7,21 (1 H, м), 6,99-7,05 (1 H, м), 3,97-4,05 (2 H, м), 3,53-3,59 (4 H, м), 2,80-2,90 (2 H, м), 2,43-2,51 (4 H, м), 2,31-2,40 (1 H, м), 1,83-1,92 (2 H, м), 1,74 (6 H, с), 1,39-1,52 (2 H, м).
ЖХ/МС: м/z 455 [М+H]+
ВЭЖХ время удерживания: 1,73 мин (условия анализа U)
[Пример 104]
Соединение B2-13
8-(4,4-Дифтор-1,4’-бипиперидин-1’-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения B2-7-2 и 4,4-дифторпиперидина в форме соли хлористоводородной кислоты.
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,59 (1 H, с), 8,25-8,32 (1 H, м), 7,97-8,02 (1 H, м), 7,96 (1 H, с), 7,52-7,59 (1 H, м), 7,16-7,21 (1 H, м), 6,99-7,05 (1 H, мz), 4,00-4,09 (2 H, м), 3,55-3,62 (2 H, м), 2,79-2,90 (2 H, м), 2,55-2,67 (4 H, м), 1,78-1,98 (5 H, м), 1,74 (6 H, с), 1,44-1,58 (2 H, м).
ЖХ/МС: м/z 489 [М+H]+
ВЭЖХ время удерживания: 1,88 мин (условия анализа U)
[Пример 105]
Соединение B2-14
8-[4-((2R,6S)-2,6-Диметил-морфолин-4-ил)пиперидин-1-ил]-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
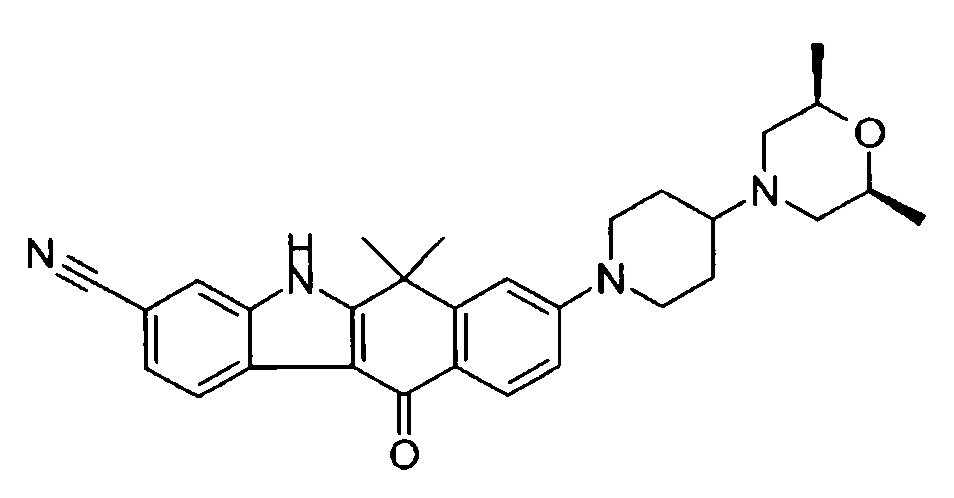
С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения B2-7-2 и (2R,6S)-2,6-диметилморфолина.
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,60 (1 H, с), 8,25-8,31 (1 H, м), 7,97-8,02 (1 H, м), 7,95 (1 H, с), 7,51-7,58 (1 H, м), 7,18 (1 H, с), 6,99-7,05 (1 H, м), 3,96-4,06 (2 H, м), 3,45-3,55 (2 H, м), 2,80-2,91 (2 H, м), 2,72-2,79 (2 H, м), 2,29-2,41 (1 H, м), 1,70-1,90 (10 H, м), 1,40-1,53 (2 H, м), 1,03 (6 H, д, 6,3 Гц).
ЖХ/МС: м/z 483 [М+H]+
ВЭЖХ время удерживания: 1,83 мин (условия анализа U)
[Пример 106]
Соединение B2-15
8-((3R,5S)-3,5-Диметилпиперазин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения B1 и 2,6-диметилпиперазина.
ЖХ/МС: m/z 399 [M+H]+
ВЭЖХ время удерживания: 1,76 мин (условия анализа U)
[Пример 107]
Соединение B2-16-1
трет-Бутиловый эфир (S)-4-(3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-ил)-3-метил-пиперазин-1-карбоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения B2-10, получали указанное в заголовке соединение, исходя из Соединения B1 и трет-бутилового эфира (S)-3-метилпиперазин-1-карбоновой кислоты.
ЖХ/МС: m/z 485 [M+H]+
ВЭЖХ время удерживания: 3,97 мин (условия анализа W)
[Пример 108]
Соединение B2-16-2
6,6-Диметил-8-((S)-2-метил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения 2-16-1.
ЖХ/МС: m/z 385 [M+H]+
ВЭЖХ время удерживания: 2,43 мин (условия анализа W)
[Пример 109]
Соединение B2-16-3
8-((S)-4-Циклобутил-2-метил-пиперазин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения B2-16-2 и циклобутанона.
1H-ЯМР(400 МГц, DМSO-d6) δ: 8,31 (1 H, д, 8 Гц), 8,03 (1 H, д, 12 Гц), 7,98 (1 H, с), 7,59 (1 H, д, 12 Гц), 7,13 (1 H, с), 6,98 (1 H, д, 8 Гц), 4,35-4,28 (1 H, м), 3,70 (1 H, д, 12 Гц), 3,02 (1 H, ддд, 12, 12,4 Гц), 2,87 (1 H, д, 8 Гц), 2,74-2,67 (2 H, м), 2,08-1,99 (2 H, м), 1,92-1,64 (10 H, м), 1,70-1,62 (2 H, м), 1,12 (3 H, д, 8 Гц).
ЖХ/МС: м/z 439 [М+H]+
ВЭЖХ время удерживания: 2,59 мин (условия анализа W)
[Пример 110]
Соединение B2-17
8-(2-Диэтиламино-этилсульфанил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-иловый эфир трифторметансульфоновой кислоты (Соединение B1, 25 мг, 0,057 ммоль) растворяли в диметоксиэтане (0,5 мл), добавляли 2-диэтиламиноэтантиол в форме соли хлористоводородной кислоты (19,6 мг, 2 экв.), Pd2(dba)3 (2,6 мг, 0,05 экв.), Xantphos (3,3 мг, 0,1 экв.) и DIPEA (0,06 мг, 6 экв.) и смесь перемешивали при 160°C в течение 30 минут. Реакционный раствор добавляли в воду, экстрагировали этилацетатом и сушили над сульфатом магния. Осушитель удаляли фильтрованием и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (дихлорметан/метанол) с получением целевого соединения (белое аморфное вещество, 22,4 мг, 93%).
1H-ЯМР (400 МГц, CDCl3) δ: 9,60 (1 H, с), 8,53-8,48 (1 H, м), 8,32 (1 H, д, J=8, 4 Гц), 7,77 (1 H, с), 7,53-7,50 (2 H, м), 7,38-7,35 (1 H, м), 3,18-3,12 (2 H, м), 2,81-2,75 (2 H, м), 2,65-2,57 (4 H, м), 1,76 (6 H, с), 1,08-1,04 (6 H, м).
ЖХ/МС: м/z 418 [М+H]+
ВЭЖХ время удерживания: 2,10 мин (условия анализа U)
[Пример 111]
Соединение B2-18
8-(2-Диизопропиламино-этилсульфанил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-17, получали указанное в заголовке соединение, исходя из Соединения B1 и 2-диизопропиламиноэтантиола в форме соли хлористоводородной кислоты.
ЖХ/МС: m/z 446 [M+H]+
ВЭЖХ время удерживания: 2,22 мин (условия анализа U)
Соединение B2-19
8-(2-Диметиламино-этилсульфанил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-17, получали указанное в заголовке соединение, исходя из Соединения B1 и 2-диметиламиноэтантиола в форме соли хлористоводородной кислоты.
ЖХ/МС: m/z 390 [M+H]+
ВЭЖХ время удерживания: 1,98 мин (условия анализа U)
[Пример 113]
Соединение B2-20
3-(3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-ил сульфанил)пропионовая кислота

С использованием тех же условий, как в способе синтеза Соединения B2-17, получали указанное в заголовке соединение, исходя из Соединения B1 и 3-меркаптопропионовой кислоты.
ЖХ/МС: m/z 391 [M+H]+
ВЭЖХ время удерживания: 2,45 мин (условия анализа U)
[Пример 114]
Соединение B2-21
8-(2,3-Дигидрокси-пропилсульфанил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-17, получали указанное в заголовке соединение, исходя из Соединения B1 и 3-меркаптопропан-1,2-диола.
ЖХ/МС: m/z 393 [M+H]+
ВЭЖХ время удерживания: 2,15 мин (условия анализа U)
[Пример 115]
Соединение B2-22-1
трет-Бутиловый эфир 4-(3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-ил)-3,6-дигидро-2H-пиридин-1-карбоновой кислоты
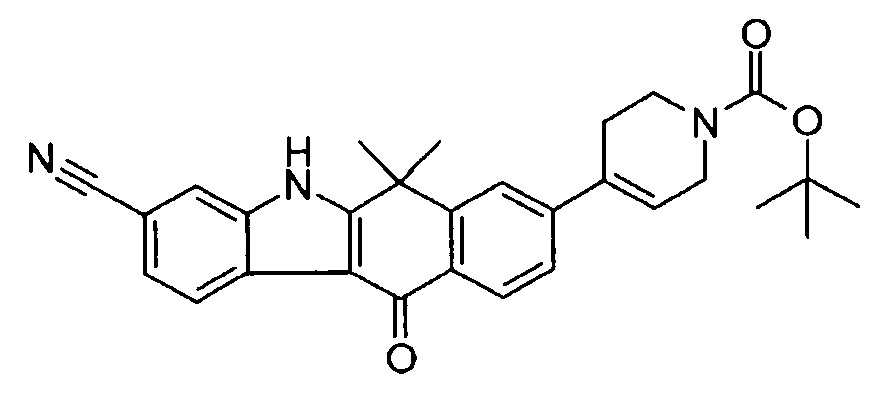
К 3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-иловому эфиру трифторметансульфоновой кислоты (Соединение B1, 7,80 г, 18,0 ммоль), трет-бутиловому эфиру 4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (6,11 г, 19,8 ммоль, 1,1 экв.), Pd(PPh3)2Cl2(630 мг, 0,898 ммоль, 0,05 экв.) и карбонату натрия (5,71 г, 53,9 ммоль, 3,0 экв.) добавляли DME (125 мл) и воду (25 мл). Смесь подвергали обработке ультразвуком в условиях пониженного давления с последующей продувкой газообразным азотом. Эту процедуру повторяли пять раз, и затем смесь дегазировали. После дальнейшего перемешивания при 80°C в течение 2 часов в атмосфере азота смесь охлаждали до комнатной температуры, добавляли воду (250 мл) и снова перемешивали в течение 30 минут. Осажденные вещества фильтровали и промывали водой (50 мл). Их дополнительно промывали при помощи CH3CN (50 мл) с получением целевого соединения в виде неочищенного продукта (серый порошок, 7,54 г, 90%).
ЖХ/МС: m/z 468 [M+H]+
ВЭЖХ время удерживания: 2,90 мин (условия анализа S)
[Пример 116]
Соединение B2-22-2
6,6-Диметил-11-оксо-8-(1,2,3,6-тетрагидро-пиридин-4-ил)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения B2-22-1.
ЖХ/МС: m/z 368 [M+H]+
ВЭЖХ время удерживания: 1,47 мин (условия анализа S)
[Пример 117]
Соединение B2-23
6,6-Диметил-8-(1-метил-1H-пиразол-4-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-22-1, получали указанное в заголовке соединение, исходя из Соединения B1 и 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола.
ЖХ/МС: m/z 367 [M+H]+
ВЭЖХ время удерживания: 2,42 мин (условия анализа U)
[Пример 118]
Соединение B2-24
6,6-Диметил-11-оксо-8-винил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

В атмосфере азота к 3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-иловому эфиру трифторметансульфоновой кислоты (Соединение B1, 1,00 г, 2,302 ммоль) добавляли н-пропанол (20 мл), винилтрифторборат калия (854 мг, 3,0 экв.), дихлор((бисдифенилфосфино)ферроценил)палладий (217 мг, 0,1 экв.) и триэтиламин (1,11 мл, 3,0 экв.), в указанном порядке, и полученную смесь перемешивали при 60°C в течение 4 часов. Сразу после завершения реакции к реакционному раствору добавляли воду. Осажденные вещества фильтровали и промывали дистиллированной водой и остатки сушили с получением указанного в заголовке соединения (666 мг, 80%).
1H-ЯМР(400 МГц, CDCl3) δ: 8,90 (1 H, с), 8,55 (1 H, д, J=7,9 Гц), 8,40 (1 H, д, J=8,5 Гц), 7,79 (1 H, с), 7,58-7,61 (3 H, м), 6,85 (1 H, дд, J=17,7, 11,0 Гц), 5,95 (1 H, д, J=17,1 Гц), 5,46 (1 H, д, J=11,0 Гц), 1,84 (6 H, с).
ЖХ/МС: м/z 313 [М+H]+
ВЭЖХ время удерживания: 3,75 мин (условия анализа W)
[Пример 119]
Соединение B2-25-1
трет-Бутиловый эфир 4-(3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илметил-пиперидин-1-карбоновой кислоты

трет-Бутиловый эфир 4-метилен-пиперидин-1-карбоновой кислоты (409 мг, 2,07 ммоль, 1,2 экв.) растворяли в ТГФ (2 мл), добавляли в атмосфере азота 9-BBN (0,5 M раствор в ТГФ, 4,83 мл, 2,42 ммоль, 1,4 экв.) и затем перемешивали при 60°C в течение 1 часа. Затем добавляли 9-BBN (0,5 M раствор в ТГФ, 5,52 мл, 2,77 ммоль, 1,6 экв.) и смесь перемешивали при 60°C в течение 1 часа. Полученную смесь охлаждали до комнатной температуры, добавляли фторид цезия (1,31 г, 8,60 ммоль, 5,0 экв.) и перемешивали при комнатной температуре в течение 30 минут.
К полученному раствору добавляли суспензию в DMF (18 мл), содержащую 3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-иловый эфир трифторметансульфоновой кислоты (Соединение B1, 750 мг, 1,73 ммоль) и дихлор((бисдифенилфосфино)ферроценил)палладий (70,5 мг, 0,0863 ммоль, 0,05 экв.), и смесь перемешивали при 100°C в течение 3 часов. После охлаждения до комнатной температуры добавляли воду (50 мл) с последующим экстрагированием этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Осушитель удаляли фильтрованием и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением трет-бутилового эфира 4-(3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илметил)пиперидин-1-карбоновой кислоты (желтый порошок, 763 мг, 91%).
ЖХ/МС: m/z 484 [M+H]+
ВЭЖХ время удерживания: 2,97 мин (условия анализа S)
[Пример 120]
Соединение B2-25-2
6,6-Диметил-11-оксо-8-пиперидин-4-илметил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения B2-25-1.
ЖХ/МС: m/z 384 [M+H]+
ВЭЖХ время удерживания: 1,40 мин (условия анализа S)
[Пример 121]
Соединение B2-26-1
Трет-бутил 4-((3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-ил)метил)пиперидин-1-ил сульфонилкарбаминовая кислота

С использованием тех же условий, как в способе синтеза Соединения A9-1, получали указанное в заголовке соединение, исходя из Соединения B2-25-2 и N-(трет-бутоксикарбонил)-N-[4-(диметилазаниумилиден)-1,4-дигидропиридин-1-ил сульфонил]азанида (CAS No. 872496-91-8).
ЖХ/МС: m/z 563 [M+H]+
ВЭЖХ время удерживания: 2,63 мин (условия анализа S)
[Пример 122]
Соединение B2-26-2
Амид 4-(3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илметил)пиперидин-1-сульфоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения B2-26-1.
ЖХ/МС: m/z 463 [M+H]+
ВЭЖХ время удерживания: 2,10 мин (условия анализа S)
[Пример 123]
Соединение B2-27
8-(1-Изопропил-пиперидин-4-илметил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения B2-25-2 и ацетона.
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,80 (1 H, с), 8,32 (1 H, д, 7,9 Гц), 8,12 (1 H, д, 7,9 Гц), 8,01 (1 H, с), 7,65 (1 H, с), 7,61 (1 H, д, 9,1 Гц), 7,30 (1 H, д, 7,9 Гц), 2,75 (2 H, д, 11,0 Гц), 2,65 (3 H, кв., 6,5 Гц), 2,04 (2 H, т, 11,0 Гц), 1,77 (6 H, с), 1,60-1,57 (3 H, м), 1,22 (2 H, т, 11,6 Гц), 0,94 (6 H, д, 6,7 Гц).
ЖХ/МС: м/z 426 [М+H]+
[Пример 124]
Соединение B2-28
3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-карбоновая кислота

В атмосфере азота, к раствору в диметилформамиде (3 мл), содержащему 3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-иловый эфир трифторметансульфоновой кислоты (Соединение B1, 150 мг, 0,345 ммоль), добавляли формиат лития моногидрат (90 мг, 5,0 экв.), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (Xantphos) (20 мг, 0,1 экв.), Pd2(dba)3(32 мг, 0,1 экв.), хлорид лития (88 мг, 6,0 экв.), N,N-диизопропилэтиламин (241 мкл, 4,0 экв.) и уксусный ангидрид (131 мкл, 4,0 экв.) и смесь перемешивали при 80°C в течение 15 часов. Сразу после завершения реакции к реакционному раствору добавляли этилацетат. Органический слой промывали, в указанном порядке, 1 M раствором хлористоводородной кислоты, дистиллированной водой и насыщенным солевым раствором. Органический слой сушили над сульфатом натрия. Осушитель удаляли фильтрованием и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (88 мг, 76%).
1H-ЯМР (400 МГц, DМSO-d6) δ: 13,17 (1 H, с), 8,35 (1 H, д, J=7,9 Гц), 8,34 (1 H, с), 8,23 (1 H, д, J=7,9 Гц), 8,07 (1 H, с), 8,02 (1 H, д, J=9,1 Гц), 7,64 (1 H, д, J=7,9 Гц), 1,80 (6 H, с).
ЖХ/МС: м/z 331 [М+H]+
ВЭЖХ время удерживания: 3,08 мин (условия анализа W)
[Пример 125]
Соединение B2-29
8-Формил-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

К суспензии 6,6-диметил-11-оксо-8-винил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрила (Соединение B2-24, 600 мг, 1,920 ммоль) в ТГФ (24 мл) и дистиллированной воде (6 мл) добавляли раствор тетраоксида осмия (192 мкл, 0,1 экв.) в трет-бутаноле и метаперйодат натрия (821 мг, 2,0 экв.) и смесь перемешивали при комнатной температуре в течение 3 часов. К реакционному раствору добавляли водный раствор тиосульфата натрия (0,3 M), затем смесь экстрагировали этилацетатом. Органический слой промывали 10% водным раствором динатрий этилендиаминтетрауксусной кислоты. Органический слой сушили над сульфатом натрия. Осушитель удаляли фильтрованием и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (470 мг, 77%).
1H-ЯМР (400 МГц, DМSO-d6) δ: 12,95 (1 H, с), 10,20 (1 H, с), 8,48 (1 H, с), 8,42 (1 H, д, J=8,5 Гц), 8,36 (1 H, д, J=8,5 Гц), 8,07 (1 H, с), 8,02 (1 H, д, J=7,9 Гц), 7,67 (1 H, д, J=7,9 Гц), 1,85 (6 H, с).
ЖХ/МС: м/z 315 [М+H]+
ВЭЖХ время удерживания: 3,38 мин (условия анализа W)
[Пример 126]
Соединение B3-1
5,6,6-Триметил-8-морфолин-4-ил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A10-1, получали указанное в заголовке соединение, исходя из Соединения B2-3.
ЖХ/МС: m/z 386 [M+H]+
ВЭЖХ время удерживания: 2,62 мин (условия анализа U)
[Пример 127]
Соединение B3-2-1
Трет-бутил 4-(3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-ил)пиперазин-1-ил сульфонилкарбаминовой кислот
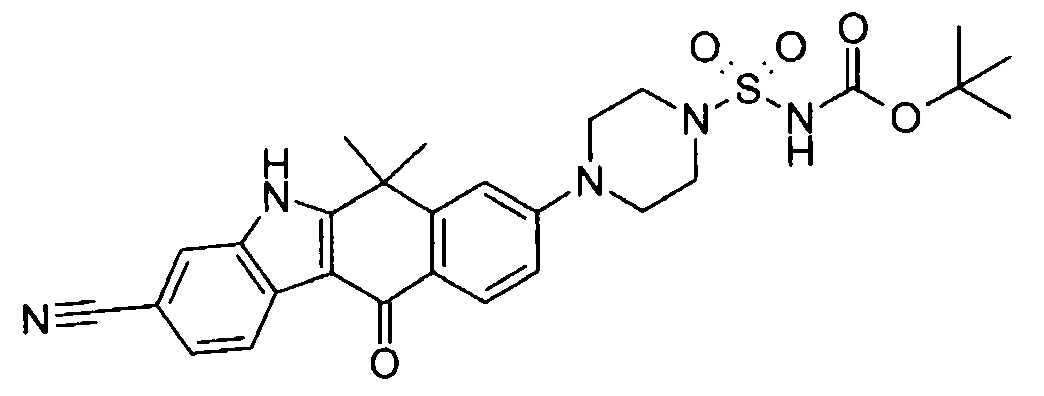
С использованием тех же условий, как в способе синтеза Соединения A9-1, получали указанное в заголовке соединение, исходя из Соединения B2-5-2 и N-(трет-бутоксикарбонил)-N-[4-(диметилазаниумилиден)-1,4-дигидропиридин-1-илсульфонил]азанида (CAS No. 872496-91-8).
ЖХ/МС: m/z 550 [M+H]+
ВЭЖХ время удерживания: 2,39 мин (условия анализа S)
[Пример 128]
Соединение B3-2-2
Амид 4-(3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-ил)пиперазин-1-сульфоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения B3-2-1.
ЖХ/МС: m/z 450 [M+H]+
ВЭЖХ время удерживания: 1,82 мин (условия анализа S)
[Пример 129]
Соединение B3-3
Диметиламид 4-(3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-ил)пиперазин-1-сульфоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения A9-1, получали указанное в заголовке соединение, исходя из Соединения B2-5-2 и диметилсульфамоилхлорида.
ЖХ/МС: m/z 478 [M+H]+
ВЭЖХ время удерживания: 2,45 мин (условия анализа S)
[Пример 130]
Соединение B3-4
Диметиламид 4-(3-циано-5,6,6-триметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-ил)пиперазин-1-сульфоновой кислоты
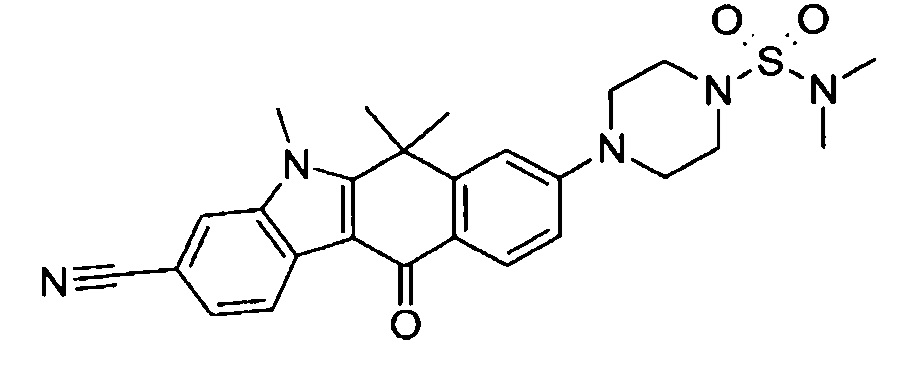
К DMF суспензии амида 4-(3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-ил)пиперазин-1-сульфоновой кислоты (Соединение B3-2-2, 20 мг, 0,04 ммоль) и гидрида натрия (21,4 мг, 12 экв.) добавляли йодметан (28 мкл, 10 экв.) и перемешивали при комнатной температуре в течение ночи. К реакционному раствору добавляли воду с последующим фильтрованием и получением целевого соединения (25,8 мг, 100%).
1H-ЯМР (270 МГц, DМSO-d6) δ: 8,43 (1 H, д, J=8,2 Гц), 8,31 (1 H, с), 8,03 (1 H, д, J=8,9 Гц), 7,64 (1 H, дд, J=8,1, 1,3 Гц), 7,30 (1 H, д, J=2,0 Гц), 7,08 (1 H, дд, J=8,9, 2,0 Гц), 4,16 (3 H, с), 3,43-3,53 (4 H, т, J=4,7 Гц), 3,26-3,41 (4H, с), 2,82 (6 H, с), 1,87 (6 H, с).
ЖХ/МС: м/z 492 [М+H]+
ВЭЖХ время удерживания: 2,69 мин (условия анализа S)
[Пример 131]
Соединение B3-5
8-(4-Циклопропил-пиперазин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

Указанное в заголовке соединение получали в виде побочного продукта синтеза Соединения F5-36.
ЖХ/МС: m/z 411 [M+H]+
ВЭЖХ время удерживания: 1,31 мин (условия анализа S)
[Пример 132]
Соединение B3-6
8-(4-Циклобутил-пиперазин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения B2-5-2 и циклобутанона.
1H-ЯМР (400 МГц, DМSO-d6) δ: 8,29 (1 H, д, J=8,2 Гц), 8,01 (1 H, д, J=8,8 Гц), 7,96 (1 H, с), 7,55 (1 H, д, J=8,2 Гц), 7,19 (1 H, д, J=2,2 Гц), 7,03 (1 H, дд, J=2,4, 8,8 Гц), 2,71-2,75 (1 H, м), 2,37-2,39(4 H, м), 1,98-2,00 (2 H, м), 1,77-1,85 (2 H, м), 1,74 (6 H, с), 1,63-1,68 (2 H, м).
ЖХ/МС: м/z 425 [М+H]+
ВЭЖХ время удерживания: 1,80 мин (условия анализа U)
[Пример 133]
Соединение B3-7
6,6-Диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения B2-5-2 и 3-оксетанона.
1H-ЯМР (400 МГц, DМSO-d6) δ: 8,29 (1 H, дд, J=8,2, 0,59 Гц), 8,02 (1 H, д, J=9,0 Гц), 7,97 (1 H, д, J=0,59 Гц), 7,56 (1 H, дд, J=8,0, 1,4 Гц), 7,22 (1 H, д, J=2,3 Гц), 7,04 (1 H, дд, J=8,8, 2,2 Гц), 4,56-4,59 (2 H, м), 4,47-4,50 (2 H, м), 3,43-3,48 (1 H, м), 3,39-3,42 (4 H, м), 2,40-2,42 (4 H, м), 1,74 (6 H, с).
ЖХ/МС: м/z 427 [М+H]+
ВЭЖХ время удерживания: 1,67 мин (условия анализа U)
[Пример 134]
Соединение B3-8
8-(2-Диэтиламино-этансульфонил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

8-(2-Диэтиламино-этилсульфанил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил (Соединение B2-17, 16,8 мг, 0,0402 ммоль) растворяли в метаноле (1,5 мл), добавляли оксон (54,3 мг, 2,2 экв.), который перед этим растворяли в воде (0,5 мл), и затем перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор концентрировали, экстрагировали этилацетатом, промывали насыщенным раствором гидрокарбоната натрия и сушили над сульфатом магния. Осушитель удаляли фильтрованием и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (дихлорметан/метанол) с получением целевого соединения (белое твердое вещество, 5,8 мг, 32%).
1H-ЯМР (400 МГц, CDCl3) δ: 9,29 (1 H, с), 8,61 (1 H, д, J=8,2 Гц), 8,52 (1 H, д, J=8,0 Гц), 8,21 (1 H, с), 8,01 (1 H, д, J=8,2 Гц), 7,81 (1 H, с), 7,61 (1 H, д, J=8,2 Гц), 3,33 (2 H, т, J=7,4 Гц), 2,95 (2 H, т, J=7,4 Гц), 2,41 (4 H, кв., J=7,2 Гц), 1,86 (6 H, с), 0,89 (4 H, т, J=7,1 Гц).
ЖХ/МС: м/z 450 [М+H]+
ВЭЖХ время удерживания: 2,05 мин (условия анализа U)
[Пример 135]
Соединение B3-9
8-(2-Диизопропиламино-этансульфонил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-8, получали указанное в заголовке соединение, исходя из Соединения B2-18.
ЖХ/МС: m/z 478 [M+H]+
ВЭЖХ время удерживания: 2,18 мин (условия анализа U)
[Пример 136]
Соединение B3-10
8-(2-Диметиламино-этансульфонил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
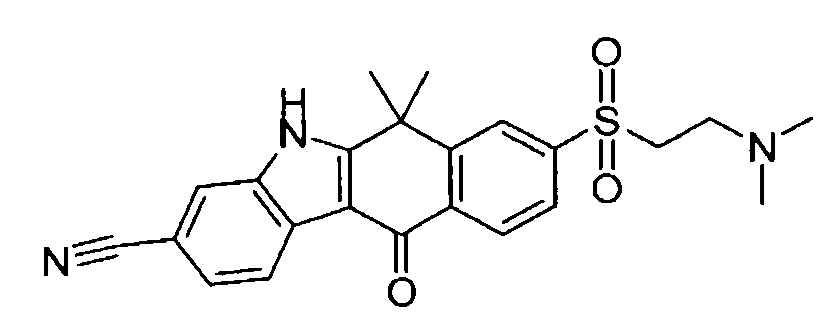
С использованием тех же условий, как в способе синтеза Соединения B3-8, получали указанное в заголовке соединение, исходя из Соединения B2-19.
ЖХ/МС: m/z 422 [M+H]+
ВЭЖХ время удерживания: 2,03 мин (условия анализа U)
[Пример 137]
Соединение B3-11
3-(3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-сульфонил)пропионовая кислота

С использованием тех же условий, как в способе синтеза Соединения B3-8, получали указанное в заголовке соединение, исходя из Соединения B2-20.
ЖХ/МС: m/z 423 [M+H]+
ВЭЖХ время удерживания: 2,28 мин (условия анализа U)
[Пример 138]
Соединение B3-12
8-(2,3-Дигидрокси-пропан-1-сульфонил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-8, получали указанное в заголовке соединение, исходя из Соединения B2-21.
ЖХ/МС: m/z 425 [M+H]+
ВЭЖХ время удерживания: 2,17 мин (условия анализа U)
[Пример 139]
Соединение B3-13-1
трет-Бутиловый эфир 4-(3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-ил)пиперидин-1-карбоновой кислоты

трет-Бутиловый эфир 4-(3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-ил)-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (Соединение B2-22-1, 16,2 г, 34,6 ммоль) растворяли в ТГФ (800 мл) и метаноле (230 мл), добавляли 10% масс. Pd/C (3,2 г) и перемешивали в атмосфере водорода в течение 19 часов. Твердое вещество фильтровали через Целит, элюировали смесью растворителей (400 мл; ТГФ/метанол=4/1) и концентрировали при пониженном давлении. Остатки растворяли в этилацетате (400 мл) и затем промывали 1% водным раствором N-ацетилцистеина, насыщенным водным раствором NaHCO3 и насыщенным солевым раствором. Органический слой сушили над сульфатом натрия. Осушитель удаляли фильтрованием, и остатки концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде неочищенного продукта (белый порошок, 14,0 г, 86%).
ЖХ/МС: m/z 470 [M+H]+
ВЭЖХ время удерживания: 2,88 мин (условия анализа S)
[Пример 140]
Соединение B3-13-2
6,6-Диметил-11-оксо-8-пиперидин-4-ил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения B3-13-1.
ЖХ/МС: m/z 370 [M+H]+
ВЭЖХ время удерживания: 1,30 мин (условия анализа S)
[Пример 141]
Соединение B3-14
8-(1,2-Дигидрокси-этил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

К ТГФ (1 мл) раствору 6,6-диметил-11-оксо-8-винил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрила (Соединение B2-24, 20 мг, 0,064 ммоль) добавляли раствор тетраоксида осмия (19 мкл, 0,3 экв.) в трет-бутаноле и 50% водный раствор N-метилморфолин-N-оксида (30 мкл, 2,0 экв.) и смесь перемешивали при комнатной температуре в течение 3 часов. К реакционному раствору добавляли 10% водный раствор динатрий этилендиаминтетрауксусной кислоты с последующим экстрагированием этилацетатом. Органический слой сушили над сульфатом натрия. Осушитель удаляли фильтрованием, и остатки, полученные после концентрирования при пониженном давлении, очищали при помощи высокоэффективной жидкостной хроматографии с получением указанного в заголовке соединения (21 мг, 63%).
1H-ЯМР(400 МГц, CD3OD) δ: 8,41 (1 H, д, J=7,9 Гц), 8,29 (1 H, д, J=7,9 Гц), 7,87 (1 H, с), 7,86 (1 H, с), 7,57 (1 H, д, J=7,9 Гц), 7,52 (1 H, д, J=6,7 Гц), 4,85 (1 H, дд, J=7,0, 4,6 Гц), 3,73 (1 H, дд, J=11,3, 4,6 Гц), 3,68 (1 H, дд, J=11,3, 7,0 Гц), 1,83 (6 H, с).
ЖХ/МС: м/z 347 [М+H]+
ВЭЖХ время удерживания: 2,68 мин (условия анализа W)
[Пример 142]
Соединение B3-15
6,6-Диметил-8-(морфолин-4-карбонил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

К раствору 3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-карбоновой кислоты (Соединение B2-28, 15 мг, 0,045 ммоль) в тетрагидрофуране (1 мл) добавляли морфолин (6 мкл, 1,5 экв.), уроний 2-(1H-7-азабензотриазол-1-ил)-1,1,3,3-тетраметилметан аминий гексафторфосфорную кислоту (HATU) (26 мг, 1,5 экв.) и N,N-диизопропилэтиламин (24 мкл, 3,0 экв.) и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционный раствор фильтровали для удаления нерастворимых веществ, и остатки, полученные после концентрирования при пониженном давлении, очищали при помощи высокоэффективной жидкостной хроматографии с получением указанного в заголовке соединения (11 мг, 55%).
1H-ЯМР (400 МГц, DМSO-d6) δ: 12,85 (1 H, с), 8,33 (1 H, д, J=8,5 Гц), 8,27 (1 H, д, J=7,9 Гц), 8,03 (1 H, с), 7,92 (1 H, с), 7,63 (1 H, д, J=8,5 Гц), 7,54 (1 H, д, J=7,9 Гц), 3,52-3,77 (6 H, м), 3,30-3,42 (2 H, м), 1,79 (6 H, с).
ЖХ/МС: м/z 400 [М+H]+
ВЭЖХ время удерживания: 2,96 мин (условия анализа W)
[Пример 143]
Соединение B3-16
8-(4-Метансульфонил-пиперазин-1-карбонил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-15, получали указанное в заголовке соединение, исходя из Соединения B2-28 и 1-метансульфонилпиперазина.
ЖХ/МС: m/z 477 [M+H]+
ВЭЖХ время удерживания: 3,03 мин (условия анализа W)
[Пример 144]
Соединение B3-17
8-(4-Гидрокси-пиперидин-1-карбонил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
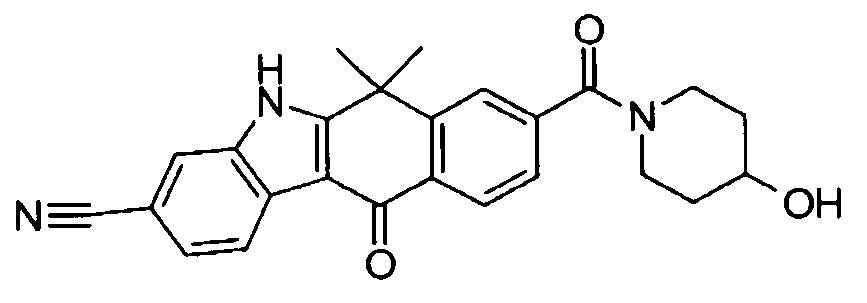
С использованием тех же условий, как в способе синтеза Соединения B3-15, получали указанное в заголовке соединение, исходя из Соединения B2-28 и пиперидин-4-ола.
ЖХ/МС: m/z 414 [M+H]+
ВЭЖХ время удерживания: 2,75 мин (условия анализа W)
[Пример 145]
Соединение B3-18
(2-Гидрокси-1-гидроксиметил-этил)амид 3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-карбоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения B3-15, получали указанное в заголовке соединение, исходя из Соединения B2-28 и 2-аминопропан-1,3-диола.
ЖХ/МС: m/z 404 [M+H]+
ВЭЖХ время удерживания: 2,60 мин (условия анализа W)
[Пример 146]
Соединение B3-19
(2-Метансульфонил-этил)амид 3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-карбоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения B3-15, получали указанное в заголовке соединение, исходя из Соединения B2-28 и 2-метансульфонилэтиламина.
ЖХ/МС: m/z 436 [M+H]+
ВЭЖХ время удерживания: 2,87 мин (условия анализа W)
[Пример 147]
Соединение B3-20
(1,1-Диоксо-тетрагидро-тиофен-3-ил)амид 3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-карбоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения B3-15, получали указанное в заголовке соединение, исходя из Соединения B2-28 и (1,1-диоксотетрагидротиофен-3-ил)амина.
ЖХ/МС: m/z 448 [M+H]+
ВЭЖХ время удерживания: 1,70 мин (условия анализа S)
[Пример 148]
Соединение B3-21
((R)-2,3-Дигидрокси-пропил)амид 3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-карбоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения B3-15, получали указанное в заголовке соединение, исходя из Соединения B2-28 и (R)-(+)-3-амино-1,2-пропандиола.
ЖХ/МС: m/z 404 [M+H]+
ВЭЖХ время удерживания: 1,38 мин (условия анализа S)
[Пример 149]
Соединение B3-22
Бис-(2-гидроксиэтил)амид 3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-карбоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения B3-15, получали указанное в заголовке соединение, исходя из Соединения B2-28 и N,N-диэтаноламин.
ЖХ/МС: m/z 418 [M+H]+
ВЭЖХ время удерживания: 1,35 мин (условия анализа S)
[Пример 150]
Соединение B3-23
Оксетан-3-иламид 3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-карбоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения B3-15, получали указанное в заголовке соединение, исходя из Соединения B2-28 и оксетан-3-иламина.
ЖХ/МС: m/z 386 [M+H]+
ВЭЖХ время удерживания: 1,63 мин (условия анализа S)
[Пример 151]
Соединение B3-24
(2-Гидрокси-этокси)амид 3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-карбоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения B3-15, получали указанное в заголовке соединение, исходя из Соединения B2-28 и 2-аминоокси-этанола.
ЖХ/МС: m/z 390 [M+H]+
ВЭЖХ время удерживания: 1,54 мин (условия анализа S)
[Пример 152]
Соединение B3-25-1
трет-Бутиловый эфир 2-[(3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-карбонил)амино]этил}карбаминовой кислоты

С использованием тех же условий, как в способе синтеза Соединения B3-15, получали указанное в заголовке соединение, исходя из Соединения B2-28 и трет-бутилового эфира (2-амино-этил)карбаминовой кислоты.
ЖХ/МС: m/z 473 [M+H]+
ВЭЖХ время удерживания: 2,08 мин (условия анализа S)
[Пример 153]
Соединение B3-25-2
(2-Амино-этил)амид 3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-карбоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения B3-25-1.
ЖХ/МС: m/z 373 [M+H]+
ВЭЖХ время удерживания: 1,19 мин (условия анализа S)
[Пример 154]
Соединение B3-25-3
(2-Метансульфониламино-этил)амид 3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-карбоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения A9-1, получали указанное в заголовке соединение, исходя из Соединения B3-25-2.
ЖХ/МС: m/z 451 [M+H]+
ВЭЖХ время удерживания: 1,62 мин (условия анализа S)
[Пример 155]
Соединение B3-26
(2-Гидрокси-этил)метил-амид 3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-карбоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения B3-15, получали указанное в заголовке соединение, исходя из Соединения B2-28 и 2-метиламино-этанол.
ЖХ/МС: m/z 388 [M+H]+
ВЭЖХ время удерживания: 1,53 мин (условия анализа S)
[Пример 156]
Соединение B3-27-1
Трет-бутил N-(2-(3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-карбоксамид)этил)сульфамоилкарбаминовая кислота
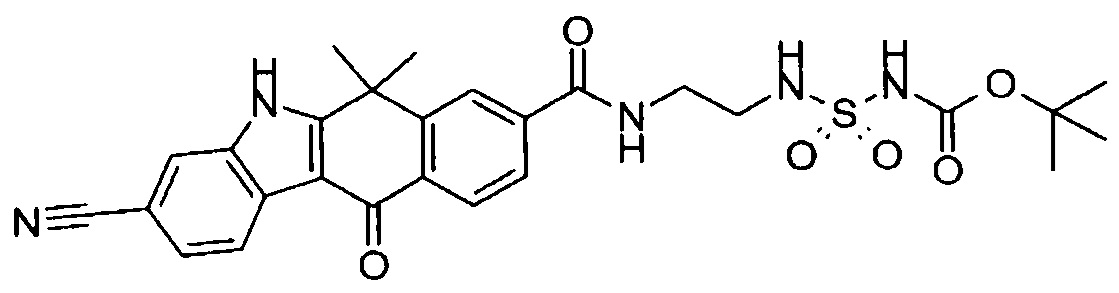
С использованием тех же условий, как в способе синтеза Соединения A9-1, получали указанное в заголовке соединение, исходя из Соединения B3-25-2 и N-(трет-бутоксикарбонил)-N-[4-(диметилазаниумилиден)-1,4-дигидропиридин-1-ил сульфонил]азанида (CAS No. 872496-91-8).
ЖХ/МС: m/z 552 [M+H]+
ВЭЖХ время удерживания: 2,03 мин (условия анализа S)
[Пример 157]
Соединение B3-27-2
3-Циано-6,6-диметил-11-оксо-N-(2-(сульфамоиламино)этил)-6,11-дигидро-5H-бензо[b]карбазол-8-карбоксамид

С использованием тех же условий, как в способе синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения B3-27-1.
ЖХ/МС: m/z 452 [M+H]+
ВЭЖХ время удерживания: 1,57 мин (условия анализа S)
[Пример 158]
Соединение B3-28
8-[4-(2-Гидрокси-этил)пиперазин-1-карбонил]-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-15, получали указанное в заголовке соединение, исходя из Соединения B2-28 и 2-пиперазин-1-илэтанола.
ЖХ/МС: m/z 443 [M+H]+
ВЭЖХ время удерживания: 1,75 мин (условия анализа U)
[Пример 159]
Соединение B3-29
8-(4-Трет-бутил-пиперазин-1-карбонил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-15, получали указанное в заголовке соединение, исходя из Соединения B2-28 и 1-трет-бутилпиперазина.
ЖХ/МС: m/z 455 [M+H]+
ВЭЖХ время удерживания: 1,88 мин (условия анализа U)
[Пример 160]
Соединение B3-30
8-[4-(2-Метокси-этил)пиперазин-1-карбонил]-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-15, получали указанное в заголовке соединение, исходя из Соединения B2-28 и 1-(2-метоксиэтил)пиперазина.
ЖХ/МС: m/z 457 [M+H]+
ВЭЖХ время удерживания: 1,83 мин (условия анализа U)
[Пример 161]
Соединение B3-31-1
трет-Бутиловый эфир 4-(3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-карбонил)пиперазин-1-карбоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения B3-15, получали указанное в заголовке соединение, исходя из Соединения B2-28 и трет-бутилового эфира пиперазин-1-карбоновой кислоты.
ЖХ/МС: m/z 499 [M+H]+
ВЭЖХ время удерживания: 2,63 мин (условия анализа U)
[Пример 162]
Соединение B3-31-2
6,6-Диметил-11-оксо-8-(пиперазин-1-карбонил)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения B3-31-1.
ЖХ/МС: m/z 399 [M+H]+
ВЭЖХ время удерживания: 1,78 мин (условия анализа U)
[Пример 163]
Соединение B3-32
6,6-Диметил-8-морфолин-4-илметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

К ТГФ (1 мл) раствору Соединения B2-29 (30 мг, 0,095 ммоль) добавляли морфолин (6 мкл, 1,5 экв.) и триацетоксиборогидрид натрия (81 мг, 2,0 экв.) и перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор фильтровали для удаления нерастворимых веществ, и остатки, полученные после концентрирования при пониженном давлении, очищали при помощи высокоэффективной жидкостной хроматографии с получением указанного в заголовке соединения (19 мг, 50%).
H-ЯМР(400 МГц, CD3OD) δ: 8,41 (1 H, д, 7,9 Гц), 8,27 (1 H, д, 8,5 Гц), 7,87 (1 с), 7,81 (1 H, с), 7,56 (1 H, д, 8,5 Гц), 7,49 (1 H, д, 7,9 Гц), 3,71 (4 H, т, 4,6 Гц), 3,68 (2 H, с), 2,51 (4 H, т, 4,6 Гц), 1,82 (6 H, с).
ЖХ/МС: м/z 386 [М+H]+
ВЭЖХ время удерживания: 2,41 мин (условия анализа W)
[Пример 164]
Соединение B3-33
6,6-Диметил-8-(4-метил-пиперазин-1-илметил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения B2-29 и 1-метилпиперазина.
1H-ЯМР(400 МГц, CD3OD) δ: 8,41 (1 H, д, 7,9 Гц), 8,26 (1 H, д, 7,9 Гц), 7,88 (1 с), 7,81 (1 H, с), 7,56 (1 H, д, 7,9 Гц), 7,48 (1 H, д, 7,9 Гц), 3,70 (2 H, с), 2,42-2,78 (8 H, м), 2,31 (3 H, с), 1,82 (6 H, с).
ЖХ/МС: м/z 399 [М+H]+
ВЭЖХ время удерживания: 2,30 мин (условия анализа W)
[Пример 165]
Соединение B3-34
8-[4-(1,1-Диоксид-4-тиоморфолинил)метил]-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения B2-29 и тиоморфолин 1,1-диоксида.
ЖХ/МС: m/z 434 [M+H]+
ВЭЖХ время удерживания: 2,75 мин (условия анализа W)
[Пример 166]
Соединение B3-35
8-(4-Метансульфонил-пиперазин-1-илметил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения B2-29 и 1-метансульфонилпиперазина.
1H-ЯМР(400 МГц, CD3OD) δ: 8,41 (1 H, д, 8,5 Гц), 8,28 (1 H, д, 7,9 Гц), 7,87 (1 с), 7,80 (1 H, с), 7,56 (1 H, д, 8,5 Гц), 7,50 (1 H, д, 7,9 Гц), 3,73 (2 H, с), 3,24-3,28 (4 H, м), 2,85 (3 H, с), 2,59-2,65 (4 H, м), 1,82 (6 H, с).
ЖХ/МС: м/z 463 [М+H]+
ВЭЖХ время удерживания: 2,47 мин (условия анализа W)
[Пример 167]
Соединение B3-36
Диметиламид 4-(3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илметил)пиперазин-1-сульфоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения B2-29 и диметиламида пиперазин-1-сульфоновой кислоты.
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,79 (1 H, с), 8,32 (1 H, д, 7,9 Гц), 8,18 (1 H, д, 7,9 Гц), 8,00 (1 с), 7,77 (1 H, с), 7,60 (1 H, д, 7,9 Гц), 7,46 (1 H, д, 7,9 Гц), 3,67 (2 H, с), 3,18-3,23 (4 H, м), 2,76 (6 H, с), 2,45-2,50 (4 H, м), 1,77 (6 H, с).
ЖХ/МС: м/z 492 [М+H]+
ВЭЖХ время удерживания: 2,58 мин (условия анализа W)
[Пример 168]
Соединение B3-37
6,6-Диметил-11-оксо-8-[(2,2,2-трифтор-этиламино)метил]-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения B2-29 и 2,2,2-трифторэтиламина.
ЖХ/МС: m/z 398 [M+H]+
ВЭЖХ время удерживания: 2,73 мин (условия анализа W)
[Пример 169]
Соединение B3-38
8-Гидроксиметил-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
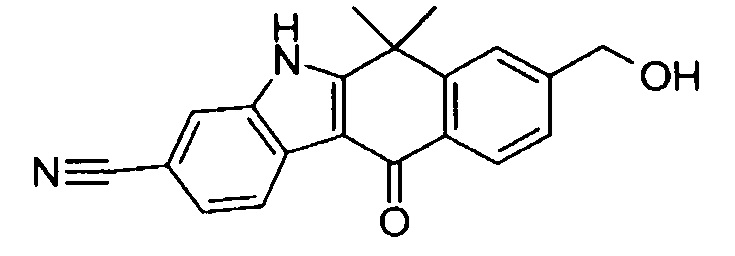
Побочный продукт, полученный в реакции синтеза Соединения B3-37, очищали при помощи высокоэффективной жидкостной хроматографии с получением целевого соединения.
ЖХ/МС: m/z 317 [M+H]+
ВЭЖХ время удерживания: 2,91 мин (условия анализа W)
[Пример 170]
Соединение B4-1
8-(1-Циклобутил-пиперидин-4-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
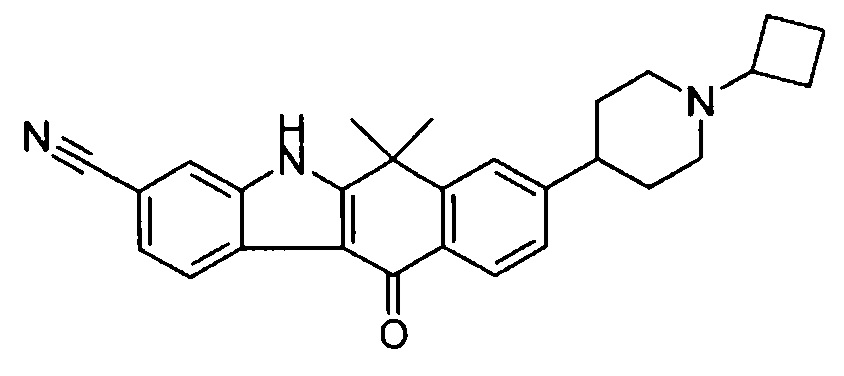
С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения B3-13-2 и циклобутанона.
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,73 (1 H, с), 8,28-8,33 (1 H, м), 8,09-8,14 (1 H, м), 7,99 (1 H, с), 7,72 (1 H, с), 7,56-7,62 (1 H, м), 7,34-7,41 (1 H, м), 3,52-3,64 (2 H, м), 2,85-2,95 (2 H, м), 2,56-2,75 (2 H, м), 1,91-2,04 (2 H, м), 1,56-1,84 (14 H, м).
ЖХ/МС: м/z 424 [М+H]+
ВЭЖХ время удерживания: 1,87 мин (условия анализа U)
[Пример 171]
Соединение B4-2
8-(1-Метансульфонил-пиперидин-4-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
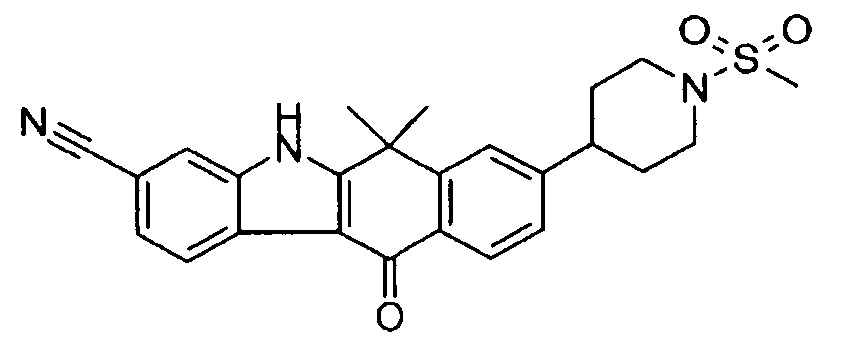
С использованием тех же условий, как в способе синтеза Соединения A9-1, получали указанное в заголовке соединение, исходя из Соединения B3-13-2 и мезилхлорида.
1H-ЯМР(270 МГц, DМSO-d6) δ: 12,77 (1 H, с), 8,31 (1 H, д, 8,6 Гц), 8,15 (1 H, д, 8,2 Гц), 8,00 (1 H, с), 7,77 (1 H, с), 7,59 (1H, д, 7,3 Гц), 7,42 (1 H, д, 8,6 Гц), 3,74-3,70 (1 H, м), 2,93 (3 H, с), 2,86-2,77 (4H, м), 1,93-1,87 (4 H, м), 1,77 (6,0 H, с).
ЖХ/МС: м/z 448 [М+H]+
ВЭЖХ время удерживания: 2,37 мин (условия анализа S)
[Пример 172]
Соединение B4-3-1
Трет-бутил 4-(3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-ил)пиперидин-1-илсульфонилкарбаминовая кислота
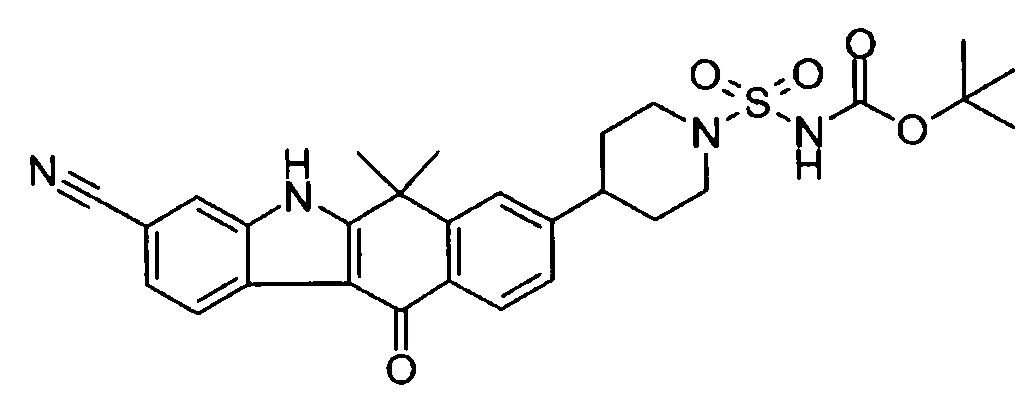
С использованием тех же условий, как в способе синтеза Соединения A9-1, получали указанное в заголовке соединение, исходя из Соединения B3-13-2 и N-(трет-бутоксикарбонил)-N-[4-(диметилазаниумилиден)-1,4-дигидропиридин-1-ил-сульфонил]азанида.
ЖХ/МС: m/z 549 [M+H]+
ВЭЖХ время удерживания: 2,72 мин (условия анализа S)
[Пример 173]
Соединение B4-3-2
Амид 4-(3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-ил)пиперидин-1-сульфоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения B4-3-1.
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,78 (1 H, с), 8,29 (1 H, д, 7,9 Гц), 8,14 (1 H, д, 8,5 Гц), 7,97 (1 H, с), 7,76 (1 H, с), 7,55 (1 H, д, 8,5 Гц), 7,41 (1 H, д, 7,9 Гц), 6,79 (2 H, с), 3,63 (2 H, д, 12,2 Гц), 2,80-2,73 (1 H, м), 2,70-2,64 (2 H, м), 1,96-1,93 (2 H, м), 1,87-1,81 (2 H, м), 1,77 (6 H, с).
ЖХ/МС: м/z 449 [М+H]+
ВЭЖХ время удерживания: 2,03 мин (условия анализа S)
[Пример 174]
Соединение B4-4
Метиламид 4-(3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-ил)пиперидин-1-сульфоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения A9-1, получали указанное в заголовке соединение, исходя из Соединения B3-13-2 и метиламида 2-оксооксазолидин-3-сульфоновой кислоты.
ЖХ/МС: m/z 463 [M+H]+
ВЭЖХ время удерживания: 2,40 мин (условия анализа S)
[Пример 175]
Соединение B4-5
Диметиламид 4-(3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-ил)пиперидин-1-сульфоновой кислоты
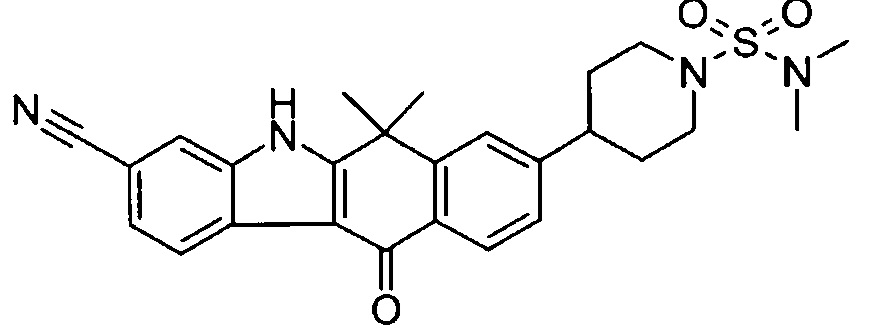
С использованием тех же условий, как в способе синтеза Соединения A9-1, получали указанное в заголовке соединение, исходя из Соединения B3-13-2 и диметилсульфамоилхлорида.
ЖХ/МС: m/z 477 [M+H]+
ВЭЖХ время удерживания: 2,65 мин (условия анализа S)
[Пример 176]
Соединение B4-6
6,6-Диметил-8-(1-метил-пиперидин-4-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A9-1, получали указанное в заголовке соединение, исходя из Соединения B3-13-2 и йодметана.
ЖХ/МС: m/z 384 [M+H]+
ВЭЖХ время удерживания: 1,50 мин (условия анализа S)
[Пример 177]
Соединение B4-7
8-(1-Изопропил-пиперидин-4-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения B3-13-2 и ацетона.
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,77 (1 H, с), 8,32 (1 H, д, 7,9 Гц), 8,13 (1 H, д, 7,9 Гц), 8,01 (1 H, с), 7,73 (1 H, с), 7,61 (1H, д, 9,1 Гц), 7,39 (1 H, д, 9,8 Гц), 2,93 (2 H, д, 11,0 Гц), 2,77-2,71 (1 H, м), 2,67-2,62 (1 H, м), 2,25 (2 H, т, 10,1 Гц), 1,80-1,73 (10 H, м), 1,02 (6 H, д, 6,7 Гц).
ЖХ/МС: м/z 412 [М+H]+
ВЭЖХ время удерживания: 1,60 мин (условия анализа S)
[Пример 178]
Соединение B4-8
6,6-Диметил-8-(1-оксетан-3-ил-пиперидин-4-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения B3-13-2 и оксетан-3-она.
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,74 (1 H, с), 8,32 (1 H, д, 7,9 Гц), 8,13 (1 H, д, 7,9 Гц), 8,00 (1 H, с), 7,74 (1 H, с), 7,61 (1 H, д, 9,8 Гц), 7,40 (1 H, д, 7,9 Гц), 4,56 (2 H, т, 6,7 Гц), 4,46 (2 H, т, 6,1 Гц), 3,46-3,39 (1 H, м), 2,85-2,82 (2 H, м), 2,71-2,64 (1 H, м), 1,92-1,86 (2 H, м), 1,82-1,79 (4 H, м), 1,77 (6 H, с).
ЖХ/МС: м/z 426 [М+H]+
ВЭЖХ время удерживания: 1,53 мин (условия анализа S)
Соль серной кислоты Соединения B4-8
6,6-Диметил-8-(1-оксетан-3-ил-пиперидин-4-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил растворяли при 80°C в смеси 5 объемов DMA и 1,4 объемов 2 н серной кислоты. После охлаждения до комнатной температуры добавляли 15 объемов ацетона по каплям, и осажденные твердые вещества фильтровали и сушили с получением 6,6-диметил-8-(1-оксетан-3-ил-пиперидин-4-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрила в форме соли серной кислоты.
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,81 (1 H, с), 10,26 (1 H, ушир. с), 8,33 (1 H, д, 8,3 Гц), 8,21 (1 H, д, 8,3 Гц), 8,04 (1 H, с), 7,75 (1 H, с), 7,63 (1 H, д, 8,3 Гц), 7,41 (1 H, д, 8,3 Гц), 4,85-4,70 (4 H, м), 4,50-4,40 (1 H, ушир. с), 3,60-3,00 (6 H, ушир. м), 2,20-2,10 (2 H, м), 2,05-1,90 (2 H, м), 1,79 (6 H, с).
ЖХ/МС: м/z 426 [М+H]+
[Пример 179]
Соединение B4-9
Этиламид 4-(3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-ил)пиперидин-1-карбоновой кислоты
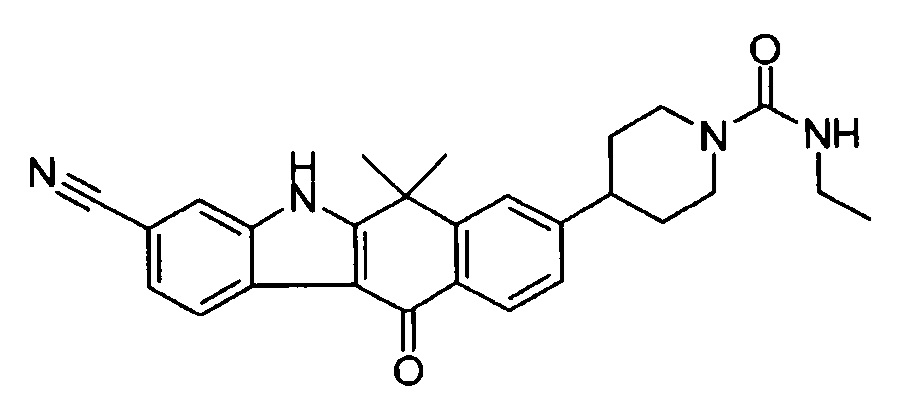
С использованием тех же условий, как в способе синтеза Соединения A9-1, получали указанное в заголовке соединение, исходя из Соединения B3-13-2 и этилизоцианата.
ЖХ/МС: m/z 441 [M+H]+
ВЭЖХ время удерживания: 2,20 мин (условия анализа S)
[Пример 180]
Соединение B4-10
8-[1-(Имидазол-1-сульфонил)пиперидин-4-ил]-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

В соответствии со способом, раскрытым в Journal of Organic Chemistry, 2003, стр. 115, 6,6-диметил-11-оксо-8-пиперидин-4-ил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил (Соединение B3-13-2, 10 мг, 0,027 ммоль) подвергали взаимодействию с 3-(имидазол-1-сульфонил)-1-метил-3H-имидазол-1-ием (19 мг, 2 экв.). После удаления растворителя остатки очищали жидкостной хроматографией с получением указанного в заголовке соединения (3 мг).
ЖХ/МС: m/z 500 [M+H]+
ВЭЖХ время удерживания: 2,80 мин (условия анализа C)
[Пример 181]
Соединение CC1
3-Метокси-5,5-диметил-6-оксо-5,6,7,8-тетрагидро-нафталин-2-сульфонилхлорид

К раствору 7-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-она (Соединение A2, 200 мг, 0,980 ммоль) в дихлорметане (2 мл) добавляли хлорсульфоновую кислоту (110 мкл, 1,70 экв.) и смесь перемешивали при комнатной температуре в течение 2 часов. К реакционному раствору добавляли оксалилхлорид (297 мкл, 3,0 экв.) и N,N-диметилформамид (45 мкл, 0,6 экв.) тремя отдельными порциями и смесь перемешивали при комнатной температуре в течение 30 минут. Реакционный раствор концентрировали при пониженном давлении с получением указанного в заголовке соединения (295 мг). Поскольку указанное в заголовке соединение не было стабильным, его структуру идентифицировали на следующей стадии.
[Пример 182]
Соединение CC2-1
7-Метокси-1,1-диметил-6-(пирролидин-1-сульфонил)-3,4-дигидро-1H-нафталин-2-он
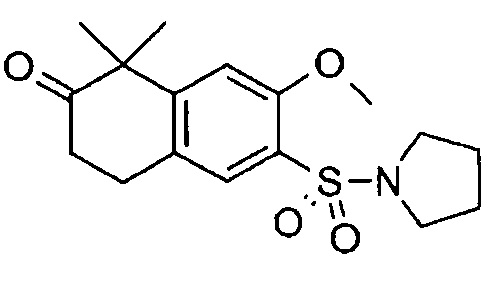
Раствор 3-метокси-5,5-диметил-6-оксо-5,6,7,8-тетрагидро-нафталин-2-сульфонилхлорида (Соединение CC1, 295 мг, 0,974 ммоль) в ТГФ (4 мл) охлаждали до 0°C и добавляли по каплям раствор пирролидина (121 мкл, 1,5 экв.) и триэтиламина (272 мкл, 2 экв.) в тетрафуране (1 мл) в течение 2 минут. Смесь перемешивали при 0°C вплоть до исчезновения Соединения CC-1. К реакционному раствору добавляли дистиллированную воду и экстрагировали этилацетатом. Органический слой промывали 10% водным раствором динатрий этилендиаминтетрауксусной кислоты. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Осушитель удаляли фильтрованием, и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (246 мг, 75%).
1H-ЯМР(400 МГц, CDCl3) δ: 7,76 (1 H, с), 6,93 (1 H, с), 3,95 (3 H, с), 3,37-3,46 (4H, м), 3,09 (0,0 H, т, J=6,9 Гц), 2,69 (0,0 H, т, J=6,9 Гц), 1,82-1,91 (4 H, м), 1,47 (6 H, с).
ЖХ/МС: м/z 338 [М+H]+
ВЭЖХ время удерживания: 3,21 мин (условия анализа W)
[Пример 183]
Соединение CC2-2
7-Метокси-1,1-диметил-6-(4-метилпиперазин-1-сульфонил)-3,4-дигидро-1H-нафталин-2-он
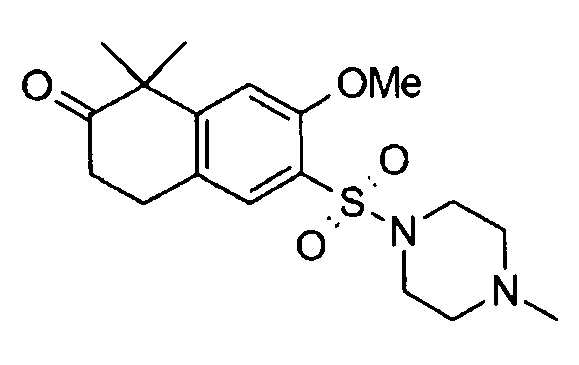
С использованием тех же условий, как в способе синтеза Соединения CC2-1, получали указанное в заголовке соединение, исходя из Соединения CC1 и N-метилпиперазина.
ЖХ/МС: m/z 367 [M+H]+
ВЭЖХ время удерживания: 2,22 мин (условия анализа Y)
[Пример 184]
Соединение CC3-1
8-Метокси-6,6-диметил-9-(пирролидин-1-сульфонил)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E2-1, получали указанное в заголовке соединение, исходя из Соединения CC2-1.
ЖХ/МС: m/z 436 [M+H]+
ВЭЖХ время удерживания: 3,76 мин (условия анализа W)
[Пример 185]
Соединение CC3-2
3-Бром-8-метокси-6,6-диметил-9-(4-метилпиперазин-1-сульфонил)-6,11-дигидро-5H-бензо[b]карбазол

С использованием тех же условий, как в способе синтеза Соединения A3-1, получали указанное в заголовке соединение, исходя из Соединения CC2-2.
ЖХ/МС: m/z 519 [M+H]+
ВЭЖХ время удерживания: 2,99 мин (условия анализа Y)
[Пример 186]
Соединение CC4-1
8-Метокси-6,6-диметил-11-оксо-9-(пирролидин-1-сульфонил)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A4, получали указанное в заголовке соединение, исходя из Соединения CC3-1.
1H-ЯМР (400 МГц, DМSO-d6) δ: 12,86 (1 H, с), 8,60 (1 H, с), 8,30 (1 H, д, J=8,5 Гц), 8,01 (1 H, с), 7,60 (1 H, с), 7,59 (1 H, д, J=8,5 Гц), 4,09 (3 H, с), 3,21-3,42 (4 H, м), 1,72-1,90 (10 H, м).
ЖХ/МС: м/z 450 [М+H]+
ВЭЖХ время удерживания: 3,40 мин (условия анализа W)
[Пример 187]
Соединение CC4-2
3-Бром-8-метокси-6,6-диметил-9-(4-метилпиперазин-1-сульфонил)-5,6-дигидро-бензо[b]карбазол-11-он

С использованием тех же условий, как в способе синтеза Соединения A4, получали указанное в заголовке соединение, исходя из Соединения CC3-2.
ЖХ/МС: m/z 532, 534 [M+H]+
ВЭЖХ время удерживания: 2,18 мин (условия анализа U)
[Пример 188]
Соединение CC-4-3
8-Метокси-6,6-диметил-9-(4-метилпиперазин-1-сульфонил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A5-2, получали указанное в заголовке соединение, исходя из Соединения CC4-2.
ЖХ/МС: m/z 479 [M+H]+
ВЭЖХ время удерживания: 1,93 мин (условия анализа U)
[Пример 189]
Соединение C1-1
3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-иловый эфир диметилсульфаминовой кислоты

8-Гидрокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил (Соединение A6, 50 мг, 0,165 ммоль) растворяли в DMF (1,5 мл), добавляли гидрид натрия (13 мг, 2,0 экв.) и диметилсульфамоилхлорид (0,02 мл, 1,2 экв.) и затем перемешивали при комнатной температуре в течение 1 часа. К реакционному раствору добавляли воду, затем смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Осушитель удаляли фильтрованием, и остатки концентрировали при пониженном давлении с получением целевого соединения (желтовато-белый порошок, 62 мг, 92%).
1H-ЯМР(270 МГц, DМSO-d6) δ: 12,87 (1 H, с), 8,40-8,30 (2 H, м), 8,05 (1 H, с), 7,82 (1 H, д, J=1,8 Гц), 7,64 (1 H, д, J=7,9 Гц), 7,50 (1 H, дд, J=8,5, 2,4 Гц), 2,96 (6 H, с), 1,81 (6 H, с).
ЖХ/МС: м/z 410 [М+H]+
ВЭЖХ время удерживания: 2,38 мин (условия анализа S)
[Пример 190]
Соединение C1-2
3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-иловый эфир морфолин-4-сульфоновой кислоты

В соответствии со способом, аналогичным способу синтеза Соединения A8-17, получали указанное в заголовке соединение в виде неочищенного продукта, исходя из Соединения A6 и Соединения A8-18-0.
[Пример 191]
Соединение C1-4
3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-иловый эфир 4-метилпиперазин-1-сульфоновой кислоты

В соответствии со способом, аналогичным способу синтеза Соединения A8-17, получали указанное в заголовке соединение в виде неочищенного продукта, исходя из Соединения A6 и Соединения A8-19-0.
[Пример 192]
Соединение C2-1
Диметиламид 3-циано-8-гидрокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-сульфоновой кислоты
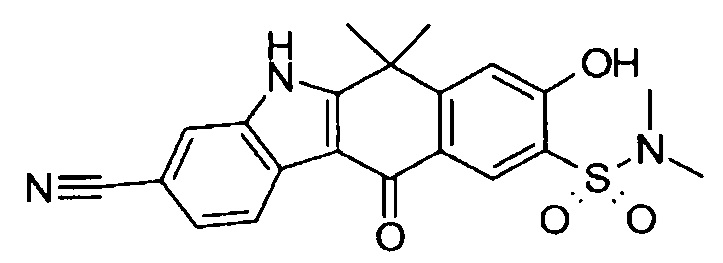
К 3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-иловому эфиру диметилсульфаминовой кислоты (Соединение C1-1, 250 мг, 0,610 ммоль) добавляли хлорид алюминия (1,0 M раствор в нитрометане (1,8 мл, 3,0 экв.)) и смесь перемешивали при 160°C в течение 10 минут в условиях микроволнового облучения. К реакционному раствору добавляли воду, затем смесь экстрагировали дихлорметаном. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Осушитель удаляли фильтрованием, и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (дихлорметан/метанол) с получением целевого соединения (желтовато-белый порошок, 99 мг, 40%).
1H-ЯМР(270 МГц, DМSO-d6) δ: 12,78 (1 H, с), 11,72 (1 H, с), 8,50 (1 H, с), 8,32 (1 H, д, J=8,5 Гц), 8,02 (1 H, с), 7,62 (1 H, д, J=7,9 Гц), 7,25 (1 H, с), 2,80 (6 H, с), 1,75 (6 H, с).
ЖХ/МС: м/z 410 [М+H]+
ВЭЖХ время удерживания: 2,00 мин (условия анализа S)
[Пример 193]
Соединение C2-2
8-Гидрокси-6,6-диметил-11-оксо-9-(пирролидин-1-сульфонил)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E3-2, получали указанное в заголовке соединение, исходя из Соединения CC4-1.
ЖХ/МС: m/z 436 [M+H]+
ВЭЖХ время удерживания: 3,32 мин (условия анализа W)
[Пример 194]
Соединение C2-3
8-Гидрокси-6,6-диметил-9-(морфолин-4-сульфонил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения C2-1, получали указанное в заголовке соединение, исходя из Соединения C1-2.
ЖХ/МС: m/z 452 [M+H]+
ВЭЖХ время удерживания: 1,89 мин (условия анализа S)
[Пример 195]
Соединение C2-4
8-Гидрокси-6,6-диметил-9-(4-метилпиперазин-1-сульфонил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
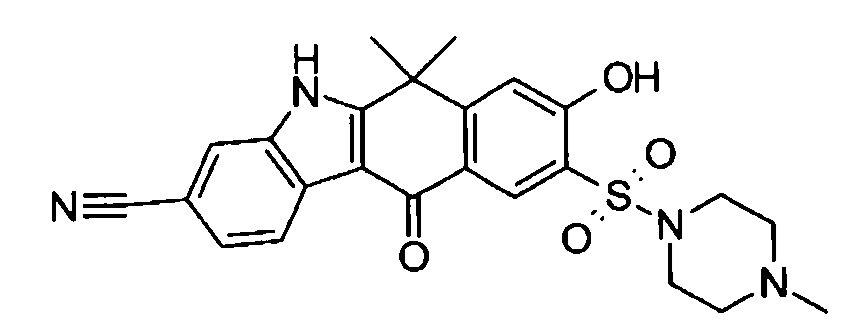
С использованием тех же условий, как в способе синтеза Соединения E3-2, получали указанное в заголовке соединение, исходя из Соединения CC4-3.
ЖХ/МС: m/z 465 [M+H]+
ВЭЖХ время удерживания: 1,87 мин (условия анализа U)
[Пример 196]
Соединение C3-1
3-Циано-9-диметилсульфамоил-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-иловый эфир трифторметансульфоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения B1, получали указанное в заголовке соединение, исходя из Соединения C2-1.
1H-ЯМР (270 МГц, DМSO-d6) δ: 13,05 (1 H, с), 8,67 (1 H, с), 8,32 (1 H, д, J=8,2 Гц), 8,06 (2 H, м), 7,67 (1 H, дд, J=7,9, 1,3 Гц), 2,79 (6 H, с), 1,84 (6 H, с).
ЖХ/МС: м/z 542 [М+H]+
ВЭЖХ время удерживания: 2,67 мин (условия анализа S)
[Пример 197]
Соединение C3-2
3-Циано-6,6-диметил-11-оксо-9-(пирролидин-1-сульфонил)-6,11-дигидро-5H-бензо[b]карбазол-8-иловый эфир трифторметансульфоновой кислоты
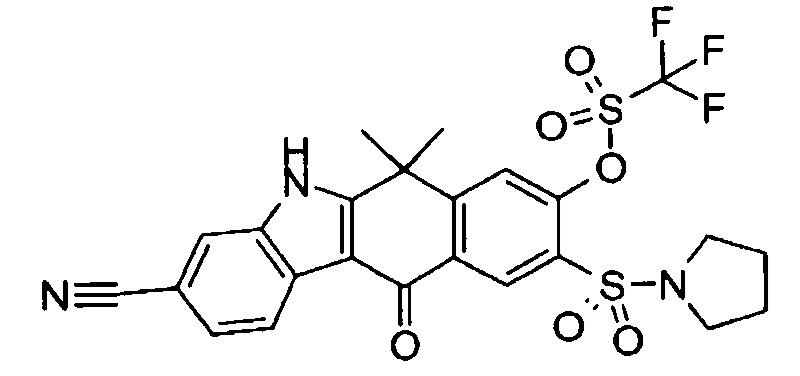
С использованием тех же условий, как в способе синтеза Соединения B1, получали указанное в заголовке соединение, исходя из Соединения C2-2.
ЖХ/МС: m/z 568 [M+H]+
ВЭЖХ время удерживания: 4,00 мин (условия анализа W)
[Пример 198]
Соединение C4-1
Диметиламид 3-циано-8-(2-метокси-этокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-сульфоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения C2-1 и 1-бром-2-метокси-этана.
1H-ЯМР(300 МГц, DМSO-d6) δ м.д. 12,8 (с, 1H), 8,58 (с, 1 H), 8,31 (д, 1 H, J=8,4 Гц), 8,03 (с, 1 H), 7,62 (м, 2 H), 4,47 (м, 2H), 3,75 (м, 2 H), 3,32 (с, 3 H), 2,27 (с, 6 H), 1,83 (с, 6 H).
ЖХ/МС: м/z 468 [М+H]+
ВЭЖХ время удерживания: 2,68 мин (условия анализа U)
[Пример 199]
Соединение C4-2
Диметиламид 3-циано-8-(2-диэтиламино-этокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-сульфоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения C2-1.
1H-ЯМР (270 МГц, DМSO-d6) δ: 8,57 (1 H, с), 8,29 (1 H, д, J=8,4 Гц), 8,02 (1 H, с), 7,70-7,60 (2 H, м), 4,37 (2 H, т, J=6,3 Гц), 2,84 (2 H, м), 2,80 (6 H, с), 2,64-2,53 (4 H, м), 1,83 (6 H, с), 0,98 (6 H, т, J=7,1 Гц).
ЖХ/МС: м/z 509 [М+H]+
ВЭЖХ время удерживания: 1,55 мин (условия анализа S)
[Пример 200]
Соединение C4-3
Диметиламид 3-циано-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-сульфоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения C2-1 и йодметана.
ЖХ/МС: m/z 424 [M+H]+
ВЭЖХ время удерживания: 2,17 мин (условия анализа S)
[Пример 201]
Соединение C4-4
Диметиламид 3-циано-6,6-диметил-11-оксо-8-(пиперидин-4-илокси)-6,11-дигидро-5H-бензо[b]карбазол-9-сульфоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения A7-1 и Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения C2-1 и трет-бутилового эфира 4-гидрокси-пиперидин-1-карбоновой кислоты.
ЖХ/МС: m/z 493 [M+H]+
ВЭЖХ время удерживания: 1,49 мин (условия анализа S)
[Пример 202]
Соединение C4-5
Диметиламид 3-циано-6,6-диметил-8-(2-морфолин-4-ил-этокси)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-сульфоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения C2-1 и 2-морфолин-4-ил-этанола.
ЖХ/МС: m/z 523 [M+H]+
ВЭЖХ время удерживания: 1,64 мин (условия анализа S)
[Пример 203]
Соединение C4-6
Диметиламид 3-циано-8-[2-(1,1-диоксо-тиоморфолин-4-ил)этокси]-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-сульфоновой кислоты
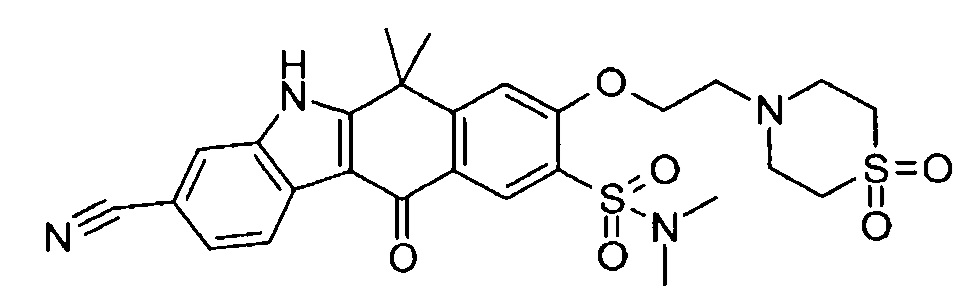
С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения C2-1 и 2-(1,1-диоксотиоморфолинo)этанола.
ЖХ/МС: m/z 571 [M+H]+
ВЭЖХ время удерживания: 1,75 мин (условия анализа S)
[Пример 204]
Соединение C4-7
Диметиламид 3-циано-8-(1-этил-пиперидин-4-илокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-сульфоновой кислоты
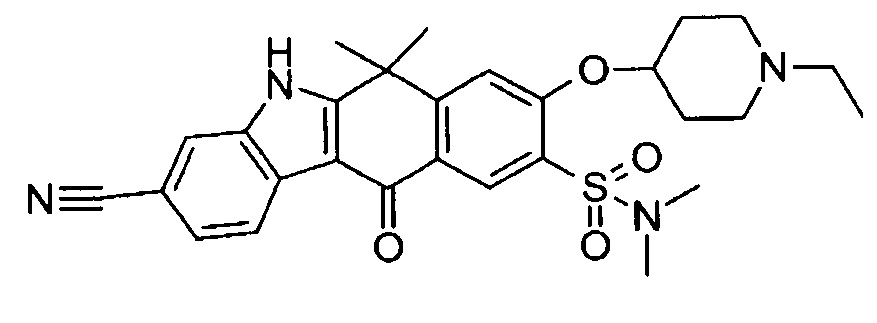
С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения C2-1 и 1-этил-пиперидин-4-ола.
ЖХ/МС: m/z 521 [M+H]+
ВЭЖХ время удерживания: 1,52 мин (условия анализа S)
[Пример 205]
Соединение C4-8
Диметиламид 3-циано-8-(4-изопропил-пиперазин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-сульфоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения C3-1.
1H-ЯМР(270 МГц, DМSO-d6) δ: 8,61 (1 H, с), 8,30 (1 H, д, J=8,1 Гц), 8,04 (1 H, с), 7,87 (1 H, с), 7,62 (1 H, дд, J=8,2, 1,8 Гц), 3,17-3,06 (2 H, м), 2,75-2,70 (6 H, с), 2,67-2,58 (2 H, м), 1,81 (6 H, с), 1,02 (6 H, д, J=6,4 Гц).
ЖХ/МС: м/z 520 [М+H]+
ВЭЖХ время удерживания: 1,52 мин (условия анализа S)
[Пример 206]
Соединение C4-9
Диметиламид 3-циано-8-[4-(2-гидроксиэтил)пиперазин-1-ил]-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-сульфоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения C3-1 и 2-пиперазин-1-ил-этанола.
ЖХ/МС: m/z 522 [M+H]+
ВЭЖХ время удерживания: 1,40 мин (условия анализа S)
[Пример 207]
Соединение C4-10
Диметиламид 3-циано-6,6-диметил-8-морфолин-4-ил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-сульфоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения C3-1 и морфолина.
ЖХ/МС: m/z 479 [M+H]+
ВЭЖХ время удерживания: 2,22 мин (условия анализа S)
[Пример 208]
Соединение C4-11
трет-Бутиловый эфир 4-(3-циано-9-диметилсульфамоил-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-ил)пиперазин-1-карбоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения C3-1 и трет-бутилового эфира пиперазин-1-карбоновой кислоты.
ЖХ/МС: m/z 578 [M+H]+
ВЭЖХ время удерживания: 2,72 мин (условия анализа S)
[Пример 209]
Соединение C4-12
Диметиламид 3-циано-6,6-диметил-11-оксо-8-пиперазин-1-ил-6,11-дигидро-5H-бензо[b]карбазол-9-сульфоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из C4-11.
1H-ЯМР (270 МГц, CD3OD) δ: 8,78 (1 H, с), 8,39 (1 H, дд, J=8,2, 0,7 Гц), 7,88 (1 H, м), 7,75 (1, 1 H, с), 7,55 (1 H, дд, J=8,2, 1,5 Гц), 3,15 (4 H, м), 3,04 (4 H, м), 2,82 (с, 6 H), 1,85 (6 H, с).
ЖХ/МС: м/z 478 [М+H]+
ВЭЖХ время удерживания: 1,43 мин (условия анализа S)
[Пример 210]
Соединение C4-13
6,6-Диметил-11-оксо-9-(пирролидин-1-сульфонил)-8-(4-пирролидин-1-ил-пиперидин-1-ил)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения C3-2 и 4-(1-пирролидил)пиперидина.
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,83 (1 H, с), 8,64 (1 H, с), 8,32 (1 H, д, 8,2 Гц), 8,03 (1 H, с), 7,80 (1 H, с), 7,63 (1 H, д, 8,2 Гц), 2,87-2,94 (4 H, м), 1,94-1,99 (4 H, м), 1,80 (6 H, с), 1,58-1,76 (10 H, м).
ЖХ/МС: м/z 572 [М+H]+
ВЭЖХ время удерживания: 2,81 мин (условия анализа W)
[Пример 211]
Соединение C4-14
8-(2-Диэтиламино-этокси)-6,6-диметил-9-(морфолин-4-сульфонил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения C2-3.
ЖХ/МС: m/z 551 [M+H]+
ВЭЖХ время удерживания: 1,46 мин (условия анализа S)
[Пример 212]
Соединение C4-15
6,6-Диметил-9-(морфолин-4-сульфонил)-11-оксо-8-(тетрагидро-пиран-4-илокси)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения C2-3 и тетрагидропиран-4-ола.
ЖХ/МС: m/z 536 [M+H]+
ВЭЖХ время удерживания: 2,05 мин (условия анализа S)
[Пример 213]
Соединение C4-16
6,6-Диметил-9-(4-метилпиперазин-1-сульфонил)-11-оксо-8-(тетрагидро-пиран-4-илокси)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения C2-4 и тетрагидропиран-4-ола.
ЖХ/МС: m/z 549 [M+H]+
ВЭЖХ время удерживания: 2,03 мин (условия анализа U)
[Пример 214]
Соединение C4-17
8-(2-Диэтиламино-этокси)-6,6-диметил-9-(4-метилпиперазин-1-сульфонил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-1, целевое соединение получали, исходя из Соединения C2-3.
ЖХ/МС: m/z 564 [M+H]+
ВЭЖХ время удерживания: 1,20 мин (условия анализа S)
[Пример 215]
Соединение C5
Диметиламид 3-циано-8-метокси-5,6,6-триметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-сульфоновой кислоты
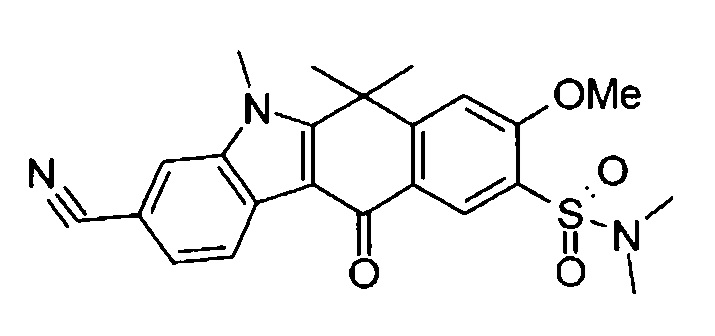
Указанное в заголовке соединение получали в виде побочного продукта синтеза Соединения C4-3.
ЖХ/МС: m/z 438 [M+H]+
ВЭЖХ время удерживания: 2,29 мин (условия анализа S)
[Пример 216]
Соединение D0-1-1
7-Метокси-1,1-диметил-6-нитро-3,4-дигидро-1H-нафталин-2-он

Тетрабутиламмонийнитрат (2,47 г, 1,07 экв.) растворяли в дихлорметане и добавляли трифторметансульфоновый ангидрид (1,33 мл, 1,07 экв.) при 0°C. Смесь перемешивали в течение 1 часа, добавляли DCM раствор 7-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-она (Соединение A2, 1,55 г, 7,59 ммоль) и затем перемешивали при 0°C в течение 2 часов и 30 минут. Реакционный раствор добавляли к насыщенному водному раствору гидрокарбоната натрия и затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Осушитель удаляли фильтрованием, и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (бледно-желтое твердое вещество, 1,144 г, 60%).
1H-ЯМР (270 МГц, DМSO-d6) δ: 7,79 (1 H, с), 7,28 (1 H, с), 3,95 (3 H, с), 3,06 (2 H, т, J=6,9 Гц), 2,64 (2 H, т, J=6,9 Гц), 1,41 (6 H, с).
ВЭЖХ время удерживания: 2,03 мин (условия анализа S)
[Пример 217]
Соединение D0-1-2
7-Метокси-1,1-диметил-8-нитро-3,4-дигидро-1H-нафталин-2-он

Указанное в заголовке соединение получали в виде побочного продукта синтеза Соединения D0-1-1.
1H-ЯМР (270 МГц, DМSO-d6) δ: 7,44 (1 H, д, J=8,6 Гц), 7,23 (1 H, д, J=8,6 Гц), 3,84 (3 H, с), 3,07 (2 H, т, J=6,9 Гц), 2,65 (2 H, т, J=6,9 Гц), 1,35 (6 H, с).
ВЭЖХ время удерживания: 2,15 мин (условия анализа S)
[Пример 218]
Соединение D0-2-1
3-Бром-8-метокси-6,6-диметил-9-нитро-6,11-дигидро-5H-бензо[b]карбазол

С использованием тех же условий, как в способе синтеза Соединения A3-1, получали указанное в заголовке соединение, исходя из Соединения D0-1-1.
ЖХ/МС: m/z 401, 403 [M+H]+
ВЭЖХ время удерживания: 3,07 мин (условия анализа S)
[Пример 219]
Соединение D0-2-2
3-Бром-8-метокси-6,6-диметил-7-нитро-6,11-дигидро-5H-бензо[b]карбазол

С использованием тех же условий, как в способе синтеза Соединения A3-1, получали указанное в заголовке соединение, исходя из Соединения D0-1-2.
ЖХ/МС: m/z 401, 403 [M+H]+
ВЭЖХ время удерживания: 3,10 мин (условия анализа S)
[Пример 220]
Соединение D0-3-1
3-Бром-8-метокси-6,6-диметил-9-нитро-5,6-дигидро-бензо[b]карбазол-11-он

С использованием тех же условий, как в способе синтеза Соединения A4, получали указанное в заголовке соединение, исходя из Соединения D0-2-1.
ЖХ/МС: m/z 415, 417 [M+H]+
ВЭЖХ время удерживания: 3,07 мин (условия анализа S)
[Пример 221]
Соединение D0-3-2
3-Бром-8-метокси-6,6-диметил-7-нитро-5,6-дигидро-бензо[b]карбазол-11-он

С использованием тех же условий, как в способе синтеза Соединения A4, получали указанное в заголовке соединение, исходя из Соединения D0-2-2.
ЖХ/МС: m/z 415, 417 [M+H]+
ВЭЖХ время удерживания: 2,72 мин (условия анализа S)
[Пример 222]
Соединение D0-4-1
8-Метокси-6,6-диметил-9-нитро-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
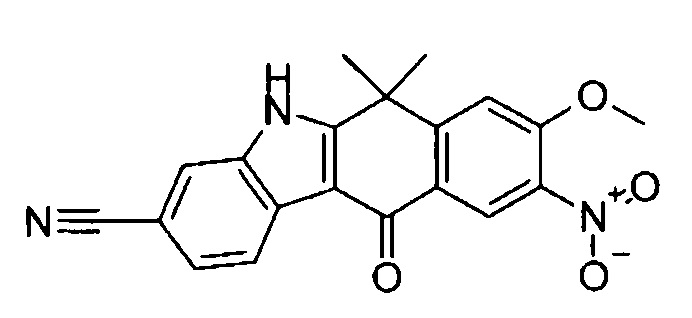
С использованием тех же условий, как в способе синтеза Соединения A5-2, получали указанное в заголовке соединение, исходя из Соединения D0-3-1.
ЖХ/МС: m/z 362 [M+H]+
ВЭЖХ время удерживания: 2,35 мин (условия анализа S)
[Пример 223]
Соединение D0-4-2
8-Метокси-6,6-диметил-7-нитро-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
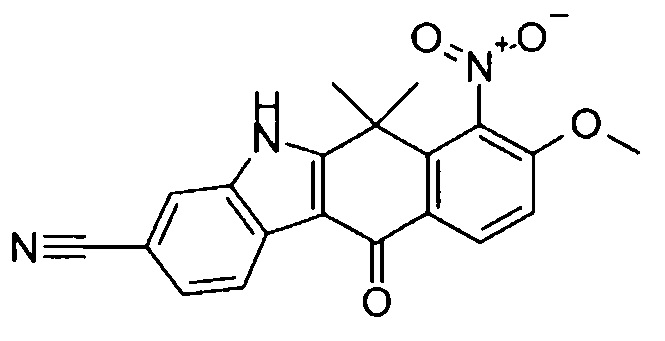
С использованием тех же условий, как в способе синтеза Соединения A5-2, получали указанное в заголовке соединение, исходя из Соединения D0-3-2.
ЖХ/МС: m/z 362 [M+H]+
ВЭЖХ время удерживания: 2,35 мин (условия анализа S)
[Пример 224]
Соединение D0-5-1
8-Гидрокси-6,6-диметил-9-нитро-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A6, получали указанное в заголовке соединение, исходя из Соединения D0-4-1.
ЖХ/МС: m/z 348 [M+H]+
ВЭЖХ время удерживания: 2,28 мин (условия анализа S)
[Пример 225]
Соединение D0-5-2
8-Гидрокси-6,6-диметил-7-нитро-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A6, получали указанное в заголовке соединение, исходя из Соединения D0-4-2.
ЖХ/МС: m/z 348 [M+H]+
ВЭЖХ время удерживания: 2,23 мин (условия анализа S)
[Пример 226]
Соединение D1
6,6-Диметил-8-(1-метилпиперидин-4-илокси)-9-нитро-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения D0-5-1 и 1-метилпиперидин-4-ола.
ЖХ/МС: m/z 445 [M+H]+
ВЭЖХ время удерживания: 1,64 мин (условия анализа S)
[Пример 227]
Соединение D2
9-Амино-6,6-диметил-8-(1-метилпиперидин-4-илокси)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

6,6-Диметил-8-(1-метилпиперидин-4-илокси)-9-нитро-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил (Соединение D1, 83 мг, 0,19 ммоль) растворяли в этаноле, добавляли водный раствор ацетата аммония и водный раствор хлорида титана(III) и затем смесь перемешивали при комнатной температуре в течение 45 минут. Реакционный раствор добавляли к насыщенному водному раствору гидрокарбоната натрия и затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Осушитель удаляли фильтрованием, и остатки концентрировали при пониженном давлении с получением указанного в заголовке соединения (желтое твердое вещество, 60 мг, 78%).
1H-ЯМР (270 МГц, DМSO-d6) δ: 12,61 (1 H, ушир. с), 8,28-8,34 (1 H, м), 7,94-8,00 (1 H, м), 7,57 (1 H, дд, J=8,2, 1,4 Гц), 7,46 (1 H, с), 7,19 (1 H, с), 4,93 (1,8 H, с), 4,65 (1,0 H, с), 4,06-4,15 (1 H, м), 3,34 (5,7 H, с), 3,16-3,18 (2 H, м), 2,55-2,67 (2 H, м), 2,17-2,33 (5 H, м), 1,89-2,07 (2H, м), 1,65-1,81 (8 H, м).
ЖХ/МС: м/z 415 [М+H]+
ВЭЖХ время удерживания: 1,12 мин (условия анализа S)
[Пример 228]
Соединение D3-1
N-[3-Циано-6,6-диметил-8-(1-метилпиперидин-4-илокси)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-ил]метансульфонамид

С использованием тех же условий, как в способе синтеза Соединения A9-1, получали указанное в заголовке соединение, исходя из Соединения D2 и метансульфонилхлорида.
ЖХ/МС: m/z 493 [M+H]+
ВЭЖХ время удерживания: 1,43 мин (условия анализа S)
[Пример 229]
Соединение D3-2
Диметиламид 3-циано-6,6-диметил-11-оксо-8-(1-метилпиперидин-4-илокси)-6,11-дигидро-5H-бензо[b]карбазол-9-сульфоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения A9-1, получали указанное в заголовке соединение, исходя из Соединения D2 и диметилсульфамоилхлорида.
1H-ЯМР (270 МГц, CD3OD) δ: 8,34-8,42 (2,0 H, м), 7,85 (1,0 H, с), 7,47-7,58 (1,0 H, м), 7,32 (1,0 H, с), 4,73-4,89 (1 H, м), 2,75-2,91 (8 H, м), 2,38-2,52 (2 H, м), 2,34 (3 H, с), 2,06-2,21 (2 H, м), 1,87-2,05 (2 H, м), 1,80 (6 H, с).
ЖХ/МС: м/z 522 [М+H]+
ВЭЖХ время удерживания: 1,66 мин (условия анализа S)
[Пример 230]
Соединение D3-3
N-[3-Циано-6,6-диметил-8-(1-метилпиперидин-4-илокси)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-ил]-2-диметиламино-ацетамид

С использованием тех же условий, как в способе синтеза Соединения A9-10, получали указанное в заголовке соединение, исходя из Соединения D2 и N,N-диметилглицина.
ЖХ/МС: m/z 500 [M+H]+
ВЭЖХ время удерживания: 1,31 мин (условия анализа S)
[Пример 231]
Соединение E1
6-Бром-7-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-он
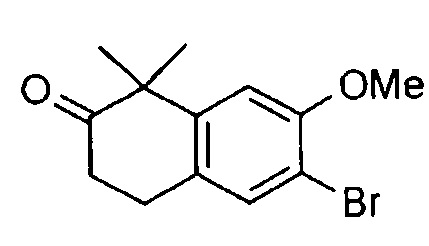
7-Метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-он (Соединение A2, 2,0 г, 9,791 ммоль) растворяли в CH3CN (40 мл), добавляли NBS (1,92 г, 1,1 экв.) и смесь перемешивали при комнатной температуре в течение 2,5 часов. Реакционный раствор добавляли в воду (40 мл), и осажденное твердое вещество фильтровали с получением указанного в заголовке соединения (белый порошок, 2,55 г, 92%).
1H-ЯМР (270 МГц, CDCl3) δ: 7,36 (1 H, с), 6,84 (1 H, с), 3,91 (3 H, с), 3,02 (2 H, т, J=6,8 Гц), 2,66 (2 H, т, J=6,8 Гц), 1,42 (6 H, с).
ЖХ/МС: м/z 283, 285 [М+H]+
ВЭЖХ время удерживания: 2,67 мин (условия анализа S)
[Пример 232]
Соединение E2-1
9-Бром-8-метокси-6,6-диметил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

6-Бром-7-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-он (Соединение E1, 7,89 г, 27,85 ммоль) и 3-гидразино-бензонитрил (4,45 г, 1,2 экв.) растворяли в TFA (250 мл) и перемешивали при 100°C в течение 2 часов. TFA удаляли при пониженном давлении, и к остаткам добавляли насыщенный водный раствор NaHCO3 (500 мл) с последующим экстрагированием этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Осушитель удаляли фильтрованием, и к остаткам, полученным после концентрирования при пониженном давлении, добавляли этилацетат. После перемешивания при комнатной температуре осажденное твердое вещество разделяли фильтрованием (Соединение E2-2). Фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде смеси с E2-2 (желтоватый белый порошок, 2,65 г).
ЖХ/МС: m/z 381, 383 [M+H]+
ВЭЖХ время удерживания: 3,03 мин (условия анализа S)
[Пример 233]
Соединение E2-2
9-Бром-8-метокси-6,6-диметил-6,11-дигидро-5H-бензо[b]карбазол-1-карбонитрил

Указанное в заголовке соединение получали в виде побочного продукта синтеза Соединения E2-1.
1H-ЯМР (270 МГц, DМSO-d6) δ: 11,70 (1 H, с), 7,69 (1 H, дд, J=8,1, 0,8 Гц), 7,55 (1 H, с), 7,48 (1 H, дд, J=7,4, 0,8 Гц), 7,27 (1 H, с), 7,22 (1 H, дд, J=8,1, 7,4 Гц), 4,23 (2 H, с), 3,91 (3 H, с), 1,70 (6 H, с).
ЖХ/МС: м/z 381, 383 [М+H]+
ВЭЖХ время удерживания: 2,92 мин (условия анализа S)
[Пример 234]
Соединение E2-3, Соединение E2-4
3,9-Дибром-8-метокси-6,6-диметил-6,11-дигидро-5H-бензо[b]карбазол
1,9-Дибром-8-метокси-6,6-диметил-6,11-дигидро-5H-бензо[b]карбазол

С использованием тех же условий, как в способе синтеза Соединения A4, указанное в заголовке соединение получали (в виде смеси), исходя из Соединения E1.
[Пример 235]
Соединение E3-1-1
9-Бром-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A4, получали указанное в заголовке соединение, исходя из Соединения E2-1.
1H-ЯМР (270 МГц, DМSO-d6) δ: 12,82 (1 H, с), 8,30 (2 H, с+д), 8,03 (1 H, с), 7,61 (1 H, дд, J=8,2, 1,4 Гц), 7,49 (1 H, с), 4,04 (3 H, с), 1,81 (6 H, с).
ЖХ/МС: м/z 395, 397 [М+H]+
ВЭЖХ время удерживания: 2,77 мин (условия анализа S)
[Пример 236]
Соединение E3-1-2
9-Бром-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-1-карбонитрил

Указанное в заголовке соединение получали в виде побочного продукта синтеза Соединения E3-1-1.
1H-ЯМР (270 МГц, DМSO-d6) δ: 12,84 (1 H, с), 8,31 (1 H, с), 7,86 (1 H, дд, J=8,2, 0,9 Гц), 7,70 (1 H, д, J=7,1 Гц), 7,47 (1 H, с), 7,43 (1 H, т, J=7,8 Гц), 4,04 (3 H, с), 1,81 (6 H, с).
ЖХ/МС: м/z 395, 397 [М+H]+
ВЭЖХ время удерживания: 2,42 мин (условия анализа S)
[Пример 237]
Соединение E3-1-3
3,9-Дибром-8-метокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

С использованием тех же условий, как в способе синтеза Соединения A4, получали указанное в заголовке соединение, исходя из Соединения E2-3 и Соединения E2-4 (смесь).
1H-ЯМР (270 МГц, DМSO-d6) δ: 12,42 (1 H, с), 8,28 (1 H, с), 8,09 (1 H, д, J=8,2 Гц), 7,68 (1 H, д, J=1,6 Гц), 7,47 (1 H, с), 7,39 (1 H, дд, J=8,3, 1,7 Гц), 4,03 (3 H, с), 1,78 (6 H, с).
ЖХ/МС: м/z 448, 450, 452 [М+H]+
ВЭЖХ время удерживания: 2,93 мин (условия анализа S)
[Пример 238]
Соединение E3-2
9-Бром-8-гидрокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

9-Бром-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил (Соединение E3-1-1, 1,0 г, 2,53 ммоль) растворяли в NMP (10 мл), добавляли NaOMe (683 мг, 5 экв.) и 1-додекантиол (3,0 мл, 5 экв.) и перемешивали при 160°C в течение 1 часа. Реакционный раствор добавляли к 0,5 н водному раствору хлористоводородной кислоты и затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Осушитель удаляли фильтрованием, и к остаткам, полученным после концентрирования при пониженном давлении, добавляли MeOH, и твердое вещество, оставшееся после растворения, фильтровали с получением указанного в заголовке соединения (желтый порошок, 1,88 г, 65%).
1H-ЯМР (400 МГц, DМSO-d6) δ: 12,77 (1 H, с), 11,13 (1 H, д, J=2,4 Гц), 8,31 (1 H, дд, J=7,9, 2,4 Гц), 8,25 (1 H, д, J=3,0 Гц), 8,01 (1 H, с), 7,61 (1 H, д, J=7,9 Гц), 7,28 (1 H, д, J=2,4 Гц), 1,74 (6H, с).
ЖХ/МС: м/z 381, 383 [М+H]+
ВЭЖХ время удерживания: 2,40 мин (условия анализа S)
[Пример 239]
Соединение E3-3
9-Бром-8-изопропокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
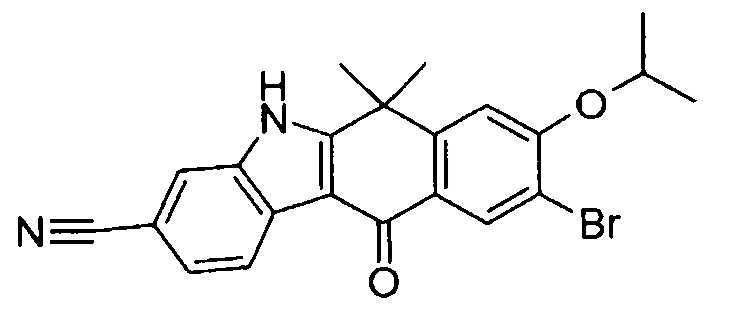
С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения E3-2 и 2-бромпропана.
1H-ЯМР (270 МГц, DМSO-d6) δ: 12,77 (1 H, с), 8,29 (2 H, с+д), 8,01 (1 H, с), 7,60 (1 H, д, J=8,1 Гц), 7,50 (1 H, с), 5,03 (1 H, м), 1,79 (6 H, с), 1,36 (6 H, д, J=5,9 Гц).
ЖХ/МС: м/z 423, 425 [М+H]+
ВЭЖХ время удерживания: 2,98 мин (условия анализа S)
[Пример 240]
Соединение E4-1
8-Метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3,9-дикарбонитрил

С использованием тех же условий, как в способе синтеза Соединения A5-2, получали указанное в заголовке соединение, исходя из Соединения E3-1-1.
1H-ЯМР (270 МГц, DМSO-d6) δ: 12,88 (1 H, ушир. с), 8,43 (1 H, с), 8,30 (1 H, д, J=8,2 Гц), 8,05 (1 H, д, J=0,5 Гц), 7,65-7,62 (2 H, м), 4,11 (3 H, с), 1,84 (6 H, с).
ЖХ/МС: м/z 342 [М+H]+
ВЭЖХ время удерживания: 2,23 мин (условия анализа S)
[Пример 241]
Соединение E4-2-1
9-(3-Гидрокси-3-метил-бут-1-инил)-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

9-Бром-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил (Соединение E3-1-1, 50 мг, 0,13 ммоль), бис(ацетонитрил)дихлорпалладий(II) (1,64 мг, 0,05 экв.), XPhos (9,05 мг, 0,15 экв.), карбонат цезия (185 мг, 4,5 экв.) и 3-метил-1-бутин-1-ол (18,6 мкл, 1,5 экв.) растворяли в ацетонитриле и перемешивали при 85°C в течение 2 часов. Реакционный раствор добавляли в воду и затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Осушитель удаляли фильтрованием, и остатки, полученные после концентрирования при пониженном давлении, очищали при помощи ВЭЖХ с получением указанного в заголовке соединения (коричневое твердое вещество, 21,3 мг, 42%).
1H-ЯМР (270 МГц, DМSO-d6) δ: 8,29 (1 H, д, J=8,1 Гц), 8,11 (1 H, с), 8,00 (1 H, с), 7,57 (1 H, д, J=8,1 Гц), 7,40 (1 H, с), 5,50 (1 H, с), 3,95 (3 H, с), 2,54 (1 H, с), 1,79 (6 H, с), 1,49 (6 H, с).
ЖХ/МС: м/z 399 [М+H]+
ВЭЖХ время удерживания: 2,10 мин (условия анализа S)
[Пример 242]
Соединение E4-2-2
9-Этинил-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
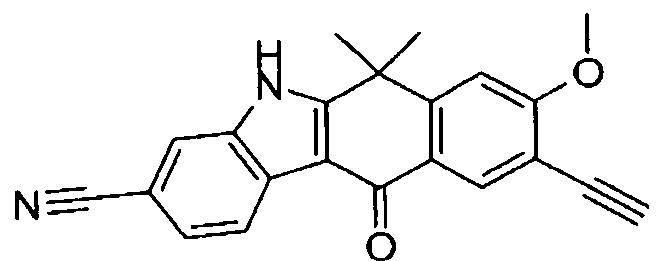
9-(3-Гидрокси-3-метил-бут-1-инил)-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил (Соединение E4-2-1, 21,3 мг, 0,05 ммоль) и гидрид натрия (3,2 мг, 1,5 экв.) растворяли в ТГФ и смесь перемешивали в течение ночи при 50°C. К реакционному раствору добавляли воду, и остатки, полученные после концентрирования при пониженном давлении, очищали при помощи ВЭЖХ с получением указанного в заголовке соединения (коричневое твердое вещество, 9,6 мг, 31%).
1H-ЯМР (270 МГц, DМSO-d6) δ: 8,26 (1 H, д, J=8,2 Гц), 8,16 (1 H, с), 7,97 (1 H, с), 7,53 (1 H, д, J=8,2 Гц), 7,41 (1 H, с), 4,32 (1 H, с), 4,00 (3 H, с), 1,79 (6 H, с).
ЖХ/МС: м/z 341 [М+H]+
ВЭЖХ время удерживания: 2,27 мин (условия анализа S)
[Пример 243]
Соединение E4-3
8-Метокси-6,6-диметил-11-оксо-9-винил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

9-Бром-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил (Соединение E3-1-1, 50 мг, 0,13 ммоль), комплекс [1,1’-бис(дифенилфосфино)ферроцен]палладий(II)дихлорида с дихлорметаном (1:1) (10,3 мг, 0,1 экв.), TEA (53 мкл, 3 экв.) и винилтрифторборат калия (51 мг, 3 экв.) растворяли в н-пропаноле и смесь перемешивали при 60°C в течение 5 дней. Реакционный раствор добавляли в воду и затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Осушитель удаляли фильтрованием, и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (коричневый порошок, 25 мг, 19%).
ЖХ/МС: m/z 343 [M+H]+
ВЭЖХ время удерживания: 2,55 мин (условия анализа S)
[Пример 244]
Соединение E4-4
9-(2-Диэтиламино-этилсульфанил)-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-17, получали указанное в заголовке соединение, исходя из Соединения E3-1-1.
ЖХ/МС: m/z 448 [M+H]+
ВЭЖХ время удерживания: 2,05 мин (условия анализа U)
[Пример 245]
Соединение E4-5
9-Изопропилсульфанил-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-17, получали указанное в заголовке соединение, исходя из Соединения E3-1-1 и натриевой соли пропан-2-тиола.
ЖХ/МС: m/z 391 [M+H]+
ВЭЖХ время удерживания: 2,98 мин (условия анализа U)
[Пример 246]
Соединение E4-6
8-Метокси-6,6-диметил-9-(4-метилпиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-10, получали указанное в заголовке соединение, исходя из Соединения E3-1-1 и 1-метилпиперазина.
1H-ЯМР (400 МГц, DМSO-d6) δ: 8,25 (1 H, д, J=7,8 Гц), 7,93 (1 H, с), 7,65 (1 H, с), 7,50 (1 H, д, J=6,8 Гц), 7,25 (1 H, с), 3,93 (3 H, с), 3,02 (4 H, ушир.), 2,22 (3 H, с), 1,73 (6 H, с).
ЖХ/МС: м/z 415 [М+H]+
ВЭЖХ время удерживания: 1,80 мин (условия анализа U)
[Пример 247]
Соединение E4-7-1
трет-Бутиловый эфир 4-(3-циано-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-ил)-3,6-дигидро-2H-пиридин-1-карбоновой кислоты

К 9-бром-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрилу (Соединение E3-1-1, 300 мг, 0,759 ммоль), трет-бутиловому эфиру 4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (282 мг, 0,911 ммоль, 1,2 экв.), Pd(PPh3)2Cl2(26,6 мг, 0,0379 ммоль, 0,05 экв.) и карбонату натрия (241 мг, 2,28 ммоль, 3,0 экв.) добавляли DME (5 мл) и воду (1 мл). Смесь подвергали обработке ультразвуком в условиях пониженного давления с последующей продувкой газообразным азотом. Эту процедуру повторяли пять раз и затем смесь дегазировали. Смесь перемешивали при 80°C в течение 80 минут в атмосфере азота. Добавляли Pd(PPh3)2Cl2(26,6 мг, 0,0379 ммоль, 0,05 экв.) и смесь затем перемешивали при 80°C в течение 20 минут. Затем смесь охлаждали до комнатной температуры и добавляли воду и этилацетат. Нерастворимые вещества фильтровали через Целит. Органический слой сушили над сульфатом натрия. Осушитель удаляли фильтрованием, с последующим концентрированием при пониженном давлении с получением указанного в заголовке соединения в виде неочищенного продукта (серый порошок).
ЖХ/МС: m/z 498 [M+H]+
ВЭЖХ время удерживания: 2,85 мин (условия анализа S)
[Пример 248]
Соединение E4-7-2
8-Метокси-6,6-диметил-11-оксо-9-(1,2,3,6-тетрагидро-пиридин-4-ил)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения B4-4-1.
ЖХ/МС: m/z 368 [M+H]+
ВЭЖХ время удерживания: 1,27 мин (условия анализа S)
[Пример 249]
Соединение E4-8-1
трет-Бутиловый эфир 4-(3-циано-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-ил)пиперидин-1-карбоновой кислоты
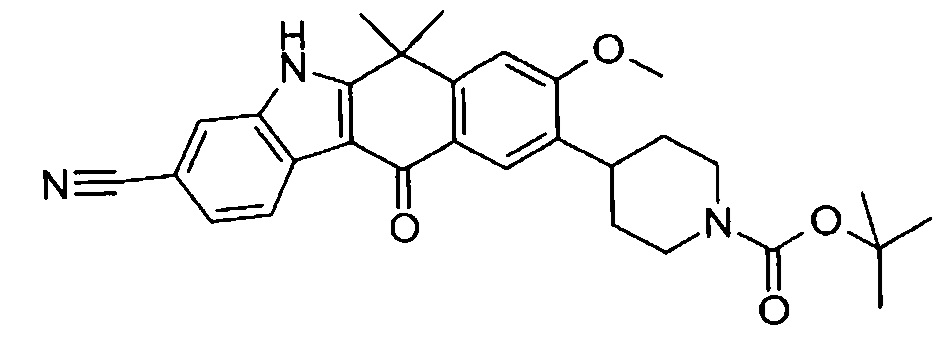
С использованием тех же условий, как в способе синтеза Соединения B3-13-1, получали указанное в заголовке соединение, исходя из Соединения B4-7-1.
ЖХ/МС: m/z 500 [M+H]+
ВЭЖХ время удерживания: 4,18 мин (условия анализа W)
[Пример 250]
Соединение E4-8-2
8-Метокси-6,6-диметил-11-оксо-9-пиперидин-4-ил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения B4-8-1.
ЖХ/МС: m/z 400 [M+H]+
ВЭЖХ время удерживания: 1,35 мин (условия анализа S)
[Пример 251]
Соединение E4-9-1
трет-Бутиловый эфир 4-(3-циано-8-изопропокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-ил)-3,6-дигидро-2H-пиридин-1-карбоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения E4-7-1, получали указанное в заголовке соединение, исходя из Соединения E3-3.
ЖХ/МС: m/z 526 [M+H]+
ВЭЖХ время удерживания: 3,13 мин (условия анализа S)
[Пример 252]
Соединение E4-9-2
8-Изопропокси-6,6-диметил-11-оксо-9-(1,2,3,6-тетрагидро-пиридин-4-ил)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения E4-9-1.
ЖХ/МС: m/z 426 [M+H]+
ВЭЖХ время удерживания: 1,40 мин (условия анализа S)
[Пример 253]
Соединение E4-10
9-Циклопропил-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E4-7-1, получали указанное в заголовке соединение, исходя из Соединения E3-1-1 и циклопропилтрифторбората калия.
ЖХ/МС: m/z 357 [M+H]+
ВЭЖХ время удерживания: 2,62 мин (условия анализа S)
[Пример 254]
Соединение E4-11
3-Циано-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-карбоновая кислота

С использованием тех же условий, как в способе синтеза Соединения B2-28, получали указанное в заголовке соединение, исходя из Соединения E3-1-1.
ЖХ/МС: m/z 361 [M+H]+
ВЭЖХ время удерживания: 1,68 мин (условия анализа S)
[Пример 255]
Соединение E5-1
9-Этил-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

Суспензию в этилацетате 8-метокси-6,6-диметил-11-оксо-9-винил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрила (Соединение E4-3, 25 мг, 0,07 ммоль) и палладия на углероде (25 мг) перемешивали при комнатной температуре в течение 1 часа в атмосфере водорода. Реакционный раствор фильтровали через Целит. Фильтрат концентрировали при пониженном давлении и полученные остатки очищали при помощи высокоэффективной жидкостной хроматографии с получением указанного в заголовке соединения (белое твердое вещество, 3,2 мг, 13%).
ЖХ/МС: m/z 345 [M+H]+
ВЭЖХ время удерживания: 2,62 мин (условия анализа S)
[Пример 256]
Соединение E5-2
9-(2-Диэтиламино-этансульфонил)-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-8, получали указанное в заголовке соединение, исходя из Соединения E4-4.
ЖХ/МС: m/z 480 [M+H]+
ВЭЖХ время удерживания: 1,97 мин (условия анализа U)
[Пример 257]
Соединение E5-3
8-Метокси-6,6-диметил-11-оксо-9-(пропан-2-сульфонил)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-8, получали указанное в заголовке соединение, исходя из Соединения E4-5.
ЖХ/МС: m/z 423 [M+H]+
ВЭЖХ время удерживания: 2,40 мин (условия анализа U)
[Пример 258]
Соединение E5-4
9-(1-Изопропил-пиперидин-4-ил)-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения E4-8-2 и ацетона.
ЖХ/МС: m/z 442 [M+H]+
ВЭЖХ время удерживания: 1,48 мин (условия анализа S)
[Пример 259]
Соединение E5-5
8-Метокси-6,6-диметил-9-(1-оксетан-3-ил-1,2,3,6-тетрагидро-пиридин-4-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения E4-7-2 и оксетан-3-она.
ЖХ/МС: m/z 454 [M+H]+
ВЭЖХ время удерживания: 1,32 мин (условия анализа S)
[Пример 260]
Соединение E5-6
8-Изопропокси-6,6-диметил-9-(1-оксетан-3-ил-1,2,3,6-тетрагидро-пиридин-4-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения E4-9-2 и оксетан-3-она.
1H-ЯМР (270 МГц, DМSO-d6) δ: 12,71 (1 H, с), 8,31 (1 H, д, J=8,2 Гц), 7,99 (1 H, с), 7,94 (1 H, с), 7,58 (1 H, д, J=7,6 Гц), 7,33 (1 H, с), 5,84 (1,0 H, м), 4,95 (1 H, м), 4,56 (4 H, дт, J=17,4, 6,3 Гц), 3,56 (1 H, м), 3,01 (2 H, ушир.), 1,78 (6 H, с), 1,34 (6 H, д, J=5,9 Гц).
ЖХ/МС: м/z 482 [М+H]+
ВЭЖХ время удерживания: 1,43 мин (условия анализа S)
[Пример 261]
Соединение E5-7
9-(4-Изопропил-пиперазин-1-карбонил)-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-15, получали указанное в заголовке соединение, исходя из Соединения E4-11 и 1-изопропилпиперазина.
ЖХ/МС: m/z 471 [M+H]+
ВЭЖХ время удерживания: 1,18 мин (условия анализа S)
[Пример 262]
Соединение E5-8
8-Метокси-6,6-диметил-9-(морфолин-4-карбонил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-15, получали указанное в заголовке соединение, исходя из Соединения E4-11 и морфолина.
ЖХ/МС: m/z 430 [M+H]+
ВЭЖХ время удерживания: 1,68 мин (условия анализа S)
[Пример 263]
Соединение E6-1
Метиловый эфир (3-циано-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-ил)пропионовой кислоты

К смеси 9-этинил-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрила (Соединение E4-2, 27 мг, 0,079 ммоль), хлорида палладия(II) (2,0 мг, 0,14 экв.), хлорида меди(II) (25,0 мг, 2,2 экв.) и ацетата натрия (14,1 мг, 2,13 экв.) добавляли метанол (1,5 мл) и затем смесь перемешивали при комнатной температуре в течение 2 дней в атмосфере оксида углерода. Смесь экстрагировали водой и этилацетатом и нерастворимые вещества отфильтровывали. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом магния. Остатки, полученные после фильтрования и концентрирования при пониженном давлении, промывали дихлорметаном с получением указанного в заголовке соединения (13,9 мг, 44%).
ЖХ/МС: m/z 399 [M+H]+
ВЭЖХ время удерживания: 2,81 мин (условия анализа F)
[Пример 264]
Соединение E6-2
(3-Циано-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-ил)пропионовая кислота

Метиловый эфир (3-циано-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-ил)пропионовой кислоты (Соединение E6-1, 15,2 мг, 0,038 ммоль) растворяли в смеси растворителей метанола (1,5 мл) и ТГФ (0,5 мл), добавляли 2 н водный раствор гидроксида калия (5 капель) и затем перемешивали при комнатной температуре в течение ночи. К реакционному раствору добавляли 0,5 н раствор хлористоводородной кислоты, затем смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом магния. Твердые вещества, полученные после фильтрования и концентрирования при пониженном давлении, промывали дихлорметаном и очищали при помощи ВЭЖХ с получением указанного в заголовке соединения (белое твердое вещество, 9,6 мг, 66%).
ЖХ/МС: m/z 385 [M+H]+
ВЭЖХ время удерживания: 2,35 мин (условия анализа F)
[Пример 265]
Соединение E6-3
9-(3-Гидрокси-3-метил-бутил)-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

9-(3-Гидрокси-3-метил-бут-1-инил)-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил (Соединение E4-2-1, 21,0 мг, 0,0527 ммоль) растворяли в этаноле (15 мл) и N,N-диметилацетамиде (2 мл), добавляли 10% Pd/C (6,7 мг) и затем перемешивали при комнатной температуре в течение ночи в атмосфере водорода. Реакционный раствор фильтровали и концентрировали при пониженном давлении. Полученные остатки разбавляли этилацетатом, промывали насыщенным солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученное твердое вещество промывали дихлорметаном с получением указанного в заголовке соединения (желтый порошок, 16,9 мг, 80%).
ЖХ/МС: m/z 403 [M+H]+
ВЭЖХ время удерживания: 5,39 мин (условия анализа H)
[Пример 266]
Соединение F1-1
трет-Бутиловый эфир 4-(9-бром-3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)пиперидин-1-карбоновой кислоты

В соответствии со способом, аналогичным способу синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения E3-2 и трет-бутилового эфира 4-трифторметансульфонилокси-пиперидин-1-карбоновой кислоты.
ЖХ/МС: m/z 564, 566 [M+H]+
ВЭЖХ время удерживания: 3,30 мин (условия анализа S)
[Пример 267]
Соединение F1-2
9-Бром-6,6-диметил-11-оксо-8-(пиперидин-4-илокси)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
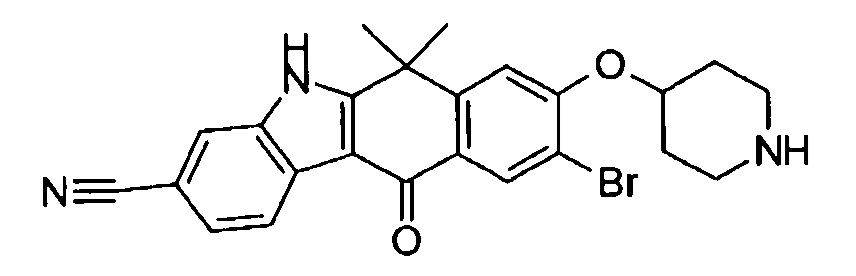
С использованием тех же условий, как в способе синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения F1-1.
ЖХ/МС: m/z 464, 466 [M+H]+
ВЭЖХ время удерживания: 1,52 мин (условия анализа S)
[Пример 268]
Соединение F1-3
9-Бром-8-(1-метансульфонил-пиперидин-4-илокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A9-1, получали указанное в заголовке соединение, исходя из Соединения F1-2 и метансульфонилхлорида.
ЖХ/МС: m/z 542, 544 [M+H]+
ВЭЖХ время удерживания: 2,57 мин (условия анализа S)
[Пример 269]
Соединение F1-4
9-Бром-6,6-диметил-11-оксо-8-(тетрагидро-пиран-4-илокси)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения E3-2 и тетрагидропиран-4-ола.
ЖХ/МС: m/z 465, 467 [M+H]+
ВЭЖХ время удерживания: 2,70 мин (условия анализа S)
[Пример 270]
Соединение F2
9-Бром-3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-иловый эфир трифторметансульфоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения B1, получали указанное в заголовке соединение, исходя из Соединения E3-2.
1H-ЯМР (270 МГц, DМSO-d6) δ: 12,99 (1 H, с), 8,51 (1 H, с), 8,31 (1 H, дд, J=8,2, 0,7 Гц), 8,17 (1 H, с), 8,07 (1 H, с), 7,67 (1 H, дд, J=8,2, 1,4 Гц), 1,81 (6 H, с).
ЖХ/МС: м/z 513, 515 [М+H]+
ВЭЖХ время удерживания: 3,13 мин (условия анализа S)
[Пример 271]
Соединение F3-1
9-Бром-6,6-диметил-8-(1-оксетан-3-ил-пиперидин-4-илокси)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения F1-2 и оксетан-3-она.
1H-ЯМР(400 МГц, DМSO-d6) δ: 8,29 (1 H, д, 8 Гц), 8,29 (1 H, с), 8,01 (1 H, с), 7,60 (1 H, д, 8 Гц), 7,55 (1 H, с), 5,00-4,95 (1 H, м), 4,55 (2 H, дд, 8,8 Гц), 4,44 (2 H, дд, 8,8 Гц), 2,52-2,46 (1 H, м), 2,33-2,29 (2 H, м), 1,96-1,94 (2 H, м), 1,79 (8 H, ушир. с).
ЖХ/МС: м/z 519, 521 [М+H]+
ВЭЖХ время удерживания: 2,78 мин (условия анализа W)
[Пример 272]
Соединение F3-2
9-Бром-6,6-диметил-11-оксо-8-(4-пирролидин-1-ил-пиперидин-1-ил)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
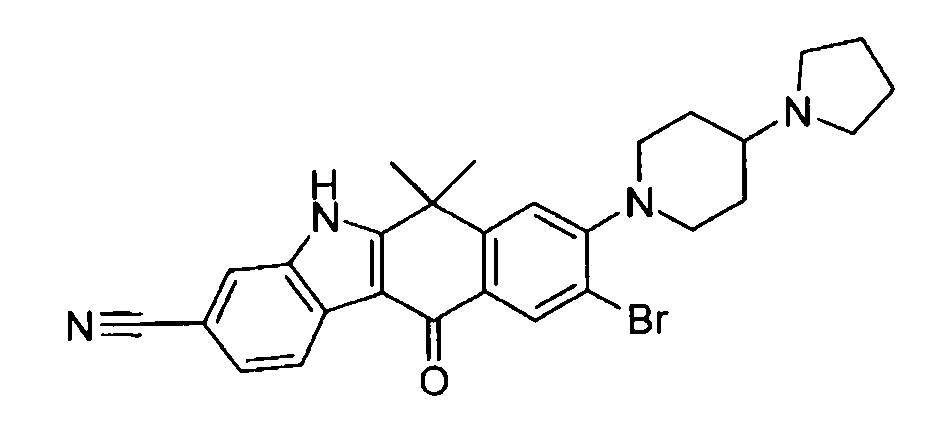
С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения F2 и 4-пирролидин-1-ил-пиперидина.
ЖХ/МС: m/z 517, 519 [M+H]+
ВЭЖХ время удерживания: 1,70 мин (условия анализа S)
[Пример 273]
Соединение F3-3
9-Бром-8-(4-метансульфонил-пиперазин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения F2 и 1-метансульфонилпиперазина.
ЖХ/МС: m/z 527, 529 [M+H]+
ВЭЖХ время удерживания: 2,48 мин (условия анализа S)
[Пример 274]
Соединение F3-4
9-Бром-6,6-диметил-8-морфолин-4-ил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения F2 и морфолина.
ЖХ/МС: m/z 450, 452 [M+H]+
ВЭЖХ время удерживания: 2,65 мин (условия анализа S)
[Пример 275]
Соединение F3-5
9-Бром-8-[4-(2-гидрокси-этил)пиперазин-1-ил]-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
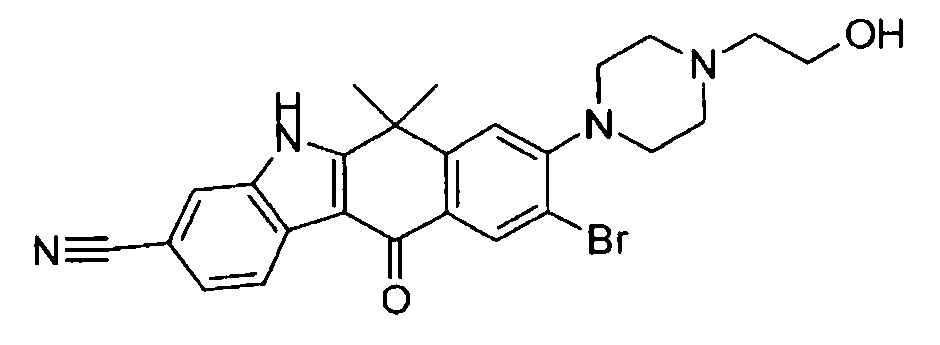
С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения F2 и 2-пиперазин-1-илэтанола.
1H-ЯМР (270 МГц, DМSO-d6) δ: 8,26 (2,0 H, с+д), 7,97 (1 H, с), 7,54 (1 H, д, J=8,7 Гц), 7,43 (1 H, с), 4,45 (1 H, т, J=5,4 Гц), 3,55 (2 H, кв., J=5,8 Гц), 3,17 (4 H, ушир.), 2,66 (2 H, ушир.), 1,76 (6 H, с).
ЖХ/МС: м/z 493, 495 [М+H]+
ВЭЖХ время удерживания: 1,43 мин (условия анализа S)
[Пример 276]
Соединение F3-6-1
трет-Бутиловый эфир [1-(9-бром-3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-ил)пиперидин-4-ил]карбаминовой кислоты

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения F2 и трет-бутилового эфира пиперидин-4-ил-карбаминовой кислоты.
ЖХ/МС: m/z 563, 565 [M+H]+
ВЭЖХ время удерживания: 3,05 мин (условия анализа S)
[Пример 277]
Соединение F3-6-2
8-(4-Амино-пиперидин-1-ил)-9-бром-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения F3-6-1.
ЖХ/МС: m/z 463, 465 [M+H]+
ВЭЖХ время удерживания: 1,47 мин (условия анализа S)
[Пример 278]
Соединение F3-7
9-Бром-8-(4-гидрокси-пиперидин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения F2 и пиперидин-4-ола.
ЖХ/МС: m/z 464, 466 [M+H]+
ВЭЖХ время удерживания: 2,25 мин (условия анализа S)
[Пример 279]
Соединение F3-8
9-Бром-8-(4-изопропил-пиперазин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
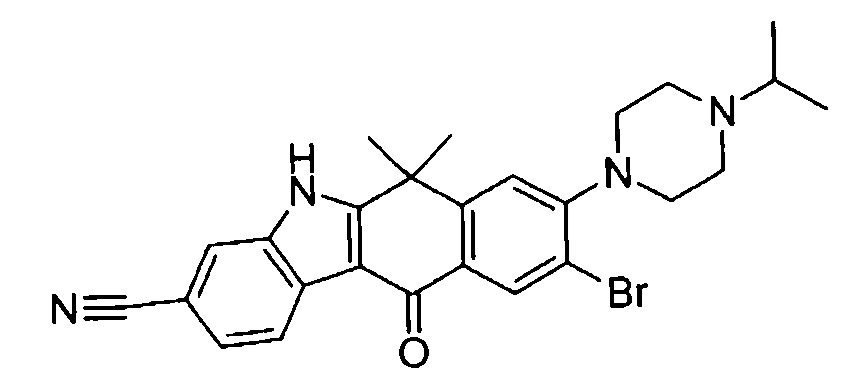
С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения F2 и 1-изопропилпиперазина.
ЖХ/МС: m/z 491, 493 [M+H]+
ВЭЖХ время удерживания: 1,58 мин (условия анализа S)
[Пример 280]
Соединение F3-9
9-Бром-6,6-диметил-11-оксо-8-пиперазин-1-ил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения F2 и пиперазина.
1H-ЯМР (DМSO-d6) δ: 8,30-8,24 (2 H, м), 8,00 (1 H, с), 7,63-7,58 (1 H, м), 7,37 (1 H, с), 3,10-3,01 (4 H, м), 2,91-2,85 (4 H, м), 1,76 (6 H, с).
ЖХ/МС: м/z 449, 451 [М+H]+
ВЭЖХ время удерживания: 1,45 мин (условия анализа S)
[Пример 281]
Соединение F3-10
трет-Бутиловый эфир 4-(9-бром-3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-ил)пиперазин-1-карбоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения F2 и трет-бутилового эфира пиперазин-1-карбоновой кислоты.
ЖХ/МС: m/z 549, 551 [M+H]+
ВЭЖХ время удерживания: 4,61 мин (условия анализа W)
[Пример 282]
Соединение F3-11
9-Бром-6,6-диметил-8-(4-морфолин-4-ил-пиперидин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
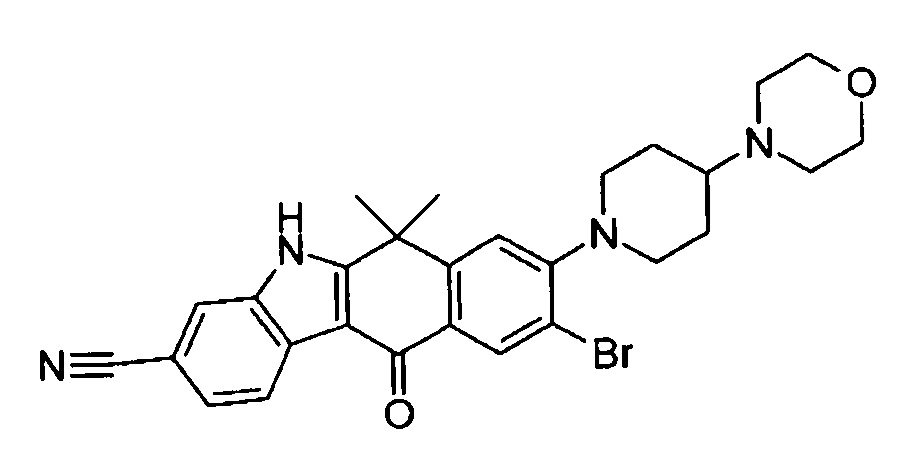
С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения F2 и 4-пиперидин-4-ил морфолина.
1H-ЯМР (DМSO-d6) δ: 8,30-8,24 (2 H, м), 8,00 (1 H, с), 7,59 (1 H, д, J=8,2 Гц), 7,42 (1 H, с), 3,66-3,45 (6 H, м), 2,80 (2 H, т, J=11,1 Гц), 2,38-2,28 (1 H, м), 1,96-1,87 (2 H, м), 1,75 (6 H, с), 1,66-1,56 (2 H, м).
ЖХ/МС: м/z 533, 535 [М+H]+
ВЭЖХ время удерживания: 1,53 мин (условия анализа S)
[Пример 283]
Соединение F4-1-1
9-Этинил-6,6-диметил-8-(1-оксетан-3-ил-пиперидин-4-илокси)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения F5-43, получали указанное в заголовке соединение, исходя из Соединения F3-1.
1H-ЯМР(400 МГц, DМSO-d6) δ: 8,30 (1 H, д, 8 Гц), 8,17 (1 H, с), 8,01 (1 H, с), 7,60 (1 H, д, 8 Гц), 7,50 (1 H, с), 4,87-4,83 (1 H, м), 4,55 (2 H, дд, 4,4 Гц), 4,45 (2 H, дд, 4,4 Гц), 3,44 (1 H, ддд, 4,4, 4 Гц), 2,33-2,24 (2 H, м), 1,99-1,91 (2 H, м), 1,78 (8 H, ушир. с).
ЖХ/МС: м/z 466 [М+H]+
ВЭЖХ время удерживания: 2,67 мин (условия анализа W)
[Пример 284]
Соединение F4-1-2
9-Этил-6,6-диметил-8-(1-оксетан-3-ил-пиперидин-4-илокси)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-13-1, получали указанное в заголовке соединение, исходя из Соединения F4-1-1.
ЖХ/МС: m/z 470 [M+H]+
ВЭЖХ время удерживания: 2,74 мин (условия анализа W)
[Пример 285]
Соединение F4-2
N-[1-(9-Бром-3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-ил)пиперидин-4-ил]метансульфонамид

С использованием тех же условий, как в способе синтеза Соединения A9-1, получали указанное в заголовке соединение, исходя из Соединения F3-6-2 и метансульфонилхлорида.
ЖХ/МС: m/z 541, 543 [M+H]+
ВЭЖХ время удерживания: 2,37 мин (условия анализа S)
[Пример 286]
Соединение F4-3
9-Бром-6,6-диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
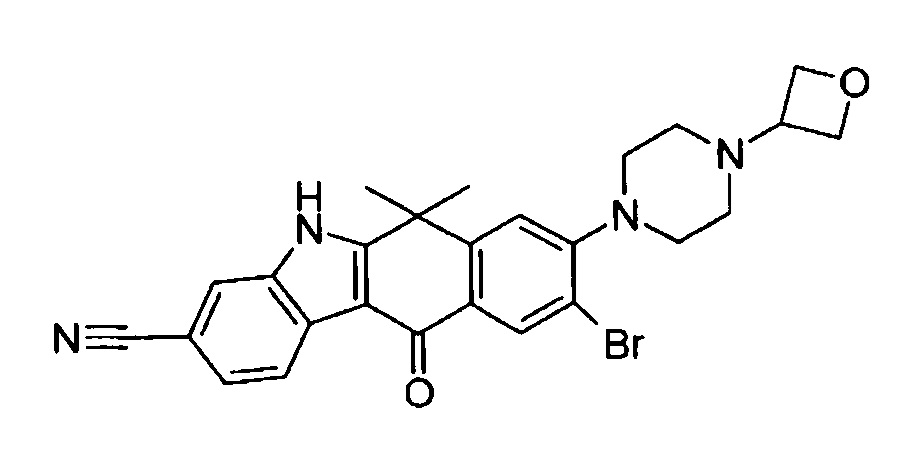
С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения F3-9 и 1-оксетан-3-она.
1H-ЯМР (270 МГц, DМSO-d6) δ: 12,83 (1 H, ушир. с), 8,31-8,32 (1 H, м), 8,27-8,29 (1 H, м), 8,01-8,04 (1 H, м), 7,59-7,64 (1 H, м), 7,48 (1 H, с), 4,59 (2 H, дд, J=6,3, 6,3 Гц), 4,48 (2 H, дд, J=6,3, 6,3 Гц), 3,52 (1 H, т, J=6,3 Гц), 3,12-3,25 (4 H, м), 2,44-2,54 (4 H, м), 1,78 (6 H, с).
ЖХ/МС: м/z 505, 507 [М+H]+
ВЭЖХ время удерживания: 1,45 мин (условия анализа S)
Гидрохлоридная соль Соединения F4-3
К 9-бром-6,6-диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрилу добавляли DMSO и 6 н раствор хлористоводородной кислоты (1,05 экв.) и растворяли в них. После сушки замораживанием осуществляли кристаллизацию с использованием этанола, содержащего 25% воды, с получением моногидрохлоридной соли 9-бром-6,6-диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрила.
1H-ЯМР (270 МГц, DМSO-d6) δ: 12,91 (1 H, ушир. с), 11,70 (1 H, ушир. с), 8,32-8,29 (2 H, м), 8,04 (1 H, с), 7,64-7,62 (1 H, м), 7,52 (1 H, с), 4,89-4,62 (4 H, ушир. м), 3,66-3,39 (1 H, м), 3,31-3,05 (8 H, ушир. м), 1,81 (6 H, с).
ЖХ/МС: м/z 505, 507 [М+H]+
[Пример 287]
Соединение F4-4
9-Бром-8-{4-[2-(2-метокси-этокси)этил]пиперазин-1-ил}-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения F3-9 и 1-бром-2-(2-метоксиэтокси)этана.
ЖХ/МС: m/z 551, 553 [M+H]+
ВЭЖХ время удерживания: 2,80 мин (условия анализа W)
[Пример 288]
Соединение F4-5
9-Бром-6,6-диметил-11-оксо-8-[4-(тетрагидро-пиран-4-ил)пиперазин-1-ил]-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения F3-9 и тетрагидропиран-4-она.
ЖХ/МС: m/z 533, 535 [M+H]+
ВЭЖХ время удерживания: 2,67 мин (условия анализа W)
[Пример 289]
Соединение F4-6
9-Бром-6,6-диметил-11-оксо-8-[4-(тетрагидро-тиопиран-4-ил)пиперазин-1-ил]-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения F3-9 и тетрагидротиопиран-4-она.
ЖХ/МС: m/z 549, 551 [M+H]+
ВЭЖХ время удерживания: 2,86 мин (условия анализа W)
[Пример 290]
Соединение F4-7
9-Бром-8-[4-(1,1-диоксо-гексагидро-1λ6-тиопиран-4-ил)пиперазин-1-ил]-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-8, получали указанное в заголовке соединение, исходя из Соединения F4-6.
ЖХ/МС: m/z 581, 583 [M+H]+
ВЭЖХ время удерживания: 2,66 мин (условия анализа W)
[Пример 291]
Соединение F4-8
9-Бром-8-(4-циклопропилметил-пиперазин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения F3-9 и бромметилциклопропана.
ЖХ/МС: m/z 503, 505 [M+H]+
ВЭЖХ время удерживания: 2,81 мин (условия анализа W)
[Пример 292]
Соединение F4-9
9-Бром-8-(4-циклопропил-пиперазин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения F3-9 и (1-этокси-циклопропокси)триметилсилана.
1H-ЯМР (270 МГц, DМSO-d6) δ: 8,22-8,30 (2 H, м), 8,00 (1 H, с), 7,56 (1 H, д, J=7,9 Гц), 7,43 (1 H, с), 3,30 (1 H, д, J=5,8 Гц), 3,11 (4 H, с), 2,75 (4 H, с), 1,75 (6H, с), 0,47 (2 H, д, J=5,8 Гц), 0,34 (2H, д, J=5,8 Гц).
ЖХ/МС: м/z 489, 491 [М+H]+
ВЭЖХ время удерживания: 1,68 мин (условия анализа S)
[Пример 293]
Соединение F4-10
9-Бром-8-(4-циклобутил-пиперазин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения F3-9 и циклобутанона.
1H-ЯМР(400 МГц, DМSO-d6) δ: 8,23-8,29 (2 H, м), 8,00 (1 H, с), 7,55 (1 H, д, 7,9 Гц), 7,45 (1 H, с), 4,04-4,15 (1 H, м), 3,10-3,20 (4 H, м), 2,39-2,48 (4 H, м), 1,97-2,06 (2 H, м), 1,78-1,88 (2 H, м), 1,77 (6 H, с), 1,61-1,72 (2 H, м).
ЖХ/МС: м/z 503, 505 [М+H]+
ВЭЖХ время удерживания: 2,78 мин (условия анализа W)
[Пример 294]
Соединение F5-1
9-Этинил-8-(4-метансульфонил-пиперазин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения F5-43, получали указанное в заголовке соединение, исходя из Соединения F3-3.
1H-ЯМР(270 МГц, DМSO-d6) δ: 12,78 (1 H, с), 8,31 (1 H, д, 8,1, 0,7 Гц), 8,19 (1 H, с), 8,02 (1 Н, дд, J=1,4, 0,7 Гц), 7,61 (1 Н, дд, J=8,2, 1,4 Гц), 7,33 (1 Н, с), 4,55 (1 Н, с), 3,43 (4 Н, ушир.), 2,98 (3 H, с), 1,79 (6 H, с).
ЖХ/МС: м/z 473 [М+H]+
ВЭЖХ время удерживания: 2,27 мин (условия анализа S)
[Пример 295]
Соединение F5-2
N-[1-(3-Циано-9-этинил-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-ил)пиперидин-4-ил]метансульфонамид

С использованием тех же условий, как в способе синтеза Соединения F5-43, получали указанное в заголовке соединение, исходя из Соединения F4-2.
1H-ЯМР (270 МГц, DМSO-d6) δ: 12,98 (1 H, с), 8,30 (1 H, д, J=8,1 Гц), 8,15 (1 H, с), 8,02 (1 H, с), 7,61 (1 H, д, J=7,9 Гц), 7,23 (2 H, с+д), 4,55 (1 H, с), 3,79 (2 H, ушир. д), 2,95 (4 H, ушир.), 1,96 (2 H, ушир. д), 1,78 (3 H, с), 1,65 (2 H, ушир. д).
ЖХ/МС: м/z 487 [М+H]+
ВЭЖХ время удерживания: 2,15 мин (условия анализа S)
[Пример 296]
Соединение F5-3
6,6-Диметил-11-оксо-8-(4-пирролидин-1-ил-пиперидин-1-ил)-6,11-дигидро-5H-бензо[b]карбазол-3,9-дикарбонитрил

С использованием тех же условий, как в способе синтеза Соединения A5-2, целевое соединение получали, исходя из Соединения F3-2.
1H-ЯМР (270 МГц, DМSO-d6) δ: 8,33 (1 H, д, J=1,3 Гц), 8,27 (1 H, дд, J=7,7, 1,3 Гц), 8,00 (1 H, с), 7,57 (1 H, д, J=7,7 Гц), 7,40 (1 H, с), 3,74 (2 H, м), 3,19-3,33 (1 H, м), 2,98-3,12 (2 H, м), 2,35-2,62 (2 H, м), 2,11-2,29 (2 H, м), 1,89-2,06 (2 H, м), 1,78 (6 H, с), 1,54-1,70 (6 H, м).
ЖХ/МС: м/z 464 [М+H]+
ВЭЖХ время удерживания: 1,55 мин (условия анализа S)
[Пример 297]
Соединение F5-4
9-Этинил-6,6-диметил-11-оксо-8-(4-пирролидин-1-ил-пиперидин-1-ил)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
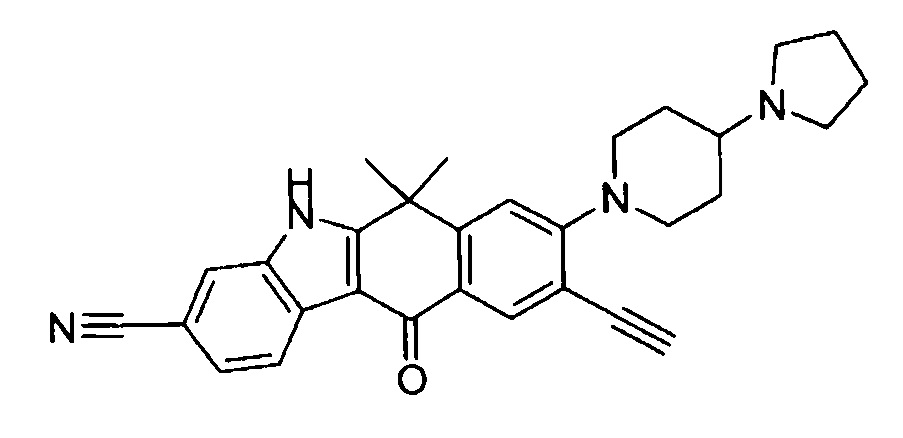
С использованием тех же условий, как в способе синтеза Соединения E4-2-1 и Соединения E4-2-2, получали указанное в заголовке соединение, исходя из Соединения F3-2.
1H-ЯМР (270 МГц, DМSO-d6) δ: 8,29 (1 H, д, J=8,2 Гц), 8,14 (1 H, с), 8,00 (1 H, с), 7,58 (1 H, дд, J=8,1, 1,3 Гц), 7,24 (1H, с), 4,50 (1 H, с), 3,70-3,83 (2 H, м), 3,34-3,48 (1 H, м), 2,83-2,98 (2 H, м), 2,45-2,58 (2 H, м), 2,10-2,23 (2 H, м), 1,90-2,03 (2 H, м), 1,76 (6 H, с), 1,51-1,74 (6 H, м).
ЖХ/МС: м/z 463 [М+H]+
ВЭЖХ время удерживания: 1,60 мин (условия анализа S)
[Пример 298]
Соединение F5-5
9-Этинил-6,6-диметил-8-морфолин-4-ил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
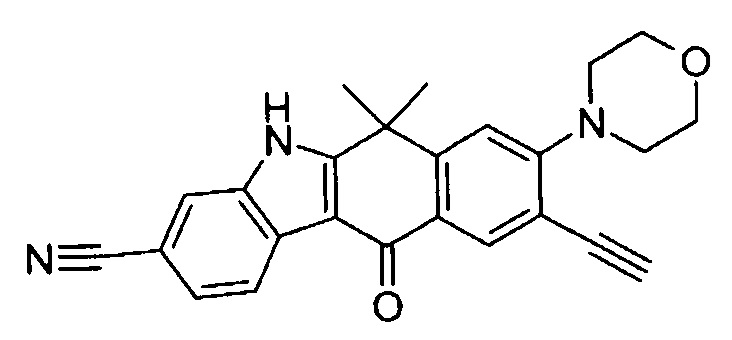
С использованием тех же условий, как в способе синтеза Соединения E4-2-1 и Соединения E4-2-2, получали указанное в заголовке соединение, исходя из Соединения F3-4.
1H-ЯМР (400 МГц, DМSO-d6) δ: 12,82 (1 H, с), 8,31 (1 H, д, J=7,9 Гц), 8,18 (1 H, с), 8,02 (1 H, с), 7,61 (1 H, д, J=7,9 Гц), 7,28 (1 H, с), 4,53 (1 H, с), 3,80 (4 H, с), 3,36 (4 H, с), 1,79 (6 H, с).
ЖХ/МС: м/z 396 [М+H]+
ВЭЖХ время удерживания: 2,32 мин (условия анализа S)
[Пример 299]
Соединение F5-6
9-(3-Диметиламино-проп-1-инил)-6,6-диметил-8-морфолин-4-ил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E4-2-1, получали указанное в заголовке соединение, исходя из Соединения F3-4 и 3-диметиламинопропина.
1H-ЯМР(270 МГц, CDCl3) δ: 8,52 (1 H, д, J=7,8 Гц), 8,47 (1 H, с), 7,76 (1 H, с), 7,56 (1 H, д, J=7,8 Гц), 7,03 (1 H, с), 3,92 (4 H, м), 3,55 (2 H, с), 3,39 (4 H, м), 2,37 (6H, с), 1,83 (6 H, с).
ЖХ/МС: м/z 453 [М+H]+
[Пример 300]
Соединение F5-7
6,6-Диметил-8-морфолин-4-ил-9-(3-морфолин-4-ил-проп-1-инил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
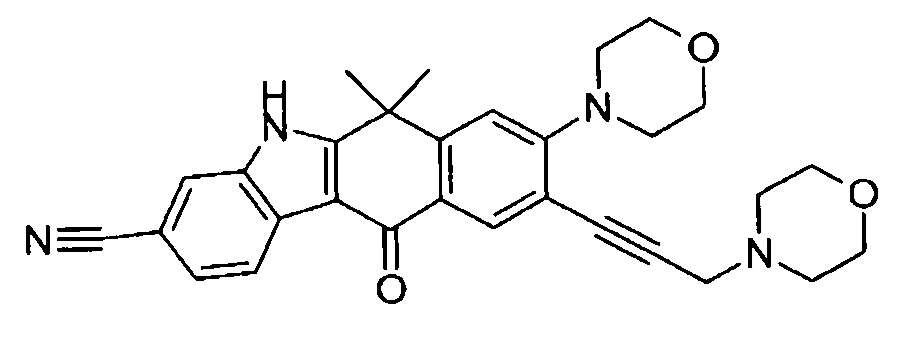
К 9-бром-6,6-диметил-8-морфолин-4-ил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрилу (Соединение F3-4, 30 мг, 0,067 ммоль), 3-бромпропину (0,01 мл, 0,13 ммоль), морфолину (0,029 мл, 0,33 ммоль), X-Phos (4,8 мг, 15% моль), PdCl2(CH3CN)2(0,9 мг, 5% мол.) и карбонату цезия (87 мг, 0,27 ммоль) добавляли ацетонитрил (2 мл) и смесь перемешивали при 80°C в течение 2 часов. Реакционный раствор добавляли в воду и затем экстрагировали дихлорметаном. Органический слой сушили над сульфатом натрия. Осушитель удаляли фильтрованием, и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (дихлорметан/метанол) с получением целевого соединения (бледно-коричневое твердое вещество, 18 мг, 64%).
1H-ЯМР(270 МГц, DМSO-d6) δ: 8,29 (1 H, д, J=7,8 Гц), 8,14 (1 H, с), 8,00 (1 H, с), 7,59 (1 H, д, J=7,8 Гц), 7,27 (1 H, с), 3,79 (4 H, м), 3,64 (4 H, м), 3,61 (2 H, с), 3,33 (4 H, м), 2,56 (4 H, м), 1,77 (6 H, с).
ЖХ/МС: м/z 495 [М+H]+
[Пример 301]
Соединение F5-8
6,6-Диметил-8-морфолин-4-ил-11-оксо-9-пент-1-инил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E4-2-1, получали указанное в заголовке соединение, исходя из Соединения F3-4 и 1-пентина.
ЖХ/МС: m/z 438 [M+H]+
ВЭЖХ время удерживания: 2,88 мин (условия анализа S)
[Пример 302]
Соединение F5-9
9-(3-Метокси-проп-1-инил)-6,6-диметил-8-морфолин-4-ил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E4-2-1, получали указанное в заголовке соединение, исходя из Соединения F3-4 и 3-метоксипропина.
1H-ЯМР(270 МГц, DМSO-d6) δ: 8,30 (1 H, д, J=7,8 Гц), 8,15 (1 H, с), 8,01 (1 H, с), 7,60 (1 H, д, J=7,8 Гц), 7,28 (1 H, с), 4,41 (2 H, с), 3,79 (4 H, м), 3,37 (3 H, с), 3,34 (4 H, м), 1,78 (6 H, с).
ЖХ/МС: м/z 440 [М+H]+
[Пример 303]
Соединение F5-10
9-[3-(4-Циклопропил-пиперазин-1-ил)-проп-1-инил]-6,6-диметил-8-морфолин-4-ил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения F5-7, получали указанное в заголовке соединение, исходя из Соединения F3-4 и 3-бромпропина и 4-циклопропилпиперазина.
ЖХ/МС: m/z 534 [M+H]+
ВЭЖХ время удерживания: 1,40 мин (условия анализа S)
[Пример 304]
Соединение F5-11
6,6-Диметил-9-(1-метил-1H-пиразол-4-ил)-8-морфолин-4-ил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E4-7-1, получали указанное в заголовке соединение, исходя из Соединения F3-4 и 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола.
1H-ЯМР (400 МГц, DМSO-d6) δ: 8,29 (1 H, д, J=7,8 Гц), 8,22 (1 H, с), 8,09 (1 H, с), 7,99 (1 H, с), 7,95 (1 H, с), 7,56-7,61 (1 H, м), 7,36 (1 H, с), 3,90 (3 H, с), 3,73 (4 H, с), 2,95 (4 H, с), 1,77 (6 H, с).
ЖХ/МС: м/z 452 [М+H]+
ВЭЖХ время удерживания: 2,18 мин (условия анализа U)
[Пример 305]
Соединение F5-12
9-Циклопропил-6,6-диметил-8-морфолин-4-ил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E4-7-1, получали указанное в заголовке соединение, исходя из Соединения F3-4 и калия циклопропилтрифторбората.
1H-ЯМР(270 МГц, CD3OD+CDCl3) δ: 8,45 (1 H, д, J=7,8 Гц), 7,83 (2 H, м), 7,54 (1 H, д, J=7,8 Гц), 7,20 (1 H, с), 3,96 (4 H, м), 3,24 (4 H, м), 2,25 (1 H, м), 1,80 (6 H, с), 1,09 (2 H, м), 0,93 (2 H, м).
ЖХ/МС: м/z 412 [М+H]+
[Пример 306]
Соединение F5-13
6,6-Диметил-8-морфолин-4-ил-11-оксо-9-винил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-24, получали указанное в заголовке соединение, исходя из Соединения F3-4 и калия винилтрифторбората.
ЖХ/МС: m/z 398 [M+H]+
ВЭЖХ время удерживания: 2,67 мин (условия анализа U)
[Пример 307]
Соединение F5-14
9-Этинил-8-(4-изопропил-пиперазин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения F5-43, получали указанное в заголовке соединение, исходя из Соединения F3-8.
1H-ЯМР (400 МГц, DМSO-d6) δ: 12,73 (1 H, с), 8,31 (1 H, д, J=9,1 Гц), 8,16 (1 H, д, J=1,2 Гц), 8,00 (1 H, с), 7,60 (1 H, д, J=7,9 Гц), 7,25 (1 H, с), 4,50 (1 H, д, J=1, 8 Гц), 2,72 (1 H, м), 2,65 (4 H, с), 1,78 (6 H, с), 1,04 (6 H, д, J=5,5 Гц).
ЖХ/МС: м/z 437 [М+H]+
ВЭЖХ время удерживания: 1,48 мин (условия анализа S)
[Пример 308]
Соединение F5-15-1
трет-Бутиловый эфир 4-(3-циано-9-циклопропил-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-ил)пиперазин-1-карбоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения E4-7-1, получали указанное в заголовке соединение, исходя из Соединения F3-10 и калия циклопропилтрифторбората.
1H-ЯМР(400 МГц, DМSO-d6) δ: 8,55( 1 H, с), 8,28-8,25 (1 H, м), 7,98-7,95 (1 H, м), 7,62 (1 H, с), 7,32 (1 H, с), 3,56-3,53 (4 h, м), 3,09-3,07 (4 H, м), 2,22-2,18 (1 H, м), 1,73 (6 H, ушир. с), 1,44 (9 H, с), 1,08-1,05 (2 H, м), 0,77-0,76 (2 H, м).
ЖХ/МС: м/z 511 [М+H]+
ВЭЖХ время удерживания: 4,50 мин (условия анализа W)
[Пример 309]
Соединение F5-15-2
9-Циклопропил-6,6-диметил-11-оксо-8-пиперазин-1-ил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения F5-15-1.
ЖХ/МС: m/z 411 [M+H]+
ВЭЖХ время удерживания: 2,67 мин (условия анализа W)
[Пример 310]
Соединение F5-16
9-Этинил-6,6-диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения F5-43, получали указанное в заголовке соединение, исходя из Соединения F4-3.
1H-ЯМР (270 МГц, DМSO-d6) δ: 12,77 (1 H, ушир. с), 8,31 (1 H, д, J=8,2 Гц), 8,16 (1 H, с), 8,02 (1 H, с), 7,61 (1 H, дд, J=8,2, 1,3 Гц), 7,27 (1 H, с), 4,59 (2 H, дд, J=6,6, 6,6 Гц), 4,51 (1 H, с), 4,49 (2 H, дд, J=6,6, 6,6 Гц), 3,51 (1 H, т, J=6,6 Гц), 3,35-3,43 (4 H, м), 2,43-2,50 (4H, с), 1,78 (6 H, с).
ЖХ/МС: м/z 451 [М+H]+
ВЭЖХ время удерживания: 1,40 мин (условия анализа S)
[Пример 311]
Соединение F5-17
6,6-Диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3,9-дикарбонитрил

В соответствии со способом, аналогичным способу синтеза Соединения A5-2, получали указанное в заголовке соединение, исходя из Соединения F4-3.
1H-ЯМР(270 МГц, DМSO-d6) δ: 12,84 (1 H, ушир. с), 8,36 (1 H, с), 8,32-8,29 (1 H, д, 8,08 Гц), 8,04 (1 H, с), 7,65-7,62 (1 H, д, 8,08 Гц), 7,44 (1 H, с), 4,62-4,57 (2 H, м), 4,52-4,47 (2 H, м), 3,81-3,78 (2 H, т, 4,61 Гц), 3,57-3,50 (1 H, м), 3,43 (4 H, м), 2,51 (4 H, м), 1,80 (6 H, с).
ЖХ/МС: м/z 452 [М+H]+
[Пример 312]
Соединение F5-18
9-(3-Метокси-проп-1-инил)-6,6-диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
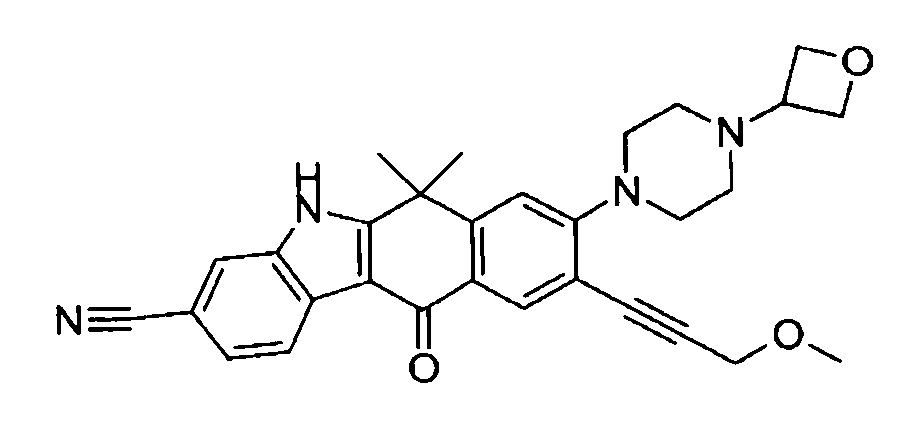
С использованием тех же условий, как в способе синтеза Соединения E4-2-1, получали указанное в заголовке соединение, исходя из Соединения F4-3 и 3-метоксипропина.
1H-ЯМР(270 МГц, DМSO-d6) δ: 12,77 (1 H, ушир. с), 8,32-8,29 (1 H, д, 8,08 Гц), 8,13 (1 H, с), 8,01 (1 H, с), 7,62-7,59 (1 H, д, 8,08 Гц), 7,27 (1 H, с), 4,62-4,57 (2 H, м), 4,52-4,47 (2 H, м), 4,39 (2 H, с), 3,53-3,47 (1 H, м), 3,38 (4 H, м), 3,36 (3 H, с), 2,51 (4 H, м), 1,77 (6 H, с).
ЖХ/МС: м/z 495 [М+H]+
[Пример 313]
Соединение F5-19
9-(3-Диметиламино-проп-1-инил)-6,6-диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
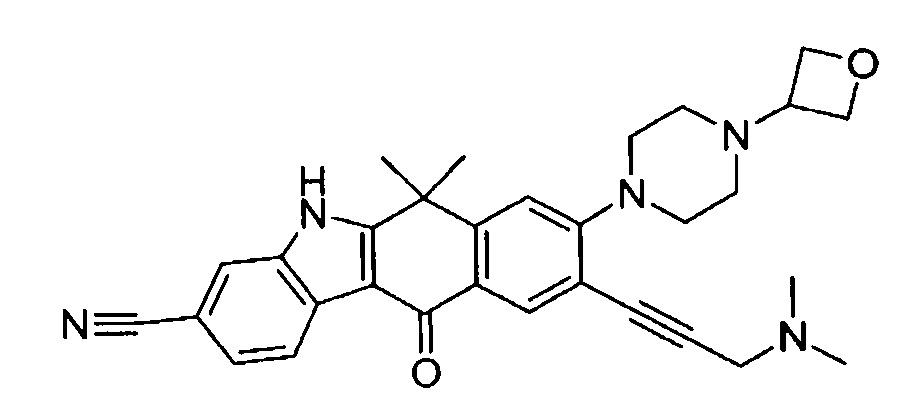
С использованием тех же условий, как в способе синтеза Соединения E4-2-1, получали указанное в заголовке соединение, исходя из Соединения F4-3 и диметил-проп-2-иниламина.
ЖХ/МС: m/z 508 [M+H]+
ВЭЖХ время удерживания: 1,07 мин (условия анализа S)
[Пример 314]
Соединение F5-20
6,6-Диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-9-[3-(4-оксетан-3-ил-пиперазин-1-ил)-проп-1-инил]-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения F5-7, получали указанное в заголовке соединение, исходя из Соединения F4-3, 3-бромпропина и 4-оксетан-3-ил-пиперазина.
1H-ЯМР(270 МГц, DМSO-d6) δ: 8,30 (1 H, д, J=7,8 Гц), 8,12 (1 H, с), 8,00 (1 H, с), 7,59 (1 H, д, J=7,8 Гц), 7,26 (1 H, с), 4,60-4,42 (8 H, м), 3,61 (2 H, с), 3,60-3,30 (6 H, м), 2,60-2,30 (12 H, м), 1,77 (6 H, с).
ЖХ/МС: м/z 605 [М+H]+
[Пример 315]
Соединение F5-21
9-Циклопентилэтинил-6,6-диметил-8-(4-оксетан-3-илпиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E4-2-1, получали указанное в заголовке соединение, исходя из Соединения F4-3 и циклопентилацетилена.
ЖХ/МС: m/z 519 [M+H]+
ВЭЖХ время удерживания: 1,80 мин (условия анализа S)
[Пример 316]
Соединение F5-22
6,6-Диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-9-проп-1-инил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E4-2-1, получали указанное в заголовке соединение, исходя из Соединения F4-3 и пропина.
1H-ЯМР(400 МГц, CD3OD) δ: 8,37 (1 H, д, J=8,2 Гц), 8,18 (1 H, с), 7,84 (1 H, с), 7,53 (1 H, д, J=8,2 Гц), 7,19 (1 H, с), 4,70-4,77 (2 H, м), 4,62-4,68 (2 H, м), 3,57-3,63 (1 H, м), 3,38-3,45 (4 H, м), 2,54-2,61 (4 H, м), 2,10 (3 H, с), 1,79 (6 H, с).
ЖХ/МС: м/z 465 [М+H]+
ВЭЖХ время удерживания: 1,90 мин (условия анализа U)
[Пример 317]
Соединение F5-23
9-(3-Гидрокси-проп-1-инил)-6,6-диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E4-2-1, TMS комплекс указанного в заголовке соединения получали, исходя из Соединения F4-3 и триметилпроп-2-инилоксисилана. Путем обработки полученного TMS комплекса тетрабутиламмонийфторидом получали указанное в заголовке соединение.
ЖХ/МС: m/z 481 [M+H]+
ВЭЖХ время удерживания: 1,30 мин (условия анализа S)
[Пример 318]
Соединение F5-24
6,6-Диметил-9-(4-метил-пент-1-инил)-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E4-2-1, получали указанное в заголовке соединение, исходя из Соединения F4-3 и 4-метилпент-1-ина.
1H-ЯМР(270 МГц, DМSO-d6) δ: 12,75 (1 H, ушир. с), 8,32-8,29 (1 H, д, 8,08 Гц), 8,08 (1 H, с), 8,01 (1 H, с), 7,62-7,59 (1 H, м), 7,23 (1 H, с), 4,61-4,57 (2 H, м), 4,51-4,46 (2 H, м), 3,51-3,47 (1 H, м), 3,37 (4 H, м), 2,46 (4 H, м), 2,41-2,39 (2 H, д, 5,94 Гц), 1,92-1,80 (1 H, м), 1,77 (6 H, с), 1,04 (3 H, с), 1,01 (3 H, с).
ЖХ/МС: м/z 507 [М+H]+
[Пример 319]
Соединение F5-25
9-Циклопропилэтинил-6,6-диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
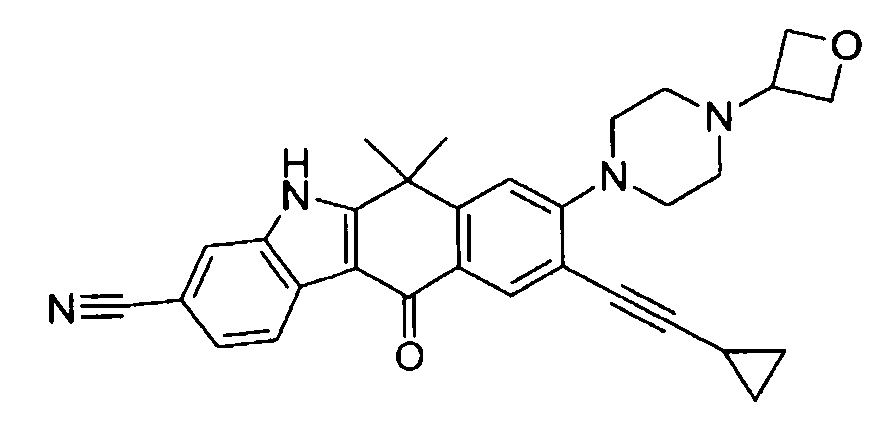
С использованием тех же условий, как в способе синтеза Соединения E4-2-1, получали указанное в заголовке соединение, исходя из Соединения F4-3 и этинилциклопропана.
1H-ЯМР(270 МГц, DМSO-d6) δ: 12,74 (1 H, ушир. с), 8,32-8,29 (1 H, д, 8,08 Гц), 8,05 (1 H, с), 8,00 (1 H, с), 7,62-7,58 (1 H, м), 7,21 (1 H, с), 4,62-4,57 (2 H, м), 4,51-4,47 (2 H, м), 3,53-3,48 (1 H, м), 3,34 (4 H, м), 2,46 (4 H, м), 1,76 (6 H, с), 1,64-1,58 (1 H, м), 0,97-0,89 (2 H, м), 0,76-0,70 (2 H, м).
ЖХ/МС: м/z 491 [М+H]+
[Пример 320]
Соединение F5-26
6,6-Диметил-9-(3-морфолин-4-ил-проп-1-инил)-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения F5-7, получали указанное в заголовке соединение, исходя из Соединения F4-3, 3-бромпропина и морфолина.
1H-ЯМР(270 МГц, DМSO-d6) δ: 8,29 (1 H, д, J=7,8 Гц), 8,13 (1 H, с), 8,02 (1 H, с), 7,59 (1 H, д, J=7,8 Гц), 7,25 (1 H, с), 4,61-4,48 (4 H, м), 3,64-3,32 (11 H, м), 2,60-2,40 (8 H, м), 1,78 (6 H, с).
ЖХ/МС: м/z 550 [М+H]+
[Пример 321]
Соединение F5-27
6,6-Диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-9-пент-1-инил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E4-2-1, получали указанное в заголовке соединение, исходя из Соединения F4-3 и 1-пентина.
1H-ЯМР (400 МГц, DМSO-d6) δ: 12,72 (1 H, ушир. с), 8,28 (1 H, д, 8,1 Гц), 8,06 (1 H, с), 7,98 (1 H, с), 7,58 (1 H, д, 8,1 Гц), 7,21 (1 H, с), 4,60-4,43 (4 H, м), 3,53-3,44 (1 H, м), 3,39-3,32 (2 H, м), 1,75 (6 H, с), 1,60-1,53 (4 H, м), 1,01 (3 H, т, 7,3 Гц).
ЖХ/МС: м/z 493 [М+H]+
ВЭЖХ время удерживания: 2,17 мин (условия анализа U)
[Пример 322]
Соединение F5-28
6,6-Диметил-9-(5-метилгекс-1-инил)-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E4-2-1, получали указанное в заголовке соединение, исходя из Соединения F4-3 и 5-метилгекс-1-ина.
ЖХ/МС: m/z 521 [M+H]+
ВЭЖХ время удерживания: 2,37 мин (условия анализа U)
[Пример 323]
Соединение F5-29
9-(3-Диэтиламино-проп-1-инил)-6,6-диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E4-2-1, получали указанное в заголовке соединение, исходя из Соединения F4-3 и 3-диэтиламинопропина.
ЖХ/МС: m/z 536 [M+H]+
ВЭЖХ время удерживания: 1,13 мин (условия анализа S)
[Пример 324]
Соединение F5-30
9-[3-(Бензил-этил-амино)-проп-1-инил]-6,6-диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E4-2-1, получали указанное в заголовке соединение, исходя из Соединения F4-3 и 3-бензил-3-этиламинопропина.
ЖХ/МС: m/z 584 [M+H]+
ВЭЖХ время удерживания: 1,32 мин (условия анализа S)
[Пример 325]
Соединение F5-31
9-[3-(1,1-Диоксо-1λ6-тиоморфолин-4-ил)-проп-1-инил]-6,6-диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E4-2-1, получали указанное в заголовке соединение, исходя из Соединения F4-3 и 3-(1,1-диоксо-1λ6-тиоморфолин-4-ил)пропина.
ЖХ/МС: m/z 598 [M+H]+
ВЭЖХ время удерживания: 1,35 мин (условия анализа S)
[Пример 326]
Соединение F5-32
9-Изопропенил-6,6-диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E4-7-1, получали указанное в заголовке соединение, исходя из Соединения F4-3 и 2-изопропенил-4,4,5,5-тетраметил-[1,3,2]диоксаборолана.
1H-ЯМР(270 МГц, CD3OD+CDCl3) δ: 8,44 (1H, д, J=7,8 Гц), 8,09 (1 H, с), 7,83 (1 H, с), 7,54 (1 H, д, J=7,8 Гц), 7,18 (1 H, с), 5,24-5,20 (2 H, м), 4,81-4,68 (4 H, м), 3,66 (1 H, м), 3,30 (4 H, м), 2,57 (4 H, м), 2,21 (3 H, с), 1,82 (6 H, с).
ЖХ/МС: м/z 467 [М+H]+
[Пример 327]
Соединение F5-33
6,6,9-Триметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
С использованием тех же условий, как в способе синтеза Соединения F5-47, получали указанное в заголовке соединение, исходя из Соединения F4-3.
1H-ЯМР(270 МГц, DМSO-d6) δ: 12,71 (1 H, ушир. с), 8,33-8,31 (1 H, д, 8,08 Гц), 8,01 (1 H, с), 7,97 (1 H, с), 7,62-7,59 (1 H, м), 7,32 (1 H, с), 4,61-4,57 (2 H, м), 4,51-4,47 (2 H, м), 3,55-3,49 (1 H, м), 3,05 (4 H, м), 2,47 (4 H, м), 2,33 (3 H, с), 1,76 (6 H, с).
ЖХ/МС: м/z 441 [М+H]+
[Пример 328]
Соединение F5-34
9-Циклопропил-6,6-диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения F5-15-2 и оксетан-3-она.
1H-ЯМР(400 МГц, DМSO-d6) δ: 8,32-8,29 (1 H, м), 8,00-7,99 (1 H, м), 7,62-7,58 (2 H, м), 7,32-7,31 (1 H, м), 4,61-4,57 (2 H, м), 4,52-4,49 (2 H, м), 3,53 (1 H, ушир. с), 3,18 (4 H, ушир. с), 1,75 (6 H, с), 1,25-1,23 (1 H, м), 1,09-1,04 (2 H, м), 0,79-0,75 (2 H, м).
ЖХ/МС: м/z 467 [М+H]+
ВЭЖХ время удерживания: 2,74 мин (условия анализа W)
[Пример 329]
Соединение F5-35
6,6-Диметил-9-(1-метил-1H-пиразол-4-ил)-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E4-7-1, получали указанное в заголовке соединение, исходя из Соединения F4-3 и 1-метил-4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-1H-пиразола.
ЖХ/МС: m/z 507 [M+H]+
ВЭЖХ время удерживания: 1,75 мин (условия анализа U)
[Пример 330]
Соединение F5-36-1
трет-Бутиловый эфир 4-[3-циано-6,6-диметил-11-оксо-8-(4-пирролидин-1-ил-пиперидин-1-ил)-6,11-дигидро-5H-бензо[b]карбазол-9-ил]-3,6-дигидро-2H-пиридин-1-карбоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения E4-7-1, получали указанное в заголовке соединение, исходя из Соединения F3-2.
ЖХ/МС: m/z 621 [M+H]+
ВЭЖХ время удерживания: 2,58 мин (условия анализа U)
[Пример 331]
Соединение F5-36-2
6,6-Диметил-11-оксо-8-(4-пирролидин-1-ил-пиперидин-1-ил)-9-(1,2,3,6-тетрагидро-пиридин-4-ил)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения F5-36-1.
ЖХ/МС: m/z 520 [M+H]+
ВЭЖХ время удерживания: 1,82 мин (условия анализа U)
[Пример 332]
Соединение F5-37
8-(4-Циклопропил-пиперазин-1-ил)-9-этинил-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения F5-43, получали указанное в заголовке соединение, исходя из Соединения F4-9.
1H-ЯМР (270 МГц, DМSO-d6) δ: 12,76 (1 H, ушир. с), 8,31 (1 H, д, J=8, 1 Гц), 8,15 (1 H, с), 8,01 (1 H, с), 7,61 (1 H, дд, J=8,1, 1,5 Гц), 7,24 (1 H, с), 4,52 (1 H, с), 3,28-3,36 (4 H, м), 3,17 (1 H, д, J=5,3 Гц), 2,70-2,77 (4 H, м), 1,76 (6 H, с), 0,47 (2 H, д, J=5,3 Гц), 0,36 (2 H, д, J=5,3 Гц).
ЖХ/МС: м/z 435 [М+H]+
ВЭЖХ время удерживания: 1,57 мин (условия анализа S)
[Пример 333]
Соединение F5-38
8-(4-Циклопропил-пиперазин-1-ил)-6,6-диметил-11-оксо-9-проп-1-инил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E4-2-1, получали указанное в заголовке соединение, исходя из Соединения F4-9 и пропина.
1H-ЯМР(270 МГц, DМSO-d6) δ: 12,76 (1 H, ушир. с), 8,31-8,28 (1 H, д, 8,08 Гц), 8,06 (1 H, с), 8,00 (1 H, с), 7,60-7,57 (1 H, м), 7,19 (1 H, с), 3,29 (4 H, м), 2,74 (4 H, м), 2,55 (1 H, м), 2,13 (3 H, с), 1,75 (6 H, с), 0,51-0,43 (2 H, м), 0,38-0,32 (2 H, м).
ЖХ/МС: м/z 449 [М+H]+
[Пример 334]
Соединение F5-39
8-(4-Циклопропил-пиперазин-1-ил)-6,6-диметил-11-оксо-9-фенил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E4-7-1, получали указанное в заголовке соединение, исходя из Соединения F4-9 и фенилборной кислоты.
ЖХ/МС: m/z 487 [M+H]+
ВЭЖХ время удерживания: 2,15 мин (условия анализа U)
[Пример 335]
Соединение F5-40
8-(4-Циклопропил-пиперазин-1-ил)-6,6-диметил-11-оксо-9-пиридин-3-ил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
С использованием тех же условий, как в способе синтеза Соединения E4-7-1, получали указанное в заголовке соединение, исходя из Соединения F4-9 и пиридин-3-борной кислоты.
ЖХ/МС: m/z 488 [M+H]+
ВЭЖХ время удерживания: 1,53 мин (условия анализа U)
[Пример 336]
Соединение F5-41
8(4-Циклопропил-пиперазин-1-ил)-6,6-диметил-11-оксо-9-тиофен-2-ил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E4-7-1, получали указанное в заголовке соединение, исходя из Соединения F4-9 и тиофен-2-борной кислоты.
ЖХ/МС: m/z 493 [M+H]+
ВЭЖХ время удерживания: 2,13 мин (условия анализа U)
[Пример 337]
Соединение F5-42
8-(4-Циклопропил-пиперазин-1-ил)-6,6,9-триметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения F5-47, получали указанное в заголовке соединение, исходя из Соединения F4-9.
1H-ЯМР(270 МГц, DМSO-d6) δ: 12,71 (1 H, ушир. с), 8,33-8,30 (1 H, д, 8,08 Гц), 8,00 (1 H, с), 7,96 (1 H, с), 7,61-7,58 (1 H, м), 7,29 (1 H, с), 2,97 (4 H, м), 2,73 (4 H, м), 2,56 (1 H, м), 2,34 (3 H, с), 1,76 (6 H, с), 1,64-1,58 (1 H, м), 0,50-0,44 (2 H, м), 0,37-0,32 (2 H, м).
ЖХ/МС: м/z 425 [М+H]+
[Пример 338]
Соединение F5-43
8-(4-Циклобутил-пиперазин-1-ил)-9-этинил-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

В атмосфере азота к суспензии в MeCN (8 мл) 9-бром-8-(4-циклобутил-пиперазин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрила (Соединение F4-10, 200 мг, 0,397 ммоль) добавляли этинилтриизопропилсилан (268 мг, 3,0 экв.), 2-дициклогексилфосфино-2’,4’,6’-триизопропилбифенил (Xphos) (39 мг, 0,2 экв.), Pd(CH3CN)2Cl2(11 мг, 0,1 экв.) и карбонат цезия (518 мг, 4,0 экв.) и смесь перемешивали и нагревали в условиях кипячения с обратным холодильником вплоть до завершения реакции. Сразу после завершения реакции к реакционному раствору добавляли дистиллированную воду, затем смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Осушитель удаляли фильтрованием, и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/метанол) с получением 8-(4-циклобутил-пиперазин-1-ил)-6,6-диметил-11-оксо-9-[(триизопропилсиланил)этинил]-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрила (179 мг, 74%).
К ТГФ (6 мл) раствору полученного соединения (179 мг, 0,295 ммоль) добавляли 1 M раствор тетрабутиламмонийфторида в ТГФ (710 мкл) и смесь перемешивали вплоть до завершения реакции. Сразу после завершения реакции к реакционному раствору добавляли этилацетат, затем смесь промывали дистиллированной водой и сушили над сульфатом натрия. Осушитель удаляли фильтрованием, и остатки, полученные после концентрирования при пониженном давлении, промывали смесью растворителей этанола и дистиллированной воды с получением указанного в заголовке соединения (67 мг, 92%).
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,85 (1 H,с), 8,31 (1 H, д, 7,9 Гц), 8,20 (1 H, с), 8,03 (1 H, с), 7,62 (1 H, д, 7,9 Гц), 7,35 (1 H, с), 4,62 (1 H, с), 3,94-4,03 (2 H, м), 3,79-3,89 (1 H, м), 3,48-3,54 (2 H, м), 3,27-3,38 (2 H, м), 2,96-3,16 (2 H, м), 2,30-2,41 (2 H, м), 2,16-2,26 (2 H, м), 1,72-1,85 (8 H, м).
ЖХ/МС: м/z 449 [М+H]+
ВЭЖХ время удерживания: 2,69 мин (условия анализа W)
[Пример 339]
Соединение F5-44
8-(4-Циклобутил-пиперазин-1-ил)-6,6-диметил-11-оксо-9-проп-1-инил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
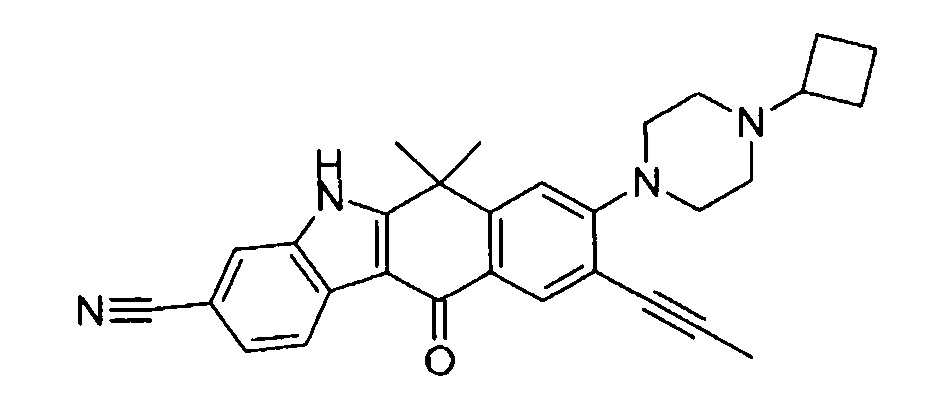
С использованием тех же условий, как в способе синтеза Соединения E4-2-1, получали указанное в заголовке соединение, исходя из Соединения F4-10 в атмосфере газообразного пропина.
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,71 (1 H, с), 8,30 (1 H, д, 7,9 Гц), 8,06 (1 H, с), 8,00 (1 H, с), 7,59 (1 H, д, 7,9 Гц), 7,20 (1 H, с), 2,75-2,83 (1 H, м), 2,40-2,48 (4 H, м), 2,11 (3 H, с), 1,97-2,06 (2 H, м), 1,76 (6 H, с), 1,62-1,71 (2 H, м).
ЖХ/МС: м/z 463 [М+H]+
ВЭЖХ время удерживания: 2,80 мин (условия анализа W)
[Пример 340]
Соединение F5-45
9-Циклобутилэтинил-8-(4-циклобутил-пиперазин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E4-2-1, получали указанное в заголовке соединение, исходя из Соединения F4-10 и этинилциклобутана.
ЖХ/МС: m/z 503 [M+H]+
ВЭЖХ время удерживания: 1,85 мин (условия анализа S)
[Пример 341]
Соединение F5-46
8-(4-Циклобутил-пиперазин-1-ил)-9-циклопропил-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения F5-15-2 и циклобутанона.
1H-ЯМР(400 МГц, DМSO-d6) δ: 8,23 (1 H, д, 8 Гц), 7,92 (1 H, ушир. с), 7,59 (1 H, с), 7,47 (1 H, ушир. д, 8 Гц), 7,28 (1 H, с), 3,12 (4 H, ушир. с), 2,80 (1 H, дддд, 8,8, 8,8 Гц), 2,20-2,13 (1 H, м), 2,01 (2 H, ушир. с), 1,86-1,68 (10 H, м), 1,05 (2 H, д, 8 Гц), 0,76 (2 H, д, 4 Гц).
ЖХ/МС: м/z 465 [М+H]+
ВЭЖХ время удерживания: 2,79 мин (условия анализа W)
Гидрохлоридная соль Соединения F5-46
К 8-(4-Циклобутил-пиперазин-1-ил)-9-циклопропил-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрилу добавляли DMSO и 6 н раствор хлористоводородной кислоты (1,05 экв.) и растворяли в них. После сушки замораживанием осуществляли кристаллизацию с использованием этанола, содержащего 25% воды, с получением моногидрохлоридной соли 8-(4-циклобутил-пиперазин-1-ил)-9-циклопропил-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрила.
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,81 (1 H, с), 10,64 (1 H, ушир. с), 8,32-8,29 (1 H, м), 8,01 (1 H, с), 7,67 (1 H, с), 7,61-7,60 (1 H, м), 7,33 (1 H, с), 4,00-3,39 (6 H, м), 3,28-3,02 (3 H, м), 2,45-2,05 (5 H, м), 1,83-1,77 (8 H, м), 1,09-1,07 (2 H, м), 0,81-0,80 (2 H, м).
ЖХ/МС: м/z 465 [М+H]+
[Пример 342]
Соединение F5-47
8-(4-Циклобутил-пиперазин-1-ил)-6,6,9-триметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

В атмосфере азота к раствору в N,N-диметилформамиде (1,5 мл) 9-бром-8-(4-циклобутил-пиперазин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрила (Соединение F4-10, 50 мг, 0,099 ммоль) добавляли триметилбороксин (12 мг, 0,1 экв.), тетракистрифенилфосфинпалладий (39 мг, 0,2 экв.) и карбонат калия (41 мг, 3,0 экв.) и смесь перемешивали при 100°C в течение 24 часов. Сразу после завершения реакции к реакционному раствору добавляли дистиллированную воду, затем смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Осушитель удаляли фильтрованием, и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/метанол) с получением указанного в заголовке соединения (25 мг, 58%).
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,67 (1 H,с), 8,31 (1 H, д, 7,9 Гц), 7,98 (1 H, с), 7,95 (1 H, с), 7,59 (1 H, д, 7,9 Гц), 7,30 (1 H, с), 2,96-3,04 (4 H, м), 2,76-2,84 (1 H, м), 2,39-2,48 (4 H, м), 2,32 (3 H, с), 1,78-1,87 (2 H, м), 1,75 (6 H, с), 1,63-1,71 (2 H, м).
ЖХ/МС: м/z 439 [М+H]+
ВЭЖХ время удерживания: 2,66 мин (условия анализа W)
[Пример 343]
Соединение F5-48
8-(4-Циклобутил-пиперазин-1-ил)-9-изопропенил-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E4-7-1, получали указанное в заголовке соединение, исходя из Соединения F4-10 и 2-изопропенил-4,4,5,5-тетраметил-[1,3,2]диоксаборолана.
ЖХ/МС: m/z 465 [M+H]+
ВЭЖХ время удерживания: 1,63 мин (условия анализа S)
[Пример 344]
Соединение F5-49
9-Этинил-6,6-диметил-8-(4-морфолин-4-ил-пиперидин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения F5-43, получали указанное в заголовке соединение, исходя из Соединения F3-11.
ЖХ/МС: m/z 479 [M+H]+
ВЭЖХ время удерживания: 1,90 мин (условия анализа U)
[Пример 345]
Соединение F5-50
6,6-Диметил-8-(4-морфолин-4-ил-пиперидин-1-ил)-11-оксо-9-проп-1-инил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
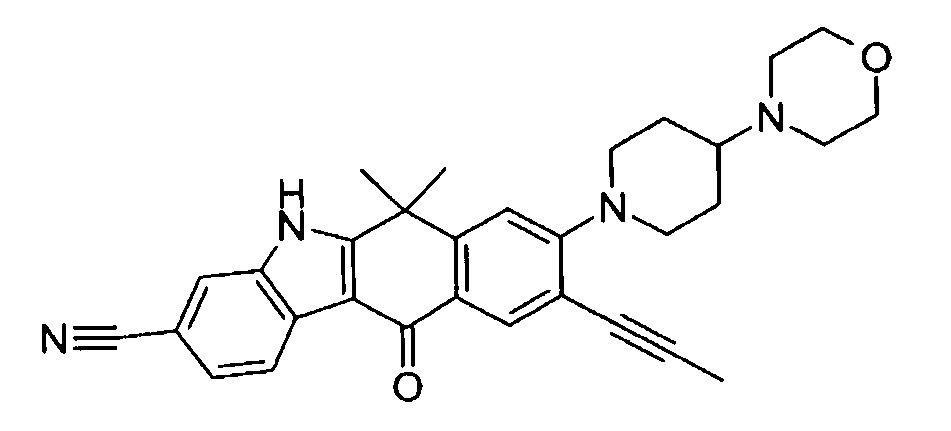
С использованием тех же условий, как в способе синтеза Соединения E4-2-1, получали указанное в заголовке соединение, исходя из Соединения F3-11 и газообразного пропина.
1H-ЯМР(270 МГц, CD3OD+CDCl3) δ: 8,40 (1 H, д, J=7,8 Гц), 8,24 (1 H, с), 7,84 (1 H, с), 7,54 (1 H, д, J=7,8 Гц), 7,14 (1 H, с), 4,01-3,96 (2 H, м), 3,78 (4 H, м), 2,88-2,84 (2 H, м), 2,68 (4 H, м), 2,16-1,73 (5 H, м), 2,16 (3 H, с), 1,80 (6 H, с).
ЖХ/МС: м/z 493 [М+H]+
[Пример 346]
Соединение F5-51
6,6,9-Триметил-8-(4-морфолин-4-ил-пиперидин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения F5-47, получали указанное в заголовке соединение, исходя из Соединения F3-11.
1H-ЯМР(270 МГц, DМSO-d6) δ: 12,70 (1 H, ушир. с), 8,33-8,30 (1 H, д, 8,08 Гц), 8,00 (1 H, с), 7,95 (1 H, с), 7,61-7,58 (1 H, м), 7,28 (1 H, с), 3,60 (4 H, м), 3,32-3,26 (2 H, м), 2,79-2,69 (2 H, м), 2,32 (3 H, с), 1,95-1,90 (2 H, м), 1,74 (6 H, с), 1,65-1,52 (2 H, м).
ЖХ/МС: м/z 469 [М+H]+
Соль метансульфоновой кислоты Соединения F5-51
К 6,6,9-триметил-8-(4-морфолин-4-ил-пиперидин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрилу добавляли DMSO и 2 н раствор метансульфоновой кислоты (1,05 экв.) и растворяли в них. После сушки замораживанием осуществляли кристаллизацию с использованием этанола с получением 6,6,9-триметил-8-(4-морфолин-4-ил-пиперидин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрила в форме соли метансульфоновой кислоты.
1H-ЯМР(270 МГц, DМSO-d6) δ: 12,72 (1 H, ушир.с), 9,60 (1 H, ушир. с), 8,33-8,31 (1 H, д, 9,8 Гц), 8,01 (1 H, с), 7,99 (1 H, с), 7,61-7,59 (1 H, м), 7,31 (1 H, с), 4,07-4,04 (2 H, м), 3,73-3,67 (2 H, м), 3,55-3,40 (8 H, м), 3,32-3,26 (1 H, м), 2,70-2,60 (2 H, м), 2,34 (3 H, с), 2,30 (3 H, с), 1,95-1,90 (2 H, м), 1,75 (6 H, с).
ЖХ/МС: м/z 469 [М+H]+
[Пример 347]
Соединение F6-1
9-(1-Изопропил-1,2,3,6-тетрагидро-пиридин-4-ил)-6,6-диметил-11-оксо-8-(4-пирролидин-1-ил-пиперидин-1-ил)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения F5-36-2 и ацетона.
1H-ЯМР (400 МГц, DМSO-d6) δ: 12,68 (1 H, ушир. с), 8,30 (1 H, д, 8,1 Гц), 7,98 (1 H, с), 7,82 (1 H, с), 7,58 (1 H, д, 8,1 Гц), 7,20 (1 H, с), 5,85 (1 H, с), 3,56-3,44 (2 H, м), 3,21-3,14 (2 H, м), 2,77-2,66 (5 H, м), 2,12-2,09 (1 H, м), 1,98-1,88 (2 H, м), 1,74 (6 H, с), 1,70-1,63 (1 H, м), 1,58-1,45 (2 H, м), 1,09-1,00 (6 H, м).
ЖХ/МС: м/z 563 [М+H]+
ВЭЖХ время удерживания: 1,90 мин (условия анализа U)
[Пример 348]
Соединение F6-2
9-(1-Метансульфонил-1,2,3,6-тетрагидро-пиридин-4-ил)-6,6-диметил-11-оксо-8-(4-пирролидин-1-ил-пиперидин-1-ил)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A9-1, получали указанное в заголовке соединение, исходя из Соединения F5-36-2.
ЖХ/МС: m/z 598 [M+H]+
ВЭЖХ время удерживания: 1,52 мин (условия анализа S)
[Пример 349]
Соединение F6-3
9-[3-(4-Циклопропил-пиперазин-1-ил)пропил]-6,6-диметил-8-морфолин-4-ил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-13-1, получали указанное в заголовке соединение, исходя из Соединения F5-10.
ЖХ/МС: m/z 538 [M+H]+
ВЭЖХ время удерживания: 1,32 мин (условия анализа S)
[Пример 350]
Соединение F6-4
9-Этил-6,6-диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-13-1, получали указанное в заголовке соединение, исходя из Соединения F5-16.
1H-ЯМР (400 МГц, DМSO-d6) δ: 12,70 (1 H, ушир. с), 8,29 (1 H, д, 8,0 Гц), 8,03-7,94 (2H, м), 7,59-7,55 (1 H, м), 7,38 (1 H, с), 4,59-4,47 (4 H, м), 3,53-5,47 (1 H, м), 3,03-2,97 (2 H, м), 2,73-2,62 (2 H, м), 1,74 (6 H, с), 1,29-1,98 (3 H, м).
ЖХ/МС: м/z 455 [М+H]+
ВЭЖХ время удерживания: 1,92 мин (условия анализа U)
Гидрохлоридная соль Соединения F6-4
К 9-этил-6,6-диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрилу добавляли DMSO и 6 н раствор хлористоводородной кислоты (1,05 экв.) и растворяли в них. После сушки замораживанием осуществляли кристаллизацию с использованием этанола, содержащего 25% воды, с получением моногидрохлоридной соли 9-этил-6,6-диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрила.
1H-ЯМР (270 МГц, DМSO-d6) δ: 12,83 (1 H, ушир. с), 11,59 (1 H, ушир. с), 8,33-8,31 (1 H, м), 8,09 (1H, с), 8,02 (1 H, с), 7,63-7,61 (1 H, м), 7,39 (1 H, с), 4,91-4,60 (4 H, ушир. м), 3,58-3,40 (1 H, м), 3,31-3,05 (8 H, ушир. м), 2,73 (2 H, кв., J=7,3), 1,81 (6 H, с), 1,29 (3 H, т, J=7,3).
ЖХ/МС: м/z 455 [М+H]+
[Пример 351]
Соединение F6-5
9-(3-Метокси-пропил)-6,6-диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
С использованием тех же условий, как в способе синтеза Соединения B3-13-1, получали указанное в заголовке соединение, исходя из Соединения F5-18.
1H-ЯМР(270 МГц, DМSO-d6) δ: 12,73 (1 H, ушир. с), 8,33-8,30 (1 H, д, 8,08 Гц), 8,01 (1 H, с), 8,00 (1 H, с), 7,62-7,59 (1 H, д, 8,08 Гц), 7,42 (1 H, с), 4,61-4,56 (2 H, м), 4,51-4,46 (2 H, м), 3,53-3,47 (1 H, м), 3,42-3,37 (2 H, м), 3,02 (4 H, м), 2,75-2,68 (2 H, м), 2,51 (4 H, м), 1,93-1,82 (2 H, м), 1,76 (6 H, с).
ЖХ/МС: м/z 499 [М+H]+
[Пример 352]
Соединение F6-6
6,6-Диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-9-[3-(4-оксетан-3-ил-пиперазин-1-ил)пропил]-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-13-1, получали указанное в заголовке соединение, исходя из Соединения F5-20.
ЖХ/МС: m/z 609 [M+H]+
ВЭЖХ время удерживания: 1,00 мин (условия анализа S)
[Пример 353]
Соединение F6-7
9-(2-Циклопентил-этил)-6,6-диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-13-1, получали указанное в заголовке соединение, исходя из Соединения F5-21.
ЖХ/МС: m/z 523 [M+H]+
ВЭЖХ время удерживания: 1,92 мин (условия анализа S)
[Пример 354]
Соединение F6-8
6,6-Диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-9-пропил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-13-1, получали указанное в заголовке соединение, исходя из Соединения F5-22.
1H-ЯМР (270 МГц, DМSO-d6) δ: 12,75 (1 H, с), 8,30 (1 H, д, J=8,2 Гц), 8,01-7,97 (2H, м), 7,59 (1 H, д, J=7,1 Гц), 7,38 (1H, с), 4,51 (4 H, дт, J=27,7, 6,3 Гц), 3,55-3,49 (1 H, м), 3,02-2,96 (4 H, м), 2,63 (2 H, т, J=7,3 Гц), 2,47-2,41 (4 H, м), 1,73 (6 H, с), 1,70-1,61 (2 H, м), 0,94 (3 H, т, J=7,4 Гц).
ЖХ/МС: м/z 469 [М+H]+
ВЭЖХ время удерживания: 1,57 мин (условия анализа S)
[Пример 355]
Соединение F6-9
8-[4-(4-Гидрокси-бутил)пиперазин-1-ил]-6,6-диметил-11-оксо-9-пропил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
Указанное в заголовке соединение получали в виде побочного продукта синтеза Соединения F6-8.
ЖХ/МС: m/z 485 [M+H]+
ВЭЖХ время удерживания: 1,61 мин (условия анализа S)
[Пример 356]
Соединение F6-10
9-(3-Гидрокси-пропил)-6,6-диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-13-1, получали указанное в заголовке соединение, исходя из Соединения F5-23.
ЖХ/МС: m/z 499 [M+H]+
ВЭЖХ время удерживания: 1,42 мин (условия анализа S)
[Пример 357]
Соединение F6-11
6,6-Диметил-9-(3-морфолин-4-ил-пропил)-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-13-1, получали указанное в заголовке соединение, исходя из Соединения F5-26.
ЖХ/МС: m/z 554 [M+H]+
ВЭЖХ время удерживания: 1,50 мин (условия анализа U)
[Пример 358]
Соединение F6-12
6,6-Диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-9-пентил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-13-1, получали указанное в заголовке соединение, исходя из Соединения F5-27.
ЖХ/МС: m/z 497 [M+H]+
ВЭЖХ время удерживания: 2,25 мин (условия анализа U)
[Пример 359]
Соединение F6-13
9-(3-Изопропокси-проп-1-инил)-6,6-диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
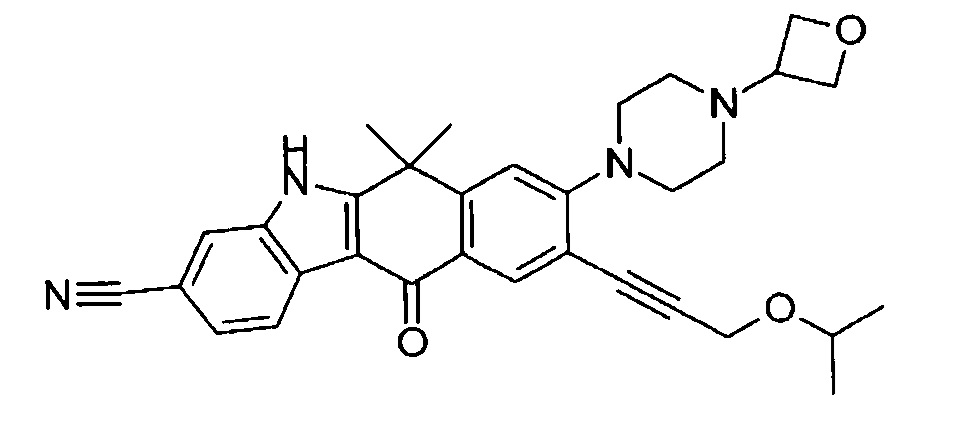
С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения F5-23 и 2-бромпропана.
1H-ЯМР(270 МГц, CD3OD+CDCl3) δ: 8,40 (1 H, д, J=7,8 Гц), 8,32 (1 H, с), 7,84 (1 H, с), 7,53 (1 H, д, J=7,8 Гц), 7,18 (1 H, с), 4,80-4,68 (4 H, м), 4,46 (2 H, с), 3,95 (1 H, м), 3,64 (1 H, м), 3,46 (4 H, м), 2,62 (4H, м), 1,82 (6 H, с), 1,24 (6 H, д, J=7,0 Гц).
ЖХ/МС: м/z 523 [М+H]+
[Пример 360]
Соединение F6-14
9-Изопропил-6,6-диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-13-1, получали указанное в заголовке соединение, исходя из Соединения F5-32.
1H-ЯМР(270 МГц, CD3OD+CDCl3) δ: 8,44 (1 H, д, J=7,8 Гц), 8,27 (1 H, с), 7,84 (1 H, с), 7,54 (1 H, д, J=7,8 Гц), 7,36 (1 H, с), 4,82-4,70 (4 H, м), 3,68 (1 H, м), 3,45 (1 H, м), 3,13-3,09 (4 H, м), 2,64-2,62 (4 H, м), 1,81 (6 H, с), 1,31 (6 H, д, J=7,0 Гц).
ЖХ/МС: м/z 469 [М+H]+
[Пример 361]
Соединение F6-15
8-(4-Циклопропил-пиперазин-1-ил)-9-этил-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-13-1, получали указанное в заголовке соединение, исходя из Соединения F5-37.
ЖХ/МС: m/z 439 [M+H]+
ВЭЖХ время удерживания: 1,98 мин (условия анализа U)
[Пример 362]
Соединение F6-16
8-(4-Циклопропил-пиперазин-1-ил)-6,6-диметил-11-оксо-9-пропил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-13-1, получали указанное в заголовке соединение, исходя из Соединения F5-38.
ЖХ/МС: m/z 453 [M+H]+
ВЭЖХ время удерживания: 1,63 мин (условия анализа S)
[Пример 363]
Соединение F6-17
8-(4-Циклобутил-пиперазин-1-ил)-9-этил-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-13-1, получали указанное в заголовке соединение, исходя из Соединения F5-43.
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,80 (1 H, с), 8,32 (1 H, д, 7,9 Гц), 8,10 (1 H, с), 8,02 (1 H, с), 7,62 (1 H, д, 7,9 Гц), 7,38 (1 H, с), 3,78-3,88 (1 H, м), 3,79-3,89 (1 H, м), 3,48-3,54 (2 H, м), 3,40-3,47 (2 H, м), 3,30-3,39 (2 H, м), 3,02-3,24 (4 H, м), 2,73 (2 H, кв., 7,3 Гц), 2,30-2,41 (2 H, м), 2,17-2,26 (2 H, м), 1,71-1,86 (8 H, м), 1,29 (3 H, т, 7,3 Гц).
ЖХ/МС: м/z 453 [М+H]+
ВЭЖХ время удерживания: 2,76 мин (условия анализа W)
Соль метансульфоновой кислоты Соединения F6-17
8-(4-Циклобутил-пиперазин-1-ил)-9-этил-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил растворяли в 6 объемах DMF при комнатной температуре и добавляли по каплям водный раствор метансульфоновой кислоты (2 M, 1,05 экв.). Полученный раствор добавляли по каплям к 60 объемам ацетонитрила, и осажденное твердое вещество фильтровали и сушили с получением 8-(4-циклобутил-пиперазин-1-ил)-9-этил-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрила в форме соли монометансульфоновой кислоты.
1H-ЯМР (400 МГц, DМSO-d6) δ: 12,75 (1 H, с), 8,31 (1 H, J=8,4 Гц), 8,07 (1 H, с), 8,01 (1 H, с), 7,59 (1 H, д, J=7,9 Гц), 7,38 (1 H, с), 3,58-2,84 (10 H, м), 2,71 (2 H, кв., J=7,5 Гц), 2,34 (3 H, с), 2,20-2,04 (4 H, м), 1,76-1,68 (8 H, м), 1,26 (3 H, т, J=7,5 Гц).
FABМS: м/z 453 [М+H]+
[Пример 364]
Соединение F6-18
8-(4-Циклобутил-пиперазин-1-ил)-6,6-диметил-11-оксо-9-пропил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-13-1, получали указанное в заголовке соединение, исходя из Соединения F5-44.
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,69 (1 H, с), 8,31 (1 H, д, 7,9 Гц), 8,01 (1 H, с), 7,99 (1 H, с), 7,60 (1 H, д, 7,9 Гц), 7,39 (1 H, с), 2,92-3,02 (4 H, м), 2,75-2,84 (1 H, м), 2,65 (2 H, т, 7,3 Гц), 2,38-2,48 (4 H, м), 1,96-2,06 (2 H, м), 1,78-1,87 (2 H, м), 1,75 (6 H, с), 1,62-1,73 (4 H, м), 0,97 (3 H, т, 7,3 Гц).
ЖХ/МС: м/z 467 [М+H]+
ВЭЖХ время удерживания: 2,96 мин (условия анализа W)
[Пример 365]
Соединение F6-19
8-(4-Циклобутил-пиперазин-1-ил)-9-изопропил-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-13, получали указанное в заголовке соединение, исходя из Соединения F5-48.
ЖХ/МС: m/z 467 [M+H]+
ВЭЖХ время удерживания: 1,67 мин (условия анализа S)
[Пример 366]
Соединение F6-20
9-Этил-6,6-диметил-8-(4-морфолин-4-ил-пиперидин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-13-1, получали указанное в заголовке соединение, исходя из Соединения F5-49.
1H-ЯМР (400 МГц, DМSO-d6) δ: 12,70 (1 H, с), 8,32 (1 H, д, J=7,9 Гц), 8,04 (1 H, с), 8,00 (1 H, с), 7,61 (1 H, д, J=8,5 Гц), 7,34 (1 H, с), 3,64-3,57 (4 H, м), 3,27-3,18 (2 H, м), 2,82-2,66 (4 H, м), 2,39-2,28 (1 H, м), 1,96-1,87 (2 H, м), 1,76 (6 H, с), 1,69-1,53 (2 H, м), 1,29 (3 H, т, J=7,3 Гц).
ЖХ/МС: м/z 483 [М+H]+
ВЭЖХ время удерживания: 1,98 мин (условия анализа U)
Гидрохлоридная соль Соединения F6-20
9-Этил-6,6-диметил-8-(4-морфолин-4-ил-пиперидин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил растворяли в смеси метилэтилкетона (10 объемов), воды (4 объема) и уксусной кислоты (3 объема) при 60°C. К растворенному раствору добавляли по каплям хлористоводородную кислоту (2 н) (1 объем). После перемешивания при 60°C в течение 30 минут добавляли по каплям этанол (25 объем). Осажденное твердое вещество фильтровали и сушили с получением моногидрохлоридной соли 9-этил-6,6-диметил-8-(4-морфолин-4-ил-пиперидин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрила.
1H-ЯМР (400 МГц, DМSO-d6) δ: 12,78 (1 H, с), 10,57 (1 H, ушир. с), 8,30 (1 H, J=8,4 Гц), 8,05 (1 H, с), 7,99 (1 H, с), 7,59 (1 H, д, J=7,9 Гц), 7,36 (1 H, с), 4,02-3,99 (2 H, м), 3,84-3,78 (2 H, м), 3,51-3,48 (2 H, м), 3,15-3,13 (1 H, с), 2,83-2,73 (2 H, с), 2,71-2,67 (2 H, с), 2,23-2,20 (2 H, м), 1,94-1,83 (2 H, м), 1,75 (6 H, с), 1,27 (3H, т, J=7,5 Гц).
FABМS: м/z 483 [М+H]+
[Пример 367]
Соединение F6-21
6,6-Диметил-8-(4-морфолин-4-ил-пиперидин-1-ил)-11-оксо-9-пропил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-13-1, получали указанное в заголовке соединение, исходя из Соединения F5-50.
1H-ЯМР(270 МГц, CD3OD+CDCl3) δ: 8,41 (1 H, д, J=7,8 Гц), 8,14 (1 H, с), 7,84 (1 H, с), 7,53 (1 H, д, J=7,8 Гц), 7,31 (1 H, с), 3,77 (4 H, м), 3,32 (2 H, м), 2,86-2,66 (8 H, м), 2,43-2,05 (3 H, м), 1,79 (6 H, с), 1,79-1,66 (4 H, м), 1,02 (3 H, т, J=7,3 Гц).
ЖХ/МС: м/z 497 [М+H]+
[Пример 368]
Соединение G2
8-Метокси-10,10-диметил-10,11-дигидро-5H-1,11-диаза-бензо[B]флуорен

2-Гидразинопиридин (1,3 г, 11,8 ммоль) и 7-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-он (Соединение A2, 2,4 г, 11,8 ммоль) растворяли в NMP (60 мл) и перемешивали при 190°C в течение 48 часов. Реакционный раствор разбавляли этилацетатом, промывали водой и сушили над сульфатом магния. Осушитель удаляли фильтрованием, и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением целевого соединения (белое твердое вещество, 101 мг, 3%).
1H-ЯМР (400 МГц, DМSO-d6) δ: 11,53 (1 H, с), 8,16-8,12 (1 H, м), 7,84 (1 H, д, J=7,8 Гц), 7,23 (1 H, д, J=8,4 Гц), 7,11 (1 H, с), 7,03-6,98 (1 H, м), 6,85-6,81 (1 H, м), 3,96 (2 H, с), 3,77 (3 H, с), 1,64 (6 H, с).
ЖХ/МС: м/z 279 [М+H]+
ВЭЖХ время удерживания: 2,08 мин (условия анализа U)
[Пример 369]
Соединение G3
8-Метокси-10,10-диметил-10,11-дигидро-1,11-диаза-бензо[b]флуорен-5-он

С использованием тех же условий, как в способе синтеза Соединения A4, получали указанное в заголовке соединение, исходя из Соединения G2.
1H-ЯМР (400 МГц, CDCl3) δ: 12,95 (1 H, ушир. с), 8,78 (1 H, д, J=7,8 Гц), 8,52 (1 H, д, J=4,9 Гц), 8,41 (1 H, д, J=8,8 Гц), 7,37 (1 H, дд, J=7,7, 5,0 Гц), 7,15 (1 H, с), 7,04-7,00 (1 H, м), 3,94 (3 H, с), 1,98 (6 H, с).
ЖХ/МС: м/z 293 [М+H]+
ВЭЖХ время удерживания: 2,13 мин (условия анализа U)
[Пример 370]
Соединение G4
8-Гидрокси-10,10-диметил-10,11-дигидро-1,11-диаза-бензо[b]флуорен-5-он

С использованием тех же условий, как в способе синтеза Соединения E3-2, получали указанное в заголовке соединение, исходя из Соединения G3.
1H-ЯМР (400 МГц, CDCl3) δ: 8,66 (1 H, д, J=7,7 Гц), 8,29 (1 H, д, J=4,9 Гц), 8,23 (1 H, д, J=13,8 Гц), 7,29 (1 H, дд, J=7,7, 5,0 Гц), 7,12 (1 H, с), 6,93 (1 H, д, J=8,6 Гц), 1,71 (6 H, с).
ЖХ/МС: м/z 279 [М+H]+
ВЭЖХ время удерживания: 1,72 мин (условия анализа U)
[Пример 371]
Соединение G5
10,10-Диметил-5-оксо-10,11-дигидро-5H-1,11-диаза-бензо[b]флуорен-8-иловый эфир трифторметансульфоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения B1, получали указанное в заголовке соединение, исходя из Соединения G4.
1H-ЯМР (400 МГц, CDCl3) δ: 8,81 (1 H, д, J=7,8 Гц), 8,60-8,52 (2 H, м), 7,55 (1 H, с), 7,46-7,40 (2 H, м), 2,01 (6 H, с).
ЖХ/МС: м/z 411 [М+H]+
ВЭЖХ время удерживания: 1,75 мин (условия анализа U)
[Пример 372]
Соединение G6
10,10-Диметил-8-(4-пирролидин-1-ил-пиперидин-1-ил)-10,11-дигидро-1,11-диаза-бензо[b]флуорен-5-он

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения G5 и 4-пирролидин-1-ил-пиперидина.
1H-ЯМР (400 МГц, CDCl3) δ: 13,12 (1 H, с), 8,78 (1 H, д, J=7,8 Гц), 8,49 (1 H, д, J=4,9 Гц), 8,29 (1 H, д, J=8,8 Гц), 7,34 (1 H, дд, J=7,7, 5,0 Гц), 7,06-6,98 (2 H, м), 3,96-3,88 (2 H, м), 3,02-3,92 (2H, м), 2,69-2,60 (4 H, м), 2,32-2,23 (1 H, м), 2,09-2,00 (4 H, м), 1,92 (6 H, с), 1,26-1,19 (4 H, м).
ЖХ/МС: м/z 415 [М+H]+
ВЭЖХ время удерживания: 1,57 мин (условия анализа U)
[Пример 373]
Соединение H1
6-Ацетил-7-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-он
К раствору 7-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-она (Соединение A2, 3 г, 14,7 ммоль) в дихлорметане (70 мл) добавляли уксусный ангидрид (1,7 мл, 1,2 экв.) и раствор хлорид алюминия–нитробензол (1 M, 44 мл, 3 экв.) при 0°C и перемешивали в течение 3 часов. Затем к реакционному раствору добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагировали два раза дихлорметаном. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом магния. Осушитель удаляли фильтрованием, и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения в виде неочищенного продукта.
[Пример 374]
Соединение H2-1
1-(3-Бром-8-метокси-6,6-диметил-6,11-дигидро-5H-бензо[b]карбазол-9-ил)этанон

С использованием тех же условий, как в способе синтеза Соединения A3-1, получали указанное в заголовке соединение, исходя из Соединения H1 и (3-бромфенил)гидразина.
ЖХ/МС: m/z 398 [M+H]+
ВЭЖХ время удерживания: 3,97 мин (условия анализа Y)
[Пример 375]
Соединение H2-2
1-(1-Бром-8-метокси-6,6-диметил-6,11-дигидро-5H-бензо[b]карбазол-9-ил)этанон
Указанное в заголовке соединение получали в виде побочного продукта синтеза Соединения H2-1.
ЖХ/МС: m/z 398 [M+H]+
ВЭЖХ время удерживания: 3,97 мин (условия анализа Y)
[Пример 376]
Соединение H3
9-Ацетил-3-бром-8-метокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он
С использованием тех же условий, как в способе синтеза Соединения A4, получали указанное в заголовке соединение, исходя из Соединения H2.
1H-ЯМР (300 МГц, DМSO-d6) δ: 1,80 (6 H, с), 2,58 (3 H, с), 4,06 (3 H, с), 7,38 (1 H, дд, 8,39 Гц, 1,91 Гц), 7,51 (1 H, с), 7,67 (1 H, ушир. с, 1,53 Гц), 8,10 (1 H, д, 8,39 Гц), 8,41 (1 H, с), 12,3 (1 H, с).
ЖХ/МС: м/z 412, 414 [М+H]+
ВЭЖХ время удерживания: 2,73 мин (условия анализа U)
[Пример 377]
Соединение H4
9-Ацетил-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

В соответствии со способом, аналогичным способу синтеза Соединения A5-2, получали указанное в заголовке соединение, исходя из Соединения H3.
1H-ЯМР (300 МГц, DМSO-d6) δ: 1,83 (6 H, с), 2,58 (3 H, с), 4,07 (3 H, с), 7,53 (1 H, с), 7,61 (1 H, д, 8,01 Гц), 8,03 (1 H, с), 8,31 (1 H, д, 8,77 Гц), 8,42 (1 H, с), 12,8 (1 H, с).
ЖХ/МС: м/z 359 [М+H]+
ВЭЖХ время удерживания: 2,47 мин (условия анализа U)
[Пример 378]
Соединение H5
9-Ацетил-8-гидрокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A6, получали указанное в заголовке соединение, исходя из Соединения H4.
1H-ЯМР (300 МГц, DМSO-d6) δ: 1,77 (6 H, с), 2,75 (3 H, с), 7,43 (1 H, с), 7,63 (1 H, д, 8,01 Гц), 8,02 (1 H, с), 8,32 (1 H, д, 8,01 Гц), 8,67 (1 H, с), 12,2 (1 H, с), 12,8 (1 H, с).
ЖХ/МС: м/z 345 [М+H]+
ВЭЖХ время удерживания: 2,27 мин (условия анализа S)
[Пример 379]
Соединение H6-1
9-Ацетил-6,6-диметил-11-оксо-8-(тетрагидро-пиран-4-илокси)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения H5 и тетрагидропиран-4-ола.
ЖХ/МС: m/z 429 [M+H]+
ВЭЖХ время удерживания: 2,48 мин (условия анализа U)
[Пример 380]
Соединение H6-2
9-Ацетил-8-(2-диэтиламино-этокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения H5.
ЖХ/МС: m/z 444 [M+H]+
ВЭЖХ время удерживания: 2,05 мин (условия анализа U)
[Пример 381]
Соединение H7
9-Ацетил-3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-иловый эфир трифторметансульфоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения B1, получали указанное в заголовке соединение, исходя из Соединения H5.
1H-ЯМР (300 МГц, DМSO-d6) δ: 1,83 (6 H, с), 2,74 (3 H, с), 7,68 (1 H, дд, 8,01 Гц, 1,53 Гц), 8,08 (2 H, с), 8,33 (1 H, д, 8,77 Гц), 8,79 (1 H, с), 12,9 (1 H, с).
[Пример 382]
Соединение H8-1
9-Ацетил-6,6-диметил-11-оксо-8-(4-пирролидин-1-ил-пиперидин-1-ил)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
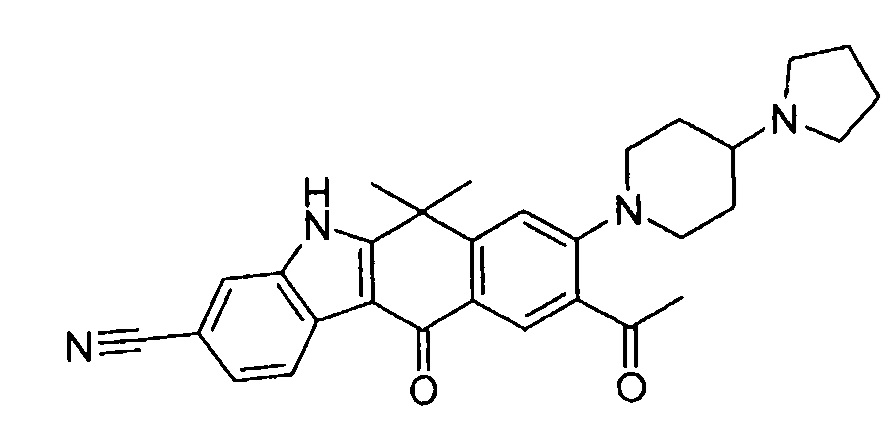
С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения H7 и 4-пирролидин-1-ил-пиперидина.
1H-ЯМР (300 МГц, DМSO-d6) δ: 1,65 (2 H, м), 1,69 (4 H, с), 1,79 (6 H, с), 1,95 (2 H, м), 2,18 (1 H, м), 2,54 (4 H, с), 2,59 (3 H, с), 2,93 (2 H, т, 11,8 Гц), 3,37 (2 H, м), 7,36 (1 H, с), 7,60 (1 H, д, 8,01), 8,01 (1 H, с), 8,13 (1 H, с), 8,30 (1 H, д, 8,39), 12,7 (1 H, с).
ЖХ/МС: м/z 481 [М+H]+
ВЭЖХ время удерживания: 2,03 мин (условия анализа U)
[Пример 383]
Соединение H8-2
9-Ацетил-8-(4-изопропил-пиперазин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения H7.
ЖХ/МС: m/z 455 [M+H]+
ВЭЖХ время удерживания: 2,02 мин (условия анализа U)
[Пример 384]
Соединение H8-3
9-Ацетил-6,6-диметил-8-морфолин-4-ил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения H7 и морфолина.
ЖХ/МС: m/z 414 [M+H]+
ВЭЖХ время удерживания: 2,11 мин (условия анализа S)
[Пример 385]
Соединение H8-4
9-Ацетил-6,6-диметил-8-(4-морфолин-4-ил-пиперидин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения H7 и 4-пиперидин-4-ил-морфолина.
ЖХ/МС: m/z 497 [M+H]+
ВЭЖХ время удерживания: 1,45 мин (условия анализа S)
[Пример 386]
Соединение H8-5
9-Ацетил-6,6-диметил-11-оксо-8-пиперазин-1-ил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения H7 и пиперазина.
ЖХ/МС: m/z 413 [M+H]+
ВЭЖХ время удерживания: 1,71 мин (условия анализа U)
[Пример 387]
Соединение H9-1
9-Ацетил-8-(4-циклобутил-пиперазин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения H8-5 и циклобутанона.
ЖХ/МС: m/z 467 [M+H]+
ВЭЖХ время удерживания: 1,82 мин (условия анализа U)
[Пример 388]
Соединение H9-2
9-Ацетил-6,6-диметил-11-оксо-8-[4-(тетрагидро-пиран-4-ил)пиперазин-1-ил]-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения H8-5 и тетрагидропиран-4-она.
ЖХ/МС: m/z 497 [M+H]+
ВЭЖХ время удерживания: 1,76 мин (условия анализа U)
[Пример 389]
Соединение H9-3
9-Ацетил-8-[4-(1,1-диметил-проп-2-инил)пиперазин-1-ил]-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

К раствору 9-ацетил-6,6-диметил-11-оксо-8-пиперазин-1-ил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрила (Соединение H8-5, 25 мг, 0,06 ммоль) в безводном ТГФ (0,5 мл) добавляли 3-хлор-3-метил-бут-1-ин (0,013 мл, 0,12 ммоль), хлорид меди(I) (0,6 мг, 0,006 ммоль) и триэтиламин (0,017 мл, 0,12 ммоль) при комнатной температуре. После перемешивания в течение 30 минут к смеси добавляли воду и экстрагировали этилацетатом. Органический слой сушили над сульфатом магния. Осушитель удаляли фильтрованием, и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на аминосиликагеле (дихлорметан/метанол) с получением указанного в заголовке соединения (белое твердое вещество, 9,8 мг, 35%).
ЖХ/МС: m/z 479 [M+H]+
ВЭЖХ время удерживания: 1,88 мин (условия анализа U)
[Пример 390]
Соединение I1-1
6-Хлор-7-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-он
7-Метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-он (Соединение A2, 3,37 г, 16,5 ммоль) растворяли в CH3CN (82 мл), добавляли NCS (2,42 г, 1,1 экв.) и перемешивали при 90°C в течение 1,5 часов. Реакционный раствор экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Осушитель удаляли, и целевое соединение получали после концентрирования при пониженном давлении (желтое маслянистое вещество, 4,45 г).
1H-ЯМР(400 МГц, CDCl3) δ: 7,16 (1 H, с), 6,85 (1 H, с), 3,90 (3 H, с), 3,00 (2 H, т, J=6,8 Гц), 2,65 (2 H, т, J=6,8 Гц), 1,42 (6 H, с).
ЖХ/МС: м/z 239 [М+H]+
ВЭЖХ время удерживания: 2,80 мин (условия анализа U)
[Пример 391]
Соединение I1-2
9-Хлор-8-метокси-6,6-диметил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
6-Хлор-7-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-он (Соединение I1-1, 4,45 г, 16,5 ммоль) и 3-гидразинобензонитрил (2,63 г, 1,2 экв.) растворяли в TFA (91 мл) и перемешивали при 90°C в течение 3 часов. Смесь концентрировали при пониженном давлении для удаления TFA и к остаткам добавляли насыщенный водный раствор NaHCO3, с последующим экстрагированием этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Осушитель удаляли фильтрованием и к остаткам, полученным после концентрирования при пониженном давлении, добавляли этилацетат. После перемешивания при комнатной температуре осажденное твердое вещество разделяли фильтрованием. Фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде смеси с I1-3 (красный порошок, 6,46 г).
[Пример 392]
Соединение I1-3
9-Хлор-8-метокси-6,6-диметил-6,11-дигидро-5H-бензо[b]карбазол-1-карбонитрил

Указанное в заголовке соединение получали в виде побочного продукта синтеза Соединения I1-2.
1H-ЯМР(400 МГц, DМSO-d6) δ: 11,66 (1 H, с), 7,65-7,69 (1 H, м), 7,44-7,48 (1 H, м), 7,39 (1 H, с), 7,29 (1 H, с), 7,17-7,23 (1 H, м), 4,21 (2 H, с), 3,91 (3 H, с), 1,69 (6 H, с).
ЖХ/МС: м/z 337 [М+H]+
ВЭЖХ время удерживания: 3,15 мин (условия анализа U)
[Пример 393]
Соединение I2-1
2-(4-Хлор-3-метокси-фенил)-2-метил-пропионитрил

1-Хлор-4-фтор-2-метокси-бензол (4,3 г, 26,78 ммоль) и изобутиронитрил (9,61 мл, 4,0 экв.) растворяли в толуоле (9,0 мл), добавляли KHMDS (80 мл, 0,5 M раствор толуол) и перемешивали при 65°C в течение 2 часов. Реакционный раствор охлаждали до комнатной температуры, добавляли 1 н водный раствор хлористоводородной кислоты и затем экстрагировали при помощи MTBE. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом магния. Осушитель удаляли фильтрованием, и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением указанного в заголовке соединения (1,72 г, 31%).
1H-ЯМР (270 МГц, CDCl3) δ: 7,37 (1 H, д, J=8,4 Гц), 7,05 (1 H, д, J=2, 1 Гц), 6,97 (1 H, дд, J=8,2, 2,1 Гц), 3,95 (3 H, с), 1,73 (6 H, с).
ВЭЖХ время удерживания: 2,33 мин (условия анализа S)
[Пример 394]
Соединение I2-2
Этиловый эфир 4-(4-хлор-3-метокси-фенил)-4-метил-3-оксопентановой кислоты
С использованием тех же условий, как в способе синтеза Соединения K3, получали указанное в заголовке соединение, исходя из Соединения I2-1.
1H-ЯМР (270 МГц, DМSO-d6) δ: 7,42 (1 H, д, J=8,1 Гц), 6,92 (1 H, д, J=2,1 Гц), 6,86 (1 H, дд, J=8,2, 2,3 Гц), 4,01 (2 H, кв., J=7,1 Гц), 3,87 (3 H, с), 3,43 (2 H, с), 1,44 (6 H, с), 1,12 (3 H, т, J=7,2 Гц).
ЖХ/МС: м/z 299, 301 [М+H]+
ВЭЖХ время удерживания: 2,52, 3,05 мин (условия анализа S)
[Пример 395]
Соединение I2-3
Этиловый эфир 4-(4-хлор-3-метокси-фенил)-2-(4-циано-2-нитро-фенил)-4-метил-3-оксопентановой кислоты
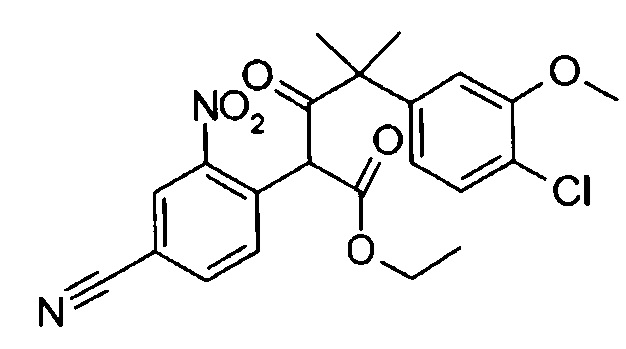
С использованием тех же условий, как в способе синтеза Соединения K4, указанное в заголовке соединение получали в виде неочищенного продукта, исходя из Соединения I2-2.
[Пример 396]
Соединение I2-4
Этиловый эфир 2-[1-(4-хлор-3-метокси-фенил)-1-метил-этил]-6-циано-1H-индол-3-карбоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения K5, указанное в заголовке соединение получали, исходя из Соединения I2-3.
ЖХ/МС: m/z 397, 399 [M+H]+
ВЭЖХ время удерживания: 2,83 мин (условия анализа S)
[Пример 397]
Соединение I3
9-Хлор-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

(Способ 1) С использованием тех же условий, как в способе синтеза Соединения A4, указанное в заголовке соединение получали, исходя из Соединения I1-2.
(Способ 2) С использованием тех же условий, как в способе синтеза Соединения L8-1, указанное в заголовке соединение получали, исходя из Соединения I2-4.
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,79 (1 H, с), 8,27-8,31 (1 H, м), 8,12 (1 H, с), 8,00-8,02 (1 H, м), 7,58-7,63 (1 H, м), 7,51 (1 H, с), 4,03 (3 H, с), 1,80 (6 H, с).
ЖХ/МС: м/z 351 [М+H]+
ВЭЖХ время удерживания: 2,87 мин (условия анализа U)
[Пример 398]
Соединение I4
9-Хлор-8-гидрокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E3-2, получали указанное в заголовке соединение, исходя из Соединения I3.
ЖХ/МС: m/z 337 [M+H]+
ВЭЖХ время удерживания: 2,47 мин (условия анализа U)
[Пример 399]
Соединение I5
9-Хлор-3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-иловый эфир трифторметансульфоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения B1, получали указанное в заголовке соединение, исходя из Соединения I4.
ЖХ/МС: m/z 469 [M+H]+
ВЭЖХ время удерживания: 3,40 мин (условия анализа U)
[Пример 400]
Соединение I6-1
9-Хлор-6,6-диметил-11-оксо-8-(4-пирролидин-1-ил-пиперидин-1-ил)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения I5 и 4-пирролидин-1-ил-пиперидина.
ЖХ/МС: m/z 473 [M+H]+
ВЭЖХ время удерживания: 2,25 мин (условия анализа U)
[Пример 401]
Соединение I6-2
9-Хлор-8-(4-изопропил-пиперазин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
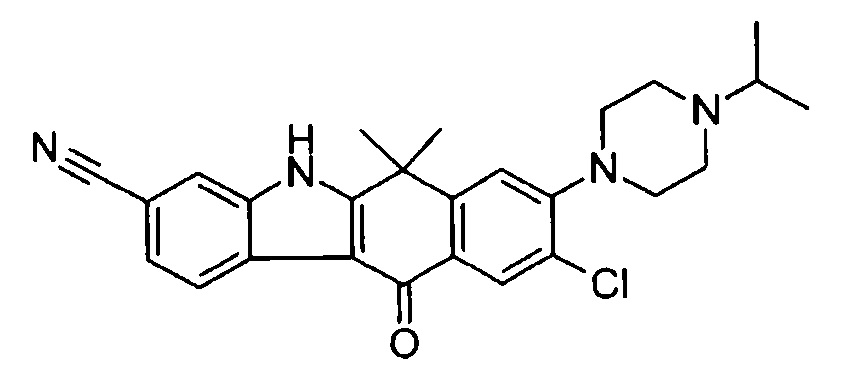
С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения I5.
ЖХ/МС: m/z 447 [M+H]+
ВЭЖХ время удерживания: 2,30 мин (условия анализа U)
[Пример 402]
Соединение I6-3
9-Хлор-6,6-диметил-8-морфолин-4-ил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из I5 и морфолина.
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,79 (1 H, с), 8,28 (1 H, д, 8,0 Гц), 8,09 (1 H, с), 8,00 (1 H, с), 7,59 (1 H, д, 8,0 Гц), 7,45 (1 H, с), 3,75-3,81 (4 H, м), 3,13-3,19 (4 H, м), 1,76 (6 H, с).
ЖХ/МС: м/z 406 [М+H]+
ВЭЖХ время удерживания: 2,88 мин (условия анализа U)
[Пример 403]
Соединение I6-4
9-Хлор-6,6-диметил-8-(4-морфолин-4-ил-пиперидин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения I5 и 4-пиперидин-4-ил-морфолина.
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,75 (1 H, с), 8,28 (1 H, д, 8,0 Гц), 8,07 (1 H, с), 8,00 (1 H, с), 7,59 (1 H, д, 8,0 Гц), 7,41 (1 H, с), 3,55-3,62 (4 H, м), 3,47-3,56 (4H, м), 2,75-2,86 (2 H, м), 2,45-2,55 (4 H, м), 2,28-2,39 (1 H, м), 1,86-1,96 (2 H, м), 1,76 (6 H, с), 1,52-1,66 (2 H, м).
ЖХ/МС: м/z 489 [М+H]+
ВЭЖХ время удерживания: 1,97 мин (условия анализа U)
[Пример 404]
Соединение I6-5-1
трет-Бутиловый эфир [1-(9-хлор-3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-ил)пиперидин-4-ил]карбаминовой кислоты

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения I5 и трет-бутилового эфира пиперидин-4-ил-карбаминовой кислоты.
ЖХ/МС: m/z 519 [M+H]+
ВЭЖХ время удерживания: 3,27 мин (условия анализа U)
[Пример 405]
Соединение I6-5-2
8-(4-Амино-пиперидин-1-ил)-9-хлор-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения I6-5-1.
ЖХ/МС: m/z 419 [M+H]+
ВЭЖХ время удерживания: 2,12 мин (условия анализа U)
[Пример 406]
Соединение I6-6
9-Хлор-6,6-диметил-11-оксо-8-пиперазин-1-ил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения I5 и пиперазина.
ЖХ/МС: m/z 405 [M+H]+
ВЭЖХ время удерживания: 1,87 мин (условия анализа U)
[Пример 407]
Соединение I7-1
N-[1-(9-Хлор-3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-ил)пиперидин-4-ил]метансульфонамид

С использованием тех же условий, как в способе синтеза Соединения A9-1, получали указанное в заголовке соединение, исходя из Соединения I6-5-2.
ЖХ/МС: m/z 497 [M+H]+
ВЭЖХ время удерживания: 2,62 мин (условия анализа U)
[Пример 408]
Соединение I7-2
9-Хлор-6,6-диметил-8-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения I5 и 1-оксетан-3-ил-пиперазин.
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,78 (1 H, с), 8,27-8,31 (1 H, м), 8,07-8,09 (1 H, с), 7,99-8,02 (1 H, м), 7,59-7,62 (1 H, м), 7,44-7,46 (1 H, с), 4,54-4,60 (2 H, м), 4,44-4,51 (2 H, м), 3,47-3,55 (1 H, м), 3,16-3,24 (4 H, м), 2,40-2,55 (4 H, м), 1,77 (6 H, с).
ЖХ/МС: м/z 461 [М+H]+
ВЭЖХ время удерживания: 2,13 мин (условия анализа U)
[Пример 409]
Соединение I7-3
9-Хлор-8-(4-циклопропил-пиперазин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения I5 и 1-циклопропилпиперазина.
ЖХ/МС: m/z 445 [M+H]+
ВЭЖХ время удерживания: 1,97 мин (условия анализа U)
[Пример 410]
Соединение I7-4
9-Хлор-8-(4-циклобутил-пиперазин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
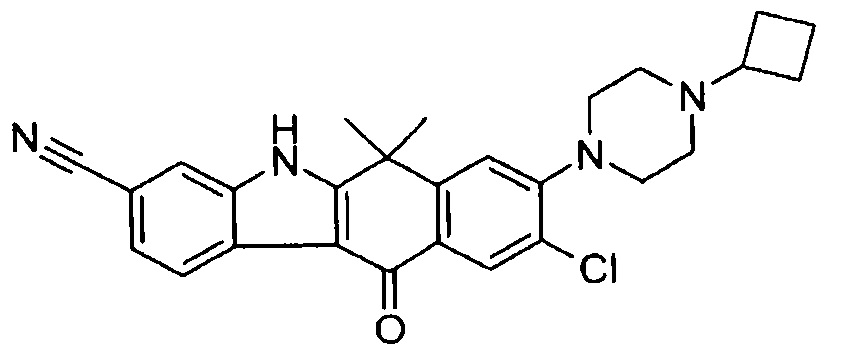
С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения I6-6 и циклобутанона.
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,78 (1 H, с), 8,29 (1 Н, д, 8,5 Гц), 8,08 (1 Н, с), 8,01 (1 Н, с), 7,60 (1 Н, д, 8,5 Гц), 7,44 (1 Н,с), 3,17-3,15 (4 н, м), 2,83-2,76 (1 Н, м), 2,47-2,44 (4 Н, м), 2,04-1,97 (2 Н, м), 1,82 (2 Н, т, 9,8 Гц), 1,77 (6 Н,с), 1,70-1,63 (2 Н, м).
ЖХ/МС: м/z 459, 461 [М+H]+
ВЭЖХ время удерживания: 1,63 мин (условия анализа S)
[Пример 411]
Соединение J2
6-Метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-он

С использованием тех же условий, как в способе синтеза Соединения A2, получали указанное в заголовке соединение, исходя из 6-метокси-3,4-дигидро-1H-нафталин-2-она и йодметана.
ЖХ/МС: m/z 205 [M+H]+
ВЭЖХ время удерживания: 1,54 мин (условия анализа S)
[Пример 412]
Соединение J3-1
9-Метокси-6,6-диметил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E2-1, получали указанное в заголовке соединение, исходя из Соединения J2 и 3-гидразино-бензонитрил.
ЖХ/МС: m/z 303 [M+H]+
ВЭЖХ время удерживания: 2,73 мин (условия анализа S)
[Пример 413]
Соединение J3-2
9-Метокси-6,6-диметил-6,11-дигидро-5H-бензо[b]карбазол-1-карбонитрил

Соединение J3-2 получали в виде побочного продукта синтеза Соединения J3-1.
ЖХ/МС: m/z 303 [M+H]+
ВЭЖХ время удерживания: 2,67 мин (условия анализа S)
[Пример 414]
Соединение J4
9-Метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A4, получали указанное в заголовке соединение, исходя из Соединения J3-1 и Соединения J3-2 (смесь).
1H-ЯМР (DМSO-d6) δ: 12,79 (1 H, с), 8,33 (1 H, д, J=8,2 Гц), 8,02 (1 H, с), 7,81 (1 H, д, J=8,6 Гц), 7,69 (1 H, д, J=3,0 Гц), 7,63 (1 H, дд, J=8,3, 1,4 Гц), 7,28 (1 H, дд, J=8,7, 3,0 Гц), 3,87 (3 H, с), 1,74 (6 H, с).
ЖХ/МС: м/z 317 [М+H]+
ВЭЖХ время удерживания: 2,25 мин (условия анализа S)
[Пример 415]
Соединение J5
9-Гидрокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A6, получали указанное в заголовке соединение, исходя из Соединения J4.
1H-ЯМР (DМSO-d6) δ: 12,75 (1 H, с), 9,77 (1 H, с), 8,32 (1 H, дд, J=8,2, 0,7 Гц), 8,01 (1 H, с), 7,68 (1 H, д, J=8,6 Гц), 7,62 (1 H, дд, J=8,2, 1,4 Гц), 7,58 (1H, д, J=2,8 Гц), 7,10 (1 H, дд, J=8,6, 2,8 Гц), 1,72 (6 H, с).
ЖХ/МС: м/z 303 [М+H]+
ВЭЖХ время удерживания: 1,75 мин (условия анализа S)
[Пример 416]
Соединение J6
3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-иловый эфир трифторметансульфоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения B1, получали указанное в заголовке соединение, исходя из Соединения J5.
1H-ЯМР (DМSO-d6) δ: 12,95 (1 H, с), 8,31 (1 H, д, J=8,2 Гц), 8,15 (2 H, м), 8,05 (1 H, с), 7,87 (1 H, дд, J=9,0, 2,7 Гц), 7,65 (1 H, д, J=8,2 Гц), 1,80 (6 H, с).
ЖХ/МС: м/z 435 [М+H]+
ВЭЖХ время удерживания: 2,75 мин (условия анализа S)
[Пример 417]
Соединение J7-1
9-Изопропокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения J4 и изопропанола.
ЖХ/МС: m/z 345 [M+H]+
ВЭЖХ время удерживания: 3,87 мин (условия анализа W)
[Пример 418]
Соединение J7-2-1
трет-Бутиловый эфир 4-(3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-илокси)пиперидин-1-карбоновой кислоты
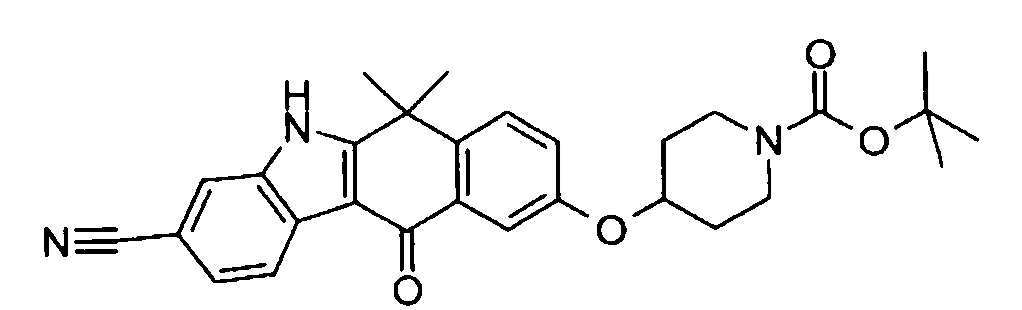
С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения J5.
ЖХ/МС: m/z 486 [M+H]+
ВЭЖХ время удерживания: 4,15 мин (условия анализа W)
[Пример 419]
Соединение J7-2-2
6,6-Диметил-11-оксо-9-(пиперидин-4-илокси)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения J7-2-1.
ЖХ/МС: m/z 386 [M+H]+
ВЭЖХ время удерживания: 2,48 мин (условия анализа W)
[Пример 420]
Соединение J7-2-3
6,6-Диметил-9-(1-оксетан-3-ил-пиперидин-4-илокси)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения J7-2-2 и оксетан-3-она.
ЖХ/МС: m/z 442 [M+H]+
ВЭЖХ время удерживания: 2,61 мин (условия анализа W)
[Пример 421]
Соединение J7-3
6,6-Диметил-11-оксо-9-(4-пирролидин-1-ил-пиперидин-1-ил)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-10, получали указанное в заголовке соединение, исходя из Соединения J6 и 4-пирролидин-1-ил-пиперидина.
1H-ЯМР (270 МГц, DМSO-d6) δ: 13,12 (1 H, с), 8,32 (1 H, д, J=8,1 Гц), 8,01 (1 H, с), 7,72 (1 H, д, J=8,7 Гц), 7,68 (1 H, д, J=2,6 Гц), 7,62 (1 H, дд, J=8,2, 1,2 Гц), 7,38 (1 H, дд, J=9,1, 2,8 Гц), 3,90 (2 H, д, J=11,5 Гц), 2,76 (2 H, т, J=12,2 Гц), 2,14 (2 H, д, J=10,9 Гц), 1,91 (4 H, ушир.), 1,74 (6 H, с).
ЖХ/МС: м/z 439 [М+H]+
ВЭЖХ время удерживания: 1,35 мин (условия анализа S)
[Пример 422]
Соединение J7-4
9-(4-Изопропил-пиперазин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-10, получали указанное в заголовке соединение, исходя из Соединения J6 и 1-изопропил-пиперазина.
1H-ЯМР (270 МГц, DМSO-d6) δ: 12,80 (1 H, с), 8,33 (1 H, д, J=7,6 Гц), 8,02 (1 H, с), 7,66 (3 H, м), 7,33 (1 H, д, J=8,2 Гц), 3,21 (4 H, ушир.), 2,66 (5 H, м), 1,72 (6 H, с), 1,02 (6 H, д, J=6,3 Гц).
ЖХ/МС: м/z 413 [М+H]+
ВЭЖХ время удерживания: 1,38 мин (условия анализа S)
[Пример 423]
Соединение J7-5
6,6-Диметил-11-оксо-9-пирролидин-1-ил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-10, получали указанное в заголовке соединение, исходя из Соединения J6 и пирролидина.
1H-ЯМР (270 МГц, DМSO-d6) δ: 8,24 (1 H, д, J=8,1 Гц), 7,91 (1 H, с), 7,59 (1 H, д, J=8,6 Гц), 7,45 (1 H, д, J=7,9 Гц), 7,30 (1 H, д, J=2,6 Гц), 6,85 (1 H, дд, J=8,6, 2,8 Гц), 3,31 (4 H, т, J=6,3 Гц), 1,99 (4 H, т, J=6,2 Гц), 1,67 (6 H, с).
ЖХ/МС: м/z 356 [М+H]+
ВЭЖХ время удерживания: 2,38 мин (условия анализа S)
[Пример 424]
Соединение J7-6
6,6-Диметил-11-оксо-9-((S)-2-пирролидин-1-илметил-пирролидин-1-ил)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-10, получали указанное в заголовке соединение, исходя из Соединения J6 и (S)-2-пирролидин-1-илметил-пирролидина.
ЖХ/МС: m/z 439 [M+H]+
ВЭЖХ время удерживания: 1,50 мин (условия анализа S)
[Пример 425]
Соединение J7-7
6,6-Диметил-11-оксо-9-пиперазин-1-ил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-10, получали указанное в заголовке соединение, исходя из Соединения J6 и пиперазина.
ЖХ/МС: m/z 371 [M+H]+
ВЭЖХ время удерживания: 1,31 мин (условия анализа S)
[Пример 426]
Соединение J7-8
9-(3-Гидрокси-3-метил-бут-1-инил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E4-2-1, получали указанное в заголовке соединение, исходя из Соединения J6.
ЖХ/МС: m/z 369 [M+H]+
ВЭЖХ время удерживания: 2,16 мин (условия анализа S)
[Пример 427]
Соединение J7-9
9-Этинил-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E4-2-2, получали указанное в заголовке соединение, исходя из Соединения J7-8.
1H-ЯМР (270 МГц, DМSO-d6) δ: 8,31 (1 H, д, J=8,1 Гц), 8,23 (1 H, д, J=1,8 Гц), 8,02 (1 H, д, J=1,3 Гц), 7,93 (1 H, д, J=8,2 Гц), 7,78 (1 H, дд, J=8, 2,1, 8 Гц), 7,61 (1 H, дд, J=8,1, 1,3 Гц), 4,31 (1 H, с), 1,77 (6 H, с).
ЖХ/МС: м/z 311 [М+H]+
ВЭЖХ время удерживания: 2,40 мин (условия анализа S)
[Пример 428]
Соединение J7-10-1
трет-Бутиловый эфир 4-(3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-ил)-3,6-дигидро-2H-пиридин-1-карбоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения B2-22-1, получали указанное в заголовке соединение, исходя из Соединения J6.
ЖХ/МС: m/z 468 [M+H]+
ВЭЖХ время удерживания: 2,90 мин (условия анализа S)
[Пример 429]
Соединение J7-10-2
6,6-Диметил-11-оксо-9-(1,2,3,6-тетрагидро-пиридин-4-ил)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения J7-10-1.
ЖХ/МС: m/z 368 [M+H]+
ВЭЖХ время удерживания: 1,27 мин (условия анализа S)
[Пример 430]
Соединение J7-11-1
9-(Пиперидин-4-илметил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-25-1 и Соединения B2-25-2, получали указанное в заголовке соединение, исходя из Соединения J6.
ЖХ/МС: m/z 384 [M+H]+
ВЭЖХ время удерживания: 1,42 мин (условия анализа S)
[Пример 431]
Соединение J7-11-2
9-(1-Изопропил-пиперидин-4-илметил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения J7-11-1 и ацетона.
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,79 (1 H, с), 8,33 (1 H, д, 7,9 Гц), 8,01 (1 H, с), 7,98 (1 H, д, 1,8 Гц), 7,79 (1 H, д, 7,9 Гц), 7,61 (1 H, д, 7,9 Гц), 7,51-7,49 (1 H, м), 2,74 (2 H, д, 11,0 Гц), 2,64-2,60 (3 H, м), 2,04 (2 H, т, 10,7 Гц), 1,77 (6 H, с), 1,60-1,51 (3 H, м), 1,23-1,14 (2 H, м), 0,94 (6 H, д, 6,7 Гц).
ЖХ/МС: м/z 426 [М+H]+
[Пример 432]
Соединение J7-12
4-(3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-илокси)масляная кислота
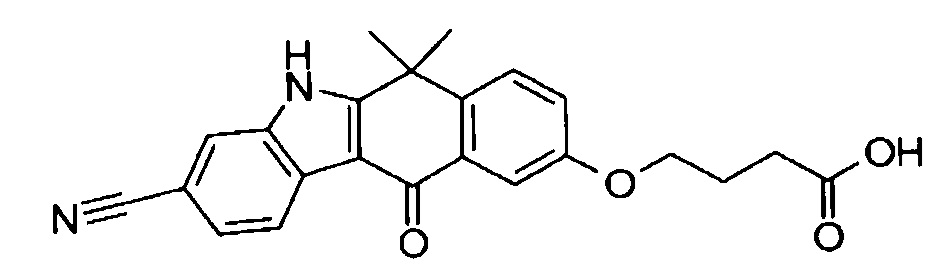
9-Гидрокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил (Соединение J5, 30 мг, 0,099 ммоль), метиловый эфир 4-броммасляной кислоты (24,9 мкл, 0,198 ммоль) и карбонат цезия (64,5 мг, 0,198 ммоль) растворяли в DMA (0,20 мл) и перемешивали при комнатной температуре в течение 4 часов. К реакционному раствору добавляли воду, затем смесь экстрагировали диэтиловым эфиром. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Желтое твердое вещество, полученное после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (метиленхлорид/MeOH) с получением метилового эфира 4-(3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-илокси)масляной кислоты в качестве промежуточного соединения.
Это промежуточное соединение растворяли в MeOH (0,50 мл), добавляли водный раствор гидроксида натрия (6 моль/л) и перемешивали при комнатной температуре в течение 30 минут. К реакционному раствору добавляли хлористоводородную кислоту (3 моль/л), экстрагировали диэтиловым эфиром. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. После концентрирования при пониженном давлении получали белое твердое вещество, затем смесь промывали метиленхлоридом с получением указанного в заголовке соединения (19,0 мг, 70%).
ЖХ/МС: m/z 389 [M+H]+
ВЭЖХ время удерживания: 2,39 мин (условия анализа F)
[Пример 433]
Соединение J7-13
5-(3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-илокси)пентановая кислота

С использованием тех же условий, как в способе синтеза Соединения J7-12, осуществляли взаимодействие Соединения J5 и метилового эфира 5-бромпентановой кислоты с получением целевого соединения (19,5 мг, 64%).
ЖХ/МС: m/z 403 [M+H]+
ВЭЖХ время удерживания: 2,49 мин (условия анализа F)
[Пример 434]
Соединение J7-14
6-(3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-илокси)гексановая кислота

С использованием тех же условий, как в способе синтеза Соединения J7-12, осуществляли взаимодействие Соединения J5 и этилового эфира 6-бромгексановой кислоты с получением целевого соединения (19,6 мг, 66%).
ЖХ/МС: m/z 417 [M+H]+
ВЭЖХ время удерживания: 2,61 мин (условия анализа F)
[Пример 435]
Соединение J7-15
3-[2-(3-Циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-илокси)этокси]пропионовая кислота

С использованием тех же условий, как в способе синтеза Соединения A7-1, осуществляли взаимодействие Соединения JJ2 и трет-бутилового эфира 3-(2-гидрокси-этокси)пропионовой кислоты с получением трет-бутилового эфира 3-[2-(3-бром-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-илокси)этокси]пропионовой кислоты.
Полученную смесь растворяли в DMA (0,30 мл), добавляли цианид меди (25,5 мг, 0,285 ммоль) и перемешивали при 200°C в течение 1 часа в условиях микроволнового облучения. Реакционный раствор разбавляли этилацетатом, промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Остатки, полученные после концентрирования при пониженном давлении, растворяли в метиленхлориде (0,75 мл). К раствору добавляли TFA (250 мкл) и перемешивали при комнатной температуре в течение 5 минут. Затем остатки, полученные после концентрирования реакционного раствора при пониженном давлении, очищали колоночной хроматографией на силикагеле (метиленхлорид/MeOH) с получением указанного в заголовке соединения (5,6 мг, 14%).
ЖХ/МС: m/z 419 [M+H]+
ВЭЖХ время удерживания: 2,31 мин (условия анализа F)
[Пример 436]
Соединение J7-16
6,6-Диметил-11-оксо-9-(пиридин-4-илметокси)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения J5 и пиридин-4-ил-метанола (бледно-желтое твердое вещество, 6,1 мг, 31%).
ЖХ/МС: m/z 394 [M+H]+
ВЭЖХ время удерживания: 1,97 мин (условия анализа F)
[Пример 437]
Соединение J7-17
6,6-Диметил-11-оксо-9-(пиридин-3-илметокси)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения JJ3-1, получали указанное в заголовке соединение, исходя из Соединения J5 и пиридин-3-ил-метанола (бледно-желтое твердое вещество, 7,9 мг, 38%).
ЖХ/МС: m/z 394 [M+H]+
ВЭЖХ время удерживания: 1,99 мин (условия анализа F)
[Пример 438]
Соединение J8-1
6,6-Диметил-9-(4-оксетан-3-ил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения J7-7 и оксетан-3-она.
ЖХ/МС: m/z 427 [M+H]+
ВЭЖХ время удерживания: 1,31 мин (условия анализа S)
[Пример 439]
Соединение J8-2
9-(4-Циклопропил-пиперазин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения J7-7 и (1-этоксициклопропокси)триметилсилана.
ЖХ/МС: m/z 411 [M+H]+
ВЭЖХ время удерживания: 1,39 мин (условия анализа S)
[Пример 440]
Соединение J8-3
9-(1-Метансульфонил-1,2,3,6-тетрагидро-пиридин-4-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A9-1, получали указанное в заголовке соединение, исходя из Соединения J7-10-2.
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,81 (1 H, с), 8,33 (1 H, д, 7,9 Гц), 8,26 (1 H, д, 2,4 Гц), 8,01 (1 H, с), 7,88-7,81 (2 H, м), 7,61 (1 H, д, 7,9 Гц), 6,36 (1 H, с), 3,93 (2 H, д, 3,0 Гц), 3,45 (2 H, т, 5,8 Гц), 2,97 (3 H, с), 2,73-2,70 (2 H, м), 1,78 (6 H, с).
ЖХ/МС: м/z 446 [М+H]+
ВЭЖХ время удерживания: 2,15 мин (условия анализа S)
[Пример 441]
Соединение J8-4
9-(1-Изопропил-1,2,3,6-тетрагидро-пиридин-4-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения J7-10-2 и ацетона.
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,82 (1 H, с), 8,33 (1 H, д, 7,9 Гц), 8,22 (1 H, д, 1,8 Гц), 8,02 (1 H, с), 7,84 (1 H, д, 8,5 Гц), 7,78 (1 H, дд, 8,2, 2,1 Гц), 7,62 (1 H, д, 7,9 Гц), 6,32 (1 H, т, 3,7 Гц), 3,23-3,20 (2 H, м), 2,83-2,76 (1 H, м), 2,72 (2 H, т, 5,5 Гц), 2,56-2,54 (2 H, м), 1,78 (6 H, с), 1,06 (6 H, д, 6,7 Гц).
ЖХ/МС: м/z 410 [М+H]+
ВЭЖХ время удерживания: 1,38 мин (условия анализа S)
[Пример 442]
Соединение J8-5
6,6-Диметил-9-(1-оксетан-3-ил-1,2,3,6-тетрагидро-пиридин-4-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения J7-10-2 и оксетан-3-она.
1H-ЯМР (270 МГц, DМSO-d6) δ: 12,81 (1 H, ушир. с), 8,34 (1 H, д, J=8,2 Гц), 8,22 (1 H, д, J=1,8 Гц), 8,03 (1 H, с), 7,76-7,90 (2 H, м), 7,64 (1 H, дд, J=8,2, 1,8 Гц), 6,25-6,34 (1 H, м), 4,60 (2 H, дд, J=6,6, 6,0 Гц), 4,52 (2 H, дд, J=6,6, 6,0 Гц), 3,57 (1 H, т, J=6,0 Гц), 3,03 (2 H, м), 2,55 (4 H, м), 1,77 (6 H, с).
ЖХ/МС: м/z 424 [М+H]+
ВЭЖХ время удерживания: 1,34 мин (условия анализа S)
[Пример 443]
Соединение J8-6
9-(1-Циклопропил-1,2,3,6-тетрагидро-пиридин-4-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения J7-10-2 и (1-этоксициклопропокси)триметилсилана.
ЖХ/МС: m/z 408 [M+H]+
ВЭЖХ время удерживания: 1,36 мин (условия анализа S)
[Пример 444]
Соединение J9-1
трет-Бутиловый эфир 4-(3-циано-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-ил)пиперидин-1-карбоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения B3-13-1, получали указанное в заголовке соединение, исходя из Соединения J7-10-1.
ЖХ/МС: m/z 414, 470 [M+H]+
ВЭЖХ время удерживания: 2,83 мин (условия анализа S)
[Пример 445]
Соединение J9-2
6,6-Диметил-11-оксо-9-пиперидин-4-ил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения J9-1.
ЖХ/МС: m/z 370 [M+H]+
ВЭЖХ время удерживания: 1,30 мин (условия анализа S)
[Пример 446]
Соединение J9-3
9-(1-Изопропил-пиперидин-4-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A9-1, получали указанное в заголовке соединение, исходя из Соединения J9-2 и 2-бромпропана.
1H-ЯМР (270 МГц, DМSO-d6) δ: 12,83 (1 H, с), 8,34 (2 H, д, J=8,1 Гц), 8,05 (2 H, м), 7,82 (1 H, д, J=8,1 Гц), 7,61 (2 H, м), 3,02 (2 H, ушир.), 2,42 (2 H, ушир.), 1,76 (6 H, с), 1,06 (6 H, д, J=6,4 Гц).
ЖХ/МС: м/z 412 [М+H]+
ВЭЖХ время удерживания: 1,45 мин (условия анализа S)
[Пример 447]
Соединение J9-4
6,6-Диметил-9-(1-оксетан-3-ил-пиперидин-4-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-13-1, получали указанное в заголовке соединение, исходя из Соединения J8-5.
ЖХ/МС: m/z 426 [M+H]+
ВЭЖХ время удерживания: 1,26 мин (условия анализа S)
[Пример 448]
Соединение J9-5
9-(1-Циклопропил-пиперидин-4-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-13-1, получали указанное в заголовке соединение, исходя из Соединения J8-6.
ЖХ/МС: m/z 410 [M+H]+
ВЭЖХ время удерживания: 1,43 мин (условия анализа S)
[Пример 449]
Соединение JJ1
3-Бром-9-метокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

6-Метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-он (Соединение J2, 2,15 г, 10,5 ммоль) и 3-бромфенилгидразин в форме соли хлористоводородной кислоты (3,11 г, 1,3 экв.) растворяли в уксусной кислоте (12 мл) и перемешивали при 100°C в течение 2,5 часов в атмосфере азота. После охлаждения к реакционному раствору добавляли этилацетат, промывали водой, насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором и сушили над сульфатом магния. После фильтрования смесь концентрировали при пониженном давлении. Полученные остатки растворяли в ТГФ (30 мл) и воде (3 мл), добавляли DDQ (5,96 г, 2,5 экв.) при 0°C и затем перемешивали при комнатной температуре в течение ночи. К реакционному раствору добавляли MTBE, промывали 0,5 н водным раствором гидроксида натрия и насыщенным солевым раствором и сушили над сульфатом магния. После фильтрования и концентрирования при пониженном давлении полученные остатки промывали при помощи MTBE с получением указанного в заголовке соединения (коричневое твердое вещество, 1,80 г, 46%).
1H-ЯМР(270 МГц, DМSO-d6) δ: 12,4 (1 H, с), 8,12 (1 H, д, J=8,6 Гц), 7,79 (1 H, д, J=8,9 Гц), 7,67-7,68 (2 H, м), 7,40 (1 H, дд, J=1,7, 8,6 Гц), 7,26 (1 H, дд, J=2,6, 8,9 Гц), 3,86 (3 H, с), 1,72 (6 H, с).
ЖХ/МС: м/z 370 [М+H]+
ВЭЖХ время удерживания: 6,45 мин (условия анализа H)
[Пример 450]
Соединение JJ2
3-Бром-9-гидрокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

3-Бром-9-метокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он (Соединение JJ1, 1,50 г, 4,05 ммоль) и пиридинийхлорид (15,2 г, 32,5 экв.) перемешивали при 160°C в течение 12 часов в атмосфере азота. После охлаждения добавляли воду и этилацетат и полученную суспензию фильтровали. Органический слой промывали водой и насыщенным солевым раствором и сушили над сульфатом магния. После фильтрования и концентрирования при пониженном давлении полученные остатки промывали при помощи MTBE с получением указанного в заголовке соединения (коричневое твердое вещество, 1,47 г, 100%).
1H-ЯМР(270 МГц, DМSO-d6) δ: 12,4 (1 H, с), 9,71 (1 H, с), 8,11 (1 H, д, J=8,2 Гц), 7,64-7,68 (2 H, м), 7,57 (1 H, д, J=3,0 Гц), 7,38 (1 H, дд, J=1,7, 8,2 Гц), 7,07 (1 H, дд, J=3,0, 8,6 Гц), 1,69 (6 H, с).
ЖХ/МС: м/z 356 [М+H]+
ВЭЖХ время удерживания: 2,52 мин (условия анализа F)
[Пример 451]
Соединение JJ3-1
3-Бром-9-((S)-2,2-диметил-[1,3]диоксолан-4-илметокси)-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

В атмосфере азота к 3-бром-9-гидрокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-ону (Соединение JJ2, 356 мг, 1,00 ммоль) и трифенилфосфину (317 мг, 1,2 экв.) добавляли ТГФ (3 мл), с последующим добавлением по каплям ((S)-2,2-диметил[1,3]диоксолан-4-ил)метанола (148 мкл, 1,2 экв.) и диизопропилазодикарбоновой кислоты (252 мкл, 1,3 экв.). Смесь затем перемешивали при 50°C в течение 2 часов. После охлаждения к реакционному раствору добавляли этилацетат, промывали насыщенным солевым раствором и сушили над сульфатом магния. После фильтрования и концентрирования при пониженном давлении полученные остатки очищали колоночной хроматографией на силикагеле (этилацетат/дихлорметан) с получением твердого вещества, затем смесь промывали дихлорметаном с получением указанного в заголовке соединения (белый порошок, 241,6 мг, 51%).
1H-ЯМР(270 МГц, DМSO-d6) δ: 12,4 (1 H, с), 8,12 (1 H, д, J=8,2 Гц), 7,79 (1 H, д, J=8,9 Гц), 7,67-7,69 (2 H, м), 7,40 (1 H, дд, J=1,8, 8,2 Гц), 7,28 (1 H, дд, J=3,0, 8,9 Гц), 4,41-4,48 (1 H, м), 4,06-4,17 (2 H, м), 3,79-3,85 (1 H, м), 1,72 (3 H, с), 1,38 (3 H, с), 1,33 (3 H, с).
ЖХ/МС: м/z 470 [М+H]+
ВЭЖХ время удерживания: 3,08 мин (условия анализа F)
[Пример 452]
Соединение JJ3-2
3-Бром-9-((R)-2,3-дигидрокси-пропокси)-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

3-Бром-9-((S)-2,2-диметил-[1,3]диоксолан-4-илметокси)-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он (Соединение JJ3-1, 18,7 мг, 0,0398 ммоль) растворяли в метаноле (1 мл) и ТГФ (0,3 мл), добавляли 1 н раствор хлористоводородной кислоты (5 капель) и перемешивали при 50°C в течение 1 часа. После охлаждения реакционный раствор концентрировали при пониженном давлении, и к полученным остаткам добавляли дихлорметан, и твердое вещество выделяли фильтрованием с получением указанного в заголовке соединения (желтый порошок, 16,8 мг, 98%).
1H-ЯМР(270 МГц, DМSO-d6) δ: 12,43(1 H, с), 8,12 (1 H, д, J=8,6 Гц), 7,78 (1 H, д, J=8,9 Гц), 7,67-7,70 (2 H, м), 7,40 (2 H, дд, J=1,8, 8,6 Гц), 7,27 (2 H, дд, J=2,8, 8,9 Гц), 4,43 (2 H, ушир.с), 4,12 (1 H, дд, J=9,9, 4,3 Гц), 3,96 (1 H, дд, J=9,7, 6,1 Гц), 3,85 (1 H, дд, J=9,9, 5,6 Гц), 3,48 (2 H, д, J=5,6 Гц), 1,72 (6 H, с).
ЖХ/МС: м/z 430 [М+H]+
ВЭЖХ время удерживания: 2,02 мин (условия анализа F)
[Пример 453]
Соединение JJ4-1
3-Бром-9-((S)-2,2-диметил[1,3]диоксолан-4-илметокси)-5,6,6-триметил-5,6-дигидро-бензо[b]карбазол-11-он

К смеси 3-бром-9-((S)-2,2-диметил[1,3]диоксолан-4-ил метокси)-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-она (Соединение JJ3-1, 33,2 мг, 0,0706 ммоль) и гидрида натрия (60% в масло, 6,4 мг, 2,3 экв.) добавляли DMA (0,55 мл) и метилйодид (0,015 мл, 3,4 экв.) в атмосфере азота при 0°C и смесь перемешивали при комнатной температуре в течение ночи. К реакционному раствору добавляли воду и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом магния. После фильтрования и концентрирования при пониженном давлении полученное твердое вещество промывали при помощи MTBE с получением указанного в заголовке соединения (белое твердое вещество, 31,2 мг, 91%).
ЖХ/МС: m/z 484 [M+H]+
ВЭЖХ время удерживания: 3,34 мин (условия анализа F)
[Пример 454]
Соединение JJ4-2
3-Бром-9-((R)-2,3-дигидрокси-пропокси)-5,6,6-триметил-5,6-дигидро-бензо[b]карбазол-11-он
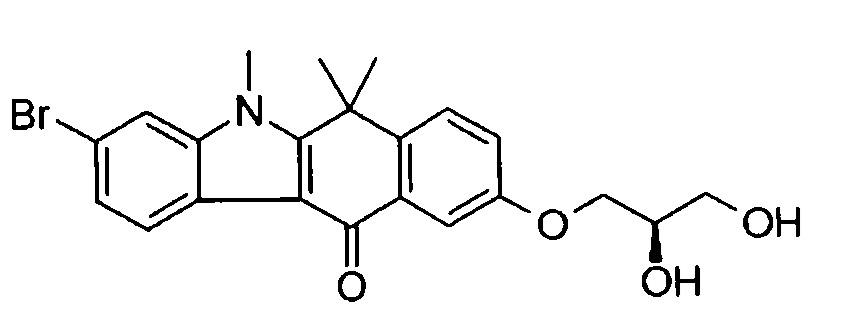
С использованием тех же условий, как в способе синтеза Соединения JJ3-2, получали указанное в заголовке соединение, исходя из Соединения JJ4-1 (желтое твердое вещество, 13,3 мг, 83%).
ЖХ/МС: m/z 444 [M+H]+
ВЭЖХ время удерживания: 2,47 мин (условия анализа F)
[Пример 455]
Соединение JJ5
(3-Бром-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-илокси)уксусная кислота

С использованием тех же условий, как в способе синтеза Соединения A7-1, метиловый эфир (3-бром-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-илокси)уксусной кислоты получали, исходя из Соединения JJ2 и метилового эфира оксиуксусной кислоты. Полученную смесь растворяли в MeOH (0,35 мл), добавляли водный раствор гидроксида натрия (6 моль/л) и перемешивали при комнатной температуре в течение 10 минут. К реакционному раствору добавляли хлористоводородную кислоту (3 моль/л), экстрагировали диэтиловым эфиром и сушили над безводным сульфатом магния. После концентрирования при пониженном давлении получали белое твердое вещество, затем смесь промывали метиленхлоридом с получением указанного в заголовке соединения (11,2 мг, 48%).
ЖХ/МС: m/z 414 [M+H]+
ВЭЖХ время удерживания: 2,50 мин (условия анализа F)
[Пример 456]
Соединение JJ6
4-(3-Бром-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-илокси)масляная кислота

3-Бром-9-гидрокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он (Соединение JJ2, 20 мг, 0,056 ммоль), метиловый эфир 4-броммасляной кислоты (7,0 мкл, 0,056 ммоль) и карбонат цезия (36,6 мг, 0,112 ммоль) растворяли в DMA (0,09 мл) и затем перемешивали при комнатной температуре в течение 1 часа. Затем к реакционному раствору добавляли метиловый эфир 4-броммасляной кислоты (7,0 мкл, 0,056 ммоль) и смесь перемешивали при комнатной температуре в течение 3 часов, с последующим перемешиванием при 45°C в течение 30 минут. К реакционному раствору добавляли воду, экстрагировали диэтиловым эфиром и сушили над безводным сульфатом магния. После концентрирования при пониженном давлении полученные остатки очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением метилового эфира 4-(3-бром-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-илокси)масляной кислоты. Это соединение растворяли в MeOH (0,50 мл), добавляли водный раствор гидроксида натрия (6 моль/л) и затем перемешивали при комнатной температуре в течение 10 минут. К реакционному раствору добавляли хлористоводородную кислоту (3 моль/л), экстрагировали диэтиловым эфиром и сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением белого твердого вещества. Это белое твердое вещество промывали метиленхлоридом с получением указанного в заголовке соединения (6,1 мг, 25%).
ЖХ/МС: m/z 442 [M+H]+
ВЭЖХ время удерживания: 2,65 мин (условия анализа F)
[Пример 457]
Соединение JJ7-1
3-Бром-9-[(4R,5R)-5-(трет-бутил-диметил-силанилоксиметил)-2,2-диметил-[1,3]диоксолан-4-илметокси]-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

С использованием тех же условий, как в способе синтеза Соединения A7-1, указанное в заголовке соединение (белое твердое вещество, 111,5 мг, 65%) получали, исходя из Соединения JJ2 и [(4R,5R)-5-(трет-бутил-диметил-силанилоксиметил)-2,2-диметил-[1,3]диоксолан-4-ил]метанола.
ЖХ/МС: m/z 614 [M+H]+
ВЭЖХ время удерживания: 4,04 мин (условия анализа F)
[Пример 458]
Соединение JJ7-2
3-Бром-6,6-диметил-9-((2R,3R)-2,3,4-тригидрокси-бутокси)-5,6-дигидро-бензо[b]карбазол-11-он

3-Бром-9-[(4R,5R)-5-(трет-бутил-диметил-силанилоксиметил)-2,2-диметил-[1,3]диоксолан-4-илметокси]-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он (Соединение JJ7-1, 13,7 мг, 0,0223 ммоль) растворяли в ТГФ (0,15 мл) и метаноле (0,1 мл), добавляли 0,5 M серной кислоты (0,05 мл) и затем перемешивали при 60°C в течение 3 часов. После охлаждения к реакционному раствору добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом магния. После фильтрования и концентрирования при пониженном давлении полученное твердое вещество промывали дихлорметаном с получением указанного в заголовке соединения (белое твердое вещество, 8,4 мг, 82%).
ЖХ/МС: m/z 460 [M+H]+
ВЭЖХ время удерживания: 2,18 мин (условия анализа F)
[Пример 459]
Соединение JJ8-1
9-[(4R,5R)-5-(Трет-бутил-диметил-силанилоксиметил)-2,2-диметил-[1,3]диоксолан-4-илметокси]-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

В соответствии со способом, аналогичным способу синтеза Соединения A5-2, указанное в заголовке соединение (11,1 мг, 50%) получали, исходя из Соединения JJ7-1 и [(4R,5R)-5-(трет-бутил-диметил-силанилоксиметил)-2,2-диметил-[1,3]диоксолан-4-ил]метанола.
ЖХ/МС: m/z 561 [M+H]+
ВЭЖХ время удерживания: 3,84 мин (условия анализа F)
[Пример 460]
Соединение JJ8-2
6,6-Диметил-11-оксо-9-((2R,3R)-2,3,4-тригидрокси-бутокси)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения JJ7-2, получали указанное в заголовке соединение, исходя из 9-[(4R,5R)-5-(трет-бутил-диметил-силанилоксиметил)-2,2-диметил-[1,3]диоксолан-4-илметокси]-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрила (Соединение JJ8-1) (белое твердое вещество, 7,8 мг, 97%).
ЖХ/МС: m/z 407 [M+H]+
ВЭЖХ время удерживания: 1,92 мин (условия анализа F)
[Пример 461]
Соединение JJ9-1
9-((R)-2,3-Дигидрокси-пропокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

К 3-бром-9-((S)-2,2-диметил-[1,3]диоксолан-4-илметокси)-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-ону (Соединение JJ3-1, 49,5 мг, 0,105 ммоль) и цианиду меди (90%, 35,3 мг, 3,4 экв.) добавляли DMA (0,5 мл) и смесь подвергали микроволновому облучению при 200°C в течение 1 часа в атмосфере азота. После охлаждения к реакционному раствору добавляли воду и экстрагировали этилацетатом. Нерастворимые вещества выделяли фильтрованием, и органический слой промывали насыщенным солевым раствором и сушили над сульфатом магния. После фильтрования и концентрирования при пониженном давлении полученные остатки очищали при помощи препаративной ТСХ (метанол/дихлорметан) с получением указанного в заголовке соединения (белое твердое вещество, 8,5 мг, 22%).
ЖХ/МС: m/z 377 [M+H]+
ВЭЖХ время удерживания: 2,02 мин (условия анализа F)
[Пример 462]
Соединение JJ9-2
9-((S)-2,2-Диметил[1,3]диоксолан-4-илметокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
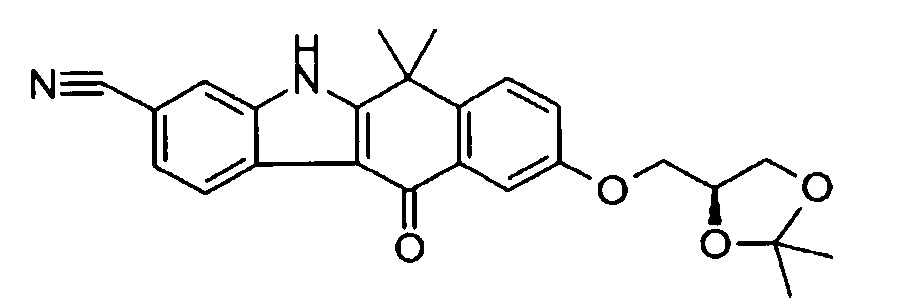
Указанное в заголовке соединение получали в виде побочного продукта синтеза Соединения JJ9-1 (белое твердое вещество, 24,8 мг, 57%).
ЖХ/МС: m/z 417 [M+H]+
ВЭЖХ время удерживания: 2,81 мин (условия анализа F)
[Пример 463]
Соединение JJ9-3
9-((S)-2,2-Диметил[1,3]диоксолан-4-илметокси)-5,6,6-триметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения JJ4-1, получали указанное в заголовке соединение, исходя из 9-((S)-2,2-диметил-[1,3]диоксолан-4-илметокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрила (Соединение JJ9-2) (17,0 мг, 84%).
ЖХ/МС: m/z 431 [M+H]+
ВЭЖХ время удерживания: 3,00 мин (условия анализа F)
[Пример 464]
Соединение JJ9-4
9-((R)-2,3-Дигидрокси-пропокси)-5,6,6-триметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения JJ3-2, получали указанное в заголовке соединение, исходя из 9-((S)-2,2-диметил[1,3]диоксолан-4-илметокси)-5,6,6-триметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрила (JJ9-3) (белое твердое вещество, 12,1 мг, 90%).
ЖХ/МС: m/z 391 [M+H]+
ВЭЖХ время удерживания: 2,13 мин (условия анализа F)
[Пример 465]
Соединение JJ10-1
9-Бензилокси-3-бром-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения JJ2 и бензилбромида (18,2 мг, 61%).
ЖХ/МС: m/z 446 [M+H]+
ВЭЖХ время удерживания: 2,68 мин (условия анализа D)
[Пример 466]
Соединение JJ10-2
5-Бензил-9-бензилокси-3-бром-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

Указанное в заголовке соединение получали в виде побочного продукта синтеза Соединения JJ10-1 (5,3 мг, 21%).
ЖХ/МС: m/z 536 [M+H]+
ВЭЖХ время удерживания: 3,17 мин (условия анализа D)
[Пример 467]
Соединение JJ10-3
3-Бром-9-(4-метокси-бензилокси)-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

С использованием тех же условий, как в способе синтеза Соединения A7-1, указанное в заголовке соединение получали путем взаимодействия Соединения JJ2 и (4-метоксифенил)метанола (7,5 мг, 28%).
ЖХ/МС: m/z 476 [M+H]+
ВЭЖХ время удерживания: 2,70 мин (условия анализа D)
[Пример 468]
Соединение K2
2-(3-Бром-4-метокси-фенил)-2-метил-пропионитрил

К суспензии трет-бутоксида калия (15,35 г, 3 экв.) в ТГФ добавляли (3-бром-4-метоксифенил)ацетонитрил (Соединение K1, 10 г, 0,044 ммоль) и затем перемешивали при 0°C в течение 1 часа. Затем добавляли йодметан (8,26 мл, 3 экв.) и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционному раствору добавляли насыщенный водный раствор хлорида аммония и воду с последующим экстрагированием этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Осушитель удаляли фильтрованием, и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (бесцветное маслянистое вещество, 11,24 г, 100%).
1H-ЯМР (270 МГц, DМSO-d6) δ: 7,69 (1 H, д, J=2,5 Гц), 7,50 (1 H, дд, J=8,6, 2,5 Гц), 7,16 (1 H, д, J=8,6 Гц), 3,86 (3 H, с), 1,67 (6 H, с).
ВЭЖХ время удерживания: 2,30 мин (условия анализа S)
[Пример 469]
Соединение K3
Этиловый эфир 4-(3-бром-4-метокси-фенил)-4-метил-3-оксопентановой кислоты
К суспензии цинка (5,72 г, 2 экв.) в ТГФ добавляли метансульфоновую кислоту (25,6 мкл, 0,01 экв.) и затем перемешивали при 80°C в течение 10 минут. Затем добавляли раствор 2-(3-бром-4-метокси-фенил)-2-метил-пропионитрил (10 г, 39,35 ммоль) в ТГФ с последующим добавлением бромэтилацетата (11,07 мл, 1,6 экв.) в течение 1 часа. Смесь затем перемешивали в течение 30 минут. К реакционному раствору добавляли 4 M раствор хлористоводородной кислоты и перемешивали при комнатной температуре в течение ночи. После экстрагирования этилацетатом органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Осушитель удаляли фильтрованием, и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (оранжевое маслянистое вещество, 9,74 г, 72%).
1H-ЯМР (270 МГц, CDCl3) δ: 7,46 (1 H, д, J=2,5 Гц), 7,16 (1 H, дд, J=8,6, 2,5 Гц), 6,89 (1 H, д, J=8,6 Гц), 4,17-4,08 (2 H, м), 3,90 (3 H, с), 3,26 (2 H, с), 1,49 (6 H, с), 1,23 (3 H, т, J=7,2 Гц).
ЖХ/МС: м/z 343, 345 [М+H]+
ВЭЖХ время удерживания: 2,64 мин (условия анализа S)
[Пример 470]
Соединение K4
Этиловый эфир 4-(3-бром-4-метокси-фенил)-2-(4-циано-2-нитро-фенил)-4-метил-3-оксопентановой кислоты

Этиловый эфир 4-(3-бром-4-метокси-фенил)-4-метил-3-оксо-пентановой кислоты (Соединение K3, 10,3 г, 30,01 ммоль) растворяли в DMF (80 мл), добавляли карбонат цезия (24,4 г, 2,5 экв.) и 4-хлор-3-нитро-бензонитрил (7,12 г, 1,3 экв.) и затем перемешивали при 45°C в течение 4 часов. Реакционный раствор добавляли к 1 н водному раствору хлористоводородной кислоты и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Осушитель удаляли фильтрованием, и после концентрирования при пониженном давлении указанное в заголовке соединение получали в виде неочищенного продукта (желтое маслянистое вещество).
ЖХ/МС: m/z 489, 491 [M+H]+
ВЭЖХ время удерживания: 2,85, 3,20 мин (условия анализа S)
[Пример 471]
Соединение K5
Этиловый эфир 2-[1-(3-бром-4-метокси-фенил)-1-метил-этил]-6-циано-1H-индол-3-карбоновой кислоты

Этиловый эфир 4-(3-бром-4-метокси-фенил)-2-(4-циано-2-нитро-фенил)-4-метил-3-оксопентановой кислоты (Соединение K4), который был получен, как описано выше, растворяли в ТГФ (140 мл) и воде (70 мл), добавляли Na2S2O4 (26,13 г, 5,0 экв.) и перемешивали при 50°C в течение ночи. Реакционный раствор добавляли к насыщенному солевому раствору и экстрагировали этилацетатом. Органический слой промывали 1 M водным раствором карбоната калия и насыщенным солевым раствором, в указанном порядке, и сушили над сульфатом натрия. Осушитель удаляли фильтрованием, и остатки, полученные после концентрирования при пониженном давлении, очищали при помощи кристаллизации в MeCN (80 мл) с получением указанного в заголовке соединения (желтое твердое вещество, 8,20 г, 62%).
1H-ЯМР (270 МГц, DМSO-d6) δ: 12,15 (1 H, с), 8,07 (1 H, д, J=8,4 Гц), 7,94 (1 H, с), 7,51 (1 H, дд, J=8,5, 1,2 Гц), 7,33 (1 H, д, J=2,1 Гц), 7,03 (1 H, дд, J=8,7, 2,4 Гц), 6,96 (1 H, д, J=8,4 Гц), 3,97 (2 H, кв., J=7,3 Гц), 3,78 (3 H, с), 1,80 (6 H, с), 1,09 (3 H, т, J=7,2 Гц).
ЖХ/МС: м/z 441, 443 [М+H]+
ВЭЖХ время удерживания: 2,85 мин (условия анализа S)
[Пример 472]
Соединение K6
8-Бром-9-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

К пентоксиду фосфора-метансульфоновой кислоте (12 мл) добавляли этиловый эфир 2-[1-(3-бром-4-метокси-фенил)-1-метил-этил]-6-циано-1H-индол-3-карбоновой кислоты (Соединение K5, 1,0 г, 2,27 ммоль) и смесь перемешивали при комнатной температуре в течение 20 минут. Реакционный раствор разбавляли при помощи MeCN (20 мл), выливали в воду (20 мл), и осажденное твердое вещество фильтровали с получением указанного в заголовке соединения (желтое твердое вещество, 763 мг, 85%).
1H-ЯМР (270 МГц, DМSO-d6) δ: 12,84 (1 H, с), 8,32 (1 H, д, J=8,1 Гц), 8,15 (1 H, с), 8,03 (1 H, с), 7,77 (1 H, с), 7,64 (1 H, дд, J=8,2, 1,4 Гц), 3,97 (3 H, с), 1,75 (6 H, с).
ЖХ/МС: м/z 395, 397 [М+H]+
ВЭЖХ время удерживания: 2,58 мин (условия анализа S)
[Пример 473]
Соединение K7-1
9-Метокси-6,6-диметил-11-оксо-8-(4-пирролидин-1-ил-пиперидин-1-ил)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения K6 и 4-пирролидин-1-ил-пиперидина.
ЖХ/МС: m/z 469 [M+H]+
ВЭЖХ время удерживания: 1,37 мин (условия анализа S)
[Пример 474]
Соединение K7-2
9-Метокси-6,6-диметил-8-(4-морфолин-1-ил-пиперидин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения K6 и 4-пиперидин-4-ил-морфолина.
1H-ЯМР (270 МГц, DМSO-d6) δ: 12,70 (1 H, с), 8,31 (1 H, д, J=8,2 Гц), 7,99 (1 H, с), 7,63 (1 H, с), 7,60 (1 H, дд, J=8,2, 1,2 Гц), 7,16 (1 H, с), 3,89 (3 H, с), 3,64 (2 H, ушир. д), 2,72 (2 H, ушир. д), 1,91 (2 H, ушир. д), 1,73 (6 H, с), 1,57 (2 H, ушир. д).
ЖХ/МС: м/z 485 [М+H]+
ВЭЖХ время удерживания: 1,33 мин (условия анализа S)
[Пример 475]
Соединение K7-3
9-Метокси-6,6-диметил-11-оксо-8-пиперазин-1-ил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, целевое соединение получали, исходя из Соединения K6 и пиперазина.
ЖХ/МС: m/z 401 [M+H]+
ВЭЖХ время удерживания: 1,31 мин (условия анализа S)
[Пример 476]
Соединение K7-4
9-Метокси-6,6-диметил-8-морфолин-4-ил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения K6 и морфолина.
ЖХ/МС: m/z 402 [M+H]+
ВЭЖХ время удерживания: 2,10 мин (условия анализа S)
[Пример 477]
Соединение K8
8-(4-Циклобутил-пиперазин-1-ил)-9-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
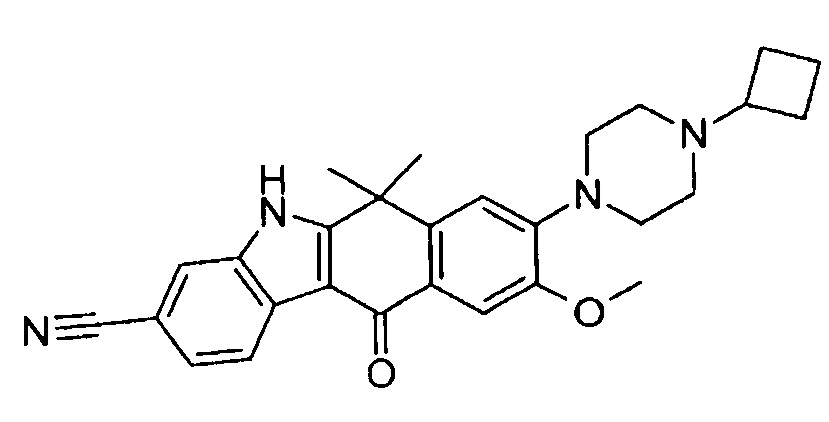
С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения K7-3 и циклобутанона.
1H-ЯМР (270 МГц, DМSO-d6) δ: 12,70 (1 H, ушир. с), 8,31 (1 H, д, J=8,2 Гц), 8,00 (1 H, с), 7,64 (1 H, с), 7,61 (1 H, дд, J=8,1, 1,3 Гц), 7,16 (1 H, с), 3,88 (3 H, с), 3,60 (1 H, т, J=6,2 Гц), 3,10-3,25 (4 H, м), 2,77 (1 H, т, J=7,1 Гц), 2,35-2,51 (4 H, м), 1,74(6 H, с), 1,58-2,08(6 H, м).
ЖХ/МС: м/z 455 [М+H]+
ВЭЖХ время удерживания: 1,45 мин (условия анализа S)
[Пример 478]
Соединение K9-1
9-Гидрокси-6,6-диметил-11-оксо-8-(4-пирролидин-1-ил-пиперидин-1-ил)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

Указанное в заголовке соединение получали в виде побочного продукта синтеза Соединения K7-1.
ЖХ/МС: m/z 455 [M+H]+
ВЭЖХ время удерживания: 1,22 мин (условия анализа S)
[Пример 479]
Соединение K9-2
9-Гидрокси-6,6-диметил-8-(4-морфолин-4-ил-пиперидин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E3-2, получали указанное в заголовке соединение, исходя из Соединения K7-2.
1H-ЯМР (270 МГц, DМSO-d6) δ: 12,65 (1 H, с), 9,61 (1 H, с), 8,30 (1 H, д, J=8,2 Гц), 7,98 (1 H, с), 7,59-7,56 (2 H, м), 7,10 (1 H, с), 3,71 (2 H, ушир. д, J=11,2 Гц), 3,60 (4 H, м), 2,66 (2 H, м), 1,88 (2 H, ушир. д, J=9,7 Гц), 1,71 (6 H, с), 1,57 (2 H, ушир. д).
ЖХ/МС: м/z 471 [М+H]+
ВЭЖХ время удерживания: 1,20 мин (условия анализа S)
[Пример 480]
Соединение K9-3
8-(4-Циклобутил-пиперазин-1-ил)-9-гидрокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E3-2, получали указанное в заголовке соединение, исходя из Соединения K8.
1H-ЯМР (270 МГц, DМSO-d6) δ: 12,66 (1 H, ушир. с), 9,67 (1 H, с), 8,31 (1 H, д, J=8,2 Гц), 7,98 (1 H, с), 7,56-7,60 (2 H, м), 709 (1 H, с), 3,10-3,24 (4 H, м), 2,77 (1 H, т, J=7,5 Гц), 2,37-2,49 (4 H, м), 1,52-2,07 (6 H, м), 1,72 (6 H, с).
ЖХ/МС: м/z 441 [М+H]+
ВЭЖХ время удерживания: 1,31 мин (условия анализа S)
[Пример 481]
Соединение K9-4
9-Гидрокси-6,6-диметил-8-морфолин-4-ил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E3-2, получали указанное в заголовке соединение, исходя из Соединения K7-4.
ЖХ/МС: m/z 388 [M+H]+
ВЭЖХ время удерживания: 1,67 мин (условия анализа S)
[Пример 482]
Соединение K10-1
9-Изопропокси-6,6-диметил-8-(4-морфолин-4-ил-пиперидин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения K9-2 и 2-бромпропана.
1H-ЯМР (270 МГц, DМSO-d6) δ: 12,68 (1 H, с), 8,30 (1 H, д, J=8,1 Гц), 7,99 (1 H, с), 7,60 (2 H, м), 7,14 (1 H, с), 4,72-4,63 (2 H, м), 3,71 (2 H, ушир. д, J=10,7 Гц), 3,59 (6 H, м), 2,68 (2 H, т, J=12,9 Гц), 2,27 (2 H, ушир. д), 1,90 (2 H, ушир. д), 1,73 (6 H, с), 1,56 (2 H, ушир.), 1,34 (6 H, д, J=5,9 Гц).
ЖХ/МС: м/z 513 [М+H]+
ВЭЖХ время удерживания: 1,48 мин (условия анализа S)
[Пример 483]
Соединение K10-2
8-(4-Циклобутил-пиперазин-1-ил)-9-изопропокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения K9-3 и 2-йодпропана.
1H-ЯМР (270 МГц, DМSO-d6) δ: 8,29 (1 H, д, J=8,1 Гц), 7,98 (1 H, с), 7,56-7,63 (2 H, м), 7,14 (1 H, с), 4,62-4,74 (1 H, м), 3,10-3,26 (4 H, м), 2,69-2,85 (1 H, м), 2,35-2,48 (4 H, м), 1,57-2,08 (6 H, м), 1,73 (6 H, с), 1,32 (6 H, д, J=6,1 Гц).
ЖХ/МС: м/z 483 [М+H]+
ВЭЖХ время удерживания: 1,65 мин (условия анализа S)
[Пример 484]
Соединение K10-3
9-(2-Метокси-этокси)-6,6-диметил-8-морфолин-4-ил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
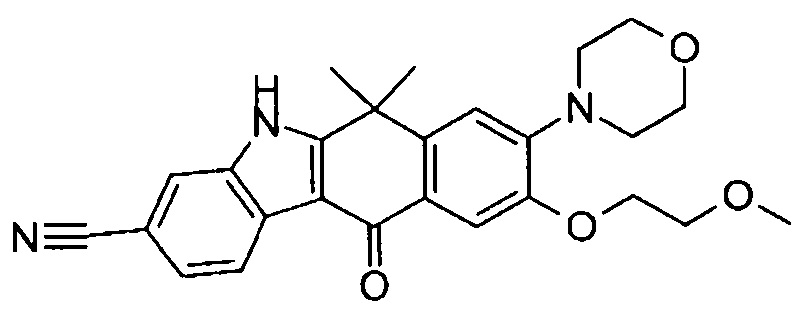
С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения K9-4 и 1-бром-2-метоксиэтана.
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,67 (1 H, с), 8,30 (1 H, д, 7,9 Гц), 7,98 (1 H, с), 7,64 (1, с), 7,58 (1 H, д, 7,9 Гц), 7,16 (1 H, с), 4,18-4,22 (2 H, м), 3,72-3,80 (6 H, м), 3,35 (3 H, с), 3,18-3,24 (4 H, с), 1,74 (1 H, с).
ЖХ/МС: м/z 446 [М+H]+
ВЭЖХ время удерживания: 3,23 мин (условия анализа W)
[Пример 485]
Соединение K10-4
9-[2-(2-Метокси-этокси)этокси]-6,6-диметил-8-морфолин-4-ил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения K9-4 и 1-бром-2-(2-метоксиэтокси)этана.
ЖХ/МС: m/z 490 [M+H]+
ВЭЖХ время удерживания: 3,16 мин (условия анализа W)
[Пример 486]
Соединение K10-5
6,6-Диметил-8-морфолин-1-ил-11-оксо-9-[(S)-(тетрагидрофуран-3-ил)окси]-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения K9-4 и 3-мезилокситетрагидрофурана.
ЖХ/МС: m/z 458 [M+H]+
ВЭЖХ время удерживания: 3,20 мин (условия анализа W)
[Пример 487]
Соединение K10-6
9-Изопропокси-6,6-диметил-8-морфолин-4-ил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения K9-4 и 2-бромпропана.
1H-ЯМР(270 МГц, DМSO-d6) δ: 12,70 (1 H, ушир. с), 8,32-8,29 (1 H, д, 8,08 Гц), 8,00 (1 H, с), 7,63 (1 H, с), 7,62-7,59 (1 H, д, 8,08 Гц), 7,16 (1 H, с), 4,75-4,66 (1 H, м), 3,77 (4 H, м), 3,19 (4 H, м), 1,74 (6 H, с), 1, 5 (3 H, с), 1,33 (3 H, с).
ЖХ/МС: м/z 430 [М+H]+
[Пример 488]
Соединение K10-7
9-(2-Гидрокси-этокси)-6,6-диметил-8-морфолин-4-ил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения K9-4 и 2-бромэтанола.
1H-ЯМР(270 МГц, DМSO-d6) δ: 12,71 (1 H, ушир. с), 8,33-8,30 (1 H, д, 8,08 Гц), 8,00 (1 H, с), 7,63 (1 H, с), 7,62-7,59 (1 H, д, 8,08 Гц), 7,16 (1 H, с), 4,13-4,09 (2 H, т, 4,61 Гц), 3,81-3,78 (2 H, т, 4,61 Гц), 3,78 (4 H, м), 3,23 (4 H, м), 1,75 (6 H, с).
ЖХ/МС: м/z 432 [М+H]+
[Пример 489]
Соединение L2-1
(4-Изопропокси-3-метокси-фенил)этилацетатный сложный эфир

(4-Гидрокси-3-метокси-фенил)этилацетатный сложный эфир (Соединение L1-1, 3,0 г, 14,27 ммоль) растворяли в DMF (70 мл), добавляли 2-йодпропан (2,9 мл, 2,0 экв.) и карбонат калия (3,94 г, 2,0 экв.) и перемешивали при 80°C в течение ночи. Реакционный раствор добавляли в воду и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Осушитель удаляли фильтрованием, и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением целевого соединения (желтое маслянистое вещество, 2,61 г, 73%).
1H-ЯМР (270 МГц, DМSO-d6) δ: 6,88 (2 H, м), 6,74 (1 H, дд, J=8,1, 2,1 Гц), 4,52-4,43 (1 H, м), 4,07 (2 H, кв., J=7,1 Гц), 3,72 (3 H, с), 3,56 (2 H, с), 1,23 (6 H, д, J=6,1 Гц), 1,18 (3 H, т, J=7,1 Гц).
ЖХ/МС: м/z 253 [М+H]+
ВЭЖХ время удерживания: 2,18 мин (условия анализа S)
[Пример 490]
Соединение L2-2
Изопропиловый эфир (4-изопропокси-3-метокси-фенил)уксусной кислоты

(4-Гидрокси-3-метокси-фенил)уксусную кислоту (Соединение L1-2, 1,5 г, 8,23 ммоль) растворяли в DMF (30 мл), добавляли 2-иодпропан (3,3 мл, 4,0 экв.) и карбонат калия (4,55 г, 4,0 экв.) и перемешивали при 80°C в течение ночи. Реакционный раствор добавляли в воду и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Осушитель удаляли фильтрованием, и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением целевого соединения (желтое маслянистое вещество, 1,21 г, 55%).
1H-ЯМР (270 МГц, DМSO-d6) δ: 6,87 (2 H, с+д), 6,73 (1 H, дд, J=8,1, 2,1 Гц), 4,94-4,84 (1 H, м), 4,52-4,43 (1 H, м), 3,72 (3H, с), 3,52 (2 H, с), 1,23 (6 H, д, J=6,1 Гц), 1,18 (6 H, д, J=6,1 Гц).
ЖХ/МС: м/z 267 [М+H]+
ВЭЖХ время удерживания: 2,40 мин (условия анализа S)
[Пример 491]
Соединение L3-1
Этиловый эфир 2-(4-изопропокси-3-метокси-фенил)-2-метил-пропионовой кислоты
С использованием тех же условий, как в способе синтеза Соединения K2, получали указанное в заголовке соединение, исходя из Соединения L2-1.
1H-ЯМР (270 МГц, DМSO-d6) δ: 6,90-6,76 (3 H, м), 4,53-4,44 (1 H, м), 4,06 (2 H, кв., J=7,1 Гц), 3,73 (3 H, с), 1,47 (6 H, с), 1,23 (6 H, д, J=6,1 Гц), 1,12 (3 H, т, J=7,0 Гц).
ЖХ/МС: м/z 281 [М+H]+
ВЭЖХ время удерживания: 2,57 мин (условия анализа S)
[Пример 492]
Соединение L3-2
Изопропиловый эфир 2-(4-изопропокси-3-метокси-фенил)-2-метил-пропионовой кислоты

С использованием тех же условий, как в способе синтеза Соединения K2, получали указанное в заголовке соединение, исходя из Соединения L2-2.
1H-ЯМР (270 МГц, DМSO-d6) δ: 6,88 (1 H, д, J=8,2 Гц), 6,79 (2 H, м), 4,94-4,84 (1 H, м), 4,53-4,44 (1 H, м), 3,72 (3 H, с), 1,45 (6 H, с), 1,23 (6 H, д, J=6,1 Гц), 1,12 (6 H, д, J=6,3 Гц).
ЖХ/МС: м/z 295 [М+H]+
ВЭЖХ время удерживания: 2,75 мин (условия анализа S)
[Пример 493]
Соединение L4
2-(4-Изопропокси-3-метокси-фенил)-2-метил-пропионовая кислота

Этиловый эфир 2-(4-изопропокси-3-метокси-фенил)-2-метил-пропионовой кислоты (Соединение L3-1, 1,45 г, 5,17 ммоль) растворяли в ТГФ (13 мл) и EtOH (13 мл), добавляли 1 н водный раствор гидроксида натрия (10,3 мл, 2,0 экв.) и перемешивали при 80°C в течение ночи. Реакционный раствор добавляли в воду и экстрагировали этилацетатом. Водный слой подкисляли с использованием 1 н водного раствора хлористоводородной кислот, экстрагировали этилацетатом, промывали насыщенным солевым раствором и сушили над сульфатом натрия. Осушитель удаляли фильтрованием, и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением целевого соединения (белое твердое вещество, 1,10 г, 84%).
1H-ЯМР (270 МГц, DМSO-d6) δ: 12,26 (1 H, с), 6,90-6,80 (3 H, м), 4,49 (1 H, м), 3,73 (3 H, с), 1,45 (6 H, с), 1,23 (6 H, д, J=6,1 Гц).
ЖХ/МС: м/z 253 [М+H]+
ВЭЖХ время удерживания: 1,83 мин (условия анализа S)
[Пример 494]
Соединение L5
Этиловый эфир 4-(4-изопропокси-3-метокси-фенил)-4-метил-3-оксопентановой кислоты

К 2-(4-изопропокси-3-метокси-фенил)-2-метил-пропионовой кислоте (Соединение L4, 1,4 г, 5,55 ммоль) добавляли тионилхлорид (10 мл) и затем перемешивали при комнатной температуре в течение 5 часов. Смесь концентрировали при пониженном давлении для удаления непрореагировавшего тионилхлорида с получением соответствующего хлорангидрида кислоты.
К MeCN (40 мл) добавляли калиевую соль моноэтилового эфира малоновой кислоты (1,98 г, 2,1 экв.), триэтиламин (2,47 мл, 3,2 экв.) и хлорид магния (1,32 г, 2,5 экв.) и смесь перемешивали при комнатной температуре в течение 2 часов. К реакционному раствору добавляли по каплям раствор полученного выше хлорангидрида кислоты в MeCN (15 мл). После завершения добавления по каплям, смесь перемешивали при комнатной температуре в течение ночи. MeCN удаляли путем дистилляции и концентрировали при пониженном давлении и к полученным остаткам добавляли 1 н водный раствор хлористоводородной кислот, экстрагировали толуолом, промывали насыщенным солевым раствором и сушили над сульфатом натрия. Осушитель удаляли фильтрованием, и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением целевого соединения (желтое маслянистое вещество, 1,45 г, 81%).
1H-ЯМР (270 МГц, DМSO-d6) δ: 6,94 (1 H, д, J=8,2 Гц), 6,76 (2 H, м), 4,56-4,47 (1 H, м), 4,00 (2 H, кв., J=7,1 Гц), 3,74 (3 H, с), 3,38 (2 H, с), 1,41 (6 H, с), 1,24 (6 H, д, J=6, 1 Гц), 1,12 (3 H, т, J=7,3 Гц).
ЖХ/МС: м/z 323 [М+H]+
ВЭЖХ время удерживания: 2,45, 3,03 мин (условия анализа S)
[Пример 495]
Соединение L6
Этиловый эфир 2-(4-циано-2-нитро-фенил)-4-(4-изопропокси-3-метокси-фенил)-4-метил-3-оксопентановой кислоты

С использованием тех же условий, как в способе синтеза Соединения K4, получали указанное в заголовке соединение, исходя из Соединения L5.
1H-ЯМР (270 МГц, DМSO-d6) δ: 8,35 (1 H, д, J=1,8 Гц), 8,14 (1 H, дд, J=8,2, 1,9 Гц), 7,67 (1 H, д, J=8,2 Гц), 6,68 (1 H, д, J=8,4 Гц), 6,59 (1 H, дд, J=8,4, 2,0 Гц), 6,45 (1 H, д, J=2,1 Гц), 5,44 (1 H, с), 4,43 (1 H, м), 4,09 (2 H, кв., J=7,1 Гц), 3,53 (3 H, с), 1,59 (3 H, с), 1,35 (3 H, с), 1,24 (6 H, дx2), 1,13 (3 H, т, J=7,1 Гц).
ЖХ/МС: м/z 469 [М+H]+
ВЭЖХ время удерживания: 2,85, 3,10 мин (условия анализа S)
[Пример 496]
Соединение L7
Этиловый эфир 6-циано-2-[1-(4-изопропокси-3-метокси-фенил)-1-метил-этил]-1H-индол-3-карбоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения K5, получали указанное в заголовке соединение, исходя из Соединения L6.
1H-ЯМР (270 МГц, DМSO-d6) δ: 12,04 (1 H, с), 8,05 (1 H, д, J=8,4 Гц), 7,93 (1 H, с), 7,49 (1 H, дд, J=8,4, 1,5 Гц), 6,79 (2 H, м), 6,54 (1 H, дд, J=8,3, 1,9 Гц), 4,43 (1 H, т, J=6,1 Гц), 3,94 (2 H, кв., J=7,0 Гц), 3,65 (3 H, с), 1,81 (6 H, с), 1,21 (6 H, д, J=5,9 Гц), 1,05 (3 H, т, J=7,1 Гц).
ЖХ/МС: м/z 421 [М+H]+
ВЭЖХ время удерживания: 2,82 мин (условия анализа S)
[Пример 497]
Соединение L8-1
9-Гидрокси-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

Этиловый эфир 6-циано-2-[1-(4-изопропокси-3-метокси-фенил)-1-метил-этил]-1H-индол-3-карбоновой кислоты (Соединение L7, 1,25 г, 2,97 ммоль) растворяли в MeCN (18 мл), добавляли метансульфоновую кислоту (3,75 мл) и затем перемешивали при 50°C в течение 8 часов. К реакционному раствору добавляли гексан, и осажденное твердое вещество фильтровали с получением указанного в заголовке соединения (желтое твердое вещество, 185 мг, 19%).
1H-ЯМР (270 МГц, DМSO-d6) δ: 12,67 (1 H, с), 8,30 (1 H, д, J=8,2 Гц), 7,99 (1 H, с), 7,59 (2 H, м), 7,28 (1 H, с), 3,93 (3 H, с), 1,75 (6 H, с).
ЖХ/МС: м/z 333 [М+H]+
ВЭЖХ время удерживания: 1,73 мин (условия анализа S)
[Пример 498]
Соединение L8-2
9-Изопропокси-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
К фильтрату, полученному в способе синтеза Соединения L8-1, добавляли воду и осуществляли экстрагирование этилацетатом. Полученную смесь промывали насыщенным солевым раствором и сушили над сульфатом натрия. Осушитель удаляли фильтрованием и смесь концентрировали при пониженном давлении с получением целевого соединения (красное аморфное вещество, 830 мг, 75%).
1H-ЯМР (270 МГц, DМSO-d6) δ: 12,72 (1 H, с), 8,31 (1 H, д, J=8,4 Гц), 8,01 (1 H, д, J=0,7 Гц), 7,66 (1 H, с), 7,61 (1 H, дд, J=8,2, 1,4 Гц), 7,33 (1 H, с), 4,65 (1 H, м), 3,93 (3 H, с), 1,77 (6 H, с), 1,32 (6 H, д, J=6,1 Гц).
ЖХ/МС: м/z 375 [М+H]+
ВЭЖХ время удерживания: 2,38 мин (условия анализа S)
[Пример 499]
Соединение L9
8-Гидрокси-9-изопропокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E3-2, получали указанное в заголовке соединение, исходя из Соединения L8-2.
1H-ЯМР (270 МГц, DМSO-d6) δ: 12,69 (1 H, с), 9,69 (1 H, с), 8,30 (1 H, д, J=8,1 Гц), 7,99 (1 H, с), 7,65 (1 H, с), 7,60 (1 H, дд, J=8,2, 1,2 Гц), 7,17 (1 H, с), 4,64 (1 H, м), 1,69 (6 H, с), 1,32 (6 H, д, J=6,1 Гц).
ЖХ/МС: м/z 361 [М+H]+
ВЭЖХ время удерживания: 2,20 мин (условия анализа S)
[Пример 500]
Соединение L10-1
8-(1-Циклобутил-пиперидин-4-илокси)-9-изопропокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения L9 и 1-циклобутилпиперидин-4-ола.
1H-ЯМР(270 МГц, CDCl3) δ: 9,31 (1 H, ушир. с), 8,54-8,50 (1 H, д, 8,08 Гц), 7,90 (1 H, с), 7,77 (1 H, с), 7,59-7,55 (1 H, м), 7,09 (1 H, с), 4,70-4,61 (1 H, м), 4,52-4,43 (1 H, м), 2,79-2,73 (1 H, м), 2,70-2,60 (2 H, м), 2,25-2,16 (2 H, м), 2,09-1,99 (4 H, м), 1,98-1,88 (4 H, м), 1,77 (6 H, с), 1,72-1,58 (2 H, м), 1,39 (3 H, с), 1,37 (3 H, с).
ЖХ/МС: м/z 498 [М+H]+
[Пример 501]
Соединение L10-2
8-((R)-1-Циклобутил-пирролидин-3-илокси)-9-изопропокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения L9 и (S)-1-циклобутилпирролидин-3-ола.
1H-ЯМР(270 МГц, CDCl3) δ: 10,63 (1 H, ушир. с), 8,51-8,48 (1 H, д, 8,08 Гц), 7,89 (1 H, с), 7,85 (1 H, с), 7,55-7,51 (1 H, м), 6,99 (1 H, с), 5,03-4,97 (1 H, м), 4,71-4,62 (1 H, м), 3,07-2,92 (2 H, м), 2,84-2,73 (2 H, м), 2,64-2,53 (1 H, м), 2,36-2,23 (2 H, м), 2,10-1,97 (2 H, м), 1,83-1,67 (2 H, м), 1,78 (6 H, с), 1,53-1,46 (2 H, м), 1,39 (3 H, с), 1,37 (3 H, с).
ЖХ/МС: м/z 484 [М+H]+
[Пример 502]
Соединение M1
7-Метокси-3,4-дигидро-2H-спиро[циклопентан-1,1’-нафталин]-2-он
К ТГФ (300 мл) раствору 7-метокси-3,4-дигидро-1H-нафталин-2-она (Соединение A1, 0,5 г, 2,84 ммоль) добавляли гидрид натрия (36,4 мг, 2,2 экв.) при 0°C. После перемешивания в течение 20 минут к реакционному раствору добавляли 1,4-дибромбутан (0,74 мл, 1,2 экв.) по каплям и смесь перемешивали при 80°C в течение 4 часов. К реакционному раствору добавляли насыщенный водный раствор хлорида аммония с последующим экстрагированием этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония и сушили над сульфатом магния. Осушитель удаляли фильтрованием, и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (желтое твердое вещество, 0,31 г, 47%).
1H-NMR(CDCl3, 300 MГц) δ: 1,79-1,92 (6 H, м), 2,42-2,27 (м, 2 H), 3,03 (т, 2 H, J=6,5 Гц), 3,81 (т, 2 H, J=6,5 Гц), 3,81 (с, 3 H), 6,73 (дд, 1 H, J=2,7 Гц, 8,0 Гц), 6,83 (д, 1 H, J=2,7 Гц), 7,09 (д, 1 H, J=8,0 Гц).
ЖХ/МС: м/z 231 [М+H]+
[Пример 503]
Соединение M2
3-Бром-8-метокси-5,11-дигидроспиро[бензо[b]карбазол-6,1’-циклопентан]

С использованием тех же условий, как в способе синтеза Соединения A3-1, получали указанное в заголовке соединение, исходя из Соединения M1 и (3-бром-фенил)гидразина.
ЖХ/МС: m/z 380, 382 [M+H]+
ВЭЖХ время удерживания: 2,90 мин (условия анализа Y)
[Пример 504]
Соединение M3
3-Бром-8-метоксиспиро[бензо[b]карбазол-6,1’-циклопентан]-11(5H)-он

С использованием тех же условий, как в способе синтеза Соединения A4, получали указанное в заголовке соединение, исходя из Соединения M2.
1H-ЯМР (CDCl3, 300 МГц) δ: 2,11-2,51 (8 H, м), 3,91 (с, 3 H), 6,98 (дд, 1 H, J=2,3 Гц, 8,8 Гц), 7,01 (д, 1 H, J=2,3 Гц), 7,41 (дд, 1 H, J=1,5 Гц, 8,4 Гц), 7,57 (д, 1 H, J=1,5 Гц), 8,30 (д, 1 H, J=8,4 Гц), 8,35 (д, 1H, J=8,8 Гц), 8,69 (с, 1 H).
ЖХ/МС: м/z 396, 398 [М+H]+
[Пример 505]
Соединение M4
8-Метокси-11-оксо-5,11-дигидроспиро[бензо[b]карбазол-6,1’-циклопентан]-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A5-2, получали указанное в заголовке соединение, исходя из Соединения M3.
1H-ЯМР (DМSO-d6, 300 МГц) δ: 2,14-2,37 (м, 8 H), 3,90 (с, 3 H), 7,05-7,10 (м, 2 H), 7,60 (дд, 1 H, J=1,5 Гц, 8,4 Гц), 7,95 (с, 1 H), 8,13 (д, 1 H, J=9,5 Гц), 8,30 (д, 1 H, J=8, 4 Гц), 12,24 (с, 1 H).
ЖХ/МС: м/z 343 [М+H]+
[Пример 506]
Соединение M5
8-Гидрокси-11-оксо-5,11-дигидроспиро[бензо[b]карбазол-6,1’-циклопентан]-3-карбонитрил
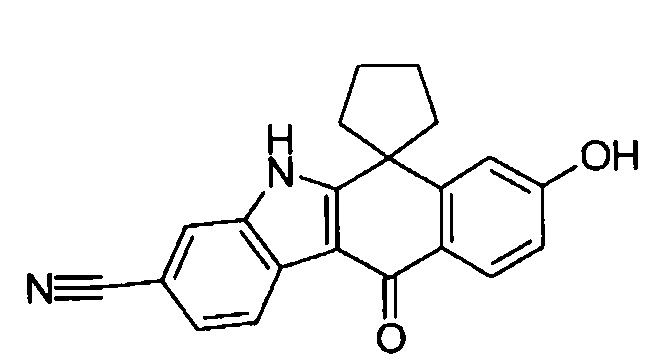
С использованием тех же условий, как в способе синтеза Соединения A6, получали указанное в заголовке соединение, исходя из Соединения M4.
1H-ЯМР (DМSO-d6, 300 МГц) δ: 2,06-2,39 (м, 8 H), 6,87 (дд, 1 H, J=1,9 Гц, 8,8 Гц), 6,90 (д, 1 H, J=1,9 Гц), 7,57 (дд, 1 H, J=1,1 Гц, 8,0 Гц), 7,95 (с, 1 H), 8,02 (д, 1 H, J=8,8 Гц), 8,30 (д, 1 H, J=8,0 Гц), 10,29 (с, 1H), 12,25 (с, 1 H).
ЖХ/МС: м/z 329 [М+H]+
[Пример 507]
Соединение M6-1
(S)-8-((2,2-Диметил-1,3-диоксолан-4-ил)метокси)-11-оксо-5,11-дигидроспиро[бензо[b]карбазол-6,1’-циклопентан]-3-карбонитрил
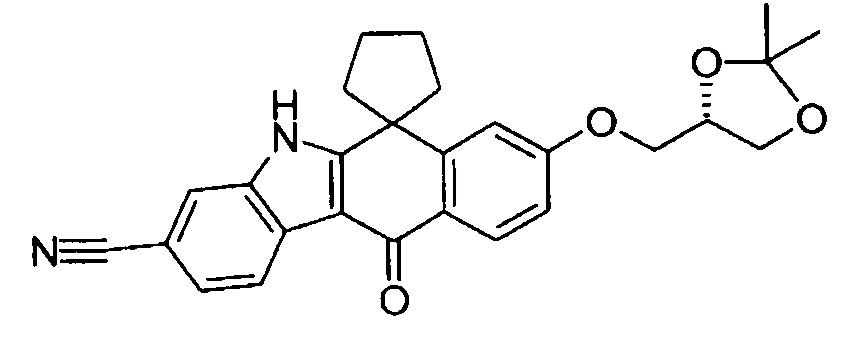
С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение в виде неочищенного продукта, исходя из Соединения M5 и (R)-2,2-диметил[1,3]диоксолан-4-илметилового эфира толуол-4-сульфоновой кислоты.
[Пример 508]
Соединение M6-2
(R)-8-(2,3-Дигидроксипропокси)-11-оксо-5,11-дигидроспиро[бензо[b]карбазол-6,1’-циклопентан]-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-14-2, получали указанное в заголовке соединение, исходя из Соединения M6-1.
ЖХ/МС: m/z 403 [M+H]+
ВЭЖХ время удерживания: 2,88 мин (условия анализа U)
[Пример 509]
Соединение N1
7-Метокси-2’,3,3’,4,5’,6’-гексагидро-2H-спиро[нафталин-1,4’-пиран]-2-он

К ТГФ (300 мл) раствору 7-метокси-3,4-дигидро-1H-нафталин-2-она (Соединение A1, 20 г, 0,11 моль) добавляли гидрид натрия (9,9 г, 3,7 экв.) при 0°C. После перемешивания в течение 10 минут к реакционному раствору добавляли по каплям 1-бром-2-(2-бром-этокси)этан (19 мл, 12 экв.) и смесь перемешивали при 80°C в течение 3 часов. К реакционному раствору добавляли насыщенный водный раствор хлорида аммония и два раза экстрагировали этилацетатом. Органический слой сушили над сульфатом магния. Осушитель удаляли фильтрованием, и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (белое твердое вещество, 13 г, 51%).
1H-ЯМР (300 МГц, CDCl3) δ: 2,07 (4 H, м), 2,70 (т, 2 H, 6,8 Гц), 3,12 (т, 2 H, 6,8 Гц), 3,81 (с, 3 H), 3,89 (м, 4 H), 6,75 (дд, 1 H, 2,6 Гц, 8,3 Гц), 6,9 (д, 1 H, 2,6 Гц), 7,0 (д, 1H, 8,3 Гц).
ЖХ/МС: м/z 247 [М+H]+
[Пример 510]
Соединение N2-1, Соединение N2-2
3-Бром-8-метокси-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]
1-Бром-8-метокси-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]

С использованием тех же условий, как в способе синтеза Соединения A3-1, указанное в заголовке соединение получали в виде смеси, исходя из Соединения N1.
[Пример 511]
Соединение N3
3-Бром-8-метокси-2’,3’,5’,6’-тетрагидроспиро[бензо[b]карбазол-6,4’-пиран]-11(5H)-он

С использованием тех же условий, как в способе синтеза Соединения A4, получали указанное в заголовке соединение, исходя из Соединения N2-1.
1H-ЯМР (300 МГц, DМSO-d6) δ: 1,9 (2 H, м), 2,4 (м, 2 H), 3,9 (с, 3 H), 4,0 (м, 2 H), 4,2 (м, 2 H), 7,1 (дд, 1 H, 2,2 Гц, 8,7 Гц), 7,3 (м, 2 H), 7,8 (д, 1 H, 2,2 Гц), 8,1 (д, 2 H, 8,7 Гц), 11,8 (с, 1 H).
ЖХ/МС: м/z 413(М+1)+
[Пример 512]
Соединение N4
8-Метокси-11-оксо-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A5-2, получали указанное в заголовке соединение, исходя из Соединения N3.
1H-ЯМР(300 МГц, DМSO-d6) δ: 1,9 (м, 2 H), 2,4 (м, 2 H), 3,9 (с, 3 H), 4,0 (м, 2 H), 4,1 (м, 2 H), 7,1 (дд, 1 H, 2,2 Гц, 8,7 Гц), 7,4 (д, 1 H, 2,2 Гц), 7,6 (дд, 1 H, 1,5 Гц, 8,3 Гц), 8,0 (с, 1 H), 8,1 (д, 1 H, 8,7 Гц), 8,3 (д, 1H, 8,3 Гц), 12,2 (с, 1 H).
ЖХ/МС: м/z 359 [М+H]+
ВЭЖХ время удерживания: 2,80 мин (условия анализа U)
[Пример 513]
Соединение N5
8-Гидрокси-11-оксо-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A6, получали указанное в заголовке соединение, исходя из Соединения N4.
1H-ЯМР(300 МГц, DМSO-d6) δ м.д. 2,0 (м, 2 H), 2,3 (м, 2 H), 4,0 (м, 2 H), 4,1 (м, 2 H), 6,9 (дд, 1 H, 1,9 Гц, 8,3 Гц), 7,3 (д, 1 H, 1,9 Гц), 7,6 (дд, 1 H, 1,5 Гц, 8,3 Гц), 8,0 (с, 1H), 8,1 (д, 1 H, 8,3 Гц), 8,3 (д, 1 H, 8,3 Гц), 10,3 (с, 1 H), 12,2(с, 1 H).
ЖХ/МС: м/z 345 [М+H]+
ВЭЖХ время удерживания: 2,37 мин (условия анализа U)
[Пример 514]
Соединение N6-1-1
(S)-8-((2,2-Диметил-1,3-диоксолан-4-ил)метокси)-11-оксо-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения N6-2 и (S)-2,2-диметил-4-п-толилоксиметил[1,3]диоксолана.
ЖХ/МС: m/z 459 [M+H]+
ВЭЖХ время удерживания: 2,93 мин (условия анализа Y)
[Пример 515]
Соединение N6-1-2
(R)-8-(2,3-Дигидроксипропокси)-11-оксо-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил
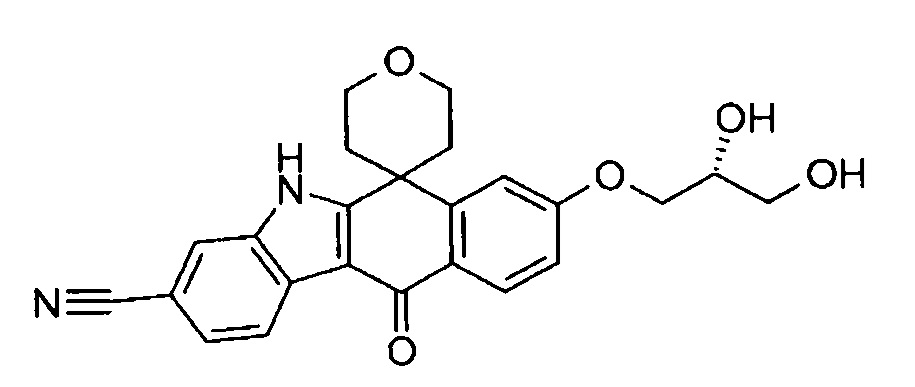
С использованием тех же условий, как в способе синтеза Соединения A7-14-2, получали указанное в заголовке соединение, исходя из Соединения N6-1-1.
ЖХ/МС: m/z 419 [M+H]+
ВЭЖХ время удерживания: 1,52 мин (условия анализа S)
[Пример 516]
Соединение N6-2
11-Оксо-8-(пиперидин-4-илокси)-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-1 и Соединение A8-1, получали указанное в заголовке соединение, исходя из Соединения N5.
ЖХ/МС: m/z 428 [M+H]+
ВЭЖХ время удерживания: 1,38 мин (условия анализа S)
[Пример 517]
Соединение N6-3
8-(3-Морфолинoэтокси)-11-оксо-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил
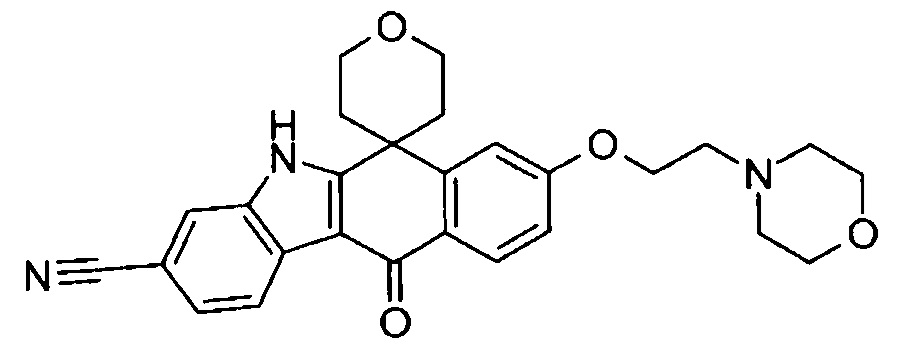
С использованием тех же условий, как в способе синтеза Соединения A8-17, получали указанное в заголовке соединение, исходя из Соединения N5.
ЖХ/МС: m/z 458 [M+H]+
ВЭЖХ время удерживания: 1,33 мин (условия анализа S)
[Пример 518]
Соединение N6-4
8-(3-Морфолинoпропокси)-11-оксо-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A8-17, получали указанное в заголовке соединение, исходя из Соединения N5.
ЖХ/МС: m/z 472 [M+H]+
ВЭЖХ время удерживания: 1,41 мин (условия анализа S)
[Пример 519]
Соединение N6-5
Диметиламид 3-циано-8-[2-(1,1-диоксо-тиоморфолин-4-ил)этокси]-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-сульфоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения A8-17, получали указанное в заголовке соединение, исходя из Соединения N5.
ЖХ/МС: m/z 506 [M+H]+
ВЭЖХ время удерживания: 1,53 мин (условия анализа S)
[Пример 520]
Соединение N6-6
8-(1-Этилпиперидин-4-илокси)-11-оксо-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения N6-2.
1H-ЯМР (300 МГц, DМSO-d6) δ: 1,02 (3 H, т, 7,25 Гц), 1,18 (2 H, м), 1,71 (2 H, м), 1,97 (4 H, м), 2,27 (2 H, м), 2,38 (3 H, м), 2,71 (2 H, м), 4,03 (2 H, м), 4,21 (2 H, м), 4,66 (1 H, с), 7,13 (1 H, дд, 8,77 Гц, 1,91 Гц), 7,39 (1 H, ушир. с, 1,91 Гц), 7,60 (1 H, д, 8,40 Гц), 8,07 (1 H, с), 8,15 (1 H, д, 8,40 Гц), 8,37 (1 H, д, 8,01 Гц), 12,2 (1 H, с).
ЖХ/МС: м/z 456 [М+H]+
ВЭЖХ время удерживания: 1,48 мин (условия анализа S)
[Пример 521]
Соединение N7
3-Циано-11-оксо-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-8-ил-трифторметансульфоновая кислота
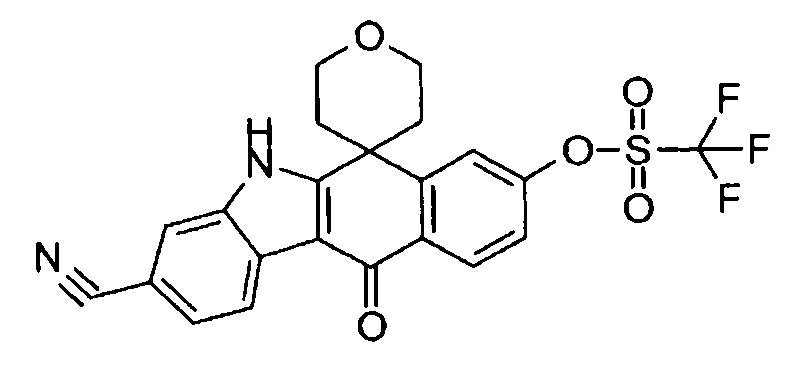
С использованием тех же условий, как в способе синтеза Соединения B1, получали указанное в заголовке соединение, исходя из Соединения N5.
ЖХ/МС: m/z 477 [M+H]+
ВЭЖХ время удерживания: 3,58 мин (условия анализа Y)
[Пример 522]
Соединение N8-1
11-Оксо-8-(4-(пирролидин-1-ил)пиперидин-1-ил)-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения N7 и 4-пирролидин-1-ил-пиперидина.
ЖХ/МС: m/z 481 [M+H]+
ВЭЖХ время удерживания: 1,75 мин (условия анализа U)
[Пример 523]
Соединение N8-2
8-(4-Морфолинoпиперидин-1-ил)-11-оксо-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения N7 и 4-пиперидин-4-ил-морфолина.
ЖХ/МС: m/z 497 [M+H]+
ВЭЖХ время удерживания: 1,70 мин (условия анализа U)
[Пример 524]
Соединение O1
6-Бром-7-метокси-2’,3,3’,4,5’,6’-гексагидро-2H-спиро[нафталин-1,4’-пиран]-2-он

С использованием тех же условий, как в способе синтеза Соединения E-1, получали указанное в заголовке соединение, исходя из Соединения N1.
1H-ЯМР (300 МГц, DМSO-d6) δ: 2,01 (4 H, м), 2,66 (2 H, т, 6,87 Гц), 3,08 (2 H, т, 6,87 Гц), 3,62 (2 H, м), 3,78 (2 H, м), 3,87 (3 H, с), 7,00 (1 H, с), 7,43 (1 H, с).
[Пример 525]
Соединение O2
9-Бром-8-метокси-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E2-1, получали указанное в заголовке соединение в виде неочищенного продукта, исходя из Соединения O1.
[Пример 526]
Соединение O3
9-Бром-8-метокси-11-оксо-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил
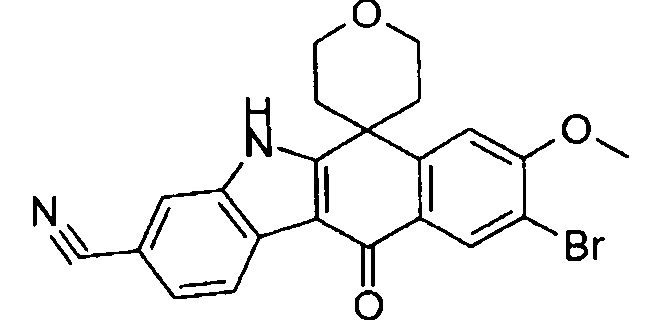
С использованием тех же условий, как в способе синтеза Соединения A4, получали указанное в заголовке соединение, исходя из Соединения O2.
1H-ЯМР (300 МГц, DМSO-d6) δ: 1,95 (2 H, д, 14,87 Гц), 2,55 (2 H, м), 4,04 (2 H, м), 4,09 (3 H, с), 4,22 (2 H, м), 7,51 (1 H, с), 7,63 (1 H, дд, 8,01 Гц, 1,53 Гц), 8,09 (1 H, с), 8,30 (1 H, с), 8,36 (1 H, д, 8,01 Гц), 12,3 (1 H, с).
ЖХ/МС: м/z 437, 439 [М+H]+
ВЭЖХ время удерживания: 2,65 мин (условия анализа U)
[Пример 527]
Соединение O4
9-Фтор-8-метокси-11-оксо-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения O5-3, получали указанное в заголовке соединение, исходя из Соединения O3.
ЖХ/МС: m/z 377 [M+H]+
ВЭЖХ время удерживания: 2,29 мин (условия анализа S)
[Пример 528]
Соединение O5-1
9-Фтор-8-гидрокси-11-оксо-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E3-2, получали указанное в заголовке соединение, исходя из Соединения O4.
ЖХ/МС: m/z 363 [M+H]+
ВЭЖХ время удерживания: 1,88 мин (условия анализа S)
[Пример 529]
Соединение O5-2
3-Циано-9-фтор-11-оксо-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-8-ил-трифторметансульфоновая кислота

С использованием тех же условий, как в способе синтеза Соединения B1, получали указанное в заголовке соединение, исходя из Соединения O5-1.
ЖХ/МС: m/z 495 [M+H]+
ВЭЖХ время удерживания: 3,47 мин (условия анализа Y)
[Пример 530]
Соединение O5-3
9-Фтор-11-оксо-8-(4-(пирролидин-1-ил)пиперидин-1-ил)-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил

К ТГФ (0,9 мл) раствору 9-бром-6-тетрагидропиран-8-пирролидинoпиперидин-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрила (Соединение O8-1, 90 мг, 0,161 ммоль) добавляли раствор н-бутиллития (2 M раствор, 0,241 мл, 3 экв.) в ТГФ при -78°C. После перемешивания в течение 30 минут к реакционному раствору добавляли по каплям раствор N-фторбензолсульфонимид (152 мг, 3 экв.) в ТГФ (1 мл). После доведения до комнатной температуры смесь перемешивали в течение 18 часов. К реакционному раствору добавляли воду и осуществляли экстрагирование этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом магния. Осушитель удаляли фильтрованием, и остатки, полученные после концентрирования при пониженном давлении, очищали при помощи высокоэффективной хроматографии с получением целевого соединения (белое твердое вещество, 0,44 мг, 0,5%).
1H-ЯМР(CDCl3+CD3OD, 300 МГц) δ: 1,75-1,94 (м, 11 H), 2,02-2,01 (м, 2 H), 2,30-2,27 (м, 1 H), 2,75-2,72 (м, 2 H), 2,90-3,00 (м, 2 H), 3,61-3,47 (м, 4 H), 4,01-3,90 (м, 4 H), 7,08 (дд, 1 H, J=1,2 Гц, 8,4 Гц), 7,29 (дд, 1 H, J=1,5 Гц, 8,1 Гц), 7,68 (д, 1 H, J=12,9 Гц), 7,72 (с, 1 H), 8,22 (д, 1 H, J=8,4 Гц).
ЖХ/МС: м/z 499 [М+H]+
ВЭЖХ время удерживания: 1,95 мин (условия анализа U)
[Пример 531]
Соединение O5-4
8-(4-Циклобутилпиперазин-1-ил)-9-фтор-11-оксо-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения O5-2 и 1-циклобутилпиперазина.
ЖХ/МС: m/z 485 [M+H]+
ВЭЖХ время удерживания: 1,97 мин (условия анализа U)
[Пример 532]
Соединение O6-1
9-Бром-8-гидрокси-11-оксо-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A6, получали указанное в заголовке соединение, исходя из Соединения O3.
ЖХ/МС: m/z 423, 425 [M+H]+
ВЭЖХ время удерживания: 2,30 мин (условия анализа U)
[Пример 533]
Соединение O6-2
9-Бром-3-циано-11-оксо-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-8-ил-трифторметансульфоновая кислота

С использованием тех же условий, как в способе синтеза Соединения B1, получали указанное в заголовке соединение, исходя из Соединения O6-1.
ЖХ/МС: m/z 555, 557 [M+H]+
ВЭЖХ время удерживания: 3,13 мин (условия анализа U)
[Пример 534]
Соединение O7-1
9-Бром-11-оксо-8-(пиперазин-1-ил)-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения O6-2 и пиперазина.
ЖХ/МС: m/z 491, 493 [M+H]+
ВЭЖХ время удерживания: 1,88 мин (условия анализа U)
[Пример 535]
Соединение O7-2
трет-Бутил 4-(9-бром-3-циано-11-оксо-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-8-ил)пиперазин-1-карбоновая кислота

К дихлорметановому (5 мл) раствору 9-бром-11-оксо-8-(пиперазин-1-ил)-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрила (Соединение O7-1, 250 мг, 0,509 ммоль) и моно-трет-бутилового эфира угольной кислоты ангидрида (122 мг, 0,560 ммоль) добавляли триэтиламин (0,21 мл, 1,53 ммоль) при 0°C и перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении, и остатки очищали колоночной хроматографией на силикагеле (метанол/дихлорметан) с получением целевого соединения в виде белого твердого вещества (212 мг, 70%).
1H-ЯМР(300 МГц, DМSO-d6) δ м.д. 1,44 (9 H, с), 1,97 (2 H, м), 2,44 (2 H, м), 1,35 (4 H, м), 3,54 (4 H, м), 4,06 (2 H, м), 4,18 (2 H, м), 7,57 (1 H, с), 7,63 (1 H, дд, 8,01 Гц, 1,52 Гц), 8,08 (1 H, д, 1,52 Гц), 8,31 (1 H, с), 8,36 (1 H, д, 8,01 Гц), 12,3 (1 H,с).
ЖХ/МС: м/z 591, 593 [М+H]+
ВЭЖХ время удерживания: 3,23 мин (условия анализа T)
[Пример 536]
Соединение O7-3
Трет-бутил 4-(3-циано-11-оксо-9-(проп-1-инил)-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-8-ил)пиперазин-1-карбоновая кислота

С использованием тех же условий, как в способе синтеза Соединения O9-1, получали указанное в заголовке соединение, исходя из Соединения O7-2.
ЖХ/МС: m/z 551 [M+H]+
ВЭЖХ время удерживания: 3,92 мин (условия анализа Y)
[Пример 537]
Соединение O7-4
11-Оксо-8-(пиперазин-1-ил)-9-(проп-1-инил)-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения O7-3.
ЖХ/МС: 451 m/z [M+H]+
ВЭЖХ время удерживания: 1,87 мин (условия анализа U)
[Пример 538]
Соединение O7-5
трет-Бутил 4-(3-Циано-9-этинил-11-оксо-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-8-ил)пиперазин-1-карбоновая кислота

ЖХ/МС: m/z 537 [M+H]+
ВЭЖХ время удерживания: 3,82 мин (условия анализа Y)
[Пример 539]
Соединение O8-1
9-Бром-11-оксо-8-(4-(пирролидин-1-ил)пиперидин-1-ил)-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения O6-2 и 4-пирролидин-1-ил-пиперидина.
ЖХ/МС: m/z 559, 561 [M+H]+
ВЭЖХ время удерживания: 2,05 мин (условия анализа U)
[Пример 540]
Соединение O8-2
9-Бром-8-(4-циклобутилпиперазин-1-ил)-11-оксо-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения O6-2 и 1-циклобутилпиперазина.
ЖХ/МС: m/z 547 [M+H]+
ВЭЖХ время удерживания: 1,61 мин (условия анализа S)
[Пример 541]
Соединение O8-3
9-Бром-8-(4-морфолинoпиперидин-1-ил)-11-оксо-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил
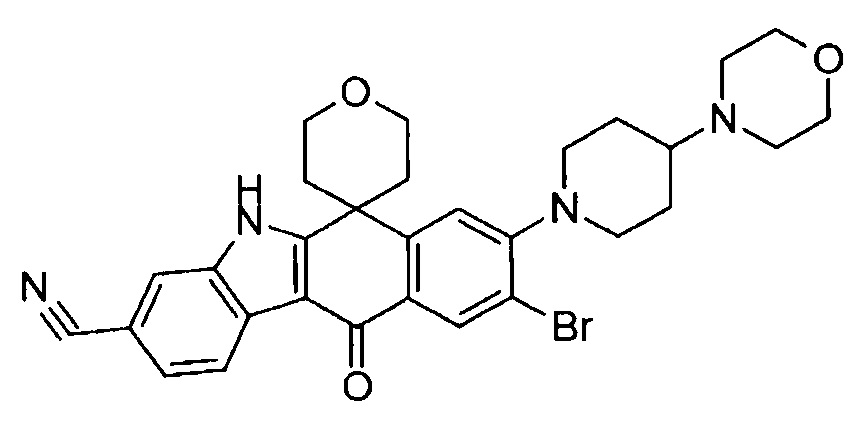
С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения O6-2 и 4-пиперидин-4-ил-морфолина.
ЖХ/МС: m/z 575, 577 [M+H]+
ВЭЖХ время удерживания: 1,95 мин (условия анализа U)
[Пример 542]
Соединение O8-4
9-Бром-8-(4-(оксетан-3-ил)пиперазин-1-ил)-11-оксо-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения O7-1 и оксетан-3-она.
ЖХ/МС: m/z 547, 549 [M+H]+
ВЭЖХ время удерживания: 1,43 мин (условия анализа S)
[Пример 543]
Соединение O8-5
9-Бром-8-(4-трет-бутилпиперазин-1-ил)-11-оксо-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил
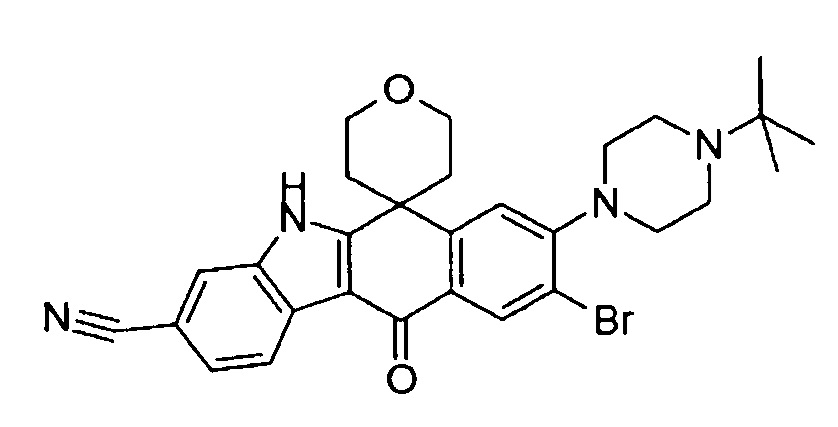
С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения O6-2 и 1-трет-бутилпиперазина.
ЖХ/МС: 547, 549 m/z [M+H]+
ВЭЖХ время удерживания: 2,07 мин (условия анализа U)
[Пример 544]
Соединение O9-1
11-Оксо-9-(проп-1-инил)-8-(4-(пирролидин-1-ил)пиперидин-1-ил)-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил

9-Бром-11-оксо-8-(4-(пирролидин-1-ил)пиперидин-1-ил)-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил (Соединение O8-1, 100 мг, 0,170 ммоль), трибутил(1-пропинил)олово (0,082 мл, 0,268 ммоль), дихлорид бис(ацетонитрил)палладия(II) (2,64 мг, 0,00895 ммоль), X-Phos (12,8 мг, 0,0269 ммоль) и карбонат цезия (262,4 мг, 0,806 ммоль) суспендировали в ацетонитриле (1 мл) и затем перемешивали при 80°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры с последующим добавлением воды и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Осушитель удаляли фильтрованием, и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (дихлорметан/метанол) с получением целевого соединения (бледно-желтое твердое вещество, 3,8 мг, 4,1%).
1H-ЯМР(300 МГц, DМSO) δ м.д. 12,20 (ушир. с, 1 H), 8,35 (д, 1 H, J=8,1 Гц), 8,06 (с, 1 H), 8,06 (д, 1 H, J=10,8 Гц), 7,58 (д, 1 H, J=8,4 Гц), 7,29 (с, 1 H), 4,25-4,23 (м, 2 H), 4,02-3,98( м, 2 H), 3,78 (д, 2 H, J=11,4 Гц), 2,93 (т, 2 H, J=11,1 Гц), 2,55 (с, 1 H), 2,45-2,28 (м, 2 H), 2,24-2,05 (м, 4 H), 2,08-1,81 (м, 4 H), 1,75-1,50 (м, 7 H).
ЖХ/МС: м/z 519 [М+H]+
ВЭЖХ время удерживания: 1,98 мин (условия анализа U)
[Пример 545]
Соединение O9-2
9-Этинил-11-оксо-8-(4-(пирролидин-1-ил)пиперидин-1-ил)-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения F5-43, получали указанное в заголовке соединение, исходя из Соединения O8-1.
ЖХ/МС: m/z 505 [M+H]+
ВЭЖХ время удерживания: 1,92 мин (условия анализа U)
[Пример 546]
Соединение O9-3
11-Оксо-8-(4-(пирролидин-1-ил)пиперидин-1-ил)-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3,9-дикарбонитрил

С использованием тех же условий, как в способе синтеза Соединения A5-2, получали указанное в заголовке соединение, исходя из Соединения O8-1.
ЖХ/МС: 506 m/z [M+H]+
ВЭЖХ время удерживания: 1,87 мин (условия анализа U)
[Пример 547]
Соединение O9-4
9-(3-Гидрокси-3-метилбут-1-инил)-11-оксо-8-(4-(пирролидин-1-ил)пиперидин-1-ил)-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил
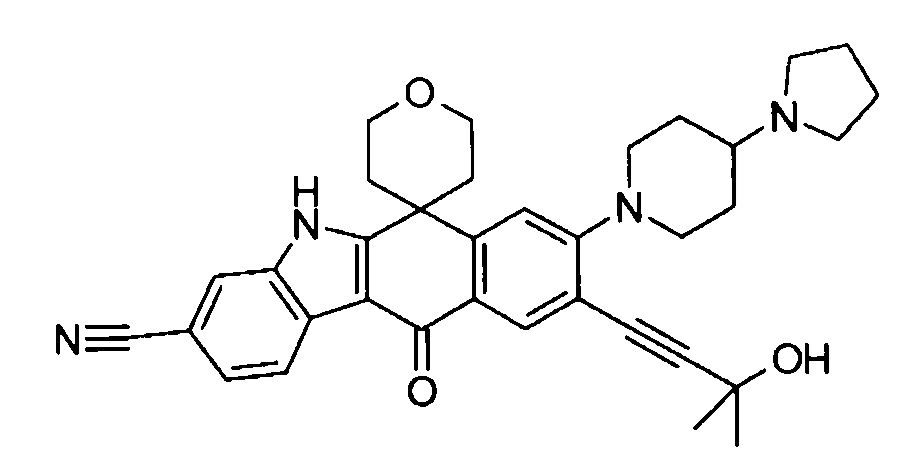
С использованием тех же условий, как в способе синтеза Соединения E4-2-1, получали указанное в заголовке соединение, исходя из Соединения O8-1.
ЖХ/МС: m/z 563 [M+H]+
ВЭЖХ время удерживания: 1,92 мин (условия анализа U)
[Пример 548]
Соединение O9-5
8-(4-Циклобутилпиперазин-1-ил)-11-оксо-9-(проп-1-инил)-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения O9-1, получали указанное в заголовке соединение, исходя из Соединения O8-2.
1H-ЯМР(300 МГц, DМSO-d6) δ: 1,6 (м, 2 H), 1,8 (м, 2 H), 1,9 (м, 4 H), 2,1 (с, 3 H), 2,4 (м, 6 H), 2,8 (м, 1 H), 3,4 (м, 4 H), 4,0 (м, 2H), 4,1 (м, 2 H), 7,3 (с, 1 H), 7,6 (д, 1 H, 8,0 Гц), 8,0 (м, 2 H), 8,3 (д, 1 H, 8,0 Гц), 12,2 (с, 1 H).
ЖХ/МС: м/z 505 [М+H]+
ВЭЖХ время удерживания: 2,03 мин (условия анализа U)
[Пример 549]
Соединение O9-6
8-(4-Циклобутилпиперазин-1-ил)-9-этинил-11-оксо-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения F5-43, получали указанное в заголовке соединение, исходя из Соединения O8-2.
1H-ЯМР (300 МГц, DМSO-d6) δ: 1,66 (2 H, м), 1,83 (2 H, т, 8,77 Гц), 1,99 (4 H, м), 2,41 (6 H, м), 2,79 (1 H, т, 7,63 Гц), 3,35 (4 H, м), 4,01 (2 H, м), 4,27 (2 H, м), 4,51 (1 H, с), 7,33 (1 H, с), 7,54 (1 H, м), 8,03 (1 H, с), 8,16 (1 H, с), 8,32 (1 H, д, 8,40 Гц), 12,3 (1 H, с).
ЖХ/МС: м/z 491 [М+H]+
ВЭЖХ время удерживания: 1,95 мин (условия анализа U)
[Пример 550]
Соединение O9-7
8-(4-Морфолинoпиперидин-1-ил)-11-оксо-9-(проп-1-инил)-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения O9-1, получали указанное в заголовке соединение, исходя из Соединения O8-3.
1H-ЯМР (300 МГц, DМSO-d6) δ: 1,57 (2 H, м), 1,95 (4 H, м), 2,14 (3 H, с), 2,37 (3 H, м), 3,35 (4 H, м), 2,83 (2 H, т, 12,6 Гц), 3,56 (4 H, с), 3,86 (2 H, д, 11,8 Гц), 4,04 (2 H, м), 4,17 (2 H, м), 7,31 (1 H, с), 7,61 (1 H, д, 8,01 Гц), 8,06 (1 H, с), 8,07 (1 H, с), 8,36 (1 H, д, 8,01 Гц), 12,3 (1 H, с).
ЖХ/МС: м/z 535 [М+H]+
ВЭЖХ время удерживания: 1,95 мин (условия анализа U)
[Пример 551]
Соединение O9-8
9-Этинил-8-(4-морфолинoпиперидин-1-ил)-11-оксо-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения F5-43, получали указанное в заголовке соединение, исходя из Соединения O8-3.
ЖХ/МС: m/z 521 [M+H]+
ВЭЖХ время удерживания: 1,90 мин (условия анализа U)
[Пример 552]
Соединение O9-9
8-(4-(Оксетан-3-ил)пиперазин-1-ил)-11-оксо-9-(проп-1-инил)-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения O7-4 и оксетан-3-она.
ЖХ/МС: m/z 507 [M+H]+
ВЭЖХ время удерживания: 1,43 мин (условия анализа S)
[Пример 553]
Соединение O10-1-1
Трет-бутил 4-(3-циано-9-этил-11-оксо-2’,3’,5,5a,5’,6’,11,11a-октагидроспиро[бензо[b]карбазол-6,4’-пиран]-8-ил)пиперазин-1-карбоновая кислота

С использованием тех же условий, как в способе синтеза Соединения B3-13-1, получали указанное в заголовке соединение, исходя из Соединения O7-5.
ЖХ/МС: m/z 541 [M+H]+
ВЭЖХ время удерживания: 3,08 мин (условия анализа S)
[Пример 554]
Соединение O10-1-2
9-Этил-11-оксо-8-(пиперазин-1-ил)-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил
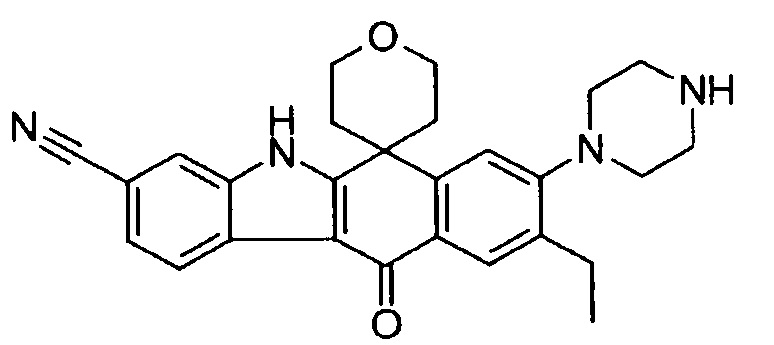
С использованием тех же условий, как в способе синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения O10-1-1.
ЖХ/МС: m/z 441 [M+H]+
ВЭЖХ время удерживания: 1,42 мин (условия анализа S)
[Пример 555]
Соединение O10-2
9-Этил-8-(4-морфолинoпиперидин-1-ил)-11-оксо-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил

В соответствии со способом, аналогичным способу синтеза Соединения B3-13-1, получали указанное в заголовке соединение, исходя из Соединения O9-8.
1H-ЯМР(400 МГц, DМSO-d6) δ: 8,23-8,21 (1H, м), 8,02-8,00 (1 H, м), 7,88-7,86 (1 H, м), 7,39-7,36 (2 H, м), 4,63-4,59 (2 H, м), 3,89-3,85 (2 H, м), 3,60-3,56 (6 H, м), 3,22-3,19 (4 H, м), 2,76-2,68 (4 H, м), 2,37-2,32 (3 H, м), 1,92-1,88 (2 H, м), 1,75-1,72 (2 H, м), 1,61-1,57 (2 H, м), 1,27-1,25 (3 H, м).
ЖХ/МС: м/z 525 [М+H]+
ВЭЖХ время удерживания: 1,48 мин (условия анализа S)
[Пример 556]
Соединение O10-3
9-Этил-8-(4-(оксетан-3-ил)пиперазин-1-ил)-11-оксо-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил
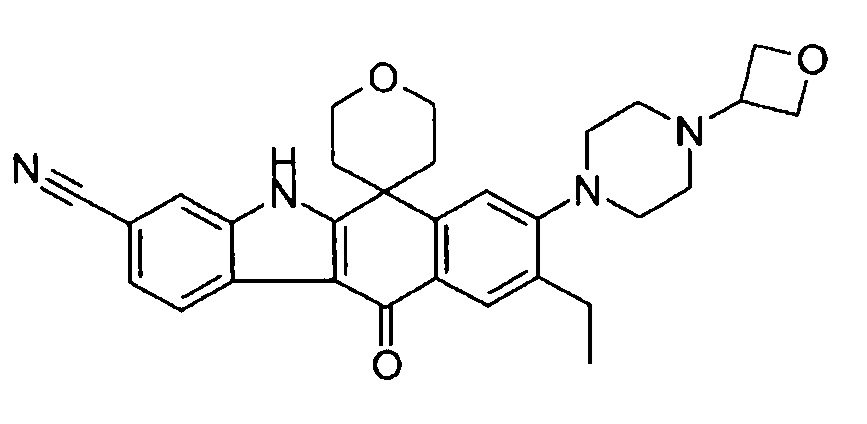
С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения O10-1-2 и оксетан-3-она.
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,26 (1 H, с), 8,39 (1 H, д, 7,9 Гц), 8,09-8,07 (2 H, м), 7,63 (1 H, д, 8,5 Гц), 7,51 (1 H, с), 4,60-4,50 (4 H, м), 4,20-4,09 (4 H, м), 3,56-3,51 (1 H, м), 3,07-3,05 (4 H, м), 2,76-2,70 (2 H, м), 2,44-2,40 (2 H, м), 2,02-1,98 (2 H, м), 1,29-1,26 (4 H, м).
ЖХ/МС: м/z 497 [М+H]+
ВЭЖХ время удерживания: 1,42 мин (условия анализа S)
[Пример 557]
Соединение O10-4
8-(4-Циклобутилпиперазин-1-ил)-9-этил-11-оксо-2’,3’,5,5’,6’,11-гексагидроспиро[бензо[b]карбазол-6,4’-пиран]-3-карбонитрил
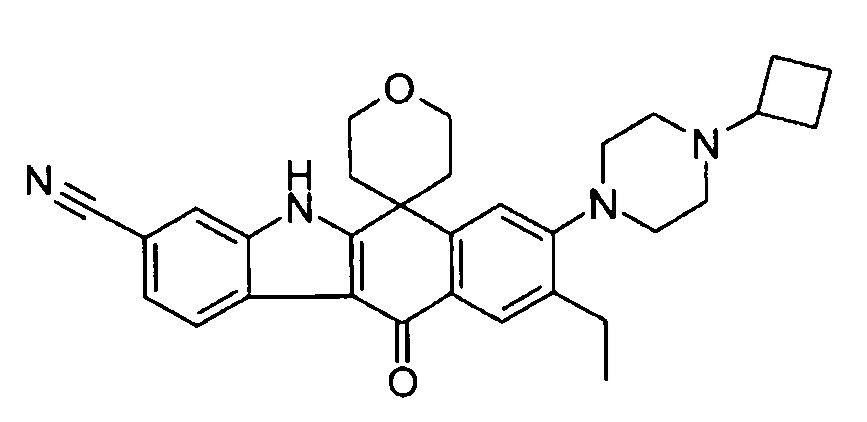
С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения O10-1-2 и циклобутанона.
ЖХ/МС: m/z 495 [M+H]+
ВЭЖХ время удерживания: 1,57 мин (условия анализа S)
[Пример 558]
Соединение P1 (промежуточное соединение)
8-Метокси-6,6-диметил-2-нитро-6,11-дигидро-5H-бензо[b]карбазол
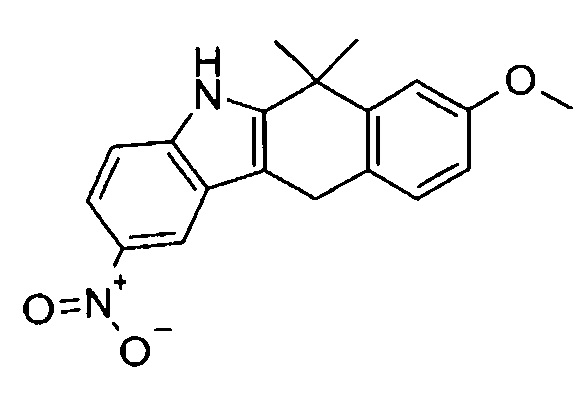
С использованием тех же условий, как в способе синтеза Соединения A3-1, получали указанное в заголовке соединение, исходя из Соединения A2 и 4-нитрофенилгидразина.
ЖХ/МС: m/z 323 [M+H]+
ВЭЖХ время удерживания: 4,08 мин (условия анализа W)
[Пример 559]
Соединение P2 (промежуточное соединение)
8-Метокси-6,6-диметил-2-нитро-5,6-дигидро-бензо[b]карбазол-11-он

С использованием тех же условий, как в способе синтеза Соединения A4, получали указанное в заголовке соединение, исходя из Соединения P1.
1H-ЯМР (400 МГц, DМSO-d6) δ: 12,85 (1 H, с), 9,03 (1 H, д, J=1,9 Гц), 8,17-8,20 (2 H, м), 7,71 (1 H, д, J=9,1 Гц), 7,38 (1 H, д, J=2,4 Гц), 7,12 (1 H, дд, J=8,5, 2,4 Гц), 3,93 (3 H, с), 1,79 (6 H, с).
ЖХ/МС: м/z 337 [М+H]+
ВЭЖХ время удерживания: 3,55 мин (условия анализа W)
[Пример 560]
Соединение P3 (промежуточное соединение)
8-Гидрокси-6,6-диметил-2-нитро-5,6-дигидро-бензо[b]карбазол-11-он

С использованием тех же условий, как в способе синтеза Соединения A6, получали указанное в заголовке соединение, исходя из Соединения P2.
ЖХ/МС: m/z 323 [M+H]+
ВЭЖХ время удерживания: 3,11 мин (условия анализа W)
[Пример 561]
Соединение P4 (промежуточное соединение)
трет-Бутиловый эфир 4-(6,6-диметил-2-нитро-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)пиперидин-1-карбоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения P3.
1H-ЯМР (400 МГц, CDCl3) δ: 9,40 (1 H, с), 9,37 (1 H, с), 8,41 (1 H, д, J=8,5 Гц), 8,24 (1 H, д, J=11,0 Гц), 7,51 (1 H, д, J=8,5 Гц), 7,13 (1 H, с), 7,03 (1 H, д, J=9,1 Гц), 4,61-4,71 (1 H, м), 3,69-3,84 (2 H, м), 3,35-3,49 (2 H, м), 1,94-2,10 (2 H, м), 1,75-1,93 (8 H, м), 1,50 (9 H, с).
ВЭЖХ время удерживания: 4,17 мин (условия анализа W)
[Пример 562]
Соединение P5
2-Амино-6,6-диметил-8-(пиперидин-4-илокси)-5,6-дигидро-бензо[b]карбазол-11-он

С использованием тех же условий, как в способе синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения P6.
1H-ЯМР (400 МГц, CD3OD) δ: 8,23 (1 H, д, J=8,5 Гц), 7,68 (1 H, д, J=2,4 Гц), 7,26 (1 H, д, J=8,5 Гц), 7,24 (1 H, д, J=2,4 Гц), 7,06 (1 H, дд, J=8,5, 2,4 Гц), 6,80 (1 H, дд, J=8,5, 2,4 Гц), 4,64-4,71 (1 H, м), 3,06-3,15 (2 H, м), 2,73-2,83 (2 H, м), 2,02-2,13 (2 H, м), 1,67-1,82 (8 H, м).
ЖХ/МС: м/z 506 [М+H]+
ВЭЖХ время удерживания: 4,17 мин (условия анализа W)
[Пример 563]
Соединение P6 (промежуточное соединение)
трет-Бутиловый эфир 4-(2-амино-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)пиперидин-1-карбоновой кислоты

К суспензии трет-бутилового эфира 4-(6,6-диметил-2-нитро-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)пиперидин-1-карбоновой кислоты (Соединение P4, 103 мг, 0,204 ммоль) в этаноле (8 мл) добавляли порошок железа (228 мг, 20 экв.), хлорид аммония (109 мг, 10 экв.) и дистиллированную воду (4 мл) и смесь перемешивали при 90°C в течение 30 минут. Сразу после завершения реакции нерастворимые вещества отфильтровывали и фильтрат экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Осушитель удаляли фильтрованием, и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (115 мг, 57%).
ЖХ/МС: m/z 476 [M+H]+
ВЭЖХ время удерживания: 2,82 мин (условия анализа W)
[Пример 564]
Соединение P7 (промежуточное соединение)
трет-Бутиловый эфир 4-(2-метансульфониламино-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)пиперидин-1-карбоновой кислоты

К раствору трет-бутилового эфира 4-(2-амино-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)пиперидин-1-карбоновой кислоты (Соединение P6, 50 мг, 0,105 ммоль)в пиридине (2 мл) добавляли мезилхлорид (9 мкл, 1,2 экв.) и перемешивали при комнатной температуре в течение 30 минут. Сразу после завершения реакции реакционный раствор концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде неочищенного продукта.
ЖХ/МС: m/z 554 [M+H]+
ВЭЖХ время удерживания: 3,60 мин (условия анализа W)
[Пример 565]
Соединение P8
N-[6,6-Диметил-11-оксо-8-(пиперидин-4-илокси)-6,11-дигидро-5H-бензо[b]карбазол-2-ил]метансульфонамид

С использованием тех же условий, как в способе синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения P7.
1H-ЯМР (400 МГц, CD3OD) δ: 8,25 (1 H, д, J=8,5 Гц), 8,16 (1 H, д, J=1,8 Гц), 7,46 (1 H, д, J=9,1 Гц), 7,27-7,29 (2 H, м), 7,09 (1 H, дд, J=9,1, 1,8 Гц), 4,67-4,75 (1 H, м), 3,09-3,18 (2 H, м), 2,95 (3H, с), 2,77-2,87 (2 H, м), 1,70-1,84 (8 H, м).
ЖХ/МС: м/z 454 [М+H]+
ВЭЖХ время удерживания: 2,22 мин (условия анализа W)
[Пример 566]
Соединение Q3 (промежуточное соединение)
2-Фтор-8-метокси-6,6-диметил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A3-1, получали указанное в заголовке соединение, исходя из Соединения A2 и 3-циано-4-фторфенилгидразина.
ЖХ/МС: m/z 321 [M+H]+
ВЭЖХ время удерживания: 4,13 мин (условия анализа W)
[Пример 567]
Соединение Q4 (промежуточное соединение)
2-Фтор-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A4, получали указанное в заголовке соединение, исходя из Соединения Q3.
1H-ЯМР (400 МГц, DМSO-d6) δ: 12,89 (1 H, с), 8,16 (1 H, д, J=8,5 Гц), 8,07 (1 H, д, J=4,9 Гц), 8,04 (1 H, д, J=9,8 Гц), 7,36 (1 H, д, J=2,4 Гц), 7,10 (1 H, дд, J=8,5, 2,4 Гц), 3,91 (3 H, с), 1,78 (3H, с).
ЖХ/МС: м/z 335 [М+H]+
ВЭЖХ время удерживания: 3,61 мин (условия анализа W)
[Пример 568]
Соединение Q5 (промежуточное соединение)
2-Фтор-8-гидрокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A6, получали указанное в заголовке соединение, исходя из Соединения Q4.
ЖХ/МС: m/z 321 [M+H]+
ВЭЖХ время удерживания: 3,16 мин (условия анализа W)
[Пример 569]
Соединение Q6 (промежуточное соединение)
трет-Бутиловый эфир 4-(3-циано-2-фтор-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)пиперидин-1-карбоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения Q5.
ЖХ/МС: m/z 504 [M+H]+
ВЭЖХ время удерживания: 4,25 мин (условия анализа W)
[Пример 570]
Соединение Q7
8-(2-Диэтиламино-этокси)-2-фтор-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения Q5.
1H-ЯМР (400 МГц, CD3OD) δ: 8,25 (1 H, д, J=8,5 Гц), 8,09 (1 H, д, J=9,8 Гц), 7,83 (1 H, д, J=5,5 Гц), 7,30 (1 H, д, J=2,4 Гц), 7,09 (1 H, дд, J=8,5, 2,4 Гц), 4,26 (2 H, т, J=5,7 Гц), 2,98 (2 H, т, J=5,7 Гц), 2,72 (4 H, кв., J=7,2 Гц), 1,81 (6 H, с), 1,13 (6 H, т, J=7,2 Гц).
ЖХ/МС: m/z 420 [M+H]+
ВЭЖХ время удерживания: 2,65 мин (условия анализа W)
[Пример 571]
Соединение Q8
2-Фтор-6,6-диметил-11-оксо-8-(пиперидин-4-илокси)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения Q6.
1H-ЯМР (400 МГц, DМSO-d6) δ: 8,11 (1 H, д, J=8,5 Гц), 7,98 (1 H, д, J=5,5 Гц), 7,96 (1 H, д, J=9,8 Гц), 7,29 (1 H, с), 7,08 (1 H, д, J=8,5 Гц), 4,58-4,69 (1 H, м), 2,93-3,05 (2 H, м), 2,60-2,69 (2 H, м), 1,94-2,03 (2 H, м), 1,74 (6 H, с), 1,45-1,57 (2 H, м).
ЖХ/МС: м/z 404 [М+H]+
ВЭЖХ время удерживания: 2,67 мин (условия анализа W)
[Пример 572]
Соединение R2
2-Фтор-3-гидразинилбензонитрил

3-Амино-2-фтор-бензонитрил (100 мг, 0,735 ммоль) растворяли в воде (0,94 мл), добавляли концентрированную хлористоводородную кислоту (0,74 мл) при 0°C и затем добавляли водный раствор (0,294 мл) нитрита натрия (61 мг, 0,882 ммоль). Полученную смесь перемешивали при 0°C в течение 1 часа. К реакционной смеси добавляли раствор хлорида олова (321 мг, 1,69 ммоль) в концентрированной хлористоводородной кислоте (0,94 мл) и перемешивали при комнатной температуре в течение 1 часа. Затем реакционный раствор нейтрализовали водным раствором гидроксида натрия и экстрагировали дихлорметаном. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Осушитель удаляли фильтрованием, и остатки получали после концентрирования при пониженном давлении с получением целевого соединения в виде неочищенного продукта.
[Пример 573]
Соединение R3
4-Фтор-8-метокси-6,6-диметил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E2-1, получали указанное в заголовке соединение в виде неочищенного продукта, исходя из Соединения A2 и Соединения R2.
[Пример 574]
Соединение R4
4-Фтор-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A4, получали указанное в заголовке соединение, исходя из Соединения R3.
ЖХ/МС: m/z 335 [M+H]+
ВЭЖХ время удерживания: 2,70 мин (условия анализа U)
[Пример 575]
Соединение R5
4-Фтор-8-гидрокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A6, получали указанное в заголовке соединение, исходя из Соединения R4.
ЖХ/МС: m/z 321 [M+H]+
ВЭЖХ время удерживания: 2,32 мин (условия анализа U)
[Пример 576]
Соединение R6
8-(2-Диэтиламино-этокси)-4-фтор-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения R5.
ЖХ/МС: m/z 420 [M+H]+
ВЭЖХ время удерживания: 1,51 мин (условия анализа S)
[Пример 577]
Соединение R7
3-Циано-4-фтор-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илтрифторметансульфоновая кислота

С использованием тех же условий, как в способе синтеза Соединения B1, получали указанное в заголовке соединение, исходя из Соединения R5.
ЖХ/МС: m/z 453 [M+H]+
ВЭЖХ время удерживания: 3,82 мин (условия анализа Y)
[Пример 578]
Соединение R8-1
4-Фтор-6,6-диметил-11-оксо-8-(4-пирролидин-1-ил-пиперидин-1-ил)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
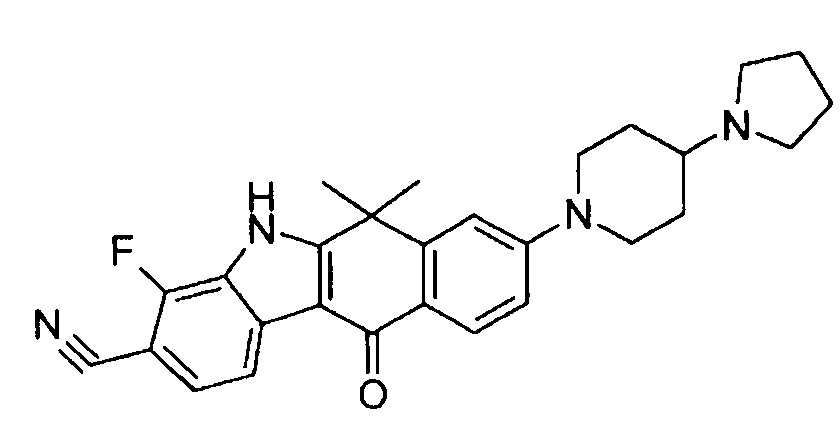
С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения R7 и 4-пирролидин-1-ил-пиперидина.
ЖХ/МС: m/z 457 [M+H]+
ВЭЖХ время удерживания: 2,10 мин (условия анализа U)
[Пример 579]
Соединение R8-2
4-Фтор-8-(4-изопропил-пиперазин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения R7.
ЖХ/МС: m/z 431 [M+H]+
ВЭЖХ время удерживания: 2,07 мин (условия анализа U)
[Пример 580]
Соединение R9-1
8-((S)-2,2-Диметил-[1,3]диоксолан-4-илметокси)-4-фтор-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение в виде неочищенного продукта, исходя из Соединения R5 и (R)-(-)-2,2-диметил-1,3-диоксолан-4-метанола.
[Пример 581]
Соединение R9-2
8-((R)-2,3-Дигидрокси-пропокси)-4-фтор-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-14-2, получали указанное в заголовке соединение, исходя из Соединения R9-1 (9,9 мг, 80%).
ЖХ/МС: m/z 395 [M+H]+
ВЭЖХ время удерживания: 2,38 мин (условия анализа C)
[Пример 582]
Соединение S1-1
3-Хлор-8-метокси-6,6-диметил-5,6-дигидробензо[b]карбазол-11-он

С использованием тех же условий, как в способе синтеза Соединения A3-1 и Соединения A4, получали указанное в заголовке соединение в виде неочищенного продукта, исходя из Соединения A2 и (3-хлорфенил)гидразина в форме соли хлористоводородной кислоты.
[Пример 583]
Соединение S1-2
3-Хлор-8-метокси-2,6,6-триметил-5,6-дигидро-бензо[b]карбазол-11-он
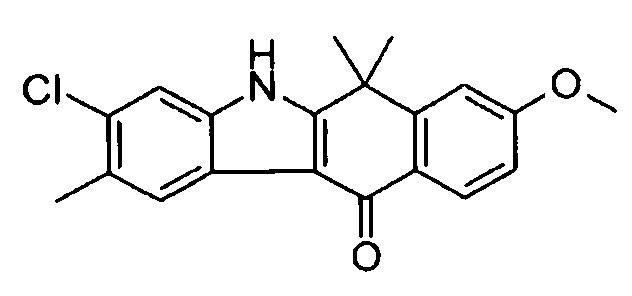
7-Метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-он (Соединение A2, 99,1 мг, 0,485 ммоль) и (3-хлор-4-метил-фенил)гидразин в форме соли хлористоводородной кислоты (100,4 мг, 1,1 экв.) растворяли в TFA (1 мл) и смесь подвергали микроволновому облучению при 80°C в течение 10 минут в атмосфере азота. После охлаждения к реакционному раствору добавляли этилацетат, промывали водой, насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором и сушили над сульфатом магния. После фильтрования и концентрирования при пониженном давлении полученные остатки растворяли в ТГФ (2 мл) и воде (0,2 мл), добавляли DDQ (125,7 мг, 1,1 экв.) и перемешивали при комнатной температуре в течение ночи. К реакционному раствору добавляли смесь растворителей гексана и этилацетата и исходные компоненты удаляли на колонке с силикагелем сухого типа. Элюент концентрировали при пониженном давлении и полученные остатки очищали при помощи препаративной ТСХ (метанол/дихлорметан) с получением указанного в заголовке соединения (19,4 мг, 12%).
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,2 (1 H, с), 8,15 (1 H, д, J=8,8 Гц), 8,12 (1 H, с), 7,52 (1 H, с), 7,32 (1 H, с), 7,07 (1 H, дд, J=2,4, 8,8 Гц), 3,90 (3 H, с), 2,45 (3 H, с), 1,73 (6 H, с).
ЖХ/МС: м/z 340 [М+H]+
ВЭЖХ время удерживания: 2,80 мин (условия анализа F)
[Пример 584]
Соединение S1-3
3-Хлор-4-фтор-8-метокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

В соответствии со способом, аналогичным способу синтеза Соединения A3-1, получали указанное в заголовке соединение, исходя из Соединения A2 и (3-хлор-2-фтор-фенил)гидразина.
ЖХ/МС: m/z 344, 346 [M+H]+
ВЭЖХ время удерживания: 2,68 мин (условия анализа S)
[Пример 585]
Соединение S1-4
9-Бром-3-хлор-8-метокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

6-Бром-7-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-он (Соединение E1, 0,2 г, 0,71 ммоль) и 3-хлорфенилгидразин в форме соли хлористоводородной кислоты (0,17 г, 1,3 экв.) растворяли в уксусной кислоте (0,5 мл). В атмосфере азота реакционный раствор перемешивали при 90°C в течение 8 часов. После охлаждения до комнатной температуры к реакционному раствору добавляли этилацетат, промывали водой, насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором и сушили над сульфатом магния. После фильтрования и концентрирования при пониженном давлении полученные остатки растворяли в ТГФ (3 мл), содержащем 10% воды, добавляли DDQ (227 мг, 3 экв.) при комнатной температуре и смесь перемешивали при комнатной температуре в течение 2 часов. К реакционному раствору добавляли смесь жидкостей ТГФ/диэтиловый эфир (1:1) и промывали 0,5 н водным раствором гидроксида натрия и насыщенным солевым раствором. После сушки при помощи сульфата натрия смесь фильтровали, и остатки, полученные после концентрирования при пониженном давлении, промывали смесью жидкостей гексан/диэтиловый эфир (1:1) с получением указанного в заголовке соединения (коричневый порошок, 86 мг).
ЖХ/МС: m/z 404, 406, 408 [M+H]+
ВЭЖХ время удерживания: 3,02 мин (условия анализа C)
[Пример 586]
Соединение S2-1
3-Хлор-8-гидрокси-6,6-диметил-5,6-дигидробензо[b]карбазол-11-он

С использованием тех же условий, как в способе синтеза Соединения A6, получали указанное в заголовке соединение, исходя из Соединения S1-1.
ЖХ/МС: m/z 312 [M+H]+
ВЭЖХ время удерживания: 4,18 мин (условия анализа H)
[Пример 587]
Соединение S2-2
3-Хлор-8-гидрокси-2,6,6-триметил-5,6-дигидро-бензо[b]карбазол-11-он

3-Хлор-8-метокси-2,6,6-триметил-5,6-дигидро-бензо[b]карбазол-11-он (Соединение S1-2, 18,9 мг, 0,0556 ммоль) и пиридинийхлорид (220 мг, 34 экв.) перемешивали при 185°C в течение 2,5 часов. После охлаждения к реакционному раствору добавляли воду и этилацетат, и органический слой промывали водой и насыщенным солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде неочищенного продукта.
[Пример 588]
Соединение S2-3
3-Хлор-4-фтор-8-гидрокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он
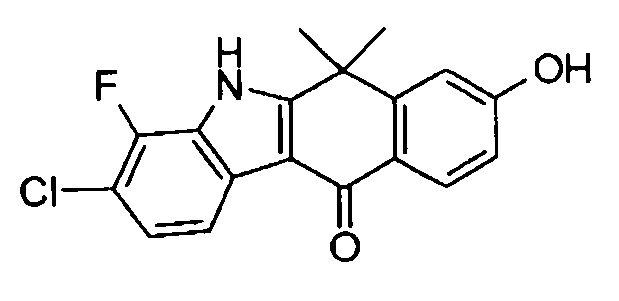
3-Хлор-4-фтор-8-метокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он (Соединение S1-3, 220,0 мг, 0,640 ммоль) и пиридинийхлорид (800 мг, 6,922 ммоль) смешивали друг с другом, нагревали до 160°C и затем перемешивали в течение 20 часов. К реакционному раствору добавляли воду. В результате, получали черное твердое вещество в виде осадка, затем смесь фильтровали и подвергали очистке колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (139,4 мг, 66%).
ЖХ/МС: m/z 330 [M+H]+
ВЭЖХ время удерживания: 2,60 мин (условия анализа F)
[Пример 589]
Соединение S2-4
9-Бром-3-хлор-8-гидрокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

С использованием тех же условий, как в способе синтеза Соединения A6, получали указанное в заголовке соединение, исходя из Соединения S1-4.
ЖХ/МС: m/z 390, 392, 394 [M+H]+
ВЭЖХ время удерживания: 2,75 мин (условия анализа C)
[Пример 590]
Соединение S3
3-Хлор-8-(2-диэтиламиноэтокси)-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он (CH5263231-000)

3-Хлор-8-гидрокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он (Соединение S2-1, 10 мг, 0,03207 ммоль) растворяли в DMF (0,1 мл), добавляли (2-хлорэтил)диэтиламин (5,5 мг, 0,03207 ммоль) и карбонат цезия (20,9 мг, 0,06414 ммоль) и перемешивали при 80°C в течение 2 часов. Реакционный раствор добавляли в воду и экстрагировали этилацетатом. Органический слой сушили над сульфатом магния. Остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на NH силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (11,6 мг, 76%).
ЖХ/МС: m/z 411 [M+H]+
ВЭЖХ время удерживания: 4,49 мин (условия анализа H)
[Пример 591]
Соединение S4
3-Хлор-2,6,6-триметил-8-((2R,3R)-2,3,4-тригидрокси-бутокси)-5,6-дигидро-бензо[b]карбазол-11-он

Неочищенный продукт Соединения S2-2 растворяли в ТГФ (0,4 мл) в атмосфере азота, вместе с ТГФ (0,2 мл) раствором трифенилфосфина (18,9 мг, 1,3 экв.) и [(4R,5R)-5-(трет-бутил-диметил-силанилоксиметил)-2,2-диметил[1,3]диоксолан-4-ил]метанола (17 мг, 1,2 экв.). К реакционному раствору добавляли DEAD (40% раствор в толуоле, 0,0031 мл, 1,2 экв.), затем смесь перемешивали при комнатной температуре в течение 40 минут и при 40°C в течение 4 часов. К реакционному раствору добавляли трифенилфосфин (18,9 мг, 1,3 экв.) и DEAD (40% раствор в толуоле, 0,002 мл, 0,8 экв.) и перемешивали при 40°C в течение ночи. К реакционному раствору добавляли этилацетат, промывали водой и насыщенным солевым раствором, сушили над сульфатом магния и фильтровали. Остатки, полученные после концентрирования при пониженном давлении, очищали при помощи препаративной ТСХ (этилацетат/гексан) с получением неочищенного продукта 8-[(4R,5R)-5-(трет-бутил-диметил-силанилоксиметил)-2,2-диметил[1,3]диоксолан-4-илметокси]-3-хлор-2,6,6-триметил-5,6-дигидро-бензо[b]карбазол-11-она (12,6 мг).
Полученную смесь растворяли в ТГФ (0,15 мл) и метаноле (0,03 мл) в атмосфере азота, добавляли 0,5 M раствор серной кислоты (0,05 мл) и перемешивали при 60°C в течение 3 часов. После охлаждения добавляли диэтиловый эфир и затем к смеси добавляли гидрокарбонат натрия (8,4 мг) и воду. Органический слой промывали насыщенным солевым раствором. Водный слой экстрагировали этилацетатом, и объединенный органический слой сушили над сульфатом магния и фильтровали. Твердое вещество, полученное после концентрирования при пониженном давлении, промывали дихлорметаном с получением целевого соединения (белое твердое вещество, 5,3 мг, 22%).
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,18 (1 H, с), 8,14 (1 H, д, J=8,8 Гц), 8,12 (1 H, с), 7,52 (1 H, с), 7,31 (1 H, д, J=2,4 Гц), 7,06 (1 H, дд, J=2,4, 8,8 Гц), 4,78 (1 H, д, J=5,9 Гц), 4,60 (1 H, д, J=5,9 Гц), 4,52 (1 H, т, J=5,4 Гц), 4,18-4,22 (1 H, м), 4,02-4,06 (1 H, м), 3,85-3,95 (1 H, м), 3,50-3,60 (2 H, м), 3,40-3,46 (1 H, м), 2,45 (3 H, с), 1,73 (3 H, с).
ЖХ/МС: м/z 430 [М+H]+
ВЭЖХ время удерживания: 2,27 мин (условия анализа F)
[Пример 592]
Соединение S5
3-Хлор-8-этокси-4-фтор-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

Указанное в заголовке соединение получали в виде побочного продукта синтеза Соединения S6.
ЖХ/МС: m/z 358 [M+H]+
ВЭЖХ время удерживания: 3,16 мин (условия анализа F)
[Пример 593]
Соединение S6
3-Хлор-8-((R)-2,3-дигидрокси-пропокси)-4-фтор-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

3-Хлор-4-фтор-8-гидрокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он (Соединение S2-3, 20,0 мг, 0,061 ммоль) растворяли в ТГФ (0,25 мл), добавляли ((S)-2,2-диметил[1,3]диоксолан-4-ил)метанол (9,8 мкл, 0,079 ммоль), трифенилфосфин (20,7 мг, 0,079 ммоль) и диэтилазодикарбоновую кислоту (35,9 мкл, 0,079 ммоль) и затем перемешивали при 40°C в течение 5 часов. Реакционный раствор концентрировали при пониженном давлении, и полученные остатки очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением промежуточного соединения 3-хлор-8-((S)-2,2-диметил[1,3]диоксолан-4-илметокси)-4-фтор-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-она. Это соединение растворяли в ТГФ (0,10 мл) и MeOH (0,08 мл), добавляли серную кислоту (0,5 M, 0,045 мл) и затем перемешивали при 60°C в течение 1 часа. К реакционному раствору добавляли насыщенный водный раствор гидрокарбоната натрия, экстрагировали этилацетатом и сушили над безводным сульфатом магния. Желтое твердое вещество, полученное после концентрирования при пониженном давлении, промывали растворителями метиленхлоридом/гексаном и фильтровали с получением указанного в заголовке соединения (4,3 мг, 18%).
ЖХ/МС: m/z 404 [M+H]+
ВЭЖХ время удерживания: 2,34 мин (условия анализа F)
[Пример 594]
Соединение S7-1
3-Хлор-9-бром-8-((S)-2,2-диметил-[1,3]диоксолан-4-илметокси)-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он
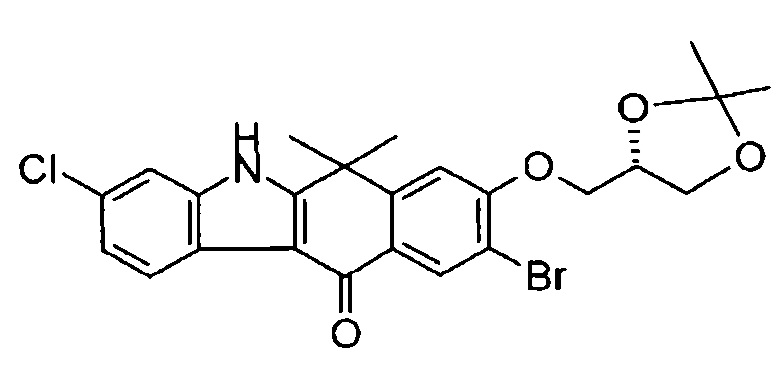
В атмосфере азота к 9-бром-3-хлор-8-гидрокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-ону (Соединение S2-4, 76 мг, 0,2 ммоль) и трифенилфосфину (69 мг, 1,3 экв.) добавляли ТГФ (2 мл) и ((S)-2,2-диметил-[1,3]диоксолан-4-ил)метанол (35 мг, 1,3 экв.) и к смеси добавляли по каплям 2,19 н раствор (118 мкл, 1,3 экв.) диэтилазодикарбоновой кислоты в толуоле с последующим перемешиванием при 50°C в течение 2 часов. После охлаждения к реакционному раствору добавляли этилацетат, промывали насыщенным солевым раствором, сушили над сульфатом натрия и фильтровали. Остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/дихлорметан) с получением твердого вещества, затем смесь промывали дихлорметаном с получением указанного в заголовке соединения (коричневый порошок, 53 мг).
ЖХ/МС: m/z 504, 506, 508 [M+H]+
ВЭЖХ время удерживания: 3,17 мин (условия анализа C)
[Пример 595]
Соединение S7-2
9-Бром-3-хлор-8-((R)-2,3-дигидрокси-пропокси)-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

3-Хлор-9-бром-8-((S)-2,2-диметил-[1,3]диоксолан-4-илметокси)-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он (Соединение S7-1, 56 мг, 0,11 ммоль) растворяли в метаноле (5 мл), добавляли 1 н раствор хлористоводородной кислоты (0,2 мл) и перемешивали при 50°C в течение 2 часов. После охлаждения реакционный раствор концентрировали при пониженном давлении и к полученным остаткам добавляли метанол с получением осажденного твердого вещества, затем смесь фильтровали с получением указанного в заголовке соединения (белый порошок, 26 мг).
ЖХ/МС: m/z 464, 466, 468 [M+H]+
ВЭЖХ время удерживания: 2,77 мин (условия анализа C)
[Пример 596]
Соединение S7-3
3-Хлор-9-бром-8-((S)-2,2-диметил-[1,3]диоксолан-4-илметокси)-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

В атмосфере азота к 9-бром-3-хлор-8-гидрокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-ону (Соединение S2-4, 112 мг, 0,29 ммоль) и трифенилфосфину (227 мг, 3 экв.) добавляли ТГФ (2 мл) и ((R)-2,2-диметил[1,3]диоксолан-4-ил)метанол (114 мг, 3 экв.) и к смеси добавляли по каплям 2,19 н раствор (0,4 мл, 3 экв.) диэтилазодикарбоновой кислоты в толуоле с последующим перемешиванием при 40°C в течение 12 часов в атмосфере азота. Остатки, полученные после концентрирования реакционного раствора при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/дихлорметан) с получением указанного в заголовке соединения (белый порошок, 100 мг).
ЖХ/МС: m/z 504, 506, 508 [M+H]+
ВЭЖХ время удерживания: 3,15 мин (условия анализа C)
[Пример 597]
Соединение S7-4
9-Бром-3-хлор-8-((S)-2,3-дигидрокси-пропокси)-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

С использованием тех же условий, как в способе синтеза Соединения S7-2, получали указанное в заголовке соединение, исходя из Соединения S7-3.
ЖХ/МС: m/z 464, 466, 468 [M+H]+
ВЭЖХ время удерживания: 2,77 мин (условия анализа C)
[Пример 598]
Соединение S8-1
9-Гидрокси-3-хлор-8-((S)-2,2-диметил-[1,3]диоксолан-4-илметокси)-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

9-Бром-3-хлор-8-((S)-2,2-диметил-[1,3]диоксолан-4-илметокси)-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он (Соединение S7-1, 30 мг, 0,06 ммоль) растворяли в смеси растворителей вода·диоксан (1:1) (0,5 мл), добавляли комплекс трис(бензилиденацетондипалладий)хлороформ (3,1 мг, 0,05 экв.), 2-ди-трет-бутилфосфино-2’,4’,6’-триизопропилбифенил (2,5 мг, 0,1 экв.) и KOH (0,5 н водный раствор 180 мкл, 1,5 экв.) и перемешивали при 60°C в течение 12 часов. После охлаждения реакционный раствор концентрировали при пониженном давлении, и полученные остатки очищали при помощи ВЭЖХ с получением указанного в заголовке соединения (белое твердое вещество, 4,6 мг).
ЖХ/МС: m/z 442, 444 [M+H]+
ВЭЖХ время удерживания: 2,78 мин (условия анализа C)
[Пример 599]
Соединение S8-2
3-Хлор-8-((R)-2,3-дигидрокси-пропокси)-9-гидрокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

С использованием тех же условий, как в способе синтеза Соединения S7-2, получали указанное в заголовке соединение, исходя из Соединения S8-1.
ЖХ/МС: m/z 402, 404 [M+H]+
ВЭЖХ время удерживания: 0,90 мин (условия анализа I)
[Пример 600]
Соединение S9-1
8-Гидрокси-6,6-диметил-11-оксо-9-(1H-тетразол-5-ил)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

9-Бром-3-хлор-8-метокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он (Соединение S1-4, 150 мг, 0,37 ммоль) растворяли в NMP, добавляли CuCN (100 мг, 3 экв.) и перемешивали при 210°C в течение 1,5 часов в условиях микроволнового облучения. После охлаждения к реакционному раствору добавляли воду и этилацетат, и осажденное твердое вещество фильтровали для удаления растворителя. Полученные остатки растворяли в DMF (1 мл), добавляли азид натрия (100 мг, 8 экв.) и хлорид аммония (5 мг) и затем перемешивали при 120°C в течение 24 часов в герметично закрытой пробирке. После добавления воды нерастворимые вещества фильтровали и очищали при помощи ВЭЖХ с получением указанного в заголовке соединения (6,5 мг).
ЖХ/МС: m/z 371 [M+H]+
ВЭЖХ время удерживания: 2,22 мин (условия анализа C)
[Пример 601]
Соединение S9-2
3-Хлор-8-гидрокси-6,6-диметил-9-(1H-тетразол-5-ил)-5,6-дигидро-бензо[b]карбазол-11-он

Указанное в заголовке соединение получали в качестве промежуточного соединения для синтеза Соединения S9-1.
ЖХ/МС: m/z 380, 382 [M+H]+
ВЭЖХ время удерживания: 2,38 мин (условия анализа C)
[Пример 602]
Соединение S10
3-Хлор-8-((R)-2,3-дигидрокси-пропокси)-9-(3-гидрокси-3-метил-бут-1-инил)-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

К смеси 9-бром-3-хлор-8-((S)-2,2-диметил[1,3]диоксолан-4-илметокси)-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-она (Соединение S7-1, 50 мг, 0,1 ммоль), бис(ацетонитрил)палладий(II) дихлорида (2,6 мг, 0,01 экв.), карбоната цезия (195 мг, 6 экв.) и 2-дициклогексилфосфино-2’,4’,6’-триизопропилбифенила (14,3 мг, 0,03 экв.) добавляли ацетонитрил (2 мл) и перемешивали при 80°C в течение 12 часов. Смолистые остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением 3-хлор-8-((S)-2,2-диметил-[1,3]диоксолан-4-илметокси)-9-(3-гидрокси-3-метил-бут-1-инил)-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-она (коричневый порошок, 105 мг).
Полученный 3-хлор-8-((S)-2,2-диметил[1,3]диоксолан-4-илметокси)-9-(3-гидрокси-3-метил-бут-1-инил)-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он (20 мг, 0,04 ммоль) растворяли в метаноле (3 мл), добавляли 1 н раствор хлористоводородной кислоты (1 мл) и перемешивали при комнатной температуре в течение 12 часов. После охлаждения реакционный раствор концентрировали при пониженном давлении, и полученные остатки промывали метиленхлоридом с получением указанного в заголовке соединения (бледно-желтый порошок, 5,2 мг).
ЖХ/МС: m/z 468, 470 [M+H]+
ВЭЖХ время удерживания: 2,70 мин (условия анализа C)
[Пример 603]
Соединение S11-1
3-Хлор-8-((R)-2,3-дигидрокси-пропокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-карбонитрил

3-Хлор-9-бром-8-((S)-2,2-диметил-[1,3]диоксолан-4-илметокси)-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он (Соединение S7-2, 17 мг, 37 мкмоль) растворяли в DMA, добавляли CuCN (17 мг, 5 экв.) и перемешивали при 220°C в течение 2 часов в условиях микроволнового облучения. После охлаждения к реакционному раствору добавляли этилацетат и осажденное твердое вещество фильтровали для удаления растворителя. Полученные остатки очищали при помощи ВЭЖХ с получением указанного в заголовке соединения (4 мг).
ЖХ/МС: m/z 409, 411 [M+H]+
ВЭЖХ время удерживания: 2,65 мин (условия анализа C)
[Пример 604]
Соединение S11-2
3-Хлор-8-гидрокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-9-карбонитрил

Указанное в заголовке соединение получали в виде побочного продукта синтеза Соединения S11-1.
ЖХ/МС: m/z 337, 339 [M+H]+
ВЭЖХ время удерживания: 2,35 мин (условия анализа C)
[Пример 605]
Соединение T1-1
3-Бром-6,6-диметил-8-[(R)-(тетрагидро-фуран-3-ил)окси]-5,6-дигидро-бензо[b]карбазол-11-он

В соответствии со способом, аналогичным способу синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения A5-1 и (S)-тетрагидро-фуран-3-ола.
ЖХ/МС: m/z 426 [M+H]+
ВЭЖХ время удерживания: 2,08 мин (условия анализа D)
[Пример 606]
Соединение T1-2
6,6-Диметил-11-оксо-8-[(R)-(тетрагидро-фуран-3-ил)окси]-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

В соответствии со способом, аналогичным способу синтеза Соединения A5-2, получали указанное в заголовке соединение, исходя из Соединения T1-1.
ЖХ/МС: m/z 373 [M+H]+
ВЭЖХ время удерживания: 1,98 мин (условия анализа A)
[Пример 607]
Соединение T2-1
3-Бром-6,6-диметил-8-[(S)-(тетрагидро-фуран-3-ил)окси]-5,6-дигидро-бензо[b]карбазол-11-он
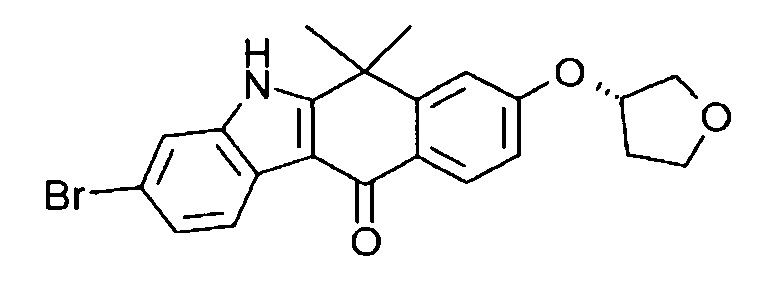
В соответствии со способом, аналогичным способу синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения A5-1 и (R)-тетрагидро-фуран-3-ола.
ЖХ/МС: m/z 426 [M+H]+
ВЭЖХ время удерживания: 6,12 мин (условия анализа H)
[Пример 608]
Соединение T2-2
6,6-Диметил-11-оксо-8-[(S)-(тетрагидро-фуран-3-ил)окси]-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
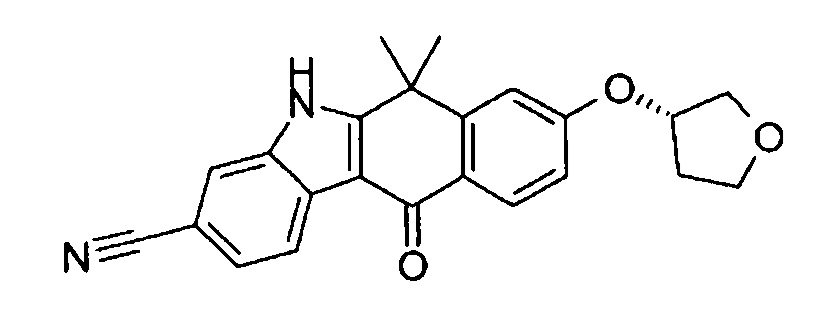
В соответствии со способом, аналогичным способу синтеза Соединения A5-2, получали указанное в заголовке соединение, исходя из Соединения T2-1.
ЖХ/МС: m/z 373 [M+H]+
ВЭЖХ время удерживания: 2,00 мин (условия анализа D)
[Пример 609]
Соединение T3-1
3-Бром-6,6-диметил-8-(тетрагидро-пиран-4-илокси)-5,6-дигидро-бензо[b]карбазол-11-он

В соответствии со способом, аналогичным способу синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения A5-1 и тетрагидро-пиран-4-ола.
ЖХ/МС: m/z 440 [M+H]+
ВЭЖХ время удерживания: 8,07 мин (условия анализа H)
[Пример 610]
Соединение T3-2
3-Бром-5,6,6-триметил-8-(тетрагидро-пиран-4-илокси)-5,6-дигидро-бензо[b]карбазол-11-он

В соответствии со способом, аналогичным способу синтеза Соединения A10-2, получали указанное в заголовке соединение, исходя из Соединения T3-1.
ЖХ/МС: m/z 454 [M+H]+
ВЭЖХ время удерживания: 6,88 мин (условия анализа H)
[Пример 611]
Соединение T4-1
3-Бром-6,6-диметил-8-(2-фенил[1,3]диоксан-5-илокси)-5,6-дигидро-бензо[b]карбазол-11-он

В соответствии со способом, аналогичным способу синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения A5-1 и 5-фенил[1,3]диоксан-2-ола.
ЖХ/МС: m/z 518 [M+H]+
ВЭЖХ время удерживания: 2,68 мин (условия анализа D)
[Пример 612]
Соединение T4-2
3-Бром-8-(2-гидрокси-1-гидроксиметил-этокси)-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

В соответствии со способом, аналогичным способу синтеза Соединения A7-13-2, получали указанное в заголовке соединение, исходя из Соединения T4-1.
ЖХ/МС: m/z 430 [M+H]+
ВЭЖХ время удерживания: 4,64 мин (условия анализа H)
[Пример 613]
Соединение T5-1
трет-Бутиловый эфир 4-(3-бром-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)пиперидин-1-карбоновой кислоты

В соответствии со способом, аналогичным способу синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения A5-1 и трет-бутилового эфира 4-гидрокси-пиперидин-1-карбоновой кислоты.
ЖХ/МС: m/z 539 [M+H]+
ВЭЖХ время удерживания: 2,72 мин (условия анализа D)
[Пример 614]
Соединение T5-2
трет-Бутиловый эфир 4-(3-бром-5,6,6-триметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)пиперидин-1-карбоновой кислоты
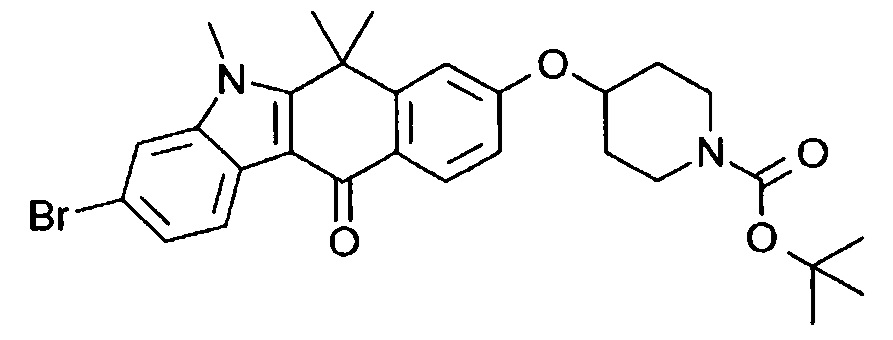
В соответствии со способом, аналогичным способу синтеза Соединения A10-1, получали указанное в заголовке соединение, исходя из Соединения T5-1.
ЖХ/МС: m/z 553 [M+H]+
ВЭЖХ время удерживания: 2,93 мин (условия анализа D)
[Пример 615]
Соединение T5-3
3-Бром-5,6,6-триметил-8-(пиперидин-4-илокси)-5,6-дигидро-бензо[b]карбазол-11-он
В соответствии со способом, аналогичным способу синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения T5-2.
ЖХ/МС: m/z 453 [M+H]+
ВЭЖХ время удерживания: 1,98 мин (условия анализа D)
[Пример 616]
Соединение T5-4
3-Бром-8-(1-метансульфонил-пиперидин-4-илокси)-5,6,6-триметил-5,6-дигидро-бензо[b]карбазол-11-он

В соответствии со способом, аналогичным способу синтеза Соединения A9-7, получали указанное в заголовке соединение, исходя из Соединения T5-3 и метансульфонилхлорида.
ЖХ/МС: m/z 531 [M+H]+
ВЭЖХ время удерживания: 2,38 мин (условия анализа D)
[Пример 617]
Соединение T5-5
8-(1-Ацетил-пиперидин-4-илокси)-3-бром-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

В соответствии со способом, аналогичным способу синтеза Соединения A9-1, получали указанное в заголовке соединение, исходя из Соединения T5-3 и уксусного ангидрида.
ЖХ/МС: m/z 482 [M+H]+
ВЭЖХ время удерживания: 2,10 мин (условия анализа D)
[Пример 618]
Соединение T6-1
3-Бром-6,6-диметил-8-[1-(2,2,2-трифторацетил)пиперидин-4-илокси]-5,6-дигидро-бензо[b]карбазол-11-он

В соответствии со способом, аналогичным способу синтеза Соединения A9-1, получали указанное в заголовке соединение, исходя из Соединения T6-2 и трифторуксусного ангидрида.
ЖХ/МС: m/z 535 [M+H]+
ВЭЖХ время удерживания: 2,53 мин (условия анализа D)
[Пример 619]
Соединение T6-2
3-Бром-6,6-диметил-8-(пиперидин-4-илокси)-5,6-дигидро-бензо[b]карбазол-11-он

3-Бром-6,6-диметил-8-[1-(2,2,2-трифторацетил)пиперидин-4-илокси]-5,6-дигидро-бензо[b]карбазол-11-он (Соединение T6-1, 28,0 мг, 52,3 мкмоль) растворяли в ТГФ (1,00 мл) и метаноле (0,50 мл), добавляли водный раствор гидроксида калия (1,00 мл, 20% масс.) и перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор добавляли в воду и экстрагировали смесью хлороформа и метанола, и сушили над сульфатом натрия. Затем, после фильтрования и концентрирования при пониженном давлении, получали 3-бром-6,6-диметил-8-(пиперидин-4-илокси)-5,6-дигидро-бензо[b]карбазол-11-он в виде неочищенного продукта.
ЖХ/МС: m/z 439 [M+H]+
ВЭЖХ время удерживания: 1,83 мин (условия анализа D)
[Пример 620]
Соединение T6-3
3-Бром-8-(1-метансульфонил-пиперидин-4-илокси)-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

В соответствии со способом, аналогичным способу синтеза Соединения A9-1, получали указанное в заголовке соединение, исходя из Соединения T6-2 и мезилхлорида.
ЖХ/МС: m/z 517 [M+H]+
ВЭЖХ время удерживания: 2,23 мин (условия анализа D)
[Пример 621]
Соединение T6-4
8-(1-Ацетил-пиперидин-4-илокси)-3-бром-5,6,6-триметил-5,6-дигидро-бензо[b]карбазол-11-он

В соответствии со способом, аналогичным способу синтеза Соединения A9-1, получали указанное в заголовке соединение, исходя из Соединения T6-2 и уксусного ангидрида.
ЖХ/МС: m/z 496 [M+H]+
ВЭЖХ время удерживания: 2,27 мин (условия анализа D)
[Пример 622]
Соединение T7-1
3-Бром-8-изопропокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

Указанное в заголовке соединение получали в виде побочного продукта синтеза Соединения T4-1.
ЖХ/МС: m/z 398 [M+H]+
ВЭЖХ время удерживания: 3,18 мин (условия анализа F)
[Пример 623]
Соединение T7-2
3-Бром-8-изопропокси-5,6,6-триметил-5,6-дигидро-бензо[b]карбазол-11-он

В соответствии со способом, аналогичным способу синтеза Соединения A10-2, получали указанное в заголовке соединение, исходя из Соединения T7-1.
ЖХ/МС: m/z 413 [M+H]+
ВЭЖХ время удерживания: 2,70 мин (условия анализа D)
[Пример 624]
Соединение T8-1
3-Бром-5,6,6-триметил-8-(2-фенил[1,3]диоксан-5-илокси)-5,6-дигидро-бензо[b]карбазол-11-он
В соответствии со способом, аналогичным способу синтеза Соединения A10-2, получали указанное в заголовке соединение, исходя из Соединения T4-1.
ЖХ/МС: m/z 532 [M+H]+
ВЭЖХ время удерживания: 2,90 мин (условия анализа D)
[Пример 625]
Соединение T8-2
3-Бром-8-(2-гидрокси-1-гидроксиметил-этокси)-5,6,6-триметил-5,6-дигидро-бензо[b]карбазол-11-он

В соответствии со способом, аналогичным способу синтеза Соединения A7-13-2, получали указанное в заголовке соединение, исходя из Соединения T4-1.
ЖХ/МС: m/z 444 [M+H]+
ВЭЖХ время удерживания: 1,90 мин (условия анализа D)
[Пример 626]
Соединение T9
N-[2-(3-Бром-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)этил]ацетамид

В соответствии со способом, аналогичным способу синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения A5-1 и (N-(2-хлорэтил)ацетамида.
ЖХ/МС: m/z 441 [M+H]+
ВЭЖХ время удерживания: 1,92 мин (условия анализа D)
[Пример 627]
Соединение T10
3-Бром-6,6-диметил-8-(оксетан-3-илокси)-5,6-дигидро-бензо[b]карбазол-11-он

В соответствии со способом, аналогичным способу синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения A5-1 и оксетан-3-илового эфира толуол-4-сульфоновой кислоты.
ЖХ/МС: m/z 412 [M+H]+
ВЭЖХ время удерживания: 2,17 мин (условия анализа D)
[Пример 628]
Соединение T11
3-Бром-8-(4-гидрокси-тетрагидро-фуран-3-илокси)-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

В атмосфере азота тетрагидро-фуро[3,4-d][1,3,2]диоксатиол-2,2-диоксид (71,5 мг, 0,420 ммоль) растворяли в DMF (1,40 мл), добавляли 3-бром-8-гидрокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он (Соединение A5-1, 50,0 мг, 0,140 ммоль) и карбонат цезия (228 мг, 0,700 ммоль) и перемешивали при 80°C в течение 15 часов. Затем к смеси добавляли серную кислоту (0,10 мл, 18 M), ТГФ (3,00 мл) и воду (0,50 мл), затем смесь перемешивали при комнатной температуре в течение 24 часов и далее при 60°C в течение 24 часов. Реакционный раствор добавляли в воду, экстрагировали этилацетатом, промывали водой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором и сушили над сульфатом натрия. После фильтрования и концентрирования при пониженном давлении полученные остатки промывали дихлорметаном и очищали колоночной хроматографией на NH силикагеле (этилацетат/ТГФ) с получением целевого соединения (44,7 мг, 72%).
ЖХ/МС: m/z 442 [M+H]+
ВЭЖХ время удерживания: 1,98 мин (условия анализа D)
[Пример 629]
Соединение T12-1
(2S,3R,4S,5R,6R)-4,5-Диацетокси-6-(3-бром-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илоксиметил)-2-метокси-тетрагидро-пиран-3-иловый эфир уксусной кислоты

В соответствии со способом, аналогичным способу синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения A5-1 и метил-2,3,4-три-O-ацетил-α-D-глюкопиранозида.
ЖХ/МС: m/z 658 [M+H]+
ВЭЖХ время удерживания: 2,38 мин (условия анализа D)
[Пример 630]
Соединение T12-2
3-Бром-6,6-диметил-8-((2R,3S,4S,5R,6S)-3,4,5-тригидрокси-6-метокси-тетрагидро-пиран-2-илметокси)-5,6-дигидро-бензо[b]карбазол-11-он

В атмосфере азота к (2S,3R,4S,5R,6R)-4,5-диацетокси-6-(3-бром-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илоксиметил)-2-метокси-тетрагидро-пиран-3-иловому эфиру уксусной кислоты (Соединение T12-1, 34,0 мг, 51,63 мкмоль) добавляли метанольный раствор (2,50 мл, 2 M) аммиака и смесь перемешивали при комнатной температуре в течение 21 часа. Реакционный раствор концентрировали при пониженном давлении, и полученные остатки промывали диэтиловым эфиром с получением целевого соединения (25,7 мг, 94%).
ЖХ/МС: m/z 532 [M+H]+
ВЭЖХ время удерживания: 2,42 мин (условия анализа D)
[Пример 631]
Соединение T13-1
трет-Бутиловый эфир (3-бром-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)уксусной кислоты

В соответствии со способом, аналогичным способу синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения A5-1 и трет-бутилового эфира бромуксусной кислоты.
ЖХ/МС: m/z 470 [M+H]+
ВЭЖХ время удерживания: 2,53 мин (условия анализа D)
[Пример 632]
Соединение T13-2
(3-Бром-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)уксусная кислота

В соответствии со способом, аналогичным способу синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения T13-1.
ЖХ/МС: m/z 414 [M+H]+
ВЭЖХ время удерживания: 1,50 мин (условия анализа D)
[Пример 633]
Соединение T13-3
2-(3-Бром-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)-N-(3-этил-3-гидрокси-пентил)ацетамид

В атмосфере азота (3-азид-1,1-диэтил-пропокси)триметилсилан (16,6 мг, 72,42 мкмоль) растворяли в толуоле (0,48 мл), добавляли 3-бром-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)уксусную кислоту (20,0 мг, 48,28 мкмоль) и молекулярные сита 4 ангстрем и смесь перемешивали при комнатной температуре в течение 5 минут. Затем к смеси добавляли триметилфосфин (10,2 мкл, 96,56 мкмоль) и перемешивали при 80°C в течение 22 часов. Реакционный раствор добавляли к хлористоводородной кислоте (1 M), экстрагировали этилацетатом, промывали водой, насыщенным водным раствором бикарбоната натрия, насыщенным солевым раствором и сушили над сульфатом натрия. После фильтрования и концентрирования при пониженном давлении полученные остатки очищали колоночной хроматографией на силикагеле (метанол/дихлорметан) с получением целевого соединения (0,7 мг, 3%).
ЖХ/МС: m/z 527 [M+H]+
ВЭЖХ время удерживания: 2,93 мин (условия анализа D)
[Пример 634]
Соединение T13-4
трет-Бутиловый эфир 4-[2-(3-бром-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)ацетил]пиперазин-1-карбоновой кислоты

В соответствии со способом, аналогичным способу синтеза Соединения A9-10, получали указанное в заголовке соединение, исходя из Соединения T13-2 и 1-(трет-бутоксикарбонил)пиперазина.
ЖХ/МС: m/z 582 [M+H]+
ВЭЖХ время удерживания: 2,32 мин (условия анализа D)
[Пример 635]
Соединение T13-5
3-Бром-6,6-диметил-8-(2-оксо-2-пиперазин-1-ил-этокси)-5,6-дигидро-бензо[b]карбазол-11-он, гидрохлоридная соль
В соответствии со способом, аналогичным способу синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения T13-4.
ЖХ/МС: m/z 482 [M+H]+
ВЭЖХ время удерживания: 1,75 мин (условия анализа D)
[Пример 636]
Соединение T13-6
3-Бром-8-[2-(4-метансульфонил-пиперазин-1-ил)-2-оксо-этокси]-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он
В соответствии со способом, аналогичным способу синтеза Соединения A9-1, получали указанное в заголовке соединение, исходя из Соединения T13-5 и метансульфонилхлорида.
ЖХ/МС: m/z 560 [M+H]+
ВЭЖХ время удерживания: 2,00 мин (условия анализа D)
[Пример 637]
Соединение T13-7
3-Бром-6,6-диметил-8-{2-оксо-2-[4-(пропан-2-сульфонил)пиперазин-1-ил]этокси}-5,6-дигидро-бензо[b]карбазол-11-он

В соответствии со способом, аналогичным способу синтеза Соединения A9-1, получали указанное в заголовке соединение, исходя из Соединения T13-5 и изопропилсульфонилхлорида.
ЖХ/МС: m/z 588 [M+H]+
ВЭЖХ время удерживания: 2,47 мин (условия анализа D)
[Пример 638]
Соединение T13-8
8-[2-(4-Ацетил-пиперазин-1-ил)-2-оксо-этокси]-3-бром-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

В соответствии со способом, аналогичным способу синтеза Соединения A9-1, получали указанное в заголовке соединение, исходя из Соединения T13-5 и уксусного ангидрида.
ЖХ/МС: m/z 524 [M+H]+
ВЭЖХ время удерживания: 1,85 мин (условия анализа D)
[Пример 639]
Соединение T13-9
3-Бром-6,6-диметил-8-[2-(4-оксетан-3-ил-пиперазин-1-ил)-2-оксо-этокси]-5,6-дигидро-бензо[b]карбазол-11-он

В соответствии со способом, аналогичным способу синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения T13-5 и 3-оксетанона.
ЖХ/МС: m/z 538 [M+H]+
ВЭЖХ время удерживания: 1,88 мин (условия анализа D)
[Пример 640]
Соединение T13-10
Метиламид 4-[2-(3-бром-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-ил-окси)ацетил]пиперазин-1-сульфоновой кислоты

В соответствии со способом, аналогичным способу синтеза Соединения A9-1, получали указанное в заголовке соединение, исходя из Соединения T13-5 и метиламида 2-оксо-оксазолидин-3-сульфоновой кислоты.
ЖХ/МС: m/z 575 [M+H]+
ВЭЖХ время удерживания: 2,29 мин (условия анализа A)
[Пример 641]
Соединение T14-1
трет-Бутиловый эфир 4-(3-бром-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илоксиметил)пиперидин-1-карбоновой кислоты

В соответствии со способом, аналогичным способу синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения A5-1 и 1-(трет-бутоксикарбонил)-4-(гидроксиметил)пиперидина.
ЖХ/МС: m/z 553 [M+H]+
ВЭЖХ время удерживания: 2,80 мин (условия анализа D)
[Пример 642]
Соединение T14-2
3-Бром-6,6-диметил-8-(пиперидин-4-илметокси)-5,6-дигидро-бензо[b]карбазол-11-он в форме соли хлористоводородной кислоты

В соответствии со способом, аналогичным способу синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения T14-1.
ЖХ/МС: m/z 454 [M+H]+
ВЭЖХ время удерживания: 1,90 мин (условия анализа D)
[Пример 643]
Соединение T14-3
3-Бром-6,6-диметил-8-(1-оксетан-3-ил-пиперидин-4-илметокси)-5,6-дигидро-бензо[b]карбазол-11-он

В соответствии со способом, аналогичным способу синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения T14-2 и 3-оксетанона.
1H-ЯМР(400 МГц, CDCl3) δ: 9,24 (1 H, с), 8,37 (1 H, д, 8,8 Гц), 8,30 (1 H, д, 8,3 Гц), 7,57 (1 H, д, 1,5 Гц), 7,41 (1 H, дд, 8,3, 1,5 Гц), 7,08 (1 H, д, 2,4 Гц), 6,98 (1 H, дд, 8,8, 2,4 Гц), 4,60-4,95 (7 H, м), 3,93 (2 H, д, 5,9 Гц), 3,50 (1 H, м), 2,83 (2 H, д, 11,2 Гц), 1,89 (4 H, м), 1,78 (6 H, с).
ЖХ/МС: м/z 509 [М+H]+
ВЭЖХ время удерживания: 2,10 мин (условия анализа A)
[Пример 644]
Соединение T14-4
8-(1-Ацетил-пиперидин-4-илметокси)-3-бром-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

В соответствии со способом, аналогичным способу синтеза Соединения A9-1, получали указанное в заголовке соединение, исходя из Соединения T14-2 и уксусного ангидрида.
ЖХ/МС: m/z 495 [M+H]+
ВЭЖХ время удерживания: 2,53 мин (условия анализа A)
[Пример 645]
Соединение T14-5
3-Бром-8-(1-метансульфонил-пиперидин-4-илметокси)-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

В соответствии со способом, аналогичным способу синтеза Соединения A9-1, получали указанное в заголовке соединение, исходя из Соединения T14-2 и метансульфонилхлорида.
ЖХ/МС: m/z 531 [M+H]+
ВЭЖХ время удерживания: 2,30 мин (условия анализа D)
[Пример 646]
Соединение T14-6
3-Бром-6,6-диметил-8-[1-(пропан-2-сульфонил)пиперидин-4-илметокси]-5,6-дигидро-бензо[b]карбазол-11-он

В соответствии со способом, аналогичным способу синтеза Соединения A9-1, получали указанное в заголовке соединение, исходя из Соединения T14-2 и изопропилсульфонилхлорида.
ЖХ/МС: m/z 559 [M+H]+
ВЭЖХ время удерживания: 2,58 мин (условия анализа D)
[Пример 647]
Соединение T14-7
трет-Бутиловый эфир 3-[4-(3-бром-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илоксиметил)пиперидин-1-ил]азетидин-1-карбоновой кислоты

В соответствии со способом, аналогичным способу синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения T14-2 и трет-бутилового эфира 3-оксо-азетидин-1-карбоновой кислоты.
ЖХ/МС: m/z 608 [M+H]+
ВЭЖХ время удерживания: 2,29 мин (условия анализа A)
[Пример 648]
Соединение T14-8
8-(1-Азетидин-3-ил-пиперидин-4-илметокси)-3-бром-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

В соответствии со способом, аналогичным способу синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения T14-7.
ЖХ/МС: m/z 508 [M+H]+
ВЭЖХ время удерживания: 1,90 мин (условия анализа A)
[Пример 649]
Соединение T14-9
3-Бром-8-[1-(1-метансульфонил-азетидин-3-ил)пиперидин-4-илметокси]-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он
В соответствии со способом, аналогичным способу синтеза Соединения A9-1, получали указанное в заголовке соединение, исходя из Соединения T14-8 и мезилхлорида.
ЖХ/МС: m/z 586 [M+H]+
ВЭЖХ время удерживания: 2,06 мин (условия анализа A)
[Пример 650]
Соединение T14-10
8-[1-(1-Ацетил-азетидин-3-ил)пиперидин-4-илметокси]-3-бром-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

В соответствии со способом, аналогичным способу синтеза Соединения A9-1, получали указанное в заголовке соединение, исходя из Соединения T14-8 и уксусного ангидрида.
ЖХ/МС: m/z 550 [M+H]+
ВЭЖХ время удерживания: 2,53 мин (условия анализа A)
[Пример 651]
Соединение T15-1
трет-Бутиловый эфир 4-[2-(3-бром-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)этил]пиперидин-1-карбоновой кислоты

В соответствии со способом, аналогичным способу синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения A5-1 и N-(трет-бутоксикарбонил)-4-пиперидинэтанола.
ЖХ/МС: m/z 567 [M+H]+
ВЭЖХ время удерживания: 2,29 мин (условия анализа D)
[Пример 652]
Соединение T15-2
3-Бром-6,6-диметил-8-(2-пиперидин-4-ил-этокси)-5,6-дигидро-бензо[b]карбазол-11-он

В соответствии со способом, аналогичным способу синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения T15-1.
ЖХ/МС: m/z 467 [M+H]+
ВЭЖХ время удерживания: 1,95 мин (условия анализа D)
[Пример 653]
Соединение T15-3
3-Бром-6,6-диметил-8-[2-(1-оксетан-3-ил-пиперидин-4-ил)этокси]-5,6-дигидро-бензо[b]карбазол-11-он

В соответствии со способом, аналогичным способу синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения T15-2 и 3-оксетанона.
ЖХ/МС: m/z 523 [M+H]+
ВЭЖХ время удерживания: 2,28 мин (условия анализа D)
[Пример 654]
Соединение T16-1
трет-Бутиловый эфир 4-(3-бром-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)-1-окса-8-аза-спиро[4,5]декан-8-карбоновой кислоты

В соответствии со способом, аналогичным способу синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения A5-1 и трет-бутиловый эфир 3-гидрокси-1-окса-8-аза-спиро[4,5]декан-8-карбоновой кислоты.
ЖХ/МС: m/z 595 [M+H]+
ВЭЖХ время удерживания: 3,08 мин (условия анализа A)
[Пример 655]
Соединение T16-2
3-Бром-6,6-диметил-8-(1-окса-8-аза-спиро[4,5]декан-4-илокси)-5,6-дигидро-бензо[b]карбазол-11-он

В соответствии со способом, аналогичным способу синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из Соединения T16-1.
ЖХ/МС: m/z 496 [M+H]+
ВЭЖХ время удерживания: 1,99 мин (условия анализа A)
[Пример 656]
Соединение T16-3
3-Бром-8-(8-метансульфонил-1-окса-8-аза-спиро[4,5]декан-4-илокси)-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

В соответствии со способом, аналогичным способу синтеза Соединения A9-1, получали указанное в заголовке соединение, исходя из Соединения T16-2 и мезилхлорида.
ЖХ/МС: m/z 573 [M+H]+
ВЭЖХ время удерживания: 2,56 мин (условия анализа A)
[Пример 657]
Соединение T16-4
3-Бром-6,6-диметил-8-(8-оксетан-3-ил-1-окса-8-аза-спиро[4,5]декан-4-илокси)-5,6-дигидро-бензо[b]карбазол-11-он
В соответствии со способом, аналогичным способу синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения T16-2 и 3-оксетанона.
ЖХ/МС: m/z 551 [M+H]+
ВЭЖХ время удерживания: 2,01 мин (условия анализа A)
[Пример 658]
Соединение T17-1
3,7,9-Трибром-8-гидрокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

В атмосфере азота трет-бутиловый эфир 4-[1,3]дитиан-2-илиден-пиперидин-1-карбоновой кислоты (100 г, 0,332 ммоль) растворяли в дихлорметане (2,50 мл), добавляли трифторметансульфоновую кислоту (30,8 мкл, 0,348 ммоль) при -20°C и перемешивали при комнатной температуре в течение 30 минут. Реакционный раствор охлаждали до -70°C и затем добавляли по каплям раствор 3-бром-8-гидрокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он (Соединение A5-1, 177 мг, 0,498 ммоль) в дихлорметане (2,50 мл) и триэтиламин (78,6 мкл, 0,564 ммоль). Затем добавляли соль триэтиламина гидротрифторкислоты (262 мкл, 1,610 ммоль) и 1,3-дибром-5,5-диметилгидантоин (460 мг, 1,610 ммоль) и перемешивали при -70°C в течение 1 часа. Реакционный раствор добавляли в водный раствор гидроксида натрия (1 M), экстрагировали этилацетатом, промывали водой, насыщенным водным раствором бикарбоната натрия, насыщенным солевым раствором и сушили над сульфатом натрия. После фильтрования и концентрирования при пониженном давлении полученные остатки очищали колоночной хроматографией на силикагеле (этилацетат/гексан) и колоночной хроматографией на аминосиликагеле (этилацетат/гексан) с получением целевого соединения (42,0 мг, 25%).
ЖХ/МС: m/z 511 [M+H]+
ВЭЖХ время удерживания: 6,34 мин (условия анализа B)
[Пример 659]
Соединение T17-2
3,7,9-Трибром-8-((S)-2,2-диметил[1,3]диоксолан-4-илметокси)-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он
В соответствии со способом, аналогичным способу синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения A17-1 и (S)-(+)-2,2-диметил-1,3-диоксолан-4-метанола.
ЖХ/МС: m/z 625 [M+H]+
ВЭЖХ время удерживания: 3,41 мин (условия анализа A)
[Пример 660]
Соединение T17-3
3,7,9-Трибром-8-((R)-2,3-дигидрокси-пропокси)-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

В соответствии со способом, аналогичным способу синтеза Соединения A7-14-2, получали указанное в заголовке соединение, исходя из Соединения T17-2.
ЖХ/МС: m/z 585 [M+H]+
ВЭЖХ время удерживания: 2,44 мин (условия анализа A)
[Пример 661]
Соединение T18-1
3-Бром-8-((S)-2,2-диметил-[1,3]диоксолан-4-илметокси)-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

3-Бром-8-гидрокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он (Соединение A5-1, 18,0 мг, 50,5 мкмоль) растворяли в DMF (0,18 мл), добавляли (R)-2,2-диметил-[1,3]диоксолан-4-илметиловый эфир толуол-4-сульфоновой кислоты (14,5 мг, 0,0505 ммоль) и карбонат калия (10,0 мг, 0,07575 ммоль) и смесь перемешивали при 70°C в течение 3 дней. Реакционный раствор добавляли в воду, экстрагировали этилацетатом, и органический слой сушили над сульфатом магния. Остатки, полученные после концентрирования при пониженном давлении, очищали при помощи препаративной ТСХ (метиленхлорид/метанол) с получением указанного в заголовке соединения (16,6 мг, 70%).
ЖХ/МС: m/z 470 [M+H]+
ВЭЖХ время удерживания: 3,01 мин (условия анализа F)
[Пример 662]
Соединение T18-2
3-Бром-8-((R)-2,3-дигидрокси-пропокси)-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

С использованием тех же условий, как в способе синтеза Соединения A7-14-2, получали указанное в заголовке соединение, исходя из Соединения T18-1.
ЖХ/МС: m/z 430 [M+H]+
ВЭЖХ время удерживания: 4,72 мин (условия анализа H)
[Пример 663]
Соединение T19-1-1
3-Бром-8-метокси-5,6,6-триметил-5,6-дигидро-бензо[b]карбазол-11-он

С использованием тех же условий, как в способе синтеза Соединения A10-1, получали указанное в заголовке соединение, исходя из Соединения A4.
ЖХ/МС: m/z 384 [M+H]+
ВЭЖХ время удерживания: 2,84 мин (условия анализа D)
[Пример 664]
Соединение T19-1
3-Бром-8-гидрокси-5,6,6-триметил-5,6-дигидро-бензо[b]карбазол-11-он

С использованием тех же условий, как в способе синтеза Соединения A6, получали указанное в заголовке соединение, исходя из Соединения T19-1-1.
ЖХ/МС: m/z 370 [M+H]+
ВЭЖХ время удерживания: 2,40 мин (условия анализа D)
[Пример 665]
Соединение T19-2
3-Бром-8-(2-диэтиламиноэтокси)-6,6-триметил-5,6-дигидро-бензо[b]карбазол-11-он

С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения A5-1 (9,8 мг, 36%).
ЖХ/МС: m/z 455 [M+H]+
ВЭЖХ время удерживания: 1,96 мин (условия анализа D)
[Пример 666]
Соединение T19-3
3-Бром-8-(2-диэтиламиноэтокси)-5,6,6-триметил-5,6-дигидро-бензо[b]карбазол-11-он

С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения T19-1.
ЖХ/МС: m/z 469 [M+H]+
ВЭЖХ время удерживания: 2,09 мин (условия анализа D)
[Пример 667]
Соединение T20
5-(3-Бром-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)пентановая кислота
С использованием тех же условий, как в способе синтеза Соединения A7-17, осуществляли взаимодействие Соединения A5-1 и метил-5-бромвалерата, добавляли 1 н раствор NaOH (140 мкл) и затем перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли 2 н раствор HCl (70 мкл) и концентрировали при пониженном давлении. Полученные остатки очищали при помощи препаративной ТСХ (метиленхлорид:метанол=15:1) с получением 7 мг (55%).
ЖХ/МС: m/z 456 [M+H]+
ВЭЖХ время удерживания: 5,88 мин (условия анализа H)
[Пример 668]
Соединение T21
(R)-5-(3-Бром-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илокси)-4-гидрокси-пентановая кислота

С использованием тех же условий, как в способе синтеза Соединения T20, получали указанное в заголовке соединение в результате взаимодействия между Соединением A5-1 и (R)-5-оксо-тетрагидрофуран-2-илметиловым эфиром толуол-4-сульфоновой кислоты.
ЖХ/МС: m/z 471 [M+H]+
ВЭЖХ время удерживания: 4,57 мин (условия анализа H)
[Пример 669]
Соединение T22-0
[5-(Трет-бутилдиметилсиланилоксиметил)-2,2-диметил[1,3]диоксолан-4-ил]метанол

К ТГФ (50 мл) добавляли NaH (1,41 г, 0,032 ммоль) при комнатной температуре с последующим добавлением ((4R,5R)-5-гидроксиметил-2,2-диметил[1,3]диоксолан-4-ил)метанола (5,0 г, 0,031 ммоль) при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 1 часа. Затем добавляли TBSCl (5,11 г, 0,034 ммоль) при комнатной температуре и перемешивали при комнатной температуре в течение ночи. К реакционному раствору добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагировали этилацетатом. Органический слой сушили над сульфатом магния. Остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (8,21 г, 96%).
1H-ЯМР(270 МГц, DМSO-d6) δ: 3,64-4,98 (6 H, м), 2,37 (1 H, м), 1,41 (3 H, с), 1,40 (3 H, с), 0,90 (9 H, с), 0,08 (6 H, с).
[Пример 670]
Соединение T22-1
3-Бром-8-[(4R,5R)-5-(трет-бутилдиметилсиланилоксиметил)-2,2-диметил-[1,3]диоксолан-4-илметокси]-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения A5-1 и [5-(трет-бутилдиметилсиланилоксиметил)-2,2-диметил[1,3]диоксолан-4-ил]метанола (Соединение T22-0) (704 мг, 80%).
ЖХ/МС: m/z 614 [M+H]+
ВЭЖХ время удерживания: 4,00 мин (условия анализа F)
[Пример 671]
Соединение T22-1-1
3-Бром-8-((1R,5R)-5-гидроксиметил-2,2-диметил[1,3]диоксолан-4-илметокси)-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

В атмосфере азота к DMF (0,4 мл) суспензии 3-бром-8-[(1R,5R)-5-(трет-бутил-диметилсиланилоксиметил)-2,2-диметил[1,3]диоксолан-4-илметокси]-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-она (Соединение T22-1, 50,3 мг, 0,0818 ммоль) и йодида меди(I) (34 мг) добавляли метоксид натрия (1 M раствор в метаноле, 0,82 мл, 0,818 ммоль) и смесь перемешивали в течение 6 часов и 45 минут при температуре окружающей среды 90°C. После охлаждения до комнатной температуры к реакционной смеси добавляли диэтиловый эфир и этилацетат, и нерастворимые вещества удаляли путем фильтрования через Целит. К концентрированным остаткам добавляли диэтиловый эфир, гексан, этилацетат и воду и затем смесь экстрагировали два раза диэтиловым эфиром. Органический слой промывали водой и затем насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали при пониженном давлении. Полученный неочищенный продукт очищали при помощи препаративной ТСХ (Merck60 F254, 0,5 мм) {раствор для элюирования: гексан/этилацетат (1:2)} с получением указанного в заголовке соединения (бесцветное маслянистое вещество, 22,6 мг, 55%).
1H-ЯМР(270 МГц, CDCl3) δ: 8,44-8,38 (1 H, ушир.), 8,39 (1 H, д, 8,6 Гц), 8,31 (1 H, д, 8,2 Гц), 7,60 (1 H, д, 1,3 Гц), 7,44 (1 H, дд, 8,2 Гц, 1,3 Гц), 7,12 (1 H, д, 2,3 Гц), 7,02 (1 H, дд, 8,6 Гц, 2,3 Гц), 4,41-4,10 (4 H, м), 4,00-3,88 (1 H, м), 3,86-3,76 (1 H, м), 1,78 (6 H, с), 1,50 (3 H, с), 1,49 (3 H, с).
ЖХ/МС: м/z 500 [М+H]+
ВЭЖХ время удерживания: 2,85 мин (условия анализа C)
[Пример 672]
Соединение T22-1-2
(3R,4R)-5-(3-Бром-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-илоксиметил)-2,2-диметил[1,3]диоксолан-4-илметиловый эфир уксусной кислоты
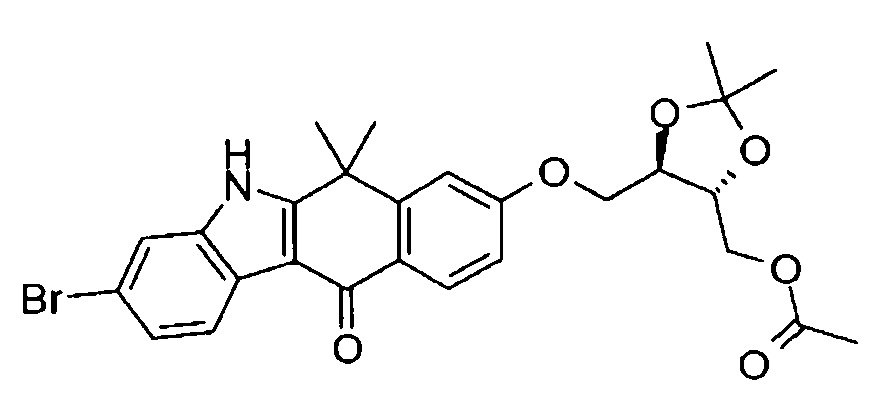
Указанное в заголовке соединение получали в виде побочного продукта синтеза T22-1-1 (белое твердое вещество, 17,8 мг, 40%).
1H-ЯМР(270 МГц, CDCl3) δ: 8,92-8,80 (1 H, ушир.), 8,40 (1 H, д, 8,9 Гц), 8,31 (1 H, д, 8,6 Гц), 7,58 (1 H, д, 1,7 Гц), 7,43 (1 H, дд, 8,6 Гц, 1,7 Гц), 7,14 (1 H, д, 2,3 Гц), 7,02 (1 H, дд, 8,9 Гц, 2,3 Гц), 4,51-4,38 (1 H, м), 4,34-4,16 (4 H, м), 2,13 (3 H, с), 1,78 (6 H, с), 1,50 (6 H, с).
ЖХ/МС: м/z 542 [М+H]+
ВЭЖХ время удерживания: 3,00 мин (условия анализа C)
[Пример 673]
Соединение T22-2
3-Бром-6,6-диметил-8-((2R,3R)-2,3,4-тригидрокси-бутокси)-5,6-дигидро-бензо[b]карбазол-11-он

С использованием тех же условий, как в способе синтеза Соединения A7-14-2, получали указанное в заголовке соединение, исходя из Соединения T22-1 (2,83 г, 95%).
ЖХ/МС: m/z 460 [M+H]+
ВЭЖХ время удерживания: 4,50 мин (условия анализа H)
[Пример 674]
Соединение T22-3
3-Бром-8-[(4R,5R)-5-(трет-бутилдиметилсиланилоксиметил)-2,2-диметил-[1,3]диоксолан-4-илметокси]-5,6,6-триметил-5,6-дигидро-бензо[b]карбазол-11-он
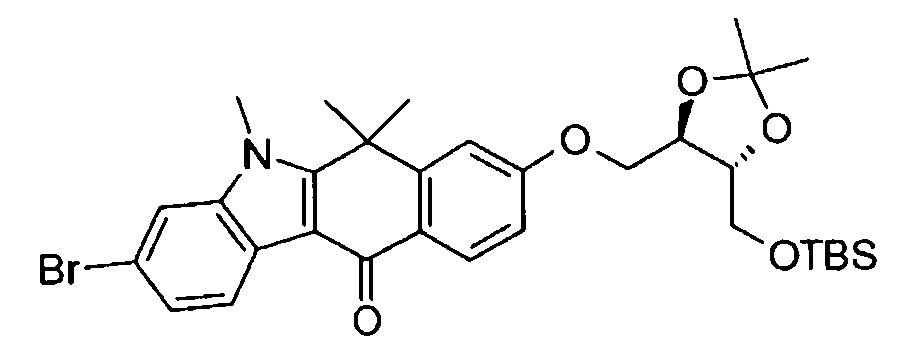
С использованием тех же условий, как в способе синтеза Соединения B3-4, получали указанное в заголовке соединение, исходя из Соединения T22-1.
ЖХ/МС: m/z 628 [M+H]+
ВЭЖХ время удерживания: 4,74 мин (условия анализа F)
[Пример 675]
Соединение T22-4
3-Бром-8-((2R,3R)-2,3-дигидрокси-пентилокси)-5,6,6-триметил-5,6-дигидро-бензо[b]карбазол-11-он

С использованием тех же условий, как в способе синтеза Соединения A7-14-2, получали указанное в заголовке соединение, исходя из Соединения T22-3.
ЖХ/МС: m/z 475 [M+H]+
ВЭЖХ время удерживания: 4,86 мин (условия анализа H)
[Пример 676]
Соединение T22-5
Метиловый эфир {3-бром-8-[(4R,5R)-5-(трет-бутилдиметилсиланилоксиметил)-2,2-диметил[1,3]диоксолан-4-илметокси]-6,6-диметил-11-оксо-6,11-дигидро-бензо[b]карбазол-5-ил}уксусной кислоты

В атмосфере азота 3-бром-8-[(4R,5R)-5-(трет-бутилдиметилсиланилоксиметил)-2,2-диметил[1,3]диоксолан-4-илметокси]-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он (Соединение T22-1, 40,0 мг, 65,2 мкмоль) растворяли в DMF (0,20 мл), добавляли при 0°C метилбромацетат (30,5 мкл, 134,5 мкмоль) и гидрид натрия (4,5 мг, 132 мкмоль) и затем перемешивали при комнатной температуре в течение 2 часов. Остатки, полученные после концентрирования реакционного раствора при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (44,5 мг, 85%).
ЖХ/МС: m/z 686 [M+H]+
ВЭЖХ время удерживания: 3,35 мин (условия анализа D)
[Пример 677]
Соединение T22-6
{3-Бром-8-[(4R,5R)-5-(трет-бутилдиметилсиланилоксиметил)-2,2-диметил-[1,3]диоксолан-4-илметокси]-6,6-диметил-11-оксо-6,11-дигидро-бензо[b]карбазол-5-ил}уксусная кислота
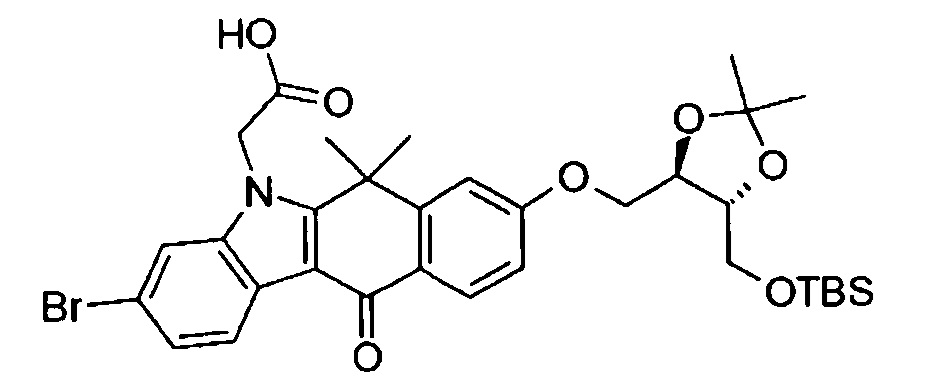
Метиловый эфир {3-бром-8-[(4R,5R)-5-(трет-бутил-диметилсиланилоксиметил)-2,2-диметил[1,3]диоксолан-4-илметокси]-6,6-диметил-11-оксо-6,11-дигидро-бензо[b]карбазол-5-ил}уксусной кислоты (Соединение T22-5, 40 мг, 60,0 мкмоль) растворяли в смеси растворителей метанола (120 мкл) и воды (30 мкл), добавляли гидроксид лития моногидрат (10 мг, 240 мкмоль) и затем перемешивали при 40°C в течение 15 минут. Остатки, полученные после концентрирования реакционного раствора при пониженном давлении, очищали колоночной хроматографией на силикагеле (метиленхлорид/метанол) с получением целевого соединения (35,2 мг, 96%).
ЖХ/МС: m/z 672 [M+H]+
ВЭЖХ время удерживания: 3,41 мин (условия анализа D)
[Пример 678]
Соединение T22-7
[3-Бром-6,6-диметил-11-оксо-8-((2R,3R)-2,3,4-тригидрокси-бутокси)-6,11-дигидро-бензо[b]карбазол-5-ил]уксусная кислота

С использованием тех же условий, как в способе синтеза Соединения A7-14-2, получали указанное в заголовке соединение, исходя из Соединения T22-6 (6,2 мг, 31%).
ЖХ/МС: m/z 518 [M+H]+
ВЭЖХ время удерживания: 1,30 мин (условия анализа D)
[Пример 679]
Соединение T22-8
Метиловый эфир [3-бром-6,6-диметил-11-оксо-8-((2R,3R)-2,3,4-тригидрокси-бутокси)-6,11-дигидро-бензо[b]карбазол-5-ил]уксусной кислоты

[3-Бром-6,6-диметил-11-оксо-8-((2R,3R)-2,3,4-тригидрокси-бутокси)-6,11-дигидро-бензо[b]карбазол-5-ил]уксусную кислоту (Соединение T22-6, 15,0 мг, 29,0 мкмоль) растворяли в метаноле (0,30 мл), добавляли триметилсилилдиазометан (0,10 мл) и затем перемешивали при комнатной температуре в течение 1 часа. Остатки, полученные после концентрирования реакционного раствора при пониженном давлении, очищали колоночной хроматографией на силикагеле (метиленхлорид/метанол) с получением целевого соединения (15,2 мг, 96%).
ЖХ/МС: m/z 532 [M+H]+
ВЭЖХ время удерживания: 1,80 мин (условия анализа D)
[Пример 680]
Соединение T23-1
3-Бром-5-((R)-1,2-дигидроксиэтил)-8-метокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

С использованием тех же условий, как в способе синтеза Соединения T18-1 и Соединения T18-2, получали указанное в заголовке соединение, исходя из Соединения A5-1 и (R)-2,2-диметил-[1,3]диоксолан-4-илметилового эфира толуол-4-сульфоновой кислоты.
ЖХ/МС: m/z 366 [M+H]+
ВЭЖХ время удерживания: 4,50 мин (условия анализа H)
[Пример 681]
Соединение T23-2
3-Бром-5-((S)-1,2-дигидроксиэтил)-8-метокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

С использованием тех же условий, как в способе синтеза Соединения T18-1 и Соединения T18-2, получали указанное в заголовке соединение, исходя из Соединения A4 и (S)-2,2-диметил[1,3]диоксолан-4-илметилового эфира толуол-4-сульфоновой кислоты.
ЖХ/МС: m/z 366 [M+H]+
ВЭЖХ время удерживания: 4,50 мин (условия анализа H)
[Пример 682]
Соединение T24-1
3-Бром-8-((S)-2,2-диметил[1,3]диоксолан-4-илметокси)-5,6,6-триметил-5,6-дигидро-бензо[b]карбазол-11-он

В атмосфере азота к DMF (1 мл) суспензии 3-бром-8-((S)-2,2-диметил[1,3]диоксолан-4-илметокси)-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-она (Соединение T18-1, 112,2 мг, 0,239 ммоль) и гидрида натрия (60%) (19 мг, 0,477 ммоль), охлажденной на ледяной бане, добавляли метилиодид (37 мл, 0,596 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 45 минут и затем добавляли насыщенный водный раствор хлорида аммония и насыщенный водный раствор тиосульфата натрия при охлаждении льдом. Смесь экстрагировали два раза смесью этилацетат/диэтиловый эфир/гексан. Органический слой промывали водой и затем водным раствором хлорида аммония, сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный неочищенный продукт очищали колоночной флэш-хроматографией {Merck Kieselgel60, раствор для элюирования: гексан/этилацетат (1:1)} с получением указанного в заголовке соединения (белое твердое вещество, 107,3 мг, 93%).
1H-ЯМР(270 МГц, CDCl3) δ: 8,41 (1 H, д, 8,6 Гц), 8,35 (1 H, д, 8,9 Гц), 7,56 (1 H, д, 1,7 Гц), 7,46 (1 H, дд, 8,6 Гц, 1,7 Гц), 7,14 (1 H, д, 2,3 Гц), 7,00 (1 H, дд, 8,9 Гц, 2,3 Гц), 4,60-4,49 (1 H, м), 4,20-3,90 (4 H, м), 4,03 (3 H, с), 1,88 (6 H, с), 1,50 (3 H, с), 1,43 (3 H, с).
ЖХ/МС: м/z 484 [М+H]+
ВЭЖХ время удерживания: 6,59 мин (условия анализа B)
[Пример 683]
Соединение T24-2
3-Бром-8-((R)-2,3-дигидрокси-пропокси)-5,6,6-триметил-5,6-дигидро-бензо[b]карбазол-11-он

В атмосфере азота к раствору 3-бром-8-((S)-2,2-диметил[1,3]диоксолан-4-илметокси)-5,6,6-триметил-5,6-дигидро-бензо[b]карбазол-11-она (Соединение T24-1, 15,5 мг, 0,0320 ммоль) в ТГФ (0,15 мл)-MeOH (0,1 мл) добавляли 0,5 M водный раствор серной кислоты (128 мкл, 0,0640 ммоль) при комнатной температуре. Реакционную смесь перемешивали при температуре окружающей среды 55°C в течение 2 часов, охлаждали до комнатной температуры и затем добавляли диэтиловый эфир и затем гидрокарбонат натрия (11 мг). Смесь экстрагировали два раза диэтиловым эфиром/этилацетатом, и органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали при пониженном давлении с получением указанного в заголовке соединения (белое твердое вещество, 11,9 мг, 84%).
1H-ЯМР(270 МГц, CD3OD) δ: 8,26 (1 H, д, 8,6 Гц), 8,20 (1 H, д, 8,9 Гц), 7,77 (1 H, д, 1,7 Гц), 7,42 (1 H, дд, 8,6 Гц, 1,7 Гц), 7,33 (1 H, д, 2,3 Гц), 7,09 (1 H, дд, 8,9 Гц, 2,3 Гц), 4,26-3,96 (3 H, м), 4,10 (3 H, с), 3,74-3,66 (1 H, м), 1,92 (6 H, с).
ЖХ/МС: м/z 444 [М+H]+
ВЭЖХ время удерживания: 4,65 мин (условия анализа B)
[Пример 684]
Соединение T25
3-Бром-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

С использованием тех же условий, как в способе синтеза Соединения A3-1 и Соединения A4, получали указанное в заголовке соединение, исходя из 3,4-дигидро-1H-нафталин-2-она (560 мг).
ЖХ/МС: m/z 340 [M+H]+
ВЭЖХ время удерживания: 4,57 мин (условия анализа H)
[Пример 685]
Соединение T26-1
8-[(4R,5R)-5-(Трет-бутилдиметилсиланилоксиметил)-2,2-диметил[1,3]диоксолан-4-илметокси]-3-йод-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он
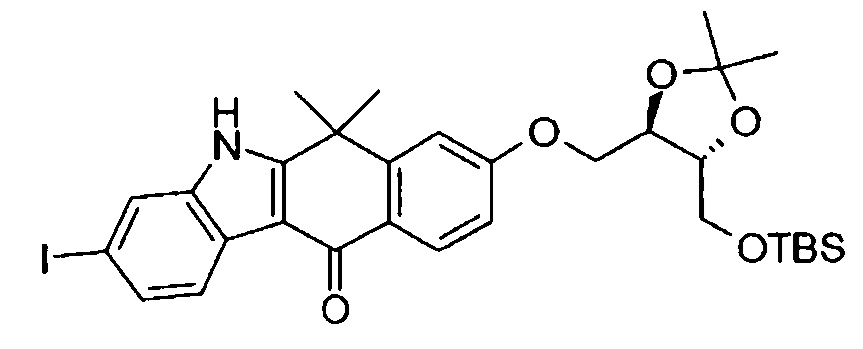
В атмосфере азота 3-бром-8-[(4R,5R)-5-(трет-бутилдиметилсиланилоксиметил)-2,2-диметил-[1,3]диоксолан-4-илметокси]-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он (Соединение T22-1, 300 мг, 0,47 ммоль), натрия йодид (147 мг, 0,94 ммоль) и йодид меди (9,40 мг, 0,047 ммоль) растворяли в диоксане (1,00 мл), добавляли (1R,2R)-N,N,N’,N’-тетраметил-циклогексан-1,2-диамин (15,4 мкл, 0,094 ммоль) и затем перемешивали при 110°C в течение 16 часов. Остатки, полученные после концентрирования реакционного раствора при пониженном давлении, очищали колоночной хроматографией на силикагеле (метиленхлорид/метанол) с получением указанного в заголовке соединения (220 мг, 70%).
ЖХ/МС: m/z 662 [M+H]+
ВЭЖХ время удерживания: 3,40 мин (условия анализа D)
[Пример 686]
Соединение T26-2
3-Йод-6,6-диметил-8-((2R,3R)-2,3,4-тригидрокси-бутокси)-5,6-дигидро-бензо[b]карбазол-11-он

С использованием тех же условий, как в способе синтеза Соединения A7-14-2, получали указанное в заголовке соединение, исходя из Соединения T26-1 (17,0 мг, 90%).
ЖХ/МС: m/z 508 [M+H]+
ВЭЖХ время удерживания: 1,77 мин (условия анализа D)
[Пример 687]
Соединение T27-1
3-Бром-9-(2-фтор-4-метокси-фенил)-8-метокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он
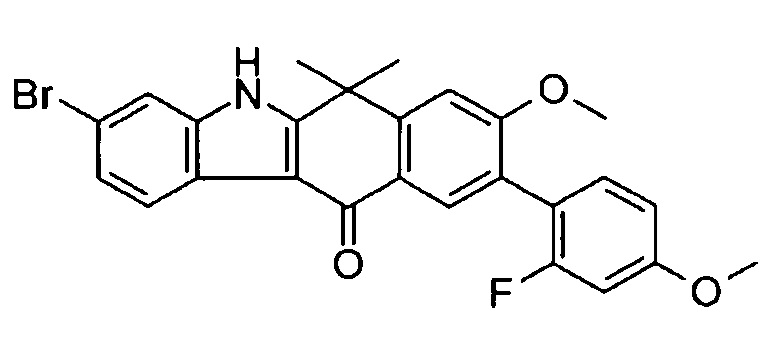
К смеси 6-бром-7-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-она (Соединение E1, 410 мг, 1,44 ммоль), тетракистрифенилфосфинпалладия (80 мг, 0,05 экв.) и карбоната натрия (614 мг, 4 экв.) добавляли толуол (3 мл) и воду (1 мл) и затем перемешивали при комнатной температуре и при 90°C в течение 3 часов. Смесь экстрагировали путем добавления воды и диэтилового эфира, и органический слой промывали насыщенным солевым раствором и сушили над сульфатом магния. Остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением 6-(2-фтор-4-метокси-фенил)-7-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-она (белое твердое вещество, 320 мг).
Полученный таким образом 6-(2-фтор-4-метокси-фенил)-7-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-он (320 мг, 0,1 ммоль) и 3-бромфенилгидразин (0,29 г, 1,3 экв.) растворяли в уксусной кислоте (1 мл) и перемешивали в атмосфере азота при 90°C в течение 8 часов. После охлаждения к реакционному раствору добавляли этилацетат, промывали водой, насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором, сушили над сульфатом магния и затем фильтровали. Остатки, полученные после концентрирования при пониженном давлении, растворяли в ТГФ (3 мл), содержащем 10% воды, добавляли DDQ (227 мг, 3 экв.) при комнатной температуре и перемешивали при комнатной температуре в течение 2 часов. К реакционному раствору добавляли смесь ТГФ/диэтиловый эфир (1:1), и реакционный раствор промывали 0,5 н водным раствором гидроксида натрия и насыщенным солевым раствором, сушили над сульфатом натрия и затем фильтровали. Остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (красное твердое вещество, 75 мг).
ЖХ/МС: m/z 494, 496 [M+H]+
ВЭЖХ время удерживания: 3,10 мин (условия анализа C)
[Пример 688]
Соединение T27-2
3-Бром-9-(2-фтор-4-гидрокси-фенил)-8-гидрокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

С использованием тех же условий, как в способе синтеза Соединения A6, получали указанное в заголовке соединение, исходя из Соединения T27-1.
ЖХ/МС: m/z 464, 466 [M+H]+
ВЭЖХ время удерживания: 2,68 мин (условия анализа C)
[Пример 689]
Соединение U5
4-Бром-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

2-Бром-3-нитро-бензонитрил (Соединение U1, 678 мг, 2,987 ммоль) растворяли в этаноле (20,9 мл) и воде (8,96 мл), добавляли уксусную кислоту (2,39 мл, 41,81 ммоль) и железо (1,17 г, 20,91 ммоль) и перемешивали при 60°C в течение 18 часов. Реакционный раствор выливали в водный раствор гидроксида натрия (1 M), экстрагировали этилацетатом, промывали водой и насыщенным солевым раствором, сушили над сульфатом натрия и затем фильтровали. После концентрирования при пониженном давлении получали 3-амино-2-бром-бензонитрил (Соединение U2) в виде неочищенного продукта.
Неочищенный продукт, полученный, как описано выше, растворяли в 12 M водном растворе хлористоводородной кислоты (4,00 мл), добавляли медленно при 0°C водный раствор, в котором нитрит натрия (247 мг, 3,584 ммоль) был растворен в воде (3,58 мл), и затем смесь перемешивали при 0°C в течение 30 минут. В условиях защиты от света, водный раствор, в котором хлорид олова дигидрат (2,02 г, 8,961 ммоль) был растворен в 12 M водном растворе хлористоводородной кислоты (4,00 мл), медленно добавляли к реакционному раствору при 0°C и затем смесь перемешивали при 0°C в течение 1 часа. Реакционный раствор выливали в 5 M водный раствор гидроксида натрия, экстрагировали этилацетатом, промывали насыщенным солевым раствором, сушили над сульфатом натрия и фильтровали. После концентрирования при пониженном давлении получали 2-бром-3-гидразино-бензонитрил (Соединение U3) в виде неочищенного продукта. В атмосфере азота к указанному неочищенному продукту и 7-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-ону (Соединение A2, 462 мг, 2,260 ммоль) добавляли TFA (6,78 мл) и перемешивали при 100°C в течение 2 часов. После охлаждения реакционный раствор выливали в насыщенный водный раствор бикарбоната натрия, экстрагировали этилацетатом, промывали водой и насыщенным солевым раствором, сушили над сульфатом натрия и фильтровали. После концентрирования при пониженном давлении получали 4-бром-8-метокси-6,6-диметил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил (Соединение U4) в виде неочищенного продукта. Указанный неочищенный продукт растворяли в ТГФ (10,0 мл) и воде (1,00 мл), добавляли 2,3-дихлор-5,6-дициано-1,4-бензохинон (1,54 г, 6,780 ммоль) и перемешивали при комнатной температуре в течение 20 часов. Реакционный раствор выливали в 1 M водный раствор гидроксида натрия, экстрагировали циклопентилметиловым эфиром, промывали 1 M водным раствором гидроксида натрия, водой и насыщенным солевым раствором, сушили над сульфатом натрия и фильтровали. Остатки, полученные после концентрирования при пониженном давлении, промывали циклопентилметиловым эфиром с получением указанного в заголовке соединения (460 мг, 52%).
ЖХ/МС: m/z 395 [M+H]+
ВЭЖХ время удерживания: 2,25 мин (условия анализа D)
[Пример 690]
Соединение U6
8-Гидрокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

К 4-бром-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрилу (Соединение U5, 325 мг, 0,822 ммоль) добавляли пиридин в форме гидрохлоридной соли (3,80 г, 32,89 ммоль) и перемешивали при 160°C в течение 28 часов. Реакционный раствор выливали в воду, экстрагировали этилацетатом, промывали водой, сушили над сульфатом натрия и фильтровали. После концентрирования при пониженном давлении указанное в заголовке соединение получали в виде неочищенного продукта.
ЖХ/МС: m/z 381 [M+H]+
ВЭЖХ время удерживания: 1,92 мин (условия анализа D)
[Пример 691]
Соединение U7-1
4-Бром-8-((R)-2,2-диметил-[1,3]диоксолан-4-илметокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-1, указанное в заголовке соединение получали в результате взаимодействия между Соединением U6 и (R)-(-)-2,2-диметил-1,3-диоксолан-4-метанолом (354 мг, 87%).
ЖХ/МС: m/z 495 [M+H]+
ВЭЖХ время удерживания: 2,35 мин (условия анализа D)
[Пример 692]
Соединение U7-2
4-Бром-8-((S)-2,3-дигидрокси-пропокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-14-2, получали указанное в заголовке соединение, исходя из Соединения U7-1.
ЖХ/МС: m/z 455 [M+H]+
ВЭЖХ время удерживания: 2,40 мин (условия анализа C)
[Пример 693]
Соединение U8-2
8-((R)-2,3-Дигидрокси-пропокси)-5,6,6-триметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения U7-1 и Соединения U7-2, указанное в заголовке соединение получали в результате взаимодействия между Соединением U6 и (S)-(+)-2,2-диметил-1,3-диоксолан-4-метанолом (4,5 мг, 29%).
ЖХ/МС: m/z 455 [M+H]+
ВЭЖХ время удерживания: 2,37 мин (условия анализа C)
[Пример 694]
Соединение U8-3-1
8-((S)-2,2-Диметил[1,3]диоксолан-4-илметокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3,4-дикарбонитрил

В атмосфере азота 4-бром-8-((S)-2,2-диметил[1,3]диоксолан-4-илметокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил (Соединение U6, 20,0 мг, 40,37 мкмоль) растворяли в DMA (0,35 мл), добавляли цианид меди(I) (18,1 мг, 201,9 мкмоль) и перемешивали при 200°C в течение 1 часа в условиях микроволнового облучения. Реакционный раствор выливали в воду, экстрагировали этилацетатом, промывали водой и насыщенным солевым раствором, сушили над сульфатом натрия и затем фильтровали. Остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения в виде неочищенного продукта.
ЖХ/МС: m/z 442 [M+H]+
ВЭЖХ время удерживания: 2,30 мин (условия анализа D)
[Пример 695]
Соединение U8-3-2
8-((R)-2,3-Дигидрокси-пропокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3,4-дикарбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-14-2, получали указанное в заголовке соединение, исходя из Соединения U8-3-1 (9,5 мг, 59%).
ЖХ/МС: m/z 402 [M+H]+
ВЭЖХ время удерживания: 2,40 мин (условия анализа D)
[Пример 696]
Соединение U8-4-1
8-((R)-2,2-Диметил[1,3]диоксолан-4-илметокси)-4-гидрокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения U9, получали указанное в заголовке соединение в виде неочищенного продукта, исходя из Соединения U8-1 (9,5 мг, 59%).
ЖХ/МС: m/z 433 [M+H]+
ВЭЖХ время удерживания: 2,34 мин (условия анализа A)
[Пример 697]
Соединение U8-4-2
8-((R)-2,3-Дигидрокси-пропокси)-4-гидрокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
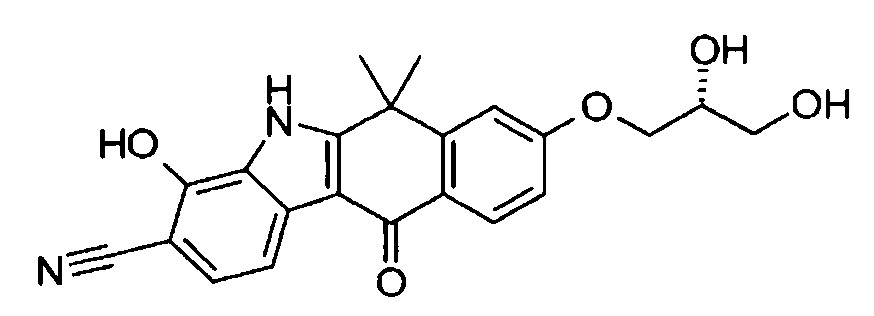
С использованием тех же условий, как в способе синтеза Соединения A7-14-2, получали указанное в заголовке соединение, исходя из Соединения U8-4-1 (неочищенный продукт) (9,7 мг, 52%).
ЖХ/МС: m/z 393 [M+H]+
ВЭЖХ время удерживания: 1,69 мин (условия анализа A)
[Пример 698]
Соединение U8-4-3
8-((R)-2,3-Дигидрокси-пропокси)-4-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

В атмосфере азота 8-((R)-2,3-дигидрокси-пропокси)-4-гидрокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил (Соединение U8-4-2, 8,0 мг, 20,39 мкмоль) растворяли в метаноле (2,0 мл) и хлороформе (2,00 мл), добавляли триметилсилилдиазометан (раствор в диэтиловом эфире, 2 M, 15,3 мкл, 30,58 мкмоль) и диизопропилэтиламин (0,05 мл) и затем перемешивали при комнатной температуре в течение 31 часа. Остатки, полученные после концентрирования реакционного раствора при пониженном давлении, очищали колоночной хроматографией на силикагеле (метанол/дихлорметан) с получением указанного в заголовке соединения (5,1 мг, 62%).
ЖХ/МС: m/z 407 [M+H]+
ВЭЖХ время удерживания: 3,74 мин (условия анализа A)
[Пример 699]
Соединение U8-5-1
8-((R)-2,2-Диметил[1,3]диоксолан-4-илметокси)-6,6-диметил-11-оксо-4-трифторметил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

В атмосфере азота 4-бром-8-((S)-2,2-диметил[1,3]диоксолан-4-илметокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил (Соединение U8-1, 25,0 мг, 50,47 мкмоль) растворяли в DMF (0,75 мл), добавляли йодид меди(I) (48,0 мг, 252,3 мкмоль) и метиловый эфир дифтор-фторсульфонилуксусной кислоты (31,9 мкл, 252,3 мкмоль) и затем перемешивали при 100°C в течение 2 дней. Реакционный раствор выливали в хлористоводородную кислоту (1 M), экстрагировали этилацетатом, промывали водой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над сульфатом натрия и затем фильтровали. Остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения в виде неочищенного продукта.
ЖХ/МС: m/z 485 [M+H]+
ВЭЖХ время удерживания: 2,88 мин (условия анализа A)
[Пример 700]
Соединение U8-5-2
8-((R)-2,3-Дигидрокси-пропокси)-6,6-диметил-11-оксо-4-трифторметил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-14-2, получали указанное в заголовке соединение, исходя из Соединения U8-5-1 (4,0 мг, 30%).
ЖХ/МС: m/z 445 [M+H]+
ВЭЖХ время удерживания: 2,17 мин (условия анализа A)
[Пример 701]
Соединение U8-6-1
4-Циклопропил-8-((S)-2,2-диметил[1,3]диоксолан-4-илметокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

В атмосфере азота 2-циклопропил-4,4,5,5-тетраметил[1,3,2]диоксаборолан (13,2 мг, 78,73 мкмоль) и фосфат калия (212,27 мг, 212,0 мкмоль) растворяли в воде (0,20 мл) и смесь перемешивали при комнатной температуре в течение 15 минут. К реакционному раствору добавляли 4-бром-8-((S)-2,2-диметил[1,3]диоксолан-4-илметокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил (Соединение U8-1, 30,0 мг, 60,56 мкмоль), ацетат палладия (1,36 мг, 6,056 мкмоль) и трициклогексилфосфин (раствор в толуоле, 20% масс., 17,0 мг, 12,11 мкмоль) и смесь перемешивали при 80°C в течение 24 часов. Реакционный раствор выливали в хлористоводородную кислоту (1 M), экстрагировали этилацетатом, промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над сульфатом натрия и затем фильтровали. Остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (13,6 мг, 49%).
ЖХ/МС: m/z 457 [M+H]+
ВЭЖХ время удерживания: 2,38 мин (условия анализа D)
[Пример 702]
Соединение U8-6-2
4-Циклопропил-8-((R)-2,3-дигидрокси-пропокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-14-2, получали указанное в заголовке соединение, исходя из Соединения U8-6-1.
ЖХ/МС: m/z 417 [M+H]+
ВЭЖХ время удерживания: 2,42 мин (условия анализа A)
[Пример 703]
Соединение U8-7-1
(S)-8-((2,2-Диметил-1,3-диоксолан-4-ил)метокси)-4,6,6-триметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

В атмосфере азота 4-бром-8-((S)-2,2-диметил[1,3]диоксолан-4-илметокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил (Соединение U8-1, 30,0 мг, 60,56 мкмоль) и хлорид лития (7,70 мг, 181,7 мкмоль) растворяли в DMF (1,00 мл), добавляли тетраметилолово (12,5 мкл, 90,84 мкмоль), тетракистрифенилфосфинпалладий (3,50 мг, 6,056 мкмоль) и трициклогексилфосфин (раствор в толуоле, 20% масс., 17,0 мг, 3,028 мкмоль) и смесь перемешивали при 100°C в течение 24 часов. Реакционный раствор выливали в хлористоводородную кислоту (1 M), экстрагировали этилацетатом, промывали водой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над сульфатом натрия и затем фильтровали. Остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением 8-((S)-2,2-диметил[1,3]диоксолан-4-илметокси)-4,6,6-триметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрила в виде неочищенного продукта (20,9 мг, 80%).
[Пример 704]
Соединение U8-7-2
8-((R)-2,3-Дигидрокси-пропокси)-4,6,6-триметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-14-2, получали указанное в заголовке соединение, исходя из Соединения U8-7-1.
ЖХ/МС: m/z 391 [M+H]+
ВЭЖХ время удерживания: 1,82 мин (условия анализа A)
[Пример 705]
Соединение U8-8-1
Амид 3-циано-8-((S)-2,2-диметил[1,3]диоксолан-4-илметокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-4-карбоновой кислоты

В атмосфере азота 4-бром-8-((S)-2,2-диметил[1,3]диоксолан-4-илметокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил (Соединение U8-1, 30,0 мг, 60,56 мкмоль), ацетат палладия (1,36 мг, 6,056 мкмоль), 1,1’-бис(дифенилфосфино)ферроцен (3,36 мг, 6,056 мкмоль), имидазол (4,12 мг, 60,56 мкмоль) и трет-бутоксид калия (10,2 мг, 90,84 мкмоль) растворяли в формамиде (3,00 мл) и смесь перемешивали при 180°C в течение 5 минут в условиях микроволнового облучения. Реакционный раствор выливали в воду, экстрагировали этилацетатом, промывали водой и насыщенным солевым раствором, сушили над сульфатом натрия и затем фильтровали. Остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (метанол/дихлорметан) с получением целевого соединения (7,6 мг, 27%).
ЖХ/МС: m/z 460 [M+H]+
ВЭЖХ время удерживания: 1,82 мин (условия анализа A)
[Пример 706]
Соединение U8-8-2
3-Циано-8-((R)-2,3-дигидрокси-пропокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-4-карбоновая кислота

С использованием тех же условий, как в способе синтеза Соединения A7-14-2, получали указанное в заголовке соединение, исходя из Соединения U8-8-1.
ЖХ/МС: m/z 421 [M+H]+
ВЭЖХ время удерживания: 1,57 мин (условия анализа A)
[Пример 707]
Соединение U8-8-3
Амид 3-циано-8-((R)-2,3-дигидрокси-пропокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-4-карбоновой кислоты

Указанное в заголовке соединение получали в виде побочного продукта синтеза Соединения U8-8-2.
ЖХ/МС: m/z 420 [M+H]+
ВЭЖХ время удерживания: 1,27 мин (условия анализа A)
[Пример 708]
Соединение U9
4-Гидрокси-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

В атмосфере азота 4-бром-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил (Соединение U5, 10,0 мг, 25,30 мкмоль), X-phos (1,07 мг, 2,530 мкмоль), гидроксид натрия (4,36 мг, 75,90 мкмоль) и Pd2dba3·CHCl3(1,31 мг, 1,265 мкмоль) растворяли в диоксане (0,50 мл) и воде (0,50 мл) и смесь перемешивали при 100°C в течение 1 часа. Реакционный раствор выливали в хлористоводородную кислоту (1 M), экстрагировали этилацетатом, промывали насыщенным солевым раствором, сушили над сульфатом натрия и затем фильтровали. Остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) и промывали дихлорметаном с получением указанного в заголовке соединения (5,4 мг, 64%).
ЖХ/МС: m/z 333 [M+H]+
ВЭЖХ время удерживания: 1,62 мин (условия анализа D)
[Пример 709]
Соединение U10-1
4-((R)-2,3-Дигидрокси-пропокси)-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-1, указанное в заголовке соединение получали в результате взаимодействия между Соединением U9 и (S)-(+)-2,2-диметил-1,3-диоксолан-4-метанолом.
ЖХ/МС: m/z 407 [M+H]+
ВЭЖХ время удерживания: 2,06 мин (условия анализа A)
[Пример 710]
Соединение U10-2
4-((S)-2,3-Дигидрокси-пропокси)-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-1, указанное в заголовке соединение получали в результате взаимодействия между Соединением U9 и (R)-(-)-2,2-диметил-1,3-диоксолан-4-метанолом.
ЖХ/МС: m/z 407 [M+H]+
ВЭЖХ время удерживания: 2,06 мин (условия анализа A)
[Пример 711]
Соединение U11
4-Амино-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

В атмосфере азота 4-бром-8-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил (Соединение U5, 25,0 мг, 63,25 мкмоль), йодид меди (2,41 мг, 12,65 мкмоль), азид натрия (20,6 мг, 316,3 мкмоль), (1S,2S)-N,N’-диметил-циклогексан-1,2-диамин (2,70 мг, 18,98 мкмоль) и аскорбат натрия (1,25 мг, 6,325 мкмоль) растворяли в этаноле (0,70 мл) и воде (0,30 мл) и смесь перемешивали при 100°C в течение 2 часов. Реакционный раствор выливали в водный раствор гидроксида натрия (1 M), экстрагировали этилацетатом, промывали водой и насыщенным солевым раствором, сушили над сульфатом натрия и затем фильтровали. Остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (метанол/дихлорметан) с получением указанного в заголовке соединения (5,6 мг, 27%).
ЖХ/МС: m/z 332 [M+H]+
ВЭЖХ время удерживания: 2,16 мин (условия анализа A)
[Пример 712]
Соединение V2
3-Фтор-8-метокси-6,6-диметил-6,11-дигидро-5H-бензо[b]карбазол
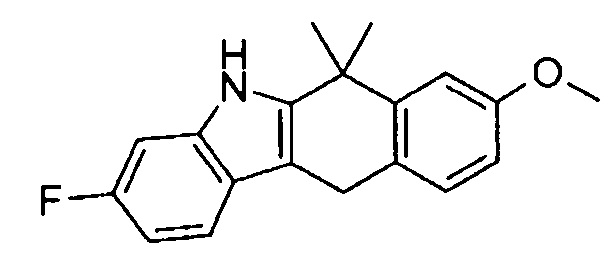
В атмосфере азота суспензию 7-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-она (Соединение A2, 101,0 мг, 0,495 ммоль) и (3-фторфенил)гидразина в форме соли хлористоводородной кислоты (Соединение V1, 96,5 мг, 0,593 ммоль) в уксусной кислоте (1 мл) перемешивали при температуре окружающей среды 95°C в течение 3,75 часов. После охлаждения до комнатной температуры к реакционной смеси добавляли воду (1 мл) и гексан/этилацетат (15:1) (0,5 мл) и перемешивали при комнатной температуре в течение 15 минут. Твердое вещество фильтровали, промывали смесью гексан/этилацетат (15:1) и затем сушили при пониженном давлении с получением указанного в заголовке соединения (порошок бежевого цвета, 72,7 мг, 50%).
1H-ЯМР(270 МГц, CDCl3) δ: 7,92-7,82 (1 H, ушир.), 7,47 (1 H, дд, 8,9 Гц, 5,6 Гц), 7,10-7,03 (2 H, м), 6,95-6,81 (2 H, м), 4,05 (2 H, с), 3,86 (3 H, с), 1,67 (6 H, с).
[Пример 713]
Соединение V3
3-Фтор-8-метокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он
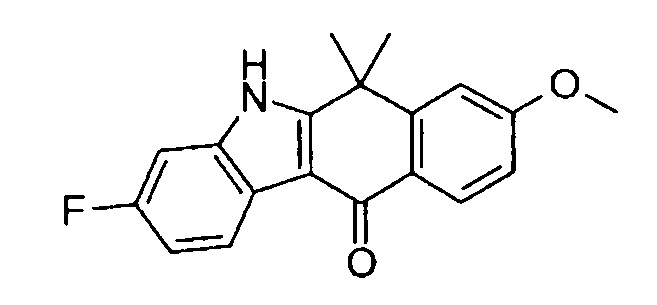
В атмосфере азота к раствору 3-фтор-8-метокси-6,6-диметил-6,11-дигидро-5H-бензо[b]карбазола (Соединение V2, 72,4 мг, 0,245 ммоль) в ТГФ (1,8 мл)-воде (0,18 мл) добавляли DDQ (122,4 мг, 0,539 ммоль) и смесь перемешивали при комнатной температуре в течение 5 часов. К реакционной смеси добавляли диэтиловый эфир и 0,5 н водный раствор гидроксида натрия (2 мл) и полученную смесь экстрагировали два раза диэтиловым эфиром. Органический слой промывали два раза 0,5 н водным раствором гидроксида натрия (2 мл) и затем два раза насыщенным солевым раствором (2 мл) и сушили над сульфатом натрия. После концентрирования при пониженном давлении к полученному неочищенному продукту добавляли гексан/этилацетат (5:1) и диэтиловый эфир, и твердое вещество растирали в порошок. После удаления надосадочной жидкости и сушки при пониженном давлении получали указанное в заголовке соединение (желтое твердое вещество, 57,0 мг, 75%).
1H-ЯМР(270 МГц, CDCl3) δ: 8,54-8,44 (1 H, ушир.), 8,43-8,33 (2 H, м), 7,16-6,98 (4 H, м), 3,93 (3 H, с), 1,77 (6 H, с).
[Пример 714]
Соединение V4
3-Фтор-8-гидрокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

Смесь 3-фтор-8-метокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-она (Соединение V3, 56,6 мг, 0,183 ммоль) и пиридинийхлорида (0,65 г) перемешивали при температуре окружающей среды 160°C в течение 12 часов. Реакционную смесь охлаждали до комнатной температуры, добавляли этилацетат и воду и полученную смесь экстрагировали четыре раза этилацетатом. Органический слой промывали водой три раза, сушили над сульфатом натрия и концентрировали при пониженном давлении. Полученный неочищенный продукт использовали на следующей стадии без дополнительной очистки (коричневое твердое вещество, 61,6 мг, 100%).
1H-ЯМР(270 МГц, CD3OD) δ: 8,20 (1 H, дд, 8,9 Гц, 5,3 Гц), 8,15 (1 H, д, 9,6 Гц), 7,17 (1 H, дд, 9,6 Гц, 2,3 Гц), 7,12 (1 H, д, 2,3 Гц), 7,05-6,95 (1 H, м), 6,88 (1 H, дд, 8,9 Гц, 2,3 Гц), 1,74 (6 H, с).
[Пример 715]
Соединение V5-1
8-[(1R,5R)-5-(Трет-бутил-диметил-силанилоксиметил)-2,2-диметил[1,3]диоксолан-4-илметокси]-3-фтор-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

В атмосфере азота к ТГФ (1,5 мл) раствору 3-фтор-8-гидрокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-она (Соединение V4, 0,183 ммоль), (4S,5R)-5-(трет-бутил-диметилсиланилоксиметил)-2,2-диметил[1,3]диоксолан-4-ола (75,9 мг, 0,275 ммоль) и трифенилфосфина (72 мг, 0,275 ммоль) добавляли раствор DEAD в толуоле (125 мкл, 0,275 ммоль) по каплям при комнатной температуре. Реакционную смесь перемешивали при температуре окружающей среды 40°C в течение 7 часов. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении, и полученный неочищенный продукт очищали при помощи препаративной ТСХ (Merck 60 F254, 0,5 мм) {раствор для элюирования: гексан/этилацетат (3:1)} с получением указанного в заголовке соединения (бледно-оранжевое аморфное вещество, 54,1 мг, 53,4%).
1H-ЯМР(270 МГц, CDCl3) δ: 8,54-8,45 (1 H, ушир.), 8,42-8,33 (2 H, м), 7,17-6,99 (4 H, м), 4,41-4,27 (2 H, м), 4,25-4,15 (1 H, м), 4,06-3,96 (1 H, м), 3,96-3,88 (1 H, м), 3,83-3,74 (1 H, м), 1,76 (3 H, с), 1,75 (3 H, с), 1,48 (3 H, с), 1,47 (3 H, с), 0,87 (9 H, с), 0,092 (6 H, с).
[Пример 716]
Соединение V5-2
3-Фтор-6,6-диметил-8-((3R,4R)-2,3,4-тригидрокси-бутокси)-5,6-дигидро-бензо[b]карбазол-11-он

В атмосфере азота к раствору 8-[(1R,5R)-5-(трет-бутил-диметилсиланилоксиметил)-2,2-диметил[1,3]диоксолан-4-илметокси]-3-фтор-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-она (Соединение V5-1, 52,8 мг, 0,0954 ммоль) в ТГФ (0,3 мл)-MeOH (0,1 мл) добавляли 0,5 M водный раствор серной кислоты (0,19 мл, 0,0954 ммоль) при комнатной температуре. Реакционную смесь перемешивали при температуре окружающей среды 55°C в течение 4 часов, охлаждали до комнатной температуры и затем добавляли диэтиловый эфир, гидрокарбонат натрия (20 мг) и воду, в указанном порядке. Смесь экстрагировали два раза диэтиловым эфиром и затем два раза этилацетатом, и органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали при пониженном давлении. Полученный неочищенный продукт промывали дихлорметаном и сушили при пониженном давлении с получением указанного в заголовке соединения (белый порошок, 29,9 мг, 78%).
1H-ЯМР(270 МГц, CD3OD) δ: 8,24 (1 H, д, 8,9 Гц), 8,19 (1 H, дд, 8,6 Гц, 5,3 Гц), 7,30 (1 H, д, 2,3 Гц), 7,18 (1 H, дд, 9,2 Гц, 2,3 Гц), 7,09 (1 H, дд, 8,9 Гц, 2,3 Гц), 7,06-6,96 (1 H, м), 4,32-4,22 (1 H, м), 4,21-4,12 (1 H, м), 4,11-4,02 (1 H, м), 3,84-3,75 (1 H, м), 3,74-3,61 (2 H, м), 1,77 (6 H, с).
ЖХ/МС: м/z 400 [М+H]+
ВЭЖХ время удерживания: 4,02 мин (условия анализа H)
[Пример 717]
Соединение W2
7-((S)-2,3-Дигидрокси-пропокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
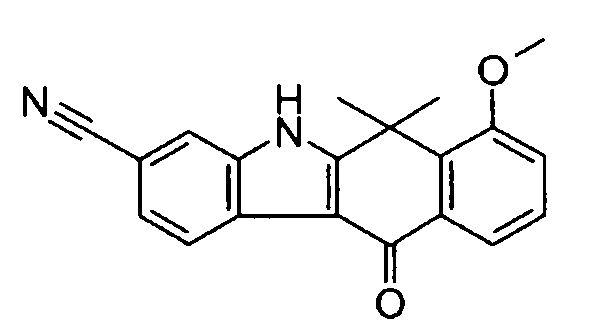
К суспензии трет-бутоксида натрия (700 мг, 2,5 экв.) в толуоле добавляли по каплям 8-метокси-3,4-дигидро-1H-нафталин-2-он (Соединение W1, 500 мг, 2,9 ммоль) при 0°C. Через 15 минут цвет раствора становился черновато-зеленым. К смешанному раствору добавляли по каплям метилйодид (1,03 г, 2,5 экв.) и перемешивали при 15°C в течение ночи. Происходило осаждение коричневого твердого вещества. Реакционный раствор добавляли к насыщенному водному раствору хлорида аммония/диэтилового эфира при перемешивании и охлаждении. Затем раствор экстрагировали диэтиловым эфиром и сушили над сульфатом натрия. После удаления растворителя при пониженном давлении полученные остатки очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением 8-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-она (350 мг).
Полученный таким образом 8-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-он (250 мг, 1,23 ммоль) и 3-цианофенилгидразин (0,2 г, 1,2 экв.) растворяли в трифторуксусной кислоте (1 мл) и перемешивали при 120°C в течение 1 часа в условиях микроволнового облучения. После охлаждения к реакционному раствору добавляли этилацетат, промывали водой, насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором, сушили над сульфатом магния и фильтровали. Остатки, полученные после концентрирования при пониженном давлении, растворяли в ТГФ (3 мл), содержащем 10% воды, и добавляли при комнатной температуре DDQ (227 мг, 3 экв.). Смесь затем перемешивали при комнатной температуре в течение 2 часов. К реакционному раствору добавляли смешанный раствор ТГФ/диэтиловый эфир (1:1), промывали 0,5 н водным раствором гидроксида натрия и насыщенным солевым раствором, сушили над сульфатом натрия и затем фильтровали. Остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением 7-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрила (коричневое твердое вещество, 54 мг).
ЖХ/МС: m/z 317 [M+H]+
ВЭЖХ время удерживания: 1,00 мин (условия анализа I)
[Пример 718]
Соединение W3
7-Гидрокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
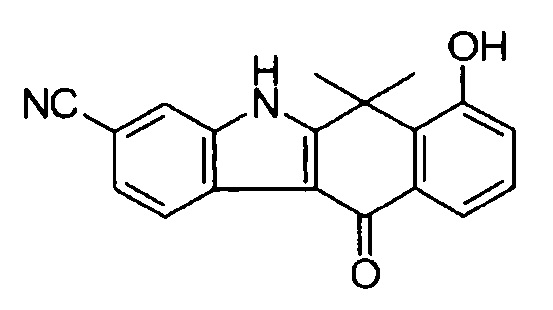
В условиях, аналогичных условиям получения Соединения A6, получали указанное в заголовке соединение, исходя из Соединения W2.
ЖХ/МС: m/z 316 [M+H]+
ВЭЖХ время удерживания: 0,93 мин (условия анализа I)
[Пример 719]
Соединение W4-1
7-((R)-2,2-Диметил[1,3]диоксолан-4-илметокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

В атмосфере азота к 7-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрилу (Соединение W3, 15 мг, 0,05 ммоль) и трифенилфосфину (40 мг, 3 экв.) добавляли ТГФ (1 мл), затем добавляли по каплям ((R)-2,2-диметил[1,3]диоксолан-4-ил)метанол (20 мг, 3 экв.) и 2,19 н раствор диэтилазодикарбоксилата (68 мкл, 3 экв.) в толуоле и смесь перемешивали при 50°C в течение 2 часов. После охлаждения к реакционному раствору добавляли этилацетат, промывали насыщенным солевым раствором, сушили над сульфатом натрия и фильтровали. Остатки, полученные после концентрирования при пониженном давлении, очищали при помощи препаративной ТСХ (этилацетат/дихлорметан), и полученное твердое вещество промывали дихлорметаном с получением целевого соединения (коричневый порошок, 5 мг).
ЖХ/МС: m/z 417 [M+H]+
ВЭЖХ время удерживания: 1,04 мин (условия анализа I)
[Пример 720]
Соединение W4-2
7-((S)-2,3-Дигидрокси-пропокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

В условиях, аналогичных условиям получения Соединения S7-2, получали указанное в заголовке соединение, исходя из Соединения W4-1.
ЖХ/МС: m/z 377 [M+H]+
ВЭЖХ время удерживания: 0,88 мин (условия анализа I)
[Пример 721]
Соединение X1
1,1-Спиро-4-пиперидин-N-паратолуолсульфонил-7-метокси-3,4-дигидро-1H-нафталин-2-он

7-Метокси-3,4-дигидро-1H-нафталин-2-он (Соединение A1, 100 мг, 0,568 ммоль) растворяли в толуоле (4 мл), добавляли NaH (60% в масло, 68 мг, 3 экв.) и перемешивали при комнатной температуре в течение 10 минут. К смешанному раствору добавляли бис-(2-йод-этил)-п-толуолсульфонамид (172 мг, 0,568 ммоль) и перемешивали при 70°C в течение 2 часов под потоком азота. После охлаждения реакционный раствор добавляли к насыщенному водному раствору хлорида аммония, экстрагировали этилацетатом, промывали насыщенным солевым раствором и затем сушили над сульфатом магния. Остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (гексан:этилацетат/3:1) с получением указанного в заголовке соединения (бесцветное маслянистое вещество, 62 мг, 33%).
ЖХ/МС: m/z 400 [M+H]+
ВЭЖХ время удерживания: 2,02 мин (условия анализа B)
[Пример 722]
Соединение X2
1,1-Спиро-4-пиперидин-N-паратолуолсульфонил-7-метокси-3,4-дигидро-1H-нафталин-2-он

1,1-Спиро-4-пиперидин-N-паратолуолсульфонил-7-метокси-3,4-дигидро-1H-нафталин-2-он (Соединение X1, 400 мг, 1,0 ммоль) и фенилгидразин (217 мг, 1,5 экв.) растворяли в уксусной кислоте (6 мл) и смесь перемешивали при 120°C в течение 4 часов в атмосфере азота. После охлаждения реакционный раствор добавляли в воду, экстрагировали этилацетатом, промывали насыщенным солевым раствором и затем сушили над сульфатом магния. Остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (гексан:этилацетат/4:1) с получением указанного в заголовке соединения (коричневое твердое вещество, 185 мг, 43%).
ЖХ/МС: m/z 473 [M+H]+
ВЭЖХ время удерживания: 7,23 мин (условия анализа B)
[Пример 723]
Соединение X3
6,6-Спиро-4-пиперидин-N-паратолуолсульфонил-8-метокси-5,6-дигидро-бензо[b]карбазол-11-он

6,6-Спиро-4-пиперидин-N-паратолуолсульфонил-8-метокси-5,6-дигидро-5H-бензо[b]карбазол (Соединение X2, 400 мг, 0,848 ммоль) и DDQ (770 мг, 4 экв.) растворяли в ТГФ (10 мл) и воде (2 мл) и затем смесь перемешивали при 50°C в течение 5 часов. После охлаждения реакционный раствор добавляли к насыщенному водному раствору гидрокарбоната натрия, экстрагировали этилацетатом, промывали насыщенным солевым раствором и затем сушили над сульфатом магния. Остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (гексан:этилацетат/3:1) с получением твердого вещества, затем смесь промывали этиловым эфиром с получением указанного в заголовке соединения (желтое твердое вещество, 86 мг, 21%).
1H-ЯМР(400 МГц, DМSO-d6) δ: 11,9 (1 H, с), 8,22 (2 H, м), 7,75 (2 H, д), 7,60 (4 H, м) 7,30 (2 H, м), 7,11 (1 H, д), 3,81 (2 H, м), 3,68 (3 H, с), 3,62 (2 H, м), 2,49 (3 H, с), 2,21 (2H, м), 2,10 (2 H, м).
ЖХ/МС: м/z 487 [М+H]+
ВЭЖХ время удерживания: 6,05 мин (условия анализа B)
[Пример 724]
Соединение X4
6,6-Спиро-4-пиперидин-8-гидрокси-5,6-дигидро-бензо[b]карбазол-11-он
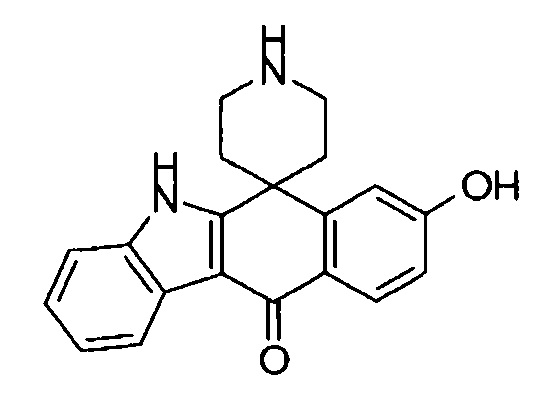
Смесь 6,6-спиро-4-пиперидин-N-паратолуолсульфонил-8-метокси-5,6-дигидро-бензо[b]карбазол-11-она (Соединение X3, 35 мг, 0,072 ммоль) и пиридина в виде гидрохлоридной соли (800 мг) перемешивали в герметично закрываемой пробирке при 160°C в течение 10 часов. После охлаждения реакционный раствор добавляли в воду, экстрагировали этилацетатом, промывали насыщенным солевым раствором и затем сушили над сульфатом магния. Остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (дихлорметан:метанол/4:1) с получением указанного в заголовке соединения (желтое твердое вещество, 30 мг, 98%).
1H-ЯМР(400 МГц, DМSO-d6) δ: 8,20 (1 H, м), 8,10 (1 H, м), 7,53 (1 H, м), 7,25 (3 H, м), 6,80 (1 H, м), 3,60 (2 H, м), 3,45 (2 H, м), 2,52 (2 H, м), 2,05 (2 H, м).
ЖХ/МС: м/z 319 [М+H]+
ВЭЖХ время удерживания: 2,86 мин (условия анализа B)
[Пример 725]
Соединение X5
8-(2-Диэтиламиноэтокси)-6,6-спиро-4-пиперидин-8-гидрокси-5,6-дигидро-бензо[b]карбазол-11-он

6,6-Спиро-4-пиперидин-8-гидрокси-5,6-дигидро-бензо[b]карбазол-11-он (Соединение X4, 30 мг, 0,094 ммоль), диэтиламиноэтанол (22 мг, 2 экв.), трифенилфосфин (50 мг, 2 экв.) и DIAD (39 мг, 2 экв.) растворяли в ТГФ (4 мл) и смесь перемешивали при комнатной температуре в течение 4 часов. Реакционный раствор добавляли в воду, экстрагировали этилацетатом, промывали насыщенным солевым раствором и затем сушили над сульфатом магния. Остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (дихлорметан:метанол/4:1) с получением указанного в заголовке соединения (желтое маслянистое вещество, 6,8 мг, 17%).
ЖХ/МС: m/z 418 [M+H]+
ВЭЖХ время удерживания: 2,75 мин (условия анализа B)
[Пример 726]
Соединение Y2
2,3-Дихлор-8-метокси-6,6-диметил-6,11-дигидро-5H-бензо[b]карбазол

В атмосфере азота суспензию 7-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-она (Соединение A2, 92,3 мг, 0,452 ммоль) и (3,4-дихлорфенил)гидразина в форме соли хлористоводородной кислоты (Соединение Y1, 96,5 мг, 0,452 ммоль) в уксусной кислоте (1 мл) перемешивали при температуре окружающей среды 90°C в течение 3,5 часов. После охлаждения до комнатной температуры к реакционной смеси добавляли диэтиловый эфир и воду и полученную смесь экстрагировали два раза диэтиловым эфиром. Органический слой промывали три раза водой, сушили над сульфатом натрия и концентрировали при пониженном давлении. Полученный неочищенный продукт очищали колоночной флэш-хроматографией {Merck Kieselgel60, раствор для элюирования: гексан/этилацетат (4:1)} с получением указанного в заголовке соединения (бледно-желтое твердое вещество, 62,1 мг, 40%).
1H-ЯМР(270 МГц, CDCl3) δ: 7,92-7,84 (1 H, ушир.), 7,62 (1 H, с), 7,46 (1 H, с), 7,05 (1 H, д, 2,6), 6,84 (1 H, дд, 8,6 Гц, 2,6 Гц), 4,01 (2 H, с), 3,86 (3 H, с), 1,67 (6 H, с).
[Пример 727]
Соединение Y3
2,3-Дихлор-8-метокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

В атмосфере азота к раствору 2,3-дихлор-8-метокси-6,6-диметил-6,11-дигидро-5H-бензо[b]карбазола (Соединение Y2, 61,0 мг, 0,176 ммоль) в 1,4-диоксане (1,7 мл)-воде (0,1 мл) добавляли DDQ (120 мг, 0,529 ммоль) и смесь перемешивали при комнатной температуре в течение 16 часов и 15 минут. Реакционную смесь очищали колоночной флэш-хроматографией {Merck Kieselgel60, раствор для элюирования: гексан/этилацетат (2:1)} с получением указанного в заголовке соединения (бледно-оранжевое твердое вещество, 16,7 мг, 26%).
1H-ЯМР(270 МГц, CDCl3) δ: 8,55 (1 H, с), 8,42-8,36 (1 H, ушир.), 8,39 (1 H, д, 8,6 Гц), 7,54 (1 H, с), 7,08 (1 H, д, 2,3 Гц), 7,03 (1 H, дд, 8,6 Гц, 2,3 Гц), 3,93 (3 H, с), 1,76 (6 H, с).
[Пример 728]
Соединение Y4
2,3-Дихлор-8-гидрокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

Смесь 2,3-дихлор-8-метокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-она (Соединение Y3, 16,5 мг, 0,0457 ммоль) и пиридинийхлорида (0,2 г) перемешивали при температуре окружающей среды 160°C в течение 7 часов. Реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат и воду. Смесь экстрагировали три раза этилацетатом. Органический слой промывали два раза водой, сушили над сульфатом натрия и концентрировали при пониженном давлении. Полученный неочищенный продукт использовали на следующей стадии без дополнительной очистки (коричневое твердое вещество, 14,8 мг, 94%).
1H-ЯМР(270 МГц, CD3OD) δ: 8,34 (1 H, с), 8,14 (1 H, д, 8,6 Гц), 7,61 (1 H, с), 7,10 (1 H, д, 2,3 Гц), 6,89 (1 H, дд, 8,6 Гц, 2,3 Гц), 1,75 (1 H, с).
[Пример 729]
Соединение Y5-1
8-[(1R,5R)-5-(Трет-бутилдиметилсиланилоксиметил)-2,2-диметил[1,3]диоксолан-4-илметокси]-2,3-дихлор-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

В атмосфере азота к ТГФ (0,3 мл) раствору 2,3-дихлор-8-гидрокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-она (Соединение Y4, 12,9 мг, 0,0373 ммоль), (4S,5R)-5-(трет-бутилдиметилсиланилоксиметил)-2,2-диметил-[1,3]диоксолан-4-ола (15,5 мг, 0,0559 ммоль) и трифенилфосфина (14,7 мг, 0,0559 ммоль) добавляли по каплям раствор DEAD в толуоле (25,4 мкл, 0,0559 ммоль) при комнатной температуре. Реакционную смесь перемешивали при температуре окружающей среды 40°C в течение 4 часов. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении, и полученный неочищенный продукт очищали при помощи препаративной ТСХ (Merck 60 F254, 0,5 мм) {раствор для элюирования: гексан/этилацетат (3:1)} с получением указанного в заголовке соединения (белое твердое вещество, 15,1 мг, 67%).
1H-ЯМР(270 МГц, CDCl3) δ: 8,55 (1 H, с), 8,44-8,37 (1 H, ушир.), 8,37 (1 H, д, 8,6 Гц), 7,54 (1 H, с), 7,15 (1 H, д, 2,6 Гц), 7,03 (1 H, дд, 8,6 Гц, 2,6 Гц), 4,41-4,26 (2 H, м), 4,25-4,15 (1 H, м), 4,06-3,86 (2 H, м), 3,83-3,73 (1 H, м), 1,76 (3 H, с), 1,75 (3 H, с), 1,48 (3 H, с), 1,47 (3 H, с), 0,90 (9 H, с), 0,092 (6 H, с).
[Пример 730]
Соединение Y5-2
2,3-Дихлор-6,6-диметил-8-((3R,4R)-2,3,4-тригидрокси-бутокси)-5,6-дигидро-бензо[b]карбазол-11-он

В атмосфере азота к раствору 8-[(1R,5R)-5-(трет-бутил-диметилсиланилоксиметил)-2,2-диметил[1,3]диоксолан-4-илметокси]-2,3-дихлор-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-она (Соединение Y5-1, 14,6 мг, 0,0242 ммоль) в ТГФ (0,2 мл)-MeOH (0,1 мл) добавляли 0,5 M водный раствор серной кислоты (96,6 мкл, 0,0483 ммоль) при комнатной температуре. Реакционную смесь перемешивали при температуре окружающей среды 55°C в течение 3 часов, охлаждали до комнатной температуры и затем добавляли диэтиловый эфир и гидрокарбонат натрия (10 мг), в указанном порядке. Смесь экстрагировали два раза диэтиловым эфиром, и органический слой промывали водой и насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали при пониженном давлении. Полученный неочищенный продукт промывали дихлорметаном и сушили при пониженном давлении с получением указанного в заголовке соединения (белое твердое вещество, 8,3 мг, 76%).
1H-ЯМР(270 МГц, CD3OD) δ: 8,35 (1 H, с), 8,24 (1 H, д, 8,9 Гц), 7,62 (1 H, с), 7,31 (1 H, д, 2,3 Гц), 7,10 (1 H, дд, 8,9 Гц, 2,3 Гц), 4,31-4,23 (1 H, м), 4,12-4,12 (1 H, м), 4,11-4,02 (1 H, м), 3,84-3,74 (1 H, м), 3,73-3,61 (1 H, м), 1,78 (6 H, с).
ЖХ/МС: m/z 450 [M+H]+
ВЭЖХ время удерживания: 4,92 мин (условия анализа H)
[Пример 731]
Соединение Z3
2-[1-(2-Бром-5-метокси-фенил)-1-метилэтил]-бензо[b]тиофен

2-(2-Бром-5-метоксифенил)-2-метил-пропионовую кислоту (1,5 г, 5,5 ммоль) растворяли в метиленхлориде (15 мл), добавляли оксалилхлорид (1,5 мл) и диметилформамид (2 мкл) при комнатной температуре и смесь перемешивали при комнатной температуре в течение 30 минут. После удаления растворителя остатки растворяли в толуоле, добавляли при комнатной температуре 2-[(трифенил-5-фосфанил)метил]бензолтиолгидробромид (2,56 г, 5,5 ммоль) и триэтиламин (2,27 мл) и затем смесь подвергали кипячению с обратным холодильником при нагревании в течение 30 минут. Затем смесь охлаждали до 0°C, добавляли гексаметилдисилазид лития (1 M раствор в тетрагидрофуране, 5,5 мл) и подвергали кипячению с обратным холодильником при нагревании в течение 24 часов. Реакционную смесь экстрагировали этилацетатом и промывали водой. Органический слой сушили над сульфатом магния. Остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (0,55 г, 28%).
1H-ЯМР(270 МГц, CDCl3) δ: 6,61 (1 H, с), 3,37 (3 H, с), 1,83 (6 H, с).
[Пример 732]
Соединение Z4
2-(1-Бензо[b]тиофен-2-ил-1-метил-этил)-4-метокси-бензойная кислота

2-[1-(2-Бром-5-метокси-фенил)-1-метилэтил]-бензо[b]тиофен (Соединение Z3, 40 мг, 0,11 ммоль) растворяли в тетрагидрофуране (0,5 мл), охлаждали до -78°C, добавляли н-бутиллитий (1,57 M, раствор в гексане, 0,07 мл) и смесь перемешивали в течение 10 минут. К реакционной смеси добавляли сухой лед и затем поддерживали в течение 1 часа. Затем к смеси добавляли 0,5 н раствор хлористоводородной кислоты, экстрагировали этилацетатом и промывали водой. Органический слой сушили над сульфатом магния. Остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (22 мг, 55%).
1H-ЯМР(270 МГц, CDCl3) δ: 7,46 (1 H, д), 7,44 (1 H, д), 6,92 (с, 1 H), 6,70 (д, 1 H), 3,84 (с, 3 H), 1,89 (6 H, с).
[Пример 733]
Соединение Z5
8-Метокси-6,6-диметил-6H-бензо[b]нафт[2,3-d]тиофен-11-он

К 2-(1-бензо[b]тиофен-2-ил-1-метилэтил)-4-метокси-бензойной кислоте (Соединение Z4, 68 мг, 0,22 ммоль) добавляли полифосфорную кислоту (3,5 г) и смесь перемешивали в течение 1 часа при 100°C при нагревании. К смеси добавляли воду, экстрагировали этилацетатом и промывали водой. Органический слой сушили над сульфатом магния. Остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (41 мг, 63%).
ЖХ/МС: m/z 309 [M+H]+
ВЭЖХ время удерживания: 2,89 мин (условия анализа C)
[Пример 734]
Соединение Z6
8-Гидрокси-6,6-диметил-6H-бензо[b]нафт[2,3-d]тиофен-11-он

В условиях, аналогичных условиям получения Соединения A6, получали указанное в заголовке соединение, исходя из Соединения Z5.
ЖХ/МС: m/z 295 [M+H]+
ВЭЖХ время удерживания: 2,91 мин (условия анализа F)
[Пример 735]
Соединение Z7
8-(2-Диэтиламино-этокси)-6,6-диметил-6H-бензо[b]нафт[2,3-d]тиофен-11-он

В соответствии со способом, аналогичным способу синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения Z6.
ЖХ/МС: m/z 394 [M+H]+
ВЭЖХ время удерживания: 5,06 мин (условия анализа F)
[Пример 736]
Соединение Z9
2-Бром-1,3-дигидрокситетрагидропиранбензол

К 4-бром-бензол-1,3-диолу (Соединение Z8, 20 г, 105,8 ммоль) и 3,4-дигидро-2H-пирану (38,6 мл) добавляли паратолуолсульфонат пиридиния (266 мг) и смесь перемешивали при 50°C в течение 1 часа. Остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (31,82 мг, 84%).
ЖХ/МС: m/z 358 [M+H]+
ВЭЖХ время удерживания: 3,15 мин (условия анализа C)
[Пример 737]
Соединение Z10
3-(2,4-Дигидрокси-фенил)-7-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-он

К 7-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-ону (Соединение A2, 10 г), 2-бром-1,3-дигидрокситетрагидропиранбензолу (Соединение Z9, 20,98 г), трет-бутоксиду натрия (5,88 г), ацетату палладия (550 мг) и тетрафторборату три-трет-бутилфосфония (710 мг) добавляли толуол (40 мл) и смесь перемешивали и нагревали при 70°C в атмосфере азота в течение 6 часов. После охлаждения к реакционной смеси добавляли метанол (38 мл) и трифторуксусную кислоту (14,54 мл) при комнатной температуре и затем перемешивали при комнатной температуре в течение ночи. К полученным остаткам добавляли метиленхлорид и насыщенный раствор дикалий гидрофосфата, и органический слой промывали насыщенным солевым раствором. Затем органический слой сушили над сульфатом магния. Остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (5,53 г, 36%).
ЖХ/МС: m/z 312 [M+H]+
ВЭЖХ время удерживания: 2,39 мин (условия анализа F)
[Пример 738]
Соединение Z11
8-Метокси-6,6-диметил-6,11-дигидро-бензо[b]нафт[2,3-d]фуран-3-иловый эфир трифторметансульфоновой кислоты

3-(2,4-Дигидрокси-фенил)-7-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-он (Соединение Z10, 5,53 г) растворяли в метиленхлориде (40 мл) и добавляли трифторметансульфоновый ангидрид (2,98 мл) при комнатной температуре. После охлаждения до 5°C добавляли диизопропилэтиламин (9,25 мл) и трифторметансульфоновый ангидрид (4,47 мл). К реакционной смеси добавляли метиленхлорид и насыщенный раствор дикалий гидрофосфата, и органический слой промывали насыщенным солевым раствором. Затем органический слой сушили над сульфатом магния. Остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (4,82 г, 64%).
ЖХ/МС: m/z 427 [M+H]+
ВЭЖХ время удерживания: 8,95 мин (условия анализа H)
[Пример 739]
Соединение Z12
8-Метокси-6,6-диметил-11-оксо-6,11-дигидро-бензо[b]нафт[2,3-d]фуран-3-иловый эфир трифторметансульфоновой кислоты

8-Метокси-6,6-диметил-6,11-дигидро-бензо[b]нафт[2,3-d]фуран-3-иловый эфир трифторметансульфоновой кислоты (Соединение Z11, 4,82 г) растворяли в ацетонитриле (48 мл) и воде (24 мл), добавляли хлорит натрия (2,55 г) и N-гидроксифталимид (369 мг) и затем смесь перемешивали при 40°C в течение 1 часа. К реакционной смеси добавляли метиленхлорид и органический слой промывали насыщенным солевым раствором. Затем органический слой сушили над сульфатом магния. Остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (2,80 г, 56%).
ЖХ/МС: m/z 441 [M+H]+
ВЭЖХ время удерживания: 8,02 мин (условия анализа H)
[Пример 740]
Соединение Z13
8-Гидрокси-6,6-диметил-11-оксо-6,11-дигидро-бензо[b]нафт[2,3-d]фуран-3-иловый эфир трифторметансульфоновой кислоты

В условиях, аналогичных условиям получения Соединения A6, получали указанное в заголовке соединение в виде неочищенного продукта, исходя из Соединения Z12.
[Пример 741]
Соединение Z14
8-[(4R,5R)-5-(трет-Бутил-диметилсиланилоксиметил)-2,2-диметил[1,3]диоксолан-4-илметокси]-6,6-диметил-11-оксо-6,11-дигидро-бензо[b]нафт[2,3-d]фуран-3-иловый эфир трифторметансульфоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения A7-1, указанное в заголовке соединение получали в виде неочищенного продукта, исходя из Соединения Z13 и [5-(трет-бутил-диметилсиланилоксиметил)-2,2-диметил-[1,3]диоксолан-4-ил]метанола (Соединение T22-0).
[Пример 742]
Соединение Z15
8-[(4R,5R)-5-(Трет-бутил-диметилсиланилоксиметил)-2,2-диметил[1,3]диоксолан-4-илметокси]-6,6-диметил-11-оксо-6,11-дигидро-бензо[b]нафт[2,3-d]фуран-3-карбонитрил

8-[(4R,5R)-5-(трет-Бутил-диметилсиланилоксиметил)-2,2-диметил[1,3]диоксолан-4-илметокси]-6,6-диметил-11-оксо-6,11-дигидро-бензо[b]нафт[2,3-d]фуран-3-иловый эфир трифторметансульфоновой кислоты (Соединение Z14, 24 мг) растворяли в DMF (0,5 мл), добавляли цианид цинка(II) (8,2 мг) и тетракистрифенилфосфинпалладий (2,0 мг) и смесь перемешивали при нагревании при 200°C в течение 20 минут в условиях микроволнового облучения. К реакционной смеси добавляли этилацетат и органический слой промывали насыщенным солевым раствором. Затем органический слой сушили над сульфатом магния. Остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (15 мг).
ЖХ/МС: m/z 562 [M+H]+
ВЭЖХ время удерживания: 4,14 мин (условия анализа F)
[Пример 743]
Соединение Z16
6,6-Диметил-11-оксо-8-((2R,3R)-2,3,4-тригидрокси-бутокси)-6,11-дигидро-бензо[b]нафт[2,3-d]фуран-3-карбонитрил

В условиях, аналогичных условиям получения Соединения S7-2, получали указанное в заголовке соединение, исходя из Соединения Z15.
ЖХ/МС: m/z 408 [M+H]+
ВЭЖХ время удерживания: 4,51 мин (условия анализа H)
[Пример 744]
Соединение K7-5
трет-Бутиловый эфир 4-(3-циано-9-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-ил)-3,6-дигидро-2H-пиридин-1-карбоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения B2-22-1, получали указанное в заголовке соединение, исходя из Соединения K6 и трет-бутилового эфира 4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-3,6-дигидро-2H-пиридин-1-карбоновой кислоты.
ЖХ/МС: m/z 498 [M+H]+
ВЭЖХ время удерживания: 4,24 мин (условия анализа W)
[Пример 745]
Соединение K7-6
9-Метокси-6,6-диметил-11-оксо-8-(1,2,3,6-тетрагидро-пиридин-4-ил)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
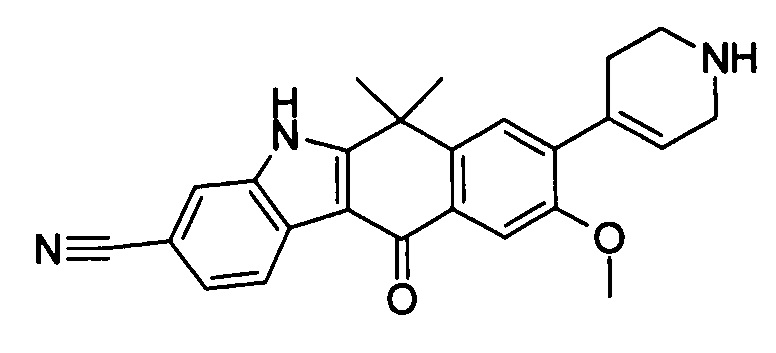
С использованием тех же условий, как в способе синтеза Соединения A8-1, получали указанное в заголовке соединение, исходя из K7-5.
ЖХ/МС: m/z 398 [M+H]+
ВЭЖХ время удерживания: 2,57 мин (условия анализа W)
[Пример 746]
Соединение K8-1
8-(1-Циклобутил-1,2,3,6-тетрагидро-пиридин-4-ил)-9-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения K7-6 и циклобутанона.
ЖХ/МС: m/z 452 [M+H]+
ВЭЖХ время удерживания: 2,72 мин (условия анализа W)
[Пример 747]
Соединение K8-2
8-(1-Циклобутил-пиперидин-4-ил)-9-метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B3-13-1, получали указанное в заголовке соединение, исходя из Соединения K8-1.
ЖХ/МС: m/z 454 [M+H]+
ВЭЖХ время удерживания: 2,76 мин (условия анализа W)
[Пример 748]
Соединение K9-5
8-(1-Циклобутил-пиперидин-4-ил)-9-гидрокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E3-2, получали указанное в заголовке соединение, исходя из Соединения K8-2.
ЖХ/МС: m/z 440 [M+H]+
ВЭЖХ время удерживания: 2,57 мин (условия анализа W)
[Пример 749]
Соединение K10-8
8-(1-Циклобутил-пиперидин-4-ил)-9-изопропокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения K9-5 и изопропилйодида.
ЖХ/МС: m/z 482 [M+H]+
ВЭЖХ время удерживания: 1,74 мин (условия анализа S)
Соединения, описанные в следующих таблицах 2-3, были синтезированы из промежуточных соединений Соединения K или Соединения L путем алкилирования гидроксильной группы в соответствии с реакцией Мицунобу, используемой для получения Соединения A7-1, или способом, используемым для синтеза Соединения A7-17 (описан в таблице).
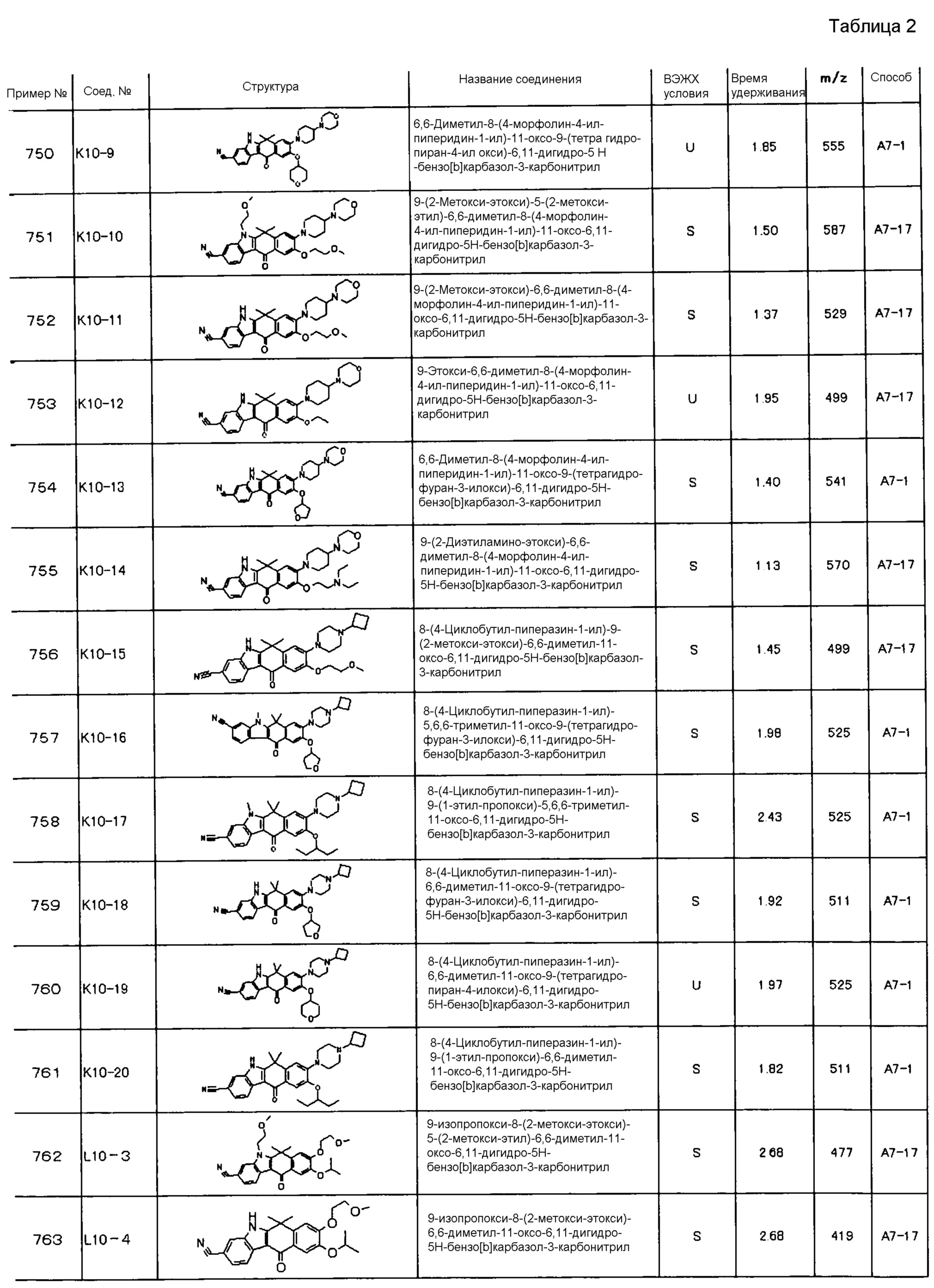
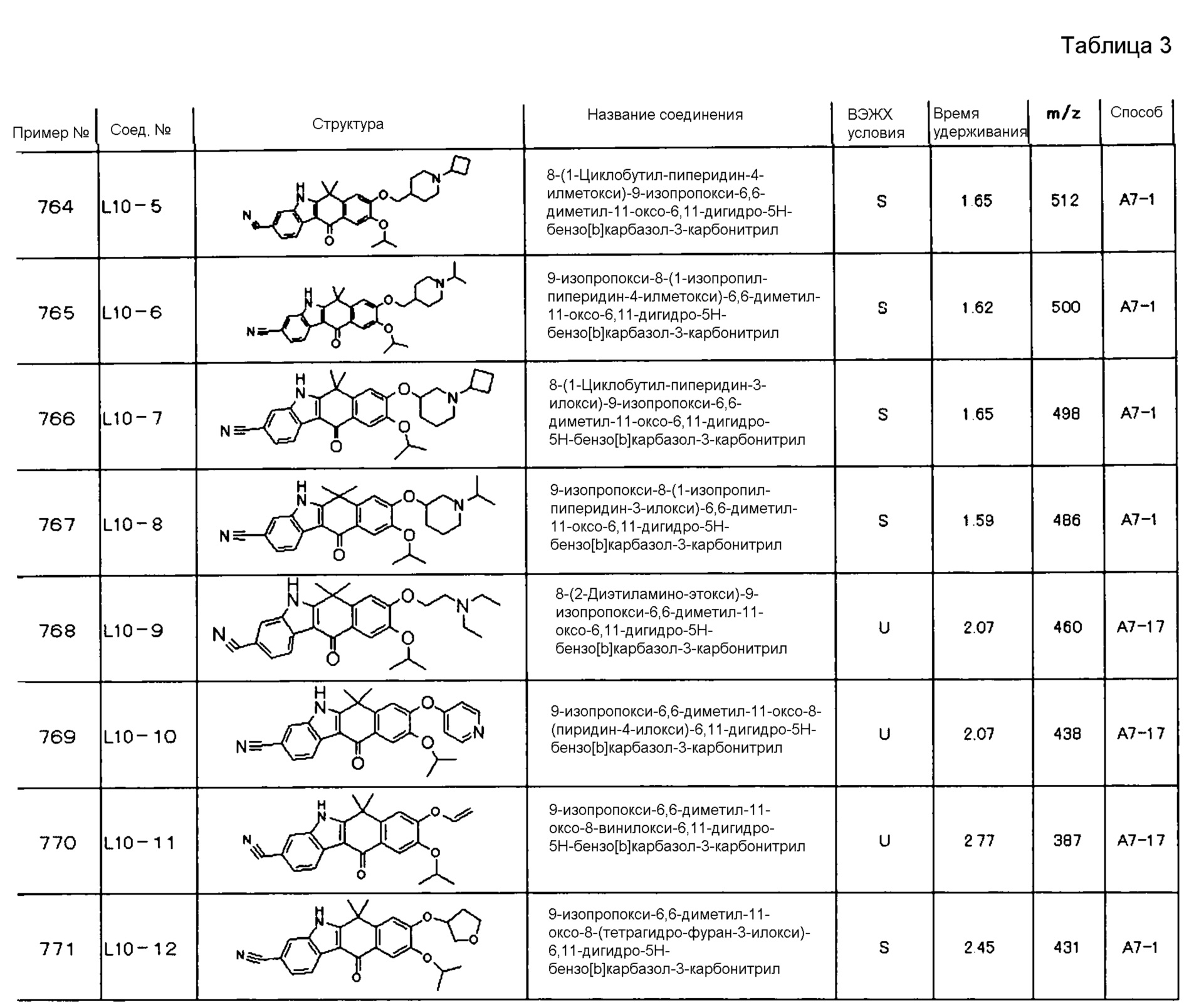
Соединения, описанные в следующей таблице 4, были синтезированы из промежуточных соединений Соединения B в соответствии со способом, описанным в таблице.

[Пример 777]
Соединение E6-4
9-Этил-8-гидрокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения E3-2, получали указанное в заголовке соединение, исходя из Соединения E5-1.
ЖХ/МС: m/z 331 [M+H]+
ВЭЖХ время удерживания: 3,42 мин (условия анализа W)
[Пример 778]
Соединение E7
3-Циано-9-этил-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-8-иловый эфир трифторметансульфоновой кислоты

С использованием тех же условий, как в способе синтеза Соединения B1, получали указанное в заголовке соединение, исходя из Соединения E6-4.
ЖХ/МС: m/z 463 [M+H]+
ВЭЖХ время удерживания: 4,39 мин (условия анализа W)
[Пример 779]
Соединение E8-1
9-Этил-6,6-диметил-11-оксо-8-пиперазин-1-ил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

Получали указанное в заголовке соединение, исходя из Соединения E7 и пиперазина, таким же способом, как способ синтеза Соединение B2-1.
ЖХ/МС: m/z 399 [M+H]+
ВЭЖХ время удерживания: 1,88 мин (условия анализа U)
[Пример 780]
Соединение E8-2
9-Этил-6,6-диметил-8-((S)-3-метил-пиперазин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения E7 и 2-(S)-метилпиперазина.
ЖХ/МС: m/z 413 [M+H]+
ВЭЖХ время удерживания: 2,76 мин (условия анализа W)
[Пример 781]
Соединение E8-3
8-((3R,5S)-3,5-Диметил-пиперазин-1-ил)-9-этил-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

С использованием тех же условий, как в способе синтеза Соединения B2-1, получали указанное в заголовке соединение, исходя из Соединения E7 и цис-2,6-диметилпиперазина.
ЖХ/МС: m/z 427 [M+H]+
ВЭЖХ время удерживания: 2,00 мин (условия анализа U)
[Пример 782]
Соединение E8-4
8-(1-Циклобутил-1,2,3,6-тетрагидро-пиридин-4-ил)-9-этил-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

Соединение 7 преобразовывали таким же способом, как Соединение B2-22-1 и Соединение 2, и затем подвергали восстановительному аминированию таким же способом, как Соединение B3-32, с получением указанного в заголовке соединения.
ЖХ/МС: m/z 450 [M+H]+
ВЭЖХ время удерживания: 2,12 мин (условия анализа U)
[Пример 783]
Соединение E9-1
8-((S)-4-Циклобутил-3-метил-пиперазин-1-ил)-9-этил-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
С использованием тех же условий, как в способе синтеза Соединения B3-32, получали указанное в заголовке соединение, исходя из Соединения E8-2 и циклобутанона.
ЖХ/МС: m/z 467 [M+H]+
ВЭЖХ время удерживания: 2,90 мин (условия анализа W)
Соединения, описанные в следующей таблице 5, получали путем ацилирования, исходя из Соединения E8-1, таким же способом, как способ синтеза Соединения A9-10.

[Пример 791]
Соединение E9-9
8-[4-(1-Циано-циклогексил)пиперазин-1-ил]-9-этил-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
9-Этил-6,6-диметил-11-оксо-8-пиперазин-1-ил-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил (45 мг) и циклогексанон (25 мг) суспендировали в хлороформе (2 мл), добавляли триметилсилилцианид (30 мг) и йодид цинка (5 мг) и смесь перемешивали при 60°C в течение 17 часов. Реакционную смесь разбавляли этилацетатом (20 мл) и органический слой промывали 10% насыщенным солевым раствором и концентрировали при пониженном давлении. Полученные остатки очищали на колонке с силикагелем (дихлорметан/метанол (=99/1)) с получением указанного в заголовке соединения (12 мг, выход 30%).
ЖХ/МС: m/z 506 [M+H]+
ВЭЖХ время удерживания: 3,00 мин (условия анализа U)
Соединения, описанные в следующей таблице 6, были синтезированы, исходя из Соединения E8-1 или Соединения PR10-1, таким же способом, как способ синтеза Соединения E9-9.

Что касается соединений, описанных в следующей таблице 7, Соединение F2 подвергали аминированию таким же способом, как Соединение B2-1. Затем получение осуществляли путем восстановительного аминирования таким же способом, как способ, описанный для Соединения B3-32.

[Пример 797]
Соединение PR1
2-(4-Винилфенил)-2-метилпропановая кислота

2-(4-Бромфенил)-2-метилпропановую кислоту (30 г), PPh3 (5,0 г), винилтрифторборат калия (24,8 г), карбонат калия (51,2 г) и ацетат палладия (1,43 г) растворяли в 1-пропаноле (198 мл) и дистиллированной воде (99 мл). После деаэрации смесь перемешивали при температуре кипения с обратным холодильником в течение 6 часов в атмосфере азота. Нерастворимые вещества удаляли фильтрованием и промывали 1-пропанолом (210 мл). Фильтрат затем концентрировали при пониженном давлении. Концентрированные остатки распределяли между CPME (300 мл) и дистиллированной водой (150 мл, содержащей 4,17 мл этилендиамина). Органический слой удаляли, и водный слой доводили до pH 5 с использованием 2 н раствора хлористоводородной кислоты. Водный слой экстрагировали смесью изопропилацетата (240 мл) и гептана (240 мл). Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Добавляли этанол (300 мл) для суспендирования и промывки полученного вещества. Твердое вещество удаляли путем фильтрования через Целит и фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения (21,7 г, 93%).
1H-ЯМР(400 МГц CDCl3) δ м.д. 7,49-7,34 (4 H, м), 6,69 (1 H, дд, J=17,6, 11,0 Гц), 5,72 (1 H, д, J=17,6 Гц), 5,23 (1 H, д, 11,0 Гц), 1,59 (с, 6 H).
ВЭЖХ время удерживания: 2,05 мин (условия анализа S)
[Пример 798]
Соединение PR2
2-(4-Этилфенил)-2-метилпропановая кислота

2-(4-Винилфенил)-2-метилпропановую кислоту (58 г) растворяли в этаноле и затем перемешивали в течение 3 часов при давлении атмосферного водорода в присутствии 10% палладия на углероде (5,8 г). Катализатор удаляли фильтрованием и фильтрат концентрировали с получением неочищенного продукта, затем смесь суспендировали и промывали гексаном с получением указанного в заголовке соединения (56,5 г, 94,8%).
1H-ЯМР(270 МГц DМSO-d6) δ м.д. 12,28 (1 H, с), 7,27-7,22 (2 H, м), 7,18-7,14 (2 H, м), 2,56 (2 H, кв., J=7,6 Гц), 1,45 (6 H, с), 1,16 (3 H, т, J=7,6 Гц).
ЖХ/МС: м/z 193 [М+H]+
ВЭЖХ время удерживания: 2,18 мин (условия анализа S)
[Пример 799]
Соединение PR3
2-(4-Этил-3-йодфенил)-2-метилпропановая кислота

2-(4-Этилфенил)-2-метилпропановую кислоту (58,1 г, 302,2 ммоль) растворяли в уксусной кислоте (175 мл), добавляли N-йодсукцинимид (71,4 г, 317,3 ммоль, 1,05 экв.) и концентрированную серную кислоту (75 мл) при 0°C. Затем смесь перемешивали при комнатной температуре в течение 2 часов. После охлаждения реакционного раствора до 0°C добавляли 10% водный раствор гидросульфита натрия (100 мл) и смесь перемешивали в течение 1 часа. К смеси добавляли H2O (450 мл) и осажденное твердое вещество фильтровали с получением указанного в заголовке соединения в виде неочищенного продукта. К неочищенному продукту добавляли этанол (150 мл) и 10% водный раствор гидросульфита натрия (50 мл) и смесь растворяли при нагревании при 50°C. После подтверждения растворения раствор охлаждали до комнатной температуры, добавляли H2O (300 мл) и затем перемешивали при 0°C в течение 1 часа. Осажденное твердое вещество фильтровали с получением указанного в заголовке соединения (95,8 г, 99%).
1H-ЯМР(270 МГц, DМSO-d6) δ м.д. 12,46 (1 H, с), 7,70 (1 H, д, J=1,8 Гц), 7,32 (1 H, дд, J=8,1, 1,8 Гц), 7,26 (1 H, д, J=8,1 Гц), 2,64 (2 H, кв., J=7,5 Гц), 1,43 (6 H, с), 1,12 (3 H, т, J=7,5 Гц).
ВЭЖХ время удерживания: 2,53 мин (условия анализа S)
[Пример 800]
Соединение PR4
Трет-бутил 4-(4-этил-3-йодфенил)-4-метил-3-оксопентановая кислота

Моно-трет-бутилмалоновую кислоту (72,5 г) растворяли в DME (360 мл), добавляли TEA (189 мл) и хлорид магния (29,63 г) и смесь перемешивали в течение 2 часов. В отдельном сосуде CDI (52,75 г) добавляли к DME (360 мл) раствору 2-(4-этил-3-йодфенил)-2-метилпропановой кислоты (90 г) и перемешивали при комнатной температуре в течение 1 часа для получения раствора. Этот раствор затем добавляли по каплям к указанной выше смеси и полученный раствор промывали при помощи DME (90 мл) и перемешивали при 70°C в течение 3 часов. Реакционную смесь разбавляли изопропилацетатом (225 мл) и гептаном (225 мл), и органический слой промывали 2 н раствором хлористоводородной кислоты (684 мл), 0,17 н раствором хлористоводородной кислоты (540 мл), 15% водным раствором хлорида аммония (540 мл), 1 н водным раствором гидроксида натрия (540 мл) и 15% насыщенным солевым раствором (540 мл), в указанном порядке. Органический слой концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде неочищенного продукта, который использовали на следующей стадии без дополнительной очистки.
1H-ЯМР(270 МГц, DМSO-d6) δ: 7,64 (1 H, д, J=2,0 Гц), 7,30 (1 H, д, J=8,1 Гц), 7,24 (1 H, д, J=8,0, 2,0 Гц), 3,32 (2 H, с), 2,65 (2 H, кв., J=7,4 Гц), 1,40 (6 H, с), 1,34 (9 H, с), 1,13 (3 H, т, J=7,4 Гц).
[Пример 801]
Соединение PR5-1
Трет-бутил 6-циано-2-(2-(4-этил-3-йодфенил)пропан-2-ил)-1H-индол-3-карбоновая кислота

Трет-бутил 4-(4-этил-3-йодфенил)-4-метил-3-оксопентановую кислоту (117,76 г) растворяли в DMF (471 мл) и добавляли карбонат цезия (276,5 г). К смеси добавляли по каплям DMF раствор (176,6 мл) 4-хлор-3-нитробензонитрила (63,9 г) (промывали при помощи DMF 58,8 мл) и смесь перемешивали при 35°C в течение 6 часов. К смеси добавляли ТГФ (588,8 мл), этилацетат (588,8 мл), уксусную кислоту (72,87 мл) и дистиллированную воду (588,8 мл) для распределения и водный слой удаляли. К органическому слою добавляли ТГФ (588,8 мл) и воду (588,8 мл) и при перемешивании добавляли гидросульфит натрия (80%, 147,76 г) небольшими порциями и смесь перемешивали при комнатной температуре в течение 3 часов. После удаления водного слоя органический слой промывали 15% насыщенным солевым раствором (588,8 мл). К органическому слою добавляли 1 н раствор хлористоводородной кислоты (94,2 мл), перемешивали в течение 1 часа и затем добавляли 1 н водный раствор гидроксида натрия (329,7 мл). Водный слой удаляли, и органический слой концентрировали при пониженном давлении. Концентрированные остатки растворяли в этаноле (824,3 мл) и добавляли по каплям дистиллированную воду (247,3 мл). Полученные осажденные кристаллы фильтровали и собирали, промывали водой:этанолом (1:2 смешанный раствор, 588,8 мл) и затем сушили с получением указанного в заголовке соединения (98,12 г, от двух стадий 63,5%).
1H-ЯМР(270 МГц, DМSO-d6) δ: 12,04 (1 H, ушир. с), 8,01 (1 H, д, J=8,4 Гц), 7,91 (1 H, д, J=0,8 Гц), 7,55 (1 H, д, J=1,8 Гц), 7,49 (1 H, дд, J=1,5, 8,4 Гц), 7,16 (1 H, д, J=8,1 Гц), 7,07 (1 H, дд, J=2,0, 8,1 Гц), 2,58 (2 H, кв., J=7,4 Гц), 1,79 (6 H, с), 1,23 (9 H, с), 1,06 (3 H, т, J=7,4 Гц).
ЖХ/МС: м/z 459, 515 [М+H]+
[Пример 802]
Соединение PR5-2
Метил 6-циано-2-(2-(4-этил-3-йодфенил)пропан-2-ил)-1H-индол-3-карбоновая кислота

Указанное в заголовке соединение получали, исходя из монометилмалоната и 2-(4-этил-3-йодфенил)-2-метилпропановой кислоты, таким же способом, как способ, описанный для Соединения PR4 и Соединения PR5-1.
1H-ЯМР(270 МГц, DМSO-d6) δ: 12,20 (с, 1 H), 8,06-8,03 (м, 1 H), 7,95-7,94 (м, 1 H), 7,58-7,57 (м, 1 H), 7,53-7,49 (м, 1 H), 7,17-7,14 (м, 1 H), 7,06-7,02 (м, 1 H), 3,46 (с, 3 H), 2,65-2,56 (кв., 2 H, J=7,5 Гц), 1,78 (с, 6 H), 1,12-1,07 (т, 3 H, J=7,5 Гц).
ЖХ/МС: м/z 473 [М+H]+
[Пример 803]
Соединение PR6
Трет-бутил 6-циано-2-(2-(4-этил-3-(4-морфолин-4-ил-пиперидин-1-ил)фенил)пропан-2-ил)-1H-индол-3-карбоновая кислота в форме соли хлористоводородной кислоты

Трет-бутил 6-циано-2-(2-(4-этил-3-йодфенил)пропан-2-ил)-1H-индол-3-карбоновую кислоту (390,5 г), 4-морфолин-4-илпиперидин (158 г) и 1,3-бис-(2,6-диизопропилфенил)имидазоил-2-илиден(аллил)палладия(II) хлорид (8,83 г) растворяли в смеси NaHMDS (1,9 M раствор в ТГФ, 1,32 л) и DME (1,95 л) под потоком азота и смесь перемешивали при 40°C в течение 1 часа. Реакционную смесь затем распределяли между изопропилацетатом (1,95 л) и 20% водным раствором хлорида аммония (1,95 л). Органический слой промывали два раза 10% насыщенным солевым раствором (1,56 л) и затем концентрировали при пониженном давлении. Полученные остатки растворяли в смеси DME (3,9 л) и воды (78,1 мл), добавляли N-ацетилцистеин (12,39 г) и перемешивали при 45°C в течение 1 часа. Затем нерастворимые вещества фильтровали и промывали при помощи DME (1,95 л). Фильтрат концентрировали при пониженном давлении. Полученные остатки растворяли в ацетоне (5,5 л) и добавляли раствор пиридинийхлорида (96,5 г), растворенного в ацетоне (195 мл) и этаноле (78 мл). Осажденное твердое вещество фильтровали, собирали, промывали ацетоном (1,95 л) и сушили с получением указанного в заголовке соединения (373 г, 83%).
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,03 (1 H, с), 10,75-10,88 (1 H, м), 7,99 (1 H, д, J=8,3 Гц), 7,93 (1 H, д, J=1,3 Гц), 7,46 (1 H, дд, J=1,3, 8,1 Гц), 7,10 (1 H, д, J=7,9 Гц), 6,88 (1 H, дд, J=1,7, 7,9 Гц), 6,79 (1 H, д, J=1,7 Гц), 3,91-4,01 (2 H, м), 3,76-3,87 (2 H, м), 3,37-3,46 (2 H, м), 3,22 (1 H, м), 2,94-3,11 (4 H, м), 2,57 (2 H, кв., J=7,5 Гц), 2,45-2,53 (2 H, м), 2,09-2,16 (2 H, м), 1,80 (6 H, с), 1,71-1,77 (2 H, м), 1,19 (9 H, с), 1,14 (3 H, т, J=7,5 Гц).
ЖХ/МС: м/z 557 [М+H]+
[Пример 804]
Соединение PR7
6-Циано-2-(2-(4-этил-3-(4-морфолин-4-ил-пиперидин-1-ил)фенил)пропан-2-ил)-1H-индол-3-карбоновая кислота
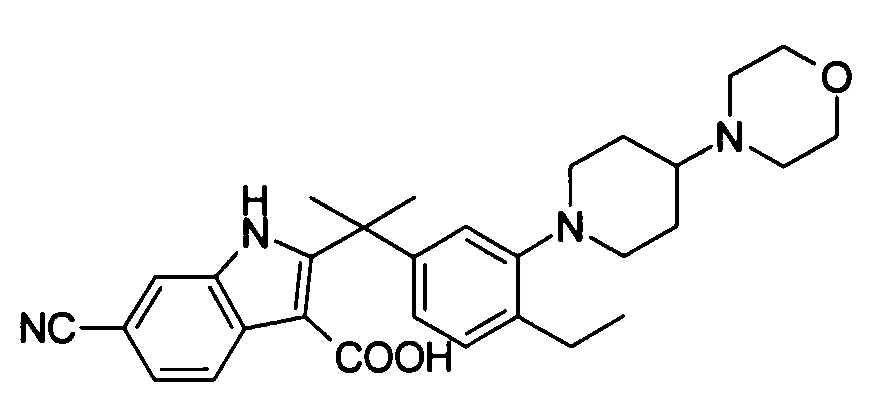
Трет-бутил 6-циано-2-(2-(4-этил-3-(4-морфолин-4-ил-пиперидин-1-ил)фенил)пропан-2-ил)-1H-индол-3-карбоновую кислоту в форме соли хлористоводородной кислоты (1400 г) суспендировали в TFE (7 л) под потоком азота и добавляли по каплям TMSCl (554 мл) при 8°C. После перемешивания в течение 3 часов к реакционному раствору добавляли ацетон (5,6 л) и водный раствор NaOH (1 н, 4,39 л) и к смеси добавляли 10% водный раствор K2HPO4 (1,4 л) для нейтрализации. Осажденное твердое вещество фильтровали и собирали, промывали два раза смешанным раствором вода:ацетон (1:1, 2,8 л) и сушили с получением указанного в заголовке соединения (1061 г, 96,6%).
1H-ЯМР(270 МГц, DМSO-d6) δ: 11,95 (1 H, с), 11,92 (1 H, ушир. с), 8,04 (1 H, д, J=8,4 Гц), 7,89 (1 H, д, J=1,3 Гц), 7,44 (1 H, дд, J=1,3, 8,4 Гц), 7,00 (1 H, д, J=8,4 Гц), 6,88 (1 H, д, J=1,8 Гц), 6,71 (1 H, дд, J=2,2, 7,9 Гц), 3,50-3,55 (4 H, м), 2,92-2,96 (2 H, м), 2,54 (2 H, кв., 7,5 Гц), 2,39-2,50 (6 H, м), 2,15-2,22 (1 H, м), 1,74-1,85 (8 H, м), 1,43-1,52 (2 H, м), 1,13 (3 H, т, J=7,5 Гц).
ЖХ/МС: м/z 501 [М+H]+
ВЭЖХ время удерживания: 1,53 мин (условия анализа U)
[Пример 805]
Соединение F6-20
9-Этил-6,6-диметил-8-(4-морфолин-4-ил-пиперидин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

6-Циано-2-(2-(4-этил-3-(4-морфолин-4-ил-пиперидин-1-ил)фенил)пропан-2-ил)-1H-индол-3-карбоновую кислоту (500 г) растворяли в смеси DMA (9,4 л), уксусного ангидрида (270 мл) и DIPEA (1170 мл) под потоком азота. Смесь перемешивали при 90°C в течение 1 часа. После охлаждения до комнатной температуры к смеси добавляли метанол (3,525 л) и затем дистиллированную воду (5,875 л). Осажденное твердое вещество фильтровали, собирали, промывали два раза смешанным раствором (метанол:вода=3:5, 1,41 л) и затем сушили с получением указанного в заголовке соединения (389,6 г, 85%).
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,70 (1 H, с), 8,32 (1 H, д, J=7,9 Гц), 8,04 (1 H, с), 8,00 (1 H, с), 7,61 (1 H, д, J=8,5 Гц), 7,34 (1 H, с), 3,64-3,57 (4 H, м), 3,27-3,18 (2 H, м), 2,82-2,66 (4 H, м), 2,39-2,28 (1 H, м), 1,96-1,87 (2 H, м), 1,76 (6 H, с), 1,69-1,53 (2 H, м), 1,29 (3 H, т, J=7,3 Гц).
ЖХ/МС: м/z 483 [М+H]+
ВЭЖХ время удерживания: 1,98 мин (условия анализа U)
Гидрохлоридная соль Соединения F6-20
9-Этил-6,6-диметил-8-(4-морфолин-4-ил-пиперидин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил (400 г) растворяли в смеси растворителей метилэтилкетона (4,8 л), уксусной кислоты (1,44 л) и дистиллированной воды (1,68 л) при комнатной температуре. Полученный раствор добавляли по каплям к смеси этанола (12 л) и 2 н хлористоводородной кислоты (0,8 л). Осажденное твердое вещество фильтровали, промывали этанолом (2 л) и сушили с получением гидрохлоридной соли Соединения F6-20 (357 г).
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,83 (1 H, с), 10,78 (1 H, с), 8,32 (1 H, д, J=8,1 Гц), 8,06 (1 H, с), 8,01 (1 H, с), 7,61 (1 H, д, J=8,1 Гц), 7,37 (1 H, с), 4,02 (2 H, м), 3,85 (2 H, м), 3,51 (2 H, м), 3,34 (1 H, м), 3,32(2 H, м), 3,15 (2 H, м), 2,81 (2 H, дд, J=11,98, 11,7 Гц), 2,72 (2 H, кв., J=7,5 Гц), 2,23 (2 H, м), 1,89 (2 H, м), 1,77 (6 H, с), 1,29 (3 H, т, J=7,5 Гц).
FABМS : м/z 483,4 [М+H]+
[Пример 806]
Соединение F6-22
9-Этил-6,6-диметил-10-(4-морфолин-4-ил-пиперидин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

Из раствора фильтрата, полученного в способе синтеза Соединения F6-20, получали указанное в заголовке соединение.
1H-ЯМР(400 МГц DМSO-d6) δ: 12,56 (1 H, с), 8,32 (1 H, д, J=7,9 Гц), 7,96 (1 H, с), 7,45-7,59 (3 H, м), 3,55-3,62 (4 H, м), 3,36-3,50 (2 H, м), 2,75-2,86 (2 H, м), 2,71 (2 H, кв., J=7,5 Гц), 2,45-2,56 (4 H, м), 2,27-2,38 (1 H, м), 1,73-1,84 (2 H, м), 1,69 (6 H, с), 1,43-1,58 (2 H, м), 1,21 (3 H, т, J=7,5 Гц).
ЖХ/МС: м/z 483 [М+H]+
ВЭЖХ время удерживания: 1,52 мин (условия анализа U)
[Пример 807]
Соединение PR8
9-Этил-6,6-диметил-8-йод-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

Трет-бутил 6-циано-2-(2-(4-этил-3-йодфенил)пропан-2-ил)-1H-индол-3-карбоновую кислоту (11 г) растворяли в реагенте Итона (200 г) и перемешивали при комнатной температуре в течение 30 минут. Реакционный раствор разбавляли ацетонитрилом (200 мл) и дистиллированной водой (400 мл). Осажденное твердое вещество собирали фильтрованием, промывали дистиллированной водой и затем сушили. Неочищенный продукт растворяли в DMA (45 мл), разбавляли ацетонитрилом (20 мл) и дистиллированной водой (18 мл) и повторно осаждали с получением указанного в заголовке соединения (6,62 г, 70%).
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,79 (1 H, с), 8,32-8,29 (2 H, м), 8,06 (1 H, с), 8,01(1 H, с), 7,62 (1 H, дд, J=1,3, 7,9 Гц), 2,78 (2 H, кв., J=7,5 Гц), 1,75 (6 H, с), 1,20 (3 H, т, J=7,5 Гц).
ЖХ/МС: м/z 441 [М+H]+
ВЭЖХ время удерживания: 3,17 мин (условия анализа U)
[Пример 808]
Соединение PR9-1
8-(1,4-Диокса-8-аза-спиро[4,5]дец-8-ил)-9-этил-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

Раствор в диоксане (50 мл) 9-этил-6,6-диметил-8-йод-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрила (5,0 г), 1,4-диокса-8-аза-спиро[4,5]декана (2,08 мл), Pd2(dba)3 (520 мг) и S-Phos (963 мг) продували газообразным азотом, добавляли NaHMDS (1M раствор в ТГФ 40 мл) и перемешивали при 60°C в течение 1 часа. Полученную смесь разбавляли этилацетатом (200 мл). Органический слой промывали три раза 10% насыщенным солевым раствором и затем концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде неочищенного продукта. Этот неочищенный продукт использовали на следующей стадии без дополнительной очистки.
ЖХ/МС: m/z 456 [M+H]+
ВЭЖХ время удерживания: 2,78 мин (условия анализа U)
[Пример 809]
Соединение PR9-2
9-Этил-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
Целевое соединение получали в виде побочного продукта Соединения PR9-1, в соответствии с разделением на колонке с силикагелем соединения Примера 810.
ЖХ/МС: m/z 315 [M+H]+
ВЭЖХ время удерживания: 2,77 мин (условия анализа U)
[Пример 810]
Соединение PR10-1
9-Этил-6,6-диметил-11-оксо-8-(4-оксопиперидин-1-ил)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
8-(1,4-Диокса-8-аза-спиро[4,5]дец-8-ил)-9-этил-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил, который был получен в Примере 809, растворяли в ТГФ (10 мл), добавляли 5 н раствор хлористоводородной кислоты (50 мл) и смесь перемешивали в течение 17 часов. Реакционную смесь нейтрализовали при помощи 5 н водного раствора гидроксида натрия и разбавляли этилацетатом (200 мл). Органический слой промывали 10% насыщенным солевым раствором и затем концентрировали при пониженном давлении. Полученные остатки очищали на колонке с силикагелем (дихлорметан/метанол = от 99/1 до 90/10) с получением указанного в заголовке соединения (2,9 г, выход от двух стадий 64%).
1H-ЯМР(400 МГц, DМSO-d6) δ: 12,70 (1 H, с), 8,32 (1 H, д, J=8,4), 8,07 (1 H, с), 7,99 (1 H, с), 7,60 (1 H, дд, J=1,3, 7,9 Гц), 7,42 (1 H, с), 3,28 (4 H, т, J=5,7), 2,80 (кв., 2 H, J=7,5 Гц), 2,55 (4 H, т, J=5,7), 1,75 (6 H, с), 1,31 (3 H, т, J=7,5 Гц).
ЖХ/МС: м/z 412 [М+H]+
ВЭЖХ время удерживания: 2,57 мин (условия анализа U)
[Пример 811]
Соединение PR11-1
9-Этил-6,6-диметил-11-оксо-8-[4-(3-оксо-пиперазин-1-ил)пиперидин-1-ил]-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

9-Этил-6,6-диметил-11-оксо-8-(4-оксопиперидин-1-ил)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил (30 мг) и 2-кетопиперазин (10 мг) растворяли в ТГФ (2 мл), добавляли триацетоксиборогидрид натрия (30 мг) и смесь перемешивали при 30°C в течение 6 часов. Реакционную смесь разбавляли этилацетатом (20 мл). Органический слой промывали 10% насыщенным солевым раствором и затем концентрировали при пониженном давлении. Полученные остатки очищали на колонке с силикагелем (дихлорметан/метанол = от 99/1 до 90/10) с получением указанного в заголовке соединения (11,5 мг, выход 32%).
ЖХ/МС: m/z 496 [M+H]+
ВЭЖХ время удерживания: 1,90 мин (условия анализа U)
[Пример 812]
Соединение PR11-2
9-Этил-8-(4-гидрокси-пиперидин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

Целевое соединение получали в виде побочного продукта Соединения PR11-1.
ЖХ/МС: m/z 414 [M+H]+
ВЭЖХ время удерживания: 2,13 мин (условия анализа S)
Соединения, описанные в следующих таблицах 8-10, были синтезированы путем введения соответствующего амина в 9-этил-6,6-диметил-8-йод-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил, в соответствии со способом, используемым для синтеза Соединения PR9-1. Хотя соответствующие литературные источники совершенно неизвестны, некоторые амины, в которых третичная алкильная группа присоединена к атому азота, были получены в соответствии со способом, описанным в Journal of Medicinal Chemistry, 45 (14), 3143-3160, 2002. Альтернативно, получение осуществляли путем введения соответствующего амина в 9-этил-6,6-диметил-11-оксо-8-(4-оксопиперидин-1-ил)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил, в соответствии со способом, который используют для синтеза Соединения PR11-1 (т.е. восстановительное аминирование).
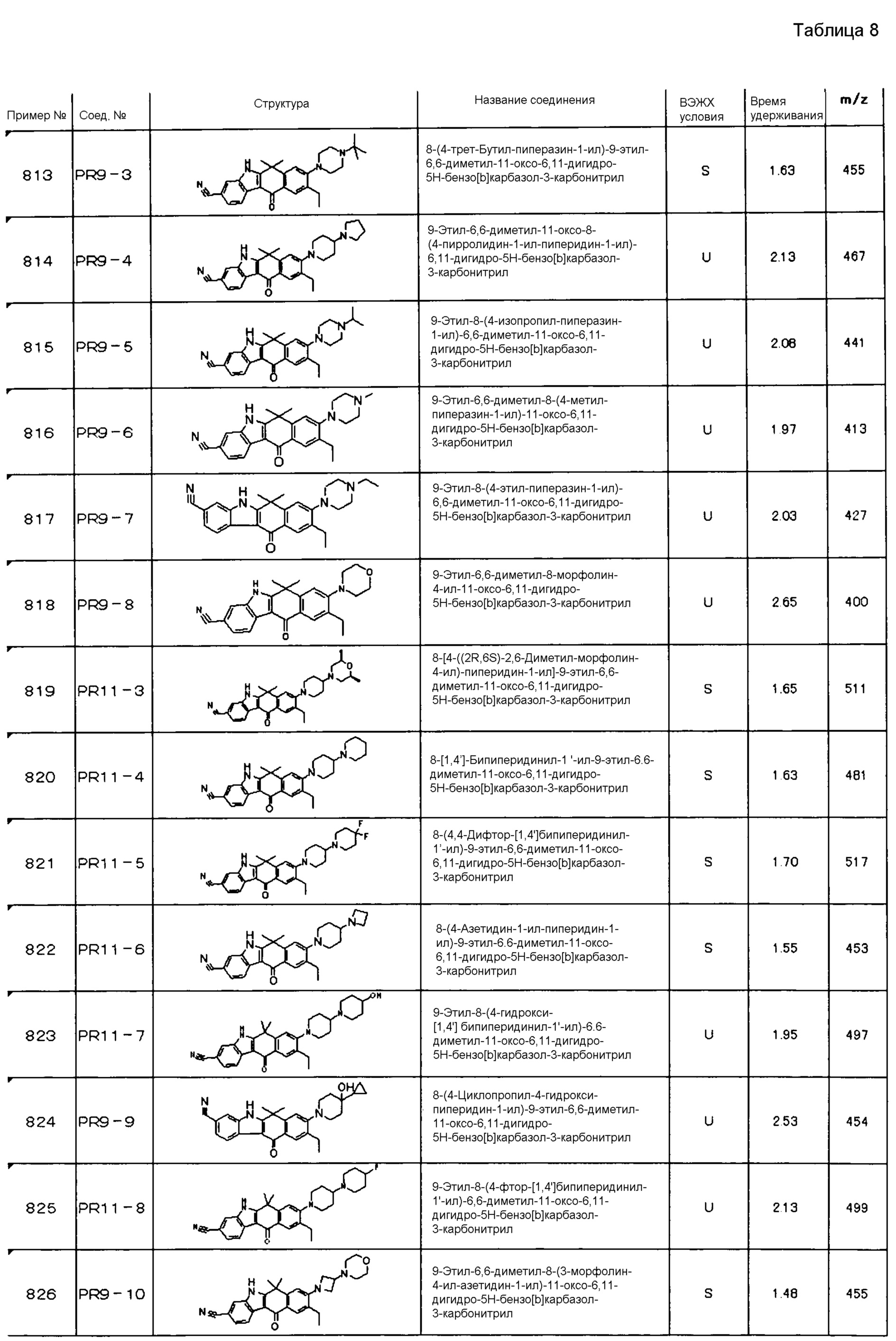
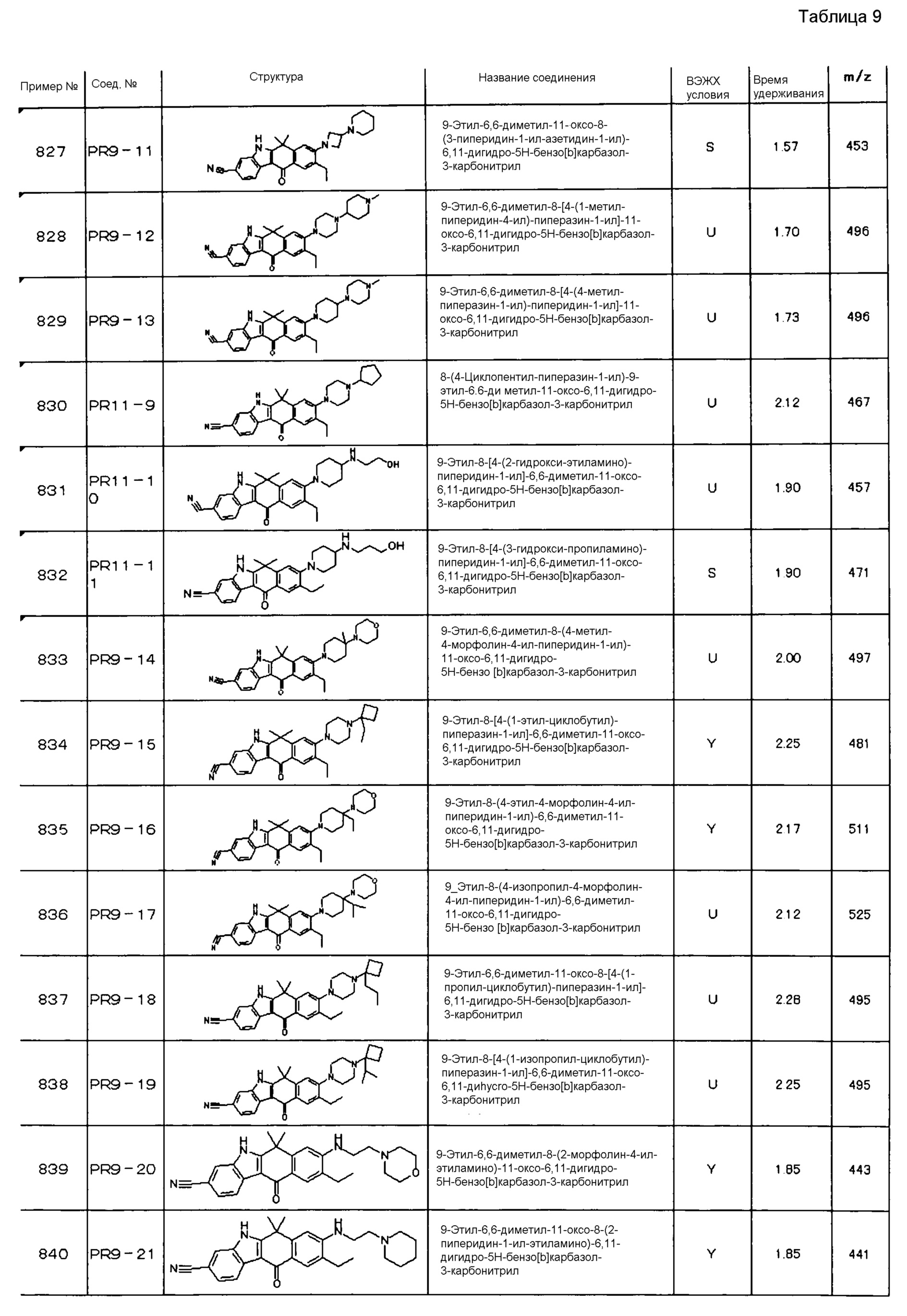

[Пример 853]
Соединение PR11-22
9-Этил-8-(4-гидроксиимино-пиперидин-1-ил)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил
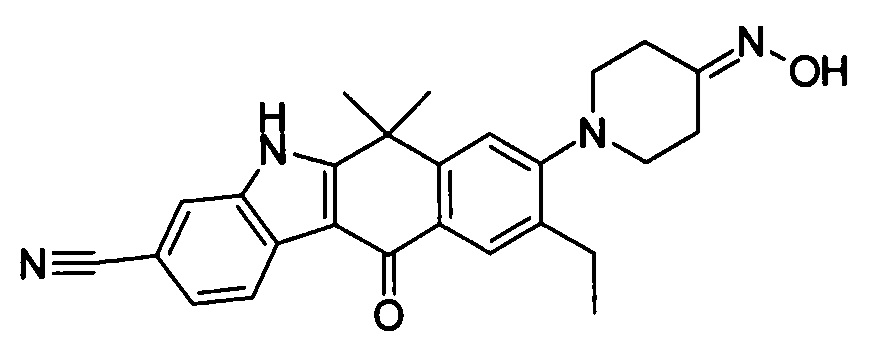
9-Этил-6,6-диметил-11-оксо-8-(4-оксопиперидин-1-ил)-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил (30 мг) и гидроксиламин в форме соли хлористоводородной кислоты (10 мг) растворяли в этаноле (5 мл) и перемешивали при 60°C в течение 6 часов. Реакционную смесь разбавляли этилацетатом (20 мл). Органический слой промывали 10% насыщенным солевым раствором и концентрировали при пониженном давлении. Полученные остатки очищали на колонке с силикагелем (дихлорметан/метанол=от 99/1 до 90/10) с получением указанного в заголовке соединения (23,5 мг, выход 74%).
ЖХ/МС: m/z 427 [M+H]+
ВЭЖХ время удерживания: 3,08 мин (условия анализа Y)
[Пример 854]
Соединение PR10-2
9-Этил-6,6-диметил-5-(2-морфолин-4-ил-этил)-8-(2-морфолин-4-ил-этиламино)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

9-Этил-6,6-диметил-8-(2-морфолин-4-ил-этиламино)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил (10 мг) растворяли в DMF (1 мл), добавляли K2CO3 (10 мг) и 1-(2-хлорэтил)морфолин (8 мг) и затем перемешивали при 90°C в течение 17 часов. Реакционную смесь разбавляли этилацетатом (10 мл). Органический слой промывали 0% насыщенным солевым раствором и концентрировали при пониженном давлении. Полученные остатки очищали на колонке с силикагелем (дихлорметан/метанол=от 99/1 до 90/10) с получением указанного в заголовке соединения (6,4 мг, выход 58%).
ЖХ/МС: m/z 556 [M+H]+
ВЭЖХ время удерживания: 1,78 мин (условия анализа Y)
[Пример 855]
Соединение F7
9-Этил-6,6-диметил-11-оксо-8-[4-(4-окси-морфолин-4-ил)пиперидин-1-ил]-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил

9-Этил-6,6-диметил-8-(4-морфолин-4-ил-пиперидин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил (400 мг) растворяли в трифторэтаноле (80 мл), добавляли 30% раствор перекиси водорода (0,8 мл) и смесь перемешивали при 60°C в течение 17 часов. Реакционную смесь концентрировали до 30 мл и разбавляли водой (20 мл). Осажденное вещество собирали фильтрованием и сушили с получением указанного в заголовке соединения (375 мг, выход 90%).
ЖХ/МС: m/z 499 [M+H]+
ВЭЖХ время удерживания: 2,05 мин (условия анализа U)
[Пример 856]
Соединение FR1
трет-Бутиловый эфир 6-циано-2-[1-(4-этил-3-йодфенил)-1-метил-этил]бензофуран-3-карбоновой кислоты
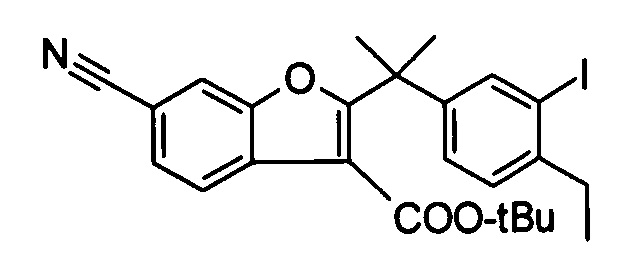
трет-Бутиловый эфир 4-(4-этил-3-йодфенил)-4-метил-3-оксопентановой кислоты (1,00 г, 2,40 ммоль) растворяли в NMP (4 мл), добавляли карбонат цезия (1,56 г, 4,80 ммоль, 2,0 экв.) и смесь перемешивали в течение 5 минут. К смеси добавляли раствор 4-хлор-3-нитро-бензонитрила (542 мг, 2,88 ммоль, 1,2 экв.) в NMP (2 мл) и смесь перемешивали при 50°C в течение 64 часов в атмосфере азота. После охлаждения до комнатной температуры добавляли этилацетат (20 мл) и органический слой промывали насыщенным водным раствором хлорида аммония (20 мл). Органический слой дополнительно промывали насыщенным солевым раствором и сушили над сульфатом натрия. Осушитель удаляли фильтрованием и остатки, полученные после концентрирования при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (белое аморфное вещество, 320 мг, 26%).
ЖХ/МС: m/z 516 [M+H]+
[Пример 857]
Соединение FR2
трет-Бутиловый эфир 6-циано-2-{1-[4-этил-3-(4-морфолин-4-ил-пиперидин-1-ил)фенил]-1-метил-этил}бензофуран-3-карбоновой кислоты
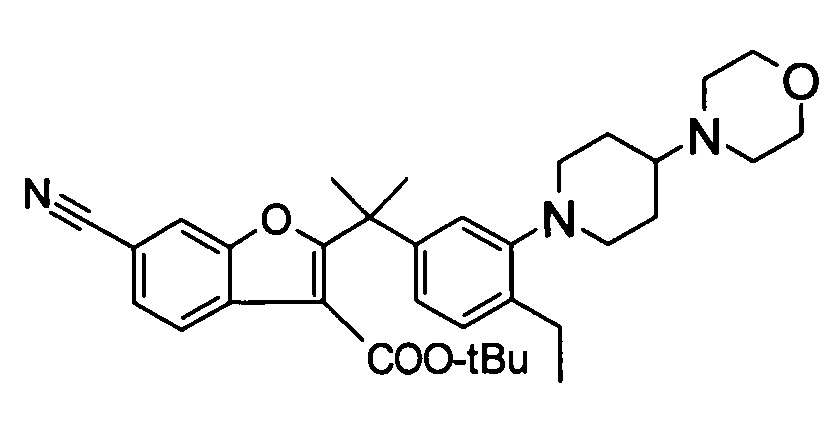
трет-Бутиловый эфир 6-циано-2-[1-(4-этил-3-йодфенил)-1-метил-этил]бензофуран-3-карбоновой кислоты преобразовывали с получением указанного в заголовке соединения таким же способом, как способ, описанный для Соединения PR6.
ЖХ/МС: m/z 558 [M+H]+
[Пример 858]
Соединение FR3
6-Циано-2-{1-[4-этил-3-(4-морфолин-4-ил-пиперидин-1-ил)фенил]-1-метил-этил}бензофуран-3-карбоновая кислота, соль йодистоводородной кислоты

Для получения указанного в заголовке соединения трет-бутиловый эфир 6-циано-2-{1-[4-этил-3-(4-морфолин-4-ил-пиперидин-1-ил)фенил]-1-метил-этил}бензофуран-3-карбоновой кислоты подвергали процедуре удаления защиты с использованием триметилсилилиодида таким же способом, как способ, описанный для Соединения PR7.
ЖХ/МС: m/z 502 [M+H]+
[Пример 859]
Соединение FR4
9-Этил-6,6-диметил-8-(4-морфолин-4-ил-пиперидин-1-ил)-11-оксо-6,11-дигидро-бензо[b]нафто[2,3-d]фуран-3-карбонитрил

6-Циано-2-{1-[4-этил-3-(4-морфолин-4-ил-пиперидин-1-ил)фенил]-1-метил-этил}бензофуран-3-карбоновую кислоту в форме соли йодистоводородной кислоты преобразовывали таким же способом, как описано в Примере 805, с получением целевого соединения.
ЖХ/МС: m/z 484 [M+H]+
[Пример 860]
Соединение LB1
2-[4-Этил-3-(4-морфолин-4-ил-пиперидин-1-ил)фенил]-2-метил-пропионовая кислота

Указанное в заголовке соединение получали, исходя из 2-(4-этил-3-йодфенил)-2-метилпропановой кислоты, путем осуществления аминирования таким же способом, как в способе синтеза Соединения PR6.
ЖХ/МС: m/z 361 [M+H]+
[Пример 861]
Соединение LB2
трет-Бутиловый эфир 2-{1-[4-этил-3-(4-морфолин-4-ил-пиперидин-1-ил)фенил]-1-метил-этил}-6-йод-1H-индол-3-карбоновой кислоты

2-[4-Этил-3-(4-морфолин-4-ил-пиперидин-1-ил)фенил]-2-метил-пропионовую кислоту преобразовывали таким же способом, как способ синтеза Соединения PR5-1, с получением указанного в заголовке соединения.
ЖХ/МС: m/z 658 [M+H]+
ВЭЖХ время удерживания: 2,76 мин (условия анализа U)
[Пример 862]
Соединение LB3
2-{1-[4-Этил-3-(4-морфолин-4-ил-пиперидин-1-ил)фенил]-1-метил-этил}-6-йод-1H-индол-3-карбоновая кислота

трет-Бутиловый эфир 2-{1-[4-этил-3-(4-морфолин-4-ил-пиперидин-1-ил)фенил]-1-метил-этил}-6-йиод-1H-индол-3-карбоновой кислоты подвергали процедуре удаления защиты таким же способом, как описано для получения Соединения PR7, с получением указанного в заголовке соединения.
ЖХ/МС: m/z 602 [M+H]+
ВЭЖХ время удерживания: 2,17 мин (условия анализа U)
[Пример 863]
Соединение LB4
9-Этил-3-йод-6,6-диметил-8-(4-морфолин-4-ил-пиперидин-1-ил)-5,6-дигидро-бензо[b]карбазол-11-он

2-{1-[4-Этил-3-(4-морфолин-4-ил-пиперидин-1-ил)фенил]-1-метил-этил}-6-йод-1H-индол-3-карбоновую кислоту преобразовывали таким же способом, как в Примере 805, с получением указанного в заголовке соединения.
ЖХ/МС: m/z 584 [M+H]+
ВЭЖХ время удерживания: 2,25 мин (условия анализа U)
Соединения, описанные в следующей таблице 11, преобразовывали и получали из 9-этил-3-йод-6,6-диметил-8-(4-морфолин-4-ил-пиперидин-1-ил)-5,6-дигидро-бензо[b]карбазол-11-она в соответствии со способом, описанным в таблице.

[Пример 867]
Соединение AZ1
(2-Фторпиридин-4-ил)метиловый эфир метансульфоновой кислоты

(2-Фторпиридин-4-ил)метанол (1 г) растворяли в DCM (40 мл), добавляли TEA (3,3 мл) и мезилхлорид (0,67 мл) и смесь перемешивали при 0°C в течение 1 часа. Смесь концентрировали и затем очищали на колонке с силикагелем (н-гексан/этилацетат=4/1) с получением указанного в заголовке соединения (1,18 г, 77%).
1H-ЯМР(270 МГц, DМSO-d6) δ: 3,21 (3 H, с), 5,38 (2 H, с), 7,22 (1 H, с), 7,39 (1 H, д, J=5,0), 8,29 (1 H, д, J=5,0).
[Пример 868]
Соединение AZ2
(2-Фторпиридин-4-ил)ацетонитрил

К раствору 2-фторпиридин-4-ил)метилового эфира метансульфоновой кислоты (1,16 г) в DMF (28 мл) добавляли цианид натрия (0,42 г) и смесь перемешивали при 80°C в течение 1 часа. Смесь разбавляли этилацетатом (100 мл) и промывали 15% насыщенным солевым раствором и дистиллированной водой, в указанном порядке. Органический слой концентрировали и очищали на колонке с силикагелем (н-гексан/этилацетат=5/1) с получением указанного в заголовке соединения (278 мг, 36%).
1H-ЯМР(270 МГц, DМSO-d6) δ: 4,22 (2 H, с), 7,18 (1 H, с), 7,36 (1 H, д, J=5,0), 8,27 (1 H, д, J=5,0).
[Пример 869]
Соединение AZ3
(2-Фторпиридин-4-ил)2-метилпропионитрил

Указанное в заголовке соединение получали, исходя из (2-фторпиридин-4-ил)ацетонитрила, таким же способом, как способ, описанный для Соединения K2.
1H-ЯМР(270 МГц, DМSO-d6) δ: 1,72 (6 H, с), 7,34 (1 H, с), 7,53 (1 H, д, J=5,3), 8,31 (1 H, д, J=5,3).
[Пример 870]
Соединение AZ4
Этиловый эфир 4-(2-фторпиридин-4-ил)-4-метил-3-оксопентановой кислоты

Указанное в заголовке соединение получали, исходя из (2-фторпиридин-4-ил)-2-метилпропионитрила таким же способом, как способ, описанный для Соединения K3.
1H-ЯМР(270 МГц, DМSO-d6) δ: 1,13 (3 H, т, J=7,3), 1,48 (6 H, с), 3,57 (2 H, с), 4,01 (2 H, кв., J=7,3), 7,12 (1 H, с), 7,25 (1 H, д, J=5,3), 8,22 (1 H, д, J=5,3).
[Пример 871]
Соединение AZ5
Этиловый эфир 6-циано-2-[1-(2-фторпиридин-4-ил)-1-метил-этил]-1H-индол-3-карбоновой кислоты

Указанное в заголовке соединение получали, исходя из этилового эфира 4-(2-фторпиридин-4-ил)-4-метил-3-оксопентановой кислоты, таким же способом, как способ, описанный для Соединения K4 и Соединения K5.
ЖХ/МС: м/z 352 [М+H]+
1H-ЯМР(270 МГц, DМSO-d6) δ: 1,05 (3 H, т, J=7,3), 1,82 (6 H, с), 3,98 (2 H, кв., J=7,3), 6,99-7,02 (2 H, м), 7,16 (1 H, дд, J=8,4, 1,5), 7,97 (1 H, с), 8,05-8,11 (2 H, м).
[Пример 872]
Соединение AZ6
Этиловый эфир 6-циано-2-[1-(2-(4-морфолин-4-ил-пиперидин-1-ил))пиридин-4-ил)-1-метил-этил]-1H-индол-3-карбоновой кислоты

Этиловый эфир 6-циано-2-[1-(2-фторпиридин-4-ил)-1-метил-этил]-1H-индол-3-карбоновой кислоты (110 мг) растворяли в NMP (3,3 мл), добавляли 4-морфолин-4-ил-пиперидин (319 мг) и перемешивали в герметично закрываемой пробирке при 120°C в течение 1 часа. Реакционную смесь разбавляли этилацетатом (50 мл) и промывали 15% насыщенным солевым раствором и дистиллированной водой, в указанном порядке. Органический слой концентрировали и очищали на колонке с силикагелем (DCM/метанол=20/1) с получением указанного в заголовке соединения (120 мг, 76%).
ЖХ/МС: m/z 502 [M+H]+
[Пример 873]
Соединение AZ7-1
Амид 5,5-диметил-3-(4-морфолин-4-ил-пиперидин-1-ил)-11-оксо-6,11-дигидро-5H-пиридо[4,3-b]карбазол-8-карбоновой кислоты

Этиловый эфир 6-циано-2-[1-(2-(4-морфолин-4-ил-пиперидин-1-ил))пиридин-4-ил)-1-метил-этил]-1H-индол-3-карбоновой кислоты (110 мг) растворяли в реагенте Итона (2,5 мл) и перемешивали при 55°C в течение 17 часов. Реакционную смесь нейтрализовали насыщенным водным раствором бикарбоната натрия. Осажденные вещества собирали фильтрованием и затем промывали водой с получением указанного в заголовке соединения (72 мг, 70%).
ЖХ/МС: m/z 474 [M+H]+
ВЭЖХ время удерживания: 1,17 мин (условия анализа U)
1H-ЯМР(270 МГц, DМSO-d6) δ: 1,38 (2 H, м), 1,75 (6 H, с), 1,88 (2 H, м), 2,44 (5 H, м), 2,94 (2 H, м), 3,57 (4 H, м), 4,58 (2 H, м), 7,10 (1 H, с), 7,32 (1 H, с), 7,75 (1 H, д, J=8,4), 8,00 (2 H, м), 8,15 (1 H, д, J=8,4), 8,85 (1 H, с), 12,3 (1 H, с).
[Пример 874]
Соединение AZ7-2
5,5-Диметил-3-(4-морфолин-4-ил-пиперидин-1-ил)-11-оксо-6,11-дигидро-5H-пиридо[4,3-b]карбазол-8-карбонитрил

Амид 5,5-диметил-3-(4-морфолин-4-ил-пиперидин-1-ил)-11-оксо-6,11-дигидро-5H-пиридо[4,3-b]карбазол-8-карбоновой кислоты (54 мг) растворяли в DMF (1 мл), добавляли тионилхлорид (25 мкл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь разбавляли водой. Осажденные вещества собирали фильтрованием с получением указанного в заголовке соединения (25 мг, 49%).
1H-ЯМР(270 МГц, DМSO-d6) δ: 1,36 (2 H, м), 1,76 (6 H, с), 1,89 (2 H, м), 2,44 (5 H, м), 2,95 (2 H, м), 3,57 (4 H, м), 4,58 (2 H, м), 7,10 (1 H, с), 7,59 (1 H, д, J=8,0), 7,99 (1 H, с), 8,29 (1 H, д, J=8,0), 8,86 (1 H, с), 12,7 (1 H, с).
ЖХ/МС: m/z 456 [M+H]+
ВЭЖХ время удерживания: 1,55 мин (условия анализа U)
Соединения, описанные в следующих таблицах 12-13, были синтезированы путем введения соответствующей аминогруппы в этиловый эфир 6-циано-2-[1-(2-фторпиридин-4-ил)-1-метил-этил]-1H-индол-3-карбоновой кислоты и образования кольца, в соответствии со способом, который используют для синтеза Соединения AZ7-1. Кроме того, получение осуществляли путем преобразования группы заместителя в положении 3 из карбоксамидной группы в цианогруппу в соответствии со способом, который используют для синтеза Соединения AZ7-2.


Соединения, описанные в следующей таблице 14, были синтезированы, исходя из (2-хлор-3-фторпиридин-4-ил)метанола, в соответствии со способом, который используют для синтеза Соединения AZ1 до AZ7-2.

[Пример 900]
Соединение BZ1
2-Циано-4-гидразинопиридин

4-Хлор-2-цианопиридин (1 г) растворяли в гидразинмоногидрате (1 мл) и 1,4-диоксане (10 мл) и перемешивали в течение ночи при температуре кипения с обратным холодильником. Реакционный раствор разбавляли водой (30 мл) и экстрагировали повторно этилацетатом. Органический слой концентрировали с получением указанного в заголовке соединения в виде неочищенного продукта, который использовали на следующей стадии без дополнительной очистки.
ЖХ/МС: m/z 135 [M+H]+
[Пример 901]
Соединение BZ2-1
8-Метокси-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[f]пиридо[4,3-b]индол-3-карбонитрил

В соответствии со способом, используемым для синтеза Соединения A3-1, это промежуточное соединение получали из 2-циано-4-гидразинопиридина и 7-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-она. Без какой-либо очистки, это промежуточное соединение подвергали окислению в соответствии со способом, используемым для синтеза Соединения A4, с получением указанного в заголовке соединения.
ЖХ/МС: m/z 318 [M+H]+
ВЭЖХ время удерживания: 2,10 мин (условия анализа U)
[Пример 902]
Соединение BZ2-2
3-Хлор-8-метокси-6,6-диметил-5,6-дигидро-бензо[f]пиридо[4,3-b]индол-11-он

В соответствии со способом, используемым для синтеза Соединения A3-1, это промежуточное соединение получали из 2-хлор-4-гидразинопиридина и 7-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-она. Без какой-либо очистки, это промежуточное соединение подвергали окислению в соответствии со способом, используемым для синтеза Соединения A4, с получением указанного в заголовке соединения.
ЖХ/МС: m/z 327, 329 [M+H]+
ВЭЖХ время удерживания: 1,80 мин (условия анализа S)
[Пример 903]
Соединение CZ1
2-Бром-8-метокси-10,10-диметил-10,11-дигидро-1,11-диаза-бензо[b]флуорен-5-он

В соответствии со способом, используемым для синтеза Соединения A3-1, это промежуточное соединение получали из 2-бром-6-гидразинопиридина и 7-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-она. Без какой-либо очистки, это промежуточное соединение подвергали окислению в соответствии со способом, используемым для синтеза Соединения A4, с получением указанного в заголовке соединения.
ЖХ/МС: m/z 371, 373 [M+H]+
ВЭЖХ время удерживания: 2,85 мин (условия анализа U)
[Пример 904]
Соединение CZ2
8-Метокси-10,10-диметил-5-оксо-10,11-дигидро-5H-1,11-диаза-бензо[b]флуорен-2-карбонитрил

В соответствии со способом 1 для Соединения A5-2, 2-бром-8-метокси-10,10-диметил-10,11-дигидро-1,11-диаза-бензо[b]флуорен-5-он подвергали цианированию с получением указанного в заголовке соединения.
ЖХ/МС: m/z 318 [M+H]+
ВЭЖХ время удерживания: 2,35 мин (условия анализа U)
[Пример 905]
Соединение CZ3
8-Гидрокси-10,10-диметил-5-оксо-10,11-дигидро-5H-1,11-диаза-бензо[b]флуорен-2-карбонитрил

В соответствии со способом, используемым для синтеза Соединения A6, 8-метокси-10,10-диметил-5-оксо-10,11-дигидро-5H-1,11-диаза-бензо[b]флуорен-2-карбонитрил подвергали деметилированию с получением указанного в заголовке соединения.
ЖХ/МС: m/z 304 [M+H]+
ВЭЖХ время удерживания: 1,72 мин (условия анализа S)
[Пример 906]
Соединение CZ4
2-циано-10,10-диметил-5-оксо-10,11-дигидро-5H-1,11-диаза-бензо[b]флуорен-8-иловый эфир трифторметансульфоновой кислоты

В соответствии со способом, используемым для синтеза Соединения B1, 8-гидрокси-10,10-диметил-5-оксо-10,11-дигидро-5H-1,11-диаза-бензо[b]флуорен-2-карбонитрил подвергали трифторметансульфон-этерификации с получением указанного в заголовке соединения.
ЖХ/МС: m/z 436 [M+H]+
ВЭЖХ время удерживания: 3,32 мин (условия анализа Y)
[Пример 907]
Соединение CZ5-1
10,10-Диметил-5-оксо-8-пиперазин-1-ил-10,11-дигидро-5H-1,11-диаза-бензо[b]флуорен-2-карбонитрил

В соответствии со способом, используемым для синтеза Соединения B2-1, в 2-циано-10,10-диметил-5-оксо-10,11-дигидро-5H-1,11-диаза-бензо[b]флуорен-8-иловый эфир трифторметансульфоновой кислоты вводили пиперазин с получением указанного в заголовке соединения.
ЖХ/МС: m/z 372 [M+H]+
ВЭЖХ время удерживания: 1,17 мин (условия анализа S)
[Пример 908]
Соединение CZ5-2
10,10-Диметил-8-(4-морфолин-4-ил-пиперидин-1-ил)-5-оксо-10,11-дигидро-5H-1,11-диаза-бензо[b]флуорен-2-карбонитрил

В соответствии со способом, используемым для синтеза Соединения B2-1, в 2-циано-10,10-диметил-5-оксо-10,11-дигидро-5H-1,11-диаза-бензо[b]флуорен-8-иловый эфир трифторметансульфоновой кислоты вводили 4-морфолин-4-илпиперидин с получением указанного в заголовке соединения.
ЖХ/МС: m/z 456 [M+H]+
ВЭЖХ время удерживания: 1,68 мин (условия анализа U)
[Пример 909]
Соединение CZ6
8-(4-Циклобутил-пиперазин-1-ил)-10,10-диметил-5-оксо-10,11-дигидро-5H-1,11-диаза-бензо[b]флуорен-2-карбонитрил

В соответствии со способом, используемым для синтеза Соединения B3-32, 10,10-диметил-5-оксо-8-пиперазин-1-ил-10,11-дигидро-5H-1,11-диаза-бензо[b]флуорен-2-карбонитрил подвергали восстановительному аминированию с использованием циклобутанона с получением указанного в заголовке соединения.
ЖХ/МС: m/z 426 [M+H]+
ВЭЖХ время удерживания: 1,60 мин (условия анализа U)
[Пример 910]
Соединение DZ1
6-Этинил-7-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-он

6-Бром-7-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-он (1 г) растворяли в ацетонитриле (50 мл), добавляли PdCl2(CH3CN)2 (45 мг), X-phos (168 мг), CsCO3 (1,2 г) и триметилсилилацетилен (0,9 мл) и смесь перемешивали при 85°C в течение 2 часов. Реакционную смесь разбавляли этилацетатом (100 мл). Органический слой промывали два раза 10% насыщенным солевым раствором и концентрировали при пониженном давлении. Полученные остатки растворяли в ТГФ (10 мл), добавляли ТГФ раствор (4 мл), содержащий тетрабутиламмонийфторид, и перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь разбавляли этилацетатом (100 мл). Органический слой промывали два раза 10% насыщенным солевым раствором и концентрировали при пониженном давлении. Полученные остатки очищали на колонке с силикагелем (н-гексан/этилацетат=9/1) с получением указанного в заголовке соединения (346 мг, за две стадии выход 43%).
ЖХ/МС: m/z 229 [M+H]+
[Пример 911]
Соединение DZ2
6-Этил-7-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-он

6-Этинил-7-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-он (346 мг) растворяли в этаноле:ТГФ (2:1 смешанный растворитель, 20 мл), добавляли 10% Pd/C (l70 мг) и затем смесь перемешивали при комнатной температуре в течение 1 часа в атмосфере водорода. Катализатор удаляли фильтрованием, и органический слой концентрировали при пониженном давлении с получением указанного в заголовке соединения (322 мг, выход 91%).
ЖХ/МС: m/z 233 [M+H]+
[Пример 912]
Соединение DZ3
2-Бром-7-этил-8-метокси-10,10-диметил-10,11-дигидро-1,11-диаза-бензо[b]флуорен-5-он

В соответствии со способом, используемым для синтеза Соединения A3-1, это промежуточное соединение получали из 2-бром-6-гидразинопиридина и 6-этил-7-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-она. Без какой-либо очистки, это промежуточное соединение подвергали окислению в соответствии со способом, используемым для синтеза Соединения A4, с получением указанного в заголовке соединения.
ЖХ/МС: m/z 399, 401 [M+H]+
ВЭЖХ время удерживания: 3,35 мин (условия анализа Y)
[Пример 913]
Соединение DZ4
7-Этил-8-метокси-10,10-диметил-5-оксо-10,11-дигидро-5H-1,11-диаза-бензо[b]флуорен-2-карбонитрил

В соответствии со способом 1 для Соединения A5-2, 2-бром-7-этил-8-метокси-10,10-диметил-10,11-дигидро-1,11-диаза-бензо[b]флуорен-5-он подвергали цианированию с получением указанного в заголовке соединения.
ЖХ/МС: m/z 346 [M+H]+
ВЭЖХ время удерживания: 3,05 мин (условия анализа Y)
[Пример 914]
Соединение DZ5
7-Этил-8-гидрокси-10,10-диметил-5-оксо-10,11-дигидро-5H-1,11-диаза-бензо[b]флуорен-2-карбонитрил

В соответствии со способом, используемым для синтеза Соединения A5, 7-этил-8-метокси-10,10-диметил-5-оксо-10,11-дигидро-5H-1,11-диаза-бензо[b]флуорен-2-карбонитрил подвергали деметилированию с получением указанного в заголовке соединения.
ЖХ/МС: m/z 332 [M+H]+
ВЭЖХ время удерживания: 2,60 мин (условия анализа Y)
[Пример 915]
Соединение DZ6-1
2-Циано-7-этил-10,10-диметил-5-оксо-10,11-дигидро-5H-1,11-диаза-бензо[b]флуорен-8-иловый эфир трифторметансульфоновой кислоты

В соответствии со способом, используемым для синтеза Соединения B1, 7-этил-8-гидрокси-10,10-диметил-5-оксо-10,11-дигидро-5H-1,11-диаза-бензо[b]флуорен-2-карбонитрил подвергали трифторметансульфон-этерификации с получением указанного в заголовке соединения.
ЖХ/МС: m/z 464 [M+H]+
ВЭЖХ время удерживания: 3,50 мин (условия анализа Y)
Соединения, описанные в следующей таблице 15, получали из 2-циано-7-этил-10,10-диметил-5-оксо-10,11-дигидро-5H-1,11-диаза-бензо[b]флуорен-8-илового эфира трифторметансульфоновой кислоты и соответствующего амина в соответствии со способом, который используют для синтеза Соединения B2-10. Соединения Примера 919 и Примера 920 получали в виде побочного продукта реакции.

[Пример 921]
Соединение DZ6-2
8-(2-Диэтиламино-этокси)-11-(2-диэтиламино-этил)-7-этил-10,10-диметил-5-оксо-10,11-дигидро-5H-1,11-диаза-бензо[b]флуорен-2-карбонитрил

В соответствии со способом, используемым для синтеза Соединения A7-17, 7-этил-8-гидрокси-10,10-диметил-5-оксо-10,11-дигидро-5H-1,11-диаза-бензо[b]флуорен-2-карбонитрил подвергали алкилированию с получением указанного в заголовке соединения.
ЖХ/МС: m/z 530 [M+H]+
ВЭЖХ время удерживания: 1,38 мин (условия анализа Y)
[Пример 922]
Соединение EZ1
Этиловый эфир 2-(6-метоксипиридин-2-ил)-2-метилпропионовой кислоты
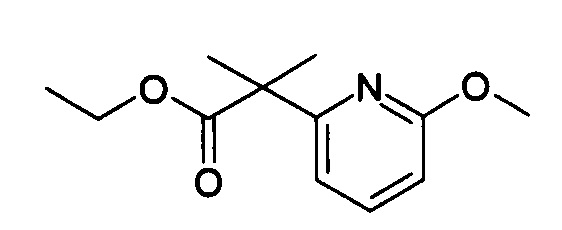
2-Бром-6-метоксипиридин (7,0 г), этилизобутират (4,75 г), три-трет-бутилфосфин (300 мг) и Pd2(dba)3 (680 мг) растворяли в толуоле (200 мл) в атмосфере азота, добавляли раствор LiHMDS (1,6 M, 24 мл) в ТГФ и смесь перемешивали при 100°C в течение 6 часов. Реакционную смесь разбавляли этилацетатом (300 мл) и промывали три раза 15% насыщенным солевым раствором (200 мл). Органический слой концентрировали при пониженном давлении, и полученные остатки очищали на колонке с силикагелем (н-гексан/этилацетат=4/1) с получением указанного в заголовке соединения (5,353 г, выход 60%).
ЖХ/МС: m/z 224 [M+H]+
[Пример 923]
Соединение EZ2
2-(6-Метокси-пиридин-2-ил)-2-метилпропионовая кислота

Этиловый эфир 2-(6-метоксипиридин-2-ил)-2-метилпропионовой кислоты (5,33 г) растворяли в метаноле (200 мл), добавляли 5 н водный раствор гидроксида калия (25 мл) и затем перемешивали при температуре кипения с обратным холодильником. Реакционную смесь концентрировали и нейтрализовали при помощи 2 н раствора хлористоводородной кислоты. Осажденные вещества собирали фильтрованием и сушили с получением указанного в заголовке соединения (3,55 г).
ЖХ/МС: m/z 196 [M+H]+
[Пример 924]
Соединение EZ3
трет-Бутиловый эфир 4-(6-метоксипиридин-2-ил)-4-метил-3-оксопентановой кислоты

Указанное в заголовке соединение синтезировали, исходя из 2-(6-метокси-пиридин-2-ил)-2-метилпропионовой кислоты и моно-трет-бутилмалоновой кислоты, в соответствии со способом, используемым для синтеза Соединения PR4. Полученную смесь использовали на следующей стадии без дополнительной очистки.
[Пример 925]
Соединение EZ4-1
трет-Бутиловый эфир 6-циано-2-[1-(6-метокси-пиридин-2-ил)-1-метил-этил]-1H-индол-3-карбоновой кислоты
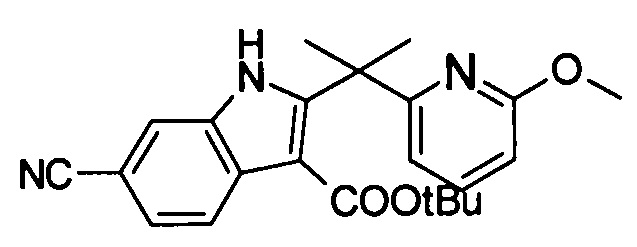
В соответствии со способом, который используют для получения Соединения PR5-1, указанное в заголовке соединение синтезировали, исходя из трет-бутилового эфира 4-(6-метокси-пиридин-2-ил)-4-метил-3-оксо-пентановой кислоты и 4-хлор-3-нитробензонитрила.
ЖХ/МС: m/z 392 [M+H]+
[Пример 926]
Соединение EZ4-2
трет-Бутиловый эфир 6-циано-2-[1-(6-метокси-пиридин-2-ил)-1-метил-этил]бензофуран-3-карбоновой кислоты
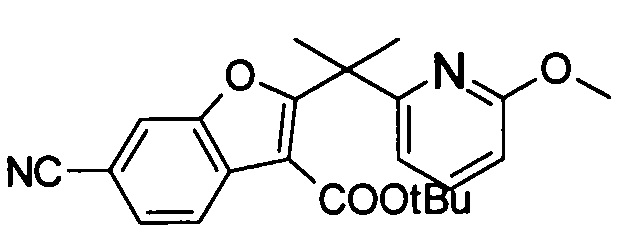
В соответствии со способом, который используют для получения Соединения FR1, указанное в заголовке соединение синтезировали, исходя из трет-бутилового эфира 4-(6-метокси-пиридин-2-ил)-4-метил-3-оксо-пентановой кислоты и 4-хлор-3-нитробензонитрила.
ЖХ/МС: m/z 393 [M+H]+
[Пример 927]
Соединение EZ5-1
6-Циано-2-[1-(6-метокси-пиридин-2-ил)-1-метил-этил]-1H-индол-3-карбоновая кислота

В соответствии со способом, который используют для получения Соединения PR7, указанное в заголовке соединение синтезировали, исходя из трет-бутилового эфира 6-циано-2-[1-(6-метокси-пиридин-2-ил)-1-метил-этил]-1H-индол-3-карбоновой кислоты.
ЖХ/МС: m/z 336 [M+H]+
[Пример 928]
Соединение EZ5-2
6-Циано-2-[1-(6-метокси-пиридин-2-ил)-1-метил-этил]бензофуран-3-карбоновая кислота

В соответствии со способом, который используют для получения Соединения PR7, указанное в заголовке соединение синтезировали, исходя из трет-бутилового эфира 6-циано-2-[1-(6-метокси-пиридин-2-ил)-1-метил-этил]бензофуран-3-карбоновой кислоты.
ЖХ/МС: m/z 337 [M+H]+
[Пример 929]
Соединение EZ6-1
Амид 2-метокси-11,11-диметил-5-оксо-10,11-дигидро-5H-пиридо[2,3-b]карбазол-8-карбоновой кислоты
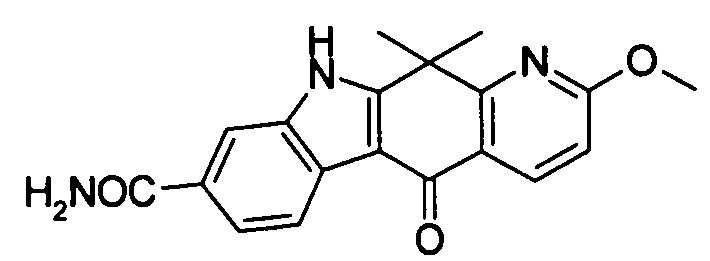
В соответствии со способом, который используют для получения Соединения AZ7-1, указанное в заголовке соединение синтезировали, исходя из 6-циано-2-[1-(6-метокси-пиридин-2-ил)-1-метил-этил]-1H-индол-3-карбоновой кислоты.
ЖХ/МС: m/z 336 [M+H]+
ВЭЖХ время удерживания: 1,98 мин (условия анализа S)
[Пример 930]
Соединение EZ6-2
Амид 2-метокси-11,11-диметил-5-оксо-5,11-дигидро-бензо[4,5]фуро[3,2-g]хинолин-8-карбоновой кислоты

В соответствии со способом, который используют для получения Соединения AZ7-1, указанное в заголовке соединение синтезировали, исходя из 6-циано-2-[1-(6-метокси-пиридин-2-ил)-1-метил-этил]бензофуран-3-карбоновой кислоты.
ЖХ/МС: m/z 337 [M+H]+
ВЭЖХ время удерживания: 2,38 мин (условия анализа S)
[Пример 931]
Соединение EZ7-1
2-Метокси-11,11-диметил-5-оксо-10,11-дигидро-5H-пиридо[2,3-b]карбазол-8-карбонитрил

В соответствии со способом, который используют для получения Соединения AZ7-2, указанное в заголовке соединение синтезировали, исходя из амида 2-метокси-11,11-диметил-5-оксо-10,11-дигидро-5H-пиридо[2,3-b]карбазол-8-карбоновой кислоты.
ЖХ/МС: m/z 318 [M+H]+
ВЭЖХ время удерживания: 2,60 мин (условия анализа S)
[Пример 932]
Соединение EZ7-2
2-Метокси-11,11-диметил-5-оксо-5,11-дигидро-бензо[4,5]фуро[3,2-g]хинолин-8-карбонитрил

В соответствии со способом, который используют для получения Соединения AZ7-2, указанное в заголовке соединение синтезировали, исходя из амида 2-метокси-11,11-диметил-5-оксо-5,11-дигидро-бензо[4,5]фуро[3,2-g]хинолин-8-карбоновой кислоты.
ЖХ/МС: m/z 319 [M+H]+
ВЭЖХ время удерживания: 3,18 мин (условия анализа S)
[Пример 933]
Соединение EZ8-1
2-Гидрокси-11,11-диметил-5-оксо-10,11-дигидро-5H-пиридо[2,3-b]карбазол-8-карбонитрил

В соответствии со способом, который используют для получения Соединения A5, 2-метокси-11,11-диметил-5-оксо-10,11-дигидро-5H-пиридо[2,3-b]карбазол-8-карбонитрил подвергали деметилированию с осуществлением синтеза указанного в заголовке соединения.
ЖХ/МС: m/z 304 [M+H]+
ВЭЖХ время удерживания: 1,70 мин (условия анализа U)
[Пример 934]
Соединение EZ8-2
2-Гидрокси-11,11-диметил-5-оксо-5,11-дигидро-бензо[4,5]фуро[3,2-g]хинолин-8-карбонитрил

В соответствии со способом, который используют для получения Соединения A5, 2-метокси-11,11-диметил-5-оксо-5,11-дигидро-бензо[4,5]фуро[3,2-g]хинолин-8-карбонитрил подвергали деметилированию с осуществлением синтеза указанного в заголовке соединения.
ЖХ/МС: m/z 305 [M+H]+
ВЭЖХ время удерживания: 2,17 мин (условия анализа U)
Соединения, описанные в следующей таблице 16, были синтезированы, исходя из 2-гидрокси-11,11-диметил-5-оксо-10,11-дигидро-5H-пиридо[2,3-b]карбазол-8-карбонитрила или из 2-гидрокси-11,11-диметил-5-оксо-5,11-дигидро-бензо[4,5]фуро[3,2-g]хинолин-8-карбонитрила, в соответствии со способом описанным в таблице.

Соединения, описанные в следующей таблице 17, были синтезированы, исходя из Соединения W3 и соответствующего галогенида, путем алкилирования гидроксильной группы в соответствии со способом, который используют для синтеза Соединения A7-17.

Соединения, описанные в следующей таблице 18, были синтезированы в соответствии со способом, представленным ниже. Конкретно, Соединение GT1-1 получали, исходя из Соединения J2 и фенилгидразина, в соответствии со способом, который используют для синтеза Соединения A3 и Соединения A4. Затем, в соответствии с метилированием, осуществляемым таким же способом, как описано для Соединения A10-1, получали Соединение GT1-2.

Соединения, описанные в следующей таблице 19, были синтезированы в соответствии со способом, представленным ниже. Конкретно, Соединение GT2-1 получали, исходя из Соединения A2 и фенилгидразина, в соответствии со способом, который используют для синтеза Соединения A3 и Соединения A4.
Затем, путем осуществления алкилирования таким же способом, как описано для Соединения A10-1, были получены Соединение GT2-2 и Соединение GT2-8.
Для получения соединений, представленных в таблице, химическое преобразование Соединения GT2-1 или 5-алкилирование Соединения GT2-1 осуществляли с использованием, в сочетании, модификаций функциональных групп (например, деметилирования в соответствии со способом, используемым для получения Соединения A6, и последующего введения функциональной группы, и т.п.), как объясняется выше и описано в таблице.

Соединения, описанные в следующей таблице 20, были синтезированы в соответствии со способом, представленным ниже. Конкретно, путем использования Соединения A2 и фенилгидразина, содержащего соответствующую группу заместителя, получали 2(или 3)-замещенный-8-метокси-6,6-диметил-6,11-дигидро-5H-бензо[b]карбазол-11-он в соответствии со способом, который используют для синтеза Соединения A3 и Соединения A4. Затем для получения соединений, представленных в таблице, химическое преобразование указанных выше соединений осуществляли с использованием, в сочетании, модификаций функциональных групп, как объясняется выше и описано в таблице.

Соединения, описанные в следующей таблице 21, были синтезированы в соответствии со способом, представленным ниже. Конкретно, путем использования Соединения E1 и фенилгидразина, содержащего соответствующую группу заместителя, 9-бром-1-хлор-8-метокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он или 9-бром-8-метокси-6,6-диметил-3-трифторметокси-5,6-дигидро-бензо[b]карбазол-11-он получали в соответствии со способом, используемым для синтеза Соединения A3 и Соединения A4. Затем для получения соединений, представленных в таблице, химическое преобразование указанных выше соединений осуществляли с использованием, в сочетании, модификаций функциональных групп, как объясняется выше и описано в таблице.

Соединения, описанные в следующих таблицах 22-23, были синтезированы в соответствии со способом, представленным ниже. Конкретно, каталитическое восстановление Соединения GT3-3 осуществляли в соответствии со способом, используемым для получения Соединения D2, с получением Соединения GT5-1.
Восстановительное алкилирование Соединения GT5-1 осуществляли в соответствии со способом, используемым для получения Соединения B3-32, для введения метильной группы или бензильной группы (Соединение GT5-2, Соединение GT5-3).
Каталитическое восстановление Соединения GT5-3 осуществляли в соответствии со способом, используемым для получения Соединения D2, с последующей обработкой с получением Соединения GT5-4.
Полученные аминопроизводные Соединений GT5-1-GT5-4 подвергали взаимодействию с соответствующим ацилхлоридом, изоцианатом или хлороформиатом в соответствии со способом, используемым для получения Соединения A9-1, с получением соединений, представленных в таблице.

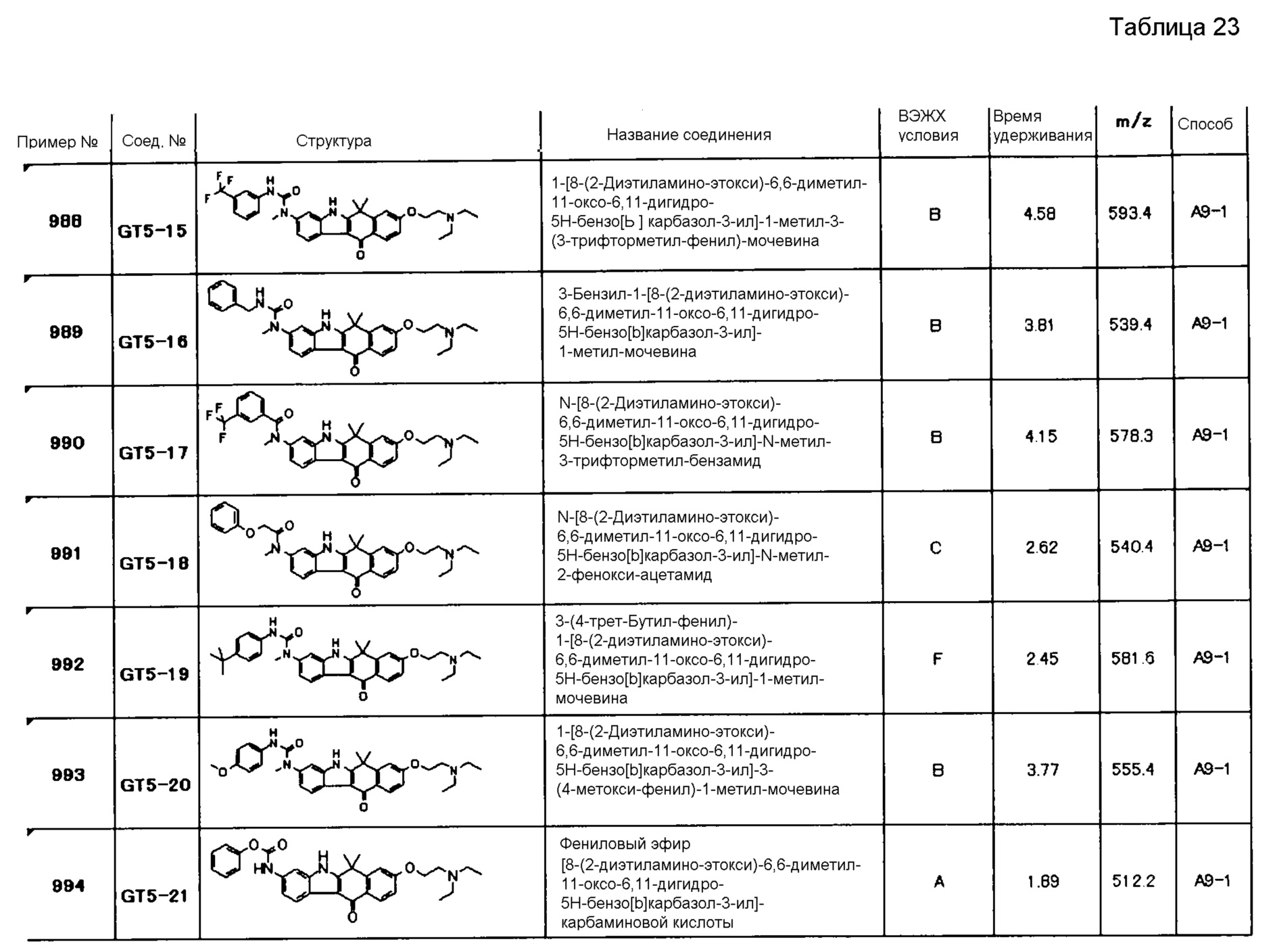
Соединения, описанные в следующей таблице 24, были синтезированы в соответствии со способом, представленным ниже. Конкретно, используя Соединение T22-1 в качестве исходного вещества, 8-[(4R,5R)-5-(трет-бутил-диметилсиланилоксиметил)-2,2-диметил-[1,3]диоксолан-4-илметокси]-6,6-диметил-5,6-дигидро-11-оксо-бензо[b]карбазол-3-карбоновую кислоту получали в соответствии со способом, который используют для получения Соединения B2-28.
Полученную карбоновую кислоту подвергали конденсации с дегидратированием с соответствующим амином, спиртом в соответствии со способом, который используют для получения Соединения A9-10. Затем осуществляли удаление защиты в соответствии со способом, используемым для получения Соединения T22-1-1 и Соединения T22-1-2, с получением соединений, описанных в таблице.

Соединения, описанные в следующей таблице 25, подвергали процедуре введения гидроксильной группы, исходя из Соединения T17-3, в соответствии со способом, описанным в JACS 2006, том 128, стр. 10964. Затем осуществляли удаление защиты в соответствии со способом, используемым для Соединения A7-14-2 и Соединения T22-2, с получением соединений, представленых ниже.

Соединения, описанные в следующей таблице 26, получали путем алкилирования в соответствии со способом, используемым для получения Соединения A7-1, исходя из Соединения GT7-1 или Соединения GT7-2, или путем карбамирования в соответствии со способом, используемым для получения соединения A9-1.

[Пример 1015]
Соединение GT9-1
8-((R)-2,3-Дигидрокси-пропокси)-6,6-диметил-3-(2H-тетразол-5-ил)-5,6-дигидро-бензо[b]карбазол-11-он

8-((S)-2,2-Диметил[1,3]диоксолан-4-илметокси)-6,6-диметил-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил (20,0 мг, 0,048 ммоль), хлорид аммония (1,28 мг, 0,024 ммоль) и NaN3(6,24 мг, 0,096 ммоль) растворяли в DMF и смесь перемешивали при 120°C в течение 14 часов. Затем к смеси добавляли NaN3(6,24 мг, 0,096 ммоль), затем смесь перемешивали при 120°C в течение 30 часов. К реакционному раствору добавляли 1 н водный раствор хлористоводородной кислоты и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и концентрировали при пониженном давлении. Полученное твердое после концентрирования вещество промывали гексаном:этилацетатом=1:1 с получением 8-((S)-2,2-диметил[1,3]диоксолан-4-илметокси)-6,6-диметил-3-(2H-тетразол-5-ил)-5,6-дигидро-бензо[b]карбазол-11-она в виде белого твердого вещества.
Полученный продукт суспендировали в MeOH (1,0 мл), добавляли 1 н водный раствор хлористоводородной кислоты и затем перемешивали при 60°C в течение 1 часа и 30 минут. После охлаждения до комнатной температуры реакционный раствор концентрировали при пониженном давлении, и полученное твердое вещество промывали при помощи DCM с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества (13,4 мг, 66,3%).
ЖХ/МС: m/z 420 [M+H]+
[Пример 1016]
Соединение GT9-2
8-((R)-2,3-Дигидрокси-пропокси)-6,6-диметил-3-тиофен-3-ил-5,6-дигидро-бензо[b]карбазол-11-он

3-Бром-8-((S)-2,2-диметил[1,3]диоксолан-4-илметокси)-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он (20,0 мг, 0,043 ммоль), тиофен-3-бороновую кислоту (10,9 мг, 0,085 ммоль), K3PO4(40 мг) и Pd(PPh3)4(9,9 мг, 0,0086 ммоль) растворяли в DMA (0,8 мл) и воде (0,2 мл) и перемешивали при 140°C в течение 10 минут в условиях микроволнового облучения. Реакционный раствор разбавляли этилацетатом и промывали насыщенным солевым раствором. Органический слой концентрировали при пониженном давлении, и полученные остатки очищали колоночной хроматографией (гексан/этилацетат) с получением 8-((S)-2,2-диметил[1,3]диоксолан-4-илметокси)-6,6-диметил-3-тиофен-3-ил-5,6-дигидро-бензо[b]карбазол-11-она.
Этот продукт суспендировали в MeOH (1,0 мл), добавляли 1 н раствор хлористоводородной кислоты и затем перемешивали при 60°C в течение 1 часа и 30 минут. Реакционный раствор концентрировали при пониженном давлении, и полученное твердое вещество промывали при помощи DCM с получением указанного в заголовке соединения в виде желтого твердого вещества (12,6 мг, 67,1%).
ЖХ/МС: m/z 434 [M+H]+
С использованием сочетания Соединения T18-1 и соответствующей бороновой кислоты или сочетания (S)-8-((2,2-диметил-1,3-диоксолан-4-ил)метокси)-6,6-диметил-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5H-бензо[b]карбазол-11(6H)-она и соответствующнго бромида реакцию осуществляли таким же способом, как описано для Соединения GT9-2, с получением соединений, представленных в следующей таблице 27.

[Пример 1022]
Соединение GT10-1
8-((2R,3R)-2,3,4-Тригидроксибутокси)-2’,3’,5’,6’-тетрагидроспиро[бензо[b]карбазол-6,4’-пиран]-11(5H)-он

Получение осуществляли таким же способом, как описано для Соединения N6-1-2.
ЖХ/МС: m/z 434 [M+H]+
ВЭЖХ время удерживания: 1,56 мин (условия анализа A)
Соединения, описанные в следующей таблице 28, были синтезированы в соответствии со способом, представленным ниже. Конкретно, используя способ получения Соединения Z10, Z11, Z12 и Z13, 8-гидрокси-6,6-диметил-6H-бензо[b]нафто[2,3-d]фуран-11-он получали, исходя из Соединения A2 и бромфенола. К полученному соединению присоединяли боковую цепь или ее синтетический эквивалент в соответствии с реакцией Мицунобу, которую используют для получения Соединения A7-1, или способом, который используют для A7-17 и т.п. Затем, если это необходимо, осуществляют модификацию функциональной группы, такую как удаление защиты и т.п., с получением соединений, перечисленных ниже.





Соединения, описанные в следующей таблице 33, были синтезированы в соответствии со способом, представленным ниже. Исходя из Соединения A2 и 2-бромфенола, содержащего атом фтора в соответствующем положении, 8-метокси-6H-бензо[b]нафто[2,3-d]фуран-11-он, содержащий атом фтора в соответствующем положении (Соединение GT12-1, GT12-2, GT12-5 и GT12-7), получали в соответствии со способом, используемым для получения Соединения Z10, Z11 и Z12. Затем осуществляли деметилирование в соответствии со способом, используемым для получения Соединения A6, с получением 8-гидрокси-6H-бензо[b]нафто[2,3-d]фуран-11-она, который содержал атом фтора в соответствующем положении. Затем, в соответствии с реакцией Мицунобу, используемой для получения Соединения A7-1, или способом алкилирования, используемым для получения Соединения A7-17, осуществляли введение соответствующей боковой цепи и, если это необходимо, модификацию функциональной группы, такую как удаление защиты и т.п., с получением соединений, перечисленных ниже.

Соединения, описанные в следующей таблице 34, были синтезированы в соответствии со способом, представленным ниже. 8-Гидрокси-6H-бензо[b]нафто[2,3-d]фуран-11-он преобразовывали в сложный эфир трифторметансульфоновой кислоты в соответствии со способом, используемым для получения Соединения B1. Затем путем осуществления способа, используемого для получения Соединения B2-1 или Соединения B2-18, были получены Соединение GT13-1, Соединение GT13-2 и Соединение GT13-3. Соединение GT13-3 подвергали окислению в соответствии со способом, используемым для получения Соединения B3-8, с получением Соединения 13-4.

Соединения, описанные в следующей таблице 35, были синтезированы в соответствии со способом, представленным ниже. Конкретно, осуществляли присоединение боковой цепи к Соединению Z13 с получением Соединения GT13-5 в соответствии со способом, который используют для получения Соединения A7-17. Затем Соединение GT13-5 или сложный эфир трифторметансульфоновой кислоты Соединения Z14 гидролизовали, с получением Соединения GT13-6 и Соединения GT13-7, в соответствии со способом, используемым для получения Соединения T20.

Соединения, описанные в следующей таблице 36, получали, подвергая Соединение GT13-6 или GT13-7 реакции Мицунобу, которую используют для получения Соединения A7-1, для введения соответствующей боковой цепи или синтетического эквивалента. Затем путем осуществления удаления защиты, если это необходимо, получали соединения, перечисленные ниже.

Соединения, описанные в следующей таблице 37, получали, исходя из Соединения GT13-7, в соответствии с карбамированием, которое используют для получения Соединения A9-1.

Соединения, описанные в следующей таблице 38, получали из соответствующих промежуточных соединений путем алкилирования и карбамирования на основе способа, описанного в таблице.
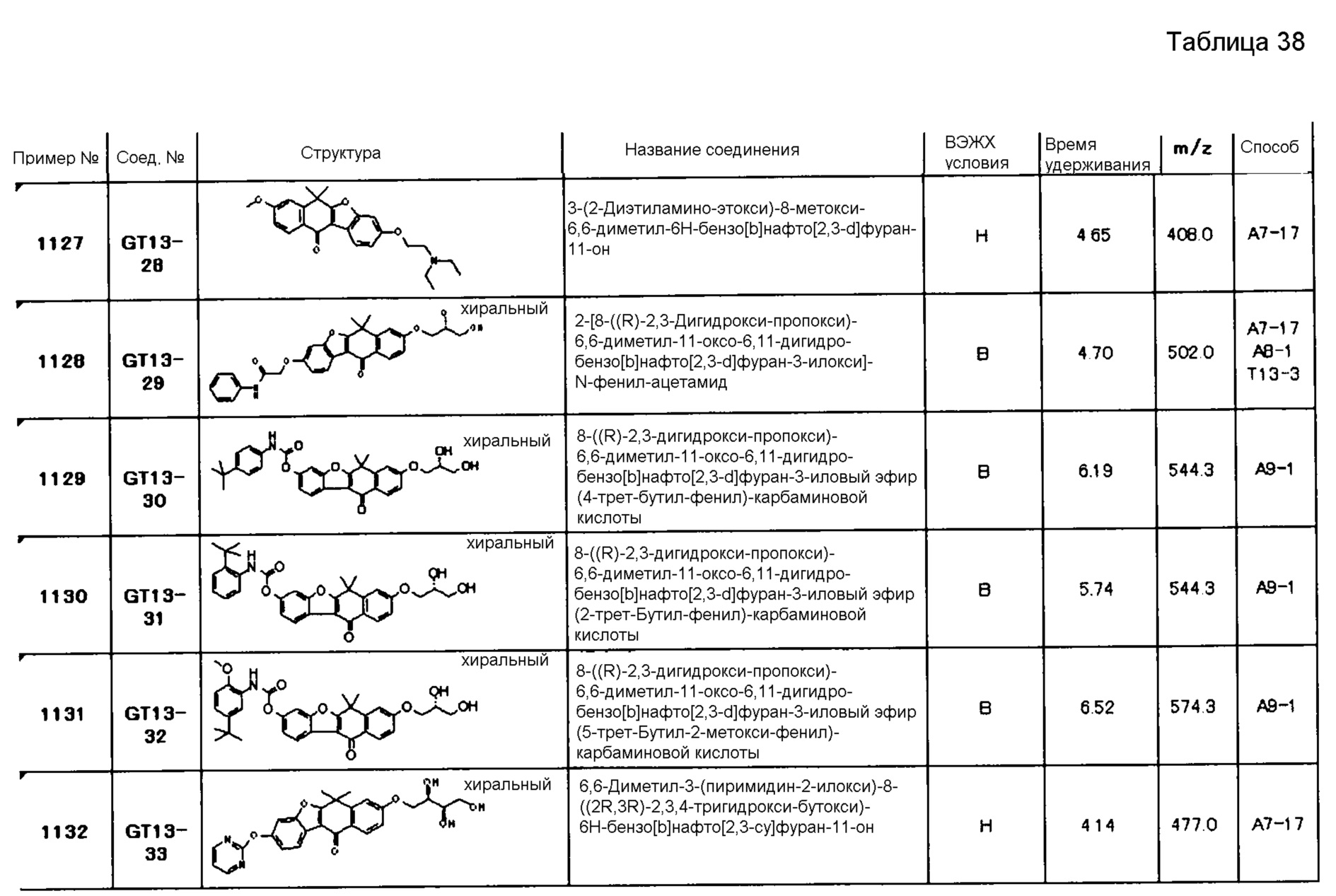
[Пример 1133]
Соединение GT14-1
3-Хлор-8-((R)-2,3-дигидрокси-пропокси)-6,6-диметил-5,6-дигидро-бензо[f]пиридо[4,3-b]индол-11-он

Соединение BZ2-2 подвергали деметилированию в соответствии со способом, используемым для получения Соединения A6, и затем вводили группу заместителя и осуществляли удаление защиты в соответствии со способом, используемым для получения Соединения A7-14-1 и A7-14-2.
ЖХ/МС: m/z 386 [M+H]+
ВЭЖХ время удерживания: 3,02 мин (условия анализа B)
[Пример 1134]
Соединение GT15-1
2-Йод-3-(4-метокси-бензилокси)пиридин

К 2-йодпиридин-3-олу (50 мг, 0,226 ммоль), K2CO3(62 мг, 0,452 ммоль) и DMF (2 мл) добавляли пара-метоксибензилхлорид (46 мкл, 0,339 ммоль) и смесь перемешивали в течение ночи при 45°C. К смеси добавляли воду и затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и остатки, полученные после концентрирования при пониженном давлении, очищали на колонке с силикагелем (этилацетат/гексан) с получением указанного в заголовке соединения (21 мг, 27%).
ЖХ/МС: m/z 342 [M+H]+
ВЭЖХ время удерживания: 3,44 мин (условия анализа Y)
[Пример 1135]
Соединение GT15-2
7-Метокси-3-[3-(4-метокси-бензилокси)пиридин-2-ил]-1,1-диметил-3,4-дигидро-1H-нафталин-2-он

К 7-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-ону (Соединение A2, 36 мг), 2-йод-3-(4-метокси-бензилокси)пиридину (Соединение GT15-1, 50 мг), трет-бутоксиду натрия (35,3 мг), Pd2(dba)3(13,5 мг) и Xantphos (17 мг) добавляли толуол (0,5 мл) и смесь перемешивали и нагревали при 80°C в течение 2,5 часов в атмосфере азота. После охлаждения реакционную смесь разбавляли этилацетатом и фильтровали через Целит. Органический слой промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором и затем концентрировали при пониженном давлении. Полученные остатки очищали на колонке с силикагелем (этилацетат/гексан) с получением указанного в заголовке соединения (27 мг, 44%).
ЖХ/МС: m/z 419 [M+H]+
ВЭЖХ время удерживания: 3,31 мин (условия анализа Y)
[Пример 1136]
Соединение GT15-3
8-Метокси-10,10-диметил-5,10-дигидро-11-окса-4-аза-бензо[b]флуорен
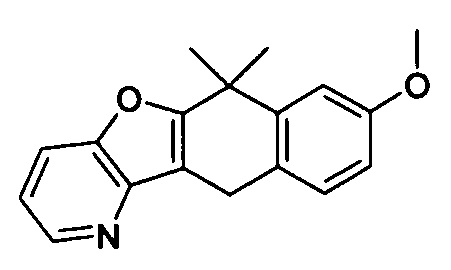
К смеси 7-метокси-3-[3-(4-метокси-бензилокси)пиридин-2-ил]-1,1-диметил-3,4-дигидро-1H-нафталин-2-она (Соединение GT15-2, 21 мг) и этилацетата (0,8 мл) добавляли серную кислоту (0,2 мл). Смесь перемешивали и нагревали при 70°C в течение 5 часов. После охлаждения реакционную смесь нейтрализовали при помощи 2 н водного раствора гидроксида натрия. Смесь разбавляли этилацетатом. Органический слой промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором и затем концентрировали при пониженном давлении. Полученные остатки очищали на колонке с силикагелем (этилацетат/гексан) с получением указанного в заголовке соединения (7 мг, 50%).
ЖХ/МС: m/z 280 [M+H]+
ВЭЖХ время удерживания: 2,71 мин (условия анализа Y)
[Пример 1137]
Соединение GT15-4
8-Метокси-10,10-диметил-10H-11-окса-4-аза-бензо[b]флуорен-5-он

8-Метокси-10,10-диметил-5,10-дигидро-11-окса-4-аза-бензо[b]флуорен (Соединение GT15-3, 22 мг) растворяли в MeCN (0,26 мл) и воде (0,13 мл), добавляли хлорит натрия (14 мг) и N-гидроксифталимид (2,6 мг) и смесь перемешивали при 40°C в течение 1 часа. Реакционную смесь разбавляли этилацетатом. Органический слой промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором и затем концентрировали при пониженном давлении. Полученные остатки очищали на колонке с силикагелем (этилацетат/гексан) с получением указанного в заголовке соединения (16 мг, 70%).
ЖХ/МС: m/z 294 [M+H]+
ВЭЖХ время удерживания: 2,85 мин (условия анализа Y)
[Пример 1138]
Соединение GT15-5
8-Гидрокси-10,10-диметил-10H-11-окса-4-аза-бензо[b]флуорен-5-он

Смесь 8-метокси-10,10-диметил-10H-11-окса-4-аза-бензо[b]флуорен-5-она (Соединение GT15-4, 25 мг) и пиридина в форме соли хлористоводородной кислоты (492 мг) перемешивали и нагревали при 178°C в течение ночи. Реакционную смесь охлаждали и добавляли воду. Смесь нейтрализовали насыщенным водным раствором бикарбоната натрия и экстрагировали при помощи DCM. Органический слой промывали насыщенным солевым раствором и затем концентрировали при пониженном давлении. Полученные остатки очищали на колонке с силикагелем (DCM/MeOH) с получением указанного в заголовке соединения (13 мг, 54%).
ЖХ/МС: m/z 280 [M+H]+
ВЭЖХ время удерживания: 2,30 мин (условия анализа Y)
[Пример 1139]
Соединение GT15-6
8-[(4R,5R)-5-(Трет-бутил-диметилсиланилоксиметил)-2,2-диметил[1,3]диоксолан-4-илметокси]-10,10-диметил-10H-11-окса-4-аза-бензо[b]флуорен-5-он

Таким же способом, как описано для Соединения A7-1, синтезировали указанное в заголовке соединение, исходя из Соединения GT15-5 и Соединения T22-0 (29 мг, 50%).
ЖХ/МС: m/z 538 [M+H]+
ВЭЖХ время удерживания: 3,64 мин (условия анализа Y)
[Пример 1140]
Соединение GT15-7
10,10-Диметил-8-((2R,3R)-2,3,4-тригидрокси-бутокси)-10H-11-окса-4-аза-бензо[b]флуорен-5-он

К смеси 8-[(4R,5R)-5-(трет-бутил-диметилсиланилоксиметил)-2,2-диметил[1,3]диоксолан-4-илметокси]-10,10-диметил-10H-11-окса-4-аза-бензо[b]флуорен-5-она (Соединение GT15-6, 27 мг), MeOH (0,1 мл) и ТГФ (0,3 мл) добавляли 0,5 н раствор серной кислоты (0,1 мл) и смесь перемешивали и нагревали при температуре 55-60°C в течение 4 часов. Реакционную смесь нейтрализовали насыщенным водным раствором бикарбоната натрия. Полученное твердое вещество фильтровали и промывали диэтиловым эфиром. Фильтрат экстрагировали смешанным раствором DCM и MeOH (DCM:MeOH=10:1). Органический слой промывали насыщенным солевым раствором и сушили над сульфатом магния. Полученное в результате фильтрования твердое вещество и остатки, полученные после концентрирования при пониженном давлении, объединяли и очищали на колонке с силикагелем (DCM/MeOH) с получением указанного в заголовке соединения (5,4 мг, 28%).
ЖХ/МС: m/z 384 [M+H]+
ВЭЖХ время удерживания: 2,02 мин (условия анализа Y)
[Пример 1141]
Соединение GT15-8
7-Метокси-3-(3-метоксиметокси-пиридин-4-ил)-1,1-диметил-3,4-дигидро-1H-нафталин-2-он

К 7-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-ону (Соединение A2, 924 мг), 4-иод-3-метоксиметокси-пиридину (1 г), трет-бутоксиду натрия (906 мг), Pd2(dba)3(173 мг) и S-Phos (185 мг) добавляли толуол (19 мл) и смесь перемешивали и нагревали при 70°C в течение 2 часов в атмосфере азота. Реакционную смесь разбавляли этилацетатом и фильтровали через Целит. Органический слой промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором и затем концентрировали при пониженном давлении. Полученные остатки очищали на колонке с силикагелем (этилацетат/гексан) с получением указанного в заголовке соединения (610 мг, 47%).
ЖХ/МС: m/z 342 [M+H]+
ВЭЖХ время удерживания: 2,60 мин (условия анализа Y)
[Пример 1142]
Соединение GT15-9
3-(3-Гидрокси-пиридин-4-ил)-7-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-он

Смесь 7-метокси-3-(3-метоксиметокси-пиридин-4-ил)-1,1-диметил-3,4-дигидро-1H-нафталин-2-она (Соединение GT15-8, 430 мг) и 4 н раствора хлористоводородной кислоты в диоксане (5 мл) нагревали и перемешивали при комнатной температуре в течение 1,5 часов. Реакционную смесь нейтрализовали при помощи 2 н водного раствора гидроксида натрия. Полученную смесь экстрагировали смесью DCM и MeOH (DCM:MeOH=9:1). Остатки, полученные после концентрирования при пониженном давлении, очищали на колонке с силикагелем (DCM/MeOH) с получением указанного в заголовке соединения (280 мг, 75%).
ЖХ/МС: m/z 298 [M+H]+
ВЭЖХ время удерживания: 2,41 мин (условия анализа Y)
[Пример 1143]
Соединение GT15-10
8-Метокси-10,10-диметил-5,10-дигидро-11-окса-2-аза-бензо[b]флуорен

Смесь 3-(3-гидрокси-пиридин-4-ил)-7-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-она (Соединение GT15-9, 270 мг) и метансульфоновой кислоты (1 мл) перемешивали и нагревали при 110°C в течение 0,5 часов. После охлаждения реакционную смесь нейтрализовали при помощи 2 н водного раствора гидроксида натрия. Полученную смесь экстрагировали смесью DCM и MeOH (DCM:MeOH=9:1). Органический слой концентрировали при пониженном давлении, и полученные остатки очищали на колонке с силикагелем (DCM/MeOH) с получением указанного в заголовке соединения (110 мг, 43%).
ЖХ/МС: m/z 280 [M+H]+
ВЭЖХ время удерживания: 2,53 мин (условия анализа Y)
[Пример 1144]
Соединение GT15-11
8-Метокси-10,10-диметил-10H-11-окса-2-аза-бензо[b]флуорен-5-он

8-Метокси-10,10-диметил-5,10-дигидро-11-окса-2-аза-бензо[b]флуорен (Соединение GT15-10, 20 мг) растворяли в ацетонитриле (0,2 мл) и воде (0,15 мл), добавляли хлорит натрия (16 мг) и N-гидроксифталимид (2,3 мг) и смесь перемешивали при 40°C в течение 40 минут. К реакционной смеси добавляли этилацетат. Органический слой промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором и затем концентрировали при пониженном давлении. Полученные остатки очищали на колонке с силикагелем (этилацетат/гексан) с получением указанного в заголовке соединения (12 мг, 57%).
ЖХ/МС: m/z 294 [M+H]+
ВЭЖХ время удерживания: 2,51 мин (условия анализа Y)
[Пример 1145]
Соединение GT15-12
8-Гидрокси-10,10-диметил-10H-11-окса-2-аза-бензо[b]флуорен-5-он

Раствор 8-метокси-10,10-диметил-10H-11-окса-2-аза-бензо[b]флуорен-5-она (Соединение GT15-11, 10 мг) в DCM (0,34 мл) охлаждали до -78°C, добавляли раствор 1,0 M BBr3 в DCM (0,17 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и насыщенный водный раствор бикарбоната натрия и полученное твердое вещество отфильтровывали. Фильтрат экстрагировали смешанным раствором DCM и MeOH (DCM:MeOH=9:1). Органический слой промывали насыщенным солевым раствором. Полученное в результате фильтрования твердое вещество и остатки, полученные после концентрирования при пониженном давлении, объединяли с получением указанного в заголовке соединения (9,5 мг, 99%).
ЖХ/МС: m/z 280 [M+H]+
ВЭЖХ время удерживания: 2,50 мин (условия анализа Y)
[Пример 1146]
Соединение GT15-13
8-[(4R,5R)-5-(Трет-бутил-диметилсиланилоксиметил)-2,2-диметил[1,3]диоксолан-4-илметокси]-10,10-диметил-10H-11-окса-2-аза-бензо[b]флуорен-5-он
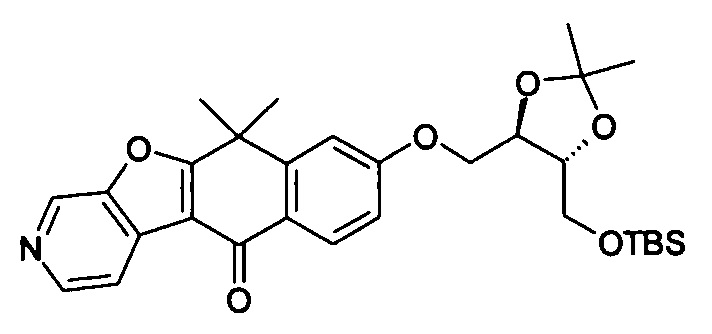
С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения GT15-12 и Соединения T22-0 (38 мг, 66%).
ЖХ/МС: m/z 538 [M+H]+
ВЭЖХ время удерживания: 3,55 мин (условия анализа Y)
[Пример 1147]
Соединение GT15-14
10,10-Диметил-8-((2R,3R)-2,3,4-тригидрокси-бутокси)-10H-11-окса-2-аза-бензо[b]флуорен-5-он

С использованием тех же условий, как в способе синтеза Соединения GT15-7, получали указанное в заголовке соединение, исходя из Соединения GT15-13 (2,1 мг, 84%).
ЖХ/МС: m/z 384 [M+H]+
ВЭЖХ время удерживания: 1,70 мин (условия анализа Y)
[Пример 1148]
Соединение GT15-15
3-Бром-2-(4-метокси-бензилокси)-пиридин

С использованием тех же условий, как в способе синтеза Соединения G15-1, получали указанное в заголовке соединение, исходя из 3-бром-пиридин-2-ола (740 мг, 88%).
ЖХ/МС: m/z 295 [M+H]+
ВЭЖХ время удерживания: 2,86 мин (условия анализа Y)
[Пример 1149]
Соединение GT15-16
7-Метокси-3-[2-(4-метокси-бензилокси)-пиридин-3-ил]-1,1-диметил-3,4-дигидро-1H-нафталин-2-он
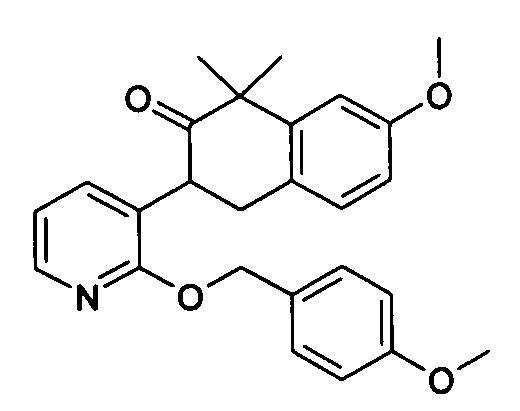
К 7-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-ону (Соединение A2, 845 мг), 3-бром-2-(4-метокси-бензилокси)пиридину (Соединение GT15-15, 1,46 г), трет-бутоксиду натрия (597 мг), ацетату палладия (18,6 мг) и три-трет-бутилфосфинтетрафторборной кислоте (21 мг) добавляли толуол (10 мл) и ТГФ (2 мл) и смесь перемешивали и нагревали при 90°C в течение 2,5 часов в атмосфере азота. После охлаждения к реакционной смеси добавляли насыщенный водный раствор хлорида аммония и затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и остатки, полученные после концентрирования при пониженном давлении, очищали на колонке с силикагелем (этилацетат/гексан) с получением указанного в заголовке соединения (140 мг, 8%).
ЖХ/МС: m/z 419 [M+H]+
ВЭЖХ время удерживания: 3,50 мин (условия анализа Y)
[Пример 1150]
Соединение GT15-17
8-Метокси-10,10-диметил-10H-11-окса-1-аза-бензо[b]флуорен-5-он

С использованием тех же условий, как в способе синтеза Соединения GT15-3, получали указанное в заголовке соединение, исходя из Соединения GT15-16 (49 мг, 52%).
ЖХ/МС: m/z 294 [M+H]+
ВЭЖХ время удерживания: 3,39 мин (условия анализа Y)
[Пример 1151]
Соединение GT15-18
8-Гидрокси-10,10-диметил-10H-11-окса-1-аза-бензо[b]флуорен-5-он

С использованием тех же условий, как в способе синтеза Соединения GT15-5, получали указанное в заголовке соединение, исходя из Соединения GT15-17 (6,5 мг, 51%).
ЖХ/МС: m/z 280 [M+H]+
ВЭЖХ время удерживания: 3,10 мин (условия анализа Y)
[Пример 1152]
Соединение GT15-19
8-[(4R,5R)-5-(Трет-бутил-диметилсиланилоксиметил)-2,2-диметил[1,3]диоксолан-4-илметокси]-10,10-диметил-10H-11-окса-1-аза-бензо[b]флуорен-5-он

С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения GT15-18 и Соединения T22-0 (4,5 мг, 11%).
ЖХ/МС: m/z 538 [M+H]+
ВЭЖХ время удерживания: 3,88 мин (условия анализа Y)
[Пример 1153]
Соединение GT15-20
10,10-Диметил-8-((2R,3R)-2,3,4-тригидрокси-бутокси)-10H-11-окса-1-аза-бензо[b]флуорен-5-он

С использованием тех же условий, как в способе синтеза Соединения GT15-7, получали указанное в заголовке соединение, исходя из Соединения GT15-19 (7,9 мг, 51%).
ЖХ/МС: m/z 384 [M+H]+
ВЭЖХ время удерживания: 2,57 мин (условия анализа Y)
[Пример 1154]
Соединение GT15-21
8-Метокси-10,10-диметил-5,10-дигидро-11-окса-3-аза-бензо[b]флуорен
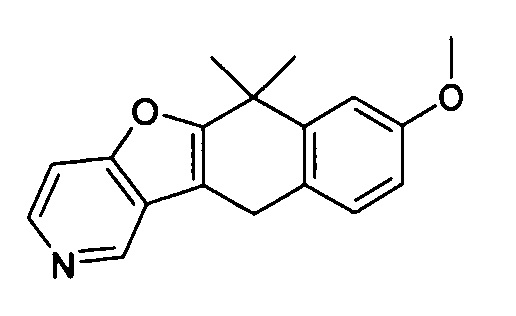
К 7-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-ону (Соединение A2, 2,5 г), 3-бром-4-хлорпиридину (2 г), трет-бутоксиду натрия (3 г), Pd2(dba)3(476 мг) и S-Phos (512 мг) добавляли толуол (20 мл) и смесь перемешивали и нагревали при 100°C в течение ночи в атмосфере азота. После охлаждения реакционную смесь разбавляли этилацетатом и фильтровали через Целит. Органический слой промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Затем органический слой сушили над сульфатом натрия. Остатки, полученные после концентрирования при пониженном давлении, очищали на колонке с силикагелем (этилацетат/гексан) с получением указанного в заголовке соединения (112 мг, 4%).
ЖХ/МС: m/z 280 [M+H]+
ВЭЖХ время удерживания: 2,46 мин (условия анализа Y)
[Пример 1155]
Соединение GT15-22
8-Метокси-10,10-диметил-10H-11-окса-3-аза-бензо[b]флуорен-5-он

С использованием тех же условий, как в способе синтеза Соединения GT15-3, получали указанное в заголовке соединение, исходя из Соединения GT15-21 (49 мг, 52%).
ЖХ/МС: m/z 294 [M+H]+
ВЭЖХ время удерживания: 2,30 мин (условия анализа Y)
[Пример 1156]
Соединение GT15-23
8-Гидрокси-10,10-диметил-10H-11-окса-3-аза-бензо[b]флуорен-5-он

С использованием тех же условий, как в способе синтеза Соединения GT15-12, получали указанное в заголовке соединение, исходя из Соединения GT15-22 (110 мг, 77%).
ЖХ/МС: m/z 280 [M+H]+
ВЭЖХ время удерживания: 1,95 мин (условия анализа Y)
[Пример 1157]
Соединение GT15-24
8-[(4R,5R)-5-(Трет-бутил-диметилсиланилоксиметил)-2,2-диметил[1,3]диоксолан-4-илметокси]-10,10-диметил-10H-11-окса-3-аза-бензо[b]флуорен-5-он

С использованием тех же условий, как в способе синтеза Соединения A7-1, получали указанное в заголовке соединение, исходя из Соединения GT15-23 и Соединение T22-0 (38 мг, 49%).
ЖХ/МС: m/z 538 [M+H]+
ВЭЖХ время удерживания: 3,40 мин (условия анализа Y)
[Пример 1158]
Соединение GT15-25
10,10-Диметил-8-((2R,3R)-2,3,4-тригидрокси-бутокси)-10H-11-окса-3-аза-бензо[b]флуорен-5-он

С использованием тех же условий, как в способе синтеза Соединения GT15-7, получали указанное в заголовке соединение, исходя из Соединения GT15-24 (17 мг, 72%).
ЖХ/МС: m/z 384 [M+H]+
ВЭЖХ время удерживания: 1,48 мин (условия анализа Y)
[Пример 1159]
Соединение GT16-1
2-(2-Бром-4-метокси-фенил)пропан-2-ол

К смеси 1-(2-бром-4-метоксифенил)этанона (300 мг), растворенного в ТГФ (3 мл) добавляли MeMgBr (3 M раствор в ТГФ, 0,52 мл) при 0°C в атмосфере азота. Затем смесь перемешивали при комнатной температуре в течение 6 часов. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и остатки, полученные после концентрирования при пониженном давлении, очищали на колонке с силикагелем (этилацетат/гексан) с получением указанного в заголовке соединения (220 мг, 69%).
1H-ЯМР (CDCL3) δ: 7,55 (1 H, д), 7,14 (1 H, д), 6,83 (1 H, дд), 3,79 (3 H, с), 2,72 (1 H, с), 1,73 (6 H, с).
[Пример 1160]
Соединение GT16-2
2-[1-(2-Бром-4-метоксифенил)-1-метилэтил]бензофуран

Смесь, содержащую 2-(2-бром-4-метоксифенил)пропан-2-ол (100 мг), 2,3-бензофуран (0,19 мл) и полифосфорную кислоту (1 г), перемешивали и нагревали при 90°C в течение 30 минут. К реакционной смеси добавляли воду и экстрагировали при помощи DCM. Остатки, полученные после концентрирования при пониженном давлении, очищали на колонке с силикагелем (DCM/гексан) с получением указанного в заголовке соединения (143 мг, 51%).
1H-ЯМР (CDCL3) δ: 7,4-7,5 (1 H, м), 7,3-7,4 (2 H, м), 7,1-7,25 (3 H, м), 6,87 (1 H, дд), 6,42 (1 H, с) 3,79 (3 H, с), 1,84 (6 H, с).
[Пример 1161]
Соединение GT16-3
2-(1-Бензофуран-2-ил-1-метил-этил)-5-метоксибензойная кислота

К смеси, содержащей 2-[1-(2-бром-4-метоксифенил)-1-метилэтил]бензофуран (140 мг) и ТГФ (2 мл), добавляли н-бутиллитий (2,5 M раствор, 0,17 мл) при -78°C в атмосфере азота. Смесь перемешивали в течение 20 минут. Полученную реакционную смесь продували газообразным диоксидом углерода в течение 15 минут. Затем к реакционной смеси добавляли насыщенный водный раствор хлорида аммония и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и остатки, полученные после концентрирования при пониженном давлении, очищали на колонке с силикагелем (DCM/MeOH) с получением указанного в заголовке соединения (68 мг, 54%).
ЖХ/МС: m/z 311 [M+H]+
ВЭЖХ время удерживания: 2,92 мин (условия анализа Y)
[Пример 1162]
Соединение GT16-4
9-Метокси-6,6-диметил-6H-бензо[b]нафто[2,3-d]фуран-11-он

К раствору 2-(1-бензофуран-2-ил-1-метилэтил)-5-метоксибензойной кислоты (63 мг) в DCM (1 мл) добавляли трифторуксусный ангидрид (0,03 мл) при комнатной температуре в атмосфере азота. Смесь перемешивали в течение 30 минут. К реакционной смеси затем добавляли воду и экстрагировали при помощи DCM. Органический слой сушили над сульфатом натрия. Остатки, полученные после концентрирования при пониженном давлении, очищали на колонке с силикагелем (DCM) с получением указанного в заголовке соединения (50 мг, 84%).
ЖХ/МС: m/z 293 [M+H]+
ВЭЖХ время удерживания: 3,49 мин (условия анализа Y)
[Пример 1163]
Соединение GT16-5
9-Гидрокси-6,6-диметил-6H-бензо[b]нафто[2,3-d]фуран-11-он

С использованием тех же условий, как в способе синтеза Соединения A6, получали указанное в заголовке соединение, исходя из Соединения GT16-4.
ЖХ/МС: m/z 279 [M+H]+
ВЭЖХ время удерживания: 3,05 мин (условия анализа Y)
[Пример 1164]
Соединение GT16-6
9-(2-Диэтиламино-этокси)-6,6-диметил-6H-бензо[b]нафто[2,3-d]фуран-11-он

С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения GT16-5.
ЖХ/МС: m/z 378 [M+H]+
ВЭЖХ время удерживания: 2,41 мин (условия анализа Y)
[Пример 1165]
Соединение GT16-7
9-((S)-2,2-Диметил[1,3]диоксолан-4-илметокси)-6,6-диметил-6H-бензо[b]нафто[2,3-d]фуран-11-он

С использованием тех же условий, как в способе синтеза Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения GT16-5 и (R)-2,2-диметил[1,3]диоксолан-4-ил метилового эфира толуол-4-сульфоновой кислоты.
ЖХ/МС: m/z 393 [M+H]+
ВЭЖХ время удерживания: 3,22 мин (условия анализа Y)
[Пример 1166]
Соединение GT16-8
9-((R)-2,3-Дигидрокси-пропокси)-6,6-диметил-6H-бензо[b]нафто[2,3-d]фуран-11-он

С использованием тех же условий, как в способе синтеза Соединения A7-14-2, получали указанное в заголовке соединение, исходя из Соединения GT16-7.
ЖХ/МС: m/z 353 [M+H]+
ВЭЖХ время удерживания: 2,83 мин (условия анализа Y)
[Пример 1167]
Соединение GT16-9
3-(6,6-Диметил-11-оксо-6,11-дигидро-бензо[b]нафто[2,3-d]фуран-9-ил)бензойная кислота

Таким же способом, как описано для Соединения GT9-2, синтезировали указанное в заголовке соединение, исходя из Соединения GT16-5.
ЖХ/МС: m/z 383 [M+H]+
ВЭЖХ время удерживания: 7,11 мин (условия анализа H)
[Пример 1168]
Соединение GT16-10
9-(4-Гидроксиметил-фенил)-6,6-диметил-6H-бензо[b]нафто[2,3-d]фуран-11-он

Таким же способом, как описано для Соединения GT9-2, синтезировали указанное в заголовке соединение, исходя из Соединения GT16-5.
ЖХ/МС: m/z 369 [M+H]+
ВЭЖХ время удерживания: 6,97 мин (условия анализа H)
Соединения, описанные в следующей таблице 39, были синтезированы в соответствии со способом, представленным ниже. Конкретно, Соединение GT17-1 получали, исходя из 8-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-она и бромфенола, следуя способу, который используют для получения Соединения Z10, Z11 и Z12. Соединение GT17-1 подвергали деметилированию в соответствии со способом, используемым для получения Соединения A6, и в результате получали 7-гидрокси-6,6-диметил-6H-бензо[b]нафто[2,3-d]фуран-11-он. Полученное гидроксисоединение подвергали алкилированию при помощи способа, используемого для получения соединения A7-1, или реакции Мицунобу, используемой для получения Соединения A7-17, для введения соответствующей боковой цепи или ее синтетического эквивалента. Затем, если это необходимо, осуществляли модификацию функциональной группы с получением Соединения GT17-2 и Соединения GT17-3.

Соединения, описанные в следующей таблице 40, были синтезированы в соответствии со способом, представленным ниже.
При помощи способа, используемого для получения Соединения Z10, Z11 и Z12, получали Соединение GT18-1, исходя из Соединения M1 и бромфенола. Кроме того, в соответствии со способом, используемым для получения Соединения A6, Соединение GT18-1 подвергали деметилированию с получением 8-гидрокси-11H-спиро[бензо[b]нафто[2,3-d]фуран-6,1’-циклопентан]-11-она, затем осуществляли введение боковой цепи на основе алкилирования, которое используют для получения Соединения A7-1. В результате получали Соединение GT18-2.
Следующие спиросоединения получали, исходя из 7-метокси-3,4-дигидро-1H-нафталин-2-она и соответствующего дибромида, таким же способом, как описано выше.

[Пример 1178]
Соединение GT19-1
8-(2-Диэтиламино-этокси)-6,6-диметил-3-трифторметил-6H-бензо[B]нафто[2,3-d]фуран-11-он

В соответствии со способом, описанным выше, осуществляли получение с использованием 7-метокси-1,1-диметил-3,4-дигидро-1H-нафталин-2-она и 2-бром-5-трифторфенола.
ЖХ/МС: m/z 446 [M+H]+
ВЭЖХ время удерживания: 3,25 мин (условия анализа C)
[Пример 1179]
Соединение GT19-2
8-(2-Диэтиламино-этокси)-6,6-диметил-3-фенил-6H-бензо[b]нафто[2,3-d]фуран-11-он

Путем осуществления сочетания по методу Сузуки Соединения GT23-5 и соответствующего реагента на основе бороновой кислоты при помощи способа, который используют для получения Соединения GT9-2, получали указанное в заголовке соединение.
ЖХ/МС: m/z 454 [M+H]+
ВЭЖХ время удерживания: 2,67 мин (условия анализа F)
[Пример 1180]
Соединение GT20-1
8-Гидрокси-6,6-диметил-3-(2-фенил-этансульфонил)-5,6-дигидро-бензо[b]карбазол-11-он

3-Бром-8-гидрокси-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он (72,2 мг, 0,203 ммоль), 2-фенилэтантиол (0,0297 мл, 0,221 ммоль), Pd2(dba)3(9,3 мг, 0,0102 ммоль), Xantphos (11,6 мг, 0,020 ммоль) и этилдиизопропиламин (0,068 мл, 0,40 ммоль) растворяли в диоксане (0,6 мл) и смесь перемешивали при 110°C в течение 16 часов в атмосфере азота. К смеси добавляли воду и этилацетат с получением суспензии, затем смесь фильтровали. Органический слой промывали водой и насыщенным солевым раствором и затем концентрировали при пониженном давлении. Полученные остатки очищали на колонке с силикагелем (этилацетат/гексан). Полученные остатки растворяли в ТГФ (4 мл) и брали надосадочную жидкость (2 мл) и добавляли к ней воду (1 мл) и OXONE (99 мг). Полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционный раствор распределяли между водой и этилацетатом. Органический слой промывали насыщенным солевым раствором и затем концентрировали при пониженном давлении. Полученные остатки очищали на колонке с силикагелем (этилацетат/гексан) с получением указанного в заголовке соединения (37,1 мг).
ЖХ/МС: m/z 446 [M+H]+
ВЭЖХ время удерживания: 2,51 мин (условия анализа F)
[Пример 1181]
Соединение GT20-2
6,6-Диметил-3-(2-фенил-этансульфонил)-8-((2R,3R)-2,3,4-тригидрокси-бутокси)-5,6-дигидро-бензо[b]карбазол-11-он и
Соединение GT20-3
8-Изопропокси-6,6-диметил-3-(2-фенил-этансульфонил)-5,6-дигидро-бензо[b]карбазол-11-он

8-Гидрокси-6,6-диметил-3-(2-фенил-этансульфонил)-5,6-дигидро-бензо[b]карбазол-11-он (30 мг, 0,0673 ммоль), [(4R,5R)-5-(трет-бутил-диметилсиланилоксиметил)-2,2-диметил[1,3]диоксолан-4-ил]метанол (22,3 мг, 0,0808 ммоль) и PPh3(23 мг, 0,0875 ммоль) растворяли в ТГФ (0,5 мл), добавляли DIAD (0,0169 мл, 0,0808 ммоль) и смесь перемешивали при 50°C в течение ночи. После охлаждения реакционный раствор фильтровали и концентрировали при пониженном давлении. Полученные остатки очищали на колонке с силикагелем (этилацетат/гексан). Полученные остатки растворяли в ТГФ (0,4 мл) и воде (0,13 мл), добавляли камфорсульфоновую кислоту (28,1 мг, 0,121 ммоль) и затем подвергали микроволновому облучению при 80°C в течение 15 минут в атмосфере азота. К реакционной смеси добавляли этилацетат. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором и затем концентрировали при пониженном давлении. Полученные остатки очищали при помощи тонкослойной хроматографии (MeOH/DCM) с получением Соединения GT20-2 (10,5 мг) и Соединения GT20-3 (2,4 мг).
Соединение GT20-2
ЖХ/МС: m/z 550 [M+H]+
ВЭЖХ время удерживания: 2,20 мин (условия анализа F)
Соединение GT20-3
ЖХ/МС: m/z 488 [M+H]+
ВЭЖХ время удерживания: 3,13 мин (условия анализа F)
[Пример 1182]
Соединение GT20-4
3-Метансульфонил-6,6-диметил-8-((2R,3R)-2,3,4-тригидрокси-бутокси)-5,6-дигидро-бензо[b]карбазол-11-он

DMA раствор (0,6 мл), содержащий Соединение GT23-2 (59,6 мг, 0,167 ммоль), метантиолат натрия (77 мг, 1,10 ммоль), Pd2(dba)3(23,7 мг, 0,0259 ммоль) и Xantphos (29,7 мг, 0,0513 ммоль), подвергали микроволновому облучению при 180°C в течение 30 минут в атмосфере азота. Реакционный раствор распределяли между водным раствором дигидрофосфосфата калия и этилацетатом. Органический слой промывали насыщенным солевым раствором и затем концентрировали при пониженном давлении. Полученные остатки очищали на колонке с силикагелем (этилацетат/гексан и MeOH/DCM). Полученные твердые вещества растворяли в ТГФ (1 мл) и воде (0,5 мл) и затем добавляли OXONE (101,4 мг). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор распределяли между водой и этилацетатом. Органический слой промывали насыщенным солевым раствором и затем концентрировали при пониженном давлении. Полученные остатки суспендировали и промывали при помощи MTBE. Полученное твердое вещество растворяли в ТГФ (0,4 мл) и добавляли PPh3(37 мг, 0,141 ммоль), [(4R,5R)-5-(трет-бутил-диметилсиланилоксиметил)-2,2-диметил[1,3]диоксолан-4-ил]метанол (39,0 мг, 0,141 ммоль) и DEAD (2,2 M раствор в толуоле, 0,064 мл, 0,141 ммоль) и смесь перемешивали при 40°C в течение 4 часов в атмосфере азота. Реакционный раствор распределяли между водой и этилацетатом. Органический слой промывали насыщенным солевым раствором и затем концентрировали при пониженном давлении. Полученные остатки очищали на колонке с силикагелем (MeOH/DCM). Полученный продукт растворяли в ТГФ (0,25 мл) и MeOH (0,05 мл), добавляли 0,5 M раствор серной кислоты (0,1 мл) и смесь перемешивали при 60°C в течение 5 часов. После охлаждения к смеси добавляли диэтиловый эфир и гидрокарбонат натрия (13 мг, 0,15 ммоль). Полученный в результате разделения водный слой фильтровали, концентрировали при пониженном давлении и суспендировали и очищали при помощи MeOH с получением указанного в заголовке соединения в виде белого твердого вещества (10,4 мг, 14%).
ЖХ/МС: m/z 460 [M+H]+
ВЭЖХ время удерживания: 1,71 мин (условия анализа F)
[Пример 1183]
Соединение GT20-5
8-((R)-2,3-Дигидрокси-пропокси)-6,6-диметил-3-метилсульфанил-5,6-дигидро-бензо[b]карбазол-11-он

3-Бром-8-((S)-2,2-диметил[1,3]диоксолан-4-илметокси)-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он (47,3 мг, 0,101 ммоль), метантиолат натрия (34,6 мг, 0,493 ммоль), Pd2(dba)3(13,1 мг, 0,0413 ммоль) и Xantphos (17,9 мг, 0,0309 ммоль) растворяли в DMA (0,5 мл) и подвергали микроволновому облучению при 200°C в течение 30 минут в атмосфере азота. Полученную смесь распределяли между водным раствором дигидрофосфосфата калия и этилацетатом. Органический слой промывали насыщенным солевым раствором и затем концентрировали при пониженном давлении. Полученные остатки очищали при помощи тонкослойной хроматографии (этилацетат/DCM). Полученное твердое вещество растворяли в ТГФ (0,23 мл) и MeOH (0,06 мл) и затем добавляли 0,5 M раствор серной кислоты (0,12 мл). Полученную смесь перемешивали при 60°C в течение 2 часов. Реакционный раствор разбавляли диэтиловым эфиром и нейтрализовали при помощи гидрокарбоната натрия (15,5 мг, 0,185 ммоль). Затем раствор распределяли между насыщенным солевым раствором и этилацетатом. Органический слой концентрировали при пониженном давлении. К полученным остаткам добавляли диэтиловый эфир. Осажденное твердое вещество фильтровали с получением указанного в заголовке соединения в виде белого твердого вещества (15,8 мг, 39%).
ЖХ/МС: m/z 398 [M+H]+
ВЭЖХ время удерживания: 4,46 мин (условия анализа H)
[Пример 1184]
Соединение GT20-5
8-((R)-2,3-Дигидрокси-пропокси)-6,6-диметил-3-тиазол-2-ил-5,6-дигидро-бензо[b]карбазол-11-он

3-Бром-8-((S)-2,2-диметил-[1,3]диоксолан-4-илметокси)-6,6-диметил-5,6-дигидробензо[b]карбазол-11-он (47 мг, 0,10 ммоль), бис(пинаколят)дибор (33 мг, 0,13 ммоль), Pd(dppf)2Cl2ㆍDCM (8,2 мг, 0,010 ммоль) и ацетат калия (294 мг, 0,3 ммоль) растворяли в диоксане (0,6 мл) и смесь перемешивали при 100°C в течение ночи в атмосфере азота. Полученную смесь распределяли между водным раствором дигидрофосфосфата калия и этилацетатом. Органический слой промывали насыщенным солевым раствором и затем концентрировали при пониженном давлении. Полученные остатки очищали на колонке с силикагелем (этилацетат/DCM) с получением 8-((S)-2,2-диметил[1,3]диоксолан-4-илметокси)-6,6-диметил-3-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-5,6-дигидро-бензо[b]карбазол-11-она (30,2 мг). Полученный продукт (11 мг) растворяли в DMA (0,4 мл), добавляли 2-бромтиазол (0,0038 мл, 0,0428 ммоль), Pd(PPh3)4(5,3 мг, 0,00459 ммоль), фосфат калия (27,4 мг, 0,129 ммоль) и воду (0,1 мл) и смесь подвергали микроволновому облучению при 140°C в течение 7 минут в атмосфере азота. Полученную смесь распределяли между водным раствором дигидрофосфосфата калия и этилацетатом. Органический слой промывали насыщенным солевым раствором и затем концентрировали при пониженном давлении. Полученные остатки очищали при помощи тонкослойной хроматографии (MeOH/DCM). Полученное твердое вещество растворяли в MeOH (1 мл) и затем добавляли 1 н раствор HCl (3 капель). Полученную смесь перемешивали при 60°C в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении и полученные остатки суспендировали и промывали смесью DCM/гексан (2/1) с последующей сушкой с получением указанного в заголовке соединения в виде желтого твердого вещества (8,7 мг).
ЖХ/МС: m/z 435 [M+H]+
ВЭЖХ время удерживания: 1,76 мин (условия анализа A)
Соединения, описанные в следующей таблице 41, также синтезировали аналогичным способом.

[Пример 1187]
Соединение GT20-8
8-((R)-2,3-Дигидрокси-пропокси)-3-метоксиметил-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он и
Соединение GT20-9
8-((R)-2,3-Дигидрокси-пропокси)-3-гидроксиметил-6,6-диметил-5,6-дигидро-бензо[b]карбазол-11-он

3-Бром-8-((S)-2,2-диметил[1,3]диоксолан-4-илметокси)-6,6-диметил-5,6-дигидробензо[b]карбазол-11-он (200,2 мг, 0,426 ммоль), ацетат палладия(II) (19 мг, 0,0848 ммоль), гексакарбонилмолибден (115,5 мг, 0,438 ммоль) и трис(o-толил)фосфин (52,5 мг, 0,172 ммоль) растворяли в ТГФ (1,3 мл) и этаноле (0,075 мл), добавляли DBU (0,195 мл) и подвергали микроволновому облучению при 160°C в течение 15 минут в атмосфере азота. Полученный реакционный раствор распределяли между водным раствором дигидрофосфосфата калия и этилацетатом. Органический слой промывали насыщенным солевым раствором и затем концентрировали при пониженном давлении. Полученные остатки растворяли в этаноле (10 мл) и ТГФ (3 мл), добавляли 2 н раствор KOH (2 мл) и перемешивали при комнатной температуре в течение 2 часов, при 50°C в течение ночи и при 70°C в течение 2 часов. Реакционный раствор распределяли между водным раствором дигидрофосфосфата калия и этилацетатом. Органический слой промывали насыщенным солевым раствором и затем концентрировали при пониженном давлении. Полученные остатки суспендировали и очищали при помощи MTBE/гексан (1/1) (155,4 мг). К раствору продукта (109 мг) в ТГФ (1,5 мл) добавляли TEA (0,052 мл, 0,373 ммоль) и этилхлороформиат (0,029 мл, 0,303 ммоль) при охлаждении льдом и смесь перемешивали при 0°C в течение 2 часов. Затем к смеси добавляли этанол (1 мл) и борогидрид натрия (75,7 мг, 2,0 ммоль), затем смесь перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор распределяли между водным раствором дигидрофосфосфата калия и этилацетатом. Органический слой промывали насыщенным солевым раствором и затем концентрировали при пониженном давлении. Полученные остатки очищали на колонке с силикагелем (MeOH/DCM) (35,2 мг). Полученное твердое вещество (9,6 мг) растворяли в MeOH (1 мл), добавляли 1 н раствор HCl (3 капли) и смесь перемешивали при 60°C в течение 90 минут. После охлаждения и концентрирования при пониженном давлении полученную смесь очищали при помощи ТСХ (MeOH/DCM) с получением Соединения GT20-8 (6,2 мг, белое твердое вещество) и Соединения GT20-9 (4,3 мг, белое твердое вещество).
Соединение GT20-8
ЖХ/МС: m/z 396 [M+H]+
ВЭЖХ время удерживания: 1,66 мин (условия анализа A)
Соединение GT20-9
ЖХ/МС: m/z 382 [M+H]+
ВЭЖХ время удерживания: 1,37 мин (условия анализа A)
[Пример 1188]
Соединение GT21-1
8-[(E)-2-(2,2-Диметил[1,3]диоксолан-4-ил)винил]-6,6-диметил-6H-бензо[b]нафто[2,3-d]фуран-11-он

К раствору 6,6-диметил-11-оксо-6,11-дигидро-бензо[b]нафто[2,3-d]фуран-8-илового эфира трифторметансульфоновой кислоты (300 мг), 2,2-диметил-4-винил[1,3]диоксолана (469 мг) и PdCl2(PPh3)2(103 мг) в DMF (4 мл) добавляли гидрокарбонат натрия (184 мг) и смесь перемешивали при 100°C в течение ночи в атмосфере азота. Реакционную смесь разбавляли этилацетатом. Органический слой промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором и затем концентрировали при пониженном давлении. Полученные остатки очищали на колонке с силикагелем (этилацетат/гексан) с получением указанного в заголовке соединения (130 мг, 46%).
ЖХ/МС: m/z 389 [M+H]+
ВЭЖХ время удерживания: 3,28 мин (условия анализа Y)
[Пример 1189]
Соединение GT21-2
8-(3,4-Дигидрокси-бутил)-6,6-диметил-6H-бензо[b]нафто[2,3-d]фуран-11-он

К раствору 8-[(E)-2-(2,2-диметил[1,3]диоксолан-4-ил)винил]-6,6-диметил-6H-бензо[b]нафто[2,3-d]фуран-11-она (125 мг) в MeOH (5 мл) добавляли 10% Pd-C (25 мг) и смесь перемешивали в течение ночи при комнатной температуре в атмосфере водорода. Катализатор удаляли фильтрованием. Остатки, полученные после концентрирования при пониженном давлении, очищали при помощи ВЭЖХ с получением указанного в заголовке соединения (35 мг, 31%).
ЖХ/МС: m/z 351 [M+H]+
ВЭЖХ время удерживания: 1,79 мин (условия анализа Y)
[Пример 1190]
Соединение GT21-3
8-Амино-6,6-диметил-6H-бензо[b]нафто[2,3-d]фуран-11-он

К 6,6-диметил-11-оксо-6,11-дигидро-бензо[b]нафто[2,3-d]фуран-8-иловому эфиру трифторметансульфоновой кислоты (100 мг), бензгидрилиденамину (0,05 мл), карбонату цезия (110 мг), ацетату палладия (2 мг) и BINAP (7 мг) добавляли ТГФ (2 мл). Смесь перемешивали и нагревали при 65°C в течение ночи в атмосфере азота и реакционную смесь разбавляли этилацетатом. Органический слой промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором и затем концентрировали при пониженном давлении. Полученные остатки очищали на колонке с силикагелем (этилацетат/гексан) с получением указанного в заголовке соединения (16 мг, 23%).
ЖХ/МС: m/z 278 [M+H]+
ВЭЖХ время удерживания: 2,52 мин (условия анализа Y)
[Пример 1191]
Соединение GT21-4
8-[((S)-2,2-Диметил[1,3]диоксолан-4-илметил)амино]-6,6-диметил-6H-бензо[b]нафто[2,3-d]фуран-11-он

Смесь, содержащую 8-амино-6,6-диметил-6H-бензо[b]нафто[2,3-d]фуран-11-он (50 мг), (R)-4-йодметил-2,2-диметил[1,3]диоксолан (104 мг), карбонат калия (150 мг) и DMF (2 мл), перемешивали и нагревали при 160°C в течение 2 дней в атмосфере азота. Реакционную смесь разбавляли этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и затем концентрировали при пониженном давлении. Полученные остатки очищали на колонке с силикагелем (этилацетат/гексан). К полученному соединению (71 мг) добавляли ТГФ (1 мл) и концентрированную хлористоводородную кислоту (8 капель) и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия и затем разбавляли этилацетатом. Органический слой промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором и затем концентрировали при пониженном давлении. Полученные остатки очищали на колонке с силикагелем (этилацетат/гексан) с получением указанного в заголовке соединения (34 мг, 51%).
ЖХ/МС: m/z 392 [M+H]+
ВЭЖХ время удерживания: 3,11 мин (условия анализа Y)
[Пример 1192]
Соединение GT21-5
8-((S)-2,3-Дигидрокси-пропиламино)-6,6-диметил-6H-бензо[b]нафто[2,3-d]фуран-11-он

Таким же способом, как описано для Соединения A7-14-2, Соединение GT21-4 подвергали процедуре удаления защиты с получением указанного в заголовке соединения.
ЖХ/МС: m/z 352 [M+H]+
ВЭЖХ время удерживания: 2,26 мин (условия анализа Y)
[Пример 1193]
Соединение GT22-1
8-(2-Диэтиламино-этокси)-6,6-диметил-3-пропил-6H-бензо[b]нафто[2,3-d]фуран-11-он

К смеси 8-(2-диэтиламино-этокси)-6,6-диметил-11-оксо-6,11-дигидро-бензо[b]нафто[2,3-d]фуран-3-илового эфира трифторметансульфоновой кислоты (15 мг), который был получен таким же способом, как описано для Соединения A7-25, трис(1метил3оксо1бутенилокси)железа(III) (1 мг), NMP (0,3 мл) и ТГФ (0,3 мл) добавляли n-PrMgBr (0,88 M раствор в ТГФ, 0,291 мл) и хлорид цинка (0,5 M раствор в ТГФ, 0,114 мл) при 0°C в атмосфере азота и смесь перемешивали при 0°C в течение 10 минут. К реакционной смеси добавляли воду и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и затем концентрировали при пониженном давлении. Полученные остатки очищали на колонке с силикагелем (этилацетат/гексан) с получением указанного в заголовке соединения (4,5 мг, 38%).
ЖХ/МС: m/z 420 [M+H]+
ВЭЖХ время удерживания: 5,77 мин (условия анализа H)
[Пример 1194]
Соединение GT22-2
8-(2-Диэтиламино-этокси)-3-этил-6,6-диметил-6H-бензо[b]нафто[2,3-d]фуран-11-он

Таким же способом, как описано для Соединения GT22-2, синтезировали указанное в заголовке соединение.
ЖХ/МС: m/z 406 [M+H]+
ВЭЖХ время удерживания: 5,12 мин (условия анализа B)
[Пример 1195]
Соединение GT23-1
3-Бром-8-метокси-6,6-диметил-6H-бензо[b]нафто[2,3-d]фуран-11-он

8-Метокси-6,6-диметил-3-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-6H-бензо[b]нафто[2,3-d]фуран-11-он (10,3 мг), который был синтезирован, исходя из Соединения Z12, с использованием тех же условий, как в способе синтеза Соединения GT20-5, смешивали с бромидом меди(II) (16,5 мг), MeOH (0,5 мл) и водой (0,25 мл) и смесь перемешивали и нагревали при 70°C в течение 2 часов. К реакционному раствору добавляли DCM для экстрагирования. Органический слой концентрировали и очищали на колонке с силикагелем с получением указанного в заголовке соединения (9,4 мг).
ЖХ/МС: m/z 371 [M+H]+
ВЭЖХ время удерживания: 7,55 мин (условия анализа B)
[Пример 1196]
Соединение GT23-2
3-Бром-8-гидрокси-6,6-диметил-6H-бензо[b]нафто[2,3-d]фуран-11-он

Таким же способом, как описано для Соединения GT15-5, 3-бром-8-метокси-6,6-диметил-6H-бензо[b]нафто[2,3-d]фуран-11-он подвергали процедуре удаления защиты с получением указанного в заголовке соединения.
ЖХ/МС: m/z 357 [M+H]+
ВЭЖХ время удерживания: 2,82 мин (условия анализа A)
Соединения, описанные в следующей таблице 42, были синтезированы, исходя из Соединения GT23-2, в соответствии со способом, указанным в таблице.

[Пример 1200]
Соединение GT24-1
8-((R)-2,3-Дигидрокси-пропокси)-3-йод-6,6-диметил-6H-бензо[b]нафто[2,3-d]фуран-11-он

К 3-бром-8-((S)-2,2-диметил[1,3]диоксолан-4-илметокси)-6,6-диметил-6H-бензо[b]нафто[2,3-d]фуран-11-ону (15 мг, 0,032 ммоль) добавляли CuI (6,2 мг, 0,032 ммоль), NaI (9,6 мг, 0,064 ммоль) и транс-N,N’-диметилциклогексан-1,2-диамин (0,01 мл) и смесь перемешивали в течение 48 часов в атмосфере азота. Реакционный раствор разбавляли этилацетатом. Органический слой промывали насыщенным солевым раствором и затем концентрировали при пониженном давлении. Полученные остатки очищали на колонке с силикагелем (этилацетат/гексан) с получением 8-((S)-2,2-диметил[1,3]диоксолан-4-илметокси)-3-йод-6,6-диметил-6H-бензо[b]нафто[2,3-d]фуран-11-она (16 мг, 97%), затем осуществляли удаление защиты в соответствии со способом A-14-2 с получением указанного в заголовке соединения.
ЖХ/МС: m/z 479 [M+H]+
ВЭЖХ время удерживания: 4,26 мин (условия анализа A)
[Пример 1201]
Соединение GT24-2
3-Иод-6,6-диметил-8-((2R,3R)-2,3,4-тригидрокси-бутокси)-6H-бензо[b]нафто[2,3-d]фуран-11-он
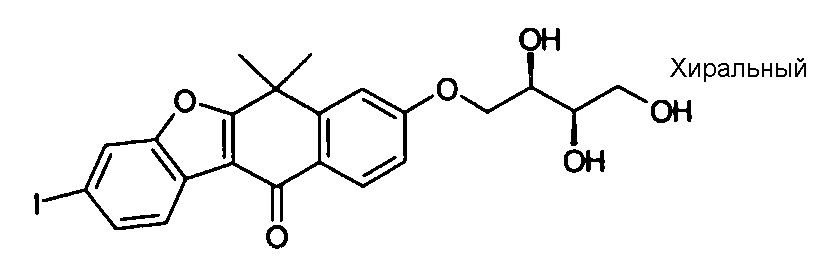
Таким же способом, как описано для Соединения GT24-1, синтезировали 3-йод-8-[(4R,5R)-5-(трет-бутил-диметил-силанилоксиметил)-2,2-диметил[1,3]диоксолан-4-илметокси]-6,6-диметил-6H-бензо[b]нафто[2,3-d]фуран-11-он, исходя из 3-бром-8-[(4R,5R)-5-(трет-бутил-диметилсиланилоксиметил)-2,2-диметил[1,3]диоксолан-4-илметокси]-6,6-диметил-6H-бензо[b]нафто[2,3-d]фуран-11-она. Затем в соответствии с таким же способом, как описано для Соединения T22-2, осуществляли удаление защиты с получением указанного в заголовке соединения.
[Пример 1202]
Соединение GT25-1
6,6-Диметил-8-(4-метил-пиперазин-1-сульфонил)-6H-бензо[b]нафто[2,3-d]фуран-11-он

С использованием способа для получения Соединения B1, 6,6-диметил-11-оксо-6,11-дигидро-бензо[b]нафто[2,3-d]фуран-8-иловый эфир трифторметансульфоновой кислоты получали, исходя из 8-гидрокси-6,6-диметил-6H-бензо[b]нафто[2,3-d]фуран-11-она. Этот сложный эфир трифторметансульфоновой кислоты (205 мг), (2R)-1-[(1R)-1-[бис(1,1-диметилэтил)фосфино]этил]-2-(дициклогексилфосфино)ферроцен (13 мг), ацетат палладия (6 мг), 2-триметилсиланил-этантиол (90 мкл) и карбонат калия (85 мг) подвергали взаимодействию в DME с получением продукта (120 мг). К раствору полученного продукта (50 мг) в бензиловом спирте (90 мкл) добавляли раствор N-хлорсукцинимида (90 мг) в DCM и смесь перемешивали при комнатной температуре. Реакционный раствор распределяли между водой и этилацетатом, и органический слой концентрировали при пониженном давлении. К раствору полученного белого твердого вещества в DCM добавляли N-метилпиперазин (10 мкл) и смесь перемешивали. Остатки, полученные после удаления растворителя путем дистилляции, очищали при помощи ТСХ с получением указанного в заголовке соединения в виде белого твердого вещества (6 мг).
[Пример 1203]
Соединение GT26-1
(2-Бром-5-метокси-фенил)ацетонитрил

К раствору метилового эфира 2-бром-5-метокси-бензойной кислоты (20 г, 81,6 ммоль) в ТГФ (1000 мл) добавляли суспензию LAH (4,07 г, 102 ммоль) в ТГФ (50 мл) при охлаждении льдом. Смесь перемешивали в течение 30 минут при охлаждении льдом. Реакционный раствор распределяли между насыщенным водным раствором Na2SO4 и этилацетатом. Органический слой промывали насыщенным солевым раствором и концентрировали при пониженном давлении. Полученные остатки растворяли в DCM (200 мл) и добавляли TEA (12,51 мл, 89,76 ммоль) и MsCl (6,63 мл, 85,68 ммоль) при охлаждении льдом, с последующим перемешиванием в течение ночи при комнатной температуре. Реакционную смесь разбавляли при помощи DCM и промывали, в указанном порядке, 10% водным раствором лимонной кислоты, насыщенным водным раствором NaHCO3 и насыщенным солевым раствором. Остатки, полученные после концентрирования при пониженном давлении, растворяли в DMF (100 мл) и добавляли раствор NaCN (40 г, 81,6 ммоль) в DMF (500 мл) при охлаждении льдом. После перемешивания в течение 2 часов при охлаждении льдом реакционную смесь экстрагировали простым эфиром, промывали насыщенным солевым раствором и сушили над сульфатом магния. Остатки, полученные после концентрирования при пониженном давлении, очищали на колонке с силикагелем (гексан:этилацетат=10:1) с получением указанного в заголовке соединения (12,1 г, 67%).
1H-ЯМР (400 МГц, CDCl3) δ 3,82 (с, 3 H), 6,77 (д, 1 H), 7,07 (с, 1 H), 7,47 (д, 1 H).
[Пример 1204]
1-(2-Бром-5-метокси-фенил)циклопропанкарбонитрил
Соединение GT26-2

2-Бром-5-метокси-фенил)ацетонитрил (12,2 г, 53,97 ммоль) растворяли в толуоле (50 мл) и добавляли тетрабутиламмонийбромид (3,55 г, 10,79 ммоль), дибромэтан (7,05 мл, 80,95 ммоль) и 50% водный раствор NaOH (50 мл) при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 4 часов. К реакционной смеси добавляли воду и экстрагировали этилацетатом. Остатки, полученные после концентрирования при пониженном давлении, очищали на колонке с силикагелем (гексан:этилацетат) с получением указанного в заголовке соединения (11,18 г, 82%).
1H-ЯМР (400 МГц, CDCl3) δ 1,33 (т, 1 H), 1,76 (т, 1 H), 3,79 (с, 3 H), 6,75-6,79 (м, 1 H), 6,89 (д, 1 H), 7,47 (д, 1 H).
[Пример 1205]
1-(2-Бром-5-метоксифенил)циклопропанкарбоновая кислота
Соединение GT26-3

1-(2-Бром-5-метокси-фенил)циклопропан карбонитрил (3,0 г, 11,9 ммоль) растворяли в этиленгликоле (30 мл). После добавления KOH (2,1 г, 33,3 ммоль) к полученному раствору смесь перемешивали и нагревали при 180°C в течение 7 часов. После охлаждения к реакционной смеси добавляли 1 н раствор HCl (90 мл). Реакционную смесь экстрагировали простым эфиром, промывали водой и насыщенным солевым раствором и сушили над сульфатом магния. После концентрирования при пониженном давлении получали указанное в заголовке соединение (12,3 г, 72%).
ЖХ/МС: m/z 272 [M+H]+
ВЭЖХ время удерживания: 2,03 мин (условия анализа Y)
[Пример 1206]
Соединение GT26-4
2-[1-(2-Бром-5-метокси-фенил)циклопропил]бензофуран

К раствору 1-(2-бром-5-метокси-фенил)циклопропанкарбоновой кислоты (0,3 г, 1,1 ммоль) в DCM (6 мл) добавляли DMF (2 капель) и оксалилхлорид (0,23 мл, 2,5 ммоль) при комнатной температуре и смесь перемешивали при комнатной температуре в течение 2 часов. Остатки, полученные после концентрирования реакционного раствора при пониженном давлении, растворяли в толуоле (6 мл), добавляли (2-гидроксибензил)трифенилфосфонийбромид (0,605 г, 1,32 ммоль) и TEA (0,46 мл, 3,3 ммоль) и полученную смесь перемешивали и нагревали при 100°C в течение ночи. Остатки, полученные после концентрирования при пониженном давлении, очищали на колонке с силикагелем (гексан:DCM) с получением указанного в заголовке соединения (0,309 г, 81%).
ЖХ/МС: m/z 343 [M+H]+
ВЭЖХ время удерживания: 3,55 мин (условия анализа Y)
[Пример 1207]
Соединение GT26-5
2-(1-Бензофуран-2-ил-циклопропил)-4-метоксибензойная кислота

К раствору 2-[1-(2-бром-5-метокси-фенил)циклопропил]бензофурана (0,259 г, 0,75 ммоль) в ТГФ (3 мл) добавляли n-BuLi при -78°C и смесь перемешивали при -78°C в течение 20 минут. Затем смесь продували газообразным диоксидом углерода. К реакционной смеси добавляли насыщенный раствор NH4Cl и экстрагировали этилацетатом. Остатки, полученные после концентрирования при пониженном давлении, очищали на колонке с силикагелем (DCM:MeOH) с получением указанного в заголовке соединения (0,163 г, 70%).
ЖХ/МС: m/z 309 [M+H]+
ВЭЖХ время удерживания: 2,67 мин (условия анализа Y)
[Пример 1208]
Соединение GT26-6
8-Метокси-11H-спиро[бензо[d]нафто[2,3-b]фуран-6,1’-циклопропан]-11-он
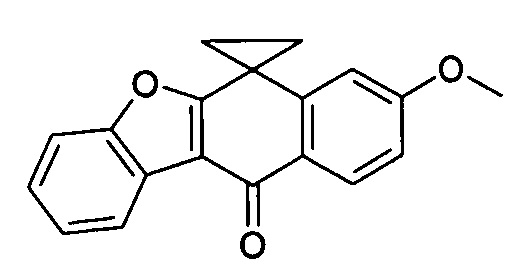
К раствору 2-(1-бензофуран-2-ил-циклопропил)-4-метокси-бензойной кислоты (1,0 г, 3,24 ммоль) в DCM (10 мл) добавляли ангидрид трифторуксусной кислоты (0,45 мл, 3,24 ммоль) при -78°C и смесь перемешивали при -78°C в течение 10 минут, при -50°C в течение 10 минут и при -30°C в течение 20 минут. Затем к смеси добавляли воду и экстрагировали при помощи DCM. Остатки, полученные после концентрирования при пониженном давлении, промывали DCM и гексаном с получением указанного в заголовке соединения (0,163 г, 70%).
ЖХ/МС: m/z 291 [M+H]+
ВЭЖХ время удерживания: 2,90 мин (условия анализа Y)
[Пример 1209]
Соединение GT26-7
8-(2-(Диэтиламино)этокси)-11H-спиро[бензо[d]нафто[2,3-b]фуран-6,1’-циклопропан]-11-он

Таким же способом, как описано для Соединения A6 и Соединения A7-17, получали указанное в заголовке соединение, исходя из 8-метокси-11H-спиро[бензо[d]нафто[2,3-b]фуран-6,1’-циклопропан]-11-она.
ЖХ/МС: m/z 376 [M+H]+
ВЭЖХ время удерживания: 1,65 мин (условия анализа Y)
[Пример 1210]
Соединение GT27-1
2-(2-Бром-5-метокси-фенил)-2-этилмасляная кислота
Метиловый эфир (2-бром-5-метоксифенил)уксусной кислоты (3,51 г, 13,5 ммоль) растворяли в DMF (4,5 мл) и добавляли NaH (2,1 г, 67,7 ммоль). Затем к смеси добавляли 15-краун-5 (1,38 мл, 6,8 ммоль) и EtI (5,5 мл, 67,7 ммоль), охлажденные до 0°C. Смесь разбавляли этилацетатом и промывали водой и насыщенным солевым раствором. Остатки, полученные после концентрирования при пониженном давлении, очищали на колонке с силикагелем (гексан-этилацетат). Затем полученную смесь растворяли в этаноле (80 мл) и воде (80 мл), добавляли KOH (91 г) и перемешивали при 140°C. Реакционный раствор экстрагировали этилацетатом и промывали водой и насыщенным солевым раствором. После концентрирования при пониженном давлении получали целевое соединение (10,62 г, 78%).
ЖХ/МС: m/z 301 [M+H]+
ВЭЖХ время удерживания: 3,07 мин (условия анализа Y)
[Пример 1211]
Соединение GT27-2
o-Толиловый эфир 2-(2-бром-5-метоксифенил)-2-этил-масляной кислоты

Соединение GT27-1 (0,5 г, 1,66 ммоль) растворяли в DCM (10 мл), добавляли DMF (2 капли) и оксалилхлорид (0,28 мл, 3,32 ммоль) и смесь перемешивали в течение 2 часов. Реакционную смесь, полученную после концентрирования при пониженном давлении, растворяли в толуоле (5 мл), добавляли DMAP (406 мг, 3,32 ммоль) и смесь нагревали при температуре кипения с обратным холодильником. Реакционную смесь экстрагировали этилацетатом, промывали 1 н раствором HCl и насыщенным солевым раствором. Остатки, полученные после концентрирования при пониженном давлении, очищали на колонке с силикагелем (гексан-этилацетат) с получением целевого соединения (0,36 г, 86%).
ЖХ/МС: m/z 393 [M+H]+
ВЭЖХ время удерживания: 3,03 мин (условия анализа Y)
[Пример 1212]
Соединение GT27-3
2-[(Трифенил-фосфанил)метил]фениловый эфир 2-(2-бром-5-метокси-фенил)-2-этил-масляной кислоты, броматная соль
Соединение GT27-2 (0,118 г, 0,302 ммоль) растворяли в тетрахлориде углерода (3 мл), добавляли н-бромсукцинимид (54 мг, 0,302 ммоль) и смесь нагревали при температуре кипения с обратным холодильником. Реакционную смесь концентрировали при пониженном давлении, и полученные остатки очищали на колонке с силикагелем (этилацетат-гексан). Полученный продукт растворяли в толуоле (3 мл), добавляли PPh3(77 мг, 0,302 ммоль) и смесь нагревали при температуре кипения с обратным холодильником. Реакционную смесь концентрировали при пониженном давлении с получением целевого соединения (130 мг, 57%).
[Пример 1213]
Соединение GT27-4
2-[1-(2-Бром-5-метокси-фенил)-1-этил-пропил]бензофуран
К раствору Соединения GT27-3 (0,14 г, 0,137 ммоль) в толуоле (3 мл) добавляли толуольный раствор (0,16 мл, 0,164 ммоль) 1 M LiHMDS. Смесь нагревали и перемешивали в течение 4 часов. Реакционную смесь концентрировали при пониженном давлении и полученные остатки очищали на колонке с силикагелем (этилацетат:гексан) с получением указанного в заголовке соединения (28 мг, 35%).
ЖХ/МС: m/z 373 [M+H]+
ВЭЖХ время удерживания: 2,73 мин (условия анализа Y)
[Пример 1214]
Соединение GT27-5
8-(2-Диэтиламино-этокси)-6,6-диэтил-6H-бензо[b]нафто[2,3-d]фуран-11-он

Таким же способом, как описано для Соединения A7-17, получали указанное в заголовке соединение, исходя из Соединения GT27-4.
ЖХ/МС: m/z 407 [M+H]+
ВЭЖХ время удерживания: 1,92 мин (условия анализа Y)
[Пример 1215]
Соединение GT27-6
8-((R)-2,3-Дигидрокси-пропокси)-6,6-диэтил-6H-бензо[b]нафто[2,3-d]фуран-11-он

Таким же способом, как описано для Соединения A7-14-1 и Соединения A7-14-2, получали указанное в заголовке соединение, исходя из Соединения GT27-4.
ЖХ/МС: m/z 381 [M+H]+
ВЭЖХ время удерживания: 2,38 мин (условия анализа Y)
Соединения, описанные в следующей таблице 43, были синтезированы в соответствии со способом, представленным ниже. В соответствии со способом, используемым для получения Соединения Z10, Z11 и Z12, получали 3-хлор-8-метокси-6H-бензо[b]нафто[2,3-d]фуран-11-он, исходя из Соединения A2 и 2-бром-5-хлорфенола. Затем осуществляли деметилирование в соответствии со способом, который используют для получения Соединения A6, и, таким образом, получали 3-хлор-8-гидрокси-6H-бензо[b]нафто[2,3-d]фуран-11-он. Затем в соответствии с реакцией Мицунобу, которую используют для получения Соединения A7-1, или способом алкилирования, который используют для получения Соединения A7-17, осуществляли введение соответствующей боковой цепи и, если это необходимо, осуществляли модификацию функциональной группы, такую как удаление защиты и т.п., с получением соединений, перечисленных ниже.

Фармакологическое испытание
1. Активность ингибирования ALK фермента
Активность ингибирования ALK измеряли, отслеживая активность ингибирования фосфорилирования с использованием биотинилированного пептида (EGPWLEEEEEAYGWMDF). Для детекции фосфорилирования биотинилированного пептида осуществляли измерение флуоресценции с разрешением по времени с использованием антитела против фосфорилированного тирозина, меченного криптатом европия, и стрептавидина, конъюгированного с XL665, т.е. аллофикоцианинового производного. Исходя из показателя ингибирования в сравнении с контрольной группой, для которой не использовали испытываемое соединение, рассчитывали концентрацию, обеспечивающую 50% ингибирование (т.е. значение ИК50).
2. Измерение активности ингибирования клеточного роста Karpas-299
Испытываемые соединения серийно разводили при помощи диметилсульфоксида, затем разбавляли фосфатно-буферным солевым раствором, который не содержал никакого Ca2+, Mg2+(×50 разведение), и 10 мкл полученного раствора добавляли в виде аликвот в 96-луночный планшет. Клеточную линию лимфомы человека KARPAS-299 подготавливали в RPMI-1640 среде, к которой добавляли 10% фетальную бычью сыворотку, с получением суспензии клеток с плотностью 10000 клеток/190 мкл. Полученную клеточную суспензию добавляли в виде аликвот в планшет (по 190 мкл на лунку), который уже содержал испытываемое соединение, планшет выдерживали в инкубаторе с 5% диоксида углерода при 37°C. Через 96 часов в каждую лунку добавляли 10 мкл WST-8 (изготовитель Dojindo Laboratories) и затем измеряли поглощающую способность при 450 нм. Исходя из показателя ингибирования клеточного роста, который получали при добавлении испытываемого соединения и сравнении с контрольной группой, для которой не использовали испытываемое соединение, рассчитывали концентрацию испытываемого соединения, обеспечивающую 50% ингибирование (т.е. значение ИК50). Результаты представлены в таблицах 44-49.





Реферат
Изобретение относится к области органической химии, а именно к гетероциклическому соединению формулы (I) или к его фармацевтически приемлемой соли, где радикалы A-A, A-A, R-Rи Rимеют значения, приведенные в формуле изобретения. Также изобретение относится к конкретным соединениям, промежуточным соединениям формулы IIIb, ингибитору ALK и фармацевтической композиции на основе соединения формулы (I). Технический результат: получено новое производное бензокарбазола, полезное при лечении рака. 8 н. и 8 з.п. ф-лы, 49 табл., 1218 пр.
Формула



Документы, цитированные в отчёте о поиске
Новые пирролокарбазолы

Комментарии