Способы применения феноксипропиламиновых соединений для лечения депрессии - RU2725112C2
Код документа: RU2725112C2
Чертежи

































Описание
Перекрестные ссылки
[0001] Настоящая заявка заявляет приоритет предварительной заявки США с серийным номером 61/756208, поданной 24 января 2013 года, предварительной заявки США с серийным номером 61/799482, поданной 15 марта 2013 года, и предварительной заявки США с серийным номером 61/852149, поданной 15 марта 2013 года, каждая из которых включена в настоящую заявку посредством ссылки в полном объеме.
Область техники, к которой относится изобретение
[0002] Настоящее изобретение в некоторых вариантах воплощения относится к композициям и способам лечения депрессии у пациента.
Уровень техники
[0003] Считают, что некоторые заболевания центральной нервной системы (например, депрессия, тревожность) вызваны расстройствами норадреналина (NA) и 5-гидрокситриптамина (5-НТ, также известного как серотонин), которые являются нейротрансмиттерами. Соответственно, считается, что увеличение 5-НТ-связанной нейротрансмиссии, в основном, оказывает влияние на депрессивное настроение и тревожность, в то время как увеличение норадренергической нейротрансмиссии рассматривается как влияющее на замедление реакции у пациентов с депрессией. Считают, что фармацевтические средства, такие как имипрамин, дезипрамин и подобные, которые наиболее часто используют для лечения депрессии, действуют на пациентов с депрессией за счет улучшения нейротрансмиссии одного или обоих NA и 5-НТ рецепторов.
[0004] Считается, что активность 5-НТ связана с рядом различных типов психических расстройств. Кроме того, 5-НТ считается ответственным за различные состояния (например, расстройства пищевого поведения, желудочно-кишечное поражение, контроль сердечно-сосудистой системы, познавательные функции и сексуальное поведение). Однако обычные антидепрессанты, такие как имипрамин, дезипрамин и подобные, неполноценны, поскольку требуется 3-4 недели или даже больше времени для проявления их антидепрессивного эффекта, что вызывает клинические проблемы.
[0005] Комбинированное использование различных фармацевтических средств было рассмотрено в попытке ускорить проявление эффектов антидепрессантов или для увеличения их эффективности (Journal of Clinical Psychiatry, Vol. 57; Supplement 7; pp 25-31). В данной статье сообщалось, что заметно сокращено время для клинического проявления эффекта путем одновременного использования селективного ингибитора (5-НТ) повторного поглощения серотонина (SSRI) и 5-HT1A антагониста, пиндолола, (Journal of Clinical Psychopharmacology, Vol. 17, No. 6, pp. 446-450). Известно, что количество высвобождаемого 5-НТ в головном мозге сильно не увеличивается при отдельном использовании SSRI, но в сочетании с 5-НТ1А антагонистом это количество заметно увеличивается (Neurochemical Research, Vol. 21, No. 5, 1996, pp. 557-562). В этих обстоятельствах в отношении проявления действия антидепрессантов была предложена "гипотеза усиления 5-НТ" Блие и де Монтиньи (Trends in Pharmacological Sciences, 1994, vol. 15, pp. 220-226). Гипотеза усиления 5-НТ означает, что эффекторный механизм антидепрессанта заключается, в конечном счете, в повышении 5-НТ высвобождения. Это основано на понимании, что обычные антидепрессанты снижают 5-НТ-высвобождение при разовом введении, но увеличивают высвобождение 5-НТ и проявляют антидепрессивный эффект только когда их вводят постоянно. В связи с указанным выше, ожидают, что лекарственное средство, которое ускоряет высвобождение 5-НТ в головном мозге с самого начала, может быть быстродействующим антидепрессантом. Другими словами, считают, что соединение, одновременно обладающее активностью ингибирования повторного поглощения серотонина и 5-НТ1А антагонистическим действием, является антидепрессантом, демонстрирующим быстрое проявление антидепрессивного эффекта, а именно, быстродействующим антидепрессантом.
[0006] Сохраняется потребность в идентификации лекарственных средств и способов для применения в лечении депрессии, и кроме того, композиций и способов лечения, которые повышают эффективность существующих способов лечения.
Сущность изобретения
[0007] В описании, представленном в настоящей заявке, показано, что соединения формулы I обладают свойствами, полезными для лечения депрессии и/или одного или нескольких симптомов депрессии. Поэтому в настоящую заявку включены способы и композиции для лечения различных аспектов депрессии.
[0008] В одном варианте воплощения изобретения представлена композиция для лечения или ослабления по меньшей мере одного симптома депрессии у субъекта-человека, которое включает введение нуждающемуся в этом субъекту терапевтически эффективного количества композиции, включающей соединение формулы I или его фармацевтически приемлемую соль, гидрат или сольват.
[0009] В одном варианте воплощения изобретения представлена композиция для лечения или ослабления по меньшей мере одного симптома депрессии у субъекта-человека, которое включает введение нуждающемуся в этом субъекту терапевтически эффективного количества композиции, включающей соединение формулы II или его фармацевтически приемлемую соль, гидрат или сольват.
[0010] В одном варианте воплощения изобретения представлен способ лечения депрессии, включающий стадию введения низкой дозы соединения формулы I или его фармацевтически приемлемой соли, гидрата или сольвата нуждающемуся в этом субъекту.
[0011] В одном варианте воплощения изобретения представлен способ лечения депрессии, включающий стадию введения низкой дозы соединения формулы II или его фармацевтически приемлемой соли, гидрата или сольвата нуждающемуся в этом субъекту.
Краткое описание чертежей
[0012] Вышеизложенное краткое содержание, а также следующее подробное описание изобретения будут лучше поняты при прочтении в сочетании с прилагаемыми чертежами.
[0013] Фиг. 1 иллюстрирует эффект имипрамина при хроническом легком стрессе. Показаны эффекты длительной обработки носителем (1 мл/кг, интраперитонеально) и имипрамином (10 мг/кг, интраперитонеально) на потребление 1% раствора сахарозы у контрольных животных (незакрашенные символы) и у животных, подверженных хроническому легкому стрессу (закрашенные символы). Обработку начинали после первых 2 недель стресса. Значения представляют собой средние значения +/- SEM.
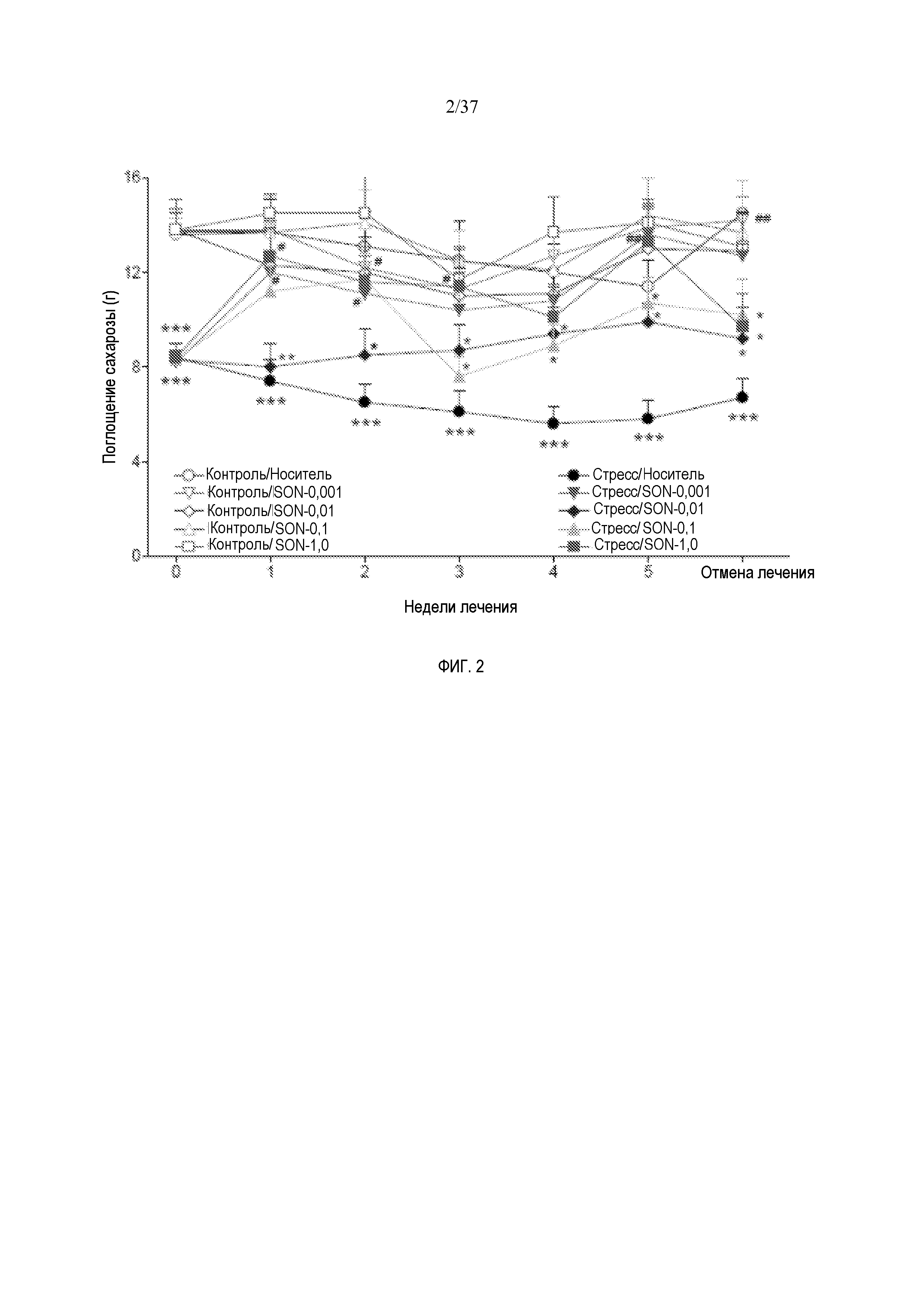
[0014] Фиг. 2 иллюстрирует эффект SON-117 при хроническом легком стрессе. Показаны эффекты длительной обработки носителем (1 мл/кг, интраперитонеально) и SON-117 (0,001, 0,01, 0,1 и 1 мг/кг, интраперитонеально) на потребление 1% раствора сахарозы у контрольных животных (незакрашенные символы) и у животных, подверженных хроническому легкому стрессу (закрашенные символы). Обработку начинали после первых 2 недель стресса. Значения представляют собой средние значения +/- SEM.
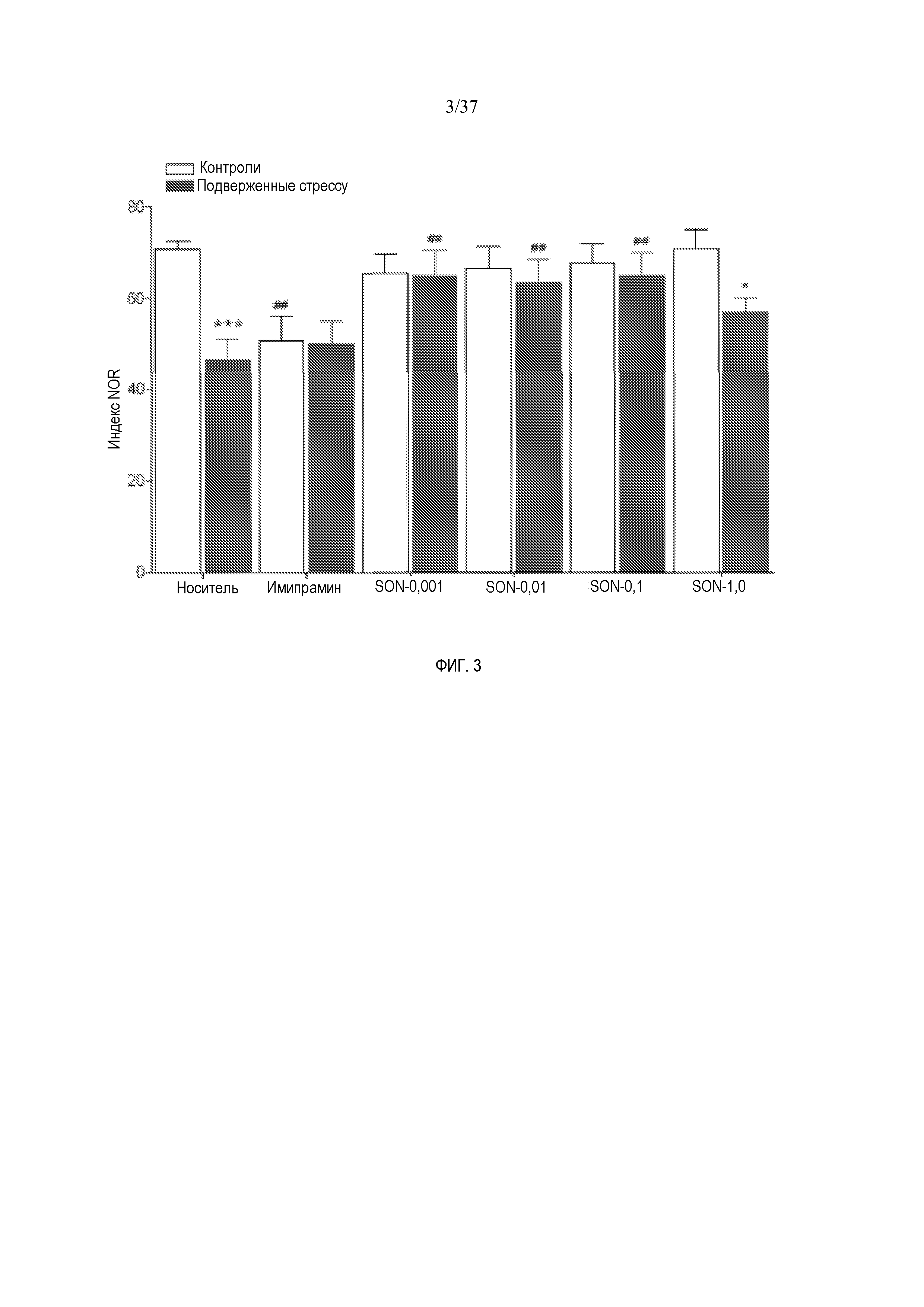
[0015] Фиг. 3 иллюстрирует эффект имипрамина и SON-117 в испытании распознавания нового объекта. Показаны эффекты длительной обработки носителем (1 мл/кг, интраперитонеально), имипрамином (10 мг/кг, интраперитонеально) и SON-117 (0,001, 0,01, 0,1 и 1 мг/кг, интраперитонеально) на поведение контрольных (незакрашенные символы) и подверженных стрессу (закрашенные символы) животных в испытании распознавания нового объекта. Испытание проводили через неделю после отмены лечения. Значения представляют собой средние значения +/- SEM.
[0016] Фиг. 4 иллюстрирует эффект циталопрама на высвобождение норэпинефрина в префронтальной коре головного мозга крысы (n=8).
[0017] Фиг. 5 иллюстрирует эффект циталопрама на высвобождение DOPAC в префронтальной коре головного мозга крысы (n=8).
[0018] Фиг. 6 иллюстрирует эффект циталопрама на высвобождение допамина в префронтальной коре головного мозга крысы (n=8).
[0019] Фиг. 7 иллюстрирует эффект циталопрама на высвобождение 5-HIAA в префронтальной коре головного мозга крысы (n=8).
[0020] Фиг. 8 иллюстрирует эффект циталопрама на высвобождение HVA в префронтальной коре головного мозга крысы (n=8).
[0021] Фиг. 9 иллюстрирует эффект циталопрама на высвобождение 5-НТ в префронтальной коре головного мозга крысы (n=8).
[0022] Фиг. 10 иллюстрирует эффект SON-117 (0,1 мг/кг) на высвобождение NE в префронтальной коре головного мозга крысы (n=8).
[0023] Фиг. 11 иллюстрирует эффект SON-117 (0,1 мг/кг) на высвобождение DOPAC в префронтальной коре головного мозга крысы (n=8).
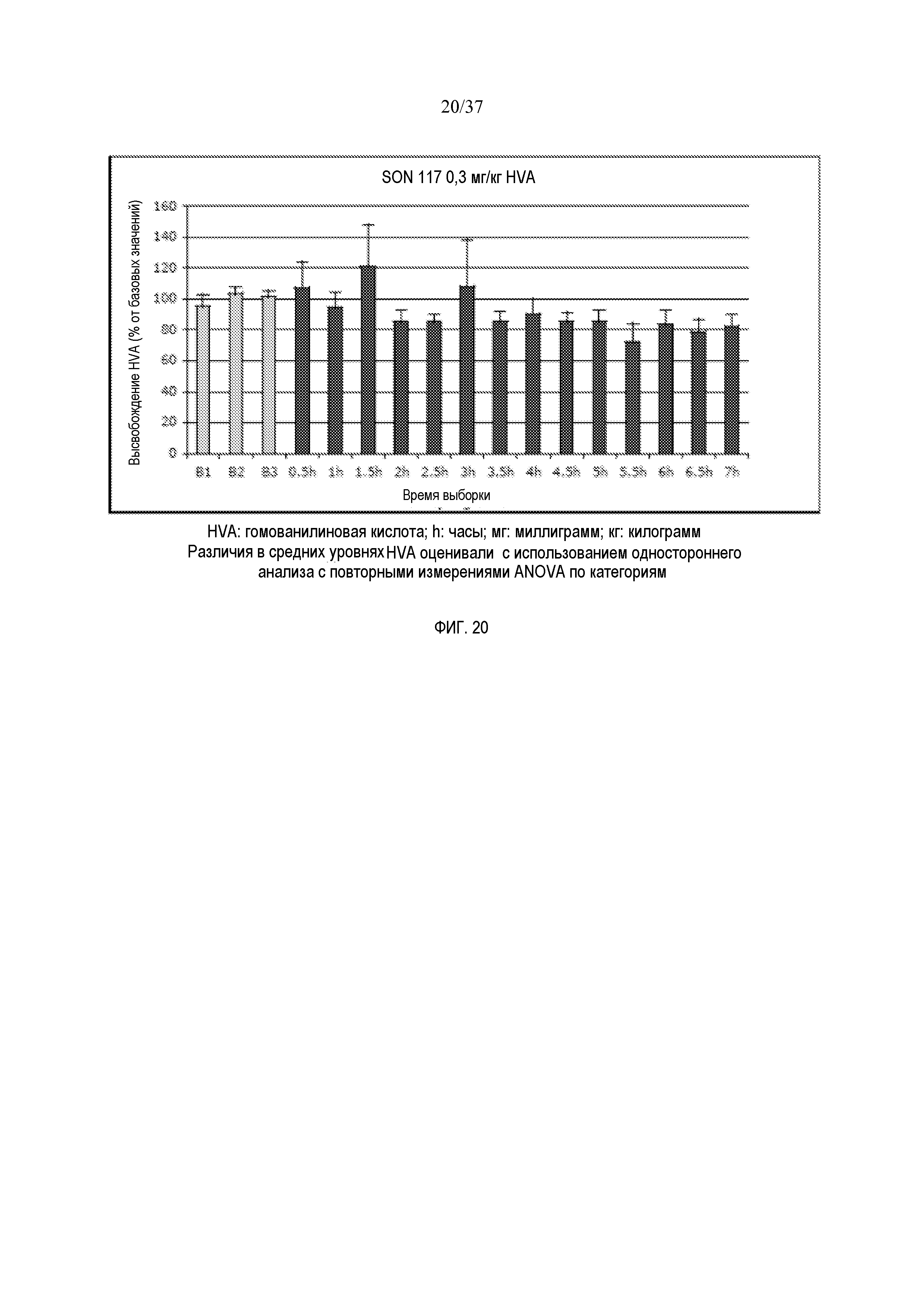
[0024] Фиг. 12 иллюстрирует эффект SON-117 (0,1 мг/кг) на высвобождение допамина в префронтальной коре головного мозга крысы (n=8).
[0025] Фиг. 13 иллюстрирует эффект SON-117 (0,1 мг/кг) на высвобождение 5-HIAA в префронтальной коре головного мозга крысы (n=8).
[0026] Фиг. 14 иллюстрирует эффект SON-117 (0,1 мг/кг) на высвобождение HVA в префронтальной коре головного мозга крысы (n=8).
[0027] Фиг. 15 иллюстрирует эффект SON-117 (0,1 мг/кг) на высвобождение 5-НТ в префронтальной коре головного мозга крысы (n=8).
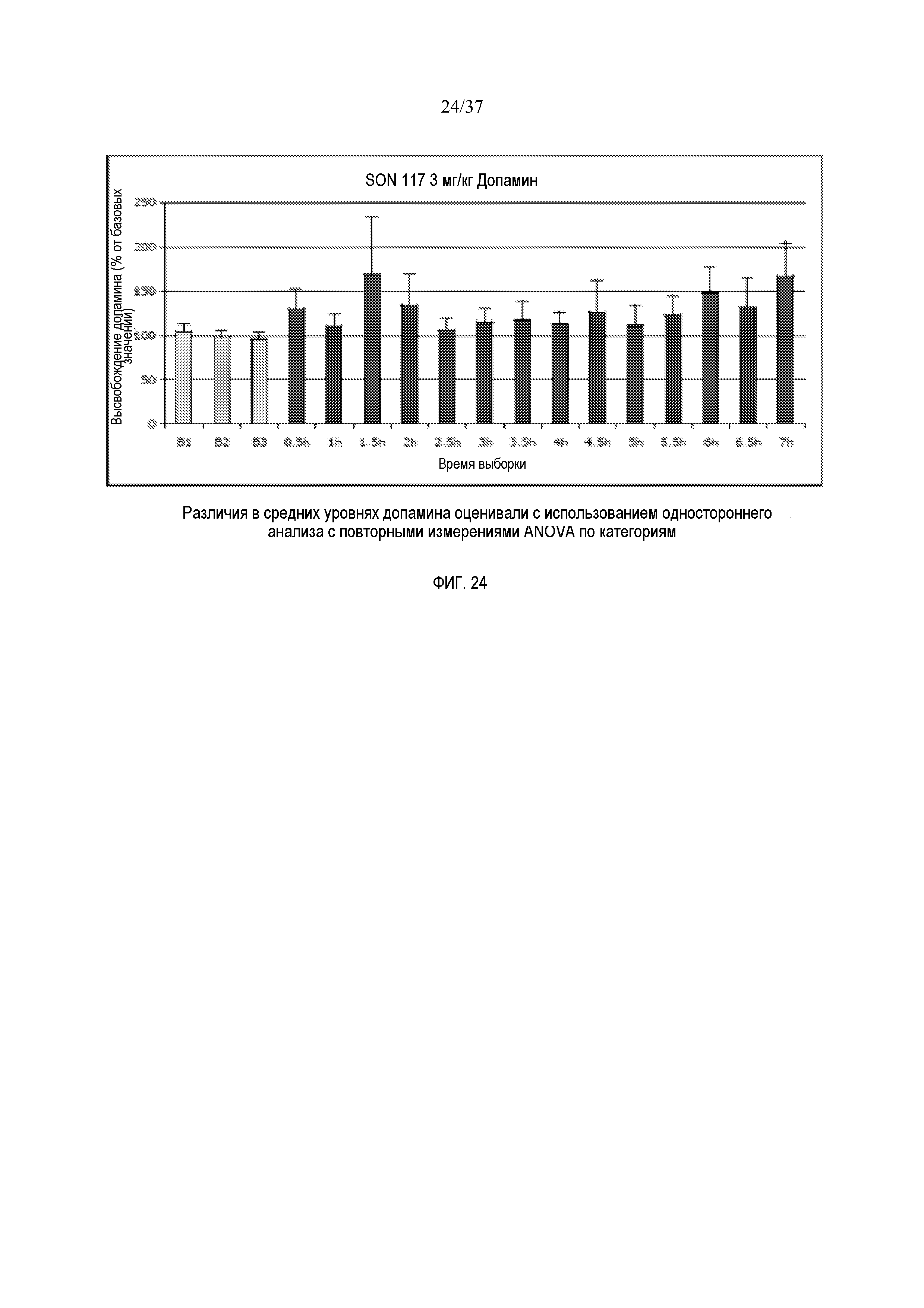
[0028] Фиг. 16 иллюстрирует эффект SON-117 (0,3 мг/кг) на высвобождение NE в префронтальной коре головного мозга крысы (n=8).
[0029] Фиг. 17 иллюстрирует эффект SON-117 (0,3 мг/кг) на высвобождение DOPAC в префронтальной коре головного мозга крысы (n=8).
[0030] Фиг. 18 иллюстрирует эффект SON-117 (0,3 мг/кг) на высвобождение допамина в префронтальной коре головного мозга крысы (n=8).
[0031] Фиг. 19 иллюстрирует эффект SON-117 (0,3 мг/кг) на высвобождение 5-HIAA в префронтальной коре головного мозга крысы (n=8).
[0032] Фиг. 20 иллюстрирует эффект SON-117 (0,3 мг/кг) на высвобождение HVA в префронтальной коре головного мозга крысы (n=8).
[0033] Фиг. 21 иллюстрирует эффект SON-117 (0,3 мг/кг) на высвобождение 5-НТ в префронтальной коре головного мозга крысы (n=8).
[0034] Фиг. 22 иллюстрирует эффект SON-117 (3 мг/кг) на высвобождение NE в префронтальной коре головного мозга крысы (n=8).
[0035] Фиг. 23 иллюстрирует эффект SON-117 (3 мг/кг) на высвобождение DOPAC в префронтальной коре головного мозга крысы (n=8).
[0036] Фиг. 24 иллюстрирует эффект SON-117 (3 мг/кг) на высвобождение допамина в префронтальной коре головного мозга крысы (n=8).
[0037] Фиг. 25 иллюстрирует эффект SON-117 (3 мг/кг) на высвобождение 5-HIAA в префронтальной коре головного мозга крысы (n=8).
[0038] Фиг. 26 иллюстрирует эффект SON-117 (3 мг/кг) на высвобождение HVA в префронтальной коре головного мозга крысы (n=8).
[0039] Фиг. 27 иллюстрирует эффект SON-117 (3 мг/кг) на высвобождение 5-НТ в префронтальной коре головного мозга крысы (n=8).
[0040] Фиг. 28 иллюстрирует эффект SON-117 по сравнению с циталопрамом на высвобождение NE в префронтальной коре головного мозга крысы. Параметры среднего значения уровней NE (+/-SEM) измеряли в каждой экспериментальной группе (n=8).
[0041] Фиг. 29 иллюстрирует эффект SON-117 по сравнению с циталопрамом на высвобождение DOPAC в префронтальной коре головного мозга крысы. Средние значения уровней DOPAC (+/-SEM) измеряли в каждой экспериментальной группе (n=8).
[0042] Фиг. 30 иллюстрирует эффект SON-117 по сравнению с циталопрамом на высвобождение допамина в префронтальной коре головного мозга крысы. Средние значения уровней допамина (+/-SEM) измеряли в каждой экспериментальной группе (n=8).
[0043] Фиг. 31 иллюстрирует эффект SON-117 по сравнению с циталопрамом на высвобождение 5-HIAA в префронтальной коре головного мозга крысы. Средние значения уровней 5-HIAA (+/-SEM) измеряли в каждой экспериментальной группе (n=8).
[0044] Фиг. 32 иллюстрирует эффект SON-117 по сравнению с циталопрамом на высвобождение HVA в префронтальной коре головного мозга крысы. Средние значения уровней HVA (+/-SEM) измеряли в каждой экспериментальной группе (n=8).
[0045] Фиг. 33 иллюстрирует эффект SON-117 по сравнению с циталопрамом на высвобождение 5-НТ в префронтальной коре головного мозга крысы. Средние значения уровней 5-НТ (+/-SEM) измеряли в каждой экспериментальной группе (n=8).
[0046] Фиг. 34 иллюстрирует фармакокинетические данные для SON-117 в день 1.
[0047] Фиг. 35 иллюстрирует фармакокинетические данные для SON-117 в день 14.
[0048] Фиг. 36 иллюстрирует фармакокинетические данные для M1 в день 1.
[0049] Фиг. 37 иллюстрирует фармакокинетические данные для M1 в день 14.
Подробное описание изобретения
[0050] В описании, содержащемся в настоящей заявке, показано, что соединения формулы I обладают свойствами, полезными для лечения депрессии и/или одного или нескольких симптомов депрессии. Поэтому в настоящую заявку включены способы и композиции для лечения различных аспектов депрессии.
[0051] Целью настоящего изобретения является обеспечение способов лечения или ослабления по меньшей мере одного симптома депрессии у субъекта, которым является человек, включающих введение нуждающемуся в этом субъекту терапевтически эффективного количества композиции, включающей соединение формулы (I) или его фармацевтически приемлемую соль, гидрат или сольват. Также целью настоящего изобретения является обеспечение композиций, включающих соединение формулы (I) или его фармацевтически приемлемую соль, гидрат или сольват, для лечения или ослабления по меньшей мере одного симптома депрессии у субъекта, которым является человек, включающего введение композиции нуждающемуся в этом субъекту. Еще одним объектом настоящего изобретения является обеспечение композиций и способов для лечения или улучшения по меньшей мере одного нарушения или параметра сна у субъекта, включая субъекта-человека, включающих введение нуждающемуся в этом субъекту терапевтически эффективного количества композиции, включающей соединение формулы (I) или его фармацевтически приемлемую соль, гидрат или сольват.
[0052] Патент США 6720320, включенный в настоящую заявку посредством ссылки в полном объеме, раскрывает феноксипропиламиновые соединения и производные, обладающие избирательным сродством в отношении 5-HT1A рецептора и антагонистической активностью против 5-НТ1А рецептора, а также активностью ингибирования повторного поглощения 5-НТ. Некоторые соединения, раскрытые в этом документе, также демонстрируют активность быстродействующего антидепрессанта. Такие соединения могут быть полезными при лечении заболеваний, которые можно терапевтически и/или профилактически лечить посредством антагонистической активности против 5-HT1A рецептора и/или ингибирования повторного поглощения 5-НТ. Однако некоторые свойства и характеристики конкретных производных не были раскрыты в патенте США 6720320. В частности, патент США 6720320 указывает, что общая суточная доза описанных феноксипропиламиновых соединений в случае перорального введения составляет 0,5-10 мг/кг, предпочтительно 1-5 мг/кг. В настоящем изобретении было неожиданно обнаружено, что эффективное лечение выбранных расстройств может быть при пероральной дозе, которая приближается к 0,001 мг/кг.
[0053] Для целей описания, содержащегося настоящей заявке, термин "аффективные расстройства" следует понимать как охватывающий такие состояния, которые определяются как аффективные расстройства в Диагностическом и Статистическом Руководстве по Психическим Расстройствам, издание пятое, 2000 ("DSM-IV-TR"), содержание которого включено в настоящую заявку посредством ссылки. Более конкретно, аффективные расстройства, подлежащие лечению в соответствии с описанием, содержащимся в настоящей заявке, включают те расстройства, которые связаны с возникновением более одного депрессивного симптома, такого как подавленное настроение, потеря интереса или удовольствия, потеря аппетита, нарушение сна, психомоторные изменения, усталость, чувство бесполезности, нарушение концентрации или мысли о смерти, при этом такие симптомы обычно проявляются в течение длительного периода времени. В одном варианте воплощения изобретения соединения формулы I используют для лечения таких состояний, которые определены в DSM-IV-TR как связанные с эпизодом глубокой депрессии, то есть периодом по меньшей мере две недели, в течение которых индивидуум, которого нужно лечить, демонстрирует либо подавленное настроение, либо потерю интереса или удовольствия, связанные с по меньшей мере четырьмя дополнительными депрессивными симптомами из приведенного выше перечня. Примеры таких состояний включают глубокое депрессивное расстройство, биполярное расстройство I типа и биполярное расстройство II типа. В другом варианте воплощения изобретения состояние, подлежащее лечению, характеризуется депрессивными симптомами, которые необязательно достигают уровня эпизода глубокой депрессии, такими как дистимическое расстройство, депрессивное расстройство, тип которого не уточняется, циклотимическое расстройство, биполярное расстройство, тип которого не уточняется, аффективное расстройство из-за общего медицинского состояния и аффективное расстройство, вызванное употреблением химических веществ. В другом варианте воплощения изобретения соединения формулы I можно использовать для лечения отдельных эпизодов глубокой депрессии, которые не охарактеризованы в DSM-IV-TR как определенное расстройство, например, те состояния, которые связаны с послеродовой депрессией, а также депрессивные симптомы, связанные с психическими состояниями, которые формально не классифицированы как аффективные расстройства, например, шизоаффективное расстройство или сезонное аффективное расстройство. Еще в одном варианте воплощения изобретения соединения формулы I можно использовать для лечения индивидуума, испытывающего два или более депрессивных симптомов, где такое состояние не характеризуется в соответствии с DSM-IV-TR как эпизод глубокой депрессии. Каждый из отмеченных выше вариантов воплощения следует рассматривать как охватываемый термином "связанные с депрессией аффективные расстройства".
Соединения и способы лечения депрессии
[0054] В одном варианте воплощения изобретения представлена композиция для лечения или ослабления по меньшей мере одного симптома депрессии у субъекта, которым является человек, включая введение нуждающемуся в этом субъекту терапевтически эффективного количества композиции, включающей соединение формулы (I) или его фармацевтически приемлемую соль, гидрат или сольват,

[0055]
[0056] где каждый символ в формуле имеет следующее значение: связь, показанная сплошной линией и пунктирной линией, представляет собой двойную связь или простую связь;
[0057] X представляет собой атом водорода, гидроксигруппу, C1-C8 алкоксигруппу, ацилоксигруппу или оксогруппу;
[0058] R1 представляет собой группу, имеющую следующую формулу

or

[0059]
[0060] где R5 представляет собой необязательно замещенную арильную группу или необязательно замещенную ароматическую гетероциклическую группу,
[0061] Z отсутствует или представляет собой --СН2---, и
[0062] R6 представляет собой атом водорода, гидроксигруппу, ацетамидогруппу, карбоксильную группу, алкоксикарбонильную группу, цианогруппу или C1-C8 алкоксигруппу;
[0063] R3 представляет собой атом водорода, C1-C18 алкильную группу или атом галогена;
[0064] V представляет собой -О--;
[0065] W отсутствует;
[0066] R7 представляет собой C1-C4 гидроксиалкильную группу, ацильную группу, необязательно замещенную насыщенную или ненасыщенную гетероциклическую группу, необязательно замещенную конденсированную гетероциклическую группу, C1-C4 алкилсульфонильную группу или формулу -Q--R9,
[0067] где
[0068] Q представляет собой --С(=O)--, --C(=S)--, --СН2-- или --S(=O)2--, и
[0069] R9 представляет собой группу, имеющую следующую формулу



[0070]






[0071]
[0072] или -NH-NH--R15,
[0073] где R10 и R11, каждый независимо, представляют собой атом водорода, C1-C18 алкильную группу, необязательно замещенную арильную группу, необязательно замещенную аралкильную группу или алкоксигруппу, R12 представляет собой атом водорода, необязательно замещенную арильную группу, С1-С18 алкильную группу, С1-С8 алкоксигруппу или ацильную группу, и R15представляет собой атом водорода, фенильную группу, C1-C4алкильную группу, C1-C2 галогенированную алкильную группу, атом галогена, С2-С4 алкенильную группу, С1-С4 гидроксиалкильную группу, алкоксиалкильную группу, алкилоксикарбонильную группу, необязательно замещенную аминогруппу, ацетамидогруппу, карбоксильную группу, ацильную группу, необязательно замещенную алкилоксигруппу, алкилтиогруппу или цианогруппу;
[0074] Ra, Rb и Rc, каждый независимо, представляют собой атом водорода, C1-C18 алкильную группу, гидроксигруппу, C1-C8алкоксигруппу, атом галогена, ацильную группу, нитрогруппу или аминогруппу;
[0075] его оптически активное соединение, его фармацевтически приемлемую соль или его гидрат;
[0076] где соединение формулы (I) присутствует в композиции в количестве от 0,01 мг/кг до 0,2 мг/кг массы тела субъекта.
[0077] В одном варианте воплощения изобретения соединение формулы (I) присутствует в композиции в количестве от 0,1 мг до 10 мг.
[0078] В других вариантах воплощения изобретения, описанных более подробно далее в настоящей заявке, дозы и схему введения для соединения формулы I можно оптимизировать в зависимости от здоровья и состояния подлежащего лечению субъекта, а также желаемого результата лечения.
[0079] Термин "рецептор", в контексте настоящей заявки, означает молекулу, с которой могут специфически взаимодействовать один или несколько видов сигнальных молекул. Например, 5-HT1A рецептор представляет собой подтип 5-НТ рецептора, который связывает нейротрансмиттер серотонин ("5-гидрокситриптамин").
[0080] Термин "субъект" относится к любому животному, включая млекопитающих, таких как, но не ограничиваясь этим, человек, мыши, крысы, другие грызуны, кролики, собаки, кошки, свиньи, крупный рогатый скот, овцы, лошади или приматы.
[0081] Термин "лечение" (и соответствующие термины "лечить" и "лечение") включает паллиативное, восстановительное и превентивное ("профилактическое") лечение субъекта. Термин "паллиативное лечение" относится к лечению, которое облегчает или уменьшает силу проявления или интенсивность состояния у субъекта без лечения состояния. Термин "превентивное лечение" (и соответствующий термин "профилактическое лечение") относится к лечению, которое предотвращает возникновение состояния у субъекта. Термин "восстановительное лечение" ("лечебный") относится к лечению, которое останавливает развитие, уменьшает патологические проявления или полностью устраняет состояние у субъекта. Лечение можно осуществлять с терапевтически эффективным количеством соединения, соли или композиции, которые вызывают биологический или лекарственный ответ ткани, системы или субъекта, который пытается получить индивидуум, такой как исследователь, врач, ветеринар или клиницист. Термин "лечение" также следует рассматривать как включающий не только полную ремиссию всех симптомов, испытываемых принимающим лечение индивидуумом, но также и облегчение одного или нескольких существующих депрессивных симптомов, а также предотвращение возникновения депрессивных симптомов путем упреждающего введения соединения формулы I индивидууму, подверженному развитию, или у которого имеется вероятность развития, депрессивных симптомов, таких как хроническая или рецидивирующая депрессия. Способы по настоящему изобретению можно использовать для лечения любого млекопитающего, демонстрирующего симптомы связанного с депрессией аффективного расстройства, например, для лечения млекопитающих, таких как кошки, собаки, крысы, кролики, лошади и подобные; однако, в предпочтительном варианте воплощения, способ используют для лечения людей. Предпочтительно, индивидуум, который нуждается в лечении, представляет собой индивидуума, у которого было диагностировано состояние, связанное с эпизодом глубокой депрессии, более предпочтительно, сильное депрессивное расстройство.
[0082] В одном аспекте описания, содержащегося в настоящей заявке, было показано, что соединения формулы I обладают свойствами, полезными для лечения депрессии и/или одного или нескольких симптомов депрессии.
[0083] В другом аспекте соединения формулы I являются полезными для повышения эффективности лечения депрессии у субъекта, получающего в настоящий момент одно или несколько соединений для лечения депрессии.
[0084] В одном варианте воплощения изобретения соединение формулы I включает соединение, представленное формулой II:

[0085]
[0086] (S)-1-(4-(3,4-дихлорфенил)пиперидино)-3-(2-(5-метил-1,3,4-оксадиазол-2-ил)бензо(b)фуран-4-илокси)-2-пропанола гидрохлорид.
[0087] В одном аспекте соединение формулы II (также называемое в настоящей заявке как SON-117 или Wf-516) обладает высоким сродством связывания с рецептором 5-НТТ, 5-HT1A и 5-HT2A. Электрофизиологические исследования с использованием SON-117 показали, что порядок эффектов SON-117 был пресинаптическим (то есть 5-НТ1А>5-НТТ>5-HT2A>постсинаптический 5-HT1A.
[0088] В одном аспекте изобретения соединение формулы I может иметь профиль связывания с рецептором со значением Ki менее чем 0,05 нмоль/л, менее чем 0,1 нмоль/л, менее чем 0,5 нмоль/л, менее чем 1,0 нмоль/л, менее чем 1,5 нмоль/л, менее чем 2,0 нмоль/л, менее чем 2,5 нмоль/л или менее чем 5 нмоль/л для 5-HT1. В одном аспекте изобретения соединение формулы I может иметь профиль связывания рецептора со значением Ki менее чем 0,05 нмоль/л, менее чем 0,1 нмоль/л, менее чем 0,5 нмоль/л, менее чем 1,0 нмоль/л, менее чем 1,5 нмоль/л, менее чем 2,0 нмоль/л, менее чем 2,5 нмоль/л или менее чем 5 нмоль/л для допаминового транспортера (DAT). Как будет понятно специалистам в данной области, могут быть вариации в сродстве связывания для соединения формулы I при испытании против одного и того же рецептора из другого организма или вида.
Сопутствующие симптомы депрессии
[0089] В одном варианте воплощения изобретения представлен способ лечения по меньшей мере одного симптома состояния или расстройства, связанного с депрессией, у субъекта, включающий введение нуждающемуся в этом субъекту терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, описанных выше. В одном варианте воплощения изобретения представлен способ, в котором соединение представляет собой соединение, представленное формулой II.
Лечение расстройств сна
[0090] В одном варианте воплощения изобретения представлен способ лечения по меньшей мере одного аспекта расстройства сна у субъекта, страдающего депрессией, который включает введение нуждающемуся в этом субъекту терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, описанных выше, где лечат по меньшей мере один аспект сна. В одном варианте воплощения изобретения лечат по меньшей мере один аспект расстройства сна. В другом варианте воплощения изобретения по меньшей мере один аспект или параметр сна у пациента улучшается. В одном варианте воплощения изобретения сон у страдающего депрессией пациента улучшается. В одном варианте воплощения изобретения по меньшей мере один симптом депрессии улучшается или лечится в связи с улучшением сна у субъекта, получающего такое лечение.
[0091] В одном аспекте нарушение по меньшей мере одного расстройства или параметра сна связано с депрессией. Однако должно быть понятно, что настоящее изобретение обеспечивает лечение по меньшей мере одного расстройства или параметра сна, вне зависимости от того, как возникает такое расстройство или нарушение параметра сна. Другими словами, расстройства сна, которые не связаны с депрессией, также можно лечить в соответствии с раскрытием, содержащимся в настоящей заявке.
[0092] В одном варианте воплощения изобретения представлена композиция для лечения или улучшения по меньшей мере одного расстройства или параметра сна у субъекта, включая человека, включающего введение нуждающемуся в этом субъекту терапевтически эффективного количества композиции, включающей соединение формулы (I) или его фармацевтически приемлемую соль, гидрат или сольват,

[0093]
[0094] где каждый символ в формуле имеет следующее значение: связь, показанная сплошной линией и пунктирной линией, представляет собой двойную связь или простую связь;
[0095] X представляет собой атом водорода, гидроксигруппу, C1-C8 алкоксигруппу, ацилоксигруппу или оксогруппу;
[0096] R1 представляет собой группу, имеющую следующую формулу

or

[0097]
[0098] где R5 представляет собой необязательно замещенную арильную группу или необязательно замещенную ароматическую гетероциклическую группу,
[0099] Z отсутствует или представляет собой --СН2--, и
[00100] R6 представляет собой атом водорода, гидроксигруппу, ацетамидогруппу, карбоксильную группу, алкоксикарбонильную группу, цианогруппу или С1-С8 алкоксигруппу;
[00101] R3 представляет собой атом водорода, C1-C18 алкильную группу или атом галогена;
[00102] V представляет собой --О--;
[00103] W отсутствует;
[00104] R7 представляет собой C1-C4 гидроксиалкильную группу, ацильную группу, необязательно замещенную насыщенную или ненасыщенную гетероциклическую группу, необязательно замещенную конденсированную гетероциклическую группу, С1-С4 алкилсульфонильную группу или формулу --Q--R9,
[00105] где
[00106] Q представляет собой --С(=O)--, --С(=S)--, --СН2-- или --S(=O)2--, и
[00107] R9 представляет собой группу, имеющую следующую формулу



[00108]






[00109]
[00110] или --NH--NH--R15,
[00111] где R10 и R11, каждый независимо, представляют собой атом водорода, C1-C18 алкильную группу, необязательно замещенную арильную группу, необязательно замещенную аралкильную группу или алкоксигруппу, R12 представляет собой атом водорода, необязательно замещенную арильную группу, C1-C18 алкильную группу, С1-С8 алкоксигруппу или ацильную группу, и R15представляет собой атом водорода, фенильную группу, С1-С4алкильную группу, C1-C2 галогенированную алкильную группу, атом галогена, С2-С4 алкенильную группу, C1-C4 гидроксиалкильную группу, алкоксиалкильную группу, алкилоксикарбонильную группу, необязательно замещенную аминогруппу, ацетамидогруппу, карбоксильную группу, ацильную группу, необязательно замещенную алкилоксигруппу, алкилтиогруппу или цианогруппу;
[00112] Ra, Rb и Rc, каждый независимо, представляют собой атом водорода, C1-C18 алкильную группу, гидроксигруппу, C1-C8алкоксигруппу, атом галогена, ацильную группу, нитрогруппу или аминогруппу;
[00113] его оптически активное соединение, его фармацевтически приемлемую соль или его гидрат;
[00114] где соединение формулы (I) присутствует в композиции в количестве от 0,01 мг/кг до 0,2 мг/кг массы тела субъекта.
[00115] В одном варианте воплощения изобретения соединение формулы (I) присутствует в композиции в количестве от 0,1 мг до 10 мг.
[00116] В одном варианте воплощения изобретения соединение формулы I представляет собой соединение, представленное формулой II.
[00117] В одном варианте воплощения изобретения субъект, которого лечат от расстройства сна соединением формулы I, также страдает от депрессии.
[00118] В одном варианте воплощения изобретения улучшают сон у пациента, не страдающего депрессией. В одном аспекте изобретения лечат и/или улучшают по меньшей мере одно расстройство или параметр сна. В одном аспекте изобретения представлен способ улучшения по меньшей мере одного аспекта сна, включающий введение нуждающемуся в этом субъекту терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, определенных выше. В одном варианте воплощения изобретения соединение формулы I представляет собой соединение, представленное формулой II.
[00119] В одном варианте воплощения изобретения представлен способ лечения расстройства сна у пациента, страдающего депрессией. В одном варианте воплощения изобретения представлен способ лечения расстройства сна у пациента после прекращения лечения другим активным фармацевтическим ингредиентом, например, соединением, являющимся антидепрессантом. В одном варианте воплощения изобретения представлен способ лечения расстройства сна в комбинации с активным фармацевтическим ингредиентом (например, соединением, являющимся антидепрессантом).
[00120] Можно лечить различные аспекты сна, в том числе, но не ограничиваясь этим, латентность наступления сна, латентность до устойчивого сна, дистрибуцию медленного сна по всему периоду сна или один или несколько сегментов периода сна, продолжительность сна в целом и архитектурные параметры сна. В одном аспекте изобретения медленный сон (SWS) увеличивается даже при низкой дозе 1 мг, когда соединение представляет собой SON-117. В одном аспекте изобретения REM активность и REM плотность увеличиваются даже при низких дозах 3 мг и 7,5 мг, когда соединение представляет собой SON-117. Эти эффекты являются характерными и неожиданными по сравнению с другими моноаминергическими антидепрессантами, такими как селективные ингибиторы повторного поглощения серотонина (SSRI) или селективные ингибиторы повторного поглощения серотонина-норэпинефрина (SNRI).
[00121] Ухудшение когнитивной способности представляет собой снижение способности думать, концентрироваться, формулировать идеи, мыслить и запоминать. В одном варианте воплощения изобретения представлен способ лечения или уменьшения ухудшения когнитивной способности или улучшения когнитивной способности, включающий введение нуждающемуся в этом субъекту терапевтически эффективного количества соединения формулы (I) или фармацевтически приемлемой соли, описанных в настоящей заявке. В одном варианте воплощения изобретения представлен способ лечения депрессии, не провоцируя ухудшения когнитивной способности. В одном варианте воплощения изобретения представлен способ лечения депрессии и восстановления, повышения и улучшения когнитивной способности у пациента после прекращения лечения другим активным фармацевтическим ингредиентом, например, соединением, являющимся антидепрессантом. В одном варианте воплощения изобретения представлен способ лечения депрессии в комбинации с активным фармацевтическим ингредиентом, ослабляющим когнитивную функцию (например, антидепрессантом, ослабляющим когнитивную функцию), не вызывая или увеличивая ухудшения когнитивной способности, или для улучшения, повышения или восстановления когнитивной функции у такого пациента. В одном варианте воплощения изобретения нет никакой потери когнитивной способности у страдающего от депрессии человека при введении SON-117, описанного в настоящей заявке. В другом варианте воплощения изобретения ухудшение когнитивной способности, имеющееся у человека, страдающего от депрессии, лечат или уменьшают путем введения SON-117, описанного в настоящей заявке. В одном варианте воплощения изобретения соединение формулы I представляет собой соединение, представленное формулой II. Как будет понятно на основе настоящего раскрытия, модификация параметров сна может улучшить когнитивную функцию. В качестве неограничивающего примера, улучшение и/или увеличение SWS улучшает когнитивную способность. В одном аспекте изобретения улучшают когнитивную способность в целом. В другом аспекте улучшают один или несколько аспектов когнитивной способности, включая, среди прочих, укрепление памяти, исполнительные функции, вербальную память и беглость речи. В одном варианте воплощения изобретения улучшают когнитивную способность у субъекта до того момента, когда у субъекта восстановится нормальная когнитивная способность. В другом варианте воплощения изобретения улучшают когнитивную способность у субъекта за пределами нормальной когнитивной способности субъекта так, что уровни когнитивной способности у субъекта повышаются.
[00122] В одном варианте воплощения изобретения улучшают когнитивную способность у субъекта, страдающего от депрессии. В другом варианте воплощения изобретения улучшают когнитивную способность у субъекта, не страдающего от депрессии.
Лечение других расстройств
[00123] В одном варианте воплощения изобретения представлен способ лечения пожилых людей с использованием композиции, описанной в настоящей заявке. В одном варианте воплощения изобретения пожилой субъект имеет предшествующее болезни Альцгеймера состояние или статус. В одном варианте воплощения изобретения пожилой субъект имеет предшествующее болезни Паркинсона состояние или статус.
[00124] В одном варианте воплощения изобретения способ лечения пожилых людей с использованием композиции, описанной в настоящей заявке, включает лечение депрессии, и необязательно может включать совместное введение одного или нескольких дополнительных терапевтических средств, описанных более подробно далее. В одном варианте воплощения изобретения способ лечения пожилых людей с использованием композиции, описанной в настоящей заявке, включает лечение депрессии, и необязательно может включать совместное введение одного или нескольких дополнительных терапевтических средств, таких как, но не ограничиваясь этим, циталопрам, эсциталопрам, сертралин, бупропион, миртазапин, моклобемид, венлафаксин, дезипрамин и нортриптилин.
[00125] В одном варианте воплощения изобретения пациенты, страдающие от повышенной сексуальной дисфункции (такой как, например, аноргазмия и отсроченная эякуляция) из-за действий антидепрессанта, который они получают, или депрессии как таковой, ощущение уменьшающейся дисфункции или даже улучшения дисфункции могут возникнуть при последовательном введении SON-117, описанного в настоящей заявке.
[00126] В одном варианте воплощения изобретения представлен способ лечения депрессии, не вызывая или не усиливая сексуальную дисфункцию. В одном варианте воплощения изобретения представлен способ лечения депрессии в комбинации с активным фармацевтическим ингредиентом (например, соединением, являющимся антидепрессантом), не вызывая или не усиливая сексуальную дисфункцию у пациента.
Лекарственные формы и количества
[00127] В одном варианте воплощения изобретения, как описано подробно далее в настоящей заявке, было обнаружено, что низкие дозы соединения формулы II, вводимые субъекту, обеспечивают удивительную эффективность для лечения депрессии. В одном аспекте изобретения расстройство сна неожиданно лечится у субъекта, которому вводят низкую дозу соединения формулы II. В другом аспекте когнитивная функция неожиданно улучшается у субъекта, которому вводят низкую дозу соединения формулы II. В одном варианте воплощения изобретения соединение формулы I вводят субъекту в дозе менее чем 0,01 мг/кг. В одном варианте воплощения изобретения соединение вводят парентерально в дозе менее чем 0,01 мг/кг. В одном варианте воплощения изобретения соединение представляет собой соединение формулы II. В одном варианте воплощения изобретения соединение формулы I вводят субъекту в дозе менее чем 0,5 мг/кг. В одном варианте воплощения изобретения соединение вводят перорально в дозе менее чем 0,5 мг/кг. В одном варианте воплощения изобретения соединение представляет собой соединение формулы II.
[00128] В одном варианте воплощения изобретения также было обнаружено, что соединение формулы I (например, соединение формулы II) имеет быстрое начало действия, и оно происходит гораздо быстрее, чем у обычных антидепрессантов, известных в данной области.
[00129] В одном варианте воплощения изобретения дозу, описанную в настоящей заявке, можно вводить в виде композиции в расчете на массу тела субъекта. В одном варианте воплощения изобретения дозу можно вводить в расчете на единицу массы тела субъекта (например, мг соединения формулы I на кг массы тела субъекта). В одном варианте воплощения изобретения дозу, описанную в настоящей заявке, можно вводить в виде композиции, основанной исключительно на массе дозы, без учета массы тела субъекта (например, мг соединения формулы I на дозу, вводимую субъекту). В одном варианте воплощения изобретения дозу определяют на основании массы соединения формулы I в лекарственной форме. В другом варианте воплощения изобретения дозу определяют на основании общей массы всех компонентов композиции, составляющей лекарственную форму.
[00130] В одном варианте воплощения изобретения введение соединения для любой цели, описанной в настоящей заявке, в любой форме или комбинации, описанной в настоящей заявке, может включать введение соединения формулы I или его фармацевтически приемлемой соли при дозе в пределах 1 нг - 100 мкг, 5 нг - 75 мкг, 10 нг - 50 мкг, 25 нг - 40 мкг, 50 нг - 30 мкг, 75 нг - 20 мкг, 100 нг - 10 мкг, 250 нг - 5 мкг, 500 нг - 200 мкг, 750 нг - 100 мкг, 1 мкг - 75 мкг, 5 мкг - 50 мкг или 10 мкг - 40 мкг. В качестве неограничивающего примера, и как описано подробно далее в настоящей заявке, доза 10 мкг - 40 мкг, например, представляет собой дозу в диапазоне от 10 мкг на кг массы тела субъекта до 40 мкг на кг массы тела субъекта, и также может представлять собой дозу в диапазоне от 10 мкг, вводимых субъекту, до 40 мкг, вводимых субъекту.
[00131] В одном варианте воплощения изобретения введение соединения для любой цели, как описано в настоящей заявке, в любой форме или комбинации, описанной в настоящей заявке, может включать введение соединения формулы I или его фармацевтически приемлемой соли при дозе в пределах 1 нг - 1 г, 5 нг - 1 г, 10 нг - 1 г, 25 нг - 1 г, 50 нг - 1 г, 75 нг - 1 г, 100 нг - 750 мг, 500 нг - 500 мг, 10 мкг - 200 мг, 15 мкг - 190 мг, 25 мкг - 180 мг, 50 мкг - 170 мг, 75 мкг - 160 мг, 100 мкг - 150 мг, 250 мкг - 140 мг, 400 мкг - 130 мг, между 500 мкг - 128 мг, 600 мкг - 100 мг, 750 мкг - 75 мг, 900 мкг - 50 мг или при дозе в пределах 0,1 мг - 64 мг.
[00132] В одном варианте воплощения изобретения введение соединения для любой цели, как описано в настоящей заявке, в любой форме или комбинации, описанной в настоящей заявке, может включать введение соединения формулы I или его фармацевтически приемлемой соли при дозе в пределах 0,01-1,0 мг, 0,05-0,75 мг, 0,08-0,6 мг, 0,01-0,2 мг, 0,05 мг - 0,15 мг, 0,08-0,12 мг, 0,4-0,6 мг, 0,45-0,55 мг или при дозе в пределах 0,48-0,52 мг.
[00133] В одном варианте воплощения изобретения соединение формулы I или его фармацевтически приемлемую соль можно вводить субъекту в соответствии с композицией и способами, описанными в настоящей заявке, в дозе около 1000 мг или менее, около 500 мг или менее, около 200 мг или менее, около 150 мг или менее, около 100 мг или менее, около 50 мг или менее, около 40 мг или менее, около 30 мг или менее, около 20 мг или менее, около 10 мг или менее, около 9 мг или менее, около 8 мг или менее, около 7 мг или менее, около 6 мг или менее, около 5 мг или менее, около 4 мг или менее, около 3 мг или менее, около 2 мг или менее, около 1 мг или менее, около 0,9 мг или менее, около 0,8 мг или менее, около 0,7 мг или менее, около 0,6 мг или менее, около 0,5 мг или менее, около 0,4 мг или менее, около 0,3 мг или менее, около 0,2 мг или менее, около 0,1 мг или менее, около 0,09 мг или менее, около 0,08 мг или менее, около 0,07 мг или менее, около 0,06 мг или менее, около 0,05 мг или менее, около 0,04 мг или менее, около 0,03 мг или менее, около 0,02 мг или менее, около 0,01 мг или менее, около 0,009 мг или менее, около 0,008 мг или менее, около 0,007 мг или менее, около 0,006 мг или менее, около 0,005 мг или менее, около 0,004 мг или менее, около 0,003 мг или менее, около 0,002 мг или менее, около 0,001 мг или менее, или около 0,0005 мг или менее.
[00134] В одном варианте воплощения изобретения соединение формулы I или его фармацевтически приемлемую соль можно вводить субъекту в соответствии с композицией и способами, описанными в настоящей заявке, в дозе около 1 г, около 500 мг или более, около 200 мг или более, около 150 мг или более, около 100 мг или более, около 50 мг или более, около 40 мг или более, около 30 мг или более, около 20 мг или более, около 10 мг или более, около 9 мг или более, около 8 мг или более, около 7 мг или более, около 6 мг или более, около 5 мг или более, около 4 мг или более, около 3 мг или более, около 2 мг или более, около 1 мг или более, около 0,9 мг или более, около 0,8 мг или более, около 0,7 мг или более, около 0,6 мг или более, около 0,5 мг или более, около 0,4 мг или более, около 0,3 мг или более, около 0,2 мг или более, около 0,1 мг или более, около 0,09 мг или более, около 0,08 мг или более, около 0,07 мг или более, около 0,06 мг или более, около 0,05 мг или более, около 0,04 мг или более, около 0,03 мг или более, около 0,02 мг или более, около 0,01 мг или более, около 0,009 мг или более, около 0,008 мг или более, около 0,007 мг или более, около 0,006 мг или более, около 0,005 мг или более, около 0,004 мг или более, около 0,003 мг или более, около 0,002 мг или более, около 0,001 мг или более, или около 0,0005 мг или более.
[00135] В одном варианте воплощения изобретения соединение формулы I или его фармацевтически приемлемую соль можно вводить субъекту в соответствии с композицией и способами, описанными в настоящей заявке, при дозе, которая включает комбинацию любых из вышеуказанных диапазонов доз. В качестве неограничивающего примера, в одном варианте воплощения изобретения соединение формулы I или его фармацевтически приемлемую соль можно вводить субъекту в соответствии с композицией и способами, описанными в настоящей заявке, в дозе около 0,1 мг или более и около 0,5 мг или менее.
[00136] В одном варианте воплощения изобретения соединение формулы I или его фармацевтически приемлемую соль можно вводить субъекту в соответствии с композицией и способами, описанными в настоящей заявке, в дозе около 1000 мг, около 500 мг, около 200 мг, около 150 мг, около 100 мг, около 50 мг, около 40 мг, около 30 мг, около 20 мг, около 10 мг, около 9 мг, около 8 мг, около 7 мг, около 6 мг, около 5 мг, около 4 мг, около 3 мг, около 2 мг, около 1 мг, около 0,9 мг, около 0,8 мг, около 0,7 мг, около 0,6 мг, около 0,5 мг, около 0,4 мг, около 0,3 мг, около 0,2 мг, около 0,1 мг, около 0,09 мг, около 0,08 мг, около 0,07 мг, около 0,06 мг, около 0,05 мг, около 0,04 мг, около 0,03 мг, около 0,02 мг, около 0,01 мг, около 0,009 мг, около 0,008 мг, около 0,007 мг, около 0,006 мг, около 0,005 мг, около 0,004 мг, около 0,003 мг, около 0,002 мг, около 0,001 мг или около 0,0005 мг.
[00137] В одном варианте воплощения изобретения соединение формулы I или его фармацевтически приемлемую соль можно вводить субъекту в соответствии с композицией и способами, описанными в настоящей заявке, в дозе 1000 мг, 500 мг, 200 мг, 150 мг, 100 мг, 50 мг, 40 мг, 30 мг, 20 мг, 10 мг, 9 мг, 8 мг, 7 мг, 6 мг, 5 мг, 4 мг, 3 мг, 2 мг, 1, 9 мг, 1, 8 мг, 1, 7 мг, 1, 6 мг, 1, 5 мг, 1,4 мг, 1,3 мг, 1,2 мг, 1,1 мг, 1 мг, 0,9 мг, 0,8 мг, 0,7 мг, 0,6 мг, 0,5 мг, 0,4 мг, 0,3 мг, 0,2 мг, 0,1 мг, 0,09 мг, 0,08 мг, 0,07 мг, 0,06 мг, 0,05 мг, 0,04 мг, 0,03 мг, 0,02 мг, 0,01 мг, 0,009 мг, 0,008 мг, 0,007 мг, 0,006 мг, 0,005 мг, 0,004 мг, 0,003 мг, 0,002 мг, 0,001 мг или 0,0005 мг.
[00138] В одном варианте воплощения изобретения соединение формулы I или его фармацевтически приемлемую соль можно вводить субъекту в соответствии с композицией и способами, описанными в настоящей заявке, в дозе около 1000 мг/кг, около 500 мг/кг, около 200 мг/кг, около 150 мг/кг, около 100 мг/кг, около 50 мг/кг, около 40 мг/кг, около 30 мг/кг, около 20 мг/кг, около 10 мг/кг, около 9 мг/кг, около 8 мг/кг, около 7 мг/кг, около 6 мг/кг, около 5 мг/кг, около 4 мг/кг, около 3 мг/кг, около 2 мг/кг, около 1,9 мг/кг, около 1,8 мг/кг, около 1,7 мг/кг, около 1,6 мг/кг, около 1,5 мг/кг, около 1,4 мг/кг, около 1,3 мг/кг, около 1,2 мг/кг, около 1,1 мг/кг, около 1 мг/кг, около 0,9 мг/кг, около 0,8 мг/кг, около 0,7 мг/кг, около 0,6 мг/кг, около 0,5 мг/кг, около 0,4 мг/кг, около 0,3 мг/кг, около 0,2 мг/кг, около 0,1 мг/кг, около 0,09 мг/кг, около 0,08 мг/кг, около 0,07 мг/кг, около 0,06 мг, около 0,05 мг, около 0,04 мг, около 0,03 мг/кг, около 0,02 мг, около 0,01 мг, около 0,009 мг, около 0,008 мг, около 0,007 мг, около 0,006 мг/кг, около 0,005 мг/кг, около 0,004 мг/кг, около 0,003 мг/кг, около 0,002 мг/кг, около 0,0019 мг/кг, около 0,0018 мг/кг, около 0,0017 мг/кг, около 0,0016 мг/кг, около 0,0015 мг/кг, около 0,0014 мг/кг, около 0,0013 мг/кг, около 0,0012 мг/кг, около 0,0011 мг/кг, около 0,001 мг/кг, около 0,0005 мг/кг или в любом диапазоне, определенном из предшествующих доз (например, около, 0013 мг/кг до около, 0016 мг/кг или около, 001 мг/кг до около, 002 мг/кг).
[00139] В одном аспекте изобретения способ введения соединения формулы I может включать титрование соединения до предварительно определенного уровня. В одном варианте воплощения изобретения соединение используют на определенном уровне (например, 0,05 мг два раза в день, 0,1 мг два раза в день, 0,2 мг два раза в день, 0,4 мг два раза в день, 0,6 мг два раза в день, 0,8 мг два раза в день, 1 мг два раза в день, 2 мг два раза в день, 4 мг два раза в день, 8 мг два раза в день, 16 мг два раза в день, 32 мг два раза в день, 64 мг два раза в день). В одном варианте воплощения изобретения соединение используют на определенном уровне (например, около 0,05 мг два раза в день, около 0,1 мг два раза в день, около 0,2 мг два раза в день, около 0,4 мг два раза в день, около 0,6 мг два раза в день, около 0,8 мг два раза в день, около 1 мг два раза в день, около 2 мг два раза в день, около 4 мг два раза в день, около 8 мг два раза в день, около 16 мг два раза в день, 32 мг два раза в день, 64 мг два раза в день). В одном варианте воплощения изобретения соединение титруют до предварительно определенной дозы (например, титрование до 0,1 мг два раза в день, 0,2 мг два раза в день, 0,4 мг два раза в день, 0,6 мг два раза в день, 0,8 мг два раза в день, 1 мг два раза в день, 2 мг два раза в день, 4 мг два раза в день, 8 мг два раза в день, 16 мг два раза в день, 32 мг два раза в день, 64 мг два раза в день и так далее). В одном варианте воплощения изобретения соединение титруют до предварительно определенной дозы (например, титрование до около 0,1 мг два раза в день, около 0,2 мг два раза в день, около 0,4 мг два раза в день, около 0,6 мг два раза в день, около 0,8 мг два раза в день, около 1 мг два раза в день, около 2 мг два раза в день, около 4 мг два раза в день, около 8 мг два раза в день, около 16 мг два раза в день, около 32 мг два раза в день, около 64 мг два раза в день и так далее). В одном варианте воплощения изобретения соединение титруют до предварительно определенной дозы, такой как доза, описанная в настоящей заявке.
[00140] В одном варианте воплощения изобретения соединение формулы I можно использовать и/или вводить субъекту в расчете на желаемую концентрацию соединения в плазме. В одном варианте воплощения изобретения дозу соединения для введения субъекту определяют путем установления дозы, необходимой для получения концентрации в плазме соединения формулы I около 10 нг/мл у субъекта. В одном варианте воплощения изобретения дозу соединения для введения субъекту определяют путем установления дозы, необходимой для получения концентрации в плазме соединения формулы I около 1 нг/мл, около 2 нг/мл, около 3 нг/мл, около 4 нг/мл, около 5 нг/мл, около 6 нг/мл, около 7 нг/мл, около 8 нг/мл, около 9 нг/мл, около 10 нг/мл, около 12 нг/мл, около 14 нг/мл, около 16 нг/мл, около 18 нг/мл, около 20 нг/мл, около 25 нг/мл, около 30 нг/мл, около 35 нг/мл, около 40 нг/мл, около 45 нг/мл или около 50 нг/мл у субъекта.
[00141] Дозу можно вводить раз в неделю, в виде разовой суточной дозы, два раза в день, три раза в день, четыре раза в день, пять раз в день или более часто. В одном варианте воплощения изобретения частота введения может составлять от 1 до 5 раз в день. В другом варианте воплощения изобретения частота введения может составлять от 2 до 4 раз в день. В другом варианте воплощения изобретения частота введения может составлять по меньшей мере 3 раза в день. В другом варианте воплощения изобретения частота введения может составлять два раза в день. В другом варианте воплощения изобретения частота введения может составлять один раз в день. В другом варианте воплощения изобретения частота введения может составлять менее одного раза в день. В других вариантах воплощения изобретения частота введения может составлять один раз в 2 дня, или один раз в 3 дня, или один раз в 4 дня, или один раз в 5 дней, или один раз в 6 дней. В другом варианте воплощения изобретения частота введения может составлять один раз в неделю. В другом варианте воплощения изобретения частота введения может определяться по требованию, когда терапевтическое лечение является необходимым или желательным. Должно быть понятно, на основании раскрытия, содержащегося в настоящей заявке, как определить, нуждается или нет субъект в дополнительной дозе и/или в продолжении введения доз. Также должно быть понятно, что выбранная частота введения может потребовать регулирования дозы активного ингредиента. Также должно быть понятно, на основании раскрытия, содержащегося в настоящей заявке, что выбранная доза активного ингредиента может потребовать регулирования частоты введения. Раскрытие, содержащееся в настоящей заявке, в комбинации со знаниями и навыками в данной области, позволит опытному специалисту оптимизировать как дозу соединения формулы I, так и частоту введения соединения формулы I для лечения депрессии у субъекта, нуждающегося в этом.
[00142] Также опытному специалисту должно быть понятно, что, в дополнение к описанным выше вариантам воплощения доз и режимов введения, как дозы, так и режим введения следует рассматривать и регулировать, как это является необходимым, в свете физического и психического здоровья субъекта, которого лечат от депрессии, включая тяжесть депрессии у субъекта.
[00143] Для терапевтического введения в соответствии с настоящим изобретением соединение формулы I можно использовать в форме его свободного основания, но предпочтительно его используют в форме фармацевтически приемлемой соли, обычно гидрохлоридной соли.
[00144] В одном варианте воплощения изобретения альтернативные соли соединения формулы I с фармацевтически приемлемыми кислотами также можно использовать для терапевтического введения, например, соли, образованные из функционального свободного основания и кислоты, включая, но не ограничиваясь этим, пальмитиновую кислоту, бромистоводородную кислоту, фосфорную кислоту, уксусную кислоту, фумаровую кислоту, малеиновую кислоту, салициловую кислоту, лимонную кислоту, щавелевую кислоту, молочную кислоту, яблочную кислоту, метансульфоновую кислоту и п-толуолсульфоновую кислоту.
[00145] Все сольваты и все альтернативные физические формы соединения формулы I или его фармацевтически приемлемых производных, описанных в настоящей заявке, включая, но не ограничиваясь этим, альтернативные кристаллические формы, аморфные формы и полиморфы, также охватываются объемом настоящего изобретения, и все ссылки на соединение формулы I в настоящей заявке включают все фармацевтически приемлемые соли и все сольваты и альтернативные физические формы соединений.
[00146] Для терапевтического введения соединение формулы I или его фармацевтически приемлемую соль, например, соединение формулы II, можно вводить в чистой форме, но предпочтительно его составляют в любую подходящую фармацевтически приемлемую и эффективную композицию, которая обеспечивает эффективные уровни активного ингредиента в организме.
[00147] Термин "фармацевтически приемлемый", как он используется в настоящей заявке в отношении соединения или композиции, относится к форме соединения или композиции, которая может увеличивать или повышать растворимость или доступность соединения в организме субъекта, чтобы промотировать или повышать биодоступность соединения или композиции. В одном аспекте раскрытие, содержащееся в настоящей заявке, также охватывает фармацевтически приемлемые гидраты, сольваты, стереоизомеры или аморфные твердые вещества соединений и композиций, описанных в настоящей заявке. Например, термин "фармацевтически приемлемая соль" предназначен для описания солевой формы одной или нескольких композиций, представленных в настоящей заявке, для повышения растворимости соединения, например, в желудочных соках желудочно-кишечного тракта пациента для промотирования растворения и биодоступности соединений и/или композиций. В одном варианте воплощения фармацевтически приемлемые соли включают соли, образованные из фармацевтически приемлемых неорганических или органических оснований и кислот. Подходящие соли включают соли, образованные из щелочных металлов, таких как калий и натрий, щелочноземельных металлов, таких как кальций, магний, и соли аммония, среди многочисленных других кислот, хорошо известных в фармацевтике. Натриевые и калиевые соли являются особенно предпочтительными как нейтральные соли карбоновых кислот и содержащих свободный кислый фосфат композиций, охватываемых настоящим изобретением. Термин "соль" означает любую соль, совместимую с использованием соединений, охватываемых настоящим изобретением. В случае, когда соединения используют в фармацевтических показаниях, включая лечение депрессии, термин "соль" означает фармацевтически приемлемую соль, совместимую с использованием соединений в качестве фармацевтических средств.
[00148] Термин "фармацевтически приемлемое производное" или "производное", как он используется в настоящей заявке, описывает любую фармацевтически приемлемую форму пролекарства (такую как сложный эфир или простой эфир, или другая пролекарственная группа), которая, при введении пациенту, обеспечивает непосредственно или опосредованно соединение по настоящему изобретению или активный метаболит соединения по настоящему изобретению.
[00149] Как описано выше, композиции включают фармацевтически приемлемые соли соединений в композиции. В других вариантах воплощения кислоты, которые используют для получения фармацевтически приемлемых кислотно-аддитивных солей указанных выше соединений, представляют собой такие, которые образуют нетоксичные кислотно-аддитивные соли, т.е. соли, содержащие фармакологически приемлемые анионы, такие как гидрохлорид, гидробромид, гидройодид, нитрат, сульфат, бисульфат, фосфат, кислый фосфат, ацетат, лактат, цитрат, кислый цитрат, тартрат, битартрат, сукцинат, малеат, фумарат, глюконат, сахарат, бензоат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат [т.е. 1,1'-метилен-бис-(2-гидрокси-3-нафтоат)], среди прочих.
[00150] В одном варианте воплощения композиции включают основно-аддитивные соли соединений по настоящему изобретению. Химические основания, которые можно использовать в качестве реагентов для получения фармацевтически приемлемых основно-аддитивных солей соединений по настоящему изобретению, которые по своей природе являются кислотными, представляют собой такие, которые образуют нетоксичные основно-аддитивные соли с такими соединениями. Такие нетоксичные соли оснований включают, но не ограничиваются этим, соли, образованные из таких фармакологически приемлемых катионов, как катионы щелочных металлов (например, калия и натрия) и катионы щелочноземельных металлов (например, кальция и магния), соли присоединения аммония или водорастворимого амина, такие как N-метилглюкамин (меглумин), и низшие алканоламмониевые и другие основные соли фармацевтически приемлемых органических аминов, среди прочих.
[00151] Как используется в настоящей заявке, термин фармацевтически приемлемые соли или комплексы относится к солям или комплексам (например, сольватам, полиморфам), которые сохраняют желаемую биологическую активность исходного соединения и демонстрируют минимальные, если они вообще присутствуют, нежелательные токсикологические эффекты. Неограничивающие примеры таких солей включают (a) кислотно-аддитивные соли, образованные с неорганическими кислотами (например, хлористоводородной кислотой, бромистоводородной кислотой, серной кислотой, фосфорной кислотой, азотной кислотой и подобными), и соли, образованные с органическими кислотами, такими как уксусная кислота, щавелевая кислота, винная кислота, янтарная кислота, яблочная кислота, аскорбиновая кислота, бензойная кислота, дубильная кислота, памовая кислота, альгиновая кислота, полиглутаминовая кислота, нафталинсульфоновые кислоты, нафталиндисульфоновые кислоты и полигалактуроновая кислота; (b) основно-аддитивные соли, образованные с поливалентными катионами металлов, таких как цинк, кальций, висмут, барий, магний, алюминий, медь, кобальт, никель, кадмий, натрий, калий и подобные, или с органическим катионом, образованным из N,N-дибензилэтилендиамина, аммония или этилендиамина; или (c) комбинации (a) и (b); например, таннатная соль цинка или т.п.
[00152] Модификации соединения могут влиять на растворимость, биодоступность и скорость метаболизма активного вещества, таким образом, обеспечивая контроль доставки активного вещества. Кроме того, модификации могут влиять на активность соединения как антидепрессанта, в некоторых случаях повышая такую активность по сравнению с исходным соединением. Это можно легко оценить путем получения производного и испытания его антидепрессивного действия в соответствии со способами, описанными в настоящей заявке, или другими способами, известными специалистам в данной области.
[00153] В одном варианте воплощения композиции могут быть составлены традиционным способом с использованием одного или нескольких фармацевтически приемлемых носителей, и их также можно вводить в виде композиций с контролируемым высвобождением. Фармацевтически приемлемые носители, которые можно использовать в этих фармацевтических композициях, включают, но не ограничиваются этим, ионообменные смолы, оксид алюминия, стеарат алюминия, лецитин, сывороточные белки, такие как человеческий сывороточный альбумин, буферные вещества, такие как фосфаты, глицин, сорбиновую кислоту, сорбат калия, смеси неполных глицеридов насыщенных растительных жирных кислот, воду, соли или электролиты, такие как проламинсульфат, динатрий гидрофосфат, гидрофосфат калия, хлорид натрия, соли цинка, коллоидный диоксид кремния, трисиликат магния, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, карбоксиметилцеллюлозу натрия, полиакрилаты, воски, полиэтилен-полиоксипропиленовые блок-полимеры, полиэтиленгликоль и ланолин.
[00154] Композиции, описанные в настоящей заявке, можно вводить перорально. В других вариантах воплощения композиции можно вводить парентерально, с использованием спрея для ингаляции, местным путем, ректально, назально, буккально, вагинально или через имплантированный резервуар. Термин "парентеральный", как он используется в настоящей заявке, включает подкожную, чрескожную, внутривенную, внутримышечную, интраартикулярную, интрасиновиальную, интрастернальную, интратекальную, интрагепатическую, внутриочаговую и интракраниальную инъекцию или инфузию. Как должно быть понятно опытному специалисту, в свете вариантов воплощения, описанных в настоящей заявке, дозу активного ингредиента или ингредиентов (например, соединения формулы I) можно регулировать в сторону увеличения или уменьшения в зависимости от выбранного пути введения. Кроме того, должно быть понятно, что оптимизация дозы активного ингредиента для любой выбранной лекарственной формы может быть желательной, и это можно осуществить с использованием способов, описанных в настоящей заявке или известных из уровня техники, для оценки эффективности соединения-антидепрессанта.
[00155] Фармацевтические композиции, воплощенные в настоящем изобретении, можно вводить перорально в любой перорально приемлемой лекарственной форме, включая, но не ограничиваясь этим, капсулы, таблетки, водные суспензии или растворы. В случае таблеток для перорального использования, носители, которые обычно используют, включают лактозу и кукурузный крахмал. В одном варианте воплощения также добавляют смазывающие вещества, такие как стеарат магния. Для перорального введения в форме капсул полезные разбавители включают лактозу и/или высушенный кукурузный крахмал, в качестве двух неограничивающих примеров. Когда водные суспензии необходимы для перорального применения, активный ингредиент объединяют с эмульгаторами и суспендирующими веществами. Если желательно, также можно добавить некоторые подсластители, отдушки или красители.
[00156] Фармацевтические композиции, охватываемые настоящим изобретением, также можно вводить при помощи назального аэрозоля или путем ингаляции. Такие композиции получают в соответствии со способами, хорошо известными в области фармацевтического формулирования, и их можно получить в виде растворов в физиологическом растворе с использованием бензилового спирта или других подходящих консервантов, промоторов абсорбции для повышения биодоступности, фторуглеродов и/или других традиционных солюбилизирующих или диспергирующих веществ.
[00157] В одном варианте воплощения соединение формулы I или его фармацевтически приемлемую соль вводят независимо от любого другого лечения.
Совместное введение соединений
[00158] В другом варианте воплощения соединение формулы I или его фармацевтически приемлемую соль вводят вместе с одним или несколькими другими лекарственными средствами. Такие другие лекарственные средства можно вводить или совместно вводить в формах и дозах, как это известно в данной области, или альтернативно, как описано выше для введения соединений формулы I.
[00159] Термин "совместное введение" или "комбинированная терапия" используется для описания терапии, в которой по меньшей мере два соединения используют для лечения депрессии или другого заболевания или состояния, описанного в настоящей заявке, одновременно. В одном варианте воплощения по меньшей мере два соединения в эффективных количествах используют для лечения депрессии или другого заболевания или состояния, описанного в настоящей заявке, одновременно. В другом варианте воплощения по меньшей мере два соединения, комбинация которых включает эффективное количество, используют для лечения депрессии или другого заболевания или состояния, описанного в настоящей заявке, одновременно. В одном варианте воплощения изобретения результат лечения по меньшей мере двумя соединениями может быть аддитивным, когда результаты лечения, полученные с использованием каждого соединения отдельно, дополняют друг друга, либо непосредственно аддитивным, либо аддитивным до степени, меньшей, чем результаты, полученные с использованием этих двух соединений по отдельности. В одном варианте воплощения изобретения результат лечения по меньшей мере двумя соединениями может быть синергическим, до разной степени. В одном варианте воплощения результат лечения по меньшей мере двумя соединениями может быть меньше, чем результаты лечения, достигаемые с использованием каждого соединения отдельно. В одном аспекте результат лечения композицией, описанной в настоящей заявке, является таким, что для одного соединения результат лечения меньше, чем достигаемый с этим соединением отдельно, тогда как результаты лечения в отношении других соединений в композиции приблизительно такие же, как результаты лечения, достигаемые отдельно. В одном аспекте изобретения результат лечения для по меньшей мере двух соединений меньше, чем достигаемый с этими соединениями по отдельности, тогда как другие соединения в композиции дают приблизительно такие же результаты, как результаты лечения, достигаемые отдельно. В одном аспекте результат лечения для всех соединений в композиции меньше, чем результат, достигаемый с этими соединениями отдельно.
[00160] Хотя термин совместное введение охватывает введение двух активных соединений пациенту одновременно, необязательно, чтобы соединения вводили пациенту одновременно, хотя эффективные количества индивидуальных соединений будут присутствовать в организме пациента одновременно.
[00161] Соединение формулы I, например, соединение, представленное формулой II, или фармацевтически приемлемую соль любого такого соединения предпочтительно можно вводить в комбинации с по меньшей мере одним другим терапевтическим средством для обеспечения лучшего лечения любого сочетания любых симптомов депрессии и/или лечения депрессии как таковой. Комбинации, применения и способы лечения по настоящему изобретению также могут обеспечивать преимущества в лечении пациентов, у которых отсутствует адекватный ответ, или которые являются резистентными к другим известным лечениям. В одном варианте воплощения по меньшей мере одно другое терапевтическое средство не является соединением формулы I. В одном варианте воплощения изобретения по меньшей мере одно другое терапевтическое средство представляет собой соединение формулы I и является отличным от другого соединения формулы I, включенного в композицию. В одном варианте воплощения соединение формулы II совместно вводят с по меньшей мере одним другим соединением формулы I, где по меньшей мере одно другое соединение формулы I не является соединением формулы II. В одном варианте воплощения изобретения соединение формулы II совместно вводят с по меньшей мере одним другим соединением, где по меньшей мере одно другое соединение не является соединением формулы I.
[00162] В одном варианте воплощения соединение формулы I можно вводить пациенту, уже принимающему лечение по меньшей мере одним антидепрессантом, для обеспечения лучшего лечения любого сочетания негативных симптомов депрессии или лечения депрессии как таковой.
[00163] В одном варианте воплощения соединение, описанное в настоящей заявке, можно совместно вводить с одним или несколькими атипичными антипсихотическими средствами. Примеры атипичных антипсихотических средств включают, но не ограничиваются этим, флуфеназин, рисперидон, оланзапин, клозапин, кветиапин, зипразидон, арипипразол, серитиндол, зотепин и пероспирон. Примеры антидепрессантов, полезных в комбинированной терапии, описанной в настоящей заявке, включают, но не ограничиваются этим, флуоксетин, циталопрам, эсциталопрам, венлафаксин, дулоксетин, бупропион.
[00164] В одном варианте воплощения соединение, описанное в настоящей заявке, можно совместно вводить с одним или несколькими анксиолитиками. В одном варианте воплощения соединение, описанное в настоящей заявке, совместно вводят с пропранололом. В одном аспекте совместно вводимое соединение может усиливать начальную активность соединения, описанного в настоящей заявке. В одном варианте воплощения бета-блокатор совместно вводят с соединением, описанным в настоящей заявке, для усиления начальной активности соединения, описанного в настоящей заявке.
[00165] Способы и дозы, описанные в настоящей заявке, соответствуют способам применения и дозам соединений формулы I и формулы II, которые описаны в настоящей заявке.
ПРИМЕРЫ
[00166] Варианты воплощения, описанные в настоящей заявке, далее будут описаны со ссылкой на следующие примеры. Эти примеры представлены только для иллюстративных целей, и раскрытие, содержащееся в настоящей заявке, никоим образом нельзя рассматривать как ограничивающееся этими примерами, но его следует рассматривать как охватывающее любой и все варианты, которые будут очевидными как результат указаний, содержащихся в настоящей заявке.
Пример 1: Эффект SON-117 на параметры сна у здоровых добровольцев
[00167] В этом исследовании отслеживали и измеряли некоторые фармакодинамические параметры сна, предсказывающие активность антидепрессанта. Сравнительное средство, используемое для положительного контроля (эсциталопрам, Celexa), действовало, как и ожидали. Были испытаны три дозы SON-117 (1 мг, 3 мг, 7,5 мг). Каждая доза демонстрировала фармакодинамический профиль, отличный от эсциталопрама и плацебо. Кроме того, самая низкая доза SON-117 (1 мг) продемонстрировала профиль, отличный от двух более высоких доз SON-117. В одном варианте воплощения SON-117 оказывал влияние на сон. В одном варианте воплощения SON-117 оказывал влияние на REM сон.
[00168] Не желая привязывать это к какой-либо конкретной теории, один возможный способ действия (из других возможных способов действия) может состоять в том, что более высокие дозы SON-117 контактируют и/или воздействуют на рецепторы, на которые не оказывают модулирующего действия низкие дозы SON-117.
Пример 2: Полисомнография
[00169] Сорок четыре (44) субъекта принимали участие в испытании для исследования сна, где 23 субъектам вводили SON-117 в количестве от 1 мг до 7,5 мг; 12 субъектам вводили плацебо; и 8 субъектам вводили эсциталопрам в дозе 20 мг. Сон регистрировали в индивидуальных с пониженной звукопроницаемостью и уютно меблированных спальнях. Во время ночного сна субъекты находились в лежачем положении, и свет был выключен. Полисомнографический монтаж состоял из 4 EEG каналов (С3А2, O1A2, С4А1 и O2A1), билатеральных электро-окулограмм и 2 субментальных электромиограмм. Различные параметры сна определяли с использованием программы Hypnos на основании визуальной оценки записей при 3 0-сек циклах в соответствии с правилом Rechtschaffen и Kales (1968). Параметры продолжительности сна включают переменные как начала сна, так и поддержания сна. Параметры архитектуры сна, которые включают параметры REM сна, включают переменные распределения стадий, документирующие продолжительность и пропорцию разных стадий сна, и переменные профиля сна, которые обеспечивают картину продолжительности разных стадий сна на протяжении периода регистрации. Весь спектральный анализ EEG ночного сна осуществляли на С3-А2 отведении при помощи алгоритма быстрого преобразования Фурье. Продолжительность цикла была 2 секунды при частоте выборки 256 Гц, и ошибку округления уменьшали с применением окна Хенинга. Визуальные оценки сна каждого 30-сек цикла синхронизировали со значениями плотности мощности, чтобы можно было осуществить анализ плотности мощности в определенный период времени, такой как REM и не-REM сон.
[00170] В этом исследовании не был обнаружен эффект SON-117 на EEG параметры сна, который мог быть сопоставимым с эффектом, вызываемым эсциталопрамом. Три дозы, испытываемые в настоящем исследовании, не оказывали существенного влияния на параметры продолжительности сна и архитектуры сна. Однако были показания, что это лекарственное средство может обладать REM сон-промотирующим эффектом, а также эффектами на REM плотность/активность, при повторном введении и при использовании двух самых высоких доз, в частности (7,5 мг). Кроме того, самая низкая доза (1 мг) могла увеличивать медленный сон (SWS) в день 1 и в день 14 во второй трети ночного периода. Эти результаты относительно SWS подтверждаются тем фактом, что Leeds Sleep Evaluation Questionnaire (LSEQ) оценивал способность засыпать, которая была легче с 1 мг SON-117, и что LSEQ определял качество сна как улучшенное. Эти субъективные эффекты на сон наблюдали после разового введения 1 мг SON-117, и они были стабильными до последней наблюдаемой точки времени, т.е. в день 16 после прекращения введения. Не было никаких подтверждений влияния прекращения введения на EEG параметры сна, в том числе на REM сон.
Пример 3: Измерение нейротрансмиттеров у крыс, обрабатываемых SON-117
[00171] Целью этого исследования была оценка, с использованием микродиализа, эффектов интраперитонеального (I.P.) введения крысам трех разных доз SON-117 на уровни допамина и его метаболитов, серотонина и его метаболита (5-HIAA), и норэпинефрина в префронтальной коре головного мозга.
[00172] Тридцать два взрослых самца крыс Wistar использовали в течение всего периода исследования (4 группы по восемь животных, запланированные для испытания, таблица 1).


[00173] Экспериментальные процедуры осуществляли в соответствии с европейскими руководящими указаниями по содержанию и использованию лабораторных животных (Council Directive 86/609/ЕЕС). Были предприняты все усилия, чтобы минимизировать страдания животных и уменьшить количество животных, используемых в экспериментах. Акклиматизация животных продолжалась по меньшей мере 5 дней. При приеме животных для эксперимента их коллективно помещали в клетки. Пищу и воду обеспечивали в виде поддерживающей диеты для животных (RM1, SDS Dietex) и распределяли ежедневно в раздаточных устройствах для пищи и воды.
[00174] Хирургическую операцию осуществляли на крысах, имеющих массу тела около 300 г в начале экспериментов. Крыс анестезировали кетамином (50 мг/кг) & ксилазином (15 мг/кг) путем внутримышечного введения. Животных помещали в стереотаксический аппарат в плоском положении черепа при постоянной установке -3,3 мм между ушными стержнями и резцовым стержнем. Животных обрабатывали местным анестетиком (ксилокаин 1%, Astra Zeneca) и анальгетиком (Temgesic, от компании Schering Plough, 0,05 мг/кг, подкожно). Рострокаудальный срединный разрез делали при помощи ланцета для обнажения дорсальной поверхности черепа. "Стереотаксический ноль" определяли по брегме в соответствии с Paxinos and Watson's atlas (1986). Делали отверстие в черепе при помощи дрели и мягкие мозговые оболочки прокалывали стерильной иглой для имплантации СМА12 направляющей канюли, в которую затем вставляли диализный зонд.
[00175] Координаты, используемые для имплантации направляющей канюли в префронтальной коре головного мозга от брегмы, были следующими: переднезаднее 3,7 мм, медиолатеральное 0,8 мм и дорсовентральное -2 мм (положение верха зонда -5 мм). Направляющую канюлю прикрепляли к черепу двумя винтами из нержавеющей стали (внешний диаметр 1,88 мм), которые были закреплены. Добавляли нанесение зубного цемента. Пластиковый воротник позволял каждому животному быть привязанным к поворотному устройству СМА 120 системы для бодрствующих животных. После хирургической операции крыс содержали в индивидуальных клетках и давали выздороветь в течение минимум 3-5 дней до начала эксперимента. Крыс приручали и помещали в пластиковый резервуар на 10 минут по меньшей мере каждый день, чтобы животные привыкли к их новому окружению для диализа. Интраперитонеальное введение физиологического раствора также осуществляли каждый день.
[00176] Диализные зонды (СМА12/3 мм, мембрана, 20 кДа отсечка, Carnegie Medicine, Stockholm, Sweden) осторожно промывали перед тем, как их вставляли в направляющую канюлю. Промывку осуществляли с использованием включающей искусственную цереброспинальную жидкость (aCSF) среды (NaCl 147 мМ, KCl 2,7 мМ, CaCl2 1,2 мМ, MgCl2 0,85 мМ) при комнатной температуре. Систему диализа затем уравновешивали при 20°С при скорости перфузии 1 мкл/мин с использованием насоса Carnegie (СМА100). Все катетеры (FEP трубки, внутренний объем 1,2 мкл/10 см, и держатели трубок), используемые для микродиализа, обрабатывали в таких же условиях.
[00177] Поток через диализный зонд с использованием aCSF раствора поддерживали при постоянной скорости 1 мкл/мин в течение всего эксперимента. Диализный зонд, через который пропускали aCSF, помещали в сосуд, содержащий раствор соединения при 10-4 М для допамина, DOPAC, 5-HIAA, норэпинефрина и серотонина и при 10-3 М для HVA. Диализат собирали из трех разных зондов в течение 30 минут для расчета среднего значения in vitro восстановления для всех испытываемых нейротрансмиттеров. Собранные фракции (30 мкл) сразу переносили в сухой лед и хранили замороженными (-80°С) до использования. Процент in vitro восстановления представляет собой отношение между концентрацией нейротрансмиттера, извлеченного из зонда, и концентрацией в маточном растворе.
[00178] Зонды, подготовленные должным образом, вставляли в направляющую канюлю и СМА120 поворотное устройство прикрепляли к животному с использованием пластикового воротника. Поток через диализный зонд с использованием aCSF поддерживали при скорости 1 мкл/мин в течение всего эксперимента. Первые четыре фракции (соответствующие 2 часам) отбрасывали, чтобы избежать эффектов паренхимных помех и убедиться, что достигнут уровень, близкий к устойчивому состоянию. Фракции затем собирали в течение периода 8,5 часов, в течение которых животные оставались спокойными. Диализаты автоматически собирали с использованием автоматического пробоотборника (коллектор микрофракций СМА 140; Carnegie Medicin) и хранили при -80° до использования в анализе. Более подробно, после 1,5 часов в базальных условиях (три базальных диализата Т-1ч30-Т-1ч, Т-1ч-Т-30мин, Т-30мин-Т0) животным вводили интраперитонеально SON-117 или циталопрам. Перфузию затем поддерживали в течение 7 часов с использованием aCSF. Диализаты (30 мкл) собирали в 300-мкл флаконы, переносили в сухой лед и затем хранили замороженными (-80°С) до использования в анализе. Замороженные образцы отправляли партнеру для анализа. В конце испытания методом микродиализа PBS с цветными чернилами пропускали через зонд для визуализации диализированной области.
[00179] Данные испытания методом микродиализа представляют убедительное доказательство того, что SON-117 индуцирует внеклеточное высвобождение катехоламинов, в частности, 5-НТ и DA, что согласуется с классическим механизмом действия, предполагаемым для широко используемых моноаминергических антидепрессантов. Однако такую модуляцию нейротрансмиттеров в микродиализном испытании наблюдали при дозах, которые намного выше, чем дозы, которые оказались эффективными в CMS модели. Например, быстро начинающуюся нормализацию поглощения сахарозы в CMS модели наблюдали при таких низких дозах, как 0,001 мг/кг, тогда как микродиализное испытание показало только незначительное нарушение высвобождения нейротрансмиттера при 0,3 мг/кг. Это обнаружение было неожиданным и подтверждает МоА для SON-117 для лечения аффективных расстройств, который является отличным от других моноаминергических антидепрессантов, для которых благоприятный эффект на настроение находится в том же диапазоне доз, как и для индуцирующих внеклеточное высвобождение катехоламинов, в том, что он не зависит только от высвобождения катехоламина и ингибирования повторного поглощения.
[00180] Анализ катехоламина: Концентрации допамина, DOPAC, HVA, 5-HIAA, 5-НТ и норэпинефрина определяли для каждого образца при помощи ВЭЖХ в сочетании с электрохимической детекцией. Система состояла из насоса (LC-10 AD; Shimadzu), охлаждаемого автоматического инжектора (Famos; Dionex), Hypersil RP 18 колонки с обращенной фазой (Aquasil, 150×1 мм, 3 мкм; ThermoHypersil) и электрохимического детектора (Decade, Antec), снабженного амперометрическим датчиком (VT-03, Antec). Хроматограммы собирали и обрабатывали с использованием интегратора (CLAS VP, Shimadzu). Подвижная фаза состояла из натрийфосфатного буфера (50 мМ NaH2PO4), 1-октансульфоновой кислоты (1,7 мМ), Na2EDTA (200 мкМ) с 5% ацетонитрила при pH 3 для DA метаболитов, и pH 4 для допамина и серотонина. Подвижная фаза доставлялась насосом при скорости потока 60 мкл/мин-1. Окислительный потенциал гальванического элемента был +650 мВ. Вводили объем 6 мкл, и время испытания для каждого определения составляло 35 минут.
[00181] 5-HIAA уровни также измеряли. Дополнительный статистический анализ осуществляли для каждой экспериментальной группы и для каждого нейротрансмиттера или метаболитов, испытываемых с использованием одностороннего анализа ANOVA с повторными измерениями.
[00182] Следующее представление результатов состоит из трех разделов. Таблица 2 представляет результаты, полученные в испытаниях восстановления. Таблицы и фиг. 4-27 подробно описывают, для каждой группы обработки, индивидуальные и средние уровни каждого нейротрансмиттера или их метаболитов, измеренные в образцах диализатов до и после интраперитонеального введения соответствующей обработки. Наконец, фиг. 28-33 графически представляют кортикальные уровни каждого нейротрансмиттера или метаболитов в разных экспериментальных группах от Т0 до Т7ч.


[00183] Образцы, собранные в процессе испытания in vitro восстановления (таблица 1), анализировали на концентрацию допамина, HVA, DOPAC, норэпинефрина, 5-HIAA и 5-НТ (измерения во вводимых растворах и в диализатах). В таблице 2 показано, что 3 независимых анализа для каждого нейротрансмиттера или метаболита являются воспроизводимыми, и можно рассчитать среднее значение in vitro восстановления для каждого нейротрансмиттера или метаболита.
[00184] Результаты выражали в виде среднего значения ±SEM из значений, полученных для 8 животных каждой экспериментальной группы, и выражали в виде процента от соответствующего среднего базального значения для допамина и метаболитов (DOPAC, HVA), норэпинефрина (NE), 5-HIAA и серотонина. 5-HIAA, являющийся метаболитом 5-НТ, анализировали в таком же ВЭЖХ эксперименте и добавляли к результатам.
[00185] Таблицы 3, 4, 5, 6, 7 и 8 представляют концентрации норэпинефрина, DOPAC, допамина, 5-HIAA, HVA и 5-НТ в диализатах (в % от соответствующего базального значения) в группе, которую обрабатывали циталопрамом, 10 мг/кг интраперитонеально.









[00186] Интраперитонеальное введение циталопрама индуцировало значимое и стабильное небольшое снижение NE концентрации (72%) в префронтальной коре головного мозга от 0,5 ч до 7 ч после введения. Для DOPAC, никакой статистически значимой разницы не наблюдали после введения циталопрама (10 мг/кг). Интраперитонеальное введение циталопрама (10 мг/кг) имело тенденцию индуцировать повышение уровней допамина от Т1,5 ч и 2,5 ч (255%). Это повышение не было значимым. Интраперитонеальное введение циталопрама (10 мг/кг) индуцировало значимое небольшое повышение 5-HIAA концентрации в префронтальной коре головного мозга при 0,5 ч и 1 ч (113%) после его введения с последующим существенным и стабильным снижением от 2 ч до 7 ч после его введения. Для HVA никакой статистически значимой разницы не было обнаружено после введения циталопрама (10 мг/кг). Интраперитонеальное введение циталопрама (10 мг/кг) индуцировало существенное повышение 5-НТ концентраций (219%) в префронтальной коре головного мозга от 1 ч до 2 ч с последующим значимым небольшим снижением 5-НТ уровней от 6 ч до 7 ч после его введения.
[00187] Таблицы 9, 10, 11, 12, 13 и 14 представляют концентрации норэпинефрина, DOPAC, допамина, 5-HIAA, HVA и 5-НТ в диализатах (в % от их соответствующего базального значения) в группе обработки SON-117 0,1 мг/кг, интраперитонеально. Для NE никакой статистически значимой разницы не было обнаружено между средним значением до введения и уровнями после введения SON-117 (0,1 мг/кг). Интраперитонеальное введение SON-117 (0,1 мг/кг) имело тенденцию индуцировать небольшое повышение DOPAC уровней от 1,5 ч до 2,5 ч и от 4,5 ч до 7 ч. Это повышение не было статистически значимым. Интраперитонеальное введение SON-117 (0,1 мг/кг) имело тенденцию индуцировать повышение уровней допамина (287%) от Т1,5 ч до 2,5 ч и от 4,5 ч до 7 ч (353%). Это повышение не было статистически значимым. Для 5-HIAA никакой статистически значимой разницы не было обнаружено между средним значением до введения и уровнями в диализатах после интраперитонеального введения SON-117 (0,1 мг/кг). Для HVA никакой статистически значимой разницы не было обнаружено между средним значением до введения и уровнями в диализатах после интраперитонеального введения SON-117 (0,1 мг/кг). Интраперитонеальное введение SON-117 (0,1 мг/кг) имело тенденцию индуцировать повышение уровней серотонина в точке времени 2,5 ч (368%) и от 4,5 ч до 7 ч (350%). Это повышение не было статистически значимым.







[00188] Таблицы 15, 16, 17, 18, 19 и 20 представляют концентрации норэпинефрина, DOPAC, допамина, 5-HIAA, HVA и 5-НТ в диализатах (в % от соответствующего базального значения) в группе обработки SON-117 0,3 мг/кг, интраперитонеально. Интраперитонеальное введение SON-117 (0,3 мг/кг) индуцировало значимое небольшое повышение NE концентраций в префронтальной коре головного мозга в точке времени 3,5 ч (117%) и от 4,5 ч до 7 ч (128%) после его введения. Для DOPAC никакой статистически значимой разницы не было обнаружено между средним значением до введения и уровнями в диализатах после интраперитонеального введения SON-117 (0,3 мг/кг). Интраперитонеальное введение SON-117 (0,3 мг/кг) имело тенденцию индуцировать повышение уровней допамина от 5,5 ч до 7 ч (298%). Это повышение не было статистически значимым. Интраперитонеальное введение SON-117 (0,3 мг/кг) индуцировало значимое и стабильное небольшое снижение 5-HIAA концентраций в префронтальной коре головного мозга в точке времени 3,5 ч и от 4,5 ч до 7 ч после его введения. Для HVA никакой статистически значимой разницы не было обнаружено между средним значением до введения и уровнями в диализатах после интраперитонеального введения SON-117 (0,3 мг/кг). Для 5-НТ никакой статистически значимой разницы не было обнаружено между средним значением до введения и уровнями в диализатах после интраперитонеального введения SON-117 (0,3 мг/кг).






[00189] Таблицы 21, 22, 23, 24, 25 и 26 представляют концентрации норэпинефрина, DOPAC, допамина, 5-HIAA, HVA и 5-НТ в диализатах (в % от соответствующего базального значения) в группе обработки SON-117, 3 мг/кг интраперитонеально. Для NE никакой статистически значимой разницы не было обнаружено между средним значением до введения и уровнями в диализатах после интраперитонеального введения SON-117 (3 мг/кг). Для DOPAC никакой статистически значимой разницы не было обнаружено между средним значением до введения и уровнями в диализатах после интраперитонеального введения SON-117 (3 мг/кг). Интраперитонеальное введение SON-117 (3 мг/кг) имело тенденцию индуцировать небольшое повышение уровней допамина в точке времени 1,5 ч (169%) и от 6 ч до 7 ч (макс. 167%). Это повышение не было статистически значимым. Интраперитонеальное введение SON-117 (3 мг/кг) индуцировало существенное и стабильное снижение концентрации 5-HIAA в префронтальной коре головного мозга от 2 ч до 7 ч (макс. 72%) после его введения. Интраперитонеальное введение SON-117 (3 мг/кг) индуцировало значимое небольшое повышение HVA концентрации в префронтальной коре головного мозга в точке времени 3,5 ч (114%) после его введения. Интраперитонеальное введение SON-117 (3 мг/кг) индуцировало существенное повышение 5-НТ концентраций в префронтальной коре головного мозга от 2 ч до 3 ч (макс. 175%) и от 5,5 ч до 7 ч (272%) после его введения.






[00190] Осуществляли общий анализ для сравнения эффекта SON-117, вводимого интраперитонеально при трех концентрациях (0,1, 0,3 и 1 мг/кг), на высвобождение катехоламинов в префронтальной коре головного мозга крысы против введения циталопрама интраперитонеально при 10 мг/кг.
[00191] Для NE общий двусторонний анализ ANOVA выявил, что: (1) есть существенная разница между группой обработки циталопрамом и SON-117 при 0,1 мг/кг на время выборки 4,5 ч и 7 ч. В точке времени 4,5 ч и 7 ч после введения соединения уровни NE были более высокими в SON-117 (0,1 мг/кг) группе по сравнению с группой обработки циталопрамом; (2) есть существенная разница между группой обработки циталопрамом и SON-117 при 0,3 мг/кг на время выборки 3,5 ч, 4 ч, 4,5 ч, 5 ч, 5,5 ч, 6 ч и 7 ч. В этих временных точках взятия проб после введения соединения уровни NE были более высокими в SON-117 (0,3 мг/кг) группе по сравнению с группой обработки циталопрамом; и (3) есть существенная разница между группой обработки циталопрамом и SON-117 при 3 мг/кг на время выборки 1,5 ч и 3,5 ч. В этих двух временных точках взятия проб после введения соединения уровни NE были более высокими в SON-117 (3 мг/кг) группе по сравнению с группой обработки циталопрамом.
[00192] Для DOPAC общий двусторонний анализ ANOVA выявил, что нет никакой существенной разницы между группой обработки циталопрамом и SON-117 при трех испытываемых дозах в функции времени. Однако наблюдали тенденцию повышенного высвобождения DOPAC с SON-117 0,1 мг/кг в точке времени 2 ч и от 4,5 ч до 7 ч.
[00193] Для допамина общий двусторонний анализ ANOVA выявил, что нет никакой существенной разницы между группой обработки циталопрамом и SON-117 при трех испытываемых дозах в функции времени. Однако наблюдали тенденцию повышенного высвобождения при двух дозах SON-117 (0,1 и 0,3 мг/кг) от 5,5 ч.
[00194] Для 5-HIAA общий двусторонний анализ ANOVA выявил, что: (1) есть существенная разница между группой обработки циталопрамом и SON-117 при 0,1 мг/кг на время выборки 0,5 ч, 4,5, 5 ч и 6,5 ч. В точке времени 0,5 ч после введения соединения уровни 5-HIAA были ниже в SON-117 группе (0,1 мг/кг) по сравнению с группой обработки циталопрамом. Наоборот, в точке времени 4,5 ч, 5 ч, 6,5 ч после введения соединения уровни 5-HIAA были более высокими в SON-117 группе (0,1 мг/кг) по сравнению с группой обработки циталопрамом; (2) нет никакой существенной разницы между группой обработки циталопрамом и SON-117 при 0,3 мг/кг в функции времени; и (3) есть существенная разница между группой обработки циталопрамом и SON-117 при 3 мг/кг на время выборки 3 ч и 3,5 ч. В этих двух точках времени после введения соединения уровни 5-HIAA были более высокими в SON-117 группе (3 мг/кг) по сравнению с группой обработки циталопрамом.
[00195] Для HVA общий двусторонний анализ ANOVA выявил, что нет никакой существенной разницы между группой обработки циталопрамом и SON-117 при трех испытываемых дозах в функции времени.
[00196] Для 5-НТ общий двусторонний анализ ANOVA выявил, что: (1) есть существенная разница между группой обработки циталопрамом и SON-117 при 0,1 мг/кг на время выборки 2,5 ч и 4,5 и 5,5 ч. Тенденцию непрерывного повышенного высвобождения допамина наблюдали от 4,5 ч до 7 ч. В этих временных точках взятия проб после введения соединения уровни 5-НТ были более высокими в SON-117 группе (0,1 мг/кг) по сравнению с группой обработки циталопрамом. Максимальное повышение, наблюдаемое с SON-117 0,1 мг/кг в точке времени 2,5 ч, составило 369% по сравнению с максимальным повышением 218% с циталопрамом в точке времени 1 ч. От 4,5 ч до 7 ч повышенное высвобождение 5-НТ сохранялось на уровне между 34 9% и 24 9%; (2) есть существенная разница между группой обработки циталопрамом и SON-117 при 0,3 мг/кг на время выборки 1 ч. Уровни 5-НТ были несколько ниже в SON-117 группе по сравнению с группой обработки циталопрамом; и (3) есть существенная разница между группой обработки циталопрамом и SON-117 при 3 мг/кг на время выборки 1 ч и 5 ч и 7 ч. В точке времени 1 ч после введения соединения уровни 5-НТ были несколько ниже в SON-117 группе (3 мг/кг) по сравнению с группой обработки циталопрамом. Наоборот, в точке времени 5 ч и 7 ч после введения соединения уровни 5-НТ были более высокими в SON-117 группе (3 мг/кг) по сравнению с группой обработки циталопрамом. Тенденцию непрерывного повышенного высвобождения допамина наблюдали от 5 ч. Максимальное повышение, наблюдаемое в точке времени 5 ч, составило 272% (выше, чем максимальное повышение 218%, наблюдаемое с циталопрамом). Повышение 183% сохранялось в точке времени 7 ч после введения SON-117.
[00197] Целью эксперимента была, частично, оценка варьирования NE, допамина и его метаболитов (DOPAC и HVA) и серотонина и его метаболита 5-HIAA в префронтальной коре головного мозга крыс после интраперитонеального введения SON-117 при трех дозах (0,1, 0,3 и 3 мг/кг). Частично, целью этого проекта также было сравнение этих варьирований, индуцированных SON-117, с эффектами сравнительного соединения, циталопрама.
[00198] Настоящее исследование показало, что введение циталопрама (10 мг/кг; интраперитонеально) сначала могло индуцировать повышение 5-НТ уровней в префронтальной коре головного мозга между 1 и 2 ч и снижение 5-НТ уровней между 6 и 7 ч после его введения. Эти изменения уровней 5-НТ были связаны с теми 5-HIAA, где наблюдали первое временное повышение 5-HIAA уровней с последующим снижением концентрации этого метаболита. Что касается допамина, то введение циталопрама не влияло на уровни нейротрансмиттера и его метаболитов DOPAC, HVA в префронтальной коре головного мозга крысы. Для допамина гетерогенность ответа между животными группы обработки циталопрамом может объяснить, почему повышение уровней допамина, наблюдаемое после введения циталопрама, не было статистически значимым. Наконец, циталопрам (10 мг/кг интраперитонеально) индуцировал значимое и стабильное небольшое снижение уровней NE, измеренных после его интраперитонеального введения.
[00199] SON-117 при трех испытываемых дозах индуцировал повышенное высвобождение NE в разных временных точках взятия проб. Повышение было более заметным, начиная с 3,5 ч после введения. Однако повышение оставалось умеренным при максимуме 129% 7 ч после введения. Для допамина тенденция повышенного высвобождения появлялась при 0,1 и 0,3 мг/кг в поздние точки времени после введения (от 5 ч при 0,1 мг/кг до от 5,5 ч при 0,3 мг/кг). При двух дозах 0,1 и 3 мг/кг SON-117 существенно повышал высвобождение 5-НТ. Интересно то, что повышения были выше, чем наблюдаемые с циталопрамом (369% против 218% для наблюдаемого максимума). Более того, повышения, наблюдаемые с SON-117, сохранялись от 4,5 ч до 7 ч. Что касается метаболитов допамина (DOPAC и HVA) и метаболита 5-НТ (5-HIAA), эффекты были менее выраженными. Тем не менее, было отмечено, что эффекты SON-117 при 0,1 мг/кг на высвобождение DOPAC были очень близки тем, которые наблюдали с допамином (повышение в точке времени 2 ч и от 4 ч до 7 ч), и уровни 5-HIAA также были модифицированы в поздние точки времени после введения SON-117 0,1 мг/кг.
[00200] Это исследование является первым исследованием для изучения эффектов SON-117 после интраперитонеального введения на высвобождение допамина, 5-НТ, норэпинефрина и метаболитов DOPAC, HVA и 5-HIAA. Были охвачены большие временные рамки, от Т0 до 7 ч после введения, и были показаны удивительные эффекты SON-117 преимущественно на допамин и 5-НТ, эти эффекты выше, чем наблюдаемые с циталопрамом. Более того, эффекты SON-117 оказались продолжительными по времени, что предполагает роль активности SON-117 в течение более продолжительного периода времени, чем 7 ч после введения.
Пример 4: Модель хронического стресса у крыс с использованием SON-117
[00201] Самцов крыс Wistar (Charles River, Germany) доставляли в лабораторию за один месяц до начала эксперимента. Помимо того, что описано ниже, животных размещали по отдельности со свободным доступом к пище и воде и поддерживали 12-часовой цикл свет/темнота в условиях постоянной температуры (22±2°С) и влажности (50±5%).
[00202] После 2-недельного периода адаптации к лабораторным условиям и условиям размещения животных сначала обучали поглощать 1% раствор сахарозы; обучение состояло из девяти 1-часовых базовых испытаний, в которых в клетки животных подавали сахарозу, с последующим лишением пищи и воды в течение 14 часов; поглощение сахарозы измеряли путем взвешивания предварительно взвешенных бутылей, содержащих раствор сахарозы, в конце испытания. Затем потребление сахарозы отслеживали в таких же условиях с недельными интервалами в течение всего эксперимента.
[00203] На основании поглощения ими сахарозы в конечном базовом испытании животных делили на две равные группы. Одну группу животных подвергали процедуре хронического легкого стресса в течение 8 последовательных недель. Каждая неделя стрессового режима состояла из: двух периодов лишения пищи или воды, двух периодов наклона клетки под углом 45 градусов, двух периодов перемежающегося освещения (свет включали и выключали через каждые 2 часа), двух периодов загрязнения клетки (250 мл воды в подстилке из древесных опилок), одного периода размещения по парам, двух периодов стробоскопического освещения низкой интенсивности (150 вспышек/мин) и трех периодов без стресса. Все стресс-факторы имели 10-14-часовую продолжительность, и их прилагали индивидуально и непрерывно, днем и ночью. Контрольных животных размещали в отдельных помещениях, и они не имели никаких контактов с подвергаемыми стрессу животными. Их лишали пищи и воды в течение 14 часов перед каждым испытанием с использованием сахарозы, но в остальном у них был свободный доступ к пище и воде в клетках, где их содержали.
[00204] На основании поглощения ими сахарозы после начальных 2 недель стресса, как подвергаемую стрессу, так и контрольную группу, каждую, далее разделяли на равные подгруппы (n=8), и в течение последующих пяти недель они получали один раз в день интраперитонеальные инъекции носителя (0,5% раствор гидроксипропилметилцеллюлозы, 1 мл/кг), SON-117 (0,001, 0,01, 0,1 и 1 мг/кг) или имипрамина (10 мг/кг) в качестве сравнительной обработки. Лекарственные средства вводили приблизительно в 10:00 часов утра и еженедельные сахарозные испытания осуществляли через 24 часа после последних инъекций лекарственного средства. Через пять недель все обработки прекращали и осуществляли одно дополнительное сахарозное испытание через одну неделю после отмены. Стресс продолжался в течение всего периода лечения и отмены.
[00205] После завершения периода введения и отмены всех контрольных и подвергаемых стрессу животных помещали в открытое поле (100 см в диаметре, 35 см в высоту) и давали исследовать два идентичных объекта (цилиндрический объект со стенками, окрашенными в белый цвет, 7 см в диаметре, 11 см в высоту) в течение времени, необходимого для завершения 15-сек изучения любого из этих объектов. Для испытания запоминания, осуществляемого через один час, один из объектов, представленных ранее, заменяли новым объектом (призматический объект со стенками, окрашенными в черный цвет, 5 см в ширину, 14 см в высоту). Крыс возвращали в открытое поле на 5 минут, и продолжительность изучения (т.е. сидение в непосредственной близости к объектам, обнюхивание или касание их) каждого объекта измерял отдельно специально обученный наблюдатель. Данные рассчитывали в соответствии со следующей формулой: [время изучения нового объекта, деленное на время изучения нового плюс знакомого объекта, умноженное на 100]. CMS и NOR данные анализировали с использованием нескольких дисперсионных анализов с тремя меж-субъектными факторами (стресс/контроль, обработки лекарственными средствами и поглощения сахарозы в последующих испытаниях). LSD критерий Фишера использовали для последующих сравнений средних значений.
[00206] Результаты исследования являются следующими. Хронический легкий стресс вызывали постепенным снижением потребления 1% раствора сахарозы. В конечном базовом испытании все животные выпивали приблизительно 13 г раствора сахарозы. После первых двух недель стресса потребление оставалось на таком же уровне у контрольных животных, но снижалось приблизительно до 8 г у подвергаемых стрессу животных [F(1,94)=169,289; p<0,001], и такая разница между контрольными и подвергаемыми стрессу животными, которым вводили носители, сохранялась на этом уровне в течение остального периода эксперимента (см. фигуры ниже).
[00207] Фиг. 1 иллюстрирует эффекты длительной обработки носителем (1 мл/кг, интраперитонеально) и имипрамином (10 мг/кг, интраперитонеально) на потребление 1% раствора сахарозы контрольными животными (незакрашенные символы) и животными, подвергаемыми хроническому легкому стрессу (закрашенные символы). Обработку начинали после 2 недель начального стресса. Значения представляют собой средние значения +/-SEM. По сравнению с введением носителя, имипрамин не имел никакого существенного эффекта на поглощение сахарозы у контрольных животных [эффект обработки: F(1,84)=1,379; NS] и постепенно повышал потребление сахарозы у подвергаемых стрессу животных, приводя к существенному эффекту обработки [F(1,84)=66,044; p<0,001] и взаимосвязи Обработка × Недели [F(5,84)=7,397; p<0,001]. По сравнению с Неделя 0 оценками, повышения поглощения сахарозы у подвергаемых стрессу животных, которым вводили имипрамин, достигали статистической значимости после четырех недель обработки (p=0,038). Этот эффект усиливался далее и поддерживался в течение одной недели после прекращения обработки. *** - p<0,001; по сравнению с обрабатываемыми носителем или обрабатываемыми лекарственным средством контрольными группами, # - p<0,0, ## - p<0,01; по сравнению с обрабатываемой лекарственным средством подвергаемой стрессу группой по состоянию на Неделю 0.
[00208] Фиг. 2 иллюстрирует эффекты длительной обработки носителем (1 мл/кг, интраперитонеально) и SON-117 (0,001, 0,01, 0,1 и 1 мг/кг, интраперитонеально) на потребление 1% раствора сахарозы контрольными животными (незакрашенные символы) и животными, подвергаемыми хроническому легкому стрессу (закрашенные символы). Обработку начали после 2 недель стресса. Значения представляют собой средние значения +/-SEM. По сравнению с введением носителя, SON-117 (все дозы) не имел никакого существенного эффекта на поглощение сахарозы у контрольных животных [эффект обработки: F(4,210)=1,174; NS] и вызывал высоко значимый эффект обработки [F(4,210)=20,964; p<0,001] и Обработка × Недели взаимосвязь [F(20,210)=11,679; p=0,039] в подвергаемых стрессу группах. По сравнению с инъекциями носителя, все четыре дозы SON-117 вызывали существенные эффекты у подвергаемых стрессу животных [0,001 мг: F(1,84)=95,974; p<0,001, 0,01 мг: F(1,84)=18,571; p<0,001, 0,1 мг: F(1,84)=33,659; p<0,001, 1 мг: F(1,84)=51,768; p<0,001]. Однако, при сравнении с Неделя 0 оценками, этот эффект достигал статистической значимости только после введения доз 0,001 и 0,01 мг/кг. Эти повышения потребления сахарозы у подвергаемых стрессу животных, обрабатываемых этими дозами, достигал значимости уже после первой недели введения (p<0,013 и p<0,031, соответственно). Через одну неделю после прекращения обработок эффект 0,001 мг/кг поддерживался, но эффект 1 мг/кг отменялся. * - p<0,05, ** - p<0,01, *** - p<0,001; по сравнению с обрабатываемыми носителем или обрабатываемыми лекарственным средством контрольными группами. # - p<0,05, ## - p<0,01; по сравнению с обрабатываемыми лекарственным средством подвергаемыми стрессу группами по состоянию на Неделю 0.
[00209] Фиг. 3 иллюстрирует эффекты длительной обработки носителем (1 мл/кг, интраперитонеально), имипрамином (10 мг/кг, интраперитонеально) и SON-117 (0,001, 0,01, 0,1 и 1 мг/кг, интраперитонеально) на поведение контрольных (незакрашенные символы) и подвергаемых стрессу (закрашенные символы) животных в испытании распознавания нового объекта. Испытание осуществляли через неделю после отмены обработки. Значения представляют собой средние значения +/-SEM. CMS процедура снижала индекс распознавания, приводя к существенному групповому эффекту [F(1,14)=22,441; p<0,001]. Имипрамин снижал индекс распознавания у контрольных животных [F(1,14)=12,101; p<0,01] и оказался неэффективным против CMS-индуцированного дефицита [F(1,14)=0,287; NS]. SON-117 (все дозы) не имел никакого существенного эффекта на индекс распознавания у контрольных животных [F(4,35)=0,346; NS] и вызывал существенный эффект обработки [F(4,35)=2,686, p<0,05] в подвергаемых стрессу группах. У подвергаемых стрессу животных SON-117, вводимый при более низких дозах 0,001, 0,01 и 0,1 мг/кг, восстанавливал индекс распознавания до уровня обрабатываемых носителем или обрабатываемых лекарственным средством контрольных животных, тогда как наивысшая доза 1 мг/кг оказалась неэффективной против CMS-индуцированного дефицита в распознавании нового объекта. * - p<0,05, *** - p<0,001; по сравнению с обрабатываемыми носителем или обрабатываемыми лекарственным средством контрольными группами. # - p<0,05, ## - p<0,01; по сравнению с обрабатываемыми носителем контрольными или подвергаемыми стрессу группами.
[00210] Перед началом индуцирующей стресс процедуры (базовая линия) контрольные животные и животные, которые должны будут подвергаться стрессу, имели сопоставимые массы тела (320 и 316 г, соответственно), и после первых двух недель стресса (Неделя 0) подвергаемые стрессу животные были только немного меньше, чем контрольные животные (336 и 352 г, соответственно). По сравнению с обрабатываемыми носителем животными, ни имипрамин, ни SON-117 не имели никакого существенного эффекта на массу тела контрольных [IMI: F1,14)=3,554; NS, SON-117: F(4,35)=1,184; NS] и подвергаемых стрессу [IMI: F1,14)=0,879; NS, SON-117: F(4,35)=2,623; р=0,051; NS] животных.
[00211] Результаты этого исследования согласуются с полученными ранее данными, показывающими, что CMS процедура вызывает существенное снижение потребления 1% раствора сахарозы, и что этот дефицит может иметь полное обратное развитие при длительной обработке имипрамином. Сила этого эффекта и его начало сопоставимы с тем, что наблюдали в других CMS исследованиях с этим антидепрессантом. SON-117 оказался активным в CMS модели депрессии; это соединение не имело никаких эффектов у контрольных животных и повышало поглощение сахарозы у подвергаемых стрессу животных. Сила действия наиболее активных доз SON-117 (0,001 и 1,0 мг/кг) была сопоставима с имипрамином; по окончании периода обработки потребление сахарозы у подвергаемых стрессу животных, обрабатываемых этими дозами, восстанавливалось до пред-стрессового уровня. Начало действия этих доз было определенно как более быстрое по сравнению с имипрамином; повышение поглощения сахарозы достигало статистической значимости уже после первой недели введения, по сравнению с четырьмя неделями в случае имипрамина. Кроме того, обработка SON-117, описанным в настоящей заявке, не была связана с когнитивным нарушением, которое наблюдали при использовании имипрамина. Другие две дозы 0,01 и 0,1 мг/кг были менее эффективными по сравнению с имипрамином: хотя поглощения были существенно выше по сравнению с обрабатываемыми носителем подвергаемыми стрессу животными, они оставались пониженными по сравнению с обрабатываемыми носителем контрольными животными и с пред-стрессовыми значениями. За исключением самых высоких доз 1 мг/кг, активность SON-117 в CMS модели сохранялась в течение одной недели после отмены обработки. Как было обнаружено в испытании распознавания нового объекта, SON-117 также может препятствовать развитию у подвергаемых стрессу животных CMS-индуцируемого дефицита рабочей памяти. Интересно то, что этот эффект наблюдали только у животных, которые продолжали поглощать большое количество сахарозы после отмены обработки.
Пример 5: Фармакокинетический анализ SON-117 и SON-117 метаболитов.
[00212] SON-117 и SON-117 метаболит M1:

[00213] исследовали в фармакокинетических испытаниях.
[00214] Фиг. 34 иллюстрирует концентрацию в плазме SON-117 как функцию времени в день 1 после введения SON-117. Фиг. 35 иллюстрирует концентрацию в плазме SON-117 как функцию времени в день 14 после введения SON-117. Эти данные демонстрируют дозопропорциональное увеличение Cmax и AUC для SON-117.
[00215] Фиг. 36 иллюстрирует концентрацию в плазме M1 метаболита SON-117 как функцию времени в день 1 после введения SON-117. Фиг. 37 иллюстрирует концентрацию в плазме M1 метаболита SON-117 как функцию времени в день 14 после введения SON-117. Эти данные демонстрируют дозопропорциональное увеличение Cmax и AUC для M1 метаболита SON-117.
[00216] Изобретение описано в настоящей заявке посредством ссылки на некоторые предпочтительные варианты воплощения. Однако, поскольку их конкретные варианты будут очевидны специалистам в данной области на основании раскрытия, содержащегося в настоящей заявке, изобретение не должно рассматриваться как ограничиваемое ими.
[00217] Должно быть понятно, что по меньшей мере некоторые из описаний настоящего изобретения были упрощены для фокусирования на элементах, которые имеют значение для ясного понимания настоящего изобретения, исключая при этом, для ясности, другие элементы, которые, как должно быть понятно средним специалистам в данной области, также могут составлять часть настоящего изобретения. Однако, поскольку такие элементы хорошо известны в данной области техники, и поскольку они необязательно способствуют лучшему пониманию настоящего изобретения, описание таких элементов не представлено в настоящей заявке.
[00218] Также, относительно того, что способ не зависит от конкретного порядка стадий, описанных в настоящей заявке, конкретный порядок стадий не следует рассматривать как ограничение формулы изобретения. Пункты формулы изобретения, направленные на способ в соответствии с настоящим изобретением, не должны ограничиваться осуществлением этих стадий в описанном порядке, и специалист в данной области легко сможет понять, что стадии могут меняться, не отступая при этом от сути и объема настоящего изобретения.
[00219] Все патенты, патентные заявки и ссылочные документы, цитируемые в настоящей заявке, полностью и целиком включены посредством ссылки, как если бы они были изложены во всей их полноте, включая, но не ограничиваясь этим, патент США No. 6720320.
Реферат
Настоящее изобретение относится к медицине, а именно к неврологии, и касается лечения нарушений сна. Для этого вводят фармацевтическую композицию, содержащую SON-117 или его метаболит, или их комбинацию, в низких дозах. Это обеспечивает эффективную коррекцию нарушений сна, в частности увеличение периода медленного сна, за счет антагонистической активности указанных соединений в отношении 5-НТ1А рецептора, а также их способности ингибировать повторное поглощение 5-HT. 14 з.п. ф-лы, 37 ил., 26 табл.
Формула





Комментарии